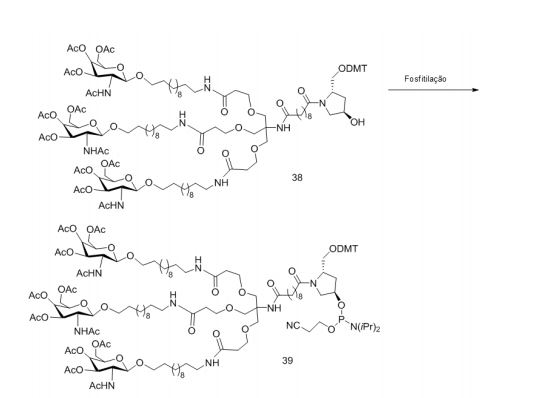
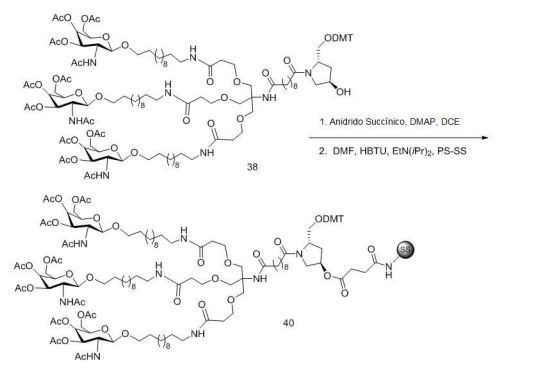
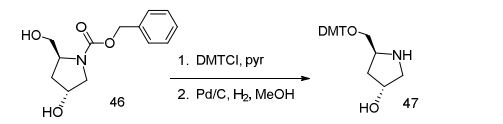
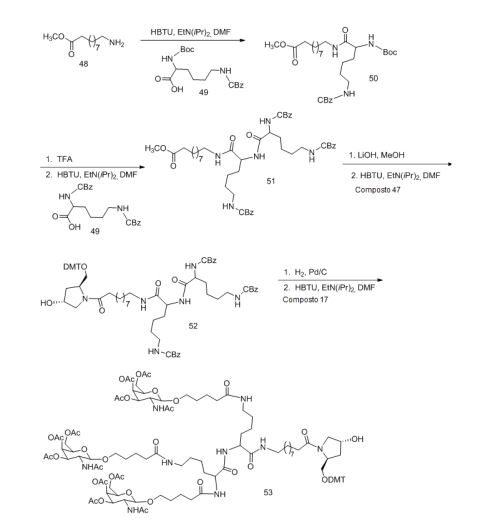
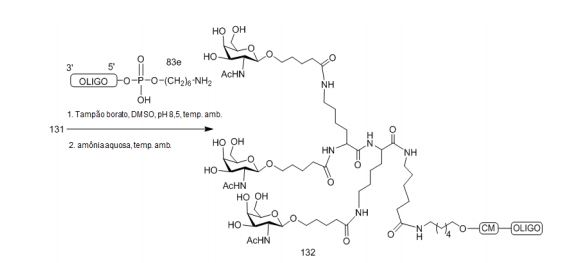
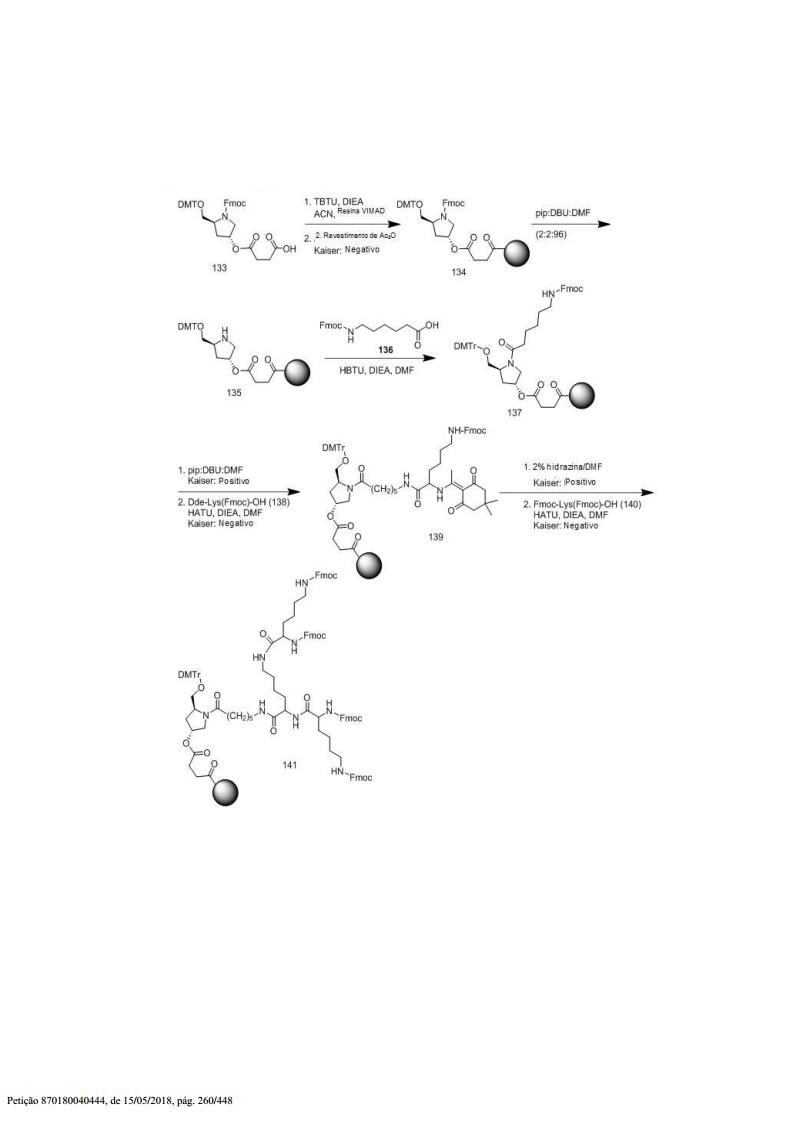
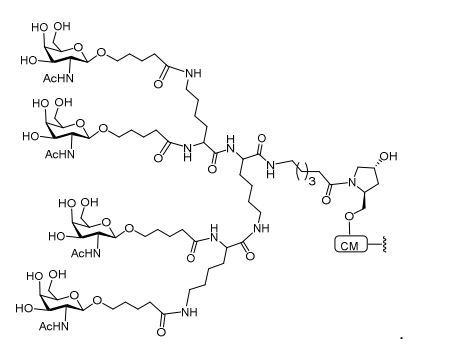
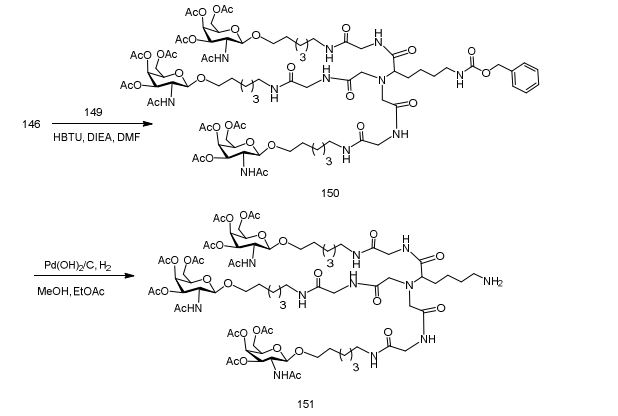
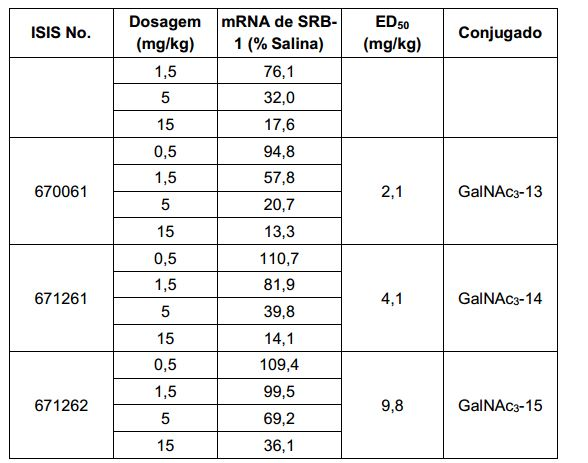
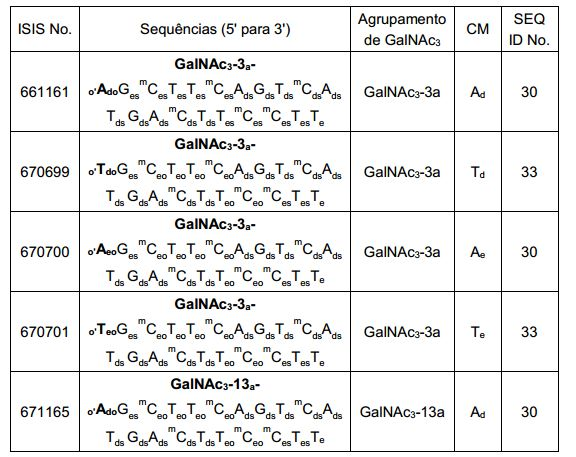
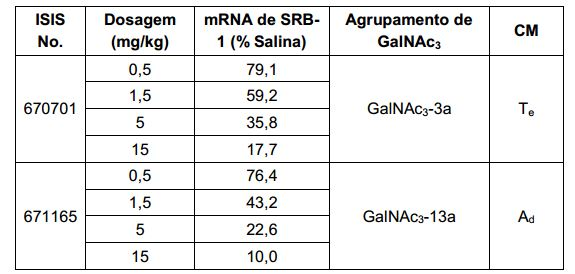
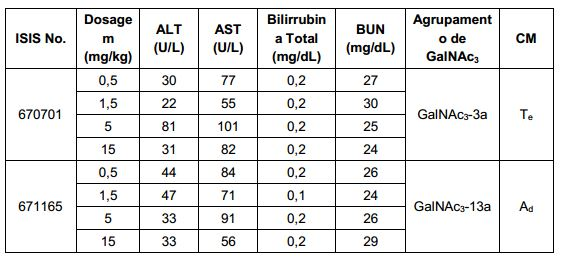
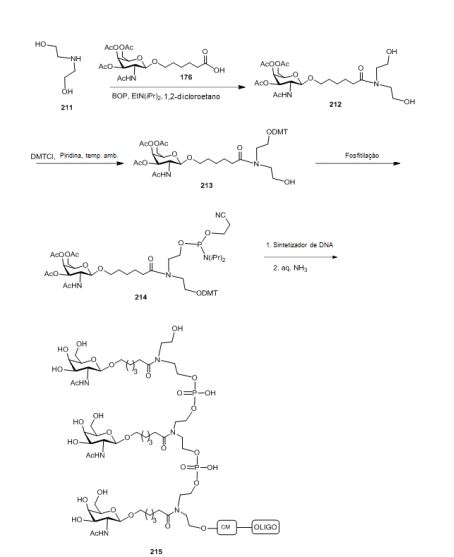
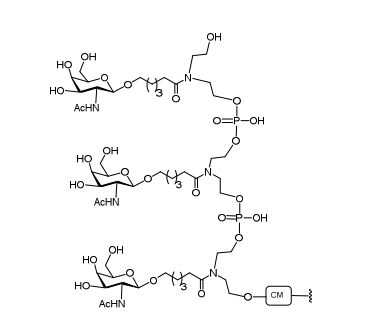
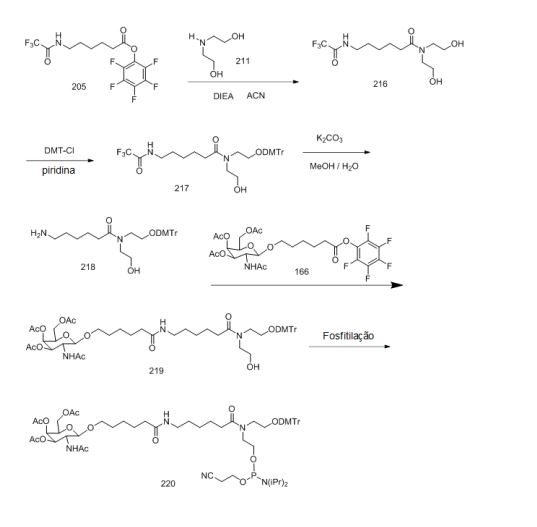
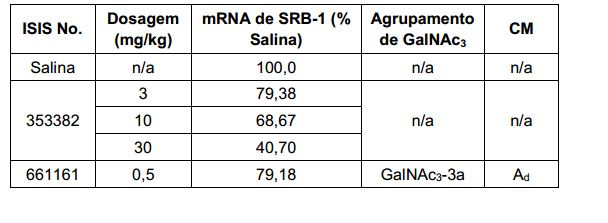
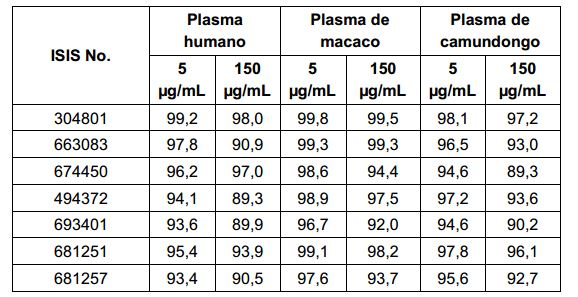
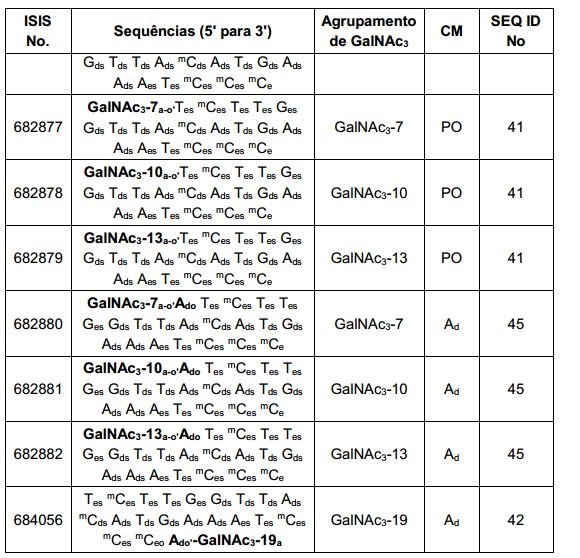
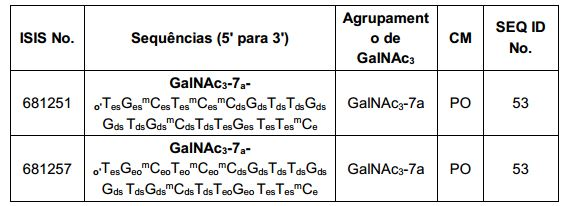
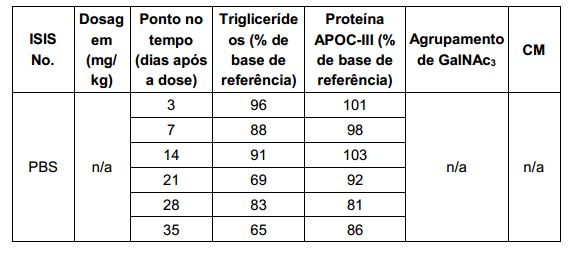
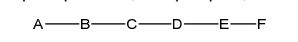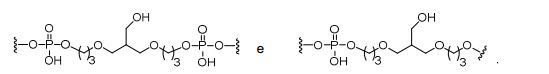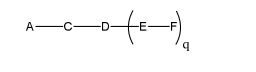[001] Dividido do BR112015027369-6, depositado em 1°.05.2014.
LISTAGEM DE SEQUÊNCIA
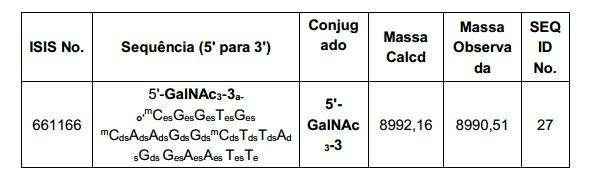
[002] O presente pedido está sendo depositado junto com uma Listagem de Sequência em formato eletrônico. A Listagem de Sequência é fornecida como um arquivo intitulado BIOL0248WOSEQ_ST25.txt criado em 1° de maio de 2014, que tem 16 Kb de tamanho. As informações no formato eletrônico da listagem sequência são incorporadas neste documento por referência em sua totalidade.
ANTECEDENTES DA INVENÇÃO
[003] O princípio por trás da tecnologia antissenso é que um composto antissenso hibridiza em ácido nucleico alvo e modula a quantidade, atividade e/ou a função do ácido nucleico alvo. Por exemplo em certos casos, compostos antissensos resultam na transcrição alterada ou tradução de um alvo. Tal modulação da expressão pode ser conseguida, por exemplo, a degradação do mRNA alvo ou inibição baseadas na ocupação. Um exemplo de modulação da função alvo de RNA pela degradação é RNase H baseada na degradação do RNA alvo mediante hibridação com um composto antissenso do tipo de DNA. Outro exemplo de modulação da expressão gênica pela degradação do alvo é a interferência de RNA (RNAi). RNAi refere-se ao silenciamento do gene mediado pelo antissenso através de um mecanismo que utiliza o complexo de silenciamento induzido por RNA (RISC). Um exemplo adicional de modulação da função-alvo do RNA é através de um mecanismo baseado em ocupação como empregado naturalmente pela micro- RNA. Micro-RNAs são pequenos RNAs não codificantes que regulam a expressão de RNAs codificantes de proteínas. A ligação de um composto antissenso para um micro-RNA impede que micro-RNA de ligação para seus alvos de RNA mensageiro e, portanto, interfere com a função do micro-RNA. Imitadores de Micro-RNA pode melhorar a função nativa do micro-RNA. Certos compostos antissensos alteram junção do pré-mRNA. Independentemente do mecanismo específico, a especificidade da sequência torna compostos antissensos atraente como ferramentas para validação de alvo e funcionalização do gene, bem como terapêutica para modular seletivamente a expressão dos genes envolvidos na patogênese das doenças.
[004] A tecnologia antissenso é um meio eficaz para modular a expressão de um ou mais produtos de genes específicos e, portanto, pode revelar-se excepcionalmente útil em várias aplicações terapêuticas, diagnósticas e de pesquisa. Nucleosídeos modificados quimicamente podem ser incorporados em compostos antissensos para melhorar uma ou mais propriedades, como resistência de nuclease, farmacocinética ou afinidade para um alvo do ácido nucleico. Em 1998, o composto antissenso, Vitravene® (fomivirsen; desenvolvido pela Isis Pharmaceuticals Inc., Carlsbad, CA) foi a primeira fármaco antissenso a conseguir liberação de comercialização da Food and Drug Administration (FDA), e atualmente é um tratamento de infecção por citomegalovírus (CMV) induzida por retinite em pacientes com AIDS.
[005] Novas modificações químicas melhoraram a potência e a eficácia dos compostos antissensos, descobrindo o potencial de distribuição oral, bem como potencializar a administração subcutânea, diminuindo o potencial de efeitos colaterais e levando a melhorias na conveniência do paciente. Modificações químicas, aumentando a potência de compostos antissensos permitem a administração de doses mais baixas, o que reduz o potencial de toxicidade, bem como diminuindo o custo total da terapia. Modificações aumentando a resistência à degradação resultam em mais lento afastamento do corpo, permitindo a dosagem menos freqüente. Diferentes tipos de modificações químicas podem ser combinados em um composto para otimizar ainda mais a eficácia do composto.
SUMÁRIO DA INVENÇÃO
[006] Em determinadas modalidades, a presente descrição fornece compostos antissenso conjugados. Em determinadas modalidades, a presente descrição fornece compostos antissensos conjugados, compreendendo o oligonucleotídeo antissenso complementar para uma transcrição do ácido nucleico. Em determinadas modalidades, a presente descrição fornece métodos que compreende entrar em contato com uma célula com um composto antissenso conjugado constituído pelo oligonucleotídeo antissenso complementar para uma transcrição do ácido nucleico. Em determinadas modalidades, a presente descrição fornece métodos que compreende entrar em contato com uma célula com um composto antissenso conjugado compreendendo oligonucleotídeo antissenso e reduzindo a quantidade ou a atividade de uma transcrição de ácido nucleico de uma célula.
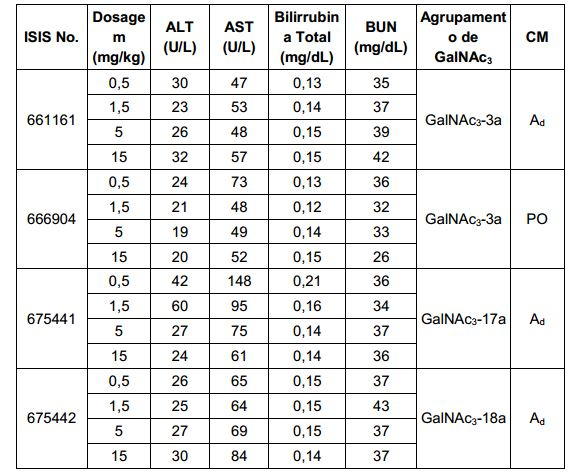
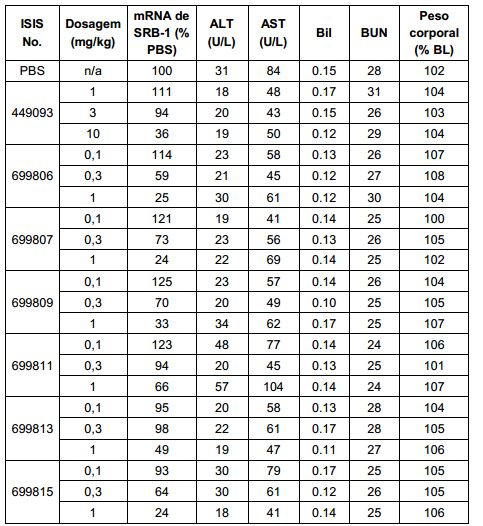
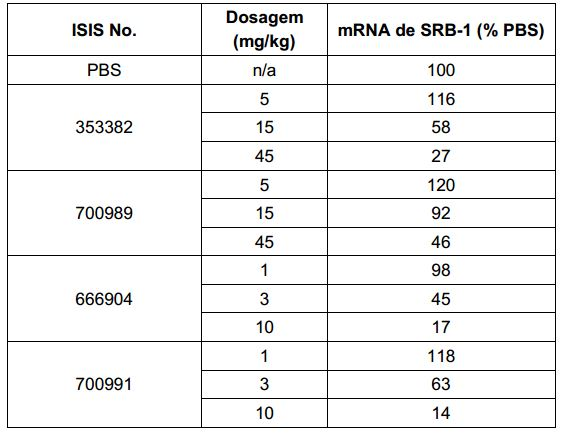
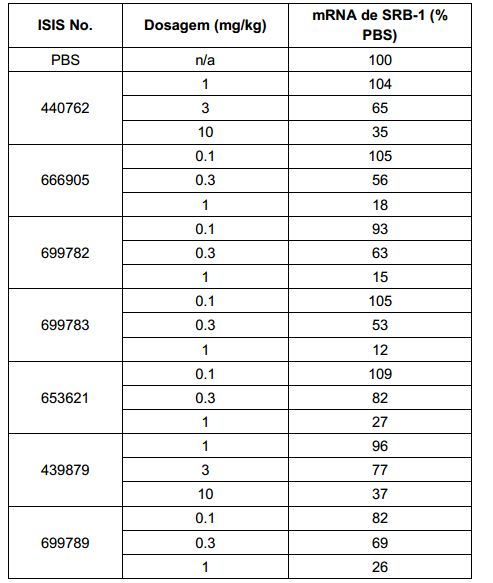
[007] O receptor asialoglicoproteína (ASGP-R) foi descrito anteriormente. Veja, por exemplo, Park et al., PNAS vol. 102, No. 47, pp 17125-17129 (2005). Tais receptores são expressos nas células do fígado, particularmente de hepatócitos. Além disso, verificou-se que compostos compreendendo aglomerados de três ligantes de N- acetilgalactosamina (GalNAc) são capazes de ligação ao ASGP-R, resultando em absorção do composto para a célula. Veja por exemplo, Khorev et al., Bioorganic and Medicinal Chemistry, 16, 9, pp 52165231 (May 2008). Nesse sentido, o conjugado compreendendo esses agrupamentos GalNAc tem sido utilizado para facilitar a absorção de certos compostos nas células do fígado, especificamente de hepatócitos. Por exemplo, foi mostrado que certos conjugados contendo GalNAc aumentam a atividade de compostos siRNA duplex nas células do fígado in vivo. Em tais casos, o conjugado contendo GalNAc normalmente é anexado para o fio do sense do siRNA duplex. Desde que a fita sense é descartada antes que a fita antissenso hibridiza em última análise, com o ácido nucleico alvo, existe pouca preocupação que o conjugado interferirá com a atividade. Normalmente, o conjugado é anexado à extremidade 3' da fita sense do siRNA. Veja por exemplo, Patente U.S. 8,106,022. Certos grupos conjugados aqui descritos são mais ativos e/ou mais fácil para sintetizar aqueles grupos conjugados descritos anteriormente.
[008] Em determinadas modalidades da presente invenção, os conjugados são anexados aos compostos antissenso de fita simples, incluindo, mas não se limitando aos compostos antissenso à base de RNase H e compostos antissenso que alteram o junção de um ácido nucleico alvo de pré-mRNA. Em tais modalidades, o conjugado deve permanecer anexado ao composto antissenso, tempo suficiente para fornecer o benefício (captação melhorada nas células) mas então deve ser clivada, ou caso contrário não interferir com as subseqüentes etapas necessárias para a atividade, tais como a hibridação de um alvo de ácidos nucleicos e interação com RNase H ou enzimas associadas com a emenda ou modulação de splice. Esse equilíbrio de propriedades é o mais importante no cenário dos compostos antissensos de filamento único do que em compostos de siRNA, em que o conjugado simplesmente pode ser ligado à fita sense. Divulgados neste documento são os compostos antissensos de filamento único conjugados tendo melhorado a potência nas células do fígado in vivo em comparação com o mesmo composto antissenso o que falta o conjugado. Tendo em conta o equilíbrio necessário para estes compostos de propriedades tal potência melhorada é surpreendente.
[009] Em determinadas modalidades, grupos conjugados aqui mencionados compreendem uma porção clivável. Como observado, sem querer ligar-se ao mecanismo, é lógico que o conjugado deve permanecer sobre o composto tempo suficiente para proporcionar melhoria na captação, mas depois disso, é desejável que uma parte ou, idealmente, a totalidade do conjugado a ser clivado, liberando o composto (por exemplo, composto antissenso) na sua forma mais ativa. Em determinadas modalidades, a porção clivável é um nucleosídeo clivável. Tais modalidades tiram proveito de nucleases endógenas na célula, anexando no resto do conjugado (o agrupamento) para do oligonucleotídeo antissenso através de um nucleosídeo através de uma ou mais obrigações cliváveis, tais como aqueles de uma ligação fosfodiéster. Em determinadas modalidades, o agrupamento está ligado para o nucleosídeo clivável através de uma ligação fosfodiéster. Em determinadas modalidades, o nucleosídeo clivável é anexado para o oligonucleotídeo antissenso (composto antissenso) por uma ligação fosfodiéster. Em determinadas modalidades, o grupo conjugado pode incluir dois ou três nucleosídeos cliváveis. Em tais modalidades, tais nucleosídeos cliváveis são ligados um ao outro, ao composto antissenso e/ou agrupamento por meio de títulos cliváveis (tais como aqueles de uma ligação fosfodiéster). Certos conjugados no presente documento não compreendem um nucleosídeo clivável e em vez disso, compreende uma ligação clivável. É mostrado que a clivagem suficiente do conjugado do oligonucleotídeo é fornecido, pelo menos, uma ligação que é vulnerável à clivagem na célula (uma ligação clivável).
[0010] Em determinadas modalidades, compostos antissenso conjugados são profármacos. Tais exemplos são administrados a um animal e, finalmente, são metabolizados para uma forma mais ativa. Por exemplo, compostos antissensos conjugados são clivados para remover a totalidade ou parte do conjugado resultando na forma ativa (ou mais ativa) do composto antissenso sem a totalidade ou alguns do conjugado.
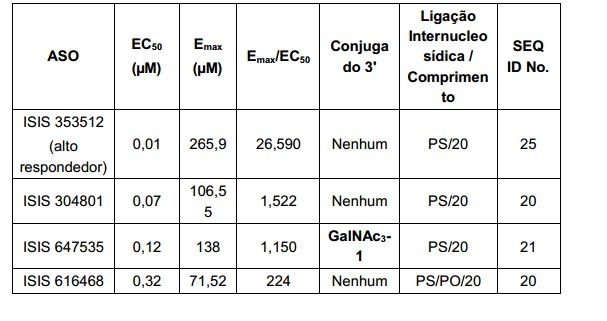
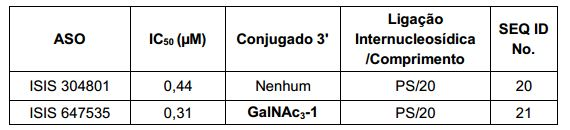
[0011] Em determinadas modalidades, os conjugados são anexados na extremidade 5' do oligonucleotídeo. Alguns desses conjugados 5' são clivados mais eficientemente do que os colegas tendo um grupo conjugado semelhante anexado à extremidade 3'. Em determinadas modalidades, atividade melhorada pode correlacionar com a clivagem melhorada. Em determinadas modalidades, oligonucleotídeos compreendendo um conjugado na extremidade 5' tem maior eficácia do que os oligonucleotídeos compreendendo um conjugado na extremidade 3' (ver, por exemplo, Exemplos, 56, 81, 83 e 84). Além disso, fixação 5' permite síntese mais simples do oligonucleotídeo. Normalmente, oligonucleotídeos são sintetizados em um apoio sólido na direção 3' para 5'. Para fazer oligonucleotídeos conjugados 3', tipicamente anexa um nucleosídeo pré-conjugados 3' para o apoio sólido e cria o oligonucleotídeo como de costume. No entanto, anexar esse nucleosídeo conjugado para o apoio sólido adiciona complicação para a síntese. Além disso, usando essa abordagem, o conjugado então está presente em toda a síntese do oligonucleotídeo e pode tornar-se degradado durante as etapas subseqüentes ou pode limitar os tipos de reações e reagentes que podem ser usados. Usando as estruturas e as técnicas descritas neste documento para oligonucleotídeos conjugados 5', podemos sintetizar o oligonucleotídeo usando técnicas padrão automatizadas e introduzir o conjugado com a extremidade (5'-maior) do nucleosídeo ou depois o oligonucleotídeo tem sido clivado do apoio sólido.
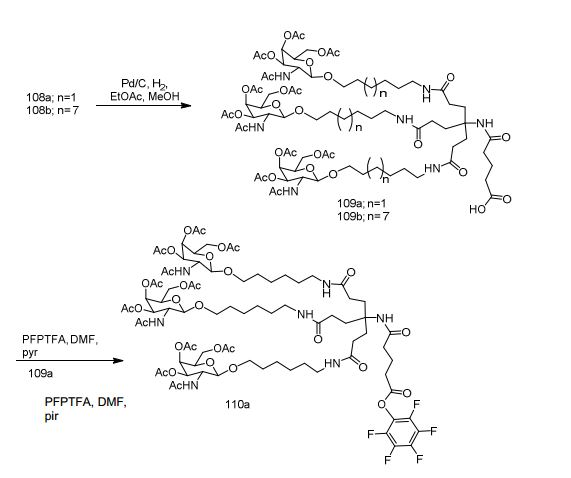
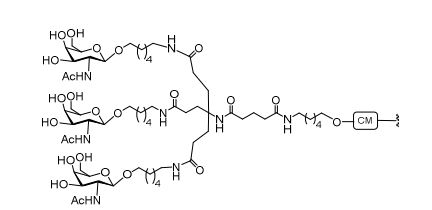
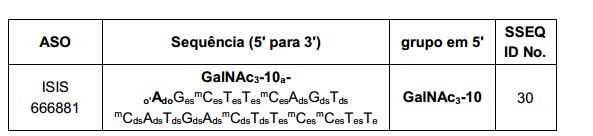
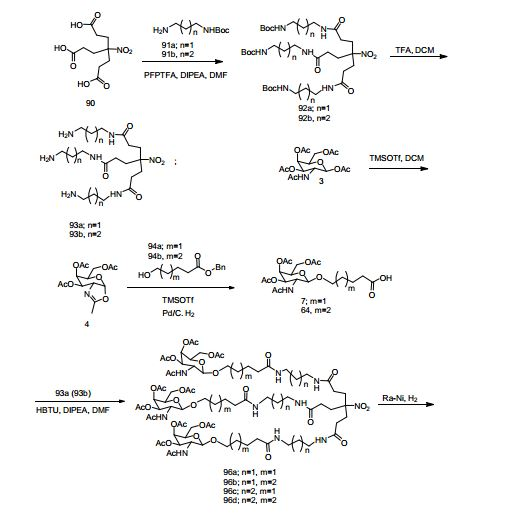
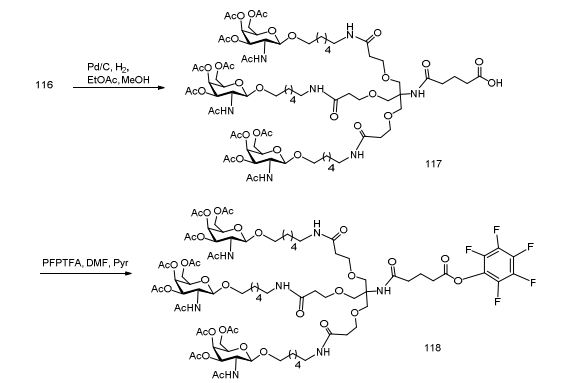
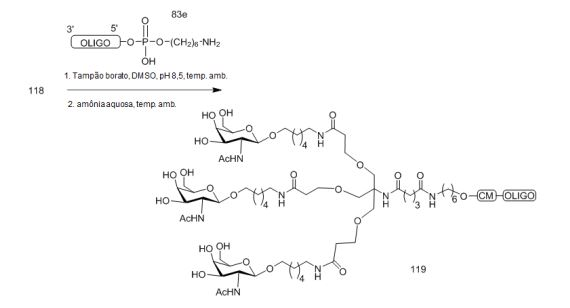
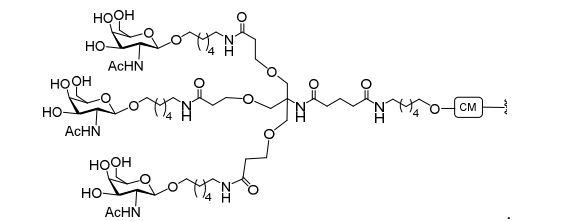
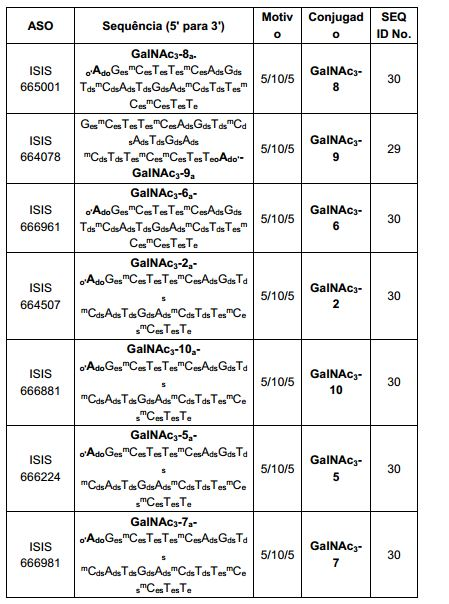
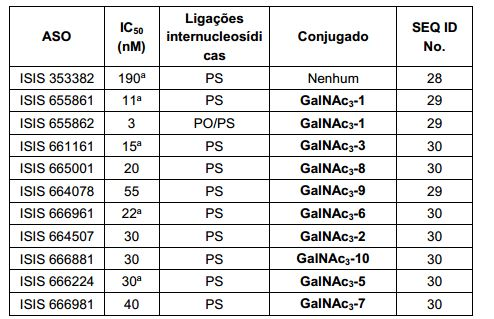
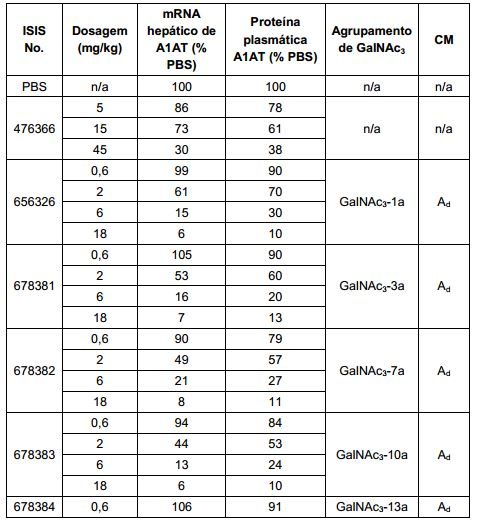
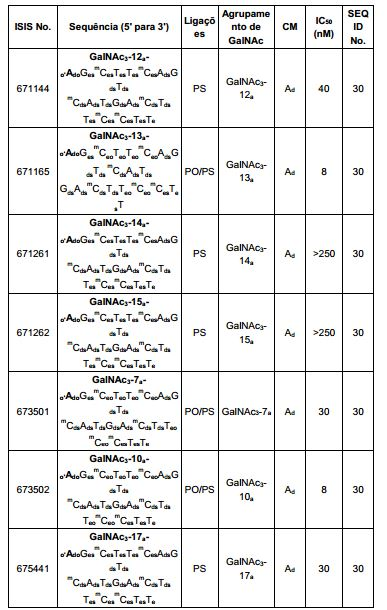
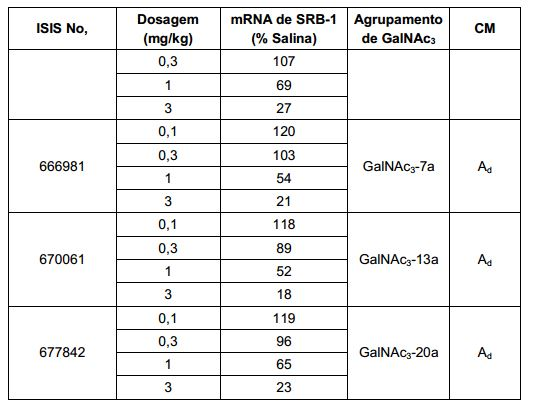
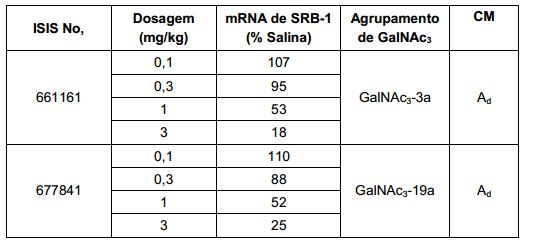
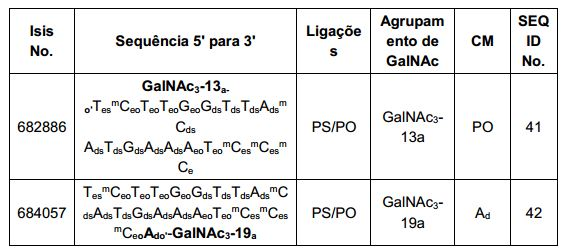
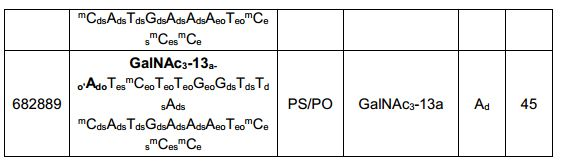
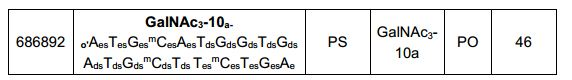
[0012] Tendo em conta a técnica e a presente descrição, um versado na técnica pode facilmente fazer quaisquer conjugados e oligonucleotídeos conjugados mencionados neste documento. Além disso, a síntese de certos conjugados e oligonucleotídeos conjugados divulgados neste documento é mais fácil e/ou requer algumas etapas, e é, portanto, menos caro do que a dos conjugados anteriormente divulgado, oferecendo vantagens na fabricação. Por exemplo, a síntese de certos grupos conjugados consiste em menos etapas sintéticas, resultando em aumento de rendimento, em relação aos grupos conjugados descritos anteriormente. Grupos conjugados como GalNAc3-10 no Exemplo 46 e GalNAc3-7 no Exemplo 48 são muito mais conjugados descritos anteriormente como os descritos em U.S. 8.106.022 ou U.S. 7.262.177 que exigem o conjunto de intermediários químicos mais simples. Por conseguinte, estes e outros conjugados aqui descritos tem vantagens sobre compostos descritosanteriormente para uso com qualquer oligonucleotídeo, incluindo oligonucleotídeos de filamento único e qualquer fita deoligonucleotídeo de filamento duplo (por exemplo, siRNA).
[0013] Da mesma forma, os grupos conjugados com apenas um ou dois ligantes GalNAc são divulgados. Como mostrado, tais grupos conjugados melhoram a atividade dos compostos antissenso. Tais compostos são mais fáceis de preparar do que conjugados compreendendo três ligantes GalNAc. Grupos conjugados compreendendo um ou dois ligantes GalNAc podem ser associados a qualquer compostos antissensos, incluindo os oligonucleotídeos de filamento único e qualquer fita de oligonucleotídeos de filamento duplo (por exemplo, siRNA).
[0014] Em determinadas modalidades, os conjugados mencionados neste documento não alteram substancialmente certas medidas de tolerabilidade. Por exemplo, ele é mostrado aqui que compostos antissensos conjugados não são mais imunogênicos do que os compostos parentais não conjugados. Uma vez que a potência é melhorada, modalidades em que a tolerabilidade permanece a mesma (ou de fato, mesmo se a tolerabilidade piora apenas ligeiramente em comparação com os ganhos de potência) tem propriedades melhoradas para a terapia.
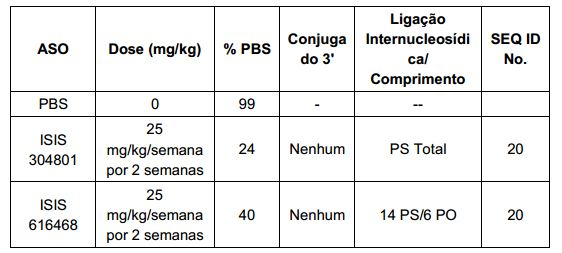
[0015] Em determinadas modalidades, a conjugação permite alterar compostos antissenso de forma a ter consequências menos atraentes na ausência de conjugação. Por exemplo, em determinadas modalidades, substituindo uma ou mais ligações de fosforotioato de um composto antissenso totalmente fosforotioato com resultados das ligações de fosfodiéster na melhoria em algumas medidas de tolerabilidade. Por exemplo, em certos casos, tais compostos antissensos, tendo um ou mais fosfodiéster são menos imunogênicos do que o mesmo composto, em que cada ligação é um fosforotioato. No entanto, em certos casos, conforme mostrado no Exemplo 26, essa mesma substituição de uma ou mais ligações de fosforotioato com ligações fosfodiésteres também resultam em reduzida absorção celular e/ou perda de potência. Em determinadas modalidades, compostos antissensos conjugados aqui descritos toleram tal mudança em ligações com pouca ou nenhuma perda na absorção e potência quando comparado com o equivalente completo de fosforotioato conjugado. Na verdade, em determinadas modalidades, por exemplo, nos Exemplos 44, 57, 59 e 86, oligonucleotídeos compreendendo um conjugado e, pelo menos, uma ligação internucleósidos de fosfodiéster, na verdade, exibem um aumento de potência in vivo, até mesmo em relação a um homólogo de fosforotioato completo compreendendo também o mesmo conjugado. Além disso, uma vez que conjugação resulta em aumentos substanciais na captação/potência uma pequena perda em que o ganho substancial pode ser aceitável para alcançar tolerância melhorada. Por conseguinte, em determinadas modalidades, compostos antissensos conjugados compreendem pelo menos uma ligação fosfodiéster.
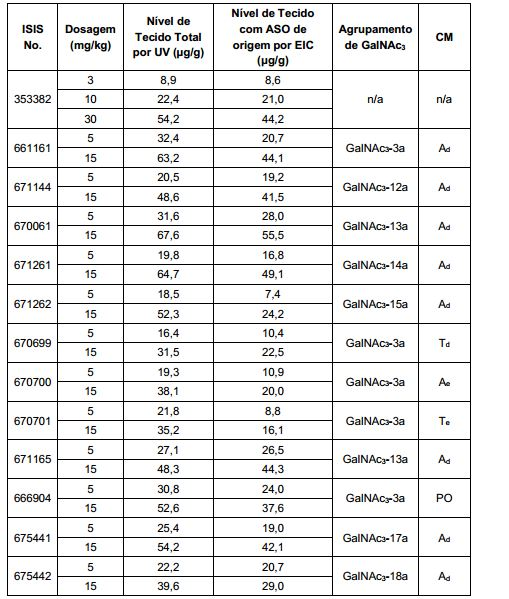
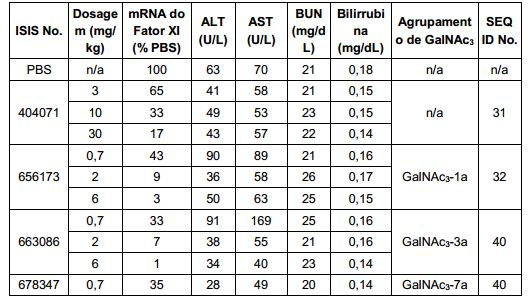
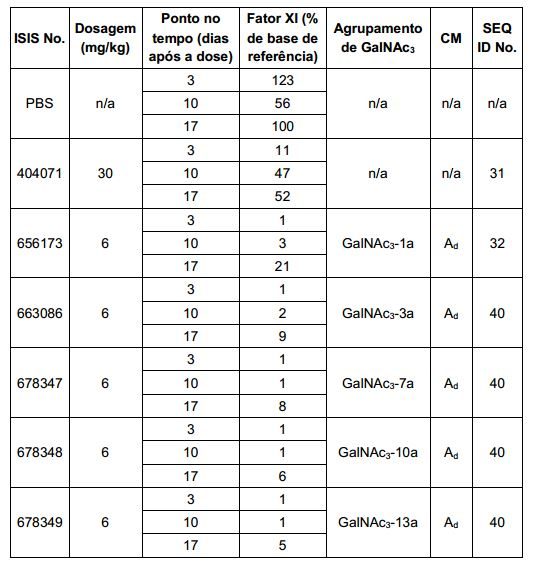
[0016] Em determinadas modalidades, a conjugação de compostos antissenso mencionados neste documento resulta no aumento da distribuição, da absorção e da atividade nos hepatócitos. Assim, mais composto é liberado para o tecido do fígado. No entanto, em determinadas modalidades, que a entrega aumentada sozinha não explica o aumento todo na atividade. Em algumas dessas modalidades, mais compostos entram nos hepatócitos. Em determinadas modalidades, mesmo que o aumento da absorção de hepatócitos não explique o aumento total na atividade. Em tais modalidades, absorção produtiva do complexo conjugado é aumentada. Por exemplo, como mostrado no Exemplo 102, determinadas modalidades dos conjugados contendo GalNAc aumentando o enriquecimento dos oligonucleotídeos antissensos em hepatócitos versus células não parenquimatosas. Este enriquecimento é benéfico para os oligonucleotídeos que os genes alvos que são expressos nos hepatócitos.
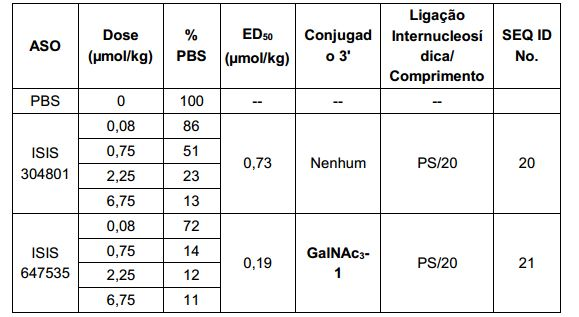
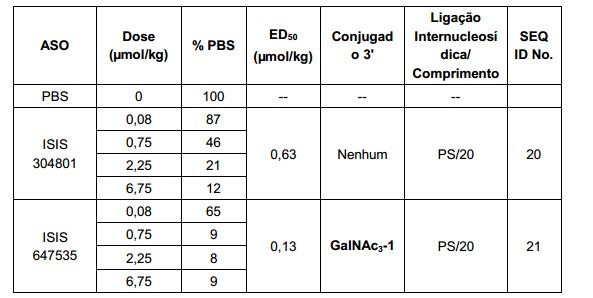
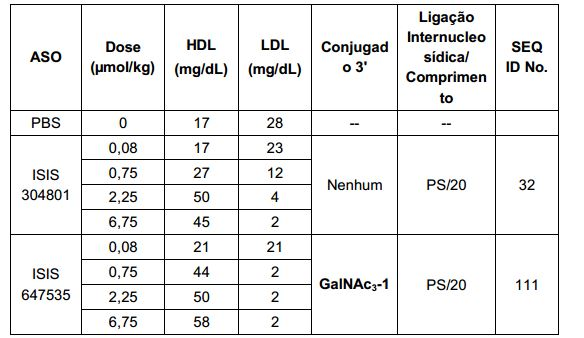
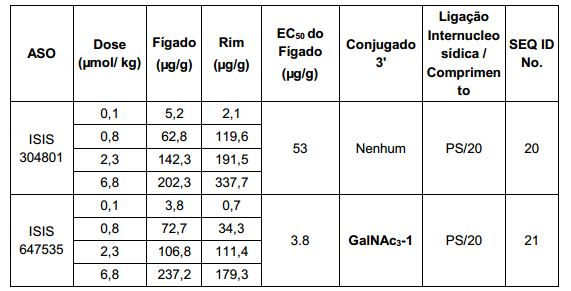
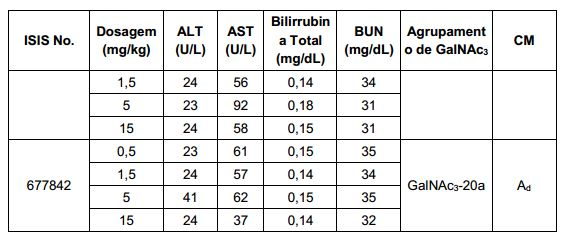
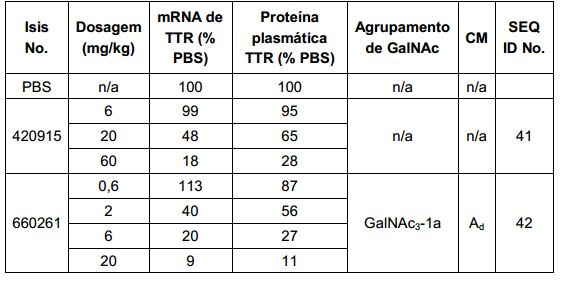
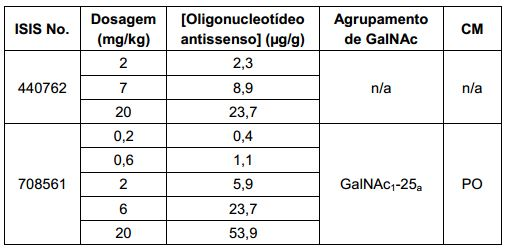
[0017] Em determinadas modalidades, os compostos antissenso conjugados mencionados neste documento resultam na exposição renal reduzida. Por exemplo, como mostrado no Exemplo 20, as concentrações dos oligonucleotídeos antissensos compreendendo determinadas modalidades de conjugados contendo GalNAc são inferiores no rim do que a dos oligonucleotídeos antissensos sem um conjugado contendo GalNAc. Há várias implicações terapêuticas benéficas. Para indicações terapêuticas em que a atividade no rim não é pedida, a exposição aos riscos de toxicidade renal, sem benefício correspondente. Além disso, a alta concentração no rim geralmente resulta na perda do compostos na urina resultando em uma depuração mais rápida Conformemente para alvos não renais, a acumulação de rim é indesejada.
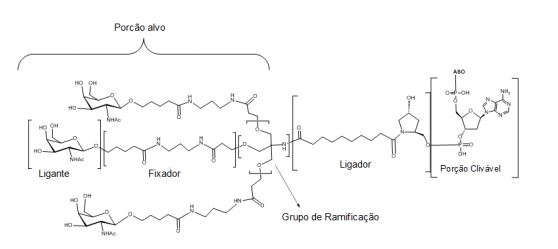
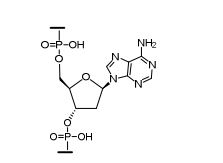
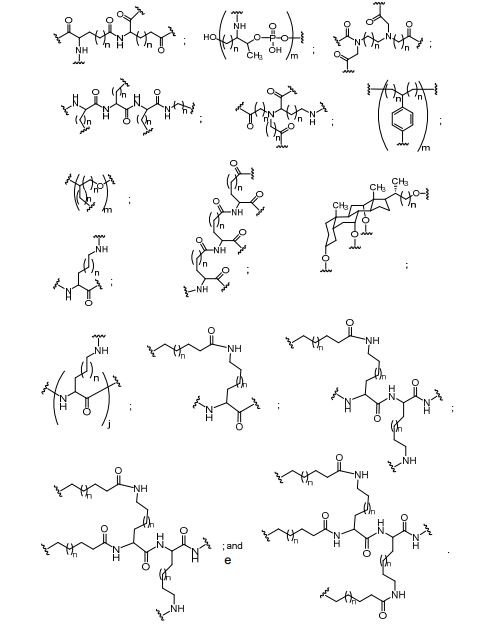
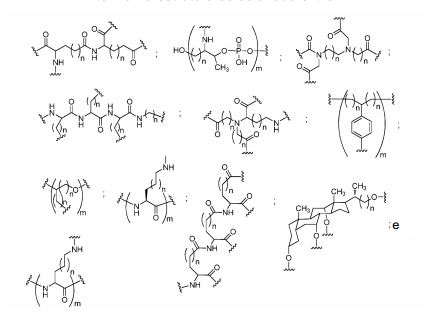
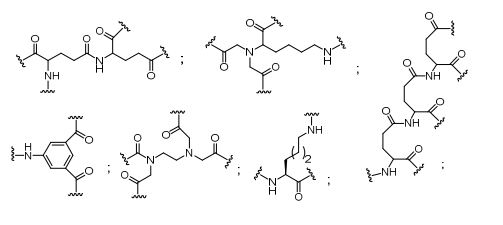
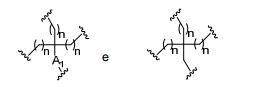
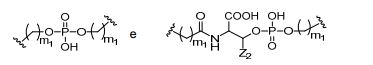
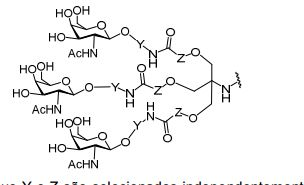
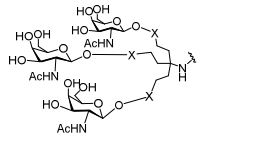
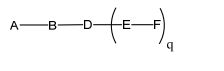
[0018] Em determinadas modalidades, a presente descrição fornece compostos antissensos conjugados, representados pela fórmula:
[0019] em que
[0020] A é o oligonucleotídeo antissenso;
[0021] B é a porção clivável
[0022] C é o ligante do conjugado
[0023] D é o grupo ramificação
[0024] cada E é uma corrente;
[0025] cada F é um ligante; e
[0026] q é um número inteiro entre 1 e 5.
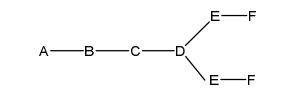
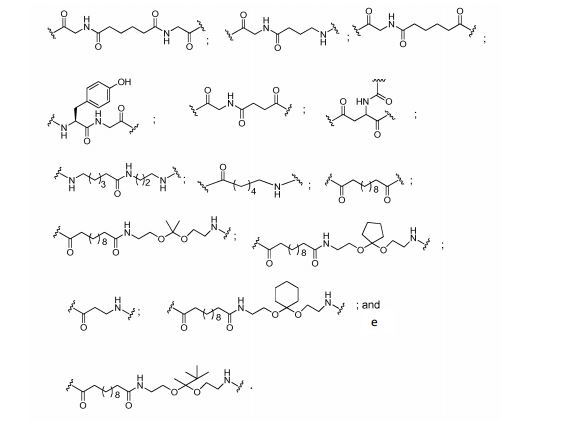
[0027] No diagrama acima e nos diagramas similares contidos neste documento, o grupo ramificação "D" ramifica-se tantas vezes quanto for necessário para acomodar o número dos grupos (E-F), conforme indicado por "q". Assim, em que q = 1, a fórmula é:
[0028] em que q = 2, a fórmula é:
[0029] em que q = 3, a fórmula é:
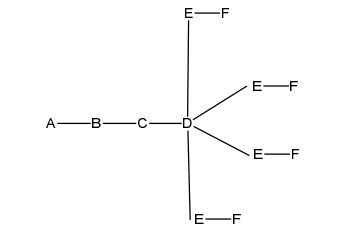
[0030] em que q = 4, a fórmula é:
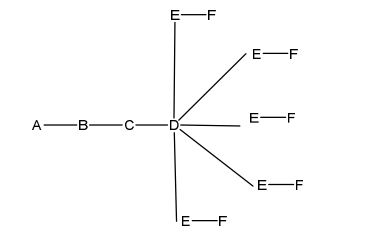
[0031] em que q = 5, a fórmula é:
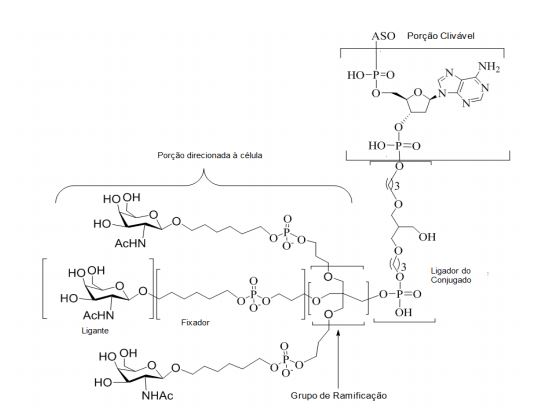
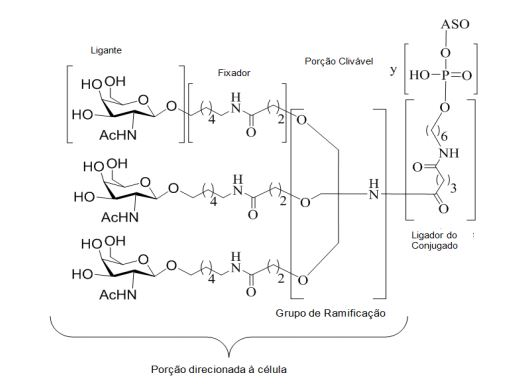
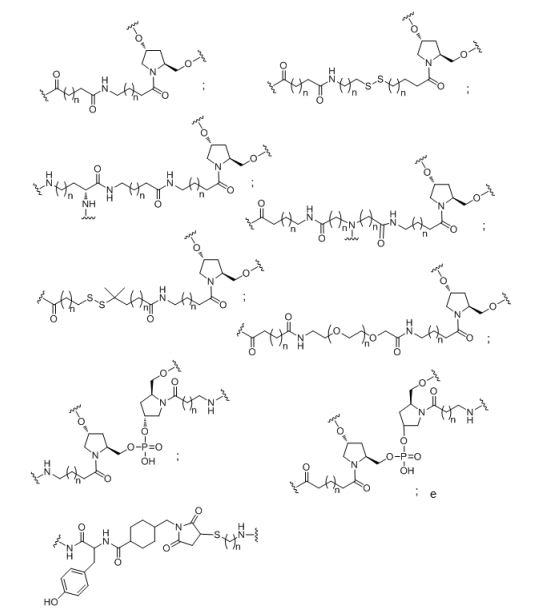
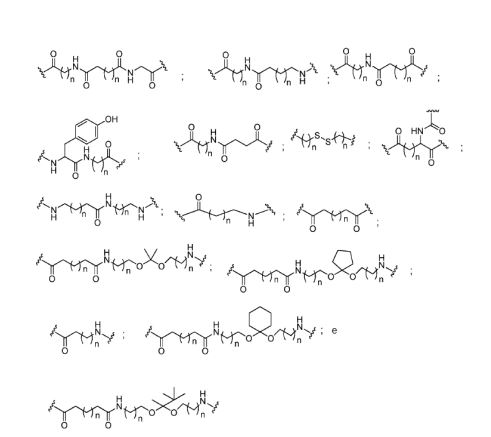
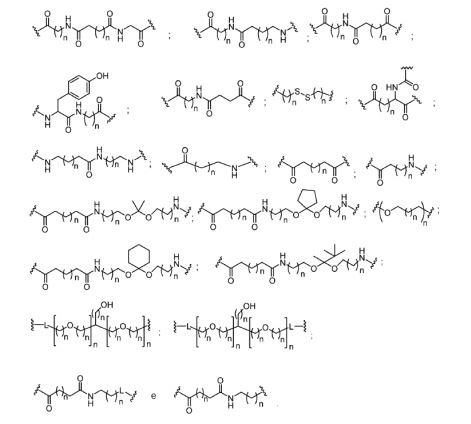
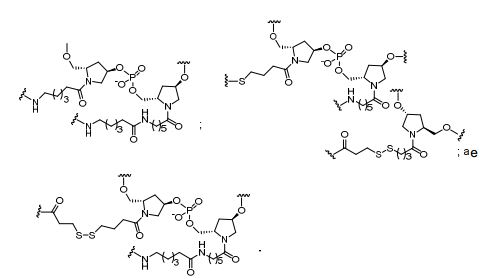
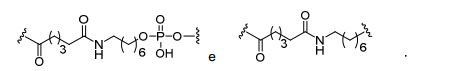
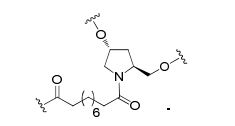
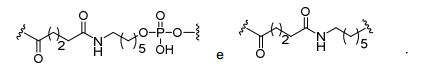
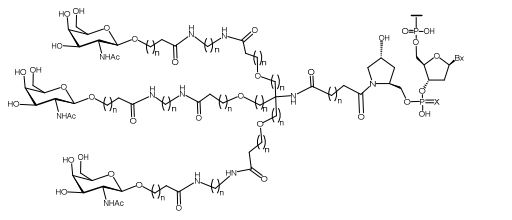
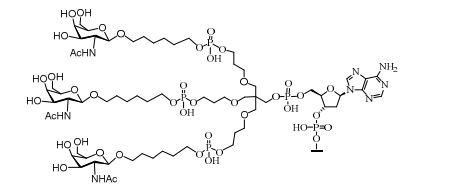
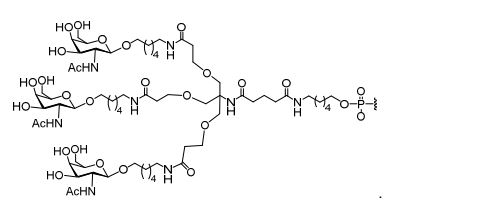
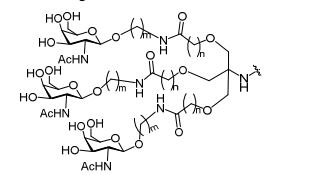
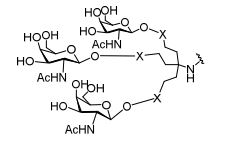
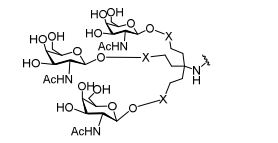
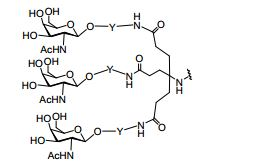
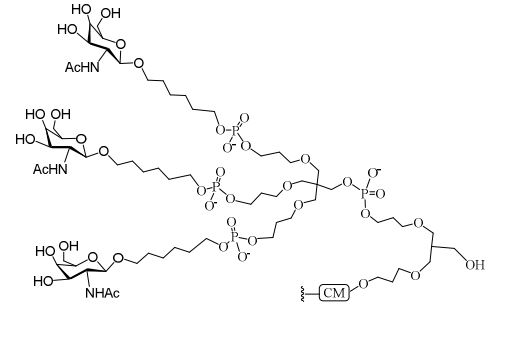
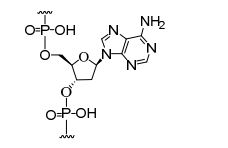
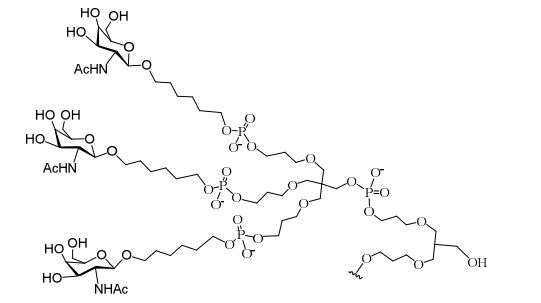
[0032] Em determinadas modalidades, compostos antissensosconjugados são fornecidos tendo a estrutura:
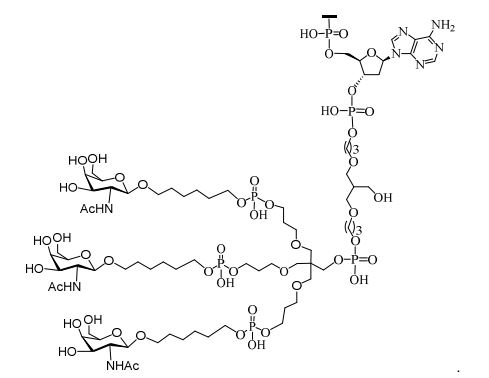
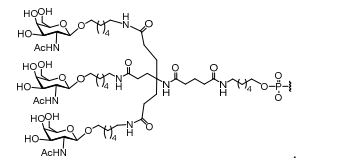
[0033]Em determinadas modalidades, compostos antissensosconjugados são fornecidos tendo a estrutura:
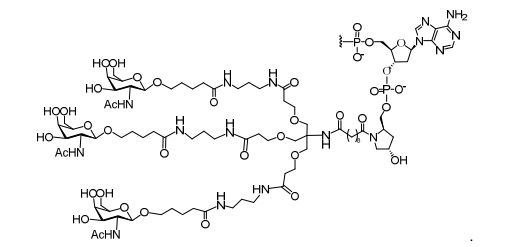
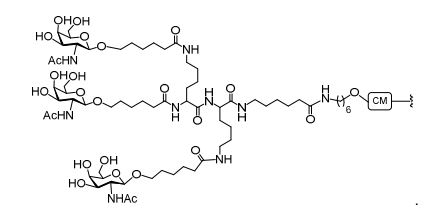
[0034] Em determinadas modalidades, compostos antissensosconjugados são fornecidos tendo a estrutura:
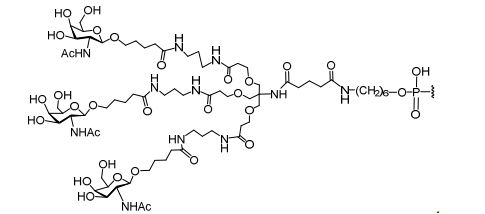
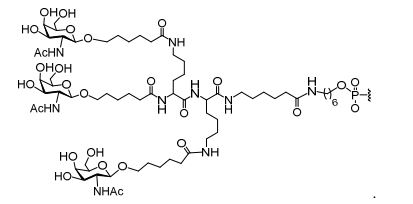
[0035] Em determinadas modalidades, compostos antissensosconjugados são fornecidos tendo a estrutura:
[0036] Em modalidades que têm mais de uma determinada variável (por exemplo, mais de um "m" ou "n"), salvo indicação em contrário, essa variável específica é selecionada de maneira independente. Assim, para uma estrutura que tem mais de um n, cada n é selecionado de forma independente assim, eles podem ser iguais ou diferentes uns dos outros.
DESCRIÇÃO DETALHADA
[0037] Deve ser compreendido que tanto a descrição geral acima quanto a descrição detalhada abaixo são exemplares e explicativas apenas e não são restritivas da descrição. Neste documento, o uso do singular inclui o plural, a menos que especificamente indicado de outra forma. Como usado neste documento, o uso de "ou" significa "e/ou" a menos que indicado de outra forma. Além disso, o uso do termo "incluindo", bem como outras formas, tais como "inclui" e "incluído", não é limitante. Além disso, termos tais como "elemento" ou "componente" abrangem os elementos e componentes compreendendo uma unidade e elementos e componentes que compreendem mais do que uma subunidade, a menos que indicado de outra forma.
[0038] Os títulos da seção neste documento são apenas com fins organizacionais e não devem ser interpretados como limitando o assunto descrito. Todos os documentos, ou partes de documentos, citados neste pedido, incluindo, mas não limitado a, patentes, pedidos de patente, artigos, livros, e tratados, são expressamente incorporados neste documento por referência em sua totalidade para qualquer finalidade.
A. DEFINIÇÕES
[0039] A menos que as definições específicas sejam fornecidas, a nomenclatura utilizada em conexão com, e os procedimentos e técnicas de, química analítica, química orgânica sintética, e químicas farmacêutica e medicinal descritos neste documento são aqueles bem conhecidos e comumente usados na técnica. As técnicas padrão podem ser usadas para a síntese química, e análise química. Determinadas técnicas e procedimentos podem ser encontrados por exemplo em"Carbohydrate Modifications in Antisense Research" Edited by Sangvi and Cook,American Chemical Society, Washington D.C., 1994; "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, Pa., 21st edition, 2005; and"Antisense Drug Technology, Principles, Strategies, and Applications" Edited by Stanley T. Crooke, CRC Press, Boca Raton, Florida; and Sambrook et al.,"Molecular Cloning, A laboratory Manual," 2nd Edition, Cold Spring Harbor Laboratory Press, 1989, que são incorporados por referência a este instrumento para qualquer efeito. Quando permitido, todas as patentes, pedidos, pedidos publicados e outras publicações e outros dados mencionados toda a descrição são incorporados por referência neste documento na sua totalidade.
[0040] A menos que indicado de outra forma, os seguintes termos têm os seguintes significados:
[0041] Como usado neste instrumento, o termo "nucleosídeo" se refere a um composto que compreende uma porção nucleobase e uma porção açúcar. Os nucleosídeos incluem, entre outros, nucleosídeos de ocorrência natural (como encontrado no DNA e RNA) e nucleosídeos modificados. Os nucleosídeos podem estar ligados a uma porção fosfato.
[0042] Como usado neste instrumento, o termo "modificação química" se refere a uma diferença química em um composto quando comparado a um equivalente de ocorrência natural. As modificações químicas dos oligonucleotídeos incluem modificações de nucleosídeos (incluindo modificações da porção açúcar e modificações da nucleobase) e modificações da ligação de internucleosídeo. Em referência a um oligonucleotídeo, a modificação química não inclui diferenças apenas na sequência de nucleobase.
[0043] Como usado neste instrumento, o termo "furanosila" se refere a uma estrutura que compreende um anel de 5 membros compreendendo quatro átomos de carbono e um átomo de oxigênio.
[0044] Como usado neste instrumento, a expressão "porção açúcar de ocorrência natural" se refere a um ribofuranosil encontrado no RNA de ocorrência natural ou a um desóxirribofuranosil encontrado no DNA de ocorrência natural.
[0045] Como usado neste instrumento, o termo "porção açúcar" se refere a uma porção açúcar de ocorrência natural ou a uma porção açúcar modificada de um nucleosídeo.
[0046] Como usado neste instrumento, a expressão "porção açúcar modificada" se refere a uma porção açúcar substituída ou a um substituto do açúcar.
[0047] Como usado neste instrumento, a expressão "porção açúcar substituída" se refere a um furanosil que não é uma porção açúcar de ocorrência natural. As porções de açúcar substituídas incluem, entre outros, furanosila que compreende substitutos na posição 2', posição 3', posição 5' e/ou posição 4'. Determinadas porções de açúcar substituídas são porções de açúcar bicíclicas.
[0048] Como usado neste instrumento, a expressão "porção açúcar substituída 2'" se refere a um furanosil que compreende um substituto na posição 2' diferente de H ou OH. Salvo indicação em contrário, uma porção açúcar substituída 2' não é uma porção açúcar bicíclica (ou seja, substituto 2' de uma porção açúcar substituída em 2' não forma uma ponte para outro átomo do anel de furanosila.
[0049] Como usado neste instrumento, "MOE" se refere a - OCH2CH2OCH3.
[0050] Conforme usado neste documento, "nucleosídeo 2'-F" se refere a um nucleosídeo que compreende um açúcar compreendendo um flúor na posição 2'. Salvo indicação em contrário, o flúor em um nucleosídeo 2'-F está na posição ribo (substituindo o OH de uma ribose natural).
[0051] Como usado neste instrumento, o termo "substituto do açúcar" se refere a uma estrutura que não compreende um furanosil e que é capaz de substituir a porção açúcar de ocorrência natural de um nucleosídeo, de modo que as subunidades do nucleosídeo sejam capazes de ligar juntos e/ou se ligar a outros nucleosídeos para formar um composto oligomérico que é capaz de hibridizar em um composto oligomérico complementar. Essas estruturas incluem anéis que compreendem um número diferente de átomos do que o furanosil (por exemplo, anéis com 4, 6 ou 7 membros); substituição do oxigênio de um furanosil por um átomo de não oxigênio (por exemplo, carbono, enxofre ou nitrogênio); ou uma mudança no número de átomos e uma substituição do oxigênio. Essas estruturas também podem compreender substituições correspondentes àquelas descritas para porções de açúcar substituídas (por exemplo, substitutos de açúcar bicíclico carbocíclico de 6 membros compreendendo opcionalmente substitutos adicionais). Substitutos do açúcar também incluem substituições de açúcar mais complexo (por exemplo, sistemas de não anel do ácido nucleico do peptídeo). Os substitutos do açúcar incluem, sem limitação, morfolino, ciclohexenil e ciclohexitol.
[0052] Como usado neste documento, a expressão "porção açúcar bicíclico" se refere a uma porção açúcar modificada compreendendo um anel de 4 a 7 membros (incluindo, entre outros, uma furanosila) compreendendo uma ponte que liga dois átomos do anel de 4 a 7 membros para formar um segundo anel, resultando em uma estrutura bicíclica. Em determinadas modalidades, o anel de 4 a 7 membros é um anel de açúcar. Em determinadas modalidades, o anel de 4 a 7 membros é uma furanosila. Em certas modalidades, a ponte conecta o 2'-carbono e o 4'-carbono do furanosila.
[0053] Como usado neste instrumento, o termo "nucleotídeo" se refere a um nucleosídeo compreende ainda um grupo ligação do fosfato. Como usado neste instrumento, os "nucleosídeos ligados" podem ou não estarem ligados por ligações de fosfato e, portanto, incluem, entre outros, "nucleotídeos ligados". Como usado neste instrumento, os "nucleosídeos ligados" são nucleosídeos que estão conectados a uma sequência contínua (ou seja, nenhum nucleosídeo adicional está presente entre aqueles que estão ligados).
[0054] Como usado neste instrumento, o termo "nucleobase" se refere a um grupo átomos que pode estar ligado a uma porção açúcar para criar um nucleosídeo que é capaz de se incorporar a um oligonucleotídeo e em que o grupo átomos é capaz de se ligar a uma nucleobase de ocorrência natural complementar de outro oligonucleotídeo ou ácido nucleico. As nucleobases podem ocorrer naturalmente ou podem ser modificadas.
[0055] Como usados neste instrumento, os termos "nucleobase não modificada" ou "nucleobase de ocorrência natural" se referem às nucleobases heterocíclicas de ocorrência natural do RNA ou DNA: as bases purínicas adenina (A) e guanina (G), e as bases pirimidínicas timina (T), citosina (C) (incluindo 5-metil C) e uracila (U).
[0056] Como usado neste instrumento, o termo "nucleobase modificada" se refere a qualquer nucleobase que não tenha ocorrência natural.
[0057] Como usado neste instrumento, o termo "nucleosídeo modificado" se refere a um nucleosídeo que consiste em pelo menos uma modificação química em comparação com os nucleosídeos do RNA ou DNA de ocorrência natural. Os nucleosídeos modificados compõem uma porção açúcar modificada e/ou uma nucleobase modificada.
[0058] Como usado neste instrumento, "nucleosídeo bicíclico" ou "BNA" se refere a um nucleosídeo que consiste em uma porção açúcar bicíclica.
[0059] Como usado neste instrumento, o termo "nucleosídeo de etila restrito" ou "cEt" se refere a um nucleosídeo que consiste em uma porção açúcar bicíclica compreendendo uma ponte de 4'-CH(CH3)-O- 2'.
[0060] Como usado neste instrumento, o termo "nucleosídeo do ácido nucleico bloqueado" ou "LNA" se refere a um nucleosídeo que consiste em uma porção açúcar bicíclica compreendendo uma ponte 4'-CH2- O-2'.
[0061] Como usado neste instrumento, a expressão "nucleosídeo substituído em 2'" se refere a um nucleosídeo que consiste em um substituto na posição 2' diferente de H ou OH. Salvo indicação em contrário, um nucleosídeo substituído em 2' não é um nucleosídeo bicíclico.
[0062] Como usado neste instrumento, o termo "desoxirribonucleosídeo" se refere a um nucleosídeo que consiste em uma porção açúcar de 2'-H furanosila, como encontrado nos desoxirribonucleosídeos de ocorrência natural (DNA). Em determinadas modalidades, um 2-desoxinucleosídeo pode compreender uma nucleobase modificada ou pode compreender uma nucleobase de RNA (por exemplo, uracila).
[0063] Conforme usado neste documento, "oligonucleotídeo" se refere a um composto compreendendo uma pluralidade de nucleosídeos ligados. Em certas modalidades, um oligonucleotídeo compreende um ou mais ribonucleosídeos (RNA) não modificados e/ou desoxirribonucleosídeos (DNA) não modificados e/ou um ou mais nucleosídeos modificados.
[0064] Como usado neste documento, "oligonucleosídeo" se refere a um oligonucleotídeo em que nenhuma das ligações de internucleosídeo contém um átomo de fósforo. Como usado neste instrumento, oligonucleotídeos incluem oligonucleosídeos.
[0065] Como usado neste instrumento, "oligonucleotídeo modificado" se refere a um oligonucleotídeo que consiste em pelo menos um nucleosídeo modificado e/ou pelo menos uma ligação de internucleosídeo modificado.
[0066] Como usado neste instrumento, "ligação" ou "grupo ligação" se refere a um grupo átomos que se ligam a dois ou mais grupos de átomos.
[0067] Como usado neste instrumento, "ligação de internucleosídeo" se refere a uma ligação covalente entre nucleosídeos adjacentes em um oligonucleotídeo.
[0068] Como usado neste instrumento, "ligação de internucleosídeo de ocorrência natural" se refere a uma ligação de fosfodiéster 3' a 5'.
[0069] Como usado neste instrumento, "ligação de internucleosídeo modificado" se refere a qualquer ligação de internucleosídeo diferente da ligação de internucleosídeo de ocorrência natural.
[0070] Como usado neste instrumento, "ligação de internucleosídeo terminal" se refere à ligação entre os últimos dois nucleosídeos de um oligonucleotídeo ou da respectiva região definida.
[0071] Como usado neste instrumento, o "grupo ligação fósforo" se refere a um grupo ligação que consiste em um átomo de fósforo. Grupos de ligação de fósforo incluem, limitação, grupos que têm a fórmula:
[0072] em que:
[0073] Ra e Rd são independentes, O, S, CH2, NH, ou NJ1 em queJ1 é alquila C1-C6 ou alquila C1-C6 substituída;
[0074] Rb é O ou S;
[0075] Rc é OH, SH, alquila C1-C6, alquila substituído C1-C6, alcóxi C1-C6, alcóxi, alcóxi substituído, amina ou amina C1-C6 substituída; e
[0076] J1 is Rb é O ou S.
[0077] Os grupos de ligação de fósforo incluem, sem limitação, fosfodiéster, fosforotioato, fosforodiotioato, fosfonato, fosforoamidato, fosforotioamidato, tionoalquil-fosfonato, fosfotriésteres, tionoalquilfosfotriéster e boranofosfato.
[0078] Como usado neste instrumento, "grupo ligação fósforo" se refere a um grupo ligação fósforo que liga diretamente dois nucleosídeos.
[0079] Como usado neste instrumento, "grupo ligação fósforo não internucleosídeo" se refere a um grupo ligação fósforo que não se liga diretamente a dois nucleosídeos. Em determinadas modalidades, um grupo ligação fósforo não internucleosídeo liga um nucleosídeo a um grupo diferente de um nucleosídeo. Em determinadas modalidades, um grupo ligação fósforo não internucleosídeo liga dois grupos, sendo que nenhum deles é um nucleosídeo.
[0080] Como usado neste instrumento, "grupo ligação neutro" se refere a um grupo ligação não é carregado. Os grupos de ligação neutros incluem, entre outros, fosfotriésteres, metilfosfonatos, MMI (- CH2-N (CH3)-O-), 3-amida (-CH2-C(=O)-N(H)-), 4-amida (-CH2-N(H)- C(=O)-), formacetal (-O-CH2-O-) e tioformacetal (-S-CH2-O-). Outros grupos de ligação neutros incluem ligações não iônicas, compreendendo siloxano (dialquilsiloxano), éster carboxilato, carboxamidas, sulfeto, éster sulfonato e amidas (ver, por exemplo: Carbohydrate Modifications in Antisense Research; Y.S. Sanghvi and P.D. Cook Eds. ACS Symposium Series 580; Capítulos 3 e 4, (pp. 40-65)). Outros grupos de ligação neutros incluem ligações não iônicas, compreendendo partes do componente N, O, S e CH2 misturadas.
[0081] Como usado neste instrumento, "grupo ligação neutro de internucleosídeo" se refere a um grupo ligação neutro que liga diretamente dois nucleosídeos.
[0082] Como usado neste instrumento, "grupo ligação neutro de não internucleosídeo" se refere a um grupo ligação neutro que não se liga diretamente a dois nucleosídeos. Em determinadas modalidades, um grupo ligação neutro de não internucleosídeo liga um nucleosídeo a um grupo diferente de um nucleosídeo. Em determinadas modalidades, um grupo ligação neutro de não internucleosídeo liga dois grupos, sendo que nenhum deles é um nucleosídeo.
[0083] Como usado neste instrumento, "composto oligoméricos" se refere a uma estrutura polimérica que compreende duas ou mais subestruturas. Em determinadas modalidades, um composto oligomérico compreende um oligonucleotídeo. Em determinadas modalidades, um composto oligomérico compreende um ou mais grupos conjugados e/ou grupos terminais. Em determinadas modalidades, um composto oligomérico consiste em um oligonucleotídeo. Compostos oligoméricos incluem também ácidos nucleicos de ocorrência natural. Em determinadas modalidades, um composto oligomérico compreende uma estrutura de uma ou mais subunidades monoméricas ligadas em que cada subunidade monomérica ligada está direta ou indiretamente anexada a uma porção base heterocíclica. Em determinadas modalidades, os compostos oligoméricos também podem incluir subunidades monoméricas que não estão ligadas a uma porção base heterocíclica fornecendo, assim, sítios abásicos. Em determinadas modalidades, as ligações juntam subunidades monoméricas, porções ou substitutos de açúcar e as porções de base heterocíclica podem ser independentemente modificadas. Em determinadas modalidades, a unidade de açúcar de ligação, que pode ou não incluir uma base heterocíclica, pode ser substituída por um mimético como monômeros em ácidos nucleicos de peptídeo.
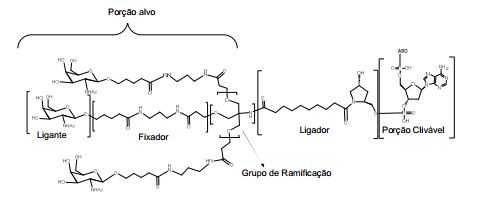
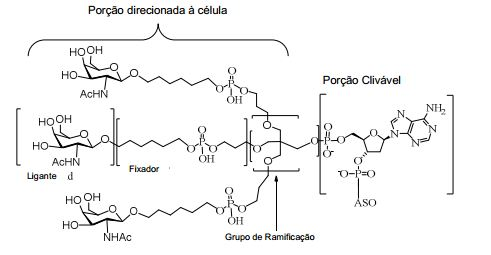
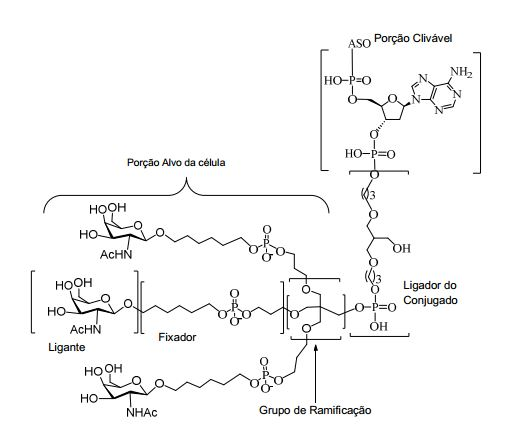
[0084] Como usado neste instrumento, "grupo terminal" se refere a um ou mais átomo incorporado à extremidade 3' ou à extremidade 5' ou a ambas extremidades de um oligonucleotídeo. Em determinadas modalidades, um grupo terminal é um grupo conjugado. Em determinadas modalidades, um grupo terminal compreende um ou mais nucleosídeos do grupo terminal.
[0085] Como usado neste instrumento, "conjugado" ou "grupo conjugado" se refere a um átomo ou grupo átomos ligados a um oligonucleotídeo ou composto oligomérico. Em geral, grupos conjugados modificam uma ou mais propriedades do composto ao qual estão afixados, incluindo, entre outros, propriedades de farmacodinâmica, farmacocinética, absorção, distribuição celular, absorção celular, carga e/ou depuração.
[0086] Como usado neste instrumento, "ligante conjugado" ou "ligante" no contexto de um grupo conjugado representa uma parte de um grupo conjugado que consiste em qualquer átomo ou grupo átomos e que liga covalentemente (1) um oligonucleotídeo à outra parte do grupo conjugado ou (2) duas ou mais partes do grupo conjugado.
[0087] Os grupos conjugados são mostrados neste instrumento como radicais, fornecendo uma ligação para a formação de ligação covalente com um composto oligomérico como um oligonucleotídeo antissenso. Em determinadas modalidades, o ponto de ligação em um composto oligomérico é o átomo de oxigênio 3' do grupo 3'-hidroxila do nucleosídeo terminal 3' do composto oligomérico. Em determinadas modalidades, o ponto de ligação ao composto oligomérico é o átomo de oxigênio 5' do grupo 5'-hidroxila do nucleosídeo terminal 5' do composto oligomérico. Em determinadas modalidades, a ligação para a formação da ligação com um composto oligomérico é uma ligação clivável. Em determinadas modalidades, essa ligação clivável constitui toda ou parte de uma porção clivável.
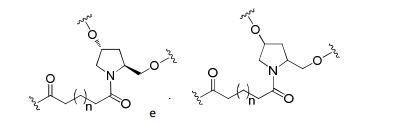
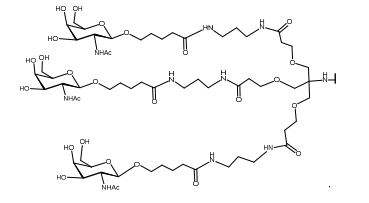
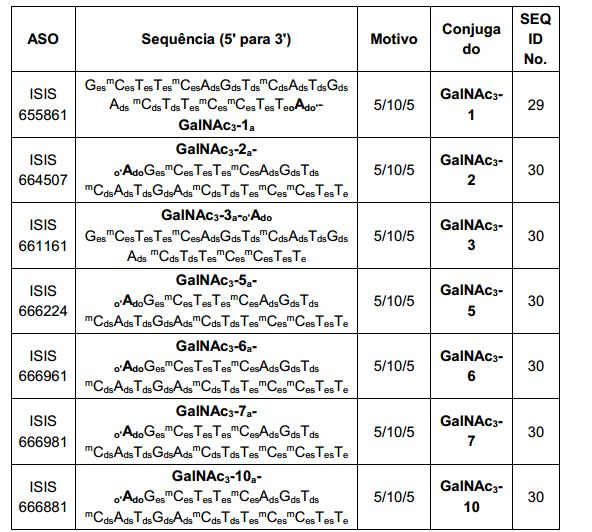
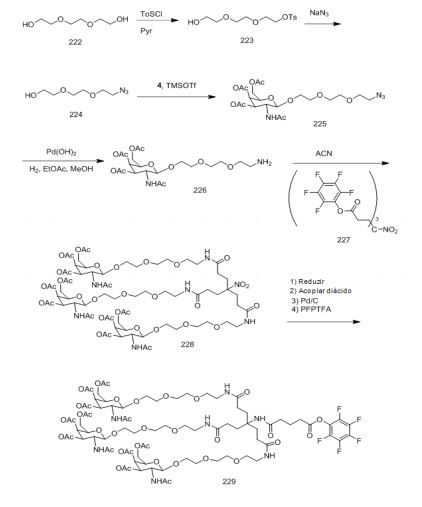
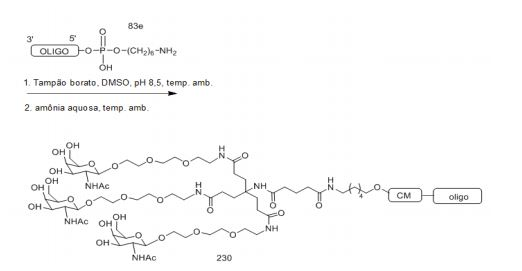
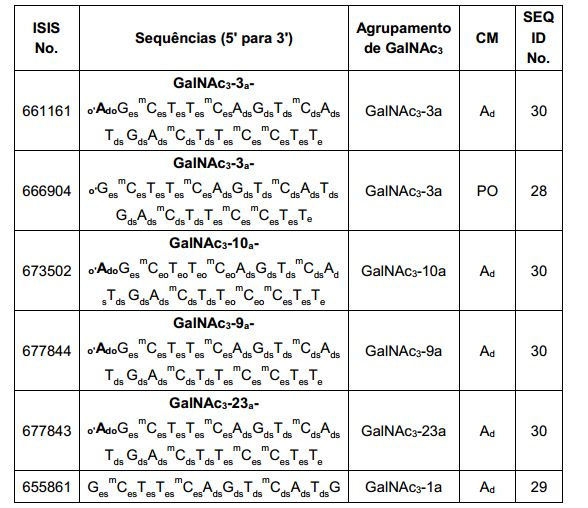
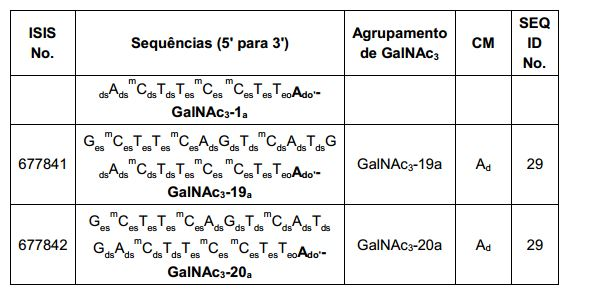
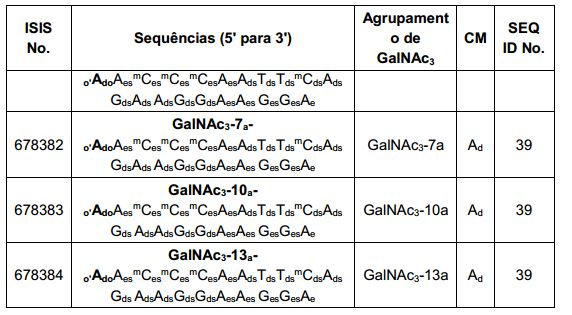
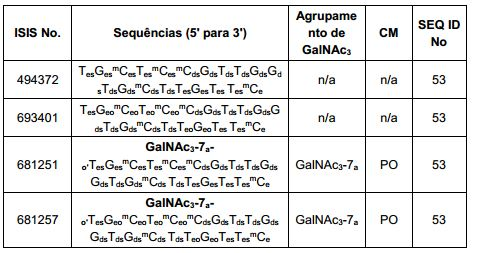
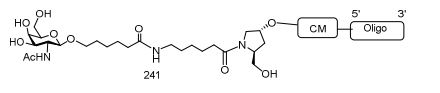
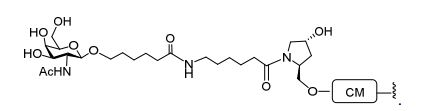
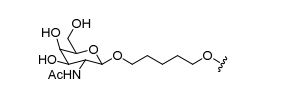
[0088] Em determinadas modalidades, os grupos conjugados compreendem uma porção clivável (por exemplo, uma ligação clivável ou um nucleosídeo clivável) e uma parte do agrupamento de carboidrato, como uma parte do agrupamento GalNAc. Essa parte do agrupamento do carboidrato compreende: uma porção direcionamento e, opcionalmente, um ligante conjugado. Em determinadas modalidades, a parte do agrupamento de carboidrato é identificada pelo número e identidade do ligante. Por exemplo, em determinadas modalidades, a parte do agrupamento do carboidrato compreende 3 grupos GalNAc e é designada "GalNAc3". Em determinadas modalidades, a parte do agrupamento de carboidrato compreende 4 grupos GalNAc e é designada "GalNAc4". Partes do agrupamento de carboidrato específicas (tendo ligante específico, grupos de ramificação e conjugados) são descritas neste documento e designadas pelo numeral romano seguido por subscrito "a". Portanto, "GalNac3-1a" se refere a uma parte do agrupamento de carboidrato específico de um grupo conjugado tendo 3 grupos GalNac e ligante identificado especificamente grupos de ramificação e grupos de ligação. Esse fragmento de agrupamento do carboidrato está afixado a um composto oligomérico via porção clivável, como uma ligação clivável ou nucleosídeo clivável.
[0089] Como usado neste instrumento, "porção clivável" se refere a uma ligação ou grupo que é capaz de ser dividido em condições fisiológicas. Em determinadas modalidades, uma porção clivável está no interior de compartimentos celulares ou subcelulares, como um lisossomo. Em determinadas modalidades, uma porção clicável é clivada por enzimas endógenas, como as nucleases. Em determinadas modalidades, uma porção clivável compreende um grupo átomos com um, dois, três, quatro ou mais de quatro ligações cliváveis.
[0090] Como usado neste instrumento, "ligação clivável" se refere a qualquer ligação química capaz de ser dividida. Em determinadas modalidades, a ligação clivável é selecionada dentre: uma amida, uma poliamida, um éster, um éter, um ou ambos ésteres de um fosfodiéster, um éster de fosfato, um carbamato, uma dissulfeto ou um peptídeo.
[0091] Como usado neste documento, "agrupamento de carboidrato" se refere a um composto que tem um ou mais resíduos de carboidrato afixados a um grupo andaime ou a um grupo ligante. (ver, e.g., Maier et al., "Synthesis of Antisense Oligonucleotides Conjugated to a Multivalent Carbohydrate Cluster for Cellular Targeting," Bioconjugate Chemistry, 2003, (14): 18-29, que está incorporado neste documento por referência em sua totalidade, ou Rensen et al, "Design and Synthesis of Novel N-Acetylgalactosamine-Terminated Glycolipids forTargeting of Lipoproteins to the Hepatic Asiaglycoprotein Receptor," J. Med. Chem. 2004, (47): 5798-5808, para exemplos de agrupamentos conjugados de carboidrato).
[0092] Como usado neste instrumento, "derivado de carboidrato" se refere a qualquer composto que pode ser sintetizado usando um carboidrato como matéria-prima ou intermediário.
[0093] Como usado neste instrumento, "carboidrato" se refere a um carboidrato de ocorrência natural, um carboidrato modificado ou um derivado do carboidrato.
[0094] Como usado neste instrumento, "grupo proteção" se refere a qualquer composto ou grupo proteção conhecido pelos versados na técnica. Exemplos não limitantes de grupos de proteção podem ser encontrados em "Protective Groups in Organic Chemistry", T. W. Greene, P. G. M. Wuts, ISBN 0-471-62301-6, John Wiley & Sons, Inc, Nova York, o qual está incorporado a este documento por referência na íntegra.
[0095] Como usado neste documento, "de fita única" se refere a um composto oligomérico que não é hibridizado ao seu complemento e que não possui auto-complementaridade suficiente para formar um duplex auto-estável.
[0096] Como usado neste instrumento, "de fita dupla" se refere a um par de compostos oligoméricos que são hibridizados a um outro ou um composto oligomérico auto-complementar único que forma uma estrutura hairpin. Em determinadas modalidades, um composto oligomérico de fita dupla compreende um primeiro e um segundo composto oligomérico.
[0097] Como usado neste instrumento, "composto antissenso" se refere a um composto que compreende ou que consiste em um oligonucleotídeo, sendo que, pelo menos uma parte dele é complementar ao ácido nucleico alvo que é capaz de hibridizar, resultando em pelo menos uma atividade antissenso.
[0098] Como usado neste instrumento, "atividade antissenso" se refere a qualquer atividade detectável e/ou mudança mensurável atribuível à hibridização de um composto antissenso para seu ácido nucleico alvo. Em determinadas modalidades, a atividade antissenso inclui modulação da quantidade ou atividade de uma transcrição do ácido nucleico alvo (por exemplo, mRNA). Em determinadas modalidades, a atividade antissenso inclui modulação da junção do pré-mRNA.
[0099] Como usado neste instrumento, "composto antissenso à base de RNase H" se refere a um composto antissenso em que pelo menos alguma atividade antissenso do composto antissenso é atribuível à hibridação do composto antissenso para um ácido nucléico alvo e clivagem subseqüente do ácido nucleico alvo pela RNase H.
[00100] Como usado neste instrumento, "composto antissenso à base de RISC" se refere a um composto antissenso em que pelo menos alguma atividade antissenso do composto antissenso é atribuída ao Complexo de Silenciamento Induzido do RNA (RISC).
[00101] Como usado neste instrumento, "detectar" ou "medir" significa que um teste ou ensaio para detecção ou medição é realizado. Essa detecção e/ou medição pode resulta em um valor zero. Assim, se um teste para detecção ou medição resultar na constatação de nenhuma atividade (atividade zero), a etapa de detecção ou medição da atividade, no entanto, foi realizada.
[00102] Como usado neste instrumento, "atividade detectável e/ou mensurável" se refere a uma atividade estatisticamente significativa que não seja equivalente a zero.
[00103] Como usado neste instrumento, "essencialmente inalterado" se refere a pouca ou nenhuma alteração em um determinado parâmetro, especificamente em relação a outro parâmetro que muda muito mais. Em determinadas modalidades, um parâmetro é essencialmente inalterado quando muda em menos de 5%. Em determinadas modalidades, um parâmetro é essencialmente inalterado se ele muda menos de duas vezes enquanto outro parâmetro muda pelo menos dez vezes. Por exemplo, em determinadas modalidades, uma atividade antissenso é uma mudança na quantidade de um ácido nucleico alvo. Em determinadas modalidades, a quantidade de ácido nucleico não alvo é essencialmente inalterada se ela muda muito menos do que o ácido nucleico alvo, mas a mudança não precisa ser zero.
[00104] Como usado neste documento, "expressão" se refere ao processo pelo qual um gene resulta, em última análise, em uma proteína. Expressão inclui, entre outros, transcrição, modificação pós- transcricional (por exemplo, junção, poliadenilação, adição de 5'-cap).
[00105] Como usado neste instrumento, "ácido nucleico alvo" se refere a uma molécula de ácido nucleico à qual um composto antissenso destina-se a hibridizar para resultar em uma atividade antissenso desejada. Oligonucleotídeos antissenso têm complementaridade suficiente para seus ácidos nucleicos alvo para permitir a hibridação em condições fisiológicas.
[00106] Como usado neste documento, "complementaridade da nucleobase" ou "complementaridade" quando em referência às nucleobases se refere a uma nucleobase capaz de se emparelhar com outra nucleobase. Por exemplo, no DNA, a adenina (A) é complementar à timina (T). Por exemplo, no RNA, a adenina (A) é complementar à uracila (U). Em certas modalidades, nucleobase complementar se refere a uma nucleobase de um composto antissenso que é capaz de se emparelhar com uma nucleobase do seu ácido nucleico alvo. Por exemplo, se uma nucleobase em uma determinada posição de um composto antissenso for capaz de fazer ligação de hidrogênio com uma nucleobase em uma determinada posição de um ácido nucleico alvo, então a posição da ligação de hidrogênio entre o oligonucleotídeo e o ácido nucleico alvo são considerados complementares nesse par de nucleobase. As nucleobases que compreendem determinadas modificações podem manter a capacidade de se emparelhar com uma nucleobase equivalente e, assim, são ainda capazes da complementaridade de base.
[00107] Como usado neste instrumento, "não complementar", em relação às nucleobases, se refere a um par de nucleobases que não forma ligações de hidrogênio com outro.
[00108] Como usado neste documento, "complementar", em relação aos compostos oligoméricos (por exemplo, nucleosídeos ligados, oligonucleotídeos ou ácidos nucleicos) se refere à capacidade desses compostos oligoméricos ou suas regiões para hibridização para um outro composto oligomérico ou sua região através da complementaridade da nucleobase. Compostos oligoméricos complementares não precisam apresentar complementaridade de nucleobase em cada nucleosídeo. Pelo contrário, algumas incompatibilidades são toleradas. Em determinadas modalidades, compostos oligoméricos complementares ou regiões são complementares em 70% das nucleobases (70% complementares). Em determinadas modalidades, compostos oligoméricos complementares ou regiões são 80% complementares. Em determinadas modalidades, compostos oligoméricos complementares ou regiões são 90% complementares. Em determinadas modalidades, compostos oligoméricos complementares ou regiões são 95% complementares. Em determinadas modalidades, compostos oligoméricos complementares ou regiões são 100% complementares.
[00109] Como usado neste documento, "incompatibilidade" se refere a uma nucleobase de um primeiro composto oligoméricos que não é capaz de se emparelhar com uma nucleobase em uma posição correspondente de um segundo composto oligomérico, quando o primeiro e o segundo composto oligomérico estão alinhados. Um ou ambos do primeiro e segundo compostos oligoméricos podem ser oligonucleotídeos.
[00110] Como usado neste documento, "hibridização" se refere ao emparelhamento de compostos oligoméricos complementares (por exemplo, um composto antissenso e seu ácido nucleico alvo). Enquanto não houver limitação a um mecanismo específico, o mecanismo mais comum de emparelhamento envolve a ligação de hidrogênio, que pode ser ligação de hidrogênio Watson-Crick, Hoogsteen ou Hoogsteen reversa entre nucleobases complementares.
[00111] Como usado neste documento, "hibridiza especificamente" se refere à capacidade de um composto oligomérico de hibridizar em um sítio de ácido nucleico com maior afinidade do que hibridizar em outro sítio de ácido nucleico.
[00112] Como usado neste documento, "totalmente complementar", em relação a um oligonucleotídeo ou à porção do mesmo, significa que cada base do oligonucleotídeo ou da porção do mesmo é capaz de se emparelhar com uma nucleobase de um ácido nucleico complementar ou porção contígua do mesmo. Assim, uma região totalmente complementar não compreende incompatibilidades nem nucleobases não hibridizadas em qualquer fita.
[00113] Como usado neste documento, "complementaridade percentual" se refere à porcentagem de nucleobases de um composto oligomérico que seja complementar a uma parte de comprimento equivalente de ácido nucleico alvo. a complementaridade percentual é calculada pela divisão do número de nucleobases do composto oligomérico que seja complementar às nucleobases nas posições correspondentes no ácido nucleico alvo pelo comprimento total do composto oligomérico.
[00114] Como usado neste documento, "identidade percentual" se refere ao número de nucleobases em um primeiro ácido nucleico que é do mesmo tipo (independente de modificação química) que as nucleobases nas posições correspondentes em um segundo ácido nucleico, dividido pelo número total de nucleobases no primeiro ácido nucleico.
[00115] Como usado neste documento, "modulação" se refere a uma mudança da quantidade ou qualidade de uma molécula, função ou atividade, em comparação com a quantidade ou qualidade de uma molécula, função ou atividade antes da modulação. Por exemplo, a modulação inclui a mudança, ou o aumento (estímulo ou indução) ou a diminuição (inibição ou redução) da expressão gênica. Como outro exemplo, a modulação da expressão pode incluir uma alteração na seleção do sítio de splice do processamento de pré-mRNA, resultando em uma alteração na quantidade absoluta ou relativa de um determinado variante de splice em comparação com a quantidade na ausência de modulação.
[00116] Como usado neste documento, "motivo químico" se refere a um padrão de modificações químicas em um oligonucleotídeo ou em uma região do mesmo. Os motivos podem ser definidos pelas modificações em determinados nucleosídeos e/ou certos grupos de ligação de um oligonucleotídeo.
[00117] Como usado neste documento, "motivo do nucleosídeo" se refere a um padrão de modificações do nucleosídeo em um oligonucleotídeo ou em uma região do mesmo. As ligações desse oligonucleotídeo podem ser modificadas ou não modificadas. Salvo indicação em contrário, os motivos descritos neste documento apenas nucleosídeos destinados a serem motivos de nucleosídeos. Assim, nesses casos, as ligações não são limitadas.
[00118] Como usado neste documento, "motivo do açúcar" se refere a um padrão de modificações do açúcar em um oligonucleotídeo ou em uma região do mesmo.
[00119] Como usado neste documento, "motivo da ligação" se refere a um padrão de modificações da ligação em um oligonucleotídeo ou em uma região do mesmo. Os nucleosídeos desse oligonucleotídeo podem ser modificados ou não modificados. Salvo indicação em contrário, os motivos descritos neste documento são apenas ligações destinadas a serem motivos de ligação. Assim, nesses casos, os nucleosídeos não são limitados.
[00120] Como usado neste documento, "motivo de modificação da nucleobase" se refere a um padrão de modificações de nucleobases ao longo de um oligonucleotídeo. Salvo indicação em contrário, um motivo de modificação da nucleobase é independente da sequência de nucleobase.
[00121] Como usado neste documento, "motivo de sequência" se refere a um padrão de nucleobases dispostos ao longo de um oligonucleotídeo ou parte do mesmo. Salvo indicação em contrário, um motivo de sequência é independente de modificações químicas e, portanto, pode ter qualquer combinação de modificações químicas, inclusive não ter modificações químicas.
[00122] Como usado neste documento, "tipo de modificação", em relação a um nucleosídeo ou um nucleosídeo de um "tipo" se refere à modificação química de um nucleosídeo e inclui nucleosídeos modificados e não modificados. Portanto, salvo indicação em contrário, um "nucleosídeo com uma modificação do primeiro tipo" pode ser um nucleosídeo não modificado.
[00123] Como usado neste documento, "diferentemente modificado" se refere às modificações químicas ou substituintes químicos que são diferentes uns dos outros, incluindo ausência de modificações. Assim, por exemplo, um nucleosídeo MOE e um nucleosídeo de DNA não modificado são "diferentemente modificados", embora o nucleosídeo do DNA não seja modificado. Da mesma forma, DNA e RNA são "diferentemente modificados", embora ambos sejam nucleosídeos não modificados de ocorrência natural. Os nucleosídeos que são os mesmos, mas por compreenderem nucleobases diferentes não são diferentemente modificados. Por exemplo, um nucleosídeo que compreende um açúcar modificado 2'-OMe e uma nucleobase adenina não modificada e um nucleosídeo compreendendo um açúcar modificado 2'-OMe e uma nucleobase timina não modificada não são diferentemente modificados.
[00124] Como usado neste documento, "o mesmo tipo de modificações" se refere às modificações que são iguais entre elas, incluindo a ausência de modificações. Assim, por exemplo, dois nucleosídeos de DNA não modificados têm "o mesmo tipo de modificação", embora o nucleosídeo de DNA não seja modificado. Esses nucleosídeos que têm o mesmo tipo de modificação podem incluir nucleobases diferentes.
[00125] Como usado neste instrumento, "regiões separadas" se refere às partes de um oligonucleotídeo em que as modificações químicas ou o motivo das modificações químicas de quaisquer partes vizinhas incluem pelo menos uma diferença para permitir que regiões separadas se distinguam uma da outra.
[00126] Como usado neste documento, "transportadora ou diluente farmaceuticamente aceitável" se refere a qualquer substância apropriada para uso na administração de um animal. Em determinadas modalidades, uma transportadora ou diluente farmaceuticamente aceitável é uma solução salina estéril. Em determinadas modalidades, essa solução salina é uma solução salina de qualidade farmacêutica.
[00127] Como usado neste documento, o termo "distúrbio metabólico" se refere a uma doença ou condição caracterizada principalmente pela desregulação do metabolismo - o conjunto complexo de reações químicas associadas à degradação de alimentos para produzir energia.
[00128] Como usado neste instrumento, o termo "distúrbio cardiovascular" se refere a uma doença ou condição caracterizada principalmente pela função prejudicada do coração ou dos vasos sanguíneos.
[00129] Como usado neste documento, o termo "sistema de anel mono- ou policíclico" deve incluir todos os sistemas de anel selecionados a partir de sistemas de anel de radical simples ou policíclico em que os anéis são fundidos ou ligados e deve incluir também sistemas de anel simples e mistos individualmente selecionados a partir de arila alifática, alicíclica, heteroarila, aralquila, arilalquila, heterocíclico, heteroarila, heteroaromático e heteroarilalquila. Essas estruturas mono e policíclicas podem conter anéis tendo o mesmo nível de saturação ou tendo cada um, de maneira independente, diferentes graus de saturação incluindo totalmente saturados, parcialmente saturados ou totalmente insaturados. Cada anel pode compreender átomos do anel selecionados a partir de C, N, O e S para dar origem a anéis heterocíclicos, bem como anéis que compreendem apenas anel apenas com átomos de C que podem estar presentes em um motivo misto, como por exemplo, benzimidazol, em que um anel tem apenas átomos de carbono anel e o anel fundido tem dois átomos de nitrogênio. O sistema de anel mono ou policíclico pode ser ainda substituído por grupos substituintes, como por exemplo, ftalimida que tem dois grupos =O afixados a um dos anéis. Os sistemas de anel mono ou policíclico podem ser afixados a moléculas de origem usando várias estratégias como diretamente através de um átomo do anel, fundido através de vários átomos do anel, através de um grupo substituinte ou através de uma porção ligação bifuncional.
[00130] Como usado neste documento, "profármaco" se refere a uma forma menos ativa ou inativa de um composto que, quando administrado a um assunto, é metabolizada para formar o composto ativo ou mais ativo (por exemplo, fármacos).
[00131] Como usado neste documento, "substituinte" e "grupo substituinte" se refere a um átomo ou grupo que substitui o átomo ou grupo um composto nomeado de origem. Por exemplo, um substituinte de um nucleosídeo modificado é qualquer átomo ou grupo que difere do átomo ou do grupo encontrado em um nucleosídeo de ocorrência natural (por exemplo, um substituinte 2' modificado é qualquer átomo ou grupo na posição 2' de um nucleosídeo diferente de H ou OH). Os grupos substituintes podem ser protegidos ou desprotegidos. Em determinadas modalidades, os compostos de presente descrição têm substituintes em uma ou em mais de uma posição do composto de origem. Os substituintes também podem ser substituídos ainda por outros grupos substituintes e podem ser afixados diretamente ou através de um grupo ligação como um grupo alquila ou hidrocarbila a um composto de origem.
[00132] Da mesma forma, como usado neste documento, "substituinte", em relação a um grupo funcional químico, se refere a um átomo ou grupo átomos que difere do átomo ou do grupo átomos normalmente presente no grupo funcional mencionado. Em determinadas modalidades, um substituinte substitui um átomo de hidrogênio do grupo funcional (por exemplo, em determinadas incorporações, o substituinte de um grupo metila substituído é um átomo ou grupo diferente do hidrogênio que substitui um dos átomos de hidrogênio de um grupo metila não substituído). Salvo indicação em contrário, os grupos favoráveis a serem usados como substituintes incluem, entre outros, halogênio, hidroxila, alquila, alquenila, alquinila, acila (O)Raa), carboxila (-C(O)O-Raa), grupos alifáticos, grupos alicíclicos, alcóxi, óxi substituído (-O-Raa), arila, aralquila, radical heterocíclico, heteroarila, heteroarilalquila, amina (-N(Rbb)(Rcc)), imina(=NRbb), amida (-C(O)N(Rbb)(Rcc) ou-N(Rbb)C(O)Raa), azido (-N3), nitro (-NO2), ciano (-CN), carbamida (-OC(O)N(Rbb)(Rcc) ou-N(Rbb)- C(O)ORaa), ureídeo (-N(Rbb)C(O)N(Rbb)(Rcc)), tioureídeo (-N(Rbb)C- (S)N(Rbb)(Rcc)), guanidinil (-N(Rbb)C(=NRbb)N(Rbb)(Rcc)), amidinil (-C(=NRbb)N(Rbb)(Rcc) ou -N(Rbb)C(=NRbb)(Raa)), tiol (-SRbb), sulfinil (-S(O)Rbb), sulfonil (-S(O)2Rbb) e sulfonamidil (-S(O)2N(Rbb)(Rcc) ou -N(Rbb)S(O)2Rbb). Onde cada Raa, Rbb e Rcc são, de forma independente, H, e um grupo funcional químico opcionalmente ligado ou um outro grupo substituinte por uma lista preferencial incluindo, entre outros, alquila, alquenila, alquinila, alifática, alcóxi, acila, arila, aralquila, heteroarila, alicíclica, heterocíclica e heteroarilalaquila. Substituintes selecionados dentro dos compostos descritos neste documento estão presentes de forma recursiva.
[00133] Como usado neste documento, "alquila" se refere um radical hidrocarboneto saturado linear ou ramificado que contém até vinte e quatro átomos de carbono. Exemplos de grupos alquila incluem sem limitação metila, etila, propila, butila, isopropila, n-hexila, octila, decila, dodecila e similares. Os grupos alquil incluem tipicamente de 1 a cerca de 24 átomos de carbono, mais tipicamente de 1 a cerca de 12 átomos de carbono (alquila C1- C12), sendo que de 1 a cerca de 6 átomos de carbono é mais preferencial.
[00134] Como usado neste documento, "alquenila" se refere a um radical uma cadeia de hidrocarboneto linear ou ramificada que contém até vinte e quatro átomos de carbono e que tem pelo menos uma ligação dupla de carbono-carbono. Exemplos de grupos alquenil incluem, entre outros, etenila, propenila, butenila, 1-metil-2-buten-1-ila, dienos como 1,3-butadieno e similares. Grupos alquenila incluem tipicamente de 2 a 24 átomos de carbono, mais tipicamente de 2 a 12 átomos de carbono, sendo de 2 a cerca de 6 átomos de carbono mais preferenciais. Grupos alquenil como usado aqui podem, opcionalmente, incluir um ou mais grupos substituintes.
[00135] Como usado neste documento, "alquinila" se refere a um radical uma cadeia de hidrocarboneto linear ou ramificada que contém até vinte e quatro átomos de carbono e que tem pelo menos uma ligação tripla de carbono-carbono. Exemplos de grupos de alquinila incluem, sem limitação, etinila, 1-propinila, 1-butinila e similares. Grupos alquinila incluem tipicamente de 2 a 24 átomos de carbono, mais tipicamente de 2 a 12 átomos de carbono, sendo de 2 a cerca de 6 átomos de carbono mais preferenciais. Grupos alquinil como usado aqui podem, opcionalmente, incluir um ou mais grupos substituintes adicionais.
[00136] Como usado neste documento, "acila" se refere a um radical formado pela remoção de um grupo hidroxila de um ácido orgânico e que tem fórmula geral -C(O)-X em que X é normalmente alifático, alicíclico ou aromático. Exemplos incluem carbonilos alifáticos, carbonilos aromáticos, sulfonis alifáticos, aromáticos sulfinis, alifáticos sulfinis, fosfatos aromáticos, fosfatos alifáticos e similares. Grupos acila como usado aqui podem, opcionalmente, incluir mais grupos substituintes.
[00137] Como usado neste documento, "alicíclico" se refere a um sistema de anel cíclico, em que o anel é alifático. O sistema de anéis pode abranger um ou mais anéis, em que pelo menos um anel é alifático. Preferenciais alicíclicos incluem anéis tendo de cerca de 5 a cerca de 9 átomos de carbono no anel. Alicíclico como usado aqui pode, opcionalmente, incluir mais grupos substituintes.
[00138] Como usado neste documento, "alifático" se refere a um radical hidrocarboneto linear ou ramificado contendo até vinte e quatro átomos de carbono, em que a saturação entre quaisquer dois átomos de carbono é uma ligação simples, dupla ou tripla. Um grupo alifático inclui preferencialmente de 1 a 24 átomos de carbono, mais tipicamente de 1 a 12 átomos de carbono, sendo de 1 a cerca de 6 átomos de carbono mais preferenciais. A cadeia linear ou ramificada de um grupo alifático pode ser interrompida com um ou mais heteroátomos que incluem nitrogênio, oxigênio, enxofre e fósforo. Tais grupos alifáticos interrompidos por heteroátomos incluem, sem limitação, polialcóxis, como glicóis de polialcaleno, poliaminas e poli- iminas. Grupos aifáticos como usados aqui podem, opcionalmente, incluir mais grupos substituintes.
[00139] Como usado neste documento, "alcóxi" se refere a um radical formado entre um grupo alquila e um átomo de oxigênio, em que o átomo de oxigênio é usado para afixar o grupo alcóxi a uma molécula de origem. Exemplos de grupos alcóxi incluem, sem limitação, metóxi, etóxi, n-propóxi, isopropóxi, n-butóxi, sec-butóxi, terc-butóxi, n-pentóxi, neopentóxi, n-hexóxi e similares. Grupos alcóxi como usado aqui podem, opcionalmente, incluir mais grupos substituintes.
[00140] Como usado neste documento, "aminoalquila" se refere um radical alquila C1-C12 substituída por amina. A porção alquila do radical forma uma ligação covalente com uma molécula de origem. O grupo amino pode ser localizado em qualquer posição e o grupo aminoalquila pode ser substituído com um grupo substituinte adicional nas partes alquila e/ou o amino.
[00141] Como usado neste instrumento, "aralquila" e "arilalquila" se refere a um grupo aromático que é ligado covalentemente a um radical alquila C1- C12. A parte de radical alquila do grupo resultante de aralquila (ou arilalquila) forma uma ligação covalente com uma molécula de origem. Exemplos incluem, sem limitação, benzila, fenetila e similares. Grupos aralquila neste documento podem, opcionalmente, incluir mais grupos substituintes ligados ao alquila, a arila ou ambos os grupos que formam o grupo radical.
[00142] Como usado neste documento, "arila" e "aromático" se refere a radicais um sistema de anel carboxílixo mono ou policíclico com um ou mais anéis aromáticos. Exemplos de grupos arila incluem sem limitação, fenila, naftila, tetrahidronaftila, indanila, idenila e similares. Sistemas de anel de arila preferenciais tem de cerca de 5 a cerca de 20 átomos de carbono em um ou mais anéis. Grupos arila como usado aqui podem, opcionalmente, incluir mais grupos substituintes.
[00143] Como usados neste documento, os termos "halo" e "halogênio" se referem a um átomo selecionado do flúor, cloro, bromo e iodo.
[00144] Como usado neste documento, "heteroarila" e "heteroaromático" se referem a um radical que compreende um sistema de anel aromático mono- ou policíclico, um sistema de anel ou um sistema de anel fundido em que pelo menos um dos anéis seja aromático e inclua um ou mais heteroátomos. Heteroarila também deve incluir sistemas de anel fundido incluindo sistemas em que um ou mais dos anéis fundidos não contêm heteroátomos. Grupos heteroarila incluem tipicamente um átomo de anel, selecionado a partir de enxofre, nitrogênio ou oxigênio. Exemplos de grupos de heteroaril incluem, sem limitação, piridinila, pirazinila, pirimidinila, pirrolila, pirazolila, imidazol, tiazoila, oxazolila, isooxazolila, tiadiazolila, oxadiazolila, tiofenila, furanila, quinolinila, isoquinolinila, benzimidazolila, benzooxazolila, quinoxalinila e similares. Radicais heteroarila podem ser anexados a uma molécula de origem diretamente ou através de uma porção ligação como um grupo alifático ou heteroátomo. Grupos heteroarila como usado aqui podem, opcionalmente, incluir mais grupos substituintes.
[00145] Como usado neste documento, "composto conjugado" se refere a quaisquer átomos, grupo de átomos ou grupo de átomos ligados adequados para serem usados como um grupo conjugado. Em determinadas modalidades, os compostos conjugados podem possuir ou conferir uma ou mais propriedades do composto ao qual estão afixados, incluindo, entre outros, propriedades de farmacodinâmica, farmacocinética, absorção, distribuição celular, absorção celular, carga e/ou depuração.
[00146] Como usado neste documento, salvo se indicado ou modificado de outro modo, o termo "de fita dupla" se refere a dois compostos oligoméricos separados que são hibridizados a outro. Esses compostos de fita dupla podem ter um ou mais nucleosídeos não hibridizantes em uma ou ambas as extremidades de uma ou ambas as fitas (overhangs) e/ou um ou mais nucleosídeos não hibridizantes internos (incompatibilidades) desde que exista complementaridade suficiente para manter a hibridização em condições fisiologicamente relevantes.
B. DETERMINADOS COMPOSTOS
[00147] Em determinadas modalidades, a invenção fornece compostos antissenso conjugados que compreendem oligonucleotídeos antissenso e um conjugado.
a. Determinados oligonucleotídeos Antissenso
[00148] Em determinadas modalidades, a invenção fornece oligonucleotídeos antissenso. Esses oligonucleotídeos antissenso compreendem nucleosídeos ligados, sendo que cada nucleosídeo compreende uma porção açúcar e uma nucleobase. A estrutura desses oligonucleotídeos antissenso pode ser considerada, em termos de características químicas, (por exemplo, modificações e padrões de modificações) e sequência de nucleobase (por exemplo, sequência de oligonucleotídeo antissenso, identidade e sequência do ácido nucleico alvo).
1. Determinadas Recursos de Química
[00149] Em determinadas modalidades, o oligonucleotídeo antissenso compreende uma ou mais modificações. Em determinadas modalidades, os oligonucleotídeos antissenso compreendem um ou mais nucleosídeos modificados e/ou ligações de internucleosídeo modificado. Em determinadas modalidades, os nucleosídeos modificados compreendem uma porção açúcar modificada e/ou uma nucleobase modificada.
1. Determinadas Porções de Açúcar
[00150] Em determinadas modalidades, os compostos da descrição compreendem um ou mais nucleosídeos modificados que consistem em uma porção açúcar modificado. Esses compostos que compreendem um ou mais nucleosídeos modificados de açúcar podem ter propriedades desejáveis, como melhor estabilidade da nuclease ou aumento da afinidade da ligação com um ácido nucleico alvo em relação a um oligonucleotídeo que consiste apenas em nucleosídeos compostos por porções de açúcar de ocorrência natural. Em determinadas modalidades, as porções de açúcar modificadas são porções de açúcar substituídas. Em determinadas modalidades, porções de açúcar modificadas são substitutos do açúcar. Esses substitutos do açúcar podem compreender uma ou mais substituições que correspondem às porções de açúcar substituídas.
[00151] Em determinadas modalidades, as porções de açúcar modificadas são porções de açúcar substituídas que compreendem um ou mais substituintes de açúcar sem ponte incluindo, entre outros, substituintes nas posições 2' e/ou 5'. Os exemplos de substituintes de açúcar apropriados para a posição 2' incluem, entre outros: 2'-F, 2'- OCH3 ("OMe" ou "O-metila"), e 2'-O(CH2)2OCH3 ("MOE"). Em determinadas modalidades, os substituintes do açúcar na posição 2' são selecionados de alila, amino, azida, tio, O-alila, alquil O-C1-C10, alquil O-C1-C10 substituído; OCF3, O(CH2)2SCH3, O(CH2)2-O- N(Rm)(Rn), e O-CH2-C(=O)-N(Rm)(Rn), em que Rm e Rn são, independentemente, H ou alquila C1-C10 substituída ou não substituída. Os exemplos de substituintes de açúcar na posição 5' incluem, entre outros: 5'-metil (R ou S); 5'-vinila e 5'-metóxi. Em determinadas modalidades, os açúcares substituídos compreendem mais de um substituinte de açúcar sem ponte, por exemplo, porções de açúcar 2'-F-5'-metila (ver, por exemplo, pedido Internacional PCT WO 2008/101157, para porções de açúcar substituídas por 5' adicional, 2'bls).
[00152] Os nucleosídeos que compreendem porções de açúcar substituídas em 2' são denominados nucleosídeos substituídos em 2'. Em determinadas modalidades, um nucleosídeo substituído em 2' compreende um grupo substituinte em 2' selecionado a partir de halo, alila, amina, azida, SH, CN, OCN, CF3, OCF3, O, S, ou N(Rm)-alquila; O, S, ou N(Rm)-alquenila; O, S ou N(Rm)-alquinila; O-alquilenil-O- alquila, alquinila,alcarila, aralquila, O-alcarila, O-aralquila, O(CH2)2SCH3, O-(CH2)2-O-N(Rm)(Rn) ou O-CH2-C(=O)-N(Rm)(Rn), em que Rm e Rn são, independentemente, H, um grupo de proteção amina ou alquila C1-C10 substituída ou não substituída. Estes grupos substituintes em 2' podem ser substituídos ainda por um ou mais grupos substituintes independentemente selecionados a partir da hidroxila, amina, alcóxi, carbóxi, benzila, fenila, nitro (NO2), tiol, tioalcóxi (S-alquila), halogênio, alquila, arila, alquenila e alquinila.
[00153] Em determinadas modalidades, um nucleosídeo substituído em 2' compreende um grupo substituinte em 2' selecionado a partir de F, NH2, N3, OCF3, O-CH3, O(CH2)3NH2, CH2-CH=CH2, O-CH2-CH=CH2, OCH2CH2OCH3, O(CH2)2SCH3, O-(CH2)2-O-N(Rm)(Rn),O(CH2)2O(CH2)2N(CH3)2, e acetamida substituída em N (O-CH2-C(=O)- N(Rm)(Rn) em que Rm e Rn são, de forma independente, H, um grupo proteção amina ou alquila C1-C10 substituída ou não substituída.
[00154] Em determinadas modalidades, um nucleosídeo substituído em 2' compreende uma porção açúcar que consiste em um grupo substituinte em 2' selecionado a partir de F, OCF3, O-CH3, OCH2CH2OCH3, O(CH2)2SCH3, O-(CH2)2-O-N(CH3)2,-O(CH2)2O(CH2)2N(CH3)2, e O-CH2-C(=O)-N(H)CH3.
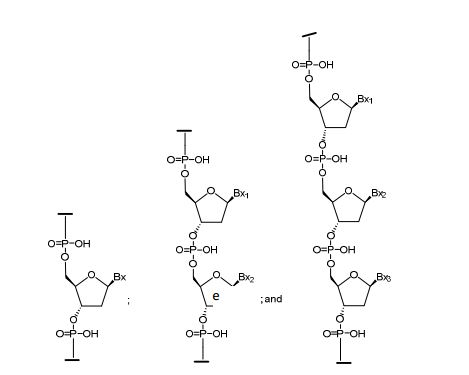
[00155] Em determinadas modalidades, um nucleosídeo substituído em 2' compreende uma porção açúcar que consiste em um grupo substituinte em 2' selecionado a partir de F, O-CH3, e OCH2CH2OCH3.
[00156] Certas porções de açúcar modificadas compreendem um substituinte de açúcar de ponte que forma um segundo anel resultando em uma porção açúcar bicíclica. Em algumas dessas modalidades, a porção açúcar bicíclica compreende uma ponte entre os átomos do anel de furanose em 4' e 2'. Exemplos desses substituintes de açúcar em 4' a 2' incluem, entre outros: -[C(Ra)(Rb)]n-, -[C(Ra)(Rb)]n-O-, -C(RaRb)-N(R)-O- ou, -C(RaRb)-O-N(R)-; 4'-CH2-2', 4'-(CH2)2-2', 4'- (CH2)3-2',. 4'-(CH2)-O-2' (LNA); 4'-(CH2)-S-2'; 4'-(CH2)2-O-2' (ENA); 4'- CH(CH3)-O-2' (cEt) e 4'-CH(CH2OCH3)-O-2', e seus análogos (ver, por exemplo Patente US N° 7.399.845, emitida em 15 de julho de 2008); 4'-C(CH3)(CH3)-O-2' e seus análogos, (ver, por exemplo WO2009/006478, publicado em 8 de janeiro de 2009); 4'-CH2- N(OCH3)-2' e seus análogos (ver, por exemplo WO2008/150729, publicado em 11 de dezembro de 2008); 4'-CH2-O-N(CH3)-2' (ver, por exemplo US2004/0171570, publicado em 2 de setembro de 2004); 4'- CH2-O-N(R)-2', e 4'-CH2-N(R)-O-2'-, em que R é, independentemente, H, um grupo de proteção ou alquila C1-C12; 4'-CH2-N(R)-O-2', onde R é H, alquila C1-C12, ou um grupo de proteção (ver, Patente US N° 7.427.672, emitida em 23 de setembro de 2008); 4'-CH2-C(H)(CH3)-2' (ver, por exemplo Chattopadhyaya, et al., J. Org. Chem.,2009, 74, 118134); e 4'-CH2-C(=CH2)-2', e seus análogos (ver, Pedido Internacional PCT publicado WO 2008/154401, publicado em 8 de dezembro de 2008).
[00157] Em determinadas modalidades, essas pontes 4' a 2' compreendem independentemente de 1 para 4 grupos ligados independentemente selecionados a partir de -[C (Ra) (Rb)]n-, - c (Ra) = C(Rb)-, - c (Ra) = N-, -C(=NRa)-, C(=O)-, - C(=S)-, - O-, -Si (Ra)2-,- S(=O)x-e -N(Ra)-;
[00158] em que:
[00159] x é 0, 1 ou 2;
[00160] n é 1, 2, 3 ou 4;
[00161] cada Ra e Rb é, independentemente, H, um grupo de proteção, hidroxila, alquila C1-C12, alquila substituída C1-C12, alquenila C2-C12, alquenila substituída C2-C12, alquinila C2-C12, alquinila substituída C2-C12, arila C5-C20, arila substituída C5-C20, radical heterociclo, radical heterociclo substituído, heteroarila, hetrarila substituída, radical alicíclico C5-C7, radical alicíclico substituído C5-C7, halogênio, OJ1, NJ1J2, SJ1, N3, COOJ1, acila (C(=O)-H), acila substituída, CN, sulfonila (S(=O)2-J1), ou sulfoxila (S(=O)-J1); e
[00162] cada J1 e J2 é, de forma independente, H, C1-C12 alquila, C1C12 alquila substituída, C2-C12 alquenila, C2-C12 alquenila substituída, C2-C12 alqueno, C2-C12 alquinila, C2-C12 alquinila substituída, C5-C20 arila, C5-C20 arila substituída, acila (C(=O)-H), acila substituída, um radical heterociclo, um radical heterociclo substituído, C1-C12 aminoalquila, C1-C12 aminoalquila substituída, ou um grupo de proteção.
[00163] Os nucleosídeos que compreendem porções de açúcar bicíclicas são chamados nucleosídeos bicíclicos ou BNAs. Nucleosídeos bicíclicos incluem, entre outros, (A) a-L-metilenóxi (4'- CH2-O-2') BNA, (B) e-D-Metilenóxi (4'-CH2-O-2') BNA (também denominado ácido nucleico bloqueado ou LNA), (C) Etilenóxi (4'- (CH2)2-O-2') BNA, (D) Amino-óxi (4'-CH2-O-N(R)-2') BNA, (E) Oxiamina (4'-CH2-N(R)-O-2') BNA, (F) Metil(metilenóxi) (4'-CH(CH3)-O-2') BNA (também denominado etil restrito ou cEt), (G) metileno-tio (4'-CH2-S-2') BNA, (H) metileno-amina (4'-CH2-N(R)-2') BNA, (I) metil carboxílico (4'- CH2-CH (CH3)-2') BNA e (J) propileno carboxílico (4'-(CH2)3-2 ') BNA como descrito abaixo.
[00164] em que Bx é uma porção nucleobase e R é, independentemente, H, um grupo de proteção ou alquila C1-C12.
[00165] As porções de açúcar bicíclicas adicionais são conhecidos na técnica, por exemplo: Singh et al., Chem. Commun., 1998, 4, 455456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Wahlestedt et al.,, Proc. Natl. Acad. Sci. U. S. A., 2000, 97, 5633-5638; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; Srivastava et al., J. Am. Chem. Soc., 129(26) 8362-8379 (Jul. 4, 2007); Elayadi et al., Curr. Opinion Invens. Drugs, 2001, 2, 558-561; Braasch et al., Chem. Biol., 2001, 8, 1-7; Orum et al., Curr. Opinion Mol. Ther., 2001, 3, 239-243; Patente U.S. Nos U.S. 7.053.207, 6.268.490, 6.770.748, 6.794.499, 7.034.133, 6.525.191, 6.670.461, e 7.399.845; WO 2004/106356, WO 1994/14226, WO 2005/021570, e WO 2007/134181; Publicação de Patente U.S. Nos. US2004/0171570, US2007/0287831, eUS2008/0039618; e Patente U.S. Nos. de Série 12/129.154, 60/989.574, 61/026.995, 61/026.998, 61/056.564, 61/086.231,61/097.787, e 61/099.844; e Pedidos Internacionais PCT Nos. PCT/US2008/064591, PCT/US2008/066154, e PCT/US2008/068922.
[00166] Em determinadas modalidades, as porções de açúcar bicíclicas e os nucleosídeos que incorporam essas porções de açúcar bicíclicas são definidas ainda pela configuração isomérica. Por exemplo, um nucleosídeo compreendendo uma ponte 4'-2' de metileno-óxi, pode estar na configuração α-L ou na configuração β-D. Anteriormente, nucleosídeos bicíclicos de a-L-metileno-óxi (4-CH2-O- 2') foram incorporados aos oligonucleotídeos antissenso que mostraram atividade antissenso (Frieden et al., Nucleic Acids Research, 2003, 21, 6365-6372).
[00167] Em determinadas modalidades, as porções de açúcar substituídas compreendem um ou mais substituintes de açúcar sem ponte e um ou mais substituinte de açúcar com ponte (por exemplo, açúcares com ponte substituídos em 5' ou em 4'-2'). (ver, Pedido Internacional PCT WO 2007/134181, publicado em 22/11/07, em que LNA é substituído, por exemplo, por um grupo 5'-metil ou 5'-vinila).
[00168] Em determinadas modalidades, porções de açúcar modificadas são substitutos do açúcar. Em algumas dessas modalidades, o átomo de oxigênio do açúcar de ocorrência natural é substituído, por exemplo, por um átomo de enxofre, carbono ou nitrogênio. Em algumas dessas modalidades, essa porção açúcar modificada também compreende substituintes com e/ou sem ponte conforme descrito acima. Por exemplo, alguns substitutos do açúcar compreendem um átomo 4'-enxofre e uma substituição na posição 2' (ver, por exemplo, Pedido de Patente US N° 2005/0130923, publicado em 16 de junho de 2005) e/ou na posição 5'. A título de exemplo adicional, os nucleosídeos bicíclicos carboxílicos com uma ponte 4'-2' foram descritos (ver, por exemplo, Freier et al., Nucleic Acids Research, 1997, 25(22), 4429-4443 and Albaek et al., J. Org. Chem., 2006, 71, 7731-7740).
[00169] Em determinadas modalidades, os substitutos de açúcar compreendem anéis com mais de 5 átomos. Por exemplo, em determinadas modalidades, um substituto do açúcar compreende um morfolino. Os compostos de morfolino e seu uso em compostos oligoméricos foram mencionados em várias patentes e artigos publicados (ver, por exemplo: Braasch et al., Biochemistry, 2002, 41, 4503-4510; e Patentes US N° 5.698.685; 5.166.315; 5.185.444; e 5.034.506). Como usado neste instrumento, o termo "morfolino" se refere a um substituto de açúcar com a seguinte estrutura:
[00170] Em determinadas modalidades, os morfolinos podem ser modificados, por exemplo, pelo acréscimo ou alteração de vários grupos substituintes da estrutura do morfolino acima. Esses substitutos do açúcar são mencionados neste documento como "morfolinos modificados"
[00171] Para outro exemplo, em determinadas modalidades, um substituto do açúcar compreende um tetraidropirano de seis membros. Esses tetraidropiranos podem ser ainda modificados ou substituídos.Os nucleosídeos que compreendem esses tetraidropiranos modificados incluem, entre outros, hexitol (HNA), ácido nucleico de anitol (ANA), ácido nucleico de manitol (MNA) (ver Leumann, CJ. Bioorg. & Med. Chem. (2002) 10:841-854), flúor HNA (F-HNA), ou aqueles compostos com a Fórmula VI:
[00172] em que independentemente para cada um do referido pelo menos um análogo de nucleosídeo de tetraidropirano de Fórmula VI:
[00173] Bx é uma porção nucleobase;
[00174] T3 e T4 são, cada um, independentemente, um grupo de ligação internucleosídeo que liga o análogo do nucleosídeo de tetraidropirano ao composto antissenso ou um de T3 e T4 é um grupo de ligação internucleosídeo que liga o análogo de nucleosídeo de tetraidropirano ao composto antissenso e o outro de T3 e T4 é H, um grupo de proteção de hidroxila, um grupo conjugado ligado ou um grupo 5' ou 3'-terminal;
[00175] q1, q2, q3, q4, q5, q6 e q7 são, cada um, independentemente,H, alquila C1- C6, alquila C1- C6 substituída, alquenila C2- C6, alquenila C2-C6 substituída, alquinila C2-C6, ou alquinila C2-C6 substituída; e
[00176] R1 e R2 é independentemente selecionado dentre:hidrogênio, halogênio, alcóxi substituído ou não substituído, NJ1J2, SJ1, N3, OC(=X)J1, OC(=X)NJ1J2, NJ3C(=X)NJ1J2, e CN, em que X é O, S, ou NJ1, e cada J1, J2, e J3 é, independentemente, H ou alquila C1-C6.
[00177] Em certas modalidades, os nucleosídeos de THP modificados de Fórmula VI são fornecidos neste documento em que q1, q2, q3, q4, q5, q6 e q7 são cada um H. Em certas modalidades, pelo menos um de q1, q2, q3, q4, q5, q6 e q7 é diferente de H. Em certas modalidades, pelo menos um de q1, q2, q3, q4, q5, q6 e q7 é metila. Em certas modalidades, os nucleosídeos de THP da Fórmula VI são fornecidos, em que um de R1 e R2 é F. Em certas modalidades, R1 é fluoro e R2 é H, R1 é metóxi e R2 é H, e R1 é metoxietóxi e R2 é H.
[00178] Muitos outros sistemas do anel do substituto do açúcar bicíclico e tricíclico também são conhecidos na técnica que podem ser usados para modificar os nucleosídeos para a incorporação nos compostos antissenso (ver, por exemplo, artigo de revisão: Leumann, J. C, Bioorganic & Medicinal Chemistry, 2002, 10, 841-854).
[00179] As combinações das modificações também são fornecidas, sem limitação, como nucleosídeos 2'-F-5'-metila substituídos (vide, Pedido Internacional PCT WO 2008/101157, publicado em 21/08/08 para outros nucleosídeos 5',2'-bis substituídos divulgados) e substituição do átomo de oxigênio do anel ribosil por S e outra substituição adicional na posição 2' (vide, Pedido de Patente U.S. publicado US2005-0130923, publicado em 16 de junho de 2005), ou alternativamente, substituição 5' de um ácido nucleico bicíclico (vide, Pedido Internacional PCT WO 2007/134181, publicado em 22/11/07, em que o nucleosideo bicíclico 4'-CH2-O-2' é ainda substituído na posição 5' por um grupo 5'-metila ou 5'-vinila). A síntese e a preparação dos nucleosídeos bicíclicos carbocíclicos juntamente com seus estudos bioquímicos e de oligomerização também foram descritos (ver, por exemplo, Srivastava et al., J. Am. Chem. Soc. 2007, 129(26), 8362-8379).
[00180] Em determinadas modalidades, a presente descrição fornece oligonucleotídeos que compreendem nucleosídeos modificados. Os nucleotídeos modificados podem incluir açúcares modificados, nucleobases modificadas, e/ou ligações modificadas. As modificações específicas são selecionadas de modo que os oligonucleotídeos resultantes possuam características desejáveis. Em certas modalidades, os oligonucleotídeos compreendem um ou mais nucleosídeos similares ao RNA. Em determinadas modalidades, os oligonucleotídeos compreendem um ou mais nucleotídeos similares ao DNA.
2. Determinadas Modificações da Nucleobase
[00181] Em determinadas modalidades, os nucleosídeos da presente descrição compreendem uma ou mais nucleobases não modificadas. Em determinadas modalidades, os nucleosídeos da presente descrição compreendem uma ou mais nucleobases modificadas.
[00182] Em determinadas modalidades, as nucleobases modificadas são selecionados a partir de: bases universais, bases hidrofóbicas, bases promíscuas, bases expansoras de tamanho e bases fluoradas definidas neste instrumento. 5-pirimidinas substituídas, 6-azapirimidinas e purinas substituídas em N-2, N-6 e O- 6, incluindo 2-aminopropiladenina, 5-propiniluracila; 5-propinilcitosina; 5-hidroximetil citosina, xantina, hipoxantina, 2-aminoadenina, 6-metil e outros derivados da alquila da adenina ou da guanuna, 2-propil e outros derivados da alquila da adenina e da guanina, 2-tiouracila, 2- tiotimina e 2-tiocitosina, 5-halouracila e citosina, 5-propinil (-C=C-CH3) uracila e citosina e outros derivados da alquinila das bases pirimidínicas, 6-azo-uracila, citosina e timina, 5-uracila (pseudo- uracila), 4-tiouracila, 8-halo, 8-amina, 8-tiol, 8-tioalquila, 8-hidroxila e outras adeninas e guaninas 8-substituídas, 5-halo especialmente 5- bromo, 5-trifluormetila e outras uracilas e citosinas 5-substituídas, 7- metilguanina e 7-metiladenina, 2-F-adenina, 2-amino-adenina, 8-aza- guanina e 8-aza-adenina, 7-deaza-guanina e 7-deaza-adenina, 3- deasa-guanina e 3-deaza-adenina, bases universais, bases hidrofóbicas, bases promíscuas, bases expansoras de tamanho e bases fluoradas definidas neste instrumento. Mais nucleobases modificadas incluem pirimidinas tricíclicas como fenoxazina citidina ([5,4-b][1,4]benzoxazin-2(3H)-ona), fenotiazina citidina (1H- pirimido[5,4-b][1,4]benzotiazin-2(3H)-ona), G-grampos como fenoxazina citidina substituída (por exemplo, 9-(2-aminoetóxi)-H- pirimido[5,4-b][1,4]benzoxazin-2(3H)-ona), carbazol citidina (2H- pirimido[4,5-b]indol-2-ona), piridoindol citidina (H- pirido[3',2':4,5]pirrolo[2,3-d]pirimidin-2-ona). As nucleobases modificadas também podem incluir aquelas em que a base purina ou pirimidina é substituída por outros heterocíclicos, por exemplo, 7- deaza-adenina, 7-deazaguanosina, 2-aminopiridina e 2-piridona. As nucleobases incluem ainda aquelas divulgadas na Patente Estados Unidos N° 3.687.808, aquelas divulgadas em The Concise Encyclopedia Of Polymer Science And Engineering,Kroschwitz, J.I., Ed., John Wiley & Sons, 1990, 858-859; aquelas divulgadas por Englisch et al., Angewandte Chemie, Edição Internacional, 1991, 30, 613; e aquelas divulgadas por Sanghvi, Y.S., Capítulo 15, Antisense Research and Applications, Crooke, S.T. and Lebleu, B., Eds., CRC Press, 1993, 273-288.
[00183] Patentes representativas dos Estados Unidos que ensinam a preparação de determinadas nucleobases modificadas mencionadas acima, bem como outras nucleobases modificadas incluem, sem limitação, US 3.687.808; 4.845.205; 5.130.302; 5.134.066; 5.175.273; 5.367.066; 5.432.272; 5.457.187; 5.459.255; 5.484.908; 5.502.177; 5.525.711; 5.552.540; 5.587.469; 5.594.121; 5.596.091; 5.614.617; 5.645.985; 5.681.941; 5.750.692; 5.763.588; 5.830.653 e 6.005.096, sendo que algumas delas são comumente pertencentes ao pedido imediato, e cada uma delas é incorporada a este instrumento por referência na sua totalidade.
3. Determinadas Ligações do Internucleosídeo
[00184] Em determinadas modalidades, a presente descrição fornece oligonucleotídeos que compreendem nucleosídeos ligados. Nessas modalidades, os nucleosídeos podem estar ligados usando qualquer ligação do internucleosídeo. As duas classes principais dos grupos de ligação do internucleosideo são definidas pela presença ou ausência de um átomo de fósforo. Ligações de internucleosídeos representativas contendo fósforo incluem, mas não estão limitadas a, fosfodiésteres (PO), fosfotriésteres, metilfosfonatos, fosforamidato, e fosforotioatos (PS). Grupos de ligação de internculeosídeo representativos contendo não fósforo incluem, entre outros, metilenometilimina (-CH2-N (CH3) -O-CH2-), tiodiéster (-O-C(O)-S-), tionocarbamato (-O-C(O)(NH)-S-); siloxano (-O-Si(H)2-O-); e N,N'- dimetil-hidrazina (-CH2-N(CH3) -N(CH3)-). Ligações modificadas, em comparação com as ligações naturais de fosfodiéster, podem ser usadas para alterar, normalmente aumentar, a resistência de nuclease do oligonucleotídeo. Em determinadas modalidades, as ligações de internucleosídeo com um átomo quiral podem ser preparadas como uma mistura racêmica ou como enantiômeros separados. As ligações quirais representativas incluem, entre outros, alquilfosfonatos e fosforotioatos. Os métodos de preparação das ligações de internucleosídeo contendo fósforo e não fósforo são bem conhecidas pelos versados na técnica.
[00185] Os oligonucleotídeos descritos neste documento contêm um ou mais centros assimétricos e, assim, dão origem a enantiômeros, diastereômeros e outras configurações estereoisoméricas que podem ser definidas, em termos de estereoquímica absoluta, como (R) ou (S), α ou β, tal como anômeros de açúcar, ou como (D) ou (L) como aminoácidos, etc. Todos os isômeros possíveis, bem como suas formas racêmicas e opticamente puras estão incluídos nos compostos antissenso.
[00186] As ligação de internucleosídeos neutros incluem, entre outros, fosfotriésteres, metilfosfonatos, MMI (3'-CH2-N(CH3)-O-5'), 3- amida (3'-CH2-C(=O)-N(H)-5'), 4-amida (3'-CH2-N(H)-C(=O)-5'), formacetal (3'-O-CH2-O-5') e tioformacetal (3'-S-CH2-O-5'). Outras ligações de internucleosídeo neutro incluem ligações não iônicas, compreendendo siloxano (dialquilsiloxano), éster carboxilato, carboxamidas, sulfeto, éster sulfonato e amidas (ver, por exemplo: Carbohydrate Modifications in Antisense Research; Y.S. Sanghvi and P.D. Cook, Eds., ACS Symposium Série 580; Capítulos 3 e 4, 40-65). Outras ligações de internucleosídeo neutro incluem ligações não iônicas, compreendendo partes do componente N, O, S e CH2 misturadas.
4. Determinados Motivos
[00187] Em determinadas modalidades, os oligonucleotídeos antissenso compreendem um ou mais nucleosídeo modificado (por exemplo, nucleosídeo que consiste em açúcar modificado e/ou nucleobase modificada) e/ou uma ou mais ligações de internucleosídeo modificado. O padrão dessas modificações em um oligonucleotídeo é referido neste documento como um motivo. Em determinadas modalidades, os motivos de açúcar, nucleobase e ligação são independentes uns dos outros.a. Determinados motivos de açúcar
[00188] Em determinadas modalidades, os oligonucleotídeos compreendem um ou mais tipos de porções de açúcar modificadas e/ou porções de açúcar de ocorrência natural dispostas ao longo do oligonucleotídeo ou da sua região em um padrão definido ou motivo de modificação do açúcar. Esses motivos podem incluir qualquer uma das modificações de açúcar discutidas neste documento e/ou outras modificações de açúcar conhecidas.
[00189] Em determinadas modalidades, os oligonucleotídeos compreendem ou consistem em uma região que tem um motivo de açúcar de gapmer, que compreende duas regiões externas ou "asas" e uma região central ou interna ou "lacuna". As três regiões de um motivo de açúcar de gapmer (5'-asa, lacuna e 3'-asa) formam uma sequência contígua de nucleosídeos em que pelo menos algumas porções de açúcar dos nucleosídeos de cada uma das asas diferem de pelo menos algumas porções de açúcar dos nucleosídeos da lacuna. Especificamente, pelo menos as porções de açúcar dos nucleosídeos de cada asa que estão mais próximas da lacuna (o nucleosídeo mais próximo de 3' de 5'-asa e o nucleosídeo mais próximo de 5' de 3'-asa) diferem da porção açúcar dos nucleosídeos da lacuna vizinha definindo, assim, o limite entre as asas e a lacuna. Em determinadas modalidades, as porções de açúcar dentro da lacuna são as mesmas. Em determinadas modalidades, a lacuna inclui um ou mais nucleosídeos com uma porção açúcar que difere da porção açúcar de um ou mais nucleosídeos da lacuna. Em determinadas modalidades, os motivos de açúcar das duas asas são os mesmos da outra (gapmer de açúcar simétrico). Em determinadas modalidades, os motivos de açúcar de 5'-asa diferem do motivo de açúcar de 3'-asa (gapmer de açúcar assimétrico).
i. Determinadas 5'-asas
[00190] Em determinadas modalidades, 5'-asa de um gapmer consiste em 1 a 8 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 1 a 7 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 1 a 6 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 1 a 5 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 2 a 5 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 3 a 5 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 4 ou 5 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 1 a 4 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 1 a 3 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 1 ou 2 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 2 a 4 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 2 ou 3 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 3 ou 4 nucleosídeos ligados. Em determinadas modalidades, 5'- asa de um gapmer consiste em 1 nucleosídeo ligado. Em determinadas modalidades, 5'-asa de um gapmer consiste em 2 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 3 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 4 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 5 nucleosídeos ligados. Em determinadas modalidades, 5'-asa de um gapmer consiste em 6 nucleosídeos ligados.
[00191] Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos dois nucleosídeos bicíclicos. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos três nucleosídeos bicíclicos. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos quatro nucleosídeos bicíclicos. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo LNA. Em determinadas modalidades, cada nucleosídeo de 5'-asa de um gapmer é um nucleosídeo bicíclico. Em determinadas modalidades, 5'-asa de um gapmer consiste em um nucleosídeo de etila restrita. Em determinadas modalidades, cada nucleosídeo de 5'-asa de um gapmer é um nucleosídeo LNA.
[00192] Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo modificado não bicíclico. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo 2'-substituído. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo 2'- MOE. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo 2'-OMe. Em determinadas modalidades, cada nucleosídeo de 5'-asa de um gapmer é um nucleosídeo modificado não bicíclico. Em determinadas modalidades, cada nucleosídeo de 5'-asa de um gapmer é um nucleosídeo 2'- substituído. Em determinadas modalidades, cada nucleosídeo de 5'- asa de um gapmer é um nucleosídeo 2'-MOE. Em determinadas modalidades, cada nucleosídeo de 5'-asa de um gapmer é um nucleosídeo 2'-OMe.
[00193] Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um 2-desoxinucleosídeo. Em determinadas modalidades, cada nucleosídeo de 5'-asa de um gapmer é um 2'- deoxinucleosídeo. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um ribonucleosídeo. Em determinadas modalidades, cada nucleosídeo de 5'-asa de um gapmer é um ribonucleosídeo. Em determinadas modalidades, um, mais de um ou cada nucleosídeo de 5'-asa é um nucleosídeo similar ao RNA.
[00194] Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo modificado não bicíclico. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'-substituído. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'- MOE. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'-OMe. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um 2'-desoxinucleosídeo.
[00195] Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita e pelo menos um nucleosídeo modificado não bicíclico. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita e pelo menos um nucleosídeo 2'- substituído. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'-MOE. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita e pelo menos um nucleosídeo 2'-OMe. Em determinadas modalidades, 5'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um 2'-desoxinucleosídeo.
ii. Determinadas 3'-asas
[00196] Em determinadas modalidades, 3'-asa de um gapmer consiste em 1 a 8 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 1 a 7 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 1 a 6 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 1 a 5 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 2 a 5 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 3 a 5 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 4 ou 5 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 1 a 4 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 1 a 3 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 1 ou 2 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 2 a 4 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 2 ou 3 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 3 ou 4 nucleosídeos ligados. Em determinadas modalidades, 3'- asa de um gapmer consiste em 1 nucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer consiste em 2 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 3 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 4 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 5 nucleosídeos ligados. Em determinadas modalidades, 3'-asa de um gapmer consiste em 6 nucleosídeos ligados.
[00197] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA. Em determinadas modalidades, cada nucleosídeo de 3'-asa de um gapmer é um nucleosídeo bicíclico. Em determinadas modalidades, 3'-asa de um gapmer consiste em um nucleosídeo de etila restrita. Em determinadas modalidades, cada nucleosídeo de 3'-asa de um gapmer é um nucleosídeo LNA.
[00198] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo modificado não bicíclico. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos dois nucleosídeos modificados não bicíclicos. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos três nucleosídeos modificados não bicíclicos. Em determinadasmodalidades, 3'-asa de um gapmer compreende pelo menos quatro nucleosídeos modificados não bicíclicos. Em determinadasmodalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo 2'-substituído. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo 2'-MOE. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo 2'-OMe. Em determinadas modalidades, cada nucleosídeo de 3'-asa de um gapmer é um nucleosídeo modificado não bicíclico. Em determinadas modalidades, cada nucleosídeo de 3'- asa de um gapmer é um nucleosídeo 2'-substituído. Em determinadas modalidades, cada nucleosídeo de 3'-asa de um gapmer é um nucleosídeo 2'-MOE. Em determinadas modalidades, cada nucleosídeo de 3'-asa de um gapmer é um nucleosídeo 2'-OMe.
[00199] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, cada nucleosídeo de 3'-asa de um gapmer é um 2'- deoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um ribonucleosídeo. Em determinadas modalidades, cada nucleosídeo de 3'-asa de um gapmer é um ribonucleosídeo. Em determinadas modalidades, um, mais de um ou cada nucleosídeo de 5'-asa é um nucleosídeo similar ao RNA.
[00200] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo modificado não bicíclico. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'-substituído. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'- MOE. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'-OMe. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um 2'-desoxinucleosídeo.
[00201] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita e pelo menos um nucleosídeo modificado não bicíclico. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita e pelo menos um nucleosídeo 2'- substituído. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um nucleosídeo 2'-MOE. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita e pelo menos um nucleosídeo 2'-OMe. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico e pelo menos um 2'-desoxinucleosídeo.
[00202] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA e pelo menos um nucleosídeo modificado não bicíclico. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA e pelo menos um nucleosídeo 2'-substituído. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA e pelo menos um nucleosídeo 2'-MOE. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA e pelo menos um nucleosídeo 2'-OMe. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA e pelo menos um 2'-desoxinucleosídeo.
[00203] Em determinadas modalidades, 3'-asa de um gapmercompreende pelo menos um nucleosídeo bicíclico, pelo menos umnucleosídeo modificado não bicíclico e pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita, pelo menos um nucleosídeo modificado não bicílico e pelo menos um 2'- desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA, pelo menos um nucleosídeo modificado não bicíclico e pelo menos um 2'- desoxinucleosídeo.
[00204] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico, pelo menos um nucleosídeo 2'-substituído e pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita, pelo menos um nucleosídeo 2'- substituído e pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA, pelo menos um nucleosídeo 2'-substituído e pelo menos um 2'-desoxinucleosídeo.
[00205] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico, pelo menos um nucleosídeo 2'-MOE e pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita, pelo menos um nucleosídeo 2'- MOE e pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA, pelo menos um nucleosídeo 2'-MOE e pelo menos um 2'-desoxinucleosídeo.
[00206] Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo bicíclico, pelo menos um nucleosídeo 2'-OMe e pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo de etila restrita, pelo menos um nucleosídeo 2'- OMe e pelo menos um 2'-desoxinucleosídeo. Em determinadas modalidades, 3'-asa de um gapmer compreende pelo menos um nucleosídeo LNA, pelo menos um nucleosídeo 2'-OMe e pelo menos um 2'-desoxinucleosídeo.
iii. Certas Regiões Centrais (lacunas)
[00207] Em determinadas modalidades, a lacuna de um gapmer consiste em 6 a 20 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 6 a 15 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 6 a 12 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 6 a 10 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 6 a 9 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 6 a 8 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 6 ou 7 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 7 a 10 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 7 a 9 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 7 ou 8 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 8 a 10 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 8 ou 9 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 6 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 7 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 8 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 9 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 10 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 11 nucleosídeos ligados. Em determinadas modalidades, a lacuna de um gapmer consiste em 12 nucleosídeos ligados.
[00208] Em determinadas modalidades, cada nucleosídeo da lacuna de um gapmer é um 2'-deoxinucleosídeo. Em certas modalidades, a lacuna compreende um ou mais nucleosídeos modificados. Em determinadas modalidades, cada nucleosídeo da lacuna de um gapmer é um 2'-deoxinucleosídeo ou é um nucleosídeo modificado que é "similar ao DNA". Em tais modalidades, "similar ao DNA" significa que o nucleosídeo tem características semelhantes ao DNA, de forma que um duplex compreendendo o gapmer e uma molécula de RNA é capaz de ativar RNase H. Por exemplo, sob certas condições, 2'-(ara)-F tem demonstrado que suporta a ativação de RNase H e, assim, é similar ao DNA. Em determinadas modalidades, um ou mais nucleosídeos da lacuna de um gapmer não é um 2'- deoxinucleosídeo e não é similar ao DNA. Em algumas dessas modalidades, o gapmer, no entanto, suporta a ativação RNase H (por exemplo, devido ao número ou a colocação dos nucleosídeos não DNA).
[00209] Em determinadas modalidades, as lacunas compreendem um trecho de não modificado de 2'-deoxinucleosídeo interrompido por um ou mais nucleosídeos modificados, resultando assim em três sub- regiões (dois trechos de um ou mais 2'-deoxinucleosídeo e um trecho de um ou mais nucleosídeos modificados interruptores). Em determinadas modalidades, nenhum trecho de 2'-deoxinucleosídeos não modificados tem mais do que 5, 6 ou 7 nucleosídeos. Em determinadas modalidades, tais trechos curtos são obtidos usando as regiões lacuna curta. Em determinadas modalidades, os trechos curtos são obtidos através da interrupção de uma região de lacuna mais comprida.
[00210] Em determinadas modalidades, a lacuna compreende um ou mais nucleosídeos modificados. Em determinadas modalidades, a lacuna compreende um ou mais nucleosídeos modificados, selecionados dentre cEt, FHNA, LNA, e 2-tio-timidina. Em determinadas modalidades, a lacuna compreende um nucleosídeo modificado. Em determinadas modalidades, a lacuna compreende uma porção de açúcar 5'-substituída selecionada dentre 5'-Me e 5'-(R)-Me. Em determinadas modalidades, a lacuna compreende dois nucleosídeos modificados. Em determinadas modalidades, a lacuna compreende três nucleosídeos modificados. Em determinadas modalidades, a lacuna compreende quatro nucleosídeos modificados. Em determinadas modalidades, a lacuna compreende dois ou mais nucleosídeos modificados e cada nucleosídeo modificado é o mesmo. Em determinadas modalidades, a lacuna compreende dois ou mais nucleosídeos modificados e cada nucleosídeo modificado é diferente.
[00211] Em determinadas modalidades, a lacuna compreende uma ou mais ligações modificadas. Em determinadas modalidades, a lacuna compreende uma ou mais ligações de fosfonato de metila. Em determinadas modalidades, a lacuna compreende duas ou mais ligações modificadas. Em certas modalidades, a lacuna compreende uma ou mais ligações modificadas e um ou mais nucleosídeos modificados. Em determinadas modalidades, a lacuna compreende uma ligação modificada e um nucleosídeo modificado. Em certas modalidades, a lacuna compreende duas ligações modificadas e dois ou mais nucleosídeos modificados.b. Determinadas Ligações do Internucleosídeo
[00212] Em determinadas modalidades, oligonucleotídeos compõem ligações de internucleosídeo modificado dispostas ao longo do oligonucleotídeo, ou região do mesmo, em um padrão definido ou motivo de ligação de internucleosídeo modificado. Em determinadas modalidades, os oligonucleotídeos compreendem uma região com um motivo de ligação de internucleosídeo alternado. Em determinadas modalidades, os oligonucleotídeos da presente descrição compreendem uma região de ligações de internucleosídeo uniformemente modificado. Em algumas dessas modalidades, o oligonucleotídeo compreende uma região que é uniformemente ligada por ligações de internucleosídeo de fosforotioato. Em determinadas modalidades, o oligonucleotídeo é uniformemente ligado por ligações de internucleosídeo de fosforotioato. Em determinadas modalidades, cada ligação de internucleosídeo do oligonucleotídeo é selecionada de fosfodiéster e fosforotioato. Em determinadas modalidades, cada liagação de internucleosídeo do oligonucleotídeo é selecionado de fosfodiéster e fosforotioato e pelo menos uma ligação de internucleosídeo é fosforotioato.
[00213] Em determinadas modalidades, o oligonucleotídeo compreende pelo menos 6 ligações de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende pelo menos 7 ligações de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende pelo menos 8 ligações de internucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende pelo menos 9 ligações deinternucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende pelo menos 10 ligações deinternucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende pelo menos 11 ligações deinternucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende pelo menos 12 ligações deinternucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende pelo menos 13 ligações deinternucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende pelo menos 14 ligações deinternucleosídeo fosforotioato.
[00214] Em determinadas modalidades, o oligonucleotídeo compreende pelo menos um bloco de, pelo menos, 6 ligações consecutivas de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende pelo menos um bloco de, pelo menos, 7 ligações consecutivas de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende pelo menos um bloco de, pelo menos, 8 ligações consecutivas de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende pelo menos um bloco de, pelo menos, 9 ligações consecutivas de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende pelo menos um bloco de, pelo menos, 10 ligações consecutivas de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende pelo menos um bloco de, pelo menos, 12 ligações consecutivas de internucleosídeo fosforotioato. Nestas determinadas modalidades, pelo menos um destes blocos está localizado na extremidade 3' do oligonucleotídeo. Nestas determinadas modalidades, pelo menos um destes blocos está localizado dentro de 3 nucleosídeos da extremidade 3' dooligonucleotídeo. Em determinadas modalidades, o oligonucleotídeo compreende menos de 15 ligações de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende menos do que 14 ligações de internucleosídeo fosforotioato. Em determinadas modalidades, o oligonucleotídeo compreende menos do que 13ligações de internucleosídeo fosforotioato. Em determinadasmodalidades, o oligonucleotídeo compreende menos do que 12ligações de internucleosídeo fosforotioato. Em determinadasmodalidades, o oligonucleotídeo compreende menos do que 11ligações de internucleosídeo fosforotioato. Em determinadasmodalidades, o oligonucleotídeo compreende menos do que 10ligações de internucleosídeo fosforotioato. Em determinadasmodalidades, o oligonucleotídeo compreende menos do que 9 ligações de internucleosídeo fosforotioato. Em determinadas modalidades, omenos do que 8 ligações de Em determinadas modalidades, o menos do que 7 ligações de internucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende menos do que 6 ligações deinternucleosídeo fosforotioato. Em determinadas modalidades, ooligonucleotídeo compreende menos do que 5 ligações deinternucleosídeo fosforotioato.
c. Determinados Motivos de Modificação da Nucleobase
[00215] Em determinadas modalidades, os oligonucleotídeos compreendem modificações químicas da nucleobase dispostas ao longo do oligonucleotídeo, ou região do mesmo, em um padrão definido ou motivo de modificação de nucleobases. Em determinadas modalidades, as modificações de nucleobase são dispostas em um motivo de gapmer. Em determinadas modalidades, as modificações de nucleobase são dispostas em um motivo alternado. Em certas modalidades, cada nucleobase é modificada. Em determinadas modalidades, nenhuma das nucleobases é quimicamente modificada.
[00216] Em determinadas modalidades, os oligonucleotídeos compreendem um bloco de nucleobases modificadas. Nestas determinadas modalidades, o bloco está na extremidade 3' do oligonucleotídeo. Em determinadas modalidades o bloco está dentro de 3 nucleotídeos da extremidade 3' do oligonucleotídeo. Nestas determinadas modalidades, o bloco está na extremidade 5' do oligonucleotídeo. Em determinadas modalidades o bloco está dentro de 3 nucleotídeos da extremidade 5' do oligonucleotídeo.
[00217] Em determinadas modalidades, as modificações de nucleobase são uma função da base natural em uma posição específica do oligonucleotídeo. Por exemplo, em determinadas modalidades cada purina ou cada pirimidina em um oligonucleotídeo é modificada. Em certas modalidades, cada adenina é modificada. Em certas modalidades, cada guanina é modificada. Em certas modalidades, cada timina é modificada. Em certas modalidades, cada citosina é modificada. Em certas modalidades, cada uracila é modificada.
[00218] Em determinadas modalidades, algumas, todas, ou nenhuma das porções de citosina em um oligonucleotídeo são porções de 5-metilcitosina. Neste documento, 5-metilcitosina não é uma "nucleobase modificada." Nesse sentido, a menos que indicado de outra forma, as nucleobases sem modificações incluem ambos os resíduos de citosina com um 5-metil e aqueles que faltando um 5- metila. Em determinadas modalidades, o estado de metilação de todas ou algumas nucleobases da citosina é especificado.
[00219] Em determinadas modalidades, modificações químicas das nucleobases compreendem a fixação de determinados grupos de conjugado de nucleobases. Em determinadas modalidades, cada purina ou cada pirimidina em um oligonucleotídeo pode ser modificada, opcionalmente, para compreender um grupo conjugado.
d. Determinados Comprimentos Totais
[00220] Em determinadas modalidades, a presente descrição fornece oligonucleotídeos de qualquer dentre uma variedade de intervalos de comprimentos. Em determinadas modalidades, os oligonucleotídeos consistem em nucleosídeos ligados de X a Y, em que X representa o menor número de nucleosídeos no intervalo e Y representa o maior número de nucleosídeos no intervalo. Nestas determinadas modalidades, X e Y são cada um selecionados independentemente de 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, e 50; contanto que X- Y. Por exemplo, em determinadas modalidades, o oligonucleotídeo pode compreender de 8 a 9, 8 a 10, 8 a 11, 8 a 12, 8 a 13, 8 a 14, 8 a 15, 8 a 16, 8 a 17, 8 a 18, 8 a 19, 8 a 20, 8 a 21, 8 a 22, 8 a 23, 8 a 24, 8 a 25, 8 a 26, 8 a 27, 8 a 28, 8 a 29, 8 a 30, 9 a 10, 9 to 11, 9 a12, 9 a 13, 9 a 14, 9 a 15, 9 a 16, 9 a 17, 9 a 18, 9 a 19, 9 a 20, 9 a 21, 9 a 22, 9 a23, 9 a 24, 9 a 25, 9 a 26, 9 a 27, 9 a 28, 9 a 29, 9 a 30, 10 a 11, 10 a28, 26 a 29, 26 a 30, 27 a 28, 27 a 29, 27 a 30, 28 a 29, 28 a 30 ou de 29 a 30 nucleosídeos ligados. Em modalidades em que o número de nucleosídeos do oligonucleotídeo de um composto é limitado, seja para um intervalo ou para um número específico, o composto pode, no entanto, compreender adicionalmente outros substituintes adicionais. Por exemplo, um oligonucleotídeo compreendendo de 8-30 nucleosídeos exclui os oligonucleotídeos com 31 nucleosídeos, mas, salvo indicação em contrário, este um oligonucleotídeo pode ainda incluir, por exemplo, um ou mais grupos de conjugado, grupos terminais ou outros substituintes.
[00221] Além disso, em que um oligonucleotídeo é descrito por um intervalo de comprimento total e por regiões com comprimentos específicos, e em que a soma dos comprimentos especificados das regiões é menor que o limite superior do intervalo do comprimento total, podendo o oligonucleotídeo ter nucleosídeos adicionais, além daqueles das regiões determinadas, desde que o número total de nucleosídeos não exceda o limite superior do intervalo do comprimento total.
5. Determinados Motivos Químicos do Oligonucleotídeo Antissenso
[00222] Em determinadas modalidades, as características estruturais químicas dos oligonucleotídeos antissenso caracterizam-se por seu motivo de açúcar, motivo de ligação internucleosídeo, motivo de modificação de nucleobase e comprimento total. Em determinadas modalidades, estes parâmetros são independentes um do outro. Assim, cada ligação de internucleosídeo do oligonucleotídeo tendo um motivo de açúcar de gapmer pode ser modificada ou não modificada e pode ou não seguir o padrão de modificação de gapmer das modificações de açúcar. Assim, as ligações de internucleosídeo dentro das regiões asa de um açúcar-gapmer podem ser as mesmas ou podem ser diferentes uma da outra e podem ser as mesmas ou diferentes das ligações de internucleosídeo da região de lacuna. Da mesma forma, estes oligonucleotídeos de açúcar-gapmer podem incluir uma ou mais nucleobase modificada independente do padrão gapmer das modificações de açúcar. Alguém versado na técnica observará que estes motivos podem ser combinados para criar uma variedade de oligonucleotídeos.
[00223] Em determinadas modalidades, a seleção da ligação de internucleosídeo e modificação de nucleosídeos não são independentes uma da outra.i. Determinadas Sequências e Alvos
[00224] Em determinadas modalidades, a invenção fornece oligonucleotídeos antissenso tendo uma sequência complementar do ácido nucleico alvo. Estes compostos antissenso são capazes de hibridar a um ácido nucleico alvo, resultando em, pelo menos, uma atividade antissenso. Em determinadas modalidades, os compostos antissenso hibridizam especificamente a um ou mais ácido nucleico alvo. Em determinadas modalidades, um composto antissenso hibridizante especificamente tem uma sequência de nucleobase compreendendo uma região com complementaridade suficiente para que um ácido nucleico alvo permita a hibridação e resulte em atividade antissenso e complementaridade insuficiente para qualquer não alvo, para evitar ou reduzir a hibridação inespecífica das sequências de ácidos nucleicos não alvo nas condições em que a hibridação específica é desejada (por exemplo, sob condições fisiológicas para in vivo ou usos terapêuticos, e em condições em que os ensaios são realizados em caso de ensaios in vitro). Em determinadas modalidades, os oligonucleotídeos são selecionados entre um alvo e não alvo, apesar do alvo e não alvo compreenderem a sequência alvo. Nestas modalidades, a seletividade pode resultar da acessibilidade relativa da região alvo de uma molécula de ácido nucleico em comparação com o outro.
[00225] Em determinadas modalidades, a presente descrição fornece compostos antissenso compreendendo os oligonucleotídeos que são totalmente complementares ao ácido nucleico alvo em toda a extensão do oligonucleotídeo. Em determinadas modalidades, os oligonucleotídeos são 99% complementares ao ácido nucleico alvo. Em determinadas modalidades, os oligonucleotídeos são 95% complementares ao ácido nucleico alvo. Em determinadas modalidades, estes oligonucleotídeos são 90% complementares ao ácido nucleico alvo.
[00226] Em determinadas modalidades, estes oligonucleotídeos são 85% complementares ao ácido nucleico alvo. Em determinadas modalidades, estes oligonucleotídeos são 80% complementares ao ácido nucleico alvo. Em determinadas modalidades, um composto antissenso compreende uma região que é totalmente complementar ao ácido nucleico alvo e é, pelo menos, 80% complementar ao ácido nucleico alvo em todo o comprimento do oligonucleotídeo. Nestas determinadas modalidades, a região de complementaridade plena é de 6 a 14 nucleobases de comprimento.
[00227] Em determinadas modalidades, os oligonucleotídeos compreendem uma região hibridizante e uma terminal. Nestas determinadas modalidades, a região hibridizante consiste em 12-30 nucleosídeos ligados e é totalmente complementar ao ácido nucleico alvo. Em determinadas modalidades, a região hibridizante inclui uma incompatibilidade em relação ao ácido nucleico alvo. Em determinadas modalidades, a região hibridizante inclui duas incompatibilidades em relação ao ácido nucleico alvo. Em determinadas modalidades, a região hibridizante inclui três incompatibilidads em relação ao ácido nucleico alvo. Em determinadas modalidade, a região terminal consiste em 1-4 nucleosídeos terminais. Em determinadas modalidades, os nucleosídeos terminais estão na extremidade 3'. Em determinadas modalidades, um ou mais dos nucleosídeos terminais não são complementares ao ácido nucleico alvo.
[00228] Os mecanismos antissenso incluem qualquer mecanismo que envolva a hibridação de um oligonucleotídeo com ácido nucleico alvo, em que a hibridização resulta em um efeito biológico. Em determinadas modalidades, esses resultados de hibridação na degradação do ácido nucleico alvo ou na ocupação com inibição ou estimulação concomitantes da maquinaria celular envolvendo, por exemplo, translação, transcrição ou junção do ácido nucleico alvo.
[00229] Um tipo de mecanismo antissenso envolvendo a degradação do RNA alvo é antissenso mediado por RNase H. RNase H é uma endonuclease celular que cliva o filamento de RNA de um duplex de DNA. É conhecido na técnica que os compostos antissenso de filamento único que são "similares ao DNA" eliciam atividade de RNase H nas células de mamíferos. A ativação de RNase H, portanto, resulta na clivagem do RNA alvo, aumentando, assim, a eficiência da inibição mediada por oligonucleotídeo similar ao DNA da expressão do gene.
[00230] Em determinadas modalidades, um grupo conjugado compreende uma porção clivável. Em determinadas modalidades, um grupo conjugado compreende uma ou mais ligação clivável. Em determinadas modalidades, um grupo conjugado compreende um ligante. Em determinadas modalidades, um ligante compreende uma porção ligante de proteínas. Em determinadas modalidades, um grupo conjugado compreende uma porção de direcionamento de célula (também referido como um grupo de direcionamento de célula). Em determinadas modalidades uma porção direcionamento de célula compreende um grupo ramificado. Em determinadas modalidades, uma porção de direcionamento de célula compreende uma ou mais correntes. Em determinadas modalidades, uma porção de direcionamento de célula compreende um carboidrato ou agrupamento de carboidratos.ii. Determinadas Porções Cliváveis
[00231] Em determinadas modalidades, uma porção clivável é uma ligação clivável. Em determinadas modalidades, uma porção clivável compreende uma ligação clivável. Em determinadas modalidades, o grupo conjugado compreende uma porção clivável. Nestas determinadas modalidades, a porção clivável é afixada ao oligonucleotídeo antissenso. Nestas determinadas modalidades, a porção clivável é afixada diretamente a porção de direcionamento de célula. Nestas determinadas modalidades, a porção clivável é afixada ao ligante conjugado. Em determinadas modalidades, a porção compreende um fosfato ou fosfodiéster. Em determinadas modalidades, a porção clivável é um nucleosídeo clivável ou nucleosídeo análogo. Em determinadas modalidades, o nucleosídeo ou nucleosídeo análogo compreende uma base heterocíclica opcionalmente protegida, selecionada a partir de uma purina, purina substituída, pirimidina ou pirimidina substituída. Em determinadas modalidades, a porção clivável é um nucleosídeo que compreende uma base heterocíclica opcionalmente protegida selecionada de uracila, timina, citosina, 4-N-benzoilcitosina, 5-metilcitosina, 4-N- benzoil-5-metilcitosina, adenina, 6-N-benzoiladenina, guanina e 2-N- isobutirilguanina. Em determinadas modalidades, a porção clivável é 2'-deoxinucleosídeo que é afixado à posição 3' do oligonucleotídeo antissenso por uma ligação fosfodiéster e é afixado ao ligante por uma ligação de fosfodiéster ou fosforotioato. Em determinadas modalidades, a porção clivável é 2'-deoxiadenosina que é afixada à posição 3' do oligonucleotídeo antissenso por uma ligação de fosfodiéster e é afixada ao ligante por uma ligação fosfodiéster ou fosforotioato. Em determinadas modalidades, a porção clivável é 2'- deóxi adenosina que é afixado à posição 3' do oligonucleotídeo antissenso por uma ligação de fosfodiéster e é afixado ao ligante por uma ligação de fosfodiéster.
[00232] Em determinadas modalidades, a porção clivável é afixada à posição 3' do oligonucleotídeo antissenso. Nestas determinadas modalidades, a porção clivável é afixada à posição 5' do oligonucleotídeo antissenso. Em determinadas modalidades, a porção clivável é afixada à posição 2' do oligonucleotídeo antissenso. Em determinadas modalidades, a porção clivável é anexado ao oligonucleotídeo antissenso por uma ligação fosfodiéster. Em determinadas modalidades, a porção clivável é afixada ao ligante por uma ligação fosforotioato ou um fosfodiéster. Em determinadas modalidades, a porção clivável é afixado ao ligante por uma ligação de fosfodiéster. Em determinadas modalidades, o grupo conjugado não inclui uma porção clivável.
[00233] Em determinadas modalidades, a porção clivável é clivada depois que o complexo foi administrado a um animal somente após ser interiorizado por uma célula alvo. Dentro da célula a porção clivável é clivada liberando, desta forma, o oligonucleotídeo antissenso ativo. Embora não seja destinado a ser limitado pela teoria, acredita-se que a porção clivável é clivada por uma ou mais nucleases dentro da célula. Em determinadas modalidades, a uma ou mais nucleases clivam a ligação de fosfodiéster entre a porção clivável e o ligante. Em determinadas modalidades, a porção clivável tem uma estrutura selecionada dentre os seguintes:
[00234] em que cada um dos Bx, Bx1, Bx2, e Bx3 éindependentemente uma porção heterocíclica. Em determinadasmodalidades, a porção clivável tem uma estrutura selecionada dentreos seguintes:
iii. Determinados Ligantes
[00235] Em determinadas modalidades, os grupos conjugados compreendem um ligante. Em algumas dessas modalidades, o ligante está covalentemente ligado à porção clivável. Em algumas dessas modalidades, o ligante está covalentemente ligado ao oligonucleotídeo antissenso. Em determinadas modalidades, o ligante está covalentemente ligado a uma porção da célula-alvo. Em determinadas modalidades, o ligante compreende ainda uma ligação covalente com um suporte sólido. Em determinadas modalidades, o ligante compreende ainda uma ligação covalente com uma porção de ligação de proteínas. Em determinadas modalidades, o ligante compreende ainda uma ligação covalente com um suporte sólido e compreende ainda uma porção de ligação de proteínas. Em determinadas modalidades, o ligante inclui várias posições para anexação dos ligantes fixados. Em determinadas modalidades, o ligante inclui várias posições para anexação dos ligantes fixados e não está anexado a um grupo de ramificação. Em determinadas modalidades, o ligante compreende ainda uma ou mais ligação clivável. Em determinadas modalidades, o grupo conjugado não inclui um ligante.
[00236] Em determinadas modalidades, o ligante inclui pelo menos um grupo linear compreendendo grupos selecionados de alquila, amida, bissulfeto, polietilenoglicol, éter, tioéter (-S-) e hidroxilamina (grupos-O-N(H)--). Em determinadas modalidades, o grupo linear compreende grupos selecionados a partir de grupos alquila, amida e éter. Em determinadas modalidades, o grupo linear compreende grupos selecionados a partir de grupos alquil e éter. Em determinadas modalidades, o grupo linear compreende pelo menos um grupo ligação fósforo. Em determinadas modalidades, o grupo linear compreende pelo menos um grupo fosfodiéster. Em determinadas modalidades, o grupo linear inclui pelo menos um grupo ligante neutro. Em determinadas modalidades, o grupo linear está covalentemente anexado à porção de célula-alvo e à porção clivável. Em determinadas modalidades, o grupo linear está covalentemente anexado à porção de célula-alvo e ao oligonucleotídeo antissenso. Em determinadas modalidades, o grupo linear está covalentemente anexado à porção de célula-alvo, à porção clivável e a um suporte sólido. Em determinadas modalidades, o grupo linear está covalentemente anexado à porção de célula-alvo, à porção clivável, a um suporte sólido a uma porção ligante de proteína. Em determinadas modalidades, o grupo linear inclui uma ou mais ligações cliváveis.
[00237] Em determinadas modalidades, o ligante inclui o grupo linear covalentemente anexado a um grupo andaime (scaffold). Em determinadas modalidades, o andaime inclui um grupo alifático ramificado compreendendo grupos selecionados de alquil amida, bissulfeto, polietilenoglicol, éter, grupos tioéter e hidroxilamina. Em determinadas modalidades, o andaime inclui um grupo alifático ramificado compreendendo grupos selecionados a partir de grupos alquila, amida e éter. Em determinadas modalidades, o andaime inclui pelo menos um sistema de anéis mono ou policíclico. Em determinadas modalidades, o andaime inclui pelo menos dois sistemas de anel mono ou policíclico. Em determinadas modalidades, o grupo linear é covalentemente anexado ao grupo andaime e o grupo andaime é covalentemente anexado à porção clivável e ao ligante. Em determinadas modalidades, o grupo linear está covalentemente anexado ao grupo andaime e o grupo andaime está covalentemente anexado à porção clivável, ao ligante e ao suporte sólido. Em determinadas modalidades, o grupo linear está covalentemente anexado ao grupo andaime e o grupo andaime está covalentemente anexado à porção e a um grupo ligante de proteína. Em determinadas modalidades, o grupo linear está covalentemente ligado ao grupo andaime e o grupo andaime está covalentemente anexado à porção clivável, ao ligante, à porção ligante de proteína e a um suporte sólido. Em determinadas modalidades, o grupo linear inclui uma ou mais ligações cliváveis.
[00238] Em determinadas modalidades, o ligante inclui uma porção de ligação de proteínas. Em determinadas modalidades, a porção ligante de proteínas é um lipídio como, por exemplo, incluindo, entre outros, colesterol, ácido cólico, ácido acético de adamantano, ácido 1- pireno butírico, di-hidrotestosterona, 1,3-Bis-O(hexadecil)glicerol, grupo geranilóxi-hexila, hexadecilglicerol, borneol, mentol, 1,3- propanodiol, grupo heptadecila, ácido palmítico, ácido mirístico, ácido O3-(oleoil)litocólico, ácido O3-(oleoil) colênico, dimetoxitritil ou fenoxazina), uma vitamina (por exemplo, folato, vitamina A, vitamina E, biotina, piridoxal), um peptídeo, um carboidrato (por exemplo, monossacarídeo, dissacarídeo, trissacarídeo, tetrassacarídeo, oligossacarídeo, polissacarídeo), um componente endossomolítico, um esteroide (por exemplo, uvaol, hecigenina, diosgenina), um terpeno (por exemplo, triterpeno, por exemplo, sarsasapogenina, friedelina, ácido litocólico derivatizado de epifriedelanol) ou um lipídio catiônico. Em determinadas modalidades, a porção ligante de proteínas é um ácido graxo saturado ou insaturado de cadeia longa de C16 a C22, colesterol, ácido cólico, vitamina E, adamantano ou 1- pentafluoropropila.
[00239] Em determinadas modalidades, um ligante tem uma estrutura selecionada entre:
[00240] em que cada n é, independentemente, de 1 a 20; e p é de 1 a 6.
[00241] Em determinadas modalidades, um ligante tem umaestrutura selecionada entre:
[00242] em que n é, independentemente, de 1 a 20.
[00243] Em determinadas modalidades, um ligante tem uma estrutura selecionada entre:
[00244] em que n é de 1 a 20.
[00245] Em determinadas modalidades, um ligante tem uma estrutura selecionada entre:
[00246] em que cada L é, independentemente, um grupo ligante fósforo ou um grupo ligante neutro; e
[00247] cada n é, independentemente, de 1 a 20.
[00248] Em determinadas modalidades, um ligante tem uma estrutura selecionada entre:
[00249] Em determinadas modalidades, um ligante tem umaestrutura selecionada entre:
[00250]Em determinadas modalidades, um ligante tem umaestrutura selecionada entre:
[00251] Em determinadas modalidades, um ligante tem umaestrutura selecionada entre:
[00252] em que n é de 1 a 20.
[00253] Em determinadas modalidades, um ligante tem uma estrutura selecionada entre:
[00254] Em determinadas modalidades, um ligante tem uma
[00255] Em determinadas modalidades, um ligante tem umaestrutura selecionada entre:
[00256] Em determinadas modalidades, o ligante conjugado tem a estrutura:
[00257] Em determinadas modalidades, o ligante conjugado tem a estrutura:
[00258] Em determinadas modalidades, um ligante tem umaestrutura selecionada entre:
[00259] Em determinadas modalidades, um ligante tem umaestrutura selecionada entre:
[00260] em que cada n é independentemente 0, 1, 2, 3, 4, 5, 6 ou 7. iv. Determinadas Porções de Direcionamento de Célula
[00261] Em determinadas modalidades, os grupos conjugados compreendem porções de direcionamento de célula. Determinadas porções de direcionamento de célula aumentam a absorção celular de compostos antissenso. Em determinadas modalidades, as porções de célula-alvo compreendem um grupo de ramificação, um ou mais fixador e um ou mais ligante. Em determinadas modalidades, porções de célula-alvo compreendem um grupo de ramificação, um ou mais ligantes e uma ou mais ligação clivável.
1. Determinados Grupos de Ramificação
[00262] Em determinadas modalidades, os grupos conjugados compreendem uma porção de direcionamento compreendendo um grupo ramificação e pelo menos dois ligantes fixados. Em determinadas modalidades, o grupo de ramificação anexa o ligante conjugado. Em determinadas modalidades, o grupo de ramificação anexa a porção clivável. Em determinadas modalidades, o grupo de ramificação anexa o oligonucleotídeo antissenso. Em determinadas modalidades, o grupo de ramificação está covalentemente anexado ao vinculador e aos ligantes fixados. Em determinadas modalidades, o grupo de ramificação compreende um grupo alifático ramificado compreendendo grupos selecionados de alquil amida, bissulfeto, polietilenoglicol, éter, grupos tioéter e hidroxilamina. Em determinadas modalidades, o grupo de ramificação compreende grupos selecionados a partir de grupos alquila, amida e éter. Em determinadas modalidades, o grupo de ramificação compreende grupos selecionados a partir de grupos alquil e éter. Em determinadas modalidades, o grupo de ramificação compreende um sistema de anéis mono ou policíclicos. Em determinadas modalidades, o grupo de ramificação compreende uma ou mais ligação clivável. Em determinadas modalidades, o grupo conjugado não inclui um grupo de ramificação.
[00263] Em determinadas modalidades, um grupo de ramificação tem uma estrutura selecionada entre:
[00264] em que n é, independentemente, de 1 a 20.
[00265] j é de 1 a 3; e
[00266] m é de 2 a 6.
[00267] Em determinadas modalidades, um grupo de ramificaçãotem uma estrutura selecionada entre:
[00268] em que n é, independentemente, de 1 a 20; e
[00269] m é de 2 a 6.
[00270] Em determinadas modalidades, um grupo de ramificação tem uma estrutura selecionada entre:
[00271] Em determinadas modalidades, um grupo de ramificaçãotem uma estrutura selecionada entre:
[00272] em que cada A1 é, independentemente, O, S, C=O ou NH;
[00273] cada n é, independentemente, de 1 a 20.
[00274] Em determinadas modalidades, um grupo de ramificaçãotem uma estrutura selecionada entre:
[00275] em que cada A1 é, independentemente, O, S, C=O ou NH;
[00276] cada n é, independentemente, de 1 a 20.
[00277] Em determinadas modalidades, um grupo de ramificaçãotem uma estrutura selecionada entre:
[00278] em que A1 é O, S, C=O ou NH; e
[00279] cada n é, independentemente, de 1 a 20.
[00280] Em determinadas modalidades, um grupo de ramificaçãotem uma estrutura selecionada entre:
[00281] Em determinadas modalidades, um grupo de ramificaçãotem uma estrutura selecionada entre:
[00282] Em determinadas modalidades, um grupo de ramificaçãotem uma estrutura selecionada entre:
[00283] Em determinadas modalidades, os grupos conjugados compreendem um ou mais fixadores covalentemente anexados ao grupo de ramificação. Em determinadas modalidades, os grupos conjugados compreendem um ou mais fixadores covalentemente anexados ao grupo de ligação. Em determinadas modalidades, cada fixador é um grupo alifático linear, compreendendo um ou mais grupos selecionados de alquila, éter, tioéter, bissulfeto, amida e grupos de polietilenoglicol em qualquer combinação. Em determinadas modalidades, cada fixador é um grupo linear, compreendendo um ou mais grupos selecionados de alquila, éter, tioéter, bissulfeto, amida, fosfodiéster e grupos de polietilenoglicol em qualquer combinação. Em determinadas modalidades, cada fixador é um grupo linear, compreendendo um ou mais grupos selecionados de alquila, éter e amida em qualquer combinação. Em determinadas modalidades, cada fixador é um grupo alifático linear compreendendo um ou mais grupos selecionados de alquila, fosfodiéster, éter e grupos amida em qualquer combinação. Em determinadas modalidades, cada fixador é um grupo alifático linear compreendendo um ou mais grupos selecionados de alquil e fosfodiéster em qualquer combinação. Em determinadas modalidades, cada fixador compreende pelo menos um grupo de ligação fósforo ou grupo de ligação neutro.
[00284] Em determinadas modalidades, o fixador inclui uma ou mais ligações cliváveis. Em determinadas modalidades, a corrente é anexada ao grupo de ramificação através de ou uma Amida ou um grupo éter. Em determinadas modalidades, o fixador é anexado ao grupo ramificação por meio de um grupo fosfodiéster. Em determinadas modalidades, o fixador é anexado ao grupo de ramificação por meio de um grupo de ligação fósforo ou grupo de ligação neutro. Em determinadas modalidades, o fixador é anexado ao grupo ramificação por meio de um um grupo éter. Em determinadas modalidades, a corrente é anexada ao ligante por meio de um um grupo amida ou éter. Em determinadas modalidades, o fixador é anexado ao ligante por meio de um um grupo éter. Em determinadas modalidades, a corrente é anexada ao ligante por meio de um um grupo amida ou éter. Em determinadas modalidades, o fixador é anexado ao ligante por meio de um um grupo éter.
[00285] Em determinadas modalidades, cada fixador compreende de cerca de 8 a cerca de 20 átomos no comprimento da cadeia entre o ligante e o grupo de ramificação. Em determinadas modalidades, cada grupo fixador compreende de cerca de 10 a cerca de 18 átomos no comprimento da cadeia entre o ligante e o grupo de ramificação. Em determinadas modalidades, cada grupo fixador compreende de cerca de 13 átomos no comprimento da cadeia.
[00286] Em determinadas modalidades, um fixador tem uma estrutura selecionada entre:
[00287] em que n é, independentemente, de 1 a 20; e
[00288] cada p é de 1 a cerca de 6.
[00289] Em determinadas modalidades, um fixador tem uma estrutura selecionada entre:
[00290] Em determinadas modalidades, um fixador tem uma estrutura selecionada entre:
[00291] em que n é, independentemente, de 1 a 20.
[00292] Em determinadas modalidades, um fixador tem uma estrutura selecionada entre:
[00293] em que L é um grupo de ligação de fósforo ou um grupo de ligação neutro;
[00294] Z1 é C(=O)O-R2;
[00295] Z2 é H, alquila C1-C6 ou alquila C1-C6 substituída;
[00296] R2 é H, alquila C1-C6 ou alquila C1-C6 substituída; e
[00297] cada m1 é, independentemente, de 0 a 20, em que pelomenos um m1 é maior que 0 para cada corrente.
[00298] Em determinadas modalidades, um fixador tem uma estrutura selecionada entre:
[00299] Em determinadas modalidades, um fixador tem uma estrutura selecionada entre:
[00300] em que Z2 é H ou CH3; e
[00301] cada m1 é, independentemente, de 0 a 20, em que pelomenos um m1 é maior que 0 para cada corrente.
[00302] Em determinadas modalidades, um fixador tem uma estrutura selecionada entre:
[00303] em que cada n é independentemente 0, 1, 2, 3, 4, 5, 6 ou 7.
[00304] Em determinadas modalidades, um fixador compreende um grupo de ligação de fósforo. Em determinadas modalidades, uma corrente não compreende nenhuma ligação amida. Em determinadas modalidades, uma corrente compreende um grupo de ligação de fósforo e não compreende nenhuma ligação amida.
3. Determinados Ligantes
[00305] Em determinadas modalidades, a presente descrição fornece ligantes em que cada ligante é covalentemente anexado a um fixador. Em determinadas modalidades, cada ligante é selecionado para ter uma afinidade para pelo menos um tipo de receptor em uma célula-alvo. Em determinadas modalidades, os ligantes são selecionados para que tenham afinidade para pelo menos um tipo de receptor na superfície de uma célula hepática de mamífero. Em determinadas modalidades, os ligantes são selecionados para que tenham afinidade para pelo menos um receptor hepático de asialoglicoproteína (ASGP-R). Em determinadas modalidades, cada ligante é um carboidrato. Em determinadas modalidades, cada ligante é, selecionados independentemente da galactose, N-acetil galactosamina, manose, glicose, glicosamina e fucose. Em determinadas modalidades, cada ligante é N-acetil galactosamina (GalNAc). Em determinadas modalidades, a porção-alvo compreende 2 a 6 ligantes. Em determinadas modalidades, a porção-alvo compreende 3 ligantes. Em determinadas modalidades, a porção-alvo compreende 3 ligantes N-acetil galactosamina.
[00306] Em determinadas modalidades, o ligante é um carboidrato, derivado de carboidrato, carboidrato modificado, agrupamento de carboidrato multivalente, polissacarídeo, polissacarídeo modificado ou derivado de polissacarídeo. Em determinadas modalidades, o ligante é um açúcar aminado ou açúcar tio. Por exemplo, açúcares aminados podem ser selecionados de qualquer número de compostos conhecidos na técnica, por exemplo, glicosamina, ácido siálico, α-D- galactosamina, N-acetilgalactosamina, 2-acetamido-2-deóxi-D- galactopiranose (GalNAc), 2-Amina-3-O-[((R)-1-carboxietil]-2-deóxi-e- D-glicopiranose (e—ácido murâmico), 2-Deóxi-2-metilamina-L- glicopiranose, 4,6-Dideóxi-4-formamida-2,3-di-O-metil-D-manopiranose, 2-Deóxi-2-sulfoamina-D-glicopiranose e N-sulfo-D- glicosamina e N-Glicoloil-a-ácido neuramínico. Por exemplo, açúcares tiolados podem ser selecionados do grupo que consiste em 5-Tio-β-D- glicopiranose, Metil 2, 3,4-tri-O-acetil-1-tio-6-O- tritil-α-D- glicopiranosida, 4-Tio-β-D-galactopiranose e etil 3,4,6,7-tetra-O-acetil- 2-deóxi-1,5-ditio-a-D-glico-heptopiranosida.
[00307] Em determinadas modalidades, "GalNac" ou "Gal-NAc" se refere a 2-(Acetilamina)-2-deóxi-D-galactopiranose, comumente referido na literatura como N-acetil galactosamina. Em determinadas modalidades, "N-acetil galactosamina " se refere a 2-(Acetilamina)-2- deóxi-D-galactopiranose. Em determinadas modalidades, "GalNac" ou "Gal-NAc" se refere a 2-(Acetilamina)-2-deóxi-D-galactopiranose. Em determinadas modalidades, "GalNac" ou "Gal-NAc" se refere a 2- (Acetilamina)-2-deóxi-D-galactopiranose, que inclui a forma β: 2- (Acetilamina)-2-Deóxi-e-D-galactopiranose e forma a: 2-(Acetilamina)- 2-Deóxi-D-galactopiranose. Em determinadas modalidades, a forma β: 2-(Acetilamina)-2-Deóxi-e-D-galactopiranose e forma a: 2- (Acetilamina)-2-deóxi-D-galactopiranose pode ser usado de forma intercambiável. Portanto, nas estruturas em que uma forma é retratada, essas estruturas destinam-se a incluir a outra forma também. Por exemplo, se a estrutura para a forma a: 2-(Acetilamina)- 2-Deóxi-D-galactopiranose é mostrado, esta estrutura destina-se a incluir a outra forma também. Em determinadas modalidades, em determinadas modalidades preferenciais, a forma β 2-(Acetilamina)-2- deóxi-D-galactopiranose é a modalidade preferencial.


2-(Acetilamina)-2-de0xi-α-D-galactopiranose.
[00308] Em determinadas modalidades, um ou mais ligantes têmuma estrutura selecionada entre:
[00309] em que R1 é selecionado de OH e NHCOOH.
[00310] Em determinadas modalidades, um ou mais ligantes têm uma estrutura selecionada entre:
[00311] Em determinadas modalidades, um ou mais ligantes têmuma estrutura selecionada entre:
[00312] Em determinadas modalidades, um ou mais ligantes têm uma estrutura selecionada entre:
i. Determinados Conjugados
[00313] Em determinadas modalidades, os grupos conjugados compreendem as características estruturais acima. Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00314] em que n é, independentemente, de 1 a 20.
[00315] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00316] Em determinadas modalidades, os grupos conjugados têma seguinte estrutura:
[00317] em que n é, independentemente, de 1 a 20.
[00318] Z é H ou um suporte sólido ligante;
[00319] Q é um composto antissenso;
[00320] X é O ou S; e
[00321] Bx é uma porção base heterocíclica.
[00322] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00323] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00324] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00325] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00326] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00327] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00328] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00329] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00330] Em determinadas modalidades, os conjugados não compreendem uma pirrolidina.
[00331] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00332] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00333] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00334] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00335] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00336] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00337] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00338] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00339] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00340] Em determinadas modalidades, os grupos conjugados têma seguinte estrutura:
[00341] Em determinadas modalidades, os grupos conjugados têm a seguinte estrutura:
[00342] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00343] em que X é uma corrente substituída ou não substituída de seis a onze átomos consecutivamente ligados.
[00344] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00345] em que X é uma corrente substituída ou não substituída de dez átomos consecutivamente ligados.
[00346] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00347] em que X é uma corrente substituída ou não substituída de quatro a onze átomos consecutivamente ligados e em que a corrente compreende exatamente uma ligação amida.
[00348] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00349] em que Y e Z são independentemente selecionados de um grupo alquila, alquenila ou alquinila C1-C12 substituído ou não substituído ou um grupo compreendendo um éter, uma cetona, uma amida, um éster, um carbamato, uma amina, uma piperidina, um fosfato, uma fosfodiéster, um fosforotioato, um triazol, uma pirrolidina, um dissulfeto ou um tioéter.
[00350] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00351] em que Y e Z são independentemente selecionados de um grupo alquil substituído ou não substituído C1-C12, ou um grupo compreendendo exatamente um éter ou exatamente dois éteres, uma amida, uma amina, uma piperidina, um fosfato, um fosfodiéster ou um fosforotioato.
[00352] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00353] em que Y e Z são selecionados independentemente de um grupo alquil substituído ou não substituído C1-C12.
[00354] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00355] em que m e n são selecionados independentemente de 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 e 12.
[00356] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00357] em que m é 4, 5, 6, 7 ou 8, e n é 1, 2, 3 ou 4.
[00358] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00359] em que X é uma corrente substituída ou não substituída de quatro a treze átomos ligados consecutivamente, e em que X não compreende um grupo éter.
[00360] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00361] em que X é uma corrente substituída ou não substituída de oito átomos consecutivamente ligados, e em que X não compreende um grupo éter.
[00362] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00363] em que X é uma corrente substituída ou não substituída de quatro a treze átomos consecutivamente ligados e em que a corrente compreende exatamente uma ligação amida, e em que X não compreende um grupo éter.
[00364] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00365] em que X é uma corrente substituída ou não substituída de quatro a treze átomos ligados consecutivamente e em que a corrente consiste em uma ligação amida e um grupo alquila C2-C11 substituído ou não substituído.
[00366] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00367] em que Y é independentemente selecionado de um grupo alquila, alquenila ou alquinila C1-C12 substituído ou não substituído ou um grupo compreendendo um éter, uma cetona, uma amida, um éster, um carbamato, uma amina, uma piperidina, um fosfato, uma fosfodiéster, um fosforotioato, um triazol, uma pirrolidina, um dissulfeto ou um tioéter.
[00368] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00369] em que Y é selecionado a partir de um grupo alquila C1-C12 substituído ou não substituído, ou um grupo compreendendo um éter, uma amina, uma piperidina, um fosfato, um fosfodiéster ou um fosforotioato.
[00370] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00371] em que Y é selecionado de um grupo alquila C1-C12 substituído ou não substituído.
[00372] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
[00373] em que n é 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 ou 12.
[00374] Em determinadas modalidades, a porção de célula-alvo do grupo conjugado tem a seguinte estrutura:
em que n é 4, 5, 6, 7 ou 8.b. Determinados compostos antissenso conjugados
[00375] Em determinadas modalidades, os conjugados estão ligados a um nucleosídeo do oligonucleotídeo antissenso nas posições 2', 3', 5' do nucleosídeo. Em determinadas modalidades, um composto antissenso conjugado tem a seguinte estrutura:
[00376] em que
[00377] A é o oligonucleotídeo antissenso;
[00378] B é a porção clivável
[00379] C é o ligante do conjugado
[00380] D é o grupo de ramificação
[00381] cada E é uma corrente;
[00382] cada F é um ligante; e
[00383] q é um número inteiro entre 1 e 5.
[00384] Em determinadas modalidades, um composto antissenso conjugado tem a seguinte estrutura:
[00385] em que
[00386] A é o oligonucleotídeo antissenso;
[00387] C é o ligante do conjugado
[00388] D é o grupo de ramificação
[00389] cada E é uma corrente;
[00390] cada F é um ligante; e
[00391] q é um número inteiro entre 1 e 5.
[00392] Em determinadas modalidades, o ligante conjugado compreende pelo menos uma ligação clivável.
[00393] Em determinadas modalidades, o grupo de ramificação compreende pelo menos uma ligação clivável.
[00394] Em determinadas modalidades, cada corrente compreende pelo menos uma ligação clivável.
[00395] Em determinadas modalidades, os conjugados estão ligados a um nucleosídeo do oligonucleotídeo antissenso nas posições 2', 3', 5' do nucleosídeo.
[00396] Em determinadas modalidades, um composto antissenso conjugado tem a seguinte estrutura:
[00397] em que
[00398] A é o oligonucleotídeo antissenso;
[00399] B é a porção clivável
[00400] C é o ligante do conjugado
[00401] cada E é uma corrente;
[00402] cada F é um ligante; e
[00403] q é um número inteiro entre 1 e 5.
[00404] Em determinadas modalidades, os conjugados estão ligados a um nucleosídeo do oligonucleotídeo antissenso nas posições 2', 3', 5' do nucleosídeo. Em determinadas modalidades, um composto antissenso conjugado tem a seguinte estrutura:
[00405] em que
[00406] A é o oligonucleotídeo antissenso;
[00407] C é o ligante do conjugado
[00408] cada E é uma corrente;
[00409] cada F é um ligante; e
[00410] q é um número inteiro entre 1 e 5.
[00411] Em determinadas modalidades, um composto antissenso conjugado tem a seguinte estrutura:
[00412] em que
[00413] A é o oligonucleotídeo antissenso;
[00414] B é a porção clivável
[00415] D é o grupo de ramificação
[00416] cada E é uma corrente;
[00417] cada F é um ligante; e
[00418] q é um número inteiro entre 1 e 5.
[00419] Em determinadas modalidades, um composto antissenso conjugado tem a seguinte estrutura:
[00420] em que
[00421] A é o oligonucleotídeo antissenso;
[00422] D é o grupo de ramificação
[00423] cada E é uma corrente;
[00424] cada F é um ligante; e
[00425] q é um número inteiro entre 1 e 5.
[00426] Em determinadas modalidades, o ligante conjugado compreende pelo menos uma ligação clivável.
[00427] Em determinadas modalidades, cada corrente compreende pelo menos uma ligação clivável.
[00428] Em determinadas modalidades, um composto antissenso conjugado tem uma estrutura selecionada entre os itens a seguir:Porção alvo
[00429] Em determinadas modalidades, um composto antissensoconjugado tem uma estrutura selecionada entre os itens a seguir:
[00430] Em determinadas modalidades, um composto antissenso conjugado tem uma estrutura selecionada entre os itens a seguir:
[00431] As patentes dos Estados Unidos representativas, as publicações do pedido de patente dos Estados Unidos e publicações do pedido de patente internacional que ensinam a preparação de certos conjugados observados acima, compostos antissenso conjugados, fixadores, grupos de ramificação, ligantes, porções cliváveis, bem como outras modificações incluem, sem limitação, U.S. N° 5.994.517, U.S. N° 6.300.319, U.S. N° 6.660.720, U.S. N° 6.906.182, U.S. N° 7.262.177, U.S. N° 7.491.805, U.S. N° 8.106.022, U.S. N° 7.723.509, U.S. N° 2006/0148740, U.S. N° 2011/0123520, WO 2013/033230 e WO 2012/037254, sendo que cada um é incorporado por referência a este documento na íntegra.
[00432] Publicações representativas que ensinam a preparação de certos conjugados observados acima, compostos antissenso conjugados, fixadores, ligantes, grupos de ramificação, ligantes, porções cliváveis, bem como outras modificações incluem, sem limitação, BIESSEN et al, "The Cholesterol Derivative of a Triantennary Galactoside with High Affinity for the Hepatic Asialoglycoprotein Receptor: a Potent Cholesterol Lowering Agent" J. Med. Chem. (1995) 38:1846-1852, BIESSEN et al., "Synthesis of Cluster Galactosides with High Affinity for the Hepatic Asialoglycoprotein Receptor" J. Med. Chem. (1995) 38:1538-1546, LEE et al., "New and more efficient multivalent glyco-ligands for asialoglycoprotein receptor of mammalian hepatocytes" Bioorganic & Medicinal Chemistry (2011) 19:2494-2500, RENSEN et al., "Determination of the Upper Size Limit for Uptake and Processing of Ligands by the Asialoglycoprotein Receptor on Hepatocytes in Vitro and in Vivo" J. Biol. Chem. (2001) 276(40):37577- 37584, RENSEN et al., "Design and Synthesis of Novel N- Acetylgalactosamine-Terminated Glycolipids for Targeting of Lipoproteins to the Hepatic Asialoglycoprotein Receptor" J. Med. Chem. (2004) 47:5798-5808, SLIEDREGT et al., "Design and Synthesis of Novel Amphiphilic Dendritic Galactosides for Selective Targeting of Liposomes to the Hepatic Asialoglycoprotein Receptor" J. Med. Chem. (1999) 42:609-618, e Valentijn et al., "Solid-phase synthesis of lysine-based cluster galactosides with high affinity for the Asialoglycoprotein Receptor" Tetrahedron, 1997, 53(2), 759-770, sendo que cada um desses itens é incorporado por referência a este documento em sua integralidade.
[00433] Em determinadas modalidades, os compostos antissenso conjugados compreendem um oligonucleotídeo à base de RNase H (como gapmer) ou um oligonucleotídeo de modulação de splice (como um oligonucleotídeo completamente modificado) e qualquer grupo conjugado compreendendo pelo menos um, dois ou três grupos GalNAc. Em determinadas modalidades, um composto antissenso conjugado compreende qualquer grupo conjugado encontrado em qualquer uma das seguintes referências: Lee, Carbohydr Res, 1978, 67, 509-514; Connolly et al., J Biol Chem, 1982, 257, 939-945; Pavia et al., Int J Pep Protein Res, 1983, 22, 539-548; Lee et al., Biochem, 1984, 23, 4255-4261; Lee et al., Glycoconjugate J, 1987, 4, 317-328; Toyokuni et al., Tetrahedron Lett, 1990, 31, 2673-2676; Biessen et al., J Med Chem, 1995, 38, 1538-1546; Valentijn et al., Tetrahedron, 1997, 53, 759-770; Kim et al., Tetrahedron Lett, 1997, 38, 3487-3490; Lee et al., Bioconjug Chem, 1997, 8, 762-765; Kato et al., Glycobiol, 2001, 11, 821-829; Rensen et al., J Biol Chem, 2001, 276, 37577-37584; Lee et al., Methods Enzymol, 2003, 362, 38-43; Westerlind et al., Glycoconj J, 2004, 21, 227-241; Lee et al., Bioorg Med Chem Lett, 2006, 16(19), 5132-5135; Maierhofer et al., Bioorg Med Chem, 2007, 15, 7661-7676; Khorev et al., Bioorg Med Chem, 2008, 16, 5216-5231; Lee et al., Bioorg Med Chem, 2011, 19, 2494-2500; Kornilova et al., Analyt Biochem, 2012, 425, 43-46; Pujol et al., Angew Chemie Int Ed Engl, 2012, 51, 7445-7448; Biessen et al., J Med Chem, 1995, 38, 18461852; Sliedregt et al., J Med Chem, 1999, 42, 609-618; Rensen et al., J Med Chem, 2004, 47, 5798-5808; Rensen et al., Arterioscler Thromb Vasc Biol, 2006, 26, 169-175; van Rossenberg et al., Gene Ther, 2004, 11, 457-464; Sato et al., J Am Chem Soc, 2004, 126, 14013-14022; Lee et al., J Org Chem, 2012, 77, 7564-7571; Biessen et al., FASEB J, 2000, 14, 1784-1792; Rajur et al., Bioconjug Chem, 1997, 8, 935-940; Duff et al., Methods Enzymol, 2000, 313, 297-321; Maier et al., Bioconjug Chem, 2003, 14, 18-29; Jayaprakash et al., Org Lett, 2010, 12, 5410-5413; Manoharan, Antisense Nucleic Acid Drug Dev, 2002, 12, 103-128; Merwin et al., Bioconjug Chem, 1994, 5, 612-620; Tomiya et al., Bioorg Med Chem, 2013, 21, 5275-5281; International applications WO1998/013381; WO2011/038356; WO1997/046098; WO2008/098788; WO2004/101619; WO2012/037254;WO2011/120053; WO2011/100131; WO2011/163121; WO2012/089602; WO2013/166121; WO2013/165816; Patentes U.S N° 4.751.219; 8.552.163; 6.908.903; 7.262.177; 5.99 4.517; 6.300.319 8.106.022; 7.491.805; 7.491.805; 7.582.744; 8.137.695; 6.383.812 6.525.031; 6.660.720; 7.723.509; 8.541.548; 8.344.125; 8.313.772 8.349.308; 8.450.467; 8.501.930; 8.158.601; 7.262.177; 6.906.1826.620.916; 8.435.491; 8.404.862; 7.851.615; Publicações de Pedido dePatente U.S. N° US2011/0097264; US2011/0097265;US2013/0004427; US2005/0164235; US2006/0148740;US2008/0281044; US2010/0240730; US2003/0119724;US2006/0183886; US2008/0206869; US2011/0269814;US2009/0286973; US2011/0207799; US2012/0136042;US2012/0165393; US2008/0281041; US2009/0203135;US2012/0035115; US2012/0095075; US2012/0101148;US2012/0128760; US2012/0157509; US2012/0230938;US2013/0109817; US2013/0121954; US2013/0178512;US2013/0236968; US2011/0123520; US2003/0077829;US2008/0108801; e US2009/0203132; sendo que cada um deles éincorporado por referência na íntegra.
C. DETERMINADOS USOS E RECURSOS
[00434] Em determinadas modalidades, os compostos antissenso conjugados apresentam redução de RNA-alvo potente in vivo. Em determinadas modalidades, os compostos antissenso não conjugados se acumulam nos rins. Em determinadas modalidades, os compostos antissenso conjugados se acumulam no fígado. Em determinadas modalidades, os compostos antissenso conjugados são bem tolerados. Essas propriedades rendem compostos antissenso conjugados particularmente úteis para inibição de muitos RNAs alvo, incluindo, entre outros, aqueles envolvidos em doenças metabólicas, cardiovasculares e outras doença, distúrbios ou condições. Assim, neste documento são apresentados métodos de tratamento dessas doenças, distúrbios ou condições contactando tecidos do fígado com os compostos antissenso conjugados direcionados aos RNAs associados a essas doenças, distúrbios ou condições. Assim, são também apresentados métodos para atenuar qualquer variedade de doenças metabólicas, cardiovasculares e outras doenças ou condições com os compostos antissenso conjugados da presente invenção.
[00435] Em determinadas modalidades, compostos antissenso conjugados são mais potentes do que a contraparte não conjugada em uma concentração de tecido específica. Sem querer se vincular a qualquer teoria ou mecanismo, em determinadas modalidades, o conjugado pode permitir que o composto antissenso conjugado entre na célula de maneira mais eficiente ou entre na célula de forma mais produtiva. Por exemplo, em determinadas modalidades os compostos antissenso conjugados podem apresentar uma redução-alvo maior em comparação com a sua contraparte não conjugada, em que o composto antissenso conjugado e sua contraparte não conjugada estão presentes no tecido nas mesmas concentrações. Por exemplo, em determinadas modalidades, os compostos antissenso conjugados podem apresentar redução-alvo maior em comparação com a sua contraparte não conjugada, em que o composto antissenso conjugado e sua contraparte não conjugada estão presentes no fígado nas mesmas concentrações.
[00436] A absorção produtiva e não produtiva de oligonucleotídeos foi discutida anteriormente (Ver, por exemplo, Geary, R. S., Wancewicz E., et al. (2009). "Effect of Dose and Plasma Concentration on Liver Uptake and Pharmacologic Activity of a 2'-Methoxyethyl Modified Chimeric Antisense Oligonucleotide Targeting PTEN." Biochem. Pharmacol. 78(3): 284-91; & Koller, E., T. M. Vincent, et al. (2011). "Mechanisms of single-stranded phosphorothioate modified antissenso oligonucleotide accumulation in hepatocytes." Nucleic Acids Res. 39(11): 4795-807). Os grupos conjugados aqui descritos podem melhorar a absorção produtiva.
[00437] Em determinadas modalidades, os grupos conjugados aqui descritos podem melhorar ainda mais a potência aumentando a afinidade do composto antissenso conjugado para um determinado tipo de célula ou tecido. Em determinadas modalidades, os grupos conjugados aqui descritos podem melhorar ainda mais a potência aumentando o reconhecimento do composto antissenso conjugado por um ou mais receptores de superfície da célula. Em determinadas modalidades, os grupos conjugados aqui descritos podem melhorar ainda mais a potência facilitando a endocitose do composto antissenso conjugado.
[00438] Em determinadas modalidades, a porção clivável pode melhorar ainda mais a potência permitindo que o conjugado seja clivado a partir do oligonucleotídeo antissenso após a entrada do composto antissenso na célula. Por conseguinte, em determinadas modalidades, os compostos antissenso conjugados podem ser administrados em doses menores do que seriam necessárias para os oligonucleotídeos antissenso não conjugados.
[00439] As ligações fosforotioato foram incorporadas aos oligonucleotídeos antissenso anteriormente. Essas ligações fosforotioato são resistentes às nucleases e, assim, melhoram a estabilidade do oligonucleotídeo. Além disso, as ligações de fosforotioato também ligam certas proteínas, o que resulta em acúmulo de oligonucleotídeo no fígado. Oligonucleotídeos com menos ligações fosforotioato acumulam menos no fígado e mais no rim (ver, por exemplo, Geary, R., "Pharmacokinetic Properties of 2'-O-(2- Methoxyethyl)-Modified Oligonucleotide Analogs in Rats," Journal of Pharmacology and Experimental Therapeutics, Vol. 296, N° 3, 890897; & Pharmacological Properties of 2'-O-Methoxyethyl Modified Oligonucleotides in Antisense a Drug Technology, Chapter 10, Crooke, S.T.,ed., 2008). Em determinadas modalidades, oligonucleotides com menos ligações internucleosídeas de fosforotioato e mais ligações internucleosídeas de fosfodiéster acumulam menos no fígado e mais no rim. Ao tratar doenças no fígado, não é desejável, por vários motivos (1) que menos fármacos entrem no sítio de ação desejado (fígado); (2) que os fármacos saiam na urina; e (3) que os rins sejam expostos a uma concentração relativamente alta de fármacos que podem resultar em toxicidade nos rins. Assim, para doenças do fígado, as ligações fosforotioato apresentam benefícios importantes.
[00440] Em determinadas modalidades, no entanto, a administração dos oligonucleotides uniformemente ligados pelas ligações internucleosídeas de fosforotioato induz uma ou mais reações pró- inflamatórias. (ver, por exemplo: J Lab Clin Med. Set 1996;128(3):329- 38. "Amplification of antibody production by phosphorothioate oligodeoxynucleotides". Branda et al.; e ver, por exemplo: Toxicologic Properties in Antisense a Drug Technology, Capítulo 12, páginas 342-351, Crooke, S.T., ed., 2008). Em determinadas modalidades, a administração de oligonucleotídeos em que a maioria das ligações internucleosídeas compreendem ligações internucleosídeas de fosforotioato induz uma ou mais reações pró-inflamatórias.
[00441] Em determinadas modalidades, o grau de efeito pró- inflamatório pode depender de várias variáveis (por exemplo, modificação da estrutura principal, efeitos fora do alvo, modificações nucleobásicas e/ou modificações nucleosídeas) ver, por exemplo: Toxicologic Properties in Antisense a Drug Technology, Capítulo 12, páginas 342-351, Crooke, S.T., ed., 2008). Em determinadas modalidades, o grau de efeito pró-inflamatório pode ser atenuado pelo ajuste de uma ou mais variáveis. Por exemplo, o grau de efeito pró- inflamatório de um determinado oligonucleotídeo pode ser mitigado pela substituição de qualquer número de ligações internucleosídeas de fosfotioato com ligações internucleosídeas de fosfodiéster reduzindo, assim, o número total de ligações internucleosídeas de fosforotioato.
[00442] Em determinadas modalidades, seria desejável para reduzir o número de ligações fósfortioato, se isso pudesse ser feito sem perder a estabilidade e sem mudar a distribuição do fígado para o rim. Por exemplo, em determinadas modalidades, o número de ligações de fósforotiotato pode ser reduzido pela substituição das ligações de fosforotioato com ligações de fosfodiéster. Em uma modalidade, o composto antissenso que tem menos ligações fosforotioato e mais ligações fosfodiéster podem induzir menos reações pró-inflamatórias ou nenhuma reação pró-inflamatória. Embora o composto antissenso tenha menos ligações fosforotioato e que mais ligações fosfodiéster possam induzir menos reações pró-inflamatórias, o composto antissenso que tem menos ligações fosforotioato e mais ligações fosfodiéster não podem ser acumuladas no fígado e pode ser menos eficazes na dose igual ou similar em comparação com um composto antissenso que tem mais ligações fosforotioato. Em determinadas modalidades é, portanto, desejável projetar um composto antissenso que tenha várias ligações fosfodiéster e várias ligações fosforotioato, mas que possua também estabilidade e boa distribuição no fígado.
[00443] Em determinadas modalidades, os compostos antissenso conjugados se acumulam mais no fígado e menos nos rins do que contrapartes não conjugadas, até mesmo quando algumas ligações fosforotioato são substituídas por ligações internucleosídeas de fosfodiéster menos pró-inflamatórias. Em determinadas modalidades, os compostos antissenso conjugados se acumulam mais no fígado e não são tão excretados na urina em comparação com suas contrapartes não conjugadas, até mesmo quando algumas das ligações fosforotioato são substituídas por ligações internucleosídeas de fosfodiéster menos pró-inflamatórias. Em determinadas modalidades, o uso de um conjugado permite a concepção de fármacos antissenso mais potentes e melhor toleradas. Com efeito, em determinadas modalidades, os compostos antissenso conjugados têm índices terapêuticos maiores do que as contrapartes não conjugadas. Isso permite que o composto antissenso conjugado seja administrado em uma dose absoluta maior, porque há um risco menor de uma resposta pró-inflmatória e menor risco de toxicidade renal. Esta dose maior, permite que a dose tenha uma frequência menor, já que se espera que o clearance (metabolismo) seja semelhante. Além disso, porque o composto é mais potente, como descrito acima, a concentração pode diminuir antes da próxima dose sem perder a atividade terapêutica, permitindo até mesmo períodos mais longos entre dosagem.
[00444] Em determinadas modalidades, a inclusão de algumas ligações de fosforotioato continuam desejáveis. Por exemplo, as ligações terminais são vulneráveis às exonucleases e, assim, em determinadas modalidades, essas ligações são fosforotioato ou outra ligação modificada. As ligações internucleosídeas que ligam dois desoxinucleosídeos são vulneráveis às endonucleases e, assim, em determinadas modalidades, essas ligações são de fosforotioato ou outra ligação modificada. As ligações internucleosídeas entre um nucleosídeo modificado e desoxinucleosídeo em que o desoxinucleosídeo está no lado 5' dos desoxinucleosídeos da ligação são vulneráveis às endonucleases e, assim, em determinadas modalidades, essas ligações são de fosforotioato ou outra ligação modificada. As ligações internucleosídeas entre dois nucleosídeos modificados de certos tipos e entre um desoxinucleosídeo e um nucleosídeo modificado de certo tipo em que o nucleosídeo modificado está no lado 5' da ligação são suficientemente resistentes à digestão da nuclease, que a ligação pode ser fosfodiéster.
[00445] Em determinadas modalidades, o oligonucleotídeo antissenso de um composto antissenso conjugado compreende menos de 16 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto compreende menos que 15 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto antissenso conjugado compreende menos de 14 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto compreende menos que 13 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto antissenso conjugado compreende menos de 12 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto antissenso conjugado compreende menos de 11 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto antissenso conjugado compreende menos de 10 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto antissenso conjugado compreende menos de 9 ligações de fosforotioato. Em determinadas modalidades, o oligonucleotídeo antissenso de um composto antissenso conjugado compreende menos de 8 ligações de fosforotioato.
[00446] Em determinadas modalidades, os compostos antissenso compreendendo um ou mais grupos conjugados aqui descritos aumentaram a atividade e/ou potência e/ou tolerabilidade em comparação com um composto antissenso sem um ou mais grupo conjugado. Nesse sentido, em determinadas modalidades, a anexação desses grupos conjugados a um oligonucleotídeo é desejável. Esses grupos conjugados podem ser anexados às extremidades 5'-, e/ou 3'- de um oligonucleotídeo. Em certos casos, a anexação na extremidade 5' é sinteticamente desejável. Normalmente, os oligonucleotídeos são sintetizados pela anexação do nucleosídeo terminal 3' a um suporte sólido e acoplamento seqüêncial de nucleosídeos de 3' a 5' usando técnicas que são bem conhecidas na técnica. Nesse sentido, se um grupo conjugado é desejado no terminal 3', é possível (1) anexar o grupo conjugado ao nucleosídeo do terminal 3' e anexar esse nucleosídeo conjugado ao suporte sólido para preparação subseqüente do oligonucleotídeo ou (2) anexar o grupo conjugado ao nucleosídeo do terminal 3' de um nucleosídeo completo após a síntese. Nenhuma dessas abordagens é muito eficiente, portanto, ambas são caras. Em particular, a anexação do nucleosídeo conjugado ao suporte sólido, demonstrada nos Exemplos deste documento, é um processo ineficiente. Em determinadas modalidades, anexar um grupo conjugado ao nucleosídeo do terminal 5' é sinteticamente mais fácil do que a anexação na extremidade 3'. É possível anexar um nucleosídeo do terminal 3' não conjugado ao suporte sólido e preparar o oligonucleotídeo usando reações padrão e bem caracterizadas. Assim, é necessário apenas anexar um nucleosídeo 5' tendo um grupo conjugado na etapa final de acoplamento. Em determinadas modalidades, isto é mais eficiente do que a anexação direta de um nucleosídeo conjugado ao suporte sólido, como normalmente é feito para preparar o oligonucleotídeo conjugado em 3'. Os exemplos neste documento demonstram anexação na extremidade 5'. Além disso, certos grupos conjugados têm vantagens sintéticas. Por exemplo, certos grupos conjugados compreendendo grupos de ligação de fósforo são sinteticamente mais simples e mais eficientemente preparados do que outros grupos conjugados, incluindo grupos conjugados relatados anteriormente (por exemplo, WO/2012/037254).
[00447] Em determinadas modalidades, os compostos antissenso conjugados são administrados a um indivíduo. Em determinadas modalidades, os compostos antissenso compreendendo um ou mais grupos conjugados aqui descritos aumentaram a atividade e/ou potência e/ou tolerabilidade em comparação com um composto antissenso sem um ou mais grupo conjugado. Sem vinculação ao mecanismo, acredita-se que o grupo conjugado ajuda com a distribuição, entrega e/ou absorção em uma célula ou tecido-alvo. Em determinadas modalidades, assim que estiver na célula ou tecido-alvo, é desejável que todo ou parte do grupo conjugado seja clivado para liberar o oligonucleotídeo ativo. Em determinadas modalidades, não é necessário que o grupo conjugado inteiro seja clivado a partir do oligonucleotídeo. Por exemplo, no Exemplo 20, um oligonucleotídeo conjugado foi administrado a camundongos e várias espécies químicas diferentes, sendo que cada uma compreende uma parte diferente do grupo conjugado restante no oligonucleotídeo, foram detectadas (Tabela 10a). Este composto antissenso conjugado demonstrou boa potência (Tabela 10). Assim, em determinadas modalidades, esse perfil metabólito de várias clivagens parciais do grupo conjugado não interfere na atividade/potência. No entanto, em determinadas modalidades, é desejável que um profármaco (oligonucleotídeo conjugados) produza um composto ativo único. Em certos casos, se várias formas do composto ativo forem encontradas, pode ser necessário determinar quantidades relativas e atividades para cada um. Em determinadas modalidades em que a revisão da regulamentação é necessária (por exemplo, USFDA ou análogo) é desejável ter uma espécie ativa única (ou predominantemente única). Em determinadas modalidades, é desejável que espécies ativas únicas sejam o oligonucleotídeo antissenso desprovido de qualquer parte do grupo conjugado. Em determinadas modalidades, os grupos conjugados na extremidade 5' são mais propensos a resultar em metabolismo completo do grupo conjugado. Sem vinculação ao mecanismo, pode ser que as enzimas endógenas responsáveis pelo metabolismo na extremidade 5' (por exemplo, nucleases 5') sejam mais ativas/eficientes do que as contrapartes 3'. Em determinadas modalidades, os grupos conjugados específicos são mais receptivos a metabolismo de uma espécie ativa única. Em determinadas modalidades, certos grupos conjugados são mais receptivos ao metabolismo do oligonucleotídeo.
D. ANTISSENSO
[00448] Em determinadas modalidades, os compostos oligoméricos da presente invenção são compostos antissenso. Nessas modalidades, o composto oligomérico é complementar ao ácido nucleico alvo. Em determinadas modalidades, um ácido nucleico alvo é um RNA. Em determinadas modalidades, um ácido nucleico alvo é um RNA não codificante. Em determinadas modalidades, um ácido nucleico alvo codifica uma proteína. Em determinadas modalidades, um ácido nucleico alvo é selecionado a partir de um mRNA, um pré- mRNA, um micro-RNA, um RNA não codificante, incluindo um RNA não codificante pequeno e um RNA direcionado pelo promotor. Em determinadas modalidades, os compostos oligoméricos são pelo menos parcialmente complementares a mais de um ácido nucleico alvo. Por exemplo, compostos oligoméricos da presente invenção podem ser imitações de micro-RNA, que normalmente se ligam a vários alvos.
[00449] Em determinadas modalidades, os compostos antissenso compreendem uma parte tendo uma sequência de nucleobase pelo menos 70% complementar à sequência de ácido nucleico alvo. Em determinadas modalidades, os compostos antissenso compreendem uma parte que tem uma sequência de nucleobase pelo menos 80% complementar à sequência de ácido nucleico alvo. Em determinadas modalidades, os compostos antissenso compreendem uma parte que tem uma sequência de nucleobase pelo menos 90% complementar à sequência de ácido nucleico alvo. Em determinadas modalidades, os compostos antissenso compõem uma parte tendo uma sequência de nucleobase pelo menos 95% complementar à sequência de nucleobase do ácido nucleico alvo. Em determinadas modalidades, os compostos antissenso compreendem uma parte que tem uma sequência de nucleobase pelo menos 98% complementar à sequência de nucleobase de ácido nucleico alvo. Em determinadas modalidades, os compostos antissenso compreendem uma parte que tem uma sequência de nucleobase que é 100% complementar à sequência de nucleobase de ácido nucleico alvo. Em determinadas modalidades, os compostos antissenso são pelo menos 70%, 80%, 90%, 95%, 98% ou 100% complementares à sequência de nucleobase de um ácido nucleico alvo em toda a extensão do composto antissenso.
[00450] Os mecanismos antissenso incluem qualquer mecanismo que envolva a hibridação de um composto oligoméricos com ácido nucleico alvo, em que a hibridização resulta em um efeito biológico. Em determinadas modalidades, esses resultados de hibridação na degradação do ácido nucleico alvo ou na ocupação com inibição ou estimulação concomitantes da maquinaria celular envolvendo, por exemplo, tradução, transcrição ou poliadenilação do ácido nucleico alvo ou de um ácido nucleico com o qual o ácido nucleico alvo pode, de outro modo, interagir.
[00451] Um tipo de mecanismo antissenso envolvendo a degradação do RNA alvo é antissenso mediado por RNase H. RNase H é uma endonuclease celular que cliva o filamento de RNA de um duplex de RNA:DNA. É conhecido na técnica que os compostos antissenso de filamento único que são "similares ao DNA" eliciam atividade de RNase H nas células de mamíferos. A ativação de RNase H, portanto, resulta na clivagem do RNA alvo, aumentando, assim, a eficiência da inibição mediada por oligonucleotídeo similar ao DNA da expressão do gene.
[00452] Os mecanismos antissenso também incluem, sem limitação, mecanismos de RNAi, que utilizam a via RISC. Esses mecanismos de RNAi incluem, sem limitação, mecanismos de siRNA, ssRNA e micro-RNA. Esses mecanismos incluem a criação de uma imitação de micro-RNA e/ou anti-micro-RNA.
[00453] Mecanismos antissenso incluem também, sem limitação, mecanismos que hibridizam ou imitam RNA não codificante diferente do micro-RNA ou mRNA. Esse RNA não codificante inclui, entre outros, RNA direcionado ao promotor e RNA curto e longo que dar efeito à transcrição ou tradução de um ou mais ácidos nucleicos.
[00454] Em determinadas modalidades, os oligonucleotídeos que compreendem conjugados aqui descritos são compostos de RNAi. Em determinadas modalidades, oligonucleotídeos oligoméricos que compreendem conjugados aqui descritos são compostos de ssRNA. Em determinadas modalidades, os oligonucleotídeos que compreendem conjugados aqui descritos são emparelhados com um segundo composto oligomérico para formar um siRNA. Em algumas dessas modalidades, o segundo composto oligomérico também compreende um conjugado. Em determinadas modalidades, o segundo composto oligomérico é qualquer ácido nucleico modificado ou não modificado. Em determinadas modalidades, os oligonucleotídeos que compreendem conjugados aqui descritos são um filamento antissenso em um composto de siRNA. Em determinadas modalidades, os oligonucleotídeos que compreendem os conjugados aqui descritos são um filamento sense em um composto de siRNA. Em modalidades em que o composto oligomérico conjugado é siRNA de fita dupla, o conjugado pode estar na fita sense, na fita antissenso ou na fita sense e na fita antissenso.D. ÁCIDOS NUCLEICOS, REGIÕES E SEGMENTOS ALVO
[00455] Em determinadas modalidades, os compostos antissenso conjugados direcionam qualquer ácido nucleico. Em determinadas modalidades, o ácido nucleico alvo codifica uma proteína alvo que é clinicamente relevante. Nessas modalidades, a modulação do ácido nucleico alvo resulta em benefício clínico. Certos ácidos nucleicos alvo incluem, entre outros, ácidos nucleicos alvo ilustrados na Tabela 1.TABELA 1: Determinados Ácidos Nucleicos Alvo
[00456] O processo de direcionamento inclui, geralmente, determinação de pelo menos uma região, segmento ou sítio-alvo no ácido nucleico alvo para que a interação antissenso ocorra de modo que resulte no efeito desejado.
[00457] Em determinadas modalidades, uma região alvo é uma região estruturalmente definida do ácido nucleico. Por exemplo, nessas modalidades, uma região-alvo pode abranger UTR 3', UTR 5', um éxon, um íntron, uma região codificante, uma região de iniciação da tradução, região de término de tradução ou outra região ou definida de ácido nucleico ou segmento-alvo.
[00458] Em determinadas modalidades, um segmento-alvo é pelo menos uma parte de cerca de 8 nucleobases de uma região-alvo à qual o composto antissenso conjugado se direciona. Os segmentos- alvo podem incluir sequências de DNA ou RNA que compreendem pelo menos 8 nucleobases consecutivas do terminal 5' de um dos segmentos-alvo (sendo que as nucleobases remanescentes são um trecho consecutivo do mesmo DNA ou RNA iniciando imediatamente a montante do terminal 5' do segmento-alvo e continuando até o DNA ou o RNA que compreende cerca de 8 a cerca de 30 nucleobases). Segmentos-alvo também são representados por sequências de DNA ou RNA que compreendem pelo menos 8 nucleobases consecutivos de terminal 3' de um dos segmentos-alvo (sendo que as nucleobases remanescentes são um trecho consecutivo do mesmo DNA ou RNA iniciando imediatamente a jusante do terminal 3' do segmento-alvo e continuando até o DNA ou o RNA que compreende cerca de 8 a 30 nucleobases). Segmentos-alvo também são representados por sequências de DNA ou RNA que compreendem pelo menos 8 nucleobases consecutivas de uma parte interna da sequência de um segmento-alvo e pode se estender em ambas as direções até o composto antissenso conjugado que compreende cerca de 8 a 30 nucleobases.
[00459] Em determinadas modalidades, os compostos antissenso direcionados aos ácidos nucleicos listados na Tabela 1 podem ser modificados conforme descrito neste documento. Em determinadas modalidades, os compostos antissenso podem ter uma porção de açúcar modificado, uma porção de açúcar não modificado ou uma mistura de porções de açúcar modificado e não modificado conforme descrito neste documento. Em determinadas modalidades, os compostos antissenso podem ter uma ligação de internucleosídeo modificado, uma ligação de internucleosídeo não modificado ou uma ligação de internucleosídeo modificado e não modificado conforme descrito neste documento. Em determinadas modalidades, os compostos antissenso podem ter uma nucleobase modificada, uma nucleobase não modificada ou uma mistura de nucleobases modificadas e não modificadas conforme descrito neste documento. Em determinadas modalidades, os compostos antissenso podem ter um motivo, conforme descrito neste documento.
[00460] Em determinadas modalidades, os compostos antissenso direcionados aos ácidos nucleicos listados na Tabela 1 podem ser conjugados conforme descrito neste documento.
1. Hepatite B (HBV)
[00461] A hepatite B é uma doença viral transmitida por via parentérica por material contaminado, como sangue e seus produtos derivados, agulhas contaminadas, sexual e verticalmente de mães infectadas ou portadoras para seus descendentes. A Organização Mundial de Saúde estimou que mais de 2 bilhões de pessoas foram infectadas em todo o mundo, com cerca de 4 milhões de casos agudos ao ano, 1 milhão de mortes ao ano e 350-400 milhões de portadores crônicos (Organização Mundial da Saúde: Geographic Prevalence of Hepatitis B Prevalence, 2004. http://www.who.int/vaccines- surveillance/graphics/htmls/hepbprev.htm).
[00462] O vírus HBV é um vírus hepatotrópico de fita dupla que infecta apenas humanos e primatas não humanos. A replicação viral ocorre predominantemente no fígado e, em menor extensão, nos rins, pâncreas, medula óssea e baço Hepatitis B virus biology. Microbiol Mol Biol Rev. 64: 2000; 51-68.). Os marcadores virais e imunológicos são detectáveis no sangue e os padrões antígeno-anticorpo característicos evoluem ao longo do tempo. O primeiro marcador viral detectável é HBsAg, seguido da hepatite B e antígeno (HBeAg) e DNA HBV. Os títulos podem ser elevados durante o período de incubação, mas os níveis de DNA HBV e HBeAg começam a diminuir no início da doença e podem ser indetectáveis no momento de pico da doença clínica (infecção pelo vírus da Hepatite B - histórico natural e consequências clínicas. N Engl J Med.. 350: 2004; 1118-1129). HBeAg é um marcador viral detectável no sangue e se correlaciona com a replicação viral ativa, e, por conseguinte, com a alta carga viral e infecciosidade (Hepatitis B e antigen—the dangerous end game of hepatitis B. N Engl J Med. 347 2002; 208-210). A presença de anticorpos anti-Anti-HBsAb e anti-HBcAb (IgG) indica a recuperação e a imunidade em um indivíduo infectado previamente.
[00463] Atualmente, as terapias recomendadas para infecção crônica pelo HBV pela American Association for the Study of Liver Diseases (AASLD) e pela European Association for the Study of the Liver (EASL) incluem interferon alfa (INFα), interferon peguilado alfa- 2a (Peg-IFN2a), entecavir e tenofovir. As terapias com nucleosídeos e nucleobases, entecavir e tenofovir, são bem-sucedidas na redução da carga viral, mas as taxas de seroconversão de HBeAg e de perda de HBsAg são ainda mais baixas do que as obtidas usando a terapia IFNα. Outras terapias similares, incluindo a lamivudina (3TC), telbivudina (LDT) e adefovir são também utilizadas, mas para as terapias com nucleosídeo/nucleobase em geral, o surgimento de resistência limita a eficácia terapêutica.
[00464] Assim, há uma necessidade na técnica de descobrir e desenvolver terapias antivirais novas. Além disso, há uma necessidade de novas terapias anti-HBV capazes de aumentar as taxas de seroconversão de HBeAg e HBsAg. Pesquisa clínica recente encontrou uma correlação entre a seroconversão e reduções em HBeAg (Fried et al (2008) Hepatology 47: 428) e reduções em HBsAg (Moucari et al (2009) Hepatology 49: 1151). As reduções nos níveis de antígeno podem ter permitido controle imunológico da infecção por HBV porque os altos níveis de antígenos devem ter se dado para induzir a tolerância imunológica. As terapias atuais com nucleosídeos para HBV são capazes de reduções drásticas nos níveis séricos de HBV, mas têm pouco impacto sobre os níveis de HBeAg e HBsAg.
[00465] Compostos antissenso que direcionam o HBV foram previamente divulgados no WO2011/047312, WO2012/145674 e WO2012/145697, incorporados a este documento por referência na sua totalidade. Estudos clínicos são planejados para avaliar o efeito dos compostos antissenso que direcionam HBV em pacientes. No entanto, ainda há a necessidade de fornecer aos pacientes opções de tratamento adicionais e mais potentes.
Determinados Compostos Antissenso Conjugados Direcionados a um Ácido Nucleico de HBV
[00466] Em determinadas modalidades, os compostos antissenso conjugados são direcionados a um ácido nucleico de HBV tendo sequência do N° de Acesso GENBANK® U95551.1, incorporado a este documento como SEQ ID NO: 1. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 é pelo menos 90%, pelo menos 95% ou 100% complementar a SEQ ID NO: 1.
[00467] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 3. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 3.
[00468] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 4. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 4.
[00469] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 5. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 5.
[00470] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 6. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 6.
[00471] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 7. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 7.
[00472] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 8. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 8.
[00473] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 9. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 9.
[00474] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 10. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 10.
[00475] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 11. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreende uma sequência de nucleobase da SEQ ID NO: 11.TABELA 2: Compostos Antissenso direcionados à SEQ ID NO deHBV: 1
[00476] Em determinadas modalidades, um composto compreende ou consiste em ISIS 505358 e um grupo conjugado. ISIS 505358 é um oligonucleotídeo modificado com a fórmula: Ges mCes Aes Ges Aes Gds Gds Tds Gds Ads Ads Gds mCds Gds Ads Aes Ges Tes Ges mCe, em que
[00477] A = uma adenina,
[00478] mC = a 5'-metilcitosina
[00479] G = uma guanina,
[00480] T = uma timina,
[00481] e = um nucleosídeo modificado 2'-O-metoxietila,
[00482] d = um 2'-desoxinucleosídeo, e
[00483] s = uma ligação internucleosídea de fosforotioato.
[00484] Em determinadas modalidades, um composto compreende ou consiste em ISIS 509934 e um grupo conjugado. ISIS 509934 é um oligonucleotídeo modificado com a fórmula: mCes mCes Aes Aes Tes Tds Tds Ads Tds Gds mCds mCds Tds Ads mCds Aes Ges mCes mCes Te, em que,
[00485] A = uma adenina,
[00486] mC = a 5'-metilcitosina
[00487] G = uma guanina,
[00488] T = uma timina,
[00489] e = um nucleosídeo modificado 2'-O-metoxietila,
[00490] d = um 2'-desoxinucleosídeo, e
[00491] s = uma ligação internucleosídea de fosforotioato.
[00492] Em determinadas modalidades, um composto compreende ou consiste em ISIS 510100 e um grupo conjugado. ISIS 510100 é um oligonucleotídeo modificado com a fórmula: Ges Ges mCes Ads Tds Ads Gds mCds Ads Gds mCds Ads Gds Ges Aes Tes Ge, em que,
[00493] A = uma adenina,
[00494] mC = a 5'-metilcitosina
[00495] G = uma guanina,
[00496] T = uma timina,
[00497] e = um nucleosídeo modificado 2'-O-metoxietila,
[00498] d = um 2'-desoxinucleosídeo, e
[00499] s = uma ligação internucleosídea de fosforotioato.
[00500] Em determinadas modalidades, um composto compreende ou consiste em ISIS 552023 e um grupo conjugado. ISIS 552023 é um oligonucleotídeo modificado com a fórmula: Aes Ges Ges Aes Ges Tes Tds mCds mCds Gds mCds Ads Gds Tds Ads Tds Ges Ges Aes Te, em que,
[00501] A = uma adenina,
[00502] mC = a 5'-metilcitosina
[00503] G = uma guanina,
[00504] T = uma timina,
[00505] e = um nucleosídeo modificado 2'-O-metoxietila,
[00506] d = um 2'-desoxinucleosídeo, e
[00507] s = uma ligação internucleosídea de fosforotioato.
[00508] Em determinadas modalidades, um composto compreende ou consiste em ISIS 552024 e um grupo conjugado. ISIS 552024 é um oligonucleotídeo modificado com a fórmula: Ges Tes Ges Aes Aes Ges mCds Gds Ads Ads Gds Tds Gds mCds Ads mCds Aes mCes Ges Ge, em que,
[00509] A = uma adenina,
[00510] mC = a 5'-metilcitosina
[00511] G = uma guanina,
[00512] T = uma timina,
[00513] e = um nucleosídeo modificado 2'-O-metoxietila,
[00514] d = um 2'-desoxinucleosídeo, e
[00515] s = uma ligação internucleosídea de fosforotioato.
[00516] Em determinadas modalidades, um composto compreende ou consiste em ISIS 552032 e um grupo conjugado. ISIS 552032 é um oligonucleotídeo modificado com a fórmula: Ges Tes Ges mCes Aes Ges Ads Gds Gds Tds Gds Ads Ads Gds mCds Gds Aes Aes Ges Te, em que,
[00517] A = uma adenina,
[00518] mC = a 5'-metilcitosina
[00519] G = uma guanina,
[00520] T = uma timina,
[00521] e = um nucleosídeo modificado 2'-O-metoxietila,
[00522] d = um 2'-desoxinucleosídeo, e
[00523] s = uma ligação internucleosídea de fosforotioato.
[00524] Em determinadas modalidades, um composto compreende ou consiste em ISIS 552859 e um grupo conjugado. ISIS 552859 é um oligonucleotídeo modificado com a fórmula: Aes Gks Gks Tds Gds Ads Ads Gds mCds Gds Ads Ads Gds Tks Gks mCe, em que,
[00525] A = uma adenina,
[00526] mC = a 5'-metilcitosina
[00527] G = uma guanina,
[00528] T = uma timina,
[00529] e = um nucleosídeo modificado 2'-O-metoxietila,
[00530] k = um nucleosídeo modificado cEt,
[00531] d = um 2'-desoxinucleosídeo, e
[00532] s = uma ligação internucleosídea de fosforotioato.
[00533] Em determinadas modalidades, um composto compreende ou consiste em ISIS 552925 e um grupo conjugado. ISIS 552925 é um oligonucleotídeo modificado com a fórmula: Tes mCks mCds Gds mCds Ads Gds Tds Ads Tds Gds Gds Aks Tes mCks Ge, em que,
[00534] A = uma adenina,
[00535] mC = a 5'-metilcitosina
[00536] G = uma guanina,
[00537] T = uma timina,
[00538] e = um nucleosídeo modificado 2'-O-metoxietila,
[00539] k = um nucleosídeo modificado cEt,
[00540] d = um 2'-desoxinucleosídeo, e
[00541] s = uma ligação internucleosídea de fosforotioato.
[00542] s = uma ligação internucleosídea de fosforotioato.
[00543] Em determinadas modalidades, um composto compreende ou consiste em ISIS 577119 e um grupo conjugado. ISIS 577119 é um oligonucleotídeo modificado com a fórmula: Aks Ads Tks Tds Tks Ads Tds Gds mCds mCds Tds Ads mCds Aes Ges mCes mCes Te, em que,
[00544] A = uma adenina,
[00545] mC = a 5'-metilcitosina
[00546] G = uma guanina,
[00547] T = uma timina,
[00548] e = um nucleosídeo modificado 2'-O-metoxietila,
[00549] k = um nucleosídeo modificado cEt,
[00550] d = um 2'-desoxinucleosídeo, e
[00551] s = uma ligação internucleosídea de fosforotioato.
[00552] Em determinadas modalidades, um composto com a seguinte estrutura química compreende ou consiste em ISIS 505358 com 5'-X, em que X é um grupo conjugado conforme descrito neste documento:
[00553] Em determinadas modalidades, um composto compreende ou consiste em ISIS 712408 com a seguinte estrutura química:
[00554] Em determinadas modalidades, um composto compreende ou consiste em ISIS 695324 com a seguinte estrutura química:
[00555] Em determinadas modalidades, um composto compreende ou consiste em SEQ ID NO: 3, 5'-GalNAc e as modificações químicas representadas pela estrutura química a seguir:
[00556] em que R1 é -OCH2CH2OCH3 (MOE) e R2 é H; ou R1 e R2 formam, em conjunto, uma ponte, em que R1 é O- e R2 é -CH2-, - CH(CH3)-, ou -CH2CH2-, e R1 e R2 são diretamente conectados de modo que a ponte resultante seja selecionada dentre: -O-CH2-, -O- CH(CH3)-, e -O-CH2CH2-;
[00557] e para cada par de R3 e R4 no mesmo anel, independentemente para cada anel: R3 é selecionado a partir de H e - OCH2CH2OCH3 e R4 é H; ou R3 e R4 formam, em conjunto, uma ponte em que R3 é -O-, e R4 é -CH2-, -CH(CH3)-, ou -CH2CH2-e R3 e R4 são conectados diretamente de modo que a ponte resultante seja selecionada dentre: -O-CH2-, -O-CH(CH3)-, e -O-CH2CH2-;
[00558] e R5 é selecionado dentre H e -CH3;
[00559] e Z é selecionado dentre S- e O-.
[00560] Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso divulgado no WO 2012/145697, que é incorporado por referência na íntegra a este documento e um grupo conjugado mencionado neste instrumento. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso que possui uma sequência de nucleobases de quaisquer SEQ ID NOs 5-310, 321-802, 804-1272, 1288-1350, 1364-1372, 1375, 1376 e 1379 divulgadas no WO 2012/145697 e um grupo conjugado aqui descrito. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso divulgado no WO 2011/047312 que é incorporado por referência na íntegra a este documento e um grupo conjugado mencionado neste instrumento. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso que possui uma sequência de nucleobases de quaisquer SEQ ID NOs 14-22 divulgadas no WO 2011/ 047312 e um grupo conjugado aqui descrito. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso divulgado no WO 2012/145674, que é incorporado por referência na íntegra a este documento e um grupo conjugado mencionado neste instrumento. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso que possui uma sequência de nucleobases de quaisquer SEQ ID NOs 18-35 divulgadas em 2012/145674. Em determinadas modalidades, um composto compreende um oligonucleotídeo de fita dupla divulgado no WO 2013/159109, que é incorporado por referência na íntegra a este documento e um grupo conjugado mencionado neste instrumento. Em determinadas modalidades, um composto compreende um oligonucleotídeo de fita dupla em que uma fita tem uma sequência de nucleobase de SEQ ID NOs 30-125 divulgadas no WO 2013/159109. As sequências de nucleobases de todas as SEQ ID NOs supracitadas são incorporadas por referência.
Indicações Terapêuticas do HBV
[00561] Em determinadas modalidades, a invenção fornece métodos para o uso de um composto antissenso conjugado direcionado a um ácido nucleico do HBV para modular a expressão do HBV em um indivíduo. Em determinadas modalidades, a expressão do HBV é reduzida.
[00562] Em determinadas modalidades, a invenção provê métodos para o uso de um composto antissenso conjugado direcionado a um ácido nucleico do HBV em uma composição farmacêutica para o tratamento de um indivíduo. Em determinadas modalidades, o indivíduo tem uma condição relacionada ao HBV. Em determinadas modalidades, a condição relacionada ao HBV inclui, entre outros, infecção crônica por HBV, inflamação, fibrose, cirrose, câncer do fígado, hepatite sérica, icterícia, câncer de fígado, inflamação do fígado, fibrose hepática, cirrose hepática, insuficiência hepática, doença inflamatória hepatocelular difusa, síndrome hemofagocítica, hepatite do soro, e viremia por HBV. Em determinadas modalidades, a condição relacionada ao HBV pode ter sintomas que podem incluir: síndrome gripal, fraqueza, dores, dor de cabeça, febre, perda de apetite, diarreia, icterícia, náuseas e vômitos, dor sobre o fígado, fezes com cor de argila ou de cor cinza, coceira generalizada, urina escura combinada com um teste positivo para a presença do vírus da Hepatite B, antígeno viral da hepatite B, ou um teste positivo para a presença de um anticorpo específico para o antígeno viral da hepatite B. Em determinadas modalidades, o indivíduo está em risco de uma condição relacionada ao HBV. Isso inclui indivíduos que têm um ou mais fatores de risco para o desenvolvimento de uma condição relacionada ao HBV, incluindo a exposição sexual a um indivíduo infectado com o vírus da hepatite B, viver na mesma casa que um indivíduo com infecção pelo vírus da hepatite B ao longo da vida, exposição ao sangue humano infectado pelo vírus da hepatite B, injeção de fármacos ilícitas, ser uma pessoa que tem hemofilia, e visitar uma área em que a hepatite B é comum. Em determinadas modalidades, o indivíduo foi identificado como necessitando de tratamento para uma condição relacionada ao HBV.
[00563] Determinadas modalidades fornecem um método de redução dos níveis de antígeno do DNA de HBV e/ou HBV em um animal infectado por HBV compreendendo a administração a um animal de um composto antissenso conjugado direcionado a um ácido nucleico do HBV. Em determinadas modalidades, o antígeno é HBsAG ou HBeAG. Em determinadas modalidades, a quantidade de antígeno HBV pode ser suficientemente reduzida para resultar em seroconversão.
[00564] Em determinadas modalidades, a invenção provê métodos para o uso de um composto antissenso conjugado direcionado a um ácido nucleico do HBV na preparação de um medicamento.
[00565] Em determinadas modalidades, a invenção fornece um composto antissenso conjugado direcionado a um ácido nucleico do HBV ou seu sal farmaceuticamente aceitável para ser usado na terapia.
[00566] Determinadas modalidades fornecem um composto antissenso conjugado direcionado a um ácido nucleico de HBV para ser usado no tratamento de uma condição relacionados ao HBV. A condição relacionada ao HBV inclui, entre outras, infecção crônica por HBV, inflamação, fibrose, cirrose, câncer do fígado, hepatite sérica, icterícia, câncer de fígado, inflamação do fígado, fibrose hepática, cirrose hepática, insuficiência hepática, doença inflamatória hepatocelular difusa, síndrome hemofagocítica, hepatite do soro, e viremia por HBV.
[00567] Determinadas modalidades fornecem um composto antissenso conjugado direcionado ao ácido nucleico de HBV para ser usado na redução de níveis de antígeno do DNA de HBV e/ou HBV em um animal infectado por HBV compreendendo a administração a um animal de um composto antissenso conjugado direcionado a um ácido nucleico do HBV. Em determinadas modalidades, o antígeno é HBsAG ou HBeAG. Em determinadas modalidades, a quantidade de antígeno HBV pode ser suficientemente reduzida para resultar em seroconversão.
[00568] Será entendido que quaisquer compostos descritos neste documento podem ser usados nos métodos e usos supracitados. Por exemplo, em determinadas modalidades, um composto antissenso conjugado direcionado a um ácido nucleico de HBV nos métodos e usos supracitados podem incluir, entre outros, um composto antissenso conjugado direcionado à SEQ ID NO: 1 compreendendo pelo menos uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NOs: 3-11; um composto antissenso conjugado direcionados à SEQ ID NO: 1 compreendendo uma sequência de nucleobases da SEQ ID NOs: 3-11; um composto que compreende ou consiste em ISIS 505358, ISIS 509934, ISIS 510100, ISIS 552023, ISIS 552024, ISIS 552032, ISIS 552859, ISIS 552925 ou ISIS 577119 e um grupo conjugado; um composto que compreende um oligonucleotídeo antissenso divulgado no WO 2012/145697, que é incorporada por referência na íntegra a este documento e um grupo conjugado; um composto que compreende um oligonucleotídeo antissenso com uma sequência de nucleobase de SEQ ID NOs 5-310, 321-802, 804-1272, 1288-1350, 1364-1372, 1375, 1376 e 1379 divulgadas no WO 2012/145697 e um grupo conjugado descrito neste documento; um composto que compreende um oligonucleotídeo com uma sequência de nucleobase de SEQ ID NOs 14-22 divulgada no WO 2011/047312 e um grupo conjugado descrito neste documento; um composto que compreende um oligonucleotídeo antissenso com uma sequência de nucleobase de SEQ ID NOs 18-35 divulgada no WO 2012/145674; ou um composto que compreende um oligonucleotídeo de fita dupla em que uma fita tem uma sequência de nucleobase de SEQ ID NOs 30-125 divulgada no WO 2013/159109.
2. Transtirretina (TTR)
[00569] A TTR (conhecida também como pré-albumina, hipertiotoxinemia, tiroxina disprealbuminêmica; amiloidose sistêmica senila, polineuropatia amiloide, amiloidose I, PALB; HST2651 distranstiretinêmica; TBPA; hipertiroxinemia eutiroidal disprealbuminêmica) é um soro/plasma e proteína do fluido cefalorraquidiano responsável pelo transporte de tiroxina e retinol (Sakaki et al, Mol Biol Med. 1989, 6:161-8). Estruturalmente, TTR é um homotetrâmero; mutações pontuais e enrolamento incorreto da proteína conduzem à deposição de fibrilhas amiloides e estão associados aos distúrbios alimentares, como amiloidose senil sistêmica (SSA), polineuropatia amiloide familiar (FAP) e cardiopatia amiloide familiar (FAC).
[00570] A TTR é sintetizada principalmente pelo fígado e pelo plexo coroide do cérebro e, em menor grau, pela retina em seres humanos (Palha, Clin Chem Lab Med,2002, 40, 1292-1300). A transtirretina que é sintetizada no fígado é segregada no sangue, ao passo que transtirretina originária no plexo coroide é destinado ao CSF. No plexo coroide, a síntese de transtirretina representa cerca de 20% da síntese de proteína local total e tanto quanto 25% do total de proteína CSF (Dickson et al., J Biol Chem, 1986, 261, 3475-3478).
[00571] Com a disponibilidade de testes diagnósticos genéticos e imuno-histoquímicos, os pacientes com amiloidose de TTR foram encontrados em muitas nações em todo o mundo. Estudos recentes indicam que amiloidose TTR não é uma doença endêmica rara como se pensava anteriormente, e pode afetar até 25% da população idosa (Tanskanen et al, Ann Med. 2008;40(3):232-9).
[00572] Ao nível bioquímico, a TTR foi identificada como o principal componente proteico nos depósitos amiloides de pacientes com FAP (Costa et al, Proc. Natl. Acad. Sci. EUA 1978, 75:4499-4503) e, posteriormente, uma substituição de metionina para valina na posição 30 da proteína foi constatada como sendo o defeito molecular mais comum que causa a doença (Saraiva et al, J. Clin. Invest. 1984, 74: 104-119). Em FAP, deposição extracelular sistêmica generalizada de agregados de TTR e fibrilas amiloides ocorre ao longo do tecido conectivo, especialmente no sistema nervoso periférico (Sousa and Saraiva, Prog. Neurobiol. 2003, 71: 385-400). Após a deposição de TTR, ocorre degeneração axonal, iniciando nas fibras amielinizadas e mielinizadas de pequeno diâmetro, e, finalmente, levando à perda neuronal em locais ganglionares.
[00573] Compostos antissenso que direcionam a TTR foram previamente divulgados nos US2005/0244869, WO2010/017509 e WO2011/139917, incorporados a este documento por referência na sua totalidade. Um oligonucleotídeo antissenso que direciona TTR, ISIS-TTRRx, está atualmente em ensaios clínicos de Fase 2/3 para estudar a sua eficácia no tratamento de indivíduos com Polineuropatia Amiloidótica Familiar. No entanto, ainda há a necessidade de oferecer aos pacientes opções de tratamento adicionais e mais potentes. Certos Compostos Antissenso Conjugados Direcionados a um Ácido Nucleico de TTR
[00574] Em determinadas modalidades, os compostos antissenso conjugados são direcionados a um ácido nucleico de TTR tendo sequência do N° de Acesso GENBANK® NM_000371.3, incorporado a este documento como SEQ ID NO: 2. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 é pelo menos 90%, pelo menos 95% ou 100% complementar a SEQ ID NO: 2.
[00575] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende pelo menos uma sequência de 8 nucleobases consecutivas da SEQ ID NOs: 12-19. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobases da SEQ ID NOs: 12-19.
[00576] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 12. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobase da SEQ ID NO: 12.
[00577] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 13. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobase da SEQ ID NO: 13.
[00578] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 14. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobase da SEQ ID NO: 14.
[00579] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 15. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobase da SEQ ID NO: 15.
[00580] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 16 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 78. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 16 compreende uma sequência de nucleobase da SEQ ID NO: 78.
[00581] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 17. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobase da SEQ ID NO: 17.
[00582] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 18. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobase da SEQ ID NO: 18.
[00583] Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de pelo menos 8 nucleobases consecutivas da SEQ ID NO: 19. Em determinadas modalidades, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreende uma sequência de nucleobase da SEQ ID NO: 19.TABELA 3: Compostos Antissenso direcionados à SEQ ID NO de HBV: 2)
[00584] Em determinadas modalidades, um composto compreende ou consiste em ISIS 420915 e um grupo conjugado. ISIS 420915 é um oligonucleotídeo modificado com a fórmula: Tes mCes Tes Tes Ges Gds Tds Tds Ads mCds Ads Tds Gds Ads Ads Aes Tes mCes mCes mCe, em que
[00585] A = uma adenina,
[00586] mC = a 5'-metilcitosina
[00587] G = uma guanina,
[00588] T = uma timina,
[00589] e = um nucleosídeo modificado 2'-O-metoxietila,
[00590] d = um 2'-desoxinucleosídeo, e
[00591] s = uma ligação internucleosídea de fosforotioato.
[00592] Em determinadas modalidades, um composto compreende ou consiste em ISIS 304299 e um grupo conjugado. ISIS 304299 é um oligonucleotídeo modificado com a fórmula: mCes Tes Tes Ges Ges Tds Tds Ads mCds Ads Tds Gds Ads Ads Ads Tes mCes mCes mCes Ae, em que
[00593] A = uma adenina,
[00594] mC = a 5'-metilcitosina
[00595] G = uma guanina,
[00596] T = uma timina,
[00597] e = um nucleosídeo modificado 2'-O-metoxietila,
[00598] d = um 2'-desoxinucleosídeo, e
[00599] s = uma ligação internucleosídea de fosforotioato.
[00600] Em determinadas modalidades, um composto compreende ou consiste em ISIS 420921 e um grupo conjugado. ISIS 420921 é um oligonucleotídeo modificado com a fórmula: Ges Ges Aes Aes Tes Ads mCds Tds mCds Tds Tds Gds Gds Tds Tds Aes mCes Aes Tes Ge, em que
[00601] A = uma adenina,
[00602] mC = a 5'-metilcitosina
[00603] G = uma guanina,
[00604] T = uma timina,
[00605] e = um nucleosídeo modificado 2'-O-metoxietila,
[00606] d = um 2'-desoxinucleosídeo, e
[00607] s = uma ligação internucleosídea de fosforotioato.
[00608] Em determinadas modalidades, um composto compreende ou consiste em ISIS 420922 e um grupo conjugado. ISIS 420922 é um oligonucleotídeo modificado com a fórmula: Tes Ges Ges Aes Aes Tds Ads mCds Tds mCds Tds Tds Gds Gds Tds Tes Aes mCes Aes Te, em que
[00609] A = uma adenina,
[00610] mC = a 5'-metilcitosina
[00611] G = uma guanina,
[00612] T = uma timina,
[00613] e = um nucleosídeo modificado 2'-O-metoxietila,
[00614] d = um 2'-desoxinucleosídeo, e
[00615] s = uma ligação internucleosídea de fosforotioato.
[00616] Em determinadas modalidades, um composto compreende ou consiste em ISIS 420950 e um grupo conjugado. ISIS 420950 é um oligonucleotídeo modificado com a fórmula: Tes Tes Tes Tes Aes Tds Tds Gds Tds mCds Tds mCds Tds Gds mCds mCes Tes Ges Ges Ae, em que
[00617] A = uma adenina,
[00618] mC = a 5'-metilcitosina
[00619] G = uma guanina,
[00620] T = uma timina,
[00621] e = um nucleosídeo modificado 2'-O-metoxietila,
[00622] d = um 2'-desoxinucleosídeo, e
[00623] s = uma ligação internucleosídea de fosforotioato.
[00624] Em determinadas modalidades, um composto compreende ou consiste em ISIS 420955 e um grupo conjugado. ISIS 420955 é um oligonucleotídeo modificado com a fórmula: Ges Aes Aes Tes Ges Tds Tds Tds Tds Ads Tds Tds Gds Tds mCds Tes mCes Tes Ges mCe, em que
[00625] A = uma adenina,
[00626] mC = a 5'-metilcitosina
[00627] G = uma guanina,
[00628] T = uma timina,
[00629] e = um nucleosídeo modificado 2'-O-metoxietila,
[00630] d = um 2'-desoxinucleosídeo, e
[00631] s = uma ligação internucleosídea de fosforotioato.
[00632] Em determinadas modalidades, um composto compreende ou consiste em ISIS 420957 e um grupo conjugado. ISIS 420957 é um oligonucleotídeo modificado com a fórmula: Aes Ges Ges Aes Aes Tds Gds Tds Tds Tds Tds Ads Tds Tds Gds Tes mCes Tes mCes Te, em que
[00633] A = uma adenina,
[00634] mC = a 5'-metilcitosina
[00635] G = uma guanina,
[00636] T = uma timina,
[00637] e = um nucleosídeo modificado 2'-O-metoxietila,
[00638] d = um 2'-desoxinucleosídeo, e
[00639] s = uma ligação internucleosídea de fosforotioato.
[00640] Em determinadas modalidades, um composto compreende ou consiste em ISIS 420959 e um grupo conjugado. ISIS 420959 é um oligonucleotídeo modificado com a fórmula: Aes mCes Aes Ges Ges Ads Ads Tds Gds Tds Tds Tds Tds Ads Tds Tes Ges Tes mCes Te, em que
[00641] A = uma adenina,
[00642] mC = a 5'-metilcitosina
[00643] G = uma guanina,
[00644] T = uma timina,
[00645] e = um nucleosídeo modificado 2'-O-metoxietila,
[00646] d = um 2'-desoxinucleosídeo, e
[00647] s = uma ligação internucleosídea de fosforotioato.
[00648] Em determinadas modalidades, um composto com a seguinte estrutura química compreende ou consiste em ISIS 420915 com 5'-X, em que X é um grupo conjugado conforme descrito neste documento:
[00649] Em determinadas modalidades, um composto compreende ou consiste em ISIS 682877 com a seguinte estrutura química:
[00650] Em determinadas modalidades, um composto compreende ou consiste em ISIS 682884 com a estrutura química a seguir:
[00651] Em determinadas modalidades, um composto compreende ou consiste em SEQ ID NO: 12, 5'-GalNAc e as modificações químicas representadas pela estrutura química a seguir:
[00652] em que R1 é -OCH2CH2OCH3 (MOE) e R2 é H; or R1 e R2 formam, em conjunto, uma ponte, em que R1 é O- e R2 é -CH2-, - CH(CH3)-, ou -CH2CH2-, e R1 e R2 são diretamente conectados de modo que a ponte resultante seja selecionada dentre: -O-CH2-, -O- CH(CH3)-, e -O-CH2CH2-;
[00653] e para cada par de R3 e R4 no mesmo anel, independentemente para cada anel: R3 é selecionado a partir de H e - OCH2CH2OCH3 e R4 é H; ou R3 e R4 formam, em conjunto, uma ponte em que R3 é -O-, e R4 é -CH2-, -CH(CH3)-, ou -CH2CH2-e R3 e R4 são conectados diretamente de modo que a ponte resultante seja selecionada dentre: -O-CH2-, -O-CH(CH3)-, e -O-CH2CH2-;
[00654] e R5 é selecionado a partir de H e -CH3;
[00655] e Z é selecionado a partir de S- e O-.
[00656] Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso divulgado no WO 2011/139917 ou US 8.101.743, que são incorporados por referência na íntegra a este documento e um grupo conjugado. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso que possui uma sequência de nucleobases de quaisquer SEQ ID NOs 8-160, 170177 divulgadas no WO 2011/139917 e um grupo conjugado aqui descrito. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso que possui uma sequência de quaisquer SEQ ID NOs 12-89 divulgadas na US 8.101.743 e um grupo conjugado aqui descrito. Em determinadas modalidades, um composto compreende um oligonucleotídeo antissenso que possui uma sequência de nucleobases complementar ao segmento alvo preferencial de quaisquer SEQ ID NOs 90-133 divulgadas na US 8.101.743 e um grupo conjugado aqui descrito. As sequências de nucleobases de todas as SEQ ID NOs supracitadas são incorporadas por referência.
Indicações Terapêuticas de TTR
[00657] Em determinadas modalidades, a invenção fornece métodos para o uso de um composto antissenso conjugado direcionado a um ácido nucleico de TTR para modular a expressão de TTR em um indivíduo. Em determinadas modalidades, a expressão de TTR é reduzida.
[00658] Em determinadas modalidades, a invenção provê métodos para o uso de um composto antissenso conjugado direcionado a um ácido nucleico de TTR em uma composição farmacêutica para o tratamento de um indivíduo. Em determinadas modalidades, o indivíduo tem uma doença, distúrbio ou condição relacionada à transtirretina ou seu respectivo sintoma. Em determinadas modalidades, a doença, distúrbio ou condição relacionada à transtirretina é a amiloidose transtirretina. "Amiloidose relacionada à transtirretina" ou "amiloidose transtirretina" ou "doença amiloide transtirretina" aqui utilizada é qualquer patologia ou doença associada à disfunção ou desregulação da transtirretina que resulta na formação de fibrilas amiloides contendo transtirretina. A amiloidose de transtirretina inclui, entre outros, amiloidose de TTR hereditária, amiloidose leptomeninges, polineuropatia amiloide familiar (FAP), cardiomiopatia amiloide familiar, amiloidose oculoleptomeningeal familiar, amiloidose cardíaca senil ou amiloidose sistêmica senila.
[00659] Em determinadas modalidades, a invenção provê métodos para o uso de um composto antissenso conjugado direcionado a um ácido nucleico de TTR na preparação de um medicamento.
[00660] Em determinadas modalidades, a invenção fornece um composto antissenso conjugado direcionado a um ácido nucleico de uma TTR ou seu sal farmaceuticamente aceitável para ser usado na terapia.
[00661] Determinadas modalidades fornecem um composto antissenso conjugado direcionado ao ácido nucleico de uma TTR ser usado no tratamento de uma doença, distúrbio ou condição relacionada à transtirretina ou seu sintoma. Em determinadas modalidades, a doença, distúrbio ou condição relacionada à transtirretina é a amiloidose transtirretina.
[00662] Será entendido que quaisquer compostos descritos neste documento podem ser usados nos métodos e usos supracitados. Por exemplo, em determinadas modalidades, um composto antissenso conjugado direcionado a um ácido nucleico de TTR nos métodos e usos supracitados podem incluir, entre outros, um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreendendo pelo menos uma sequência de 8 nucleobases consecutivas da SEQ ID NOs: 12-19; um composto antissenso conjugado direcionado à SEQ ID NO: 2 compreendendo uma sequência de nucleobases da SEQ ID NO: 12-19; um composto que compreende ou consiste em ISIS 420915, ISIS 304299, ISIS 420921, ISIS 420922, ISIS 420950, ISIS 420955, ISIS 420957, ou ISIS 420959 e um grupo conjugado; um composto que compreende um oligonucleotídeo antissenso divulgado no WO 2011/139917 ou US 8,101,743, que são incorporados por referência na íntegra a este documento, e um grupo conjugado; um composto que compreende um oligonucleotídeo antissenso com uma sequência de nucleobase da SEQ ID NOs 8-160, 170-177 divulgadas no WO 2011/139917 e um grupo conjugado descrito neste documento; um oligonucleotídeo antissenso com uma sequência de nucleobase da SEQ ID NOs 12-89 divulgada na US 8.101.743 e um grupo conjugado descrito neste documento; ou um composto que compreende um oligonucleotídeo antissenso com uma sequência de nucleobase complementar ao segmento alvo preferencial da SEQ ID NOs 90-133 divulgada em US 8.101.743 e um grupo conjugado descrito neste documento. As sequências de nucleobases de todas as SEQ ID NOs supracitadas são incorporadas por referência.
E. DETERMINADAS COMPOSIÇÕES FARMACÊUTICAS
[00663] Em determinadas modalidades, a presente descrição fornece composições farmacêuticas que compreendem um ou mais compostos antissenso. Em determinadas modalidades, essa composição farmacêutica compreende um diluente ou transportador farmaceuticamente aceitável adequado. Em determinadas modalidades, a composição farmacêutica compreende uma solução salina estéril e um ou mais compostos antissenso. Em determinadas modalidades, essa composição farmacêutica consiste em uma solução salina estéril e em um ou mais compostos antissenso. Em determinadas modalidades, a solução salina é uma solução salina de qualidade farmacêutica. Em determinadas modalidades, a composição farmacêutica compreende um ou mais compostos antissenso e água estéril. Em determinadas modalidades, a composição farmacêutica consiste em um ou mais compostos antissenso e em água estéril. Em determinadas modalidades, a solução salina estéril é uma solução salina de qualidade farmacêutica. Em determinadas modalidades, uma composição farmacêutica compreende um ou mais compostos antissenso e solução salina tamponada com fosfato (PBS). Em determinadas modalidades, uma composição farmacêutica consiste em um ou mais compostos antissenso e solução salina tamponada com fosfato (PBS). Em determinadas modalidades, a solução salina estéril é uma PBS de qualidade farmacêutica.
[00664] Em determinadas modalidades, os compostos antissenso podem ser misturados com substâncias ativas e/ou inertes farmaceuticamente aceitáveis para a preparação de composições e formulações farmacêuticas. As composições e métodos para a formulação de composições farmacêuticas irão depender de vários critérios, incluindo, entre outros, via de administração, extensão da doença, ou dose a ser administrada.
[00665] As composições farmacêuticas que compreendem compostos antissenso englobam quaisquer sais farmaceuticamente aceitáveis, ésteres ou sais desses ésteres. Em determinadas modalidades, as composições farmacêuticas que compreendem compostos antissenso compreendem um ou mais oligonucleotídeos que, após administração a um animal, incluindo um ser humano, são capazes de proporcionar (direta ou indiretamente) o metabólito biologicamente ativo ou seu resíduo. Nesse sentido, por exemplo, a descrição também é delineada para sais farmaceuticamente aceitáveis de compostos antissenso, profármacos, sais farmaceuticamente aceitáveis dessas profármacos, e outros bioequivalentes. Os sais farmaceuticamente aceitáveis adequados incluem, mas não estão limitados a, sais de sódio e potássio.
[00666] Uma profármaco pode incluir a incorporação de nucleosídeos adicionais em uma ou em ambas as extremidades de um oligonucleotídeo que são clivados por nucleases endógenas dentro do corpo, para formar o oligonucleotídeo antissenso ativo.
[00667] Porções lipídicas estão sendo utilizadas em terapias de ácido nucleico em vários métodos. Em alguns desses métodos, o ácido nucleico é introduzido em lipossomas pré-formados ou lipoplexos feitos de misturas de lípidos catiônicos e lípidos neutros. Em determinados métodos, os complexos de DNA com lipídios mono ou policatiônicos são formados sem a presença de um lípido neutro. Em determinadas modalidades, uma porção lipídica é selecionada para aumentar a distribuição de um agente farmacêutico para uma célula ou tecido específico. Em determinadas modalidades, uma porção lipídica é selecionada para aumentar a distribuição de um agente farmacêutico para um tecido adiposo. Em determinadas modalidades, uma porção lipídica é selecionada para aumentar a distribuição de um agente farmacêutico para um tecido muscular.
[00668] Em determinadas modalidades, as composições farmacêuticas aqui previstas compreendem um ou mais oligonucleotídeos modificados e um ou mais excipientes. Em determinadas modalidades, os excipientes são selecionados a partir da água, soluções salinas, álcool, polietilenoglicóis, gelatina, lactose, amilase, estearato de magnésio, talco, ácido silícico, parafina viscosa, hidroximetilcelulose e polivinilpirrolidona.
[00669] Em determinadas modalidades, uma composição farmacêutica aqui prevista compreende um sistema de distribuição. Exemplos de sistemas de entrega incluem, entre outros, lipossomas e emulsões. Certos sistemas de entrega são úteis para a preparação de certas composições farmacêuticas, incluindo aquelas que compreendem compostos hidrofóbicos. Em determinadas modalidades, certos solventes orgânicos, como dimetilsulfóxido são usados.
[00670] Em determinadas modalidades, uma composição farmacêutica aqui prevista compreende uma ou mais moléculas de entrega específicas do tecido destinadas a entregar um ou mais agentes farmacêuticos da presente descrição aos tecidos ou aos tipos de células específicas. Por exemplo, em determinadas modalidades, as composições farmacêuticas incluem lipossomas revestidos com um anticorpo específico para o tecido.
[00671] Em determinadas modalidades, uma composição farmacêutica aqui prevista compreende um sistema de cossolvente. Alguns desses sistemas de cossolvente compreendem, por exemplo, álcool benzílico, um surfactante não polar, um polímero orgânico miscível em água e uma fase aquosa. Em determinadas modalidades, estes sistemas cossolventes são utilizados para compostos hidrofóbicos. Um exemplo não limitante desse sistema cossolvente é o sistema cossolvente VPD, o qual é uma solução absoluta de etanol compreendendo 3% p/v de álcool benzílico, 8% p/v de surfactante não polar Polissorbato 80™ e 65 % p/v de polietilenoglicol 300. As proporções desses sistemas cossolventes podem variar consideravelmente sem alterar significativamente as suas características de solubilidade e toxicidade. Além disso, a identidade dos componentes cossolventes pode variar: por exemplo, outros surfactantes podem ser utilizados ao invés do Polissorbato 80™; o tamanho da porção polietilenoglicol pode variar; outros polímeros biocompatíveis podem substituir o polietilenoglicol, por exemplo, polivinil pirrolidona; e outros açúcares ou polissacáridos podem substituir a dextrose.
[00672] Em determinadas modalidades, uma composição farmacêutica aqui prevista é preparada para administração oral. Em determinadas modalidades, as composições farmacêuticas são preparadas para administração bucal.
[00673] Em determinadas modalidades, uma composição farmacêutica é preparada para administração por injeção (por exemplo, intravenosa, subcutânea, intramuscular, etc.). Em determinadas modalidades, uma composição farmacêutica compreende um transportador e é formulada em solução aquosa, como água ou tampões fisiologicamente compatíveis como solução de Hanks, solução de Ringer, ou tampão de solução salina fisiológica. Em determinadas modalidades, são incluídos outros ingredientes (por exemplo, ingredientes que ajudam na solubilidade ou que servem de conservantes). Em determinadas modalidades, as suspensões injetáveis são preparadas usando transportadores líquidos apropriados, agentes de suspensão e similares. São apresentadas certas composições farmacêuticas para injeção em forma de dosagem unitária, por exemplo, em ampolas ou em recipientes de doses múltiplas. Certas composições farmacêuticas para injeção são suspensões, soluções ou emulsões em veículos oleosos ou aquosos, e podem conter agentes de formulação como agentes de suspensão, estabilizantes e/ou dispersantes. Alguns solventes adequados para utilização em composições farmacêuticas para injeção incluem, entre outros, solventes lipofílicos e óleos gordos, como óleo de sésamo, ésteres de ácidos gordos sintéticos, como oleato de etila ou triglicerídeos e lipossomas. As suspensões de injeção aquosas podem conter substâncias que aumentam a viscosidade da suspensão, como carboximetilcelulose de sódio, sorbitol, ou dextrano. Opcionalmente, essas suspensões também podem conter estabilizadores ou agentes adequados que aumentam a solubilidade dos agentes farmacêuticos para permitir a preparação de soluções altamente concentradas.
[00674] Em determinadas modalidades, uma composição farmacêutica é preparada para administração transmucosa. Em determinadas modalidades, penetrantes apropriados para a barreira a ser permeada são usados na formulação. Esses penetrantes são geralmente conhecidos na técnica.
[00675] Em determinadas modalidades, uma composição farmacêutica aqui prevista compreende um oligonucleotídeo em uma quantidade terapeuticamente eficaz. Em determinadas modalidades, a quantidade terapeuticamente eficaz é suficiente para prevenir, aliviar ou melhorar os sintomas de uma doença ou prolongar a sobrevivência do indivíduo a ser tratado. A determinação de uma quantidade terapeuticamente eficaz está bem dentro da capacidade dos versados na técnica.
[00676] Em determinadas modalidades, um ou mais oligonucleotídeos modificados aqui previstos são formulados como um profármaco. Em determinadas modalidades, mediante administração in vivo, um profármaco é quimicamente convertido em uma forma biologicamente, farmaceuticamente ou terapeuticamente mais ativa de um oligonucleotídeo. Em determinadas modalidades, os profármacos são úteis porque são mais fáceis de serem administrados do que a forma ativa correspondente. Por exemplo, em alguns casos, uma profármaco pode ser mais biodisponível (por exemplo, através de administração por via oral) do que a forma ativa correspondente. Em certos casos, um profármaco pode ter solubilidade melhorada em comparação com a forma ativa correspondente. Em determinadas modalidades, os profármacos são menos solúveis em água do que a forma ativa correspondente. Em certos casos, esses profármacos possuem transmissão superior, através das membranas celulares, em que a solubilidade em água é prejudicial para a mobilidade. Em determinadas modalidades, um profármaco é um éster. Em algumas dessas modalidades, o éster é metabolicamente hidrolisado em ácido carboxílico após administração. Em certos casos, o ácido carboxílico que contém composto é a forma ativa correspondente. Em determinadas modalidades, um profármaco compreende um peptídeo curto (poliaminoácido) ligado a um grupo ácido. Em determinadas modalidades, o peptídeo é clivado após a administração de modo a formar a forma ativa correspondente.
[00677] Em determinadas modalidades, a presente invenção fornece composições e métodos para reduzir a quantidade ou a atividade de um ácido nucleico alvo em uma célula. Em determinadas modalidades, a célula está em um animal. Em determinadas modalidades, o animal é um mamífero. Em determinadas modalidades, o animal é um roedor. Em determinadas modalidades, o animal é um primata. Em determinadas modalidades, o animal é um primata não humano. Em determinadas modalidades, o animal é um ser humano.
[00678] Em determinadas modalidades, a presente descrição fornece métodos de administração de uma composição farmacêutica compreendendo um oligonucleotídeo da presente descrição a um animal. Vias de administração adequadas incluem, entre outras, oral, retal, transmucosa, intestinal, entérica, tópica, por supositório, através de inalação, por via intratecal, intracerebroventricular, intraperitoneal, intranasal, intraocular, intratumoral, e parentérica (por exemplo, intravenosa, intramuscular, intramedular, e subcutânea). Em determinadas modalidades, intratecais farmacêuticas são administradas para atingir exposições locais ao invés de sistêmicas. Por exemplo, as composições farmacêuticas podem ser injetadas diretamente na área de efeito desejado (por exemplo, no fígado).
DESCRIÇÃO NÃO LIMITANTE E INCORPORAÇÃO POR REFERÊNCIA
[00679] Enquanto determinados compostos, composições e métodos descritos neste documento foram descritos com especificidade em conformidade com determinadas modalidades, os exemplos a seguir servem apenas para ilustrar os compostos descritos neste documento e não se destinam a limitar o mesmo. Cada uma das referências, números de acesso GenBank e similares relatados no presente pedido estão incorporados neste documento em sua totalidade para referência.
[00680] Determinados compostos, composições e métodos aqui contidos são descritos como "compreendendo exatamente" ou "que compreendem exatamente" um número específico de um elemento ou recurso específico. Essas descrições são usadas para indicar que, embora o composto, composição ou método possa compreender outros elementos adicionais, o número do elemento ou recurso específico é o número identificado. Por exemplo, "um conjugado que compreende exatamente um GalNAc" é um conjugado que contém um e somente um GalNAc, embora possa conter outros elementos além de um GalNAc.
[00681] Embora a listagem de sequências que acompanha este depósito identifique cada sequência como "RNA" ou "DNA" conforme necessário, na realidade, essas sequências podem ser modificadas com qualquer combinação de modificações químicas. Os versados na técnica apreciarão de imediato que essa designação "RNA" ou "DNA" para descrever oligonucleotídeos modificados é, em certos casos, arbitrária. Por exemplo, um oligonucleotídeo que compreende um nucleosídeo compreendendo uma porção de açúcar 2'-OH e uma base timina poderia ser descrito como um DNA que possui um açúcar modificado (2'-OH para 2'-H natural do DNA) ou como um RNA que possui uma base modificada (timina (uracila metilada) para uracila natural do RNA).
[00682] Por conseguinte, as sequências de ácido nucleico aqui providas, incluindo, entre outros, aquelas na listagem de sequência, destinam-se a englobar ácidos nucleicos com qualquer combinação de RNA e/ou DNA natural ou modificada, incluindo, entre outros, esses ácidos nucleicos modificados com nucleobases modificadas. A título de exemplo e sem limitação, um oligonucleotídeo com uma sequência de nucleobases "ATCGATCG" engloba quaisquer oligonucleotídeos com essa sequência de nucleobases, modificada ou não modificada, incluindo, entre outros, esses compostos que compreendem bases do RNA, como aquelas com uma sequência "AUCGAUCG "e aquelas que possuem algumas bases de DNA e algumas bases de RNA, como "AUCGATCG " e oligonucleotídeos com outras bases modificadas, como "ATmeCGAUCG," em que meC indica uma base de citosina que compreende um grupo metil na posição 5.
EXEMPLOS
[00683] Os exemplos a seguir ilustram determinadas modalidades da presente descrição e não são limitantes. Além disso, se modalidades específicas forem providas, os inventores contemplaram um pedido genérico dessas modalidades específicas. Por exemplo, a descrição de um oligonucleotídeo que tem um motivo específico provê suporte razoável para oligonucleotídeos adicionais que têm o mesmo motivo ou motivo semelhante. E, por exemplo, se uma modificação específica de alta afinidade surgir em uma posição específica, outras modificações de alta afinidade na mesma posição são consideradas adequadas, salvo indicação contrária.Exemplo 1: Método Geral para a Preparação de Fosforamiditos, Compostos 1, 1a e 2
Bx é uma base heterocíclica;
[00684] Os compostos 1, 1a e 2 foram preparados de acordo com procedimentos bem conhecidos na técnica, descritos na relatório aqui contida (ver Seth et al., Bioorg. Med. Chem., 2011, 21(4), 1122-1125, J. Org. Chem., 2010, 75(5), 1569-1581, Nucleic Acids Symposium Series, 2008, 52(1), 553-554).; e também publicado nos Pedidos Internacionais PCT (WO 2011/115818, WO 2010/077578, WO2010/036698, WO2009/143369, WO 2009/006478, e WO 2007/090071) e patente US N° 7569686).Exemplo 2: Preparação do Composto 7
[00685] Os compostos 3 (2-acetamida-1,3,4,6-tetra-O-acetil-2- des0xi-β-Dgalactopiranose ou galactosamina pentaacetato) estão comercialmente disponíveis. O composto 5 foi preparado de acordo com procedimentos publicados (Weber et al., J. Med. Chem., 1991, 34, 2692).Exemplo 3: Preparação do Composto 11
[00686] Os compostos 8 e 9 estão comercialmente disponíveis.Exemplo 4: Preparação do Composto 18
[00687] O composto 11 foi preparado de acordo com os procedimentos ilustrados no Exemplo 3. O composto 14 está comercialmente disponível. O composto 17 foi preparado usando procedimentos similares relatados por Rensen et al., J. Med. Chem., 2004, 47, 5798-5808.Exemplo 5: Preparação do Composto 23
[00688] Os compostos 19 e 21 estão comercialmente disponíveis.Exemplo 6: Preparação do Composto 24
[00689] Os compostos 18 e 23 foram preparados de acordo com os procedimentos ilustrados nos Exemplos 4 e 5.Exemplo 7: Preparação do Composto 25
[00690] O composto 24 foi preparado de acordo comos procedimentos ilustrados no Exemplo 6.Exemplo 8: Preparação do Composto 26
[00691] O composto 24 é preparado de acordo comos procedimentos ilustrados no Exemplo 6.Exemplo 9: Preparação geral de ASOs conjugadoscompreendendo GalNAc3-1 no terminal 3', Composto 29
[00692] em que GalNAc3-1 protegida tem a estrutura:
[00693] A parte do agrupamento de GalNAc3 do grupo conjugado GalNAc3-1 (GalNAc3-1a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Onde GalNAc3-1a tem a fórmula:
[00694] O suporte sólido ligou GalNAc3-1 protegida, Composto 25, foi preparado de acordo com os procedimentos ilustrados no Exemplo 7. Composto 29 oligomérico compreendendo GalNAc3-1 no terminal 3' foi preparado utilizando procedimentos padrão em síntese de DNA/RNA automatizado (ver Dupouy et al., Angew. Chem. Int. Ed., 2006, 45, 3623-3627). Blocos de construção de fosforamidita, Compostos 1 e 1a foram preparados de acordo com os procedimentos ilustrados no Exemplo 1. As fosforamiditas ilustradas pretendem ser representativas e não pretendem ser limitantes como outros blocos de construção de fosforamidita podem ser utilizados para preparar compostos oligoméricos com uma sequência e composição predeterminada. A ordem e quantidade de fosforamiditas adicionadas ao suporte sólido podem ser ajustadas para preparar compostos oligoméricos com lacunas como descrito neste instrumento. Esses compostos oligoméricos lacunados podem ter uma composição predeterminada e uma sequência de base mencionada por um determinado alvo.Exemplo 10: Preparação geral de ASOs conjugados compreendendo GalNAc3-1 no terminal 5', Composto 34
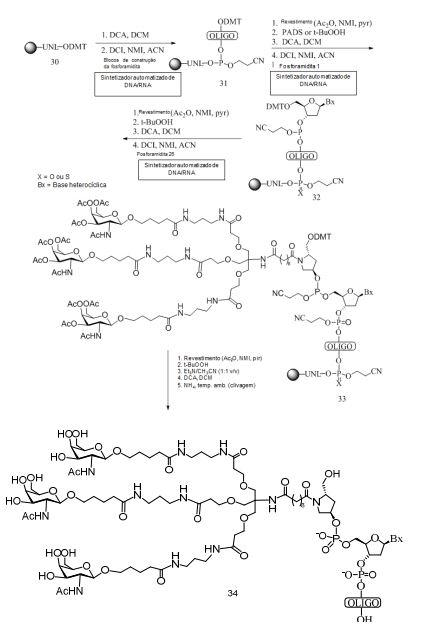
[00695] O UnylinkerTM 30 está comercialmente disponível.Composto Oligomérico 34 compreendendo um agrupamento GalNAc3- 1 no terminal 5' é preparado utilizando procedimentos padrão em síntese de DNA/RNA automatizado (ver Dupouy et al., Angew. Chem. Int. Ed., 2006, 45, 3623-3627). Blocos de construção de fosforamidita, Compostos 1 e 1a foram preparados de acordo com os procedimentos ilustrados no Exemplo 1. As fosforamiditas ilustradas pretendem ser representativas e não pretendem ser limitantes como outros blocos de construção de fosforamidita podem ser utilizados para preparar compostos oligoméricos com uma sequência e composição predeterminada. A ordem e quantidade de fosforamiditas adicionadas ao suporte sólido podem ser ajustadas para preparar compostos oligoméricos com lacunas como descrito neste instrumento. Esses compostos oligoméricos lacunados podem ter uma composição predeterminada e uma sequência de base mencionada por um determinado alvo.Exemplo 11: Preparação do Composto 39
[00696] Os compostos 4, 13 e 23 foram preparados de acordo com os procedimentos ilustrados nos Exemplos 2, 4 e 5. Composto 35 é preparado utilizando processos semelhantes publicados em Rouchaud et al., Eur. J. Org. Chem., 2011, 12, 2346-2353.Exemplo 12: Preparação do Composto 40
[00697] O composto 38 é preparado de acordo com os procedimentos ilustrados no Exemplo 11.Exemplo 13: Preparação do Composto 44
[00698] Os compostos 23 e 36 são preparados de acordo com os procedimentos ilustrados nos exemplos 5 e 11. Composto 41 é preparado utilizando processos semelhantes publicados no WO 2009082607.Exemplo 14: Preparação do Composto 45
[00699] O composto 43 é preparado de acordo com os procedimentos ilustrados no Exemplo 13.Exemplo 15: Preparação do Composto 47
[00700] O composto 46 está comercialmente disponível.Exemplo 16: Preparação do Composto 53
[00701] Compostos 48 e 49 estão comercialmente disponíveis. Os compostos 17 e 47 são preparados de acordo com os procedimentos ilustrados nos Exemplos 4 e 15.Exemplo 17: Preparação do Composto 54
[00702] procedimentos ilustrados no Exemplo 16.Exemplo 18: Preparação do Composto 55
[00703] O composto 53 é preparado de acordo com os procedimentos ilustrados no Exemplo 16.Exemplo 19: Método geral para a preparação de ASOs conjugados compreendendo GalNAc3-1 na posição 3' por meio de técnicas em fase sólida (preparação de ISIS 647535, 647536 e 651900)
[00704] Salvo indicação em contrário, todos os reagentes e soluções utilizadas para a síntese dos compostos oligoméricos são adquiridas de fontes comerciais. Blocos de construção de fosforamidita padrão e suporte sólido são usados para a incorporação de resíduos de nucleosídeos que incluem, por exemplo, T, A, G, e resíduos mC. Uma solução de fosforamidita a 0,1 M em anidro acetonitrila foi utilizada para β-D-2-desoxirribonucleosideo e 2'-MOE.
[00705] As sínteses ASO foram realizadas em sintetizador ABI 394 (escala de 1-2 μmol) ou em sintetizador oligopiloto GE Healthcare Bioscience ÃKTA (escala de 40-200 μmol) pelo método de acoplamento de fosforamidita em suporte sólido VIMAD carregado de GalNAc3-1 (110 μmol/g, Guzaev et al., 2003) empacotada na coluna. Para a etapa de acoplamento, as fosforamiditas foram entregues 4 vezes em excesso sobre a carga sobre o suporte sólido e a condensação de fosforamidita foi realizada por 10 min. Todas as outras etapas seguiram os protocolos-padrão fornecidos pelo fabricante. Uma solução de ácido dicloroacético a 6% em tolueno foi utilizada para remover o grupo dimetoxitritila (DMT) do grupo 5'- hidroxila do nucleotídeo. 4,5-Dicianoimidazol (0,7 M) em anidro CH3CN foi usado como ativador passo durante a etapa de acoplamento. As ligações de fosforotioato foram introduzidas por sulfurização com solução a 0,1 M de hidreto de xantano em piridina/CH3CN 1:1 para um tempo de contato de 3 minutos. Uma solução de 20% terc- butilhidroperóxido em CH3CN contendo 6% de água foi utilizada como um agente oxidante para prover ligações internucleosídeas de fosfodiéster com um tempo de contato de 12 minutos.
[00706] Depois da sequência desejada foi montada, os grupos protetores de cianoetil fosfato foram desprotegidos utilizando uma mistura 1:1 (v/v) de uma mistura de trietilamina e acetonitrila, com um tempo de contato de 45 minutos. ASOs de ligação de suporte sólido foram suspensos em amônia aquosa (28-30% em peso) e aquecidos a 55°C por 6 h.
[00707] Os ASOs não ligados foram então filtrados e a amônia foi fervida. O resíduo foi purificado por cromatografia líquida de alta pressão em uma coluna de troca aniônica forte (GE Healthcare Bioscience, Fonte 30Q, 30 μm, com 2,54 x 8 cm, A = 100 mM acetato de amônia em 30% de CH3CN aquoso, B = 1,5 M de NaBr, em A, 040% de B em 60 min, fluxo 14 mL min-1, À = 260 nm). O resíduo foi dessalinizado por HPLC em uma coluna de fase inversa para produzir ASOs desejados com um rendimento isolado de 15-30% com base na carga inicial sobre o suporte sólido. ASOs foram caracterizados pela análise MS acoplado íon-par-HPLC com sistema Agilent 1100 MSD.
[00708] Os oligonucleotídeos antissenso que não compreendem um conjugado foram sintetizados utilizando procedimentos de síntese de oligonucleotídeos convencionais bem conhecidos na técnica.
[00709] Usando esses métodos, três compostos antissenso separados que direcionam à ApoC III estavam preparados. Como resumido na Tabela 4 abaixo, três compostos antissenso que direcionam à ApoC III tinham a mesma sequência de nucleobases; ISIS 304801 é um gapmer 5-10-5 MOE com todas as ligações de fosforotioato; ISIS 647535 é o mesmo que ISIS 304801, salvo se tinha GalNAc3-1 conjugada na extremidade 3'; e ISIS 647536 é o mesmo que ISIS 647535 salvo se determinadas ligações internucleosídeas desse composto forem ligações de fosfodiéster. Como resumido ainda na Tabela 4, dois compostos antissenso separados que direcionam ao SRB-1 foram sintetizados. ISIS 440762 foi um gapmer 2-10-2 cEt com todas as ligações internucleosídeas de fosforotioato; ISIS 651900 é o mesmo que ISIS 440762, exceto se incluiu uma GalNAc3-1 na sua extremidade 3'.TABELA 4
[00710] ASO modificado direcionando ApoC III e SRB-1
[00711] Subscritos: "e" indicam nucleosídeo 2'-MOE modificado; "d" indica β-D-2-desoximbonucleosideo; "k" indica nucleosídeo bicíclico 6'-(S)-CH3 (por exemplo, cEt); "s" indica ligações internucleosídeas de fosforotioato (PS); "o" indica ligações internucleosídeas de fosfodiéster (PO); e "o" indica -O-P(=O)(OH)-. O subscrito "m" indica 5- metilcitosinas. "GalNAc3-1" indica um grupo conjugado com a estrutura mostrada anteriormente no Exemplo 9. Observe que GalNAc3-1 compreende uma adenosina clivável que liga ASO ao restante do conjugado, que é designada "GalNAc3-1a." Esta nomenclatura é usada na tabela acima, para mostrar a sequência de nucleobases completo, incluindo a adenosina, que faz parte do conjugado. Assim, na tabela acima, as seqüências também poderiam ser listadas como terminando com "GalNAc3-1" com "Ado" omitido. Esta convenção de uso do subscrito "a" para indicar a parte de um grupo conjugado desprovido de nucleosídeo clivável ou porção clivável é usada nesses Exemplos. Esta parte de um grupo conjugado desprovido de porção clivável é denominada "agrupamento" ou "agrupamento conjugado" ou agrupamento " "GalNAc3. Em determinados casos, é conveniente descrever um grupo conjugado apresentando, separadamente, seu agrupamento e sua porção clivável.Exemplo 20: Inibição antissenso dependente de dose de ApoC III humana em camundongos transgênicos huApoC III
[00712] ISIS 304801 e ISIS 647535, cada um direcionando ApoC III humana e descrita acima, foram testados separadamente e avaliados em um estudo dependente da dose para sua capacidade de inibir ApoC III humana em camundongos transgênicos ApoC III humana. Tratamento
[00713] Camundongos transgênicos APOCIII humana foram mantidos em um ciclo de luz/escuro de 12 horas e foram alimentados ad libitum Teklad lab Chow. Os animais foram aclimatados por pelo menos 7 dias no centro de investigação antes do início do experimento. ASOs foram preparados em PBS e esterilizados pela filtração através de um filtro de 0,2 mícron. ASOs foram dissolvidos em PBS 0,9% para injeção.
[00714] Camundongos transgênicos ApoC III humana foi injetada por via intraperitoneal uma vez por semana por duas semanas com ISIS 304801 ou 647535 em 0,08, 0,25. 0,75, 2,25 ou 6,75 μmol/kg ou com PBS como controle. Cada grupo de tratamento consistiu em 4 animais. Quarenta e oito horas após a administração da última dose, foi retirado sangue de cada camundongo e os camundongos foram sacrificados e os tecidos foram coletados.Análise de ApoC III mRNA
[00715] Os níveis de mRNA de ApoC III nos fígados dos camundongos foram determinados usando PCR em tempo real e reagente de quantificação RIBOGREEN® RNA (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis de mRNA de ApoC III foram determinados em relação ao RNA total (usando Ribogreen), antes da normalização para controle tratado com PBS. Os resultados abaixo são apresentados como a média percentual dos níveis de mRNA de ApoC III para cada grupo de tratamento, normalizado para o controle tratado com PBS e é indicado como "% PBS". A metade da dosagem máxima eficaz (ED50) de cada ASO é também apresentada na Tabela 5 abaixo.
[00716] Como ilustrado, ambos os compostos antissenso reduziram o RNA da ApoC III em relação ao controle com PBS. Além disso, o composto conjugado antissenso para GalNAc3-1 (ISIS 647535) foi substancialmente mais potente do que o composto antissenso sem GalNAc3-1 de conjugada (ISIS 304801).TABELA 5
[00717] Efeito do tratamento de ASO nos níveis de mRNA de ApoC III em camundongos transgênicos ApoC III humana
[00718] Análise da proteína ApoC III do plasma foi determinada usando procedimentos relatados por Graham et al, Circulation Research, publicado online antes da impressão em 29 de março de 2013.
[00719] Cerca de 100 μl de plasma isolado de camundongos foram analisados sem diluição, usando um Analisador Clínico Olympus e um ensaio de ApoC III turbidométrico comercialmente disponível (Kamiya, Cat N° KAI-006, Kamiya Biomedical, Seattle, WA). O protocolo do ensaio foi realizado como descrito pelo fornecedor.
[00720] Como mostrado na Tabela 6 abaixo, ambos os compostos antissenso reduziram a proteína ApoC III em relação ao controle com PBS. Além disso, o composto conjugado antissenso para GalNAc3-1 (ISIS 647535) foi substancialmente mais potente do que o composto antissenso sem GalNAc3-1 de conjugada (ISIS 304801).TABELA 6
[00721] Efeito do tratamento de ASO nos níveis da proteína do plasma ApoC III em camundongos transgênicos ApoC III humana
[00722] Triglicerídeos e colesterol do plasma foram extraídos pelo método de Bligh e Dyer (Bligh, E.G. e Dyer, W.J. Can. J. Biochem. Physiol. 37: 911-917, 1959)(Bligh, E and Dyer, W, Can J Biochem Physiol, 37, 911-917, 1959)(Bligh, E and Dyer, W, Can J Biochem Physiol, 37, 911-917, 1959) e medidos pelo uso do analisador clínico Beckmann Coulter e reagentes comercialmente disponíveis.
[00723] Os níveis de triglicerídeo foram medidos em relação aos camundongos injetados com PBS e são indicadas como "% PBS". Os resultados são apresentados na Tabela 7. Como ilustrado, ambos os compostos antissenso reduziram os níveis de triglicerídeo. Além disso, o composto conjugado antissenso para GalNAc3-1 (ISIS 647535) foi substancialmente mais potente do que o composto antissenso sem GalNAc3-1 de conjugada (ISIS 304801).TABELA 7
[00724] Efeito do tratamento com ASO nos níveis de triglicerídeo em camundongos transgênicos
[00725] As amostras de plasma foram analisadas por HPLC para determinar a quantidade de colesterol total e as diferentes porções de colesterol (HDL e LDL). Os resultados são apresentados nas Tabelas 8 e 9. Como ilustrado, ambos os compostos antissenso reduziram os níveis de colesterol total; ambos reduziram o LDL; e ambos aumentaram o HDL. Além disso, o composto conjugado antissenso para GalNAc3-1 (ISIS 647535) foi substancialmente mais potente do que o composto antissenso sem GalNAc3-1 de conjugada (ISIS 304801). Um aumento nos níveis de HDL e uma diminuição nos níveis de LDL é um efeito benéfico cardiovascular de inibição antissenso de ApoC III.TABELA 8
[00726] Efeito do tratamento com ASO nos níveis de colesterol total em camundongos transgênicos
TABELA 9
[00727] Efeito do tratamento de ASO em níveis de colesterol HDL e LDL em camundongos transgênicos
[00728] A PK dos ASOs também foi avaliada. As amostras de fígado e de rim foram picadas e extraídas utilizando protocolos convencionais. As amostras foram analisadas em MSD1 utilizando IP- HPLC-MS. O nível do tecido (μg/g) de comprimento total e ISIS 304801 e 647535 foi medido e os resultados estão apresentados na Tabela 10. Como ilustrado, as concentrações do fígado dos compostos antissenso totais de comprimento completo eram semelhantes para os dois compostos antissenso. Assim, mesmo que o composto antissenso conjugado de GalNAc3-1seja mais ativo no fígado (como demonstrado pelos dados do RNA e da proteína acima), ele não está presente em concentrações substancialmente elevadas no fígado. De fato, o EC50 calculado (apresentado na Tabela 10) confirma que o aumento observado na potência do composto conjugado não pode ser inteiramente atribuído ao aumento do acúmulo. Este resultado sugere que o conjugado melhorou a potência por um mecanismo diferente da acumulação no fígado sozinho, possivelmente pela melhoria da absorção produtiva do composto antissenso nas células.
[00729] Os resultados também mostram que a concentração do composto antissenso conjugado GalNAc3-1 no rim é menor do que o do composto antissenso desprovido do conjugado de GalNAc. Há várias implicações terapêuticas benéficas. Para indicações terapêuticas em que a atividade no rim não é pedida, a exposição aos riscos de toxicidade renal, sem benefício correspondente. Além disso, a alta concentração no rim geralmente resulta na perda dos compostos na urina resultando em uma depuração mais rápida. Portanto, para alvos não renais, o acúmulo no rim não é desejado. Estes dados sugerem que a conjugação de GalNAc3-1 reduz a acumulação no rim. TABELA 10
[00730] Análise PK do tratamento com ASO em camundongos transgênicos
[00731] Os metabólitos de ISIS 647535 também foram identificados e suas massas foram confirmadas pela análise de espectrometria de massa de alta resolução. Os locais de clivagem e as estruturas dos metabólitos observados são mostrados abaixo. A % relativa de ASO de comprimento completo foi calculada utilizando procedimentos convencionais e os resultados são apresentados na Tabela 10a. O metabólito principal de ISIS 647535 foi ASO de comprimento completo desprovido do conjugado inteiro (ou seja, ISIS 304.801), que resulta da clivagem no sítio de clivagem A, mostrado abaixo. Além disso, metabólitos adicionais resultantes de outros sítios de clivagem também foram observados. Estes resultados sugerem que a introdução de outras ligações cliváveis como ésteres, peptídeos, dissulfuretos, fosforamidatos ou acil-hidrazonas entre o açúcar GalNAc3-1 e ASO, que podem ser clivados pelas enzimas dentro da célula, ou que podem clivar no ambiente redutivo do citosol, ou que são lábeis ao pH ácido no interior dos endossomos e lisossomos também pode ser úteis.TABELA 10A
[00732] Metabólitos de comprimento completo de ISIS 647535Metabólito ASO Sítio de clivagem % Relativa
Exemplo 21: Inibição antissenso da ApoC III humana em camundongos transgênicos ApoC III humana em estudo de administração única
[00733] ISIS 304801, 647535 e 647536 cada direcionando ApoC III humana e descrito na Tabela 4, foram ainda avaliados em um estudo de administração única pela sua capacidade de inibir a ApoC III humana em camundongos transgênicos ApoC III humana.Tratamento
[00734] Camundongos transgênicos APOCIII humana foram mantidos em um ciclo de luz/escuro de 12 horas e foram alimentados ad libitum Teklad lab Chow. Os animais foram aclimatados por pelo menos 7 dias no centro de investigação antes do início do experimento. ASOs foram preparados em PBS e esterilizados pela filtração através de um filtro de 0,2 mícron. ASOs foram dissolvidos em PBS 0,9% para injeção.
[00735] Camundongos transgênicos ApoC III humana foram injetados por via intraperitoneal em uma dosagem mostrada abaixo com ISIS 304801, 647535 ou 647536 (descritos acima) ou com controle tratado com PBS. O grupo de tratamento consistiu em 3 animais e o grupo controle consistiu em 4 animais. Antes do tratamento, bem como após a última dose, o sangue foi retirado de cada camundongo e as amostras de plasma foram analisadas. Os camundongos foram sacrificados 72 horas após a última administração.
[00736] As amostras foram coletadas e analisadas para determinar o mRNA da ApoC III e os níveis proteicos no fígado; triglicerídeos plasmáticos; e colesterol, incluindo as porções HDL e LDL foram avaliadas como descrito acima (Exemplo 20). Os dados dessas análises são apresentados nas Tabelas 11-15 abaixo. Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro foram medidos em relação aos camundongos injetados com salina usando protocolos-padrão. A níveis de ALT e AST mostrou que os compostos antissenso foram bem tolerados em todas as doses administradas.
[00737] Estes resultados mostram melhora na potência para compostos antissenso que compreendem um conjugado GalNAc3-1 no terminal 3' (ISIS 647535 e 647536) em comparação com o composto antissenso sem o conjugado GalNAc33-1 (ISIS 304801). Além disso, o ISIS 647536, que compreende um conjugado GalNAc3-1 e algumas ligações fosfodiéster eram tão potentes quanto ISIS 647535, as quais compreendem o mesmo conjugado e todas as ligações internucleosídeas no ASO são fosforotioato.TABELA 11
[00738] Efeito do tratamento de ASO nos níveis de mRNA de ApoC III em camundongos transgênicos ApoC III humana
TABELA 12
[00739] Efeito do tratamento de ASO nos níveis da proteína do plasma ApoC III em camundongos transgênicos ApoC III humana
TABELA 13
[00740] Efeito do tratamento com ASO nos níveis de triglicerídeo em camundongos transgênicos
TABELA 14
[00741] Efeito do tratamento com ASO nos níveis de colesterol total em camundongos transgênicos
TABELA 15
[00742] Efeito do tratamento de ASO em níveis de colesterol HDL e LDL em camundongos transgênicos
[00743] Estes resultados confirmam que o conjugado GalNAc3-1 aumenta a potência de um composto antissenso. Os resultados também mostram uma potência igual de compostos antissenso conjugados GalNAc3-1 em que os oligonucleótidos antissenso misturaram ligações (ISIS 647536 que tem seis ligações fosfodiéster) e uma versão completa de fosforotioato do mesmo composto antissenso (ISIS 647535).
[00744] As ligações de fosforotioato proveem várias propriedades para compostos antissenso. Por exemplo, elas resistem à digestão da nuclease e ligam proteínas resultando no acúmulo do composto no fígado, em vez de no rim/urina. Estas são as propriedades desejáveis, especialmente quando tratam de uma indicação no fígado. No entanto, as ligações de fosforotioato também foram associadas a uma resposta inflamatória. Por conseguinte, a redução do número de ligações fosforotioato em um composto é esperada para reduzir o risco de inflamação, mas também para diminuir a concentração do composto no fígado, aumentar a concentração na urina e rim, diminuir a estabilidade na presença de nucleases, e reduzir a potência global. Os presentes resultados mostram que um composto antissenso conjugado GalNAc3-1 em que determinadas ligações de fosforotioato foram substituídas por ligações fosfodiéster são tão potentes contra um alvo no fígado como um homólogo tendo ligações completas de fosforotioato. Espera-se que esses sejam menos pró-inflamatórios (ver Exemplo 24 que descreve uma experiência que mostra a redução de resultados PS no efeito inflamatório reduzido).Exemplo 22: Efeito do ASO modificado do conjugado GalNAc3-1 direcionando ao SRB-1 in vivo
[00745] ISIS 440762 e 651900, cada um direcionando ao SRB-1 e descritos na Tabela 4, foram avaliados em um estudo dependente da dose quanto à sua capacidade de inibir a SRB-1 em camundongos Balb/c.Tratamento
[00746] Camundongos Balb/c machos de seis semanas de idade (Laboratório Jackson, Bar Harbor, ME) foram injetados por via subcutânea uma vez na dosagem mostrada abaixo com ISIS 440762, 651900 ou com controle tratado com PBS. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 48 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis de mRNA de SRB-1 foram determinados em relação ao RNA total (usando Ribogreen), antes da normalização para controle tratado com PBS. Os resultados abaixo são apresentados como a média percentual dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizado para o controle tratado com PBS e é indicado como "% PBS".
[00747] Como ilustrado na Tabela 16, ambos os compostos antissenso reduziram os níveis de mRNA do SRB-1. Além disso, o composto antissenso compreendendo o conjugado GalNAc3-1 (ISIS 651900) foi substancialmente mais potente do que o composto antissenso sem o conjugado GalNAc3-1 (ISIS 304801). Estes resultados demonstram que o benefício da potência dos conjugados de GalNAc3-1 é observado utilizando oligonucleotídeos antissenso complementares a um alvo diferente e com nucleosídeos quimicamente diferentes, neste caso nucleosídeos modificados compreendem porções de açúcar etílico (uma porção de açúcar bicíclico).TABELA 16
[00748] Efeito do tratamento com ASO sobre os níveis de mRNA deSRB-1 em camundongos Balb/c
Exemplo 23: Protocolo do Ensaio de Células Mononucleares do Sangue Periférico Humano (hPBMC)
[00749] O ensaio de hPBMC foi realizado utilizando o método dos tubos CPT BD Vacutainer. Uma amostra de todo o sangue de doadores voluntários com consentimento informado na clínica US HealthWorks (Faraday & El Camino Real, Carlsbad) foi obtida e recolhidos em tubos 4-15 BD Vacutainer CPT 8 ml (VWR Cat. N° BD362753). O volume de sangue total inicial aproximado de sangue total nos tubos CPT para cada doador foi registrado utilizando a ficha de dados de ensaio PBMC.
[00750] A amostra de sangue foi misturada novamente imediatamente antes da centrifugação, invertendo suavemente os tubos de 8-10 vezes. Tubos CPT foram centrifugados à temperatura ambiente (18-25°C) em um rotor horizontal (swing-ou t) por 30 min. em 1500-1800 RCF com pausa (2700 RPM Beckman Allegra 6R). As células foram recuperadas a partir da interface buffy coat (entre Ficoll e camadas de gel de polímero); transferidas para um tubo cônico estéril de 50 ml e reunidos em tubos 5 CPT/50 ml tubo/doador cônico. As células foram então lavadas duas vezes com PBS (Ca++, Mg++ livre; GIBCO). Os tubos foram enchidos até 50 ml e misturados pela inversão diversas vezes. A amostra foi então centrifugada em 330 x g durante 15 minutos à temperatura ambiente (1215 rpm, em Beckman Allegra 6R) e foram aspirados sobrenadantes tanto quanto possíveis, sem perturbar o sedimento. O sedimento celular foi desalojado por agitação suave do tubo e as células foram ressuspensas em RPMI+10% FBS+pen/strep (~1 ml/10 ml volume de sangue total inicial). Uma amostra de 60 μl foi pipetada em um frasco de amostras (Beckman Coulter) com 600 μl de reagente VersaLyse (Beckman Coulter N° A09777) e foi suavemente agitada por 10-15 seg. Foi permitido que a amostra fosse incubada por 10 min. à temperatura ambiente, sendo novamente misturada antes da contagem. A suspensão de células foi contada no analisador de viabilidade da célula Vicell XR (Beckman Coulter), utilizando o tipo de célula PBMC (fator de diluição de 1:11 foi armazenado com outros parâmetros). Foi registrada a célula viva/ml e a viabilidade. A suspensão de células foi diluída a 1 x 107 PBMC vivo/ml em RPMI+10% FBS+pen/strep.
[00751] As células foram plaqueadas a 5 x 105 em 50 uL/poço placa de cultura do tecido de 96 poços (Falcon Microtest). 50 μl/poço de 2x concentração de oligos/controles diluídos em RPMI+10% FBS+pen/strep foram adicionados conforme modelo experimental (100 μl/poço total). As placas foram colocadas no agitador e foram deixadas para misturar por aprox. 1 min. Após serem incubadas por 24 horas a 37°C; 5% de CO 2, as placas foram centrifugadas a 400 x g por 10 minutos antes da remoção do sobrenadante para o ensaio de citocina MSD (ou seja, IL-6, IL-10, IL-8 e MCP-1 humana).Exemplo 24: Avaliação dos Efeitos Pró-inflamatórios no Ensaio de hPBMC para ASOs conjugados GalNAc3-1
[00752] Os oligonucleotídeos antissenso (ASOs) listados na Tabela 17 foram avaliados quanto ao efeito pró-inflamatório no ensaio de hPBMC utilizando o protocolo descrito no Exemplo 23. ISIS 353512 é um padrão interno conhecido por ser um respondedor elevado para liberação de IL-6 no ensaio. Os hPBMCs foram isolados de doadores novos e voluntários e foram tratados com ASO em concentrações de 0, 0,0128, 0,064, 0,32, 1,6, 8, 40 e 200 μM. Após um tratamento de 24 horas, os níveis de citocinas foram medidos.
[00753] Os níveis de IL-6 foram utilizados como leitura primária. O EC50 e Emáx foram calculados usando procedimentos padrão. Os resultados são expressos como a razão média entre Emáx/EC50 de dois doadores e são denotados como "Emáx/EC50." A razão mais baixa indica uma diminuição relativa na resposta pró-inflamatória e a razão mais elevada indica um aumento relativo na resposta pró- inflamatória.
[00754] No que diz respeito aos compostos de teste, o composto menos pró-inflamatório foi o ASO ligado ao PS/PO (ISIS 616468). O ASO conjugado GalNAc3-1 ISIS 647535 era ligeiramente menos pró- inflamatório do que sua contraparte não conjugada ISIS 304801. Estes resultados indicam que a incorporação de algumas ligações PO reduz a reação pró-inflamatória e adição de um conjugado GalNAc3-1 não torna um composto mais pró-inflamatório e pode reduzir a resposta pró-inflamatória. Por conseguinte, seria de esperar que um composto antissenso compreendendo ligações PS/PO mistas e um conjugado GalNAc3-1 produziria respostas pró-inflamatórias mais baixas em relação ao composto antissenso ligado ao PS completo, com ou sem um conjugado GalNAc3-1. Estes resultados demonstram que compostos antissenso conjugados GalNAc3-1, particularmente aqueles conjugados com teor reduzido de PS são menos pró- inflamatórios.
[00755] Juntos, estes resultados sugerem que um composto conjugado GalNAc3-1, particularmente um com teor reduzido de PS, pode ser administrado a uma dose mais elevada do que um composto antissenso do PS completo da contraparte desprovido do conjugado GalNAc3-1. Uma vez que não se espera que a meia-vida seja substancialmente diferente para estes compostos, essa administração resultaria em uma dosagem menos freqüente. Na verdade essa administração poderia ser ainda menos freqüente, porque os compostos conjugados GalNAc3-1</g>são mais potentes (Ver Exemplos 20-22) e a nova dosagem é necessária uma vez que a concentração de um composto ficou abaixo de um nível desejado, em que esse nível desejado se baseia na potência.TABELA 17
[00757] Subscritos: "e" indicam nucleosídeo 2'-MOE modificado; "d" indica e-D-2-desoxirribonucleosídeo; "k" indica nucleosídeo bicíclico 6'-(S)-CH3 (por exemplo, cEt); "s" indica ligações internucleosídeas de fosforotioato (PS); "o" indica ligações internucleosídeas de fosfodiéster (PO); e "o" indica -O-P(=O)(OH)-. O subscrito "m" indica 5- metilcitosinas. "Ado'-GalNAc3-1a" indica um conjugado com a estrutura GalNAc3-1 mostrada no Exemplo 9 anexada à extremidade 3' do oligonucleotídeo antissenso, conforme indicado.TABELA 18
[00758] Efeito de Pró-inflamatório dos ASOs direcionando ApoC III no ensaio de hPBMC
Exemplo 25: Efeito de ASO modificado do conjugado GalNAc3-1 direcionando à ApoC III humana in vitro
[00759] ISIS 304801 e 647535 descritos acima foram testados im vitro. As células de hepatócitos primários de camundongos transgênicos em uma densidade de 25.000 células por poço, foram tratados com concentrações de 0,03,0,08, 0,24, 0,74, 2,22, 6,67 e 20 μM de oligonucleotídeos modificados. Após um período de tratamento de aproximadamente 16 horas, o RNA foi isolado das células e os níveis de mRNA foram medidos por PCR em tempo real quantitativa e os níveis de mRNA de hApoC III foram ajustados de acordo com o conteúdo total de RNA total, conforme medido por RIBOGREEN®.
[00760] A IC50 foi calculada usando métodos padrão e os resultados são apresentados na Tabela 19. Como ilustrado, uma potência comparável foi observada em células tratadas com ISIS 647535 em comparação com o controle, ISIS 304801.TABELA 19
[00761] ASO Modificado direcionando ApoC III humano em hepatócitos primários
[00762] Neste experimento, os benefícios de grande potência da conjugação de GalNAc3-1 que são observados in vivo não foram observados in vitro. Experimentos de absorção livres subseqüentes em hepatócitos primários <g id="8039">in vitro</g> mostraram aumento da potência de oligonucletoídeos compreendendo vários conjugados GalNAc relativos aos oligonucleotídeos desprovidos do conjugado GalNAc. (ver Exemplos 60, 82 e 92)Exemplo 26: Efeito das ligações PO/PS na Atividade do ASO da ApoC III
[00763] Camundongos transgênicos ApoC III humana foram injetados por via intraperitoneal uma vez em 25 mg/kg de ISIS 304801 ou 616468 (descritos acima) ou com controle tratado com PBS uma vez por semana por duas semanas. O grupo de tratamento consistiu em 3 animais e o grupo controle consistiu em 4 animais. Antes do tratamento, bem como após a última dose, o sangue foi retirado de cada camundongo e as amostras de plasma foram analisadas. Os camundongos foram sacrificados 72 horas após a última administração.
[00764] As amostras foram coletadas e analisadas para determinar os níveis da proteína ApoC III no fígado descritos acima (Exemplo 20). Os dados dessas análises são apresentados na Tabela 20 abaixo.
[00765] Estes resultados mostram redução na potência de compostos antissenso com PO/PS (ISIS 616468) nas asas relativas ao PS completo (ISIS 304801).TABELA 20
[00766] Efeito do tratamento com ASO nos níveis da proteína ApoC III em camundongos transgênicos ApoC III humana
Exemplo 27: Composto 56
[00767] Composto 56 está comercialmente disponível de GlenResearch, ou pode ser preparados de acordo com procedimentos publicados relatados por Shchepinov et al., Nucleic Acids Research, 1997, 25(22), 4447-4454.Exemplo 28: Preparação do Composto 60
[00768] O composto 4 foi preparado de acordo com os procedimentos ilustrados no Exemplo 2. O composto 57 está comercialmente disponível. Composto 60 foi confirmado por análise estrutural.
[00769] Composto 57 destina-se a ser representativo e não destina- se a ser limitante como outros diois de alquil substituídos ou não substituídos monoprotegidos incluindo, entre outros, aqueles apresentados no relatório aqui contido podem ser utilizados para preparar fosforamiditas com uma composição predeterminada.Exemplo 29: Preparação do Composto 63
[00770] Os compostos 61 e 62 são preparados utilizando procedimentos semelhantes aos relatados por Tober et al., Eur. J. Org. Chem., 2013, 3, 566-577; e Jiang et al., Tetrahedron, 2007, 63(19), 3982-3988.
[00771] Alternativamente, o Composto 63 é preparado utilizando procedimentos semelhantes aos relatados na literatura científica e de patentes por Kim et al., Synlett, 2003, 12, 1838-1840; e Kim et al.,, Pedido Internacional PCT publicado, WO 2004063208. Exemplo 30: Preparação do Composto 63b
[00772] Composto 63a é preparado utilizando procedimentos semelhantes aos relatados por Hanessian et al., Canadian Journal of Chemistry, 1996, 74(9), 1731-1737.Exemplo 31: Preparação do Composto 63d
[00773] Composto 63c é preparado utilizando procedimentos semelhantes aos relatados por Chen et al., Chinese Chemical Letters, 1998, 9(5), 451-453.Exemplo 32: Preparação do Composto 67
[00774] O Composto 64 foi preparado de acordo com os procedimentos ilustrados no Exemplo 2. Composto 65 é preparado utilizando procedimentos semelhantes aos relatados por Or et al., Pedido Internacional PCT publicado, WO 2009003009. Os grupos protetores utilizados para o Composto 65 são destinados a serem representativos e não pretendem ser limitantes como outros grupos protetores, incluindo, entre outros, aqueles apresentados no relatório aqui contido podem ser utilizados.Exemplo 33: Preparação do Composto 70
[00775] O Composto 64 foi preparado de acordo com os procedimentos ilustrados no Exemplo 2. O composto 68 está comercialmente disponível. Os grupos protetores utilizados para o Composto 68 são destinados a serem representativos e não pretendem ser limitantes como outros grupos protetores, incluindo, entre outros, aqueles apresentados no relatório aqui contido podem ser utilizados. Pág 158Exemplo 34: Preparação do Composto 75a
[00776] Composto 75 é preparado de acordo com os procedimentos publicados relatados por Shchepinov et al., Nucleic Acids Research, 1997, 25(22), 4447-4454.Exemplo 35: Preparação do Composto 79
[00777] Composto 76 foi preparado de acordo com os procedimentos publicados relatados por Shchepinov et al., Nucleic Acids Research, 1997, 25(22), 4447-4454.Exemplo 36: Preparação do Composto 79a
[00778] O composto 77 é preparado de acordo com os procedimentos ilustrados no Exemplo 35.Exemplo 37: Método geral para a preparação do composto oligomérico conjugado 82 compreendendo um conjugado GalNAc3-2 ligado ao fosfodiéster no terminal 5 ' via suporte sólido (Método I)
[00779] em que GalNAc GalNAc3-2 tem a estrutura:
[00780] A parte do agrupamento de GalNAc3 do grupo conjugado GalNAc3-2 (GalNAc3-2a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Onde GalNAc3-2a tem a fórmula:
[00781] Composto oligomérico ligado ao VIMAD 79b foi preparado utilizando procedimentos padrão para síntese de DNA/RNA automatizado (ver Dupouy et al., Angew. Chem. Int. Ed., 2006, 45, 3623-3627). Os compostos de fosforamidita 56 e 60 foram preparados de acordo com os procedimentos ilustrados nos Exemplos 27 e 28, respectivamente. As fosforamiditas ilustradas pretendem ser representativas e não pretendem ser limitantes como outros blocos de construção de fosforamiditas, incluindo, entre outros, aquelas apresentadas no relatório aqui contido podem ser usadas para preparar compostos oligoméricos com um grupo conjugado ligado do fosfodiéster no terminal 5'. A ordem e quantidade de fosforamiditas adicionadas ao suporte sólido podem ser ajustadas para preparar compostos oligoméricos descritos neste instrumento com qualquer sequência ou composição predeterminada.Exemplo 38: Método alternativo para a preparação do composto oligomérico 82 compreendendo um conjugado GalNAc3-2 ligado ao fosfodiéster no terminal 5' (Método II)

[00782] Composto oligomérico ligado ao VIMAD 79b foi preparado utilizando procedimentos padrão para síntese de DNA/RNA automatizado (ver Dupouy et al., Angew. Chem. Int. Ed., 2006, 45, 3623-3627). Fosforamidita do agrupamento GalNAc3-2, Composto 79 foi preparado de acordo com os procedimentos ilustrados no Exemplo 35. Este método alternativo permite uma instalação de uma etapa do do conjugado GalNAc3-2 ligado ao fosfodiéster para o composto oligomérico na etapa final da síntese. As fosforamiditas ilustradas pretendem ser representativas e não pretendem ser limitantes como outros blocos de construção de fosforamiditas, incluindo, entre outros, aquelas apresentadas no relatório aqui contido podem ser usadas para preparar compostos oligoméricos com um grupo conjugado ligado do fosfodiéster no terminal 5'. A ordem e quantidade de fosforamiditas adicionadas ao suporte sólido podem ser ajustadas para preparar compostos oligoméricos descritos neste instrumento com qualquer sequência ou composição predeterminada.Exemplo 39: Método geral para a preparação de composto oligomérico de 83h compreendendo Conjugado GalNAc3-3 noTerminal 5' (GalNAc3-1 modificado para anexação da extremidade 5') via Suporte Sólido


[00783] O composto 18 foi preparado de acordo com os procedimentos ilustrados no Exemplo 4. Os compostos 83a e 83b estão disponíveis comercialmente. O composto oligomérico 83e, compreendendo uma hexilamina ligada ao fosfodiéster foi preparada usando procedimentos de síntese de oligonucleotídeo padrão. O tratamento do composto oligomérico protegido com amônia aquosa forneceu composto oligomérico conjugado 5'-GalNAc3-3 (83h).
[00784] Onde GalNAc3-3 tem a estrutura:
[00785] A parte do agrupamento de GalNAc3 do grupo conjugado GalNAc3-3 (GalNAc3-3a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Onde GalNAc3-2a tem a fórmula:
Exemplo 40: Método geral para a preparação do compostooligomérico conjugado 89 compreendendo um conjugadoGalNAc3-4 ligado ao fosfodiéster no terminal 3' via suporte sólido
[00786] Em que GalNAc3-4 tem a estrutura:
[00787] Em que CM é uma porção clivável. Em determinadas modalidades, a porção clivável é:
[00788] A parte do agrupamento de GalNAc3 do grupo conjugado GalNAc3-4 (GalNAc3-4a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Onde GalNAc3-4a tem a fórmula:
[00789] O Composto 30 do suporte sólido funcionalizado do Unylinker 30 protegido está comercialmente disponível. O Composto 84 é preparado usando procedimentos semelhantes aos relatados na literatura (ver SShchepinov et al., Nucleic Acids Research, 1997, 25(22),4447-4454; Shchepinov et al., Nucleic Acids Research, 1999, 27, 3035-3041; e Hornet et al., Nucleic Acids Research, 1997, 25,4842-4849).
[00790] Os blocos de construção de fosforamidita, Compostos 60 e 79a são preparados de acordo com os procedimentos ilustrados nos Exemplos 28 e 36. As fosforamiditas ilustradas pretendem ser representativas e não pretendem ser limitantes como outros blocos de construção de fosforamiditas podem ser utilizados para preparar compostos oligoméricos com um conjugado ligado ao fosfodiéster no terminal 3' com uma sequência e composição predeterminadas. A ordem e quantidade de fosforamiditas adicionadas ao suporte sólido podem ser ajustadas para preparar compostos oligoméricos descritos neste instrumento com qualquer sequência ou composição predeterminada.Exemplo 41: Método geral para a preparação de ASOs compreendendo um conjugado GalNAc3-2 ligado ao fosfodiéster (ver Exemplo 37, Bx é adenina) na posição 5' via técnicas de fase sólida (preparação de ISIS 661134)
[00791] Salvo indicação em contrário, todos os reagentes e soluções utilizadas para a síntese dos compostos oligoméricos são adquiridas de fontes comerciais. Blocos de construção de fosforamidita padrão e suporte sólido são usados para a incorporação de resíduos de nucleosídeos que incluem, por exemplo, T, A, G, e resíduos mC. Compostos de fosforamidita 56 e 60 foram utilizados para sintetizar o conjugado GalNAc3-2 ligado ao fosfodiéster no terminal 5'. Uma solução de fosforamidita a 0,1 M em anidro acetonitrila foi utilizada para β-D-2-desoximbonucleosideo e 2'-MOE.
[00792] As sínteses ASO foram realizadas em sintetizador ABI 394 (escala de 1-2 μmol) ou em sintetizador oligopiloto GE Healthcare Bioscience ÃKTA (escala de 40-200 μmol) pelo método de acoplamento de fosforamidita em suporte sólido VIMAD (110 μmol/g, Guzaev et al., 2003) empacotada na coluna. Para a etapa de acoplamento, as fosforamiditas foram entregues 4 vezes em excesso sobre a carga sobre a carga inicial do suporte sólido e acoplamento da fosforamidita foi realizada por 10 min. Todas as outras etapas seguiram os protocolos-padrão fornecidos pelo fabricante. Uma solução de ácido dicloroacético a 6% em tolueno foi utilizada para remover o grupo dimetoxitritila (DMT) dos grupos 5'-hidroxila do nucleotídeo. 4,5-Dicianoimidazol (0,7 M) em anidro CH3CN foi usado como ativador passo durante a etapa de acoplamento. As ligações de fosforotioato foram introduzidas por sulfurização com solução a 0,1 M de hidreto de xantano em piridina/CH3CN 1:1 para um tempo de contato de 3 minutos. Uma solução de 20% terc-butil-hidroperóxido em CH3CN contendo 6% de água foi utilizada como um agente oxidante para prover ligações internucleosídeas de fosfodiéster com um tempo de contato de 12 minutos.
[00793] Depois da sequência desejada ter sido montada, os grupos protetores de cianoetil fosfato foram desprotegidos usando uma dietilamina a 20% em tolueno (v/v) com um tempo de contato de 45 minutos. ASOs de ligação de suporte sólido foram suspensos em amônia aquosa (28-30% em peso) e aquecidos a 55°C p or 6 h.
[00794] Os ASOs não ligados foram então filtrados e a amônia foi fervida. O resíduo foi purificado por cromatografia líquida de alta pressão em uma coluna de troca aniônica forte (GE Healthcare Bioscience, Fonte 30Q, 30 μm, com 2,54 x 8 cm, A = 100 mM acetato de amônia em 30% de CH3CN aquoso, B = 1,5 M de NaBr, em A, 0-40% de B em 60 min, fluxo 14 mL min-1, À = 260 nm). O resíduo foi dessalinizado por HPLC em uma coluna de fase inversa para produzir ASOs desejados com um rendimento isolado de 15-30% com base na carga inicial sobre o suporte sólido. ASOs foram caracterizados pela análise MS acoplado íon-par-HPLC com sistema Agilent 1100 MSD. TABELA 21
[00795] ASO compreendendo um conjugado GalNAc3-2 ligado ao fosfodiéster na posição 5' direcionando SRB-1ISIS No. Sequência (5' para 3') Massa CalCd Massa Observad a SEQ ID No.661134 GalNAc3-2a- o’AdoTksmCksAdsGdsTdsmCdsAdsTds Gds AdsmCdsTdsTksmCk 6482,2 6481,6 26
[00796] Subscritos: "e" indicam nucleosídeo 2'-MOE modificado; "d" indica e-D-2-desoxirribonucleosídeo; "k" indica nucleosídeo bicíclico 6'-(S)-CH3 (por exemplo, cEt); "s" indica ligações internucleosídeas de fosforotioato (PS); "o" indica ligações internucleosídeas de fosfodiéster (PO); e "o" indica -O-P(=O)(OH)-. Sobrescrito "m" indica 5- metilcitosinas. A estrutura de GalNAc3-2um é mostrada no Exemplo 37.Exemplo 42: Método geral para a preparação de ASOs compreendendo conjugado GalNAc3-3 na posição 5' por meio de técnicas em fase sólida (preparação de ISIS 661166)
[00797] A síntese para ISIS 661.166 foi realizada usando procedimentos semelhantes ilustrados nos Exemplos 39 e 41.
[00798] ISIS 661166 é um gapmer 5-10-5 MOE, em que a posição 5' compreende um conjugado GalNAc3-3. ASO foi caracterizado pela análise MS acoplado íon-par-HPLC com sistema Agilent 1100 MSD.TABELA 21A
[00799] ASO compreendendo um conjugado GalNAc3-3 na posição 5' via ligação de hexilamina fosfodiéster direcionando Malat-1
[00800] Subscritos: "e" indica o nucleosídeo 2'-MOE modificado; "d" indica o β-D-2-desoximbonucleosideo; "s" indica as ligações internucleosídeos de fosforotioato (PS); "o" indica as ligações internucleosídeos de fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. O subscrito "m" indica 5-metilcitosinas. A estrutura de "5'-GalNAc3-3a" é mostrada no Exemplo 39.Exemplo 43: Estudo dependente de dose de GalNAc3-2 ligado a fosfodiéster (ver os exemplos 37 e 41, Bx é adenina) no terminal 5' que direciona o SRB-1 in vivo.
[00801] ISIS 661134 (ver o Exemplo 41) que compreende um conjugado GalNAc3-2 ligado a fosfodiéster no terminal 5' fio testado em um estudo dependente de dose para a inbição antissenso de SRB- 1 em camundongos. O ISIS 440762 e 651900 não conjugados (conjugado (GalNAc3-1 no terminal 3', ver o Exemplo 9) foram incluídos no estudo para comparação e são descritos anteriormente na Tabela 4.Tratamento
[00802] Camundongos Balb/c machos de seis semanas de idade (Laboratório Jackson, Bar Harbor, ME) foram injetados por via subcutânea uma vez na dosagem mostrada abaixo com ISIS 440762, 651900 ou com controle tratado com PBS. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis de mRNA de SRB-1 foram determinados em relação ao RNA total (usando Ribogreen), antes da normalização para controle tratado com PBS. Os resultados abaixo são apresentados como a média percentual dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizado para o controle tratado com PBS e é indicado como "% PBS". Os ED50s foram medidos usando métodos semelhantes, conforme descrito anteriormente e são apresentados a seguir.
[00803] Conforme ilustrado na Tabela 22, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. De fato, os oligonucleotídeos antissenso que compreendem o conjugado de GalNAc3-2 ligado ao fosfodiéster no terminal 5' (ISIS 661134) ou o conjugado de GalNAc3-1 ligado no teminal 3' (ISIS 651900) mostraram melhora substancial de potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 440762). Além disso, ISIS 661134, que compreende o conjugado GalNAc3-2 ligado ao fosfodiéster no terminal 5' foi equipotente em comparação ao ISIS 651900, que compreende o conjugado de GalNAc3-1 no terminal 3'.TABELA 22
[00804] ASOscontendo GalNAc3-1 ou GalNAc3-2 direcionandoSRB-1
[00805] Estruturas para 3' GalNAc3-1 e 5' GalNAc3-2foram descritas anteriormente nos Exemplos 9 e 37.Análise Farmacocinética (PK)
[00806] A PK dos ASOs do grupo dose alta (7 mg/kg) foi examinada e avaliada da mesma forma como ilustrado no Exemplo 20. A amostra de fígado foi cortada e extraída usando protocolos-padrão. Os metabólitos de comprimento total de 661134 (5' GalNAc3-2) e ISIS 651900 (3' GalNAc3-1) foram identificados e suas massas foram confirmadas por análise de espectrometria de massa de alta resolução. Os resultados mostraram que o maior metabólito detectado para o ASO compreendendo um conjugado de GalNAc3-2 ligado ao fosfodiéster no terminal 5' (ISIS 661134) foi ISIS 440762 (dados não mostrados). Nenhum metabólito adicional, em um nível detectável, foi observado. Ao contrário de sua contraparte, os metabólitos adicionais semelhantes àqueles relatados anteriormente na Tabela 10a foram observados para o ASO com conjugado de GalNAc3-1 no terminal 3' (ISIS 651900). Esses resultados sugerem que ter o conjugado de GalNAc3-1 ou GalNAc3-2 pode melhorar o perfil da PK dos ASOs sem comprometer sua potência.Exemplo 44: Efeito de ligações de PO/PS na inibição antissenso de ASOs compreendendo o conjugado de GalNAc3-1 (ver o Exemplo 9) no terminal 3' que se direciona ao SRB-1
[00807] ISIS 655861 e 655862 compreendendo um conjugado de GalNAc3-1 no terminal 3', cada um se direcionando ao SRB-1, foram testados em um estudo de administração única para sua capacidade em inibir o SRB-1 em camundongos. O composto não conjugado de origem, ISIS 353382 foi incluído no estudo para comparação.
[00808] Os ASOs são gapmeros 5-10-5 MOE, em que a região de lacuna compreende dez 2'-desoxirribonucleosídeos e cada região de asa compreende cinco nucleosídeos 2'-MOE modificados. Os ASOs foram preparados usando métodos semelhantes conforme ilustrado anteriormente no Exemplo 19 e são descritos na Tabela 23 abaixo.TABELA 23
[00809] Os ASOs modificados compreendendo o conjugado deGalNAc3-1 no terminal 3' direcionando ao SRB-1
[00810] Subscritos: "e" indica o nucleosídeo 2'-MOE modificado; "d" indica o e-D-2-desoxirribonucleosídeo; "s" indica as ligações internucleosídeos de fosforotioato (PS); "o" indica as ligações internucleosídeos de fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. O subscrito "m" indica 5-metilcitosinas. A estrutura "GalNAc3-1" é mostrada no Exemplo 39. Tratamento
[00811] Camundongos Balb/c machos de seis semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea uma vez na dosagem mostrada abaixo com ISIS 353382, 655861, 655862 ou com controle tratado com PBS. Cada grupo de tratamento consistiu em 4 animais. Antes do tratamento, bem como após a última dose, o sangue foi retirado de cada camundongo e as amostras de plasma foram analisadas. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis de mRNA de SRB-1 foram determinados em relação ao RNA total (usando Ribogreen), antes da normalização para controle tratado com PBS. Os resultados abaixo são apresentados como a média percentual dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizado para o controle tratado com PBS e é indicado como "% PBS". Os ED50s foram medidos usando métodos semelhantes, conforme descrito anteriormente e são relatados abaixo.
[00812] Conforme ilustrado na Tabela 24, o tratamento com oligonucleotídeos antissenso reduziu os níveis de mRNA de SRB-1 de uma forma dependente de dose em comparação ao controle tratado com PBS. De fato, os oligonucleotídeos antissenso que compreendem o conjugado de GalNAc3-1 no terminal 3' (ISIS 655861 e 655862) mostraram melhora substancial de potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 353382). Além disso, o ISIS 655862 com ligações de PS/PO mistas mostrou uma melhora na potência em relação ao PS completo (ISIS 655861).TABELA 24
[00813] Efeito de ligações de PO/PS na inibição antissenso de ASOs compreendendo o conjugado GalNAc3-1 no terminal 3'direcionando ao SRB-1
[00814] Os níveis de transaminase, alanina aminotransferase (ALT)e aspartato aminotransferase (AST) hepáticas no soro foram medidos em relação aos camundongos injetados com salina usando protocolos- padrão. Os pesos dos órgãos também foram avaliados. Os resultados demonstraram que não foi observada nenhuma elevação nos níveis de transaminase (Tabela 25) ou pesos dos órgãos (dados não-mostrados) em camundongos tratados com ASOs em comparação ao controle com PBS. Além disso, o ASO com ligações de PS/PO mistas (ISIS 655862) mostraram níveis de transaminase semelhantes em comparação ao P completo (ISIS 655861). TABELA 25
[00815] Efeito de ligações de PO/PS sobre os níveis de transaminase de ASOs compreendendo o conjugado GalNAc3-1 no terminal 3' direcionando ao SRB-1
Exemplo 45: Preparação de Éster de PFP, Composto 110a
[00816] O Composto 4 (9,5 g, 28,8 mmol) foi tratado com os compostos 103a ou 103b (38 mmol), individualmente, e TMSOTf (0,5 EQ.) e peneiras moleculares em diclorometano (200 mL) e foram agitados por 16 horas à temperatura ambiente. Nesse tempo, a camada orgânicas foi filtrada através de celite, em seguida lavada com bicarbonato de sódio, água e salmoura. A camada orgânica foi então separada e seca com sulfato de sódio, filtrada e reduzida sob pressão reduzida. O óleo resultando foi purificado por cromatografia em sílica- gel (2%-->10% metanol/diclorometano) para gerar os compostos 104a e 104b em >80% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00817] Os compostos 104a e 104b foram tratados nas mesmas condições como para os compostos 100a-d (Exemplo 47), para gerar os compostos 105a e 105b em >90% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00818] Os compostos 105a e 105b fora tratados, individualmente, com o composto 90 sob as mesmas condições que os compostos 901a-d, para gerar os compostos 106a (80%) e 106b (20%). LCMS e RMN de prótons foram consistentes com a estrutura.
[00819] Os compostos 106a e 106b foram tratados nas mesmas condições que os compostos 96a-d (Exemplo 47), para gerar o 107a (60%) e 107b (20%). LCMS e RMN de prótons foram consistentes com a estrutura.
[00820] Os compostos 107a e 107b foram tratados nas mesmas condições que os compostos 97a-d (Exemplo 47), para gerar os compostos 108a e 108b em 40-60% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00821] Os compostos 108a (60%) e 108b (40%) foram tratados nas mesmas condições para os compostos 100a-d (Exemplo 47), para gerar os compostos 109a e 109b em >80% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00822] O composto 109a foi tratado nas mesmas condições que os compostos 101a-d (Exemplo 47), para gerar o Composto 110a em 30-60% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura. Alternativamente, o Composto 110b pode ser preparado de forma semelhante, começando com o Composto 109b.Exemplo 46: Procedimento Geral para Conjugação com Ésteres de PFP (Oligonucleotídeo 111); Preparação de ISIS 666881 (GalNAc3-10)
[00823] Um oligonucleotídeo modificado 5'-hexilamina foi sintetizado e purificado usando procedimentos de oligonucleotídeo de fase sólida padrão. O oligonucleotídeo modificado 5'-hexilamina foi dissolvido em tetraborato de sódio 0,1 M, pH 8,5 (200 μL) e 3 equivalentes de um agrupamento de GalNAc3 esterificado com PFP selecionado dissolvido em DMSO (50 μL) foi adicionado. Se o éster de PFP precipitou após a adição na solução de ASO, DMSO foi adicionado até que todo o éster de PFP estivesse na solução. A reação foi concluída após cerca de 16 h de mistura à temperatura ambiente. A solução resultante foi diluída com água a 12 mL e, em seguida, rotacionada em 3000 rpm em um filtro de rotação com um limite de massa de 3000 Da. Este processo foi repetido duas vezes para remover as impurezas de pequenas moléculas. A solução foi então liofilizada à secura e redissolvida em amônia aquosa concentrada e misturada à temperatura ambiente por 2,5 h seguido por concentração em vácuo para remover a maior parte da amônia. O oligonucleotídeo conjugado foi purificado e dessalinizado por RP- HPLC e liofilizado para fornecer o oligonucleotídeo conjugado GalNAc3.
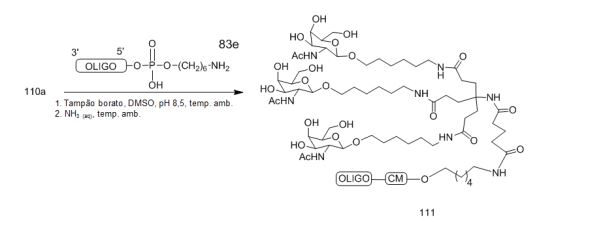
[00824] O oligonucleotídeo 111 é conjugado com GalNAc3-10. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-2 (GalNAc3-2a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é -P(=O)(OH)-Ad-P(=O)(OH)- como mostrado no oligonucleotídeo (ISIS 666881) sintetizado com o GalNAc3-10 abaixo. A estrutura de GalNAc3-10 (GalNAc3-10a-CM-) é mostrada abaixo:
[00825] Após este procedimento geral, o ISIS 666881 foi preparado. O oligonucleotídeo modificado 5'-hexilamino, ISIS 660254, foi sintetizado e purificado usando procedimentos de oligonucleotídeo de fase sólida padrão. O ISIS 660254 (40 mg, 5,2 μmol) foi dissolvido em tetraborato de sódio 0,1 M, pH 8,5 (200 μL) e 3 equivalentes, foi adicionado éster de PFP (Composto 110a) dissolvido em DMSO (50 μL). O éster de PFP precipitou após a adição na solução de ASO, exigindo DMSO adicional (600 μL) para dissolver completamente o éster de PFP. A reação foi concluída após cerca de 16 h de mistura à temperatura ambiente. A solução resultante foi diluída com água a 12 mL de volume total e rotacionada em 3000 rpm em um filtro de rotação com um limite de massa de 3000 Da. Este processo foi repetido duas vezes para remover as impurezas de pequenas moléculas. A solução foi liofilizada à secura e redissolvido em amônina aquosa concentrada com mistura à temperatura ambiente por 2,5 h seguido por concentração em vácuo para remover a maior parte da amônia. O oligonucleotídeo conjugado foi purificado e dessalinizado por RP- HPLC e liofilizado para gerar o ISIS 666881 em 90% de rendimento em peso (42 mg, 4,7 μmol).
[00826] Oligonucleotídeo conjugado GalNAc3-10
[00827] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica umnucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.Exemplo 47: Preparação do Oligonucleotídeo 102Compreendendo GalNAc3-8
[00828] O triácido 90 (4 g, 14,43 mmol) foi dissolvido em DMF (120 mL) e N,N--Di-isopropiletilamina (12,35 mL, 72 mmol). Trifluoroacetato de pentafluorofenil (8,9 mL, 52 mmol) foi adicionado em gotas, sob argônio, e a reação foi deixada agitar à temperatura ambiente por 30 minutos. Boc-diamina 91a ou 91b (68,87 mmol) foi adicionada, juntamente com N,N-Di-isopropiletilamina (12,35 mL, 72 mmol), e a reação foi deixada agitar à temperatura ambiente por 16 horas. Nesse tempo, o DMF foi reduzido em >75% sob pressão reduzida e, em seguida, a mistura foi dissolvida em diclorometano. A camada orgânica foi lavada com bicarbonato de sódio, água e salmoura. A camada orgânica foi então separada e seca com sulfato de sódio, filtrada e reduzida a um óleo sob pressão reduzida. O óleo resultante foi purificado por cromatografia em sílica-gel (2%-->10% metanol/diclorometano) para gerar os compostos 92a e 92b em um rendimento de aproximadamente 80%. LCMS e RMN de prótons foram consistentes com a estrutura.
[00829] O composto 92a ou 92b (6,7 mmol) foi tratado com 20 mL de diclorometano e 20 mL de ácido trifluoroacético à temperatura ambiente por 16 horas. A solução resultante foi evaporada e, em seguida, dissolvida em metanol e tratada com resina DOWEX-OH por 30 minutos. A solução resultante foi filtrada e reduzida a um óleo sob pressão reduzida para gerar 85-90% de rendimento dos compostos 93a e 93b.
[00830] O composto 7 ou 64 (9,6 mmol) foram tratados com HBTU (3,7 g, 9,6 mmol) e N,N-Di-isopropiletilamina (5 mL) em DMF (20 mL) por 15 minutos. A isto foi adicionado qualquer um do composto 93a ou 93b (3 mmol), e deixado agitar à temperatura ambiente por 16 horas. Nesse tempo, o DMF foi reduzido em >75% sob pressão reduzida e, em seguida, a mistura foi dissolvida em diclorometano. A camada orgânica foi lavada com bicarbonato de sódio, água e salmoura. A camada orgânica foi então separada e seca com sulfato de sódio, filtrada e reduzida a um óleo sob pressão reduzida. O óleo resultante foi purificado por cromatografia em sílica-gel (5%-->20% metanol/diclorometano) para gerar os compostos 96a-d em 20-40% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00831] Os compostos 96a-d (0,75 mmol), individualmente, foram hidrogenados com Níquel Raney por 3 horas em Etanol (75 mL). Nesse tempo, o catalisador foi removido por filtração através de celite, e o etanol removido sob pressão reduzida para gerar os compostos 97a-d em 80-90% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00832] O composto 23 (0,32 g, 0,53 mmol) foi tratado com HBTU (0,2 g, 0,53 mmol) e N,N-Di-isopropiletilamina (0,19 mL, 1,14 mmol) em DMF (30mL) por 15 minutos. A isto foram adicionados os compostos 97a-d (0,38 mmol), individualmente, e deixados agitar à temperatura ambiente por 16 horas. Nesse tempo, o DMF foi reduzido em >75% sob pressão reduzida e, em seguida, a mistura foi dissolvida em diclorometano. A camada orgânica foi lavada com bicarbonato de sódio, água e salmoura. A camada orgânica foi então separada e seca com sulfato de sódio, filtrada e reduzida a um óleo sob pressão reduzida. O óleo resultante foi purificado por cromatografia em sílica- gel (2%-->20% metanol/diclorometano) para gerar os compostos 98a-d em 30-40% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00833] O composto 99 (0,17 g, 0,76 mmol) foi tratado com HBTU (0,29 g, 0,76 mmol) e N,N-Di-isopropiletilamina (0,35 mL, 2,0 mmol) em DMF (50mL) por 15 minutos. A isto foram adicionados os compostos 97a-d (0,51 mmol), individualmente, e deixados agitar à temperatura ambiente por 16 horas. Nesse tempo, o DMF foi reduzido em >75% sob pressão reduzida e, em seguida, a mistura foi dissolvida em diclorometano. A camada orgânica foi lavada com bicarbonato de sódio, água e salmoura. A camada orgânica foi então separada e seca com sulfato de sódio, filtrada e reduzida a um óleo sob pressão reduzida. O óleo resultante foi purificado por cromatografia em sílica- gel (5%-->20% metanol/diclorometano) para gerar os compostos 100a- d em 40-60% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00834] Os compostos 100a-d (0,16 mmol), individualmente, foram hidrogenados com 10% Pd(OH)2/C por 3 horas em metanol/acetato de etil (1:1, 50 mL). Nesse tempo, o catalisador foi removido por filtração através de celite, e os compostos orgânicos removidos sob pressão reduzida para gerar os compostos 101a-d em 80-90% de rendimento. LCMS e RMN de prótons foram consistentes com a estrutura.
[00835] Os compostos 101a-d (0,15 mmol), individualmente, foram dissolvidos em DMF (15 mL) e piridina (0,016 mL, 0,2 mmol). Trifluoroacetato de pentafluorofenila (0,034 mL, 0,2 mmol) foi adicionado em gotas, sob argônio, e a reação foi deixada agitar à temperatura ambiente por 30 minutos. Nesse tempo, o DMF foi reduzido em >75% sob pressão reduzida e, em seguida, a mistura foi dissolvida em diclorometano. A camada orgânica foi lavada com bicarbonato de sódio, água e salmoura. A camada orgânica foi então separada e seca com sulfato de sódio, filtrada e reduzida a um óleo sob pressão reduzida. O óleo resultante foi purificado por cromatografia em sílica-gel (2%-->5% metanol/diclorometane) para gerar os compostos 102a-d em um rendimento aproximado de 80%. LCMS e RMN de prótons foram consistentes com a estrutura.
[00836] O Composto Oligomérico 102, compreendendo um grupo conjugado de GalNAc3-8, foi preparado usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-2 (GalNAc3-8a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em uma modalidade preferencial, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-.
[00837] A estrutura de GalNAc3-8 (GalNAc3-8a-CM-) é mostrada abaixo:
Exemplo 48: Preparação do Oligonucleotídeo 119Compreendendo GalNAc3-7
[00838] O composto 112 foi sintetizado após o procedimento descrito na literatura (J. Med. Chem. 2004, 47, 5798-5808).
[00839] O composto 112 (5g, 8,6 mmol) foi dissolvido em 1:1 de metanol/acetato de etila (22 mL/22 mL). Foi adicionado hidróxido de paládio em carbono (0,5 g). A mistura de reação foi agitada à temperatura ambiente em hidrogênio por 12 horas. A mistura da reação foi filtrada através de uma almofada de celite e a almofada foi lavada com 1:1 de metanol/acetato de etila. O filtrado e as lavagens foram combinadas e concentradas à secura para produzir o Compostos 105a (quantitativo). A estrutura foi confirmada por LCMS.
[00840] O composto 113 (1,25 g, 2,7 mmol), HBTU (3,2 g, 8,4 mmol) e DIEA (2,8 mL, 16,2 mmol) foram dissolvidos em DMF (17 mL) e a mistura de reação foi agitada à temperatura ambiente por 5 min. A isto, uma solução do Composto 105a (3,77 g, 8,4 mmol) em DMF anidro (20 mL) foi adicionada. A mistura de reação foi agitada à temperatura ambiente por 6 horas. O solvente foi removido sob pressão reduzida para render um óleo. O resíduo foi dissolvido em CH2Cl2 (100 mL) e lavado com solução de NaHCO3 saturada aquosa (100 mL) e salmoura (100 mL). A fase orgânica foi separada, seca (NA2SO4), filtrada e evaporada. O resíduo foi purificado por cromatografia de coluna em sílica-gel e eluído com MeOH 10 a 20% em diclorometano para produzir o Composto 114 (1,45 g, 30%). A estrutura foi confirmada por LCMS e análise 1H RMN.
[00841] O composto 114 (1,43 g, 0,8 mmol) foi dissolvido em 1:1 de metanol/acetato de etila (4 mL/4 mL). Foi adicionado paládio em carbono (úmido, 0,14 g). A mistura de reação foi lavada com hidrogênio e foi agitada à temperatura ambiente em hidrogênio por 12 h. A mistura de reação foi filtrada através de uma almofada de celite. A camada de celite foi lavada com metanol/acetato de etila (1:1). O filtrado e as lavagens foram combinadas e evaporadas sob pressão reduzida para produzir o Composto 115 (quantitativo). A estrutura foi confirmada por LCMS e análise 1H RMN.
[00842] O composto 83a (0,17 g, 0,75 mmol), HBTU (0,31 g, 0,83 mmol) e DIEA (0,26 mL, 1,5 mmol) foram dissolvidos em DMF anidro (5 mL) e a mistura de reação foi agitada à temperatura ambiente por 5 min. A isto, foi adicionada uma solução do Composto 115 (1,22 g, 0,75 mmol) em DMF e a reação foi agitada à temperatura ambiente por 6 h. O solvente foi removido sob pressão reduzida e o resíduo foi dissolvido em CH2Cl2. A camada orgânica foi lavada com solução de NaHCO3 aquosa saturada e salmoura e foi seca com Na2SO4 anidro e filtrada. A camada orgânica foi concentrada à secura e o resíduo obtido foi purificado por cromatografia de coluna em sílica-gel e eluído com 3 a 15% de MeOH em diclorometano para produzir o Composto 116 (0,84 g, 61%). A estrutura foi confirmada por LCMS e análise 1HRMN.
[00843] O composto 116 (0,74 g, 0,4 mmol) foi dissolvido em 1:1 de metanol/acetato de etila (5 mL/5 mL). Foi adicionado paládio em carbono (úmido, 0,074 g). A mistura de reação foi lavada com hidrogênio e foi agitada à temperatura ambiente em hidrogênio por 12 h. A mistura de reação foi filtrada através de uma almofada de celite. A camada de celite foi lavada com metanol/acetato de etila (1:1). O filtrado e as lavagens foram combinadas e evaporadas sob pressão reduzida para produzir o composto 117 (0,73 g, 98%). A estrutura foi confirmada por LCMS e análise 1H RMN.
[00844] O composto 117 (0,63 g, 0,36 mmol) foi dissolvido em DMF anidro (3 mL). A esta solução, N,N--Di-isopropiletilamina (70 μL, 0,4 mmol) e trifuloroacetato de pentafluorofenil (72 μL, 0,42 mmol) foram adicionados. A mistura de reação foi agitada à temperatura ambiente por 12 h e vertida em uma solução de NaHCO3 aquosa saturada. A mistura foi extraída com diclorometano, lavada com salmoura e seca sobre Na2SO4 anidro. A solução de diclorometano foi concentrada à secura e purificada com cromatografia de coluna em sílica-gel e eluída com 5 a 10% de MeOH em diclorometano para produzir o composto 118 (0,51 g, 79%). A estrutura foi confirmada por LCMS e análise 1H e 1H e 19F RMN
[00845] O Composto Oligomérico 119, compreendendo um grupo conjugado de GalNAc3-7 foi preparado usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-2 (GalNAc3-7a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-.
[00846] A estrutura de GalNAc3-7 (GalNAc3-7a-CM-) é mostrada abaixo:
Exemplo 49: Preparação do Oligonucleotídeo 132Compreendendo GalNAc3-5
[00847] O composto 120 (14,01 g, 40 mmol) e HBTU (14,06 g, 37 mmol) foram dissolvidos em DMF anidro (80 mL). Trietilamina (11,2 mL, 80,35 mmol) foi adicionada e agitada por 5 min. A mistura de reação foi resfriada em banho gelado e uma solução do composto 121 (10 g, mmol) em DMF anidro (20 mL) foi adicionada. Trietilamina adicional (4,5 mL, 32,28 mmol) foi adicionada e a mistura de reação foi agitada por 18 h sob atmosfera de argônio. A reação foi monitorada por TLC (acetato de etil:hexano; 1:1; Rf = 0,47). O solvente foi removido sob pressão reduzida. O resíduo foi absorvido em EtOAc (300 mL) e lavado com 1M NaHSO4 (3 x 150 mL), solução de NaHCO3 aquosa saturada (3 x 150 mL) e salmoura (2 x 100 mL). A camada orgânica foi seca com Na2SO4. O agente de secagem foi removido por filtração e a camada orgânica foi concentrada por evaporação giratória. A mistura crua foi purificada por cromatografia de coluna em sílica-gel e eluída, usando-se EtOAc 35 - 50% em hexano para produzir um composto 122 (15,50 g, 78,13%). A estrutura foi confirmada por LCMS e análise 1H RMN. Massa m/z 589,3 [M + H]+.
[00848] Uma solução de LiOH (92,15 mmol) em água (20 mL) e THF (10 mL) foi adicionada a uma solução resfriada do Composto 122 (7,75 g, 13,16 mmol) dissolvido em metanol (15 mL). A mistura de reação foi agitada à temperatura ambiente por 45 min e monitorada por TLC (EtOAc:hexano; 1:1). A mistura de reação foi concentrada à metade do volume sob pressão reduzida. A solução restante foi resfriada em banho gelado e neutralizado, adicionando-se HCl concentrado. A mistura de reação foi diluída, extraída com EtOAc (120 mL) e lavada com salmoura (100 mL). Uma emulsão foi formada e limpa durante a noite. A camada orgânica foi separada, seca (Na2SO4), filtrada e evaporada para produzir o Composto 123 (8,42 g). O sal residual é a causa provável de excesso de massa. LCMS é consistente com a estrutura. O produto foi usado sem nenhuma purificação adicional. M.W.cal:574.36; M.W.fd:575.3 [M + H]+.
[00849] O composto 126 foi sintetizado após o procedimentodescrito na literatura (J. Am. Chem. Soc. 2011, 133, 958-963).
[00850] O composto 123 (7,419 g, 12,91 mmol), HOBt (3,49 g, 25,82 mmol) e o composto 126 (6,33 g, 16,14 mmol) foram dissolvidos em DMF (40 mL) e a mistura de reação resultante foi resfriada em banho gelado. A isto, N,N-Di-isopropiletilamina (4,42 mL, 25,82 mmol), PyBop (8,7 g, 16,7 mmol) seguido por agente de acoplamento Bop (1,17 g, 2,66 mmol) foram adicionados sob uma atmosfera de argônio. O banho gelado foi removido e a solução foi deixada aquecer à temperatura ambiente. A reação foi concluída 1 h como determinado por TLC (DCM:MeOH:AA; 89:10:1). A mistura de reação foi concentrada sob pressão reduzida. O resíduo foi dissolvido em EtOAc (200 mL) e lavado com 1 M NaHSO4 (3x100 mL), NaHCO3 saturada aquosa (3x100 mL) e salmoura (2x100 mL). A fase orgânica foi separada, seca (Na2SO4), filtrada e concentrada. O resíduo foi purificado por cromatografia de coluna em sílica-gel com um gradiente de 50% hexanos/EtOAC a 100% EtOAc para produzir o Composto 127 (9,4 g) como uma espuma branca. LCMS e RMN foram consistentes com a estrutura. Massa m/z 778,4 [M + H] +.
[00851] Ácido trifluoroacético (12 mL) foi adicionado a uma solução do composto 127 (1,57 g, 2,02 mmol) em diclorometano (12 mL) e agitado à temperatura ambiente por 1 h. A mistura de reação foi coevaporada com tolueno (30 mL) sob pressão reduzida à secura. O resíduo obtido foi coevaporado duas vezes com acetonitrila (30 mL) e tolueno (40 mL) para produzir o Composto 128 (1,67 g) como sal de trifluoro acetato para a etapa seguinte sem purificação adicional. LCMS e RMN foram consistentes com a estrutura. Massa m/z 478,2 [M + H] +.
[00852] O composto 7 (0,43 g, 0,963 mmol), HATU (0,35 g, 0,91 mmol), e HOAt (0,035 g, 0,26 mmol) foram combinados e secos por 4 h com P2O5 sob pressão reduzida em um frasco de fundo redondo e, em seguida, dissolvidos em DMF anidro (1 mL) e agitados por 5 min. A isto, uma solução do composto 128 (0,20 g, 0,26 mmol) em DMF anidro (0,2 mL) e N,N-Di-isopropiletilamina (0,2 mL) foi adicionada. A mistura de reação foi agitada à temperatura ambiente sob uma atmosfera de argônio. A reação foi concluída após 30 min como determinado por LCMS e TLC (7% MeOH/DCM). A mistura de reação foi concentrada sob pressão reduzida. O resíduo foi dissolvido em DCM (30 mL) e lavado com 1 M NaHSO4 (3x20 mL), NaHCO3 saturada aquosa (3x20 mL) e salmoura (3x20 mL). A fase orgânica foi separada, seca sobre Na2SO4, filtrada e concentrada. O resíduo foi purificado por cromatografia de coluna em sílica-gel usando 5-15% de MeOH em diclorometano para produzir o Composto 129 (96,6 mg). LCMS e 1H RMN são consistentes com a estrutura. Massa m/z 883,4 [M + 2H]+.
[00853] O composto 129 (0,09 g, 0,051 mmol) foi dissolvido em metanol (5 mL) em 20 mL de frasco de cintilação. A isto, foi adicionada uma pequena quantidade de 10% Pd/C (0,015 mg) e o recipiente de reação foi carregado com gás H2. A mistura de reação foi agitada à temperatura ambiente sob uma atmosfera de H2 por 18 h. A mistura da reação foi filtrada através de uma almofada de Celite e a almofada foi lavada com metanol. As lavagens do filtrado foram agrupadas e concentradas sob pressão reduzida para produzir o Composto 130 (0,08 g). LCMS e RMN foram consistentes com a estrutura. O produto foi utilizado sem purificação adicional. Massa m/z 838,3 [M + 2H]+.
[00854] A um frasco de fundo redondo pontudo de 10 mL foram adicionados o composto 130 (75,8 mg, 0,046 mmol), 0,37 M de piridina/DMF (200 μL) e uma barra de agitação. A esta solução, foi adicionada 0,7 M de trifluoroacetato de pentafluorofenil/DMF (100 μL) em gotas com agitação. A reação foi concluída depois de 1 h, conforme determinado pela LC MS. O solvente foi removido sob pressão reduzida e o resíduo foi dissolvido em CHCl3 (~ 10 mL). A camada orgânica foi particionada contra NaHSO4 (1 M, 10 mL), NaHCO3 aquosa saturada (10 mL) e salmoura (10 mL) três vezes cada. A fase orgânica foi separada e seca com Na2SO4, filtrada e concentrada para produzir o Composto 131 (77,7 mg). LCMS é consistente com a estrutura. Usada sem purificação adicional. Massa m/z 921,3 [M + 2H]+.
[00855] O Composto Oligomérico 132, compreendendo um grupo conjugado de GalNAc3-5, foi preparado usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-5 (GalNAc3-5a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-.
[00856] A estrutura de GalNAc3-5 (GalNAc3-5a-CM-) é mostrada abaixo:
Exemplo 50: Preparação do Oligonucleotídeo 114Compreendendo GalNAc4-11
[00857] Síntese do Composto 134. A um frasco de Merrifield foi adicionada resina de aminometil VIMAD (2,5 g, 450 μmol/g) que foi lavada com acetonitrila, dimetilformamida, diclorometano e acetonitrila. A resina foi inchada em acetonitrila (4 mL). O composto 133 foi pré- ativado em um frasco de fundo redondo de 100 mL, adicionando-se 20 (1,0 mmol, 0,747 g), TBTU (1,0 mmol, 0,321 g), acetonitrila (5 mL) e DIEA (3,0 mmol, 0,5 mL). Esta solução foi deixada agitar por 5 min e foi então adicionada ao frasco de Merrifield com agitação. A suspensão foi agitada por 3 h. A mistura de reação foi drenada e a resina foi lavada com acetonitrila, DMF e DCM. Um novo carregamento de resina foi quantificado, medindo-se a absorbância do cátion de DMT em 500 nm (coeficiente de extinção = 76000) em DCM e determinado para ser 238 μmol/g. A resina foi revestida, suspendendo-se em uma solução de anidrido acético por dez minutos três vezes.
[00858] O composto ligado ao suporte sólido 141 foi sintetizado usando métodos iterativos de síntese de peptídeo de fase sólida à base de Fmoc. Uma pequena quantidade de suporte de sólido foi retirada e suspensa em amônia aquosa (28-30% em peso) por 6 h. O composto clivado foi analisado por LC-MS e a a massa observada foi consistente com a estrutura. Massa m/z 1063,8 [M + 2H]+.
[00859] O composto ligado ao suporte sólido 142 foi sintetizado usando os métodos de síntese de peptídeo de fase sólida.
[00860] O composto ligado ao suporte sólido 143 foi sintetizado usando síntese de fase sólida padrão em um sintetizador de DNA.
[00861] O composto ligado ao suporte sólido 143 foi suspenso em amônia aquosa (28-30% em peso) e aquecido a 55°C po r 16 h. A solução foi resfriada e o suporte sólido foi filtrado. O filtrado foi concentrado e o resíduo dissolvido em água e purificado por HPLC em uma coluna de troca de ânion forte. As porções contendo o composto de comprimento total 144 foram agrupadas e dessalinizadas. O composto oligomérico conjugado a GalNAc4-11 foi analisado por LC- MS e a massa observada foi consistente com a estrutura.
[00862] A parte do agrupamento de GalNAc3 do grupo conjugado GalNAc4-11 (GalNAc4-11a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad- P(=O)(OH)-.
[00863] A estrutura de GalNAc4-11 (GalNAc4-11a-CM) é mostrada abaixo:
Exemplo 51: Preparação do Oligonucleotídeo 155
[00864] O composto 146 foi sintetizado conforme descrito na literatura (Analytical Biochemistry 1995, 229, 54-60).
[00865] O composto 4 (15 g, 45,55 mmol) e o composto 35b (14,3 gramas, 57 mmol) foram dissolvidos em CH2Cl2 (200 ml). Peneiras moleculares ativadas (4 Â. 2 g, em pó) foram adicionadas, e a reação foi agitada por 30 minutos sob atmosfera de nitrogênio. TMS-OTf fio adicionado (4,1 ml, 22,77 mmol) e a reação foi deixada agitar à temperatura ambiente durante a noite. Após conclusão, a reação foi extinta vertendo-se em uma solução de NaHCO3 aquosa saturada (500 ml) e gelo esmagado (~150 g). A camada orgânica foi separada, lavada com salmoura, seca com MgSO4, filtrada, e foi concentrada em um óleo laranja sob pressão reduzida. O material bruto foi purificado por cromatografia de coluna em sílica-gel e eluído com 2-10 % MeOH em CH2Cl2 para produzir o Composto 112 (16,53 g, 63%). LCMS e 1H RMN foram consistentes com o composto esperado.
[00866] O composto 112 (4,27 g, 7,35 mmol) foi dissolvido em 1:1 MeOH/EtOAc (40 ml). A mistura de reação foi purgada, ebulindo-se um fluxo de argônio através da solução por 15 minutos. Um catalisador de Pearlman (hidróxido de paládio em carbono, 400 mg) foi adicionado, e o gás hidrogênio foi ebulido através da solução por 30 minutos. Após a conclusão (TLC 10% de MeOH em CH2Cl2, e LCMS), o catalisador foi removido por filtração através de uma camada de celite. O filtrado foi concentrado por evaporação giratória, e foi seco brevemente sob alto vácuo para produzir o Composto 105a (3,28 g). LCMS e 1H RMN foram consistentes com o produto desejado.
[00867] O composto 147 (2,31 g, 11 mmol) foi dissolvido em DMF anidro (100 mL). N,N-Di-isopropiletilamina (DIEA, 3,9 mL, 22 mmol) foi adicionada, seguido por HBTU (4 g, 10,5 mmol). A mistura de reação foi deixada agitar por ~15 minutos sob nitrogênio. A isto, uma solução do composto 105a (3,3 g, 7,4 mmol) em DMF seco foi adicionada e agitada por 2 h sob atmosfera de nitrogênio. A ração foi diluída com EtOAc e lavada com NaHCO3 aquoso saturado e salmoura. A fase orgânica foi separada, seca (MgSO4), filtrada e concentrada em um xarope laranja. O material bruto foi purificado por cromatografia de coluna em sílica-gel e eluído com 2-5% MeOH em CH2Cl2 para produzir o Composto 148 (3,44 g, 73%). LCMS e 1H RMN foram consistentes com o produto esperado.
[00868] O composto 148 (3,3 g, 5,2 mmol) foi dissolvido em 1:1 MeOH/EtOAc (75 ml). A mistura de reação foi purgada, ebulindo-se um fluxo de argônio através da solução por 15 minutos. Um catalisador de Pearlman (hidróxido de paládio em carbono) foi adicionado (350 mg). O gás hidrogênio foi ebulido através da solução por 30 minutos. Após a conclusão (TLC 10% de MeOH em DCM, e LCMS), o catalisador foi removido por filtração através de uma camada de celite. O filtrado foi concentrado por evaporação giratória, e foi seco brevemente sob alto vácuo para produzir o Composto 149 (2,6 g). A LCMS foi consistente com o produto desejado. O resíduo foi dissolvido em DMF seco (10 ml) e foi usado imediatamente na etapa seguinte.
[00869] O composto 146 (0,68 g, 1,73 mmol) foi dissolvido em DMF seco (20 ml). A isto, DIEA (450 μL, 2,6 mmol, 1.5 eq.) e HBTU (1,96 g, 0.5.2 mmol) foram adicionados. A mistura de reação foi deixada agitar por 15 minutos à temperatura ambiente sob nitrogênio. Uma solução do composto 149 (2,6 g) em DMF anidro (10 mL) foi adicionada. O pH da reação foi ajustado para pH = 9-10 pela adição de DIEA (se necessário). A mistura de reação foi agitada à temperatura ambiente sob nitrogênio por 2 h. Após a conclusão, a reação foi diluída com EtOAc (100 mL) e foi lavada com NaHCO3 aquoso saturado seguido de salmoura. A fase orgânica foi separada, seca sobre MgSO4, filtrada e concentrada. O resíduo foi purificado por cromatografia de coluna em sílica-gel e eluído com 2-10 % MeOH em CH2Cl2 para produzir o Composto 150 (0,62 g, 20%). LCMS e RMN 1H foram consistentes com o produto desejado.
[00870] O composto 150 (0,62 g) foi dissolvido em 1:1 MeOH/EtOAc (5 L). A mistura de reação foi purgada, ebulindo-se um fluxo de argônio através da solução por 15 minutos. Um catalisador de Pearlman (hidróxido de paládio em carbono) foi adicionado (60 mg). O gás hidrogênio foi ebulido através da solução por 30 minutos. Após a conclusão (TLC 10% de MeOH em DCM, e LCMS), o catalisador foi removido por filtração (filtro de Teflon da ponta na seringa, 0,45 μm). O filtrado foi concentrado por evaporação giratória, e foi seco brevemente sob alto vácuo para produzir o Composto 151 (0,57 g). A LCMS foi consistente com o produto desejado. O produto foi dissolvido em 4 mL de DMF seco e foi usado imediatamente na etapa seguinte.
[00871] O composto 83a (0,11 g, 0,33 mmol) foi dissolvido em DMF anidro (5 mL) e N,N-Di-isopropiletilamina (75 μL, 1 mmol) e PFP-TFA (90 μL, 0,76 mmol) foram adicionados. A mistura de reação se tornou magenta após o contato, e se tornou gradualmente laranja durante os próximos 30 minutos. O progresso da reação foi monitorado por TLC e LCMS. Após a conclusão (formação de éster de PFP), uma solução do composto 151 (0,57 g, 0,33 mmol) em DMF foi adicionada. O pH da reação foi ajustado para pH = 9-10 pela adição de N,N-Di- isopropiletilamina (se necessário). A mistura de reação foi agitada sob nitrogênio por ~30 min. Após a conclusão, a maior parte do solvente foi removida sob pressão reduzida. O resíduo foi diluído com CH2Cl2 e lavado com NaHCO3 saturado e aquoso, seguido de salmoura. A fase orgânica foi separada, seca sobre MgSO4, filtrada e concentrada em um xarope laranja. O resíduo foi purificado por cromatografia de coluna em sílica-gel (2-10 % MeOH em CH2Cl2) para produzir o Composto 152 (0,35 g, 55%). LCMS e RMN 1H foram consistentes com o produto desejado.
[00872] O composto 152 (0,35 g, 0,182 mmol) foi dissolvido em 1:1 MeOH/EtOAc (10 mL). A mistura de reação foi purgada, ebulindo-se um fluxo de argônio através da solução por 15 minutos. Um catalisador de Pearlman (hidróxido de paládio em carbono) foi adicionado (35 mg). O gás hidrogênio foi ebulido através da solução por 30 minutos. Após a conclusão (TLC 10% de MeOH em DCM, e LCMS), o catalisador foi removido por filtração (filtro de Teflon da ponta na seringa, 0,45 μm). O filtrado foi concentrado por evaporação giratória, e foi seco brevemente sob alto vácuo para produzir o Composto 153 (0,33 g, quantitativo). A LCMS foi consistente com o produto desejado.
[00873] O composto 153 (0,33 g, 0,18 mmol) foi dissolvido em DMF anidro (5 mL) com agitação sob nitogênio. A isto,N,N-Di- isopropiletilamina (65 μL, 0,37 mmol) e PFP-TFA (35 μL, 0,28 mmol) foram adicionados. A mistura de reação foi agitada sob nitrogênio por ~30 min. A mistura de reação se tornou magenta após o contato, e gradualmente se tornou laranja. O pH da mistura de reação foi mantida em pH = 9-10, adicionando-se mais N,N-Di-isopropiletilamina. O progresso da reação foi monitorado por TLC e LCMS. Após a conclusão, a maior parte do solvente foi removido sob pressão reduzida. O resíduo foi diluído com CH2Cl2 (50 mL) e lavado com NaHCO3 aquoso saturado, seguido de salmoura. A camada orgânica foi seca com MgSO4, filtrada e concentrada em um xarope laranja. O resíduo foi purificado por cromatografia de coluna em sílica-gel e eluído com 2-10% MeOH em CH2Cl2 para produzir o Composto 154 (0,29 g, 79%). LCMS e RMN 1H foram consistentes com o produto desejado.
[00874] O Composto Oligomérico 155, compreendendo um grupo conjugado de GalNAc3-6, foi preparado usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-6 (GalNAc3-6a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-.
[00875] A estrutura de GalNAc3-6 (GalNAc3-6a-CM-) é mostrada abaixo:
Exemplo 52: Preparação do Oligonucleotídeo 1160Compreendendo GalNAc3-9
[00876] O composto 156 foi sintetizado após o procedimento descrito na literatura (J. Med. Chem. 2004, 47, 5798-5808).
[00877] O composto 156, (18,60 g, 29,28 mmol) foi dissolvido emmetanol (200 mL). Paládio em carbono (6,15 g, 10% em peso, carregamento (base seca), pó de carbono de matriz, úmido) foi adicionado. A mistura de reação foi agitada à temperatura ambiente em hidrogênio por 18 horas. A mistura da reação foi filtrada através de uma almofada de celite e a almofada de celite foi totalmente lavada com metanol. O filtrado combinado foi lavado e concentrado à secura. O resíduo foi purificado por cromatografia de coluna em sílica-gel e eluído com 5-10% de metanol em diclorometano para produzir o Composto 157 (14,26 g, 89%). Massa m/z 544,1 [M-H]-.
[00878] O composto 157 (5 g, 9,17 mmol) foi dissolvido em DMF anidro (30 mL). HBTU (3,65 g, 9,61 mmol) e N,N-Di-isopropiletilamina (13,73 mL, 78,81 mmol) foram adicionados e a mistura de reação foi agitada à temperatura ambiente por 5 minutos. A isto, foi adicionada uma solução do composto 47 (2,96 g, 7,04 mmol). A mistura de reação foi agitada à temperatura ambiente por 8 horas. A mistura de reação foi vertida em uma solução de NaHCO3 aquosa saturada. A mistura foi extraída com acetato de etila e a camada orgânica foi lavada com salmoura e seca (Na2SO4), filtrada e evaporada. O resíduo foi purificado por cromatografia de coluna em sílica-gel e eluído com 50% de acetato de etil em hexano para produzir o Composto 158 (8,25 g, 73,3%). A estrutura foi confirmada por LCMS e análise 1H RMN.
[00879] O composto 158 (7,2 g, 7,61 mmol) foi seco com P2O5 sob pressão reduzida. O composto seco foi dissolvido em DMF anidro (50 mL). A isto, 1H-tetrazol (0,43 g, 6,09 mmol) e N-metilimidazol (0,3 mL, 3,81 mmol) e fosforodiamidita de 2-cianoetil-N,N,N',N'-tetraisopropil (3,65 mL, 11,50 mmol) foram adicionados. A mistura de reação foi agitada sob uma atmosfera de argônio por 4 h. A mistura da reação foi diluída com acetato de etila (200 mL). A mistura de reação foi lavada com NaHCO3 saturado e salmoura. A fase orgânica foi separada, seca (NA2SO4), filtrada e evaporada. O resíduo foi purificado por cromatografia de coluna em sílica-gel e eluído com 50-90% e acetato de etil em hexano para produzir o Composto 159 (7,82 g, 80,5%). A estrutura foi confirmada por LCMS e análise 1H RMN.
[00880] O composto oligomérico 160, compreendendo um grupo do conjugado de GalNAc3-9, foi preparado usando procedimentos de síntese de oligonucleotídeo padrão. Três unidades do composto 159 foram acopladas ao suporte sólido, seguido por fosforamiditas nucleotídicas. O tratamento do composto oligomérico protegido com amônia aquosa produziu o composto 160. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-9 (GalNAc3-9a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3-9 (GalNAc3-9a-CM) é mostrada abaixo:
Exemplo 53: Procedimento alternativo para a preparação do Composto 18 (GalNAc3-1a e GalNAc3-3a)
[00881] A lactona 161 foi reagida com diamino propano (3-5 eq) ou diamino propano protegido por Mono-Boc (1 eq) para fornecer o álcool 162a ou 162b. Quado a propanodiamina não protegida foi usada para a reação acima, o excesso de diamina foi removido por evaporação sob alto vácuo e o grupo amino livre em 162a foi protegido usando CbzCl para fornecer o 162b como um sólido branco após a purificação por cromatografia de coluna. O álcool 162b foi ainda reagido com o composto 4 na presença de TMSOTf para fornecer o 163a que foi convertido em 163b pela remoção do grupo Cbz usando hidrogenação catalítica. O éster de pentafluorofenil (PFP) 164 foi preparado, reagindo-se o triácido 113 (ver o Exemplo 48) com PFPTFA (3,5 eq) e piridina (3,5 eq) em DMF (0,1 a 0,5 M). O triéster 164 foi diretamente reagido com a amina 163b (3-4 eq) e DIPEA (3-4 eq) para fornecer o Composto 18. O método acima facilita grandemente a purificação dos intermediários e minimiza a formação de subprodutos que são formados usando o procedimento descrito no Exemplo 4.Exemplo 54: Procedimento alternativo para a preparação doComposto 18 (GalNAc3-1a e GalNAc3-3a)
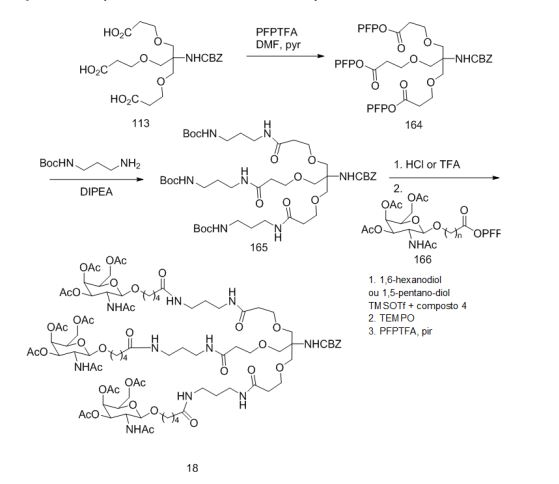
[00882] O éster triPFP 164 foi preparado a partir do ácido 113 usando o procedimento delineado no exemplo 53 acima e reagido com diamina protegida por mono-Boc para fornecer o 165 em um rendimento essencialmente quantitativo. Os grupos Boc foram removidos com ácido clorídrico ou ácido trifluoroacético para fornecer a triamina que foi reagida com o ácido ativado por PFP 166 na presença de uma base adequada, tal como DIPEA para fornecer o Composto 18.
[00883] O ácido de Gal-NAc protegido por PFP 166 foi preparado a partir do ácido correspondente pelo tratamento com PFPTFA (1-1,2 eq) e piridina (1-1,2 eq) em DMF. O ácido precursor, por sua vez, foi preparado a partir do álcool correspondente por oxidação usando TEMPO (0,2 eq) e BAIB em acetonitrila e água. O álcool precursor foi preparado a partir do intermediário de açúcar 4 pela reação com 1,6- hexanodiol (ou 1,5-pentanodiol ou outro diol para outros n valores) (2-4 eq) e TMSOTf usando as condições descritas anteriormente no exemplo 47.Exemplo 55: Estudo dependente de dose de oligonucleotídeos compreendendo grupos de conjugados em 3' e em 5' (comparação de GalNAc3-1, 3, 8 and 9) direcionando ao SRB-1 in vivo
[00884] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos. ISIS 353382 não conjugado foi incluído como um padrão. Cada um dos diversos grupos de conjugado de GalNAc3 foi ligado tanto ao terminal 3' quanto ao 5' do oligonucleotídeos respectivo por um nucleosídeo de 2'-desoxiadenosina ligado a fosfodiéster (porção clivável).TABELA 26
[00885] ASO modificado que se direciona ao SRB-1
[00886] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00887] A estrutura de GalNAc3-1a foi mostrada anteriormente no Exemplo 9. A estrutura de GalNAc3-9 foi mostrada anteriormente no Exemplo 52. A estrutura de GalNAc3-3 foi mostrada anteriormente no Exemplo 39. A estrutura de GalNAc3-8 foi mostrada anteriormente no Exemplo 47.Tratamento
[00888] Camundongos Balb/c machos de seis semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea uma vez na dosagem mostrada abaixo com ISIS 353382, 655861, 664078, 661161, 665001 ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizados para o controle com salina.
[00889] Conforme ilustrado na Tabela 27, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. De fato, os oligonucleotídeos antissenso que compreendem os conjugados de GalNAc3-1 e GalNAc3-9 ligados ao fosfodiéster no terminal 3' (ISIS 655861 e ISIS 664078) ou os conjugados de GalNAc3-3 e GalNAc3-8 ligados no teminal 5' (ISIS 661161 e ISIS 665001) mostraram melhora substancial de potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 353382). Além disso, o ISIS 664078, que compreende um conjugado de GalNAc3-9 no terminal 3' foi essencialmente equipotente comparado ao ISIS 655861, que compreende um conjugado de GalNAc3-1 no terminal 3'. Os oligonucleotídeos antissenso conjugados em 5', ISIS 661161 e ISIS 665001, que compreendem um GalNAc3-3 ou GalNAc3-9, respectivamente, tiveram maior potência em comparação aos oligonucleotídeos antissenso conjugados em 3' (ISIS 655861 e ISIS 664078).TABELA 27
[00890] ASOs contendo GalNAc3-1, 3, 8 ou 9 que se direciona ao SRB-1
[00891] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro foram medidos em relação aos camundongos injetados com salina usando protocolos- padrão. Também foram avaliadas a bilirrubina total e BUN. A alteração nos pesos corporais foi avaliada sem nenhuma alteração significativa do grupo com salina. Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na tabela abaixo.
Exemplo 56: Estudo dependente de dose de oligonucleotídeos compreendendo grupos de conjugados em 3' e em 5' (comparação de GalNAc3-1, 2, 3, 5, 6, 7 e 10) direcionando ao SRB-1 in vivo
[00892] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos. ISIS 353382 não conjugado foi incluído como um padrão. Cada um dos diversos grupos de conjugado de GalNAc3 foi ligado ao terminal 5' do respectivo oligonucleotídeo por um nucleosídeo de 2'-desoxiadenosina ligado a fosfodiéster (porção clivável), exceto pelo ISIS 655861 que teve o grupo conjugado de GalNAc3 ligado no terminal 3'.TABELA 29
[00893] ASO modificado que se direciona ao SRB-1ASO Sequência (5' para 3') Motivo Conjuga do SEQ ID No.
[00894] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00895] A estrutura de GalNAc3-1a foi mostrada anteriormente no Exemplo 9. A estrutura de GalNAc3-2a foi mostrada anteriormente no Exemplo 37. A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura de GalNAc3-5a foi mostrada anteriormente no Exemplo 49. A estrutura de GalNAc3-6a foi mostrada anteriormente no Exemplo 51. A estrutura de GalNAc3-7a foi mostrada anteriormente no Exemplo 48. A estrutura de GalNAc3-10a foi mostrada anteriormente no Exemplo 46.Tratamento
[00896] Camundongos Balb/c machos de seis semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados uma vez na dosagem mostrada abaixo com ISIS 353382, 655861, 664507, 661161, 666224, 666961, 666981, 666881 ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizados para o controle com salina.
[00897] Conforme ilustrado na Tabela 30, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. De fato, os oligonucleotídeos antissenso mostraram melhora substancial na potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 353382). Os oligonucleotídeos antissenso conjugados em 5' mostraram um ligeiro aumento na potência em comparação ao oligonucleotídeo antissenso conjugado em 3'.
[00898] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro foram medidos em relação aos camundongos injetados com salina usando protocolos- padrão. Também foram avaliadas a bilirrubina total e BUN. A alteração nos pesos corporais foi avaliada sem nenhuma alteração significativa do grupo com salina. Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na Tabela 31 abaixo.
Exemplo 57: Duração do estudo de ação de oligonucleotídeos compreendendo um grupo conjugado em 3' que se direciona a ApoC III in vivo
[00899] Camundongos foram injetados uma vez que as doses indicadas abaixo e monitorados durante o curso de 42 dias para os níveis de ApoC-III e de triglicerídeos plasmáticos (TG plasmático). O estudo foi realizado usando 3 camundongos transgênicos que expressam a APOC-III humana em cada grupo.Tabela 32
[00900] ASO modificado que se direciona à ApoC III
[00901] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00902] A estrutura de GalNAc3-1a foi mostrada anteriormente noExemplo 9.Tabela 33
[00903] Níveis de mRNA de ApoC III (% de Salina no Dia 1) e TGPlasmático (% de Salina no Dia 1)
[00904] Como pode ser visto na tabela acima, a duração da açãoaumentou com a adição do grupo conjugado em 3' em comparação ao oligonucleotídeo não conjugado. Houver um aumento adicional na duração da ação para o oligonucleotídeo de PO/PS misto conjugado 647536 em comparação ao oligonucleotídeo PS completo conjugado 647535. Exemplo 58: Estudo dependente de dose de oligonucleotídeos compreendendo grupos de conjugados em 3' (comparação de GalNAc3-1 e GalNAc4-11) direcionando ao SRB-1 in vivo
[00905] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos. ISIS 440762 não conjugado foi incluído como um padrão não conjugado. Cada um dos grupos de conjugado foi ligado no terminal 3' do respectivo oligonucleotídeo por uma porção clivável do nucleosídeo de 2'-desoxiadenosina ligado a fosfodiéster.
[00906] A estrutura de GalNAc3-1a foi mostrada anteriormente no Exemplo 9. A estrutura de GalNAc3-11a foi mostrada anteriormente no Exemplo 50.Tratamento
[00907] Camundongos Balb/c machos de seis semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea uma vez na dosagem mostrada abaixo com ISIS 440762, 651900, 663748 ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizados para o controle com salina.
[00908] Conforme ilustrado na Tabela 34, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. Os oligonucleotídeos antissenso que compreendem os conjugados de GalNAc3-1 e GalNAc4-11 ligados a fosfodiéster no terminal 3' (ISIS 651900 e ISIS 663748) mostraram melhora substancial na potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 440762). Os dois conjugados de oligonucleotídeos, GalNAc3-1 e GalNAc4-11 eram equipotentes.TABELA 34
[00909] ASO modificado que se direciona ao SRB-1
[00910] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "k" indica um nucleosídeo bicíclico 6'- (S)-CH3; "d" indica um β-D-2-desoximbonucleosideo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00911] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro também foram medidos em relação aos camundongos que foram injetados com solução salina usando protocolos-padrão. Também foram avaliadas a bilirrubina total e BUN. A alteração nos pesos corporais foi avaliada sem nenhuma alteração significativa do grupo com salina. Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na Tabela 35 abaixo.
Exemplo 59: Efeitos do conjugado GalNAc3-1 direcionando FXI in vivo
[00912] Os oligonucleotídeos listados abaixo foram testados em um estudo de doses múltiplas para a inibição antissenso de FXI em camundongos. ISIS 404071 foi incluído como um padrão não conjugado. Cada um dos grupos de conjugado foi ligado no terminal 3' do respectivo oligonucleotídeo por uma porção clivável de nucleosídeo de 2'-desoxiadenosina ligado a fosfodiéster.TABELA 36
[00913] ASOs modificados direcionados ao FXI
[00914] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00915] A estrutura de GalNAc3-1a foi mostrada anteriormente no Exemplo 9.Tratamento
[00916] Camundongos Balb/c machos de seis semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea duas vezes por semana por 3 semanas na dosagem mostrada abaixo com ISIS 404071, 656172, 656173 ou controle tratado com PBS. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de FXI no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis da proteína FXI plasmáticos também foram medidos usando ELISA. Os níveis de mRNA de FXI foram determinados em relação ao RNA total (usando RIBOGREEN®), antes da normalização para controles tratados com PBS. Os resultados são apresentados a seguir como a porcentagem média dos níveis de mRNA de FXI para cada grupo de tratamento. Os dados foram normalizados para os controles tratados com PBS e é denotado como "% de PBS". Os ED50s foram medidos usando métodos semelhantes, conforme descrito anteriormente e são apresentados a seguir.TABELA 37
[00917] mRNA do Fator XI (% de Salina)
[00918] Conforme ilustrado na Tabela 37, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de FXI de uma forma dependente da dose. Os oligonucleotídeos que compreendem um grupo conjugado de 3'-GalNAc3-1 mostrou melhora substancial na potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 404071). Entre os dois oligonucleotídeos conjugados, uma melhora na potência foi ainda fornecida, substituindo-se algumas das ligações PS por PO (ISIS 656173).
[00919] Conforme ilustrado na Tabela 37a, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de da proteína FXI de uma forma dependente da dose. Os oligonucleotídeos que compreendem um grupo conjugado de 3'-GalNAc3-1 mostrou melhora substancial na potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 404071). Entre os dois oligonucleotídeos conjugados, uma melhora na potência foi ainda fornecida, substituindo-se algumas das ligações PS por PO (ISIS 656173).TABELA 37A
[00920] Proteína Fator XI (% de Salina)
[00921] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro também foram medidos em relação aos camundongos que foram injetados com solução salina usando protocolos-padrão. Bilirrubina total, albumina total, CRE e BUN também foram avaliados. A alteração nos pesos corporais foi avaliada sem nenhuma alteração significativa do grupo com salina. Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na tabela abaixo.
Exemplo 60: Efeitos de ASOs conjugados que se direcionam aoSRB-1 in vitro
[00922] Os oligonucleotídeos listados abaixo foram testados em um estudo de doses múltiplas para inibição antissenso de SRB-1 em hepatócitos de camundongo primários. ISIS 353382 foi incluído como um padrão não conjugado. Cada um dos grupos de conjugado foi ligado no terminal 3' ou 5' do respectivo oligonucleotídeo por uma porção clivável de nucleosídeo de 2'-desoxiadenosina ligado a fosfodiéster.TABELA 39
[00923] ASO modificado que se direciona ao SRB-1
[00924] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00925] A estrutura de GalNAc3-1a foi mostrada anteriormente no Exemplo 9. A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura de GalNAc3-8a foi mostrada anteriormente no Exemplo 47. A estrutura de GalNAc3-9a foi mostrada anteriormente no Exemplo 52. A estrutura de GalNAc3-6a foi mostrada anteriormente no Exemplo 51. A estrutura de GalNAc3-2a foi mostrada anteriormente no Exemplo 37. A estrutura de GalNAc3-10a foi mostrada anteriormente no Exemplo 46. A estrutura de GalNAc3-5a foi mostrada anteriormente no Exemplo 49. A estrutura de GalNAc3-7a foi mostrada anteriormente no Exemplo 48.Tratamento
[00926] Os oligonucleotídeos listados acima foram testados in vitro em células hepatócitos primários de camundongo colocadas em uma densidade de 25.000 células por poço e tratadas com 0,03, 0,08, 0,24, 0,74, 2,22, 6,67 ou 20 nM de oligonucleotídeo modificado. Após um período de tratamento de aproximadamente 16 horas, o RNA foi isolado das células e os níveis de mRNA foram medidos por PCR em tempo rea quantitativa e os níveis de mRNA de SRB-1 foram ajustados de acordo com o conteúdo total de RNA, conforme medido por RIBOGREEN®.
[00927] A IC50 foi calculada usando métodos padrão e os resultados são apresentados na Tabela 40. Os resultados mostram que, sob condições de absorção livre nas quais nenhum reagente ou nenhuma técnica de eletroporação são usados para promover artificialmente a entrada dos oligonucleotídeos nas células, os oligonucleotídeos que compreendem um conjugado de GalNAc foram significativamente mais potentes nos hepatócitos do que o oligonucleotídeo de origem (ISIS 353382) que não compreende um conjugado de GalNAc.
[00928] Média de múltiplas execuções.Exemplo 61: Preparação do composto oligomérico 175 compreendendo GalNAc3-12
[00929] O composto 169 está disponível comercialmente. O composto 172 foi preparado pela adição de benzil (perfluorofenil) glutarato ao composto 171. O benzil (perfluorofenil) glutarato foi preparado, adicionando-se PFP-TFA e DIEA ao ácido 5-(benzilóxi)-5- oxopentanoico em DMF. O Composto Oligomérico 175, compreendendo um grupo conjugado de GalNAc3-12 foi preparado a partir do composto 174 usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-12 (GalNAc3-12a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad- P(=O)(OH)-. A estrutura de GalNAc3-12 (GalNAc3-12a-CM-) é mostrada abaixo:
Exemplo 62: Preparação do composto oligomérico 180
[00930] O composto 176 foi preparado usando o procedimento geral mostrado no Exemplo 2. O Composto Oligomérico 180, compreendendo um grupo conjugado de GalNAc3-13, foi preparado a partir do composto 177 usando os procedimentos gerais ilustrados no Exemplo 49. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-13 (GalNAc3-13a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad- P(=O)(OH)-. A estrutura de GalNAc3-13 (GalNAc3-13a-CM-) é mostrada abaixo:
Exemplo 63: Preparação do composto oligomérico 188compreendendo GalNAc3-14
[00931] Os compostos 181 e 185 estão disponíveis comercialmente. O Composto Oligomérico 188, compreendendo um grupo conjugado de GalNAc3-14 foi preparado a partir do composto 187 usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-14 (GalNAc3-14a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3-14 (GalNAc3-14a-CM-) é mostrada abaixo:
Exemplo 64: Preparação do composto oligomérico 197 compreendendo GalNAc3-15
[00932] O composto 189 está disponível comercialmente. O composto 195 foi preparado usando o procedimento geral mostrado no Exemplo 31. O composto oligomérico 197, que compreende um grupo conjugado de GalNAc3-15, foi preparado a partir dos compostos 194 e 195 usando procedimentos de síntese de oligonucleotídeo padrão. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-15 (GalNAc3-15a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3-15 (GalNAc3-15a-CM-) é mostrada abaixoExemplo 65: Estudo dependente de dose de oligonucleotídeos compreendendo grupos de conjugados em 5' (comparação de GalNAc3-3, 12, 13, 14 e 15) direcionando ao SRB-1 in vivo
[00933] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos. ISIS 353382 não conjugado foi incluído como um padrão. Cada um dos grupos de conjugado GalNAc3 foi ligado no terminal 5' do respectivo oligonucleotídeo por uma porção clivável de nucleosídeo de 2'-desoxiadenosina ligado a fosfodiéster (porção clivável).TABELA 41
[00934] ASOs modificados direcionados a SRB-1
[00935] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00936] A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura de GalNAc3-12a foi mostrada anteriormente no Exemplo 61. A estrutura de GalNAc3-13a foi mostrada anteriormente no Exemplo 62. A estrutura de GalNAc3-14a foi mostrada anteriormente no Exemplo 63. A estrutura de GalNAc3-15a foi mostrada anteriormente no Exemplo 64.Tratamento
[00937] Camundongos C57bl6 de seis a oito semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea uma ou duas vezes na dosagem mostrada abaixo com ISIS 353382, 661161, 671144, 670061, 671261, 671262, ou com solução salina. Os camundongos que foram dosados duas vezes receberam a segunda dose três dias após a primeira dose. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizados para o controle com salina.
[00938] Conforme ilustrado na Tabela 42, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. Nenhuma diferença significativa no knockdown alvo foi observada entre os animais que receberam uma dose única e os animais que receberam duas doses (ver ISIS 353382, dosagens 30 e 2 x 15 mg/kg; e ISIS 661161 dosagens 5 e 2 x 2,5 mg/kg). Os oligonucleotídeos que compreendem os conjugados de GalNAc3-3, 12, 13, 14 e 15 ligados a fosfodiéster mostraram melhora substancial na potência em comparação ao oligonucleotídeo antissenso não conjugado (ISIS 335382).TABELA 42
[00939] mRNA de SRB-1 (% de Salina)
[00940] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro também foram medidos em relação aos camundongos que foram injetados com solução salina usando protocolos-padrão. Também foram avaliadas a bilirrubina total e BUN. As alterações dos pesos corporais foram avaliadas sem nenhuma diferença significativa do grupo com salina (dados não-mostrados). Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na Tabela 43 abaixo.
Exemplo 66: Efeito de diversas porções cliváveis sobre a inibição antissenso in vivo pelo oligonucleotídeos que se direcionam ao SRB-1 compreendendo um agrupamento de 5'-GalNAc3.
[00941] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos. Cada grupo conjugado GalNAc3 foi ligado no terminal 5' do respectivo oligonucleotídeo por uma porção clivável de nucleosídeo de 2'-desoxiadenosina ligado a fosfodiéster (porção clivável) (CM). TABELA 44
[00942] ASOs modificados direcionados a SRB-1
[00943] Letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metilcitosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um β-D-2'- desoxirribonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00944] A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura de GalNAc3-13a foi mostrada anteriormente no Exemplo 62.Tratamento
[00945] Camundongos C57bl6 de seis a oito semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subscutânea uma vez na dosagem mostrada abaixo com ISIS 661161, 670699, 670700, 670701, 671165, ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 no fígado usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizados para o controle com salina.
[00946] Conforme ilustrado na Tabela 45, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. Os oligonucleotídeos antissenso compreendendo diversas porções cliváveis todos mostraram potências semelhantes.TABELA 45
[00947] mRNA de SRB-1 (% de Salina)
[00948] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro também foram medidos em relação aos camundongos que foram injetados com solução salina usando protocolos-padrão. Também foram avaliadas a bilirrubina total e BUN. As alterações dos pesos corporais foram avaliadas sem nenhuma diferença significativa do grupo com salina (dados não-mostrados). Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na Tabela 46 abaixo.
Exemplo 67: Preparação do composto oligomérico 199 compreendendo GalNAc3-16
[00949] O Composto Oligomérico 199, compreendendo um grupo conjugado de GalNAc3-7 foi preparado usando os procedimentos gerais ilustrados nos Exemplos 7 e 9. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-16 (GalNAc3-16a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é -P(=O) (OH)-umd- P(=O)(OH)-. A estrutura de GalNAc3-16 (GalNAc3-16a- CM-) é mostrada abaixo:
Exemplo 68: Preparação do composto oligomérico 200compreendendo GalNAc3-17
[00950] O Composto Oligomérico 1200, compreendendo um grupo conjugado de GalNAc3-17, foi preparado usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-17 (GalNAc3-17a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3-17 (GalNAc3-17a- CM-) é mostrada abaixo:
Exemplo 69: Preparação compreendendo GalNAc3-18
[00951] O Composto Oligomérico 201, compreendendo um grupo conjugado de GalNAc3-18, foi preparado usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-18 (GalNAc3-18a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3-18 (GalNAc3-18a- CM-) é mostrada abaixo:
Exemplo 70: Preparação do composto oligomérico 204compreendendo GalNAc3-19
[00952] O Composto Oligomérico 204, compreendendo um grupo conjugado de GalNAc3-14 foi preparado a partir do composto 64 usando os procedimentos gerais ilustrados no Exemplo 52. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-19 (GalNAc3-19a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3- 19 (GalNAc3-19a-CM-) é mostrada abaixo:
Exemplo 71: Preparação do composto oligomérico 210 compreendendo GalNAc3-20
[00953] O composto 205 foi preparado, adicionando-se PFP-TFA e DIEA ao ácido 6-(2,2,2-trifluoroacetamido)hexanoico em acetonitrila, que foi preparada pela adição de anidrido tríflico ao ácido 6- aminohexanoico. A mistura de ração foi aquecida a 80°C, em seguida abaixada para temperatura ambiente. O Composto Oligomérico 210, compreendendo um grupo conjugado de GalNAc3-20 foi preparado a partir do composto 208 usando os procedimentos gerais ilustrados no Exemplo 52. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-20 (GalNAc3-20a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad- P(=O)(OH)-. A estrutura de GalNAc3-20 (GalNAc3-20a-CM-) émostrada abaixo:
Exemplo 72: Preparação do composto oligomérico 215 compreendendo GalNAc3-21
[00954] O composto 211 está disponível comercialmente. O Composto Oligomérico 215, compreendendo um grupo conjugado de GalNAc3-21 foi preparado a partir do composto 213 usando os procedimentos gerais ilustrados no Exemplo 52. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-21 (GalNAc3-21a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3- 21 (GalNAc3-10a-CM-) é mostrada abaixo:
Exemplo 73: Preparação do composto oligomérico 221compreendendo GalNAc3-22
[00955] O composto 220 foi preparado a partir do composto 219 usando tetrazolida de di-isopropilamônio. O Composto Oligomérico 221, compreendendo um grupo conjugado de GalNAc3-21, é preparado a partir do composto 220 usando os procedimentos gerais ilustrados no Exemplo 52. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-22 (GalNAc3-22a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, a porção clivável é-P(=O)(OH)-Ad-P(=O)(OH)-. A estrutura de GalNAc3-22 (GalNAc3-20a- CM-) é mostrada abaixo:
Exemplo 74: Efeito de diversas porções cliváveis sobre a inibição antissenso in vivo pelo oligonucleotídeos que se direcionam ao SRB-1 compreendendo um agrupamento de 5'-GalNAc3.
[00956] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos. Cada um dos grupos de conjugado de GalNAc3 foi ligado no terminal 5' do respectivo oligonucleotídeo.TABELA 47
[00957] ASOs modificados direcionados a SRB-1
[00958] Em todas as tabelas, as letras maiúsculas indicam a nucleobase para cada nucleosídeo e mC indica uma 5-metil citosina. Subscritos: "e" indica um nucleosídeo 2'-MOE modificado; "d" indica um e-D-2-desoximbonucleosídeo; "s" indica uma ligação internucleosídica fosforotioato (PS); "o" indica uma ligação internucleosídica fosfodiéster (PO); e "o'" indica -O-P(=O)(OH)-. Os grupos de conjugado estão em negrito.
[00959] A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura de GalNAc3-17a foi mostrada anteriormente no Exemplo 68, e a estrutura de GalNAc3-18a foi mostrada no Exemplo 69.Tratamento
[00960] Camundongos C57BL/6 de seis a oito semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea uma vez na dosagem mostrada abaixo com um oligonucleotídeo listado na Tabela 47 ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizados para o controle com salina.
[00961] Conforme ilustrado na Tabela 48, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. Os oligonucleotídeos antissenso que compreendem um conjugado de GalNAc mostraram potências semelhantes e foram significativamente mais potentes do que o oligonucleotídeo de origem em que faltava um conjugado de GalNAc.TABELA 48
[00962] mRNA de SRB-1 (% de Salina)
[00963] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro também foram medidos em relação aos camundongos que foram injetados com solução salina usando protocolos-padrão. Também foram avaliadas a bilirrubina total e BUN. A alteração nos pesos corporais foi avaliada sem nenhuma alteração significativa do grupo com salina (dados não- mostrados). Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na Tabela 49 abaixo.TABELA 49
Exemplo 75: Análise farmacocinética de oligonucleotídeos comprendendo um grupo conjugado em 5'
[00964] A PK dos ASOs nas Tabelas 41, 44 e 47 acima foi avaliada usando amostras de fígado que foram obtidas após os procedimentos de tratamento descritos nos Exemplos 65, 66 e 74. As amostras de fígado foram cortadas e extraídas usando protocolos-padrão e analisadas por IP-HPLC-MS juntamente com um padrão interno. O nível de tecido combinado (μg/g) de todos os metabólitos foi medido pela integração dos picos de UV apropriados, e o nível de tecido do ASO de comprimento total em que faltava o conjugado ("de origem", que tem N° Isis 353382 neste caso) foi medido usando os cromatogramas de íon extraído apropriados (EIC). TABELA 50:
[00965] Análise PK no Fígado
[00966] Os resultados na Tabela 50 acima mostram que houve maiores níveis de tecido hepático dos oligonucleotídeos compreendendo um grupo conjugado de GalNAc3 do que do oligonucleotídeo de origem que não compreende um grupo conjugado de GalNAc3 (ISIS 353382) 72 horas após a administração do oligonucleotídeo, particularmente ao levar em consideração as diferenças na dosagem entre os oligonucleotídeos com e sem um grupo conjugado de GalNAc3. Além disso, em 72 horas, 40-98% de cada oligonucleotídeo compreendendo um grupo conjugado deGalNAc3 foram metabolizados no composto de origem, indicando que os grupos de conjugado de GalNAc3 foram clivados a partir dos oligonucleotídeos.Exemplo 76: Preparação do composto oligomérico 230 compreendendo GalNAc3-23
[00967] O composto 222 está disponível comercialmente. 44,48 ml (0,33 mol) do composto 222 foram tratados com cloreto de tosil (25,39 g, 0,13 mol) em piridina (500mL) por 16 horas. A reação foi então evaporada para um óleo, dissolvida em EtOAc e lavada com água, NaHCO3 saturado, salmoura e foi seca sobre Na2SO4. O acetato de etila foi concentrado até a secura e purificado por cromatografia em coluna, eluído com EtOAc/hexanos (1:1) seguidos de 10% de metanol em CH2Cl2 para render o composto 223 como um óleo incolor. LCMS e RMN foram consistentes com a estrutura. 10 g (32,86 mmol) de 1- Tosiltrietileno glicol (composto 223) foi tratado com azida sódica (10,68 g, 164,28 mmol) em DMSO (100 mL) à temperatura ambiente por 17 horas. A mistura de reação foi então vertida em água, e extraída com EtOAc. A camada orgânica foi lavada com água três vezes e seca sobre Na2SO4. A camada orgânica foi concentrada até a secura para render 5,3 g do composto 224 (92%). LCMS e RMN foram consistentes com a estrutura. 1-Azidotrietileno glicol (composto 224, 5,53 g, 23,69 mmol) e o composto 4 (6 g, 18,22 mmol) foram tratados com peneiras moleculares 4A (5 g), e TMSOTf (1,65 ml, 9,11 mmol) em diclorometano (100 mL) sob uma atmosfera inerte. Após 14 horas, a reação foi filtrada para remover as peneiras, e a camada orgânica foi lavada com NAHCO3 saturado, água, salmoura e foi seca sobre Na2SO4. A camada orgânica foi concentrada à secura e purificada por cromatografia de coluna, eluída com um gradiente de metanol 2 a 4% em diclorometano para gerar o composto 225. LCMS e RMN foram consistentes com a estrutura. O composto 225 (11,9 g, 23,59 mmol) foi hidrogenado em EtOAc/Metanol (4:1, 250 mL) com catalisador de Pearlman. Após 8 horas, o catalisador foi removido por filtração e os solventes removidos à secura para gerar o composto 226. LCMS e RMN foram consistentes com a estrutura.
[00968] A fim de gerar o composto 227, uma solução de ácido nitrometanotrispropiônico (4,17 g, 15,04 mmol) e base de Hunig (10,3 ml, 60,17 mmol) em DMF (100 mL) foram tratados em gotas com acetato de pentaflourotrifluoro (9,05 ml, 52,65 mmol). Após 30 minutos, a reação foi vertida em água gelada e extraída com EtOAc. A camada orgânica foi lavada com água, salmoura e seca sobre Na2SO4. A camada orgânica foi concentrada à secura e, em seguida, recristalizada a partir do heptano para render o composto 227 como um sólido branco. LCMS e RMN foram consistentes com a estrutura. O composto 227 (1,5 g, 1,93 mmol) e o composto 226 (3,7 g, 7,74 mmol) foram agitados à temperatura ambiente em acetonitrila (15 mL) por 2 horas. A reação foi então evaporada à secura e purificada por cromatografia de coluna, eluindo-se com um gradiente de metanol 2 a 10% em diclorometano para gerar o composto 228. LCMS e RMN foram consistentes com a estrutura. O composto 228 (1,7 g, 1,02 mmol) foi tratado com níquel de Raney (cerca de 2 g úmido) em etanol (100mL) em uma atmosfera de hidrogênio. Após 12 horas, o catalisador foi removido por filtração e a camada orgânica foi evaporada a um sólido que foi usado diretamente na etapa seguinte. LCMS e RMN foram consistentes com a estrutura. Este sólido (0,87 g, 0,53 mmol) foi tratado com ácido benzilglutárico (0,18 g, 0,8 mmol), HBTU (0,3 g, 0,8 mmol) e DIEA (273,7 μl, 1,6 mmol) em DMF (5 mL). Após 16 horas, o DMF foi removido sob pressão reduzida a 65°C a um óleo, e o óleo foi dissolvido em diclorometano. A camada orgânica foi lavada com solução de NaHCO3, salmoura e seca sobre Na2SO4. Após a evaporação da camada orgânica, o composto foi purificado por cromatografia de coluna e eluído com um gradiente de metanol 2 a 20% em diclorometano para gerar o produto acoplado. LCMS e RMN foram consistentes com a estrutura. O éster benzílico foi desprotegido com catalisador de Pearlman sob uma atmosfera de hidrogênio por 1 hora. O catalisador foi então removido por filtração e os solventes removidos à secura para gerar o ácido. LCMS e RMN foram consistentes com a estrutura. O ácido (486 mg, 0,27 mmol) foi dissolvido em DMF seco (3 mL). Piridina (53,61 μl, 0,66 mmol) foi adicionada e a reação foi purgada com argônio. Acetato de pentaflourotriflouro (46,39 μl, 0,4 mmol) foi lentamente adicionado à mistura de reação. A cor da reação mudou de amarelo pálido para vinho, e gerou uma fumaça clara que foi dissipada com um fluxo de argônio. A reação foi deixada agitar à temperatura ambiente por uma hora (a conclusão da reação foi confirmada por LCMS). O solvente foi removido sob pressão reduzida (rotovap) a 70°C. O resíduo foi diluído com DCM e lavado com 1N NaHSO4, salmoura, bicarbonato de sódio saturado e salmoura novamente. Os produtos orgânicos foram secos com NaSO4, filtrados, e foram concentrados à secura para gerar 225 mg do composto 229 como uma espuma amarela frágil. LCMS e RMN foram consistentes com a estrutura.
[00969] O Composto Oligomérico 230, compreendendo um grupo conjugado de GalNAc3-23 foi preparado a partir do composto 229 usando os procedimentos gerais ilustrados no Exemplo 46. A parte do agrupamento GalNAc3 do grupo conjugado GalNAc3-23 (GalNAc3- 23a) pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. A estrutura de GalNAc3-23 (GalNAc3-23a-CM) é mostrada abaixo:
Exemplo 77: Inibição antissenso in vivo por oligonucleotídeos que direcionam SRB-1 compreendendo conjugado GalNAc3
[00970] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos.TABELA 51
[00971] ASOs modificados direcionados a SRB-1
[00972] A estrutura GalNAc3-1a foi mostrada anteriormente no Exemplo 9, GalNAc3-3a foi mostrada no Exemplo 39, GalNAc3-9a foi mostrada no Exemplo 52, GalNAc3-10a foi mostrada no Exemplo 46, GalNAc3-19a foi mostrada no Exemplo 70, GalNAc3-20a foi mostrada no Exemplo 71 e GalNAc3-23um foi mostrada no Exemplo 76.Tratamento
[00973] Camundongos C57BL/6 de seis a oito semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram, cada um, injetados por via subcutânea uma vez em uma dosagem mostrada abaixo com um oligonucleotídeo listado na Tabela 51 ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final para determinar os níveis de mRNA de SRB-1 usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento, normalizados para o controle com salina.
[00974] Conforme ilustrado na Tabela 52, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose. TABELA 52
[00975] mRNA de SRB-1 (% de Salina)
[00976] Os níveis de transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas no soro também foram medidos usando protocolos-padrão. Também foram avaliadas a bilirrubina total e BUN. As alterações dos pesos corporais foram avaliadas sem nenhuma diferença significativa do grupo com salina (dados não-mostrados). Os valores de ALTs, ASTs, bilirrubina total e BUN são mostrados na Tabela 53 abaixo.
Exemplo 78: Inibição antissenso in vivo por oligonucleotídeos que direcionam Angiotensinogênio compreendendo conjugado GalNAc3
[00977] Os oligonucleotídeos listados abaixo foram testados em um estudo dependente de dose para inibição antissenso do Angiotensinogênio (AGT) em ratos Sprague Dawley normotensos.TABELA 54
[00978] ASOs modificados direcionados a AGT
[00979] A estrutura de GalNAc3-1a foi mostrada anteriormente no Exemplo 9.Tratamento
[00980] Ratos Sprague Dawley machos de seis semanas de idade foram, cada um, injetados por via subcutânea uma vez por semana em uma dosagem mostrada abaixo, para um total de três doses, com um oligonculeotídeo listado na Tabela 54 ou com PBS. Cada grupo de tratamento consistiu em 4 animais. Os ratos foram sacrificados 72 horas após a dose final. Os níveis de mRNA hepáticos de AGT foram medidos usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis plasmáticos da proteína AGT foram medidos usando o ELISA de Angiotensinogênio Total (Catálogo # JP27412, IBL International, Toronto, ON) com plasma diluído 1:20.000. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de AGT no fígado ou níveis da proteína AGT no plasma para cada grupo de tratamento, normalizados para o controle com PBS.
[00981] Conforme ilustrado no Tabela 55, o tratamento com oligonucleotídeos antissenso diminuiu os níveis da proteína plasmática e do mRNA hepático de AGT de uma forma dependente da dose, e o oligonucleotídeo compreendendo um conjugado de GalNAc foi significativamente mais potente do que o oligonucleotídeo de origem em que faltava um conjugado de GalNAc.TABELA 55
[00982] Níveis da proteína plasmáticos e do mRNA hepático de AGT
[00983] Os níveis da transaminase, alanina aminotransferase (ALT) e aspartato aminotransferase (AST) hepáticas, no plasma e os pesos corporais também foram medidos no momento do sacrifício usando protocolos-padrão. Os resultados são mostrados na Tabela 56 abaixo. TABELA 56
[00984] Níveis de transaminase hepática e pesos corporais dos ratos
Exemplo 79: Duração do estudo de ação in vivo de oligonucleotídeos que direcionam APOC-III compreendendo um conjugado GalNAc3
[00985] Os oligonucleotídeos listados na Tabela 57 abaixo foram testados em um estudo de dose única para a duração da ação em camundongos.TABELA 57
[00986] ASOs modificados direcionados a APOC-III
[00987] A estrutura GalNAc3-1a foi mostrada anteriormente no Exemplo 9, GalNAc3-1a foi mostrada no Exemplo 9, GalNAc3-3a foi mostrada no Exemplo 39, GalNAc3-7a foi mostrada no Exemplo 48, GalNAc3-10a foi mostrada no Exemplo 46, GalNAc3-13a foi mostrada no Exemplo 62.Tratamento
[00988] Camundongos transgênicos de seis a oito semanas de idade que expressam APOC-III humana foram, cada um, injetados por via subcutânea uma vez com um oligonucleotídeo listado na Tabela 57 ou com PBS. Cada grupo de tratamento consistiu em 3 animais. O sangue foi retirado antes da dosagem para determinar a base de referência e em 72 horas, 1 semana, 2 semanas, 3 semanas, 4 semanas, 5 semanas e 6 semanas após a dose. Os níveis de triglicerídeos plasmáticos e da proteína APOC-III foram medidos conforme descrito no Exemplo 20. Os resultados abaixo são apresentados como a porcentagem média dos níveis de triglicerídeos plasmáticos e de APOC-III para cada grupo de tratamento, normalizados para os níveis de base de referência, mostrando que os oligonucleotídeos que compreendem um grupo conjugado de GalNAc exibiam uma duração mais longa de ação do que o oligonucleotídeo de origem sem um grupo conjugado (ISIS 304801), mesmo com a dosagem do original sendo três vezes a dosagem dos oligonucleotídeos que compreendem um grupo conjugado de GalNAc. TABELA 58
[00989] Níveis de triglicerídeos plasmáticos e da proteínaAPOC-III em camundongos trangênicos
Exemplo 80: Inibição antissenso in vivo por oligonucleotídeos que direcionam Alfa-1-Antitripsina (A1AT) compreendendo conjugado GalNAc3
[00990] Os oligonucleotídeos listados na Tabela 59 abaixo foram testados em um estudo para a inibição dependente de dose de A1AT em camundongos.TABELA 59
[00991] ASOs modificados direcionados à A1AT
[00992] A estrutura GalNAc3-1a foi mostrada anteriormente no Exemplo 9, GalNAc3-1a foi mostrada no Exemplo 9, GalNAc3-3a foi mostrada no Exemplo 39, GalNAc3-7a foi mostrada no Exemplo 48, GalNAc3-10a foi mostrada no Exemplo 46, GalNAc3-13a foi mostrada no Exemplo 62.Tratamento
[00993] Camundongos C57BL/6 machos de seis semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram, cada um, injetados por vis subcutânea uma vez por semana em uma dosagem mostrada abaixo, para um total de três doses, com um oligonucleotídeo listado na Tabela 59 ou com PBS. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final. Os níveis de mRNA hepáticos de A1AT foram medidos usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis da proteína plasmática A1AT foram determinados usando o ELISA de Alfa-1 Antitripsina de Camundongo (catálogo # 41-A1AMS-E01, Alpco, Salem, NH). Os resultados abaixo são apresentados como a porcentagem média dos níveis da proteína plasmática e do mRNA hepático de A1AT para cada grupo de tratamento, normalizados para o controle com PBS.
[00994] Conforme ilustrado na Tabela 60, o tratamento com oligonucleotídeos antissenso diminuiu os níveis da proteína plasmática A1AT e do mRNA hepático de A1AT de uma forma dependente da dose. Os oligonucleotídeos compreendendo um conjugado de GalNAc foram significativamente mais potentes do que o original (ISIS 476366).TABELA 60
[00995] Níveis da proteína plasmática e do mRNA hepático deA1AT
[00996] Os níveis de BUN e transaminase hepática no plasma foram medidos no momento de sacrifício usando protocolos-padrão. Os pesos corporais e os pesos dos órgãos também foram medidos. Os resultados são mostrados na Tabela 61 abaixo. O peso corporal é mostrado como % em relação à base de referência. Os pesos dos órgãos são mostrados como % de peso corporal em relação ao grupo controle com PBS.
Exemplo 81: Duração do estudo de ação in vivo de oligonucleotídeos que direcionam A1AT compreendendo um agrupamento GalNAc3
[00997] Os oligonucleotídeos listados na Tabela 59 foram testados em um estudo de dose única para duração da ação em camundongos. Tratamento
[00998] Os camundongos C57BL/6 machos de seis semanas de idade foram, cada um, injetados por via subcutânea uma vez com um oligonucleotídeo listado na Tabela 59 ou com PBS. Cada grupo de tratamento consistiu em 4 animais. O sangue foi retirado o dia antes da dosagem para determinar a base de referência e em 5, 12, 19 e 25 dias após a dose. Os níveis da proteína A1AT plasmática foram medidos através de ELISA (ver o Exemplo 80). Os resultados abaixo são apresentados como a porcentagem média dos níveis da proteína A1AT plasmática para cada grupo de tratamento, normalizados para os níveis de base de referência. Os resultados mostram que os oligonucleotídeos que compreendem um conjugado de GalNAc eram mais potentes e tinham maior duração de ação do que o original em que faltava um conjugado de GalNAc (ISIS 476366). Além disso, os oligonucleotídeos que compreendem um conjugado de 5'-GalNAc (ISIS 678381, 678382, 678383 e 678384) eram geralmente ainda mais potentes com maior duração de ação do que o oligonucleotídeo que compreende um conjugado de 3'-GalNAc (ISIS 656326).TABELA 62
[00999] Níveis da proteína A1AT plasmática em camundongos
Exemplo 82: Inibição antissenso in vitro por oligonucleotídeos que direcionam SRB-1 compreendendo conjugado GalNAc3
[001000] Os hepatócitos primários de fígado de camundongo foram semeados em placas de 96 poços em 15.000 células/poço 2 horas antes do tratamento. Os oligonucleotídeos listados na Tabela 63 foram adicionados em 2, 10, 50 ou 250 nM em meio Williams E e as células foram incubadas durante a noite a 37°C em 5% de CO2 As células foram lisadas 16 horas após a adição do oligonucleotídeo, e o RNA total foi purificado usando RNease 3000 BioRobot (Qiagen). Os níveis de mRNA de SRB-1 foram determinados usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os valores de IC50 foram determinados usando o software Prism 4 (GraphPad). Os resultados mostram que os oligonucleotídeos que compreendem uma variedade de diferentes grupos de conjugado de GalNAc e uma variedade de diferentes porções cliváveis são significativamente mais potentes em um experimento de absorção livre in vitro do que os oligonucleotídeos de origem em que faltam um grupo conjugado de GalNAc (ISIS 353382 e 666841).TABELA 63
[001001] Inibição da expressão de SRB-1 in vitro
[001002] A estrutura GalNAc3-1a foi mostrada anteriormente no Exemplo 9, GalNAc3-3a foi mostrada anteriormente no Exemplo 39, GalNAc3-5a foi mostrada anteriormente no Exemplo 49, GalNAc3-6a foi mostrada no Exemplo 51, GalNAc3-7a foi mostrada no Exemplo 48, GalNAc3-8a foi mostrada no Exemplo 47, GalNAc3-9a foi mostrada no Exemplo 52, GalNAc3-10afoi mostrada no Exemplo 46, GalNAc3-12a foi mostrada no Exemplo 61, GalNAc3-13a foi mostrada no Exemplo 62, GalNAc3-14a foi mostrada no Exemplo 63, GalNAc3-15a foi mostrada no Exemplo 64, GalNAc3-17a foi mostrada no Exemplo 68, GalNAc3- 18a foi mostrada no Exemplo 69, GalNAc3-19a foi mostrada no Exemplo 70, GalNAc3-20a foi mostrada no Exemplo 71 e GalNAc3-23a foi mostrada no Exemplo 76.Exemplo 83: Inibição antissenso in vivo por oligonucleotídeos que se direcionam ao Fator XI compreendendo um agrupamento GalNAc3
[001003] Os oligonucleotídeos listados na Tabela 64 abaixo foram testados em um estudo para inibição dependente de dose do Fator XI em camundongos.TABELA 64
[001004] Oligonucleotídeos modificados que se direcionam ao Fator XI
[001005] A estrutura GalNAc3-1a foi mostrada anteriormente no Exemplo 9, GalNAc3-1a foi mostrada no Exemplo 9, GalNAc3-3a foi mostrada no Exemplo 39, GalNAc3-7a foi mostrada no Exemplo 48, GalNAc3-10a foi mostrada no Exemplo 46, GalNAc3-13a foi mostrada no Exemplo 62.Tratamento
[001006] Camundongos de seis a oito semanas de idade foram, cada um, injetados por via subcutânea uma vez por semana em uma dosagem mostrada abaixo, para um total de três doses, com um oligonucleotídeo listado abaixo ou com PBS. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a dose final. Os níveis de mRNA hepático do Fator XI foram medidos usando PCR em tempo real e normalizados para ciclofilina de acordo com protocolos-padrão. Transaminases hepáticas, BUN e bilirrubina também foram medidos. Os resultados abaixo são apresentados como a porcentagem média para cada grupo de tratamento, normalizados para o controle com PBS.
[001007] Conforme ilustrado na Tabela 65, o tratamento com oligonucleotídeos antissenso diminuiu o mRNA hepático do Fator XI de uma forma dependente de dose. Os resultados mostram que os oligonucleotídeos compreendendo um conjugado de GalNAc foi mais potente do que o original em que falta um conjugado de GalNAc (ISIS 404071). Além disso, os oligonucleotídeos compreendeno um conjugado de 5'-GalNAc (ISIS 663086, 678347, 678348 e 678349) foram ainda mais potentes do que o oligonucleotídeo que compreende um conjugado de 3'-GalNAc (ISIS 656173).TABELA 65
[001008] Níveis de mRNA hepático do Fator XI, transaminase hepática, BUN e bilirrubina
Exemplo 84: Duração do estudo de ação in vivo de oligonucleotídeos que direcionam Fator XI compreendendo um conjugado GalNAc3
[001009] Os oligonucleotídeos listados na Tabela 64 foram testados em um estudo de dose única para duração da ação em camundongos. Tratamento
[001010] Camundongos de seis a oito semanas foram, cada um, injetados por via subcutânea uma vez com um oligonucleotídeo listado na Tabela 64 ou com PBS. Cada grupo de tratamento consistiu em 4 animais. O sangue foi retirado por sangramentos da cauda no dia antes da dosagem para determinar a base de referência e em 3, 10 e 17 dias após a dose. Os níveis da proteína Fator XI plasmático foram medidos por ELISA usando anticorpos de captura do Fator XI e de detecção biotinilados da R & D Systems, Minneapolis, MN (catálogo # AF2460 e # BAF2460, respectivamente) e o Conjunto B do Reagente OptEIA (Catálogo # 550534, BD Biosciences, San Jose, CA). Os resultados abaixo são apresentados como a porcentagem média dos níveis da proteína Fator XI plasmático para cada grupo de tratamento, normalizados para os níveis de base de referência. Os resultados mostram que os oligonucleotídeos que compreendem um conjugado de GalNAc eram mais potentes com maior duração de ação do que o original em que faltava um conjugado de GalNAc (ISIS 404071). Além disso, os oligonucleotídeos que compreendem um conjugado de 5'- GalNAc (ISIS 663086, 678347, 678348 e 678349) foram ainda mais potentes com uma maior duração de ação do que o oligonucleotídeo que compreende um conjugado de 3'-GalNAc (ISIS 656173).TABELA 66
[001011] Níveis da proteína Fator XI plasmático em camundongos
Exemplo 85: Inibição antissenso in vivo por oligonucleotídeos que direcionam SRB-1 compreendendo conjugado GalNAc3
[001012] Os oligonucleotídeos listados na Tabela 63 foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos.Tratamento
[001013] Camundongos de seis a oito semanas de idade C57BL/6 foram, cada um, injetados por via subcutânea uma vez por semana em uma dosagem mostrada abaixo, para um total de três doses, com um oligonucleotídeo listado na Tabela 63 ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 48 horas após a administração final para determinar os níveis de mRNA de SRB-1 usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os resultados abaixo são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 hepáticos para cada grupo de tratamento, normalizados para o controle com salina.
[001014] Conforme ilustrado nas Tabela 67 e 68, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente da dose.TABELA 67
[001015] mRNA de SRB-1 no fígado
TABELA 68
[001016] mRNA de SRB-1 no fígado
[001017] Os níveis de transaminases hepáticas, bilirrubina total, BUN, e pesos corporais também foram medidos usando protocolos- padrão. Os valores médios para cada grupo de tratamento são mostrados na Tabela 69 abaixo.
Exemplo 86: Inibição antissenso in vivo por oligonucleotídeos que se direcionam à TTR compreendendo um agrupamento GalNAc3
[001018] Os oligonucleotídeos listados na Tabela 70 abaixo foram testados em um estudo dependente de dose para a inibição antissenso da transtirretina humana (TTR) em camundongos transgênicos que expressam o gene da TTR humana. Tratamento
[001019] Camundongos transgênicos para TTR de oito semanas de idade foram, cada um, injetados por via subcutânea uma vez por semana por três semanas, para um total de três doses, com um oligonucleotídeo e dosagem listados nas tabelas abaixo ou com PBS. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final. Os sangramentos da cauda foram realizados em vários momentos por todo o experimento, e os níveis plasmáticos de proteína TTR, ALT e AST foram medidos e relatados nas Tabelas 72-74. Após os animais serem sacrificados, os níveis plasmáticos de ALT, AST e TTR humana foram medidos, assim como os pesos corporais, pesos dos órgãos, e níveis hepáticos de mRNA de TTR humana. Os níveis da proteína TTR foram medidos usando um analisador clínico (AU480, Beckman Coulter, CA). PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) Foram usados de acordo com protocolos-padrão para determinar os níveis hepáticos de mRNA de TTR humana. Os resultados apresentados nas Tabelas 7174 são os valores médios para cada grupo de tratamento. Os níveis de mRNA são os valores médios relativos à média para o grupo com PBS. Os níveis plasmáticos da proteína são os valores médios relativos ao valor médio para o grupo com PBS na base de referência. Os pesos corporais são a mudança de peso percentual média da base de referência até o sacrifício para cada grupo de tratamento individual. Os pesos dos órgãos mostrados são normalizados para o peso do corpo do animal, e o peso do órgão normalizado médio para cada grupo de tratamento é então apresentado em relação ao peso do órgão normalizado médio para o grupo com PBS.
[001020] Nas Tabelas 71-74, "BL" indica base de referência, as medições que foram tomadas imediatamente antes da primeira dose. Conforme ilustrado nas Tabelas 71 e 72, o tratamento com oligonucleotídeos antissenso diminuiu o nível de expressão de TTR de uma forma dependente de dose. Os oligonucleotídeos compreendendo um conjugado de GalNAc foram mais potentes que o de origem em que faltava o conjugado de GalNAc (ISIS 420915). Além disso, os oligonucleotídeos que compreendem um conjugado de GalNAc e ligações internucleosídicas PS/PO mistas foram ainda mais potentes que o oligonucleotídeo que compreende um conjugado de GalNAc e ligações PS totais.TABELA 70
[001021] Oligonucleotídeos direcionados à TTR humana
[001022] A legenda para a Tabela 72 pode ser encontrada no Exemplo 74. A estrutura "GalNAc3-1" foi mostrada no Exemplo 9. A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura GalNAc3-7a foi mostrada no Exemplo 48. A estrutura de GalNAc3-10a foi mostrada no Exemplo 46. A estrutura de GalNAc3-13a foi mostrada no Exemplo 62. A estrutura de GalNAc3-19a foi mostrada no Exemplo 70.TABELA 71
[001023] Inibição antissenso de TTR humana in vivo
TABELA 72
[001024] Inibição antissenso de TTR humana in vivo
TABELA 73
[001025] Níveis de transaminases, alterações do peso corporal e peso dos órgãos relativos
TABELA 74
[001026] Níveis de transaminases, alterações do peso corporal e peso dos órgãos relativos
Exemplo 87: Duração da ação in vivo por doses únicas de oligonucleotídeos direcionados à TTR compreendendo um agrupamento de GalNAc3
[001027] Os números ISIS 420915 e 660261 (ver a Tabela 70) foram testados em um estudo de dose única para a duração da ação em camundongos. Os números ISIS 420915, 682883 e 682885 (ver a Tabela 70) também foram testados em um estudo de dose única para duração da ação em camundongos.Tratamento
[001028] Camundongos transgênicos machos de oito semanas de idade que expressam TTR humana foram, cada um, injetados por via subcutânea uma vez com 100 mg/kg de N°. ISIS 420915 ou 13,5 mg/kg de N°. ISIS 660261. Cada grupo de tratamento consistiu em 4 animais. Os sangramentos da cauda foram realizados antes da dosagem para determinar a base de referência e nos dias 3, 7, 10, 17, 24 e 39 após a dose. Os níveis plasmáticos da proteína TTR foram medidos conforme descrito o Exemplo 86. Os resultados abaixo são apresentados como a porcentagem média dos níveis plasmáticos da proteína TTR para cada grupo de tratamento, normalizados para os níveis de base de referência.TABELA 75
[001029] Níveis plasmáticos da proteína TTR
Tratamento
[001030] Camundongos transgênicos fêmeas que expressam a TTR humana foram, cada um, injetados por via subcutânea uma vez com 100 mg/kg de N°. ISIS 420915, 10,0 mg/kg de N°. ISIS 682883, ou 10,0 mg/kg de 682885. Cada grupo de tratamento consistiu em 4 animais. Os sangramentos da cauda foram realizados antes da dosagem para determinar a base de referência e nos dias 3, 7, 10, 17, 24 e 39 após a dose. Os níveis plasmáticos da proteína TTR foram medidos conforme descrito o Exemplo 86. Os resultados abaixo são apresentados como a porcentagem média dos níveis plasmáticos da proteína TTR para cada grupo de tratamento, normalizados para os níveis de base de referência.TABELA 76
[001031] Níveis plasmáticos da proteína TTR
[001032] Os resultados na Tabela 75 e 76 mostram que os oligonucleotídeos que compreendem um conjugado de GalNAc são mais potentes com uma duração de ação maior que o oligonucleotídeo de origem e que falta um conjugado (ISIS 420915).Exemplo 88: Modulação de Junção in vivo por oligonucleotídeos que direcionam à SMN compreendendo um conjugado GalNAc3
[001033] Os oligonucleotídeos listados na Tabela 77 foram testados para a modulação por junção da sobrevivência do neurônio motor (SMN) humana em camundongos.TABELA 77
[001034] ASOs modificados direcionados a SMN
[001035] A estrutura de GalNAc3-7a foi mostrada anteriormente no Exemplo 48. "X" indica uma amina primária 5' gerada por Gene Tools (Philomath, OR), e GalNAc3-7b indica a estrutura de GalNAc3-7um sem a parte -NH-C6-O do ligante como mostrado abaixo:
[001036] Os números ISIS 703421 e 703422 são oligonucleotídeos de morfolino, em que cada nucleotídeo dos dois oligonucleotídeos é um nucleotídeo de morfolino.Tratamento
[001037] Camundongos transgênicos de seis semanas de idade que expressam SMN humana foram injetados por via subcutânea uma vez com um oligonucleotídeo listado na Tabela 78 ou com solução salina. Cada grupo de tratamento consistiu em 2 machos e 2 fêmeas. Os camundongos foram sacrificados 3 dias após a dose para determinar os níveis hepáticos de mRNA de SMN humana com e sem o éxon 7 usando PCR em tempo real, de acordo com protocolos-padrão. O RNA total foi medido usando o reagente Ribogreen. Os níveis de mRNA da SMN foram nomalizados para mRNA total, e normalizados ainda para as médias para o grupo tratado com salina. As razões médias resultantes entre mRNA de SMN incluindo o éxon 7 e mRNA de SMN faltando o éxon 7 são mostradas na Tabela 78. Os resultados mostram que os oligonucleotídeos totalmente modificados que modulam o junção e compreendem um conjugado de GalNAc são significativamente mais potentes em alterar o junção no fígado do que os oligonucleotídeos de origem em que falta o conjugado de GalNAc. Além disso, esta tendência é mantida para várias químicas de modificação, incluindo 2'-MOE e oligonucleotídeos modificados por morfolino.TABELA 78
[001038] Efeito de oligonucleotídeos direcionados à SMN humana in vivo
Exemplo 89: Inibição antissenso in vivo por oligonucleotídeos direcionados à Apolipoproteína A (Apo(A)) compreendendo um conjugado de GalNAc3
[001039] Os oligonucleotídeos listados na Tabela 79 abaixo foram testados em um estudo para a inibição dependente de dose de Apo(a) em camundongos transgênicos. TABELA 79
[001040] ASOs modificados direcionados à Apo(a)
[001041] A estrutura GalNAc3-7a foi mostrada no Exemplo 48.Tratamento
[001042] Camundongos C57BL/6 fêmeas de oito semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram, cada um, injetados por via subcutânea uma vez por semana em uma dosagem mostrada abaixo, para um total de seis doses, com um oligonucleotídeo listado na Tabela 79 ou com PBS. Cada grupo de tratamento consistiu em 3-4 animais. Os sangramentos da cauda foram realizados no dia anterior à primeira dose e semanalmente após cada dose para determinar os níveis plasmáticos da proteína Apo(a). Os camundongos foram sacrificados dois dias após a administração final. Os níveis de mRNA hepáticos de Apo(a) foram determinados usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. Os níveis plasmáticos da proteína Apo(a) foram determinados usando ELISA, e os níveis hepáticos da transaminase foram dteerminados. Os resultados da proteína plasmática e do mRNA na Tabela 80 são apresentados como a porcentagem média do grupo de tratamento em relação ao grupo tratado com PBS. Os níveis da proteína plasmática foram ainda normalizados para o valor de base de referência (BL) para o grupo com PBS. Os níveis de transaminase absolutos médios e os pesos corporais (% em relação às médias de base de referência) são relatados na Tabela 81.
[001043] Como ilustrado na Tabela 80, o tratamento com os oligonucleotídeos diminuiu os níveis da proteína plasmática e do mRNA hepático da Apo(a) de uma forma dependente de dose. Além disso, o oligonucleotídeo que compreende o conjugado de GalNAc foi significativamente mais potente com uma duração maior de ação do que o oligonucleotídeo de origem em que falta o conjugado de GalNAc. Como ilustrado na Tabela 81, os níveis de transaminase e os pesos corporais não foram afetados pelo oligonucleotídeos, indicando que os oligonucleotídeos foram bem tolerados.TABELA 80
[001044] Níveis de proteína plasmática e de mRNA hepático deApo(a)
Exemplo 90: Inibição antissenso in vivo por oligonucleotídeos que se direcionam à TTR compreendendo um agrupamento GalNAc3
[001045] Os oligonucleotídeos listados na Tabela 82 abaixo foram testados em um estudo dependente de dose para a inibição antissenso da transtirretina humana (TTR) em camundongos transgênicos que expressam o gene da TTR humana.Tratamento
[001046] Camundongos transgênicos para TTR foram, cada um, injetados por via subcutânea uma vez por semana por três semanas, para um total de três doses, com um oligonucleotídeo e dosagem listados na Tabela 83 ou com PBS. Cada grupo de tratamento consistiu em 4 animais. Antes da primeira dose, um sangramento da cauda foi realizado para determinar os níveis plasmáticos da proteína TTR na base de referência (BL). Os camundongos foram sacrificados 72 horas após a administração final. Os níveis da proteína TTR foram medidos usando um analisador clínico (AU480, Beckman Coulter, CA). PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) Foram usados de acordo com protocolos-padrão para determinar os níveis hepáticos de mRNA de TTR humana. Os resultados apresentados na Tabela 83 são os valores médios para cada grupo de tratamento. Os níveis de mRNA são os valores médios relativos à média para o grupo com PBS. Os níveis plasmáticos da proteína são os valores médios relativos ao valor médio para o grupo com PBS na base de referência. "BL" indica base de referência, as medições que foram tomadas imediatamente antes da primeira dose. Conforme ilustrado na Tabela 83, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de FXI de uma forma dependente da dose.de expressão de TTR de uma forma dependente da dose. Os oligonucleotídeos que compreendem um conjugado de GalNAc foram mais potentes do que o de origem em que falta um conjugado de GalNAc (ISIS 420915), e os oligonucleotídeos que compreendem uma porção clivável de fosfodiéster ou desoxiadenosina mostraram melhoras significativas na potência em comparação ao de origem em que falta um conjugado (ver os números ISIS 682883 e 666943 vs 420915 e ver os Exemplo 86 e 87).TABELA 82
[001047] Oligonucleotídeos direcionados à TTR humana
[001048] A legenda para a Tabela 82 pode ser encontrada no Exemplo 74. A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura GalNAc3-7a foi mostrada no Exemplo 48. A estrutura de GalNAc3-10a foi mostrada no Exemplo 46. A estrutura de GalNAc3-13a foi mostrada no Exemplo 62.TABELA 83
[001049] Inibição antissenso de TTR humana in vivo
Exemplo 91: Inibição antissenso in vivo por oligonucleotídeos direcionados ao Fator VII compreendendo um conjugado de GalNAc3 em primatas não humanos
[001050] Os oligonucleotídeos listados na Tabela 84 abaixo foram testados em um estudo de aumento de dose não terminal para a inibição antissenso do Fator VII em macacos.Tratamento
[001051] Macacos expostos (não virgens) foram, cada um, injetados por via subcutânea nos dias 0, 15 e 29 com doses crescentes de um oligonucleotídeo listado na Tabela 84 ou com PBS. Cada grupo de tratamento consistiu em 4 machos e 1 fêmea. Antes da primeira dose e em vários momentos após isso, as retiradas de sangue foram realizadas para determinar os níveis plasmáticos da proteína Fator VII. Os níveis da proteína Fator VII foram medidos por ELISA. Os resultados apresentados na Tabela 85 são os valores médios para cada grupo de tratamento em relação ao valor médio para o grupo com PBS na base de referência (BL), as medidas tomadas imediatamente antes da primeira dose. Como ilustrado na Tabela 85, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de expressão do Fator VII d euma forma dependente de dose, e o oligonucleotídeo compreendnedo o conjugado de GalNAc foi significativamente mais potente em macacos em comparação ao oligonucleotídeo em que falta um conjugado de GalNAcTABELA 84
[001052] Oligonucleotídeos direcionados ao Factor VII
[001053] A legenda para a Tabela 84 pode ser encontrada noExemplo 74. A estrutura de GalNAc3-10a foi mostrada no Exemplo 46.TABELA 85
[001054] Níveis plasmáticos da proteína Fator VII
Exemplo 92: Inibição antissenso em hepatócitos primários por oligonucleotídeos antissenso direcionados à Apo-CIII compreendendo um conjugado de GalNAc3
[001055] Os hepatócitos primários de camundongo foram semeados em placas de 96 poços em 15.000 células por poço, e os oligonucleotídeos listados na Tabela 86, direcionados à ApoC-III, foram adicionados em 0,46, 1,37, 4,12, ou 12,35, 37,04, 111,11, ou 333,33 nM ou 1,00 μM. Após a incubação com os oligonucleotídeos por 24 horas, as células foram lisadas e o RNA total foi purificado usando RNeasy (Qiagen). Os níveis de mRNA da ApoC-III foram determinados usando PCR em tempo real e reagente de quantificação de RNA RIBOGREEN® (Molecular Probes, Inc. Eugene, OR) de acordo com protocolos-padrão. de acordo com os protocolos-padrão. Os valores de IC50 foram determinados usando o software Prism 4 (GraphPad). Os resultados mostram que independentemente de se a porção clivável era um fosfodiéster ou uma adenosina ligada a fosfodiéster, os oligonucleotídeos que compreendem um conjugado de GalNAc foram significativamente mais potentes do que o oligonucleotídeo de origem em que falta um conjugado.TABELA 86
[001056] Inibição da expressão de APOC-III de camundongo em hepatócitos primários de camundongo
[001057] A estrutura GalNAc3-1a foi mostrada anteriormente no Exemplo 9, GalNAc3-3a foi mostrada no Exemplo 39, GalNAc3-7a foi mostrada no Exemplo 48, GalNAc3-10a foi mostrada no Exemplo 46, GalNAc3-13a foi mostrada no Exemplo 62, GalNAc3-19a foi mostrada no Exemplo 70.Exemplo 93: Inibição antissenso in vivo por oligonucleotídeos que direcionam SRB-1 compreendendo asas misturadas e um conjugado 5'-GalNAc3
[001058] Os oligonucleotídeos listados na Tabela 87 foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos.TABELA 87
[001059] ASOs modificados direcionados a SRB-1
[001060] A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39, e a estrutura de GalNAc3-7a foi mostrada anteriormente no Exemplo 48. Subscritos: "e" indica o nucleosídeo modificado por 2'- MOE; "d" indica β-D-2-desoximbonucleosideo; "k" indica nucleosídeo bicíclico 6'-(S)-CH3 (cEt); "s" indica ligações internucleosídicas de fosforotioato (PS); "o" indica ligações internucleosídicas de fosfodiéster (PO). O sobrescrito "m" indica 5-metilcitosinas.Tratamento
[001061] Camundongos C57BL/6 de seis a oito semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea uma vez na dosagem mostrada abaixo com um oligonucleotídeo listado na Tabela 87 ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final. Os níveis hepáticos de mRNA de SRB-1 foram medidos usando PCR em tempo real. Os níveis de mRNA de SRB-1 foram normalizados para os níveis de mRNA de ciclofilina, de acordo com protocolos-padrão. Os resultados são apresentados como a porcentagem média dos níveis de mRNA de SRB-1 para cada grupo de tratamento em relação ao grupo controle com salina. Como ilustrado na Tabela 88, o tratamento com oligonucleotídeos antissenso diminuiu os níveis de mRNA de SRB-1 de uma forma dependente de dose, e os oligonucleotídeos do gapmer que compreendem um conjugado de GalNAc e têm asas que eram modificações de cEt total ou de açúcar misto foram significativamente mais potentes do que o oligonucleotídeo de origem em que falta um conjugado e que compreende asas modificadas por cEt total.
[001062] Os pesos corporais, transaminases hepáticas, bilirrubina total, e BUN também foram medidos, e os valores médios para cada grupo de tratamento são mostrados na Tabela 88. O peso corporal é mostrado como o peso corporal percentual médio relativo ao peso do corpo de base de referência (% BL) medido imediatamente antes da dose de oligonucleotídeo.TABELA 88
[001063] Níveis de mRNA de SRB-1, ALT, AST, BUN e bilirrubina total e pesos corporais
Exemplo 94: Inibição antissenso in vivo por oligonucleotídeos que direcionam SRB-1 compreendendo modificações de 2'-açúcar e um conjugado 5'-GalNAc3
[001064] Os oligonucleotídeos listados na Tabela 89 foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos.TABELA 89
[001065] ASOs modificados direcionados a SRB-1
[001066] O subscrito "m" indica um nucleosídeo modificado por 2'-O- metila. Ver o Exemplo 74 para a legenda completa da tabela. A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39, e a estrutura de GalNAc3-7a foi mostrada anteriormente no Exemplo 48. Tratamento
[001067] O estudo foi completado usando o protocolo descrito no Exemplo 93. Os resultados são mostrados na Tabela 90 abaixo e mostram que os oligonucleotídeos modificados por 2'-MOE e 2'-OMe compreendendo um conjugado de GalNAc foram significativamente mais potentes do que os respectivos oligonucleotídeos de origem em que faltam um conjugado. Os resultados das medições de pesos corporais, transaminases hepáticas, bilirrubina total, e BUN indicam que os compostos foram todos bem tolerados. TABELA 90
[001068] mRNA de SRB-1
Exemplo 95: Inibição antissenso in vivo por oligonucleotídeos que direcionam SRB-1 compreendendo nucleosídeos bicílicos e um conjugado 5'-GalNAc3
[001069] Os oligonucleotídeos listados na Tabela 91 foram testados em um estudo dependente de dose para a inibição antissenso de SRB-1 em camundongos.TABELA 91
[001070] ASOs modificados direcionados a SRB-1
[001071] O subscrito "g" indica um nucleosídeo de fluoro-HNA, o subscrito "l" indica um nucleosídeo bloqueado compreendendo uma ponte de 2'-O-CH2-4'. Veja a legenda da tabela do Exemplo 74 para outras abreviações. A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 9, e a estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39 e a estrutura de GalNAc3-7a foi mostrada anteriormente no Exemplo 48.Tratamento
[001072] O estudo foi completado usando o protocolo descrito no Exemplo 93. Os resultados são mostrados na Tabela 92 abaixo e mostram que os oligonucleotídeos que compreendem um conjugado de GalNAc e várias modificações de nucleosídeo bicíclico foram significativamente mais potentes do que o oligonucleotídeo de origem em que falta um conjugado e que compreende modificações de nucleosídeo bicíclico. Além disso, o oligonucleotídeo que compreende um conjugado de GalNAc e modificações de fluoro-HNA foi significativamente mais potente do que o de origem em que falta um conjugado e que compreende modificações de fluoro-HNA. Os resultados das medições de pesos corporais, transaminases hepáticas, bilirrubina total, e BUN indicam que os compostos foram todos bem tolerados.TABELA 92
[001073] Níveis de mRNA de SRB-1, ALT, AST, BUN e bilirrubina total e pesos corporais
Exemplo 96: Ligação de proteína plasmática de oligonucleotídeos antissenso compreendendo um grupo conjugado de GalNAc3
[001074] Os oligonucleotídeos listados na Tabela 57 direcionados à ApoC-III e os oligonucleotídeos na Tabela 93 direcionados à Apo(a) foram testados em um ensaio de ultra-filtração a fim de avaliar a ligação da proteína plasmática.TABELA 93
[001075] Oligonucleotídeos modificados direcionados à Apo(a)
[001076] Veja o Exemplo 74 para a legenda da tabela. A estrutura de GalNAc3-7a foi mostrada anteriormente no Exemplo 48.
[001077] Unidades de ultrafiltração Ultrafree-MC (30.000 NMWL, membrana de celulose regenerada de baixa ligação, Millipore, Bedford, MA) foram pré-condicionadas com 300 μL de 0,5% de Tween 80 e centrifugadas a 2000 g por 10 minutos, em seguida com 300μL de uma solução de 300 μg/mL de um oligonucleotídeo controle em H2O e centrifugadas em 2000 g por 16 minutos. A fim de avaliar a ligação não específica aos filtros de cada oligonucleotídeo de teste das Tabelas 57 e 93 a serem usados nos estudos, 300 μL de uma solução de 250 ng/mL de oligonucleotídeo em H2O em pH 7,4 foram colocados nos filtros pré-condicionados e centrifugados a 2000 g por 16 minutos. As amostras não filtradas e filtradas foram analisadas por um ensaio ELISA para determinar as concentrações do oligonucleotídeo. Três réplicas foram usadas para se obter uma concentração média para cada amostra. A concentração da amostra filtrada em relação à amostra não filtrada é usada para determinar a porcentagem de oligonucleotídeo que é recuperada através do filtro na ausência de plasma (% de recuperação).
[001078] Amostras de plasma inteiras congeladas coletadas em K3- EDTA de voluntários humanos sem fármacos normais, macacos cynomolgus e camundongos CD-1 foram compradas da Bioreclamation LLC (Westbury, NY). Os oligonucleotídeos de teste foram adicionados a alíquotas de 1,2 mL de plasma em duas concentrações (5 e 150 μg/mL). Uma alíquota (300 μL) de cada amostra de plasma enriquecida foi colocada em uma unidade de filtro pré-condicionada e incubada a 37°C por 30 minutos, imediatamente após por centrifugação a 2000 g por 16 minutos. As alíquotas das amostras de plasma enriquecidas filtrada e não filtrada foram analisadas por ELISA para determinar a concentração de oligonucleotídeo em cada amostra. Três replicatas por concentração foram usadas para determinar a porcentagem média de oligonucleotídeo ligado e não ligado em cada amostra. A concentração média da amostra filtrada em relação à concentração da amostra não filtrada é usada é usada para determinar a porcentagem de oligonucleotídeo no plasma que não está ligada às proteínas plasmáticas (% não ligado). Os valores de oligonucleotídeo não ligado final são corrigidos para a ligação não específica, dividindo-se o % não ligado pelo % de recuperação para cada oligonucleotídeo. Os valores de % de oligonucleotídeo ligado final são determinados, subtraindo-se os valores de % não ligado de 100. Os resultados são mostrados na Tabela 94 para as duas concentrações de oligonucleotídeo testadas (5 e 150 μg/mL) em cada espécie de plasma. Os resultados mostram que os grupos de conjugados de GalNAc não têm um impacto significativo sobre a ligação às proteínas plasmáticas. Além disso, os oligonucleotídeos com ligações internucleosídicas PS totais e ligações PO/PS mistas ligam proteínas plasmáticas, e aqueles com ligações PS totais ligam proteínas plasmáticas em um grau um pouco maior do que aqueles com ligações PO/PS mistas.TABELA 94
[001079] Percentual do oligonucleotídeo modificado ligado às proteínas plasmáticas
Exemplo 97: Oligonucleotídeos modificados que direcionam a TTR compreendendo um grupo conjugado GalNAc3
[001080] Os oligonucleotídeos mostrados na Tabela 95 que compreendem um conjugado de GalNAc foram projetados para se direcionar à TTR.TABELA 95
[001081] Oligonucleotídeos modificados direcionados à TTR
[001082] A legenda para a Tabela 95 pode ser encontrada noExemplo 74. A estrutura "GalNAc3-1" foi mostrada no Exemplo 9. A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39. A estrutura GalNAc3-7a foi mostrada no Exemplo 48. A estrutura de GalNAc3-10a foi mostrada no Exemplo 46. A estrutura de GalNAc3-13a foi mostrada no Exemplo 62. A estrutura de GalNAc3-19a foi mostrada no Exemplo 70.Exemplo 98: Avaliação dos efeitos pro-inflamatórios de oligonucleotídeos compreendendo um conjugado de GalNAc no ensaio hPMBC
[001083] Os oligonucleotídeos são listados na Tabela 96 e foram testados para os efeitos pró-inflamatórios em um ensaio hPMBC conforme descrito nos Exemplos 23 e 24. (Veja as Tabelas 17, 70, 82 e 95 para descrições dos oligonucleotídeos.) ISIS 353512 é um alto respondedor usado como um controle positivo, e os outros oligonucleotídeos são descritos nas Tabelas 70, 82 e 95. Os resultados mostrados na Tabela 96 foram obtidos usando sangue de um doador voluntário. Os resultados mostram que os oligonculeotídeos que compreendem ligações internucleosídicas PO/PS mistas produziram respostas pró-inflamatórias significativamente menores em comparação aos mesmos oligonucleotídeos com ligações PS totais. Além disso, o grupo conjugado de GalNAc não teve um efeito significativo neste ensaio.
Exemplo 99: Afinidades de ligação dos oligonucleotídeos que compreendem um conjugado de GalNAc para o receptor de asialoglicoproteína
[001084] As afinidades de ligação dos oligonucleotídeos listados na Tabela 97 (ver a Tabela 63 para as descrições dos oligonucleotídeos) para o receptor de asialoglicoproteína foram testadas em um ensaio de ligação de receptor competitivo. O ligante competidor, α1- glicoproteína ácida (AGP), foi incubada em 50 mM de tampão de acetato de sódio (pH 5) com 1 U de neuraminidase-agarose por 16 horas em 37°C, e > 90% de desialilação foram confirmados pelo ensaio de ácido siálico ou cromatografia de exclusão por tamanho (SEC). Monocloreto de iodo foi usado para iodar o AGP de acordo com o mesmo procedimento por Atsma et al. (ver J Lipid Res. 1991 Jan; 32(1):173-81.) Neste método, a αl-glicoproteina ácida desialilada (de- AGP) foi adicionada a 10 mM de cloreto de iodo, Na125I, e 1 M de glicina em NaOH 0,25 M. Após a incubação por 10 minutos à temperatura ambiente, de-AGP marcado com 125I foi separado de 125I livre, concentrando-se a mistura duas vezes utilizando uma coluna de giro 3 KDMWCO. A proteína foi testada para eficiência de marcação e pureza em um sistema de HPLC equipado com uma coluna Agilent SEC-3 (7,8x300mm) e um contador β-RAM. Experimentos de competição utilizando de-AGP marcado com 125I e vários agrupamentos de GalNAc contendo ASOs foram realizados conforme se segue. Células HepG2 humanas (106 células/ml) foram colocadas em placas de 6 poços em 2 ml de meio de crescimento apropriado. Foram usados o meio MEM complementado com 10% de soro bovino fetal (FBS), 2 mM de L-Glutamina e 10mM de HEPES. As células foram incubadas 16-20 horas em 37°C com 5% e 10% de CO2 respectivamente. As células foram lavadas com meio sem FBS antes do experimento. As células foram incubadas por 30 min em 37°C com 1 ml de mix de competição contendo meio de crescimento apropriado com 2% de FBS, 10<g id="29269">-8</g> M de de-AGP marcado com<g id="29270">125</g>I e cluster de GalNAc contendo ASOs em concentrações variando de 10-11 a 10-5 M. Ligações não específicas foram determinadas na presença de 10-2 M de açúcar de GalNAc. As células foram lavadas duas vezes com meio sem FBS para remover o de-AGP marcado com 125I não ligado e o competidor ASO de GalNAc. As células foram lisadas usando um tampão RLT da Qiagen contendo 1% de β-mercaptoetanol. Os lisados foram transferidos para tubos de ensaio de fundo redondo após um breve ciclo de congelamento/descongelamento de 10 min e analisados em um contador y. As ligações não específicas foram subtraídas antes de dividir as contagens de proteína com 125I pelo valor das contagens de concentração mais baixas de GalNAc-ASO. As curvas de inibição foram ajustadas para uma única equação de ligação de competição de sítio usando um algoritmo de regressão não linear para calcular as afinidades de ligação (KD's).
[001085] Os resultados na Tabela 97 foram obtidos a partir de experimentos realizados em cinco dias diferentes. Os resultados para os oligonucleotídeos marcados com sobrescrito "a" são a média dos experimentos realizados em dois dias diferentes. Os resultados mostram que os oligonucleotídeos que compreendem um grupo conjugado de GalNAc na extremidade 5' ligavam-se ao receptor de asialoglicoproteína nas células HepG2 humanas com afinidade 1,5 a 16 vezes maior do que os oligonucleotídeos que compreendem um grupo conjugado de GalNAc na extremidade 3'.TABELA 97
[001086] Resultados do ensaio de ligação ao receptor de asialoglicoproteína
Exemplo 100: Inibição antissenso in vivo por oligonucleotídeos compreendendo um grupo conjugado de GalNAc direcionados à Apo(a) in vivo
[001087] Os oligonucleotídeos listados na Tabela 98a abaixo foram testados em um estudo de dose única para a duração da ação em camundongos.TABELA 98A
[001088] ASOs modificados direcionados à APO(a)
[001089] A estrutura GalNAc3-7a foi mostrada no Exemplo 48.Tratamento
[001090] Camundongos transgênicos fêmeas que expressam a Apo(a) humana foram, cada um, injetados por via subcutânea uma vez por semana, por um total de 6 doses, com um oligonucleotídeo e a dosagem listada na Tabela 98b ou com PBS. Cada grupo de tratamento consistiu em 3 animais. O sangue foi retirado no dia antes da dosagem para determinar os níveis de base de referência da proteína Apo(a) no plasma e em 72 horas, 1 semana e 2 semanas após a primeira dose. Retiradas adicionais de sangue ocorrerão em 3 semanas, 4 semanas, 5 semanas e 6 semanas após a primeira dose. Os níveis da proteína Apo(a) foram medidos usando um ELISA. Os resultados na Tabela 98b são apresentados como a porcentagem média dos níveis da proteína Apo(a) no plasma para cada grupo de tratamento, normalizados para os níveis de base de referência (% BL). Os resultados mostram que os oligonucleotídeos que compreendem um grupo conjugado de GalNAc exibiam potente redução na expressão de Apo(a). Este potente efeito foi observado para o oligonucleotídeo que compreende ligações internucleosídicas PS totais e para o oligonucleotídeo que compreende ligações PO e PS mistas. TABELA 98B
[001091] Níveis plasmáticos da proteína Apo(a)
Exemplo 101: Inibição antissenso por oligonucleotídeos compreendendo um cluster de GalNAc ligado através de uma porção estável
[001092] Os oligonucleotídeos listados na Tabela 99 foram testados para a inibição da expressão de APOC-III de camundongos in vivo. Camundongos C57Bl/6 foram, cada um, injetados por via subcutânea uma vez com um oligonucleotídeo listado na Tabela 99 ou com PBS. Cada grupo de tratamento consistiu em 4 animais. Cada camundongo tratado com ISIS 440670 recebeu uma dose de 2, 6, 20, ou 60 mg/kg. Cada camundongo tratado com ISIS 680772 ou 696847 recebeu 0,6, 2, 6, ou 20 mg/kg. O grupo conjugado de GalNAc de ISIS 696847 é ligado através de uma porção estável, uma ligação fosforotioato em vez de uma ligação contendo fosfodiéster facilmente clivável. Os animais foram sacrificados 72 horas após a dose. Os níveis hepáticos de mRNA de APOC-III foram medidos usando PCR em tempo real. Os níveis de mRNA de APOC-III foram normalizados para os níveis de mRNA de ciclofilina, de acordo com protocolos-padrão. Os resultados são apresentados na Tabela 99 como a porcentagem média dos níveis de mRNA de APOC-III para cada grupo de tratamento em relação ao grupo controle com salina. Os resultados mostram que os oligonucleotídeos que compreendem um grupo conjugado de GalNAC foram significativamente mais potentes do que o oligonucleotídeo em que falta um grupo conjugado. Além disso, o oligonucleotídeo que compreende um grupo conjugado de GalNAc ligado ao oligonucleotídeo através de uma porção clivável(ISIS 680772) foi até mais potente do que o oligonucleotídeo que compreende um grupo conjugado de GalNAc ligado ao oligonucleotídeo através de uma porção estável (ISIS 696847).TABELA 99
[001093] Oligonucleotídeos modificados direcionados à APOC-III de camundongo
[001094] A estrutura GalNAc3-7a foi mostrada no Exemplo 48.Exemplo 102: Distribuição no fígado de oligonucleótidos antissenso compreendendo um conjugado de GalNAc
[001095] A distribuição no fígado de ISIS 353382 (ver a Tabela 23) que não compreende um conjugado de GalNAc e ISIS 655861 (ver a Tabela 23) que compreende um conjugado de GalNAc foi avaliada. Camundongos balb/c machos foram injetados por via subcutânea uma vez com ISIS 353382 ou 655861 em uma dosagem listada na Tabela 100. Cada grupo de tratamento consistiu em 3 animais, exceto para o grupo 18 mg/kg para ISIS 655861, que consistiu em 2 animais. Os animais foram sacrificados 48 horas após a dose para determinar a distribuição no fígado dos oligonucleotídeos. A fim de medir o número de moléculas de oligonucleotídeo antissenso por célula, um marcador de tris-bipiridina de rutênio(II) (MSD TAG, Meso Scale Discovery) foi conjugado a uma sonda de oligonucleotídeo usada para detectar os oligonucleotídeos antissenso. Os resultados apresentados na Tabela 100 são as concentrações médias de oligonucleotídeo para cada grupo de tratamento em unidades de milhões de moléculas de oligonucleotídeo por célula. Os resultados mostram que, em doses equivalentes, o oligonucleotídeo que compreende um conjugado de GalNAc esteve presente em concentrações maiores o fígado total e em hepatócitos do que o oligonucleotídeo que não compreende um conjugado de GalNAc. Além disso, o oligonucleotídeo que compreende um conjugado de GalNAc esteve presente em concentrações mais baixas em células hepáticas não parenquimatosas do que o oligonucleotídeo que não compreende um conjugado de GalNAc. E, embora as concentrações de ISIS 655861 em hepatócitos e em células hepáticas não parenquimatosas sejam semelhantes por célula, o fígado é aproximadamente 80% de hepatócitos em volume. Assim, a maioria do oligonucleotídeo ISIS 655861 que esteve presente no fígado foi encontrada nos hepatócitos, considerando que a maioria do oligonucleotídeo ISIS 353382 que esteve presente no fígado foi encontrada em células hepáticas não parenquimatosas.
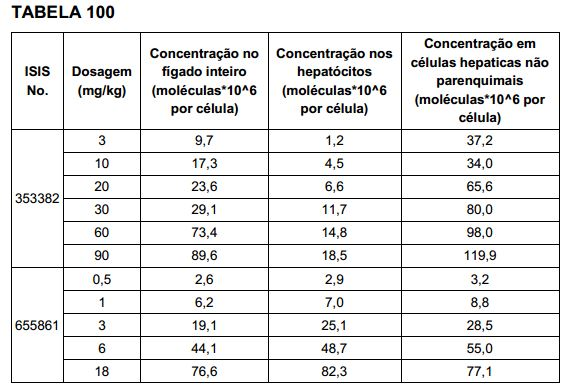
Exemplo 103: Duração do estudo de ação in vivo de oligonucleotídeos que direcionam APOC-III compreendendo um conjugado GalNAc3
[001096] Os oligonucleotídeos listados na Tabela 101 abaixo foram testados em um estudo de dose única para a duração da ação em camundongos.TABELA 101
[001097] ASOs modificados direcionados a APOC-III
[001098] A estrutura de GalNAc3-3a foi mostrada anteriormente no Exemplo 39, e a estrutura de GalNAc3-18a foi mostrada no Exemplo 70.Tratamento
[001099] Camundongos transgênicos fêmeas que expressam a APOC-III humana foram, cada um, injetados por via subcutânea uma vez com um oligonucleotídeo listado na Tabela 101 ou com PBS. Cada grupo de tratamento consistiu em 3 animais. O sangue foi retirado antes da dosagem para determinar a base de referência e em 3, 7, 14, 21, 28, 35 e 42 dias após a dose. Os níveis de triglicerídeos plasmáticos e da proteína APOC-III foram medidos conforme descrito no Exemplo 20. Os resultados na Tabela 102 são apresentados como a percentagem média dos níveis de triglicerídeos plasmáticos e APOC-III para cada grupo de tratamento, normalizados para os níveis de base de referência. Uma comparação dos resultados na Tabela 58 do Exemplo 79 com os resultados na Tabela 102 abaixo mostra que os oligonucleotídeos que compreendem uma mistura de ligações internucleosídicas de fosfodiéster e fosforotioato exibiram maior duração de ação do que os oligonucleotídeos equivalentes que compreendem apenas ligações internucleosídicas de fosforotioato.TABELA 102
[001100] Níveis de triglicerídeos plasmáticos e da proteínaAPOC-III em camundongos trangênicos
Exemplo 104: Síntese de oligonucleotídeos compreendendo um conjugado de 5'-GalNAc2
[001101] O composto 120 está disponível comercialmente, e a síntese do composto 126 é descrita no Exemplo 49. O composto 120 (1 g, 2,89 mmol), HBTU (0,39 g, 2,89 mmol), e HOBt (1,64 g, 4,33 mmol) foram dissolvidos em DMF (10 mL) e N,N-di-isopropiletilamina (1,75 mL, 10,1 mmol) foi adicionada. Após cerca de 5 min, éster benzílico de ácido aminohexanoico (1,36 g, 3,46 mmol) foi adicionado à reação. Após 3 h, a mistura de reação foi vertida em 100 mL de 1 M de NaHSO4 e extraída com 2 x 50 mL de acetato de etila. As camadas orgânicas foram combinadas e lavadas com 3 x 40 mL de NaHCO3 saturado e 2 x de salmoura e foram secas com Na2SO4, filtradas e concentradas. O produto foi purificado por cromatografia de coluna em sílica-gel (DCM:EA:Hex, 1:1:1) para produzir o composto 231. LCMS e RMN foram consistentes com a estrutura. O composto 231 (1,34 g, 2,438 mmol) foi dissolvido em diclorometano (10 mL) e ácido trifluoracético (10 mL) foi adicionado. Após agitação em temperatura ambiente por 2 h, a mistura de reação foi concentrada sob pressão reduzida e coevaporada com tolueno (3 x 10 mL). O resíduo foi seco sob pressão reduzida para produzir o composto 232 como sal de trifluoroacetato. A síntese do composto 166 é descrita no Exemplo 54. O composto 166 (3,39 g, 5,40 mmol) foi dissolvido em DMF (3 mL). Uma solução do composto 232 (1,3 g, 2,25 mmol) foi dissolvida em DMF (3 mL) e N,N-di-isopropiletilamina (1,55 mL) foi adicionada. A reação foi agitada à temperatura ambiente por 30 minutos, em seguida, vertida em água (80 mL) e a camada aquosa foi extraída com EtOAc (2x100 mL). A fase orgânica foi separada e lavada com NaHCO3 saturado aquoso (3 x 80 mL), 1 M NaHSO4 (3 x 80 mL) e salmoura (2 x 80 mL) e, em seguida, foi seca (Na2SO4), filtrada e concentrada. O resíduo foi purificado por cromatografia de coluna em sílica-gel para produzir o composto 233. LCMS e RMN foram consistentes com a estrutura. O composto 233 (0,59 g, 0,48 mmol) foi dissolvido em metanol (2,2 mL) e acetato de etil (2,2 mL). Paládio em carbono (10% em peso Pd/C, molhado, 0,07 g) foi adicionado, e a mistura da reação foi agitada sob atmosfera de hidrogênio por 3 h. A mistura de reação foi filtrada através de uma almofada de Celite e concentrada para produzir o ácido carboxílico. O ácido carboxílico (1,32 g, 1,15 mmol, ácido sem cluster) foi dissolvido em DMF (3,2 mL). A isto, N,N-di-isopropiletilamina (0,3 mL, 1,73 mmol) e PFPTFA (0,30 mL, 1,73 mmol) foram adicionados. Após 30 min de agitação à temperatura ambiente, a mistura de reação foi vertida em água (40 mL) e extraída com EtOAc (2 x 50 mL). Um acompanhamento-padrão foi concluído conforme descrito acima para produzir o composto 234. LCMS e RMN foram consistentes com a estrutura. O oligonucleotídeo 235 foi preparado usando o procedimento geral descrito no Exemplo 46. A parte do agrupamento GalNAc2 do grupo conjugado GalNAc2-24 (GalNAc2-24a) pode ser combinado com qualquer porção clivável presente no oligonucleotídeo para fornecer uma variedade de grupos conjugados. A estrutura de GalNAc2-24 (GalNAc2-24a-CM) é mostrada abaixo:
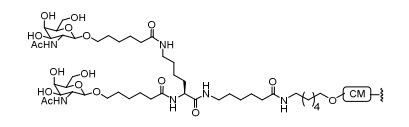
Exemplo 105: Síntese de oligonucleotídeos compreendendo um conjugado de GalNAc1-25
[001102] A síntese do composto 166 é descrita no Exemplo 54. O oligonucleotídeo 236 foi preparado usando o procedimento geral descrito no Exemplo 46.
[001103] Alternativamente, o oligonucleotídeo 236 foi sintetizado usando o esquema abaixo, e o composto 238 foi usado para formar o oligonucleotídeo 236 usando os procedimentos descritos no Exemplo 10.
[001104] A parte do agrupamento GalNAc1 (GalNAc1-25a) do grupo conjugado GalNAc1-25 pode ser combinado com qualquer porção clivável presente no oligonucleotídeo para fornecer uma variedade de grupos conjugados. A estrutura de GalNAc1-25 (GalNAc1-25a-CM) é mostrada abaixo:
Exemplo 106: Inibição antissenso in vivo por oligonucleotídeos que direcionam SRB-1 compreendendo conjugado 5'-GalNAc2 ou 5'-GalNAc3
[001105] Os oligonucleotídeos listados nas Tabelas 103 e 104 foram testados em estudos dependentes de dose para uma inibição antissenso de SRB-1 em camundongos.Tratamento
[001106] Camundongos C57BL/6 machos de seis semanas de idade (Jackson Laboratory, Bar Harbor, ME) foram injetados por via subcutânea uma vez com 2, 7, ou 20 mg/kg de N°. ISIS 440762; ou com 0,2, 0,6, 2, 6, ou 20 mg/kg de N°. ISIS 686221, 686222, ou 708561; ou com solução salina. Cada grupo de tratamento consistiu em 4 animais. Os camundongos foram sacrificados 72 horas após a administração final. Os níveis hepáticos de mRNA de SRB-1 foram medidos usando PCR em tempo real. Os níveis de mRNA de SRB-1 foram normalizados para os níveis de mRNA de ciclofilina, de acordo com protocolos-padrão. Os oligonucleotídeos antissenso diminuíram os níveis de mRNA de SRB-1 de uma forma dependente de dose, e os resultados de ED50 são apresentados nas Tabelas 103 e 104. Embora estudos anteriores mostrem que os oligonucleotídeos conjugados a GalNAc trivalentes foram significativamente mais potentes do que os oligonucleotídeos conjugados a GalNAc, que foram, por sua vez, significativamente mais potentes do que os oligonucleotídeos conjugados a GalNAc monovalentes (ver, p. ex., Khorev et al., Bioorg. & Med. Chem., Vol. 16, 5216-5231 (2008)), o tratamento com oligonucleotídeos antissenso compreendendo clusters de GalNAc monovalentes, divalentes e trivalentes diminuiu os níveis de mRNA de SRB-1 com potências semelhantes, como mostrado nas Tabelas 103 e 104.TABELA 103
[001107] Oligonucleotídeos modificados direcionados a SRB-1
[001108] Veja o Exemplo 93 para a legenda da tabela. A estrutura de GalNAc3-13a foi mostrada anteriormente no Exemplo 62, e a estrutura de GalNAc3-24a foi mostrada no Exemplo 104.TABELA 104
[001109] Oligonucleotídeos modificados direcionados a SRB-1
[001110] Veja o Exemplo 93 para a legenda da tabela. A estrutura de GalNAc1-25a foi mostrada no Exemplo 105.
[001111] As concentrações dos oligonucleotídeos nas Tabelas 103 e 104 no fígado também foram avaliadas, usando os procedimentos descritos no Exemplo 75. Os resultados mostrados nas Tabelas 104a e 104b abaixo são os níveis médios totais teciduais do oligonucleotídeo antissenso para cada grupo de tratamento, conforme medido por UV em unidades de μg de oligonucleotídeo por grama de tecido hepático. Os resultados mostram que os oligonucleotídeos que compreendem um grupo conjugado de GalNAc acumulado no fígado em níveis significativamente mais altos do que a mesma dose do oligonucleotídeo em que falta um grupo conjugado de GalNAc. Além disso, os oligonucleotídeos antissenso que compreendem um, dois ou três ligantes de GalNAc em seus respectivos grupos de conjugado todos se acumularam o fígado em níveis semelhantes. Este resultado é surpreendente em vista da referência da literatura de Khorev et al. citada acima e é consistente com os dados de atividade mostrados nas Tabelas 103 e 104 acima.TABELA 104A
[001112] Concentrações no fígado de oligonucleotídeos compreendendo um grupo conjugado GalNAc2 ou GalNAc3
TABELA 104B
[001113] Concentrações no fígado de oligonucleotídeos compreendendo um grupo conjugado GalNAc1
Exemplo 107: Síntese de oligonucleotídeos compreendendo um conjugado de GalNAc1-26 ou GalNAc1-27
[001114] O oligonucleotídeo 239 é sintetizado através do acoplamento do composto 47 (ver o Exemplo 15) ao ácido 64 (ver o Exemplo 32) usando HBTU e DIEA em DMF. O composto contendo amida resultante é fosfitilado, em seguida, adicionado à extremidade 5' de um oligonucleotídeo usando os procedimentos descritos no Exemplo 10. A parte do agrupamento GalNAc1 (GalNAc1-26a) do grupo conjugado GalNAc1-26 pode ser combinado com qualquer porção clivável presente no oligonucleotídeo para fornecer uma variedade de grupos conjugados. A estrutura de GalNAc1-26 (GalNAc1-26a-CM) é mostrada abaixo:
[001115] A fim de adicionar o grupo conjugado de GalNAc1 à extremidade 3' de um oligonucleotídeo, a amida formada a partir da reação dos compostos 47 e 64 é adicionada a um suporte sólido usando os procedimentos descritos no Exemplo 7. A síntese do oligonucleotídeo é então concluída usando os procedimentos descritos no Exemplo 9 a fim de formar o oligonucleotídeo 240.
[001116] A parte do agrupamento GalNAc1 (GalNAc1-27a) do grupo conjugado GalNAc1-27 pode ser combinado com qualquer porção clivável presente no oligonucleotídeo para fornecer uma variedade de grupos conjugados. A estrutura de GalNAc1-27 (GalNAc1-27a-CM) é mostrada abaixo:
Exemplo 108: Inibição antissenso in vivo por oligonucleotídeos compreendendo um grupo conjugado de GalNAc direcionados à Apo(a) in vivo
[001117] Os oligonucleotídeos listados na Tabela 105 abaixo foram testados em um estudo de dose única em camundongos.TABELA 105
[001118] ASOs modificados direcionados à APO(a)
[001119] A estrutura GalNAc3-7a foi mostrada no Exemplo 48.Tratamento
[001120] Camundongos transgênicos machos que expressam a Apo(a) humana foram, cada um injetados por via subcutânea uma vez com um oligonucleotídeo e dosagem listados na Tabela 106 ou com PBS. Cada grupo de tratamento consistiu em 4 animais. O sangue foi retirado no dia antes da dosagem para determinar os níveis de base de referência da proteína Apo(a) no plasma e em 1 semana após a primeira dose. Retiradas adicionais de sangue ocorrerão semanalmente por aproximadamente 8 semanas. Os níveis da proteína Apo(a) foram medidos usando um ELISA. Os resultados na Tabela 106 são apresentados como a porcentagem média dos níveis da proteína Apo(a) plasmática para cada grupo de tratamento, normalizados para os níveis de base de referência (% BL). Os resultados mostram que os oligonucleotídeos antissenso reduziram a expressão da proteína Apo(a). Além disso, os oligonucleotídeos que compreendem um grupo conjugado de GalNAc exibiram uma redução até mais potente da expressão de Apo(a) do que os oligonucleotídeos que não compreendem um grupo conjugado.TABELA 106
[001121] Níveis plasmáticos da proteína Apo(a)
Exemplo 109: Síntese de oligonucleotídeos compreendendo um conjugado de GalNAc1-28 ou GalNAc1-29
[001122] O oligonucleotídeo 241 é sintetizado usando procedimentos semelhantes àqueles descritos no Exemplo 71 para formar o intermediário fosforamidita, seguido pelos procedimentos descritos no Exemplo 10 para sintetizar o oligonucleotídeo. A parte do agrupamento GalNAc1 (GalNAc1-28a) do grupo conjugado GalNAc1-28 pode ser combinado com qualquer porção clivável presente no oligonucleotídeo para fornecer uma variedade de grupos conjugados. A estrutura de GalNAc1-28 (GalNAc1-28a-CM) é mostrada abaixo:
[001123] A fim de adicionar o grupo conjugado de GalNAc1 à extremidade 3' de um oligonucleotídeo, procedimentos semelhantes àqueles descritos no Exemplo 71 são usados para formar o intermediário hidroxila, que é então adicionado ao suporte sólido usando os procedimentos descritos no Exemplo 7. A síntese do oligonucleotídeo é então concluída usando os procedimentos descritos no Exemplo 9 a fim de formar o oligonucleotídeo 242.
[001124] A parte do agrupamento GalNAc1 (GalNAc1-29a) do grupo conjugado GalNAc1-29 pode ser combinado com qualquer porção clivável presente no oligonucleotídeo para fornecer uma variedade de grupos conjugados. A estrutura de GalNAc1-29 (GalNAc1-29a-CM) é mostrada abaixo:
Exemplo 110: Síntese de oligonucleotídeos compreendendo um conjugado de GalNAc1-30
[001125] O oligonucleotídeo 246 compreendendo um grupo conjugado de GalNAc1-30, em que Y é selecionado de O, S, uma alquila C1-C10 substituída ou não substituída, amina, amina substituída, azido, alquenila ou alquinila, é sintetizado como mostrado acima. A parte do agrupamento GalNAc1 (GalNAc1-30a) do grupo conjugado GalNAc1-30 pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, o símbolo Y é parte da porção clivável. Em determinadas modalidades, Y é parte de uma porção estável, e a porção clivável está presente no oligonucleotídeo. A estrutura de GalNAc1-30a é mostrada abaixo:
Exemplo 111 Síntese de oligonucleotídeos compreendendo um conjugado de GalNAc2-31 ou GalNAc2-32
[001126] O oligonucleotídeo 250 compreendendo um grupoconjugado de GalNAc2-31, em que Y é selecionado de O, S, uma alquila C1-C10 substituída ou não substituída, amina, amina substituída, azido, alquenila ou alquinila, é sintetizado como mostrado acima. A parte do agrupamento GalNAc2 (GalNAc2-31a) do grupo conjugado GalNAc2-31 pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, o grupo contendo Y diretamente adjacente à extremidade 5' do oligonucleotídeo é parte da porção clivável. Em determinadas modalidades, o grupo contendo Y diretamente adjacente à extremidade 5' do oligonucleotídeo é parte de uma porção estável, e a porção clivável está presente no oligonucleotídeo. A estrutura de GalNAc2-31a é mostrada abaixo:
[001127] A síntese de um oligonucleotídeo compreendendo um conjugado de GalNAc2-32 é mostrada abaixo.
[001128] O oligonucleotídeo 252 compreendendo um grupo conjugado de GalNAc2-32, em que Y é selecionado de O, S, uma alquila C1-C10 substituída ou não substituída, amina, amina substituída, azido, alquenila ou alquinila, é sintetizado como mostrado acima. A parte do agrupamento GalNAc2 (GalNAc2-32a) do grupo conjugado GalNAc2-32 pode ser combinado com qualquer porção clivável para fornecer uma variedade de grupos conjugados. Em determinadas modalidades, o grupo contendo Y diretamente adjacente à extremidade 5' do oligonucleotídeo é parte da porção clivável. Em determinadas modalidades, o grupo contendo Y diretamente adjacente à extremidade 5' do oligonucleotídeo é parte de uma porção estável, e a porção clivável está presente no oligonucleotídeo. A estrutura de GalNAc2-32a é mostrada abaixo:
Exemplo 112: Oligonucleotídeo modificados compreendendo um conjugado de GalNAc1
[001129] Os oligonucleotídeos na Tabela 107 direcionados a SRB-1 foram sintetizados com um grupo conjugado de GalNAc1 a fim de testar ainda mais a potência dos oligonucleotídeos que compreendem grupos de conjugado que contêm um ligante de GalNAc.
Exemplo 113: Oligonucleotídeos modificados compreendendo um grupo conjugado GalNAc que direciona ao Vírus da Hepatite B (HBV)
[001130] Os oligonucleotídeos listados na Tabela 108 abaixo foram designados ao HBV alvo. Em determinadas modalidades, uma porção clivável é uma ligação fosfodiéster.