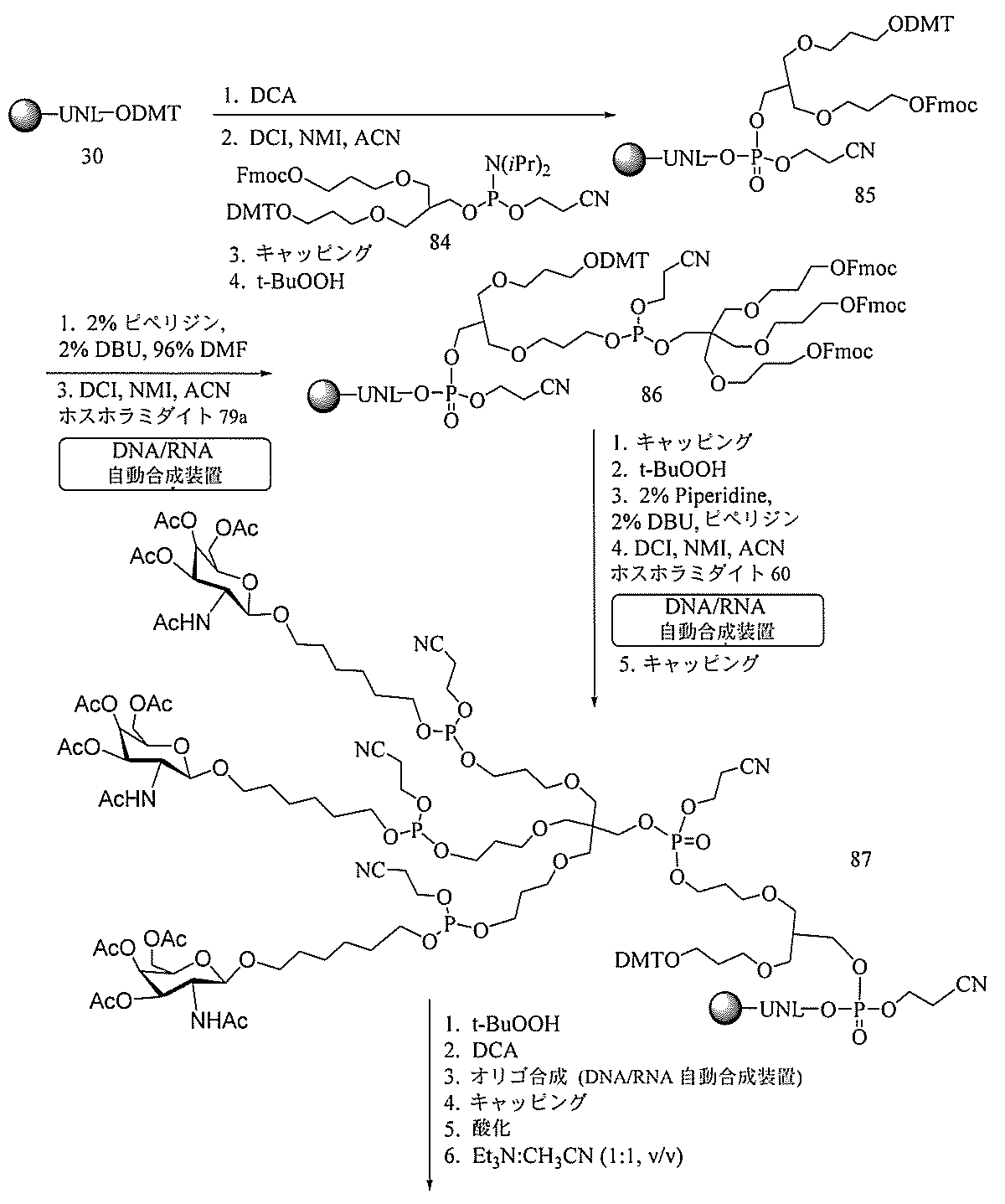
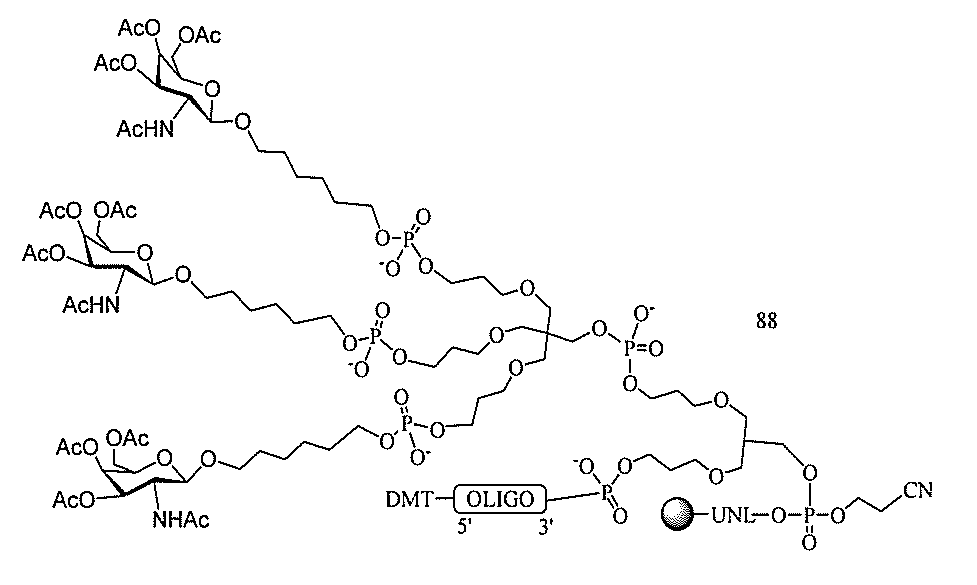
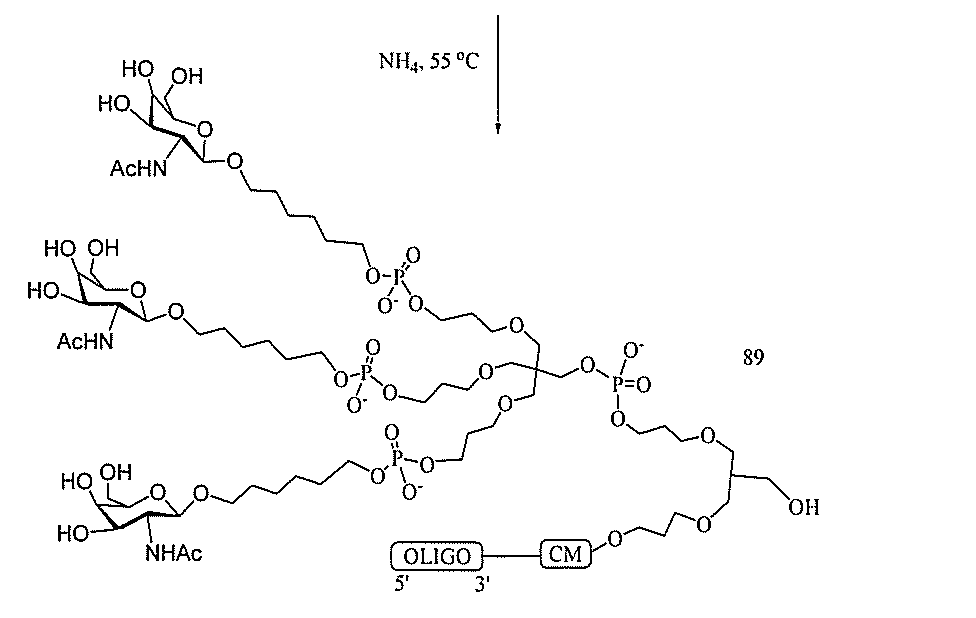
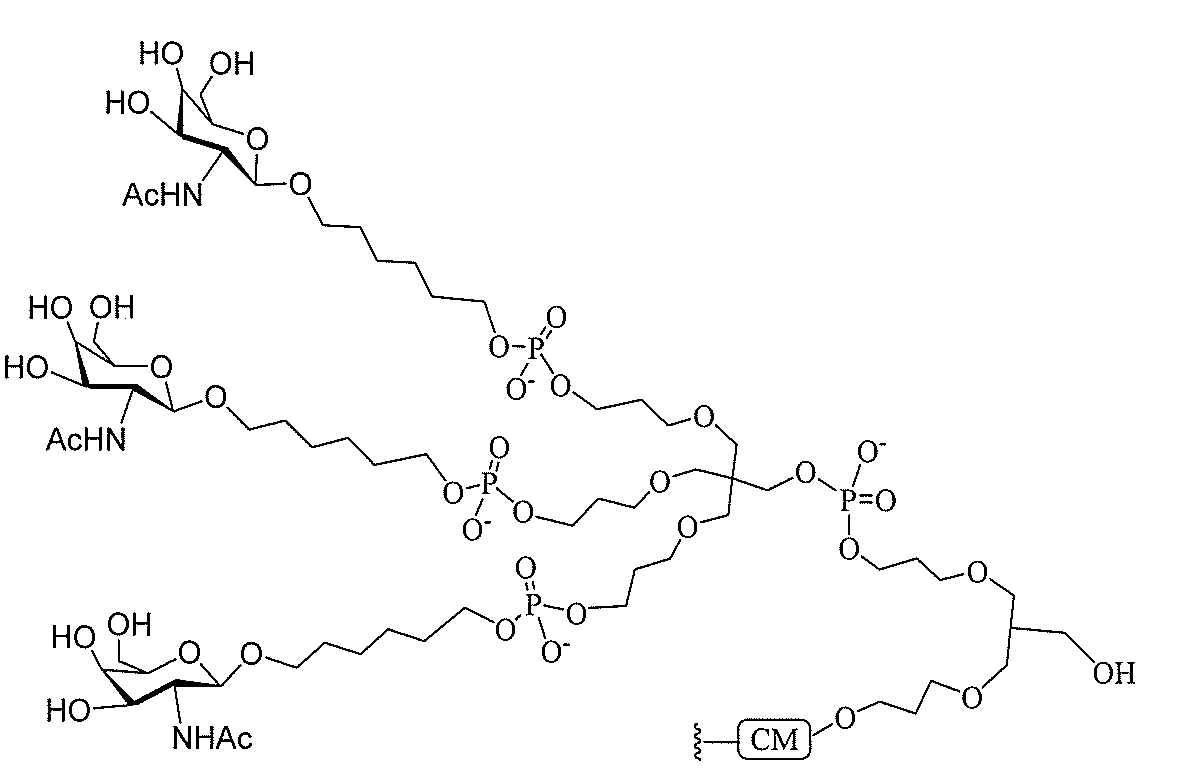
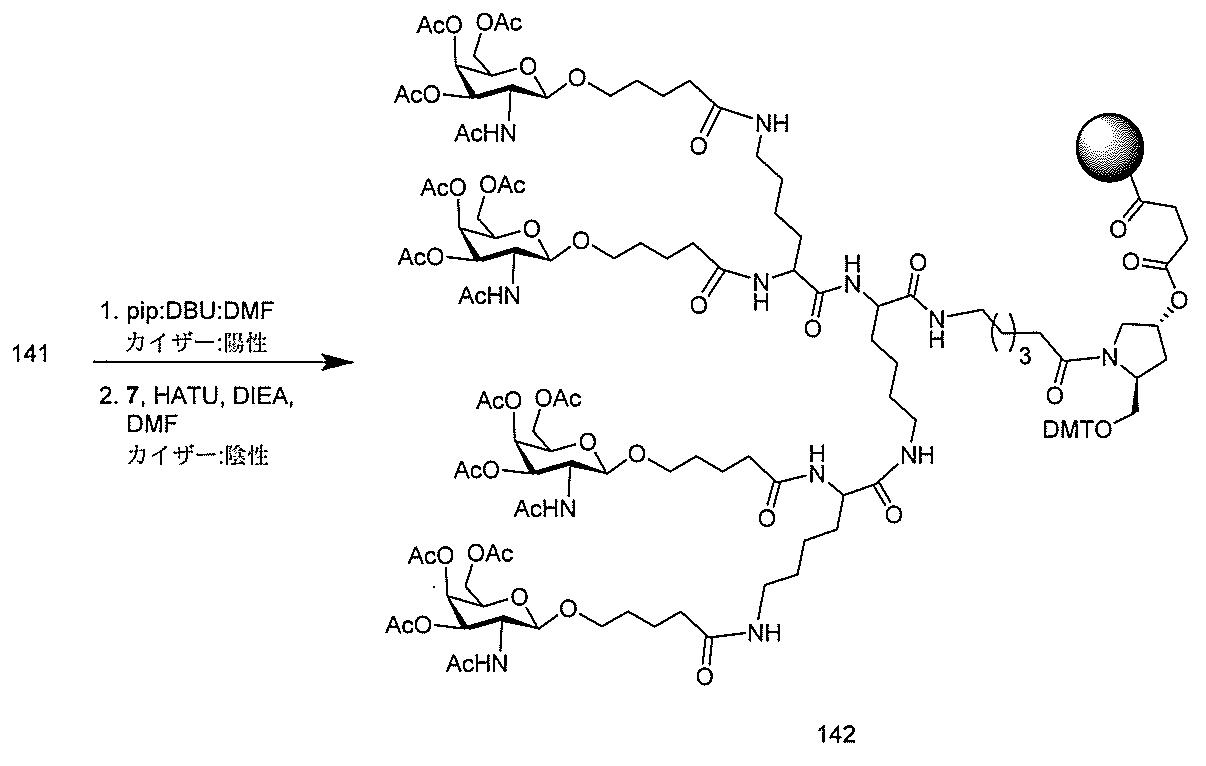
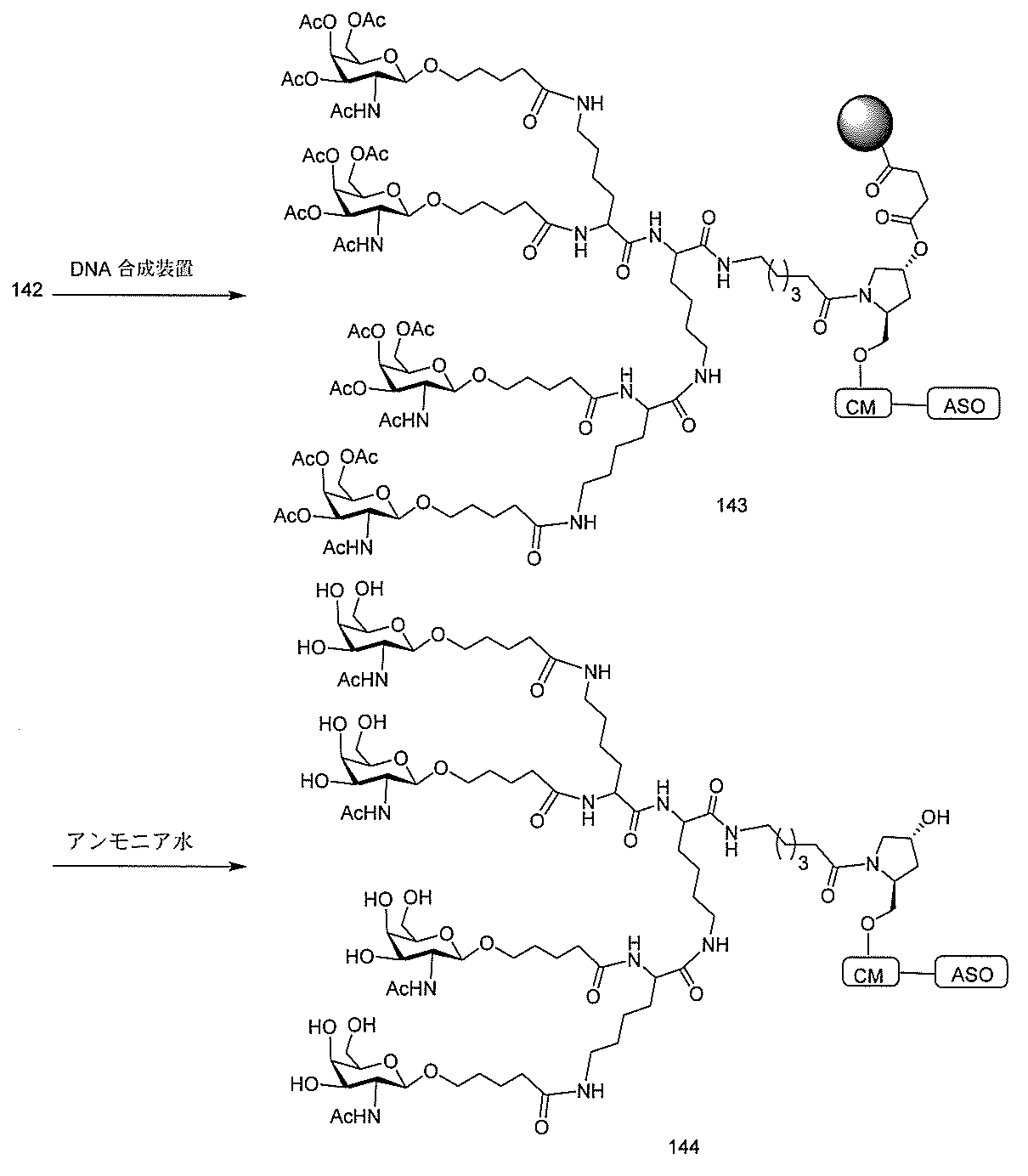
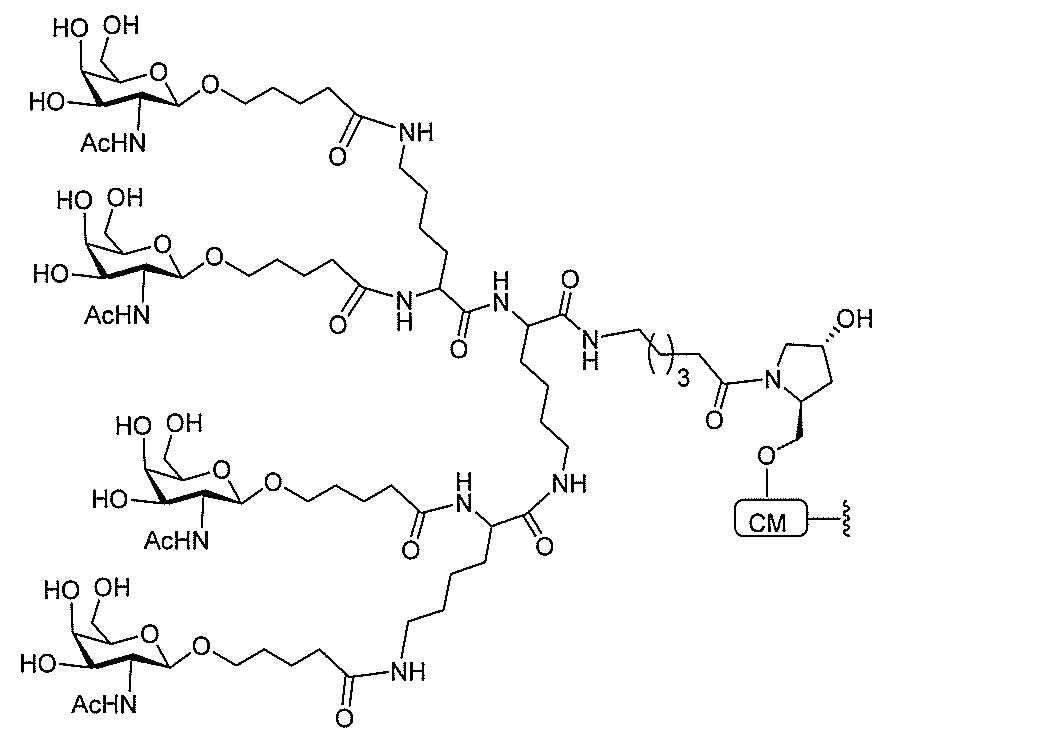
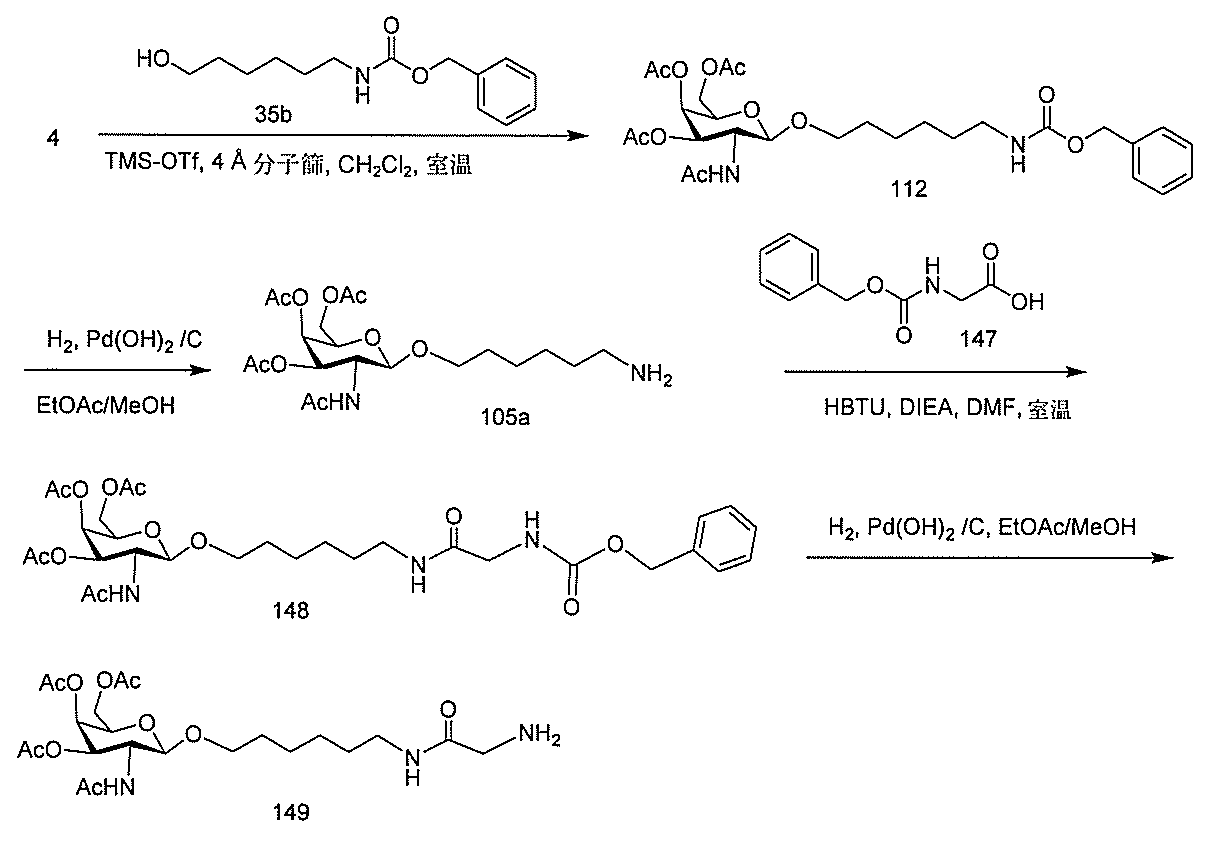
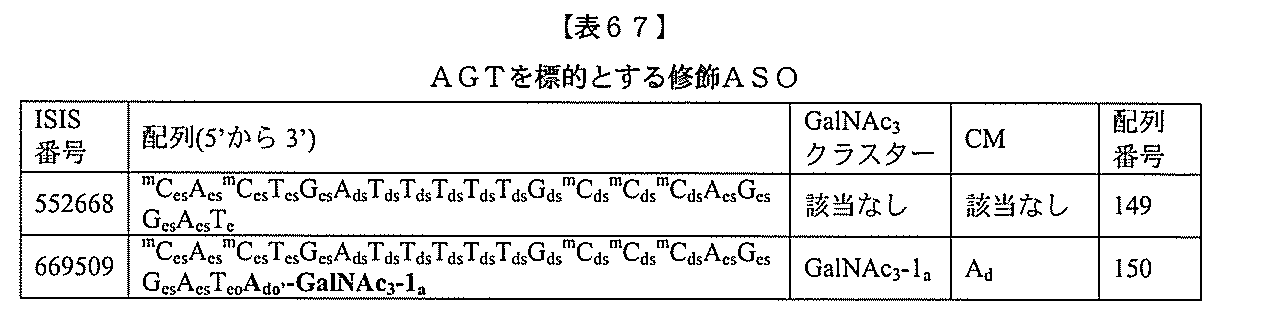
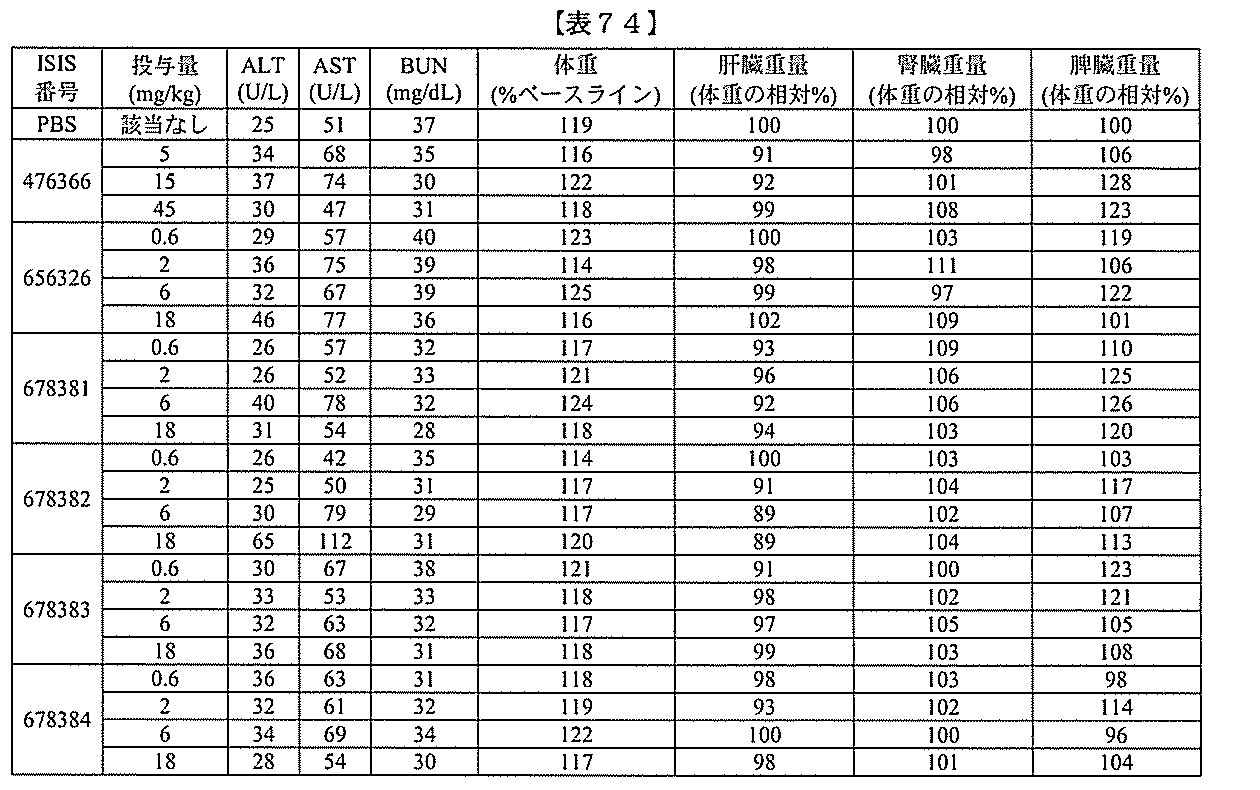
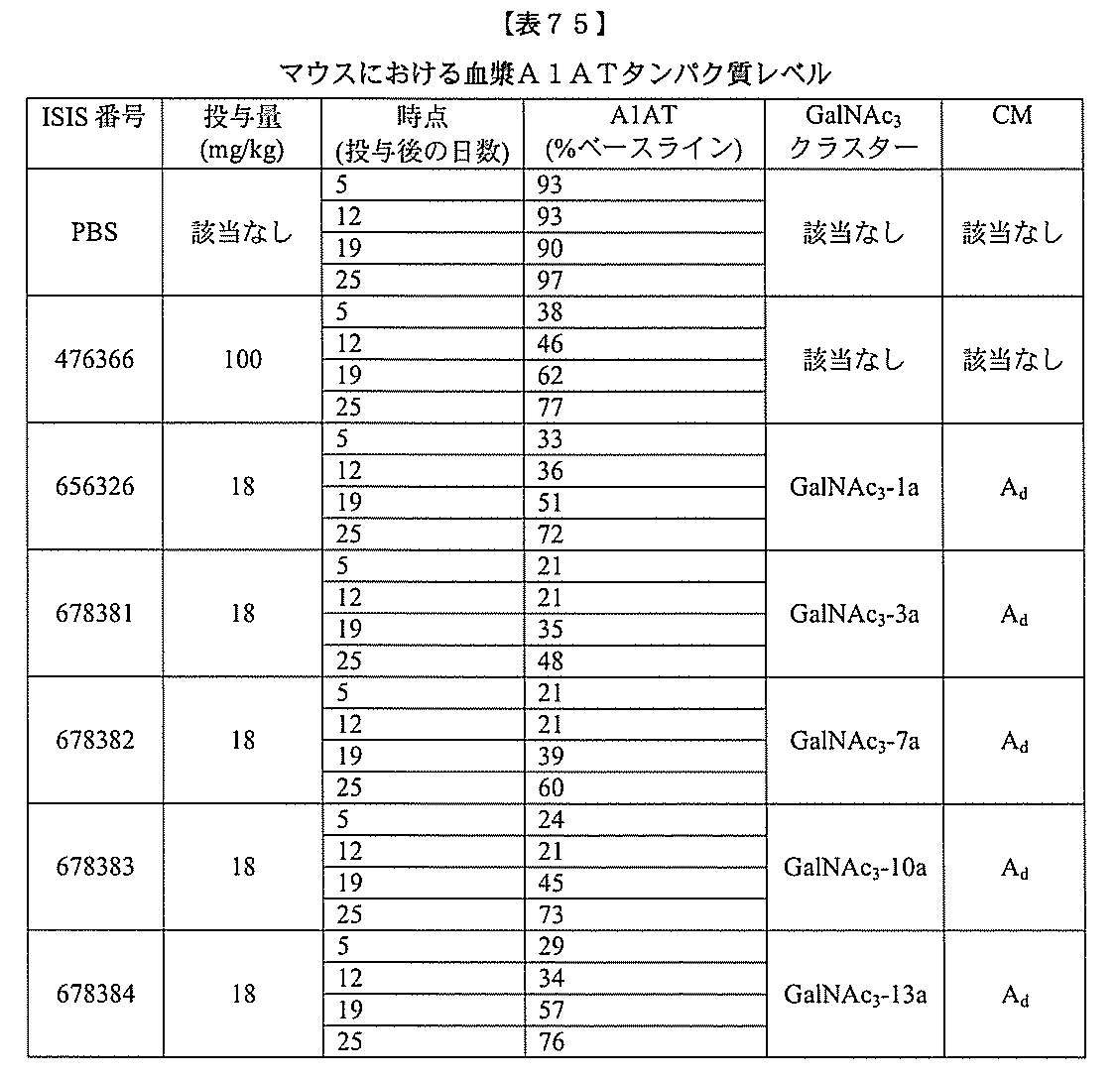
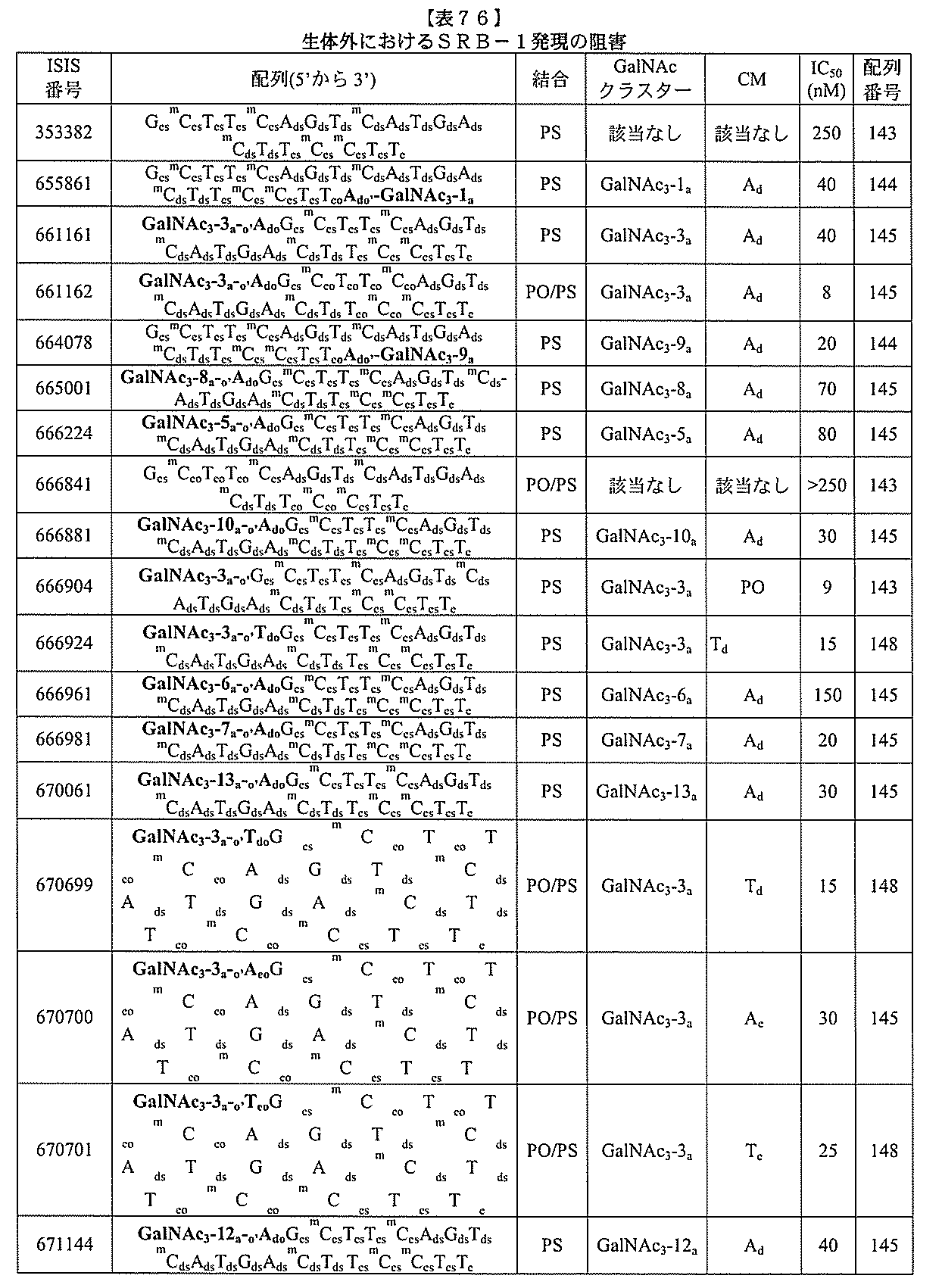
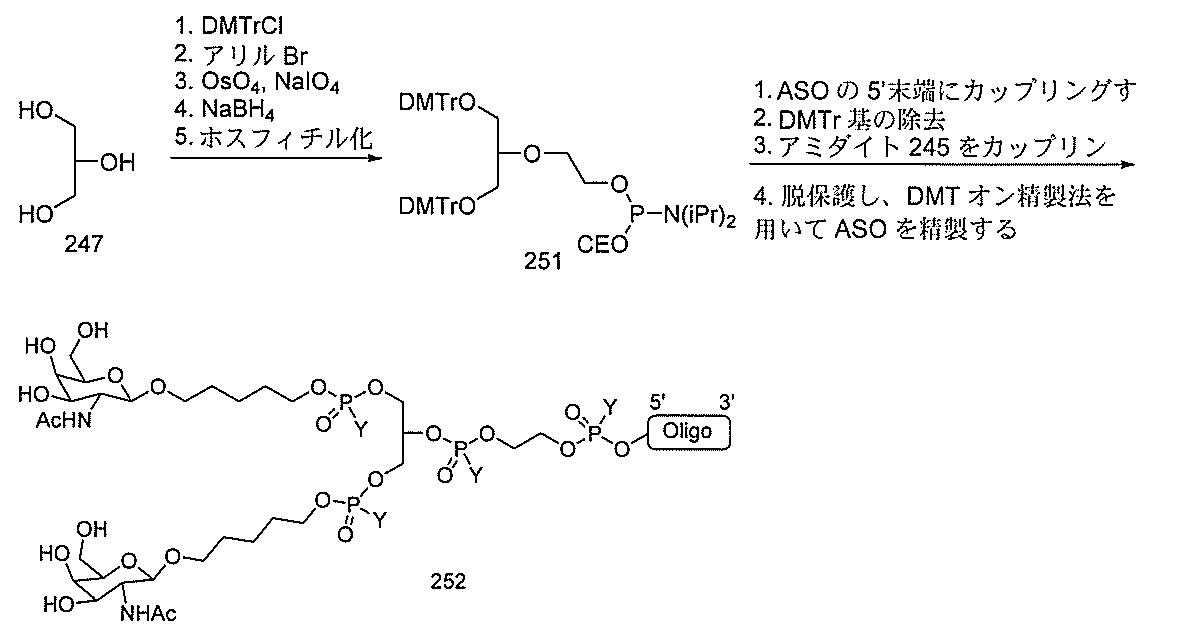
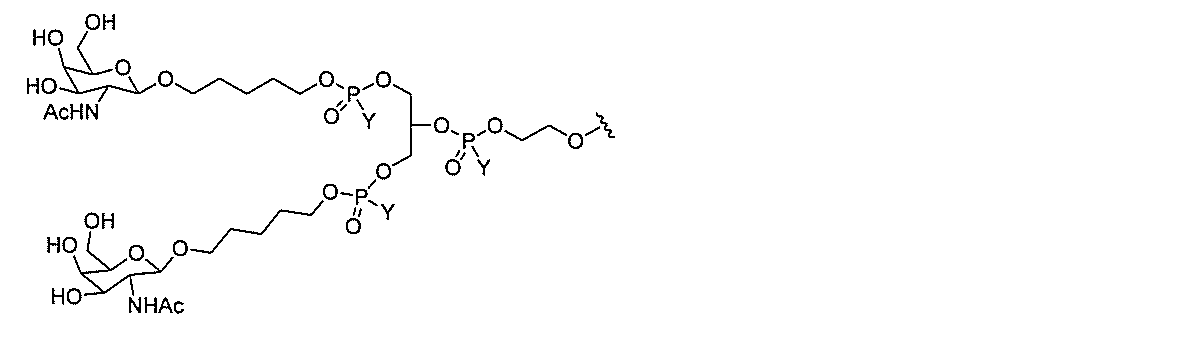
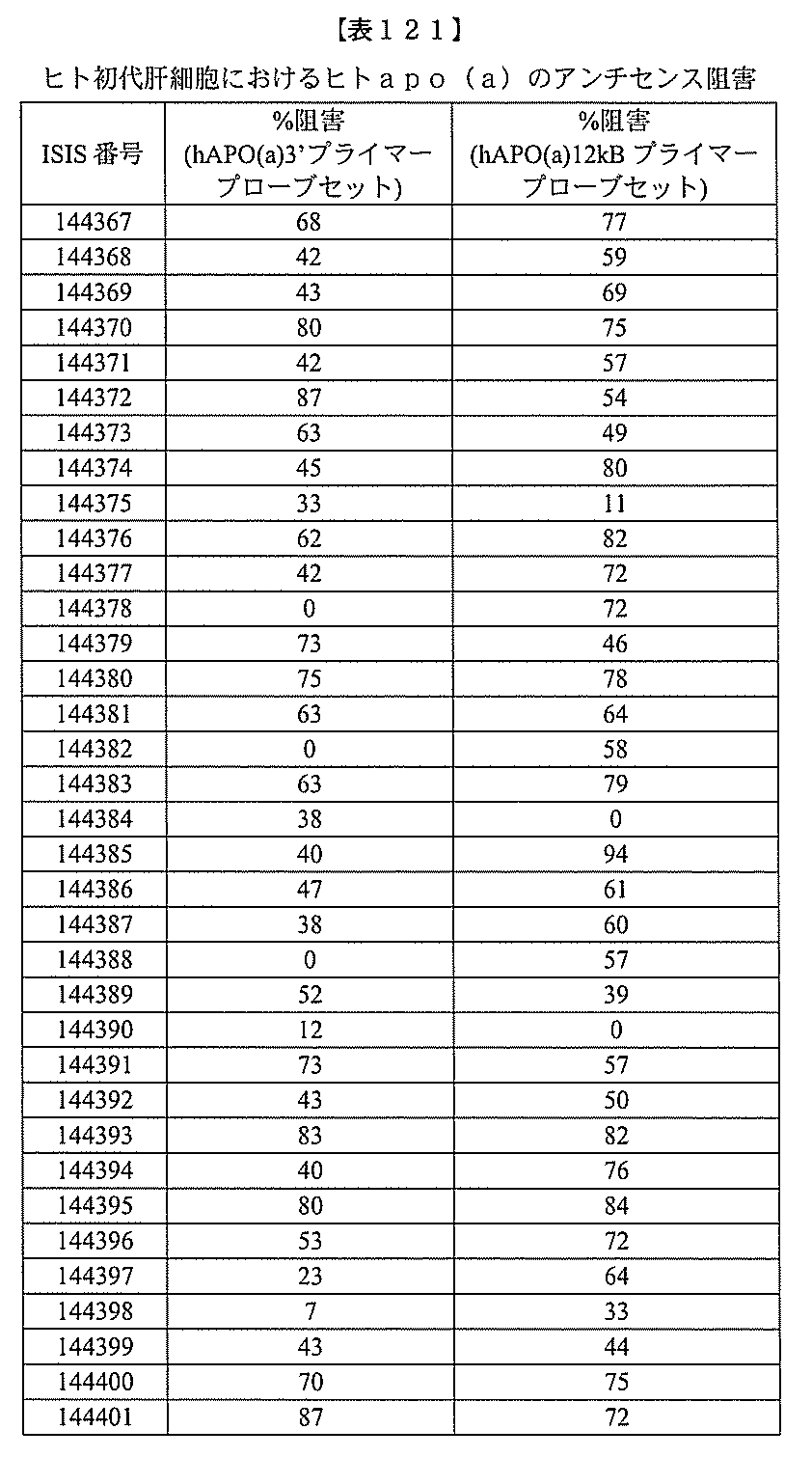
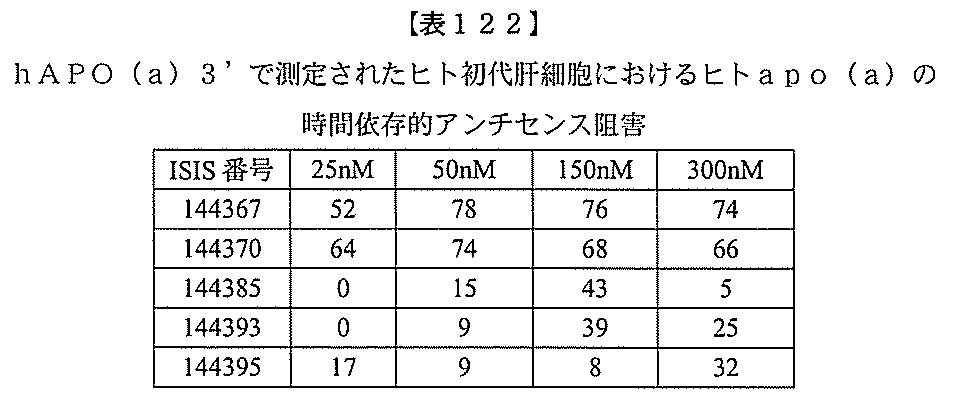
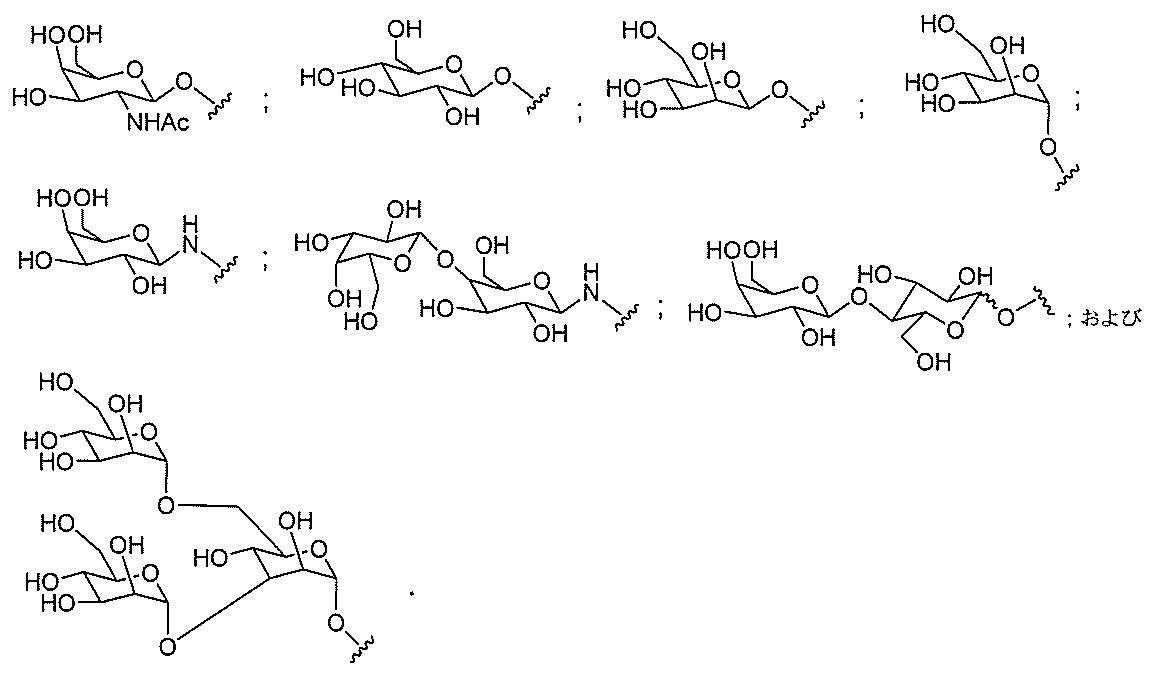
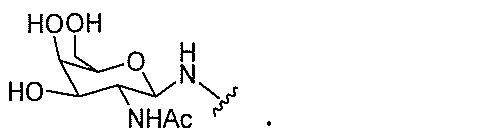
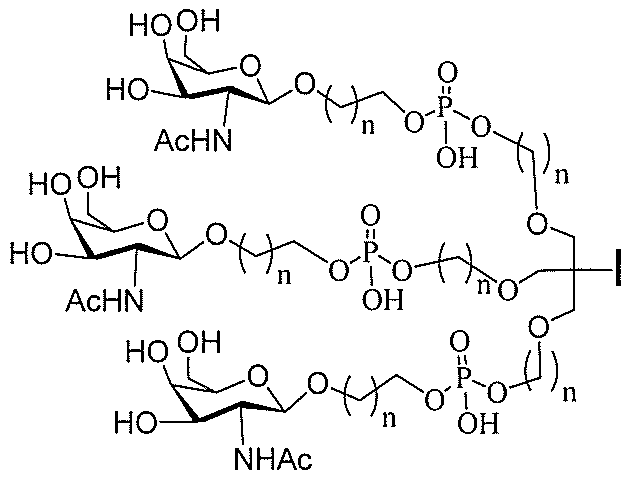
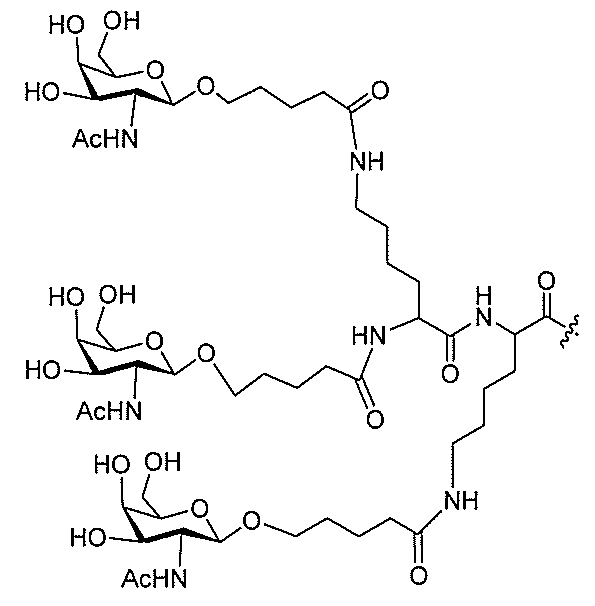
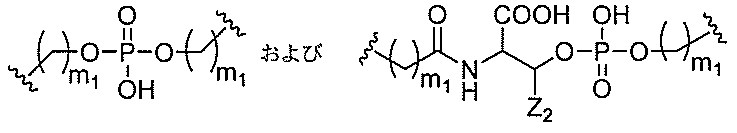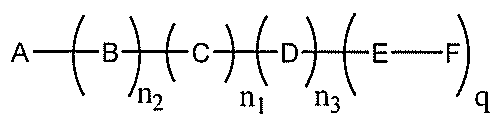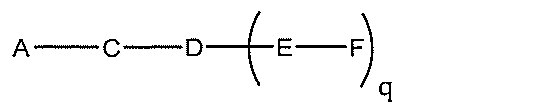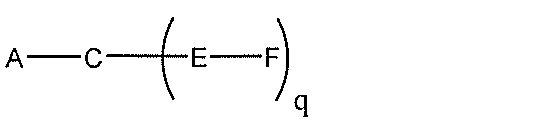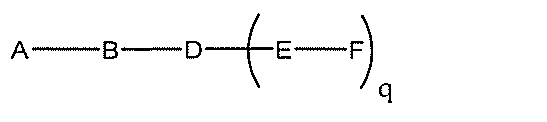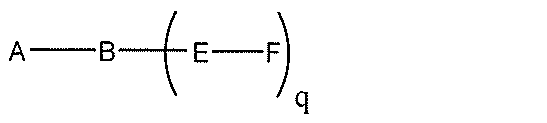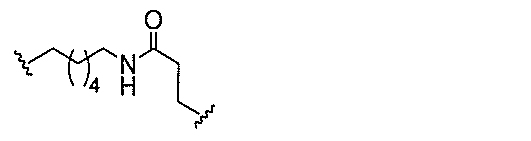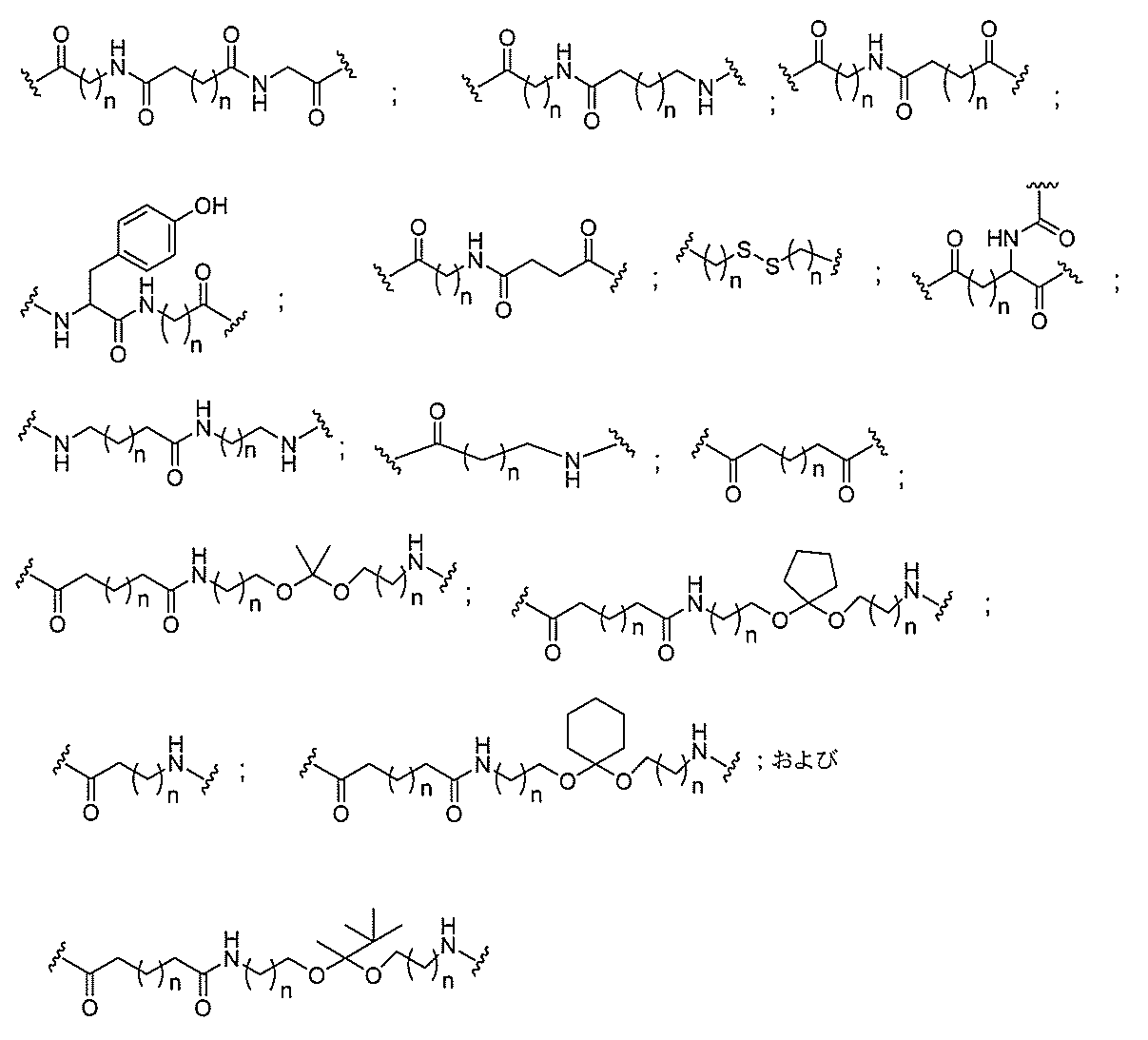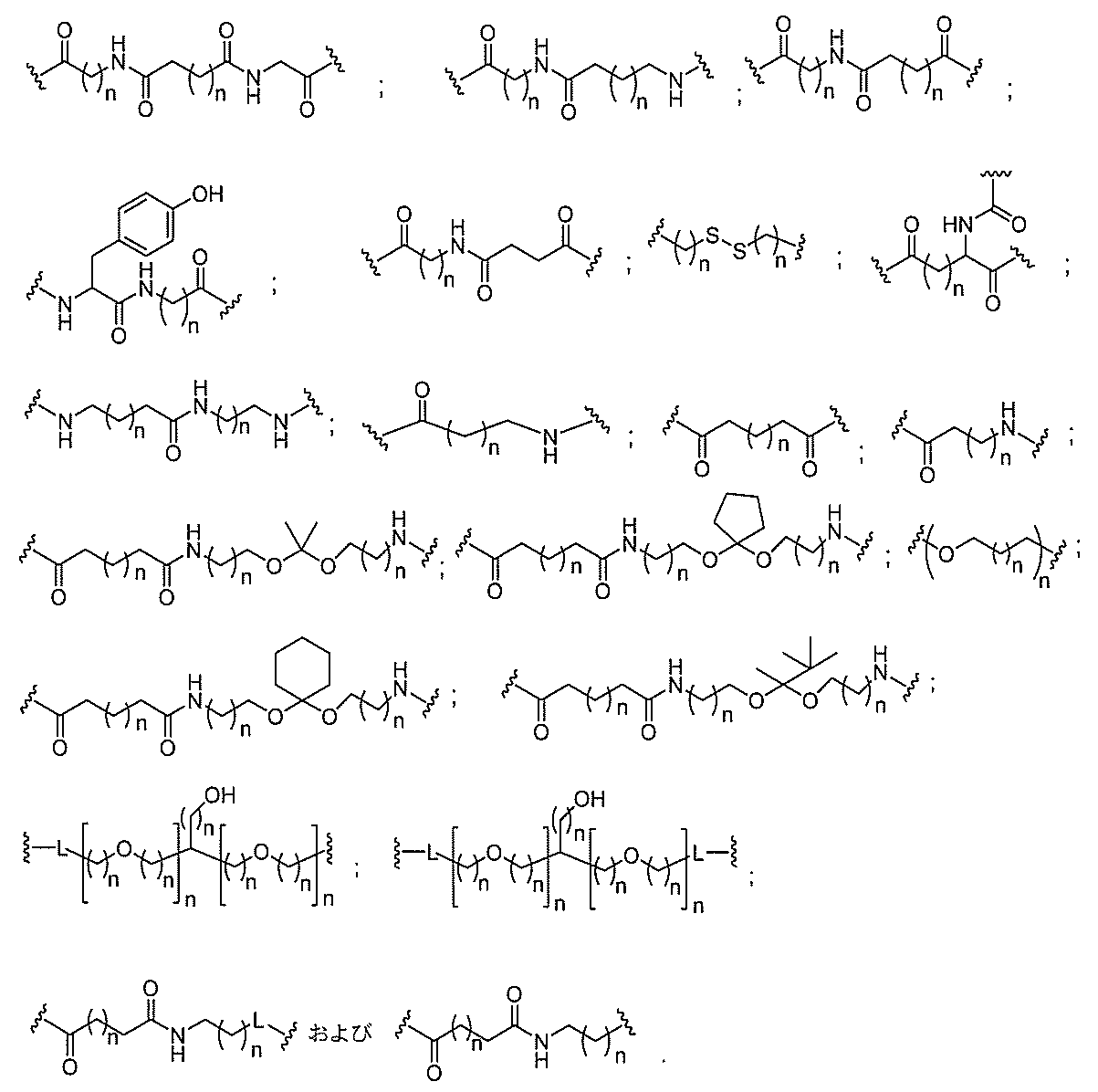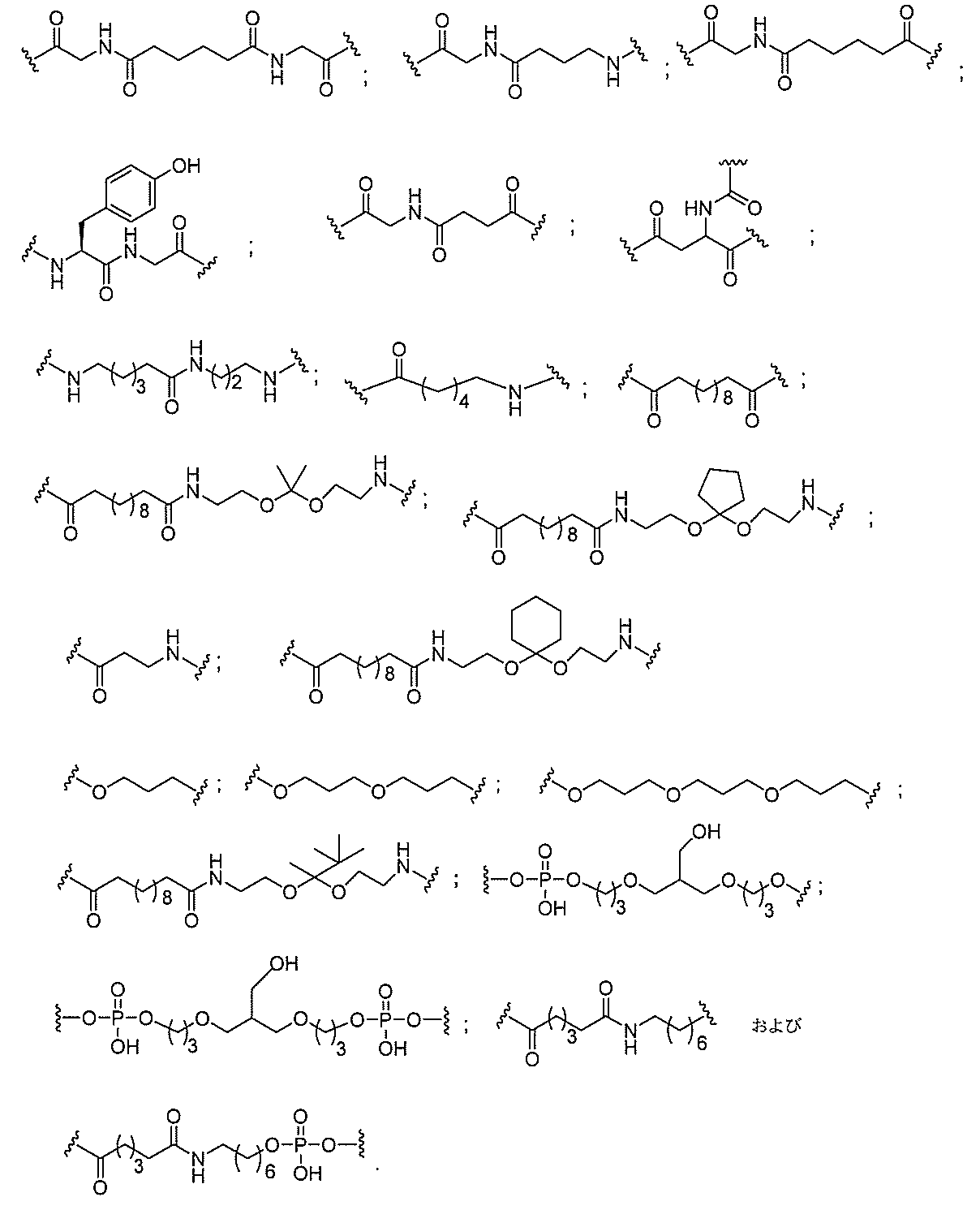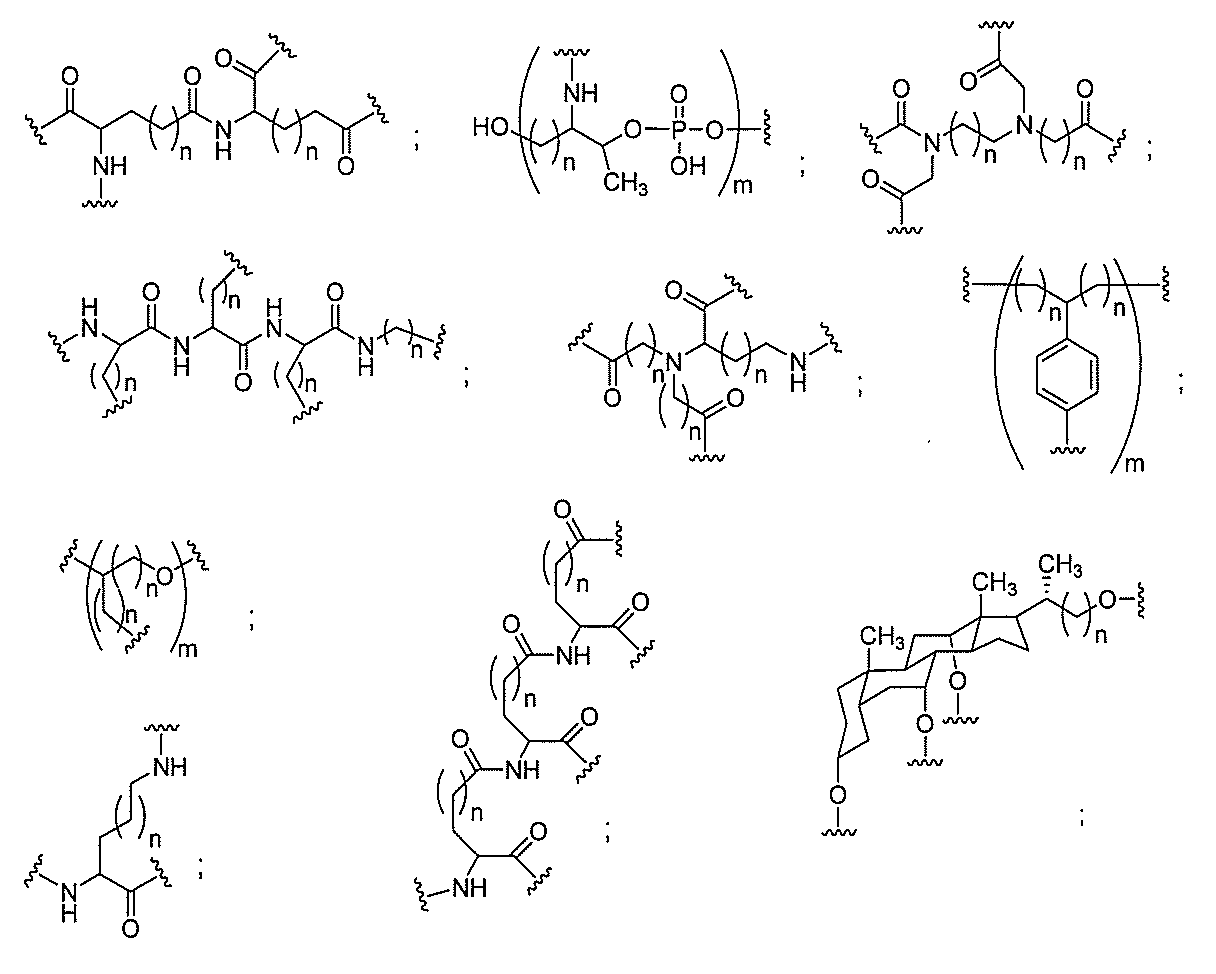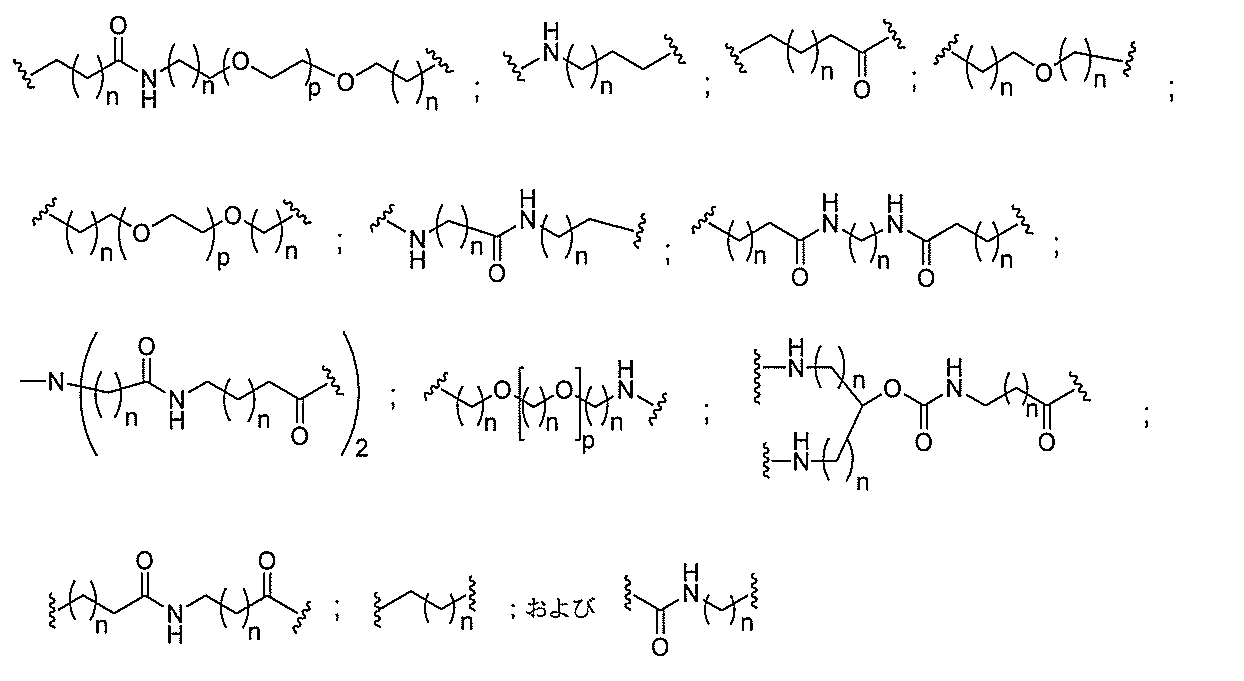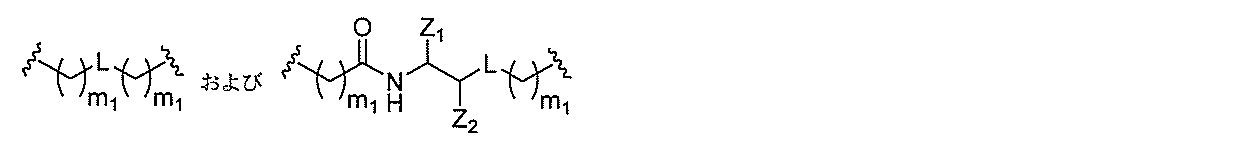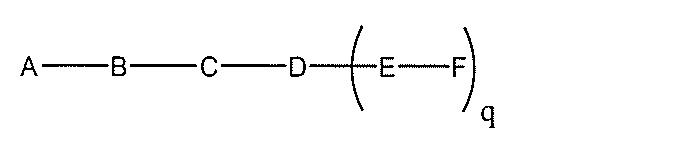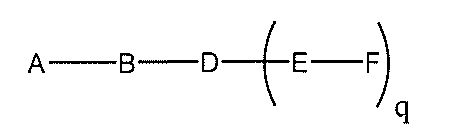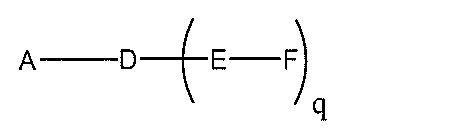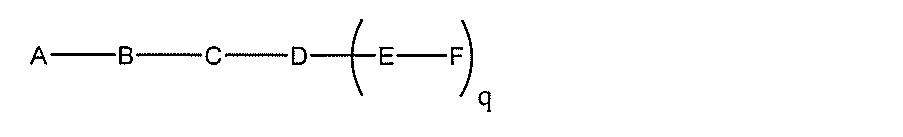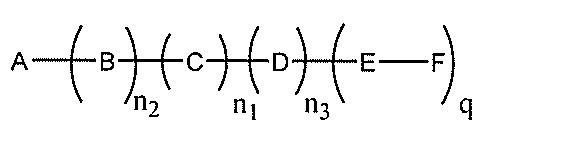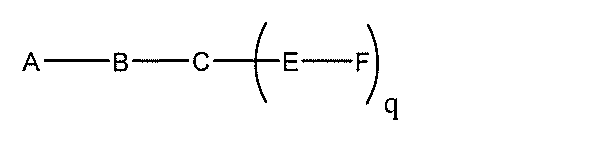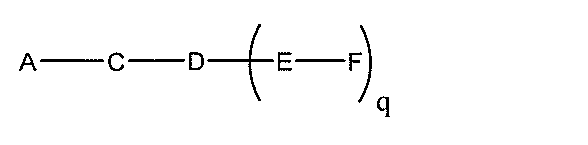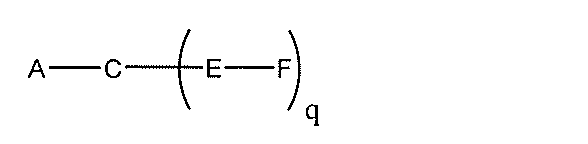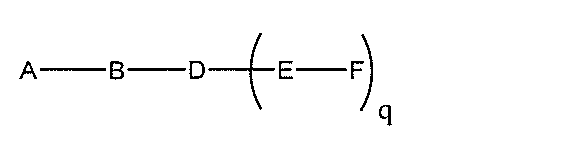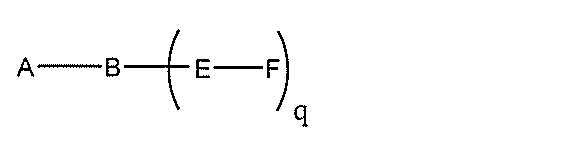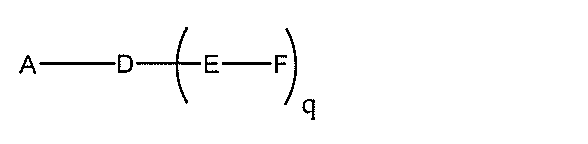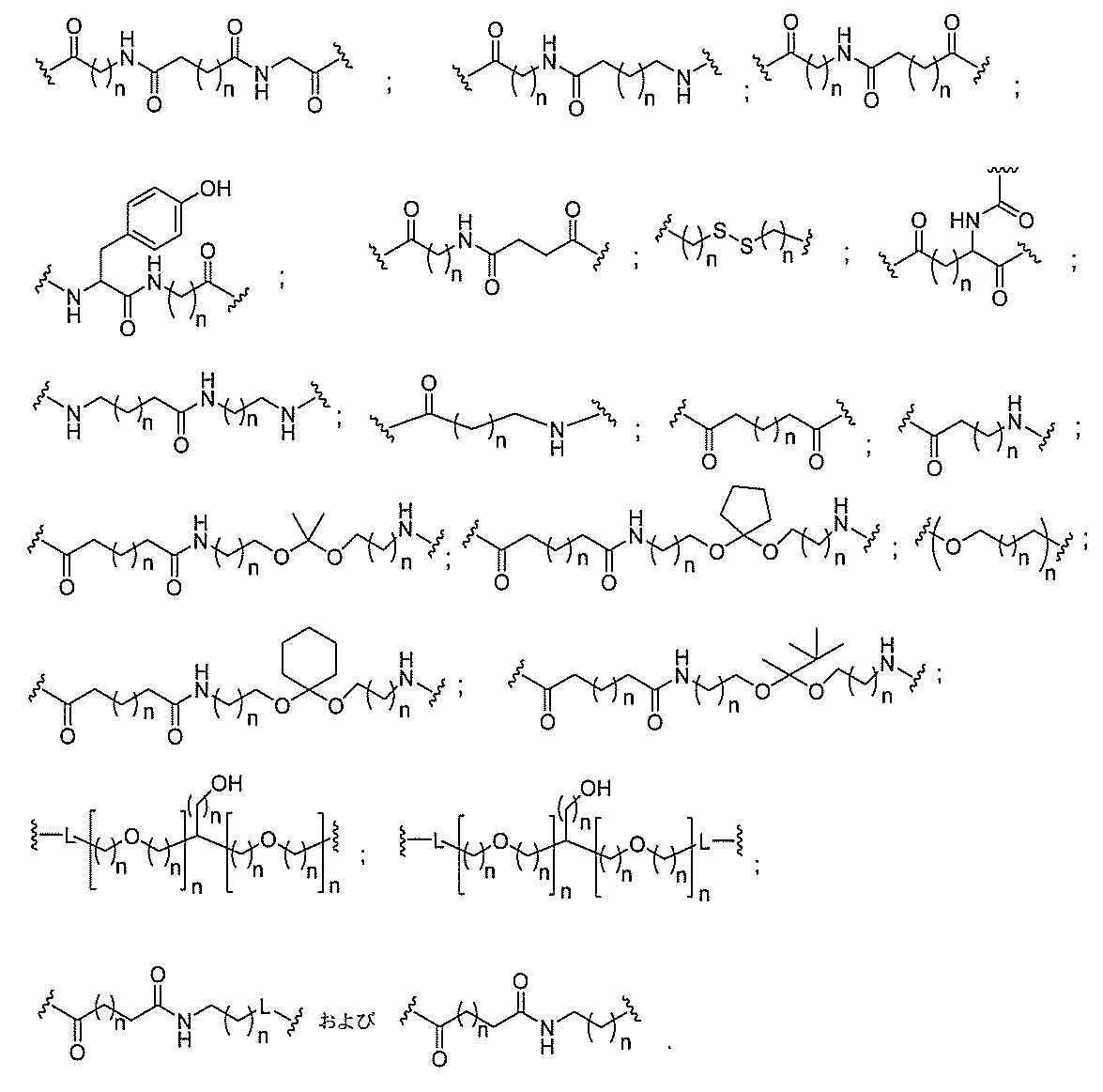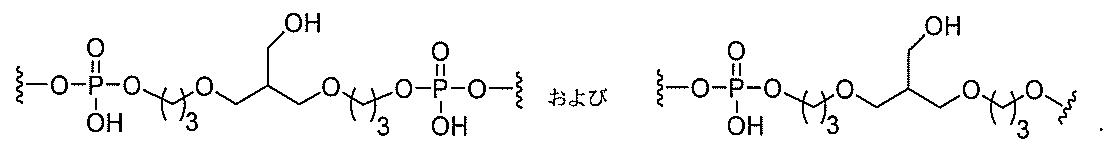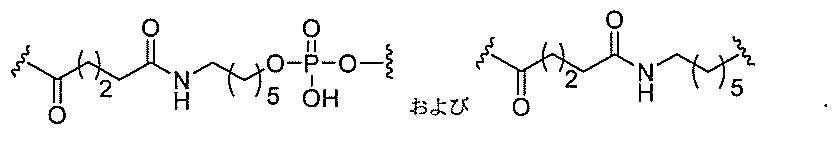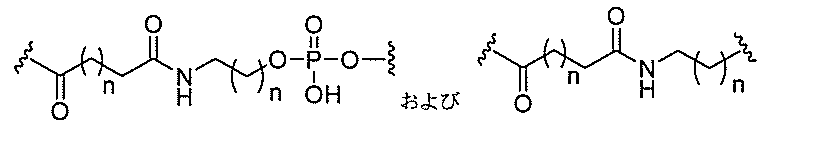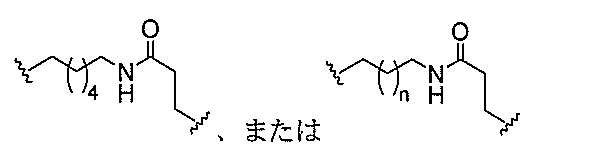JP2022017514A - アポリポタンパク質(a)発現を調節するための組成物および方法 - Google Patents
アポリポタンパク質(a)発現を調節するための組成物および方法 Download PDFInfo
- Publication number
- JP2022017514A JP2022017514A JP2021181533A JP2021181533A JP2022017514A JP 2022017514 A JP2022017514 A JP 2022017514A JP 2021181533 A JP2021181533 A JP 2021181533A JP 2021181533 A JP2021181533 A JP 2021181533A JP 2022017514 A JP2022017514 A JP 2022017514A
- Authority
- JP
- Japan
- Prior art keywords
- compound according
- certain embodiments
- compound
- group
- conjugated
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 CC(C)NNC(C)(C)ONN* Chemical compound CC(C)NNC(C)(C)ONN* 0.000 description 159
- HOVAGTYPODGVJG-UHFFFAOYSA-N COC(C(C1O)O)OC(CO)C1O Chemical compound COC(C(C1O)O)OC(CO)C1O HOVAGTYPODGVJG-UHFFFAOYSA-N 0.000 description 3
- BEXGMGPZUNBHOF-UHFFFAOYSA-N CCC(C(C)C(C1NC(C)=O)O)OC1NC Chemical compound CCC(C(C)C(C1NC(C)=O)O)OC1NC BEXGMGPZUNBHOF-UHFFFAOYSA-N 0.000 description 2
- MJBQRZWIDYBFFT-UHFFFAOYSA-N CCC(C(C)C(C1NC(C)=O)O)OC1OC Chemical compound CCC(C(C)C(C1NC(C)=O)O)OC1OC MJBQRZWIDYBFFT-UHFFFAOYSA-N 0.000 description 2
- RXZPTLGCACZFNV-UHFFFAOYSA-N CCC(C(C)C(C1O)O)OC1NC Chemical compound CCC(C(C)C(C1O)O)OC1NC RXZPTLGCACZFNV-UHFFFAOYSA-N 0.000 description 2
- FMTMIHHMLRUDCN-UHFFFAOYSA-N CNC(C(C1O)O)OC(CO)C1OC(C(C1O)O)OC(CO)C1O Chemical compound CNC(C(C1O)O)OC(CO)C1OC(C(C1O)O)OC(CO)C1O FMTMIHHMLRUDCN-UHFFFAOYSA-N 0.000 description 2
- IUXMYQOZGZRWLI-UHFFFAOYSA-N CC(C)CC(C)(C)CNCC(N)=O Chemical compound CC(C)CC(C)(C)CNCC(N)=O IUXMYQOZGZRWLI-UHFFFAOYSA-N 0.000 description 1
- FOHYJINVJDDOCX-UHFFFAOYSA-N CC(C)CNNC(C)(C)OP Chemical compound CC(C)CNNC(C)(C)OP FOHYJINVJDDOCX-UHFFFAOYSA-N 0.000 description 1
- WUUVNFHNYXPUGY-UHFFFAOYSA-N CC(NC(C1O)C(OCCOCCOCCNC(CCC(CCC(NCCOCCOCCOC(C(C2O)NC(C)=O)OC(CO)C2O)=O)(CCC(NCCOCCOCCOC(C(C2O)NC(C)=O)OC(CO)C2O)=O)N)=O)OC(CO)C1O)=O Chemical compound CC(NC(C1O)C(OCCOCCOCCNC(CCC(CCC(NCCOCCOCCOC(C(C2O)NC(C)=O)OC(CO)C2O)=O)(CCC(NCCOCCOCCOC(C(C2O)NC(C)=O)OC(CO)C2O)=O)N)=O)OC(CO)C1O)=O WUUVNFHNYXPUGY-UHFFFAOYSA-N 0.000 description 1
- RZKBNVPXARWALO-UHFFFAOYSA-N CCC(C(C)C(C1NC(C)=O)O)OC1NC(C)C Chemical compound CCC(C(C)C(C1NC(C)=O)O)OC1NC(C)C RZKBNVPXARWALO-UHFFFAOYSA-N 0.000 description 1
- IZJWWWREBCKESM-UHFFFAOYSA-N CCC(C(C)C1OC(C)=O)[U]C2C1N=C(C)C1C2C1 Chemical compound CCC(C(C)C1OC(C)=O)[U]C2C1N=C(C)C1C2C1 IZJWWWREBCKESM-UHFFFAOYSA-N 0.000 description 1
- HKFFKPOYNUQAQG-UHFFFAOYSA-N CCC(COC(C)C)(CON)CONC Chemical compound CCC(COC(C)C)(CON)CONC HKFFKPOYNUQAQG-UHFFFAOYSA-N 0.000 description 1
- JVQALPFABFBUJW-UHFFFAOYSA-N CCCOCCNC(C)=O Chemical compound CCCOCCNC(C)=O JVQALPFABFBUJW-UHFFFAOYSA-N 0.000 description 1
- BFXKDJHSPRVBKL-QWNNWUTASA-O CCC[C@H](C)/C(/O)=C(\[C@@H](O)OCCCCCC[OH2+])/NC(C)=O Chemical compound CCC[C@H](C)/C(/O)=C(\[C@@H](O)OCCCCCC[OH2+])/NC(C)=O BFXKDJHSPRVBKL-QWNNWUTASA-O 0.000 description 1
- XKUAJUUCRYXCJT-UHFFFAOYSA-N CCNCCCCC(C(C(C)C)=O)NC(C(CCCCNS=C)NC(C)C)=O Chemical compound CCNCCCCC(C(C(C)C)=O)NC(C(CCCCNS=C)NC(C)C)=O XKUAJUUCRYXCJT-UHFFFAOYSA-N 0.000 description 1
- VVKQBKJKGBSGNX-UHFFFAOYSA-N CCOP(O)(OC1=CCC=C1)=O Chemical compound CCOP(O)(OC1=CCC=C1)=O VVKQBKJKGBSGNX-UHFFFAOYSA-N 0.000 description 1
- BGVNXXPMVRONSD-WKNPJEECSA-N CCP(O)(OC[C@H]([C@H](C1)OP(NC)(O)=C)OC1[n]1c2ncnc(N)c2nc1)=O Chemical compound CCP(O)(OC[C@H]([C@H](C1)OP(NC)(O)=C)OC1[n]1c2ncnc(N)c2nc1)=O BGVNXXPMVRONSD-WKNPJEECSA-N 0.000 description 1
- LZMWXZYTOHGCTO-UEJVZZJDSA-N CP(O)(OCC([C@H](C1)OP(C)(O)=O)OC1[n]1c2ncnc(N)c2nc1)=O Chemical compound CP(O)(OCC([C@H](C1)OP(C)(O)=O)OC1[n]1c2ncnc(N)c2nc1)=O LZMWXZYTOHGCTO-UEJVZZJDSA-N 0.000 description 1
- MGTWXWKLYUMAON-UHFFFAOYSA-N Cc(cc1)ccc1S(OO)(=O)=O Chemical compound Cc(cc1)ccc1S(OO)(=O)=O MGTWXWKLYUMAON-UHFFFAOYSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N NCCCCCC(O)=O Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- HLYHYBCTNCRNQH-UHFFFAOYSA-N OCC(C(C(C1O)O)O)OC1OCC(C(C(C1O)OC(C(C2O)O)OC(CO)C2O)O)OC1OI Chemical compound OCC(C(C(C1O)O)O)OC1OCC(C(C(C1O)OC(C(C2O)O)OC(CO)C2O)O)OC1OI HLYHYBCTNCRNQH-UHFFFAOYSA-N 0.000 description 1
- WVDDGKGOMKODPV-UHFFFAOYSA-N OCc1ccccc1 Chemical compound OCc1ccccc1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7125—Nucleic acids or oligonucleotides having modified internucleoside linkage, i.e. other than 3'-5' phosphodiesters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/549—Sugars, nucleosides, nucleotides or nucleic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1137—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y301/00—Hydrolases acting on ester bonds (3.1)
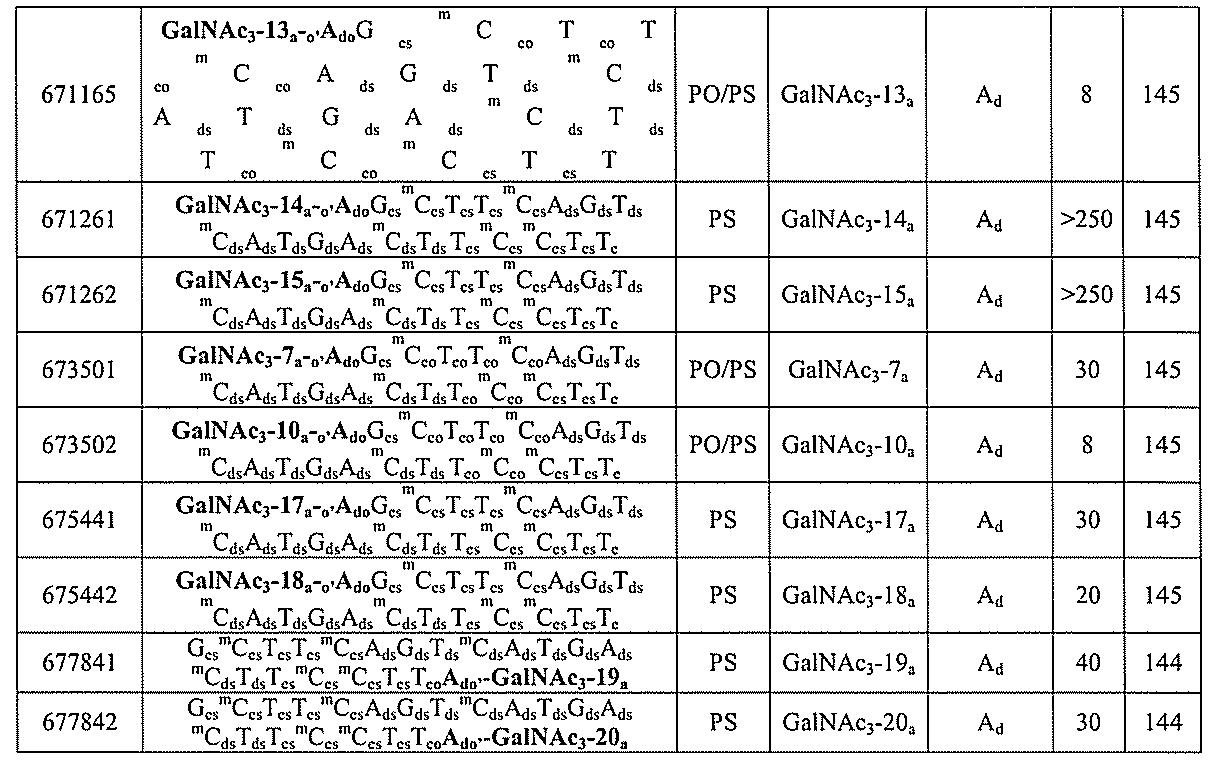
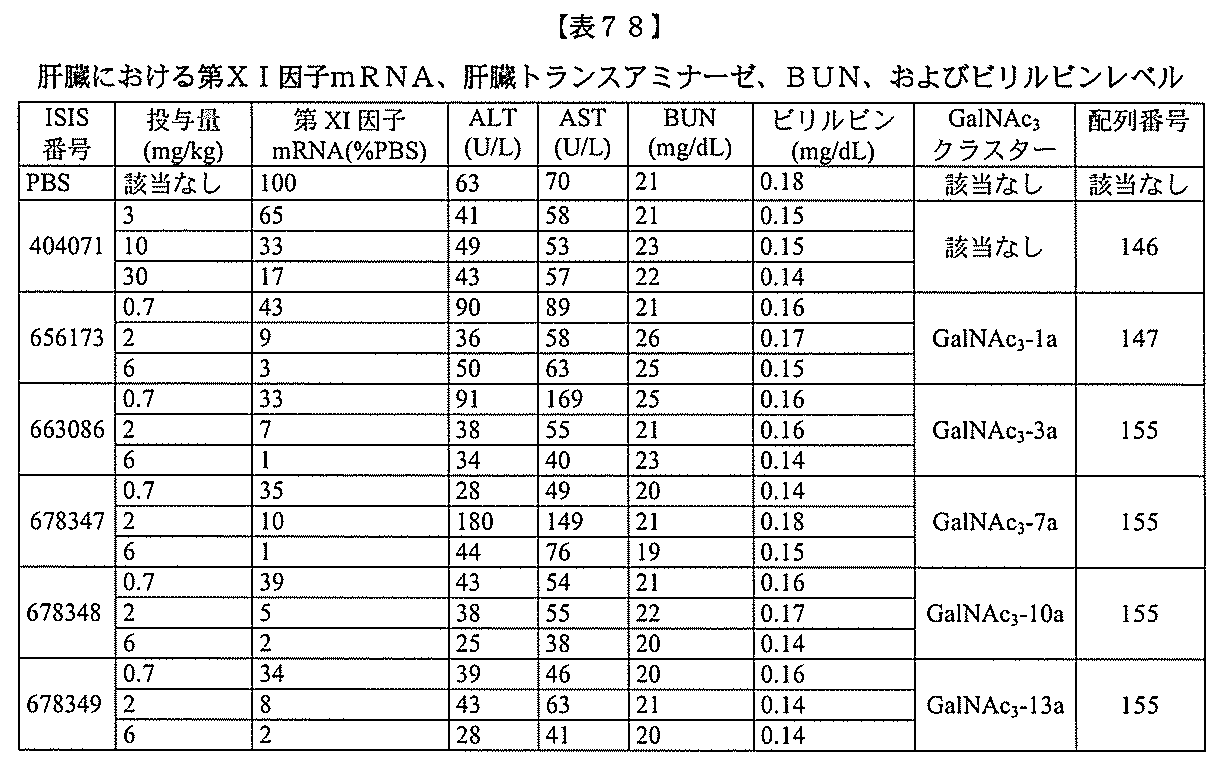
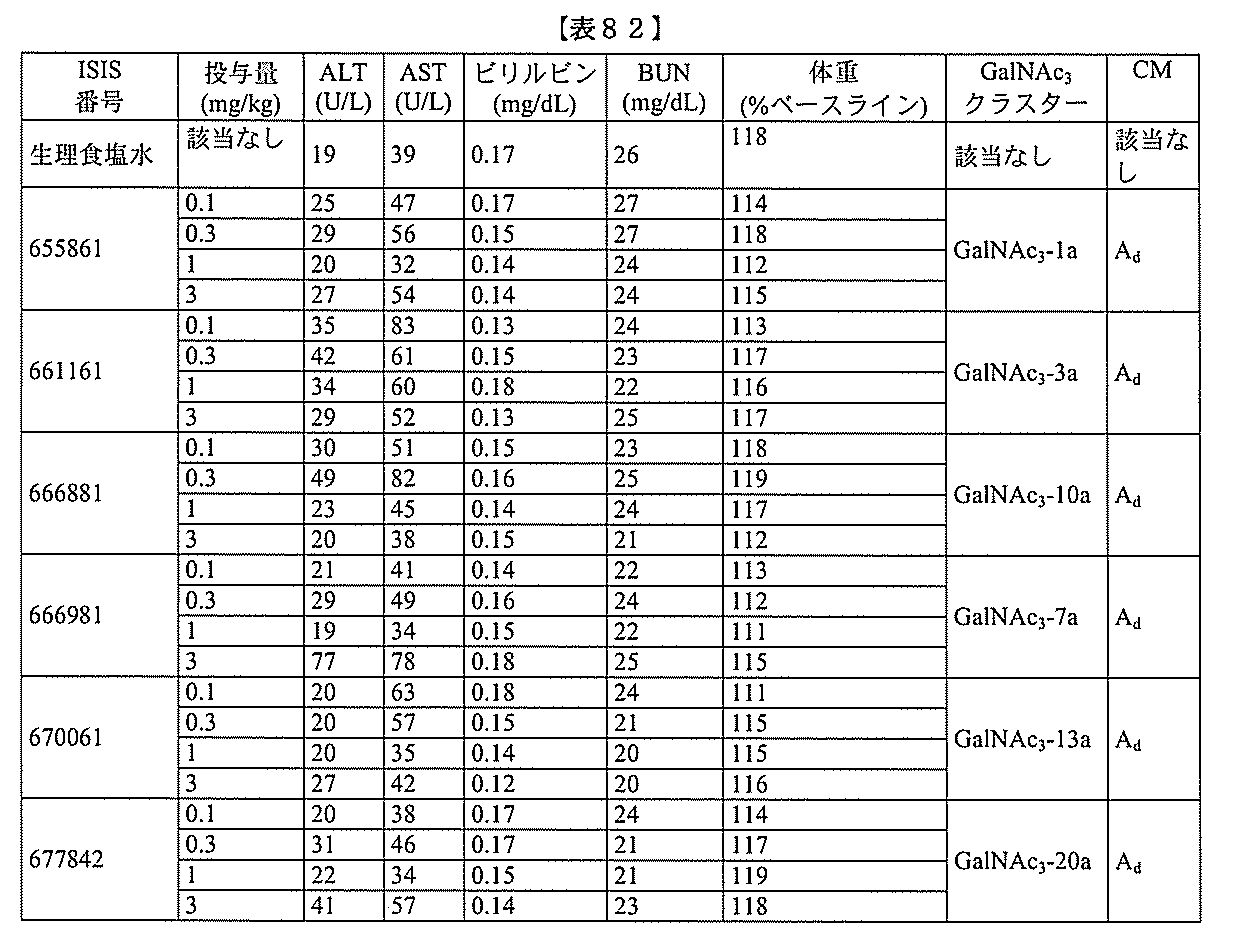
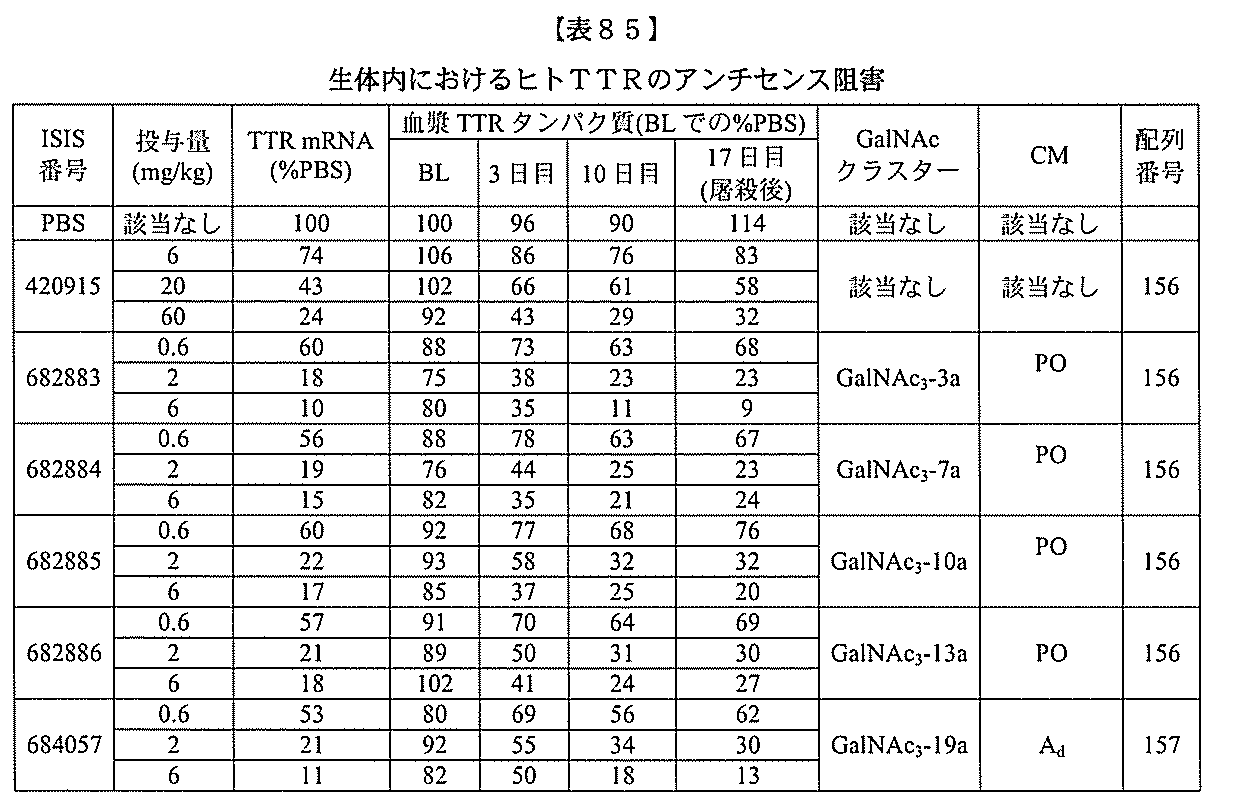
- C12Y301/03—Phosphoric monoester hydrolases (3.1.3)
- C12Y301/03048—Protein-tyrosine-phosphatase (3.1.3.48)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
- C12N2310/113—Antisense targeting other non-coding nucleic acids, e.g. antagomirs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/17—Immunomodulatory nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/31—Chemical structure of the backbone
- C12N2310/315—Phosphorothioates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/321—2'-O-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/322—2'-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/323—Chemical structure of the sugar modified ring structure
- C12N2310/3231—Chemical structure of the sugar modified ring structure having an additional ring, e.g. LNA, ENA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
- C12N2310/334—Modified C
- C12N2310/3341—5-Methylcytosine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/341—Gapmers, i.e. of the type ===---===
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/34—Spatial arrangement of the modifications
- C12N2310/346—Spatial arrangement of the modifications having a combination of backbone and sugar modifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3511—Conjugate intercalating or cleaving agent
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3513—Protein; Peptide
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3515—Lipophilic moiety, e.g. cholesterol
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/352—Nature of the modification linked to the nucleic acid via a carbon atom
- C12N2310/3525—MOE, methoxyethoxy
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/353—Nature of the modification linked to the nucleic acid via an atom other than carbon
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Virology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Steroid Compounds (AREA)
- Liquid Crystal Substances (AREA)
Abstract
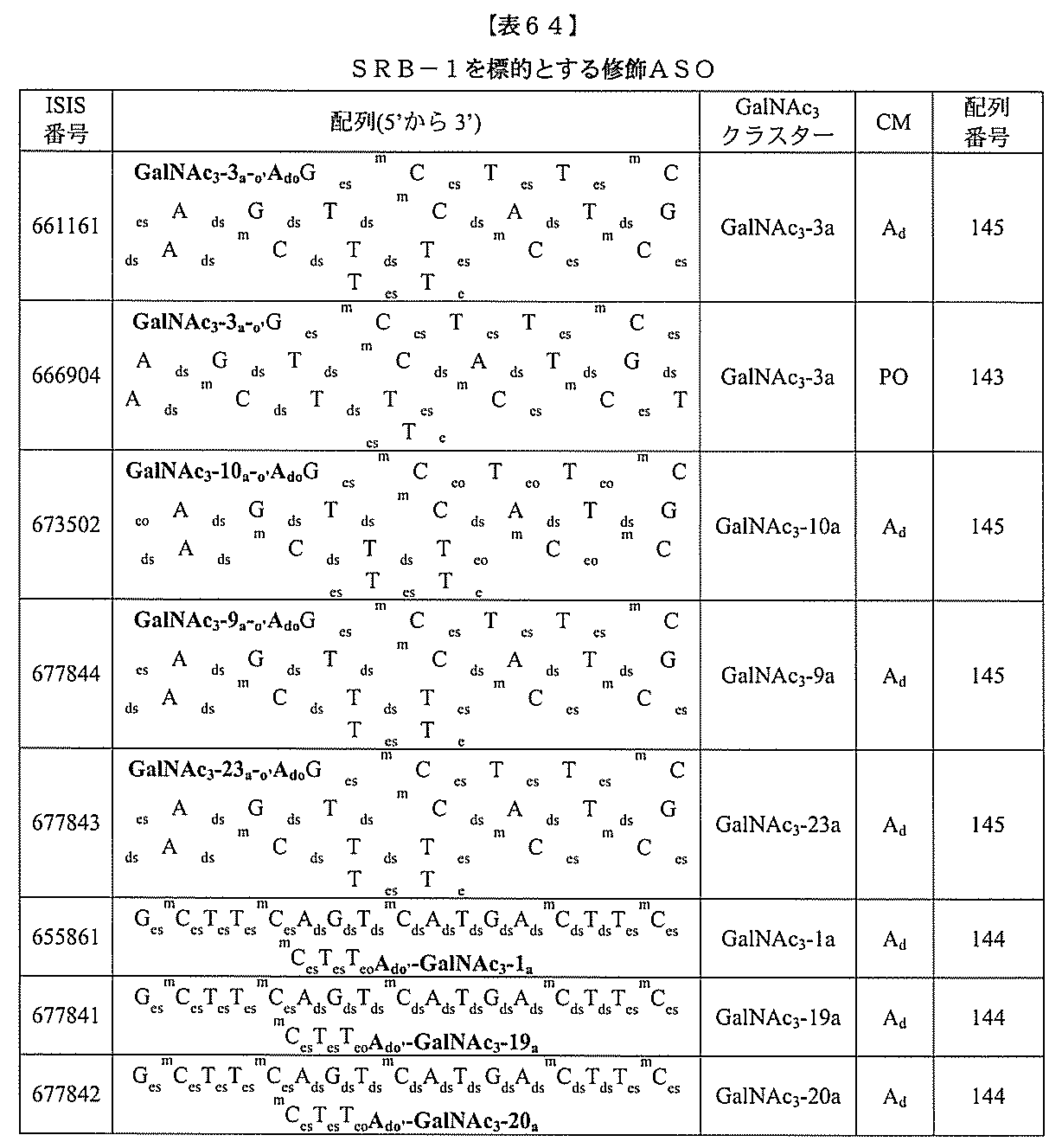
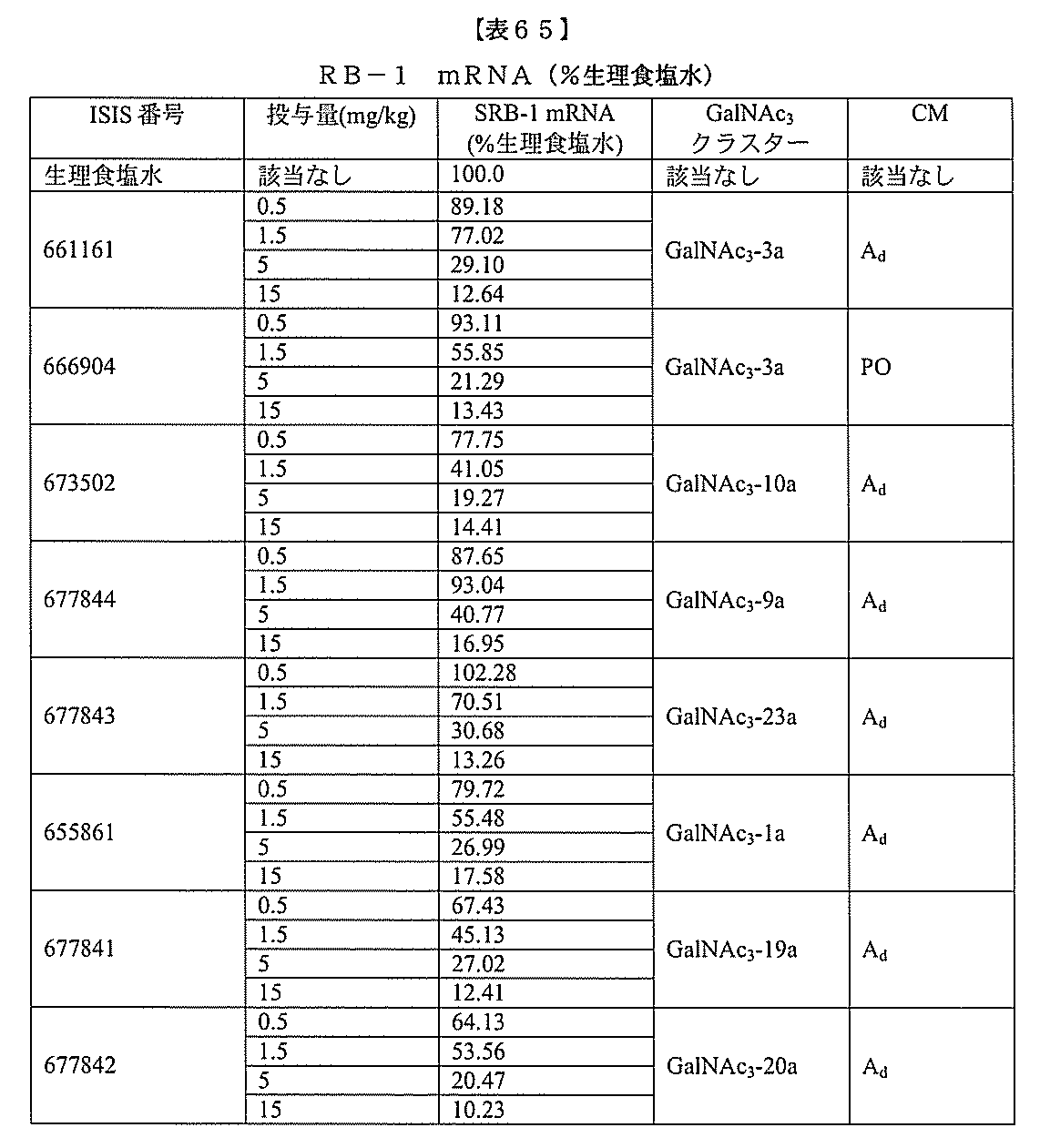
【解決手段】修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオチドが、12~30個の連結したヌクレオシドからなり、かつ特定の塩基配列の特定の核酸塩基の等長部分に相補的な少なくとも8個の連続した核酸塩基の一部を含む核酸塩基配列を含み、前記修飾オリゴヌクレオチドの前記核酸塩基配列が、前記特定の塩基配列に少なくとも80%相補的である、化合物を提供する。
【選択図】なし
Description
本出願は、配列表とともに電子形式で出願されている。この配列表は、2014年5月
1日に作成された432KbのサイズのBIOL0250WOSEQ_ST25.txt
という名前のファイルとして提供される。この配列表の電子形式の情報は、参照によりそ
の全体が本明細書に組み込まれる。
ズし、標的核酸の量、活性、および/または機能を調節することである。例えば、ある特
定の事例において、アンチセンス化合物は、標的の転写または翻訳の変化をもたらす。発
現のそのような調節は、例えば、標的mRNA分解または占有に基づく阻害によって達成
され得る。分解によるRNA標的機能の調節の一例には、DNA様アンチセンス化合物と
のハイブリダイゼーション時の標的RNAのRNase Hに基づく分解がある。標的分
解による遺伝子発現の調節のもう1つの例には、RNA干渉(RNAi)がある。RNA
iは、RNA誘導サイレンシング複合体(RISC)を利用する機構を介したアンチセン
ス媒介性遺伝子サイレンシングを指す。RNA標的機能の調節のさらなる例は、マイクロ
RNAによって自然に用いられる機構等の占有に基づく機構によるものである。マイクロ
RNAは、タンパク質コードRNAの発現を調整する小非コードRNAである。マイクロ
RNAへのアンチセンス化合物の結合は、そのマイクロRNAのそのメッセンジャーRN
A標的への結合を防ぎ、それ故にマイクロRNAの機能を妨げる。マイクロRNA模倣物
は、生来のマイクロRNA機能を高めることができる。ある特定のアンチセンス化合物は
、プレmRNAのスプライシングを変化させる。特異的機構にかかわらず、配列特異性は
、標的の検証および遺伝子の機能化の手段、ならびに疾患の発病に関与する遺伝子の発現
を選択的に調節する治療薬としてアンチセンス化合物を魅力的なものにする。
段であり、それ故に、多くの治療的用途、診断的用途、および研究用途に一意的に有用で
あることが判明し得る。化学修飾ヌクレオシドは、アンチセンス化合物に組み込まれ、標
的核酸のヌクレアーゼ耐性、薬物動態、または親和性等の1つ以上の特性を強化すること
ができる。1998年、アンチセンス化合物であるVitravene(登録商標)(ホ
ミビルセン、Isis Pharmaceuticals Inc.(Carlsbad
,CA)によって開発されたもの)が、アメリカ食品医薬品局(FDA)の販売許可を得
た最初のアンチセンス薬物であり、現在、AIDS患者におけるサイトメガロウイルス(
CMV)誘導性網膜炎の治療薬である。
の可能性を見出し、皮下投与を強化し、副作用の可能性を減少させ、患者の利便性の向上
につながっている。アンチセンス化合物の強度を増加させる化学修飾は、低用量の投与を
可能にし、毒性の可能性を減少させ、全体の治療費を削減する。分解に対する耐性を増加
させる修飾は、体内からのより緩徐な排除をもたらし、投薬頻度の低下を可能にする。異
なる種類の化学修飾を1個の化合物内で組み合わせて、化合物の有効性をさらに最適化す
ることができる。
ングで包囲されたアシルグリセロールおよびコレステリルエステルの非極性コアからなる
球状でミセル様の粒子である。リポタンパク質は、それらの機能的および物理的特性に基
づいて、5つの広範なカテゴリー:カイロミクロン、超低密度リポタンパク質(VLDL
)、中間密度リポタンパク質(IDL)、低密度リポタンパク質(LDL)、および高密
度リポタンパク質(HDL)に分類されている。カイロミクロンは、食物脂質を腸から組
織に輸送する。VLDL、IDL、およびLDLはすべて、トリアシルグリセロールおよ
びコレステロールを肝臓から組織に輸送する。HDLは、内因性コレステロールを組織か
ら肝臓に輸送する。
タンパク質密度は、それらの外側コーティングの密度が内核の密度未満であるため、粒径
を増加させることなく増加する。リポタンパク質のタンパク質成分は、アポリポタンパク
質として知られている。少なくとも9個のアポリポタンパク質が様々なヒトリポタンパク
質間で有意な量で分布している。
特のLDL粒子からなり、その中で、1個のアポリポタンパク質B(apoB)タンパク
質がジスルフィド結合を介して単一アポリポタンパク質(a)[apo(a)]タンパク
質に連結される。このapo(a)タンパク質は、特にクリングルIV2型反復ドメイン
内のプラスミノーゲンと高度の相同性を共有する。循環Lp(a)のレベルは、分子中に
存在するクリングルIV2型可変反復配列の数に反比例し、両対立遺伝子が個体内で共発
現するため、ヘテロ接合性血漿アイソフォームプロファイルを提示することができる(K
raft et al.,Eur J Hum Genet,1996;4(2):74
-87)。apo(a)におけるこのクリングル反復ドメインが、その血栓形成促進特性
および抗線維素溶解特性に関与し得、かつアテローム性動脈硬化進行を高める可能性があ
ると考えられる。
治療されたリウマチ性関節炎患者における研究において、血漿レベルは、3ヶ月治療した
後に30%減少した(Schultz et al.,PLoS One 2010;5
:e14328)。
れている(Bergmark et al.,J Lipid Res 2008;49
:2230-2239、Tsimikas et al.,Circulation.2
009;119(13):1711-1719)。
子阻害剤1型発現を誘導し、かつマクロファージインターロイキン-8分泌を活性化し得
ることを示唆する(Koschinsky and Marcovina,Curr O
pin Lipidol 2004;15:167-174)。重要なことに、近年の遺
伝子関連研究は、Lp(a)が、心筋梗塞、発作、末梢血管疾患、および腹部大動脈瘤の
独立危険因子であることを明らかにした(Rifai et al.,Clin Che
m 2004;50:1364-71、Erqou et al.,JAMA 2009
;302:412-23、Kamstrup et al.,Circulation
2008;117:176-84)。さらに、近年の早発性冠動脈疾患(PROCARD
IS)研究において、Clarke et al.(Clarke et al.,NE
JM(2009)361;2518-2528)は、冠状動脈性心臓病および血漿Lp(
a)濃度との間の強く独立した関連性を説明している。さらに、Solfrizzi e
t al.は、血清Lp(a)の増加がアルツハイマー病(AD)の危険性の増加に関係
し得ることを示唆した(Solfrizzi et al.,J Neurol Neu
rosurg Psychiatry 2002,72:732-736)。現在、診療
所状況において、心臓血管疾患を治療するための間接的なapo(a)阻害剤の例には、
血漿Lp(a)レベルを、それぞれ、18%、39%、32%、36%、43%、および
17%低下させる、アスピリン、ナイアシン、ミポメルセン、アナセトラピブ、エプロチ
ローム、およびロミタピドが挙げられる。さらに、Lp(a)アフェレーシスは、Lp(
a)粒子を含有するapo(a)を減少させるために診療所において用いられている。
治療的戦略は、制限されている。リボザイムオリゴヌクレオチド(米国特許第5,877
,022)およびアンチセンスオリゴヌクレオチド(国際公開第WO2005/0002
01号、国際公開第WO2003/014397号、国際公開第WO2013/1774
68号、米国特許第20040242516号、米国特許第8,138,328号、同第
8,673,632号、および同第7,259,150号、Merki et al.,
J Am Coll Cardiol 2011;57:1611-1621(各出版物
が参照によりその全体が組み込まれる))が開発されているが、いずれも商業的使用が認
められていない。
険性の高い患者におけるapo(a)レベルを強力かつ選択的に減少させることのできる
新規の薬剤の明らかな満たされていない医学的必要性が未だ存在する。
明細書に提供される。ある特定の実施形態において、apo(a)特異的阻害剤は、ap
o(a)mRNAおよびタンパク質の発現を減少させる。Lp(a)レベルの発現を調節
するための組成物および方法が本明細書に提供される。
の実施形態において、apo(a)特異的阻害剤は、核酸、タンパク質、または小分子で
ある。ある特定の実施形態において、apo(a)特異的阻害剤は、共役体を有するap
o(a)を標的とするアンチセンスオリゴヌクレオチドである。ある特定の実施形態にお
いて、apo(a)特異的阻害剤は、修飾オリゴヌクレオチドおよび共役体であり、修飾
オリゴヌクレオチドは、12~30個の連結したヌクレオシドからなり、かつ配列番号1
の核酸塩基3901~3920の等長部分に相補的な少なくとも8個の連続した核酸塩基
の一部を含む核酸塩基配列を含み、修飾オリゴヌクレオチドの核酸塩基配列は、配列番号
1に少なくとも80%相補的である。ある特定の実施形態において、apo(a)特異的
阻害剤は、修飾オリゴヌクレオチドおよび共役体であり、修飾オリゴヌクレオチドは、1
2~30個の連結したヌクレオシドからなり、かつ配列番号1~130、133、134
の核酸塩基配列の少なくとも8、最小9、最小10、最小11、少なくとも12、最小1
3、少なくとも14、少なくとも15、少なくとも16、最小17、最小18、最小19
、または20個の連続した核酸塩基を含む核酸塩基配列を有する。ある特定の実施形態に
おいて、apo(a)特異的阻害剤は、修飾オリゴヌクレオチドおよび共役体であり、修
飾オリゴヌクレオチドは、20個の連結したヌクレオシドからなり、かつ配列番号58の
うちのいずれかの少なくとも8個の連続した核酸塩基を含む核酸塩基配列を有し、修飾オ
リゴヌクレオチドは、(a)10個の連結したデオキシヌクレオシドからなるギャップセ
グメント、(b)5個の連結したヌクレオシドからなる5’ウィングセグメント、(c)
5個の連結したヌクレオシドからなる3’ウィングセグメントを含み、ギャップセグメン
トは、5’ウィングセグメントと3’ウィングセグメントとの間に位置付けられ、各ウィ
ングセグメントの各ヌクレオシドは、2’-O-メトキシエチル糖を含み、少なくとも1
個のヌクレオシド間結合は、ホスホロチオエート結合であり、各シトシン残基は、5-メ
チルシトシンである。
び薬剤的に許容される担体または希釈剤を含む組成物を提供する。
。ある特定の実施形態において、調節は、動物における細胞または組織内で生じる。ある
特定の実施形態において、動物は、ヒトである。ある特定の実施形態において、調節は、
apo(a)mRNAレベルの低下である。ある特定の実施形態において、調節は、ap
o(a)タンパク質レベルの低下である。ある特定の実施形態において、apo(a)m
RNAレベルとapo(a)タンパク質レベルのいずれも低下する。ある特定の実施形態
において、調節は、Lp(a)レベルの低下である。そのような低下は、時間依存的また
は用量依存的様式で生じ得る。
を提供する。ある特定の実施形態は、apo(a)関連疾患、障害、および状態を予防し
、治療し、遅延させ、その進行を遅らせ、かつ/または改善するための組成物および方法
を提供する。ある特定の実施形態は、Lp(a)関連疾患、障害、および状態を予防し、
治療し、遅延させ、その進行を遅らせ、かつ/または改善するための組成物および方法を
提供する。ある特定の実施形態において、そのような疾患、障害、および状態は、炎症性
、心臓血管、および/または代謝性疾患、障害、および状態である。ある特定の実施形態
において、治療用の組成物および方法は、apo(a)特異的阻害剤をそれを必要とする
個体に投与することを含む。ある特定の実施形態において、apo(a)特異的阻害剤は
、核酸である。ある特定の実施形態において、核酸は、アンチセンス化合物である。ある
特定の実施形態において、アンチセンス化合物は、修飾オリゴヌクレオチドである。ある
特定の実施形態において、アンチセンス化合物は、共役体を有する修飾オリゴヌクレオチ
ドである。
定の実施形態において、本開示は、核酸転写物に相補的なアンチセンスオリゴヌクレオチ
ドを含む共役アンチセンス化合物を提供する。ある特定の実施形態において、本開示は、
細胞を核酸転写物に相補的なアンチセンスオリゴヌクレオチドを含む共役アンチセンス化
合物と接触させることを含む方法を提供する。ある特定の実施形態において、本開示は、
細胞をアンチセンスオリゴヌクレオチドを含む共役アンチセンス化合物と接触させること
と、細胞内の核酸転写物の量または活性を低減させることと、を含む方法を提供する。
rk et al.,PNAS vol.102,No.47,pp17125-171
29(2005)を参照されたい。そのような受容体は、肝臓細胞、具体的には、肝細胞
上で発現する。さらに、3個のN-アセチルガラクトサミン(GalNAc)リガンドの
クラスターを含む化合物はASGP-Rに結合することができ、細胞内への化合物の取り
込みをもたらすことが示されている。例えば、Khorev et al.,Bioor
ganicおよびMedicinal Chemistry,16,9,pp5216-
5231(May 2008)を参照されたい。したがって、そのようなGalNAcク
ラスターを含む共役体を用いて、肝臓細胞、具体的には、肝細胞へのある特定の化合物の
取り込みを促進している。例えば、ある特定のGalNAc含有共役体が生体内で肝臓細
胞における二本鎖siRNA化合物の活性を増加させることが示されている。そのような
事例において、GalNAc含有共役体は、典型的には、siRNA二本鎖のセンス鎖に
結合される。アンチセンス鎖が最終的に標的核酸とハイブリダイズする前にセンス鎖が処
分されるため、共役体が活性を妨げるといった懸念はほとんどない。典型的には、共役体
は、siRNAのセンス鎖の3’末端に結合される。例えば、米国特許第8,106,0
22号を参照されたい。本明細書に記載のある特定の共役基は、以前に説明された共役基
よりも活性であり、かつ/または合成し易い。
ングを変化させるRNase Hベースのアンチセンス化合物およびアンチセンス化合物
を含むが、これらに限定されない一本鎖アンチセンス化合物に結合される。そのような実
施形態において、共役体は、利益(細胞内への取り込みの改善)を提供するのに十分な期
間、アンチセンス化合物に結合したままであるべきであるが、切断されるか、またはさも
なければスプライシングまたはスプライシング調節に関連した標的核酸へのハイブリダイ
ゼーションおよびRNase Hまたは酵素との相互作用等の活性に必要なその後のステ
ップを妨げないか、のいずれかであるべきである。このような特性のバランスは、siR
NA化合物よりも一本鎖アンチセンス化合物状況下においてより重要であり、共役体は、
単にセンス鎖に結合され得る。共役体を欠く同一のアンチセンス化合物と比較して、生体
内で肝臓細胞における強度の改善を有する共役体一本鎖アンチセンス化合物が本明細書に
開示される。これらの化合物の要求される特性バランスを考慮すると、そのような強度の
改善は、驚くべきことである。
述のように、機構によって束縛されることを望むことなく、共役体が、取り込みの強化を
提供するのに十分長い期間、化合物に残存したままであるべきだが、その後、共役体の一
部、または理想的には、共役体のすべてが切断されて、親化合物(例えば、アンチセンス
化合物)をその最も活性な形態で放出することが望ましいことは論理的である。ある特定
の実施形態において、切断可能な部分は、切断可能なヌクレオシドである。そのような実
施形態は、ホスホジエステル結合等の1個以上の切断可能な結合によってヌクレオシドを
介して共役体の残り(クラスター)をアンチセンスオリゴヌクレオチドに結合させること
によって、細胞内の内因性ヌクレアーゼをうまく利用する。ある特定の実施形態において
、クラスターは、ホスホジエステル結合によって切断可能なヌクレオシドに結合される。
ある特定の実施形態において、切断可能なヌクレオシドは、ホスホジエステル結合によっ
てアンチセンスオリゴヌクレオチド(アンチセンス化合物)に結合される。ある特定の実
施形態において、共役基は、2個または3個の切断可能なヌクレオシドを含み得る。その
ような実施形態において、そのような切断可能なヌクレオシドは、切断可能な結合(ホス
ホジエステル結合等)によって、互いに、アンチセンス化合物に、かつ/またはクラスタ
ーに連結される。本明細書におけるある特定の共役体は、切断可能なヌクレオシドを含ま
ず、代わりに切断可能な結合を含む。オリゴヌクレオチドからの共役体の十分な切断が、
細胞における切断に対して脆弱な少なくとも1個の結合(切断可能な結合)によって提供
されることが示される。
ようなプロドラッグは、動物に投与され、最終的により活性な形態に代謝される。例えば
、共役アンチセンス化合物は、切断されて、共役体のすべてまたは一部を除去し、共役体
のすべてまたは一部を欠くアンチセンス化合物の活性(またはより活性な)形態をもたら
す。
。ある特定のそのような5’共役体は、3’末端に結合される同様の共役基を有する対応
物よりも効率的に切断される。ある特定の実施形態において、活性の改善は、切断の改善
と相関し得る。ある特定の実施形態において、5’末端に共役体を含むオリゴヌクレオチ
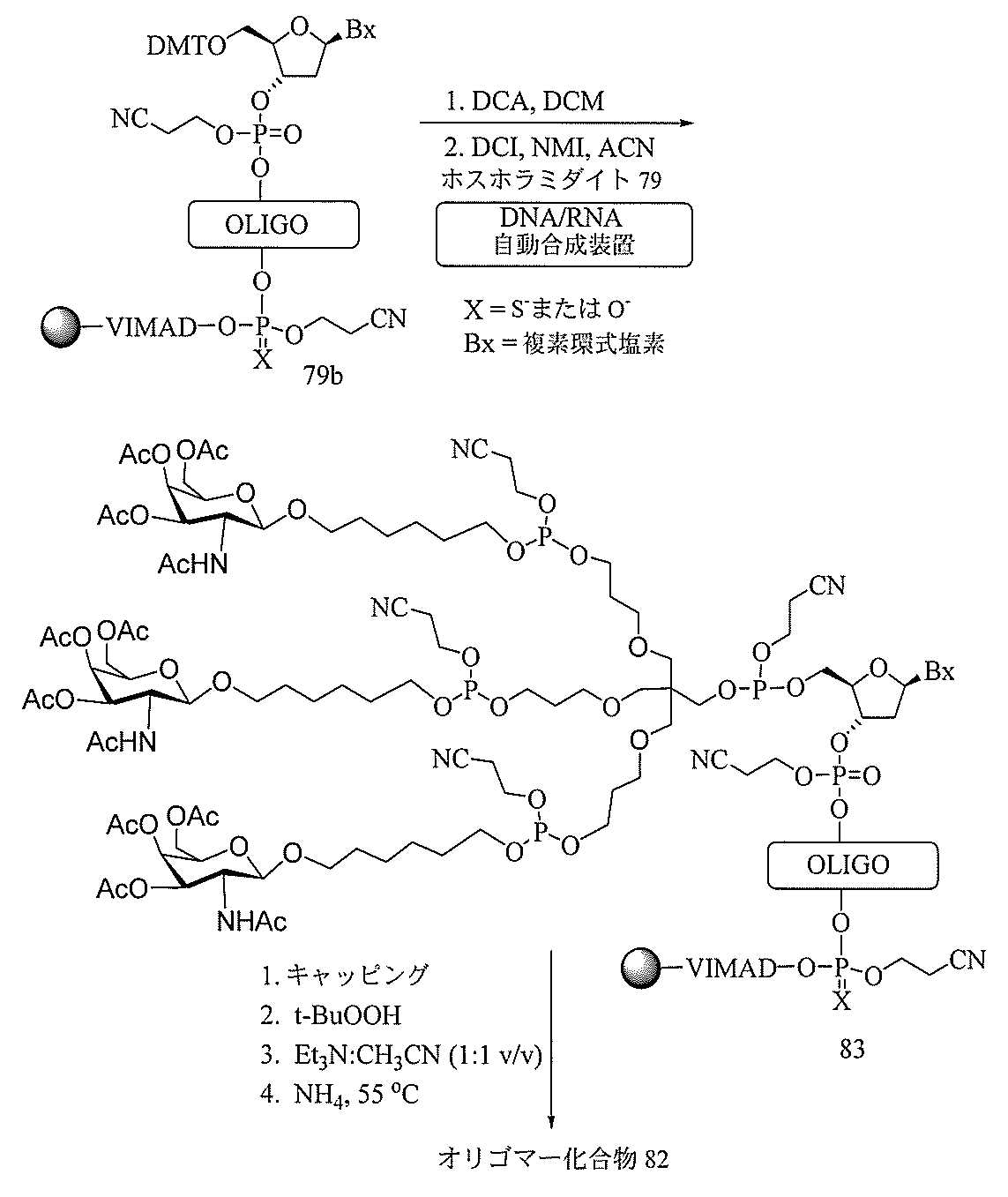
ドの有効性は、3’末端に共役体を含むオリゴヌクレオチドよりも高い(例えば、実施例
56、81、83、および84を参照のこと)。さらに、5’結合は、より単純なオリゴ
ヌクレオチド合成を可能にする。典型的には、オリゴヌクレオチドは、3’から5’の方
向に固体支持体上で合成される。3’共役オリゴヌクレオチドを作製するために、典型的
には、プレ共役3’ヌクレオシドを固体支持体に結合させ、その後、オリゴヌクレオチド
を通常通りに構築する。しかしながら、その共役ヌクレオシドを固体支持体に結合させる
ことは、合成を複雑にする。さらに、この手段を用いることにより、共役体は、次いでオ
リゴヌクレオチドの合成を通じて存在し、その後のステップ中で分解された状態になり得
るか、または使用され得る反応物および試薬の種類を限定し得る。本明細書に記載の5’
共役オリゴヌクレオチドの構造および技術を用いることにより、標準の自動化技術を用い
てオリゴヌクレオチドを合成して、最終(最も5’側の)ヌクレオシドとの共役体を導入
することができるか、またはオリゴヌクレオチドが固体支持体から切断された後にオリゴ
ヌクレオチドを合成することができる。
リゴヌクレオチドのうちのいずれかを容易に作製することができる。さらに、本明細書に
開示されるある特定のそのような共役体および共役オリゴヌクレオチドの合成は、以前に
開示された共役体の合成よりも容易であり、かつ/またはわずかなステップしか必要とせ
ず、それ故に安価であり、製造において利点を提供する。例えば、ある特定の共役基の合
成は、以前に説明された共役基と比較して、より少ない合成ステップからなり、収率の増
加をもたらす。実施例46のGalNAc3-10および実施例48のGalNAc3-
7等の共役基は、より多くの化学中間体の構築を必要とする米国特許第8,106,02
2号または米国特許第7,262,177号に記載される共役体等の以前に説明された共
役体よりもはるかに単純である。したがって、本明細書に記載のこれらおよび他の共役体
は、一本鎖オリゴヌクレオチドおよび二本鎖オリゴヌクレオチド(例えば、siRNA)
のいずれかの鎖を含む任意のオリゴヌクレオチドと併せて用いる際に、以前に説明された
化合物よりも有利である。
される。示されるように、そのような共役基は、アンチセンス化合物の活性を改善する。
そのような化合物は、3個のGalNAcリガンドを含む共役体よりも調製が簡単である
。1つまたは2個のGalNAcリガンドを含む共役基は、一本鎖オリゴヌクレオチドお
よび二本鎖オリゴヌクレオチド(例えば、siRNA)のいずれかの鎖を含む任意のアン
チセンス化合物に結合され得る。
に変化させない。例えば、共役アンチセンス化合物の免疫原性が非共役親化合物の免疫原
性よりも低いことが本明細書に示される。強度が改善されるため、耐容性が同一のままで
ある(または強度の増加と比較して耐容性がほんのわずか低下した場合でさえも同一のま
まである)実施形態は、改善された治療特性を有する。
果を有する方法でアンチセンス化合物を変化させることを可能にする。例えば、ある特定
の実施形態において、完全なホスホロチオエートアンチセンス化合物の1個以上のホスホ
ロチオエート結合をホスホジエステル結合に置換することで、ある程度の耐容性の改善を
もたらす。例えば、ある特定の事例において、1個以上のホスホジエステルを有するその
ようなアンチセンス化合物の免疫原性は、各結合がホスホロチオエート結合である同一の
化合物の免疫原性よりも低い。しかしながら、ある特定の事例において、実施例26に示
されるように、1個以上のホスホロチオエート結合のホスホジエステル結合への同様な置
換は、細胞取り込みの低下および/または強度の損失ももたらす。ある特定の実施形態に
おいて、本明細書に記載の共役アンチセンス化合物は、完全なホスホロチオエート共役対
応物と比較して、取り込みおよび強度をほとんどまたはまったく失うことなくそのような
結合の変化に耐える。実際、ある特定の実施形態において、例えば、実施例44、57、
59、および86において、共役体および少なくとも1個のホスホジエステルヌクレオシ
ド間結合を含むオリゴヌクレオチドは、同様に同一の共役体を含む完全なホスホロチオエ
ート対応物と比較した場合でも、生体内における強度の増加を実際に示す。さらに、共役
が取り込み/強度の実質的な増加をもたらすため、その実質的な増加のわずかな損失は、
耐容性の改善を達成するには許容範囲内であり得る。したがって、ある特定の実施形態に
おいて、共役アンチセンス化合物は、少なくとも1個のホスホジエステル結合を含む。
における送達、取り込み、および活性の増大をもたらす。したがって、より多くの化合物
が肝臓組織に送達される。しかしながら、ある特定の実施形態において、そのような送達
の増大だけでは、全体の活性増大を明白にしない。ある特定のそのような実施形態におい
て、より多くの化合物が肝細胞に入る。ある特定の実施形態において、そのような肝細胞
取り込みの増大でさえも、全体の活性増大を明白にしない。そのような実施形態において
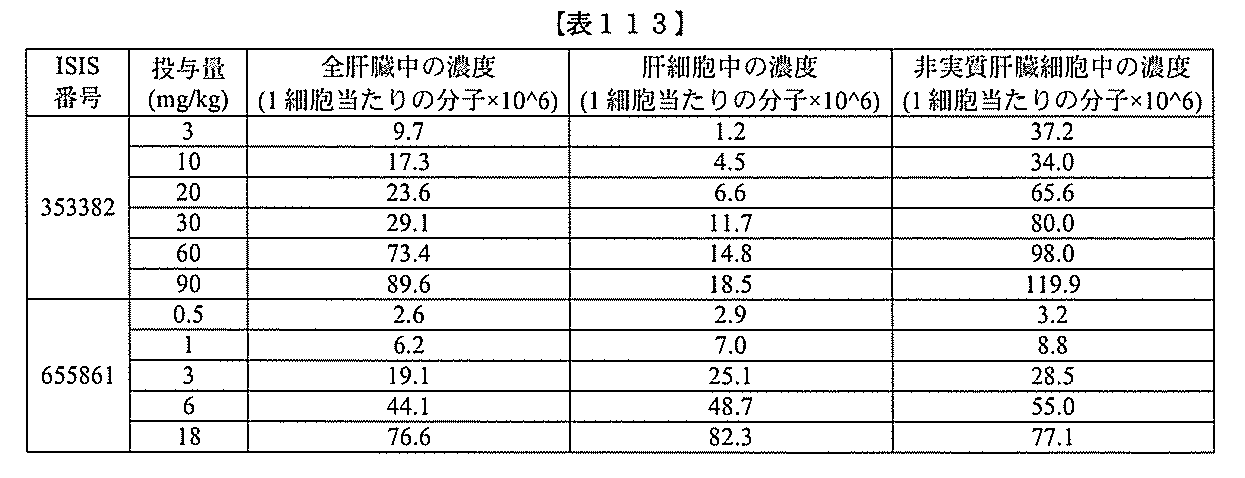
、共役化合物の生産的な取り込みが増大する。例えば、実施例102に示されるように、
GalNAc含有共役体のある特定の実施形態は、非実質細胞と比較して、肝細胞におけ
るアンチセンスオリゴヌクレオチドの濃縮を増大させる。この濃縮は、肝細胞において発
現される遺伝子を標的とするオリゴヌクレオチドに有益である。
の低下をもたらす。例えば、実施例20に示されるように、GalNAc含有共役体のあ
る特定の実施形態を含むアンチセンスオリゴヌクレオチドの濃度は、腎臓において、Ga
lNAc含有共役体を欠くアンチセンスオリゴヌクレオチドの濃度よりも低い。これは、
いくつかの有益な治療的意味を有する。腎臓における活性が要求されない治療的指標にお
いて、腎臓への曝露は、腎毒性の危険性を有し、それに見合う利益がない。さらに、腎臓
における高濃度は、典型的には、尿への化合物の損失をもたらし、より迅速なクリアラン
スをもたらす。したがって、非腎臓標的の場合、腎臓内での蓄積は望ましくない。
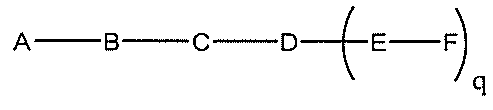
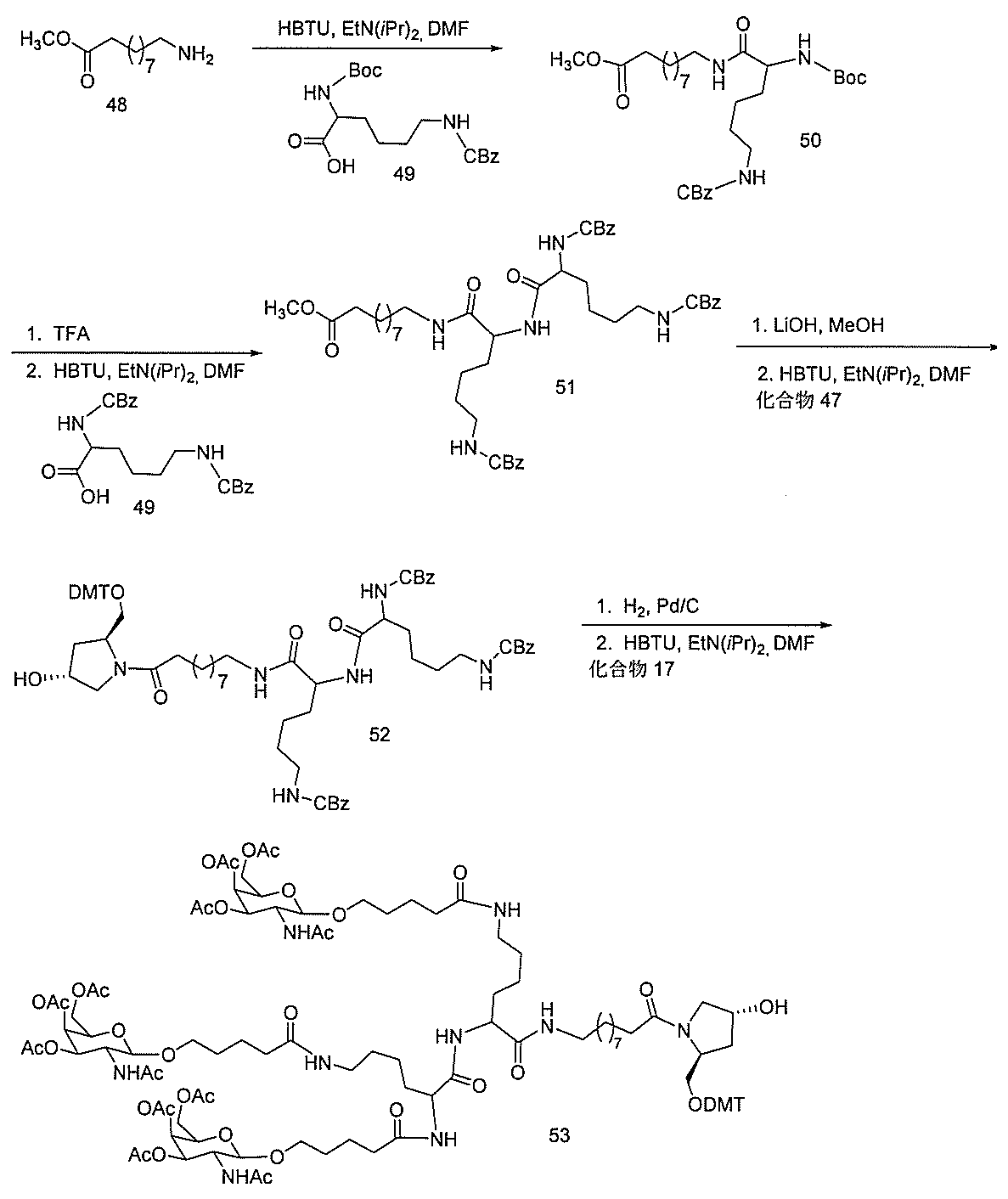
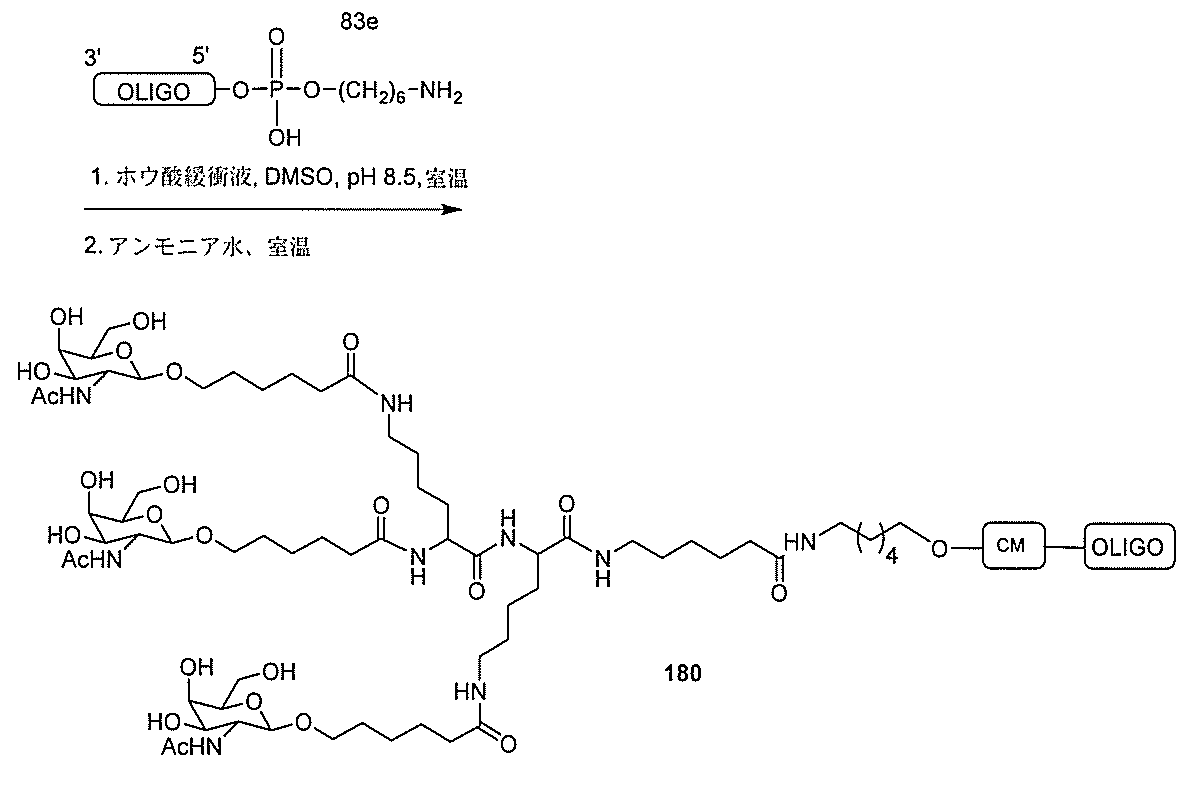
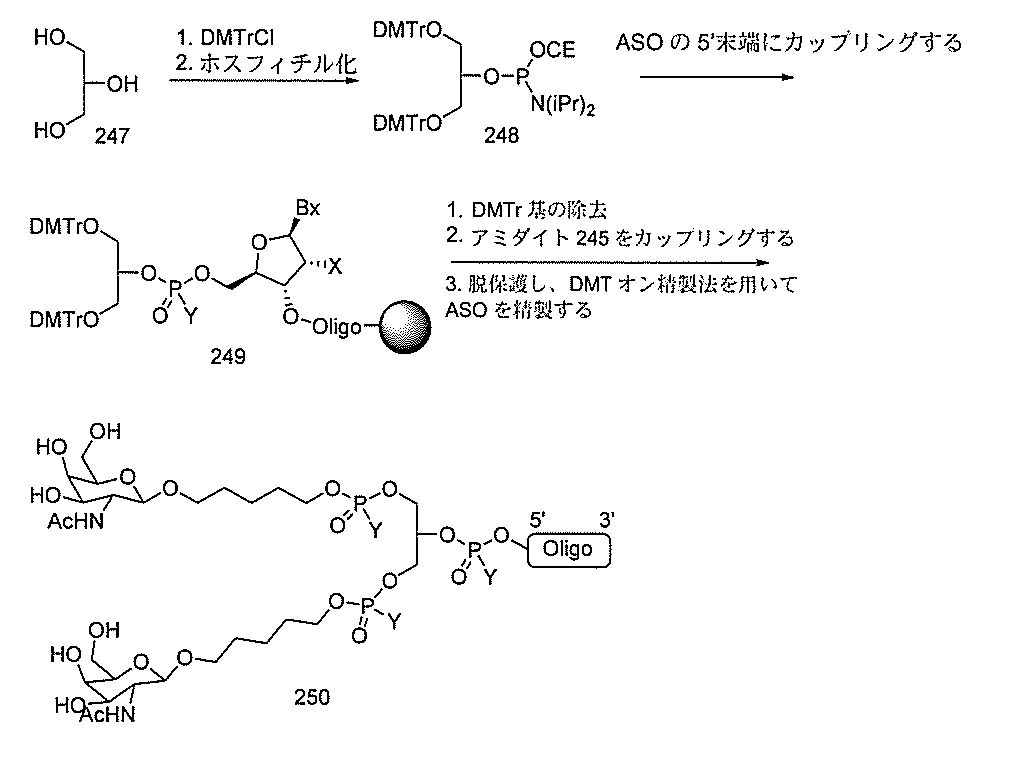
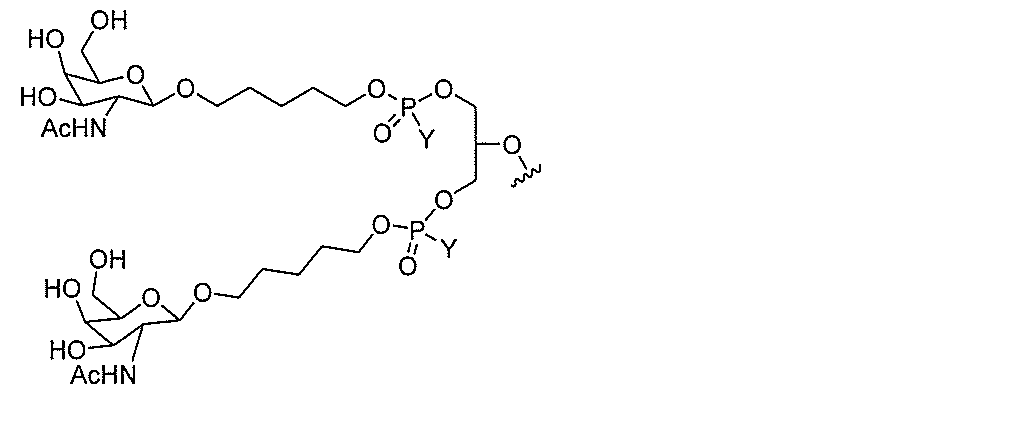
化合物を提供し、
Aは、アンチセンスオリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Cは、共役リンカーであり、
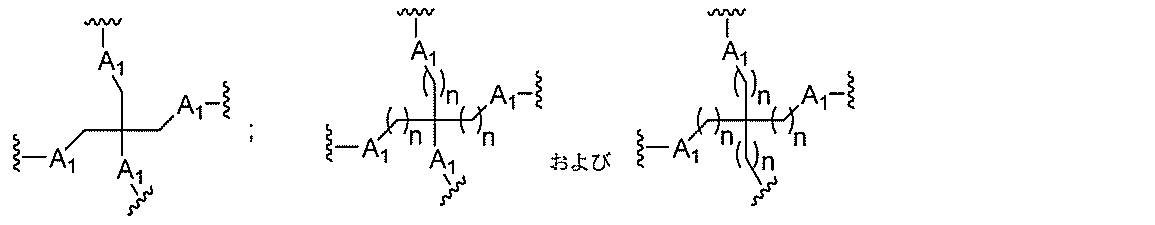
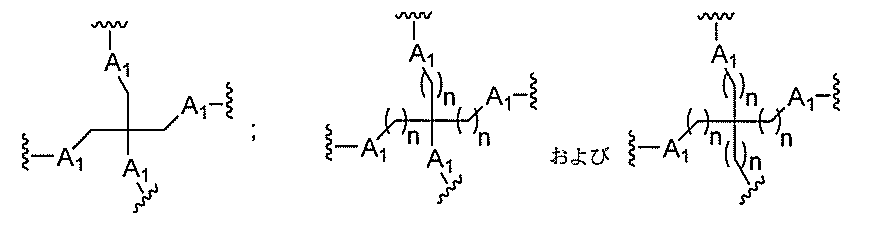
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
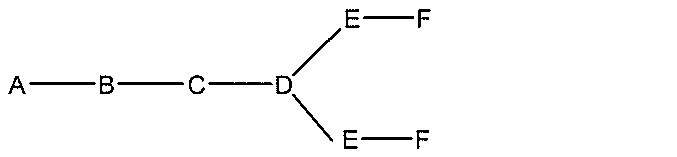
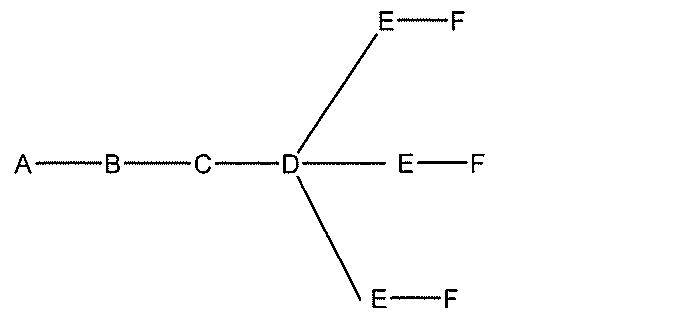
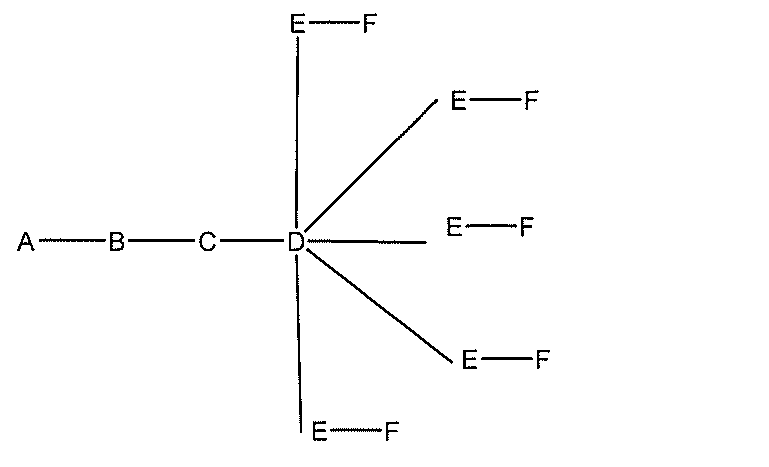
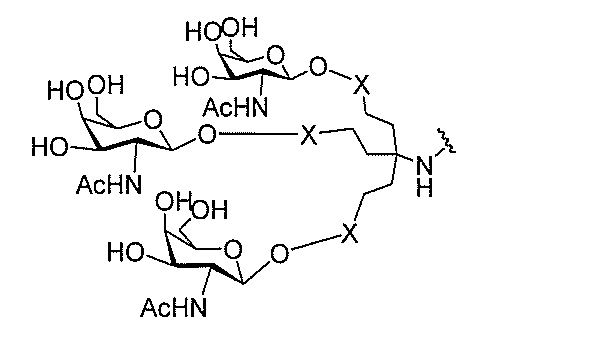
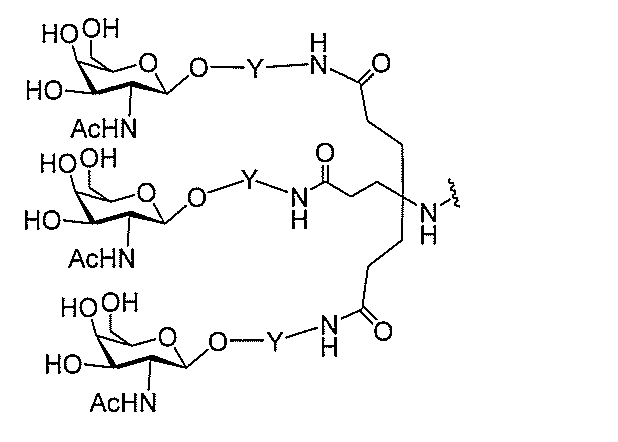
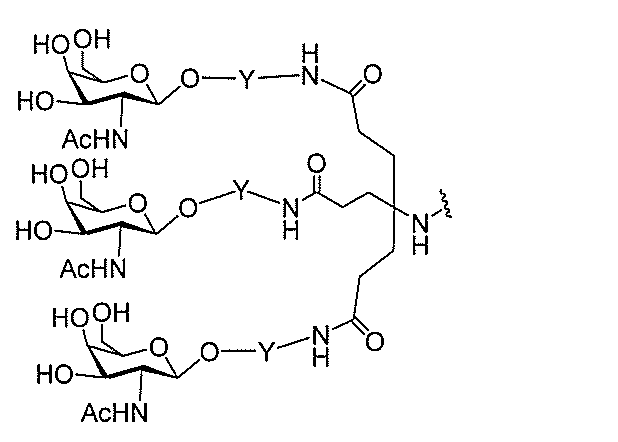
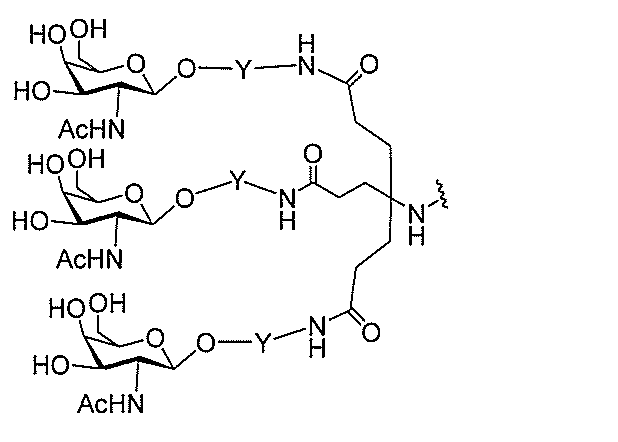
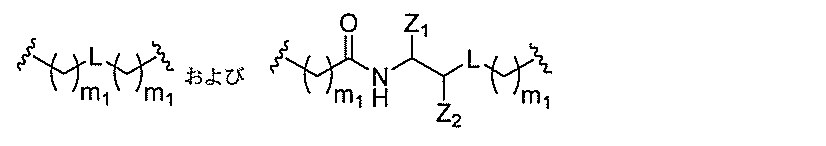
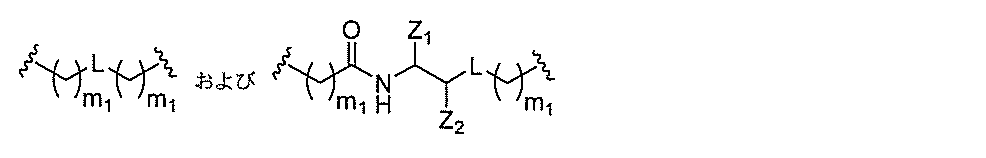
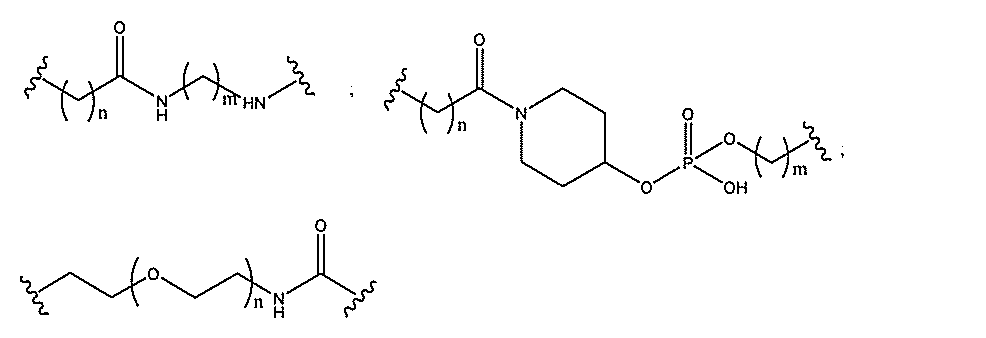
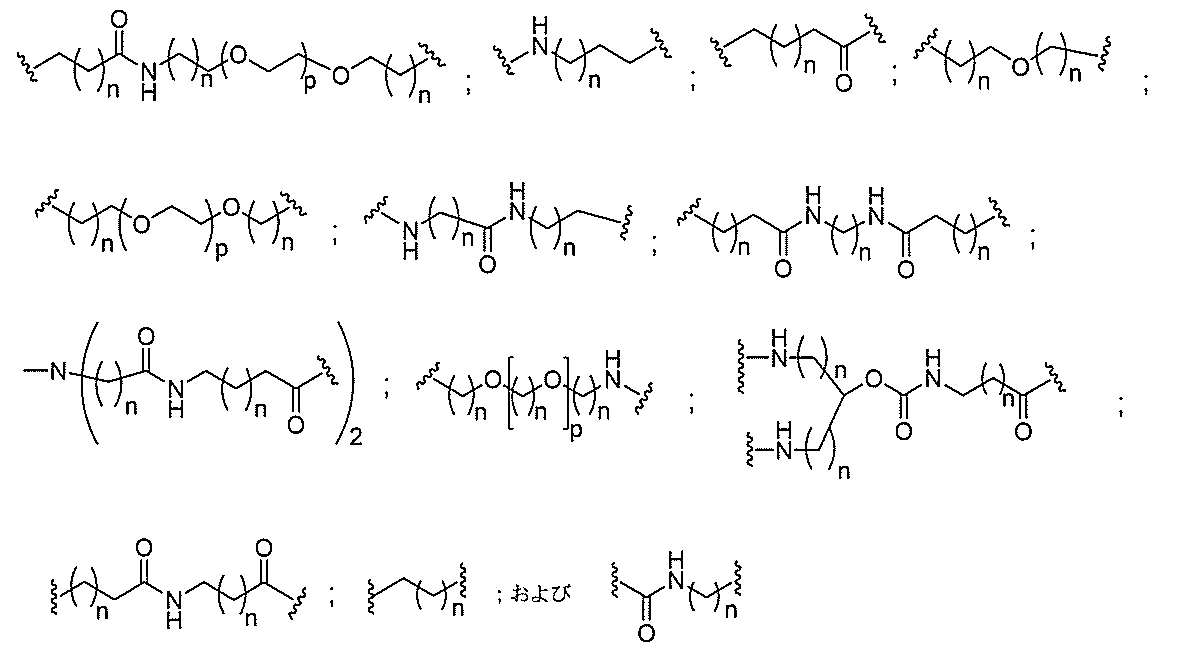
qは、1~5の整数である。
る(E~F)基の数を収容するのに必要なだけ分岐を繰り返す。したがって、q=1の場
合、式は、以下のものであり、
形態において、別途示されない限り、各々のそのような特定の変数は、独立して選択され
る。したがって、2つ以上のnを有する構造の場合、各nは、独立して選択さるため、互
いに同一であり得るか、同一であり得ない。
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、5’-Xを
有する修飾オリゴヌクレオチドISIS 494372を含み、式中、Xは、GalNA
cを含む共役基である。ある特定の実施形態において、アンチセンス化合物は、5’-X
を有する修飾オリゴヌクレオチドISIS 494372からなり、式中、Xは、Gal
NAcを含む共役基である。
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、共役修飾オ
リゴヌクレオチドISIS 681251を含む。ある特定の実施形態において、アンチ
センス化合物は、共役修飾オリゴヌクレオチドISIS 681251からなる。
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、共役体修飾
オリゴヌクレオチドISIS 681257を含む。ある特定の実施形態において、アン
チセンス化合物は、共役修飾オリゴヌクレオチドISIS 681257からなる。
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、ウィングの
糖修飾が変化する5’-GalNAcを有する配列番号58を有する修飾オリゴヌクレオ
チドを含む。ある特定の実施形態において、アンチセンス化合物は、ウィングの糖修飾が
変化する5’-GalNAcを有する配列番号58を有する修飾オリゴヌクレオチドから
なり、
たはR1およびR2が一緒になって橋を形成するかのいずれかであり、そこで、R1が、
-O-であり、R2が、-CH2-、-CH(CH3)-、または-CH2CH2-であ
り、結果として生じる橋が、-O-CH2-、-O-CH(CH3)-、および-O-C
H2CH2-から選択されるように、R1およびR2が直接連結され、
同一の環上、独立して、各環のR3とR4の各対について、R3が、Hおよび-OCH
2CH2OCH3から選択され、R4が、Hであるか、またはR3およびR4が一緒にな
って橋を形成するかのいずれかであり、そこで、R3が、-O-であり、R4が、-CH
2-、-CH(CH3)-、または-CH2CH2-であり、結果として生じる橋が、-
O-CH2-、-O-CH(CH3)-、および-O-CH2CH2-から選択されるよ
うに、R3およびR4が直接連結され、
R5が、Hおよび-CH3から選択され、
Zが、S-およびO-から選択される。
本開示は、以下の非限定的な番号付けされた実施形態を提供する。
って、本開示を限定するものではないことを理解されたい。本明細書において、単数形の
使用は、別途明確に記述されない限り、複数形を含む。本明細書で使用されるとき、「ま
たは(or)」の使用は、別途記述されない限り、「および/または(and/or)」
を意味する。さらに、「含む(including)」という用語、ならびに「含む(i
nclude)」および「含まれる(included)」等の他の形態の使用は、限定
的ではない。また、「要素」または「成分」等の用語は、別途明確に記述されない限り、
1つのユニットを含む複数の要素および複数の成分と2つ以上のサブユニットを含む複数
の要素および複数の成分の両方を包含する。
定するものと解釈されるべきではない。特許、特許出願、記事、書籍、および論文を含む
が、これらに限定されない本出願において引用されるすべての文書または文書の一部は、
参照によりそれらの全体があらゆる目的のために本明細書に明確に組み込まれる。
A.定義
医化学および製薬化学に関連して用いられる学名、ならびにそれらの手順および技法は、
周知であり、当技術分野で一般に使用されるものである。標準の技法は、化学合成および
化学分析において使用され得る。ある特定のそのような技法および手順は、例えば、“C
arbohydrate Modifications in Antisense R
esearch”Edited by Sangvi and Cook,Americ
an Chemical Society,Washington D.C.,1994
、“Remington’s Pharmaceutical Sciences,”M
ack Publishing Co.,Easton,Pa.,21st editi
on,2005、および“Antisense Drug Technology,Pr
inciples,Strategies,and Applications”Edi
ted by Stanley T.Crooke,CRC Press,Boca R
aton,Florida、ならびにSambrook et al.,“Molecu
lar Cloning、A laboratory Manual,”2nd Edi
tion,Cold Spring Harbor Laboratory Press
,1989において見出すことができ、これらは、あらゆる目的のために参照により本明
細書に組み込まれる。許容される場合、本開示を通して参照されるすべての特許、出願、
公開された出願、および他の出版物、ならびに他のデータは、参照によりそれらの全体が
本明細書に組み込まれる。
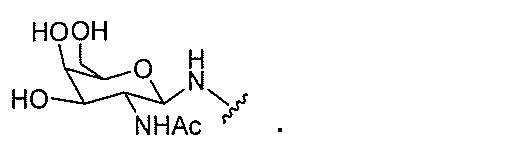
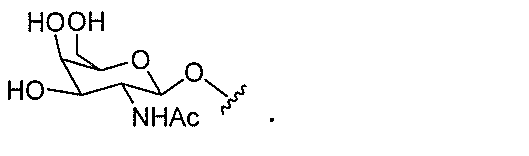
本明細書で使用されるとき、「ヌクレオシド」とは、核酸塩基部分および糖部分を含む
化合物を意味する。ヌクレオシドには、天然に存在するヌクレオシド(DNAおよびRN
Aに見られるもの)ならびに修飾ヌクレオシドが含まれるが、これらに限定されない。ヌ
クレオシドは、ホスフェート部分に連結され得る。
の化合物の化学的相違を意味する。オリゴヌクレオチド化学修飾は、ヌクレオシド修飾(
糖部分修飾および核酸塩基修飾を含む)ならびにヌクレオシド間結合修飾を含む。オリゴ
ヌクレオチドに関して、化学修飾は、核酸塩基配列においてのみ相違を含まない。
を含む5員環を含む構造を意味する。
見られるリボフラノシルまたは天然に存在するDNAに見られるデオキシリボフラノシル
を意味する。
たは修飾糖部分を意味する。
る。
ノシルを意味する。置換糖部分には、2’位、3’位、5’位、および/または4’位に
置換基を含むフラノシルが含まれるが、これらに限定されない。ある特定の置換糖部分は
、二環式糖部分である。
置換基を含むフラノシルを意味する。別途示されない限り、2’-置換糖部分は、二環式
糖部分ではない(すなわち、2’-置換糖部分の2’-置換基は、フラノシル環の別の原
子への橋を形成しない)。
含むヌクレオシドを指す。別途示されない限り、2’-Fヌクレオシドにおけるフッ素は
、(天然リボースのOHを置換する)リボ位に存在する。
ドサブユニットが一緒に結合し、かつ/または他のヌクレオシドに結合して、相補的なオ
リゴマー化合物にハイブリダイズすることができるオリゴマー化合物を形成することがで
きるように、フラノシルを含まず、かつヌクレオシドの天然に存在する糖部分を置換する
ことができる構造を意味する。そのような構造は、フラノシル(例えば、4、6、もしく
は7員環)とは異なる数の原子、フラノシルの酸素の非酸素原子(例えば、炭素、硫黄、
もしくは窒素)への置換、または原子の数の変化および酸素の置換の両方を含む環を含む
。そのような構造はまた、置換糖部分(例えば、さらなる置換基を任意に含む6員炭素環
式二環式糖代理物)について記載された置換に対応する置換も含み得る。糖代理物はまた
、より複雑な糖置換物(例えば、ペプチド核酸の非環系)も含む。糖代理物には、モルフ
ォリノ、シクロヘキセニル、およびシクロヘキシトールが含まれるが、これらに限定され
ない。
で第2の環を形成して、二環式構造をもたらす橋を含む4~7員環(フラノシルを含むが
、これに限定されない)を含む修飾糖部分を意味する。ある特定の実施形態において、4
~7員環は、糖環である。ある特定の実施形態において、4~7員環は、フラノシルであ
る。ある特定のそのような実施形態において、橋は、フラノシルの2’-炭素と4’-炭
素とをつなぐ。
核酸には、リボ核酸(RNA)、デオキシリボ核酸(DNA)、一本鎖核酸(ssDNA
)、二本鎖核酸(dsDNA)、低分子干渉リボ核酸(siRNA)、およびマイクロR
NA(miRNA)が含まれる。核酸は、単一分子中にこれらの要素の任意の組み合わせ
も含み得る。
ヌクレオシドを意味する。本明細書で使用されるとき、「連結したヌクレオシド」は、ホ
スフェート結合によって連結されてもされなくてもよく、それ故に、「連結したヌクレオ
チド」を含むが、これに限定されない。本明細書で使用されるとき、「連結したヌクレオ
シド」は、連続した配列において連結されるヌクレオシドである(すなわち、さらなるヌ
クレオシドは、連結される配列間に存在しない)。
ドに組み込むことができるヌクレオシドを作成することができる原子団を意味し、この原
子団は、別のオリゴヌクレオチドまたは核酸の相補的な天然に存在する核酸塩基と結合す
ることができる。核酸塩基は、天然に存在し得るか、または修飾され得る。本明細書で使
用されるとき、「核酸塩基配列」とは、任意の糖、結合、または核酸塩基修飾とは無関係
に連続した核酸塩基の順序を意味する。
いう用語は、RNAまたはDNAの天然に存在する複素環式核酸塩基を意味し、プリンは
、アデニン(A)およびグアニン(G)をベースとし、ピリミジンは、チミン(T)、シ
トシン(C)(5-メチルCを含む)、およびウラシル(U)をベースとする。
任意の核酸塩基を意味する。
DNAヌクレオシドと比較して、少なくとも1つの化学修飾を含むヌクレオシドを意味す
る。修飾ヌクレオシドは、修飾糖部分および/または修飾核酸塩基を含む。
部分を含むヌクレオシドを意味する。
-CH(CH3)-O-2’橋を含む二環式糖部分を含むヌクレオシドを意味する。
-CH2-O-2’橋を含む二環式糖部分を含むヌクレオシドを意味する。
’位に置換基を含むヌクレオシドを意味する。別途示されない限り、2’-置換ヌクレオ
シドは、二環式ヌクレオシドではない。
リボヌクレオシド(DNA)に見られる2’-Hフラノシル糖部分を含むヌクレオシドを
意味する。ある特定の実施形態において、2’-デオキシヌクレオシドは、修飾核酸塩基
を含み得るか、またはRNA核酸塩基(例えば、ウラシル)を含み得る。
シドを含む化合物を意味する。ある特定の実施形態において、オリゴヌクレオチドは、1
個以上の非修飾リボヌクレオシド(RNA)および/または非修飾デオキシリボヌクレオ
シド(DNA)および/または1個以上の修飾ヌクレオシドを含む。
のいずれもリン原子を含有しないオリゴヌクレオチドを意味する。本明細書で使用される
とき、オリゴヌクレオチドは、オリゴヌクレオシドを含む。
ヌクレオシドおよび/または少なくとも1個の修飾ヌクレオシド間結合を含むオリゴヌク
レオチドを意味する。
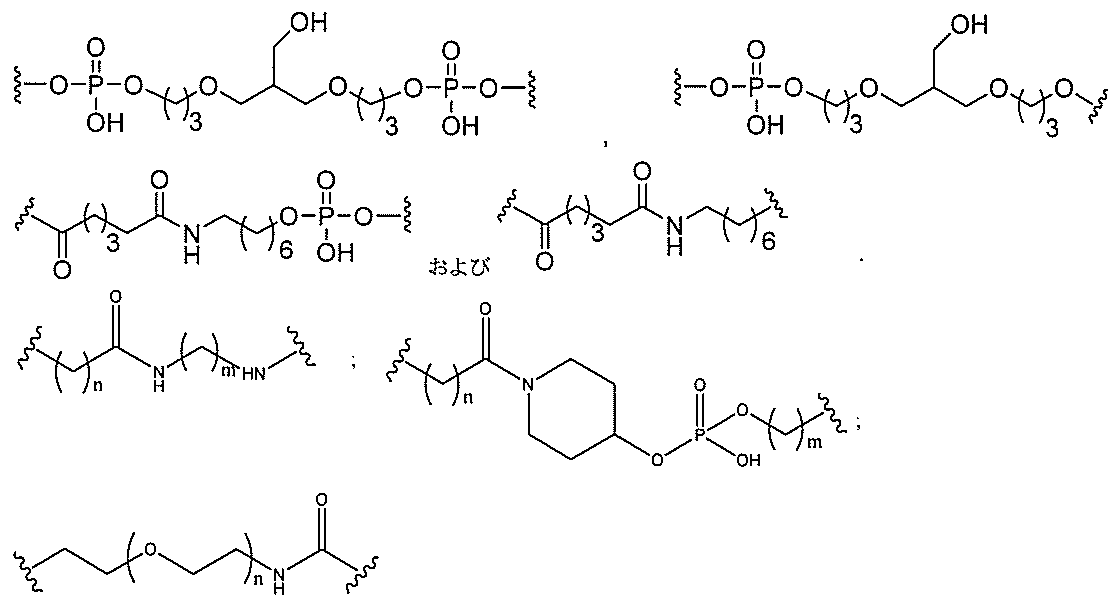
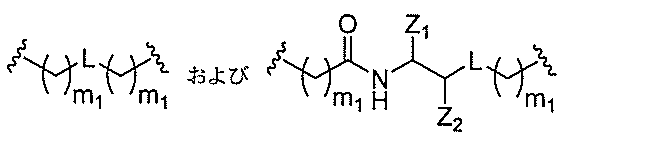
一緒に結合する原子団を意味する。
接したヌクレオシド間の共有結合を意味する。
’へのホスホジエステル結合を意味する。
オシド間結合以外の任意のヌクレオシド間結合を意味する。
たはその定義された領域の最後の2個のヌクレオシド間の結合を意味する。
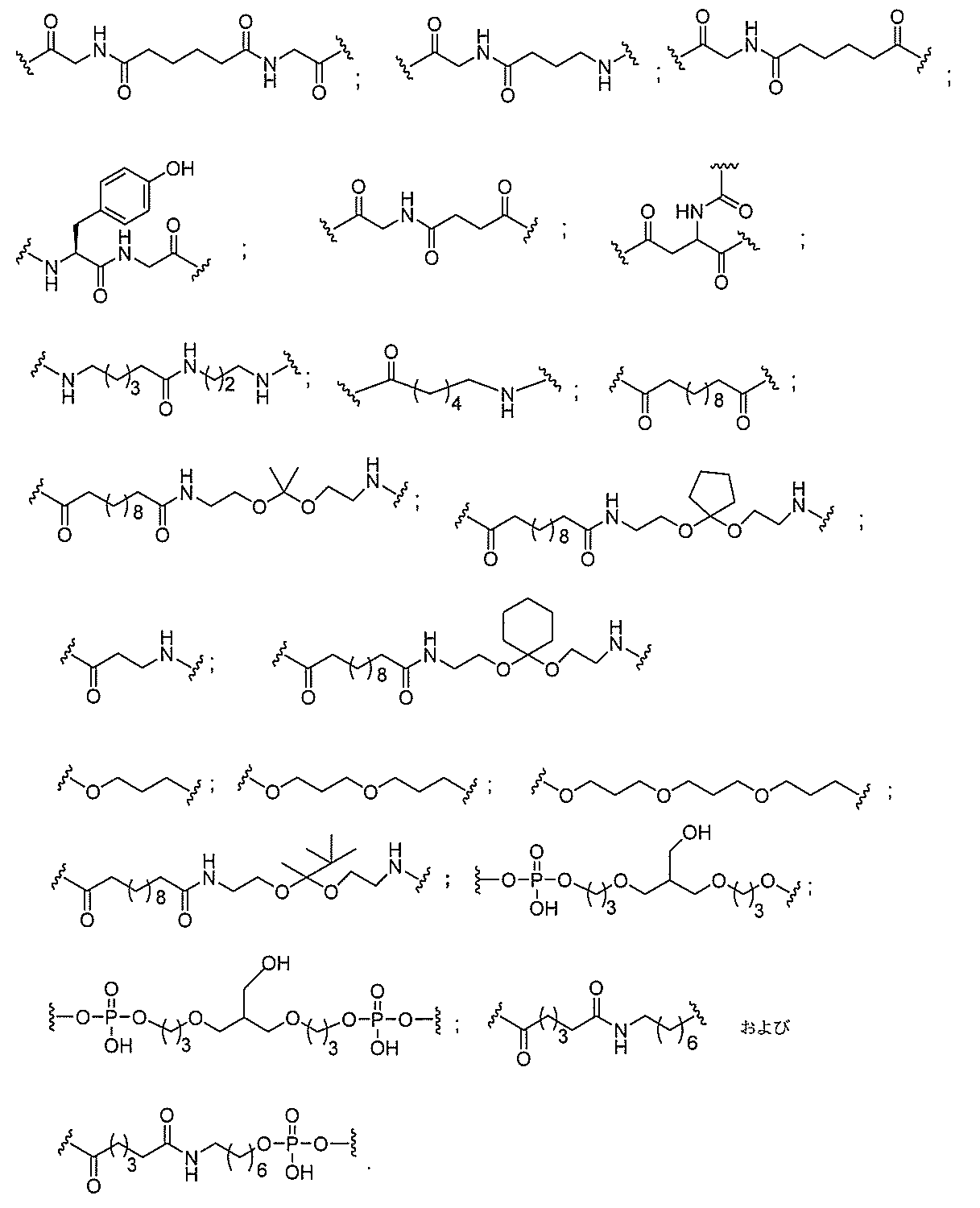
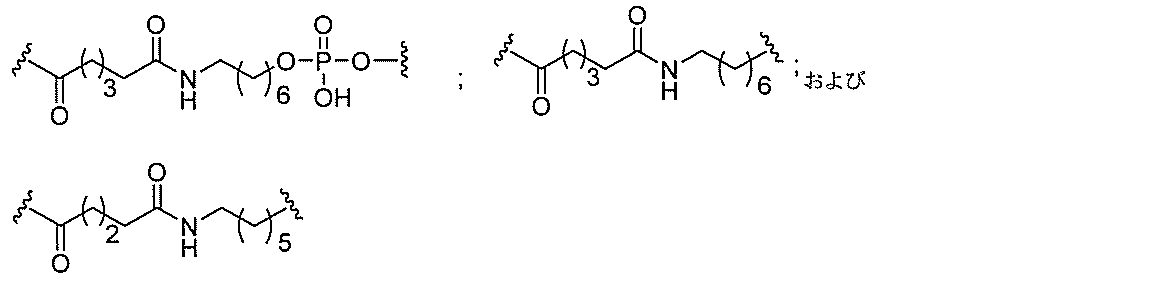
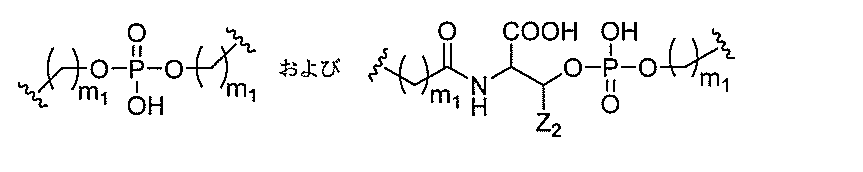
リン結合基には、以下の式を有する基が含まれるが、これに限定されず、
RaおよびRdは各々、独立して、O、S、CH2、NH、またはNJ1であり、J1
は、C1~C6アルキルまたは置換C1~C6アルキルであり、
Rbは、OまたはSであり、
Rcは、OH、SH、C1~C6アルキル、置換C1~C6アルキル、C1~C6アル
コキシ、置換C1~C6アルコキシ、アミノ、または置換アミノであり、
J1は、Rbが、OまたはSである。
スホネート、ホスホラミデート、ホスホロチオアミデート、チオノアルキルホスホネート
、ホスホトリエステル、チオノアルキルホスホトリエステル、およびボラノホスフェート
が含まれるが、これらに限定されない。
を直接結合するリン結合基を意味する。
ドを直接結合しないリン結合基を意味する。ある特定の実施形態において、
非ヌクレオシド間リン結合基は、ヌクレオシドをヌクレオシド以外の基に結合させる。
非ヌクレオシド間リン結合基は、2個の基を結合するが、これらはいずれもヌクレオシ
ドではない。
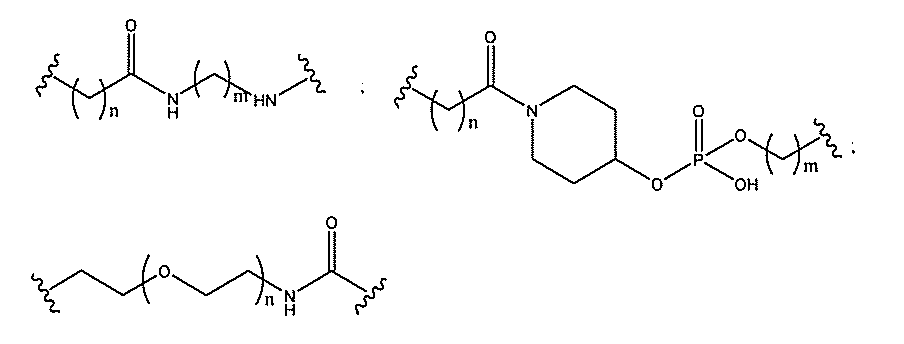
。中性結合基には、ホスホトリエステル、メチルホスホネート、MMI(-CH2-N(
CH3)-O-)、アミド-3(-CH2-C(=O)-N(H)-)、アミド-4(-
CH2-N(H)-C(=O)-)、ホルムアセタール(-O-CH2-O-)、および
チオホルムアセタール(-S-CH2-O-)が含まれるが、これらに限定されない。さ
らに、中性結合基には、シロキサン(ジアルキルシロキサン)、カルボン酸エステル、カ
ルボキサミド、硫化物、スルホン酸エステル、およびアミドを含む非イオン性結合が含ま
れる(例えば、Carbohydrate Modifications in Ant
isense Research;Y.S.Sanghvi and P.D.Cook
Eds.ACS Symposium Series 580;Chapters 3
and 4(pp.40-65)を参照されたい)。さらに、中性結合基は、混合され
たN、O、S、およびCH2成分部分を含む非イオン性結合を含む。
を直接結合する中性結合基を意味する。
ドを直接結合しない中性結合基を意味する。ある特定の実施形態において、非ヌクレオシ
ド間中性結合基は、ヌクレオシドをヌクレオシド以外の基に結合させる。
、これらはいずれもヌクレオシドではない。
合体構造を意味する。ある特定の実施形態において、オリゴマー化合物は、オリゴヌクレ
オチドを含む。ある特定の実施形態において、オリゴマー化合物は、1個以上の共役基お
よび/または末端基を含む。ある特定の実施形態において、オリゴマー化合物は、オリゴ
ヌクレオチドからなる。オリゴマー化合物はまた、天然に存在する核酸も含む。ある特定
の実施形態において、オリゴマー化合物は、1個以上の連結した単量体サブユニットの骨
格を含み、各連結した単量体サブユニットは、複素環式塩基部分に直接的または間接的に
結合される。ある特定の実施形態において、オリゴマー化合物はまた、複素環式塩基部分
に連結されない単量体サブユニットも含み得、それにより脱塩基部位を提供し得る。ある
特定の実施形態において、単量体サブユニット、糖部分または代理物、および複素環式塩
基部分を結び付ける結合は、独立して修飾され得る。ある特定の実施形態において、複素
環式塩基を含み得るか、または含み得ない結合糖単位は、ペプチド核酸における単量体等
の模倣物と置換され得る。
5’末端のいずれか、またはこれら両方に結合される1個以上の原子を意味する。ある特
定の実施形態において、末端基は、共役基である。ある特定の実施形態において、末端基
は、1個以上の末端基ヌクレオシドを含む。
たはオリゴマー化合物に結合される原子または原子団を意味する。概して、共役基は、薬
力学的特性、薬物動態学的特性、結合特性、吸収特性、細胞分布特性、細胞取り込み特性
、電荷特性、および/またはクリアランス特性を含むが、これらに限定されない、それら
が結合する化合物の1つ以上の特性を修飾する。
とは、任意の原子または原子団を含む共役基の一部を意味し、(1)オリゴヌクレオチド
を共役基の別の部分と共有結合させるか、または(2)共役基の2個以上の部分を共有結
合させる。
等のオリゴマー化合物への共有結合を形成するための結合を提供する。ある特定の実施形
態において、オリゴマー化合物における結合点は、オリゴマー化合物の3’末端ヌクレオ
シドの3’-ヒドロキシル基の3’-酸素原子である。ある特定の実施形態において、オ
リゴマー化合物における結合点は、オリゴマー化合物の5’末端ヌクレオシドの5’-ヒ
ドロキシル基の5’-酸素原子である。ある特定の実施形態において、オリゴマー化合物
への結合を形成するための結合は、切断可能な結合である。ある特定のそのような実施形
態において、そのような切断可能な結合は、切断可能な部分のすべてまたは一部を構成す
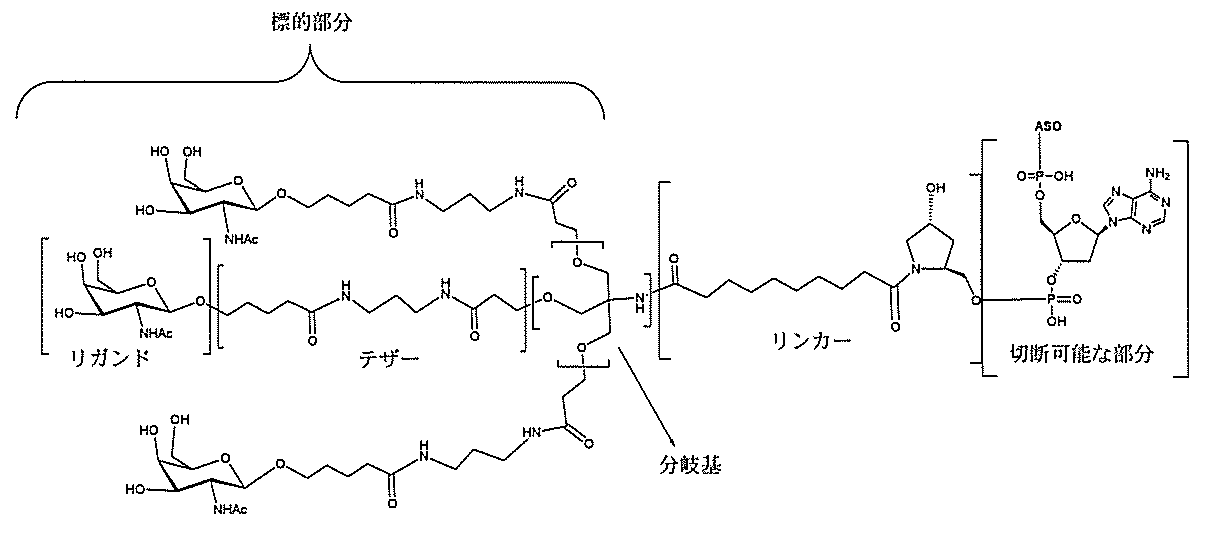
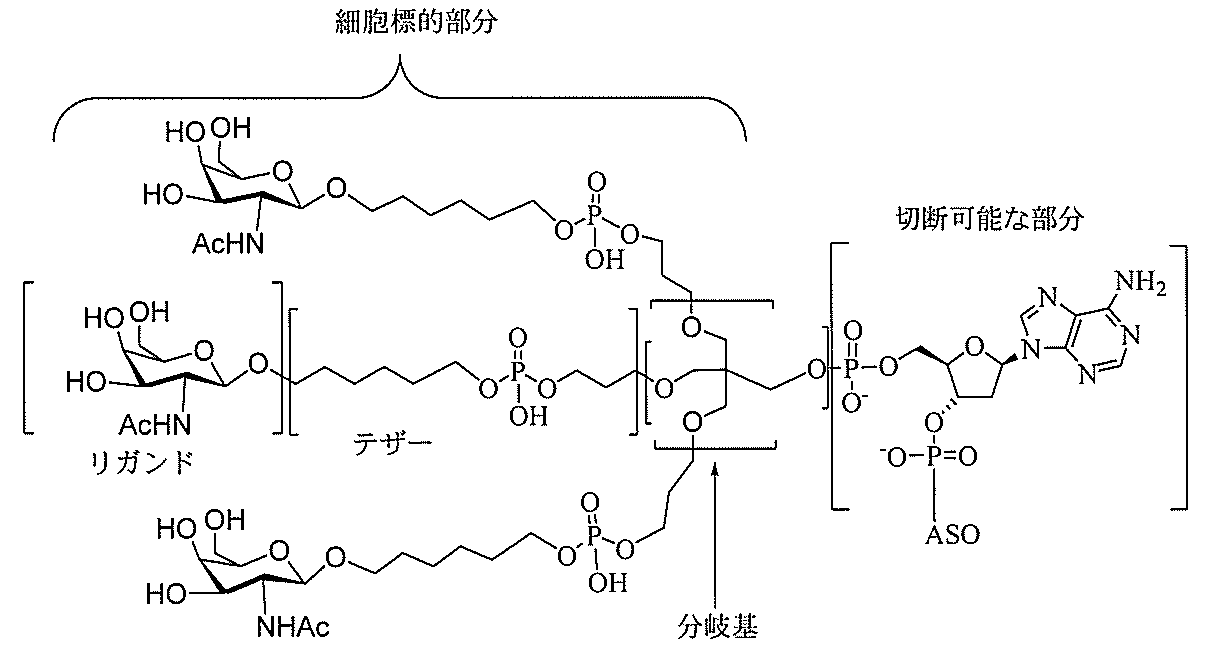
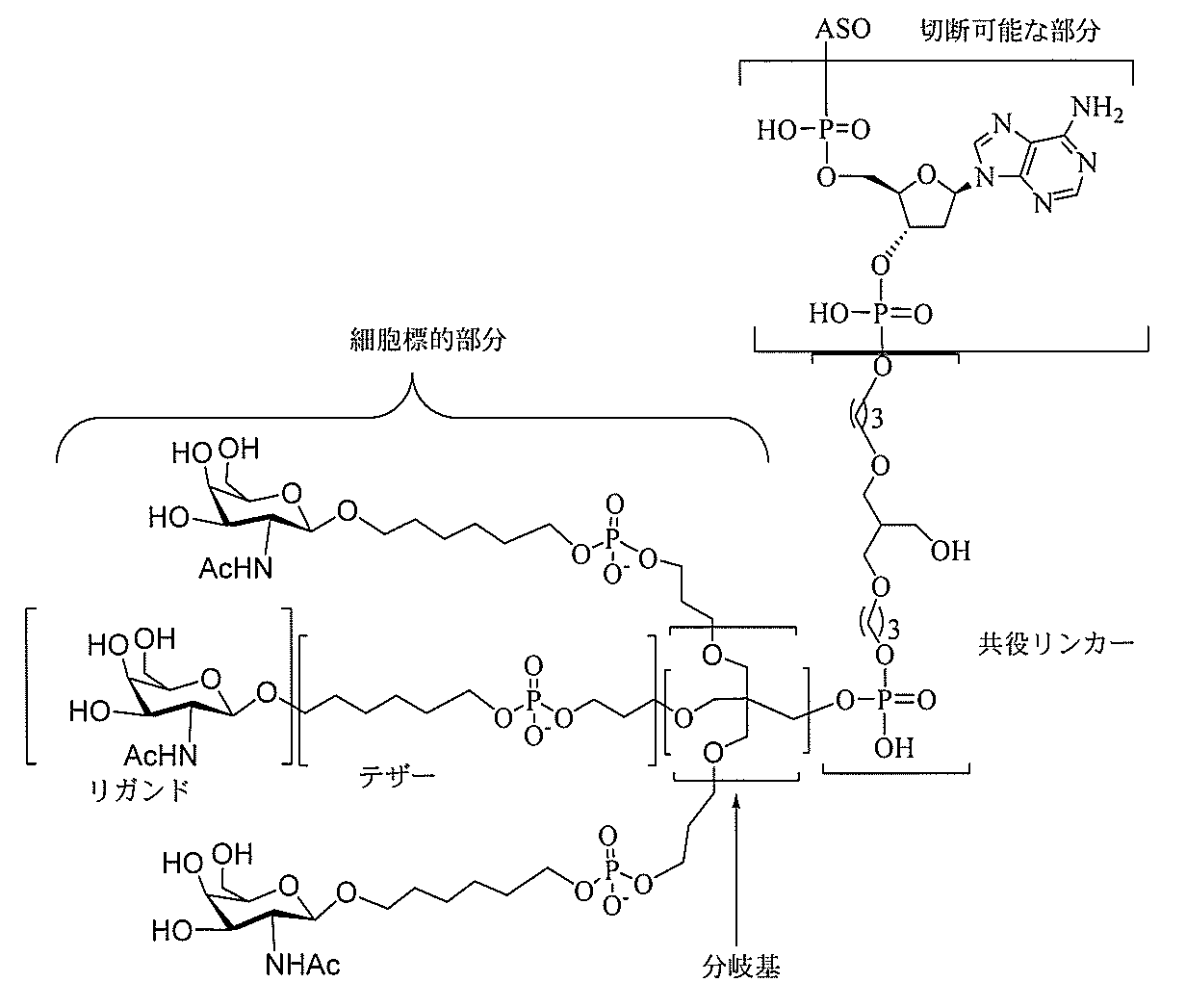
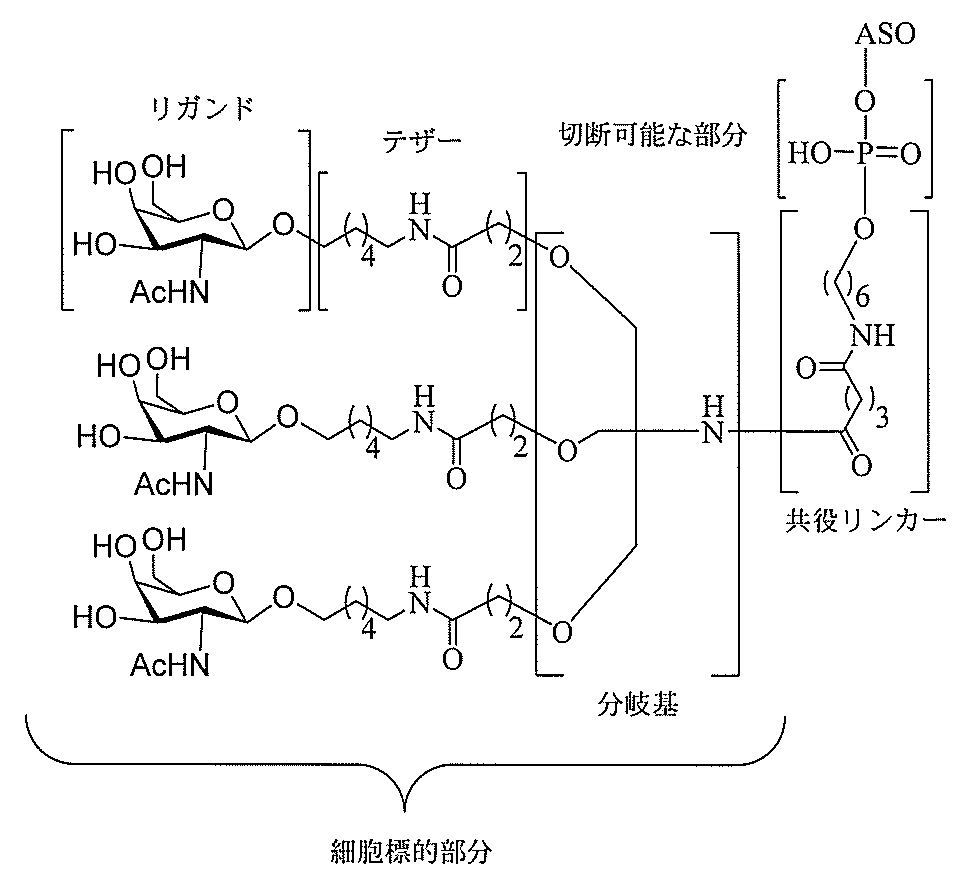
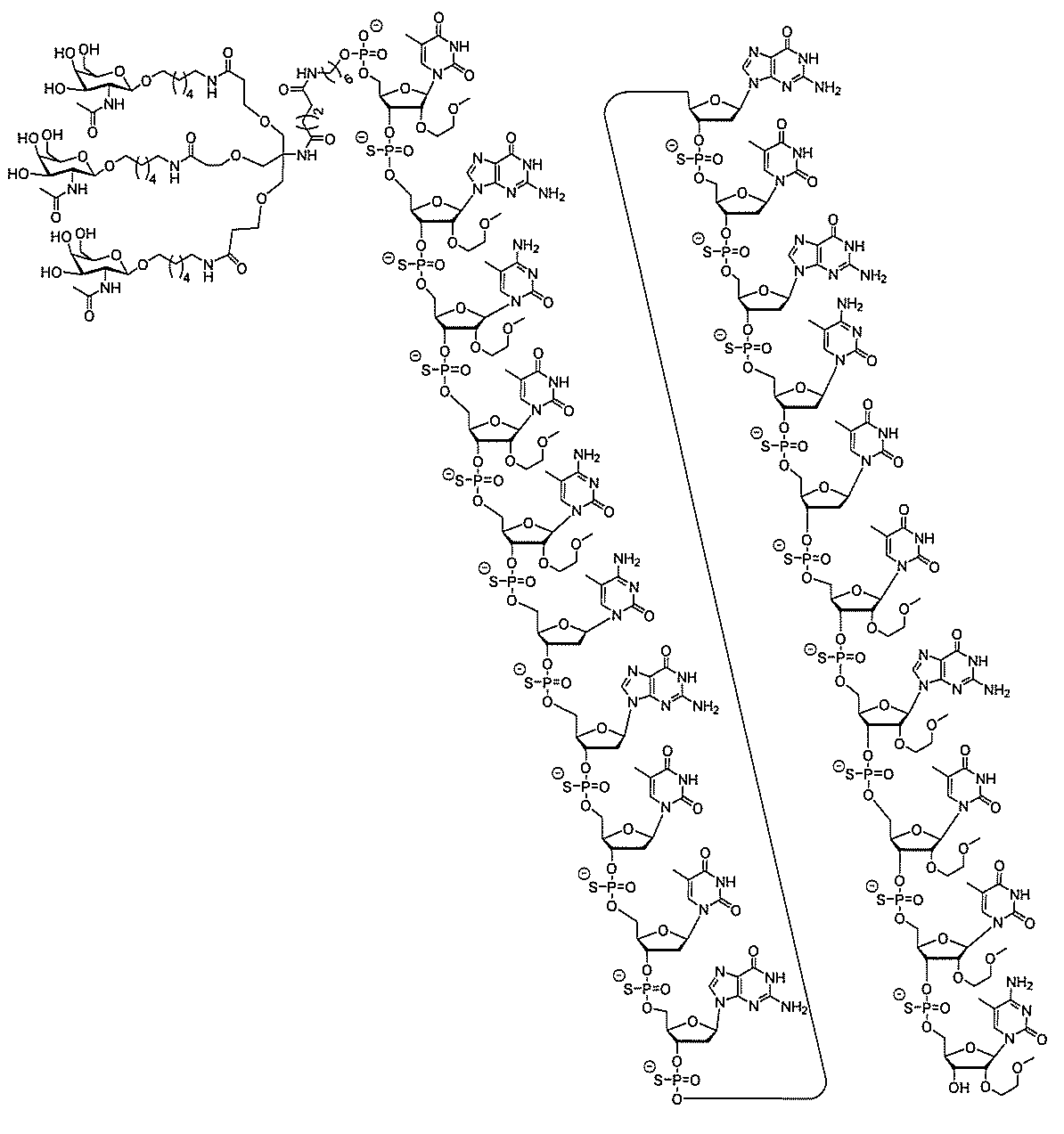
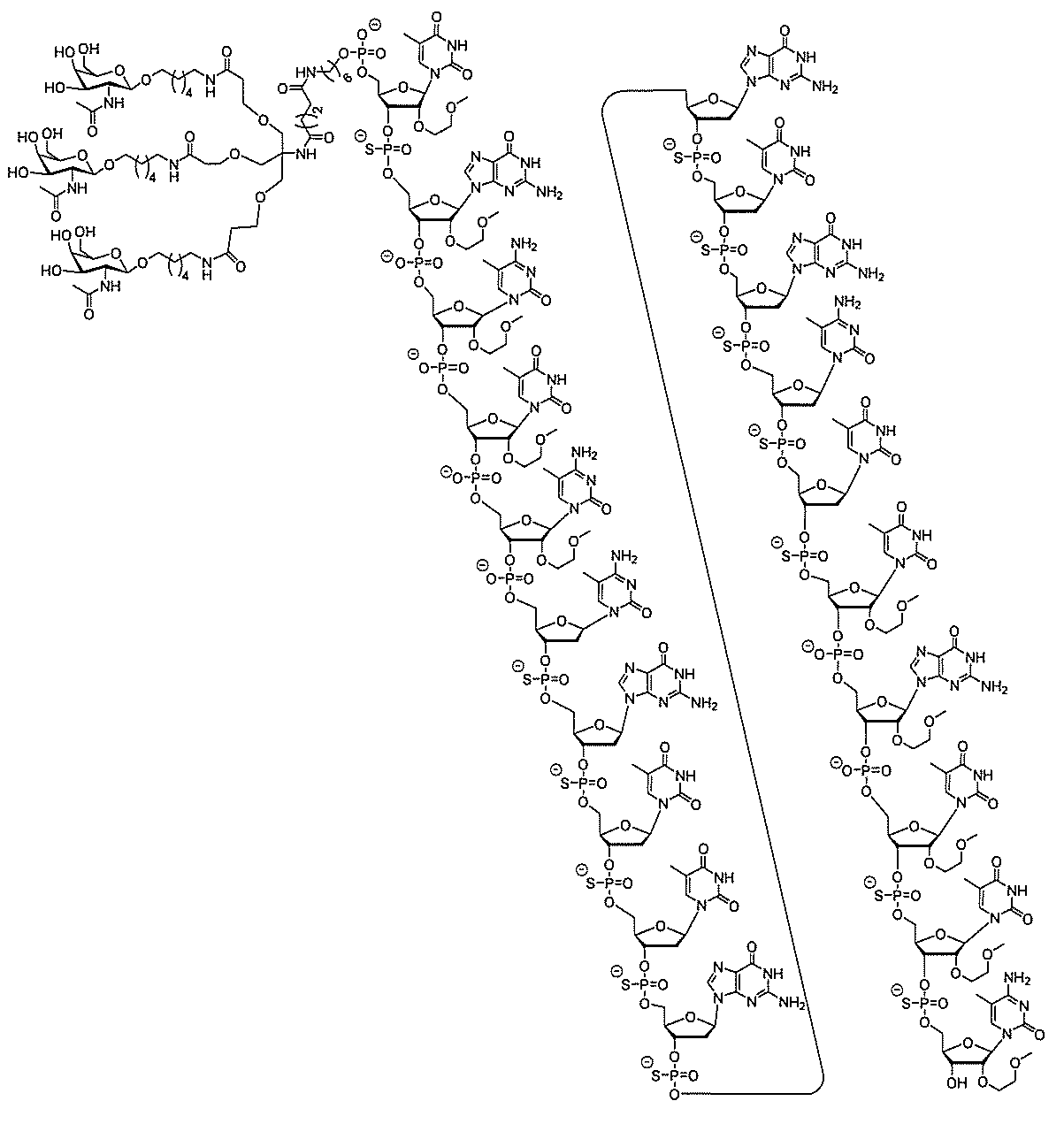
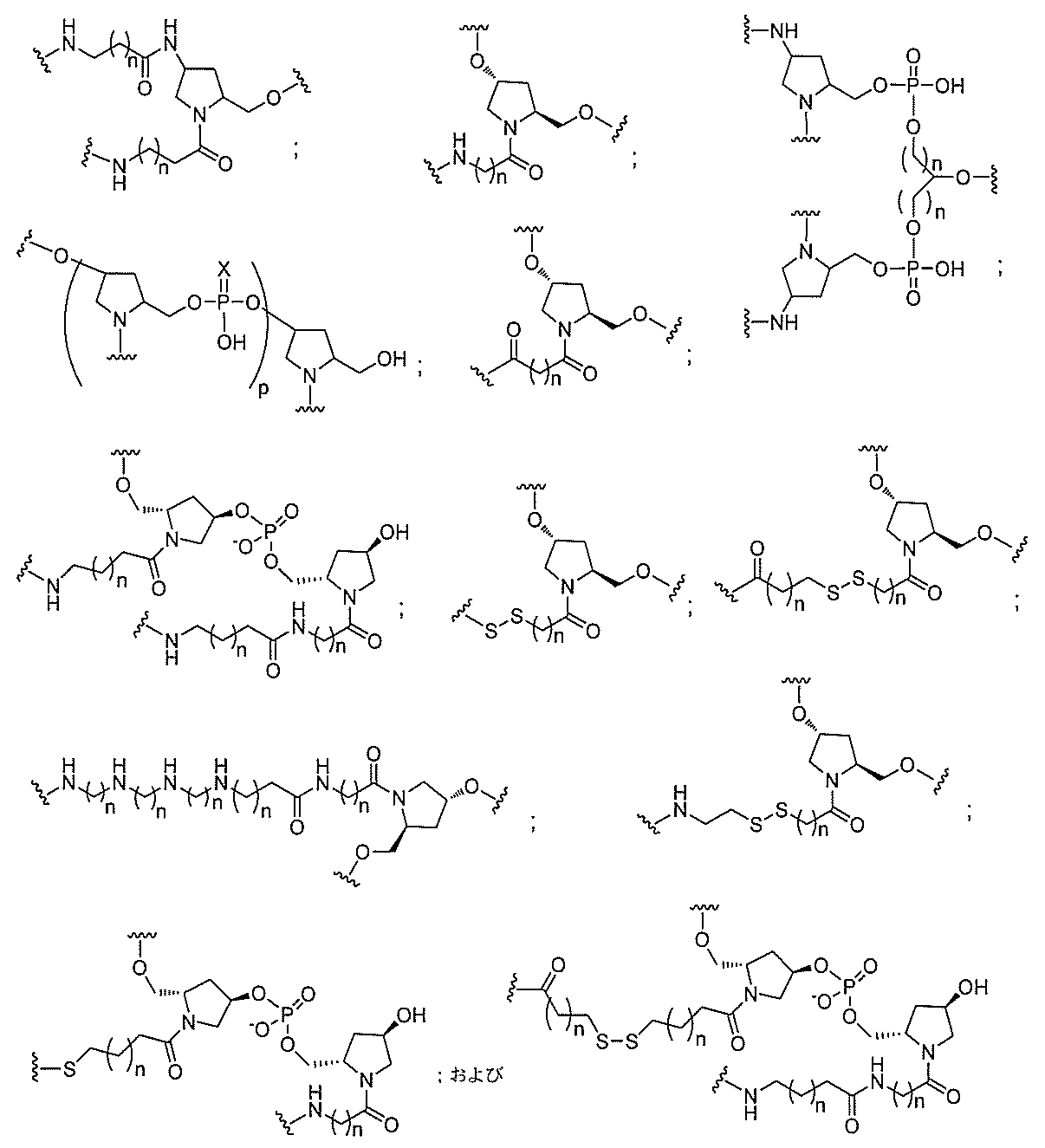
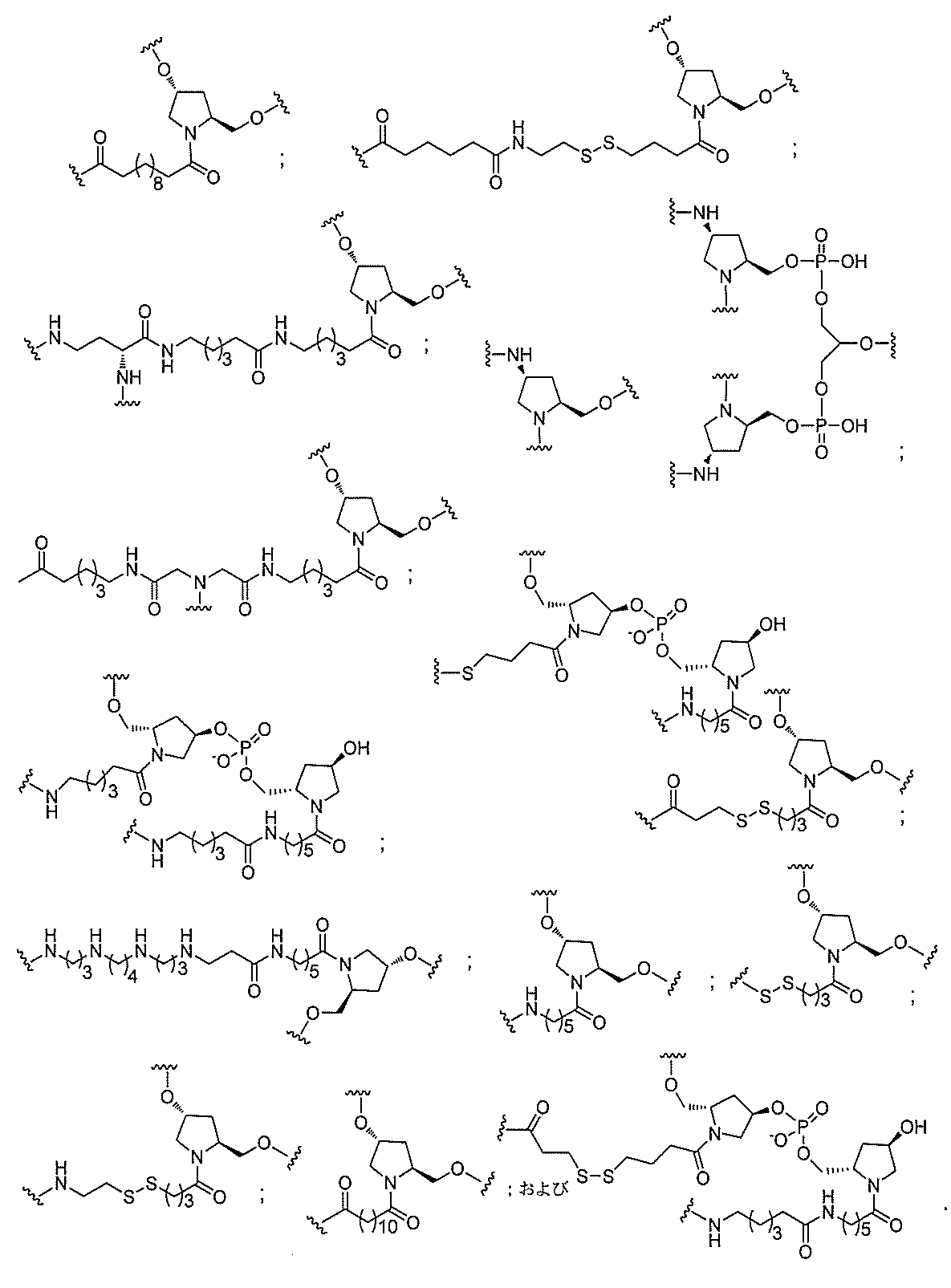
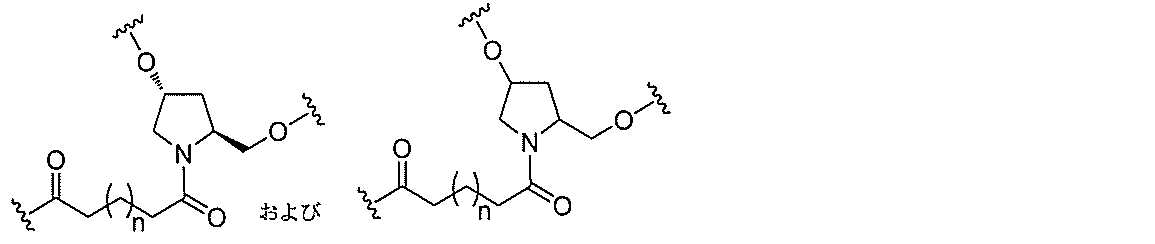
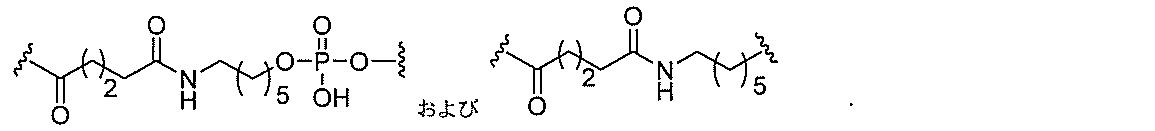
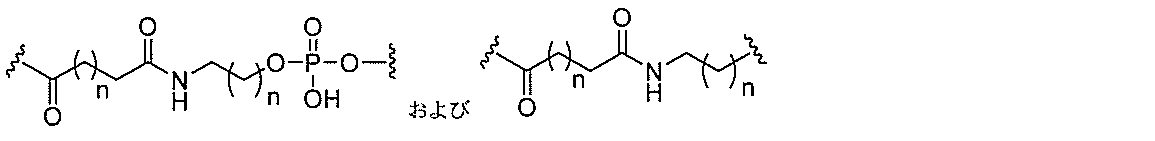
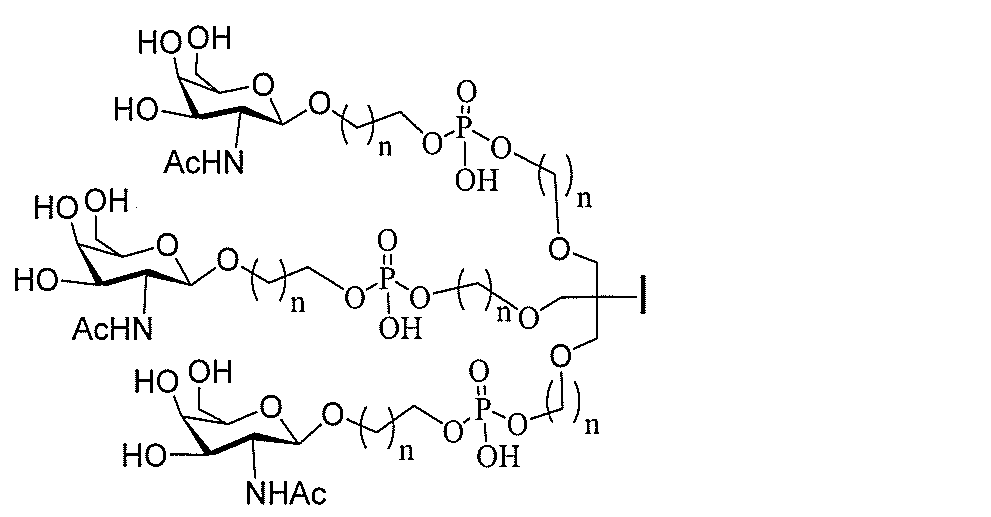
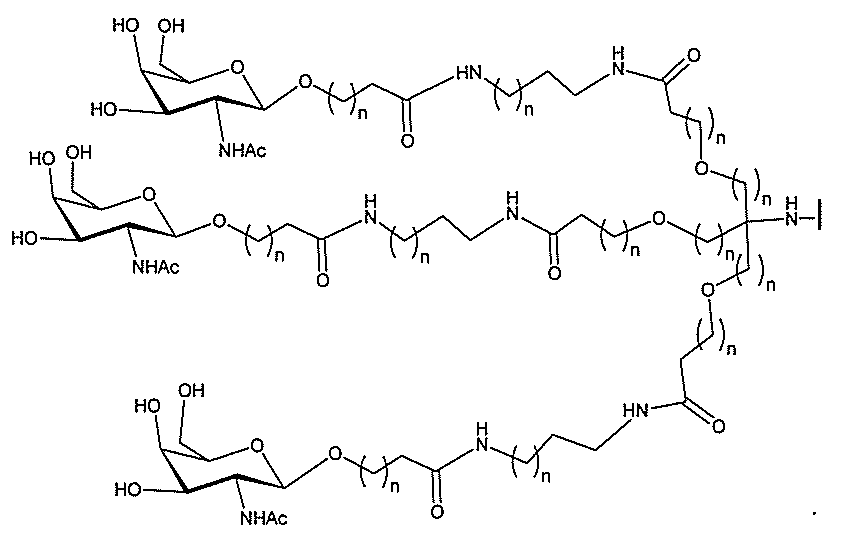
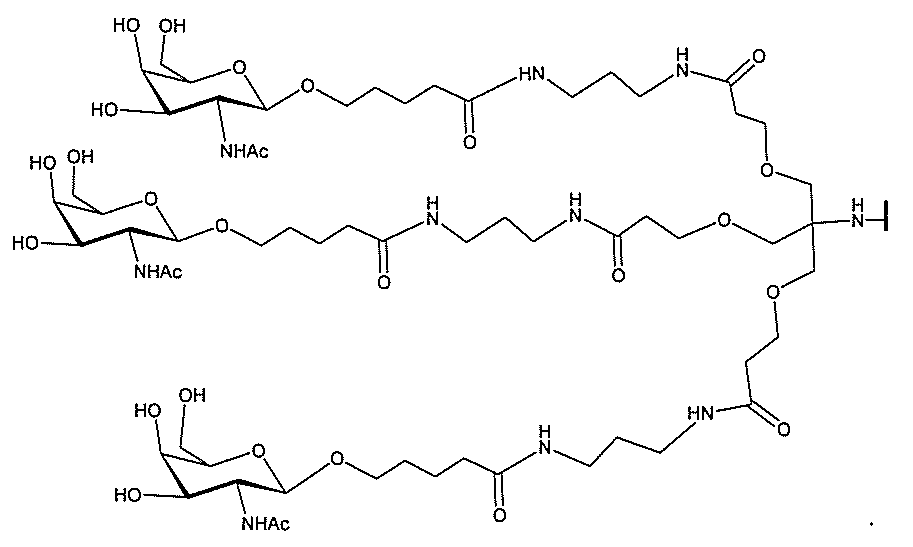
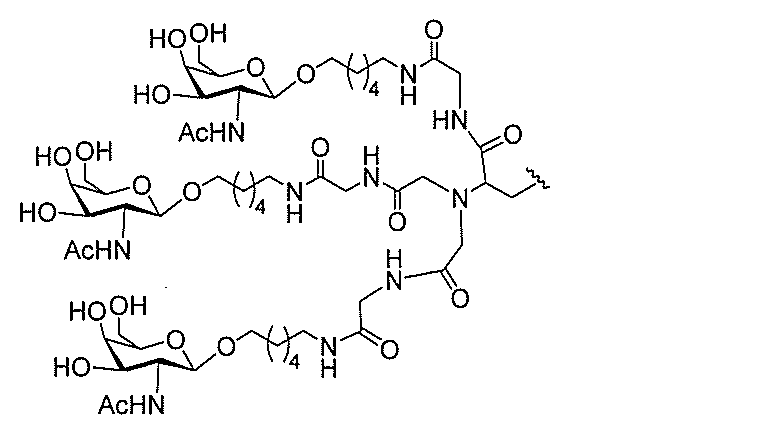
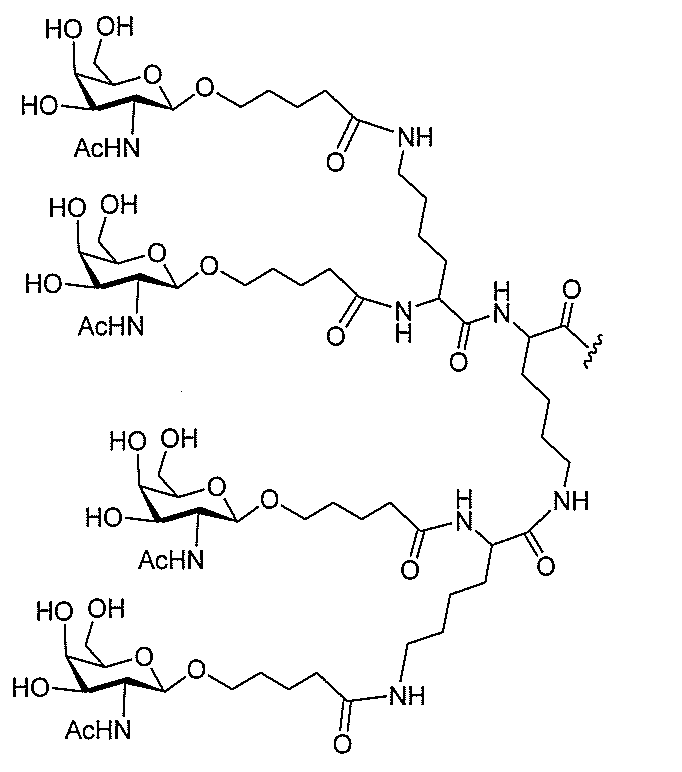
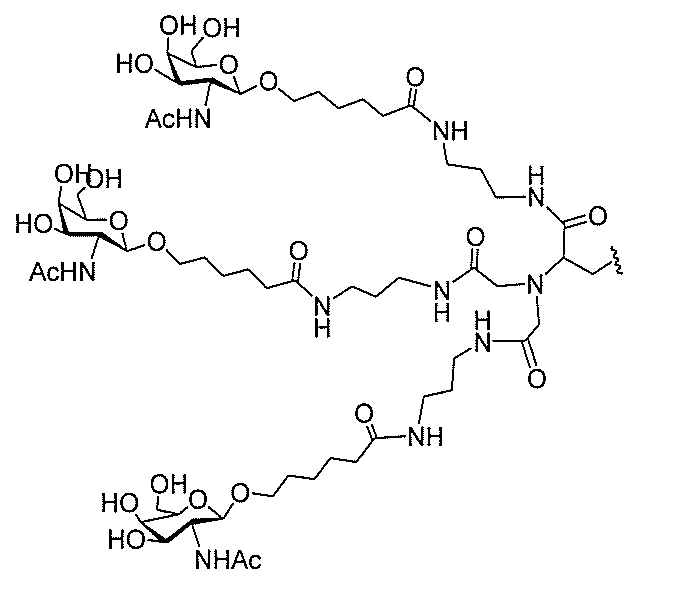
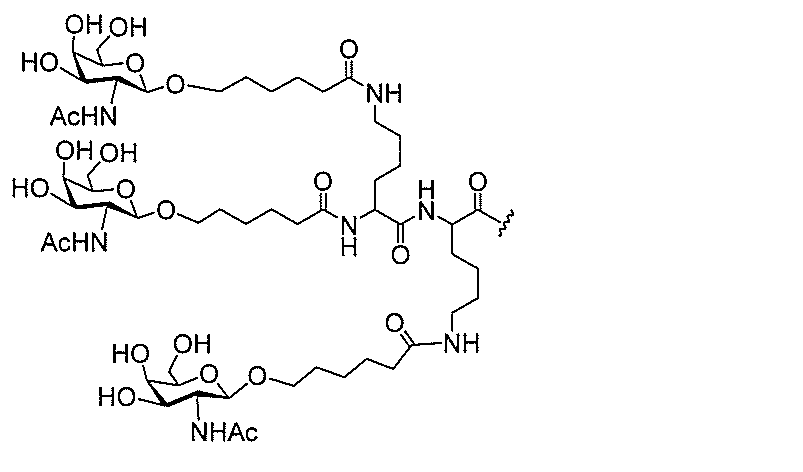
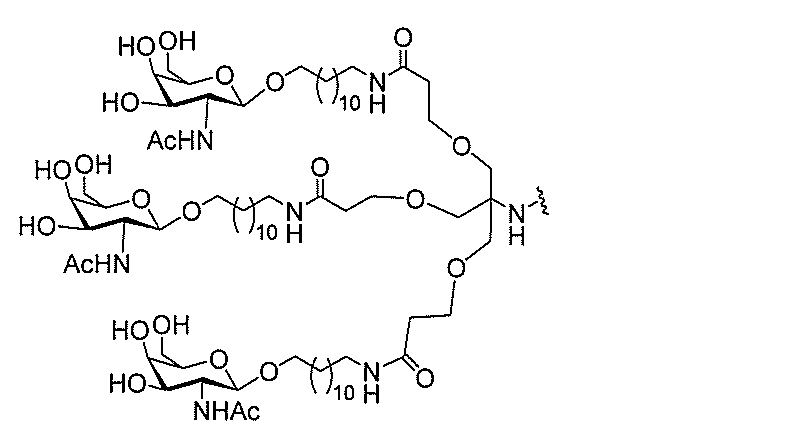
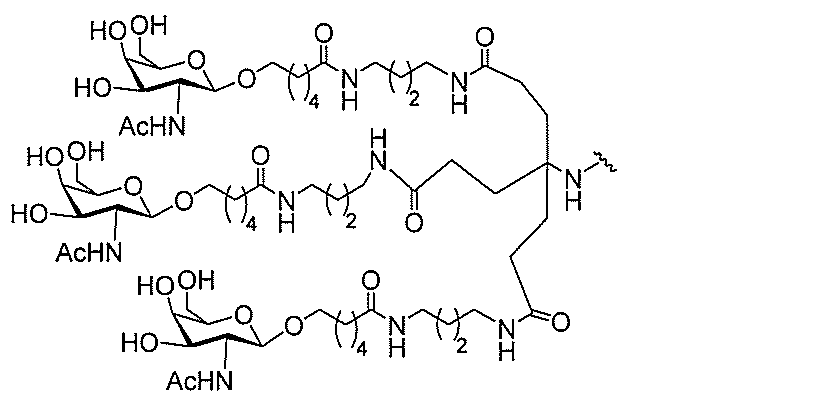
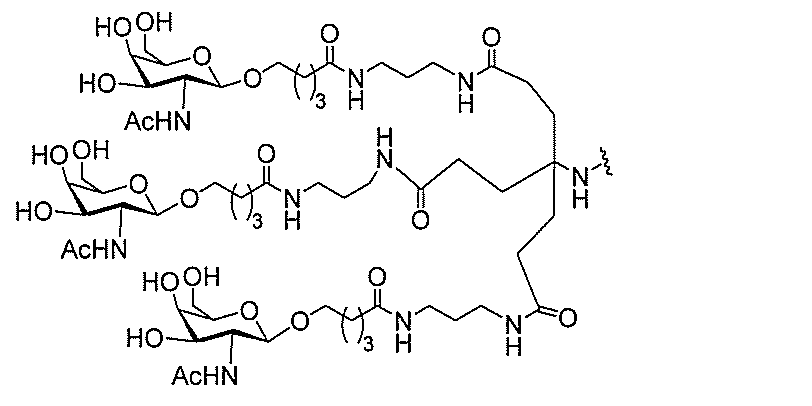
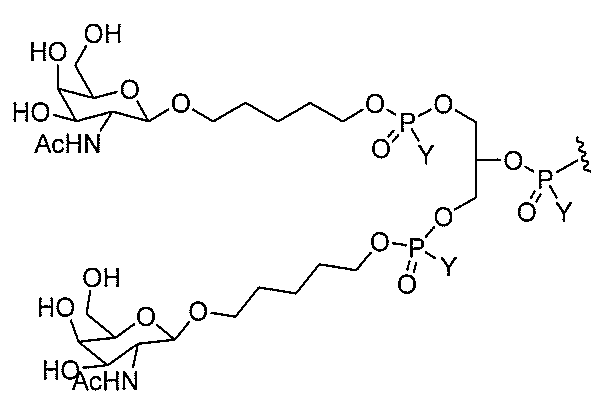
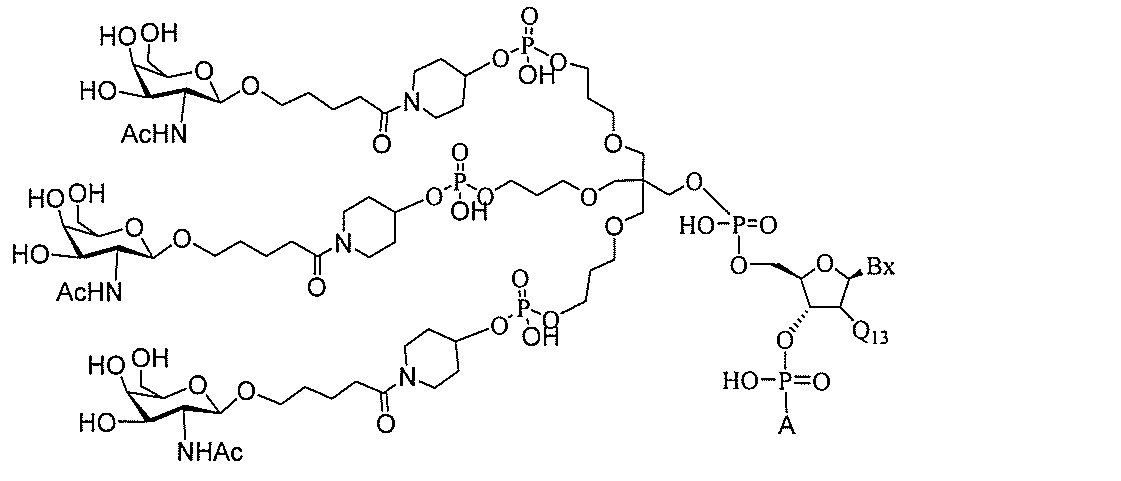
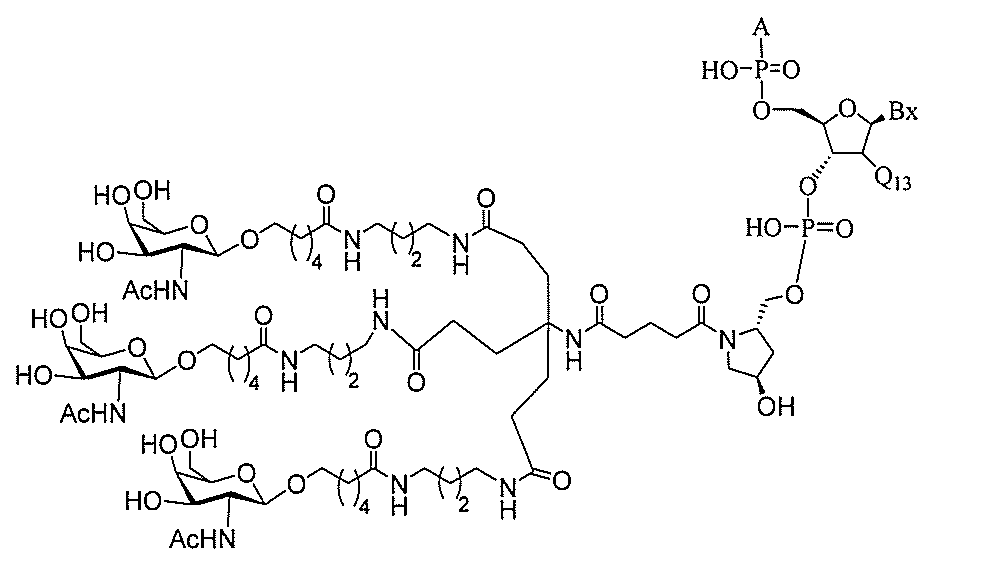
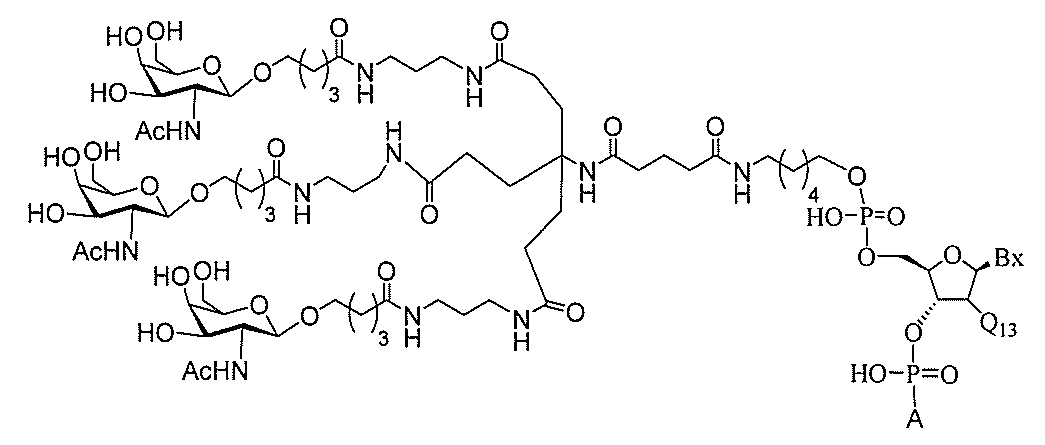
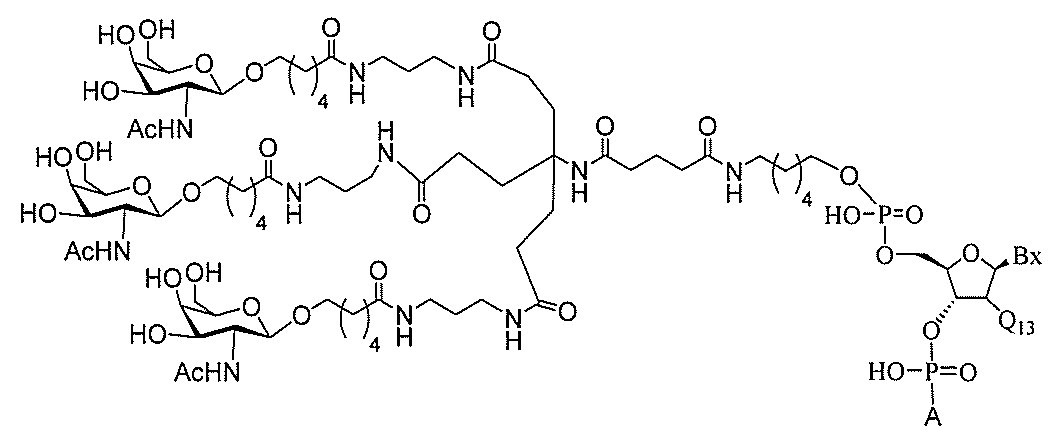
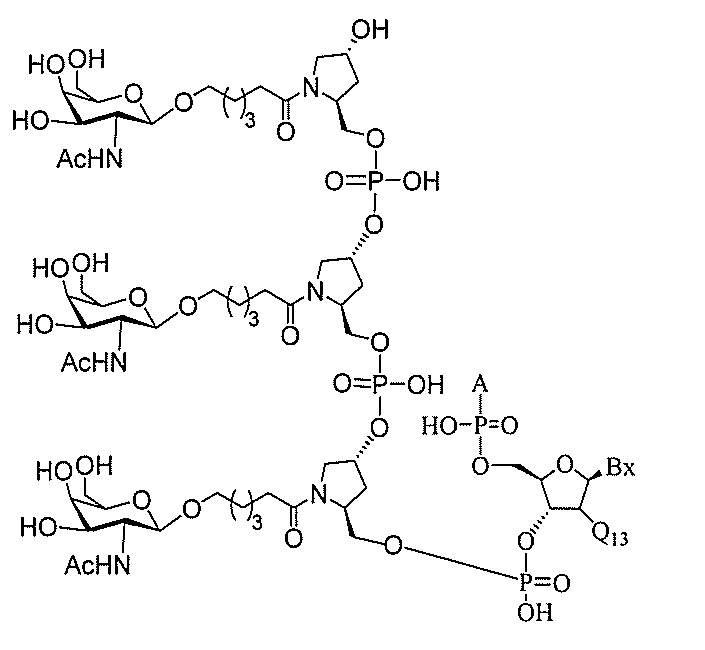
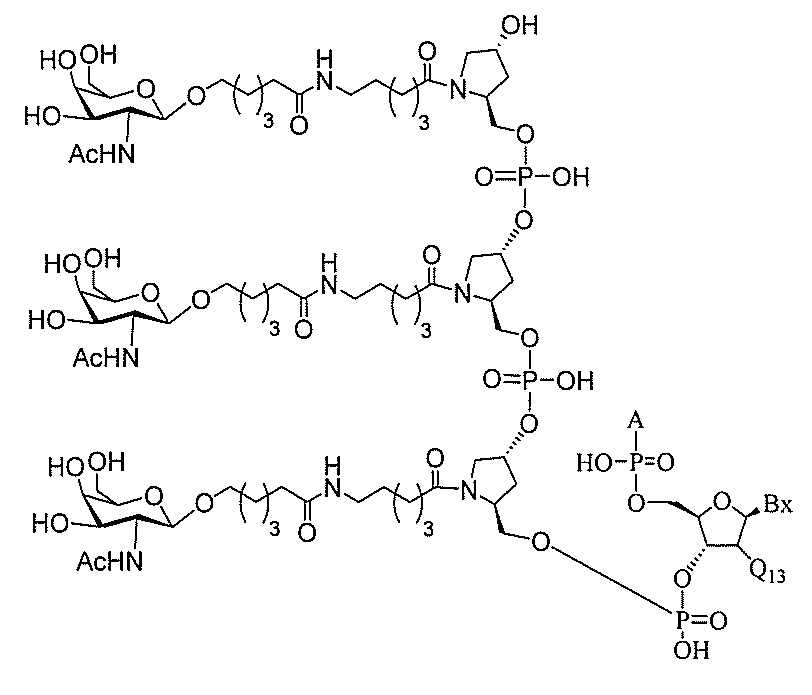
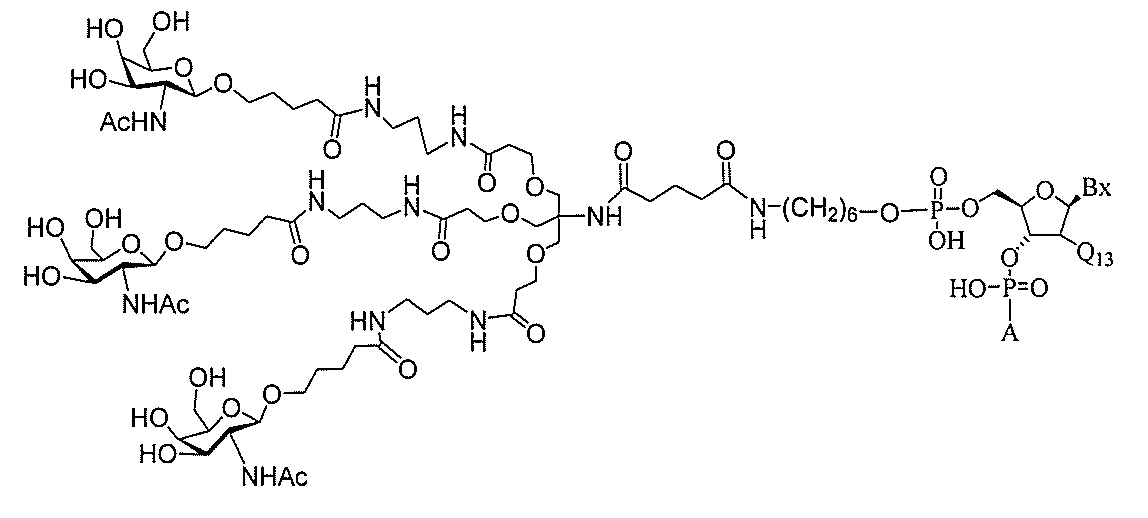
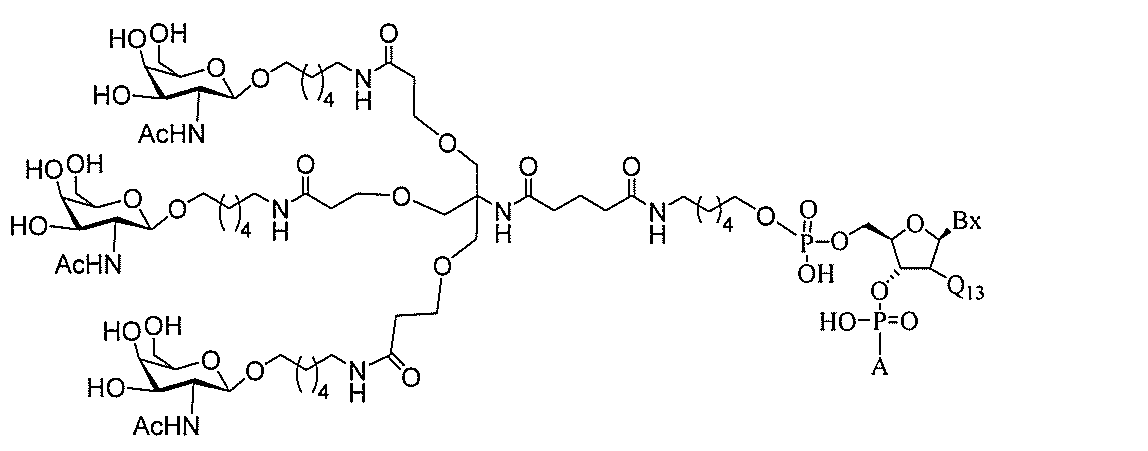
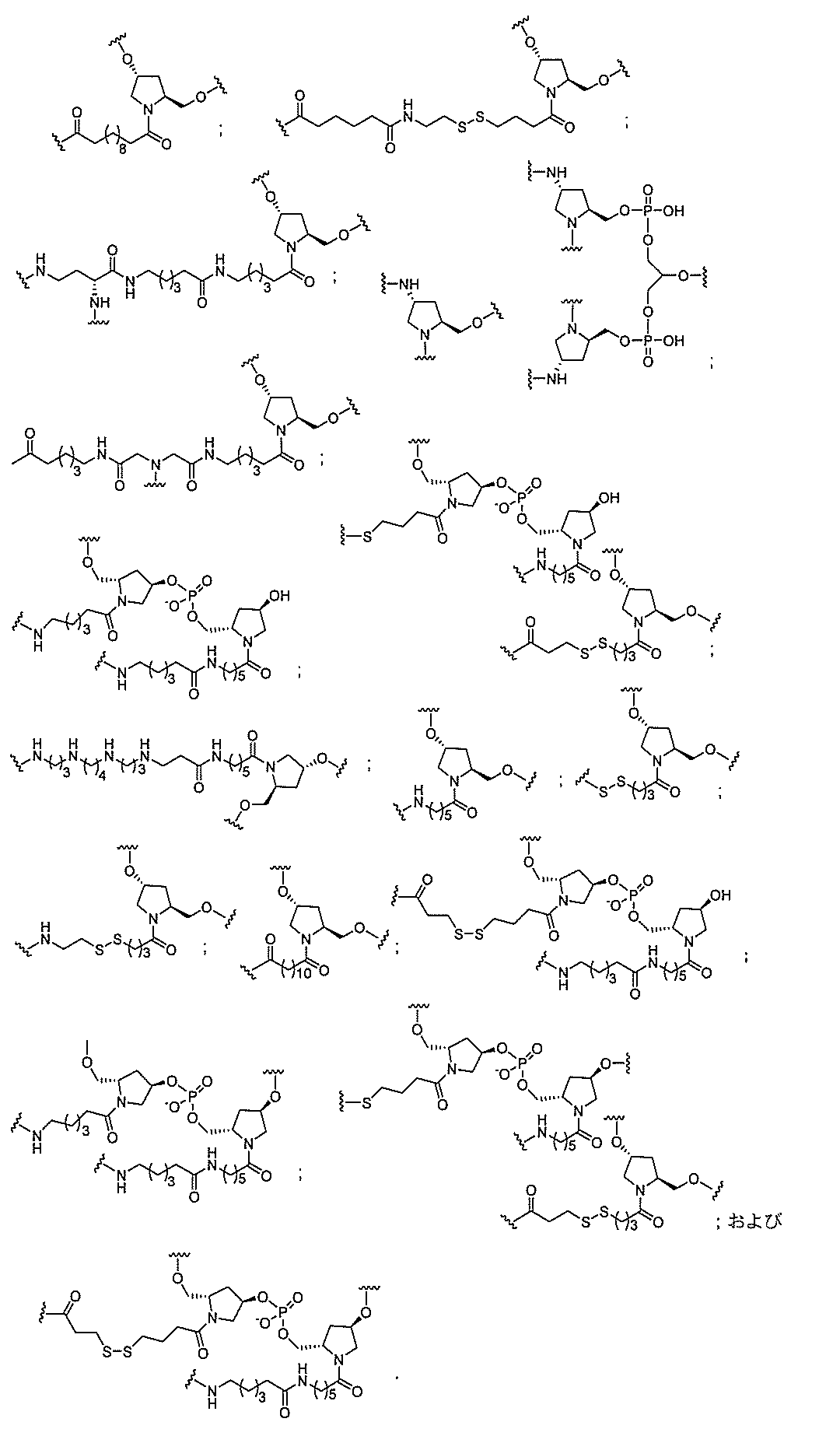
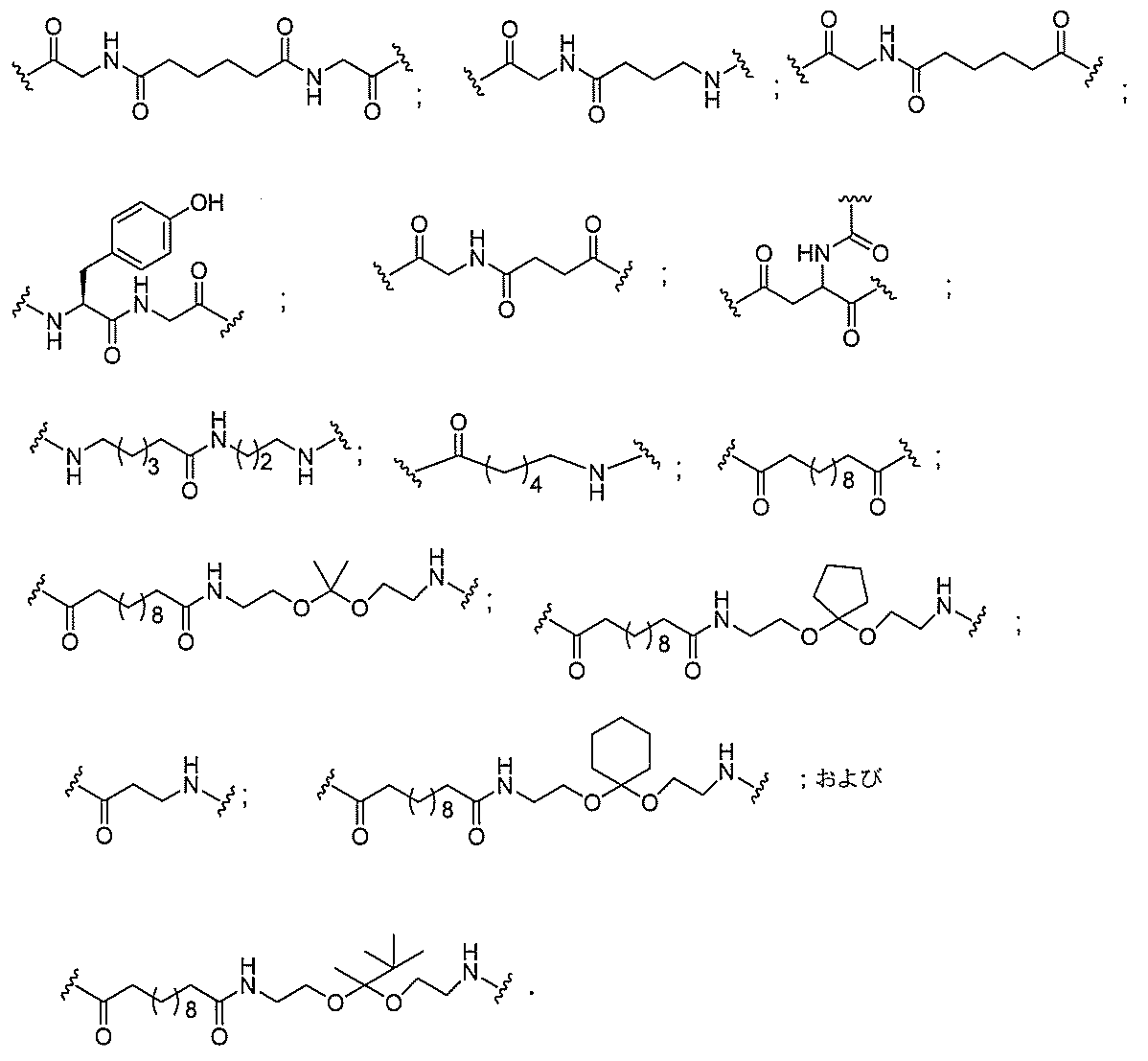
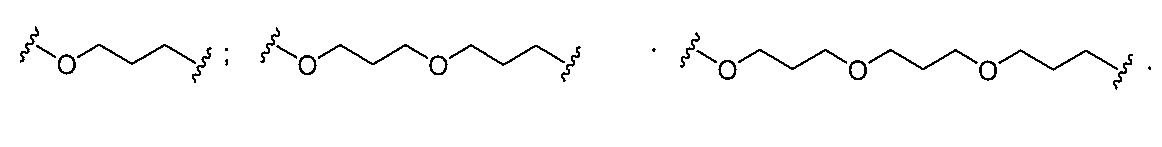
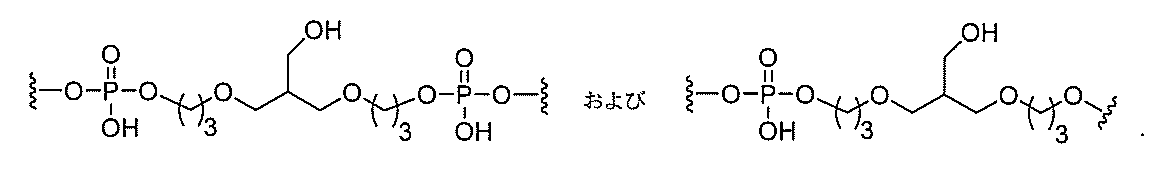
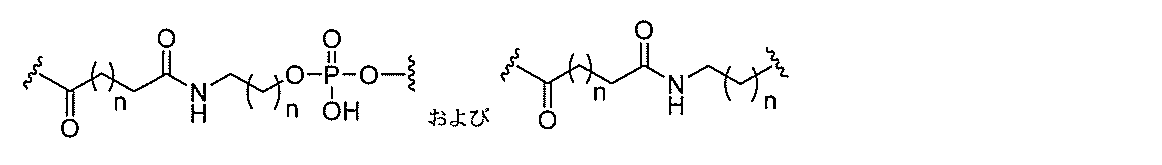
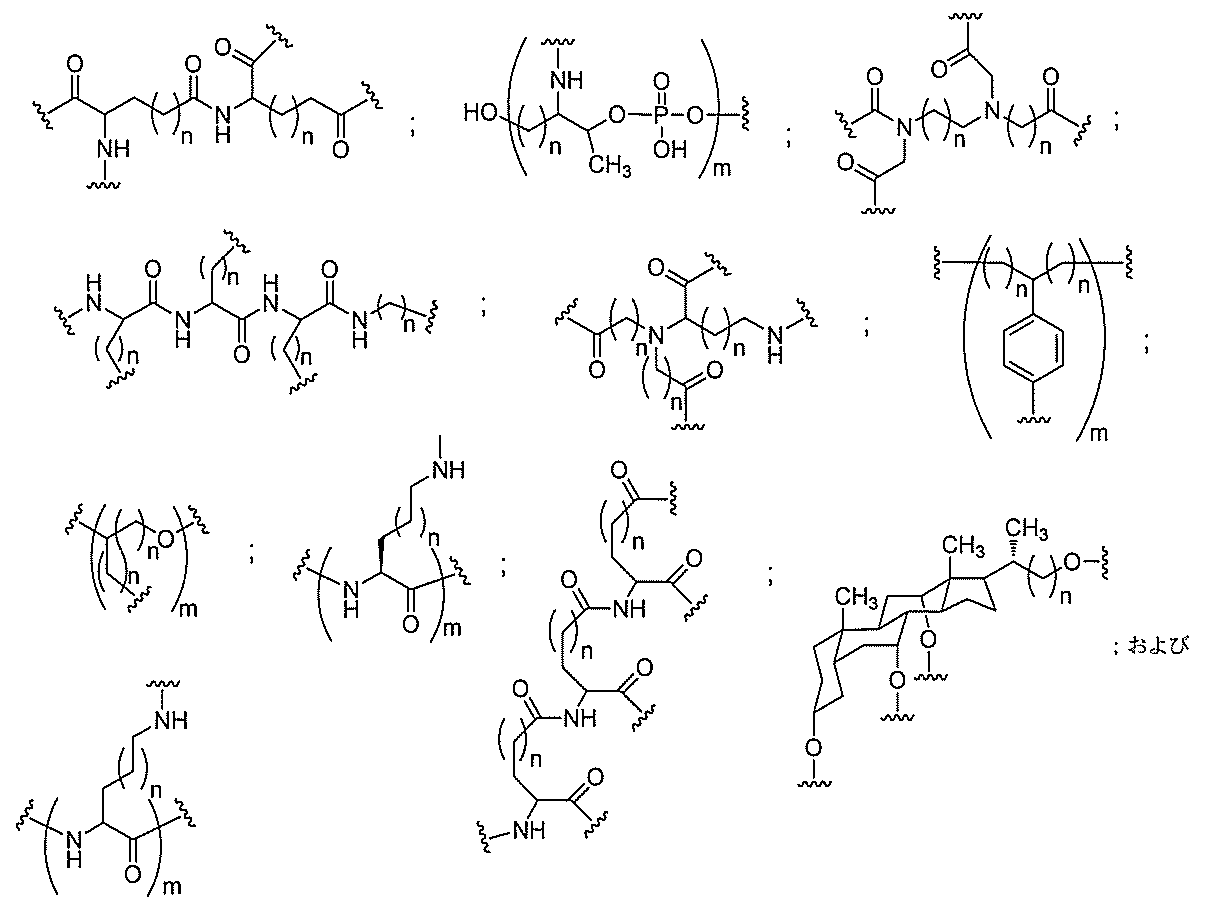
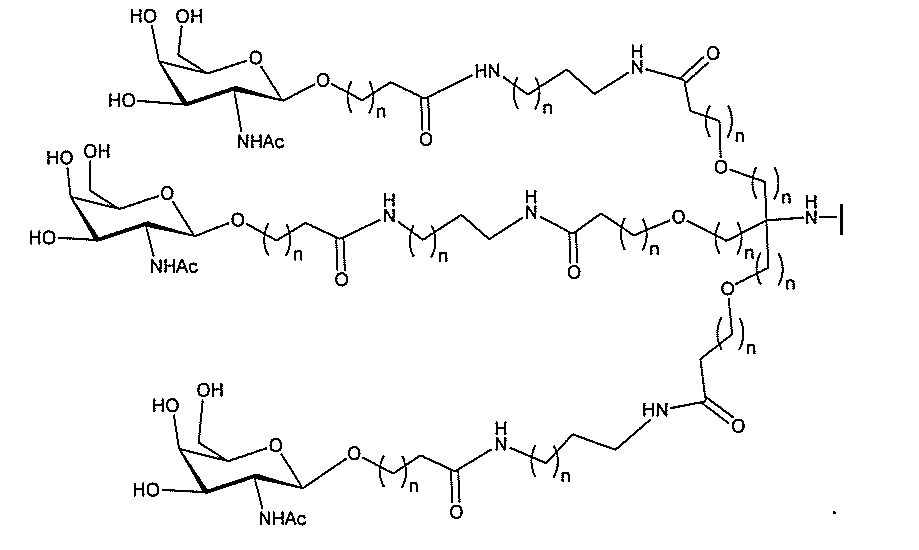
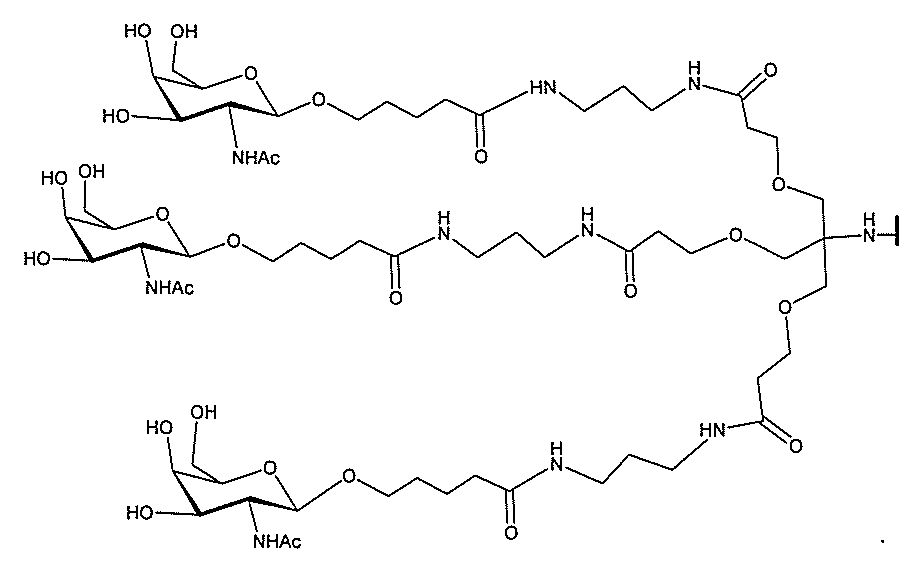
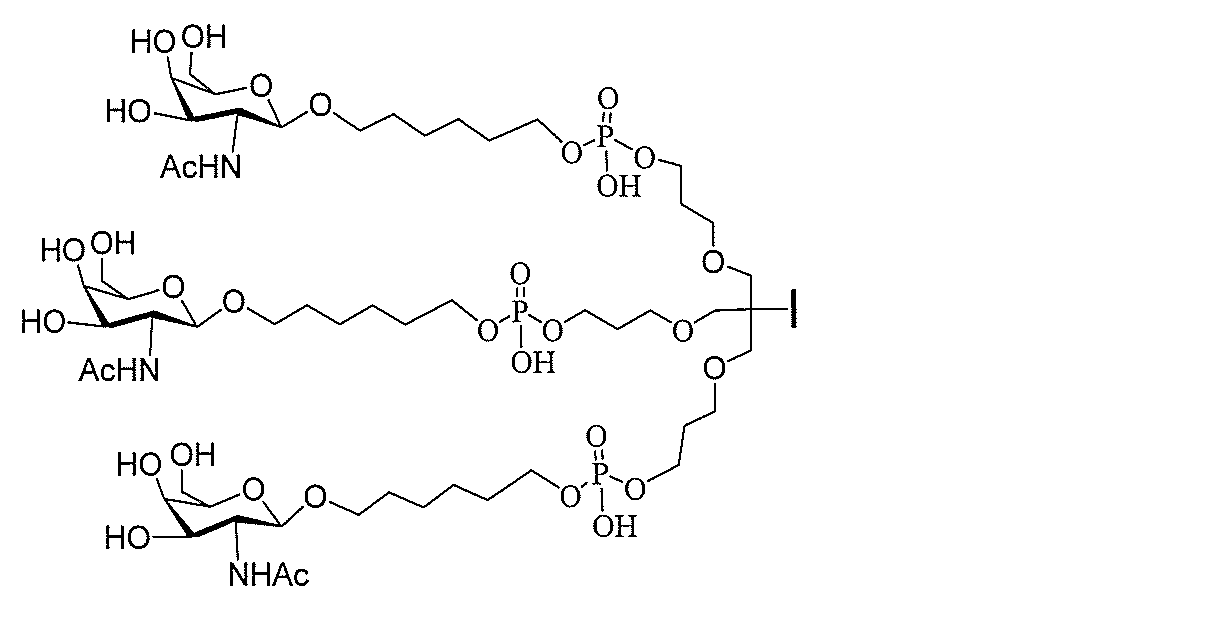
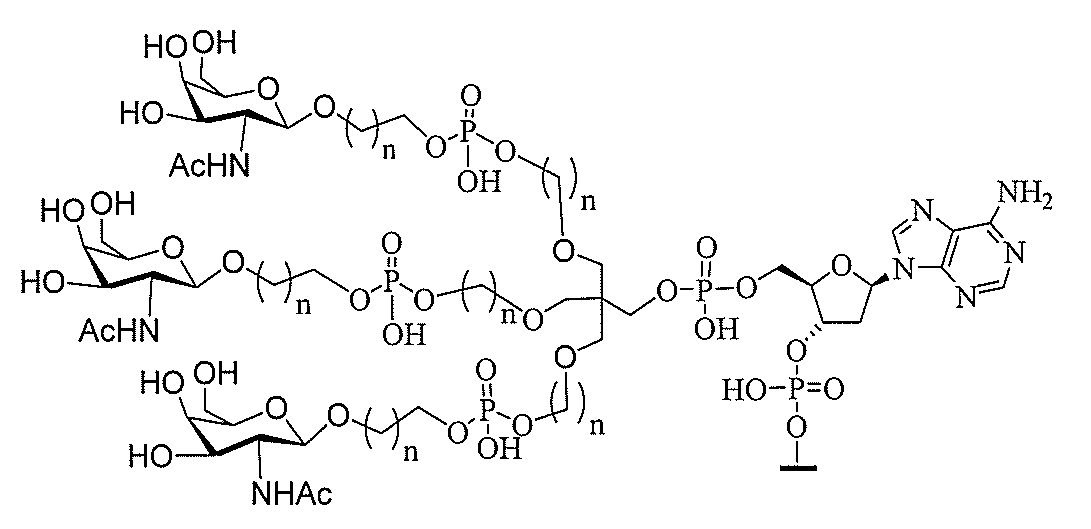
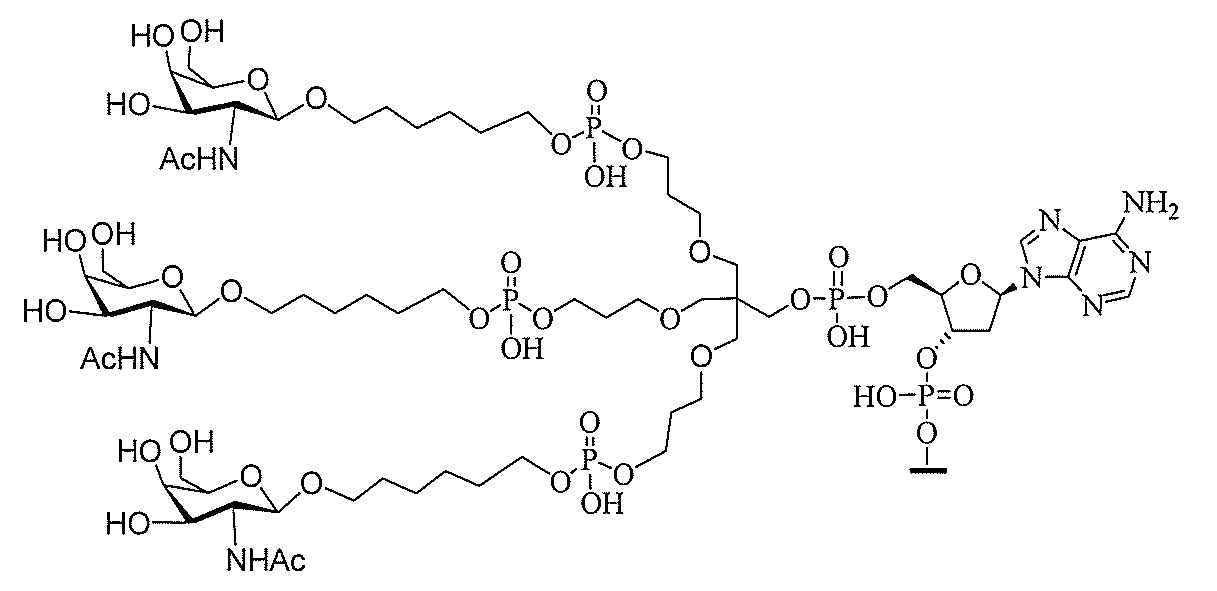
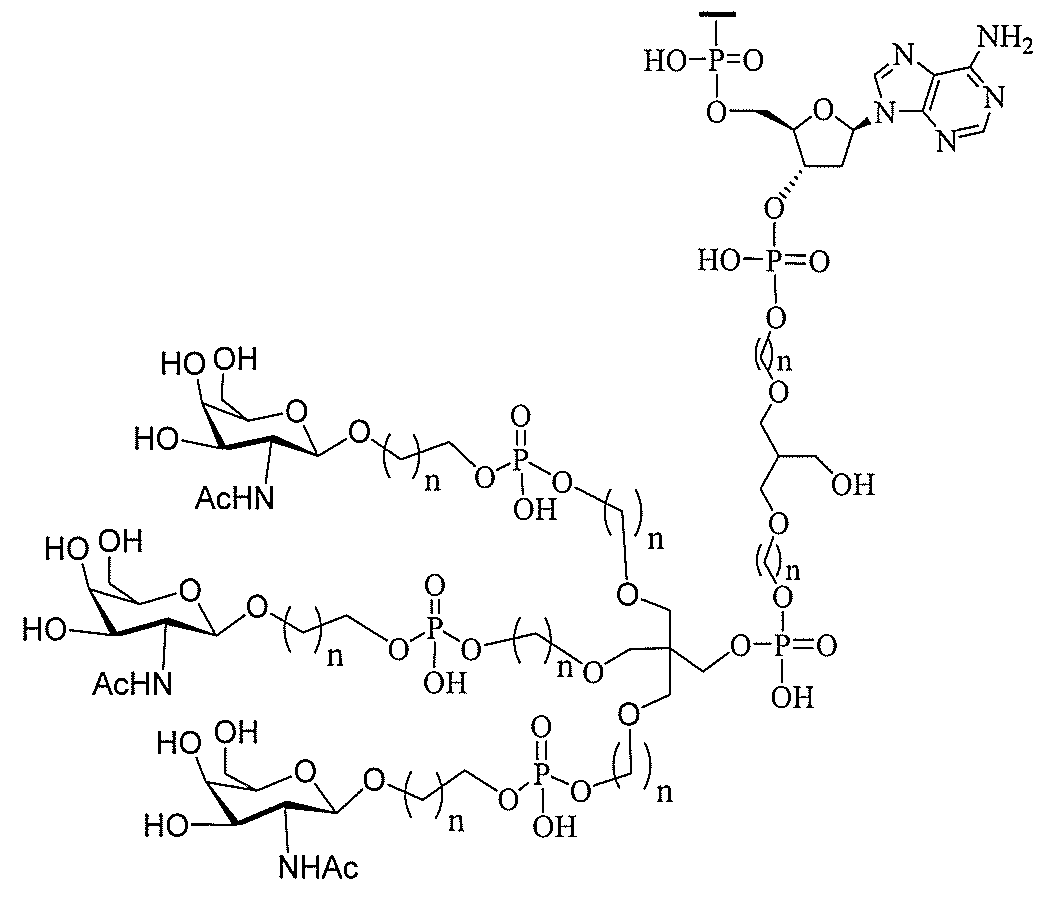
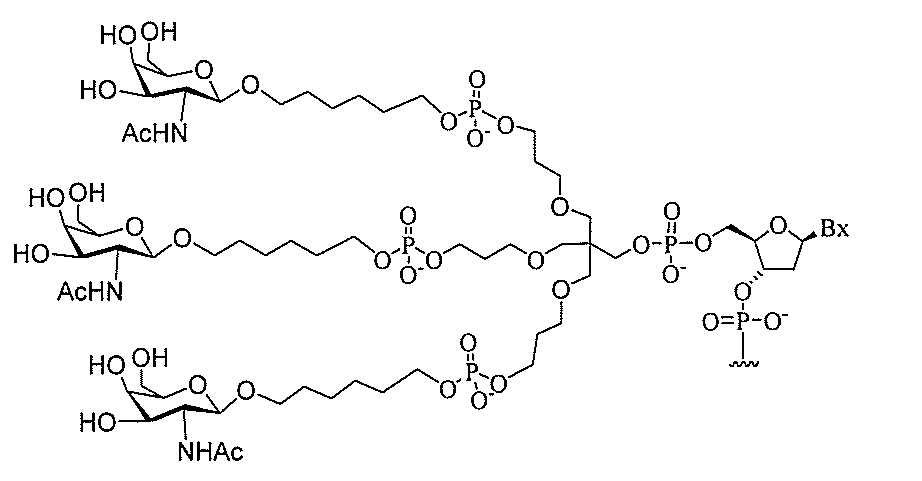
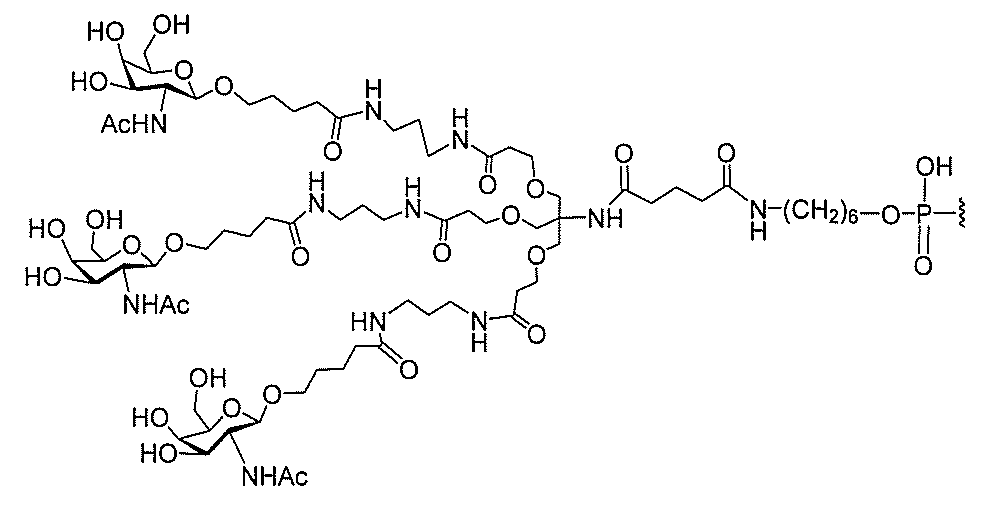
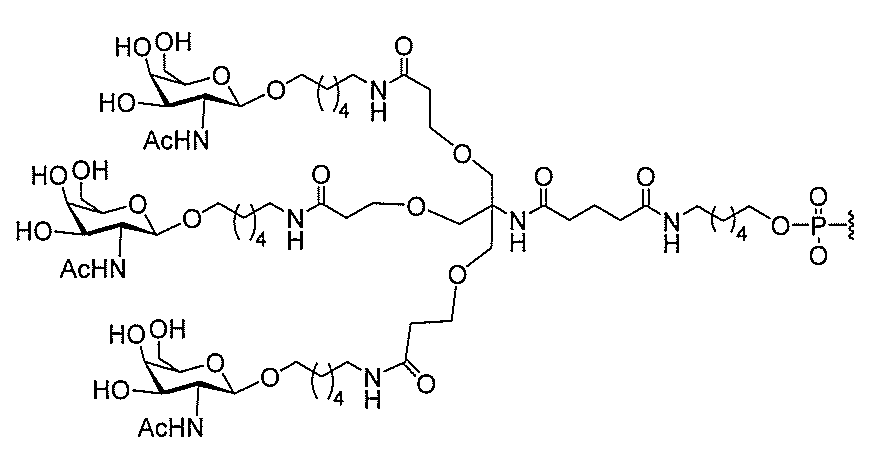
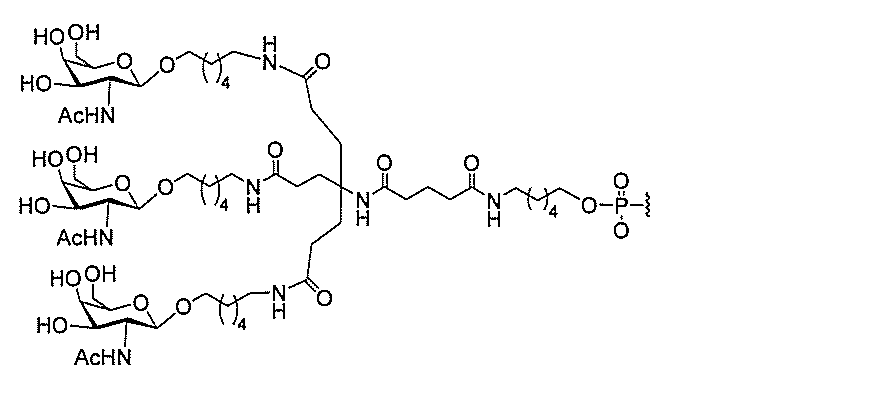
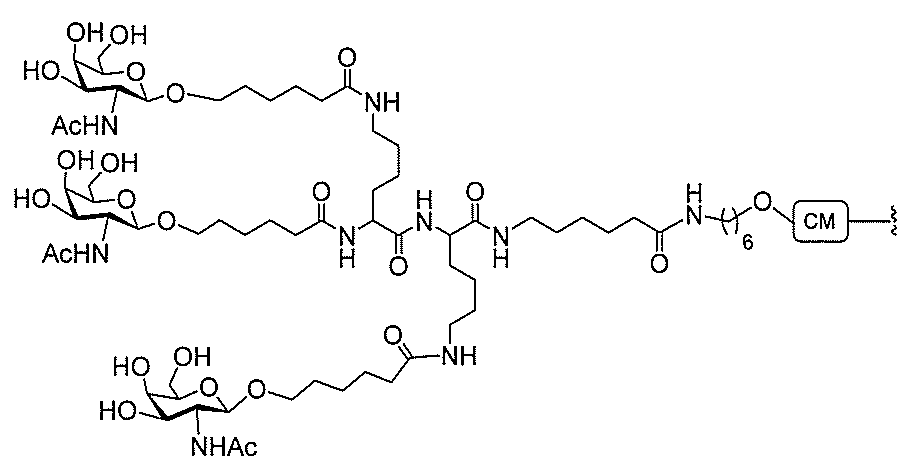
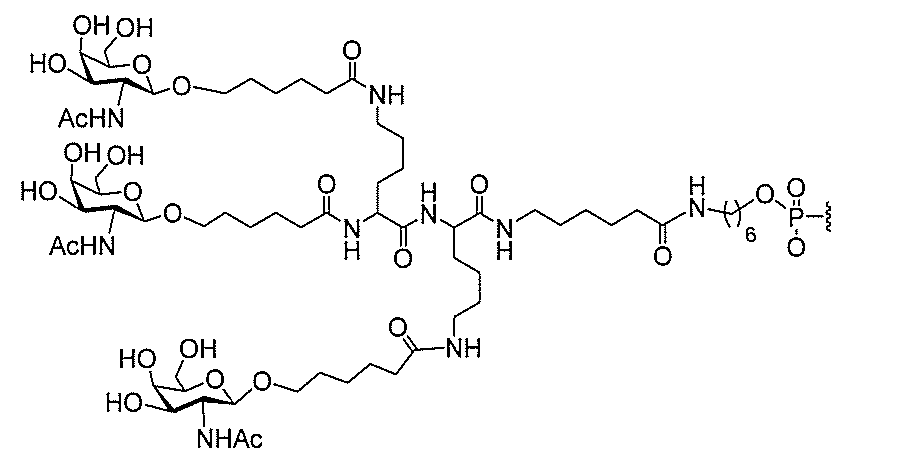
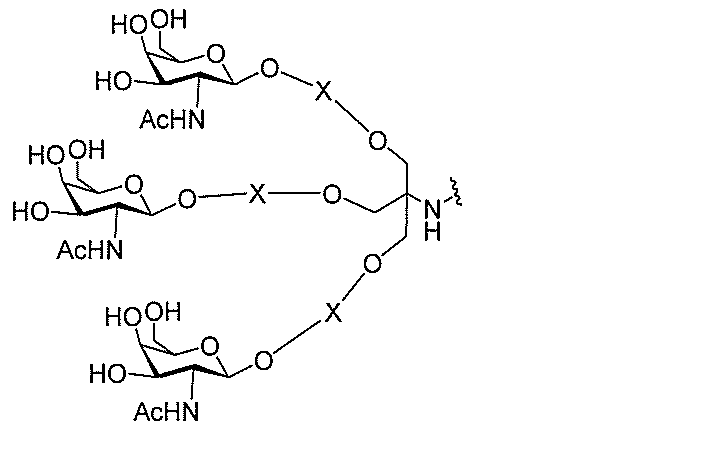
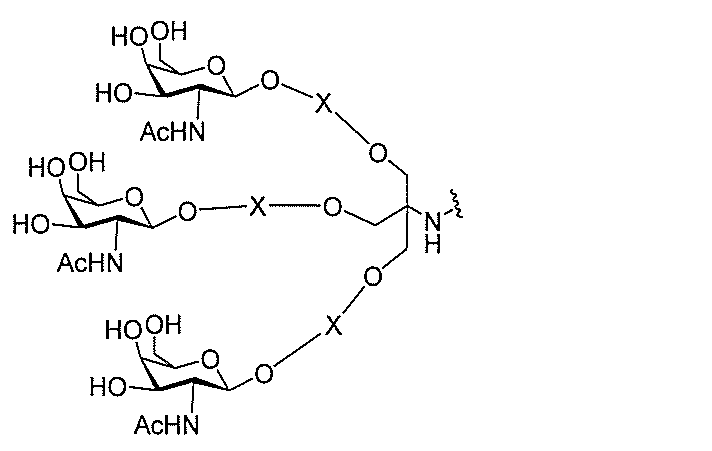
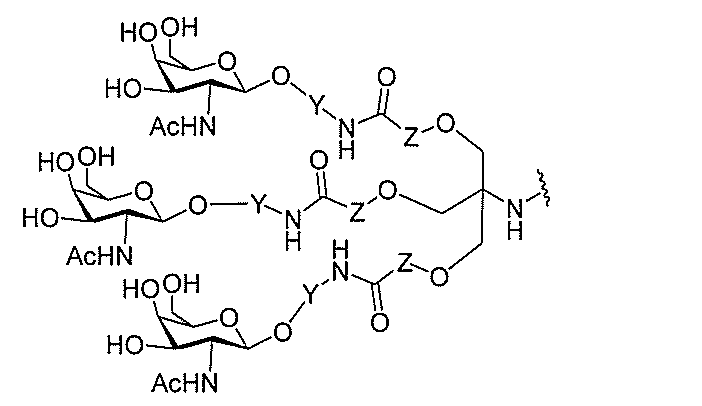
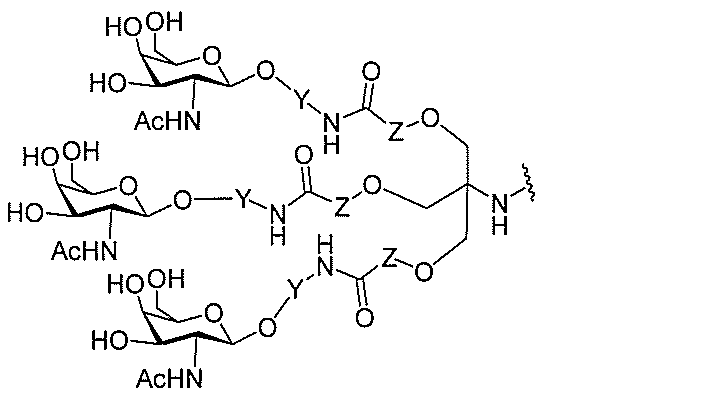
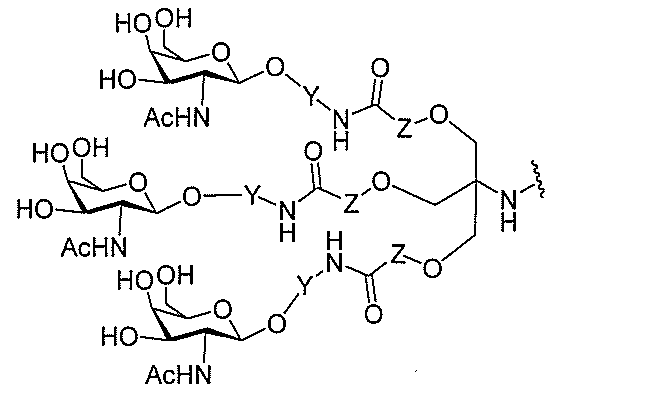
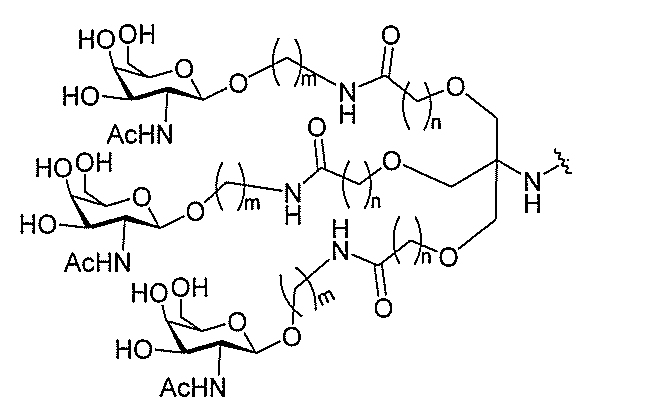
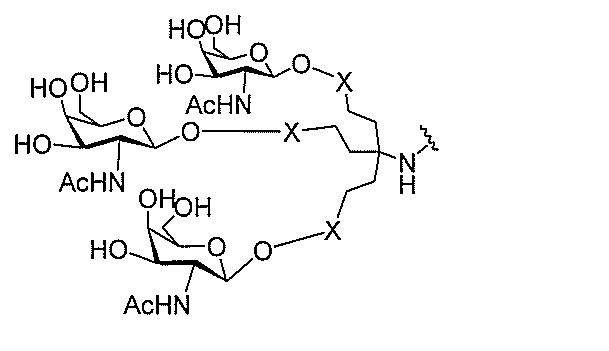
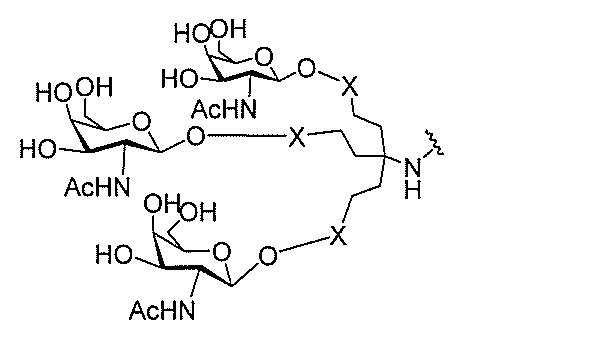
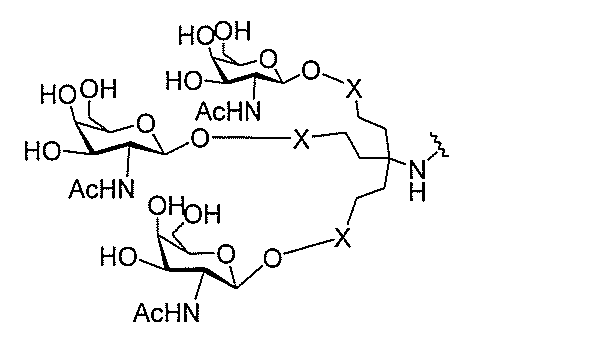
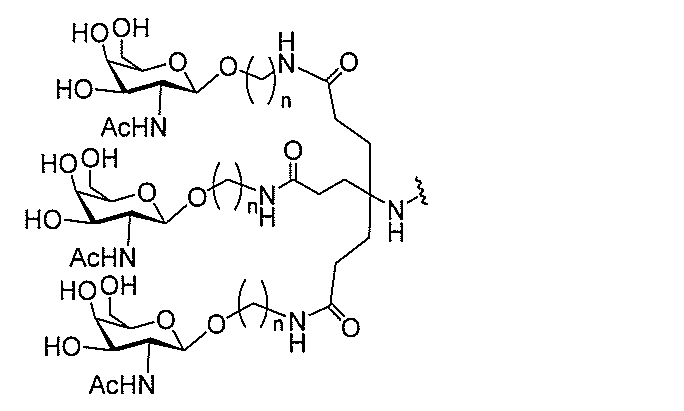
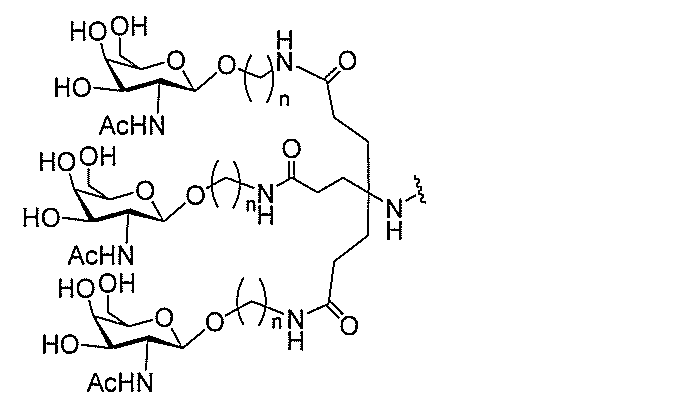
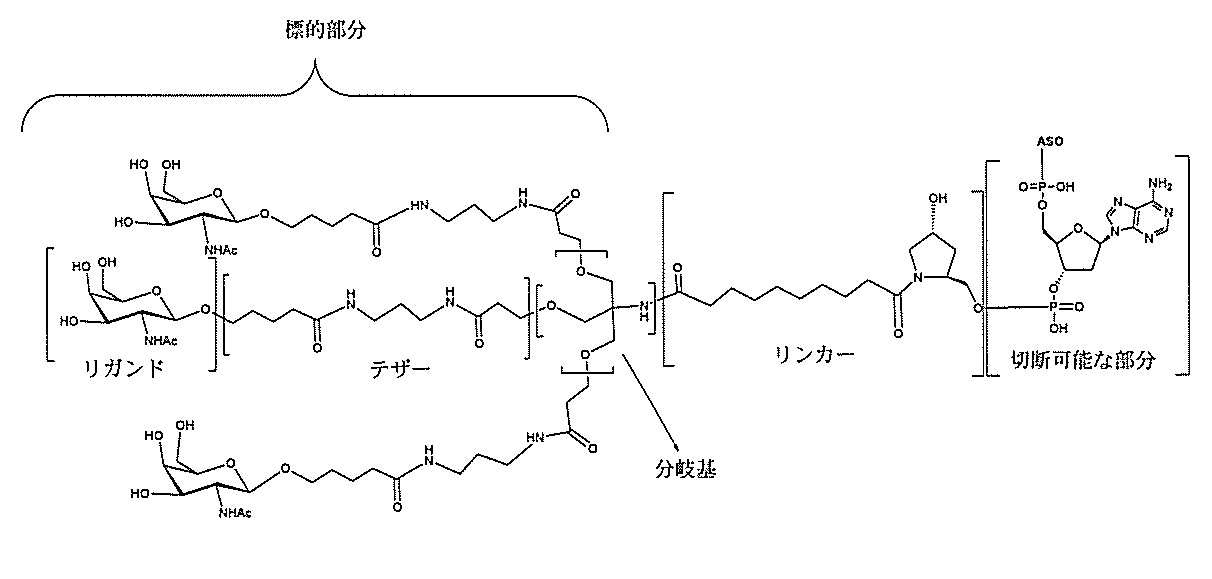
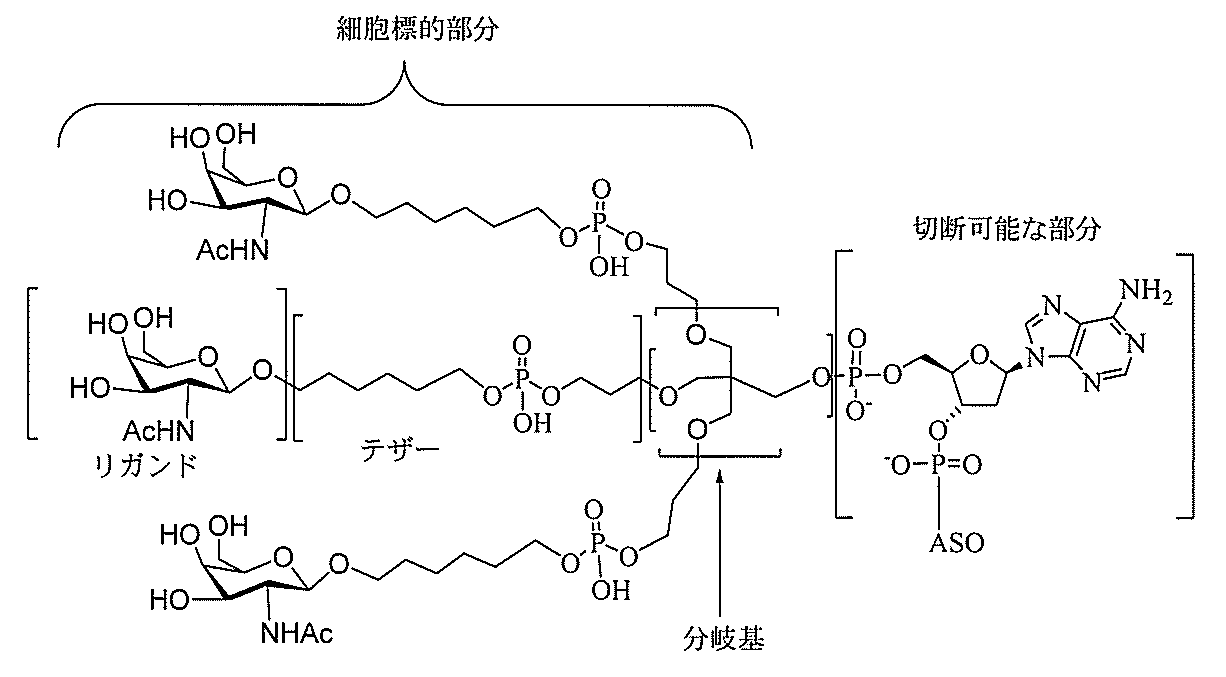
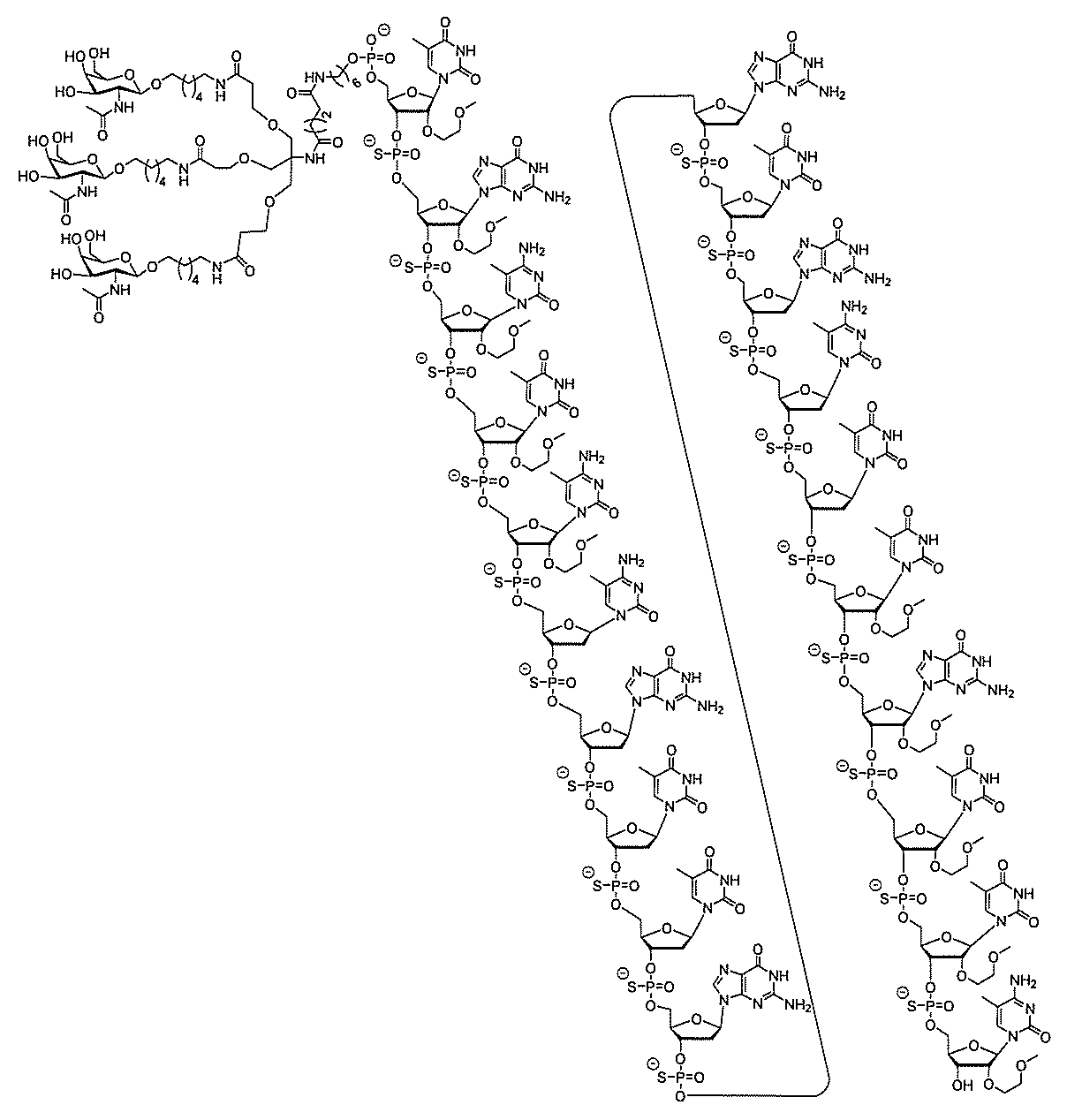
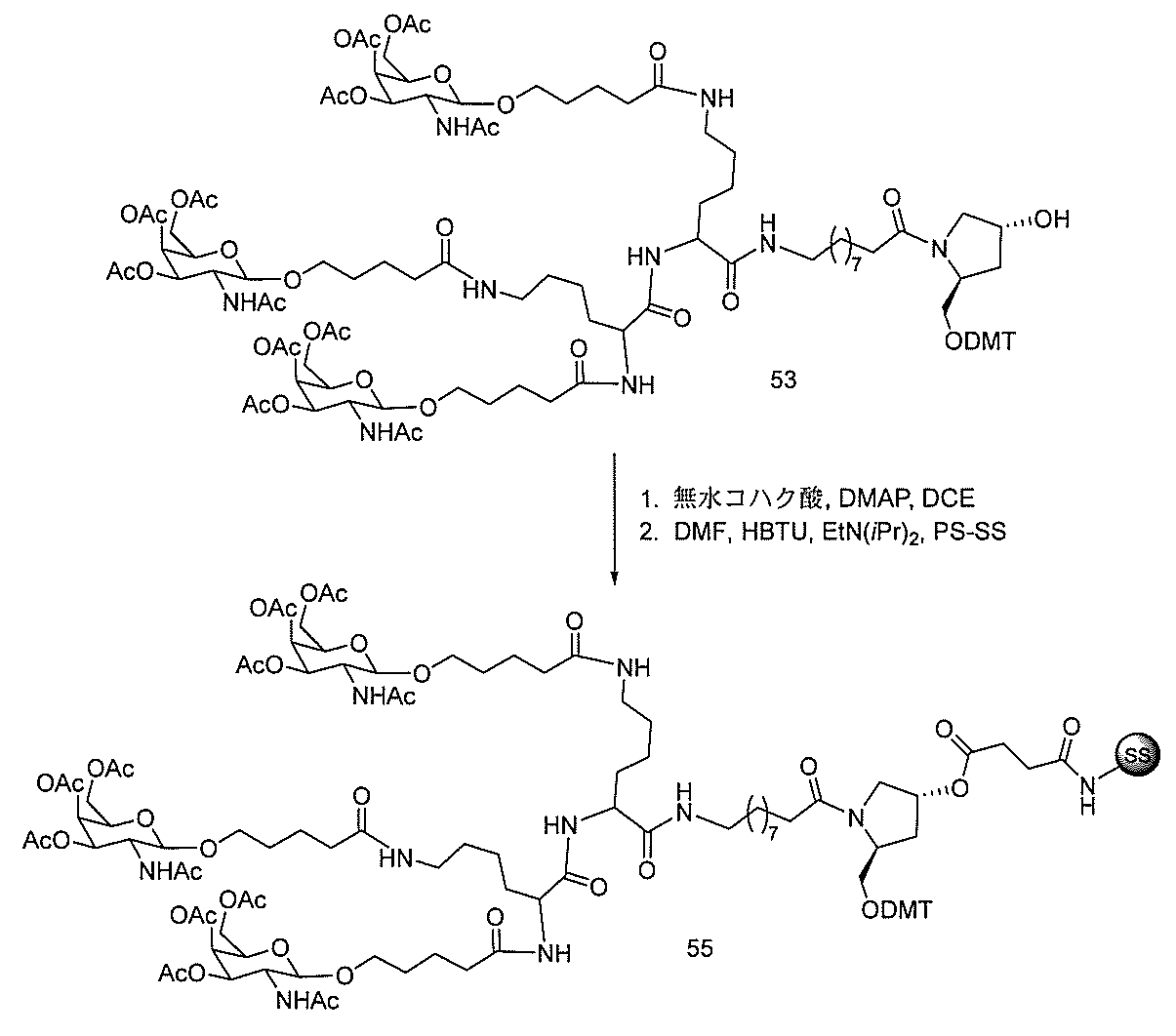
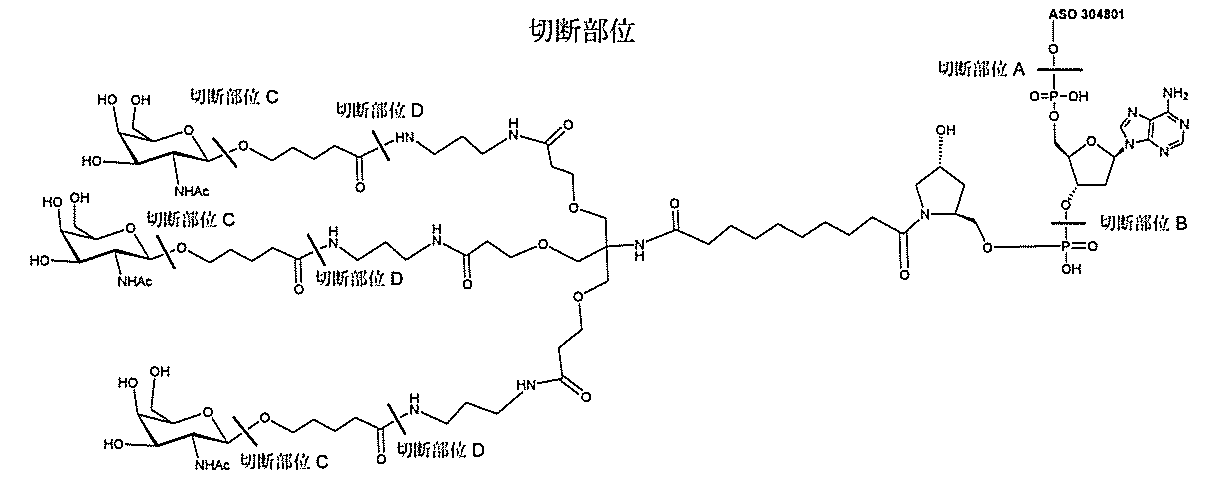
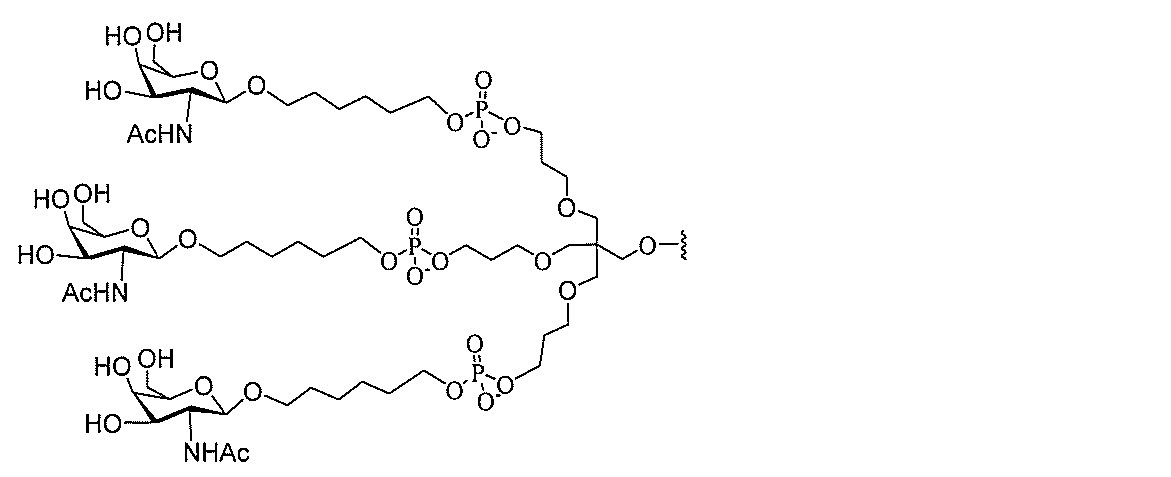
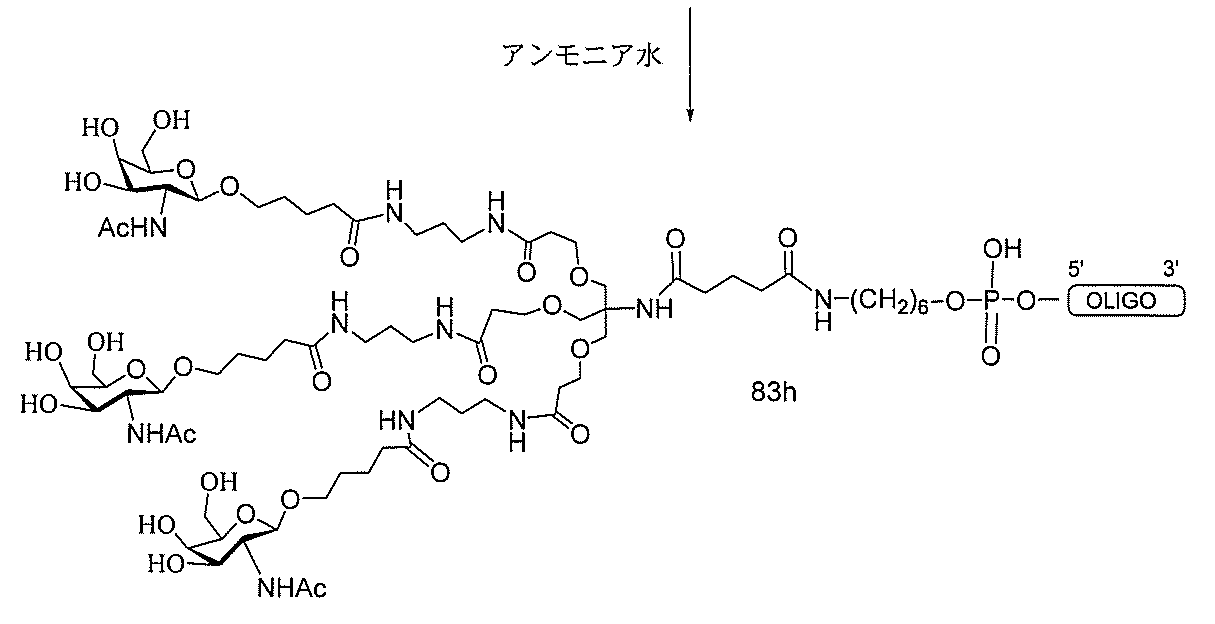
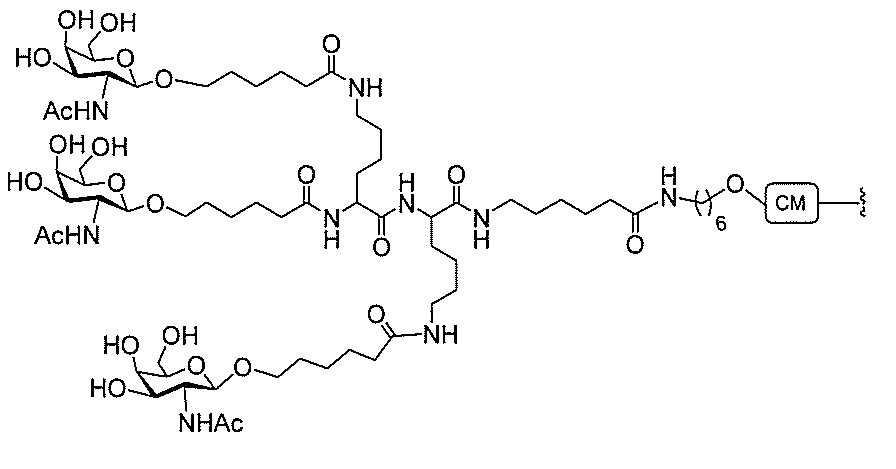
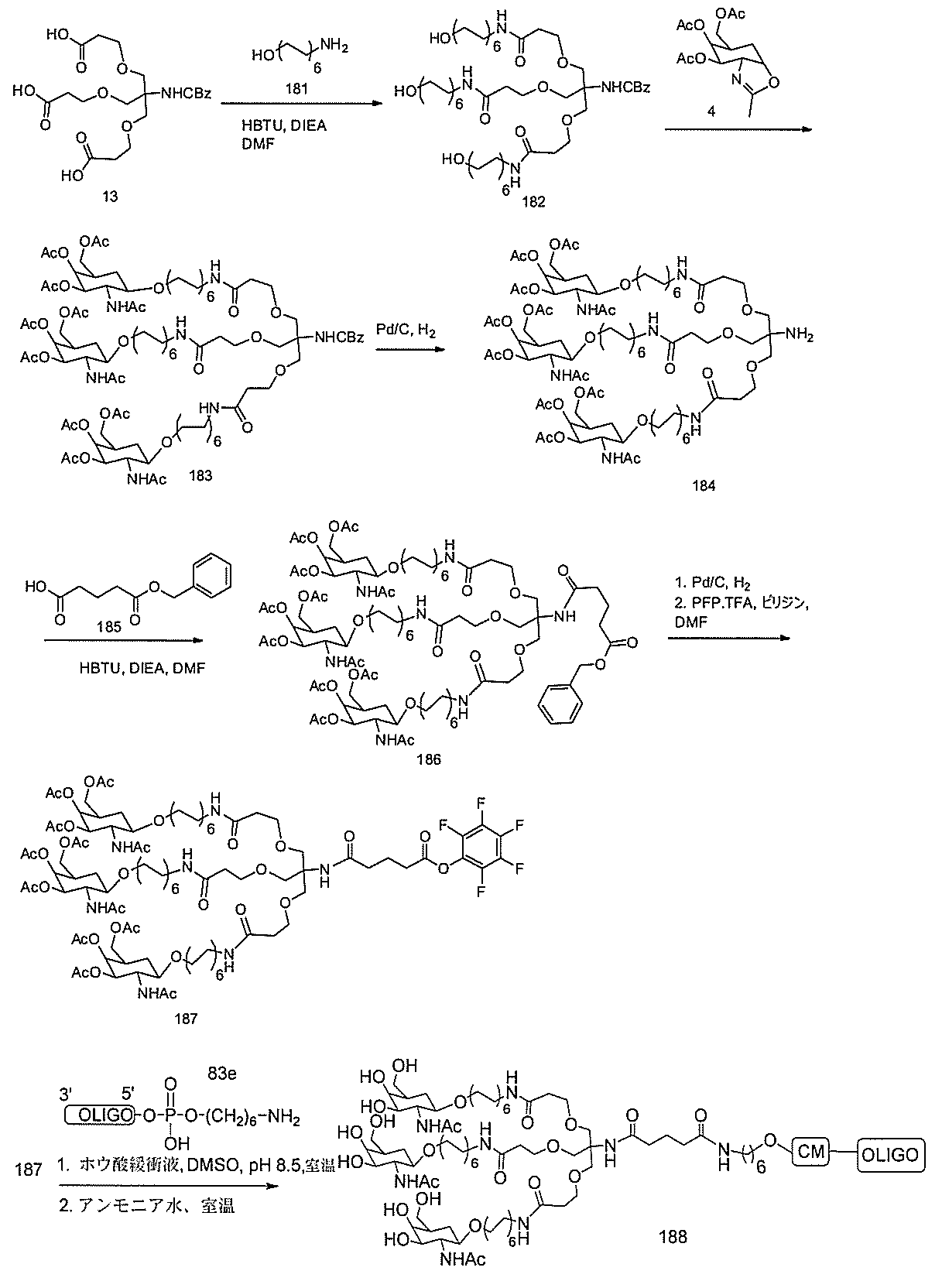
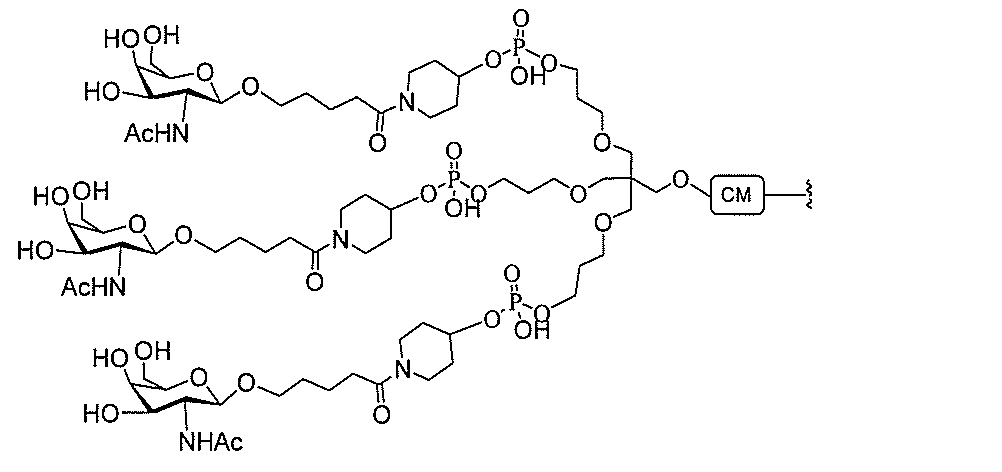
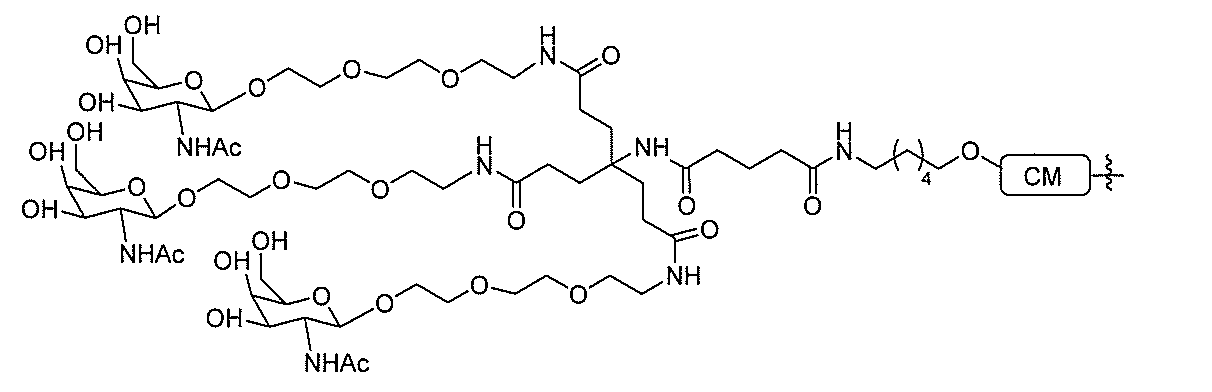
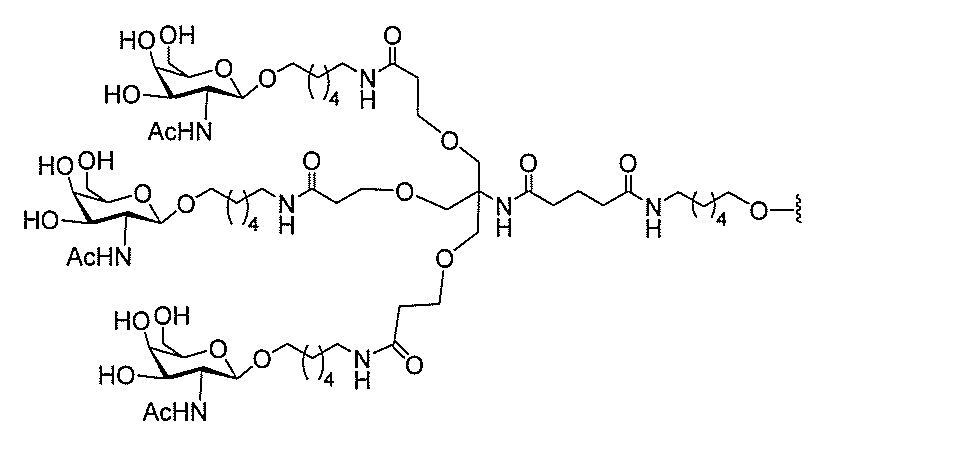
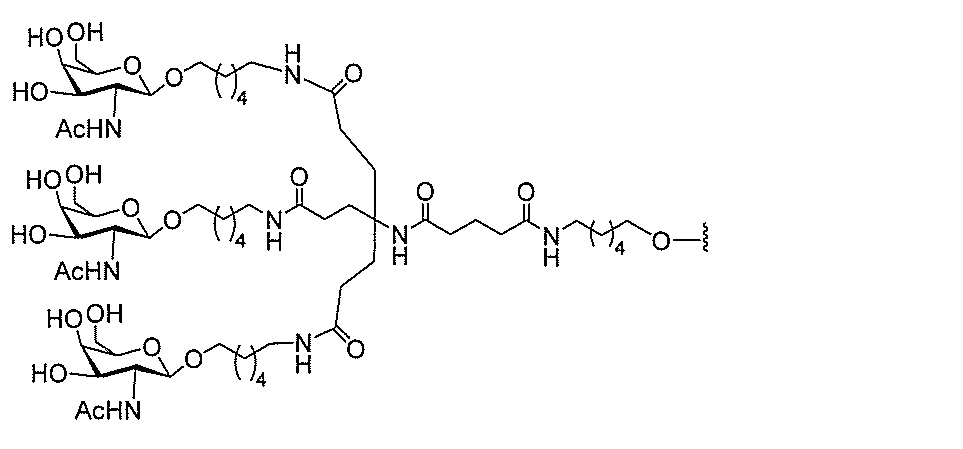
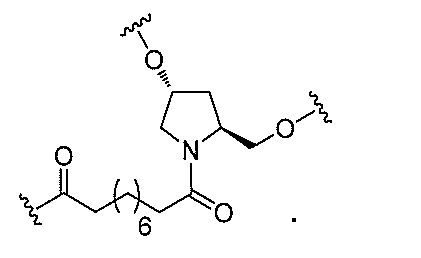
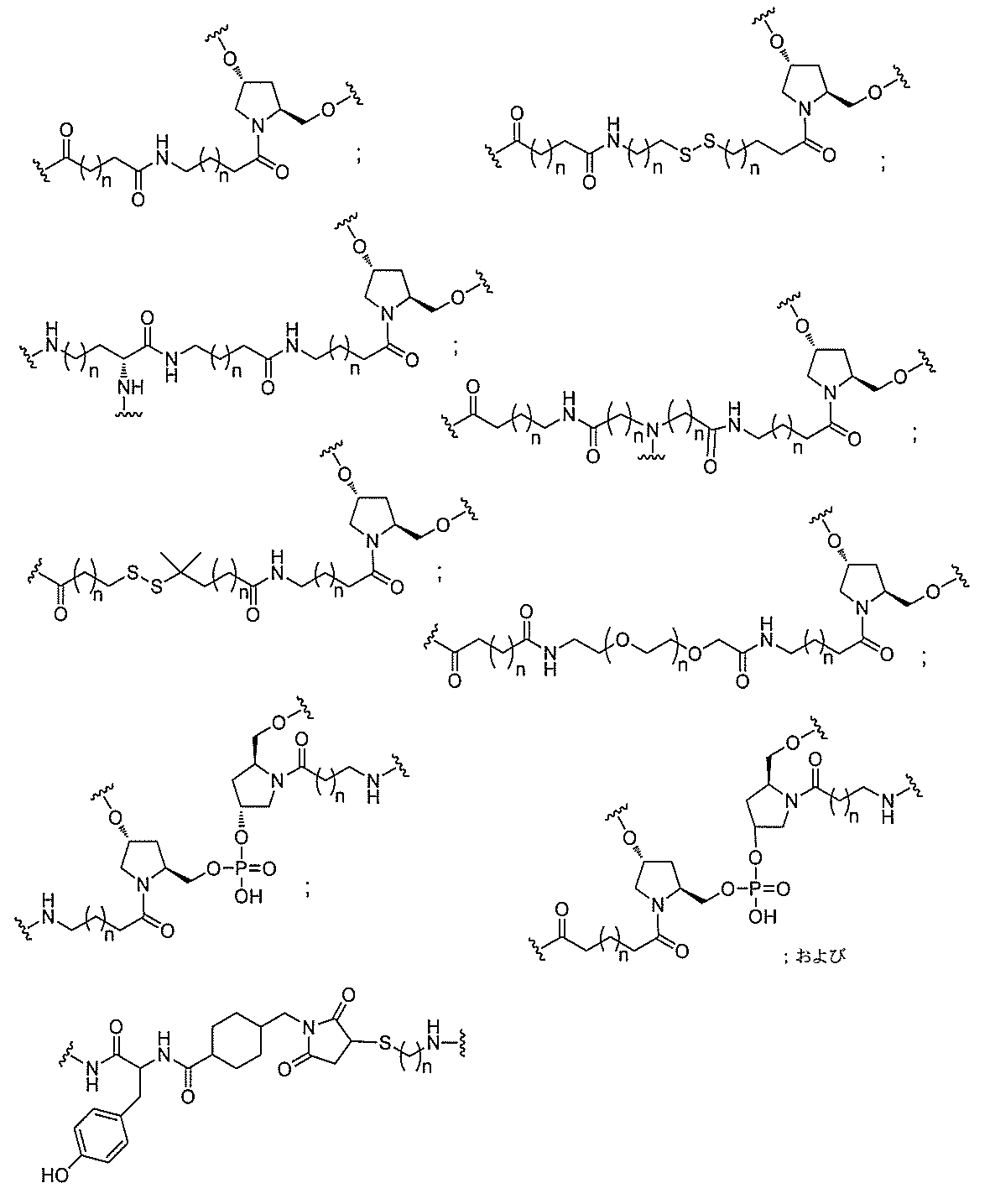
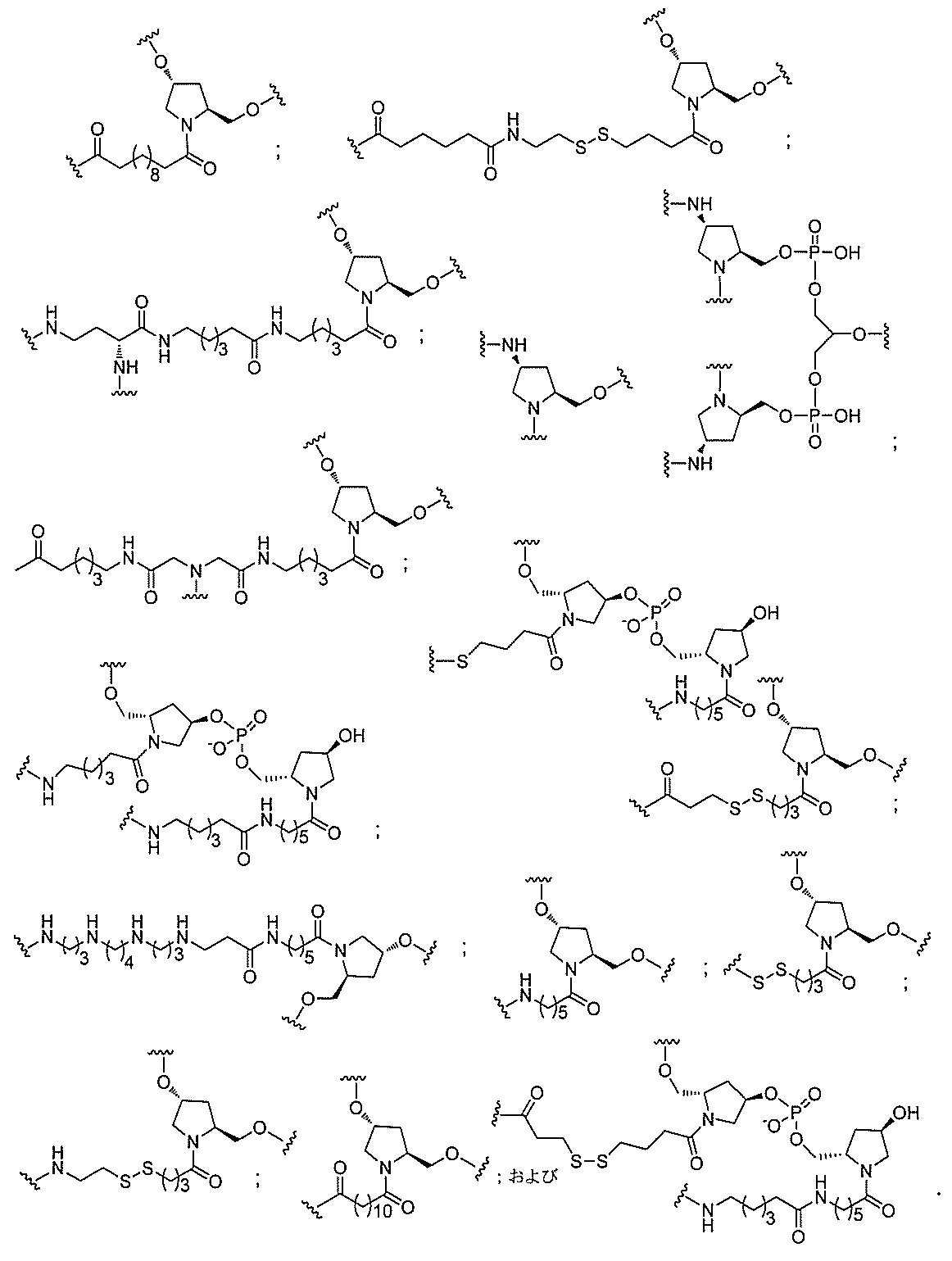
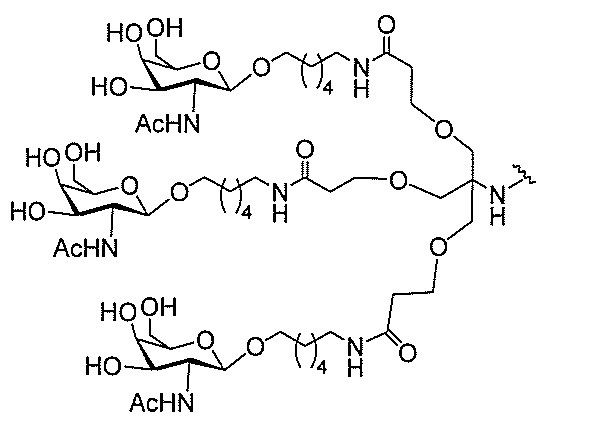
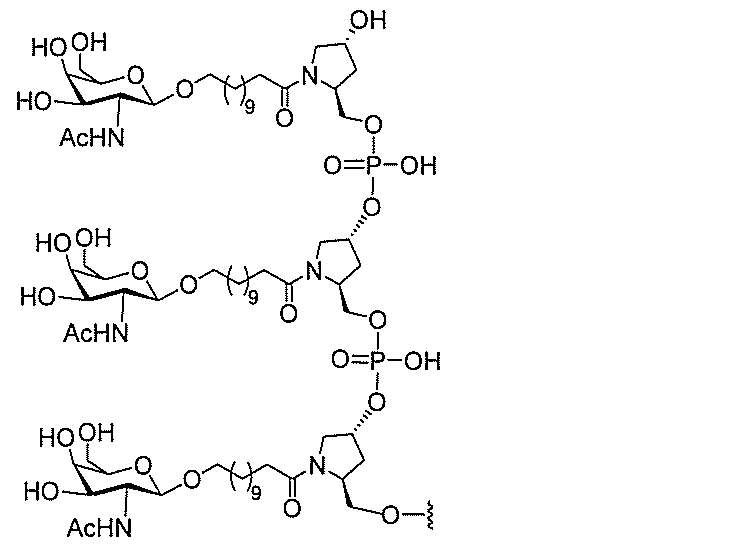
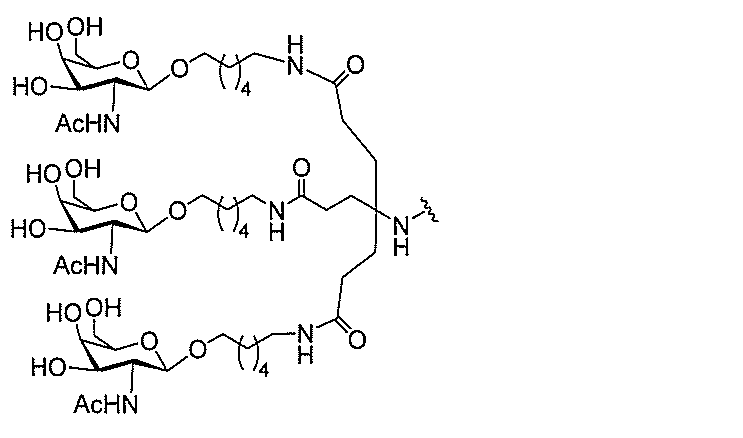
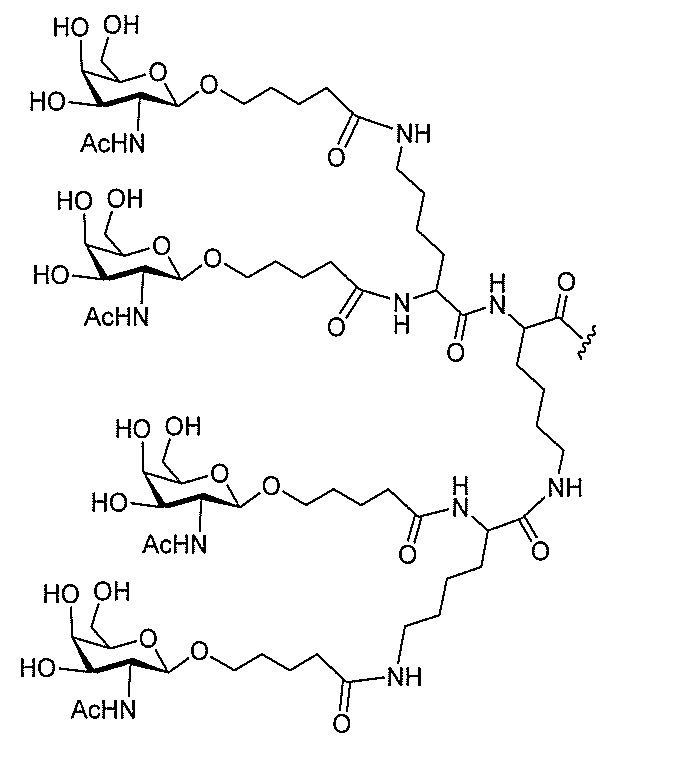
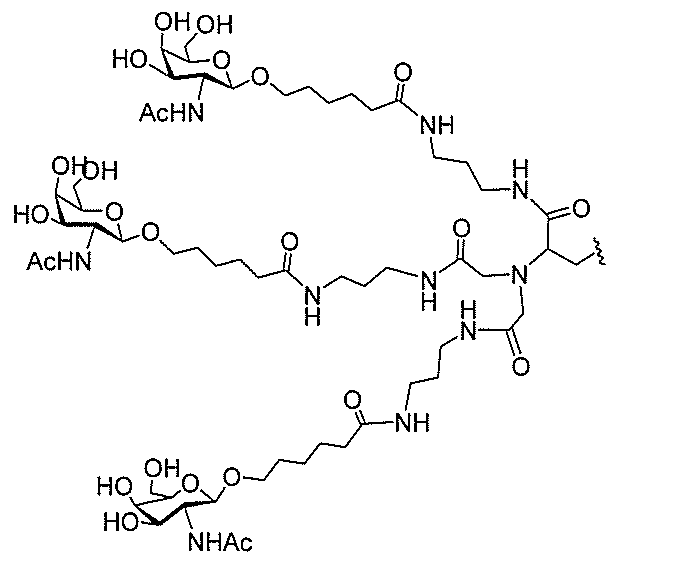
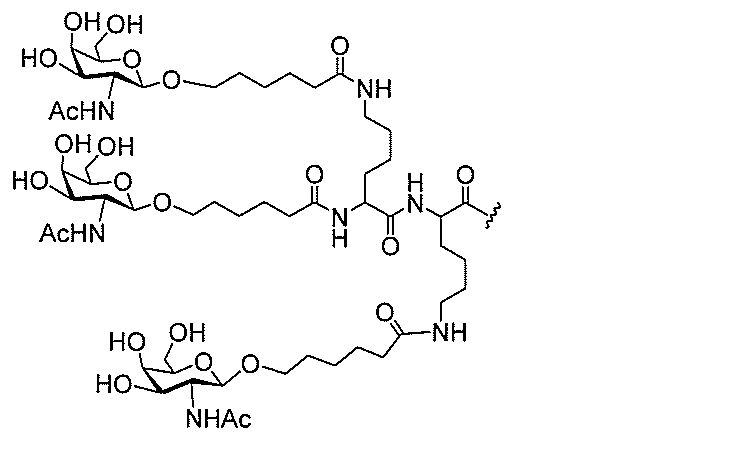
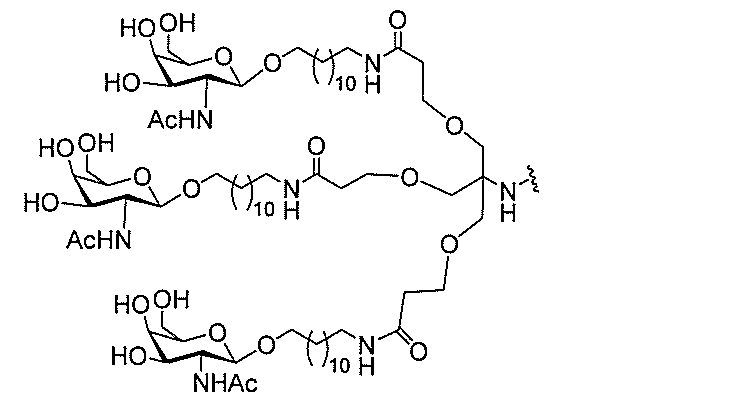
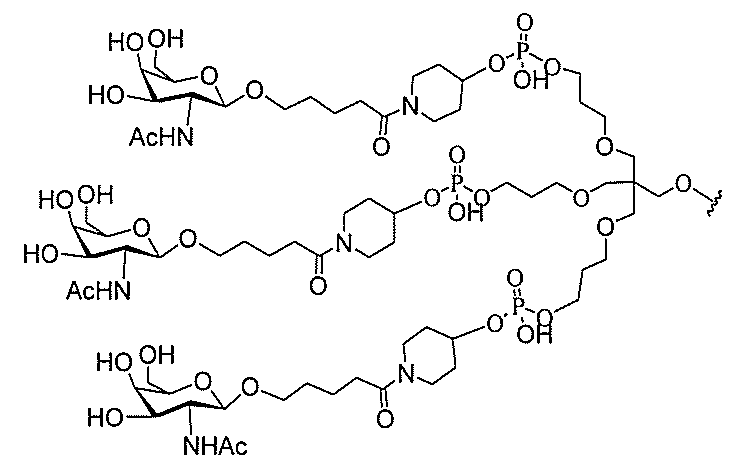
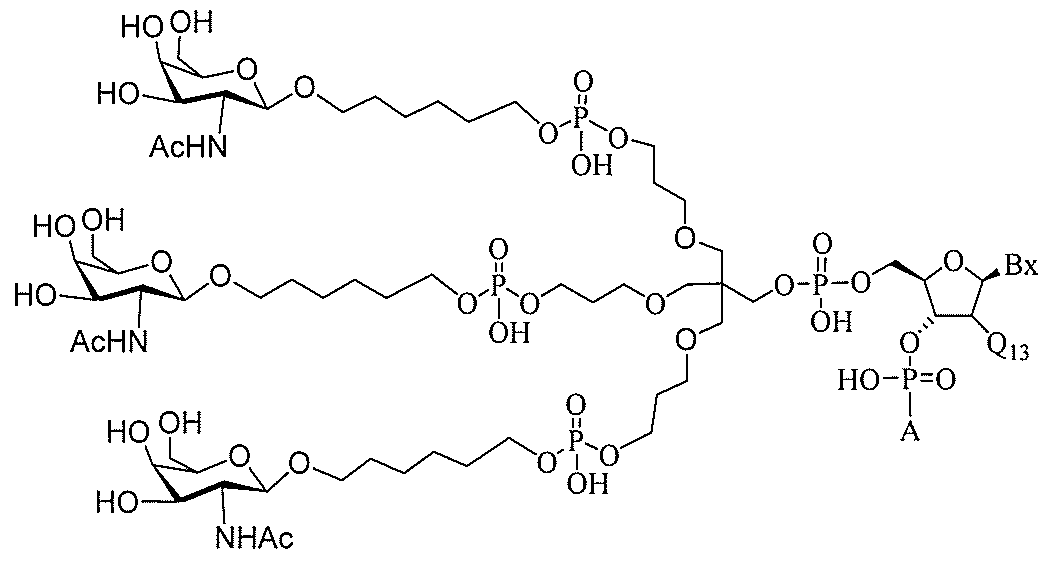
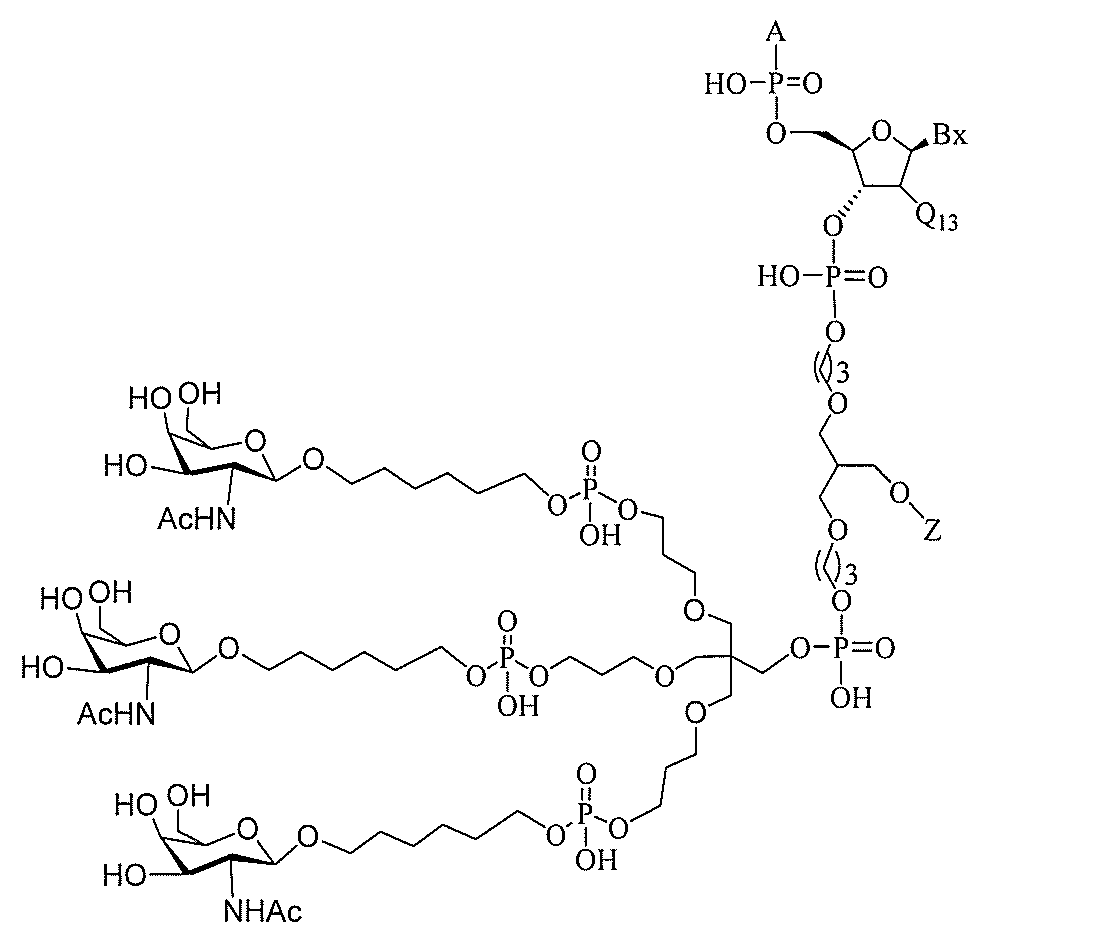
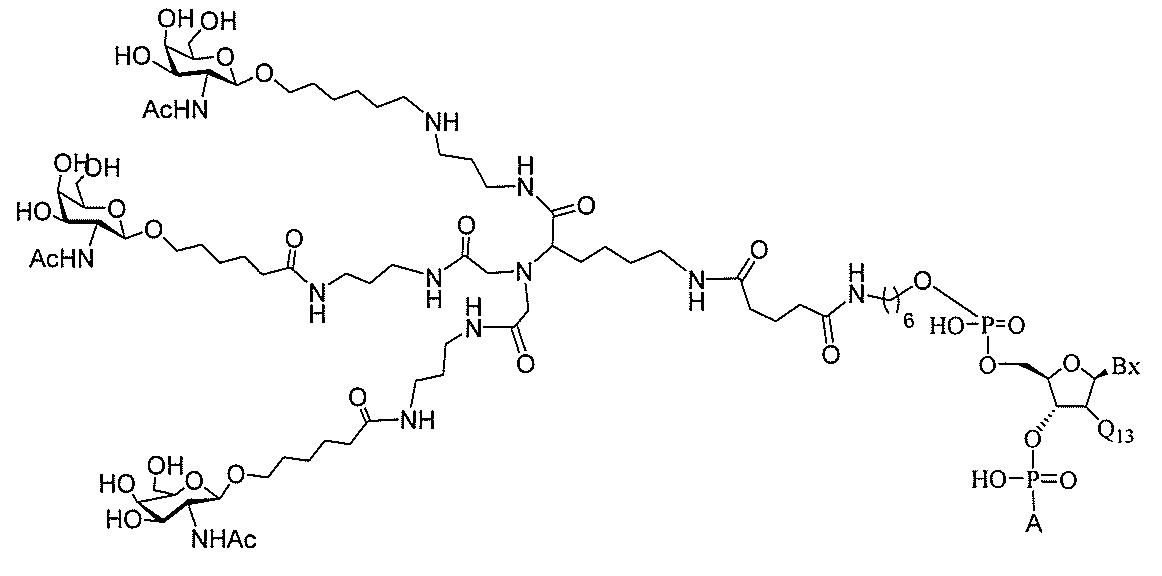
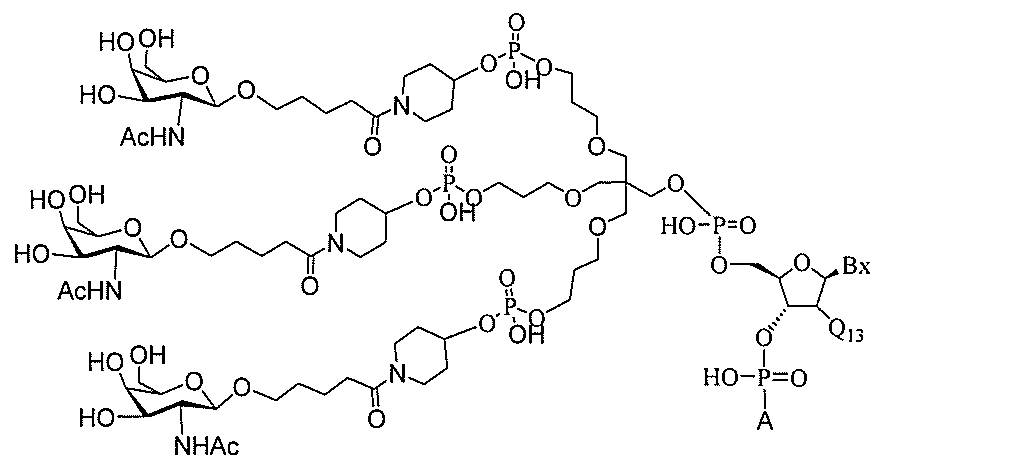
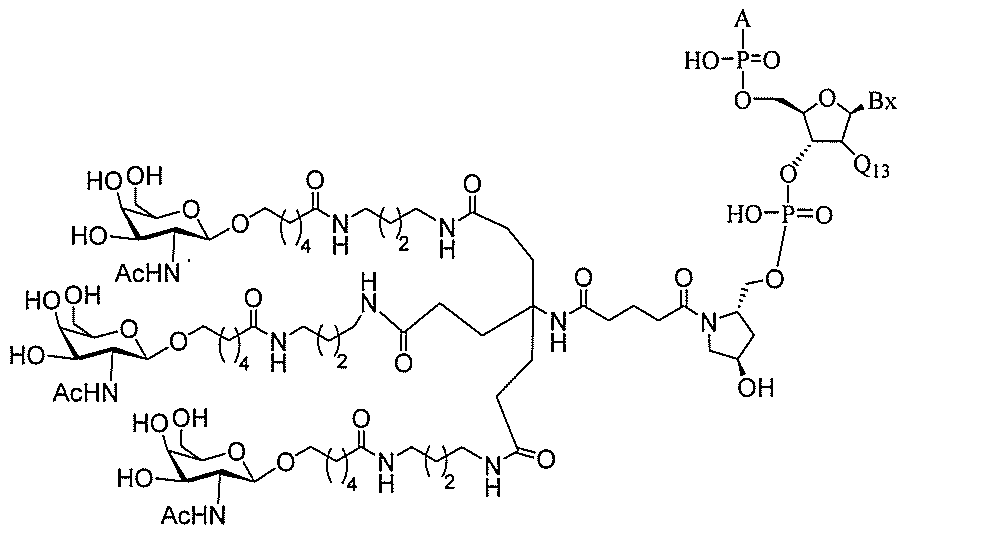
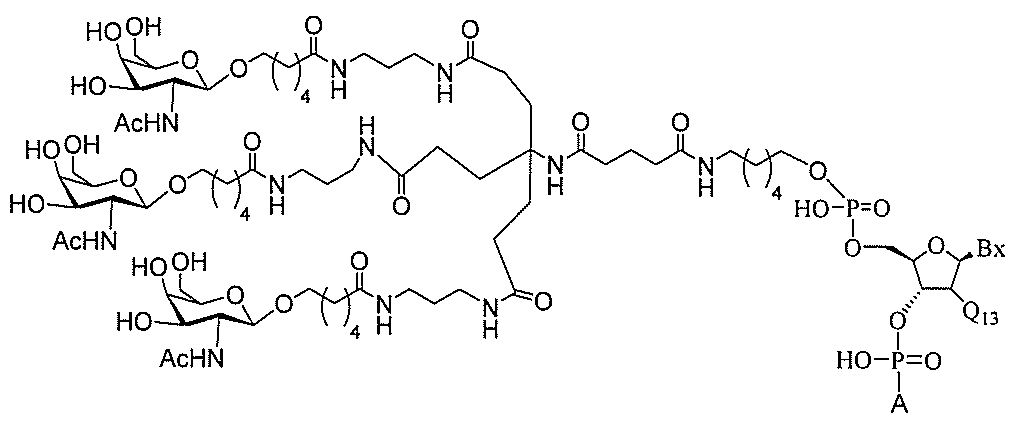
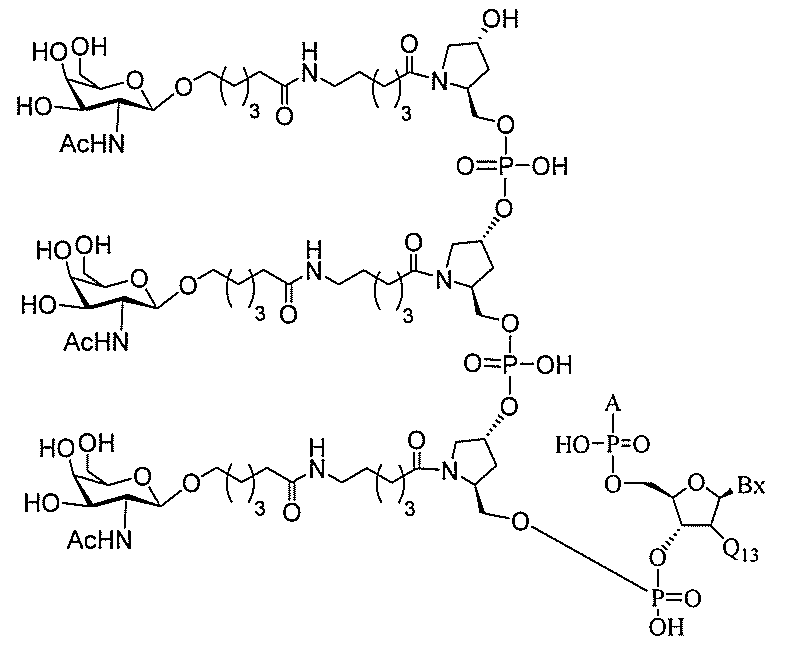
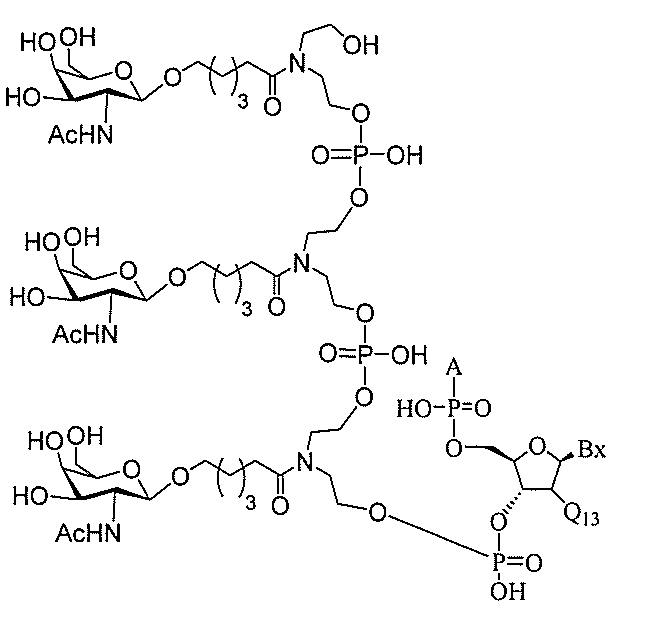
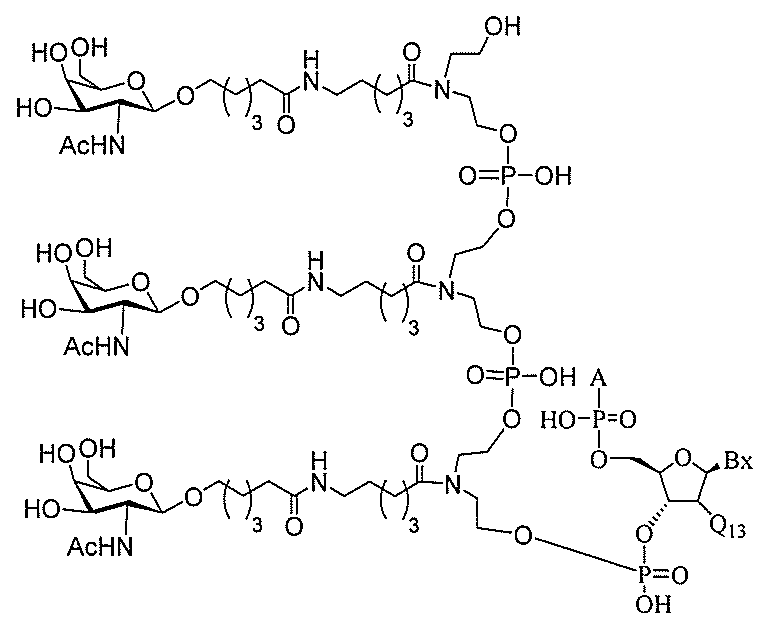
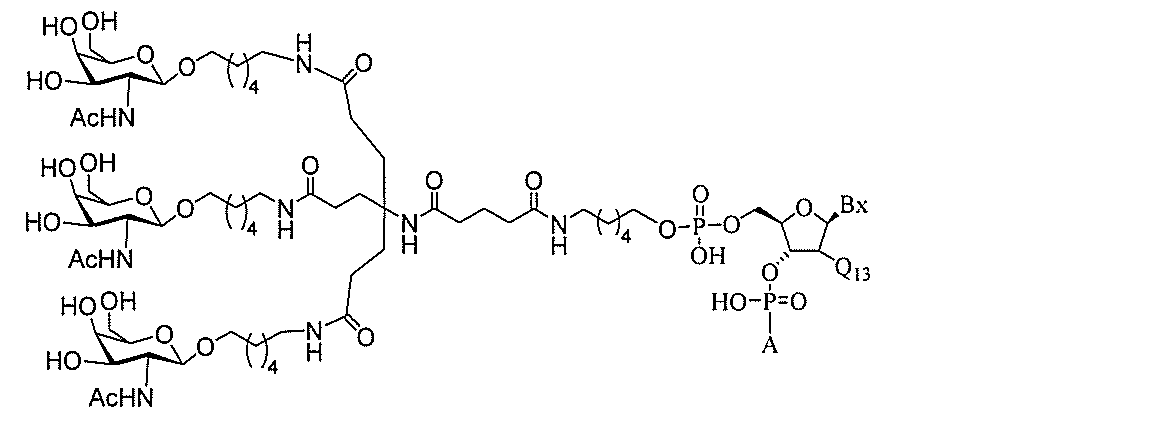
る。
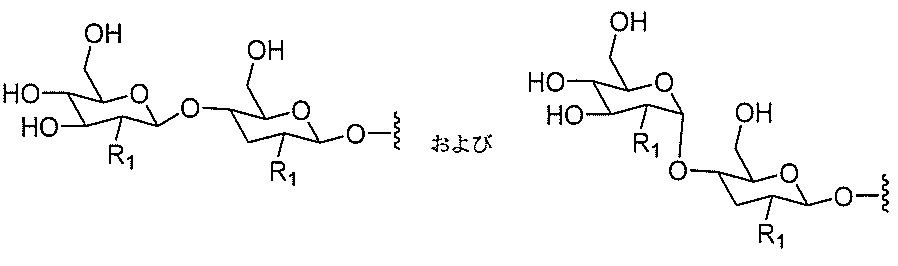
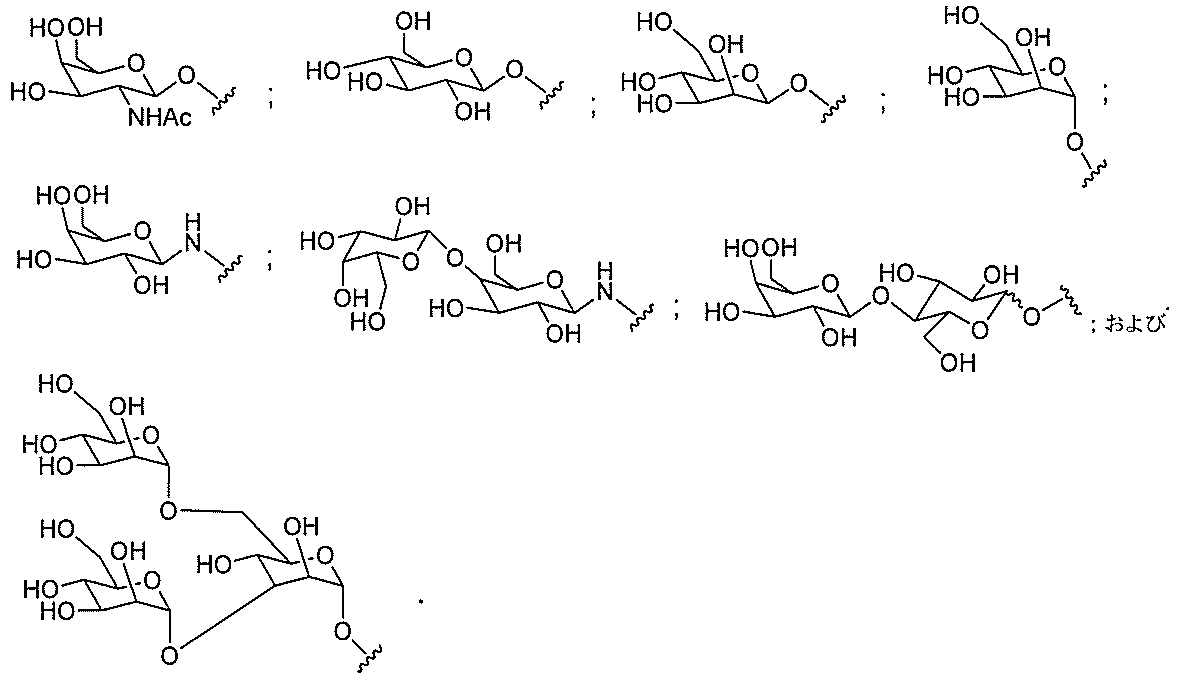
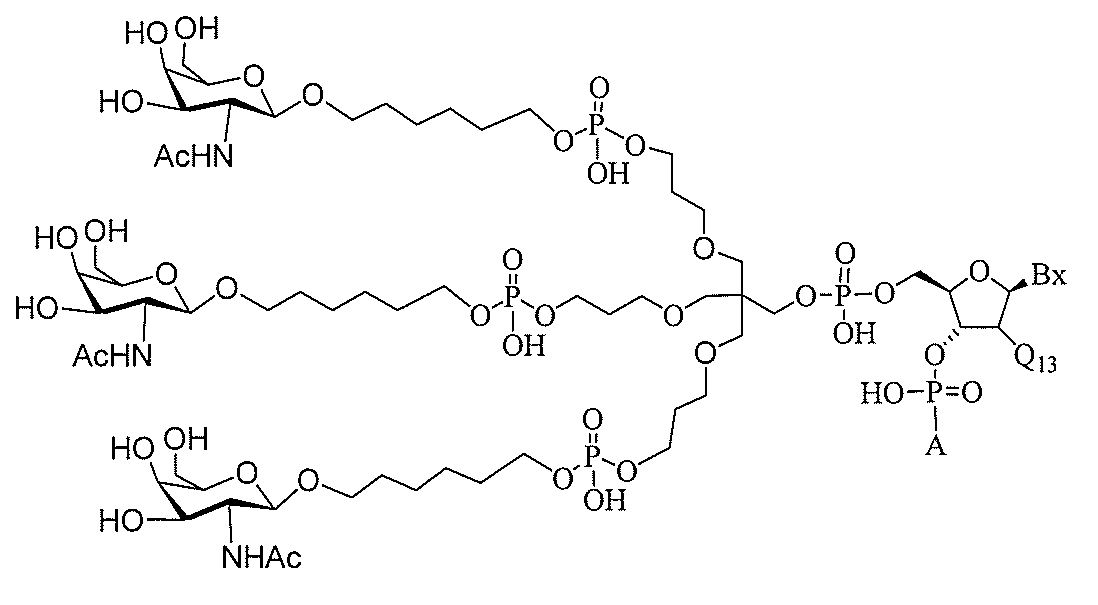
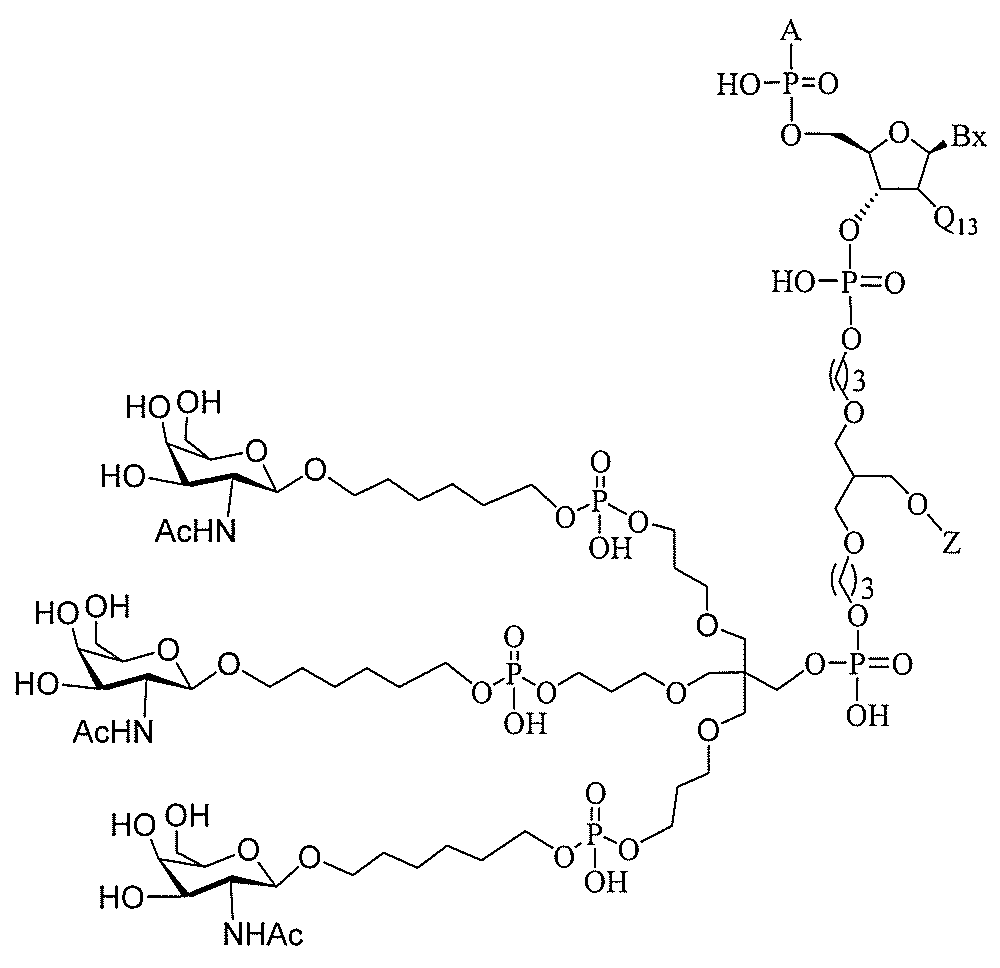
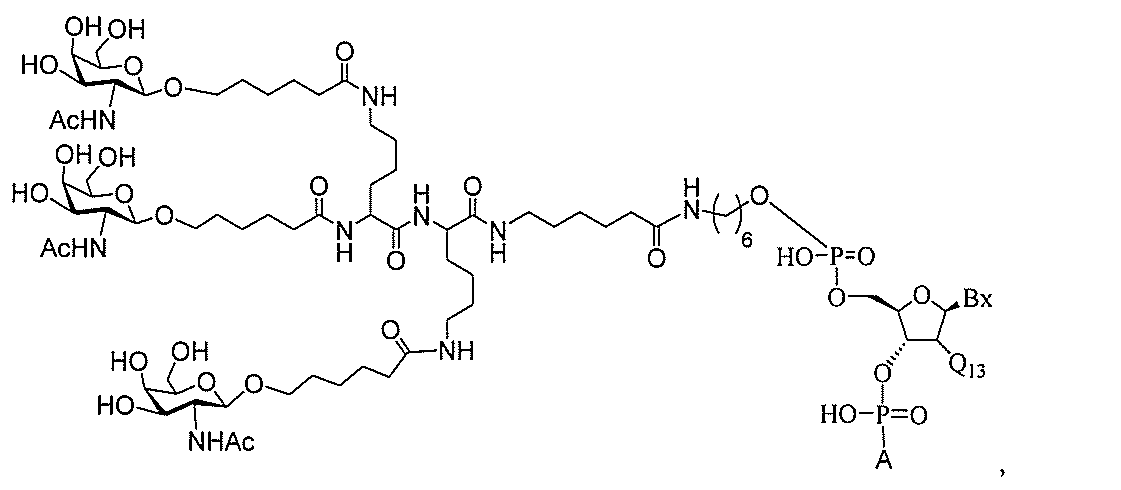
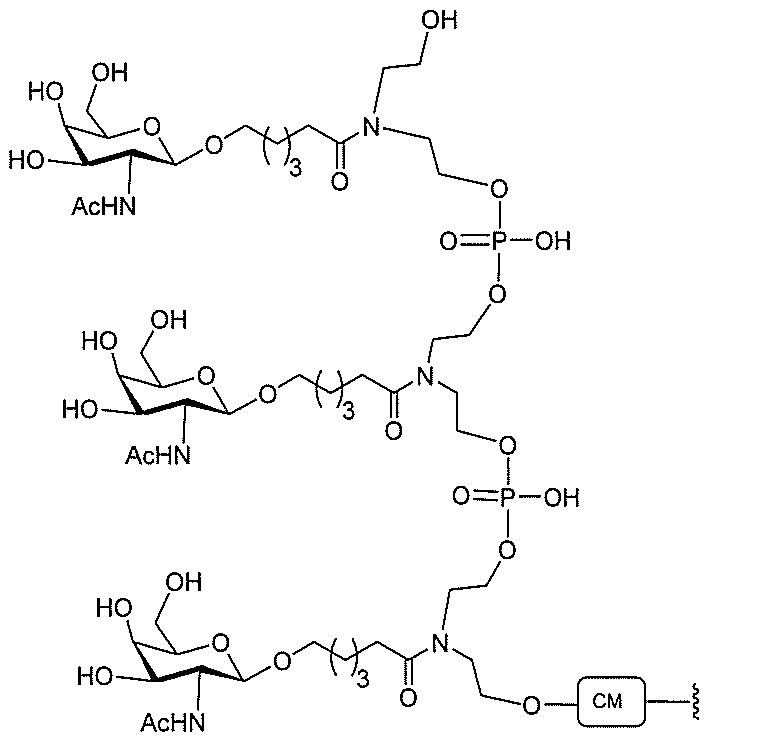
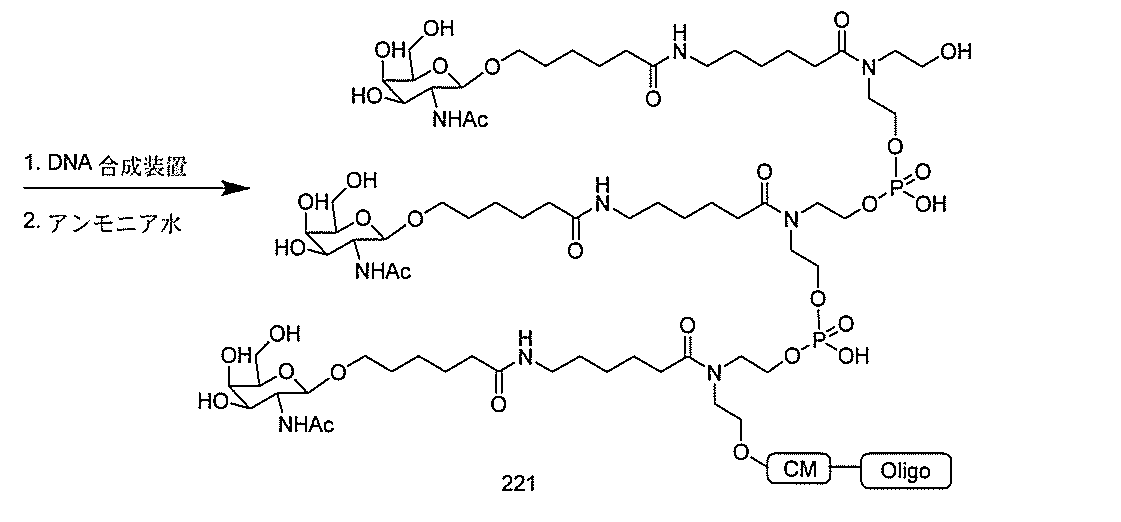
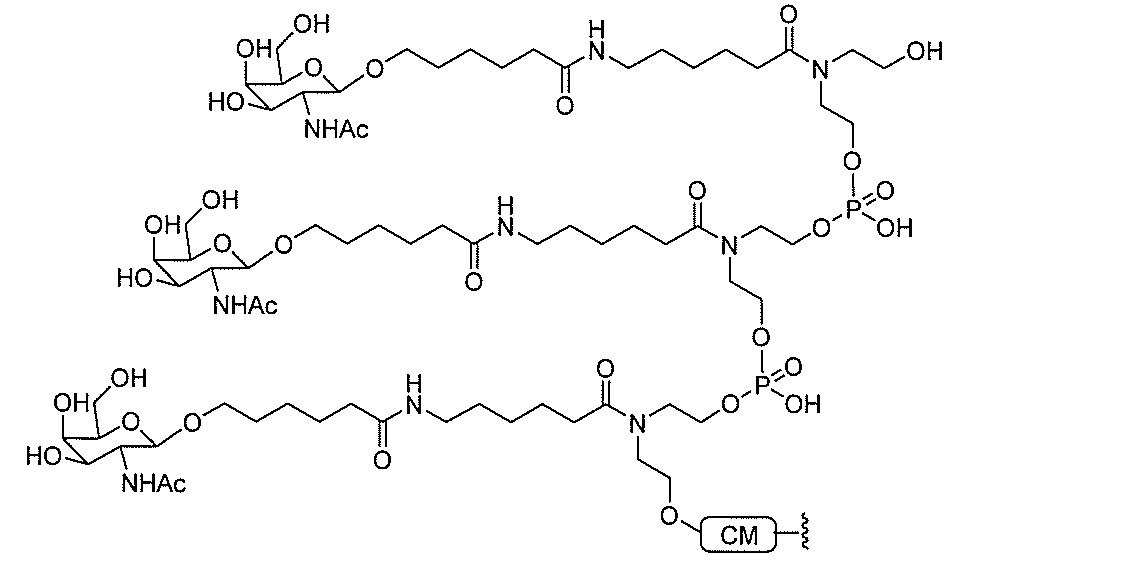
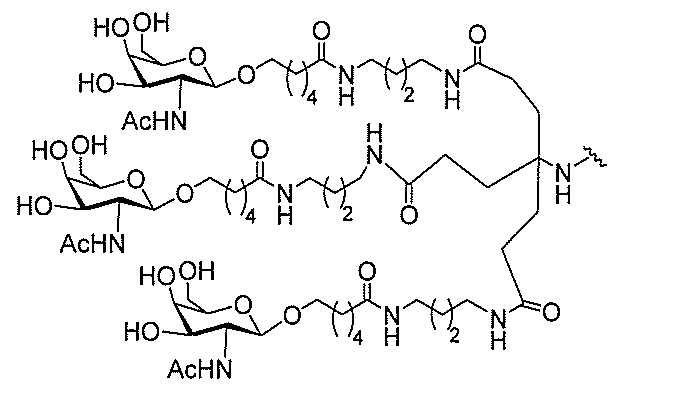
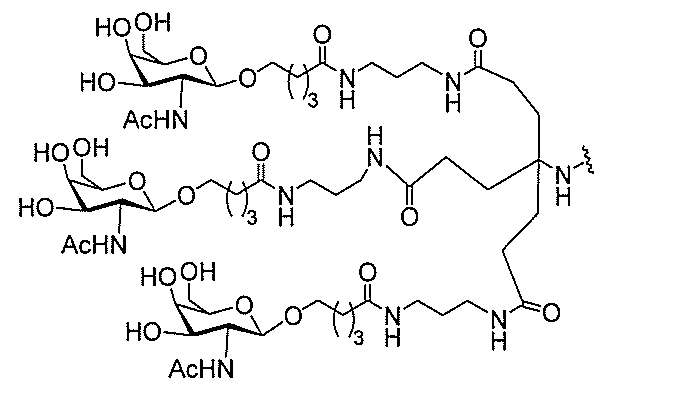
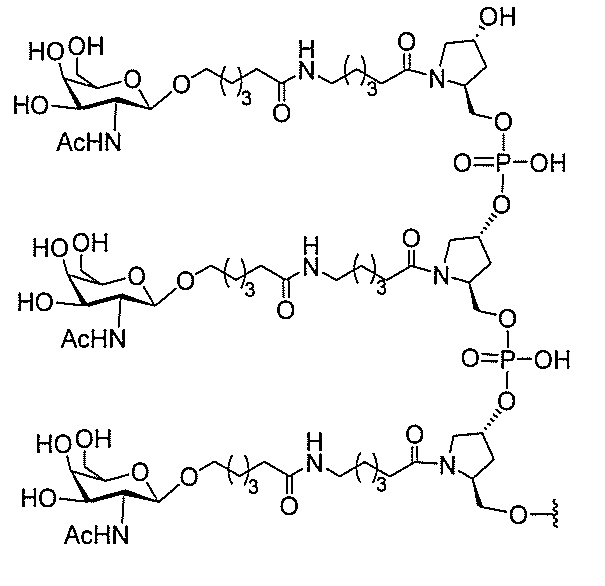
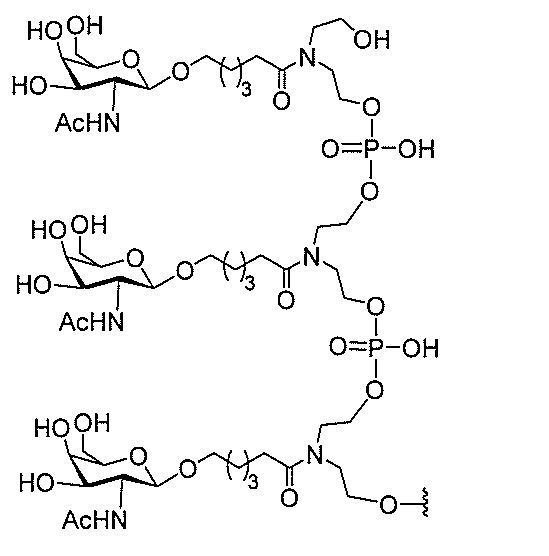
たは切断可能なヌクレオシド)およびGalNAcクラスター部分等の炭水化物クラスタ
ー部分を含む。そのような炭水化物クラスター部分は、標的部分と、任意に、共役リンカ
ーを含む。ある特定の実施形態において、炭水化物クラスター部分は、リガンドの数およ
び同一性によって特定される。例えば、ある特定の実施形態において、炭水化物クラスタ
ー部分は、3個のGalNAc基を含み、「GalNAc3」と表記される。ある特定の
実施形態において、炭水化物クラスター部分は、4個のGalNAc基を含み、「Gal
NAc4」と表記される。特定の炭水化物クラスター部分(特異的テザー、分岐、および
共役リンカー基を有する)は、本明細書に記載され、ローマ数字、続いて下付き文字「a
」で表記される。したがって、「GalNac3-1a」は、3個のGalNac基、な
らびに特異的に特定されたテザー、分岐、および結合基を有する共役基の特定の炭水化物
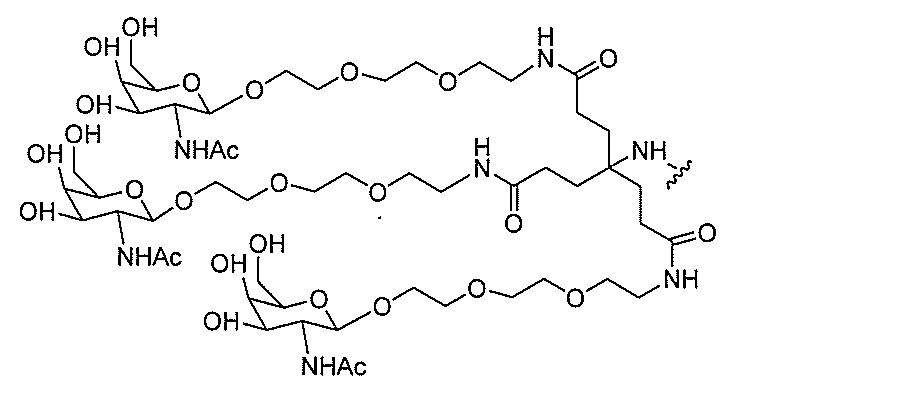
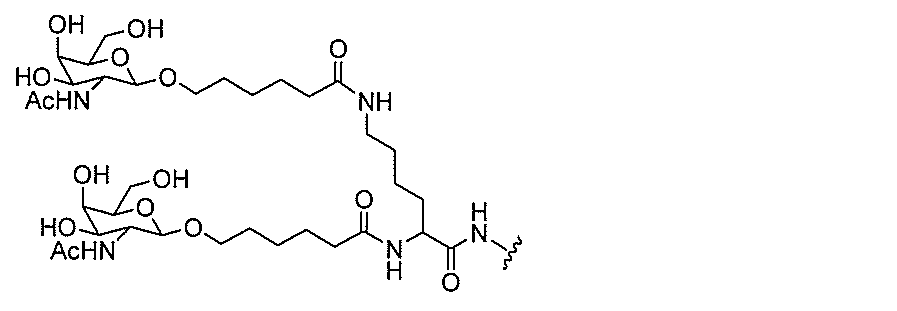
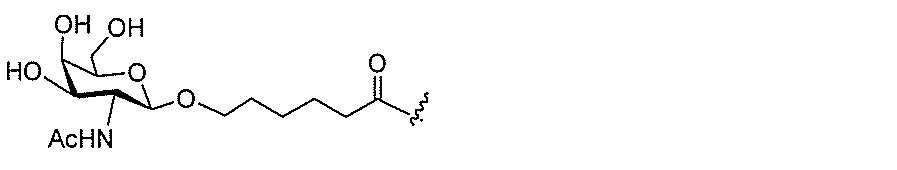
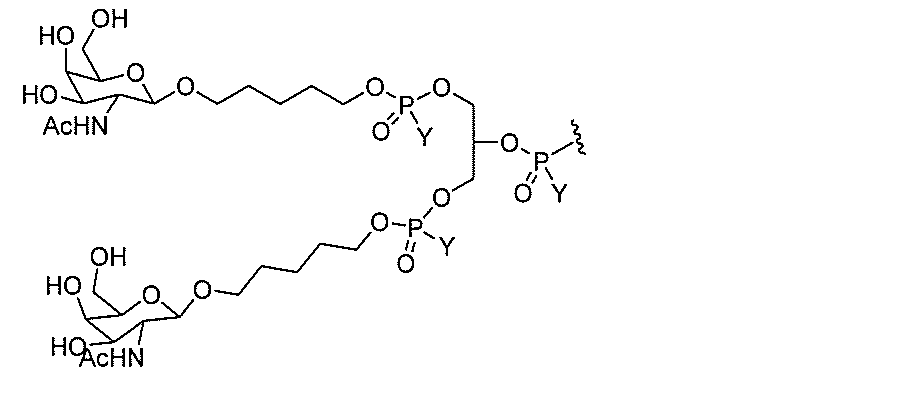
クラスター部分を指す。そのような炭水化物クラスター断片は、切断可能な結合または切
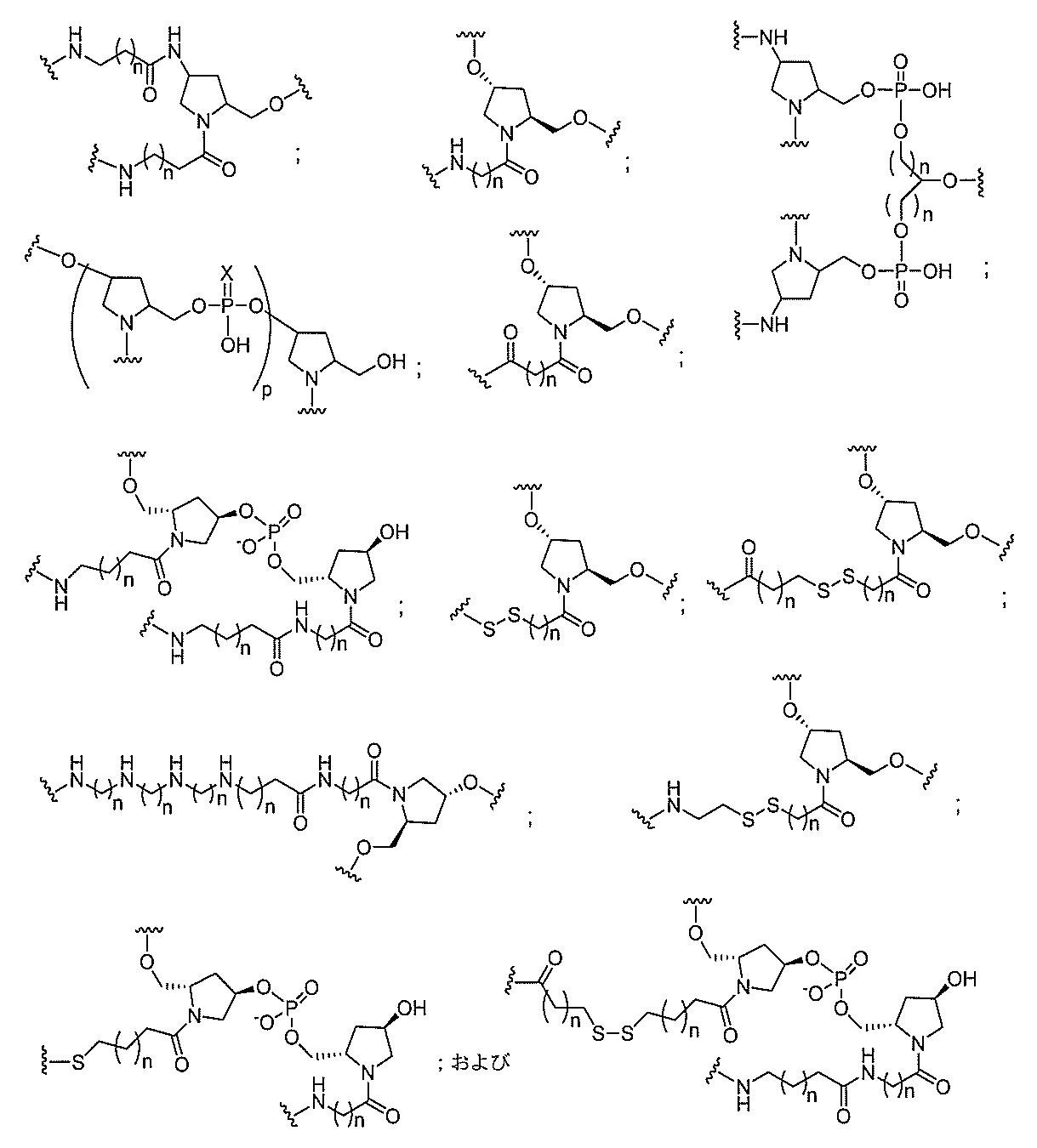
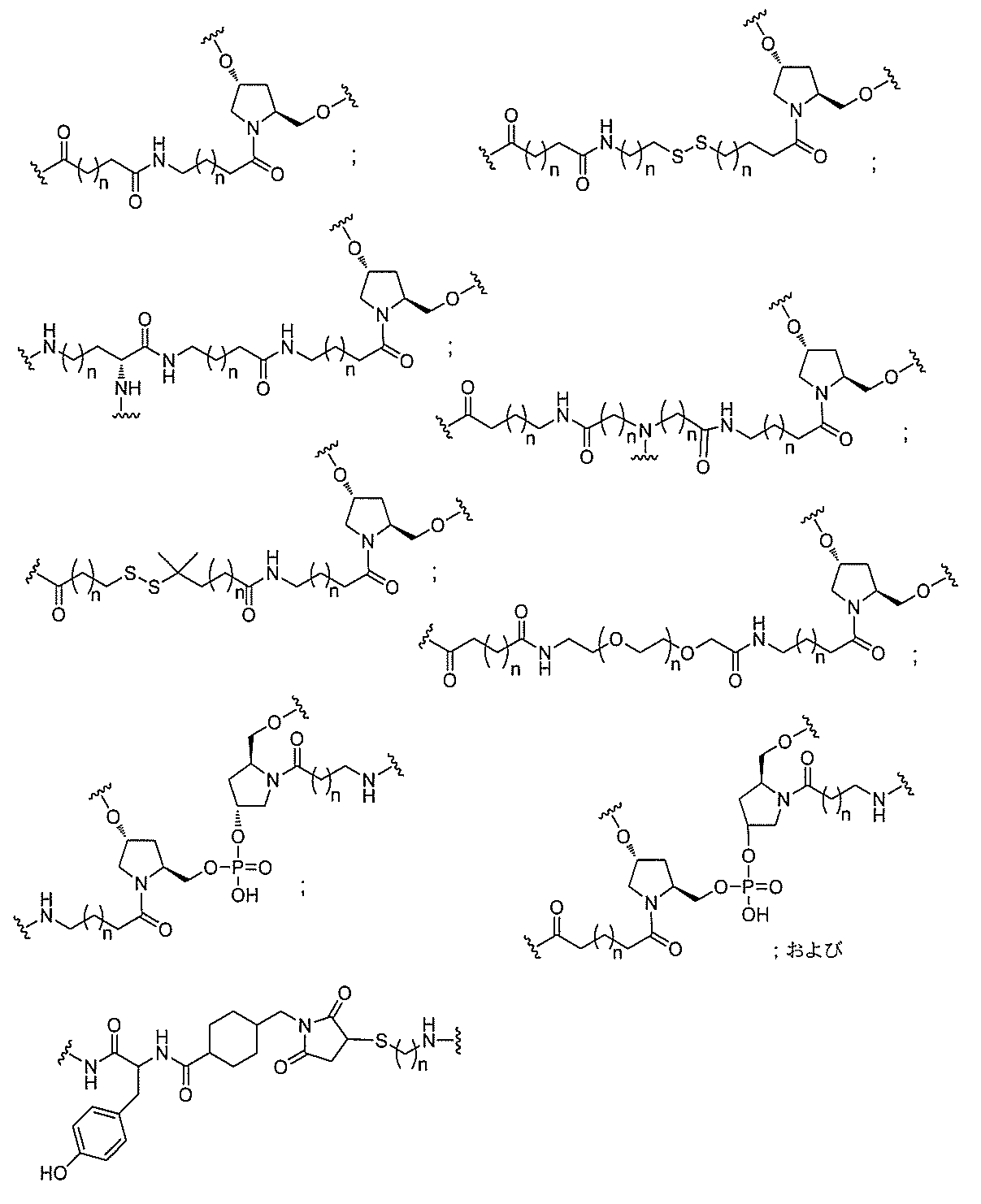
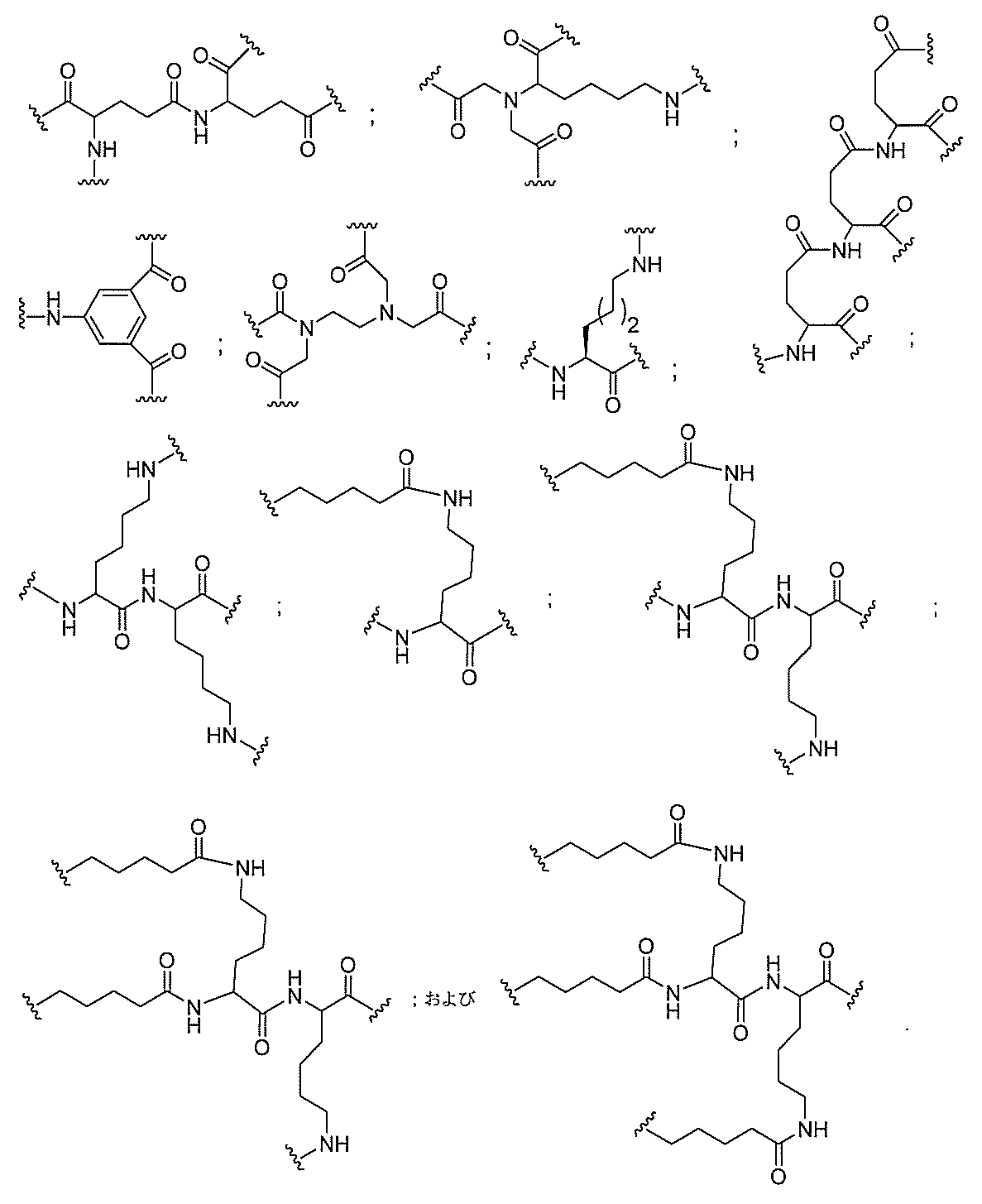
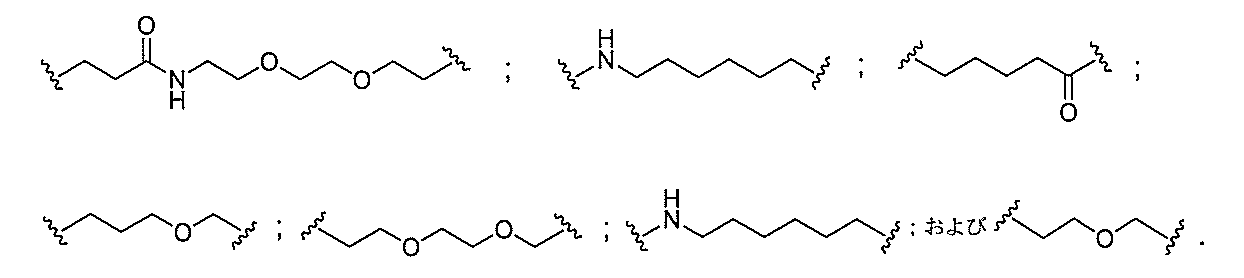
断可能なヌクレオシド等の切断可能な部分を介してオリゴマー化合物に結合される。
結合または基を意味する。ある特定の実施形態において、切断可能な部分は、リソソーム
等の細胞または細胞内コンパートメント内で切断される。ある特定の実施形態において、
切断可能な部分は、ヌクレアーゼ等の内因性酵素によって切断される。ある特定の実施形
態において、切断可能な部分は、1個、2個、3個、4個、または4個以上の切断可能な
結合を有する原子団を含む。
本明細書で使用されるとき、「切断可能な結合」とは、分割され得る任意の化学結合を意
味する。ある特定の実施形態において、切断可能な結合は、アミド、ポリアミド、エステ
ル、エーテル、ホスホジエステルの一方もしくは両方のエステル、リン酸エステル、カル
バメート、ジスルフィド、またはペプチドの中から選択される。
合される1個以上の炭水化物残基を有する化合物を意味する(例えば、炭水化物共役クラ
スターの例として、参照によりその全体が本明細書に組み込まれる、Maier et
al.,“Synthesis of Antisense Oligonucleot
ides Conjugated to a Multivalent Carbohy
drate Cluster for Cellular Targeting,”Bi
oconjugate Chemistry,2003,(14):18-29、または
Rensen et al.,“Design and Synthesis of N
ovel N-Acetylgalactosamine-Terminated Gl
ycolipids for Targeting of Lipoproteins
to the Hepatic Asiaglycoprotein Receptor
,”J.Med.Chem.2004,(47):5798-5808を参照のこと)。
て、1つ以上の化学修飾を有する任意の炭水化物を意味する。
水化物を用いて合成され得る任意の化合物を意味する。
物、または炭水化物誘導体を意味する。
基を意味する。保護基の非限定的な例は、“Protective Groups in
Organic Chemistry”,T.W.Greene,P.G.M.Wut
s,ISBN 0-471-62301-6,John Wiley & Sons,I
nc,New Yorkにおいて見出され得、参照によりその全体が本明細書に組み込ま
れる。
つ安定した自己二本鎖を形成するのに十分な自己相補性を欠くオリゴマー化合物を意味す
る。
化合物の対またはヘアピン構造を形成する単一の自己相補的なオリゴマー化合物を意味す
る。ある特定の実施形態において、二本鎖オリゴマー化合物は、第1および第2のオリゴ
マー化合物を含む。
か、またはそれからなる化合物を意味し、その少なくとも一部は、それがハイブリダイズ
することができる標的核酸に相補的であり、少なくとも1つのアンチセンス活性をもたら
す。
的核酸へのハイブリダイゼーションに起因する任意の検出可能および/または測定可能な
変化を意味する。ある特定の実施形態において、アンチセンス活性は、標的核酸転写物(
例えば、mRNA)の量または活性の調節を含む。ある特定の実施形態において、アンチ
センス活性は、プレmRNAのスプライシングの調節を含む。
ンチセンス化合物のアンチセンス活性の少なくとも一部が、アンチセンス化合物の標的核
酸へのハイブリダイゼーションおよびその後のRNase Hによる標的核酸の切断に起
因するアンチセンス化合物を意味する。
ンス化合物のアンチセンス活性の少なくとも一部が、RNA誘導サイレンシング複合体(
RISC)に起因するアンチセンス化合物を意味する。
験またはアッセイが実行されることを意味する。そのような検出および/または測定は、
ゼロの値をもたらし得る。したがって、検出または測定のための試験が活性なし(ゼロの
活性)の知見をもたらす場合、活性を検出または測定するステップは、それでもやはり実
行されている。
はない統計的に有意な活性を意味する。
と特に比較して、特定のパラメータに変化がほとんどまたは全くないことを意味する。あ
る特定の実施形態において、あるパラメータが5%未満変化するとき、そのパラメータは
、本質的に不変である。ある特定の実施形態において、あるパラメータが2倍未満変化す
る場合、そのパラメータは、本質的に不変である一方で、別のパラメータは、少なくとも
10倍変化する。例えば、ある特定の実施形態において、アンチセンス活性は、標的核酸
の量の変化である。ある特定のそのような実施形態において、非標的核酸の量の変化が標
的核酸の量の変化よりもはるかに小さい場合、それは本質的に不変であるが、変化がゼロ
である必要はない。
程を意味する。発現には、転写、転写後修飾(例えば、スプライシング、ポリアデニル化
、5’-キャップの付加)、および翻訳が含まれるが、これらに限定されない。
して所望のアンチセンス活性をもたらすよう意図される核酸分子を意味する。アンチセン
スオリゴヌクレオチドは、生理学的条件下でハイブリダイゼーションを可能にするのに十
分なそれらの標的核酸に対する相補性を有する。
は、別の核酸塩基と塩基対合することができる核酸塩基を意味する。例えば、DNAにお
いて、アデニン(A)は、チミン(T)に相補的である。例えば、RNAにおいて、アデ
ニン(A)は、ウラシル(U)に相補的である。ある特定の実施形態において、相補的核
酸塩基とは、その標的核酸の核酸塩基と塩基対合することができるアンチセンス化合物の
核酸塩基を意味する。例えば、アンチセンス化合物のある特定の位置の核酸塩基が、標的
核酸のある特定の位置の核酸塩基と水素結合することができる場合、オリゴヌクレオチド
と標的核酸との間の水素結合の位置は、その核酸塩基対において相補的であると見なされ
る。ある特定の修飾を含む核酸塩基は、対応する核酸塩基と対合する能力を維持し得、そ
れ故に、依然として核酸塩基相補性を有することができる。
形成しない核酸塩基の対を意味する。
ゴヌクレオチド、または核酸)に関して「相補的な」とは、そのようなオリゴマー化合物
またはそれらの領域が核酸塩基相補性を介して別のオリゴマー化合物またはそれらの領域
にハイブリダイズする能力を意味する。相補的なオリゴマー化合物は、各ヌクレオシドで
核酸塩基相補性を有する必要はない。むしろ、いくつかのミスマッチが許容される。ある
特定の実施形態において、相補的なオリゴマー化合物または領域は、核酸塩基の70%で
相補的である(70%相補的である)。ある特定の実施形態において、相補的なオリゴマ
ー化合物または領域は、80%相補的である。ある特定の実施形態において、相補的なオ
リゴマー化合物または領域は、90%相補的である。ある特定の実施形態において、相補
的なオリゴマー化合物または領域は、95%相補的である。ある特定の実施形態において
、相補的なオリゴマー化合物または領域は、100%相補的である。
が整列するときに、第2のオリゴマー化合物の対応する位置で核酸塩基と対合することが
できない第1のオリゴマー化合物の核酸塩基を意味する。第1および第2のオリゴマー化
合物のいずれかまたは両方ともにオリゴヌクレオチドであり得る。
合物(例えば、アンチセンス化合物およびその標的核酸)の対合を意味する。特定の機構
に限定されないが、最も一般的な対合機構には水素結合が含まれ、これは、相補的核酸塩
基間のワトソン・クリック水素結合、フーグスティーン水素結合、または逆フーグスティ
ーン水素結合であり得る。
が、ある核酸部位にハイブリダイズするよりも高い親和性で別の核酸部位にハイブリダイ
ズする能力を意味する。
的な」とは、オリゴヌクレオチドまたはその部分の各核酸塩基が、相補的な核酸またはそ
の連続した部分の核酸塩基と対合することができることを意味する。したがって、完全に
相補的な領域は、いずれの鎖でもミスマッチまたは非ハイブリダイズ核酸塩基を含まない
。
なオリゴマー化合物の核酸塩基の割合を意味する。パーセント相補性は、標的核酸の対応
する位置の核酸塩基に相補的なオリゴマー化合物の核酸塩基の数をオリゴマー化合物の全
長で割ることによって計算される。
で割った、第2の核酸の対応する位置の核酸塩基と同一の(化学修飾から独立した)種類
の第1の核酸の核酸塩基の数を意味する。
たは質と比較した、分子、機能、もしくは活性の量または質の変化を意味する。例えば、
調節は、遺伝子発現における増加(刺激もしくは誘導)または減少(阻害もしくは低減)
のいずれかの変化を含む。さらなる例として、発現の調節は、調節の不在下における量と
比較した、特定のスプライス変異体の絶対量または相対量の変化をもたらすプレmRNA
処理のスプライス部位選択の変化を含み得る。
域における化学修飾のパターンを意味する。モチーフは、オリゴヌクレオチドのある特定
のヌクレオシドおよび/またはある特定の結合基での修飾によって定義され得る。
はその領域におけるヌクレオシド修飾のパターンを意味する。そのようなオリゴヌクレオ
チドの結合は、修飾または非修飾であり得る。別途示されない限り、本明細書においてヌ
クレオシドのみを記載するモチーフは、ヌクレオシドモチーフであるよう意図される。し
たがって、そのような事例において、結合は限定されない。
における糖修飾のパターンを意味する。
域における結合修飾のパターンを意味する。そのようなオリゴヌクレオチドのヌクレオシ
ドは、修飾または非修飾であり得る。別途示されない限り、本明細書において結合のみを
記載するモチーフは、結合モチーフであるよう意図される。したがって、そのような事例
において、ヌクレオシドは限定されない。
った核酸塩基への修飾のパターンを意味する。別途示されない限り、核酸塩基修飾モチー
フは、核酸塩基配列から独立している。
分に沿って整列した核酸塩基のパターンを意味する。別途示されない限り、配列モチーフ
は、化学修飾から独立しており、それ故に、化学修飾なしを含む化学修飾の任意の組み合
わせを有し得る。
「修飾の種類」とは、ヌクレオシドの化学修飾を意味し、修飾および非修飾ヌクレオシド
を含む。したがって、別途示されない限り、「第1の種類の修飾を有するヌクレオシド」
は、非修飾ヌクレオシドであり得る。
なる化学修飾または化学置換基を意味する。したがって、例えば、MOEヌクレオシドお
よび非修飾DNAヌクレオシドは、DNAヌクレオシドが修飾されていなくても「別々に
修飾される」。同様に、DNAおよびRNAは、これら両方ともに天然に存在する非修飾
ヌクレオシドであっても「別々に修飾される」。同一であるが、異なる核酸塩基を含むヌ
クレオシドは、別々に修飾されない。例えば、2’-OMe修飾糖および非修飾アデニン
核酸塩基を含むヌクレオシドと2’-OMe修飾糖および非修飾チミン核酸塩基を含むヌ
クレオシドは、別々に修飾されない。
一の修飾を指す。したがって、例えば、2個の非修飾DNAヌクレオシドは、DNAヌク
レオシドが修飾されていなくても「同一の種類の修飾」を有する。同一の種類の修飾を有
するそのようなヌクレオシドは、異なる核酸塩基を含み得る。
、任意の隣接する部分の化学修飾または化学修飾のモチーフは、別個の領域が互いに区別
されることを可能にする少なくとも1つの相違点を含む。
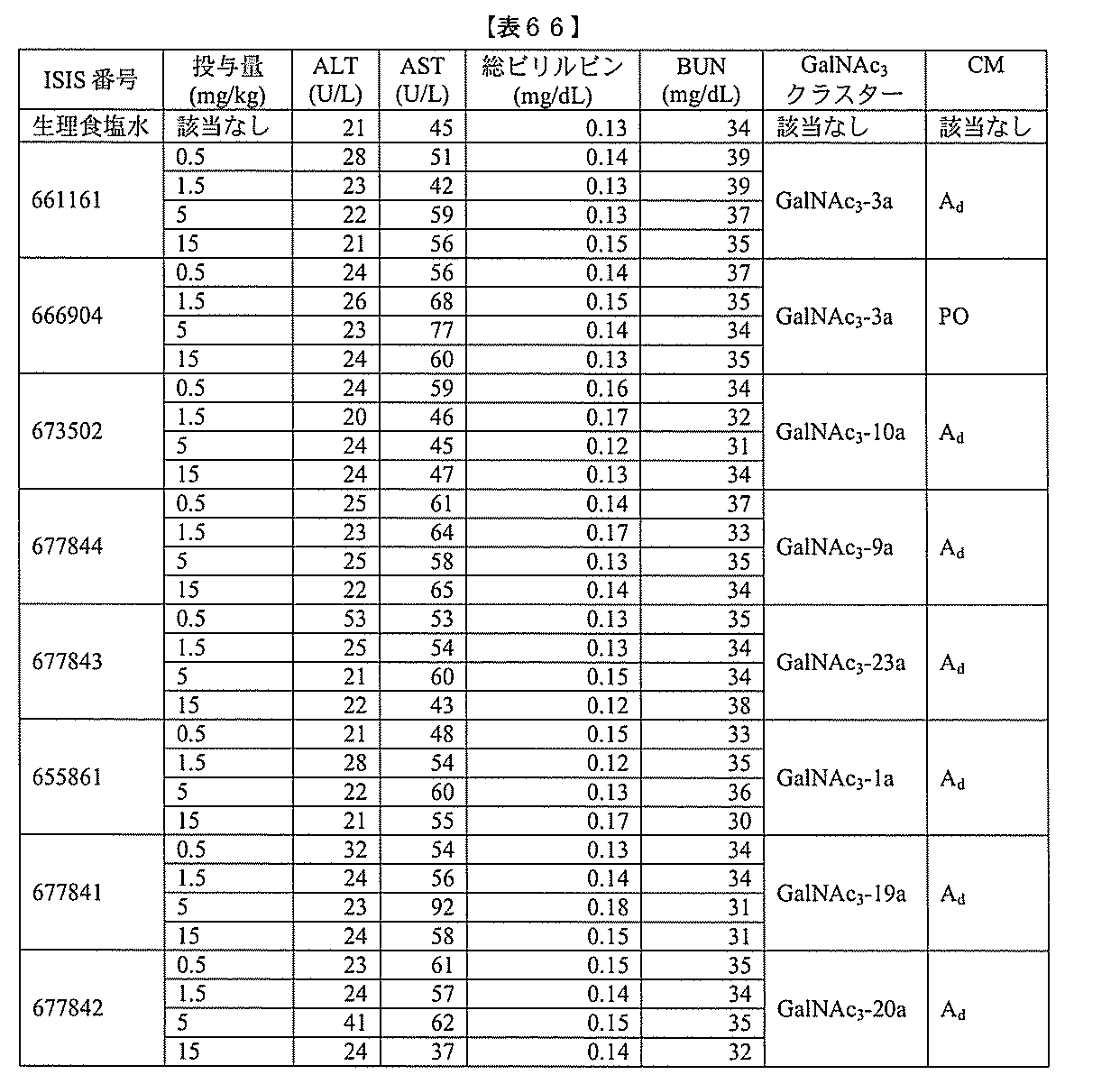
投与における使用に好適な任意の物質を意味する。ある特定の実施形態において、薬剤的
に許容される担体または希釈剤は、滅菌生理食塩水である。ある特定の実施形態において
、そのような滅菌生理食塩水は、医薬品グレードの生理食塩水である。
エネルギーを生成することに関連した一連の複雑な化学反応)の異常調節を特徴とする疾
患または状態を意味する。
障害を特徴とする疾患または状態を意味する。
多環式ラジカル環系から選択されるすべての環系を含むよう意図されており、前記環は、
縮合または連結され、脂肪族、脂環式、アリール、ヘテロアリール、アラルキル、アリー
ルアルキル、複素環式、ヘテロアリール、ヘテロ芳香族、およびヘテロアリールアルキル
から個別に選択される単一環系および混合環系を含むよう意図される。そのような単環式
および多環式構造は、各々が同一のレベルの飽和を有するか、または各々が独立して、完
全に飽和、部分的に飽和、もしくは完全に不飽和を含む様々な程度の飽和を有する環を含
有し得る。各環は、複素環式環、および例えばベンズイミダゾール等の混合モチーフに存
在し得るC環原子のみを含む環を生じさせるために、C、N、O、およびSから選択され
る環原子を含み得、1個の環は、炭素環原子のみを有し、縮合環は、2個の窒素原子を有
する。単環式または多環式環系は、例えば、前記環のうちの1個に結合される2個の=O
基を有するフタルイミド等の置換基とさらに置換され得る。単環式または多環式環系は、
環原子を介した直接結合、複数の環原子を介した縮合、置換基を介した結合、または二機
能性結合部分を介した結合等の様々な戦略を用いて親分子に結合され得る。
性化合物またはより活性の化合物(例えば、薬物)を形成する化合物の不活性形態または
活性の低い形態を意味する。
substituent group)」とは、指名された親化合物の原子または基を置
換する原子または基を意味する。例えば、修飾ヌクレオシドの置換基は、天然に存在する
ヌクレオシドに見られる原子または基とは異なる任意の原子または基である(例えば、修
飾された2’-置換基は、HまたはOH以外のヌクレオシドの2’位の任意の原子または
基である)。置換基は、保護されても保護されなくてもよい。ある特定の実施形態におい
て、本開示の化合物は、親化合物の1つの位置または2つ以上の位置に置換基を有する。
置換基は、他の置換基ともさらに置換され得、親化合物に直接結合され得るか、またはア
ルキル基もしくはヒドロカルビル基等の結合基を介して結合され得る。
官能基に通常存在する原子または原子団とは異なる原子または原子団を意味する。ある特
定の実施形態において、置換基は、官能基の水素原子を置換する(例えば、ある特定の実
施形態において、置換メチル基の置換基は、非置換メチル基の水素原子のうちの1個を置
換する水素以外の原子または基である)。別途示されない限り、置換基としての使用に従
順な基には、ハロゲン、ヒドロキシル、アルキル、アルケニル、アルキニル、アシル(-
C(O)Raa)、カルボキシル(-C(O)O-Raa)、脂肪族基、脂環式基、アル
コキシ、置換オキシ(-O-Raa)、アリール、アラルキル、複素環式ラジカル、ヘテ
ロアリール、ヘテロアリールアルキル、アミノ(-N(Rbb)(Rcc))、イミノ(
=NRbb)、アミド(-C(O)N(Rbb)(Rcc)または-N(Rbb)C(O
)Raa)、アジド(-N3)、ニトロ(-NO2)、シアノ(-CN)、カルバミド(
-OC(O)N(Rbb)(Rcc)または-N(Rbb)C(O)ORaa)、ウレイ
ド(-N(Rbb)C(O)N(Rbb)(Rcc))、チオウレイド(-N(Rbb)
C(S)N(Rbb)(Rcc))、グアニジニル(-N(Rbb)C(=NRbb)N
(Rbb)(Rcc))、アミジニル(-C(=NRbb)N(Rbb)(Rcc)また
は-N(Rbb)C(=NRbb)(Raa))、チオール(-SRbb)、スルフィニ
ル(-S(O)Rbb)、スルホニル(-S(O)2Rbb)、およびスルホンアミジル
(-S(O)2N(Rbb)(Rcc)または-N(Rbb)S(O)2Rbb)が含ま
れるが、これらに限定されない。式中、各Raa、Rbb、およびRccは、独立して、
H、任意に連結された化学官能基、またはアルキル、アルケニル、アルキニル、脂肪族、
アルコキシ、アシル、アリール、アラルキル、ヘテロアリール、脂環式、複素環式、およ
びヘテロアリールアルキルを含むが、これらに限定されない好ましいリストを有するさら
なる置換基である。本明細書に記載の化合物内の選択された置換基は、再帰的程度まで存
在する。
素原子を含有する飽和直鎖または分岐鎖炭化水素ラジカルを意味する。アルキル基の例と
して、メチル、エチル、プロピル、ブチル、イソプロピル、n-ヘキシル、オクチル、デ
シル、ドデシル等が挙げられるが、これらに限定されない。アルキル基は、典型的には、
1~約24個の炭素原子、より典型的には、1~約12個の炭素原子(C1~C12アル
キル)を含み、1~約6個の炭素原子がより好ましい。
つ少なくとも1個の炭素-炭素二重結合を有する直鎖または分岐鎖炭化水素鎖ラジカルを
意味する。アルケニル基の例として、エテニル、プロペニル、ブテニル、1-メチル-2
-ブテン-1-イル、1,3-ブタジエン等のジエン等が挙げられるが、これらに限定さ
れない。アルケニル基は、典型的には、2~約24個の炭素原子、より典型的には、2~
約12個の炭素原子を含み、2~約6個の炭素原子がより好ましい。本明細書で使用され
るアルケニル基は、1個以上のさらなる置換基を任意に含み得る。
つ少なくとも1個の炭素-炭素三重結合を有する直鎖または分岐鎖炭化水素ラジカルを意
味する。アルキニル基の例として、エチニル、1-プロピニル、1-ブチニル等が挙げら
れるが、これらに限定されない。アルキニル基は、典型的には、2~約24個の炭素原子
、より典型的には、2~約12個の炭素原子を含み、2~約6個の炭素原子がより好まし
い。本明細書で使用されるアルキニル基は、1個以上のさらなる置換基を任意に含み得る
。
って形成されたラジカルを意味し、一般式-C(O)-Xを有し、式中、Xは、典型的に
は、脂肪族、脂環式、または芳香族である。例として、脂肪族カルボニル、芳香族カルボ
ニル、脂肪族スルホニル、芳香族スルフィニル、脂肪族スルフィニル、芳香族ホスフェー
ト、脂肪族ホスフェート等が挙げられる。本明細書で使用されるアシル基は、さらなる置
換基を任意に含み得る。
ある。前記環系は、1個以上の環を含み得、少なくとも1個の環は、脂肪族である。好ま
しい脂環式基は、環内に約5~約9個の炭素原子を有する環を含む。本明細書で使用され
る脂環式基は、さらなる置換基を任意に含み得る。
たは分岐鎖炭化水素ラジカルを意味し、任意の2個の炭素原子の間の飽和は、一重、二重
、または三重結合である。脂肪族基は、好ましくは、1~約24個の炭素原子、より典型
的には、1~約12個の炭素原子を含有し、1~約6個の炭素原子がより好ましい。脂肪
族基の直鎖または分岐鎖は、窒素、酸素、硫黄、およびリンを含む1個以上のヘテロ原子
で中断され得る。ヘテロ原子によって中断されるそのような脂肪族基には、ポリアルコキ
シ、例えば、ポリアルキレングリコール、ポリアミン、およびポリイミンが含まれるが、
これらに限定されない。本明細書で使用される脂肪族基は、さらなる置換基を任意に含み
得る。
されたラジカルを意味し、前記酸素原子を用いて、アルコキシ基を親分子に結合させる。
アルコキシ基の例として、メトキシ、エトキシ、プロポキシ、イソプロポキシ、n-ブト
キシ、sec-ブトキシ、tert-ブトキシ、n-ペントキシ、ネオペントキシ、n-
ヘキソキシ等が挙げられるが、これらに限定されない。本明細書で使用されるアルコキシ
基は、さらなる置換基を任意に含み得る。
アルキルラジカルを意味する。前記ラジカルのアルキル部分は、親分子と共有結合を形成
する。アミノ基は、任意の位置に位置し得、アミノアルキル基は、アルキルおよび/また
はアミノ部分のさらなる置換基で置換され得る。
C12アルキルラジカルに共有結合される芳香族基を意味する。結果として生じるアラル
キル(またはアリールアルキル)基のアルキルラジカル部分は、親分子と共有結合を形成
する。例として、ベンジル、フェネチル等が挙げられるが、これらに限定されない。本明
細書で使用されるアラルキル基は、ラジカル基を形成するアルキル、アリール、またはこ
れら両方の基に結合されるさらなる置換基を任意に含み得る。
を有する単環式または多環式炭素環式環系ラジカルを意味する。アリール基の例として、
フェニル、ナフチル、テトラヒドロナフチル、インダニル、イデニル等が挙げられるが、
これらに限定されない。好ましいアリール環系は、1個以上の環内に約5~約20個の炭
素原子を有する。本明細書で使用されるアリール基は、さらなる置換基を任意に含み得る
。
およびヨウ素から選択される原子を意味する。
もしくは多環式芳香族環、環系、または縮合環系を含むラジカルを意味し、前記環のうち
の少なくとも1つは、芳香族であり、1個以上のヘテロ原子を含む。ヘテロアリールは、
縮合環のうちの1個以上がヘテロ原子を含有しない系を含む縮合環系もまた含むよう意図
される。ヘテロアリール基は、典型的には、硫黄、窒素、または酸素から選択される1個
の環原子を含む。ヘテロアリール基の例として、ピリジニル、ピラジニル、ピリミジニル
、ピロリル、ピラゾリル、イミダゾリル、チアゾリル、オキサゾリル、イソオキサゾリル
、チアジアゾリル、オキサジアゾリル、チオフェニル、フラニル、キノリニル、イソキノ
リニル、ベンズイミダゾリル、ベンゾオキサゾリル、キノキサリニル等が挙げられるが、
これらに限定されない。ヘテロアリールラジカルは、親分子に直接結合され得るか、また
は脂肪族基もしくはヘテロ原子等の結合部分を介して結合され得る。本明細書で使用され
るヘテロアリール基は、さらなる置換基を任意に含み得る。
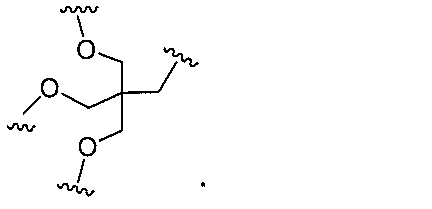
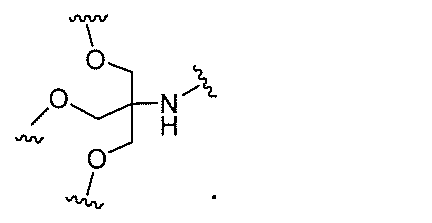
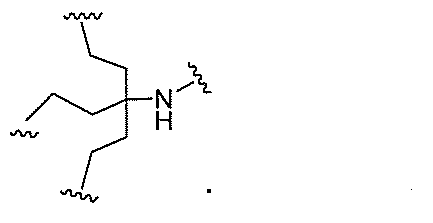
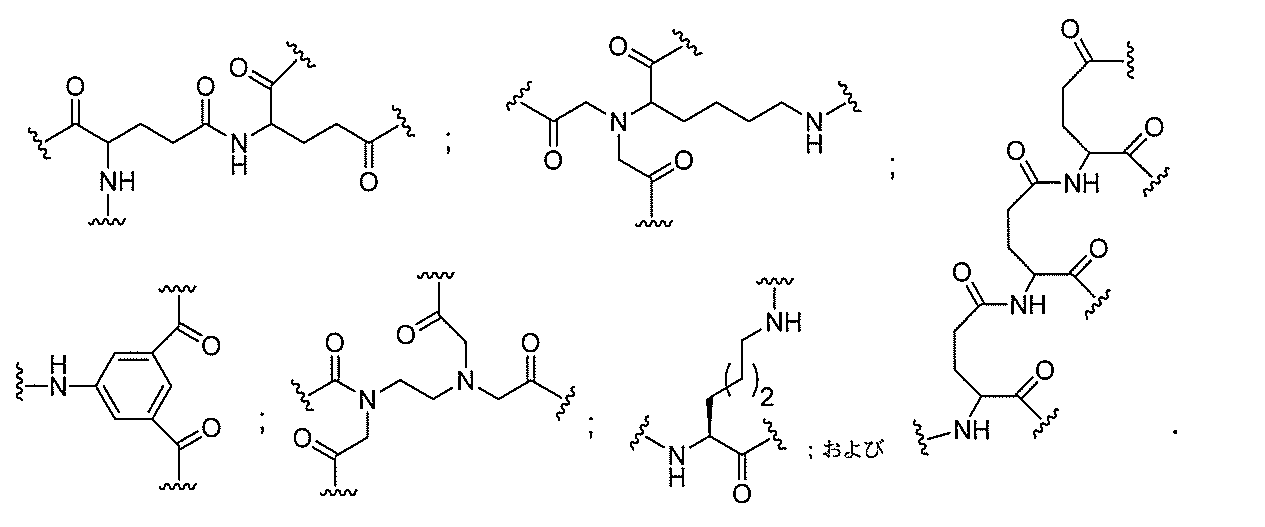
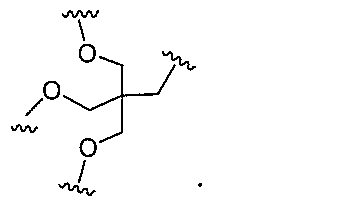
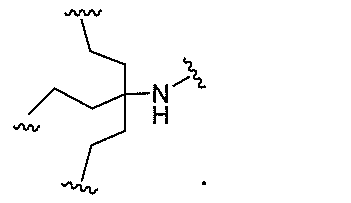
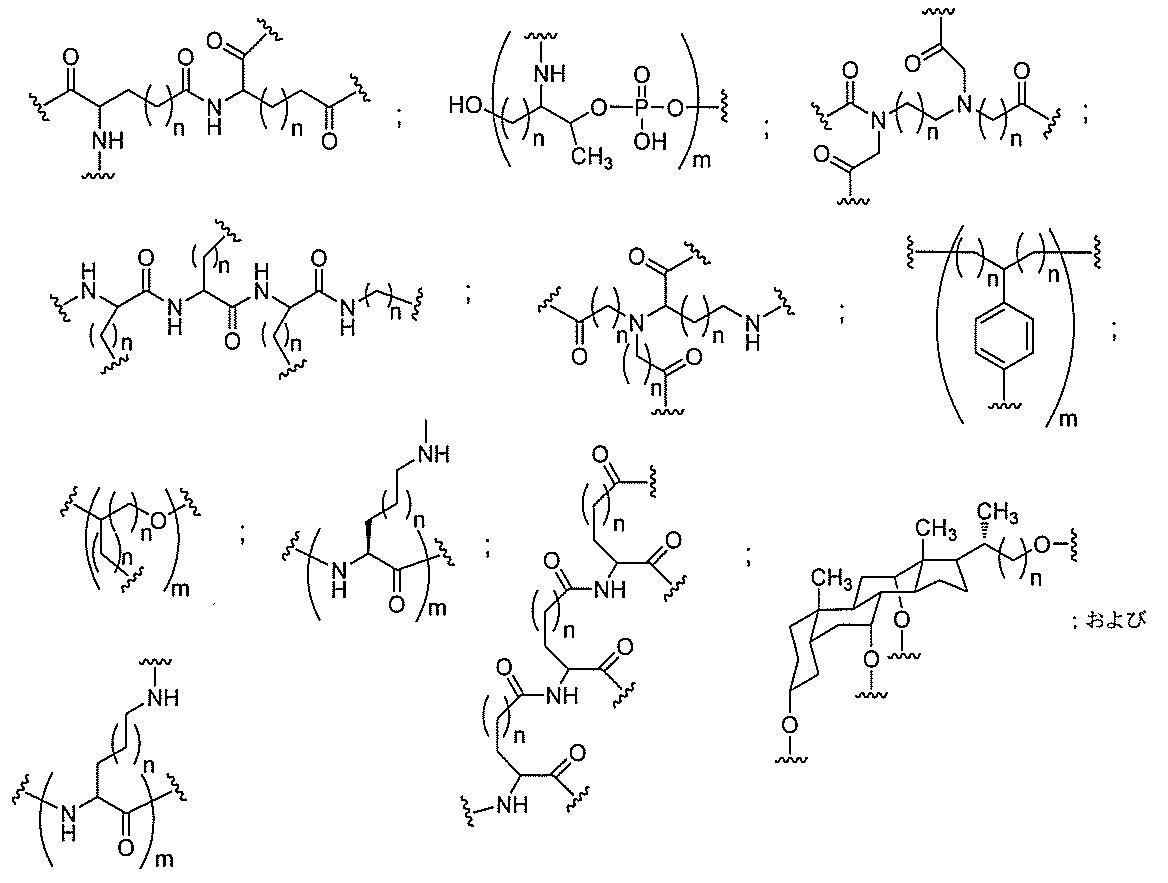
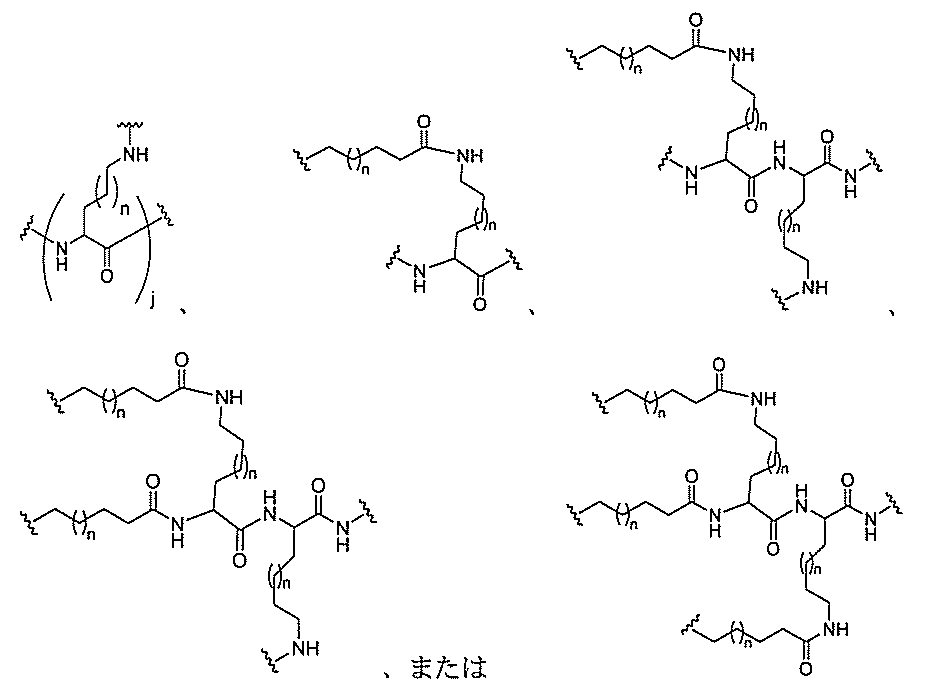
原子、原子団、または結合原子団を意味する。ある特定の実施形態において、共役化合物
は、薬力学的特性、薬物動態学的特性、結合特性、吸収特性、細胞分布特性、細胞取り込
み特性、電荷特性、および/またはクリアランス特性を含むが、これらに限定されない1
つ以上の特性を有し得るか、または付与し得る。
という用語は、互いにハイブリダイズされる2個の別個のオリゴマー化合物を指す。その
ような二本鎖化合物は、一方もしくは両方の鎖(オーバーハング)の一方もしくは両方の
末端に1個以上のヌクレオシドまたはハイブリダイズしていないヌクレオシドを有し得、
かつ/または1個以上のハイブリダイズしていない内部ヌクレオシド(ミスマッチ)を有
し得るが、但し、生理学的関連条件下でハイブリダイゼーションを維持するのに十分な相
補性が存在することを条件とする。
5’側のヌクレオチドに相補的な標的核酸のヌクレオチドを指す。
ーカーが約50%増加し得る」と述べられている場合、マーカーが45%~55%増加し
得るという意味が含まれる。
患者に同時に現れる任意の様式でそれら2つの薬剤を共投与することを指す。同時投与は
、両方の薬剤が、単一の医薬組成物で、同一の剤形で、または同一の投与経路によって投
与されることを必要としない。両方の薬剤の効果が同時に現われなくてもよい。効果は、
ある期間の重複しか必要とせず、共に広範囲に及ぶ必要はない。
ることを意味し、医療専門家による投与および自己投与を含むが、これらに限定されない
。個体への医薬品の投与は、連続投与、長期投与、短期投与、または間欠投与であり得る
。投与は、非経口投与または非非経口(non-parenteral)投与であり得る
。
ることができる活性物質を意味する。「第1の薬剤」とは、本発明の治療用化合物を意味
する。例えば、第1の薬剤は、apo(a)を標的とするアンチセンスオリゴヌクレオチ
ドであり得る。「第2の薬剤」とは、本発明の第2の治療用化合物(例えば、apo(a
)を標的とする第2のアンチセンスオリゴヌクレオチド)および/または非apo(a)
治療用化合物を意味する。
たは「改善する(ameliorating)」とは、関連疾患、障害、または状態の少
なくとも1つの指標、兆候、または症状の軽減を指す。指標の重症度は、当業者に既知の
主観的または客観的尺度によって決定され得る。
ヌ、ネコ、ブタ、および非ヒト霊長類(サルおよびチンパンジーを含むが、これらに限定
されない)を含むが、これらに限定されない非ヒト動物を指す。
核酸またはタンパク質配列を意味する。例えば、ある特定の実施形態において、apo(
a)は、apo(a)をコードするDNA配列、apo(a)をコードするDNAから転
写されたRNA配列(イントロンおよびエクソンを含むゲノムDNAを含む)、apo(
a)をコードするmRNA配列、またはapo(a)をコードするペプチド配列を含む。
意の核酸を意味する。例えば、ある特定の実施形態において、apo(a)核酸は、ap
o(a)をコードするDNA配列、apo(a)をコードするDNAから転写されたRN
A配列(イントロンおよびエクソンを含むゲノムDNAを含む)、およびapo(a)を
コードするmRNA配列を含む。
をコードするmRNAを意味する。
する任意のタンパク質配列を意味する。
よび/またはapo(a)タンパク質の発現を特異的に阻害することができる任意の薬剤
を指す。例えば、apo(a)特異的阻害剤は、核酸(アンチセンス化合物を含む)、ペ
プチド、抗体、小分子、ならびにapo(a)核酸および/またはapo(a)タンパク
質の発現を阻害することができる他の薬剤を含む。ある特定の実施形態において、apo
(a)核酸発現および/またはapo(a)タンパク質発現を特異的に調節することによ
り、apo(a)特異的阻害剤は、下流成分を含む脂質輸送系の他の成分に影響を与え得
る。同様に、ある特定の実施形態において、apo(a)特異的阻害剤は、動物における
他の分子過程に影響を与え得る。
影響を及ぼす動脈の硬化を意味し、脂肪沈着物の存在を特徴とする。脂肪沈着物は、「ア
テローム」または「プラーク」と呼ばれ、主にコレステロールおよび他の脂肪、カルシウ
ム、ならびに瘢痕組織からなり、動脈の内膜を損傷する。
心臓に供給する微小血管の狭窄を意味し、これは、多くの場合、アテローム性動脈硬化症
の結果である。
ンスリンまたはインスリン感受性の低下に起因する代謝障害および異常に高い血糖(高血
糖症)を特徴とする症候群である。特徴的な症状は、高血糖値に起因した過剰な尿産生(
多尿症)、排尿増加を補うための過剰な口渇および水分摂取の増加(多渇症)、目の視覚
への高血糖の影響に起因した視界のぼやけ、原因不明の体重減少、および嗜眠である。
尿病」とは、2型糖尿病、HDL-Cの減少、トリグリセリド(TG)の増加、および小
さく高密度のLDL粒子の増加を特徴とする状態を意味する。
あるか、または望ましい組成物中の成分を意味する。例えば、注入された組成物中の希釈
剤は、液体、例えば、生理食塩水であり得る。
の過剰産生または欠損を含む、脂質および/またはリポタンパク質代謝の障害を指す。脂
質異常症は、カイロミクロン、コレステロール、およびトリグリセリド等の脂質、ならび
に低密度リポタンパク質(LDL)コレステロール等のリポタンパク質の増加により明ら
かになり得る。
剤、錠剤、または当技術分野で既知の他の投薬単位を意味する。ある特定の実施形態にお
いて、投薬単位は、凍結乾燥されたアンチセンスオリゴヌクレオチドを含有するバイアル
である。ある特定の実施形態において、投薬単位は、再構成されたアンチセンスオリゴヌ
クレオチドを含有するバイアルである。
間に提供される医薬品の特定の量を意味する。ある特定の実施形態において、用量は、1
、2、またはそれ以上のボーラス、錠剤、または注入で投与され得る。例えば、ある特定
の実施形態において、皮下投与が所望される場合、所望の用量は、単回注入では容易に提
供されない体積を必要とし、それ故に、2回以上注入して所望の用量を達成することがで
きる。ある特定の実施形態において、医薬品は、輸液によって長期間にわたって、または
連続して投与される。用量は、1時間、1日、1週間、または1ヶ月当たりの医薬品の量
で提示され得る。用量は、mg/kgまたはg/kgでも提示され得る。
品を必要とする個体において所望の生理学的結果をもたらすのに十分な活性医薬品の量を
意味する。有効な量は、治療される個体の健康および身体状態、治療される個体の分類群
、組成物の製剤、個体の病状の評価、ならびに他の関連因子によって個体間で異なり得る
。
1の核酸の核酸塩基配列の各核酸塩基が、第2の核酸の第2の核酸塩基配列中に相補的な
核酸塩基を有すことを意味する。ある特定の実施形態において、第1の核酸は、アンチセ
ンス化合物であり、第2の核酸は、標的核酸である。
して細胞によって使用される単糖である。「血漿グルコース」とは、血漿中に存在するグ
ルコースを指す。
、高密度リポタンパク質粒子に関連したコレステロールを意味する。血清(または血漿)
中のHDL-の濃度は、典型的には、mg/dLまたはnmol/L単位で定量される。
「血清HDL-C」および「血漿HDL-C」とは、それぞれ、血清および血漿中のHD
L-Cを意味する。
タチン、ロスバスタチン、フルバスタチン、ロバスタチン、プラバスタチン、およびシン
バスタチン等の酵素HMG-CoAレダクターゼの阻害によって作用する薬剤を意味する
。
ロールを検出し、その治療の評価する全米コレステロール教育プログラム(NCEP)の
専門委員会報告書のガイドラインに見られる、コレステロールの上昇、または循環(血漿
)コレステロール、LDL-コレステロール、およびVLDL-コレステロールを特徴と
する状態を意味する(Arch.Int.Med.(1988)148,36-39を参
照のこと)。
「脂質異常症(hyperlipemia)」は、血清脂質または循環(血漿)脂質の上
昇を特徴とする状態である。この状態は、異常に高い脂肪濃度を示す。循環血液中の脂質
画分は、コレステロール、低密度リポタンパク質、超低密度リポタンパク質、カイロミク
ロン、およびトリグリセリドである。脂質異常症のフレドリクソン分類は、電気泳動また
は超遠心分離によって測定されるTGおよびコレステロール豊富なリポタンパク質粒子の
パターンに基づき、一般に高トリグリセリド血症等の脂質異常症の主な原因を特徴付ける
ために用いられる(FredricksonおよびLee,Circulation,1
965,31:321-327、Fredrickson et al.,New En
g J Med,1967,276(1):34-42)。
上昇を特徴とする状態を意味する。その病因には、一時的要因(すなわち、遺伝子的原因
)および二次的要因(糖尿病、代謝症候群/インスリン抵抗性、肥満、運動不足、喫煙、
過剰なアルコール摂取、および炭水化物が非常に多い食事等の他の根本にある原因)、ま
たは、多くの場合、これらの組み合わせが含まれる(Yuan et al.CMAJ,
2007,176:1113-1120)。
有する動物を選択する」とは、高コレステロール血症、高血糖症、脂質異常症、高トリグ
リセリド血症、高血圧症、インスリン抵抗性の増加、インスリン感受性の低下、標準以上
の体重、および/もしくは標準以上の体脂肪含量、またはこれらの任意の組み合わせを含
むが、これらに限定されない、代謝性疾患、心臓血管疾患、もしくは代謝症候群を発症し
やすいか、または代謝性疾患、心臓血管疾患、もしくは代謝症候群と診断された対象を特
定または選択すること、あるいは、代謝性疾患、心臓血管疾患、または代謝症候群の任意
の症状を有する対象を特定または選択することを意味する。そのような特定は、血清また
は循環(血漿)コレステロールの測定、血清または循環(血漿)血糖の測定、血清または
循環(血漿)トリグリセリドの測定、血圧の測定、体脂肪含量の測定、体重の測定等の標
準の臨床試験または評価を含むが、これらに限定されない任意の方法によって達成され得
る。
の発症またはその危険性の低減を意味する。有害な心臓血管系イベントの例には、死、再
梗塞、発作、心臓性ショック、肺浮腫、心停止、および心房律動不整が挙げられるが、こ
れらに限定されない。
領域、区分、ヌクレオチド、および/またはヌクレオシド間に介在要素が存在しないこと
を意味する。
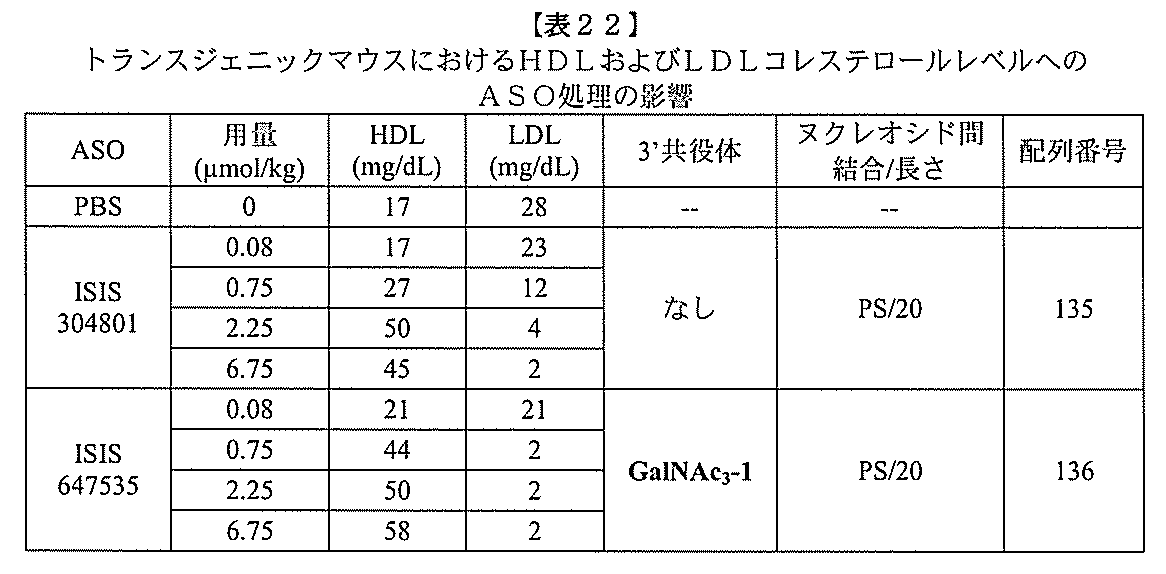
化合物も投与されていない動物のHDLレベルと比較して、本発明の少なくとも1つの化
合物の投与後の動物におけるHDLのレベルの増加を意味する。
療法に選択されたヒトまたは非ヒト動物を意味する。
するそのような治療または療法に選択されたヒトまたは非ヒト動物を指す。
る」、「増加させる」、「減少させる」、「低減させる」等は、2つの状態間の量的差を
示す。例えば、「apo(a)の活性または発現を阻害するのに有効な量」とは、処理さ
れた試料のapo(a)の活性または発現のレベルが処理されていない試料のapo(a
)の活性または発現のレベルとは異なることを意味する。そのような用語は、例えば、発
現のレベルおよび活性のレベルに適用される。
または他の状態を指す。例えば、リウマチ性関節炎および肝線維症は、炎症状態である。
炎症状態の他の例には、敗血症、心筋虚血/再灌流傷害、成人呼吸窮迫症候群、腎炎、移
植片拒絶、炎症性腸疾患、多発性硬化症、動脈硬化症、アテローム性動脈硬化症、および
血管炎が挙げられる。
ク質の発現または活性の減少または阻止を指し、必ずしも発現または活性の完全な排除を
示すわけではない。
肪、筋肉、および肝細胞から正常なインスリン応答をもたらすには不十分である状態と定
義される。脂肪細胞におけるインスリン抵抗性は、血漿中の遊離脂肪酸を上昇させる貯蔵
されたトリグリセリドの加水分解をもたらす。筋肉におけるインスリン抵抗性がグルコー
ス取り込みを減少させる一方で、肺におけるインスリン抵抗性は、グルコース貯蔵を減少
させ、これら両方の影響は、血糖を上昇させる働きをする。インスリン抵抗性に起因した
インスリンおよびグルコースの高血漿レベルは、多くの場合、代謝症候群および2型糖尿
病に至る。
ースを処理するかの尺度である。高インスリン感受性を有する個体がグルコースを効果的
に処理する一方で、低インスリン感受性を有する個体は、グルコースを効果的に処理しな
い。
、LDL、VLDL)の減少を意味する。「脂質上昇」とは、対象における脂質(例えば
、HDL)の増加を意味する。脂質低下または脂質上昇は、1回以上の用量で経時的に生
じ得る。
る1つ以上の脂質を減少させるために対象に提供される治療レジメンを意味する。ある特
定の実施形態において、脂質低下療法は、対象におけるapo(a)、CETP、apo
B、総コレステロール、LDL-C、VLDL-C、IDL-C、非HDL-C、トリグ
リセリド、小さく高密度のLDL粒子、およびLp(a)のうちの1つ以上を減少させる
ために提供される。脂質低下療法の例には、apoB阻害剤、スタチン、フィブラート、
およびMTP阻害剤が挙げられるが、これらに限定されない。
とは、血清、血漿、およびリンパ液中に見られるタンパク質群を指し、脂質輸送に重要で
ある。各リポタンパク質の化学組成物は、例えば、HDLが、脂質よりも高い割合のタン
パク質を有する一方で、VLDLが、脂質よりも低い割合のタンパク質を有するという点
で異なる。
るLDL様粒子を含む。apo(a)は、ジスルフィド結合によってapoBに連結され
る。
」とは、低密度リポタンパク質粒子中で運搬されるコレステロールを意味する。血清(ま
たは血漿)中のLDL-Cの濃度は、典型的には、mg/dLまたはnmol/L単位で
定量される。「血清LDL-C」および「血漿LDL-C」とは、それぞれ、血清および
血漿中のLDL-Cを意味する。
い危険性に寄与する因子を指す。ある特定の実施形態において、冠状動脈性心臓病の主要
危険因子には、喫煙、高血圧、高LDL、低HDL-C、冠状動脈性心臓病の家族歴、年
齢、および本明細書に開示される他の因子が含まれるが、これらに限定されない。
化または障害を特徴とする状態を指す。「代謝性」および「代謝」は、当技術分野で周知
の用語であり、一般に、生きている生物内で生じるあらゆる種類の生化学的プロセスを含
む。代謝性障害には、高血糖症、前糖尿病、糖尿病(1型および2型)、肥満、インスリ
ン抵抗性、代謝症候群、ならびに2型糖尿病に起因する脂質異常症が含まれるが、これら
に限定されない。
危険因子のクラスタ化を特徴とする状態を意味する。ある特定の実施形態において、代謝
症候群は、以下の因子:男性において102cmを超え、女性において88cmを超える
ウエスト周り;少なくとも150mg/dLの血清トリグリセリド;男性において40m
g/dL未満、女性において50mg/dL未満のHDL-C;少なくとも130/85
mmHgの血圧;および少なくとも110mg/dLの空腹時グルコースのうちのいずれ
か3つの存在によって特定される。これらの決定因子は、臨床診療時に容易に測定され得
る(JAMA,2001,285:2486-2497)。
投与、静脈内投与、筋肉内投与、動脈内投与、腹腔内投与、または頭蓋内投与、例えば、
髄腔内もしくは脳室内投与が含まれる。投与は、連続投与、長期投与、短期投与、または
間欠投与であり得る。
アミノ酸を連結することによって形成される分子を意味する。ペプチドは、ポリペプチド
およびタンパク質を指す。
供する物質を意味する。例えば、ある特定の実施形態において、apo(a)を標的にす
るアンチセンスオリゴヌクレオチドは、医薬品である。
適な物質の混合物を意味する。例えば、医薬組成物は、1つ以上の活性剤と医薬担体、例
えば、滅菌水溶液を含み得る。
ステル、プロドラッグ、多形体、異性体、同位体標識バリアント、薬剤的に許容される塩
、および当技術分野で既知の他の誘導体等の本明細書に記載の化合物の誘導体を包含する
。
理学的および薬剤的に許容される塩、すなわち、親化合物の所望の生物学的活性を保持し
、かつそれに望ましくない毒物学的影響を与えない塩を意味する。「薬剤的に許容される
塩」または「塩」という用語は、薬剤的に許容される非毒性酸または塩基(無機または有
機酸および塩基を含む)から調製された塩を含む。本明細書に記載の化合物の「薬剤的に
許容される塩」は、当技術分野で周知の方法によって調製され得る。薬剤的に許容される
塩の概説については、Stahl and Wermuth,Handbook of
Pharmaceutical Salts:Properties,Selectio
n and Use(Wiley-VCH,Weinheim,Germany,200
2)を参照されたい。アンチセンスオリゴヌクレオチドのナトリウム塩は、有用であり、
ヒトへの治療的投与に広く受け入れられている。したがって、一実施形態において、本明
細書に記載の化合物は、ナトリウム塩の形態である。
核酸塩基の定義された数を意味する。ある特定の実施形態において、部分は、標的核酸の
連続した核酸塩基の定義された数である。ある特定の実施形態において、部分は、アンチ
センス化合物の連続した核酸塩基の定義された数である。
、疾患、障害、もしくは状態の発病もしくは発症を遅延させるか、または未然に防ぐこと
を指す。予防は、疾患、障害、または状態の発症の危険性を低下させることも意味する。
レベルを上昇させるとは、血漿中のHDLの量を増加させることを意味する。
または少ない数に減らすことを意味する。例えば、血漿トリグリセリドレベルを低下させ
るとは、血漿中のトリグリセリドの量を減らすことを意味する。
能な構造、機能、または特性を有する標的核酸の一部と定義される。例えば、標的領域は
、3’UTR、5’UTR、エクソン、イントロン、エクソン/イントロン接合点、コー
ディング領域、翻訳開始領域、翻訳終結領域、または他の定義される核酸領域を包含し得
る。apo(a)の構造的に定義された領域は、NCBI等の配列データベースの受入番
号によって得ることができ、そのような情報は、参照により本明細書に組み込まれる。あ
る特定の実施形態において、標的領域は、標的領域内のある標的セグメントの5’標的部
位から標的領域内の別の標的セグメントの3’標的部位までの配列を包含し得る。
剤」と組み合わせて用いられ得る薬剤を意味する。第2の治療薬には、apo(a)また
はapoBを標的とするアンチセンスオリゴヌクレオチドが含まれ得るが、これに限定さ
れない。第2の薬剤には、抗apo(a)抗体、apo(a)ペプチド阻害剤、コレステ
ロール低下剤、脂質低下剤、グルコース低下剤、および抗炎症薬も含まれ得る。
定義される。例えば、「標的セグメント」とは、1つ以上のアンチセンス化合物が標的と
する標的核酸のヌクレオチド配列を意味する。「5’標的部位」は、標的セグメントの最
も5’側のヌクレオチドを指す。「3’標的部位」は、標的セグメントの最も3’側のヌ
クレオチドを指す。あるいは、「開始部位」とは、標的セグメントの最も5’側のヌクレ
オチドを指し得、「終止部位」とは、標的セグメントの最も3’側のヌクレオチドを指す
。標的セグメントは、ある配列の「開始部位」で始まり、別の配列の「終止部位」で終わ
り得る。
阻害する薬剤を意味する。
ヒト動物を意味する。
たは障害に起因し、かつそれを伴う現象を意味し、その指標として働く。例えば、アンギ
ナ、胸痛、息切れ、動悸、衰弱、目まい、嘔気、発汗、頻脈、徐脈、不整脈、心房細動、
下肢の腫れ、チアノーゼ、疲労、失神、顔のしびれ、肢のしびれ、跛行もしくは筋けいれ
ん、腹部腫脹、または発熱は、心臓血管疾患または障害の症状である。
異的にハイブリダイズし、かつ所望の効果を引き起こすアンチセンス化合物の設計および
選択のプロセスを意味する。
医薬品の量を意味する。
(adipose)組織量および/またはコレステロールを低下させるように意図された
食生活および生活スタイルの変化を意味する。そのような変化は、心臓病を発症する危険
性を低下させることができ、1日の総カロリー、総脂質、飽和脂肪、多価不飽和脂肪、一
価不飽和脂肪、炭水化物、タンパク質、コレステロール、不溶性繊維の食事摂取量の推奨
、ならびに身体的活動の推奨を含み得る。
物を投与して、疾患、障害、または状態の変化または改善をもたらすことを指す。
子と結合されるグリセロールからなる脂質または中性脂肪を意味する。
非依存性糖尿病」、「NIDDM」、「肥満関連糖尿病」、または「成人発症糖尿病」と
しても既知の「2型糖尿病」は、主にインスリン抵抗性、相対的インスリン欠損、および
高血糖症を特徴とする代謝性障害である。
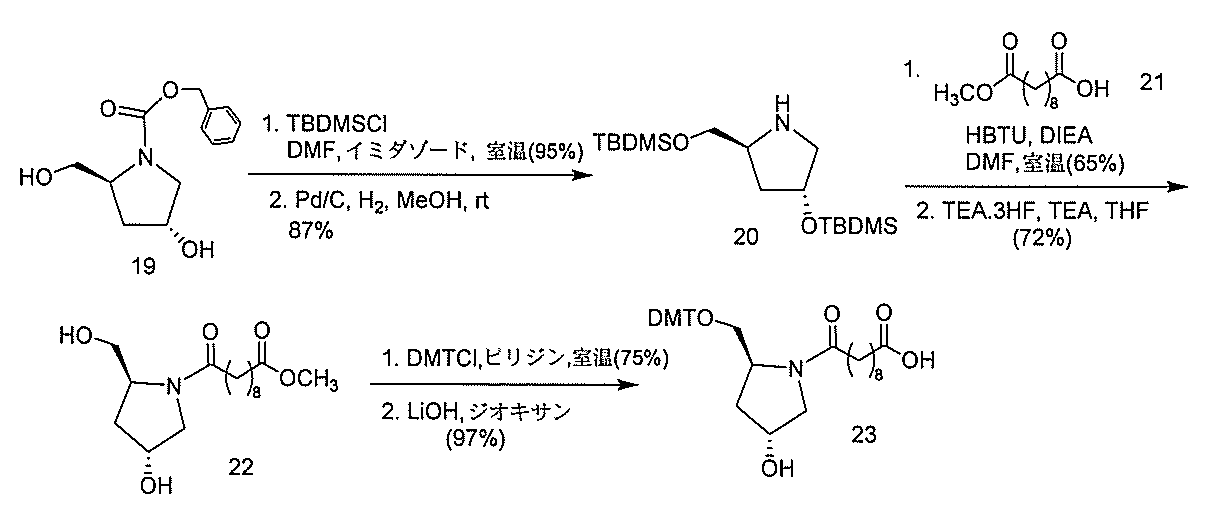
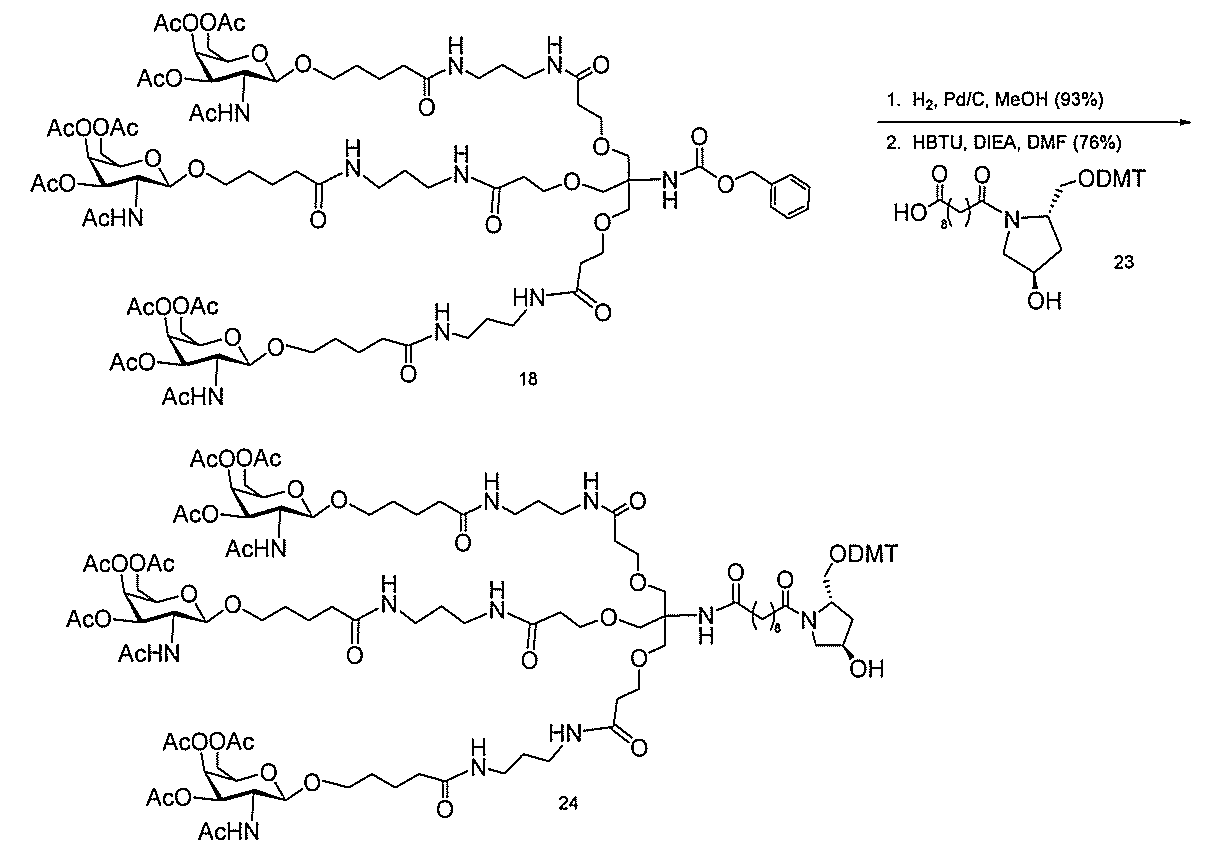
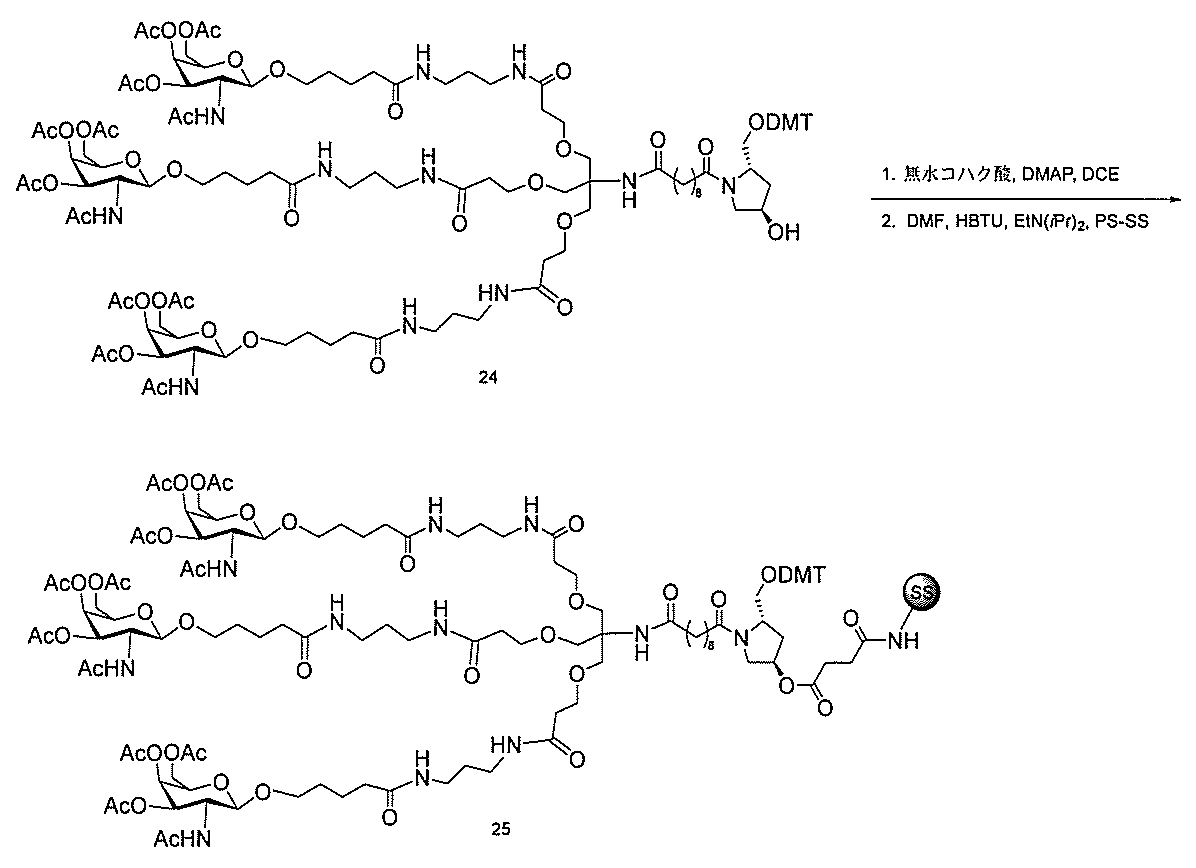
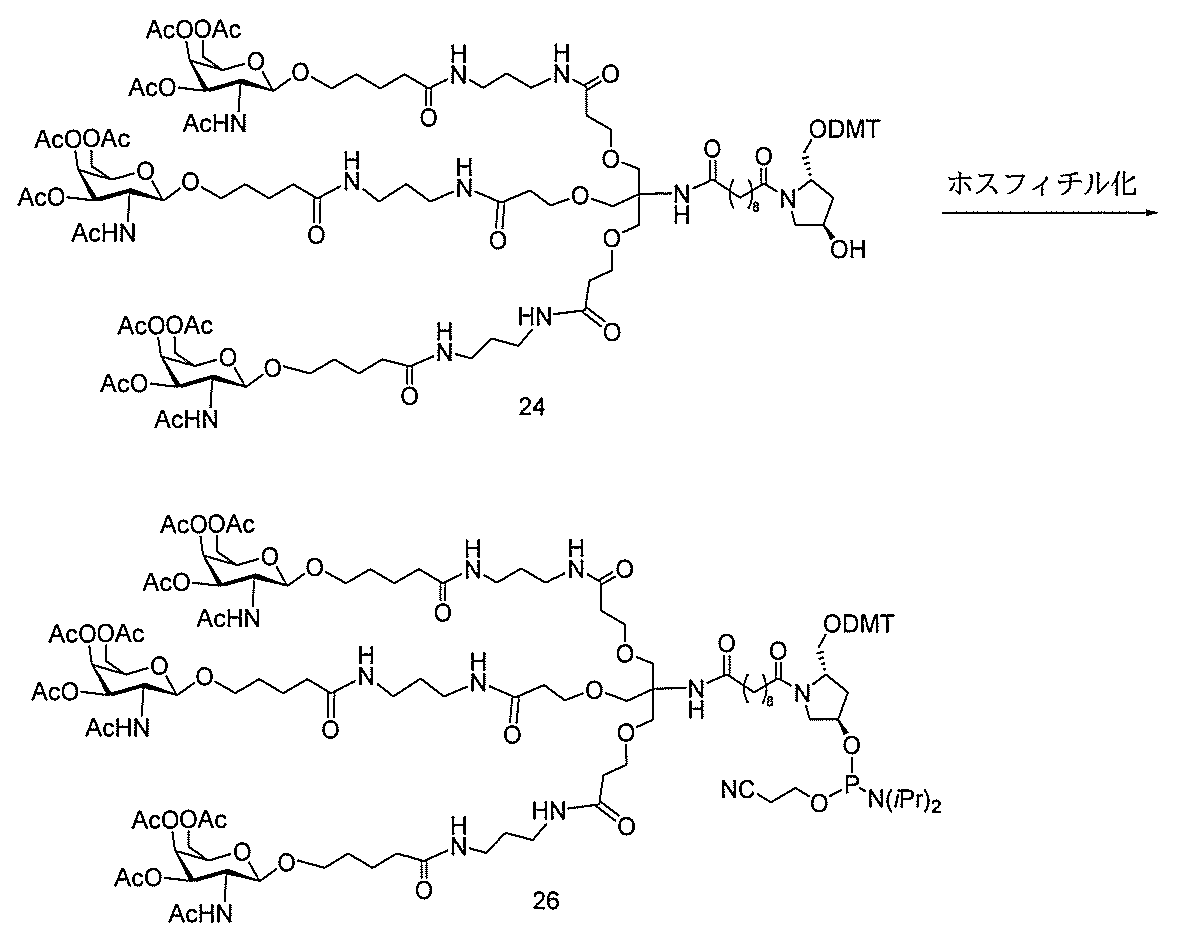
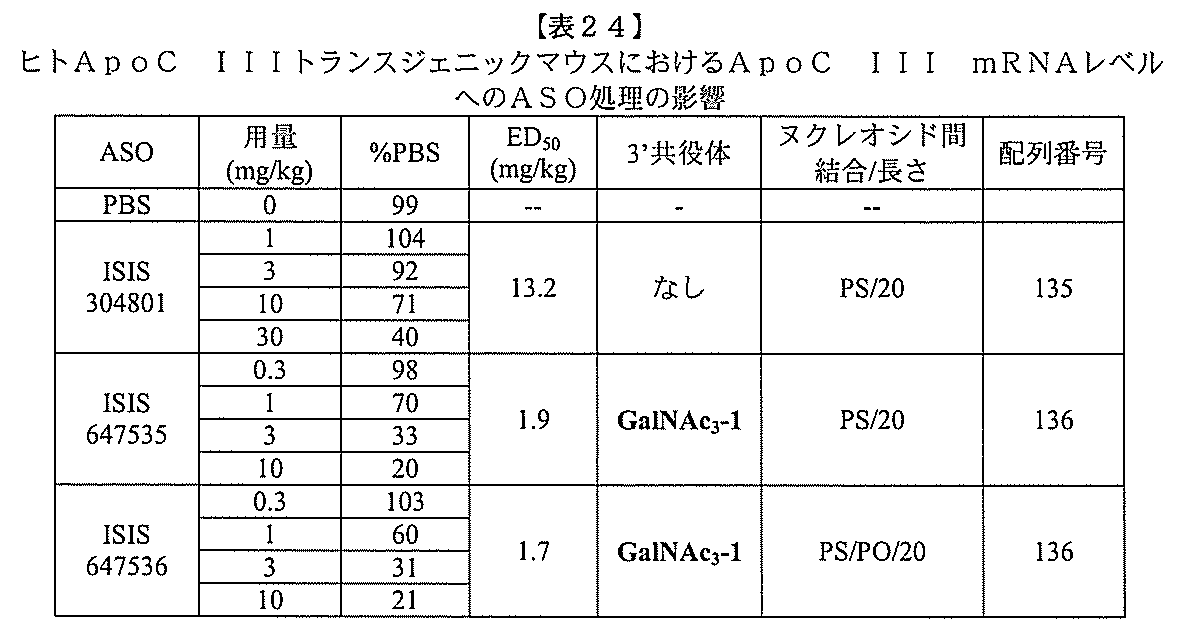
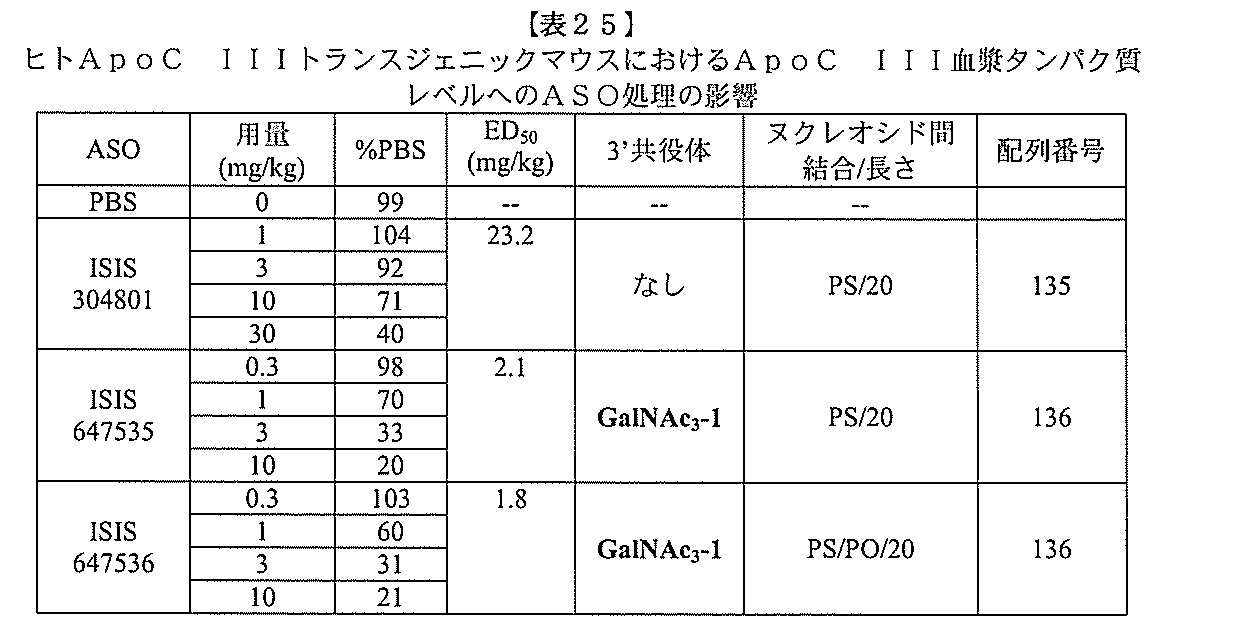
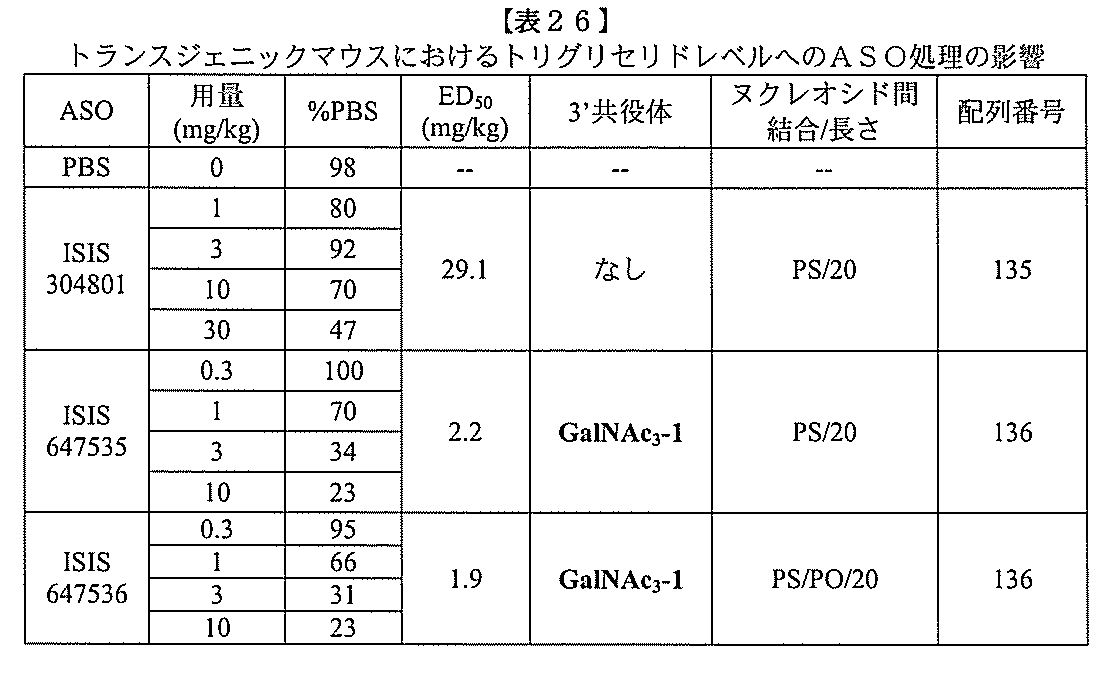
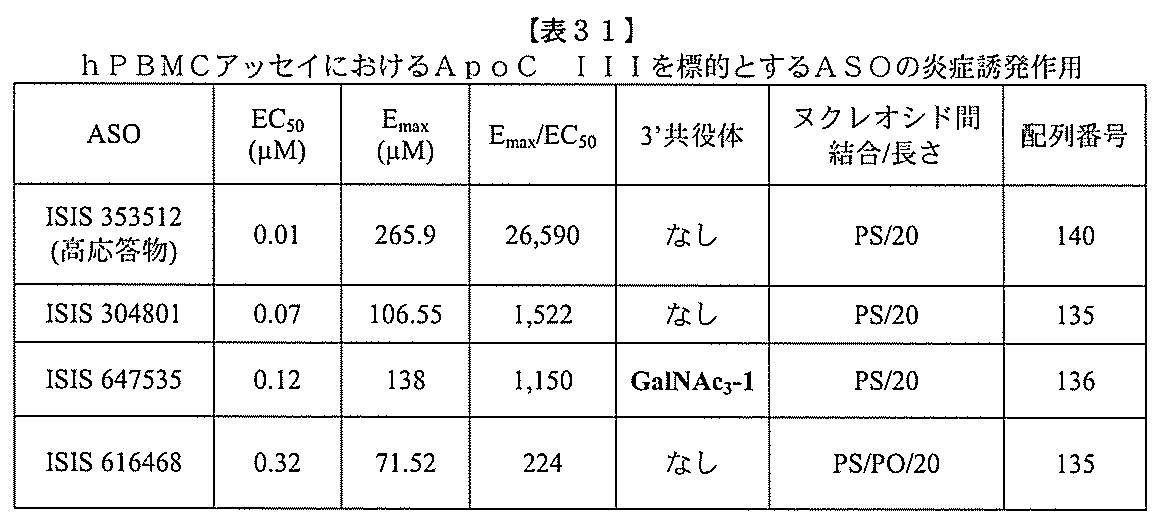
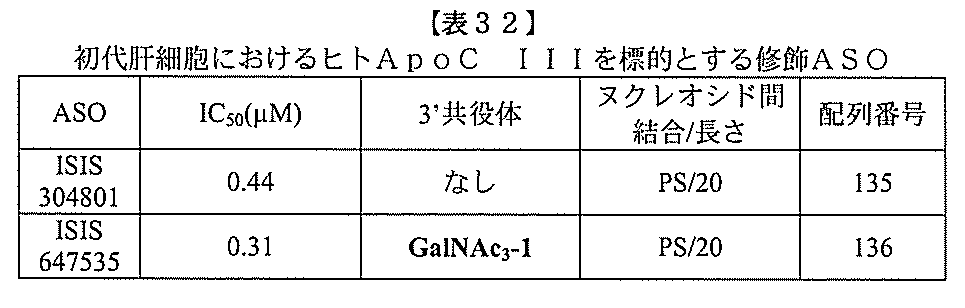
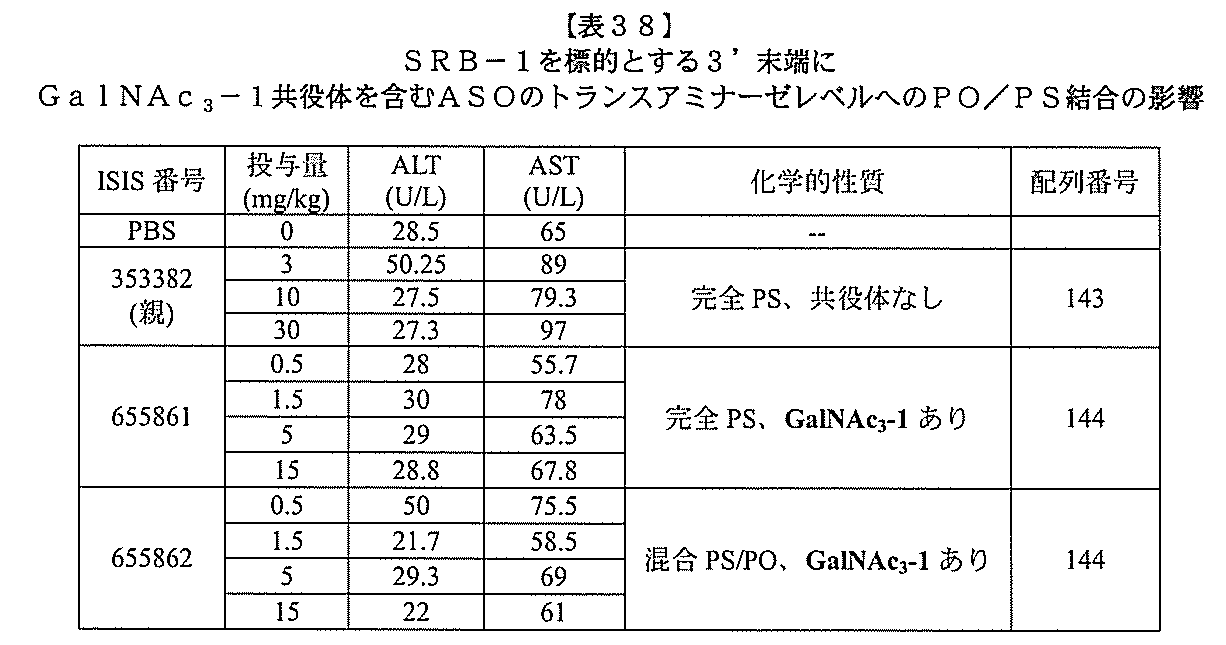
ある特定の実施形態
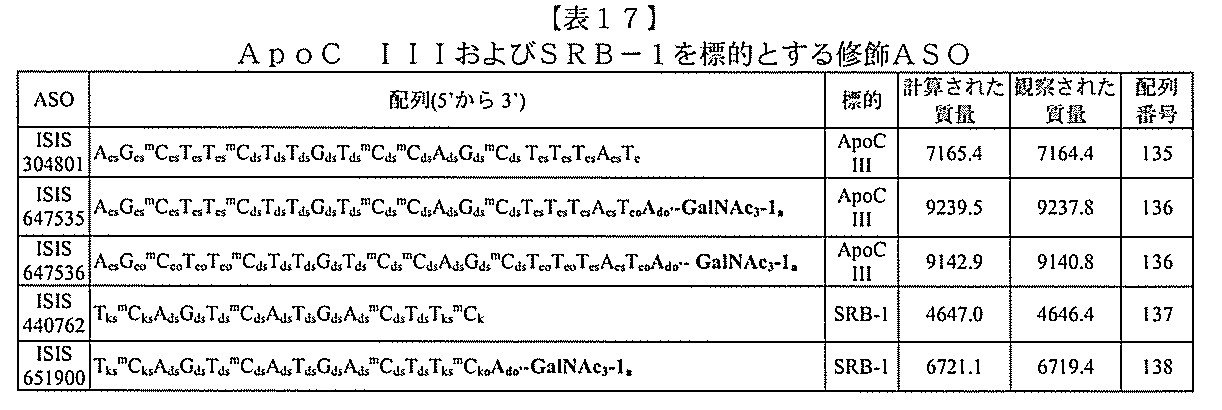
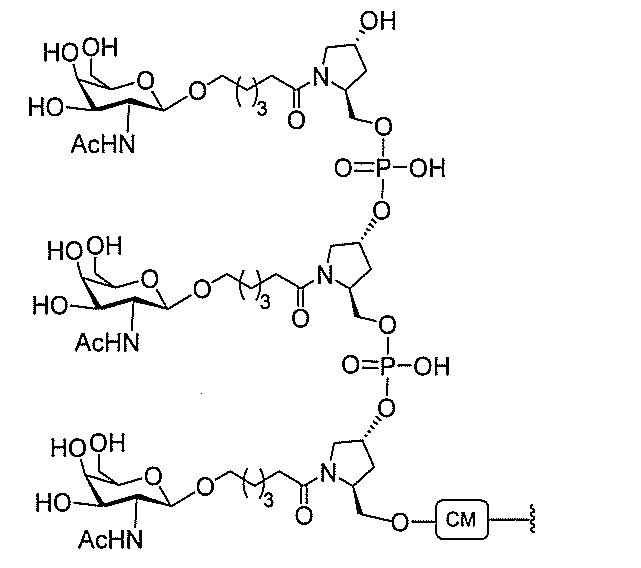
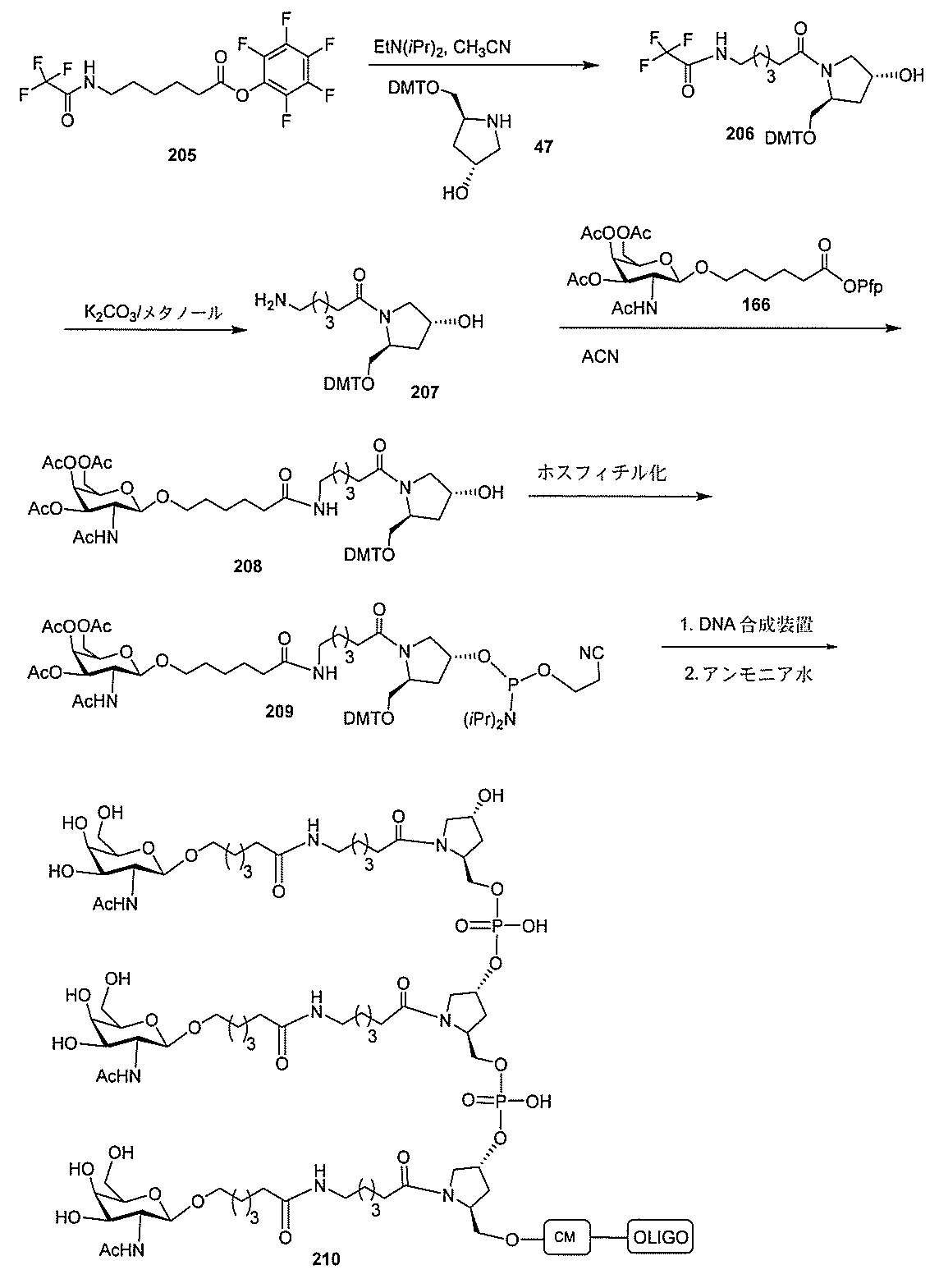
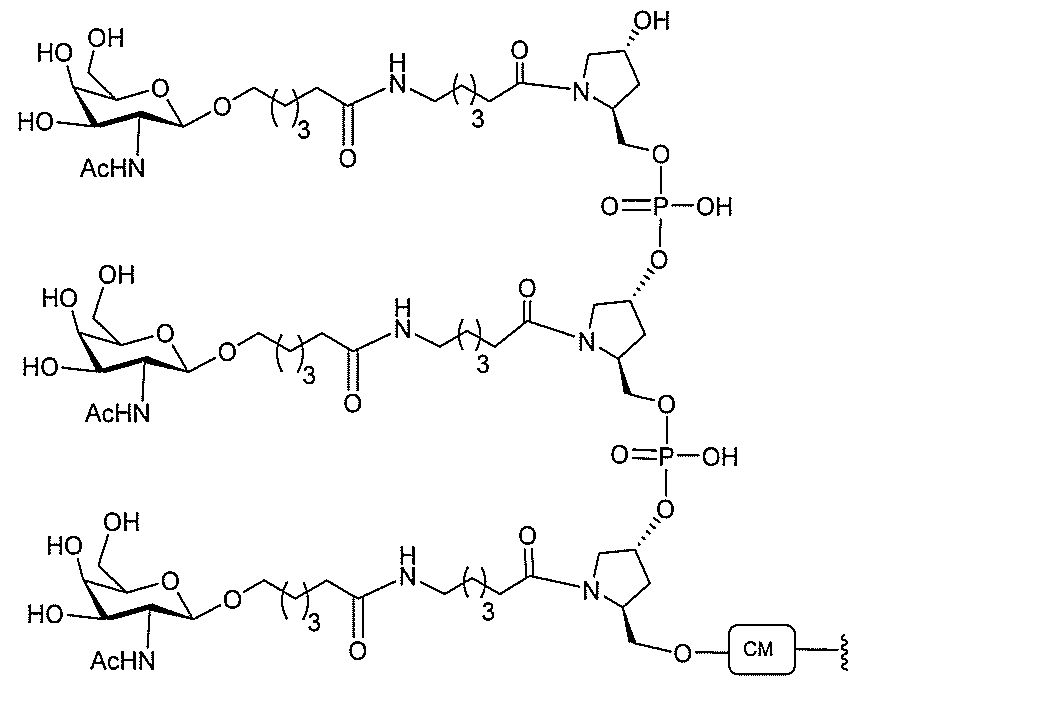
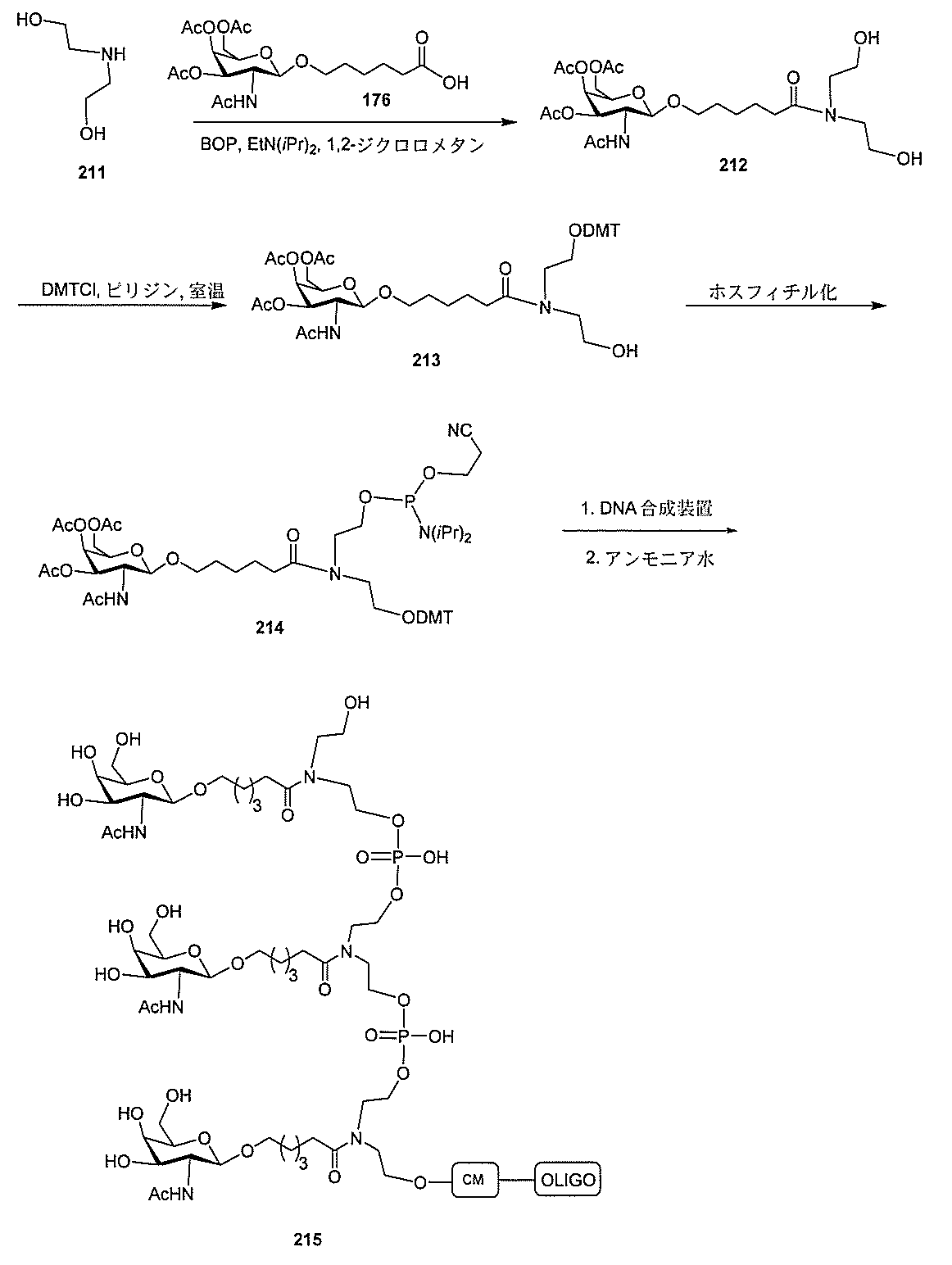
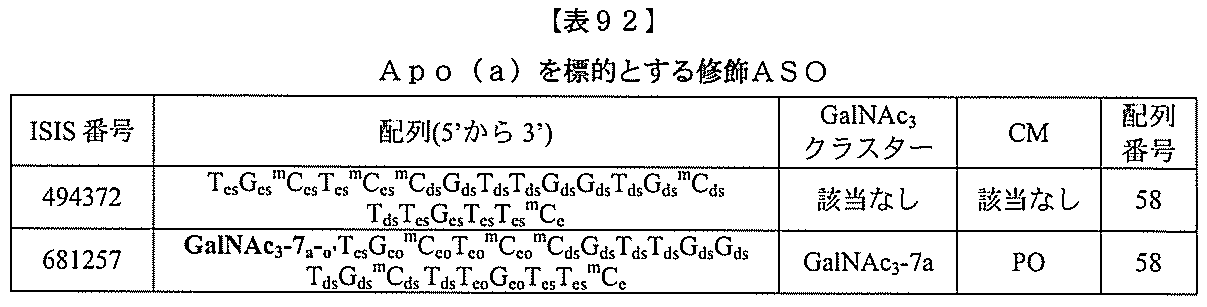
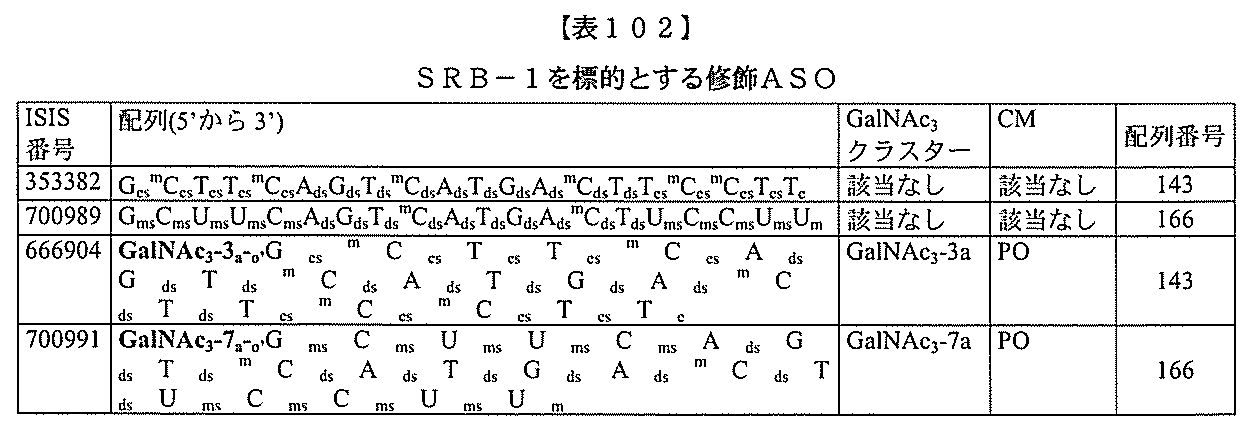
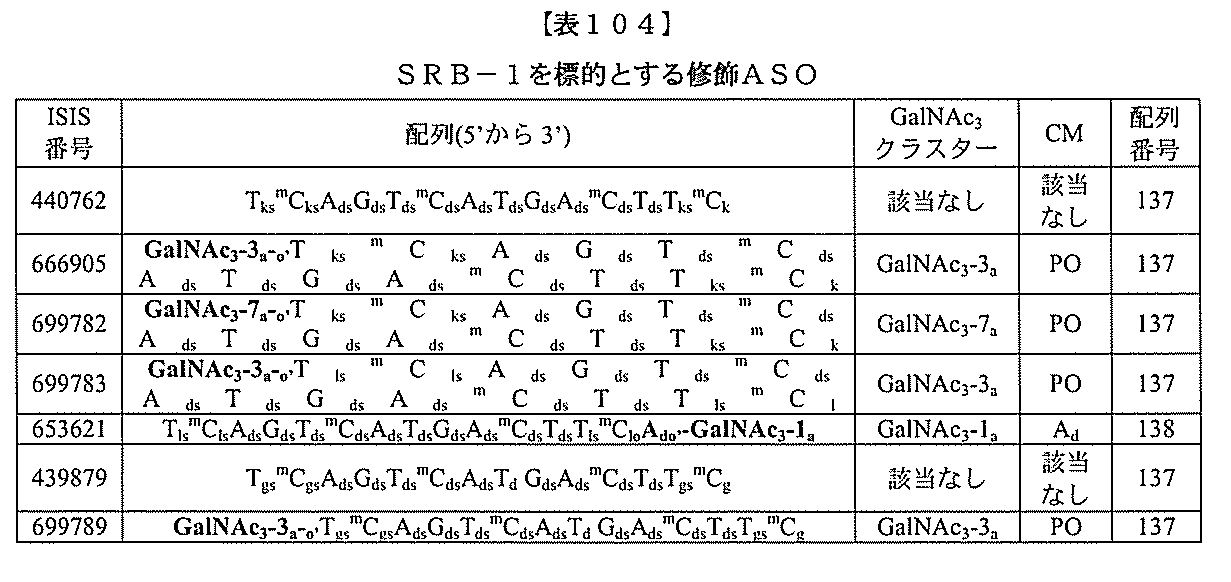
)(apo(a))を標的にするsiRNAまたはアンチセンスオリゴヌクレオチドと、
本明細書に記載の共役基とを含む。共役に好適なapo(a)を標的にするアンチセンス
オリゴヌクレオチドの例として、参照によりそれらの全体が本明細書に組み込まれる、国
際公開第WO2013/177468号、米国特許第US8,673,632号、同第U
S7,259,150号、および米国特許出願公開第US2004/0242516号に
開示されるものが挙げられるが、これらに限定されない。ある特定の実施形態において、
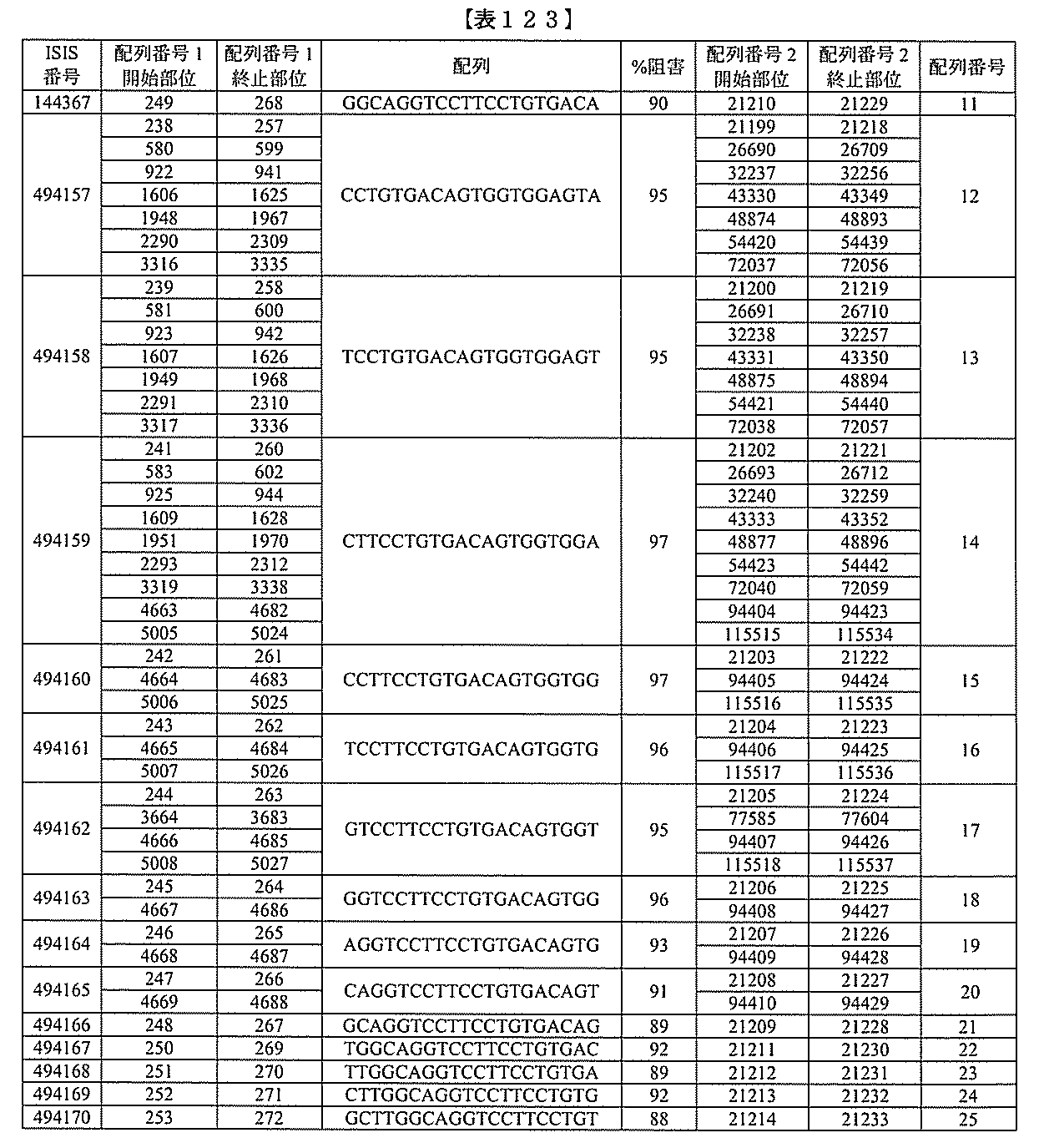
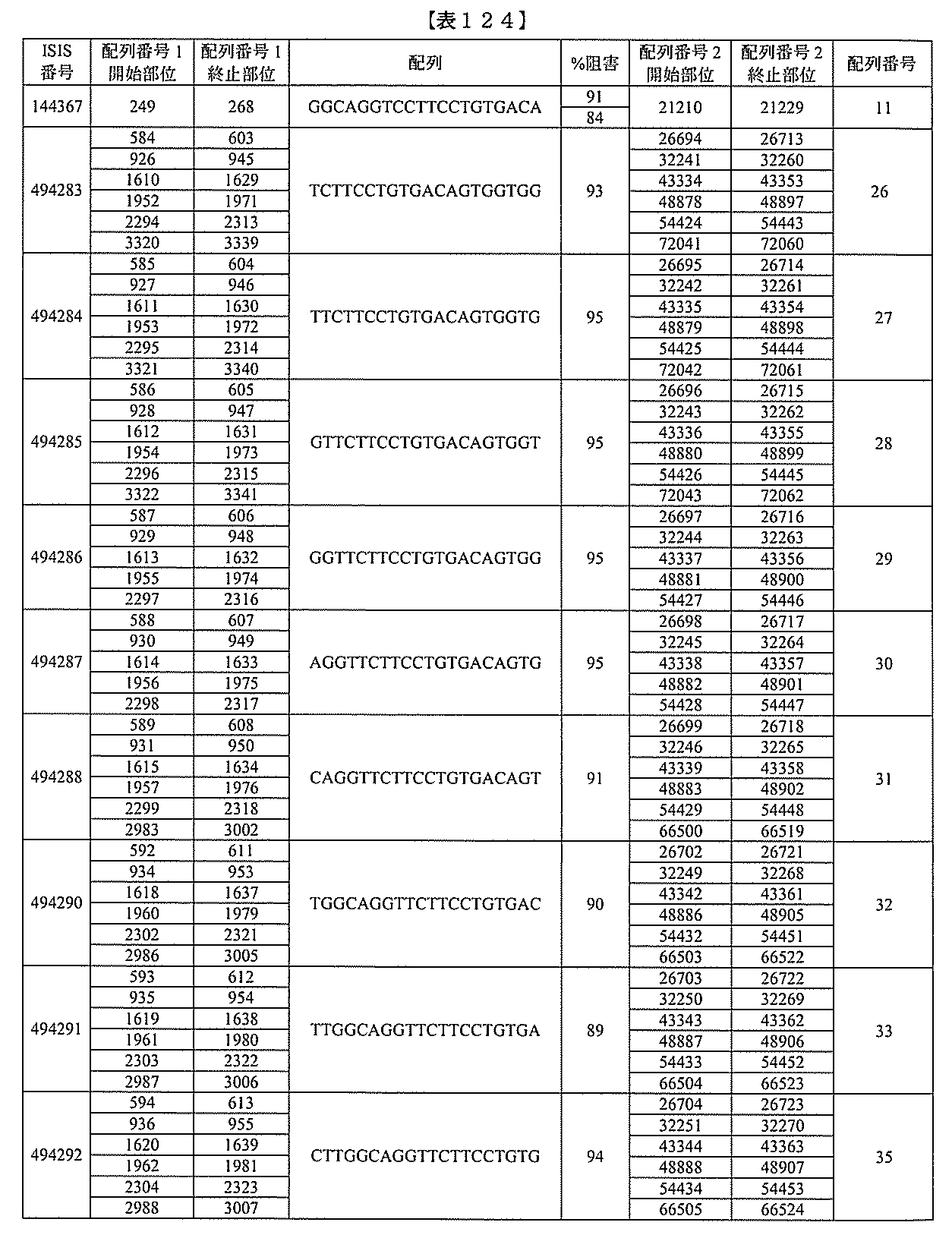
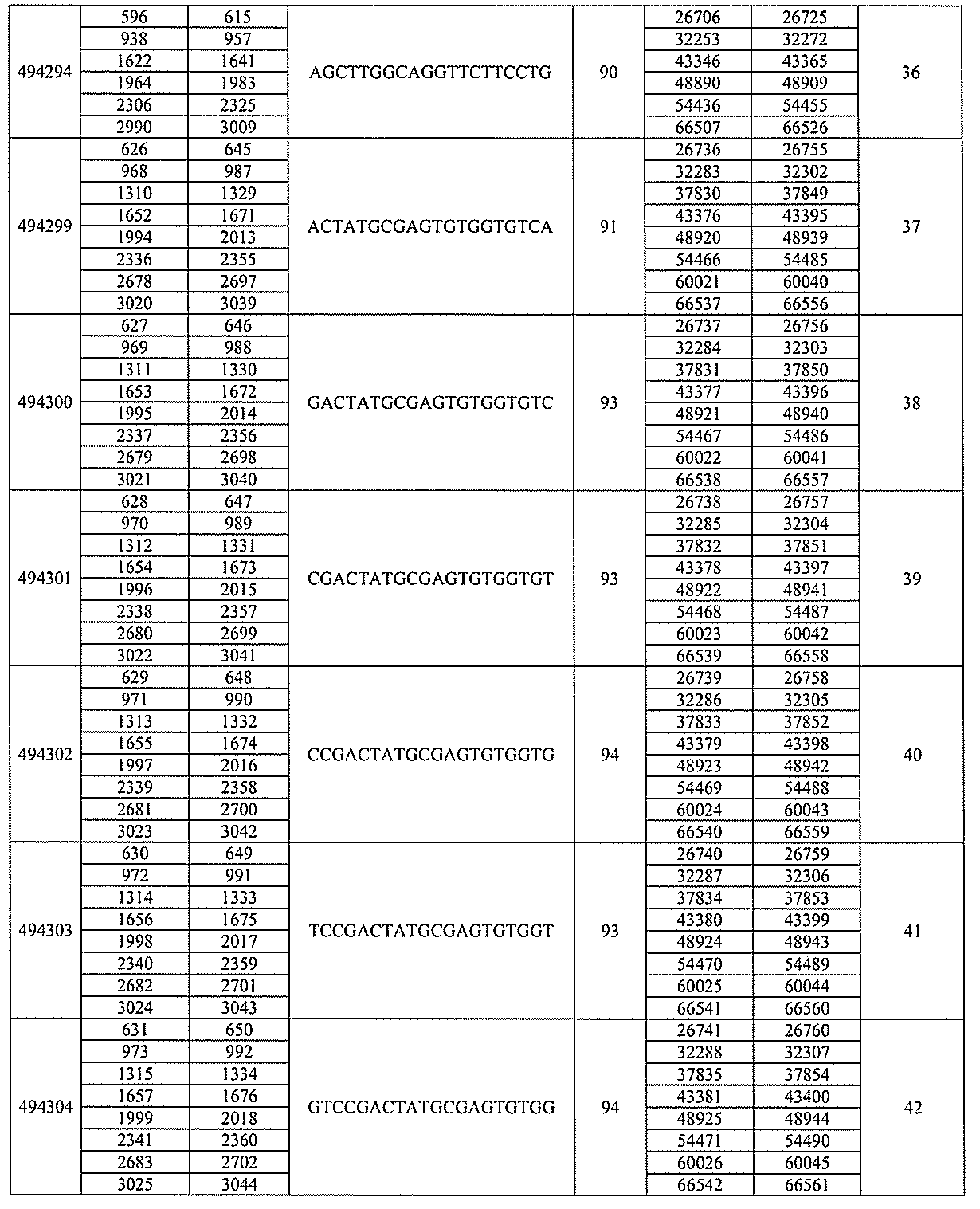
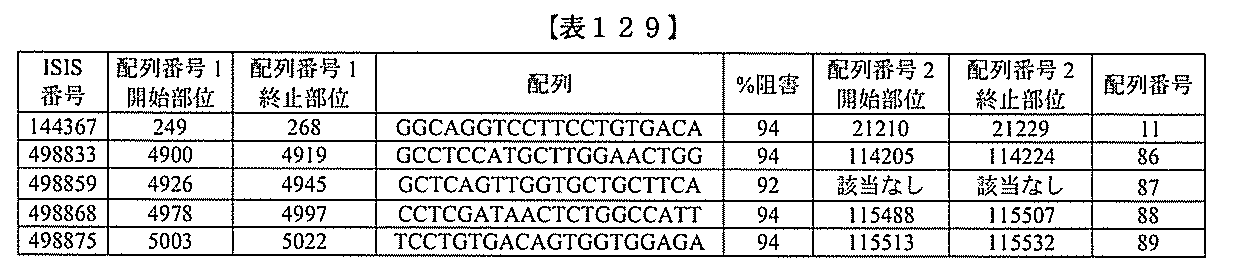
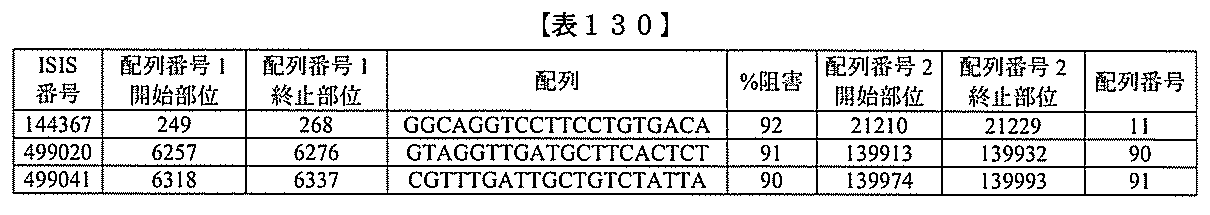
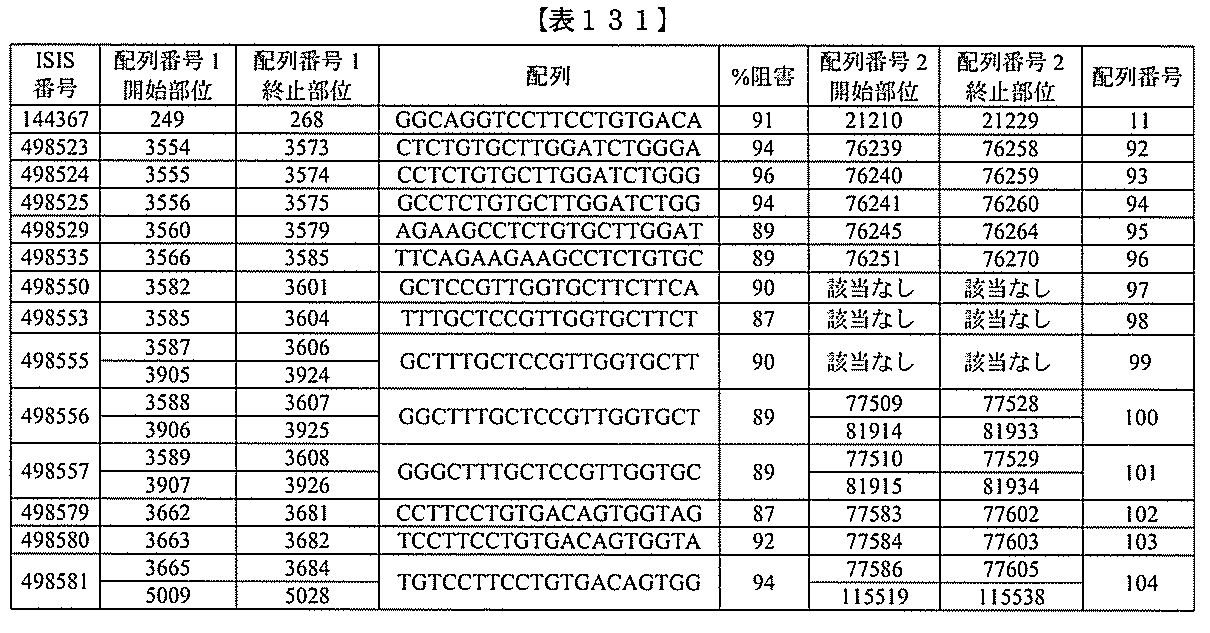
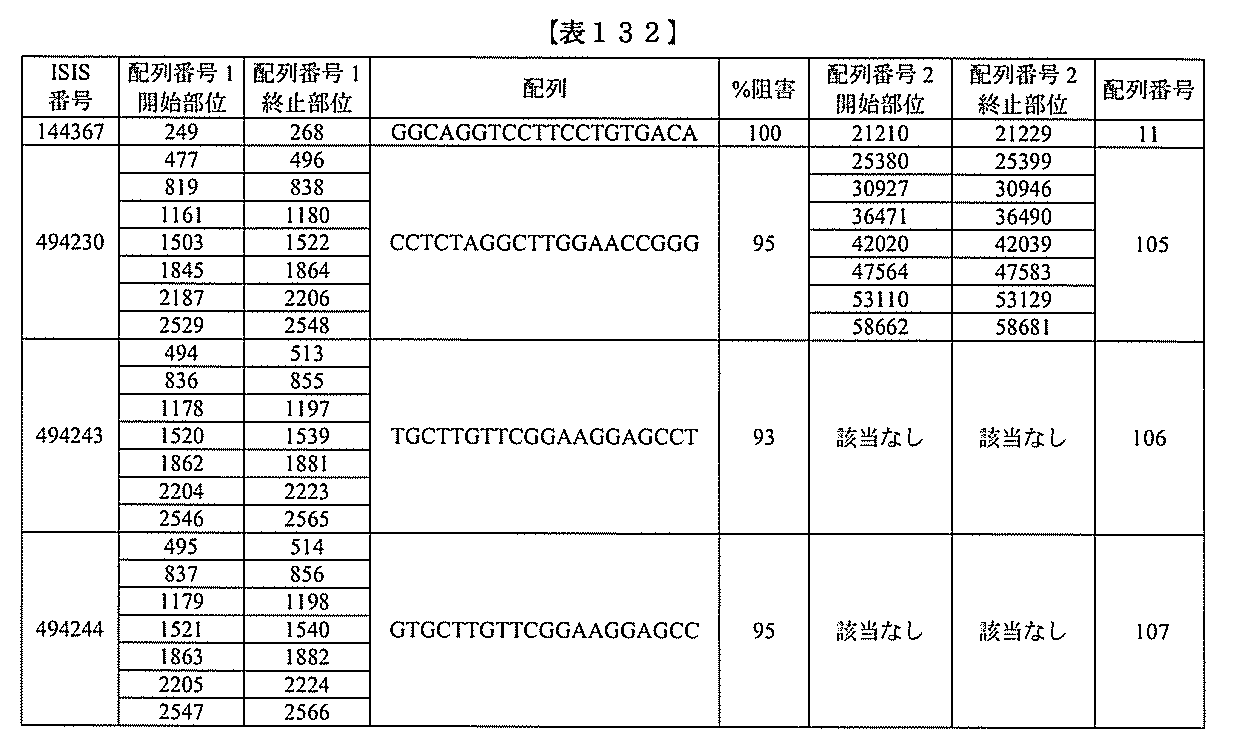
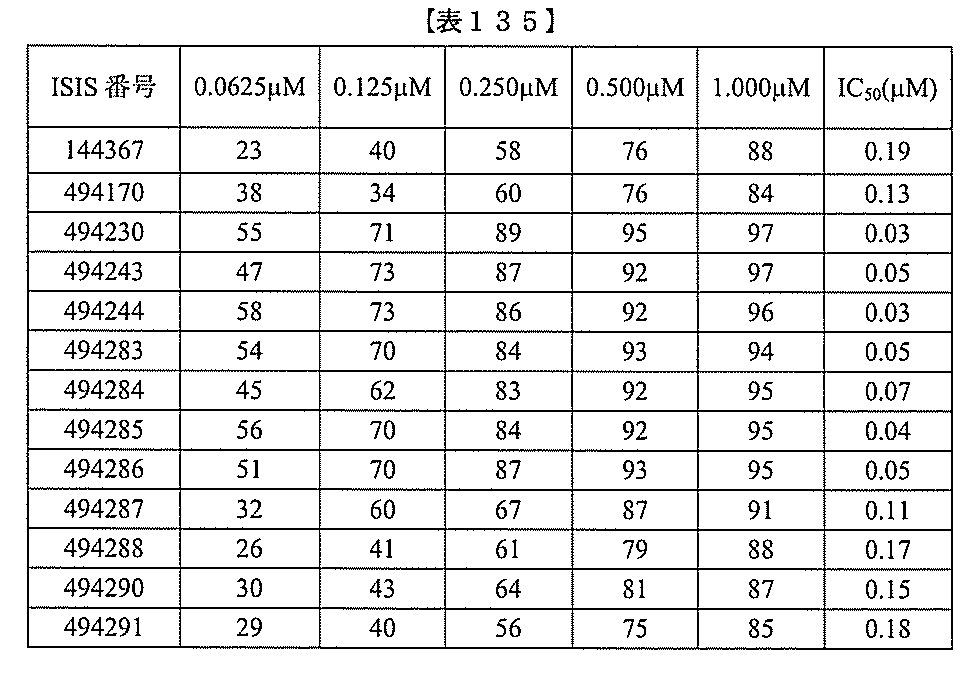
化合物は、国際公開第WO2013/177468号に開示される、配列番号12~13
0、133、134のうちのいずれかの核酸塩基配列を有するアンチセンスオリゴヌクレ
オチドと、本明細書に記載の共役基とを含む。ある特定の実施形態において、化合物は、
米国特許第US8,673,632号に開示される、配列番号11~45および85~9
6のうちのいずれかの核酸塩基配列を有するアンチセンスオリゴヌクレオチドと、本明細
書に記載の共役基とを含む。ある特定の実施形態において、化合物は、米国特許第US7
,259,150号に開示される、配列番号11~45のうちのいずれかの核酸塩基配列
を有するアンチセンスオリゴヌクレオチドと、本明細書に記載の共役基とを含む。ある特
定の実施形態において、化合物は、米国特許出願公開第US2004/0242516号
に開示される、配列番号7~41のうちのいずれかの核酸塩基配列を有するアンチセンス
オリゴヌクレオチドと、本明細書に記載の共役基とを含む。前記参照される配列番号のう
ちのすべての核酸塩基配列が参照により本明細書に組み込まれる。
の化合物および方法を提供する。ある特定の実施形態において、化合物は、apo(a)
関連疾患を治療、予防、または改善するためのapo(a)特異的阻害剤である。ある特
定の実施形態において、化合物は、apo(a)を標的とするアンチセンスオリゴヌクレ
オチドである。ある特定の実施形態において、化合物は、apo(a)を標的とするアン
チセンスオリゴヌクレオチドおよび共役基である。
する。ある特定の実施形態において、化合物は、Lp(a)関連疾患を治療、予防、また
は改善するためのapo(a)特異的阻害剤である。ある特定の実施形態において、化合
物は、apo(a)を標的とするアンチセンスオリゴヌクレオチドである。ある特定の実
施形態において、化合物は、apo(a)を標的とするアンチセンスオリゴヌクレオチド
および共役基である。
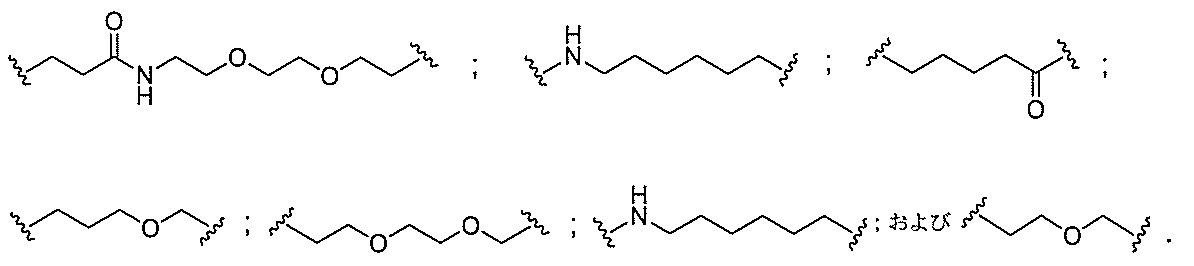
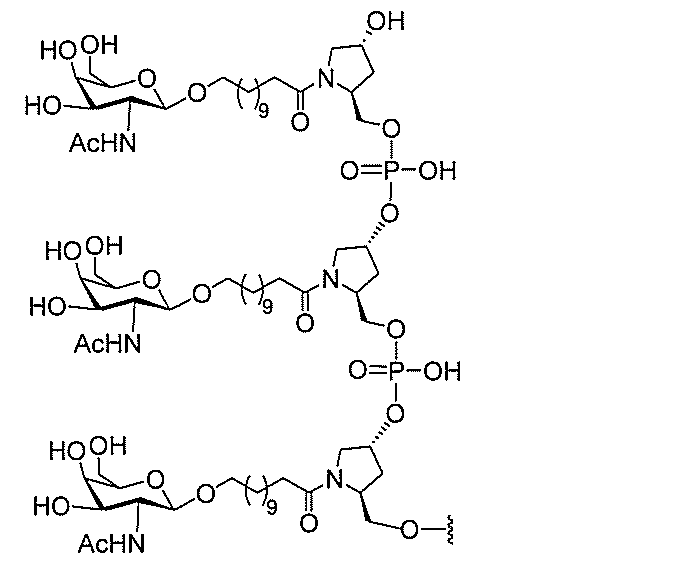
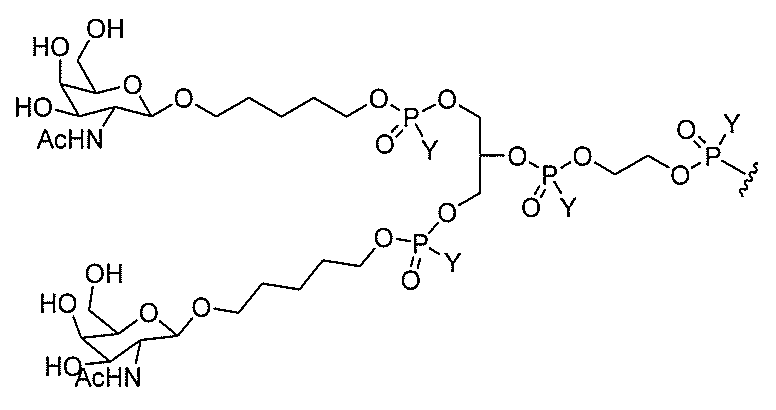
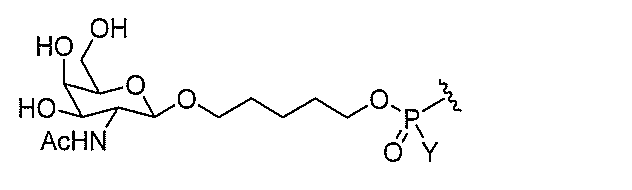
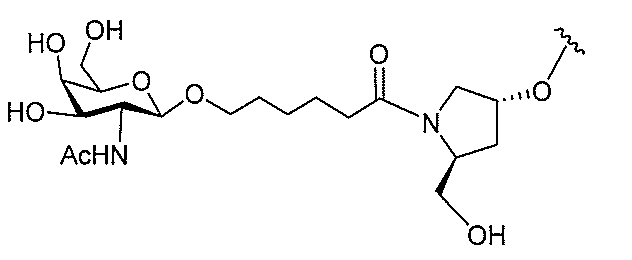
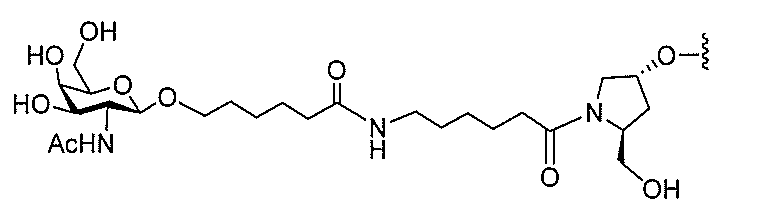
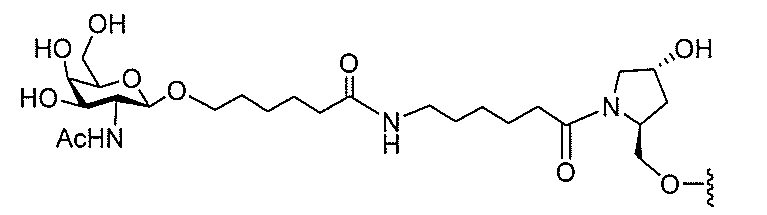
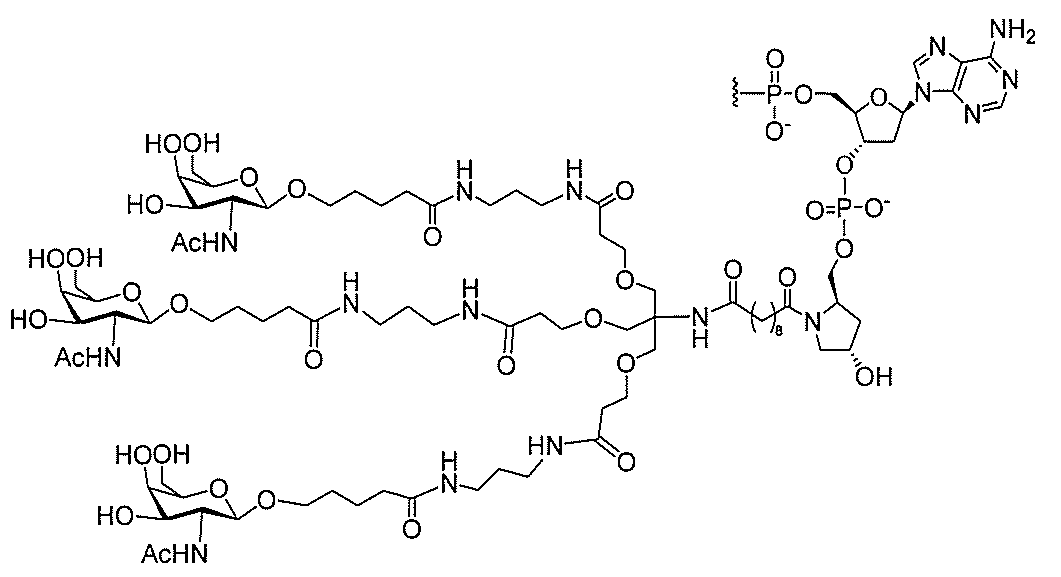
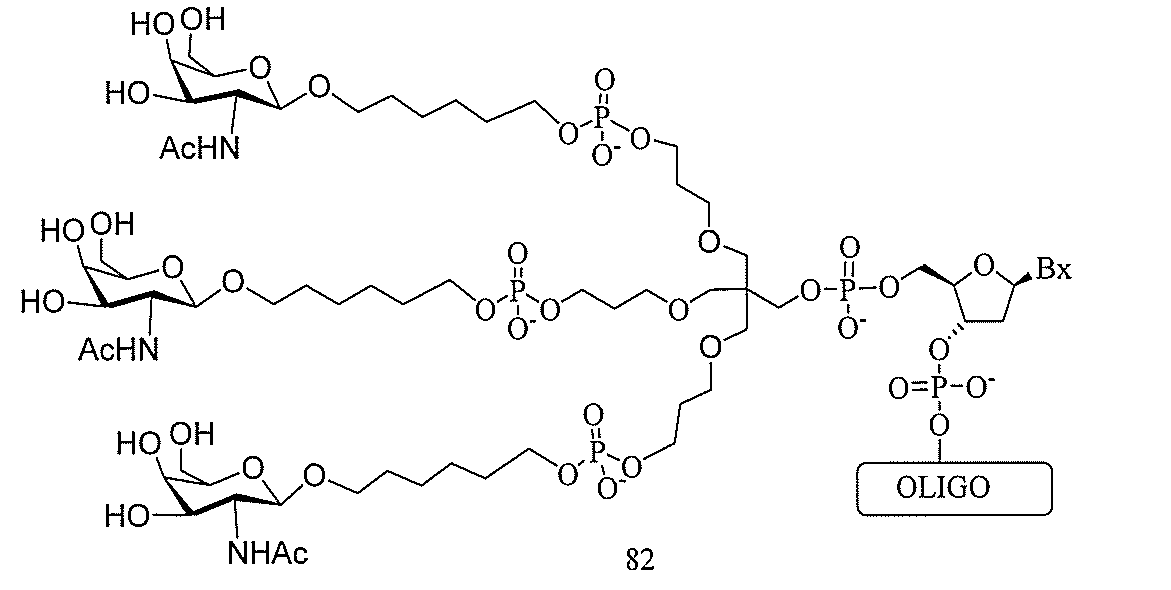
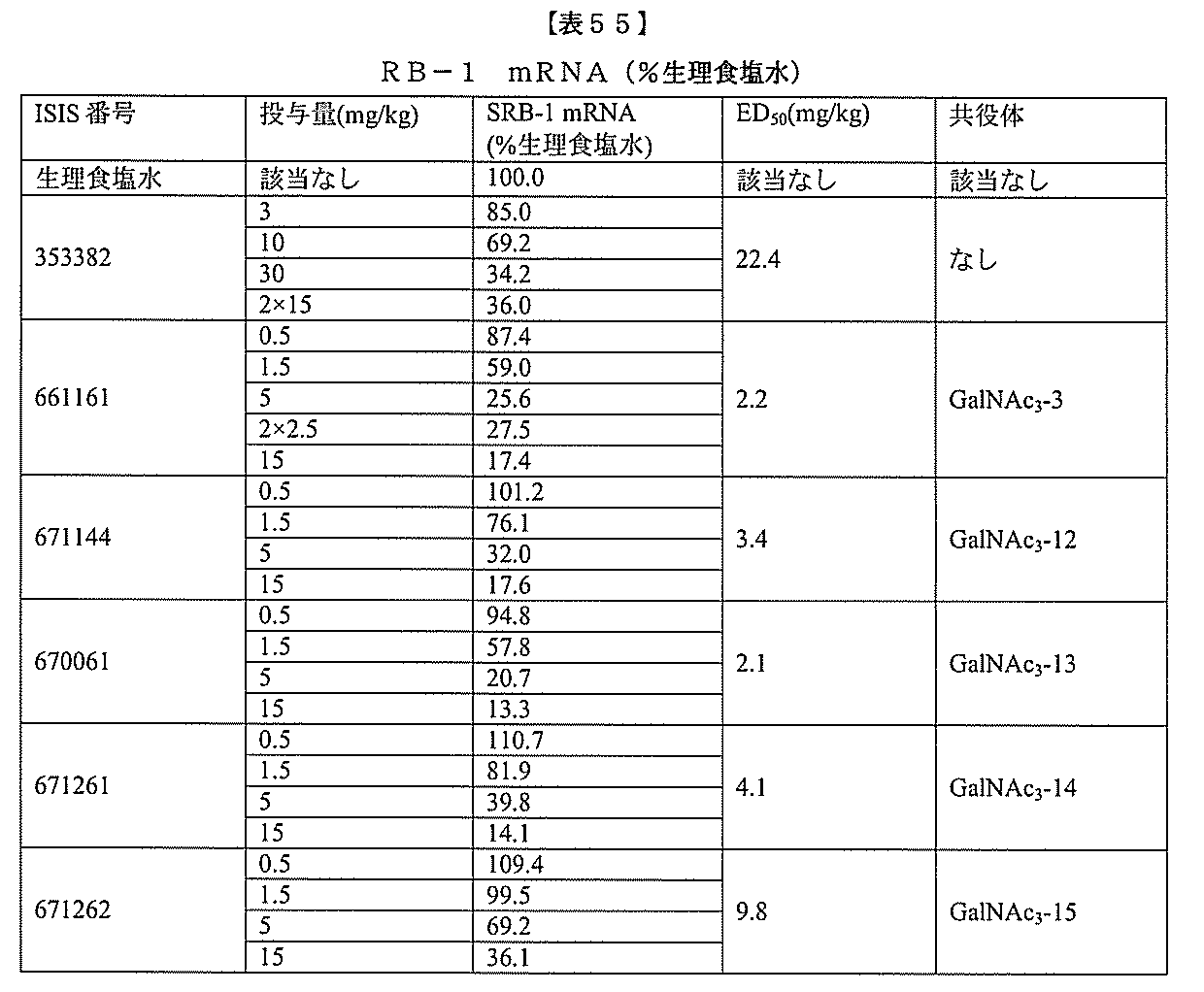
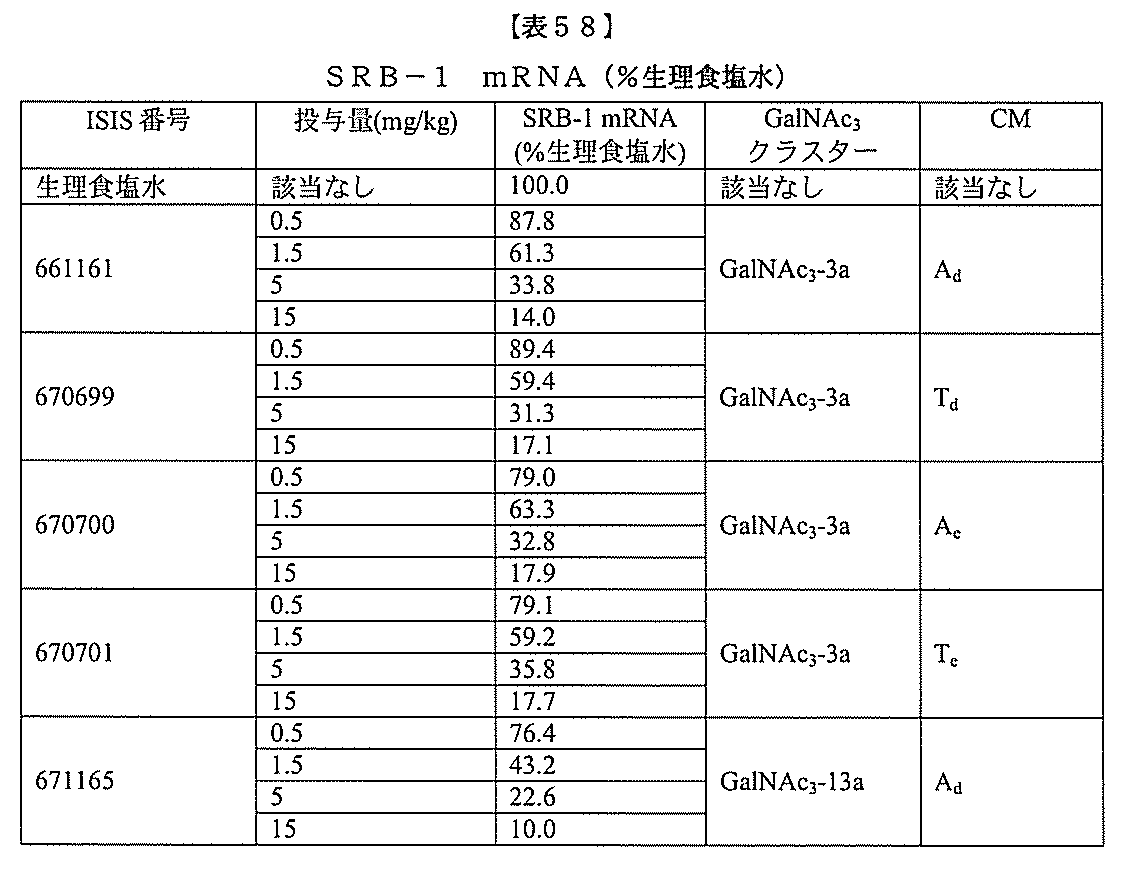
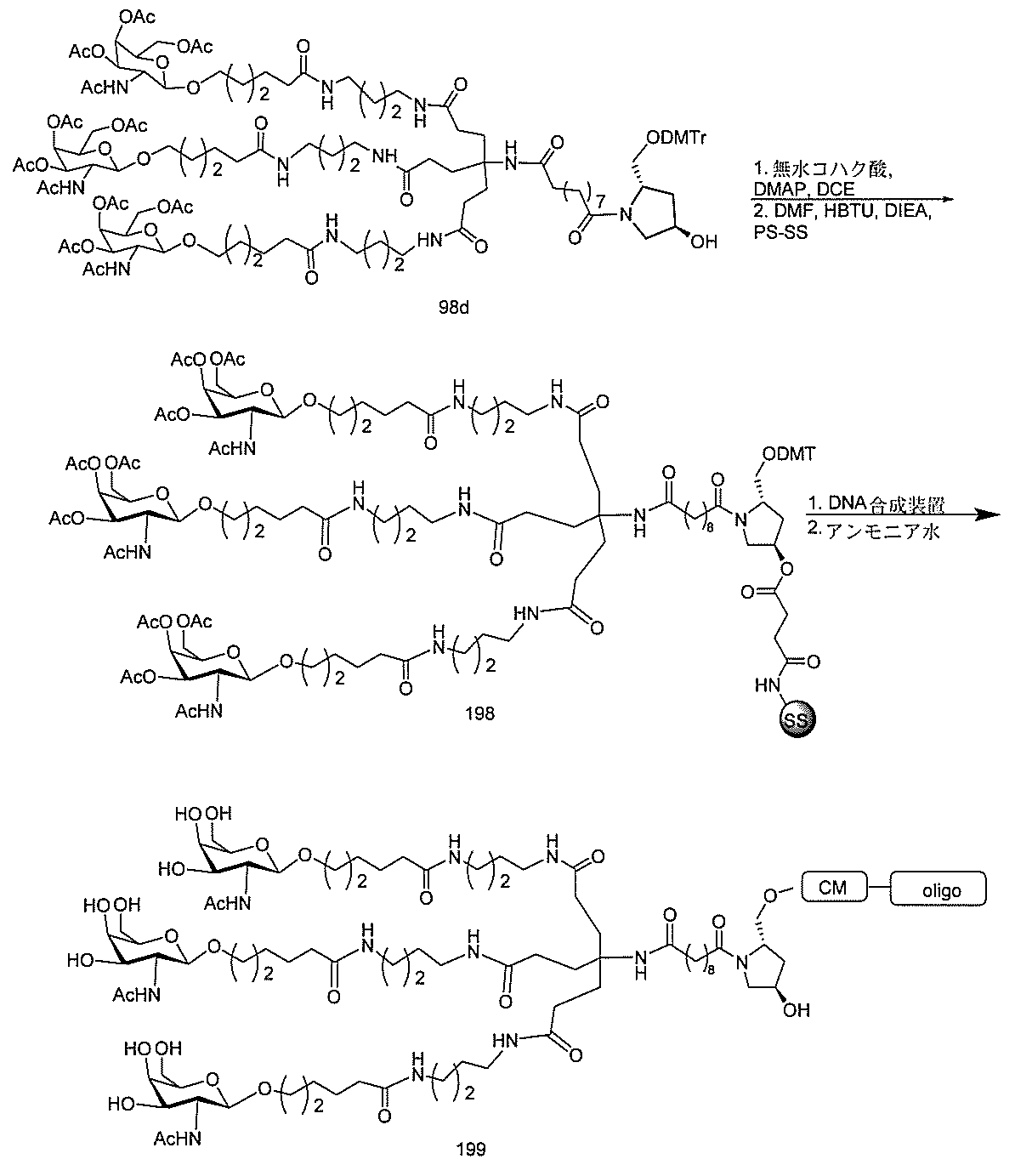
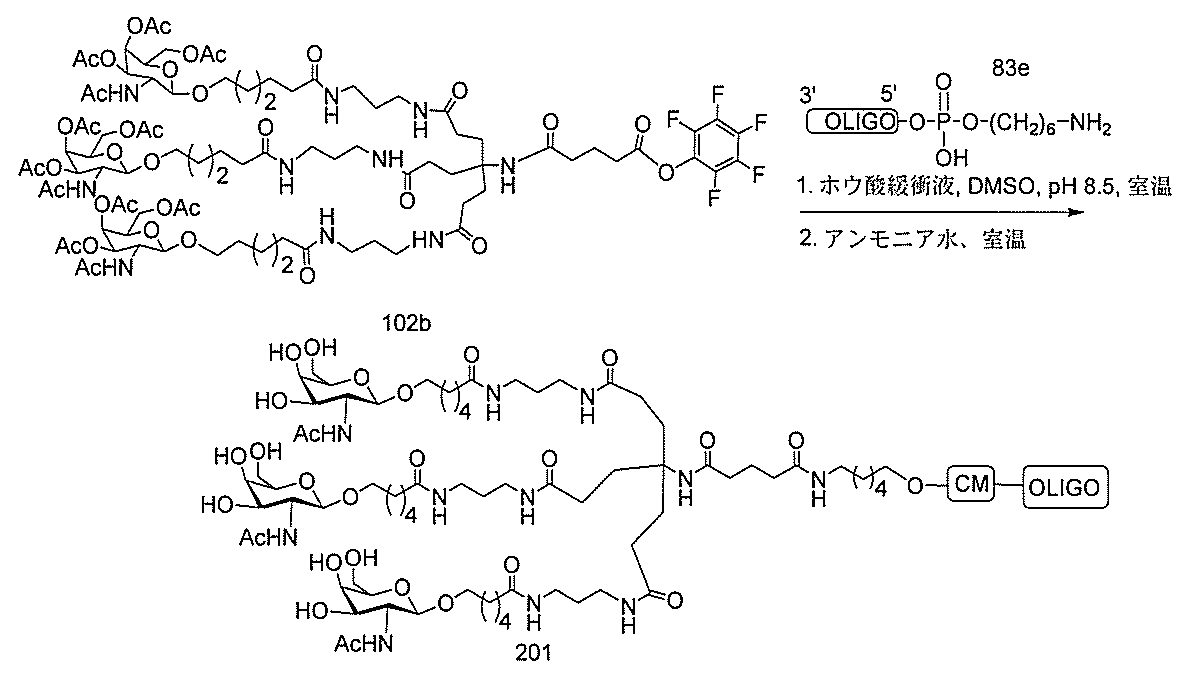
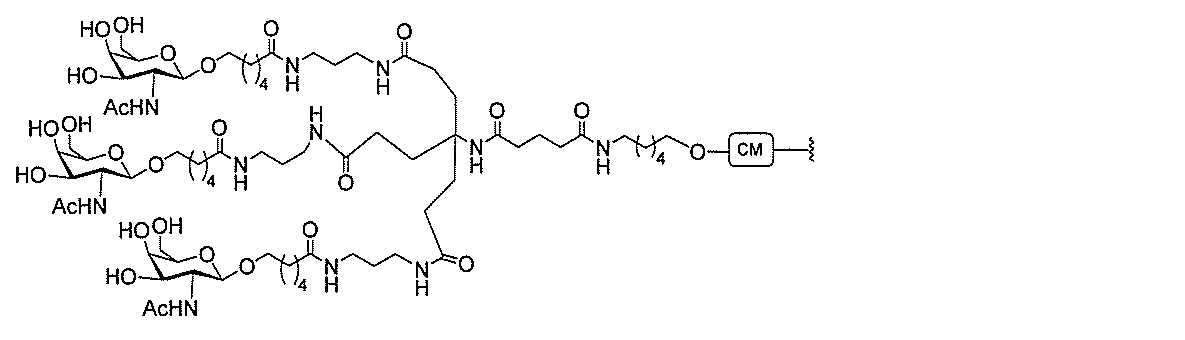
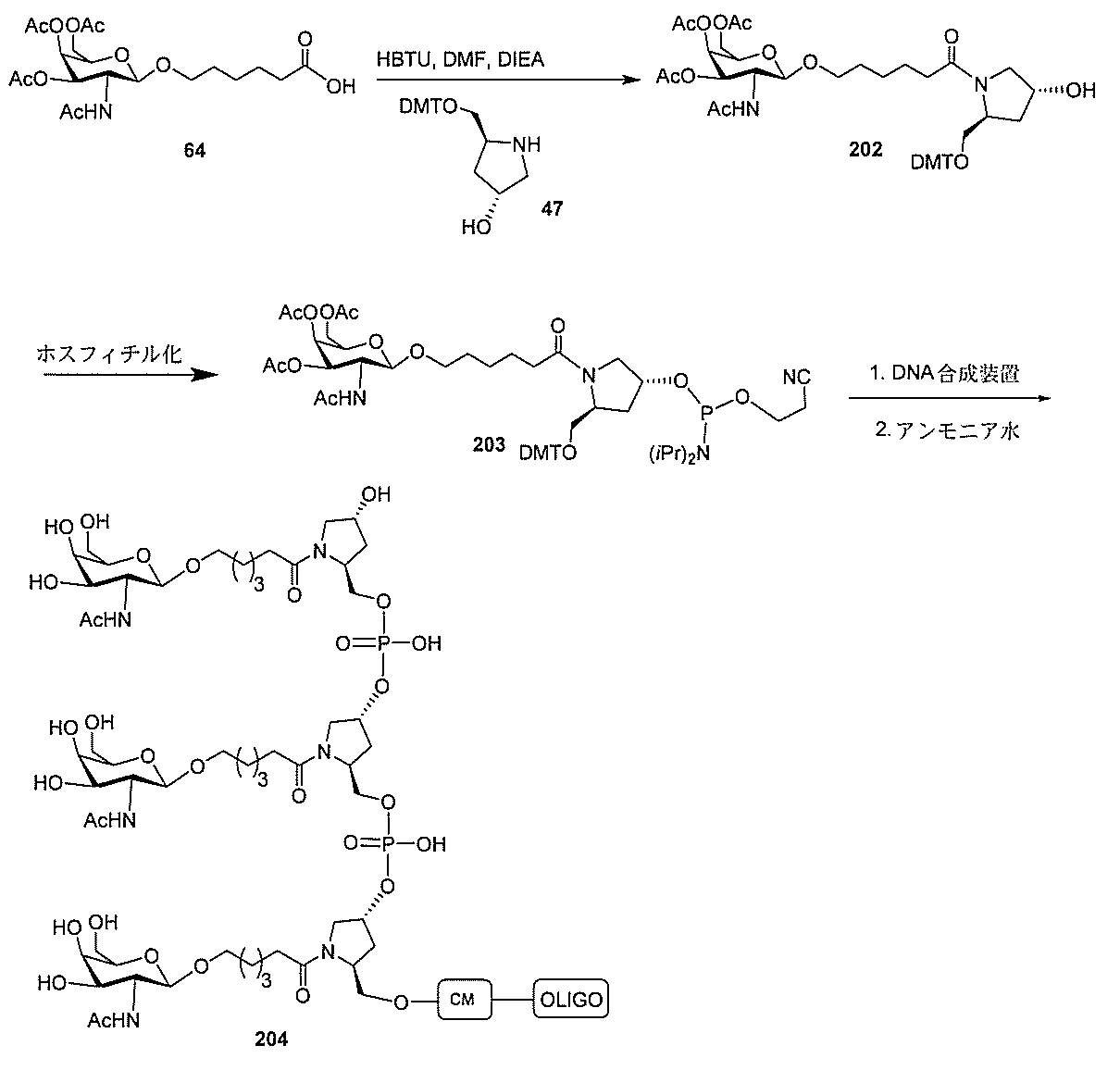
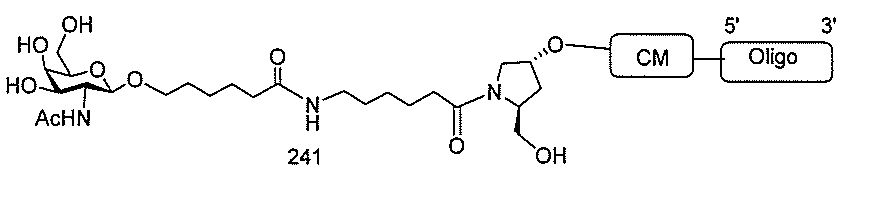
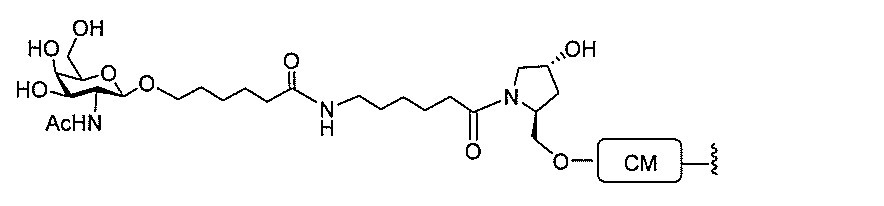
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなる。ある特定の実施形態において、共役基を有する修飾オリゴヌクレオチドは
、15~30、18~24、19~22、13~25、14~25、15~25個の連結
したヌクレオシドからなる。ある特定の実施形態において、共役基を有する修飾オリゴヌ
クレオチドは、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少
なくとも16、少なくとも17、少なくとも18、少なくとも19、少なくとも20、少
なくとも21、少なくとも22、少なくとも23、少なくとも24、少なくとも25、少
なくとも26、少なくとも27、少なくとも28、少なくとも29、または30個の連結
したヌクレオシドを含む。ある特定の実施形態において、共役基を有する修飾オリゴヌク
レオチドは、20個の連結したヌクレオシドからなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、配列番号1~4のうちのいずれか
のの等長部分に相補的な少なくとも8、少なくとも9、少なくとも10、少なくとも11
、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16
、少なくとも17、少なくとも18、少なくとも19、または20個の連続した核酸塩基
を含む。
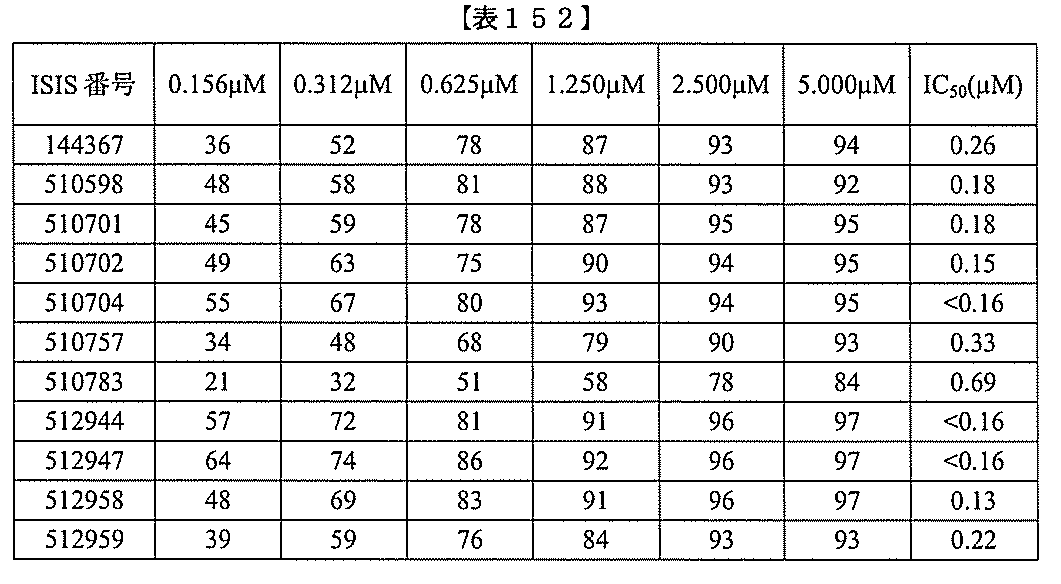
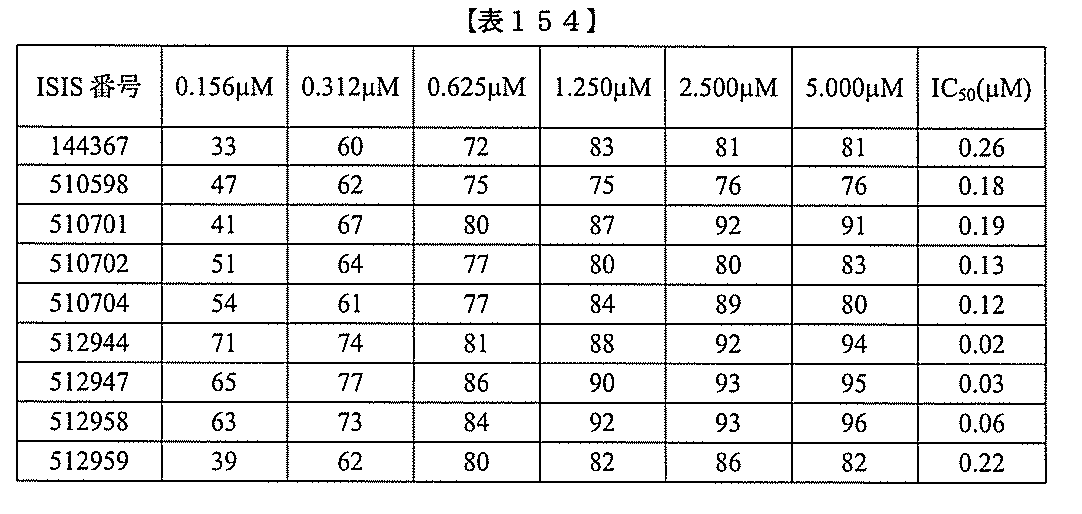
および共役基を含む化合物を提供し、修飾オリゴヌクレオチドは、例えば実施例114お
よび117に示される標的セグメントのうちのいずれかの等長部分に相補的な少なくとも
8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも13
、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも18
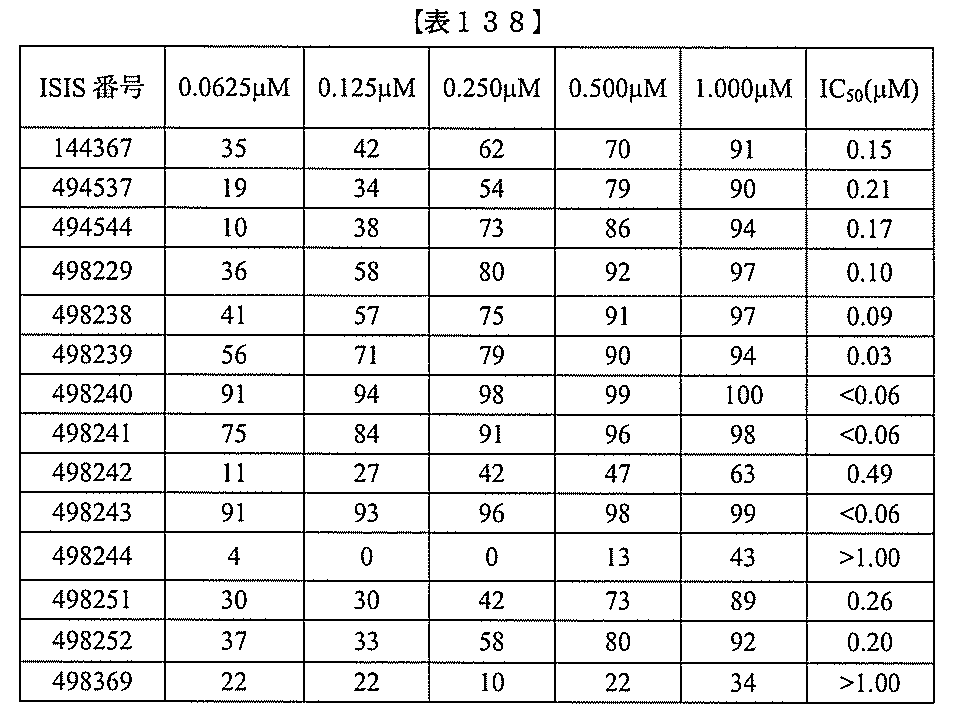
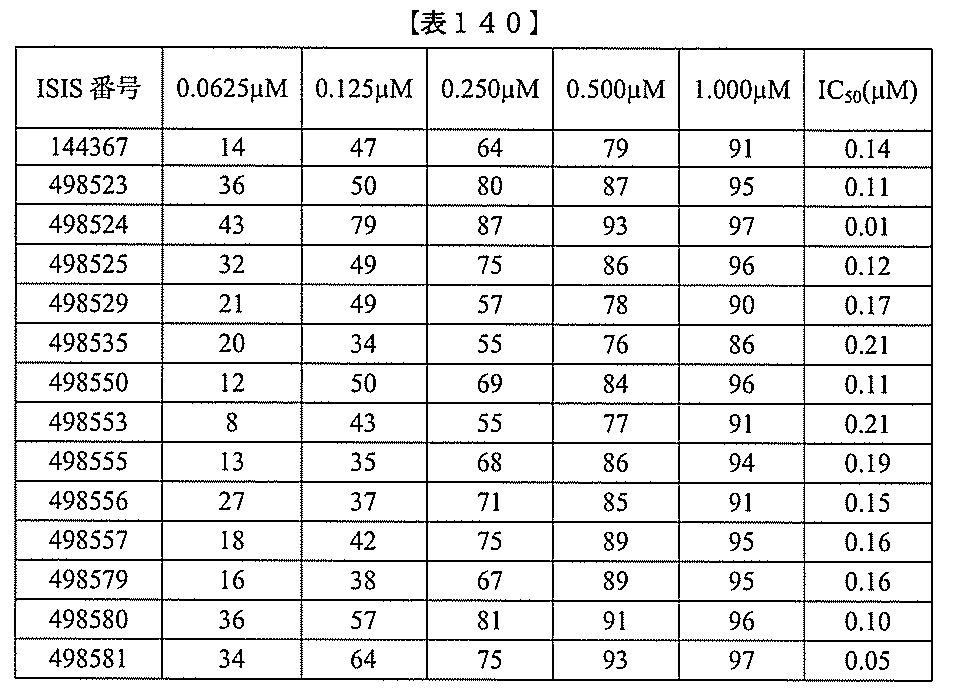
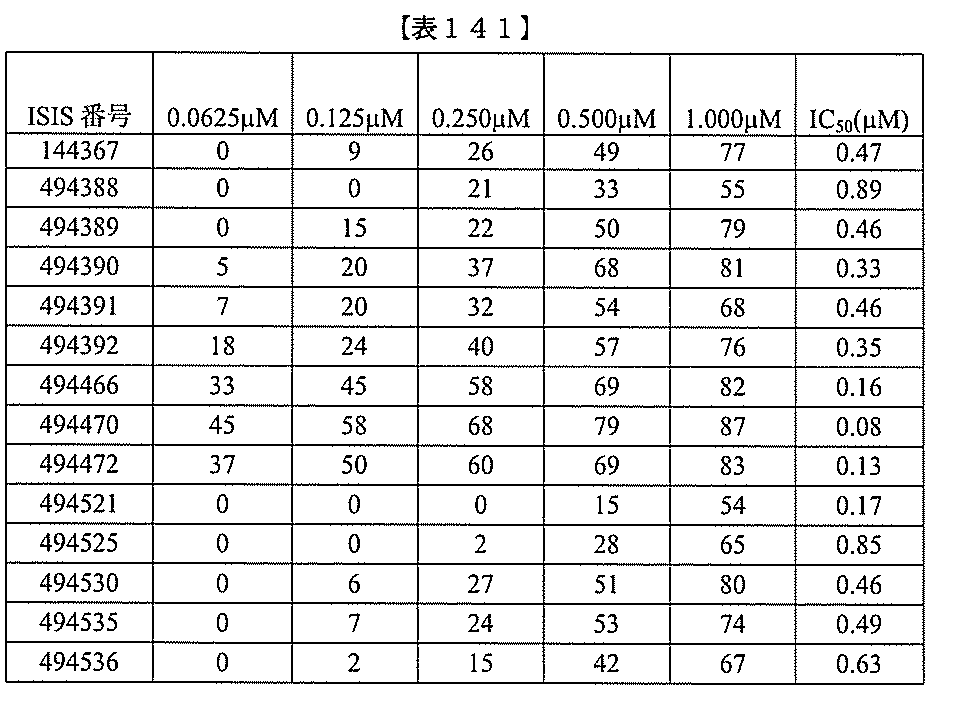
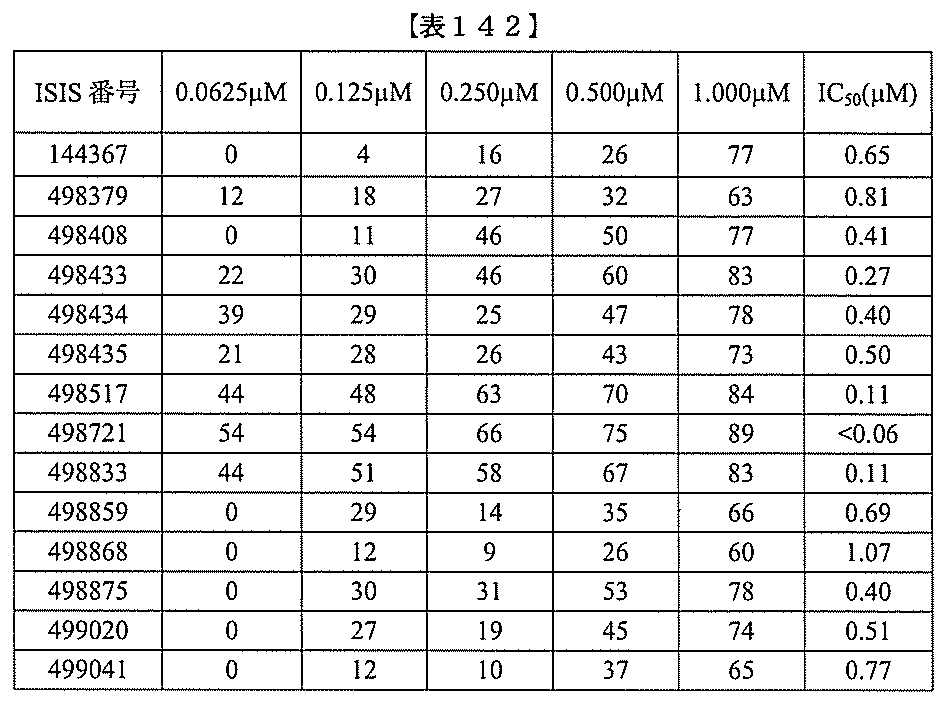
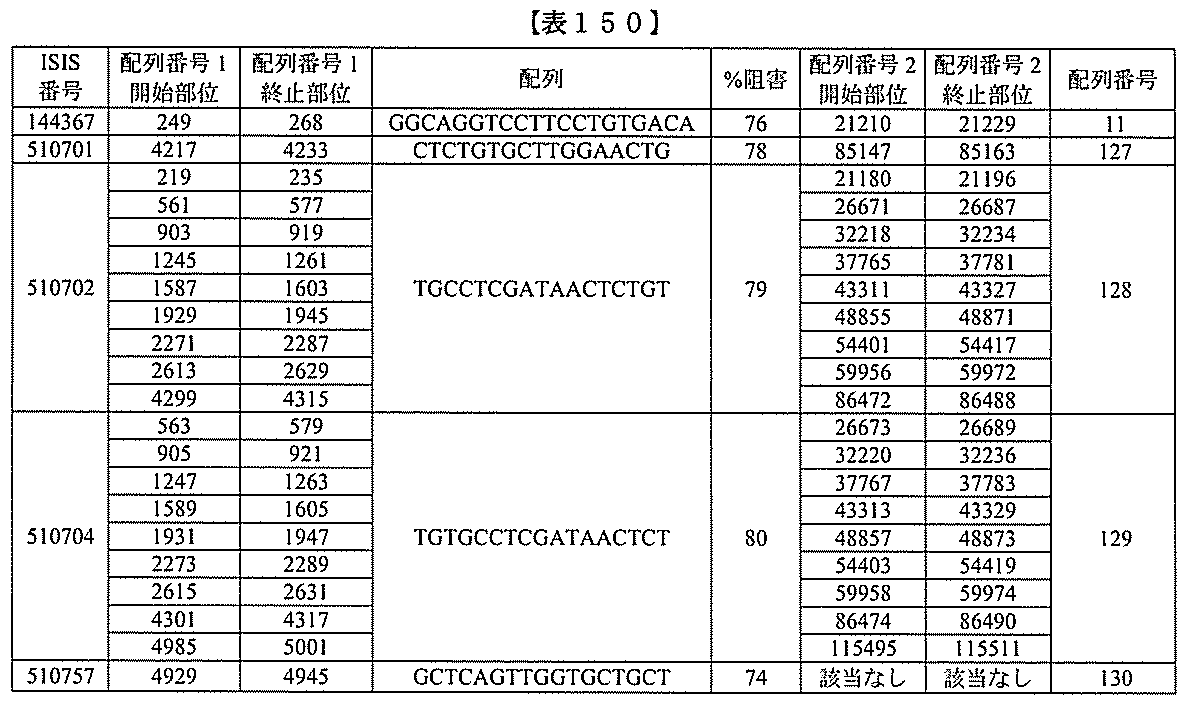
、少なくとも19、または20個の連続した核酸塩基を含む。表において、「開始部位」
とは、標的セグメントの最も5’側のヌクレオチドを指し、「終止部位」とは、標的セグ
メントの最も3’側のヌクレオチドを指す。標的セグメントは、表に列記される各配列の
開始部位から終止部位に及び得る。あるいは、標的セグメントは、ある配列の開始部位か
らの範囲であり得、別の配列の終止部位で終わり得る。例えば、表125に示されるよう
に、標的セグメントは、3901から3920(配列番号58の開始部位から終止部位)
に及び得る。別の例において、表125に示されるように、標的セグメントは、3900
から3923(配列番号57の開始部位から配列番号61の終止部位)に及び得る。
基を含む化合物を提供し、修飾オリゴヌクレオチドの核酸塩基配列は、配列番号1~4の
うちのいずれかに少なくとも80%、少なくとも85%、少なくとも90%、少なくとも
95%、または100%相補的である。ある特定の実施形態は、apo(a)を標的とす
る修飾オリゴヌクレオチドおよび共役基を含む化合物を提供し、修飾オリゴヌクレオチド
の核酸塩基配列は、例えば実施例114および117に示される標的セグメントのうちの
いずれかに少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%
、または100%相補的である。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号1の核酸塩基3901~3920の等長部分に相補的な少な
くとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくと
も13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくと
も18、少なくとも19、または20個の連続した核酸塩基の一部を含む核酸塩基配列を
含み、修飾オリゴヌクレオチドの核酸塩基配列は、配列番号1に少なくとも80%相補的
である。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号1の核酸塩基3900~3923の等長部分に相補的な少な
くとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくと
も13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくと
も18、少なくとも19、少なくとも20、少なくとも21、少なくとも22、少なくと
も23、少なくとも24、少なくとも25、少なくとも26、少なくとも27、少なくと
も28、少なくとも29、または30個の連続した核酸塩基を含む核酸塩基配列を含み、
修飾オリゴヌクレオチドの核酸塩基配列は、配列番号1に少なくとも80%相補的である
。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号12~130、133、134の核酸塩基配列のうちのいず
れかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12
、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17
、少なくとも18、少なくとも19、または20個の連続した核酸塩基を含む核酸塩基配
列を有する。ある特定の実施形態において、修飾オリゴヌクレオチドは、配列番号12~
130、133、134の核酸塩基配列のうちのいずれか1つの少なくとも8個の連続し
た核酸塩基を含む核酸塩基配列を有する。ある特定の実施形態において、化合物は、配列
番号12~130、133、134のうちのいずれか1つと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号12~20、22~33、35~44、47~50、51、
53、57~62、65~66、68、70~79、81、85~86、89~90、9
2~94、97、105~110、103~104、133~134の核酸塩基配列のう
ちのいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なく
とも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なく
とも17、少なくとも18、少なくとも19、または20個の連続した核酸塩基を含む核
酸塩基配列を有する。ある特定の実施形態において、化合物は、配列番号12~20、2
2~33、35~44、47~50、51、53、57~62、65~66、68、70
~79、81、85~86、89~90、92~94、97、105~110、103~
104、133~134の核酸塩基配列のうちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号12~19、26~30、32、35、38~44、46~
47、50、57~58、61、64~66、68、72~74、76~77、92~9
4、103~110の核酸塩基配列のうちのいずれかの少なくとも8、少なくとも9、少
なくとも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少
なくとも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、ま
たは20個の連続した核酸塩基を含む核酸塩基配列を有する。ある特定の実施形態におい
て、化合物は、配列番号12~19、26~30、32、35、38~44、46~47
、50、57~58、61、64~66、68、72~74、76~77、92~94、
103~110の核酸塩基配列のうちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号111、114~121、123~129の核酸塩基配列の
うちのいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少な
くとも12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少な
くとも17、少なくとも18、少なくとも19、または20個の連続した核酸塩基を含む
核酸塩基配列を有する。ある特定の実施形態において、化合物は、配列番号111、11
4~121、123~129の核酸塩基配列のうちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号14、17、18、26~28、39、71、106~10
7の核酸塩基配列のうちのいずれかの少なくとも8、少なくとも9、少なくとも10、少
なくとも11、少なくとも12、少なくとも13、少なくとも14、少なくとも15、少
なくとも16、少なくとも17、少なくとも18、少なくとも19、または20個の連続
した核酸塩基を含む核酸塩基配列を有する。ある特定の実施形態において、化合物は、配
列番号14、17、18、26~28、39、71、106~107の核酸塩基配列のう
ちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号14、26~29、39~40、82の核酸塩基配列のうち
のいずれかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくと
も12、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくと
も17、少なくとも18、少なくとも19、または20個の連続した核酸塩基を含む核酸
塩基配列を有する。ある特定の実施形態において、化合物は、配列番号14、26~29
、39~40、82の核酸塩基配列のうちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号14、16~18の核酸塩基配列のうちのいずれかの少なく
とも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくとも
13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくとも
18、少なくとも19、または20個の連続した核酸塩基を含む核酸塩基配列を有する。
ある特定の実施形態において、化合物は、配列番号14、16~18の核酸塩基配列のう
ちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号26~27、107の核酸塩基配列のうちのいずれかの少な
くとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、少なくと
も13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、少なくと
も18、少なくとも19、または20個の連続した核酸塩基を含む核酸塩基配列を有する
。ある特定の実施形態において、化合物は、配列番号26~27、107の核酸塩基配列
のうちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号28~29、39~40、47の核酸塩基配列のうちのいず
れかの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12
、少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17
、少なくとも18、少なくとも19、または20個の連続した核酸塩基を含む核酸塩基配
列を有する。ある特定の実施形態において、化合物は、配列番号28~29、39~40
、47の核酸塩基配列のうちのいずれかと共役基からなる。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号28、93、104、134の核酸塩基配列のうちのいずれ
かの少なくとも8、少なくとも9、少なくとも10、少なくとも11、少なくとも12、
少なくとも13、少なくとも14、少なくとも15、少なくとも16、少なくとも17、
少なくとも18、少なくとも19、または20個の連続した核酸塩基を含む核酸塩基配列
を有する。ある特定の実施形態において、化合物は、配列番号28、93、104、13
4の核酸塩基配列のうちのいずれかと共役基からなる。
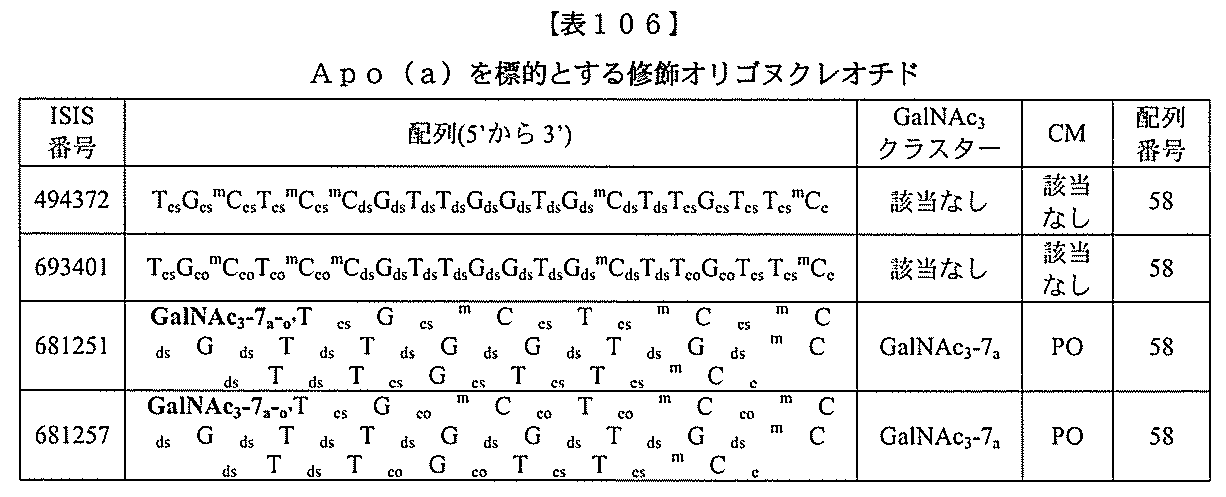
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ配列番号58の核酸塩基配列の少なくとも8、少なくとも9、少なく
とも10、少なくとも11、少なくとも12、少なくとも13、少なくとも14、少なく
とも15、少なくとも16、少なくとも17、少なくとも18、少なくとも19、または
20個の連続した核酸塩基を含む核酸塩基配列を有する。ある特定の実施形態において、
共役基を有する修飾オリゴヌクレオチドは、配列番号58の核酸塩基配列の少なくとも8
個の連続した核酸塩基を含む核酸塩基配列を有する。ある特定の実施形態において、化合
物は、配列番号58および共役基からなる。
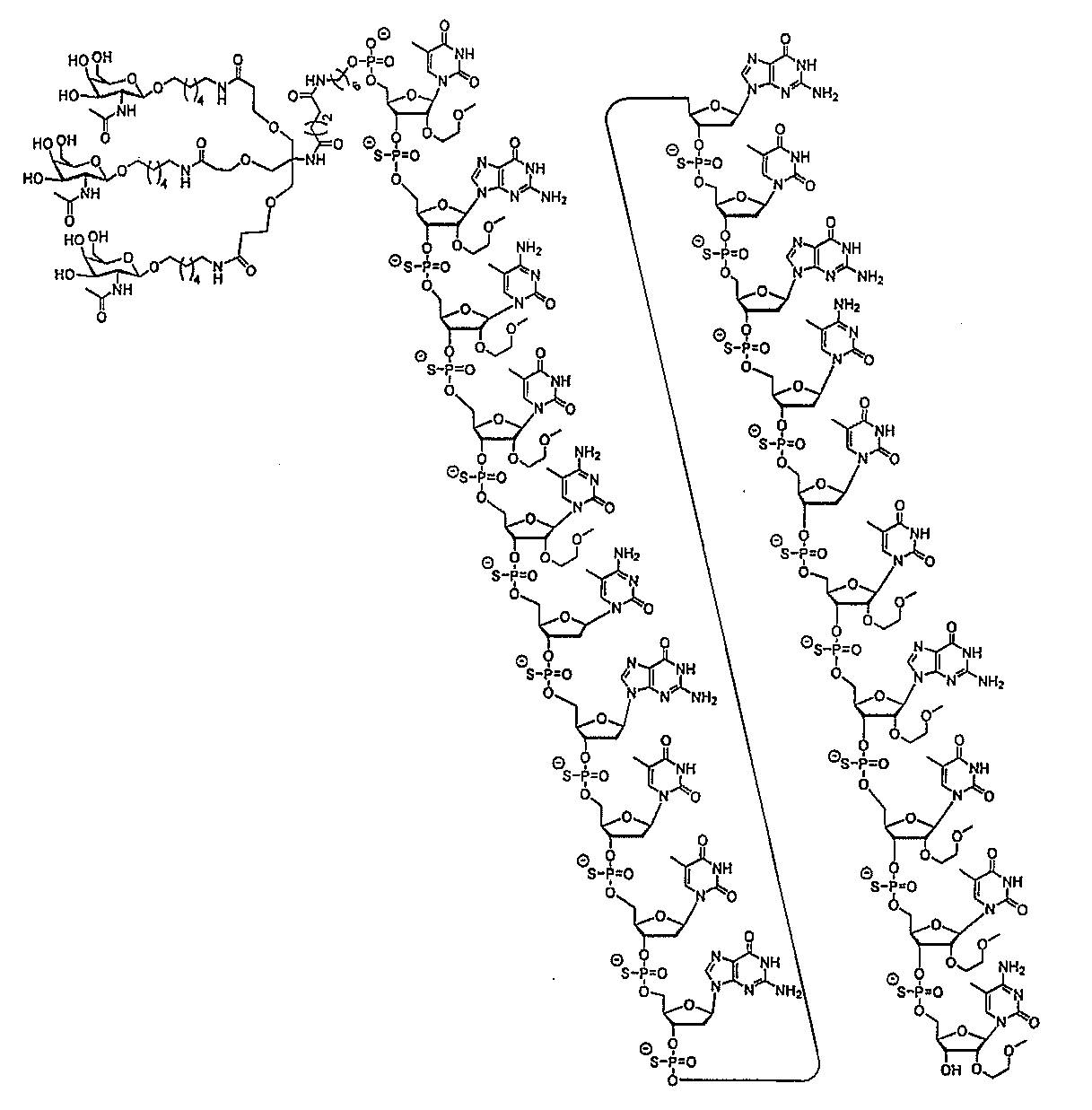
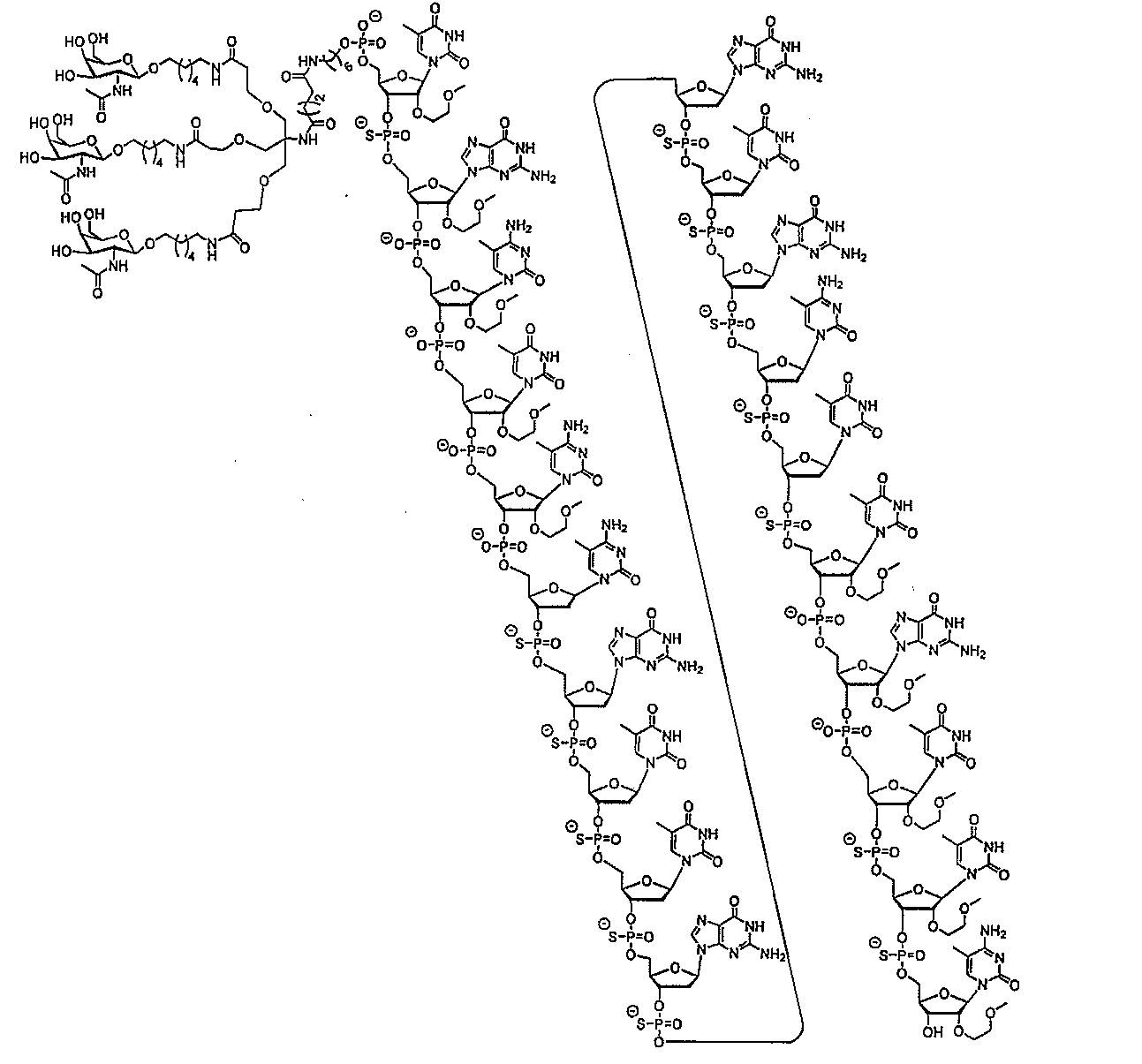
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、5’-Xを
有する修飾オリゴヌクレオチドISIS 494372を含み、式中、Xは、GalNA
cを含む共役基である。ある特定の実施形態において、アンチセンス化合物は、5’-X
を有する修飾オリゴヌクレオチドISIS 494372からなり、式中、Xは、Gal
NAcを含む共役基である。
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、共役修飾オ
リゴヌクレオチドISIS 681251を含む。ある特定の実施形態において、アンチ
センス化合物は、共役修飾オリゴヌクレオチドISIS 681251からなる。
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、共役体修飾
オリゴヌクレオチドISIS 681257を含む。ある特定の実施形態において、アン
チセンス化合物は、共役修飾オリゴヌクレオチドISIS 681257からなる。
ス化合物を提供する。ある特定の実施形態において、アンチセンス化合物は、ウィングの
糖修飾が変化する5’-GalNAcを有する配列番号58の核酸塩基配列を有する修飾
オリゴヌクレオチドを含む。ある特定の実施形態において、アンチセンス化合物は、ウィ
ングの糖修飾が変化する5’-GalNAcを有する配列番号58の核酸塩基配列を有す
る修飾オリゴヌクレオチドからなり、
たはR1およびR2が一緒になって橋を形成するかのいずれかであり、そこで、R1が、
-O-であり、R2が、-CH2-、-CH(CH3)-、または-CH2CH2-であ
り、結果として生じる橋が、-O-CH2-、-O-CH(CH3)-、および-O-C
H2CH2-から選択されるように、R1およびR2が直接連結され、
同一の環上、独立して、各環のR3とR4の各対について、R3が、Hおよび-OCH
2CH2OCH3から選択され、R4が、Hであるか、またはR3およびR4が一緒にな
って橋を形成するかのいずれかであり、そこで、R3が、-O-であり、R4が、-CH
2-、-CH(CH3)-、または-CH2CH2-であり、結果として生じる橋が、-
O-CH2-、-O-CH(CH3)-、および-O-CH2CH2-から選択されるよ
うに、R3およびR4が直接連結され、
R5が、Hおよび-CH3から選択され、
Zが、S-およびO-から選択される。
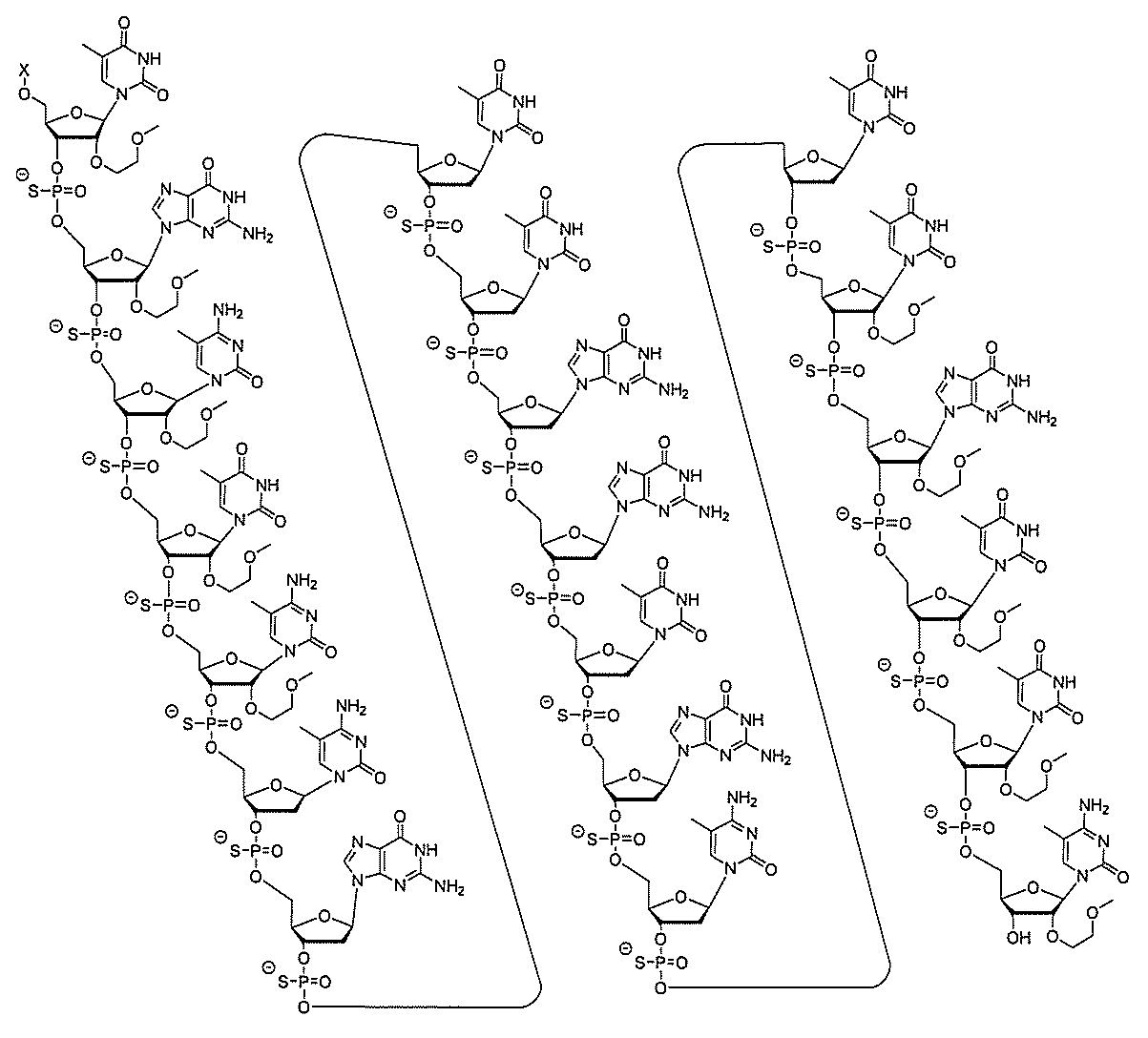
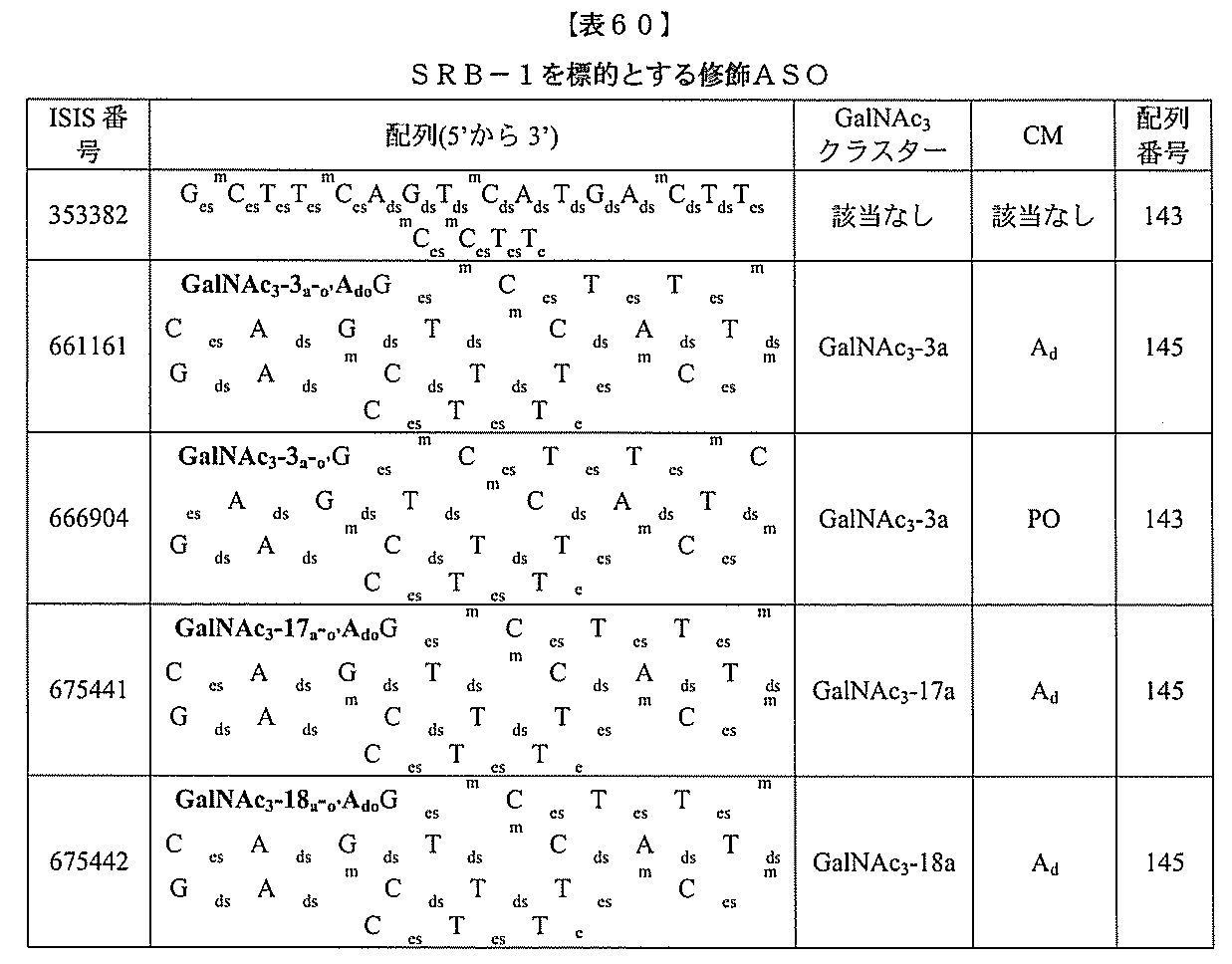
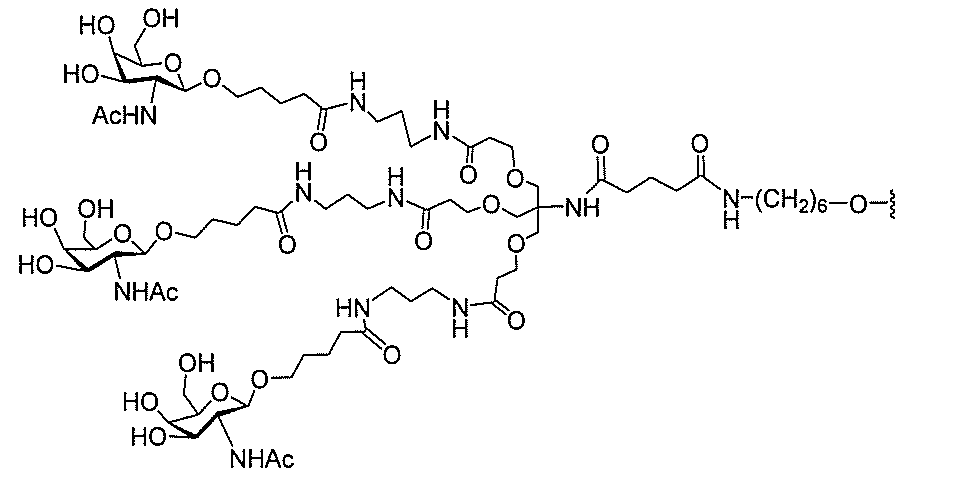
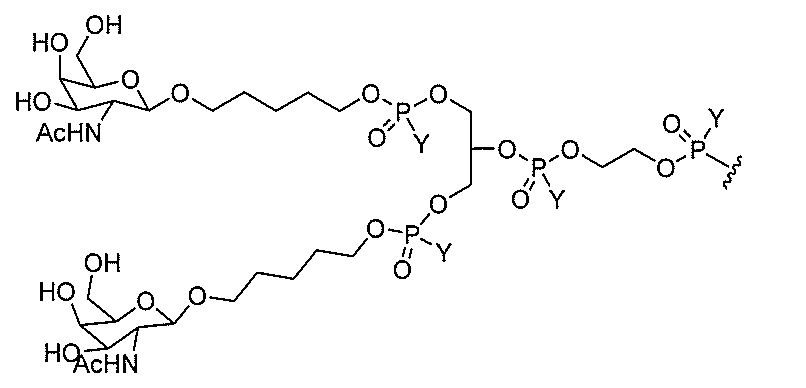
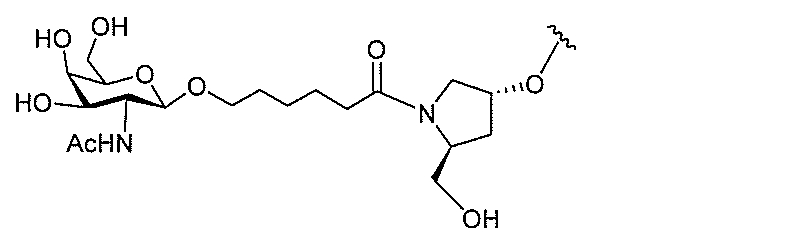
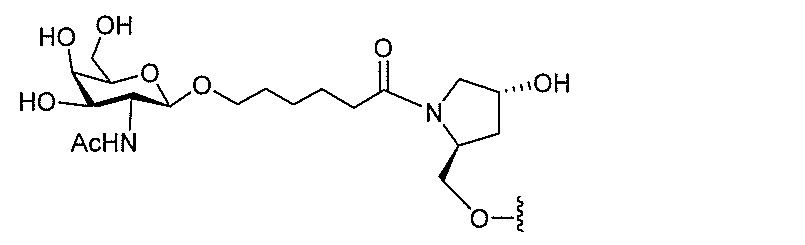
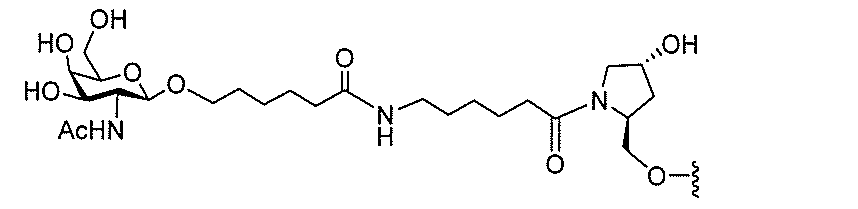
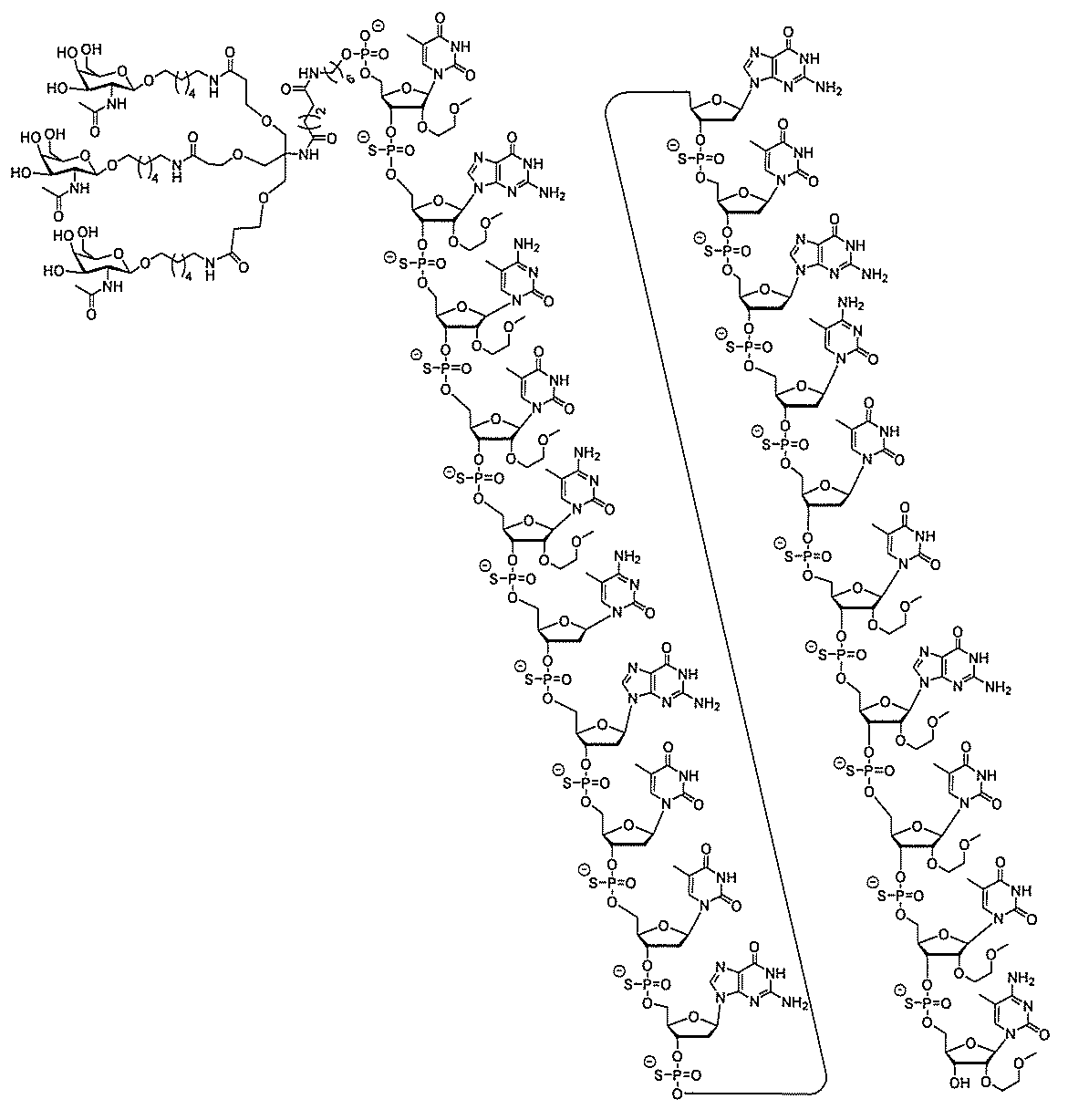
基を含む化合物を提供し、修飾オリゴヌクレオチドは、一本鎖である。
基を含む化合物を提供し、少なくとも1個のヌクレオシド間結合は、修飾ヌクレオシド間
結合である。ある特定の実施形態において、修飾ヌクレオシド間結合は、ホスホロチオエ
ートヌクレオシド間結合である。ある特定の実施形態において、前記修飾オリゴヌクレオ
チドの少なくとも1、少なくとも2、少なくとも3、少なくとも4、少なくとも5、少な
くとも6、少なくとも7、少なくとも8、少なくとも9、または少なくとも10個のヌク
レオシド間結合は、ホスホロチオエートヌクレオシド間結合である。ある特定の実施形態
において、各ヌクレオシド間結合は、ホスホロチオエートヌクレオシド間結合である。あ
る特定の実施形態において、修飾オリゴヌクレオチドは、少なくとも1、少なくとも2、
少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも
8、少なくとも9、または少なくとも10個のホスホジエステルヌクレオシド間結合を含
む。ある特定の実施形態において、修飾オリゴヌクレオチドの各ヌクレオシド間結合は、
ホスホジエステルヌクレオシド間結合およびホスホロチオエートヌクレオシド間結合から
選択される。
基を含む化合物を提供し、少なくとも1個のヌクレオシドは、修飾核酸塩基を含む。ある
特定の実施形態において、修飾核酸塩基は、5-メチルシトシンである。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、少なくとも1個の修飾糖を含む。
ある特定の実施形態において、修飾糖は、二環糖である。ある特定の実施形態において、
修飾糖は、2’-O-メトキシエチル、拘束エチル、3’-フルオロ-HNA、または4
’-(CH2)n-O-2’橋を含み、式中、nは、1または2である。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、12~30個の連結したヌクレオ
シドからなり、かつ(a)連結したデオキシヌクレオシドからなるギャップセグメント、
(b)連結したヌクレオシドからなる5’ウィングセグメント、(c)連結したヌクレオ
シドからなる3’ウィングセグメントを含み、ギャップセグメントは、5’ウィングセグ
メントと3’ウィングセグメントとの間に位置付けられ、各ウィングセグメントの各ヌク
レオシドは、修飾糖を含む。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、20個の連結したヌクレオシドか
らなり、かつ(a)10個の連結したデオキシヌクレオシドからなるギャップセグメント
、(b)5個の連結したヌクレオシドからなる5’ウィングセグメント、(c)5個の連
結したヌクレオシドからなる3’ウィングセグメントを含み、ギャップセグメントは、5
’ウィングセグメントと3’ウィングセグメントとの間に位置付けられ、各ウィングセグ
メントの各ヌクレオシドは、2’-O-メトキシエチル糖を含み、少なくとも1個のヌク
レオシド間結合は、ホスホロチオエート結合であり、各シトシン残基は、5-メチルシト
シンである。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、20個の連結したヌクレオシドか
らなり、かつ配列番号12~130、133、134のうちのいずれかの少なくとも8個
の連続した核酸塩基を含む核酸塩基配列を有し、修飾オリゴヌクレオチドは、(a)10
個の連結したデオキシヌクレオシドからなるギャップセグメント、(b)5個の連結した
ヌクレオシドからなる5’ウィングセグメント、(c)5個の連結したヌクレオシドから
なる3’ウィングセグメントを含み、ギャップセグメントは、5’ウィングセグメントと
3’ウィングセグメントとの間に位置付けられ、各ウィングセグメントの各ヌクレオシド
は、2’-O-メトキシエチル糖を含み、少なくとも1個のヌクレオシド間結合は、ホス
ホロチオエート結合であり、各シトシン残基は、5-メチルシトシンである。
基を含む化合物を提供し、修飾オリゴヌクレオチドは、20個の連結したヌクレオシドか
らなり、かつ配列番号58の少なくとも8個の連続した核酸塩基を含む核酸塩基配列を有
し、修飾オリゴヌクレオチドは、(a)10個の連結したデオキシヌクレオシドからなる
ギャップセグメント、(b)5個の連結したヌクレオシドからなる5’ウィングセグメン
ト、(c)5個の連結したヌクレオシドからなる3’ウィングセグメントを含み、ギャッ
プセグメントは、5’ウィングセグメントと3’ウィングセグメントとの間に位置付けら
れ、各ウィングセグメントの各ヌクレオシドは、2’-O-メトキシエチル糖を含み、少
なくとも1個のヌクレオシド間結合は、ホスホロチオエート結合であり、各シトシン残基
は、5-メチルシトシンである。
基を提供し、修飾オリゴヌクレオチドは、配列番号58の核酸塩基配列を有する20個の
連結したヌクレオシドからなり、修飾オリゴヌクレオチドは、(a)10個の連結したデ
オキシヌクレオシドからなるギャップセグメント、(b)5個の連結したヌクレオシドか
らなる5’ウィングセグメント、(c)5個の連結したヌクレオシドからなる3’ウィン
グセグメントを含み、ギャップセグメントは、5’ウィングセグメントと3’ウィングセ
グメントとの間に位置付けられ、各ウィングセグメントの各ヌクレオシドは、2’-O-
メトキシエチル糖を含み、少なくとも1個のヌクレオシド間結合は、ホスホロチオエート
結合であり、各シトシン残基は、5-メチルシトシンである。
リゴヌクレオチドに連結される。ある特定の実施形態において、共役基は、飾オリゴヌク
レオチドの3’末端で修飾オリゴヌクレオチドに連結される。
形態において、共役基は、2個以上のリガンドを含む。ある特定の実施形態において、共
役基は、3個以上のリガンドを含む。ある特定の実施形態において、共役基は、3個のリ
ガンドを含む。ある特定の実施形態において、各リガンドは、多糖、修飾多糖、糖、修飾
多糖、マンノース、ガラクトース、マンノース誘導体、ガラクトース誘導体、D-マンノ
ピラノース、L-マンノピラノース、D-アラビノース、L-ガラクトース、D-キシロ
フラノース、L-キシロフラノース、D-グルコース、L-グルコース、D-ガラクトー
ス、L-ガラクトース、α-D-マンノフラノース、β-D-マンノフラノース、α-D
-マンノピラノース、β-D-マンノピラノース、α-D-グルコピラノース、β-D-
グルコピラノース、α-D-グルコフラノース、β-D-グルコフラノース、α-D-フ
ルクトフラノース、α-D-フルクトピラノース、α-D-ガラクトピラノース、β-D
-ガラクトピラノース、α-D-ガラクトフラノース、β-D-ガラクトフラノース、グ
ルコサミン、シアル酸、α-D-ガラクトサミン、N-アセチルガラクトサミン、2-ア
ミノ-3-O-[(R)-1-カルボキシエチル]-2-デオキシ-β-D-グルコピラ
ノース、2-デオキシ-2-メチルアミノ-L-グルコピラノース、4,6-ジデオキシ
-4-ホルムアミド-2,3-ジ-O-メチル-D-マンノピラノース、2-デオキシ-
2-スルホアミノ-D-グルコピラノース、N-グリコロイル-α-ノイラミン酸、5-
チオ-β-D-グルコピラノース、メチル2,3,4-トリ-O-アセチル-1-チオ-
6-O-トリチル-α-D-グルコピラノシド、4-チオ-β-D-ガラクトピラノース
、エチル3,4,6,7-テトラ-O-アセチル-2-デオキシ-1,5-ジチオ-α-
D-グルコ-ヘプトピラノシド、2,5-アンヒドロ-D-アロノニトリル、リボース、
D-リボース、D-4-チオリボース、L-リボース、L-4-チオリボースの中から選
択される。ある特定の実施形態において、各リガンドは、N-アセチルガラクトサミンで
ある。
基を含む。
を有し、
Z1は、C(=O)O-R2であり、
Z2は、H、C1~C6アルキル、または置換C1~C6アルキであり、
R2は、H、C1~C6アルキルまたは置換C1~C6アルキであり、
各m1は、独立して、0~20であり、少なくとも1つのm1は、各テザーに対して0
を超える。
を有し、
各m1は、独立して、0~20であり、少なくとも1つのm1は、各テザーに対して0
を超える。
Aは、修飾オリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、修飾オリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
各nは、独立して、0または1であり、
qは、1~5の整数である。
ある特定の実施形態において、化合物は、以下の式によって表される構造を有し、
Aは、修飾オリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Cは、共役リンカーであり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、修飾オリゴヌクレオチドであり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、修飾オリゴヌクレオチドであり、
Cは、共役リンカーであり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、修飾オリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、修飾オリゴヌクレオチドであり、
Bは、切断可能な部分であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、修飾オリゴヌクレオチドであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
態において、共役リンカーは、ピロリジンを含まない。ある特定の実施形態において、共
役リンカーは、PEGを含む。ある特定の実施形態において、共役リンカーは、アミドを
含む。ある特定の実施形態において、共役リンカーは、少なくとも2個のアミドを含む。
ある特定の実施形態において、共役リンカーは、アミドを含まない。ある特定の実施形態
において、共役リンカーは、ポリアミドを含む。ある特定の実施形態において、共役リン
カーは、アミンを含む。ある特定の実施形態において、共役リンカーは、1個以上のジス
ルフィド結合を含む。ある特定の実施形態において、共役リンカーは、タンパク質結合部
分を含む。ある特定の実施形態において、タンパク質結合部分は、脂質を含む。
ダマンタン酢酸、1-ピレン酪酸、ジヒドロテストステロン、1,3-ビス-O(ヘキサ
デシル)グリセロール、ゲラニルオキシヘキシル基、ヘキサデシルグリセロール、ボルネ
オール、メントール、1,3-プロパンジオール、ヘプタデシル基、パルミチン酸、ミリ
スチン酸、O3-(オレオイル)リトコール酸、O3-(オレオイル)コレン酸、ジメト
キシトリチル、またはフェノキサジン)、ビタミン(例えば、葉酸塩、ビタミンA、ビタ
ミンE、ビオチン、ピリドキサール)、ペプチド、炭水化物(例えば、単糖、二糖、三糖
、四糖、オリゴ糖、多糖)、エンドソーム溶解成分、ステロイド(例えば、ウバオール、
ヘシゲニン、ジオスゲニン)、テルペン(例えば、トリテルペン、例えば、サルササポゲ
ニン、フリーデリン、エピフリーデラノール誘導体化リトコール酸)、またはカチオン性
脂質の中から選択される。
は不飽和脂肪酸、コレステロール、コール酸、ビタミンE、アダマンタン、または1-ペ
ンタフルオロプロピルの中から選択される。
Z1は、C(=O)O-R2であり、
Z2は、H、C1~C6アルキル、または置換C1~C6アルキであり、
R2は、H、C1~C6アルキルまたは置換C1~C6アルキであり、
各m1は、独立して、0~20であり、少なくとも1つのm1は、各テザーに対して0
を超える。
。ある特定の実施形態において、少なくとも1個のテザーは、アミドを含む。ある特定の
実施形態において、少なくとも1個のテザーは、ポリアミドを含む。ある特定の実施形態
において、少なくとも1個のテザーは、アミンを含む。ある特定の実施形態において、少
なくとも2個のテザーが互いに異なる。ある特定の実施形態において、テザーのすべてが
互いに同一である。ある特定の実施形態において、各テザーは、以下の中から選択され、
各pは、1~約6である。
において、リガンドは、マンノース-6-ホスフェートである。
の中から選択される切断可能な部分を含む。
とオリゴヌクレオチドとの間にホスホロチオエート結合を含む。ある特定の実施形態にお
いて、共役基は、アミド切断可能な部分を含む。ある特定の実施形態において、共役基は
、エステル切断可能な部分を含む。
Q13は、HまたはO(CH2)2-OCH3であり、
Aは、修飾オリゴヌクレオチドであり、
Bxは、複素環式塩基部分である。
Q13は、HまたはO(CH2)2-OCH3であり、
Aは、修飾オリゴヌクレオチドであり、
Bxは、複素環式塩基部分である。
Q13は、HまたはO(CH2)2-OCH3であり、
Aは、修飾オリゴヌクレオチドであり、
Zは、Hまたは結合固体支持体であり、
Bxは、複素環式塩基部分である。
Q13は、HまたはO(CH2)2-OCH3であり、
Aは、修飾オリゴヌクレオチドであり、
Zは、Hまたは結合固体支持体であり、
Bxは、複素環式塩基部分である。
はシトシン、もしくは5-メチルシトシンの中から選択される。ある特定の実施形態にお
いて、Bxは、アデニンである。ある特定の実施形態において、Bxは、チミンである。
ある特定の実施形態において、Q13は、O(CH2)2-OCH3である。ある特定の
実施形態において、Q13は、Hである。
化合物は、薬剤的に許容される担体または希釈剤をさらに含む。ある特定の実施形態にお
いて、化合物は、apo(a)を標的とする修飾オリゴヌクレオチドおよび共役基、また
はその塩、ならびに薬剤的に許容される担体または希釈剤を含む。
し、化合物の粘度レベルは、40センチポイズ(cP)未満である。ある特定の実施形態
において、本明細書に記載の共役アンチセンス化合物は、実施例125に記載のパラメー
タで測定されたときに、40cP未満、35cP未満、30cP未満、25cP未満、2
0cP未満、または15cP未満の粘度を有するため、有効である。
物または組成物を投与することを含む方法を提供する。ある特定の実施形態において、共
役アンチセンス化合物の投与は、心臓血管、代謝性、および/もしくは炎症性疾患を予防
するか、治療するか、改善するか、またはその進行を遅らせる。
法において用いるための組成物および方法を提供する。ある特定の実施形態は、Lp(a
)関連疾患、障害、または状態を治療するための療法において用いるための組成物および
方法を提供する。ある特定の実施形態において、apo(a)および/またはLp(a)
レベルは、動物において上昇する。ある特定の実施形態において、組成物は、apo(a
)特異的阻害剤を含む化合物である。ある特定の実施形態において、apo(a)特異的
阻害剤は、核酸である。ある特定の実施形態において、核酸は、アンチセンス化合物であ
る。ある特定の実施形態において、アンチセンス化合物は、apo(a)を標的とする修
飾オリゴヌクレオチドである。ある特定の実施形態において、アンチセンス化合物は、a
po(a)を標的とする修飾オリゴヌクレオチドおよび共役基である。ある特定の実施形
態において、共役基を有するapo(a)を標的とする修飾オリゴヌクレオチドは、心臓
血管および/もしくは代謝性疾患、障害、または状態を治療し、予防し、その進行を遅ら
せ、改善する際に用いられる。ある特定の実施形態において、治療用の組成物および方法
は、apo(a)特異的阻害剤をそれを必要とする個体に投与することを含む。
供する。ある特定の実施形態は、Lp(a)レベルを低下させるための組成物および方法
を提供する。ある特定の実施形態において、組織、臓器、または対象におけるapo(a
)レベルの低下は、LDL:HDL比またはTG:HDL比を改善する。ある特定の実施
形態は、動物におけるapo(a)mRNAまたはタンパク質発現を減少させるための組
成物および方法を提供し、動物に本明細書に開示される共役アンチセンス化合物または組
成物を投与して、動物におけるapo(a)mRNAまたはタンパク質発現を減少させる
ことを含む。ある特定の実施形態は、動物におけるLp(a)レベルを低下させるための
組成物および方法を提供し、動物に本明細書に開示される共役アンチセンス化合物または
組成物を投与して、動物におけるapo(a)mRNAまたはタンパク質発現を減少させ
ることを含む。
、および状態を予防し、治療し、遅延させ、それらの進行を遅延らせ、かつ/または改善
するための組成物および方法を提供する。ある特定の実施形態は、組成物を必要とする対
象におけるLp(a)関連疾患、障害、および状態を予防し、治療し、遅延させ、それら
の進行を遅らせ、かつ/または改善するための組成物および方法を提供する。ある特定の
実施形態において、そのような疾患、障害、および状態には、炎症性、心臓血管、および
/または代謝性疾患、障害、および状態が含まれる。ある特定のそのような心臓血管疾患
、障害、または状態には、乳糜血症、高トリグリセリド血症、大動脈弁狭窄症、動脈瘤(
例えば、腹部大動脈瘤)、アンギナ、不整脈、アテローム性動脈硬化症、脳血管疾患、冠
動脈疾患、冠状動脈性心臓病、脂質異常症、高コレステロール血症、脂質異常症、高血圧
症、高トリグリセリド血症、心筋梗塞、末梢血管疾患(例えば、末梢動脈疾患、末梢動脈
閉塞疾患)、網膜血管閉塞、または発作が含まれるが、これらに限定されない。ある特定
のそのような代謝性疾患、障害、または状態には、高血糖症、前糖尿病、糖尿病(I型お
よびII型)、肥満、インスリン抵抗性、代謝症候群、および糖尿病性脂質異常症が含ま
れるが、これらに限定されない。ある特定のそのような炎症性疾患、障害、または状態に
は、大動脈弁狭窄症、冠状動脈疾患(CAD)、アルツハイマー病、および血栓塞栓性疾
患、障害、または状態が含まれるが、これらに限定されない。ある特定の血栓塞栓性疾患
、障害、または状態には、発作、血栓症(例えば、静脈血栓塞栓症)、心筋梗塞、および
末梢血管疾患が含まれるが、これらに限定されない。ある特定の実施形態は、大動脈弁狭
窄症を予防し、治療し、遅延させ、進行を遅らせ、かつ/または改善するための組成物お
よび方法を提供する。
減させる方法を提供する。ある特定の実施形態において、これらの症状には、アンギナ、
胸痛、息切れ、動悸、衰弱、目まい、嘔気、発汗、頻脈、徐脈、不整脈、心房細動、下肢
の腫れ、チアノーゼ、疲労、失神、顔のしびれ、肢のしびれ、跛行または筋けいれん、腹
部腫脹、および発熱が含まれるが、これらに限定されない。ある特定の実施形態は、大動
脈弁狭窄症の少なくとも1つの症状を軽減する方法を提供する。
織、または臓器内で生じる。ある特定の実施形態において、調節は、動物における細胞、
組織、または臓器内で生じる。ある特定の実施形態において、調節は、apo(a)mR
NAレベルの低下である。ある特定の実施形態において、調節は、apo(a)タンパク
質レベルの低下である。ある特定の実施形態において、apo(a)mRNAレベルとa
po(a)タンパク質レベルのいずれも低下する。ある特定の実施形態において、調節は
、Lp(a)レベルの低下である。そのような低下は、時間依存的または用量依存的様式
で生じ得る。
実施形態において、非経口投与は、皮下投与である。
たは療法と共投与される。ある特定の実施形態において、共役アンチセンス化合物または
組成物および第2の薬剤は、同時に投与される。
施形態において、第2の薬剤は、LDL、TG、またはコレステロール低下剤である。あ
る特定の実施形態において、第2の薬剤は、抗炎症薬である。ある特定の実施形態におい
て、第2の薬剤は、アルツハイマー病薬である。ある特定の実施形態において、第2の薬
剤は、非ステロイド系抗炎症薬(NSAID、例えば、アスピリン)、ナイアシン(例え
ば、Niaspan)、ニコチン酸、apoB阻害剤(例えば、Mipomersen)
、CETP阻害剤(例えば、Anacetrapib)、apo(a)阻害剤、甲状腺ホ
ルモン類似体(例えば、Eprotirome)、HMG-CoAレダクターゼ阻害剤(
例えば、スタチン)、フィブラート(例えば、Gemfibrozil)、およびミクロ
ソームトリグリセリド輸送タンパク質阻害剤(例えば、Lomitapide)であり得
るが、これらに限定されない。療法は、Lp(a)アフェレーシスであり得るが、これに
限定されない。薬剤または療法は、共投与され得るか、または同時に投与され得る。薬剤
または療法は、連続して投与され得るか、またはその後に投与され得る。
a)を標的にする共役アンチセンス化合物の使用を提供するある特定の実施形態は、動物
におけるLp(a)レベルを低下させるためのapo(a)を標的にする。共役アンチセ
ンス化合物の使用を提供する。ある特定の実施形態は、apo(a)に関連した疾患、障
害、または状態を治療、予防、または改善するためのapo(a)を標的にする共役アン
チセンス化合物の使用を提供する。ある特定の実施形態は、Lp(a)に関連した疾患、
障害、または状態を治療、予防、または改善するためのapo(a)を標的にする共役ア
ンチセンス化合物の使用を提供する。
けるapo(a)を標的にする共役アンチセンス化合物の使用を提供する。ある特定の実
施形態は、動物におけるLp(a)レベルを低下させる薬剤の調製におけるapo(a)
を標的にする共役アンチセンス化合物の使用を提供する。ある特定の実施形態は、apo
(a)に関連した疾患、障害、または状態を治療、予防、または改善する薬剤の調製のた
めの共役アンチセンス化合物の使用を提供する。ある特定の実施形態は、Lp(a)に関
連した疾患、障害、または状態を治療、予防、または改善する薬剤の調製のための共役ア
ンチセンス化合物の使用を提供する。
の1つ以上を治療するか、改善するか、遅らせるか、または予防する薬剤の製造における
本明細書に記載の共役アンチセンス化合物の使用を提供する。
は改善するためのキットを提供し、このキットは、(i)本明細書に記載のapo(a)
特異的阻害剤と、任意に(ii)本明細書に記載の第2の薬剤または療法を含む。
または状態を治療、予防、または改善するためのキットを用いるための取扱説明書をさら
に含み得る。
B.ある特定の化合物
体を含む共役アンチセンス化合物を提供する。
a.ある特定のアンチセンスオリゴヌクレオチド
。そのようなアンチセンスオリゴヌクレオチドは、連結したヌクレオシドを含み、各ヌク
レオシドは、糖部分および核酸塩基を含む。そのようなアンチセンスオリゴヌクレオチド
の構造は、化学的特徴(例えば、修飾および修飾パターン)ならびに核酸塩基配列(例え
ば、アンチセンスオリゴヌクレオチドの配列、同一性、および標的核酸の配列)の点から
考慮され得る。
i.ある特定の化学的特徴
含む。ある特定のそのような実施形態において、アンチセンスオリゴヌクレオチドは、1
個以上の修飾ヌクレオシドおよび/または修飾ヌクレオシド間結合を含む。ある特定の実
施形態において、修飾ヌクレオシドは、修飾糖部分および/または修飾核酸塩基を含む。
1.ある特定の糖部分
クレオシドを含む。1個以上の糖修飾ヌクレオシドを含むそのような化合物は、天然に存
在する糖部分を含むヌクレオシドのみを含むオリゴヌクレオチドと比較して、ヌクレアー
ゼ安定性の強化または標的核酸との結合親和性の増大等の望ましい特性を有し得る。ある
特定の実施形態において、修飾糖部分は、置換糖部分である。ある特定の実施形態におい
て、修飾糖部分は、糖代理物である。そのような糖代理物は、置換糖部分の置換に対応す
る1つ以上の置換を含み得る。
含むが、これらに限定されない1個以上の非架橋糖糖置換基を含む置換糖部分である。2
’位に好適な糖置換基の例として、2’-F、2’-OCH3(「OMe」または「O-
メチル」)、および2’-O(CH2)2OCH3(「MOE」)が挙げられるが、これ
らに限定されない。ある特定の実施形態において、2’位の糖置換基は、アリル、アミノ
、アジド、チオ、O-アリル、O-C1~C10アルキル、O-C1~C10置換アルキ
ル、OCF3、O(CH2)2SCH3、O(CH2)2-O-N(Rm)(Rn)、お
よびO-CH2-C(=O)-N(Rm)(Rn)から選択され、式中、各RmおよびR
nは、独立して、Hまたは置換もしくは非置換C1~C10アルキルである。5’位の糖
置換基の例には、5’-メチル(RまたはS)、5’-ビニル、および5’-メトキシが
挙げられるが、これらに限定されない。ある特定の実施形態において、置換糖は、2個以
上の非架橋糖置換基、例えば、2’-F-5’-メチル糖部分を含む(さらなる5’,2
’-ビス置換糖部分およびヌクレオシドについては、例えば、PCT国際出願第WO20
08/101157号を参照のこと)。
定の実施形態において、2’-置換ヌクレオシドは、ハロ、アリル、アミノ、アジド、S
H、CN、OCN、CF3、OCF3、O、S、またはN(Rm)-アルキル;O、S、
またはN(Rm)-アルケニル;O、S、またはN(Rm)-アルキニル;O-アルキレ
ニル-O-アルキル、アルキニル、アラルキル、アラルキル、O-アルカリル、O-アラ
ルキル、O(CH2)2SCH3、O-(CH2)2-O-N(Rm)(Rn);または
O-CH2-C(=O)-N(Rm)(Rn)から選択される2’-置換基を含み、式中
、各RmおよびRnは、独立して、H、アミノ保護基、または置換もしくは非置換換C1
~C10アルキルである。これらの2’-置換基は、ヒドロキシル、アミノ、アルコキシ
、カルボキシ、ベンジル、フェニル、ニトロ(NO2)、チオール、チオアルコキシ(S
-アルキル)、ハロゲン、アルキル、アリール、アルケニル、およびアルキニルから独立
して選択される1個以上の置換基とさらに置換され得る。
3、O-CH3、O(CH2)3NH2、CH2-CH=CH2、O-CH2-CH=C
H2、OCH2CH2OCH3、O(CH2)2SCH3、O-(CH2)2-O-N(
Rm)(Rn)、O(CH2)2O(CH2)2N(CH3)2、およびN-置換アセト
アミド(O-CH2-C(=O)-N(Rm)(Rn)から選択される2’-置換基を含
み、式中、各RmおよびRnは、独立して、H、アミノ保護基、または置換もしくは非置
換C1~C10アルキルである。
、OCH2CH2OCH3、O(CH2)2SCH3、O-(CH2)2-O-N(CH
3)2、-O(CH2)2O(CH2)2N(CH3)2、およびO-CH2-C(=O
)-N(H)CH3から選択される2’-置換基を含む糖部分を含む。
CH2CH2OCH3から選択される2’-置換基を含む糖部分を含む。
含む。ある特定のそのような実施形態において、二環式糖部分は、4’フラノース環原子
と2’フラノース環原子との間に橋を含む。そのような4’から2’の糖置換基の例には
、-[C(Ra)(Rb)]n-、-[C(Ra)(Rb)]n-O-、-C(RaRb
)-N(R)-O-、または-C(RaRb)-O-N(R)-;4’-CH2-2’、
4’-(CH2)2-2’、4’-(CH2)3-2’、4’-(CH2)-O-2’(
LNA);4’-(CH2)-S-2’;4’-(CH2)2-O-2’(ENA);4
’-CH(CH3)-O-2’(cEt);および4’-CH(CH2OCH3)-O-
2’;ならびにこれらの類似体(例えば、2008年7月15日に発行された米国特許第
7,399,845号を参照のこと);4’-C(CH3)(CH3)-O-2’および
その類似体(例えば、2009年1月8日に公開された国際公開第WO2009/006
478号を参照のこと);4’-CH2-N(OCH3)-2’およびその類似体(例え
ば、2008年12月11日に公開された国際公開第WO2008/150729号を参
照のこと);4’-CH2-O-N(CH3)-2’(例えば、2004年9月2日に公
開されたUS2004/0171570号を参照のこと);4’-CH2-O-N(R)
-2’;ならびに4’-CH2-N(R)-O-2’-(式中、各Rが、独立して、H、
保護基、またはC1~C12アルキルである);4’-CH2-N(R)-O-2’(式
中、Rが、H、C1~C12アルキル、または保護基である)(2008年9月23日に
発行された米国特許第7,427,672号を参照のこと);4’-CH2-C(H)(
CH3)-2’(例えば、Chattopadhyaya,et al.,J.Org.
Chem.,2009,74,118-134);ならびに4’-CH2-C(=CH2
)-2’およびその類似体(2008年12月8日に公開されたPCT国際出願第WO2
008/154401号を参照のこと)が挙げられるが、これらに限定されない。
a)(Rb)]n-、-C(Ra)=C(Rb)-、-C(Ra)=N-、-C(=NR
a)-、-C(=O)-、-C(=S)-、-O-、-Si(Ra)2-、-S(=O)
x-、および-N(Ra)-から独立して選択される1~4の結合基を含み、
式中、
xは、0、1、または2であり、
nは、1、2、3、または4であり、
各RaおよびRbは、独立して、H、保護基、ヒドロキシル、C1~C12アルキル、
置換C1~C12アルキル、C2~C12アルケニル、置換C2~C12アルケニル、C
2~C12アルキニル、置換C2~C12アルキニル、C5~C20アリール、置換C5
~C20アリール、複素環式ラジカル、置換複素環式ラジカル、ヘテロアリール、置換ヘ
テロアリール、C5~C7脂環式ラジカル、置換C5~C7脂環式ラジカル、ハロゲン、
OJ1、NJ1J2、SJ1、N3、COOJ1、アシル(C(=O)-H)、置換アシ
ル、CN、スルホニル(S(=O)2-J1)、またはスルホキシル(S(=O)-J1
)であり、
各J1およびJ2は、独立して、H、C1~C12アルキル、置換C1~C12アルキ
ル、C2~C12アルケニル、置換C2~C12アルケニル、C2~C12アルキニル、
置換C2~C12アルキニル、C5~C20アリール、置換C5~C20アリール、アシ
ル(C(=O)-H)、置換アシル、複素環式ラジカル、置換複素環式ラジカル、C1~
C12アミノアルキル、置換C1~C12アミノアルキル、または保護基である。
環式ヌクレオシドには、以下に示される、(A)α-L-メチレンオキシ(4’-CH2
-O-2’)BNA、(B)β-D-メチレンオキシ(4’-CH2-O-2’)BNA
(ロックド核酸またはLNAとも称される)、(C)エチレンオキシ(4’-(CH2)
2-O-2’)BNA、(D)アミノオキシ(4’-CH2-O-N(R)-2’)BN
A、(E)オキシアミノ(4’-CH2-N(R)-O-2’)BNA、(F)メチル(
メチレンオキシ)(4’-CH(CH3)-O-2’)BNA(拘束エチルまたはcEt
とも称される)、(G)メチレン-チオ(4’-CH2-S-2’)BNA、(H)メチ
レン-アミノ(4’-CH2-N(R)-2’)BNA、(I)メチル炭素環式(4’-
CH2-CH(CH3)-2’)BNA、および(J)プロピレン炭素環式(4’-(C
H2)3-2’)BNAが含まれるが、これらに限定されず、
2アルキルである。
.,Chem.Commun.,1998,4,455-456、Koshkin et
al.,Tetrahedron,1998,54,3607-3630、Wahle
stedt et al.,Proc.Natl.Acad.Sci.U.S.A.,2
000,97,5633-5638、Kumar et al.,Bioorg.Med
.Chem.Lett.,1998,8,2219-2222、Singh et al
.,J.Org.Chem.,1998,63,10035-10039、Srivas
tava et al.,J.Am.Chem.Soc.,129(26)8362-8
379(Jul.4,2007)、Elayadi et al.,Curr.Opin
ion Invens.Drugs,2001,2,558-561、Braasch
et al.,Chem.Biol.,2001,8,1-7、Orum et al.
,Curr.Opinion Mol.Ther.,2001,3,239-243、米
国特許第7,053,207号、同第6,268,490号、同第6,770,748号
、同第6,794,499号、同第7,034,133号、同第6,525,191号、
同第6,670,461号、および同第7,399,845号、国際公開第WO2004
/106356号、同第WO1994/14226号、同第WO2005/021570
号、および同第WO2007/134181号、米国特許公開第US2004/0171
570号、同第US2007/0287831号、および同第US2008/00396
18号、米国特許第12/129,154号、同第60/989,574号、同第61/
026,995号、同第61/026,998号、同第61/056,564号、同第6
1/086,231号、同第61/097,787号、および同第61/099,844
号、ならびにPCT国際出願第PCT/US2008/064591号、同第PCT/U
S2008/066154号、および同第PCT/US2008/068922号である
。
ヌクレオシドは、異性体配置によってさらに定義される。例えば、4’-2’メチレン-
オキシ橋を含むヌクレオシドは、α-L配置またはβ-D配置であり得る。以前に、α-
L-メチレンオキシ(4’-CH2-O-2’)二環式ヌクレオシドが、アンチセンス活
性を示すアンチセンスオリゴヌクレオチドに組み込まれている(Frieden et
al.,Nucleic Acids Research,2003,21,6365-
6372)。
上の架橋糖置換基(例えば、5’-置換および4’-2’架橋糖)を含む(2007年1
1月22日に公開されたPCT国際出願第WO2007/134181号(LNAが例え
ば5’-メチルまたは5’-ビニル基で置換されている)を参照のこと)。
実施形態において、天然に存在する糖の酸素原子は、例えば、硫黄、炭素、または窒素原
子で置換される。ある特定のそのような実施形態において、そのような修飾糖部分は、上
述の架橋および/または非架橋置換基も含む。例えば、ある特定の糖代理物は、4’-硫
黄原子ならびに2’位(例えば、2005年6月16日に公開された米国特許出願第US
2005/0130923号を参照のこと)および/または5’位での置換を含む。さら
なる例として、4’-2’橋を有する炭素環式二環式ヌクレオシドが記載されている(例
えば、Freier et al.,Nucleic Acids Research,
1997,25(22),4429-4443、およびAlbaek et al.,J
.Org.Chem.,2006,71,7731-7740を参照のこと)。
、ある特定の実施形態において、糖代理物は、モルフォリノを含む。モルフォリノ化合物
およびオリゴマー化合物におけるそれらの使用は、多数の特許および公開論文(例えば、
Braasch et al.,Biochemistry,2002,41,4503
-4510、ならびに米国特許第5,698,685号、同第5,166,315号、同
第5,185,444号、および同第5,034,506号を参照のこと)で報告されて
いる。本明細書で使用されるとき、「モルフォリノ」という用語は、以下の構造を有する
糖代理物を意味する。
の様々な置換基を付加または変更することによって修飾され得る。そのような糖代理物は
、本明細書において「修飾モルフォリノ」と称される。
含む。そのようなテトラヒドロピランは、さらに修飾または置換され得る。そのような修
飾テトラヒドロピランを含むヌクレオシドには、ヘキシトール核酸(HNA)、アニトー
ル核酸(ANA)、マニトール核酸(MNA)(Leumann,CJ.Bioorg.
& Med.Chem.(2002)10:841-854を参照のこと)、フルオロH
NA(F-HNA)、および以下の式VIを有する化合物が含まれるが、これらに限定さ
れず、
体の各々について、
Bxは、核酸塩基部分であり、
T3およびT4は各々、独立して、テトラヒドロピランヌクレオシド類似体をアンチセ
ンス化合物に結合させるヌクレオシド間結合基であるか、またはT3およびT4のうちの
一方は、テトラヒドロピランヌクレオシド類似体をアンチセンス化合物に結合させるヌク
レオシド間結合基であり、T3およびT4のうちの他方は、H、ヒドロキシル保護基、結
合共役基、または5’もしくは3’-末端基であり、
q1、q2、q3、q4、q5、q6、およびq7は各々、独立して、H、C1~C6
アルキル、置換C1~C6アルキル、C2~C6アルケニル、置換C2~C6アルケニル
、C2~C6アルキニル、または置換C2~C6アルキニルであり、
R1およびR2の各々は、水素、ハロゲン、置換または非置換アルコキシ、NJ1J2
、SJ1、N3、OC(=X)J1、OC(=X)NJ1J2、NJ3C(=X)NJ1
J2、およびCNの中から独立して選択され、式中、Xは、O、S、またはNJ1であり
、各J1、J2、およびJ3は、独立して、HまたはC1~C6アルキルである。
1、q2、q3、q4、q5、q6、およびq7は各々、Hである。ある特定の実施形態
において、q1、q2、q3、q4、q5、q6、およびq7のうちの少なくとも1つは
、H以外である。ある特定の実施形態において、q1、q2、q3、q4、q5、q6、
およびq7のうちの少なくとも1つは、メチルである。ある特定の実施形態において、式
VIのTHPヌクレオシドが提供され、式中、R1およびR2のうちの一方がFである。
ある特定の実施形態において、R1がフルオロであり、R2がHであり、R1がメトキシ
であり、R2がHであり、R1がメトキシエトキシであり、R2がHである。
多くの他のビシクロおよびトリシクロ糖代理物環系も当技術分野で既知である(例えば、
総説:Leumann,J.C,Bioorganic & Medicinal Ch
emistry,2002,10,841-854を参照のこと)。
レオシドについては、2008年8月21日に公開されたPCT国際出願第WO2008
/101157号を参照のこと)、ならびにリボシル環酸素原子のSとの置換および2’
位でのさらなる置換(2005年6月16日に公開された米国特許出願第US2005-
0130923号を参照のこと)、またはあるいは二環式核酸の5’-置換(4’-CH
2-O-2’二環式ヌクレオシドが5’位で5’-メチルまたは5’-ビニル基でさらに
置換される、2007年11月22日に公開されたPCT国際出願第WO2007/13
4181号を参照のこと)等であるが、これらに限定されない修飾の組み合わせも提供さ
れる。炭素環式二環式ヌクレオシドのオリゴマー化および生化学的研究に加えて、それら
の合成および調製も記載されている(例えば、Srivastava et al.,J
.Am.Chem.Soc.2007,129(26),8362-8379を参照のこ
と)。
を提供する。これらの修飾ヌクレオチドは、修飾糖、修飾核酸塩基、および/または修飾
結合を含み得る。特異的修飾は、結果として生じるオリゴヌクレオチドが望ましい特徴を
有するように選択される。ある特定の実施形態において、オリゴヌクレオチドは、1個以
上のRNA様ヌクレオシドを含む。ある特定の実施形態において、オリゴヌクレオチドは
、1個以上のDNA様ヌクレオチドを含む。
2.ある特定の核酸塩基修飾
含む。ある特定の実施形態において、本開示のヌクレオシドは、1個以上の修飾核酸塩基
を含む。
基、疎水性塩基、乱交雑塩基、サイズ拡大塩基、およびフッ素化塩基から選択される。5
-置換ピリミジン、6-アザピリミジン、ならびにN-2、N-6、およびO-6置換プ
リンには、本明細書で定義される、2-アミノプロピルアデニン、5-プロピニルウラシ
ル;5-プロピニルシトシン;5-ヒドロキシメチルシトシン、キサンチン、ヒポキサン
チン、2-アミノアデニン、6-メチルならびにアデニンおよびグアニンの他のアルキル
誘導体、2-プロピルならびにアデニンおよびグアニンの他のアルキル誘導体、2-チオ
ウラシル、2-チオチミンおよび2-チオシトシン、5-ハロウラシルおよびシトシン、
5-プロピニル(-CoC-CH3)ウラシルならびにシトシンおよびピリミジン塩基の
他のアルキニル誘導体、6-アゾウラシル、シトシンおよびチミン、5-ウラシル(シュ
ードウラシル)、4-チオウラシル、8-ハロ、8-アミノ、8-チオール、8-チオア
ルキル、8-ヒドロキシルならびに他の8-置換アデニンおよびグアニン、5-ハロ、特
に、5-ブロモ、5-トリフルオロメチルならびに他の5-置換ウラシルおよびシトシン
、7-メチルグアニンおよび7-メチルアデニン、2-F-アデニン、2-アミノ-アデ
ニン、8-アザグアニンおよび8-アザアデニン、7-デアザグアニンおよび7-デアザ
アデニン、3-デアザグアニンおよび3-デアザアデニン、ユニバーサル塩基、疎水性塩
基、乱交雑塩基、サイズ拡大塩基、およびフッ素化塩基が含まれる。さらに、修飾核酸塩
基には、三環式ピリミジン、例えば、フェノキサジンシチジン([5,4-b][1,4
]ベンゾオキサジン-2(3H)-オン)、フェノチアジンシチジン(1H-ピリミド[
5,4-b][1,4]ベンゾチアジン-2(3H)-オン)、G-クランプ、例えば、
置換フェノキサジンシチジン(例えば、9-(2-アミノエトキシ)-H-ピリミド[5
,4-b][1,4]ベンゾオキサジン-2(3H)-オン)、カルバゾールシチジン(
2H-ピリミド[4,5-b]インドール-2-オン)、ピリドインドールシチジン(H
-ピリド[3’,2’:4,5]ピロロ[2,3-d]ピリミジン-2-オン)が含まれ
る。修飾核酸塩基には、プリンまたはピリミジン塩基が、他の複素環、例えば、7-デア
ザ-アデニン、7-デアザグアノシン、2-アミノピリジン、および2-ピリドンに置換
される塩基も含まれ得る。さらに、核酸塩基には、米国特許第3,687,808号に開
示される塩基、The Concise Encyclopedia Of Polym
er Science and Engineering,Kroschwitz,J.
I.,Ed.,John Wiley & Sons,1990,858-859に開示
される塩基、Englisch et al.,Angewandte Chemie,
International Edition,1991,30,613によって開示さ
れる塩基、およびSanghvi,Y.S.,Chapter 15,Antisens
e Research and Applications,Crooke,S.T.a
nd Lebleu,B.,Eds.,CRC Press,1993,273-288
によって開示される塩基が含まれる。
国特許には、米国特許第3,687,808号、同第4,845,205号、同第5,1
30,302号、同第5,134,066号、同第5,175,273号、同第5,36
7,066号、同第5,432,272号、同第5,457,187号、同第5,459
,255号、同第5,484,908号、同第5,502,177号、同第5,525,
711号、同第5,552,540号、同第5,587,469号、同第5,594,1
21号、同第5,596,091号、同第5,614,617号、同第5,645,98
5号、同第5,681,941号、同第5,750,692号、同第5,763,588
号、同第5,830,653号、および同第6,005,096号が含まれるが、これら
に限定されず、これらのある特定の特許は、本出願と共同所有されており、これらの各々
は、参照によりその全体が本明細書に組み込まれる。
3.ある特定のヌクレオシド間結合
チドを提供する。そのような実施形態において、ヌクレオシドは、任意のヌクレオシド間
結合を用いて一緒に連結され得る。ヌクレオシド間結合基の2つの主なクラスは、リン原
子の存在または不在によって定義される。代表的なリン含有ヌクレオシド間結合は、ホス
ホジエステル(PO)、ホスホトリエステル、メチルホスホネート、ホスホラミデート、
およびホスホロチオエート(PS)を含むが、これらに限定されない。代表的な非リン含
有ヌクレオシド間結合基は、メチレンメチルイミノ(-CH2-N(CH3)-O-CH
2-)、チオジエステル(-O-C(O)-S-)、チオノカルバメート(-O-C(O
)(NH)-S-)、シロキサン(-O-Si(H)2-O-)、およびN,N’-ジメ
チルヒドラジン(-CH2-N(CH3)-N(CH3)-)を含むが、これらに限定さ
れない。修飾結合は、天然ホスホジエステル結合と比較して、オリゴヌクレオチドのヌク
レアーゼ耐性を変化させる、典型的には、増加させるために用いられ得る。ある特定の実
施形態において、キラル原子を有するヌクレオシド間結合は、ラセミ混合物として、また
は別個の鏡像異性体として調製され得る。代表的なキラル結合は、アルキルホスホネート
およびホスホロチオエートを含むが、これらに限定されない。リン含有および非リン含有
ヌクレオシド間結合の調製方法は、当業者に周知である。
対立体化学の点で、(R)もしくは(S)、糖アノマー等の場合、αもしくはβ、または
アミノ酸等の場合、(D)もしくは(L)と定義され得る、鏡像異性体、ジアステレオマ
ー、および他の立体異性体配置を生じさせる。本明細書に提供されるアンチセンス化合物
には、すべてのそのような考えられる異性体、ならびにそれらのラセミ形態および光学的
に純粋な形態が含まれる。
’-CH2-N(CH3)-O-5’)、アミド-3(3’-CH2-C(=O)-N(
H)-5’)、アミド-4((3’-CH2-N(H)-C(=O)-5’)、ホルムア
セタール(3’-O-CH2-O-5’)、およびチオホルムアセタール(3’-S-C
H2-O-5’)が含まれるが、これらに限定されない。さらに、中性ヌクレオシド間結
合には、シロキサン(ジアルキルシロキサン)、カルボン酸エステル、カルボキサミド、
硫化物、スルホン酸エステル、およびアミドを含む非イオン性結合が含まれる(例えば、
Carbohydrate Modifications in Antisense
Research;Y.S.Sanghvi and P.D.Cook,Eds.,A
CS Symposium Series 580;Chapters 3 and 4
,40-65を参照のこと)。さらに、中性ヌクレオシド間結合には、混合したN、O、
S、およびCH2成分部分を含む非イオン性結合が含まれる。
4.ある特定のモチーフ
飾ヌクレオシド(例えば、修飾糖および/または修飾核酸塩基を含むヌクレオシド)なら
びに/または1個以上の修飾ヌクレオシド間結合を含む。オリゴヌクレオチドにおけるそ
のような修飾のパターンは、本明細書においてモチーフと称される。ある特定の実施形態
において、糖、核酸塩基、および結合モチーフは、互いに独立している。
a.ある特定の糖モチーフ
飾モチーフでオリゴヌクレオチドまたはその領域に沿って配置された1種類以上の修飾糖
部分および/または天然に存在する糖部分を含む。そのようなモチーフは、本明細書で論
じられる糖修飾および/または他の既知の糖修飾のうちのいずれかを含み得る。
グ」および中央もしくは内部領域または「ギャップ」を含むギャップマー糖モチーフを有
する領域を含むか、またはそれからなる。ギャップマー糖モチーフの3個の領域(5’-
ウィング、ギャップ、および3’-ウィング)は、ヌクレオシドの連続した配列を形成し
、これらのウィングの各々のヌクレオシドの糖部分の少なくとも一部は、このギャップの
ヌクレオシドの糖部分の少なくとも一部とは異なる。具体的には、少なくとも、ギャップ
に最も近い(5’-ウィングの最も3’側のヌクレオシドおよび3’-ウィングの最も5
’側のヌクレオシド)各ウィングのヌクレオシドの糖部分が、隣接するギャップヌクレオ
シドの糖部分とは異なり、それ故に、ウィングとギャップとの間の境界を定義する。ある
特定の実施形態において、ギャップ内の糖部分は、互いに同一である。ある特定の実施形
態において、ギャップは、ギャップの1個以上の他のヌクレオシドの糖部分とは異なる糖
部分を有する1個以上のヌクレオシドを含む。ある特定の実施形態において、2個のウィ
ングの糖モチーフは、互いに同一である(対称性糖ギャップマー)。ある特定の実施形態
において、5’-ウィングの糖モチーフは、3’-ウィングの糖モチーフとは異なる(不
斉糖ギャップマー)。
i.ある特定の5’-ウィング
ヌクレオシドからなる。ある特定の実施形態において、ギャップマーの5’-ウィングは
、1~7個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマ
ーの5’-ウィングは、1~6個の連結したヌクレオシドからなる。ある特定の実施形態
において、ギャップマーの5’-ウィングは、1~5個の連結したヌクレオシドからなる
。ある特定の実施形態において、ギャップマーの5’-ウィングは、2~5個の連結した
ヌクレオシドからなる。ある特定の実施形態において、ギャップマーの5’-ウィングは
、3~5個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマ
ーの5’-ウィングは、4または5個の連結したヌクレオシドからなる。ある特定の実施
形態において、ギャップマーの5’-ウィングは、1~4個の連結したヌクレオシドから
なる。ある特定の実施形態において、ギャップマーの5’-ウィングは、1~3個の連結
したヌクレオシドからなる。ある特定の実施形態において、ギャップマーの5’-ウィン
グは、1または2個の連結したヌクレオシドからなる。ある特定の実施形態において、ギ
ャップマーの5’-ウィングは、2~4個の連結したヌクレオシドからなる。ある特定の
実施形態において、ギャップマーの5’-ウィングは、2または3個の連結したヌクレオ
シドからなる。ある特定の実施形態において、ギャップマーの5’-ウィングは、3また
は4個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマーの
5’-ウィングは、1個のヌクレオシドからなる。ある特定の実施形態において、ギャッ
プマーの5’-ウィングは、2個の連結したヌクレオシドからなる。ある特定の実施形態
において、ギャップマーの5’-ウィングは、3個の連結したヌクレオシドからなる。あ
る特定の実施形態において、ギャップマーの5’-ウィングは、4個の連結したヌクレオ
シドからなる。ある特定の実施形態において、ギャップマーの5’-ウィングは、5個の
連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマーの5’-ウ
ィングは、6個の連結したヌクレオシドからなる。
環式ヌクレオシドを含む。ある特定の実施形態において、ギャップマーの5’-ウィング
は、少なくとも2個の二環式ヌクレオシドを含む。ある特定の実施形態において、ギャッ
プマーの5’-ウィングは、少なくとも3個の二環式ヌクレオシドを含む。ある特定の実
施形態において、ギャップマーの5’-ウィングは、少なくとも4個の二環式ヌクレオシ
ドを含む。ある特定の実施形態において、ギャップマーの5’-ウィングは、少なくとも
1個の拘束エチルヌクレオシドを含む。ある特定の実施形態において、ギャップマーの5
’-ウィングは、少なくとも1個のLNAヌクレオシドを含む。ある特定の実施形態にお
いて、ギャップマーの5’-ウィングの各ヌクレオシドは、二環式ヌクレオシドである。
ある特定の実施形態において、ギャップマーの5’-ウィングの各ヌクレオシドは、拘束
エチルヌクレオシドである。ある特定の実施形態において、ギャップマーの5’-ウィン
グの各ヌクレオシドは、LNAヌクレオシドである。
二環式修飾ヌクレオシドを含む。ある特定の実施形態において、ギャップマーの5’-ウ
ィングは、少なくとも1個の2’-置換ヌクレオシドを含む。ある特定の実施形態におい
て、ギャップマーの5’-ウィングは、少なくとも1個の2’-MOEヌクレオシドを含
む。ある特定の実施形態において、ギャップマーの5’-ウィングは、少なくとも1個の
2’-OMeヌクレオシドを含む。ある特定の実施形態において、ギャップマーの5’-
ウィングの各ヌクレオシドは、非二環式修飾ヌクレオシドである。ある特定の実施形態に
おいて、ギャップマーの5’-ウィングの各ヌクレオシドは、2’-置換ヌクレオシドで
ある。ある特定の実施形態において、ギャップマーの5’-ウィングの各ヌクレオシドは
、2’-MOEヌクレオシドである。ある特定の実施形態において、ギャップマーの5’
-ウィングの各ヌクレオシドは、2’-OMeヌクレオシドである。
’-デオキシヌクレオシドを含む。ある特定の実施形態において、ギャップマーの5’-
ウィングの各ヌクレオシドは、2’-デオキシヌクレオシドである。ある特定の実施形態
において、ギャップマーの5’-ウィングは、少なくとも1個のリボヌクレオシドを含む
。ある特定の実施形態において、ギャップマーの5’-ウィングの各ヌクレオシドは、リ
ボヌクレオシドである。ある特定の実施形態において、5’-ウィングのヌクレオシドの
うちの1個、2個以上、または各々は、RNA様ヌクレオシドである。
環式ヌクレオシドおよび少なくとも1個の非二環式修飾ヌクレオシドを含む。ある特定の
実施形態において、ギャップマーの5’-ウィングは、少なくとも1個の二環式ヌクレオ
シドおよび少なくとも1個の2’-置換ヌクレオシドを含む。ある特定の実施形態におい
て、ギャップマーの5’-ウィングは、少なくとも1個の二環式ヌクレオシドおよび少な
くとも1個の2’-MOEヌクレオシドを含む。ある特定の実施形態において、ギャップ
マーの5’-ウィングは、少なくとも1個の二環式ヌクレオシドおよび少なくとも1個の
2’-OMeヌクレオシドを含む。ある特定の実施形態において、ギャップマーの5’-
ウィングは、少なくとも1個の二環式ヌクレオシドおよび少なくとも1個の2’-デオキ
シヌクレオシドを含む。
束エチルヌクレオシドおよび少なくとも1個の非二環式修飾ヌクレオシドを含む。ある特
定の実施形態において、ギャップマーの5’-ウィングは、少なくとも1個の拘束エチル
ヌクレオシドおよび少なくとも1個の2’-置換ヌクレオシドを含む。ある特定の実施形
態において、ギャップマーの5’-ウィングは、少なくとも1個の拘束エチルヌクレオシ
ドおよび少なくとも1個の2’-MOEヌクレオシドを含む。ある特定の実施形態におい
て、ギャップマーの5’-ウィングは、少なくとも1個の拘束エチルヌクレオシドおよび
少なくとも1個の2’-OMeヌクレオシドを含む。ある特定の実施形態において、ギャ
ップマーの5’-ウィングは、少なくとも1個の拘束エチルヌクレオシドおよび少なくと
も1個の2’-デオキシヌクレオシドを含む。
ii.ある特定の3’-ウィング
ヌクレオシドからなる。ある特定の実施形態において、ギャップマーの3’-ウィングは
、1~7個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマ
ーの3’-ウィングは、1~6個の連結したヌクレオシドからなる。ある特定の実施形態
において、ギャップマーの3’-ウィングは、1~5個の連結したヌクレオシドからなる
。ある特定の実施形態において、ギャップマーの3’-ウィングは、2~5個の連結した
ヌクレオシドからなる。ある特定の実施形態において、ギャップマーの3’-ウィングは
、3~5個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマ
ーの3’-ウィングは、4または5個の連結したヌクレオシドからなる。ある特定の実施
形態において、ギャップマーの3’-ウィングは、1~4個の連結したヌクレオシドから
なる。ある特定の実施形態において、ギャップマーの3’-ウィングは、1~3個の連結
したヌクレオシドからなる。ある特定の実施形態において、ギャップマーの3’-ウィン
グは、1または2個の連結したヌクレオシドからなる。ある特定の実施形態において、ギ
ャップマーの3’-ウィングは、2~4個の連結したヌクレオシドからなる。ある特定の
実施形態において、ギャップマーの3’-ウィングは、2または3個の連結したヌクレオ
シドからなる。ある特定の実施形態において、ギャップマーの3’-ウィングは、3また
は4個の連結したヌクレオシドからなる。
からなる。ある特定の実施形態において、ギャップマーの3’-ウィングは、2個の連結
したヌクレオシドからなる。ある特定の実施形態において、ギャップマーの3’-ウィン
グは、3個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマ
ーの3’-ウィングは、4個の連結したヌクレオシドからなる。ある特定の実施形態にお
いて、ギャップマーの3’-ウィングは、5個の連結したヌクレオシドからなる。ある特
定の実施形態において、ギャップマーの3’-ウィングは、6個の連結したヌクレオシド
からなる。
環式ヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3’-ウィング
は、少なくとも1個の拘束エチルヌクレオシドを含む。ある特定の実施形態において、ギ
ャップマーの3’-ウィングは、少なくとも1個のLNAヌクレオシドを含む。ある特定
の実施形態において、ギャップマーの3’-ウィングの各ヌクレオシドは、二環式ヌクレ
オシドである。ある特定の実施形態において、ギャップマーの3’-ウィングの各ヌクレ
オシドは、拘束エチルヌクレオシドである。ある特定の実施形態において、ギャップマー
の3’-ウィングの各ヌクレオシドは、LNAヌクレオシドである。
二環式修飾ヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3’-ウ
ィングは、少なくとも2個の非二環式修飾ヌクレオシドを含む。ある特定の実施形態にお
いて、ギャップマーの3’-ウィングは、少なくとも3個の非二環式修飾ヌクレオシドを
含む。ある特定の実施形態において、ギャップマーの3’-ウィングは、少なくとも4個
の非二環式修飾ヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3’
-ウィングは、少なくとも1個の2’-置換ヌクレオシドを含む。ある特定の実施形態に
おいて、ギャップマーの3’-ウィングは、少なくとも1個の2’-MOEヌクレオシド
を含む。ある特定の実施形態において、ギャップマーの3’-ウィングは、少なくとも1
個の2’-OMeヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3
’-ウィングの各ヌクレオシドは、非二環式修飾ヌクレオシドである。ある特定の実施形
態において、ギャップマーの3’-ウィングの各ヌクレオシドは、2’-置換ヌクレオシ
ドである。ある特定の実施形態において、ギャップマーの3’-ウィングの各ヌクレオシ
ドは、2’-MOEヌクレオシドである。ある特定の実施形態において、ギャップマーの
3’-ウィングの各ヌクレオシドは、2’-OMeヌクレオシドである。
’-デオキシヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3’-
ウィングの各ヌクレオシドは、2’-デオキシヌクレオシドである。ある特定の実施形態
において、ギャップマーの3’-ウィングは、少なくとも1個のリボヌクレオシドを含む
。ある特定の実施形態において、ギャップマーの3’-ウィングの各ヌクレオシドは、リ
ボヌクレオシドである。ある特定の実施形態において、5’-ウィングのヌクレオシドの
うちの1個、2個以上、または各々は、RNA様ヌクレオシドである。
環式ヌクレオシドおよび少なくとも1個の非二環式修飾ヌクレオシドを含む。ある特定の
実施形態において、ギャップマーの3’-ウィングは、少なくとも1個の二環式ヌクレオ
シドおよび少なくとも1個の2’-置換ヌクレオシドを含む。ある特定の実施形態におい
て、ギャップマーの3’-ウィングは、少なくとも1個の二環式ヌクレオシドおよび少な
くとも1個の2’-MOEヌクレオシドを含む。ある特定の実施形態において、ギャップ
マーの3’-ウィングは、少なくとも1個の二環式ヌクレオシドおよび少なくとも1個の
2’-OMeヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3’-
ウィングは、少なくとも1個の二環式ヌクレオシドおよび少なくとも1個の2’-デオキ
シヌクレオシドを含む。
束エチルヌクレオシドおよび少なくとも1個の非二環式修飾ヌクレオシドを含む。ある特
定の実施形態において、ギャップマーの3’-ウィングは、少なくとも1個の拘束エチル
ヌクレオシドおよび少なくとも1個の2’-置換ヌクレオシドを含む。ある特定の実施形
態において、ギャップマーの3’-ウィングは、少なくとも1個の拘束エチルヌクレオシ
ドおよび少なくとも1個の2’-MOEヌクレオシドを含む。ある特定の実施形態におい
て、ギャップマーの3’-ウィングは、少なくとも1個の拘束エチルヌクレオシドおよび
少なくとも1個の2’-OMeヌクレオシドを含む。ある特定の実施形態において、ギャ
ップマーの3’-ウィングは、少なくとも1個の拘束エチルヌクレオシドおよび少なくと
も1個の2’-デオキシヌクレオシドを含む。
NAヌクレオシドおよび少なくとも1個の非二環式修飾ヌクレオシドを含む。ある特定の
実施形態において、ギャップマーの3’-ウィングは、少なくとも1個のLNAヌクレオ
シドおよび少なくとも1個の2’-置換ヌクレオシドを含む。ある特定の実施形態におい
て、ギャップマーの3’-ウィングは、少なくとも1個のLNAヌクレオシドおよび少な
くとも1個の2’-MOEヌクレオシドを含む。ある特定の実施形態において、ギャップ
マーの3’-ウィングは、少なくとも1個のLNAヌクレオシドおよび少なくとも1個の
2’-OMeヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3’-
ウィングは、少なくとも1個のLNAヌクレオシドおよび少なくとも1個の2’-デオキ
シヌクレオシドを含む。
環式ヌクレオシド、少なくとも1個の非二環式修飾ヌクレオシド、および少なくとも1個
の2’-デオキシヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3
’-ウィングは、少なくとも1個の拘束エチルヌクレオシド、少なくとも1個の非二環式
修飾ヌクレオシド、および少なくとも1個の2’-デオキシヌクレオシドを含む。ある特
定の実施形態において、ギャップマーの3’-ウィングは、少なくとも1個のLNAヌク
レオシド、少なくとも1個の非二環式修飾ヌクレオシド、および少なくとも1個の2’-
デオキシヌクレオシドを含む。
環式ヌクレオシド、少なくとも1個の2’-置換ヌクレオシド、および少なくとも1個の
2’-デオキシヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3’
-ウィングは、少なくとも1個の拘束エチルヌクレオシド、少なくとも1個の2’-置換
ヌクレオシド、および少なくとも1個の2’-デオキシヌクレオシドを含む。ある特定の
実施形態において、ギャップマーの3’-ウィングは、少なくとも1個のLNAヌクレオ
シド、少なくとも1個の2’-置換ヌクレオシド、および少なくとも1個の2’-デオキ
シヌクレオシドを含む。
環式ヌクレオシド、少なくとも1個の2’-MOEヌクレオシド、および少なくとも1個
の2’-デオキシヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3
’-ウィングは、少なくとも1個の拘束エチルヌクレオシド、少なくとも1個の2’-M
OEヌクレオシド、および少なくとも1個の2’-デオキシヌクレオシドを含む。ある特
定の実施形態において、ギャップマーの3’-ウィングは、少なくとも1個のLNAヌク
レオシド、少なくとも1個の2’-MOEヌクレオシド、および少なくとも1個の2’-
デオキシヌクレオシドを含む。
環式ヌクレオシド、少なくとも1個の2’-OMeヌクレオシド、および少なくとも1個
の2’-デオキシヌクレオシドを含む。ある特定の実施形態において、ギャップマーの3
’-ウィングは、少なくとも1個の拘束エチルヌクレオシド、少なくとも1個の2’-O
Meヌクレオシド、および少なくとも1個の2’-デオキシヌクレオシドを含む。ある特
定の実施形態において、ギャップマーの3’-ウィングは、少なくとも1個のLNAヌク
レオシド、少なくとも1個の2’-OMeヌクレオシド、および少なくとも1個の2’-
デオキシヌクレオシドを含む。
iii.ある特定の中央領域(ギャップ)
レオシドからなる。ある特定の実施形態において、ギャップマーのギャップは、6~15
個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマーのギャ
ップは、6~12個の連結したヌクレオシドからなる。ある特定の実施形態において、ギ
ャップマーのギャップは、6~10個の連結したヌクレオシドからなる。ある特定の実施
形態において、ギャップマーのギャップは、6~9個の連結したヌクレオシドからなる。
ある特定の実施形態において、ギャップマーのギャップは、6~8個の連結したヌクレオ
シドからなる。ある特定の実施形態において、ギャップマーのギャップは、6または7個
の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマーのギャッ
プは、7~10個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャ
ップマーのギャップは、7~9個の連結したヌクレオシドからなる。ある特定の実施形態
において、ギャップマーのギャップは、7または8個の連結したヌクレオシドからなる。
ある特定の実施形態において、ギャップマーのギャップは、8~10個の連結したヌクレ
オシドからなる。ある特定の実施形態において、ギャップマーのギャップは、8または9
個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップマーのギャ
ップは、6個の連結したヌクレオシドからなる。ある特定の実施形態において、ギャップ
マーのギャップは、7個の連結したヌクレオシドからなる。ある特定の実施形態において
、ギャップマーのギャップは、8個の連結したヌクレオシドからなる。ある特定の実施形
態において、ギャップマーのギャップは、9個の連結したヌクレオシドからなる。ある特
定の実施形態において、ギャップマーのギャップは、10個の連結したヌクレオシドから
なる。ある特定の実施形態において、ギャップマーのギャップは、11個の連結したヌク
レオシドからなる。ある特定の実施形態において、ギャップマーのギャップは、12個の
連結したヌクレオシドからなる。
オキシヌクレオシドである。ある特定の実施形態において、ギャップは、1個以上の修飾
ヌクレオシドを含む。ある特定の実施形態において、ギャップマーのギャップの各ヌクレ
オシドは、2’-デオキシヌクレオシドであるか、または「DNA様」の修飾ヌクレオシ
ドである。そのような実施形態において、「DNA様」とは、ギャップマーおよびRNA
分子を含む二本鎖がRNase Hを活性化することができるようにヌクレオシドがDN
Aと同様の特徴を有することを意味する。例えば、ある特定の条件下で、2’-(ara
)-Fは、RNase Hの活性化を支援することが示されており、それ故に、DNA様
である。ある特定の実施形態において、ギャップマーのギャップの1個以上のヌクレオシ
ドは、2’-デオキシヌクレオシドではなく、DNA様でもない。ある特定のそのような
実施形態において、ギャップマーは、それでもやはり、RNase Hの活性化を支援す
る(例えば、非DNAヌクレオシドの数または設置のおかげで)。
された一続きの非修飾2’-デオキシヌクレオシドを含み、それ故に、3個のサブ領域(
2つの一続きの、1個以上の2’-デオキシヌクレオシドおよび一続きの1個以上の中断
修飾ヌクレオシド)をもたらす。ある特定の実施形態において、いずれの一続きの非修飾
2’-デオキシヌクレオシドも、5、6、または7個のヌクレオシドより短い。ある特定
の実施形態において、そのような短い続きは、短いギャップ領域を用いることによって達
成される。ある特定の実施形態において、短い一続きは、より長いギャップ領域を中断す
ることによって達成される。
特定の実施形態において、ギャップは、cEt、FHNA、LNA、および2-チオ-チ
ミジンの中から選択される1個以上の修飾ヌクレオシドを含む。ある特定の実施形態にお
いて、ギャップは、1個の修飾ヌクレオシドを含む。ある特定の実施形態において、ギャ
ップは、5’-Meおよび5’-(R)-Meの中から選択される5’-置換糖部分を含
む。ある特定の実施形態において、ギャップは、2個の修飾ヌクレオシドを含む。ある特
定の実施形態において、ギャップは、3個の修飾ヌクレオシドを含む。ある特定の実施形
態において、ギャップは、4個の修飾ヌクレオシドを含む。ある特定の実施形態において
、ギャップは、2個以上の修飾ヌクレオシドを含み、各修飾ヌクレオシドは同一である。
ある特定の実施形態において、ギャップは、2個以上の修飾ヌクレオシドを含み、各修飾
ヌクレオシドは異なる。
施形態において、ギャップは、1個以上のメチルホスホネート結合を含む。ある特定の実
施形態において、ギャップは、2個以上の修飾結合を含む。ある特定の実施形態において
、ギャップは、1個以上の修飾結合および1個以上の修飾ヌクレオシドを含む。ある特定
の実施形態において、ギャップは、1個の修飾結合および1個の修飾ヌクレオシドを含む
。ある特定の実施形態において、ギャップは、2個の修飾結合および2個以上の修飾ヌク
レオシドを含む。
b.ある特定のヌクレオシド間結合モチーフ
ヌクレオシド間結合モチーフでオリゴヌクレオチドまたはその領域に沿って配置された修
飾ヌクレオシド間結合を含む。ある特定の実施形態において、オリゴヌクレオチドは、交
互のヌクレオシド間結合モチーフを有する領域を含む。ある特定の実施形態において、本
開示のオリゴヌクレオチドは、均一に修飾されたヌクレオシド間結合の領域を含む。ある
特定のそのような実施形態において、オリゴヌクレオチドは、ホスホロチオエートヌクレ
オシド間結合によって均一に連結された領域を含む。ある特定の実施形態において、オリ
ゴヌクレオチドは、ホスホロチオエートヌクレオシド間結合によって均一に連結される。
ある特定の実施形態において、オリゴヌクレオチドの各ヌクレオシド間結合は、ホスホジ
エステルおよびホスホロチオエートから選択される。ある特定の実施形態において、オリ
ゴヌクレオチドの各ヌクレオシド間結合は、ホスホジエステルおよびホスホロチオエート
から選択され、少なくとも1個のヌクレオシド間結合は、ホスホロチオエートである。
エートヌクレオシド間結合を含む。ある特定の実施形態において、オリゴヌクレオチドは
、少なくとも7個のホスホロチオエートヌクレオシド間結合を含む。ある特定の実施形態
において、オリゴヌクレオチドは、少なくとも8個のホスホロチオエートヌクレオシド間
結合を含む。ある特定の実施形態において、オリゴヌクレオチドは、少なくとも9個のホ
スホロチオエートヌクレオシド間結合を含む。ある特定の実施形態において、オリゴヌク
レオチドは、少なくとも10個のホスホロチオエートヌクレオシド間結合を含む。ある特
定の実施形態において、オリゴヌクレオチドは、少なくとも11個のホスホロチオエート
ヌクレオシド間結合を含む。ある特定の実施形態において、オリゴヌクレオチドは、少な
くとも12個のホスホロチオエートヌクレオシド間結合を含む。ある特定の実施形態にお
いて、オリゴヌクレオチドは、少なくとも13個のホスホロチオエートヌクレオシド間結
合を含む。ある特定の実施形態において、オリゴヌクレオチドは、少なくとも14個のホ
スホロチオエートヌクレオシド間結合を含む。
ホロチオエートヌクレオシド間結合の少なくとも1個のブロックを含む。ある特定の実施
形態において、オリゴヌクレオチドは、少なくとも7個の連続したホスホロチオエートヌ
クレオシド間結合の少なくとも1個のブロックを含む。ある特定の実施形態において、オ
リゴヌクレオチドは、少なくとも8個の連続したホスホロチオエートヌクレオシド間結合
の少なくとも1個のブロックを含む。ある特定の実施形態において、オリゴヌクレオチド
は、少なくとも9個の連続したホスホロチオエートヌクレオシド間結合の少なくとも1個
のブロックを含む。ある特定の実施形態において、オリゴヌクレオチドは、少なくとも1
0個の連続したホスホロチオエートヌクレオシド間結合の少なくとも1個のブロックを含
む。ある特定の実施形態において、オリゴヌクレオチドは、少なくとも1個の12個の連
続したホスホロチオエートヌクレオシド間結合の少なくとも1個のブロックを含む。ある
特定のそのような実施形態において、少なくとも1個のそのようなブロックは、オリゴヌ
クレオチドの3’末端に位置する。ある特定のそのような実施形態において、少なくとも
1個のそのようなブロックは、オリゴヌクレオチドの3’末端の3個のヌクレオシド内に
位置する。ある特定の実施形態において、オリゴヌクレオチドは、15個未満のホスホロ
チオエートヌクレオシド間結合を含む。ある特定の実施形態において、オリゴヌクレオチ
ドは、14個未満のホスホロチオエートヌクレオシド間結合を含む。ある特定の実施形態
において、オリゴヌクレオチドは、13個未満のホスホロチオエートヌクレオシド間結合
を含む。ある特定の実施形態において、オリゴヌクレオチドは、12個未満のホスホロチ
オエートヌクレオシド間結合を含む。ある特定の実施形態において、オリゴヌクレオチド
は、11個未満のホスホロチオエートヌクレオシド間結合を含む。ある特定の実施形態に
おいて、オリゴヌクレオチドは、10個未満のホスホロチオエートヌクレオシド間結合を
含む。ある特定の実施形態において、オリゴヌクレオチドは、9個未満のホスホロチオエ
ートヌクレオシド間結合を含む。ある特定の実施形態において、オリゴヌクレオチドは、
8個未満のホスホロチオエートヌクレオシド間結合を含む。ある特定の実施形態において
、オリゴヌクレオチドは、7個未満のホスホロチオエートヌクレオシド間結合を含む。あ
る特定の実施形態において、オリゴヌクレオチドは、6個未満のホスホロチオエートヌク
レオシド間結合を含む。ある特定の実施形態において、オリゴヌクレオチドは、5個未満
のホスホロチオエートヌクレオシド間結合を含む。
c.ある特定の核酸塩基修飾モチーフ
塩基修飾モチーフでオリゴヌクレオチドまたはその領域に沿って配置された核酸塩基に対
する化学修飾を含む。ある特定のそのような実施形態において、核酸塩基修飾は、ギャッ
プモチーフで配置される。ある特定の実施形態において、核酸塩基修飾は、交互のモチー
フで配置される。ある特定の実施形態において、各核酸塩基が修飾される。ある特定の実
施形態において、核酸塩基のうちのいずれも化学修飾されない。
。ある特定のそのような実施形態において、ブロックは、オリゴヌクレオチドの3’末端
に存在する。ある特定の実施形態において、ブロックは、オリゴヌクレオチドの3’末端
の3個のヌクレオチド内に存在する。ある特定のそのような実施形態において、ブロック
は、オリゴヌクレオチドの5’末端に存在する。ある特定の実施形態において、ブロック
は、オリゴヌクレオチドの5’末端の3個のヌクレオチド内に存在する。
ける天然塩基の機能である。例えば、ある特定の実施形態において、オリゴヌクレオチド
の各プリンまたは各ピリミジンが修飾される。ある特定の実施形態において、各アデニン
が修飾される。ある特定の実施形態において、各グアニンが修飾される。ある特定の実施
形態において、各チミンが修飾される。ある特定の実施形態において、各シトシンが修飾
される。ある特定の実施形態において、各ウラシルが修飾される。
しくはすべてが5-メチルシトシン部分であるか、またはいずれも5-メチルシトシン部
分ではない。本明細書において、5-メチルシトシンは、「修飾核酸塩基」ではない。し
たがって、別途示されない限り、非修飾核酸塩基は、5-メチルを有するシトシン残基お
よび5-メチルを欠くシトシン残基の両方を含む。ある特定の実施形態において、すべて
またはいくつかのシトシン核酸塩基のメチル化状態が特定される。
塩基への結合を含む。ある特定の実施形態において、オリゴヌクレオチドの各プリンまた
は各ピリミジンは、共役基を含むように任意に修飾され得る。
d.ある特定の全長
ヌクレオチドを提供する。ある特定の実施形態において、オリゴヌクレオチドは、X~Y
個の連結したヌクレオシドからなり、ここで、Xは、その範囲の最小数のヌクレオシドを
表し、Yは、その範囲の最大数のヌクレオシドを表す。ある特定のそのような実施形態に
おいて、XおよびYは各々、8、9、10、11、12、13、14、15、16、17
、18、19、20、21、22、23、24、25、26、27、28、29、30、
31、32、33、34、35、36、37、38、39、40、41、42、43、4
4、45、46、47、48、49、および50から独立して選択されるが、但し、Xが
Y以下であることを条件とする。例えば、ある特定の実施形態において、オリゴヌクレオ
チドは、8~9、8~10、8~11、8~12、8~13、8~14、8~15、8~
16、8~17、8~18、8~19、8~20、8~21、8~22、8~23、8~
24、8~25、8~26、8~27、8~28、8~29、8~30、9~10、9~
11、9~12、9~13、9~14、9~15、9~16、9~17、9~18、9~
19、9~20、9~21、9~22、9~23、9~24、9~25、9~26、9~
27、9~28、9~29、9~30、10~11、10~12、10~13、10~1
4、10~15、10~16、10~17、10~18、10~19、10~20、10
~21、10~22、10~23、10~24、10~25、10~26、10~27、
10~28、10~29、10~30、11~12、11~13、11~14、11~1
5、11~16、11~17、11~18、11~19、11~20、11~21、11
~22、11~23、11~24、11~25、11~26、11~27、11~28、
11~29、11~30、12~13、12~14、12~15、12~16、12~1
7、12~18、12~19、12~20、12~21、12~22、12~23、12
~24、12~25、12~26、12~27、12~28、12~29、12~30、
13~14、13~15、13~16、13~17、13~18、13~19、13~2
0、13~21、13~22、13~23、13~24、13~25、13~26、13
~27、13~28、13~29、13~30、14~15、14~16、14~17、
14~18、14~19、14~20、14~21、14~22、14~23、14~2
4、14~25、14~26、14~27、14~28、14~29、14~30、15
~16、15~17、15~18、15~19、15~20、15~21、15~22、
15~23、15~24、15~25、15~26、15~27、15~28、15~2
9、15~30、16~17、16~18、16~19、16~20、16~21、16
~22、16~23、16~24、16~25、16~26、16~27、16~28、
16~29、16~30、17~18、17~19、17~20、17~21、17~2
2、17~23、17~24、17~25、17~26、17~27、17~28、17
~29、17~30、18~19、18~20、18~21、18~22、18~23、
18~24、18~25、18~26、18~27、18~28、18~29、18~3
0、19~20、19~21、19~22、19~23、19~24、19~25、19
~26、19~29、19~28、19~29、19~30、20~21、20~22、
20~23、20~24、20~25、20~26、20~27、20~28、20~2
9、20~30、21~22、21~23、21~24、21~25、21~26、21
~27、21~28、21~29、21~30、22~23、22~24、22~25、
22~26、22~27、22~28、22~29、22~30、23~24、23~2
5、23~26、23~27、23~28、23~29、23~30、24~25、24
~26、24~27、24~28、24~29、24~30、25~26、25~27、
25~28、25~29、25~30、26~27、26~28、26~29、26~3
0、27~28、27~29、27~30、28~29、28~30、または29~30
個の連結したヌクレオシドからなり得る。ある範囲またはある特定の数にかかわらず、化
合物のオリゴヌクレオチドのヌクレオシドの数が限定される実施形態において、この化合
物は、それでもやはり、さらなる他の置換基をさらに含み得る。例えば、8~30個のヌ
クレオシドを含むオリゴヌクレオチドは、31個のヌクレオシドを有するオリゴヌクレオ
チドを除外するが、別途示されない限り、そのようなオリゴヌクレオチドは、例えば、1
個以上の共役基、末端基、または他の置換基をさらに含み得る。
れ、かつそれらの領域の特定の長さの合計が全長範囲の上限未満である場合、オリゴヌク
レオチドは、特定の領域の長さを超えてさらなるヌクレオシドを有し得るが、但し、ヌク
レオシドの総数が全長範囲の上限を超えないことを条件とする。
5.ある特定のアンチセンスオリゴヌクレオチドの化学的モチーフ
それらの糖モチーフ、ヌクレオシド間結合モチーフ、核酸塩基修飾モチーフ、および全長
によって特徴付けられる。ある特定の実施形態において、そのようなパラメータは各々、
互いに独立している。したがって、ギャップマー糖モチーフを有するオリゴヌクレオチド
の各ヌクレオシド間結合は、修飾されても修飾されなくてもよく、糖修飾のギャップマー
修飾パターンに従っても従わなくてもよい。したがって、糖ギャップマーのウィング領域
内のヌクレオシド間結合は、互いに同一であるか、または異なり得、ギャップ領域のヌク
レオシド間結合と同一であるか、または異なり得る。同様に、そのような糖ギャップマー
オリゴヌクレオチドは、糖修飾のギャップマーパターンから独立して1個以上の修飾核酸
塩基を含み得る。当業者であれば、そのようなモチーフが組み合わされて様々なオリゴヌ
クレオチドを作成し得ることを認識する。
互いに独立していない。
i.ある特定の配列および標的
スオリゴヌクレオチドを提供する。そのようなアンチセンス化合物は、標的核酸にハイブ
リダイズすることができ、少なくとも1つのアンチセンス活性をもたらす。ある特定の実
施形態において、アンチセンス化合物は、1個以上の標的核酸に特異的にハイブリダイズ
する。ある特定の実施形態において、特異的にハイブリダイズするアンチセンス化合物は
、標的核酸に対して、ハイブリダイゼーションを可能にし、かつアンチセンス活性をもた
らすのに十分な相補性と、任意の非標的に対して、特異的ハイブリダイゼーションが所望
される条件下(例えば、生体内または治療的使用のために生理学的条件下、かつ生体外ア
ッセイの場合、アッセイが実行される条件下)で非標的核酸配列への非特異的ハイブリダ
イゼーションを回避するか、または減少させるのに不十分な相補性とを有する領域を含む
核酸塩基配列と、を有する。ある特定の実施形態において、標的および非標的が両方とも
に標的配列を含むが、オリゴヌクレオチドは、標的と非標的との間で選択的である。その
ような実施形態において、選択性は、一方の核酸分子と比較した他方の核酸分子の標的領
域の相対近接性に起因し得る。
酸に完全に相補的なオリゴヌクレオチドを含むアンチセンス化合物を提供する。ある特定
の実施形態において、オリゴヌクレオチドは、標的核酸に99%相補的である。ある特定
の実施形態において、オリゴヌクレオチドは、標的核酸に95%相補的である。ある特定
の実施形態において、そのようなオリゴヌクレオチドは、標的核酸に90%相補的である
。
補的である。ある特定の実施形態において、そのようなオリゴヌクレオチドは、標的核酸
に80%相補的である。ある特定の実施形態において、アンチセンス化合物は、標的核酸
に完全に相補的であり、かつオリゴヌクレオチドの全長にわたって標的核酸に少なくとも
80%相補的な領域を含む。ある特定のそのような実施形態において、完全な相補性の領
域は、6~14核酸塩基長である。
領域を含む。ある特定のそのような実施形態において、ハイブリダイズ領域は、12~3
0個の連結したヌクレオシドからなり、標的核酸に完全に相補的である。ある特定の実施
形態において、ハイブリダイズ領域は、標的核酸と比較して、1つのミスマッチを含む。
ある特定の実施形態において、ハイブリダイズ領域は、標的核酸と比較して、2つのミス
マッチを含む。ある特定の実施形態において、ハイブリダイズ領域は、標的核酸と比較し
て、3つのミスマッチを含む。ある特定の実施形態において、末端領域は、1~4個の末
端ヌクレオシドからなる。ある特定の実施形態において、末端ヌクレオシドは、3’末端
に存在する。ある特定の実施形態において、末端ヌクレオシドのうちの1個以上は、標的
核酸に相補的ではない。
う任意の機構を含み、このハイブリダイゼーションは、生物学的効果をもたらす。ある特
定の実施形態において、そのようなハイブリダイゼーションは、例えば、標的核酸の翻訳
、転写、またはスプライシングを伴う細胞機構の同時に起こる阻害または刺激による標的
核酸分解または占有のいずれかをもたらす。
である。RNase Hは、RNA:DNA二本鎖のRNA鎖を切断する細胞性エンドヌ
クレアーゼである。「DNA様」の一本鎖アンチセンス化合物が哺乳類細胞におけるRN
ase H活性を誘発することが当技術分野で既知である。したがって、RNase H
の活性化は、RNA標的の切断をもたらし、それにより遺伝子発現のDNA様オリゴヌク
レオチド媒介阻害の効率を大幅に向上させる。
において、共役基は、1個以上の切断可能な結合を含む。ある特定の実施形態において、
共役基は、リンカーを含む。ある特定の実施形態において、リンカーは、タンパク質結合
部分を含む。ある特定の実施形態において、共役基は、細胞標的部分(細胞標的基とも称
される)を含む。ある特定の実施形態において、細胞標的部分は、分岐基を含む。ある特
定の実施形態において、細胞標的部分は、1個以上のテザーを含む。ある特定の実施形態
において、細胞標的部分は、炭水化物または炭水化物クラスターを含む。
ii.ある特定の切断可能な部分
実施形態において、切断可能な部分は、切断可能な結合を含む。ある特定の実施形態にお
いて、共役基は、切断可能な部分を含む。ある特定のそのような実施形態において、切断
可能な部分は、アンチセンスオリゴヌクレオチドに結合する。ある特定のそのような実施
形態において、切断可能な部分は、細胞標的部分に直接結合する。ある特定のそのような
実施形態において、切断可能な部分は、共役リンカーに結合する。ある特定の実施形態に
おいて、切断可能な部分は、ホスフェートまたはホスホジエステルを含む。ある特定の実
施形態において、切断可能な部分は、切断可能なヌクレオシドまたはヌクレオシド類似体
である。ある特定の実施形態において、ヌクレオシドまたはヌクレオシド類似体は、プリ
ン、置換プリン、ピリミジン、または置換ピリミジンから選択される任意に保護された複
素環式塩基を含む。ある特定の実施形態において、切断可能な部分は、ウラシル、チミン
、シトシン、4-N-ベンゾイルシトシン、5-メチルシトシン、4-N-ベンゾイル-
5-メチルシトシン、アデニン、6-N-ベンゾイルアデニン、グアニン、および2-N
-イソブチリルグアニンから選択される任意に保護された複素環式塩基を含むヌクレオシ
ドである。ある特定の実施形態において、切断可能な部分は、ホスホジエステル結合によ
ってアンチセンスオリゴヌクレオチドの3’位に結合され、かつホスホジエステルまたは
ホスホロチオエート結合によってリンカーに結合される2’-デオキシヌクレオシドであ
る。ある特定の実施形態において、切断可能な部分は、ホスホジエステル結合によってア
ンチセンスオリゴヌクレオチドの3’位に結合され、かつホスホジエステルまたはホスホ
ロチオエート結合によってリンカーに結合される2’-デオキシアデノシンである。ある
特定の実施形態において、切断可能な部分は、ホスホジエステル結合によってアンチセン
スオリゴヌクレオチドの3’位に結合され、かつホスホジエステル結合によってリンカー
に結合される2’-デオキシアデノシンである。
3’位に結合される。ある特定の実施形態において、切断可能な部分は、アンチセンスオ
リゴヌクレオチドの5’位に結合される。ある特定の実施形態において、切断可能な部分
は、アンチセンスオリゴヌクレオチドの2’位に結合される。ある特定の実施形態におい
て、切断可能な部分は、ホスホジエステル結合によってアンチセンスオリゴヌクレオチド
に結合される。ある特定の実施形態において、切断可能な部分は、ホスホジエステル結合
またはホスホロチオエート結合のいずれかによってリンカーに結合される。ある特定の実
施形態において、切断可能な部分は、ホスホジエステル結合によってリンカーに結合され
る。ある特定の実施形態において、共役基は、切断可能な部分を含まない。
れた後にのみ、複合体が動物に投与された後に切断される。細胞内で切断可能な部分が切
断され、それにより活性アンチセンスオリゴヌクレオチドを放出する。理論によって束縛
されることを望むものではないが、切断可能な部分が細胞内で1個以上のヌクレアーゼに
よって切断されることが考えられる。ある特定の実施形態において、1個以上のヌクレア
ーゼは、切断可能な部分とリンカーとの間のホスホジエステル結合を切断する。ある特定
の実施形態において、切断可能な部分は、以下の中から選択される構造を有し、
ある。ある特定の実施形態において、切断可能な部分は、以下の中から選択される構造を
有する。
iii.ある特定のリンカー
形態において、リンカーは、切断可能な部分に共有結合される。ある特定のそのような実
施形態において、リンカーは、アンチセンスオリゴヌクレオチドに共有結合される。ある
特定の実施形態において、リンカーは、細胞標的部分に共有結合される。ある特定の実施
形態において、リンカーは、固体支持体への共有結合をさらに含む。ある特定の実施形態
において、リンカーは、タンパク質結合部分への共有結合をさらに含む。ある特定の実施
形態において、リンカーは、固体支持体への共有結合をさらに含み、タンパク質結合部分
への共有結合もさらに含む。ある特定の実施形態において、リンカーは、テザーリガンド
の結合のために複数の位置を含む。ある特定の実施形態において、リンカーは、テザーリ
ガンドの結合のために複数の位置を含み、分岐基に結合されない。ある特定の実施形態に
おいて、リンカーは、1個以上の切断可能な結合をさらに含む。ある特定の実施形態にお
いて、共役基は、リンカーを含まない。
チレングリコール、エーテル、チオエーテル(-S-)、およびヒドロキシルアミノ(-
O-N(H)-)基から選択される基を含む少なくとも1個の線状基を含む。ある特定の
実施形態において、線状基は、アルキル、アミド、およびエーテル基から選択される基を
含む。ある特定の実施形態において、線状基は、アルキルおよびエーテル基から選択され
る基を含む。ある特定の実施形態において、線状基は、少なくとも1個のリン結合基を含
む。ある特定の実施形態において、線状基は、少なくとも1個のホスホジエステル基を含
む。ある特定の実施形態において、線状基は、少なくとも1個の中性結合基を含む。ある
特定の実施形態において、線状基は、細胞標的部分および切断可能な部分に共有結合され
る。ある特定の実施形態において、線状基は、細胞標的部分およびアンチセンスオリゴヌ
クレオチドに共有結合される。ある特定の実施形態において、線状基は、細胞標的部分、
切断可能な部分、および固体支持体に共有結合される。ある特定の実施形態において、線
状基は、細胞標的部分、切断可能な部分、固体支持体、およびタンパク質結合部分に共有
結合される。ある特定の実施形態において、線状基は、1個以上の切断可能な結合を含む
。
る特定の実施形態において、足場は、アルキル、アミド、ジスルフィド、ポリエチレング
リコール、エーテル、チオエーテル、およびヒドロキシルアミノ基から選択される基を含
む分岐状脂肪族基を含む。ある特定の実施形態において、足場は、アルキル、アミド、お
よびエーテル基から選択される基を含む分岐状脂肪族基を含む。ある特定の実施形態にお
いて、足場は、少なくとも1個の単環式または多環式環系を含む。ある特定の実施形態に
おいて、足場は、少なくとも2個の単環式または多環式環系を含む。ある特定の実施形態
において、線状基は、足場基に共有結合され、足場基は、切断可能な部分およびリンカー
に共有結合される。ある特定の実施形態において、線状基は、足場基に共有結合され、足
場基は、切断可能な部分、リンカー、および固体支持体に共有結合される。ある特定の実
施形態において、線状基は、足場基に共有結合され、足場基は、切断可能な部分、リンカ
ー、およびタンパク質結合部分に共有結合される。ある特定の実施形態において、線状基
は、足場基に共有結合され、足場基は、切断可能な部分、リンカー、タンパク質結合部分
、および固体支持体に共有結合される。ある特定の実施形態において、足場基は、1個以
上の切断可能な結合を含む。
施形態において、タンパク質結合部分は、例えば、コレステロール、コール酸、アダマン
タン酢酸、1-ピレン酪酸、ジヒドロテストステロン、1,3-ビス-O(ヘキサデシル
)グリセロール、ゲラニルオキシヘキシル基、ヘキサデシルグリセロール、ボルネオール
、メントール、1,3-プロパンジオール、ヘプタデシル基、パルミチン酸、ミリスチン
酸、O3-(オレオイル)リトコール酸、O3-(オレオイル)コレン酸、ジメトキシト
リチル、またはフェノキサジン)、ビタミン(例えば、葉酸塩、ビタミンA、ビタミンE
、ビオチン、ピリドキサール)、ペプチド、炭水化物(例えば、単糖、二糖、三糖、四糖
、オリゴ糖、多糖)、エンドソーム溶解成分、ステロイド(例えば、ウバオール、ヘシゲ
ニン、ジオスゲニン)、テルペン(例えば、トリテルペン、例えば、サルササポゲニン、
フリーデリン、エピフリーデラノール誘導体化リトコール酸)、またはカチオン性脂質を
含むが、これらに限定されない脂質である。ある特定の実施形態において、タンパク質結
合部分は、C16~C22長鎖飽和もしくは不飽和脂肪酸、コレステロール、コール酸、
ビタミンE、アダマンタン、または1-ペンタフルオロプロピルである。
細胞標的部分は、アンチセンス化合物の細胞取り込みを増加させる。ある特定の実施形態
において、細胞標的部分は、分岐基、1個以上のテザー、および1個以上のリガンドを含
む。ある特定の実施形態において、細胞標的部分は、分岐基、1個以上のテザー、1個以
上のリガンド、および1個以上の切断可能な結合を含む。
1.ある特定の分岐基
ドを含む標的部分を含む。ある特定の実施形態において、分岐基は、共役リンカーを結合
する。ある特定の実施形態において、分岐基は、切断可能な部分を結合する。ある特定の
実施形態において、分岐基は、アンチセンスオリゴヌクレオチドを結合する。ある特定の
実施形態において、分岐基は、リンカーおよびテザーリガンドの各々に共有結合される。
ある特定の実施形態において、分岐基は、アルキル、アミド、ジスルフィド、ポリエチレ
ングリコール、エーテル、チオエーテルおよびヒドロキシルアミノ基から選択される基を
含む分岐状脂肪族基を含む。ある特定の実施形態において、分岐基は、アルキル、アミド
、およびエーテル基から選択される基を含む。ある特定の実施形態において、分岐基は、
アルキルおよびエーテル基から選択される基を含む。ある特定の実施形態において、分岐
基は、単環式または多環式環系を含む。ある特定の実施形態において、分岐基は、1個以
上の切断可能な結合を含む。ある特定の実施形態において、共役基は、分岐基を含まない
。
含む。ある特定の実施形態において、共役基は、結合基に共有結合される1個以上のテザ
ーを含む。ある特定の実施形態において、各テザーは、任意の組み合わせで、アルキル、
エーテル、チオエーテル、ジスルフィド、アミド、およびポリエチレングリコール基から
選択される1個以上の基を含む線状脂肪族基である。ある特定の実施形態において、各テ
ザーは、任意の組み合わせで、アルキル、置換アルキル、エーテル、チオエーテル、ジス
ルフィド、アミド、ホスホジエステルおよびポリエチレングリコール基から選択される1
個以上の基を含む線状脂肪族基である。ある特定の実施形態において、各テザーは、任意
の組み合わせで、アルキル、エーテル、およびアミド基から選択される1個以上の基を含
む線状脂肪族基である。ある特定の実施形態において、各テザーは、任意の組み合わせで
、アルキル、置換アルキル、ホスホジエステル、エーテル、およびアミド基から選択され
る1個以上の基を含む線状脂肪族基である。ある特定の実施形態において、各テザーは、
任意の組み合わせで、アルキルおよびホスホジエステルから選択される1個以上の基を含
む線状脂肪族基である。ある特定の実施形態において、各テザーは、少なくとも1個のリ
ン結合基または中性結合基を含む。
の実施形態において、テザーは、アミド基またはエーテル基のいずれかを介して分岐基に
結合される。ある特定の実施形態において、テザーは、ホスホジエステル基を介して分岐
基に結合される。ある特定の実施形態において、テザーは、リン結合基または中性結合基
を介して分岐基に結合される。ある特定の実施形態において、テザーは、エーテル基を介
して分岐基に結合される。ある特定の実施形態において、テザーは、アミド基またはエー
テル基のいずれかを介してリガンドに結合される。ある特定の実施形態において、テザー
は、エーテル基を介してリガンドに結合される。ある特定の実施形態において、テザーは
、アミド基またはエーテル基のいずれかを介してリガンドに結合される。ある特定の実施
形態において、テザーは、エーテル基を介してリガンドに結合される。
原子鎖長を含む。ある特定の実施形態において、各テザー基は、リガンドと分岐基との間
に約10~約18の原子鎖長を含む。ある特定の実施形態において、各テザー基は、約1
3の原子鎖長を含む。
Z1は、C(=O)O-R2であり、
Z2は、H、C1~C6アルキル、または置換C1~C6アルキであり、
R2は、H、C1~C6アルキル、または置換C1~C6アルキであり、
各m1は、独立して、0~20であり、少なくとも1つのm1は、各テザーに対して0
を超える。
各m1は、独立して、0~20であり、少なくとも1つのm1は、各テザーに対して0
を超える。
いて、テザーは、いかなるアミド結合も含まない。ある特定の実施形態において、テザー
は、リン結合基を含み、いかなるアミド結合も含まない。
3.ある特定のリガンド
ドを提供する。ある特定の実施形態において、各リガンドは、標的細胞において少なくと
も1種類の受容体に対する親和性を有するように選択される。ある特定の実施形態におい
て、哺乳類肝臓細胞の表面において少なくとも1種類の受容体に対する親和性を有するリ
ガンドが選択される。ある特定の実施形態において、肝アシアロ糖タンパク質受容体(A
SGP-R)に対する親和性を有するリガンドが選択される。ある特定の実施形態におい
て、各リガンドは、炭水化物である。ある特定の実施形態において、各リガンドは、ガラ
クトース、N-アセチルガラクトースアミン、マンノース、グルコース、グルコサミン、
およびフコースから独立して選択される。ある特定の実施形態において、各リガンドは、
N-アセチルガラクトースアミン(GalNAc)である。ある特定の実施形態において
、標的部分は、2~6個のリガンドを含む。ある特定の実施形態において、標的部分は、
3個のリガンドを含む。ある特定の実施形態において、標的部分は、3個のN-アセチル
ガラクトースアミンリガンドを含む。
、多価炭水化物クラスター、多糖、修飾多糖、または多糖誘導体である。ある特定の実施
形態において、リガンドは、アミノ糖またはチオ糖である。例えば、アミノ糖は、当技術
分野で既知の任意の数の化合物、例えば、グルコサミン、シアル酸、α-D-ガラクトサ
ミン、N-アセチルガラクトサミン、2-アセトアミド-2-デオキシ-D-ガラクトピ
ラノース(GalNAc)、2-アミノ-3-O-[(R)-1-カルボキシエチル]-
2-デオキシ-β-D-グルコピラノース(β-ムラミン酸)、2-デオキシ-2-メチ
ルアミノ-L-グルコピラノース、4,6-ジデオキシ-4-ホルムアミド-2,3-ジ
-O-メチル-D-マンノピラノース、2-デオキシ-2-スルホアミノ-D-グルコピ
ラノース、およびN-スルホ-D-グルコサミン、およびN-グリコロイル-α-ノイラ
ミン酸から選択され得る。例えば、チオ糖は、5-チオ-β-D-グルコピラノース、メ
チル2,3,4-トリ-O-アセチル-1-チオ-6-O-トリチル-α-D-グルコピ
ラノシド、4-チオ-β-D-ガラクトピラノース、およびエチル3,4,6,7-テト
ラ-O-アセチル-2-デオキシ-1,5-ジチオ-α-D-グルコ-ヘプトピラノシド
からなる群から選択され得る。
で一般にN-アセチルガラクトサミンと称される2-(アセチルアミノ)-2-デオキシ
-D-ガラクトピラノースを指す。ある特定の実施形態において、「N-アセチルガラク
トサミン」は、2-(アセチルアミノ)-2-デオキシ-D-ガラクトピラノースを指す
。ある特定の実施形態において、「GalNac」または「Gal-NAc」は、2-(
アセチルアミノ)-2-デオキシ-D-ガラクトピラノースを指す。ある特定の実施形態
において、「GalNac」または「Gal-NAc」は、β形態:2-(アセチルアミ
ノ)-2-デオキシ-β-D-ガラクトピラノースおよびα形態:2-(アセチルアミノ
)-2-デオキシ-D-ガラクトピラノースの両方を含む、2-(アセチルアミノ)-2
-デオキシ-D-ガラクトピラノースを指す。ある特定の実施形態において、β形態:2
-(アセチルアミノ)-2-デオキシ-β-D-ガラクトピラノースおよびα形態:2-
(アセチルアミノ)-2-デオキシ-D-ガラクトピラノースはどちらも、同義に使用さ
れ得る。したがって、1つの形態が示される構造において、これらの構造は、他の形態も
同様に含むよう意図される。例えば、α形態:2-(アセチルアミノ)-2-デオキシ-
D-ガラクトピラノースの構造が示される場合、この構造は、他の形態も同様に含むよう
意図される。ある特定の実施形態において、ある特定の好ましい実施形態において、β形
態:2-(アセチルアミノ)-2-デオキシ-D-ガラクトピラノースが好ましい実施形
態である。
Zは、Hまたは結合固体支持体であり、
Qは、アンチセンス化合物であり、
Xは、OまたはSであり、
Bxは、複素環式塩基部分である。
はアルキニル基、またはエーテル、ケトン、アミド、エステル、カルバメート、アミン、
ピペリジン、ホスフェート、ホスホジエステル、ホスホロチオエート、トリアゾール、ピ
ロリジン、ジスルフィド、もしくはチオエーテルを含む基から独立して選択される。
、
のエーテルもしくは正確に2個のエーテル、アミド、アミン、ピペリジン、ホスフェート
、ホスホジエステル、もしくはホスホロチオエートを含む基から独立して選択される。
は、正確に1個のアミド結合を含み、Xは、エーテル基を含まない。
は、アミド結合および置換または非置換C2~C11アルキル基からなる。
ル基、またはエーテル、ケトン、アミド、エステル、カルバメート、アミン、ピペリジン
、ホスフェート、ホスホジエステル、ホスホロチオエート、トリアゾール、ピロリジン、
ジスルフィド、もしくはチオエーテルを含む基から選択される。
、
ピペリジン、ホスフェート、ホスホジエステル、もしくはホスホロチオエートを含む基か
ら選択される。
アンチセンスオリゴヌクレオチドのヌクレオシドに結合される。ある特定の実施形態にお
いて、共役アンチセンス化合物は、以下の構造を有し、
Aは、アンチセンスオリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、アンチセンスオリゴヌクレオチドであり、
Cは、共役リンカーであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
ある特定のそのような実施形態において、共役リンカーは、少なくとも1個の切断可能
な結合を含む。
ある特定のそのような実施形態において、分岐基は、少なくとも1個の切断可能な結合
を含む。
ある特定の実施形態において、各テザーは、少なくとも1個の切断可能な結合を含む。
アンチセンスオリゴヌクレオチドのヌクレオシドに結合される。
Aは、アンチセンスオリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Cは、共役リンカーであり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
アンチセンスオリゴヌクレオチドのヌクレオシドに結合される。ある特定の実施形態にお
いて、共役アンチセンス化合物は、以下の構造を有し、
Aは、アンチセンスオリゴヌクレオチドであり、
Cは、共役リンカーであり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、アンチセンスオリゴヌクレオチドであり、
Bは、切断可能な部分であり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
Aは、アンチセンスオリゴヌクレオチドであり、
Dは、分岐基であり、
各Eは、テザーであり、
各Fは、リガンドであり、
qは、1~5の整数である。
な結合を含む。
可能な部分、ならびに他の修飾のある特定の調製を教示する代表的な米国特許、米国特許
出願公開物、および国際特許出願公開物には、米国特許第5,994,517号、同第6
,300,319号、同第6,660,720号、同第6,906,182号、同第7,
262,177号、同第7,491,805号、同第8,106,022号、同第7,7
23,509号、同第2006/0148740号、同第2011/0123520号、
国際公開第WO2013/033230号、および同第WO2012/037254号が
含まれるが、これらに限定されず、これらの各々は、参照によりその全体が本明細書に組
み込まれる。
可能な部分、ならびに他の修飾のある特定の調製を教示する代表的な出版物には、BIE
SSEN et al.,“The Cholesterol Derivative
of a Triantennary Galactoside with High
Affinity for the Hepatic Asialoglycoprot
ein Receptor:a Potent Cholesterol Loweri
ng Agent”J.Med.Chem.(1995)38:1846-1852、B
IESSEN et al.,“Synthesis of Cluster Gala
ctosides with High Affinity for the Hepa
tic Asialoglycoprotein Receptor”J.Med.Ch
em.(1995)38:1538-1546、LEE et al.,“New an
d more efficient multivalent glyco-ligan
ds for asialoglycoprotein receptor of ma
mmalian hepatocytes”Bioorganic & Medicin
al Chemistry(2011)19:2494-2500、RENSEN et
al.,“Determination of the Upper Size Li
mit for Uptake and Processing of Ligands
by the Asialoglycoprotein Receptor on H
epatocytes in Vitro and in Vivo”J.Biol.C
hem.(2001)276(40):37577-37584、RENSEN et
al.,“Design and Synthesis of Novel N-Ace
tylgalactosamine-Terminated Glycolipids
for Targeting of Lipoproteins to the Hep
atic Asialoglycoprotein Receptor”J.Med.C
hem.(2004)47:5798-5808、SLIEDREGT et al.,
“esign and Synthesis of Novel Amphiphili
c Dendritic Galactosides for Selective T
argeting of Liposomes to the Hepatic Asi
aloglycoprotein Receptor”J.Med.Chem.(199
9)42:609-618、およびValentijn et al.,“Solid-
phase synthesis of lysine-based cluster
galactosides with high affinity for the
Asialoglycoprotein Receptor”Tetrahedron,
1997,53(2),759-770が含まれるが、これらに限定されず、これらの各
々は、参照によりその全体が本明細書に組み込まれる。
リゴヌクレオチド(ギャップマー等)またはスプライス調節オリゴヌクレオチド(完全修
飾オリゴヌクレオチド等)、および少なくとも1つ、2つ、または3個のGalNAc基
を含む任意の共役基を含む。 ある特定の実施形態において、共役アンチセンス化合物は
、以下の参考文献:Lee,Carbohydr Res,1978,67,509-5
14、Connolly et al.,J Biol Chem,1982,257,
939-945、Pavia et al.,Int J Pep Protein R
es,1983,22,539-548、Lee et al.,Biochem,19
84,23,4255-4261、Lee et al.,Glycoconjugat
e J,1987,4,317-328、Toyokuni et al.,Tetra
hedron Lett,1990,31,2673-2676、Biessen et
al.,J Med Chem,1995,38,1538-1546、Valent
ijn et al.,Tetrahedron,1997,53,759-770、K
im et al.,Tetrahedron Lett,1997,38,3487-
3490、Lee et al.,Bioconjug Chem,1997,8,76
2-765、Kato et al.,Glycobiol,2001,11,821-
829、Rensen et al.,J Biol Chem,2001,276,3
7577-37584、Lee et al.,Methods Enzymol,20
03,362,38-43、Westerlind et al.,Glycoconj
J,2004,21,227-241、Lee et al.,Bioorg Med
Chem Lett,2006,16(19),5132-5135、Maierho
fer et al.,Bioorg Med Chem,2007,15,7661-
7676、Khorev et al.,Bioorg Med Chem,2008,
16,5216-5231、Lee et al.,Bioorg Med Chem,
2011,19,2494-2500、Kornilova et al.,Analy
t Biochem,2012,425,43-46、Pujol et al.,An
gew Chemie Int Ed Engl,2012,51,7445-7448
、Biessen et al.,J Med Chem,1995,38,1846-
1852、Sliedregt et al.,J Med Chem,1999,42
,609-618、Rensen et al.,J Med Chem,2004,4
7,5798-5808、Rensen et al.,Arterioscler T
hromb Vasc Biol,2006,26,169-175、van Ross
enberg et al.,Gene Ther,2004,11,457-464、
Sato et al.,J Am Chem Soc,2004,126,14013
-14022、Lee et al.,J Org Chem,2012,77,756
4-7571、Biessen et al.,FASEB J,2000,14,17
84-1792、Rajur et al.,Bioconjug Chem,1997
,8,935-940、Duff et al.,Methods Enzymol,2
000,313,297-321、Maier et al.,Bioconjug C
hem,2003,14,18-29、Jayaprakash et al.,Org
Lett,2010,12,5410-5413、Manoharan,Antise
nse Nucleic Acid Drug Dev,2002,12,103-12
8、Merwin et al.,Bioconjug Chem,1994,5,61
2-620、Tomiya et al.,Bioorg Med Chem,2013
,21,5275-5281、国際公開第WO1998/013381号、同第WO20
11/038356号、同第WO1997/046098号、同第WO2008/098
788号、同第WO2004/101619号、同第WO2012/037254号、同
第WO2011/120053号、同第WO2011/100131号、同第WO201
1/163121号、同第WO2012/177947号、同第WO2013/0332
30号、同第WO2013/075035号、同第WO2012/083185号、同第
WO2012/083046号、同第WO2009/082607号、同第WO2009
/134487号、同第WO2010/144740号、同第WO2010/14801
3号、同第WO1997/020563号、同第WO2010/088537号、同第W
O2002/043771号、同第WO2010/129709号、同第WO2012/
068187号、同第WO2009/126933号、同第WO2004/024757
号、同第WO2010/054406号、同第WO2012/089352号、同第WO
2012/089602号、同第WO2013/166121号、同第WO2013/1
65816号、米国特許第4,751,219号、同第8,552,163号、同第6,
908,903号、同第7,262,177号、同第5,994,517号、同第6,3
00,319号、同第8,106,022号、同第7,491,805号、同第7,49
1,805号、同第7,582,744号、同第8,137,695号、同第6,383
,812号、同第6,525,031号、同第6,660,720号、同第7,723,
509号、同第8,541,548号、同第8,344,125号、同第8,313,7
72号、同第8,349,308号、同第8,450,467号、同第8,501,93
0号、同第8,158,601号、同第7,262,177号、同第6,906,182
号、同第6,620,916号、同第8,435,491号、同第8,404,862号
、同第7,851,615;公開された米国特許出願公開第US2011/009726
4号、同第US2011/0097265号、同第US2013/0004427号、同
第US2005/0164235号、同第US2006/0148740号、同第US2
008/0281044号、同第US2010/0240730号、同第US2003/
0119724号、同第US2006/0183886号、同第US2008/0206
869号、同第US2011/0269814号、同第US2009/0286973号
、同第US2011/0207799号、同第US2012/0136042号、同第U
S2012/0165393号、同第US2008/0281041号、同第US200
9/0203135号、同第US2012/0035115号、同第US2012/00
95075号、同第US2012/0101148号、同第US2012/012876
0号、同第US2012/0157509号、同第US2012/0230938号、同
第US2013/0109817号、同第US2013/0121954号、同第US2
013/0178512号、同第US2013/0236968号、同第US2011/
0123520号、同第US2003/0077829号、同第US2008/0108
801号、および同第US2009/0203132号のうちのいずれかにおいて見出さ
れる任意の共役基を含み、これらの各々は、参照によりその全体が組み込まれる。
C.ある特定の用途および特徴
な減少を示す。ある特定の実施形態において、非共役アンチセンス化合物は、腎臓に蓄積
する。ある特定の実施形態において、共役アンチセンス化合物は、肝臓に蓄積する。ある
特定の実施形態において、共役アンチセンス化合物は、良好な耐容性を示す。そのような
特性は、共役アンチセンス化合物を、代謝性、心臓血管、および他の疾患、障害、または
状態に関与する標的RNAを含むが、これらに限定されない多くの標的RNAの阻害に特
に有用にする。したがって、肝臓組織を、そのような疾患、障害、または状態に関連した
RNAを標的にする共役アンチセンス化合物と接触させることによって、そのような疾患
、障害、または状態を治療する方法が本明細書に提供される。したがって、本発明の共役
アンチセンス化合物を用いて、様々な代謝性、心臓血管、および他の疾患、障害、または
状態のうちのいずれかを改善するための方法も提供される。
応物よりも強力である。いかなる理論または機構によって束縛されることを望むことなく
、ある特定の実施形態において、共役体は、共役アンチセンス化合物がより効率的に細胞
に入るか、またはより生産的に細胞に入ることを可能にし得る。例えば、ある特定の実施
形態において、共役アンチセンス化合物は、その非共役対応物と比較して、より高い標的
減少を示し得、共役アンチセンス化合物およびその非共役対応物は両方ともに、同一の濃
度で組織に存在する。例えば、ある特定の実施形態において、共役アンチセンス化合物は
、その非共役対応物と比較して、より高い標的減少を示し得、共役アンチセンス化合物お
よびその非共役対応物は両方ともに、同一の濃度で肝臓に存在する。
えば、Geary,R.S.,E.Wancewicz,et al.(2009).“
Effect of Dose and Plasma Concentration
on Liver Uptake and Pharmacologic Activi
ty of a 2’-Methoxyethyl Modified Chimeri
c Antisense Oligonucleotide Targeting PT
EN.”Biochem.Pharmacol.78(3):284-91、およびKo
ller,E.,T.M.Vincent,et al.(2011).“Mechan
isms of single-stranded phosphorothioate
modified antisense oligonucleotide accu
mulation in hepatocytes.”Nucleic Acids R
es.39(11):4795-807を参照のこと)。本明細書に記載の共役基は、生
産的な取り込みを改善し得る。
織に対する共役アンチセンス化合物の親和性を増加させることによって強度をさらに改善
し得る。ある特定の実施形態において、本明細書に記載の共役基は、1個以上の細胞表面
受容体による共役アンチセンス化合物の認識を増加させることによって強度をさらに改善
し得る。ある特定の実施形態において、本明細書に記載の共役基は、共役アンチセンス化
合物のエンドサイトーシスを促進することによって強度をさらに改善し得る。
った後に共役体がアンチセンスオリゴヌクレオチドから切断されることを可能にすること
によって強度をさらに改善し得る。したがって、ある特定の実施形態において、共役アン
チセンス化合物は、非共役アンチセンスオリゴヌクレオチドに必要な用量よりも低い用量
で投与され得る。
る。そのようなホスホロチオエート結合は、ヌクレアーゼに耐性を示すため、オリゴヌク
レオチドの安定性を改善する。さらに、ホスホロチオエート結合は、ある特定のタンパク
質にも結合し、肝臓におけるアンチセンスオリゴヌクレオチドの蓄積をもたらす。より少
ないホスホロチオエート結合を有するオリゴヌクレオチドは、肝臓にあまり蓄積せず、腎
臓により多く蓄積する(例えば、Geary,R.,“Pharmacokinetic
Properties of 2’-O-(2-Methoxyethyl)-Mod
ified Oligonucleotide Analogs in Rats,”J
ournal of Pharmacology and Experimental
Therapeutics-,Vol.296,No.3,890-897、およびPh
armacological Properties of 2’-O-Methoxy
ethyl Modified Oligonucleotides in Antis
ense a Drug Technology,Chapter 10,Crooke
,S.T.,ed.,2008を参照のこと)。ある特定の実施形態において、より少な
いホスホロチオエートヌクレオシド間結合およびより多くのホスホジエステルヌクレオシ
ド間結合を有するオリゴヌクレオチドは、肝臓にあまり蓄積せず、腎臓により多く蓄積す
る。肝臓における疾患を治療する際、これは、(1)薬物が所望の作用部位(肝臓)にあ
まり到達せず、(2)薬物が尿に流出し、(3)腎臓が比較的高い濃度の、腎臓に毒性を
もたらし得る薬物に曝露される、といったいくつかの理由のため、望ましくない。したが
って、肝臓疾患の場合、ホスホロチオエート結合は、重要な利益を提供する。
によって均一に連結されたオリゴヌクレオチドの投与は、1つ以上の炎症誘発反応を誘導
する(例えば、J Lab Clin Med.1996 Sep;128(3):32
9-38.“Amplification of antibody producti
on by phosphorothioate oligodeoxynucleot
ides”.Branda et al.を参照されたく、例えば、Toxicolog
ic Properties in Antisense a Drug Techno
logy,Chapter 12,pages 342-351,Crooke,S.T
.,ed.,2008も参照のこと)。ある特定の実施形態において、ヌクレオシド間結
合の多くがホスホロチオエートヌクレオシド間結合を含むオリゴヌクレオチドの投与は、
1つ以上の炎症誘発反応を誘導する。
格修飾、オフ標的作用、核酸塩基修飾、および/またはヌクレオシド修飾)に依存し得る
(例えば、Toxicologic Properties in Antisense
a Drug Technology,Chapter 12,pages 342-
351,Crooke,S.T.,ed.,2008を参照されたい)。ある特定の実施
形態において、炎症誘発作用の程度は、1つ以上の可変物を調整することによって軽減さ
れ得る。例えば、所与のオリゴヌクレオチドの炎症誘発作用の程度は、任意の数のホスホ
ロチオエートヌクレオシド間結合をホスホジエステルヌクレオシド間結合に置き換え、そ
れによりホスホロチオエートヌクレオシド間結合の総数を減少させることによって軽減さ
れ得る。
く、そうすることで、安定性を失うことも、肝臓から腎臓への分布を変化させることもな
く減少させることができる。例えば、ある特定の実施形態において、ホスホロチオエート
結合の数は、ホスホロチオエート結合をホスホジエステル結合に置き換えることによって
減少され得る。そのような実施形態において、より少ないホスホロチオエート結合および
より多くのホスホジエステル結合を有するアンチセンス化合物は、より低い炎症誘発反応
を誘導するか、全く誘導しない。より少ないホスホロチオエート結合およびより多くのホ
スホジエステル結合を有するアンチセンス化合物はより低い炎症誘発反応を誘導するが、
より少ないホスホロチオエート結合およびより多くのホスホジエステル結合を有するアン
チセンス化合物は、肝臓に蓄積せず、より多くのホスホロチオエート結合を有するアンチ
センス化合物と比較して、同一または同様の用量で有効性がより低くあり得る。したがっ
て、ある特定の実施形態において、複数のホスホジエステル結合および複数のホスホロチ
オエート結合を有するが、安定性および肝臓への良好な分布も有するアンチセンス化合物
を設計することが望ましい。
の低いホスホジエステルヌクレオシド間結合と置き換えられる場合でも、共役アンチセン
ス化合物は、非共役対応物と比較して、肝臓により多く蓄積し、腎臓にはあまり蓄積しな
い。ある特定の実施形態において、ホスホロチオエート結合のうちのいくつかが炎症誘発
性の低いホスホジエステルヌクレオシド間結合と置き換えられる場合でも、共役アンチセ
ンス化合物は、その非共役対応物と比較して、肝臓により多く蓄積し、その非共役対応物
ほど尿に排泄されない。ある特定の実施形態において、共役体を使用することで、より強
力でより良好な耐性のアンチセンス薬物を設計することが可能になる。実際には、ある特
定の実施形態において、共役アンチセンス化合物は、非共役対応物よりも大きい治療指数
を有する。これは、炎症誘発応答の危険性がより低く、かつ腎毒性の危険性もより低いた
め、共役アンチセンス化合物がより高い絶対用量で投与されることを可能にする。このよ
り高い用量は、排除(代謝)が同様であると見込まれるため、低頻度で投薬されることを
可能にする。さらに、上述のように、化合物がより強力であるため、治療活性を失うこと
なく次の投薬の前に濃度をより低くすることができ、さらに長い投薬間期間を可能にする
。
い。例えば、末端結合がエキソヌクレアーゼに対して脆弱であるため、ある特定の実施形
態において、これらの結合は、ホスホロチオエートまたは他の修飾結合である。2個のデ
オキシヌクレオシドを結合するヌクレオシド間結合がエンドヌクレアーゼに対して脆弱で
あるため、ある特定の実施形態において、これらのこれらの結合は、ホスホロチオエート
または他の修飾結合である。デオキシヌクレオシドが結合デオキシヌクレオシドの5’側
にある修飾ヌクレオシドとデオキシヌクレオシドとの間のヌクレオシド間結合がエンドヌ
クレアーゼに対して脆弱であるため、ある特定の実施形態において、これらのこれらの結
合は、ホスホロチオエートまたは他の修飾結合である。修飾ヌクレオシドが結合の5’側
にある、ある特定の種類の2個の修飾ヌクレオシド間、およびある特定の種類のデオキシ
ヌクレオシドと修飾ヌクレオシドとの間のヌクレオシド間結合がヌクレアーゼ消化に十分
に耐性を示すため、この結合は、ホスホジエステルであり得る。
チドは、16個未満のホスホロチオエート結合を含む。ある特定の実施形態において、共
役アンチセンス化合物のアンチセンスオリゴヌクレオチドは、15個未満のホスホロチオ
エート結合を含む。ある特定の実施形態において、共役アンチセンス化合物のアンチセン
スオリゴヌクレオチドは、14個未満のホスホロチオエート結合を含む。ある特定の実施
形態において、共役アンチセンス化合物のアンチセンスオリゴヌクレオチドは、13個未
満のホスホロチオエート結合を含む。ある特定の実施形態において、共役アンチセンス化
合物のアンチセンスオリゴヌクレオチドは、12個未満のホスホロチオエート結合を含む
。ある特定の実施形態において、共役アンチセンス化合物のアンチセンスオリゴヌクレオ
チドは、11個未満のホスホロチオエート結合を含む。ある特定の実施形態において、共
役アンチセンス化合物のアンチセンスオリゴヌクレオチドは、10個未満のホスホロチオ
エート結合を含む。ある特定の実施形態において、共役アンチセンス化合物のアンチセン
スオリゴヌクレオチドは、9個未満のホスホロチオエート結合を含む。ある特定の実施形
態において、共役アンチセンス化合物のアンチセンスオリゴヌクレオチドは、8個未満の
ホスホロチオエート結合を含む。
化合物は、そのような1個以上の共役基を欠く親アンチセンス化合物と比較して、増加し
た活性および/または強度および/または耐容性を有する。したがって、ある特定の実施
形態において、そのような共役基のオリゴヌクレオチドへの結合が望ましい。そのような
共役基は、オリゴヌクレオチドの5’末端および/または3’末端に結合され得る。ある
特定の事例において、5’末端での結合が合成的に望ましい。典型的には、オリゴヌクレ
オチドは、当技術分野で周知の技法を用いて、3’末端ヌクレオシドの固体支持体への結
合および3’から5’までのヌクレオシドの連続カップリングによって合成される。した
がって、共役基が3’末端で所望される場合、(1)共役基を3’末端ヌクレオシドに結
合させ、オリゴヌクレオチドのその後の調製のために、その共役ヌクレオシドを固体支持
体に結合させるか、または(2)合成後に、共役基を完全なオリゴヌクレオチドの3’末
端ヌクレオシドに結合させることができる。これらの手段のいずれもあまり効率的ではな
く、それ故に、これらはいずれも費用のかかる手段である。具体的には、共役ヌクレオシ
ドの固体支持体への結合は、本明細書の実施例において実証されるが、非効率的なプロセ
スである。ある特定の実施形態において、共役基を5’末端ヌクレオシドに結合させるこ
とは、3’末端での結合よりも合成的に容易である。特徴のはっきりした標準の反応を用
いて、非共役3’末端ヌクレオシドを固体支持体に結合させ、このオリゴヌクレオチドを
調製することができる。その後、最終カップリングステップで共役基を有する5’ヌクレ
オシドを結合させることのみを必要とする。ある特定の実施形態において、これは、3’
-共役オリゴヌクレオチドを調製するために典型的に行われる共役ヌクレオシドの固体支
持体への直接結合よりも効率的である。本明細書の実施例は、5’末端での結合を実証す
る。加えて、ある特定の共役基は、合成利点を有する。例えば、リン結合基を含むある特
定の共役基は、以前に報告された共役基(例えば、国際公開第WO/2012/0372
54号)を含む他の共役基よりも合成的に単純であり、かつ効率的に調製される。
うな実施形態において、本明細書に記載の1個以上の共役基を含むアンチセンス化合物は
、そのような1個以上の共役基を欠く親アンチセンス化合物と比較して、増加した活性お
よび/または強度および/または耐容性を有する。機構によって束縛されることなく、共
役基が、標的細胞または組織への分布、送達、および/または取り込みに役立つと考えら
れる。ある特定の実施形態において、標的細胞または組織に入ると、共役基のすべてまた
は一部が切断されて、活性オリゴヌクレオチドを放出することが望ましい。ある特定の実
施形態において、すべての共役基がオリゴヌクレオチドから切断される必要はない。例え
ば、実施例20において、共役オリゴヌクレオチドをマウスに投与し、各々がオリゴヌク
レオチドに残った共役基の異なる部分を含むいくつかの異なる化学種を検出した(表23
a)。この共役アンチセンス化合物は、良好な強度を示した(表23)。したがって、あ
る特定の実施形態において、共役基の複数の部分的切断のそのような代謝物プロファイル
は、活性/強度を妨げない。それにもかかわらず、ある特定の実施形態において、プロド
ラッグ(共役オリゴヌクレオチド)が単一の活性化合物を産出することが望ましい。ある
特定の事例において、活性化合物の複数の形態が見出される場合、各形態の相対量および
活性を決定する必要があり得る。ある特定の実施形態において、規制調査が要求される場
合(例えば、USFDAまたは対応物)、単一の(または主に単一の)活性種を有するこ
とが望ましい。ある特定のそのような実施形態において、そのような単一の活性種が共役
基の任意の部分を欠くアンチセンスオリゴヌクレオチドであることが望ましい。ある特定
の実施形態において、5’末端の共役基は、共役基の完全な代謝をもたらす可能性が高い
。機構によって束縛されることなく、5’末端(例えば、5’ヌクレアーゼ)の代謝に関
与する内因性酵素が3’対応物よりも活性/効率的であり得る。ある特定の実施形態にお
いて、これらの特定の共役基は、単一の活性種への代謝により従順である。ある特定の実
施形態において、ある特定の共役基は、オリゴヌクレオチドへの代謝により従順である。
D.アンチセンス
る。そのような実施形態において、オリゴマー化合物は、標的核酸に相補的である。ある
特定の実施形態において、標的核酸は、RNAである。ある特定の実施形態において、標
的核酸は、非コードRNAである。ある特定の実施形態において、標的核酸は、タンパク
質をコードする。ある特定の実施形態において、標的核酸は、mRNA、プレmRNA、
マイクロRNA、小非コードRNAを含む非コードRNA、およびプロモーター指向性R
NAから選択される。ある特定の実施形態において、オリゴマー化合物は、2個以上の標
的核酸に少なくとも部分的に相補的である。例えば、本発明のオリゴマー化合物は、マイ
クロRNA模倣物であり、これは、典型的には、複数の標的に結合する。
くとも70%相補的な核酸塩基配列を有する部分を含む。ある特定の実施形態において、
アンチセンス化合物は、標的核酸の核酸塩基配列に少なくとも80%相補的な核酸塩基配
列を有する部分を含む。ある特定の実施形態において、アンチセンス化合物は、標的核酸
の核酸塩基配列に少なくとも90%相補的な核酸塩基配列を有する部分を含む。ある特定
の実施形態において、アンチセンス化合物は、標的核酸の核酸塩基配列に少なくとも95
%相補的な核酸塩基配列を有する部分を含む。ある特定の実施形態において、アンチセン
ス化合物は、標的核酸の核酸塩基配列に少なくとも98%相補的な核酸塩基配列を有する
部分を含む。ある特定の実施形態において、アンチセンス化合物は、標的核酸の核酸塩基
配列に100%相補的な核酸塩基配列を有する部分を含む。ある特定の実施形態において
、アンチセンス化合物は、アンチセンス化合物の全長にわたって、標的核酸の核酸塩基配
列に少なくとも70%、80%、90%、95%、98%、または100%相補的である
。
任意の機構を含み、このハイブリダイゼーションは、生物学的効果をもたらす。ある特定
の実施形態において、そのようなハイブリダイゼーションは、例えば、標的核酸の、また
は標的核酸が別の方法で相互作用し得る核酸の翻訳、転写、またはポリアデニル化を伴う
細胞機構の同時に起こる阻害または刺激により、標的核酸の分解または占有のいずれかを
もたらす。
である。RNase Hは、RNA:DNA二本鎖のRNA鎖を切断する細胞性エンドヌ
クレアーゼである。「DNA様」の一本鎖アンチセンス化合物が哺乳類細胞におけるRN
ase H活性を誘発することが当技術分野で既知である。したがって、RNase H
の活性化は、RNA標的の切断をもたらし、それにより遺伝子発現のDNA様オリゴヌク
レオチド媒介阻害の効率を大幅に向上させる。
限定されない。そのようなRNAi機構には、siRNA、ssRNA、およびマイクロ
RNA機構が含まれるが、これらに限定されない。そのような機構は、マイクロRNA模
倣物および/または抗マイクロRNAの作成を含む。
リダイズさせるか、または模倣する機構も含まれるが、これに限定されない。そのような
非コードRNAには、1個以上の核酸の転写または翻訳をもたらすプロモーター指向性R
NAならびに短いRNAおよび長いRNAが含まれるが、これらに限定されない。
RNAi化合物である。ある特定の実施形態において、本明細書に記載の共役体を含むオ
リゴマーオリゴヌクレオチドは、ssRNA化合物である。ある特定の実施形態において
、本明細書に記載の共役体を含むオリゴヌクレオチドは、第2のオリゴマー化合物と対合
されて、siRNAを形成する。ある特定のそのような実施形態において、第2のオリゴ
マー化合物は、共役体も含む。ある特定の実施形態において、第2のオリゴマー化合物は
、任意の修飾または非修飾核酸である。ある特定の実施形態において、本明細書に記載の
共役体を含むオリゴヌクレオチドは、siRNA化合物におけるアンチセンス鎖である。
ある特定の実施形態において、本明細書に記載の共役体を含むオリゴヌクレオチドは、s
iRNA化合物におけるセンス鎖である。共役オリゴマー化合物が二本鎖siRnAであ
る実施形態において、共役体は、センス鎖に、アンチセンス鎖に、またはセンス鎖および
アンチセンス鎖の両方に存在し得る。
C.アポリポタンパク質(a)(apo(a))
標的とするある特定の実施形態において、標的核酸は、臨床的に関連するapo(a)標
的タンパク質をコードする。そのような実施形態において、標的核酸の調節は、臨床的利
益をもたらす。
通常、標的核酸内の少なくとも1個の標的領域、セグメント、または部位の決定を含む。
えば、ある特定のそのような実施形態において、標的領域は、3’UTR、5’UTR、
エキソン、イントロン、コーディング領域、翻訳開始領域、翻訳終結領域、または他の定
義された核酸領域もしくは標的セグメントを包含し得る。
れる標的領域の少なくとも約8核酸塩基部分である。標的セグメントは、標的セグメント
のうちの1個の5’末端から少なくとも8個の連続した核酸塩基を含むDNAまたはRN
A配列を含み得る(残りの核酸塩基は、標的セグメントの5’末端のすぐ上流で開始し、
DNAまたはRNAが約8~約30個の核酸塩基を含むまで続く連続した一続きの同一の
DNAまたはRNAである)。標的セグメントは、標的セグメントのうちの1個の3’末
端から少なくとも8個の連続した核酸塩基を含むDNAまたはRNA配列によっても表さ
れる(残りの核酸塩基は、標的セグメントの3’末端のすぐ下流で開始し、DNAまたは
RNAが約8~約30個の核酸塩基を含むまで続く連続した一続きの同一のDNAまたは
RNAである)。標的セグメントは、標的セグメントの配列の内部部分から少なくとも8
個の連続した核酸塩基を含むDNAまたはRNA配列によっても表され、共役アンチセン
ス化合物が約8~約30個の核酸塩基を含むまでいずれかの方向または両方向に延在し得
る。
本明細書に記載されるように修飾され得る。ある特定の実施形態において、アンチセンス
化合物は、本明細書に記載の修飾糖部分、非修飾糖部分、または修飾および非修飾糖部分
の混合物を有し得る。ある特定の実施形態において、アンチセンス化合物は、本明細書に
記載の修飾ヌクレオシド間結合、非修飾ヌクレオシド間結合、または修飾および非修飾ヌ
クレオシド間結合の混合物を有し得る。ある特定の実施形態において、アンチセンス化合
物は、本明細書に記載の修飾核酸塩基、非修飾核酸塩基、または修飾および非修飾核酸塩
基の混合物を有し得る。ある特定の実施形態において、アンチセンス化合物は、本明細書
に記載のモチーフを有し得る。
本明細書に記載されるように共役され得る。
質B(apoB)タンパク質に連結されて、リポタンパク質(a)(Lp(a))粒子を
形成する。このapo(a)タンパク質は、特にクリングルIV2型反復ドメイン内のプ
ラスミノーゲンと高度の相同性を共有する。apo(a)のクリングル反復ドメインは、
その血栓形成促進特性および抗線維素溶解特性に関与し得、アテローム性動脈硬化進行を
高める可能性があると考えられる。Apo(a)は、IL-6によって転写調整され、I
L-6阻害剤(トシリズマブ)で治療されたリウマチ性関節炎患者の研究において、治療
から3ヶ月後に血漿レベルが30%低下した。Apo(a)は、酸化リン脂質に優先的に
結合し、血管炎症を増強することが示されている。さらに、研究は、Lp(a)粒子がま
た、内皮透過性を刺激し、プラスミノーゲン活性化因子阻害剤1型発現を誘導し、マクロ
ファージインターロイキン-8分泌を活性化し得ることを示唆する。重要なことに、最近
の遺伝的関連研究は、Lp(a)が、心筋梗塞、脳卒中、末梢血管疾患、および腹部大動
脈瘤の独立した危険因子であったことを明らかにした。さらに、早発性冠動脈疾患(PR
OCARDIS)研究において、Clarke et al.は、冠状動脈性心臓病と血
漿中のLp(a)濃度との間の強固な独立した関連性を説明している。さらに、Solf
rizzi et al.は、血清中のLp(a)の増加が、アルツハイマー病(AD)
の危険性の増加に関係し得ることを示唆した。apo(a)を標的とするアンチセンス化
合物は、参照によりその全体が本明細書に組み込まれる、国際公開第WO2005/00
0201号および米国特許第US2010-0331390号に以前に開示されている。
Apo(a)を標的とするアンチセンスオリゴヌクレオチド、ISIS-APOARxを
第I相臨床試験において評価して、その安全性プロファイルを試験した。
Apo(a)核酸を標的にするある特定の共役アンチセンス化合物
)受入番号NM_005577.2(配列番号1として本明細書に組み込まれる);ヌク
レオチド3230000~3380000から切断されたGENBANK受入番号NT_
007422.12(配列番号2として本明細書に組み込まれる);ヌクレオチド651
20000~65258000から切断されたGENBANK受入番号NT_02574
1.15(配列番号3として本明細書に指定される);およびGENBANK受入番号N
M_005577.1(配列番号4として本明細書に組み込まれる)の配列を有するAp
o(a)核酸を標的にする。ある特定のそのような実施形態において、共役アンチセンス
化合物は、配列番号1~4のうちのいずれかの核酸塩基配列に少なくとも90%、少なく
とも95%、または100%相補的である。
にする共役アンチセンス化合物は、配列番号12~130、133、134のうちのいず
れかの核酸塩基配列から選択される少なくとも8個の連続した核酸塩基配列を含む。ある
特定の実施形態において、配列番号1~4のうちのいずれかを標的にする共役アンチセン
ス化合物は、配列番号12~130、133、134のうちのいずれかの核酸塩基配列か
ら選択される核酸塩基配列を含む。
Apo(a)治療指標
ンス化合物を用いて対象におけるapo(a)の発現を調節するための方法を提供する。
ある特定の実施形態において、apo(a)の発現が低下する。
を含む、対象を治療する方法が提供される。ある特定の実施形態において、本発明は、医
薬組成物中のapo(a)核酸を標的にする共役アンチセンス化合物を用いて対象を治療
するための方法を提供する。ある特定の実施形態において、個体は、apo(a)関連疾
患を有する。ある特定の実施形態において、個体は、Lp(a)関連疾患を有する。ある
特定の実施形態において、個体は、炎症性、心臓血管、および/もしくは代謝性疾患、障
害、または状態を有する。
患、障害、または状態を有する。
リグリセリド血症、大動脈弁狭窄症、動脈瘤(例えば、腹部大動脈瘤)、アンギナ、不整
脈、アテローム性動脈硬化症、脳血管疾患、冠動脈疾患、冠状動脈性心臓病、脂質異常症
、高コレステロール血症、脂質異常症、高血圧症、高トリグリセリド血症、心筋梗塞、末
梢血管疾患(例えば、末梢動脈疾患)、発作等が含まれるが、これらに限定されない。
心臓血管疾患、障害、または状態の生理学的マーカーまたは表現型を調節する。例えば、
この化合物を動物に投与することにより、未処理の動物と比較して、これらの動物におけ
るLDLおよびコレステロールレベルを低下させることができる。ある特定の実施形態に
おいて、生理学的マーカーまたは表現型の調節は、化合物によるapo(a)の阻害に関
連し得る。
、定量化可能であり得る。例えば、LDLまたはコレステロールレベルは、例えば、標準
の脂質試験によって測定および定量化され得る。そのようなマーカーについて、ある特定
の実施形態において、マーカーは、約5、10、15、20、25、30、35、40、
45、50、55、60、65、70、75、80、85、90、95、もしくは99%
、またはこれらの値のうちのいずれか2つによって定義される範囲に減少し得る。
必要とする対象における心臓血管疾患、障害、または状態に関連した症状を予防、治療、
または改善するための方法も提供される。ある特定の実施形態において、心臓血管疾患、
障害、または状態に関連した症状の発症率を低下させるための方法が提供される。ある特
定の実施形態において、心臓血管疾患、障害、または状態に関連した症状の重症度を低下
させるための方法が提供される。そのような実施形態において、方法は、治療的に有効な
量のapo(a)核酸を標的にする化合物をそれを必要とする個体に投与することを含む
。
、障害、または状態に関連した当業者に既知の任意の症状は、本明細書に記載の化合物お
よび方法を用いて予防されるか、治療されるか、改善されるか、またはさもなければ調節
され得る。ある特定の実施形態において、症状は、アンギナ、胸痛、息切れ、動悸、衰弱
、目まい、嘔気、発汗、頻脈、徐脈、不整脈、心房細動、下肢の腫れ、チアノーゼ、疲労
、失神、顔のしびれ、肢のしびれ、跛行または筋けいれん、腹部腫脹、または発熱のうち
のいずれかであり得るが、これらに限定されない。
病、糖尿病(I型およびII型)、肥満、インスリン抵抗性、代謝症候群、および糖尿病
性脂質異常症が含まれるが、これらに限定されない。
代謝性疾患、障害、または状態の生理学的マーカーまたは表現型を調節する。例えば、こ
の化合物を動物に投与することにより、未処理の動物と比較して、これらの動物における
グルコースおよびインスリン耐性レベルを低下させることができる。ある特定の実施形態
において、生理学的マーカーまたは表現型の調節は、化合物によるapo(a)の阻害に
関連し得る。
定量化可能であり得る。例えば、グルコースレベルまたはインスリン耐性は、当技術分野
で既知の標準の試験によって測定および定量化され得る。そのようなマーカーについて、
ある特定の実施形態において、マーカーは、約5、10、15、20、25、30、35
、40、45、50、55、60、65、70、75、80、85、90、95、もしく
は99%、またはこれらの値のいずれか2つによって定義される範囲に減少し得る。別の
例において、インスリン感受性は、当技術分野で既知の標準の試験によって測定および定
量化され得る。そのようなマーカーについて、ある特定の実施形態において、マーカーは
、約5、10、15、20、25、30、35、40、45、50、55、60、65、
70、75、80、85、90、95、もしくは99%、またはこれらの値のいずれか2
つによって定義される範囲に増加し得る。
要とする対象における代謝性疾患、障害、または状態に関連した症状を予防、治療、また
は改善するための方法も提供される。ある特定の実施形態において、代謝性疾患、障害、
または状態に関連した症状の発症率を低下させるための方法が提供される。ある特定の実
施形態において、代謝性疾患、障害、または状態に関連した症状の重症度を低下させるた
めの方法が提供される。そのような実施形態において、方法は、治療的に有効な量のap
o(a)核酸を標的にする化合物をそれを必要とする個体に投与することを含む。
害、または状態に関連した当業者に既知の任意の症状は、本明細書に記載の化合物および
方法を用いて予防されるか、治療されるか、改善されるか、またはさもなければ調節され
得る。ある特定の実施形態において、症状は、過剰な尿産生(多尿症)、過剰な口渇およ
び水分摂取の増加(多渇症)、視界のぼやけ、体重減少、および嗜眠のうちのいずれかで
あり得るが、これらに限定されない。
大動脈弁狭窄症、冠状動脈疾患(CAD)、アルツハイマー病、および血栓塞栓性疾患、
障害、または状態が含まれるが、これらに限定されない。ある特定の血栓塞栓性疾患、障
害、または状態には、発作、血栓症、心筋梗塞、および末梢血管疾患が含まれるが、これ
らに限定されない。
炎症性疾患、障害、または状態の生理学的マーカーまたは表現型を調節する。例えば、こ
の化合物を動物に投与することにより、未処置動物と比較して、これらの動物における炎
症性サイトカインまたは他の炎症マーカーのレベルを低下させることができる。ある特定
の実施形態において、生理学的マーカーまたは表現型の調節は、化合物によるapo(a
)の阻害に関連し得る。
定量化可能であり得る。例えば、サイトカインレベルは、当技術分野で既知の標準の試験
によって測定および定量化され得る。そのようなマーカーについて、ある特定の実施形態
において、マーカーは、少なくとも約5%、10%、15%、20%、25%、30%、
35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、
85%、90%、95%、もしくは99%、またはこれらの値のいずれか2つによって定
義される範囲に減少し得る。
要とする対象における炎症性疾患、障害、または状態に関連した症状を予防、治療、また
は改善するための方法も提供される。ある特定の実施形態において、炎症性疾患、障害、
または状態に関連した症状の発症率を低下させるための方法が提供される。ある特定の実
施形態において、炎症性疾患、障害、または状態に関連した症状の重症度を低下させるた
めの方法が提供される。そのような実施形態において、方法は、治療的に有効な量のap
o(a)核酸を標的にする化合物をそれを必要とする個体に投与することを含む。
成物を投与することを含む、apo(a)関連疾患、障害、または状態を有する個体を治
療する方法が提供される。ある特定の実施形態において、個体は、上昇したapo(a)
レベルを有する。ある特定の実施形態において、本明細書に記載の治療的に有効な量の1
つ以上の医薬組成物を投与することを含む、Lp(a)関連疾患、障害、または状態を有
する個体を治療する方法が提供される。ある特定の実施形態において、個体は、上昇した
Lp(a)レベルを有する。ある特定の実施形態において、個体は、炎症性、心臓血管、
および/もしくは代謝性疾患、障害、または状態を有する。ある特定の実施形態において
、治療的に有効な量のapo(a)核酸を標的にするアンチセンス化合物の投与は、ap
o(a)またはLp(a)レベルを監視することを伴う。ある特定の実施形態において、
治療的に有効な量のapo(a)核酸を標的にするアンチセンス化合物投与は、炎症性、
心臓血管、および/もしくは代謝性疾患、またはapo(a)の発現に関連した他の疾患
過程のマーカーを監視して、アンチセンス化合物への個体の応答を決定することを伴う。
医師がapo(a)を標的とするアンチセンス化合物の投与への個体の応答を用いること
により、化合物での治療的介入の量および期間を決定することができる。
与は、少なくとも約15%、20%、25%、30%、35%、40%、45%、50%
、55%、60%、65%、70%、75%、80%、85%、90%、95%、もしく
は99%、またはこれらの値のいずれか2つによって定義される範囲でapo(a)発現
の減少をもたらす。ある特定の実施形態において、apo(a)発現は、少なくとも10
0mg/dL以下、90mg/dL以下、80mg/dL以下、70mg/dL以下、6
0mg/dL以下、50mg/dL以下、40mg/dL以下、30mg/dL以下、2
0mg/dL以下、または10mg/dL以下に減少する。
与は、少なくとも約15%、20%、25%、30%、35%、40%、45%、50%
、55%、60%、65%、70%、75%、80%、85%、90%、95%、もしく
は99%、またはこれらの値のいずれか2つによって定義される範囲のLp(a)発現の
減少をもたらす。ある特定の実施形態において、Lp(a)発現は、少なくとも200m
g/dL以下、190mg/dL以下、180mg/dL以下、175mg/dL以下、
170mg/dL以下、160mg/dL以下、150mg/dL以下、140mg/d
L以下、130mg/dL以下、120mg/dL以下、110mg/dL以下、100
mg/dL以下、90mg/dL以下、80mg/dL以下、70mg/dL以下、60
mg/dL以下、55mg/dL以下、50mg/dL以下、45mg/dL以下、40
mg/dL以下、35mg/dL以下、30mg/dL以下、25mg/dL以下、20
mg/dL以下、15mg/dL以下、または10mg/dL以下に減少する。
ンス化合物を用いて薬剤を調製するための方法を提供する。ある特定の実施形態において
、apo(a)を標的にする共役アンチセンス化合物を含む医薬組成物を用いて、炎症性
、心臓血管、および/もしくは代謝性疾患、障害、または状態に罹患するか、またはこれ
らにかかりやすい患者を治療するための薬剤を調製する。
Apo(a)治療集団
高い(Lippi et al.,Clinica Chimica Acta,201
1,412:797-801;Solfrizz et al.).高Lp(a)レベル
を有する多くの対象において、現在の治療は、Lp(a)レベルを安全なレベルに低下さ
せることができない。Apo(a)は、Lp(a)の形成に重要な役割を果たし、それ故
にapo(a)を減少させることが、Lp(a)を減少させ、Lp(a)に関連した疾患
を予防、治療、または改善する。
昇したapo(a)レベルおよび/またはLp(a)レベルを有するヒト動物に適応され
る。ある特定の実施形態において、ヒトは、10mg/dL以上、20mg/dL以上、
30mg/dL以上、40mg/dL以上、50mg/dL以上、60mg/dL以上、
70mg/dL以上、80mg/dL以上、90mg/dL以上、または100mg/d
L以上のapo(a)レベルを有する。ある特定の実施形態において、ヒトは、10mg
/dL以上、15mg/dL以上、20mg/dL以上、25mg/dL以上、30mg
/dL以上、35mg/dL以上、40mg/dL以上、50mg/dL以上、60mg
/dL以上、70mg/dL以上、80mg/dL以上、90mg/dL以上、100m
g/dL以上、110mg/dL以上、120mg/dL以上、130mg/dL以上、
140mg/dL以上、150mg/dL以上、160mg/dL以上、170mg/d
L以上、175mg/dL以上、180mg/dL以上、190mg/dL以上、200
mg/dL以上のLp(a)レベルを有する。
D.ある特定の医薬組成物
成物を提供する。ある特定の実施形態において、そのような医薬組成物は、好適な薬剤的
に許容される希釈剤または担体を含む。ある特定の実施形態において、医薬組成物は、滅
菌生理食塩溶液および1個以上のアンチセンス化合物を含む。ある特定の実施形態におい
て、そのような医薬組成物は、滅菌生理食塩溶液および1個以上のアンチセンス化合物か
らなる。ある特定の実施形態において、滅菌生理食塩水は、医薬品グレードの生理食塩水
である。ある特定の実施形態において、医薬組成物は、1個以上のアンチセンス化合物お
よび滅菌水を含む。ある特定の実施形態において、医薬組成物は、1個以上のアンチセン
ス化合物および滅菌水からなる。ある特定の実施形態において、滅菌生理食塩水は、医薬
品グレードの水である。ある特定の実施形態において、医薬組成物は、1個以上のアンチ
センス化合物およびリン酸緩衝生理食塩水(PBS)を含む。ある特定の実施形態におい
て、医薬組成物は、1個以上のアンチセンス化合物および滅菌リン酸緩衝生理食塩水(P
BS)からなる。ある特定の実施形態において、滅菌生理食塩水は、医薬品グレードのP
BSである。
るために薬剤的に許容される活性および/または不活性物質と混合され得る。組成物およ
び医薬組成物を製剤化するための方法は、投与経路、疾患の程度、または投与される用量
を含むが、これらに限定されないいくつかの基準に依存する。
たはそのようなエステルの塩を包含する。ある特定の実施形態において、アンチセンス化
合物を含む医薬組成物は、ヒトを含む動物への投与時に、生物学的に活性な代謝物または
その残渣を(直接的または間接的に)提供することができる1個以上のオリゴヌクレオチ
ドを含む。したがって、例えば、本開示は、アンチセンス化合物の薬剤的に許容される塩
、プロドラッグ、そのようなプロドラッグの薬剤的に許容される塩、および他の生物学的
等価物を対象とする。好適な薬剤的に許容される塩には、ナトリウム塩およびカリウム塩
が含まれるが、これらに限定されない。
ゴヌクレオチドを形成するオリゴヌクレオチドの一方または両方の末端におけるさらなる
ヌクレオシドの組み込みを含み得る。
法において、核酸は、カチオン性脂質と中性脂質の混合物から作られた事前形成されたリ
ポソームまたはリポプレックスに導入される。ある特定の方法において、モノまたはポリ
カチオン性脂質とのDNA複合体は、中性脂質の存在なしで形成される。ある特定の実施
形態において、脂質部分は、特定の細胞または組織への薬剤の分布を増加させるように選
択される。ある特定の実施形態において、脂質部分は、脂肪組織への薬剤の分布を増加さ
せるように選択される。ある特定の実施形態において、脂質部分は、筋肉組織への薬剤の
分布を増加させるように選択される。
リゴヌクレオチドおよび1個以上の賦形剤を含む。ある特定のそのような実施形態におい
て、賦形剤は、水、食塩水、アルコール、ポリエチレングリコール、ゼラチン、ラクトー
ス、アミラーゼ、ステアリン酸マグネシウム、滑石、ケイ酸、粘性パラフィン、ヒドロキ
シメチルセルロース、およびポリビニルピロリドンから選択される。
達系の例として、リポソームおよびエマルジョンが挙げられるが、これらに限定されない
。ある特定の送達系は、疎水性化合物を含む医薬組成物を含むある特定の医薬組成物の調
製に有用である。ある特定の実施形態において、ジメチルスルホキシド等のある特定の有
機溶媒が用いられる。
細胞型に本開示の1個以上の薬剤を送達するように設計された1個以上の組織特異的送達
分子を含む。例えば、ある特定の実施形態において、医薬組成物は、組織特異的抗体でコ
ーティングされたリポソームを含む。
ある特定のそのような共溶媒系は、例えば、ベンジルアルコール、非極性界面活性剤、水
混和性有機ポリマー、および水相を含む。ある特定の実施形態において、そのような共溶
媒系は、疎水性化合物に用いられる。そのような共溶媒系の非限定的な例にはVPD共溶
媒系があり、これは、3w/v%のベンジルアルコール、8w/v%の非極性界面活性剤
ポリソルベート80(商標)、および65w/v%のポリエチレングリコール300を含
む無水エタノールの溶液である。そのような共溶媒系の割合は、それらの溶解度および毒
性特性を著しく変化させることなく大幅に変化し得る。さらに、共溶媒成分の同一性は変
化し得、例えば、他の界面活性剤をポリソルベート80(商標)の代わりに使用してもよ
く、ポリエチレングリコールの画分サイズは変化し得、他の生体適合性ポリマーは、ポリ
エチレングリコール、例えば、ポリビニルピロリドンに取って代わり得、他の糖または多
糖は、デキストロースと置き換わり得る。
調製される。ある特定の実施形態において、医薬組成物は、口腔投与のために調製される
。
、筋肉内等)のために調製される。ある特定のそのような実施形態において、医薬組成物
は、担体を含み、水溶液、例えば、水または生理学的に相溶性の緩衝液、例えば、ハンク
ス溶液、リンガー溶液、または生理学的生理食塩水緩衝液等の中で製剤化される。ある特
定の実施形態において、他の成分(例えば、溶解に役立つか、または防腐剤の役目を果た
す成分)が含まれる。ある特定の実施形態において、注入可能な懸濁液は、適切な液体担
体、懸濁化剤等を用いて調製される。注入用のある特定の医薬組成物は、単位剤形で、例
えば、アンプル単位で提供されるか、または多用量容器内に提供される。注入用のある特
定の医薬組成物は、油性または水性ビヒクル中の懸濁液、溶液、またはエマルジョンであ
り、懸濁化剤、安定化剤、および/または分散剤等の製剤化剤を含有し得る。注入用の医
薬組成物における使用に好適なある特定の溶媒には、親油性溶媒および脂肪油、例えば、
ゴマ油、合成脂肪酸エステル、例えば、オレイン酸エチルまたはトリグリセリド、および
リポソームが含まれるが、これらに限定されない。水性注入懸濁液は、カルボキシルメチ
ルセルロースナトリウム、ソルビトール、またはデキストラン等の懸濁液の粘度を増加さ
せる物質を含有し得る。任意に、そのような懸濁液は、好適な安定剤または高度に濃縮さ
れた溶液の調製を可能にする薬剤の溶解度を増加させる薬剤も含有し得る。
定のそのような実施形態において、浸透する障壁に適切な浸透剤が製剤化において用いら
れる。そのような浸透剤は、一般に当技術分野で既知である。
量のオリゴヌクレオチドを含む。ある特定の実施形態において、治療的に効果的な量は、
疾患の症状を防止するか、疾患の症状を軽減するか、もしくは疾患の症状を改善するか、
または治療される対象の生存期間を延長させるのに十分な量である。治療的に効果的な量
の決定は、十分に当業者の能力の範囲内である。
ドは、プロドラッグとして製剤化される。ある特定の実施形態において、生体内投与時に
、プロドラッグは、オリゴヌクレオチドの生物学的に、薬剤的に、または治療的により活
性な形態に化学変換される。ある特定の実施形態において、プロドラッグは、対応する活
性形態よりも投与し易いため、有用である。例えば、ある特定の事例において、プロドラ
ッグは、対応する活性形態よりも生物学的に利用可能である(例えば、経口投与によって
)。ある特定の事例において、プロドラッグは、対応する活性形態と比較して、改善され
た溶解度を有し得る。ある特定の実施形態において、プロドラッグは、対応する活性形態
よりも水溶性が低い。ある特定の事例において、そのようなプロドラッグは、水溶解度が
移動性に害を及ぼす細胞膜にわたって優れた透過性を有する。ある特定の実施形態におい
て、プロドラッグは、エステルである。ある特定のそのような実施形態において、エステ
ルは、投与時にカルボン酸に代謝的に加水分解される。ある特定の事例において、カルボ
ン酸含有化合物は、対応する活性形態である。ある特定の実施形態において、プロドラッ
グは、酸基に結合される短ペプチド(ポリアミノ酸)を含む。ある特定のそのような実施
形態において、ペプチドは、投与時に切断されて、対応する活性形態を形成する。
る、組成物および方法を提供する。ある特定の実施形態において、細胞は、動物内に存在
する。ある特定の実施形態において、動物は、哺乳動物である。ある特定の実施形態にお
いて、動物は、齧歯動物である。ある特定の実施形態において、動物は、霊長類である。
ある特定の実施形態において、動物は、非ヒト霊長類である。ある特定の実施形態におい
て、動物は、ヒトである。
物を動物に投与する方法を提供する。好適な投与経路には、経口投与、直腸投与、経粘膜
投与、腸内投与、経腸投与、局所投与、坐薬投与、吸入による投与、髄腔内投与、脳室内
投与、腹腔内投与、鼻腔内投与、眼内投与、腫瘍内投与、ならびに非経口(例えば、静脈
内、筋肉内、髄内、および皮下)投与が含まれるが、これらに限定されない。ある特定の
実施形態において、薬学的髄腔内薬が投与されて、全身曝露ではなく局所曝露を達成する
。例えば、医薬組成物は、所望の罹患部に(例えば、肝臓に)直接注入され得る。
参照による非限定的な開示および組み込み
て具体的に記載されているが、以下の実施例は、本明細書に記載の化合物を例証する役目
のみを果たし、それを限定するようには意図されていない。本出願に列挙される参考文献
、GenBank受入番号等の各々は、参照によりその全体が本明細書に組み込まれる。
れか一方と特定するが、実際には、それらの配列は、化学修飾の任意の組み合わせで修飾
され得る。当業者であれば、修飾オリゴヌクレオチドを説明するための「RNA」または
「DNA」のそのような指定が、ある特定の事例において、任意であることを容易に認識
する。例えば、2’-OH糖部分およびチミン塩基を含むヌクレオシドを含むオリゴヌク
レオチドは、修飾糖を有するDNA(DNAの天然2’-Hの場合、2’-OH)または
修飾塩基を有するRNA(RNAの天然ウラシルの場合、チミン(メチル化ウラシル))
と記載され得る。
酸配列は、修飾核酸塩基を有するそのような核酸を含むが、これらに限定されない天然ま
たは修飾RNAおよび/またはDNAの任意の組み合わせを含有する核酸を包含するよう
意図される。さらなる例であって制限するものではなく、核酸塩基配列「ATCGATC
G」を有するオリゴヌクレオチドは、修飾または非修飾にかかわらず、RNA塩基、例え
ば、配列「AUCGAUCG」を有するオリゴヌクレオチド、ならびに「AUCGATC
G」等のいくつかのDNA塩基およびいくつかのRNA塩基を有するオリゴヌクレオチド
、ならびに「ATmeCGAUCG」等の他の修飾塩基を有するオリゴヌクレオチドを含
むそのような化合物を含むが、これらに限定されないそのような核酸塩基配列を有する任
意のオリゴヌクレオチドを包含し、式中、meCは、5位にメチル基を含むシトシン塩基
を示す。
はない。さらに、特定の実施形態が提供される場合、本発明者らは、それらの特定の実施
形態の一般的適用を企図している。例えば、特定のモチーフを有するオリゴヌクレオチド
の開示は、そのモチーフまたは同様のモチーフを有するさらなるオリゴヌクレオチドへの
合理的な支持を提供する。同様に、例えば、特定の高親和性修飾が特定の位置に出現する
場合、同一の位置での他の高親和性修飾は、別途示されない限り、好適であると見なされ
る。
実施例1:ホスホラミダイト(化合物1、1a、および2)の調製のための一般的方法
製した(Seth et al.,Bioorg.Med.Chem.,2011,21
(4),1122-1125,J.Org.Chem.,2010,75(5),156
9-1581,Nucleic Acids Symposium Series,20
08,52(1),553-554)、ならびに公開されたPCT国際出願(国際公開第
WO2011/115818号、同第WO2010/077578号、同第WO2010
/036698号、同第WO2009/143369号、同第WO2009/00647
8、および同第WO2007/090071号)、ならびに米国特許第7,569,68
6号も参照のこと)。
実施例2:化合物7の調製
-β-Dガラクトピラノースまたはガラクトサミンペンタアセテート)は、市販のもので
ある。化合物5を公開された手順(Weber et al.,J.Med.Chem.
,1991,34,2692)に従って調製した。
実施例3:化合物11の調製
ある。化合物17を、Rensen et al.(J.Med.Chem.,2004
,47,5798-5808)によって報告された同様の手順を用いて調製した。
実施例5:化合物23の調製
りに調製した。3’末端にGalNAc3-1を含むオリゴマー化合物29を、自動DN
A/RNA合成における標準の手順を用いて調製した(Dupouy et al.,A
ngew.Chem.Int.Ed.,2006,45,3623-3627を参照のこ
と)。ホスホラミダイト構築ブロック(化合物1および1a)を実施例1に例証される手
順通りに調製した。他のホスホラミダイト構築ブロックを用いて既定の配列および組成を
有するオリゴマー化合物を調製することができるため、例証されるホスホラミダイトは、
代表的なものであり、限定するようには意図されていない。固体支持体に添加されるホス
ホラミダイトの順序および量を調整して、本明細書に記載のギャップトオリゴマー化合物
を調製することができる。そのようなギャップトオリゴマー化合物は、任意の所与の標的
によって指示される既定の組成および塩基配列を有し得る。
実施例10:5’末端にGalNAc3-1を含む共役ASO(化合物34)の一般的調
製
1クラスターを含むオリゴマー化合物34を、自動DNA/RNA合成における標準の手
順を用いて調製する(Dupouy et al.,Angew.Chem.Int.E
d.,2006,45,3623-3627を参照のこと)。ホスホラミダイト構築ブロ
ック(化合物1および1a)を実施例1に例証される手順通りに調製した。他のホスホラ
ミダイト構築ブロックを用いて既定の配列および組成を有するオリゴマー化合物を調製す
ることができるため、例証されるホスホラミダイトは、代表的なものであり、限定するよ
うには意図されていない。固体支持体に添加されるホスホラミダイトの順序および量を調
整して、本明細書に記載のギャップトオリゴマー化合物を調製することができる。そのよ
うなギャップトオリゴマー化合物は、任意の所与の標的によって指示される既定の組成お
よび塩基配列を有し得る。
実施例11:化合物39の調製
た。化合物35をRouchaud et al.,Eur.J.Org.Chem.,
2011,12,2346-2353に公開された同様の手順を用いて調製する。
実施例12:化合物40の調製
実施例19:固相技法による3’位にGalNAc3-1を含む共役ASOの調製のため
の一般的方法(ISIS 647535、647536、および651900の調製)
業的供給源から購入する。標準のホスホラミダイト構築ブロックおよび固体支持体を、例
えば、T、A、G、およびmC残基を含む、ヌクレオシド残基の組み込みのために用いる
。無水アセトニトリル中のホスホラミダイトの0.1M溶液をβ-D-2’-デオキシリ
ボヌクレオシドおよび2’-MOEに用いた。
ol/g、Guzaev et al.,2003)におけるホスホラミダイトカップリ
ング方法を用いて、ASO合成を、ABI 394合成装置(1~2μmolの規模)ま
たはGE Healthcare Bioscience AeKTAオリゴパイロット
合成装置(40~200μmolの規模)上で実行した。このカップリングステップにつ
いて、固体支持体の充填に対して4倍超過したホスホラミダイトを送達し、ホスホラミダ
イト縮合を10分間行った。すべての他のステップは、製造業者から提供された標準のプ
ロトコルに従った。トルエン中の6%ジクロロ酢酸の溶液を用いて、ヌクレオチドの5’
-ヒドロキシル基からジメトキシトリチル(DMT)基を除去した。カップリングステッ
プ中、無水CH3CN中の4,5-ジシアノイミダゾール(0.7M)を活性剤として用
いた。ホスホロチオエート結合を、3分間の接触時間で、1:1のピリジン/CH3CN
のキサンタンヒドリドの0.1M溶液との硫化によって導入した。6%の水を含有するC
H3CN中の20%のtert-ブチルヒドロペルオキシドの溶液を酸化剤として用いて
、12分間の接触時間で、ホスホジエステルヌクレオシド間結合を得た。
で、トリエチルアミンとアセトニトリルの1:1(v/v)の混合物を用いて脱保護した
。固体支持体結合ASOをアンモニア水(28~30重量%)中に懸濁し、55℃で6時
間加熱した。
ラム上での高圧液体クロマトグラフィーによって精製した(GE Healthcare
Bioscience、Source 30Q、30μm、2.54×8cm、A=3
0%CH3CN水溶液中100mM酢酸アンモニウム、B=A中1.5M NaBr、6
0分後0~40%のB、流量14mL/分-1、λ=260nm)。残渣を逆相カラム上
でのHPLCにより脱塩して、固体支持体への初期充填に基づいて15~30%の単離収
率で所望のASOを得た。ASOを、Agilent 1100 MSDシステムを用い
たイオン対HPLCカップリングMS分析によって特徴付けた。
チセンスオリゴヌクレオチドを合成した。
物を調製した。以下の表17に要約されるように、ApoC IIIを標的とする3個の
アンチセンス化合物の各々は、同一の核酸塩基配列を有し、ISIS 304801は、
すべてのホスホロチオエート結合を有する5-10-5MOEギャップマーであり、IS
IS 647535は、GalNAc3-1をその3’末端で共役させたことを除いて、
ISIS 304801と同一であり、ISIS 647536は、その化合物のある特
定のヌクレオシド間結合がホスホジエステル結合であることを除いて、ISIS 647
535と同一であった。表17にさらに要約されるように、SRB-1を標的とする2個
の別個のアンチセンス化合物を合成した。ISIS 440762は、すべてのホスホロ
チオエートヌクレオシド間結合を有する2-10-2 cEtギャップマーであり、IS
IS 651900は、その3’末端にGalNAc3-1を含めたことを除いて、IS
IS 440762と同一であった。
-デオキシリボヌクレオシドを示し、「k」は、6’-(S)-CH3二環式ヌクレオシ
ド(例えば、cEt)を示し、「s」は、ホスホロチオエートヌクレオシド間結合(PS
)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」は
、-O-P(=O)(OH)-を示す。上付き文字「m」は、5-メチルシトシンを示す
。「GalNAc3-1」は、先に実施例9に示された構造を有する共役基を示す。Ga
lNAc3-1が、ASOを共役体の残りに連結させる切断可能なアデノシンを含み、「
GalNAc3-1a」と指定されることに留意されたい。上述の表でこの命名法を用い
て、共役体の一部であるアデノシンを含む全核酸塩基配列を示す。したがって、上述の表
において、「Ado」を省略して「GalNAc3-1」で終了する配列を列記すること
もできる。下付き文字「a」を用いて切断可能なヌクレオシドまたは切断可能な部分を欠
く共役基の部分を示すこの慣例をこれらの実施形態にわたって用いる。切断可能な部分を
欠く共役基のこの部分は、本明細書において「クラスター」または「共役クラスター」ま
たは「GalNAc3クラスター」と称される。ある特定の事例において、これは、その
クラスターおよびその切断可能な部分を別々に提供することによって共役基を説明するの
に好都合である。
実施例20:huApoC IIIトランスジェニックマウスにおけるヒトApoC I
IIの用量依存的アンチセンス阻害
1およびISIS 647535を別々に試験し、用量依存的試験において、ヒトApo
C IIIトランスジェニックマウスにおけるヒトApoC IIIを阻害するそれらの
能力について評価した。
処理
lad実験食餌を不断給餌した。実験開始前に動物を研究施設で少なくとも7日間順化さ
せた。ASOをPBS中に調製し、0.2ミクロンのフィルターを通して濾過して滅菌し
た。注入のためにASOを0.9%PBS中に溶解した。
647535を、0.08、0.25、0.75、2.25、もしくは6.75μmol
/kgで、または対照としてPBSを、週1回2週間、腹腔内注入した。各処理群は、4
匹の動物から成った。最終用量の投与から48時間後に血液を各マウスから採取し、マウ
スを屠殺し、組織を収集した。
ApoC III mRNA分析
RNA定量化試薬(Molecular Probes,Inc.Eugene,OR)
を用いて、マウスの肝臓におけるApoC III mRNAレベルを決定した。PBS
処理対照に規準化する前に(Ribogreenを用いて)ApoC III mRNA
レベルを全RNAに対して相対的に決定した。以下の結果を、PBS処理対照に規準化さ
れた各処理群のApoC III mRNAレベルの平均パーセントとして提示し、「%
PBS」で表示する。各ASOの半数効果濃度(ED50)も以下の表18に提示する。
II RNAを減少させた。さらに、GalNAc3-1に共役されるアンチセンス化合
物(ISIS 647535)は、GalNAc3-1共役体を欠くアンチセンス化合物
(ISIS 304801)よりもはるかに強力であった。
ApoC IIIタンパク質分析(比濁アッセイ)
Circulation Research)によって報告された手順を用いて、血漿A
poC IIIタンパク質分析を決定した。
析器および市販の比濁ApoC IIIアッセイ(Kamiya、カタログ番号KAI-
006、Kamiya Biomedical,Seattle,WA)を用いて分析し
た。アッセイプロトコルを供給業者が説明する通りに実行した。
ApoC IIIタンパク質を減少させた。さらに、GalNAc3-1に共役されるア
ンチセンス化合物(ISIS 647535)は、GalNAc3-1共役体を欠くアン
チセンス化合物(ISIS 304801)よりもはるかに強力であった。
Bligh,E.G.and Dyer,W.J.Can.J.Biochem.Phy
siol.37:911-917、1959)(Bligh,E and Dyer,W
,Can J Biochem Physiol,37,911-917,1959)(
Bligh,E and Dyer,W,Can J Biochem Physiol
,37,911-917,1959)を用いて抽出し、Beckmann Coulte
r臨床分析器および市販の試薬を用いて測定した。
S」で表示する。結果を表20に提示する。例証されるように、両方のアンチセンス化合
物がトリグリセリドレベルを低下させた。さらに、GalNAc3-1に共役されるアン
チセンス化合物(ISIS 647535)は、GalNAc3-1共役体を欠くアンチ
センス化合物(ISIS 304801)よりもはるかに強力であった。
HDLおよびLDL)の異なる画分の量を決定した。結果を表21および22に提示する
。例証されるように、両方のアンチセンス化合物が総コレステロールレベルを低下させ、
LDLを低下させ、HDLを上昇させた。さらに、GalNAc3-1に共役されるアン
チセンス化合物(ISIS 647535)は、GalNAc3-1共役体を欠くアンチ
センス化合物(ISIS 304801)よりもはるかに強力であった。HDLレベルの
増加およびLDLレベルの減少は、ApoC IIIのアンチセンス阻害の心臓血管の有
益な影響である。
薬物動態分析(PK)
抽出した。試料をIP-HPLC-MSを利用するMSD1で分析した。全長ISIS
304801および647535の組織レベル(μg/g)を測定し、結果を表23に提
供する。例証されるように、総全長アンチセンス化合物の肝臓濃度は、これら2個のアン
チセンス化合物と同様であった。したがって、GalNAc3-1共役アンチセンス化合
物が肝臓でより活性であるが(上のRNAおよびタンパク質データによって実証されるよ
うに)、肝臓内で著しく高い濃度では存在しない。実際には、計算されたEC50(表2
3に提供される)は、共役化合物の強度の観察された増加が蓄積の増加に完全に起因する
わけではないことを裏付ける。この結果は、共役体が、肝臓蓄積単独以外の機構によって
、恐らくアンチセンス化合物の細胞への生産的な取り込みを改善することによって、強度
を改善したことを示唆する。
Ac共役体を欠くアンチセンス化合物の濃度よりも低いことも示す。これは、いくつかの
有益な治療的意味を有する。腎臓における活性が要求されない治療的指標において、腎臓
への曝露は、腎毒性の危険性を有し、それに見合う利益がない。さらに、腎臓における高
濃度は、典型的には、尿への化合物の損失をもたらし、より迅速なクリアランスをもたら
す。したがって、非腎臓標的の場合、腎臓蓄積は望ましくない。これらのデータは、Ga
lNAc3-1共役が腎臓蓄積を減少させることを示唆する。
確認した。観察された代謝物の切断部位および構造を以下に示す。標準の手順を用いて全
長ASOの相対%を計算し、結果を表23に提示する。ISIS 647535の主な代
謝物は、全共役体を欠く全長ASO(すなわち、ISIS 304801)であり、これ
は、以下に示される切断部位Aでの切断に由来する。さらに、他の切断部位に由来するさ
らなる代謝物も観察された。これらの結果は、細胞内の酵素によって切断され得るか、ま
たはサイトゾルの還元環境下で切断し得るか、またはエンドソームおよびリゾソーム内の
酸性pHに適応性のある、GalNAc3-1糖とASOとの間のエステル、ペプチド、
ジスルフィド、ホスホラミデート、またはアシルヒドラゾン等の他の切断可能な結合の導
入も有用であり得ることを示唆する。
けるヒトApoC IIIのアンチセンス阻害
801、647535、および647536を、単回投与試験において、ヒトApoC
IIIトランスジェニックマウスにおけるヒトApoC IIIを阻害するそれらの能力
についてさらに評価した。
処理
lad実験食餌を不断給餌した。実験開始前に動物を研究施設で少なくとも7日間順化さ
せた。ASOをPBS中に調製し、0.2ミクロンのフィルターを通して濾過して滅菌し
た。注入のためにASOを0.9%PBS中に溶解した。
535、もしくは647536(上述のもの)、またはPBS処理対照を、以下に示され
る投与量で1回、腹腔内注入した。処理群は、3匹の動物から成り、対照群は、4匹の動
物から成った。治療前および最終服用後に血液を各マウスから採取し、血漿試料を分析し
た。最終投与の72時間後にマウスを屠殺した。
レベル、血漿トリグリセリド、ならびにHDLおよびLDL画分を含むコレステロールを
決定し、上述(実施例20)のように評価した。これらの分析からのデータを、以下の表
24~28に提示する。血清における肝臓トランスアミナーゼレベル、アラニンアミノト
ランスフェラーゼ(ALT)、およびアスパラギン酸アミノトランスフェラーゼ(AST
)を、標準のプロトコルを用いて、生理食塩水を注入したマウスに対して相対的に測定し
た。ALTおよびASTレベルは、アンチセンス化合物がすべての投与量で良好な耐性で
あったことを示した。
04801)と比較して、3’末端GalNAc3-1共役体を含むアンチセンス化合物
(ISIS 647535および647536)の強度の改善を示す。さらに、GalN
Ac3-1共役体およびいくつかのホスホジエステル結合を含むISIS 647536
は、同一の共役体を含むISIS 647535と同程度に強力であり、ASO内のすべ
てのヌクレオシド間結合は、ホスホロチオエート結合である。
とを裏付ける。これらの結果は、GalNAc3-1共役アンチセンス化合物の同等の強
度も示し、これらのアンチセンスオリゴヌクレオチドは、混合結合(6個のホスホジエス
テル結合を有するISIS 647536)および同一のアンチセンス化合物の完全なホ
スホロチオエートバージョン(ISIS 647535)を有する。
、これらは、ヌクレアーゼ消化に抵抗し、タンパク質に結合し、腎臓/尿ではなく肝臓に
おける化合物の蓄積をもたらす。これらは、肝臓における兆候を治療する際に特に望まし
い特性である。しかしながら、ホスホロチオエート結合は、炎症性応答とも関連している
。したがって、化合物におけるホスホロチオエート結合の数を減少させることにより、炎
症の危険性の減少が見込まれるが、肝臓中の化合物の濃度も低下させ、腎臓および尿中の
濃度を増加させ、ヌクレアーゼの存在下で安定性を低下させ、全体の強度を低下させる。
これらの結果は、ある特定のホスホロチオエート結合がホスホジエステル結合に置換され
たGalNAc3-1共役アンチセンス化合物が、肝臓における標的に対して、完全なホ
スホロチオエート結合を有する対応物と同程度に強力であることを示す。そのような化合
物は、より炎症誘発性が低いと見込まれる(PSの減少が炎症性効果の減少をもたらすこ
とを示す実験を説明する実施例24を参照のこと)。
実施例22:生体内におけるSRB-1を標的とするGalNAc3-1共役修飾ASO
の影響
び651900を、用量依存的試験において、Balb/cマウスにおけるSRB-1を
阻害するそれらの能力について評価した。
処理
arbor,ME)に、ISIS 440762、651900、またはPBS処理対照
を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物から成った。
最終投与の48時間後にマウスを屠殺して、標準のプロトコルに従ってリアルタイムPC
RおよびRIBOGREEN(登録商標)RNA定量化試薬(Molecular Pr
obes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNA
レベルを決定した。PBS処理対照に規準化する前に(Ribogreenを用いて)S
RB-1 mRNAレベルを全RNAに対して相対的に決定した。以下の結果を、PBS
処理対照に規準化された各処理群のSRB-1 mRNAレベルの平均パーセントとして
提示し、「%PBS」で表示する。
を低下させた。さらに、GalNAc3-1共役体(ISIS 651900)を含むア
ンチセンス化合物は、GalNAc3-1共役体を欠くアンチセンス化合物(ISIS
440762)よりもはるかに強力であった。これらの結果は、異なる標的に相補的であ
り、かつ異なる化学修飾ヌクレオシドを有するアンチセンスオリゴヌクレオチドを用いて
、GalNAc3-1共役体の強度利益が観察されることを示し、この事例において、修
飾ヌクレオシドは、拘束エチル糖部分(二環式糖部分)を含む。
実施例23:ヒト末梢血単核細胞(hPBMC)アッセイプロトコル
。US HealthWorks clinic(Faraday & El Cami
no Real、Carlsbad)においてインフォームドコンセントを得た志願ドナ
ー由来の全血試料を得て、4~15個のBD Vacutainer CPT8mLチュ
ーブ(VWRカタログ番号BD362753)内に収集した。PBMCアッセイデータシ
ートを用いて、各ドナーのCPTチューブ内の開始合計全血量の近似値を記録した。
た。CPTチューブを、水平(スイングアウト)ローター内で、室温(18~25℃)で
30分間、ブレーキオフで1500~1800RCFで遠心分離した(2700RPM、
Beckman Allegra 6R)。細胞を(Ficollとポリマーゲル層との
間の)バフィーコート界面から回収し、50mLの滅菌円錐チューブに移し、最大5個の
CPTチューブ/50mLの円錐チューブ/ドナーをプールした。その後、細胞をPBS
(Ca++、Mg++を含まない;GIBCO)で2回洗浄した。チューブを最大50m
Lまで満たし、数回反転させて混合した。その後、試料を、室温で15分間、330×g
で遠心分離し(1215RPM、Beckman Allegra 6R)、ペレットを
乱すことなくできるだけ多くの上澄みを吸引した。チューブを穏やかに回転させて細胞ペ
レットを取り除き、細胞をRPMI+10%FBS+pen/strep(約1mL/1
0mLの開始全血量)中に再懸濁した。60μLの試料を、600μLのVersaLy
se試薬(Beckman Coulter、カタログ番号A09777)を有する試料
バイアル(Beckman Coulter)にピペット注入し、10~15秒間穏やか
にボルテックスした。試料を室温で10分間インキュベートさせ、計数前に再度混合した
。PBMC細胞型を用いたVicell XR細胞生存率分析器(Beckman Co
ulter)で細胞懸濁液を計数した(1:11の希釈係数を他のパラメータで保存した
)。生細胞/mLおよび生存率を記録した。細胞懸濁液をRPMI+10%FBS+pe
n/strep中で1×107生PBMC/mLに希釈した。
/ウェル中に5×105でプレーティングした。RPMI+10%FBS+pen/st
rep中で希釈した2倍濃度のオリゴ/対照の50μL/ウェルを実験テンプレートに従
って添加した(合計100μL/ウェル)。プレートを振盪器に設置し、約1分間混合さ
せた。37℃、5%CO2で24時間インキュベートした後、プレートを400×gで1
0分間遠心分離し、その後、MSDサイトカインアッセイ(すなわち、ヒトIL-6、I
L-10、IL-8、およびMCP-1)のために上澄みを除去した。
実施例24:hPBMCアッセイにおけるGalNAc3-1共役ASOの炎症誘発作用
の評価
されるプロトコルを用いたhPBMCアッセイにおいて炎症誘発作用について評価した。
ISIS 353512は、このアッセイにおいてIL-6放出に対する高応答物として
知られる内部標準物である。hPBMCを新鮮な志願ドナーから単離し、0、0.012
8、0.064、0.32、1.6、8、40、および200μm濃度のASOで処理し
た。
maxを計算した。結果を2つのドナー由来のEmax/EC50の平均比率として表し
、「Emax/EC50」で表示する。より低い比率は、炎症誘発応答の相対的減少を示
し、より高い比率は、炎症誘発応答の相対的増加を示す。
S 616468)であった。GalNAc3-1共役ASO(ISIS 647535
)は、その非共役対応物(ISIS 304801)よりもわずかに炎症誘発性が低かっ
た。これらの結果は、いくつかのPO結合の組み込みが炎症誘発反応を減少させ、Gal
NAc3-1共役体の添加が化合物の炎症誘発性を高めず、炎症誘発応答を減少させ得る
ことを示す。したがって、混合PS/PO結合およびGalNAc3-1共役体の両方を
含むアンチセンス化合物が、完全PS結合アンチセンス化合物(GalNAc3-1共役
体の有無にかかわらず)と比較して、より低い炎症誘発応答をもたらすことが予想される
であろう。これらの結果は、GalNAc3-1共役アンチセンス化合物、特に減少した
PS含有量を有するものの炎症誘発性がより低いことを示す。
を有するものを、対応物であるGalNAc3-1共役体を欠く完全PSアンチセンス化
合物よりも高い用量で投与することができることを示唆する。これらの化合物の半減期が
実質的に異なることが予想されないため、そのようなより高い投与量は、結果として低頻
度の投薬につながる。GalNAc3-1共役化合物がより強力であり(実施例20~2
2を参照のこと)、化合物の濃度が所望のレベル未満に低下した時点で再投薬が必要であ
るため、実際には、そのような投与の頻度はさらに低く、そのような所望のレベルは、強
度に基づく。
-デオキシリボヌクレオシドを示し、「k」は、6’-(S)-CH3二環式ヌクレオシ
ド(例えば、cEt)を示し、「s」は、ホスホロチオエートヌクレオシド間結合(PS
)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」は
、-O-P(=O)(OH)-を示す。上付き文字「m」は、5-メチルシトシンを示す
。「Ado’-GalNAc3-1a」は、示されるように、アンチセンスオリゴヌクレ
オチドの3’末端に結合される、実施例9に示される構造GalNAc3-1を有する共
役体を示す。
修飾ASOの影響
ニックマウス由来の25,000細胞/ウェルの密度の初代肝細胞を、0.03,0.0
8、0.24、0.74、2.22、6.67、および20μm濃度の修飾オリゴヌクレ
オチドで処理した。約16時間の処理期間後、RNAを細胞から単離し、mRNAレベル
を定量的リアルタイムPCRで測定し、hApoC III mRNAレベルをRIBO
GREENで測定された全RNA含有量に従って調整した。
生体外では観察されなかった。生体外での初代肝細胞におけるその後の遊離取り込み実験
は、GalNAc共役体を欠くオリゴヌクレオチドと比較して、様々なGalNAc共役
体を含むオリゴヌクレオチドの強度の増加を示した(実施例60、82、および92を参
照のこと)。
実施例26:ApoC III ASO活性へのPO/PS結合の影響
ISIS 616468(両方ともに上述のもの)またはPBS処理対照を、25mg/
kgで週1回2週間、腹腔内注入した。処理群は、3匹の動物から成り、対照群は、4匹
の動物から成った。治療前および最終服用後に血液を各マウスから採取し、血漿試料を分
析した。最終投与の72時間後にマウスを屠殺した。
ルを決定した(実施例20)。これらの分析からのデータを、以下の表33に提示する。
pinov et al.,Nucleic Acids Research,1997
,25(22),4447-4454によって報告された公開された手順に従って調製す
ることができる。
実施例28:化合物60の調製
る。化合物60を構造分析で確認した。
は非置換アルキルジオールを用いて既定の組成を有するホスホラミダイトを調製すること
ができるため、化合物57は、代表的なものであり、限定するようには意図されていない
。
実施例29:化合物63の調製
.,2013,3,566-577、およびJiang et al.,Tetrahe
dron,2007,63(19),3982-3988によって報告された手順と同様
の手順を用いて調製する。
ett,2003,12,1838-1840)、ならびにKim et al.の公開
されたPCT国際出願第WO2004063208号に報告される手順と同様の手順を用
いて調製する。
実施例30:化合物63bの調製
al of Chemistry,1996,74(9),1731-1737によって
報告された手順と同様の手順を用いて調製する。
実施例31:化合物63dの調製
tters,1998,9(5),451-453によって報告された手順と同様の手順
を用いて調製する。
実施例32:化合物67の調製
al.の公開されたPCT国際出願第WO2009003009号によって報告された手
順と同様の手順を用いて調製する。本明細書に提示されるものを含むが、これらに限定さ
れない他の保護基を用いることができるため、化合物65に用いた保護基は、代表的なも
のであり、限定するようには意図されていない。
実施例33:化合物70の調製
ある。本明細書に提示されるものを含むが、これらに限定されない他の保護基を用いるこ
とができるため、化合物68に用いた保護基は、代表的なものであり、限定するようには
意図されていない。
実施例34:化合物75aの調製
esearch,1997,25(22),4447-4454によって報告された公開
された手順に従って調製する。
esearch,1997,25(22),4447-4454によって報告された公開
された手順に従って調製した。
実施例36:化合物79aの調製
実施例37:固体支持体による5’末端にホスホジエステル結合GalNAc3-2共役
体を含む共役オリゴマー化合物82の調製のための一般的方法(方法I)
順を用いて調製した(Dupouy et al.,Angew.Chem.Int.E
d.,2006,45,3623-3627を参照のこと)。ホスホラミダイト化合物5
6および60を、それぞれ、実施例27および28にそれぞれ例証される手順通りに調製
した。本明細書に提示されるものを含むが、これらに限定されない他のホスホラミダイト
構築ブロックを用いて、5’末端にホスホジエステル結合共役基を有するオリゴマー化合
物を調製することができるため、例証されるホスホラミダイトは、代表的なものであり、
限定するようには意図されていない。固体支持体に添加されるホスホラミダイトの順序お
よび量を調整して、任意の既定の配列および組成を有する本明細書に記載のオリゴマー化
合物を調製することができる。
実施例38:5’末端にホスホジエステル結合GalNAc3-2共役体を含むオリゴマ
ー化合物82の調製のための代替方法(方法II)
順を用いて調製した(Dupouy et al.,Angew.Chem.Int.E
d.,2006,45,3623-3627を参照のこと)。GalNAc3-2クラス
ターホスホラミダイト(化合物79)を実施例35に例証される手順通りに調製した。こ
の代替方法は、合成の最終ステップでのホスホジエステル結合GalNAc3-2共役体
のオリゴマー化合物への一段階導入を可能にする。本明細書に提示されるものを含むが、
これらに限定されない他のホスホラミダイト構築ブロックを用いて5’末端にホスホジエ
ステル共役体を有するオリゴマー化合物を調製することができるため、例証されるホスホ
ラミダイトは、代表的なものであり、限定するようには意図されていない。固体支持体に
添加されるホスホラミダイトの順序および量を調整して、任意の既定の配列および組成を
有する本明細書に記載のオリゴマー化合物を調製することができる。
実施例39:固体支持体による5’末端にGalNAc3-3共役体(5’末端結合のた
めにGalNAc3-1修飾されたもの)を含むオリゴマー化合物83hの調製のための
一般的方法
、市販のものである。ホスホジエステル結合ヘキシルアミンを含むオリゴマー化合物83
eを標準のオリゴヌクレオチド合成手順を用いて調製した。保護されたオリゴマー化合物
をアンモニア水で処理することにより、5’-GalNAc3-3共役オリゴマー化合物
(83h)を得た。
を任意の切断可能な部分と組み合わせて、様々な共役基を得ることができる。GalNA
c3-3aは、以下の式を有する。
実施例40:固体支持体による3’末端にホスホジエステル結合GalNAc3-4共役
体を含むオリゴマー化合物89の調製のための一般的方法
合物84を、文献に報告される手順と同様の手順を用いて調製する(Shchepino
v et al.,Nucleic Acids Research,1997,25(
22),4447-4454、Shchepinov et al.,Nucleic
Acids Research,1999,27,3035-3041、およびHorn
et et al.,Nucleic Acids Research,1997,25
,4842-4849を参照のこと)。
例証される手順通りに調製する。他のホスホラミダイト構築ブロックを用いて、既定の配
列および組成を有する3’末端にホスホジエステル結合共役体を有するオリゴマー化合物
を調製することができるため、例証されるホスホラミダイトは、代表的なものであり、限
定するようには意図されていない。固体支持体に添加されるホスホラミダイトの順序およ
び量を調整して、任意の既定の配列および組成を有する本明細書に記載のオリゴマー化合
物を調製することができる。
実施例41:固相技法による5’位にホスホジエステル結合GalNAc3-2(Bxが
アデニンである実施例37を参照のこと)共役体を含むASOの調製のための一般的方法
(ISIS 661134の調製)
業的供給源から購入する。標準のホスホラミダイト構築ブロックおよび固体支持体を、例
えば、T、A、G、およびmC残基を含む、ヌクレオシド残基の組み込みのために用いる
。ホスホラミダイト化合物56および60を用いて、5’末端のホスホジエステル結合G
alNAc3-2共役体を合成した。無水アセトニトリル中のホスホラミダイトの0.1
M溶液をb-D-2’-デオキシリボヌクレオシドおよび2’-MOEに用いた。
al.,2003)におけるホスホラミダイトカップリング方法を用いて、ASO合成
を、ABI 394合成装置(1~2μmolの規模)またはGE Healthcar
e Bioscience AeKTAオリゴパイロット合成装置(40~200μmo
lの規模)上で実行した。このカップリングステップについて、固体支持体の初期充填に
対して4倍超過したホスホラミダイトを送達し、ホスホラミダイトカップリングを10分
間行った。すべての他のステップは、製造業者から提供された標準のプロトコルに従った
。トルエン中の6%ジクロロ酢酸の溶液を用いて、ヌクレオチドの5’-ヒドロキシル基
からジメトキシトリチル(DMT)基を除去した。カップリングステップ中、無水CH3
CN中の4,5-ジシアノイミダゾール(0.7M)を活性剤として用いた。ホスホロチ
オエート結合を、3分間の接触時間で、1:1のピリジン/CH3CNのキサンタンヒド
リドの0.1M溶液との硫化によって導入した。6%の水を含有するCH3CN中の20
%のtert-ブチルヒドロペルオキシドの溶液を酸化剤として用いて、12分間の接触
時間で、ホスホジエステルヌクレオシド間結合を得た。
で、トルエン中の20%ジエチルアミン(v/v)を用いて脱保護した。固体支持体結合
ASOをアンモニア水(28~30重量%)中に懸濁し、55℃で6時間加熱した。
その後、非結合ASOを濾過し、アンモニアを沸去した。残渣を強力なアニオン交換カラ
ム上での高圧液体クロマトグラフィーによって精製した(GE Healthcare
Bioscience、Source 30Q、30μm、2.54×8cm、A=30
%CH3CN水溶液中100mM酢酸アンモニウム、B=A中1.5M NaBr、60
分後0~40%のB、流量14mL/分-1、λ=260nm)。残渣を逆相カラム上で
のHPLCにより脱塩して、固体支持体への初期充填に基づいて15~30%の単離収率
で所望のASOを得た。ASOを、Agilent 1100 MSDシステムを用いた
イオン対HPLCカップリングMS分析によって特徴付けた。
-デオキシリボヌクレオシドを示し、「k」は、6’-(S)-CH3二環式ヌクレオシ
ド(例えば、cEt)を示し、「s」は、ホスホロチオエートヌクレオシド間結合(PS
)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」は
、-O-P(=O)(OH)-を示す。上付き文字「m」は、5-メチルシトシンを示す
。GalNAc3-2aの構造は、実施例37に示される。
実施例42:固相技法による5’位にGalNAc3-3共役体を含むASOの調製のた
めの一般的方法(ISIS 661166の調製)
順を用いて実行した。
OEギャップマーである。ASOを、Agilent 1100 MSDシステムを用い
たイオン対HPLCカップリングMS分析によって特徴付けた。
-デオキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合
(PS)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o
’」は、-O-P(=O)(OH)-を示す。上付き文字「m」は、5-メチルシトシン
を示す。「5’-GalNAc3-3a」の構造は、実施例39に示される。
実施例43:生体内におけるSRB-1を標的とする5’末端でのホスホジエステル結合
GalNAc3-2の用量依存的試験(Bxがアデニンである実施例37および41を参
照のこと)
34(実施例41を参照のこと)を、用量依存的試験においてマウスにおけるSRB-1
のアンチセンス阻害について試験した。非共役ISIS 440762および65190
0(3’末端にGalNAc3-1共役体、実施例9を参照のこと)を比較のために試験
に含め、先の表17に記載する。
処理
arbor,ME)に、ISIS 440762、651900、661134、または
PBS処理対照を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動
物から成った。最終投与の72時間後にマウスを屠殺して、標準のプロトコルに従ってリ
アルタイムPCRおよびRIBOGREEN(登録商標)RNA定量化試薬(Molec
ular Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB
-1 mRNAレベルを決定した。PBS処理対照に規準化する前に(Ribogree
nを用いて)SRB-1 mRNAレベルを全RNAに対して相対的に決定した。以下の
結果を、PBS処理対照に規準化された各処理群のSRB-1 mRNAレベルの平均パ
ーセントとして提示し、「%PBS」で表示する。前記方法と同様の方法を用いてED5
0を測定し、以下に提示する。
様式でSRB-1 mRNAレベルを低下させた。実際には、5’末端にホスホジエステ
ル結合GalNAc3-2共役体(ISIS 661134)または3’末端に連結され
たGalNAc3-1共役体(ISIS 651900)を含むアンチセンスオリゴヌク
レオチドは、非共役アンチセンスオリゴヌクレオチド(ISIS 440762)と比較
して、強度の大幅な改善を示した。さらに、5’末端にホスホジエステル結合GalNA
c3-2共役体を含むISIS 661134は、3’末端にGalNAc3-1共役体
を含むISIS 651900と比較して、等効力であった。
37に記載されている。
薬物動態分析(PK)
一の様式で評価した。肝臓試料を切り刻み、標準のプロトコルを用いて抽出した。661
134(5’GalNAc3-2)およびISIS 651900(3’GalNAc3
-1)の全長代謝物を特定し、これらの質量を高分解能質量分析によって確認した。結果
は、5’末端にホスホジエステル結合GalNAc3-2共役体を含むASO(ISIS
661134)に対して検出された主な代謝物が、ISIS 440762であったこ
とを示した(データ示されず)。検出可能なレベルでさらなる代謝物は観察されなかった
。その対応物とは異なり、先の表23aに報告された代謝物と同様のさらなる代謝物が、
3’末端にGalNAc3-1共役体を有するASO(ISIS 651900)で観察
された。これらの結果は、ホスホジエステル結合GalNAc3-1またはGalNAc
3-2共役体を有することで、それらの強度を損なうことなくASOのPKプロファイル
を改善し得ることを示唆する。
実施例44:SRB-1を標的とする3’末端にGalNAc3-1共役体(実施例9を
参照のこと)を含むASOのアンチセンス阻害へのPO/PS結合の影響
655861および655862を、単回投与試験においてマウスにおけるSRB-1
を阻害するそれらの能力について試験した。親非共役化合物ISIS 353382を比
較のために試験に含めた。
オキシリボヌクレオシドを含み、各ウィング領域は、5個の2’-MOE修飾ヌクレオシ
ドを含む。ASOを先の実施例19に例証される方法と同様の方法を用いて調製し、以下
の表36に示す。
-デオキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合
(PS)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o
’」は、-O-P(=O)(OH)-を示す。上付き文字「m」は、5-メチルシトシン
を示す。「GalNAc3-1」の構造は、実施例9に示される。
処理
arbor,ME)に、ISIS 353382、655861、655862、または
PBS処理対照を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動
物から成った。治療前および最終服用後に血液を各マウスから採取し、血漿試料を分析し
た。最終投与の72時間後にマウスを屠殺して、標準のプロトコルに従ってリアルタイム
PCRおよびRIBOGREEN(登録商標)RNA定量化試薬(Molecular
Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mR
NAレベルを決定した。PBS処理対照に規準化する前に(Ribogreenを用いて
)SRB-1 mRNAレベルを全RNAに対して相対的に決定した。以下の結果を、P
BS処理対照に規準化された各処理群のSRB-1 mRNAレベルの平均パーセントと
して提示し、「%PBS」で表示する。前記方法と同様の方法を用いてED50を測定し
、以下に報告する。
対照と比較して、用量依存的様式でSRB-1 mRNAレベルを低下させた。実際には
、3’末端にGalNAc3-1共役体を含むアンチセンスオリゴヌクレオチド(ISI
S 655861および655862)は、非共役アンチセンスオリゴヌクレオチド(I
SIS 353382)と比較して、強度の大幅な改善を示した。さらに、混合PS/P
O結合を有するISIS 655862は、完全PS(ISIS 655861)と比較
して、強度の改善を示した。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。臓器重量も評価し
た。結果は、PBS対照と比較して、ASOで処理したマウスにおいて、トランスアミナ
ーゼレベル(表38)の増加も臓器重量(データ示されず)の増加も観察されなかったこ
とを示した。さらに、混合PS/PO結合を有するASO(ISIS 655862)は
、完全PS(ISIS 655861)と比較して、同様のトランスアミナーゼレベルを
示した。
mole)で個別に処理し、ジクロロメタン(200mL)中のTMSOTf(0.5当
量)および分子篩で処理し、室温で16時間撹拌した。この時点で、セライトを通して有
機層を濾過し、その後、重炭酸ナトリウム、水、およびブラインで洗浄した。その後、有
機層を分離し、硫酸ナトリウム上で乾燥させ、濾過し、減圧下で還元した。結果として生
じた油をシリカゲルクロマトグラフィー(2%→10%メタノール/ジクロロメタン)に
よって精製して、80%超の収率で化合物104aおよび104bを得た。LCMSおよ
びプロトンNMRは、その構造と一致した。
理して、90%超の収率で化合物105aおよび105bを得た。LCMSおよびプロト
ンNMRは、その構造と一致した。
別に処理して、化合物106a(80%)および106b(20%)を得た。LCMSお
よびプロトンNMRは、その構造と一致した。
して、107a(60%)および107b(20%)を得た。LCMSおよびプロトンN
MRは、その構造と一致した。
して、40~60%の収率で化合物108aおよび108bを得た。LCMSおよびプロ
トンNMRは、その構造と一致した。
7)と同一の条件で処理して、80%超の収率で化合物109aおよび109bを得た。
LCMSおよびプロトンNMRは、その構造と一致した。
60%の収率で化合物110aを得た。LCMSおよびプロトンNMRは、その構造と一
致した。あるいは、化合物110bを化合物109bから開始して同様の様式で調製する
ことができる。
実施例46:PFPエステル(オリゴヌクレオチド111)との共役のための一般的手順
;ISIS 666881(GalNAc3-10)の調製
チドを合成し、精製した。5’-ヘキシルアミノ修飾オリゴヌクレオチドを0.1M四ホ
ウ酸ナトリウム(pH8.5、200μL)中に溶解し、DMSO(50μL)中に溶解
した3当量の選択されたPFPエステル化GalNAc3クラスターを添加した。ASO
溶液への添加時にPFPエステルが沈殿した場合、すべてのPFPエステルが溶液中に存
在するまでDMSOを添加した。室温で約16時間混合した後、反応が完了した。結果と
して生じた溶液を水で希釈して12mLにし、その後、3000Daの質量カットオフで
スピンフィルターに3000rpmで沈降させた。このプロセスを2回繰り返して、小分
子不純物を除去した。その後、この溶液を凍結乾燥乾固させ、濃縮アンモニア水中に再溶
解し、室温で2.5時間混合し、その後、真空内で濃縮して、アンモニアの大部分を除去
した。共役オリゴヌクレオチドを精製し、RP-HPLCによって脱塩し、凍結乾燥させ
て、GalNAc3共役オリゴヌクレオチドを得た。
-10のGalNAc3クラスター部分(GalNAc3-10a)を任意の切断可能な
部分と組み合わせて、様々な共役基を得ることができる。ある特定の実施形態において、
切断可能な部分は、以下のGalNAc3-10で合成されたオリゴヌクレオチド(IS
IS 666881)に示される-P(=O)(OH)-Ad-P(=O)(OH)-で
ある。GalNAc3-10(GalNAc3-10a-CM-)の構造を以下に示す。
レオチド手順を用いて5’-ヘキシルアミノ修飾オリゴヌクレオチド(ISIS 660
254)を合成し、精製した。ISIS 660254(40mg、5.2μmol)を
0.1M四ホウ酸ナトリウム(pH8.5、200μL)中に溶解し、DMSO(50μ
L)中に溶解した3当量のPFPエステル(化合物110a)を添加した。ASO溶液へ
の添加時にPFPエステルが沈殿した場合、PFPエステルを完全に溶解するためにさら
なるDMSO(600μL)が必要であった。室温で約16時間混合した後、反応が完了
した。この溶液を水で希釈して全体積12mLにし、3000Daの質量カットオフでス
ピンフィルターに3000rpmで沈降させた。このプロセスを2回繰り返して、小分子
不純物を除去した。この溶液を凍結乾燥乾固させ、濃縮アンモニア水中に再溶解し、室温
で2.5時間混合し、その後、真空内で濃縮して、アンモニアの大部分を除去した。共役
オリゴヌクレオチドを精製し、RP-HPLCによって脱塩し、凍結乾燥させて、90重
量%の収率でISIS 666881(42mg、4.7μmol)を得た。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
実施例47:GalNAc3-8を含むオリゴヌクレオチド102の調製
プロピルエチルアミン(12.35mL、72mmole)中に溶解した。トリフルオロ
酢酸ペンタフルオロフェニル(8.9mL、52mmole)をアルゴン下で滴加し、反
応物を室温で30分間撹拌させた。Boc-ジアミン91aまたは91b(68.87m
mol)をN,N-ジイソプロピルエチルアミン(12.35mL、72mmole)と
ともに添加し、反応物を室温で16時間撹拌させた。この時点で、DMFを減圧下で75
%超還元し、その後、混合物をジクロロメタン中に溶解した。有機層を重炭酸ナトリウム
、水、およびブラインで洗浄した。その後、有機層を分離し、硫酸ナトリウム上で乾燥さ
せ、濾過し、減圧下で油に還元した。結果として生じた油をシリカゲルクロマトグラフィ
ー(2%→10%メタノール/ジクロロメタン)によって精製して、約80%の収率で化
合物92aおよび92bを得た。LCMSおよびプロトンNMRは、その構造と一致した
。
0mLのトリフルオロ酢酸で、室温で16時間処理した。結果として生じた溶液を蒸発さ
せ、その後、メタノール中に溶解し、DOWEX-OH樹脂で30分間処理した。結果と
して生じた溶液を濾過し、減圧下で油に還元して、85~90%の収率の化合物93aお
よび93bを得た。
g、9.6mmole)およびN,N-ジイソプロピルエチルアミン(5mL)で15分
間処理した。これに、化合物93aまたは93b(3mmole)のいずれかを添加し、
室温で16時間撹拌させた。この時点で、DMFを減圧下で75%超還元し、その後、混
合物をジクロロメタン中に溶解した。有機層を重炭酸ナトリウム、水、およびブラインで
洗浄した。その後、有機層を分離し、硫酸ナトリウム上で乾燥させ、濾過し、減圧下で油
に還元した。結果として生じた油をシリカゲルクロマトグラフィー(5%→20%メタノ
ール/ジクロロメタン)によって精製して、20~40%の収率で化合物96a~dを得
た。LCMSおよびプロトンNMRは、その構造と一致した。
(75mL)中で個別に水素化した。この時点で、セライトを通して触媒を濾去し、エタ
ノールを減圧下で除去して、80~90%の収率で化合物97a~dを得た。LCMSお
よびプロトンNMRは、その構造と一致した。
0.2g、0.53mmole)およびN,N-ジイソプロピルエチルアミン(0.19
mL、1.14mmole)で15分間処理した。これに、化合物97a~d(0.38
mmole)を個別に添加し、室温で16時間撹拌させた。この時点で、DMFを減圧下
で75%超還元し、その後、混合物をジクロロメタン中に溶解した。有機層を重炭酸ナト
リウム、水、およびブラインで洗浄した。その後、有機層を分離し、硫酸ナトリウム上で
乾燥させ、濾過し、減圧下で油に還元した。結果として生じた油をシリカゲルクロマトグ
ラフィー(2%→20%メタノール/ジクロロメタン)によって精製して、30~40%
の収率で化合物98a~dを得た。LCMSおよびプロトンNMRは、その構造と一致し
た。
0.29g、0.76mmole)およびN,N-ジイソプロピルエチルアミン(0.3
5mL、2.0mmole)で15分間処理した。これに、化合物97a~d(0.51
mmole)を個別に添加し、室温で16時間撹拌させた。この時点で、DMFを減圧下
で75%超還元し、その後、混合物をジクロロメタン中に溶解した。有機層を重炭酸ナト
リウム、水、およびブラインで洗浄した。その後、有機層を分離し、硫酸ナトリウム上で
乾燥させ、濾過し、減圧下で油に還元した。結果として生じた油をシリカゲルクロマトグ
ラフィー(5%→20%メタノール/ジクロロメタン)によって精製して、40~60%
の収率で化合物100a~dを得た。LCMSおよびプロトンNMRは、その構造と一致
した。
、メタノール/酢酸エチル(1:1、50mL)中で個別に水素化した。この時点で、セ
ライトを通して触媒を濾去し、有機物を減圧下で除去して、80~90%の収率で化合物
101a~dを得た。LCMSおよびプロトンNMRは、その構造と一致した。
.016mL、0.2mmole)中に個別に溶解した。トリフルオロ酢酸ペンタフルオ
ロフェニル(0.034mL、0.2mmole)をアルゴン下で滴加し、反応物を室温
で30分間撹拌させた。この時点で、DMFを減圧下で75%超還元し、その後、混合物
をジクロロメタン中に溶解した。有機層を重炭酸ナトリウム、水、およびブラインで洗浄
した。その後、有機層を分離し、硫酸ナトリウム上で乾燥させ、濾過し、減圧下で油に還
元した。結果として生じた油をシリカゲルクロマトグラフィー(2%→5%メタノール/
ジクロロメタン)によって精製して、約80%の収率で化合物102a~dを得た。LC
MSおよびプロトンNMRは、その構造と一致した。
マー化合物102を調製した。共役基GalNAc3-8のGalNAc3クラスター部
分(GalNAc3-8a)を任意の切断可能な部分と組み合わせて、様々な共役基を得
ることができる。好ましい一実施形態において、切断可能な部分は、-P(=O)(OH
)-Ad-P(=O)(OH)-である。
順に従って化合物112を合成した。
22mL)中に溶解した。炭素(0.5g)上水酸化パラジウムを添加した。反応混合物
を室温で12時間、水素下で撹拌した。セライトパッドを通して反応混合物を濾過し、そ
のパッドを1:1メタノール/酢酸エチルで洗浄した。濾液と洗浄物を合わせ、濃縮乾固
させて、化合物105a(定量的)を得た。この構造を、LCMSによって確認した。
)、およびDIEA(2.8mL、16.2mmol)を無水DMF(17mL)中に溶
解し、反応混合物を室温で5分間撹拌した。これに、無水DMF(20mL)中の化合物
105a(3.77g、8.4mmol)の溶液を添加した。反応物を室温で6時間撹拌
した。溶媒を減圧下で除去して、油を得た。残渣をCH2Cl2(100mL)中に溶解
し、飽和NaHCO3水溶液(100mL)およびブライン(100mL)で洗浄した。
有機相を分離し、乾燥させ(Na2SO4)、濾過し、濃縮した。残渣をシリカゲルカラ
ムクロマトグラフィーによって精製し、ジクロロメタン中10~20%MeOHで溶出し
て、化合物114(1.45g、30%)を得た。この構造を、LCMSおよび1H N
MR分析によって確認した。
L/4mL)中に溶解した。炭素(湿性、0.14g)上パラジウムを添加した。反応混
合物を水素で洗い流し、室温で12時間、水素下で撹拌した。セライトパッドを通して反
応混合物を濾過した。このセライトパッドをメタノール/酢酸エチル(1:1)で洗浄し
た。濾液と洗浄物を一緒に合わせ、減圧下で蒸発させて、化合物115(定量的)を得た
。この構造を、LCMSおよび1H NMR分析によって確認した。
mol)、およびDIEA(0.26mL、1.5mmol)を無水DMF(5mL)中
に溶解し、反応混合物を室温で5分間撹拌した。これに、無水DMF中の化合物115(
1.22g、0.75mmol)の溶液を添加し、反応物を室温で6時間撹拌した。溶媒
を減圧下で除去し、残渣をCH2Cl2中に溶解した。有機層を飽和NaHCO3水溶液
およびブラインで洗浄し、無水Na2SO4上で乾燥させ、濾過した。有機層を濃縮乾固
させ、得られた残渣をシリカゲルカラムクロマトグラフィーによって精製し、ジクロロメ
タン中3~15%MeOHで溶出して、化合物116(0.84g、61%)を得た。こ
の構造を、LC MSおよび1H NMR分析によって確認した。
L/5mL)中に溶解した。炭素(湿性、0.074g)上パラジウムを添加した。反応
混合物を水素で洗い流し、室温で12時間、水素下で撹拌した。セライトパッドを通して
反応混合物を濾過した。このセライトパッドをメタノール/酢酸エチル(1:1)で洗浄
した。濾液と洗浄物を一緒に合わせ、減圧下で蒸発させて、化合物117(0.73g、
98%)を得た。この構造を、LCMSおよび1H NMR分析によって確認した。
。この溶液に、N,Nジイソプロピルエチルアミン(70μL、0.4mmol)および
トリフルオロ酢酸ペンタフルオロフェニル(72μL、0.42mmol)を添加した。
反応混合物を室温で12時間撹拌し、飽和NaHCO3水溶液に注いだ。この混合物をジ
クロロメタンで抽出し、ブラインで洗浄し、無水Na2SO4上で乾燥させた。このジク
ロロメタン溶液を濃縮乾固させ、シリカゲルカラムクロマトグラフィーで精製し、ジクロ
ロメタン中5~10%MeOHで溶出して、化合物118(0.51g、79%)を得た
。この構造を、LCMS、ならびに1Hおよび1Hおよび19F NMRによって確認し
た。
マー化合物119を調製した。共役基GalNAc3-7のGalNAc3クラスター部
分(GalNAc3-7a)を任意の切断可能な部分と組み合わせて、様々な共役基を得
ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O)(OH
)-Ad-P(=O)(OH)-である。
mol)を無水DMF(80mL)中に溶解した。トリエチルアミン(11.2mL、8
0.35mmol)を添加し、5分間撹拌した。反応混合物を氷浴中で冷却し、無水DM
F(20mL)中の化合物121(10g、mmol)の溶液を添加した。さらなるトリ
エチルアミン(4.5mL、32.28mmol)を添加し、反応混合物をアルゴン雰囲
気下で18時間撹拌した。TLC(1:1の酢酸エチル:ヘキサン;Rf=0.47)に
よって反応を監視した。溶媒を減圧下で除去した。残渣をEtOAc(300mL)中に
取り込み、1M NaHSO4(3×150mL)、飽和NaHCO3水溶液(3×15
0mL)、およびブライン(2×100mL)で洗浄した。有機層をNa2SO4で乾燥
させた。乾燥剤を濾去し、有機層を回転蒸発によって濃縮した。粗混合物をシリカゲルカ
ラムクロマトグラフィーによって精製し、ヘキサン中35~50%EtOAcを用いて溶
出して、化合物122(15.50g、78.13%)を得た。この構造を、LCMSお
よび1H NMR分析によって確認した。質量(m/z)589.3[M+H]+。
を、メタノール(15mL)中に溶解した冷却した化合物122の溶液(7.75g、1
3.16mmol)に添加した。反応混合物を室温で45分間撹拌し、TLC(1:1の
EtOAc:ヘキサン)によって監視した。反応混合物を減圧下で濃縮して、半分の体積
にした。残りの溶液を氷浴中で冷却して、濃縮HClを添加して中和した。反応混合物を
希釈し、EtOAc(120mL)で抽出し、ブライン(100mL)で洗浄した。エマ
ルジョンを形成し、一晩静置した後に取り除いた。有機層を分離し、乾燥させ(Na2S
O4)、濾過し、蒸発させて、化合物123(8.42g)を得た。残留塩は、過剰な質
量の推定原因である。LCMSは、この構造と一致した。この生成物をさらに精製するこ
となく使用した。M.W.計算値:574.36、M.W.実測値:575.3[M+H
]+。
82mmol)、および化合物126(6.33g、16.14mmol)をDMF(4
0mL)中に溶解し、結果として生じた反応混合物を氷浴中で冷却した。これに、N,N
ジイソプロピルエチルアミン(4.42mL、25.82mmol)、PyBop(8.
7g、16.7mmol)、続いて、Bopカップリング試薬(1.17g、2.66m
mol)をアルゴン雰囲気下で添加した。氷浴を除去し、溶液を室温まで温めた。1時間
後に反応が完了し、TLC(89:10:1のDCM:MeOH:AA)によって決定し
た。反応混合物を減圧下で濃縮した。残渣をEtOAc(200mL)中に溶解し、1M
NaHSO4(3×100mL)、飽和NaHCO3水溶液(3×100mL)、およ
びブライン(2×100mL)で洗浄した。有機相を分離し、乾燥させ(Na2SO4)
、濾過し、濃縮した。残渣を50%ヘキサン/EtOAC:100%EtOAcの勾配で
のシリカゲルカラムクロマトグラフィーによって精製して、白色の発泡体として化合物1
27(9.4g)を得た。LCMSおよび1H NMRは、その構造と一致した。質量(
m/z)778.4[M+H]+。
57g、2.02mmol)の溶液に添加し、室温で1時間撹拌した。反応混合物を減圧
下でトルエン(30mL)と共蒸発乾固させた。得られた残渣をアセトニトリル(30m
L)およびトルエン(40mL)と2回共蒸発させて、トリフルオロ酢酸塩として化合物
128(1.67g)を得て、さらに精製することなく次のステップで使用した。LCM
Sおよび1H NMRは、その構造と一致した。質量(m/z)478.2[M+H]+
。
5g、0.91mmol)、およびHOAt(0.035g、0.26mmol)を一緒
に合わせ、減圧下で、P2O5上で4時間乾燥させ、その後、無水DMF(1mL)中に
溶解し、5分間撹拌した。これに無水DMF(0.2mL)およびN,Nジイソプロピル
エチルアミン(0.2mL)中の化合物128(0.20g、0.26mmol)の溶液
を添加した。反応混合物を室温で、アルゴン雰囲気下で撹拌した。30分間後に反応が完
了し、LCMSおよびTLC(7%MeOH/DCM)によって決定した。反応混合物を
減圧下で濃縮した。残渣をDCM(30mL)中に溶解し、1M NaHSO4(3×2
0mL)、飽和NaHCO3水溶液(3×20mL)、およびブライン(3×20mL)
で洗浄した。有機相を分離し、Na2SO4上で乾燥させ、濾過し、濃縮した。残渣をジ
クロロメタン中5~15%MeOHを用いたシリカゲルカラムクロマトグラフィーによっ
て精製して、化合物129(96.6mg)を得た。LC MSおよび1H NMRは、
その構造と一致する。質量(m/z)883.4[M+2H]+。
ol)をメタノール(5mL)中に溶解した。これに、少量の10%Pd/C(0.01
5mg)を添加し、反応容器をH2ガスで洗い流した。反応混合物を室温で18時間、H
2雰囲気下で撹拌した。セライトパッドを通して反応混合物を濾過し、このセライトパッ
ドをメタノールで洗浄した。濾液洗浄物を一緒にプールし、減圧下で濃縮して、化合物1
30(0.08g)を得た。LCMSおよび1H NMRは、その構造と一致した。この
生成物をさらに精製することなく使用した。質量(m/z)838.3[M+2H]+。
ol)、0.37Mピリジン/DMF(200μL)、および撹拌棒を添加した。この溶
液に、0.7Mトリフルオロ酢酸ペンタフルオロフェニル/DMF(100μL)を撹拌
しながら滴加した。1時間後に反応が完了し、LC MSによって決定した。溶媒を減圧
下で除去し、残渣をCHCl3(約10mL)中に溶解した。有機層をNaHSO4(1
M、10mL)、飽和NaHCO3水溶液(10mL)、およびブライン(10mL)に
それぞれ3回分配した。有機相を分離し、Na2SO4上で乾燥させ、濾過し、濃縮して
、化合物131(77.7mg)を得た。LCMSは、この構造と一致した。さらに精製
することなく使用した。質量(m/z)921.3[M+2H]+。
マー化合物132を調製した。共役基GalNAc3-5のGalNAc3クラスター部
分(GalNAc3-5a)を任意の切断可能な部分と組み合わせて、様々な共役基を得
ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O)(OH
)-Ad-P(=O)(OH)-である。
ルムアミド、ジクロロメタン、およびアセトニトリルで洗浄したアミノメチルVIMAD
樹脂(2.5g、450μmol/g)を添加した。この樹脂は、アセトニトリル(4m
L)中で膨潤した。20(1.0mmol、0.747g)、TBTU(1.0mmol
、0.321g)、アセトニトリル(5mL)、およびDIEA(3.0mmol、0.
5mL)を添加して、化合物133を100mLの丸底フラスコ内で事前に活性化した。
この溶液を5分間撹拌させ、その後、振盪しながらMerrifieldフラスコに添加
した。懸濁液を3時間振盪させた。反応混合物を排出し、樹脂をアセトニトリル、DMF
、およびDCMで洗浄した。DCM中500nm(消光係数=76000)でDMTカチ
オンの吸光度を測定することにより新たな樹脂充填を定量化し、238μmol/gであ
ると決定した。無水酢酸溶液中で10分間3回懸濁することにより、この樹脂をキャップ
した。
を合成した。少量の固体支持体を回収し、アンモニア水(28~30重量%)中に6時間
懸濁した。切断された化合物をLC-MSによって分析し、観察された質量は、その構造
と一致した。質量(m/z)1063.8[M+2H]+。
した。
で16時間加熱した。溶液を冷却し、固体支持体を濾過した。濾液を濃縮し、残渣を水中
に溶解し、強アニオン交換カラム上でHPLCによって精製した。全長化合物144を含
有する画分を一緒にプールし、脱塩した。結果として生じたGalNAc4-11共役オ
リゴマー化合物をLC-MSによって分析し、観察された質量は、その構造と一致した。
a)を任意の切断可能な部分と組み合わせて、様々な共役基を得ることができる。ある特
定の実施形態において、切断可能な部分は、-P(=O)(OH)-Ad-P(=O)(
OH)-である。
mmol)をCH2Cl2(200mL)中に溶解した。活性化分子篩(4A、2g、粉
末)を添加し、反応物を窒素雰囲気下で30分間撹拌させた。TMS-OTfを添加し(
4.1mL、22.77mmol)、反応物を室温で一晩撹拌させた。完了した時点で、
飽和NaHCO3水溶液(500mL)および粉砕氷(約150g)を注いで反応物を反
応停止処理した。有機層を分離し、ブラインで洗浄し、MgSO4上で乾燥させ、濾過し
、減圧下で濃縮してオレンジ色の油を得た。粗物質をシリカゲルカラムクロマトグラフィ
ーによって精製し、CH2Cl2中2~10%MeOHで溶出して、化合物112(16
.53g、63%)を得た。LCMSおよび1H NMRは、予想した化合物と一致した
。
0mL)中に溶解した。この溶液を通してアルゴン流を15分間泡立てて反応混合物をパ
ージした。パールマン触媒(炭素上水酸化パラジウム、400mg)を添加し、この溶液
を通して水素ガスを30分間泡立てた。完了した時点で(TLC(CH2Cl2中10%
MeOH)およびLCMS)、セライトパッドを通して触媒を濾去した。濾液を回転蒸発
によって濃縮し、高真空下で短時間乾燥させて、化合物105a(3.28g)を得た。
LCMSおよび1H NMRは、所望の生成物と一致した。
。N,N-ジイソプロピルエチルアミン(DIEA、3.9mL、22mmol)、続い
て、HBTU(4g、10.5mmol)を添加した。反応混合物を窒素下で約15分間
撹拌させた。これに、乾燥DMF中の化合物105a(3.3g、7.4mmol)の溶
液を添加し、窒素雰囲気下で2時間撹拌した。反応物をEtOAcで希釈し、飽和NaH
CO3水溶液およびブラインで洗浄した。有機相を分離し、乾燥させ(MgSO4)、濾
過し、濃縮してオレンジ色のシロップを得た。粗物質をカラムクロマトグラフィー(CH
2Cl2中2~5%MeOH)によって精製して、化合物148(3.44g、73%)
を得た。LCMSおよび1H NMRは、予想した生成物と一致した。
L)中に溶解した。この溶液を通してアルゴン流を15分間泡立てて反応混合物をパージ
した。パールマン触媒(炭素上水酸化パラジウム)を添加した(350mg)。この溶液
を通して水素ガスを30分間泡立てた。完了した時点で(TLC(DCM中10%MeO
H)およびLCMS)、セライトパッドを通して触媒を濾去した。濾液を回転蒸発によっ
て濃縮し、高真空下で短時間乾燥させて、化合物149(2.6g)を得た。LCMSは
、所望の生成物と一致した。残渣を乾燥DMF(10mL)中に溶解し、次のステップで
即座に使用した。
た。これに、DIEA(450μL、2.6mmol、1.5当量)およびHBTU(1
.96g、0.5.2mmol)を添加した。反応混合物を室温で15分間、窒素下で撹
拌させた。無水DMF(10mL)中の化合物149(2.6g)の溶液を添加した。D
IEAを添加することにより(必要に応じて)、反応物のpHをpH=9~10に調整し
た。反応物を室温で2時間、窒素下で撹拌させた。完了した時点で、反応物をEtOAc
(100mL)で希釈し、飽和NaHCO3水溶液で洗浄し、続いて、ブラインで洗浄し
た。有機相を分離し、MgSO4上で乾燥させ、濾過し、濃縮した。残渣をシリカゲルカ
ラムクロマトグラフィーによって精製し、CH2Cl2中2~10%MeOHで溶出して
、化合物150(0.62g、20%)を得た。LCMSおよび1H NMRは、所望の
生成物と一致した。
この溶液を通してアルゴン流を15分間泡立てて反応混合物をパージした。パールマン触
媒(炭素上水酸化パラジウム)を添加した(60mg)。この溶液を通して水素ガスを3
0分間泡立てた。完了した時点で(TLC(DCM中10%MeOH)およびLCMS)
、触媒を濾去した(シリンジチップTeflonフィルター、0.45μm)。濾液を回
転蒸発によって濃縮し、高真空下で短時間乾燥させて、化合物151(0.57g)を得
た。LCMSは、所望の生成物と一致した。この生成物を4mLの乾燥DMF中に溶解し
、次のステップで即座に使用した。
N,N-ジイソプロピルエチルアミン(75μL、1mmol)およびPFP-TFA(
90μL、0.76mmol)を添加した。接触時に反応混合物は赤紫色になり、その後
30分間かけて徐々にオレンジ色になった。TLCおよびLCMSによって反応の進行を
監視した。完了した時点で(PFPエステルの形成)、DMFを中の化合物151(0.
57g、0.33mmol)の溶液を添加した。N,N-ジイソプロピルエチルアミンを
添加することにより(必要に応じて)、反応物のpHをpH=9~10に調整した。反応
混合物を窒素下で約30分間撹拌した。完了した時点で、溶媒の大部分を減圧下で除去し
た。残渣をCH2Cl2で希釈し、飽和NaHCO3水溶液で洗浄し、続いて、ブライン
で洗浄した。有機相を分離し、MgSO4上で乾燥させ、濾過し、濃縮してオレンジ色の
シロップを得た。残渣をシリカゲルカラムクロマトグラフィー(CH2Cl2中2~10
%MeOH)によって精製して、化合物152(0.35g、55%)を得た。LCMS
および1H NMRは、所望の生成物と一致した。
10mL)中に溶解した。この溶液を通してアルゴン流を15分間泡立てて反応混合物を
パージした。パールマン触媒(炭素上水酸化パラジウム)を添加した(35mg)。この
溶液を通して水素ガスを30分間泡立てた。完了した時点で(TLC(DCM中10%M
eOH)およびLCMS)、触媒を濾去した(シリンジチップTeflonフィルター、
0.45μm)。濾液を回転蒸発によって濃縮し、高真空下で短時間乾燥させて、化合物
153(0.33g、定量的)を得た。LCMSは、所望の生成物と一致した。
5mL)中に溶解した。これに、N,N-ジイソプロピルエチルアミン(65μL、0.
37mmol)およびPFP-TFA(35μL、0.28mmol)を添加した。反応
混合物を窒素下で約30分間撹拌した。接触時に反応混合物は赤紫色になり、徐々にオレ
ンジ色になった。さらにN,-ジイソプロピルエチルアミンを添加することにより、反応
混合物のpHをpH=9~10で維持した。TLCおよびLCMSによって反応の進行を
監視した。完了した時点で、溶媒の大部分を減圧下で除去した。残渣をCH2Cl2(5
0mL)で希釈し、飽和NaHCO3水溶液で洗浄し、続いて、ブラインで洗浄した。有
機層をMgSO4上で乾燥させ、濾過し、濃縮してオレンジ色のシロップを得た。残渣を
シリカゲルカラムクロマトグラフィーによって精製し、CH2Cl2中2~10%MeO
Hで溶出して、化合物154(0.29g、79%)を得た。LCMSおよび1H NM
Rは、所望の生成物と一致した。
マー化合物155を調製した。共役基GalNAc3-6のGalNAc3クラスター部
分(GalNAc3-6a)を任意の切断可能な部分と組み合わせて、様々な共役基を得
ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O)(OH
)-Ad-P(=O)(OH)-である。
順に従って化合物156を合成した。
溶解した。炭素(6.15g、10重量%、充填(乾燥ベース)、マトリックス炭素粉末
、湿式)上パラジウムを添加した。反応混合物を室温で18時間、水素下で撹拌した。セ
ライトパッドを通して反応混合物を濾過し、このセライトパッドをメタノールで完全に洗
浄した。合わせた濾液を洗浄し、濃縮乾固させた。残渣をシリカゲルカラムクロマトグラ
フィーによって精製し、ジクロロメタン中5~10%メタノールで溶出して、化合物15
7(14.26g、89%)を得た。質量(m/z)544.1[M-H]-。
BTU(3.65g、9.61mmol)およびN,N-ジイソプロピルエチルアミン(
13.73mL、78.81mmol)を添加し、反応混合物を室温で5分間撹拌した。
これに、化合物47(2.96g、7.04mmol)の溶液を添加した。反応物を室温
で8時間撹拌した。反応混合物を飽和NaHCO3水溶液に注いだ。この混合物を酢酸エ
チルで抽出し、有機層をブラインで洗浄し、乾燥させ(Na2SO4)、濾過し、蒸発さ
せた。得られた残渣をシリカゲルカラムクロマトグラフィーによって精製し、ヘキサン中
50%酢酸エチルで溶出して、化合物158(8.25g、73.3%)を得た。この構
造を、MSおよび1H NMR分析によって確認した。
燥させた化合物を無水DMF(50mL)中に溶解した。これに、1H-テトラゾール(
0.43g、6.09mmol)およびN-メチルイミダゾール(0.3mL、3.81
mmol)および2-シアノエチル-N,N,N’,N’-テトライソプロピルホスホロ
ジアミダイト(3.65mL、11.50mmol)を添加した。反応混合物をアルゴン
雰囲気下で4時間撹拌した。反応混合物を酢酸エチル(200mL)で希釈した。反応混
合物を飽和NaHCO3およびブラインで洗浄した。有機相を分離し、乾燥させ(Na2
SO4)、濾過し、濃縮した。残渣をシリカゲルカラムクロマトグラフィーによって精製
し、ヘキサン中50~90%酢酸エチルで溶出して、化合物159(7.82g、80.
5%)を得た。この構造を、LCMSおよび31P NMR分析によって確認した。
マー化合物160を調製した。化合物159の3つの単位を固体支持体に、続いて、ヌク
レオチドホスホラミダイトにカップリングした。保護されたオリゴマー化合物をアンモニ
ア水で処理して、化合物160を得た。共役基GalNAc3-9のGalNAc3クラ
スター部分(GalNAc3-9a)を任意の切断可能な部分と組み合わせて、様々な共
役基を得ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O
)(OH)-Ad-P(=O)(OH)-である。GalNAc3-9(GalNAc3
-9a-CM)の構造を以下に示す。
ための代替手順
ノプロパン(1当量)と反応させて、アルコール162aまたは162bを得た。非保護
プロパンジアミンを上述の反応で用いた場合、過剰なジアミンを高真空下で蒸発させて除
去し、CbzClを用いて162a中の遊離アミノ基を保護して、カラムクロマトグラフ
ィーによって精製した後に、白色の固体として162bを得た。アルコール162bをT
MSOTfの存在下で化合物4とさらに反応させ163aを得て、触媒水素化を用いてC
bz基を除去することにより、これを163bに変換した。ペンタフルオロフェニル(P
FP)エステル164を、三酸113(実施例48を参照のこと)をDMF(0.1~0
.5M)中のPFPTFA(3.5当量)およびピリジン(3.5当量)と接触させるこ
とによって調製した。トリエステル164をアミン163b(3~4当量)およびDIP
EA(3~4当量)と直接反応させて、化合物18を得た。上述の方法は、中間体精製を
大幅に促進し、実施例4に記載される手順を用いて形成される副生成物の形成を最小限に
抑える。
実施例54:化合物18(GalNAc3-1aおよびGalNAc3-3a)の調製の
ための代替手順
製し、モノBoc保護ジアミンと反応させて、本質的に定量的な収率で165を得た。B
oc基を塩酸またはトリフルオロ酢酸で除去して、トリアミンを得て、これをDIPEA
等の好適な塩基の存在下でPFP活性化酸166と反応させて、化合物18を得た。
することにより、PFP保護Gal-NAc酸166を対応する酸から調製した。次いで
、アセトニトリルおよび水中のTEMPO(0.2当量)およびBAIBを用いて酸化す
ることにより、前駆酸を対応するアルコールから調製した。先の実施例47に記載される
条件を用いて1,6-ヘキサンジオール(または1,5-ペンタンジオールもしくは他の
n値の他のジオール)(2~4当量)およびTMSOTfと反応させることにより、前駆
アルコールを糖中間体4から調製した。
実施例55:生体内におけるSRB-1を標的とする3’-共役基または5’-共役基の
いずれかを含むオリゴヌクレオチドの用量依存的試験(GalNAc3-1、3、8、お
よび9の比較)
B-1のアンチセンス阻害について試験した。非共役ISIS 353382を標準物と
して含めた。様々なGalNAc3共役基の各々を、ホスホジエステル結合2’-デオキ
シアデノシンヌクレオシドの切断可能な部分によってそれぞれのオリゴヌクレオチドの3
’末端または5’末端のいずれかに結合させた。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
、先の実施例52に示した。GalNAc3-3の構造は、先の実施例39に示した。G
alNAc3-8の構造は、先の実施例47に示した。
処理
arbor,ME)に、ISIS 353382、655861、664078、661
161、665001、または生理食塩水を、以下に示される投与量で1回、皮下注入し
た。各処理群は、4匹の動物から成った。最終投与の72時間後にマウスを屠殺して、標
準のプロトコルに従ってリアルタイムPCRおよびRIBOGREEN(登録商標)RN
A定量化試薬(Molecular Probes,Inc.Eugene,OR)を用
いて、肝臓におけるSRB-1 mRNAレベルを決定した。以下の結果を、生理食塩水
(対照)に規準化された各処理群のSRB-1 mRNAレベルの平均パーセントとして
提示する。
様式でSRB-1 mRNAレベルを低下させた。実際には、3’末端にホスホジエステ
ル結合GalNAc3-1およびGalNAc3-9共役体(ISIS 655861お
よびISIS 664078)ならびに5’末端に連結されたGalNAc3-3および
GalNAc3-8共役体(ISIS 661161およびISIS 665001)を
含むアンチセンスオリゴヌクレオチドは、非共役アンチセンスオリゴヌクレオチド(IS
IS 353382)と比較して、強度の大幅な改善を示した。さらに、3’末端にGa
lNAc3-9共役体を含むISIS 664078は、3’末端にGalNAc3-1
共役体を含むISIS 655861と比較して、本質的に等効力であった。それぞれ、
GalNAc3-3またはGalNAc3-9を含む5’共役アンチセンスオリゴヌクレ
オチドISIS 661161およびISIS 665001は、3’共役アンチセンス
オリゴヌクレオチド(ISIS 655861およびISIS 664078)と比較し
て、強度を増加させた。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。総ビリルビンおよ
びBUNも評価した。体重の変化を評価し、生理食塩水群との有意な変化は見られなかっ
た。ALT、AST、総ビリルビン、およびBUN値を、以下の表に示す。
いずれかを含むオリゴヌクレオチドの用量依存的試験(GalNAc3-1、2、3、5
、6、7、および10の比較)
B-1のアンチセンス阻害について試験した。非共役ISIS 353382を標準物と
して含めた。3’末端にGalNAc3共役基を結合させたISIS 655861を除
いて、様々なGalNAc3共役基の各々を、ホスホジエステル結合2’-デオキシアデ
ノシンヌクレオシドの切断可能な部分によってそれぞれのオリゴヌクレオチドの5’末端
に結合させた。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
は、先の実施例37に示した。GalNAc3-3aの構造は、先の実施例39に示した
。GalNAc3-5aの構造は、先の実施例49に示した。GalNAc3-6aの構
造は、先の実施例51に示した。GalNAc3-7aの構造は、先の実施例48に示し
た。GalNAc3-10aの構造は、先の実施例46に示した。
処理
arbor,ME)に、ISIS 353382、655861、664507、661
161、666224、666961、666981、666881、または生理食塩水
を、以下に示される投与量で1回皮下注入した。各処理群は、4匹の動物から成った。最
終投与の72時間後にマウスを屠殺して、標準のプロトコルに従ってリアルタイムPCR
およびRIBOGREEN(登録商標)RNA定量化試薬(Molecular Pro
bes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1 mRNAレ
ベルを決定した。以下の結果を、生理食塩水(対照)に規準化された各処理群のSRB-
1 mRNAレベルの平均パーセントとして提示する。
様式でSRB-1 mRNAレベルを低下させた。実際には、共役アンチセンスオリゴヌ
クレオチドは、非共役アンチセンスオリゴヌクレオチド(ISIS 353382)と比
較して、強度の大幅な改善を示した。5’共役アンチセンスオリゴヌクレオチドは、3’
共役アンチセンスオリゴヌクレオチドと比較して、強度のわずかな増加を示した。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。総ビリルビンおよ
びBUNも評価した。体重の変化を評価し、生理食塩水群との有意な変化は見られなかっ
た。ALT、AST、総ビリルビン、およびBUN値を、以下の表44に示す。
クレオチドの作用持続時間試験
ド(血漿TG)レベルを42日間にわたって監視した。各群におけるヒトAPOC-II
Iを発現する3匹のトランスジェニックマウスを用いて、この試験を実行した。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
’-共役基の添加とともに増加した。共役完全PSオリゴヌクレオチド647535と比
較して、共役混合PO/PSオリゴヌクレオチド647536の作用持続時間がさらに増
加した。
実施例58:生体内におけるSRB-1を標的とする3’-共役基を含むオリゴヌクレオ
チドの用量依存的試験(GalNAc3-1およびGalNAc4-11の比較)
B-1のアンチセンス阻害について試験した。非共役ISIS 440762を非共役標
準物として含めた。共役基の各々を、ホスホジエステル結合2’-デオキシアデノシンヌ
クレオシドの切断可能な部分によってそれぞれのオリゴヌクレオチドの3’末端に結合さ
せた。
造GalNAcは、先の実施例50に示した。
処理
arbor,ME)に、ISIS 440762、651900、663748、または
生理食塩水を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物か
ら成った。最終投与の72時間後にマウスを屠殺して、標準のプロトコルに従ってリアル
タイムPCRおよびRIBOGREEN(登録商標)RNA定量化試薬(Molecul
ar Probes,Inc.Eugene,OR)を用いて、肝臓におけるSRB-1
mRNAレベルを決定した。以下の結果を、生理食塩水(対照)に規準化された各処理
群のSRB-1 mRNAレベルの平均パーセントとして提示する。
様式でSRB-1 mRNAレベルを低下させた。3’末端にホスホジエステル結合Ga
lNAc3-1およびGalNAc4-11共役体を含むアンチセンスオリゴヌクレオチ
ド(ISIS 651900およびISIS 663748)は、非共役アンチセンスオ
リゴヌクレオチド(ISIS 440762)と比較して、強度の大幅な増加を示した。
2個の共役オリゴヌクレオチド、GalNAc3-1およびGalNAc4-11は、等
効力であった。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「k」は、6’-(S)-C
H3二環式ヌクレオシドを示し、「d」は、β-D-2’-デオキシリボヌクレオシドを
示し、「s」は、ホスホロチオエートヌクレオシド間結合(PS)を示し、「o」は、ホ
スホジエステルヌクレオシド間結合(PO)を示し、「o’」は、-O-P(=O)(O
H)-を示す。共役基は、太字で表示されている。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。総ビリルビンおよ
びBUNも評価した。体重の変化を評価し、生理食塩水群との有意な変化は見られなかっ
た。ALT、AST、総ビリルビン、およびBUN値を、以下の表48に示す。
Iのアンチセンス阻害について試験した。ISIS 404071を非共役標準物として
含めた。共役基の各々を、ホスホジエステル結合2’-デオキシアデノシンヌクレオシド
の切断可能な部分によってそれぞれのオリゴヌクレオチドの3’末端に結合させた。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
処理
arbor,ME)に、ISIS 404071、656172、656173、または
PBS処理対照を、以下に示される投与量で週2回3週間、皮下注入した。各処理群は、
4匹の動物から成った。最終投与の72時間後にマウスを屠殺して、標準のプロトコルに
従ってリアルタイムPCRおよびRIBOGREEN(登録商標)RNA定量化試薬(M
olecular Probes,Inc.Eugene,OR)を用いて、肝臓におけ
るFXI mRNAレベルを決定した。ELISAを用いて血漿FXIタンパク質レベル
も測定した。PBS処理対照に規準化する前に(RIBOGREEN(登録商標)を用い
て)FXI mRNAレベルを全RNAに対して相対的に決定した。以下の結果を、各処
理群のFXI mRNAレベルの平均パーセントとして提示する。データをPBS処理対
照に規準化し、「%PBS」で表示する。前記方法と同様の方法を用いてED50を測定
し、以下に提示する。
様式でFXI mRNAレベルを低下させた。3’-GalNAc3-1共役基を含むオ
リゴヌクレオチドは、非共役アンチセンスオリゴヌクレオチド(ISIS 404071
)と比較して、強度の大幅な増加を示した。PS結合のうちのいくつかをPO(ISIS
656173)と置き換えることによって、これら2個の共役オリゴヌクレオチドの間
で強度の増加がさらに提供された。
的様式でFXIタンパク質レベルを低下させた。3’-GalNAc3-1共役基を含む
オリゴヌクレオチドは、非共役アンチセンスオリゴヌクレオチド(ISIS 40407
1)と比較して、強度の大幅な増加を示した。PS結合のうちのいくつかをPO(ISI
S 656173)と置き換えることによって、これら2個の共役オリゴヌクレオチドの
間で強度の増加がさらに提供された。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。総ビリルビン、総
アルブミン、CRE、およびBUNも評価した。体重の変化を評価し、生理食塩水群との
有意な変化は見られなかった。ALT、AST、総ビリルビン、およびBUN値を、以下
の表に示す。
おけるSRB-1のアンチセンス阻害について試験した。ISIS 353382を非共
役標準物として含めた。共役基の各々を、ホスホジエステル結合2’-デオキシアデノシ
ンヌクレオシドの切断可能な部分によってそれぞれのオリゴヌクレオチドの3’末端また
は5’末端に結合させた。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
は、先の実施例39に示した。GalNAc3-8aの構造は、先の実施例47に示した
。GalNAc3-9aの構造は、先の実施例52に示した。GalNAc3-6aの構
造は、先の実施例51に示した。GalNAc3-2aの構造は、先の実施例37に示し
た。GalNAc3-10aの構造は、先の実施例46に示した。GalNAc3-5a
の構造は、先の実施例49に示した。GalNAc3-7aの構造は、先の実施例48に
示した。
処理
ングし、かつ0.03、0.08、0.24、0.74、2.22、6.67、または2
0nMの修飾オリゴヌクレオチドで処理した初代マウス肝細胞において生体外で試験した
。約16時間の処理期間後、RNAを細胞から単離し、mRNAレベルを定量的リアルタ
イムPCRで測定し、RIBOGREEN(登録商標)で測定された総RNA含有量に従
ってSRB-1 mRNAレベルを調整した。
レオチドの細胞への進入を人工的に促進するために試薬も電気穿孔技法も用いない遊離取
り込み条件下で、GalNAc共役体を含むオリゴヌクレオチドは、GalNAc共役体
を含まない親オリゴヌクレオチド(ISIS 353382)よりも肝細胞において著し
く強力であったことを示す。
を化合物171に添加することによって化合物172を調製した。PFP-TFAおよび
DIEAをDMF中の5-(ベンジルオキシ)-5-オキソペンタン酸に添加することに
よって、ベンジル(ペルフルオロフェニル)グルタレートを調製した。実施例46に例証
される一般的手順を用いて、GalNAc3-12共役基を含むオリゴマー化合物175
を化合物174から調製した。共役基GalNAc3-12のGalNAc3クラスター
部分(GalNAc3-12a)を任意の切断可能な部分と組み合わせて、様々な共役基
を得ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O)(
OH)-Ad-P(=O)(OH)-である。GalNAc3-12(GalNAc3-
12a-CM-)の構造を以下に示す。
される一般的手順を用いて、GalNAc3-13共役基を含むオリゴマー化合物180
を化合物177から調製した。共役基GalNAc3-13のGalNAc3クラスター
部分(GalNAc3-13a)を任意の切断可能な部分と組み合わせて、様々な共役基
を得ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O)(
OH)-Ad-P(=O)(OH)-である。GalNAc3-13(GalNAc3-
13a-CM-)の構造を以下に示す。
を用いて、GalNAc3-14共役基を含むオリゴマー化合物188を化合物187か
ら調製した。共役基GalNAc3-14のGalNAc3クラスター部分(GalNA
c3-14a)を任意の切断可能な部分と組み合わせて、様々な共役基を得ることができ
る。ある特定の実施形態において、切断可能な部分は、-P(=O)(OH)-Ad-P
(=O)(OH)-である。GalNAc3-14(GalNAc3-14a-CM-)
の構造を以下に示す。
物195を調製した。標準のオリゴヌクレオチド合成手順を用いて、GalNAc3-1
5共役基を含むオリゴマー化合物197を化合物194および195から調製した。共役
基GalNAc3-15のGalNAc3クラスター部分(GalNAc3-15a)を
任意の切断可能な部分と組み合わせて、様々な共役基を得ることができる。ある特定の実
施形態において、切断可能な部分は、-P(=O)(OH)-Ad-P(=O)(OH)
-である。GalNAc3-15(GalNAc3-15a-CM-)の構造を以下に示
す。
チドの用量依存的試験(GalNAc3-3、12、13、14、および15の比較)
B-1のアンチセンス阻害について試験した。非共役ISIS 353382を標準物と
して含めた。GalNAc3共役基の各々を、ホスホジエステル結合2’-デオキシアデ
ノシンヌクレオシドの切断可能な部分によってそれぞれのオリゴヌクレオチドの5’末端
に結合させた。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
構造は、先の実施例61に示した。GalNAc3-13aの構造は、先の実施例62に
示した。GalNAc3-14aの構造は、先の実施例63に示した。GalNAc3-
15aの構造は、先の実施例64に示した。
処理
Harbor,ME)に、ISIS 353382、661161、671144、67
0061、671261、671262、または生理食塩水を、以下に示される投与量で
1回または2回、皮下注入した。2回投与されたマウスは、第1の投与の3日後に第2の
投与を受けた。各処理群は、4匹の動物から成った。最終投与の72時間後にマウスを屠
殺して、標準のプロトコルに従ってリアルタイムPCRおよびRIBOGREEN(登録
商標)RNA定量化試薬(Molecular Probes,Inc.Eugene,
OR)を用いて、肝臓におけるSRB-1 mRNAレベルを決定した。以下の結果を、
生理食塩水(対照)に規準化された各処理群のSRB-1 mRNAレベルの平均パーセ
ントとして提示する。
様式でSRB-1 mRNAレベルを低下させた。単回用量を受けた動物と2回の用量を
受けた動物との間で標的ノックダウンの著しい差は観察されなかった(ISIS 353
382の投与量30および2×15mg/kg、ならびにISIS 661161の投与
量5および2×2.5mg/kgを参照のこと)。ホスホジエステル結合GalNAc3
-3、12、13、14、および15共役体を含むアンチセンスオリゴヌクレオチドは、
非共役アンチセンスオリゴヌクレオチド(ISIS 335382)と比較して、強度の
大幅な増加を示した。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。総ビリルビンおよ
びBUNも評価した。体重の変化を評価し、生理食塩水群との有意な差は見られなかった
(データ示されず)。ALT、AST、総ビリルビン、およびBUN値を、以下の表56
に示す。
レオチドによる生体内におけるアンチセンス阻害への様々な切断可能な部分の影響
B-1のアンチセンス阻害について試験した。GalNAc3共役基の各々を、ホスホジ
エステルの連結したヌクレオシドの切断可能な部分(CM)によってそれぞれのオリゴヌ
クレオチドの5’末端に結合させた。
付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」は、β-D-2’-デ
オキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌクレオシド間結合(P
S)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)を示し、「o’」
は、-O-P(=O)(OH)-を示す。共役基は、太字で表示されている。
構造は、先の実施例62に示した。
処理
Harbor,ME)に、ISIS 661161、670699、670700、67
0701、671165、または生理食塩水を、以下に示される投与量で1回、皮下注入
した。各処理群は、4匹の動物から成った。最終投与の72時間後にマウスを屠殺して、
標準のプロトコルに従ってリアルタイムPCRおよびRIBOGREEN(登録商標)R
NA定量化試薬(Molecular Probes,Inc.Eugene,OR)を
用いて、肝臓におけるSRB-1 mRNAレベルを決定した。以下の結果を、生理食塩
水(対照)に規準化された各処理群のSRB-1 mRNAレベルの平均パーセントとし
て提示する。
様式でSRB-1 mRNAレベルを低下させた。様々な切断可能な部分を含むアンチセ
ンスオリゴヌクレオチドはすべて、同様の強度を示した。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。総ビリルビンおよ
びBUNも評価した。体重の変化を評価し、生理食塩水群との有意な差は見られなかった
(データ示されず)。ALT、AST、総ビリルビン、およびBUN値を、以下の表56
に示す。
むオリゴマー化合物199を調製する。共役基GalNAc3-16のGalNAc3ク
ラスター部分(GalNAc3-16a)を任意の切断可能な部分と組み合わせて、様々
な共役基を得ることができる。ある特定の実施形態において、切断可能な部分は、-P(
=O)(OH)-Ad-P(=O)(OH)-である。GalNAc3-16(GalN
Ac3-16a-CM-)の構造を以下に示す。
ゴマー化合物200を調製した。GalNAc3-17のGalNAc3クラスター部分
(GalNAc3-17a)を任意の切断可能な部分と組み合わせて、様々な共役基を得
ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O)(OH
)-Ad-P(=O)(OH)-である。GalNAc3-17(GalNAc3-17
a-CM-)の構造を以下に示す。
ゴマー化合物201を調製した。共役基GalNAc3-18のGalNAc3クラスタ
ー部分(GalNAc3-18a)を任意の切断可能な部分と組み合わせて、様々な共役
基を得ることができる。ある特定の実施形態において、切断可能な部分は、-P(=O)
(OH)-Ad-P(=O)(OH)-である。GalNAc3-18(GalNAc3
-18a-CM-)の構造を以下に示す。
ゴマー化合物204を化合物64から調製した。共役基GalNAc3-19のGalN
Ac3クラスター部分(GalNAc3-19a)を任意の切断可能な部分と組み合わせ
て、様々な共役基を得ることができる。ある特定の実施形態において、切断可能な部分は
、-P(=O)(OH)-Ad-P(=O)(OH)-である。GalNAc3-19(
GalNAc3-19a-CM-)の構造を以下に示す。
することによって調製したアセトニトリル中の6-(2,2,2-トリフルオロアセトア
ミド)ヘキサン酸に添加することによって、化合物205を調製した。反応混合物を80
℃に加熱し、その後、室温まで下げた。実施例52に例証される一般的手順を用いて、G
alNAc3-20共役基を含むオリゴマー化合物210を化合物208から調製した。
共役基GalNAc3-20のGalNAc3クラスター部分(GalNAc3-20a
)を任意の切断可能な部分と組み合わせて、様々な共役基を得ることができる。ある特定
の実施形態において、切断可能な部分は、-P(=O)(OH)-Ad-P(=O)(O
H)-である。GalNAc3-20(GalNAc3-20a-CM-)の構造を以下
に示す。
alNAc3-21共役基を含むオリゴマー化合物215を化合物213から調製した。
共役基GalNAc3-21のGalNAc3クラスター部分(GalNAc3-21a
)を任意の切断可能な部分と組み合わせて、様々な共役基を得ることができる。ある特定
の実施形態において、切断可能な部分は、-P(=O)(OH)-Ad-P(=O)(O
H)-である。GalNAc3-21(GalNAc3-21a-CM-)の構造を以下
に示す。
調製した。実施例52に例証される一般的手順を用いて、GalNAc3-21共役基を
含むオリゴマー化合物221を化合物220から調製する。共役基GalNAc3-22
のGalNAc3クラスター部分(GalNAc3-22a)を任意の切断可能な部分と
組み合わせて、様々な共役基を得ることができる。ある特定の実施形態において、切断可
能な部分は、-P(=O)(OH)-Ad-P(=O)(OH)-である。GalNAc
3-22(GalNAc3-22a-CM-)の構造を以下に示す。
チドによる生体内におけるアンチセンス阻害への様々な切断可能な部分の影響
B-1のアンチセンス阻害について試験した。GalNAc3共役基の各々を、それぞれ
のオリゴヌクレオチドの5’末端に結合させた。
ルシトシンを示す。下付き文字「e」は、2’-MOE修飾ヌクレオシドを示し、「d」
は、β-D-2’-デオキシリボヌクレオシドを示し、「s」は、ホスホロチオエートヌ
クレオシド間結合(PS)を示し、「o」は、ホスホジエステルヌクレオシド間結合(P
O)を示し、「o’」は、-O-P(=O)(OH)-を示す。共役基は、太字で表示さ
れている。
構造は、先の実施例68に示し、GalNAc3-18aの構造は、実施例69に示した
。
処理
Harbor,ME)に、表60に列記されるオリゴヌクレオチドまたは生理食塩水を
、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物から成った。最
終投与の72時間後にマウスを屠殺して、標準のプロトコルに従ってリアルタイムPCR
およびRIBOGREEN(登録商標)RNA定量化試薬(Molecular Pro
bes,Inc.Eugene,OR)を用いて、SRB-1 mRNAレベルを決定し
た。以下の結果を、生理食塩水(対照)に規準化された各処理群のSRB-1 mRNA
レベルの平均パーセントとして提示する。
様式でSRB-1 mRNAレベルを低下させた。GalNAc共役体を含むアンチセン
スオリゴヌクレオチドは、同様の強度を示し、GalNAc共役体を欠く親オリゴヌクレ
オチドよりも著しく強力であった。
LT)、およびアスパラギン酸アミノトランスフェラーゼ(AST)を、標準のプロトコ
ルを用いて、生理食塩水を注入したマウスに対して相対的に測定した。総ビリルビンおよ
びBUNも評価した。体重の変化を評価し、生理食塩水群との有意な変化は見られなかっ
た(データ示されず)。ALT、AST、総ビリルビン、およびBUN値を、以下の表6
2に示す。
上の表54、57、および60におけるASOのPKを評価した。肝臓試料を切り刻み、
標準のプロトコルを用いて抽出し、内部標準とともにIP-HPLC-MSによって分析
した。適切なUVピークを統合することによってすべての代謝物の合わせた組織レベル(
μg/g)を測定し、適切な抽出イオンクロマトグラム(EIC)を用いて、共役体(こ
の場合、ISIS番号353382の「親」)を欠く全長ASOの組織レベルを測定した
。
GalNAc3共役基を有しないオリゴヌクレオチドとの間の投薬の差を考慮に入れた場
合、オリゴヌクレオチド投与の72時間後に、GalNAc3共役基を含むオリゴヌクレ
オチドの肝臓組織レベルが、GalNAc3共役基を含まない親オリゴヌクレオチド(I
SIS 353382)の肝臓組織レベルよりも高かったことを示す。さらに、72時間
までに、GalNAc3共役基を含む各オリゴヌクレオチドの40~98%が親化合物に
代謝され、GalNAc3共役基がオリゴヌクレオチドから切断されたことを示す。
実施例76:GalNAc3-23を含むオリゴマー化合物230の調製
2をピリジン(500mL)中の塩化トシル(25.39g、0.13mol)で16時
間処理した。その後、反応物を蒸発させて油にし、EtOAc中に溶解し、水、飽和Na
HCO3、ブラインで洗浄し、Na2SO4上で乾燥させた。酢酸エチルを濃縮乾固させ
、カラムクロマトグラフィーによって精製し、EtOAc/ヘキサン(1:1)、続いて
、CH2Cl2中10%メタノールで溶出して、無色の油として化合物223を得た。L
CMSおよびNMRは、その構造と一致した。10g(32.86mmol)の1-トシ
ルトリエチレングリコール(化合物223)を、DMSO(100mL)中のアジ化ナト
リウム(10.68g、164.28mmol)で、室温で17時間処理した。その後、
反応混合物を水上に注ぎ、EtOAcで抽出した。有機層を水で3回洗浄し、Na2SO
4上で乾燥させた。有機層を濃縮乾固させて、5.3gの化合物224(92%)を得た
。LCMSおよびNMRは、その構造と一致した。1-アジドトリエチレングリコール(
化合物224、5.53g、23.69mmol)および化合物4(6g、18.22m
mol)を、4A分子篩(5g)およびジクロロメタン(100mL)中のTMSOTf
(1.65mL、9.11mmol)で、不活性雰囲気下で処理した。14時間後、反応
物を濾過して篩を除去し、有機層を飽和NaHCO3、水、ブラインで洗浄し、Na2S
O4上で乾燥させた。有機層を濃縮乾固させ、カラムクロマトグラフィーによって精製し
、ジクロロメタン中2~4%メタノールの勾配で溶出して、化合物225を得た。LCM
SおよびNMRは、その構造と一致した。化合物225(11.9g、23.59mmo
l)をパールマン触媒上で、EtOAc/メタノール(4:1、250mL)中で水素化
した。8時間後、触媒を濾去し、溶媒を除去乾固して、化合物226を得た。LCMSお
よびNMRは、その構造と一致した。
オン酸(4.17g、15.04mmol)およびヒューニッヒ塩基(10.3mL、6
0.17mmol)の溶液をペンタフルオロトリフルオロアセテート(9.05mL、5
2.65mmol)で液滴処理した。30分間後、反応物を氷水上に注ぎ、EtOAcで
抽出した。有機層を水、ブラインで洗浄し、Na2SO4上で乾燥させた。有機層を濃縮
乾固させ、その後、ヘプタンから再結晶化して、白色の固体として化合物227を得た。
LCMSおよびNMRは、その構造と一致した。化合物227(1.5g、1.93mm
ol)および化合物226(3.7g、7.74mmol)をアセトニトリル(15mL
)中で、室温で2時間撹拌した。その後、反応物を蒸発乾固し、カラムクロマトグラフィ
ーによって精製し、ジクロロメタン中2~10%メタノールの勾配で溶出して、化合物2
28を得た。LCMSおよびNMRは、その構造と一致した。化合物228(1.7g、
1.02mmol)をエタノール(100mL)中のラネーニッケル(約2g、湿性)で
、水素雰囲気下で処理した。12時間後、触媒を濾去し、有機層を蒸発させて固体にし、
これを次のステップで直接使用した。LCMSおよびNMRは、その構造と一致した。こ
の固体(0.87g、0.53mmol)をDMF(5mL)中のベンジルグルタル酸(
0.18g、0.8mmol)、HBTU(0.3g、0.8mmol)、およびDIE
A(273.7μL、1.6mmol)で処理した。16時間後、DMFを減圧下で65
℃で除去して油にし、この油をジクロロメタン中に溶解した。有機層を飽和NaHCO3
、ブラインで洗浄し、Na2SO4上で乾燥させた。有機層を蒸発させた後、化合物をカ
ラムクロマトグラフィーによって精製し、ジクロロメタン中2~20%メタノールの勾配
で溶出して、カップリング生成物を得た。LCMSおよびNMRは、その構造と一致した
。ベンジルエステルをパールマン触媒で、水素雰囲気下で1時間脱保護した。その後、こ
の触媒を濾去し、溶媒を除去乾固して、酸を得た。LCMSおよびNMRは、その構造と
一致した。酸(486mg、0.27mmol)を乾燥DMF(3mL)中に溶解した。
ピリジン(53.61μL、0.66mmol)を添加し、反応物をアルゴンでパージし
た。ペンタフルオロトリフルオロアセテート(46.39μL、0.4mmol)を反応
混合物に緩徐に添加した。反応物の色が淡黄色からワイン色に変化し、少しの煙を発し、
この煙をアルゴン流で吹き飛ばした。反応物を室温で1時間撹拌させた(反応の完了をL
CMSによって確認した)。この溶媒を減圧下(回転蒸発)で70℃で除去した。残渣を
DCMで希釈し、1N NaHSO4、ブライン、飽和重炭酸ナトリウム、および再度ブ
ラインで洗浄した。有機物をNa2SO4上で乾燥させ、濾過し、濃縮乾固させて、黄色
の脆性発泡体として225mgの化合物229を得た。LCMSおよびNMRは、その構
造と一致した。
ゴマー化合物230を化合物229から調製した。GalNAc3-23共役基のGal
NAc3クラスター部分(GalNAc3-23a)を任意の切断可能な部分と組み合わ
せて、様々な共役基を得ることができる。GalNAc3-23(GalNAc3-23
a-CM)の構造を以下に示す。
よる生体内におけるアンチセンス阻害
例39に示し、GalNAc3-9aは、実施例52に示し、GalNAc3-10aは
、実施例46に示し、GalNAc3-19aは、実施例70に示し、GalNAc3-
20aは、実施例71に示し、GalNAc3-23aは、実施例76に示した。
処理
Harbor,ME)の各々に、表64に列記されるオリゴヌクレオチドまたは生理食
塩水を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物から成っ
た。最終投与の72時間後にマウスを屠殺して、標準のプロトコルに従ってリアルタイム
PCRおよびRIBOGREEN(登録商標)RNA定量化試薬(Molecular
Probes,Inc.Eugene,OR)を用いて、SRB-1 mRNAレベルを
決定した。以下の結果を、生理食塩水(対照)に規準化された各処理群のSRB-1 m
RNAレベルの平均パーセントとして提示する。
トランスフェラーゼ(ALT)、およびアスパラギン酸アミノトランスフェラーゼ(AS
T)も測定した。総ビリルビンおよびBUNも評価した。体重の変化を評価し、生理食塩
水群との有意な変化は見られなかった(データ示されず)。ALT、AST、総ビリルビ
ン、およびBUN値を、以下の表66に示す。
クレオチドによる生体内におけるアンチセンス阻害
処理
ヌクレオチドまたはPBSを、以下に示される投与量で週1回、合計3回の投与で、皮下
注入した。各処理群は、4匹の動物から成った。最終投与の72時間後にラットを屠殺し
た。標準のプロトコルに従ってリアルタイムPCRおよびRIBOGREEN(登録商標
)RNA定量化試薬(Molecular Probes,Inc.Eugene,OR
)を用いて、肝臓におけるAGT mRNAレベルを決定した。全アンギオテンシノーゲ
ンELISA(カタログ番号JP27412、IBL International,T
oronto,ON)を用いて、1:20,000で希釈したAGT血漿タンパク質レベ
ルを測定した。以下の結果を、PBS対照に規準化された各処理群の肝臓におけるAGT
mRNAレベルまたは血漿におけるAGTタンパク質レベルの平均パーセントとして提
示する。
様式で肝臓におけるAGT mRNAおよび血漿タンパク質レベルを低下させ、GalN
Ac共役体を含むオリゴヌクレオチドは、GalNAc共役体を欠く親オリゴヌクレオチ
ドよりも著しく強力であった。
ンアミノトランスフェラーゼ(ALT)、およびアスパラギン酸アミノトランスフェラー
ゼ(AST)、ならびに体重も測定した。結果を以下の表69に示す。
チドの生体内における作用持続時間
例39に示し、GalNAc3-7aは、実施例48に示し、GalNAc3-10aは
、実施例46に示し、GalNAc3-13aは、実施例62に示した。
処理
70に列記されるオリゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、3
匹の動物から成った。投薬前に血液を採取して、ベースライン、ならびに投与後72時間
、1週間、2週間、3週間、4週間、5週間、および6週間時点のレベルを決定した。実
施例20に記載されるように、血漿トリグリセリドおよびAPOC-IIIタンパク質レ
ベルを測定した。以下の結果を、ベースラインレベルに規準化された各処理群の血漿トリ
グリセリドおよびAPOC-IIIレベルの平均パーセントとして提示し、親オリゴヌク
レオチドの投与量がGalNAc共役基を含むオリゴヌクレオチドの投与量の3倍であっ
たにもかかわらず、GalNAc共役基を含むオリゴヌクレオチドが共役基(ISIS
304801)を有しない親オリゴヌクレオチドよりも長い作用持続時間を示したことを
示す。
例39に示し、GalNAc3-7aは、実施例48に示し、GalNAc3-10aは
、実施例46に示し、GalNAc3-13aは、実施例62に示した。
処理
Harbor,ME)の各々に、表72に列記されるオリゴヌクレオチドまたはPBSを
、以下に示される投与量で週1回、合計3回の投与で、皮下注入した。各処理群は、4匹
の動物から成った。最終投与の72時間後にマウスを屠殺した。標準のプロトコルに従っ
てリアルタイムPCRおよびRIBOGREEN(登録商標)RNA定量化試薬(Mol
ecular Probes,Inc.Eugene,OR)を用いて、肝臓におけるA
1AT mRNAレベルを決定した。マウスα1-抗トリプシンELISA(カタログ番
号41-A1AMS-E01、Alpco,Salem,NH)を用いて、A1AT血漿
タンパク質レベルを決定した。以下の結果を、PBS対照に規準化された各処理群の肝臓
におけるA1AT mRNAおよび血漿タンパク質レベルの平均パーセントとして提示す
る。
様式で肝臓におけるA1AT mRNAおよびA1AT血漿タンパク質レベルを低下させ
た。GalNAc共役体を含むオリゴヌクレオチドは、親(ISIS 476366)よ
りも著しく強力であった。
ベルを測定した。体重および臓器重量も測定した。結果を以下の表74に示す。体重を、
ベースラインと比較した%として示す。臓器重量を、PBS対照群と比較した体重の%と
して示す。
の生体内における作用持続時間
持続時間について試験した。
処理
たはPBSを1回皮下注入した。各処理群は、4匹の動物から成った。投薬の前日に血液
を採取して、ベースライン、ならびに投与後5、12、19、および25日時点のレベル
を決定した。ELISAを用いて血漿A1ATタンパク質レベルを測定した(実施例80
を参照のこと)。以下の結果を、ベースラインレベルに規準化された各処理群の血漿A1
ATタンパク質レベルの平均パーセントとして提示する。結果は、GalNAc共役体を
含むオリゴヌクレオチドがGalNAc共役体を欠く親(ISIS 476366)より
も強力であり、かつより長い作用持続時間を有したことを示す。さらに、5’-GalN
Ac共役体を含むオリゴヌクレオチド(ISIS 678381、678382、678
383、および678384)は、概して、3’-GalNAc共役体を含むオリゴヌク
レオチド(ISIS 656326)よりもさらに強力であり、さらに長い作用持続時間
を有した。
よる生体外におけるアンチセンス阻害
トに播種した。表76に列記されるオリゴヌクレオチドをウィリアムE培地に2、10、
50、または250nMで添加し、細胞を37℃、5%CO2で一晩インキュベートした
。オリゴヌクレオチド添加の16時間後に細胞を溶解し、RNease 3000 Bi
oRobot(Qiagen)を用いて全RNAを精製した。標準のプロトコルに従って
リアルタイムPCRおよびRIBOGREEN(登録商標)RNA定量化試薬(Mole
cular Probes,Inc.Eugene,OR)を用いて、SRB-1 mR
NAレベルを決定した。Prism 4ソフトウェア(GraphPad)を用いて、I
C50値を決定した。結果は、様々な異なるGalNAc共役基および様々な異なる切断
可能な部分を含むオリゴヌクレオチドが、生体外遊離取り込み実験において、GalNA
c共役基を欠く親オリゴヌクレオチド(ISIS 353382および666841)よ
りも著しく強力であることを示す。
例39に示し、GalNAc3-5aは、実施例49に示し、GalNAc3-6aは、
実施例51に示し、GalNAc3-7aは、実施例48に示し、GalNAc3-8a
は、実施例47に示し、GalNAc3-9aは、実施例52に示し、GalNAc3-
10aは、実施例46に示し、GalNAc3-12aは、実施例61に示し、GalN
Ac3-13aは、実施例62に示し、GalNAc3-14aは、実施例63に示し、
GalNAc3-15aは、実施例64に示し、GalNAc3-17aは、実施例68
に示し、GalNAc3-18aは、実施例69に示し、GalNAc3-19aは、実
施例70に示し、GalNAc3-20aは、実施例71に示し、GalNAc3-23
aは、実施例76に示した。
実施例83:GalNAc3クラスターを含む第XI因子を標的とするオリゴヌクレオチ
ドによる生体内におけるアンチセンス阻害
例39に示し、GalNAc3-7aは、実施例48に示し、GalNAc3-10aは
、実施例46に示し、GalNAc3-13aは、実施例62に示した。
処理
以下に示される投与量で週1回、合計3回の投与で、皮下注入した。各処理群は、4匹の
動物から成った。最終投与の72時間後にマウスを屠殺した。リアルタイムPCRを用い
て肝臓における第XI因子mRNAレベルを測定し、標準のプロトコルに従ってシクロフ
ィリンに規準化した。肝臓トランスアミナーゼ、BUN、およびビリルビンも測定した。
以下の結果を、PBS対照に規準化された各処理群の平均パーセントとして提示する。
様式で肝臓における第XI因子mRNAを低下させた。結果は、GalNAc共役体を含
むオリゴヌクレオチドが、GalNAc共役体を欠く親(ISIS 404071)より
も強力であったことを示す。さらに、5’-GalNAc共役体を含むオリゴヌクレオチ
ド(ISIS 663086、678347、678348、および678349)は、
3’-GalNAc共役体を含むオリゴヌクレオチド(ISIS 656173)よりも
さらに強力であった。
生体内における作用持続時間
持続時間について試験した。
処理
1回皮下注入した。各処理群は、4匹の動物から成った。投薬の前日に尾出血によって血
液を採取して、ベースライン、ならびに投与後3、10、および17日間時点のレベルを
決定した。R & D Systems(Minneapolis,MN)の第XI因子
捕捉およびビオチン化検出抗体(それぞれ、カタログ番号AF2460およびBAF24
60)、ならびにOptEIA試薬セットB(カタログ番号550534、BD Bio
sciences,San Jose,CA)を用いて、第XI因子血漿タンパク質レベ
ルをELISAによって測定した。以下の結果を、ベースラインレベルに規準化された各
処理群の第XI因子血漿タンパク質レベルの平均パーセントとして提示する。結果は、G
alNAc共役体を含むオリゴヌクレオチドが、GalNAc共役体を欠く親(ISIS
404071)よりも強力であり、より長い作用持続時間を有したことを示す。さらに
、5’-GalNAc共役体を含むオリゴヌクレオチド(ISIS 663086、67
8347、678348、および678349)は、3’-GalNAc共役体を含むオ
リゴヌクレオチド(ISIS 656173)よりもさらに強力であり、さらに長い作用
持続時間を有した。
よる生体内におけるアンチセンス阻害
RB-1のアンチセンス阻害について試験した。
処理
または生理食塩水を、以下に示される投与量で週1回、合計3回の投与で、皮下注入した
。各処理群は、4匹の動物から成った。最終投与の48時間後にマウスを屠殺して、標準
のプロトコルに従ってリアルタイムPCRおよびRIBOGREEN(登録商標)RNA
定量化試薬(Molecular Probes,Inc.Eugene,OR)を用い
て、SRB-1 mRNAレベルを決定した。以下の結果を、生理食塩水(対照)に規準
化された各処理群の肝臓におけるSRB-1 mRNAレベルの平均パーセントとして提
示する。
および体重も測定した。各処理群の平均値を以下の表82に示す。
よる生体内におけるアンチセンス阻害
遺伝子を発現するトランスジェニックマウスにおけるヒトトランスサイレチン(TTR)
のアンチセンス阻害について試験した。
処理
レオチドおよび投与量またはPBSを、週1回3週間、合計3回の投与で、皮下注入した
。各処理群は、4匹の動物から成った。最終投与の72時間後にマウスを屠殺した。この
実験を通して様々な時点で尾出血を実行し、血漿TTRタンパク質、ALT、およびAS
Tレベルを測定し、表85~87に報告した。動物を屠殺した後、血漿ALT、AST、
およびヒトTTRレベルを測定し、体重、臓器重量、および肝臓におけるヒトTTR m
RNAレベルも測定した。臨床分析器(AU480、Beckman Coulter,
CA)を用いて、TTRタンパク質レベルを測定した。標準のプロトコルに従ってリアル
タイムPCRおよびRIBOGREEN(登録商標)RNA定量化試薬(Molecul
ar Probes,Inc.Eugene,OR)を用いて、肝臓におけるヒトTTR
mRNAレベルを決定した。表84~87に提示される結果は、各処理群の平均値であ
る。mRNAレベルは、PBS群の平均と比較した平均値である。血漿タンパク質レベル
は、ベースラインでのPBS群の平均値と比較した平均値である。体重は、個々の処理群
それぞれを屠殺するまでのベースラインからの平均体重変化率である。示される臓器重量
は、動物の体重に規準化されており、各処理群の平均規準化臓器重量を、PBS群の平均
規準化臓器重量と比較して提示する。
。表84および85に例証されるように、アンチセンスオリゴヌクレオチドでの処理は、
用量依存的様式でTTR発現レベルを低下させた。GalNAc共役体を含むオリゴヌク
レオチドは、GalNAc共役体を欠く親(ISIS 420915)よりも強力であっ
た。さらに、GalNAc共役体を含むオリゴヌクレオチドおよび混合PS/POヌクレ
オシド間結合は、GalNAc共役体および完全PS結合を含むオリゴヌクレオチドより
もさらに強力であった。
実施例9に示した。GalNAc3-3aの構造は、実施例39に示した。GalNAc
3-7aの構造は、実施例48に示した。GalNAc3-10aの構造は、実施例46
に示した。GalNAc3-13aの構造は、実施例62に示した。GalNAc3-1
9aの構造は、実施例70に示した。
単回投与による生体内における作用持続時間
験においてマウスにおける作用持続時間について試験した。ISIS番号420915、
682883、および682885(表83を参照のこと)も、単回投与試験においてマ
ウスにおける作用持続時間について試験した。
処理
gのISIS番号420915または13.5mg/kgのISIS番号660261を
1回皮下注入した。各処理群は、4匹の動物から成った。投薬前に尾出血を実行して、ベ
ースライン、ならびに投与後3、7、10、17、24、および39日目のレベルを決定
した。実施例86に記載されるように、血漿TTRタンパク質レベルを測定した。以下の
結果を、ベースラインレベルに規準化された各処理群の血漿TTRレベルの平均パーセン
トとして提示する。
処理
IS番号420915、10.0mg/kgのISIS番号682883、または10.
0mg/kgの682885を1回皮下注入した。各処理群は、4匹の動物から成った。
投薬前に尾出血を実行して、ベースライン、ならびに投与後3、7、10、17、24、
および39日目のレベルを決定した。実施例86に記載されるように、血漿TTRタンパ
ク質レベルを測定した。以下の結果を、ベースラインレベルに規準化された各処理群の血
漿TTRレベルの平均パーセントとして提示する。
共役体を欠く親オリゴヌクレオチド(ISIS 420915)よりも強力であり、より
長い作用持続時間を有することを示す。
実施例88:GalNAc3共役体を含むSMNを標的とするオリゴヌクレオチドによる
生体内におけるスプライシング調節
ols(Philomath,OR)によって生成された5’一次アミンを示し、Gal
NAc3-7bは、以下に示されるリンカーの-NH-C6-O部分を欠くGalNAc
3-7aの構造を示す。
あり、これら2個のオリゴヌクレオチドの各ヌクレオチドは、モルフォリノヌクレオチド
である。
処理
ゴヌクレオチドまたは生理食塩水を1回皮下注入した。各処理群は、2匹の雄および2匹
の雌から成った。投与の3日後にマウスを屠殺して、標準のプロトコルに従ってリアルタ
イムPCRを用いて、エキソン7を有する場合とエキソン7を有しない場合の肝臓におけ
るヒトSMN mRNAレベルを決定した。Ribogreen試薬を用いて総RNAを
測定した。SMN mRNAレベルを総mRNAに規準化し、生理食塩水処理群の平均に
さらに規準化した。結果として生じたエキソン7を含むSMN mRNAとエキソン7を
欠くSMN mRNAとの平均比を表91に示す。結果は、スプライシングを調節し、か
つGalNAc共役体を含む完全修飾オリゴヌクレオチドが、GlaNAc共役体を欠く
親オリゴヌクレオチドよりも肝臓におけるスプライシングの変化に著しく強力であること
を示す。さらに、この傾向は、2’-MOEおよびモルフォリノ修飾オリゴヌクレオチド
を含む複数の化学修飾において維持される。
とするオリゴヌクレオチドによる生体内におけるアンチセンス阻害
処理
Harbor,ME)の各々に、表92に列記されるオリゴヌクレオチドまたはPBSを
、以下に示される投与量で週1回、合計6回の投与で、皮下注入した。各処理群は、3~
4匹の動物から成った。第1の投与の前日に、かつ各投与後週1回、尾出血を実行して、
血漿Apo(a)タンパク質レベルを決定した。最終投与の2日後にマウスを屠殺した。
標準のプロトコルに従ってリアルタイムPCRおよびRIBOGREEN(登録商標)R
NA定量化試薬(Molecular Probes,Inc.Eugene,OR)を
用いて、肝臓におけるApo(a)mRNAレベルを決定した。ELISAを用いてAp
o(a)血漿タンパク質レベルを決定し、肝臓トランスアミナーゼレベルを決定した。表
93におけるmRNAおよび血漿タンパク質の結果を、PBS処理群と比較した処理群の
平均パーセントとして提示する。血漿タンパク質レベルをPBS群のベースライン(BL
)値にさらに規準化した。平均絶対トランスアミナーゼレベルおよび体重(ベースライン
平均と比較した%)が表94に報告される。
おけるApo(a)mRNAおよび血漿タンパク質レベルを低下させた。さらに、Gal
NAc共役体を含むオリゴヌクレオチドは、GalNAc共役体を欠く親オリゴヌクレオ
チドよりも著しく強力であり、より長い作用持続時間を有した。表94に例証されるよう
に、トランスアミナーゼレベルおよび体重はオリゴヌクレオチドの影響を受けず、オリゴ
ヌクレオチドが良好な耐容性を示したことを示す。
よる生体内におけるアンチセンス阻害
遺伝子を発現するトランスジェニックマウスにおけるヒトトランスサイレチン(TTR)
のアンチセンス阻害について試験した。
処理
よび投与量またはPBSを、週1回3週間、合計3回の投与で、皮下注入した。各処理群
は、4匹の動物から成った。第1の投与の前に、尾出血を実行して、ベースライン(BL
)での血漿TTRタンパク質レベルを決定した。最終投与の72時間後にマウスを屠殺し
た。臨床分析器(AU480、Beckman Coulter,CA)を用いて、TT
Rタンパク質レベルを測定した。標準のプロトコルに従ってリアルタイムPCRおよびR
IBOGREEN(登録商標)RNA定量化試薬(Molecular Probes,
Inc.Eugene,OR)を用いて、肝臓におけるヒトTTR mRNAレベルを決
定した。表96に提示される結果は、各処理群の平均値である。mRNAレベルは、PB
S群の平均と比較した平均値である。血漿タンパク質レベルは、ベースラインでのPBS
群の平均値と比較した平均値である。「BL」は、第1の投与の直前に測定したベースラ
インを示す。表96に例証されるように、アンチセンスオリゴヌクレオチドでの処理は、
用量依存的様式でTTR発現レベルを低下させた。GalNAc共役体を含むオリゴヌク
レオチドは、GalNAc共役体を欠く親(ISIS 420915)よりも強力であり
、ホスホジエステルまたはデオキシアデノシンの切断可能な部分を含むオリゴヌクレオチ
ドは、共役体を欠く親と比較して、強度の著しい改善を示した(ISIS番号68288
3および666943対420915、ならびに実施例86および87を参照のこと)。
、実施例39に示した。GalNAc3-7aの構造は、実施例48に示した。GalN
Ac3-10aの構造は、実施例46に示した。GalNAc3-13aの構造は、実施
例62に示した。
るオリゴヌクレオチドによる生体内におけるアンチセンス阻害
minal,dose escalation study)においてサルにおける第V
II因子のアンチセンス阻害について試験した。
処理
ヌクレオチドまたはPBSを、0、15、および29日目に皮下注入した。各処理群は、
4匹の雄および1匹の雌から成った。第1の投与の前とその後の様々な時点で、血液採取
を実行して、血漿第VII因子タンパク質レベルを決定した。ELISAによって第VI
I因子タンパク質レベルを測定した。表98に提示される結果は、第1の投与の直前に測
定したベースライン(BL)でのPBS群の平均値と比較した各処理群の平均値である。
表98に例証されるように、アンチセンスオリゴヌクレオチドでの処理は、用量依存的様
式で第VII因子の発現レベルを低下させ、GalNAc共役体を含むオリゴヌクレオチ
ドは、サルにおいてGalNAc共役体を欠くオリゴヌクレオチドよりも著しく強力であ
った。
は、実施例46に示した。
リゴヌクレオチドによる初代肝細胞におけるアンチセンス阻害
ApoC-IIIを標的とする表99に列記されるオリゴヌクレオチドを、0.46、1
.37、4.12、または12.35、37.04、111.11、もしくは333.3
3nMまたは1.00μmで添加した。オリゴヌクレオチドとともに24時間インキュベ
ートした後、細胞を溶解し、RNeasy(Qiagen)を用いて総RNAを精製した
。標準のプロトコルに従ってリアルタイムPCRおよびRIBOGREEN(登録商標)
RNA定量化試薬(Molecular Probes,Inc.)を用いて、ApoC
-III mRNAレベルを決定した。Prism 4ソフトウェア(GraphPad
)を用いて、IC50値を決定した。結果は、切断可能な部分がホスホジエステル結合デ
オキシアデノシンかホスホジエステル結合デオキシアデノシンかにかかわらず、GalN
Ac共役体を含むオリゴヌクレオチドが、共役体を欠く親オリゴヌクレオチドよりも著し
く強力であったことを示す。
例39に示し、GalNAc3-7aは、実施例48に示し、GalNAc3-10aは
、実施例46に示し、GalNAc3-13aは、実施例62に示し、GalNAc3-
19aは、実施例70に示した。
実施例93:混合ウィングおよび5’-GalNAc3共役体を含むSRB-1を標的と
するオリゴヌクレオチドによる生体内におけるアンチセンス阻害
は、先の実施例48に示した。下付き文字「e」は、2’-MOE修飾ヌクレオシドを示
し、「d」は、β-D-2’-デオキシリボヌクレオシドを示し、「k」は、6’-(S
)-CH3二環式ヌクレオシド(cEt)を示し、「s」は、ホスホロチオエートヌクレ
オシド間結合(PS)を示し、「o」は、ホスホジエステルヌクレオシド間結合(PO)
を示す。上付き文字「m」は、5-メチルシトシンを示す。
処理
Harbor,ME)に、表100に列記されるオリゴヌクレオチドまたは生理食塩水
を、以下に示される投与量で1回、皮下注入した。各処理群は、4匹の動物から成った。
最終投与の72時間後にマウスを屠殺した。リアルタイムPCRを用いて、肝臓における
SRB-1 mRNAレベルを測定した。標準のプロトコルに従って、SRB-1 mR
NAレベルをシクロフィリンmRNAレベルに規準化した。結果を、生理食塩水対照群と
比較した各処理群のSRB-1 mRNAレベルの平均パーセントとして提示する。表1
01に例証されるように、アンチセンスオリゴヌクレオチドでの処理は、用量依存的様式
でSRB-1 mRNAレベルを低下させ、GalNAc共役体を含み、かつ完全cEt
または混合糖修飾のいずれかのウィングを有するギャップマーオリゴヌクレオチドは、共
役体を欠き、かつ完全cEt修飾ウィングを含む親オリゴヌクレオチドよりも著しく強力
であった。
均値を表101に示す。体重を、オリゴヌクレオチド投与の直前に測定したベースライン
体重(%BL)と比較した平均体重率として示す。
するオリゴヌクレオチドによる生体内におけるアンチセンス阻害
ついては、実施例74を参照されたい。GalNAc3-3aの構造は、先の実施例39
に示し、GalNAc3-7aの構造は、先の実施例48に示した。
処理
示し、GalNAc共役体を含む2’-MOE修飾オリゴヌクレオチドと2’-OMe修
飾オリゴヌクレオチドとが両方ともに、共役体を欠くそれぞれの親オリゴヌクレオチドよ
りも著しく強力であったことを示す。体重、肝臓トランスアミナーゼ、総ビリルビン、お
よびBUNの測定結果は、これらの化合物がすべて良好な耐容性であったことを示した。
標的とするオリゴヌクレオチドによる生体内におけるアンチセンス阻害
’-O-CH2-4’橋を含むロックドヌクレオシドを示す。他の省略形については、実
施例74の表の説明文を参照されたい。GalNAc3-1aの構造は、先の実施例9に
示し、GalNAc3-3aの構造は、先の実施例39に示し、GalNAc3-7aの
構造は、先の実施例48に示した。
処理
示し、GalNAc共役体および様々な二環式ヌクレオシド修飾を含むオリゴヌクレオチ
ドが、共役体を欠くが二環式ヌクレオシド修飾を含む親オリゴヌクレオチドよりも著しく
強力であったことを示す。さらに、GalNAc共役体およびフルオロ-HNA修飾を含
むオリゴヌクレオチドは、共役体を欠くがフルオロ-HNA修飾を含む親よりも著しく強
力であった。体重、肝臓トランスアミナーゼ、総ビリルビン、およびBUNの測定結果は
、これらの化合物がすべて良好な耐容性であったことを示した。
ク質結合
先の実施例48に示した。
ロース膜、Millipore,Bedford,MA)を300μLの0.5%Twe
en 80で事前に条件付け、2000gで10分間遠心分離し、その後、H2O中30
0μLの300μg/mL対照オリゴヌクレオチド溶液で事前に条件付け、2000gで
16分間遠心分離した。これらの試験で用いる表70および106の各試験オリゴヌクレ
オチドのフィルターへの非特異的結合を評価するために、H2O中300μLの250n
g/mLオリゴヌクレオチド溶液(pH7.4)を事前に条件付けたフィルターに設置し
、2000gで16分間遠心分離した。ELISAアッセイによって濾過していない試料
および濾過した試料を分析して、オリゴヌクレオチド濃度を決定した。3つの複製物を用
いて各試料の平均濃度を得た。濾過していない試料と比較した濾過した試料の平均濃度を
用いて、血漿の不在下でフィルターによって回収されたオリゴヌクレオチドの割合(%回
収)を決定する。
K3-EDTA中に収集された凍結全血漿試料をBioreclamation LLC
(Westbury,NY)から購入した。試験オリゴヌクレオチドを、2つの濃度(5
μg/mLおよび150μg/mL)で血漿の1.2mLの一定分量に添加した。各スパ
イクした血漿試料の一定分量(300μL)を事前に条件付けられたフィルターユニット
内に設置し、37°Cで30分間インキュベートした直後に2000gで16分間遠心分
離した。ELISAによって、濾過してスパイクした血漿試料および濾過していないスパ
イクした血漿試料の一定分量を分析して、各試料中のオリゴヌクレオチドの濃度を決定し
た。1つの濃度毎に3つの複製物を用いて、各試料中の結合オリゴヌクレオチドおよび非
結合オリゴヌクレオチドの平均割合を決定した。濾過していない試料の濃度と比較した濾
過した試料の平均濃度を用いて、血漿タンパク質に結合されていない血漿中のオリゴヌク
レオチドの割合(%非結合)を決定する。各オリゴヌクレオチドの%非結合を%回収で割
ることによって、最終非結合オリゴヌクレオチド値を非特異的結合に対して補正する。最
終%非結合値を100から差し引くことによって、最終%結合オリゴヌクレオチド値を決
定する。各種の血漿において試験した2つの濃度のオリゴヌクレオチド(5μg/mLお
よび150μg/mL)の結果を表107に示す。結果は、GalNAc共役基が血漿タ
ンパク質結合に大きな影響を与えないことを示す。さらに、完全PSヌクレオシド間結合
を有するオリゴヌクレオチドも混合PO/PS結合を有するオリゴヌクレオチドも血漿タ
ンパク質に結合し、完全PS結合を有するオリゴヌクレオチドは、混合PO/PS結合を
有するオリゴヌクレオチドよりも若干高い程度に血漿タンパク質に結合する。
、実施例9に示した。GalNAc3-3aの構造は、実施例39に示した。GalNA
c3-7aの構造は、実施例48に示した。GalNAc3-10aの構造は、実施例4
6に示した。GalNAc3-13aの構造は、実施例62に示した。GalNAc3-
19aの構造は、実施例70に示した。
実施例98:hPMBCアッセイにおけるGalNAc共役体を含むオリゴヌクレオチド
の炎症誘発作用の評価
にhPMBCアッセイにおいて炎症誘発作用について試験した(オリゴヌクレオチドの説
明については、表30、83、95、および108を参照のこと)。ISIS 3535
12は、正の対照として用いられる高応答物であり、他のオリゴヌクレオチドは、表83
、95、および108に記載されるものである。1人の志願ドナー由来の血液を用いて表
109に示される結果を得た。結果は、混合PO/PSヌクレオシド間結合を含むオリゴ
ヌクレオチドが、完全PS結合を有する同一のオリゴヌクレオチドと比較して、著しく低
い炎症誘発応答をもたらしたことを示す。さらに、GalNAc共役基は、このアッセイ
において大きく影響しなかった。
レオチドの結合親和性
ゴヌクレオチドの説明については、表76を参照のこと)の結合親和性を、競合的受容体
結合アッセイにおいて試験した。競合相手のリガンドであるα1-酸糖タンパク質(AG
P)を、50mM酢酸ナトリウム緩衝液(pH5)中で1Uノイラミニダーゼ-アガロー
スとともに37℃で16時間インキュベートし、シアル酸アッセイまたはサイズ排除クロ
マトグラフィー(SEC)のいずれかで90%を超える脱シアル化を確認した。Atsm
a et al.(J Lipid Res.1991 Jan;32(1):173-
81を参照のこと)の手順に従って、一塩化ヨウ素を用いてAGPをヨウ素化した。この
方法において、脱シアル化α1-酸糖タンパク質(de-AGP)を、10mM塩化ヨウ
素、Na125I、および0.25M NaOH中の1Mグリシンに添加した。室温で1
0分間インキュベートした後、3 KDMWCOスピンカラムを利用してこの混合物を2
回濃縮することによって、125I標識de-AGPを遊離125Iから分離した。この
タンパク質を、Agilent SEC-3カラム(7.8×300mm)およびβ-R
AMカウンタを装備したHPLCシステムにおいて標識効率および純度について試験した
。125I標識de-AGPおよびASOを含有する様々なGalNAcクラスターを利
用した競合実験を以下の通りに実行した。ヒトHepG2細胞(106細胞/mL)を、
2mLの適切な成長培地中の6ウェルプレートにプレーティングした。10%ウシ胎児血
清(FBS)、2mM L-グルタミン、および10mM HEPESを補充したMEM
培地を用いた。細胞を、それぞれ、5%および10%CO2で、37℃で16~20時間
インキュベートした。実験前に細胞をFBSを有しない培地で洗浄した。細胞を、2%F
BSを有する適切な成長培地を含有する1mLの競合混合物、10-8M 125I標識
de-AGP、および10-11~10-5Mの範囲の濃度のASOを含有するGalN
Acクラスターとともに、37℃で30分間インキュベートした。10-2M GalN
Ac糖の存在下で非特異的結合を決定した。細胞をFBSを有しない培地で2回洗浄して
、非結合125I標識de-AGPおよび競合相手であるGalNAc ASOを除去し
た。1%β-メルカプトエタノールを含有するQiagenのRLT緩衝液を用いて、細
胞を溶解した。10分間の短時間凍結/解凍サイクル後に溶解物を丸底アッセイチューブ
に移し、γ-カウンタでアッセイした。非特異的結合を差し引いた後に、125Iタンパ
ク質カウントを最も低いGalNAc-ASO濃度カウントの値で割った。非線形回帰ア
ルゴリズムを用いた単一部位競合結合等式に従って阻害曲線を当てはめて、結合親和性(
KD)を計算した。
付いたオリゴヌクレオチドの結果は、2つの異なる日に実行した実験の平均である。結果
は、5’末端にGalNAc共役基を含むオリゴヌクレオチドがヒトHepG2細胞上の
アシアロ糖タンパク質受容体に結合し、3’末端にGalNAc共役基を含むオリゴヌク
レオチドよりも1.5~16倍高い親和性を有することを示す。
ゴヌクレオチドによる生体内におけるアンチセンス阻害
処理
されるオリゴヌクレオチドおよび投与量またはPBSを、週1回、合計6回の投与で、皮
下注入した。各処理群は、3匹の動物から成った。投薬の前日に血液を採取して、血漿中
のApo(a)タンパク質のベースラインレベル、ならびに第1の投与後72時間、1週
間、および2週間時点のレベルを決定した。第1の投与後3週間、4週間、5週間、およ
び6週間時点でさらに血液を採取する。ELISAを用いて血漿Apo(a)タンパク質
レベルを測定した。表111bにおける結果を、ベースラインレベル(%BL)に規準化
された各処理群の血漿Apo(a)タンパク質レベルの平均パーセントとして提示し、結
果は、GalNAc共役基を含むオリゴヌクレオチドがApo(a)発現の強力な減少を
示したことを示す。この強力な影響は、完全PSヌクレオシド間結合を含むオリゴヌクレ
オチドおよび混合POおよびPS結合を含むオリゴヌクレオチドにおいて観察された。
クレオチドによるアンチセンス阻害
現の阻害について試験した。C57Bl/6マウスの各々に、表112に列記されるオリ
ゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、4匹の動物から成った。
ISIS 440670で処理した各マウスは、2、6、20、または60mg/kgの
投与を受けた。ISIS 680772または696847で処理した各マウスは、0.
6、2、6、または20mg/kgを受けた。ISIS 696847のGalNAc共
役基は、安定した部分(容易に切断可能なホスホジエステル含有結合の代わりにホスホロ
チオエート結合)を介して連結されている。投与の72時間後に動物を屠殺した。リアル
タイムPCRを用いて、肝臓におけるAPOC-III mRNAレベルを測定した。標
準のプロトコルに従って、APOC-III mRNAレベルをシクロフィリンmRNA
レベルに規準化した。結果を、生理食塩水対照群と比較した各処理群のAPOC-III
mRNAレベルの平均パーセントとして表112に提示する。結果は、GalNAc共
役基を含むオリゴヌクレオチドが、共役基を欠くオリゴヌクレオチドよりも著しく強力で
あったことを示す。さらに、切断可能な部分を介してオリゴヌクレオチドに連結されたG
alNAc共役基を含むオリゴヌクレオチド(ISIS 680772)は、安定した部
分を介してオリゴヌクレオチドに連結されたGalNAc共役基を含むオリゴヌクレオチ
ド(ISIS 696847)よりもさらに強力であった。
実施例102:GalNAc共役体を含むアンチセンスオリゴヌクレオチドの肝臓におけ
る分布
GalNAc共役体を含むISIS 655861(表36を参照のこと)の肝臓におけ
る分布を評価した。雄balb/cマウスに、ISIS 353382または65586
1を、表113に列記される投与量で1回、皮下注入した。2匹の動物から成った18m
g/kgのISIS 655861群を除いて、各処理群は、3匹の動物から成った。投
与の48時間後に動物を屠殺して、オリゴヌクレオチドの肝臓における分布を決定した。
1細胞当たりのアンチセンスオリゴヌクレオチド分子の数を測定するために、ルテニウム
(II)トリス-ビピリジン標識(MSD TAG、Meso Scale Disco
very)を、アンチセンスオリゴヌクレオチドを検出するために用いるオリゴヌクレオ
チドプローブに共役させた。表113に提示される結果は、1細胞当たり何百万ものオリ
ゴヌクレオチド分子単位の各処理群のオリゴヌクレオチドの平均濃度である。結果は、等
価用量で、GalNAc共役体を含むオリゴヌクレオチドが、全肝臓および肝細胞におい
て、GalNAc共役体を含まないオリゴヌクレオチドよりも高い濃度で存在したことを
示す。さらに、GalNAc共役体を含むオリゴヌクレオチドは、非実質肝臓細胞におい
て、GalNAc共役体を含まないオリゴヌクレオチドよりも低い濃度で存在した。1細
胞当たりの肝細胞および非実質肝臓細胞におけるISIS 655861の濃度が同様で
あった一方で、肝臓は、約80体積%肝細胞であった。したがって、肝臓内に存在するI
SIS 655861オリゴヌクレオチドの大部分が肝細胞内に見られる一方で、肝臓内
に存在するISIS 353382オリゴヌクレオチドの大部分は、非実質肝臓細胞内に
見られた。
オチドの生体内における作用持続時間
例70に示した。
処理
記されるオリゴヌクレオチドまたはPBSを1回皮下注入した。各処理群は、3匹の動物
から成った。投薬前に血液を採取して、ベースライン、ならびに投与後3、7、14、2
1、28、35、および42日間のレベルを決定した。実施例20に記載されるように、
血漿トリグリセリドおよびAPOC-IIIタンパク質レベルを測定した。表115にお
ける結果を、ベースラインレベルに規準化された各処理群の血漿トリグリセリドおよびA
POC-IIIレベルの平均パーセントとして提示する。実施例79の表71における結
果と以下の表115における結果の比較は、ホスホジエステルヌクレオシド間結合および
ホスホロチオエートヌクレオシド間結合の両方を含むオリゴヌクレオチドが、ホスホロチ
オエートヌクレオシド間結合のみを含む等価オリゴヌクレオチドよりも増加した作用持続
時間を示したことを示す。
化合物120(1g、2.89mmol)、HBTU(0.39g、2.89mmol)
、およびHOBt(1.64g、4.33mmol)を、DMF(10mL)中に溶解し
、N,N-ジイソプロピルエチルアミン(1.75mL、10.1mmol)を添加した
。約5分後、アミノヘキサン酸ベンジルエステル(1.36g、3.46mmol)をこ
の反応物に添加した。3時間後、反応混合物を100mLの1M NaHSO4に注ぎ、
2×50mL酢酸エチルで抽出した。有機層を合わせ、3×40mL飽和NaHCO3お
よび2倍ブラインで洗浄し、Na2SO4で乾燥させ、濾過し、濃縮した。この生成物を
シリカゲルカラムクロマトグラフィー(DCM:EA:Hex=1:1:1)によって精
製して、化合物231を得た。LCMSおよびNMRは、その構造と一致した。化合物2
31(1.34g、2.438mmol)をジクロロメタン(10mL)中に溶解し、ト
リフルオロ酢酸(10mL)を添加した。室温で2時間撹拌した後、反応混合物を減圧下
で濃縮し、トルエン(3×10mL)と共蒸発させた。残渣を減圧下で乾燥させて、トリ
フルオロ酢酸塩として化合物232を得た。化合物166の合成は、実施例54に記載さ
れる。化合物166(3.39g、5.40mmol)をDMF(3mL)中に溶解した
。化合物232(1.3g、2.25mmol)の溶液をDMF(3mL)中に溶解し、
N,N-ジイソプロピルエチルアミン(1.55mL)を添加した。反応物を室温で30
分間撹拌し、その後、水(80mL)に注ぎ、水層をEtOAc(2×100mL)で抽
出した。有機相を分離し、飽和NaHCO3水溶液(3×80mL)、1M NaHSO
4(3×80mL)、およびブライン(2×80mL)で洗浄し、その後、乾燥させ(N
a2SO4)、濾過し、濃縮した。残渣をシリカゲルカラムクロマトグラフィーによって
精製して、化合物233を得た。LCMSおよびNMRは、その構造と一致した。化合物
233(0.59g、0.48mmol)をメタノール(2.2mL)および酢酸エチル
(2.2mL)中に溶解した。炭素上パラジウム(10重量%Pd/C、湿性、0.07
g)を添加し、反応混合物を水素雰囲気下で3時間撹拌した。セライトパッドを通して反
応混合物を濾過し、濃縮して、カルボン酸を得た。カルボン酸(1.32g、1.15m
mol、クラスター遊離酸)をDMF(3.2mL)中に溶解した。これに、N,N-ジ
イソプロピルエチルアミン(0.3mL、1.73mmol)およびPFPTFA(0.
30mL、1.73mmol)を添加した。室温で30分間撹拌した後、反応混合物を水
(40mL)に注ぎ、EtOAc(2×50mL)で抽出した。上述のように標準の後処
理を完了して、化合物234を得た。LCMSおよびNMRは、その構造と一致した。実
施例46に記載される一般的手順を用いて、オリゴヌクレオチド235を調製した。共役
基GalNAc2-24のGalNAc2クラスター部分(GalNAc2-24a)を
オリゴヌクレオチド上に存在する任意の切断可能な部分と組み合わせて、様々な共役基を
得ることができる。GalNAc2-24(GalNAc2-24a-CM)の構造を以
下に示す。
を用いて、オリゴヌクレオチド236を調製した。
a)をオリゴヌクレオチド上に存在する任意の切断可能な部分と組み合わせて、様々な共
役基を得ることができる。GalNAc1-25(GalNAc1-25a-CM)の構
造を以下に示す。
1を標的とするオリゴヌクレオチドによる生体内におけるアンチセンス阻害
ウスにおけるSRB-1のアンチセンス阻害について試験した。
処理
Harbor,ME)に、2、7、もしくは20mg/kgのISIS番号440762
;または0.2、0.6、2、6、もしくは20mg/kgのISIS番号686221
、686222、もしくは708561;または生理食塩水を1回皮下注入した。各処理
群は、4匹の動物から成った。最終投与の72時間後にマウスを屠殺した。リアルタイム
PCRを用いて、肝臓におけるSRB-1 mRNAレベルを測定した。標準のプロトコ
ルに従って、SRB-1 mRNAレベルをシクロフィリンmRNAレベルに規準化した
。アンチセンスオリゴヌクレオチドは、用量依存的様式でSRB-1 mRNAレベルを
低下させ、ED50結果を、表116および117に提示する。以前の研究において、三
価GalNAc共役オリゴヌクレオチドが二価GalNAc共役オリゴヌクレオチドより
も著しく強力であり、これは、次いで、一価GalNAc共役オリゴヌクレオチドよりも
著しく強力であったことが示されたが(例えば、Khorev et al.,Bioo
rg.& Med.Chem.,Vol.16,5216-5231(2008)を参照
のこと)、表116および117に示されるように、一価、二価、および三価GalNA
cクラスターを含むアンチセンスオリゴヌクレオチドでの処理は、同様の強度でSRB-
1 mRNAレベルを低下させた。
、実施例105に示した。
ヌクレオチドの濃度も評価した。以下の表117aおよび117bに示される結果は、肝
臓組織のオリゴヌクレオチド(μg)/g単位のUVによって測定された各処理群の平均
総アンチセンスオリゴヌクレオチド組織レベルである。結果は、GalNAc共役基を含
むオリゴヌクレオチドがGalNAc共役基を欠く同一の用量のオリゴヌクレオチドより
も著しく高いレベルで肝臓に蓄積したことを示す。さらに、それらのそれぞれの共役基に
1、2、または3個のGalNAcリガンドを含むアンチセンスオリゴヌクレオチドはす
べて同様のレベルで肝臓に蓄積した。上記のKhorev et al.の文献参照を考
慮すると、これは意外な結果であり、上の表116および117に示される活性データと
一致する。
クレオチドの合成
実施例15を参照のこと)と酸64(実施例32を参照のこと)とのカップリングによっ
て合成する。結果として生じたアミド含有化合物をホスフィチル化し、その後、実施例1
0に記載される手順を用いて、オリゴヌクレオチドの5’末端に付加する。共役基Gal
NAc1-26のGalNAc2クラスター部分(GalNAc1-26a)をオリゴヌ
クレオチド上に存在する任意の切断可能な部分と組み合わせて、様々な共役基を得ること
ができる。GalNAc1-26(GalNAc1-26a-CM)の構造を以下に示す
。
記載される手順を用いて、化合物47と64の反応から形成されたアミドを固体支持体に
付加する。その後、実施例9に記載される手順を用いて、オリゴヌクレオチド合成を完了
して、オリゴヌクレオチド240を形成する。
a)をオリゴヌクレオチド上に存在する任意の切断可能な部分と組み合わせて、様々な共
役基を得ることができる。GalNAc1-27(GalNAc1-27a-CM)の構
造を以下に示す。
ゴヌクレオチドによる生体内におけるアンチセンス阻害
処理
れるオリゴヌクレオチドおよび投与量またはPBSを1回皮下注入した。各処理群は、4
匹の動物から成った。投薬の前日に血液を採取して、血漿中のApo(a)タンパク質の
ベースラインレベルおよび第1の投与後の1週間時点のレベルを決定した。週1回約8週
間、さらに血液を採取する。ELISAを用いて血漿Apo(a)タンパク質レベルを測
定した。表119における結果を、ベースラインレベル(%BL)に規準化された各処理
群の血漿Apo(a)タンパク質レベルの平均パーセントとして提示し、結果は、アンチ
センスオリゴヌクレオチドがApo(a)タンパク質の発現を低下させたことを示す。さ
らに、GalNAc共役基を含むオリゴヌクレオチドは、共役基を含まないオリゴヌクレ
オチドよりもさらに強力なApo(a)発現の減少を示した。
クレオチドの合成
て、ホスホラミダイト中間体を形成し、続いて、実施例10に記載される手順を用いてオ
リゴヌクレオチドを合成する。共役基GalNAc1-28のGalNAc2クラスター
部分(GalNAc1-28a)をオリゴヌクレオチド上に存在する任意の切断可能な部
分と組み合わせて、様々な共役基を得ることができる。GalNAc1-28(GalN
Ac1-28a-CM)の構造を以下に示す。
に記載される手順と同様の手順を用いてヒドロキシル中間体を形成し、その後、実施例7
に記載される手順を用いてこれを固体支持体に付加する。その後、実施例9に記載される
手順を用いてオリゴヌクレオチド合成を完了させて、オリゴヌクレオチド242を形成す
る。
a)をオリゴヌクレオチド上に存在する任意の切断可能な部分と組み合わせて、様々な共
役基を得ることができる。GalNAc1-29(GalNAc1-29a-CM)の構
造を以下に示す。
置換もしくは非置換C1~C10アルキル、アミノ、置換アミノ、アジド、アルケニル、
またはアルキニルから選択される)を上に示されるように合成する。共役基GalNAc
1-30のGalNAc1クラスター部分(GalNAc1-30a)を任意の切断可能
な部分と組み合わせて、様々な共役基を得ることができる。ある特定の実施形態において
、Yは、切断可能な部分の一部である。ある特定の実施形態において、Yは、安定した部
分の一部であり、切断可能な部分は、オリゴヌクレオチド上に存在する。GalNAc1
-30aの構造を以下に示す。
クレオチドの合成
置換もしくは非置換C1~C10アルキル、アミノ、置換アミノ、アジド、アルケニル、
またはアルキニルから選択される)を上に示されるように合成する。共役基GalNAc
2-31のGalNAc2クラスター部分(GalNAc2-31a)を任意の切断可能
な部分と組み合わせて、様々な共役基を得ることができる。ある特定の実施形態において
、オリゴヌクレオチドの5’末端に直接隣接したY含有基は、切断可能な部分の一部であ
る。ある特定の実施形態において、オリゴヌクレオチドの5’末端に直接隣接したY含有
基は、安定した部分の一部であり、切断可能な部分は、オリゴヌクレオチド上に存在する
。GalNAc2-31aの構造を以下に示す。
置換もしくは非置換C1~C10アルキル、アミノ、置換アミノ、アジド、アルケニル、
またはアルキニルから選択される)を上に示されるように合成する。共役基GalNAc
2-32のGalNAc1クラスター部分(GalNAc2-32a)を任意の切断可能
な部分と組み合わせて、様々な共役基を得ることができる。ある特定の実施形態において
、オリゴヌクレオチドの5’末端に直接隣接したY含有基は、切断可能な部分の一部であ
る。ある特定の実施形態において、オリゴヌクレオチドの5’末端に直接隣接したY含有
基は、安定した部分の一部であり、切断可能な部分は、オリゴヌクレオチド上に存在する
。GalNAc2-32aの構造を以下に示す。
して、GalNAcリガンドを含有する共役基を含むオリゴヌクレオチドの強度をさらに
試験した。
の時間依存的アンチセンス阻害
公開第WO2005/000201号)から選択されたギャップマーアンチセンスオリゴ
ヌクレオチドを、ヒト初代肝細胞における単回投与アッセイにおいて試験した。細胞をT
issue Transformation Technologies(BD Bio
sciences,Franklin Lakes,NJ)から得て、150nMのアン
チセンスオリゴヌクレオチドで処理した。約16時間の処理期間後、RNAを細胞から単
離し、apo(a)mRNAレベルを定量的リアルタイムPCRで測定した。ヒトapo
(a)プライマープローブセットhAPO(a)3’(本明細書において配列番号5と指
定される、順方向配列ACAGCAATCAAACGAAGACACTG;本明細書にお
いて配列番号6と指定される、逆方向配列AGCTTATACACAAAAATACCA
AAAATGC;本明細書において配列番号7と指定される、プローブ配列TCCCAG
CTACCAGCTATGCCAAACCTT)を用いて、mRNAレベルを測定した。
さらに、ヒトapo(a)プライマープローブセットhAPO(a)12kB(本明細書
において配列番号8と指定される、順方向配列CCACAGTGGCCCCGGT;本明
細書において配列番号9と指定される、逆方向配列ACAGGGCTTTTCTCAGG
TGGT;本明細書において配列番号10と指定される、プローブ配列CCAAGCAC
AGAGGCTCCTTCTGAACAAG)を用いて、mRNAレベルを測定した。A
po(a)mRNAレベルをGAPDH mRNA発現に規準化した。結果を、未処理の
対照細胞に対するapo(a)の阻害パーセントとして以下の表に提示する。
のために選択した。
定されるように、25nM、50nM、150nM、または300nMの濃度のアンチセ
ンスオリゴヌクレオチドで試験した。約16時間の処理期間後、RNAを細胞から単離し
、apo(a)mRNAレベルを定量的リアルタイムPCRで測定した。ヒトapo(a
)プライマープローブセットhAPO(a)3’を用いてmRNAレベルを測定した。A
po(a)mRNAレベルをGAPDH mRNA発現に規準化した。結果を、未処理の
対照細胞に対するapo(a)の阻害パーセントとして提示する。
および用量依存性を示した。したがって、ISIS 144367を、本明細書に開示さ
れる新たに設計されたアンチセンスオリゴヌクレオチドの強度を比較するための基準アン
チセンスオリゴヌクレオチドと見なした。
実施例114:トランスジェニックマウス初代肝細胞におけるヒトapo(a)のアンチ
センス阻害
外におけるapo(a)mRNAへのそれらの影響について試験した。これらのアンチセ
ンスオリゴヌクレオチドを、同様の培養条件を有した一連の平行実験において強度につい
て試験した。ヒトapo(a)トランスジェニックマウス由来の初代肝細胞(Fraze
r,K.A.et al.,Nat.Genet.1995.9:424-431)をこ
の研究で用いた。35,000細胞/ウェルの密度の肝細胞を、電気穿孔法を用いて1,
000nMのアンチセンスオリゴヌクレオチドでトランスフェクトした。約24時間の処
理期間後、RNAを細胞から単離し、apo(a)mRNAレベルを定量的リアルタイム
PCRで測定した。ヒトプライマープローブセットhAPO(a)12kBを用いてmR
NAレベルを測定した。Apo(a)mRNAレベルをRIBOGREEN(登録商標)
で測定された全RNA含有量に従って調整した。各実験の結果を以下の別々の表に提示す
る。ISIS 144367を新たなアンチセンスオリゴヌクレオチドの基準として使用
し、この研究にも含めた。結果を、未処理の対照細胞に対するapo(a)の阻害パーセ
ントとして提示する。合計1,511個のギャップマーをこれらの培養条件下で試験した
。さらなる試験のために選択したアンチセンスオリゴヌクレオチドのみを以下の表に提示
し、各表は、別々の実験を表す。
ップマーとして設計した。これらのギャップマーは、20ヌクレオシド長であり、中央ギ
ャップセグメントは、10個の2’-デオキシヌクレオシドからなり、各々5個のヌクレ
オシドを含む5’方向および3’方向のウィングセグメントに隣接する。5’ウィングセ
グメントの各ヌクレオシドおよび3’ウィングセグメントの各ヌクレオシドは、2’-M
OE修飾を有する。各ギャップマー全体にわたるヌクレオシド間結合は、ホスホロチオエ
ート(P=S)結合である。各ギャップマー全体にわたるすべてのシトシン残基は、5-
メチルシトシンである。
スオリゴヌクレオチドは、オリゴヌクレオチドがクリングル配列を標的とするか否かに応
じて、apo(a)の1個以上の領域を標的とし得る。「開始部位」とは、ギャップマー
がヒト配列において標的とする最も5’側のヌクレオシドを指す。「終止部位」とは、ギ
ャップマーがヒト配列において標的とする最も3’側のヌクレオシドを指す。apo(a
)アンチセンスオリゴヌクレオチドは、それがクリングル反復を標的とするか否かに応じ
て、2つ以上の「開始部位」または「終止部位」を有し得る。
号1と指定されるヒトapo(a)mRNA(GENBANK受入番号NM_00557
7.2)または本明細書において配列番号2と指定されるヒトapo(a)ゲノム配列(
ヌクレオチド3230000~3380000から切断されたGENBANK受入番号N
T_007422.12)のいずれか、またはこれら両方の1個以上の領域を標的にする
。「該当なし」とは、アンチセンスオリゴヌクレオチドが100%の相補性でその特定の
配列を標的としないことを示す。
アンチセンス阻害
ーを選択し、同様の培養条件を有する一連の平行実験において、様々な用量でトランスジ
ェニックマウス初代肝細胞において試験した。細胞を35,000/ウェルの密度でプレ
ーティングし、電気穿孔法を用いて、0.0625μM、0.125μM、0.25μM
、0.500μM、または1.000μMの濃度のアンチセンスオリゴヌクレオチドでト
ランスフェクトした。約16時間の処理期間後、RNAを細胞から単離し、apo(a)
mRNAレベルを定量的リアルタイムPCRで測定した。Apo(a)プライマープロー
ブセットhAPO(a)12kBを用いてmRNAレベルを測定した。Apo(a)mR
NAレベルをRIBOGREEN(登録商標)で測定された全RNA含有量に従って調整
した。結果を、未処理の対照細胞に対する阻害パーセントとして提示する。
各オリゴヌクレオチドの半最大阻害濃度(IC50)もこれらの表に提示する。Apo(
a)mRNAレベルは、アンチセンスオリゴヌクレオチドで処理した細胞において、時間
依存的様式で著しく低下した。新たに設計されたオリゴヌクレオチドの強度を、基準オリ
ゴヌクレオチドISIS 144367と比較した。
94158(配列番号13)、ISIS 494159(配列番号14)、ISIS 4
94160(配列番号15)、ISIS 494161(配列番号16)、ISIS 4
94162(配列番号17)、ISIS 494163(配列番号18)、ISIS 4
94164(配列番号19)、ISIS 494165(配列番号20)、ISIS 4
94167(配列番号22)、ISIS 494168(配列番号23)、ISIS 4
94169(配列番号24)、ISIS 494170(配列番号25)、ISIS 4
94230(配列番号105)、ISIS 494243(配列番号106)、ISIS
494244(配列番号107)、ISIS 494283(配列番号26)、ISI
S 494284(配列番号27)、ISIS 494285(配列番号28)、ISI
S 494286(配列番号29)、ISIS 494287(配列番号30)、ISI
S 494288(配列番号31)、ISIS 494290(配列番号32)、ISI
S 494291(配列番号33)、ISIS 494292(配列番号35)、ISI
S 494294(配列番号36)、ISIS 494299(配列番号37)、ISI
S 494300(配列番号38)、ISIS 494301(配列番号39)、ISI
S 494302(配列番号40)、ISIS 494303(配列番号41)、ISI
S 494304(配列番号42)、ISIS 494305(配列番号43)、ISI
S 494306(配列番号44)、ISIS 494311(配列番号47)、ISI
S 494334(配列番号48)、ISIS 494336(配列番号49)、ISI
S 494337(配列番号50)、ISIS 494338(配列番号133)、IS
IS 494371(配列番号57)、ISIS 494372(配列番号58)、IS
IS 494373(配列番号59)、ISIS 494374(配列番号60)、IS
IS 494375(配列番号61)、ISIS 494386(配列番号62)、IS
IS 494389(配列番号65)、ISIS 494390(配列番号66)、IS
IS 494392(配列番号68)、ISIS 494466(配列番号108)、I
SIS 494470(配列番号109)、ISIS 494472(配列番号110)
、ISIS 494521(配列番号51)、ISIS 494530(配列番号53)
、ISIS 498229(配列番号75)、ISIS 498238(配列番号76)
、ISIS 498239(配列番号77)、ISIS 498240(配列番号78)
、ISIS 498241(配列番号79)、ISIS 498243(配列番号81)
、ISIS 498379(配列番号70)、ISIS 498408(配列番号71)
、ISIS 498433(配列番号72)、ISIS 498434(配列番号73)
、ISIS 498435(配列番号74)、ISIS 498517(配列番号85)
、ISIS 498523(配列番号92)、ISIS 498524(配列番号93)
、ISIS 498525(配列番号94)、ISIS 498550(配列番号97)
、ISIS 498580(配列番号103)、ISIS 498581(配列番号10
4)、ISIS 498721(ATGCCTCGATAACTCCGTCC;配列番号
134)、ISIS 498833(配列番号86)、ISIS 498875(配列番
号89)、およびISIS 499020(配列番号90)は、ISIS 144367
(配列番号11)よりも強力であった。
実施例116:トランスジェニックマウス初代肝細胞におけるapo(a)の時間依存的
アンチセンス阻害
研究において、様々な用量でトランスジェニックマウス初代肝細胞において試験した。細
胞を35,000/ウェルの密度でプレーティングし、電気穿孔法を用いて、以下の表に
指定されるように、0.049μM、0.148μM、0.444μM、1.333μM
、または4.000μMの濃度のアンチセンスオリゴヌクレオチドでトランスフェクトし
た。約16時間の処理期間後、RNAを細胞から単離し、apo(a)mRNAレベルを
定量的リアルタイムPCRで測定した。Apo(a)プライマープローブセットhAPO
(a)12kBを用いてmRNAレベルを測定した。Apo(a)mRNAレベルをRI
BOGREEN(登録商標)で測定された全RNA含有量に従って調整した。結果を、未
処理の対照細胞に対する阻害パーセントとして提示する。
各オリゴヌクレオチドの半最大阻害濃度(IC50)もこれらの表に提示する。Apo(
a)mRNAレベルは、アンチセンスオリゴヌクレオチドで処理した細胞において、時間
依存的様式で著しく低下した。新たに設計されたオリゴヌクレオチドの強度を、基準オリ
ゴヌクレオチドISIS 144367と比較した。以下の表に提示されるように、IS
IS 494157(配列番号12)、ISIS 494158(配列番号13)、IS
IS 494159(配列番号14)、ISIS 494160(配列番号15)、IS
IS 494161(配列番号16)、ISIS 494162(配列番号17)、IS
IS 494163(配列番号18)、ISIS 494164(配列番号19)、IS
IS 494230(配列番号105)、ISIS 494243(配列番号106)、
ISIS 494244(配列番号107)、ISIS 494283(配列番号26)
、ISIS 494284(配列番号27)、ISIS 494285(配列番号28)
、ISIS 494286(配列番号29)、ISIS 494287(配列番号30)
、ISIS 494290(配列番号32)、ISIS 494292(配列番号35)
、ISIS 494300(配列番号38)、ISIS 494301(配列番号39)
、ISIS 494302(配列番号40)、ISIS 494303(配列番号41)
、ISIS 494304(配列番号42)、ISIS 494305(配列番号43)
、ISIS 494306(配列番号44)、ISIS 494310(配列番号46)
、ISIS 494311(配列番号47)、ISIS 494337(配列番号50)
、ISIS 494371(配列番号57)、ISIS 494372(配列番号58)
、ISIS 494375(配列番号61)、ISIS 494388(配列番号64)
、ISIS 494389(配列番号65)、ISIS 494390(配列番号66)
、ISIS 494392(配列番号68)、ISIS 494466(配列番号108
)、ISIS 494470(配列番号109)、ISIS 494472(配列番号1
10)、ISIS 498238(配列番号76)、ISIS 498239(配列番号
77)、ISIS 498433(配列番号72)、ISIS 498434(配列番号
73)、ISIS 498435(配列番号74)、ISIS 498523(配列番号
92)、ISIS 498524(配列番号93)、ISIS 498525(配列番号
94)、ISIS 498580(配列番号103)、およびISIS 498581(
配列番号104)は、ISIS 144367(配列番号11)よりも強力であった。
センス阻害
し、生体外におけるapo(a)mRNAへのそれらの影響について試験した。これらの
アンチセンスオリゴヌクレオチドを、同様の培養条件を有した一連の実験において試験し
た。ヒトapo(a)トランスジェニックマウス由来の初代肝細胞をこの研究に用いた。
35,000細胞/ウェルの密度の肝細胞を、電気穿孔法を用いて1,000nMのアン
チセンスオリゴヌクレオチドでトランスフェクトした。約24時間の処理期間後、RNA
を細胞から単離し、apo(a)mRNAレベルを定量的リアルタイムPCRで測定した
。ヒトプライマープローブセットhAPO(a)12kBを用いてmRNAレベルを測定
した。Apo(a)mRNAレベルをRIBOGREEN(登録商標)で測定された全R
NA含有量に従って調整した。各実験の結果を以下の別々の表に提示する。ISIS 1
44367も比較のためにこの研究に含めた。結果を、未処理の対照細胞に対するapo
(a)の阻害パーセントとして提示する。合計231個のアンチセンスオリゴヌクレオチ
ドをこれらの培養条件下で試験した。さらなる研究のために選択したアンチセンスオリゴ
ヌクレオチドのみを以下に提示する。
ップマーとして設計した。これらのギャップマーは、17ヌクレオシド長であり、中央ギ
ャップセグメントは、10個の2’-デオキシヌクレオシドからなり、それぞれ、3個の
ヌクレオシドおよび4個のヌクレオシドを含む5’方向および3’方向のウィングセグメ
ントに隣接する。5’ウィングセグメントの各ヌクレオシドおよび3’ウィングセグメン
トの各ヌクレオシドは、2’-MOE修飾を有する。各ギャップマー全体にわたるヌクレ
オシド間結合は、ホスホロチオエート(P=S)結合である。各ギャップマー全体にわた
るすべてのシトシン残基は、5-メチルシトシンである。
スオリゴヌクレオチドは、オリゴヌクレオチドがクリングル配列を標的とするか否かに応
じて、apo(a)の1個以上の領域を標的とし得る。「開始部位」とは、ギャップマー
がヒト配列において標的とする最も5’側のヌクレオシドを指す。「終止部位」とは、ギ
ャップマーがヒト配列において標的とする最も3’側のヌクレオシドを指す。apo(a
)アンチセンスオリゴヌクレオチドは、それがクリングル反復を標的とするか否かに応じ
て、2つ以上の「開始部位」または「終止部位」を有し得る。
1と指定されるヒトapo(a)mRNA(GENBANK受入番号NM_005577
.2)または本明細書において配列番号2と指定されるヒトapo(a)ゲノム配列(ヌ
クレオチド3230000~3380000から切断されたGENBANK受入番号NT
_007422.12)のいずれか、またはこれら両方の複数の領域を標的にする。「該
当なし」とは、アンチセンスオリゴヌクレオチドが100%の相補性でその特定の配列を
標的としないことを示す。
アンチセンス阻害
研究において、様々な用量でトランスジェニックマウス初代肝細胞において試験した。細
胞を35,000/ウェルの密度でプレーティングし、電気穿孔法を用いて、以下の表に
指定されるように、0.156μM、0.313μM、0.625μM、1.250μM
、2.500μM、または5.000μMの濃度のアンチセンスオリゴヌクレオチドでト
ランスフェクトした。約16時間の処理期間後、RNAを細胞から単離し、apo(a)
mRNAレベルを定量的リアルタイムPCRで測定した。Apo(a)プライマープロー
ブセットhAPO(a)12kBを用いてmRNAレベルを測定した。Apo(a)mR
NAレベルをRIBOGREEN(登録商標)で測定された全RNA含有量に従って調整
した。結果を、未処理の対照細胞に対する阻害パーセントとして提示する。
いて、時間依存的様式で著しく低下した。新たに設計されたオリゴヌクレオチドの強度を
、基準オリゴヌクレオチドISIS 144367と比較した。上の表に提示されるよう
に、ISIS 510542(配列番号111)、ISIS 510545(配列番号1
14)、ISIS 510546(配列番号115)、ISIS 510547(配列番
号116)、ISIS 510548(配列番号117)、ISIS 510549(配
列番号118)、ISIS 510595(配列番号119)、ISIS 510597
(配列番号120)、ISIS 510598(配列番号121)、ISIS 5107
01(配列番号127)、ISIS 510702(配列番号128)、ISIS 51
0704(配列番号129)、ISIS 512944(配列番号123)、ISIS
512947(配列番号124)、ISIS 512958(配列番号125)、および
ISIS 512959(配列番号126)は、ISIS 144367(配列番号11
)よりも強力であった。
実施例119:ヒトapo(a)トランスジェニックマウスにおけるヒトapo(a)の
生体内におけるアンチセンス阻害の影響
et al.,Nat.Genet.1995.9:424-431)を以下に記載され
る研究において利用した。上述の生体外におけるapo(a)mRNAの統計的に有意な
阻害を示したISISアンチセンスオリゴヌクレオチドを、このモデルにおいてさらに評
価した。
研究1
実験食餌を不断給餌した。これらのマウスを、各4匹のマウスから成る処理群に分けた。
これらの群に、ISIS 494159、ISIS 494160、ISIS 4941
61、ISIS 494162、ISIS 494163、ISIS 494230、I
SIS 494243、ISIS 494244、ISIS 494283、ISIS
494284、ISIS 494285、ISIS 494286、ISIS 4943
01、ISIS 494302、ISIS 494304、ISIS 494466、I
SIS 494470、ISIS 494472、ISIS 498239、ISIS
498408、ISIS 498517、ISIS 494158、ISIS 4943
11、ISIS 494337、ISIS 494372、ISIS 498238、I
SIS 498523、ISIS 498525、ISIS 510548、ISIS
512944、ISIS 512947、またはISIS 512958を、25mg/
kgの用量で週2回2週間、腹腔内注入した。1つのマウス群に、PBSを週2回2週間
、腹腔内注入した。このPBS群を対照群とした。最終投与の2日後、マウスを安楽死さ
せ、臓器を採取し、分析を行った。
ヒトapo(a)mRNAの阻害
NAをRT-PCRで定量化した。結果を以下の表に提示し、PBS対照と比較したap
o(a)mRNAの阻害パーセントとして表す。
い阻害を示す。ISIS 494159(配列番号14)、ISIS 494162(配
列番号17)、ISIS 494163(配列番号18)、ISIS 494243(配
列番号106)、ISIS 494244(配列番号107)、ISIS 494283
(配列番号26)、ISIS 494284(配列番号27)、ISIS 494285
(配列番号28)、ISIS 494301(配列番号39)、およびISIS 498
408(配列番号71)は、基準ISIS 144367(配列番号11)よりも強力で
あった。
ヒトapo(a)タンパク質の阻害
ala,Sweden)を用いて、すべての処理群由来の血漿ヒトapo(a)タンパク
質を測定した。結果を以下の表に提示し、PBS対照と比較したapo(a)mRNAの
阻害パーセントとして表す。
い阻害を示す。ISIS 494159(配列番号14)、ISIS 494244(配
列番号82)、ISIS 494283(配列番号26)、ISIS 494284(配
列番号27)、ISIS 494285(配列番号28)、ISIS 494286(配
列番号29)、ISIS 494301(配列番号39)、およびISIS 49430
2(配列番号40)は、基準ISIS 144367(配列番号11)と同程度の強度で
あるか、またはそれより強力であった。
研究2
S 494163、およびISIS 494243を、このトランスジェニックモデルに
おいてさらに評価した。ISIS 144367を比較のために含めた。
処理
けた。これらの群に、ISIS 144367、ISIS 494159、ISIS 4
94161、ISIS 494162、ISIS 494163、またはISIS 49
4243を、1.5mg/kg、5mg/kg、15mg/kg、または50mg/kg
の用量で週2回2週間、腹腔内注入した。1つのマウス群に、PBSを週2回2週間、腹
腔内注入した。このPBS群を対照群とした。最終投与の2日後、マウスを安楽死させ、
臓器を採取し、分析を行った。
ヒトapo(a)mRNAの阻害
い阻害を示す。ISIS 494159(配列番号14)、ISIS 494161(配
列番号16)、494162(配列番号17)、およびISIS 94163(配列番号
18)は、基準ISIS 144367(配列番号11)よりも有効であった。ヒトap
o(a)タンパク質レベルの低下
1106-01、Uppsala,Sweden)を用いて、ヒトapo(a)タンパク
質レベルを定量化した。結果を以下の表に提示し、PBS対照と比較したapo(a)タ
ンパク質レベルの減少パーセントとして表す。
レベルの著しい阻害を示す。ISIS 494159(配列番号14)、ISIS 49
4161(配列番号16)、ISIS 494162(配列番号17)、およびISIS
494163(配列番号18)は、基準ISIS 144367(配列番号11)より
も有効であった。
研究3
、このモデルにおいてさらに評価した。ISIS 144367を比較のために含めた。
処理
けた。これらの群に、ISIS 144367、ISIS 494244、ISIS 4
94283、またはISIS 494284を、0.75mg/kg、2.5mg/kg
、7.5mg/kg、または25mg/kgの用量で週2回2週間、腹腔内注入した。1
つのマウス群に、PBSを週2回2週間、腹腔内注入した。このPBS群を対照群とした
。最終投与の2日後、マウスを安楽死させ、臓器を採取し、分析を行った。
ヒトapo(a)mRNAの阻害
い阻害を示す。ISIS 494244(配列番号107)、ISIS 494283(
配列番号26)、およびISIS 494284(配列番号27)は、基準ISIS 1
44367(配列番号11)よりも有効であった。
ヒトapo(a)タンパク質レベルの低下
1106-01、Uppsala,Sweden)を用いて、ヒトapo(a)タンパク
質レベルを定量化した。結果を以下の表に提示し、PBS対照と比較したapo(a)タ
ンパク質レベルの減少パーセントとして表す。
レベルの著しい阻害を示す。ISIS 494244(配列番号107)、ISIS 4
94283(配列番号26)、およびISIS 494284(配列番号27)は、基準
ISIS 144367(配列番号11)よりも有効であった。
研究4
S 494302、およびISIS 494311を、このモデルにおいてさらに評価し
た。
処理
けた。各そのような群に、ISIS 494285、ISIS 494286、ISIS
494301、ISIS 494302、またはISIS 494311を、5mg/
kg、15mg/kg、または50mg/kgの用量で週2回2週間、腹腔内注入した。
3匹マウスからなる1群に、PBSを週2回2週間、腹腔内注入した。このPBS群を対
照群とした。最終投与の2日後、マウスを安楽死させ、臓器を採取し、分析を行った。
ヒトapo(a)mRNAの阻害
Rで定量化した。結果を以下の表に提示し、PBS対照と比較したapo(a)mRNA
の阻害パーセントとして表す。データは、ISIS 494285(配列番号28)、I
SIS 494286(配列番号29)、ISIS 494301(配列番号39)、I
SIS 494302(配列番号 40)、およびISIS 494311(配列番号4
7)によるapo(a)mRNAの著しい阻害を示す。
1106-01、Uppsala,Sweden)を用いて、ヒトapo(a)タンパク
質レベルを定量化した。結果を以下の表に提示し、PBS対照と比較したapo(a)タ
ンパク質レベルの減少パーセントとして表す。データは、ISIS 494285、IS
IS 494286、ISIS 494301、ISIS 494302、およびISI
S 494311によるapo(a)血漿タンパク質レベルの著しい低下を示す。
S 498721、およびISIS 498833を、このモデルにおいてさらに評価し
た。
処理
けた。これらの群に、ISIS 494372、ISIS 498524、ISIS 4
98581、ISIS 498721、またはISIS 498833を、5mg/kg
、15mg/kg、または50mg/kgの用量で週2回2週間、腹腔内注入した。3匹
マウスからなる1群に、PBSを週2回2週間、腹腔内注入した。このPBS群を対照群
とした。最終投与の2日後、マウスを安楽死させ、臓器を採取し、分析を行った。
ヒトapo(a)mRNAの阻害
Rで定量化した。結果を以下の表に提示し、PBS対照と比較したapo(a)mRNA
の阻害パーセントとして表す。データは、ISIS 494372(配列番号28)、I
SIS 498524(配列番号93)、ISIS 498581(配列番号104)、
およびISIS 498721(ATGCCTCGATAACTCCGTCC;配列番号
134)によるapo(a)mRNAの著しい阻害を示す。
1106-01、Uppsala,Sweden)を用いて、ヒトapo(a)タンパク
質レベルを定量化した。結果を以下の表に提示し、PBS対照と比較したapo(a)タ
ンパク質レベルの減少パーセントとして表す。データは、ISIS 494372(配列
番号28)、ISIS 498581(配列番号104)、およびISIS 49872
1(ATGCCTCGATAACTCCGTCC;配列番号134)によるapo(a)
血漿タンパク質レベルの著しい減少を示す。
ヌクレオチドの耐容性
1マウスおよびSprague-Dawleyラットにおける耐容性研究のために上述の
研究から選択した。齧歯類は、内因性apo(a)を発現せず、それ故に、これらの研究
は、動物におけるapo(a)の阻害によって引き起こされ得る任意の表現型の変化では
なく、動物における各ヒトアンチセンスオリゴヌクレオチドの耐容性を試験した。
CD1マウスにおける耐容性:研究1
デルであり、多くの場合、安全性および有効性試験に利用される。マウスを、上述の研究
から選択されたISISアンチセンスオリゴヌクレオチドで処理し、様々な血漿化学マー
カーのレベルの変化について評価した。
処理
61、ISIS 494162、ISIS 494244、ISIS 494283、I
SIS 494284、ISIS 494285、ISIS 494286、ISIS
494301、ISIS 494302、ISIS 494311、ISIS 4943
37、ISIS 494372、およびISIS 510548を、週2回6週間、皮下
注入した。6週齢の雄CD1マウスの1群に、PBSを、週2回6週間、皮下注入した。
最終投与の48時間後にマウスを安楽死させ、臓器および血漿をさらなる分析のために採
取した。
血漿化学マーカー
床化学分析装置(Hitachi Olympus AU400e、Melville,
NY)を用いて、トランスアミナーゼ、ビリルビン、アルブミン、クレアチニン、および
BUNの血漿レベルを測定した。結果を以下の表に提示する。アンチセンスオリゴヌクレ
オチドの予想範囲を外れて肝臓または腎臓機能マーカーのうちのいずれかのレベルの変化
を引き起こしたISISオリゴヌクレオチドを、さらなる研究から除外した。
スオリゴヌクレオチドの予想範囲を外れて臓器重量の任意の変化を引き起こしたISIS
オリゴヌクレオチドを、さらなる研究から除外した。
多目的モデルである。これらのラットを上述の研究から選択されたISISアンチセンス
オリゴヌクレオチドで処理し、様々な血漿化学マーカーのレベルの変化を評価した。
処理
9、ISIS 494161、ISIS 494162、ISIS 494244、IS
IS 494283、ISIS 494284、ISIS 494285、ISIS 4
94286、ISIS 494301、ISIS 494302、ISIS 49431
1、ISIS 494337、ISIS 494372、およびISIS 510548
を、週2回8週間、皮下注入した。6匹の雄Sprague-Dawleyラットの1群
に、PBSを、週2回8週間、皮下注入した。最終投与の48時間後にラットを安楽死さ
せ、臓器および血漿をさらなる分析のために採取した。
血漿化学マーカー
床化学分析装置(Hitachi Olympus AU400e、Melville,
NY)を用いて、トランスアミナーゼ、ビリルビン、アルブミン、クレアチニン、および
BUNの血漿レベルを測定した。結果を以下の表に提示する。アンチセンスオリゴヌクレ
オチドの予想範囲を外れて肝臓または腎臓機能マーカーのうちのいずれかのレベルの変化
を引き起こしたISISオリゴヌクレオチドを、さらなる研究から除外した。
装置(Hitachi Olympus AU400e、Melville,NY)を用
いて、総タンパク質およびクレアチニンの尿レベルを測定した。結果を以下の表に提示し
、mg/dL単位で表す。
スオリゴヌクレオチドの予想範囲を外れて臓器重量の任意の変化を引き起こしたISIS
オリゴヌクレオチドを、さらなる研究から除外した。
とを考慮して、ISIS 494372が、CD1マウスモデルとSprague-Da
wleyラットモデルの両方において最も耐性の高いアンチセンス化合物であったことを
示した。
実施例121:CD1マウスにおけるアンチセンスオリゴヌクレオチドの薬物動態
ヌクレオチド濃度を評価した。
処理
494284、ISIS 494286、ISIS 494301、ISIS 4943
02、またはISIS 494372を、週2回6週間、皮下注入した。最終投与の2日
後にこれらのマウスを屠殺した。肝臓を分析のために採取した。
オリゴヌクレオチド濃度の測定
ム(液体-液体)抽出の後に固相抽出が続く以前に公開された方法(Leeds et
al.,1996、Geary et al.,1999)を修正したものである。内部
標準物(ISIS 355868、27-mer2’-O-メトキシエチル修飾ホスホロ
チオエートオリゴヌクレオチド、GCGTTTGCTCTTCTTCTTGCGTTTT
TT(本明細書において配列番号131と指定される))を抽出前に添加した。較正曲線
を用いて組織試料濃度を計算し、定量下限(LLOQ)は、約1.14μg/gであった
。その後、WinNonlinソフトウェア(PHARSIGHT)を用いて半減期を計
算した。
S 494372が肝臓および腎臓において許容濃度であったことを示す。
オチドの薬物動態
および腎臓におけるオリゴヌクレオチド濃度を評価した。
処理
284、ISIS 494286、ISIS 494301、ISIS 494302、
またはISIS 494372を、週2回3週間、皮下注入した。最終投与の2日後にラ
ットを屠殺した。肝臓を分析のために採取した。
オリゴヌクレオチド濃度の測定
ム(液体-液体)抽出の後に固相抽出が続く以前に公開された方法(Leeds et
al.,1996、Geary et al.,1999)を修正したものである。内部
標準物(ISIS 355868、27-mer2’-O-メトキシエチル修飾ホスホロ
チオエートオリゴヌクレオチド、GCGTTTGCTCTTCTTCTTGCGTTTT
TT(本明細書において配列番号131と指定される))を抽出前に添加した。較正曲線
を用いて組織試料濃度を計算し、定量下限(LLOQ)は、約1.14μg/gであった
。その後、WinNonlinソフトウェア(PHARSIGHT)を用いて半減期を計
算した。
S 494372が肝臓および腎臓において許容濃度であったことを示す。
スオリゴヌクレオチドの影響
で処理した。この研究に着手した時点では、カニクイザルゲノム配列は、全米バイオテク
ノロジー情報センター(NCBI)データベースからは入手不可能であり、それ故に、カ
ニクイザル遺伝子配列との交差反応を確認することはできなかった。代わりに、カニクイ
ザルにおいて用いたISISアンチセンスオリゴヌクレオチドの配列を、相同性について
アカゲザル配列と比較した。アカゲザル配列と相同性を有するISISオリゴヌクレオチ
ドがカニクイザル配列と完全に交差反応することも予想される。
001098061.1(本明細書において配列番号132と指定される))とも交差反
応する。ヒトオリゴヌクレオチドとアカゲザル配列との間の相補性が高いほど、ヒトオリ
ゴヌクレオチドがアカゲザル配列と交差反応することができる可能性が高くなる。配列番
号132の各オリゴヌクレオチドの開始部位および終止部位を以下の表に提示する。各ア
ンチセンスオリゴヌクレオチドは、配列番号132における2つ以上の領域を標的とし、
複数の開始部位を有する。「開始部位」とは、ギャップマーがアカゲザル配列において標
的とする最も5’側のヌクレオチドを指す。「ミスマッチ」とは、ヒトオリゴヌクレオチ
ド配列とアカゲザル配列との間のミスマッチしたヌクレオチドの数を指す。
般健康状態について毎日監視した。これらのサルは、2~4歳であり、体重2~4kgで
あった。無作為に割り当てられた4匹の雄カニクイザルの7群各々に、適切な大きさのス
テンレス製の投与針およびシリンジを用いて、ISISオリゴヌクレオチドまたはPBS
を、サルの背部の4つの部位のうちの1つに皮下注入した。1回の投与につき1つの部位
に時計回りに注入した。これらのサルに、40mg/kgのISIS 494283、I
SIS 494284、ISIS 494286、ISIS 494301、ISIS
494302、またはISIS 494372を、負荷用量として1週目に週4回(1、
3、5、および7日目)、その後、2~12週目に週1回投与した。8匹のカニクイザル
の対照群に、PBSを、1週目に3回4回(1、3、5、および7日目)、その後、2~
12週目に週1回皮下注入した。
監視した。処理により一時的または軽度を超える疼痛もしくは苦痛、損傷、または疾病を
経験した任意の動物を、研究責任者と相談した後に獣医により疼痛を緩和するための承認
鎮痛剤または薬剤を用いて処理した。不良な健康状態または瀕死の可能性のある状態にあ
る任意の動物を、さらなる監視および安楽死の可能性のために特定した。例えば、ISI
S 494302の処理群における1匹の動物が56日目に瀕死で見つかり、安楽死させ
た。予定された動物の安楽死を、深麻酔下での瀉血により、86日目および87日目に行
った。この実施例に記載のプロトコルは、動物管理使用委員会(IACUC)によって認
可されたものである。
標的減少
RNA分析
マープローブセットABI Hs00916691_m1(Applied Biosy
stems,Carlsbad,CA)を用いて肝臓組織から抽出した。結果を、PBS
対照に対するapo(a)mRNAの阻害パーセントとして提示する。以下の表に示され
るように、ISISアンチセンスオリゴヌクレオチドでの処理は、PBS対照と比較して
、apo(a)mRNAの著しい減少をもたらした。
腿静脈から採取した。血液試料を、血漿分離のためにK2-EDTAを含有する管に入れ
た。これらの管を、室温で10分間、3,000rpmで遠心分離して、血漿を得た。A
po(a)ELISAキット(Mercodia 10-1106-01、Uppsal
a,Sweden)を用いてApo(a)タンパク質レベルを分析した。結果を、ベース
ラインからのレベルの変化パーセントとして提示する。以下の表に示されるように、いく
つかのISISアンチセンスオリゴヌクレオチドでの処理は、PBS対照と比較して、a
po(a)タンパク質レベルの著しい減少をもたらした。具体的には、ISIS 494
372での処理は、カニクイザルのapo(a)の血漿タンパク質レベルを減少させた。
臓器重量を86日目に測定した。体重を測定し、以下の表に提示する。臓器重量を測定し
、データを以下の表に提示する。結果は、ISIS 494372での処理が、サルの体
重および臓器重量の観点において、良好な耐性を示したことを示す。
に一晩絶食させた。各動物から約1.5mLの血液を採取し、血清分離のために抗凝血剤
を有しない管に入れた。これらの管を室温で最低90分間保管し、その後、室温で10分
間、3,000rpmで遠心分離して、血清を得た。Toshiba 200FR NE
O化学分析装置(Toshiba Co.,Japan)を用いて、様々な肝臓機能マー
カーのレベルを測定した。ALTおよびASTの血漿レベルを測定し、結果を以下の表に
提示し、IU/L単位で表す。肝臓機能マーカーであるビリルビンも同様に測定し、以下
の表に提示し、mg/dL単位で表す。結果は、ISIS 494372での処理が、サ
ルにおける肝臓機能の観点において、良好な耐性を示したことを示す。
、血液試料を分析用に採取した。サルを血液採取の前に一晩絶食させた。各動物から約1
.5mLの血液を採取し、血清分離のために抗凝血剤を有しない管に入れた。これらの管
を室温で最低90分間保管し、その後、室温で10分間、3,000rpmで遠心分離し
て、血清を得た。Toshiba 200FR NEO化学分析装置(Toshiba
Co.,Japan)を用いて、肝臓において合成され、かつ炎症のマーカーとしての機
能を果たすC反応性タンパク質(CRP)を測定した。結果は、ISIS 494372
での処理がサルにおいていかなる炎症も引き起こさなかったことを示す。
るために、血液試料を84日目(投与前)および85日目(投与の24時間後)に分析用
に採取した。各動物から約0.5mLの血液を採取し、血清分離のために抗凝血剤を有し
ない管に入れた。これらの管を室温で最低90分間保管し、その後、室温で10分間、3
,000rpmで遠心分離して、血清を得た。Toshiba 200FR NEO化学
分析装置(Toshiba Co.,Japan)を用いてC3を測定した。結果は、I
SIS 494372での処理がサルにおける補体経路にいかなる影響も引き起こさなか
ったことを示す。
価するために、約0.5mLの血液の血液試料を87日目に利用可能な研究用動物の各々
からK2-EDTAを含有する管に収集した。ADVIA120血液学的分析装置(Ba
yer,USA)を用いて、試料を、赤血球(RBC)数、白血球(WBC)数、ならび
に血小板数について分析した。データを以下の表に提示する。
点において、良好な耐性を示したことを示す。
つ別の13週間にわたって回復させたサルにおける肝臓のapo(a)mRNAおよび血
漿apo(a)レベルを測定することによって特徴付けた。
処理
のステンレス製の投与針およびシリンジを用いて、ISISオリゴヌクレオチドまたはP
BSを、サルの背部(肩甲部)の4つの部位のうちの1つに皮下注入した。これらのサル
に、以下の表に示されるように、負荷用量として1週目に週4回(1、3、5、および7
日目)、その後、維持用量として2~13週目に週1回投与した。1週目の負荷用量をm
g/kg/用量で表し、2~13週目の維持用量をmg/kg/週で表す。
復期に動物から採取した。加えて、異なる日に血漿試料を収集して、apo(a)タンパ
ク質レベルを測定した。この非臨床研究を、アメリカ食品医薬品局(FDA)医薬品安全
性試験実施基準(Good Laboratory Practice(GLP))規制
の連邦法第21章第58条に従って行った。
RNA分析
結した肝臓の一片(0.2g)を2mLのRLT溶液(Qiagen)中で均質化した。
結果として生じた溶解物をQiagen RNeasyミニカラムに適用した。精製およ
び定量化後、組織をRT-PCR分析に供した。リアルタイム蛍光RT-PCR検出を用
いるPerkin-Elmer ABI Prism 7700配列決定システムを用い
て、apo(a)mRNAを定量化した。アッセイは、蛍光レポーターおよび反対側の端
に消光染料で標識された標的特異的プローブに基づく。プローブをTaq DNAポリメ
ラーゼの5’-エキソヌクレアーゼ活性によって加水分解し、反応中に検出され得るレポ
ーター染料の蛍光発光の増加をもたらす。アカゲザルapo(a)mRNA転写物(GE
NBANK受入番号XM_001098061.2(配列番号132)配列の1512位
を標的とするプローブセット(ABI Rhesus LPAプローブセットID Rh
02789275_m1、Applied Biosystems,Carlsbad,
CA))を用いて、カニクイザルの肝臓におけるapo(a)mRNA発現レベルを測定
した。RIBOGREEN(登録商標)を用いてApo(a)発現を規準化した。結果を
、PBS対照に対するapo(a)mRNAの阻害パーセントとして提示する。
て、apo(a)mRNAの時間依存的減少をもたらした。30日目に、肝臓におけるa
po(a)mRNA発現は、時間依存的様式で、それぞれ、12mg/kg/週および4
0mg/kg/週の投与コホートにおいて74%および99%減少した。これらの減少は
、一方向ANOVA(ダネット多重比較試験、P<0.05)により、統計的に有意であ
る。
発現レベルは、依然として、それぞれ、12mg/kg/週および40mg/kg/週の
投与コホートにおいて49%および69%減少した。
ppsala,Sweden)を用いて約20μlの血漿を分析した。アッセイプトロコ
ルを製造業者が説明する通りに実行した。結果を1日目(投与前)のapo(a)血漿タ
ンパク質濃度からの変化パーセントとして以下の表に提示する。ダネット多重比較試験を
用いた1日目のベースライン血漿apo(a)からの統計的に有意な差には星印が付いて
いる。
察された。回復期において、40mg/kg/週の投与コホートにおけるapo(a)血
漿タンパク質レベルは、それぞれ、回復の4週間後および13週間後(121日目および
182日目)にベースラインの22%および93%であった。12mg/kg/週のコホ
ートにおける回復率は、40mg/kg/週のコホートで見られた回復率と類似していた
。
の粘度測定
クリーニングするために、上述の研究から選択されたアンチセンスオリゴヌクレオチドの
粘度を測定した。40cPを超える粘度を有するオリゴヌクレオチドは、最適粘度未満を
有するであろう。
0μLの水を添加し、バイアルを50℃で加熱することによりアンチセンスオリゴヌクレ
オチドを溶液に溶解させた。予熱した試料の一部(75μL)をマイクロ粘度計(Cam
bridge)にピペットで移した。マイクロ粘度計の温度を25℃に設定し、試料の粘
度を測定した。85℃、260nMでのUV読み取り(Cary UV機器)のために、
予熱した試料の別の一部(20μL)を10mLの水にピペットで移した。結果を以下の
表に提示し、これは、アンチセンスオリゴヌクレオチド溶液の大半の粘度が上述の基準下
で最適であることを示す。最適でなかったものを「粘性」と表示する。特に、ISIS
494372の粘度が上述の基準下で最適であった。
ある態様において、本発明は以下であってもよい。
[態様1]
修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオチドが、12~30個の連結したヌクレオシドからなり、かつ配列番号1の核酸塩基3901~3920の等長部分に相補的な少なくとも8個の連続した核酸塩基の一部を含む核酸塩基配列を含み、前記修飾オリゴヌクレオチドの前記核酸塩基配列が、配列番号1に少なくとも80%相補的である、化合物。
[態様2]
前記修飾オリゴヌクレオチドが、配列番号1の等長部分に相補的な少なくとも10、少なくとも12、少なくとも14、少なくとも16、少なくとも18、少なくとも19、または少なくとも20個の連続した核酸塩基の一部を含む核酸塩基配列を含む、態様1に記載の化合物。
[態様3]
修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオチドが、12~30個の連結したヌクレオシドからなり、かつ配列番号1の核酸塩基3900~3923の等長部分に相補的な少なくとも8、少なくとも10、少なくとも12、少なくとも14、少なくとも15、または少なくとも16個の連続した核酸塩基の一部を含む核酸塩基配列を含み、前記修飾オリゴヌクレオチドの前記核酸塩基配列が、配列番号1に少なくとも80%相補的である、化合物。
[態様4]
前記修飾オリゴヌクレオチドの前記核酸塩基配列が、配列番号1に少なくとも85%、少なくとも90%、少なくとも95%、または100%相補的である、態様1~3のいずれかに記載の化合物。
[態様5]
修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオチドが、12~30個の連結したヌクレオシドからなり、かつ配列番号58の核酸塩基配列の少なくとも8、最小9、最小10、最小11、少なくとも12、最小13、少なくとも14、少なくとも15、少なくとも16、最小17、最小18、最小19、または20個の連続した核酸塩基を含む核酸塩基配列を有する、化合物。
[態様6]
修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオチドが、12~30個の連結したヌクレオシドからなり、かつ配列番号12~130、133、134の核酸塩基配列のうちのいずれかの少なくとも8、最小9、最小10、最小11、少なくとも12、最小13、少なくとも14、少なくとも15、少なくとも16、最小17、最小18、最小19、または20個の連続した核酸塩基を含む核酸塩基配列を有する、化合物。
[態様7]
前記修飾オリゴヌクレオチドが一本鎖である、態様1~6のいずれかに記載の化合物。
[態様8]
前記修飾オリゴヌクレオチドが二本鎖である、態様1~6のいずれかに記載の化合物。
[態様9]
前記修飾オリゴヌクレオチドが少なくとも1個の修飾ヌクレオシド間結合を含む、態様1~のいずれかに記載の化合物。
[態様10]
前記修飾ヌクレオシド間結合がホスホロチオエートヌクレオシド間結合である、態様9に記載の化合物。
[態様11]
前記修飾オリゴヌクレオチドが少なくとも1個のホスホジエステルヌクレオシド間結合を含む、態様10に記載の化合物。
[態様12]
前記修飾オリゴヌクレオチドが少なくとも2個のホスホジエステルヌクレオシド間結合を含む、態様10に記載の化合物。
[態様13]
前記修飾オリゴヌクレオチドが少なくとも3個のホスホジエステルヌクレオシド間結合を含む、態様10に記載の化合物。
[態様14]
前記修飾オリゴヌクレオチドが少なくとも4個のホスホジエステルヌクレオシド間結合を含む、態様10に記載の化合物。
[態様15]
前記修飾オリゴヌクレオチドが少なくとも5個のホスホジエステルヌクレオシド間結合を含む、態様10に記載の化合物。
[態様16]
前記修飾オリゴヌクレオチドが少なくとも6個のホスホジエステルヌクレオシド間結合を含む、態様10に記載の化合物。
[態様17]
前記修飾オリゴヌクレオチドが少なくとも7個のホスホジエステルヌクレオシド間結合を含む、態様10に記載の化合物。
[態様18]
前記修飾オリゴヌクレオチドの各ヌクレオシド間結合が、ホスホジエステルヌクレオシド間結合およびホスホロチオエートヌクレオシド間結合から選択される、態様11~17のいずれかに記載の化合物。
[態様19]
前記修飾オリゴヌクレオチドの各ヌクレオシド間結合が、ホスホロチオエートヌクレオシド間結合を含み、ホスホロチオエートヌクレオシド間結合である、態様1~8のいずれかに記載の化合物。
[態様20]
ISIS 494372および共役基からなる化合物。
[態様21]
前記修飾オリゴヌクレオチドが少なくとも1個の修飾糖を含む、態様1~20のいずれかに記載の化合物。
[態様22]
少なくとも1個の修飾糖が二環糖である、態様21に記載の化合物。
[態様23]
少なくとも1個の修飾糖が、2’-O-メトキシエチル、拘束エチル、3’-フルオロ-HNA、または4’-(CH2)n-O-2’橋を含み、式中、nが、1または2である、態様21に記載の化合物。
[態様24]
少なくとも1個のヌクレオシドが、修飾核酸塩基を含む、態様1~23のいずれかに記載の化合物。
[態様25]
前記修飾核酸塩基が5-メチルシトシンである、態様24に記載の化合物。
[態様26]
前記修飾オリゴヌクレオチドが、12~30個の連結したヌクレオシドからなり、かつ
連結したデオキシヌクレオシドからなるギャップセグメントと、
連結したヌクレオシドからなる5’ウィングセグメントと、
連結したヌクレオシドからなる3’ウィングセグメントと、を含み、
前記ギャップセグメントが、前記5’ウィングセグメントと前記3’ウィングセグメントとの間に位置付けられ、各ウィングセグメントの各ヌクレオシドが、修飾糖を含む、態様1~25のいずれかに記載の化合物。
[態様27]
前記修飾オリゴヌクレオチドが、15~30、18~24、19~22、13~25、14~25、15~25、16、または20個の連結したヌクレオシドからなる、態様1~26のいずれかに記載の化合物。
[態様28]
修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオチドが、20個の連結したヌクレオシドからなり、かつ配列番号58のうちのいずれかの等長部分に相補的なa少なくとも8個の連続した核酸塩基を含む核酸塩基配列を有し、前記修飾オリゴヌクレオチドが、
10個の連結したデオキシヌクレオシドからなるギャップセグメントと、
5個の連結したヌクレオシドからなる5’ウィングセグメントと、
5個の連結したヌクレオシドからなる3’ウィングセグメントと、を含み、
前記ギャップセグメントが、前記5’ウィングセグメントと前記3’ウィングセグメントとの間に位置付けられ、各ウィングセグメントの各ヌクレオシドが、2’-O-メトキシエチル糖を含み、各ヌクレオシド間結合が、ホスホロチオエート結合であり、各シトシン残基が、5-メチルシトシンである、化合物。
[態様176]
以下の式
を有する化合物であって、
式中、xが、GalNAcを含む共役基である、化合物。
[態様177]
以下の式
を有する化合物。
[態様178]
以下の式
を有する化合物。
[態様179]
以下の式
を有する化合物であって、
式中、R1が、-OCH2CH2OCH3(MOE)であり、R2が、Hであるか、またはR1およびR2が一緒になって橋を形成するかのいずれかであり、そこで、R1が、-O-であり、R2が、-CH2-、-CH(CH3)-、または-CH2CH2-であり、結果として生じる橋が、-O-CH2-、-O-CH(CH3)-、および-O-CH2CH2-から選択されるように、R1およびR2が直接連結され、
同一の環上、独立して、各環のR3とR4の各対について、R3が、Hおよび-OCH2CH2OCH3から選択され、R4が、Hであるか、またはR3およびR4が一緒になって橋を形成するかのいずれかであり、そこで、R3が、-O-であり、R4が、-CH2-、-CH(CH3)-、または-CH2CH2-であり、結果として生じる橋が、-O-CH2-、-O-CH(CH3)-、および-O-CH2CH2-から選択されるように、R3およびR4が直接連結され、
R5が、Hおよび-CH3から選択され、
Zが、S-およびO-から選択される、化合物。
[態様180]
態様1~179のいずれかに記載の前記化合物またはその塩と、薬剤的に許容される担体または希釈剤のうちの少なくとも1つと、を含む、組成物。
[態様181]
態様1~180のいずれかに記載の前記化合物を含むプロドラッグ。
[態様182]
動物に態様1~181のいずれかに記載の前記化合物または組成物を投与することを含む、方法。
[態様183]
前記動物がヒトである、態様181に記載の方法。
[態様184]
前記化合物の投与が、心臓血管、代謝性、および/もしくは炎症性疾患行を予防するか、治療するか、改善するか、またはその進行を遅らせる、態様181に記載の方法。
[態様185]
前記化合物または組成物と第2の薬剤を共投与することを含む、態様182に記載の方法。
[態様186]
前記化合物または組成物と前記第2の薬剤が同時に投与される、態様185に記載の方法。
[態様187]
前記投与が非経口投与である、態様176に記載の方法。
[態様188]
前記投与が皮下投与である、態様176に記載の方法。
[態様189]
動物におけるapo(a)mRNAまたはタンパク質発現を減少させる方法であって、前記動物に態様1~181のいずれかに記載の前記化合物または組成物を投与して、前記動物におけるapo(a)mRNAまたはタンパク質発現を減少させることを含む、方法。
[態様190]
動物におけるLp(a)レベルを減少させる方法であって、前記動物に態様1~181のいずれかに記載の前記化合物または組成物を投与して、前記動物におけるapo(a)mRNAまたはタンパク質発現を減少させることを含む、方法。
[態様191]
治療に用いるための態様1~190のいずれかに記載の前記化合物を含む組成物。
[態様192]
apo(a)の上昇および/またはLp(a)の上昇に関連した疾患を治療するか、予防するか、またはその進行を遅らせる際に用いられる、態様191に記載の化合物。
[態様193]
前記疾患が、炎症性、心臓血管、もしくは代謝性疾患、障害、または状態である、態様191に記載の化合物。
Claims (193)
- 修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオ
チドが、12~30個の連結したヌクレオシドからなり、かつ配列番号1の核酸塩基39
01~3920の等長部分に相補的な少なくとも8個の連続した核酸塩基の一部を含む核
酸塩基配列を含み、前記修飾オリゴヌクレオチドの前記核酸塩基配列が、配列番号1に少
なくとも80%相補的である、化合物。 - 前記修飾オリゴヌクレオチドが、配列番号1の等長部分に相補的な少なくとも10、少
なくとも12、少なくとも14、少なくとも16、少なくとも18、少なくとも19、ま
たは少なくとも20個の連続した核酸塩基の一部を含む核酸塩基配列を含む、請求項1に
記載の化合物。 - 修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオ
チドが、12~30個の連結したヌクレオシドからなり、かつ配列番号1の核酸塩基39
00~3923の等長部分に相補的な少なくとも8、少なくとも10、少なくとも12、
少なくとも14、少なくとも15、または少なくとも16個の連続した核酸塩基の一部を
含む核酸塩基配列を含み、前記修飾オリゴヌクレオチドの前記核酸塩基配列が、配列番号
1に少なくとも80%相補的である、化合物。 - 前記修飾オリゴヌクレオチドの前記核酸塩基配列が、配列番号1に少なくとも85%、
少なくとも90%、少なくとも95%、または100%相補的である、請求項1~3のい
ずれかに記載の化合物。 - 修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオ
チドが、12~30個の連結したヌクレオシドからなり、かつ配列番号58の核酸塩基配
列の少なくとも8、最小9、最小10、最小11、少なくとも12、最小13、少なくと
も14、少なくとも15、少なくとも16、最小17、最小18、最小19、または20
個の連続した核酸塩基を含む核酸塩基配列を有する、化合物。 - 修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオ
チドが、12~30個の連結したヌクレオシドからなり、かつ配列番号12~130、1
33、134の核酸塩基配列のうちのいずれかの少なくとも8、最小9、最小10、最小
11、少なくとも12、最小13、少なくとも14、少なくとも15、少なくとも16、
最小17、最小18、最小19、または20個の連続した核酸塩基を含む核酸塩基配列を
有する、化合物。 - 前記修飾オリゴヌクレオチドが一本鎖である、請求項1~6のいずれかに記載の化合物
。 - 前記修飾オリゴヌクレオチドが二本鎖である、請求項1~6のいずれかに記載の化合物
。 - 前記修飾オリゴヌクレオチドが少なくとも1個の修飾ヌクレオシド間結合を含む、請求
項1~のいずれかに記載の化合物。 - 前記修飾ヌクレオシド間結合がホスホロチオエートヌクレオシド間結合である、請求項
9に記載の化合物。 - 前記修飾オリゴヌクレオチドが少なくとも1個のホスホジエステルヌクレオシド間結合
を含む、請求項10に記載の化合物。 - 前記修飾オリゴヌクレオチドが少なくとも2個のホスホジエステルヌクレオシド間結合
を含む、請求項10に記載の化合物。 - 前記修飾オリゴヌクレオチドが少なくとも3個のホスホジエステルヌクレオシド間結合
を含む、請求項10に記載の化合物。 - 前記修飾オリゴヌクレオチドが少なくとも4個のホスホジエステルヌクレオシド間結合
を含む、請求項10に記載の化合物。 - 前記修飾オリゴヌクレオチドが少なくとも5個のホスホジエステルヌクレオシド間結合
を含む、請求項10に記載の化合物。 - 前記修飾オリゴヌクレオチドが少なくとも6個のホスホジエステルヌクレオシド間結合
を含む、請求項10に記載の化合物。 - 前記修飾オリゴヌクレオチドが少なくとも7個のホスホジエステルヌクレオシド間結合
を含む、請求項10に記載の化合物。 - 前記修飾オリゴヌクレオチドの各ヌクレオシド間結合が、ホスホジエステルヌクレオシ
ド間結合およびホスホロチオエートヌクレオシド間結合から選択される、請求項11~1
7のいずれかに記載の化合物。 - 前記修飾オリゴヌクレオチドの各ヌクレオシド間結合が、ホスホロチオエートヌクレオ
シド間結合を含み、ホスホロチオエートヌクレオシド間結合である、請求項1~8のいず
れかに記載の化合物。 - ISIS 494372および共役基からなる化合物。
- 前記修飾オリゴヌクレオチドが少なくとも1個の修飾糖を含む、請求項1~20のいず
れかに記載の化合物。 - 少なくとも1個の修飾糖が二環糖である、請求項21に記載の化合物。
- 少なくとも1個の修飾糖が、2’-O-メトキシエチル、拘束エチル、3’-フルオロ
-HNA、または4’-(CH2)n-O-2’橋を含み、式中、nが、1または2であ
る、請求項21に記載の化合物。 - 少なくとも1個のヌクレオシドが、修飾核酸塩基を含む、請求項1~23のいずれかに
記載の化合物。 - 前記修飾核酸塩基が5-メチルシトシンである、請求項24に記載の化合物。
- 前記修飾オリゴヌクレオチドが、12~30個の連結したヌクレオシドからなり、かつ
連結したデオキシヌクレオシドからなるギャップセグメントと、
連結したヌクレオシドからなる5’ウィングセグメントと、
連結したヌクレオシドからなる3’ウィングセグメントと、を含み、
前記ギャップセグメントが、前記5’ウィングセグメントと前記3’ウィングセグメ
ントとの間に位置付けられ、各ウィングセグメントの各ヌクレオシドが、修飾糖を含む、
請求項1~25のいずれかに記載の化合物。 - 前記修飾オリゴヌクレオチドが、15~30、18~24、19~22、13~25、
14~25、15~25、16、または20個の連結したヌクレオシドからなる、請求項
1~26のいずれかに記載の化合物。 - 修飾オリゴヌクレオチドおよび共役基を含む化合物であって、前記修飾オリゴヌクレオ
チドが、20個の連結したヌクレオシドからなり、かつ配列番号58のうちのいずれかの
等長部分に相補的なa少なくとも8個の連続した核酸塩基を含む核酸塩基配列を有し、前
記修飾オリゴヌクレオチドが、
10個の連結したデオキシヌクレオシドからなるギャップセグメントと、
5個の連結したヌクレオシドからなる5’ウィングセグメントと、
5個の連結したヌクレオシドからなる3’ウィングセグメントと、を含み、
前記ギャップセグメントが、前記5’ウィングセグメントと前記3’ウィングセグメ
ントとの間に位置付けられ、各ウィングセグメントの各ヌクレオシドが、2’-O-メト
キシエチル糖を含み、各ヌクレオシド間結合が、ホスホロチオエート結合であり、各シト
シン残基が、5-メチルシトシンである、化合物。 - 前記共役基が、前記修飾オリゴヌクレオチドの5’末端で前記修飾オリゴヌクレオチド
に連結される、請求項1~28のいずれかに記載の化合物。 - 前記共役基が、前記修飾オリゴヌクレオチドの3’末端で前記修飾オリゴヌクレオチド
に連結される、請求項1~28のいずれかに記載の化合物。 - 前記共役基が、正確に1個のリガンドを含む、請求項1~30のいずれかに記載の化合
物。 - 前記共役基が、正確に2個のリガンドを含む、請求項1~30のいずれかに記載の化合
物。 - 前記共役基が、3個以上のリガンドを含む、請求項1~30のいずれかに記載の化合物
。 - 前記共役基が、正確に3個のリガンドを含む、請求項1~30のいずれかに記載の化合
物。 - 各リガンドが、多糖、修飾多糖、糖、修飾多糖、マンノース、ガラクトース、マンノー
ス誘導体、ガラクトース誘導体、D-マンノピラノース、L-マンノピラノース、D-ア
ラビノース、L-ガラクトース、D-キシロフラノース、L-キシロフラノース、D-グ
ルコース、L-グルコース、D-ガラクトース、L-ガラクトース、α-D-マンノフラ
ノース、β-D-マンノフラノース、α-D-マンノピラノース、β-D-マンノピラノ
ース、α-D-グルコピラノース、β-D-グルコピラノース、α-D-グルコフラノー
ス、β-D-グルコフラノース、α-D-フルクトフラノース、α-D-フルクトピラノ
ース、α-D-ガラクトピラノース、β-D-ガラクトピラノース、α-D-ガラクトフ
ラノース、β-D-ガラクトフラノース、グルコサミン、シアル酸、α-D-ガラクトサ
ミン、N-アセチルガラクトサミン、2-アミノ-3-O-[(R)-1-カルボキシエ
チル]-2-デオキシ-β-D-グルコピラノース、2-デオキシ-2-メチルアミノ-
L-グルコピラノース、4,6-ジデオキシ-4-ホルムアミド-2,3-ジ-O-メチ
ル-D-マンノピラノース、2-デオキシ-2-スルホアミノ-D-グルコピラノース、
N-グリコロイル-α-ノイラミン酸、5-チオ-β-D-グルコピラノース、メチル2
,3,4-トリ-O-アセチル-1-チオ-6-O-トリチル-α-D-グルコピラノシ
ド、4-チオ-β-D-ガラクトピラノース、エチル3,4,6,7-テトラ-O-アセ
チル-2-デオキシ-1,5-ジチオ-α-D-グルコ-ヘプトピラノシド、2,5-ア
ンヒドロ-D-アロノニトリル、リボース、D-リボース、D-4-チオリボース、L-
リボース、L-4-チオリボースの中から選択される、請求項31~34のいずれかに記
載の化合物。 - 各リガンドがN-アセチルガラクトサミンである、請求項35に記載の化合物。
- 前記共役基が、少なくとも1個のリン結合基または中性結合基を含む、請求項30~3
6のいずれかに記載の化合物。 - 前記共役基が、前記修飾オリゴヌクレオチドに共有結合される、請求項1~46のいず
れかに記載の化合物。 - 前記共役リンカーがピロリジンを含む、請求項48~61のいずれかに記載の化合物。
- 前記共役リンカーがピロリジンを含まない、請求項48~61のいずれかに記載の化合
物。 - 前記共役リンカーがPEGを含む、請求項48~63のいずれかに記載の化合物。
- 前記共役リンカーがアミドを含む、請求項48~64のいずれかに記載の化合物。
- 前記共役リンカーが少なくとも2個のアミドを含む、請求項48~64のいずれかに記
載の化合物。 - 前記共役リンカーがアミドを含まない、請求項48~64のいずれかに記載の化合物。
- 前記共役リンカーがポリアミドを含む、請求項48~67のいずれかに記載の化合物。
- 前記共役リンカーがアミンを含む、請求項48~68のいずれかに記載の化合物。
- 前記共役リンカーが1個以上のジスルフィド結合を含む、請求項48~69のいずれか
に記載の化合物。 - 前記共役リンカーがタンパク質結合部分を含む、請求項48~70のいずれかに記載の
化合物。 - 前記タンパク質結合部分が脂質を含む、請求項71に記載の化合物。
- 前記タンパク質結合部分が、コレステロール、コール酸、アダマンタン酢酸、1-ピレ
ン酪酸、ジヒドロテストステロン、1,3-ビス-O(ヘキサデシル)グリセロール、ゲ
ラニルオキシヘキシル基、ヘキサデシルグリセロール、ボルネオール、メントール、1,
3-プロパンジオール、ヘプタデシル基、パルミチン酸、ミリスチン酸、O3-(オレオ
イル)リトコール酸、O3-(オレオイル)コレン酸、ジメトキシトリチル、またはフェ
ノキサジン)、ビタミン(例えば、葉酸塩、ビタミンA、ビタミンE、ビオチン、ピリド
キサール)、ペプチド、炭水化物(例えば、単糖、二糖、三糖、四糖、オリゴ糖、多糖)
、エンドソーム溶解成分、ステロイド(例えば、ウバオール、ヘシゲニン、ジオスゲニン
)、テルペン(例えば、トリテルペン、例えば、サルササポゲニン、フリーデリン、エピ
フリーデラノール誘導体化リトコール酸)、またはカチオン性脂質の中から選択される、
請求項71に記載の化合物。 - 前記タンパク質結合部分が、C16~C22長鎖飽和もしくは不飽和脂肪酸、コレステ
ロール、コール酸、ビタミンE、アダマンタン、または1-ペンタフルオロプロピルの中
から選択される、請求項71に記載の化合物。 - 前記分岐基がエーテルを含む、請求項48~81のいずれかに記載の化合物。
- 少なくとも1個のテザーがエチレングリコールを含む、請求項48~93のいずれかに
記載の化合物。 - 少なくとも1個のテザーがアミドを含む、請求項48~93または95のいずれかに記
載の化合物。 - 少なくとも1個のテザーがポリアミドを含む、請求項48~93または95のいずれか
に記載の化合物。 - 少なくとも1個のテザーがアミンを含む、請求項48~93または95のいずれかに記
載の化合物。 - 少なくとも2個のテザーが互いに異なる、請求項48~93または95のいずれかに記
載の化合物。 - 前記テザーのすべてが互いに同一である、請求項48~93または95のいずれかに記
載の化合物。 - 前記リガンドがガラクトースである、請求項47~108のいずれかに記載の化合物。
- 前記リガンドがマンノース-6-ホスフェートである、請求項47~108のいずれか
に記載の化合物。 - 前記共役基が細胞標的部分を含む、請求項1~30または56~81のいずれかに記載
の化合物。 - 前記共役基が、ホスホジエステル、アミド、またはエステルの中から選択される切断可
能な部分を含む、請求項1~147のいずれかに記載の化合物。 - 前記共役基が、ホスホジエステル切断可能な部分を含む、請求項1~147のいずれか
に記載の化合物。 - 前記共役基が、切断可能な部分を含まず、前記共役基が、前記共役基と前記オリゴヌク
レオチドとの間にホスホロチオエート結合を含む、請求項1~147のいずれかに記載の
化合物。 - 前記共役基が、アミド切断可能な部分を含む、請求項1~150のいずれかに記載の化
合物。 - 前記共役基が、エステル切断可能な部分を含む、請求項1~150のいずれかに記載の
化合物。 - Bxが、アデニン、グアニン、チミン、ウラシル、またはシトシン、もしくは5-メチ
ルシトシンの中から選択される、請求項153~170のいずれかに記載の化合物。 - Bxがアデニンである、請求項153~170のいずれかに記載の化合物。
- Bxがチミンである、請求項153~170のいずれかに記載の化合物。
- Q13がO(CH2)2-OCH3である、請求項153~170のいずれかに記載の
化合物。 - Q13がHである、請求項153~170のいずれかに記載の化合物。
- 以下の式
式中、R1が、-OCH2CH2OCH3(MOE)であり、R2が、Hであるか、ま
たはR1およびR2が一緒になって橋を形成するかのいずれかであり、そこで、R1が、
-O-であり、R2が、-CH2-、-CH(CH3)-、または-CH2CH2-であ
り、結果として生じる橋が、-O-CH2-、-O-CH(CH3)-、および-O-C
H2CH2-から選択されるように、R1およびR2が直接連結され、
同一の環上、独立して、各環のR3とR4の各対について、R3が、Hおよび-OCH
2CH2OCH3から選択され、R4が、Hであるか、またはR3およびR4が一緒にな
って橋を形成するかのいずれかであり、そこで、R3が、-O-であり、R4が、-CH
2-、-CH(CH3)-、または-CH2CH2-であり、結果として生じる橋が、-
O-CH2-、-O-CH(CH3)-、および-O-CH2CH2-から選択されるよ
うに、R3およびR4が直接連結され、
R5が、Hおよび-CH3から選択され、
Zが、S-およびO-から選択される、化合物。 - 請求項1~179のいずれかに記載の前記化合物またはその塩と、薬剤的に許容される
担体または希釈剤のうちの少なくとも1つと、を含む、組成物。 - 請求項1~180のいずれかに記載の前記化合物を含むプロドラッグ。
- 動物に請求項1~181のいずれかに記載の前記化合物または組成物を投与することを
含む、方法。 - 前記動物がヒトである、請求項181に記載の方法。
- 前記化合物の投与が、心臓血管、代謝性、および/もしくは炎症性疾患行を予防するか
、治療するか、改善するか、またはその進行を遅らせる、請求項181に記載の方法。 - 前記化合物または組成物と第2の薬剤を共投与することを含む、請求項182に記載の
方法。 - 前記化合物または組成物と前記第2の薬剤が同時に投与される、請求項185に記載の
方法。 - 前記投与が非経口投与である、請求項176に記載の方法。
- 前記投与が皮下投与である、請求項176に記載の方法。
- 動物におけるapo(a)mRNAまたはタンパク質発現を減少させる方法であって、
前記動物に請求項1~181のいずれかに記載の前記化合物または組成物を投与して、前
記動物におけるapo(a)mRNAまたはタンパク質発現を減少させることを含む、方
法。 - 動物におけるLp(a)レベルを減少させる方法であって、前記動物に請求項1~18
1のいずれかに記載の前記化合物または組成物を投与して、前記動物におけるapo(a
)mRNAまたはタンパク質発現を減少させることを含む、方法。 - 治療に用いるための請求項1~190のいずれかに記載の前記化合物を含む組成物。
- apo(a)の上昇および/またはLp(a)の上昇に関連した疾患を治療するか、予
防するか、またはその進行を遅らせる際に用いられる、請求項191に記載の化合物。 - 前記疾患が、炎症性、心臓血管、もしくは代謝性疾患、障害、または状態である、請求
項191に記載の化合物。
Applications Claiming Priority (15)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361818442P | 2013-05-01 | 2013-05-01 | |
| US61/818,442 | 2013-05-01 | ||
| US201361823826P | 2013-05-15 | 2013-05-15 | |
| US61/823,826 | 2013-05-15 | ||
| US201361843887P | 2013-07-08 | 2013-07-08 | |
| US61/843,887 | 2013-07-08 | ||
| US201361871673P | 2013-08-29 | 2013-08-29 | |
| US61/871,673 | 2013-08-29 | ||
| US201361880790P | 2013-09-20 | 2013-09-20 | |
| US61/880,790 | 2013-09-20 | ||
| US201461976991P | 2014-04-08 | 2014-04-08 | |
| US61/976,991 | 2014-04-08 | ||
| US201461986867P | 2014-04-30 | 2014-04-30 | |
| US61/986,867 | 2014-04-30 | ||
| JP2019170394A JP7429103B2 (ja) | 2013-05-01 | 2019-09-19 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019170394A Division JP7429103B2 (ja) | 2013-05-01 | 2019-09-19 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2022017514A true JP2022017514A (ja) | 2022-01-25 |
Family
ID=51843959
Family Applications (23)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016512052A Active JP6216444B2 (ja) | 2013-05-01 | 2014-05-01 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2016512055A Expired - Fee Related JP6456362B2 (ja) | 2013-05-01 | 2014-05-01 | 組成物および方法 |
| JP2016512054A Active JP6995478B2 (ja) | 2013-05-01 | 2014-05-01 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2016512053A Active JP6387084B2 (ja) | 2013-05-01 | 2014-05-01 | アポリポタンパク質c−iiiの発現を調節するための組成物および方法 |
| JP2016512051A Active JP6769866B2 (ja) | 2013-05-01 | 2014-05-01 | 共役アンチセンス化合物およびそれらの使用 |
| JP2017182019A Active JP6592486B2 (ja) | 2013-05-01 | 2017-09-22 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2018148112A Active JP6652602B2 (ja) | 2013-05-01 | 2018-08-07 | アポリポタンパク質c−iiiの発現を調節するための組成物および方法 |
| JP2018236205A Expired - Fee Related JP6639629B2 (ja) | 2013-05-01 | 2018-12-18 | 組成物および方法 |
| JP2019170394A Active JP7429103B2 (ja) | 2013-05-01 | 2019-09-19 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2019211074A Active JP6866459B2 (ja) | 2013-05-01 | 2019-11-22 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2019211075A Pending JP2020039355A (ja) | 2013-05-01 | 2019-11-22 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2019229981A Ceased JP2020058370A (ja) | 2013-05-01 | 2019-12-20 | 組成物および方法 |
| JP2020008836A Pending JP2020074787A (ja) | 2013-05-01 | 2020-01-23 | アポリポタンパク質c−iiiの発現を調節するための組成物および方法 |
| JP2020158332A Active JP7177127B2 (ja) | 2013-05-01 | 2020-09-23 | 共役(conjugated)アンチセンス化合物およびそれらの使用 |
| JP2021023118A Withdrawn JP2021074021A (ja) | 2013-05-01 | 2021-02-17 | 組成物および方法 |
| JP2021065088A Active JP7339294B2 (ja) | 2013-05-01 | 2021-04-07 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2021181533A Pending JP2022017514A (ja) | 2013-05-01 | 2021-11-05 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2022180094A Pending JP2023012548A (ja) | 2013-05-01 | 2022-11-10 | 共役(conjugated)アンチセンス化合物およびそれらの使用 |
| JP2023093703A Active JP7633311B2 (ja) | 2013-05-01 | 2023-06-07 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2023181938A Pending JP2024010070A (ja) | 2013-05-01 | 2023-10-23 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2024091116A Pending JP2024116224A (ja) | 2013-05-01 | 2024-06-05 | 共役(conjugated)アンチセンス化合物およびそれらの使用 |
| JP2025018106A Pending JP2025072530A (ja) | 2013-05-01 | 2025-02-06 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2025118631A Pending JP2025174962A (ja) | 2013-05-01 | 2025-07-14 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
Family Applications Before (16)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016512052A Active JP6216444B2 (ja) | 2013-05-01 | 2014-05-01 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2016512055A Expired - Fee Related JP6456362B2 (ja) | 2013-05-01 | 2014-05-01 | 組成物および方法 |
| JP2016512054A Active JP6995478B2 (ja) | 2013-05-01 | 2014-05-01 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2016512053A Active JP6387084B2 (ja) | 2013-05-01 | 2014-05-01 | アポリポタンパク質c−iiiの発現を調節するための組成物および方法 |
| JP2016512051A Active JP6769866B2 (ja) | 2013-05-01 | 2014-05-01 | 共役アンチセンス化合物およびそれらの使用 |
| JP2017182019A Active JP6592486B2 (ja) | 2013-05-01 | 2017-09-22 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2018148112A Active JP6652602B2 (ja) | 2013-05-01 | 2018-08-07 | アポリポタンパク質c−iiiの発現を調節するための組成物および方法 |
| JP2018236205A Expired - Fee Related JP6639629B2 (ja) | 2013-05-01 | 2018-12-18 | 組成物および方法 |
| JP2019170394A Active JP7429103B2 (ja) | 2013-05-01 | 2019-09-19 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2019211074A Active JP6866459B2 (ja) | 2013-05-01 | 2019-11-22 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2019211075A Pending JP2020039355A (ja) | 2013-05-01 | 2019-11-22 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2019229981A Ceased JP2020058370A (ja) | 2013-05-01 | 2019-12-20 | 組成物および方法 |
| JP2020008836A Pending JP2020074787A (ja) | 2013-05-01 | 2020-01-23 | アポリポタンパク質c−iiiの発現を調節するための組成物および方法 |
| JP2020158332A Active JP7177127B2 (ja) | 2013-05-01 | 2020-09-23 | 共役(conjugated)アンチセンス化合物およびそれらの使用 |
| JP2021023118A Withdrawn JP2021074021A (ja) | 2013-05-01 | 2021-02-17 | 組成物および方法 |
| JP2021065088A Active JP7339294B2 (ja) | 2013-05-01 | 2021-04-07 | Hbvおよびttr発現を調節するための組成物および方法 |
Family Applications After (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022180094A Pending JP2023012548A (ja) | 2013-05-01 | 2022-11-10 | 共役(conjugated)アンチセンス化合物およびそれらの使用 |
| JP2023093703A Active JP7633311B2 (ja) | 2013-05-01 | 2023-06-07 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2023181938A Pending JP2024010070A (ja) | 2013-05-01 | 2023-10-23 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
| JP2024091116A Pending JP2024116224A (ja) | 2013-05-01 | 2024-06-05 | 共役(conjugated)アンチセンス化合物およびそれらの使用 |
| JP2025018106A Pending JP2025072530A (ja) | 2013-05-01 | 2025-02-06 | Hbvおよびttr発現を調節するための組成物および方法 |
| JP2025118631A Pending JP2025174962A (ja) | 2013-05-01 | 2025-07-14 | アポリポタンパク質(a)発現を調節するための組成物および方法 |
Country Status (40)
Families Citing this family (505)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101773551B1 (ko) | 2008-10-15 | 2017-08-31 | 아이오니스 파마수티컬즈, 인코포레이티드 | 인자 11 발현의 조정 |
| KR101881596B1 (ko) | 2008-12-02 | 2018-07-24 | 웨이브 라이프 사이언시스 재팬 인코포레이티드 | 인 원자 변형된 핵산의 합성 방법 |
| RU2612521C2 (ru) | 2009-07-06 | 2017-03-09 | Онтории, Инк. | Новые пролекарства нуклеиновых кислот и способы их применения |
| JP5868324B2 (ja) | 2010-09-24 | 2016-02-24 | 株式会社Wave Life Sciences Japan | 不斉補助基 |
| EP3521451A1 (en) | 2010-11-17 | 2019-08-07 | Ionis Pharmaceuticals, Inc. | Modulation of alpha synuclein expression |
| BR112014001244A2 (pt) | 2011-07-19 | 2017-02-21 | Wave Life Sciences Pte Ltd | métodos para a síntese de ácidos nucléicos funcionalizados |
| EP2751270B1 (en) * | 2011-08-29 | 2018-08-22 | Ionis Pharmaceuticals, Inc. | Oligomer-conjugate complexes and their use |
| AU2013202595B2 (en) | 2012-03-30 | 2016-04-21 | Biogen Ma Inc. | Methods for modulating Tau expression for reducing seizure and modifying a neurodegenerative syndrome |
| WO2013159108A2 (en) * | 2012-04-20 | 2013-10-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising bicyclic nucleotides and uses thereof |
| US20160002624A1 (en) | 2012-05-17 | 2016-01-07 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide compositions |
| US9574193B2 (en) | 2012-05-17 | 2017-02-21 | Ionis Pharmaceuticals, Inc. | Methods and compositions for modulating apolipoprotein (a) expression |
| KR102657351B1 (ko) * | 2012-05-24 | 2024-04-16 | 아이오니스 파마수티컬즈, 인코포레이티드 | 아포지질단백질 (a) 발현을 조절하는 방법들 및 조성물들 |
| CN112007045A (zh) | 2012-07-13 | 2020-12-01 | 波涛生命科学有限公司 | 手性控制 |
| BR112015000723A2 (pt) | 2012-07-13 | 2017-06-27 | Shin Nippon Biomedical Laboratories Ltd | adjuvante de ácido nucléico quiral |
| ES2862073T3 (es) | 2012-07-13 | 2021-10-06 | Wave Life Sciences Ltd | Grupo auxiliar asimétrico |
| CA2889044A1 (en) * | 2012-11-15 | 2014-05-22 | Roche Innovation Center Copenhagen A/S | Anti apob antisense conjugate compounds |
| MX2015009056A (es) * | 2013-01-30 | 2015-10-05 | Hoffmann La Roche | Conjugados de oligonucleotidos de acido nucleico bloqueado y carbohidratos. |
| DK2956176T3 (en) * | 2013-02-14 | 2018-08-27 | Ionis Pharmaceuticals Inc | MODULATION OF APOLIPOPROTEIN C-III (APOCIII) EXPRESSION IN LIPOPROTEIN LIPASE DEFICIENT (LPLD) POPULATIONS |
| SG10201803157XA (en) | 2013-05-01 | 2018-05-30 | Regulus Therapeutics Inc | Microrna compounds and methods for modulating mir-122 |
| CA2909868C (en) | 2013-05-01 | 2021-10-19 | Regulus Therapeutics Inc. | Compounds and methods for enhanced cellular uptake |
| BR112015027322A8 (pt) | 2013-05-01 | 2018-01-02 | Isis Pharmaceuticals Inc | Compostos antissenso conjugados e sua utilização |
| MX391977B (es) | 2013-06-27 | 2025-03-21 | Roche Innovation Ct Copenhagen As | Oligómeros antisentido y conjugados con diana en la proteína-convertasa subtilisina/kexina tipo 9(pcsk9). |
| EP4039278A1 (en) * | 2013-07-11 | 2022-08-10 | Alnylam Pharmaceuticals, Inc. | Oligonucleotide-ligand conjugates and process for their preparation |
| JP6617702B2 (ja) | 2013-07-15 | 2019-12-11 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | Fty720のアザサイクリック拘束アナログ |
| TWI772856B (zh) | 2013-07-19 | 2022-08-01 | 美商百健Ma公司 | 用於調節τ蛋白表現之組合物 |
| US9943604B2 (en) | 2013-09-20 | 2018-04-17 | Ionis Pharmaceuticals, Inc. | Targeted therapeutic nucleosides and their use |
| TWI669393B (zh) * | 2013-10-02 | 2019-08-21 | 艾爾妮蘭製藥公司 | 抑制lect2基因表現之組合物及方法 |
| US11162096B2 (en) | 2013-10-14 | 2021-11-02 | Ionis Pharmaceuticals, Inc | Methods for modulating expression of C9ORF72 antisense transcript |
| US9994846B2 (en) | 2013-10-25 | 2018-06-12 | Regulus Therapeutics Inc. | MicroRNA compounds and methods for modulating miR-21 activity |
| KR20160083876A (ko) * | 2013-11-14 | 2016-07-12 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | ApoB 안티센스 접합체 화합물 |
| WO2015105083A1 (ja) * | 2014-01-07 | 2015-07-16 | 塩野義製薬株式会社 | アンチセンスオリゴヌクレオチド及び糖誘導体を含む二本鎖オリゴヌクレオチド |
| EP3095459A4 (en) | 2014-01-15 | 2017-08-23 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having antitumor effect and antitumor agent |
| US10144933B2 (en) | 2014-01-15 | 2018-12-04 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having immunity induction activity, and immunity induction activator |
| EP3095460A4 (en) | 2014-01-15 | 2017-08-23 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having anti-allergic activity, and anti-allergic agent |
| CN113278617A (zh) | 2014-01-16 | 2021-08-20 | 波涛生命科学有限公司 | 手性设计 |
| EP3105331B1 (en) | 2014-02-11 | 2021-06-23 | Alnylam Pharmaceuticals, Inc. | Ketohexokinase (khk) irna compositions and methods of use thereof |
| LT3119888T (lt) | 2014-03-19 | 2021-10-11 | Ionis Pharmaceuticals, Inc. | Kompozicijos, skirtos ataksino 2 raiškos moduliavimui |
| WO2015143245A1 (en) | 2014-03-19 | 2015-09-24 | Isis Pharmaceuticals, Inc. | Methods for modulating ataxin 2 expression |
| SI3126499T1 (sl) | 2014-04-01 | 2020-09-30 | Biogen Ma Inc. | Sestave za moduliranje izražanja SOD-1 |
| BR122020024446B8 (pt) | 2014-05-01 | 2022-06-28 | Ionis Pharmaceuticals Inc | Compostos para modulação da expressão do receptor do hormônio de crescimento |
| EP3811977B1 (en) * | 2014-05-01 | 2025-12-03 | Ionis Pharmaceuticals, Inc. | Method for synthesis of reactive conjugate clusters |
| HUE052709T2 (hu) | 2014-05-01 | 2021-05-28 | Ionis Pharmaceuticals Inc | Módosított antiszensz oligonukleotidok konjugátumai és azok alkalmazása PKK expressziójának módosítására |
| MX380866B (es) * | 2014-05-01 | 2025-03-12 | Ionis Pharmaceuticals Inc | Composiciones y métodos para modular la expresión del factor b del complemento. |
| EP3845547A1 (en) | 2014-05-01 | 2021-07-07 | Ionis Pharmaceuticals, Inc. | Galnac3 conjugated modified oligonucleotide for modulating angiopoietin-like 3 expression |
| GB201408623D0 (en) | 2014-05-15 | 2014-07-02 | Santaris Pharma As | Oligomers and oligomer conjugates |
| CN112301031A (zh) | 2014-05-22 | 2021-02-02 | 阿尔尼拉姆医药品有限公司 | 血管紧张素原(AGT)iRNA组合物及其使用方法 |
| GB201410693D0 (en) | 2014-06-16 | 2014-07-30 | Univ Southampton | Splicing modulation |
| BR112017001931A2 (pt) | 2014-08-07 | 2017-11-28 | Regulus Therapeutics Inc | direcionamento de micrornas para distúrbios metabólicos |
| US10436802B2 (en) | 2014-09-12 | 2019-10-08 | Biogen Ma Inc. | Methods for treating spinal muscular atrophy |
| CN107109411B (zh) | 2014-10-03 | 2022-07-01 | 冷泉港实验室 | 核基因输出的定向增加 |
| CN106795200B (zh) * | 2014-10-10 | 2020-06-19 | 豪夫迈·罗氏有限公司 | Galnac亚磷酰胺、其核酸缀合物及其用途 |
| EP3207138B1 (en) * | 2014-10-17 | 2020-07-15 | Alnylam Pharmaceuticals, Inc. | Polynucleotide agents targeting aminolevulinic acid synthase-1 (alas1) and uses thereof |
| JOP20200092A1 (ar) | 2014-11-10 | 2017-06-16 | Alnylam Pharmaceuticals Inc | تركيبات iRNA لفيروس الكبد B (HBV) وطرق لاستخدامها |
| AU2015350120B2 (en) * | 2014-11-17 | 2021-05-27 | Alnylam Pharmaceuticals, Inc. | Apolipoprotein C3 (APOC3) iRNA compositions and methods of use thereof |
| EP3234141A4 (en) | 2014-12-18 | 2018-06-20 | Alnylam Pharmaceuticals, Inc. | Reversir tm compounds |
| US10793855B2 (en) | 2015-01-06 | 2020-10-06 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of C9ORF72 antisense transcript |
| US10538763B2 (en) | 2015-01-16 | 2020-01-21 | Ionis Pharmaceuticals, Inc. | Compounds and methods for modulation of DUX4 |
| CA2976445A1 (en) | 2015-02-13 | 2016-08-18 | Alnylam Pharmaceuticals, Inc. | Patatin-like phospholipase domain containing 3 (pnpla3) irna compositions and methods of use thereof |
| AU2016217825B2 (en) * | 2015-02-15 | 2022-03-10 | Arcturus Therapeutics, Inc. | Acyl-amino-LNA and/or hydrocarbyl-amino-LNA oligonucleotides |
| US11129844B2 (en) | 2015-03-03 | 2021-09-28 | Ionis Pharmaceuticals, Inc. | Compositions and methods for modulating MECP2 expression |
| HK1249140A1 (zh) | 2015-04-03 | 2018-10-26 | Ionis Pharmaceuticals, Inc. | 用於调节tmprss6表达的化合物和方法 |
| JP6892433B2 (ja) | 2015-04-03 | 2021-06-23 | ユニバーシティ・オブ・マサチューセッツUniversity Of Massachusetts | 十分に安定化された非対称sirna |
| WO2016164746A1 (en) | 2015-04-08 | 2016-10-13 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for inhibiting expression of the lect2 gene |
| WO2016167780A1 (en) | 2015-04-16 | 2016-10-20 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of c9orf72 antisense transcript |
| US11249071B2 (en) | 2015-04-24 | 2022-02-15 | California Institute Of Technology | Reactivation of x chromosome genes |
| EP3310918B1 (en) | 2015-06-18 | 2020-08-05 | Alnylam Pharmaceuticals, Inc. | Polynucleotide agents targeting hydroxyacid oxidase (glycolate oxidase, hao1) and methods of use thereof |
| WO2016209862A1 (en) | 2015-06-23 | 2016-12-29 | Alnylam Pharmaceuticals, Inc. | Glucokinase (gck) irna compositions and methods of use thereof |
| EP3313989B1 (en) | 2015-06-29 | 2024-12-25 | Ionis Pharmaceuticals, Inc. | Modified crispr rna and modified single crispr rna and uses thereof |
| WO2017011286A1 (en) | 2015-07-10 | 2017-01-19 | Alnylam Pharmaceuticals, Inc. | Insulin-like growth factor binding protein, acid labile subunit (igfals) and insulin-like growth factor 1 (igf-1) irna compositions and methods of use thereof |
| ES2917181T3 (es) | 2015-07-10 | 2022-07-07 | Ionis Pharmaceuticals Inc | Moduladores de diacilglicerol aciltransferasa 2 (DGAT2) |
| EP3323893A4 (en) * | 2015-07-16 | 2019-03-27 | Kyowa Hakko Kirin Co., Ltd. | BETA2GPI GENE EXPRESSION-INHIBITING NUCLEIC ACID COMPLEX |
| MA43072A (fr) | 2015-07-22 | 2018-05-30 | Wave Life Sciences Ltd | Compositions d'oligonucléotides et procédés associés |
| CN107709342B (zh) | 2015-08-06 | 2021-09-03 | 豪夫迈·罗氏有限公司 | 制备乙酰半乳糖胺酸衍生物的方法 |
| CN105111118B (zh) * | 2015-08-14 | 2017-04-12 | 天津小新医药科技有限公司 | L‑薄荷醇类p2y12受体拮抗剂、制备方法及其用途 |
| CN105111119B (zh) * | 2015-08-14 | 2017-04-12 | 天津小新医药科技有限公司 | 一类卤代苯l‑薄荷醇类p2y12受体拮抗剂及其用途 |
| WO2017030973A1 (en) | 2015-08-14 | 2017-02-23 | University Of Massachusetts | Bioactive conjugates for oligonucleotide delivery |
| WO2017032726A1 (en) | 2015-08-24 | 2017-03-02 | Roche Innovation Center Copenhagen A/S | Lna-g process |
| EA201890619A1 (ru) | 2015-09-02 | 2018-09-28 | Элнилэм Фармасьютикалз, Инк. | КОМПОЗИЦИИ iRNA ЛИГАНДА 1 БЕЛКА ЗАПРОГРАММИРОВАННОЙ ГИБЕЛИ КЛЕТОК 1 (PD-L1) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ |
| EP3353328A4 (en) | 2015-09-24 | 2019-06-12 | Ionis Pharmaceuticals, Inc. | MODULATORS OF KRAS EXPRESSION |
| JP6853539B2 (ja) | 2015-09-24 | 2021-03-31 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニアThe Regents Of The University Of California | 合成スフィンゴ脂質様分子、薬物、これらの合成方法、および処置方法 |
| WO2017053720A1 (en) * | 2015-09-25 | 2017-03-30 | Tarveda Therapeutics, Inc. | RNAi CONJUGATES, PARTICLES AND FORMULATIONS THEREOF |
| US20210052631A1 (en) * | 2015-09-25 | 2021-02-25 | Ionis Pharmaceuticals, Inc. | Conjugated antisense compounds and their use |
| WO2017053999A1 (en) | 2015-09-25 | 2017-03-30 | Ionis Pharmaceuticals, Inc. | Conjugated antisense compounds and their use |
| US10533175B2 (en) | 2015-09-25 | 2020-01-14 | Ionis Pharmaceuticals, Inc. | Compositions and methods for modulating Ataxin 3 expression |
| JOP20210043A1 (ar) * | 2015-10-01 | 2017-06-16 | Arrowhead Pharmaceuticals Inc | تراكيب وأساليب لتثبيط تعبير جيني للـ lpa |
| KR20180073584A (ko) | 2015-10-02 | 2018-07-02 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | 올리고뉴클레오타이드 접합 방법 |
| MY200263A (en) | 2015-10-08 | 2023-12-18 | Ionis Pharmaceuticals Inc | Compounds and methods for modulating angiotensinogen expression |
| EP3359685A1 (en) | 2015-10-09 | 2018-08-15 | University Of Southampton | Modulation of gene expression and screening for deregulated protein expression |
| US10955407B2 (en) | 2015-10-22 | 2021-03-23 | Roche Innovation Center Copenhagen A/S | In vitro toxicity screening assay |
| WO2017068087A1 (en) | 2015-10-22 | 2017-04-27 | Roche Innovation Center Copenhagen A/S | Oligonucleotide detection method |
| CN113952353A (zh) * | 2015-11-06 | 2022-01-21 | Ionis制药公司 | 调节载脂蛋白(a)表达 |
| PT4119569T (pt) | 2015-11-06 | 2024-10-23 | Ionis Pharmaceuticals Inc | Compostos antissentido conjugados para utilização em terapia |
| MX378999B (es) * | 2015-11-16 | 2025-03-10 | Hoffmann La Roche | Fosforamidita de agrupacion de n-acetilgalactosamina (galnac). |
| US11058709B1 (en) | 2015-12-04 | 2021-07-13 | Ionis Pharmaceuticals, Inc. | Methods of treating breast cancer |
| US11096956B2 (en) | 2015-12-14 | 2021-08-24 | Stoke Therapeutics, Inc. | Antisense oligomers and uses thereof |
| US11083745B2 (en) | 2015-12-14 | 2021-08-10 | Cold Spring Harbor Laboratory | Antisense oligomers for treatment of autosomal dominant mental retardation-5 and Dravet Syndrome |
| EP3397288A4 (en) | 2015-12-31 | 2019-09-11 | Ionis Pharmaceuticals, Inc. | PROCESS FOR REDUCING ATAXIN-2 EXPRESSION |
| EP3400300A4 (en) | 2016-01-05 | 2019-08-07 | Ionis Pharmaceuticals, Inc. | PROCESS FOR REDUCING LRRK2 EXPRESSION |
| JP2019503176A (ja) | 2016-01-12 | 2019-02-07 | インターロイキン ジェネティクス, インコーポレイテッド | 処置に対する応答を予測するための方法 |
| CN116064544A (zh) | 2016-01-26 | 2023-05-05 | 日产化学株式会社 | 单链寡核苷酸 |
| EP3409780B1 (en) | 2016-01-29 | 2021-01-20 | Kyowa Kirin Co., Ltd. | Nucleic acid complex |
| WO2017132669A1 (en) * | 2016-01-31 | 2017-08-03 | University Of Massachusetts | Branched oligonucleotides |
| CN113797348A (zh) | 2016-03-07 | 2021-12-17 | 箭头药业股份有限公司 | 用于治疗性化合物的靶向配体 |
| WO2017156242A1 (en) | 2016-03-09 | 2017-09-14 | Ionis Pharmaceuticals, Inc. | Methods and compositions for inhibiting pmp22 expression |
| HRP20210315T1 (hr) | 2016-03-14 | 2021-04-16 | F. Hoffmann - La Roche Ag | Oligonukleotidi za smanjenje ekspresije pd-l1 |
| US10577607B2 (en) | 2016-03-16 | 2020-03-03 | Ionis Pharmaceuticals, Inc. | Modulation of DYRK1B expression |
| US10961271B2 (en) | 2016-03-16 | 2021-03-30 | Ionis Pharmaceuticals, Inc. | Methods of modulating KEAP1 |
| EP3228326A1 (en) * | 2016-04-05 | 2017-10-11 | Silence Therapeutics GmbH | Nucleic acid linked to a trivalent glycoconjugate |
| MA45478A (fr) * | 2016-04-11 | 2019-02-20 | Arbutus Biopharma Corp | Compositions de conjugués d'acides nucléiques ciblés |
| AU2017248637A1 (en) | 2016-04-13 | 2018-09-27 | Ionis Pharmaceuticals, Inc. | Methods for reducing C9ORF72 expression |
| EP3442983A1 (en) | 2016-04-14 | 2019-02-20 | H. Hoffnabb-La Roche Ag | TRITYL-MONO-Ga1NAc COMPOUNDS AND THEIR USE |
| MA45295A (fr) | 2016-04-19 | 2019-02-27 | Alnylam Pharmaceuticals Inc | Composition d'arni de protéine de liaison de lipoprotéines haute densité (hdlbp/vigiline) et procédés pour les utiliser |
| WO2017188898A1 (en) | 2016-04-29 | 2017-11-02 | Nanyang Technological University | G-quadruplex-containing antisense oligonucleotides |
| MA45270A (fr) | 2016-05-04 | 2017-11-09 | Wave Life Sciences Ltd | Compositions d'oligonucléotides et procédés associés |
| CA3021994A1 (en) | 2016-05-06 | 2017-11-09 | Brett P. Monia | Glp-1 receptor ligand moiety conjugated oligonucleotides and uses thereof |
| MA45496A (fr) | 2016-06-17 | 2019-04-24 | Hoffmann La Roche | Molécules d'acide nucléique pour la réduction de l'arnm de padd5 ou pad7 pour le traitement d'une infection par l'hépatite b |
| CA3023514A1 (en) | 2016-06-17 | 2017-12-21 | Ionis Pharmaceuticals, Inc. | Modulation of gys1 expression |
| WO2017216340A1 (en) | 2016-06-17 | 2017-12-21 | F. Hoffmann-La Roche Ag | In vitro nephrotoxicity screening assay |
| JP7012033B2 (ja) | 2016-06-17 | 2022-02-10 | エフ.ホフマン-ラ ロシュ アーゲー | インビトロ腎毒性スクリーニングアッセイ |
| CN109477103A (zh) | 2016-06-22 | 2019-03-15 | ProQR治疗上市公司Ⅱ | 单链rna-编辑寡核苷酸 |
| US12251446B2 (en) | 2016-06-30 | 2025-03-18 | Kyowa Kirin Co., Ltd. | Nucleic acid conjugate |
| AU2017296195A1 (en) | 2016-07-11 | 2019-01-24 | Translate Bio Ma, Inc. | Nucleic acid conjugates and uses thereof |
| US10781175B2 (en) | 2016-07-15 | 2020-09-22 | Am Chemicals Llc | Solid supports and phosphoramidite building blocks for oligonucleotide conjugates |
| PE20190513A1 (es) | 2016-07-15 | 2019-04-10 | Ionis Pharmaceuticals Inc | Compuestos y metodos para la modulacion de smn2 |
| US11753638B2 (en) | 2016-08-12 | 2023-09-12 | University Of Massachusetts | Conjugated oligonucleotides |
| WO2018035380A1 (en) | 2016-08-17 | 2018-02-22 | Solstice Biologics, Ltd. | Polynucleotide constructs |
| ES2837076T3 (es) | 2016-09-01 | 2021-06-29 | Proqr Therapeutics Ii Bv | Oligonucleótidos para la edición de ARN de cadena sencilla modificados químicamente |
| US10294474B2 (en) | 2016-09-02 | 2019-05-21 | Arrowhead Pharmaceuticals, Inc. | Targeting ligands |
| US20190275171A1 (en) * | 2016-09-23 | 2019-09-12 | Ionis Pharmaceuticals, Inc. | Gene therapy and targeted delivery of conjugated compounds |
| JOP20190065A1 (ar) | 2016-09-29 | 2019-03-28 | Ionis Pharmaceuticals Inc | مركبات وطرق لتقليل التعبير عن tau |
| CN109661233A (zh) * | 2016-10-06 | 2019-04-19 | Ionis 制药公司 | 缀合低聚化合物的方法 |
| JP2019537427A (ja) | 2016-10-27 | 2019-12-26 | カリフォルニア インスティチュート オブ テクノロジー | X染色体の再活性化のためのhdac阻害剤組成物 |
| JOP20190104A1 (ar) | 2016-11-10 | 2019-05-07 | Ionis Pharmaceuticals Inc | مركبات وطرق لتقليل التعبير عن atxn3 |
| WO2018089914A1 (en) * | 2016-11-11 | 2018-05-17 | Alios Biopharma, Inc. | Oligonucleotide targeting strategy for hbv cccdna |
| TWI788312B (zh) | 2016-11-23 | 2023-01-01 | 美商阿尼拉製藥公司 | 絲胺酸蛋白酶抑制因子A1 iRNA組成物及其使用方法 |
| AU2017368050A1 (en) | 2016-11-29 | 2019-06-20 | Puretech Lyt, Inc. | Exosomes for delivery of therapeutic agents |
| WO2018102745A1 (en) | 2016-12-02 | 2018-06-07 | Cold Spring Harbor Laboratory | Modulation of lnc05 expression |
| WO2018110980A1 (ko) * | 2016-12-13 | 2018-06-21 | 주식회사 에이엠사이언스 | B형 간염 예방 또는 치료용 의약 조성물 |
| TWI790217B (zh) | 2016-12-16 | 2023-01-21 | 美商阿尼拉製藥公司 | 使用甲狀腺素運載蛋白(TTR)iRNA組成物於治療或預防TTR相關疾病之方法 |
| CN108239644B (zh) * | 2016-12-23 | 2021-05-28 | 苏州瑞博生物技术股份有限公司 | 一种小干扰核酸和药物组合物及其用途 |
| US10329620B2 (en) | 2017-01-12 | 2019-06-25 | Cardioforecast Ltd. | Methods and kits for treating cardiovascular disease |
| US20190367920A1 (en) | 2017-01-13 | 2019-12-05 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides for modulating nfkb1 expression |
| EP3568477A1 (en) | 2017-01-13 | 2019-11-20 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides for modulating rela expression |
| EP3568480A1 (en) | 2017-01-13 | 2019-11-20 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides for modulating nfkb2 expression |
| EP3568481A1 (en) | 2017-01-13 | 2019-11-20 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides for modulating relb expression |
| WO2018130582A1 (en) | 2017-01-13 | 2018-07-19 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides for modulating rel expression |
| US11572558B2 (en) | 2017-02-06 | 2023-02-07 | Nissan Chemical Corporation | Single-stranded oligonucleotide |
| WO2018165564A1 (en) * | 2017-03-09 | 2018-09-13 | Ionis Pharmaceuticals, Inc. | Morpholino modified oligomeric compounds |
| KR102520654B1 (ko) | 2017-03-10 | 2023-04-10 | 고쿠리츠켄큐카이하츠호진 고쿠리츠 세이쿠이료켄큐센타 | 안티센스 올리고뉴클레오티드 및 당원병 Ia형 예방 또는 치료용 조성물 |
| JOP20190215A1 (ar) | 2017-03-24 | 2019-09-19 | Ionis Pharmaceuticals Inc | مُعدّلات التعبير الوراثي عن pcsk9 |
| IL321221A (en) | 2017-04-05 | 2025-07-01 | Silence Therapeutics Gmbh | Products and compositions |
| EP3385272A1 (en) | 2017-04-05 | 2018-10-10 | Silence Therapeutics GmbH | Further novel oligonucleotide-ligand conjugates |
| NZ757927A (en) | 2017-04-11 | 2023-07-28 | Arbutus Biopharma Corp | Targeted compositions |
| CN118384268A (zh) | 2017-04-18 | 2024-07-26 | 阿尔尼拉姆医药品有限公司 | 具有乙肝病毒(hbv)感染的受试者的治疗方法 |
| WO2018215049A1 (en) | 2017-05-23 | 2018-11-29 | F. Hoffmann-La Roche Ag | Process for galnac oligonucleotide conjugates |
| JP6952366B2 (ja) * | 2017-05-26 | 2021-10-20 | 国立研究開発法人国立循環器病研究センター | Pcsk9を標的としたアンチセンス核酸 |
| JP2020522265A (ja) * | 2017-06-02 | 2020-07-30 | ウェイブ ライフ サイエンシズ リミテッドWave Life Sciences Ltd. | オリゴヌクレオチド組成物及びその使用方法 |
| WO2018223056A1 (en) | 2017-06-02 | 2018-12-06 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| EP3599844A4 (en) * | 2017-06-07 | 2021-01-13 | University of Massachusetts | ANTI-ADAM33 OLIGONUCLEOTIDES AND RELATED PROCESSES |
| JP7406793B2 (ja) | 2017-06-23 | 2023-12-28 | ユニバーシティー オブ マサチューセッツ | 2テイル自己デリバリー型siRNAおよび関連方法 |
| WO2019006455A1 (en) | 2017-06-30 | 2019-01-03 | Solstice Biologics, Ltd. | AUXILIARIES OF CHIRAL PHOSPHORAMIDITIS AND METHODS OF USE THEREOF |
| AU2018301477A1 (en) | 2017-07-13 | 2020-02-27 | Alnylam Pharmaceuticals Inc. | Lactate dehydrogenase a (LDHA) iRNA compositions and methods of use thereof |
| CN110997918A (zh) | 2017-07-26 | 2020-04-10 | 日产化学株式会社 | 单链寡核苷酸 |
| WO2019027009A1 (ja) * | 2017-08-02 | 2019-02-07 | 協和発酵キリン株式会社 | 核酸複合体 |
| TW201909925A (zh) * | 2017-08-02 | 2019-03-16 | 日商協和醱酵麒麟有限公司 | 核酸複合體 |
| WO2019030313A2 (en) | 2017-08-11 | 2019-02-14 | Roche Innovation Center Copenhagen A/S | OLIGONUCLEOTIDES FOR MODULATION OF UBE3C EXPRESSION |
| JP2020531450A (ja) | 2017-08-17 | 2020-11-05 | アルナイラム ファーマシューティカルズ, インコーポレイテッドAlnylam Pharmaceuticals, Inc. | 調整性reversir(商標)化合物 |
| CA3071033A1 (en) | 2017-08-18 | 2019-02-21 | Ionis Pharmaceuticals, Inc. | Modulation of the notch signaling pathway for treatment of respiratory disorders |
| WO2019038228A1 (en) | 2017-08-22 | 2019-02-28 | Roche Innovation Center Copenhagen A/S | OLIGONUCLEOTIDES FOR MODULATION OF TOM1 EXPRESSION |
| SMT202400071T1 (it) | 2017-08-25 | 2024-03-13 | Stoke Therapeutics Inc | Oligomeri antisenso per il trattamento di condizioni e malattie |
| WO2019051173A1 (en) | 2017-09-08 | 2019-03-14 | Ionis Pharmaceuticals, Inc. | MODULATORS OF SMAD7 EXPRESSION |
| BR112020004955A2 (pt) * | 2017-09-14 | 2020-10-06 | Janssen Biopharma, Inc. | derivados de galnac |
| CN118530993A (zh) | 2017-09-29 | 2024-08-23 | 因特利亚治疗公司 | 用于ttr基因编辑及治疗attr淀粉样变性的组合物及方法 |
| EP3585162B1 (en) | 2017-09-29 | 2023-08-30 | Regeneron Pharmaceuticals, Inc. | Rodents comprising a humanized ttr locus and methods of use |
| WO2019073018A1 (en) | 2017-10-13 | 2019-04-18 | Roche Innovation Center Copenhagen A/S | METHODS OF IDENTIFYING ANTISENSE OLIGONUCLEOTIDE IMPROVED OLIGONUCLEOTIDE PHOSPHOROTHIOATE STEREODEFINIS VARIANTS USING PARTIALLY STEREODEFINIS OLIGONUCLEOTIDE SUB LIBRARIES |
| PE20200868A1 (es) | 2017-10-16 | 2020-08-31 | Hoffmann La Roche | OLIGONUCLEOTIDOS ANTISENTIDO Y CONJUGADOS QUE LOS COMPRENDEN PARA LA REDUCCION DEL ARNm DE PAPD5 Y PAPD7 |
| SG11202002940QA (en) | 2017-11-01 | 2020-04-29 | Alnylam Pharmaceuticals Inc | Complement component c3 irna compositions and methods of use thereof |
| TWI809004B (zh) | 2017-11-09 | 2023-07-21 | 美商Ionis製藥公司 | 用於降低snca表現之化合物及方法 |
| EP3710587A1 (en) | 2017-11-16 | 2020-09-23 | Alnylam Pharmaceuticals, Inc. | Kisspeptin 1 (kiss1) irna compositions and methods of use thereof |
| WO2019100039A1 (en) | 2017-11-20 | 2019-05-23 | Alnylam Pharmaceuticals, Inc. | Serum amyloid p component (apcs) irna compositions and methods of use thereof |
| EP3718572B1 (en) | 2017-12-01 | 2024-07-31 | Suzhou Ribo Life Science Co., Ltd. | Nucleic acid, composition and conjugate containing nucleic acid, preparation method and use |
| JP7261494B2 (ja) | 2017-12-01 | 2023-04-20 | スーチョウ リボ ライフ サイエンス カンパニー、リミテッド | 核酸、当該核酸を含む組成物及び複合体ならびに調製方法と使用 |
| EP3719128B1 (en) | 2017-12-01 | 2025-01-15 | Suzhou Ribo Life Science Co., Ltd. | Double-stranded oligonucleotide, composition and conjugate comprising double-stranded oligonucleotide, preparation method therefor and use thereof |
| JP7360716B2 (ja) | 2017-12-01 | 2023-10-13 | スーチョウ リボ ライフ サイエンス カンパニー、リミテッド | 核酸、当該核酸を含む組成物および複合体ならびに調製方法と使用 |
| WO2019105404A1 (zh) * | 2017-12-01 | 2019-06-06 | 苏州瑞博生物技术有限公司 | 一种核酸、含有该核酸的组合物与缀合物及制备方法和用途 |
| WO2019105403A1 (zh) * | 2017-12-01 | 2019-06-06 | 苏州瑞博生物技术有限公司 | 一种核酸、含有该核酸的组合物与缀合物及制备方法和用途 |
| CN118291456A (zh) | 2017-12-01 | 2024-07-05 | 苏州瑞博生物技术股份有限公司 | 一种核酸、含有该核酸的组合物与缀合物及制备方法和用途 |
| EP3724333A2 (en) | 2017-12-11 | 2020-10-21 | Roche Innovation Center Copenhagen A/S | Oligonucleotides for modulating fndc3b expression |
| WO2019115417A2 (en) | 2017-12-12 | 2019-06-20 | Roche Innovation Center Copenhagen A/S | Oligonucleotides for modulating rb1 expression |
| US11725208B2 (en) | 2017-12-14 | 2023-08-15 | Ionis Pharmaceuticals, Inc. | Conjugated antisense compounds and their use |
| CN111727252A (zh) | 2017-12-18 | 2020-09-29 | 阿尔尼拉姆医药品有限公司 | 高速泳动族盒-1(HMGB1)iRNA组合物及其使用方法 |
| JP2021507253A (ja) | 2017-12-21 | 2021-02-22 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Htra1 rnaアンタゴニストについてのコンパニオン診断 |
| WO2019126641A2 (en) | 2017-12-21 | 2019-06-27 | Ionis Pharmaceuticals, Inc. | Modulation of frataxin expression |
| EP4092117A1 (en) | 2017-12-22 | 2022-11-23 | Roche Innovation Center Copenhagen A/S | Gapmer oligonucleotides comprising a phosphorodithioate internucleoside linkage |
| EP4074724A1 (en) | 2017-12-22 | 2022-10-19 | Roche Innovation Center Copenhagen A/S | Oligonucleotides comprising a phosphorodithioate internucleoside linkage |
| JP2021508327A (ja) | 2017-12-22 | 2021-03-04 | ロシュ イノベーション センター コペンハーゲン エーエス | 新規のチオホスホラミダイト |
| US11485752B2 (en) * | 2017-12-26 | 2022-11-01 | Guangzhou Ribobio Co., Ltd. | Modified oligonucleotides and compound that can be used for synthesizing same |
| CN109957566B (zh) * | 2017-12-26 | 2023-08-25 | 广州市锐博生物科技有限公司 | 修饰的寡核苷酸和可用于合成修饰的寡核苷酸的化合物 |
| JP7436030B2 (ja) | 2017-12-29 | 2024-02-21 | スーチョウ リボ ライフ サイエンス カンパニー、リミテッド | 複合体及びその調製方法と使用 |
| EP3737758A1 (en) | 2018-01-10 | 2020-11-18 | Roche Innovation Center Copenhagen A/S | Oligonucleotides for modulating pias4 expression |
| US12178855B2 (en) | 2018-01-10 | 2024-12-31 | Translate Bio Ma, Inc. | Compositions and methods for facilitating delivery of synthetic nucleic acids to cells |
| KR20200109338A (ko) | 2018-01-12 | 2020-09-22 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | 알파-시누클레인 안티센스 올리고뉴클레오티드 및 이의 용도 |
| SG11202006528XA (en) | 2018-01-12 | 2020-08-28 | Bristol Myers Squibb Co | Antisense oligonucleotides targeting alpha-synuclein and uses thereof |
| EP3737760A1 (en) | 2018-01-12 | 2020-11-18 | Roche Innovation Center Copenhagen A/S | Oligonucleotides for modulating gsk3b expression |
| CN120310791A (zh) | 2018-01-12 | 2025-07-15 | 百时美施贵宝公司 | 靶向α-突触核蛋白的反义寡核苷酸及其用途 |
| JP2021511072A (ja) | 2018-01-15 | 2021-05-06 | アイオニス・ファーマシューティカルズ・インコーポレイテッドIonis Pharmaceuticals,Inc. | Dnm2発現のモジュレーター |
| JP2021510525A (ja) | 2018-01-17 | 2021-04-30 | ロシュ イノベーション センター コペンハーゲン エーエス | Erc1発現を調節するためのオリゴヌクレオチド |
| JP2021511029A (ja) | 2018-01-18 | 2021-05-06 | ロシュ イノベーション センター コペンハーゲン エーエス | Srebp1を標的とするアンチセンスオリゴヌクレオチド |
| WO2019145386A1 (en) | 2018-01-26 | 2019-08-01 | Roche Innovation Center Copenhagen A/S | Oligonucleotides for modulating csnk1d expression |
| AU2019218987B2 (en) | 2018-02-12 | 2025-04-24 | Ionis Pharmaceuticals, Inc. | Modified compounds and uses thereof |
| KR20200120675A (ko) | 2018-02-14 | 2020-10-21 | 딥 지노믹스 인코포레이티드 | 윌슨병을 위한 올리고뉴클레오티드 요법 |
| KR20200140805A (ko) | 2018-02-21 | 2020-12-16 | 브리스톨-마이어스 스큅 컴퍼니 | Camk2d 안티센스 올리고뉴클레오티드 및 그의 용도 |
| US11732260B2 (en) | 2018-03-02 | 2023-08-22 | Ionis Pharmaceuticals, Inc. | Compounds and methods for the modulation of amyloid-β precursor protein |
| TWI840345B (zh) | 2018-03-02 | 2024-05-01 | 美商Ionis製藥公司 | Irf4表現之調節劑 |
| KR102398295B1 (ko) * | 2018-03-09 | 2022-05-17 | 다이이찌 산쿄 가부시키가이샤 | 당원병 Ia형 치료약 |
| US11661601B2 (en) | 2018-03-22 | 2023-05-30 | Ionis Pharmaceuticals, Inc. | Methods for modulating FMR1 expression |
| PE20211912A1 (es) | 2018-04-05 | 2021-09-28 | Centre Nat Rech Scient | Uso de inhibidores de fubp1 para el tratamiento de infeccion de virus de hepatitis b |
| CA3094020A1 (en) | 2018-04-11 | 2019-10-17 | Ionis Pharmaceuticals, Inc. | Modulators of ezh2 expression |
| WO2019213016A1 (en) | 2018-04-30 | 2019-11-07 | The Children's Hospital Of Philadelphia | Methods of improving anemias by combining agents |
| JP2021523227A (ja) | 2018-05-04 | 2021-09-02 | ストーク セラピューティクス,インク. | コレステリルエステル蓄積症の処置のための方法及び組成物 |
| JP2021522816A (ja) | 2018-05-07 | 2021-09-02 | ロシュ イノベーション センター コペンハーゲン エーエス | オリゴヌクレオチド治療のための超並列的探索方法 |
| JP7279081B2 (ja) | 2018-05-08 | 2023-05-22 | レグルス セラピューティクス インコーポレイテッド | Mir-122を調節するためのマイクロrna化合物及び方法 |
| MY204000A (en) * | 2018-05-09 | 2024-07-31 | Ionis Pharmaceuticals Inc | Compounds and methods for reducing fxi expression |
| MX2020011911A (es) | 2018-05-09 | 2021-01-29 | Ionis Pharmaceuticals Inc | Compuestos y metodos para reducir de la expresion de atxn3. |
| AU2019265904A1 (en) | 2018-05-11 | 2020-11-12 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| TWI851574B (zh) | 2018-05-14 | 2024-08-11 | 美商阿尼拉製藥公司 | 血管收縮素原(AGT)iRNA組成物及其使用方法 |
| GB201808146D0 (en) | 2018-05-18 | 2018-07-11 | Proqr Therapeutics Ii Bv | Stereospecific Linkages in RNA Editing Oligonucleotides |
| JP7557378B2 (ja) | 2018-06-14 | 2024-09-27 | アイオーニス ファーマシューティカルズ, インコーポレーテッド | Stmn2発現を増加させるための化合物及び方法 |
| TWI833770B (zh) | 2018-06-27 | 2024-03-01 | 美商Ionis製藥公司 | 用於減少 lrrk2 表現之化合物及方法 |
| KR102585973B1 (ko) | 2018-07-03 | 2023-10-10 | 에프. 호프만-라 로슈 아게 | 타우 발현을 조절하기 위한 올리고뉴클레오티드 |
| WO2020007826A1 (en) | 2018-07-05 | 2020-01-09 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides targeting mbtps1 |
| WO2020011745A2 (en) | 2018-07-11 | 2020-01-16 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides targeting cers6 |
| WO2020011744A2 (en) | 2018-07-11 | 2020-01-16 | Roche Innovation Center Copenhagen A/S | Antisense oligonucleotides targeting cers5 |
| CR20210015A (es) | 2018-07-13 | 2021-03-22 | Hoffmann La Roche | Oligonucleótidos para modular la expresión de rtel 1 |
| EP3823725A4 (en) | 2018-07-17 | 2023-05-10 | Aronora, Inc. | METHODS FOR SAFELY REDUCING THROMBOPOIETIN |
| TWI843738B (zh) | 2018-07-25 | 2024-06-01 | 美商Ionis製藥公司 | 用於減少atxn2表現之化合物及方法 |
| MX2021001019A (es) | 2018-07-31 | 2021-04-19 | Roche Innovation Ct Copenhagen As | Oligonucleotidos que comprenden enlace internucleosidico de fosforotritioato. |
| CN119912512A (zh) | 2018-07-31 | 2025-05-02 | 罗氏创新中心哥本哈根有限公司 | 包含三硫代磷酸酯核苷间键的寡核苷酸 |
| WO2020033748A1 (en) | 2018-08-08 | 2020-02-13 | Arcturus Therapeutics, Inc. | Compositions and agents against nonalcoholic steatohepatitis |
| AU2019316640A1 (en) | 2018-08-10 | 2021-03-18 | University Of Massachusetts | Modified oligonucleotides targeting SNPs |
| BR112021001613A2 (pt) | 2018-08-13 | 2021-05-04 | Alnylam Pharmaceuticals, Inc. | agentes de ácido ribonucleico de fita dupla, célula, composições farmacêuticas, métodos de inibição da expressão gênica, de inibição da replicação e de tratar um sujeito, métodos para reduzir o nível de um antígeno e para reduzir a carga viral e uso de um agente de dsrna |
| WO2020038377A1 (zh) | 2018-08-21 | 2020-02-27 | 苏州瑞博生物技术有限公司 | 一种核酸、含有该核酸的药物组合物和缀合物及其用途 |
| US11279930B2 (en) | 2018-08-23 | 2022-03-22 | University Of Massachusetts | O-methyl rich fully stabilized oligonucleotides |
| CN113728102A (zh) | 2018-08-28 | 2021-11-30 | 罗氏创新中心哥本哈根有限公司 | 使用剪接调节化合物进行新抗原工程化 |
| EP3853364A1 (en) | 2018-09-18 | 2021-07-28 | Alnylam Pharmaceuticals, Inc. | Ketohexokinase (khk) irna compositions and methods of use thereof |
| TWI869213B (zh) | 2018-09-19 | 2025-01-01 | 美商Ionis製藥公司 | Pnpla3表現之調節劑 |
| US11896674B2 (en) | 2018-09-30 | 2024-02-13 | Suzhou Ribo Life Science Co., Ltd. | SiRNA conjugate, preparation method therefor and use thereof |
| WO2020077390A1 (en) * | 2018-10-18 | 2020-04-23 | Murdoch University | Antisense therapy for ptp1b related conditions |
| US10913951B2 (en) | 2018-10-31 | 2021-02-09 | University of Pittsburgh—of the Commonwealth System of Higher Education | Silencing of HNF4A-P2 isoforms with siRNA to improve hepatocyte function in liver failure |
| KR20210091703A (ko) | 2018-11-09 | 2021-07-22 | 노파르티스 아게 | apo(a)를 표적화하는 콘쥬게이션된 안티센스 화합물로 심혈관 사건의 위험을 감소시키는 방법 |
| TW202028222A (zh) | 2018-11-14 | 2020-08-01 | 美商Ionis製藥公司 | Foxp3表現之調節劑 |
| SG11202104666SA (en) | 2018-11-15 | 2021-06-29 | Ionis Pharmaceuticals Inc | Modulators of irf5 expression |
| BR112021007476A2 (pt) | 2018-11-21 | 2021-11-03 | Ionis Pharmaceuticals Inc | Compostos e métodos para reduzir a expressão de príon |
| US12416004B2 (en) | 2018-11-23 | 2025-09-16 | Sanofi | RNA compositions and methods for inhibiting ANGPTL8 |
| EP3888663A1 (en) | 2018-11-30 | 2021-10-06 | Kyowa Kirin Co., Ltd. | Nucleic acid complex |
| WO2020117706A1 (en) | 2018-12-03 | 2020-06-11 | Triplet Therapeutics, Inc. | Methods for the treatment of trinucleotide repeat expansion disorders associated with mlh3 activity |
| AU2019406186A1 (en) | 2018-12-20 | 2021-07-15 | Praxis Precision Medicines, Inc. | Compositions and methods for the treatment of KCNT1 related disorders |
| MX2021007503A (es) | 2018-12-21 | 2021-08-05 | Ionis Pharmaceuticals Inc | Moduladores de la expresion de hsd17b13. |
| GB201821269D0 (en) | 2018-12-28 | 2019-02-13 | Nippon Shinyaku Co Ltd | Myostatin signal inhibitor |
| JP7507495B2 (ja) * | 2018-12-28 | 2024-06-28 | スーチョウ リボ ライフ サイエンス カンパニー、リミテッド | 核酸、当該核酸を含む組成物及び複合体ならびに調製方法と使用 |
| CN111377985B (zh) * | 2018-12-29 | 2023-11-10 | 苏州瑞博生物技术股份有限公司 | 化合物和缀合物及其制备方法和用途 |
| CA3125441A1 (en) | 2019-01-18 | 2020-07-23 | University Of Massachusetts | Dynamic pharmacokinetic-modifying anchors |
| CN113330117B (zh) * | 2019-01-18 | 2024-05-28 | 苏州瑞博生物技术股份有限公司 | 一种核酸、含有该核酸的组合物与缀合物及制备方法和用途 |
| WO2020160453A1 (en) | 2019-01-31 | 2020-08-06 | Ionis Pharmaceuticals, Inc. | Modulators of yap1 expression |
| JP2022521512A (ja) | 2019-02-20 | 2022-04-08 | ロシュ イノベーション センター コペンハーゲン エーエス | 新規ホスホルアミダイト |
| CA3130431A1 (en) | 2019-02-20 | 2020-08-27 | Roche Innovation Center Copenhagen A/S | Phosphonoacetate gapmer oligonucleotides |
| CN109799330B (zh) * | 2019-02-22 | 2021-03-02 | 华中科技大学同济医学院附属同济医院 | 神经氨酸及神经氨酸酶抑制剂在慢性心力衰竭中的应用 |
| WO2020173845A1 (en) | 2019-02-26 | 2020-09-03 | Roche Innovation Center Copenhagen A/S | Oligonucleotide formulation method |
| MY208565A (en) | 2019-02-27 | 2025-05-15 | Ionis Pharmaceuticals Inc | Modulators of malat1 expression |
| EP3931323A4 (en) * | 2019-02-28 | 2023-04-05 | Deep Genomics Incorporated | LIGAND AGGREGATES AND METHODS OF USE AND PREPARATION |
| CA3133629A1 (en) * | 2019-03-21 | 2020-09-24 | Mitotherapeutix Llc | Multivalent ligand clusters for targeted delivery of therapeutic agents |
| CR20210538A (es) | 2019-03-29 | 2021-12-06 | Ionis Pharmaceuticals Inc | Compuestos y métodos para modular ube3a-ats |
| WO2020201144A1 (en) | 2019-04-02 | 2020-10-08 | Proqr Therapeutics Ii B.V. | Antisense oligonucleotides for immunotherapy |
| KR20210149107A (ko) | 2019-04-03 | 2021-12-08 | 브리스톨-마이어스 스큅 컴퍼니 | Angptl2 안티센스 올리고뉴클레오티드 및 그의 용도 |
| US20220251128A1 (en) * | 2019-05-17 | 2022-08-11 | Ionis Pharmaceuticals, Inc. | Synthesis of oligomeric compounds comprising phosphorothioate diester and phosphodiester linkages |
| CN117701564A (zh) | 2019-05-22 | 2024-03-15 | 苏州瑞博生物技术股份有限公司 | 核酸、药物组合物与缀合物及制备方法和用途 |
| WO2020233651A1 (zh) | 2019-05-22 | 2020-11-26 | 苏州瑞博生物技术股份有限公司 | 核酸、药物组合物与缀合物及制备方法和用途 |
| CN118256498A (zh) * | 2019-05-22 | 2024-06-28 | 苏州瑞博生物技术股份有限公司 | 核酸、药物组合物与缀合物及制备方法和用途 |
| CN113811613B (zh) | 2019-05-22 | 2024-04-05 | 苏州瑞博生物技术股份有限公司 | 核酸、药物组合物与缀合物及制备方法和用途 |
| EP3992290A4 (en) | 2019-05-24 | 2023-11-15 | Suzhou Ribo Life Science Co., Ltd. | NUCLEIC ACID, PHARMACEUTICAL COMPOSITION AND CONJUGATE, METHOD FOR THE PRODUCTION THEREOF AND USE THEREOF |
| CN113795280B (zh) | 2019-05-24 | 2024-04-05 | 苏州瑞博生物技术股份有限公司 | 核酸、药物组合物与缀合物及制备方法和用途 |
| WO2020238766A1 (zh) | 2019-05-24 | 2020-12-03 | 苏州瑞博生物技术股份有限公司 | 核酸、药物组合物与缀合物及制备方法和用途 |
| ES3033104T3 (en) | 2019-05-28 | 2025-07-30 | Ionis Pharmaceuticals Inc | Compounds and methods for reducing fus expression |
| MX2021014206A (es) | 2019-05-31 | 2022-01-06 | Aligos Therapeutics Inc | Oligonucleotidos gapmer modificados y metodos de uso. |
| AU2020286382A1 (en) | 2019-06-04 | 2021-11-04 | Regeneron Pharmaceuticals, Inc. | Non-human animals comprising a humanized TTR locus with a beta-slip mutation and methods of use |
| AU2020301419A1 (en) | 2019-06-25 | 2022-01-20 | Amgen Inc. | Purification methods for carbohydrate-linked oligonucleotides |
| ES3048358T3 (en) | 2019-07-26 | 2025-12-10 | Ionis Pharmaceuticals Inc | Compounds and methods for modulating gfap |
| WO2021022108A2 (en) | 2019-08-01 | 2021-02-04 | Alnylam Pharmaceuticals, Inc. | CARBOXYPEPTIDASE B2 (CPB2) iRNA COMPOSITIONS AND METHODS OF USE THEREOF |
| EP4007812A1 (en) | 2019-08-01 | 2022-06-08 | Alnylam Pharmaceuticals, Inc. | Serpin family f member 2 (serpinf2) irna compositions and methods of use thereof |
| CA3149835A1 (en) | 2019-08-09 | 2021-02-18 | University Of Massachusetts | Chemically modified oligonucleotides targeting snps |
| EP4013870A1 (en) | 2019-08-13 | 2022-06-22 | Alnylam Pharmaceuticals, Inc. | Small ribosomal protein subunit 25 (rps25) irna agent compositions and methods of use thereof |
| KR20220062517A (ko) * | 2019-08-15 | 2022-05-17 | 아이오니스 파마수티컬즈, 인코포레이티드 | 결합 변형된 올리고머 화합물 및 이의 용도 |
| US20220290156A1 (en) | 2019-08-27 | 2022-09-15 | Sanofi | Compositions and methods for inhibiting pcsk9 |
| US20230076803A1 (en) | 2019-08-29 | 2023-03-09 | Suzhou Ribo Life Science Co., Ltd. | Compound and drug conjugate, and preparation method and use thereof |
| EP4022062A1 (en) | 2019-08-30 | 2022-07-06 | Alnylam Pharmaceuticals, Inc. | Neurofilament light chain (nfl) as a biomarker for transthyretin amyloidosis polyneuropathy |
| JP7672394B2 (ja) * | 2019-09-03 | 2025-05-07 | アークトゥラス・セラピューティクス・インコーポレイテッド | 治療的に活性な複合体のアシアロ糖タンパク質受容体媒介送達 |
| JP7636333B2 (ja) | 2019-09-10 | 2025-02-26 | 第一三共株式会社 | 肝臓送達用GalNAc-オリゴヌクレオチドコンジュゲートおよび製造方法 |
| US12365894B2 (en) | 2019-09-16 | 2025-07-22 | University Of Massachusetts | Branched lipid conjugates of siRNA for specific tissue delivery |
| EP4031140A1 (en) | 2019-09-20 | 2022-07-27 | F. Hoffmann-La Roche AG | Method of treating hbv infection using a core protein allosteric modulator |
| JP7757277B2 (ja) | 2019-10-14 | 2025-10-21 | アストラゼネカ・アクチエボラーグ | Pnpla3発現のモジュレーター |
| EP4045652A1 (en) | 2019-10-18 | 2022-08-24 | Alnylam Pharmaceuticals, Inc. | Solute carrier family member irna compositions and methods of use thereof |
| EP4048793A1 (en) | 2019-10-22 | 2022-08-31 | Alnylam Pharmaceuticals, Inc. | Complement component c3 irna compositions and methods of use thereof |
| CA3155921A1 (en) | 2019-11-01 | 2021-05-06 | Alnylam Pharmaceuticals, Inc. | HUNTINGTINE (HTT) TARGETING RNAI AGENT COMPOSITIONS AND METHODS OF USE THEREOF |
| CN114981431A (zh) | 2019-11-13 | 2022-08-30 | 阿尔尼拉姆医药品有限公司 | 用于治疗血管紧张素原(agt)相关病症的方法和组合物 |
| EP4061945A1 (en) | 2019-11-22 | 2022-09-28 | Alnylam Pharmaceuticals, Inc. | Ataxin3 (atxn3) rnai agent compositions and methods of use thereof |
| CN112876534B (zh) * | 2019-11-29 | 2024-02-09 | 苏州瑞博生物技术股份有限公司 | 肝靶向化合物及缀合物 |
| BR112022011417A2 (pt) | 2019-12-13 | 2022-08-30 | Alnylam Pharmaceuticals Inc | Composições do agente de irna da fase de leitura aberta 72 do cromossomo humano 9 (c9orf72) e métodos de uso das mesmas |
| TW202138559A (zh) | 2019-12-16 | 2021-10-16 | 美商阿尼拉製藥公司 | 含類PATATIN磷脂酶結構域3(PNPLA3)iRNA組成物及其使用方法 |
| CN111041025B (zh) | 2019-12-17 | 2021-06-18 | 深圳市瑞吉生物科技有限公司 | 基于结合N-乙酰半乳糖胺多肽的mRNA靶向分子及其制备方法 |
| EP4077671A1 (en) | 2019-12-19 | 2022-10-26 | F. Hoffmann-La Roche AG | Use of saraf inhibitors for treating hepatitis b virus infection |
| CN114829599A (zh) | 2019-12-19 | 2022-07-29 | 豪夫迈·罗氏有限公司 | Scamp3抑制剂用于治疗乙型肝炎病毒感染的用途 |
| JP7634542B2 (ja) | 2019-12-19 | 2025-02-21 | エフ. ホフマン-ラ ロシュ アーゲー | B型肝炎ウイルス感染症を処置するためのsept9阻害剤の使用 |
| JP7653997B2 (ja) | 2019-12-19 | 2025-03-31 | エフ. ホフマン-ラ ロシュ アーゲー | B型肝炎ウイルス感染を処置するためのcops3阻害剤の使用 |
| JP2023506550A (ja) | 2019-12-19 | 2023-02-16 | エフ. ホフマン-ラ ロシュ エージー. | B型肝炎ウイルス感染症を処置するためのsbds阻害剤の使用 |
| CA3162008A1 (en) | 2019-12-24 | 2021-07-01 | F. Hoffmann-La Roche Ag | Method of treating virus infection using a tlr7 agonist |
| EP4081639A1 (en) | 2019-12-24 | 2022-11-02 | F. Hoffmann-La Roche AG | Pharmaceutical combination of a therapeutic oligonucleotide targeting hbv and a tlr7 agonist for treatment of hbv |
| AU2020415322A1 (en) | 2019-12-24 | 2022-06-16 | F. Hoffmann-La Roche Ag | Pharmaceutical combination of antiviral agents targeting HBV and/or an immune modulator for treatment of HBV |
| EP4071163A4 (en) * | 2020-01-30 | 2024-03-20 | Eisai R&D Management Co., Ltd. | NUCLEIC ACID COMPLEX AND PHARMACEUTICAL COMPOSITION CONTAINING SAME |
| CA3170377A1 (en) | 2020-02-10 | 2021-08-19 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for silencing vegf-a expression |
| JP7735288B2 (ja) | 2020-02-18 | 2025-09-08 | アルナイラム ファーマシューティカルズ, インコーポレイテッド | アポリポタンパク質C3(APOC3)iRNA組成物およびその使用法 |
| JP7446443B2 (ja) | 2020-02-28 | 2024-03-08 | アイオーニス ファーマシューティカルズ, インコーポレーテッド | Smn2を調節するための化合物及び方法 |
| CN115484932B (zh) | 2020-03-04 | 2024-12-10 | 维乎医疗有限公司 | 用于靶向rna递送的组合物和方法 |
| EP4114947A1 (en) | 2020-03-05 | 2023-01-11 | Alnylam Pharmaceuticals, Inc. | Complement component c3 irna compositions and methods of use thereof for treating or preventing complement component c3-associated diseases |
| KR20220152270A (ko) | 2020-03-06 | 2022-11-15 | 알닐람 파마슈티칼스 인코포레이티드 | 트랜스티레틴 (ttr)의 발현을 억제하기 위한 조성물 및 방법 |
| EP4114948A1 (en) | 2020-03-06 | 2023-01-11 | Alnylam Pharmaceuticals, Inc. | Ketohexokinase (khk) irna compositions and methods of use thereof |
| WO2021188611A1 (en) | 2020-03-18 | 2021-09-23 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for treating subjects having a heterozygous alanine-glyoxylate aminotransferase gene (agxt) variant |
| MX2022011801A (es) | 2020-03-23 | 2022-10-07 | Amgen Inc | Anticuerpos monoclonales contra acidos nucleicos modificados quimicamente y usos de los mismos. |
| CN115485381A (zh) * | 2020-03-26 | 2022-12-16 | 国立研究开发法人国立循环器病研究中心 | 以apoc3为靶点的反义核酸 |
| JP2023519274A (ja) | 2020-03-26 | 2023-05-10 | アルナイラム ファーマシューティカルズ, インコーポレイテッド | コロナウイルスiRNA組成物およびその使用方法 |
| US20230295622A1 (en) | 2020-04-06 | 2023-09-21 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for silencing myoc expression |
| EP4133077A1 (en) | 2020-04-07 | 2023-02-15 | Alnylam Pharmaceuticals, Inc. | Transmembrane serine protease 2 (tmprss2) irna compositions and methods of use thereof |
| WO2021206917A1 (en) | 2020-04-07 | 2021-10-14 | Alnylam Pharmaceuticals, Inc. | ANGIOTENSIN-CONVERTING ENZYME 2 (ACE2) iRNA COMPOSITIONS AND METHODS OF USE THEREOF |
| US20230159933A1 (en) | 2020-04-07 | 2023-05-25 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for silencing scn9a expression |
| BR112022021462A2 (pt) | 2020-04-21 | 2023-01-17 | Flagship Pioneering Inc | Moléculas bifuncionais e métodos de sua utilização |
| CN111575279A (zh) * | 2020-04-27 | 2020-08-25 | 江苏为真生物医药技术股份有限公司 | 利用asgpr小分子配体特异性捕获肝细胞外囊泡或循环肿瘤细胞的方法 |
| EP4143319A1 (en) | 2020-04-27 | 2023-03-08 | Alnylam Pharmaceuticals, Inc. | Apolipoprotein e (apoe) irna agent compositions and methods of use thereof |
| CN116096381A (zh) | 2020-04-30 | 2023-05-09 | 阿尔尼拉姆医药品有限公司 | 补体因子B(CFB)iRNA组合物及其使用方法 |
| IL297435A (en) | 2020-05-01 | 2022-12-01 | Ionis Pharmaceuticals Inc | Compounds and methods for modulating atxn1 |
| CA3173647A1 (en) | 2020-05-11 | 2021-11-18 | Isabel AZNAREZ | Opa1 antisense oligomers for treatment of conditions and diseases |
| WO2021231675A1 (en) | 2020-05-15 | 2021-11-18 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of argininosuccinate synthetase (ass1) |
| EP4150087A1 (en) | 2020-05-15 | 2023-03-22 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of gap junction protein beta 2 (gjb2) |
| WO2021231692A1 (en) | 2020-05-15 | 2021-11-18 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of otoferlin (otof) |
| EP4150078A1 (en) | 2020-05-15 | 2023-03-22 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of argininosuccinate lyase (asl) |
| WO2021231691A1 (en) | 2020-05-15 | 2021-11-18 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of retinoschisin 1 (rsi) |
| EP4150086A1 (en) | 2020-05-15 | 2023-03-22 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of leucine rich repeat kinase 2 (lrrk2) |
| EP4150077A1 (en) | 2020-05-15 | 2023-03-22 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of transmembrane channel-like protein 1 (tmc1) |
| WO2021231680A1 (en) | 2020-05-15 | 2021-11-18 | Korro Bio, Inc. | Methods and compositions for the adar-mediated editing of methyl-cpg binding protein 2 (mecp2) |
| CN113683651A (zh) * | 2020-05-19 | 2021-11-23 | 上海京新生物医药有限公司 | 一种GalNAc中间体的制备方法 |
| AR122534A1 (es) | 2020-06-03 | 2022-09-21 | Triplet Therapeutics Inc | Métodos para el tratamiento de los trastornos de expansión por repetición de nucleótidos asociados con la actividad de msh3 |
| CN116075592A (zh) | 2020-06-09 | 2023-05-05 | 阿尔尼拉姆医药品有限公司 | 用于沉默gpam(线粒体甘油-3-磷酸酰基转移酶1)表达的sirna组合物和方法 |
| EP4162050A1 (en) | 2020-06-09 | 2023-04-12 | Alnylam Pharmaceuticals, Inc. | Rnai compositions and methods of use thereof for delivery by inhalation |
| US20240033278A9 (en) * | 2020-06-10 | 2024-02-01 | Medshine Discovery Inc. | Conjugate group and conjugate |
| WO2021257782A1 (en) | 2020-06-18 | 2021-12-23 | Alnylam Pharmaceuticals, Inc. | XANTHINE DEHYDROGENASE (XDH) iRNA COMPOSITIONS AND METHODS OF USE THEREOF |
| ES3002193T3 (en) * | 2020-06-24 | 2025-03-06 | Sapreme Tech Bv | Conjugate of galnac and saponin, therapeutic composition comprising said conjugate and a galnac-oligonucleotide conjugate |
| AR122731A1 (es) | 2020-06-26 | 2022-10-05 | Hoffmann La Roche | Oligonucleótidos mejorados para modular la expresión de fubp1 |
| JP2023532518A (ja) | 2020-06-29 | 2023-07-28 | アイオーニス ファーマシューティカルズ, インコーポレーテッド | Plp1を調節するための化合物及び方法 |
| CN111744019B (zh) | 2020-07-01 | 2023-08-04 | 深圳瑞吉生物科技有限公司 | 基于甘露糖的mRNA靶向递送系统及其应用 |
| KR20230050336A (ko) | 2020-07-10 | 2023-04-14 | 인스티튜트 내셔널 드 라 싼테 에 드 라 리셰르셰 메디칼르 (인 썸) | 뇌전증을 치료하기 위한 방법과 조성물 |
| BR112023001624A2 (pt) | 2020-07-28 | 2023-02-23 | Ionis Pharmaceuticals Inc | Compostos e métodos para reduzir a expressão de app |
| JP2023536994A (ja) | 2020-08-07 | 2023-08-30 | アイオーニス ファーマシューティカルズ, インコーポレーテッド | Scn2aを調節する化合物および方法 |
| WO2022036126A2 (en) * | 2020-08-13 | 2022-02-17 | Amgen Inc. | RNAi CONSTRUCTS AND METHODS FOR INHIBITING MARC1 EXPRESSION |
| CN116157522A (zh) | 2020-08-21 | 2023-05-23 | 豪夫迈·罗氏有限公司 | A1cf抑制剂用于治疗乙型肝炎病毒感染的用途 |
| EP4217489A1 (en) | 2020-09-24 | 2023-08-02 | Alnylam Pharmaceuticals, Inc. | Dipeptidyl peptidase 4 (dpp4) irna compositions and methods of use thereof |
| WO2022076291A1 (en) | 2020-10-05 | 2022-04-14 | Alnylam Pharmaceuticals, Inc. | G protein-coupled receptor 75 (gpr75) irna compositions and methods of use thereof |
| EP4229200A1 (en) | 2020-10-16 | 2023-08-23 | Sanofi | Novel rna compositions and methods for inhibiting angptl3 |
| WO2022079221A1 (en) | 2020-10-16 | 2022-04-21 | Sanofi | Rna compositions and methods for inhibiting lipoprotein(a) |
| EP4232582A1 (en) | 2020-10-23 | 2023-08-30 | Alnylam Pharmaceuticals, Inc. | Mucin 5b (muc5b) irna compositions and methods of use thereof |
| EP4244355A1 (en) | 2020-11-13 | 2023-09-20 | Alnylam Pharmaceuticals, Inc. | Coagulation factor v (f5) irna compositions and methods of use thereof |
| KR20230108728A (ko) | 2020-11-18 | 2023-07-18 | 아이오니스 파마수티컬즈, 인코포레이티드 | 앤지오텐시노겐 발현을 조절하기 위한 화합물 및 방법 |
| WO2022106695A1 (en) | 2020-11-23 | 2022-05-27 | Alpha Anomeric Sas | Nucleic acid duplexes |
| EP4259795A1 (en) | 2020-12-08 | 2023-10-18 | Alnylam Pharmaceuticals, Inc. | Coagulation factor x (f10) irna compositions and methods of use thereof |
| GB2603454A (en) | 2020-12-09 | 2022-08-10 | Ucl Business Ltd | Novel therapeutics for the treatment of neurodegenerative disorders |
| CA3205040A1 (en) | 2020-12-18 | 2022-06-23 | Ionis Pharmaceuticals, Inc. | Compounds and methods for modulating factor xii |
| WO2022136466A1 (en) | 2020-12-23 | 2022-06-30 | Argonaute RNA Limited | Treatment of cardiovascular disease |
| US20250320500A1 (en) | 2020-12-29 | 2025-10-16 | Suzhou Ribo Life Science Co., Ltd. | Nucleic acid, pharmaceutical composition and sirna conjugate containing the nucleic acid, preparation method therefor, and use thereof |
| WO2022150260A1 (en) | 2021-01-05 | 2022-07-14 | Alnylam Pharmaceuticals, Inc. | COMPLEMENT COMPONENT 9 (C9) iRNA COMPOSITIONS AND METHODS OF USE THEREOF |
| WO2022162161A1 (en) * | 2021-01-30 | 2022-08-04 | E-Therapeutics Plc | Conjugated oligonucleotide compounds, methods of making and uses thereof |
| JP2024504505A (ja) * | 2021-01-30 | 2024-01-31 | イー セラピューティクス パブリック リミテッド カンパニー | コンジュゲートオリゴヌクレオチド化合物、その作製方法及び使用 |
| CN117355534A (zh) * | 2021-01-30 | 2024-01-05 | e-生物有限公司 | 缀合寡核苷酸化合物、其制备方法和用途 |
| AU2022215065A1 (en) * | 2021-01-30 | 2023-07-27 | E-Therapeutics Plc | Conjugated oligonucleotide compounds, methods of making and uses thereof |
| WO2022162157A1 (en) * | 2021-01-30 | 2022-08-04 | E-Therapeutics Plc | Conjugated oligonucleotide compounds, methods of making and uses thereof |
| TW202246500A (zh) | 2021-02-02 | 2022-12-01 | 瑞士商赫孚孟拉羅股份公司 | 用於抑制 rtel1 表現之增強型寡核苷酸 |
| WO2022174000A2 (en) | 2021-02-12 | 2022-08-18 | Alnylam Pharmaceuticals, Inc. | Superoxide dismutase 1 (sod1) irna compositions and methods of use thereof for treating or preventing superoxide dismutase 1- (sod1-) associated neurodegenerative diseases |
| US20250034561A1 (en) * | 2021-02-18 | 2025-01-30 | Oneglobe Holdings Limited | Novel Compositions for Conjugating Oligonucleotides and Carbohydrates |
| CN117222739A (zh) | 2021-02-25 | 2023-12-12 | 阿尔尼拉姆医药品有限公司 | 朊病毒蛋白(prnp)irna组合物和其使用方法 |
| AU2022226098A1 (en) | 2021-02-26 | 2023-08-24 | Alnylam Pharmaceuticals, Inc. | KETOHEXOKINASE (KHK) iRNA COMPOSITIONS AND METHODS OF USE THEREOF |
| JP2024508896A (ja) | 2021-03-04 | 2024-02-28 | アルナイラム ファーマシューティカルズ, インコーポレイテッド | アンジオポエチン様3(ANGPTL3)iRNA組成物およびその使用方法 |
| WO2022189861A1 (en) | 2021-03-08 | 2022-09-15 | Tollys | Carbohydrate conjugates of tlr3 ligands and uses thereof |
| CA3212650A1 (en) | 2021-03-08 | 2022-09-15 | Les Laboratoires Servier | Antisense oligonucleotides for inhibiting alpha-synuclein expression |
| EP4305169A1 (en) | 2021-03-12 | 2024-01-17 | Alnylam Pharmaceuticals, Inc. | Glycogen synthase kinase 3 alpha (gsk3a) irna compositions and methods of use thereof |
| TW202305134A (zh) | 2021-03-29 | 2023-02-01 | 美商艾拉倫製藥股份有限公司 | 杭丁頓蛋白(HTT)iRNA劑組成物及其使用方法 |
| EP4314293A1 (en) | 2021-04-01 | 2024-02-07 | Alnylam Pharmaceuticals, Inc. | Proline dehydrogenase 2 (prodh2) irna compositions and methods of use thereof |
| US12084662B2 (en) | 2021-04-14 | 2024-09-10 | Dicerna Pharmaceuticals, Inc. | Compositions and methods for modulating PNPLA3 expression |
| IL307926A (en) | 2021-04-26 | 2023-12-01 | Alnylam Pharmaceuticals Inc | Transmembrane assemblies, serine 6 ((TMPRSS6 IRNA) and methods of using them |
| EP4330396A1 (en) | 2021-04-29 | 2024-03-06 | Alnylam Pharmaceuticals, Inc. | Signal transducer and activator of transcription factor 6 (stat6) irna compositions and methods of use thereof |
| WO2022232650A1 (en) * | 2021-04-30 | 2022-11-03 | Ionis Pharmaceuticals, Inc. | Methods for reducing agt expression |
| JP2024522068A (ja) | 2021-05-18 | 2024-06-11 | アルナイラム ファーマシューティカルズ, インコーポレイテッド | ナトリウム-グルコース共輸送体2(sglt2)irna組成物およびその使用方法 |
| US20240263177A1 (en) | 2021-05-20 | 2024-08-08 | Korro Bio, Inc. | Methods and Compositions for Adar-Mediated Editing |
| WO2022256283A2 (en) | 2021-06-01 | 2022-12-08 | Korro Bio, Inc. | Methods for restoring protein function using adar |
| WO2022256395A1 (en) | 2021-06-02 | 2022-12-08 | Alnylam Pharmaceuticals, Inc. | Patatin-like phospholipase domain containing 3 (pnpla3) irna compositions and methods of use thereof |
| TW202308663A (zh) | 2021-06-04 | 2023-03-01 | 美商艾拉倫製藥股份有限公司 | 人類染色體9開讀框72(C9ORF72)iRNA劑組成物及其使用方法 |
| AR126070A1 (es) | 2021-06-08 | 2023-09-06 | Alnylam Pharmaceuticals Inc | Composiciones y métodos para tratar o prevenir la enfermedad de stargardt y/o trastornos asociados con la proteína transportadora de retinol 4 (rbp4) |
| MX2023015230A (es) | 2021-06-18 | 2024-01-18 | Ionis Pharmaceuticals Inc | Compuestos y metodos para reducir la expresion de ifnar1. |
| CA3174095A1 (en) | 2021-06-23 | 2022-12-29 | Vignesh Narayan HARIHARAN | Optimized anti-flt1 oligonucleotide compounds for treatment of preeclampsia and other angiogenic disorders |
| TW202315646A (zh) * | 2021-06-24 | 2023-04-16 | 美商美國禮來大藥廠 | 新穎之rna治療劑及其用途 |
| JP2024522852A (ja) * | 2021-06-24 | 2024-06-21 | イーライ リリー アンド カンパニー | 新規治療用送達部分及びその使用 |
| WO2023278410A1 (en) | 2021-06-29 | 2023-01-05 | Korro Bio, Inc. | Methods and compositions for adar-mediated editing |
| US20230194709A9 (en) | 2021-06-29 | 2023-06-22 | Seagate Technology Llc | Range information detection using coherent pulse sets with selected waveform characteristics |
| MX2023015489A (es) | 2021-06-30 | 2024-01-19 | Alnylam Pharmaceuticals Inc | Metodos y composiciones para tratar un trastorno asociado al angiotensinogeno (agt). |
| AU2022304946A1 (en) * | 2021-07-02 | 2024-02-15 | Tuojie Biotech (Shanghai) Co., Ltd. | Nucleic acid ligand and conjugate thereof, and preparation method therefor and use thereof |
| KR20240035502A (ko) | 2021-07-08 | 2024-03-15 | 니뽄 신야쿠 가부시키가이샤 | 신독성 경감제 |
| JPWO2023282346A1 (ja) | 2021-07-08 | 2023-01-12 | ||
| EP4368176A4 (en) | 2021-07-08 | 2025-06-25 | Nippon Shinyaku Co., Ltd. | Nephrotoxicity reducing agent |
| EP4373934A1 (en) | 2021-07-19 | 2024-05-29 | Alnylam Pharmaceuticals, Inc. | Methods and compositions for treating subjects having or at risk of developing a non-primary hyperoxaluria disease or disorder |
| TW202325312A (zh) | 2021-07-23 | 2023-07-01 | 美商艾拉倫製藥股份有限公司 | β-鏈蛋白(CTNNB1)iRNA組成物及其使用方法 |
| EP4377458A1 (en) | 2021-07-29 | 2024-06-05 | Alnylam Pharmaceuticals, Inc. | 3-hydroxy-3-methylglutaryl-coa reductase (hmgcr) irna compositions and methods of use thereof |
| CA3227852A1 (en) | 2021-08-03 | 2023-02-09 | Alnylam Pharmaceuticals, Inc. | Transthyretin (ttr) irna compositions and methods of use thereof |
| WO2023015223A2 (en) * | 2021-08-03 | 2023-02-09 | Verve Therapeutics, Inc. | Compositions and methods for targeted rna delivery |
| IL310295A (en) | 2021-08-04 | 2024-03-01 | Alnylam Pharmaceuticals Inc | iRNA compositions and methods for silencing angiotensinogen (AGT) |
| JP2024534766A (ja) | 2021-08-13 | 2024-09-26 | アルナイラム ファーマシューティカルズ, インコーポレイテッド | 第XII因子(F12)iRNA組成物およびその使用方法 |
| EP4395790A2 (en) | 2021-08-31 | 2024-07-10 | Alnylam Pharmaceuticals, Inc. | Cell death-inducing dffa-like effector b (cideb) irna compositions and methods of use thereof |
| EP4402263A2 (en) | 2021-09-14 | 2024-07-24 | Argonaute Rna Limited | Treatment of cardiovascular disease |
| EP4401742A2 (en) | 2021-09-17 | 2024-07-24 | Alnylam Pharmaceuticals, Inc. | Irna compositions and methods for silencing complement component 3 (c3) |
| EP4403633A1 (en) * | 2021-09-18 | 2024-07-24 | Genoval Therapeutics Co., Ltd. | Lpa inhibitor and use thereof |
| CN118159654A (zh) | 2021-09-20 | 2024-06-07 | 阿尔尼拉姆医药品有限公司 | 抑制素亚基βE(INHBE)调节剂组合物及其使用方法 |
| AU2022349576A1 (en) * | 2021-09-23 | 2024-02-15 | Shanghai Argo Biopharmaceutical Co., Ltd. | Multivalent ligand clusters with diamine scaffold for targeted delivery of therapeutic agents |
| CA3233755A1 (en) | 2021-10-01 | 2023-04-06 | Adarx Pharmaceuticals, Inc. | Prekallikrein-modulating compositions and methods of use thereof |
| WO2023069603A1 (en) | 2021-10-22 | 2023-04-27 | Korro Bio, Inc. | Methods and compositions for disrupting nrf2-keap1 protein interaction by adar mediated rna editing |
| CA3234636A1 (en) | 2021-10-29 | 2023-05-04 | Alnylam Pharmaceuticals, Inc. | Complement factor b (cfb) irna compositions and methods of use thereof |
| EP4423272A2 (en) | 2021-10-29 | 2024-09-04 | Alnylam Pharmaceuticals, Inc. | Huntingtin (htt) irna agent compositions and methods of use thereof |
| WO2023083906A2 (en) | 2021-11-11 | 2023-05-19 | F. Hoffmann-La Roche Ag | Pharmaceutical combinations for treatment of hbv |
| CN119452086A (zh) | 2021-12-03 | 2025-02-14 | 奎里斯公司 | 具有修饰的主链化学的gapmer反义寡核苷酸 |
| GB202117758D0 (en) | 2021-12-09 | 2022-01-26 | Ucl Business Ltd | Therapeutics for the treatment of neurodegenerative disorders |
| WO2023109945A1 (zh) * | 2021-12-16 | 2023-06-22 | 上海拓界生物医药科技有限公司 | 一种dsRNA、其制备方法及应用 |
| TW202340465A (zh) * | 2021-12-16 | 2023-10-16 | 大陸商上海拓界生物醫藥科技有限公司 | 靶向lpa的sirna及綴合物 |
| WO2023111210A1 (en) | 2021-12-17 | 2023-06-22 | F. Hoffmann-La Roche Ag | Combination of oligonucleotides for modulating rtel1 and fubp1 |
| JP2025504845A (ja) * | 2022-01-20 | 2025-02-19 | 上海拓界生物医薬科技有限公司 | dsRNA、その使用及び調製方法 |
| TW202345865A (zh) * | 2022-01-24 | 2023-12-01 | 大陸商上海舶望製藥有限公司 | 抑制LPA(Apo(a))蛋白表達的組合物和方法 |
| WO2023141314A2 (en) | 2022-01-24 | 2023-07-27 | Alnylam Pharmaceuticals, Inc. | Heparin sulfate biosynthesis pathway enzyme irna agent compositions and methods of use thereof |
| EP4471140A1 (en) * | 2022-01-30 | 2024-12-04 | Rona Bioscience, Limited | Targeting ligand containing n-acetylgalactosamine |
| US20240167040A1 (en) | 2022-02-21 | 2024-05-23 | Hoffmann-La Roche Inc. | Antisense oligonucleotide |
| CN120129745A (zh) | 2022-03-10 | 2025-06-10 | 日本新药株式会社 | 抗病毒反义低聚物 |
| CN114703184B (zh) * | 2022-03-11 | 2024-06-18 | 厦门甘宝利生物医药有限公司 | Lpa抑制剂及其用途 |
| AU2023234185A1 (en) | 2022-03-16 | 2024-10-03 | Daiichi Sankyo Company, Limited | siRNA FOR SUPPRESSING EXPRESSION OF TRANSFERRIN RECEPTOR-2 |
| TW202400787A (zh) | 2022-03-16 | 2024-01-01 | 美商安彼瑞可股份有限公司 | 改良siRNA生物可利用性之GalNAc組合物 |
| WO2023176863A1 (ja) | 2022-03-16 | 2023-09-21 | 第一三共株式会社 | RNAi活性を有する化学修飾オリゴヌクレオチド |
| KR20240163743A (ko) | 2022-03-28 | 2024-11-19 | 엠피리코 인크. | 변형된 올리고뉴클레오티드 |
| CN115028670B (zh) * | 2022-06-24 | 2023-07-28 | 四川大学华西医院 | 一种n-乙酰基-d-半乳糖胺三聚体前体的制备方法 |
| CN119654412A (zh) * | 2022-06-27 | 2025-03-18 | 中美瑞康核酸技术(南通)研究院有限公司 | 激活补体因子h表达的寡核苷酸调节剂 |
| WO2024013361A1 (en) | 2022-07-15 | 2024-01-18 | Proqr Therapeutics Ii B.V. | Oligonucleotides for adar-mediated rna editing and use thereof |
| EP4555085A1 (en) | 2022-07-15 | 2025-05-21 | ProQR Therapeutics II B.V. | Chemically modified oligonucleotides for adar-mediated rna editing |
| CN116814621B (zh) * | 2022-08-05 | 2025-09-09 | 厦门甘宝利生物医药有限公司 | 一种抑制apoc3基因表达的rna抑制剂及其应用 |
| CN120077130A (zh) | 2022-08-18 | 2025-05-30 | 阿尔尼拉姆医药品有限公司 | 通用非靶向sirna组合物及其使用方法 |
| MA71735A (fr) | 2022-09-15 | 2025-05-30 | Regeneron Pharmaceuticals, Inc. | Compositions d'arni de 17b-hydroxystéroïde déshydrogénase de type 13 (hsd17b13) et leurs procédés d'utilisation |
| AU2023347222A1 (en) | 2022-09-23 | 2025-03-27 | Ionis Pharmaceuticals, Inc. | Compounds and methods for reducing mecp2 expression |
| WO2024098061A2 (en) | 2022-11-04 | 2024-05-10 | Genkardia Inc. | Oligonucleotide-based therapeutics targeting cyclin d2 for the treatment of heart failure |
| WO2024106539A1 (ja) * | 2022-11-18 | 2024-05-23 | 株式会社ボナック | リガンドコンジュゲート物質及びそれを含む核酸並びにその用途 |
| EP4619524A1 (en) | 2022-11-18 | 2025-09-24 | Genkardia Inc. | Methods and compositions for preventing, treating, or reversing cardiac diastolic dysfunction |
| KR20250122469A (ko) * | 2022-11-23 | 2025-08-13 | 프레첼 테라퓨틱스, 인크. | 암 및 대사 질환의 치료를 위한 조성물 및 방법 |
| CR20250257A (es) | 2022-12-02 | 2025-08-28 | Shanghai Argo Biopharmaceutical Co Ltd | Análogos de ácidos nucleicos bicíclicos abásicos y compuestos oligoméricos preparados a partir de estos |
| WO2024137545A1 (en) | 2022-12-19 | 2024-06-27 | Arnatar Therapeutics, Inc | Arnatar compounds and methods for enhanced cellular uptake |
| CN120712352A (zh) | 2022-12-19 | 2025-09-26 | 昂拓生物医药有限公司 | 高级rna靶向(arnatar) |
| AR131419A1 (es) * | 2022-12-21 | 2025-03-19 | Lilly Co Eli | TERAPÉUTICOS NOVEDOSOS DE iARN DE FAS Y USOS DE ESTOS |
| EP4649153A1 (en) * | 2023-01-10 | 2025-11-19 | Ausperbio Therapeutics Inc. | Modified multi-segmented antisense oligonucleotides for use |
| WO2024168010A2 (en) | 2023-02-09 | 2024-08-15 | Alnylam Pharmaceuticals, Inc. | Reversir molecules and methods of use thereof |
| WO2024175113A1 (zh) * | 2023-02-24 | 2024-08-29 | 南京明德新药研发有限公司 | 包含R和E的双链siRNA类似物及其缀合物 |
| TW202448484A (zh) | 2023-04-20 | 2024-12-16 | 美商雅迪克斯製藥公司 | Mapt調節組合物及其使用方法 |
| WO2024220746A2 (en) | 2023-04-21 | 2024-10-24 | Flagship Pioneering Innovations Vii, Llc | Rnai agents targeting fatty acid synthase and related methods |
| WO2024221135A1 (en) * | 2023-04-23 | 2024-10-31 | Ausper Biopharma Co., Ltd. | Oligonucleotides for use in modulating immune responses against hepatitis b viral infection |
| US20240374741A1 (en) * | 2023-05-11 | 2024-11-14 | Synerk Biotech Limited | Compound, a conjugate and uses thereof |
| TW202502385A (zh) | 2023-05-12 | 2025-01-16 | 美商雅迪克斯製藥公司 | Nmda配位體結合之化合物及其用途 |
| UY40743A (es) * | 2023-05-19 | 2024-12-13 | Shanghai Argo Biopharmaceutical Co Ltd | COMPOSICIONES Y MÉTODOS PARA INHIBIR LA EXPRESIÓN DEL factor de coagulación XI (FXI) |
| AU2024279767A1 (en) | 2023-05-26 | 2025-12-04 | Adarx Pharmaceuticals, Inc. | Sod1-modulating compositions and methods of use thereof |
| AU2024280186A1 (en) * | 2023-05-31 | 2025-12-04 | Tuojie Biotech (Shanghai) Co., Ltd. | Dsrna targeting lpa and use thereof |
| WO2024255761A1 (zh) * | 2023-06-12 | 2024-12-19 | 大睿生物 | 包含糖的寡核苷酸递送配体 |
| EP4562158A1 (en) | 2023-06-13 | 2025-06-04 | Arnatar Therapeutics, Inc | Advanced rna targeting (arnatar) for angiotensinogen |
| WO2024263694A1 (en) | 2023-06-20 | 2024-12-26 | Adarx Pharmaceuticals, Inc. | Lrrk2-modulating compositions and methods of use thereof |
| CN119219716A (zh) * | 2023-06-30 | 2024-12-31 | 上海维申医药有限公司 | 新型GalNAc的靶向递送片段及其制备和应用 |
| WO2025015338A1 (en) | 2023-07-13 | 2025-01-16 | Korro Bio, Inc. | Rna-editing oligonucleotides and uses thereof |
| WO2025015335A1 (en) | 2023-07-13 | 2025-01-16 | Korro Bio, Inc. | Rna-editing oligonucleotides and uses thereof |
| GB202311324D0 (en) | 2023-07-24 | 2023-09-06 | Astrazeneca Ab | Multivalent cargo-carrying complexes and uses thereof |
| WO2025021831A1 (en) | 2023-07-24 | 2025-01-30 | Astrazeneca Ab | Multivalent cargo-carrying complexes and uses thereof |
| GB202311334D0 (en) | 2023-07-24 | 2023-09-06 | Astrazeneca Ab | Multivalent cargo-carrying complexes and uses thereof |
| WO2025034422A1 (en) | 2023-08-04 | 2025-02-13 | Alnylam Pharmaceuticals, Inc. | Methods and compositions for treating ctnnb1-associated disorders |
| WO2025036916A1 (en) | 2023-08-16 | 2025-02-20 | Les Laboratoires Servier | Oligonucleotides for modulating kcnt1 expression |
| TW202511489A (zh) * | 2023-08-31 | 2025-03-16 | 大陸商正大天晴藥業集團股份有限公司 | 靶向凝血因子xi的雙鏈核糖核酸 |
| TW202526017A (zh) * | 2023-09-14 | 2025-07-01 | 美商Ionis製藥公司 | 用於減少apociii表現的化合物及方法 |
| CN116925160B (zh) * | 2023-09-15 | 2023-12-08 | 天津全和诚科技有限责任公司 | 一种GalNAc含糖环中间体及其制备方法 |
| US20250215044A1 (en) * | 2023-09-21 | 2025-07-03 | Ionis Pharmaceuticals, Inc. | Compounds and Methods for Inhibiting LPA |
| WO2025064819A1 (en) * | 2023-09-21 | 2025-03-27 | Ionis Pharmaceuticals, Inc. | Compounds and methods for inhibiting lpa |
| GB202314724D0 (en) | 2023-09-26 | 2023-11-08 | Astrazeneca Ab | compounds and methods for reducing psd3 expression |
| TW202530408A (zh) * | 2023-09-29 | 2025-08-01 | 美商英西特羅公司 | 用於治療非酒精性脂肪肝病的組合物與方法 |
| CN118680948B (zh) * | 2023-10-20 | 2025-08-22 | 思合基因(北京)生物科技有限公司 | 寡核苷酸及其在抗乙型肝炎病毒中的应用 |
| WO2025096809A1 (en) | 2023-10-31 | 2025-05-08 | Korro Bio, Inc. | Oligonucleotides comprising phosphoramidate internucleotide linkages |
| WO2025113470A1 (en) * | 2023-11-27 | 2025-06-05 | Shanghai Argo Biopharmaceutical Co., Ltd. | Compositions and methods for inhibiting expression of transthyretin (ttr) |
| WO2025119212A1 (zh) * | 2023-12-05 | 2025-06-12 | 广东东阳光药业股份有限公司 | 一种新型的双链siRNA、其缀合物及其用途 |
| CN117568313B (zh) * | 2024-01-15 | 2024-04-26 | 上海贝斯昂科生物科技有限公司 | 基因编辑组合物及其用途 |
| CN120309684A (zh) * | 2024-01-15 | 2025-07-15 | 武汉人福创新药物研发中心有限公司 | 靶向化合物及其用途 |
| WO2025155911A1 (en) | 2024-01-18 | 2025-07-24 | Proqr Therapeutics Ii B.V. | Antisense oligonucleotides for the treatment of hurler syndrome |
| WO2025165891A1 (en) | 2024-01-29 | 2025-08-07 | Arnatar Therapeutics, Inc | Translation enhancing nucleic acid compounds: aso coupled translation - upregulation 1 (act-up1) and uses thereof |
| US20250297260A1 (en) | 2024-03-22 | 2025-09-25 | Takeda Pharmaceutical Company Limited | Compositions and methods for inhibiting cytochrome p450 family 7 subfamily a member 1 (cyp7a1) expression |
| GB202404661D0 (en) | 2024-04-02 | 2024-05-15 | Proqr Therapeutics Ii Bv | Antisense oligoncleotides for the treatment of liver disease |
| WO2025224230A1 (en) | 2024-04-25 | 2025-10-30 | Proqr Therapeutics Ii B.V. | Antisense oligonucleotides for the treatment of fatty liver disease |
| CN118146284B (zh) * | 2024-05-08 | 2024-07-26 | 北京悦康科创医药科技股份有限公司 | 一种GalNAc化合物、其与寡核苷酸缀合物及制备方法 |
| WO2025242702A1 (en) * | 2024-05-23 | 2025-11-27 | Glaxosmithkline Intellectual Property Development Limited | Enzymatic process for producing n-acetyl galactosamine clusters |
Family Cites Families (380)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3687808A (en) | 1969-08-14 | 1972-08-29 | Univ Leland Stanford Junior | Synthetic polynucleotides |
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| US4500707A (en) | 1980-02-29 | 1985-02-19 | University Patents, Inc. | Nucleosides useful in the preparation of polynucleotides |
| US5132418A (en) | 1980-02-29 | 1992-07-21 | University Patents, Inc. | Process for preparing polynucleotides |
| US4469863A (en) | 1980-11-12 | 1984-09-04 | Ts O Paul O P | Nonionic nucleic acid alkyl and aryl phosphonates and processes for manufacture and use thereof |
| US4973679A (en) | 1981-03-27 | 1990-11-27 | University Patents, Inc. | Process for oligonucleo tide synthesis using phosphormidite intermediates |
| US4415732A (en) | 1981-03-27 | 1983-11-15 | University Patents, Inc. | Phosphoramidite compounds and processes |
| US4668777A (en) | 1981-03-27 | 1987-05-26 | University Patents, Inc. | Phosphoramidite nucleoside compounds |
| US5023243A (en) | 1981-10-23 | 1991-06-11 | Molecular Biosystems, Inc. | Oligonucleotide therapeutic agent and method of making same |
| US4476301A (en) | 1982-04-29 | 1984-10-09 | Centre National De La Recherche Scientifique | Oligonucleotides, a process for preparing the same and their application as mediators of the action of interferon |
| DE3329892A1 (de) | 1983-08-18 | 1985-03-07 | Köster, Hubert, Prof. Dr., 2000 Hamburg | Verfahren zur herstellung von oligonucleotiden |
| US5118800A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | Oligonucleotides possessing a primary amino group in the terminal nucleotide |
| USRE34036E (en) | 1984-06-06 | 1992-08-18 | National Research Development Corporation | Data transmission using a transparent tone-in band system |
| US5550111A (en) | 1984-07-11 | 1996-08-27 | Temple University-Of The Commonwealth System Of Higher Education | Dual action 2',5'-oligoadenylate antiviral derivatives and uses thereof |
| FR2567892B1 (fr) | 1984-07-19 | 1989-02-17 | Centre Nat Rech Scient | Nouveaux oligonucleotides, leur procede de preparation et leurs applications comme mediateurs dans le developpement des effets des interferons |
| US5367066A (en) | 1984-10-16 | 1994-11-22 | Chiron Corporation | Oligonucleotides with selectably cleavable and/or abasic sites |
| FR2575751B1 (fr) | 1985-01-08 | 1987-04-03 | Pasteur Institut | Nouveaux nucleosides de derives de l'adenosine, leur preparation et leurs applications biologiques |
| US4751219A (en) | 1985-02-05 | 1988-06-14 | Nederlandse Centrale Organisatie Voor Toegepast-Natuur-Wetenschappelijk Onderzoek | Synthetic glycolipides, a process for the preparation thereof and several uses for these synthetic glycolipides |
| US5235033A (en) | 1985-03-15 | 1993-08-10 | Anti-Gene Development Group | Alpha-morpholino ribonucleoside derivatives and polymers thereof |
| US5506337A (en) | 1985-03-15 | 1996-04-09 | Antivirals Inc. | Morpholino-subunit combinatorial library and method |
| US5185444A (en) | 1985-03-15 | 1993-02-09 | Anti-Gene Deveopment Group | Uncharged morpolino-based polymers having phosphorous containing chiral intersubunit linkages |
| US5034506A (en) | 1985-03-15 | 1991-07-23 | Anti-Gene Development Group | Uncharged morpholino-based polymers having achiral intersubunit linkages |
| US5405938A (en) | 1989-12-20 | 1995-04-11 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| US5166315A (en) | 1989-12-20 | 1992-11-24 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| DE3788914T2 (de) | 1986-09-08 | 1994-08-25 | Ajinomoto Kk | Verbindungen zur Spaltung von RNS an eine spezifische Position, Oligomere, verwendet bei der Herstellung dieser Verbindungen und Ausgangsprodukte für die Synthese dieser Oligomere. |
| US5276019A (en) | 1987-03-25 | 1994-01-04 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| US5264423A (en) | 1987-03-25 | 1993-11-23 | The United States Of America As Represented By The Department Of Health And Human Services | Inhibitors for replication of retroviruses and for the expression of oncogene products |
| GB8712540D0 (en) * | 1987-05-28 | 1987-07-01 | Ucb Sa | Expression of human proapolipoprotein a-i |
| JP2828642B2 (ja) | 1987-06-24 | 1998-11-25 | ハワード フローレイ インスティテュト オブ イクスペリメンタル フィジオロジー アンド メディシン | ヌクレオシド誘導体 |
| US5188897A (en) | 1987-10-22 | 1993-02-23 | Temple University Of The Commonwealth System Of Higher Education | Encapsulated 2',5'-phosphorothioate oligoadenylates |
| US4924624A (en) | 1987-10-22 | 1990-05-15 | Temple University-Of The Commonwealth System Of Higher Education | 2,',5'-phosphorothioate oligoadenylates and plant antiviral uses thereof |
| ATE151467T1 (de) | 1987-11-30 | 1997-04-15 | Univ Iowa Res Found | Durch modifikationen an der 3'-terminalen phosphodiesterbindung stabilisierte dna moleküle, ihre verwendung als nukleinsäuresonden sowie als therapeutische mittel zur hemmung der expression spezifischer zielgene |
| US5403711A (en) | 1987-11-30 | 1995-04-04 | University Of Iowa Research Foundation | Nucleic acid hybridization and amplification method for detection of specific sequences in which a complementary labeled nucleic acid probe is cleaved |
| WO1989009221A1 (en) | 1988-03-25 | 1989-10-05 | University Of Virginia Alumni Patents Foundation | Oligonucleotide n-alkylphosphoramidates |
| US5278302A (en) | 1988-05-26 | 1994-01-11 | University Patents, Inc. | Polynucleotide phosphorodithioates |
| US5216141A (en) | 1988-06-06 | 1993-06-01 | Benner Steven A | Oligonucleotide analogs containing sulfur linkages |
| US5175273A (en) | 1988-07-01 | 1992-12-29 | Genentech, Inc. | Nucleic acid intercalating agents |
| US5194599A (en) | 1988-09-23 | 1993-03-16 | Gilead Sciences, Inc. | Hydrogen phosphonodithioate compositions |
| US5256775A (en) | 1989-06-05 | 1993-10-26 | Gilead Sciences, Inc. | Exonuclease-resistant oligonucleotides |
| US5134066A (en) | 1989-08-29 | 1992-07-28 | Monsanto Company | Improved probes using nucleosides containing 3-dezauracil analogs |
| US5591722A (en) | 1989-09-15 | 1997-01-07 | Southern Research Institute | 2'-deoxy-4'-thioribonucleosides and their antiviral activity |
| US5721218A (en) | 1989-10-23 | 1998-02-24 | Gilead Sciences, Inc. | Oligonucleotides with inverted polarity |
| US5399676A (en) | 1989-10-23 | 1995-03-21 | Gilead Sciences | Oligonucleotides with inverted polarity |
| US5264564A (en) | 1989-10-24 | 1993-11-23 | Gilead Sciences | Oligonucleotide analogs with novel linkages |
| US5264562A (en) | 1989-10-24 | 1993-11-23 | Gilead Sciences, Inc. | Oligonucleotide analogs with novel linkages |
| DE69034150T2 (de) | 1989-10-24 | 2005-08-25 | Isis Pharmaceuticals, Inc., Carlsbad | 2'-Modifizierte Oligonukleotide |
| US5177198A (en) | 1989-11-30 | 1993-01-05 | University Of N.C. At Chapel Hill | Process for preparing oligoribonucleoside and oligodeoxyribonucleoside boranophosphates |
| US5130302A (en) | 1989-12-20 | 1992-07-14 | Boron Bilogicals, Inc. | Boronated nucleoside, nucleotide and oligonucleotide compounds, compositions and methods for using same |
| US5587470A (en) | 1990-01-11 | 1996-12-24 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US6005087A (en) | 1995-06-06 | 1999-12-21 | Isis Pharmaceuticals, Inc. | 2'-modified oligonucleotides |
| US5457191A (en) | 1990-01-11 | 1995-10-10 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US5859221A (en) | 1990-01-11 | 1999-01-12 | Isis Pharmaceuticals, Inc. | 2'-modified oligonucleotides |
| US5670633A (en) | 1990-01-11 | 1997-09-23 | Isis Pharmaceuticals, Inc. | Sugar modified oligonucleotides that detect and modulate gene expression |
| US7101993B1 (en) | 1990-01-11 | 2006-09-05 | Isis Pharmaceuticals, Inc. | Oligonucleotides containing 2′-O-modified purines |
| US5459255A (en) | 1990-01-11 | 1995-10-17 | Isis Pharmaceuticals, Inc. | N-2 substituted purines |
| US5681941A (en) | 1990-01-11 | 1997-10-28 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US5646265A (en) | 1990-01-11 | 1997-07-08 | Isis Pharmceuticals, Inc. | Process for the preparation of 2'-O-alkyl purine phosphoramidites |
| US5623065A (en) | 1990-08-13 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Gapped 2' modified oligonucleotides |
| US5587361A (en) | 1991-10-15 | 1996-12-24 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5220007A (en) | 1990-02-15 | 1993-06-15 | The Worcester Foundation For Experimental Biology | Method of site-specific alteration of RNA and production of encoded polypeptides |
| US5149797A (en) | 1990-02-15 | 1992-09-22 | The Worcester Foundation For Experimental Biology | Method of site-specific alteration of rna and production of encoded polypeptides |
| US5321131A (en) | 1990-03-08 | 1994-06-14 | Hybridon, Inc. | Site-specific functionalization of oligodeoxynucleotides for non-radioactive labelling |
| US5470967A (en) | 1990-04-10 | 1995-11-28 | The Dupont Merck Pharmaceutical Company | Oligonucleotide analogs with sulfamate linkages |
| GB9009980D0 (en) | 1990-05-03 | 1990-06-27 | Amersham Int Plc | Phosphoramidite derivatives,their preparation and the use thereof in the incorporation of reporter groups on synthetic oligonucleotides |
| DK0455905T3 (da) | 1990-05-11 | 1998-12-07 | Microprobe Corp | Dipsticks til nukleinsyrehybridiseringsassays og fremgangsmåde til kovalent immobilisering af oligonukleotider |
| US5608046A (en) | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5386023A (en) | 1990-07-27 | 1995-01-31 | Isis Pharmaceuticals | Backbone modified oligonucleotide analogs and preparation thereof through reductive coupling |
| US5602240A (en) | 1990-07-27 | 1997-02-11 | Ciba Geigy Ag. | Backbone modified oligonucleotide analogs |
| US5223618A (en) | 1990-08-13 | 1993-06-29 | Isis Pharmaceuticals, Inc. | 4'-desmethyl nucleoside analog compounds |
| US5677437A (en) | 1990-07-27 | 1997-10-14 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5618704A (en) | 1990-07-27 | 1997-04-08 | Isis Pharmacueticals, Inc. | Backbone-modified oligonucleotide analogs and preparation thereof through radical coupling |
| US5378825A (en) | 1990-07-27 | 1995-01-03 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs |
| US5489677A (en) | 1990-07-27 | 1996-02-06 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent oxygen and nitrogen atoms |
| US5623070A (en) | 1990-07-27 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| JPH0874B2 (ja) | 1990-07-27 | 1996-01-10 | アイシス・ファーマシューティカルス・インコーポレーテッド | 遺伝子発現を検出および変調するヌクレアーゼ耐性、ピリミジン修飾オリゴヌクレオチド |
| US5610289A (en) | 1990-07-27 | 1997-03-11 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogues |
| US5541307A (en) | 1990-07-27 | 1996-07-30 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs and solid phase synthesis thereof |
| PT98562B (pt) | 1990-08-03 | 1999-01-29 | Sanofi Sa | Processo para a preparacao de composicoes que compreendem sequencias de nucleo-sidos com cerca de 6 a cerca de 200 bases resistentes a nucleases |
| US5177196A (en) | 1990-08-16 | 1993-01-05 | Microprobe Corporation | Oligo (α-arabinofuranosyl nucleotides) and α-arabinofuranosyl precursors thereof |
| US5214134A (en) | 1990-09-12 | 1993-05-25 | Sterling Winthrop Inc. | Process of linking nucleosides with a siloxane bridge |
| US5561225A (en) | 1990-09-19 | 1996-10-01 | Southern Research Institute | Polynucleotide analogs containing sulfonate and sulfonamide internucleoside linkages |
| JPH06505704A (ja) | 1990-09-20 | 1994-06-30 | ギリアド サイエンシズ,インコーポレイテッド | 改変ヌクレオシド間結合 |
| US5432272A (en) | 1990-10-09 | 1995-07-11 | Benner; Steven A. | Method for incorporating into a DNA or RNA oligonucleotide using nucleotides bearing heterocyclic bases |
| US6582908B2 (en) | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| US5948903A (en) | 1991-01-11 | 1999-09-07 | Isis Pharmaceuticals, Inc. | Synthesis of 3-deazapurines |
| US5672697A (en) | 1991-02-08 | 1997-09-30 | Gilead Sciences, Inc. | Nucleoside 5'-methylene phosphonates |
| US7015315B1 (en) | 1991-12-24 | 2006-03-21 | Isis Pharmaceuticals, Inc. | Gapped oligonucleotides |
| US5571799A (en) | 1991-08-12 | 1996-11-05 | Basco, Ltd. | (2'-5') oligoadenylate analogues useful as inhibitors of host-v5.-graft response |
| EP0538194B1 (de) | 1991-10-17 | 1997-06-04 | Novartis AG | Bicyclische Nukleoside, Oligonukleotide, Verfahren zu deren Herstellung und Zwischenprodukte |
| US5594121A (en) | 1991-11-07 | 1997-01-14 | Gilead Sciences, Inc. | Enhanced triple-helix and double-helix formation with oligomers containing modified purines |
| US5484908A (en) | 1991-11-26 | 1996-01-16 | Gilead Sciences, Inc. | Oligonucleotides containing 5-propynyl pyrimidines |
| TW393513B (en) | 1991-11-26 | 2000-06-11 | Isis Pharmaceuticals Inc | Enhanced triple-helix and double-helix formation with oligomers containing modified pyrimidines |
| DE637965T1 (de) | 1991-11-26 | 1995-12-14 | Gilead Sciences Inc | Gesteigerte bildung von triple- und doppelhelices aus oligomeren mit modifizierten pyrimidinen. |
| US5792608A (en) | 1991-12-12 | 1998-08-11 | Gilead Sciences, Inc. | Nuclease stable and binding competent oligomers and methods for their use |
| US5359044A (en) | 1991-12-13 | 1994-10-25 | Isis Pharmaceuticals | Cyclobutyl oligonucleotide surrogates |
| US5700922A (en) | 1991-12-24 | 1997-12-23 | Isis Pharmaceuticals, Inc. | PNA-DNA-PNA chimeric macromolecules |
| KR940703846A (ko) * | 1991-12-24 | 1994-12-12 | 비. 린네 파샬 | 갭(gap)이 형성된 2′ 변성된 올리고뉴클레오티드(gapped 2′ modifed oligonucleotides) |
| FR2687679B1 (fr) | 1992-02-05 | 1994-10-28 | Centre Nat Rech Scient | Oligothionucleotides. |
| US5633360A (en) | 1992-04-14 | 1997-05-27 | Gilead Sciences, Inc. | Oligonucleotide analogs capable of passive cell membrane permeation |
| US5434257A (en) | 1992-06-01 | 1995-07-18 | Gilead Sciences, Inc. | Binding compentent oligomers containing unsaturated 3',5' and 2',5' linkages |
| EP0577558A2 (de) | 1992-07-01 | 1994-01-05 | Ciba-Geigy Ag | Carbocyclische Nukleoside mit bicyclischen Ringen, Oligonukleotide daraus, Verfahren zu deren Herstellung, deren Verwendung und Zwischenproduckte |
| US5652355A (en) | 1992-07-23 | 1997-07-29 | Worcester Foundation For Experimental Biology | Hybrid oligonucleotide phosphorothioates |
| WO1994002499A1 (en) | 1992-07-27 | 1994-02-03 | Hybridon, Inc. | Oligonucleotide alkylphosphonothioates |
| JPH08504559A (ja) | 1992-12-14 | 1996-05-14 | ハネウエル・インコーポレーテッド | 個別に制御される冗長巻線を有するモータシステム |
| JPH08508714A (ja) | 1993-01-25 | 1996-09-17 | ハイブライドン インコーポレイテッド | オリゴヌクレオチド・アルキルホスホネートおよびアルキルホスホノチオエート |
| US5476925A (en) | 1993-02-01 | 1995-12-19 | Northwestern University | Oligodeoxyribonucleotides including 3'-aminonucleoside-phosphoramidate linkages and terminal 3'-amino groups |
| GB9304620D0 (en) | 1993-03-06 | 1993-04-21 | Ciba Geigy Ag | Compounds |
| GB9304618D0 (en) | 1993-03-06 | 1993-04-21 | Ciba Geigy Ag | Chemical compounds |
| ES2107205T3 (es) | 1993-03-30 | 1997-11-16 | Sanofi Sa | Analogos de nucleosidos aciclicos y secuencias oligonucleotidas que los contienen. |
| HU9501974D0 (en) | 1993-03-31 | 1995-09-28 | Sterling Winthrop Inc | Oligonucleotides with amide linkages replacing phosphodiester linkages |
| US5502177A (en) | 1993-09-17 | 1996-03-26 | Gilead Sciences, Inc. | Pyrimidine derivatives for labeled binding partners |
| US5801154A (en) | 1993-10-18 | 1998-09-01 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide modulation of multidrug resistance-associated protein |
| US5457187A (en) | 1993-12-08 | 1995-10-10 | Board Of Regents University Of Nebraska | Oligonucleotides containing 5-fluorouracil |
| US5446137B1 (en) | 1993-12-09 | 1998-10-06 | Behringwerke Ag | Oligonucleotides containing 4'-substituted nucleotides |
| JP3585238B2 (ja) | 1993-12-09 | 2004-11-04 | トーマス ジェファーソン ユニバーシティー | 真核細胞における部位特異的突然変異誘発のための化合物および方法 |
| US5519134A (en) | 1994-01-11 | 1996-05-21 | Isis Pharmaceuticals, Inc. | Pyrrolidine-containing monomers and oligomers |
| US5728518A (en) | 1994-01-12 | 1998-03-17 | The Immune Response Corporation | Antiviral poly-and oligonucleotides |
| US5596091A (en) | 1994-03-18 | 1997-01-21 | The Regents Of The University Of California | Antisense oligonucleotides comprising 5-aminoalkyl pyrimidine nucleotides |
| US5627053A (en) | 1994-03-29 | 1997-05-06 | Ribozyme Pharmaceuticals, Inc. | 2'deoxy-2'-alkylnucleotide containing nucleic acid |
| US5625050A (en) | 1994-03-31 | 1997-04-29 | Amgen Inc. | Modified oligonucleotides and intermediates useful in nucleic acid therapeutics |
| US5646269A (en) | 1994-04-28 | 1997-07-08 | Gilead Sciences, Inc. | Method for oligonucleotide analog synthesis |
| US5525711A (en) | 1994-05-18 | 1996-06-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Pteridine nucleotide analogs as fluorescent DNA probes |
| US5597909A (en) | 1994-08-25 | 1997-01-28 | Chiron Corporation | Polynucleotide reagents containing modified deoxyribose moieties, and associated methods of synthesis and use |
| US5599706A (en) | 1994-09-23 | 1997-02-04 | Stinchcomb; Dan T. | Ribozymes targeted to apo(a) mRNA |
| US5681940A (en) * | 1994-11-02 | 1997-10-28 | Icn Pharmaceuticals | Sugar modified nucleosides and oligonucleotides |
| US6172045B1 (en) | 1994-12-07 | 2001-01-09 | Neorx Corporation | Cluster clearing agents |
| US6908903B1 (en) | 1994-12-07 | 2005-06-21 | Aletheon Pharmaceuticals, Inc. | Cluster clearing agents |
| US5652356A (en) | 1995-08-17 | 1997-07-29 | Hybridon, Inc. | Inverted chimeric and hybrid oligonucleotides |
| JP2000501414A (ja) | 1995-11-22 | 2000-02-08 | ザ・ジョンズ・ホプキンス・ユニバーシティー | 生体分子の細胞取り込みを高めるリガンド |
| US20030119724A1 (en) | 1995-11-22 | 2003-06-26 | Ts`O Paul O.P. | Ligands to enhance cellular uptake of biomolecules |
| US5998203A (en) | 1996-04-16 | 1999-12-07 | Ribozyme Pharmaceuticals, Inc. | Enzymatic nucleic acids containing 5'-and/or 3'-cap structures |
| WO1998013381A1 (fr) | 1996-09-26 | 1998-04-02 | Ajinomoto Co., Inc. | Proteines modifiees physiologiquement actives et compositions medicamenteuses les contenant |
| US6770748B2 (en) | 1997-03-07 | 2004-08-03 | Takeshi Imanishi | Bicyclonucleoside and oligonucleotide analogue |
| JP3756313B2 (ja) | 1997-03-07 | 2006-03-15 | 武 今西 | 新規ビシクロヌクレオシド及びオリゴヌクレオチド類縁体 |
| USRE44779E1 (en) | 1997-03-07 | 2014-02-25 | Santaris Pharma A/S | Bicyclonucleoside and oligonucleotide analogues |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| AU9063398A (en) | 1997-09-12 | 1999-04-05 | Exiqon A/S | Oligonucleotide analogues |
| US7572582B2 (en) | 1997-09-12 | 2009-08-11 | Exiqon A/S | Oligonucleotide analogues |
| US20040171564A1 (en) | 1997-11-20 | 2004-09-02 | Honkanen Richard E. | Antisense oligonucleotide modulation of human serine/threonine protein phosphatase gene expression |
| US20030228597A1 (en) | 1998-04-13 | 2003-12-11 | Cowsert Lex M. | Identification of genetic targets for modulation by oligonucleotides and generation of oligonucleotides for gene modulation |
| US6300319B1 (en) | 1998-06-16 | 2001-10-09 | Isis Pharmaceuticals, Inc. | Targeted oligonucleotide conjugates |
| US6043352A (en) | 1998-08-07 | 2000-03-28 | Isis Pharmaceuticals, Inc. | 2'-O-Dimethylaminoethyloxyethyl-modified oligonucleotides |
| CN1263510C (zh) | 1998-08-19 | 2006-07-12 | 巴克斯特健康护理股份有限公司 | 多糖-蛋白质缀合物或寡糖-蛋白质缀合物、其制备方法及其应用 |
| RU2249463C2 (ru) * | 1998-08-19 | 2005-04-10 | Бакстер Хелфкэа С.А. | Иммуногенный конъюгат бета-пропионамид-связанного полисахарида с белком, использующийся в качестве вакцины |
| US6166239A (en) | 1998-09-04 | 2000-12-26 | Isis Pharmaceuticals, Inc. | Oligonucleotide protecting groups |
| RU2233844C2 (ru) | 1999-02-12 | 2004-08-10 | Санкио Компани Лимитед | Новые нуклеозидные и олигонуклеотидные аналоги |
| US20030170249A1 (en) | 1999-02-19 | 2003-09-11 | Hakomori Sen-Itiroh | Vaccines directed to cancer-associated carbohydrate antigens |
| US7084125B2 (en) | 1999-03-18 | 2006-08-01 | Exiqon A/S | Xylo-LNA analogues |
| US6159694A (en) | 1999-04-08 | 2000-12-12 | Isis Pharmaceuticals Inc. | Antisense modulation of stat3 expression |
| US7098192B2 (en) | 1999-04-08 | 2006-08-29 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide modulation of STAT3 expression |
| KR20010112944A (ko) | 1999-04-21 | 2001-12-22 | 이곤 이 버그 | 폴리뉴클레오티드 서열의 기능을 억제하기 위한 방법 및조성물 |
| AU776362B2 (en) | 1999-05-04 | 2004-09-09 | Roche Innovation Center Copenhagen A/S | L-ribo-LNA analogues |
| US6525191B1 (en) | 1999-05-11 | 2003-02-25 | Kanda S. Ramasamy | Conformationally constrained L-nucleosides |
| US6383812B1 (en) | 1999-05-28 | 2002-05-07 | Academia Sinica | Anti liver disease drug R-YEEE and method of synthesizing branched galactose-terminal glycoproteins |
| US8541548B2 (en) | 1999-06-07 | 2013-09-24 | Arrowhead Madison Inc. | Compounds and methods for reversible modification of biologically active molecules |
| US20080281041A1 (en) | 1999-06-07 | 2008-11-13 | Rozema David B | Reversibly Masked Polymers |
| US6656730B1 (en) | 1999-06-15 | 2003-12-02 | Isis Pharmaceuticals, Inc. | Oligonucleotides conjugated to protein-binding drugs |
| EP1210363A2 (en) | 1999-07-16 | 2002-06-05 | Hyseq, Inc. | Novel angiopoietin materials and methods |
| JP4151751B2 (ja) | 1999-07-22 | 2008-09-17 | 第一三共株式会社 | 新規ビシクロヌクレオシド類縁体 |
| DE19935303A1 (de) | 1999-07-28 | 2001-02-08 | Aventis Pharma Gmbh | Oligonukleotide zur Inhibierung der Expression von humanem eg5 |
| US20020082227A1 (en) | 1999-09-30 | 2002-06-27 | Scott Henry | Use of oligonucleotides for inhibition of complement activation |
| US20050112118A1 (en) | 1999-12-02 | 2005-05-26 | Myriad Genetics, Incorporated | Compositions and methods for treating inflammatory disorders |
| EP1239050A4 (en) | 1999-12-09 | 2004-07-21 | Sankyo Co | METHOD FOR TESTING CURATIVE OR PREVENTIVE AGENT OF HYPERLIPEMIA |
| AU2698301A (en) | 1999-12-30 | 2001-07-16 | K.U. Leuven Research And Development | Cyclohexene nucleic acids |
| US6261840B1 (en) | 2000-01-18 | 2001-07-17 | Isis Pharmaceuticals, Inc. | Antisense modulation of PTP1B expression |
| US20020055479A1 (en) | 2000-01-18 | 2002-05-09 | Cowsert Lex M. | Antisense modulation of PTP1B expression |
| US7179796B2 (en) | 2000-01-18 | 2007-02-20 | Isis Pharmaceuticals, Inc. | Antisense modulation of PTP1B expression |
| US6602857B1 (en) | 2000-01-18 | 2003-08-05 | Isis Pharmaceuticals, Inc. | Antisense modulation of PTP1B expression |
| US8202979B2 (en) | 2002-02-20 | 2012-06-19 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid |
| US7833992B2 (en) | 2001-05-18 | 2010-11-16 | Merck Sharpe & Dohme | Conjugates and compositions for cellular delivery |
| US7491805B2 (en) | 2001-05-18 | 2009-02-17 | Sirna Therapeutics, Inc. | Conjugates and compositions for cellular delivery |
| AU2001241541A1 (en) | 2000-02-17 | 2001-08-27 | Millennium Predictive Medicine, Inc. | Novel genes, compositions, kits, and methods for identification, assessment, prevention, and therapy of human prostate cancer |
| EP1314734A1 (en) | 2000-08-29 | 2003-05-28 | Takeshi Imanishi | Novel nucleoside analogs and oligonucleotide derivatives containing these analogs |
| US6426220B1 (en) | 2000-10-30 | 2002-07-30 | Isis Pharmaceuticals, Inc. | Antisense modulation of calreticulin expression |
| US6906182B2 (en) | 2000-12-01 | 2005-06-14 | Cell Works Therapeutics, Inc. | Conjugates of glycosylated/galactosylated peptide, bifunctional linker, and nucleotidic monomers/polymers, and related compositions and method of use |
| US20030077829A1 (en) | 2001-04-30 | 2003-04-24 | Protiva Biotherapeutics Inc.. | Lipid-based formulations |
| WO2002101039A1 (fr) | 2001-06-08 | 2002-12-19 | Sankyo Company, Limited | Procede de test de medicament destine a traiter ou a prevenir des maladies telles que l'hyperlipemie |
| US20030158403A1 (en) | 2001-07-03 | 2003-08-21 | Isis Pharmaceuticals, Inc. | Nuclease resistant chimeric oligonucleotides |
| EP1499627A2 (en) | 2001-07-03 | 2005-01-26 | ISIS Pharmaceuticals, Inc. | Nuclease resistant chimeric oligonucleotides |
| US20030175906A1 (en) | 2001-07-03 | 2003-09-18 | Muthiah Manoharan | Nuclease resistant chimeric oligonucleotides |
| US6964950B2 (en) | 2001-07-25 | 2005-11-15 | Isis Pharmaceuticals, Inc. | Antisense modulation of C-reactive protein expression |
| US7425545B2 (en) | 2001-07-25 | 2008-09-16 | Isis Pharmaceuticals, Inc. | Modulation of C-reactive protein expression |
| US7227014B2 (en) | 2001-08-07 | 2007-06-05 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein (a) expression |
| US7259150B2 (en) | 2001-08-07 | 2007-08-21 | Isis Pharmaceuticals, Inc. | Modulation of apolipoprotein (a) expression |
| WO2003014397A1 (en) | 2001-08-09 | 2003-02-20 | Biomedlab Corporation | Probe for detection of enteric virus detection kit and method for enteric virus with the same |
| AU2002334307A1 (en) | 2001-09-04 | 2003-03-18 | Exiqon A/S | Novel lna compositions and uses thereof |
| US7439043B2 (en) | 2001-10-10 | 2008-10-21 | Neose Technologies, Inc. | Galactosyl nucleotide sugars |
| KR101012904B1 (ko) | 2001-11-16 | 2011-02-08 | 제넨테크, 인크. | 안지오포이에틴-유사 단백질 3 angptl3을 함유하는조성물 및 이를 사용하는 방법 |
| US20100240730A1 (en) | 2002-02-20 | 2010-09-23 | Merck Sharp And Dohme Corp. | RNA Interference Mediated Inhibition of Gene Expression Using Chemically Modified Short Interfering Nucleic Acid (siNA) |
| WO2004011624A2 (en) | 2002-07-31 | 2004-02-05 | Nucleonics, Inc. | Double stranded rna structures and constructs, and methods for generating and using the same |
| US8729036B2 (en) | 2002-08-07 | 2014-05-20 | University Of Massachusetts | Compositions for RNA interference and methods of use thereof |
| WO2004024757A2 (en) | 2002-09-11 | 2004-03-25 | Santaris Pharma A/S | Modified pna molecules |
| WO2004035765A2 (en) | 2002-10-18 | 2004-04-29 | Nucleonics, Inc. | Double-stranded rna structures and constructs, and methods for generating and using the same |
| AU2003291753B2 (en) | 2002-11-05 | 2010-07-08 | Isis Pharmaceuticals, Inc. | Polycyclic sugar surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| EP2957568B1 (en) | 2002-11-05 | 2016-12-21 | Ionis Pharmaceuticals, Inc. | Compositions comprising alternating 2'-modified nucleosides for use in gene modulation |
| US7511131B2 (en) | 2002-11-13 | 2009-03-31 | Genzyme Corporation | Antisense modulation of apolipoprotein B expression |
| WO2004044181A2 (en) | 2002-11-13 | 2004-05-27 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein b expression |
| US20060009410A1 (en) | 2002-11-13 | 2006-01-12 | Crooke Rosanne M | Effects of apolipoprotein B inhibition on gene expression profiles in animals |
| EP2213738B1 (en) | 2002-11-14 | 2012-10-10 | Dharmacon, Inc. | siRNA molecules targeting Bcl-2 |
| US7482117B2 (en) | 2002-12-20 | 2009-01-27 | Celera Corporation | Genetic polymorphisms associated with myocardial infarction, methods of detection and uses thereof |
| US6673661B1 (en) | 2002-12-20 | 2004-01-06 | Taiwan Semiconductor Manufacturing Co., Ltd. | Self-aligned method for forming dual gate thin film transistor (TFT) device |
| WO2004063208A1 (en) | 2003-01-09 | 2004-07-29 | Postech Foundation | New phosphoramidite compounds |
| WO2004072046A2 (en) | 2003-02-12 | 2004-08-26 | Carex S.A. | Quinoline derivatives and their use for modulation of lxr activity |
| US7803781B2 (en) | 2003-02-28 | 2010-09-28 | Isis Pharmaceuticals, Inc. | Modulation of growth hormone receptor expression and insulin-like growth factor expression |
| EP2239329A1 (en) | 2003-03-07 | 2010-10-13 | Alnylam Pharmaceuticals, Inc. | Therapeutic compositions |
| AU2004227414A1 (en) * | 2003-04-03 | 2004-10-21 | Alnylam Pharmaceuticals | iRNA conjugates |
| US7598227B2 (en) * | 2003-04-16 | 2009-10-06 | Isis Pharmaceuticals Inc. | Modulation of apolipoprotein C-III expression |
| US7851615B2 (en) | 2003-04-17 | 2010-12-14 | Alnylam Pharmaceuticals, Inc. | Lipophilic conjugated iRNA agents |
| CA2522637C (en) | 2003-04-17 | 2014-01-21 | Alnylam Pharmaceuticals, Inc. | Modified irna agents |
| US7723509B2 (en) | 2003-04-17 | 2010-05-25 | Alnylam Pharmaceuticals | IRNA agents with biocleavable tethers |
| US7750142B2 (en) | 2003-04-28 | 2010-07-06 | Isis Pharmaceuticals, Inc. | Modulation of glucagon receptor expression |
| US7399853B2 (en) | 2003-04-28 | 2008-07-15 | Isis Pharmaceuticals | Modulation of glucagon receptor expression |
| WO2004101619A1 (ja) | 2003-05-15 | 2004-11-25 | Shionogi Co., Ltd. | 機能的糖ペプチドの合理的設計および合成 |
| WO2004106356A1 (en) | 2003-05-27 | 2004-12-09 | Syddansk Universitet | Functionalized nucleotide derivatives |
| ATE555118T1 (de) | 2003-08-28 | 2012-05-15 | Takeshi Imanishi | Neue synthetische nukleidsäuren vom typ mit quervernetzter n-o-bindung |
| JP5379347B2 (ja) | 2003-09-18 | 2013-12-25 | アイシス ファーマシューティカルズ, インコーポレーテッド | 4’−チオヌクレオシドおよびオリゴマー化合物 |
| PE20050469A1 (es) | 2003-09-18 | 2005-09-10 | Lilly Co Eli | Modulacion de la expresion de eif4e |
| WO2005038013A1 (en) * | 2003-10-07 | 2005-04-28 | Isis Pharmaceuticals, Inc. | Artisense oligonucleotides optimized for kidney targeting |
| US7959919B2 (en) | 2003-11-19 | 2011-06-14 | Novelmed Therapeutics, Inc. | Method of inhibiting factor B-mediated complement activation |
| WO2005065686A1 (en) | 2004-01-07 | 2005-07-21 | Adipogen Pharmaceuticals Pty Limited | Differentiation modulating agents and uses therefor |
| EP1711606A2 (en) | 2004-01-20 | 2006-10-18 | Isis Pharmaceuticals, Inc. | Modulation of glucocorticoid receptor expression |
| CA2559962C (en) * | 2004-02-05 | 2011-03-15 | Japan Science And Technology Agency | Linker compound, ligand complex and process for producing them |
| US20050244869A1 (en) | 2004-04-05 | 2005-11-03 | Brown-Driver Vickie L | Modulation of transthyretin expression |
| WO2005097155A1 (ja) | 2004-04-08 | 2005-10-20 | Takara Bio Inc. | 神経突起伸長誘導剤 |
| CA2566286A1 (en) | 2004-05-11 | 2005-12-08 | Rnai Co., Ltd. | Polynucleotide causing rna interfere and method of regulating gene expression with the use of the same |
| CA2569419A1 (en) | 2004-06-03 | 2005-12-22 | Isis Pharmaceuticals, Inc. | Double strand compositions comprising differentially modified strands for use in gene modulation |
| WO2006014729A2 (en) | 2004-07-20 | 2006-02-09 | Genentech, Inc. | Inhibitors of angiopoietin-like 4 protein, combinations, and their use |
| LT1781698T (lt) | 2004-07-20 | 2016-09-26 | Genentech, Inc. | Į angiopoetiną panašaus baltymo 4 kompozicijos ir panaudojimo būdai |
| WO2006020768A2 (en) | 2004-08-10 | 2006-02-23 | Alnylam Pharmaceuticals, Inc. | Chemically modified oligonucleotides |
| ES2663810T3 (es) * | 2004-08-10 | 2018-04-17 | Kastle Therapeutics, Llc | Métodos para modular los niveles de lipoproteínas y colesterol en humanos |
| US20090203132A1 (en) | 2004-09-09 | 2009-08-13 | Swayze Eric E | Pyrrolidinyl groups for attaching conjugates to oligomeric compounds |
| AU2005295756B2 (en) | 2004-10-13 | 2012-02-02 | Isis Parmaceuticals, Inc. | Antisense modulation of PTP1B expression |
| WO2006047842A2 (en) | 2004-11-08 | 2006-05-11 | K.U. Leuven Research And Development | Modified nucleosides for rna interference |
| US20060148740A1 (en) | 2005-01-05 | 2006-07-06 | Prosensa B.V. | Mannose-6-phosphate receptor mediated gene transfer into muscle cells |
| WO2006078217A1 (en) | 2005-01-24 | 2006-07-27 | Avaris Ab | COMPLEX CONTAINING SiRNA, ShRNA OR ANTISENSE MOLECULE AND FUNCTIONAL ENTITY, FOR IMPROVED SPECIFICITY AND DELIVERY |
| JP2009507499A (ja) * | 2005-09-15 | 2009-02-26 | サンタリス ファーマ アー/エス | Apo−b100発現の抑制のためのrnaアンタゴニスト化合物 |
| WO2007035759A1 (en) | 2005-09-19 | 2007-03-29 | Johnson & Johnson Pharmaceutical Research & Development L.L.C. | Modulation of glucocorticoid receptor expression |
| EP2096170B1 (en) | 2005-09-19 | 2011-08-10 | Isis Pharmaceuticals, Inc. | Modulation of glucagon receptor expression |
| WO2007089611A2 (en) | 2006-01-26 | 2007-08-09 | Isis Pharmaceuticals Inc. | Compositions and their uses directed to huntingtin |
| EP1984381B1 (en) | 2006-01-27 | 2010-09-29 | Isis Pharmaceuticals, Inc. | 6-modified bicyclic nucleic acid analogs |
| US7569686B1 (en) | 2006-01-27 | 2009-08-04 | Isis Pharmaceuticals, Inc. | Compounds and methods for synthesis of bicyclic nucleic acid analogs |
| CN101553236A (zh) * | 2006-05-05 | 2009-10-07 | 埃西斯药品公司 | 调节gccr的表达的化合物和方法 |
| WO2007131237A2 (en) | 2006-05-05 | 2007-11-15 | Isis Pharmaceuticals, Inc. | Compounds and methods for modulating expression of ptp1b |
| US7666854B2 (en) | 2006-05-11 | 2010-02-23 | Isis Pharmaceuticals, Inc. | Bis-modified bicyclic nucleic acid analogs |
| ES2389737T3 (es) | 2006-05-11 | 2012-10-31 | Isis Pharmaceuticals, Inc. | Análogos de ácidos nucleicos bicíclicos modificados en 5' |
| EP2057284A4 (en) | 2006-08-04 | 2011-06-29 | Isis Pharmaceuticals Inc | COMPOSITIONS AND METHODS OF MODULATING JNK PROTEINS |
| US8658211B2 (en) | 2006-08-18 | 2014-02-25 | Arrowhead Madison Inc. | Polyconjugates for in vivo delivery of polynucleotides |
| WO2008022309A2 (en) | 2006-08-18 | 2008-02-21 | F. Hoffmann-La Roche Ag | Polyconjugates for in vivo delivery of polynucleotides |
| US8252755B2 (en) | 2006-09-22 | 2012-08-28 | Dharmacon, Inc. | Duplex oligonucleotide complexes and methods for gene silencing by RNA interference |
| EP2410053B2 (en) | 2006-10-18 | 2020-07-15 | Ionis Pharmaceuticals, Inc. | Antisense compounds |
| US8093222B2 (en) | 2006-11-27 | 2012-01-10 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| KR20090103894A (ko) | 2006-11-27 | 2009-10-01 | 아이시스 파마수티컬즈 인코포레이티드 | 고콜레스테롤혈증을 치료하는 방법 |
| HUE033960T2 (en) | 2006-12-08 | 2018-01-29 | Lexicon Pharmaceuticals Inc | Monoclonal Antibodies to ANGPTL3 |
| CA2839162A1 (en) * | 2006-12-20 | 2008-06-26 | Xoma Technology Ltd. | Methods for the treatment of il-1-.beta. related diseases |
| EP2125852B1 (en) | 2007-02-15 | 2016-04-06 | Ionis Pharmaceuticals, Inc. | 5'-substituted-2'-f modified nucleosides and oligomeric compounds prepared therefrom |
| EP2606911A1 (en) | 2007-02-16 | 2013-06-26 | KTB Tumorforschungsgesellschaft mbH | Receptor And Antigen Targeted Prodrug |
| JP5332064B2 (ja) | 2007-03-01 | 2013-11-06 | ウェルスタット イムノセラピューティクス, エルエルシー | 炎症により特徴付けられる疾患の治療 |
| CA2679244A1 (en) | 2007-03-02 | 2009-03-05 | Mdrna, Inc. | Nucleic acid compounds for inhibiting myc gene expression and uses thereof |
| US8877917B2 (en) | 2007-04-23 | 2014-11-04 | Alnylam Pharmaceuticals, Inc. | Glycoconjugates of RNA interference agents |
| US8278425B2 (en) | 2007-05-30 | 2012-10-02 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| DK2173760T4 (en) | 2007-06-08 | 2016-02-08 | Isis Pharmaceuticals Inc | Carbocyclic bicyclic nukleinsyreanaloge |
| US20090004140A1 (en) | 2007-06-26 | 2009-01-01 | Yao-Ling Qiu | 4-substituted pyrrolidine as anti-infectives |
| US8278283B2 (en) | 2007-07-05 | 2012-10-02 | Isis Pharmaceuticals, Inc. | 6-disubstituted or unsaturated bicyclic nucleic acid analogs |
| CN101821277B (zh) | 2007-08-15 | 2014-05-07 | Isis制药公司 | 四氢吡喃核酸类似物 |
| AU2008290217B2 (en) * | 2007-08-20 | 2013-09-05 | Protalix Ltd. | Saccharide-containing protein conjugates and uses thereof |
| US8486904B2 (en) | 2007-10-01 | 2013-07-16 | Isis Pharmaceuticals, Inc. | Antisense modulation of fibroblast growth factor receptor 4 expression |
| CN102076852A (zh) | 2007-11-09 | 2011-05-25 | Isis药物公司 | 因子7表达的调节 |
| US8546556B2 (en) | 2007-11-21 | 2013-10-01 | Isis Pharmaceuticals, Inc | Carbocyclic alpha-L-bicyclic nucleic acid analogs |
| WO2009082607A2 (en) * | 2007-12-04 | 2009-07-02 | Alnylam Pharmaceuticals, Inc. | Targeting lipids |
| JP4585611B2 (ja) | 2007-12-27 | 2010-11-24 | 株式会社ステリック再生医科学研究所 | 糖鎖関連遺伝子、およびその利用 |
| EP2245039A4 (en) | 2008-01-31 | 2012-06-06 | Alnylam Pharmaceuticals Inc | OPTIMIZED METHODS FOR EXPORING DSRNA TO TARGET THE PCSK9 GEN |
| EP2265627A2 (en) | 2008-02-07 | 2010-12-29 | Isis Pharmaceuticals, Inc. | Bicyclic cyclohexitol nucleic acid analogs |
| WO2009142822A2 (en) | 2008-03-26 | 2009-11-26 | Alnylam Pharmaceuticals, Inc. | 2-f modified rna interference agents |
| US8575123B2 (en) | 2008-04-11 | 2013-11-05 | Tekmira Pharmaceuticals Corporation | Site-specific delivery of nucleic acids by combining targeting ligands with endosomolytic components |
| WO2009143369A2 (en) | 2008-05-22 | 2009-11-26 | Isis Pharmaceuticals, Inc. | Method of preparing nucleosides and analogs thereof without using chromatography |
| WO2009148605A2 (en) | 2008-06-04 | 2009-12-10 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| WO2010006215A1 (en) | 2008-07-09 | 2010-01-14 | Celera Corporation | Genetic polymorphisms associated with cardiovascular diseases, methods of detection and uses thereof |
| EP2323667A4 (en) * | 2008-08-07 | 2012-07-25 | Isis Pharmaceuticals Inc | MODULATION OF TRANSTHYRETIN EXPRESSION BY TREATMENT OF CNS DISEASES |
| US8962580B2 (en) | 2008-09-23 | 2015-02-24 | Alnylam Pharmaceuticals, Inc. | Chemical modifications of monomers and oligonucleotides with cycloaddition |
| WO2010036698A1 (en) | 2008-09-24 | 2010-04-01 | Isis Pharmaceuticals, Inc. | Substituted alpha-l-bicyclic nucleosides |
| EP2361256B1 (en) | 2008-09-24 | 2013-04-10 | Isis Pharmaceuticals, Inc. | Cyclohexenyl nucleic acid analogs |
| KR101773551B1 (ko) | 2008-10-15 | 2017-08-31 | 아이오니스 파마수티컬즈, 인코포레이티드 | 인자 11 발현의 조정 |
| WO2010048228A2 (en) * | 2008-10-20 | 2010-04-29 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for inhibiting expression of transthyretin |
| US8987435B2 (en) | 2008-10-24 | 2015-03-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and methods |
| CN102264374B (zh) | 2008-10-24 | 2015-01-07 | Isis制药公司 | 5′和2′双取代的核苷和由其制备的低聚化合物 |
| WO2010054406A1 (en) | 2008-11-10 | 2010-05-14 | Alnylam Pharmaceuticals, Inc. | Novel lipids and compositions for the delivery of therapeutics |
| WO2010083615A1 (en) | 2009-01-26 | 2010-07-29 | Protiva Biotherapeutics, Inc. | Compositions and methods for silencing apolipoprotein c-iii expression |
| WO2010088537A2 (en) | 2009-01-29 | 2010-08-05 | Alnylam Pharmaceuticals, Inc. | Improved lipid formulation |
| EP3424939A1 (en) | 2009-03-02 | 2019-01-09 | Alnylam Pharmaceuticals Inc. | Nucleic acid chemical modifications |
| FR2943060B1 (fr) | 2009-03-13 | 2013-01-04 | Commissariat Energie Atomique | Agents chelatants d'ions metalliques, leurs procedes de preparation et leurs applications |
| MX2011010930A (es) | 2009-04-15 | 2012-04-30 | Isis Pharmaceuticals Inc | Modulacion de respuestas inflamatorias a través de factor xi. |
| NZ711583A (en) | 2009-05-05 | 2017-03-31 | Arbutus Biopharma Corp | Lipid compositions |
| CA2764158A1 (en) | 2009-06-01 | 2010-12-09 | Halo-Bio Rnai Therapeutics, Inc. | Polynucleotides for multivalent rna interference, compositions and methods of use thereof |
| KR102066189B1 (ko) * | 2009-06-10 | 2020-01-14 | 알닐람 파마슈티칼스 인코포레이티드 | 향상된 지질 조성물 |
| EA201270019A1 (ru) | 2009-06-15 | 2012-06-29 | Элнилэм Фармасьютикалз, Инк. | Двуцепочечная рнк, включенная в липидный состав и мишенью которой является ген pcsk9 |
| EP2451823A4 (en) | 2009-07-06 | 2013-07-03 | Alnylam Pharmaceuticals Inc | COMPOSITIONS AND METHODS FOR ENHANCING THE PRODUCTION OF A BIOLOGICAL PRODUCT |
| WO2011005860A2 (en) | 2009-07-07 | 2011-01-13 | Alnylam Pharmaceuticals, Inc. | 5' phosphate mimics |
| WO2011005861A1 (en) | 2009-07-07 | 2011-01-13 | Alnylam Pharmaceuticals, Inc. | Oligonucleotide end caps |
| EP2454369A4 (en) | 2009-07-16 | 2013-07-03 | Isis Pharmaceuticals Inc | MODULATION OF FACTOR 7 EXPRESSION |
| EP2462153B1 (en) | 2009-08-06 | 2015-07-29 | Isis Pharmaceuticals, Inc. | Bicyclic cyclohexose nucleic acid analogs |
| US8901072B2 (en) * | 2009-08-12 | 2014-12-02 | The Medicines Company | Glycopeptide and lipoglycopeptide antibiotics with improved solubility |
| TWI458493B (zh) | 2009-09-25 | 2014-11-01 | Iner Aec Executive Yuan | 新穎肝標靶藥劑與合成方法 |
| US8598334B2 (en) | 2009-10-16 | 2013-12-03 | Glaxo Group Limited | HBV antisense inhibitors |
| TWI388338B (zh) | 2009-10-26 | 2013-03-11 | Iner Aec Executive Yuan | 對聚合醣鏈進行放射標誌以作為肝受體造影劑之方法 |
| TWI391144B (zh) | 2009-10-26 | 2013-04-01 | Iner Aec Executive Yuan | 一種定量肝殘餘功能的檢驗方法與其新穎肝受體造影檢驗藥劑 |
| JP5723378B2 (ja) * | 2009-11-03 | 2015-05-27 | アルナイラム ファーマシューティカルズ, インコーポレイテッドAlnylam Pharmaceuticals, Inc. | トランスサイレチン(ttr)を阻害する脂質製剤化組成物及び方法 |
| WO2011072290A2 (en) | 2009-12-11 | 2011-06-16 | The Regents Of The University Of Michigan | Targeted dendrimer-drug conjugates |
| ES2677969T3 (es) | 2010-01-08 | 2018-08-07 | Ionis Pharmaceuticals, Inc. | Modulación de la expresión tipo angiopoyetina 3 |
| US9198972B2 (en) | 2010-01-28 | 2015-12-01 | Alnylam Pharmaceuticals, Inc. | Monomers and oligonucleotides comprising cycloaddition adduct(s) |
| RS54578B1 (sr) | 2010-02-24 | 2016-06-30 | Arrowhead Research Corporation | Preparati za ciljano dopremanje sirnk |
| WO2011115818A1 (en) | 2010-03-17 | 2011-09-22 | Isis Pharmaceuticals, Inc. | 5'-substituted bicyclic nucleosides and oligomeric compounds prepared therefrom |
| US20130109817A1 (en) | 2010-03-26 | 2013-05-02 | Mersana Therapeutics, Inc. | Modified Polymers for Delivery of Polynucleotides, Method of Manufacture, and Methods of Use Thereof |
| CA2794307A1 (en) | 2010-03-26 | 2011-09-29 | Mersana Therapeutics, Inc. | Modified polymers for delivery of polynucleotides, method of manufacture, and methods of use thereof |
| US9102938B2 (en) | 2010-04-01 | 2015-08-11 | Alnylam Pharmaceuticals, Inc. | 2′ and 5′ modified monomers and oligonucleotides |
| WO2011133876A2 (en) | 2010-04-22 | 2011-10-27 | Alnylam Pharmaceuticals, Inc. | Oligonucleotides comprising acyclic and abasic nucleosides and analogs |
| WO2011133871A2 (en) | 2010-04-22 | 2011-10-27 | Alnylam Pharmaceuticals, Inc. | 5'-end derivatives |
| WO2011139699A2 (en) | 2010-04-28 | 2011-11-10 | Isis Pharmaceuticals, Inc. | 5' modified nucleosides and oligomeric compounds prepared therefrom |
| JP6005628B2 (ja) | 2010-04-28 | 2016-10-12 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | 修飾ヌクレオシド、その類似体、およびこれらから調製されるオリゴマー化合物 |
| JP5896175B2 (ja) | 2010-04-29 | 2016-03-30 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | トランスサイレチン発現の調節 |
| US20130236968A1 (en) | 2010-06-21 | 2013-09-12 | Alnylam Pharmaceuticals, Inc. | Multifunctional copolymers for nucleic acid delivery |
| EP2616543A1 (en) | 2010-09-15 | 2013-07-24 | Alnylam Pharmaceuticals, Inc. | MODIFIED iRNA AGENTS |
| US8603994B2 (en) | 2010-11-11 | 2013-12-10 | Valted, Llc | Transcriptional repression leading to Parkinson's disease |
| WO2012068187A1 (en) | 2010-11-19 | 2012-05-24 | Merck Sharp & Dohme Corp. | Poly(amide) polymers for the delivery of oligonucleotides |
| US8501930B2 (en) | 2010-12-17 | 2013-08-06 | Arrowhead Madison Inc. | Peptide-based in vivo siRNA delivery system |
| JP2014504295A (ja) | 2010-12-17 | 2014-02-20 | アローヘッド リサーチ コーポレイション | siRNA用ガラクトースクラスター−薬物動態調節剤標的指向部分 |
| CN103282503B (zh) | 2010-12-29 | 2015-12-02 | 弗·哈夫曼-拉罗切有限公司 | 用于细胞内递送核酸的小分子缀合物 |
| WO2012109395A1 (en) | 2011-02-08 | 2012-08-16 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising bicyclic nucleotides and uses thereof |
| SMT201900060T1 (it) | 2011-04-01 | 2019-02-28 | Ionis Pharmaceuticals Inc | Modulazione dell'espressione del trasduttore di segnale e dell'attivatore di trascrizione 3 (stat3) |
| CA2832972C (en) * | 2011-04-13 | 2019-04-30 | Isis Pharmaceuticals, Inc. | Antisense modulation of ptp1b expression |
| US20120295961A1 (en) | 2011-04-21 | 2012-11-22 | Swayze Eric E | Modulation of hepatitis b virus (hbv) expression |
| MX340408B (es) | 2011-04-21 | 2016-07-07 | Ionis Pharmaceuticals Inc | Modulacion de la expresion del virus de hepatitis b (vhb). |
| UA115309C2 (uk) | 2011-04-27 | 2017-10-25 | Іоніс Фармасьютікалз, Інк. | Модуляція експресії аполіпопротеїну ciii (apociii) |
| WO2012174154A1 (en) | 2011-06-13 | 2012-12-20 | Isis Pharmaceuticals, Inc. | Modulation of inflammatory responses by factor vii |
| CA2839437A1 (en) * | 2011-06-16 | 2012-12-20 | Isis Pharmaceuticals, Inc. | Antisense modulation of fibroblast growth factor receptor 4 expression |
| KR102232287B1 (ko) | 2011-06-21 | 2021-03-29 | 알닐람 파마슈티칼스 인코포레이티드 | 안지오포이에틴-유사 3(ANGPTL3) iRNA 조성물 및 그 사용 방법 |
| RU2631805C2 (ru) | 2011-06-21 | 2017-09-26 | Элнилэм Фармасьютикалз, Инк. | Композиции и способы ингибирования экспрессии генов аполипопротеина с-iii (арос3) |
| WO2012177639A2 (en) | 2011-06-22 | 2012-12-27 | Alnylam Pharmaceuticals, Inc. | Bioprocessing and bioproduction using avian cell lines |
| US20130017250A1 (en) * | 2011-07-15 | 2013-01-17 | The Trustees Of Columbia University In The City Of New York | Methods For High Density Lipoprotein Cholesterol Regulation |
| CN104024328A (zh) | 2011-08-26 | 2014-09-03 | 箭头研究公司 | 用于体内核酸递送的聚(乙烯基酯)聚合物 |
| EP2751270B1 (en) | 2011-08-29 | 2018-08-22 | Ionis Pharmaceuticals, Inc. | Oligomer-conjugate complexes and their use |
| US8865674B2 (en) | 2011-09-20 | 2014-10-21 | Isis Pharmaceuticals, Inc. | Antisense modulation of GCGR expression |
| KR20140084232A (ko) | 2011-10-25 | 2014-07-04 | 아이시스 파마수티컬즈 인코포레이티드 | Gccr 발현의 안티센스 조절 |
| AU2012340159B2 (en) | 2011-11-18 | 2017-09-07 | Alnylam Pharmaceuticals, Inc. | RNAi agents, compositions and methods of use thereof for treating transthyretin (TTR) associated diseases |
| WO2013119979A1 (en) | 2012-02-08 | 2013-08-15 | Isis Pharmaceuticals, Inc. | Methods and compositions for modulating factor vii expression |
| WO2013142514A1 (en) | 2012-03-19 | 2013-09-26 | Isis Pharmaceuticals, Inc. | Methods and compositions for modulating alpha-1-antitrypsin expression |
| WO2013142571A2 (en) | 2012-03-20 | 2013-09-26 | Cornell University | Assays for the identification of compounds that modulate lipid homeostasis |
| US9133461B2 (en) | 2012-04-10 | 2015-09-15 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for inhibiting expression of the ALAS1 gene |
| WO2013159109A1 (en) | 2012-04-20 | 2013-10-24 | Isis Pharmaceuticals, Inc. | Modulation of hepatitis b virus (hbv) expression |
| WO2013159108A2 (en) | 2012-04-20 | 2013-10-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising bicyclic nucleotides and uses thereof |
| EP3453762B1 (en) | 2012-05-02 | 2021-04-21 | Sirna Therapeutics, Inc. | Short interfering nucleic acid (sina) compositions |
| TW201808342A (zh) | 2012-05-02 | 2018-03-16 | 喜納製藥公司 | 包含四galnac之新穎結合物及傳送寡核苷酸之方法 |
| US20160002624A1 (en) | 2012-05-17 | 2016-01-07 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide compositions |
| US9574193B2 (en) | 2012-05-17 | 2017-02-21 | Ionis Pharmaceuticals, Inc. | Methods and compositions for modulating apolipoprotein (a) expression |
| KR102657351B1 (ko) | 2012-05-24 | 2024-04-16 | 아이오니스 파마수티컬즈, 인코포레이티드 | 아포지질단백질 (a) 발현을 조절하는 방법들 및 조성물들 |
| WO2013192233A1 (en) | 2012-06-18 | 2013-12-27 | Isis Pharmaceuticals, Inc. | Compounds and method for improved cellular uptake of antisense compounds |
| EP4253395A3 (en) | 2012-08-06 | 2023-11-29 | Alnylam Pharmaceuticals, Inc. | Processes for the preparation of carbohydrate conjugated rna agents |
| US9695418B2 (en) | 2012-10-11 | 2017-07-04 | Ionis Pharmaceuticals, Inc. | Oligomeric compounds comprising bicyclic nucleosides and uses thereof |
| CA2889044A1 (en) | 2012-11-15 | 2014-05-22 | Roche Innovation Center Copenhagen A/S | Anti apob antisense conjugate compounds |
| MX2015009056A (es) | 2013-01-30 | 2015-10-05 | Hoffmann La Roche | Conjugados de oligonucleotidos de acido nucleico bloqueado y carbohidratos. |
| WO2014118272A1 (en) | 2013-01-30 | 2014-08-07 | Santaris Pharma A/S | Antimir-122 oligonucleotide carbohydrate conjugates |
| BR112015027322A8 (pt) | 2013-05-01 | 2018-01-02 | Isis Pharmaceuticals Inc | Compostos antissenso conjugados e sua utilização |
| US9884045B2 (en) | 2013-05-16 | 2018-02-06 | Sumitomo Dainippon Pharma Co., Ltd. | Transplantation adjuvant in cell therapy using neural progenitor cells |
| US20160122761A1 (en) | 2013-06-21 | 2016-05-05 | Isis Pharmaceuticals, Inc. | Compositions and methods for modulation of target nucleic acids |
| MX391977B (es) | 2013-06-27 | 2025-03-21 | Roche Innovation Ct Copenhagen As | Oligómeros antisentido y conjugados con diana en la proteína-convertasa subtilisina/kexina tipo 9(pcsk9). |
| JP6487913B2 (ja) | 2013-07-02 | 2019-03-20 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | 成長ホルモン受容体のモジュレータ |
| EP4039278A1 (en) | 2013-07-11 | 2022-08-10 | Alnylam Pharmaceuticals, Inc. | Oligonucleotide-ligand conjugates and process for their preparation |
| BR112016004671B1 (pt) | 2013-09-13 | 2020-12-29 | Ionis Pharmaceuticals, Inc. | compostos moduladores do fator b do complemento, composição compreendendo os referidos compostos e usos dos compostos ou da composição |
| US9943604B2 (en) | 2013-09-20 | 2018-04-17 | Ionis Pharmaceuticals, Inc. | Targeted therapeutic nucleosides and their use |
| KR20160083876A (ko) | 2013-11-14 | 2016-07-12 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | ApoB 안티센스 접합체 화합물 |
| WO2015085158A1 (en) | 2013-12-06 | 2015-06-11 | Dicerna Pharmaceuticals, Inc. | Methods and compositions for the specific inhibition of transthyretin (ttr) by double-stranded rna |
| WO2015105083A1 (ja) * | 2014-01-07 | 2015-07-16 | 塩野義製薬株式会社 | アンチセンスオリゴヌクレオチド及び糖誘導体を含む二本鎖オリゴヌクレオチド |
| EP3845547A1 (en) | 2014-05-01 | 2021-07-07 | Ionis Pharmaceuticals, Inc. | Galnac3 conjugated modified oligonucleotide for modulating angiopoietin-like 3 expression |
| HUE052709T2 (hu) | 2014-05-01 | 2021-05-28 | Ionis Pharmaceuticals Inc | Módosított antiszensz oligonukleotidok konjugátumai és azok alkalmazása PKK expressziójának módosítására |
| EP3811977B1 (en) | 2014-05-01 | 2025-12-03 | Ionis Pharmaceuticals, Inc. | Method for synthesis of reactive conjugate clusters |
| BR122020024446B8 (pt) | 2014-05-01 | 2022-06-28 | Ionis Pharmaceuticals Inc | Compostos para modulação da expressão do receptor do hormônio de crescimento |
| MX380866B (es) | 2014-05-01 | 2025-03-12 | Ionis Pharmaceuticals Inc | Composiciones y métodos para modular la expresión del factor b del complemento. |
| US10570169B2 (en) | 2014-05-22 | 2020-02-25 | Ionis Pharmaceuticals, Inc. | Conjugated antisense compounds and their use |
| US20170145424A1 (en) | 2014-06-06 | 2017-05-25 | Ionis Pharmaceuticals, Inc. | Compositions and methods for enhanced intestinal absorption of conjugated oligomeric compounds |
| CN113952353A (zh) * | 2015-11-06 | 2022-01-21 | Ionis制药公司 | 调节载脂蛋白(a)表达 |
| PT4119569T (pt) * | 2015-11-06 | 2024-10-23 | Ionis Pharmaceuticals Inc | Compostos antissentido conjugados para utilização em terapia |
-
2014
- 2014-05-01 BR BR112015027322A patent/BR112015027322A8/pt not_active Application Discontinuation
- 2014-05-01 AU AU2014259750A patent/AU2014259750B2/en active Active
- 2014-05-01 CN CN202110394825.6A patent/CN113293163A/zh active Pending
- 2014-05-01 KR KR1020237024621A patent/KR102712053B1/ko active Active
- 2014-05-01 NZ NZ753018A patent/NZ753018A/en unknown
- 2014-05-01 KR KR1020217009333A patent/KR20210037752A/ko not_active Ceased
- 2014-05-01 NZ NZ631552A patent/NZ631552A/en not_active IP Right Cessation
- 2014-05-01 DK DK14791557.3T patent/DK2991656T3/da active
- 2014-05-01 KR KR1020157033029A patent/KR102424855B1/ko active Active
- 2014-05-01 BR BR122018009831-7A patent/BR122018009831B1/pt active IP Right Grant
- 2014-05-01 WO PCT/US2014/036460 patent/WO2014179625A1/en not_active Ceased
- 2014-05-01 KR KR1020157033028A patent/KR102315836B1/ko active Active
- 2014-05-01 RU RU2015151203A patent/RU2650510C2/ru active
- 2014-05-01 PT PT147911879T patent/PT2992009T/pt unknown
- 2014-05-01 JP JP2016512052A patent/JP6216444B2/ja active Active
- 2014-05-01 KR KR1020227045740A patent/KR20230006933A/ko not_active Ceased
- 2014-05-01 EP EP19206748.6A patent/EP3633039A1/en not_active Withdrawn
- 2014-05-01 SG SG10201906382QA patent/SG10201906382QA/en unknown
- 2014-05-01 ES ES14791344T patent/ES2730015T3/es active Active
- 2014-05-01 EP EP14791344.6A patent/EP2992098B1/en active Active
- 2014-05-01 MX MX2015015264A patent/MX2015015264A/es active IP Right Grant
- 2014-05-01 AU AU2014259757A patent/AU2014259757B2/en not_active Ceased
- 2014-05-01 ES ES19164959T patent/ES2885174T3/es active Active
- 2014-05-01 BR BR112015027321A patent/BR112015027321A8/pt not_active Application Discontinuation
- 2014-05-01 JP JP2016512055A patent/JP6456362B2/ja not_active Expired - Fee Related
- 2014-05-01 CR CR20190269A patent/CR20190269A/es unknown
- 2014-05-01 DK DK14791344.6T patent/DK2992098T3/da active
- 2014-05-01 RS RS20201052A patent/RS60796B1/sr unknown
- 2014-05-01 AU AU2014259756A patent/AU2014259756B2/en active Active
- 2014-05-01 BR BR112015027369-6A patent/BR112015027369B1/pt active IP Right Grant
- 2014-05-01 SI SI201431207T patent/SI2992098T1/sl unknown
- 2014-05-01 EP EP25155370.7A patent/EP4529927A3/en active Pending
- 2014-05-01 KR KR1020157033025A patent/KR102235678B1/ko not_active Expired - Fee Related
- 2014-05-01 MY MYPI2015703904A patent/MY178929A/en unknown
- 2014-05-01 PL PL14791187T patent/PL2992009T3/pl unknown
- 2014-05-01 IL IL315582A patent/IL315582A/en unknown
- 2014-05-01 CN CN201910037432.2A patent/CN110066795A/zh active Pending
- 2014-05-01 LT LTEP14791187.9T patent/LT2992009T/lt unknown
- 2014-05-01 SG SG11201508800WA patent/SG11201508800WA/en unknown
- 2014-05-01 WO PCT/US2014/036463 patent/WO2014179627A2/en not_active Ceased
- 2014-05-01 KR KR1020157033027A patent/KR101857707B1/ko active Active
- 2014-05-01 CA CA2921162A patent/CA2921162A1/en active Pending
- 2014-05-01 SG SG10201801813YA patent/SG10201801813YA/en unknown
- 2014-05-01 EP EP19160031.1A patent/EP3546579A1/en active Pending
- 2014-05-01 DK DK19164959.9T patent/DK3524680T3/da active
- 2014-05-01 EP EP19164959.9A patent/EP3524680B1/en active Active
- 2014-05-01 RU RU2019110030A patent/RU2019110030A/ru unknown
- 2014-05-01 MX MX2015015220A patent/MX384824B/es unknown
- 2014-05-01 IL IL296543A patent/IL296543B2/en unknown
- 2014-05-01 KR KR1020217033430A patent/KR102482890B1/ko active Active
- 2014-05-01 CN CN201480035618.XA patent/CN105378085B/zh active Active
- 2014-05-01 CN CN202010402246.7A patent/CN111593051A/zh active Pending
- 2014-05-01 RU RU2015151202A patent/RU2670614C9/ru active
- 2014-05-01 CN CN201480035633.4A patent/CN105378082B/zh active Active
- 2014-05-01 RU RU2015151199A patent/RU2697152C2/ru active
- 2014-05-01 PT PT191649599T patent/PT3524680T/pt unknown
- 2014-05-01 CN CN201910037434.1A patent/CN110079524B/zh active Active
- 2014-05-01 CN CN202111358415.2A patent/CN114058617A/zh active Pending
- 2014-05-01 KR KR1020197019617A patent/KR102212275B1/ko active Active
- 2014-05-01 RU RU2015151200A patent/RU2699985C2/ru active
- 2014-05-01 KR KR1020187013079A patent/KR102138781B1/ko active Active
- 2014-05-01 HU HUE14791344A patent/HUE043697T2/hu unknown
- 2014-05-01 JP JP2016512054A patent/JP6995478B2/ja active Active
- 2014-05-01 RU RU2019124314A patent/RU2019124314A/ru unknown
- 2014-05-01 CA CA2921518A patent/CA2921518A1/en not_active Abandoned
- 2014-05-01 JP JP2016512053A patent/JP6387084B2/ja active Active
- 2014-05-01 WO PCT/US2014/036452 patent/WO2014179620A1/en not_active Ceased
- 2014-05-01 MX MX2015015239A patent/MX373334B/es active IP Right Grant
- 2014-05-01 EP EP20205948.1A patent/EP3828275A1/en active Pending
- 2014-05-01 NZ NZ631512A patent/NZ631512A/en unknown
- 2014-05-01 RS RS20190682A patent/RS58981B1/sr unknown
- 2014-05-01 US US14/267,842 patent/US9127276B2/en active Active
- 2014-05-01 EA EA201891479A patent/EA036584B1/ru unknown
- 2014-05-01 CN CN202011081520.1A patent/CN112921036B/zh active Active
- 2014-05-01 CN CN201480035625.XA patent/CN105377887B/zh active Active
- 2014-05-01 CN CN202411684710.0A patent/CN119913147A/zh active Pending
- 2014-05-01 EP EP24189241.3A patent/EP4438129A3/en active Pending
- 2014-05-01 WO PCT/US2014/036462 patent/WO2014179626A2/en not_active Ceased
- 2014-05-01 PT PT14791344T patent/PT2992098T/pt unknown
- 2014-05-01 HR HRP20190987TT patent/HRP20190987T1/hr unknown
- 2014-05-01 KR KR1020157033031A patent/KR20160002977A/ko not_active Ceased
- 2014-05-01 CA CA2921167A patent/CA2921167C/en active Active
- 2014-05-01 PE PE2015002330A patent/PE20152002A1/es unknown
- 2014-05-01 HR HRP20201378TT patent/HRP20201378T1/hr unknown
- 2014-05-01 EP EP14791863.5A patent/EP2992097B1/en active Active
- 2014-05-01 DK DK14791187.9T patent/DK2992009T3/da active
- 2014-05-01 EP EP14792010.2A patent/EP2991661B1/en active Active
- 2014-05-01 UA UAA201708429A patent/UA120287C2/uk unknown
- 2014-05-01 EP EP19217148.6A patent/EP3690049A1/en active Pending
- 2014-05-01 KR KR1020227025268A patent/KR102651423B1/ko active Active
- 2014-05-01 UA UAA201511840A patent/UA121017C2/uk unknown
- 2014-05-01 SG SG11201508870VA patent/SG11201508870VA/en unknown
- 2014-05-01 PL PL14791344T patent/PL2992098T3/pl unknown
- 2014-05-01 MY MYPI2018000863A patent/MY198359A/en unknown
- 2014-05-01 CA CA2921509A patent/CA2921509C/en active Active
- 2014-05-01 MX MX2016012654A patent/MX381034B/es unknown
- 2014-05-01 IL IL284593A patent/IL284593B2/en unknown
- 2014-05-01 ME MEP-2019-157A patent/ME03390B/me unknown
- 2014-05-01 SG SG10201801507RA patent/SG10201801507RA/en unknown
- 2014-05-01 LT LTEP14791344.6T patent/LT2992098T/lt unknown
- 2014-05-01 KR KR1020217003080A patent/KR20210014758A/ko not_active Ceased
- 2014-05-01 ES ES14791187T patent/ES2819213T3/es active Active
- 2014-05-01 AU AU2014259755A patent/AU2014259755B2/en active Active
- 2014-05-01 ES ES14791557T patent/ES2778442T3/es active Active
- 2014-05-01 PE PE2016001724A patent/PE20161430A1/es unknown
- 2014-05-01 KR KR1020247009422A patent/KR20240042220A/ko active Pending
- 2014-05-01 JP JP2016512051A patent/JP6769866B2/ja active Active
- 2014-05-01 CN CN201480035624.5A patent/CN105392488B/zh active Active
- 2014-05-01 RU RU2015151204A patent/RU2686080C2/ru active
- 2014-05-01 MX MX2015015234A patent/MX2015015234A/es active IP Right Grant
- 2014-05-01 KR KR1020207021245A patent/KR20200090966A/ko not_active Ceased
- 2014-05-01 US US14/888,318 patent/US9714421B2/en not_active Expired - Fee Related
- 2014-05-01 NZ NZ631537A patent/NZ631537A/en unknown
- 2014-05-01 CN CN201910036892.3A patent/CN110042098B/zh active Active
- 2014-05-01 BR BR112015027319A patent/BR112015027319A8/pt active Search and Examination
- 2014-05-01 BR BR112015027377-7A patent/BR112015027377B1/pt active IP Right Grant
- 2014-05-01 CA CA2921514A patent/CA2921514C/en active Active
- 2014-05-01 HU HUE14791187A patent/HUE050394T2/hu unknown
- 2014-05-01 SI SI201431660T patent/SI2992009T1/sl unknown
- 2014-05-01 NZ NZ740338A patent/NZ740338A/en unknown
- 2014-05-01 MX MX2015015263A patent/MX373306B/es active IP Right Grant
- 2014-05-01 KR KR1020247032116A patent/KR20240147701A/ko active Pending
- 2014-05-01 EP EP14791557.3A patent/EP2991656B1/en active Active
- 2014-05-01 EA EA201592093A patent/EA031393B1/ru unknown
- 2014-05-01 WO PCT/US2014/036466 patent/WO2014179629A2/en not_active Ceased
- 2014-05-01 KR KR1020217039866A patent/KR102558571B1/ko active Active
- 2014-05-01 RU RU2018112167A patent/RU2018112167A/ru not_active Application Discontinuation
- 2014-05-01 EP EP14791187.9A patent/EP2992009B1/en active Active
- 2014-05-01 EP EP22181753.9A patent/EP4155403A1/en active Pending
- 2014-05-01 AU AU2014259759A patent/AU2014259759B2/en not_active Expired - Fee Related
- 2014-05-01 MA MA60161A patent/MA60161B1/fr unknown
- 2014-05-01 CN CN201480035635.3A patent/CN108064162B/zh active Active
- 2014-05-01 SM SM20190316T patent/SMT201900316T1/it unknown
- 2014-12-30 US US14/586,826 patent/US9163239B2/en active Active
- 2014-12-30 US US14/586,751 patent/US9181549B2/en active Active
- 2014-12-31 US US14/588,061 patent/US9181550B2/en active Active
-
2015
- 2015-02-27 US US14/633,491 patent/US9145558B2/en active Active
- 2015-06-19 US US14/744,539 patent/US20160017323A1/en not_active Abandoned
- 2015-08-10 US US14/822,493 patent/US9932580B2/en active Active
- 2015-08-28 US US14/839,580 patent/US9957504B2/en active Active
- 2015-08-28 US US14/839,521 patent/US9932581B2/en active Active
- 2015-09-29 ZA ZA2015/07218A patent/ZA201507218B/en unknown
- 2015-09-29 ZA ZA2015/07216A patent/ZA201507216B/en unknown
- 2015-10-15 IL IL242132A patent/IL242132B/en active IP Right Grant
- 2015-10-15 IL IL242125A patent/IL242125B/en active IP Right Grant
- 2015-10-15 IL IL242126A patent/IL242126B/en active IP Right Grant
- 2015-10-15 IL IL242124A patent/IL242124B/en active IP Right Grant
- 2015-10-28 DO DO2015000268A patent/DOP2015000268A/es unknown
- 2015-10-29 PH PH12015502493A patent/PH12015502493B1/en unknown
- 2015-10-30 MX MX2020002184A patent/MX2020002184A/es unknown
- 2015-10-30 MX MX2021008899A patent/MX2021008899A/es unknown
- 2015-10-30 MX MX2019010441A patent/MX2019010441A/es unknown
- 2015-10-30 MX MX2021008901A patent/MX2021008901A/es unknown
- 2015-10-30 MX MX2019010443A patent/MX2019010443A/es unknown
- 2015-10-30 MX MX2020004209A patent/MX2020004209A/es unknown
- 2015-10-30 CL CL2015003217A patent/CL2015003217A1/es unknown
- 2015-11-12 CR CR20150612A patent/CR20150612A/es unknown
-
2016
- 2016-09-07 CL CL2016002262A patent/CL2016002262A1/es unknown
- 2016-10-24 DO DO2016000287A patent/DOP2016000287A/es unknown
-
2017
- 2017-01-19 AU AU2017200365A patent/AU2017200365C1/en active Active
- 2017-02-13 AU AU2017200950A patent/AU2017200950B2/en active Active
- 2017-05-23 AU AU2017203436A patent/AU2017203436B2/en active Active
- 2017-06-09 US US15/618,365 patent/US20180002693A1/en not_active Abandoned
- 2017-08-25 US US15/687,306 patent/US10683499B2/en active Active
- 2017-09-22 JP JP2017182019A patent/JP6592486B2/ja active Active
-
2018
- 2018-02-07 US US15/891,118 patent/US10927372B2/en active Active
- 2018-02-07 US US15/891,156 patent/US10883104B2/en active Active
- 2018-02-14 US US15/896,379 patent/US20190055554A1/en not_active Abandoned
- 2018-08-07 JP JP2018148112A patent/JP6652602B2/ja active Active
- 2018-09-12 PH PH12018501963A patent/PH12018501963A1/en unknown
- 2018-09-20 IL IL261901A patent/IL261901B/en active IP Right Grant
- 2018-11-22 AU AU2018267625A patent/AU2018267625B2/en active Active
- 2018-12-18 JP JP2018236205A patent/JP6639629B2/ja not_active Expired - Fee Related
- 2018-12-19 IL IL263843A patent/IL263843B/en active IP Right Grant
- 2018-12-26 US US16/232,733 patent/US10844379B2/en active Active
-
2019
- 2019-01-14 IL IL264241A patent/IL264241B/en active IP Right Grant
- 2019-01-31 IL IL264580A patent/IL264580B/en active IP Right Grant
- 2019-02-07 AU AU2019200820A patent/AU2019200820B2/en active Active
- 2019-04-15 AU AU2019202598A patent/AU2019202598A1/en not_active Abandoned
- 2019-05-25 AU AU2019203674A patent/AU2019203674B2/en active Active
- 2019-05-29 PH PH12019501191A patent/PH12019501191A1/en unknown
- 2019-06-26 CY CY20191100660T patent/CY1121879T1/el unknown
- 2019-07-03 AU AU2019204784A patent/AU2019204784C1/en active Active
- 2019-09-19 JP JP2019170394A patent/JP7429103B2/ja active Active
- 2019-11-06 IL IL270464A patent/IL270464B/en unknown
- 2019-11-22 JP JP2019211074A patent/JP6866459B2/ja active Active
- 2019-11-22 JP JP2019211075A patent/JP2020039355A/ja active Pending
- 2019-12-20 JP JP2019229981A patent/JP2020058370A/ja not_active Ceased
-
2020
- 2020-01-23 JP JP2020008836A patent/JP2020074787A/ja active Pending
- 2020-02-12 IL IL272617A patent/IL272617A/en unknown
- 2020-02-13 US US16/790,557 patent/US20220275365A9/en not_active Abandoned
- 2020-03-02 US US16/806,941 patent/US20200224198A1/en not_active Abandoned
- 2020-03-09 IL IL273184A patent/IL273184B/en unknown
- 2020-03-10 IL IL273205A patent/IL273205A/en unknown
- 2020-03-15 IL IL273312A patent/IL273312A/en unknown
- 2020-04-20 IL IL274064A patent/IL274064B/en active IP Right Grant
- 2020-06-24 US US16/910,727 patent/US20210130823A1/en not_active Abandoned
- 2020-07-22 AU AU2020207820A patent/AU2020207820A1/en not_active Withdrawn
- 2020-08-11 AU AU2020217347A patent/AU2020217347A1/en not_active Abandoned
- 2020-09-14 AU AU2020233603A patent/AU2020233603A1/en not_active Abandoned
- 2020-09-22 CY CY20201100892T patent/CY1123369T1/el unknown
- 2020-09-23 JP JP2020158332A patent/JP7177127B2/ja active Active
- 2020-10-01 US US17/060,440 patent/US11851655B2/en active Active
- 2020-10-14 US US17/070,287 patent/US11299736B1/en active Active
- 2020-12-07 US US17/114,177 patent/US20210395734A1/en not_active Abandoned
-
2021
- 2021-02-17 JP JP2021023118A patent/JP2021074021A/ja not_active Withdrawn
- 2021-04-07 JP JP2021065088A patent/JP7339294B2/ja active Active
- 2021-05-17 DO DO2021000095A patent/DOP2021000095A/es unknown
- 2021-06-02 IL IL283660A patent/IL283660A/en unknown
- 2021-06-14 IL IL284000A patent/IL284000A/en unknown
- 2021-06-23 AU AU2021204244A patent/AU2021204244B2/en active Active
- 2021-11-05 JP JP2021181533A patent/JP2022017514A/ja active Pending
-
2022
- 2022-04-27 AU AU2022202770A patent/AU2022202770B2/en active Active
- 2022-10-21 US US17/970,887 patent/US20230151365A1/en active Pending
- 2022-11-10 JP JP2022180094A patent/JP2023012548A/ja active Pending
-
2023
- 2023-06-07 JP JP2023093703A patent/JP7633311B2/ja active Active
- 2023-07-11 US US18/350,195 patent/US20240247260A1/en not_active Abandoned
- 2023-10-23 JP JP2023181938A patent/JP2024010070A/ja active Pending
- 2023-11-03 US US18/501,779 patent/US12291709B2/en active Active
-
2024
- 2024-01-17 AU AU2024200296A patent/AU2024200296A1/en active Pending
- 2024-06-05 JP JP2024091116A patent/JP2024116224A/ja active Pending
- 2024-11-22 AU AU2024266799A patent/AU2024266799A1/en active Pending
- 2024-12-16 US US18/983,163 patent/US20250346899A1/en active Pending
-
2025
- 2025-02-06 JP JP2025018106A patent/JP2025072530A/ja active Pending
- 2025-07-14 JP JP2025118631A patent/JP2025174962A/ja active Pending
- 2025-08-13 NO NO2025037C patent/NO2025037I1/no unknown
- 2025-08-18 FI FIC20250028C patent/FIC20250028I1/fi unknown
- 2025-08-30 FR FR25C1033C patent/FR25C1033I1/fr active Active
- 2025-09-03 NL NL301341C patent/NL301341I2/nl unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2022017514A (ja) | アポリポタンパク質(a)発現を調節するための組成物および方法 | |
| JP6842578B2 (ja) | アンジオポエチン様因子3発現を調節するための組成物及び方法 | |
| US12509684B2 (en) | Compositions and methods for modulating apolipoprotein C-III expression | |
| RU2824214C1 (ru) | Композиции и способы модулирования экспрессии аполипопротеина (a) | |
| HK40058004A (en) | Compositions and methods for modulating apolipoprotein c-iii expression |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211203 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20211203 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20221122 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230217 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20230419 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20230711 |