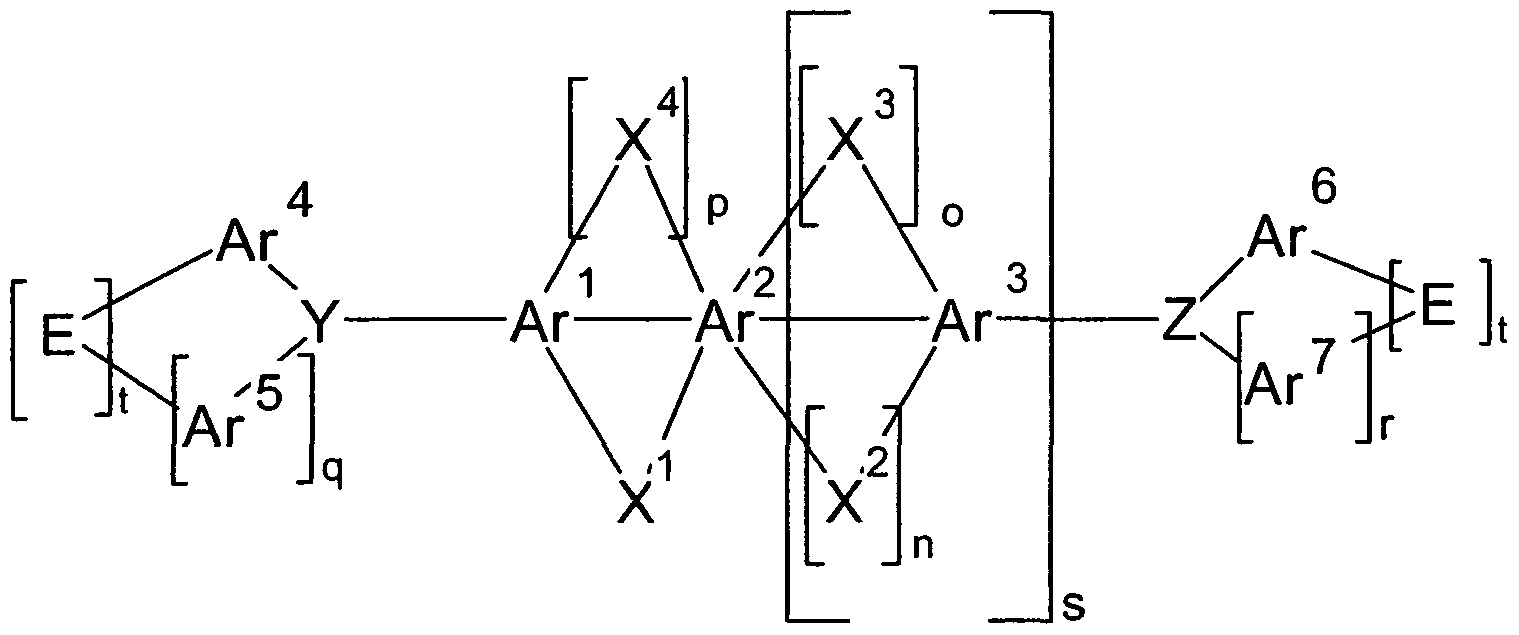
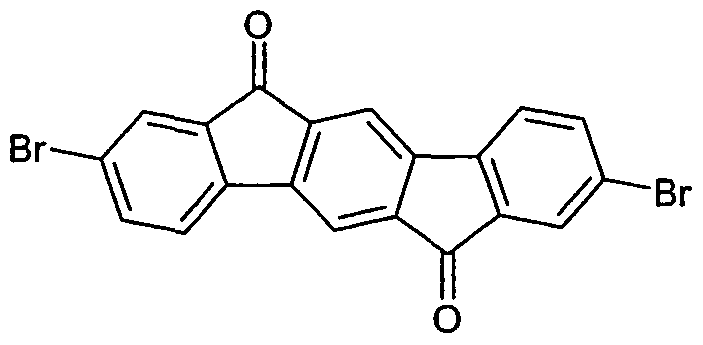
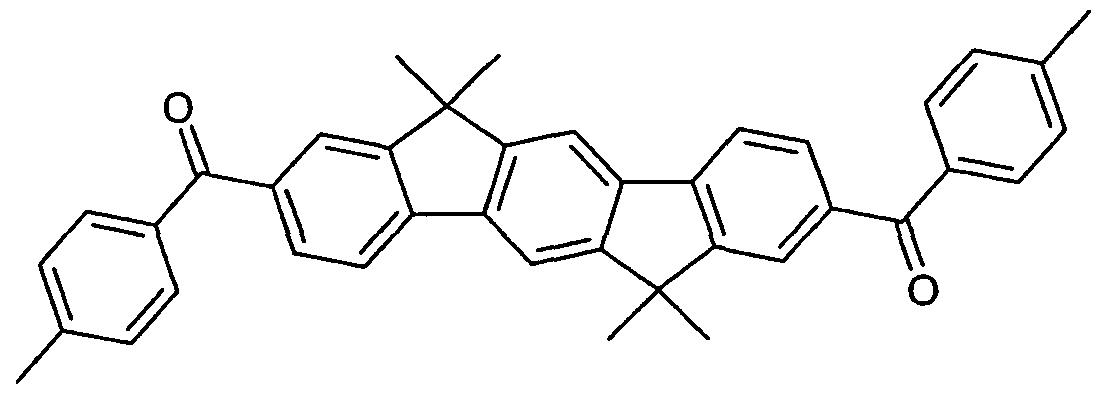
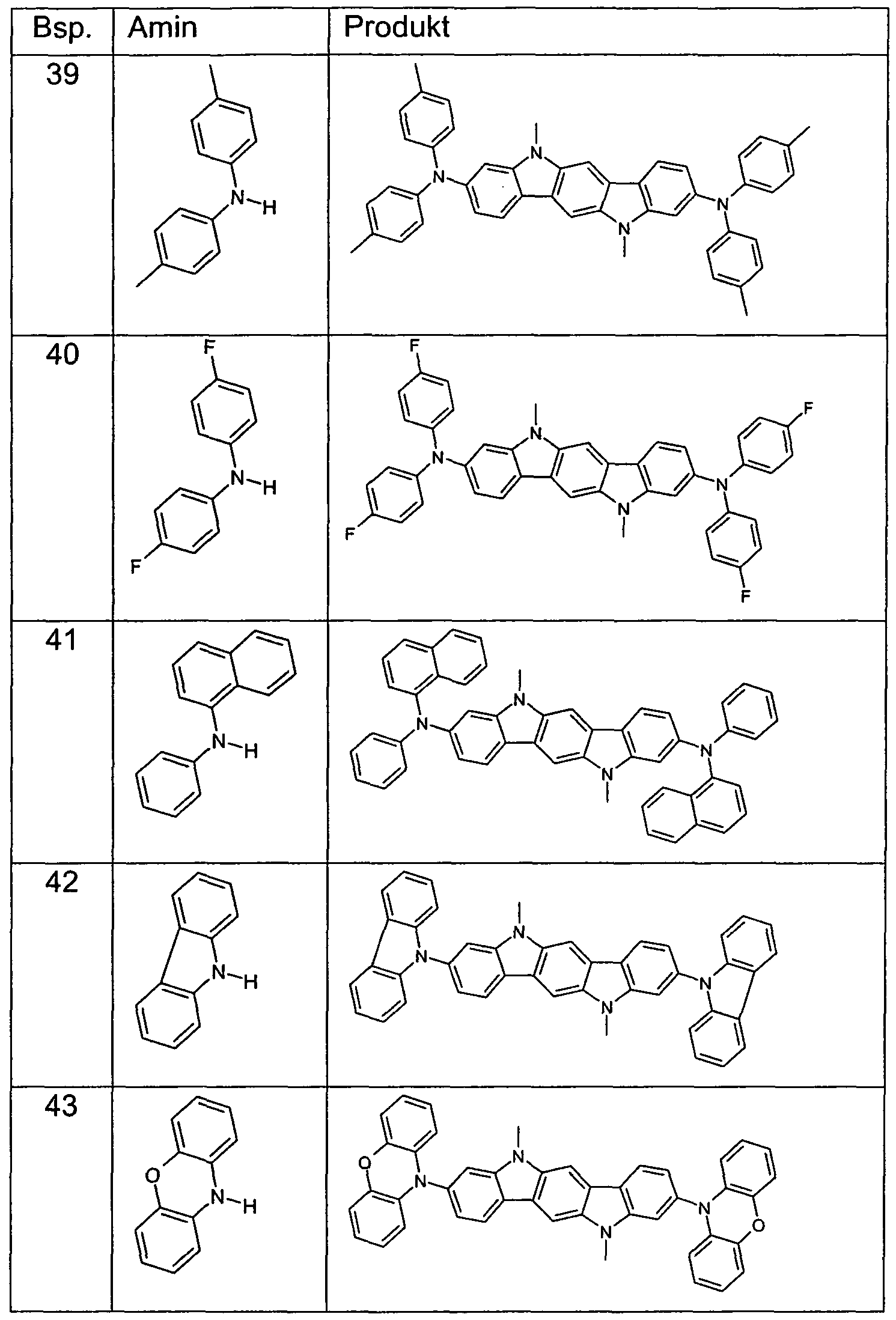
WO2006122630A1 - Verbindungen für organische elektronische vorrichtungen - Google Patents
Verbindungen für organische elektronische vorrichtungen Download PDFInfo
- Publication number
- WO2006122630A1 WO2006122630A1 PCT/EP2006/003670 EP2006003670W WO2006122630A1 WO 2006122630 A1 WO2006122630 A1 WO 2006122630A1 EP 2006003670 W EP2006003670 W EP 2006003670W WO 2006122630 A1 WO2006122630 A1 WO 2006122630A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- compounds
- occurrence
- formula
- different
- aromatic
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 125
- 239000000463 material Substances 0.000 claims description 70
- -1 C = O Chemical compound 0.000 claims description 63
- 230000005525 hole transport Effects 0.000 claims description 57
- 125000003118 aryl group Chemical group 0.000 claims description 56
- 229910052760 oxygen Inorganic materials 0.000 claims description 31
- 238000002347 injection Methods 0.000 claims description 30
- 239000007924 injection Substances 0.000 claims description 30
- 229910052717 sulfur Inorganic materials 0.000 claims description 29
- 125000004432 carbon atom Chemical group C* 0.000 claims description 22
- 125000001072 heteroaryl group Chemical group 0.000 claims description 20
- 229910052799 carbon Inorganic materials 0.000 claims description 17
- 125000004122 cyclic group Chemical group 0.000 claims description 16
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 12
- 125000000217 alkyl group Chemical group 0.000 claims description 11
- 229920000642 polymer Polymers 0.000 claims description 11
- 229910052731 fluorine Inorganic materials 0.000 claims description 9
- PJULCNAVAGQLAT-UHFFFAOYSA-N indeno[2,1-a]fluorene Chemical class C1=CC=C2C=C3C4=CC5=CC=CC=C5C4=CC=C3C2=C1 PJULCNAVAGQLAT-UHFFFAOYSA-N 0.000 claims description 9
- 229910052757 nitrogen Inorganic materials 0.000 claims description 9
- 125000004429 atom Chemical group 0.000 claims description 7
- 229910052794 bromium Inorganic materials 0.000 claims description 7
- 239000000412 dendrimer Substances 0.000 claims description 7
- 229920000736 dendritic polymer Polymers 0.000 claims description 7
- 239000011159 matrix material Substances 0.000 claims description 7
- ICPSWZFVWAPUKF-UHFFFAOYSA-N 1,1'-spirobi[fluorene] Chemical compound C1=CC=C2C=C3C4(C=5C(C6=CC=CC=C6C=5)=CC=C4)C=CC=C3C2=C1 ICPSWZFVWAPUKF-UHFFFAOYSA-N 0.000 claims description 6
- 229910052787 antimony Inorganic materials 0.000 claims description 6
- 229910052785 arsenic Inorganic materials 0.000 claims description 6
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 6
- 229910052698 phosphorus Inorganic materials 0.000 claims description 6
- 229930192474 thiophene Chemical class 0.000 claims description 6
- 125000003545 alkoxy group Chemical group 0.000 claims description 5
- 230000000903 blocking effect Effects 0.000 claims description 5
- 229910052739 hydrogen Inorganic materials 0.000 claims description 5
- 150000002576 ketones Chemical class 0.000 claims description 5
- MPQXHAGKBWFSNV-UHFFFAOYSA-N oxidophosphanium Chemical class [PH3]=O MPQXHAGKBWFSNV-UHFFFAOYSA-N 0.000 claims description 5
- 125000005259 triarylamine group Chemical group 0.000 claims description 5
- 229910052801 chlorine Inorganic materials 0.000 claims description 4
- 229920000547 conjugated polymer Polymers 0.000 claims description 4
- 125000006165 cyclic alkyl group Chemical group 0.000 claims description 4
- 229910052740 iodine Inorganic materials 0.000 claims description 4
- 229910052751 metal Inorganic materials 0.000 claims description 4
- 239000002184 metal Chemical class 0.000 claims description 4
- 150000003462 sulfoxides Chemical class 0.000 claims description 4
- 125000005309 thioalkoxy group Chemical group 0.000 claims description 4
- 125000001424 substituent group Chemical group 0.000 claims description 3
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 claims description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 claims description 2
- 150000008365 aromatic ketones Chemical class 0.000 claims description 2
- 125000004104 aryloxy group Chemical group 0.000 claims description 2
- 150000001716 carbazoles Chemical class 0.000 claims description 2
- 230000005669 field effect Effects 0.000 claims description 2
- 125000005553 heteroaryloxy group Chemical group 0.000 claims description 2
- 125000002950 monocyclic group Chemical group 0.000 claims description 2
- 150000002987 phenanthrenes Chemical class 0.000 claims description 2
- 239000011574 phosphorus Substances 0.000 claims description 2
- 108091008695 photoreceptors Proteins 0.000 claims description 2
- 238000010791 quenching Methods 0.000 claims description 2
- 229910052711 selenium Inorganic materials 0.000 claims description 2
- 229910052714 tellurium Inorganic materials 0.000 claims description 2
- 239000010409 thin film Substances 0.000 claims description 2
- 150000003577 thiophenes Chemical class 0.000 claims description 2
- 125000003983 fluorenyl group Chemical class C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 claims 1
- 239000002019 doping agent Substances 0.000 abstract description 10
- 230000006872 improvement Effects 0.000 abstract description 3
- 238000001228 spectrum Methods 0.000 abstract 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 42
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 18
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 17
- 238000004128 high performance liquid chromatography Methods 0.000 description 17
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 17
- 150000003254 radicals Chemical class 0.000 description 17
- 230000000052 comparative effect Effects 0.000 description 16
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 15
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- 239000000203 mixture Substances 0.000 description 15
- 238000000034 method Methods 0.000 description 14
- 238000000859 sublimation Methods 0.000 description 14
- 230000008022 sublimation Effects 0.000 description 14
- RMBPEFMHABBEKP-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2C3=C[CH]C=CC3=CC2=C1 RMBPEFMHABBEKP-UHFFFAOYSA-N 0.000 description 13
- RFFLAFLAYFXFSW-UHFFFAOYSA-N 1,2-dichlorobenzene Chemical compound ClC1=CC=CC=C1Cl RFFLAFLAYFXFSW-UHFFFAOYSA-N 0.000 description 12
- 239000007983 Tris buffer Substances 0.000 description 12
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 12
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 12
- 239000000243 solution Substances 0.000 description 12
- 238000003786 synthesis reaction Methods 0.000 description 11
- 238000005160 1H NMR spectroscopy Methods 0.000 description 10
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 10
- DMBHHRLKUKUOEG-UHFFFAOYSA-N diphenylamine Chemical compound C=1C=CC=CC=1NC1=CC=CC=C1 DMBHHRLKUKUOEG-UHFFFAOYSA-N 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 9
- 238000001816 cooling Methods 0.000 description 9
- 238000007429 general method Methods 0.000 description 9
- 238000004519 manufacturing process Methods 0.000 description 9
- 238000001953 recrystallisation Methods 0.000 description 9
- NSRBXXWZFGGDPX-UHFFFAOYSA-N 2,8-dibromo-6,6,12,12-tetramethylindeno[1,2-b]fluorene Chemical compound C1=C2C3=CC=C(Br)C=C3C(C)(C)C2=CC2=C1C(C)(C)C1=CC(Br)=CC=C12 NSRBXXWZFGGDPX-UHFFFAOYSA-N 0.000 description 8
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 8
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 8
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 7
- 238000010992 reflux Methods 0.000 description 7
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- REDXJYDRNCIFBQ-UHFFFAOYSA-N aluminium(3+) Chemical compound [Al+3] REDXJYDRNCIFBQ-UHFFFAOYSA-N 0.000 description 6
- 238000001194 electroluminescence spectrum Methods 0.000 description 6
- IFYXDUXOWSLKPL-UHFFFAOYSA-N indeno[2,1-a]fluorene-5,11-dione Chemical compound C1=C2C(C=3C(=CC(C4=C5C=CC=CC5=CC=34)=O)C2=CC=C1)=O IFYXDUXOWSLKPL-UHFFFAOYSA-N 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 6
- MTUBTKOZCCGPSU-UHFFFAOYSA-N 2-n-naphthalen-1-yl-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound C1=CC=CC=C1N(C=1C(=CC=CC=1)N(C=1C=CC=CC=1)C=1C2=CC=CC=C2C=CC=1)C1=CC=CC=C1 MTUBTKOZCCGPSU-UHFFFAOYSA-N 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- OCHLUUFRAVAYIM-UHFFFAOYSA-N bis(9,9'-spirobi[fluorene]-2-yl)methanone Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1(C1=C2)C3=CC=CC=C3C1=CC=C2C(=O)C1=CC=C(C=2C(=CC=CC=2)C23C4=CC=CC=C4C4=CC=CC=C43)C2=C1 OCHLUUFRAVAYIM-UHFFFAOYSA-N 0.000 description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 239000011541 reaction mixture Substances 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 4
- VMDDQHKTCPOZNM-UHFFFAOYSA-N 6,6,12,12-tetramethylindeno[1,2-b]fluorene Chemical compound C12=CC=CC=C2C(C)(C)C2=C1C=C1C(C)(C)C3=CC=CC=C3C1=C2 VMDDQHKTCPOZNM-UHFFFAOYSA-N 0.000 description 4
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 4
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 4
- 239000013078 crystal Substances 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 4
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- OPPSYCGZHQVDPM-UHFFFAOYSA-N 2-bromo-4-tert-butyl-1-(4-tert-butylphenyl)benzene Chemical group C1=CC(C(C)(C)C)=CC=C1C1=CC=C(C(C)(C)C)C=C1Br OPPSYCGZHQVDPM-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 229910052797 bismuth Inorganic materials 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 239000004020 conductor Substances 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 238000000354 decomposition reaction Methods 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- CMJXNUDSBHMDJM-UHFFFAOYSA-N n,n-diphenyl-1,1'-spirobi[fluorene]-2'-amine Chemical compound C12=CC=CC=C2C=C2C1=CC=CC21C2=CC3=CC=CC=C3C2=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 CMJXNUDSBHMDJM-UHFFFAOYSA-N 0.000 description 3
- 239000012074 organic phase Substances 0.000 description 3
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 3
- 238000006116 polymerization reaction Methods 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 2
- VOIVTTPPKHORBL-UHFFFAOYSA-N 1-naphthalen-1-ylanthracene Chemical compound C1=CC=C2C(C=3C4=CC5=CC=CC=C5C=C4C=CC=3)=CC=CC2=C1 VOIVTTPPKHORBL-UHFFFAOYSA-N 0.000 description 2
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 2
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- GWNJZSGBZMLRBW-UHFFFAOYSA-N 9,10-dinaphthalen-1-ylanthracene Chemical compound C12=CC=CC=C2C(C=2C3=CC=CC=C3C=CC=2)=C(C=CC=C2)C2=C1C1=CC=CC2=CC=CC=C12 GWNJZSGBZMLRBW-UHFFFAOYSA-N 0.000 description 2
- ZHQNDEHZACHHTA-UHFFFAOYSA-N 9,9-dimethylfluorene Chemical compound C1=CC=C2C(C)(C)C3=CC=CC=C3C2=C1 ZHQNDEHZACHHTA-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- 239000007818 Grignard reagent Substances 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 238000006069 Suzuki reaction reaction Methods 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- 235000010290 biphenyl Nutrition 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical compound C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 2
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- MCRSZLVSRGTMIH-UHFFFAOYSA-N ditert-butyl(chloro)phosphane Chemical compound CC(C)(C)P(Cl)C(C)(C)C MCRSZLVSRGTMIH-UHFFFAOYSA-N 0.000 description 2
- 239000012039 electrophile Substances 0.000 description 2
- 230000008570 general process Effects 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- SWGQKRKXZZPKJA-UHFFFAOYSA-N indeno[2,1-a]fluorene-1,2-diamine Chemical class C1=CC=C2C=C3C4=CC5=C(N)C(N)=CC=C5C4=CC=C3C2=C1 SWGQKRKXZZPKJA-UHFFFAOYSA-N 0.000 description 2
- 238000007641 inkjet printing Methods 0.000 description 2
- RBTARNINKXHZNM-UHFFFAOYSA-K iron trichloride Chemical compound Cl[Fe](Cl)Cl RBTARNINKXHZNM-UHFFFAOYSA-K 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- HQDYNFWTFJFEPR-UHFFFAOYSA-N 1,2,3,3a-tetrahydropyrene Chemical class C1=C2CCCC(C=C3)C2=C2C3=CC=CC2=C1 HQDYNFWTFJFEPR-UHFFFAOYSA-N 0.000 description 1
- ZFXBERJDEUDDMX-UHFFFAOYSA-N 1,2,3,5-tetrazine Chemical compound C1=NC=NN=N1 ZFXBERJDEUDDMX-UHFFFAOYSA-N 0.000 description 1
- FNQJDLTXOVEEFB-UHFFFAOYSA-N 1,2,3-benzothiadiazole Chemical compound C1=CC=C2SN=NC2=C1 FNQJDLTXOVEEFB-UHFFFAOYSA-N 0.000 description 1
- UGUHFDPGDQDVGX-UHFFFAOYSA-N 1,2,3-thiadiazole Chemical compound C1=CSN=N1 UGUHFDPGDQDVGX-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- HTJMXYRLEDBSLT-UHFFFAOYSA-N 1,2,4,5-tetrazine Chemical compound C1=NN=CN=N1 HTJMXYRLEDBSLT-UHFFFAOYSA-N 0.000 description 1
- BBVIDBNAYOIXOE-UHFFFAOYSA-N 1,2,4-oxadiazole Chemical compound C=1N=CON=1 BBVIDBNAYOIXOE-UHFFFAOYSA-N 0.000 description 1
- YGTAZGSLCXNBQL-UHFFFAOYSA-N 1,2,4-thiadiazole Chemical compound C=1N=CSN=1 YGTAZGSLCXNBQL-UHFFFAOYSA-N 0.000 description 1
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 1
- UDGKZGLPXCRRAM-UHFFFAOYSA-N 1,2,5-thiadiazole Chemical compound C=1C=NSN=1 UDGKZGLPXCRRAM-UHFFFAOYSA-N 0.000 description 1
- UUSUFQUCLACDTA-UHFFFAOYSA-N 1,2-dihydropyrene Chemical compound C1=CC=C2C=CC3=CCCC4=CC=C1C2=C43 UUSUFQUCLACDTA-UHFFFAOYSA-N 0.000 description 1
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical compound C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 1
- MBIZXFATKUQOOA-UHFFFAOYSA-N 1,3,4-thiadiazole Chemical compound C1=NN=CS1 MBIZXFATKUQOOA-UHFFFAOYSA-N 0.000 description 1
- JIHQDMXYYFUGFV-UHFFFAOYSA-N 1,3,5-triazine Chemical compound C1=NC=NC=N1 JIHQDMXYYFUGFV-UHFFFAOYSA-N 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- IVKPEQAIHJWGGT-UHFFFAOYSA-N 1,4-dibromo-2,5-diiodobenzene Chemical compound BrC1=CC(I)=C(Br)C=C1I IVKPEQAIHJWGGT-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- UHXOHPVVEHBKKT-UHFFFAOYSA-N 1-(2,2-diphenylethenyl)-4-[4-(2,2-diphenylethenyl)phenyl]benzene Chemical compound C=1C=C(C=2C=CC(C=C(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)C=CC=1C=C(C=1C=CC=CC=1)C1=CC=CC=C1 UHXOHPVVEHBKKT-UHFFFAOYSA-N 0.000 description 1
- KTADSLDAUJLZGL-UHFFFAOYSA-N 1-bromo-2-phenylbenzene Chemical group BrC1=CC=CC=C1C1=CC=CC=C1 KTADSLDAUJLZGL-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- USYCQABRSUEURP-UHFFFAOYSA-N 1h-benzo[f]benzimidazole Chemical compound C1=CC=C2C=C(NC=N3)C3=CC2=C1 USYCQABRSUEURP-UHFFFAOYSA-N 0.000 description 1
- JUUZQMUWOVDZSD-UHFFFAOYSA-N 1h-imidazole;pyrazine Chemical compound C1=CNC=N1.C1=CN=CC=N1 JUUZQMUWOVDZSD-UHFFFAOYSA-N 0.000 description 1
- PLJDGKPRGUMSAA-UHFFFAOYSA-N 2,2',7,7'-tetraphenyl-1,1'-spirobi[fluorene] Chemical compound C12=CC=C(C=3C=CC=CC=3)C=C2C=C(C23C(=CC=C4C5=CC=C(C=C5C=C43)C=3C=CC=CC=3)C=3C=CC=CC=3)C1=CC=C2C1=CC=CC=C1 PLJDGKPRGUMSAA-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- LYTMVABTDYMBQK-UHFFFAOYSA-N 2-benzothiophene Chemical compound C1=CC=CC2=CSC=C21 LYTMVABTDYMBQK-UHFFFAOYSA-N 0.000 description 1
- WONYVCKUEUULQN-UHFFFAOYSA-N 2-methyl-n-(2-methylphenyl)aniline Chemical compound CC1=CC=CC=C1NC1=CC=CC=C1C WONYVCKUEUULQN-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- HPYOKGGSVCJKPK-UHFFFAOYSA-N 3,9-dibromo-1,7-dimethyl-6h-indolo[2,3-b]carbazole Chemical compound C12=CC=C(Br)C=C2N(C)C(C2)=C1C=C1C2=NC2=C1C(C)=CC(Br)=C2 HPYOKGGSVCJKPK-UHFFFAOYSA-N 0.000 description 1
- WXCKKDNEPSXTPN-UHFFFAOYSA-N 3,9-dibromo-5,11-didodecylindolo[3,2-b]carbazole Chemical compound CCCCCCCCCCCCN1C2=CC(Br)=CC=C2C2=C1C=C1C3=CC=C(Br)C=C3N(CCCCCCCCCCCC)C1=C2 WXCKKDNEPSXTPN-UHFFFAOYSA-N 0.000 description 1
- YOAWLDOMBTXKPK-UHFFFAOYSA-N 3,9-dibromo-5,11-dimethylindolo[3,2-b]carbazole Chemical compound CN1C2=CC(Br)=CC=C2C2=C1C=C1C3=CC=C(Br)C=C3N(C)C1=C2 YOAWLDOMBTXKPK-UHFFFAOYSA-N 0.000 description 1
- VAJLGRHMEFMPPI-UHFFFAOYSA-N 4-(2,2-diphenylethenyl)-n,n-bis[4-(2,2-diphenylethenyl)phenyl]aniline Chemical compound C=1C=C(N(C=2C=CC(C=C(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)C=2C=CC(C=C(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)C=CC=1C=C(C=1C=CC=CC=1)C1=CC=CC=C1 VAJLGRHMEFMPPI-UHFFFAOYSA-N 0.000 description 1
- RHPVVNRNAHRJOQ-UHFFFAOYSA-N 4-methyl-n-(4-methylphenyl)aniline Chemical compound C1=CC(C)=CC=C1NC1=CC=C(C)C=C1 RHPVVNRNAHRJOQ-UHFFFAOYSA-N 0.000 description 1
- VCZNNAKNUVJVGX-UHFFFAOYSA-N 4-methylbenzonitrile Chemical compound CC1=CC=C(C#N)C=C1 VCZNNAKNUVJVGX-UHFFFAOYSA-N 0.000 description 1
- OPEKHRGERHDLRK-UHFFFAOYSA-N 4-tert-butyl-n-(4-tert-butylphenyl)aniline Chemical compound C1=CC(C(C)(C)C)=CC=C1NC1=CC=C(C(C)(C)C)C=C1 OPEKHRGERHDLRK-UHFFFAOYSA-N 0.000 description 1
- UOMXLEWVJZEVGP-UHFFFAOYSA-N 4-tert-butyl-n-phenylaniline Chemical compound C1=CC(C(C)(C)C)=CC=C1NC1=CC=CC=C1 UOMXLEWVJZEVGP-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- WGZBYYLJAZSHSC-UHFFFAOYSA-N 5,11-dimethyl-3-n,3-n,9-n,9-n-tetraphenylindolo[3,2-b]carbazole-3,9-diamine Chemical compound C=1C=C2C=3C=C4N(C)C5=CC(N(C=6C=CC=CC=6)C=6C=CC=CC=6)=CC=C5C4=CC=3N(C)C2=CC=1N(C=1C=CC=CC=1)C1=CC=CC=C1 WGZBYYLJAZSHSC-UHFFFAOYSA-N 0.000 description 1
- IGDNJMOBPOHHRN-UHFFFAOYSA-N 5h-benzo[b]phosphindole Chemical compound C1=CC=C2C3=CC=CC=C3PC2=C1 IGDNJMOBPOHHRN-UHFFFAOYSA-N 0.000 description 1
- QBBPWJMJLXOORS-UHFFFAOYSA-N 6,12-dihydroindeno[1,2-b]fluorene Chemical compound C1C2=CC=CC=C2C2=C1C=C1C3=CC=CC=C3CC1=C2 QBBPWJMJLXOORS-UHFFFAOYSA-N 0.000 description 1
- SNFCXVRWFNAHQX-UHFFFAOYSA-N 9,9'-spirobi[fluorene] Chemical compound C12=CC=CC=C2C2=CC=CC=C2C21C1=CC=CC=C1C1=CC=CC=C21 SNFCXVRWFNAHQX-UHFFFAOYSA-N 0.000 description 1
- BPMFPOGUJAAYHL-UHFFFAOYSA-N 9H-Pyrido[2,3-b]indole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=N1 BPMFPOGUJAAYHL-UHFFFAOYSA-N 0.000 description 1
- 239000005964 Acibenzolar-S-methyl Substances 0.000 description 1
- FMMWHPNWAFZXNH-UHFFFAOYSA-N Benz[a]pyrene Chemical compound C1=C2C3=CC=CC=C3C=C(C=C3)C2=C2C3=CC=CC2=C1 FMMWHPNWAFZXNH-UHFFFAOYSA-N 0.000 description 1
- GOGQUNAJVLKMNN-UHFFFAOYSA-N CC(C)(c1c2)c3cc(-c(c(C4(C)C)c5)ccc5Br)c4cc3-c1cc(C(C)(C)c1c3)c2-c1ccc3Br Chemical compound CC(C)(c1c2)c3cc(-c(c(C4(C)C)c5)ccc5Br)c4cc3-c1cc(C(C)(C)c1c3)c2-c1ccc3Br GOGQUNAJVLKMNN-UHFFFAOYSA-N 0.000 description 1
- YZRUFIYYONQMOO-UHFFFAOYSA-N C[n]1c2cc(N3c(cccc4)c4Sc4c3cccc4)ccc2c2c1cc(c(c([n]1C)c3)ccc3N3c(cccc4)c4Sc4ccccc34)c1c2 Chemical compound C[n]1c2cc(N3c(cccc4)c4Sc4c3cccc4)ccc2c2c1cc(c(c([n]1C)c3)ccc3N3c(cccc4)c4Sc4ccccc34)c1c2 YZRUFIYYONQMOO-UHFFFAOYSA-N 0.000 description 1
- 101000801643 Homo sapiens Retinal-specific phospholipid-transporting ATPase ABCA4 Proteins 0.000 description 1
- 229910021578 Iron(III) chloride Inorganic materials 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- KYBOEDMIEOXWOO-UHFFFAOYSA-N O=C(C1C=CC=CC11)c(cc2-c3ccccc33)c1cc2C3=O Chemical compound O=C(C1C=CC=CC11)c(cc2-c3ccccc33)c1cc2C3=O KYBOEDMIEOXWOO-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- FENIOIAMLQKKEL-UHFFFAOYSA-N P.C1=C2C=C3C(=CC=C4C=5C=CC=CC5C=C34)C2=CC=C1 Chemical class P.C1=C2C=C3C(=CC=C4C=5C=CC=CC5C=C34)C2=CC=C1 FENIOIAMLQKKEL-UHFFFAOYSA-N 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102100033617 Retinal-specific phospholipid-transporting ATPase ABCA4 Human genes 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- XBDYBAVJXHJMNQ-UHFFFAOYSA-N Tetrahydroanthracene Natural products C1=CC=C2C=C(CCCC3)C3=CC2=C1 XBDYBAVJXHJMNQ-UHFFFAOYSA-N 0.000 description 1
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical compound C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- IVFLQBRNWIUEFU-UHFFFAOYSA-N [O-][N+](c(cc1C2)ccc1-c(cc1Cc3c4)c2cc1-c3ccc4[N+]([O-])=O)=O Chemical compound [O-][N+](c(cc1C2)ccc1-c(cc1Cc3c4)c2cc1-c3ccc4[N+]([O-])=O)=O IVFLQBRNWIUEFU-UHFFFAOYSA-N 0.000 description 1
- BYNPVFHVZRNRQD-UHFFFAOYSA-N acetic acid;benzene Chemical compound CC(O)=O.C1=CC=CC=C1 BYNPVFHVZRNRQD-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 238000010719 annulation reaction Methods 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- WMUIZUWOEIQJEH-UHFFFAOYSA-N benzo[e][1,3]benzoxazole Chemical compound C1=CC=C2C(N=CO3)=C3C=CC2=C1 WMUIZUWOEIQJEH-UHFFFAOYSA-N 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 239000012455 biphasic mixture Substances 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 150000004074 biphenyls Chemical class 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 239000012159 carrier gas Substances 0.000 description 1
- XGRJZXREYAXTGV-UHFFFAOYSA-N chlorodiphenylphosphine Chemical compound C=1C=CC=CC=1P(Cl)C1=CC=CC=C1 XGRJZXREYAXTGV-UHFFFAOYSA-N 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 150000001987 diarylethers Chemical class 0.000 description 1
- IMDXZWRLUZPMDH-UHFFFAOYSA-N dichlorophenylphosphine Chemical compound ClP(Cl)C1=CC=CC=C1 IMDXZWRLUZPMDH-UHFFFAOYSA-N 0.000 description 1
- XXPBFNVKTVJZKF-UHFFFAOYSA-N dihydrophenanthrene Natural products C1=CC=C2CCC3=CC=CC=C3C2=C1 XXPBFNVKTVJZKF-UHFFFAOYSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 150000002220 fluorenes Chemical class 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 150000002367 halogens Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 235000010299 hexamethylene tetramine Nutrition 0.000 description 1
- VKYKSIONXSXAKP-UHFFFAOYSA-N hexamethylenetetramine Chemical class C1N(C2)CN3CN1CN2C3 VKYKSIONXSXAKP-UHFFFAOYSA-N 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 1
- VVVPGLRKXQSQSZ-UHFFFAOYSA-N indolo[3,2-c]carbazole Chemical class C1=CC=CC2=NC3=C4C5=CC=CC=C5N=C4C=CC3=C21 VVVPGLRKXQSQSZ-UHFFFAOYSA-N 0.000 description 1
- 150000002503 iridium Chemical class 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 238000006138 lithiation reaction Methods 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- FGGAOQTXQHKQOW-UHFFFAOYSA-N n,n-diphenylnaphthalen-1-amine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=CC=C1 FGGAOQTXQHKQOW-UHFFFAOYSA-N 0.000 description 1
- VWYDYNGPYMOCMD-UHFFFAOYSA-N n,n-diphenylnaphthalen-2-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C=CC=CC2=CC=1)C1=CC=CC=C1 VWYDYNGPYMOCMD-UHFFFAOYSA-N 0.000 description 1
- ADUFDSSCDCLUFT-UHFFFAOYSA-N n-[4-(4-aminophenyl)phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC(N)=CC=C1C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 ADUFDSSCDCLUFT-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000006396 nitration reaction Methods 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 238000007645 offset printing Methods 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- AUONHKJOIZSQGR-UHFFFAOYSA-N oxophosphane Chemical compound P=O AUONHKJOIZSQGR-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 1
- 229950000688 phenothiazine Drugs 0.000 description 1
- 150000003003 phosphines Chemical class 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- 238000006798 ring closing metathesis reaction Methods 0.000 description 1
- 238000002390 rotary evaporation Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000005092 sublimation method Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 150000001911 terphenyls Chemical class 0.000 description 1
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 1
- AGGKEGLBGGJEBZ-UHFFFAOYSA-N tetramethylenedisulfotetramine Chemical compound C1N(S2(=O)=O)CN3S(=O)(=O)N1CN2C3 AGGKEGLBGGJEBZ-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 238000001931 thermography Methods 0.000 description 1
- 238000010023 transfer printing Methods 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- ODHXBMXNKOYIBV-UHFFFAOYSA-N triphenylamine Chemical compound C1=CC=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 ODHXBMXNKOYIBV-UHFFFAOYSA-N 0.000 description 1
- 238000002061 vacuum sublimation Methods 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- 238000001947 vapour-phase growth Methods 0.000 description 1
- 238000010792 warming Methods 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C13/00—Cyclic hydrocarbons containing rings other than, or in addition to, six-membered aromatic rings
- C07C13/28—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof
- C07C13/32—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof with condensed rings
- C07C13/62—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof with condensed rings with more than three condensed rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C13/00—Cyclic hydrocarbons containing rings other than, or in addition to, six-membered aromatic rings
- C07C13/28—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof
- C07C13/32—Polycyclic hydrocarbons or acyclic hydrocarbon derivatives thereof with condensed rings
- C07C13/72—Spiro hydrocarbons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C17/00—Preparation of halogenated hydrocarbons
- C07C17/093—Preparation of halogenated hydrocarbons by replacement by halogens
- C07C17/10—Preparation of halogenated hydrocarbons by replacement by halogens of hydrogen atoms
- C07C17/12—Preparation of halogenated hydrocarbons by replacement by halogens of hydrogen atoms in the ring of aromatic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C17/00—Preparation of halogenated hydrocarbons
- C07C17/26—Preparation of halogenated hydrocarbons by reactions involving an increase in the number of carbon atoms in the skeleton
- C07C17/263—Preparation of halogenated hydrocarbons by reactions involving an increase in the number of carbon atoms in the skeleton by condensation reactions
- C07C17/2632—Preparation of halogenated hydrocarbons by reactions involving an increase in the number of carbon atoms in the skeleton by condensation reactions involving an organo-magnesium compound, e.g. Grignard synthesis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C205/00—Compounds containing nitro groups bound to a carbon skeleton
- C07C205/06—Compounds containing nitro groups bound to a carbon skeleton having nitro groups bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/43—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
- C07C211/57—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton
- C07C211/61—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton with at least one of the condensed ring systems formed by three or more rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/61—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups
- C07C45/63—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups by introduction of halogen; by substitution of halogen atoms by other halogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/587—Unsaturated compounds containing a keto groups being part of a ring
- C07C49/687—Unsaturated compounds containing a keto groups being part of a ring containing halogen
- C07C49/697—Unsaturated compounds containing a keto groups being part of a ring containing halogen containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/76—Ketones containing a keto group bound to a six-membered aromatic ring
- C07C49/782—Ketones containing a keto group bound to a six-membered aromatic ring polycyclic
- C07C49/792—Ketones containing a keto group bound to a six-membered aromatic ring polycyclic containing rings other than six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/76—Ketones containing a keto group bound to a six-membered aromatic ring
- C07C49/80—Ketones containing a keto group bound to a six-membered aromatic ring containing halogen
- C07C49/813—Ketones containing a keto group bound to a six-membered aromatic ring containing halogen polycyclic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/56—Ring systems containing three or more rings
- C07D209/80—[b, c]- or [b, d]-condensed
- C07D209/82—Carbazoles; Hydrogenated carbazoles
- C07D209/88—Carbazoles; Hydrogenated carbazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
- C07D215/42—Nitrogen atoms attached in position 4
- C07D215/44—Nitrogen atoms attached in position 4 with aryl radicals attached to said nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D279/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one sulfur atom as the only ring hetero atoms
- C07D279/10—1,4-Thiazines; Hydrogenated 1,4-thiazines
- C07D279/14—1,4-Thiazines; Hydrogenated 1,4-thiazines condensed with carbocyclic rings or ring systems
- C07D279/18—[b, e]-condensed with two six-membered rings
- C07D279/22—[b, e]-condensed with two six-membered rings with carbon atoms directly attached to the ring nitrogen atom
- C07D279/24—[b, e]-condensed with two six-membered rings with carbon atoms directly attached to the ring nitrogen atom with hydrocarbon radicals, substituted by amino radicals, attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/91—Dibenzofurans; Hydrogenated dibenzofurans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/94—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom spiro-condensed with carbocyclic rings or ring systems, e.g. griseofulvins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/78—Ring systems having three or more relevant rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/96—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings spiro-condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/04—1,3-Dioxanes; Hydrogenated 1,3-dioxanes
- C07D319/08—1,3-Dioxanes; Hydrogenated 1,3-dioxanes condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D321/00—Heterocyclic compounds containing rings having two oxygen atoms as the only ring hetero atoms, not provided for by groups C07D317/00 - C07D319/00
- C07D321/02—Seven-membered rings
- C07D321/10—Seven-membered rings condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/50—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/50—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D333/76—Dibenzothiophenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D493/00—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system
- C07D493/02—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system in which the condensed system contains two hetero rings
- C07D493/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic Table
- C07F5/02—Boron compounds
- C07F5/027—Organoboranes and organoborohydrides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/50—Organo-phosphines
- C07F9/5027—Polyphosphines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/50—Organo-phosphines
- C07F9/53—Organo-phosphine oxides; Organo-phosphine thioxides
- C07F9/5325—Aromatic phosphine oxides or thioxides (P-C aromatic linkage)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/50—Organo-phosphines
- C07F9/53—Organo-phosphine oxides; Organo-phosphine thioxides
- C07F9/5329—Polyphosphine oxides or thioxides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6564—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms
- C07F9/6568—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus atoms as the only ring hetero atoms
- C07F9/65685—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus atoms as the only ring hetero atoms the ring phosphorus atom being part of a phosphine oxide or thioxide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6564—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms
- C07F9/6571—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus and oxygen atoms as the only ring hetero atoms
- C07F9/657163—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom having phosphorus atoms, with or without nitrogen, oxygen, sulfur, selenium or tellurium atoms, as ring hetero atoms having phosphorus and oxygen atoms as the only ring hetero atoms the ring phosphorus atom being bound to at least one carbon atom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
- H10K50/15—Hole transporting layers
- H10K50/155—Hole transporting layers comprising dopants
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/17—Carrier injection layers
- H10K50/171—Electron injection layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K71/00—Manufacture or treatment specially adapted for the organic devices covered by this subclass
- H10K71/30—Doping active layers, e.g. electron transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/623—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing five rings, e.g. pentacene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/624—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing six or more rings
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/636—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising heteroaromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6574—Polycyclic condensed heteroaromatic hydrocarbons comprising only oxygen in the heteroaromatic polycondensed ring system, e.g. cumarine dyes
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6576—Polycyclic condensed heteroaromatic hydrocarbons comprising only sulfur in the heteroaromatic polycondensed ring system, e.g. benzothiophene
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/02—Ortho- or ortho- and peri-condensed systems
- C07C2603/54—Ortho- or ortho- and peri-condensed systems containing more than five condensed rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/56—Ring systems containing bridged rings
- C07C2603/90—Ring systems containing bridged rings containing more than four rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1033—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1037—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with sulfur
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1096—Heterocyclic compounds characterised by ligands containing other heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/18—Metal complexes
- C09K2211/185—Metal complexes of the platinum group, i.e. Os, Ir, Pt, Ru, Rh or Pd
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/125—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers specially adapted for multicolour light emission, e.g. for emitting white light
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/324—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising aluminium, e.g. Alq3
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/341—Transition metal complexes, e.g. Ru(II)polypyridine complexes
- H10K85/342—Transition metal complexes, e.g. Ru(II)polypyridine complexes comprising iridium
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/622—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing four rings, e.g. pyrene
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P70/00—Climate change mitigation technologies in the production process for final industrial or consumer products
- Y02P70/50—Manufacturing or production processes characterised by the final manufactured product
Definitions
- the present invention describes novel compounds and their use in organic electronic devices.
- the operating voltage is quite high, especially with fluorescent OLEDs, and should therefore be further reduced to improve power efficiency. This is especially important for mobile applications.
- organic electroluminescent devices which contain certain compounds listed below as blue-emitting dopants in a host material, have significant improvements over the prior art. With these materials it is possible to obtain longer lifetimes with higher efficiency. In addition, unlike prior art materials, these compounds can also be sublimated in significant quantities without appreciable decomposition, and are therefore much easier to handle than prior art materials.
- Ar 1 , Ar 2 , Ar 3 is the same or different at each occurrence and is an aryl or heteroaryl group having 5 to 24 aromatic ring atoms, which may be substituted by one or more R 1 ;
- Ar 4 , Ar 5 , Ar 6 , Ar 7 is identical or different at each occurrence and is an aromatic or heteroaromatic ring system having 5 to 40 aromatic ring atoms, which may be substituted by one or more radicals R 1 ;
- R 2 is the same or different at each occurrence, H or an aliphatic or aromatic hydrocarbon radical having 1 to 20 carbon atoms;
- q, r is 1 for each occurrence, if the corresponding central atom of the group Y or Z is an element of the 5th main group, and is 0 for each occurrence, if the corresponding central atom of the group Y or Z is an element of the 4th or 6th main group;
- s is 1, 2 or 3;
- An aryl group or a heteroaryl group in the context of this invention is understood as meaning an aromatic group or heteroaromatic group having a common aromatic electron system, where an aryl group has 6 to 24 C atoms and a heteroaryl group has 2 to 24 C atoms and a total of at least 5 aromatic ring atoms includes.
- the heteroatoms are preferably selected from N, O and / or S.
- this may be a simple homo- or heterocycle, for example benzene, pyridine, thiophene, etc., or it may be a fused aromatic ring system which at least two aromatic or heteroaromatic rings, for example benzene rings, are "fused" together, ie fused together by annulation, ie have at least one common edge and thus also a common aromatic system
- systems such as naphthalene, anthracene, phenanthrene, pyrene, etc. as aryl groups and quinoline, acridine, benzothiophene, carbazole, etc. are to be seen as heteroaryl groups in the context of this invention, while, for example, biphenyl, fluorene, spirobifluorene, etc. are not aryl groups, since these are separate aromatic electron systems.
- An aromatic ring system in the sense of this invention contains 6 to 40 carbon atoms in the ring system.
- a heteroaromatic ring system in the sense of this invention contains 2 to 40 C atoms and at least one heteroatom in the ring system, with the proviso that the sum of the C atoms and heteroatoms gives at least 5.
- the heteroatoms are preferably selected from N, O and / or S.
- An aromatic or heteroaromatic ring system in the sense of this invention is to be understood as meaning a system which does not necessarily contain only aryl or heteroaryl groups, but in which several aryls are also present - or heteroaryl groups by a short, non-aromatic unit (less than 10% of the atoms other than H, preferably less than 5% of the atoms other than H), such as.
- a C, N or O atom can be interrupted.
- systems such as 9,9'-spirobifluorene, 9,9-diarylfluorene, triarylamine, diaryl ethers, etc. are also to be understood as aromatic ring systems in the context of this invention.
- a C 1 - to C 40 -alkyl group in which individual H atoms or C 1 -C 4 groups may also be substituted by the abovementioned groups, particularly preferably the radicals methyl, ethyl, n-propyl, i Propyl, n-butyl, i-butyl, s-butyl, t-butyl, 2-methylbutyl, n-pentyl, s -pentyl, cyclopentyl, n -hexyl, cyclohexyl, n -heptyl, cycloheptyl, n-octyl, cyclooctyl , 2-ethylhexyl, trifluoromethyl, pentafluoroethyl, 2,2,2-trifluoroethyl, ethenyl, propenyl, butenyl, pentenyl, cyclopen
- a C 1 to C 40 alkoxy group is more preferably understood as meaning methoxy, ethoxy, n-propoxy, isopropoxy, n-butoxy, isobutoxy, s-butoxy, t-butoxy or 2-methylbutoxy.
- aryl or heteroaryl group which may be monovalent or bivalent depending on the use, which may be substituted in each case with the abovementioned radicals R 1 and which may be linked via any position on the aromatic or heteroaromatic, are especially groups which are derived from benzene, naphthalene, anthracene, phenanthrene, pyrene, dihydropyrene, chrysene, perylene, fluoranthene, tetracene, pentacene, benzpyrene, furan, benzofuran, isobenzofuran, dibenzofuran, thiophene, benzothiophene, isobenzothiophene, dibenzothiophene, pyrrole, Indole, isoindole, carbazole, pyridine, quinoline, isoquinoline, acridine, phenanthridine, benzo-5,6-quinoline, benzo
- aromatic and heteroaromatic ring systems are understood to mean in particular biphenyls, terphenyls, fluorene, spirobifluorene, dihydrophenanthrene, tetrahydropyrenes and cis- or trans-indenofluorene, in addition to the abovementioned aryl and heteroaryl groups.
- the direct link between Y, Ar 1 , Ar 2 , Ar 3 and Z is particularly preferably via the para-positions of the benzene (or the corresponding positions of the other aromatics).
- Ar 4 , Ar 5 , Ar 6 and Ar 7 are identical or different at each occurrence of phenyl, 1-naphthyl or 2-naphthyl, which may each be substituted by one or two radicals R 1 .
- R 1 is identical or different at each occurrence for H, F, CN, a straight-chain alkyl group having 1 to 5 C atoms or a branched alkyl group having 3 to 5 C
- radicals R 1 may be, or a monovalent aryl or heteroaryl group having 5 to 16 aromatic ring atoms which may be substituted with one or more non-aromatic radicals R 1 ; it is also possible for two radicals R 1 to form a ring system with one another.
- radicals R 1 are selected from straight-chain alkyl groups having 1 to 4 C atoms or branched alkyl groups having 3 or 4 C atoms, in particular methyl groups, or phenyl groups; In this case, two or more radicals R 1 together form a ring system.
- radicals R 1 together form a ring system, a spiro-structure is thereby formed. This may be particularly preferred when the radicals R 1 are phenyl groups. This then results in structures of the general formula (1e),
- Examples of preferred compounds according to formula (1) are the structures (1) to (104) depicted below.
- Another object of the invention are thus conjugated, partially conjugated and non-conjugated polymers, oligomers or dendrimers containing one or more compounds of formula (1), wherein one or more radicals R 1 represent bonds of the compound of formula (1) to the polymer or dendrimer.
- the unit according to formula (1) is preferably bonded via the groups Ar 4 , Ar 5 , Ar 6 and / or Ar 7 into the polymer.
- These polymers may contain additional repeat units. These further repeating units are preferably selected from the group consisting of fluorenes (for example according to EP 842208 or WO 00/22026), spirobifluorenes (for example according to EP 707020, EP 894107 or EP 04028865.6), triarylamines, para-phenylenes (for example in accordance with WO 92/18552), carbazoles (for example according to WO 04/070772 and WO 04/113468), thiophenes (for example according to EP 1028136), dihydrophenanthrenes (for example according to US Pat WO 05/014689), indenofluorenes (for example according to WO 04/041901 and WO 04/113412), aromatic ketones (for example according to WO 05/040302), phenanthrenes (for example according to WO 05/104264) and / or metal complexes, in particular ortho-metallated iridium complexes. It
- the compounds of the invention can according to the expert known synthesis steps, such as. Bromination, Suzuki coupling,
- the indenofluorene precursors can be prepared as depicted in Synthetic Scheme 1: by Suzuki coupling of a benzoic boronic acid and 1,4-dibromo-2,5-bis (methylcarboxylate) benzene followed by ring closure on exposure to a strong acid and reduction the unsubstituted trans indenofluorene, which can be alkylated with alkylating agents. This can either be halogenated, for example brominated, or be converted by nitration and reduction into the corresponding amino compound.
- the synthesis of bis-diarylamino-indenofluorenes can be accomplished by Hartwig-Buchwald coupling of the dibromo compound as shown in Synthetic Scheme 2.
- Analogously convertible electrophiles AsCl 3 , SbCl 3 , BiCl 3 , ArylPCI, Aryl 2 PCI, SCI 2 , SOCl 2 , SO 2 Cl 2 ,
- the compounds according to formula (1) can be used in organic electroluminescent devices.
- the exact use of the compounds depends on the substituents and in particular on the choice of the groups Y and Z, but also on the choice of the groups X 1 to X 4 .
- the compound according to formula (1) is used in the emitting layer, preferably used in admixture with at least one further compound. It is preferable that the compound of the formula (1) in the mixture is the emitting compound (the dopant). This is especially true when the symbols Y and Z are nitrogen.
- Preferred host materials are organic compounds whose emission is shorter than that of the compound of formula (1) or which do not emit at all.
- the proportion of the compound of formula (1) in the mixture of the emitting layer is between 0.1 and 99.0 wt.%, Preferably between 0.5 and 50.0 wt.%, Particularly preferably between 1.0 and 20.0 wt.%, In particular between 1.0 and 10.0 wt. %. Accordingly, the proportion of host material in the layer is between 1.0 and 99.9 % By weight, preferably between 50.0 and 99.5% by weight, more preferably between 80.0 and 99.0% by weight, in particular between 90.0 and 99.0% by weight.
- Preferred host materials are selected from the classes of the oligo- arylenes (eg 2,2 ', 7,7'-tetraphenyl-spirobifluorene according to EP 676461 or dinaphthylanthracene), in particular the oligo-arylenes containing condensed aromatic groups, the oligo-arylenevinylenes (eg DPVBi or spiro-DPVBi according to EP 676461), the polypodal metal complexes (eg according to WO 04/081017), the hole-conducting compounds (eg according to WO 04/058911), the electron-conducting compounds, in particular Ketones, phosphine oxides, sulfoxides, etc. (eg according to WO 05/084081 or WO 05/084082), the atropisomers (eg according to the unpublished application EP 04026402.0) or the boronic acid derivatives (e.g.,
- Particularly preferred host materials are selected from the classes of the oligoarylenes containing naphthalene, anthracene and / or pyrene or atropisomers of these compounds, the oligo- arylenvinylene, the ketones, the phosphine oxides and the sulfoxides.
- Very particularly preferred host materials are selected from the classes of oligoarylenes containing anthracene and / or pyrene or atropisomers of these compounds, the phosphine oxides and the sulfoxides.
- the compounds according to formula (1) are used as hole transport material and / or as hole injection material. This is especially true when the symbols Y and Z and / or the symbols X 1 to X 4 are nitrogen.
- the compounds are then preferably used in a hole transport layer and / or in a hole injection layer.
- a hole injection layer in the sense of this invention is a layer which is directly adjacent to the anode.
- a hole transport layer in the sense of this invention is a layer that lies between the hole injection layer and the emission layer.
- the compounds according to formula (1) are used as hole-transporting or hole-injecting material, it may be preferable if they are doped with electron-accepting compounds, for example with F 4 -TCNQ or with compounds as described in EP 1476881 or EP 1596445.
- the compound according to formula (1) is used as hole transport material in a hole transport layer, a proportion of 100% may also be preferred, ie the use of this compound as a pure material.
- compounds of the formula (1) can be employed either as an emissive unit and / or as a hole-transporting unit and / or as an electron-transporting unit.
- organic electroluminescent devices characterized in that a plurality of emitting compounds are used in the same layer or in different layers, wherein at least one of these compounds has a structure according to formula (1). More preferably, these compounds have a total of several emission maxima between 380 nm and 750 nm, so that overall white emission results, d. H.
- at least one further emitting compound which can fluoresce or phosphoresce and which emits yellow, orange or red light is also used.
- broadband emitters can be used for white emitting OLEDs.
- the organic electroluminescent device may contain further layers. These may be, for example: hole injection layer, hole transport layer, hole blocking layer, electron transport layer, electron injection layer and / or a charge generation layer (T.Matsumoto et al., Multiphoton Organic EL Device Having Charge Generation Layer, IDMC 2003, Taiwan, Session 21 OLED (5)) , However, it should be noted at this point that not necessarily each of these layers must be present. Thus, particularly when using compounds according to formula (1) with electron-conducting host materials, very good results continue to be obtained if the organic electroluminescent device does not contain a separate electron transport layer and the emitting layer directly adjoins the electron injection layer or the cathode.
- the host material can also simultaneously serve as an electron transport material in an electron transport layer. It may likewise be preferred if the organic electroluminescent device does not contain a separate hole transport layer and the emitting layer directly adjoins the hole injection layer or the anode. Furthermore, it may be preferred if the compound of formula (1) is used simultaneously as a dopant in the emitting layer and as a hole-conducting compound (as a pure substance or as a mixture) in a hole transport layer and / or in a hole injection layer.
- an organic electroluminescent device characterized in that one or more layers are coated with a sublimation process.
- the materials are vacuum sublimation mbar, preferably less than 10 "6 mbar, particularly preferably less than 10" -7 mbar at a pressure below 10 -5 jn.
- organic electroluminescent device characterized in that one or more layers with the
- OVPD Organic Vapor Phase Deposition
- carrier gas sublimation a carrier gas sublimation
- the materials are applied at a pressure between 10 ⁇ 5 mbar and 1 bar.
- an organic electroluminescent device characterized in that one or more layers of solution, such. B. by spin coating, or with any printing process, such.
- screen printing flexographic printing or offset printing, but more preferably LITI (Light Induced Thermal Imaging, thermal transfer printing) or inkjet printing (inkjet printing), are produced. For this are soluble
- the compounds according to the invention When used in organic electroluminescent devices, the compounds according to the invention have the following surprising advantages over the prior art:
- the compounds can be sublimated well and without significant decomposition, thereby being easier to process and therefore more suitable for use in OLEDs than prior art materials. Without wishing to be bound by any particular theory, we suspect that the higher thermal stability is due to the absence of olefinic double bonds. In the present application text and also in the examples below, the use of the compounds according to the invention with respect to OLEDs and the corresponding displays is aimed at. Despite this limitation of the description, it is possible for the skilled person without further inventive step to use the compounds of the invention for other uses in other electronic devices, such.
- O-FETs organic field effect transistors
- O-TFTs organic thin-film transistors
- O-LETs organic light-emitting transistors
- O-ICs organic integrated circuits
- O-SCs organic solar cells
- O-FQDs organic FeId quench devices
- LOCs light-emitting electrochemical cells
- O-lasers organic laser diodes
- the starting materials can be obtained from the companies ALDRICH or ABCR (palladium (II) acetate, di-tert-butyl-chlorophosphine, amines, inorganics, solvents).
- ALDRICH or ABCR palladium (II) acetate, di-tert-butyl-chlorophosphine, amines, inorganics, solvents.
- 6,12-Dihydro- [1,2b] indenofluorene is prepared according to Hadizad et al., Org. Lett. 2005, 7 (5), 795-797
- [1, 2b] indenofluorene-6,12-dione is prepared according to Deuschel et al., HeIv. Chim.
- the preparation is analogous to the preparation of 9,9-dimethylfluorene from 6,12-dihydro-indeno [1, 2b] fluorene, dimethyl sulfate and sodium hydroxide solution according to JP 08113542. Yield 86.0% d. Th .; Purity 98% n. 1 H-NMR.
- EXAMPLE 46 Production of OLEDs with Indenofluorene Diamines as Hole Injection Material or Hole Transport Material in Fluorescent OLEDs
- OLEDs are produced by a general process according to WO 04/058911, which in individual cases depends on the respective conditions (eg layer thickness variation, for optimum efficiency or to achieve color) is adjusted.
- HIL Hole Injection Layer 20 nm PEDOT (spun from water, supplied by H.C.
- HTM1 Hole transport layer (HTM1) B2 (compound according to Example 2) or B1 (compound according to Example 1) or B9 (compound according to Example 9) or B15 (compound according to Example 15) or B37 (Compound according to Example 37) or: as Comparative Example 4.4 ', 4 "-Tris (N-1-naphthyl-N-phenylamino) -triphenylamine
- HTM2 Hole transport layer 20 nm NPB (N-naphthyl-N-phenyl-4,4'-diaminobiphenyl)
- the OLEDs can also be produced without PEDOT as hole injection layer. In these cases, then the inventive
- Indenofluorene-diamine derivative the hole injection compound. These OLEDs show comparably good properties.
- OLEDs are characterized by default; for this the electroluminescence spectra, the efficiency (measured in cd / A) and the Power efficiency (measured in Im / W) as a function of the brightness, calculated from the current-voltage-brightness characteristics (lUL characteristics).
- Table 1 summarizes the results of some OLEDs (Examples 47 to 62) in which the layer thickness of the hole transport layer (HTM1) is varied.
- HTM1 hole transport layer
- NaphDATA is used in Comparative Examples.
- the host material H1 is 9,10-bis (1-naphthyl) anthracene, D1 is used as the dopant. Both are shown below:
- OLEDs containing the hole transport material (HTM1) according to the invention show a significantly lower operating voltage than with naphDATA according to the prior art as hole transport material. Furthermore, the operating voltage is independent of the layer thickness of the hole transport layer. This property is of great advantage for the construction of full-color displays, since the thickness of the pixels of the primary colors blue, green and red can be made the same by varying the layer thickness of the hole-transport layer.
- the hole transport material according to the invention can therefore serve here as a thickness compensation layer without adversely affecting the electrooptical properties of the device. As can be seen from the comparative examples, this is for hole transport material (NaphDATA) according to the prior art Technology not the case: Here, with a larger layer thickness of the hole transport layer, a significantly higher operating voltage is required.
- OLEDs takes place according to a general method according to WO 04/093207, which in individual cases is adapted to the respective conditions (eg layer thickness variation in order to achieve optimum efficiency or color).
- HIL Hole Injection Layer 20 nm PEDOT (spin-on from water, supplied by H.C. Starck, Goslar, Germany; poly (3,4-ethylenedioxy-2,5-thiophene))
- Hole transport layer (HTM1) B2 compound according to Example 2 or: as Comparative Example 4,4 ', 4 "-Tris (N-1-naphthyl-N-phenylamino) -triphenylamine
- HTM2 Hole transport layer 20 nm (evaporated, S-TAD prepared according to WO99 / 12888, 2,2 ', 7 ) 7 I tetrakis
- Emission layer 40 nm Ketone-1 (bis (9,9'-spirobifluorene-2-yl) ketone (evaporated, synthesized acc
- the OLEDs can also be produced without PEDOT as hole injection layer.
- the inventive indenofluorene-diamine derivative is the hole injection compound.
- OLEDs are characterized by default; For this purpose, the electroluminescence spectra, the efficiency (measured in cd / A) and the power efficiency (measured in Im / W) as a function of the brightness, calculated from current-voltage-brightness characteristics (IUL characteristics) are determined.
- Table 2 summarizes the results of some OLEDs (Examples 64 to 68) in which the layer thickness of the hole transport layer (HTM1) is varied.
- HTM1 hole transport layer
- NaphDATA is used in Comparative Examples.
- OLEDs containing the hole transport material (HTM1) according to the invention show a significantly lower operating voltage and a higher efficiency than with naphDATA according to the prior art as hole transport material. Furthermore, the operating voltage is independent of the layer thickness of the hole transport layer.
- the hole transport material according to the invention can thus serve here as a thickness compensation layer without adversely affecting the electrooptical properties of the device.
- Example 69 Preparation of OLEDs with Indenofluorenketonen or Indenofluorenphosphinoxiden as an electron transport material in phosphorescent OLEDs
- OLEDs takes place according to a general method according to WO 04/093207, which in individual cases is adapted to the respective conditions (eg layer thickness variation in order to achieve optimum efficiency or color).
- HIL Hole injection layer 20 nm PEDOT (spun from water, referred to by HC Starck, Goslar, Germany; Poly (3,4-ethylenedioxy-2,5-thiophene))
- Hole Transport Layer (HTM1) 20nm 4,4 ', 4 "-tris (N-1-naphthyl-N-phenylamino) -triphenylamine (abbreviated as NaphDATA purchased from SynTec)
- Hole Transport Layer (HTM2) 20nm S-TAD (evaporated; -TAD prepared according to WO99 / 12888; 2,2 ', 7, T-tetrakis (diphenylamino) -spirobifluorene)
- Emission layer 40 nm ketone-1 (bis (9,9'-spirobifluorene-2-yl) ketone (vapor-deposited, synthesized according to WO 04/093207), doped with 15% triplet
- OLEDs are characterized by default; For this purpose, the electroluminescence spectra, the efficiency (measured in cd / A) and the power efficiency (measured in Im / W) as a function of the brightness, calculated from current-voltage-brightness characteristics (ILJL characteristics) are determined.
- Table 3 summarizes the results of some OLEDs (Examples 70 to 73) in which the electron transport layer (ETL) is varied.
- ETL electron transport layer
- Alq is used in Comparative Examples.
- the emitter E1 and the matrix material ketone-1 are shown in Example 63.
- Example 74 Preparation of red-phosphorescent OLEDs with indenofluoro ketones or indenofluorenephosphine oxides as triplet matrix material
- OLEDs takes place according to a general method according to WO 04/093207, which in individual cases is adapted to the respective conditions (eg layer thickness variation in order to achieve optimum efficiency or color).
- HIL Hole Injection Layer 20 nm PEDOT (spun from water, supplied by H.C.
- HTM1 Hole Transport Layer (HTM1) 20nm 4,4 ', 4 "-tris (N-1-naphthyl-N-phenylamino) -triphenylamine (abbreviated as
- HTM2 Hole transport layer 20 nm S-TAD (vapor-deposited; S-TAD prepared according to WO99 / 12888; 2,2 ', 7, T-tetrakis (diphenylamino) -spirobifluorene)
- Emission layer 20 nm B19 (compound according to Example 26) or 20 nm B26 (compound according to Example 31) or 20 nm B31 (compound according to Example 31) or ketone 1 (bis (9,9'-spirobifluoren-2-yl) ketone ( vapor-deposited, synthesized according to WO 04/093207) (comparison standard), each doped with 10% triplet emitter E2 (synthesized according to WO 05/033244)
- OLEDs Cathode 1 nm LiF, then 150 nm Al. These OLEDs are characterized by default; For this purpose, the electroluminescence spectra, the efficiency (measured in cd / A) and the power efficiency (measured in Im / W) as a function of the brightness, calculated from current-voltage-brightness characteristics (IUL characteristics) are determined.
- Table 4 summarizes the results of some OLEDs (Examples 75 to 78) in which the triplet matrix material of the emission layer (EML) is varied.
- EML emission layer
- ketone-1 is used in Comparative Examples.
- the emitter E1 and the triplet matrix material ketone-1 are shown below for the sake of clarity:
- OLEDs takes place according to a general method according to WO 04/058911, which in individual cases is adapted to the respective circumstances (eg layer thickness variation in order to achieve optimum efficiency or color).
- HIL Hole Injection Layer 20 nm PEDOT (spin-on from water, supplied by H.C. Starck, Goslar, Germany; poly (3,4-ethylenedioxy-2,5-thiophene))
- Hole transport layer (HTM1) 20 nm B2 (compound according to Example 2); Hole transport layer (HTM2) 20 nm NPB (N-naphthyl-N-phenyl-4,4 1 -diaminobiphenyl)
- OLEDs are characterized by default; For this purpose, the electroluminescence spectra, the efficiency (measured in cd / A) and the power efficiency (measured in Im / W) as a function of the brightness, calculated from current-voltage-brightness characteristics (ILJL characteristics) are determined.
- OLEDs containing the dopants B2 according to the invention exhibit efficient deep blue emission.
- B17 compound according to Example 17
- the internal quantum efficiency is close to 100%.
- Example 87 Bis (N- (4-tert-butylphenyl) -N- (4-bromophenyl) amino) -6,6,12,12-tetraocty-1-6,12-dihydroindeno [1, 2b] fluorene
- 6,12, dihydroindeno [1, 2b] fluoren can be used as monomer for the polymerization, for example for the polymerization according to Suzuki or according to Yamamoto.
- This compound is particularly well suited for incorporation in conjugated or partially conjugated polymers and is particularly useful as a hole-conducting compound in these polymers.
- the preparation is carried out analogously to the preparation of 9,9-dimethylfluorene from 12,15-dihydro-6H-diindeno [1, 2-b: 2 ', 1' -h] fluorene (Stauner et ai, Helv Chim Acta, 1970,.. 53 (6), 1311), dimethyl sulfate and sodium hydroxide solution according to JP 08113542. Yield 61.0% of theory Th .; Purity 97% n. 1 H-NMR.
- the reaction mixture is concentrated in vacuo to 200 ml volume, treated with 1000 ml of ethanol, the precipitate is filtered off with suction, stirred with 1000 ml of hot ethanol, filtered off with suction, washed three times with 300 ml of ethanol and dried in vacuo. Yield: 139.0 g (167 mmol), 83.6% of theory. Th .; Purity: 98% n. 1 H-NMR.
- EXAMPLE 91 Production of OLEDs with Indenofluorene Tetramines or Hexamines as Hole Injection Material or Hole Transport Material in Fluorescent OLEDs
- OLEDs are produced by a general process according to WO 04/058911, which in individual cases depends on the respective conditions (eg layer thickness variation to achieve optimum efficiency or color) is adjusted.
- HIL Hole Injection Layer
- PEDOT spun from water, obtained from HC Starck, Goslar, Germany
- HTM2 Hole transport layer 20 nm NPB (N-naphthyl-N-phenyl-4,4 1 -diaminobiphenyl)
- Emission layer 30 nm, doped layer of 9,10-bis (1-naphthylanthracene) as host material (abbreviated H1), doped with 5% Tris [4- (2,2-)] diphenylvinyl) -phenyl] amine as dopant
- the OLEDs can also be produced without PEDOT as hole injection layer. In these cases, the indenofluorene tetramine or hexamine derivative according to the invention is then the hole injection compound. These OLEDs show comparably good properties.
- OLEDs are characterized by default; For this purpose, the electroluminescence spectra, the efficiency (measured in cd / A) and the power efficiency (measured in Im / W) as a function of the brightness, calculated from current-voltage-brightness characteristics (LUL characteristic curves) are determined.
- Table 6 summarizes the results of some OLEDs (Examples 92 to 94) in which the layer thickness of the hole transport layer (HTM1) is varied.
- HTM1 hole transport layer
- NaphDATA is used in Comparative Examples.
- the host material H1 is 9,10-bis (1-naphthyl) anthracene, D1 is used as the dopant. Both are shown below:
- Host H1 Dotand D1 As can be seen from Examples 92 and 93 of the invention in Table 6, OLEDs containing the hole transport material (HTM1) according to the invention show a significantly higher efficiency than with naphDATA according to the prior art as hole transport material. Furthermore, the operating voltage is independent of the layer thickness of the hole transport layer. This property is of great advantage for the construction of full-color displays, since the thickness of the pixels of the primary colors blue, green and red can be made the same by varying the layer thickness of the hole-transport layer.
- the hole transport material according to the invention can therefore serve here as a thickness compensation layer without adversely affecting the electrooptical properties of the device. As can be seen from the comparative examples, this is not the case for hole transport material (NaphDATA) according to the prior art: Here, with a larger layer thickness of the hole transport layer, a significantly higher operating voltage is required.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Molecular Biology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Optics & Photonics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Manufacturing & Machinery (AREA)
- Electroluminescent Light Sources (AREA)
- Indole Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Quinoline Compounds (AREA)
- Nitrogen- Or Sulfur-Containing Heterocyclic Ring Compounds With Rings Of Six Or More Members (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
Description
Claims
Priority Applications (10)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020077029742A KR101346467B1 (ko) | 2005-05-20 | 2006-04-21 | 유기 전자 장치용 화합물 |
| JP2008511579A JP5237090B2 (ja) | 2005-05-20 | 2006-04-21 | 有機電子素子のための化合物 |
| CN200680017539.1A CN101228250B (zh) | 2005-05-20 | 2006-04-21 | 用于有机电子器件的化合物 |
| BRPI0610859-8A BRPI0610859A2 (pt) | 2005-05-20 | 2006-04-21 | compostos para dispositivos eletrÈnicos orgánicos |
| MX2007014449A MX2007014449A (es) | 2005-05-20 | 2006-04-21 | Compuestos para dispositivos electronicos organicos. |
| US11/914,824 US8852756B2 (en) | 2005-05-20 | 2006-04-21 | Materials for organic electroluminescent devices |
| AU2006246743A AU2006246743B2 (en) | 2005-05-20 | 2006-04-21 | Compounds for organic electronic devices |
| CA2608765A CA2608765C (en) | 2005-05-20 | 2006-04-21 | Compounds for organic electronic devices |
| EP06724488.9A EP1883688B1 (de) | 2005-05-20 | 2006-04-21 | Verbindungen für organische elektronische vorrichtungen |
| US14/505,261 US9461249B2 (en) | 2005-05-20 | 2014-10-02 | Compounds for organic electronic devices |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102005023437A DE102005023437A1 (de) | 2005-05-20 | 2005-05-20 | Verbindungen für organische elektronische Vorrichtungen |
| DE102005023437.2 | 2005-05-30 |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US11/914,824 A-371-Of-International US8852756B2 (en) | 2005-05-20 | 2006-04-21 | Materials for organic electroluminescent devices |
| US14/505,261 Continuation US9461249B2 (en) | 2005-05-20 | 2014-10-02 | Compounds for organic electronic devices |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2006122630A1 true WO2006122630A1 (de) | 2006-11-23 |
Family
ID=36658908
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2006/003670 WO2006122630A1 (de) | 2005-05-20 | 2006-04-21 | Verbindungen für organische elektronische vorrichtungen |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US8852756B2 (de) |
| EP (1) | EP1883688B1 (de) |
| JP (1) | JP5237090B2 (de) |
| KR (1) | KR101346467B1 (de) |
| CN (1) | CN101228250B (de) |
| AU (1) | AU2006246743B2 (de) |
| BR (1) | BRPI0610859A2 (de) |
| CA (1) | CA2608765C (de) |
| DE (1) | DE102005023437A1 (de) |
| MX (1) | MX2007014449A (de) |
| RU (1) | RU2419648C2 (de) |
| TW (1) | TWI428424B (de) |
| WO (1) | WO2006122630A1 (de) |
Cited By (326)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008005609A1 (en) * | 2006-04-17 | 2008-01-10 | Battelle Memorial Institute | Organic materials with phosphine sulfide moieties having tunable electric and electroluminescent properties |
| WO2008006449A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2008062636A1 (en) * | 2006-11-24 | 2008-05-29 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescent element using the same |
| JP2008147256A (ja) * | 2006-12-06 | 2008-06-26 | Hiroshima Univ | 電界効果トランジスタ |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2060574A1 (de) | 2007-11-16 | 2009-05-20 | Samsung Mobile Display Co., Ltd. | Heterozyklische Verbindung und organische lichtemittierende Vorrichtung damit |
| WO2009099060A1 (ja) * | 2008-02-04 | 2009-08-13 | Idemitsu Kosan Co., Ltd. | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| DE102008008953A1 (de) | 2008-02-13 | 2009-08-20 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2009190999A (ja) * | 2008-02-13 | 2009-08-27 | Osaka Univ | 縮合環化合物及びその製造方法、重合体、これらを含む有機薄膜、並びに、これを備える有機薄膜素子及び有機薄膜トランジスタ。 |
| JP2009530371A (ja) * | 2006-03-23 | 2009-08-27 | エルジー・ケム・リミテッド | 新規なジアミン誘導体、その製造方法およびそれを用いた有機電気素子 |
| DE102008017591A1 (de) | 2008-04-07 | 2009-10-08 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2009136595A1 (ja) * | 2008-05-08 | 2009-11-12 | 新日鐵化学株式会社 | 有機電界発光素子用化合物及び有機電界発光素子 |
| DE102008024182A1 (de) | 2008-05-19 | 2009-11-26 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtung |
| WO2009145016A1 (ja) | 2008-05-29 | 2009-12-03 | 出光興産株式会社 | 芳香族アミン誘導体及びそれらを用いた有機エレクトロルミネッセンス素子 |
| WO2009148015A1 (ja) | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2009148062A1 (ja) | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | 多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2009148016A1 (ja) | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2010045281A (ja) * | 2008-08-18 | 2010-02-25 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| DE102008045663A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Fluorverbrückte Assoziate für optoelektronische Anwendungen |
| DE102008050841A1 (de) | 2008-10-08 | 2010-04-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008049037A1 (de) | 2008-09-25 | 2010-04-22 | Merck Patent Gmbh | Neue Polymere mit niedriger Polydispersität |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010061824A1 (ja) | 2008-11-25 | 2010-06-03 | 出光興産株式会社 | 芳香族アミン誘導体及び有機エレクトロルミネッセンス素子 |
| DE102008063490A1 (de) | 2008-12-17 | 2010-06-24 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005289A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005290A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2010083869A2 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009009277A1 (de) | 2009-02-17 | 2010-08-19 | Merck Patent Gmbh | Organische elektronische Vorrichtung |
| JP2010528110A (ja) * | 2007-06-05 | 2010-08-19 | エルジー・ケム・リミテッド | 光学異方性化合物及びこれを含む樹脂組成物 |
| WO2010102706A1 (de) | 2009-03-09 | 2010-09-16 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2010108579A1 (de) | 2009-03-23 | 2010-09-30 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102009017064A1 (de) | 2009-04-09 | 2010-10-14 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| US20100295027A1 (en) * | 2009-05-22 | 2010-11-25 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device |
| WO2010136109A1 (de) * | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010149259A2 (en) | 2009-06-22 | 2010-12-29 | Merck Patent Gmbh | Conducting formulation |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011012212A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2011015265A2 (en) | 2009-08-04 | 2011-02-10 | Merck Patent Gmbh | Electronic devices comprising multi cyclic hydrocarbons |
| EP2292618A1 (de) * | 2009-09-04 | 2011-03-09 | Samsung Mobile Display Co., Ltd. | Polycyclische Heteroaryl Verbindungen enthaltenden organische lichtemittierende Vorrichtung |
| DE102009041289A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009042680A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011032686A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Formulierungen zur herstellung von elektronischen vorrichtungen |
| EP2301920A1 (de) * | 2009-09-02 | 2011-03-30 | Samsung Mobile Display Co., Ltd. | Naphthoindol Derivate enthaltende organische lichtemittierende Vorrichtung |
| WO2011035836A1 (de) | 2009-09-23 | 2011-03-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009051172A1 (de) | 2009-10-29 | 2011-05-05 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053191A1 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010136110A3 (de) * | 2009-05-29 | 2011-05-26 | Merck Patent Gmbh | Polymere, die substituierte indenofluorenderivate als struktureinheit enthalten, verfahren zu deren herstellung sowie deren verwendung |
| WO2011076325A1 (en) | 2009-12-23 | 2011-06-30 | Merck Patent Gmbh | Compositions comprising polymeric binders |
| WO2011076323A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Formulations comprising phase-separated functional materials |
| WO2011076314A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent formulations |
| WO2011076326A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent functional surfactants |
| WO2011076324A1 (en) | 2009-12-23 | 2011-06-30 | Merck Patent Gmbh | Compositions comprising organic semiconducting compounds |
| WO2011088877A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2011090149A1 (ja) | 2010-01-21 | 2011-07-28 | 出光興産株式会社 | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2011091946A1 (de) | 2010-01-30 | 2011-08-04 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung mit integrierter schicht zur farbkonvertierung |
| DE102010006377A1 (de) | 2010-01-29 | 2011-08-04 | Merck Patent GmbH, 64293 | Styrolbasierte Copolymere, insbesondere für die Anwendung in optoelektronischen Bauteilen |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010010481A1 (de) | 2010-03-06 | 2011-09-08 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011110277A1 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Fibers in therapy and cosmetics |
| WO2011110275A2 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Radiative fibers |
| DE102010010631A1 (de) | 2010-03-09 | 2011-09-15 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011116869A1 (de) | 2010-03-26 | 2011-09-29 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010014933A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011128035A1 (en) | 2010-04-12 | 2011-10-20 | Merck Patent Gmbh | Composition and method for preparation of organic electronic devices |
| WO2011128034A1 (en) | 2010-04-12 | 2011-10-20 | Merck Patent Gmbh | Composition having improved performance |
| US8049411B2 (en) * | 2008-06-05 | 2011-11-01 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| US8057919B2 (en) * | 2008-06-05 | 2011-11-15 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| US8057920B2 (en) | 2007-11-16 | 2011-11-15 | Samsung Mobile Display Co., Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
| WO2011141109A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2011147523A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Formulation and method for preparation of organic electronic devices |
| WO2011147521A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Down conversion |
| WO2011147522A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Compositions comprising quantum dots |
| WO2011149284A2 (ko) * | 2010-05-26 | 2011-12-01 | 덕산하이메탈(주) | 헤테로 원자를 포함하는 카바졸과 플루오렌이 융합된 화합물 및 이를 이용한 유기전기소자, 그 단말 |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012013270A1 (en) | 2010-07-26 | 2012-02-02 | Merck Patent Gmbh | Nanocrystals in devices |
| WO2012013272A1 (en) | 2010-07-26 | 2012-02-02 | Merck Patent Gmbh | Quantum dots and hosts |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| US8138355B2 (en) * | 2006-08-28 | 2012-03-20 | Tosoh Corporation | Heteroacene derivative, tetrahaloterphenyl derivative, and processes for producing the same |
| DE102010048074A1 (de) | 2010-10-09 | 2012-04-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010048607A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012048781A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien auf basis von triphenylen für organische elektrolumineszenzvorrichtungen |
| JP2012510154A (ja) * | 2008-11-26 | 2012-04-26 | グレイセル・ディスプレイ・インコーポレーテッド | 電界発光化合物を発光材料として採用している電界発光素子 |
| DE102010054525A1 (de) | 2010-12-15 | 2012-04-26 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| KR101146930B1 (ko) * | 2009-05-22 | 2012-05-23 | 덕산하이메탈(주) | 2개이상의 오원자 헤테로 고리를 포함하는 화합물 및 이를 이용한 유기전기소자, 그 단말 |
| DE102010054316A1 (de) | 2010-12-13 | 2012-06-14 | Merck Patent Gmbh | Substituierte Tetraarylbenzole |
| WO2012084114A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012084115A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012095143A1 (de) | 2011-01-13 | 2012-07-19 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| CN102625819A (zh) * | 2009-07-23 | 2012-08-01 | 罗门哈斯电子材料韩国有限公司 | 新有机电致发光化合物和使用该化合物的有机电致发光设备 |
| DE102011011104A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte Dibenzonaphtacene |
| WO2012110178A1 (en) | 2011-02-14 | 2012-08-23 | Merck Patent Gmbh | Device and method for treatment of cells and cell tissue |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012126566A1 (en) | 2011-03-24 | 2012-09-27 | Merck Patent Gmbh | Organic ionic functional materials |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| CN102766085A (zh) * | 2012-08-08 | 2012-11-07 | 中山大学 | 含咔唑和大共轭结构的新型功能二胺单体及其制备方法和用途 |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012152366A1 (en) | 2011-05-12 | 2012-11-15 | Merck Patent Gmbh | Organic ionic compounds, compositions and electronic devices |
| US8318323B2 (en) | 2008-06-05 | 2012-11-27 | Idemitsu Kosan Co., Ltd. | Polycyclic compounds and organic electroluminescence device employing the same |
| WO2012159213A1 (en) * | 2011-05-25 | 2012-11-29 | American Dye Source, Inc. | Compounds with oxime ester and/or acyl groups |
| WO2012163464A1 (en) | 2011-06-01 | 2012-12-06 | Merck Patent Gmbh | Hybrid ambipolar tfts |
| DE102011104745A1 (de) | 2011-06-17 | 2012-12-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2013013754A1 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Copolymers with functionalized side chains |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| JP2013033982A (ja) * | 2007-03-26 | 2013-02-14 | Fujifilm Corp | 有機電界発光素子 |
| DE102012016192A1 (de) | 2011-08-19 | 2013-02-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2013026515A1 (de) | 2011-08-22 | 2013-02-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2013050101A1 (de) | 2011-10-06 | 2013-04-11 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102011117422A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung in elektronischen Vorrichtungen |
| WO2013060418A1 (en) | 2011-10-27 | 2013-05-02 | Merck Patent Gmbh | Materials for electronic devices |
| DE102011121022A1 (de) | 2011-12-13 | 2013-06-13 | Merck Patent Gmbh | Organische Sensibilisatoren für Up- Conversion |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| WO2013113349A1 (en) | 2012-01-30 | 2013-08-08 | Merck Patent Gmbh | Nanocrystals on fibers |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| WO2013135352A1 (de) | 2012-03-15 | 2013-09-19 | Merck Patent Gmbh | Elektronische vorrichtungen |
| WO2014044344A1 (de) | 2012-09-18 | 2014-03-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014056565A1 (de) * | 2012-10-09 | 2014-04-17 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014067614A1 (de) | 2012-10-31 | 2014-05-08 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106523A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US20140239283A1 (en) * | 2005-03-18 | 2014-08-28 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescence device utilizing the same |
| US8889271B2 (en) | 2006-11-26 | 2014-11-18 | Duksan High Metal Co., Ltd. | Compound containing a 5-membered heterocycle and organic light-emitting diode using same, and terminal for same |
| WO2015014427A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elektrooptische vorrichtung und deren verwendung |
| WO2015014429A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elekrolumineszenzvorrichtung |
| WO2015022051A1 (de) * | 2013-08-15 | 2015-02-19 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| KR20150048182A (ko) | 2012-08-27 | 2015-05-06 | 후지필름 가부시키가이샤 | 유기 박막 트랜지스터, 유기 반도체 박막 및 유기 반도체 재료 |
| JP2015092574A (ja) * | 2014-11-17 | 2015-05-14 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| WO2015082037A1 (en) | 2013-12-06 | 2015-06-11 | Merck Patent Gmbh | Compositions containing a polymeric binder which comprises acrylic and/or methacrylic acid ester units |
| WO2015082046A2 (de) | 2013-12-06 | 2015-06-11 | Merck Patent Gmbh | Substituierte oxepine |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015128052A1 (de) * | 2014-02-28 | 2015-09-03 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| KR101554600B1 (ko) | 2013-06-07 | 2015-09-22 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| WO2015165563A1 (de) | 2014-04-30 | 2015-11-05 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US9196842B2 (en) | 2012-06-29 | 2015-11-24 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescent element |
| WO2015192941A1 (de) | 2014-06-18 | 2015-12-23 | Merck Patent Gmbh | Zusammensetzungen für elektronische vorrichtungen |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| EP2889296A4 (de) * | 2012-08-21 | 2016-06-15 | Cheil Ind Inc | Verbindung für eine organische optoelektronische vorrichtung, organische lichtemittierende diode damit und anzeigevorrichtung mit der organischen lichtemittierenden diode |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016120007A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Formulations with a low particle content |
| WO2016124304A1 (de) | 2015-02-03 | 2016-08-11 | Merck Patent Gmbh | Metallkomplexe |
| US9425416B2 (en) | 2013-06-07 | 2016-08-23 | Samsung Display Co., Ltd. | Condensed cyclic compound and organic light-emitting device including the same |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| WO2016184540A1 (en) | 2015-05-18 | 2016-11-24 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2016193243A1 (en) | 2015-06-03 | 2016-12-08 | Udc Ireland Limited | Highly efficient oled devices with very short decay times |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| US9530966B2 (en) | 2013-03-28 | 2016-12-27 | Sumitomo Chemical Company, Limited | Polymer compound and light emitting device using the same |
| WO2017008883A1 (en) | 2015-07-15 | 2017-01-19 | Merck Patent Gmbh | Composition comprising organic semiconducting compounds |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| WO2017025165A1 (de) * | 2015-08-12 | 2017-02-16 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2017036574A1 (de) * | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | 6,9,15,18-tetrahydro-s-indaceno[1,2-b:5,6-b']difluoren- derivate und ihre verwendung in elektronischen vorrichtungen |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| EP3176241A1 (de) * | 2009-12-07 | 2017-06-07 | Nippon Steel & Sumikin Chemical Co., Ltd. | Organisches lichtemittierendes material und organisches lichtemittierendes element |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| EP3182478A1 (de) * | 2015-12-18 | 2017-06-21 | Novaled GmbH | Elektroneninjektionsschicht für eine organische leuchtdiode (oled) |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| US9714253B2 (en) | 2012-08-27 | 2017-07-25 | Fujifilm Corporation | Organic thin film transistor, organic semiconductor thin film, and organic semiconductor material |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| US9755157B2 (en) | 2013-08-05 | 2017-09-05 | Cheil Industries, Inc. | Organic compound and organic optoelectric device and display device |
| WO2017157783A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine formulierung enthaltend mindestens einen organischen halbleiter |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2018095392A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 有机混合物、组合物以及有机电子器件 |
| WO2018095888A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused 2,8-diaminoindeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095940A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused indeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095381A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 印刷油墨组合物及其制备方法和用途 |
| WO2018095395A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 高聚物、包含其的混合物、组合物和有机电子器件以及用于聚合的单体 |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| WO2018099433A1 (zh) * | 2016-11-30 | 2018-06-07 | 广州华睿光电材料有限公司 | 稠环化合物及其应用、混合物、有机电子器件 |
| WO2018103744A1 (zh) | 2016-12-08 | 2018-06-14 | 广州华睿光电材料有限公司 | 混合物、组合物及有机电子器件 |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114882A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| WO2018134392A1 (en) | 2017-01-23 | 2018-07-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018158232A1 (en) | 2017-03-01 | 2018-09-07 | Merck Patent Gmbh | Organic electroluminescent device |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018189134A1 (de) | 2017-04-13 | 2018-10-18 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2018197447A1 (de) | 2017-04-25 | 2018-11-01 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| US10121973B2 (en) | 2011-12-30 | 2018-11-06 | Cheil Industries, Inc. | Compound for organic optoelectronic device, organic light-emitting diode including same, and display device including organic light-emitting diode |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| US10125214B2 (en) | 2009-07-22 | 2018-11-13 | Merck Patent Gmbh | Materials for electronic devices |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2018234220A1 (de) | 2017-06-21 | 2018-12-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019002198A1 (en) | 2017-06-26 | 2019-01-03 | Merck Patent Gmbh | HOMOGENEOUS MIXTURES |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| WO2019007823A1 (en) | 2017-07-03 | 2019-01-10 | Merck Patent Gmbh | LOW-PHENOL IMPURITY FORMULATIONS |
| WO2019007866A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019007867A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| WO2019020538A1 (de) | 2017-07-25 | 2019-01-31 | Merck Patent Gmbh | Metallkomplexe |
| JP2019019137A (ja) * | 2007-12-03 | 2019-02-07 | 株式会社半導体エネルギー研究所 | 化合物 |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019048458A1 (de) * | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019076789A1 (en) | 2017-10-17 | 2019-04-25 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019096717A2 (de) | 2017-11-14 | 2019-05-23 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019101835A1 (en) | 2017-11-24 | 2019-05-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019101833A1 (en) | 2017-11-24 | 2019-05-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US10323180B2 (en) | 2014-12-04 | 2019-06-18 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Deuterated organic compound, mixture and composition containing said compound, and organic electronic device |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019115423A1 (de) | 2017-12-13 | 2019-06-20 | Merck Patent Gmbh | Metallkomplexe |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| US10347851B2 (en) | 2013-12-20 | 2019-07-09 | Udc Ireland Limited | Highly efficient OLED devices with very short decay times |
| WO2019158453A1 (de) | 2018-02-13 | 2019-08-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019170578A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019170572A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN110256473A (zh) * | 2019-06-28 | 2019-09-20 | 武汉天马微电子有限公司 | 一种化合物、有机光电装置和电子设备 |
| EP3569603A1 (de) | 2018-05-14 | 2019-11-20 | Idemitsu Kosan Co., Ltd. | Polycyclische verbindung und organisches elektrolumineszenzelement mit der polycyclischen verbindung |
| WO2019229011A1 (de) | 2018-05-30 | 2019-12-05 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| US10510967B2 (en) | 2014-12-11 | 2019-12-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Organic compound, and mixture, formulation and organic device comprising the same |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| CN110615783A (zh) * | 2019-09-23 | 2019-12-27 | 大连理工大学 | 一类以吡嗪并茚酮为电子受体的电致发光材料及应用 |
| US10573827B2 (en) | 2014-12-11 | 2020-02-25 | Guangzhou Chinaray Optoelectronics Materials Ltd. | Organic metal complex, and polymer, mixture, composition and organic electronic device containing same and use thereof |
| WO2020043646A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043657A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043640A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020053150A1 (en) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| EP3647393A1 (de) | 2013-07-30 | 2020-05-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2020089138A1 (en) | 2018-10-31 | 2020-05-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| US10658594B2 (en) | 2017-12-06 | 2020-05-19 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and novel compound |
| KR20200083463A (ko) | 2017-11-02 | 2020-07-08 | 이데미쓰 고산 가부시키가이샤 | 신규 화합물 및 유기 일렉트로루미네센스 소자 |
| WO2020165064A1 (de) | 2019-02-11 | 2020-08-20 | Merck Patent Gmbh | Mononukleare iridiumkomplexe mit drei ortho-metallierten bidentaten liganden und optischer orientierungsanisotropie |
| WO2020169241A1 (de) | 2019-02-18 | 2020-08-27 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2020178230A1 (en) | 2019-03-04 | 2020-09-10 | Merck Patent Gmbh | Ligands for nano-sized materials |
| EP3712229A1 (de) | 2013-07-30 | 2020-09-23 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2020208051A1 (en) | 2019-04-11 | 2020-10-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US10840450B2 (en) | 2014-12-04 | 2020-11-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Polymer, and mixture or formulation, and organic electronic device containing same, and monomer thereof |
| WO2021052921A1 (de) | 2019-09-19 | 2021-03-25 | Merck Patent Gmbh | Mischung von zwei hostmaterialien und organische elektrolumineszierende vorrichtung damit |
| WO2021089447A1 (de) | 2019-11-04 | 2021-05-14 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021089450A1 (en) | 2019-11-04 | 2021-05-14 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021094269A1 (en) | 2019-11-12 | 2021-05-20 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021110741A1 (en) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021110720A1 (de) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Metallkomplexe |
| WO2021180950A1 (en) | 2020-03-13 | 2021-09-16 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021180614A1 (de) | 2020-03-11 | 2021-09-16 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021180625A1 (de) | 2020-03-11 | 2021-09-16 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021191058A1 (en) | 2020-03-23 | 2021-09-30 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021213917A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Emulsions comprising organic functional materials |
| US11161933B2 (en) | 2016-12-13 | 2021-11-02 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Conjugated polymer and use thereof in organic electronic device |
| WO2021239772A1 (de) | 2020-05-29 | 2021-12-02 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021259824A1 (de) | 2020-06-23 | 2021-12-30 | Merck Patent Gmbh | Verfahren zur herstellung einer mischung |
| WO2022017998A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022017997A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US11292875B2 (en) | 2016-12-22 | 2022-04-05 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Cross-linkable polymer based on Diels-Alder reaction and use thereof in organic electronic device |
| WO2022069380A1 (de) | 2020-09-29 | 2022-04-07 | Merck Patent Gmbh | Mononukleare tripodale hexadentate iridium komplexe zur verwendung in oleds |
| WO2022078432A1 (zh) | 2020-10-14 | 2022-04-21 | 浙江光昊光电科技有限公司 | 组合物及其在光电领域的应用 |
| WO2022112541A1 (en) | 2020-11-30 | 2022-06-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| US11447496B2 (en) | 2016-11-23 | 2022-09-20 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Nitrogen-containing fused heterocyclic ring compound and application thereof |
| WO2022200638A1 (de) | 2021-07-06 | 2022-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022214506A1 (en) | 2021-04-09 | 2022-10-13 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022214566A1 (en) | 2021-04-09 | 2022-10-13 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022214507A1 (en) | 2021-04-09 | 2022-10-13 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP4079742A1 (de) | 2021-04-14 | 2022-10-26 | Merck Patent GmbH | Metallkomplexe |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022243403A1 (de) | 2021-05-21 | 2022-11-24 | Merck Patent Gmbh | Verfahren zur kontinuierlichen aufreinigung von mindestens einem funktionalen material und vorrichtung zur kontinuierlichen aufreinigung von mindestens einem funktionalen material |
| US11512039B2 (en) | 2016-11-23 | 2022-11-29 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Aromatic amine derivatives, preparation methods therefor, and uses thereof |
| US11518723B2 (en) | 2016-11-23 | 2022-12-06 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Fused ring compound, high polymer, mixture, composition and organic electronic component |
| US11555128B2 (en) | 2015-11-12 | 2023-01-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Printing composition, electronic device comprising same and preparation method for functional material thin film |
| WO2023012084A1 (en) | 2021-08-02 | 2023-02-09 | Merck Patent Gmbh | A printing method by combining inks |
| WO2023031073A1 (en) | 2021-08-31 | 2023-03-09 | Merck Patent Gmbh | Composition |
| WO2023036976A1 (en) | 2021-09-13 | 2023-03-16 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2023052313A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052275A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052272A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052314A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| US11634444B2 (en) | 2016-11-23 | 2023-04-25 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Metal organic complex, high polymer, composition, and organic electronic component |
| WO2023094412A1 (de) | 2021-11-25 | 2023-06-01 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US11672174B2 (en) | 2016-12-08 | 2023-06-06 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Pyrene-triazine derivative and applications thereof in organic electronic component |
| WO2023117837A1 (de) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023152346A1 (de) | 2022-02-14 | 2023-08-17 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023208899A1 (en) | 2022-04-28 | 2023-11-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2023222559A1 (de) | 2022-05-18 | 2023-11-23 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023237458A1 (en) | 2022-06-07 | 2023-12-14 | Merck Patent Gmbh | Method of printing a functional layer of an electronic device by combining inks |
| WO2023247663A1 (de) | 2022-06-24 | 2023-12-28 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2023247662A1 (de) | 2022-06-24 | 2023-12-28 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2024013004A1 (de) | 2022-07-11 | 2024-01-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024033282A1 (en) | 2022-08-09 | 2024-02-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024094670A1 (en) | 2022-11-04 | 2024-05-10 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024105066A1 (en) | 2022-11-17 | 2024-05-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024126635A1 (en) | 2022-12-16 | 2024-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2024132892A1 (en) | 2022-12-19 | 2024-06-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024133048A1 (en) | 2022-12-20 | 2024-06-27 | Merck Patent Gmbh | Method for preparing deuterated aromatic compounds |
| WO2024132993A1 (de) | 2022-12-19 | 2024-06-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
Families Citing this family (131)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102005023437A1 (de) * | 2005-05-20 | 2006-11-30 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtungen |
| DE102005040411A1 (de) | 2005-08-26 | 2007-03-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| KR101144358B1 (ko) * | 2009-05-13 | 2012-05-11 | 덕산하이메탈(주) | 오원자 헤테로 고리를 포함하는 화합물 및 이를 이용한 유기전기소자, 그 단말 |
| JP4811314B2 (ja) * | 2007-03-27 | 2011-11-09 | セイコーエプソン株式会社 | 有機elデバイス |
| US8703302B2 (en) * | 2008-05-08 | 2014-04-22 | Nippon Steel & Sumikin Chemical Co., Ltd. | Indolocarbazole derivative with aromatic phosphne oxide group for organic electroluminescent device and organic electroluminescent device containing same |
| DE102008035413A1 (de) * | 2008-07-29 | 2010-02-04 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtungen |
| KR101027582B1 (ko) * | 2008-12-06 | 2011-04-06 | 대주전자재료 주식회사 | 포스핀 옥사이드계 화합물 및 이를 이용한 유기 전기발광 소자 |
| KR101609275B1 (ko) * | 2008-12-16 | 2016-04-06 | 삼성디스플레이 주식회사 | 유기 화합물 및 이를 포함하는 유기 발광 소자 |
| KR101511072B1 (ko) * | 2009-03-20 | 2015-04-10 | 롬엔드하스전자재료코리아유한회사 | 신규한 유기 발광 화합물 및 이를 포함하는 유기 전계 발광소자 |
| JP5390693B2 (ja) * | 2009-03-30 | 2014-01-15 | ドゥクサン ハイ メタル カンパニー リミテッド | 有機電子素子及びその化合物、端末 |
| KR101477613B1 (ko) * | 2009-03-31 | 2014-12-30 | 롬엔드하스전자재료코리아유한회사 | 신규한 유기 전자재료용 화합물 및 이를 포함하는 유기 전자 소자 |
| WO2010113761A1 (ja) * | 2009-03-31 | 2010-10-07 | 新日鐵化学株式会社 | 有機電界発光素子 |
| CN104119265B (zh) | 2009-06-03 | 2016-07-13 | 富士胶片株式会社 | 光电转换元件,其制备方法,光传感器,成像装置及其驱动方法 |
| TWI472511B (zh) * | 2009-06-03 | 2015-02-11 | Fujifilm Corp | 光電變換元件及攝像元件 |
| KR101174088B1 (ko) * | 2009-06-25 | 2012-08-14 | 제일모직주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| JP2011046697A (ja) * | 2009-07-30 | 2011-03-10 | Mitsubishi Chemicals Corp | 新規ホスフィン化合物,およびこれを用いた電極バッファー材料ならびに光電変換素子 |
| WO2011049063A1 (ja) * | 2009-10-23 | 2011-04-28 | 新日鐵化学株式会社 | 有機電界発光素子 |
| KR101137388B1 (ko) | 2009-11-13 | 2012-04-20 | 삼성모바일디스플레이주식회사 | 유기 전계 발광 장치 |
| US9006754B2 (en) | 2010-01-26 | 2015-04-14 | Lightizer Korea Co. | Multichip light emitting diode (LED) and method of manufacture |
| US8587187B2 (en) * | 2010-12-06 | 2013-11-19 | Byoung GU Cho | Light diffusion of visible edge lines in a multi-dimensional modular display |
| JP5648641B2 (ja) * | 2010-01-28 | 2015-01-07 | コニカミノルタ株式会社 | 有機光電変換素子 |
| DE102010007938A1 (de) * | 2010-02-12 | 2011-10-06 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| TWI477579B (zh) | 2010-02-12 | 2015-03-21 | Nippon Steel & Sumikin Chem Co | Organic electroluminescent elements |
| KR101757444B1 (ko) * | 2010-04-30 | 2017-07-13 | 삼성디스플레이 주식회사 | 유기 전계 발광 장치 |
| US9099660B2 (en) | 2010-06-15 | 2015-08-04 | University Of Oregon | Alkynyl-substituted indenofluorenes useful in electronic and electro-optical devices |
| US8673183B2 (en) | 2010-07-06 | 2014-03-18 | National Research Council Of Canada | Tetrazine monomers and copolymers for use in organic electronic devices |
| JP5499972B2 (ja) * | 2010-07-23 | 2014-05-21 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子用材料、および有機エレクトロルミネッセンス素子、これを用いた表示装置、照明装置 |
| WO2012014500A1 (ja) * | 2010-07-30 | 2012-02-02 | 保土谷化学工業株式会社 | インデノカルバゾール環構造を有する化合物および有機エレクトロルミネッセンス素子 |
| KR101832171B1 (ko) | 2010-10-25 | 2018-04-16 | 삼성디스플레이 주식회사 | 축합환 화합물, 이를 포함한 유기 발광 소자 및 상기 유기 발광 소자를 포함한 평판 표시 장치 |
| KR101423173B1 (ko) * | 2010-11-04 | 2014-07-25 | 제일모직 주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| KR101531612B1 (ko) * | 2010-12-02 | 2015-06-25 | 제일모직 주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| US9685613B2 (en) * | 2010-12-20 | 2017-06-20 | E I Du Pont De Nemours And Company | Electroactive materials |
| US9238623B2 (en) | 2011-01-17 | 2016-01-19 | Samsung Display Co., Ltd. | Condensed-cyclic compound and organic light-emitting diode including the same |
| US9653689B2 (en) | 2011-01-17 | 2017-05-16 | Samsung Display Co., Ltd. | Condensed-cyclic compound and organic light-emitting diode including the same |
| WO2012124412A1 (ja) | 2011-03-16 | 2012-09-20 | 新日鐵化学株式会社 | 含窒素芳香族化合物及び有機電界発光素子 |
| KR101382373B1 (ko) * | 2011-04-19 | 2014-04-08 | 단국대학교 산학협력단 | 시클로펜타플루오렌계 화합물 및 이를 포함하는 유기전계 발광소자 |
| EP2546901A1 (de) * | 2011-07-13 | 2013-01-16 | Koninklijke Philips Electronics N.V. | Wellenlängenumwandlungselement |
| WO2013013765A1 (en) * | 2011-07-27 | 2013-01-31 | Merck Patent Gmbh | Small molecules and their use as organic semiconductors |
| KR20130015400A (ko) | 2011-08-03 | 2013-02-14 | 삼성디스플레이 주식회사 | 헤테로고리 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| BR112014006697A2 (pt) * | 2011-09-21 | 2017-03-28 | Merck Patent Gmbh | derivados de carbazol para dispositivos eletroluminescentes orgânicos |
| JP2014150083A (ja) * | 2011-09-30 | 2014-08-21 | Fujifilm Corp | 有機電界発光素子 |
| JP2013118349A (ja) | 2011-11-02 | 2013-06-13 | Udc Ireland Ltd | 有機電界発光素子、有機電界発光素子用材料並びに該有機電界発光素子を用いた発光装置、表示装置及び照明装置 |
| KR101972831B1 (ko) * | 2011-11-23 | 2019-04-26 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US8921578B2 (en) | 2011-12-12 | 2014-12-30 | State of Oregan Acting by and Through the State Board of Higher Education on Behalf of the University of Oregan | Heteroatomic indenofluorenes |
| KR102054229B1 (ko) * | 2012-01-13 | 2019-12-11 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| JP6016482B2 (ja) * | 2012-07-03 | 2016-10-26 | キヤノン株式会社 | ジベンゾキサンテン化合物、有機発光素子、表示装置、画像情報処理装置及び画像形成装置 |
| CN103570627B (zh) * | 2012-07-27 | 2015-12-16 | 昆山维信诺显示技术有限公司 | 一种含有嘧啶或吡嗪或三嗪基团的茚并芴类衍生物及应用 |
| KR101482632B1 (ko) * | 2012-10-10 | 2015-01-15 | 대주전자재료 주식회사 | 스파이로형 유기 재료 및 이를 이용한 유기 전기발광 소자 |
| JP6091151B2 (ja) * | 2012-10-15 | 2017-03-08 | 富士フイルム株式会社 | 有機薄膜トランジスタ、有機半導体薄膜および有機半導体材料 |
| CN102898854B (zh) * | 2012-10-19 | 2013-11-27 | 中国科学院长春应用化学研究所 | 以含烷氧基取代芴单元的三芳胺为给体的有机染料及在染料敏化太阳电池中的应用 |
| TWI605055B (zh) * | 2012-12-21 | 2017-11-11 | 陶氏全球科技有限責任公司 | 啡膦化合物 |
| RU2532565C2 (ru) * | 2013-01-09 | 2014-11-10 | Федеральное государственное автономное образовательное учреждение высшего профессионального образования "ЮЖНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ" | Многослойное электролюминесцентное устройство |
| EP2976329B1 (de) * | 2013-03-22 | 2018-06-27 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| CN104073246A (zh) * | 2013-03-29 | 2014-10-01 | 海洋王照明科技股份有限公司 | 一种有机电致磷光主体材料及其制备方法和有机电致发光器件 |
| RU2532903C1 (ru) * | 2013-07-09 | 2014-11-20 | Федеральное государственное автономное образовательное учреждение высшего профессионального образования "Уральский федеральный университет имени первого Президента России Б.Н. Ельцина" | Способ синтеза 2-додецил-5-(2,3,7,8-бис-(9н,10н-антрацен-9,10-диил)пирен-1-ил)тиофена - мономолекулярного оптического сенсора для обнаружения нитроароматических соединений |
| RU2532164C1 (ru) * | 2013-07-30 | 2014-10-27 | Федеральное государственное автономное образовательное учреждение высшего профессионального образования "Уральский федеральный университет имени первого Президента России Б.Н. Ельцина" | Способ синтеза 5,5'-(2,3,7,8-бис-(9н,10н-антрацен-9,10-диил)пирен-1,6-диил)бис(2-додецилтиофена) - мономолекулярного оптического сенсора для обнаружения нитроароматических соединений |
| KR20160038052A (ko) * | 2013-08-05 | 2016-04-06 | 바스프 에스이 | 시안화 나프탈렌벤즈이미다졸 화합물 |
| RU2568489C2 (ru) * | 2013-08-29 | 2015-11-20 | Федеральное государственное бюджетное учреждение науки Институт проблем химической физики Российской академии наук (ИПХФ РАН) | Сопряженный полимер на основе карбазола и циклопентадитиофена и его применение в качестве электролюминесцентного материала в органических светоизлучающих диодах |
| KR102291490B1 (ko) * | 2013-12-12 | 2021-08-23 | 삼성디스플레이 주식회사 | 아민계 화합물 및 이를 포함한 유기 발광 소자 |
| JP6033802B2 (ja) * | 2014-02-06 | 2016-11-30 | 富士フイルム株式会社 | 有機薄膜トランジスタ、有機半導体薄膜および有機半導体材料 |
| KR102030354B1 (ko) | 2014-05-13 | 2019-10-10 | 에스에프씨주식회사 | 방향족 아민기를 포함하는 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| KR102508566B1 (ko) * | 2014-07-10 | 2023-03-13 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| KR102319999B1 (ko) * | 2014-07-10 | 2021-11-01 | 삼성디스플레이 주식회사 | 유기 화합물 및 이를 포함하는 유기 발광 장치 |
| KR102293894B1 (ko) | 2014-07-28 | 2021-08-27 | 에스에프씨주식회사 | 헤테로고리를 포함하는 축합 플루오렌 유도체 |
| KR102030377B1 (ko) | 2014-07-28 | 2019-10-10 | 에스에프씨주식회사 | 헤테로고리를 포함하는 축합 플루오렌 유도체 |
| US9951270B2 (en) * | 2014-10-30 | 2018-04-24 | Lg Chem, Ltd. | Multicyclic compound and organic electronic device using the same |
| KR102357167B1 (ko) * | 2014-11-19 | 2022-02-08 | 엘지디스플레이 주식회사 | 피리미딘 유도체 및 이를 포함하는 유기전계발광소자 |
| KR102384224B1 (ko) | 2014-12-30 | 2022-04-08 | 삼성전자주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| KR102190108B1 (ko) | 2014-12-31 | 2020-12-11 | 에스에프씨주식회사 | 고효율과 장수명을 갖는 유기 발광 소자 |
| KR102201104B1 (ko) | 2015-01-13 | 2021-01-11 | 에스에프씨주식회사 | 고효율과 장수명을 갖는 유기 발광 소자 |
| WO2016125706A1 (ja) * | 2015-02-03 | 2016-08-11 | 保土谷化学工業株式会社 | 有機エレクトロルミネッセンス素子 |
| KR101974860B1 (ko) | 2015-02-04 | 2019-09-05 | 에스에프씨주식회사 | 저전압구동이 가능하며 장수명을 갖는 유기 발광 소자 |
| US9773988B2 (en) | 2015-04-10 | 2017-09-26 | University Of Oregon | Diindenoanthracene and diindenopentacene |
| KR102456078B1 (ko) * | 2015-04-28 | 2022-10-19 | 삼성디스플레이 주식회사 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR102630643B1 (ko) * | 2015-05-27 | 2024-01-31 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| US10312449B2 (en) * | 2015-05-27 | 2019-06-04 | Samsung Display Co., Ltd. | Organic light-emitting device |
| US20160351817A1 (en) * | 2015-05-27 | 2016-12-01 | Samsung Display Co., Ltd. | Organic light-emitting device |
| KR102002031B1 (ko) | 2015-06-12 | 2019-07-23 | 에스에프씨주식회사 | 고효율을 갖는 유기 발광 소자 |
| KR102002034B1 (ko) | 2015-07-09 | 2019-07-22 | 에스에프씨주식회사 | 고효율과 장수명을 갖는 유기 발광 소자 |
| EP3333241B1 (de) | 2015-08-06 | 2022-10-05 | SFC Co., Ltd. | Organisches lichtemittierendes element mit hoher effizienz |
| KR101650294B1 (ko) * | 2015-08-21 | 2016-08-24 | 롬엔드하스전자재료코리아유한회사 | 신규한 유기 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| US11251378B2 (en) | 2015-10-13 | 2022-02-15 | Sfc Co., Ltd. | Organic light-emitting diode having alleviated luminance reduction in low dynamic range |
| WO2017072678A1 (en) | 2015-10-26 | 2017-05-04 | Oti Lumionics Inc. | Method for patterning a coating on a surface and device including a patterned coating |
| KR101976408B1 (ko) | 2015-11-10 | 2019-05-16 | 에스에프씨주식회사 | 저전압구동이 가능하며 고효율의 유기 발광 소자 |
| KR102469075B1 (ko) | 2015-11-12 | 2022-11-24 | 에스에프씨 주식회사 | 고효율 특성을 갖는 유기 발광 소자 |
| JP6688608B2 (ja) * | 2015-12-28 | 2020-04-28 | 大電株式会社 | 有機電子輸送材料及びこれを用いた有機電界発光素子 |
| JP6808319B2 (ja) * | 2015-12-28 | 2021-01-06 | 大電株式会社 | 有機電子輸送材料及びこれを用いた有機電界発光素子 |
| RU2616296C1 (ru) * | 2016-01-11 | 2017-04-14 | Федеральное государственное бюджетное учреждение науки Институт органического синтеза им. И.Я. Постовского Уральского отделения Российской академии наук | Применение 4-(5-R-тиофен-2-ил)пиримидина в качестве мономолекулярного оптического сенсора для обнаружения нитроароматических соединений |
| KR102547685B1 (ko) | 2016-02-22 | 2023-06-27 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| KR102577003B1 (ko) * | 2016-06-03 | 2023-09-12 | 삼성디스플레이 주식회사 | 화합물 및 이를 포함하는 유기 발광 소자 |
| CN107573306B (zh) * | 2016-07-05 | 2020-04-28 | 上海和辉光电有限公司 | 一种有机电致发光化合物 |
| KR101900726B1 (ko) | 2016-07-14 | 2018-09-20 | 에스에프씨주식회사 | 고효율 특성을 갖는 유기 발광 소자 |
| US20180093962A1 (en) * | 2016-10-05 | 2018-04-05 | Sfc Co., Ltd. | Novel organic compound and oranic light-emitting diode comprising same background of the invention |
| KR20180037695A (ko) | 2016-10-05 | 2018-04-13 | 에스에프씨 주식회사 | 장수명, 저전압 및 고효율 특성을 갖는 유기 발광 소자 |
| KR20180037717A (ko) | 2016-10-05 | 2018-04-13 | 에스에프씨 주식회사 | 장수명, 저전압 및 고효율 특성을 갖는 유기 발광 소자 |
| CN106831817B (zh) * | 2016-12-30 | 2019-09-03 | 上海天马有机发光显示技术有限公司 | 一种有机电致发光材料以及有机光电装置 |
| KR102122213B1 (ko) | 2017-01-04 | 2020-06-12 | 에스에프씨주식회사 | 고효율을 갖는 유기 발광 소자 |
| KR102377207B1 (ko) | 2017-01-04 | 2022-03-22 | 에스에프씨주식회사 | 고효율을 갖는 유기 발광 소자 |
| CN107056626B (zh) * | 2017-03-17 | 2019-03-22 | 吉林奥来德光电材料股份有限公司 | 一种化合物及其制备方法和应用 |
| US11930703B2 (en) * | 2017-03-17 | 2024-03-12 | Semiconductor Energy Laboratory Co., Ltd. | Organic compound, light-emitting element, light-emitting device, electronic device, display device, and lighting device |
| CN110785867B (zh) | 2017-04-26 | 2023-05-02 | Oti照明公司 | 用于图案化表面上覆层的方法和包括图案化覆层的装置 |
| JP7264488B2 (ja) | 2017-05-17 | 2023-04-25 | オーティーアイ ルミオニクス インコーポレーテッド | パターン化コーティングにわたって伝導性コーティングを選択的に堆積させるための方法および伝導性コーティングを含むデバイス |
| EP4194442A1 (de) * | 2017-05-23 | 2023-06-14 | Novaled GmbH | Organische elektronische vorrichtung mit einer organischen halbleiterschicht |
| CN109575054A (zh) * | 2017-09-29 | 2019-04-05 | 江苏三月光电科技有限公司 | 一种含硼六元杂环衍生物及其在有机电致发光器件中的应用 |
| CN107759775B (zh) * | 2017-10-23 | 2020-06-05 | 华南协同创新研究院 | 含砜基稠环结构的具有强双光子效应的给受体型交替聚合物、制法与应用 |
| US11751415B2 (en) | 2018-02-02 | 2023-09-05 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| GB201804512D0 (en) * | 2018-03-21 | 2018-05-02 | Univ Birmingham | Luminescent compounds |
| JP7320851B2 (ja) | 2018-05-07 | 2023-08-04 | オーティーアイ ルミオニクス インコーポレーテッド | 補助電極を提供するための方法および補助電極を含むデバイス |
| CN108558948B (zh) * | 2018-06-04 | 2020-04-07 | 河南省科学院化学研究所有限公司 | 一种含双磷杂环戊二烯稠环有机电致发光化合物及其合成方法 |
| KR20190141053A (ko) | 2018-06-12 | 2019-12-23 | 삼성디스플레이 주식회사 | 헤테로시클릭 화합물 및 이를 포함한 유기 발광 소자 |
| KR102608414B1 (ko) * | 2018-06-22 | 2023-12-01 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| KR20200007256A (ko) * | 2018-07-12 | 2020-01-22 | 에스에프씨 주식회사 | 저전압구동이 가능하며 고효율의 유기 발광 소자 |
| CN109134519B (zh) * | 2018-09-28 | 2021-07-13 | 武汉天马微电子有限公司 | 硼杂环化合物以及有机发光显示装置 |
| CN109516985B (zh) * | 2018-11-02 | 2020-08-25 | 湘潭大学 | 一种1,3-二(2-吡啶基)苯受体单元和引达省并二吡啶二酮有机半导体材料及应用 |
| US20220158101A1 (en) * | 2018-12-20 | 2022-05-19 | Merck Patent Gmbh | Materials for electronic devices |
| US11021489B2 (en) | 2019-03-01 | 2021-06-01 | University Of Oregon | Polycyclic aromatic compound embodiments and methods of making and using the same |
| JP7390739B2 (ja) | 2019-03-07 | 2023-12-04 | オーティーアイ ルミオニクス インコーポレーテッド | 核生成抑制コーティングを形成するための材料およびそれを組み込んだデバイス |
| KR20220046551A (ko) | 2019-06-26 | 2022-04-14 | 오티아이 루미오닉스 인크. | 광 회절 특성을 갖는 광 투과 영역을 포함하는 광전자 디바이스 |
| US11832473B2 (en) | 2019-06-26 | 2023-11-28 | Oti Lumionics Inc. | Optoelectronic device including light transmissive regions, with light diffraction characteristics |
| KR20220045202A (ko) | 2019-08-09 | 2022-04-12 | 오티아이 루미오닉스 인크. | 보조 전극 및 파티션을 포함하는 광전자 디바이스 |
| CN110483576B (zh) * | 2019-09-25 | 2022-03-18 | 宁波卢米蓝新材料有限公司 | 一种含膦稠杂环化合物及其制备方法和用途 |
| CN110563763A (zh) * | 2019-09-29 | 2019-12-13 | 上海天马有机发光显示技术有限公司 | 一种化合物及其应用 |
| CN114075172A (zh) * | 2020-08-11 | 2022-02-22 | 罗门哈斯电子材料韩国有限公司 | 有机电致发光化合物、多种主体材料和包含其的有机电致发光装置 |
| US11985841B2 (en) | 2020-12-07 | 2024-05-14 | Oti Lumionics Inc. | Patterning a conductive deposited layer using a nucleation inhibiting coating and an underlying metallic coating |
| KR102556335B1 (ko) * | 2020-12-22 | 2023-07-18 | 엘티소재주식회사 | 헤테로고리 화합물 및 이를 포함하는 유기 발광 소자 |
| KR102488944B1 (ko) * | 2021-03-16 | 2023-01-13 | 엘지디스플레이 주식회사 | 피리미딘 유도체 및 이를 포함하는 유기전계발광소자 |
| CN113087593A (zh) * | 2021-04-08 | 2021-07-09 | 南京工业职业技术大学 | 一种基于三氟甲基苯功能化的螺芴有机激光材料、微晶制备与应用 |
| CN113582909B (zh) * | 2021-07-30 | 2023-04-25 | 上海钥熠电子科技有限公司 | 大位阻咔唑化合物及其在有机电致发光显示器件中的应用 |
| CN117343078A (zh) | 2021-11-25 | 2024-01-05 | 北京夏禾科技有限公司 | 有机电致发光材料和器件 |
| CN116574131A (zh) * | 2022-12-08 | 2023-08-11 | 四川阿格瑞新材料有限公司 | 一种电子传输材料及其在电致发光器件中的应用 |
| CN118184523A (zh) * | 2024-05-16 | 2024-06-14 | 天津派森新材料技术有限责任公司 | 二胺化合物、其中间体及聚酰亚胺薄膜 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000026324A (ja) * | 1998-07-02 | 2000-01-25 | Mitsui Chemicals Inc | 炭化水素化合物および有機電界発光素子 |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS62264056A (ja) | 1986-05-12 | 1987-11-17 | Canon Inc | 電子写真感光体 |
| JPH04358884A (ja) | 1991-06-05 | 1992-12-11 | Brother Ind Ltd | 画像形成方法 |
| DE59510315D1 (de) * | 1994-04-07 | 2002-09-19 | Covion Organic Semiconductors | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| JP3855372B2 (ja) | 1997-06-09 | 2006-12-06 | 東洋インキ製造株式会社 | 有機エレクトロルミネッセンス素子材料およびそれを使用した有機エレクトロルミネッセンス素子 |
| JP3792029B2 (ja) * | 1997-11-25 | 2006-06-28 | 三井化学株式会社 | 有機電界発光素子 |
| JP3835917B2 (ja) * | 1998-02-04 | 2006-10-18 | 三井化学株式会社 | 有機電界発光素子 |
| JP4117093B2 (ja) * | 1998-12-28 | 2008-07-09 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子用材料およびそれを使用した有機エレクトロルミネッセンス素子 |
| JP4799717B2 (ja) | 1999-05-24 | 2011-10-26 | 三井化学株式会社 | アミン化合物 |
| JP4220624B2 (ja) * | 1999-07-30 | 2009-02-04 | 三井化学株式会社 | アミン化合物 |
| US6566086B1 (en) | 2000-01-28 | 2003-05-20 | Fal Diagnostics | Diagnostic kit for detecting creatine levels |
| KR100346984B1 (ko) | 2000-02-08 | 2002-07-31 | 삼성에스디아이 주식회사 | 열안정성이 우수한 유기 전기발광 소자용 정공수송성화합물 및 그 제조방법 |
| JP4996794B2 (ja) | 2000-08-10 | 2012-08-08 | 三井化学株式会社 | 炭化水素化合物、有機電界発光素子用材料および有機電界発光素子 |
| US6479172B2 (en) * | 2001-01-26 | 2002-11-12 | Xerox Corporation | Electroluminescent (EL) devices |
| JP4672899B2 (ja) | 2001-04-20 | 2011-04-20 | 三井化学株式会社 | 有機電界発光素子、有機電界発光素子の発光材料および正孔注入輸送材料 |
| JP4240841B2 (ja) | 2001-04-27 | 2009-03-18 | キヤノン株式会社 | 有機発光素子 |
| JP2002326965A (ja) * | 2001-05-02 | 2002-11-15 | Sony Corp | スピロフルオレン化合物及びその製造方法、並びにその合成中間体、及びそのスピロフルオレン化合物を用いた有機電界発光素子 |
| JP4220696B2 (ja) | 2001-10-16 | 2009-02-04 | 三井化学株式会社 | 炭化水素化合物、有機電界発光素子用材料および有機電界発光素子 |
| JP4080213B2 (ja) * | 2002-02-01 | 2008-04-23 | 三井化学株式会社 | 有機電界発光素子 |
| JP4140882B2 (ja) | 2002-03-06 | 2008-08-27 | 靖彦 城田 | トルクセン誘導体 |
| JP4250370B2 (ja) * | 2002-03-08 | 2009-04-08 | キヤノン株式会社 | 有機化合物、電界発光素子及び表示装置 |
| JP4338367B2 (ja) * | 2002-07-11 | 2009-10-07 | 三井化学株式会社 | 化合物、有機電界発光素子用材料および有機電界発光素子 |
| JP2004042485A (ja) * | 2002-07-12 | 2004-02-12 | Mitsui Chemicals Inc | 光記録媒体及び炭化水素化合物 |
| JP3902993B2 (ja) * | 2002-08-27 | 2007-04-11 | キヤノン株式会社 | フルオレン化合物及びそれを用いた有機発光素子 |
| DE10249723A1 (de) * | 2002-10-25 | 2004-05-06 | Covion Organic Semiconductors Gmbh | Arylamin-Einheiten enthaltende konjugierte Polymere, deren Darstellung und Verwendung |
| GB0226010D0 (en) * | 2002-11-08 | 2002-12-18 | Cambridge Display Tech Ltd | Polymers for use in organic electroluminescent devices |
| US20040131881A1 (en) * | 2002-12-31 | 2004-07-08 | Eastman Kodak Company | Complex fluorene-containing compounds for use in OLED devices |
| US6849348B2 (en) | 2002-12-31 | 2005-02-01 | Eastman Kodak Company | Complex fluorene-containing compounds |
| JP2005082702A (ja) | 2003-09-09 | 2005-03-31 | Toyo Ink Mfg Co Ltd | 有機エレクトロルミネッセンス用素子材料およびそれを用いた有機エレクトロルミネッセンス素子 |
| JP4325336B2 (ja) | 2003-09-19 | 2009-09-02 | 東洋インキ製造株式会社 | 有機エレクトロルミネッセンス素子用材料および有機エレクトロルミネッセンス素子 |
| JP4059834B2 (ja) | 2003-10-15 | 2008-03-12 | 三井化学株式会社 | フルオレン化合物、アミン化合物、該アミン化合物の製造方法および該アミン化合物を含有する有機電界発光素子 |
| TW200613515A (en) | 2004-06-26 | 2006-05-01 | Merck Patent Gmbh | Compounds for organic electronic devices |
| WO2006062078A1 (ja) * | 2004-12-08 | 2006-06-15 | Idemitsu Kosan Co., Ltd. | 有機エレクトロルミネッセンス素子 |
| KR100949214B1 (ko) | 2005-03-18 | 2010-03-24 | 이데미쓰 고산 가부시키가이샤 | 방향족 아민 유도체 및 그것을 사용한 유기 전기발광 소자 |
| US20060228898A1 (en) | 2005-03-30 | 2006-10-12 | Cory Wajda | Method and system for forming a high-k dielectric layer |
| CN101155895B (zh) | 2005-04-14 | 2011-12-28 | 默克专利有限公司 | 用于有机电子器件的化合物 |
| DE102005023437A1 (de) * | 2005-05-20 | 2006-11-30 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtungen |
| DE102005040411A1 (de) * | 2005-08-26 | 2007-03-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2007119454A (ja) * | 2005-09-30 | 2007-05-17 | Chisso Corp | フェナレン化合物 |
| US8795847B2 (en) * | 2005-12-08 | 2014-08-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| USRE44831E1 (en) * | 2006-01-05 | 2014-04-08 | Konica Minolta Holdings, Inc. | Organic electroluminescent device, display, and illuminating device |
| DE102006031990A1 (de) * | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102006035035A1 (de) * | 2006-07-28 | 2008-01-31 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2009203183A (ja) | 2008-02-27 | 2009-09-10 | Tosoh Corp | ヘテロアセン誘導体の製造方法 |
-
2005
- 2005-05-20 DE DE102005023437A patent/DE102005023437A1/de not_active Withdrawn
-
2006
- 2006-04-21 RU RU2007146793/04A patent/RU2419648C2/ru not_active IP Right Cessation
- 2006-04-21 CA CA2608765A patent/CA2608765C/en active Active
- 2006-04-21 JP JP2008511579A patent/JP5237090B2/ja active Active
- 2006-04-21 CN CN200680017539.1A patent/CN101228250B/zh active Active
- 2006-04-21 BR BRPI0610859-8A patent/BRPI0610859A2/pt not_active IP Right Cessation
- 2006-04-21 US US11/914,824 patent/US8852756B2/en active Active
- 2006-04-21 MX MX2007014449A patent/MX2007014449A/es unknown
- 2006-04-21 AU AU2006246743A patent/AU2006246743B2/en not_active Ceased
- 2006-04-21 EP EP06724488.9A patent/EP1883688B1/de active Active
- 2006-04-21 WO PCT/EP2006/003670 patent/WO2006122630A1/de active Application Filing
- 2006-04-21 KR KR1020077029742A patent/KR101346467B1/ko active IP Right Grant
- 2006-05-17 TW TW095117529A patent/TWI428424B/zh active
-
2014
- 2014-10-02 US US14/505,261 patent/US9461249B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000026324A (ja) * | 1998-07-02 | 2000-01-25 | Mitsui Chemicals Inc | 炭化水素化合物および有機電界発光素子 |
Non-Patent Citations (2)
| Title |
|---|
| PATENT ABSTRACTS OF JAPAN vol. 2000, no. 04 31 August 2000 (2000-08-31) * |
| XIAO-YU ET AL, THE JOURNAL OF ORGANIC CHEMISTRY, vol. 69, no. 18, 3 September 2004 (2004-09-03), pages 6050 - 6058, XP002391238 * |
Cited By (492)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20140239283A1 (en) * | 2005-03-18 | 2014-08-28 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescence device utilizing the same |
| US10312452B2 (en) * | 2005-03-18 | 2019-06-04 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescence device utilizing the same |
| JP2009530371A (ja) * | 2006-03-23 | 2009-08-27 | エルジー・ケム・リミテッド | 新規なジアミン誘導体、その製造方法およびそれを用いた有機電気素子 |
| US8173272B2 (en) | 2006-03-23 | 2012-05-08 | Lg Chem, Ltd. | Diamine derivatives, preparation method thereof and organic electronic device using the same |
| WO2008005609A1 (en) * | 2006-04-17 | 2008-01-10 | Battelle Memorial Institute | Organic materials with phosphine sulfide moieties having tunable electric and electroluminescent properties |
| WO2008006449A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| US8138355B2 (en) * | 2006-08-28 | 2012-03-20 | Tosoh Corporation | Heteroacene derivative, tetrahaloterphenyl derivative, and processes for producing the same |
| WO2008062636A1 (en) * | 2006-11-24 | 2008-05-29 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescent element using the same |
| US8895159B2 (en) | 2006-11-24 | 2014-11-25 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescence device using the same |
| US8394510B2 (en) | 2006-11-24 | 2013-03-12 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescence device using the same |
| JP5133259B2 (ja) * | 2006-11-24 | 2013-01-30 | 出光興産株式会社 | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| US8889271B2 (en) | 2006-11-26 | 2014-11-18 | Duksan High Metal Co., Ltd. | Compound containing a 5-membered heterocycle and organic light-emitting diode using same, and terminal for same |
| JP2008147256A (ja) * | 2006-12-06 | 2008-06-26 | Hiroshima Univ | 電界効果トランジスタ |
| JP2013033982A (ja) * | 2007-03-26 | 2013-02-14 | Fujifilm Corp | 有機電界発光素子 |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2010528110A (ja) * | 2007-06-05 | 2010-08-19 | エルジー・ケム・リミテッド | 光学異方性化合物及びこれを含む樹脂組成物 |
| US8883952B2 (en) | 2007-06-05 | 2014-11-11 | Lg Chem, Ltd. | Optically anisotropic compound and resin composition comprising the same |
| JP2014159399A (ja) * | 2007-06-05 | 2014-09-04 | Lg Chem Ltd | 光学異方性化合物及びこれを含む樹脂組成物 |
| US7846559B2 (en) | 2007-11-16 | 2010-12-07 | Samsung Mobile Display Co., Ltd. | Heterocyclic compound and an organic light emitting device comprising the same |
| US8057920B2 (en) | 2007-11-16 | 2011-11-15 | Samsung Mobile Display Co., Ltd. | Heterocyclic compound and organic light emitting device comprising the same |
| CN101434605B (zh) * | 2007-11-16 | 2013-07-17 | 三星显示有限公司 | 杂环化合物以及包括该杂环化合物的有机发光装置 |
| EP2060574A1 (de) | 2007-11-16 | 2009-05-20 | Samsung Mobile Display Co., Ltd. | Heterozyklische Verbindung und organische lichtemittierende Vorrichtung damit |
| JP2019019137A (ja) * | 2007-12-03 | 2019-02-07 | 株式会社半導体エネルギー研究所 | 化合物 |
| US10556864B2 (en) | 2007-12-03 | 2020-02-11 | Semiconductor Energy Laboratory Co., Ltd. | Carbazole derivative, and light-emitting element, light-emitting device, and electronic device using the carbazole derivative |
| JP5400623B2 (ja) * | 2008-02-04 | 2014-01-29 | 出光興産株式会社 | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2009099060A1 (ja) * | 2008-02-04 | 2009-08-13 | Idemitsu Kosan Co., Ltd. | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| DE102008008953B4 (de) | 2008-02-13 | 2019-05-09 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2009190999A (ja) * | 2008-02-13 | 2009-08-27 | Osaka Univ | 縮合環化合物及びその製造方法、重合体、これらを含む有機薄膜、並びに、これを備える有機薄膜素子及び有機薄膜トランジスタ。 |
| DE102008008953A1 (de) | 2008-02-13 | 2009-08-20 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US8993123B2 (en) | 2008-02-13 | 2015-03-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102008017591A1 (de) | 2008-04-07 | 2009-10-08 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US8795848B2 (en) | 2008-05-08 | 2014-08-05 | Nippon Steel & Sumikin Chemical Co., Ltd. | Indolocarbazole derivative with fused heterocyclic aromatic group for organic electroluminescent device and organic electroluminescent device containing same |
| WO2009136595A1 (ja) * | 2008-05-08 | 2009-11-12 | 新日鐵化学株式会社 | 有機電界発光素子用化合物及び有機電界発光素子 |
| US8766001B2 (en) | 2008-05-19 | 2014-07-01 | Merck Patent Gmbh | Compounds for electronic devices |
| KR100938796B1 (ko) * | 2008-05-19 | 2010-01-27 | 메르크 파텐트 게엠베하 | 유기 전자 소자용 화합물 |
| CN102026958B (zh) * | 2008-05-19 | 2014-08-20 | 默克专利有限公司 | 用于电子器件的化合物 |
| WO2009141026A1 (de) * | 2008-05-19 | 2009-11-26 | Merck Patent Gmbh, | Verbindungen für elektronische vorrichtungen |
| DE102008024182A1 (de) | 2008-05-19 | 2009-11-26 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtung |
| WO2009145016A1 (ja) | 2008-05-29 | 2009-12-03 | 出光興産株式会社 | 芳香族アミン誘導体及びそれらを用いた有機エレクトロルミネッセンス素子 |
| KR101523124B1 (ko) * | 2008-06-05 | 2015-05-26 | 이데미쓰 고산 가부시키가이샤 | 할로젠 화합물, 다환계 화합물 및 그것을 사용한 유기 전기발광 소자 |
| US20220407018A1 (en) * | 2008-06-05 | 2022-12-22 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| US9847493B2 (en) | 2008-06-05 | 2017-12-19 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| WO2009148015A1 (ja) | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| US8057919B2 (en) * | 2008-06-05 | 2011-11-15 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| US8318323B2 (en) | 2008-06-05 | 2012-11-27 | Idemitsu Kosan Co., Ltd. | Polycyclic compounds and organic electroluminescence device employing the same |
| US8049411B2 (en) * | 2008-06-05 | 2011-11-01 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| US10020454B2 (en) | 2008-06-05 | 2018-07-10 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| US8409730B2 (en) | 2008-06-05 | 2013-04-02 | Idemitsu Kosan Co., Ltd. | Crosslinked pi-conjugated heteroacene compound for organic electroluminescence device and organic electroluminescence device using the same |
| US9660203B2 (en) | 2008-06-05 | 2017-05-23 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| US10026907B2 (en) | 2008-06-05 | 2018-07-17 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| WO2009148062A1 (ja) | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | 多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| US11069862B2 (en) | 2008-06-05 | 2021-07-20 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| US8927118B2 (en) | 2008-06-05 | 2015-01-06 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| JP5238025B2 (ja) * | 2008-06-05 | 2013-07-17 | 出光興産株式会社 | 多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2009148016A1 (ja) | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| TWI450897B (zh) * | 2008-06-05 | 2014-09-01 | Idemitsu Kosan Co | Halogen compounds, polycyclic compounds and organic electroluminescent devices using the same |
| US9056870B2 (en) | 2008-06-05 | 2015-06-16 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| JP5666907B2 (ja) * | 2008-06-05 | 2015-02-12 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| CN105037368A (zh) * | 2008-06-05 | 2015-11-11 | 出光兴产株式会社 | 卤素化合物、多环系化合物及使用其的有机电致发光元件 |
| US8372529B2 (en) | 2008-06-05 | 2013-02-12 | Idemitsu Kosan Co., Ltd. | Crosslinked pi-conjugated heteroacene compound for organic electroluminescence device and organic electroluminescence device using the same |
| CN102056899B (zh) * | 2008-06-05 | 2013-11-20 | 出光兴产株式会社 | 多环化合物及使用其的有机电致发光元件 |
| KR101340241B1 (ko) | 2008-06-05 | 2013-12-10 | 이데미쓰 고산 가부시키가이샤 | 다환계 화합물 및 그것을 이용한 유기 전기발광 소자 |
| KR101500796B1 (ko) * | 2008-06-05 | 2015-03-09 | 이데미쓰 고산 가부시키가이샤 | 할로젠 화합물, 다환계 화합물 및 그것을 이용한 유기 전기발광 소자 |
| US11895917B2 (en) | 2008-06-05 | 2024-02-06 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device using the same |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2010045281A (ja) * | 2008-08-18 | 2010-02-25 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| DE102008045663A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Fluorverbrückte Assoziate für optoelektronische Anwendungen |
| DE102008049037A1 (de) | 2008-09-25 | 2010-04-22 | Merck Patent Gmbh | Neue Polymere mit niedriger Polydispersität |
| US8637168B2 (en) | 2008-10-08 | 2014-01-28 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| DE102008050841A1 (de) | 2008-10-08 | 2010-04-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008050841B4 (de) | 2008-10-08 | 2019-08-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010049050A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| KR20160028507A (ko) | 2008-11-25 | 2016-03-11 | 이데미쓰 고산 가부시키가이샤 | 방향족 아민 유도체 및 유기 전기발광 소자 |
| KR20110097784A (ko) | 2008-11-25 | 2011-08-31 | 이데미쓰 고산 가부시키가이샤 | 방향족 아민 유도체 및 유기 전기발광 소자 |
| WO2010061824A1 (ja) | 2008-11-25 | 2010-06-03 | 出光興産株式会社 | 芳香族アミン誘導体及び有機エレクトロルミネッセンス素子 |
| EP3156403A1 (de) | 2008-11-25 | 2017-04-19 | Idemitsu Kosan Co., Ltd | Aromatisches aminderivat und organisches elektrolumineszenzelement |
| JP2012510154A (ja) * | 2008-11-26 | 2012-04-26 | グレイセル・ディスプレイ・インコーポレーテッド | 電界発光化合物を発光材料として採用している電界発光素子 |
| DE102008063490B4 (de) | 2008-12-17 | 2023-06-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung und Verfahren zum Einstellen des Farbortes einer weiß emittierenden Elektrolumineszenzvorrichtung |
| DE102008063490A1 (de) | 2008-12-17 | 2010-06-24 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| US9475792B2 (en) | 2009-01-20 | 2016-10-25 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| DE102009005289B4 (de) | 2009-01-20 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung und elektronische Vorrichtungen, enthaltend diese |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005289A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US20110272684A1 (en) * | 2009-01-20 | 2011-11-10 | Amir Hossain Parham | Materials for organic electroluminescence devices |
| CN102272264A (zh) * | 2009-01-20 | 2011-12-07 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| WO2010083871A1 (de) | 2009-01-20 | 2010-07-29 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102009005290A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| CN102272264B (zh) * | 2009-01-20 | 2015-12-16 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| WO2010083872A3 (de) * | 2009-01-20 | 2010-09-23 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010083872A2 (de) | 2009-01-20 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US9034485B2 (en) | 2009-01-20 | 2015-05-19 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2010083873A1 (de) | 2009-01-20 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010083869A2 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US9006503B2 (en) | 2009-01-23 | 2015-04-14 | Merck Patent Gmbh | Organic electroluminescence devices containing substituted benzo[C]phenanthrenes |
| US8710284B2 (en) | 2009-01-23 | 2014-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices containing substituted 10-benzo[c]phenanthrenes |
| DE102009005746A1 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US9066410B2 (en) | 2009-02-17 | 2015-06-23 | Merck Patent Gmbh | Organic electronic device |
| DE102009009277B4 (de) | 2009-02-17 | 2023-12-07 | Merck Patent Gmbh | Organische elektronische Vorrichtung, Verfahren zu deren Herstellung und Verwendung von Verbindungen |
| DE102009009277A1 (de) | 2009-02-17 | 2010-08-19 | Merck Patent Gmbh | Organische elektronische Vorrichtung |
| WO2010094378A1 (de) | 2009-02-17 | 2010-08-26 | Merck Patent Gmbh | Organische elektronische vorrichtung |
| DE102009012346B4 (de) | 2009-03-09 | 2024-02-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung und Verfahren zu deren Herstellung |
| DE102009012346A1 (de) | 2009-03-09 | 2010-09-16 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2010102706A1 (de) | 2009-03-09 | 2010-09-16 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| US9444064B2 (en) | 2009-03-23 | 2016-09-13 | Merck Patent Gmbh | Organic electroluminescent device |
| DE102009014513A1 (de) | 2009-03-23 | 2010-09-30 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2010108579A1 (de) | 2009-03-23 | 2010-09-30 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2010115498A1 (de) | 2009-04-09 | 2010-10-14 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102009017064A1 (de) | 2009-04-09 | 2010-10-14 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| US20100295027A1 (en) * | 2009-05-22 | 2010-11-25 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device |
| KR101146930B1 (ko) * | 2009-05-22 | 2012-05-23 | 덕산하이메탈(주) | 2개이상의 오원자 헤테로 고리를 포함하는 화합물 및 이를 이용한 유기전기소자, 그 단말 |
| US9126970B2 (en) | 2009-05-29 | 2015-09-08 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102009023155A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010136110A3 (de) * | 2009-05-29 | 2011-05-26 | Merck Patent Gmbh | Polymere, die substituierte indenofluorenderivate als struktureinheit enthalten, verfahren zu deren herstellung sowie deren verwendung |
| WO2010136109A1 (de) * | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US9537105B2 (en) | 2009-05-29 | 2017-01-03 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US9349960B2 (en) | 2009-05-29 | 2016-05-24 | Merck Patent Gmbh | Compounds and polymers which contain substituted indenofluorene derivatives as structural unit, process for the preparation thereof, and the use thereof as electronic devices and mixtures and solutions |
| WO2010149259A2 (en) | 2009-06-22 | 2010-12-29 | Merck Patent Gmbh | Conducting formulation |
| WO2011000455A1 (de) | 2009-06-30 | 2011-01-06 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| US10125214B2 (en) | 2009-07-22 | 2018-11-13 | Merck Patent Gmbh | Materials for electronic devices |
| CN102625819B (zh) * | 2009-07-23 | 2015-12-02 | 罗门哈斯电子材料韩国有限公司 | 新有机电致发光化合物和使用该化合物的有机电致发光设备 |
| CN102625819A (zh) * | 2009-07-23 | 2012-08-01 | 罗门哈斯电子材料韩国有限公司 | 新有机电致发光化合物和使用该化合物的有机电致发光设备 |
| DE102009034625A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011012212A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2011015265A2 (en) | 2009-08-04 | 2011-02-10 | Merck Patent Gmbh | Electronic devices comprising multi cyclic hydrocarbons |
| CN102001988B (zh) * | 2009-09-02 | 2014-10-01 | 三星显示有限公司 | 杂环化合物和包括该杂环化合物的有机发光装置 |
| EP2301920A1 (de) * | 2009-09-02 | 2011-03-30 | Samsung Mobile Display Co., Ltd. | Naphthoindol Derivate enthaltende organische lichtemittierende Vorrichtung |
| CN102001988A (zh) * | 2009-09-02 | 2011-04-06 | 三星移动显示器株式会社 | 杂环化合物和包括该杂环化合物的有机发光装置 |
| US8362470B2 (en) | 2009-09-04 | 2013-01-29 | Samsung Display Co., Ltd. | Organic light emitting device |
| EP2292618A1 (de) * | 2009-09-04 | 2011-03-09 | Samsung Mobile Display Co., Ltd. | Polycyclische Heteroaryl Verbindungen enthaltenden organische lichtemittierende Vorrichtung |
| CN102010414A (zh) * | 2009-09-04 | 2011-04-13 | 三星移动显示器株式会社 | 杂环化合物及包含其的有机发光装置和平板显示设备 |
| CN102010414B (zh) * | 2009-09-04 | 2015-11-25 | 三星显示有限公司 | 杂环化合物及包含其的有机发光装置和平板显示设备 |
| DE102009041289A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011032624A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2011032686A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Formulierungen zur herstellung von elektronischen vorrichtungen |
| WO2011035836A1 (de) | 2009-09-23 | 2011-03-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2011035835A1 (de) | 2009-09-23 | 2011-03-31 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102009042680A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009051172A1 (de) | 2009-10-29 | 2011-05-05 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011050888A1 (de) | 2009-10-29 | 2011-05-05 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009053191A1 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011054442A2 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| WO2011057701A1 (de) | 2009-11-10 | 2011-05-19 | Merck Patent Gmbh | Organische verbindungen für elektroluminiszenz vorrichtungen |
| US9090590B2 (en) | 2009-11-10 | 2015-07-28 | Merck Patent Gmbh | Organic compounds for electroluminescent devices |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011060859A1 (de) | 2009-11-17 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3176241A1 (de) * | 2009-12-07 | 2017-06-07 | Nippon Steel & Sumikin Chemical Co., Ltd. | Organisches lichtemittierendes material und organisches lichtemittierendes element |
| EP4039774A1 (de) * | 2009-12-07 | 2022-08-10 | NIPPON STEEL Chemical & Material Co., Ltd. | Organisches lichtemittierendes material und organisches lichtemittierendes element |
| WO2011076323A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Formulations comprising phase-separated functional materials |
| WO2011076314A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent formulations |
| WO2011076326A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent functional surfactants |
| WO2011076325A1 (en) | 2009-12-23 | 2011-06-30 | Merck Patent Gmbh | Compositions comprising polymeric binders |
| WO2011076324A1 (en) | 2009-12-23 | 2011-06-30 | Merck Patent Gmbh | Compositions comprising organic semiconducting compounds |
| WO2011076380A1 (en) | 2009-12-23 | 2011-06-30 | Merck Patent Gmbh | Composition for the preparation of organic electronic (oe) devices |
| EP2725632A1 (de) | 2009-12-23 | 2014-04-30 | Merck Patent GmbH | Verwendung von zusammensetzungen mit inerten polymerbindern zur herstellung einer lichtmittierenden diode |
| WO2011090149A1 (ja) | 2010-01-21 | 2011-07-28 | 出光興産株式会社 | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2011088877A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010005697A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent GmbH, 64293 | Verbindungen für elektronische Vorrichtungen |
| DE102010006377A1 (de) | 2010-01-29 | 2011-08-04 | Merck Patent GmbH, 64293 | Styrolbasierte Copolymere, insbesondere für die Anwendung in optoelektronischen Bauteilen |
| WO2011091838A1 (de) | 2010-01-29 | 2011-08-04 | Merck Patent Gmbh | Styrolbasierte copolymere, insbesondere für die anwendung in optoelektronischen bauteilen |
| WO2011091946A1 (de) | 2010-01-30 | 2011-08-04 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung mit integrierter schicht zur farbkonvertierung |
| DE102010006280A1 (de) | 2010-01-30 | 2011-08-04 | Merck Patent GmbH, 64293 | Farbkonvertierung |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2011107186A2 (de) | 2010-03-02 | 2011-09-09 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010010481A1 (de) | 2010-03-06 | 2011-09-08 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011110262A1 (de) | 2010-03-06 | 2011-09-15 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2011110276A1 (de) | 2010-03-09 | 2011-09-15 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102010010631A1 (de) | 2010-03-09 | 2011-09-15 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011110275A2 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Radiative fibers |
| WO2011110277A1 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Fibers in therapy and cosmetics |
| WO2011116869A1 (de) | 2010-03-26 | 2011-09-29 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010013068A1 (de) | 2010-03-26 | 2011-09-29 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2011128035A1 (en) | 2010-04-12 | 2011-10-20 | Merck Patent Gmbh | Composition and method for preparation of organic electronic devices |
| WO2011128034A1 (en) | 2010-04-12 | 2011-10-20 | Merck Patent Gmbh | Composition having improved performance |
| WO2011128017A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Überbrückte triarylamine und -phosphine als materialien für elektronische vorrichtungen |
| US9422287B2 (en) | 2010-04-14 | 2016-08-23 | Merck Patent Gmbh | Bridged triarylamines and -phosphines as materials for electronic devices |
| DE102010014933A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| CN102971319A (zh) * | 2010-04-14 | 2013-03-13 | 默克专利有限公司 | 作为用于电子器件的材料的桥接三芳基胺和三芳基膦 |
| CN102971319B (zh) * | 2010-04-14 | 2016-08-03 | 默克专利有限公司 | 作为用于电子器件的材料的桥接三芳基胺和三芳基膦 |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| DE102010020044A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011141109A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2011149284A3 (ko) * | 2010-05-26 | 2012-04-19 | 덕산하이메탈(주) | 헤테로 원자를 포함하는 카바졸과 플루오렌이 융합된 화합물 및 이를 이용한 유기전기소자, 그 단말 |
| WO2011149284A2 (ko) * | 2010-05-26 | 2011-12-01 | 덕산하이메탈(주) | 헤테로 원자를 포함하는 카바졸과 플루오렌이 융합된 화합물 및 이를 이용한 유기전기소자, 그 단말 |
| WO2011147523A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Formulation and method for preparation of organic electronic devices |
| WO2011147521A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Down conversion |
| WO2011147522A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Compositions comprising quantum dots |
| EP3309236A1 (de) | 2010-05-27 | 2018-04-18 | Merck Patent GmbH | Zusammensetzungen mit quantenpunkten |
| WO2011157346A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011160757A1 (de) | 2010-06-22 | 2011-12-29 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012013270A1 (en) | 2010-07-26 | 2012-02-02 | Merck Patent Gmbh | Nanocrystals in devices |
| WO2012013272A1 (en) | 2010-07-26 | 2012-02-02 | Merck Patent Gmbh | Quantum dots and hosts |
| US9893297B2 (en) | 2010-08-05 | 2018-02-13 | Merck Patent Gmbh | Materials for electronic devices |
| US10749117B2 (en) | 2010-08-05 | 2020-08-18 | Merck Patent Gmbh | Materials for electronic devices |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2012016630A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102010048074A1 (de) | 2010-10-09 | 2012-04-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2012045384A1 (de) | 2010-10-09 | 2012-04-12 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102010048607A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012048781A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien auf basis von triphenylen für organische elektrolumineszenzvorrichtungen |
| WO2012048780A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010054316A1 (de) | 2010-12-13 | 2012-06-14 | Merck Patent Gmbh | Substituierte Tetraarylbenzole |
| WO2012079678A1 (de) | 2010-12-13 | 2012-06-21 | Merck Patent Gmbh | Substituierte tetraarylbenzole |
| DE102010054525A1 (de) | 2010-12-15 | 2012-04-26 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2012079673A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102010055902A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010055901A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2012084115A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012084114A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012095143A1 (de) | 2011-01-13 | 2012-07-19 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| DE102011011104A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte Dibenzonaphtacene |
| WO2012107163A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte dibenzonaphtacene |
| WO2012110178A1 (en) | 2011-02-14 | 2012-08-23 | Merck Patent Gmbh | Device and method for treatment of cells and cell tissue |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012110182A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012126566A1 (en) | 2011-03-24 | 2012-09-27 | Merck Patent Gmbh | Organic ionic functional materials |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012152366A1 (en) | 2011-05-12 | 2012-11-15 | Merck Patent Gmbh | Organic ionic compounds, compositions and electronic devices |
| WO2012159213A1 (en) * | 2011-05-25 | 2012-11-29 | American Dye Source, Inc. | Compounds with oxime ester and/or acyl groups |
| US9382259B2 (en) | 2011-05-25 | 2016-07-05 | American Dye Source, Inc. | Compounds with oxime ester and/or acyl groups |
| US9127017B2 (en) | 2011-05-25 | 2015-09-08 | American Dye Source, Inc. | Compounds with oxime ester and/or acyl groups |
| WO2012163464A1 (en) | 2011-06-01 | 2012-12-06 | Merck Patent Gmbh | Hybrid ambipolar tfts |
| WO2012171609A1 (de) | 2011-06-17 | 2012-12-20 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102011104745A1 (de) | 2011-06-17 | 2012-12-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2013013754A1 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Copolymers with functionalized side chains |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP3439065A1 (de) | 2011-08-03 | 2019-02-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| DE102012016192A1 (de) | 2011-08-19 | 2013-02-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2013026515A1 (de) | 2011-08-22 | 2013-02-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2013050101A1 (de) | 2011-10-06 | 2013-04-11 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2013060418A1 (en) | 2011-10-27 | 2013-05-02 | Merck Patent Gmbh | Materials for electronic devices |
| WO2013060411A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte polymere, verfahren zu deren herstellung sowie deren verwendung in elektronischen vorrichtungen |
| DE102011117422A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung in elektronischen Vorrichtungen |
| WO2013087162A1 (de) | 2011-12-13 | 2013-06-20 | Merck Patent Gmbh | Organische sensibilisatoren für die aufwärtskonvers ion (up-conversion) |
| DE102011121022A1 (de) | 2011-12-13 | 2013-06-13 | Merck Patent Gmbh | Organische Sensibilisatoren für Up- Conversion |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| US10121973B2 (en) | 2011-12-30 | 2018-11-06 | Cheil Industries, Inc. | Compound for organic optoelectronic device, organic light-emitting diode including same, and display device including organic light-emitting diode |
| WO2013113349A1 (en) | 2012-01-30 | 2013-08-08 | Merck Patent Gmbh | Nanocrystals on fibers |
| EP3235892A1 (de) | 2012-02-14 | 2017-10-25 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3101088A1 (de) | 2012-02-14 | 2016-12-07 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| EP3460864A1 (de) | 2012-03-15 | 2019-03-27 | Merck Patent GmbH | Elektronische vorrichtungen |
| WO2013135352A1 (de) | 2012-03-15 | 2013-09-19 | Merck Patent Gmbh | Elektronische vorrichtungen |
| EP4369378A2 (de) | 2012-03-15 | 2024-05-15 | Merck Patent GmbH | Elektronische vorrichtungen |
| US9196842B2 (en) | 2012-06-29 | 2015-11-24 | Idemitsu Kosan Co., Ltd. | Aromatic amine derivative and organic electroluminescent element |
| CN102766085A (zh) * | 2012-08-08 | 2012-11-07 | 中山大学 | 含咔唑和大共轭结构的新型功能二胺单体及其制备方法和用途 |
| EP2889296A4 (de) * | 2012-08-21 | 2016-06-15 | Cheil Ind Inc | Verbindung für eine organische optoelektronische vorrichtung, organische lichtemittierende diode damit und anzeigevorrichtung mit der organischen lichtemittierenden diode |
| US10333081B2 (en) | 2012-08-21 | 2019-06-25 | Samsung Sdi Co., Ltd. | Compound for organic optoelectronic device, organic light emitting diode including the same and display including the organic light emitting diode |
| US9899607B2 (en) | 2012-08-21 | 2018-02-20 | Samsung Sdi Co., Ltd. | Compound for organic optoelectronic device, organic light emitting diode including the same and display including the organic light emitting diode |
| US9586972B2 (en) | 2012-08-27 | 2017-03-07 | Fujifilm Corporation | Organic thin film transistor, organic semiconductor thin film, and organic semiconductor material |
| US9714253B2 (en) | 2012-08-27 | 2017-07-25 | Fujifilm Corporation | Organic thin film transistor, organic semiconductor thin film, and organic semiconductor material |
| KR20150048182A (ko) | 2012-08-27 | 2015-05-06 | 후지필름 가부시키가이샤 | 유기 박막 트랜지스터, 유기 반도체 박막 및 유기 반도체 재료 |
| WO2014044344A1 (de) | 2012-09-18 | 2014-03-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014056565A1 (de) * | 2012-10-09 | 2014-04-17 | Merck Patent Gmbh | Elektronische vorrichtung |
| US9917272B2 (en) | 2012-10-09 | 2018-03-13 | Merck Patent Gmbh | Electronic device |
| US10270052B2 (en) | 2012-10-09 | 2019-04-23 | Merck Patent Gmbh | Electronic device |
| EP3806176A1 (de) | 2012-10-31 | 2021-04-14 | Merck Patent GmbH | Elektronische vorrichtung |
| WO2014067614A1 (de) | 2012-10-31 | 2014-05-08 | Merck Patent Gmbh | Elektronische vorrichtung |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106523A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US9530966B2 (en) | 2013-03-28 | 2016-12-27 | Sumitomo Chemical Company, Limited | Polymer compound and light emitting device using the same |
| KR101554600B1 (ko) | 2013-06-07 | 2015-09-22 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| US9425416B2 (en) | 2013-06-07 | 2016-08-23 | Samsung Display Co., Ltd. | Condensed cyclic compound and organic light-emitting device including the same |
| WO2015014427A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elektrooptische vorrichtung und deren verwendung |
| WO2015014429A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elekrolumineszenzvorrichtung |
| EP3647393A1 (de) | 2013-07-30 | 2020-05-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| EP3712229A1 (de) | 2013-07-30 | 2020-09-23 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| US9755157B2 (en) | 2013-08-05 | 2017-09-05 | Cheil Industries, Inc. | Organic compound and organic optoelectric device and display device |
| US9978950B2 (en) | 2013-08-15 | 2018-05-22 | Merck Patent Gmbh | Materials for electronic devices |
| WO2015022051A1 (de) * | 2013-08-15 | 2015-02-19 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US10665790B2 (en) | 2013-08-15 | 2020-05-26 | Merck Patent Gmbh | Materials for electronic devices |
| US9837617B2 (en) | 2013-08-15 | 2017-12-05 | Merck Patent Gmbh | Materials for electronic devices |
| WO2015082046A2 (de) | 2013-12-06 | 2015-06-11 | Merck Patent Gmbh | Substituierte oxepine |
| WO2015082037A1 (en) | 2013-12-06 | 2015-06-11 | Merck Patent Gmbh | Compositions containing a polymeric binder which comprises acrylic and/or methacrylic acid ester units |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US11075346B2 (en) | 2013-12-20 | 2021-07-27 | Udc Ireland Limited | Highly efficient OLED devices with very short decay times |
| US10347851B2 (en) | 2013-12-20 | 2019-07-09 | Udc Ireland Limited | Highly efficient OLED devices with very short decay times |
| EP3916822A1 (de) | 2013-12-20 | 2021-12-01 | UDC Ireland Limited | Hocheffiziente oled-vorrichtungen mit sehr kurzer abklingzeit |
| US11765967B2 (en) | 2013-12-20 | 2023-09-19 | Udc Ireland Limited | Highly efficient OLED devices with very short decay times |
| US10957864B2 (en) | 2014-02-28 | 2021-03-23 | Merck Patent Gmbh | Materials for organic light-emitting devices |
| WO2015128052A1 (de) * | 2014-02-28 | 2015-09-03 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| KR102362338B1 (ko) | 2014-02-28 | 2022-02-11 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| KR20160126076A (ko) * | 2014-02-28 | 2016-11-01 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| EP3533794A2 (de) | 2014-04-30 | 2019-09-04 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2015165563A1 (de) | 2014-04-30 | 2015-11-05 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102014008722A1 (de) | 2014-06-18 | 2015-12-24 | Merck Patent Gmbh | Zusammensetzungen für elektronische Vorrichtungen |
| WO2015192941A1 (de) | 2014-06-18 | 2015-12-23 | Merck Patent Gmbh | Zusammensetzungen für elektronische vorrichtungen |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| JP2015092574A (ja) * | 2014-11-17 | 2015-05-14 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| US10840450B2 (en) | 2014-12-04 | 2020-11-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Polymer, and mixture or formulation, and organic electronic device containing same, and monomer thereof |
| US10323180B2 (en) | 2014-12-04 | 2019-06-18 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Deuterated organic compound, mixture and composition containing said compound, and organic electronic device |
| US10573827B2 (en) | 2014-12-11 | 2020-02-25 | Guangzhou Chinaray Optoelectronics Materials Ltd. | Organic metal complex, and polymer, mixture, composition and organic electronic device containing same and use thereof |
| US10510967B2 (en) | 2014-12-11 | 2019-12-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Organic compound, and mixture, formulation and organic device comprising the same |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016120007A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Formulations with a low particle content |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016124304A1 (de) | 2015-02-03 | 2016-08-11 | Merck Patent Gmbh | Metallkomplexe |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| WO2016184540A1 (en) | 2015-05-18 | 2016-11-24 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP4060757A1 (de) | 2015-06-03 | 2022-09-21 | UDC Ireland Limited | Hocheffiziente oled-vorrichtungen mit sehr kurzer abklingzeit |
| WO2016193243A1 (en) | 2015-06-03 | 2016-12-08 | Udc Ireland Limited | Highly efficient oled devices with very short decay times |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| EP3581633A1 (de) | 2015-06-12 | 2019-12-18 | Merck Patent GmbH | Ester mit nichtaromatischen zyklen als lösungsmittel für oled-formulierungen |
| WO2017008883A1 (en) | 2015-07-15 | 2017-01-19 | Merck Patent Gmbh | Composition comprising organic semiconducting compounds |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| US10790456B2 (en) | 2015-08-12 | 2020-09-29 | Merck Patent Gmbh | Materials for electronic devices |
| WO2017025165A1 (de) * | 2015-08-12 | 2017-02-16 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| US11158816B2 (en) | 2015-08-28 | 2021-10-26 | Merck Patent Gmbh | 6,9,15,18-tetrahydro-s-indaceno[1,2-b:5,6-b′]difluorene derivatives and use thereof in electronic devices |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2017036574A1 (de) * | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | 6,9,15,18-tetrahydro-s-indaceno[1,2-b:5,6-b']difluoren- derivate und ihre verwendung in elektronischen vorrichtungen |
| US11555128B2 (en) | 2015-11-12 | 2023-01-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Printing composition, electronic device comprising same and preparation method for functional material thin film |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| EP4084109A1 (de) | 2015-12-15 | 2022-11-02 | Merck Patent GmbH | Ester mit aromatischen gruppen als lösungsmittel für organische elektronische formulierungen |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017102822A1 (en) * | 2015-12-18 | 2017-06-22 | Novaled Gmbh | Electron injection layer for an organic light-emitting diode (oled) |
| CN108463898A (zh) * | 2015-12-18 | 2018-08-28 | 诺瓦尔德股份有限公司 | 用于有机发光二极管(oled)的电子注入层 |
| CN108463898B (zh) * | 2015-12-18 | 2021-12-10 | 诺瓦尔德股份有限公司 | 用于有机发光二极管(oled)的电子注入层 |
| EP3182478A1 (de) * | 2015-12-18 | 2017-06-21 | Novaled GmbH | Elektroneninjektionsschicht für eine organische leuchtdiode (oled) |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017157783A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine formulierung enthaltend mindestens einen organischen halbleiter |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| EP3792235A1 (de) | 2016-07-08 | 2021-03-17 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| EP4113643A1 (de) | 2016-10-10 | 2023-01-04 | Merck Patent GmbH | Elektronische vorrichtung |
| EP4255151A2 (de) | 2016-10-10 | 2023-10-04 | Merck Patent GmbH | Spiro[fluoren-9,9'-(thio)xanthen] verbindungen |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| US11512039B2 (en) | 2016-11-23 | 2022-11-29 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Aromatic amine derivatives, preparation methods therefor, and uses thereof |
| WO2018095392A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 有机混合物、组合物以及有机电子器件 |
| US11634444B2 (en) | 2016-11-23 | 2023-04-25 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Metal organic complex, high polymer, composition, and organic electronic component |
| US11248138B2 (en) | 2016-11-23 | 2022-02-15 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Printing ink formulations, preparation methods and uses thereof |
| US11447496B2 (en) | 2016-11-23 | 2022-09-20 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Nitrogen-containing fused heterocyclic ring compound and application thereof |
| US11518723B2 (en) | 2016-11-23 | 2022-12-06 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Fused ring compound, high polymer, mixture, composition and organic electronic component |
| WO2018095381A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 印刷油墨组合物及其制备方法和用途 |
| WO2018095395A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 高聚物、包含其的混合物、组合物和有机电子器件以及用于聚合的单体 |
| US11453745B2 (en) | 2016-11-23 | 2022-09-27 | Guangzhou Chinaray Optoelectronic Materials Ltd. | High polymer, mixture containing same, composition, organic electronic component, and monomer for polymerization |
| WO2018095940A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused indeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095888A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused 2,8-diaminoindeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| CN109790456A (zh) * | 2016-11-30 | 2019-05-21 | 广州华睿光电材料有限公司 | 稠环化合物及其应用、混合物、有机电子器件 |
| WO2018099433A1 (zh) * | 2016-11-30 | 2018-06-07 | 广州华睿光电材料有限公司 | 稠环化合物及其应用、混合物、有机电子器件 |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| US10978642B2 (en) | 2016-12-08 | 2021-04-13 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Mixture, composition and organic electronic device |
| US11672174B2 (en) | 2016-12-08 | 2023-06-06 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Pyrene-triazine derivative and applications thereof in organic electronic component |
| WO2018103744A1 (zh) | 2016-12-08 | 2018-06-14 | 广州华睿光电材料有限公司 | 混合物、组合物及有机电子器件 |
| US11161933B2 (en) | 2016-12-13 | 2021-11-02 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Conjugated polymer and use thereof in organic electronic device |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114882A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US11292875B2 (en) | 2016-12-22 | 2022-04-05 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Cross-linkable polymer based on Diels-Alder reaction and use thereof in organic electronic device |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| WO2018134392A1 (en) | 2017-01-23 | 2018-07-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018158232A1 (en) | 2017-03-01 | 2018-09-07 | Merck Patent Gmbh | Organic electroluminescent device |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018189134A1 (de) | 2017-04-13 | 2018-10-18 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2018197447A1 (de) | 2017-04-25 | 2018-11-01 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018234220A1 (de) | 2017-06-21 | 2018-12-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019002198A1 (en) | 2017-06-26 | 2019-01-03 | Merck Patent Gmbh | HOMOGENEOUS MIXTURES |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| WO2019007823A1 (en) | 2017-07-03 | 2019-01-10 | Merck Patent Gmbh | LOW-PHENOL IMPURITY FORMULATIONS |
| WO2019007867A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| EP4186898A1 (de) | 2017-07-05 | 2023-05-31 | Merck Patent GmbH | Zusammensetzung für organische elektronische verbindungen |
| WO2019007866A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| WO2019020538A1 (de) | 2017-07-25 | 2019-01-31 | Merck Patent Gmbh | Metallkomplexe |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| CN111051293A (zh) * | 2017-09-08 | 2020-04-21 | 默克专利有限公司 | 用于电子器件的材料 |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019048458A1 (de) * | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| CN111051293B (zh) * | 2017-09-08 | 2024-02-13 | 默克专利有限公司 | 用于电子器件的材料 |
| WO2019076789A1 (en) | 2017-10-17 | 2019-04-25 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| KR20200083463A (ko) | 2017-11-02 | 2020-07-08 | 이데미쓰 고산 가부시키가이샤 | 신규 화합물 및 유기 일렉트로루미네센스 소자 |
| WO2019096717A2 (de) | 2017-11-14 | 2019-05-23 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| EP4242286A2 (de) | 2017-11-23 | 2023-09-13 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019101835A1 (en) | 2017-11-24 | 2019-05-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019101833A1 (en) | 2017-11-24 | 2019-05-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US10658594B2 (en) | 2017-12-06 | 2020-05-19 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and novel compound |
| US10672989B2 (en) | 2017-12-06 | 2020-06-02 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and novel compound |
| WO2019115423A1 (de) | 2017-12-13 | 2019-06-20 | Merck Patent Gmbh | Metallkomplexe |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| WO2019158453A1 (de) | 2018-02-13 | 2019-08-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019170578A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019170572A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN111819167A (zh) * | 2018-03-16 | 2020-10-23 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP3569603A1 (de) | 2018-05-14 | 2019-11-20 | Idemitsu Kosan Co., Ltd. | Polycyclische verbindung und organisches elektrolumineszenzelement mit der polycyclischen verbindung |
| WO2019229011A1 (de) | 2018-05-30 | 2019-12-05 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2020043646A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043657A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043640A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020053150A1 (en) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| WO2020089138A1 (en) | 2018-10-31 | 2020-05-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2020165064A1 (de) | 2019-02-11 | 2020-08-20 | Merck Patent Gmbh | Mononukleare iridiumkomplexe mit drei ortho-metallierten bidentaten liganden und optischer orientierungsanisotropie |
| WO2020169241A1 (de) | 2019-02-18 | 2020-08-27 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2020178230A1 (en) | 2019-03-04 | 2020-09-10 | Merck Patent Gmbh | Ligands for nano-sized materials |
| WO2020208051A1 (en) | 2019-04-11 | 2020-10-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN110256473B (zh) * | 2019-06-28 | 2022-03-11 | 武汉天马微电子有限公司 | 一种化合物、有机光电装置和电子设备 |
| CN110256473A (zh) * | 2019-06-28 | 2019-09-20 | 武汉天马微电子有限公司 | 一种化合物、有机光电装置和电子设备 |
| WO2021052921A1 (de) | 2019-09-19 | 2021-03-25 | Merck Patent Gmbh | Mischung von zwei hostmaterialien und organische elektrolumineszierende vorrichtung damit |
| CN110615783B (zh) * | 2019-09-23 | 2021-04-20 | 大连理工大学 | 一类以吡嗪并茚酮为电子受体的电致发光材料及应用 |
| CN110615783A (zh) * | 2019-09-23 | 2019-12-27 | 大连理工大学 | 一类以吡嗪并茚酮为电子受体的电致发光材料及应用 |
| WO2021089450A1 (en) | 2019-11-04 | 2021-05-14 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021089447A1 (de) | 2019-11-04 | 2021-05-14 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021094269A1 (en) | 2019-11-12 | 2021-05-20 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021110741A1 (en) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021110720A1 (de) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Metallkomplexe |
| WO2021180625A1 (de) | 2020-03-11 | 2021-09-16 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021180614A1 (de) | 2020-03-11 | 2021-09-16 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021180950A1 (en) | 2020-03-13 | 2021-09-16 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021191058A1 (en) | 2020-03-23 | 2021-09-30 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021213917A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Emulsions comprising organic functional materials |
| WO2021239772A1 (de) | 2020-05-29 | 2021-12-02 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021259824A1 (de) | 2020-06-23 | 2021-12-30 | Merck Patent Gmbh | Verfahren zur herstellung einer mischung |
| WO2022017998A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022017997A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022069380A1 (de) | 2020-09-29 | 2022-04-07 | Merck Patent Gmbh | Mononukleare tripodale hexadentate iridium komplexe zur verwendung in oleds |
| WO2022078432A1 (zh) | 2020-10-14 | 2022-04-21 | 浙江光昊光电科技有限公司 | 组合物及其在光电领域的应用 |
| WO2022112541A1 (en) | 2020-11-30 | 2022-06-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| WO2022214507A1 (en) | 2021-04-09 | 2022-10-13 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022214506A1 (en) | 2021-04-09 | 2022-10-13 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022214566A1 (en) | 2021-04-09 | 2022-10-13 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP4079742A1 (de) | 2021-04-14 | 2022-10-26 | Merck Patent GmbH | Metallkomplexe |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022243403A1 (de) | 2021-05-21 | 2022-11-24 | Merck Patent Gmbh | Verfahren zur kontinuierlichen aufreinigung von mindestens einem funktionalen material und vorrichtung zur kontinuierlichen aufreinigung von mindestens einem funktionalen material |
| WO2022200638A1 (de) | 2021-07-06 | 2022-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023012084A1 (en) | 2021-08-02 | 2023-02-09 | Merck Patent Gmbh | A printing method by combining inks |
| WO2023031073A1 (en) | 2021-08-31 | 2023-03-09 | Merck Patent Gmbh | Composition |
| WO2023036976A1 (en) | 2021-09-13 | 2023-03-16 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2023052314A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052272A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052275A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052313A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2023094412A1 (de) | 2021-11-25 | 2023-06-01 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023117837A1 (de) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023152346A1 (de) | 2022-02-14 | 2023-08-17 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023208899A1 (en) | 2022-04-28 | 2023-11-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2023222559A1 (de) | 2022-05-18 | 2023-11-23 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023237458A1 (en) | 2022-06-07 | 2023-12-14 | Merck Patent Gmbh | Method of printing a functional layer of an electronic device by combining inks |
| WO2023247663A1 (de) | 2022-06-24 | 2023-12-28 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2023247662A1 (de) | 2022-06-24 | 2023-12-28 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2024013004A1 (de) | 2022-07-11 | 2024-01-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024033282A1 (en) | 2022-08-09 | 2024-02-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024094670A1 (en) | 2022-11-04 | 2024-05-10 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024105066A1 (en) | 2022-11-17 | 2024-05-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024126635A1 (en) | 2022-12-16 | 2024-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2024132892A1 (en) | 2022-12-19 | 2024-06-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024132993A1 (de) | 2022-12-19 | 2024-06-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024133048A1 (en) | 2022-12-20 | 2024-06-27 | Merck Patent Gmbh | Method for preparing deuterated aromatic compounds |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2006246743A1 (en) | 2006-11-23 |
| CA2608765A1 (en) | 2006-11-23 |
| RU2007146793A (ru) | 2009-06-27 |
| CA2608765C (en) | 2014-01-28 |
| US8852756B2 (en) | 2014-10-07 |
| AU2006246743B2 (en) | 2012-05-31 |
| RU2419648C2 (ru) | 2011-05-27 |
| CN101228250B (zh) | 2016-08-10 |
| EP1883688A1 (de) | 2008-02-06 |
| DE102005023437A1 (de) | 2006-11-30 |
| TWI428424B (zh) | 2014-03-01 |
| BRPI0610859A2 (pt) | 2010-08-03 |
| MX2007014449A (es) | 2008-02-07 |
| KR101346467B1 (ko) | 2014-01-02 |
| KR20080015865A (ko) | 2008-02-20 |
| JP5237090B2 (ja) | 2013-07-17 |
| JP2008545630A (ja) | 2008-12-18 |
| US9461249B2 (en) | 2016-10-04 |
| US20150031896A1 (en) | 2015-01-29 |
| CN101228250A (zh) | 2008-07-23 |
| EP1883688B1 (de) | 2018-04-11 |
| US20080220285A1 (en) | 2008-09-11 |
| TW200706636A (en) | 2007-02-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1883688B1 (de) | Verbindungen für organische elektronische vorrichtungen | |
| EP1869141B1 (de) | Verbindungen für organische elektronische vorrichtungen | |
| EP2001972B1 (de) | Materialen für organische elektrolumineszenzvorrichtungen | |
| EP1957605B1 (de) | Organische elektrolumineszenzvorrichtungen | |
| EP1817272B1 (de) | Verbindungen f]r organische elektronische vorrichtungen | |
| EP2046915B1 (de) | Neue materialien für organische elektrolumineszenzvorrichtungen | |
| EP1763501B1 (de) | Verbindungen für organische elektronische vorrichtungen | |
| EP1924670B1 (de) | Verbindungen für organische elektronische vorrichtungen | |
| EP1761962B1 (de) | Organische elektrolumineszenzvorrichtung | |
| DE112009003900B4 (de) | Verbindungen für elektronische Vorrichtungen, Verfahren zu deren Herstellung, deren Verwendung und elektronische Vorrichtungen | |
| EP2102309B1 (de) | Carbazol-derivate für organische elektrolumineszenzvorrichtungen | |
| EP1957603B1 (de) | Organische elektrolumineszenzvorrichtungen | |
| EP1999226B1 (de) | Neue materialien für organische elektrolumineszenzvorrichtungen | |
| EP2260023B1 (de) | Fluorenderivate für organische elektrolumineszenzvorrichtungen | |
| EP2663567A1 (de) | Verbindungen für organische elektrolumineszenzvorrichtungen | |
| WO2007140847A1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| WO2007022845A1 (de) | Neue materialien für organische elektrolumineszenzvorrichtungen | |
| DE102009005288A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| DE102008054141A1 (de) | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | ||
| WWE | Wipo information: entry into national phase |
Ref document number: 2006724488 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 12007502559 Country of ref document: PH |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2608765 Country of ref document: CA Ref document number: MX/a/2007/014449 Country of ref document: MX |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2008511579 Country of ref document: JP Ref document number: 200680017539.1 Country of ref document: CN |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWW | Wipo information: withdrawn in national office |
Ref document number: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 4836/KOLNP/2007 Country of ref document: IN |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2006246743 Country of ref document: AU Ref document number: 2007146793 Country of ref document: RU Ref document number: 1020077029742 Country of ref document: KR |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 11914824 Country of ref document: US |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2006246743 Country of ref document: AU |
|
| WWP | Wipo information: published in national office |
Ref document number: 2006246743 Country of ref document: AU |
|
| WWP | Wipo information: published in national office |
Ref document number: 2006724488 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: PI0610859 Country of ref document: BR Kind code of ref document: A2 |