DE102009031021A1 - Materialien für organische Elektrolumineszenzvorrichtungen - Google Patents
Materialien für organische Elektrolumineszenzvorrichtungen Download PDFInfo
- Publication number
- DE102009031021A1 DE102009031021A1 DE102009031021A DE102009031021A DE102009031021A1 DE 102009031021 A1 DE102009031021 A1 DE 102009031021A1 DE 102009031021 A DE102009031021 A DE 102009031021A DE 102009031021 A DE102009031021 A DE 102009031021A DE 102009031021 A1 DE102009031021 A1 DE 102009031021A1
- Authority
- DE
- Germany
- Prior art keywords
- group
- atoms
- substituted
- radicals
- aromatic ring
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 CC1*(C(C)(C)**(C)C2=C(*(C**)C3=C)C(*4)=NC3=*C)C2=C4C(C)(C)*1 Chemical compound CC1*(C(C)(C)**(C)C2=C(*(C**)C3=C)C(*4)=NC3=*C)C2=C4C(C)(C)*1 0.000 description 5
- BOWLXRFSHCRQSJ-UHFFFAOYSA-N CC1(C)c(cc(cc2)-c3ccccc3[N+]([O-])=O)c2-c2ccccc12 Chemical compound CC1(C)c(cc(cc2)-c3ccccc3[N+]([O-])=O)c2-c2ccccc12 BOWLXRFSHCRQSJ-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains three hetero rings
- C07D487/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S428/00—Stock material or miscellaneous articles
- Y10S428/917—Electroluminescent
Abstract
Die vorliegende Erfindung beschreibt neue Indenofluoren-Derivate, die vorzugsweise als Matrixmaterialien für phosphoreszierende Dotanden oder als Elektronentransportmaterialien eingesetzt werden können, insbesondere zur Verwendung in der Emissions- und/oder Ladungstransportschicht von Elektrolumineszenzvorrichtungen. Die Erfindung betrifft ferner Pten enthalten, und ein Verfahren zur Herstellung der erfindungsgemäßen Verbindungen sowie elektronische Vorrichtungen, die diese enthalten.
Description
- Die vorliegende Erfindung beschreibt neue Indenocarbazol-Derivate, die vorzugsweise als Matrixmaterialien für phosphoreszierende Dotanden oder als Elektronentransportmaterialien eingesetzt werden können, insbesondere zur Verwendung in der Emissions- und/oder Ladungstransportschicht von Elektrolumineszenzvorrichtungen. Die Erfindung betrifft ferner Polymere, die diese Verbindungen als Struktureinheiten enthalten und ein Verfahren zur Herstellung der erfindungsgemäßen Verbindungen sowie elektronische Vorrichtungen, die diese Verbindungen enthalten.
- Organische Halbleiter werden für eine Reihe verschiedenartiger elektronischer Anwendungen entwickelt. Der Aufbau organischer Elektrolumineszenzvorrichtungen (OLEDs), in denen diese organischen Halbleiter als funktionelle Materialien eingesetzt werden, ist beispielsweise in
US 4539507 ,US 5151629 ,EP 0676461 undWO 98/27136 - Gerade auch bei phosphoreszierenden Elektrolumineszenzvorrichtungen sind noch Verbesserungen der oben genannten Eigenschaften erforderlich. Insbesondere besteht Verbesserungsbedarf bei Matrixmaterialien für phosphoreszierende Emitter, die gleichzeitig zu guter Effizienz, hoher Lebensdauer und geringer Betriebsspannung führen. Gerade die Eigenschaften der Matrixmaterialien sind häufig limitierend für die Lebensdauer und die Effizienz der organischen Elektrolumineszenzvorrichtung.
- Gemäß dem Stand der Technik werden häufig Carbazolderivate, z. B. Bis(carbazolyl)biphenyl, als Matrixmaterialien verwendet. Hier besteht noch Verbesserungsbedarf insbesondere in Bezug auf die Lebensdauer und die Glasübergangstemperatur der Materialien.
- Weiterhin werden Ketone (
WO 04/093207 WO 05/003253 - Weiterhin werden Metallkomplexe, beispielsweise BAlq oder Bis[2-(2-benzothiazol)phenolat]-zink(II), als Matrixmaterialien für phosphoreszierende Emitter verwendet. Hier besteht noch Verbesserungsbedarf insbesondere in Bezug auf die Betriebsspannung und die chemische Stabilität. Rein organische Verbindungen sind häufig stabiler als diese Metallkomplexe. So sind einige dieser Metallkomplexe hydrolyseempfindlich, was die Handhabung der Komplexe erschwert.
- Insbesondere besteht noch Verbesserungsbedarf bei Matrixmaterialien für phosphoreszierende Emitter, welche gleichzeitig zu hohen Effizienzen, langen Lebensdauern und geringen Betriebsspannungen führen und welche auch mit phosphoreszierenden Emittern, welche Ketoketonat-Liganden tragen, kompatibel sind.
- Ebenso sind auch bei Elektronentransportmaterialien noch Verbesserungen der Eigenschaften wünschenswert, da gerade auch die Eigenschaften des Elektronentransportmaterials einen wesentlichen Einfluss auf die oben genannten Eigenschaften der organischen Elektrolumineszenzvorrichtung ausüben. Insbesondere besteht Verbesserungsbedarf bei Elektronentransportmaterialien, welche gleichzeitig zu guter Effizienz, hoher Lebensdauer und geringer Betriebsspannung führen.
- Dabei wäre es wünschenswert, Elektronentransportmaterialien zur Verfügung zu haben, welche zu einer besseren Elektroneninjektion in die emittierende Schicht führen, da eine elektronenreichere Emissionsschicht zu einer besseren Effizienz führt. Außerdem kann durch eine bessere Injektion die Betriebsspannung gesenkt werden. Hierfür sind daher weitere Verbesserungen des Elektronentransportmaterials erforderlich.
- Elektrolumineszenzvorrichtungen, die AlQ3 als Elektronenleiter verwenden, sind schon lange bekannt und wurden schon 1993 in
US 4,539,507 beschrieben. AlQ3 wird seither häufig als Elektronentransportmaterial verwendet, hat allerdings mehrere Nachteile: Es lässt sich nicht rückstandsfrei aufdampfen, da es sich bei der Sublimationstemperatur teilweise zersetzt, was insbesondere für Produktionsanlagen ein großes Problem darstellt. Dies hat zur Folge, dass die Aufdampfquellen immer wieder gereinigt oder gewechselt werden müssen. Des Weiteren gelangen Zersetzungsprodukte von AlQ3 in die OLED, die dort zu einer verringerten Lebensdauer und reduzierten Quanten- und Leistungseffizienz beitragen. AlQ3 hat außerdem eine niedrige Elektronenbeweglichkeit, was zu höheren Spannungen und damit zu einer niedrigeren Leistungseffizienz führt. Um Kurzschlüsse im Display zu vermeiden, würde man gern die Schichtdicke erhöhen; dies ist mit AlQ3 wegen der geringen Ladungsträgerbeweglichkeit und der daraus resultierenden Spannungserhöhung nicht möglich. Die Ladungsträgerbeweglichkeit anderer Elektronenleiter (US 4,539,507 ) ist ebenfalls zu gering, um dickere Schichten damit aufzubauen, wobei die Lebensdauer der OLED noch schlechter ist als bei Verwendung von AlQ3. Als ungünstig erweist sich auch die Eigenfarbe (im Feststoff gelb) von AlQ3, die gerade bei blauen OLEDs durch Reabsorption und schwache Reemission zu Farbverschiebungen führen kann. Hier sind blaue OLEDs nur mit starken Effizienz- bzw. Farborteinbußen darstellbar. - Es besteht also weiterhin Bedarf an Elektronentransportmaterialien, die in organischen Elektrolumineszenzvorrichtungen zu guten Effizienzen und gleichzeitig zu hohen Lebensdauern führen. Es wurde nun überraschend gefunden, dass organische Elektrolumineszenzvorrichtungen, die bestimmte – im Folgenden aufgeführte – Indenofluoren-Derivate als Elektronentransportmaterialien enthalten, deutliche Verbesserungen gegenüber dem Stand der Technik aufweisen. Mit diesen Materialien ist es möglich, gleichzeitig hohe Effizienzen und lange Lebensdauern zu erhalten, was mit Materialien gemäß dem Stand der Technik nicht möglich ist. Zudem wurde gefunden, dass zusätzlich die Betriebsspannungen deutlich gesenkt werden können, was höheren Leistungseffizienzen entspricht.
- Weiterhin wurde gefunden, dass elektronische Vorrichtungen, die diese Indenofluoren-Derivate als Elektronentransportmaterialien in Kombination mit einer organischen Alkalimetallverbindung enthalten, deutliche Verbesserungen gegenüber dem Stand der Technik aufweisen. Mit dieser Materialkombination werden gleichzeitig hohe Effizienzen und lange Lebensdauern erzielt und die Betriebsspannungen gesenkt.
-
EP 1860097 ,WO 2006/100896 DE 102006025846 ,WO 2006/122630 WO 2008132103 ,WO2008006449 ,WO2008056746 ,WO2008149691 ,WO 2008146839 undWO 2008/006449 - Es besteht folglich weiterhin Bedarf sowohl an verbesserten Matrixmaterialien für phosphoreszierende Dotanden, die geeignet sind, die Effizienz von organischen Elektrolumineszenzvorrichtungen zu verbessern, gleichzeitig zu hohen Lebensdauern führen und die technisch unproblematisch zu verarbeiten sind, als auch an verbesserten Elektronentransportmaterialien.
- Die Aufgabe der vorliegenden Erfindung besteht somit in der Bereitstellung solcher Verbindungen.
- Es wurde überraschend gefunden, dass Elektrolumineszenzvorrichtungen, die erfindungsgemäße indenocarbazolderivate verwenden, deutliche Verbesserungen gegenüber dem Stand der Technik aufweisen, insbesondere beim Einsatz als Matrixmaterialien für phosphoreszierende Dotanden oder als Elektronentransportmaterialien. Es ergeben sich zum einen längere Lebensdauern, zum anderen geringere Betriebsspannungen aufgrund von Änderungen in der Grenzflächenmorphologie sowie eine geringere Abhängigkeit der Spannung von der Transportschichtdicke, möglicherweise aufgrund verbesserter Elektronenmobilität.
- Die Erfindung stellt dazu eine Verbindung der folgenden Formel I bereit: Formel I wobei die verwendeten Symbole und Indices die folgenden Bedeutungen haben:
W ist gleich oder verschieden bei jedem Auftreten N oder CR1;
Y ist gleich oder verschieden bei jedem Auftreten N oder CR2;
E ist entweder eine kovalente Einfachbindung oder ist eine bivalente Einheit, die aus der Gruppe ausgewählt ist, die aus N(R3), C(R3)2, Si(R3)2, C=O, C=NR3, C=C(R3)2, S, S=O, SO2, P(R3) und P(=O)R3 besteht;
X ist gleich oder verschieden bei jedem Auftreten eine bivalente Einheit, die aus der Gruppe ausgewählt ist, die aus C(R3)2, N(R3), Si(R3)2, C=O, C=NR3, C=C(R3)2, S, O, S=O, SO2, P(R3) und P(=O)R3 besteht, mit der Maßgabe, dass, wenn E eine kovalente Einfachbindung ist, X eine bivalente Einheit ist, die aus der Gruppe ausgewählt ist, die aus C(R3)2, Si(R3)2, C=O, C=NR3, C=C(R3)2, S, O, S=O, SO2, P(R3) und P(=O)R3 besteht;
n, m sind unabhängig voneinander 0 oder 1, mit der Maßgabe, dass die Summe aus n und m gleich 1 oder 2 ist;
Ar ist eine bivalente oder trivalente, mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 40 aromatischen Ringatomen, die mit einem oder mehreren Resten R4a substituiert sein kann;
Ar1 ist eine mono- oder polycyclische heteroaromatische Gruppe mit 5 bis 40 aromatischen Ringatomen, die mit einem oder mehreren Resten R4b substituiert sein kann;
L ist entweder eine kovalente Einfachbindung oder stellt eine bivalente Einheit dar, die aus der Gruppe ausgewählt ist, die aus -C(O)-, -Ar2-C(O)- und -Ar2- besteht, wobei für den Fall, dass die bivalente Einheit -Ar2-C(O)- ist, die Gruppe Ar2 an N bindet und C(O) an die Gruppe Ar1 bindet;
Ar2 ist eine bivalente mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 40 aromatischen Ringatomen, die mit einem oder mehreren Resten R4a oder R4b substituiert sein kann;
R1, R2 sind gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus Folgendem besteht: H, D, F, Cl, Br, I, N(Ar3)2, C(=O)Ar3, P(=O)(Ar3)2, S(=O)Ar3, S(=O)2Ar3, CN, eine geradkettige Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 1 bis 40 C-Atomen oder eine verzweigte oder cyclische Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 3 bis 40 C-Atomen oder eine Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R5 substituiert sein kann und wobei jeweils eine oder mehrere nicht benachbarte CH2-Gruppen durch R5C=CR5, C≡C, C=O, C=S,, P(=O)(R5), SO, SO2, NR5, O, S oder CONR5 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann, oder eine Aryloxy- oder Heteroaryloxygruppe mit 5 bis 40 aromatischen Ringatomen, die durch einen oder mehrere Reste R5 substituiert sein kann, oder eine Kombination dieser Systeme; wobei auch zwei oder mehrere benachbarte Substituenten R1 und/oder R2 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können;
R3 ist gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus Folgendem besteht: H, D, F, Cl, Br, I, N(AT3)2, C(=O)AT3, P(=O)(Ar3)2, S(=O)AT3, S(=O)2Ar3, CR5=CR5Ar3, CN, NO2, Si(R5)3, B(OR5)2, OSO2R5, eine geradkettige Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 1 bis 40 C-Atomen oder eine verzweigte oder cyclische Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 3 bis 40 C-Atomen oder eine Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R5 substituiert sein kann und wobei jeweils eine oder mehrere nicht benachbarte CH2-Gruppen durch R5C=CR5, C≡C, Si(R5)2, Ge(R5)2, Sn(R5)2, C=O, C=S, C=Se, C=NR5, P(=O)(R5), SO, SO2, NR5, O, S oder CONR5 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann, oder eine Aryloxy- oder Heteroaryloxygruppe mit 5 bis 40 aromatischen Ringatomen, die durch einen oder mehrere Reste R5 substituiert sein kann, oder eine Kombination dieser Systeme; wobei auch zwei oder mehrere benachbarte Substituenten R3 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können;
R4a, R4b sind jeweils gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus folgendem besteht: D, F, Cl, Br, I, N(Ar3)2, C(=O)Ar3, P(=O)(Ar3)2, S(=O)Ar3, S(=O)2Ar3, CN, eine geradkettige Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 1 bis 40 C-Atomen oder eine verzweigte oder cyclische Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 3 bis 40 C-Atomen oder eine Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R5 substituiert sein kann und wobei jeweils eine oder mehrere nicht benachbarte CH2-Gruppen durch R5C=CR5, C≡C, C=O, C=S,, P(=O)(R5), SO, SO2, NR5, O, S oder CONR5 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann, oder eine Aryloxy- oder Heteroaryloxygruppe mit 5 bis 40 aromatischen Ringatomen, die durch einen oder mehrere Reste R5 substituiert sein kann, oder eine Kombination dieser Systeme; wobei auch zwei oder mehrere benachbarte Substituenten R4a oder R4b miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können;
Ar3 ist ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann;
R5 ist gleich oder verschieden bei jedem Auftreten H, D, eine geradkettige Alkylgruppe mit 1 bis 20 C-Atomen oder eine verzweigte oder cyclische Alkylgruppe mit 3 bis 20 C-Atomen, wobei eine oder mehrere nicht benachbarte CH2-Gruppen durch NH, O oder S ersetzt sein können und wobei ein oder mehrere H-Atome durch F ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 20 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann; wobei auch zwei oder mehrere Substituenten R5 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können;
R6 ist gleich oder verschieden bei jedem Auftreten H, D, F, CN, eine geradkettige Alkylgruppe mit 1 bis 20 C-Atomen oder eine verzweigte oder cyclische Alkylgruppe mit 3 bis 20 C-Atomen, wobei eine oder mehrere nicht benachbarte CH2-Gruppen durch NH, O oder S ersetzt sein können und wobei ein oder mehrere H-Atome durch F ersetzt sein können; wobei auch zwei oder mehrere Substituenten R6 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können;
Z stellt eine bivalente Gruppe -(CH2)q- dar, wobei q gleich 1, 2, 3, 4 oder 5 ist, bevozugt 1, 2, 3 oder 4, stärker bevorzugt 1, 2 oder 3, und am stärksten bevorzugt 1 oder 2. - Eine bivalente oder trivalente mono- oder polycyclische aromatische oder heteroaromatische Einheit, wie für Ar definiert, enthält vorzugsweise 5 bis 40, stärker bevorzugt 5 bis 20, am bevorzugtesten 5 bis 10 aromatische Ringatome. Ist die Einheit eine aromatische Einheit, so enthält sie vorzugsweise 6 bis 40, stärker bevorzugt 6 bis 20, am bevorzugtesten 6 bis 10 Kohlenstoffatome als Ringatome. Ist die Einheit eine heteroaromatische Einheit enthält sie 5 bis 40, stärker bevorzugt 5 bis 20, am bevorzugtesten 5 bis 10 aromatische Ringatome, von denen mindestens eines ein Heteroatom ist. Die Heteroatome sind bevorzugt ausgewählt aus N, O und/oder S. Dabei wird unter einer aromatischen bzw. heteroaromatischen Einheit entweder ein einfacher aromatischer Cyclus, also Benzol, bzw. ein einfacher heteroaromatischer Cyclus, beispielsweise Pyridin, Pyrimidin, Thiophen, etc., oder eine kondensierte Aryl- oder Heteroarylgruppe, beispielsweise Naphthalin, Anthracen, Phenanthren, Chinolin, Isochinolin, Benzothiophen, Benzofuran und Indol etc., verstanden.
- Erfindungsgemäße Beispiele für die aromatische oder heteroaromatische Einheit sind demgemäß: Benzol, Naphthalin, Anthracen, Phenanthren, Pyren, Chrysen, Benzanthracen, Perylen, Naphthacen, Pentacen, Benzpyren, Furan, Benzofuran, Isobenzofuran, Dibenzofuran, Thiophen, Benzothiophen, Isobenzothiophen, Dibenzothiophen, Pyrrol, Indol, Isoindol, Pyridin, Chinolin, Isochinolin, Acridin, Phenanthridin, Benzo-5,6-chinolin, Benzo-6,7-chinolin, Benzo-7,8-chinolin, Phenothiazin, Phenoxazin, Pyrazol, Indazol, Imidazol, Benzimidazol, Naphthimidazol, Phenanthrimidazol, Pyridimidazol, Pyrazinimidazol, Chinoxalinimidazol, Oxazol, Benzoxazol, Naphthoxazol, Anthroxazol, Phenanthroxazol, Isoxazol, 1,2-Thiazol, 1,3-Thiazol, Benzothiazol, Pyridazin, Benzopyridazin, Pyrimidin, Benzpyrimidin, Chinoxalin, 1,5-Diazaanthracen, 2,7-Diazapyren, 2,3-Diazapyren, 1,6-Diazapyren, 1,8-Diazapyren, 4,5-Diazapyren, 4,5,9,10-Tetraazaperylen, Pyrazin, Phenazin, Phenoxazin, Phenothiazin, Fluorubin, Naphthyridin, Benzocarbolin, Phenanthrolin, 1,2,3-Triazol, 1,2,4-Triazol, Benzotriazol, 1,2,3-Oxadiazol, 1,2,4-Oxadiazol, 1,2,5-Oxadiazol, 1,3,4-Oxadiazol, 1,2,3-Thiadiazol, 1,2,4-Thiadiazol, 1,2,5-Thiadiazol, 1,3,4-Thiadiazol, 1,3,5-Triazin, 1,2,4-Triazin, 1,2,3-Triazin, Tetrazol, 1,2,4,5-Tetrazin, 1,2,3,4-Tetrazin, 1,2,3,5-Tetrazin, Purin, Pteridin, Indolizin und Benzothiadiazol.
- Als bivalente oder trivalente Einheit liegen die zuvor genannten Verbindungen so vor, dass zwei oder drei Wasserstoffsubstituenten nicht vorhanden sind und diese Verbindungen an diesen Stellen – wie in Formel I angegeben – gebunden sind.
- Unter einer mono- oder polycyclischen aromatischen oder heteroaromatischen Gruppe versteht man in der vorliegenden Erfindung einen monovalenten Rest, der ansonsten genauso definiert ist wie die mono- oder polycyclische aromatische oder heteroaromatische Einheit. Die zuvor genannten Beispiele sind auch hier exemplarisch.
- Im Rahmen der vorliegenden Erfindung wird unter einer geradkettigen, verzweigten oder cyclischen Alkylgruppe eine Alkyl-, Alkenyl- und Alkinylgruppen mit vorzugsweise 1 bis 40 C-Atomen, stärker bevorzugt 1 bis 20 C-Atomen, bzw. 3 bis 40 C-Atomen, stärker bevorzugt 3 bis 20 C-Atomen verstanden. Cyclische Alkylgruppen können mono-, bi- oder polycyclische Alkylgruppen sein. Einzelne -CH- oder -CH2-Gruppen können durch N, NH, O oder S ersetzt sein. Bevorzugt sind die Reste Methyl, Ethyl, n-Propyl, i-Propyl, n-Butyl, i-Butyl, s-Butyl, t-Butyl, 2-Methylbutyl, n-Pentyl, s-Pentyl, t-Pentyl, Cyclopentyl, n-Hexyl, Cyclohexyl, n-Heptyl, Cycloheptyl, n-Octyl, Cyclooctyl, 2-Ethylhexyl, Trifluormethyl, Pentafluorethyl, 2,2,2-Trifluorethyl, Ethenyl, Propenyl, Butenyl, Pentenyl, Cyclopentenyl, Hexenyl, Cyclohexenyl, Heptenyl, Cycloheptenyl, Octenyl, Cyclooctenyl, Ethinyl, Propinyl, Butinyl, Pentinyl, Hexinyl, Heptinyl oder Octinyl verstanden. Unter einer C1- bis C40-Alkoxygruppe werden bevorzugt Methoxy, Trifluormethoxy, Ethoxy, n-Propoxy, i-Propoxy, n-Butoxy, i-Butoxy, s-Butoxy, t-Butoxy oder 2-Methylbutoxy verstanden.
- Unter einer Alkoxygruppe bzw. Thioalkylgruppe versteht man eine wie oben definierte Alkylgruppe, die über eine O- oder S-Atom gebunden ist.
- Die Alkylgruppen, Alkoxygruppen bzw. Thioalkylgruppen können zudem durch einen oder mehrere wie oben definierte Reste R5 substituiert sein.
- Unter einem mono- oder polycylischen aromatischen Ringsystem versteht man im Sinne dieser Erfindung vorzugsweise ein aromatisches Ringsystem mit 6 bis 40 Kohlenstoffatomen, bevorzugt 6 bis 30, besonders bevorzugt 6 bis 12 Kohlenstoffatomen. Unter einem aromatischen Ringsystem im Sinne der vorliegenden Erfindung soll ein System verstanden werden, das nicht notwendigerweise nur aromatische Gruppen enthält, sondern in dem auch mehrere aromatische durch eine kurze nichtaromatische Einheit (< 10% der von H verschiedenen Atome, vorzugsweise < 5% der von H verschiedenen Atome), wie beispielsweise sp3-hybridisierter C, O, N, etc., oder einer CO-Gruppe unterbrochen sein können. Diese aromatischen Ringsysteme können monocyclisch oder polycyclisch sein, d. h. sie können einen Ring (z. B. Phenyl) oder zwei oder mehr Ringe aufweisen, welche auch kondensiert (z. B. Naphthyl) oder kovalent verknüpft sein können (z. B. Biphenyl), oder eine Kombination von kondensierten und verknüpften Ringen beinhalten. Besonders bevorzugt sind jedoch kondensierte Ringe.
- Bevorzugte aromatische Ringsysteme sind z. B. Benzol, Biphenyl, Terphenyl, Naphthalin, Anthracen, Binaphthyl, Phenanthren, Benzanthracen, Dihydrophenanthren, Pyren, Dihydropyren, Chrysen, Perylen, Tetracen, Pentacen, Benzpyren, Fluoren, Spirobifluoren und Inden.
- Unter einem mono- oder polycylischen heteroaromatischen Ringsystem versteht man im Sinne dieser Erfindung vorzugsweise ein heteroaromatisches Ringsystem mit 5 bis 40 Ringatomen, bevorzugt 5 bis 30, besonders bevorzugt 5 bis 14 Ringatomen. Das heteroaromatische Ringsystem enthält mindestens ein Heteroatom ausgewählt aus N, O und S (die verbleibenden Atome sind Kohlenstoff). Unter einem heteroaromatischen Ringsystem soll zudem ein System verstanden werden, das nicht notwendigerweise nur aromatische oder heteroaromatische Gruppen enthält, sondern in dem auch mehrere aromatische bzw. heteroaromatische Gruppen durch eine kurze nicht-aromatische Einheit (< 10% der von H verschiedenen Atome, vorzugsweise < 5% der von H verschiedenen Atome), wie beispielsweise sp3-hybridisierter C, O, N, etc., oder einer CO-Gruppe unterbrochen sein können. Diese heteroaromatischen Ringsysteme können monocyclisch oder polycyclisch sein, d. h. sie können einen Ring (z. B. Pyridyl) oder zwei oder mehr Ringe aufweisen, welche auch kondensiert oder kovalent verknüpft sein können, oder eine Kombination von kondensierten und verknüpften Ringen beinhalten. Besonders bevorzugt sind kondensierte Ringe.
- Bevorzugte heteroaromatische Ringsysteme sind z. B. 5-gliedrige Ringe wie Pyrrol, Pyrazol, Imidazol, 1,2,3-Triazol, 1,2,4-Triazol, Tetrazol, Furan, Thiophen, Selenophen, Oxazol, Isoxazol, 1,2-Thiazol, 1,3-Thiazol, 1,2,3-Oxadiazol, 1,2,4-Oxadiazol, 1,2,5-Oxadiazol, 1,3,4-Oxadiazol, 1,2,3-Thiadiazol, 1,2,4-Thiadiazol, 1,2,5-Thiadiazol, 1,3,4-Thiadiazol, 6-gliedrige Ringe wie Pyridin, Pyridazin, Pyrimidin, Pyrazin, 1,3,5-Triazin, 1,2,4-Triazin, 1,2,3-Triazin, 1,2,4,5-Tetrazin, 1,2,3,4-Tetrazin, 1,2,3,5-Tetrazin, oder kondensierte Gruppen wie Indol, Isoindol, Indolizin, Indazol, Benzimidazol, Benzotriazol, Purin, Naphthimidazol, Phenanthrimidazol, Pyridimidazol, Pyrazinimidazol, Chinoxalinimidazol, Benzoxazol, Naphthoxazol, Anthroxazol, Phenanthroxazol, Isoxazol, Benzothiazol, Benzofuran, Isobenzofuran, Dibenzofuran, Chinolin, Isochinolin, Pteridin, Benzo-5,6-chinolin, Benzo-6,7-chinolin, Benzo-7,8-chinolin, Benzoisochinolin, Acridin, Phenothiazin, Phenoxazin, Benzopyridazin, Benzopyrimidin, Chinoxalin, Phenazin, Naphthyridin, Azacarbazol, Benzocarbolin, Phenanthridin, Phenanthrolin, Thieno[2,3b]thiophen, Thieno[3,2b]thiophen, Dithienothiophen, Isobenzothiophen, Dibenzothiophen, Benzothiadiazothiophen oder Kombinationen dieser Gruppen. Besonders bevorzugt sind Imidazol, Benzimidazol und Pyridin.
- Bilden zwei Substituenten, z. B. zwei R1 oder R1 und R2, miteinander ein bivalentes mono- oder polycyclisches aromatisches oder heteroaromatisches Ringsystem, so kann die oben genannte kurze nicht-aromatische Einheit auch direkt an Y oder W binden. In diesem Fall ist die kurze nichtaromatische Einheit besonders bevorzugt eine CO-Gruppe.
- Unter einer Aryloxy- bzw. Heteroaryloxygruppe mit 5 bis 40 aromatischen Ringatomen versteht man eine Gruppe, die über ein O-Atom eine wie oben definierte mono- oder polycylische aromatische oder heteroaromatische Gruppe mit 5 bis 40 Ringatomen trägt. Die Aryloxy- bzw. Heteroaryloxygruppe kann ebenso ein oder mehrere Substituenten tragen, die oben definiert sind.
- In einer weiteren Ausführungsform der vorliegenden Erfindung ist Y vorzugsweise gleich CR1.
- Ebenso ist es eine weitere Ausführungsform der vorliegenden Erfindung, dass W vorzugsweise CR2 ist.
- In einer noch weiteren Ausführungsform der vorliegenden Erfindung ist E vorzugsweise entweder eine kovalente Einfachbindung oder eine bivalente Einheit ausgewählt aus N(R3), C(R3)2, O und S. Noch stärker bevorzugt ist E gleich eine kovalente Einfachbindung.
- In einer noch weiteren Ausführungsform der vorliegenden Erfindung ist X vorzugsweise gleich oder verschieden bei jedem Auftreten eine bivalente Einheit, die aus der Gruppe ausgewählt ist, die aus C(R3)2, S und O besteht. Besonders bevorzugt ist X gleich C(R3)2.
- In einer noch weiteren Ausführungsform ist Ar vorzugsweise eine bivalente oder trivalente mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 10 aromatischen Ringatomen, die mit einem oder mehreren Resten R4a substituiert sein kann. Insbesondere bevorzugt ist Ar gleich Phenylen oder Naphthylen, am bevorzugtesten Phenylen.
- In einer noch weiteren Ausführungsform der vorliegenden Erfindung ist Ar1 vorzugsweise eine mono- oder polycyclische heteroaromatische Gruppe mit 5 bis 10 aromatischen Ringatomen, die mit einem oder mehreren Resten R4b substituiert sein kann. Besonders bevorzugt ist Ar1 eine elektronenarme heteroaromatische Gruppe, die mit einem oder mehreren Resten R4b substituiert sein kann. Noch stärker bevorzugt sind demnach heteroaromatische Gruppen mit 6 aromatischen Ringatomen, von denen mindestens eines ein N-Atom ist, oder heteroaromatische Gruppen mit 5 aromatischen Ringatomen, von denen mindestens 2 Heteroatome sind, bevorzugt mindestens eines davon ein N-Atom, das/die jeweils mit R4b substituiert sein kann/können, wobei an diese Gruppen jeweils auch weitere Aryl- oder Heteroarylgruppen ankondensiert sein können. Bevorzugte Beispiele hierfür sind: Pyridin, Pyrazin, Pyrimidin, Pyridazin, 1,2,4-Triazin, 1,3,5-Triazin, Chinolin, Isochinolin, Chinoxalin, Pyrazol, Imidazol, Benzimidazol, Thiazol, Benzothiazol, Oxazol oder Benzooxazol, die jeweils mit R4b substituiert sein können. Am bevorzugtesten ist Ar1 ein mit R4b substituiertes oder unsubstituiertes 1,3,5-Triazin.
- In einer noch weiteren Ausführungsform der vorliegenden Erfindung ist L vorzugsweise eine kovalente Einfachbindung oder eine bivalente Einheit -Ar2-. Bevorzugt ist Ar2 hierbei eine bivalente mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 10 aromatischen Ringatomen, die mit einem oder mehreren Resten R4a oder R4b substituiert sein kann. Besonders bevorzugte Beispiele hierfür sind Phenylen, Naphthylen, stärker bevorzugt Phenylen.
- In einer weiteren Ausführungsform sind R1 und R2 jeweils unabhängig voneinander vorzugsweise aus der Gruppe ausgewählt, die aus H, D, N(Ar3)2, C(=O)Ar3, einer geradkettigen Alkylgruppe mit 1 bis 20 C-Atomen oder einer verzweigten oder cyclischen Alkylgruppe mit 3 bis 20 C-Atomen und einem mono- oder polycylischen aromatischen oder heteroaromatischen Ringsystem mit 5 bis 20 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann, besteht.
- Besonders bevorzugt ist R2 gleich H und einer der beiden R1 ist H und das andere ist ausgewählt aus H, N(Ar3)2, C(=O)Ar3 und einem mono- oder polycylischen aromatischen Ringsystem mit 5 bis 20 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann. Alternativ dazu können auch zwei R1 oder R1 und R2 zusammen ein mono- oder polycyclisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 20 aromatischen Ringatomen bilden. Bevorzugte Beispiele hierfür sind die Folgenden: wobei die bivalenten Systeme über die gestrichelten Linien gebunden werden.
- In einer weiteren Ausführungsform der vorliegenden Erfindung ist R3 vorzugsweise gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus H, D, einer geradkettigen Alkylgruppe mit 1 bis 10 C-Atomen, einer verzweigten oder cyclischen Alkylgruppe mit 3 bis 10 C-Atomen und einem mono- oder polycylischen aromatischen oder heteroaromatischen Ringsystem mit 5 bis 10 aromatischen Ringatomen besteht. Bevorzugt sind hierbei Methyl, Phenyl, Diphenyl-amino-p-phenyl, und 3-(N-phenyl)-carbazolyl. Alternativ können auch zwei R3 miteinander ein bivalentes mono- oder polycyclisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 20 aromatischen Ringatomen bilden. Ein besonders bevorzugtes Beispiel hierfür ist: wobei die gestrichelten Linien die Bindungen zu X darstellen.
- In einer weiteren Ausführungsform der vorliegenden Erfindung ist R4a vorzugsweise gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus folgendem besteht: N(Ar3)2, C(=O)Ar3, eine geradkettige Alkylgruppe mit 1 bis 6 C-Atomen oder eine verzweigte oder cyclische Alkylgruppe mit 3 bis 6 C-Atomen, wobei ein oder mehrere H-Atome durch F ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 20 aromatischen Ringatomen. Besonders bevorzugte Beispiele hierfür sind Phenyl, Diphenylamin und C(=O)-Ph.
- In einer weiteren Ausführungsform der vorliegenden Erfindung ist R4b vorzugsweise gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus folgendem besteht: CN, F, eine geradkettige Alkylgruppe mit 1 bis 6 C-Atomen, eine verzweigte oder cyclische Alkylgruppe mit 3 bis 6 C-Atomen, wobei ein oder mehrere H-Atome durch F ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 20 aromatischen Ringatomen. Besonders bevorzugte Beispiele hierfür sind Phenyl, Naphthyl und Carbazolyl.
- In einer noch weiteren Ausführungsform der vorliegenden Erfindung ist Ar3 vorzugsweise ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 20 aromatischen Ringatomen.
- In einer weiteren Ausführungsform der vorliegenden Erfindung ist die Summe der Indizes n + m = 1.
- Es ist Bestandteil der vorliegenden Erfindung, dass die genannten Ausführungsformen, bzw. bevorzugten Bereiche oder Defintionen der vorliegenden Erfindung beliebig miteinander kombiniert werden können.
-
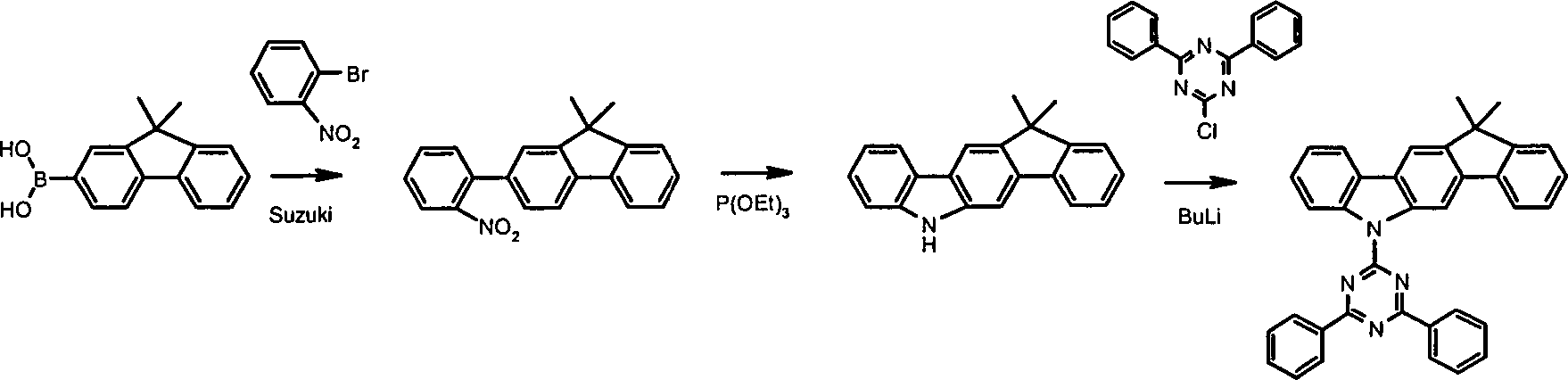
- Die erfindungsgemäßen Verbindungen können nach dem Fachmann bekannten Syntheseschritten, wie z. B. Bromierung, Suzuki-Kupplung, Hartwig-Buchwald-Kupplung, etc., dargestellt werden. Die Synthese von von erfindungsgemäßen Verbindungen ist allgemein in den folgenden Schemata 1 bis 3 dargestellt.
- Die Synthese geht beispielsweise aus von 9,9 Dimethylfluorenyl-2-boronsäure (Synlett, 2006, 5, 737–740), welche in einer Suzuki-Kupplung mit 1-Brom-2-nitrobenzol gekuppelt wird. Die Nitrogruppe wird unter Einwirkung eines Phosphits, beispielsweise Triethylphosphit, zum Ring geschlossen, so dass man das entsprechende Indenocarbazolderivat erhält. Der Stickstoff kann dann durch Alkylierungsmittel alkyliert oder in einer Hartwig-Buchwald-Reaktion aryliert werden. So kann die Gruppe Ar1 eingeführt werden. Dabei können die Strukturen selbstverständlich auch durch weitere Substituenten substituiert sein.
- Ein alternative Herstellungsmöglichkeit ist in Schema 2 gezeigt.
- Die Synthese geht aus von einem 2-Bromcarbazolderivat. Dieses wird mit einem 1-Boronsäure-2-methylcarbonyl-Derivat von Benzol in einer Suzuki-Kupplung umgesetzt. Anschließend wird der Stickstoff mit einer Thionylgruppe geschützt. Die Carbonylgruppe wird mit Methyllithium zu einer Hydroxygruppe reduziert. Der anschließende Ringschluss kann unter Einwirkung von Polyphosphorsäure erfolgen. Nach Abspaltung der Thionylschutzgruppe kann der Stickstoff dann durch Alkylierungsmittel alkyliert oder in einer Hartwig-Buchwald-Reaktion aryliert werden. So kann die Gruppe Ar1 eingeführt werden.
- Eine weitere alternative Herstellungsmöglichkeit ist in Schema 3 gezeigt.
- Die Synthese geht aus von einem 2-Bromfluorenderivat. Dieses wird mit einem 1-Boronsäure-2-methylcarbonyl-Derivat von Benzol in einer Suzuki-Kupplung umgesetzt. Anschließend wird die Methylcarbonylgruppe mit Methyllithium zu einer 1-Hydroxy-isopropylgruppe reduziert. Der anschließende Ringschluss kann unter Einwirkung von Polyphosphorsäure erfolgen. Der Stickstoff wird dann entweder durch Alkylierungsmittel alkyliert oder in einer Hartwig-Buchwald-Reaktion aryliert. So kann die Gruppe Ar1 eingeführt werden.
- Ein weiterer Gegenstand der Erfindung ist ein Verfahren zur Herstellung einer Verbindung der allgemeinen Formel I, umfassend die Schritte:
- a) Kupplung eines Carbazolderivats oder Fluorenderivats mit einem Benzolderivat, und
- b) Arylierung des Carbazol-Stickstoff zur Einführung von Ar1.
- Die oben dargestellten Verbindungen können auch zur Herstellung von Polymeren, Oligomeren oder Dendrimeren verwendet werden. Dies erfolgt gewöhnlich über polymerisierbare funktionelle Gruppen. Hierzu sind insbesondere solche Verbindungen bevorzugt, welche mit reaktiven Abgangsgruppen, wie Brom, Iod, Boronsäure, Boronsäureester, Tosylat oder Triflat substituiert sind. Diese können als Comonomere zur Erzeugung entsprechender konjugierter, teilkonjugierter oder nicht-konjugierter Polymere, Oligomere oder auch als Kern von Dendrimeren Verwendung finden. Die Polymerisation erfolgt dabei bevorzugt über die Halogenfunktionalität bzw. die Boronsäurefunktionalität. Die Polymere können auch über vernetzbare Gruppen verfügen bzw. vernetzt sein. Insbesondere eignen sich vernetzbare Gruppen, welche dann in der Schicht der elektronischen Vorrichtung vernetzt werden.
- Ein weiterer Gegenstand der Erfindung sind somit Polymere, Oligomere oder Dendrimere, enthaltend eine oder mehrere Verbindungen gemäß Formel I, wobei ein oder mehrere Reste oder H-Atome der oben definierten Verbindungen eine Bindung zum Polymer, Oligomer oder Dendrimer darstellen. Dabei können die Polymere, Oligomere oder Dendrimere konjugiert, teilkonjugiert oder nicht-konjugiert sein. Ebenfalls umfasst sind Mischungen (Elends) der erfindungsgemäßen Polymere, Oligomere oder Dendrimere mit weiteren Polymeren, Oligomeren oder Dendrimeren.
- Als Oligomer wird im Sinne dieser Erfindung eine Verbindung bezeichnet, welche etwa drei bis neun Wiederholungseinheiten aufweist. Als Polymer im Sinne der Erfindung wird eine Verbindung verstanden, welche zehn oder mehr Wiederholungseinheiten aufweist.
- Diese Oligomere oder Polymere können weitere Wiederholungseinheiten enthalten. Diese weiteren Wiederholungseinheiten sind vorzugsweise ausgewählt aus der Gruppe, bestehend aus Fluorenen (z. B. gemäß
EP 842208 WO 00/22026 EP 707020 EP 894107 EP 04028865.6 WO 92/18552 WO 04/070772 WO 04/113468 EP 1028136 ), Dihydrophenanthrenen (z. B. gemäßWO 05/014689 WO 04/041901 WO 04/113412 WO 05/040302 WO 05/104264 - Die Verbindungen gemäß Formel I können in elektronischen Vorrichtungen, insbesondere in organischen Elektrolumineszenzvorrichtungen eingesetzt werden. Die genaue Verwendung der Verbindungen hängt dabei von den Substituenten ab.
- Ein weiterer Gegenstand der Erfindung ist daher die Verwendung der Verbindungen gemäß Formel I bzw. der oben definierten Polymere, Oligomere oder Dendrimere in elektronischen Vorrichtungen.
- Ein weiterer Gegenstand der Erfindung ist eine elektronische Vorrichtung, enthaltend mindestens eine Verbindung, wie oben definiert, oder ein Polymer, Oligomer oder Dendrimer, wie oben definiert. Ebenfalls von der Erfindung umfasst sind Mischungen (Elends) der erfindungsgemäßen Oligomere, Polymere oder Dendrimere, gegebenenfalls mit weiteren davon verschiedenen Oligomeren, Polymeren oder Dendrimeren oderweiteren niedermolekularen Verbindungen.
- Die elektronische Vorrichtung ist bevorzugt ausgewählt aus der Gruppe bestehend aus organischen Elektrolumineszenzvorrichtungen (OLEDs), organischen Feld-Effekt-Transistoren (O-FETs), organischen Dünnfilmtransistoren (O-TFTs), organischen lichtemittierenden Transistoren (O-LETs), organischen integrierten Schaltungen (O-ICs), organischen Solarzellen (O-SCs), organischen Feld-Quench-Devices (O-FQDs), lichtemittierenden elektrochemischen Zellen (LECs), organischen Photorezeptoren oder organischen Laserdioden (O-Laser).
- Gegenstand der vorliegenden Erfindung sind auch organische Elektrolumineszensvorrichtungen, die dadurch gekennzeichnet sind, dass mehrere emittierende Verbindungen in derselben Schicht oder in unterschiedlichen Schichten verwendet werden. Dabei kann die erfindungsgemäße Verbindung der Formel I entweder in einer emittierenden Schicht als Matrixmaterial oder in einer Elektronentransportschicht als Elektronentransportmaterial oder in einer Lochtransportschicht als Lochtransportmaterial eingesetzt werden. Erfindungsgemäße Verbindungen können jedoch auch in mehreren der genannten Schichten eingesetzt werden. Besonders bevorzugt weisen diese Emissionsschichten insgesamt mehrere Emissionsmaxima zwischen 380 nm und 750 nm auf, so dass insgesamt weiße Emission resultiert, d. h. in den emittierenden Schichten werden verschiedene emittierende Verbindungen verwendet, die fluoreszieren oder phosphoreszieren können und die blaues und gelbes, oranges oder rotes Licht emittieren. Insbesondere bevorzugt sind Dreischichtsysteme, also Systeme mit drei emittierenden Schichten, wobei mindestens eine dieser Schichten mindestens eine Verbindung gemäß Formel I und mindestens einen phosphoreszierenden Emitter enthält und wobei die drei Schichten blaue, grüne und orange oder rote Emission zeigen (für den prinzipiellen Aufbau siehe z. B.
WO 05/011013 - Außer Kathode, Anode und mindestens einer der bereits genannten Schichten kann die organische Elektrolumineszenzvorrichtung noch weitere Schichten enthalten. Diese können beispielsweise sein: Lochinjektionsschicht, Elektronenblockierschicht, Lochblockierschicht, Elektroneninjektionsschicht und/oder eine Charge-Generation Layer (T. Matsumoto et al., Multiphoton Organic EL Device Having Charge Generation Layer, IDMC 2003, Taiwan; Session 21 OLED (5)). Es sei aber an dieser Stelle darauf hingewiesen, dass nicht notwendigerweise jede dieser Schichten vorhanden sein muss. So werden insbesondere bei Verwendung von Verbindungen gemäß Formel I mit elektronenleitenden Hostmaterialien weiterhin sehr gute Ergebnisse erhalten, wenn die organische Elektrolumineszenzvorrichtung keine separate Elektronentransportschicht enthält und die emittierende Schicht direkt an die Elektroneninjektionsschicht oder an die Kathode grenzt. Alternativ kann das Hostmaterial auch gleichzeitig in einer Elektronentransportschicht als Elektronentransportmaterial dienen. Ebenfalls kann es bevorzugt sein, wenn die organische Elektrolumineszenzvorrichtung keine separate Lochtransportschicht enthält und die emittierende Schicht direkt an die Lochinjektionsschicht oder an die Anode grenzt.
- Es ist im Rahmen der Erfindung bevorzugt, dass in der elektronischen Vorrichtung die erfindungsgemäßen Verbindungen gemäß Formel I oder die erfindungsgemäßen Polymere, Oligomere oder Dendrimere als Matrixmaterial für phosphoreszierende Dotanden eingesetzt werden.
- Es ist im Rahmen der Erfindung ferner bevorzugt, dass in der elektronischen Vorrichtung die erfindungsgemäßen Verbindungen gemäß Formel I oder die erfindungsgemäßen Polymere, Oligomere oder Dendrimere als Elektronentransportmaterial in einer Elektronentransportschicht und/oder als Lochtransportmaterial in der Lochtransportschicht und/oder als Lochblockiermaterial in einer Lochblockierschicht eingesetzt werden.
- Eine organische Elektrolumineszenzvorrichtung ist eine Vorrichtung, welche Anode, Kathode und mindestens eine emittierende Schicht, welche zwischen der Anode und der Kathode angeordnet ist, enthält. Zusätzlich können noch jeweils eine oder mehrere Elektronentransportschichten und/oder Lochtransportschichten enthalten sein. Eine erfindungsgemäße organische Elektrolumineszenzvorrichtung enthält mindestens eine Schicht zwischen der Anode und der Kathode, die eine Verbindung der Formel I enthält.
- In einer weiteren Ausführungsform der vorliegenden Erfindung werden die Verbindungen der Fomel I als Matrixmaterial für emittierende Materialien, vorzugsweise phosphoreszierende Dotanden eingesetzt. Hierbei ist es besonders bevorzugt, dass die Verbindungen der Formel I als Matrixmaterial für emittierende Materialien in einer organischen Elektrolumineszenzvorrichtung eingesetzt werden.
- In einer weiteren bevorzugten Ausführungsform der Erfindung kann die organische Elektrolumineszenzvorrichtung auch mehrere emittierende Schichten enthalten, wobei mindestens eine emittierende Schicht mindestens eine Verbindung gemäß Formel I und mindestens einen bevorzugt phosphoreszierenden Emitter enthält.
- Weiterer Gegenstand der Erfindung sind daher auch Mischungen aus einer oder mehreren Verbindungen gemäß Formel I mit einer oder mehreren emittierenden Verbindungen.
- Die Mischung aus der Verbindung gemäß Formel I und dem phosphoreszierenden Emitter, die in der emittierenden Schicht eingesetzt wird, enthält bevorzugt zwischen 99 und 50 Vol.-%, vorzugsweise zwischen 98 und 50 Vol.-%, besonders bevorzugt zwischen 97 und 60 Vol.-%, insbesondere zwischen 95 und 85 Vol.-% der Verbindung gemäß Formel I bezogen auf die Gesamtmischung aus Emitter und Matrixmaterial. Entsprechend enthält die Mischung zwischen 1 und 50 Vol.-%, vorzugsweise zwischen 2 und 50 Vol.-%, besonders bevorzugt zwischen 3 und 40 Vol.-%, insbesondere zwischen 5 und 15 Vol.-% des phosphoreszierenden Emitters bezogen auf die Gesamtmischung aus Emitter und Matrixmaterial.
- Eine weitere bevorzugte Ausführungsform der vorliegenden Erfindung ist der Einsatz der erfindungsgemäßen Verbindung als Matrixmaterial für einen phosphoreszierenden Emitter in Kombination mit einem weiteren Matrixmaterial. Besonders geeignete Matrixmaterialien, welche in Kombination mit den erfindungsgemäßen Verbindungen eingesetzt werden können, sind aromatische Ketone, aromatische Phosphinoxide oder aromatische Sulfoxide oder Sulfone, z. B. gemäß
WO 04/013080 WO 04/093207 WO 06/005627 DE 102008033943.1 , Triarylamine, Carbazolderivate, z. B. CBP (N,N-Bis-carbazolylbiphenyl) oder die inWO 05/039246 US 2005/0069729 JP 2004/288381 EP 1205527 oderWO 08/086851 WO 07/063754 WO 08/056746 EP 1617710 ,EP 1617711 ,EP 1731584 ,JP 2005/347160 WO 07/137725 WO 05/111172 WO 06/117052 DE 102008036982.9 ,WO 07/063754 WO 08/056746 EP 652273 WO 09/062578 DE 102008056688.8 , Diazaphosphol-Derivate, z. B. gemäß der nicht offen gelegten AnmeldungDE 102009022858.6 , oder Indenocarbazolderivate, z. B. gemäß der nicht offen gelegten AnmeldungDE 102009023155.2 . - Als phosphoreszierende Verbindungen (= Triplettemitter) eignen sich insbesondere Verbindungen, die bei geeigneter Anregung Licht, vorzugsweise im sichtbaren Bereich, emittieren und außerdem mindestens ein Atom der Ordnungszahl größer 20, bevorzugt größer 38 und kleiner 84, besonders bevorzugt größer 56 und kleiner 80 enthalten. Bevorzugt werden als Phosphoreszenzemitter Verbindungen, die Kupfer, Molybdän, Wolfram, Rhenium, Ruthenium, Osmium, Rhodium, Iridium, Palladium, Platin, Silber, Gold oder Europium enthalten, verwendet, insbesondere Verbindungen, die Iridium oder Platin enthalten.
- Beispiele der oben beschriebenen Emitter können den Anmeldungen
WO 00/70655 WO 01/41512 WO 02/02714 WO 02/15645 EP 1191613 ,EP 1191612 ,EP 1191614 ,WO 05/033244 WO 05/019373 US 2005/0258742 - Es kann auch bevorzugt sein, zwei oder mehr unterschiedliche phosphoreszierende Emitter in einer emittierenden Schicht zu verwenden, insbesondere Emitter, welche unterschiedliche Emissionsmaxima haben. So ist es durch Einsatz beispielsweise eines grün und eines rot phosphoreszierenden Emitters möglich, rote Lumineszenz mit einer verbesserten Effizienz zu erzielen.
- In einer weiteren Ausführungsform der Erfindung enthält die erfindungsgemäße organische Elektrolumineszenzvorrichtung keine separate Lochinjektionsschicht und/oder Lochtransportschicht und/oder Lochblockierschicht und/oder Elektronentransportschicht, d. h. die emittierende Schicht grenzt direkt an die Lochinjektionschicht oder die Anode an, und/oder die emittierende Schicht grenzt direkt an die Elektronentransportschicht oder die Elektroneninjektionsschicht oder die Kathode an, wie zum Beispiel in
WO 05/053051 WO 09/030981 - In einer weiteren Ausführungsform der vorliegenden Erfindung werden die Verbindungen gemäß Fomel I als Elektronentransportmaterial eingesetzt, bevorzugt in einer Elektronentransportschicht. Besonders bevorzugte Verbindungen sind in diesem Fall Verbindungen der Formel I, die als Ar1eine elektronenarme heteroaromatische Gruppe aufweisen, wie oben genauer ausgeführt.
- Werden die Verbindungen der Formel I als Elektronentransportmaterial in einer organischen Elektrolumineszenzvorrichtung eingesetzt, so können sie auch erfindungsgemäß in Kombination mit einer organischen oder anorganischen Alkalimetallverbindung eingesetzt werden. Dabei bedeutet „in Kombination mit einer organischen Alkalimetallverbindung”, dass die Verbindungen der Formel I und die Alkalimetallverbindung entweder als Mischung in einer Schicht oder separat in zwei aufeinander folgenden Schichten vorliegen. In einer bevorzugten Ausführungsform der Erfindung liegen die Verbindungen der Formel I und die organische Alkalimetallverbindung als Mischung in einer Schicht vor.
- Unter einer organischen Alkalimetallverbindung im Sinne dieser Erfindung soll eine Verbindung verstanden werden, welche mindestens ein Alkalimetall, also Lithium, Natrium, Kalium, Rubidium oder Caesium, enthält und welche weiterhin mindestens einen organischen Liganden enthält. Geeignete organische Alkalimetallverbindungen sind beispielsweise die in
WO 07/050301 WO 07/050334 EP 1144543 offenbarten Verbindungen. Diese sind via Zitat Bestandteil der vorliegenden Anmeldung. - Bevorzugte organische Alkalimetallverbindungen sind die Verbindungen der folgenden Formel A, wobei R1 dieselbe Bedeutung hat, wie oben beschrieben, die gebogene Linie zwei oder drei Atome und Bindungen darstellt, welche erforderlich sind, um mit M einen 5- oder 6-Ring zu ergänzen, wobei diese Atome auch durch einen oder mehrere Reste R1 substituiert sein können, und M ein Alkalimetall, ausgewählt aus der Gruppe bestehend aus Lithium, Natrium, Kalium, Rubidium oder Caesium, darstellt.
- Dabei ist es möglich, dass der Komplex gemäß Formel A in monomerer Form vorliegt, wie oben abgebildet, oder dass er in Form von Aggregaten vorliegt, beispielsweise aus zwei Alkalimetallionen und zwei Liganden, vier Alkalimetallionen und vier Liganden, sechs Alkalimetallionen und sechs Liganden oder andere Aggregate.
-
-
- Bevorzugt ist das Alkalimetall gewählt aus Lithium, Natrium und Kalium, besonders bevorzugt Lithium und Natrium, ganz besonders bevorzugt Lithium.
- Besonders bevorzugt ist eine Verbindung der Formel B, insbesondere mit M = Lithium. Ganz besonders bevorzugt ist weiterhin die Index k = 0. Ganz besonders bevorzugt handelt es sich also um unsubstituiertes Lithiumchinolinat.
- Ganz besonders bevorzugt enthält die organische Elektrolumineszenzvorrichtung eine Mischung aus einer Verbindung der Formel I mit Ar1 gleich einer elektronenarmen heteroaromatischen Gruppe und einer organischen Alkalimetallverbindung der Formel B, bevorzugt mit M = Lithium, insbesondere unsubsubstituiertes Lithiumchinolinat.
- Beispiele für geeignete organische Alkalimetallverbindungen sind die in der folgenden Tabelle aufgeführten Strukturen (1) bis (45).
- Wenn die Verbindung der Fomel I und die organische oder anorganische Alkalimetallverbindung in einer Mischung vorliegen, beträgt das Verhältnis der Verbindung der Formel I zur organischen Alkalimetallverbindung bevorzugt 20:80 bis 80:20, besonders bevorzugt 30:70 bis 70:30, ganz besonders bevorzugt 30:70 bis 50:50, insbesondere 30:70 bis 45:55, jeweils bezogen auf das Volumen. Besonders bevorzugt liegt also die organischen Alkalimetallverbindung in höherem Anteil vor als die Verbindung der Formel I.
- Wenn die Verbindung der Formel I und die organische oder anorganische Alkalimetallverbindung in einer Mischung vorliegen beträgt die Schichtdicke dieser Elektronentransportschicht bevorzugt zwischen 3 und 150 nm, besonders bevorzugt zwischen 5 und 100 nm, ganz besonders bevorzugt zwischen 10 und 60 nm, insbesondere zwischen 15 und 40 nm.
- Wenn die Verbindung der Formel I und die organische oder anorganische Alkalimetallverbindung in zwei aufeinanderfolgenden Schichten vorliegen, so beträgt die Schichtdicke der Schicht, welche die Verbindung der Formel I enthält, bevorzugt zwischen 3 und 150 nm, besonders bevorzugt zwischen 5 und 100 nm, ganz besonders bevorzugt zwischen 10 und 60 nm, insbesondere zwischen 15 und 40 nm. Die Schichtdicke der Schicht, welche die organische oder anorganische Alkalimetallverbindung enthält und welche zwischen der Schicht mit der Verbindung gemäß Formel I und der Kathode angeordnet ist, beträgt bevorzugt zwischen 0.5 und 20 nm, besonders bevorzugt zwischen 1 und 10 nm, ganz besonders bevorzugt zwischen 1 und 5 nm, insbesondere zwischen 1.5 und 3 nm.
- Es ist weiterhin ein Gegenstand der vorliegenden Erfindung, dass die Verbindungen gemäß Formel I als Lochblockiermaterial eingesetzt werden. Die Verbindungen werden dann bevorzugt in einer Lochblockierschicht eingesetzt, insbesondere in einer phosphoreszierenden OLED. Eine Lochblockierschicht im Sinne dieser Erfindung ist eine Schicht, welche zwischen einer emittierenden Schicht und einer Elektronentransportschicht angeordnet ist.
- Es ist weiterhin ein Gegenstand der vorliegenden Erfindung, dass die Verbindungen gemäß Formel I als Lochtransportmaterial und/oder als Lochinjektionsmaterial eingesetzt werden. Die Verbindungen werden dann bevorzugt in einer Lochtransportschicht und/oder in einer Lochinjektionsschicht eingesetzt. Eine Lochinjektionsschicht im Sinne dieser Erfindung ist eine Schicht, die direkt an die Anode angrenzt. Eine Lochtransportschicht im Sinne dieser Erfindung ist eine Schicht, die zwischen der Lochinjektionsschicht und der Emissionsschicht liegt.
- Als Kathode sind Metalle mit geringer Austrittsarbeit, Metalllegierungen oder mehrlagige Strukturen aus verschiedenen Metallen bevorzugt, wie beispielsweise Erdalkalimetalle, Alkalimetalle, Hauptgruppenmetalle oder Lanthanoide (z. B. Ca, Ba, Mg, Al, In, Mg, Yb, Sm, etc.). Bei mehrlagigen Strukturen können auch zusätzlich zu den genannten Metallen weitere Metalle verwendet werden, die eine relativ hohe Austrittsarbeit aufweisen, wie z. B. Ag, wobei dann in der Regel Kombinationen der Metalle, wie beispielsweise Ca/Ag oder Ba/Ag verwendet werden. Ebenso bevorzugt sind Metalllegierungen, insbesondere Legierungen aus einem Alkalimetall oder Erdalkalimetall und Silber, besonders bevorzugt eine Legierung aus Mg und Ag. Es kann auch bevorzugt sein, zwischen einer metallischen Kathode und dem organischen Halbleiter eine dünne Zwischenschicht eines Materials mit einer hohen Dielektrizitätskonstante einzubringen. Hierfür kommen beispielsweise Alkalimetall- oder Erdalkalimetallfluoride, aber auch die entsprechenden Oxide oder Carbonate in Frage (z. B. LiF, Li2O, CsF, Cs2CO3, BaF2, MgO, NaF, etc.). Die Schichtdicke dieser Schicht beträgt bevorzugt zwischen 0.5 und 5 nm.
- Als Anode sind Materialien mit hoher Austrittsarbeit bevorzugt. Bevorzugt weist die Anode eine Austrittsarbeit größer 4.5 eV gegen Vakuum auf. Hierfür sind einerseits Metalle mit hohem Redoxpotential geeignet, wie beispielsweise Ag, Pt oder Au. Es können andererseits auch Metall/Metalloxid-Elektroden (z. B. Al/Ni/NiOx, Al/PtOx, WoO3) bevorzugt sein. Für einige Anwendungen muss mindestens eine der Elektroden transparent sein, um entweder die Bestrahlung des organischen Materials (O-SC) oder die Auskopplung von Licht (OLED/PLED, O-Laser) zu ermöglichen. Ein bevorzugter Aufbau verwendet eine transparente Anode. Bevorzugte Anodenmaterialien sind hier leitfähige gemischte Metalloxide. Besonders bevorzugt sind Indium-Zinn-Oxid (ITO) oder Indium-Zink Oxid (IZO). Bevorzugt sind weiterhin leitfähige, dotierte organische Materialien, insbesondere leitfähige dotierte Polymere.
- Die Vorrichtung wird entsprechend (je nach Anwendung) strukturiert, kontaktiert und schließlich hermetisch versiegelt, da sich die Lebensdauer derartiger Vorrichtungen bei Anwesenheit von Wasser und/oder Luft drastisch verkürzt.
- Auch in Polymeren, Oligomeren oder Dendrimeren können Verbindungen gemäß Formel I entweder als lochtransportierende Einheit und/oder als elektronentransportierende Einheit und/oder als Matrix für phosphoreszierende Einheiten eingesetzt werden.
- Weiterhin bevorzugt ist eine organische Elektrolumineszenzvorrichtung, dadurch gekennzeichnet, dass eine oder mehrere Schichten mit einem Sublimationsverfahren beschichtet werden. Dabei werden die Materialien in Vakuum-Sublimationsanlagen bei einem Anfangsdruck kleiner 10–5 mbar, bevorzugt kleiner 10–6 mbar aufgedampft. Es sei aber angemerkt, dass der Anfangsdruck auch noch geringer sein kann, beispielsweise kleiner 10–7 mbar.
- Bevorzugt ist ebenfalls eine organische Elektrolumineszenzvorrichtung, dadurch gekennzeichnet, dass eine oder mehrere Schichten mit dem OVPD (Organic Vapour Phase Deposition) Verfahren oder mit Hilfe einer Trägergassublimation beschichtet werden. Dabei werden die Materialien bei einem Druck zwischen 10–5 mbar und 1 bar aufgebracht. Ein Spezialfall dieses Verfahrens ist das OVJP (Organic Vapour Jet Printing) Verfahren, bei dem die Materialien direkt durch eine Düse aufgebracht und so strukturiert werden (z. B. M. S. Arnold et al., Appl. Phys. Lett. 2008, 92, 053301).
- Weiterhin bevorzugt ist eine organische Elektrolumineszenzvorrichtung, dadurch gekennzeichnet, dass eine oder mehrere Schichten aus Lösung, wie z. B. durch Spincoating, oder mit einem beliebigen Druckverfahren, wie z. B. Siebdruck, Flexodruck oder Offsetdruck, besonders bevorzugt aber LITI (Light Induced Thermal Imaging, Thermotransferdruck) oder Ink-Jet Druck (Tintenstrahldruck), hergestellt werden. Hierfür sind lösliche Verbindungen gemäß Formel I nötig. Hohe Löslichkeit lässt sich durch geeignete Substitution der Verbindungen erreichen. Diese Verfahren zur Herstellung von Schichten eignen sich insbesondere auch für Polymere, Oligomere oder Dendrimere.
- Die organische Elektrolumineszenzvorrichtung kann auch als Hybridsystem hergestellt werden, indem eine oder mehrere Schichten aus Lösung aufgebracht werden und eine oder mehrere andere Schichten aufgedampft werden. So ist es beispielsweise möglich, eine emittierende Schicht enthaltend eine Verbindung gemäß Formel I und einen phosphoreszierenden Dotanden aus Lösung aufzubringen und darauf eine Lochblockierschicht und/oder eine Elektronentransportschicht im Vakuum aufzudampfen. Ebenso kann die emittierende Schicht enthaltend eine Verbindung gemäß Formel I und einen phosphoreszierenden Dotanden im Vakuum aufgedampft werden und eine oder mehrere andere Schichten können aus Lösung aufgebracht werden. Alternativ oder ergänzend ist es beispielsweise auch möglich, eine emittierende Schicht aus Lösung aufzubringen und darauf eine Elektronentransportschicht enthaltend eine Verbindung gemäß Formel I, ggf. in Kombination mit einer organischen Alkalimetallverbindung, im Vakuum aufzudampfen.
- Diese Verfahren sind dem Fachmann generell bekannt und können von ihm ohne Probleme auf organische Elektrolumineszenzvorrichtungen enthaltend Verbindungen gemäß Formel I bzw. die oben aufgeführten bevorzugten Ausführungsformen angewandt werden.
- Für das Aufbringen aus Lösung sind Lösungen bzw. Formulierungen der erfindungsgemäßen Verbindung erforderlich. Ein weiterer Gegenstand der vorliegenden Erfindung ist daher eine Formulierung enthaltend mindestens eine Verbindung der Formel I und mindestens ein organisches Lösemittel. Dabei können alle organischen Lösemittel verwendet werden, wie sie üblicherweise zur Herstellung organischer Elektrolumineszenzvorrichtungen verwendet werden.
- Ein weiterer Gegenstand der vorliegenden Erfindung sind Mischungen, enthaltend mindestens einen phosphoreszierenden Emitter und mindestens eine Verbindung gemäß Formel I.
- Die erfindungsgemäßen Verbindungen weisen bei Verwendung in organischen Elektrolumineszenzvorrichtungen folgende überraschende Vorteile gegenüber dem Stand der Technik auf:
- 1. Die erfindungsgemäßen Verbindungen eignen sich sehr gut für die Verwendung als Matrixmaterial für phosphoreszierende Emitter und führen in dieser Verwendung zu guten Effizienzen, hohen Lebensdauern und geringen Betriebsspannungen.
- 2. Die Leistungseffizienz entsprechender Vorrichtungen wird höher im Vergleich zu Systemen gemäß dem Stand der Technik, insbesondere bei Verwendung dicker Schichten. Dies gilt insbesondere bei Verwendung der erfindungsgemäßen Verbindung in einer Elektronentransportschicht.
- 3. Die Stabilität entsprechender Vorrichtungen wird höher im Vergleich zu Systemen gemäß dem Stand der Technik, was sich vor allem in einer deutlich höheren Lebensdauer zeigt, insbesondere bei Verwendung dicker Schichten.
- 4. Die erfindungsgemäßen organische Elektroluminszenzvorrichtungen weisen gleichzeitig eine verringerte Betriebsspannung auf.
- 5. Die erfindungsgemäßen organischen Elektrolumineszenzvorrichtungen weisen eine sehr hohe Effizienz auf. Die verbesserte Effizienz ist möglicherweise auf eine verbesserte Elektroneninjektion aus der Elektronentransportschicht in die emittierende Schicht zurückzuführen.
- Abschließend soll angemerkt werden, dass alle bevorzugten und alle nicht als explizit bevorzugt genannten Merkmale der oben genannten erfindungsgemäßen Verbindungen, ihrer Verwendung in elektronischen Vorrichtungen und der elektronischen Vorrichtungen selbst beliebig miteinander kombiniert werden können. Alle resultierenden Kombinationen sind ebenfalls Bestandteil dieser Erfindung.
- Die Erfindung wird nun durch die nachfolgenden Beispiele näher erläutert, ohne sie dadurch einschränken zu wollen. Der Fachmann kann, ohne erfinderisch tätig zu werden, weitere erfindungsgemäße Verbindungen synthetisieren und diese in elektronischen Vorrichtungen einsetzen.
- Beispiele
- Die nachfolgenden Synthesen werden, sofern nicht anders angegeben, unter einer Schutzgasatmosphäre in getrockneten Lösungsmitteln durchgeführt.
- Eine gut gerührte Suspension von 23,8 g (100 mmol) 9,9-Dimethylfluorenyl-2-boronsäure, 20,6 g (102 mmol) 1-Brom-2-nitrobenzol, 51 g (221 mmol) Trikaliumphosphat in einem Gemisch aus 380 ml Toluol, 190 ml Dioxan und 480 ml Wasser wird mit 913 mg (3 mmol) Tri-o-tolylphosphin und dann 112 mg (0,5 mmol) Palladium(II)acetat versetzt und anschließend 16 h unter Rückfluss erhitzt. Nach Erkalten wird der ausgefallene Feststoff abgesaugt, dreimal mit 50 ml Toluol, dreimal mit 50 ml Ethanol:Wasser (1:1, v:v) und dreimal mit 100 ml Ethanol gewaschen, dreimal aus DMF (ca. 10 ml/g) umkristallisiert. Ausbeute: 25,3 g (80 mmol), 81%.
- Eine Mischung aus 75 g (238 mmol) 2-(2-Nitro-phenyl)-9,9-dimethyl-9H-fluoren und 290.3 ml (1669 mmol) Triethylphosphit wird 12 h unter Rückfluss erhitzt. Anschließend wird das restliche Triethylphosphit abdestilliert (72–76°C/9 mm Hg). Der Rückstand wird mit Wasser/MeOH (1:1) versetzt, der Feststoff abfiltriert und umkristallisiert. Ausbeute: 61,3 g (216 mmol), 92%.
- 1,5 g (37,5 mmol) NaH (60% in Öl) wird in 150 ml Dichlormethan vorgelegt. Dazu tropft man bei RT eine Lösung aus 8 g (28 mmol) 12,12-Di-methyl-6,12-dihydro-6-aza-indeno[1,2-b]fluoren in Dichloromethan hinzu. Nach 1 h Stunde wird 8,5 g (31 mmol) 2-chlor-4,6-diphenyl-(1,3,5)-Triazin zugetropft und 8 h bei RT gerührt. Der ausgefallene Feststoff wird aus Toluol umkristallisiert. Die ausgefallenen Kristalle werden abgesaugt, mit etwas MeOH gewaschen und im Vakuum getrocknet; Ausbeute: 11,6 g; 80% d. Th.; Reinheit: 99.9% nach HPLC.
- Vergleichsbeispiele 1 bis 7 und Beispiele 4 bis 14: Herstellung der OLEDs
- Die Herstellung von erfindungsgemäßen OLEDs sowie OLEDs nach dem Stand der Technik erfolgt nach einem allgemeinen Verfahren gemäß
WO 04/058911 - In den folgenden Vergleichsbeispielen 1 bis 7 und den Beispielen 4 bis 14 (siehe Tabellen 1 und 2) werden die Ergebnisse verschiedener OLEDs vorgestellt. Glasplättchen, die mit strukturiertem ITO (Indium Zinn Oxid) der Dicke 150 nm beschichtet sind, werden zur verbesserten Prozessierung mit 20 nm PEDOT (aus Wasser aufgeschleudert; bezogen von H. C. Starck, Goslar, Deutschland; Poly(3,4-ethylendioxy-2,5-thiophen)) beschichtet. Diese beschichteten Glasplättchen sind die Substrate, auf welche die OLEDs aufgebracht werden. Die OLEDs haben prinzipiell folgenden Schichtaufbau: Substrat/optionale Lochinjektionsschicht (HIL1) 5 nm/Lochtransportschicht (HTM1)/Elektronenblockierschicht (EBL) 20 nm/Emissionsschicht (EML)/optionale Lochblockierschicht (HBL) 10 nm/Elektronentransportschicht (ETM) und abschließend eine Kathode. Die Kathode wird durch eine 100 nm dicke Aluminiumschicht gebildet, wobei je nach verwendetem Elektronentransportmaterial eine 1 nm dicke Elektroneninjektionsschicht aus LiF zwischen Kathode und Elektronentransportschicht eingebracht ist. Der genaue Aufbau der OLEDs wird im Zusammenhang mit den weiter unten aufgeführten Beispielen erläutert. Die zur Herstellung der OLEDs verwendeten Materialien sind in Tabelle 3 gezeigt.
- Alle Materialien werden in einer Vakuumkammer thermisch aufgedampft. Dabei besteht die Emissionsschicht immer aus mindestens einem Matrixmaterial (Host) und einem Dotierstoff (Dotand), der dem Hostmaterial bzw. den Hostmaterialien durch Coverdampfung beigemischt wird.
- Die OLEDs werden standardmäßig charakterisiert. Hierfür werden die Elektrolumineszenzspektren, die Stromeffizienz (gemessen in cd/A), die Leistungseffizienz (gemessen in lm/W) und die externe Quanteneffizienz (EQE, gemessen in Prozent) in Abhängigkeit der Helligkeit, berechnet aus Strom-Spannungs-Helligkeits-Kennlinien (IUL-Kennlinien), sowie die Lebensdauer bestimmt. Als Lebensdauer wird die Zeit definiert, nach der die Helligkeit von einer bestimmten Starthelligkeit aus auf die Hälfte gesunken ist. Dieser Wert kann mit Hilfe dem Fachmann bekannten Umrechnungsformeln auf eine Angabe für andere Starthelligkeiten umgerechnet werden. Hierbei ist die Lebensdauer für eine Starthelligkeit von 1000 cd/m2 eine übliche Angabe.
- Verwendung von erfindungsgemäßen Verbindungen als Elektronentransportmaterialien
- In Tabelle 1 sind Daten einiger OLEDs gezeigt, welche die Vorteile beim Einsatz von erfindungsgemäßen Verbindungen in der Elektronentransportschicht zeigen. Die OLEDs bestehen aus der Schichtfolge Substrat/Lochinjektionsschicht (HIL1) 5 nm/Lochtransportschicht (HTM1) 140 nm/NPB 20 nm/Emissionsschicht 30 nm/Elektronentransportschicht (ETM) 20 nm/optional 1 nm LiF/Aluminium 100 nm. Dabei besteht die Emissionsschicht aus dem Hostmaterial H1, welches zu einem Volumenanteil von 5% mit dem blau emittierenden Dotanden D1 dotiert ist. In dem Vergleichsbeispiel 2 und den Beispielen 5 und 7 wird als Elektronentransportschicht eine durch Coverdampfung hergestellte Mischschicht aus einem Elektronentransportmaterial und LiQ eingesetzt. Der Volumenanteil von LiQ beträgt hierbei 60%.
- Die OLEDs entsprechend den Vergleichsbeispielen 1 und 2 und den Beispielen 4 bis 7 zeigen vergleichbare CIE Farbkoordinaten sowie eine vergleichbare Lebensdauer von etwa 150 h bei einer Starthelligkeit von 6000 cd/m2. Dies entspricht ca. 5500 h bei einer Starthelligkeit von 1000 cd/m2, wenn man dem Fachmann bekannte Extrapolationsformeln zu Grunde legt.
- Der Einsatz der erfindungsgemäßen Materialien ETM2 und ETM3 führt zu einer deutlichen Verbesserung sowohl der externen Quanteneffizienz (EQE), der Stromeffizienz (in cd/A), vor allem aber auch der Betriebsspannung und damit der Leistungseffizienz (in lm/W). Gerade die Steigerung der Leistungseffizienz ist im Hinblick auf Mobilanwendungen wichtig. Hier ist bereits eine Steigerung um 10% Prozent als deutliche Verbesserung anzusehen.
- Die höchste Verbesserung in der Leistungseffizienz erzielt man mit LiF als Elektroneninjektionsschicht. Hier steigert die Verwendung der erfindungsgemäßen Verbindungen ETM2 bzw. ETM3 die Leistungseffizienz um etwa 40% gegenüber dem Einsatz von Alq3 (Vergleich von Vergleichsbeispiel 1 mit den Beispielen 4 und 6). Auch beim Einsatz einer gemischten Elektronentransportschicht, welche schon mit dem Elektronentransportmaterial ETM1 gemäß dem Stand der Technik eine gute Leistungseffizienz ergibt (Vergleichsbeispiel 2), lässt sich durch Einsatz von ETM2 bzw. ETM3 eine deutliche Verbesserung um ca. 15% erreichen (Vergleich von Vergleichsbeispiel 2 mit den Beispielen 5 und 7).
- Weiterhin zeigt die erfindungsgemäße Verbindung ETM3 eine wesentlich verbesserte Prozessierbarkeit gegenüber dem Stand der Technik ETM1. Von den Materialien werden bei gleichen Aufdampfbedingungen (Aufdampfrate von 0.1 nm/s) etwa 1 μm dicke Schichten abgeschieden.
- Hierbei zeigt das erfindungsgemäße Material ETM3 keine Verstopfung der Aufdampfquelle („clogging”). Hingegen wächst bei Verwendung von ETM1 am oberen Rand der Aufdampfquelle eine Schicht des Materials ringförmig nach innen. Hierdurch ist nach ca. 1.5 h Aufdampfzeit keine kontrollierte Schichtabscheidung mehr möglich. Die erfindungsgemäßen Verbindungen sind also wesentlich besser für einen Einsatz in der Massenproduktion geeignet als die Verbindung ETM1 gemäß dem Stand der Technik. Tabelle 1: Verwendung von erfindungsgemäßen Verbindungen als Elektronentransortmaterialien
ETM EIM Spannung für 1000 cd/m2 Effizienz bei 1000 cd/m2 Effizienz bei 1000 cd/m2 EQE bei 1000 cd/m2 CIE x/y bei 1000 cd/m2 Vergleichsbeispiel 1 Alq3 LiF 1 nm 6.4 V 5.1 cd/A 2.5 lm/W 4.2% 0.142/0.151 Vergleichsbeispiel 2 ETM1: LiQ - 4.7 V 8.1 cd/A 5.4 lm/W 6.3% 0.142/0.155 Beispiel 4 ETM2 LiF 1 nm 5.8 V 6.2 cd/A 3.4 lm/W 4.9% 0.141/0.154 Beispiel 5 ETM2: LiQ - 4.5 V 8.8 cd/A 6.1 lm/W 6.9% 0.142/0.156 Beispiel 6 ETM3 LiF 1 nm 5.6 V 6.4 cd/A 3.6 lm/W 5.0% 0.141/0.152 Beispiel 7 ETM3: LiQ - 4.5 V 9 cd/A 6.3 lm/W 7.1% 0.143/0.157 - Verwendung von erfindungsgemäßen Verbindungen als Hostmaterialien für phosphoreszierende Dotanden
- Die erfindungsgemäßen Verbindungen lassen sich auch als Hostmaterialien (Wirtsmaterialen) für phosphoreszierende Dotanden einsetzen.
- Hierbei kommen neben der Verbindung H5 die im vorigen Abschnitt beschriebenen Materialien ETM2 und ETM3 zum Einsatz, die der Übersichtlichkeit halber im Folgenden als H3 und H4 bezeichnet werden. Als Vergleich gemäß dem Stand der Technik wird die Verbindung H2 verwendet. Es werden OLEDs mit dem grün emittierenden Dotanden TEG1 sowie den rot emittierenden Dotanden TER1 und TER2 verglichen.
- Die OLEDs haben den Aufbau Substrat/Lochtransportschicht (HTM1)/Elektronenblockerschicht (EBL) 20 nm/Emissionsschicht (EML)/optionale Lochblockierschicht (HBL) 10 nm/Elektronentransportschicht (ETM)/optional LiF 1 nm/Aluminium 100 nm. In den OLEDs der Vergleichsbeispiele 3 bis 5 und der Beispiele 8 bis 10 beträgt die Dicke der Lochtransportschicht 20 nm, die Elektronenblockierschicht wird durch NPB gebildet, die Elektronentransportschicht ist eine 20 nm dicke Alq3 Schicht mit einer 1 nm dicken Elektroninjektionsschicht aus LiF. Die OLEDs des Vergleichsbeispiels 5 und des Beispiels 10 enthalten zusätzlich eine 10 nm dicke Lochblockierschicht des Materials H2 zwischen Emissionsschicht und Elektronentransportschicht. Die OLEDs der Vergleichsbeispiele 6 und 7 und der Beispiele 11 bis 14 enthalten eine 160 nm dicke Lochtransportschicht und eine Elektronenblockierschicht, welche durch das Material EBM1 gebildet wird. Als Elektronentransportschicht enthalten diese OLEDs eine Mischung aus ETM1 und LiQ im Volumenverhältnis 50%:50%, eine Elektroneninjektionsschicht ist nicht vorhanden. In den OLEDs des Vergleichsbeispiels 6 und der Beispiele 11 und 13 ist eine 10 nm dicke Lochblockierschicht aus Material H2 vorhanden; die Dicke der Elektronentransportschicht beträgt 30 nm. Die Lochblockierschicht ist in den OLEDs des Vergleichsbeispiels 7 und der Beispiele 12 und 14 nicht vorhanden; die Dicke der Elektronentransportschicht beträgt hier 40 nm.
- Durch Einsatz der erfindungsgemäßen Verbindungen H3, H4 und H5 ergeben sich deutliche Verbesserungen hinsichtlich Effizienz, Betriebsspannung sowie Lebensdauer im Vergleich zur Verwendung von H2 gemäß dem Stand der Technik (siehe Tabelle 2).
- In rot emittierenden OLEDs erhält man beim Einsatz des Hostmaterials H5 eine 25–50%ige Steigerung der Leistungseffizienz, je nachdem ob der Dotand TER1 oder TER2 verwendet wird und ob ein weiteres Hostmaterial anwesend ist (Vergleich der Vergleichsbeispiel 3 bis 5 mit den Beispielen 8 bis 10). Weiterhin erhöht sich die Lebensdauer beim Einsatz von H5 um 20–35% gegenüber Bauteilen, in denen das Material H2 gemäß dem Stand der Technik eingesetzt wird. Die erfindungsgemäßen Verbindungen ergeben beim Einsatz als Hostmaterial in rot emittierenden phosphoreszierenden OLEDs somit signifikante Verbesserungen in allen relevanten Parametern.
- Durch Einsatz der erfindungsgemäßen Materialien H3 und H4 in grün emittierenden phosphoreszierenden OLEDs lassen sich Effizienz, Betriebsspannung und Lebensdauer sogar noch deutlicher verbessern als in den eben beschriebenen rot emittierenden OLEDs. Die Verwendung von H4 als Hostmaterial ergibt gegenüber dem Einsatz von H2 eine Verbesserung um 35–40% in der Leistungseffizienz und eine Steigerung um etwa 30–40% in der Lebensdauer (Vergleich von Vergleichsbeispiel 6 mit Beispiel 13, bzw. Vergleichsbeispiel 7 mit Beispiel 14). Die sehr hohe Steigerung der Leistungseffizienz ergibt sich vor allem durch die deutliche Verringerung der Betriebsspannung um etwa 1 V. Im Vergleich zum Stand der Technik H2 ergibt sich beim Einsatz der erfindungsgemäßen Verbindung H3 ebenfalls eine deutliche Verbesserung der Leistungseffizienz um etwa 20%, die Lebensdauer erhöht sich um 20–30% (Vergleich von Vergleichsbeispiel 6 mit Beispiel 11, bzw. Vergleichsbeispiel 7 mit Beispiel 12). Tabelle 2: Verwendung von erfindungsgemäßen Verbindungen als Hostmaterialien in phoshoreszierenden OLEDs
EML HBL Spannung für 1000 cd/m2 Effizienz bei 1000 cd/m2 Effizienz bei 1000 cd/m2 CIE x/y bei 1000 cd/m2 Lebensdauer ab 1000 cd/m2 Vergleichsbeispiel 3 H2:TER1 (85%:15%) - 5.0 V 7.2 cd/A 4.5 lm/W 0.69/0.31 14000 Vergleichsbeispiel 4 H2:TER2 (85%:15%) - 6.5 V 9.0 cd/A 4.3 lm/W 0.66/0.33 18000 Vergleichsbeispiel 5 H2:CBP:TER1 (45%:45%:10%) H2 5.2 V 8.1 cd/A 4.9 lm/W 0.68/0.32 15000 Vergleichsbeispiel 6 H2:TEG1 (90%:10%) H2 4.7 V 55 cd/A 37 lm/W 0.36/0.61 27000 Vergleichsbeispiel 7 H2:TEG1 (90%:10%) - 4.6 V 54 cd/A 37 lm/W 0.37/0.60 24000 Beispiel 8 H5:TER1 (85%:15%) - 4.4 V 8.1 cd/A 5.8 lm/W 0.69/0.31 17000 Beispiel 9 H5:TER2 (85%:15%) - 4.7 V 9.9 cd/A 6.6 lm/W 0.65/0.32 23000 Beispiel 10 H5:CBP:TER1 (45%:45%:10%) H2 4.6 V 8.9 cd/A 6.1 lm/W 0.69/0.31 20000 Beispiel 11 H3:TEG1 (90%:10%) H2 3.9 V 54 cd/A 44 lm/W 0.37/0.60 35000 Beispiel 12 H3:TEG1 (90%:10%) - 3.8 V 53 cd/A 44 lm/W 0.37/0.60 29000 Beispiel 13 H4:TEG1 (90%:10%) H2 3.8 V 60 cd/A 50 lm/W 0.37/0.61 37000 Beispiel 14 H4:TEG1 (90%:10%) - 3.6 V 58 cd/A 51 lm/W 0.38/0.60 32000 - ZITATE ENTHALTEN IN DER BESCHREIBUNG
- Diese Liste der vom Anmelder aufgeführten Dokumente wurde automatisiert erzeugt und ist ausschließlich zur besseren Information des Lesers aufgenommen. Die Liste ist nicht Bestandteil der deutschen Patent- bzw. Gebrauchsmusteranmeldung. Das DPMA übernimmt keinerlei Haftung für etwaige Fehler oder Auslassungen.
- Zitierte Patentliteratur
-
- - US 4539507 [0002, 0010, 0010]
- - US 5151629 [0002]
- - EP 0676461 [0002]
- - WO 98/27136 [0002]
- - WO 04/093207 [0005, 0071]
- - WO 05/003253 [0005]
- - EP 1860097 [0013]
- - WO 2006/100896 [0013]
- - DE 102006025846 [0013]
- - WO 2006/122630 [0013]
- - WO 2008132103 [0013]
- - WO 2008006449 [0013]
- - WO 2008056746 [0013]
- - WO 2008149691 [0013]
- - WO 2008146839 [0013]
- - WO 2008/006449 [0013]
- - EP 842208 [0057]
- - WO 00/22026 [0057]
- - EP 707020 [0057]
- - EP 894107 [0057]
- - EP 04028865 [0057]
- - WO 92/18552 [0057]
- - WO 04/070772 [0057]
- - WO 04/113468 [0057]
- - EP 1028136 [0057]
- - WO 05/014689 [0057]
- - WO 04/041901 [0057]
- - WO 04/113412 [0057]
- - WO 05/040302 [0057]
- - WO 05/104264 [0057]
- - WO 05/011013 [0062]
- - WO 04/013080 [0071]
- - WO 06/005627 [0071]
- - DE 102008033943 [0071]
- - WO 05/039246 [0071]
- - US 2005/0069729 [0071]
- - JP 2004/288381 [0071]
- - EP 1205527 [0071]
- - WO 08/086851 [0071]
- - WO 07/063754 [0071, 0071]
- - WO 08/056746 [0071, 0071]
- - EP 1617710 [0071]
- - EP 1617711 [0071]
- - EP 1731584 [0071]
- - JP 2005/347160 [0071]
- - WO 07/137725 [0071]
- - WO 05/111172 [0071]
- - WO 06/117052 [0071]
- - DE 102008036982 [0071]
- - EP 652273 [0071]
- - WO 09/062578 [0071]
- - DE 102008056688 [0071]
- - DE 102009022858 [0071]
- - DE 102009023155 [0071]
- - WO 00/70655 [0073]
- - WO 01/41512 [0073]
- - WO 02/02714 [0073]
- - WO 02/15645 [0073]
- - EP 1191613 [0073]
- - EP 1191612 [0073]
- - EP 1191614 [0073]
- - WO 05/033244 [0073]
- - WO 05/019373 [0073]
- - US 2005/0258742 [0073]
- - WO 05/053051 [0075]
- - WO 09/030981 [0075]
- - WO 07/050301 [0078]
- - WO 07/050334 [0078]
- - EP 1144543 [0078]
- - WO 04/058911 [0110]
- Zitierte Nicht-Patentliteratur
-
- - Synlett, 2006, 5, 737–740 [0048]
- - T. Matsumoto et al., Multiphoton Organic EL Device Having Charge Generation Layer, IDMC 2003, Taiwan; Session 21 OLED (5) [0063]
- - M. S. Arnold et al., Appl. Phys. Lett. 2008, 92, 053301 [0097]
- - H. C. Starck, Goslar, Deutschland; Poly(3,4-ethylendioxy-2,5-thiophen) [0111]
Claims (16)
- Verbindung der Formel I: Formel I wobei die verwendeten Symbole und Indices die folgenden Bedeutungen haben: W ist gleich oder verschieden bei jedem Auftreten N oder CR1; Y ist gleich oder verschieden bei jedem Auftreten N oder CR2; E ist entweder eine kovalente Einfachbindung oder ist eine bivalente Einheit, die aus der Gruppe ausgewählt ist, die aus N(R3), C(R3)2, Si(R3)2, C=O, C=NR3, C=C(R3)2, S, S=O, SO2, P(R3) und P(=O)R3 besteht; X ist gleich oder verschieden bei jedem Auftreten eine bivalente Einheit, die aus der Gruppe ausgewählt ist, die aus C(R3)2, N(R3), Si(R3)2, C=O, C=NR3, C=C(R3)2, S, O, S=O, SO2, P(R3) und P(=O)R3 besteht, mit der Maßgabe, dass, wenn E eine kovalente Einfachbindung ist, X eine bivalente Einheit ist, die aus der Gruppe ausgewählt ist, die aus C(R3)2, Si(R3)2, C=O, C=NR3, C=C(R3)2, S, O, S=O, SO2, P(R3) und P(=O)R3 besteht; n, m sind unabhängig voneinander 0 oder 1, mit der Maßgabe, dass die Summe aus n und m gleich 1 oder 2 ist; Ar ist eine bivalente oder trivalente, mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 40 aromatischen Ringatomen, die mit einem oder mehreren Resten R4a substituiert sein kann; Ar1 ist eine mono- oder polycyclische heteroaromatische Gruppe mit 5 bis 40 aromatischen Ringatomen, die mit einem oder mehreren Resten R4b substituiert sein kann; L ist entweder eine kovalente Einfachbindung oder stellt eine bivalente Einheit dar, die aus der Gruppe ausgewählt ist, die aus -C(O)-, -Ar2-C(O)- und -Ar2- besteht, wobei für den Fall, dass die bivalente Einheit -Ar2-C(O)- ist, die Gruppe Ar2 an N bindet und C(O) an die Gruppe Ar1 bindet; Ar2 ist eine bivalente mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 40 aromatischen Ringatomen, die mit einem oder mehreren Resten R4a oder R4b substituiert sein kann; R1, R2 sind gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus Folgendem besteht: H, D, F, Cl, Br, I, N(Ar3)2, C(=O)Ar3, P(=O)(Ar3)2, S(=O)Ar3, S(=O)2Ar3, CN, eine geradkettige Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 1 bis 40 C-Atomen oder eine verzweigte oder cyclische Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 3 bis 40 C-Atomen oder eine Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R5 substituiert sein kann und wobei jeweils eine oder mehrere nicht benachbarte CH2-Gruppen durch R5C=CR5, C≡C, C=O, C=S,, P(=O)(R5), SO, SO2, NR5, O, S oder CONR5 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann, oder eine Aryloxy- oder Heteroaryloxygruppe mit 5 bis 40 aromatischen Ringatomen, die durch einen oder mehrere Reste R5 substituiert sein kann, oder eine Kombination dieser Systeme; wobei auch zwei oder mehrere benachbarte Substituenten R1 und/oder R2 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können; R3 ist gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus Folgendem besteht: H, D, F, Cl, Br, I, N(Ar3)2, C(=O)Ar3, P(=O)(Ar3)2, S(=O)Ar3, S(=O)2Ar3, CR5=CR5Ar3, CN, NO2, Si(R5)3, B(OR5)2, OSO2R5, eine geradkettige Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 1 bis 40 C-Atomen oder eine verzweigte oder cyclische Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 3 bis 40 C-Atomen oder eine Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R5 substituiert sein kann und wobei jeweils eine oder mehrere nicht benachbarte CH2-Gruppen durch R5C=CR5, C≡C, Si(R5)2, Ge(R5)2, Sn(R5)2, C=O, C=S, C=Se, C=NR5, P(=O)(R5), SO, SO2, NR5, O, S oder CONR5 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann, oder eine Aryloxy- oder Heteroaryloxygruppe mit 5 bis 40 aromatischen Ringatomen, die durch einen oder mehrere Reste R5 substituiert sein kann, oder eine Kombination dieser Systeme; wobei auch zwei oder mehrere benachbarte Substituenten R3 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können; R4a, R4b sind jeweils gleich oder verschieden bei jedem Auftreten aus der Gruppe ausgewählt, die aus folgendem besteht: D, F, Cl, Br, I, N(Ar3)2, C(=O)AT3, P(=O)(Ar3)2, S(=O)Ar3, S(=O)2Ar3, CN, eine geradkettige Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 1 bis 40 C-Atomen oder eine verzweigte oder cyclische Alkyl-, Alkoxy- oder Thioalkoxygruppe mit 3 bis 40 C-Atomen oder eine Alkenyl- oder Alkinylgruppe mit 2 bis 40 C-Atomen, die jeweils mit einem oder mehreren Resten R5 substituiert sein kann und wobei jeweils eine oder mehrere nicht benachbarte CH2-Gruppen durch R5C=CR5, C≡C, C=O, C=S,, P(=O)(R5), SO, SO2, NR5, O, S oder CONR5 ersetzt sein können und wobei ein oder mehrere H-Atome durch D, F, Cl, Br, I, CN oder NO2 ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann, oder eine Aryloxy- oder Heteroaryloxygruppe mit 5 bis 40 aromatischen Ringatomen, die durch einen oder mehrere Reste R5 substituiert sein kann, oder eine Kombination dieser Systeme; wobei auch zwei oder mehrere benachbarte Substituenten R4a oder R4b miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können; Ar3 ist ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 40 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann; R5 ist gleich oder verschieden bei jedem Auftreten H, D, eine geradkettige Alkylgruppe mit 1 bis 20 C-Atomen oder eine verzweigte oder cyclische Alkylgruppe mit 3 bis 20 C-Atomen, wobei eine oder mehrere nicht benachbarte CH2-Gruppen durch NH, O oder S ersetzt sein können und wobei ein oder mehrere H-Atome durch F ersetzt sein können, oder ein mono- oder polycylisches aromatisches oder heteroaromatisches Ringsystem mit 5 bis 20 aromatischen Ringatomen, das jeweils durch einen oder mehrere Reste R6 substituiert sein kann; wobei auch zwei oder mehrere Substituenten R5 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können; R6 ist gleich oder verschieden bei jedem Auftreten H, D, F, CN, eine geradkettige Alkylgruppe mit 1 bis 20 C-Atomen oder eine verzweigte oder cyclische Alkylgruppe mit 3 bis 20 C-Atomen, wobei eine oder mehrere nicht benachbarte CH2-Gruppen durch NH, O oder S ersetzt sein können und wobei ein oder mehrere H-Atome durch F ersetzt sein können; wobei auch zwei oder mehrere Substituenten R6 miteinander über eine kovalente Einfachbindung oder eine bivalente Gruppe Z verknüpft sein können; Z stellt eine bivalente Gruppe -(CH2)q- dar, wobei q gleich 1, 2, 3, 4 oder 5 ist, bevozugt 1, 2, 3 oder 4, stärker bevorzugt 1, 2 oder 3, und am stärksten bevorzugt 1 oder 2.
- Verbindung nach Anspruch 1, dadurch gekennzeichnet, dass Y gleich oder verschieden bei jedem Auftreten CR1 ist und dass W gleich oder verschieden bei jedem Auftreten CR2 ist.
- Verbindung nach Anspruch 1 oder 2, dadurch gekennzeichnet, dass E entweder eine kovalente Einfachbindung oder eine bivalente Einheit ausgewählt aus N(R3), C(R3)2, O und S ist.
- Verbindung nach einem oder mehreren der Ansprüche 1 bis 3, dadurch gekennzeichnet, dass X gleich oder verschieden bei jedem Auftreten eine bivalente Einheit ist, die aus der Gruppe ausgewählt ist, die aus C(R3)2, S und O besteht.
- Verbindung nach einem oder mehreren der Ansprüche 1 bis 4, dadurch gekennzeichnet, dass Ar eine bivalente oder tivalente mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 10 aromatischen Ringatomen, die mit einem oder mehreren Resten R4a substituiert sein kann, bevorzugt gleich Phenylen oder Naphthylen, welches jeweils mit einem oder mehreren Resten R4a substituiert sein kann.
- Verbindung nach einem oder mehreren der Ansprüche 1 bis 5, dadurch gekennzeichnet, dass Ar1 eine elektronenarme, mono- oder polycyclische heteroaromatische Gruppe mit 5 bis 10 aromatischen Ringatomen, die mit einem oder mehreren Resten R4b substituiert sein kann, darstellt.
- Verbindung nach Anspruch 6, dadurch gekennzeichnet, dass Ar1 ausgewählt ist aus der Gruppe bestehend aus Pyridin, Pyrazin, Pyrimidin, Pyridazin, 1,2,4-Triazin, 1,3,5-Triazin, Chinolin, Isochinolin, Chinoxalin, Pyrazol, Imidazol, Benzimidazol, Thiazol, Benzothiazol, Oxazol oder Benzooxazol, die jeweils mit R4b substituiert sein können.
- Verbindung nach einem oder mehreren der Ansprüche 1 bis 7, dadurch gekennzeichnet, dass L eine kovalente Einfachbindung oder eine bivalente Einheit -Ar2- ist, wobei Ar2 bevorzugt für eine bivalente mono- oder polycyclische aromatische oder heteroaromatische Einheit mit 5 bis 10 aromatischen Ringatomen steht, die mit einem oder mehreren Resten R4a oder R4b substituiert sein kann.
- Verbindung nach einem oder mehreren der Ansprüche 1 bis 8, dadurch gekennzeichnet, dass die Summe der Indizes n + m = 1 ist.
- Verfahren zur Herstellung einer Verbindung nach einem oder mehreren der Ansprüche 1 bis 9, umfassend die Schritte: a) Kupplung eines Carbazolderivats oder Fluorenderivats mit einem Benzolderivat, und b) Arylierung des Carbazol-Stickstoff zur Einführung von Ar1.
- Polymer, Oligomer oder Dendrimer, enthaltend eine oder mehrere Verbindungen nach einem oder mehreren der Ansprüche 1 bis 9, wobei ein oder mehrere Reste oder H-Atome der oben definierten Verbindungen eine Bindung zum Polymer, Oligomer oder Dendrimer darstellen.
- Verwendung einer Verbindung nach einem oder mehreren der Ansprüche 1 bis 9 bzw. eines Polymers, Oligomers oder Dendrimers nach Anspruch 11 in einer elektronischen Vorrichtung.
- Elektronische Vorrichtung, enthaltend mindestens eine Verbindung nach einem oder mehreren der Ansprüche 1 bis 9, oder ein Polymer, Oligomer oder Dendrimer nach Anspruch 11, wobei die elektronische Vorrichtung bevorzugt ausgewählt ist aus der Gruppe bestehend aus organischen Elektrolumineszenzvorrichtungen (OLEDs), organischen Feld-Effekt-Transistoren (O-FETs), organischen Dünnfilmtransistoren (O-TFTs), organischen lichtemittierenden Transistoren (O-LETs), organischen integrierten Schaltungen (O-ICs), organischen Solarzellen (O-SCs), organischen Feld-Quench-Devices (O-FQDs), lichtemittierenden elektrochemischen Zellen (LECs), organischen Photorezeptoren oder organischen Laserdioden (O-Laser).
- Organische Elektrolumineszenzvorrichtung nach Anspruch 13, dadurch gekennzeichnet, dass die Verbindung nach einem oder mehreren der Ansprüche 1 bis 9 oder das Polymer, Oligomer oder Dendrimer nach Anspruch 11 als Matrixmaterial für phosphoreszierende Dotanden in einer emittierenden Schicht und/oder als Elektronentransportmaterial in einer Elektronentransportschicht und/oder als Lochtransportmaterial in der Lochtransportschicht und/oder als Lochblockiermaterial in einer Lochblockierschicht eingesetzt wird.
- Mischung aus einer oder mehreren Verbindungen nach einem oder mehreren der Ansprüche 1 bis 9 und/oder einem oder mehreren Polymeren, Oligomeren bzw. Dendrimeren nach Anspruch 11 mit einer oder mehreren emittierenden Verbindungen.
- Formulierung enthaltend mindestens eine Verbindung nach einem oder mehreren der Ansprüche 1 bis 9 und/oder ein Polymer, Oligomer oder Dendrimer nach Anspruch 11 oder eine Mischung nach Anspruch 15 und mindestens ein organisches Lösemittel.
Priority Applications (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102009031021A DE102009031021A1 (de) | 2009-06-30 | 2009-06-30 | Materialien für organische Elektrolumineszenzvorrichtungen |
| CN201080029223.0A CN102471602B (zh) | 2009-06-30 | 2010-06-01 | 用于有机电致发光器件的材料 |
| PCT/EP2010/003324 WO2011000455A1 (de) | 2009-06-30 | 2010-06-01 | Materialien für organische elektrolumineszenzvorrichtungen |
| US13/379,879 US9040172B2 (en) | 2009-06-30 | 2010-06-01 | Materials for organic electroluminescent devices |
| DE112010002775.7T DE112010002775B4 (de) | 2009-06-30 | 2010-06-01 | Materialien für organische elektrolumineszenzvorrichtungen |
| KR1020127002648A KR101777883B1 (ko) | 2009-06-30 | 2010-06-01 | 유기 전계발광 소자용 재료 |
| JP2012516542A JP5734965B2 (ja) | 2009-06-30 | 2010-06-01 | 有機エレクトロルミネセンス素子のための材料 |
| TW099120837A TW201127811A (en) | 2009-06-30 | 2010-06-25 | Materials for organic electroluminescent devices |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102009031021A DE102009031021A1 (de) | 2009-06-30 | 2009-06-30 | Materialien für organische Elektrolumineszenzvorrichtungen |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE102009031021A1 true DE102009031021A1 (de) | 2011-01-05 |
Family
ID=42542439
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE102009031021A Withdrawn DE102009031021A1 (de) | 2009-06-30 | 2009-06-30 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE112010002775.7T Active DE112010002775B4 (de) | 2009-06-30 | 2010-06-01 | Materialien für organische elektrolumineszenzvorrichtungen |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE112010002775.7T Active DE112010002775B4 (de) | 2009-06-30 | 2010-06-01 | Materialien für organische elektrolumineszenzvorrichtungen |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9040172B2 (de) |
| JP (1) | JP5734965B2 (de) |
| KR (1) | KR101777883B1 (de) |
| CN (1) | CN102471602B (de) |
| DE (2) | DE102009031021A1 (de) |
| TW (1) | TW201127811A (de) |
| WO (1) | WO2011000455A1 (de) |
Cited By (90)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102009032922A1 (de) | 2009-07-14 | 2011-01-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009041289A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009041414A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Metallkomplexe |
| WO2011032686A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Formulierungen zur herstellung von elektronischen vorrichtungen |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102009053645A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtung |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009057167A1 (de) | 2009-12-05 | 2011-06-09 | Merck Patent Gmbh | Elektronische Vorrichtung enthaltend Metallkomplexe |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010009193A1 (de) | 2010-02-24 | 2011-08-25 | Merck Patent GmbH, 64293 | Fluor-Fluor Assoziate |
| DE102010010481A1 (de) | 2010-03-06 | 2011-09-08 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010018321A1 (de) | 2010-04-27 | 2011-10-27 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010019306A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| DE102010020567A1 (de) | 2010-05-14 | 2011-11-17 | Merck Patent Gmbh | Metallkomplexe |
| DE102010020044A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010027319A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027317A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027218A1 (de) | 2010-07-15 | 2012-01-19 | Merck Patent Gmbh | Organische Komplexe enthaltend Metalle |
| DE102010027316A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010045405A1 (de) | 2010-09-15 | 2012-03-15 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012038029A1 (de) | 2010-09-24 | 2012-03-29 | Merck Patent Gmbh | Phosphorhaltige metallkomplexe |
| DE102010046412A1 (de) | 2010-09-23 | 2012-03-29 | Merck Patent Gmbh | Metall-Ligand Koordinationsverbindungen |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010054525A1 (de) | 2010-12-15 | 2012-04-26 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010054316A1 (de) | 2010-12-13 | 2012-06-14 | Merck Patent Gmbh | Substituierte Tetraarylbenzole |
| DE102010055901A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2012084115A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| EP2482159A2 (de) | 2011-01-28 | 2012-08-01 | Honeywell International, Inc. | Verfahren und umkonfigurierbare System zur Optimierung der Leistung eines zustandsabhängigen Wartungssystems |
| WO2012107158A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | 1,3 - dioxan-5-on-verbindungen |
| DE102011011104A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte Dibenzonaphtacene |
| DE102012016192A1 (de) | 2011-08-19 | 2013-02-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| WO2013060411A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte polymere, verfahren zu deren herstellung sowie deren verwendung in elektronischen vorrichtungen |
| WO2013097920A1 (en) | 2011-12-27 | 2013-07-04 | Merck Patent Gmbh | Metal complexes comprising 1,2,3-triazoles |
| WO2013107487A1 (en) | 2012-01-16 | 2013-07-25 | Merck Patent Gmbh | Organic metal complexes |
| WO2013174471A1 (en) | 2012-05-24 | 2013-11-28 | Merck Patent Gmbh | Metal complexes comprising condensed heteroaromatic rings |
| WO2014166585A1 (de) * | 2013-04-08 | 2014-10-16 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2015106789A1 (de) * | 2014-01-17 | 2015-07-23 | Merck Patent Gmbh | Materialien f?r organische elektrolumineszenzvorrichtungen |
| EP2799515A4 (de) * | 2011-12-30 | 2015-08-12 | Cheil Ind Inc | Verbindung für eine organische optoelektronische vorrichtung, organische lichtemittierende diode damit und anzeigevorrichtung mit der organischen lichtemittierenden diode |
| WO2015124255A1 (de) * | 2014-02-21 | 2015-08-27 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| US20160093812A1 (en) * | 2013-04-08 | 2016-03-31 | Merck Patent Gmbh | Organic electroluminescent device |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| US10069079B2 (en) | 2013-04-08 | 2018-09-04 | Merck Patent Gmbh | Organic electroluminescent device with thermally activated delayed fluorescence material |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| US10193094B2 (en) | 2013-04-08 | 2019-01-29 | Merck Patent Gmbh | Organic light-emitting device having delayed fluorescence |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| EP3432378A4 (de) * | 2016-03-15 | 2019-11-20 | NIPPON STEEL Chemical & Material Co., Ltd. | Organisches elektrolumineszentes element |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021259824A1 (de) | 2020-06-23 | 2021-12-30 | Merck Patent Gmbh | Verfahren zur herstellung einer mischung |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022243403A1 (de) | 2021-05-21 | 2022-11-24 | Merck Patent Gmbh | Verfahren zur kontinuierlichen aufreinigung von mindestens einem funktionalen material und vorrichtung zur kontinuierlichen aufreinigung von mindestens einem funktionalen material |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
Families Citing this family (331)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102009052428A1 (de) * | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| US9273080B2 (en) | 2010-06-15 | 2016-03-01 | Merek Patent Gmbh | Metal complexes |
| US9324954B2 (en) | 2010-11-24 | 2016-04-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR101531612B1 (ko) | 2010-12-02 | 2015-06-25 | 제일모직 주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| DE102011106849A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Verfahren zur Synthese N-N verknüpfter und um die N-N Bindung rotationsgehinderter bis-N-heterocyclische Carbene und deren Einsatz als Liganden für Metallkomplexe |
| KR101375359B1 (ko) * | 2011-01-19 | 2014-03-21 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 이용한 유기 광소자 |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| CN102153503A (zh) * | 2011-02-22 | 2011-08-17 | 黑龙江省科学院石油化学研究院 | 咔唑-芴类化合物及其合成方法 |
| US9469667B2 (en) | 2011-04-04 | 2016-10-18 | Merck Patent Gmbh | Metal complexes |
| KR101920513B1 (ko) | 2011-04-05 | 2018-11-20 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스 |
| US9876171B2 (en) | 2011-04-13 | 2018-01-23 | Merck Patent Gmbh | Materials for electronic devices |
| KR102013465B1 (ko) * | 2011-04-13 | 2019-08-22 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| KR101979469B1 (ko) | 2011-04-18 | 2019-05-16 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| CN103502388B (zh) | 2011-04-18 | 2016-06-01 | 默克专利有限公司 | 用于电子器件的化合物 |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| EP2705552B1 (de) | 2011-05-05 | 2015-03-04 | Merck Patent GmbH | Verbindungen für elektronische vorrichtungen |
| EP2705550B1 (de) | 2011-05-05 | 2017-07-05 | Merck Patent GmbH | Verbindungen für elektronische vorrichtungen |
| DE102012007810A1 (de) | 2011-05-16 | 2012-11-22 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| US9118022B2 (en) | 2011-06-03 | 2015-08-25 | Merck Patent Gmbh | Organic electroluminescent device |
| KR101972184B1 (ko) | 2011-06-03 | 2019-04-24 | 메르크 파텐트 게엠베하 | 금속 착물 |
| KR101853875B1 (ko) | 2011-06-22 | 2018-05-03 | 삼성디스플레이 주식회사 | 헤테로고리 화합물 및 이를 포함한 유기발광 소자 |
| KR101421791B1 (ko) * | 2011-06-27 | 2014-07-24 | 주식회사 엘지화학 | 새로운 화합물 및 이를 이용한 유기 발광 소자 |
| CN103635481A (zh) | 2011-06-28 | 2014-03-12 | 默克专利有限公司 | 金属络合物 |
| JP6100258B2 (ja) | 2011-07-29 | 2017-03-22 | メルク パテント ゲーエムベーハー | 電子素子のための化合物 |
| KR20130015400A (ko) * | 2011-08-03 | 2013-02-14 | 삼성디스플레이 주식회사 | 헤테로고리 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| CN103718317B (zh) | 2011-08-03 | 2016-11-16 | 默克专利有限公司 | 用于电子器件的材料 |
| KR101967014B1 (ko) | 2011-08-10 | 2019-04-08 | 메르크 파텐트 게엠베하 | 금속 착물 |
| EP2748878B1 (de) | 2011-08-22 | 2020-04-01 | Merck Patent GmbH | Organische elektrolumineszenzvorrichtung |
| WO2013041176A1 (de) | 2011-09-21 | 2013-03-28 | Merck Patent Gmbh | Carbazolderivate für organische elektrolumineszenzvorrichtungen |
| JP6165746B2 (ja) | 2011-10-20 | 2017-07-19 | メルク パテント ゲーエムベーハー | 有機エレクトロルミッセンス素子のための材料 |
| CN104024371B (zh) | 2011-11-01 | 2015-11-25 | 默克专利有限公司 | 有机电致发光器件 |
| KR101395607B1 (ko) * | 2011-11-11 | 2014-05-16 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 이용한 유기 광소자 |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| KR101390523B1 (ko) * | 2011-12-08 | 2014-05-07 | 주식회사 두산 | 신규 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| EP2791105B1 (de) | 2011-12-12 | 2020-03-18 | Merck Patent GmbH | Verbindungen für elektronische vorrichtungen |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| KR101497133B1 (ko) * | 2011-12-23 | 2015-02-27 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| KR101497134B1 (ko) * | 2011-12-29 | 2015-03-02 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| WO2013105747A1 (ko) * | 2012-01-13 | 2013-07-18 | 덕산하이메탈(주) | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR101917715B1 (ko) | 2012-01-18 | 2018-11-13 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| WO2013108997A1 (ko) * | 2012-01-18 | 2013-07-25 | 덕산하이메탈(주) | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| KR101498278B1 (ko) * | 2012-01-18 | 2015-03-06 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| KR102015765B1 (ko) | 2012-02-14 | 2019-10-21 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 스피로비플루오렌 화합물 |
| EP3460864A1 (de) | 2012-03-15 | 2019-03-27 | Merck Patent GmbH | Elektronische vorrichtungen |
| WO2013139431A1 (de) | 2012-03-23 | 2013-09-26 | Merck Patent Gmbh | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen |
| JP5594750B2 (ja) * | 2012-05-17 | 2014-09-24 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| KR101507423B1 (ko) | 2012-06-22 | 2015-04-08 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| EP2872589B1 (de) | 2012-07-10 | 2017-07-26 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| KR101552135B1 (ko) * | 2012-07-13 | 2015-09-10 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US9837622B2 (en) | 2012-07-13 | 2017-12-05 | Merck Patent Gmbh | Metal complexes |
| JP6382193B2 (ja) | 2012-07-23 | 2018-08-29 | メルク パテント ゲーエムベーハー | 化合物および有機エレクトロルミッセンス素子 |
| WO2014015935A2 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektronische vorrichtungen |
| CN104507932B (zh) | 2012-07-23 | 2016-12-07 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| US9768391B2 (en) | 2012-07-23 | 2017-09-19 | Merck Patent Gmbh | Derivatives of 2-diarylaminofluorene and organic electronic compounds containing them |
| EP3424936B1 (de) | 2012-08-07 | 2021-04-07 | Merck Patent GmbH | Metallkomplexe |
| KR102015270B1 (ko) | 2012-08-10 | 2019-08-28 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 물질 |
| JP6239624B2 (ja) | 2012-09-18 | 2017-11-29 | メルク パテント ゲーエムベーハー | 電子素子のための材料 |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| JP6250684B2 (ja) | 2012-10-11 | 2017-12-20 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンス素子のための材料 |
| DE102012020167A1 (de) | 2012-10-13 | 2014-04-17 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| JP6469579B2 (ja) | 2012-10-31 | 2019-02-13 | メルク パテント ゲーエムベーハー | 電子素子 |
| DE102012021650A1 (de) | 2012-11-03 | 2014-05-08 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2014072017A1 (de) | 2012-11-12 | 2014-05-15 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014079532A1 (de) | 2012-11-20 | 2014-05-30 | Merck Patent Gmbh | Formulierung in hochreinem l?sungsmittel zur herstellung elektronischer vorrichtungen |
| KR102173856B1 (ko) | 2012-11-30 | 2020-11-04 | 메르크 파텐트 게엠베하 | 전자 소자 |
| KR102321547B1 (ko) * | 2012-12-21 | 2021-11-03 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| KR20140088003A (ko) * | 2012-12-31 | 2014-07-09 | 제일모직주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| EP2941469A2 (de) | 2013-01-03 | 2015-11-11 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| JP6367229B2 (ja) | 2013-01-03 | 2018-08-01 | メルク パテント ゲーエムベーハー | 電子素子のための化合物 |
| WO2014112360A1 (ja) * | 2013-01-17 | 2014-07-24 | 保土谷化学工業株式会社 | インデノアクリダン環構造を有する化合物および有機エレクトロルミネッセンス素子 |
| WO2014123392A1 (ko) | 2013-02-07 | 2014-08-14 | 주식회사 엘지화학 | 헤테로환 화합물 및 이를 이용한 유기 발광 소자 |
| KR101576570B1 (ko) | 2013-02-18 | 2015-12-10 | 주식회사 두산 | 유기 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| KR102191023B1 (ko) * | 2013-02-28 | 2020-12-15 | 에스에프씨 주식회사 | 유기발광 화합물 및 이를 포함하는 유기전계발광소자 |
| DE102013008189A1 (de) | 2013-05-14 | 2014-12-04 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| KR20180129977A (ko) | 2013-07-30 | 2018-12-05 | 메르크 파텐트 게엠베하 | 전자 소자용 물질 |
| WO2015014435A1 (de) | 2013-07-30 | 2015-02-05 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| KR101653338B1 (ko) * | 2013-08-05 | 2016-09-01 | 제일모직 주식회사 | 유기 화합물, 유기 광전자 소자 및 표시 장치 |
| KR102116495B1 (ko) * | 2013-08-28 | 2020-06-03 | 삼성디스플레이 주식회사 | 축합환 화합물을 포함하는 유기 전계 발광 소자 |
| EP3904361A3 (de) | 2013-10-02 | 2022-04-20 | Merck Patent GmbH | Borenthaltende verbindungen |
| KR102616941B1 (ko) | 2013-12-06 | 2023-12-21 | 메르크 파텐트 게엠베하 | 화합물 및 유기 전자 소자 |
| US10374170B2 (en) | 2013-12-06 | 2019-08-06 | Merck Patent Gmbh | Substituted oxepines |
| CN105814170B (zh) | 2013-12-12 | 2019-11-05 | 默克专利有限公司 | 电子器件的材料 |
| CN103936659B (zh) * | 2013-12-12 | 2016-06-22 | 石家庄诚志永华显示材料有限公司 | 含有碳桥联咔唑结构单元的化合物及其制备方法与应用 |
| KR102388354B1 (ko) | 2013-12-19 | 2022-04-19 | 메르크 파텐트 게엠베하 | 헤테로시클릭 스피로 화합물 |
| KR20150093440A (ko) * | 2014-02-07 | 2015-08-18 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 소자 |
| EP2907815B1 (de) | 2014-02-12 | 2023-12-06 | Samsung Electronics Co., Ltd. | Kondensierte zyklische Verbindung und organische lichtemittierende Vorrichtung damit |
| KR20150108330A (ko) * | 2014-03-17 | 2015-09-25 | 롬엔드하스전자재료코리아유한회사 | 전자 버퍼 재료 및 이를 포함하는 유기 전계 발광 소자 |
| WO2015142040A1 (en) | 2014-03-17 | 2015-09-24 | Rohm And Haas Electronic Materials Korea Ltd. | Electron buffering material and organic electroluminescent device |
| KR102411748B1 (ko) * | 2014-03-17 | 2022-06-23 | 롬엔드하스전자재료코리아유한회사 | 전자 버퍼 재료 및 유기 전계 발광 소자 |
| KR101537500B1 (ko) * | 2014-04-04 | 2015-07-20 | 주식회사 엘지화학 | 유기 발광 소자 |
| KR102434545B1 (ko) | 2014-04-30 | 2022-08-19 | 메르크 파텐트 게엠베하 | 전자 소자용 재료 |
| WO2015169412A1 (de) | 2014-05-05 | 2015-11-12 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| KR20150128590A (ko) * | 2014-05-08 | 2015-11-18 | 롬엔드하스전자재료코리아유한회사 | 전자전달재료 및 이를 포함하는 유기 전계 발광 소자 |
| WO2015170930A1 (en) * | 2014-05-08 | 2015-11-12 | Rohm And Haas Electronic Materials Korea Ltd. | An electron transport material and an organic electroluminescence device comprising the same |
| KR20150141147A (ko) * | 2014-06-09 | 2015-12-17 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| DE102015006708A1 (de) | 2014-06-12 | 2015-12-17 | Merck Patent Gmbh | Metallkomplexe |
| DE102014008722A1 (de) | 2014-06-18 | 2015-12-24 | Merck Patent Gmbh | Zusammensetzungen für elektronische Vorrichtungen |
| US11107994B2 (en) | 2014-06-18 | 2021-08-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN106470997B (zh) | 2014-06-25 | 2019-06-04 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR102319999B1 (ko) | 2014-07-10 | 2021-11-01 | 삼성디스플레이 주식회사 | 유기 화합물 및 이를 포함하는 유기 발광 장치 |
| KR20160010333A (ko) * | 2014-07-17 | 2016-01-27 | 롬엔드하스전자재료코리아유한회사 | 전자전달재료 및 이를 포함하는 유기 전계 발광 소자 |
| WO2016010380A1 (en) | 2014-07-17 | 2016-01-21 | Rohm And Haas Electronic Materials Korea Ltd. | Electron transport material and organic electroluminescent device comprising the same |
| KR102479149B1 (ko) | 2014-07-21 | 2022-12-19 | 메르크 파텐트 게엠베하 | 전자 소자용 재료 |
| KR20160014556A (ko) * | 2014-07-29 | 2016-02-11 | 롬엔드하스전자재료코리아유한회사 | 전자 버퍼 재료 및 유기 전계 발광 소자 |
| DE102014012818A1 (de) | 2014-08-28 | 2016-03-03 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| US20170309841A1 (en) * | 2014-10-17 | 2017-10-26 | Rohm And Haas Electronic Materials Korea Ltd. | A plurality of host materials and an organic electroluminescence device comprising the same |
| CN107108500A (zh) | 2014-11-11 | 2017-08-29 | 默克专利有限公司 | 有机电致发光器件的材料 |
| KR101771051B1 (ko) * | 2014-11-18 | 2017-08-24 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| EP3032605B1 (de) | 2014-12-08 | 2019-08-21 | LG Display Co., Ltd. | Organische lichtemittierende anzeigevorrichtung |
| KR102432080B1 (ko) * | 2014-12-08 | 2022-08-16 | 엘지디스플레이 주식회사 | 유기전계발광소자 |
| KR102493553B1 (ko) | 2014-12-12 | 2023-01-30 | 메르크 파텐트 게엠베하 | 가용성 기를 갖는 유기 화합물 |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| KR102424977B1 (ko) | 2015-04-14 | 2022-07-26 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| US11208401B2 (en) | 2015-06-10 | 2021-12-28 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN114805091A (zh) | 2015-07-22 | 2022-07-29 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| GB201513037D0 (en) | 2015-07-23 | 2015-09-09 | Merck Patent Gmbh | Phenyl-derived compound for use in organic electronic devices |
| US11538995B2 (en) | 2015-07-29 | 2022-12-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017025166A1 (en) | 2015-08-13 | 2017-02-16 | Merck Patent Gmbh | Hexamethylindanes |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| KR102417039B1 (ko) * | 2015-08-20 | 2022-07-05 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| TWI564294B (zh) | 2015-08-24 | 2017-01-01 | 國立清華大學 | 載子產生材料與有機發光二極體 |
| US10703762B2 (en) | 2015-08-28 | 2020-07-07 | Idemitsu Kosan Co., Ltd. | Compound, material for organic electroluminescence device, organic electroluminescence device and electronic apparatus |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| DE102015013381A1 (de) | 2015-10-14 | 2017-04-20 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| US11355714B2 (en) | 2015-10-27 | 2022-06-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR102591635B1 (ko) * | 2015-10-27 | 2023-10-20 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| KR102399570B1 (ko) | 2015-11-26 | 2022-05-19 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| DE102015016016A1 (de) | 2015-12-10 | 2017-06-14 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| KR102630644B1 (ko) | 2015-12-17 | 2024-01-30 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| US11910707B2 (en) | 2015-12-23 | 2024-02-20 | Samsung Display Co., Ltd. | Organic light-emitting device |
| JP7051691B2 (ja) | 2016-02-05 | 2022-04-11 | メルク パテント ゲーエムベーハー | 電子素子のための材料 |
| KR20180118748A (ko) | 2016-03-03 | 2018-10-31 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| TWI745361B (zh) | 2016-03-17 | 2021-11-11 | 德商麥克專利有限公司 | 具有螺聯茀結構之化合物 |
| KR20180133376A (ko) | 2016-04-11 | 2018-12-14 | 메르크 파텐트 게엠베하 | 디벤조푸란 및/또는 디벤조티오펜 구조를 포함하는 헤테로시클릭 화합물 |
| CN107043382A (zh) * | 2016-04-25 | 2017-08-15 | 中节能万润股份有限公司 | 一种以三嗪为核心的化合物及其在有机电致发光器件上的应用 |
| CN107068879B (zh) * | 2016-04-25 | 2020-09-22 | 中节能万润股份有限公司 | 一种含有三嗪类化合物的有机电致发光器件及其应用 |
| KR102385482B1 (ko) | 2016-04-29 | 2022-04-12 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| CN105936821A (zh) * | 2016-05-04 | 2016-09-14 | 中节能万润股份有限公司 | 一类双茚并吩恶嗪有机电致发光材料及其应用 |
| KR20170127101A (ko) | 2016-05-10 | 2017-11-21 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| CN106008537B (zh) * | 2016-05-19 | 2018-03-30 | 中节能万润股份有限公司 | 一种双极性主体有机电致发光材料及其应用 |
| CN109195951B (zh) | 2016-06-03 | 2023-03-31 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR102404836B1 (ko) | 2016-06-30 | 2022-06-02 | 메르크 파텐트 게엠베하 | 금속 착물로부터의 거울상이성질체 혼합물의 분리 방법 |
| KR102599160B1 (ko) | 2016-07-08 | 2023-11-07 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| JP7039549B2 (ja) | 2016-07-14 | 2022-03-22 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 金属錯体 |
| KR102449937B1 (ko) | 2016-07-25 | 2022-09-30 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자에서 방사체로서 사용하기 위한 금속 착물 |
| JP7030780B2 (ja) | 2016-07-25 | 2022-03-07 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 三脚型二座副配位子を含む、二核およびオリゴ核の金属錯体、並びにその電子デバイスにおける使用 |
| WO2018041769A1 (de) | 2016-08-30 | 2018-03-08 | Merck Patent Gmbh | Bl- und trinukleare metallkomplexe aufgebaut aus zwei miteinander verknüpften tripodalen hexadentaten liganden zur verwendung in elektrolumineszenzvorrichtungen |
| WO2018050584A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| TW201827425A (zh) | 2016-09-14 | 2018-08-01 | 德商麥克專利有限公司 | 具有咔唑結構之化合物 |
| EP3515925B1 (de) | 2016-09-21 | 2020-10-21 | Merck Patent GmbH | Binukleare metallkomplexe für den einsatz als emitter in organischen elektrolumineszenzvorrichtungen |
| WO2018060218A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Carbazole mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| TWI766884B (zh) | 2016-09-30 | 2022-06-11 | 德商麥克專利有限公司 | 具有二氮雜二苯并呋喃或二氮雜二苯并噻吩結構的化合物、其製法及其用途 |
| TWI764942B (zh) | 2016-10-10 | 2022-05-21 | 德商麥克專利有限公司 | 電子裝置 |
| CN109803975A (zh) | 2016-10-12 | 2019-05-24 | 默克专利有限公司 | 双核金属络合物和含有所述金属络合物的电子器件、特别是有机电致发光器件 |
| JP7064487B2 (ja) | 2016-10-12 | 2022-05-10 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 金属錯体 |
| JP7023946B2 (ja) | 2016-10-13 | 2022-02-22 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 金属錯体 |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| JP2019535683A (ja) | 2016-10-25 | 2019-12-12 | メルク、パテント、ゲゼルシャフト、ミット、ベシュレンクテル、ハフツングMerck Patent GmbH | 金属錯体 |
| KR20190079646A (ko) | 2016-11-02 | 2019-07-05 | 메르크 파텐트 게엠베하 | 전자 소자용 재료 |
| KR102564613B1 (ko) | 2016-11-08 | 2023-08-07 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| US11345687B2 (en) | 2016-11-09 | 2022-05-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI756292B (zh) | 2016-11-14 | 2022-03-01 | 德商麥克專利有限公司 | 具有受體基團與供體基團之化合物 |
| WO2018091435A1 (en) | 2016-11-17 | 2018-05-24 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TW201833118A (zh) | 2016-11-22 | 2018-09-16 | 德商麥克專利有限公司 | 用於電子裝置之材料 |
| US11713319B2 (en) | 2016-11-30 | 2023-08-01 | Merck Patent Gmbh | Compounds having valerolactam structures |
| US11466021B2 (en) | 2016-12-05 | 2022-10-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TW201831468A (zh) | 2016-12-05 | 2018-09-01 | 德商麥克專利有限公司 | 含氮的雜環化合物 |
| WO2018104193A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018114882A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| KR102633478B1 (ko) * | 2016-12-23 | 2024-02-06 | 솔루스첨단소재 주식회사 | 유기 화합물 및 이를 이용한 유기 전계 발광 소자 |
| CN106632413A (zh) * | 2016-12-30 | 2017-05-10 | 上海升翕光电科技有限公司 | 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件 |
| CN106632392A (zh) * | 2016-12-30 | 2017-05-10 | 上海升翕光电科技有限公司 | 苯并噻吩并咔唑类有机发光材料及其制备方法和有机发光器件 |
| EP3565816B1 (de) | 2017-01-04 | 2022-03-16 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| US10964894B2 (en) | 2017-01-25 | 2021-03-30 | Merck Patent Gmbh | Carbazole derivatives |
| EP3573985B1 (de) | 2017-01-30 | 2023-01-18 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| US20200013960A1 (en) | 2017-02-02 | 2020-01-09 | Merck Patent Gmbh | Materials for electronic devices |
| TW201835075A (zh) | 2017-02-14 | 2018-10-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| US11616201B2 (en) | 2017-02-24 | 2023-03-28 | Idemitsu Kosan Co., Ltd. | Specific ladder type compounds for organic light emitting devices |
| US11393987B2 (en) | 2017-03-01 | 2022-07-19 | Merck Patent Gmbh | Organic electroluminescent device |
| US20200055822A1 (en) | 2017-03-02 | 2020-02-20 | Merck Patent Gmbh | Materials for organic electronic devices |
| TW201843143A (zh) | 2017-03-13 | 2018-12-16 | 德商麥克專利有限公司 | 含有芳基胺結構之化合物 |
| KR102539248B1 (ko) | 2017-03-15 | 2023-06-02 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| EP3601257B1 (de) | 2017-03-29 | 2021-10-27 | Merck Patent GmbH | Aromatische verbindungen |
| KR102608491B1 (ko) | 2017-04-13 | 2023-11-30 | 메르크 파텐트 게엠베하 | 유기 전자 디바이스용 조성물 |
| WO2018206537A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Carbazole-based bodipys for organic electroluminescent devices |
| US11056656B2 (en) | 2017-05-11 | 2021-07-06 | Merck Patent Gmbh | Organoboron complexes and their use in organic electroluminescent devices |
| KR101826013B1 (ko) * | 2017-05-19 | 2018-03-22 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR102596593B1 (ko) | 2017-05-22 | 2023-11-01 | 메르크 파텐트 게엠베하 | 전자 디바이스를 위한 헥사시클릭 헤테로방향족 화합물 |
| TW201920343A (zh) | 2017-06-21 | 2019-06-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| KR20200020841A (ko) | 2017-06-23 | 2020-02-26 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| EP3645766A1 (de) | 2017-06-26 | 2020-05-06 | Merck Patent GmbH | Homogene mischungen |
| CN110799484B (zh) | 2017-06-28 | 2023-09-26 | 默克专利有限公司 | 用于电子器件的材料 |
| KR102423253B1 (ko) * | 2017-06-29 | 2022-07-21 | 솔루스첨단소재 주식회사 | 유기 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| TWI768075B (zh) | 2017-07-05 | 2022-06-21 | 德商麥克專利有限公司 | 用於有機電子裝置之組成物 |
| EP3649123B1 (de) | 2017-07-05 | 2023-03-15 | Merck Patent GmbH | Zusammensetzung für organische elektronische vorrichtungen |
| TWI776926B (zh) | 2017-07-25 | 2022-09-11 | 德商麥克專利有限公司 | 金屬錯合物 |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| KR20200051722A (ko) | 2017-09-08 | 2020-05-13 | 메르크 파텐트 게엠베하 | 전자 디바이스용 재료 |
| WO2019052933A1 (de) | 2017-09-12 | 2019-03-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019054634A1 (ko) * | 2017-09-12 | 2019-03-21 | 주식회사 엘지화학 | 신규한 헤테로 고리 화합물 및 이를 이용한 유기발광 소자 |
| EP3692043B1 (de) | 2017-10-06 | 2022-11-02 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| CN108675975A (zh) | 2017-10-17 | 2018-10-19 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| US11437588B2 (en) | 2017-10-24 | 2022-09-06 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI785142B (zh) | 2017-11-14 | 2022-12-01 | 德商麥克專利有限公司 | 用於有機電子裝置之組成物 |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| JP7293228B2 (ja) | 2017-12-13 | 2023-06-19 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 金属錯体 |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| TW201938562A (zh) | 2017-12-19 | 2019-10-01 | 德商麥克專利有限公司 | 雜環化合物 |
| US20210036245A1 (en) | 2017-12-20 | 2021-02-04 | Merck Patent Gmbh | Heteroaromatic compounds |
| GB2569636A (en) * | 2017-12-21 | 2019-06-26 | Sumitomo Chemical Co | Composition |
| TWI811290B (zh) | 2018-01-25 | 2023-08-11 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| US20220289778A1 (en) | 2018-02-13 | 2022-09-15 | Merck Patent Gmbh | Metal complexes |
| TWI802656B (zh) | 2018-03-06 | 2023-05-21 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| TW201938761A (zh) | 2018-03-06 | 2019-10-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置的材料 |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI828664B (zh) | 2018-03-19 | 2024-01-11 | 愛爾蘭商Udc愛爾蘭責任有限公司 | 金屬錯合物 |
| US20220332724A1 (en) | 2018-05-30 | 2022-10-20 | Merck Patent Gmbh | Composition for organic electronic devices |
| EP3803998A1 (de) | 2018-06-07 | 2021-04-14 | Merck Patent GmbH | Organische elektrolumineszenzvorrichtungen |
| KR20210031714A (ko) | 2018-07-09 | 2021-03-22 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| WO2020016264A1 (en) | 2018-07-20 | 2020-01-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| JP7325731B2 (ja) | 2018-08-23 | 2023-08-15 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| WO2020043657A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043646A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TWI823993B (zh) | 2018-08-28 | 2023-12-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| CN112639052A (zh) | 2018-09-12 | 2021-04-09 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| TW202030902A (zh) | 2018-09-12 | 2020-08-16 | 德商麥克專利有限公司 | 電致發光裝置 |
| TWI826522B (zh) | 2018-09-12 | 2023-12-21 | 德商麥克專利有限公司 | 電致發光裝置 |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| EP3856717A2 (de) | 2018-09-27 | 2021-08-04 | Merck Patent GmbH | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| CN112930343A (zh) | 2018-10-31 | 2021-06-08 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| US11917906B2 (en) | 2018-11-05 | 2024-02-27 | Merck Patent Gmbh | Compounds that can be used in an organic electronic device |
| KR20210089205A (ko) | 2018-11-06 | 2021-07-15 | 메르크 파텐트 게엠베하 | Oled 용 유기 전계 발광 재료로서 5,6-디페닐-5,6-디히드로디벤즈[c,e][1,2]아자포스포린 및 6-페닐-6h-디벤조[c,e][1,2]티아진-5,5-디옥사이드 유도체 및 유사한 화합물 |
| US20220006018A1 (en) | 2018-11-14 | 2022-01-06 | Merck Patent Gmbh | Compounds that can be used for producing an organic electronic device |
| CN113195500A (zh) | 2018-11-15 | 2021-07-30 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| TW202039493A (zh) | 2018-12-19 | 2020-11-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| US20220127285A1 (en) | 2019-01-16 | 2022-04-28 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| TW202043247A (zh) | 2019-02-11 | 2020-12-01 | 德商麥克專利有限公司 | 金屬錯合物 |
| KR20210132673A (ko) | 2019-02-18 | 2021-11-04 | 메르크 파텐트 게엠베하 | 유기 전자 디바이스용 조성물 |
| CN109824576B (zh) * | 2019-02-21 | 2021-01-19 | 青岛海洋生物医药研究院股份有限公司 | 一种有机光电材料中间体二甲基茚并咔唑的合成方法 |
| US20220127286A1 (en) | 2019-03-04 | 2022-04-28 | Merck Patent Gmbh | Ligands for nano-sized materials |
| WO2020182779A1 (de) | 2019-03-12 | 2020-09-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3941920B1 (de) | 2019-03-20 | 2024-03-20 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| CN113614082A (zh) | 2019-03-25 | 2021-11-05 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP3935063A1 (de) | 2019-04-11 | 2022-01-12 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| JP2022529926A (ja) | 2019-04-15 | 2022-06-27 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 金属錯体 |
| KR20220052966A (ko) | 2019-08-26 | 2022-04-28 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| KR20220056223A (ko) | 2019-09-02 | 2022-05-04 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| TW202122558A (zh) | 2019-09-03 | 2021-06-16 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| EP4031546A1 (de) | 2019-09-16 | 2022-07-27 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2021052921A1 (de) | 2019-09-19 | 2021-03-25 | Merck Patent Gmbh | Mischung von zwei hostmaterialien und organische elektrolumineszierende vorrichtung damit |
| US20220384735A1 (en) | 2019-09-20 | 2022-12-01 | Merck Patent Gmbh | Peri-condensed heterocyclic compounds as materials for electronic devices |
| CN114514628A (zh) | 2019-10-22 | 2022-05-17 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR20220090539A (ko) | 2019-10-25 | 2022-06-29 | 메르크 파텐트 게엠베하 | 유기 전자 디바이스에서 사용될 수 있는 화합물 |
| EP4055642A1 (de) | 2019-11-04 | 2022-09-14 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| TW202134252A (zh) | 2019-11-12 | 2021-09-16 | 德商麥克專利有限公司 | 有機電致發光裝置用材料 |
| CN114787173A (zh) | 2019-12-04 | 2022-07-22 | 默克专利有限公司 | 金属络合物 |
| TW202136181A (zh) | 2019-12-04 | 2021-10-01 | 德商麥克專利有限公司 | 有機電致發光裝置用的材料 |
| TW202136471A (zh) | 2019-12-17 | 2021-10-01 | 德商麥克專利有限公司 | 有機電致發光裝置用的材料 |
| JP2023506572A (ja) | 2019-12-18 | 2023-02-16 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子のための芳香族化合物 |
| JP2023506570A (ja) | 2019-12-19 | 2023-02-16 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子のための多環式化合物 |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| WO2021170522A1 (de) | 2020-02-25 | 2021-09-02 | Merck Patent Gmbh | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| EP4115457A1 (de) | 2020-03-02 | 2023-01-11 | Merck Patent GmbH | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| CN115298847A (zh) | 2020-03-17 | 2022-11-04 | 默克专利有限公司 | 用于有机电致发光器件的杂环化合物 |
| US20230157170A1 (en) | 2020-03-17 | 2023-05-18 | Merck Patent Gmbh | Heteroaromatic compounds for organic electroluminescent devices |
| EP4126884A1 (de) | 2020-03-23 | 2023-02-08 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| CN115210234A (zh) | 2020-03-24 | 2022-10-18 | 默克专利有限公司 | 用于电子器件的材料 |
| EP4126880A1 (de) | 2020-03-26 | 2023-02-08 | Merck Patent GmbH | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| US20230151026A1 (en) | 2020-04-02 | 2023-05-18 | Merck Patent Gmbh | Multi-layer body for diffuse transillumination |
| WO2021204646A1 (de) | 2020-04-06 | 2021-10-14 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| TW202208594A (zh) | 2020-05-27 | 2022-03-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| JP2023527235A (ja) | 2020-05-29 | 2023-06-27 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセントデバイス |
| EP4168397A1 (de) | 2020-06-18 | 2023-04-26 | Merck Patent GmbH | Indenoazanaphthaline |
| WO2022002772A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| KR20230028315A (ko) | 2020-06-29 | 2023-02-28 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 복소환 화합물 |
| EP4185574A1 (de) | 2020-07-22 | 2023-05-31 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| CN116157402A (zh) | 2020-08-06 | 2023-05-23 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR20230048122A (ko) | 2020-08-13 | 2023-04-10 | 메르크 파텐트 게엠베하 | 금속 착물 |
| KR20230053629A (ko) | 2020-08-18 | 2023-04-21 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 재료 |
| TW202223066A (zh) | 2020-08-19 | 2022-06-16 | 德商麥克專利有限公司 | 用於有機電致發光裝置之材料 |
| JP2023542915A (ja) | 2020-09-18 | 2023-10-12 | 三星ディスプレイ株式會社 | 有機エレクトロルミネッセンス素子 |
| WO2022069380A1 (de) | 2020-09-29 | 2022-04-07 | Merck Patent Gmbh | Mononukleare tripodale hexadentate iridium komplexe zur verwendung in oleds |
| TW202222748A (zh) | 2020-09-30 | 2022-06-16 | 德商麥克專利有限公司 | 用於結構化有機電致發光裝置的功能層之化合物 |
| TW202229215A (zh) | 2020-09-30 | 2022-08-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置功能層之結構化的化合物 |
| CN116323859A (zh) | 2020-10-16 | 2023-06-23 | 默克专利有限公司 | 用于有机电致发光器件的杂环化合物 |
| US20230380285A1 (en) | 2020-10-16 | 2023-11-23 | Merck Patent Gmbh | Compounds comprising heteroatoms for organic electroluminescent devices |
| WO2022101171A1 (de) | 2020-11-10 | 2022-05-19 | Merck Patent Gmbh | Schwefelhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| US20230416264A1 (en) | 2020-12-02 | 2023-12-28 | Merck Patent Gmbh | Heterocyclic compounds for organic electroluminescent devices |
| CN116568690A (zh) | 2020-12-10 | 2023-08-08 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP4261910A1 (de) | 2020-12-11 | 2023-10-18 | NIPPON STEEL Chemical & Material Co., Ltd. | Material für ein organisches elektrolumineszenzelement und organisches elektrolumineszenzelement |
| CN116724040A (zh) | 2020-12-18 | 2023-09-08 | 默克专利有限公司 | 用于有机电致发光器件的含氮化合物 |
| TW202241900A (zh) | 2020-12-18 | 2022-11-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置之含氮雜芳烴 |
| KR20230122094A (ko) | 2020-12-18 | 2023-08-22 | 메르크 파텐트 게엠베하 | Oled에 사용하기 위한 청색 형광 방출체로서의 인돌로[3.2.1-jk]카르바졸-6-카르보니트릴유도체 |
| CN116745287A (zh) | 2021-01-05 | 2023-09-12 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| KR20230137375A (ko) | 2021-01-25 | 2023-10-04 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 질소 화합물 |
| WO2022184601A1 (de) | 2021-03-02 | 2022-09-09 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| CN117043302A (zh) | 2021-03-18 | 2023-11-10 | 默克专利有限公司 | 用于有机电致发光器件的杂芳族化合物 |
| EP4079742A1 (de) | 2021-04-14 | 2022-10-26 | Merck Patent GmbH | Metallkomplexe |
| CN117203191A (zh) | 2021-04-29 | 2023-12-08 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP4330240A1 (de) | 2021-04-29 | 2024-03-06 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| CN117425655A (zh) | 2021-04-30 | 2024-01-19 | 默克专利有限公司 | 用于有机电致发光器件的含氮杂环化合物 |
| WO2022200638A1 (de) | 2021-07-06 | 2022-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023052313A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052314A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052275A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052272A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| CN113968811B (zh) * | 2021-11-16 | 2023-06-23 | 阜阳欣奕华材料科技有限公司 | 茚并咔唑类有机化合物及其应用 |
| WO2023094412A1 (de) | 2021-11-25 | 2023-06-01 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| WO2023110742A1 (de) | 2021-12-13 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023117837A1 (de) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023117836A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| WO2023117835A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| TW202340423A (zh) | 2022-01-20 | 2023-10-16 | 德商麥克專利有限公司 | 具有混合主體系統之有機電元件 |
| WO2023152063A1 (de) | 2022-02-09 | 2023-08-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023152346A1 (de) | 2022-02-14 | 2023-08-17 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023222559A1 (de) | 2022-05-18 | 2023-11-23 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2024013004A1 (de) | 2022-07-11 | 2024-01-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP4311849A1 (de) | 2022-07-27 | 2024-01-31 | UDC Ireland Limited | Metallkomplexe |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
Citations (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4539507A (en) | 1983-03-25 | 1985-09-03 | Eastman Kodak Company | Organic electroluminescent devices having improved power conversion efficiencies |
| US5151629A (en) | 1991-08-01 | 1992-09-29 | Eastman Kodak Company | Blue emitting internal junction organic electroluminescent device (I) |
| WO1992018552A1 (de) | 1991-04-11 | 1992-10-29 | Wacker-Chemie Gmbh | Leiterpolymere mit konjugierten doppelbindungen |
| EP0652273A1 (de) | 1993-11-09 | 1995-05-10 | Shinko Electric Industries Co. Ltd. | Organisches Material für elektrolumineszente Vorrichtung und elektrolumineszente Vorrichtung |
| EP0676461A2 (de) | 1994-04-07 | 1995-10-11 | Hoechst Aktiengesellschaft | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0707020A2 (de) | 1994-10-14 | 1996-04-17 | Hoechst Aktiengesellschaft | Konjugierte Polymere mit Spirozentren und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0842208A1 (de) | 1995-07-28 | 1998-05-20 | The Dow Chemical Company | 2,7-aryl-9-substituierte fluorene und 9-substituierte fluorenoligomere und polymere |
| WO1998027136A1 (de) | 1996-12-16 | 1998-06-25 | Aventis Research & Technologies Gmbh & Co Kg | ARYLSUBSTITUIERTE POLY(p-ARYLENVINYLENE), VERFAHREN ZUR HERSTELLUNG UND DEREN VERWENDUNG IN ELEKTROLUMINESZENZBAUELEMENTEN |
| EP0894107A1 (de) | 1996-04-17 | 1999-02-03 | Hoechst Research & Technology Deutschland GmbH & Co. KG | Polymere mit spiroatomen und ihre verwendung als elektrolumineszenzmaterialien |
| WO2000022026A1 (de) | 1998-10-10 | 2000-04-20 | Celanese Ventures Gmbh | Konjugierte polymere, enthaltend spezielle fluoren-bausteine mit verbesserten eigenschaften |
| EP1028136A2 (de) | 1999-02-10 | 2000-08-16 | Carnegie-Mellon University | Ein Verfahren zur Herstellung von Poly(3-substituierten)thiophenen |
| WO2000070655A2 (en) | 1999-05-13 | 2000-11-23 | The Trustees Of Princeton University | Very high efficiency organic light emitting devices based on electrophosphorescence |
| WO2001041512A1 (en) | 1999-12-01 | 2001-06-07 | The Trustees Of Princeton University | Complexes of form l2mx as phosphorescent dopants for organic leds |
| EP1144543A1 (de) | 1998-12-02 | 2001-10-17 | South Bank University Enterprises Ltd. | Elektrolumineszente chinolate |
| WO2002002714A2 (en) | 2000-06-30 | 2002-01-10 | E.I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| WO2002015645A1 (en) | 2000-08-11 | 2002-02-21 | The Trustees Of Princeton University | Organometallic compounds and emission-shifting organic electrophosphorescence |
| EP1191614A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung und dafür verwendete Metallkoordinationsverbindung |
| EP1191613A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| EP1191612A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| EP1205527A1 (de) | 2000-03-27 | 2002-05-15 | Idemitsu Kosan Co., Ltd. | Organische elektrolumineszierende vorrichtung |
| WO2004013080A1 (en) | 2002-08-01 | 2004-02-12 | Covion Organic Semiconductors Gmbh | Spirobifluorene derivatives, their preparation and uses thereof |
| WO2004041901A1 (en) | 2002-11-08 | 2004-05-21 | Covion Organic Semiconductors Gmbh | Aryl-substituted polyindenofluorenes for use in organic electroluminiscent devices |
| WO2004058911A2 (de) | 2002-12-23 | 2004-07-15 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2004070772A2 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte polymere und blends, deren darstellung und verwendung |
| JP2004288381A (ja) | 2003-03-19 | 2004-10-14 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子 |
| WO2004093207A2 (de) | 2003-04-15 | 2004-10-28 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialien, deren verwendung und elektronikbauteile enthaltend diese mischungen |
| WO2004113468A1 (de) | 2003-06-26 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Neue materialien für die elektrolumineszenz |
| WO2004113412A2 (en) | 2003-06-23 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Polymer |
| WO2005003253A2 (de) | 2003-07-07 | 2005-01-13 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialen, deren verwendung und elektronikbauteile enthaltend diese |
| WO2005011013A1 (de) | 2003-07-21 | 2005-02-03 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2005014689A2 (de) | 2003-08-12 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung |
| WO2005019373A2 (de) | 2003-08-19 | 2005-03-03 | Basf Aktiengesellschaft | Übergangsmetallkomplexe mit carbenliganden als emitter für organische licht-emittierende dioden (oleds) |
| US20050069729A1 (en) | 2003-09-30 | 2005-03-31 | Konica Minolta Holdings, Inc. | Organic electroluminescent element, illuminator, display and compound |
| WO2005033244A1 (de) | 2003-09-29 | 2005-04-14 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| WO2005040302A1 (de) | 2003-10-22 | 2005-05-06 | Merck Patent Gmbh | Neue materialien für die elektrolumineszenz und deren verwendung |
| WO2005053051A1 (de) | 2003-11-25 | 2005-06-09 | Merck Patent Gmbh | Organisches elektrolumineszenzelement |
| WO2005104264A1 (de) | 2004-04-26 | 2005-11-03 | Merck Patent Gmbh | Elektrolumineszierende polymere und deren verwendung |
| US20050258742A1 (en) | 2004-05-18 | 2005-11-24 | Yui-Yi Tsai | Carbene containing metal complexes as OLEDs |
| WO2005111172A2 (de) | 2004-05-11 | 2005-11-24 | Merck Patent Gmbh | Neue materialmischungen für die elektrolumineszenz |
| JP2005347160A (ja) | 2004-06-04 | 2005-12-15 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| EP1617710A1 (de) | 2003-04-23 | 2006-01-18 | Konica Minolta Holdings, Inc. | Material für ein organisches elektrolumineszenzgerät, organisches elektrolumineszenzgerät, beleuchtungsvorrichtung und anzeige |
| WO2006005627A1 (en) | 2004-07-15 | 2006-01-19 | Merck Patent Gmbh | Oligomeric derivatives of spirobifluorene, their preparation and use |
| WO2006100896A1 (ja) | 2005-03-18 | 2006-09-28 | Idemitsu Kosan Co., Ltd. | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2006117052A1 (de) | 2005-05-03 | 2006-11-09 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung und in deren herstellung verwendete boronsäure- und borinsäure-derivate |
| WO2006122630A1 (de) | 2005-05-20 | 2006-11-23 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| EP1731584A1 (de) | 2004-03-31 | 2006-12-13 | Konica Minolta Holdings, Inc. | Organischer elektrolumineszenzvorrichtungsstoff, organische elektrolumineszenzvorrichtung, display und beleuchtungsvorrichtung |
| WO2007050334A1 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007050301A2 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007063754A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| DE102006025846A1 (de) | 2006-06-02 | 2007-12-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2007137725A1 (de) | 2006-05-31 | 2007-12-06 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2008006449A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2008056746A1 (fr) | 2006-11-09 | 2008-05-15 | Nippon Steel Chemical Co., Ltd. | Composé pour un dispositif électroluminescent organique et dispositif électroluminescent organique |
| WO2008086851A1 (de) | 2007-01-18 | 2008-07-24 | Merck Patent Gmbh | Carbazol-derivate für organische elektrolumineszenzvorrichtungen |
| WO2008132103A1 (de) | 2007-04-26 | 2008-11-06 | Basf Se | Pentaphenylenderivate als photosensibilisatoren in solarzellen |
| WO2008146839A1 (ja) | 2007-05-29 | 2008-12-04 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2008149691A1 (ja) | 2007-05-30 | 2008-12-11 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2009030981A2 (en) | 2006-12-28 | 2009-03-12 | Universal Display Corporation | Long lifetime phosphorescent organic light emitting device (oled) structures |
| WO2009062578A1 (de) | 2007-11-12 | 2009-05-22 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen enthaltend azomethin-metall-komplexe |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008036982A1 (de) | 2008-08-08 | 2010-02-11 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009023155A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5843607A (en) * | 1997-10-02 | 1998-12-01 | Xerox Corporation | Indolocarbazole photoconductors |
| US6479172B2 (en) | 2001-01-26 | 2002-11-12 | Xerox Corporation | Electroluminescent (EL) devices |
| US8334058B2 (en) | 2005-04-14 | 2012-12-18 | Merck Patent Gmbh | Compounds for organic electronic devices |
| JP2006339577A (ja) * | 2005-06-06 | 2006-12-14 | Konica Minolta Holdings Inc | 有機半導体薄膜及び有機薄膜トランジスタ |
| KR101500796B1 (ko) * | 2008-06-05 | 2015-03-09 | 이데미쓰 고산 가부시키가이샤 | 할로젠 화합물, 다환계 화합물 및 그것을 이용한 유기 전기발광 소자 |
| WO2009148015A1 (ja) | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| KR101333694B1 (ko) * | 2009-06-25 | 2013-11-27 | 제일모직주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| KR101174088B1 (ko) * | 2009-06-25 | 2012-08-14 | 제일모직주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
-
2009
- 2009-06-30 DE DE102009031021A patent/DE102009031021A1/de not_active Withdrawn
-
2010
- 2010-06-01 CN CN201080029223.0A patent/CN102471602B/zh active Active
- 2010-06-01 WO PCT/EP2010/003324 patent/WO2011000455A1/de active Application Filing
- 2010-06-01 US US13/379,879 patent/US9040172B2/en active Active
- 2010-06-01 JP JP2012516542A patent/JP5734965B2/ja active Active
- 2010-06-01 DE DE112010002775.7T patent/DE112010002775B4/de active Active
- 2010-06-01 KR KR1020127002648A patent/KR101777883B1/ko active IP Right Grant
- 2010-06-25 TW TW099120837A patent/TW201127811A/zh unknown
Patent Citations (66)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4539507A (en) | 1983-03-25 | 1985-09-03 | Eastman Kodak Company | Organic electroluminescent devices having improved power conversion efficiencies |
| WO1992018552A1 (de) | 1991-04-11 | 1992-10-29 | Wacker-Chemie Gmbh | Leiterpolymere mit konjugierten doppelbindungen |
| US5151629A (en) | 1991-08-01 | 1992-09-29 | Eastman Kodak Company | Blue emitting internal junction organic electroluminescent device (I) |
| EP0652273A1 (de) | 1993-11-09 | 1995-05-10 | Shinko Electric Industries Co. Ltd. | Organisches Material für elektrolumineszente Vorrichtung und elektrolumineszente Vorrichtung |
| EP0676461A2 (de) | 1994-04-07 | 1995-10-11 | Hoechst Aktiengesellschaft | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0707020A2 (de) | 1994-10-14 | 1996-04-17 | Hoechst Aktiengesellschaft | Konjugierte Polymere mit Spirozentren und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0842208A1 (de) | 1995-07-28 | 1998-05-20 | The Dow Chemical Company | 2,7-aryl-9-substituierte fluorene und 9-substituierte fluorenoligomere und polymere |
| EP0894107A1 (de) | 1996-04-17 | 1999-02-03 | Hoechst Research & Technology Deutschland GmbH & Co. KG | Polymere mit spiroatomen und ihre verwendung als elektrolumineszenzmaterialien |
| WO1998027136A1 (de) | 1996-12-16 | 1998-06-25 | Aventis Research & Technologies Gmbh & Co Kg | ARYLSUBSTITUIERTE POLY(p-ARYLENVINYLENE), VERFAHREN ZUR HERSTELLUNG UND DEREN VERWENDUNG IN ELEKTROLUMINESZENZBAUELEMENTEN |
| WO2000022026A1 (de) | 1998-10-10 | 2000-04-20 | Celanese Ventures Gmbh | Konjugierte polymere, enthaltend spezielle fluoren-bausteine mit verbesserten eigenschaften |
| EP1144543A1 (de) | 1998-12-02 | 2001-10-17 | South Bank University Enterprises Ltd. | Elektrolumineszente chinolate |
| EP1028136A2 (de) | 1999-02-10 | 2000-08-16 | Carnegie-Mellon University | Ein Verfahren zur Herstellung von Poly(3-substituierten)thiophenen |
| WO2000070655A2 (en) | 1999-05-13 | 2000-11-23 | The Trustees Of Princeton University | Very high efficiency organic light emitting devices based on electrophosphorescence |
| WO2001041512A1 (en) | 1999-12-01 | 2001-06-07 | The Trustees Of Princeton University | Complexes of form l2mx as phosphorescent dopants for organic leds |
| EP1205527A1 (de) | 2000-03-27 | 2002-05-15 | Idemitsu Kosan Co., Ltd. | Organische elektrolumineszierende vorrichtung |
| WO2002002714A2 (en) | 2000-06-30 | 2002-01-10 | E.I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| WO2002015645A1 (en) | 2000-08-11 | 2002-02-21 | The Trustees Of Princeton University | Organometallic compounds and emission-shifting organic electrophosphorescence |
| EP1191614A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung und dafür verwendete Metallkoordinationsverbindung |
| EP1191613A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| EP1191612A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| WO2004013080A1 (en) | 2002-08-01 | 2004-02-12 | Covion Organic Semiconductors Gmbh | Spirobifluorene derivatives, their preparation and uses thereof |
| WO2004041901A1 (en) | 2002-11-08 | 2004-05-21 | Covion Organic Semiconductors Gmbh | Aryl-substituted polyindenofluorenes for use in organic electroluminiscent devices |
| WO2004058911A2 (de) | 2002-12-23 | 2004-07-15 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2004070772A2 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte polymere und blends, deren darstellung und verwendung |
| JP2004288381A (ja) | 2003-03-19 | 2004-10-14 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子 |
| WO2004093207A2 (de) | 2003-04-15 | 2004-10-28 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialien, deren verwendung und elektronikbauteile enthaltend diese mischungen |
| EP1617711A1 (de) | 2003-04-23 | 2006-01-18 | Konica Minolta Holdings, Inc. | Organisches elektrolumineszenzbauelement und anzeige |
| EP1617710A1 (de) | 2003-04-23 | 2006-01-18 | Konica Minolta Holdings, Inc. | Material für ein organisches elektrolumineszenzgerät, organisches elektrolumineszenzgerät, beleuchtungsvorrichtung und anzeige |
| WO2004113412A2 (en) | 2003-06-23 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Polymer |
| WO2004113468A1 (de) | 2003-06-26 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Neue materialien für die elektrolumineszenz |
| WO2005003253A2 (de) | 2003-07-07 | 2005-01-13 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialen, deren verwendung und elektronikbauteile enthaltend diese |
| WO2005011013A1 (de) | 2003-07-21 | 2005-02-03 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2005014689A2 (de) | 2003-08-12 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung |
| WO2005019373A2 (de) | 2003-08-19 | 2005-03-03 | Basf Aktiengesellschaft | Übergangsmetallkomplexe mit carbenliganden als emitter für organische licht-emittierende dioden (oleds) |
| WO2005033244A1 (de) | 2003-09-29 | 2005-04-14 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| US20050069729A1 (en) | 2003-09-30 | 2005-03-31 | Konica Minolta Holdings, Inc. | Organic electroluminescent element, illuminator, display and compound |
| WO2005039246A1 (ja) | 2003-09-30 | 2005-04-28 | Konica Minolta Holdings, Inc. | 有機エレクトロルミネッセンス素子、照明装置、表示装置 |
| WO2005040302A1 (de) | 2003-10-22 | 2005-05-06 | Merck Patent Gmbh | Neue materialien für die elektrolumineszenz und deren verwendung |
| WO2005053051A1 (de) | 2003-11-25 | 2005-06-09 | Merck Patent Gmbh | Organisches elektrolumineszenzelement |
| EP1731584A1 (de) | 2004-03-31 | 2006-12-13 | Konica Minolta Holdings, Inc. | Organischer elektrolumineszenzvorrichtungsstoff, organische elektrolumineszenzvorrichtung, display und beleuchtungsvorrichtung |
| WO2005104264A1 (de) | 2004-04-26 | 2005-11-03 | Merck Patent Gmbh | Elektrolumineszierende polymere und deren verwendung |
| WO2005111172A2 (de) | 2004-05-11 | 2005-11-24 | Merck Patent Gmbh | Neue materialmischungen für die elektrolumineszenz |
| US20050258742A1 (en) | 2004-05-18 | 2005-11-24 | Yui-Yi Tsai | Carbene containing metal complexes as OLEDs |
| JP2005347160A (ja) | 2004-06-04 | 2005-12-15 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| WO2006005627A1 (en) | 2004-07-15 | 2006-01-19 | Merck Patent Gmbh | Oligomeric derivatives of spirobifluorene, their preparation and use |
| WO2006100896A1 (ja) | 2005-03-18 | 2006-09-28 | Idemitsu Kosan Co., Ltd. | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| EP1860097A1 (de) | 2005-03-18 | 2007-11-28 | Idemitsu Kosan Co., Ltd. | Aromatisches aminderivat und organisches elektrolumineszenzgerät, bei dem dieses verwendet wird |
| WO2006117052A1 (de) | 2005-05-03 | 2006-11-09 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung und in deren herstellung verwendete boronsäure- und borinsäure-derivate |
| WO2006122630A1 (de) | 2005-05-20 | 2006-11-23 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| WO2007050301A2 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007050334A1 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007063754A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2007137725A1 (de) | 2006-05-31 | 2007-12-06 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| DE102006025846A1 (de) | 2006-06-02 | 2007-12-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2008006449A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2008056746A1 (fr) | 2006-11-09 | 2008-05-15 | Nippon Steel Chemical Co., Ltd. | Composé pour un dispositif électroluminescent organique et dispositif électroluminescent organique |
| WO2009030981A2 (en) | 2006-12-28 | 2009-03-12 | Universal Display Corporation | Long lifetime phosphorescent organic light emitting device (oled) structures |
| WO2008086851A1 (de) | 2007-01-18 | 2008-07-24 | Merck Patent Gmbh | Carbazol-derivate für organische elektrolumineszenzvorrichtungen |
| WO2008132103A1 (de) | 2007-04-26 | 2008-11-06 | Basf Se | Pentaphenylenderivate als photosensibilisatoren in solarzellen |
| WO2008146839A1 (ja) | 2007-05-29 | 2008-12-04 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2008149691A1 (ja) | 2007-05-30 | 2008-12-11 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2009062578A1 (de) | 2007-11-12 | 2009-05-22 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen enthaltend azomethin-metall-komplexe |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008036982A1 (de) | 2008-08-08 | 2010-02-11 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009023155A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
Non-Patent Citations (4)
| Title |
|---|
| H. C. Starck, Goslar, Deutschland; Poly(3,4-ethylendioxy-2,5-thiophen) |
| M. S. Arnold et al., Appl. Phys. Lett. 2008, 92, 053301 |
| Synlett, 2006, 5, 737-740 |
| T. Matsumoto et al., Multiphoton Organic EL Device Having Charge Generation Layer, IDMC 2003, Taiwan; Session 21 OLED (5) |
Cited By (114)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102009032922A1 (de) | 2009-07-14 | 2011-01-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009041289A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009041414A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Metallkomplexe |
| WO2011032686A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Formulierungen zur herstellung von elektronischen vorrichtungen |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011035836A1 (de) | 2009-09-23 | 2011-03-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011042107A2 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102009053645A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtung |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009057167A1 (de) | 2009-12-05 | 2011-06-09 | Merck Patent Gmbh | Elektronische Vorrichtung enthaltend Metallkomplexe |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010009193A1 (de) | 2010-02-24 | 2011-08-25 | Merck Patent GmbH, 64293 | Fluor-Fluor Assoziate |
| DE102010009193B4 (de) | 2010-02-24 | 2022-05-19 | MERCK Patent Gesellschaft mit beschränkter Haftung | Zusammensetzung enthaltend Fluor-Fluor Assoziate, Verfahren zu deren Herstellung, deren Verwendung sowie organische elektronische Vorrichtung diese enthaltend |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010010481A1 (de) | 2010-03-06 | 2011-09-08 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010018321A1 (de) | 2010-04-27 | 2011-10-27 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| DE102010019306A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| DE102010020044A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010020567A1 (de) | 2010-05-14 | 2011-11-17 | Merck Patent Gmbh | Metallkomplexe |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2896627A1 (de) | 2010-07-15 | 2015-07-22 | Merck Patent GmbH | Organische Komplexe enthaltend Metalle |
| DE102010027218A1 (de) | 2010-07-15 | 2012-01-19 | Merck Patent Gmbh | Organische Komplexe enthaltend Metalle |
| WO2012007103A1 (de) | 2010-07-15 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe mit organischen liganden und deren verwendung in oleds |
| EP3121183A1 (de) | 2010-07-15 | 2017-01-25 | Merck Patent GmbH | Organische komplexe enthaltend metalle |
| WO2012007088A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027316A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027317A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027319A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010045405A1 (de) | 2010-09-15 | 2012-03-15 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010046412A1 (de) | 2010-09-23 | 2012-03-29 | Merck Patent Gmbh | Metall-Ligand Koordinationsverbindungen |
| DE102010046412B4 (de) | 2010-09-23 | 2022-01-13 | Merck Patent Gmbh | Metall-Ligand Koordinationsverbindungen |
| WO2012038029A1 (de) | 2010-09-24 | 2012-03-29 | Merck Patent Gmbh | Phosphorhaltige metallkomplexe |
| DE102010046512A1 (de) | 2010-09-24 | 2012-03-29 | Merck Patent Gmbh | Phosphorhaltige Metallkomplexe |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012079678A1 (de) | 2010-12-13 | 2012-06-21 | Merck Patent Gmbh | Substituierte tetraarylbenzole |
| DE102010054316A1 (de) | 2010-12-13 | 2012-06-14 | Merck Patent Gmbh | Substituierte Tetraarylbenzole |
| WO2012079673A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102010054525A1 (de) | 2010-12-15 | 2012-04-26 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010055902A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2012084114A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012084115A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102010055901A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| EP2482159A2 (de) | 2011-01-28 | 2012-08-01 | Honeywell International, Inc. | Verfahren und umkonfigurierbare System zur Optimierung der Leistung eines zustandsabhängigen Wartungssystems |
| WO2012107158A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | 1,3 - dioxan-5-on-verbindungen |
| DE102011010841A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | (1,3)-Dioxan-5-on-Verbindungen |
| WO2012107163A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte dibenzonaphtacene |
| DE102011011104A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte Dibenzonaphtacene |
| DE102012016192A1 (de) | 2011-08-19 | 2013-02-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| WO2013060411A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte polymere, verfahren zu deren herstellung sowie deren verwendung in elektronischen vorrichtungen |
| WO2013097920A1 (en) | 2011-12-27 | 2013-07-04 | Merck Patent Gmbh | Metal complexes comprising 1,2,3-triazoles |
| EP2799515A4 (de) * | 2011-12-30 | 2015-08-12 | Cheil Ind Inc | Verbindung für eine organische optoelektronische vorrichtung, organische lichtemittierende diode damit und anzeigevorrichtung mit der organischen lichtemittierenden diode |
| US10121973B2 (en) | 2011-12-30 | 2018-11-06 | Cheil Industries, Inc. | Compound for organic optoelectronic device, organic light-emitting diode including same, and display device including organic light-emitting diode |
| US9768389B2 (en) | 2011-12-30 | 2017-09-19 | Cheil Industries, Inc. | Compound for optoelectronic device, organic light-emitting diode including same, and display device including organic light-emitting diode |
| WO2013107487A1 (en) | 2012-01-16 | 2013-07-25 | Merck Patent Gmbh | Organic metal complexes |
| WO2013174471A1 (en) | 2012-05-24 | 2013-11-28 | Merck Patent Gmbh | Metal complexes comprising condensed heteroaromatic rings |
| US10249828B2 (en) | 2013-04-08 | 2019-04-02 | Merck Patent Gmbh | Organic electroluminescent device |
| WO2014166585A1 (de) * | 2013-04-08 | 2014-10-16 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| US10069079B2 (en) | 2013-04-08 | 2018-09-04 | Merck Patent Gmbh | Organic electroluminescent device with thermally activated delayed fluorescence material |
| US20160093812A1 (en) * | 2013-04-08 | 2016-03-31 | Merck Patent Gmbh | Organic electroluminescent device |
| US10193094B2 (en) | 2013-04-08 | 2019-01-29 | Merck Patent Gmbh | Organic light-emitting device having delayed fluorescence |
| US10000694B2 (en) | 2014-01-17 | 2018-06-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2015106789A1 (de) * | 2014-01-17 | 2015-07-23 | Merck Patent Gmbh | Materialien f?r organische elektrolumineszenzvorrichtungen |
| WO2015124255A1 (de) * | 2014-02-21 | 2015-08-27 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US11245079B2 (en) | 2014-02-21 | 2022-02-08 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| EP3581633A1 (de) | 2015-06-12 | 2019-12-18 | Merck Patent GmbH | Ester mit nichtaromatischen zyklen als lösungsmittel für oled-formulierungen |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| EP4084109A1 (de) | 2015-12-15 | 2022-11-02 | Merck Patent GmbH | Ester mit aromatischen gruppen als lösungsmittel für organische elektronische formulierungen |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017157783A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine formulierung enthaltend mindestens einen organischen halbleiter |
| EP3432378A4 (de) * | 2016-03-15 | 2019-11-20 | NIPPON STEEL Chemical & Material Co., Ltd. | Organisches elektrolumineszentes element |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021259824A1 (de) | 2020-06-23 | 2021-12-30 | Merck Patent Gmbh | Verfahren zur herstellung einer mischung |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022243403A1 (de) | 2021-05-21 | 2022-11-24 | Merck Patent Gmbh | Verfahren zur kontinuierlichen aufreinigung von mindestens einem funktionalen material und vorrichtung zur kontinuierlichen aufreinigung von mindestens einem funktionalen material |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
Also Published As
| Publication number | Publication date |
|---|---|
| CN102471602B (zh) | 2014-05-07 |
| JP2012531383A (ja) | 2012-12-10 |
| TW201127811A (en) | 2011-08-16 |
| DE112010002775B4 (de) | 2021-08-12 |
| KR20120103551A (ko) | 2012-09-19 |
| JP5734965B2 (ja) | 2015-06-17 |
| CN102471602A (zh) | 2012-05-23 |
| US9040172B2 (en) | 2015-05-26 |
| DE112010002775A5 (de) | 2012-09-20 |
| WO2011000455A1 (de) | 2011-01-06 |
| US20120097899A1 (en) | 2012-04-26 |
| KR101777883B1 (ko) | 2017-09-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE112010002775B4 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| DE102009005289B4 (de) | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung und elektronische Vorrichtungen, enthaltend diese | |
| DE112010004381B4 (de) | Materialien für elektronische Vorrichtungen | |
| EP2303814B1 (de) | Verbindungen für elektronische vorrichtungen | |
| EP2705550B1 (de) | Verbindungen für elektronische vorrichtungen | |
| EP2344609B1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| EP2705552B1 (de) | Verbindungen für elektronische vorrichtungen | |
| EP2791105B1 (de) | Verbindungen für elektronische vorrichtungen | |
| DE102009009277B4 (de) | Organische elektronische Vorrichtung, Verfahren zu deren Herstellung und Verwendung von Verbindungen | |
| EP2663567B1 (de) | Verbindungen für organische elektrolumineszenzvorrichtungen | |
| EP2102309B1 (de) | Carbazol-derivate für organische elektrolumineszenzvorrichtungen | |
| EP3439065B1 (de) | Materialien für elektronische vorrichtungen | |
| EP1761962B1 (de) | Organische elektrolumineszenzvorrichtung | |
| WO2010083873A1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| DE112011103412B4 (de) | Materialien für elektronische Vorrichtungen | |
| DE102009023155A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| DE102009032922A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| DE102009053645A1 (de) | Materialien für organische Elektrolumineszenzvorrichtung | |
| DE102008057051A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| WO2010083871A1 (de) | Verbindungen für elektronische vorrichtungen | |
| DE102009022858A1 (de) | Organische Elektrolumineszenzvorrichtungen | |
| DE102009053644A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| DE102010024542A1 (de) | Materialien für elektronische Vorrichtungen | |
| DE102010012738A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| DE102010005697A1 (de) | Verbindungen für elektronische Vorrichtungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| R119 | Application deemed withdrawn, or ip right lapsed, due to non-payment of renewal fee |
Effective date: 20120103 |