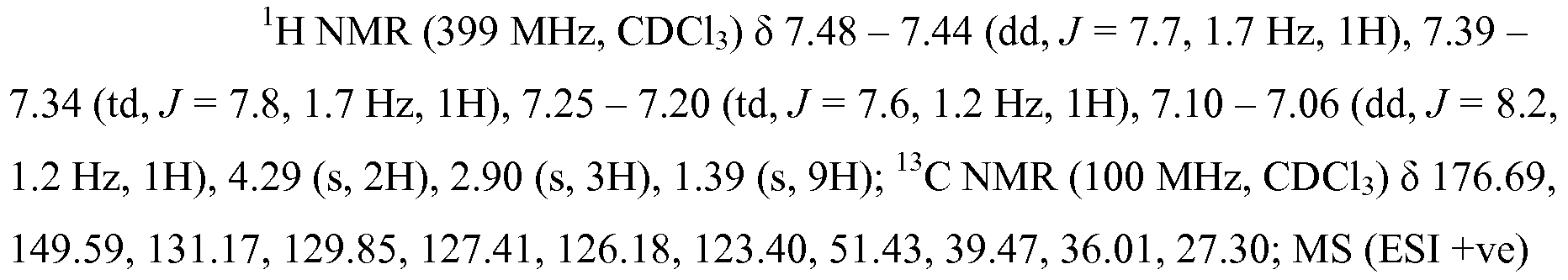KR20140068884A - 관능화된 핵산의 합성 방법 - Google Patents
관능화된 핵산의 합성 방법 Download PDFInfo
- Publication number
- KR20140068884A KR20140068884A KR1020147004108A KR20147004108A KR20140068884A KR 20140068884 A KR20140068884 A KR 20140068884A KR 1020147004108 A KR1020147004108 A KR 1020147004108A KR 20147004108 A KR20147004108 A KR 20147004108A KR 20140068884 A KR20140068884 A KR 20140068884A
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- alkenyl
- alkynyl
- aryl
- trimethylsilyl
- Prior art date
Links
- GKXASWWKVLIZQU-UHFFFAOYSA-N CN1CCN(CCS)CC1 Chemical compound CN1CCN(CCS)CC1 GKXASWWKVLIZQU-UHFFFAOYSA-N 0.000 description 3
- JVGGQLLNQPHZBJ-UHFFFAOYSA-N COC(C1N(CCS)CCC1)=O Chemical compound COC(C1N(CCS)CCC1)=O JVGGQLLNQPHZBJ-UHFFFAOYSA-N 0.000 description 3
- FJOXVWJOCNVDDI-UHFFFAOYSA-N SCCN1CCCC1 Chemical compound SCCN1CCCC1 FJOXVWJOCNVDDI-UHFFFAOYSA-N 0.000 description 3
- YZVWMFBVTTUSAW-UHFFFAOYSA-N SCCN1CCOCC1 Chemical compound SCCN1CCOCC1 YZVWMFBVTTUSAW-UHFFFAOYSA-N 0.000 description 3
- RBEOKVIECRYFNC-UHFFFAOYSA-N CC(OCC(C(C(C1OC(C)=O)OC(C)=O)O)OC1S)=O Chemical compound CC(OCC(C(C(C1OC(C)=O)OC(C)=O)O)OC1S)=O RBEOKVIECRYFNC-UHFFFAOYSA-N 0.000 description 2
- LGXUNUOIKIHNFU-UHFFFAOYSA-N CC(C)CC[N](C)(C)CCS Chemical compound CC(C)CC[N](C)(C)CCS LGXUNUOIKIHNFU-UHFFFAOYSA-N 0.000 description 1
- SFOZKJGZNOBSHF-UHFFFAOYSA-N CC(OCC(C(C(C1OC(C)=O)OC(C)=O)OC(C)=O)OC1S)=O Chemical compound CC(OCC(C(C(C1OC(C)=O)OC(C)=O)OC(C)=O)OC1S)=O SFOZKJGZNOBSHF-UHFFFAOYSA-N 0.000 description 1
- 0 CCC1C=CC=CC1CC(*)=O Chemical compound CCC1C=CC=CC1CC(*)=O 0.000 description 1
- XMVDMEGSBIAYRX-UHFFFAOYSA-N CCc1ccccc1C(S)=O Chemical compound CCc1ccccc1C(S)=O XMVDMEGSBIAYRX-UHFFFAOYSA-N 0.000 description 1
- HIRRKMHVXDVMGL-UHFFFAOYSA-N CCc1ccccc1CCS Chemical compound CCc1ccccc1CCS HIRRKMHVXDVMGL-UHFFFAOYSA-N 0.000 description 1
- QTTAKXPPGQAQPS-UHFFFAOYSA-N CCc1ccccc1CS Chemical compound CCc1ccccc1CS QTTAKXPPGQAQPS-UHFFFAOYSA-N 0.000 description 1
- UXONEHFVTRTISG-UHFFFAOYSA-N C[N](C)(C)CCS Chemical compound C[N](C)(C)CCS UXONEHFVTRTISG-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/04—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with deoxyribosyl as saccharide radical
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/63—Esters of sulfonic acids
- C07C309/64—Esters of sulfonic acids having sulfur atoms of esterified sulfo groups bound to acyclic carbon atoms
- C07C309/65—Esters of sulfonic acids having sulfur atoms of esterified sulfo groups bound to acyclic carbon atoms of a saturated carbon skeleton
- C07C309/66—Methanesulfonates
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/10—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by doubly bound oxygen or sulphur atoms
- C07D295/104—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by doubly bound oxygen or sulphur atoms with the ring nitrogen atoms and the doubly bound oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
- C07D295/108—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by doubly bound oxygen or sulphur atoms with the ring nitrogen atoms and the doubly bound oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings to an acyclic saturated chain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H13/00—Compounds containing saccharide radicals esterified by carbonic acid or derivatives thereof, or by organic acids, e.g. phosphonic acids
- C07H13/02—Compounds containing saccharide radicals esterified by carbonic acid or derivatives thereof, or by organic acids, e.g. phosphonic acids by carboxylic acids
- C07H13/04—Compounds containing saccharide radicals esterified by carbonic acid or derivatives thereof, or by organic acids, e.g. phosphonic acids by carboxylic acids having the esterifying carboxyl radicals attached to acyclic carbon atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
티오술포네이트 시약의 유도체 합성 방법이 본원에 기재된다. 상기 시약은 입체특이적 방식으로 H-포스포네이트로부터 포스포로티오트리에스테르를 합성하는데 이용된다.
Description
관련 출원에 대한 상호 참조
본 출원은 2011 년 7 월 19 일에 출원한 미국 가출원 일련 번호 61/509,526 에 대해 우선권을 주장하며, 이는 그 전체가 본원에 참조로 포함된다.
올리고뉴클레오티드는 치료, 진단, 연구 및 나노물질 적용에 유용하다. 치료법에 대한 DNA 또는 RNA 의 자연 서열의 이용은, 세포외 및 세포내 뉴클레아제에 대한 그의 불안정성, 불량한 세포 침투 및 분포로 인해 제한된다. 추가로, 시험관내 연구는 결합 친화성, 상보적 RNA 에 대한 서열 특이적 결합 (Cosstick and Eckstein, 1985; LaPlanche et al ., 1986; Latimer et al ., 1989; Hacia et al ., 1994; Mesmaeker et al ., 1995), 뉴클레아제에 대한 안정성과 같은 안티센스 뉴클레오티드의 특성이 인 원자의 입체배치에 의해 영향받는다는 것을 나타낸 바 있다. 따라서, 수많은 시험관내 및 생체내 적용을 위해 유비쿼터스 뉴클레아제에 대한 안정성을 부여하고, 상보적 RNA 에 대한 결합 친화성을 증가시키고, 세포 침투 및 생물분류를 증가시키도록 개질된 올리고뉴클레오티드가 필요하다.
발명의 개요
신규한 관능화된 핵산 및 핵산 전구약물의 합성 방법이 본원에 개시된다. 일부 구현예에서, 핵산은 키랄 인 부분을 포함한다.
한 구현예는 하기 단계를 포함하는 구조 IIIa 의 포스포로티오트리에스테르의 제조 방법을 제공하며:
i) 구조 Ia 의 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계; 및
ii) 실릴옥시포스포네이트를 구조 IIa 의 티오술포네이트 시약과 반응시켜 구조 IIIa 의 포스포로티오트리에스테르를 제공하는 단계;
이때,
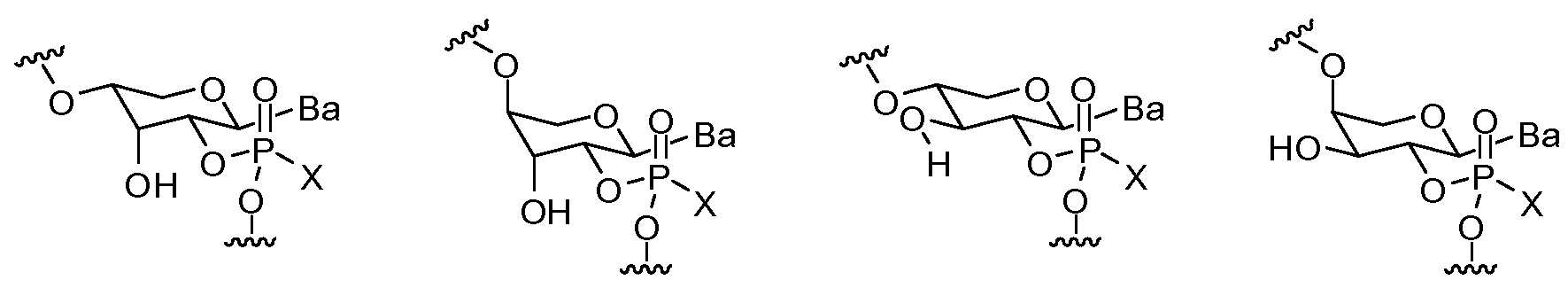
구조 Ia 의 H-포스포네이트는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IIa 의 티오술포네이트 시약은 하기 구조를 갖고:
[식 중,
X 는 알킬, 시클로알킬 또는 헤테로아릴이고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택됨];
구조 IIIa 의 포스포로티오트리에스테르는 하기 구조를 갖는다:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임].
또 다른 구현예는 W 가 O 인 구조 IIIa 의 포스포로티오트리에스테르의 제조 방법을 제공한다.
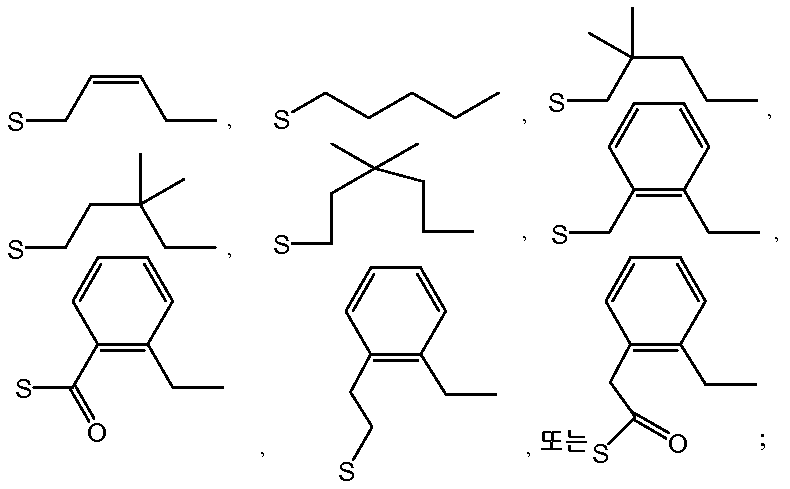
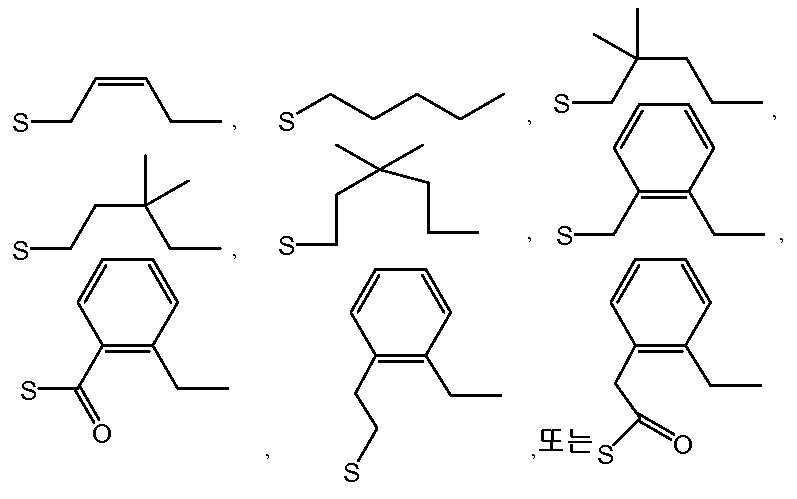
또 다른 구현예는 R1 이 하기에서 선택되고:
R2 가 하기에서 선택되는:
구조 IIIa 의 포스포로티오트리에스테르 제조 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 하기에서 선택되는 구조 IIIa 의 포스포로티오트리에스테르의 제조 방법을 제공한다:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법을 제공한다.
또 다른 구현예는 H-포스포네이트가 고체상에 공유결합하는 방법을 제공한다.
한 구현예는 하기 단계를 포함하는 구조 IIIb 의 비-입체무작위 (non-stereorandom) 인 결합 (phosphorous linkage) 을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공하며:
i) 구조 Ib 의 비-입체무작위 인 결합을 포함하는 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계; 및
ii) 실릴옥시포스포네이트를 구조 IIb 의 티오술포네이트 시약과 반응시켜 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ib 의 비-입체무작위 인 결합을 포함하는 H-포스포네이트는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IIb 의 티오술포네이트 시약은 하기 구조를 갖고:
[식 중,
X 는 알킬, 시클로알킬, 아릴 또는 헤테로아릴이고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택됨];
구조 IIIb 의 비-입체무작위 인 결합을 포함하는 키랄 포스포로티오트리에스테르는 하기 구조를 갖는다:
[식 중,
W 는 독립적으로 O, NH 또는 CH2 에서 선택되고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임].
또 다른 구현예는 W 이 O 인, 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공한다.
또 다른 구현예는 R1 이 하기에서 선택되고:
R2 가 하기에서 선택되는:
구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 하기에서 선택되는, 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공한다:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법을 제공한다.
또 다른 구현예는 H-포스포네이트가 고체상에 공유결합하는 방법을 제공한다.
한 구현예는 하기 단계를 포함하는 구조 IIIc 의 포스포로티오트리에스테르의 제조 방법을 제공하며:
i) 구조 Ic 의 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계;
ii) 실릴옥시포스포네이트를 구조 IVc 의 비스(티오술포네이트) 시약과 반응시켜 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르를 제공하는 단계;
iii) 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르를 구조 VIc 의 친핵체와 반응시켜 구조 IIIc 의 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ic 의 H-포스포네이트는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IVc 의 비스(티오술포네이트) 시약은 하기 구조를 갖고:
[식 중,
X 는 알킬렌, 알케닐렌, 아릴렌 또는 헤테로아릴렌이고;
각각의 R6 은 독립적으로 알킬, 시클로알킬, 아릴 또는 헤테로아릴임];
구조 VIc 의 친핵체가 하기 구조를 갖고:
R7-SH
[식 중,
R7 은 알킬, 알케닐, 아릴, 헤테로시클로 아미노알킬 또는 (헤테로시클로)알킬에서 선택됨];
구조 IIIc 의 포스포로티오트리에스테르는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R 은 R7-S-S-X- 이고;
R7 은 알킬, 알케닐, 아릴, 헤테로시클로 아미노알킬 또는 (헤테로시클로)알킬이고;
X 는 알킬렌, 알케닐렌, 아릴렌 또는 헤테로아릴렌이고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
이때, 구조 Ic 의 H-포스포네이트, 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르 및 구조 IIIc 의 포스포로티오트리에스테르의 인 결합은 임의로는 비-입체무작위 인 결합을 포함할 수 있다.
또 다른 구현예는 구조 IIIb 의 포스포로티오트리에스테르가 비-입체무작위 인 결합을 포함하고 구조 Ic 의 H-포스포네이트가 비-입체무작위 인 결합을 포함하고; W 가 독립적으로 O, NH 또는 CH2 에서 선택되는 방법을 제공한다. 또 다른 구현예는 W 가 O 인 방법을 제공한다.
또 다른 구현예는 R6 이 메틸인 방법을 제공한다.
또 다른 구현예는 구조 IVc 의 비스(티오술포네이트) 시약이 하기에서 선택되는 방법을 제공한다:
또 다른 구현예는 구조 VIc 의 친핵체가 하기 구조를 갖는 방법을 제공한다:
또 다른 구현예는 실릴화 시약이 하기에서 선택되는, 구조 IIIc 의 포스포로티오트리에스테르의 제조 방법을 제공한다:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법을 제공한다.
또 다른 구현예는 H-포스포네이트가 고체상에 공유결합하는 방법을 제공한다.
참고문헌의 포함
본 명세서에서는 본원에 언급된 모든 출판물 및 특허 출원들을, 각 개별 출판물 또는 특허 출원이 참고문헌으로 포함되는 것으로 구체적이고 개별적으로 표시된 것과 마찬가지로 참고문헌으로 포함한다.
본 발명의 신규한 특성을 첨부된 특허청구범위에서 특별히 설명한다. 본 발명의 원리를 이용하는 설명적 구현예를 나타내는 하기 상세한 설명 및 하기와 같은 동반 도면을 참조로 하여, 본 발명의 특성 및 유리한 점의 보다 양호한 이해가 이루어질 것이다.
도 1 은 실시예 6 에서 기재한 바와 같이 CD3CN 중의 화합물 100S 의 31P NMR 스펙트럼을 제공하고;
도 2 는 실시예 6 에서 기재한 바와 같이 BSTFA 첨가 후 CD3CN 중의 화합물 100S 의 31P NMR 스펙트럼을 제공하고;
도 3 은 실시예 6 에서 기재한 바와 같이 BSTFA, TEA 및 MTS 첨가 후 CD3CN 중의 화합물 100S 의 31P NMR 스펙트럼을 제공하고;
도 4 는 실시예 6 에서 기재한 바와 같이 CD3CN 중의 화합물 100R 의 31P NMR 스펙트럼을 제공하고;
도 5 는 실시예 6 에서 기재한 바와 같이 CD3CN 중의 화합물 100R 의 31P NMR 스펙트럼을 제공하고;
도 6 은 실시예 6 에서 기재한 바와 같이 BSTFA, TEA 및 MTS 첨가 후 CD3CN 중의 화합물 100R 의 31P NMR 스펙트럼을 제공한다.
도 1 은 실시예 6 에서 기재한 바와 같이 CD3CN 중의 화합물 100S 의 31P NMR 스펙트럼을 제공하고;
도 2 는 실시예 6 에서 기재한 바와 같이 BSTFA 첨가 후 CD3CN 중의 화합물 100S 의 31P NMR 스펙트럼을 제공하고;
도 3 은 실시예 6 에서 기재한 바와 같이 BSTFA, TEA 및 MTS 첨가 후 CD3CN 중의 화합물 100S 의 31P NMR 스펙트럼을 제공하고;
도 4 는 실시예 6 에서 기재한 바와 같이 CD3CN 중의 화합물 100R 의 31P NMR 스펙트럼을 제공하고;
도 5 는 실시예 6 에서 기재한 바와 같이 CD3CN 중의 화합물 100R 의 31P NMR 스펙트럼을 제공하고;
도 6 은 실시예 6 에서 기재한 바와 같이 BSTFA, TEA 및 MTS 첨가 후 CD3CN 중의 화합물 100R 의 31P NMR 스펙트럼을 제공한다.
발명의 상세한 설명
달리 언급되지 않는 한, 명세서 및 특허청구범위를 포함하는 본 출원에 사용된 하기의 용어들은 하기와 같은 정의를 갖는다. 명세서 및 첨부된 특허청구범위에 사용된 바와 같이, 단수 형태는 해당 문맥에서 달리 명확하게 지시하지 않는 한 복수 대상물을 포함한다는 것에 유의해야 한다. 달리 나타내지 않는 한, 질량 분광계, NMR, HPLC, 단백질 화학, 생화학, 재조합 DNA 기술 및 약학의 통상적인 방법이 이용된다. 본 출원에서, "또는" 또는 "및" 의 사용은 달리 언급되지 않는 한 "및/또는" 을 의미한다. 더욱이, 용어 "포함" 및 그의 기타 형태, 예컨대 "포함하다" 및 "포함되는" 은 제한의 의미가 아니다.
특정 화학 용어
달리 표시되지 않는 한, 이에 제한되지 않으나 "알킬", "아민", "아릴" 과 같은 사용된 일반적인 화학 용어들은 비치환형이다.
본원에 사용된 바와 같이, C1-Cx 는 C1-C2, C1-C3 ... C1-Cx 를 포함한다. 단지 예로써, "C1-C4" 로 나타내는 기는 해당 부분에 1 내지 4 개의 탄소 원자가 있다는 것을 나타내며, 즉 1 개의 탄소 원자, 2 개의 탄소 원자, 3 개의 탄소 원자 또는 4 개의 탄소 원자를 포함하는 기 뿐만 아니라 C1-C2 및 C1-C3 범위의 기를 나타낸다. 따라서 단지 예로써, "C1-C4 알킬" 은 알킬기 내에 1 내지 4 개의 탄소 원자가 있다는 것을 나타내고, 즉 알킬기가 메틸, 에틸, 프로필, 이소-프로필, n-부틸, 이소-부틸, sec-부틸 및 t-부틸 중에서 선택된다. 본원에 나타낼 때마다, 수치 범위, 예컨대 "1 내지 10" 은 주어진 범위 내의 각 정수를 지칭하며; 예를 들어 "1 내지 10 개의 탄소 원자" 는, 해당 기가 1 개의 탄소 원자, 2 개의 탄소 원자, 3 개의 탄소 원자, 4 개의 탄소 원자, 5 개의 탄소 원자, 6 개의 탄소 원자, 7 개의 탄소 원자, 8 개의 탄소 원자, 9 개의 탄소 원자 또는 10 개의 탄소 원자를 가질 수 있다는 것을 의미한다.
단독으로 또는 조합하여 본원에 사용된 용어 "헤테로원자" 또는 "헤테로" 는 탄소 또는 수소 이외의 원자를 지칭한다. 헤테로원자는 산소, 질소, 황, 인, 규소, 셀레늄 및 주석에서 독립적으로 선택될 수 있으나, 이들 원자에 제한되지 않는다. 2 개 이상의 헤테로원자가 존재하는 구현예에서, 2 개 이상의 헤테로원자는 서로 동일하거나, 2 개 이상의 헤테로원자의 일부 또는 전부가 서로 상이할 수 있다.
단독으로 또는 조합하여 본원에 사용된 용어 "알킬" 은 1 내지 약 10 개의 탄소 원자 또는 1 내지 6 개의 탄소 원자를 갖는 직쇄 또는 분지쇄 포화 탄화수소 모노라디칼을 지칭한다. 그 예는 비제한적으로, 메틸, 에틸, n-프로필, 이소프로필, 2-메틸-1-프로필, 2-메틸-2-프로필, 2-메틸-1-부틸, 3-메틸-1-부틸, 2-메틸-3-부틸, 2,2-디메틸-1-프로필, 2-메틸-1-펜틸, 3-메틸-1-펜틸, 4-메틸-1-펜틸, 2-메틸-2-펜틸, 3-메틸-2-펜틸, 4-메틸-2-펜틸, 2,2-디메틸-1-부틸, 3,3-디메틸-1-부틸, 2-에틸-1-부틸, n-부틸, 이소부틸, sec-부틸, t-부틸, n-펜틸, 이소펜틸, 네오펜틸, tert-아밀 및 헥실, 및 더 긴 알킬기, 예컨대 헵틸, 옥틸 등을 포함한다. 본원에 제시될 때마다, 수치 범위, 예컨대 "C1-C6 알킬" 또는 "C1 -6 알킬" 은, 알킬기가 1 개의 탄소 원자, 2 개의 탄소 원자, 3 개의 탄소 원자, 4 개의 탄소 원자, 5 개의 탄소 원자 또는 6 개의 탄소 원자로 이루어질 수 있다는 것을 의미한다. 한 구현예에서, "알킬" 은 치환된다. 달리 나타내지 않는 한, "알킬" 은 비치환된다.
단독으로 또는 조합되어 본원에 사용된 용어 "알케닐" 은 1 개 이상의 탄소-탄소 이중결합 및 2 내지 약 10 개의 탄소 원자, 또는 2 내지 약 6 개의 탄소 원자를 갖는 직쇄 또는 분지쇄 탄화수소 모노라디칼을 지칭한다. 상기 기는 이중 결합(들) 에 대해 시스 또는 트랜스 입체배치의 것일 수 있고, 두 이성질체를 전부 포함하는 것으로 이해되어야 한다. 그 예는 비제한적으로, 에테닐 (-CH=CH2), 1-프로페닐 (-CH2CH=CH2), 이소프로페닐 [-C(CH3)=CH2], 부테닐, 1,3-부타디에닐 등을 포함한다. 본원에 제시될 때마다, 수치 범위, 예컨대 "C2-C6 알케닐" 또는 "C2 -6 알케닐" 은, 알케닐기가 2 개의 탄소 원자, 3 개의 탄소 원자, 4 개의 탄소 원자, 5 개의 탄소 원자 또는 6 개의 탄소 원자로 이루어질 수 있다는 것을 의미한다. 한 구현예에서, "알케닐" 은 치환된다. 달리 나타내지 않는 한, "알케닐" 은 비치환된다.
단독으로 또는 조합되어 본원에 사용된 용어 "알키닐" 은 1 개 이상의 탄소-탄소 삼중결합 및 2 내지 약 10 개의 탄소 원자, 또는 2 내지 약 6 개의 탄소 원자를 갖는 직쇄 또는 분지쇄 탄화수소 모노라디칼을 지칭한다. 그 예는 비제한적으로, 에티닐, 2-프로피닐, 2-부티닐, 1,3-부타디이닐 등을 포함한다. 본원에 제시될 때마다, 수치 범위, 예컨대 "C2-C6 알키닐" 또는 "C2 -6 알키닐" 은, 알키닐기가 2 개의 탄소 원자, 3 개의 탄소 원자, 4 개의 탄소 원자, 5 개의 탄소 원자 또는 6 개의 탄소 원자로 이루어질 수 있다는 것을 의미한다. 한 구현예에서, "알키닐" 은 치환된다. 달리 나타내지 않는 한, "알키닐" 은 비치환된다.
단독으로 또는 조합되어 본원에 사용된 용어 "헤테로알킬", "헤테로알케닐" 및 "헤테로알키닐" 은 하나 이상의 골격 사슬 탄소 원자 (및 적당한 경우 임의의 회합된 수소 원자) 가 각각 독립적으로 헤테로원자 (즉, 탄소 원자 이외의 원자, 예컨대 이에 제한되지 않으나, 산소, 질소, 황, 규소, 인, 주석 또는 이의 조합) 또는 헤테로원자기, 예컨대 이에 제한되지 않으나, -O-O-, -S-S-, -O-S-, -S-O-, =N-N= -N=N-, -N=N-NH-, -P(O)2-, -0-P(O)2-, -P(O)2-O-, -S(O)-, -S(O)2-, -SnH2- 등으로 대체되는, 상기 기재한 바와 같은 각각의 알킬, 알케닐 및 알키닐 구조를 지칭한다.
단독으로 또는 조합되어 본원에 사용된 용어 "할로알킬", "할로알케닐" 및 "할로알키닐" 은, 하나 이상의 수소 원자가 불소, 염소, 브롬 또는 요오드 원자, 또는 이의 조합에 의해 대체되는, 상기 정의한 바와 같은 각각의 알킬, 알케닐 및 알키닐기를 지칭한다. 일부 구현예에서, 2 개 이상의 수소 원자는 서로 동일한 할로겐 원자로 대체될 수 있고 (예를 들어, 디플루오로메틸); 다른 구현예에서 2 개 이상의 수소 원자는 전부 서로 동일하지는 않은 할로겐 원자로 대체될 수 있다 (예를 들어, 1-클로로-1-플루오로-1-요오도에틸). 할로알킬기의 비제한적 예는 플루오로메틸, 클로로메틸 및 브로모에틸이다. 할로알케닐기의 비제한적 예는 브로모에테닐이다. 할로알키닐기의 비제한적 예는 클로로에티닐이다.
단독으로 또는 조합되어 본원에 사용된 용어 "탄소 사슬" 은, 선형, 시클릭 또는 이의 임의의 조합인 임의의 알킬, 알케닐, 알키닐, 헤테로알킬, 헤테로알케닐 또는 헤테로알키닐기를 지칭한다. 사슬이 링커의 일부이고, 링커가 코어 골격의 일부로서 하나 이상의 고리를 포함하는 경우, "사슬" 이 오직 주어진 고리의 하부 또는 상부를 이루며 그 두 가지를 전부 이루지는 않는 이들 탄소 원자만을 포함하고, 이때 상기 고리(들)의 상부 및 하부의 길이는 동등하지 않다면, 사슬 길이 계산을 목적으로 더 짧은 거리가 사슬 길이 결정에 이용될 것이다. 사슬이 골격의 일부로서 헤테로원자를 포함하는 경우, 상기 원자는 탄소 사슬 길이의 일부분으로 계산되지 않는다.
단독으로 또는 조합되어 본원에 사용된 용어 "시클로알킬" 은 3 내지 약 15 개의 고리 탄소 원자 또는 3 내지 약 10 개의 고리 탄소 원자를 포함하는 포화, 탄화수소 모노라디칼 고리를 지칭하지만, 추가적인 비-고리 탄소 원자를 치환기로서 포함할 수 있다 (예를 들어, 메틸시클로프로필). 본원에 제시될 때마다, 수치 범위, 예컨대 "C3-C6 시클로알킬" 또는 "C3 -6 시클로알킬" 은, 시클로알킬기가 3 개의 탄소 원자, 4 개의 탄소 원자, 5 개의 탄소 원자 또는 6 개의 탄소 원자로 이루어질 수 있다는 것을 의미하고, 즉 시클로프로필, 시클로부틸, 시클로펜틸 또는 시클로헵틸이지만, 본 정의는 또한 수치 범위가 지정되지 않은 용어 "시클로알킬" 의 경우도 포괄한다. 상기 용어는 융합, 비-융합, 브릿지연결 (bridged) 및 스피로 라디칼을 포함한다. 융합 시클로알킬은 부착 고리가 시클로알킬 고리이고, 나머지 개별 고리가 알리시클릭, 헤테로시클릭, 방향족, 헤테로방향족 또는 이의 임의의 조합인 2 내지 4 개의 융합 고리를 포함할 수 있다. 그 예는 비제한적으로, 시클로프로필, 시클로펜틸, 시클로헥실, 데칼리닐 및 바이시클로 [2.2.1] 헵틸 및 아다만틸 고리계를 포함한다. 구체적인 예는 비제한적으로, 하기의 부분을 포함한다:
한 구현예에서, "시클로알킬" 은 치환된다. 달리 나타내지 않는 한, "시클로알킬" 은 비치환된다.
단독으로 또는 조합되어 본원에 사용된 용어 "비-방향족 헤테로시클릴" 및 "헤테로알리시클릴" 은 하나 이상의 고리 원자가 이에 제한되지 않으나 산소, 질소, 황, 인, 규소, 셀레늄 및 주석에서 독립적으로 선택되는 탄소 이외의 원자인 3 내지 약 20 개의 고리 원자를 포함하는 포화, 부분 포화, 또는 완전 포화 비-방향족 고리 모노라디칼을 지칭한다. 2 개 이상의 헤테로원자가 고리 내에 존재하는 구현예에서, 2 개 이상의 헤테로원자는 서로 동일할 수 있거나, 2 개 이상의 헤테로원자의 일부 또는 전부가 서로 상이할 수 있다. 상기 용어는 융합, 비-융합, 브릿지연결 및 스피로 라디칼을 포함한다. 융합 비-방향족 헤테로시클릭 라디칼은, 결합 고리가 비-방향족 헤테로사이클이고, 기타 개별 고리가 알리시클릭, 헤테로시클릭, 방향족, 헤테로방향족 또는 이의 임의의 조합일 수 있는 2 내지 4 개의 융합 고리를 포함할 수 있다. 융합 고리계는 단일 결합 또는 이중 결합을 통해서 뿐만 아니라, 탄소-탄소, 탄소-헤테로원자 또는 헤테로원자-헤테로원자인 결합을 통해서 융합될 수 있다. 상기 용어는 또한 3 내지 약 12 개의 골격 고리 원자를 갖는 라디칼 뿐만 아니라 3 내지 약 10 개의 골격 고리 원자를 갖는 것을 포함한다. 비-방향족 헤테로시클릭 서브유닛의 그의 모체 분자에 대한 부착은 헤테로원자 또는 탄소 원자를 통한 것일 수 있다. 마찬가지로, 추가적인 치환이 헤테로원자 또는 탄소 원자를 통해 존재할 수 있다. 비제한적인 예로서, 이미다졸리딘 비-방향족 헤테로사이클은 그의 N 원자를 통해 (이미다졸리딘-1-일 또는 이미다졸리딘-3-일) 또는 임의의 그의 탄소 원자를 통해 (이미다졸리딘-2-일, 이미다졸리딘-4-일 또는 이미다졸리딘-5-일) 모체 원자에 부착될 수 있다. 특정 구현예에서, 비-방향족 헤테로사이클은 하나 이상의 카르보닐 또는 티오카르보닐기, 예컨대 옥소- 및 티오-포함기를 포함할 수 있다. 그 예는 비제한적으로, 피롤리디닐, 테트라히드로푸라닐, 디히드로푸라닐, 테트라히드로티에닐, 테트라히드로피라닐, 디히드로피라닐, 테트라히드로티오피라닐, 피페리디노, 모르폴리노, 티오모르폴리노, 티옥사닐, 피페라지닐, 아제티디닐, 옥세타닐, 티에타닐, 호모피페리디닐, 옥세파닐, 티에파닐, 옥사제피닐, 디아제피닐, 티아제피닐, 1,2,3,6-테트라히드로피리디닐, 2-피롤리닐, 3-피롤리닐, 인돌리닐, 2H-피라닐, 4H-피라닐, 디옥사닐, 1,3-디옥솔라닐, 피라졸리닐, 디티아닐, 디티올라닐, 디히드로피라닐, 디히드로티에닐, 디히드로푸라닐, 피라졸리디닐, 이미다졸리닐, 이미다졸리디닐, 3-아자바이시클로[3.1.0]헥사닐, 3-아자바이시클로[4.1.0]헵타닐, 3H-인돌릴 및 퀴놀리지닐을 포함한다. 비-방향족 헤테로사이클로 또한 지칭하는 헤테로시클로알킬기의 구체적 예는 하기를 포함한다:
상기 용어는 또한, 비제한적으로, 단당류, 다당류 및 올리고당류를 포함하는 탄수화물의 모든 고리 형태를 포함한다. 한 구현예에서, "비-방향족 헤테로시클릴" 또는 "헤테로알리시클릴" 은 치환된다. 달리 나타내지 않는 한, "비-방향족 헤테로시클릴" 또는 "헤테로알리시클릴" 은 비치환된다.
단독으로 또는 조합되어 본원에 사용된 용어 "아릴" 은 6 내지 약 20 개의 고리 탄소 원자의 방향족 탄화수소 라디칼을 지칭하고, 융합 및 비-융합 아릴 고리를 포함한다. 융합 아릴 고리 라디칼은 부착 고리가 아릴 고리이고, 기타 개별 고리가 알리시클릭, 헤테로시클릭, 방향족, 헤테로방향족 또는 이의 임의의 조합일 수 있는 2 내지 4 개의 융합 고리를 포함한다. 또한, 용어 아릴은 6 내지 약 12 개의 고리 탄소 원자를 포함하는 융합 및 비-융합 고리 뿐만 아니라 6 내지 약 10 개의 고리 탄소 원자를 포함하는 것도 포함한다. 단일 고리 아릴기의 비제한적 예는 페닐을 포함하고; 융합 고리 아릴기는 나프틸, 페난트레닐, 안트라세닐, 아줄레닐을 포함하고; 비-융합 바이-아릴기는 바이페닐을 포함한다. 한 구현예에서, "아릴" 은 치환된다. 달리 나타내지 않는 한, "아릴" 은 비치환된다.
단독으로 또는 조합되어 본원에 사용된 용어 "헤테로아릴" 은 약 5 내지 약 20 개의 골격 고리 원자를 포함하는 방향족 모노라디칼을 지칭하며, 이때 하나 이상의 고리 원자가 이에 제한되지 않으나 산소, 질소, 황, 인, 규소, 셀레늄 및 주석에서 독립적으로 선택되고, 단, 상기 기의 고리가 2 개의 인접하는 O 또는 S 원자를 포함하지는 않는다. 고리 내에 2 개 이상의 헤테로원자가 존재하는 구현예에서, 상기 2 개 이상의 헤테로원자는 서로 동일하거나, 상기 2 개 이상의 헤테로원자의 일부 또는 전부가 서로 상이할 수 있다. 상기 용어 헤테로아릴은 1 개 이상의 헤테로원자를 갖는 융합 및 비-융합 헤테로아릴 라디칼을 포함한다. 용어 헤테로아릴은 또한 5 내지 약 12 개의 골격 고리 원자를 갖는 융합 및 비-융합 헤테로아릴 뿐만 아니라 5 내지 약 10 개의 골격 고리 원자를 갖는 것도 포함한다. 헤테로아릴기에 대한 결합은 탄소 원자 또는 헤테로원자를 통한 것일 수 있다. 이에 따라, 비제한적 예로서, 이미다졸기는 임의의 그의 탄소 원자를 통해 (이미다졸-2-일, 이미다졸-4-일 또는 이미다졸-5-일), 또는 그의 질소 원자를 통해 (이미다졸-1-일 또는 이미다졸-3-일) 모체 원자에 부착될 수 있다. 마찬가지로, 헤테로아릴기는 추가로 그의 탄소 원자의 일부 또는 전부 및/또는 그의 헤테로원자의 일부 또는 전부를 통해 치환될 수 있다. 융합 헤테로아릴 라디칼은 부착 고리가 헤테로방향족 고리이고, 기타 개별 고리가 알리시클릭, 헤테로시클릭, 방향족, 헤테로방향족 또는 이의 임의의 조합일 수 있는 2 내지 4 개의 융합 고리를 포함할 수 있다. 단일 고리 헤테로아릴기의 비제한적 예는 피리딜을 포함하고; 융합 고리 헤테로아릴기는 벤즈이미다졸릴, 퀴놀리닐, 아크리디닐을 포함하고; 비-융합 바이-헤테로아릴기는 바이피리디닐을 포함한다. 헤테로아릴의 추가예는 비제한적으로, 푸라닐, 티에닐, 옥사졸릴, 아크리디닐, 페나지닐, 벤즈이미다졸릴, 벤조푸라닐, 벤족사졸릴, 벤조티아졸릴, 벤조티아디아졸릴, 벤조티오페닐, 벤족사디아졸릴, 벤조트리아졸릴, 이미다졸릴, 인돌릴, 이속사졸릴, 이소퀴놀리닐, 인돌리지닐, 이소티아졸릴, 이소인돌릴옥사디아졸릴, 인다졸릴, 피리딜, 피리다질, 피리미딜, 피라지닐, 피롤릴, 피라지닐, 피라졸릴, 푸리닐, 프탈라지닐, 프테리디닐, 퀴놀리닐, 퀴나졸리닐, 퀴녹살리닐, 트리아졸릴, 테트라졸릴, 티아졸릴, 트리아지닐, 티아디아졸릴 등, 및 그의 옥시드, 예를 들어 피리딜-N-옥시드를 포함한다. 헤테로아릴기의 구체적인 예는 하기의 부분을 포함한다:
한 구현예에서, "헤테로아릴" 은 치환된다. 달리 나타내지 않는 한, "헤테로아릴" 은 비치환된다.
단독으로 또는 조합되어 본원에 사용된 용어 "헤테로시클릴" 은 헤테로알리시클릴 및 헤테로아릴기를 지칭한다. 본원에서, 헤테로사이클 내 탄소 원자의 개수가 명시될 때 (예를 들어, C1-C6 헤테로사이클) 마다, 하나 이상의 비-탄소 원자 (헤테로원자) 가 고리 내에 존재해야 한다. "C1-C6 헤테로사이클" 과 같은 지정은 고리 내 탄소 원자의 개수만 지칭할 뿐이고, 고리 내 원자의 총 개수를 지칭하지 않는다. "4 내지 6 원 헤테로사이클" 과 같은 지정은 고리 내에 포함되어 있는 원자의 총 개수를 지칭한다 (즉 4, 5 또는 6 원 고리에서는, 하나 이상의 원자가 탄소 원자이고, 하나 이상의 원자가 헤테로원자이고, 나머지 2 내지 4 개의 원자가 탄소 원자 또는 헤테로원자임). 2 개 이상의 헤테로원자를 갖는 헤테로사이클에 대해서는, 그러한 2 개 이상의 헤테로원자가 서로 동일하거나 상이할 수 있다. 비-방향족 헤테로시클릭기는 고리 내에 오직 3 개의 원자를 갖는 기를 포함하는 한편, 방향족 헤테로시클릭기는 고리 내에 5 개 이상의 원자를 가져야만 한다. 헤테로사이클에 대한 결합 (즉, 모체 분자에 대한 부착 또는 추가 치환) 은 헤테로원자 또는 탄소 원자를 통해 존재할 수 있다. 한 구현예에서, "헤테로시클릴" 은 치환된다. 달리 나타내지 않는 한, "헤테로시클릴" 은 비치환된다.
단독으로 또는 조합하여 본원에 사용된 용어 "할로겐", "할로" 또는 "할라이드" 는 플루오로, 클로로, 브로모 및/또는 요오도를 지칭한다.
화합물 또는 그의 약학적으로 허용가능한 염은 하나 이상의 비대칭 중심을 포함할 수 있으며 그에 따라 절대 입체화학에 관해, 예컨대 (R)- 또는 (S)- 로 정의될 수 있는 거울상이성질체, 부분입체이성질체 및 기타 입체이성질체 형태가 생길 수 있다. 본원에 기재된 화합물이 올레핀성 이중 결합 또는 기하학적 비대칭의 다른 중심을 포함하는 경우, 그리고 달리 명기하지 않는 한, 상기 화합물이 Z 및 E 기하학적 이성질체 모두 (예를 들어, 시스 또는 트랜스) 를 포함하는 것으로 의도된다. 마찬가지로, 모든 가능한 이성질체 뿐만 아니라 그의 라세미체 및 광학적 순수 형태, 및 모든 호변이성질체 형태가 또한 포함되는 것으로 의도된다.
"입체이성질체" 는 중첩될 수 없는, 상이한 3 차원 구조를 갖지만 동일한 결합에 의해 결합된 동일한 원자로 이루어진 2 개 이상의 화합물 사이의 관계를 지칭한다. 용어 "거울상이성질체" 는 서로 중첩될 수 없는 거울 이미지인 2 개의 입체이성질체를 지칭한다. 본원에 개시된 화합물, 및 이의 혼합물의 각종 입체이성질체가 본 개시물의 범주 내에 있으며 특히 거울상이성질체를 포함하는 것으로 고려된다.
"호변이성질체" 는 분자의 1 개 원자에서 동일 분자의 또 다른 원자로 양성자 이동이 일어날 수 있는 화합물을 지칭한다. 본원에 나타낸 상기 화합물은 호변이성질체로서 존재할 수 있다. 호변이성질체화가 가능한 용액에서, 호변이성질체의 화학적 평형이 존재할 것이다. 호변이성질체의 정확한 비는 온도, 용매 및 pH 를 포함하는 여러 인자에 따라 좌우된다. 호변이성질체 평형의 일부 예를 하기에서 나타낸다.
본원에 사용되는 용어 "비-입체무작위 인 결합(들)" 은 포스포디에스테르에서의 키랄 인 원자, 또는 기타 등전자 결합 유형, 뉴클레오티드간 (internucleotide) 결합을 지칭한다. 1 개 초과의 인 뉴클레오티드간 결합을 포함하는 구현예에 대해서, 인에서의 키랄성의 좌우상 (handedness) 은 각각의 인 원자에서 독립적으로 선택된다. 한 구현예에서, 본원에 기재된 올리고뉴클레오티드는 순수 부분입체이성질체이다. 또 다른 구현예에서, 올리고뉴클레오티드는 95% 초과의 부분입체이성질체적 순도를 갖는다. 또 다른 구현예에서, 올리고뉴클레오티드는 90% 초과의 부분입체이성질체적 순도를 갖는다.
"임의의" 또는 "임의로는" 은 후속 기재된 사건 또는 환경이 발생할 수 있거나 발생하지 않을 수 있으며, 상기 기재가 상기 사건 또는 환경이 발생하는 경우 및 발생하지 않는 경우를 포함한다는 것을 의미한다. 예를 들어, "임의 치환된 알킬" 은 알킬 라디칼이 치환될 수 있거나 치환되지 않을 수 있으며 상기 기재가 치환된 아릴 라디칼 및 치환되지 않은 아릴 라디칼 모두를 포함한다는 것을 의미한다.
특정 핵산 용어
천연 핵산은 포스페이트 골격을 갖고; 인공 핵산은 기타 유형의 골격을 가질 수 있으나, 동일한 염기를 포함한다.
본원에 사용된 용어 "뉴클레오티드" 는 헤테로시클릭 염기, 당 및 하나 이상의 포스페이트 기로 이루어지는 폴리뉴클레오티드의 단량체 유닛을 지칭한다. 자연 발생적 염기 (구아닌 (G), 아데닌 (A), 시토신 (C), 티민 (T) 및 우라실 (U)) 는 퓨린 또는 피리미딘의 유도체인데, 여기에는 자연 발생적 및 비-자연 발생적 염기 유사체도 역시 포함된다는 점을 이해해야 한다. 자연 발생적 당은 펜토오스 (오탄당) 데옥시리보오스 (DNA 를 형성함) 또는 리보오스 (RNA 를 형성함) 인데, 자연 발생적 및 비-자연 발생적 당 유사체가 또한 포함된다는 점을 이해해야 한다. 핵산은 포스페이트 결합을 통해 연결되어 핵산 또는 폴리뉴클레오티드를 형성하지만, 수많은 기타 결합이 당업계에 공지되어 있다 (예컨대, 비제한적으로, 포스포로티오에이트, 보라노포스페이트 등). 인공 핵산은 PNA (펩티드 핵산), 포스포티오네이트, 및 본래 핵산의 포스페이트 골격의 기타 변형체를 포함한다.
용어 "뉴클레오시드" 는 핵염기 또는 개질된 핵염기가 당 또는 개질된 당에 공유결합되는 부분을 지칭한다.
용어 "당" 은 폐쇄 및/또는 개방 형태의 단당류를 지칭한다. 당은 비제한적으로, 리보오스, 데옥시리보오스, 펜토푸라노오스, 펜토피라노오스 및 헥소피라노오스 부분을 포함한다.
용어 "개질된 당" 은 당을 대체할 수 있는 부분을 지칭한다. 개질된 당은 당의 공간적 배치, 전기적 특성 또는 일부 기타 물리화학적 특성을 모방한다.
본원에 사용된 용어 "핵산" 및 "폴리뉴클레오티드" 는 리보뉴클레오티드 (RNA) 또는 데옥시리보뉴클레오티드 (DNA) 인 임의의 길이의 뉴클레오티드의 중합체 형태를 지칭한다. 상기 용어는 분자의 1 차 구조를 지칭하며, 따라서 이중- 및 단일-가닥 DNA, 및 이중- 및 단일-가닥 RNA 를 포함한다. 상기 용어는, 등가물로서, 비제한적으로, 메틸화 및/또는 캡핑된 폴리뉴클레오티드와 같은 개질된 폴리뉴클레오티드 및 뉴클레오티드 유사체로 만들어진 RNA 또는 DNA 의 유사체를 포함한다. 상기 용어는 폴리- 또는 올리고-리보뉴클레오티드 (RNA) 및 폴리- 또는 올리고-데옥시리보뉴클레오티드 (DNA); 핵염기 및/또는 개질된 핵염기의 N-글리코시드 또는 C-글리코시드로부터 유도된 RNA 또는 DNA; 당 및/또는 개질된 당으로부터 유도된 핵산; 및 포스페이트 브릿지 및/또는 개질된 인-원자 브릿지로부터 유도된 핵산을 포함한다. 상기 용어는 핵염기, 개질된 핵염기, 당, 개질된 당, 포스페이트 브릿지 또는 개질된 인 원자 브릿지의 임의의 조합을 포함하는 핵산을 포함한다. 그 예는 비제한적으로, 리보오스 부분을 포함하는 핵산, 데옥시리보오스 부분을 포함하는 핵산, 리보오스 및 데옥시리보오스 부분 모두를 포함하는 핵산, 리보오스 및 개질된 리보오스 부분을 포함하는 핵산을 포함한다. 접두어 폴리- 는 약 1 내지 약 10,000 개의 뉴클레오티드 단량체를 포함하는 핵산을 지칭하고, 접두어 올리고- 는 약 1 내지 약 200 개의 뉴클레오티드 단량체 유닛을 포함하는 핵산을 지칭한다.
용어 "핵염기" 는 하나의 핵산 가닥을 또 다른 상보적 핵산 가닥에 서열 특이적 방식으로 결합시키는 수소-결합을 수반하는 핵산의 일부분을 지칭한다. 가장 흔한 자연-발생적 핵염기는 아데닌 (A), 구아닌 (G), 우라실 (U), 시토신 (C) 및 티민 (T) 이다.
용어 "개질된 핵염기" 는 핵염기를 대체할 수 있는 부분을 지칭한다. 개질된 핵염기는 해당 핵염기의 공간적 배치, 전기적 특성 또는 일부 기타 물리화학적 특성을 모방하고, 하나의 핵산 가닥을 또 다른 상보적 핵산 가닥에 서열 특이적 방식으로 결합시키는 수소-결합의 특성을 보유한다. 개질된 핵염기는 용융 거동, 세포내 효소에 의한 인식 또는 올리고뉴클레오티드 이중 구조 (duplex) 의 활성에 실질적으로 영향을 주지 않고, 다섯 가지 자연 발생적 염기 (우라실, 티민, 아데닌, 시토신 또는 구아닌) 전부와 짝을 이룰 수 있다.
용어 "키랄 시약" 은 키랄이거나 또는 거울상이성질적으로 순수하고, 핵산 합성에서 비대칭 유도에 사용될 수 있는 화합물을 지칭한다.
용어 "키랄 리간드" 또는 "키랄 보조물" 은 키랄이거나 또는 거울상이성질적으로 순수하고, 반응의 입체화학 결과를 제어하는 부분을 지칭한다.
축합 반응에서, 용어 "축합 시약" 은 덜 반응성인 부위를 활성화시키고, 이를 친핵체에 의해 보다 공격받기 쉽게 만드는 시약을 지칭한다.
용어 "차단기" 는 관능기의 반응성을 일시적으로 차단하는 기를 지칭한다. 관능기는 차단기의 제거에 의해 후속하여 탈차단될 수 있다.
용어 "부분" 은 분자의 특정 분절 또는 관능기를 지칭한다. 화학물 부분은 종종 분자에 내입되어 있거나 그에 첨부되는 화학적 본체로 인식된다.
용어 "고체 지지체" 는 핵산의 합성적 대량 생산을 가능하게 하고, 필요에 따라 재사용할 수 있는 임의의 지지체를 지칭한다. 본원에 사용된 바와 같이, 상기 용어는 핵산 합성을 위해 수행되는 반응 단계에 이용되는 매질에 불용성이며 반응성 기를 포함하도록 유도체화되는 중합체를 지칭한다.
용어 "연결 부분" 은 말단 뉴클레오시드 및 고체 지지체 사이에, 또는 말단 뉴클레오시드 및 또 다른 뉴클레오시드, 뉴클레오티드 또는 핵산 사이에 임의로 위치하는 임의의 부분을 지칭한다.
"DNA 분자" 는 데옥시리보뉴클레오티드 (아데닌, 구아닌, 티민 또는 시토신) 의 그의 단일 가닥 형태의 중합체 형태 또는 이중-가닥 나선을 지칭한다. 상기 용어는 분자의 1 차 및 2 차 구조만을 지칭하며, 임의의 특별한 3 차 형태를 한정하지는 않는다. 따라서, 상기 용어는 그 중에서도 선형 DNA 분자 (예를 들어 제한효소부위 분절), 바이러스, 플라스미드 및 염색체에서 발견되는 이중 가닥 DNA 를 포함한다. 특별한 이중 가닥 DNA 분자의 구조를 논의함에 있어서, 서열은 본원에서 DNA 의 비-전사 가닥 (즉, mRNA 에 대해 상동인 서열을 갖는 가닥) 을 따라 5' 에서 3' 방향으로의 서열로만 주어지는 일반적인 통념에 따라 기재될 수 있다.
본원에 사용된 바와 같이, "안티센스" 핵산 분자는 단백질을 인코딩하는 "센스" 핵산에 상보적인, 예를 들어 이중-가닥 cDNA 분자의 코딩 가닥에 상보적이거나, mRNA 서열에 상보적이거나 또는 유전자의 코딩 가닥에 상보적인 뉴클레오티드 서열을 포함한다. 따라서, 안티센스 핵산 분자는 센스 핵산 분자에 수소 결합할 수 있다.
본원에 사용된 바와 같이, "상보적 DNA" 또는 "cDNA" 는 mRNA 의 역전사에 의해 합성되고, 그로부터 개재 서열 (인트론) 이 제거된 재조합 폴리뉴클레오티드를 포함한다.
신규한
관능화된
핵산 및 핵산
전구약물의
제조를 위한 합성 방법
본원에 기재된 것은, 신규한 관능화된 핵산 및 핵산 전구약물의 합성 방법이다. 일부 구현예에서, 상기 핵산은 키랄 인 부분을 포함한다.
한 구현예는 하기 단계를 포함하는 구조 IIIa 의 포스포로티오트리에스테르의 제조 방법을 제공하며:
i) 구조 Ia 의 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계; 및
ii) 실릴옥시포스포네이트를 구조 IIa 의 티오술포네이트 시약과 반응시켜 구조 IIIa 의 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ia 의 H-포스포네이트는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IIa 의 티오술포네이트 시약은 하기 구조를 갖고:
[식 중,
X 는 알킬, 시클로알킬 또는 헤테로아릴이고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택됨];
구조 IIIa 의 포스포로티오트리에스테르는 하기 구조를 갖는다:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임].
또 다른 구현예는 W 이 O 인 구조 IIIa 의 포스포로티오트리에스테르의 제조 방법을 제공한다.
또 다른 구현예는 R1 이 하기에서 선택되고:
R2 가 하기에서 선택되는:
구조 IIIa 의 포스포로티오트리에스테르 제조 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 하기에서 선택되는, 구조 IIIa 의 포스포로티오트리에스테르의 제조 방법을 제공한다:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법을 제공한다.
또 다른 구현예는 H-포스포네이트가 고체상에 공유결합하는 방법을 제공한다.
한 구현예는 하기 단계를 포함하는, 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공하며:
i) 구조 Ib 의 비-입체무작위 인 결합을 포함하는 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계; 및
ii) 실릴옥시포스포네이트를 구조 IIb 의 티오술포네이트 시약과 반응시켜 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ib 의 비-입체무작위 인 결합을 포함하는 H-포스포네이트는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IIb 의 티오술포네이트 시약은 하기 구조를 갖고:
[식 중,
X 는 알킬, 시클로알킬, 아릴 또는 헤테로아릴이고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택됨];
구조 IIIb 의 비-입체무작위 인 결합을 포함하는 키랄 포스포로티오트리에스테르는 하기 구조를 갖는다:
[식 중,
W 는 독립적으로 O, NH 또는 CH2 에서 선택되고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임].
또 다른 구현예는 W 가 O 인, 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공한다.
또 다른 구현예는 R1 이 하기에서 선택되고:
R2 가 하기에서 선택되는:
구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 하기에서 선택되는, 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르의 제조 방법을 제공한다:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법을 제공한다.
또 다른 구현예는 H-포스포네이트가 고체상에 공유결합하는 방법을 제공한다.
한 구현예는 하기 단계를 포함하는 구조 IIIc 의 포스포로티오트리에스테르의 제조 방법을 제공하며:
i) 구조 Ic 의 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계;
ii) 실릴옥시포스포네이트를 구조 IVc 의 비스(티오술포네이트) 시약과 반응시켜 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르를 제공하는 단계;
iii) 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르를 구조 VIc 의 친핵체와 반응시켜 구조 IIIc 의 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ic 의 H-포스포네이트는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IVc 의 비스(티오술포네이트) 시약은 하기 구조를 갖고:
[식 중,
X 는 알킬렌, 알케닐렌, 아릴렌 또는 헤테로아릴렌이고;
각각의 R6 은 독립적으로 알킬, 시클로알킬, 아릴 또는 헤테로아릴임];
구조 VIc 의 친핵체가 하기 구조를 갖고:
R7-SH
[식 중,
R7 은 알킬, 알케닐, 아릴, 헤테로시클로 아미노알킬 또는 (헤테로시클로)알킬에서 선택됨];
구조 IIIc 의 포스포로티오트리에스테르는 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R 은 R7-S-S-X- 이고;
R7 은 알킬, 알케닐, 아릴, 헤테로시클로 아미노알킬 또는 (헤테로시클로)알킬이고;
X 는 알킬렌, 알케닐렌, 아릴렌 또는 헤테로아릴렌이고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
이때 구조 Ic 의 H-포스포네이트, 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르 및 구조 IIIc 의 포스포로티오트리에스테르의 인 결합은 임의로는 비-입체무작위 인 결합을 포함할 수 있다.
또 다른 구현예는 구조 IIIb 의 포스포로티오트리에스테르가 비-입체무작위 인 결합을 포함하고 구조 Ic 의 H-포스포네이트가 비-입체무작위 인 결합을 포함하며; W 가 독립적으로 O, NH 또는 CH2 에서 선택되는 방법을 제공한다. 또 다른 구현예는 W 가 O 인 방법을 제공한다.
또 다른 구현예는 R6 이 메틸인 방법을 제공한다.
또 다른 구현예는 구조 IVc 의 비스(티오술포네이트) 시약이 하기에서 선택되는 방법을 제공한다:
또 다른 구현예는 구조 VIc 의 친핵체가 하기 구조를 갖는 방법을 제공한다:
또 다른 구현예는 실릴화 시약이 하기에서 선택되는, 구조 IIIc 의 포스포로티오트리에스테르의 제조 방법을 제공한다:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법을 제공한다.
또 다른 구현예는 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법을 제공한다.
또 다른 구현예는 H-포스포네이트가 고체상에 공유결합하는 방법을 제공한다.
개질된
올리고뉴클레오티드
올리고뉴클레오티드는 전구약물 계획 적용을 통해 향상될 수 있는 여러 약학적 특성을 갖는다. 특히, 올리고뉴클레오티드는 뉴클레아제에 의해 빠르게 분해되며 세포질 세포 멤브레인을 통한 불량한 세포 흡수를 나타낸다 (Poijarvi-Virta et al., Curr. Med. Chem. (2006), 13(28); 3441-65; Wagner et al., Med. Res. Rev. (2000), 20(6):417-51; Peyrottes et al., Mini Rev. Med. Chem. (2004), 4(4):395-408; Gosselin et al., (1996), 43(1):196-208; Bologna et al., (2002), Antisense & Nucleic Acid Drug Development 12:33-41). 한 예에서, Vives 등 (Nucleic Acids Research (1999), 27(20):4071-76) 은 tert-부틸 SATE 프로-올리고뉴클레오티드가 모체 올리고뉴클레오티드에 비해 현저히 증가한 세포 침투를 나타냈다는 것을 발견하였다. 본원에 기재된 것은 개질된 올리고뉴클레오티드 또는 프로뉴클레오티드의 합성 방법이다.
본 발명의 방법에서 사용하는 반응 조건 및 시약
조건
아키랄 (achiral) H-포스포네이트 부분을 포함하는 분자 및 5'-OH 부분을 포함하는 뉴클레오시드를 반응시켜 축합된 중간체를 형성시키는 단계는 임의의 중간체를 단리하는 일 없이 일어날 수 있다. 일부 구현예에서, 아키랄 H-포스포네이트 부분을 포함하는 분자 및 5'-0H 부분을 포함하는 뉴클레오시드를 반응시켜 축합된 중간체를 형성시키는 단계는 단일-용기 (one-pot) 반응으로 일어난다. 한 구현예에서, 아키랄 H-포스포네이트 부분을 포함하는 분자, 축합제, 키랄 시약 및 자유 친핵성 부분을 포함하는 화합물을 반응 혼합물에 상이한 시점에 첨가한다. 또 다른 구현예에서, 아키랄 H-포스포네이트 부분을 포함하는 분자, 축합제 및 키랄 시약은 동일한 반응기 또는 반응 용기에 존재한다. 또 다른 구현예에서, 아키랄 H-포스포네이트 부분을 포함하는 분자, 축합제, 키랄 시약 및 자유 친핵성 부분을 포함하는 화합물은 동일 반응 또는 동일 용기에 존재한다. 이는 반응이 중간체의 단리 없이 수행되도록 하며, 시간-소모적 단계를 제거하여, 경제적이고 효율적인 합성을 초래한다. 특정 구현예에서, 아키랄 H-포스포네이트, 축합제, 키랄 아미노 알코올, 5'-OH 뉴클레오시드는 반응에서 동일 시점에 존재한다. 추가 구현예에서, 축합을 위한 키랄 중간체의 형성은 제자리에서 형성되고, 축합 반응 전에 단리되지 않는다. 또 다른 구현예에서, 아키랄 H-포스포네이트 부분을 포함하는 분자는, 축합제, 키랄 시약과의, 키랄 중간체와 자유 5'-OH 부분을 포함하는 화합물과의 반응시 사용되는 것과 상이한 반응 용기에서의 반응에 의해 활성화된다.
고체 지지체 상의 합성
일부 구현예에서, 핵산의 합성은 용액에서 수행된다. 다른 구현예에서, 핵산의 합성은 고체상에서 수행된다. 고체 지지체의 반응기는 보호되지 않거나 보호될 수 있다. 올리고뉴클레오티드 합성 동안, 고체 지지체는 여러 합성 사이클에서 다양한 시약으로 처리되어, 개별적인 뉴클레오티드 유닛을 이용한 성장 올리고뉴클레오티드 사슬의 단계적 연장이 달성된다. 고체 지지체와 직접 연결되는 사슬 말단에서의 뉴클레오시드 유닛은 본원에 사용된 바와 같이 "첫 번째 뉴클레오시드" 로 언급한다. 첫 번째 뉴클레오시드는 링커 부분, 즉 고체 지지체의 중합체 및 뉴클레오시드의 둘 모두에 대한 공유 결합을 갖는 디라디칼을 통해 고체 지지체에 결합된다. 링커는 올리고뉴클레오티드 사슬을 조립하기 위해 수행되는 합성 사이클 동안에는 온전하며, 사슬 조립 후 절단되어 지지체로부터 올리고뉴클레오티드를 유리시킨다.
고체상 핵산 합성을 위한 고체 지지체는 예를 들어, 하기 문헌에 기재된 지지체를 포함한다: US 특허 4,659,774, 5,141,813, 4,458,066; Caruthers U.S. 특허 번호 4,415,732, 4,458,066, 4,500,707, 4,668,777, 4,973,679 및 5,132,418; Andrus et al. U.S. 특허 번호 5,047,524, 5,262,530; 및 Koster U.S. 특허 번호 4,725,677 (Re34,069 로 재발행). 일부 구현예에서, 고체상은 유기 중합체 지지체이다. 다른 구현예에서, 고체상은 무기 중합체 지지체이다. 일부 구현예에서, 유기 중합체 지지체는 폴리스티렌, 아미노메틸 폴리스티렌, 폴리에틸렌 글리콜-폴리스티렌 그래프트 공중합체, 폴리아크릴아미드, 폴리메타크릴레이트, 폴리비닐알코올, 고도의 가교된 중합체 (HCP), 또는 기타 합성 중합체, 탄수화물 예컨대 셀룰로오스 및 전분 또는 기타 중합체성 탄수화물, 또는 기타 유기 중합체 및 임의의 공중합체, 복합 재료 또는 상기 무기 또는 유기 재료의 조합이다. 다른 구현예에서, 무기 중합체 지지체는 실리카, 알루미나, 조절 공극 유리 (controlled poreglass) (CPG) 로서, 실리카-겔 지지체인 것, 또는 아미노프로필 CPG 이다. 기타 유용한 고체 지지체는 불소 고체 지지체 (예를 들어 WO/2005/070859 참조), 장쇄 알킬아민 (LCAA) 조절 공극 유리 (CPG) 고체 지지체 (예를 들어 S.P. Adams, K. S. Kavka, E. J. Wykes, S. B. Holder and G. R. Galluppi, J. Am . Chem . Soc, 1983, 105, 661-663; G. R. Gough, M. J. Bruden and P. T. Gilham, Tetrahedron Lett ., 1981, 22, 4177-4180 참조) 를 포함한다. 멤브레인 지지체 및 중합체 멤브레인 (예를 들어 Innovation and Perspectives in Solid Phase Synthesis, Peptides, Proteins and Nucleic Acids, ch 21 pp 157-162, 1994, Ed. Roger Epton 및 U.S. 특허 번호 4,923,901 참조) 이 또한 핵산 합성에 유용하다. 일단 형성되면, 멤브레인은 핵산 합성에 사용하기 위해 화학적으로 관능화될 수 있다. 멤브레인에 대한 관능기의 부착에 추가하여, 멤브레인에 부착된 링커 또는 스페이서기의 사용은 멤브레인과 합성된 사슬 사이의 입체장애적 방해를 최소화하는데 사용될 수 있다.
기타 적합한 고체 지지체는, 예를 들어 PrimerTM 200 지지체, 조절 공극 유리 (CPG), 옥살릴-조절 공극 유리로서 시판되는 유리 (예를 들어, Alul, et al , Nucleic Acids Research, 1991, 19, 1527 참조), TentaGel Support - 아미노폴리에틸렌글리콜 유도체화 지지체 (예를 들어 Wright, et al ., Tetrahedron Lett., 1993, 34, 3373 참조), 및 Poros - 폴리스티렌/디비닐벤젠의 공중합체를 포함하는 고체상 방법론에 사용하기에 적합한 것으로 당업계에 일반적으로 공지되어 있는 것들을 포함한다.
표면 활성화 중합체는 여러 고체 지지체 매질 상 천연 및 개질 핵산 및 단백질의 합성에 있어서의 사용에 대해 입증된 바 있다. 고체 지지체 재료는 다공성에 있어서 적합하게 균일하고, 충분한 아민 함량을 갖고, 통합성을 잃지 않고 임의의 수반하는 조작을 거치기에 충분히 유연한 임의의 중합체일 수 있다. 적합한 선택된 재료의 예는 나일론, 폴리프로필렌, 폴리에스테르, 폴리테트라플루오로에틸렌, 폴리스티렌, 폴리카르보네이트 및 니트로셀룰로오스를 포함한다. 기타 재료는 조사자의 설계에 따라 고체 지지체로서 제공될 수 있다. 일부 설계를 고려하면, 예를 들어 코팅된 금속, 특히 금 또는 백금이 선택될 수 있다 (예를 들어 US 공개 번호 20010055761 참조). 올리고뉴클레오티드 합성의 한 구현예에서, 예를 들어 뉴클레오시드는 히드록실 또는 아미노 잔기로 관능화되는 고체 지지체에 고정되어 있다. 대안적으로, 상기 고체 지지체는 유도체화되어, 산에 불안정한 트리알콕시트리틸기, 예컨대 트리메톡시트리틸기 (TMT) 를 제공한다. 이론에 얽매이지 않고, 트리알콕시트리틸 보호기의 존재로 인해 DNA 합성기에서 통상 사용되는 조건 하에서의 초기 데트리틸화 (detritylation) 가 가능할 것으로 예상된다. 암모니아수가 있는 용액에서 올리고뉴클레오티드 물질의 더 빠른 방출을 위해서는 디글리코에이트 링커가 임의로 지지체에 도입된다.
연결 부분
연결 부분 또는 링커는 임의로는 자유 친핵성 부분을 포함하는 화합물에 고체 지지체를 연결하기 위해 사용된다. 적합한 링커는 공지되어 있는데, 예컨대 고체상 합성 기술에서 초기 뉴클레오시드 분자의 관능기 (예를 들어, 히드록실기) 에 고체 지지체를 연결하기 위해 제공되는 짧은 분자들이 있다. 일부 구현예에서, 연결 부분은 숙시남산 링커, 또는 숙시네이트 링커 (-CO-CH2-CH2-CO-), 또는 옥살릴 링커 (-CO-CO-) 이다. 다른 구현예에서, 연결 부분 및 뉴클레오시드는 에스테르 결합을 통해 함께 결합된다. 다른 구현예에서, 연결 부분 및 뉴클레오시드는 아미드 결합을 통해 함께 결합된다. 추가 구현예에서, 연결 부분은 뉴클레오시드를 또 다른 뉴클레오티드 또는 핵산에 연결한다. 적합한 링커는, 예를 들어 [Oligonucleotides And Analogues A Practical Approach, Ekstein, F. Ed., IRL Press, N. Y., 1991, Chapter 1] 에 개시되어 있다.
링커 부분은 자유 친핵성 부분을 포함하는 화합물을, 또 다른 뉴클레오시드, 뉴클레오티드 또는 핵산에 연결하기 위해 사용된다. 일부 구현예에서, 연결 부분은 포스포디에스테르 연결이다. 다른 구현예에서, 연결 부분은 H-포스포네이트 부분이다. 또 다른 구현예에서, 연결 부분은 X-포스포네이트 부분이다.
합성을 위한 용매
핵산의 합성은 비양성자성 유기 용매에서 수행된다. 일부 구현예에서, 용매는 아세토니트릴, 피리딘 또는 NMP 이다. 일부 구현예에서, 용매는 아세톤, 아세토니트릴, NMP, 에틸 아세테이트, THF, 디옥산, DMF, DMSO, DCM, 클로로포름, 피리딘, 2,6-루티딘, HMPA, HMPT, DMA, 글라임 (glyme), 디글라임, 술폰, 메틸 tert-부틸 에테르 또는 이의 조합이다. 일부 구현예에서, 용매는 극성, 비양성자성 유기 용매이다. 일부 구현예에서, 용매는 무수물이다.
차단기를 제거하기 위한 산성화 조건
차단기를 제거하기 위한 산성화는 브뢴스테드 산 또는 루이스 산에 의해 달성된다. 일부 구현예에서, 산성화는 R1 차단기 제거에 사용된다. 유용한 브뢴스테드 산은 유기 용매 또는 물 (80% 아세트산의 경우) 에서 pKa (수 중 25℃) 값이 -0.6 (트리플루오로아세트산) 내지 4.76 (아세트산) 인, 카르복실산, 알킬술폰산, 아릴술폰산, 인산 및 그의 유도체, 포스폰산 및 그의 유도체, 알킬포스폰산 및 그의 유도체, 아릴포스폰산 및 그의 유도체, 포스핀산, 디알킬포스핀산 및 디아릴포스핀산이다. 산성화 단계에 사용되는 산의 농도 (1 내지 80%) 는 산의 산성도에 따라 좌우된다. 산성 세기에 대한 검토시에는, 강산 조건이 퓨리닐 및 피리미디닐 염기가 리보오스 고리로부터 절단되는 탈퓨린화/탈피리미딘화를 초래할 것임을 고려해야 한다.
일부 구현예에서, 산성화는 유기 용매 중의 루이스 산에 의해 달성된다. 유용한 루이스 산은 ZnX2 (식 중, X 는 Cl, Br, I 또는 CF3SO3 임) 이다.
일부 구현예에서, 산성화는 축합된 중간체에서 퓨린 부분을 제거하지 않고 상기 축합된 중간체를 식 4 의 화합물로 전환시키기에 유효한 양의 브뢴스테드 또는 루이스 산을 첨가하는 것을 포함한다.
산성화 단계에서 유용한 산은 또한 비제한적으로, 유기 용매 중 10% 인산, 유기 용매 중 10% 염산, 유기 용매 중 1% 트리플루오로아세트산, 유기 용매 중 3% 디클로로아세트산 또는 물 중 80% 아세트산을 포함한다. 공정에서 사용하는 임의의 브뢴스테드 또는 루이스 산의 농도는 산의 농도가 당 부분으로부터 핵염기의 절단을 초래하는 농도를 초과하지 않도록 선택된다.
일부 구현예에서, 산성화는 유기 용매 중 1% 트리플루오로아세트산을 첨가하는 것을 포함한다. 일부 구현예에서, 산성화는 유기 용매 중 약 0.1% 내지 약 8% 트리플루오로아세트산을 첨가하는 것을 포함한다. 다른 구현예에서, 산성화는 유기 용매 중 3% 디클로로아세트산을 첨가하는 것을 포함한다. 다른 구현예에서, 산성화는 유기 용매 중 약 0.1% 내지 약 10% 디클로로아세트산을 첨가하는 것을 포함한다. 또 다른 구현예에서, 산성화는 유기 용매 중 3% 트리클로로아세트산을 첨가하는 것을 포함한다. 또 다른 구현예에서, 산성화는 유기 용매 중 약 0.1% 내지 약 10% 트리클로로아세트산을 첨가하는 것을 포함한다. 일부 구현예에서, 산성화는 물 중 80% 아세트산을 첨가하는 것을 포함한다. 일부 구현예에서, 산성화는 물 중 약 50% 내지 약 90%, 또는 약 50% 내지 약 80%, 약 50% 내지 약 70%, 약 50% 내지 약 60%, 약 70% 내지 약 90% 아세트산을 첨가하는 것을 포함한다. 일부 구현예에서, 산성화는 산성 용매에 양이온 스캐빈져를 추가로 첨가하는 것을 포함한다. 특정 구현예에서, 양이온 스캐빈져는 트리에틸실란 또는 트리이소프로필실란일 수 있다. 일부 구현예에서, R1 은 축합된 중간체의 산성화 단계 이전에 탈차단된다. 일부 구현예에서, R1 은 유기 용매 중 1% 트리플루오로아세트산을 첨가하는 것을 포함하는 산성화에 의해 탈차단된다. 일부 구현예에서, R1 은 유기 용매 중 3% 디클로로아세트산을 첨가하는 것을 포함하는 산성화에 의해 탈차단된다. 일부 구현예에서, R1 은 유기 용매 중 3% 트리클로로아세트산을 첨가하는 것을 포함하는 산성화에 의해 탈차단된다.
차단 부분 또는 기의 제거
핵염기 또는 당 부분에 위치한 히드록실 또는 아미노 부분과 같은 관능기는 일상적으로 차단 (보호) 기 (부분) 로 합성 동안 차단되고, 후속하여 탈차단된다. 일반적으로, 차단기는 분자의 화학적 관능성이 특이적 반응 조건에 대해 불활성이 되도록 하며, 이후에 분자의 나머지 부분에 실질적으로 손상을 주지 않으면서 분자 내 이러한 관능성으로부터 제거될 수 있다 (예를 들어, Green and Wuts, Protective Groups in Organic Synthesis, 2nd Ed., John Wiley & Sons, New York, 1991 참조). 예를 들어, 아미노기는 질소 차단기 예컨대 프탈이미도, 9-플루드레닐메톡시카르보닐 (FMOC), 트리페닐메틸술페닐, t-BOC, 4,4'-디메톡시트리틸 (DMTr), 4-메톡시트리틸 (MMTr), 9-페닐잔틴-9-일 (픽실), 트리틸 (Tr), 또는 9-(p-메톡시페닐)잔틴-9-일 (MOX) 로 차단될 수 있다. 카르복실기는 아세틸기로서 보호될 수 있다. 히드록시기는, 테트라히드로피라닐 (THP), t-부틸디메틸실릴 (TBDMS), 1-[(2-클로로-4-메틸)페닐]-4-메톡시피페리딘-4-일 (Ctmp), 1-(2-플루오로페닐)-4-메톡시피페리딘-4-일 (Fpmp), 1-(2-클로로에톡시)에틸, 3-메톡시-1,5-디카르보메톡시펜탄-3-일 (MDP), 비스(2-아세톡시에톡시)메틸 (ACE), 트리이소프로필실릴옥시메틸 (TOM), 1-(2-시아노에톡시)에틸 (CEE), 2-시아노에톡시메틸 (CEM), [4-(N-디클로로아세틸-N-메틸아미노)벤질옥시]메틸, 2-시아노에틸 (CN), 피발로일옥시메틸 (PivOM), 레부닐옥시메틸 (ALE) 과 같이 보호될 수 있다. 기타 대표적인 히드록실 차단기는 기재된 바 있다 (예를 들어 Beaucage et al , Tetrahedron, 1992, 46, 2223 참조). 일부 구현예에서, 히드록실 차단기는 산에 불안정한 기, 예컨대 트리틸, 모노메톡시트리틸, 디메톡시트리틸, 트리메톡시트리틸, 9-페닐잔틴-9-일 (픽실) 및 9-(p-메톡시페닐)잔틴-9-일 (MOX) 이다. 화학 관능기는 또한 이들을 전구체 형태에 포함시킴으로써 차단될 수 있다. 따라서, 아지도기가 아민으로 용이하게 전환되므로, 아지도기가 아민의 차단된 형태로 간주될 수 있다. 핵산 합성에 이용되는 추가적인 대표적 보호기는 공지되어 있다 (예를 들어, Agrawal et al., Protocols for Oligonucleotide Conjugates, Eds., Humana Press, New Jersey, 1994, vol. 26, pp. 1-72 참조).
핵산으로부터 차단기를 제거하기 위한 다양한 방법이 공지되어 있으며 사용된다. 일부 구현예에서, 모든 차단기가 제거된다. 다른 구현예에서, 차단기는 부분적으로 제거된다. 또 다른 구현예에서, 반응 조건은 특정 부분 상의 차단기를 제거하도록 조정될 수 있다. R2 가 차단기인 특정 구현예에서, R2 에서의 차단기의 제거는 R1 에서의 차단기의 제거에 대해 직교성이다. R1 및 R2 에서의 차단기는 합성 단계 동안에는 온전하며, 사슬 조립 후 총괄적으로 제거된다. 일부 구현예에서, R2 차단기는 고체 지지체로부터의 핵산의 절단 및 핵염기 차단기의 제거와 동시에 제거된다. 특정 구현예에서, R1 에서의 차단기가 제거되는 한편, R2 에서의 차단기 및 핵염기는 온전하게 남아 있다. R1 에서의 차단기는 1 차 아민, 2 차 아민 또는 이의 혼합물과 같은 유기 염기를 이용해 고체 지지체 상에서 절단가능하다. R1 위치의 탈보호는 통상 전면 말단 탈보호 (front end deprotection) 로서 지칭된다.
한 구현예에서, 핵염기 차단기가, 존재한다면, 산성 시약을 이용해 각 핵산의 조립 후 절단가능하다. 또 다른 구현예에서, 하나 이상의 핵염기 차단기는 산성 조건도 염기성 조건도 아닌 조건 하에 절단가능한데, 예를 들어 플루오라이드 염 또는 염산 착물을 이용해 절단가능하다. 또 다른 구현예에서, 하나 이상의 핵염기 차단기는 염기 또는 염기성 용매의 존재 하에 각 핵산의 조립 후 절단가능하며, 여기서 핵염기 차단기는 아민을 이용한 전면 말단 탈보호의 조건에 대해 안정하다.
일부 구현예에서, 핵염기에 대한 차단기는 필요하지 않다. 다른 구현예에서, 핵염기에 대한 차단기가 필요하다. 또 다른 구현예에서, 특정 핵염기는 차단기를 필요로 하는 한편, 다른 핵염기는 차단기를 필요로 하지 않는다. 핵염기가 차단된 구현예에서, 차단기는 전면 말단에서 차단기를 제거하기에 적절한 조건 하에 완전히 또는 부분적으로 제거된다. 예를 들어, R1 은 ORa 를 나타낼 수 있고 (이때 Ra 는 아실임), Ba 는 이소부티릴, 아세틸 또는 4-(tert-부틸페녹시)아세틸을 비제한적으로 포함하는 아실기로 차단된 구아닌을 나타낸다. R1 및 Ba 에서의 아실기는 동일한 탈차단 단계 동안 제거되거나 부분적으로 제거된다.
올리고뉴클레오시드
포스포로티오에이트
연결의 입체화학
올리고뉴클레오시드 포스포로티오에이트는 치료 가능성을 나타낸 바 있다 (Stein et al ., Science (1993), 261:1004-12; Agrawal et al ., Antisence Res. and Dev. (1992), 2:261-66; Bayever et al ., Antisense Res. and Dev. (1993), 3:383-390). 포스포로티오에이트의 입체화학과 무관하게 제조된 올리고뉴클레오시드 포스포로티오에이트는 2n 개 부분입체이성질체의 혼합물로서 존재하는데, 여기서 n 은 뉴클레오티드간 포스포로티오에이트 연결의 개수이다. 이들 부분입체이성질체 포스포로티오에이트의 화학적 및 생물학적 특성은 차이가 있을 수 있다. 예를 들어, 문헌 [Wada et al (Nucleic Acids Symposium Series No. 51 p. 119-120; doi:10.1093/nass/nrm060)] 에서는 입체구조 규정된-(Rp)-(Ups)9U/(Ap)9A 이중구조물이 천연-(Up)9U/(Ap)9A 의 경우보다 더 높은 Tm 값을 나타내고, 입체구조 규정된-(Sp)-(Ups)9U 는 이중구조를 형성하지 않는다는 것이 발견된 바 있다. 또 다른 예에서, 문헌 [Tang et al ., (Nucleosides Nucleotides (1995), 14:985-990)] 에서의 연구는 입체구조적으로 순수한 Rp-올리고데옥시리보뉴클레오시드 포스포로티오에이트가, 규정되지 않은 인 키랄성을 갖는 모체 올리고데옥시리보뉴클레오시드 포스포로티오에이트에 비해 인간 혈청에 내재하는 뉴클레아제에 대해 더 낮은 안정성을 갖는다는 것을 발견하였다.
핵염기
및
개질된
핵염기
본원에 기재된 방법 및 화합물에서 이용한 핵염기 Ba 는 천연 핵염기 또는 천연 핵염기로부터 유도된 개질된 핵염기이다. 그 예는 비제한적으로, 그의 각 아미노기가 아실 보호기에 의해 보호되는 우라실, 티민, 아데닌, 시토신 및 구아닌, 2-플루오로우라실, 2-플루오로시토신, 5-브로모우라실, 5-요오도우라실, 2,6-디아미노퓨린, 아자시토신, 피리미딘 유사체 예컨대 슈도이소시토신 및 슈도우라실 및 기타 개질된 핵염기 예컨대 8-치환 퓨린, 잔틴, 또는 하이포잔틴 (잔틴, 또는 하이포잔틴은 천연 분해 산물임) 을 포함한다. [Chiu and Rana, RNA, 2003, 9, 1034-1048, Limbach et al . Nucleic Acids Research, 1994, 22, 2183-2196 및 Revankar and Rao, Comprehensive Natural Products Chemistry, vol. 7, 313] 에서 개시된 개질된 핵염기가 또한 본원에 기재된 방법 및 화합물의 Ba 부분으로서 고려된다.
하기 일반식으로 나타내는 화합물이 또한 개질된 핵염기로서 고려된다:
상기 식에서, R8 은, 단지 예로써 메틸, 이소프로필, 페닐, 벤질 또는 페녹시메틸기를 포함하는, 탄소수가 1 내지 15 인 선형 또는 분지형 알킬, 아릴, 아르알킬 또는 아릴옥실알킬기이고; 각각의 R9 및 R10 은 탄소수가 1 내지 4 인 선형 또는 분지형 알킬기를 나타낸다.
개질된 핵염기는 또한 하나 이상의 벤젠 고리가 추가되어 있는 확장된 크기의 핵염기를 포함한다. [Glen Research catalog (www.glenresearch.com); Krueger AT et al, Acc . Chem . Res ., 2007, 40, 141-150; Kool, ET, Acc . Chem . Res., 2002, 35, 936-943; Benner S.A., et al., Nat . Rev . Genet ., 2005, 6, 553-543; Romesberg, F.E., et al ., Curr . Opin . Chem . Biol ., 2003, 7, 723-733; Hirao, I., Curr . Opin . Chem . Biol ., 2006, 10, 622-627] 에 기재된 핵 염기 대체물이 본원에 기재된 핵산의 합성에 유용한 것으로서 고려된다. 이들 확장된 크기의 핵염기의 일부예를 하기에 나타낸다:
본원에서, 개질된 핵염기는 또한, 핵염기로는 간주되지는 않으나, 비제한적으로, 코린- 또는 포르피린-유도성 고리와 같은 기타 부분인 구조를 포함한다. 포르피린-유도성 염기 대체물이 [Morales-Rojas, H and Kool, ET, Org . Lett ., 2002, 4, 4377-4380] 에서 기재된 바 있다. 염기 대체물로서 사용할 수 있는 포르피린-유도성 고리의 예를 하기에 나타낸다:
기타 개질된 핵염기는 또한 하기에 나타낸 것들과 같은 염기 대체물을 포함한다:
형광성인 개질된 핵염기가 또한 고려된다. 이들 염기 대체물의 비제한적 예는 하기 나타낸 바와 같은 페난트렌, 피렌, 스틸벤, 이소잔틴, 이소잔토프테린, 터페닐, 터티오펜, 벤조터티오펜, 쿠마린, 루마진, 테터드 (tethered) 스틸벤, 벤조-우라실 및 나프토-우라실을 포함한다:
개질된 핵염기는 비치환되거나 헤테로원자, 알킬기, 또는 형광 부분에 이어진 연결 부분, 비오틴 또는 아비딘 부분, 또는 기타 단백질 또는 펩티드와 같은 추가 치환을 포함할 수 있다. 개질된 핵염기는 또한 대부분의 전통적 견해에서는 핵염기는 아니지만, 핵염기와 유사하게 기능하는 특정한 "만능 염기 (universal base)" 를 포함한다. 이러한 만능 염기의 한 대표적인 예는 3-니트로피롤이다.
기타 뉴클레오시드가 또한 본원에 개시된 방법에서 사용될 수 있으며, 개질된 핵염기, 또는 개질된 당에 공유결합한 핵염기를 혼입하는 뉴클레오시드를 포함한다. 개질된 핵염기를 혼입하는 뉴클레오시드의 일부 예는 4-아세틸시티딘; 5-(카르복시히드록실메틸)우리딘; 2'-O-메틸시티딘; 5-카르복시메틸아미노메틸-2-티오우리딘; 5-카르복시메틸아미노메틸우리딘; 디히드로우리딘; 2'-O-메틸슈도우리딘; 베타,D-갈락토실큐에오신; 2'-O-메틸구아노신; N 6-이소펜테닐아데노신; 1-메틸아데노신; 1-메틸슈도우리딘; 1-메틸구아노신; l-메틸이노신; 2,2-디메틸구아노신; 2-메틸아데노신; 2-메틸구아노신; N 7-메틸구아노신; 3-메틸-시티딘; 5-메틸시티딘; N 6-메틸아데노신; 7-메틸구아노신; 5-메틸아미노에틸우리딘; 5-메톡시아미노메틸-2-티오우리딘; 베타,D-만노실큐에오신; 5-메톡시카르보닐메틸우리딘; 5-메톡시우리딘; 2-메틸티오-N 6-이소펜테닐아데노신; N-((9-베타,D-리보푸라노실-2-메틸티오퓨린-6-일)카르바모일)트레오닌; N-((9-베타,D-리보푸라노실퓨린-6-일)-N-메틸카르바모일)트레오닌; 우리딘-5-옥시아세트산 메틸에스테르; 우리딘-5-옥시아세트산 (v); 슈도우리딘; 큐에오신 (queosine); 2-티오시티딘; 5-메틸-2-티오우리딘; 2-티오우리딘; 4-티오우리딘; 5-메틸우리딘; 2'-O-메틸-5-메틸우리딘; 및 2'-O-메틸우리딘을 포함한다.
일부 구현예에서, 뉴클레오시드는 6'-위치에서 (R) 또는 (S)-키랄성을 갖는 6'-개질된 바이시클릭 뉴클레오시드 유사체를 포함하고, US 특허 번호 7,399,845 에 기재된 유사체를 포함한다. 다른 구현예에서, 뉴클레오시드는 5'-위치에서 (R) 또는 (S)-키랄성을 갖는 5'-개질된 바이시클릭 뉴클레오시드 유사체를 포함하고, US 특허 공개 번호 20070287831 에 기재된 유사체를 포함한다.
일부 구현예에서, 핵염기 또는 개질된 핵염기는 항체, 항체 분절, 비오틴, 아비딘, 스트렙타비딘, 수용체 리간드 또는 킬레이트화 부분과 같은 생물분자 결합 부분을 포함한다. 다른 구현예에서, Ba 는 5-브로모우라실, 5-요오도우라실 또는 2,6-디아미노퓨린이다. 또 다른 구현예에서, Ba 는 형광 또는 생물분자 결합 부분으로의 치환에 의해 개질된다. 일부 구현예에서, Ba 상의 치환기는 형광 부분이다. 다른 구현예에서, Ba 상의 치환기는 비오틴 또는 아비딘이다.
뉴클레오티드/뉴클레오시드의
개질된
당
가장 흔한 자연 발생적 뉴클레오티드는 핵염기 아데노신 (A), 시토신 (C), 구아닌 (G) 및 티민 (T) 또는 우라실 (U) 에 연결된 리보오스 당이다. 뉴클레오티드 내의 포스페이트기 또는 개질된 인 원자 부분이 당 또는 개질된 당의 다양한 위치에 연결될 수 있는 개질된 뉴클레오티드가 또한 고려된다. 비제한적 예로서, 포스페이트기 또는 개질된 인-원자 부분이 당 또는 개질된 당의 2', 3', 4' 또는 5' 히드록실 부분에 연결될 수 있다. 본원에 기재된 개질된 핵염기를 혼입하는 뉴클레오티드가 또한 본원에 개시된 공정에서 사용될 수 있다. 일부 구현예에서, 비보호 -OH 부분을 포함하는 뉴클레오티드 또는 개질된 뉴클레오티드가 본원에 개시된 공정에서 사용된다.
모식도 1-4b 에 기재된 리보오스 부분에 추가하여, 기타 개질된 당이 또한 본원에 개시된 핵산에 혼입될 수 있다. 일부 구현예에서, 개질된 당은 2' 위치에서 하기의 것들 중 하나를 포함하는 하나 이상의 치환기를 포함한다: F; CF3, CN, N3, NO, NO2, O-, S-, 또는 N-알킬; O-, S-, 또는 N-알케닐; O-, S- 또는 N-알키닐; 또는 O-알킬-0-알킬, O-알킬-N-알킬 또는 N-알킬-O-알킬 (이때 알킬, 알케닐 및 알키닐은 치환 또는 비치환된 C1-C10 알킬 또는 C2-C10 알케닐 및 알키닐일 수 있음). 치환기의 예는 비제한적으로, O(CH2)nOCH3 및 O(CH2)nNH2 (식 중, n 은 1 내지 약 10 임), MOE, DMAOE, DMAEOE 를 포함한다. 본원에서는 또한 WO 2001/088198; 및 Martin et al ., Helv . Chim . Acta, 1995, 78, 486-504 에서 기재된 개질된 당이 고려된다. 일부 구현예에서, 개질된 당은 치환된 실릴기, RNA 절단기, 리포터기, 형광 표지, 인터칼레이터 (intercalator), 핵산의 약동학적 특성을 향상시키기 위한 기, 또는 핵산의 약력학적 특성을 향상시키기 위한 기, 및 유사한 특성을 갖는 기타 치환기를 포함한다. 개질은 3'-말단 뉴클레오티드 상의 당의 3' 위치 또는 5'-말단 뉴클레오티드의 5' 위치를 포함하는, 당 또는 개질된 당의 2', 3', 4', 5' 또는 6' 위치에서 이루어질 수 있다.
개질된 당은 또한 펜토푸라노실 당 대신에 시클로부틸 또는 시클로펜틸 부분과 같은 당 모방체를 포함한다. 이러한 개질된 당 구조의 제조를 교시하는 대표적인 미국 특허는 비제한적으로, US 특허 번호: 4,981,957; 5,118,800; 5,319,080; 및 5,359,044 를 포함한다. 고려되는 일부 개질된 당은 하기를 포함한다:
개질된 당의 기타 비제한적 예는 글리세롤을 포함하는데, 이는 글리세롤 핵산 (GNA) 유사체를 형성한다. GNA 유사체의 한 예를 하기에 나타내며, 이는 [Zhang, R et al ., J. Am . Chem . Soc ., 2008, 130, 5846-5847; Zhang L, et al ., J. Am . Chem . Soc ., 2005, 127, 4174-4175 및 Tsai CH et al ., PNAS, 2007, 14598-14603] 에서 기재되어 있다:
상기 식 중에서, X 는 본원에서 정의한 바와 같다. GNA 유도성 유사체의 또 다른 예, 포르밀 글리세롤의 혼합된 아세탈 아미날 기재의 유연성 핵산 (FNA) 은 [Joyce GF et al ., PNAS, 1987, 84, 4398-4402 및 Heuberger BD and Switzer C, J. Am . Chem . Soc ., 2008, 130, 412-413] 에서 기재되며, 이를 하기에 나타낸다:
개질된 당의 기타 비제한적 예는 헥소피라노실 (6' 내지 4'), 펜토피라노실 (4' 내지 2'), 펜토피라노실 (4' 내지 3') 또는 테트로푸라노실 (3' 내지 2') 당을 포함한다.
고려되는 헥소피라노실 (6' 내지 4') 당은 하기를 포함한다:
고려되는 펜토피라노실 (4' 내지 2') 당은 하기를 포함한다:
고려되는 펜토피라노실 (4' 내지 3') 당은 하기를 포함한다:
고려되는 테트로푸라노실 (3' 내지 2') 당은 하기를 포함한다:
고려되는 기타 개질된 당은 하기를 포함한다:
추가 고려되는 것은 X 가 S, Se, CH2, N-Me, N-Et 또는 N-iPr 에서 선택되는, 하기에서 설명한 당 모방체이다.
개질된 당 및 당 모방체는 하기 문헌을 비제한적으로 포함하는 당업계에 공지된 방법에 의해 제조될 수 있다: A. Eschenmoser, Science (1999), 284:2118; M. Bohringer et al , Helv. Chim. Acta (1992), 75:1416-1477; M. Egli et al, J. Am. Chem. Soc. (2006), 128(33):10847-56; A. Eschenmoser in Chemical Synthesis: Gnosis to Prognosis , C. Chatgilialoglu and V. Sniekus, Ed., (Kluwer Academic, Netherlands, 1996), p.293; K.-U. Schoning et al , Science (2000), 290:1347-1351; A. Eschenmoser et al , Helv. Chim. Acta (1992), 75:218; J. Hunziker et al , Helv. Chim. Acta (1993), 76:259; G. Otting et al , Helv. Chim. Acta (1993), 76:2701; K. Groebke et al , Helv. Chim. Acta (1998), 81:375; 및 A. Eschenmoser, Science (1999), 284:2118.
차단기
기재된 반응에서, 특정 구현예에서는 반응에서 원치않는 해당 기들의 참여가 방지되도록 반응성 관능기, 예를 들어 히드록시, 아미노, 티올 또는 카르복시기 (이들은 최종 생성물에서 바람직함) 를 보호하는 것이 필요하다. 보호기는 일부 또는 모든 반응성 부분을 차단하고, 보호기가 제거될 때까지 상기 기들이 화학 반응에 참여하는 것을 방지하는데 사용된다. 한 구현예에서, 각각의 보호기는 상이한 수단에 의해 제거가능하다. 완전히 이질적인 반응 조건 하에서 절단되는 보호기는 차별적 제거의 필요조건을 충족시킨다. 일부 구현예에서, 보호기는 산, 염기 및/또는 가수소분해에 의해 제거된다. 트리틸, 디메톡시트리틸, 아세탈 및 t-부틸디메틸실릴과 같은 기는 산에 불안정하고, 특정 구현예에서는 가수소분해에 의해 제거가능한 Cbz 기 및/또는 염기에 불안정한 Fmoc 기로 보호된 아미노기의 존재 하에 카르복시 및 히드록시 반응성 부분을 보호하는데 사용된다. 다른 구현예에서, 카르복실산 및 히드록시 반응성 부분은, t-부틸카르바메이트와 같은 산에 불안정한 기 또는 산 및 염기 모두에 대해 안정하나 가수분해로 제거가능한 카르바메이트로 차단된 아민의 존재 하에 비제한적으로 메틸, 에틸 및 아세틸과 같은 염기에 불안정한 기로 차단된다.
또 다른 구현예에서, 히드록시 반응성 부분은 가수분해로 제거가능한 보호기 예컨대 벤질기로 차단되는 한편, 산과 수소 결합할 수 있는 아민기는 Fmoc 과 같은 염기에 불안정한 기로 차단된다. 또 다른 구현예에서, 카르복실산 반응성 부분은 단순한 에스테르 화합물로의 전환에 의해 보호되거나, 또 다른 구현예에서 이들은 산화로 제거가능한 보호기 예컨대 2,4-디메톡시벤질로 차단되는 한편, 공존하는 아미노기는 불소에 불안정한 실릴 또는 카르바메이트 차단기로 차단된다.
알릴 차단기는, 안정하고, 후속적으로 금속 또는 파이-산 (pi-acid) 촉매에 의해 제거될 수 있기 때문에 산- 및 염기-보호기의 존재 하에 유용하다. 예를 들어, 알릴-차단된 히드록시기는 산에 불안정한 t-부틸카르바메이트 또는 염기에 불안정한 아세테이트 아민 보호기의 존재 하에 Pd(O)-촉매화 반응을 이용해 탈보호될 수 있다. 보호기의 또 다른 형태는 화합물 또는 중간체가 부착되어 있는 수지이다. 잔기가 수지에 부착되어 있는 한, 관능기는 차단되며 반응할 수 없다. 수지로부터 일단 방출되면, 관능기는 반응할 수 있다.
본원에 기재된 화합물의 합성에 유용한 통상적인 차단/보호기는 단지 예로써 하기의 것이다:
합성 동안 뉴클레오티드를 보호하기에 유용한 대표적인 보호기는, 염기에 불안정한 보호기 및 산에 불안정한 보호기를 포함한다. 염기에 불안정한 보호기는 헤테로시클릭 핵염기의 엑소시클릭 아미노기를 보호하는데 사용된다. 이러한 유형의 보호는 일반적으로 아실화에 의해 이루어진다. 이 목적을 위해 통상 사용되는 세 가지 아실화기는 벤조일 클로라이드, 페녹시아세트산 무수물 및 이소부티릴 클로라이드이다. 이들 보호기는 핵산 합성 동안 사용되는 반응 조건에 대해 안정하며, 합성 종료시 염기 처리 동안에는 대략적으로 동등한 속도로 절단된다.
일부 구현예에서, 5'-보호기는 트리틸, 모노메톡시 트리틸, 디메톡시트리틸, 트리메톡시트리틸, 2-클로로트리틸, DATE, TBTr, 9-페닐잔틴-9-일 (픽실) 또는 9-(p-메톡시페닐)잔틴-9-일 (MOX) 이다.
일부 구현예에서, 티올 부분은 본원에 기재된 화합물 내에 혼입되며 보호된다. 일부 구현예에서, 보호기는 비제한적으로, 픽실, 트리틸, 벤질, p-메톡시벤질 (PMB) 또는 tert-부틸 (t-Bu) 을 포함한다.
보호기의 생성 및 그의 제거에 대해 적용가능한 기술의 상세한 설명에 추가로, 기타 보호기가 [Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999, 및 Kocienski, Protective Groups, Thieme Verlag, New York, NY, 1994] (이러한 개시물에 대해 본원에 참조로 포함됨) 에 기재되어 있다.
하기에 제공되는 실시예는 본 발명의 화합물 및 이러한 화합물의 제조 방법을 추가로 설명하고 예시한다. 본 발명의 범주는 하기 실시예 및 제조예의 범주에 의해 어떤 방식으로도 제한되지 않는다는 것이 이해될 것이다.
실시예
실시예
1 -
메탄티오술포네이트
시약의 합성
모식도 1
화합물 2: DCM (50 mL) 중 (Z)-부트-2-엔-1,4-디올 (0.93 ml, 11.3 mmol) 및 트리에틸아민 (3.3 ml, 24 mmol) 의 용액을 DCM (50 mL) 중 메탄술포닐 클로라이드 (1.9 ml, 24 mmol) 의 교반 빙냉 용액에 적가하였다. 실온에서 0.5 시간 동안 교반한 후, 혼합물을 얼음에 붓고 추출하였다. 유기층을 수집하고, 건조시키고 (MgSO4), 여과하고 2.66 g, 96% 의 화합물 2 로 환원시켜, 이를 NMR 에 의해 반응의 다음 단계에서 직접 사용하기 위해 충분히 순수한지를 판단하였다.
화합물 3: MeOH (20 ml) 중 나트륨 메탄술포노티오에이트 (1.51 g, 11.3 mmol) 를 순수 (neat) (Z)-부트-2-엔-1,4-디일 디메탄술포네이트 (1.25 g, 5.12 mmol) 로 실온에서 처리하였다. 5 분 후, 침전 발생이 관찰되었다. 36 시간 후, 혼합물을 물과 DCM 사이에서 구분시켰다. 유기층을 분리하고, 건조시키고 (MgSO4), 여과하고 환원시켜 무색 오일을 수득하였다. 컬럼 크로마토그래피 (ISCO) 로, 흐릿한 무색 오일로서 순수 생성물을 수득하였다. 컬럼 크로마토그래피로, 순수 화합물 3 (0.89 g, 63%) 을 무색 오일로서 수득하였다.
화합물 4: 아르곤 분위기 하에, 모르폴린 (10 g, 115 mmol) 을 둥근 바닥 플라스크 내에서 에틸렌 술피드 (15 g, 250 mmol) 에 첨가하였다. 반응물을 7 시간 동안 교반하고, 실리카 겔 컬럼에 직접 적재하였다. 상기 컬럼을 DCM 으로 먼저 세척한 후 2% MeOH/DCM 을 사용하여, 화합물 4 (15.3 g, 91%) 를 무색 오일로서 수득하였다.
화합물 5: 2-모르폴리노에탄티올 (0.21 g, 1.44 mmol) 의 DCM 용액 (1 mL) 을 DCM (10 mL) 중 화합물 3 (0.40 g, 1.44 mmol) 의 교반 용액에 실온에서 실린지를 통해 적가하였다. 첨가 직후, TLC 를 확인하여 생성물의 신속한 형성 및 일부 수량의 이량체를 밝혀내었다. 0.5 시간 후, 물을 첨가하여 혼합물을 구분시켰다. 추출시, 오렌지색 층을 분리한 후 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피로, 화합물 5 (0.29 g, 58%) 를 무색 오일로서 수득하였다.
화합물 5b: 화합물 4b (395 mg, 1.085 mmol) 의 DCM 용액 (1 mL) 을 화합물 3 (300 mg, 1.085 mmol) 의 교반 DCM (15 mL) 용액에 실온에서 실린지를 통해 적가하였다. 1 시간 후, 생성된 용액을 물을 첨가하여 구분시켰다. 추출시, 유기층을 분리한 후 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피로, 화합물 5b 를 무색 오일 (0.35 g, 58%) 로서 수득하였다.
화합물 6: DCM (50 ml) 중 (Z)-부트-2-엔-1,4-디올 (0.93 ml, 11.3 mmol) 및 트리에틸아민 (1.6 mL, 11.5 mmol) 의 빙냉 용액을 피발로일 클로라이드 (1.4 ml, 11.4 mmol) 로 2 분에 걸쳐 실린지를 통해 적상 처리하였다. 1 시간 후, TLC 는 양호한 반응을 나타내었다.
생성된 혼합물을 물을 첨가하여 구분시켰다. 추출시, 유기층을 분리한 후 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 이러한 미가공 화합물은 TLC (Rf = 0.6, 1:1 EtOAc/헥산) 에 의해 출발 디올을 함유하지 않는 것으로 발견되었고, 미가공물을 사용하여 메실레이트를 제조하였다. 상기 미가공 물질을 트리에틸아민 (1.7 mL, 12 mmol) 을 함유하는 DCM (50 ml) 중에서 취하고, 빙조에서 냉각하였다. 메탄술포닐 클로라이드 (0.98 ml, 12.66 mmol) 를 2 분에 걸쳐 실린지를 통해 적가하였다. 첨가 직후 TLC 는 출발 물질의 완전한 소비를 나타내었다. 생성된 혼합물을 물을 첨가하여 구분시켰다. 추출시, 유기층을 분리한 후 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피로, 순수 화합물 6, 1.48 g, 52% 를 무색 오일로서 수득하였다.
화합물 7: 나트륨 메탄술포노티오에이트 (0.63 g, 4.70 mmol) 및 (Z)-4-(메틸술포닐옥시)부트-2-에닐 피발레이트 (1.00 g, 4.00 mmol) 의 MeOH (10 ml) 용액을 실온에서 18 시간 동안 교반하여, 백색 침전물이 형성되었다 (10 분 후). 생성된 혼합물을 물 및 DCM 을 첨가하여 구분시켰다. DCM 에 추출시, 유기층을 분리한 후 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피로, 화합물 7, 0.83 g, 78% 를 무색 오일로서 수득하였다.
화합물 9: 피발로일 클로라이드 (0.60 g, 5.0 mmol) 를 DCM (20 ml) 중 S-2-히드록시에틸 메탄술포노티오에이트 (0.65 g, 4.16 mmol) 의 교반 용액에 적가하였다. 실온에서 2 시간 후, 백색 침전물과 함께 생성된 혼합물을 물로 구분시켰다. 유기층을 분리하고, 건조시키고 (Ns2SO4), 여과하고 오일로 환원시켰다. 컬럼으로, 화합물 9 를 무색 오일 (0.45 g, 45%) 로서 수득하였다.
화합물 11: 피발로일 클로라이드 (4.96 ml, 40.3 mmol) 를 2-(히드록시메틸)페놀 (5 g, 40.3 mmol) 및 트리에틸아민 (5.61 ml, 40.3 mmol) 의 빙냉 DCM 용액 (50 mL) 에 실린지를 통해 적가하였다. 미가공 피발레이트 에스테르의 빙냉 용액을 트리에틸아민 (6.74 ml, 48.4 mmol) 및 50 mL DCM 으로 처리하였다. 메탄술포닐 클로라이드 (3.43 ml, 44.3 mmol) 를 이후 실린지를 통해 천천히 첨가하고 (5 분), 생성된 혼합물을 실온으로 가온하였다. 상기 혼합물을 얼음에 붓고, 유기층을 분리한 후 포화 NaHCO3 (수용액) 으로 세척하고, 건조시키고 (MgSO4), 여과하고 10.5 g 미가공 옅은 황색 오일로 환원시켰다.
컬럼 (ISCO) 으로, 순수 11 5.45 g, 47% 를 수득하였다.
화합물 12: 나트륨 메탄술포노티오에이트 (0.825 g, 6.15 mmol) 의 MeOH (20 mL) 용액을 실온에서 2-((메틸술포닐옥시)메틸)페닐 피발레이트 (1.76 g, 6.15 mmol) 로 처리하고, 18 시간 동안 교반되게 두었다. 혼합물을 물과 DCM 사이에서 구분시켰다. 유기층을 분리하고, 건조시키고 (MgSO4), 여과하고 환원시켜 무색 오일을 수득하였다. 컬럼 크로마토그래피로, 순수 화합물 12 를 흐릿한 무색 오일, 0.754 g, 41% 로서 수득하였다.
화합물 14: 클로로메틸 피발레이트 (0.478 ml, 3.32 mmol) 를 아세톤 (7 ml) 중 요오드화나트륨 (0.050 g, 0.33 mmol) 및 나트륨 메탄술포노티오에이트 (0.445 g, 3.32 mmol) 의 교반 혼합물에 실온에서 첨가하였다. 24 시간 후, TLC 는 생성물로의 양호한 전환을 나타내었다. 용매를 제거하고, 잔류물을 물과 DCM 사이에서 구분시켰다. 유기층을 분리하고 건조시키고 (MgSO4), 여과하고 환원시켜 무색 오일을 수득하였다. 컬럼 크로마토그래피로, 순수 14 를 약간 분홍색의 고체, 0.41 g, 55% 로서 수득하였다.
Rf = 0.5 (20% EtOAc/헥산).
화합물 16: 이전에 기재된 바와 같이 15 및 NaMTS 로부터 제조하였다: US 3,484,473
화합물 18: 이전에 기재된 바와 같이 17 및 NaMTS 로부터 제조하였다: Chem. Pharm. Bull. Vol. 12(11) p. 1271, 1964.
화합물 19: 2-모르폴리노에탄티올 (0.17 g, 1.2 mmol) 의 DCM 용액 (1 mL) 을 DCM (10 mL) 중 화합물 18 (300 mg, 1.2 mmol) 의 교반 용액에 실온에서 실린지를 통해 적가하였다. 첨가 직후, TLC 를 확인하여 생성물의 신속한 형성 및 일부 이량체를 밝혀내었다. 0.5 시간 후, NaHCO3 을 첨가하여 혼합물을 구분시켰다. 추출시, 유기층을 분리한 후 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피로, 순수 19 (0.20 g, 53%) 를 무색 오일로서 수득하였다.
화합물 21: 화합물 11 에 대해 기재한 것과 유사한 절차에 의해 화합물 20 을 화합물 21 로 전환하였다.
화합물 22: 화합물 12 에 대해 기재한 것과 유사한 절차에 의해 화합물 21 을 화합물 22 로 전환하였다.
화합물 23: 화합물 23 을 문헌 방법 (Journal of Medicinal Chemistry, 50(23), 5568-5570; 2007) 에 따라 제조하였다.
화합물 24: 화합물 23 (1 mmol) 의 빙냉 피리딘 용액 (10 mL) 을 아세틸 클로라이드 (1 mmol) 로, 그 다음 5 분 후 MsCl (1.1 mmol) 로, 적상 방식으로 연속하여 처리하였다. 상기 용액을 실온으로 가온한 후 용매를 제거하였다. 잔류물을 EtOAc 에 용해하고, 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피에 의해 정제하여 순수 화합물 24 를 수득하였다.
화합물 25: 화합물 12 에 대해 기재한 것과 유사한 절차에 의해 화합물 24 를 화합물 25 로 전환하였다.
화합물 27: 화합물 14 에 대해 기재한 것과 유사한 절차에 의해 화합물 26 을 화합물 27 로 전환하였다.
화합물 29: 화합물 14 에 대해 기재한 것과 유사한 절차에 의해 화합물 28 을 화합물 29 로 전환하였다.
화합물 30: 화합물 30 을 문헌 방법 (Tetrahedron, 42(2), 601-7; 1986) 에 따라 제조하였다.
화합물 31: 화합물 31 을 특허 절차 (US 20090181444) 에 따라 화합물 30 으로부터 제조하였다.
화합물 33: 화합물 33 을 특허 절차 (US 20090181444) 에 따라 화합물 32 로부터 제조하였다.
화합물 36: 화합물 34 (1 mmol) 의 빙냉 DCM (20 mL) 용액을 NEt3 (1 mmol) 으로 처리한 후 TMS-Cl (1.1 mmol) 을 적가하였다. 1 시간 후, 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 미가공 TMS 보호된 물질을 THF (10 mL) 에 재용해하고, 이때 PPh3 (1.2 mmol), 화합물 35 (1.2 mmol), 그 다음 DEAD (1.2 mmol, 적하) 를 계속하여 첨가하였다. 실온에서 18 시간 동안 교반한 후, 용매를 진공 하 제거하고, 잔류물을 DCM 에 재용해하고, 이의 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피에 의해 정제하여 순수 화합물 36 을 수득하였다.
화합물 37: 화합물 36 (0.5 mmol) 의 THF (10 mL) 용액을 TBAF (THF 중 1M 용액 1 mmol) 로 처리하면서, TLC 에 의해 모니터링하였다. TMS 절단 완료시, 용매를 진공 하 제거하고, 잔류물을 DCM 에 재용해하고, 이의 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 미가공 알코올을 피리딘 (5 mL) 에 재용해하고, TsCl (0.55 mmol) 을 첨가하였다. 실온에서 18 시간 후, 용매를 제거하고, 잔류물을 DCM 에 재용해하고, 이의 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피에 의해 정제하여 순수 화합물 37 을 수득하였다.
화합물 38: 화합물 12 에 대해 기재한 것과 유사한 절차에 의해 화합물 37 을 화합물 38 로 전환하였다.
화합물 40: 화합물 39 (1 mmol) 의 빙냉 DCM (20 mL) 용액을 NEt3 (1 mmol) 로 처리한 후 TMS-Cl (1.1 mmol) 을 적가하였다. 1 시간 후, 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 미가공 TMS 보호된 물질을 THF (10 mL) 에 재용해하고, 이때 PPh3 (1.2 mmol), 칼륨 p-톨루엔티오술포네이트 (KTTS, 1.2 mmol), 무수 ZnCl2 (1 mmol), 그 다음 DEAD (1.2 mmol, 적하) 를 계속하여 첨가하였다. 실온에서 18 시간 동안 교반한 후, 용매를 진공 하 제거하고, 잔류물을 DCM 에 재용해하고, 이의 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피에 의해 정제하여 순수 화합물 40 을 수득하였다.
화합물 41: 화합물 40 (0.5 mmol) 의 THF (10 mL) 용액을 TBAF (THF 중 1M 용액 1 mmol) 로 처리하면서, TLC 에 의해 모니터링하였다. TMS 절단 완료시, 용매를 진공 하 제거하고, 잔류물을 DCM 에 재용해하고, 이의 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 미가공 알코올을 THF (10 mL) 에 재용해하고, 이때 PPh3 (1.2 mmol), 화합물 35 (1.2 mmol), 그 다음 DEAD (1.2 mmol, 적하) 를 계속하여 첨가하였다. 실온에서 18 시간 동안 교반한 후, 용매를 진공 하 제거하고, 잔류물을 DCM 에 재용해하고, 이의 용액을 물로 세척하고, 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피에 의해 정제하여 순수 화합물 40 을 수득하였다.
화합물 42: 화합물 14 에 대해 기재한 것과 유사한 절차에 의해 화합물 41 을 화합물 42 로 전환하였다.
실시예
2 -
용액상으로
포스포로티오트리에스테르를
제공하기 위한 H-
포스포네이트의
티오알킬화
모식도 2
BSTFA = N,O-비스(트리메틸실릴)트리플루오로아세트아미드 : CF3C=NSi(CH3)3OSi(CH3)3
화합물 100: 디-DMTr H-포스포네이트 TT 이량체 (100) 에 대한 합성 절차는 이전에 기재된 바 있다 (Froehler, Brian C.; Ng, Peter G.; Matteucci, Mark D., Nucleic Acids Research (1986), 14(13), 5399-5407; Garegg, Per J.; Lindh, Ingvar; Regberg, Tor; Stawinski, Jacek; Stroemberg, Roger; Henrichson, Christina Tetrahedron Letters (1986), 27(34), 4051-4054).
화합물 101: 화합물 100, 부분입체이성질체 (200 mg, 0.176 mmol) 의 혼합물을 ACN (6 mL) 에 용해한 후 트리메틸실릴 2,2,2-트리플루오로-N-(트리메틸실릴)아세트이미데이트 (227 mg, 0.882 mmol) 를 첨가하였다. ACN (2 mL) 중 (Z)-S-4-((2-모르폴리노에틸)디술파닐)부트-2-에닐 메탄술포노티오에이트 (121 mg, 0.353 mmol) 의 용액을 이후 대략 동일한 3 회분으로 1 시간에 걸쳐 첨가하면서, TLC 및 HPLC/MS 에 의해 모니터링하였다. 3 시간 후, 생성된 용액을 물을 첨가하여 구분시켰다. 추출시, 유기층을 분리한 후 건조시키고 (MgSO4), 여과하고 진공 하 환원시켰다. 컬럼 크로마토그래피로, 화합물 101 을 백색 거품, 225 mg, 91% 로서 수득하였다.
화합물 201: 화합물 101 (0.150 g, 0.107 mmol) 을 3% TCA/DCM (10 mL) 과 함께 10 분에 걸쳐 교반하였다. TLC 및 HPLC/MS 는 반응이 완료되었음을 나타내었다. 10 mL 의 MeOH 를 첨가하고 2 분 동안 교반을 지속하였다. 용매를 증발시키고, 잔류물을 컬럼 크로마토그래피에 의해 정제하여 화합물 201 (85 mg, 100%) 을 백색 고체로서 수득하였다.
화합물 102: 화합물 101 (417 mg, 90%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 (400 mg, 0.352 mmol) 을 화합물 102 로 전환하였다.
화합물 202: 화합물 101 (105 mg, 97%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 102 (200 mg, 0.151 mmol) 를 화합물 202 로 전환하였다.
화합물 103: 화합물 101 (379 mg, 83%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 (400 mg, 0.352 mmol) 을 화합물 103 으로 전환하였다.
화합물 203: 화합물 201 (103 mg, 98%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 103 (200 mg, 0.154 mmol) 을 화합물 203 으로 전환하였다.
화합물 104: 화합물 101 (451 mg, 94%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 (400 mg, 0.352 mmol) 을 화합물 104 로 전환하였다.
화합물 204: 화합물 201 (98 mg, 88%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 104 (200 mg, 0.147 mmol) 를 화합물 204 로 전환하였다.
화합물 105: 화합물 101 (158 mg, 70%) 에 대해 기재한 것과 유사한 절차에서 화합물 14 를 사용하여 화합물 100 (200 mg, 0.176 mmol) 을 화합물 105 로 전환하였다.
화합물 205: 화합물 201 (66 mg, 91%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 105 (137 mg, 0.107 mmol) 를 화합물 205 로 전환하였다.
화합물 106: 화합물 19 를 사용하고 화합물 101 (0.35 g, 71%) 에 대해 기재한 것과 유사한 절차에 따라 화합물 100 (405 mg, 0.357 mmol) 을 화합물 106 으로 전환하였다.
화합물 206: 화합물 201 (110 mg, 98%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 106 (200 mg, 0.146 mmol) 을 화합물 206 으로 전환하였다.
화합물 107: 화합물 5 대신 화합물 22 를 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 107 로 전환하였다.
화합물 207: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 107 을 화합물 207 로 전환하였다.
화합물 108: 화합물 5 대신 화합물 25 를 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 108 로 전환하였다.
화합물 208: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 108 을 화합물 208 로 전환하였다.
화합물 109: 화합물 5 대신 화합물 27 을 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 109 로 전환하였다.
화합물 209: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 109 를 화합물 209 로 전환하였다.
화합물 110: 화합물 5 대신 화합물 29 를 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 110 으로 전환하였다.
화합물 210: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 110 을 화합물 210 으로 전환하였다.
화합물 111: 화합물 5 대신 화합물 31 을 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 111 로 전환하였다.
화합물 211: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 111 을 화합물 211 로 전환하였다.
화합물 112: 화합물 5 대신 화합물 33 을 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 112 로 전환하였다.
화합물 212: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 112 를 화합물 212 로 전환하였다.
화합물 113: 화합물 5 대신 화합물 38 을 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 113 으로 전환하였다.
화합물 213: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 113 을 화합물 213 으로 전환하였다.
화합물 114: 화합물 5 대신 화합물 41 을 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 114 로 전환하였다.
화합물 214: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 114 를 화합물 214 로 전환하였다.
화합물 115: 화합물 5 대신 화합물 43 을 사용하여, 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 115 로 전환하였다.
화합물 215: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 115 를 화합물 215 로 전환하였다.
실시예
3 -
비스
(
메탄티오술포네이트
) 시약을 사용하는
포스포로티오트리에스테르의
대안적 합성
모식도 3
화합물 150: 화합물 101 (170 mg, 50%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 (300 mg, 0.264 mmol) 을 화합물 150 으로 전환하였다.
화합물 151: 화합물 150 (150 mg, 0.116 mmol) 의 DCM (5 mL) 용액을 실온에서 2-모르폴리노에탄티올 (17 mg, 0.116 mmol) 로 처리하면서 TLC 에 의해 모니터링하였다. 0.5 시간 후, 혼합물을 NaHCO3 으로 세척하고, DCM 에 5x 추출하였다. 유기 추출물을 건조시키고 (MgSO4), 여과하고 환원시켰다. 컬럼 크로마토그래피로, 화합물 151 을 무색 고체 거품으로서 수득하였다 (81 mg, 51%).
화합물 251: 화합물 201 (10 mg, 24%) 에 대해 기재한 것과 유사한 절차에 의해 화합물 151 (75 mg, 0.055 mmol) 을 화합물 251 로 전환하였다. MS (ESI +ve): 계산치 (M+H): 754.17, 측정치: 754.19. Rf = 0.3 (10% MeOH/DCM).
화합물 152: 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 152 로 전환하였다.
모식도 4. 지지체 상 포스포로티오에이트 트리에스테르의 합성
(i) Beaucage 시약, BSA, ACN, (ii) 28% NH3 수용액, (iii) NH4OAc (AA) 완충액, (iv) MTS-Me, BSTFA, Et3N, ACN, (v) PrNH2, ACN, (vi) 화합물 12, BSTFA, ACN
화합물 153: 화합물 4 대신 1-티오-β-D-글루코오스 테트라아세테이트를 사용하여, 화합물 151 에 대해 기재한 것과 유사한 절차에 의해 화합물 152 를 화합물 153 으로 전환하였다.
화합물 253: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 153 을 화합물 253 으로 전환하였다.
화합물 154: 화합물 101 에 대해 기재한 것과 유사한 절차에 의해 화합물 100 을 화합물 154 로 전환하였다.
화합물 155: 화합물 151 에 대해 기재한 것과 유사한 절차에 의해 화합물 154 를 화합물 155 로 전환하였다.
화합물 255: 화합물 201 에 대해 기재한 것과 유사한 절차에 의해 화합물 155 를 화합물 255 로 전환하였다.
실시예
4 - 고체상으로
포스포로티오트리에스테르를
제공하기 위한 H-
포스포네이트의
티오알킬화
화합물 300: 보고된 방법에 따라 (Rp)-CAGT-H-포스포네이트-옥살릴 링커-CPG 의 합성을 Applied Biosystems 394 DNA/RNA 합성기에서 실행하였다 (Journal of American Chemical Society 2008, 130, 16031-16037; Angewandte Chemie International Edition 2009, 48, 496-499).
화합물 301: ( S p )- CAGT - 포스포로티오에이트 (R = H): (Rp)-CAGT-H-포스포네이트-옥살릴 링커-CPG 를 0.2 M Beaucage 시약/CH3CN-BSA (9:1, v/v) 에 의해 처리하고, 실온에서 1 시간 동안 교반한 후, CS2 및 아세토니트릴로 연속하여 세척하고 감압 하 건조시켰다. 생성된 CPG 를 2 mL 의 28% 수성 NH3 으로 처리하고 실온에서 18 시간 동안 교반하였다. 감압 하 NH3 의 제거 후, 생성된 산물을 LC/MS 및 HPLC 에 의해 분석하였다.
화합물 302: ( S p )- CAGT - S - 메틸 포스포로티오트리에스테르 (R = Me ): BSTFA (50 μL, 188 μmol) 및 아세토니트릴 (500 μL) 을 (Rp)-CAGT-H-포스포네이트-옥살릴 링커-CPG (14.7 mg, 1 μmol) 에 첨가한 후, 상기 혼합물을 실온에서 20 분 동안 진탕하였다. S-메틸 메탄 술포노티오에이트 (20 μL, 212 μmol) 및 NEt3 (50 μL) 을 첨가하고, 실온에서 1 시간 동안 진탕을 지속하였다. CPG 를 CH3CN 으로 세척한 후 진공 하 건조시켰다. 건조 CH3CN (2 mL) 중 20% PrNH2 를 CPG 에 첨가하고, 혼합물을 실온에서 16 시간 동안 교반하였다. 용매를 감압 하 제거하고 CH3CN 을 혼합물에 첨가하였다. CPG 를 여과에 의해 제거하고, 여과물을 감압 하 농축하였다. CH3CN/DMSO/0.5 M AA 완충액 (1:1:1, v/v/v) 을 첨가하고, 혼합물을 실온에서 16 시간 동안 교반한 후, LC/MS 및 HPLC 에 의해 분석하였다.
화합물 303: 지지체 상에서 화합물 300 의 황화, 그 이후 절단에 의해 화합물 303 을 제조하였다. ACN (450 μL), BSTFA (50 μL) 및 화합물 12 (20 mg) 를 화합물 300 (1 μmol) 에 첨가하여 이를 18 시간 동안 진탕하였다. CPG 를 여과에 의해 수집하여 건조 CH3CN (2 mL) 중 20% PrNH2 에 재현탁하고, 실온에서 16 시간 동안 진탕하였다. 용매를 감압 하 제거하고, 잔류물을 RPHPLC 에 의해 정제하여 순수 화합물 303 을 수득하였다.
실시예
5 -
용액상으로
포스포로티오트리에스테르를
제공하기 위한 H-
포스포네이트의
티오알킬화
모식도 5. 용액 중 포스포로티오에이트 트리에스테르의 합성
(i) 2:1:2 v/v/v ACN:BSTFA:PrNH2, 18 시간 실온, (ii) 피리딘, BSTFA, R-MTS, 실온, (iii) 1:1 v/v MeOH:0.5M TEAA, 18 시간 실온
화합물 305: 화합물 300 (0.5 μmol) 을 ACN (125 μL) 중에서 취한 후 BSTFA (62 μL) 를 첨가하고, 혼합물을 20 분 동안 진탕하였다. PrNH2 (125 μL) 를 첨가하고, 바이알을 18 시간 동안 회전시켰다. 여과하고 1 mL ACN 으로 세척한 후, 용매를 진공 하 제거하고, 잔류물을 톨루엔으로 3x 동시증발시켜 미가공 화합물 304 를 수득하였다. 잔류물을 피리딘 (375 μL) 에 재용해하고 BSTFA (16 μL, 60.0 μmol) 로 처리한 후 화합물 9 (7.2 mg, 30.0 μmol) 로 처리하면서 Ar 하 교반하였다. 실온에서 2 시간 후, 용매를 제거하고 잔류물을 MeOH (0.125 mL) 로 1 시간 동안 처리한 후, AA (0.5 M, 0.125 mL) 를 첨가하고 혼합물을 실온에서 2 시간 동안 교반하였다. 생성물을 RPHPLC 에 의해 정제하여 화합물 305 를 수득하였다.
화합물 303: 화합물 9 를 화합물 12 로 바꾸어, 화합물 305 에 대해 기재한 것과 유사한 절차에 의해 화합물 303 을 제조하였다.
화합물 306: 화합물 14 를 화합물 12 로 바꾸어, 화합물 305 에 대해 기재한 것과 유사한 절차에 의해 화합물 306 을 제조하였다.
화합물 307: 화합물 29 를 화합물 12 로 바꾸어, 화합물 305 에 대해 기재한 것과 유사한 절차에 의해 화합물 307 을 제조하였다.
화합물 308: 화합물 31 을 화합물 12 로 바꾸어, 화합물 305 에 대해 기재한 것과 유사한 절차에 의해 화합물 308 을 제조하였다.
화합물 309: 화합물 38 을 화합물 12 로 바꾸어, 화합물 305 에 대해 기재한 것과 유사한 절차에 의해 화합물 309 를 제조하였다.
실시예
6 - H-
포스포네이트의
입체선택적
티오알킬화
목표: 포스포로티오 트리에스테르를 생성시키기 위한 H-포스포네이트에 대한 MTS 시약의 반응이 입체특이적이라는 것을 입증하기 위함. 31P NMR 을 사용하여 반응 과정 동안의 변화를 추적하였다.
모식도 5
실험 절차: NMR 튜브 내에 0.8 mL CD3CN 중 화합물 100S 5'-O-(4,4'-디메톡시트리틸)티미딘-3'-일 3'-O-(4,4'-디메톡시트리틸)티미딘-5'-일 H-포스포네이트 (20 mg, 18 μmol) 를 첨가하고 31P NMR 스펙트럼을 기록하였다. BSTFA (17 μL, 176 μmol) 를 동일한 NMR 튜브에 첨가하고 5 분 후 31P NMR 스펙트럼을 다시 기록하였다. 트리에틸아민 (49 μL, 352 μmol) 및 S-메틸 메탄티오술포네이트 (22 μL, 88 μmol) 를 동일한 NMR 튜브에 첨가하고 31P NMR 스펙트럼을 즉시 기록하였다.
Rp 이성질체 (화합물 100R) 에 대해 동일한 절차를 반복하였다. 출발 물질, 중간체 및 생성물에 대해 기록한 31P NMR 스펙트럼은, 인 원자에서의 입체화학이 반응동안 유지된다는 것을 보여준다.
본 발명의 바람직한 구현예를 본원에 나타내고 기재하였으나, 이러한 구현예가 단지 예로써 제공된다는 것이 당업자에게 명백할 것이다. 본 발명을 벗어남이 없이 수많은 변화, 변경 및 대체가 당업자에게 발생할 것이다. 본원에 기재된 본 발명의 구현예에 대한 다양한 대안들이 본 발명의 실행에 있어서 이용될 수 있다는 점이 이해되어야 한다. 하기 특허청구범위는 본 발명의 범주를 규정하는 것으로 의도되며, 이들 특허청구범위 범주 내의 방법 및 구조 및 그의 등가물이 그로 인해 포괄되는 것으로 의도된다.
Claims (18)
- 하기 단계를 포함하는 구조 IIIa 의 포스포로티오트리에스테르의 제조 방법으로서:
i) 구조 Ia 의 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계; 및
ii) 실릴옥시포스포네이트를 구조 IIa 의 티오술포네이트 시약과 반응시켜 구조 IIIa 의 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ia 의 H-포스포네이트가 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IIa 의 티오술포네이트 시약이 하기 구조를 갖고:
[식 중,
X 는 알킬, 시클로알킬 또는 헤테로아릴이고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택됨];
구조 IIIa 의 포스포로티오트리에스테르가 하기 구조를 갖는 방법:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임]. - 하기 단계를 포함하는 구조 IIIb 의 비-입체무작위 (non-stereorandom) 인 결합 (phosphorous linkage) 을 포함하는 포스포로티오트리에스테르의 제조 방법으로서:
i) 구조 Ib 의 비-입체무작위 인 결합을 포함하는 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계; 및
ii) 실릴옥시포스포네이트를 구조 IIb 의 티오술포네이트 시약과 반응시켜 구조 IIIb 의 비-입체무작위 인 결합을 포함하는 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ib 의 비-입체무작위 인 결합을 포함하는 H-포스포네이트가 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IIb 의 티오술포네이트 시약이 하기 구조를 갖고:
[식 중,
X 는 알킬, 시클로알킬, 아릴 또는 헤테로아릴이고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택됨];
구조 IIIb 의 비-입체무작위 인 결합을 포함하는 키랄 포스포로티오트리에스테르가 하기 구조를 갖는 방법:
[식 중,
W 는 독립적으로 O, NH 또는 CH2 에서 선택되고;
R 은 알킬, 알케닐, 알키닐, 시클로알킬, 아릴, 아르알킬, 헤테로아릴, 헤테로아르알킬 또는 R1-R2 이고;
R1 은 -S-알케닐렌-, -S-알킬렌-, -S-알킬렌-아릴-알킬렌-, -S-CO-아릴-알킬렌- 또는 -S-CO-알킬렌-아릴-알킬렌- 에서 선택되고;
R2 는 헤테로시클로-알킬렌-S-, 헤테로시클로-알케닐렌-S-, 아미노알킬-S- 또는 (알킬)4N-알킬렌-S- 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임]. - 제 1 항 또는 제 2 항에 있어서, W 가 O 인 방법.
- 제 1 항 또는 제 2 항에 있어서, 실릴화 시약이 하기에서 선택되는 방법:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트. - 제 5 항에 있어서, 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법.
- 제 6 항에 있어서, 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법.
- 제 1 항 또는 제 2 항에 있어서, H-포스포네이트가 고체상에 공유결합하는 방법.
- 하기 단계를 포함하는 구조 IIIc 의 포스포로티오트리에스테르의 제조 방법으로서:
i) 구조 Ic 의 H-포스포네이트를 실릴화 시약과 반응시켜 실릴옥시포스포네이트를 제공하는 단계;
ii) 실릴옥시포스포네이트를 구조 IVc 의 비스(티오술포네이트) 시약과 반응시켜 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르를 제공하는 단계;
iii) 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르를 구조 VIc 의 친핵체와 반응시켜 구조 IIIc 의 포스포로티오트리에스테르를 제공하는 단계;
이때,
구조 Ic 의 H-포스포네이트가 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
구조 IVc 의 비스(티오술포네이트) 시약이 하기 구조를 갖고:
[식 중,
X 는 알킬렌, 알케닐렌, 아릴렌 또는 헤테로아릴렌이고;
각각의 R6 은 독립적으로 알킬, 시클로알킬, 아릴 또는 헤테로아릴임];
구조 VIc 의 친핵체가 하기 구조를 갖고:
R7-SH
[식 중,
R7 은 알킬, 알케닐, 아릴, 헤테로시클로 아미노알킬 또는 (헤테로시클로)알킬에서 선택됨];
구조 IIIc 의 포스포로티오트리에스테르가 하기 구조를 갖고:
[식 중,
W 는 독립적으로 O, S, NH 또는 CH2 에서 선택되고;
R 은 R7-S-S-X- 이고;
R7 은 알킬, 알케닐, 아릴, 헤테로시클로 아미노알킬 또는 (헤테로시클로)알킬이고;
X 는 알킬렌, 알케닐렌, 아릴렌 또는 헤테로아릴렌이고;
R3 은 -OH, -SH, -NRdRd, -N3, 할로겐, 수소, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -P(O)(Re)2, -HP(O)(Re), -ORa 또는 -SRc 이고;
Y1 은 O, NRd, S 또는 Se 이고;
Ra 는 차단기이고;
Rc 는 차단기이고;
각각의 경우 Rd 는 독립적으로 수소, 알킬, 알케닐, 알키닐, 아릴, 아실, 치환된 실릴, 카르바메이트, -P(O)(Re)2 또는 -HP(O)(Re) 이고;
각각의 경우 Re 는 독립적으로 수소, 알킬, 아릴, 알케닐, 알키닐, 알킬-Y2-, 알케닐-Y2-, 알키닐-Y2-, 아릴-Y2- 또는 헤테로아릴-Y2-, 또는 Na+1, Li+1 또는 K+1 인 양이온이고;
Y2 는 O, NRd 또는 S 이고;
각각의 경우 R4 는 독립적으로 수소, -OH, -SH, -NRdRd, -N3, 할로겐, 알킬, 알케닐, 알키닐, 알킬-Y1-, 알케닐-Y1-, 알키닐-Y1-, 아릴-Y1-, 헤테로아릴-Y1-, -ORb 또는 -SRc 이고, Rb 는 차단기이고;
각각의 경우 Ba 는 독립적으로 차단 또는 미차단된 아데닌, 시토신, 구아닌, 티민, 우라실 또는 개질된 핵염기이고;
R5 는 수소, 차단기, 고체 지지체에 이어진 연결 부분 또는 핵산에 이어진 연결 부분이고;
n 은 1 내지 약 200 임];
이때, 구조 Ic 의 H-포스포네이트, 구조 Vc 의 티오술포네이트기를 포함하는 포스포로티오트리에스테르 및 구조 IIIc 의 포스포로티오트리에스테르의 인 결합이 임의로는 비-입체무작위 인 결합을 포함할 수 있는 방법. - 제 8 항에 있어서, 구조 IIIb 의 포스포로티오트리에스테르가 비-입체무작위 인 결합을 포함하고, 구조 Ic 의 H-포스포네이트가 비-입체무작위 인 결합을 포함하고; W 가 독립적으로 O, NH 또는 CH2 에서 선택되는 방법.
- 제 9 항 또는 제 10 항에 있어서, W 가 O 인 방법.
- 제 9 항에 있어서, R6 이 메틸인 방법.
- 제 9 항에 있어서, 실릴화 시약이 하기에서 선택되는 방법:
1,1,3,3-테트라메틸-1,3-디페닐디실라잔;
1,3-디메틸-1,1,3,3-테트라페닐디실라잔;
1-(트리메틸실릴)이미다졸;
N-트리메틸실릴-N-메틸 트리플루오로아세트아미드;
비스(디메틸아미노)디메틸실란;
브로모트리메틸실란;
클로로디메틸(펜타플루오로페닐)실란;
클로로트리에틸실란;
클로로트리이소프로필실란;
클로로트리메틸실란;
디클로로디메틸실란;
헥사메틸디실라잔;
N,N'-비스(트리메틸실릴)우레아;
N,N-비스(트리메틸실릴)메틸아민;
N,N-디메틸트리메틸실릴아민;
N,O-비스(트리메틸실릴)아세트아미드;
N,O-비스(트리메틸실릴)카르바메이트;
N,O-비스(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-(트리메틸실릴)트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드;
N-메틸-N-트리메틸실릴헵타플루오로부티르아미드;
트리메틸실릴트리플레이트;
트리에틸실릴트리플레이트;
트리이소프로필실릴트리플레이트; 또는
tert-부틸디메틸실릴트리플레이트. - 제 15 항에 있어서, 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드, 트리메틸실릴트리플레이트, 클로로트리메틸실란 또는 1-(트리메틸실릴)이미다졸에서 선택되는 방법.
- 제 16 항에 있어서, 실릴화 시약이 N,O-비스(트리메틸실릴)트리플루오로아세트아미드에서 선택되는 방법.
- 제 17 항에 있어서, H-포스포네이트가 고체상에 공유결합하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161509526P | 2011-07-19 | 2011-07-19 | |
| US61/509,526 | 2011-07-19 | ||
| PCT/US2012/046805 WO2013012758A1 (en) | 2011-07-19 | 2012-07-13 | Methods for the synthesis of functionalized nucleic acids |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140068884A true KR20140068884A (ko) | 2014-06-09 |
Family
ID=47558410
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147004108A KR20140068884A (ko) | 2011-07-19 | 2012-07-13 | 관능화된 핵산의 합성 방법 |
Country Status (16)
| Country | Link |
|---|---|
| US (3) | US9605019B2 (ko) |
| EP (2) | EP2734208B1 (ko) |
| JP (2) | JP6128529B2 (ko) |
| KR (1) | KR20140068884A (ko) |
| CN (2) | CN103796657B (ko) |
| AU (1) | AU2012284265B2 (ko) |
| BR (1) | BR112014001244A2 (ko) |
| CA (1) | CA2842358C (ko) |
| DK (1) | DK2734208T3 (ko) |
| ES (1) | ES2626488T3 (ko) |
| HK (1) | HK1198479A1 (ko) |
| IL (1) | IL230522B (ko) |
| MX (1) | MX347361B (ko) |
| RU (1) | RU2014105311A (ko) |
| SG (1) | SG10201700554VA (ko) |
| WO (1) | WO2013012758A1 (ko) |
Families Citing this family (72)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2744987C (en) | 2008-12-02 | 2018-01-16 | Chiralgen, Ltd. | Method for the synthesis of phosphorus atom modified nucleic acids |
| KR101141544B1 (ko) | 2009-03-13 | 2012-05-03 | 한국과학기술원 | 에스아이알엔에이 다중 접합체 및 이의 제조방법 |
| AU2010270714B2 (en) | 2009-07-06 | 2015-08-13 | Wave Life Sciences Ltd. | Novel nucleic acid prodrugs and methods use thereof |
| EP2620428B1 (en) | 2010-09-24 | 2019-05-22 | Wave Life Sciences Ltd. | Asymmetric auxiliary group |
| SG10201700554VA (en) * | 2011-07-19 | 2017-03-30 | Wave Life Sciences Pte Ltd | Methods for the synthesis of functionalized nucleic acids |
| BR112015000723A2 (pt) | 2012-07-13 | 2017-06-27 | Shin Nippon Biomedical Laboratories Ltd | adjuvante de ácido nucléico quiral |
| SG11201500239VA (en) | 2012-07-13 | 2015-03-30 | Wave Life Sciences Japan | Asymmetric auxiliary group |
| WO2014012081A2 (en) | 2012-07-13 | 2014-01-16 | Ontorii, Inc. | Chiral control |
| AU2014346658A1 (en) * | 2013-11-06 | 2016-06-02 | Solstice Biologics, Ltd. | Polynucleotide constructs having disulfide groups |
| EP3095461A4 (en) | 2014-01-15 | 2017-08-23 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having immunity induction activity, and immunity induction activator |
| US10149905B2 (en) | 2014-01-15 | 2018-12-11 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having antitumor effect and antitumor agent |
| JPWO2015108046A1 (ja) | 2014-01-15 | 2017-03-23 | 株式会社新日本科学 | 抗アレルギー作用を有するキラル核酸アジュバンド及び抗アレルギー剤 |
| MX2016009290A (es) | 2014-01-16 | 2017-02-28 | Wave Life Sciences Ltd | Diseño quiral. |
| WO2015125845A1 (ja) * | 2014-02-20 | 2015-08-27 | 塩野義製薬株式会社 | 含窒素非芳香族複素環を含む核酸のリン酸部位修飾 |
| GB201410693D0 (en) | 2014-06-16 | 2014-07-30 | Univ Southampton | Splicing modulation |
| RU2708237C2 (ru) | 2014-08-22 | 2019-12-05 | Общество с ограниченной ответственностью "НооГен" | Модифицированные олигонуклеотиды и способ их получения |
| CN114010788A (zh) | 2014-08-22 | 2022-02-08 | 奥克兰联合服务有限公司 | 通道调节剂 |
| CA2963288A1 (en) | 2014-10-03 | 2016-04-07 | Cold Spring Harbor Laboratory | Targeted augmentation of nuclear gene output |
| CN107208092B (zh) | 2014-12-16 | 2021-09-10 | 罗氏创新中心哥本哈根有限公司 | 手性毒性筛选方法 |
| KR20180039621A (ko) | 2015-06-15 | 2018-04-18 | 엠펙 엘에이, 엘엘씨 | 정의된 다중 접합체 올리고뉴클레오티드 |
| EP3315507A4 (en) * | 2015-06-26 | 2019-02-27 | Kyowa Hakko Kirin Co., Ltd. | An oligonucleotide |
| MA43072A (fr) | 2015-07-22 | 2018-05-30 | Wave Life Sciences Ltd | Compositions d'oligonucléotides et procédés associés |
| US10196639B2 (en) | 2015-10-09 | 2019-02-05 | University Of Southampton | Modulation of gene expression and screening for deregulated protein expression |
| AU2016334232B2 (en) | 2015-10-09 | 2022-05-26 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| ES2903394T3 (es) | 2015-12-14 | 2022-04-01 | Cold Spring Harbor Laboratory | Composiciones para el tratamiento de la retinitis pigmentosa 13 |
| JP2018538288A (ja) | 2015-12-14 | 2018-12-27 | コールド スプリング ハーバー ラボラトリー | アラジール症候群の処置のためのアンチセンスオリゴマー |
| US11096956B2 (en) | 2015-12-14 | 2021-08-24 | Stoke Therapeutics, Inc. | Antisense oligomers and uses thereof |
| EP3390636B1 (en) | 2015-12-14 | 2021-05-19 | Cold Spring Harbor Laboratory | Antisense oligomers for treatment of dravet syndrome |
| EP4104867A3 (en) | 2015-12-14 | 2023-03-01 | Cold Spring Harbor Laboratory | Compositions and methods for treatment of central nervous system diseases |
| CA3005090A1 (en) | 2015-12-14 | 2017-06-22 | Cold Spring Harbor Laboratory | Compositions and methods for treatment of liver diseases |
| WO2017155058A1 (ja) * | 2016-03-09 | 2017-09-14 | 学校法人東京理科大学 | Rnaハイブリッド形成用核酸オリゴマー |
| CN114685589A (zh) | 2016-03-13 | 2022-07-01 | 波涛生命科学有限公司 | 用于亚磷酰胺和寡核苷酸合成的组合物和方法 |
| JP6748219B2 (ja) | 2016-03-14 | 2020-08-26 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Pd−l1発現低減用のオリゴヌクレオチド |
| MA45470A (fr) | 2016-04-01 | 2019-02-06 | Avidity Biosciences Llc | Acides nucléiques kras et leurs utilisations |
| MA45469A (fr) | 2016-04-01 | 2019-02-06 | Avidity Biosciences Llc | Acides nucléiques de bêta-caténine et leurs utilisations |
| MA45349A (fr) | 2016-04-01 | 2019-02-06 | Avidity Biosciences Llc | Acides nucléiques egfr et leurs utilisations |
| MA45328A (fr) | 2016-04-01 | 2019-02-06 | Avidity Biosciences Llc | Compositions acide nucléique-polypeptide et utilisations de celles-ci |
| MA45471A (fr) | 2016-04-01 | 2019-02-06 | Avidity Biosciences Llc | Acides nucléiques de phosphatidylinositol-3-kinase et leurs utilisations |
| MA45270A (fr) | 2016-05-04 | 2017-11-09 | Wave Life Sciences Ltd | Compositions d'oligonucléotides et procédés associés |
| US11013757B2 (en) | 2016-06-03 | 2021-05-25 | Wave Life Sciences Ltd. | Oligonucleotides, compositions and methods thereof |
| US11981703B2 (en) | 2016-08-17 | 2024-05-14 | Sirius Therapeutics, Inc. | Polynucleotide constructs |
| WO2018098264A1 (en) | 2016-11-23 | 2018-05-31 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
| SG11201906200WA (en) | 2017-01-06 | 2019-08-27 | Avidity Biosciences Llc | Nucleic acid-polypeptide compositions and methods of inducing exon skipping |
| CN106667176A (zh) * | 2017-03-01 | 2017-05-17 | 戴建华 | 一种治疗痤疮的药枕 |
| EP4011396A1 (en) * | 2017-03-10 | 2022-06-15 | QuiaPEG Pharmaceuticals AB | Releasable conjugates |
| WO2018223056A1 (en) | 2017-06-02 | 2018-12-06 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods of use thereof |
| JP7557941B2 (ja) | 2017-06-02 | 2024-09-30 | ウェイブ ライフ サイエンシズ リミテッド | オリゴヌクレオチド組成物及びその使用方法 |
| EP3642182A4 (en) | 2017-06-21 | 2020-12-09 | Wave Life Sciences Ltd. | COMPOUNDS, COMPOSITIONS AND SYNTHESIS METHODS |
| WO2019006455A1 (en) | 2017-06-30 | 2019-01-03 | Solstice Biologics, Ltd. | AUXILIARIES OF CHIRAL PHOSPHORAMIDITIS AND METHODS OF USE THEREOF |
| GB201711809D0 (en) | 2017-07-21 | 2017-09-06 | Governors Of The Univ Of Alberta | Antisense oligonucleotide |
| KR20200035301A (ko) | 2017-08-08 | 2020-04-02 | 웨이브 라이프 사이언시스 리미티드 | 올리고뉴클레오티드 조성물 및 이의 방법 |
| WO2019040923A1 (en) | 2017-08-25 | 2019-02-28 | Stoke Therapeutics, Inc. | ANTISENSE OLIGOMERS FOR THE TREATMENT OF DISEASE CONDITIONS AND OTHER DISEASES |
| KR20200052369A (ko) | 2017-09-18 | 2020-05-14 | 웨이브 라이프 사이언시스 리미티드 | 올리고뉴클레오티드 제조 기술 |
| CA3077213A1 (en) | 2017-10-04 | 2019-04-11 | Avidity Biosciences, Inc. | Nucleic acid-polypeptide compositions and uses thereof |
| EP3694530A4 (en) | 2017-10-12 | 2021-06-30 | Wave Life Sciences Ltd. | OLIGONUCLEOTIDE COMPOSITIONS AND METHOD FOR THEREFORE |
| JP7394753B2 (ja) | 2017-10-18 | 2023-12-08 | サレプタ セラピューティクス, インコーポレイテッド | アンチセンスオリゴマー化合物 |
| GB2610100B (en) | 2017-10-23 | 2023-08-16 | Stoke Therapeutics Inc | Antisense oligomers for treatment of non-sense mediated RNA decay based conditions and diseases |
| AU2018378812A1 (en) | 2017-12-06 | 2020-07-09 | Avidity Biosciences, Inc. | Compositions and methods of treating muscle atrophy and myotonic dystrophy |
| MX2020011695A (es) | 2018-05-04 | 2021-02-26 | Stoke Therapeutics Inc | Métodos y composiciones para el tratamiento de la enfermedad por almacenamiento de éster de colesterilo. |
| BR112021004689A2 (pt) | 2018-09-12 | 2021-06-08 | Quiapeg Pharmaceuticals Ab | conjugados glp-1 liberáveis |
| KR102270138B1 (ko) * | 2018-09-17 | 2021-06-28 | 삼성에스디아이 주식회사 | 실리카 막 형성용 조성물, 실리카 막의 제조방법 및 실리카 막 |
| EP3898693A4 (en) | 2018-12-21 | 2022-09-21 | Avidity Biosciences, Inc. | ANTI-TRANSFERRIN RECEPTOR ANTIBODIES AND USES THEREOF |
| CN114375296A (zh) | 2019-06-06 | 2022-04-19 | 艾维迪提生物科学公司 | 核酸多肽组合物及其用途 |
| CN114375297A (zh) | 2019-06-06 | 2022-04-19 | 艾维迪提生物科学公司 | Una亚酰胺及其用途 |
| CA3172111A1 (en) | 2020-03-19 | 2021-09-23 | Barbora MALECOVA | Compositions and methods of treating facioscapulohumeral muscular dystrophy |
| MX2022011880A (es) | 2020-03-27 | 2022-10-20 | Avidity Biosciences Inc | Composiciones y metodos para tratar distrofia muscular. |
| EP4150092A1 (en) | 2020-05-11 | 2023-03-22 | Stoke Therapeutics, Inc. | Opa1 antisense oligomers for treatment of conditions and diseases |
| AU2021274944A1 (en) | 2020-05-22 | 2022-12-15 | Wave Life Sciences Ltd. | Double stranded oligonucleotide compositions and methods relating thereto |
| AU2022266383A1 (en) * | 2021-04-28 | 2023-11-16 | Japan Science And Technology Agency | Artificial nucleic acid and nucleic acid delivering method using same |
| AU2022345098A1 (en) | 2021-09-16 | 2024-04-04 | Avidity Biosciences, Inc. | Compositions and methods of treating facioscapulohumeral muscular dystrophy |
| US12071621B2 (en) | 2022-04-05 | 2024-08-27 | Avidity Biosciences, Inc. | Anti-transferrin receptor antibody-PMO conjugates for inducing DMD exon 44 skipping |
| WO2023220737A2 (en) * | 2022-05-13 | 2023-11-16 | Adarx Pharmaceuticals, Inc. | Oligonucleotides having a synthetic backbone and synthesis thereof |
Family Cites Families (689)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2878264A (en) | 1959-03-17 | Substituted amino alcohols | ||
| CH372667A (de) | 1957-09-26 | 1963-10-31 | Robins Co Inc A H | Verfahren zur Herstellung von 3-Aryl-3-pyrrolidinolen |
| US3135766A (en) | 1961-10-03 | 1964-06-02 | Mead Johnson & Co | 3-substituted-3-pyrrolidinols |
| US3484473A (en) * | 1967-05-12 | 1969-12-16 | Buckman Labor Inc | Methylene bisesters of thiolsulfonic acids |
| DE1934150A1 (de) | 1968-07-10 | 1970-01-15 | Pennwalt Corp | Neue 1-Alkanoyloxy-1,2,4,5-tetrahydro-3H,3-benzazepine |
| US3687808A (en) | 1969-08-14 | 1972-08-29 | Univ Leland Stanford Junior | Synthetic polynucleotides |
| US3745162A (en) | 1970-08-31 | 1973-07-10 | Robins Co Inc A H | 1,2,3,4-tetrahydroisoquinoline-2-(thio)-carboxamides |
| GB1448437A (en) | 1973-02-24 | 1976-09-08 | Beecham Group Ltd | Diphenylpropylamines |
| US4022791A (en) | 1975-06-03 | 1977-05-10 | Pfizer Inc. | 2-Aminomethyl-3,4-dihydronaphthalenes |
| GB1504424A (en) | 1975-08-09 | 1978-03-22 | Beecham Group Ltd | Isoquinoline-derived aminoethers |
| BR7807288A (pt) | 1977-11-08 | 1979-06-12 | Genentech Inc | Processo para sintese de polinucleotidos |
| DD133885B1 (de) | 1978-01-04 | 1981-02-25 | Hans Lehmann | Mittel zur bekaempfung von phytopathogenen bakterien und pilzen |
| US5132418A (en) | 1980-02-29 | 1992-07-21 | University Patents, Inc. | Process for preparing polynucleotides |
| US4500707A (en) | 1980-02-29 | 1985-02-19 | University Patents, Inc. | Nucleosides useful in the preparation of polynucleotides |
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| US4415732A (en) | 1981-03-27 | 1983-11-15 | University Patents, Inc. | Phosphoramidite compounds and processes |
| US4973679A (en) | 1981-03-27 | 1990-11-27 | University Patents, Inc. | Process for oligonucleo tide synthesis using phosphormidite intermediates |
| US4668777A (en) | 1981-03-27 | 1987-05-26 | University Patents, Inc. | Phosphoramidite nucleoside compounds |
| US4542142A (en) | 1982-11-22 | 1985-09-17 | Roussel Uclaf | Insecticidal cyclopropane carboxylic acid derivatives with 3-unsaturated-side chain |
| USRE34069E (en) | 1983-08-18 | 1992-09-15 | Biosyntech Gmbh | Process for the preparation of oligonucleotides |
| DE3329892A1 (de) | 1983-08-18 | 1985-03-07 | Köster, Hubert, Prof. Dr., 2000 Hamburg | Verfahren zur herstellung von oligonucleotiden |
| US5118800A (en) | 1983-12-20 | 1992-06-02 | California Institute Of Technology | Oligonucleotides possessing a primary amino group in the terminal nucleotide |
| US5643889A (en) | 1984-07-11 | 1997-07-01 | Temple University-Of The Commonwealth System Of Pennsylvania | Cholesterol conjugates of 2'5'-oligoadenylate derivatives and antiviral uses thereof |
| FR2567892B1 (fr) | 1984-07-19 | 1989-02-17 | Centre Nat Rech Scient | Nouveaux oligonucleotides, leur procede de preparation et leurs applications comme mediateurs dans le developpement des effets des interferons |
| US5367066A (en) | 1984-10-16 | 1994-11-22 | Chiron Corporation | Oligonucleotides with selectably cleavable and/or abasic sites |
| FR2575751B1 (fr) | 1985-01-08 | 1987-04-03 | Pasteur Institut | Nouveaux nucleosides de derives de l'adenosine, leur preparation et leurs applications biologiques |
| FR2576898B1 (fr) | 1985-02-01 | 1988-01-08 | Lafon Labor | Derives de 3-phenyl-tetrahydropyridine, procede de preparation et utilisation en therapeutique |
| US4659774A (en) | 1985-11-01 | 1987-04-21 | American Hoechst Corporation | Support for solid-phase oligonucleotide synthesis |
| US4840956A (en) | 1986-02-18 | 1989-06-20 | Warner-Lambert Company | Novel disubstituted-7-pyrrolidinoquinoline antibacterial agents |
| US4735949A (en) | 1986-02-18 | 1988-04-05 | Warner-Lambert Company | Disubstituted-7-pyrrolidinonaphthyridine antibacterial agents |
| IL83663A0 (en) | 1986-10-27 | 1988-01-31 | Robins Co Inc A H | Preparation of 3-pyrrolidinols |
| JP2828642B2 (ja) | 1987-06-24 | 1998-11-25 | ハワード フローレイ インスティテュト オブ イクスペリメンタル フィジオロジー アンド メディシン | ヌクレオシド誘導体 |
| EP0302349B1 (en) | 1987-07-30 | 1993-09-29 | Bar Ilan University | Biologically active carboxylic acid esters |
| US4923901A (en) | 1987-09-04 | 1990-05-08 | Millipore Corporation | Membranes with bound oligonucleotides and peptides |
| US5175273A (en) | 1988-07-01 | 1992-12-29 | Genentech, Inc. | Nucleic acid intercalating agents |
| US4943629A (en) | 1988-08-12 | 1990-07-24 | American Cyanamid Company | Antidiabetic alpha-substituted phosphonates |
| US4945158A (en) | 1988-08-12 | 1990-07-31 | American Cyanamid Company | Antidiabetic phosphonates |
| US5262530A (en) | 1988-12-21 | 1993-11-16 | Applied Biosystems, Inc. | Automated system for polynucleotide synthesis and purification |
| US5047524A (en) | 1988-12-21 | 1991-09-10 | Applied Biosystems, Inc. | Automated system for polynucleotide synthesis and purification |
| JP2794461B2 (ja) | 1989-08-17 | 1998-09-03 | 有機合成薬品工業株式会社 | ホスホアミダイト化合物及びそれを用いたオリゴリボヌクレオチドの固相合成法 |
| US5141813A (en) | 1989-08-28 | 1992-08-25 | Clontech Laboratories, Inc. | Multifunctional controlled pore glass reagent for solid phase oligonucleotide synthesis |
| US5134066A (en) | 1989-08-29 | 1992-07-28 | Monsanto Company | Improved probes using nucleosides containing 3-dezauracil analogs |
| CA2029273A1 (en) | 1989-12-04 | 1991-06-05 | Christine L. Brakel | Modified nucleotide compounds |
| WO1991009594A1 (en) | 1989-12-28 | 1991-07-11 | Virginia Commonwealth University | Sigma receptor ligands and the use thereof |
| US5130302A (en) | 1989-12-20 | 1992-07-14 | Boron Bilogicals, Inc. | Boronated nucleoside, nucleotide and oligonucleotide compounds, compositions and methods for using same |
| US5635488A (en) | 1991-10-15 | 1997-06-03 | Isis Pharmaceuticals, Inc. | Compounds having phosphorodithioate linkages of high chiral purity |
| US7101993B1 (en) | 1990-01-11 | 2006-09-05 | Isis Pharmaceuticals, Inc. | Oligonucleotides containing 2′-O-modified purines |
| US5506212A (en) | 1990-01-11 | 1996-04-09 | Isis Pharmaceuticals, Inc. | Oligonucleotides with substantially chirally pure phosphorothioate linkages |
| US5646265A (en) | 1990-01-11 | 1997-07-08 | Isis Pharmceuticals, Inc. | Process for the preparation of 2'-O-alkyl purine phosphoramidites |
| US5681941A (en) | 1990-01-11 | 1997-10-28 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US5852188A (en) | 1990-01-11 | 1998-12-22 | Isis Pharmaceuticals, Inc. | Oligonucleotides having chiral phosphorus linkages |
| US5212295A (en) | 1990-01-11 | 1993-05-18 | Isis Pharmaceuticals | Monomers for preparation of oligonucleotides having chiral phosphorus linkages |
| US5459255A (en) | 1990-01-11 | 1995-10-17 | Isis Pharmaceuticals, Inc. | N-2 substituted purines |
| US5914396A (en) | 1990-01-11 | 1999-06-22 | Isis Pharmaceuticals, Inc. | 2'-O-modified nucleosides and phosphoramidites |
| US5587470A (en) | 1990-01-11 | 1996-12-24 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US5620963A (en) | 1991-10-15 | 1997-04-15 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating protein kinase C having phosphorothioate linkages of high chiral purity |
| EP0604409B1 (en) | 1990-01-11 | 2004-07-14 | Isis Pharmaceuticals, Inc. | Oligonucleotide analogs for detecting and modulating rna activity and gene expression |
| US5587361A (en) | 1991-10-15 | 1996-12-24 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5457191A (en) | 1990-01-11 | 1995-10-10 | Isis Pharmaceuticals, Inc. | 3-deazapurines |
| US6339066B1 (en) | 1990-01-11 | 2002-01-15 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotides which have phosphorothioate linkages of high chiral purity and which modulate βI, βII, γ, δ, Ε, ζ and η isoforms of human protein kinase C |
| US5292875A (en) | 1990-04-20 | 1994-03-08 | Lynx Therapeutics, Inc. | Method of synthesizing sulfurized oligonucleotide analogs |
| US5151510A (en) | 1990-04-20 | 1992-09-29 | Applied Biosystems, Inc. | Method of synethesizing sulfurized oligonucleotide analogs |
| ATE186464T1 (de) | 1990-05-23 | 1999-11-15 | Isis Pharmaceuticals Inc | Zusammensetzungen und verfahren zur regulierung der rns-aktivität durch abänderung der rns ''5'- cap-struktur'' |
| DE69126530T2 (de) | 1990-07-27 | 1998-02-05 | Isis Pharmaceutical, Inc., Carlsbad, Calif. | Nuklease resistente, pyrimidin modifizierte oligonukleotide, die die gen-expression detektieren und modulieren |
| US5608046A (en) | 1990-07-27 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Conjugated 4'-desmethyl nucleoside analog compounds |
| US5386023A (en) | 1990-07-27 | 1995-01-31 | Isis Pharmaceuticals | Backbone modified oligonucleotide analogs and preparation thereof through reductive coupling |
| US6121433A (en) | 1990-07-27 | 2000-09-19 | Isis Pharmaceuticals, Inc. | Oligomeric compounds having nitrogen-containing linkages |
| US6087482A (en) | 1990-07-27 | 2000-07-11 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5378825A (en) | 1990-07-27 | 1995-01-03 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs |
| US5623070A (en) | 1990-07-27 | 1997-04-22 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5610289A (en) | 1990-07-27 | 1997-03-11 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogues |
| US5688941A (en) | 1990-07-27 | 1997-11-18 | Isis Pharmaceuticals, Inc. | Methods of making conjugated 4' desmethyl nucleoside analog compounds |
| US5677437A (en) | 1990-07-27 | 1997-10-14 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5223618A (en) | 1990-08-13 | 1993-06-29 | Isis Pharmaceuticals, Inc. | 4'-desmethyl nucleoside analog compounds |
| US5489677A (en) | 1990-07-27 | 1996-02-06 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent oxygen and nitrogen atoms |
| US5783682A (en) | 1990-07-27 | 1998-07-21 | Isis Pharmaceuticals, Inc. | Oligonucleotide mimics having nitrogen-containing linkages |
| US5138045A (en) | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US5602240A (en) | 1990-07-27 | 1997-02-11 | Ciba Geigy Ag. | Backbone modified oligonucleotide analogs |
| US5541307A (en) | 1990-07-27 | 1996-07-30 | Isis Pharmaceuticals, Inc. | Backbone modified oligonucleotide analogs and solid phase synthesis thereof |
| US5792844A (en) | 1990-07-27 | 1998-08-11 | Isis Pharmaceuticals, Inc. | Oligonucleoside linkages containing adjacent nitrogen atoms |
| US5618704A (en) | 1990-07-27 | 1997-04-08 | Isis Pharmacueticals, Inc. | Backbone-modified oligonucleotide analogs and preparation thereof through radical coupling |
| WO1994022886A1 (en) | 1993-03-30 | 1994-10-13 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| US5998603A (en) | 1994-09-29 | 1999-12-07 | Isis Pharmaceuticals, Inc. | 4'-desmethyl nucleoside analogs, and oligomers thereof |
| US5834607A (en) | 1990-07-27 | 1998-11-10 | Isis Pharmaceuticals, Inc. | Amines and methods of making and using the same |
| US5432272A (en) | 1990-10-09 | 1995-07-11 | Benner; Steven A. | Method for incorporating into a DNA or RNA oligonucleotide using nucleotides bearing heterocyclic bases |
| JPH04348044A (ja) | 1991-02-21 | 1992-12-03 | Matsushita Electron Corp | 半導体用樹脂封止装置 |
| US5512668A (en) | 1991-03-06 | 1996-04-30 | Polish Academy Of Sciences | Solid phase oligonucleotide synthesis using phospholane intermediates |
| US20020183502A1 (en) | 1991-05-21 | 2002-12-05 | Mesmaeker Alain De | Backbone-modified oligonucleotide analogs and methods for using same |
| US7015315B1 (en) | 1991-12-24 | 2006-03-21 | Isis Pharmaceuticals, Inc. | Gapped oligonucleotides |
| US6414112B1 (en) | 1991-05-24 | 2002-07-02 | Ole Buchardt | Peptide nucleic acids having 2,6-diaminopurine nucleobases |
| JPH04348077A (ja) | 1991-05-24 | 1992-12-03 | Nec Corp | 薄膜トランジスタ |
| AT405053B (de) | 1991-06-10 | 1999-05-25 | Lucky Ltd | Hepatitis-c-diagnosemittel und -impfstoffe |
| US5359052A (en) | 1991-08-05 | 1994-10-25 | Polish Academy Of Sciences | Chalcophospholanes useful in the synthesis of oligonucleoside phosphorothioates, phosphorodithioates and related selenates |
| US5646267A (en) | 1991-08-05 | 1997-07-08 | Polish Academy Of Sciences | Method of making oligonucleotides and oligonucleotide analogs using phospholanes and enantiomerically resolved phospholane analogues |
| US6369209B1 (en) | 1999-05-03 | 2002-04-09 | Isis Pharmaceuticals, Inc. | Oligonucleotides having A-DNA form and B-DNA form conformational geometry |
| US7119184B2 (en) | 1991-08-12 | 2006-10-10 | Isis Pharmaceuticals, Inc. | Oligonucleotides having A-DNA form and B-DNA form conformational geometry |
| US5599797A (en) | 1991-10-15 | 1997-02-04 | Isis Pharmaceuticals, Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5576302A (en) | 1991-10-15 | 1996-11-19 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating hepatitis C virus having phosphorothioate linkages of high chiral purity |
| ATE221127T1 (de) | 1991-10-15 | 2002-08-15 | Isis Pharmaceuticals Inc | Über chirale phosphoratome gebundene oligonukleotide |
| US5654284A (en) | 1991-10-15 | 1997-08-05 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating RAF kinase having phosphorothioate linkages of high chiral purity |
| US5661134A (en) | 1991-10-15 | 1997-08-26 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating Ha-ras or Ki-ras having phosphorothioate linkages of high chiral purity |
| US5607923A (en) | 1991-10-15 | 1997-03-04 | Isis Pharmaceuticals, Inc. | Oligonucleotides for modulating cytomegalovirus having phosphorothioate linkages of high chiral purity |
| DE59208572D1 (de) | 1991-10-17 | 1997-07-10 | Ciba Geigy Ag | Bicyclische Nukleoside, Oligonukleotide, Verfahren zu deren Herstellung und Zwischenprodukte |
| US5594121A (en) | 1991-11-07 | 1997-01-14 | Gilead Sciences, Inc. | Enhanced triple-helix and double-helix formation with oligomers containing modified purines |
| US6235887B1 (en) | 1991-11-26 | 2001-05-22 | Isis Pharmaceuticals, Inc. | Enhanced triple-helix and double-helix formation directed by oligonucleotides containing modified pyrimidines |
| US5484908A (en) | 1991-11-26 | 1996-01-16 | Gilead Sciences, Inc. | Oligonucleotides containing 5-propynyl pyrimidines |
| US5359044A (en) | 1991-12-13 | 1994-10-25 | Isis Pharmaceuticals | Cyclobutyl oligonucleotide surrogates |
| DE69233599T2 (de) | 1991-12-24 | 2006-12-14 | Isis Pharmaceuticals, Inc., Carlsbad | Unterbrochene 2'-modifizierte Oligonukleotide |
| GB9213601D0 (en) | 1992-06-26 | 1992-08-12 | Mastico Robert A | Protein based delivery system |
| US7067497B2 (en) | 1992-09-29 | 2006-06-27 | Isis Pharmaceuticals, Inc. | Modulation of telomere length by oligonucleotides having a G-core sequence |
| US6444656B1 (en) | 1992-12-23 | 2002-09-03 | Biochem Pharma, Inc. | Antiviral phosphonate nucleotides |
| US6005107A (en) | 1992-12-23 | 1999-12-21 | Biochem Pharma, Inc. | Antiviral compounds |
| EP0677056B1 (en) | 1993-01-25 | 1996-05-22 | HYBRIDON, Inc. | Oligonucleotide alkylphosphonates and alkylphosphonothioates |
| HU9501978D0 (en) | 1993-03-31 | 1995-09-28 | Sterling Winthorp Inc | Bifunctional nucleosides, oligomers thereof, and methods of making and using the same |
| EP0691979A1 (en) | 1993-03-31 | 1996-01-17 | Sanofi | Novel 5'-substituted nucleosides and oligomers produced therefrom |
| US5955591A (en) | 1993-05-12 | 1999-09-21 | Imbach; Jean-Louis | Phosphotriester oligonucleotides, amidites and method of preparation |
| US6015886A (en) | 1993-05-24 | 2000-01-18 | Chemgenes Corporation | Oligonucleotide phosphate esters |
| DE69412704T2 (de) | 1993-06-10 | 1999-02-04 | Idemitsu Petrochemical Co., Ltd., Tokio/Tokyo | Spritzgiessform |
| US5502177A (en) | 1993-09-17 | 1996-03-26 | Gilead Sciences, Inc. | Pyrimidine derivatives for labeled binding partners |
| US5643989A (en) | 1993-10-29 | 1997-07-01 | Azdel, Inc. | Fiber reinforced functionalized polyolefin composites |
| US5457187A (en) | 1993-12-08 | 1995-10-10 | Board Of Regents University Of Nebraska | Oligonucleotides containing 5-fluorouracil |
| DE4435728A1 (de) | 1994-01-19 | 1995-07-20 | Boehringer Mannheim Gmbh | Biotinsilan-Verbindungen und diese Verbindungen enthaltende Bindematrix |
| US6117679A (en) | 1994-02-17 | 2000-09-12 | Maxygen, Inc. | Methods for generating polynucleotides having desired characteristics by iterative selection and recombination |
| AU1806795A (en) | 1994-02-22 | 1995-09-04 | Novo Nordisk A/S | A method of preparing a variant of a lipolytic enzyme |
| US5596091A (en) | 1994-03-18 | 1997-01-21 | The Regents Of The University Of California | Antisense oligonucleotides comprising 5-aminoalkyl pyrimidine nucleotides |
| EP0759073A1 (en) | 1994-05-11 | 1997-02-26 | Novo Nordisk A/S | AN ENZYME WITH ENDO-1,3(4)-$g(b)-GLUCANASE ACTIVITY |
| US5525711A (en) | 1994-05-18 | 1996-06-11 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Pteridine nucleotide analogs as fluorescent DNA probes |
| HRP950288A2 (en) | 1994-05-31 | 1997-08-31 | Bayer Ag | Oxalylamino-benzofuran- and benzothienyl-derivatives |
| DE69507197T2 (de) | 1994-05-31 | 1999-05-27 | Bayer Ag, 51373 Leverkusen | Aminobenzofuryl- und -thienylderivate |
| US6239116B1 (en) | 1994-07-15 | 2001-05-29 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| EP1167377B2 (en) | 1994-07-15 | 2012-08-08 | University of Iowa Research Foundation | Immunomodulatory oligonucleotides |
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| DE69521517T2 (de) | 1994-09-07 | 2002-04-18 | Hybridon, Inc. | Prodrug-oligonukleotide |
| US5681940A (en) | 1994-11-02 | 1997-10-28 | Icn Pharmaceuticals | Sugar modified nucleosides and oligonucleotides |
| AU4514696A (en) | 1994-12-22 | 1996-07-10 | Hybridon, Inc. | Synthesis of stereospecific oligonucleotide phosphorothioates |
| GB9501465D0 (en) * | 1995-01-25 | 1995-03-15 | King S College London | Nucleoside phosphorothioate derivatives,synthesis and use thereof |
| US6166197A (en) | 1995-03-06 | 2000-12-26 | Isis Pharmaceuticals, Inc. | Oligomeric compounds having pyrimidine nucleotide (S) with 2'and 5 substitutions |
| AU5359496A (en) | 1995-03-06 | 1996-09-23 | Isis Pharmaceuticals, Inc. | Improved process for the synthesis of 2'-o-substituted pyrimidines and oligomeric compounds therefrom |
| EP0739983B1 (en) | 1995-04-27 | 2009-12-30 | Takara Bio Inc. | Gene encoding lacto-n-biosidase |
| RU2205874C2 (ru) | 1995-05-11 | 2003-06-10 | Апплайд Резеч Системз Арс Холдинг Н.В. | Нуклеотидная последовательность, способная ингибировать активность il-6, плазмидный вектор для трансфекции в клетки млекопитающих, нуклеотидная последовательность, используемая при терапии, фармацевтическая композиция (варианты) |
| EP0828729A1 (en) | 1995-05-19 | 1998-03-18 | Glycomed Incorporated | Collection of activated glycoside compounds and their biological use |
| AU5871196A (en) | 1995-05-23 | 1996-12-24 | Hybridon, Inc. | Methods and compounds for the synthesis of oligonucleotides and the oligonucleotides thereby produced |
| AU5869696A (en) | 1995-05-23 | 1996-12-11 | Hybridon, Inc. | Novel synthons for stereoselective oligonucleotide synthesis |
| CA2223103A1 (en) | 1995-06-06 | 1996-12-12 | Isis Pharmaceuticals Inc. | Oligonucleotides having phosphorothioate linkages of high chiral purity |
| US5932450A (en) | 1995-06-07 | 1999-08-03 | Gen-Probe Incorporated | Enzymatic synthesis of oligonucleotides using digestible templates |
| DE69636649T2 (de) | 1995-06-29 | 2007-10-04 | Takara Bio Inc., Otsu | Für einen Endoglycoceramidase-Aktivator kodierendes Gen |
| US5795765A (en) | 1995-06-29 | 1998-08-18 | Takara Shuzo Co., Ltd. | Gene encoding endoglycoceramidase |
| US6017700A (en) | 1995-08-04 | 2000-01-25 | Bayer Corporation | Cationic oligonucleotides, and related methods of synthesis and use |
| US5936080A (en) | 1996-05-24 | 1999-08-10 | Genta Incorporated | Compositions and methods for the synthesis of organophosphorus derivatives |
| WO1997009443A1 (en) | 1995-09-05 | 1997-03-13 | Michigan State University | PROCESS FOR THE ISOLATION AND PURIFICATION OF TAXOL AND TAXANES FROM TAXUS spp |
| US6160109A (en) | 1995-10-20 | 2000-12-12 | Isis Pharmaceuticals, Inc. | Preparation of phosphorothioate and boranophosphate oligomers |
| US6476216B1 (en) | 1995-10-20 | 2002-11-05 | Mcgill University | Preparation of phosphorothioate oligomers |
| US5734041A (en) | 1995-10-20 | 1998-03-31 | Mcgill University | Preparation of chiral phosphorothioate oligomers |
| US7018793B1 (en) | 1995-12-07 | 2006-03-28 | Diversa Corporation | Combinatorial screening of mixed populations of organisms |
| US6214805B1 (en) | 1996-02-15 | 2001-04-10 | The United States Of America As Represented By The Department Of Health And Human Services | RNase L activators and antisense oligonucleotides effective to treat RSV infections |
| US5998602A (en) | 1996-02-15 | 1999-12-07 | The Cleveland Clinic Fouindation And Government | RNase L activators and antisense oligonucleotides effective to treat RSV infections |
| GB9604669D0 (en) | 1996-03-05 | 1996-05-01 | Ciba Geigy Ag | Chemical compounds |
| US5824669A (en) | 1996-03-22 | 1998-10-20 | Nitromed, Inc. | Nitrosated and nitrosylated compounds and compositions and their use for treating respiratory disorders |
| DE69738254T2 (de) | 1996-05-10 | 2008-08-14 | Novozymes A/S | Methode zur bereitstellung von dna sequenzen |
| US5856465A (en) | 1996-05-24 | 1999-01-05 | Polska Akademia Nauk Centrum Badan Molekularnych I Makromolekularnych | Compositions and methods for the synthesis of chirally pure organophosphorus nucleoside derivatives |
| US5898031A (en) | 1996-06-06 | 1999-04-27 | Isis Pharmaceuticals, Inc. | Oligoribonucleotides for cleaving RNA |
| DE19622783A1 (de) | 1996-06-07 | 1997-12-11 | Hoechst Ag | Isolierung der Biosynthesegene für Pseudo-Oligosaccharide aus Streptomyces glaucescens GLA.O und ihre Verwendung |
| DE69736667T2 (de) | 1996-07-16 | 2007-09-06 | Gen-Probe Inc., San Diego | Verfahren zum nachweis und amplifikation von nukleinsäuresequenzen unter verbrauch von modifizierten oligonukleotiden mit erhöhter zielschmelztemperatur (tm) |
| ATE311402T1 (de) | 1996-07-24 | 2005-12-15 | Buchardt Dorte | Peptidnukleinsäuren mit erhöhter bindungsaffinität, sequenzspezifität und löslichkeit |
| AU4156197A (en) | 1996-08-21 | 1998-03-06 | Hybridon, Inc. | Oligonucleotide prodrugs |
| US6056973A (en) | 1996-10-11 | 2000-05-02 | Sequus Pharmaceuticals, Inc. | Therapeutic liposome composition and method of preparation |
| GB9621522D0 (en) | 1996-10-16 | 1996-12-04 | Biocompatibles Ltd | Synthesis of phosphorus compounds |
| US6639062B2 (en) | 1997-02-14 | 2003-10-28 | Isis Pharmaceuticals, Inc. | Aminooxy-modified nucleosidic compounds and oligomeric compounds prepared therefrom |
| US6172209B1 (en) | 1997-02-14 | 2001-01-09 | Isis Pharmaceuticals Inc. | Aminooxy-modified oligonucleotides and methods for making same |
| US6369237B1 (en) | 1997-03-07 | 2002-04-09 | President And Fellows Of Harvard College | DNA glycosylase inhibitors, and uses related thereto |
| US6015887A (en) | 1997-04-11 | 2000-01-18 | Isis Pharmaceuticals, Inc. | Chiral peptide nucleic acids and methods for preparing same |
| US6468983B2 (en) | 1997-04-21 | 2002-10-22 | The Cleveland Clinic Foundation | RNase L activators and antisense oligonucleotides effective to treat telomerase-expressing malignancies |
| PL184612B1 (pl) | 1997-04-25 | 2002-11-29 | Pan | Sposób wytwarzania modyfikowanych P chiralnych analogów nukleotydów |
| CA2291839A1 (en) | 1997-05-28 | 1998-12-03 | Peter E. Nielsen | Conjugated peptide nucleic acids having enhanced cellular uptake |
| JP2002507212A (ja) | 1997-06-27 | 2002-03-05 | ザ、プロクター、エンド、ギャンブル、カンパニー | プロ芳香性環状アセタール |
| WO1999005160A2 (en) | 1997-07-25 | 1999-02-04 | Hybridon, Inc. | Oligonuclotides having 3' terminal stereospecific phosphorothioates |
| US6767739B2 (en) | 2001-07-30 | 2004-07-27 | Isis Pharmaceuticals Inc. | Antisense modulation of microsomal triglyceride transfer protein expression |
| US6383808B1 (en) | 2000-09-11 | 2002-05-07 | Isis Pharmaceuticals, Inc. | Antisense inhibition of clusterin expression |
| GB9717158D0 (en) | 1997-08-13 | 1997-10-22 | King S College London | Solution synthesis of oligonucleotides and their phosphorothioate analogues |
| US6750344B1 (en) | 1997-09-05 | 2004-06-15 | Isis Pharmaceuticals, Inc. | Amine compounds and combinatorial libraries comprising same |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| DE19741715A1 (de) | 1997-09-22 | 1999-03-25 | Hoechst Ag | Pentopyranosyl-Nucleosid, seine Herstellung und Verwendung |
| US6232463B1 (en) | 1997-10-09 | 2001-05-15 | Isis Pharmaceuticals, Inc. | Substituted purines and oligonucleotide cross-linking |
| US6528640B1 (en) | 1997-11-05 | 2003-03-04 | Ribozyme Pharmaceuticals, Incorporated | Synthetic ribonucleic acids with RNAse activity |
| US6617438B1 (en) | 1997-11-05 | 2003-09-09 | Sirna Therapeutics, Inc. | Oligoribonucleotides with enzymatic activity |
| US6080543A (en) | 1997-12-08 | 2000-06-27 | E. & J. Gallo Winery | Detection of fungal pathogens |
| US6582936B1 (en) | 1997-12-12 | 2003-06-24 | The Regents Of The University Of California | Methods for making nucleic acids |
| US6248519B1 (en) | 1998-03-11 | 2001-06-19 | E & J Gallo Winery | Detection of fermentation-related microorganisms |
| US7045610B2 (en) | 1998-04-03 | 2006-05-16 | Epoch Biosciences, Inc. | Modified oligonucleotides for mismatch discrimination |
| JP2002513763A (ja) | 1998-05-06 | 2002-05-14 | ユニバーシティ オブ アイオワ リサーチ ファウンデーション | Cpgオリゴヌクレオチドを使用して寄生生物感染および関連する疾患を予防および処置するための方法 |
| WO1999058118A2 (en) | 1998-05-14 | 1999-11-18 | Cpg Immunopharmaceuticals Gmbh | METHODS FOR REGULATING HEMATOPOIESIS USING CpG-OLIGONUCLEOTIDES |
| US6242589B1 (en) | 1998-07-14 | 2001-06-05 | Isis Pharmaceuticals, Inc. | Phosphorothioate oligonucleotides having modified internucleoside linkages |
| US6867294B1 (en) | 1998-07-14 | 2005-03-15 | Isis Pharmaceuticals, Inc. | Gapped oligomers having site specific chiral phosphorothioate internucleoside linkages |
| JP2002521489A (ja) | 1998-07-27 | 2002-07-16 | ユニバーシティ オブ アイオワ リサーチ ファウンデーション | CpGオリゴヌクレオチドの立体異性体および関連する方法 |
| WO2000009159A1 (en) | 1998-08-10 | 2000-02-24 | Aquila Biopharmaceuticals, Inc. | Compositions of cpg and saponin adjuvants and methods thereof |
| WO2000023444A1 (en) | 1998-10-21 | 2000-04-27 | Abbott Laboratories | 5,7-disubstituted-4-aminopyrido[2,3-d]pyrimidine compounds |
| US6995259B1 (en) | 1998-10-23 | 2006-02-07 | Sirna Therapeutics, Inc. | Method for the chemical synthesis of oligonucleotides |
| WO2000031110A1 (en) | 1998-11-25 | 2000-06-02 | Isis Pharmaceuticals, Inc. | Identification of disease predictive nucleic acids |
| US6451524B1 (en) | 1998-11-25 | 2002-09-17 | Isis Pharmaceuticals, Inc. | Identification of disease predictive nucleic acids |
| DE69941223D1 (de) * | 1998-12-21 | 2009-09-17 | Billig Fritz | Chemisch modifizierte enzymen mit mehrfachgeladenen varianten |
| AU1853600A (en) | 1999-01-06 | 2000-07-24 | Choong-Chin Liew | Method for the detection of gene transcripts in blood and uses thereof |
| US6265172B1 (en) | 1999-02-08 | 2001-07-24 | University Of Kentucky | Diagnostic test and therapy for manganese superoxide dismutate (mNsod) associated diseases |
| US6121437A (en) | 1999-03-16 | 2000-09-19 | Isis Pharmaceuticals, Inc. | Phosphate and thiophosphate protecting groups |
| US6506594B1 (en) | 1999-03-19 | 2003-01-14 | Cornell Res Foundation Inc | Detection of nucleic acid sequence differences using the ligase detection reaction with addressable arrays |
| GB9907245D0 (en) | 1999-03-29 | 1999-05-26 | Goldsborough Andrew | Cleavage of nucleic acids from solid supports |
| JP3072345B1 (ja) | 1999-03-31 | 2000-07-31 | 農林水産省家畜衛生試験場長 | 豚丹毒菌の組換えサブユニットワクチン |
| US5998148A (en) | 1999-04-08 | 1999-12-07 | Isis Pharmaceuticals Inc. | Antisense modulation of microtubule-associated protein 4 expression |
| US6977245B2 (en) | 1999-04-12 | 2005-12-20 | The United States Of America As Represented By The Department Of Health And Human Services | Oligodeoxynucleotide and its use to induce an immune response |
| US6300069B1 (en) | 1999-05-03 | 2001-10-09 | Qiagen Gmbh | Generation and amplification of nucleic acids from ribonucleic acids |
| US6656730B1 (en) | 1999-06-15 | 2003-12-02 | Isis Pharmaceuticals, Inc. | Oligonucleotides conjugated to protein-binding drugs |
| US6066500A (en) | 1999-06-25 | 2000-05-23 | Isis Pharmaceuticals Inc. | Antisense modulation of Beta catenin expression |
| US6271004B1 (en) | 1999-06-25 | 2001-08-07 | Display Systems Biotech A/S | Method for improved reverse transcription at high temperatures |
| US6414135B1 (en) | 1999-07-07 | 2002-07-02 | Isis Pharmaceuticals, Inc. | C3′-methylene hydrogen phosphonate monomers and related compounds |
| US20030092647A1 (en) | 2001-08-08 | 2003-05-15 | Crooke Rosanne M. | Antisense modulation of cholesteryl ester transfer protein expression |
| US6147200A (en) | 1999-08-19 | 2000-11-14 | Isis Pharmaceuticals, Inc. | 2'-O-acetamido modified monomers and oligomers |
| US7264932B2 (en) | 1999-09-24 | 2007-09-04 | Applera Corporation | Nuclease inhibitor cocktail |
| AP1775A (en) | 1999-09-25 | 2007-08-28 | Univ Iowa Res Found | Immunostimulatory nucleic acids. |
| EP1220684B2 (en) | 1999-09-27 | 2010-07-14 | Coley Pharmaceutical Group, Inc. | Methods related to immunostimulatory nucleic acid-induced interferon |
| US6949520B1 (en) | 1999-09-27 | 2005-09-27 | Coley Pharmaceutical Group, Inc. | Methods related to immunostimulatory nucleic acid-induced interferon |
| US20020082227A1 (en) | 1999-09-30 | 2002-06-27 | Scott Henry | Use of oligonucleotides for inhibition of complement activation |
| US6309836B1 (en) * | 1999-10-05 | 2001-10-30 | Marek Kwiatkowski | Compounds for protecting hydroxyls and methods for their use |
| WO2001025488A2 (en) | 1999-10-06 | 2001-04-12 | Quark Biotech, Inc. | Method for enrichment of natural antisense messenger rna |
| GB9924285D0 (en) | 1999-10-14 | 1999-12-15 | Avecia Ltd | Process |
| US20010055761A1 (en) | 1999-10-29 | 2001-12-27 | Agilent Technologies | Small scale dna synthesis using polymeric solid support with functionalized regions |
| FR2800750B1 (fr) | 1999-11-05 | 2003-01-31 | Centre Nat Rech Scient | Proteines membranaires ctl (choline transporter like) impliquees dans le transport de la choline |
| WO2001040515A1 (en) | 1999-11-12 | 2001-06-07 | Isis Pharmaceuticals, Inc. | Gapped oligomers having site specific chiral phosphorothioate internucleoside linkages |
| US6322985B1 (en) | 1999-12-27 | 2001-11-27 | Technion Research And Development Foundation Ltd. | Abundant, well distributed and hyperpolymorphic simple sequence repeats in prokaryote genomes and use of same for prokaryote classification and typing |
| WO2001050349A1 (en) | 1999-12-30 | 2001-07-12 | Rutgers, The State University Of New Jersey | Electronic document customization and transformation utilizing user feedback |
| JP2004510953A (ja) | 1999-12-30 | 2004-04-08 | キャボット コーポレイション | 改良された性質を有するセンサー |
| US6649750B1 (en) | 2000-01-05 | 2003-11-18 | Isis Pharmaceuticals, Inc. | Process for the preparation of oligonucleotide compounds |
| US6159697A (en) | 2000-01-19 | 2000-12-12 | Isis Pharmaceuticals, Inc. | Antisense modulation of Smad7 expression |
| US7585847B2 (en) | 2000-02-03 | 2009-09-08 | Coley Pharmaceutical Group, Inc. | Immunostimulatory nucleic acids for the treatment of asthma and allergy |
| US6495677B1 (en) | 2000-02-15 | 2002-12-17 | Kanda S. Ramasamy | Nucleoside compounds |
| CA2335389A1 (en) | 2000-03-01 | 2001-09-01 | Message Pharmaceuticals, Inc. | Novel bacterial rnase p proteins and their use in identifying antibacterial compounds |
| GB0004889D0 (en) * | 2000-03-01 | 2000-04-19 | Avecia Ltd | Synthesis of oligonucleotides |
| AU2001245823A1 (en) | 2000-03-17 | 2001-10-03 | Corixa Corporation | Novel amphipathic aldehydes and their use as adjuvants and immunoeffectors |
| PT1278728E (pt) | 2000-04-20 | 2004-10-29 | Hoffmann La Roche | Derivados de pirrolidina e de piperidina e sua utilizacao no tratamento de disturbios neurodegenerativos |
| DE10019756A1 (de) | 2000-04-20 | 2001-10-25 | Bayer Ag | Verfahren zur Herstellung von superabsorbierenden Polymeren aus Polyacrylnitrilen |
| US20020013287A1 (en) | 2000-05-09 | 2002-01-31 | Reliable Biopharmaceuticals, Inc. St Louis Missouri | Polymeric compounds useful as prodrugs |
| US6492171B2 (en) | 2000-05-16 | 2002-12-10 | Isis Pharmaceuticals, Inc. | Antisense modulation of TERT expression |
| US6815542B2 (en) | 2000-06-16 | 2004-11-09 | Ribapharm, Inc. | Nucleoside compounds and uses thereof |
| EP1307469B1 (en) | 2000-08-03 | 2008-01-23 | Boehringer Mannheim Gmbh | Nucleic acid binding compounds containing pyrazolo¬3,4-d pyrimidine analogues of purin-2,6-diamine and their uses |
| US6725412B1 (en) | 2000-08-15 | 2004-04-20 | Dolby Laboratories Licensing Corporation | Low latency data encoder |
| US6809195B1 (en) | 2000-08-16 | 2004-10-26 | Isis Pharmaceuticals, Inc. | Process for the preparation of oligonucleotides |
| US6559279B1 (en) | 2000-09-08 | 2003-05-06 | Isis Pharmaceuticals, Inc. | Process for preparing peptide derivatized oligomeric compounds |
| EP1366077B1 (en) | 2000-09-15 | 2011-05-25 | Coley Pharmaceutical GmbH | PROCESS FOR HIGH THROUGHPUT SCREENING OF CpG-BASED IMMUNO-AGONIST/ANTAGONIST |
| EP1191097A1 (en) | 2000-09-21 | 2002-03-27 | Leids Universitair Medisch Centrum | Induction of exon skipping in eukaryotic cells |
| GB0024752D0 (en) | 2000-10-10 | 2000-11-22 | Univ Belfast | Oxidative halogenation of aromatic compounds |
| NZ525320A (en) | 2000-10-18 | 2004-10-29 | Glaxosmithkline Biolog S | Combinations of immunostimulatory oligonucleotides (CpG), saponin and optionally lipopolysaccharides as potent vaccine adjuvants |
| US6372492B1 (en) | 2000-10-30 | 2002-04-16 | Isis Pharmaceuticals, Inc. | Antisense modulation of talin expression |
| US6682889B1 (en) | 2000-11-08 | 2004-01-27 | Becton, Dickinson And Company | Amplification and detection of organisms of the Chlamydiaceae family |
| NL1016978C2 (nl) | 2000-12-22 | 2002-06-25 | Robert Jan Colenbrander | Inrichting en werkwijze voor het verpakken en bereiden van voedsel en werkwijze voor het vervaardigen van een dergelijke inrichting. |
| EP1539188B1 (en) | 2001-01-22 | 2015-01-07 | Merck Sharp & Dohme Corp. | Nucleoside derivatives as inhibitors of rna-dependent rna viral polymerase |
| US8008459B2 (en) | 2001-01-25 | 2011-08-30 | Evolva Sa | Concatemers of differentially expressed multiple genes |
| WO2002059297A2 (en) | 2001-01-25 | 2002-08-01 | Evolva Biotech A/S | A library of a collection of cells |
| WO2002059294A1 (en) | 2001-01-26 | 2002-08-01 | Commonwealth Scientific And Industrial Research O Rganisation | Methods and means for producing efficient silencing construct using recombinational cloning |
| US20050277133A1 (en) | 2001-05-18 | 2005-12-15 | Sirna Therapeutics, Inc. | RNA interference mediated treatment of polyglutamine (polyQ) repeat expansion diseases using short interfering nucleic acid (siNA) |
| US20030207804A1 (en) | 2001-05-25 | 2003-11-06 | Muthiah Manoharan | Modified peptide nucleic acids |
| GB0113523D0 (en) | 2001-06-04 | 2001-07-25 | Torotrak Dev Ltd | An Hydraulic control circuit for a continuosly variable transmission |
| US20030069410A1 (en) | 2001-06-14 | 2003-04-10 | Isis Pharmaceuticals, Inc. | Methods for preparing oligonucleotides having chiral phosphorothioate linkages |
| US20050019915A1 (en) | 2001-06-21 | 2005-01-27 | Bennett C. Frank | Antisense modulation of superoxide dismutase 1, soluble expression |
| NZ530632A (en) | 2001-06-29 | 2007-04-27 | Chiron Corp | HCV E1E2 vaccine compositions comprising E1E2 antigens, submicron oil-in-water emulsions and/or CpG oligonucleotides |
| CA2452458A1 (en) | 2001-07-03 | 2003-01-16 | Isis Pharmaceuticals, Inc. | Nuclease resistant chimeric oligonucleotides |
| US7205399B1 (en) | 2001-07-06 | 2007-04-17 | Sirna Therapeutics, Inc. | Methods and reagents for oligonucleotide synthesis |
| US6440739B1 (en) | 2001-07-17 | 2002-08-27 | Isis Pharmaceuticals, Inc. | Antisense modulation of glioma-associated oncogene-2 expression |
| US7425545B2 (en) | 2001-07-25 | 2008-09-16 | Isis Pharmaceuticals, Inc. | Modulation of C-reactive protein expression |
| US6455308B1 (en) | 2001-08-01 | 2002-09-24 | Isis Pharmaceuticals, Inc. | Antisense modulation of serum amyloid A4 expression |
| US7407943B2 (en) | 2001-08-01 | 2008-08-05 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein B expression |
| US7888324B2 (en) | 2001-08-01 | 2011-02-15 | Genzyme Corporation | Antisense modulation of apolipoprotein B expression |
| US7227014B2 (en) | 2001-08-07 | 2007-06-05 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein (a) expression |
| US7259150B2 (en) | 2001-08-07 | 2007-08-21 | Isis Pharmaceuticals, Inc. | Modulation of apolipoprotein (a) expression |
| US7354909B2 (en) | 2001-08-14 | 2008-04-08 | The United States Of America As Represented By Secretary Of The Department Of Health And Human Services | Method for rapid generation of mature dendritic cells |
| WO2003017930A2 (en) | 2001-08-24 | 2003-03-06 | Massachusetts Institute Of Technology | Reagents that facilitate the purification of compounds synthesized on a solid support |
| US7049122B2 (en) | 2001-09-21 | 2006-05-23 | Academia Sinica | Mutant-type lipases and applications thereof |
| US6933288B2 (en) | 2002-02-04 | 2005-08-23 | Isis Pharmaceuticals, Inc. | Pyranosyl cytosines: pharmaceutical formulations and methods |
| JP4348044B2 (ja) | 2002-02-12 | 2009-10-21 | 株式会社キラルジェン | 立体規則性の高いジヌクレオシドホスホロチオエートの製造法 |
| US20040149587A1 (en) | 2002-02-15 | 2004-08-05 | George Hradil | Electroplating solution containing organic acid complexing agent |
| US20030159938A1 (en) | 2002-02-15 | 2003-08-28 | George Hradil | Electroplating solution containing organic acid complexing agent |
| US20050096284A1 (en) | 2002-02-20 | 2005-05-05 | Sirna Therapeutics, Inc. | RNA interference mediated treatment of polyglutamine (polyQ) repeat expansion diseases using short interfering nucleic acid (siNA) |
| US8232383B2 (en) | 2002-02-20 | 2012-07-31 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| JP2005525358A (ja) | 2002-02-28 | 2005-08-25 | ビオタ インコーポレーティッド | ヌクレオチド模倣体およびそのプロドラッグ |
| CA2477795A1 (en) | 2002-02-28 | 2003-09-12 | Kandasamy Sakthivel | Nucleoside 5'-monophosphate mimics and their prodrugs |
| US7288376B2 (en) | 2002-03-22 | 2007-10-30 | Council Of Scientific And Industrial Research | Method of detection of SP-A2 gene variants useful for prediction of predisposition to aspergillosis |
| US20040102394A1 (en) | 2002-11-23 | 2004-05-27 | Isis Pharmaceuticals Inc. | Modulation of huntingtin interacting protein 2 expression |
| US7247621B2 (en) | 2002-04-30 | 2007-07-24 | Valeant Research & Development | Antiviral phosphonate compounds and methods therefor |
| WO2003097662A1 (en) | 2002-05-15 | 2003-11-27 | Isis Pharmaceuticals, Inc. | Antisense modulation of apolipoprotein b expression |
| US20040014108A1 (en) | 2002-05-24 | 2004-01-22 | Eldrup Anne B. | Oligonucleotides having modified nucleoside units |
| AU2003237249A1 (en) | 2002-05-24 | 2003-12-12 | Isis Pharmaceuticals, Inc. | Oligonucleotides having modified nucleoside units |
| US7507808B2 (en) | 2002-12-12 | 2009-03-24 | Isis Pharmaceuticals, Inc. | Modulation of endothelial lipase expression |
| WO2003106477A1 (en) | 2002-06-01 | 2003-12-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds that include carbocyclic nucleosides and their use in gene modulation |
| EP1513552B1 (en) | 2002-06-20 | 2010-12-01 | Cytos Biotechnology AG | Packaged virus-like particles in combination with cpg for use as adjuvants with allergens : method of preparation and use |
| WO2004003228A1 (en) | 2002-07-01 | 2004-01-08 | Unisearch Limited | Genotyping method |
| EP2314690A1 (en) | 2002-07-10 | 2011-04-27 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | RNA-interference by single-stranded RNA molecules |
| US20040023905A1 (en) | 2002-07-31 | 2004-02-05 | Isis Pharmaceuticals Inc. | Antisense modulation of LAR expression |
| US20050042646A1 (en) | 2002-08-05 | 2005-02-24 | Davidson Beverly L. | RNA interference suppresion of neurodegenerative diseases and methods of use thereof |
| US20080274989A1 (en) | 2002-08-05 | 2008-11-06 | University Of Iowa Research Foundation | Rna Interference Suppression of Neurodegenerative Diseases and Methods of Use Thereof |
| US20050255086A1 (en) | 2002-08-05 | 2005-11-17 | Davidson Beverly L | Nucleic acid silencing of Huntington's Disease gene |
| US8729036B2 (en) | 2002-08-07 | 2014-05-20 | University Of Massachusetts | Compositions for RNA interference and methods of use thereof |
| WO2004014312A2 (en) | 2002-08-08 | 2004-02-19 | Sirna Therapeutics, Inc. | Small-mer compositions and methods of use |
| AR040996A1 (es) | 2002-08-19 | 2005-04-27 | Coley Pharm Group Inc | Acidos nucleicos inmunoestimuladores |
| US7414116B2 (en) | 2002-08-23 | 2008-08-19 | Illumina Cambridge Limited | Labelled nucleotides |
| EA008940B1 (ru) | 2002-09-13 | 2007-10-26 | Репликор, Инк. | Антивирусные олигонуклеотиды, не связанные с комплементарностью последовательностей |
| US7572604B2 (en) | 2002-10-07 | 2009-08-11 | Isis Innovation Limited | Modified carbohydrate processing enzyme |
| US7030230B2 (en) | 2002-10-25 | 2006-04-18 | Isis Pharmaceuticals, Inc. | Process of purifying phosphoramidites |
| ATE544466T1 (de) | 2002-10-29 | 2012-02-15 | Coley Pharm Group Inc | Verwendung von cpg oligonukleotide zur behandlung von hepatitis c virus infektion |
| WO2004042018A2 (en) | 2002-11-01 | 2004-05-21 | The Regents Of The University Of Colorado | Dopamine neurons from human embryonic stem cells |
| AU2003291721A1 (en) | 2002-11-05 | 2004-06-03 | Isis Pharmaceuticals, Inc. | Phosphorous-linked oligomeric compounds and their use in gene modulation |
| WO2004044132A2 (en) | 2002-11-05 | 2004-05-27 | Isis Pharmaceuticals, Inc. | Modified oligonucleotides for use in rna interference |
| CA2505090A1 (en) | 2002-11-05 | 2004-05-27 | Isis Pharmaceuticals, Inc. | Conjugated oligomeric compounds and their use in gene modulation |
| CA2504694C (en) | 2002-11-05 | 2013-10-01 | Isis Pharmaceuticals, Inc. | Polycyclic sugar surrogate-containing oligomeric compounds and compositions for use in gene modulation |
| US7381527B2 (en) | 2002-11-06 | 2008-06-03 | Council Of Scientific And Industrial Research | Method of detection of SP-A2 gene variants |
| US7511131B2 (en) | 2002-11-13 | 2009-03-31 | Genzyme Corporation | Antisense modulation of apolipoprotein B expression |
| AU2003294281B2 (en) | 2002-11-13 | 2010-05-20 | Kastle Therapeutics, Llc | Antisense modulation of apolipoprotein B expression |
| DK2284266T3 (da) | 2002-11-14 | 2014-01-13 | Thermo Fisher Scient Biosciences Inc | sIRNA-MOLEKYLE MOD TP53 |
| WO2004080466A1 (en) | 2003-03-07 | 2004-09-23 | Ribapharm Inc. | Cytidine analogs and methods of use |
| EP3450559A1 (en) | 2003-03-07 | 2019-03-06 | Alnylam Pharmaceuticals, Inc. | Therapeutic compositions |
| WO2004083432A1 (en) | 2003-03-21 | 2004-09-30 | Academisch Ziekenhuis Leiden | Modulation of exon recognition in pre-mrna by interfering with the secondary rna structure |
| GB0306657D0 (en) | 2003-03-24 | 2003-04-30 | Avecia Ltd | Process and compounds |
| EP1605972A2 (en) | 2003-03-26 | 2005-12-21 | Cytos Biotechnology AG | Hiv-peptide-carrier-conjugates |
| US7537767B2 (en) | 2003-03-26 | 2009-05-26 | Cytis Biotechnology Ag | Melan-A- carrier conjugates |
| ITRM20030149A1 (it) | 2003-04-02 | 2004-10-03 | Giuliani Spa | Oligonucleotidi (odn) antisenso per smad7 e loro usi in campo medico |
| US7598227B2 (en) | 2003-04-16 | 2009-10-06 | Isis Pharmaceuticals Inc. | Modulation of apolipoprotein C-III expression |
| US7470724B2 (en) | 2003-04-25 | 2008-12-30 | Gilead Sciences, Inc. | Phosphonate compounds having immuno-modulatory activity |
| EP1617848A2 (en) | 2003-04-25 | 2006-01-25 | Gilead Sciences, Inc. | Anti-cancer phosphonate conjugates |
| US20090247488A1 (en) | 2003-04-25 | 2009-10-01 | Carina Cannizzaro | Anti-inflammatory phosphonate compounds |
| US20050261237A1 (en) | 2003-04-25 | 2005-11-24 | Boojamra Constantine G | Nucleoside phosphonate analogs |
| EA014685B1 (ru) | 2003-04-25 | 2010-12-30 | Джилид Сайэнс, Инк. | Фосфонатсодержащие антивирусные соединения (варианты) и фармацевтическая композиция на их основе |
| US7452901B2 (en) | 2003-04-25 | 2008-11-18 | Gilead Sciences, Inc. | Anti-cancer phosphonate analogs |
| WO2004096233A2 (en) | 2003-04-25 | 2004-11-11 | Gilead Sciences, Inc. | Nucleoside phosphonate conjugates |
| WO2005002626A2 (en) | 2003-04-25 | 2005-01-13 | Gilead Sciences, Inc. | Therapeutic phosphonate compounds |
| US7432261B2 (en) | 2003-04-25 | 2008-10-07 | Gilead Sciences, Inc. | Anti-inflammatory phosphonate compounds |
| CN101410120A (zh) | 2003-04-25 | 2009-04-15 | 吉里德科学公司 | 抗炎的膦酸酯化合物 |
| US7407965B2 (en) | 2003-04-25 | 2008-08-05 | Gilead Sciences, Inc. | Phosphonate analogs for treating metabolic diseases |
| US7045306B2 (en) | 2003-04-28 | 2006-05-16 | The General Hospital Corporation | Method for identifying compounds in vitro that modulate the dysregulation of transcription of transcription mediated by mutant huntingtin protein |
| US7214491B2 (en) | 2003-05-07 | 2007-05-08 | E. I. Du Pont De Nemours And Company | Δ-12 desaturase gene suitable for altering levels of polyunsaturated fatty acids in oleaginous yeasts |
| WO2004101787A1 (ja) | 2003-05-14 | 2004-11-25 | Japan Science And Technology Agency | ハンチンチン遺伝子の発現抑制 |
| CA2524495A1 (en) | 2003-06-03 | 2005-01-13 | Eli Lilly And Company | Modulation of survivin expression |
| CA2528774A1 (en) | 2003-06-20 | 2005-01-27 | Coley Pharmaceutical Gmbh | Small molecule toll-like receptor (tlr) antagonists |
| WO2005013901A2 (en) | 2003-07-31 | 2005-02-17 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding rnas |
| JP2005089441A (ja) | 2003-08-08 | 2005-04-07 | Toudai Tlo Ltd | 立体規則性の高いリン原子修飾ヌクレオチド類縁体の製造法 |
| JP2011088935A (ja) | 2003-08-08 | 2011-05-06 | Chiralgen Ltd | リン原子修飾ヌクレオチド類縁体の製造のための光学活性ヌクレオシド3’−ホスホロアミダイト |
| US7825235B2 (en) | 2003-08-18 | 2010-11-02 | Isis Pharmaceuticals, Inc. | Modulation of diacylglycerol acyltransferase 2 expression |
| JP2007502778A (ja) | 2003-08-21 | 2007-02-15 | グリフィス ユニバーシティ | 新規スルフェンアミドオキシド |
| JP2007502779A (ja) | 2003-08-21 | 2007-02-15 | グリフィス ユニバーシティ | 新規スルフェンアミド |
| WO2005021568A2 (en) | 2003-08-27 | 2005-03-10 | Biota, Inc. | Novel tricyclic nucleosides or nucleotides as therapeutic agents |
| JP4731324B2 (ja) | 2003-08-28 | 2011-07-20 | 武 今西 | N−o結合性架橋構造型新規人工核酸 |
| JP4580870B2 (ja) | 2003-09-02 | 2010-11-17 | 株式会社キラルジェン | リボヌクレオチド又はリボヌクレオチド誘導体の製造方法 |
| JP4616175B2 (ja) | 2003-09-02 | 2011-01-19 | 株式会社キラルジェン | 5’−ホスフィチル化モノマーおよびh−ホスホネートオリゴヌクレオチド誘導体の製造方法 |
| US20050074801A1 (en) | 2003-09-09 | 2005-04-07 | Monia Brett P. | Chimeric oligomeric compounds comprising alternating regions of northern and southern conformational geometry |
| US20050053981A1 (en) | 2003-09-09 | 2005-03-10 | Swayze Eric E. | Gapped oligomeric compounds having linked bicyclic sugar moieties at the termini |
| DK3342425T3 (da) | 2003-09-09 | 2020-03-16 | Geron Corp | Modificerede oligonukleotider til inhibering af telomerase |
| US8680063B2 (en) | 2003-09-12 | 2014-03-25 | University Of Massachusetts | RNA interference for the treatment of gain-of-function disorders |
| EP2821085B1 (en) | 2003-09-12 | 2020-04-29 | University of Massachusetts | Rna interference for the treatment of gain-of-function disorders |
| GB0323968D0 (en) | 2003-10-13 | 2003-11-19 | Glaxosmithkline Biolog Sa | Immunogenic compositions |
| KR101107818B1 (ko) | 2003-10-30 | 2012-01-31 | 콜레이 파마시티컬 그룹, 인코포레이티드 | 향상된 면역자극 효능을 가진 c-부류 올리고뉴클레오티드유사체 |
| US20050239102A1 (en) | 2003-10-31 | 2005-10-27 | Verdine Gregory L | Nucleic acid binding oligonucleotides |
| US7846436B2 (en) | 2003-11-28 | 2010-12-07 | Chemgenes Corporation | Oligonucleotides and related compounds |
| AU2003300239A1 (en) | 2003-12-29 | 2005-07-21 | Galapagos Genomics N.V. | Modulators of bone homeostasis identified in a high-throughput screen |
| WO2005070859A1 (ja) | 2004-01-27 | 2005-08-04 | Takeshi Wada | フルオラス担体およびそれを用いたオリゴヌクレオチド誘導体の製造方法 |
| US20050176045A1 (en) | 2004-02-06 | 2005-08-11 | Dharmacon, Inc. | SNP discriminatory siRNA |
| EP1725250A2 (en) | 2004-02-18 | 2006-11-29 | Frutarom Ltd. | Method for the preparation of peptide-oligonucleotide conjugates |
| JP3976742B2 (ja) | 2004-02-27 | 2007-09-19 | 江守商事株式会社 | インターフェロンアルファを誘導する免疫刺激オリゴヌクレオチド |
| WO2005085272A1 (ja) | 2004-03-05 | 2005-09-15 | Takeshi Wada | ボラノホスフェートモノマーおよびそれを用いたオリゴヌクレオチド誘導体の製造方法 |
| JP4865544B2 (ja) | 2004-03-25 | 2012-02-01 | 株式会社キラルジェン | 立体規則性の高いリボヌクレオチド類縁体及びデオキシリボヌクレオチド類縁体の製造法 |
| US20050244869A1 (en) | 2004-04-05 | 2005-11-03 | Brown-Driver Vickie L | Modulation of transthyretin expression |
| AU2005230684B2 (en) | 2004-04-05 | 2011-10-06 | Alnylam Pharmaceuticals, Inc. | Process and reagents for oligonucleotide synthesis and purification |
| TWI350168B (en) | 2004-05-07 | 2011-10-11 | Incyte Corp | Amido compounds and their use as pharmaceuticals |
| WO2005116268A2 (en) | 2004-05-27 | 2005-12-08 | The Government Of The United States Of America As Represented By The Secretary, Department Of Health | Differential expression of molecules associated with acute stroke |
| US7759318B1 (en) | 2004-05-28 | 2010-07-20 | Isis Pharmaceuticals, Inc. | Identification of novel pathways, genes and promoter motifs regulating adipogenesis |
| JP2008501693A (ja) | 2004-06-03 | 2008-01-24 | アイシス ファーマシューティカルズ、インク. | 遺伝子調節で使用するための個別に調節された鎖を有する二本鎖組成物 |
| EP2206781B1 (en) | 2004-06-28 | 2015-12-02 | The University Of Western Australia | Antisense oligonucleotides for inducing exon skipping and methods of use thereof |
| EP1786472B1 (en) | 2004-08-10 | 2013-01-16 | Genzyme Corporation | Antisense modulation of apolipoprotein b expression |
| JP5157168B2 (ja) | 2004-08-26 | 2013-03-06 | 日本新薬株式会社 | ホスホロアミダイト化合物及びオリゴrnaの製法 |
| US20070066551A1 (en) | 2004-09-07 | 2007-03-22 | Keefe Anthony D | Aptamer medicinal chemistry |
| US7884086B2 (en) | 2004-09-08 | 2011-02-08 | Isis Pharmaceuticals, Inc. | Conjugates for use in hepatocyte free uptake assays |
| US20090203132A1 (en) | 2004-09-09 | 2009-08-13 | Swayze Eric E | Pyrrolidinyl groups for attaching conjugates to oligomeric compounds |
| EP1799859B1 (en) | 2004-09-17 | 2014-07-02 | Isis Pharmaceuticals, Inc. | Enhanced antisense oligonucleotides |
| CA2582464A1 (en) | 2004-10-13 | 2006-04-27 | Sanjay Bhanot | Antisense modulation of ptp1b expression |
| US8212011B2 (en) | 2004-11-03 | 2012-07-03 | University Of Kansas | Novobiocin analogues |
| WO2006050501A2 (en) | 2004-11-03 | 2006-05-11 | University Of Kansas | Novobiocin analogues as anticancer agents |
| US9120774B2 (en) | 2004-11-03 | 2015-09-01 | University Of Kansas | Novobiocin analogues having modified sugar moieties |
| US8212012B2 (en) | 2004-11-03 | 2012-07-03 | University Of Kansas | Novobiocin analogues having modified sugar moieties |
| US7622451B2 (en) | 2004-11-03 | 2009-11-24 | University Of Kansas | Novobiocin analogues as neuroprotective agents and in the treatment of autoimmune disorders |
| KR100721928B1 (ko) | 2004-11-05 | 2007-05-28 | 주식회사 바이오씨에스 | CpG 올리고데옥시뉴클레오티드를 함유하는 피부질환의치료 또는 예방용 약학적 조성물 |
| EP1657307A1 (en) | 2004-11-16 | 2006-05-17 | Immunotech S.A. | Oligonucleotides that induce the secretion of GM-CSF |
| EP1819365B1 (en) | 2004-12-09 | 2014-07-02 | Alnylam Pharmaceuticals Inc. | Compositions and methods for inducing an immune response in a mammal and methods of avoiding an immune response to oligonucleotide agents such as short interfering RNAs |
| US9809824B2 (en) | 2004-12-13 | 2017-11-07 | The United States Of America, Represented By The Secretary, Department Of Health And Human Services | CpG oligonucleotide prodrugs, compositions thereof and associated therapeutic methods |
| WO2006066260A2 (en) | 2004-12-17 | 2006-06-22 | Thiosense, Inc. | Compositions of and methods for producing phosphorus-chiral monomers and oligomers |
| US20070099851A1 (en) | 2004-12-30 | 2007-05-03 | Linn Gregory S | Stable analogues of ribose-1-phosphate and methods for treating diabetes and other metabolic disorders |
| US20060183763A1 (en) | 2004-12-31 | 2006-08-17 | Pfizer Inc | Novel pyrrolidyl derivatives of heteroaromatic compounds |
| EP1841777B1 (en) | 2005-01-28 | 2015-09-30 | Kwon, Hyung-Joo | Oligonucleotides derived from mycobacterium for stimulating immune function, treating immune-related diseases, atopic dermatitis and/or protecting normal immune cell |
| WO2006091915A2 (en) | 2005-02-24 | 2006-08-31 | Coley Pharmaceutical Group, Inc. | Immunostimulatory oligonucleotides |
| WO2006137953A1 (en) | 2005-04-01 | 2006-12-28 | The Regents Of The Univerisity Of California | Phosphono-pent-2-en-1-yl nucleosides and analogs |
| CA2591586A1 (en) | 2005-05-05 | 2006-11-09 | Antisense Pharma Gmbh | Dosage of oligonucleotides |
| US7902352B2 (en) | 2005-05-06 | 2011-03-08 | Medtronic, Inc. | Isolated nucleic acid duplex for reducing huntington gene expression |
| WO2006121960A2 (en) | 2005-05-06 | 2006-11-16 | Medtronic, Inc. | Methods and sequences to suppress primate huntington gene expression |
| HUE027486T2 (en) | 2005-06-23 | 2016-09-28 | Isis Pharmaceuticals Inc | Preparations and methods for modifying SMN2-Splicing |
| US9133517B2 (en) | 2005-06-28 | 2015-09-15 | Medtronics, Inc. | Methods and sequences to preferentially suppress expression of mutated huntingtin |
| WO2007002904A2 (en) | 2005-06-28 | 2007-01-04 | Medtronic, Inc. | Methods and sequences to preferentially suppress expression of mutated huntingtin |
| US20090162316A1 (en) | 2005-07-05 | 2009-06-25 | Harvard University | Liver targeted conjugates |
| JP4984634B2 (ja) | 2005-07-21 | 2012-07-25 | ソニー株式会社 | 物理情報取得方法および物理情報取得装置 |
| US8632963B2 (en) | 2005-07-28 | 2014-01-21 | Id-Fish Technology Inc. | Method for improving cell permeability to foreign particles |
| DE602006019455D1 (de) | 2005-08-29 | 2011-02-17 | Regulus Therapeutics Inc | Verfahren für mir-122a-modulation |
| EP1937312B1 (en) | 2005-08-30 | 2016-06-29 | Ionis Pharmaceuticals, Inc. | Chimeric oligomeric compounds for modulation of splicing |
| US7700567B2 (en) | 2005-09-29 | 2010-04-20 | Supergen, Inc. | Oligonucleotide analogues incorporating 5-aza-cytosine therein |
| US20070077993A1 (en) | 2005-09-30 | 2007-04-05 | Midgley Timothy M | Method and apparatus for collecting user game play data and crediting users in a gaming environment |
| EP2982679A1 (en) | 2005-10-12 | 2016-02-10 | Idera Pharmaceuticals, Inc. | Immune regulatory oligonucleotide (iro) compounds to modulate toll-like receptor based immune response |
| US9308252B2 (en) | 2005-10-27 | 2016-04-12 | Cook Biotech, Inc. | Extracellular matrix materials as vaccine adjuvants for diseases associated with infectious pathogens or toxins |
| EP1942185A4 (en) | 2005-10-28 | 2009-11-25 | Tosoh Corp | PROCESS FOR PREPARING CAROTINOIDY SYNTHETIZING MICROORGANISM AND METHOD FOR CAROTINOID PRODUCTION |
| EP2325315B1 (en) | 2005-10-28 | 2014-05-07 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for inhibiting expression of huntingtin gene |
| JP2009515896A (ja) | 2005-11-11 | 2009-04-16 | ファイザー・インク | 免疫調節性オリゴデオキシヌクレオチドを使用する併用療法 |
| WO2007064291A1 (en) | 2005-11-30 | 2007-06-07 | Jyoti Chattopadhyaya | Method and compounds for rna synthesis |
| ES2707787T3 (es) | 2005-12-02 | 2019-04-05 | Ionis Pharmaceuticals Inc | Análogos antibacterianos de aminoglucósido 4,5-sustituidos que tienen sustituyentes múltiples |
| US8076303B2 (en) | 2005-12-13 | 2011-12-13 | Spring Bank Pharmaceuticals, Inc. | Nucleotide and oligonucleotide prodrugs |
| GEP20104974B (en) | 2005-12-21 | 2010-04-26 | Pfizer Prod Inc | Carbonylamino pyrrolopyrazoles, protent kinase inhibitors |
| PL3210633T3 (pl) | 2006-01-26 | 2019-12-31 | Ionis Pharmaceuticals, Inc. | Kompozycje i ich zastosowania ukierunkowane na huntingtynę |
| PL2314594T3 (pl) | 2006-01-27 | 2014-12-31 | Isis Pharmaceuticals Inc | Zmodyfikowane w pozycji 6 analogi bicykliczne kwasów nukleinowych |
| ES2553284T5 (es) | 2006-02-15 | 2021-08-31 | Rechtsanwalt Thomas Beck | Composiciones y procedimientos para formulaciones de oligonucleótidos |
| JP4713514B2 (ja) | 2006-02-20 | 2011-06-29 | エフ.ホフマン−ラ ロシュ アーゲー | 改善された標識試薬 |
| US8383660B2 (en) | 2006-03-10 | 2013-02-26 | Pfizer Inc. | Dibenzyl amine compounds and derivatives |
| CA2647827A1 (en) | 2006-03-31 | 2007-10-11 | Applied Biosystems Inc. | Reagents useful for synthesizing rhodamine-labeled oligonucleotides |
| US8088582B2 (en) | 2006-04-06 | 2012-01-03 | Ibis Biosciences, Inc. | Compositions for the use in identification of fungi |
| JP5016666B2 (ja) | 2006-04-20 | 2012-09-05 | エフ.ホフマン−ラ ロシュ アーゲー | ケモカイン受容体のジアゼパン誘導体モジュレーター |
| WO2007123386A1 (es) | 2006-04-24 | 2007-11-01 | Sigma Alimentos, S.A. De C.V. | Método para la detección y cuantificación múltiple y simultánea de patógenos mediante la reacción en cadena de la polimerasa en tiempo real |
| WO2007127219A2 (en) | 2006-04-25 | 2007-11-08 | Immune Disease Institute, Inc. | Targeted delivery to leukocytes using protein carriers |
| GB0608838D0 (en) | 2006-05-04 | 2006-06-14 | Novartis Ag | Organic compounds |
| EP2023936A4 (en) | 2006-05-05 | 2010-11-24 | Isis Pharmaceuticals Inc | COMPOSITIONS AND THEIR USES ASSOCIATED WITH THE ALPHA PTPR RECEPTOR |
| JP2009536222A (ja) | 2006-05-05 | 2009-10-08 | アイシス ファーマシューティカルズ, インコーポレーテッド | Pcsk9の発現を調節するための化合物および方法 |
| US20090012120A1 (en) | 2006-05-10 | 2009-01-08 | Board Of Trustees Of Michigan State University | Synthesis of N-heterocycles, beta-amino acids, and allyl amines via aza-payne mediated reaction of ylides and hydroxy aziridines |
| US7666854B2 (en) | 2006-05-11 | 2010-02-23 | Isis Pharmaceuticals, Inc. | Bis-modified bicyclic nucleic acid analogs |
| CA2651453C (en) | 2006-05-11 | 2014-10-14 | Isis Pharmaceuticals, Inc. | 5'-modified bicyclic nucleic acid analogs |
| CN101460620B (zh) | 2006-05-31 | 2012-02-15 | 东丽株式会社 | 免疫刺激寡核苷酸及其药物用途 |
| US8097596B2 (en) | 2006-06-30 | 2012-01-17 | Lakewood-Amedex, Inc. | Compositions and methods for the treatment of muscle wasting |
| CA2662704A1 (en) | 2006-07-07 | 2008-01-10 | University Of Massachusetts | Rna silencing compositions and methods for the treatment of huntington's disease |
| US20090093425A1 (en) | 2006-07-12 | 2009-04-09 | The Regents Of The University Of California | Transducible delivery of nucleic acids by reversible phosphotriester charge neutralization protecting groups |
| EP2051977A2 (en) | 2006-07-20 | 2009-04-29 | Amgen Inc. | SUBSTITUTED AZOLE AROMATIC HETEROCYCLES AS INHIBITORS OF LLbeta-HSD-1 |
| GB0614947D0 (en) | 2006-07-27 | 2006-09-06 | Isis Innovation | Epitope reduction therapy |
| CA2660052A1 (en) | 2006-08-04 | 2008-02-07 | Isis Pharmaceuticals, Inc. | Compositions and methods for the modulation of jnk proteins |
| AT504194B1 (de) | 2006-09-07 | 2008-07-15 | Oesterr Rotes Kreuz | Bakteriennachweis |
| US8138330B2 (en) | 2006-09-11 | 2012-03-20 | Sigma-Aldrich Co. Llc | Process for the synthesis of oligonucleotides |
| NZ575437A (en) | 2006-09-27 | 2012-02-24 | Coley Pharm Gmbh | Cpg oligonucleotide analogs containing hydrophobic t analogs with enhanced immunostimulatory activity |
| DK2092065T4 (da) | 2006-10-18 | 2019-10-21 | Ionis Pharmaceuticals Inc | Antisense-forbindelser |
| AU2007309195A1 (en) | 2006-10-23 | 2008-05-02 | Irm Llc | Cathepsin proteases inhibitors |
| CN101558157A (zh) | 2006-10-26 | 2009-10-14 | 科勒制药有限责任公司 | 寡核糖核苷酸及其应用 |
| FR2908414B1 (fr) | 2006-11-13 | 2012-01-20 | Centre Nat Rech Scient | Immobilisation de proteines membranaires sur un support par l'intermediaire d'une molecule amphiphile |
| WO2008060621A2 (en) | 2006-11-17 | 2008-05-22 | Abbott Laboratories | Aminopyrrolidines as chemokine receptor antagonists |
| US8084437B2 (en) | 2006-11-27 | 2011-12-27 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| US8093222B2 (en) | 2006-11-27 | 2012-01-10 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| WO2008073959A2 (en) | 2006-12-12 | 2008-06-19 | Idera Pharmaceuticals, Inc. | Synthetic agonists of tlr9 |
| UY30892A1 (es) | 2007-02-07 | 2008-09-02 | Smithkline Beckman Corp | Inhibidores de la actividad akt |
| US20100190837A1 (en) | 2007-02-15 | 2010-07-29 | Isis Pharmaceuticals, Inc. | 5'-Substituted-2-F' Modified Nucleosides and Oligomeric Compounds Prepared Therefrom |
| CN101679979A (zh) | 2007-03-24 | 2010-03-24 | 基酶有限公司 | 施用与人载脂蛋白b互补的反义寡核苷酸 |
| US7960353B2 (en) | 2007-05-10 | 2011-06-14 | University Of Kansas | Novobiocin analogues as neuroprotective agents and in the treatment of autoimmune disorders |
| PL2158316T3 (pl) | 2007-05-11 | 2015-10-30 | Adynxx Inc | Ekspresja genowa oraz ból |
| US8222407B2 (en) * | 2007-05-24 | 2012-07-17 | Kyorin Pharmaceutical Co., Ltd. | Mutilin derivative having heterocyclic aromatic ring carboxylic acid structure in substituent at 14-position |
| GB0710186D0 (en) | 2007-05-29 | 2007-07-04 | Texas Instr Denmark | PWM loop with minimum allasing error property |
| CA2688321A1 (en) | 2007-05-30 | 2008-12-11 | Isis Pharmaceuticals, Inc. | N-substituted-aminomethylene bridged bicyclic nucleic acid analogs |
| KR20100038295A (ko) | 2007-06-05 | 2010-04-14 | 엔에스아베 필리알 아프 뉴로서치 스웨덴 아베 스베리게 | 피질 카테콜아민성 신경 전달의 조정자로서의 이치환된 페닐피롤리딘 |
| EP2173760B2 (en) | 2007-06-08 | 2015-11-04 | Isis Pharmaceuticals, Inc. | Carbocyclic bicyclic nucleic acid analogs |
| US20100298280A1 (en) | 2007-06-13 | 2010-11-25 | Petra Kioschis-Schneider | Compounds for the Modulation of Huntingtin Aggregation, Methods and Means for Identifying Such Compounds |
| DE602007005629D1 (de) | 2007-06-18 | 2010-05-12 | Commissariat Energie Atomique | Reversibles siRNA-Silencing eines mutierten und endogenen Huntington-Wildtypgens und dessen Anwendung zur Behandlung von Morbus Huntington |
| GB0712494D0 (en) | 2007-06-27 | 2007-08-08 | Isis Innovation | Substrate reduction therapy |
| ES2376507T5 (es) | 2007-07-05 | 2015-08-31 | Isis Pharmaceuticals, Inc. | Análogos de ácidos nucleicos bicíclicos 6-disustituidos |
| WO2009014887A2 (en) | 2007-07-09 | 2009-01-29 | Idera Pharmaceuticals, Inc. | Stabilized immune modulatory rna (simra) compounds |
| TWI413530B (zh) | 2007-07-20 | 2013-11-01 | Kao Corp | 有機聚矽氧 |
| US8008011B2 (en) | 2007-07-31 | 2011-08-30 | University Of Saskatchewan | Genetic variation in pro-melanin-concentrating hormone gene affects carcass traits in cattle |
| US7812003B2 (en) | 2007-08-02 | 2010-10-12 | Safe Stephen H | Antisense microRNA and uses therefor |
| WO2009023819A2 (en) | 2007-08-15 | 2009-02-19 | Idera Pharmaceuticals, Inc. | Toll like receptor modulators |
| EP2215102B1 (en) | 2007-10-01 | 2016-02-17 | Ionis Pharmaceuticals, Inc. | Antisense modulation of fibroblast growth factor receptor 4 expression |
| KR100886139B1 (ko) | 2007-11-13 | 2009-02-27 | 주식회사 삼천리제약 | 올리고뉴클레오타이드의 제조방법 |
| AR069869A1 (es) | 2007-12-21 | 2010-02-24 | Exelixis Inc | Derivados de benzofuro[3,2-d]pirimidinas inhibidores de proteinquinasas,composiciones farmaceuticas que los comprenden y usos de los mismos en el tratamiento del cancer. |
| TWI340765B (en) | 2007-12-26 | 2011-04-21 | Ind Tech Res Inst | Oligonucleotide sequences and dna chip for identifying filamentous microorganisms and the identification method thereof |
| WO2009089689A1 (en) | 2008-01-15 | 2009-07-23 | Mediatek Inc. | Multimedia presenting system, multimedia processing apparatus thereof, and method for presenting video and audio signals |
| WO2009089659A1 (en) | 2008-01-18 | 2009-07-23 | Shanghai Targetdrug Co., Ltd. | Pyrollidine-based compounds |
| JP2011515653A (ja) | 2008-02-04 | 2011-05-19 | ガラパゴス・ナムローゼ・フェンノートシャップ | 神経変性疾患の治療に有用な標的配列及びそれらの同定方法 |
| JP2009190983A (ja) | 2008-02-12 | 2009-08-27 | Tokyo Institute Of Technology | オリゴヌクレオチド誘導体 |
| WO2009117589A1 (en) | 2008-03-21 | 2009-09-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising tricyclic nucleosides and methods for their use |
| WO2009120878A2 (en) | 2008-03-26 | 2009-10-01 | Alnylam Pharmaceuticals, Inc. | Non-natural ribonucleotides, and methods of use thereof |
| CN103816174B (zh) | 2008-04-03 | 2017-12-05 | 春堤制药公司 | 用于治疗病毒感染的化合物和方法 |
| WO2009124238A1 (en) | 2008-04-04 | 2009-10-08 | Isis Pharmaceuticals, Inc. | Oligomeric compounds comprising neutrally linked terminal bicyclic nucleosides |
| EP2262820B1 (de) | 2008-04-04 | 2013-06-19 | Universität Hamburg | Verfahren zur stereoselektiven synthese von phosphorverbindungen |
| US8679750B2 (en) | 2008-05-09 | 2014-03-25 | The University Of British Columbia | Methods and compositions for the treatment of Huntington'S disease |
| AU2009244013B2 (en) | 2008-05-09 | 2015-06-25 | The University Of British Columbia | Methods and compositions for the treatment of Huntington's disease |
| EP2300102B1 (en) | 2008-05-15 | 2014-01-08 | Dynavax Technologies Corporation | Immunostimulatory sequences containing CpG for use in the treatment of allergic rhinitis |
| WO2009143387A2 (en) | 2008-05-22 | 2009-11-26 | Isis Pharmaceuticals, Inc. | Modulation of smrt expression |
| WO2009143391A2 (en) | 2008-05-22 | 2009-11-26 | Isis Pharmaceuticals, Inc | Methods for modulation expression of creb |
| WO2009143390A2 (en) | 2008-05-22 | 2009-11-26 | Isis Pharmaceuticals, Inc. | Methods for modulating expression of rbp4 |
| WO2009148605A2 (en) | 2008-06-04 | 2009-12-10 | Isis Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia |
| CA2728559A1 (en) | 2008-07-03 | 2010-01-07 | Exelixis Inc. | Cdk modulators |
| WO2010030849A1 (en) | 2008-09-12 | 2010-03-18 | University Of Louisville Research Foundation, Inc. | Compositions and methods for treating cancer,inhibiting proliferation, and inducing cell death |
| US8163707B2 (en) | 2008-09-15 | 2012-04-24 | Enanta Pharmaceuticals, Inc. | 4′-allene-substituted nucleoside derivatives |
| EP3067359A1 (en) | 2008-09-23 | 2016-09-14 | Scott G. Petersen | Self delivering bio-labile phosphate protected pro-oligos for oligonucleotide based therapeutics and mediating rna interference |
| DK2361256T3 (da) | 2008-09-24 | 2013-07-01 | Isis Pharmaceuticals Inc | Cyclohexenyl-nukleinsyreanaloger |
| DK2356129T3 (da) | 2008-09-24 | 2013-05-13 | Isis Pharmaceuticals Inc | Substituerede alpha-L-bicykliske nukleosider |
| KR20110086815A (ko) | 2008-10-07 | 2011-08-01 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 텔로머라제 억제제 및 그의 사용 방법 |
| US8765931B2 (en) | 2008-10-22 | 2014-07-01 | Quark Pharmaceuticals, Inc. | Double-stranded oligonucleotide compound for down-regulating the expression of CASP2 gene |
| WO2010048549A2 (en) | 2008-10-24 | 2010-04-29 | Isis Pharmaceuticals, Inc. | 5' and 2' bis-substituted nucleosides and oligomeric compounds prepared therefrom |
| EP2447274B1 (en) | 2008-10-24 | 2017-10-04 | Ionis Pharmaceuticals, Inc. | Oligomeric compounds and methods |
| CA2744987C (en) | 2008-12-02 | 2018-01-16 | Chiralgen, Ltd. | Method for the synthesis of phosphorus atom modified nucleic acids |
| JP2012513450A (ja) | 2008-12-23 | 2012-06-14 | ギリンダス・アメリカ・インコーポレイテッド | 硫化剤およびオリゴヌクレオチドを合成するためのその使用 |
| WO2010080953A1 (en) | 2009-01-08 | 2010-07-15 | Isis Pharmaceuticals, Inc. | Transgenic murine model of human lipoprotein metabolism, hypercholesterolemia and cardiovascular disease |
| KR20100087540A (ko) | 2009-01-28 | 2010-08-05 | 삼성전자주식회사 | 잉크젯 기록용 잉크 조성물 |
| WO2010091301A1 (en) | 2009-02-06 | 2010-08-12 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and excipients |
| EP2396409A2 (en) | 2009-02-10 | 2011-12-21 | Idera Pharmaceuticals, Inc. | Synthetic rna-based agonists of tlr7 |
| JP5766617B2 (ja) | 2009-02-20 | 2015-08-19 | ユニバーシティ・オブ・カンザス | 修飾された糖部分を有するノボビオシン類似体 |
| AU2010221419B2 (en) | 2009-03-02 | 2015-10-01 | Alnylam Pharmaceuticals, Inc. | Nucleic acid chemical modifications |
| US9107933B2 (en) | 2009-03-16 | 2015-08-18 | Isis Pharmaceuticals, Inc. | Compositions and methods of targeting apolipoprotein B for the reduction of apolipoprotein C-III |
| WO2010113937A1 (ja) | 2009-03-31 | 2010-10-07 | 武田薬品工業株式会社 | ヌクレオシドの製造方法 |
| US8987222B2 (en) | 2009-04-08 | 2015-03-24 | University Of Massachusetts | Single nucleotide polymorphism (SNP) targeting therapies for the treatment of huntington'S disease |
| US20120156138A1 (en) | 2009-04-14 | 2012-06-21 | Smith Larry J | Methods and Compositions for the Treatment of Medical Conditions Involving Cellular Reprogramming |
| WO2010129853A2 (en) | 2009-05-07 | 2010-11-11 | The Regents Of The University Of California | TRANSDUCIBLE DELIVERY OF NUCLEIC ACIDS USING MODIFIED dsRNA BINDING DOMAINS |
| WO2010141471A2 (en) | 2009-06-01 | 2010-12-09 | The Regents Of The University Of California | Nucleic acid delivery compositions and methods of use thereof |
| EP2437753B1 (en) | 2009-06-05 | 2016-08-31 | Infectious Disease Research Institute | Synthetic glucopyranosyl lipid adjuvants and vaccine compositions containing them |
| DK3449926T3 (da) | 2009-06-17 | 2019-11-11 | Biogen Ma Inc | Sammensætninger og fremgangsmåder til modulering af smn2-splejsning hos et individ |
| JP5670097B2 (ja) | 2009-06-19 | 2015-02-18 | 花王株式会社 | 二層分離型毛髪化粧料 |
| WO2010150789A1 (ja) | 2009-06-23 | 2010-12-29 | 武田薬品工業株式会社 | 核酸の合成法 |
| US8329024B2 (en) | 2009-07-06 | 2012-12-11 | Ada Technologies, Inc. | Electrochemical device and method for long-term measurement of hypohalites |
| AU2010270714B2 (en) | 2009-07-06 | 2015-08-13 | Wave Life Sciences Ltd. | Novel nucleic acid prodrugs and methods use thereof |
| US8927513B2 (en) | 2009-07-07 | 2015-01-06 | Alnylam Pharmaceuticals, Inc. | 5′ phosphate mimics |
| WO2011005942A2 (en) | 2009-07-08 | 2011-01-13 | Idera Pharmaceuticals, Inc. | Oligonucleotide-based compounds as inhibitors of toll-like receptors |
| WO2011010706A1 (ja) | 2009-07-23 | 2011-01-27 | 武田薬品工業株式会社 | Fgf21シスエレメント結合物質 |
| WO2011015572A1 (en) | 2009-08-03 | 2011-02-10 | Galapagos Nv | Molecular targets and compounds, and methods to identify the same, useful in the treatment of neurodegenerative diseases |
| WO2011015573A1 (en) | 2009-08-03 | 2011-02-10 | Galapagos Nv | Molecular targets and compounds, and methods to identify the same, useful in the treatment of neurodegenerative diseases |
| UA107360C2 (en) | 2009-08-05 | 2014-12-25 | Biogen Idec Inc | Bicyclic aryl sphingosine 1-phosphate analogs |
| EP2462153B1 (en) | 2009-08-06 | 2015-07-29 | Isis Pharmaceuticals, Inc. | Bicyclic cyclohexose nucleic acid analogs |
| US8927553B2 (en) | 2009-08-10 | 2015-01-06 | Daljit Singh Dhanoa | Deuterium-enriched alkyl sulfonamides and uses thereof |
| CA2931725C (en) | 2009-09-11 | 2021-10-19 | Ionis Pharmaceuticals, Inc. | Modulation of huntingtin expression |
| JP5878758B2 (ja) | 2009-09-16 | 2016-03-08 | 株式会社Wave Life Sciences Japan | Rna及びその誘導体合成のための新規保護基 |
| EP2480667A4 (en) | 2009-09-25 | 2013-07-03 | Isis Pharmaceuticals Inc | MODULATION OF TTC39 EXPRESSION FOR HDL INCREASE |
| EA201290147A1 (ru) | 2009-10-15 | 2012-11-30 | Пфайзер Инк. | Пирроло[2,3-d]пиримидиновые соединения |
| TWI475051B (zh) | 2009-11-18 | 2015-03-01 | Kao Corp | Organic polysiloxane |
| JP5809408B2 (ja) | 2009-11-25 | 2015-11-10 | 花王株式会社 | 毛髪化粧料 |
| EP2512246B1 (en) | 2009-12-17 | 2015-09-30 | Merck Sharp & Dohme Corp. | Aminopyrimidines as syk inhibitors |
| AU2009357506A1 (en) | 2009-12-28 | 2012-07-05 | Achira Labs Pvt. Ltd. | Diagnostic gel composition, method for making a diagnostic gel composition |
| ES2677969T3 (es) | 2010-01-08 | 2018-08-07 | Ionis Pharmaceuticals, Inc. | Modulación de la expresión tipo angiopoyetina 3 |
| US8750507B2 (en) | 2010-01-25 | 2014-06-10 | Cisco Technology, Inc. | Dynamic group creation for managed key servers |
| WO2011097643A1 (en) | 2010-02-08 | 2011-08-11 | Isis Pharmaceuticals, Inc. | Selective reduction of allelic variants |
| JP6018506B2 (ja) | 2010-02-08 | 2016-11-02 | アイオーニス ファーマシューティカルズ, インコーポレーテッドIonis Pharmaceuticals,Inc. | 対立遺伝子多様体の選択的低減 |
| CA2786973C (en) | 2010-02-10 | 2018-04-10 | Robert Hermann Gibbon | 6-amino-2-{[(1s)-1-methylbutyl] oxy}-9-[5-(1-piperidinyl)-7,9-dihydro-8h-purin-8-one maleate |
| WO2011108682A1 (ja) | 2010-03-05 | 2011-09-09 | 国立大学法人 東京大学 | リボヌクレオシドホスホロチオエートの製造方法 |
| WO2011127175A1 (en) | 2010-04-06 | 2011-10-13 | Isis Pharmaceuticals, Inc. | Modulation of cd130 (gp130) expression |
| AU2011237426A1 (en) | 2010-04-07 | 2012-11-22 | Isis Pharmaceuticals, Inc. | Modulation of CETP expression |
| US9725479B2 (en) | 2010-04-22 | 2017-08-08 | Ionis Pharmaceuticals, Inc. | 5′-end derivatives |
| US9127033B2 (en) | 2010-04-28 | 2015-09-08 | Isis Pharmaceuticals, Inc. | 5′ modified nucleosides and oligomeric compounds prepared therefrom |
| CN103154014B (zh) | 2010-04-28 | 2015-03-25 | Isis制药公司 | 修饰核苷、其类似物以及由它们制备的寡聚化合物 |
| WO2011139911A2 (en) | 2010-04-29 | 2011-11-10 | Isis Pharmaceuticals, Inc. | Lipid formulated single stranded rna |
| US8906607B2 (en) | 2010-04-30 | 2014-12-09 | Cellectis | Method for modulating double-strand break-induced homologous recombination |
| GB201008902D0 (en) | 2010-05-27 | 2010-07-14 | Imp Innovations Ltd | Membrane enhanced polymer sythesis |
| US20130253168A1 (en) | 2010-08-31 | 2013-09-26 | Steven L. Colletti | Novel single chemical entities and methods for delivery of oligonucleotides |
| EP2620428B1 (en) | 2010-09-24 | 2019-05-22 | Wave Life Sciences Ltd. | Asymmetric auxiliary group |
| JP5996431B2 (ja) | 2010-09-30 | 2016-09-21 | Lsipファンド運営合同会社 | 優性変異遺伝子発現抑制剤 |
| KR101381048B1 (ko) | 2010-10-20 | 2014-04-14 | 씨제이제일제당 (주) | O-포스포세린 생산 균주 및 이로부터 생산된 o-포스포세린으로부터 l-시스테인 또는 이의 유도체의 생산방법 |
| DK2632472T3 (en) | 2010-10-29 | 2018-03-19 | Sirna Therapeutics Inc | RNA INTERFERENCE-MEDIATED INHIBITION OF GENE EXPRESSION USING SHORT INTERFERRING NUCLEIC ACIDS (SINA) |
| EP3702460A1 (en) | 2010-11-12 | 2020-09-02 | The General Hospital Corporation | Polycomb-associated non-coding rnas |
| EP2647644B1 (en) | 2010-11-30 | 2020-09-09 | Wave Life Sciences Japan, Inc. | 2'-o-modified rna |
| WO2012092367A1 (en) | 2010-12-28 | 2012-07-05 | University Of Rochester | Nucleic acid binding compounds, methods of making, and use thereof |
| EP3067421B1 (en) | 2011-02-08 | 2018-10-10 | Ionis Pharmaceuticals, Inc. | Oligomeric compounds comprising bicyclic nucleotides and uses thereof |
| WO2012109667A1 (en) | 2011-02-12 | 2012-08-16 | University Of Iowa Research Foundation | Therapeutic compounds |
| WO2012151324A1 (en) | 2011-05-02 | 2012-11-08 | Isis Pharmaceuticals, Inc. | Antisense compounds targeting genes associated with usher syndrome |
| FR2975600B1 (fr) | 2011-05-24 | 2013-07-05 | Assist Publ Hopitaux De Paris | Agents pour le traitement de tumeurs |
| SG10201700554VA (en) | 2011-07-19 | 2017-03-30 | Wave Life Sciences Pte Ltd | Methods for the synthesis of functionalized nucleic acids |
| AR088140A1 (es) | 2011-07-19 | 2014-05-14 | Univ Idaho | Sonda y metodo para direccionar acidos nucleicos |
| EP2742056B2 (en) | 2011-08-11 | 2020-06-10 | Ionis Pharmaceuticals, Inc. | Selective antisense compounds and uses thereof |
| EP2751269B1 (en) | 2011-08-29 | 2016-03-23 | Ionis Pharmaceuticals, Inc. | Methods and compounds useful in conditions related to repeat expansion |
| US20140080896A1 (en) | 2011-08-30 | 2014-03-20 | The Regents Of The University Of California | Identification of small molecules that facilitate therapeutic exon skipping |
| CA2846307C (en) | 2011-08-31 | 2020-03-10 | Hospital District Of Helsinki And Uusimaa | Method for diagnosing a neurodegenerative disease |
| US20140255936A1 (en) | 2011-09-09 | 2014-09-11 | Mayo Foundation For Medical Education And Research | Detecting frontotemporal dementia and amyotrophic lateral sclerosis |
| JP6317675B2 (ja) | 2011-11-30 | 2018-04-25 | サレプタ セラピューティクス, インコーポレイテッド | 延長リピート病を処置するためのオリゴヌクレオチド |
| EP2790736B1 (en) | 2011-12-12 | 2018-01-31 | Oncoimmunin, Inc. | In vivo delivery of oligonucleotides |
| CA2859581C (en) | 2011-12-16 | 2022-03-22 | National University Corporation Tokyo Medical And Dental University | Chimeric double-stranded nucleic acid |
| CN102675386B (zh) | 2011-12-24 | 2014-07-02 | 河南科技大学 | 一种龙胆苦苷分离提纯方法 |
| US8957042B2 (en) | 2012-03-07 | 2015-02-17 | The Texas A&M University System | Cancer treatment targeting non-coding RNA overexpression |
| JP6242378B2 (ja) | 2012-03-13 | 2017-12-06 | ギリアード サイエンシーズ, インコーポレイテッド | 抗ウイルス処置のための2’−置換カルバヌクレオシド類似体 |
| KR20130114435A (ko) | 2012-04-09 | 2013-10-17 | 삼성전자주식회사 | 다수의 전극을 갖는 생분자 검출 장치 |
| EP4400169A2 (en) | 2012-04-23 | 2024-07-17 | Vico Therapeutics B.V. | Rna modulating oligonucleotides with improved characteristics for the treatment of neuromuscular disorders |
| AU2013266393B2 (en) | 2012-05-22 | 2017-09-28 | Idenix Pharmaceuticals Llc | D-amino acid compounds for liver disease |
| IN2014DN10144A (ko) | 2012-05-30 | 2015-08-21 | Hokkaido System Science Co Ltd | |
| WO2014012081A2 (en) | 2012-07-13 | 2014-01-16 | Ontorii, Inc. | Chiral control |
| SG11201500239VA (en) | 2012-07-13 | 2015-03-30 | Wave Life Sciences Japan | Asymmetric auxiliary group |
| BR112015000723A2 (pt) | 2012-07-13 | 2017-06-27 | Shin Nippon Biomedical Laboratories Ltd | adjuvante de ácido nucléico quiral |
| AU2013299717B2 (en) | 2012-08-06 | 2018-06-28 | Alnylam Pharmaceuticals, Inc. | Carbohydrate conjugated RNA agents and process for their preparation |
| KR102237882B1 (ko) | 2012-08-15 | 2021-04-07 | 아이오니스 파마수티컬즈, 인코포레이티드 | 변형된 캡핑 프로토콜을 이용하는 올리고머 화합물 제조 방법 |
| CA2887884A1 (en) | 2012-10-12 | 2014-04-17 | Isis Pharmaceuticals, Inc. | Selective antisense compounds and uses thereof |
| RU2020127664A (ru) | 2012-10-15 | 2020-09-17 | Ионис Фармасьютикалз, Инк. | Композиции для модуляции экспрессии гена c9orf72 |
| WO2014062736A1 (en) | 2012-10-15 | 2014-04-24 | Isis Pharmaceuticals, Inc. | Methods for monitoring c9orf72 expression |
| ES2762326T5 (es) | 2012-10-15 | 2023-04-27 | Ionis Pharmaceuticals Inc | Métodos para modular la expresión de C9ORF72 |
| EP2725029A1 (en) | 2012-10-29 | 2014-04-30 | Laboratoire Biodim | New antibacterial compounds and biological applications thereof |
| KR20150090894A (ko) | 2012-10-29 | 2015-08-06 | 코크리스탈 파마, 아이엔씨. | 바이러스 감염 및 암 치료용 피리미딘 뉴클레오티드 및 그들의 모노포스페이트 프로드럭 |
| US9725474B2 (en) | 2012-10-31 | 2017-08-08 | Takeda Pharmaceutical Company Limited | Modified nucleic acid |
| KR20150083920A (ko) | 2012-11-15 | 2015-07-20 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | 항 apob 안티센스 접합체 화합물 |
| BR112015012051A2 (pt) | 2012-11-26 | 2017-12-12 | Roche Innovation Ct Copenhagen As | composições e métodos para modulação de expressão de fgfr3 |
| EP2935304A1 (en) | 2012-12-19 | 2015-10-28 | IDENIX Pharmaceuticals, Inc. | 4'-fluoro nucleosides for the treatment of hcv |
| WO2014118272A1 (en) | 2013-01-30 | 2014-08-07 | Santaris Pharma A/S | Antimir-122 oligonucleotide carbohydrate conjugates |
| KR20150110562A (ko) | 2013-01-30 | 2015-10-02 | 에프. 호프만-라 로슈 아게 | Lna 올리고뉴클레오타이드 탄수화물 컨쥬게이트 |
| WO2014121287A2 (en) | 2013-02-04 | 2014-08-07 | Isis Pharmaceuticals, Inc. | Selective antisense compounds and uses thereof |
| DK2958998T3 (en) | 2013-02-22 | 2018-04-16 | Sirna Therapeutics Inc | SHORT INTERFERATING NUCLEIC ACID (SINA) MOLECULES CONTAINING A 2'-INTERNUCLEOSIDE BOND |
| AU2014222150A1 (en) | 2013-03-01 | 2015-09-10 | National University Corporation Tokyo Medical And Dental University | Chimeric single-stranded antisense polynucleotides and double-stranded antisense agent |
| US20160050929A1 (en) | 2013-03-28 | 2016-02-25 | Syngenta Limited | Methods of controlling neonicotinoid resistant pests |
| EA201500984A1 (ru) | 2013-03-28 | 2016-04-29 | Зингента Партисипейшнс Аг | Способы контроля устойчивых к неоникотиноидам вредителей |
| RU2686080C2 (ru) | 2013-05-01 | 2019-04-24 | Ионис Фармасьютикалз, Инк. | Композиции и способы |
| CN105228999B (zh) | 2013-05-24 | 2021-03-02 | 味之素株式会社 | 吗啉代寡核苷酸的制备方法 |
| WO2014188001A1 (en) | 2013-05-24 | 2014-11-27 | Santaris Pharma A/S | Oligonucleotide modulators of b-cell cll/lymphoma 11a (bcl11a) and uses thereof |
| JP6472087B2 (ja) | 2013-05-30 | 2019-02-27 | 国立大学法人 東京医科歯科大学 | 治療用オリゴヌクレオチドを送達するための二本鎖剤 |
| AU2014282666A1 (en) | 2013-06-16 | 2016-01-07 | National University Corporation Tokyo Medical And Dental University | Double-stranded antisense nucleic acid with exon-skipping effect |
| EP3011028B1 (en) | 2013-06-21 | 2019-06-12 | Ionis Pharmaceuticals, Inc. | Compositions and methods for modulation of target nucleic acids |
| DK3013959T3 (da) | 2013-06-27 | 2020-02-17 | Roche Innovation Ct Copenhagen As | Antisense-oligomerer og konjugater målrettet pcsk9 |
| TWI657819B (zh) | 2013-07-19 | 2019-05-01 | 美商Ionis製藥公司 | 用於調節τ蛋白表現之組合物 |
| ES2750608T3 (es) | 2013-07-25 | 2020-03-26 | Exicure Inc | Construcciones esféricas a base de ácido nucleico como agentes inmunoestimulantes para uso profiláctico y terapéutico |
| EP3027617A4 (en) | 2013-07-31 | 2017-04-12 | Ionis Pharmaceuticals, Inc. | Methods and compounds useful in conditions related to repeat expansion |
| US20160214974A1 (en) | 2013-09-06 | 2016-07-28 | Syngenta Participations Ag | Insecticidal compounds |
| WO2015051169A2 (en) | 2013-10-02 | 2015-04-09 | Moderna Therapeutics, Inc. | Polynucleotide molecules and uses thereof |
| SG11201602503TA (en) | 2013-10-03 | 2016-04-28 | Moderna Therapeutics Inc | Polynucleotides encoding low density lipoprotein receptor |
| US9988627B2 (en) | 2013-10-04 | 2018-06-05 | Novartis Ag | Formats for organic compounds for use in RNA interference |
| MY192689A (en) | 2013-10-11 | 2022-09-01 | Ionis Pharmaceuticals Inc | Compositions for modulating c9orf72 expression |
| EP3058069B1 (en) | 2013-10-14 | 2019-07-24 | Ionis Pharmaceuticals, Inc. | Methods for modulating expression of c9orf72 antisense transcript |
| EP3058068B1 (en) | 2013-10-14 | 2019-04-24 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of c9orf72 antisense transcript |
| CN105934524A (zh) | 2013-11-11 | 2016-09-07 | 桑格摩生物科学股份有限公司 | 用于治疗亨廷顿氏病的方法和组合物 |
| KR20160083876A (ko) | 2013-11-14 | 2016-07-12 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | ApoB 안티센스 접합체 화합물 |
| US20150167017A1 (en) | 2013-12-13 | 2015-06-18 | Moderna Therapeutics, Inc. | Alternative nucleic acid molecules and uses thereof |
| EP3095461A4 (en) | 2014-01-15 | 2017-08-23 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having immunity induction activity, and immunity induction activator |
| US10149905B2 (en) | 2014-01-15 | 2018-12-11 | Shin Nippon Biomedical Laboratories, Ltd. | Chiral nucleic acid adjuvant having antitumor effect and antitumor agent |
| JPWO2015108046A1 (ja) | 2014-01-15 | 2017-03-23 | 株式会社新日本科学 | 抗アレルギー作用を有するキラル核酸アジュバンド及び抗アレルギー剤 |
| MX2016009290A (es) | 2014-01-16 | 2017-02-28 | Wave Life Sciences Ltd | Diseño quiral. |
| EP4410805A2 (en) | 2014-03-18 | 2024-08-07 | University of Massachusetts | Raav-based compositions and methods for treating amyotrophic lateral sclerosis |
| EP3137476B1 (en) | 2014-04-28 | 2019-10-09 | Ionis Pharmaceuticals, Inc. | Linkage modified oligomeric compounds |
| KR102356388B1 (ko) | 2014-05-01 | 2022-01-26 | 아이오니스 파마수티컬즈, 인코포레이티드 | 안지오포이에틴-유사 3 발현을 조절하기 위한 조성물 및 방법 |
| WO2015171932A1 (en) | 2014-05-08 | 2015-11-12 | Sangamo Biosciences, Inc. | Methods and compositions for treating huntington's disease |
| CN107075514A (zh) | 2014-05-20 | 2017-08-18 | 衣阿华大学研究基金会 | 亨廷顿氏病的治疗化合物 |
| US20160017327A1 (en) | 2014-07-11 | 2016-01-21 | The Johns Hopkins University | Phosphorodiamidate morpholino oligomers (pmos) and their use in suppression of mutant huntingtin expression and attenuation of neurotoxicity |
| EP3169693B1 (en) | 2014-07-16 | 2022-03-09 | ModernaTX, Inc. | Chimeric polynucleotides |
| EP2982758A1 (en) | 2014-08-04 | 2016-02-10 | Centre Hospitalier Universitaire Vaudois (CHUV) | Genome editing for the treatment of huntington's disease |
| EP3178807B1 (en) | 2014-08-07 | 2020-04-29 | Takeda Pharmaceutical Company Limited | Cationic lipid |
| WO2016024205A1 (en) | 2014-08-15 | 2016-02-18 | Pfizer Inc. | Oligomers targeting hexanucleotide repeat expansion in human c9orf72 gene |
| WO2016037191A1 (en) | 2014-09-05 | 2016-03-10 | Health Research, Inc. | Use of huntingtin-derived plasmids and peptides for active immunization as a huntington's disease (hd) therapeutic |
| WO2016081444A1 (en) | 2014-11-17 | 2016-05-26 | Alnylam Pharmaceuticals, Inc. | Apolipoprotein c3 (apoc3) irna compositions and methods of use thereof |
| WO2016079181A1 (en) | 2014-11-19 | 2016-05-26 | Roche Innovation Center Copenhagen A/S | Lna gapmer oligonucleotides comprising chiral phosphorothioate linkages |
| CN107208092B (zh) | 2014-12-16 | 2021-09-10 | 罗氏创新中心哥本哈根有限公司 | 手性毒性筛选方法 |
| PL3237618T3 (pl) | 2014-12-24 | 2019-09-30 | Uniqure Ip B.V. | Supresja genu huntingtyny indukowana rnai |
| US9688707B2 (en) | 2014-12-30 | 2017-06-27 | Ionis Pharmaceuticals, Inc. | Bicyclic morpholino compounds and oligomeric compounds prepared therefrom |
| WO2016112132A1 (en) | 2015-01-06 | 2016-07-14 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of c9orf72 antisense transcript |
| EP3253875B1 (en) | 2015-02-04 | 2020-01-08 | H. Hoffnabb-La Roche Ag | Tau antisense oligomers and uses thereof |
| CN107636159B (zh) | 2015-02-04 | 2022-06-14 | 百时美施贵宝公司 | 选择治疗性分子的方法 |
| WO2016127002A1 (en) | 2015-02-04 | 2016-08-11 | Bristol-Myers Squibb Company | Lna oligonucleotides with alternating flanks |
| CA2976075A1 (en) | 2015-02-10 | 2016-08-18 | Genzyme Corporation | Variant rnai |
| CA2976445A1 (en) | 2015-02-13 | 2016-08-18 | Alnylam Pharmaceuticals, Inc. | Patatin-like phospholipase domain containing 3 (pnpla3) irna compositions and methods of use thereof |
| US10370659B2 (en) | 2015-02-23 | 2019-08-06 | Ionis Pharmaceuticals, Inc. | Compounds and methods for increasing antisense activity |
| EP3265098A4 (en) | 2015-03-03 | 2019-02-13 | Ionis Pharmaceuticals, Inc. | COMPOSITIONS FOR MODULATING MECP2 EXPRESSION |
| WO2016145142A1 (en) | 2015-03-10 | 2016-09-15 | Emory University | Nucleotide and nucleoside therapeutics compositions and uses related thereto |
| WO2016154096A1 (en) | 2015-03-20 | 2016-09-29 | Ionis Pharmaceuticals, Inc. | Modulation of smggds expression |
| PT3277814T (pt) | 2015-04-03 | 2020-07-28 | Univ Massachusetts | Compostos de oligonucleótidos para visar marn de huntingtina |
| US10851371B2 (en) | 2015-04-10 | 2020-12-01 | Ionis Pharmaceuticals, Inc. | Modulation of SMN expression |
| US10407678B2 (en) | 2015-04-16 | 2019-09-10 | Ionis Pharmaceuticals, Inc. | Compositions for modulating expression of C9ORF72 antisense transcript |
| KR102258516B1 (ko) | 2015-04-16 | 2021-05-31 | 아이오니스 파마수티컬즈, 인코포레이티드 | C9orf72 발현을 조절하기 위한 조성물 |
| WO2016209862A1 (en) | 2015-06-23 | 2016-12-29 | Alnylam Pharmaceuticals, Inc. | Glucokinase (gck) irna compositions and methods of use thereof |
| CA2990699A1 (en) | 2015-06-29 | 2017-01-05 | Ionis Pharmaceuticals, Inc. | Modified crispr rna and modified single crispr rna and uses thereof |
| US10494632B2 (en) | 2015-07-10 | 2019-12-03 | Alnylam Pharmaceuticals, Inc. | Insulin-like growth factor binding protein, acid labile subunit (IGFALS) compositions and methods of use thereof |
| US20180312845A1 (en) | 2015-07-10 | 2018-11-01 | Ionis Pharmaceuticals, Inc. | Modulators of diacyglycerol acyltransferase 2 (dgat2) |
| AU2016295168B2 (en) | 2015-07-17 | 2021-08-19 | Alnylam Pharmaceuticals, Inc. | Multi-targeted single entity conjugates |
| MA43072A (fr) | 2015-07-22 | 2018-05-30 | Wave Life Sciences Ltd | Compositions d'oligonucléotides et procédés associés |
| TW201718620A (zh) | 2015-07-27 | 2017-06-01 | 阿尼拉製藥公司 | 黃嘌呤脫氫酶(XDH)iRNA組成物及其使用方法 |
| US10208307B2 (en) | 2015-07-31 | 2019-02-19 | Alnylam Pharmaceuticals, Inc. | Transthyretin (TTR) iRNA compositions and methods of use thereof for treating or preventing TTR-associated diseases |
| WO2017032726A1 (en) | 2015-08-24 | 2017-03-02 | Roche Innovation Center Copenhagen A/S | Lna-g process |
| IL257486B (en) | 2015-08-25 | 2022-07-01 | Alnylam Pharmaceuticals Inc | Methods and preparations for treating disorders related to the pcsk9 gene |
| AU2016315584B2 (en) | 2015-09-02 | 2022-07-14 | Alnylam Pharmaceuticals, Inc. | Programmed cell death 1 ligand 1 (PD-L1) iRNA compositions and methods of use thereof |
| WO2017048620A1 (en) | 2015-09-14 | 2017-03-23 | Alnylam Pharmaceuticals, Inc. | Polynucleotide agents targeting patatin-like phospholipase domain containing 3 (pnpla3) and methods of use thereof |
| CA3000709A1 (en) | 2015-10-01 | 2017-04-06 | Memorial Sloan-Kettering Cancer Center | Inhibitors of menaquinone biosynthesis |
| US10874686B2 (en) | 2015-10-01 | 2020-12-29 | Memorial Sloan-Kettering Cancer Center | Anthranilyl-adenosinemonosulfamate analogs and uses thereof |
| KR20180073584A (ko) | 2015-10-02 | 2018-07-02 | 로슈 이노베이션 센터 코펜하겐 에이/에스 | 올리고뉴클레오타이드 접합 방법 |
| AU2016334232B2 (en) | 2015-10-09 | 2022-05-26 | Wave Life Sciences Ltd. | Oligonucleotide compositions and methods thereof |
| EP3183347A4 (en) | 2015-10-17 | 2018-04-18 | Lifesplice Pharma LLC | Splice modulating oligonucleotides and methods of use thereof |
| WO2017068087A1 (en) | 2015-10-22 | 2017-04-27 | Roche Innovation Center Copenhagen A/S | Oligonucleotide detection method |
| EP3394258B1 (en) | 2015-10-22 | 2021-09-22 | Roche Innovation Center Copenhagen A/S | In vitro toxicity screening assay |
| US11260073B2 (en) | 2015-11-02 | 2022-03-01 | Ionis Pharmaceuticals, Inc. | Compounds and methods for modulating C90RF72 |
| MX2018004978A (es) | 2015-11-12 | 2018-07-06 | Hoffmann La Roche | Oligonucleotidos para inducir la expresion paterna de la ligasa de la proteina ubiquitina e3a (ube3a). |
| CN114685589A (zh) | 2016-03-13 | 2022-07-01 | 波涛生命科学有限公司 | 用于亚磷酰胺和寡核苷酸合成的组合物和方法 |
| JP6748219B2 (ja) | 2016-03-14 | 2020-08-26 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Pd−l1発現低減用のオリゴヌクレオチド |
| CN108779139A (zh) | 2016-03-18 | 2018-11-09 | 罗氏创新中心哥本哈根有限公司 | 酰基保护的l-lna-鸟嘌呤核苷单体 |
| WO2017165489A1 (en) | 2016-03-23 | 2017-09-28 | Emory University | Antiviral agents for treating zika and dengue virus infections |
| ES2933435T3 (es) | 2016-04-13 | 2023-02-08 | Ionis Pharmaceuticals Inc | Métodos para reducir la expresión de C9ORF72 |
| US11248019B2 (en) | 2016-04-14 | 2022-02-15 | Hoffmann-La Roche Inc. | Trityl-mono-GalNAc compounds and their use |
| MA45270A (fr) | 2016-05-04 | 2017-11-09 | Wave Life Sciences Ltd | Compositions d'oligonucléotides et procédés associés |
| MA45290A (fr) | 2016-05-04 | 2019-03-13 | Wave Life Sciences Ltd | Procédés et compositions d'agents biologiquement actifs |
| WO2017194498A1 (en) | 2016-05-12 | 2017-11-16 | Roche Innovation Center Copenhagen A/S | Enhanced coupling of stereodefined oxazaphospholidine phosphoramidite monomers to nucleoside or oligonucleotide |
| ES2954252T3 (es) | 2016-05-13 | 2023-11-21 | Hoffmann La Roche | Matrices y dispositivos de recogida de muestras basados en proteínas |
| WO2017198775A1 (en) | 2016-05-18 | 2017-11-23 | Eth Zurich | Stereoselective synthesis of phosphorothioate oligoribonucleotides |
| US11013757B2 (en) | 2016-06-03 | 2021-05-25 | Wave Life Sciences Ltd. | Oligonucleotides, compositions and methods thereof |
| US20190240346A1 (en) | 2016-06-20 | 2019-08-08 | Genahead Bio, Inc. | Antibody-drug conjugate |
| WO2018022473A1 (en) | 2016-07-25 | 2018-02-01 | Wave Life Sciences Ltd. | Phasing |
| WO2018098264A1 (en) | 2016-11-23 | 2018-05-31 | Wave Life Sciences Ltd. | Compositions and methods for phosphoramidite and oligonucleotide synthesis |
-
2012
- 2012-07-13 SG SG10201700554VA patent/SG10201700554VA/en unknown
- 2012-07-13 AU AU2012284265A patent/AU2012284265B2/en active Active
- 2012-07-13 MX MX2014000716A patent/MX347361B/es active IP Right Grant
- 2012-07-13 DK DK12814522.4T patent/DK2734208T3/en active
- 2012-07-13 KR KR1020147004108A patent/KR20140068884A/ko not_active Application Discontinuation
- 2012-07-13 CN CN201280041560.0A patent/CN103796657B/zh active Active
- 2012-07-13 ES ES12814522.4T patent/ES2626488T3/es active Active
- 2012-07-13 CN CN201710437875.1A patent/CN107365339A/zh active Pending
- 2012-07-13 US US14/233,579 patent/US9605019B2/en active Active
- 2012-07-13 EP EP12814522.4A patent/EP2734208B1/en active Active
- 2012-07-13 CA CA2842358A patent/CA2842358C/en active Active
- 2012-07-13 RU RU2014105311/04A patent/RU2014105311A/ru unknown
- 2012-07-13 WO PCT/US2012/046805 patent/WO2013012758A1/en active Application Filing
- 2012-07-13 JP JP2014521681A patent/JP6128529B2/ja active Active
- 2012-07-13 EP EP17158311.5A patent/EP3248982A1/en not_active Withdrawn
- 2012-07-13 BR BR112014001244A patent/BR112014001244A2/pt not_active Application Discontinuation
-
2014
- 2014-01-19 IL IL230522A patent/IL230522B/en active IP Right Grant
- 2014-11-26 HK HK14111931.3A patent/HK1198479A1/xx unknown
-
2016
- 2016-07-28 US US15/222,910 patent/US20170029457A1/en not_active Abandoned
-
2017
- 2017-04-04 JP JP2017074528A patent/JP6490133B2/ja active Active
-
2018
- 2018-03-30 US US15/941,494 patent/US10280192B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| HK1198479A1 (en) | 2015-05-08 |
| CA2842358C (en) | 2020-07-14 |
| US20180222936A1 (en) | 2018-08-09 |
| ES2626488T8 (es) | 2017-08-14 |
| WO2013012758A1 (en) | 2013-01-24 |
| MX347361B (es) | 2017-04-12 |
| EP3248982A1 (en) | 2017-11-29 |
| US20140194610A1 (en) | 2014-07-10 |
| IL230522A0 (en) | 2014-03-31 |
| US10280192B2 (en) | 2019-05-07 |
| CA2842358A1 (en) | 2013-01-24 |
| EP2734208B1 (en) | 2017-03-01 |
| CN103796657A (zh) | 2014-05-14 |
| EP2734208A1 (en) | 2014-05-28 |
| BR112014001244A2 (pt) | 2017-02-21 |
| JP2014522862A (ja) | 2014-09-08 |
| CN107365339A (zh) | 2017-11-21 |
| JP6490133B2 (ja) | 2019-03-27 |
| JP6128529B2 (ja) | 2017-05-17 |
| JP2017141272A (ja) | 2017-08-17 |
| DK2734208T3 (en) | 2017-06-19 |
| SG10201700554VA (en) | 2017-03-30 |
| CN103796657B (zh) | 2017-07-11 |
| US20170029457A1 (en) | 2017-02-02 |
| RU2014105311A (ru) | 2015-08-27 |
| AU2012284265B2 (en) | 2017-08-17 |
| US9605019B2 (en) | 2017-03-28 |
| EP2734208A4 (en) | 2015-03-18 |
| MX2014000716A (es) | 2014-05-22 |
| ES2626488T3 (es) | 2017-07-25 |
| AU2012284265A1 (en) | 2014-02-06 |
| IL230522B (en) | 2018-02-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10280192B2 (en) | Methods for the synthesis of functionalized nucleic acids | |
| JP6038860B2 (ja) | リン原子修飾核酸の合成方法 | |
| KR20210003793A (ko) | 신규 인 (v)-기반 시약, 그의 제조 방법, 및 입체-규정된 유기인 (v) 화합물을 제조하는데 있어서의 그의 용도 | |
| CN103889999A (zh) | 用于合成寡核糖核苷酸的离子标记 | |
| EP0611075A1 (en) | Modified oligodeoxyribonucleotides, their preparation and their therapeutic use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |