KR20130135866A - Fc 도메인 내의 돌연변이를 갖는 안정한 이종이량체 항체 디자인 - Google Patents
Fc 도메인 내의 돌연변이를 갖는 안정한 이종이량체 항체 디자인 Download PDFInfo
- Publication number
- KR20130135866A KR20130135866A KR1020137014071A KR20137014071A KR20130135866A KR 20130135866 A KR20130135866 A KR 20130135866A KR 1020137014071 A KR1020137014071 A KR 1020137014071A KR 20137014071 A KR20137014071 A KR 20137014071A KR 20130135866 A KR20130135866 A KR 20130135866A
- Authority
- KR
- South Korea
- Prior art keywords
- amino acid
- heterodimer
- domain
- variant
- isolated heterodimer
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Oncology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Transplantation (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
제공된 스카폴드는 이펙터 기능의 조절에 관여하는 다양한 Fc 수용체들 사이의 선택성을 천연 동종이량체(대칭) Fc 분자에 의해 달성될 수 있는 선택성보다 높은 수준으로 달성하고 생성된 변이체 Fc 이종이량체의 증가된 안정성 및 순도를 달성하기 위해 다양한 도메인들(예를 들면, CH2 및 CH3) 내에 비대칭으로 존재하는 중쇄를 갖는다. 이들 신규 분자들은 항체가 거동하는 천연 방식을 변경하도록 디자인되어 있고 치료제에서 사용되는 불균질한 성분들의 복합체를 포함한다.
Description
1. 도입
1.1 관련 출원에 대한 상호 참조
본원은 2010년 11월 5일자로 출원된 미국 가특허출원 제61/410,746호; 2010년 12월 21일자로 출원된 미국 가특허출원 제61/425,375호; 2011년 2월 3일자로 출원된 미국 가특허출원 제61/439,341호; 2011년 4월 14일자로 출원된 미국 가특허출원 제61/475,614호; 2011년 5월 31일자로 출원된 미국 가특허출원 제61/491,846호; 및 2011년 6월 16일자로 출원된 미국 가특허출원 제61/497,861호(이들 각각은 전체적으로 본원에 참고로 도입됨)의 미국 특허법 제119조(e)(35 U.S.C. §119(e)) 하의 이익을 주장한다.
1.2 서열목록에 관한 진술
본원은 2011년 11월 4일자로 생성되었고 15 킬로바이트의 크기를 갖는 텍스트 파일 자임워크스(Zymeworks) V84467WO.txt로서 본원과 함께 제출된 서열목록을 참고로 도입한다.
1.3. 발명의 기술분야
본 개시내용은 일반적으로 폴리펩티드 이종이량체, 이의 조성물, 및 이러한 폴리펩티드 이종이량체를 제조하고 사용하는 방법을 제공한다. 보다 구체적으로, 본 발명은 이종이량체 Fc 도메인을 포함하는 열안정성 다중특이적 항체(이중특이적 항체를 포함함)에 관한 것이다.
1.4 발명의 배경기술
이중특이적 항체는 2개의 분리된 상이한 항원들(또는 동일한 항원의 상이한 에피토프들)에 동시적으로 결합할 수 있는 항체 기초 분자이다. 이중특이적 항체의 한 용도는 세포독성 면역 이펙터(effector) 세포가 예컨대, 항체 의존성 세포 매개 세포독성(ADCC)에 의한 종양 세포의 향상된 사멸을 위해 전용되게 하는 것이다. 이 상황에서, 이중특이적 항체의 한 아암(arm)은 종양 세포 상의 항원에 결합하고, 다른 아암은 이펙터 세포 상에서 발현된 결정인자(determinant)에 결합한다. 이중특이적 항체는 종양 세포와 이펙터 세포를 가교연결함으로써 이펙터 세포를 종양 세포의 근처에 데려올 뿐만 아니라 이들의 활성화를 동시적으로 유발하여 효과적인 종양 세포 사멸을 이끌어낸다. 또한, 이중특이적 항체는 화학요법제 또는 방사성요법제가 종양 조직 내에 풍부하게 하여 정상 조직에 대한 유해한 효과를 최소화하는 데에 사용되어 왔다. 이 상황에서, 이중특이적 항체의 한 아암은 파괴에 대해 표적화된 세포 상에서 발현된 항원에 결합하고, 다른 아암은 화학요법 약물, 방사성동위원소 또는 독소를 전달한다.
이중특이적 항체의 일반적인 개발에서 주요 장애물은 임상전 연구 및 임상 연구 둘다를 위한 충분한 질 및 양의 물질을 제조하는 것이 어렵다는 점이다.
전장 이중특이적 항체의 전통적인 제조는 2개의 면역글로불린 중쇄-경쇄 쌍의 동시발현에 기초하고, 이때 상기 2개의 쇄는 상이한 특이성을 갖는다(Millstein et al., 1983, Nature, 305:537-539). 항체 분자의 Fc 부분이 이량체화하는 고유의 성향은 중쇄와 경쇄의 다양한 조합으로 구성된 최대 10개의 상이한 IgG 분자들(이들 중 하나만이 정확한 이중특이적 구조를 가짐)의 복합 혼합물의 형성을 초래한다. 통상적으로 친화성 크로마토그래피 단계에 의해 수행되는 정확한 분자의 정제는 다소 번거롭고 생성물 수율은 낮다. 유사한 절차가 PCT 국제 공보 제WO 93/08829호 및 문헌(Traunecker et al., 1991, EMBO J., 10:3655-3659)에 개시되어 있다. 따라서, 전통적인 하이브리도마 기법을 이용하여 2개의 상이한 표적들에 결합하도록 선택된 2개의 Fab 아암을 갖는 이중특이적 항체 분자의 제조는 도전과제이다(Segal DM et al. (2001) J Immunol Methods. 248, 1-6). 삼기능성 항체인 카투막소맙(Catumaxomab)은 래트/마우스 쿠아드로마(quadroma) 유래의 이중특이적 mAb이고 이 분자의 정제는 단백질 A 컬럼 기초 크로마토그래피 분리에서의 pH 의존성 용출에 기초하여 달성된다(Lindhofer H. et al. (1995) J. Immunol. 155, 219-225).
이중특이적 항체 제조를 위한 또 다른 전통적인 방법은 상이한 특이성을 갖는 2개의 항체 또는 이들의 단편의 화학적 접합이다. 그러나, 이 방법도 복잡하고, 화학적 변형 과정은 항체를 불활성화시킬 수 있거나 응집을 촉진할 수 있다. 원치 않는 생성물로부터의 정제가 어려운 과제로 남아 있기 때문에, 이중특이적 항체의 생성된 낮은 수율 및 좋지 않은 질은 이 과정이 임상 개발을 위해 요구되는 대규모 제조에 적합하지 않게 한다. 또한, 이들 분자들은 전통적인 항체 입체구조를 유지할 수 없다.
최근에, 다양한 이종이량체화 기법이 이중특이적 항체의 제조를 개선하는 데에 이용되고 있다. 그러나, 단순한 이종이량체화 도메인, 예컨대, Jun/Fos 코일드-코일(coiled-coil)과 scFv 도메인의 융합은 동종이량체와 이종이량체의 혼합물을 발생시키고 재폴딩에 의해 조립될 필요가 있다(de Kruif and Logtenberg, J. Biol. Chem. 271: 7630-4, 1996). scFv 단편과 전장 항체의 융합도 이량체화 방안으로서 이용되었다(Coloma and Morrison, Nat. Biotechnol. 15: 159-63, 1997). 그러나, 이러한 융합은 좋지 않은 고체 조직 침투 성능을 갖는 큰 분자를 발생시킨다. 2개의 scFv 단편들의 융합도 이중특이적 단백질을 발생시키는 데에 이용되고 있다(예를 들면, 미국 매릴랜드주 베데스다에 소재하는 마이크로멧 인코포레이티드(Micromet Inc.)에 의한 BITE® 항체, 미국 특허 제7,635,472호). 그러나, 이러한 단백질들은 Fc 영역을 함유하지 않으므로 Fc 영역을 통한 그들의 활성의 조절을 허용하지 않는다. 또한, 이들 단백질들은 작으므로(약 55 kDa) 혈청에서 상대적으로 짧은 반감기를 갖는다.
다른 이종이량체화 기법에서, 이중특이적 항체는 한 아암 내의 제1 결합 특이성을 갖는 하이브리드 면역글로불린 중쇄, 및 다른 아암 내의 (제2 결합 특이성을 제공하는) 하이브리드 면역글로불린 중쇄-경쇄 쌍으로 구성된다. 이 비대칭 구조는 이중특이적 분자의 절반에서만 면역글로불린 경쇄가 존재하는 것이 용이한 분리 방법을 제공하기 때문에 원치 않는 면역글로불린 쇄 조합물로부터 원하는 이중특이적 화합물의 분리를 용이하게 하는 것으로 밝혀졌다. 이 방법은 PCT 국제 공보 제WO 94/04690호에 개시되어 있다. 이중특이적 항체의 발생에 대한 추가 세부설명에 대해서는 예를 들면, 문헌(Suresh et al., 1986, Methods in Enzymology, 121:210)을 참조한다.
PCT 국제 공보 제WO 96/27011호에 기재된 또 다른 방법에 따르면, 재조합 세포 배양물로부터 회수되는 이종이량체의 백분율을 최대화하도록 한 쌍의 항체 분자를 조작할 수 있다. 이 방법에서, 제1 항체 분자의 CH3 경계면으로부터의 하나 이상의 작은 아미노산 측쇄를 보다 큰 측쇄(예를 들면, 티로신 또는 트립토판)로 치환시킨다. 큰 아미노산 측쇄를 보다 작은 아미노산 측쇄(예를 들면, 알라닌 또는 트레오닌)로 치환시킴으로써 상기 큰 측쇄(들)와 동일하거나 유사한 크기의 보완 "캐비티(cavities)"를 제2 항체 분자의 경계면 상에서 생성한다. 이것은 다른 원치 않는 최종 생성물, 예컨대, 동종이량체에 비해 이종이량체의 수율을 증가시키는 기작을 제공한다[미국 특허 제005731168A호, 미국 특허 제007183076B2호, 문헌(Ridgway JB, Presta LG, Carter P. Protein Eng 1996 Jul; 9(7): 617-21), 및 문헌(Atwell S, Ridgway JB, Wells JA, Carter P. J Mol Biol 1997 Jul 4; 270(1): 26-35)]. 구나세카란(Gunasekaran)과 동료들(Gunasekaran K. et al. (2010) J Biol Chem. 285, 19637-46)은 최근에 선택적 이종이량체화 목적을 달성하기 위해 상보적 정전기 디자인 방법을 이용하였다. 데이비스(Davis)와 동료들(Davis, JH. et al. (2010) Prot Eng Des Sel; 23(4):195-202)은 인간 IgA 및 IgG CH3 서열의 교대 절편으로 구성된 가닥 교환 조작된 도메인(SEED)을 사용하여 CH3 도메인을 디자인하였고, 이들은 우선적으로 이종이량체의 형태로 결합한다. 그러나, 이들 기술들 모두가 모 분자 또는 야생형 분자보다 상당히 덜 안정한 이종이량체 Fc 영역을 포함하는 항체를 발생시킨다.
따라서, 증가된 안정성 및 순도를 갖는 이종이량체를 선택하도록 변형된 대안적인 다중특이적 변이체 Fc 이종이량체, 특히 변이체 CH3 도메인에 대한 필요성이 당업계에 남아있다.
2. 발명의 요약
본 발명의 한 양태에 따라, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 상기 이종이량체 Fc 영역은 Fcγ 수용체의 선택적 결합을 촉진하기 위한 비대칭 아미노산 변형을 포함하는 변이체 CH2 도메인을 추가로 포함한다. 한 실시양태에서, 상기 변이체 CH2 도메인은 야생형 CH2 도메인에 비해 Fcγ IIIa 수용체에 선택적으로 결합한다. 한 실시양태에서, 상기 변이체 CH3 도메인은 약 70℃ 이상의 용융 온도(Tm)를 갖는다.
또 다른 양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 70℃ 이상의 용융 온도(Tm)를 갖는다. 한 실시양태에서, 이종이량체 Fc 영역은 야생형 Fc 영역에 비해 상대적으로 CH3 도메인 내에 추가 이황화 결합을 포함하지 않고, 보다 구체적으로 상기 이종이량체 Fc 영역은 야생형 Fc 영역에 비해 상대적으로 CH3 도메인 내에 추가 이황화 결합을 포함하지 않는다. 대안적 실시양태에서, 이종이량체 Fc 영역은 야생형 Fc 영역에 비해 상대적으로 변이체 CH3 도메인 내에 추가 이황화 결합을 포함하되, 용융 온도(Tm)는 상기 추가 이황화 결합의 부재 하에서 약 70℃ 이상이다. 또 다른 실시양태에서, 이종이량체 Fc 영역은 야생형 Fc 영역에 비해 상대적으로 변이체 CH3 도메인 내에 추가 이황화 결합을 포함하고, 이때 상기 변이체 CH3 도메인은 약 77.5℃ 이상의 용융 온도(Tm)를 갖는다.
한 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 70℃ 이상의 용융 온도(Tm)를 갖고, 상기 이종이량체 Fc 영역은 약 90% 초과의 순도를 갖거나, 상기 이종이량체 Fc 영역은 약 95% 이상의 순도를 갖거나, 상기 이종이량체 Fc 영역은 약 98% 이상의 순도를 갖는다.
또한, 한 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 70℃ 이상의 용융 온도(Tm)를 갖거나, 상기 Tm은 약 71℃ 이상이거나, 상기 Tm은 약 74℃ 이상이다. 또 다른 실시양태에서, 상기 이종이량체 Fc 영역은 약 98% 이상의 순도를 갖고 상기 Tm은 약 73℃이거나, 상기 이종이량체 Fc 영역은 약 90% 이상의 순도를 갖고 상기 Tm은 약 75℃이다.
일부 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 L351Y 및 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366A 및 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다. 한 양태에서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드는 위치 T411, D399, S400, F405, N390 또는 K392에서 추가 아미노산 변형을 포함한다. 위치 T411에서의 아미노산 변형은 T411N, T411R, T411Q, T411K, T411D, T411E 및 T411W로부터 선택된다. 위치 D399에서의 아미노산 변형은 D399R, D399W, D399Y 및 D399K로부터 선택된다. 위치 S400에서의 아미노산 변형은 S400E, S400D, S400R 및 S400K로부터 선택된다. 위치 F405에서의 아미노산 변형은 F405I, F405M, F405T, F405S, F405V 및 F405W로부터 선택된다. 위치 N390에서의 아미노산 변형은 N390R, N390K 및 N390D로부터 선택된다. 위치 K392에서의 아미노산 변형은 K392V, K392M, K392R, K392L, K392F 및 K392E로부터 선택된다.
일부 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 L351Y 및 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366V 및 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366V 및 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다. 한 양태에서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드는 아미노산 변형 K392E, T411E, D399R 및 S400R을 추가로 포함한다. 또 다른 양태에서, 제1 CH3 도메인 폴리펩티드는 아미노산 변형 D399R, S400R 및 Y407A를 포함하고, 제2 CH3 도메인 폴리펩티드는 아미노산 변형 T366A, K409F, K392E 및 T411E를 포함한다. 추가 실시양태에서, 변이체 CH3 도메인은 약 74℃ 이상의 용융 온도(Tm)를 갖고, 상기 이종이량체는 약 95% 이상의 순도를 갖는다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 위치 L351에서의 아미노산 변형 및 아미노산 변형 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 위치 T366에서의 아미노산 변형 및 아미노산 변형 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다. 한 양태에서, 위치 L351에서의 아미노산 변형은 L351Y, L351I, L351D, L351R 및 L351F로부터 선택된다. 또 다른 양태에서, 위치 Y407에서의 아미노산 변형은 Y407A, Y407V 또는 Y407S로부터 선택된다. 또 다른 양태에서, 위치 T366에서의 아미노산 변형은 T366A, T366I, T366L, T366M, T366Y, T366S, T366C, T366V 및 T366W로부터 선택된다. 한 실시양태에서, 변이체 CH3 도메인은 약 75℃ 이상의 용융 온도(Tm)를 갖고, 상기 이종이량체는 약 90% 이상의 순도를 갖는다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 위치 F405에서의 아미노산 변형 및 아미노산 변형 L351Y 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다. 한 양태에서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드는 위치 K392, T411, T366, L368 또는 S400에서 아미노산 변형을 포함한다. 위치 F405에서의 아미노산 변형은 F405A, F405I, F405M, F405T, F405S, F405V 또는 F405W이다. 위치 K392에서의 아미노산 변형은 K392V, K392M, K392R, K392L, K392F 또는 K392E이다. 위치 T411에서의 아미노산 변형은 T411N, T411R, T411Q, T411K, T411D, T411E 또는 T411W이다. 위치 S400에서의 아미노산 변형은 S400E, S400D, S400R 또는 S400K이다. 위치 T366에서의 아미노산 변형은 T366A, T366I, T366L, T366M, T366Y, T366S, T366C, T366V 또는 T366W이다. 위치 L368에서의 아미노산 변형은 L368D, L368R, L368T, L368M, L368V, L368F, L368S 또는 L368A이다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 L351Y, F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다. 한 양태에서, 제2 CH3 도메인 폴리펩티드는 아미노산 변형 T366L 또는 T366I를 포함한다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366I, K392M 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다.
일부 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366L, K392M 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366L 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366I 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함한다.
상기 이종다량체의 일부 실시양태에서, 이중특이적 항체 또는 다중특이적 항체가 제공된다.
또 다른 실시양태에서, 본 발명의 이종다량체 및 약학적으로 허용가능한 담체를 포함하는 조성물이 제공된다.
또 다른 실시양태에서, 본 발명의 이종다량체를 코딩하는 핵산을 포함하는 숙주 세포가 제공된다.
일부 실시양태에서, 하나 이상의 치료 항체를 포함하는 이종다량체가 제공된다. 한 양태에서, 치료 항체는 아바고보맙(abagovomab), 아달리무맙(adalimumab), 알렘투주맙(alemtuzumab), 아우로그랍(aurograb), 바피뉴주맙(bapineuzumab), 바실릭시맙(basiliximab), 벨리무맙(belimumab), 베바시주맙(bevacizumab), 브리아키누맙(briakinumab), 카나키누맙(canakinumab), 카투막소맙(catumaxomab), 세르톨리주맙 페골(certolizumab pegol), 세툭시맙(cetuximab), 다클리주맙(daclizumab), 데노수맙(denosumab), 에팔리주맙(efalizumab), 갈릭시맙(galiximab), 젬투주맙 오조가미신(gemtuzumab ozogamicin), 골리무맙(golimumab), 이브리투모맙 티욱세탄(ibritumomab tiuxetan), 인플릭시맙(infliximab), 이필리무맙(ipilimumab), 루밀릭시맙(lumiliximab), 메폴리주맙(mepolizumab), 모타비주맙(motavizumab), 뮤로모납(muromonab), 마이코그랍(mycograb), 나탈리주맙(natalizumab), 니모투주맙(nimotuzumab), 오크렐리주맙(ocrelizumab), 오파투무맙(ofatumumab), 오말리주맙(omalizumab), 팔리비주맙(palivizumab), 파니투무맙(panitumumab), 페르투주맙(pertuzumab), 라니비주맙(ranibizumab), 레슬리주맙(reslizumab), 리툭시맙(rituximab), 테플리주맙(teplizumab), 토실리주맙(tocilizumab)/아틀리주맙(atlizumab), 토시투모맙(tositumomab), 트라스투주맙(trastuzumab), 프록시늄(Proxinium)TM, 렌카렉스(Rencarex)TM, 우스테키누맙(ustekinumab) 및 잘루투무맙(zalutumumab)으로 구성된 군으로부터 선택된다.
본 발명의 이종다량체의 또 다른 실시양태에서, 암 항원을 특징으로 하는 암을 갖는 환자에서 암을 치료하는 방법으로서, 치료 유효량의 이종다량체를 상기 환자에게 투여하는 단계를 포함하는 방법이 제공된다.
본 발명의 이종다량체의 또 다른 실시양태에서, 면역 항원을 특징으로 하는 면역 장애를 갖는 환자에서 면역 장애를 치료하는 방법으로서, 치료 유효량의 이종다량체를 상기 환자에게 투여하는 단계를 포함하는 방법이 제공된다.
또 다른 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 표 1, 표 6 또는 표 7에 나열된 변이체들로부터 선택된다.
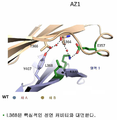
도 1은 CH3(상부), CH2(중간) 및 수용체 영역을 보여주는, 야생형 항체의 도식 3-D 구조이다. 좌측 상의 점선 직사각형은 CH3의 표적 면적의 2개 영역인 영역 1 및 영역 2를 보여주는 우측에 확대되어 있다.
도 2는 위치 368에서 야생형 잔기를 보여주는 도식 3-D 표시이다.
도 3은 돌연변이된 위치 368을 보여주는 영역 1의 도식 3-D 표시이다.
도 4는 영역 2 내의 추가 돌연변이의 도식 3-D 표시이다.
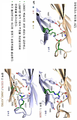
도 5는 처음 3개 변이체 AZ1, AZ2 및 AZ3에 대한 충돌 점수, 경계면 면적 차이, 팩킹 차이, 정전기 에너지 차이 및 전체적인 "친화성 점수"에 대한 인-실리코(in silico) 계산의 표이다.
도 6은 변이체 AZ1 "상에 구축된" 변이체 AZ2 및 AZ3을 보여주는 도식 3-D 영상을 보여준다.
도 7은 AZ2 및 AZ3 변이체의 도식 3-D 표시를 보여준다.
도 8은 AZ1, AZ2 및 AZ3 이종이량체 및 동종이량체에 대한, 도 5에서와 같은 표를 보여준다. 친화성 점수는 동종이량체와 관련 없으므로 동종이량체에 대한 그 양태를 보여주는 점수는 없다.
도 9는 야생형(좌측) 및 돌연변이된 AZ4(우측)의 3-D 표시의 도식 표시이다.
도 10은 AZ4 이종이량체 및 동종이량체에 대한 인-실리코 계산을 보여주는, 도 5와 같은 표이다.
도 11은 CH3 변이체 AZ5(좌측) 및 AZ6(우측)의 도식 표시이다.
도 12는 AZ4, AZ5 및 AZ6에 대한 인-실리코 데이터를 보여주는, 도 5에 대해 기재된 바와 같은 표이다.
도 13은 이종이량체 방법을 이용하였을 때 수용체 영역에서의 결합 특징의 가능성을 보여주는 도면과 함께, 항체의 도식 3-D 표시(좌측)이다.
도 14는 IgG 분자의 개략적 표시이다.
도 15는 Fcγ 수용체들의 다중 서열 정렬을 보여준다. 진뱅크(Genebank)/유니프롯(Uniprot) 서열 ID는 다음과 같다: FcγRIIA(sp P12318), FcγRIIB(sp P31994), FcγRIIC(gi 126116592), FcγRIIIA(sp P08637), FcγRIIIB(sp O75015).
도 16은 Fc-FcγRIIIb 복합체의 결정 구조의 개략도이다(PDB ID: 1T83, Radaev & Sun). Fc와 Fcγ 수용체의 1:1 복합체가 Fc의 2개 쇄들과 FcγR 사이의 비대칭 접촉과 함께 관찰된다.
도 17은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자의 개략도를 보여준다: 비대칭 Fc 스카폴드 및 비대칭 Fc-단량체 IgG 아암.
도 18은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자의 개략도를 보여준다: 비대칭 Fc-단일특이적 IgG 아암 및 비대칭 Fc-이중특이적 IgG 아암(공통의 경쇄).
도 19는 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자의 예시를 보여준다: 비대칭 Fc-이중특이적 IgG 아암 및 기능성 분자, 예컨대, 독소.
도 20은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자를 예시한다: 비대칭 Fc-단일 scFv 아암 및 비대칭 Fc-이중특이적 scFv 아암.
도 21은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자를 예시한다: 비대칭 Fc-삼중특이적 scFv 아암 및 비대칭 Fc-사중특이적 scFv 아암.
도 22는 보다 우수한 FcγR 선택성을 위한 Fc의 한 면 상의 돌연변이의 비대칭 디자인이 FcγR 상호작용에 대한 생산적 면 및 야생형 유사 상호작용을 갖는 비생산적 면을 도입한다는 것을 보여준다. Fc의 비생산적 면 상의 돌연변이는 FcR과의 상호작용을 차단하고 Fc의 극성을 편향시켜 생산적 면 상에서만 상호작용하도록 도입될 수 있다.
도 23은 야생형 인간 IgG1에 대한 아미노산 서열을 보여준다.
도 24는 하기 더 상세히 기재되어 있는 바와 같이 양성 디자인 방법과 음성 디자인 방법을 조합하는, Fc 이종이량체 디자인의 반복 과정을 보여준다.
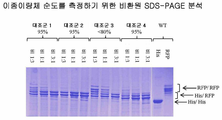
도 25는 이종이량체 순도를 측정하는 데에 이용된 시험관내 분석을 보여준다. 상기 분석은 상이한 분자량의 하기 2개 Fc 중쇄를 갖는 전장 단일특이적 항체 스카폴드에 기초한다: 중쇄 A는 C-말단 히스태그(HisTag)(His)를 갖고, 중쇄 B는 C-말단 절단가능한 mRFP 태그(RFP)를 갖는다. 상기 2개 중쇄 A(His) 및 B(RFP)는 고정된 양의 경쇄와 함께 상이한 상대적 비로 발현되어 상이한 분자량을 갖는 3개의 가능한 이량체 종을 발생시킨다: a) 동종이량체 쇄 A(His)/쇄 A(His)(약 150 kDa); b) 이종이량체 쇄 A(His)/쇄 B(RFP)(약 175 kDa); 및 c) 동종이량체 쇄(RFP)/쇄 B(RFP)(약 200 kDa). 발현 후, 실시예 2에 기재되어 있는 바와 같이, 이종이량체 대 2개의 동종이량체의 비는 분자량에 의한 3개의 이량체 종의 분리를 가능하게 하는 비환원 SDS-PAGE에 의해 측정되었다. SDS-PAGE 겔은 쿠마시 브릴리언트 블루(Coomassie Brilliant Blue)로 염색되었다.
도 25a: 시험된 변이체는 WT 쇄 A(His) 단독; WT 쇄 B(RFP) 단독; WT 쇄 A(His) 플러스 쇄 B(RFP); 및 95% 초과의 보고된 이종이량체 순도를 갖는 대조군 1 쇄 A(His) 플러스 쇄 B(RFP)이었다. 이량체 밴드의 조성은 상기 예시된 바와 같이 IgG-Fc에 대한 항체(항-Fc), mRFP 태그에 대한 항체(항-mRFP) 및 히스태그에 대한 항체(항-His)를 사용하는 웨스턴 블롯에 의해 검증되었다. SDS-PAGE는 His/His 동종이량체에 대한 단일 밴드, His/RFP 이종이량체에 대한 이중 밴드 및 RFP 동종이량체에 대한 다중 밴드를 보여준다. 상기 다중 밴드는 mRFP 태그의 인공물이고 Fc 이종이량체의 물리적 성질에 영향을 미치지 않는 것으로 확인되었다.
도 25b: SDS-PAGE 분석은 공개된 Fc 이종이량체 변이체 대조군 1 내지 4를 대조군으로서 사용함으로써 검증되었다(표 A 참조). 상기 변이체들은 쇄 A(His) 대 쇄 B(RFP)의 상이한 상대적 비로 발현되었다: 구체적으로, 비 1:3은 25%,10%,65%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 1:1은 25%,20%,55%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 3:1은 25%,40%,35%의 LC,HC_His,HC_mRFP 비와 동등하다(쇄 A(His) 대 쇄 B(RFP)의 겉보기 1:1 발현은 WT Fc의 경우 20%/55%(His/RFP)에 가까운 것으로 확인되었다).
도 25c는 스카폴드 1 변이체의 이종이량체 순도를 측정하기 위한 비환원 SDS-PAGE 분석을 보여준다. Fc 변이체들은 쇄 A(His) 대 쇄 B(RFP)의 상이한 상대적 비로 발혀되었고 도 2에 기재된 바와 같이 비환원 SDS-PAGE에 의해 분석되었다. 구체적으로, 비 1:3은 25%,10%,65%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 1:1은 25%,20%,55%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 3:1은 25%,40%,35%의 LC,HC_His,HC_mRFP 비와 동등하다(쇄 A(His) 대 쇄 B(RFP)의 겉보기 1:1 발현은 WT Fc의 경우 20%/55%(His/RFP)에 가까운 것으로 확인되었다).
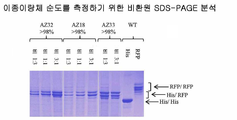
도 26은 단백질 A 친화성 크로마토그래피에 의해 정제되고 도 25에 기재된 바와 같이 비환원 SDS-PAGE에 의해 분석된, 쇄 A(His) 대 쇄 B(RFP)의 특정 비(표 2 참조)로 발현된 Fc 이종이량체 변이체를 보여준다.
도 26A는 상이한 변이체들이 SDS-PAGE 결과의 가시적 검사에 기초한 순도의 카테고리로 어떻게 분류되는지를 예시한다. 비교를 위해, 동등한 양의 단백질 A 정제된 생성물을 겔 상에 적재하였다. 비환원 SDS-PAGE에 기초한 순도의 이 정의는 선택된 변이체 대한 LC/MS에 의해 확인되었다(도 28 참조).
도 26B는 스카폴드 1 및 2의 선택된 단백질 A 정제된 이종이량체 변이체의 예시적 SDS-PAGE 결과이다(AZ94, AZ86, AZ70, AZ33 및 AZ34).
도 27은 CH3-CH3 도메인의 용융 온도를 측정하기 위한 DSC 분석을 예시하고, 이때 2종의 독립적인 방법들이 이용되었다.
도 27A: 온도기록도가 4개의 독립적인 비-2-상태-전이에 피팅되었고 헤르셉틴에 대한 보고된 문헌 값들에 가까운 CH2 및 Fab 전이에 대한 약 72℃(CH2) 및 약 82℃(Fab)의 값을 산출하도록 최적화되었다.
도 27B: 이종이량체 변이체들에 대한 표준화된 온도기록도 및 기준 보정된 온도기록도가 WT로부터 차감되어 CH3 전이에 대해서만 양성 및 음성 차이 피크를 산출하였다.
도 28은 실시예 2에 기재된 바와 같은 예시적 변이체 AZ70의 LC/MS 분석을 예시한다. 글리코실화된 이종이량체 및 동종이량체에 대한 예측된(계산된 평균) 질량이 표시되어 있다. 이종이량체 질량과 일치하는 영역은 글리신의 상실(-57 Da) 및 1개 또는 2개의 헥소스의 추가(각각 +162 Da 및 +324 Da)에 상응하는 주 피크를 함유한다. 이종이량체 순도는 상기 동종이량체들 중 어느 하나에 상응하는 상당한 피크가 존재하지 않는 경우 90% 초과로서 분류된다.
도 29는 WT Fc(도 29A); AZ6(도 29B); AZ33(도 29C); 및 AZ19(도 29D)의 CH3 경계면을 보여준다. 상세한 설명 단락에 기재된 바와 같은 포괄적인 인-실리코 분석 및 변이체들과 WT의 비교는 WT보다 더 낮은 초기 AZ33 이종이량체의 안정성에 대한 이유들 중 하나가 Y407 및 T366의 코어 상호작용/팩킹의 상실이라는 것을 보여주었다. 초기 AZ33은 도 29B에 예시된 바와 같이 이 소수성 코어에서 비최적 팩킹을 보여주는데, 이것은 이 영역, 특히 위치 T366에서의 최적화가 AZ33의 안정성을 개선할 것임을 암시한다. 이것은 T366I 및 T366L을 갖는 도 29C 및 도 29D에 예시되어 있다. 실험적 데이터는 이 구조적 분석과 상관관계를 갖고 T366L이 Tm의 최대 개선을 제공한다는 것을 보여준다. 실시예 5를 참조한다.
도 30은 초기 스카폴드 1 변이체 AZ8에서 예시된, 입체구조적 동역학 분석의 유용성 및 중요성을 보여준다. 인-실리코 돌연변이유발 후 구조(WT에 가까운 주쇄 입체구조)가 50 ns 분자 동역학 시뮬레이션 분석의 대표적인 구조와 겹쳐져 있다. 도면은 AZ8 변이체 대 WT의 루프 영역 D399-S400에서의 큰 입체구조적 차이를 강조하고, 이 차이는 소수성 코어를 용매에 노출시키고 AZ8 이종이량체의 감소된 안정성을 야기한다.
도 31은 포괄적인 인-실리코 분석 및 MD 시뮬레이션으로부터의 정보가 기재된 양성 디자인 방법에서 어떻게 이용되었는지를 예시한다. 도 30에 예시된 바와 같이, WT보다 더 낮은 AZ8의 안정성에 대한 이유들 중 하나는 주로 F405 팩킹 상호작용의 상실에 기인하는, 루프 399-400 내지 409의 약화된 상호작용이다(도 31A(WT) 대 도 31B(AZ8)의 비교 참조). 양성 디자인 방법들 중 하나는 399-400 루프 입체구조를 안정화시키기 위한, 면적의 소수성 팩킹의 최적화이었다. 이것은 도 31C에 예시되어 있는 K392M 돌연변이에 의해 달성되었다. 도 31C는 초기 음성 디자인 변이체 AZ8의 74℃ 대 68℃의 Tm을 갖는 이종이량체 AZ33을 나타낸다.
도 32는 분자 동역학 궤도의 주요 성분 분석을 이용하였을 때 관찰된 Fc 분자의 동역학을 예시한다. 도 32A는 기준물질로서 Fc 구조의 주쇄 선을 보여준다. 도 32B 및 32C는 Fc 구조에서 상부 2개의 주요 움직임 방식에 따라 관찰된 동역학의 중첩을 나타낸다. 쇄 A 및 B의 CH2 도메인들은 서로에 대해 상대적으로 상당한 개방/폐쇄 움직임을 나타내는 반면, CH3 도메인들은 상대적으로 경직되어 있다. CH3 경계면에서의 돌연변이는 CH2 도메인에서의 이 개방/폐쇄 움직임의 상대적 유연성 및 동역학에 영향을 미친다.
도 33은 2개의 스카폴드-2 변이체들 대 WT의 소수성 코어 팩킹을 예시한다: WT Fc(도 33A); AZ63(도 33B); 및 AZ70(도 33C). 초기 스카폴드-2 변이체의 포괄적인 인-실리코 분석은 Y407-T366의 코어 WT 상호작용의 상실이 WT보다 더 낮은 초기 스카폴드-2 변이체의 안정성에 대한 이유들 중 하나라는 것을 암시하였다. Y407-T366의 상실은 돌연변이 K409F에 의해 부분적으로 보완되지만, 도 33B에 예시된 바와 같이, 특히 T366A 돌연변이는 WT에 비해 상기 변이체를 불안정화시키는 캐비티를 소수성 코어 내에 남겨둔다. 도 33C에서 Fc 변이체 AZ70으로 나타낸 바와 같이 추가 돌연변이 T366V_L351Y에 의한 이 소수성 코어의 표적화는 성공적인 것으로 입증되었고; AZ70은 75.5℃의 실험적으로 측정된 Tm을 갖는다. 표 4 및 실시예 6을 참조한다.
도 34는 2개의 스카폴드-2 변이체들 대 WT의 루프 399-400의 상호작용을 예시한다: WT Fc(도 34A); AZ63(도 34B); 및 AZ94(도 34C). 초기 스카폴드-2 변이체의 포괄적인 인-실리코 분석은 돌연변이 K409F로 인한 WT 염-가교 K409-D399의 상실(도 34A) 및 이로 인해 충족되지 않은 D399(도 34B)가 399-400 루프의 보다 더 "개방된" 입체구조를 야기한다는 것을 암시하였다. 나아가, 이것은 소수성 코어의 보다 많은 용매 노출 및 WT에 비해 변이체의 추가 불안정화를 초래한다. 399-400 루프를 안정화시키고 K409-D399 상호작용의 상실을 보완하기 위해 이용되는 방법들 중 하나는 변이체 AZ94에 대해 도 34C에 예시된 바와 같이 추가 염 가교 D399R-T411E 및 S400R-K392E의 디자인이었다. 실험 데이터는 95% 초과의 순도 및 74℃의 Tm을 보여주었다. 표 4 및 실시예 6을 참조한다. 추가로, AZ94가 초기 스카폴드-2 변이체(순도 <90%, Tm 71℃)에 비해 상당히 더 높은 순도 및 안정성을 갖는다고 하더라도, AZ94의 소수성 코어 돌연변이는 변이체 AZ70에서 확인된 "가장 우수한" 소수성 코어 돌연변이보다 덜 바람직하다(도 33). AZ70에서 소수성 코어 내의 돌연변이(T366V_L351Y)가 루프 399-400에서 AZ94의 염-가교 돌연변이로부터 멀리 떨어져 있기 때문에, AZ70 아미노산 돌연변이와 추가 AZ94 돌연변이의 조합은 AZ70 또는 AZ94보다 더 높은 용융 온도를 가질 것으로 예상된다. 이 조합은 실시예 1 내지 4에 기재된 바와 같이 시험될 수 있다.
도 35는 6개의 Fcγ 수용체에 결합하는 동종이량체 IgG1 Fc, 이종이량체 변이체 het1(대조군 1)(A:Y349C_T366S_L368A_Y407V/B:S354C_T366W) 및 het2(대조군 4)(A:K409D_K392D/B:D399K_D356K)의 결합 상수(Ka(M-1))를 예시한다. 이종이량체 Fc 변이체는 야생형 IgG1 Fc에 비해 Fcγ 수용체와의 약간 변경된 결합을 보여주는 경향을 나타낸다. 실시예 7을 참조한다.
도 36a는 기준으로서 야생형 결합 강도에 기초할 때 IIbF, IIBY 및 IIaR 수용체에 대한 야생형 IgG1 Fc 및 이의 다양한 동종이량체 및 비대칭 돌연변이체 형태들의 상대적 결합 강도를 보여준다. (Homo Fc + S267D)는 2개의 쇄 상에 S267D 돌연변이를 갖는 동종이량체 Fc의 결합 강도를 의미한다. (Het Fc + asym S267D)는 Fc에서 2개의 쇄들 중 하나에 도입된 S267D 돌연변이를 갖는 이종이량체 Fc의 결합 강도를 의미한다. 상기 2개의 Fc 쇄들 중 어느 하나 상에 돌연변이를 도입함으로써 수득된 결합 강도의 평균이 보고되어 있다. 1개의 쇄 상에 이 돌연변이를 도입하는 것은 결합 강도를 동종이량체 방식으로 도입된 동일한 돌연변이에 대해 관찰된 강도의 대략 절반까지 감소시켰다. (Het Fc + asym S267D + asym E269K)는 2개의 Fc 쇄들 중 하나 상에 비대칭 방식으로 도입된 S267D 및 E269K 돌연변이 둘다를 갖는 이종이량체 Fc의 결합 강도를 의미한다. E269K 돌연변이는 FcgR과 Fc의 면들 중 하나의 상호작용을 차단하고 결합 강도를 비대칭 S267D 변이체(Het Fc + S267D) 자체에 대해 관찰된 결합 강도의 대략 절반까지 감소시킬 수 있다. 이때, Het Fc는 도 35에서 변이체 het2(대조군 4)에 대해 표시된 바와 같이 CH3 돌연변이로 구성된다.
도 36b는 다양한 Fc 및 이의 변이체들과 다수의 FcgRIIa, FcgRIIb 및 FcgRIIIa 동종이형(allotypes)의 결합 상수(Ka(M-1))를 보여준다. 야생형 IgG1 Fc와 다양한 Fcg 수용체들의 Ka는 수평 음영을 갖는 막대로서 표시되어 있다. 수직 음영을 갖는 막대(동종이량체 기초 2)는 돌연변이 S239D/D265S/I332E/S298A를 갖는 동종이량체 Fc의 Ka를 나타낸다. 비스듬한 음영을 갖는 막대는 CH2 도메인 내에 비대칭 돌연변이 A:S239D/D265S/I332E/E269K 및 B:S239D/D265S/S298A를 갖는 이종이량체 Fc의 Ka나타낸다. 비대칭 돌연변이의 도입은 IIIa 수용체와 IIa/IIb 수용체 사이의 증가된 선택성을 달성할 수 있다. 이때, 이종이량체 Fc는 도 35에서 변이체 het2(대조군 4)에 대해 표시된 바와 같이 CH3 돌연변이로 구성된다.
도 36c는 야생형 IgG1, 및 Fc 영역의 CH2 도메인 내에 동종이량체 또는 비대칭 돌연변이를 포함하는 3개의 다른 변이체들에 대한 결합 상수(Ka(M-1))를 보여준다. 야생형 Fc의 Ka는 격자무늬 음영을 갖는 막대로 표시되어 있다. Fc의 2개 쇄들 상에 동종이량체 방식으로 도입된 기초 돌연변이 S239D/K326E/A330L/I332E/S298A를 갖는 Fc 변이체(동종이량체 기초 1)의 Ka는 비스듬한 패턴을 갖는 막대로 표시되어 있다. 관련된 돌연변이가 이종이량체 Fc(이종 기초 1)의 쇄 A 및 B 내에 비대칭 방식으로 도입된 것은 수평선으로 표시되어 있다. 수직 음영 선을 갖는 막대는 E269K 돌연변이를 포함하는 비대칭 변이체(이종 기초 1+PD)를 나타낸다. 이때, 이종이량체 Fc는 도 35에서 변이체 het2(대조군 4)에 대해 표시된 바와 같이 CH3 돌연변이로 구성된다.
도 37 - 표 6은 스카폴드 1에 대해 실시예 5에 기재된 바와 같은 제3 디자인 단계에 기초한 변이체 CH3 도메인들의 목록이다.
도 38 - 표 7은 스카폴드 2에 대해 실시예 6에 기재된 바와 같은 제3 디자인 단계에 기초한 변이체 CH3 도메인들의 목록이다.
도 2는 위치 368에서 야생형 잔기를 보여주는 도식 3-D 표시이다.
도 3은 돌연변이된 위치 368을 보여주는 영역 1의 도식 3-D 표시이다.
도 4는 영역 2 내의 추가 돌연변이의 도식 3-D 표시이다.
도 5는 처음 3개 변이체 AZ1, AZ2 및 AZ3에 대한 충돌 점수, 경계면 면적 차이, 팩킹 차이, 정전기 에너지 차이 및 전체적인 "친화성 점수"에 대한 인-실리코(in silico) 계산의 표이다.
도 6은 변이체 AZ1 "상에 구축된" 변이체 AZ2 및 AZ3을 보여주는 도식 3-D 영상을 보여준다.
도 7은 AZ2 및 AZ3 변이체의 도식 3-D 표시를 보여준다.
도 8은 AZ1, AZ2 및 AZ3 이종이량체 및 동종이량체에 대한, 도 5에서와 같은 표를 보여준다. 친화성 점수는 동종이량체와 관련 없으므로 동종이량체에 대한 그 양태를 보여주는 점수는 없다.
도 9는 야생형(좌측) 및 돌연변이된 AZ4(우측)의 3-D 표시의 도식 표시이다.
도 10은 AZ4 이종이량체 및 동종이량체에 대한 인-실리코 계산을 보여주는, 도 5와 같은 표이다.
도 11은 CH3 변이체 AZ5(좌측) 및 AZ6(우측)의 도식 표시이다.
도 12는 AZ4, AZ5 및 AZ6에 대한 인-실리코 데이터를 보여주는, 도 5에 대해 기재된 바와 같은 표이다.
도 13은 이종이량체 방법을 이용하였을 때 수용체 영역에서의 결합 특징의 가능성을 보여주는 도면과 함께, 항체의 도식 3-D 표시(좌측)이다.
도 14는 IgG 분자의 개략적 표시이다.
도 15는 Fcγ 수용체들의 다중 서열 정렬을 보여준다. 진뱅크(Genebank)/유니프롯(Uniprot) 서열 ID는 다음과 같다: FcγRIIA(sp P12318), FcγRIIB(sp P31994), FcγRIIC(gi 126116592), FcγRIIIA(sp P08637), FcγRIIIB(sp O75015).
도 16은 Fc-FcγRIIIb 복합체의 결정 구조의 개략도이다(PDB ID: 1T83, Radaev & Sun). Fc와 Fcγ 수용체의 1:1 복합체가 Fc의 2개 쇄들과 FcγR 사이의 비대칭 접촉과 함께 관찰된다.
도 17은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자의 개략도를 보여준다: 비대칭 Fc 스카폴드 및 비대칭 Fc-단량체 IgG 아암.
도 18은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자의 개략도를 보여준다: 비대칭 Fc-단일특이적 IgG 아암 및 비대칭 Fc-이중특이적 IgG 아암(공통의 경쇄).
도 19는 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자의 예시를 보여준다: 비대칭 Fc-이중특이적 IgG 아암 및 기능성 분자, 예컨대, 독소.
도 20은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자를 예시한다: 비대칭 Fc-단일 scFv 아암 및 비대칭 Fc-이중특이적 scFv 아암.
도 21은 비대칭 Fc 스카폴드에 기초한 대안적 다기능성 분자를 예시한다: 비대칭 Fc-삼중특이적 scFv 아암 및 비대칭 Fc-사중특이적 scFv 아암.
도 22는 보다 우수한 FcγR 선택성을 위한 Fc의 한 면 상의 돌연변이의 비대칭 디자인이 FcγR 상호작용에 대한 생산적 면 및 야생형 유사 상호작용을 갖는 비생산적 면을 도입한다는 것을 보여준다. Fc의 비생산적 면 상의 돌연변이는 FcR과의 상호작용을 차단하고 Fc의 극성을 편향시켜 생산적 면 상에서만 상호작용하도록 도입될 수 있다.
도 23은 야생형 인간 IgG1에 대한 아미노산 서열을 보여준다.
도 24는 하기 더 상세히 기재되어 있는 바와 같이 양성 디자인 방법과 음성 디자인 방법을 조합하는, Fc 이종이량체 디자인의 반복 과정을 보여준다.
도 25는 이종이량체 순도를 측정하는 데에 이용된 시험관내 분석을 보여준다. 상기 분석은 상이한 분자량의 하기 2개 Fc 중쇄를 갖는 전장 단일특이적 항체 스카폴드에 기초한다: 중쇄 A는 C-말단 히스태그(HisTag)(His)를 갖고, 중쇄 B는 C-말단 절단가능한 mRFP 태그(RFP)를 갖는다. 상기 2개 중쇄 A(His) 및 B(RFP)는 고정된 양의 경쇄와 함께 상이한 상대적 비로 발현되어 상이한 분자량을 갖는 3개의 가능한 이량체 종을 발생시킨다: a) 동종이량체 쇄 A(His)/쇄 A(His)(약 150 kDa); b) 이종이량체 쇄 A(His)/쇄 B(RFP)(약 175 kDa); 및 c) 동종이량체 쇄(RFP)/쇄 B(RFP)(약 200 kDa). 발현 후, 실시예 2에 기재되어 있는 바와 같이, 이종이량체 대 2개의 동종이량체의 비는 분자량에 의한 3개의 이량체 종의 분리를 가능하게 하는 비환원 SDS-PAGE에 의해 측정되었다. SDS-PAGE 겔은 쿠마시 브릴리언트 블루(Coomassie Brilliant Blue)로 염색되었다.
도 25a: 시험된 변이체는 WT 쇄 A(His) 단독; WT 쇄 B(RFP) 단독; WT 쇄 A(His) 플러스 쇄 B(RFP); 및 95% 초과의 보고된 이종이량체 순도를 갖는 대조군 1 쇄 A(His) 플러스 쇄 B(RFP)이었다. 이량체 밴드의 조성은 상기 예시된 바와 같이 IgG-Fc에 대한 항체(항-Fc), mRFP 태그에 대한 항체(항-mRFP) 및 히스태그에 대한 항체(항-His)를 사용하는 웨스턴 블롯에 의해 검증되었다. SDS-PAGE는 His/His 동종이량체에 대한 단일 밴드, His/RFP 이종이량체에 대한 이중 밴드 및 RFP 동종이량체에 대한 다중 밴드를 보여준다. 상기 다중 밴드는 mRFP 태그의 인공물이고 Fc 이종이량체의 물리적 성질에 영향을 미치지 않는 것으로 확인되었다.
도 25b: SDS-PAGE 분석은 공개된 Fc 이종이량체 변이체 대조군 1 내지 4를 대조군으로서 사용함으로써 검증되었다(표 A 참조). 상기 변이체들은 쇄 A(His) 대 쇄 B(RFP)의 상이한 상대적 비로 발현되었다: 구체적으로, 비 1:3은 25%,10%,65%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 1:1은 25%,20%,55%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 3:1은 25%,40%,35%의 LC,HC_His,HC_mRFP 비와 동등하다(쇄 A(His) 대 쇄 B(RFP)의 겉보기 1:1 발현은 WT Fc의 경우 20%/55%(His/RFP)에 가까운 것으로 확인되었다).
도 25c는 스카폴드 1 변이체의 이종이량체 순도를 측정하기 위한 비환원 SDS-PAGE 분석을 보여준다. Fc 변이체들은 쇄 A(His) 대 쇄 B(RFP)의 상이한 상대적 비로 발혀되었고 도 2에 기재된 바와 같이 비환원 SDS-PAGE에 의해 분석되었다. 구체적으로, 비 1:3은 25%,10%,65%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 1:1은 25%,20%,55%의 LC,HC_His,HC_mRFP 비와 동등하고, 비 3:1은 25%,40%,35%의 LC,HC_His,HC_mRFP 비와 동등하다(쇄 A(His) 대 쇄 B(RFP)의 겉보기 1:1 발현은 WT Fc의 경우 20%/55%(His/RFP)에 가까운 것으로 확인되었다).
도 26은 단백질 A 친화성 크로마토그래피에 의해 정제되고 도 25에 기재된 바와 같이 비환원 SDS-PAGE에 의해 분석된, 쇄 A(His) 대 쇄 B(RFP)의 특정 비(표 2 참조)로 발현된 Fc 이종이량체 변이체를 보여준다.
도 26A는 상이한 변이체들이 SDS-PAGE 결과의 가시적 검사에 기초한 순도의 카테고리로 어떻게 분류되는지를 예시한다. 비교를 위해, 동등한 양의 단백질 A 정제된 생성물을 겔 상에 적재하였다. 비환원 SDS-PAGE에 기초한 순도의 이 정의는 선택된 변이체 대한 LC/MS에 의해 확인되었다(도 28 참조).
도 26B는 스카폴드 1 및 2의 선택된 단백질 A 정제된 이종이량체 변이체의 예시적 SDS-PAGE 결과이다(AZ94, AZ86, AZ70, AZ33 및 AZ34).
도 27은 CH3-CH3 도메인의 용융 온도를 측정하기 위한 DSC 분석을 예시하고, 이때 2종의 독립적인 방법들이 이용되었다.
도 27A: 온도기록도가 4개의 독립적인 비-2-상태-전이에 피팅되었고 헤르셉틴에 대한 보고된 문헌 값들에 가까운 CH2 및 Fab 전이에 대한 약 72℃(CH2) 및 약 82℃(Fab)의 값을 산출하도록 최적화되었다.
도 27B: 이종이량체 변이체들에 대한 표준화된 온도기록도 및 기준 보정된 온도기록도가 WT로부터 차감되어 CH3 전이에 대해서만 양성 및 음성 차이 피크를 산출하였다.
도 28은 실시예 2에 기재된 바와 같은 예시적 변이체 AZ70의 LC/MS 분석을 예시한다. 글리코실화된 이종이량체 및 동종이량체에 대한 예측된(계산된 평균) 질량이 표시되어 있다. 이종이량체 질량과 일치하는 영역은 글리신의 상실(-57 Da) 및 1개 또는 2개의 헥소스의 추가(각각 +162 Da 및 +324 Da)에 상응하는 주 피크를 함유한다. 이종이량체 순도는 상기 동종이량체들 중 어느 하나에 상응하는 상당한 피크가 존재하지 않는 경우 90% 초과로서 분류된다.
도 29는 WT Fc(도 29A); AZ6(도 29B); AZ33(도 29C); 및 AZ19(도 29D)의 CH3 경계면을 보여준다. 상세한 설명 단락에 기재된 바와 같은 포괄적인 인-실리코 분석 및 변이체들과 WT의 비교는 WT보다 더 낮은 초기 AZ33 이종이량체의 안정성에 대한 이유들 중 하나가 Y407 및 T366의 코어 상호작용/팩킹의 상실이라는 것을 보여주었다. 초기 AZ33은 도 29B에 예시된 바와 같이 이 소수성 코어에서 비최적 팩킹을 보여주는데, 이것은 이 영역, 특히 위치 T366에서의 최적화가 AZ33의 안정성을 개선할 것임을 암시한다. 이것은 T366I 및 T366L을 갖는 도 29C 및 도 29D에 예시되어 있다. 실험적 데이터는 이 구조적 분석과 상관관계를 갖고 T366L이 Tm의 최대 개선을 제공한다는 것을 보여준다. 실시예 5를 참조한다.
도 30은 초기 스카폴드 1 변이체 AZ8에서 예시된, 입체구조적 동역학 분석의 유용성 및 중요성을 보여준다. 인-실리코 돌연변이유발 후 구조(WT에 가까운 주쇄 입체구조)가 50 ns 분자 동역학 시뮬레이션 분석의 대표적인 구조와 겹쳐져 있다. 도면은 AZ8 변이체 대 WT의 루프 영역 D399-S400에서의 큰 입체구조적 차이를 강조하고, 이 차이는 소수성 코어를 용매에 노출시키고 AZ8 이종이량체의 감소된 안정성을 야기한다.
도 31은 포괄적인 인-실리코 분석 및 MD 시뮬레이션으로부터의 정보가 기재된 양성 디자인 방법에서 어떻게 이용되었는지를 예시한다. 도 30에 예시된 바와 같이, WT보다 더 낮은 AZ8의 안정성에 대한 이유들 중 하나는 주로 F405 팩킹 상호작용의 상실에 기인하는, 루프 399-400 내지 409의 약화된 상호작용이다(도 31A(WT) 대 도 31B(AZ8)의 비교 참조). 양성 디자인 방법들 중 하나는 399-400 루프 입체구조를 안정화시키기 위한, 면적의 소수성 팩킹의 최적화이었다. 이것은 도 31C에 예시되어 있는 K392M 돌연변이에 의해 달성되었다. 도 31C는 초기 음성 디자인 변이체 AZ8의 74℃ 대 68℃의 Tm을 갖는 이종이량체 AZ33을 나타낸다.
도 32는 분자 동역학 궤도의 주요 성분 분석을 이용하였을 때 관찰된 Fc 분자의 동역학을 예시한다. 도 32A는 기준물질로서 Fc 구조의 주쇄 선을 보여준다. 도 32B 및 32C는 Fc 구조에서 상부 2개의 주요 움직임 방식에 따라 관찰된 동역학의 중첩을 나타낸다. 쇄 A 및 B의 CH2 도메인들은 서로에 대해 상대적으로 상당한 개방/폐쇄 움직임을 나타내는 반면, CH3 도메인들은 상대적으로 경직되어 있다. CH3 경계면에서의 돌연변이는 CH2 도메인에서의 이 개방/폐쇄 움직임의 상대적 유연성 및 동역학에 영향을 미친다.
도 33은 2개의 스카폴드-2 변이체들 대 WT의 소수성 코어 팩킹을 예시한다: WT Fc(도 33A); AZ63(도 33B); 및 AZ70(도 33C). 초기 스카폴드-2 변이체의 포괄적인 인-실리코 분석은 Y407-T366의 코어 WT 상호작용의 상실이 WT보다 더 낮은 초기 스카폴드-2 변이체의 안정성에 대한 이유들 중 하나라는 것을 암시하였다. Y407-T366의 상실은 돌연변이 K409F에 의해 부분적으로 보완되지만, 도 33B에 예시된 바와 같이, 특히 T366A 돌연변이는 WT에 비해 상기 변이체를 불안정화시키는 캐비티를 소수성 코어 내에 남겨둔다. 도 33C에서 Fc 변이체 AZ70으로 나타낸 바와 같이 추가 돌연변이 T366V_L351Y에 의한 이 소수성 코어의 표적화는 성공적인 것으로 입증되었고; AZ70은 75.5℃의 실험적으로 측정된 Tm을 갖는다. 표 4 및 실시예 6을 참조한다.
도 34는 2개의 스카폴드-2 변이체들 대 WT의 루프 399-400의 상호작용을 예시한다: WT Fc(도 34A); AZ63(도 34B); 및 AZ94(도 34C). 초기 스카폴드-2 변이체의 포괄적인 인-실리코 분석은 돌연변이 K409F로 인한 WT 염-가교 K409-D399의 상실(도 34A) 및 이로 인해 충족되지 않은 D399(도 34B)가 399-400 루프의 보다 더 "개방된" 입체구조를 야기한다는 것을 암시하였다. 나아가, 이것은 소수성 코어의 보다 많은 용매 노출 및 WT에 비해 변이체의 추가 불안정화를 초래한다. 399-400 루프를 안정화시키고 K409-D399 상호작용의 상실을 보완하기 위해 이용되는 방법들 중 하나는 변이체 AZ94에 대해 도 34C에 예시된 바와 같이 추가 염 가교 D399R-T411E 및 S400R-K392E의 디자인이었다. 실험 데이터는 95% 초과의 순도 및 74℃의 Tm을 보여주었다. 표 4 및 실시예 6을 참조한다. 추가로, AZ94가 초기 스카폴드-2 변이체(순도 <90%, Tm 71℃)에 비해 상당히 더 높은 순도 및 안정성을 갖는다고 하더라도, AZ94의 소수성 코어 돌연변이는 변이체 AZ70에서 확인된 "가장 우수한" 소수성 코어 돌연변이보다 덜 바람직하다(도 33). AZ70에서 소수성 코어 내의 돌연변이(T366V_L351Y)가 루프 399-400에서 AZ94의 염-가교 돌연변이로부터 멀리 떨어져 있기 때문에, AZ70 아미노산 돌연변이와 추가 AZ94 돌연변이의 조합은 AZ70 또는 AZ94보다 더 높은 용융 온도를 가질 것으로 예상된다. 이 조합은 실시예 1 내지 4에 기재된 바와 같이 시험될 수 있다.
도 35는 6개의 Fcγ 수용체에 결합하는 동종이량체 IgG1 Fc, 이종이량체 변이체 het1(대조군 1)(A:Y349C_T366S_L368A_Y407V/B:S354C_T366W) 및 het2(대조군 4)(A:K409D_K392D/B:D399K_D356K)의 결합 상수(Ka(M-1))를 예시한다. 이종이량체 Fc 변이체는 야생형 IgG1 Fc에 비해 Fcγ 수용체와의 약간 변경된 결합을 보여주는 경향을 나타낸다. 실시예 7을 참조한다.
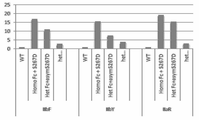
도 36a는 기준으로서 야생형 결합 강도에 기초할 때 IIbF, IIBY 및 IIaR 수용체에 대한 야생형 IgG1 Fc 및 이의 다양한 동종이량체 및 비대칭 돌연변이체 형태들의 상대적 결합 강도를 보여준다. (Homo Fc + S267D)는 2개의 쇄 상에 S267D 돌연변이를 갖는 동종이량체 Fc의 결합 강도를 의미한다. (Het Fc + asym S267D)는 Fc에서 2개의 쇄들 중 하나에 도입된 S267D 돌연변이를 갖는 이종이량체 Fc의 결합 강도를 의미한다. 상기 2개의 Fc 쇄들 중 어느 하나 상에 돌연변이를 도입함으로써 수득된 결합 강도의 평균이 보고되어 있다. 1개의 쇄 상에 이 돌연변이를 도입하는 것은 결합 강도를 동종이량체 방식으로 도입된 동일한 돌연변이에 대해 관찰된 강도의 대략 절반까지 감소시켰다. (Het Fc + asym S267D + asym E269K)는 2개의 Fc 쇄들 중 하나 상에 비대칭 방식으로 도입된 S267D 및 E269K 돌연변이 둘다를 갖는 이종이량체 Fc의 결합 강도를 의미한다. E269K 돌연변이는 FcgR과 Fc의 면들 중 하나의 상호작용을 차단하고 결합 강도를 비대칭 S267D 변이체(Het Fc + S267D) 자체에 대해 관찰된 결합 강도의 대략 절반까지 감소시킬 수 있다. 이때, Het Fc는 도 35에서 변이체 het2(대조군 4)에 대해 표시된 바와 같이 CH3 돌연변이로 구성된다.
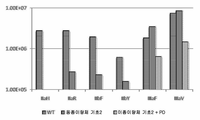
도 36b는 다양한 Fc 및 이의 변이체들과 다수의 FcgRIIa, FcgRIIb 및 FcgRIIIa 동종이형(allotypes)의 결합 상수(Ka(M-1))를 보여준다. 야생형 IgG1 Fc와 다양한 Fcg 수용체들의 Ka는 수평 음영을 갖는 막대로서 표시되어 있다. 수직 음영을 갖는 막대(동종이량체 기초 2)는 돌연변이 S239D/D265S/I332E/S298A를 갖는 동종이량체 Fc의 Ka를 나타낸다. 비스듬한 음영을 갖는 막대는 CH2 도메인 내에 비대칭 돌연변이 A:S239D/D265S/I332E/E269K 및 B:S239D/D265S/S298A를 갖는 이종이량체 Fc의 Ka나타낸다. 비대칭 돌연변이의 도입은 IIIa 수용체와 IIa/IIb 수용체 사이의 증가된 선택성을 달성할 수 있다. 이때, 이종이량체 Fc는 도 35에서 변이체 het2(대조군 4)에 대해 표시된 바와 같이 CH3 돌연변이로 구성된다.
도 36c는 야생형 IgG1, 및 Fc 영역의 CH2 도메인 내에 동종이량체 또는 비대칭 돌연변이를 포함하는 3개의 다른 변이체들에 대한 결합 상수(Ka(M-1))를 보여준다. 야생형 Fc의 Ka는 격자무늬 음영을 갖는 막대로 표시되어 있다. Fc의 2개 쇄들 상에 동종이량체 방식으로 도입된 기초 돌연변이 S239D/K326E/A330L/I332E/S298A를 갖는 Fc 변이체(동종이량체 기초 1)의 Ka는 비스듬한 패턴을 갖는 막대로 표시되어 있다. 관련된 돌연변이가 이종이량체 Fc(이종 기초 1)의 쇄 A 및 B 내에 비대칭 방식으로 도입된 것은 수평선으로 표시되어 있다. 수직 음영 선을 갖는 막대는 E269K 돌연변이를 포함하는 비대칭 변이체(이종 기초 1+PD)를 나타낸다. 이때, 이종이량체 Fc는 도 35에서 변이체 het2(대조군 4)에 대해 표시된 바와 같이 CH3 돌연변이로 구성된다.
도 37 - 표 6은 스카폴드 1에 대해 실시예 5에 기재된 바와 같은 제3 디자인 단계에 기초한 변이체 CH3 도메인들의 목록이다.
도 38 - 표 7은 스카폴드 2에 대해 실시예 6에 기재된 바와 같은 제3 디자인 단계에 기초한 변이체 CH3 도메인들의 목록이다.
4. 상세한 설명
본 발명은 이종이량체 형성을 촉진하기 위한 특정 아미노산 변형을 포함하는 변형된 CH3 도메인을 제공한다. 한 실시양태에서, 변형된 CH3 도메인은 이종이량체 형성을 촉진하기 위한 특정 아미노산 변형을 포함한다(예를 들면, 표 1 참조). 또 다른 실시양태에서, 변형된 CH3 도메인은 증가된 안정성을 갖는 이량체 형성을 촉진하기 위한 특정 아미노산 변형을 포함한다(예를 들면, 표 4, 표 6 및 표 7 참조). 안정성은 CH3 도메인의 용융 온도(Tm)로서 측정되고, 증가된 안정성은 약 70℃ 이상의 Tm을 의미한다. CH3 도메인은 이종다량체 또는 이중특이적 항체의 Fc 영역의 일부를 형성한다. 따라서, 한 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변형된 또는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 표 1에 나열된 변이체들로부터 선택된다. 제2 실시양태에서, 이종이량체 Fc 영역을 포함하는 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 70℃ 이상의 용융 온도(Tm)를 갖는다.
변형된 CH3 도메인을 발생시키는 데에 이용될 수 있는 아미노산 변형은 아미노산 삽입, 결실, 치환 및 재배열을 포함하나 이들로 한정되지 않는다. CH3 도메인의 변형 및 변형된 CH3 도메인은 본원에서 "CH3 변형", "변형된 CH3 도메인", "변이체 CH3 도메인" 또는 "CH3 변이체"로서 총칭된다. 이들 변형된 CH3 도메인들은 선택된 분자 내로 도입될 수 있다. 따라서, 한 실시양태에서 변형된 CH3 도메인을 포함하는 Fc 영역(본원에서 사용된 바와 같이, "Fc 영역" 및 유사한 용어는 CH3 도메인의 적어도 일부를 포함하는 임의의 중쇄 불변 영역 도메인을 포괄함)을 포함하는 분자, 구체적으로 폴리펩티드, 보다 구체적으로 면역글로불린(예를 들면, 항체) 및 다른 결합 단백질이 제공된다. 변형된 CH3 도메인(예를 들면, 하나 이상의 아미노산 삽입, 결실, 치환 또는 재배열을 포함하는 CH3 도메인)을 포함하는 Fc 영역을 포함하는 분자는 본원에서 "Fc 변이체", "이종이량체" 또는 "이종다량체"로서 지칭된다. 본 Fc 변이체는 이종이량체 Fc 변이체 또는 영역을 발생시키기 위해 비대칭적으로 변형된 CH3 도메인을 포함한다. 각각의 Fc 영역이 1개의 쇄 A 및 1개의 쇄 B 폴리펩티드를 포함하는 한, Fc 영역은 상호교환적으로 사용될 수 있는 2개의 중쇄 불변 도메인 폴리펩티드(쇄 A 및 쇄 B)로 구성된다. 2개의 변형된 CH3 도메인이 Fc 변이체를 형성하는 경우 아미노산 변형은 비대칭 방식으로 CH3 내로 도입되어 이종이량체를 발생시킨다(예를 들면, 표 1 참조). 본원에서 사용된 바와 같이, 비대칭 아미노산 변형은 임의의 변형이고, 이때 한 폴리펩티드(예를 들면, "쇄 A") 상의 특정 위치에 존재하는 아미노산은 이종이량체 또는 Fc 변이체의 동일 위치에 존재하는 제2 폴리펩티드(예를 들면, "쇄 B") 상의 아미노산과 상이하다. 이것은 2개의 아미노산들 중 하나만이 변형된 결과일 수 있거나, 아미노산 둘다가 Fc 변이체의 쇄 A 및 쇄 B로부터의 2개의 상이한 아미노산으로 변형된 결과일 수 있다. 변이체 CH3 도메인은 하나 이상의 비대칭 아미노산 변형을 포함하는 것으로 이해된다.
본 설명에서, 달리 표시되어 있지 않은 한, 임의의 농도 범위, 백분율 범위, 비 범위 또는 정수 범위는 언급된 범위 내의 임의의 정수 및 적절한 경우 이들의 분수(예컨대, 정수의 십분의 일 및 백분의 일)의 값을 포함하는 것으로 이해되어야 한다. 본원에서 사용된 바와 같이, 달리 표시되어 있지 않은 한, "약"은 표시된 범위, 값, 순서 또는 구조의 ± 10%를 의미한다. 문맥이 달리 표시하거나 명시하지 않은 한, 본원에서 사용된 바와 같은 용어 "한" 및 "하나"는 나열된 성분들 중 "하나 이상"을 의미하는 것임을 이해해야 한다. 대안적 용어(예를 들면, "또는")의 사용은 대안들 중 어느 하나, 둘다 또는 이들의 임의의 조합을 의미하는 것으로 이해되어야 한다. 본원에서 사용된 바와 같이, 용어 "함유한다" 및 "포함한다"는 동의어로 사용된다. 또한, 본원에 기재된 구조들 및 치환기들(예를 들면, 변이체 CH3 도메인들)의 다양한 조합으로부터 유도된 개별 단일 쇄 폴리펩티드 또는 이종이량체는 각각의 단일 쇄 폴리펩티드 또는 이종이량체가 개별적으로 기재된 것과 동일한 정도로 본원에 의해 개시된다는 것을 이해해야 한다. 따라서, 개별 단일 쇄 폴리펩티드 또는 이종이량체를 형성하기 위한 특정 성분의 선택은 본 개시내용의 범위 내에 있다.
"제1 폴리펩티드"는 제2 폴리펩티드와 결합될 임의의 폴리펩티드이고 본원에서 "쇄 A"로도 지칭된다. 제1 폴리펩티드와 제2 폴리펩티드는 "경계면"에서 만난다. "제2 폴리펩티드"는 "경계면"을 통해 제1 폴리펩티드와 결합될 임의의 폴리펩티드이고 본원에서 "쇄 B"로도 지칭된다. "경계면"은 제2 폴리펩티드의 경계면에서 하나 이상의 "접촉" 아미노산 잔기와 상호작용하는 제1 폴리펩티드 내의 "접촉" 아미노산 잔기를 포함한다. 본원에서 사용된 바와 같이, 경계면은 바람직하게는 IgG 항체, 가장 바람직하게는 인간 IgG1 항체로부터 유래된 Fc 영역의 CH3 도메인을 포함한다.
본원에서 사용된 바와 같이, "단리된" 이종다량체는 그의 천연 세포 배양 환경의 성분으로부터 확인되고 분리되고/되거나 회수된 이종다량체를 의미한다. 그의 천연 환경의 오염 성분은 이종다량체에 대한 진단 또는 치료 용도를 방해할 물질이고 효소, 호르몬 및 다른 단백질성 또는 비단백질성 용질을 포함할 수 있다.
변이체 Fc 이종이량체는 일반적으로 실질적인 균질성까지 정제된다. 어구 "실질적으로 균질한", "실질적으로 균질한 형태" 및 "실질적인 균질성"은 생성물이 원치 않는 폴리펩티드 조합물(예를 들면, 동종이량체)로부터 유래된 부산물을 실질적으로 갖지 않는다는 것을 표시하기 위해 사용된다. 순도의 관점에서 표현될 때, 실질적인 균질성은 부산물의 양이 10%를 초과하지 않고 바람직하게는 5% 미만, 보다 바람직하게는 1% 미만, 가장 바람직하게는 0.5% 미만이라는 것을 의미하고, 이때 백분율은 중량을 기준으로 한 것이다.
본원에서 상이하게 명시적으로 정의되어 있지 않은 한, 항체 기술 분야의 당업자에 의해 이해되는 용어들은 당업계에서 획득된 의미가 각각 부여받는다. 항체는 가변 영역, 힌지(hinge) 영역 및 불변 도메인을 갖는 것으로 공지되어 있다. 면역글로불린 구조 및 기능은 예를 들면, 문헌(Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988))에서 검토되어 있다.
야생형 동종이량체로부터 변이체 Fc 이종이량체의 디자인은 안정성 대 특이성의 균형을 이룸으로써 단백질 조작의 면에서 양성 및 음성 디자인의 개념에 의해 예시되고, 이때 돌연변이는 폴리펩티드가 세포 배양 조건에서 발현될 때 동종이량체 형성에 비해 이종이량체 형성을 유도할 목적으로 도입된다. 음성 디자인 방법은 용적이 큰 측쇄를 한 쇄 상에 도입하고 작은 측쇄를 반대 쇄 상에 도입함으로써, 예를 들면, 제넨테크(Genentech)에 의해 개발된 놉스-인투-홀스(knobs-into-holes) 방법(Ridgway JB, Presta LG, Carter P. 'Knobs-into-holes' engineering of antibody CH3 domains for heavy chain heterodimerization. Protein Eng. 1996 Jul;9(7):617-21; Atwell S, Ridgway JB, Wells JA, Carter P. Stable heterodimers from remodeling the domain interface of a homodimer using a phage display library. J Mol Biol. 270(1):26-35 (1997)))을 이용함으로써, 또는 동종이량체 형성의 반발을 초래하는 정전기 조작, 예를 들면, 암젠(Amgen)에 의해 개발된 정전기 조종 방법(Gunaskekaran K, et al. Enhancing antibody Fc heterodimer formation through electrostatic steering effects: applications to bispecific molecules and monovalent IgG. JBC 285 (25): 19637-19646 (2010))을 이용함으로써 동종이량체의 형성에 불리한 상호작용을 최대화한다. 이들 2개 예에서, 이종이량체 형성을 유도하기 위해 음성 디자인 비대칭 점 돌연변이가 야생형 CH3 도메인 내로 도입되었다. 최근에, Fc 이종이량체를 개발하기 위해 음성 디자인 방법만이 이용되어 왔다. 공개된 결과는 음성 디자인 방법만을 이용하여 디자인한 이종이량체가 95% 초과의 이종이량체 순도와 함께 높은 특이성을 나타내지만 복합체를 상당히 불안정화시킨다는 것을 보여준다(상기). 이들 음성 디자인 이종이량체는 69℃ 이하의 변형된 CH3 도메인의 용융 온도를 보유하고 야생형에 비해 추가 이황화 결합을 갖지 않는다. 하기 표 A를 참조한다.
[표 A]
음성 디자인과 대조적으로, 단백질을 조작하기 위해 이용되는 일반적인 개념은 양성 디자인이다. 이 경우, 아미노산 변형은 단백질 내의 또는 단백질 사이의 유리한 상호작용을 최대화하기 위해 폴리펩티드 내로 도입된다. 이 방법은 동종이량체에 대한 영향을 무시하면서 원하는 이종이량체를 특이적으로 안정화시키는 다수의 돌연변이를 도입할 때, 순 효과가 동종이량체에 비해 원하는 이종이량체 상호작용에 대한 보다 우수한 특이성 및 이로 인한 보다 높은 이종이량체 특이성일 것이라고 가정한다. 양성 디자인 방법은 원하는 단백질 상호작용의 안정성을 최적화하지만 90% 초과의 특이성을 좀처럼 달성하지 못한다는 것이 단백질 조작의 면에서 이해된다(Havranek JJ & Harbury PB. Automated design of specificity in molecular recognition. Nat Struct Biol. 10(1):45-52 (2003); Bolon DN, Grant RA, Baker TA, Sauer RT. Specificity versus stability in computational protein design. Proc Natl Acad Sci U S A. 6;102(36):12724-9 (2005); Huang PS, Love JJ, Mayo SL. A de novo designed protein protein interface Protein Sci. 16(12):2770-4 (2007)). 따라서, 지금까지, 치료 항체 제조 및 개발을 위해 특이성이 안정성보다 더 중요하였기 때문에 양성 디자인 방법은 Fc 이종이량체를 디자인하는 데에 이용되지 않았다. 또한, 유리한 양성 디자인 돌연변이가 예측되기 어려울 수 있다. 안정성, 예컨대, 추가 이황화 결합을 개선하기 위한 다른 방법이 Fc 이종이량체의 안정성을 개선하기 위해 시도되었으나 상기 분자에 대한 개선은 제한적으로 성공적이었다(표 A 참조). 이것은 모든 조작된 Fc CH3 도메인 이황화 결합들이 용매에 노출되고 이것이 이황화 결합의 수명을 단축시킴으로써 특히 조작된 CH3 도메인이 (이황화 결합의 부재 하에서 69℃의 Tm을 갖는 대조군 4에서와 같이) 추가 이황화 결합의 부재 하에서 70℃ 미만의 Tm을 가질 때 이종이량체의 장기간 안정성에 대한 상당한 영향을 미치기 때문일 수 있다(대조군 2 참조). CH3 도메인의 (용융 온도로서 측정된) 고유 안정성이 이황화 결합의 부재 하에서 70℃ 이상인 한, 특히 CH3 도메인의 (용융 온도로서 측정된) 고유 안정성이 이황화 결합의 부재 하에서 72℃ 이상일 때, 안정성을 개선하기 위한 다른 방법, 예컨대, 이황화 결합도 본 Fc 변이체와 함께 이용될 수 있다는 것이 고려된다.
따라서, 본 발명자들은 안정하고 고도로 특이적인 이종이량체를 형성하는, Fc 이종이량체를 디자인하는 신규 방법을 본원에서 개시한다. 이 디자인 방법은 구조적 모델링 및 컴퓨터를 이용한 모델링에 의해 안내된 단백질 조작 기법과 함께 음성 디자인 방법 및 양성 디자인 방법 둘다를 조합한다. 이 강력한 방법은 본 발명자들이 IgG1 CH3 도메인 내의 돌연변이들의 신규 조합을 디자인할 수 있게 하였고, 이때 표준 세포 배양 조건만을 이용하여 동종이량체에 비해 90% 초과의 순도를 갖는 이종이량체를 형성하였고, 생성된 이종이량체는 70℃ 이상의 용융 온도를 가졌다. 예시적 실시양태에서, Fc 변이체 이종이량체는 73℃ 이상의 용융 온도 및 98% 초과의 순도를 갖는다. 다른 예시적 실시양태에서, Fc 변이체 이종이량체는 75℃ 이상의 용융 온도 및 90% 초과의 순도를 갖는다.
일부 실시양태에서, 이종이량체 Fc 영역을 포함하는 단리된 이종다량체가 제공되고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 70℃ 이상의 용융 온도(Tm)를 갖는다. 본원에서 사용된 바와 같이, "증가된 안정성" 또는 "안정한 이종이량체"는 이종이량체 형성에 있어서 약 70℃ 이상의 용융 온도를 갖는 변이체 CH3 도메인을 의미한다. 또한, 용어 "이종이량체 형성을 촉진하기 위한"은 본원에서 동종이량체 형성에 비해 90% 초과의 이종이량체 형성을 발생시키는 CH3 도메인 내의 아미노산 돌연변이를 의미하는 것으로 이해된다.
추가 실시양태에서, 증가된 안정성은 추가 이황화 결합의 부재 하에서 존재한다. 특히, 증가된 안정성은 CH3 도메인 내의 추가 이황화 결합의 부재 하에서 존재한다. 한 실시양태에서, 변이체 CH3 도메인은 야생형 CH3 도메인에 비해 추가 이황화 결합을 포함하지 않는다. 대안적 실시양태에서, 변이체 CH3은 야생형 CH3 도메인에 비해 하나 이상의 이황화 결합을 포함하되, 상기 변이체 CH3은 이황화 결합의 부재 하에서 70℃ 이상의 용융 온도를 갖는다. 한 실시양태에서, 변이체 CH3 도메인은 야생형 CH3 도메인에 비해 하나 이상의 이황화 결합을 포함하고, 상기 변이체 CH3 도메인은 약 77.5℃ 이상의 용융 온도(Tm)를 갖는다. 한 실시양태에서, 변이체 CH3 도메인은 야생형 CH3 도메인에 비해 하나 이상의 이황화 결합을 포함하고, 상기 변이체 CH3 도메인은 약 78℃ 이상의 용융 온도(Tm)를 갖는다. 또 다른 실시양태에서, 변이체 CH3 도메인은 야생형 CH3 도메인에 비해 하나 이상의 이황화 결합을 포함하고, 상기 변이체 CH3 도메인은 약 78℃ 초과, 약 78.5℃ 초과, 약 79℃ 초과, 약 79.5℃ 초과, 약 80℃ 초과, 약 80.5℃ 초과 또는 약 81℃ 초과의 용융 온도(Tm)를 갖는다.
한 실시양태에서, 변이체 CH3 도메인은 약 70℃ 초과, 약 70.5℃ 초과, 약 71℃ 초과, 약 71.5℃ 초과, 약 72℃ 초과, 약 72.5℃ 초과, 약 73℃ 초과, 약 73.5℃ 초과, 약 74℃ 초과, 약 74.5℃ 초과, 약 75℃ 초과, 약 75.5℃ 초과, 약 76℃ 초과, 약 76.5℃ 초과, 약 77℃ 초과, 약 77.5℃ 초과, 약 78℃ 초과, 약 78.5℃ 초과, 약 79℃ 초과, 약 79.5℃ 초과, 약 80℃ 초과, 약 80.5℃ 초과 또는 약 81℃ 초과의 용융 온도를 갖는다. 또 다른 실시양태에서, 변이체 CH3 도메인은 약 70℃, 약 70.5℃, 약 71℃, 약 71.5℃, 약 72℃, 약 72.5℃, 약 73℃, 약 73.5℃, 약 74℃, 약 74.5℃, 약 75℃, 약 75.5℃, 약 76℃, 약 76.5℃, 약 77℃, 약 77.5℃, 약 78℃, 약 78.5℃, 약 79℃, 약 79.5℃, 약 80℃, 약 80.5℃ 또는 약 81℃의 용융 온도를 갖는다. 또 다른 실시양태에서, 변이체 CH3 도메인은 약 70℃ 내지 약 81℃, 약 70.5℃ 내지 약 81℃, 약 71℃ 내지 약 81℃, 약 71.5℃ 내지 약 81℃, 약 72℃ 내지 약 81℃, 약 72.5℃ 내지 약 81℃, 약 73℃ 내지 약 81℃, 약 73.5℃ 내지 약 81℃, 약 74℃ 내지 약 81℃, 약 74.5℃ 내지 약 81℃, 약 75℃ 내지 약 81℃, 약 75.5℃ 내지 약 81℃, 약 76℃ 내지 약 81℃, 약 76.5℃ 내지 약 81℃, 약 77℃ 내지 약 81℃, 약 77.5℃ 내지 약 81℃, 약 78℃ 내지 약 81℃, 약 78.5℃ 내지 약 81℃, 또는 약 79℃ 내지 약 81℃의 용융 온도를 갖는다. 또 다른 실시양태에서, 변이체 CH3 도메인은 약 71℃ 내지 약 76℃, 약 72℃ 내지 약 76℃, 약 73℃ 내지 약 76℃, 또는 약 74℃ 내지 약 76℃의 용융 온도를 갖는다.
개선된 안정성 이외에, 이종이량체 Fc 영역은 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함한다. 이들 아미노산 돌연변이는 동종이량체 형성에 비해 이종이량체 형성을 촉진하는 것으로 이해된다. 동종이량체 형성에 비해 이 이종이량체 형성은 본원에서 "순도", "특이성", "이종이량체 순도" 또는 "이종이량체 특이성"으로서 총칭된다. 이종이량체 순도는 이종이량체 종의 선택적 정제 전에 표준 세포 배양 조건 하에서 용액에서 형성된 동종이량체 종에 비해 형성된 원하는 이종이량체의 백분율을 의미하는 것으로 이해된다. 예를 들면, 90%의 이종이량체 순도는 용액 중의 이량체 종의 90%가 원하는 이종이량체라는 것을 표시한다. 한 실시양태에서, Fc 변이체 이종이량체는 약 90% 초과, 약 91% 초과, 약 92% 초과, 약 93% 초과, 약 94% 초과, 약 95% 초과, 약 96% 초과, 약 97% 초과, 약 98% 초과 또는 약 99% 초과의 순도를 갖는다. 또 다른 실시양태에서, Fc 변이체 이종이량체는 약 90%, 약 91%, 약 92%, 약 93%, 약 94%, 약 95%, 약 96%, 약 97%, 약 98%, 약 99% 또는 약 100%의 순도를 갖는다.
특정 실시양태에서, 단리된 이종다량체는 이종이량체 Fc 영역을 포함하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 70℃ 이상의 용융 온도(Tm)를 갖고, 생성된 이종이량체는 90% 초과의 순도를 갖는다. 한 양태에서, 생성된 Fc 변이체 이종이량체는 90% 초과의 순도를 갖고, 변이체 CH3 도메인은 약 70℃ 초과, 약 71℃ 초과, 약 72℃ 초과, 약 73℃ 초과, 약 74℃ 초과, 약 75℃ 초과, 약 76℃ 초과, 약 77℃ 초과, 약 78℃ 초과, 약 79℃ 초과, 약 80℃ 초과 또는 약 81℃ 초과의 용융 온도를 갖는다. 추가 양태에서, 변이체 CH3 도메인은 70℃ 이상의 용융 온도를 갖고, 생성된 Fc 변이체 이종이량체는 약 90% 초과, 약 91% 초과, 약 92% 초과, 약 93% 초과, 약 94% 초과, 약 95% 초과, 약 96% 초과, 약 97% 초과, 약 98% 초과 또는 약 99% 초과의 순도를 갖는다.
개선된 안정성 및 순도를 갖는 이들 Fc 변이체들을 디자인하기 위해, 본 발명자들은 컴퓨터를 이용한 디자인 및 실험 스크리닝의 반복 과정을 이용하여 양성 디자인 방법과 음성 디자인 방법의 가장 성공적인 조합을 선택하였다(도 24 참조).
구체적으로, 초기 디자인 단계에서, 상이한 음성 디자인 Fc 변이체 이종이량체들을 제조하였고 실시예 1 내지 3에 기재된 바와 같이 발현 및 안정성에 대해 시험하였다. 초기 디자인 단계는 Fc 변이체 이종이량체 AZ1 내지 AZ16을 포함하였다(표 1 참조). 낮은 안정성(예를 들면, 71℃ 미만의 Tm)을 가질 것으로 예측되었던 음성 디자인 Fc 변이체 이종이량체들의 이 초기 세트로부터 90% 초과의 순도 및 약 68℃ 이상의 용융 온도를 갖는 Fc 변이체 이종이량체들을 추가 개발을 위해 선택하였다. 이것은 Fc 변이체 이종이량체 AZ6, AZ8 및 AZ15를 포함하였다. 제2 디자인 단계에서, 선택된 Fc 변이체 이종이량체들을 상세한 컴퓨터를 이용한 분석 및 구조적 분석 후 양성 디자인 방법을 이용하여 추가로 변형시켜 안정성 및 순도 둘다를 유도하였다. 선택된 Fc 변이체 이종이량체들(AZ6, AZ8 및 AZ15)을 컴퓨터를 이용한 방법 및 포괄적인 구조-기능 분석으로 각각 분석하여, 이들 Fc 변이체가 야생형 Fc 동종이량체의 안정성(IgG1의 경우 81℃임)보다 더 낮은 안정성을 갖는 구조적 이유를 확인하였다. Fc 변이체 이종이량체 및 Tm 값의 목록에 대해서는 표 4를 참조한다.
일부 실시양태에서, 변이체 CH3 도메인은 AZ1, AZ2, AZ3, AZ4, AZ5, AZ6, AZ7, AZ8, AZ9, AZ10, AZ11, AZ12, AZ13, AZ14, AZ15 및 AZ16으로부터 선택된다. 선택된 실시양태에서, 변이체 CH3 도메인은 AZ6, AZ8 또는 AZ15이다.
컴퓨터를 이용한 수단 및 구조-기능 분석은 분자 동역학 분석(MD), 측쇄/주쇄 재팩킹, 지식 기초 잠재력(KBP), 캐비티 및 (소수성) 팩킹 분석(LJ, CCSD, SASA, dSASA(탄소/모든 원자)), 정전기-GB 계산 및 커플링 분석을 포함하였으나 이들로 한정되지 않았다(컴퓨터를 이용한 방법의 개요에 대해서는 도 24 참조).
본 발명자들의 단백질 조작 방법의 한 양태는 X-선 결정학으로부터 유도된 Fc IgG 단백질의 구조적 정보와, CH3 도메인의 야생형 및 변이체 형태의 컴퓨터를 이용한 모델링 및 시뮬레이션의 조합에 의존하였다. 이것은 본 발명자들이 개별 아미노산의 잠재적 역할 및 그들의 협동 작용에 대한 신규 구조적 및 물리화학적 통찰을 획득할 수 있게 하였다. 다수의 변이체 CH3 도메인들로부터 수득된 이들 구조적 및 물리화학적 통찰은 그들의 안정성 및 순도에 관한 수득된 실험 데이터와 함께 본 발명자들이 Fc 동종이량체와 비교된 Fc 이종이량체의 순도 및 안정성과 시뮬레이션된 구조적 모델 사이의 관계에 대한 이해를 발전시키는 데에 도움을 주었다. 본 발명자들의 시뮬레이션을 실행하기 위해, 본 발명자들은 완전하고 현실적인 모델을 구축하고 IgG1 항체의 야생형 Fc 구조의 질을 개량함으로써 시작하였다. X-선 결정학으로부터 유도된 단백질 구조는 생리학적 조건 하에서 수성 매질 중의 단백질의 일부 특징에 대한 세부사항 면에서 결여되어 있고, 본 발명자들의 개량 절차는 이들 한계점들을 다루었다. 이들은 단백질 구조의 결실 영역(종종 단백질의 유연한 부분, 예컨대, 루프 및 몇몇 잔기 측쇄)의 구축, 중성 잔기 및 하전된 잔기의 양성자화 상태의 평가 및 정의, 및 상기 단백질과 결합된 잠재적 기능적으로 관련된 물 분자의 배치를 포함한다.
분자 동역학(MD) 알고리즘은 본 발명자들이 수성 환경에서 Fc 동종이량체 및 변이체 CH3 도메인의 고유 동역학 성질을 평가하기 위해 단백질 구조를 시뮬레이션함으로써 사용한 하나의 수단이다. 분자 동역학 시뮬레이션은 단백질 및 이의 국소 환경 내의 모든 원자 물질들, 이 경우 Fc 및 이의 주변 물 분자를 구성하는 원자들 사이에 작용하는 상호작용 및 힘으로부터 발생하는 움직임으로부터 비롯된 분자의 동역학 궤도를 추적한다. 분자 동역학 시뮬레이션 후, 상기 궤도의 다양한 양태를 분석하여 Fc 동종이량체 및 변이체 Fc 이종이량체의 구조적 및 동역학적 특징에 대한 통찰을 획득하였고, 본 발명자들은 이 통찰을 이용하여 상기 분자의 순도 및 안정성 둘다를 개선하는 특정 아미노산 돌연변이를 확인하였다.
따라서, 발생된 MD 궤도를 방법, 예컨대, 주 성분 분석을 이용하여 연구함으로써 Fc 구조에서 고유 저 주파수 움직임 방식을 밝혔다. 이것은 단백질의 잠재적 입체구조적 하위상태에 대한 통찰을 제공한다(도 32 참조). Fc 영역에서 쇄 A와 B 사이의 매우 중요한 단백질-단백질 상호작용은 CH3 도메인의 경계면에서 일어나지만, 본 발명자들의 시뮬레이션은 이 경계면이 서로에 대해 CH2 도메인들의 N-말단의 "개방" 및 "폐쇄"를 수반하는 움직임으로 힌지로서 작용한다는 것을 보여주었다. CH2 도메인은 도 16에서 볼 수 있는 바와 같이 이 말단에서 FcgR과 상호작용한다. 따라서, 이론에 구속받고자 하는 것은 아니지만, CH3 경계면에서 아미노산 돌연변이의 도입이 Fc의 N-말단에서 개방/폐쇄 움직임의 크기 및 성질에 영향을 미침으로써 Fc가 FcgR과 상호작용하는 방법에 영향을 미치는 듯하다. 실시예 4 및 표 5를 참조한다.
또한, 발생된 MD 궤도를 연구함으로써 Fc 구조에서 특정 아미노산 잔기 위치들의 돌연변이성을 이들의 유연성의 프로파일링 및 이들의 환경의 분석에 기초하여 확인하였다. 이 알고리즘은 본 발명자들이 단백질 구조 및 기능에 영향을 미칠 수 있는 잔기를 확인할 수 있게 함으로써 변이체 CH3 도메인의 후속 디자인 단계를 위한 잔기 특징 및 돌연변이성에 대한 독특한 통찰을 제공하였다. 또한, 이 분석은 본 발명자들이 다수의 시뮬레이션을 비교하고 프로파일링 후 이상치(outliers)에 기초하여 돌연변이성을 평가할 수 있게 하였다.
또한, 발생된 MD 궤도를 연구함으로써 단백질에서 상호관련된 잔기 움직임 및 잔기들 사이의 커플링의 결과로서 잔기들의 네트워크의 형성을 확인하였다. Fc 구조 내의 잔기들의 동역학적 상관관계 및 네트워크의 발견은 동역학적 물질로서 단백질을 이해하고 멀리 떨어져 있는 부위들에서의 돌연변이들의 효과에 대한 통찰을 발전시키는 데에 있어서 매우 중요한 단계이다. 예를 들면, 실시예 6을 참조한다.
따라서, 본 발명자들은 돌연변이의 부위의 국소 환경에 대한 돌연변이의 영향을 상세히 연구하였다. 쇄 A와 B 사이의 CH3 경계면에서 잘 팩킹된 코어의 형성은 안정한 Fc 구조에서 상기 2개의 쇄들의 자연발생적 페어링을 위해 매우 중요하다. 우수한 팩킹은 접촉 기들 사이의 유리한 상호작용과 커플링된 상호작용하는 분자 파트너들 사이의 강한 구조적 상보성의 결과이다. 유리한 상호작용은 용매 노출로부터 잘 제거된 파묻힌 소수성 접촉으로부터 발생되고/되거나 친수성 극성 기들 사이의 상보적 정전기 접촉의 형성으로부터 발생된다. 이들 소수성 접촉 및 친수성 접촉은 CH3 경계면에서 이량체 형성의 자유 에너지에 에트로피적으로 및 엔탈피적으로 기여한다. 본 발명자들은 다양한 알고리즘을 이용하여 쇄 A와 쇄 B 사이의 CH3 경계면에서 팩킹을 정확하게 모델링한 후, 다수의 관련된 물리화학적 성질의 점수를 매겨 상기 경계면의 열역학적 성질을 평가한다.
본 발명자들은 유연성 주쇄를 포함하는 다수의 단백질 팩킹 방법을 이용하여 본 발명자들이 컴퓨터를 이용하여 스크리닝한 많은 수의 변이체들에 대한 모델 구조를 최적화하고 준비하였다. 팩킹 후, 본 발명자들은 접촉 밀도, 충돌 점수, 수소 결합, 소수성 및 정전기를 포함하는 다수의 관점을 평가하였다. 용매화 모델의 이용은 본 발명자들이 용매 환경의 효과를 보다 정확하게 다루고 단백질 내의 특정 위치의 돌연변이 후 자유 에너지 차이를 대안적 잔기 유형과 대조할 수 있게 하였다. 접촉 밀도 및 충돌 점수는 효과적인 단백질 팩킹의 매우 중요한 양태인 상보성의 척도를 제공한다. 이들 스크리닝 절차는 쌍별 잔기 상호작용 에너지 및 엔트로피 계산에 의존하는 지식 기초 잠재력 또는 커플링 분석 방법의 적용에 기초한다.
이 포괄적인 인-실리코 분석은 경계면 핫스폿(hotspots), 비대칭의 부위, 캐비티 및 잘 팩킹되지 않은 영역, 개별 부위의 구조적 동역학 및 국소 비폴딩의 부위에 대해 야생형과 비교된 각각의 Fc 변이체의 차이의 상세한 이해를 제공하였다. 기재된 컴퓨터를 이용한 분석의 이들 조합된 결과들은 보다 낮은 안정성(예를 들면, 68℃의 Tm) 및/또는 90% 미만 순도의 보다 낮은 특이성에 대한 조합된 원인이면서 최적화되지 않은 특정 잔기, 서열/구조적 모티프 및 캐비티를 확인시켜주었다. 제2 디자인 단계에서, 본 발명자들은 추가 점 돌연변이로 이들 가설을 구체적으로 다루기 위해 표적화된 양성 디자인을 이용하였고 전술된 방법 및 분석을 이용하여 인-실리코 조작으로 이들을 시험하였다(도 24 참조). 단계 2에서 각각 표적화된 디자인에 대한 안정성 및 순도를 개선하기 위해 디자인된 Fc 변이체 이종이량체(Fc 변이체 이종이량체 AZ17 내지 AZ101)를 실시예 1 내지 4에 기재된 바와 같이 발현 및 안정성에 대해 실험적으로 검증하였다.
일부 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 AZ17, AZ18, AZ19, AZ20, AZ21, AZ22, AZ23, AZ24, AZ25, AZ26, AZ27, AZ28, AZ29, AZ30, AZ31, AZ32, AZ33, AZ34, AZ35, AZ36, AZ37, AZ38, AZ39, AZ40, AZ41, AZ42, AZ43, AZ44, AZ45, AZ46, AZ47, AZ48, AZ49, AZ50, AZ51, AZ52, AZ53, AZ54, AZ55, AZ56, AZ57, AZ58, AZ59, AZ60, AZ61, AZ62, AZ63, AZ64, AZ65, AZ66, AZ67, AZ68, AZ69, AZ70, AZ71, AZ72, AZ73, AZ74, AZ75, AZ76, AZ77, AZ78, AZ79, AZ80, AZ81, AZ82, AZ83, AZ84, AZ85, AZ86, AZ87, AZ88, AZ89, AZ90, AZ91, AZ92, AZ93, AZ94, AZ95, AZ96, AZ97, AZ98, AZ99, AZ100 또는 AZ101이다. 예시적 실시양태에서, 상기 변이체 CH3 도메인은 AZ17, AZ18, AZ19, AZ20, AZ21, AZ22, AZ23, AZ24, AZ25, AZ26, AZ27, AZ28, AZ29, AZ30, AZ31, AZ32, AZ33, AZ34, AZ38, AZ42, AZ43, AZ44, AZ45, AZ46, AZ47, AZ48, AZ49, AZ50, AZ52, AZ53, AZ54, AZ58, AZ59, AZ60, AZ61, AZ62, AZ63, AZ64, AZ65, AZ66, AZ67, AZ68, AZ69, AZ70, AZ71, AZ72, AZ73, AZ74, AZ75, AZ76, AZ77, AZ78, AZ79, AZ81, AZ82, AZ83, AZ84, AZ85, AZ86, AZ87, AZ88, AZ89, AZ91, AZ92, AZ93, AZ94, AZ95, AZ98, AZ99, AZ100 또는 AZ101이다. 특정 실시양태에서, 상기 변이체 CH3 도메인은 AZ33 또는 AZ34이다. 또 다른 실시양태에서, 상기 변이체 CH3 도메인은 AZ70 또는 AZ90이다.
예시적 실시양태에서, 상기 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366I, K392M 및 T394W를 포함한다. 또 다른 실시양태에서, 제1 폴리펩티드는 아미노산 변형 L351Y, S400E, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366I, N390R, K392M 및 T394W를 포함한다.
컴퓨터를 이용한 구조-기능 분석, 표적화된 조작 및 실험 검증의 이 반복 과정을 이용하여 후속 디자인 단계에서 표 1에 나열된 남은 Fc 변이체들을 디자인하였고 70℃ 초과의 CH3 도메인 용융 온도와 함께 90% 초과의 순도 및 증가된 안정성을 갖는 Fc 변이체 이종이량체를 발생시켰다. 일부 실시양태에서, 상기 Fc 변이체는 AZ1 내지 AZ136으로부터 선택된 아미노산 돌연변이를 포함한다. 추가 실시양태에서, Fc 변이체는 표 4에 나열된 Fc 변이체들로부터 선택된 아미노산 돌연변이를 포함한다.
제1 디자인 단계 및 제2 디자인 단계로부터 2개의 코어 스카폴드, 즉 스카폴드 1 및 스카폴드 2가 확인되었고, 이때 추가 아미노산 변형이 Fc 변이체 이종이량체의 순도 및 안정성을 미세하게 조정하기 위해 이들 스카폴드들 내로 도입되었다. AZ8, AZ17 내지 AZ62 및 표 6에 나열된 변이체들을 포함하는 스카폴드 1의 개발에 대한 상세한 설명에 관해서는 실시예 5를 참조한다. AZ15, AZ63 내지 AZ101 및 표 7에 나열된 변이체들을 포함하는 스카폴드 2의 개발에 대한 상세한 설명에 관해서는 실시예 6을 참조한다.
스카폴드 1의 코어 돌연변이는 L351Y_F405A_Y407V/T394W를 포함한다. 스카폴드 1a는 아미노산 돌연변이 T366I_K392M_T394W/F405A_Y407V를 포함하고, 스카폴드 1b는 아미노산 돌연변이 T366L_K392M_T394W/F405A_Y407V를 포함한다. 실시예 5를 참조한다.
일부 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T394W를 포함한다. 한 양태에서, 변이체 CH3 도메인은 위치 F405 및/또는 K392에서 점 돌연변이를 추가로 포함한다. 위치 K392에서의 이들 돌연변이는 K392V, K392M, K392R, K392L, K392F 또는 K392E를 포함하나 이들로 한정되지 않는다. 위치 F405에서의 이들 돌연변이는 F405I, F405M, F405S, F405S, F405V 또는 F405W를 포함하나 이들로 한정되지 않는다. 또 다른 양태에서, 변이체 CH3 도메인은 위치 T411 및/또는 S400에서 점 돌연변이를 추가로 포함한다. 위치 T411에서의 이들 돌연변이는 T411N, T411R, T411Q, T411K, T411D, T411E 또는 T411W를 포함하나 이들로 한정되지 않는다. 위치 S400에서의 이들 돌연변이는 S400E, S400D, S400R 또는 S400K를 포함하나 이들로 한정되지 않는다. 또 다른 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T394W를 포함하고, 이때 제1 폴리펩티드 및/또는 제2 폴리펩티드는 위치 T366 및/또는 L368에서 추가 아미노산 변형을 포함한다. 위치 T366에서의 이들 돌연변이는 T366A, T366I, T366L, T366M, T366Y, T366S, T366C, T366V 또는 T366W를 포함하나 이들로 한정되지 않는다. 예시적 실시양태에서, 위치 T366에서의 아미노산 돌연변이는 T366I이다. 또 다른 예시적 실시양태에서, 위치 T366에서의 아미노산 돌연변이는 T366L이다. 위치 L368에서의 돌연변이는 L368D, L368R, L368T, L368M, L368V, L368F, L368S 및 L368A를 포함하나 이들로 한정되지 않는다.
일부 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366L 및 T394W를 포함한다. 또 다른 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366I 및 T394W를 포함한다.
일부 다른 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366L, K392M 및 T394W를 포함한다. 또 다른 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366I, K392M 및 T394W를 포함한다.
또 다른 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366L, K392M 및 T394W를 포함한다. 또 다른 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366I, K392M 및 T394W를 포함한다.
일부 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366L 및 T394W를 포함한다. 또 다른 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366I 및 T394W를 포함한다.
예시적 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 74℃ 이상의 용융 온도(Tm)를 갖는다. 또 다른 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 74℃ 이상의 용융 온도(Tm)를 갖고 상기 이종이량체는 약 98% 이상의 순도를 갖는다.
일부 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 70℃ 초과의 용융 온도(Tm)를 갖고 상기 변이체 CH3 도메인은 표 6으로부터 선택된다.
스카폴드 2의 코어 돌연변이는 L351Y_Y407A/T366A_K409F를 포함한다. 스카폴드 2a는 아미노산 돌연변이 L351Y_Y407A/T366V_K409F를 포함하고, 스카폴드 2b는 아미노산 돌연변이 Y407A/T366A_K409F를 포함한다. 실시예 6을 참조한다.
일부 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y 및 Y407A를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366A 및 K409F를 포함한다. 한 양태에서, 변이체 CH3 도메인은 위치 T366, L351 및 Y407에서 점 돌연변이를 추가로 포함한다. 위치 T366에서의 이들 돌연변이는 T366I, T366L, T366M, T366Y, T366S, T366C, T366V 또는 T366W를 포함하나 이들로 한정되지 않는다. 특정 실시양태에서, 위치 T366에서의 돌연변이는 T366V이다. 위치 L351에서의 돌연변이는 L351I, L351D, L351R 또는 L351F를 포함하나 이들로 한정되지 않는다. 위치 Y407에서의 돌연변이는 Y407V 또는 Y407S를 포함하나 이들로 한정되지 않는다. 표 1, 표 4 및 실시예 6에 나열된 CH3 변이체 AZ63 내지 AZ70을 참조한다.
예시적 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y 및 Y407A를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366A 및 K409F를 포함한다.
예시적 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 75.5℃ 이상의 용융 온도(Tm)를 갖는다. 또 다른 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 75℃ 이상의 용융 온도(Tm)를 갖고 상기 이종이량체는 약 90% 이상의 순도를 갖는다.
다른 일부 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 L351Y 및 Y407A를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366A 및 K409F를 포함하고, 이때 상기 변이체 CH3 도메인은 위치 T411, D399, S400, F405, N390 및/또는 K392에서 하나 이상의 아미노산 변형을 포함한다. 위치 D399에서의 이들 돌연변이는 D399R, D399W, D399Y 또는 D399K를 포함하나 이들로 한정되지 않는다. 위치 T411에서의 돌연변이는 T411N, T411R, T411Q, T411K, T411D, T411E 또는 T411W를 포함하나 이들로 한정되지 않는다. 위치 S400에서의 돌연변이는 S400E, S400D, S400R 또는 S400K를 포함하나 이들로 한정되지 않는다. 위치 F405에서의 돌연변이는 F405I, F405M, F405S, F405S, F405V 또는 F405W를 포함하나 이들로 한정되지 않는다. 위치 N390에서의 돌연변이는 N390R, N390K 또는 N390D를 포함하나 이들로 한정되지 않는다. 위치 K392에서의 돌연변이는 K392V, K392M, K392R, K392L, K392F 또는 K392E를 포함하나 이들로 한정되지 않는다. 표 1, 표 4 및 실시예 6에 나열된 CH3 변이체 AZ71 내지 AZ101을 참조한다.
예시적 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드(본원에서 쇄 A 및 쇄 B로도 지칭됨)를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 Y407A를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366A 및 K409F를 포함한다. 한 양태에서, 이 변이체 CH3 도메인은 아미노산 변형 K392E, T411E, D399R 및 S400R을 추가로 포함한다. 추가 실시양태에서, 변이체 CH3 도메인은 제1 폴리펩티드 및 제2 폴리펩티드를 포함하고, 이때 제1 폴리펩티드는 아미노산 변형 D399R, S400R 및 Y407A를 포함하고, 제2 폴리펩티드는 아미노산 변형 T366A, K409F, K392E 및 T411E를 포함한다.
예시적 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 74℃ 이상의 용융 온도(Tm)를 갖는다. 또 다른 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 약 74℃ 이상의 용융 온도(Tm)를 갖고 상기 이종이량체는 약 95% 이상의 순도를 갖는다.
일부 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 70℃ 초과의 용융 온도(Tm)를 갖고, 상기 변이체 CH3 도메인은 표 7로부터 선택된다.
나아가, 개선된 안정성 및 순도를 갖는 Fc 변이체 이종이량체를 디자인하는 이 신규 방법은 Fc 영역의 다른 클래스 및 동종형에 적용될 수 있다. 일부 실시양태에서, Fc 영역은 인간 IgG Fc 영역이다. 추가 실시양태에서, 인간 IgG Fc 영역은 인간 IgGl, IgG2, IgG3 또는 IgG4 Fc 영역이다. 몇몇 실시양태에서, Fc 영역은 IgG, IgA, IgD, IgE 및 IgM으로 구성된 군으로부터 선택된 면역글로불린으로부터 유래된다. 몇몇 실시양태에서, IgG는 IgG1, IgG2a, IgG2b, IgG3 및 IgG4로 구성된 군으로부터 선택된 하위유형의 IgG이다.
[표 1]
본원에서 정의된 바와 같은 Fc 영역은 CH3 도메인 또는 이의 단편을 포함하고 힌지, CH1 또는 CH2를 포함하는 하나 이상의 추가 불변 영역 도메인 또는 이의 단편을 추가로 포함할 수 있다. Fc 아미노산 잔기의 넘버링은 문헌(Kabat et al., 1991, NIH Publication 91-3242, National Technical Information Service, Springfield, Va)에 기재된 바와 같은 EU 지수의 넘버링이라는 것이 이해될 것이다. "카바트에 기재된 바와 같은 EU 지수"는 인간 IgG1 카바트 항체의 EU 지수 넘버링을 의미한다. 편의상, 표 B는 인간 IgG1로부터의 CH2 및 CH3 도메인의 카바트에 기재된 바와 같은 EU 지수에 따라 넘버링된 아미노산을 제공한다.
[표 B]
일부 실시양태에서, Fc 변이체는 CH2 도메인을 포함한다. 몇몇 실시양태에서, CH2 도메인은 변이체 CH2 도메인이다. 몇몇 실시양태에서, 변이체 CH2 도메인은 제1 폴리펩티드 쇄 및/또는 제2 폴리펩티드 쇄 내에 비대칭 아미노산 치환을 포함한다. 몇몇 실시양태에서, 이종다량체는 상기 이종다량체의 1개 쇄가 Fc 수용체에 선택적으로 결합하도록 CH2 도메인 내에 비대칭 아미노산 치환을 포함한다.
일부 실시양태에서, 이종다량체는 Fc 수용체에 선택적으로 결합한다. 몇몇 실시양태에서, Fc 수용체는 Fcγ 수용체 패밀리의 구성원이다. 몇몇 실시양태에서, 상기 수용체는 FcγRI, FcγRIIa, FcγRIIb, FcγRIIc, FcγRIIIa 및 FcγRIIIb로부터 선택된다. 한 실시양태에서, CH2 도메인은 Fcγ 수용체와의 선택적 결합을 촉진하는 비대칭 아미노산 변형을 포함한다.
몇몇 실시양태에서, 이종다량체는 FcγRIIIa에 선택적으로 결합한다. 몇몇 실시양태에서, 이종다량체는 S267D, K392D 및 K409D로부터 선택된 비대칭 아미노산 치환을 포함한다. 몇몇 실시양태에서, 이종다량체는 FcγRIIa에 선택적으로 결합한다. 몇몇 실시양태에서, 이종다량체는 S239D, K326E, A330L 및 I332E로부터 선택된 비대칭 아미노산 치환을 포함한다. 몇몇 실시양태에서, 이종다량체는 FcγRIIb에 선택적으로 결합한다. 몇몇 실시양태에서, 이종다량체는 S239D, D265S, E269K 및 I332E로부터 선택된 비대칭 아미노산 치환을 포함한다. 몇몇 실시양태에서, 이종다량체는 FcγRIIIa 및 FcγRIIa에 선택적으로 결합한다. 몇몇 실시양태에서, 이종다량체는 S239D, D265S 및 S298A로부터 선택된 비대칭 아미노산 치환을 포함한다. 몇몇 실시양태에서, 이종다량체는 FcγRIIIa 및 FcγRIIb에 선택적으로 결합한다. 몇몇 실시양태에서, 이종다량체는 S239D, S298A, K326E, A330L 및 I332E로부터 선택된 비대칭 아미노산 치환을 포함한다. 몇몇 실시양태에서, 이종다량체는 FcγRIIa 및 FcγRIIb에 선택적으로 결합한다. 몇몇 실시양태에서, 이종다량체는 S239D, D265S, S298A 및 I332E로부터 선택된 비대칭 아미노산 치환을 포함한다.
일부 실시양태에서, 본원에 기재된 이종다량체를 포함하는 다기능성 치료제를 디자인하는 방법이 제공된다. 몇몇 실시양태에서, 변이체 Fc 이종이량체를 포함하는 이기능성 치료제를 디자인하는 방법이 제공된다. 몇몇 실시양태에서, CH3 도메인 내에 돌연변이를 갖는 유도된 변이체 Fc 이종이량체의 CH2 도메인 내의 비대칭 돌연변이를 디자인하는 방법이 제공된다. 몇몇 실시양태에서, 비대칭 Fc 내의 돌연변이에 기초하여 상이한 Fcγ 수용체에 대한 선택성을 디자인하는 방법이 제공된다. 일부 실시양태에서, Fcγ 수용체의 결합을 Fc 분자의 한 면으로 편향되게 하는 돌연변이를 디자인하는 방법이 제공된다. 일부 실시양태에서, Fcγ 수용체가 본원에 기재된 이종다량체의 비대칭 Fc 스카폴드의 한 면과만 상호작용하도록 편향시키는 극성 유발제(driver)를 디자인하는 방법이 제공된다.
몇몇 실시양태에서, 우선적인 Fcγ 수용체 선택성 프로파일을 이끌어내는 돌연변이를 비대칭 Fc의 CH2 도메인 내에 포함하는 폴리펩티드가 제공된다. 몇몇 실시양태에서, CH3 도메인 내의 돌연변이는 이종이량체 Fc의 우선적인 형성을 이끌어낸다. 일부 실시양태에서, 본원에 기재된 비대칭 Fc에 기초하여 이중특이적 치료제를 디자인하는 방법이 제공된다. 일부 실시양태에서, 본원에 기재된 비대칭 Fc에 기초하여 다중특이적 치료제를 디자인하는 방법이 제공된다.
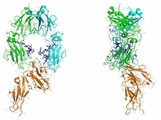
단일클론 항체, 예컨대, IgG는 다수의 면역글로불린(Ig) 구조 도메인들을 각각 포함하는 동등한 2개의 중쇄 및 2개의 경쇄 폴리펩티드로 구성된 대칭 분자이다(도 14). mAb의 IgG 클래스는 4개의 동형체 중 하나, 즉 IgG1, IgG2, IgG3 또는 IgG4로 존재한다. 중쇄는 4개의 (VH, CH1, CH2 및 CH3) Ig 도메인으로 구성되고, 경쇄는 2개의 (VL 및 CL) Ig 도메인으로 구성된다. 중쇄 각각으로부터의 VH 및 CH1 도메인은 경쇄의 VL 및 CL 도메인과 조합되어 mAb의 2개 Fab("항원 결합 단편") 아암을 형성한다. 2개의 중쇄의 CH3 도메인과 CH2 도메인은 CH3 도메인을 가로지른 단백질-단백질 접촉 및 CH2 도메인 내의 글리코실화를 통해 상호작용하여 동종이량체 Fc("결정화가능한 단편") 영역을 형성한다. 항체의 CH1 도메인과 CH2 도메인 사이의 링커 영역은 항체 분자의 힌지 영역을 구성한다. mAb의 Fab 영역과 Fc 영역을 연결하는 것 이외에, 힌지는 2개의 중쇄를 가로지른 이황화 연결을 유지하고 이들을 함께 붙잡고 있다. 힌지 영역 내의 아미노산 및 이황화 연결의 수는 IgG의 4개 동종형들 사이에 현저히 상이하다. IgG 분자 내의 글리코실화 패턴은 상당히 다양할 수 있고, 약 30개의 상이한 탄수화물 모이어티들이 IgG 분자에서 관찰되었다(Arnold J.N.; Wormald M.R.; Sim R.B.; Rudd P.M. and Dwek R.A. (2007) Annual Reviews of Immunology 25, 21-50).
단일클론 항체 구조의 대칭 성질은 동일한 에피토프를 인식하도록 성숙된 그들의 항원 결합 성능 친화성을 갖는 2개의 Fab 아암을 발생시킨다. 다른 한편으로, 항체 분자의 Fc 부분은 면역 또는 "이펙터" 세포 상의 다양한 수용체 분자들과의 상호작용에 관여하고, 이들 상호작용 중 일부는 이펙터 기능, 예컨대, 항체 의존성 세포 매개 세포독성(ADCC), 항체 의존성 세포 매개 식균작용(ADCP) 및 보체 활성화를 매개하는 역할을 수행한다. 일반적으로, 이펙터 기능은 병원체 또는 독소 중화 및 제거를 이끌어내는 면역 반응, 보체 활성화 및 체액 면역 시스템으로부터의 식균 반응을 포함한다. 이펙터 세포 상의 Fcγ 수용체(FcγR) 분자는 일체형 항체-항원 면역 복합체에 포함된 활성화된 IgG 항체의 Fc와 접촉하여 이펙터 반응을 매개하고 조절한다. 단일클론 항체에 기초한 단백질 치료제와 이들 Fcγ 수용체의 상호작용의 최적화는 이들 약물 후보물질들의 효능을 개선할 수 있다.
인간에서, 각각의 클래스 내에 추가 다형체 유형을 갖는 FcγR들의 공지된 3개 클래스들이 존재한다. IgG1 분자 내의 Fc는 나노몰 범위 내의 해리 상수로 FcγRI(CD64)에 결합하는 것으로 공지되어 있는 반면, FcγRII(CD32) 및 FcγRIII(CD16) 결합은 마이크로몰 범위에서 일어난다(Bruhns P.; Iannascoli B.; England P.; Mancardi D.A.; Fernandez N.; Jorieux S. and Daeron M. (2009) Blood 113: 3716-25). 고 친화성 FcγRI 수용체는 단량체 형태로 IgG에 결합할 수 있는 반면, 저 친화성 FcγRII 및 FcγRIII 수용체는 친화력(avidity) 효과의 결과로서 항원-항체 면역 복합체 또는 IgG 응집체에만 결합할 수 있다. 상이한 IgG 형태들은 상이한 FcγR들에 대해 상이한 친화성을 갖고, 특히 IgG1 및 IgG3은 보다 강한 활성을 나타낸다. Fcγ 수용체는 경막 단백질의 세포외 도메인이고 세포 내의 신호전달 경로를 조절하는 데에 관여하는 세포질 도메인을 보유한다. 이들 분자들은 항체에 의해 매개된 면역 복합체와의 결합시 면역 세포 표면 상에서 밀집되었을 때 이들 세포 표면 수용체들의 세포질 말단 상에서 FcγR에 연결된 신호전달 유닛의 성질에 따라 이펙터 반응을 조절한다(Nimmerjahn F. and Ravetch J.V. (2008) Nature Immu Rev 8(1):34-47).
인간 염색체 수준에서, 3개의 유전자들이 FcγRI(FcγRIA, FcγRIB, FcγRIC) 및 FcγRII(FcγRIIA, FcγRIIB, FcγRIIC)를 코딩하고, 2개의 유전자들이 FcγRIII(FcγRIIIA, FcγRIIIB)을 코딩한다. IgG 결합 인간 Fcγ 수용체들 중에서 FcγRIA, FcγRIC 및 FcγRIIIA 유형들은 이펙터 기능의 활성화를 이끌어내는 세포질 면역수용체 티로신 기초 활성화 모티프(ITAM)를 함유하는 공통의 γ-쇄 신호 어댑터 단백질과 막 결합되어 있는 것으로 밝혀졌다. FcγRIIA 및 FcγRIIC도 세포질 ITAM을 포함하지만 공통의 γ-쇄 신호 어댑터 단백질을 갖지 않는다. 동시에, FcγRIIB는 면역수용체 티로신 기초 억제 모티프(ITIM)에 연결되어 있다. ITIM 인산화를 초래하는 FcγRIIB의 활성화는 활성화 신호전달 캐스케이드(cascade)의 억제를 초래한다. FcγRIIIB는 티로신 기초 면역조절 세포질 꼬리들 중 어느 것도 결여하지만 GPI(글리코실-포스파티딜-이노시톨) 고착제(anchor)를 갖고 FcγRIIA의 존재 하에서 몇몇 과립구의 활성화에 기여하는 것으로 밝혀졌다.
[표 C]
ITAM 및 ITIM 모티프 및 관련된 수용체 분자의 기능적 역할이 공지되어 있지만, 조합되어 신호전달을 조절하는 성질 및 기작은 특히 신호전달도입에 관여하는 다른 면역 세포 표면 수용체 및 어댑터 분자(예를 들면, BCR들, CD22, CD45 등)의 숙주의 활성과 조합될 때 완전히 이해되지 않는다. 이 상황에서, 정교한 선택성 프로파일로 이들 Fcγ 수용체들과 상호작용할 수 있는 Fc 유사 분자의 디자인은 미묘한 조절 활성을 갖는 이러한 수용체 분자의 효과를 파악하고 조절하고자 하는 임의의 시도에서 귀중한 스카폴드이다.
FcγR들을 식별할 수 있는 항체 분자들을 디자인하고자 하는 노력은 FcγRII 및 FcγRIII 수용체 유형의 세포외 Fc 결합 구획들이 적어도 부분적으로 조상 절편 중복(ancestral segment duplication)에 기인할 수 있는 높은 서열 유사성을 나타낸다는 사실(도 15)에 의해 복잡해진다. FcγRII 수용체의 2개 주요 유형인 A 및 B는 69% 서열 동일성을 갖는 반면, FcγRIIA 및 FcγRIIIA는 약 44% 서열 동일성을 나타낸다. FcγRIIB 및 FcγRIIC는 세포내 영역에서 상당히 상이하지만(각각 ITIM 및 ITAM 모티프의 존재가 주목할만함) 세포외 영역에서 단지 2개의 잔기에 의해 구별된다. 그 결과, 1개의 수용체에 결합하는 데에 필요한 치료 항체 분자가 다른 수용체 클래스에도 잠재적으로 결합하여 의도되지 않은 치료 효과를 발생시킬 가능성이 있다는 것이 예측될 수 있다.
추가 복잡한 문제로서, 수용체 클래스 각각이 다수의 단일 뉴클레오티드 다형성(SNP) 및 카피 수 변경(CNV)을 제공한다. 발생된 수용체 다양성은 IgG에 대한 그들의 친화성 및 그의 작용 기작에 상이하게 영향을 미친다. 이들 유전적 변경은 Fcγ 수용체에 대한 특정 IgG 서브클래스의 친화성에 영향을 미치거나, 다운스트림 이펙터 이벤트를 변경하거나 수용체 발현의 수준을 변경하는 기작에 영향을 미침으로써, 기능적으로 관련된 표현형, 비기능적 수용체 변이체 또는 기능적으로 미공지된 수용체 변이체를 발생시킬 수 있다(Bournazos S.; Woof J.M.; Hart S.P. and Dransfield I. (2009) Clinical and Experimental Immunology 157(2):244-54). 이들은 활성화 수용체 신호전달과 억제 수용체 신호전달 사이의 균형을 변경하여 질환 감수성 표현형의 생성을 초래하는 복잡한 효과를 잠재적으로 발생시킨다.
이들 대립형질 변경들 중 일부는 표 C에 나열되어 있다. 특히, FcγRIIa에서 R131 변이체는 IgG1에 대한 높은 반응자인 반면, 대안적 H131 변이체는 IgG2 및 IgG3과의 보다 효율적인 상호작용을 보인다. FcγRIIIa의 경우, 위치 158에서 V에 대한 동형접합성 공여자는 인간 IgG1, IgG3 및 IgG4에 대한 전자 동종이형의 보다 높은 친화성으로 인해 동형접합 F/F158 개체에 비해 증가된 NK 세포 활성을 나타낸다. FcγRIIIb의 대립형질 변이체 NA1 및 NA2는 상기 수용체의 글리코실화에서의 차이를 초래하는 4개 아미노산 치환의 결과이다. NA1 대립형질은 호중구에 의한 면역 복합체의 향상된 결합 및 식균작용을 제공한다. FcγRIIB는 2개의 공지된 대립형질 변이체, 즉 232I 및 232T를 갖는다. 232T 변이체는 그의 음성 조절 활성에서 강하게 손상되어 있는 것으로 공지되어 있다. FcγR 다형성의 빈도; 및 이 빈도와, 감염 또는 질환 상태, 예컨대, 전신성 홍반 루푸스(SLE), 류마티스성 관절염(RA), 혈관염, 면역 매개 혈전성 자반증(ITP), 중증근육무력증, 다발성 경화증(MS) 및 면역 신경병증(귈랑-바레 증후군(GBS))의 소인에 대한 상이한 반응성의 관련성이 보고되었다.
FcγR 유전자, 특히 FcγRIIIB, FcγRIIc 및 FcγRIIIA의 좌위에서의 카피 수 변경은 입증되었고, 이들 차이와 이들 수용체의 세포 표면 발현 사이의 추가 상관관계가 인지되었다. 대조적으로, FcγRIIa 및 FcγRIIb는 유전자 카피 수 변경을 보이지 않는다. FcγRIIIb의 낮은 카피 수는 실제로 자가면역 질환인 전신성 홍반 루푸스(SLE)에서 사구체신염과 관련되어 있다(Aitman TJ et al. (2006) Nature 16; 439(7078):851-5). 이것은 비신호전달 GPI 모듈이 FcγRIIIb 수용체에 고착된다는 사실이 주어졌을 때 특히 흥미롭다. 이들 FcγRIIIb 수용체들의 존재가 Fc와 다른 신호전달 FcγR들의 상호작용의 경쟁적 억제제로서 잠재적으로 작용할 수 있다고 가정될 수 있다. FcγRIIc에서의 카피 수 변경의 효과도 특히 흥미롭다. FcγRIIc 내의 위치 202에 존재하는 C/T SNP는 글루타민 잔기를 정지 코돈으로 전환시켜 기능성 단백질의 발생을 방해한다. FcγRIIc의 기능성 개방 판독 프레임(open reading frame)은 건강한 개체(백인 집단)의 9%에서 발현되고, ITP 집단에서 대립형질의 상당한 과다발현(19%)이 존재하는데, 이것은 ITP에 대한 이들 표현형들의 소인을 암시한다(Breunis WB et al. (2008) Blood 111(3):1029-38). NK 세포 상에서 기능성 FcγRIIc를 발현하는 개체에서 달성된 ADCC는 FcγRIIIa보다 더 높은 정도로 이들 수용체들에 의해 매개된다는 것이 입증되었다. 이들 다형성 및 유전적 변경과 관련된 이러한 복잡성은 고도로 다듬어진 치료제를 필요로 하는 맞춤형 치료 방법에 대한 필요성을 강조한다.
다양한 이펙터 세포들은 이들 Fcγ 수용체들의 제시에서 상이할 뿐만 아니라 그들의 체액 및 조직 분포에서도 상이하고, 따라서 이 차이는 그들의 활성화 및 작용 기작에서의 변경에 기여한다(표 D). 특정 FcγR 유형을 인식하도록 치료 항체의 선택성을 조정하고 이펙터 세포의 일부 클래스들의 영향을 조절하는 것은 특정 질환 상태에 대한 이펙터 기작의 최적화를 이끌어낸다. 이것은 치료될 질환 상태에 따라 특정 이펙터 양상을 선택적으로 활성화시키거나 억제하기 위한 것이다.
[표 D]
추가로, FcγR들은 소포 수지상세포, 내피세포, 미세아교세포, 파골세포 및 혈관사이세포에 의해서도 발현된다. 현재, 이들 다른 세포들 상에서의 FcγR 발현의 기능적 의의는 공지되어 있지 않다.
고 친화성 FcγRI은 3개의 C형 면역글로불린 수퍼패밀리(IgSF) 도메인으로 구성되는 반면, 저 친화성 FcγRII 및 FcγRIII은 각각 2개의 C형 IgSF 도메인으로 구성된다. FcγRIIa, FcγRIIb, FcγRIIIa 및 FcγRIIIb 수용체 단백질들의 구조는 결정학에 의해 밝혀졌다. 이들 구조들에서 2개의 IgSF 도메인들은 서로에 대해 상대적으로 50° 내지 55°에 위치하고 힌지에 의해 연결되어 있다.
Fc-FcγR 공복합체(co-complex)의 공개적으로 이용가능한 구조는 Fc-FcγRIIIb 시스템의 구조이고, 상기 복합체에서 FcγR 기하구조는 단백질의 아포(apo) 상태에서 관찰된 기하구조와 매우 유사하게 유지된다(Sondermann P.; Huber R.; Oosthuizen V. and Jacob U. (2000) Nature 406, 267-273; Radaev S.; Motyaka S.; Fridman W.; Sautes-Fridman C. and Sun P.D. (2001) J Biol Chem 276, 16469-16477; Sondermann P. et al. Biochem Soc Trans. 2002 Aug; 30(4):481-6; Sondermann P, Oosthuizen V. Immunol Lett. 2002 Jun 3; 82(1-2):51-6; Radaev S, Sun P. Mol Immunol. 2002 May; 38(14):1073-83)(도 16). 상기 수용체들 사이의 강한 서열 유사성 및 구조적 유사성은 다른 수용체들에 결합된 Fc의 비교 모델의 기초를 형성한다. 다른 한편으로, 이들 수용체 분자들 사이의 서열 유사성 및 구조적 유사성은 상기 수용체들과 그들의 다양한 동형체들 사이의 정교한 선택성을 갖는 Fc의 디자인을 어렵게 만든다.
결정학에 기초한 Fc-FcγR 복합체의 구조적 평가 전, Fc 분자에서 대칭의 2배 축이 2개의 잠재적 결합 부위 및 Fc-FcγR 결합에 대한 효과적인 2:1 화학양론을 의미하는지에 대한 의문이 존재하였다. Fc-FcγR 상호작용의 핵 자기 공명(NMR) 기초 구조적 연구는 상기 분자의 한 면 상에서의 Fc와 1개 FcγR의 결합이 제2 FcγR 분자와 동일한 항체 분자의 Fc의 결합을 방해하는 입체구조적 변화를 유도한다는 것을 보여준다(Kato K. et al (2000) J. Mol. Biol. 295(2):213-24). Fc-FcγRIIIb의 이용가능한 공결정(co-crystal) 복합체의 기하구조는 FcγR과 Fc가 1:1 화학양론으로 비대칭 배향으로 결합한다는 것을 확인시켜준다. 도 16에 나타낸 바와 같이, FcγR은 편자 모양 Fc 분자의 한 말단 상의 갈라진 틈에 결합하고 2개의 쇄들로부터의 CH2 도메인과 접촉하고 있다.
알라닌 스캐닝 돌연변이유발(Shields RL et al. (2001) JBC 276(9): 6591-604)은 다양한 수용체 유형들과 상호접촉하여 Fc-FcγR 상호작용 및 인식에 관여하는 Fc의 잔기들에 대한 통찰을 제공한다. 전통적으로, 치료 항체의 최적화는 활성화 수용체 FcγRIII과의 증가된 결합(미국 특허 제6,737,056호) 또는 FcγRIIb에 대한 감소된 친화성(미국 특허출원 공보 제2009/0010920A1호)을 나타내는 돌연변이 근처에 집중되었다. 이들 대안적 변이체들에서, 돌연변이는 2개의 쇄들 내에 동시에 도입된다.
단일클론 항체는 종종 표적 및 이펙터 면역 세포의 공간적 국소화를 유도함으로써 그의 치료 활성을 나타낸다. 천연 항체는 그의 Fab 도메인을 사용하여 표적과 상호작용하고 Fc 도메인을 사용하여 이펙터 세포와 상호작용함으로써 이것을 매개한다. 이들은 세포 매개 반응이 유도될 수 있도록 면역 복합체를 이펙터 세포와 대면하여 병치할 수 있다. 다수의 항체 분자들에 의한 단일 표적의 표적화를 포함하는 면역 복합체의 형성에서 유래되는, FcγR 신호전달에 필요한 친화력 효과는 면역 작용에서 시공적인 조직화의 중요성의 또 다른 예이다.
mAb 분자의 이펙터 활성의 일부로서 유도된 세포 신호전달에 대한 시공적인 양태도 존재한다. 세포 신호전달, 예컨대, FcγR 분자 활성화에 기초한 세포 신호전달은 지질 래프트(rafts)로서 지칭되는 막 도메인의 영역 내에서의 관련 수용체 분자들의 국소화를 수반한다. 지질 래프트에는 글리코스핑고지질 및 콜레스테롤, 및 Src 패밀리 인산화효소(kinases)를 포함하는 업스트림 신호 전달도입제의 여러 클래스들이 풍부하다. 세포 자극시, 다양한 신호전달 분자, 어댑터 단백질 및 신호전달 인산화효소뿐만 아니라 인산분해효소(phosphatases)가 동원된다. 지질 래프트에서 분자 조립은 신호 전달도입을 위해 중요하다.
상이한 항원 특이성과 증가된 친화력을 조합하여 보다 우수한 결합 성질을 제공하는 비천연 디자인 방법은 이중특이적 치료제 디자인의 기초이다. 이중특이적 항체, 또는 다른 형태의 이중특이적 또는 다기능성 단백질 치료제는 표적과 다양한 이펙터 세포들 사이의 상호작용을 매개하기 위해 디자인된다(Muller & Kontermann (2010) BioDrugs 24(2):89-98). 다중특이적 치료 분자는 헬퍼 T 세포 또는 다른 면역 이펙터 세포를 특정 표적 세포로 다시 향하게 하도록 조작된다.
또 다른 실시양태에서, 본 발명은 FcγRIIa, FcγRIIb 및/또는 FcγRIIIa에 대한 계산된 결합 친화성에 기초하여 인-실리코에서 Fc 변이체 폴리펩티드를 확인하는 방법에 관한 것이다. 또 다른 실시양태에서, 상기 방법은 상기 Fc 변이체 폴리펩티드의 인-실리코 정전기, 용매화, 팩킹, 팩킹 밀도, 수소 결합 및 엔트로피 효과를 계산하는 단계를 추가로 포함한다. 또 다른 실시양태에서, 본 발명의 방법은 Fc 변이체 폴리펩티드를 구축하는 단계, 치료 항체의 면에서 상기 폴리펩티드를 발현시키는 단계, 및 포유동물 세포에서 상기 항체를 추가로 발현시키는 단계를 추가로 포함한다. 또 다른 실시양태에서, 본 발명의 방법은 인-실리코에서 확인된 Fc 변이체 폴리펩티드를 부위 지정 돌연변이유발, PCR 기초 돌연변이유발, 카세트 돌연변이유발 또는 드 노보(de novo) 합성으로 구축하는 단계를 포함한다.
합성 Fc 스카폴드의 디자인에서 고려되어야 하는 인자는 입체적 반발에 대한 인-실리코 계산, 파묻힌 경계면 면적의 변화, 상대적 접촉 밀도, 상대적 용매화 및 정전기 효과를 포함한다. 이들 모든 매트릭스들을 사용하여 친화성 점수를 수득하였다.
한 양태에서, 본원은 이종이량체 Fc 상에 구축된 비대칭 스카폴드의 디자인을 통해 정교한 FcγR 선택성 프로파일을 달성하는 분자 디자인을 기술한다. 이 스카폴드는 CH2 도메인 내의 비대칭 돌연변이가 다양한 신규 선택성 프로파일을 달성할 수 있게 한다. 추가로, 상기 스카폴드는 다기능성(이기능성, 삼기능성, 사기능성 또는 오기능성) 치료 분자의 조작을 위한 고유 특징을 갖는다.
비대칭 스카폴드는 분자의 보다 우수한 재활용을 가능하게 하고 그의 반감기 및 관련된 약물동역학적 성질을 향상시키기 위해 신생아 Fc 수용체(FcRn)에 대한 pH 의존성 결합 성질에 대해 최적화될 수 있다.
비대칭 스카폴드는 기능적으로 관련된 FcγRI 수용체 동종이형과의 결합에 대해 최적화될 수 있다. FcγRI은 만성 염증성 장애, 예컨대, 류마티스성 관절염, 아토피성 피부염, 건선 및 다수의 폐 질환들에 관여하는 대식세포 상의 두드러진 마커이다.
비대칭 스카폴드는 단백질 A 결합에 대해 최적화될 수 있다. 단백질 A 결합은 종종 항체 분자의 분리 및 정제를 위해 이용된다. 저장 동안 치료제의 응집을 피하기 위해 돌연변이가 비대칭 스카폴드 내에 도입될 수 있다.
따라서, 본 발명의 Fc 변이체는 특히, 증가된 혈청 반감기, 증가된 결합 친화성, 감소된 면역원성, 증가된 생성, 향상된 또는 감소된 ADCC 또는 CDC 활성, 변경된 글리코실화 및/또는 이황화 결합 및 변형된 결합 특이성을 포함하나 이들로 한정되지 않는 바람직한 특징을 갖는 항체를 발생시키는 하나 이상의 추가 아미노산 잔기 치환, 돌연변이 및/또는 변형을 함유할 수 있다는 것이 구체적으로 고려된다.
본 발명의 Fc 변이체는 비교가능한 분자에 비해 상대적으로 증가된 포유동물, 특히 인간 생체내 반감기(예를 들면, 혈청 반감기), 증가된 생체내 안정성(예를 들면, 혈청 반감기) 및/또는 증가된 시험관내 안정성(예를 들면, 저장 수명), 및/또는 증가된 용융 온도(Tm)를 포함하는 다른 변경된 특징을 가질 수 있다는 것이 고려된다. 한 실시양태에서, 본 발명의 Fc 변이체는 15일 초과, 20일 초과, 25일 초과, 30일 초과, 35일 초과, 40일 초과, 45일 초과, 2개월 초과, 3개월 초과, 4개월 초과 또는 5개월 초과의 생체내 반감기를 갖는다. 또 다른 실시양태에서, 본 발명의 Fc 변이체는 15일 초과, 30일 초과, 2개월 초과, 3개월 초과, 6개월 초과, 12개월 초과, 24개월 초과, 36개월 초과 또는 60개월 초과의 시험관내 반감기(예를 들면, 액체 또는 분말 제제)를 갖는다.
본 발명의 Fc 변이체는 대상체에게 투여되었을 때 변경된 면역원성을 가질 수 있다는 것도 당업자에 의해 인식될 것이다. 따라서, 상기 Fc 변이체의 면역원성을 최소화하는 변이체 CH3 도메인은 일반적으로 치료 적용을 위해 보다 더 바람직하다는 것이 고려된다.
본 발명의 Fc 변이체는 이펙터 기능을 변경하는 변형을 포함하나 이것으로 한정되지 않는 다른 Fc 변형과 조합될 수 있다. 본 발명은 본 발명의 Fc 변이체를 다른 Fc 변형과 조합하여 항체 또는 Fc 융합 단백질에서 부가적, 상승작용적 또는 신규 성질을 제공하는 것을 포괄한다. 이러한 변형은 힌지, CH1 또는 CH2(또는, 상기 변형이 본 발명의 변이체 CH3 도메인의 안정성 및 순도 성질을 부정적으로 변경하지 않는 한, CH3) 도메인 또는 이들의 조합물에서 존재할 수 있다. 본 발명의 Fc 변이체는 그들과 조합되는 변형의 성질을 향상시킨다는 것이 고려된다. 예를 들면, 본 발명의 Fc 변이체가 야생형 Fc 영역을 포함하는 비교가능한 분자보다 더 높은 친화성으로 FcγRIIIA에 결합하는 것으로 공지된 돌연변이체와 조합되는 경우, 본 발명의 돌연변이체와의 조합은 FcγRIIIA 친화성을 보다 높은 배수만큼 향상시킨다.
한 실시양태에서, 본 발명의 Fc 변이체는 다른 공지된 Fc 변이체, 예컨대, 하기 문헌들에 개시된 Fc 변이체와 조합될 수 있다: 문헌(Duncan et al., 1988, Nature 332:563-564); 문헌(Lund et al., 1991, J Immunol 147:2657-2662); 문헌(Lund et al., 1992, Mol Immunol 29:53-59); 문헌(Alegre et al., 1994, Transplantation 57:1537-1543); 문헌(Hutchins et al., 1995, Proc Natl. Acad Sci USA 92:11980-11984); 문헌(Jefferis et al., 1995, Immunol Lett. 44:111-117); 문헌(Lund et al., 1995, Faseb J 9:115-119); 문헌(Jefferis et al., 1996, Immunol Lett 54:101-104); 문헌(Lund et al., 1996, Immunol 157:4963-4969); 문헌(Armour et al., 1999, Eur J Immunol 29:2613-2624); 문헌(Idusogie et al., 2000, J Immunol 164:4178-4184); 문헌(Reddy et al., 2000, J Immunol 164:1925-1933); 문헌(Xu et al., 2000, Cell Immunol 200:16-26); 문헌(Idusogie et al., 2001, J Immunol 166:2571-2575); 문헌(Shields et al., 2001, J Biol Chem 276:6591-6604); 문헌(Jefferis et al., 2002, Immunol Lett 82:57-65); 문헌(Presta et al., 2002, Biochem Soc Trans 30:487-490); 미국 특허 제5,624,821호, 제5,885,573호 및 제6,194,551호; 미국 특허출원 제60/601,634호 및 제60/608,852호; 및 PCT 국제 공보 제WO 00/42072호 및 제WO 99/58572호.
당업자는 본 발명의 Fc 변이체가 변경된 Fc 리간드(예를 들면, FcγR, C1q) 결합 성질(결합 성질의 예로는 결합 특이성, 평형 해리 상수(KD), 해리 및 결합 속도(각각 Koff 및 Kon), 결합 친화성 및/또는 친화력)을 가질 수 있고 일부 변경이 보다 더 또는 보다 덜 바람직하다는 것을 이해할 것이다. 평형 해리 상수(KD)가 koff/kon으로서 정의된다는 것은 당업계에서 잘 공지되어 있다. 일반적으로, 낮은 KD를 갖는 결합 분자(예를 들면, 항체)가 높은 KD를 갖는 결합 분자(예를 들면, 항체)보다 바람직한 것으로 이해된다. 그러나, 몇몇 경우, kon 또는 koff의 값이 KD의 값보다 더 적절할 수 있다. 당업자는 어떤 반응속도 파라미터가 주어진 항체 적용에 가장 중요한지를 결정할 수 있다. 예를 들면, Fc와 음성 조절제 FcγRIIB의 결합을 비변화된 상태로 남기거나 심지어 감소시키면서 Fc와 하나 이상의 양성 조절제(예를 들면, FcγRIIIA)의 결합을 향상시키는 변형된 CH3 및/또는 CH2는 ADCC 활성을 향상시키는 데에 보다 더 유리할 것이다. 대안적으로, 하나 이상의 양성 조절제와의 결합을 감소시키고/시키거나 FcγRIIB와의 결합을 향상시키는 변형된 CH3 및/또는 CH2는 ADCC 활성을 감소시키는 데에 유리할 것이다. 따라서, 결합 친화성의 비(예를 들면, 평형 해리 상수(KD))는 Fc 변이체의 ADCC 활성이 향상되는지 아니면 감소되는지를 표시할 수 있다. 예를 들면, FcγRIIIA/FcγRIIB 평형 해리 상수(KD)의 비의 감소는 개선된 ADCC 활성과 상관관계를 가질 것이지만, 상기 비의 증가는 ADCC 활성의 감소와 상관관계를 가질 것이다.
Fc 변이체의 특징규명의 일부로서, 상기 변이체를 FcγRIIIA(CD16a) 및 FcγRIIB(CD32b)에 대한 그들의 결합 친화성에 대해 시험하였고 야생형 IgG1과 비교된 비로서 보고하였다. (실시예 4 및 표 5를 참조한다.) 이 경우, 이들 활성화 Fc 수용체 및 억제 Fc 수용체와의 결합에 대한 CH3 도메인 돌연변이의 영향을 평가할 수 있었다. 한 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 70℃ 초과의 용융 온도(Tm)를 갖고, 이때 상기 이종이량체와 CD16a의 결합은 야생형 동종이량체와 비교될 때 거의 동일하다. 일부 실시양태에서, 상기 이종이량체와 CD16a의 결합은 야생형 동종이량체에 비해 증가된다. 대안적 실시양태에서, 상기 이종이량체와 CD16a의 결합은 야생형 동종이량체에 비해 감소된다.
일부 실시양태에서, 본원은 이종이량체 Fc 영역을 포함하는 단리된 이종다량체를 제공하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 70℃ 초과의 용융 온도(Tm)를 갖고, 이때 상기 이종이량체와 CD32b의 결합은 야생형 동종이량체와 비교될 때 거의 동일하다. 일부 실시양태에서, 상기 이종이량체와 CD32b의 결합은 야생형 동종이량체에 비해 증가된다. 대안적 실시양태에서, 상기 이종이량체와 CD32b의 결합은 야생형 동종이량체에 비해 감소된다.
당업자는 CD16a 및 CD32b와의 결합에 대한 KD를 Fc 변이체 대 야생형 동종이량체의 비로서 보고하는 대신에, 상기 KD를 CD16a에 결합하는 Fc 변이체 대 CD32b에 결합하는 Fc 변이체의 비로서 보고할 수 있다는 것을 이해할 것이다(데이터는 제시되지 않음). 이 비는 하기 보다 상세히 기재된 바와 같이 야생형에 비해 비변화된, 증가된 또는 감소된, ADCC에 대한 변이체 CH3 도메인 돌연변이의 효과 표시를 제공할 것이다.
ELISA 분석, 표면 플라스몬 공명 분석, 면역침전 분석(하기 "특징규명 및 기능 분석"의 표제를 갖는 단락 참조) 및 다른 방법, 예컨대, 간접 결합 분석, 경쟁 억제 분석, 형광 공명 에너지 전달(FRET), 겔 전기영동 및 크로마토그래피(예를 들면, 겔 여과)를 포함하나 이들로 한정되지 않는, Fc-FcγR 상호작용, 즉 Fc 영역과 FcγR의 특이적 결합을 측정하는 당업계의 공지된 시험관내 분석(생화학적 또는 면역학적 기초 분석)을 이용하여 FcγR에 대한 본 발명의 Fc 변이체의 친화성 및 결합 성질을 먼저 측정한다. 이들 방법들 및 다른 방법들은 조사될 성분들 중 하나 이상의 성분 상의 표지를 이용할 수 있고/있거나 발색 표지, 형광 표지, 발광 표지 또는 동위원소 표지를 포함하나 이들로 한정되지 않는 다양한 검출 방법들을 이용할 수 있다. 결합 친화성 및 반응속도에 대한 상세한 설명은 항체-면역원 상호작용에 초점을 두는 문헌(Paul, W. E., ed., Fundamental Immunology, 4th Ed., Lippincott-Raven, Philadelphia (1999))에서 찾을 수 있다.
본 발명의 분자의 결합 성질은 하나 이상의 FcγR 매개자 이펙터 세포 기능을 측정하는 시험관내 기능 분석(하기 "특징규명 및 기능 분석"의 표제를 갖는 단락 참조)에 의해서도 특징규명된다는 것이 고려된다. 일부 실시양태에서, 본 발명의 분자는 시험관내 기초 분석에서의 결합 성질과 유사한 생체내 모델(예컨대, 본원에 기재되고 개시된 생체내 모델)에서의 결합 성질을 갖는다. 그러나, 본 발명은 시험관내 기초 분석에서 원하는 표현형을 나타내지 않지만 생체내에서 원하는 표현형을 나타내는 본 발명의 분자를 배제하지 않는다.
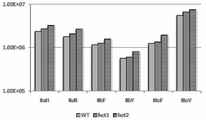
본 발명은 비교가능한 분자에 비해 상대적으로 증가된 친화성으로 FcγRIIIA(CD16a)에 결합하는 Fc 변이체를 포괄한다. 특정 실시양태에서, 본 발명의 Fc 변이체는 비교가능한 분자에 비해 상대적으로 증가된 친화성으로 FcγRIIIA에 결합하고 비교가능한 분자에 비해 상대적으로 비변화된 또는 감소된 결합 친화성으로 FcγRIIB(CD32b)에 결합한다. 또 다른 실시양태에서, 본 발명의 Fc 변이체는 비교가능한 분자에 비해 상대적으로 감소된 FcγRIIIA/FcγRIIB 평형 해리 상수(KD)의 비를 갖는다.
비교가능한 분자에 비해 상대적으로 감소된 친화성으로 FcγRIIIA(CD16a)에 결합하는 Fc 변이체도 본 발명에 의해 포괄된다. 특정 실시양태에서, 본 발명의 Fc 변이체는 비교가능한 분자에 비해 상대적으로 감소된 친화성으로 FcγRIIIA에 결합하고 비교가능한 분자에 비해 상대적으로 비변화된 또는 증가된 결합 친화성으로 FcγRIIB에 결합한다.
한 실시양태에서, Fc 변이체는 증가된 친화성으로 FcγRIIIA에 결합한다. 특정 실시양태에서, 상기 Fc 변이체는 비교가능한 분자의 FcγRIIIA에 대한 친화성보다 2배 이상, 3배 이상, 5배 이상, 7배 이상, 10배 이상, 20배 이상, 30배 이상, 40배 이상, 50배 이상, 60배 이상, 70배 이상, 80배 이상, 90배 이상, 100배 이상 또는 200배 이상 더 높은 FcγRIIIA에 대한 친화성을 갖는다. 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 증가된 FcγRIIIA에 대한 친화성을 갖는다.
또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 약 2배 내지 10배, 약 5배 내지 50배, 약 25배 내지 250배, 약 100배 내지 500배 또는 약 250배 내지 1000배 감소된 Fc 리간드(예를 들면, FcγR, C1q)에 대한 평형 해리 상수(KD)를 갖는다.
또 다른 실시양태에서, 상기 Fc 변이체는 비교가능한 분자에 비해 상대적으로 2배 이상, 3배 이상, 5배 이상, 7배 이상, 10배 이상, 20배 이상, 30배 이상, 40배 이상, 50배 이상, 60배 이상, 70배 이상, 80배 이상, 90배 이상, 100배 이상, 200배 이상, 400배 이상 또는 600배 이상 감소된 FcγRIIIA에 대한 평형 해리 상수(KD)를 갖는다. 또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 감소된 FcγRIIIA에 대한 평형 해리 상수(KD)를 갖는다.
한 실시양태에서, Fc 변이체는 비변화된 또는 감소된 친화성으로 FcγRIIB에 결합한다. 특정 실시양태에서, 상기 Fc 변이체는 비교가능한 분자에 비해 상대적으로 비변화된, 또는 1배 이상, 3배 이상, 5배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 감소된 FcγRIIB에 대한 친화성을 갖는다. 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 비변화된, 또는 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 감소된 FcγRIIB에 대한 친화성을 갖는다.
또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 비변화된, 또는 2배 이상, 3배 이상, 5배 이상, 7배 이상, 10배 이상, 20배 이상, 30배 이상, 40배 이상, 50배 이상, 60배 이상, 70배 이상, 80배 이상, 90배 이상, 100배 이상 또는 200배 이상 증가된 FcγRIIB에 대한 평형 해리 상수(KD)를 갖는다. 또 다른 특정 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 비변화된, 또는 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 증가된 FcγRIIB에 대한 평형 해리 상수(KD)를 갖는다.
또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 증가된 친화성으로 FcγRIIIA에 결합하고 비교가능한 분자에 비해 상대적으로 비변화된 또는 감소된 친화성으로 FcγRIIB에 결합한다. 특정 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 1배 이상, 3배 이상, 5배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 증가된 FcγRIIIA에 대한 친화성을 갖는다. 또 다른 특정 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 비변화된, 또는 2배 이상, 3배 이상, 5배 이상, 7배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 감소된 FcγRIIB에 대한 친화성을 갖는다. 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 증가된 FcγRIIIA에 대한 친화성을 갖고, 상기 Fc 변이체는 비교가능한 분자에 비해 상대적으로 비변화된, 또는 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 증가된 FcγRIIB에 대한 친화성을 갖는다.
또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 감소된 FcγRIIIA/FcγRIIB 평형 해리 상수(KD)의 비를 갖는다. 특정 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 1배 이상, 3배 이상, 5배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 감소된 FcγRIIIA/FcγRIIB 평형 해리 상수(KD)의 비를 갖는다. 또 다른 특정 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 감소된 FcγRIIIA/FcγRIIB 평형 해리 상수(KD)의 비를 갖는다.
또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 감소된 친화성으로 FcγRIIIA에 결합한다. 특정 실시양태에서, 상기 Fc 변이체는 비교가능한 분자에 비해 상대적으로 1배 이상, 3배 이상, 5배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 감소된 FcγRIIIA에 대한 친화성을 갖는다. 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 감소된 FcγRIIIA에 대한 친화성을 갖는다.
또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 감소된 친화성으로 FcγRIIIA에 결합하고 비교가능한 분자에 비해 상대적으로 비변화된 또는 증가된 친화성으로 FcγRIIB에 결합한다. 특정 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 1배 이상, 3배 이상, 5배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 감소된 FcγRIIIA에 대한 친화성을 갖는다. 또 다른 특정 실시양태에서, Fc 변이체는 비교가능한 분자의 FcγRIIB에 대한 친화성보다 2배 이상, 3배 이상, 5배 이상, 7배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 더 높은 FcγRIIB에 대한 친화성을 갖는다. 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 감소된 FcγRIIIA에 대한 친화성을 갖고, 상기 Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 증가된 FcγRIIB에 대한 친화성을 갖는다.
또 다른 실시양태에서, Fc 변이체는 비교가능한 분자의 FcγRIIIA에 대한 평형 해리 상수(KD)에 비해 1배 이상, 3배 이상, 5배 이상, 10배 이상, 20배 이상 또는 50배 이상 증가된 FcγRIIIA에 대한 평형 해리 상수(KD)를 갖는다. 특정 실시양태에서, 상기 Fc 변이체는 비교가능한 분자에 비해 상대적으로 2배 이상, 3배 이상, 5배 이상, 7배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 감소된 FcγRIIB에 대한 평형 해리 상수(KD)를 갖는다.
FcγR 선택성에 대한 CH2 변경
Fc-FcγR 복합체에서 Fc-FcγR 단백질-단백질 상호작용은 Fc 분자 내의 2개 쇄가 FcγR 분자 상의 2개의 상이한 부위와 상호작용한다는 것을 암시한다. 천연 Fc 분자 내의 2개 중쇄에서 대칭이 존재하지만, 1개 쇄 상의 잔기들 주변의 국소 FcγR 환경은 반대 Fc 쇄 상의 동일한 잔기 위치를 둘러싸는 FcγR 잔기와 상이하다. 2개의 대칭 관련 위치들은 FcγR 잔기들의 상이한 선택과 상호작용한다.
Fc와 FcγR의 결합에서 비대칭이 존재하는 한, Fc 분자의 쇄 A 및 B에 공존하는 돌연변이는 대칭 방식으로의 FcγR과의 상호작용에 영향을 미치지 않는다. 동종이량체 Fc 구조에서 Fc의 1개 쇄와 그의 국소 FcγR 환경의 상호작용을 최적화하기 위해 돌연변이가 도입될 때, 제2 쇄 내의 상응하는 돌연변이는 필요한 FcγR 결합 및 선택성 프로파일에 유리할 수 있거나, 불리할 수 있거나 기여하지 않을 수 있다.
구조 및 컴퓨터 이용에 의해 안내된 방법을 이용하여 Fc의 2개 쇄에서 비대칭 돌연변이를 조작함으로써 Fc의 2개 쇄 상에 동일한 돌연변이를 도입하는 전통적인 Fc 조작 방법의 이들 한계점을 극복한다. Fc의 2개 쇄가 수용체 분자의 그들의 상응하는 면과의 향상된 결합을 위해 독립적으로 최적화되는 경우 수용체들 사이의 보다 우수한 결합 선택성을 달성할 수 있다.
예를 들면, Fc의 1개 쇄 상의 특정 위치에 존재하는 돌연변이는 특정 잔기에 대한 선택성을 향상시키도록 디자인될 수 있는 반면(양성 디자인 노력), 동일한 잔기 위치는 대안적 Fcγ 수용체 유형의 그의 국소 환경과 불리하게 상호작용하도록 돌연변이될 수 있고(음성 디자인 노력), 이로써 2개 수용체들 사이의 보다 우수한 선택성을 달성할 수 있다. 일부 실시양태에서, 상이한 Fcγ 수용체에 비해 1개의 Fcγ 수용체에 선택적으로 결합하는(예를 들면, FcgRIIb 대신에 FcgRIIIa에 선택적으로 결합하는) CH2 도메인 내의 비대칭 아미노산 변형을 디자인하는 방법이 제공된다. 다른 일부 실시양태에서, 이종이량체 형성을 촉진하기 위한 아미노산 변형을 CH3 도메인 내에 포함하는 변이체 Fc 이종이량체의 CH2 도메인 내의 비대칭 아미노산 변형을 디자인하는 방법이 제공된다. 또 다른 실시양태에서, CH2 도메인 내에 비대칭 아미노산 변형을 포함하는 변이체 Fc 이종이량체에 기초하여 상이한 Fcγ 수용체에 대한 선택성을 디자인하는 방법이 제공된다. 또 다른 실시양태에서, Fcγ 수용체와 Fc 분자의 한 면의 결합을 편향시키는 비대칭 아미노산 변형을 디자인하는 방법이 제공된다. 다른 일부 실시양태에서, Fcγ 수용체가 CH2 도메인 내에 비대칭 아미노산 변형을 포함하는 변이체 Fc 이종이량체의 한 면과만 상호작용하도록 편향시키는 극성 유발제를 디자인하는 방법이 제공된다.
CH2 도메인 내의 돌연변이의 비대칭 디자인은 Fc 분자의 한 면 상에서 FcγR을 인식하도록 다듬어질 수 있다. 이것은 비대칭 Fc 스카폴드의 생산적 면을 구성하는 반면, 반대 면은 디자인된 선택성 프로파일 없이 야생형 유사 상호작용 성향을 제공하고 비생산적 면으로서 간주될 수 있다. 음성 디자인 방법을 이용하여 상기 비생산 면 상에 돌연변이를 도입하여 비대칭 Fc 스카폴드의 이 면과 FcγR의 상호작용을 차단함으로써, Fcγ 수용체에 대한 원하는 상호작용 경향을 강화할 수 있다.
[표 E]
또한, 본 발명은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하는 Fc 영역에 융합된 결합 도메인을 포함하는 융합 폴리펩티드에 관한 것으로서, 이때 상기 변이체 CH3 도메인은 70℃ 초과의 용융 온도(Tm)를 갖는다. 변이체 CH3 도메인을 포함하는 이종이량체를 포함하는 분자는 당업자에게 잘 공지된 방법에 의해 발생될 수 있다는 것이 구체적으로 고려된다. 요약하건대, 이러한 방법은 원하는 특이성을 갖는 가변 영역 또는 결합 도메인(예를 들면, 파지 디스플레이 또는 발현 라이브러리로부터 단리되거나 인간 또는 비인간 항체로부터 유래된 가변 영역 또는 수용체의 결합 도메인)과 변이체 Fc 이종이량체의 조합을 포함하나 이것으로 한정되지 않는다. 대안적으로, 당업자는 Fc 영역을 포함하는 분자(예를 들면, 항체)의 Fc 영역 내의 CH3 도메인을 변형시킴으로써 변이체 Fc 이종이량체를 발생시킬 수 있다.
한 실시양태에서, Fc 변이체는 항체 또는 Fc 융합 단백질이다. 특정 실시양태에서, 본 발명은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하는 Fc 영역을 포함하는 항체를 제공하고, 이때 상기 변이체 CH3 도메인은 70℃ 초과의 용융 온도(Tm)를 갖는다. 이러한 항체는 Fc 변이체를 발생시키도록 변형될 수 있는 CH3 도메인을 함유하는 Fc 영역을 천연적으로 포함하는 IgG 분자, 또는 변이체 CH3 도메인을 포함하는 Fc 영역을 함유하도록 조작된 항체 유도체를 포함한다. 본 발명의 Fc 변이체는 변이체 CH3 도메인을 포함하는 Fc 영역을 포함하는, 바람직하게는 항원에 특이적으로 결합하는(즉, 특이적 항원-항체 결합을 분석하는 당업계의 잘 공지된 면역분석에 의해 측정되었을 때 비특이적 결합과 경쟁하는) 임의의 항체 분자를 포함한다. 이러한 항체는 다중클론 항체, 단일클론 항체, 단일특이적 항체, 이중특이적 항체, 다중특이적 항체, 인간 항체, 인간화된 항체, 키메라 항체, 단일 쇄 항체, Fab 단편, F(ab′)2 단편, 이황화 결합된 Fvs, 및 VL 또는 VH 도메인을 함유하거나 심지어 항원에 특이적으로 결합하는 상보성 결정 영역(CDR)을 함유하는 단편(일부 경우 변이체 Fc 이종이량체를 함유하거나 변이체 Fc 이종이량체에 융합되도록 조작됨)을 포함하나 이들로 한정되지 않는다.
"항체 의존성 세포 매개 세포독성" 또는 "ADCC""는 일부 세포독성 세포(예를 들면, 천연 살해(NK)세포, 호중구 및 대식세포) 상에 존재하는 Fc 수용체(FcR) 상에 결합된 분비된 항체가 이들 세포독성 이펙터 세포들로 하여금 항원-치유 표적 세포에 특이적으로 결합한 후 상기 표적 세포를 세포독소로 사멸시킬 수 있게 하는 세포독성의 한 형태를 의미한다. 표적 세포의 표면에 대해 유도된 특이적 고 친화성 IgG 항체는 세포독성 세포를 "무장시키고" 이러한 사멸을 위해 절대적으로 필요하다. 표적 세포의 용해는 세포외에서 일어나고 직접적인 세포 대 세포 접촉을 필요로 하고 보체를 수반하지 않는다.
ADCC에 의한 표적 세포의 용해를 매개하는 임의의 특정 항체의 능력을 분석할 수 있다. ADCC 활성을 평가하기 위해, 항원-항체 복합체에 의해 활성화되어 표적 세포의 세포용해를 초래할 수 있는 면역 이펙터 세포와 함께 관심 있는 항체를 표적 세포에 첨가한다. 세포용해는 일반적으로 용해된 세포로부터의 표지(방사성 기질, 형광 염료 또는 천연 세포내 단백질)의 방출에 의해 검출된다. 이러한 분석에 유용한 이펙터 세포는 말초혈 단핵세포(PBMC) 및 천연 살해(NK) 세포를 포함한다. 시험관내 ADCC 분석의 구체적인 예는 문헌(Wisecarver et al., 1985, 79:277); 문헌(Bruggemann et al., 1987, J Exp Med 166:1351); 문헌(Wilkinson et al., 2001, J Immunol Methods 258:183); 문헌(Patel et al., 1995 J Immunol Methods 184:29) 및 본원(하기 "특징규명 및 기능 분석"의 표제를 갖는 단락 참조)에 기재되어 있다. 대안적으로 또는 추가로, 관심 있는 항체의 ADCC 활성은 생체내, 예를 들면, 동물 모델, 예컨대, 문헌(Clynes et al., 1998, PNAS USA 95:652)에 개시된 동물 모델에서 평가될 수 있다.
본 발명의 Fc 변이체는 하나 이상의 FcγR 매개자 이펙터 세포 기능을 측정하는 시험관내 기능 분석에 의해 특징규명된다는 것이 고려된다. 특정 실시양태에서, 본 발명의 분자는 시험관내 기초 분석에서의 결합 성질 및 이펙터 세포 기능과 유사한 생체내 모델(예컨대, 본원에 기재되고 개시된 생체내 모델)에서의 결합 성질 및 이펙터 세포 기능을 갖는다. 그러나, 본 발명은 시험관내 기초 분석에서 원하는 표현형을 나타내지 않지만 생체내에서 원하는 표현형을 나타내는 본 발명의 분자를 배제하지 않는다.
본 발명은 향상된 CDC 기능을 갖는 Fc 변이체를 추가로 제공한다. 한 실시양태에서, Fc 변이체는 증가된 CDC 활성을 갖는다. 한 실시양태에서, Fc 변이체는 비교가능한 분자의 CDC 활성보다 2배 이상, 3배 이상, 5배 이상, 10배 이상, 50배 이상 또는 100배 이상 더 높은 CDC 활성을 갖는다. 또 다른 실시양태에서, Fc 변이체는 비교가능한 분자의 친화성보다 2배 이상, 3배 이상, 5배 이상, 7배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 더 높은 친화성으로 C1q에 결합한다. 또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 증가된 CDC 활성을 갖는다. 특정 실시양태에서, 본 발명의 Fc 변이체는 증가된 친화성으로 C1q에 결합하고, 향상된 CDC 활성을 갖고, 하나 이상의 항원에 특이적으로 결합한다.
또한, 본 발명은 감소된 CDC 기능을 갖는 Fc 변이체를 제공한다. 한 실시양태에서, Fc 변이체는 감소된 CDC 활성을 갖는다. 한 실시양태에서, Fc 변이체는 비교가능한 분자의 CDC 활성보다 2배 이상, 3배 이상, 5배 이상, 10배 이상, 50배 이상 또는 100배 이상 더 낮은 CDC 활성을 갖는다. 또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 1배 이상, 3배 이상, 5배 이상, 10배 이상, 20배 이상, 50배 이상 또는 100배 이상 감소된 친화성으로 C1q에 결합한다. 또 다른 실시양태에서, Fc 변이체는 비교가능한 분자에 비해 상대적으로 10% 이상, 20% 이상, 30% 이상, 40% 이상, 50% 이상, 60% 이상, 70% 이상, 80% 이상, 90% 이상, 100% 이상, 150% 이상 또는 200% 이상 감소된 CDC 활성을 갖는다. 특정 실시양태에서, Fc 변이체는 감소된 친화성으로 C1q에 결합하고, 감소된 CDC 활성을 갖고, 하나 이상의 항원에 특이적으로 결합한다.
몇몇 실시양태에서, Fc 변이체는 하나 이상의 조작된 당형태(glycoform), 즉 Fc 영역을 포함하는 분자에 공유부착된 탄수화물 조성물을 포함한다. 조작된 당형태는 이펙터 기능의 향상 또는 감소를 포함하나 이들로 한정되지 않는 다양한 목적에 유용할 수 있다. 조작된 당형태는 당업자에게 공지된 임의의 방법, 예를 들면, 조작된 또는 변이체 발현 균주의 사용, 하나 이상의 효소, 예를 들면, β(1,4)-N-아세틸글루코스아미닐트랜스퍼라제 III(GnTI11)와의 동시발현, 다양한 유기체 또는 다양한 유기체로부터의 세포주에서 Fc 영역을 포함하는 분자의 발현, 또는 Fc 영역을 포함하는 분자의 발현 후 탄수화물(들)의 변형에 의해 발생될 수 있다. 조작된 당형태를 발생시키는 방법은 당업계에서 공지되어 있고, 문헌(Umana et al., 1999, Nat. Biotechnol 17:176-180), 문헌(Davies et al., 20017 Biotechnol Bioeng 74:288-294), 문헌(Shields et al., 2002, J Biol Chem 277:26733-26740), 문헌(Shinkawa et al., 2003, J Biol Chem 278:3466-3473), 미국 특허 제6,602,684호, 미국 특허출원 제10/277,370호, 미국 특허출원 제10/113,929호, PCT 국제 공보 제WO 00/61739A1호, PCT 국제 공보 제WO 01/292246A1호, PCT 국제 공보 제WO 02/311140A1호 및 PCT 국제 공보 제WO 02/30954A1호에 기재된 방법; 포틸리전트(Potillegent)™ 기술(바이오와 인코포레이티드(Biowa, Inc.), 미국 뉴저지주 프린스톤 소재); 및 글리코(Glyco)MAb™ 글리코실화 조작 기술(글리카트 바이오테크놀로지 아게(GLYCART biotechnology AG), 스위스 취리히 소재)을 포함하나 이들로 한정되지 않는다. 예를 들면, PCT 국제 공보 제WO 00061739호, 유럽 특허출원 공보 제01229125호, 미국 특허출원 공보 제20030115614호 및 문헌(Okazaki et al., 2004, JMB, 336: 1239-49)을 참조한다.
Fc 변이체는 가변 영역 및 이종이량체 Fc 영역을 포함하는 항체를 포함하고, 이때 상기 이종이량체 Fc 영역은 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인은 70℃ 초과의 용융 온도(Tm)를 갖는 것이 고려된다. 항체인 Fc 변이체는 하나 이상의 항원에 특이적으로 결합하는 가변 도메인 또는 이의 단편을, 변이체 CH3 도메인을 포함하는 이종이량체 Fc 영역과 조합함으로써 "드 노보" 제조될 수 있다. 대안적으로, 이종이량체 Fc 변이체는 항원에 결합하는 Fc 영역 함유 항체의 CH3 도메인을 변형시킴으로써 제조될 수 있다.
본 발명의 항체는 합성 항체, 단일클론 항체, 재조합 제조된 항체, 인트라바디, 단일특이적 항체, 다중특이적 항체, 이중특이적 항체, 인간 항체, 인간화된 항체, 키메라 항체, 합성 항체, 단일 쇄 FvFcs(scFvFc), 단일 쇄 Fvs(scFv), 및 항-이디오타입(항-Id) 항체를 포함할 수 있으나 이들로 한정되지 않는다. 특히, 본 발명의 방법에서 사용되는 항체는 면역글로불린 분자 및 면역글로불린 분자의 면역학적 활성 부분을 포함한다. 본 발명의 면역글로불린 분자는 임의의 유형(예를 들면, IgG, IgE, IgM, IgD, IgA 및 IgY), 클래스(예를 들면, IgG1, IgG2, IgG3, IgG4, IgA1 및 IgA2) 또는 서브클래스의 면역글로불린 분자일 수 있다.
본 발명의 항체는 조류 및 포유동물(예를 들면, 인간, 뮤린, 당나귀, 양, 토끼, 염소, 기니아 피그, 낙타, 말 또는 닭)을 포함하는 임의의 동물로부터 유래될 수 있다. 특정 실시양태에서, 항체는 인간 또는 인간화된 단일클론 항체, 특히 이중특이적 단일클론 항체이다. 본원에서 사용된 바와 같이, "인간" 항체는 인간 면역글로불린의 아미노산 서열을 갖는 항체를 포함하고 인간 면역글로불린 라이브러리로부터 단리되거나 인간 유전자로부터 항체를 발현하는 마우스로부터 단리된 항체를 포함한다.
모든 폴리펩티들처럼 항체는 폴리펩티드가 순 전하를 보유하지 않는 pH로서 일반적으로 정의되는 등전점(pI)을 갖는다. 용액의 pH가 단백질의 등전점(pI)과 동일할 때 단백질 가용성이 전형적으로 가장 낮다는 것은 당업계에서 공지되어 있다. 항체에서 이온화가능한 잔기의 수 및 위치를 변경하여 pI를 조절함으로써 가용성을 최적화할 수 있다. 예를 들면, 폴리펩티드의 pI는 적절한 아미노산 치환을 만들어(예를 들면, 비하전된 잔기, 예컨대, 알라닌을 하전된 아미노산, 예컨대, 라이신으로 치환시켜) 조절할 수 있다. 임의의 특정 이론에 구속받고자 하는 것은 아니지만, 항체의 pI를 변화시키는 상기 항체의 아미노산 치환은 상기 항체의 가용성 및/또는 안정성을 개선할 수 있다. 당업자는 어떤 아미노산 치환이 특정 항체의 원하는 pI를 달성하는 데에 가장 적절할 것인지를 이해할 것이다. 단백질의 pI는 등전 포커싱(isoelectric focusing) 및 컴퓨터를 이용한 다양한 알고리즘을 포함하나 이들로 한정되지 않는 다양한 방법에 의해 측정될 수 있다(예를 들면, 문헌(Bjellqvist et al., 1993, Electrophoresis 14:1023) 참조). 한 실시양태에서, 본 발명의 Fc 변이체의 pI는 pH 6.2 내지 pH 8.0이다. 또 다른 실시양태에서, 본 발명의 항체의 pI는 pH 6.8 내지 pH 7.4이다. 한 실시양태에서, 본 발명의 Fc 변이체의 pI를 변경시키는 치환은 항원에 대한 상기 변이체의 결합 친화성을 유의하게 감소시키지 않을 것이다. 증가된 안정성을 갖는 변이체 CH3 도메인도 pI를 변화시킬 수 있다는 것이 고려된다. 한 실시양태에서, 변이체 Fc 이종이량체는 특히 증가된 안정성 및 순도 둘다 및 pI의 임의의 원하는 변화에 영향을 미치도록 선택된다.
본 발명의 항체는 단일특이적, 이중특이적 또는 삼중특이적일 수 있거나 보다 더 높은 다중특이성을 가질 수 있다. 다중특이적 항체는 원하는 표적 분자의 상이한 에피토프들에 특이적으로 결합할 수 있거나 표준 분자 및 이종 에피토프, 예컨대, 이종 폴리펩티드 또는 고체 지지체 물질 둘다에 특이적으로 결합할 수 있다. 예를 들면, PCT 국제 공보 제WO 94/04690호, 제WO 93/17715호, 제WO 92/08802호, 제WO 91/00360호 및 제WO 92/05793호; 문헌(Tutt, et al., 1991, J. Immunol. 147:60-69); 미국 특허 제4,474,893호, 제4,714,681호, 제4,925,648호, 제5,573,920호 및 제5,601,819호; 및 문헌(Kostelny et al., 1992, J. Immunol. 148:1547)을 참조한다.
다기능성 표적화 분자의 다양한 실시양태들이 도 20에 나타낸 바와 같이 이 비대칭 스카폴드에 기초하여 디자인될 수 있다.
다중특이적 항체는 2개 이상의 상이한 항원에 대한 결합 특이성을 갖는다. 이러한 분자는 통상적으로 단지 2개의 항원에 결합할 것이지만(즉, 이중특이적 항체, BsAb), 추가 특이성을 갖는 항체, 예컨대, 삼중특이적 항체는 본 발명에 의해 포괄된다. BsAb의 예로는 종양 세포 항원에 대해 유도된 한 아암 및 세포독성 분자에 대해 유도된 다른 아암을 갖는 BsAb, 2개의 상이한 종양 세포 항원들에 대해 유도된 2개의 아암을 갖는 BsAb, 2개의 상이한 가용성 리간드들에 대해 유도된 2개의 아암을 갖는 BsAb, 가용성 리간드에 대해 유도된 한 아암 및 세포 표면 수용체에 대해 유도된 다른 아암을 갖는 BsAb, 또는 2개의 상이한 세포 표면 수용체들에 대해 유도된 2개의 아암을 갖는 BsAb가 있으나 이들로 한정되지 않는다. 이중특이적 항체의 제조 방법은 당업계에서 공지되어 있다.
상이한 방법에 따르면, 원하는 결합 특이성을 갖는 항체 가변 도메인(항체-항원 결합 부위)은 면역글로불린 불변 도메인 서열에 융합된다. 상기 융합은 힌지의 적어도 일부, CH2 및 CH3 영역을 포함하는 면역글로불린 중쇄 불변 도메인과의 융합일 수 있다. 경쇄 결합에 필요한 부위를 함유하는 제1 중쇄 불변 영역(CH1)은 융합체들 중 적어도 하나에 존재한다는 것이 고려된다. 면역글로불린 중쇄 융합체 및 원하는 경우 면역글로불린 경쇄를 코딩하는 DNA들은 분리된 발현 벡터 내로 삽입되고 적합한 숙주 유기체 내로 동시형질감염된다. 이것은 구축에서 사용된 3개의 폴리펩티드 쇄들의 동등하지 않은 비가 최적 수율을 제공하는 실시양태에서 3개의 폴리펩티드 단편의 상호 비율을 조절하는 데 있어서 큰 유연성을 제공한다. 실시예 1 및 표 2를 참조한다. 그러나, 동등한 비의 2개 이상의 폴리펩티드 쇄들의 발현이 높은 수율을 발생시킬 때 또는 상기 비가 특별한 의의를 갖지 않을 때 2개의 또는 모든 3개의 폴리펩티드 쇄들에 대한 코딩 서열을 1개의 발현 벡터 내에 삽입할 수 있다.
이중특이적 항체는 가교연결된 또는 "이종접합체" 항체를 포함한다. 예를 들면, 이종접합체에서 항체들 중 하나는 아비딘에 커플링될 수 있고 다른 하나는 바이오틴에 커플링될 수 있다. 예를 들면, 이러한 항체는 면역 시스템 세포를 원치 않는 세포에 표적화하기 위해(미국 특허 제4,676,980호) 및 HIV 감염을 치료하기 위해(PCT 국제 공보 제WO 91/00360호 및 제WO 92/200373호, 및 유럽 특허 제03089호) 제안되었다. 임의의 편리한 가교연결 방법을 이용하여 이종접합체 항체를 제조할 수 있다. 적합한 가교연결제는 당업계에서 잘 공지되어 있고 다수의 가교연결 기법들과 함께 미국 특허 제4,676,980호에 개시되어 있다.
본 발명의 변이체 CH3 도메인 및 생성된 Fc 이종이량체를 포함하는, 2 초과의 원자가를 갖는 항체가 고려된다. 예를 들면, 삼중특이적 항체가 제조될 수 있다. 예를 들면, 문헌(Tutt et al. J. Immunol. 147: 60 (1991))을 참조한다.
본 발명의 항체는 포유동물(예를 들면, 인간)에서 15일 초과, 20일 초과, 25일 초과, 30일 초과, 35일 초과, 40일 초과, 45일 초과, 2개월 초과, 3개월 초과, 4개월 초과 또는 5개월 초과의 반감기(예를 들면, 혈청 반감기)를 갖는 항체도 포괄한다. 포유동물(예를 들면, 인간)에서 본 발명의 항체의 증가된 반감기는 상기 포유동물에서 상기 항체 또는 항체 단편의 혈청 역가를 보다 더 높임으로써 상기 항체 또는 항체 단편의 투여 빈도를 감소시키고/시키거나 투여될 상기 항체 또는 항체 단편의 농도를 감소시킨다. 증가된 시험관내 반감기를 갖는 항체는 당업자에게 공지된 기법에 의해 발생될 수 있다. 예를 들면, 증가된 생체내 반감기를 갖는 항체는 Fc 도메인과 FcRn 수용체 사이의 상호작용에 관여하는 아미노산 잔기로서 확인된 아미노산 잔기를 변형시킴으로써(예를 들면, 치환시키거나, 결실시키거나 부가함으로써) 발생될 수 있다(예를 들면, PCT 국제 공보 제WO 97/34631호 및 제WO 04/029207호; 미국 특허 제6,737,056호; 및 미국 특허 공보 제2003/0190311호 참조).
변이체 CH3 도메인을 포함하는 변이체 Fc 이종이량체가 다중특이적 항체(본원에서 본 발명의 항체로서 지칭됨)인 특정 실시양태에서, 본 발명의 항체는 관심 있는 항원에 특이적으로 결합한다. 특히, 본 발명의 항체는 이중특이적 항체이다. 한 실시양태에서, 본 발명의 항체는 폴리펩티드 항원에 특이적으로 결합한다. 또 다른 실시양태에서, 본 발명의 항체는 비폴리펩티드 항원에 특이적으로 결합한다. 또 다른 실시양태에서, 질환 또는 장애를 앓고 있는 포유동물에게 본 발명의 항체를 투여함으로써 상기 포유동물에서 치료 이점을 발생시킬 수 있다.
하기 단백질 목록뿐만 아니라 하기 단백질 목록에 속하는 서브유닛, 도메인, 모티프 및 에피토프를 포함하나 이들로 한정되지 않는 사실상 임의의 분자가 변이체 Fc 이종이량체 단백질(예를 들면, 항체, Fc 융합 단백질)에 의해 표적화될 수 있고/있거나 변이체 Fc 이종이량체 단백질 내로 도입될 수 있다: 레닌; 인간 성장 호르몬 및 소 성장 호르몬을 포함하는 성장 호르몬; 성장 호르몬 방출 인자; 부갑상선 호르몬; 갑상선 자극 호르몬; 지단백질; 알파-1-항트립신; 인슐린 A-쇄; 인슐린 B-쇄; 전구인슐린; 여포 자극 호르몬; 칼시토닌; 황체 형성 호르몬; 글루카곤; 응고 인자, 예컨대, 인자 VII, 인자 VIIIC, 인자 IX, 조직 인자(TF) 및 본 빌레브란트(von Willebrands) 인자; 항-응고 인자, 예컨대, 단백질 C; 심방나트륨이뇨 인자; 폐 계면활성제; 플라스미노겐 활성화제, 예컨대, 유로키나제(urokinase), 또는 인간 소변 또는 조직 유형 플라스미노겐 활성화제(t-PA); 봄베신; 트롬빈; 조혈 성장 인자; 종양 괴사 인자-알파 및 종양 괴사 인자-베타; 엔케팔리나제(enkephalinase); RANTES(regulated on activation normally T-cell expressed and secreted); 인간 대식세포 염증 단백질(MIP-1-알파); 혈청 알부민, 예컨대, 인간 혈청 알부민; 뮬러리안(Muellerian) 억제 물질; 렐락신(relaxin) A-쇄; 렐락신 B-쇄; 전구렐락신; 마우스 성선자극호르몬 관련 펩티드; 미생물 단백질, 예컨대, 베타-락타마제(lactamase); DNase; IgE; 세포독성 T-림프구 관련 항원(CTLA), 예컨대, CTLA-4; 인히빈(inhibin); 액티빈(activin); 혈관 내피 성장 인자(VEGF); 호르몬 또는 성장 인자에 대한 수용체, 예컨대, EGFR, VEGFR; 인터페론, 예컨대, 알파 인터페론(α-IFN), 베타 인터페론(β-IFN) 및 감마 인터페론(γ-IFN); 단백질 A 또는 D; 류마티스 인자; 신경영양 인자, 예컨대, 골 유래의 신경영양 인자(BDNF), 뉴로트로핀-3, 뉴로트로핀-4, 뉴로트로핀-5 또는 뉴로트로핀-6(NT-3, NT-4, NT-5 또는 NT-6), 또는 신경 성장 인자; 혈소판 유래의 성장 인자(PDGF); 섬유모세포 성장 인자, 예컨대, AFGF 및 PFGF; 표피 성장 인자(EGF); 형질전이 성장 인자(TGF), 예컨대, TGF-알파 및 TGF-베타(TGF-1, TGF-2, TGF-3, TGF-4 또는 TGF-5를 포함함); 인슐린 유사 성장 인자-I 및 인슐린 유사 성장 인자-II(IGF-I 및 IGF-II); 데스(des)(1-3)-IGF-I(뇌 IGF-I), 인슐린 유사 성장 인자 결합 단백질; CD 단백질, 예컨대, CD2, CD3, CD4, CD8, CD11a, CD14, CD18, CD19, CD20, CD22, CD23, CD25, CD33, CD34, CD40, CD40L, CD52, CD63, CD64, CD80 및 CD147; 에리쓰로포이에틴; 골유도성 인자; 면역독소; 골 형태형성 단백질(BMP); 인터페론, 예컨대, 인터페론-알파, 인터페론-베타 및 인터페론-감마; 콜로니 자극 인자(CSF), 예컨대, M-CSF, GM-CSF 및 G-CSF; 인터루킨(IL), 예를 들면, IL-1 내지 IL-13; TNFα, 수퍼록사이드 디스뮤타제(superoxide dismutase); T-세포 수용체; 표면 막 단백질; 부패 가속화 인자; 바이러스 항원, 예컨대, AIDS 외피의 부분, 예를 들면, gp120; 수송 단백질; 귀소(homing) 수용체; 어드레신(addressin); 조절 단백질; 세포 부착 분자, 예컨대, LFA-1, Mac 1, p150.95, VLA-4, ICAM-1, ICAM-3 및 VCAM, a4/p7 인테그린 및 Xv/p3 인테그린(a 또는 이의 서브유닛을 포함함), 인테그린 알파 서브유닛, 예컨대, CD49a, CD49b, CD49c, CD49d, CD49e, CD49f, 알파7, 알파8, 알파9, 알파D, CD11a, CD11b, CD51, CD11c, CD41, 알파IIb, 알파IELb; 인테그린 베타 서브유닛, 예컨대, CD29, CD18, CD61, CD104, 베타5, 베타6, 베타7 및 베타8; αVβ3, αVβ5 및 α4β7을 포함하나 이들로 한정되지 않는 인테그린 서브유닛 조합물; 아폽토시스 경로의 구성원; IgE; 혈액 군 항원; flk2/flt3 수용체; 비만(OB) 수용체; mp1 수용체; CTLA-4; 단백질 C; Eph 수용체, 예컨대, EphA2, EphA4, EphB2 등; 인간 백혈구 항원(HLA), 예컨대, HLA-DR; 보체 단백질, 예컨대, 보체 수용체 CR1, C1Rq 및 다른 보체 인자, 예컨대, C3 및 C5; 당단백질 수용체, 예컨대, GpIbα, GPIIb/IIIa 및 CD200; 및 상기 나열된 폴리펩티드들 중 임의의 폴리펩티드의 단편.
하기 항원들을 포함하나 이들로 한정되지 않는 암 항원에 특이적으로 결합하는 본 발명의 항체도 고려된다: ALK 수용체(플레이오트로핀(pleiotrophin) 수용체), 플레이오트로핀, KS 1/4 범(pan)-암종 항원; 난소 암종 항원(CA125); 전립선 산성 포스페이트; 전립선 특이적 항원(PSA); 흑색종 관련 항원 p97; 흑색종 항원 gp75; 고분자량 흑색종 항원(HMW-MAA); 전립선 특이적 막 항원; 암배아 항원(CEA); 다형성 상피 뮤신 항원; 인간 모유 지방 구형 항원; 대장 종양 관련 항원, 예컨대, CEA, TAG-72, CO17-1A, GICA 19-9, CTA-1 및 LEA; 버킷 림프종 항원-38.13; CD19; 인간 B-림프종 항원-CD20; CD33; 흑색종 특이적 항원, 예컨대, 강글리오사이드 GD2, 강글리오사이드 GD3, 강글리오사이드 GM2 및 강글리오사이드 GM3; 종양 특이적 이식 유형 세포 표면 항원(TSTA); T-항원, DNA 종양 바이러스 및 RNA 종양 바이러스의 외피 항원을 포함하는, 바이러스에 의해 유도된 종양 항원; 발암태아성 항원-알파-태아단백질, 예컨대, 결장의 CEA, 5T4 발암태아성 영양막 당단백질 및 방광 종양 발암태아성 항원; 분화 항원, 예컨대, 인간 폐 암종 항원 L6 및 L20; 섬유육종의 항원; 인간 백혈병 T 세포 항원-Gp37; 신생당단백질; 스핑고지질; 유방암 항원, 예컨대, EGFR(표피 성장 인자 수용체); NY-BR-16; NY-BR-16 및 HER2 항원(p185HER2); 다형성 상피 뮤신(PEM); 악성 인간 림프구 항원-APO-1; 분화 항원, 예컨대, 태아 적혈구에서 발견된 I 항원; 성인 적혈구에서 발견된 일차 내배엽 I 항원; 착상전 배아; 위 선암종에서 발견된 I(Ma); 유방 상피에서 발견된 M18 및 M39; 골수 세포에서 발견된 SSEA-1; VEP8; VEP9; Myl; Va4-D5; 대장암에서 발견된 D156-22; TRA-1-85(혈액 군 H); 정소암 및 난소암에서 발견된 SCP-1; 결장 선암종에서 발견된 C14; 폐 선암종에서 발견된 F3; 위암에서 발견된 AH6; Y 햅텐; 배아 암종 세포에서 발견된 Ley; TL5(혈액 군 A); A431 세포에서 발견된 EGF 수용체; 췌장암에서 발견된 E1 시리즈(혈액 군 B); 배아 암종 세포에서 발견된 FC10.2; 위 선암종 항원; 선암종에서 발견된 CO-514(혈액 군 Lea); 선암종에서 발견된 NS-10; CO-43(혈액 군 Leb); A431 세포의 EGF 수용체에서 발견된 G49; 결장 선암종에서 발견된 MH2(혈액 군 ALeb/Ley); 결장암에서 발견된 19.9; 위암 뮤신; 골수 세포에서 발견된 T5A7; 흑색종에서 발견된 R24; 배아 암종 세포에서 발견된 4.2, GD3, D1.1, OFA-1, GM2, OFA-2, GD2 및 M1:22:25:8, 및 4 세포 내지 8 세포 단계 배아에서 발견된 SSEA-3 및 SSEA-4; 피부 T 세포 림프종 항원; MART-1 항원; 시알리(Sialy) Tn(STn) 항원; 결장암 항원 NY-CO-45; 폐암 항원 NY-LU-12 발리안트(valiant) A; 선암종 항원 ART1; 부신생물(Paraneoplastic) 관련 뇌-정소-암 항원(발암신경 항원 MA2; 부신생물 신경 항원); 신경종양학적 복부(ventral) 항원 2(NOVA2); 간세포암종 항원 유전자 520; 종양 관련 항원 CO-029; 종양 관련 항원 MAGE-C1(암/정소 항원 CT7), MAGE-B1(MAGE-XP 항원), MAGE-B2(DAM6), MAGE-2, MAGE-4-a, MAGE-4-b 및 MAGE-X2; 암-정소 항원(NY-EOS-1); 및 상기 나열된 폴리펩티드들 중 임의의 폴리펩티드의 단편.
일부 실시양태에서, 본원에 기재된 이종다량체는 하나 이상의 치료 항체를 포함한다. 몇몇 실시양태에서, 치료 항체는 암 표적 항원에 결합한다. 한 실시양태에서, 치료 항체는 아바고보맙, 아달리무맙, 알렘투주맙, 아우로그랍, 바피뉴주맙, 바실릭시맙, 벨리무맙, 베바시주맙, 브리아키누맙, 카나키누맙, 카투막소맙, 세르톨리주맙 페골, 세툭시맙, 다클리주맙, 데노수맙, 에팔리주맙, 갈릭시맙, 젬투주맙 오조가미신, 골리무맙, 이브리투모맙 티욱세탄, 인플릭시맙, 이필리무맙, 루밀릭시맙, 메폴리주맙, 모타비주맙, 뮤로모납, 마이코그랍, 나탈리주맙, 니모투주맙, 오크렐리주맙, 오파투무맙, 오말리주맙, 팔리비주맙, 파니투무맙, 페르투주맙, 라니비주맙, 레슬리주맙, 리툭시맙, 테플리주맙, 토실리주맙/아틀리주맙, 토시투모맙, 트라스투주맙, 프록시늄TM, 렌카렉스TM, 우스테키누맙, 잘루투무맙 및 임의의 다른 항체 중 하나일 수 있거나 이들로 구성된 군으로부터 선택된다.
본 발명의 항체는 (즉, 임의의 유형의 분자와 항체의 공유부착에 의해) 변형된 유도체를 포함한다. 비한정적 방식으로 예를 들면, 항체 유도체는 예를 들면, 글리코실화, 아세틸화, 페길화, 인산화, 아미드화, 공지된 보호/차단 기에 의한 유도체화, 단백질용해성 절단, 세포 리간드 또는 다른 단백질과의 연결 등에 의해 변형된 항체를 포함한다. 다수의 화학적 변형들 중 임의의 화학적 변형이 특이적 화학적 절단, 아세틸화, 포르밀화, 투니카마이신의 대사적 합성 등을 포함하나 이들로 한정되지 않는 공지된 기법에 의해 수행될 수 있다. 추가로, 상기 유도체는 하나 이상의 비고전적 아미노산을 함유할 수 있다.
증가된 생체내 반감기를 갖는 항체 또는 이의 단편은 중합체 분자, 예컨대, 고분자량 폴리에틸렌글리콜(PEG)을 항체 또는 항체 단편에 부착시킴으로써 발생될 수 있다. PEG와 항체 또는 항체 단편의 N-말단 또는 C-말단의 부위 특이적 접합 또는 라이신 잔기 상에 존재하는 엡실론-아미노 기를 통해 다기능성 링거를 사용하거나 사용하지 않고 PEG를 상기 항체 또는 항체 단편에 부착시킬 수 있다. 생물학적 활성의 상실을 최소화하는 직쇄 또는 분지쇄 중합체 유도체화가 이용될 것이다. PEG 분자와 항체의 적절한 접합을 보장하기 위해 접합도는 SDS-PAGE 및 질량 분광측정법에 의해 철저히 모니터링될 것이다. 비반응된 PEG는 예를 들면, 크기 배제 또는 이온 교환 크로마토그래피에 의해 항체-PEG 접합체로부터 분리될 수 있다.
추가로, 생체내에서 보다 더 안정하거나 생체내에서 보다 긴 반감기를 갖는 항체 또는 항체 단편을 제조하기 위해 항체를 알부민에 접합시킬 수 있다. 기법은 당업계에서 잘 공지되어 있다(예를 들면, PCT 국제 공보 제WO 93/15199호, 제WO 93/15200호 및 제WO 01/77137호; 및 유럽 특허 제413,622호 참조). 본 발명은 펩티드, 폴리펩티드, 단백질, 융합 단백질, 핵산 분자, 소분자, 미메틱(mimetic) 물질, 합성 약물, 무기 분자 및 유기 분자를 포함하나 이들로 한정되지 않는 하나 이상의 모이어티에 접합되거나 융합된 항체 또는 이의 단편의 용도를 포괄한다.
본 발명은 이종 단백질 또는 폴리펩티드(또는 이들의 단편, 예를 들면, 10개 이상, 20개 이상, 30개 이상, 40개 이상, 50개 이상, 60개 이상, 70개 이상, 80개 이상, 90개 이상 또는 100개 이상의 아미노산으로 구성된 폴리펩티드)에 재조합적으로 융합되거나 화학적으로 접합되어 융합 단백질을 발생시키는 항체 또는 이의 단편의 용도를 포괄한다. 상기 융합은 반드시 직접적일 필요는 없고 링커 서열을 통해 일어날 수 있다. 예를 들면, 항체는 항체를 특정 세포 표면 수용체에 대해 특이적인 항체에 융합시키거나 접합시킴으로써 시험관내에서 또는 생체내에서 이종 폴리펩티드를 특정 세포 유형에 표적화하는 데에 사용될 수 있다. 당업계에서 공지된 방법을 이용하여 이종 폴리펩티드에 융합되거나 접합된 항체를 시험관내 면역분석 및 정제 방법에서 사용할 수도 있다. 예를 들면, PCT 국제 공보 제WO 93/21232호, 유럽 특허 제439,095호, 문헌(Naramura et al., 1994, Immunol. Lett. 39:91-99), 미국 특허 제5,474,981호, 문헌(Gillies et al., 1992, PNAS 89:1428-1432) 및 문헌(Fell et al., 1991, J. Immunol. 146:2446-2452)을 참조한다.
본 발명은 항체 단편에 융합되거나 접합된 이종 단백질, 펩티드 또는 폴리펩티드를 포함하는 조성물을 추가로 포함한다. 예를 들면, 이종 폴리펩티드는 Fab 단편, Fd 단편, Fv 단편, F(ab)2 단편, VH 도메인, VL 도메인, VH CDR, VL CDR, 또는 이들의 단편에 융합될 수 있거나 접합될 수 있다. 폴리펩티드를 항체 부분에 융합시키거나 접합시키는 방법은 당업계에서 잘 공지되어 있다. 예를 들면, 미국 특허 제5,336,603호, 제5,622,929호, 제5,359,046호, 제5,349,053호, 제5,447,851호 및 제5,112,946호; 유럽 특허 제307,434호 및 제367,166호; PCT 국제 공보 제WO 96/04388호 및 제WO 91/06570호; 문헌(Ashkenazi et al., 1991, Proc. Natl. Acad. Sci. USA 88: 10535-10539); 문헌(Zheng et al., 1995, J. Immunol. 154:5590-5600); 및 문헌(Vil et al., 1992, Proc. Natl. Acad. Sci. USA 89:11337-11341)을 참조한다.
추가 융합 단백질, 예를 들면, 항원(예를 들면, 상기 항원)에 특이적으로 결합하는 항체의 추가 융합 단백질은 유전자 셔플링, 모티프 셔플링, 엑손 셔플링 및/또는 코돈 셔플링("DNA 셔플링"으로서 총칭됨) 기법을 통해 발생될 수 있다. DNA 셔플링을 이용하여 본 발명의 항체 또는 이의 단편의 활성을 변경시킬 수 있다(예를 들면, 보다 높은 친화성 및 보다 낮은 해리 속도를 갖는 항체 또는 이의 단편). 일반적으로, 미국 특허 제5,605,793호, 제5,811,238호, 제5,830,721호, 제5,834,252호 및 제5,837,458호; 문헌(Patten et al., 1997, Curr. Opinion Biotechnol. 8:724-33); 문헌(Harayama, 1998, Trends Biotechnol. 16(2): 76-82); 문헌(Hansson, et al., 1999, J. Mol. Biol. 287:265-76); 및 문헌(Lorenzo and Blasco, 1998, Biotechniques 24(2): 308-313)을 참조한다. 항체 또는 이의 단편, 또는 코딩된 항체 또는 이의 단편은 재조합 전에 오류 유발 PCR, 무작위 뉴클레오티드 삽입 또는 다른 방법에 의한 무작위 돌연변이유발에 노출됨으로써 변경될 수 있다. 항체 또는 항체 단편을 코딩하는 폴리뉴클레오티드의 하나 이상의 부분으로서, 항원에 특이적으로 결합하는 부분은 하나 이상의 이종 분자의 하나 이상의 성분, 모티프, 절편, 부분, 도메인, 단편 등과 조합될 수 있다.
본 발명은 치료제에 접합된 변이체 Fc 이종이량체 또는 이의 단편의 용도를 추가로 포괄한다.
항체 또는 이의 단편은 치료 모이어티, 예컨대, 세포독소, 예를 들면, 세포증식정지제 또는 살세포제, 치료제 또는 방사성 금속 이온, 예를 들면, 알파-방사제에 접합될 수 있다. 세포독소 또는 세포독성제는 세포에 유해한 임의의 물질을 포함한다. 예로는 리보뉴클레아제(ribonuclease), 모노메틸아우리스타틴 E 및 F, 파클리탁셀, 사이토칼라신 B, 그라미시딘 D, 에티듐 브로마이드, 에메틴, 미토마이신, 에토포사이드, 테노포사이드, 빈크리스틴, 빈블라스틴, 콜히친, 독소루비신, 다우노루비신, 디하이드록시 안쓰라신 디온, 미톡산트론, 미쓰라마이신, 악티노마이신 D, 1-데하이드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤, 퓨로마이신, 에피루비신, 및 사이클로포스프아미드 및 이들의 유사체 및 상동체가 있다. 치료제는 항대사물질(예를 들면, 메토트렉세이트, 6-머캡토푸린, 6-티오구아닌, 사이타라빈, 5-플루오로우라실 데카르바진), 알킬화제(예를 들면, 메클로르에타민, 티오에파 클로람부실, 멜팔란, 카르무스틴(BCNU) 및 로무스틴(CCNU), 사이클로포스프아미드, 부설판, 디브로모만니톨, 스트렙토조토신, 미토마이신 C 및 시스디클로로디아민 백금(II)(DDP) 시스플라틴), 안쓰라사이클린(예를 들면, 다우노루비신(이전 명칭: 다우노마이신) 및 독소루비신), 항생제(예를 들면, 닥티노마이신(이전 명칭: 악티노마이신), 블레오마이신, 미쓰라마이신, 및 안쓰라마이신(AMC)), 및 항-유사분열제(예를 들면, 빈크리스틴 및 빈블라스틴)를 포함하나 이들로 한정되지 않는다. 치료 모이어티의 보다 광범위한 목록은 PCT 국제 공보 제WO 03/075957호에서 발견될 수 있다.
추가로, 항체 또는 이의 단편은 주어진 생물학적 반응을 변형시키는 치료제 또는 약물 모이어티에 접합될 수 있다. 치료제 또는 약물 모이어티는 고전적인 화학적 치료제로 한정되는 것으로서 간주되어서는 안 된다. 예를 들면, 약물 모이어티는 원하는 생물학적 활성을 보유하는 단백질 또는 폴리펩티드일 수 있다. 이러한 단백질은 예를 들면, 독소, 예컨대, 애브린, 리신 A, 온코나제(Onconase)(또는 또 다른 세포독성 RNase), 슈도모나스 외독소, 콜레라 독소 또는 디프테리아 독소; 단백질, 예컨대, 종양 괴사 인자, α-인터페론, β-인터페론, 신경 성장 인자, 혈소판 유래의 성장 인자, 조직 플라스미노겐 활성화제, 아폽토시스제, 예를 들면, TNF-α, TNF-β, AIM I(PCT 국제 공보 제WO 97/33899호 참조), AIM II(PCT 국제 공보 제WO 97/34911호 참조), Fas 리간드(Takahashi et al., 1994, J. Immunol., 6:1567), 및 VEGI(PCT 국제 공보 제WO 99/23105호 참조), 혈전제 또는 항혈관신생제, 예를 들면, 안지오스타틴 또는 엔도스타틴; 또는 생물학적 반응 변형제, 예를 들면, 림포카인(예를 들면, 인터루킨-1("IL-1"), 인터루킨-2("IL-2"), 인터루킨-6("IL-6"), 과립구 대식세포 콜로니 자극 인자("GM-CSF"), 및 과립구 콜로니 자극 인자("G-CSF")), 또는 성장 인자(예를 들면, 성장 호르몬("GH"))을 포함할 수 있다.
더욱이, 항체는 치료 모이어티, 예컨대, 방사성 물질, 또는 방사성금속 이온의 접합에 유용한 거대고리 킬레이터에 접합될 수 있다(방사성물질의 예에 대해서는 상기 참조). 일부 실시양태에서, 상기 거대고리 킬레이터는 링커 분자를 통해 항체에 접합될 수 있는 1,4,7,10-테트라아자사이클로도데칸-N,N',N",N"-테트라아세트산(DOTA)이다. 이러한 링커 분자는 당업계에서 통상적으로 공지되어 있고 문헌(Denardo et al., 1998, Clin Cancer Res. 4:2483), 문헌(Peterson et al., 1999, Bioconjug. Chem. 10:553) 및 문헌(Zimmerman et al., 1999, Nucl. Med. Biol. 26:943)에 기재되어 있다.
항체를 폴리펩티드 모이어티에 융합시키거나 접합시키는 방법은 당업계에서 공지되어 있다. 예를 들면, 미국 특허 제5,336,603호, 제5,622,929호, 제5,359,046호, 제5,349,053호, 제5,447,851호 및 제5,112,946호; 유럽 특허 제307,434호 및 제367,166호; PCT 국제 공보 제WO 96/04388호 및 제WO 91/06570호; 문헌(Ashkenazi et al., 1991, PNAS USA 88:10535); 문헌(Zheng et al., 1995, J Immunol 154:5590); 및 문헌(Vil et al., 1992, PNAS USA 89:11337)을 참조한다. 항체와 모이어티의 융합은 반드시 직접적일 필요는 없고 링커 서열을 통해 일어날 수 있다. 이러한 링커 분자는 당업계에서 통상적으로 공지되어 있고 문헌(Denardo et al., 1998, Clin Cancer Res 4:2483), 문헌(Peterson et al., 1999, Bioconjug Chem 10:553), 문헌(Zimmerman et al., 1999, Nucl Med Biol 26:943) 및 문헌(Garnett, 2002, Adv Drug Deliv Rev 53:171)에 기재되어 있다.
Fc 변이체, 또는 이의 유도체, 유사체 또는 단편(예를 들면, 본 발명의 항체 또는 융합 단백질)의 재조합 발현은 Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 코딩하는 폴리뉴클레오티드를 함유하는 발현 벡터의 구축을 필요로 한다. 일단 Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 코딩하는 폴리뉴클레오티드가 수득되면, 상기 Fc 변이체(예를 들면, 항체 또는 융합 단백질)의 제조를 위한 벡터는 당업계에서 잘 공지된 기법을 이용하는 재조합 DNA 기술에 의해 제조될 수 있다. 따라서, Fc 변이체(예를 들면, 항체 또는 융합 단백질) 코딩 뉴클레오티드 서열을 함유하는 폴리뉴클레오티드를 발현시켜 단백질을 제조하는 방법이 본원에 기재되어 있다. 당업자에게 잘 공지되어 있는 방법을 이용하여, Fc 변이체(예를 들면, 항체 또는 융합 단백질) 코딩 서열 및 적절한 전사 및 번역 조절 신호를 함유하는 발현 벡터를 구축할 수 있다. 이들 방법은 예를 들면, 시험관내 재조합 DNA 기법, 합성 기법 및 생체내 유전적 재조합을 포함한다. 따라서, 본 발명은 프로모터에 작동가능하게 연결된, 본 발명의 Fc 변이체를 코딩하는 뉴클레오티드 서열을 포함하는 복제가능한 벡터를 제공한다. 전장 항체 쇄(예를 들면, 중쇄 또는 경쇄)의 발현을 위해 또는 비항체 유래의 폴리펩티드와 적어도 변이체 CH3 도메인을 포함하는 Fc 영역의 융합체를 포함하는 완전한 Fc 변이체의 발현을 위해, 상기 벡터가 항체 분자의 불변 영역(예를 들면, PCT 국제 공보 제WO 86/05807호, PCT 국제 공보 제WO 89/01036호 및 미국 특허 제5,122,464호 참조) 및 항체의 가변 도메인을 코딩하는 뉴클레오티드 서열을 포함할 수 있거나, Fc 변이체를 발생시키는 폴리펩티드가 상기 벡터 내로 클로닝될 수 있다.
발현 벡터는 통상적인 기법에 의해 숙주 세포로 전달되고, 이어서 형질감염된 세포는 통상적인 기법에 의해 배양되어 본 발명의 Fc 변이체를 생성한다. 따라서, 본 발명은 이종 프로모터에 작동가능하게 연결된, 본 발명의 Fc 변이체를 코딩하는 폴리뉴클레오티드를 함유하는 숙주 세포를 포함한다. 이중 쇄 항체를 포함하는 Fc 변이체의 발현을 위한 특정 실시양태에서, 하기 상세히 기재된 바와 같이, 중쇄 및 경쇄 둘다를 코딩하는 벡터는 전체 면역글로불린 분자의 발현을 위해 숙주 세포 내에서 동시발현될 수 있다.
다양한 숙주 발현 벡터 시스템을 사용하여 본 발명의 Fc 변이체(예를 들면, 항체 또는 융합 단백질 분자)를 발현시킬 수 있다(예를 들면, 미국 특허 제5,807,715호 참조). 이러한 숙주 발현 시스템은 관심 있는 코딩 서열이 생성된 후 정제될 수 있는 비히클을 나타낼 뿐만 아니라 적절한 뉴클레오티드 코딩 서열로 형질전환되었거나 형질감염되었을 때 제자리에서 본 발명의 Fc 변이체를 발현할 수 있는 세포도 나타낸다. 이들은 Fc 변이체 코딩 서열을 함유하는 재조합 박테리오파지 DNA, 플라스미드 DNA 또는 코스미드 DNA 발현 벡터로 형질전환된 미생물, 예컨대, 세균(예를 들면, 이. 콜라이(E. coli) 및 바실러스 서브틸리스(B. subtilis)); Fc 변이체 코딩 서열을 함유하는 재조합 효모 발현 벡터로 형질전환된 효모(예를 들면, 사카로마이세스 피키아(Saccharomyces Pichia)); Fc 변이체 코딩 서열을 함유하는 재조합 바이러스 발현 벡터(예를 들면, 바큘로바이러스)로 감염된 곤충 세포 시스템; Fc 변이체 코딩 서열을 함유하는 재조합 바이러스 발현 벡터(예를 들면, 꽃양배추 모자이크 바이러스, CaMV; 담배 모자이크 바이러스, TMV)로 감염되거나 Fc 변이체 코딩 서열을 함유하는 재조합 플라스미드 발현 벡터(예를 들면, Ti 플라스미드)로 형질전환된 식물 세포 시스템; 또는 포유동물 세포의 게놈으로부터 유래된 프로모터(예를 들면, 메탈로티오네인 프로모터) 또는 포유동물 바이러스로부터 유래된 프로모터(예를 들면, 아데노바이러스 후기 프로모터; 백시니아 바이러스 7.5K 프로모터)를 함유하는 재조합 발현 구축물을 보유하는 포유동물 세포 시스템(예를 들면, COS, CHO, BHK, 293, NS0 및 3T3 세포)을 포함하나 이들로 한정되지 않는다. 일부 실시양태에서, 세균 세포, 예컨대, 에스케리치아 콜라이(Escherichia coli) 또는 진핵 세포가 재조합 항체 또는 융합 단백질 분자인 Fc 변이체의 발현을 위해 사용된다. 예를 들면, 포유동물 세포, 예컨대, 중국 햄스터 난소 세포(CHO)는 벡터, 예컨대, 인간 사이토메갈로바이러스로부터의 주요 중간 초기 유전자 프로모터 요소와 함께 항체를 위한 효과적인 발현 시스템이다(Foecking et al., 1986, Gene 45:101; and Cockett et al., 1990, Bio/Technology 8:2). 특정 실시양태에서, 본 발명의 Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 코딩하는 뉴클레오티드 서열의 발현은 항시적(constitutive) 프로모터, 유도성 프로모터 또는 조직 특이적 프로모터에 의해 조절된다.
세균 시스템에서, 다수의 발현 벡터들이 발현될 Fc 변이체(예를 들면, 항체 또는 융합 단백질)에 대해 의도된 용도에 따라 유리하게 선택될 수 있다. 예를 들면, 다량의 이러한 단백질이 Fc 변이체의 약학 조성물의 발생을 위해 제조되어야 하는 경우, 용이하게 정제되는 고도의 융합 단백질 생성물의 발현을 유도하는 벡터가 바람직할 수 있다. 이러한 벡터는 lac Z-융합 단백질이 제조되도록 Fc 변이체 코딩 서열이 lac Z 코딩 서열과 인 프레임으로 벡터 내로 개별적으로 라이게이션될 수 있는 이. 콜라이 발현 벡터 pUR278(Ruther et al., 1983, EMBO 12:1791); pIN 벡터(Inouye & Inouye, 1985, Nucleic Acids Res. 13:3101-3109; Van Heeke & Schuster, 1989, J. Biol. Chem. 24:5503-5509) 등을 포함하나 이들로 한정되지 않는다. 또한, pGEX 벡터를 사용하여 글루타티온 5-트랜스퍼라제(GST)와의 융합 단백질로서 외래 폴리펩티드를 발현시킬 수 있다. 일반적으로, 이러한 융합 단백질은 가용성을 나타내고 매트릭스 글루타티온 아가로스 비드에의 흡착 및 결합 후 자유 글루타티온의 존재 하에서의 용출에 의해 용해된 세포로부터 용이하게 정제될 수 있다. pGEX 벡터는 클로닝된 표적 유전자 생성물이 GST 모이어티로부터 방출될 수 있도록 트롬빈 또는 인자 Xa 프로테아제 절단 부위를 포함하도록 디자인된다.
곤충 시스템에서, 오토그라파 칼리포르니카(Autographa californica) 핵 다면체형성(polyhedrosis) 바이러스(AcNPV)가 외래 유전자를 발현하기 위한 벡터로서 사용된다. 상기 바이러스는 스포도프테라 프루기페르다(Spodoptera frugiperda) 세포에서 증식한다. Fc 변이체(예를 들면, 항체 또는 융합 단백질) 코딩 서열은 상기 바이러스의 비필수 영역(예를 들면, 폴리헤드린 유전자) 내로 개별적으로 클로닝될 수 있고 AcNPV 프로모터(예를 들면, 폴리헤드린 프로모터)의 조절 하에 배치될 수 있다.
포유동물 숙주 세포에서, 다수의 바이러스 기초 발현 시스템들이 이용될 수 있다. 아데노바이러스가 발현 벡터로서 사용되는 경우, 관심 있는 Fc 변이체(예를 들면, 항체 또는 융합 단백질) 코딩 서열은 아데노바이러스 전사/번역 조절 복합체, 예를 들면, 후기 프로모터 및 삼부분(tripartite) 리더 서열에 라이게이션될 수 있다. 그 다음, 이 키메라 유전자는 시험관내 또는 생체내 재조합에 의해 아데노바이러스 게놈 내로 삽입될 수 있다. 바이러스 게놈의 비필수 영역(예를 들면, 영역 E1 또는 E3) 내로의 삽입은 감염된 숙주에서 생존가능하고 Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 발현할 수 있는 재조합 바이러스를 발생시킬 것이다(예를 들면, 문헌(Logan & Shenk, 1984, Proc. Natl. Acad. Sci. USA 81:355-359) 참조). 삽입된 항체 코딩 서열의 효율적인 번역을 위해 특이적 개시 신호도 요구될 수 있다. 이들 신호는 ATG 개시 코돈 및 인접 서열을 포함한다. 나아가, 개시 코돈은 전체 삽입체의 번역을 보장하기 위해 원하는 코딩 서열의 판독 프레임과 일치하여(in phase) 존재해야 한다. 이들 외인성 번역 조절 신호 및 개시 코돈은 다양한 기원, 즉 천연 및 합성 기원으로부터 유래될 수 있다. 발현의 효율은 적절한 전사 인핸서(enhancer) 요소, 전사 종결요소 등의 포함에 의해 향상될 수 있다(예를 들면, 문헌(Bittner et al., 1987, Methods in Enzymol. 153:516-544) 참조).
Fc 변이체(예를 들면, 항체 또는 융합 단백질)의 발현은 당업계에서 공지된 임의의 프로모터 또는 인핸서 요소에 의해 조절될 수 있다. Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 코딩하는 유전자의 발현을 조절하기 위해 사용될 수 있는 프로모터는 SV40 초기 프로모터 영역(Bernoist and Chambon, 1981, Nature 290:304-310), 라우스 육종 바이러스의 3' 긴 말단 반복부(repeat) 내에 함유된 프로모터(Yamamoto, et al., 1980, Cell 22:787-797), 헤르페스 티미딘 인산화효소 프로모터(Wagner et al., 1981, Proc. Natl. Acad. Sci. U.S.A. 78:1441-1445), 메탈로티오네인 유전자의 조절 서열(Brinster et al., 1982, Nature 296:39-42), 테트라사이클린(Tet) 프로모터(Gossen et al., 1995, Proc. Nat. Acad. Sci. USA 89:5547-5551); 원핵 발현 벡터, 예컨대, β-락타마제 프로모터(Villa-Kamaroff et al., 1978, Proc. Natl. Acad. Sci. U.S.A. 75:3727-3731) 또는 tac 프로모터(DeBoer et al., 1983, Proc. Natl. Acad. Sci. U.S.A. 80:21-25; 문헌("Useful proteins from recombinant bacteria" in Scientific American, 1980, 242:74-94) 또한 참조); 노팔린(nopaline) 합성효소 프로모터 영역(Herrera-Estrella et al., Nature 303:209-213), 꽃양배추 모자이크 바이러스 35S RNA 프로모터(Gardner et al., 1981, Nucl. Acids Res. 9:2871), 또는 광합성 효소 리불로스 비포스페이트 카복실라제의 프로모터(Herrera-Estrella et al., 1984, Nature 310:115-120)를 포함하는 식물 발현 벡터; 효모 또는 다른 진균으로부터의 프로모터 요소, 예컨대, Gal 4 프로모터, ADC(알코올 탈수소효소) 프로모터, PGK(포스포글리세롤 인산화효소) 프로모터, 알칼리성 인산분해효소 프로모터; 및 조직 특이성을 나타내고 형질전환 동물에서 이용되고 있는 하기 동물 전사 조절 영역을 포함하나 이들로 한정되지 않는다: 췌장 선포세포에서 활성을 나타내는 엘라스타제(elastase) I 유전자 조절 영역(Swift et al., 1984, Cell 38:639-646; Ornitz et al., 1986, Cold Spring Harbor Symp. Quant. Biol. 50:399-409; MacDonald, 1987, Hepatology 7:425-515), 췌장 베타 세포에서 활성을 나타내는 인슐린 유전자 조절 영역(Hanahan, 1985, Nature 315:115-122), 림프 세포에서 활성을 나타내는 면역글로불린 유전자 조절 영역(Grosschedl et al., 1984, Cell 38:647-658; Adames et al., 1985, Nature 318:533-538; Alexander et al., 1987, Mol. Cell. Biol. 7:1436-1444), 정소, 유방, 림프 및 비만 세포에서 활성을 나타내는 마우스 유선 종양 바이러스 조절 영역(Leder et al., 1986, Cell 45:485-495), 간에서 활성을 나타내는 알부민 유전자 조절 영역(Pinkert et al., 1987, Genes and Devel. 1:268-276), 간에서 활성을 나타내는 알파-태아단백질 유전자 조절 영역(Krumlauf et al., 1985, Mol. Cell. Biol. 5:1639-1648; Hammer et al., 1987, Science 235:53-58), 간에서 활성을 나타내는 알파 1-항트립신 유전자 조절 영역(Kelsey et al., 1987, Genes and Devel. 1:161-171), 골수 세포에서 활성을 나타내는 베타-글로빈 유전자 조절 영역(Mogram et al., 1985, Nature 315:338-340; Kollias et al., 1986, Cell 46:89-94), 뇌 내의 희소돌기아교세포에서 활성을 나타내는 수초 염기성 단백질 유전자 조절 영역(Readhead et al., 1987, Cell 48:703-712), 골격근에서 활성을 나타내는 미요신 경쇄-2 유전자 조절 영역(Sani, 1985, Nature 314:283-286), 신경 세포에서 활성을 나타내는 신경 특이적 에놀라제(NSE)(Morelli et al., 1999, Gen. Virol. 80:571-83), 신경 세포에서 활성을 나타내는 뇌 유래의 신경영양 인자(BDNF) 유전자 조절 영역(Tabuchi et al., 1998, Biochem. Biophysic. Res. Com. 253:818-823), 성상세포에서 활성을 나타내는 아교세포 섬유 산성 단백질(GFAP) 프로모터(Gomes et al., 1999, Braz J Med Biol Res 32(5): 619-631; Morelli et al., 1999, Gen. Virol. 80:571-83), 및 시상하부에서 활성을 나타내는 성선자극호르몬 방출 호르몬 유전자 조절 영역(Mason et al., 1986, Science 234:1372-1378).
본 발명의 Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 코딩하는 유전자의 삽입체를 함유하는 발현 벡터는 하기 3종의 일반적인 방법에 의해 확인될 수 있다: (a) 핵산 혼성화, (b) "마커" 유전자 기능의 존재 또는 부재, 및 (c) 삽입된 서열의 발현. 제1 방법에서, 발현 벡터에서 펩티드, 폴리펩티드, 단백질 또는 융합 단백질을 코딩하는 유전자의 존재는 상기 펩티드, 폴리펩티드, 단백질 또는 융합 단백질 각각을 코딩하는 삽입된 유전자에 대한 상동성을 나타내는 서열을 포함하는 프로브를 사용하는 핵산 혼성화에 의해 검출될 수 있다. 제2 방법에서, 재조합 벡터/숙주 시스템은 항체 또는 융합 단백질을 코딩하는 뉴클레오티드 서열의 벡터 내로의 삽입에 의해 야기되는 일부 "마커" 유전자 기능(예를 들면, 티미딘 인산화효소 활성, 항생제에 대한 내성, 형질전환 표현형, 바큘로바이러스 내에서의 폐색체(occlusion body) 형성 등)의 존재 또는 부재에 기초하여 확인되고 선택될 수 있다. 예를 들면, Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 코딩하는 뉴클레오티드 서열이 벡터의 마커 유전자 서열 내로 삽입되는 경우, 항체 또는 융합 단백질 삽입체를 코딩하는 유전자를 함유하는 재조합체는 마커 유전자 기능의 부재에 의해 확인될 수 있다. 제3 방법에서, 재조합 발현 벡터는 재조합체에 의해 발현된 유전자 생성물(예를 들면, 항체 또는 융합 단백질)의 분석에 의해 확인될 수 있다. 이러한 분석은 예를 들면, 시험관내 분석 시스템에서의 융합 단백질의 물리적 또는 기능적 성질, 예를 들면, 항-생체활성 분자 항체와의 결합에 기초할 수 있다.
또한, 삽입된 서열의 발현을 조절하거나 원하는 특정 방식으로 유전자 생성물을 변형시키고 프로세싱하는 숙주 세포 균주가 선택될 수 있다. 일부 프로모터들로부터의 발현은 일부 유도제들의 존재 하에서 상승될 수 있으므로, 유전적으로 조작된 융합 단백질의 발현은 조절될 수 있다. 나아가, 상이한 숙주 세포들은 번역 및 번역 후 프로세싱 및 변형(예를 들면, 단백질의 글리코실화, 인산화 등)을 위한 특징적이고 특이적인 기작을 갖는다. 발현된 외래 단백질의 원하는 변형 및 프로세싱을 보장하도록 적절한 세포주 또는 숙주 시스템이 선택될 수 있다. 예를 들면, 세균 시스템에서의 발현은 비글리코실화된 생성물을 생성할 것이고, 효모에서의 발현은 글리코실화된 생성물을 생성할 것이다. 유전자 생성물의 일차 전사체의 적절한 프로세싱(예를 들면, 글리코실화 및 인산화)을 위한 세포 기구를 보유하는 진핵 숙주 세포가 사용될 수 있다. 이러한 포유동물 숙주 세포는 CHO, VERY, BHK, Hela, COS, MDCK, 293, 3T3, WI38, NS0 및 특히 신경 세포주, 예를 들면, SK-N-AS, SK-N-FI, SK-N-DZ 인간 신경모세포종(Sugimoto et al., 1984, J. Natl. Cancer Inst. 73: 51-57), SK-N-SH 인간 신경모세포종(Biochim. Biophys. Acta, 1982, 704: 450-460), Daoy 인간 소뇌 수모세포종(He et al., 1992, Cancer Res. 52: 1144-1148), DBTRG-05MG 아교모세포종 세포(Kruse et al., 1992, In Vitro Cell. Dev. Biol. 28A: 609-614), IMR-32 인간 신경모세포종(Cancer Res., 1970, 30: 2110-2118), 1321N1 인간 성상세포종(Proc. Natl. Acad. Sci. USA, 1977, 74: 4816), MOG-G-CCM 인간 성상세포종(Br. J. Cancer, 1984, 49: 269), U87MG 인간 아교모세포종-성상세포종(Acta Pathol. Microbiol. Scand., 1968, 74: 465-486), A172 인간 아교모세포종(Olopade et al., 1992, Cancer Res. 52: 2523-2529), C6 래트 아교종 세포(Benda et al., 1968, Science 161: 370-371), Neuro-2a 마우스 신경모세포종(Proc. Natl. Acad. Sci. USA, 1970, 65: 129-136), NB41A3 마우스 신경모세포종(Proc. Natl. Acad. Sci. USA, 1962, 48: 1184-1190), SCP 양 맥락얼기(Bolin et al., 1994, J. Virol. Methods 48: 211-221), G355-5, PG-4 고양이 정상 성상세포(Haapala et al., 1985, J. Virol. 53: 827-833), Mpf 흰담비 뇌(Trowbridge et al., 1982, In Vitro 18: 952-960), 및 정상 세포주, 예컨대, CTX TNA2 래트 정상 피질 뇌(Radany et al., 1992, Proc. Natl. Acad. Sci. USA 89: 6467-6471), 예컨대, CRL7030 및 Hs578Bst를 포함하나 이들로 한정되지 않는다. 나아가, 상이한 벡터/숙주 발현 시스템들이 상이한 정도로 프로세싱 반응을 수행할 수 있다.
재조합 단백질의 장기간 고수율 생성을 위해, 안정한 발현이 종종 바람직하다. 예를 들면, 본 발명의 Fc 변이체(예를 들면, 항체 또는 융합 단백질)를 안정하게 발현하는 세포주가 조작될 수 있다. 바이러스 복제 기점을 함유하는 발현 벡터를 사용하기 보다는 숙주 세포를 적절한 발현 조절 요소(예를 들면, 프로모터, 인핸서, 서열, 전사 종결요소, 폴리아데닐화 부위 등)에 의해 조절되는 DNA 및 선택 마커로 형질전환시킬 수 있다. 외래 DNA의 도입 후, 조작된 세포를 영양강화 배지에서 1일 내지 2일 동안 증식시킬 수 있고, 이어서 선택 배지로 교체한다. 재조합 플라스미드 내의 선택 마커는 선택에 대한 내성을 부여하고 세포가 상기 플라스미드를 그의 염색체 내로 안정하게 삽입하고 증식하여 군집(추후 클로닝되고 세포주로 증폭될 수 있음)을 형성할 수 있게 한다. 이 방법은 항원에 특이적으로 결합하는 Fc 변이체를 발현하는 세포주를 조작하는 데에 유리하게 이용될 수 있다. 이러한 조작된 세포주는 항원에 특이적으로 결합하는 Fc 변이체(예를 들면, 폴리펩티드 또는 융합 단백질)의 활성에 영향을 미치는 화합물의 스크리닝 및 평가에 있어서 특히 유용할 수 있다.
각각 tk-세포, hgprt-세포 또는 aprt-세포에서 사용될 수 있는 헤르페스 심플렉스 바이러스 티미딘 인산화효소(Wigler et al., 1977, Cell 11:223), 하이포잔틴-구아닌 포스포리보실트랜스퍼라제(Szybalska & Szybalski, 1962, Proc. Natl. Acad. Sci. USA 48:2026) 및 아데닌 포스포리보실트랜스퍼라제(Lowy et al., 1980, Cell 22:817) 유전자를 포함하나 이들로 한정되지 않는 다수의 선택 시스템들이 이용될 수 있다. 또한, 항대사물질 내성이 메토트렉세이트에 대한 내성을 부여하는 dhfr(Wigler et al., 1980, Natl. Acad. Sci. USA 77:3567; O'Hare et al., 1981, Proc. Natl. Acad. Sci. USA 78:1527); 마이코페놀산에 대한 내성을 부여하는 gpt(Mulligan & Berg, 1981, Proc. Natl. Acad. Sci. USA 78:2072); 아미노글리코사이드 G-418에 대한 내성을 부여하는 neo(Colberre-Garapin et al., 1981, J. Mol. Biol. 150:1); 및 하이그로마이신에 대한 내성을 부여하는 hygro(Santerre et al., 1984, Gene 30:147) 유전자들에 대한 선택의 기초로서 이용될 수 있다.
일단 본 발명의 Fc 변이체(예를 들면, 항체 또는 융합 단백질)가 재조합 발현에 의해 생성되면, 상기 변이체는 당업계에서 공지되어 있는 임의의 단백질 정제 방법, 예를 들면, 크로마토그래피(예를 들면, 이온 교환, 친화성, 특히 단백질 A 후 특이적 항원에 대한 친화성, 및 크기분류(sizing) 컬럼 크로마토그래피), 원심분리, 상이한 가용성, 또는 임의의 다른 표준 단백질 정제 기법에 의해 정제될 수 있다.
Fc 변이체는 분비 신호 없이 직접적으로 생성되었을 때 숙주 세포 용해물로부터 회수될 수도 있지만 일반적으로 배양 배지로부터 분비된 폴리펩티드로서 회수된다. Fc 변이체가 막에 결합된 경우, 상기 Fc 변이체는 적합한 세제 용액(예를 들면, 트리톤-X 100)의 사용을 통해 막으로부터 방출될 수 있다.
Fc 변이체가 인간으로부터 유래된 재조합 세포 이외의 재조합 세포에서 생성된 경우, 상기 Fc 변이체는 인간으로부터 유래된 단백질 또는 폴리펩티드를 완전히 갖지 않는다. 그러나, Fc 변이체에 대해 실질적으로 균질한 제제를 수득하기 위해 재조합 세포 단백질 또는 폴리펩티드로부터 Fc 변이체를 정제하는 것이 필요하다. 제1 단계로서, 배양 배지 또는 용해물을 통상적으로 원심분리하여 미립자 세포 데브리스를 제거한다.
항체 불변 도메인을 갖는 Fc 이종이량체는 하이드록실아파타이트 크로마토그래피, 겔 전기영동, 투석 또는 친화성 크로마토그래피에 의해 편리하게 정제될 수 있고, 이때 친화성 크로마토그래피가 바람직한 정제 기법이다. 다른 단백질 정제 기법, 예컨대, 이온 교환 컬럼 상에서의 분획화, 에탄올 침전, 역상 HPLC, 실리카 겔 상의 크로마토그래피, 헤파린 세파로스 상의 크로마토그래피, 음이온 또는 양이온 교환 수지(예컨대, 폴리아스파르트산 컬럼) 상의 크로마토그래피, 크로마토포커싱, SDS-PAGE 및 황산암모늄 침전도 회수될 폴리펩티드에 따라 이용될 수 있다. 친화성 리간드로서의 단백질 A의 적합성은 사용되는 면역글로불린 Fc 도메인의 종 및 동종형에 의해 좌우된다. 단백질 A는 인간 γ1, γ2 또는 γ4 중쇄에 기초한 면역글로불린 Fc 영역을 정제하는 데에 사용될 수 있다(Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). 단백질 G는 모든 마우스 동종형들 및 인간 γ3에 대해 권장된다(Guss et al., EMBO J. 5:1567-1575 (1986)). 친화성 리간드가 부착되는 매트릭스는 가장 흔하게는 아가로스이지만, 다른 매트릭스가 이용될 수 있다. 기계적으로 안정한 매트릭스, 예컨대, 조절된 공극 유리 또는 폴리(스티렌디비닐)벤젠이 아가로스에 의해 달성될 수 있는 보다 빠른 유속 및 보다 짧은 프로세싱 시간을 가능하게 한다. 면역어드헤신(immunoadhesin)과 단백질 A 또는 G 친화성 컬럼의 결합을 위한 조건은 전체적으로 Fc 도메인의 특징, 즉 그의 종 및 동종형에 의해 좌우된다. 일반적으로, 적절한 리간드가 선택된 경우, 효율적인 결합은 조건이 조절되지 않은 배양액으로부터 직접적으로 일어난다. 결합된 변이체 Fc 이종이량체는 산성 pH(3.0 이상)에서 효율적으로 용출될 수 있거나 약한 카오트로픽(chaotropic) 염을 함유하는 중성 pH 완충제에서 효율적으로 용출될 수 있다. 이 친화성 크로마토그래피 단계는 95% 초과의 순도를 갖는 변이체 Fc 이종이량체 제제를 발생시킬 수 있다.
Fc 변이체(예를 들면, 항체 또는 융합 단백질)의 발현 수준은 벡터 증폭에 의해 증가될 수 있다(예를 들면, 문헌(Bebbington and Hentschel, The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol. 3. (Academic Press, New York, 1987)) 참조). 예를 들면, 항체 또는 융합 단백질을 발현하는 벡터 시스템 내의 마커가 증폭될 수 있는 경우, 숙주 세포의 배양물에 존재하는 억제제의 수준의 증가는 마커 유전자의 카피 수를 증가시킬 것이다. 증폭된 영역이 항체 유전자와 관련되어 있기 때문에, 항체 또는 융합 단백질의 생성도 증가할 것이다(Crouse et al., 1983, Mol. Cell. Biol. 3:257).
숙주 세포는 본 발명의 2개 발현 벡터들, 예를 들면, 중쇄 유래의 폴리펩티드를 코딩하는 제1 벡터 및 경쇄 유래의 폴리펩티드를 코딩하는 제2 벡터로 동시형질감염될 수 있다. 상기 2개의 벡터들은 중쇄 폴리펩티드 및 경쇄 폴리펩티드의 동등한 발현을 가능하게는 동일한 선택 마커를 함유할 수 있다. 대안적으로, 융합 단백질, 또는 중쇄 폴리펩티드 및 경쇄 폴리펩티드 둘다를 코딩하고 발현할 수 있는 단일 벡터가 사용될 수 있다. 융합 단백질, 또는 중쇄 및 경쇄에 대한 코딩 서열은 cDNA 또는 게놈 DNA를 포함할 수 있다.
특징규명 및 기능 분석
본 발명의 Fc 변이체(예를 들면, 항체 또는 융합 단백질)는 다양한 방식으로 특징규명될 수 있다. 한 실시양태에서, SDS-PAGE 겔, 웨스턴 블롯, 밀도측정법 또는 질량 분광측정법을 포함하나 이들로 한정되지 않는 당업계의 잘 공지된 기법을 이용하여 변이체 Fc 이종이량체의 순도를 평가한다. 크기 배제 크로마토그래피, UV 가시광 및 CD 분광법, 질량 분광법, 시차 광 산란, 벤치 탑 안정성 분석, 다른 특징규명 기법과 커플링된 동결 해동, 시차 주사 열량측정법, 시차 주사 형광측정법, 소수성 상호작용 크로마토그래피, 등전 포커싱, 수용체 결합 분석 또는 상대적 단백질 발현 수준을 포함하나 이들로 한정되지 않는 다수의 기법을 이용하여 단백질 안정성을 특징규명할 수 있다. 예시적 실시양태에서, 당업계에서 잘 공지된 기법, 예컨대, 시차 주사 열량측정법 또는 시차 주사 형광측정법을 이용하여 야생형 CH3 도메인과 비교된 변이체 CH3 도메인의 용융 온도로 변이체 Fc 이종이량체의 안정성을 평가한다.
본 발명의 Fc 변이체는 리간드(예를 들면, FcγRIIIA, FcγRIIB, C1q)에 특이적으로 결합하는 능력에 대해 평가될 수도 있다. 이러한 분석은 용액 내에서(예를 들면, 문헌(Houghten, Bio/Techniques, 13:412-421, 1992)), 비드 상에서(Lam, Nature, 354:82-84, 1991), 칩 상에서(Fodor, Nature, 364:555-556, 1993), 세균 상에서(미국 특허 제5,223,409호), 플라스미드 상에서(Cull et al., Proc. Natl. Acad. Sci. USA, 89:1865-1869, 1992) 또는 파지 상에서(Scott and Smith, Science, 249:386-390, 1990; Devlin, Science, 249:404-406, 1990; Cwirla et al., Proc. Natl. Acad. Sci. USA, 87:6378-6382, 1990; and Felici, J. Mol. Biol., 222:301-310, 1991) 수행될 수 있다. 그 다음, 리간드(예를 들면, FcγRIIIA, FcγRIIB, C1q 또는 항원)에 특이적으로 결합하는 것으로 확인된 분자들은 리간드에 대한 그들의 친화성에 대해 분석될 수 있다.
본 발명의 Fc 변이체는 당업계에서 공지된 임의의 방법에 의해 분자, 예컨대, 항원(예를 들면, 암 항원 및 다른 항원과의 교차반응성) 또는 리간드(예를 들면, FcγR)와의 특이적 결합에 대해 분석될 수 있다. 특이적 결합 및 교차반응성을 분석하는 데에 이용될 수 있는 면역분석은 기법, 예컨대, 웨스턴 블롯, 방사면역분석, ELISA(효소 연결된 면역흡착 분석), "샌드위치" 면역분석, 면역침전 분석, 침강소 반응, 겔 확산, 침강소 반응, 면역확산 분석, 응집 분석, 보체 고정화 분석, 면역방사측정 분석, 형광 면역분석 또는 단백질 A 면역분석을 이용하는 경쟁 분석 및 비경쟁 분석 시스템을 포함하나 이들로 한정되지 않는다. 이러한 분석들은 당업계에서 상용되고 잘 공지되어 있다(예를 들면, 문헌(Ausubel et al., eds, 1994, Current Protocols in Molecular Biology, Vol. 1, John Wiley & Sons, Inc., New York) 참조).
본 발명의 Fc 변이체와 분자, 예컨대, 항원 또는 리간드(예를 들면, FcγR)의 결합 친화성 및 상호작용의 해리 속도는 경쟁 결합 분석에 의해 측정될 수 있다. 경쟁 결합 분석의 일례는 표지된 리간드, 예컨대, FcγR(예를 들면, 3H 또는 125I)을 증가하는 양의 비표지된 리간드, 예컨대, FcγR의 존재 하에서 관심 있는 분자(예를 들면, 본 발명의 Fc 변이체)와 함께 항온처리하는 단계 및 상기 표지된 리간드에 결합된 상기 분자를 검출하는 단계를 포함하는 방사면역분석이다. 리간드에 대한 본 발명의 분자의 친화성 및 결합 해리 속도는 스캐차드(scatchard) 분석에 의해 포화 데이터로부터 측정될 수 있다.
또한, 당업계에서 공지된 임의의 표면 플라스몬 공명(SPR) 기초 분석(예를 들면, 비아코어(BIAcore) 반응속도 분석)을 이용하여 Fc 변이체의 반응속도 파라미터를 측정할 수 있다. SPR 기초 기술의 검토를 위해서는 문헌(Mullet et al., 2000, Methods 22: 77-91), 문헌(Dong et al., 2002, Review in Mol. Biotech., 82: 303-23), 문헌(Fivash et al., 1998, Current Opinion in Biotechnology 9: 97-101) 및 문헌(Rich et al., 2000, Current Opinion in Biotechnology 11: 54-61)을 참조한다. 추가로, 미국 특허 제6,373,577호, 제6,289,286호, 제5,322,798호, 제5,341,215호 및 제6,268,125호에 기재된, 단백질-단백질 상호작용을 측정하는 임의의 SPR 기구 및 SPR 기초 방법이 본 발명의 방법에서 고려된다.
당업자에게 공지된 임의의 기법을 이용하는 형광 활성화된 세포 분류(FACS)가 Fc 변이체와 세포 표면 상에서 발현된 분자(예를 들면, FcγRIIIA, FcγRIIB)의 결합을 특징규명하는 데에 이용될 수 있다. 유세포 분류기는 라이브러리 삽입체를 함유하는 다수의 개별 세포들을 신속하게 조사할 수 있다(예를 들면, 시간 당 1000만 개 내지 1억 개의 세포)(Shapiro et al., Practical Flow, Cytometry, 1995). 생물학적 세포를 분류하고 조사하는 유세포 분석기는 당업계에서 잘 공지되어 있다. 공지된 유세포 분석기는 예를 들면, 미국 특허 제4,347,935호, 제5,464,581호, 제5,483,469호, 제5,602,039호, 제5,643,796호 및 제6,211,477호에 기재되어 있다. 다른 공지된 유세포 분석기는 벡톤 디킨슨 앤드 컴파니(Becton Dickinson and Company)에 의해 제작된 FACS 밴티지(Vantage)™ 시스템 및 유니온 바이오메트리카(Union Biometrica)에 의해 제작된 COPAS™ 시스템이다.
본 발명의 Fc 변이체는 FcγR 매개 이펙터 세포 기능을 매개하는 그의 능력을 특징으로 할 수 있다. 분석될 수 있는 이펙터 세포 기능의 예로는 항체 의존성 세포 매개 세포독성(ADCC), 식균작용, 옵소닌화, 옵소닌식균작용, C1q 결합 및 보체 의존성 세포 매개 세포독성(CDC)이 있으나 이들로 한정되지 않는다. 당업자에게 공지된, 이펙터 세포 기능 활성을 측정하는 임의의 세포 기초 또는 세포 부재 분석이 이용될 수 있다(이펙터 세포 분석에 대해서는 문헌(Perussia et al., 2000, Methods Mol. Biol. 121: 179-92), 문헌(Baggiolini et al., 1998 Experientia, 44(10): 841-8), 문헌(Lehmann et al., 2000 J. Immunol. Methods, 243(1-2): 229-42), 문헌(Brown E J. 1994, Methods Cell Biol., 45: 147-64), 문헌(Munn et al., 1990 J. Exp. Med., 172: 231-237), 문헌(Abdul-Majid et al., 2002 Scand. J. Immunol. 55: 70-81) 및 문헌(Ding et al., 1998, Immunity 8:403-411) 참조).
특히, 당업자에게 공지된 임의의 표준 방법을 이용하여 본 발명의 Fc 변이체를 이펙터 세포(예를 들면, 천연 살해 세포)에서의 FcγR 매개 ADCC 활성에 대해 분석할 수 있다(예를 들면, 문헌(Perussia et al., 2000, Methods Mol. Biol. 121: 179-92) 참조). 본 발명의 분자의 ADCC 활성을 측정하는 예시적 분석은 표적 세포를 [51Cr]Na2CrO4(이 세포막 투과성 분자는 세포질 단백질에 결합하고 느린 반응속도로 세포로부터 자발적으로 방출되지만 표적 세포 괴사 후 대량으로 방출되기 때문에 표지를 위해 통상적으로 사용됨)로 표지하는 단계; 상기 표적 세포를 본 발명의 Fc 변이체로 옵소닌화하는 단계; 옵소닌화된 방사성표지된 표적 세포를 마이크로타이터 플레이트에서 표적 세포 대 이펙터 세포의 적절한 비로 이펙터 세포와 조합하는 단계; 세포의 혼합물을 37℃에서 16시간 내지 18시간 동안 항온처리하는 단계; 및 상청액을 수집하는 단계; 및 방사성을 분석하는 단계를 포함하는 51Cr 방출 분석에 기초한다. 그 다음, 예를 들면, 하기 식을 이용하여 본 발명의 분자의 세포독성을 측정할 수 있다: % 용해 = (실험 cpm - 표적 누출 cpm)/(세제 용해 cpm - 표적 누출 cpm) X 100%, 또는 대안적으로, % 용해 = (ADCC-AICC)/(최대 방출 - 자발적 방출). 하기 식을 이용하여 특이적 용해를 계산할 수 있다: 특이적 용해 = 본 발명의 분자의 존재 하에서의 % 용해 - 본 발명의 분자의 부재 하에서의 % 용해. 표적:이펙터 세포 비 또는 항체 농도를 변경함으로써 그래프를 발생시킬 수 있다.
C1q에 결합하여 보체 의존성 세포독성(CDC)을 매개하는 Fc 변이체의 능력을 특징규명하는 방법은 당업계에서 잘 공지되어 있다. 예를 들면, C1q 결합을 측정하기 위해, C1q 결합 ELISA를 수행할 수 있다. 예시적 분석은 하기 단계를 포함할 수 있다: 분석 플레이트를 4℃에서 코팅 완충제 중의 폴리펩티드 변이체 또는 출발 폴리펩티드(대조군)로 밤새 코팅할 수 있다. 그 다음, 상기 플레이트를 세척하고 차단할 수 있다. 세척 후, 인간 C1q의 분취액을 각각의 웰에 첨가하고 실온에서 2시간 동안 항온처리할 수 있다. 추가 세척 후, 100 ㎕의 양 항-보체 C1q 퍼록시다제 접합 항체를 각각의 웰에 첨가하고 실온에서 1시간 동안 항온처리할 수 있다. 상기 플레이트를 세척 완충제로 다시 세척할 수 있고, OPD(O-페닐렌디아민 디하이드로클로라이드(시그마))를 함유하는 100 ㎕의 기질 완충제를 각각의 웰에 첨가할 수 있다. 황색 색채의 등장에 의해 관찰된 산화 반응을 30분 동안 진행시킬 수 있고 100 ㎕의 4.5 NH2SO4를 첨가하여 중단시킬 수 있다. 그 다음, 흡광도를 (492-405) nm에서 판독할 수 있다.
보체 활성화를 평가하기 위해, (예를 들면, 문헌(Gazzano-Santoro et al., 1996, J. Immunol. Methods 202:163)에 기재된 바와 같이) 보체 의존성 세포독성(CDC) 분석을 수행할 수 있다. 요약하건대, 다양한 농도의 Fc 변이체 및 인간 보체를 완충제로 희석할 수 있다. Fc 변이체에 결합하는 항원을 발현하는 세포를 약 1×106개 세포/㎖의 밀도까지 희석할 수 있다. Fc 변이체, 희석된 인간 보체 및 항원을 발현하는 세포의 혼합물을 평저 조직 배양 96웰 플레이트에 첨가하고 37℃ 및 5% CO2에서 2시간 동안 항온처리하여 보체 매개 세포 용해를 용이하게 할 수 있다. 그 다음, 50 ㎕의 알라마 블루(alamar blue)(아큐메드 인터내셔날(Accumed International))를 각각의 웰에 첨가하고 37℃에서 밤새 항온처리할 수 있다. 530 nm에서 여기하고 590 nm에서 방사하는 96웰 형광측정기를 이용하여 흡광도를 측정한다. 결과를 상대적 형광 유닛(RFU)으로 표현할 수 있다. 표준 곡선으로부터 샘플 농도를 계산할 수 있고, 비교가능한 분자(즉, 비변형된 또는 야생형 CH3 도메인을 갖는 Fc 영역을 포함하는 분자)에 비해 상대적인 % 활성을 관심 있는 Fc 변이체에 대해 기록한다.
기니아 피그, 토끼 또는 인간 혈청을 사용하여 보체 분석을 수행할 수 있다. 문헌(Korzeniewski et al., 1983, Immunol. Methods 64(3): 313-20) 및 문헌(Decker et al., 1988, J. Immunol Methods 115(1): 61-9)에 기재된 바와 같이 세포내 효소, 예컨대, 락테이트 탈수소효소(LDH)의 방출을 모니터링하거나 표적 세포를 표지하는 세포내 표지, 예컨대, 유로퓸, 크로뮴 51 또는 인듐 111의 방출을 모니터링함으로써 표적 세포의 보체 용해를 검출할 수 있다.
방법
본 발명은 질환, 장애 또는 감염과 관련된 하나 이상의 증상을 예방하거나, 치료하거나 호전시키기 위해 본 발명의 하나 이상의 Fc 변이체를 동물, 특히 포유동물, 특히 인간에게 투여하는 것을 포괄한다. 본 발명의 Fc 변이체는 이펙터 세포 기능(예를 들면, ADCC, CDC)의 변경된 효능이 요구되는 질환 또는 장애의 치료 또는 예방에 특히 유용하다. 상기 Fc 변이체 및 이의 조성물은 일차 또는 전이성 신생물 질환(즉, 암) 및 감염성 질환의 치료 또는 예방에 특히 유용하다. 본 발명의 분자는 당업계에서 공지된 바와 같이 또는 본원에 기재되어 있는 바와 같이 약학적으로 허용가능한 조성물로 제공될 수 있다. 하기 상세히 기재되어 있는 바와 같이, 본 발명의 분자는 암(특히, 수동 면역요법), 자가면역 질환, 염증성 장애 또는 감염성 질환을 치료하거나 예방하는 방법에서 사용될 수 있다.
본 발명의 Fc 변이체는 암, 자가면역 질환, 염증성 장애 또는 감염성 질환의 치료 또는 예방용으로 당업계에서 공지된 다른 치료제와 함께 유리하게 사용될 수도 있다. 특정 실시양태에서, 본 발명의 Fc 변이체는 예를 들면, 분자와 상호작용하는 이펙터 세포의 수 또는 활성을 증가시키고 면역 반응을 증가시키는 데에 기여하는 단일클론 또는 키메라 항체, 림포카인 또는 조혈 성장 인자(예컨대, IL-2, IL-3 및 IL-7)와 함께 사용될 수 있다. 본 발명의 Fc 변이체는 질환, 장애 또는 감염의 치료를 위해 사용되는 하나 이상의 약물, 예를 들면, 항암제, 소염제 또는 항바이러스제와 함께 유리하게 사용될 수도 있다.
따라서, 본 발명은 본 발명의 하나 이상의 Fc 변이체를 투여함으로써 암 및 관련 병태와 관련된 하나 이상의 증상을 예방하거나, 치료하거나 호전시키는 방법을 제공한다. 임의의 작용 기작에 구속되고자 하는 것은 아니지만, 비교가능한 분자보다 더 높은 친화성으로 FcγRIIIA 및/또는 FcγRIIA와 결합하고 비교가능한 분자보다 더 낮은 친화성으로 FcγRIIB에도 결합하는 본 발명의 Fc 변이체, 및/또는 향상된 이펙터 기능, 예를 들면, ADCC, CDC, 식균작용, 옵소닌화 등을 갖는 상기 Fc 변이체는 암세포의 선택적 표적화 및 효율적 파괴를 발생시킬 것이다.
추가로, 본 발명은 현행 표준 및 실험 화학요법, 호르몬 요법, 생물학적 요법, 면역요법, 방사선 요법 또는 수술을 포함하나 이들로 한정되지 않는, 암의 치료 또는 예방용으로 당업자에게 공지된 다른 요법과 함께 본 발명의 하나 이상의 Fc 변이체를 투여하는 것을 추가로 포괄한다. 몇몇 실시양태에서, 본 발명의 분자는 암의 치료 및/또는 예방용으로 당업자에게 공지된 하나 이상의 항암제, 치료 항체 또는 다른 약제의 치료 또는 예방 유효량과 함께 투여될 수 있다. 본 발명의 Fc 변이체와 함께 사용될 수 있는 투약법 및 요법의 예는 당업계에서 잘 공지되어 있고 다른 문헌(예를 들면, PCT 국제 공보 제WO 02/070007호 및 제WO 03/075957호 참조)에 상세히 기재되어 있다.
본 발명의 방법 및 조성물에 치료될 수 있거나 예방될 수 있는 암 및 관련 장애는 하기 장애들을 포함하나 이들로 한정되지 않는다: 백혈병, 림프종, 다발성 골수종, 골 및 결합 조직 육종, 뇌종양, 유방암, 부신암, 갑상선암, 췌장암, 뇌하수체암, 안암, 질암, 음문암, 자궁경부암, 자궁암, 난소암, 식도암, 위암, 결장암, 직장암, 간암, 담낭암, 담관암종, 폐암, 정소암, 전립선암, 음경암, 구강암, 타액선암, 인두암, 피부암, 신장암, 및 방광암(이러한 장애들의 검토를 위해서는 문헌(Fishman et al., 1985, Medicine, 2d Ed., J.B. Lippincott Co., Philadelphia) 및 문헌(Murphy et al., 1997, Informed Decisions: The Complete Book of Cancer Diagnosis, Treatment, and Recovery, Viking Penguin, Penguin Books U.S.A., Inc., United States of America) 참조).
본 발명은 암 및 관련 장애의 치료 및/또는 예방용으로 당업계에서 공지된 임의의 항체가 본 발명의 변이체 CH3 도메인을 포함하는 Fc 영역을 포함하도록 상기 항체를 조작하는 것을 추가로 고려한다.
특정 실시양태에서, 본 발명의 분자(예를 들면, 변이체 Fc 이종이량체를 포함하는 항체)는 일차 종양의 성장 또는 암세포의 전이를 본 발명의 상기 분자의 부재 하에서의 일차 종양의 성장 또는 전이에 비해 상대적으로 99% 이상, 95% 이상, 90% 이상, 85% 이상, 80% 이상, 75% 이상, 70% 이상, 60% 이상, 50% 이상, 45% 이상, 40% 이상, 35% 이상, 30% 이상, 25% 이상, 20% 이상 또는 10% 이상 억제하거나 감소시킨다.
본 발명은 대상체에서 염증성 장애와 관련된 하나 이상의 증상을 예방하거나, 치료하거나 관리하기 위한 본 발명의 하나 이상의 Fc 변이체의 용도를 포괄한다. 임의의 작용 기작에 구속받고자 하는 것은 아니지만, FcγRIIB에 대한 향상된 친화성을 갖는 Fc 변이체는 활성화 수용체의 약화 및 이로써 면역 반응의 약화를 초래할 것이고 자가면역 장애의 치료 및/또는 예방을 위한 치료 효능을 가질 것이다. 나아가, 염증 장애와 관련된 하나 초과의 표적에 결합하는 항체, 예컨대, 변이체 Fc 이종이량체를 포함하는 이중특이적 항체는 1가 요법에 비해 상승작용적 효과를 제공할 수 있다.
본 발명은 치료 또는 예방 유효량의 하나 이상의 소염제와 함께 본 발명의 Fc 변이체를 투여하는 것을 추가로 포괄한다. 또한, 본 발명은 치료 또는 예방 유효량의 하나 이상의 면역조절제와 함께 본 발명의 Fc 변이체를 상기 대상체에게 투여하는 단계를 추가로 포함하는, 자가면역 질환과 관련된 하나 이상의 증상을 예방하거나, 치료하거나 관리하는 방법을 제공한다. 본 발명의 Fc 변이체의 투여에 의해 치료될 수 있는 자가면역 질환의 예로는 하기 질환들이 있으나 이들로 한정되지 않는다: 원형 탈모증, 강직성 척추염, 항인지질 증후군, 자가면역 애디슨병, 부신의 자가면역 질환, 자가면역 용혈성 빈혈, 자가면역 간염, 자가면역 난소염 및 고환염, 자가면역 혈소판감소증, 베체트병, 수포성 유천포창, 심근염, 복강 스프루-피부염, 만성 피로 면역 기능장애 증후군(CFIDS), 만성 염증성 탈수초 다발신경병증, 처그-스트라우스 증후군, 반흔성 유천포창, CREST 증후군, 저온 응집소 질환, 크론병, 원반모양 루푸스, 본태성 혼합 한냉글로불린혈증, 섬유근육통-섬유근육염, 사구체신염, 그레이브스병, 귈랑-바레, 하시모토 갑상선염, 특발성 폐 섬유증, 특발성 혈소판감소성 자반증(ITP), IgA 신경병증, 소아 관절염, 편평태선, 홍반 루푸스, 메니에르병, 혼합 결합 조직 질환, 다발성 경화증, 1형 또는 면역 매개 진성 당뇨병, 중증근육무력증, 심상성 유천포창, 악성 빈혈, 결절다발동맥염, 다발연골염, 다분비선 증후군, 류마티스성 다발근육통, 다발근육염 및 피부근육염, 일차 무감마글로불린혈증, 일차 담관간경화증, 건선, 건선성 관절염, 레이나울드 현상, 레이터 증후군, 류마티스성 관절염, 사르코이드증, 공피증, 쇼그렌 증후군, 강직 증후군, 전신성 홍반 루푸스, 홍반 루푸스, 타카야수 동맥염, 측두 동맥염/거대세포 동맥염, 궤양성 결장염, 포도막염, 혈관염, 예컨대, 헤르페스모양피부염 혈관염, 백반증 및 베게너 육아종증. 염증 장애의 예로는 천식, 뇌염, 염증성 장 질환, 만성 폐색성 폐 질환(COPD), 알레르기성 장애, 패혈증성 쇼크, 폐 섬유증, 미분화된 척추관절병증, 미분화된 관절병증, 관절염, 염증성 골용해, 및 만성 바이러스 또는 세균 감염으로부터 비롯된 만성 염증이 있으나 이들로 한정되지 않는다. 몇몇 자가면역 장애는 염증성 병태와 관련되어 있으므로 자가면역 장애와 염증성 장애 사이에 중첩이 있는 것으로 간주된다. 따라서, 몇몇 자가면역 장애는 염증성 장애로서 간주될 수도 있다. 본 발명의 방법에 따라 예방될 수 있거나, 치료될 수 있거나 관리될 수 있는 염증성 장애의 예로는 천식, 뇌염, 염증성 장 질환, 만성 폐색성 폐 질환(COPD), 알레르기성 장애, 패혈증성 쇼크, 폐 섬유증, 미분화된 척추관절병증, 미분화된 관절병증, 관절염, 염증성 골용해, 및 만성 바이러스 또는 세균 감염으로부터 비롯된 만성 염증이 있으나 이들로 한정되지 않는다.
본 발명의 Fc 변이체는 염증성 장애를 갖는 동물, 특히 포유동물에 의해 경험된 염증을 감소시키는 데에 사용될 수도 있다. 특정 실시양태에서, 본 발명의 Fc는 동물의 염증을 상기 분자가 투여되지 않은 동물의 염증에 비해 상대적으로 99% 이상, 95% 이상, 90% 이상, 85% 이상, 80% 이상, 75% 이상, 70% 이상, 60% 이상, 50% 이상, 45% 이상, 40% 이상, 35% 이상, 30% 이상, 25% 이상, 20% 이상 또는 10% 이상 감소시킨다.
본 발명은 자가면역 질환 또는 염증성 질환의 치료 및/또는 예방용으로 당업계에서 공지된 임의의 항체가 본 발명의 변이체 Fc 이종이량체를 포함하도록 상기 항체를 조작하는 것을 추가로 고려한다.
본 발명은 치료 또는 예방 유효량의 본 발명의 하나 이상의 Fc 변이체를 투여하는 단계를 포함하는, 대상체에서 감염성 질환을 치료하거나 예방하는 방법도 포괄한다. 본 발명의 Fc 변이체에 의해 치료될 수 있거나 예방될 수 있는 감염성 질환은 바이러스, 세균, 진균, 원생동물 및 기생충을 포함하나 이들로 한정되지 않는 감염성 물질에 의해 야기된다.
본 발명의 방법과 함께 본 발명의 Fc 변이체를 사용하여 치료할 수 있거나 예방할 수 있는 바이러스 질환은 하기 바이러스들에 의해 야기되는 바이러스 질환들을 포함하나 이들로 한정되지 않는다: A형 간염 바이러스, B형 간염 바이러스, C형 간염 바이러스, 인플루엔자 바이러스, 수두 바이러스, 아데노바이러스, 헤르페스 심플렉스 I형 바이러스((HSV-I), 헤르페스 심플렉스 II형 바이러스((HSV-II), 우역 바이러스, 리노바이러스, 에코바이러스, 로타바이러스, 호흡기 세포융합 바이러스, 유두종 바이러스, 파포바 바이러스, 사이토메갈로바이러스, 에키노바이러스, 아르보바이러스, 헌타바이러스, 콕사키 바이러스, 볼거리 바이러스, 홍역 바이러스, 풍진 바이러스, 폴리오 바이러스, 천연두 바이러스, 엡스테인 바 바이러스, 인간 면역결핍 바이러스 I형(HIV-I), 인간 면역결핍 바이러스 II형(HIV-II), 및 바이러스 질환, 예컨대, 바이러스 수막염, 뇌염, 뎅기 또는 천연두의 병인 물질.
본 발명의 방법과 함께 본 발명의 Fc 변이체를 사용하여 치료할 수 있거나 예방할 수 있는, 세균에 의해 야기되는 세균 질환은 하기 세균 질환들을 포함하나 이들로 한정되지 않는다: 마이코박테리아 리케치아(mycobacteria rickettsia), 마이코플라스마, 네이세리아(neisseria), 슈도모나스 뉴모니아(S. pneumonia), 보렐리아 부르그도르페리(Borrelia burgdorferi)(라임병), 바실러스 안트라시스(Bacillus antracis)(탄저병), 파상풍, 스트렙토코커스(streptococcus), 스타필로코커스(staphylococcus), 마이코박테리움, 파상풍, 백일해, 콜레라, 흑사병, 디프테리아, 클라미디아, 스타필로코커스 아우레우스(S. aureus) 및 레기오넬라(legionella). 본 발명의 방법과 함께 본 발명의 분자를 사용하여 치료할 수 있거나 예방할 수 있는, 원생동물에 의해 야기되는 원생동물 질환은 하기 원생동물 질환들을 포함하나 이들로 한정되지 않는다: 레이쉬매니아(leishmania), 코크지디오아(kokzidioa), 트립파노소마(trypanosoma) 또는 말라리아. 본 발명의 방법과 함께 본 발명의 분자를 사용하여 치료할 수 있거나 예방할 수 있는, 기생충에 의해 야기되는 기생충 질환은 하기 기생충 질환들을 포함하나 이들로 한정되지 않는다: 클라미디아(chlamydia) 및 리케치아(rickettsia).
몇몇 실시양태에서, 본 발명의 Fc 변이체는 감염성 질환의 치료 및/또는 예방용으로 당업자에게 공지된 하나 이상의 추가 치료제의 치료 또는 예방 유효량과 함께 투여될 수 있다. 본 발명은 감염성 질환의 치료 및/또는 예방용으로 당업자에게 공지된 다른 분자(항생제, 항진균제 및 항바이러스제를 포함하나 이들로 한정되지 않음)와 함께 본 발명의 분자를 사용하는 것을 고려한다.
본 발명은 본 발명의 Fc 변이체(예를 들면, 항체, 폴리펩티드)를 포함하는 방법 및 약학 조성물을 제공한다. 또한, 본 발명은 유효량의 하나 이상의 본 발명의 Fc 변이체, 또는 하나 이상의 본 발명의 Fc 변이체를 포함하는 약학 조성물을 대상체에게 투여함으로써 질환, 장애 또는 감염과 관련된 하나 이상의 증상을 치료하고 예방하고 호전시키는 방법을 제공한다. 한 양태에서, 상기 Fc 변이체는 실질적으로 정제된다(즉, 그의 효과를 제한하거나 원치 않는 부작용을 생성하는 물질(동종이량체 및 다른 세포 물질을 포함함)을 실질적으로 갖지 않는다). 특정 실시양태에서, 대상체는 동물, 예컨대, 비영장류(예를 들면, 소, 돼지, 말, 고양이, 개, 래트 등) 및 영장류(예를 들면, 원숭이, 예컨대, 사이노몰거스 원숭이 및 인간)을 포함하는 포유동물이다. 특정 실시양태에서, 대상체는 인간이다. 또 다른 특정 실시양태에서, 본 발명의 항체는 대상체와 동일한 종으로부터 유래된다.
조성물의 투여 경로는 치료될 병태에 의해 좌우된다. 예를 들면, 전신 장애, 예컨대, 림프암 또는 전이된 종양의 치료를 위해서는 정맥내 주사가 바람직할 수 있다. 투여될 조성물의 투여량은 표준 투여량-반응 연구와 함께 과도한 실험 없이 당업자에 의해 측정될 수 있다. 이러한 측정을 수행하는 데 있어서 고려될 관련 환경은 치료될 병태 또는 병태들, 투여될 조성물의 선택, 개별 환자의 연령, 체중 및 반응, 및 환자의 증상의 중증도를 포함한다. 상기 조성물은 병태에 따라 환자에게 경구, 비경구, 비내, 질, 직장, 설측, 설하, 협측, 협내 및/또는 경피 투여될 수 있다.
따라서, 경구, 설측, 설하, 협측 및 협내 투여를 위해 디자인된 조성물은 당업계에서 잘 공지된 수단, 예를 들면, 불활성 희석제 또는 식용성 담체에 의해 과도한 실험 없이 만들어질 수 있다. 상기 조성물은 젤라틴 캡슐 내에 봉입될 수 있거나 정제로 압축될 수 있다. 경구 치료 투여를 위해, 본 발명의 약학 조성물은 부형제와 함께 도입될 수 있고 정제, 트로치, 캡슐제, 엘릭시르, 현탁액, 시럽, 와이퍼, 저작 검 등의 형태로 사용될 수 있다.
정제, 환제, 캡슐제, 트로치 등은 결합제, 수용제, 붕해제, 윤활제, 감미제 및/또는 방향제도 함유할 수 있다. 결합제의 몇몇 예로는 미세결정질 셀룰로스, 검 트라가칸쓰 및 젤라틴이 있다. 부형제의 예로는 전분 및 락토스가 있다. 붕해제의 몇몇 예로는 알긴산, 옥수수전분 등이 있다. 윤활제의 예로는 스테아르산마그네슘 및 스테아르산칼륨이 있다. 활택제의 일례는 콜로이드성 이산화규소이다. 감미제의 몇몇 예로는 수크로스, 사카린 등이 있다. 방향제의 예로는 페퍼민트, 메틸 살리실레이트, 오랜지 방향제 등이 있다. 이들 다양한 조성물들의 제조에 사용되는 물질은 약학적으로 순수해야 하고 사용되는 양에서 독성을 나타내지 않아야 한다.
본 발명의 약학 조성물은 비경구, 예를 들면, 정맥내, 근육내, 경막내 및/또는 피하 주사에 의해 투여될 수 있다. 비경구 투여는 본 발명의 조성물을 용액 또는 현탁액 내로 도입함으로써 달성될 수 있다. 이러한 용액 또는 현탁액은 멸균 희석제, 예컨대, 주사용수, 식염수 용액, 고정유, 폴리에틸렌 글리콜, 글리세린, 프로필렌 글리콜 및/또는 다른 합성 용매도 포함할 수 있다. 비경구 제제는 항균제, 예컨대, 벤질 알코올 및/또는 메틸 파라벤, 항산화제, 예컨대, 아스코르브산 및/또는 중아황산나트륨, 및 킬레이팅제, 예컨대, EDTA도 포함할 수 있다. 완충제, 예컨대, 아세트산염, 시트르산염 및 인산염, 및 긴장성 조절제, 예컨대, 염화나트륨 및 덱스트로스도 첨가될 수 있다. 비경구 제제는 앰플, 일회용 주사기, 및/또는 유리 또는 플라스틱으로 만들어진 다회 투여량 바이알 내에 봉입될 수 있다. 직장 투여는 조성물을 직장 및/또는 대장 내로 투여하는 것을 포함한다. 이것은 좌약제 및/또는 관장제의 사용을 통해 달성될 수 있다. 좌약 제제는 당업계에서 공지된 방법에 의해 제조될 수 있다. 경피 제제는 피부를 통한 조성물의 경피 흡수를 포함한다. 경피 제제는 패치, 연고, 크림, 겔, 고약 등을 포함한다. 본 발명의 조성물은 환자에게 비내 투여될 수 있다. 본원에서 사용된 바와 같이, 비내 투여 또는 비 투여는 조성물을 환자의 비도 및/또는 비강의 점막으로 투여하는 것을 포함한다.
본 발명의 약학 조성물은 질환, 장애 또는 감염과 관련된 하나 이상의 증상을 예방하거나 치료하거나 호전시키기 위해 본 발명의 방법에 따라 사용될 수 있다. 본 발명의 약학 조성물은 멸균되어 있고 대상체에게 투여하기에 적합한 형태로 존재한다는 것이 고려된다.
한 실시양태에서, 본 발명의 조성물은 내독소 및/또는 관련 발열원성 물질을 실질적으로 갖지 않는 발열원 무함유 제제이다. 내독소는 미생물의 내부에 국한되어 있고 미생물이 분해되거나 사멸할 때 방출되는 독소를 포함한다. 발열원성 물질은 세균 및 다른 미생물의 외막으로부터의 발열 유도 열안정성 물질(당단백질)도 포함한다. 이들 물질들 둘다가 인간에게 투여된 경우 발열, 저혈압 및 쇼크를 야기할 수 있다. 잠재적 유해 효과로 인해 소량의 내독소조차도 정맥내로 투여되는 약학 약물 용액으로부터 제거하는 것이 유리하다. 식품의약청("FDA")은 정맥내 약물 적용을 위해 1시간의 단일 기간 이내에 체중 kg 당 투여량 당 5 내독소 유닛(EU)의 상한을 설정하였다(The United States Pharmacopeial Convention, Pharmacopeial Forum 26 (1):223 (2000)). 치료 단백질이 체중 kg 당 수백 또는 수천 mg의 양으로 투여되는 경우(단일클론 항체를 사용하는 경우일 수 있음), 미량의 내독소조차도 제거하는 것이 유리하다. 특정 실시양태에서, 조성물 중의 내독소 및 발열원 수준은 10 EU/mg 미만, 5 EU/mg 미만, 1 EU/mg 미만, 0.1 EU/mg 미만, 0.01 EU/mg 미만 또는 0.001 EU/mg 미만이다.
본 발명은 하기 단계들을 포함하는, 질환, 장애 또는 감염과 관련된 하나 이상의 증상을 예방하거나, 치료하거나 호전시키는 방법을 제공한다: (a) 하나 이상의 Fc 변이체를 포함하는 조성물을 상기 예방, 치료 또는 호전이 필요한 대상체에게 1회 투여량의 예방 또는 치료 유효량으로 투여하는 단계; 및 (b) 1회 이상의 후속 투여량의 상기 Fc 변이체를 투여하여 항원에 연속적으로 결합하는 Fc 변이체의 혈장 농도를 원하는 수준(예를 들면, 약 0.1 ㎍/㎖ 내지 약 100 ㎍/㎖)에서 유지하는 단계. 특정 실시양태에서, Fc 변이체의 혈장 농도는 10 ㎍/㎖, 15 ㎍/㎖, 20 ㎍/㎖, 25 ㎍/㎖, 30 ㎍/㎖, 35 ㎍/㎖, 40 ㎍/㎖, 45 ㎍/㎖ 또는 50 ㎍/㎖에서 유지된다. 특정 실시양태에서, 투여될 Fc 변이체의 상기 유효량은 투여량 당 1 mg/kg 이상 내지 8 mg/kg이다. 또 다른 특정 실시양태에서, 투여될 Fc 변이체의 상기 유효량은 투여량 당 4 mg/kg 이상 내지 5 mg/kg이다. 또 다른 특정 실시양태에서, 투여될 Fc 변이체의 상기 유효량은 투여량 당 50 mg 내지 250 mg이다. 또 다른 특정 실시양태에서, 투여될 Fc 변이체의 상기 유효량은 투여량 당 100 mg 내지 200 mg이다.
본 발명은 질환, 장애 또는 감염과 관련된 하나 이상의 증상을 예방하거나, 치료하거나 호전시키는 프로토콜도 포괄하고, 이때 Fc 변이체가 Fc 변이체 및/또는 변이체 융합 단백질 이외의 요법(예를 들면, 예방제 또는 치료제)과 함께 사용된다. 본 발명은 본 발명의 Fc 변이체가 현재 표준 및 실험 화학요법을 포함하는 다른 암 요법을 증강시키고 이들 다른 암 요법과 상승작용하고/하거나, 이들 다른 암 요법의 효능을 향상시키고/시키거나, 이들 다른 암 요법의 내성을 개선하고/하거나, 이들 다른 암 요법에 의해 야기된 부작용을 감소시킨다는 인식에 부분적으로 기초한다. 본 발명의 조합 요법은 부가적 효능, 부가적 치료 효과 또는 상승작용적 효과를 갖는다. 본 발명의 병용 요법은 질환, 장애 또는 감염과 관련된 하나 이상의 증상을 예방하거나, 치료하거나 호전시키기 위해 Fc 변이체와 함께 사용되는 요법(예를 들면, 예방제 또는 치료제)의 투여량을 낮출 수 있고/있거나, 질환, 장애 또는 감염을 갖는 대상체의 삶의 질을 개선하고/하거나 예방 또는 치료 효과를 달성하기 위해 이러한 예방제 또는 치료제를 상기 대상체에게 투여하는 빈도를 낮출 수 있다. 또한, 본 발명의 병용 요법은 현재 단일 약제 요법 및/또는 기존 병용 요법의 투여와 관련된 원치 않는 또는 불리한 부작용을 감소시키거나 회피함으로써 치료 프로토콜에의 환자 순응성을 개선한다. 본 발명의 Fc 변이체와 함께 사용될 수 있는 다수의 분자들이 당업계에서 잘 공지되어 있다. 예를 들면, PCT 국제 공보 제WO 02/070007호, PCT 국제 공보 제WO 03/075957호 및 미국 특허 공보 제2005/064514호를 참조한다.
본 발명은 FcγR 및/또는 C1q에 대한 변경된 결합 친화성, 및 변경된 ADCC 및/또는 CDC 활성을 갖고 항원에 특이적으로 결합하고 검출가능한 물질, 치료제 또는 치료 약물에 접합되어 있거나 융합되어 있는 하나 이상의 Fc 변이체를 하나 이상의 용기 내에 포함하는, 질환, 장애 또는 감염과 관련된 하나 이상의 증상의 모니터링, 진단, 예방, 치료 또는 호전을 위해 사용될 키트를 제공한다.
5.
실시예
하기 실시예는 본 발명의 실시를 예시하기 위해 제공된다. 하기 실시예는 본 발명의 전체 범위를 한정하거나 정의하기 위한 것이 아니다.
실시예 1: 이종이량체 Fc 도메인을 갖는 2가 이중특이적 항체의 발생
인간/포유동물 발현을 위해 최적화된 코돈을 사용하는 유전자 합성을 통해 항체 중쇄 및 경쇄를 코딩하는 유전자를 구축하였다. 공지된 Her2/neu 결합 Ab(Carter P. et al. (1992) Humanization of an anti P185 Her2 antibody for human cancer therapy. Proc Natl Acad Sci 89, 4285)로부터 Fab 서열을 발생시켰고, Fc는 IgG1 동종형(서열번호 1)이었다. 최종 유전자 생성물을 포유동물 발현 벡터 pTT5(NRC-BRI, 캐나다 소재) 내로 서브클로닝하였다(Durocher, Y., Perret, S. & Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human HEK293-EBNA1 cells. Nucleic acids research 30, E9 (2002)). pTT5 주형 벡터의 부위 지정 돌연변이유발을 통해 돌연변이를 CH3 도메인 내에 도입하였다. 만들어진 변이체 CH3 도메인 돌연변이들의 목록에 대해서는 표 1, 표 6 및 표 7을 참조한다.
이종이량체의 형성을 평가하고 동종이량체 대 이종이량체의 비를 측정하기 위해, 상이한 크기의 C-말단 연장부를 갖는 2개의 이종이량체 중쇄(구체적으로, C-말단 히스태그를 갖는 쇄 A 및 C-말단 mRFP 플러스 스트렙태그(StrepTag)II를 갖는 쇄 B)를 디자인하였다. 이 분자량 차이는 도 25a에 예시된 바와 같이 비환원 SDS-PAGE에서 동종이량체 대 이종이량체의 구별을 가능하게 한다.
대수 증식기에서 HEK293 세포를 2.5:1의 PEI:DNA 비로 1 mg/㎖의 25 kDa 수성 폴리에틸렌이민(PEI, 폴리사이언시스(Polysciences))으로 형질감염시켰다(Raymond C. et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods. 55(1):44-51 (2011)). 이종이량체의 형성을 위한 최적 농도 범위를 측정하기 위해, DNA를 상기 2개 중쇄의 3개 상이한 비로 형질감염시켰다. 예를 들면, 이것은 2 ㎖ 배양 부피, 및 5% GFP, 45% 연어 정자 DNA, 25% 경쇄 및 25% 총 중쇄로 구성된 형질감염 DNA를 이용하여 수행하였고, 이때 65%/55%/35% 또는 10%/20%/40%에서 (C-말단 히스태그를 갖는) 중쇄 A 플라스미드 및 (C-말단 스트렙태그II 플러스 RFP를 갖는) 중쇄 B 플라스미드를 10%/65%, 20%/55% 및 40%/35%의 3개 상이한 상대적 비(쇄_A(His)/쇄_B(mRFP))로 샘플링하였다(WT_His/WT_mRFP 이종이량체의 겉보기 1:1 발현 비는 DNA 비 20%/55%에 가까운 것으로 측정되었다). F17 혈청 무함유 배지(깁코(Gibco))에서 형질감염시킨지 4시간 내지 48시간 후, TN1 펩톤을 0.5%의 최종 농도로 첨가하였다. 발현된 항체를 SDS-PAGE로 분석하여 최적 이종이량체 형성을 위한 중쇄 대 경쇄의 가장 우수한 비를 측정하였다(도 25b 및 25c 참조).
5% GFP 및 45% 연어 정자 DNA와 함께 AZ33 및 AZ34의 선택된 DNA 비, 예를 들면, 50% 경쇄 플라스미드, 25% 중쇄 A 플라스미드 및 25% 중쇄 B를 사용하여 150 ㎖의 세포 배양물을 전술된 바와 같이 형질감염시켰다. 5일 내지 6일 후, 4000 rpm에서의 원심분리 후 수집된 배양 배지를 사용하여 형질감염된 세포를 수거하였고 0.45 ㎛ 필터를 이용하여 정화시켰다. 순도 및 용융 온도의 측정을 포함하는 추가 분석을 위해 발생된 CH3 돌연변이를 갖는 항체들 각각에 대한 규모 확대 형질감염 분석에서 사용된 경쇄 및 중쇄 A 및 B 플라스미드의 백분율의 목록에 대해서는 하기 표 2를 참조한다.
[표 2]
실시예
2:
이종이량체
Fc
도메인을 갖는 2가 단일특이적 항체의 정제
정화된 배양 배지를 MabSelect SuRe(지이 헬쓰케어(GE Healthcare)) 단백질 A 컬럼 상에 적재하고 pH 7.2에서 10배 컬럼 부피의 PBS 완충제로 세척하였다. pH 11에서 TRIS로 중화된 항체를 함유하는 풀링된 분획과 함께, pH 3.6에서 10배 컬럼 부피의 시트르산염 완충제를 사용하여 항체를 용출하였다. Econo-Pac 10DG 컬럼(바이오-라드(Bio-Rad))을 이용하여 단백질을 최종적으로 탈염시켰다. 25℃에서 PBS에서 1:10,000의 비로 항체를 장내인산화효소(enterokinase)(NEB)와 함께 밤새 항온처리하여 중쇄 B 상의 C-말단 mRFP 태그를 제거하였다. 겔 여과로 혼합물로부터 항체를 정제하였다. 겔 여과를 위해, 3.5 mg의 항체 혼합물을 1.5 ㎖까지 농축하였고 AKTA 익스프레스(Express) FPLC를 통해 1 ㎖/분의 유속으로 세파덱스(Sephadex) 200 하이로드(HiLoad) 16/600 200 pg 컬럼(지이 헬쓰케어) 상에 적재하였다. pH 7.4에서 PBS 완충제를 1 ㎖/분의 유속으로 사용하였다. 정제된 항체에 상응하는 분획을 수집하고 약 1 mg/㎖까지 농축하고 -80℃에서 저장하였다.
비환원 SDS-PAGE 및 질량 분광측정법을 이용하여 동종이량체와 비교된 이종이량체의 형성을 분석하였다. 단백질 A 정제된 항체를 4% 내지 12% 구배 SDS-PAGE 비환원 겔 상에서 런닝시켜 장내인산화효소(EK) 처리 전에 형성된 이종이량체의 백분율을 측정하였다(도 26 참조). 질량 분광측정법을 위해, 모든 트랩(Trap) LC/MS(ESI-TOF) 실험을 워터스(Waters) Q-TOF2 질량 분광측정기와 접속된 아질런트(Agilent) 1100 HPLC 시스템 상에서 수행하였다. 5 ㎍의 겔 여과 정제된 항체를 단백질 마이크로트랩(1.0 × 8.0 mm) 내로 주입하고 1% 아세토니트릴로 8분 동안 세척하고 1% 내지 20% 아세토니트릴 구배/0.1% 포름산 구배로 2분 동안 세척한 후, 20% 내지 60% 아세토니트릴/0.1% 포름산 구배로 20분 동안 용출하였다. 용출물(30 ㎕/분 내지 50 ㎕/분)을 분광측정기로 향하게 하였고, 이때 스펙트럼이 매초마다 획득되었다(m/z 800 내지 4,000)(도 28 참조). 각각 85% 초과의 이종이량체 형성을 갖는 AZ12 및 AZ14를 제외하고 추가 분석을 위해 90% 초과의 이종이량체를 갖는 변이체를 선택하였다.
실시예
3: 시차 주사 열량측정법(
DSC
)을 이용하여
이종이량체
Fc
도메인을 갖는 2가 단일특이적 항체의 안정성 측정
GE VP-모세관 기구를 이용하여 모든 DSC 실험을 수행하였다. 단백질을 PBS(pH 7.4) 내로 완충제 교환하고 0.4 mg/㎖ 내지 0.5 mg/㎖까지 희석하였고, 0.137 ㎖를 샘플 셀 내에 적재하고 20℃부터 100℃까지 1℃/분의 스캔 속도로 측정하였다. 오리진(Origin) 소프트웨어(지이 헬쓰케어)를 이용하여 데이터를 분석하고, PBS 완충제 배경을 차감하였다(도 27 참조). 시험된 변이체들의 목록 및 측정된 용융 온도에 대해서는 표 3을 참조한다. 70℃ 이상의 용융 온도를 갖는 변이체들의 목록 및 각각의 변이체에 대한 특이적 Tm에 대해서는 표 4를 참조한다.
[표 3]
[표 4]
실시예 4: 표면 플라스몬 공명을 이용한 FcγR 결합의 평가
pH 7.4에서 10 mM HEPES, 150 mM NaCl, 3.4 mM EDTA 및 0.05% 트윈 20과 함께 바이오라드 프로테온(BioRad ProteOn) XPR36 기구를 25℃에서 이용하여 모든 결합 실험을 수행하였다. 대략 3000 공명 유닛(RU)이 소광된 남은 활성 기로 고정될 때까지 10 mM NaOAc(pH 4.5) 중의 4.0 ㎍/㎖를 25 ㎕/분의 속도로 주입하여 재조합 HER-2/neu(p185, ErbB-2(이바이오사이언시스 인코포레이티드(eBiosciences, Inc.))를 활성화된 GLM 센서칩 상에서 포획하였다. 안정한 기준을 확립하기 위한 완충제 주입 후 25 ㎕/분의 속도로 240초 동안 주입하였을 때(대략 500 RU를 발생시킴) 변이체 CH3 도메인을 포함하는 정제된 항-HER-2/neu 항체 40 ㎍/㎖가 Her-2/neu 단백질에 결합함으로써 상기 센서칩 상에서 간접적으로 포획되었다. 180초 해리 단계를 가지면서 FcγR(CD16a(f 동종이형) 및 CD32b) 농도(6000, 2000, 667, 222 및 74.0 nM)를 60 ㎕/분의 속도로 120초 동안 주입하여 결합 센소그램의 세트를 수득하였다. 발생된 KD 값을 평형 피트 모델을 이용하여 결합 등온선으로부터 측정하였고, 값을 3회의 독립적인 실시의 평균으로서 보고하였다. 야생형 IgG1 Fc 도메인과의 비교를 수행하였고, 결합을 WT kD 대 변이체 kD의 비로서 표현하였다(표 5 참조).
[표 5]
실시예
5:
Fc
_
CH3
조작을 이용한
Fc
변이체의
합리적인 디자인 -
스카폴드
1(1a 및 1b), 및
AZ17
-62 및
AZ133
-
AZ2438
의 개발
초기 음성 디자인 Fc 변이체 AZ8을 안정성 및 순도에 대해 개선하기 위해, 전술된 구조적 방법 및 컴퓨터를 이용한 방법을 이용하였다(도 24 참조). 예를 들면, AZ8의 상세한 구조-기능 분석은 야생형 인간 IgG1과 비교된 AZ8의 도입된 돌연변이 L351Y_V397S_F405A_Y407V/K392V_T394W 각각에 대한 상세한 이해를 제공하였고 중요한 코어 이종이량체 돌연변이가 L351Y_F405A_Y407V/T394W인 반면, V397S 및 K392V가 이종이량체 형성과 관련되지 않는다는 것을 보여주었다. 상기 코어 돌연변이(L351Y_F405A_Y407V/T394W)는 본원에서 "스카폴드 1" 돌연변이로서 지칭된다. 나아가, 상기 분석은 야생형(WT) 동종이량체 형성에 비해 상실되는 중요한 경계면 핫스폿이 WT-F405-K409 및 Y407-T366의 상호작용, 및 Y407-Y407 및 -F405의 팩킹이라는 것을 보여주었다(도 29 참조). 이것은 루프 영역 D399-S400-D401(도 30 참조) 및 K370에서의 관련 β-시트에서 큰 입체구조적 차이를 보여준 팩킹, 캐비티 및 MD 분석에 반영되었다. 이것은 쇄간 상호작용 K409-D399의 상실(도 30 참조), 및 K370과 E357의 강한 수소결합의 약화를 초래하였다(K370은 S364 및 E357과 더 이상 직접적으로 접촉하지 않지만 전체적으로 용매에 노출된다). WT IgG1 CH3 도메인에서, 이들 영역들은 경계면을 가장자리에 고정시키고 벌크 용매 경쟁으로부터 코어 상호작용을 보호하고 유리한 소수성 반 데르 발스 상호작용의 동역학적 발생을 증가시킨다. 결과는 WT에 비해 AZ8의 보다 낮은 파묻힌 표면적 및 소수성 코어의 보다 높은 용매 접근성이었다. 이것은 WT 안정성에 비해 AZ8의 보다 낮은 안정성에 대해 가장 중요한 인자가 a) WT-F405-K409 상호작용의 상실 및 F405의 팩킹, 및 b) Y407-Y407 및 Y407-T366의 강한 팩킹 상호작용의 상실이라는 것을 암시하였다. 도 29를 참조한다.
결과적으로, 본 발명자들은 WT에 비해 AZ8의 낮은 안정성의 원인이 되는 핵심 잔기/서열 모티프를 확인하였다. 따라서, AZ8의 안정성 및 이종이량체 특이성을 개선하기 위해, 후속 양성 디자인 조작 노력은 보다 더 "폐쇄된" - WT 유사 입체구조에서 위치 399-401의 루프 입체구조의 안정화(도 30 참조), 및 위치 T366 및 L368에서 소수성 코어의 전체적인 약간 감소된(보다 더 느슨한) 팩킹에 대한 보완(도 29 참조)에 특히 집중되었다.
위치 399-401의 루프 입체구조의 이 안정화를 달성하기 위해, 기재된 컴퓨터를 이용한 방법을 이용하여 본 발명자들의 상이한 표적화된 디자인 방안을 평가하였다. 구체적으로, Fc 변이체 AZ8에 대한 3개의 상이한 독립적인 옵션들을 분석하여 상기 확인된 핵심 영역을 안정성의 개선에 대해 최적화하였다. 먼저, 소수성 코어를 보호하고 399-400의 루프 입체구조를 안정화시키기 위해 위치 K409 및 F405A에 인접한 캐비티를 보다 더 우수한 소수성 팩킹에 대해 평가하였다(도 30 참조). 이것은 위치 F405 및 K392에서의 추가 점 돌연변이를 포함하였으나 이들로 한정되지 않았다. 둘째, 399-400의 루프 입체구조를 안정화시키고 소수성 코어를 보호하기 위해 위치 399-409의 정전기 상호작용의 개선에 대해 옵션들을 평가하였다. 이것은 위치 T411 및 S400에서의 추가 점 돌연변이를 포함하였으나 이들로 한정되지 않았다. 셋째, 코어 소수성 팩킹을 개선하기 위해 코어 팩킹 위치 T366, T394W 및 L368에서 캐비티를 평가하였다(도 29 참조). 이것은 위치 T366 및 L368에서의 추가 점 돌연변이를 포함하였으나 이들로 한정되지 않았다. 상이한 독립적인 양성 디자인 방안을 인-실리코에서 평가하였고, 컴퓨터를 이용한 수단을 이용하여 확인한 가장 우수한 순위의 변이체들(AZ17-AZ62)을 실시예 1 내지 4에 기재된 바와 같이 발현 및 안정성에 대해 실험적으로 검증하였다. 이 디자인 단계로부터 수득된, 70℃ 이상의 용융 온도를 갖는 Fc 변이체들의 목록에 대해서는 표 4를 참조한다.
Fc 변이체 AZ33은 안정성 및 순도를 개선하기 위해 스카폴드 1이 스카폴드 1a 돌연변이를 발생시키도록 변형되어 있는 Fc 변이체의 개발의 일례이다. 이 Fc 변이체는 소수성 코어를 보호하고 399-400의 루프 입체구조를 안정화시키기 위해 위치 392-394-409 및 366에서 소수성 팩킹을 개선하고자 하는 목적으로 AZ8에 기초하여 디자인되었다. 이 Fc 변이체 AZ33 이종이량체는 AZ8의 코어 돌연변이와 상이한 2개의 추가 점 돌연변이 K392M 및 T366I를 갖는다. 상기 돌연변이 T366I_K392M_T394W/F405A_Y407V는 본원에서 "스카폴드 1a" 돌연변이로서 지칭된다. 돌연변이 K392M은 소수성 코어를 보호하고 399-400의 루프 입체구조를 안정화시키기 위해 위치 K409 및 F405A에 인접한 캐비티에서 팩킹을 개선하도록 디자인되었다(도 31 참조). T366I는 코어 소수성 팩킹을 개선하고 T394W 쇄의 동종이량체의 형성을 제거하도록 디자인되었다(도 29 참조). AZ33에 대한 실험 데이터는 초기 음성 디자인 Fc 변이체 AZ8(Tm 68℃)에 비해 상당히 개선된 안정성을 보였는데, 이때 AZ33은 74℃의 Tm 및 98% 초과의 이종이량체 함량을 갖는다(도 25c 참조).
Fc
변이체
이종이량체의
단계 3 디자인에서
스카폴드
1 돌연변이를 사용한 Fc
변이체의
개발
AZ33이 초기 출발 변이체 AZ8에 비해 상당한 안정성 및 특이성(또는 순도) 개선을 제공한다 하더라도, 본 발명자들의 분석은 Fc 변이체 이종이량체의 안정성의 추가 개선이 AZ33의 실험 데이터 및 전술된 디자인 방법을 이용한 추가 아미노산 변형에 의해 달성될 수 있다는 것을 보여준다. 상이한 디자인 방안이 발현 및 안정성에 대해 독립적으로 시험되었지만, 독립적인 디자인 방안은 전달가능하고, 가장 성공적인 이종이량체는 상이한 디자인들의 조합을 함유할 것이다. 구체적으로, AZ8의 최적화를 위해, 잔기 L366T-L368에서 코어 팩킹을 최적화하는 돌연변이들과 독립적으로 K409-F405A-K392에 인접한 캐비티에서 팩킹 돌연변이들을 평가하였다. 이들 2개 영역 366-368 및 409-405-392는 서로 멀리 떨어져 있고 독립적인 것으로서 간주된다. 예를 들면, Fc 변이체 AZ33은 366-368이 아니라 409-405-392에서 팩킹에 대해 최적화되어 있는데, 이는 이들 최적화 돌연변이들이 별도로 평가되었기 때문이다. 366-368 돌연변이들의 비교는 T366L이 T366 및 T366I(Fc 변이체 AZ33의 개발에서 사용된 점 돌연변이)에 비해 개선된 안정성을 갖는다는 것을 암시한다. 결과적으로, 제시된 실험 데이터는 예를 들면, T366I 대신에 T366L의 도입에 의한 AZ33의 추가 최적화를 즉시 암시한다. 따라서, CH3 도메인 내의 아미노산 돌연변이 T366L_K392M_T394W/F405A_Y407V는 본원에서 "스카폴드 1b" 돌연변이로서 지칭된다.
유사한 방식으로, 완전한 실험 데이터를 분석함으로써 현재 Fc 변이체 이종이량체 AZ33을 추가로 개선하기 위해 사용될 수 있는 점 돌연변이를 확인하였다. 이들 확인된 돌연변이들을 전술된 컴퓨터를 이용한 방법으로 분석하고 순위를 매겨 표 6에 나타낸 바와 같은 AZ33에 기초한 추가 Fc 변이체 이종이량체들의 목록을 수득하였다.
실시예
6:
Fc
_
CH3
조작을 이용한
Fc
변이체의
합리적인 디자인 -
스카폴드
2(a 및 b), 및
AZ63
-101 및
AZ2199
-
AZ2524
의 개발
초기 음성 디자인 단계 Fc 변이체 AZ15를 안정성 및 순도에 대해 개선하기 위해, 전술된 구조적 방법 및 컴퓨터를 이용한 방법을 이용하였다(도 24 참조). 예를 들면, Fc 변이체 AZ15의 상세한 구조-기능 분석은 야생형(WT) 인간 IgG1과 비교된 AZ15의 도입된 돌연변이 L351Y_Y407A/E357L_T366A_K409F_T411N 각각에 대한 상세한 이해를 제공하였고 중요한 코어 이종이량체 돌연변이가 L351Y_Y407A/T366A_K409F인 반면, E357L 및 T411N이 이종이량체 형성 및 안정성과 직접적으로 관련되지 않는다는 것을 보여주었다. 상기 코어 돌연변이(L351Y_Y407A/T366A_K409F)는 본원에서 "스카폴드 2" 돌연변이로서 지칭된다. 나아가, 상기 분석은 야생형(WT) 동종이량체 형성에 비해 상실되는 중요한 경계면 핫스폿이 염 가교 D399-K409, 수소결합 Y407-T366 및 Y407-Y407의 팩킹이라는 것을 보여주었다. 하기 제공된 본 발명자들의 상세한 분석은 본 발명자들이 어떻게 본 발명자들의 원래의 Fc 변이체 AZ15의 안정성을 개선하였는지, 및 개선된 안정성을 갖는 이들 Fc 변이체들을 달성하기 위해 만들어진 위치 및 아미노산 변형을 기술한다.
스카폴드 2 돌연변이를 이용한 Fc 변이체의 개발, 및 스카폴드 2a 돌연변이의 추가 개발
본 발명자들의 인-실리코 분석은 WT-Y407-Y407 상호작용의 상실로 인한 Fc 변이체 AZ15 돌연변이 K409F_T366A_Y407A의 비최적 팩킹 및 소수성 코어의 전체적인 감소된 팩킹을 보여주었다. 후속 조작 단계에서 양성 디자인 노력은 초기 Fc 변이체 AZ15에서 이들 팩킹 결함을 보완하기 위한 점 돌연변이에 집중되었다. 표적화된 잔기는 위치 T366, L351 및 Y407을 포함하였다. 이들의 상이한 조합들을 인-실리코에서 시험하였고 컴퓨터를 이용한 수단을 이용하여 확인한 가장 우수한 순위의 Fc 변이체들(AZ63-AZ70)을 실시예 1 내지 4에 기재된 바와 같이 발현 및 안정성에 대해 실험적으로 검증하였다.
Fc 변이체 AZ70은 안정성 및 순도를 개선하기 위해 스카폴드 2가 스카폴드 2a 돌연변이를 발생시키도록 변형되어 있는 Fc 변이체의 개발의 일례이다. 이 Fc 변이체는 전술된 바와 같이 소수성 코어에서 보다 우수한 팩킹을 달성하고자 하는 목적으로 AZ15에 기초하여 디자인되었다. Fc 변이체 AZ70은 T366이 T366A 대신에 T366V로 돌연변이되었다는 점을 제외하고 전술된 바와 동일한 스카폴드 2 코어 돌연변이(L351Y_Y407A/T366A_K409F)를 갖는다. L351Y 돌연변이는 366A_409F/407A 변이체 용융 온도를 71.5℃에서 74℃로 개선하고, 366A로부터 366V로의 추가 변화는 Tm을 75.5℃까지 개선한다(각각 71.5℃, 74℃ 및 75.5℃의 Tm을 갖는 표 4의 AZ63, AZ64 및 AZ70 참조). 상기 코어 돌연변이(L351Y_Y407A/T366V_K409F)는 본원에서 "스카폴드 2a" 돌연변이로서 지칭된다. Fc 변이체 AZ70에 대한 실험 데이터는 초기 음성 디자인 Fc 변이체 AZ15(Tm 71℃)에 비해 상당히 개선된 안정성을 보여주었는데, 이때 AZ70은 75.5℃의 Tm 및 90% 초과의 이종이량체 함량을 갖는다(도 33 및 27 참조).
스카폴드
2 돌연변이를 이용한
Fc
변이체의
개발 및
스카폴드
2b 돌연변이의 추가 개발
분자 동역학 시뮬레이션(MD) 및 팩킹 분석은 아마도 WT 염 가교 K409-D399의 상실로 인한 루프 399-400의 바람직한 보다 더 "개방된" 입체구조를 보여주었다. 또한, 이것은 K392와의 보완 상호작용을 선호하고 상기 루프의 보다 더 "개방된" 입체구조를 유도하는 충족되지 않은 D399를 발생시킨다. 상기 보다 더 "개방된" 루프 입체구조는 코어 CH3 도메인 경계면 잔기의 전체적인 감소된 팩킹 및 보다 더 높은 용매 접근성을 초래하고, 이것은 이종이량체 복합체를 상당히 불안정화시켰다. 따라서, 표적화된 양성 디자인 노력들 중 하나는 D399-K409 염 가교 및 K409의 팩킹 상호작용의 상실을 보완하는 추가 점 돌연변이를 이용하여 이 루프를 보다 더 "폐쇄된" WT 유사 입체구조로 유지하는 것이었다. 표적화된 잔기는 위치 T411, D399, S400, F405, N390, K392 및 이들의 조합을 포함하였다. 상이한 팩킹, 소수성 및 정전기 양성 조작 방법을 상기 위치들에 대해 인-실리코에서 시험하였고, 컴퓨터를 이용한 수단을 이용하여 확인한 가장 우수한 순위의 Fc 변이체들(AZ71-AZ101)을 실시예 1 내지 4에 기재된 바와 같이 발현 및 안정성에 대해 실험적으로 검증하였다.
Fc 변이체 AZ94는 안정성 및 순도를 개선하기 위해 스카폴드 2가 추가 점 돌연변이와 함께 스카폴드 2b 돌연변이를 발생시키도록 변형되어 있는 Fc 변이체의 개발의 일례이다. 이 Fc 변이체는 루프 399-400을 보다 더 "폐쇄된" WT 유사 입체구조로 유지하고 전술된 바와 같은 D399-K409 염 가교의 상실을 보완하고자 하는 목적으로 AZ15에 기초하여 디자인되었다. Fc 변이체 AZ94는 스카폴드 2에 대한 4개의 추가 점 돌연변이(L351Y_Y407A/T366A_K409F)를 갖고 L351Y를 야생형 L351로 복귀시켜 이 Fc 변이체에 대한 코어 돌연변이로서 (Y407A/T366A_K409F)를 남긴다. 상기 코어 돌연변이 Y407A/T366A_K409F는 본원에서 "스카폴드 2b" 돌연변이로서 지칭된다. AZ94의 4개 추가 점 돌연변이는 K392E_T411E/D399R_S400R이다. 돌연변이 T411E/D399R은 추가 염 가교를 형성하고 K409/D399 상호작용의 상실을 보완하도록 조작되었다(도 34). 추가로, 이 염 가교는 2개의 잠재적 동종이량체에서 전하-전하 상호작용에 불리하게 작용함으로써 동종이량체 형성을 방해하도록 디자인되었다. 추가 돌연변이 K392E/S400R은 또 다른 염 가교를 형성하여 399-400 루프를 보다 더 "폐쇄된" WT 유사 입체구조로 더 유지하기 위한 것이었다(도 34). AZ94에 대한 실험 데이터는 초기 음성 디자인 Fc 변이체 AZ15((Tm 71℃, 90% 초과의 순도)에 비해 개선된 안정성 및 순도를 보였고, 이때 Fc 변이체 AZ94는 74℃의 Tm 및 95% 초과의 이종이량체 함량 또는 순도를 갖는다.
Fc
변이체
이종이량체의
단계 3 디자인에서
스카폴드
2 돌연변이를 이용한 Fc
변이체의
개발
Fc 변이체 AZ70 및 AZ94 둘다가 초기 음성 디자인 Fc 변이체 AZ15에 비해 안정성 및 순도의 상당한 개선을 제공하지만, 본 발명자들의 분석 및 AZ70과 AZ94의 비교는 Fc 변이체 이종이량체의 안정성에 대한 추가 개선이 추가 아미노산 변형에 의해 달성될 수 있다는 것을 직접적으로 보여준다. 예를 들면, Fc 변이체 AZ70 및 AZ94는 초기 변이체 AZ15에서 2개의 상이한 비최적화된 영역들을 표적화하도록 디자인되었고, 이것은 소수성 코어에서의 팩킹을 개선하고 코어 경계면 잔기의 외부에서 돌연변이를 만들어 추가 염 가교 및 수소결합을 발생시켜 위치 399-401의 루프 입체구조를 안정화시킴으로써 달성되었다. Fc 변이체 AZ70 및 AZ94의 추가 점 돌연변이는 서로 멀리 떨어져 있으므로 독립적이고 2a 및 2b 돌연변이를 포함하는 동일한 스카폴드 2 코어 돌연변이 주변에서 디자인된 다른 Fc 변이체로 전달될 수 있다. 특히, AZ70만이 최적화된 코어 돌연변이 L351Y_Y407A/T366A_K409F를 보유하되 추가 염 가교를 전혀 보유하지 않는 반면, AZ94는 4개의 추가 정전기 돌연변이(K392E_T411E/D399R_S400R)를 포함하되 소수성 코어 경계면에서 1개 더 적은 돌연변이(Y407A/T366A_K409F)를 갖는다. 이들 스카폴드 2b 돌연변이들은 AZ70보다 덜 안정하지만(예를 들면, AZ94와 동등한 코어 돌연변이 및 72℃의 Tm을 갖는 AZ63 참조), K392E_T411E/D399R_S400R 돌연변이의 추가에 의해 보완된다. 제시된 실험 안정성 및 순도 데이터는 소수성 코어를 최적화하는 AZ70의 돌연변이와 AZ94의 정전기 돌연변이의 조합이 Fc 변이체 이종이량체의 안정성 및 순도를 더 개선할 것임을 보여준다. 유사한 방식으로, 스카폴드 2 Fc 변이체(AZ63-101)에 대한 완전한 실험 데이터를 분석함으로써 Fc 변이체 이종이량체 AZ70 및 AZ94를 더 개선하기 위해 사용될 수 있는 점 돌연변이를 확인하였다. 이들 확인된 돌연변이들을 전술된 컴퓨터를 이용한 방법으로 더 분석하고 순위를 매겨 표 7에 나타낸 바와 같은 AZ70 및 AZ94에 기초한 추가 Fc 변이체 이종이량체들의 목록을 수득하였다.
실시예 7: FcgR 결합에 대한 이종이량체 CH3의 효과
FcgR에 대한 이종이량체 Fc 활성의 원형 일례로서, 본 발명자들은 실시예 4에 기재된 SPR 분석에서 Her2 결합 Fab 아암과 함께 이종이량체 Fc 영역 A:K409D_K392D/B:D399K_D356K(대조군 1(도 35에서 het 1)) 및 A:Y349C_T366S_L368A_Y407V/B:S354C_T366W(대조군 4(도 35에서 het 2))를 갖는 2개의 변이체 항체들을 FcgR 결합에 대해 시험하였다. 도 35에 나타낸 바와 같이, 본 발명자들은 상기 이종이량체 Fc 영역들 둘다가 야생형 IgG1 Fc 영역과 동일한 상대적 강도로 상이한 Fcγ 수용체들에 결합하지만, 전체적으로 상기 이종이량체 Fc 영역이 야생형 항체보다 약간 더 우수하게 FcgR 각각에 결합한다는 것을 관찰하였다. 이것은 Fc의 CH3 경계면에 존재하는 돌연변이가 본 발명자들의 분자 동역학 시뮬레이션 및 분석에서 관찰된 바와 같이 CH2 도메인을 가로질러 Fcγ 수용체에 대한 Fc 영역의 결합 강도에 영향을 미칠 수 있다는 것을 암시한다.
실시예 8: FcgR 결합에 대한 이종이량체 Fc의 CH2 내의 비대칭 돌연변이의 효과
Fc 영역의 CH2 도메인 내의 위치 267에 존재하는 세린의 아스파르트산으로의 돌연변이(S267D)는 CH2 도메인의 2개 쇄들 내에 동종이량체 방식으로 도입되었을 때 Fcγ IIbF, IIbY 및 IIaR 수용체들과의 결합을 향상시키는 것으로 공지되어 있다. 도 36a에 제시된 데이터가 보여주는 바와 같이, 이 돌연변이를 이종이량체 Fc 분자 내의 CH2 도메인들 중 단지 1개의 CH2 도메인 상에 도입함으로써, 이 돌연변이가 동종이량체 CH2 Fc 내로 도입될 때에 비해 상대적으로 대략 절반의 결합 강도 개선을 획득할 수 있다. 다른 한편으로, Fc의 동종이량체 CH2 도메인 내의 E269K 돌연변이는 Fc 영역과 FcgR의 결합을 방해한다. 본 발명자들은 이들 유리한 돌연변이 및 불리한 돌연변이를 Fc의 CH2 도메인 내의 2개 쇄들 중 하나 상에 비대칭적으로 도입함으로써 Fcg 수용체에 대한 Fc 영역의 결합 강도를 향상 조절하는 방법을 제공한다. 이종이량체 Fc 내의 1개 CH2 쇄 상에서 비대칭 방식에 의한 E269K 돌연변이의 도입은 상기 돌연변이가 존재하는 면에서 FcgR의 결합을 차단하면서 상기 Fc의 다른 면이 정상적인 방식으로 FcgR과 상호작용하게 함으로써 극성 유발제로서 작용한다. 이 실험으로부터의 결과는 도 36a에 제시되어 있다. 독립적인 방식으로 Fc의 쇄 둘다를 통해 결합 강도를 선택적으로 변경할 기회는 Fc와 Fcg 수용체 사이의 결합 강도 및 선택성을 조절하는 증가된 기회를 제공한다. 따라서, CH2 도메인 내의 돌연변이의 이러한 비대칭 디자인은 본 발명들이 일부 결합 모델에 유리하거나 불리하도록 양성 및 음성 디자인 방법을 도입할 수 있게 함으로써 선택성을 도입할 보다 많은 기회를 제공한다.
후속 실험에서, 본 발명자들은 Fcγ IIaR, IIbF 및 IIbY 수용체와의 보다 더 약한 결합을 계속 나타내면서 Fcγ IIIaF 및 IIIaV 수용체에 대한 증가된 결합 강도를 보이는 기초 Fc 돌연변이체 S239D_D265S_I332E_S298A의 선택성 프로파일을 변경하였다. 이것은 도 36b에 나타낸 결합 프로파일에서 보여진다. 본 발명자들은 비대칭 돌연변이 E269K를 쇄 A 내로 도입하고 쇄 B에서 I332E 돌연변이를 회피함으로써 IIa 및 IIb 수용체 결합을 더 약화시키고 Fc가 IIIa 수용체 결합에 대해 보다 더 특이적이게 만드는 신규 FcgR 결합 프로파일을 발생시킬 수 있었다.
도 36c에 나타낸 또 다른 예에서, 비대칭 돌연변이는 CH2 도메인 내의 돌연변이 S239D/K326E/A330L/I332E/S298A를 포함하는 동종이량체 Fc에 비해 상대적으로 강조되어 있다. 이 변이체는 야생형 IgG1 Fc에 비해 상대적으로 IIIa 수용체에 대한 증가된 결합을 보일 뿐만 아니라 야생형 Fc보다 약간 더 강하게 IIa 및 IIb 수용체에 결합한다. 또한, 비대칭 방식 A:S239D/K326E/A330L/I332E 및 B:S298A에 의한 이들 돌연변이들의 도입은 IIIa 결합을 감소시키고 과정에서 선택성을 느슨하게 하면서 IIa/IIb 수용체 결합을 증가시킨다. 본 발명자들은 비대칭 E269K 돌연변이를 이 이종이량체 변이체 내로 도입함으로써(즉, A:S239D/K326E/A330L/I332E/E269K 및 B:S298A) IIa/IIb 결합을 야생형 수준으로 다시 감소시킬 수 있다. 이것은 Fc의 CH2 도메인 내의 비대칭 돌연변이의 사용이 개선된 FcγR 선택성을 디자인할 상당한 기회를 제공할 수 있다는 사실을 강조한다.
실시예에서 사용된 시약들은 상업적으로 입수될 수 있거나 당업계에서 공지된 상업적으로 입수가능한 기구, 방법 또는 시약의 사용을 통해 제조될 수 있다. 상기 실시예는 본 발명의 다양한 양태 및 본 발명의 방법의 실시를 예시한다. 실시예는 본 발명의 많은 상이한 실시양태들의 배타적 설명을 제공하기 위한 것이 아니다. 따라서, 상기 본 발명이 명확한 이해를 목적으로 예시 및 예에 의해 다소 상세히 기재되어 있다 하더라도, 당업계에서 통상의 기술을 가진 자는 첨부된 특허청구범위 기술적 사상 또는 범위를 벗어나지 않으면서 본 발명에 대한 많은 변화 및 변형을 만들 수 있다는 것을 용이하게 인식할 것이다.
본 명세서에서 언급된 모든 공개문헌들, 특허들 및 특허출원들은 각각의 개별 공개문헌, 특허 또는 특허출원이 본원에 참고로 도입되는 것으로 구체적으로 및 개별적으로 표시되어 있는 것과 동일한 정도로 본 명세서 내로 참고로 도입된다.
SEQUENCE LISTING
<110> ZYMEWORKS INC.
CABRERA, Eric
von KREUDENSTEIN, Thomas
DIXIT, Surjit
LARIO, Paula
POON, David
D'ANGELO, Igor
<120> Stable Heterodimeric Antibody Design with Mutations in the Fc
Domain
<130> V84467WO
<150> US 61/410,746
<151> 2010-11-05
<150> US 61/425,375
<151> 2010-12-21
<150> US 61/439,341
<151> 2011-02-03
<150> US 61/475,614
<151> 2011-04-14
<150> US 61/491,846
<151> 2011-05-31
<150> US 61/497,861
<151> 2011-06-16
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 212
<212> PRT
<213> Homo sapiens
<400> 1
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
1 5 10 15
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
20 25 30
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
35 40 45
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
50 55 60
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
65 70 75 80
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
85 90 95
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
100 105 110
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
115 120 125
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
130 135 140
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
145 150 155 160
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
165 170 175
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
180 185 190
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
195 200 205
Ser Pro Gly Lys
210
<210> 2
<211> 317
<212> PRT
<213> Homo sapiens
<400> 2
Met Thr Met Glu Thr Gln Met Ser Gln Asn Val Cys Pro Arg Asn Leu
1 5 10 15
Trp Leu Leu Gln Pro Leu Thr Val Leu Leu Leu Leu Ala Ser Ala Asp
20 25 30
Ser Gln Ala Ala Ala Pro Pro Lys Ala Val Leu Lys Leu Glu Pro Pro
35 40 45
Trp Ile Asn Val Leu Gln Glu Asp Ser Val Thr Leu Thr Cys Gln Gly
50 55 60
Ala Arg Ser Pro Glu Ser Asp Ser Ile Gln Trp Phe His Asn Gly Asn
65 70 75 80
Leu Ile Pro Thr His Thr Gln Pro Ser Tyr Arg Phe Lys Ala Asn Asn
85 90 95
Asn Asp Ser Gly Glu Tyr Thr Cys Gln Thr Gly Gln Thr Ser Leu Ser
100 105 110
Asp Pro Val His Leu Thr Val Leu Ser Glu Trp Leu Val Leu Gln Thr
115 120 125
Pro His Leu Glu Phe Gln Glu Gly Glu Thr Ile Met Leu Arg Cys His
130 135 140
Ser Trp Lys Asp Lys Pro Leu Val Lys Val Thr Phe Phe Gln Asn Gly
145 150 155 160
Lys Ser Gln Lys Phe Ser His Leu Asp Pro Thr Phe Ser Ile Pro Gln
165 170 175
Ala Asn His Ser His Ser Gly Asp Tyr His Cys Thr Gly Asn Ile Gly
180 185 190
Tyr Thr Leu Phe Ser Ser Lys Pro Val Thr Ile Thr Val Gln Val Pro
195 200 205
Ser Met Gly Ser Ser Ser Pro Met Gly Ile Ile Val Ala Val Val Ile
210 215 220
Ala Thr Ala Val Ala Ala Ile Val Ala Ala Val Val Ala Leu Ile Tyr
225 230 235 240
Cys Arg Lys Lys Arg Ile Ser Ala Asn Ser Thr Asp Pro Val Lys Ala
245 250 255
Ala Gln Phe Glu Pro Pro Gly Arg Gln Met Ile Ala Ile Arg Lys Arg
260 265 270
Gln Leu Glu Glu Thr Asn Asn Asp Tyr Glu Thr Ala Asp Gly Gly Tyr
275 280 285
Met Thr Leu Asn Pro Arg Ala Pro Thr Asp Asp Asp Lys Asn Ile Tyr
290 295 300
Leu Thr Leu Pro Pro Asn Asp His Val Asn Ser Asn Asn
305 310 315
<210> 3
<211> 310
<212> PRT
<213> Homo sapiens
<400> 3
Met Gly Ile Leu Ser Phe Leu Pro Val Leu Ala Thr Glu Ser Asp Trp
1 5 10 15
Ala Asp Cys Lys Ser Pro Gln Pro Trp Gly His Met Leu Leu Trp Thr
20 25 30
Ala Val Leu Phe Leu Ala Pro Val Ala Gly Thr Pro Ala Ala Pro Pro
35 40 45
Lys Ala Val Leu Lys Leu Glu Pro Gln Trp Ile Asn Val Leu Gln Glu
50 55 60
Asp Ser Val Thr Leu Thr Cys Arg Gly Thr His Ser Pro Glu Ser Asp
65 70 75 80
Ser Ile Gln Trp Phe His Asn Gly Asn Leu Ile Pro Thr His Thr Gln
85 90 95
Pro Ser Tyr Arg Phe Lys Ala Asn Asn Asn Asp Ser Gly Glu Tyr Thr
100 105 110
Cys Gln Thr Gly Gln Thr Ser Leu Ser Asp Pro Val His Leu Thr Val
115 120 125
Leu Ser Glu Trp Leu Val Leu Gln Thr Pro His Leu Glu Phe Gln Glu
130 135 140
Gly Glu Thr Ile Val Leu Arg Cys His Ser Trp Lys Asp Lys Pro Leu
145 150 155 160
Val Lys Val Thr Phe Phe Gln Asn Gly Lys Ser Lys Lys Phe Ser Arg
165 170 175
Ser Asp Pro Asn Phe Ser Ile Pro Gln Ala Asn His Ser His Ser Gly
180 185 190
Asp Tyr His Cys Thr Gly Asn Ile Gly Tyr Thr Leu Tyr Ser Ser Lys
195 200 205
Pro Val Thr Ile Thr Val Gln Ala Pro Ser Ser Ser Pro Met Gly Ile
210 215 220
Ile Val Ala Val Val Thr Gly Ile Ala Val Ala Ala Ile Val Ala Ala
225 230 235 240
Val Val Ala Leu Ile Tyr Cys Arg Lys Lys Arg Ile Ser Ala Leu Pro
245 250 255
Gly Tyr Pro Glu Cys Arg Glu Met Gly Glu Thr Leu Pro Glu Lys Pro
260 265 270
Ala Asn Pro Thr Asn Pro Asp Glu Ala Asp Lys Val Gly Ala Glu Asn
275 280 285
Thr Ile Thr Tyr Ser Leu Leu Met His Pro Asp Ala Leu Glu Glu Pro
290 295 300
Asp Asp Gln Asn Arg Ile
305 310
<210> 4
<211> 323
<212> PRT
<213> Homo sapiens
<400> 4
Met Gly Ile Leu Ser Phe Leu Pro Val Leu Ala Thr Glu Ser Asp Trp
1 5 10 15
Ala Asp Cys Lys Ser Pro Gln Pro Trp Gly His Met Leu Leu Trp Thr
20 25 30
Ala Val Leu Phe Leu Ala Pro Val Ala Gly Thr Pro Ala Ala Pro Pro
35 40 45
Lys Ala Val Leu Lys Leu Glu Pro Gln Trp Ile Asn Val Leu Gln Glu
50 55 60
Asp Ser Val Thr Leu Thr Cys Arg Gly Thr His Ser Pro Glu Ser Asp
65 70 75 80
Ser Ile Pro Trp Phe His Asn Gly Asn Leu Ile Pro Thr His Thr Gln
85 90 95
Pro Ser Tyr Arg Phe Lys Ala Asn Asn Asn Asp Ser Gly Glu Tyr Thr
100 105 110
Cys Gln Thr Gly Gln Thr Ser Leu Ser Asp Pro Val His Leu Thr Val
115 120 125
Leu Ser Glu Trp Leu Val Leu Gln Thr Pro His Leu Glu Phe Gln Glu
130 135 140
Gly Glu Thr Ile Val Leu Arg Cys His Ser Trp Lys Asp Lys Pro Leu
145 150 155 160
Val Lys Val Thr Phe Phe Gln Asn Gly Lys Ser Lys Lys Phe Ser Arg
165 170 175
Ser Asp Pro Asn Phe Ser Ile Pro Gln Ala Asn His Ser His Ser Gly
180 185 190
Asp Tyr His Cys Thr Gly Asn Ile Gly Tyr Thr Leu Tyr Ser Ser Lys
195 200 205
Pro Val Thr Ile Thr Val Gln Ala Pro Ser Ser Ser Pro Met Gly Ile
210 215 220
Ile Val Ala Val Val Thr Gly Ile Ala Val Ala Ala Ile Val Ala Ala
225 230 235 240
Val Val Ala Leu Ile Tyr Cys Arg Lys Lys Arg Ile Ser Ala Asn Ser
245 250 255
Thr Asp Pro Val Lys Ala Ala Gln Phe Glu Pro Pro Gly Arg Gln Met
260 265 270
Ile Ala Ile Arg Lys Arg Gln Pro Glu Glu Thr Asn Asn Asp Tyr Glu
275 280 285
Thr Ala Asp Gly Gly Tyr Met Thr Leu Asn Pro Arg Ala Pro Thr Asp
290 295 300
Asp Asp Lys Asn Ile Tyr Leu Thr Leu Pro Pro Asn Asp His Val Asn
305 310 315 320
Ser Asn Asn
<210> 5
<211> 254
<212> PRT
<213> Homo sapiens
<400> 5
Met Trp Gln Leu Leu Leu Pro Thr Ala Leu Leu Leu Leu Val Ser Ala
1 5 10 15
Gly Met Arg Thr Glu Asp Leu Pro Lys Ala Val Val Phe Leu Glu Pro
20 25 30
Gln Trp Tyr Arg Val Leu Glu Lys Asp Ser Val Thr Leu Lys Cys Gln
35 40 45
Gly Ala Tyr Ser Pro Glu Asp Asn Ser Thr Gln Trp Phe His Asn Glu
50 55 60
Ser Leu Ile Ser Ser Gln Ala Ser Ser Tyr Phe Ile Asp Ala Ala Thr
65 70 75 80
Val Asp Asp Ser Gly Glu Tyr Arg Cys Gln Thr Asn Leu Ser Thr Leu
85 90 95
Ser Asp Pro Val Gln Leu Glu Val His Ile Gly Trp Leu Leu Leu Gln
100 105 110
Ala Pro Arg Trp Val Phe Lys Glu Glu Asp Pro Ile His Leu Arg Cys
115 120 125
His Ser Trp Lys Asn Thr Ala Leu His Lys Val Thr Tyr Leu Gln Asn
130 135 140
Gly Lys Gly Arg Lys Tyr Phe His His Asn Ser Asp Phe Tyr Ile Pro
145 150 155 160
Lys Ala Thr Leu Lys Asp Ser Gly Ser Tyr Phe Cys Arg Gly Leu Phe
165 170 175
Gly Ser Lys Asn Val Ser Ser Glu Thr Val Asn Ile Thr Ile Thr Gln
180 185 190
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln
195 200 205
Val Ser Phe Cys Leu Val Met Val Leu Leu Phe Ala Val Asp Thr Gly
210 215 220
Leu Tyr Phe Ser Val Lys Thr Asn Ile Arg Ser Ser Thr Arg Asp Trp
225 230 235 240
Lys Asp His Lys Phe Lys Trp Arg Lys Asp Pro Gln Asp Lys
245 250
<210> 6
<211> 233
<212> PRT
<213> Homo sapiens
<400> 6
Met Trp Gln Leu Leu Leu Pro Thr Ala Leu Leu Leu Leu Val Ser Ala
1 5 10 15
Gly Met Arg Thr Glu Asp Leu Pro Lys Ala Val Val Phe Leu Glu Pro
20 25 30
Gln Trp Tyr Ser Val Leu Glu Lys Asp Ser Val Thr Leu Lys Cys Gln
35 40 45
Gly Ala Tyr Ser Pro Glu Asp Asn Ser Thr Gln Trp Phe His Asn Glu
50 55 60
Ser Leu Ile Ser Ser Gln Ala Ser Ser Tyr Phe Ile Asp Ala Ala Thr
65 70 75 80
Val Asn Asp Ser Gly Glu Tyr Arg Cys Gln Thr Asn Leu Ser Thr Leu
85 90 95
Ser Asp Pro Val Gln Leu Glu Val His Ile Gly Trp Leu Leu Leu Gln
100 105 110
Ala Pro Arg Trp Val Phe Lys Glu Glu Asp Pro Ile His Leu Arg Cys
115 120 125
His Ser Trp Lys Asn Thr Ala Leu His Lys Val Thr Tyr Leu Gln Asn
130 135 140
Gly Lys Asp Arg Lys Tyr Phe His His Asn Ser Asp Phe His Ile Pro
145 150 155 160
Lys Ala Thr Leu Lys Asp Ser Gly Ser Tyr Phe Cys Arg Gly Leu Val
165 170 175
Gly Ser Lys Asn Val Ser Ser Glu Thr Val Asn Ile Thr Ile Thr Gln
180 185 190
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Ser Pro Pro Gly Tyr Gln
195 200 205
Val Ser Phe Cys Leu Val Met Val Leu Leu Phe Ala Val Asp Thr Gly
210 215 220
Leu Tyr Phe Ser Val Lys Thr Asn Ile
225 230
Claims (90)
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인이 약 70℃ 이상의 용융 온도(Tm)를 갖는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 이종이량체 Fc 영역이 Fcγ 수용체의 선택적 결합을 촉진하기 위한 비대칭 아미노산 변형을 포함하는 변이체 CH2 도메인을 추가로 포함하는 것인 단리된 이종다량체.
- 제2항에 있어서, 변이체 CH2 도메인이 야생형 CH2 도메인에 비해 FcγIIIa 수용체에 선택적으로 결합하는 것인 단리된 이종다량체.
- 제2항 또는 제3항에 있어서, 변이체 CH3 도메인이 약 70℃ 이상의 용융 온도(Tm)를 갖는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 야생형 Fc 영역에 비해 상대적으로 CH3 도메인 내에 추가 이황화 결합을 포함하지 않는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 야생형 Fc 영역에 비해 상대적으로 변이체 CH3 도메인 내에 추가 이황화 결합을 포함하되, 용융 온도(Tm)가 상기 추가 이황화 결합의 부재 하에서 약 70℃ 이상인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 야생형 Fc 영역에 비해 상대적으로 변이체 CH3 도메인 내에 추가 이황화 결합을 포함하고, 상기 변이체 CH3 도메인이 약 77.5℃ 이상의 용융 온도(Tm)를 갖는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 약 90% 초과의 순도를 갖는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 약 95% 이상의 순도를 갖는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 약 98% 이상의 순도를 갖는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, Tm이 약 71℃ 이상인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, Tm이 약 74℃ 이상인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 약 98% 이상의 순도를 갖고 Tm이 약 73℃인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이종이량체 Fc 영역이 약 90% 이상의 순도를 갖고 Tm이 약 75℃인 단리된 이종다량체.
- 제1항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 L351Y 및 Y407A를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366A 및 K409F를 포함하는 것인 단리된 이종다량체.
- 제15항에 있어서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드가 위치 T411, D399, S400, F405, N390 또는 K392에서 추가 아미노산 변형을 포함하는 것인 단리된 이종다량체.
- 제16항에 있어서, 위치 T411에서의 아미노산 변형이 T411N, T411R, T411Q, T411K, T411D, T411E 및 T411W로부터 선택되는 것인 단리된 이종다량체.
- 제16항에 있어서, 위치 D399에서의 아미노산 변형이 D399R, D399W, D399Y 및 D399K로부터 선택되는 것인 단리된 이종다량체.
- 제16항에 있어서, 위치 S400에서의 아미노산 변형이 S400E, S400D, S400R 및 S400K로부터 선택되는 것인 단리된 이종다량체.
- 제16항에 있어서, 위치 F405에서의 아미노산 변형이 F405I, F405M, F405T, F405S, F405V 및 F405W로부터 선택되는 것인 단리된 이종다량체.
- 제16항에 있어서, 위치 N390에서의 아미노산 변형이 N390R, N390K 및 N390D로부터 선택되는 것인 단리된 이종다량체.
- 제16항에 있어서, 위치 K392에서의 아미노산 변형이 K392V, K392M, K392R, K392L, K392F 및 K392E로부터 선택되는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 L351Y 및 Y407A를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366V 및 K409F를 포함하는 것인 단리된 이종다량체.
- 제1항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 Y407A를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366A 및 K409F를 포함하는 것인 단리된 이종다량체.
- 제24항에 있어서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드가 추가 아미노산 변형 K392E, T411E, D399R 및 S400R을 포함하는 것인 단리된 이종다량체.
- 제24항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 D399R, S400R 및 Y407A를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366A, K409F, K392E 및 T411E를 포함하는 것인 단리된 이종다량체.
- 제24항 내지 제26항 중 어느 한 항에 있어서, 변이체 CH3 도메인이 약 74℃ 이상의 용융 온도(Tm)를 갖고, 이종이량체가 약 95% 이상의 순도를 갖는 것인 단리된 이종다량체.
- 제1항에 있어서, 제1 CH3 도메인 폴리펩티드가 위치 L351 및 Y407에서 아미노산 변형을 포함하고, 제2 CH3 도메인 폴리펩티드가 위치 T366에서의 아미노산 변형 및 아미노산 변형 K409F를 포함하는 것인 단리된 이종다량체.
- 제28항에 있어서, 위치 L351에서의 아미노산 변형이 L351Y, L351I, L351D, L351R 및 L351F로부터 선택되는 것인 단리된 이종다량체.
- 제28항에 있어서, 위치 Y407에서의 아미노산 변형이 Y407A, Y407V 및 Y407S로부터 선택되는 것인 단리된 이종다량체.
- 제28항에 있어서, 위치 T366에서의 아미노산 변형이 T366A, T366I, T366L, T366M, T366Y, T366S, T366C, T366V 및 T366W로부터 선택되는 것인 단리된 이종다량체.
- 제28항 내지 제31항 중 어느 한 항에 있어서, 변이체 CH3 도메인이 약 75℃ 이상의 용융 온도(Tm)를 갖고 이종이량체가 약 90% 이상의 순도를 갖는 것인 단리된 이종다량체.
- 제1항에 있어서, 제1 CH3 도메인 폴리펩티드가 위치 F405에서의 아미노산 변형 및 아미노산 변형 L351Y 및 Y407V를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T394W를 포함하는 것인 단리된 이종다량체.
- 제33항에 있어서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드가 위치 K392, T411, T366, L368 또는 S400에서 아미노산 변형을 포함하는 것인 단리된 이종다량체.
- 제33항에 있어서, 위치 F405에서의 아미노산 변형이 F405A, F405I, F405M, F405T, F405S, F405V 또는 F405W인 단리된 이종다량체.
- 제34항에 있어서, 위치 K392에서의 아미노산 변형이 K392V, K392M, K392R, K392L, K392F 또는 K392E인 단리된 이종다량체.
- 제34항에 있어서, 위치 T411에서의 아미노산 변형이 T411N, T411R, T411Q, T411K, T411D, T411E 또는 T411W인 단리된 이종다량체.
- 제34항에 있어서, 위치 S400에서의 아미노산 변형이 S400E, S400D, S400R 또는 S400K인 단리된 이종다량체.
- 제34항에 있어서, 위치 T366에서의 아미노산 변형이 T366A, T366I, T366L, T366M, T366Y, T366S, T366C, T366V 또는 T366W인 단리된 이종다량체.
- 제34항에 있어서, 위치 L368에서의 아미노산 변형이 L368D, L368R, L368T, L368M, L368V, L368F, L368S 또는 L368A인 단리된 이종다량체.
- 제1항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 L351Y, F405A 및 Y407V를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T394W를 포함하는 것인 단리된 이종다량체.
- 제41항에 있어서, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366L 또는 T366I를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366I, K392M 및 T394W를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366L, K392M 및 T394W를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366L 및 T394W를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 F405A 및 Y407V를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366I 및 T394W를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 변이체 CH3 도메인이 표 4에 나열된 변이체들로부터 선택된 아미노산 돌연변이를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 변이체 CH3 도메인이 표 6에 나열된 변이체들로부터 선택된 아미노산 돌연변이를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 변이체 CH3 도메인이 표 7에 나열된 변이체들로부터 선택된 아미노산 돌연변이를 포함하는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 L351Y 및 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366A 및 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 제50항에 있어서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드가 위치 T411, D399, S400, F405, N390 또는 K392에서 추가 아미노산 변형을 포함하는 것인 단리된 이종다량체.
- 제51항에 있어서, 위치 T411에서의 아미노산 변형이 T411N, T411R, T411Q, T411K, T411D, T411E 및 T411W로부터 선택되는 것인 단리된 이종다량체.
- 제51항에 있어서, 위치 D399에서의 아미노산 변형이 D399R, D399W, D399Y 및 D399K로부터 선택되는 것인 단리된 이종다량체.
- 제51항에 있어서, 위치 S400에서의 아미노산 변형이 S400E, S400D, S400R 및 S400K로부터 선택되는 것인 단리된 이종다량체.
- 제51항에 있어서, 위치 F405에서의 아미노산 변형이 F405I, F405M, F405T, F405S, F405V 및 F405W로부터 선택되는 것인 단리된 이종다량체.
- 제51항에 있어서, 위치 N390에서의 아미노산 변형이 N390R, N390K 및 N390D로부터 선택되는 것인 단리된 이종다량체.
- 제51항에 있어서, 위치 K392에서의 아미노산 변형이 K392V, K392M, K392R, K392L, K392F 및 K392E로부터 선택되는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 L351Y 및 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366V 및 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366A 및 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 제59항에 있어서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드가 추가 아미노산 변형 K392E, T411E, D399R 및 S400R을 포함하는 것인 단리된 이종다량체.
- 제59항에 있어서, 제1 CH3 도메인 폴리펩티드가 아미노산 변형 D399R, S400R 및 Y407A를 포함하고, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366A, K409F, K392E 및 T411E를 포함하는 것인 단리된 이종다량체.
- 제59항 내지 제61항 중 어느 한 항에 있어서, 변이체 CH3 도메인이 약 74℃ 이상의 용융 온도(Tm)를 갖고 이종이량체가 약 95% 이상의 순도를 갖는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 위치 L351에서의 아미노산 변형 및 아미노산 변형 Y407A를 포함하는 제1 CH3 도메인 폴리펩티드, 및 위치 T366에서의 아미노산 변형 및 아미노산 변형 K409F를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 제63항에 있어서, 위치 L351에서의 아미노산 변형이 L351Y, L351I, L351D, L351R 및 L351F로부터 선택되는 것인 단리된 이종다량체.
- 제63항에 있어서, 위치 Y407에서의 아미노산 변형이 Y407A, Y407V 및 Y407S로부터 선택되는 것인 단리된 이종다량체.
- 제63항에 있어서, 위치 T366에서의 아미노산 변형이 T366A, T366I, T366L, T366M, T366Y, T366S, T366C, T366V 및 T366W로부터 선택되는 것인 단리된 이종다량체.
- 제63항 내지 제66항 중 어느 한 항에 있어서, 변이체 CH3 도메인이 약 75℃ 이상의 용융 온도(Tm)를 갖고 이종이량체가 약 90% 이상의 순도를 갖는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 위치 F405에서의 아미노산 변형 및 아미노산 변형 L351Y 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 제68항에 있어서, 제1 CH3 도메인 폴리펩티드 또는 제2 CH3 도메인 폴리펩티드가 위치 K392, T411, T366, L368 또는 S400에서 아미노산 변형을 포함하는 것인 단리된 이종다량체.
- 제68항에 있어서, 위치 F405에서의 아미노산 변형이 F405A, F405I, F405M, F405T, F405S, F405V 또는 F405W인 단리된 이종다량체.
- 제69항에 있어서, 위치 K392에서의 아미노산 변형이 K392V, K392M, K392R, K392L, K392F 또는 K392E인 단리된 이종다량체.
- 제69항에 있어서, 위치 T411에서의 아미노산 변형이 T411N, T411R, T411Q, T411K, T411D, T411E 또는 T411W인 단리된 이종다량체.
- 제69항에 있어서, 위치 S400에서의 아미노산 변형이 S400E, S400D, S400R 또는 S400K인 단리된 이종다량체.
- 제69항에 있어서, 위치 T366에서의 아미노산 변형이 T366A, T366I, T366L, T366M, T366Y, T366S, T366C, T366V 또는 T366W인 단리된 이종다량체.
- 제69항에 있어서, 위치 L368에서의 아미노산 변형이 L368D, L368R, L368T, L368M, L368V, L368F, L368S 또는 L368A인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 L351Y, F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 제76항에 있어서, 제2 CH3 도메인 폴리펩티드가 아미노산 변형 T366L 또는 T366I를 포함하는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366I, K392M 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366L, K392M 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366L 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 아미노산 변형 F405A 및 Y407V를 포함하는 제1 CH3 도메인 폴리펩티드, 및 아미노산 변형 T366I 및 T394W를 포함하는 제2 CH3 도메인 폴리펩티드를 포함하는 것인 단리된 이종다량체.
- 제1항 내지 제3항, 제50항, 제58항, 제59항, 제63항, 제68항, 제76항 및 제78항 내지 제81항 중 어느 한 항에 있어서, 상기 이종다량체가 이중특이적 항체인 단리된 이종다량체.
- 제1항 내지 제3항, 제50항, 제58항, 제59항, 제63항, 제68항, 제76항 및 제78항 내지 제81항 중 어느 한 항에 있어서, 상기 이종다량체가 다중특이적 항체인 단리된 이종다량체.
- 제1항 내지 제3항, 제50항, 제58항, 제59항, 제63항, 제68항, 제76항 및 제78항 내지 제81항 중 어느 한 항에 따른 이종다량체 및 약학적으로 허용가능한 담체를 포함하는 조성물.
- 제1항 내지 제3항, 제50항, 제58항, 제59항, 제63항, 제68항, 제76항 및 제78항 내지 제81항 중 어느 한 항에 따른 이종다량체를 코딩하는 핵산을 포함하는 숙주 세포.
- 제1항 내지 제3항, 제50항, 제58항, 제59항, 제63항, 제68항, 제76항 및 제78항 내지 제81항 중 어느 한 항에 있어서, 이종다량체가 하나 이상의 치료 항체를 포함하는 것인 단리된 이종다량체.
- 제1항에 있어서, 이종다량체가 아바고보맙(abagovomab), 아달리무맙(adalimumab), 알렘투주맙(alemtuzumab), 아우로그랍(aurograb), 바피뉴주맙(bapineuzumab), 바실릭시맙(basiliximab), 벨리무맙(belimumab), 베바시주맙(bevacizumab), 브리아키누맙(briakinumab), 카나키누맙(canakinumab), 카투막소맙(catumaxomab), 세르톨리주맙 페골(certolizumab pegol), 세툭시맙(cetuximab), 다클리주맙(daclizumab), 데노수맙(denosumab), 에팔리주맙(efalizumab), 갈릭시맙(galiximab), 젬투주맙 오조가미신(gemtuzumab ozogamicin), 골리무맙(golimumab), 이브리투모맙 티욱세탄(ibritumomab tiuxetan), 인플릭시맙(infliximab), 이필리무맙(ipilimumab), 루밀릭시맙(lumiliximab), 메폴리주맙(mepolizumab), 모타비주맙(motavizumab), 뮤로모납(muromonab), 마이코그랍(mycograb), 나탈리주맙(natalizumab), 니모투주맙(nimotuzumab), 오크렐리주맙(ocrelizumab), 오파투무맙(ofatumumab), 오말리주맙(omalizumab), 팔리비주맙(palivizumab), 파니투무맙(panitumumab), 페르투주맙(pertuzumab), 라니비주맙(ranibizumab), 레슬리주맙(reslizumab), 리툭시맙(rituximab), 테플리주맙(teplizumab), 토실리주맙(tocilizumab)/아틀리주맙(atlizumab), 토시투모맙(tositumomab), 트라스투주맙(trastuzumab), 프록시늄(Proxinium)TM, 렌카렉스(Rencarex)TM, 우스테키누맙(ustekinumab) 및 잘루투무맙(zalutumumab)으로 구성된 군으로부터 선택된 하나 이상의 치료 항체를 포함하는 것인 단리된 이종다량체.
- 암 항원을 특징으로 하는 암을 갖는 환자에서 암을 치료하는 방법으로서, 치료 유효량의 제86항의 이종다량체를 상기 환자에게 투여하는 단계를 포함하는 방법.
- 면역 항원을 특징으로 하는 면역 장애를 갖는 환자에서 면역 장애를 치료하는 방법으로서, 치료 유효량의 제86항의 이종다량체를 상기 환자에게 투여하는 단계를 포함하는 방법.
- 이종이량체 Fc 영역을 포함하는 단리된 이종다량체로서, 이때 상기 이종이량체 Fc 영역이 증가된 안정성을 갖는 이종이량체 형성을 촉진하기 위한 아미노산 돌연변이를 포함하는 변이체 CH3 도메인을 포함하고, 이때 상기 변이체 CH3 도메인이 표 1, 표 6 또는 표 7에 나열된 변이체들로부터 선택되는 것인 단리된 이종다량체.
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US41074610P | 2010-11-05 | 2010-11-05 | |
| US61/410,746 | 2010-11-05 | ||
| US201061425375P | 2010-12-21 | 2010-12-21 | |
| US61/425,375 | 2010-12-21 | ||
| US201161439341P | 2011-02-03 | 2011-02-03 | |
| US61/439,341 | 2011-02-03 | ||
| US201161475614P | 2011-04-14 | 2011-04-14 | |
| US61/475,614 | 2011-04-14 | ||
| US201161491846P | 2011-05-31 | 2011-05-31 | |
| US61/491,846 | 2011-05-31 | ||
| US201161497861P | 2011-06-16 | 2011-06-16 | |
| US61/497,861 | 2011-06-16 | ||
| PCT/CA2011/001238 WO2012058768A1 (en) | 2010-11-05 | 2011-11-04 | Stable heterodimeric antibody design with mutations in the fc domain |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197002645A Division KR101973930B1 (ko) | 2010-11-05 | 2011-11-04 | Fc 도메인 내의 돌연변이를 갖는 안정한 이종이량체 항체 디자인 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130135866A true KR20130135866A (ko) | 2013-12-11 |
Family
ID=46023901
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137014071A KR20130135866A (ko) | 2010-11-05 | 2011-11-04 | Fc 도메인 내의 돌연변이를 갖는 안정한 이종이량체 항체 디자인 |
| KR1020197002645A KR101973930B1 (ko) | 2010-11-05 | 2011-11-04 | Fc 도메인 내의 돌연변이를 갖는 안정한 이종이량체 항체 디자인 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197002645A KR101973930B1 (ko) | 2010-11-05 | 2011-11-04 | Fc 도메인 내의 돌연변이를 갖는 안정한 이종이량체 항체 디자인 |
Country Status (19)
| Country | Link |
|---|---|
| US (3) | US9562109B2 (ko) |
| EP (1) | EP2635607B1 (ko) |
| JP (1) | JP6167040B2 (ko) |
| KR (2) | KR20130135866A (ko) |
| CN (2) | CN103429620B (ko) |
| AU (1) | AU2011325833C1 (ko) |
| BR (1) | BR112013011811A2 (ko) |
| CA (1) | CA2815266C (ko) |
| CY (1) | CY1122409T1 (ko) |
| DK (1) | DK2635607T3 (ko) |
| ES (1) | ES2758994T3 (ko) |
| HR (1) | HRP20192045T1 (ko) |
| HU (1) | HUE047228T2 (ko) |
| MX (1) | MX352929B (ko) |
| PL (1) | PL2635607T3 (ko) |
| PT (1) | PT2635607T (ko) |
| RS (1) | RS59589B1 (ko) |
| RU (1) | RU2604490C2 (ko) |
| WO (1) | WO2012058768A1 (ko) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11155639B2 (en) | 2015-10-12 | 2021-10-26 | Ajou University Industry—Academic Cooperation Foundation | Method for producing antibody CH3 domain heterodimeric mutant pair using yeast mating and CH3 mutant pair produced thereby |
| US11286311B2 (en) | 2012-11-27 | 2022-03-29 | Ajou University Industry-Academic Cooperation Foundation | CH3 domain variant pair inducing formation of heterodimer of heavy chain constant region of antibody at high efficiency, method for preparing same, and use thereof |
| US12060436B2 (en) | 2012-11-28 | 2024-08-13 | Zymeworks Bc Inc. | Engineered immunoglobulin heavy chain-light chain pairs and uses thereof |
Families Citing this family (598)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2965865C (en) | 2002-07-18 | 2021-10-19 | Merus N.V. | Recombinant production of mixtures of antibodies |
| USRE47770E1 (en) | 2002-07-18 | 2019-12-17 | Merus N.V. | Recombinant production of mixtures of antibodies |
| EP3050963B1 (en) | 2005-03-31 | 2019-09-18 | Chugai Seiyaku Kabushiki Kaisha | Process for production of polypeptide by regulation of assembly |
| WO2007114319A1 (ja) | 2006-03-31 | 2007-10-11 | Chugai Seiyaku Kabushiki Kaisha | 抗体の血中動態を制御する方法 |
| ES2654040T3 (es) | 2006-03-31 | 2018-02-12 | Chugai Seiyaku Kabushiki Kaisha | Método de modificación de anticuerpos para la purificación de anticuerpos biespecíficos |
| EP2626372B1 (en) | 2007-03-29 | 2018-03-21 | Genmab A/S | Bispecific antibodies and methods for production thereof |
| WO2009041613A1 (ja) | 2007-09-26 | 2009-04-02 | Chugai Seiyaku Kabushiki Kaisha | 抗体定常領域改変体 |
| CN101874042B9 (zh) | 2007-09-26 | 2019-01-01 | 中外制药株式会社 | 利用cdr的氨基酸取代来改变抗体等电点的方法 |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| HUE028536T2 (en) * | 2008-01-07 | 2016-12-28 | Amgen Inc | Method for producing antibody to FC heterodimer molecules using electrostatic control effects |
| CA2729100C (en) | 2008-06-26 | 2018-01-02 | Acceleron Pharma Inc. | Methods for dosing an activin-actriia antagonist and monitoring of treated patients |
| TWI544077B (zh) | 2009-03-19 | 2016-08-01 | Chugai Pharmaceutical Co Ltd | Antibody constant region change body |
| PL2417156T3 (pl) | 2009-04-07 | 2015-07-31 | Roche Glycart Ag | Trójwartościowe, bispecyficzne przeciwciała |
| US9676845B2 (en) | 2009-06-16 | 2017-06-13 | Hoffmann-La Roche, Inc. | Bispecific antigen binding proteins |
| US9493578B2 (en) | 2009-09-02 | 2016-11-15 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| CA2781519A1 (en) | 2009-09-16 | 2011-03-24 | Genentech, Inc. | Coiled coil and/or tether containing protein complexes and uses thereof |
| US10435458B2 (en) | 2010-03-04 | 2019-10-08 | Chugai Seiyaku Kabushiki Kaisha | Antibody constant region variants with reduced Fcgammar binding |
| TW201138821A (en) | 2010-03-26 | 2011-11-16 | Roche Glycart Ag | Bispecific antibodies |
| PT2560993T (pt) | 2010-04-20 | 2024-09-16 | Genmab As | Proteínas contendo anticorpo heterodimérico fc e métodos para a produção das mesmas |
| CN107253992B (zh) | 2010-05-27 | 2022-03-11 | 根马布股份公司 | 针对her2的单克隆抗体 |
| AU2011283694B2 (en) | 2010-07-29 | 2017-04-13 | Xencor, Inc. | Antibodies with modified isoelectric points |
| EP2603526A1 (en) * | 2010-08-13 | 2013-06-19 | Medimmune Limited | Monomeric polypeptides comprising variant fc regions and methods of use |
| RS59589B1 (sr) | 2010-11-05 | 2019-12-31 | Zymeworks Inc | Dizajniranje stabilnog heterodimernog antitela sa mutacijama u fc domenu |
| KR101398363B1 (ko) | 2010-11-17 | 2014-05-22 | 추가이 세이야쿠 가부시키가이샤 | 혈액응고 제viii 인자의 기능을 대체하는 기능을 갖는 다중특이성 항원 결합 분자 |
| CN103403025B (zh) | 2011-02-28 | 2016-10-12 | 弗·哈夫曼-拉罗切有限公司 | 单价抗原结合蛋白 |
| KR101638224B1 (ko) | 2011-02-28 | 2016-07-08 | 에프. 호프만-라 로슈 아게 | 항원 결합 단백질 |
| JP6101638B2 (ja) | 2011-03-03 | 2017-03-22 | ザイムワークス,インコーポレイテッド | 多価ヘテロマルチマー足場設計及び構築物 |
| JP5972915B2 (ja) * | 2011-03-16 | 2016-08-17 | アムジエン・インコーポレーテツド | Fc変異体 |
| CN107840894A (zh) | 2011-03-25 | 2018-03-27 | 格兰马克药品股份有限公司 | 异二聚体免疫球蛋白 |
| EP2694092B1 (en) | 2011-04-08 | 2017-01-04 | Amgen Inc. | Method of treating or ameliorating metabolic disorders using growth differentiation factor 15 (gdf-15) |
| CA2832389A1 (en) | 2011-04-20 | 2012-10-26 | Genmab A/S | Bispecific antibodies against her2 and cd3 |
| BR112013032630B1 (pt) * | 2011-06-30 | 2022-06-14 | Chugai Seiyaku Kabushiki Kaisha | Polipeptídeo heterodimerizado compreendendo região fc de igg |
| UA117901C2 (uk) | 2011-07-06 | 2018-10-25 | Ґенмаб Б.В. | Спосіб посилення ефекторної функції вихідного поліпептиду, його варіанти та їх застосування |
| WO2013022855A1 (en) * | 2011-08-05 | 2013-02-14 | Xencor, Inc. | Antibodies with modified isoelectric points and immunofiltering |
| EP2747781B1 (en) | 2011-08-23 | 2017-11-15 | Roche Glycart AG | Bispecific antibodies specific for t-cell activating antigens and a tumor antigen and methods of use |
| GB201116092D0 (en) | 2011-09-16 | 2011-11-02 | Bioceros B V | Antibodies and uses thereof |
| AU2012323287B2 (en) * | 2011-10-10 | 2018-02-01 | Xencor, Inc. | A method for purifying antibodies |
| US10851178B2 (en) | 2011-10-10 | 2020-12-01 | Xencor, Inc. | Heterodimeric human IgG1 polypeptides with isoelectric point modifications |
| EP3674320A3 (en) | 2011-10-27 | 2020-08-12 | Genmab A/S | Production of heterodimeric proteins |
| US11851476B2 (en) | 2011-10-31 | 2023-12-26 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule having regulated conjugation between heavy-chain and light-chain |
| JP6326371B2 (ja) * | 2011-11-04 | 2018-05-16 | ザイムワークス,インコーポレイテッド | Fcドメインにおける変異を有する安定なヘテロ二量体抗体デザイン |
| KR102024066B1 (ko) | 2011-11-23 | 2019-09-24 | 비오벤 쓰리 리미티드 | 재조합 단백질 및 그들의 치료적 용도 |
| EP2804631B1 (en) | 2012-01-20 | 2021-03-17 | i2 Pharmaceuticals, Inc. | Surrobody conjugates |
| WO2013113008A1 (en) | 2012-01-26 | 2013-08-01 | Amgen Inc. | Growth differentiation factor 15 (gdf-15) polypeptides |
| AU2013249985B2 (en) | 2012-04-20 | 2017-11-23 | Merus N.V. | Methods and means for the production of Ig-like molecules |
| US9212227B2 (en) | 2012-04-30 | 2015-12-15 | Janssen Biotech, Inc. | ST2L antibody antagonists for the treatment of ST2L-mediated inflammatory pulmonary conditions |
| JP6351572B2 (ja) * | 2012-05-10 | 2018-07-04 | ザイムワークス,インコーポレイテッド | Fcドメインに突然変異を有する免疫グロブリン重鎖のヘテロ多量体構築物 |
| CA2873720A1 (en) * | 2012-05-10 | 2013-11-14 | Zymeworks Inc. | Single-arm monovalent antibody constructs and uses thereof |
| JP6628966B2 (ja) | 2012-06-14 | 2020-01-15 | 中外製薬株式会社 | 改変されたFc領域を含む抗原結合分子 |
| US9499634B2 (en) | 2012-06-25 | 2016-11-22 | Zymeworks Inc. | Process and methods for efficient manufacturing of highly pure asymmetric antibodies in mammalian cells |
| EP3632462A1 (en) | 2012-07-06 | 2020-04-08 | Genmab B.V. | Dimeric protein with triple mutations |
| SG11201408646VA (en) | 2012-07-06 | 2015-01-29 | Genmab Bv | Dimeric protein with triple mutations |
| WO2014012082A2 (en) | 2012-07-13 | 2014-01-16 | Zymeworks Inc. | Multivalent heteromultimer scaffold design an constructs |
| CN104640562A (zh) * | 2012-07-13 | 2015-05-20 | 酵活有限公司 | 包含抗-cd3构建体的双特异性不对称异二聚体 |
| CA2878587A1 (en) * | 2012-07-23 | 2014-01-30 | Zymeworks Inc. | Immunoglobulin constructs comprising selective pairing of the light and heavy chains |
| AU2013306700B2 (en) | 2012-08-24 | 2019-05-02 | Chugai Seiyaku Kabushiki Kaisha | FcgammaRIIb-specific Fc region variant |
| US11236168B2 (en) | 2012-08-24 | 2022-02-01 | Chugai Seiyaku Kabushiki Kaisha | Mouse FcγammaRII-specific Fc antibody |
| ES2692951T3 (es) | 2012-09-27 | 2018-12-05 | Merus N.V. | Anticuerpos IgG biespecíficos como acopladores de células T |
| US9771573B2 (en) | 2012-10-03 | 2017-09-26 | Zymeworks Inc. | Methods of quantitating heavy and light chain polypeptide pairs |
| WO2014056783A1 (en) | 2012-10-08 | 2014-04-17 | Roche Glycart Ag | Fc-free antibodies comprising two fab-fragments and methods of use |
| AU2013337578C1 (en) * | 2012-11-02 | 2018-04-12 | Zymeworks Inc. | Crystal structures of heterodimeric Fc domains |
| JP6571527B2 (ja) * | 2012-11-21 | 2019-09-04 | ウーハン ワイゼットワイ バイオファルマ カンパニー リミテッドWuhan Yzy Biopharma Co., Ltd. | 二重特異性抗体 |
| CA3182876A1 (en) | 2012-11-21 | 2014-05-30 | Janssen Biotech, Inc. | Bispecific egfr/c-met antibodies |
| CA3206122A1 (en) | 2012-11-28 | 2014-06-05 | Zymeworks Bc Inc. | Engineered immunoglobulin heavy chain-light chain pairs and uses thereof |
| US10766960B2 (en) | 2012-12-27 | 2020-09-08 | Chugai Seiyaku Kabushiki Kaisha | Heterodimerized polypeptide |
| WO2014108198A1 (en) | 2013-01-10 | 2014-07-17 | Genmab B.V. | Human igg1 fc region variants and uses thereof |
| US9605084B2 (en) | 2013-03-15 | 2017-03-28 | Xencor, Inc. | Heterodimeric proteins |
| US10131710B2 (en) | 2013-01-14 | 2018-11-20 | Xencor, Inc. | Optimized antibody variable regions |
| US9701759B2 (en) | 2013-01-14 | 2017-07-11 | Xencor, Inc. | Heterodimeric proteins |
| US10738132B2 (en) | 2013-01-14 | 2020-08-11 | Xencor, Inc. | Heterodimeric proteins |
| US10968276B2 (en) | 2013-03-12 | 2021-04-06 | Xencor, Inc. | Optimized anti-CD3 variable regions |
| US10487155B2 (en) | 2013-01-14 | 2019-11-26 | Xencor, Inc. | Heterodimeric proteins |
| US11053316B2 (en) | 2013-01-14 | 2021-07-06 | Xencor, Inc. | Optimized antibody variable regions |
| WO2014113510A1 (en) | 2013-01-15 | 2014-07-24 | Xencor, Inc. | Rapid clearance of antigen complexes using novel antibodies |
| US10047163B2 (en) | 2013-02-08 | 2018-08-14 | Abbvie Stemcentrx Llc | Multispecific constructs |
| ES2775207T3 (es) | 2013-02-26 | 2020-07-24 | Roche Glycart Ag | Moléculas de unión a antígeno activadoras de linfocitos T biespecíficas específicas para CD3 y CEA |
| JP6499087B2 (ja) | 2013-02-26 | 2019-04-10 | ロシュ グリクアート アーゲー | 二重特異性t細胞活性化抗原結合分子 |
| US10858417B2 (en) | 2013-03-15 | 2020-12-08 | Xencor, Inc. | Heterodimeric proteins |
| EP2970461A4 (en) | 2013-03-15 | 2016-11-23 | Janssen Biotech Inc | INTERFERON ALPHA AND OMEGA ANTIBODY ANTAGONISTS |
| EP3421495A3 (en) | 2013-03-15 | 2019-05-15 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| US10106624B2 (en) | 2013-03-15 | 2018-10-23 | Xencor, Inc. | Heterodimeric proteins |
| CN105377889B (zh) | 2013-03-15 | 2020-07-17 | Xencor股份有限公司 | 异二聚体蛋白 |
| US10519242B2 (en) | 2013-03-15 | 2019-12-31 | Xencor, Inc. | Targeting regulatory T cells with heterodimeric proteins |
| MX2015013288A (es) | 2013-03-18 | 2016-04-07 | Biocerox Prod Bv | Anticuerpos anti-cd134 (ox40) humanizados y usos de los mismos. |
| AU2014250434B2 (en) | 2013-04-02 | 2019-08-08 | Chugai Seiyaku Kabushiki Kaisha | Fc region variant |
| AU2014261631B2 (en) | 2013-04-29 | 2019-02-14 | F. Hoffmann-La Roche Ag | FcRn-binding abolished anti-IGF-1R antibodies and their use in the treatment of vascular eye diseases |
| JP6618893B2 (ja) | 2013-04-29 | 2019-12-11 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Fc受容体結合が変更された非対称抗体および使用方法 |
| SG10201800492PA (en) | 2013-04-29 | 2018-03-28 | Hoffmann La Roche | Human fcrn-binding modified antibodies and methods of use |
| US10239951B2 (en) | 2013-05-08 | 2019-03-26 | Zymeworks Inc. | Bispecific HER2 and HER3 antigen binding constructs |
| WO2014190441A1 (en) | 2013-05-31 | 2014-12-04 | Zymeworks Inc. | Heteromultimers with reduced or silenced effector function |
| CN113248615A (zh) | 2013-07-05 | 2021-08-13 | 根马布股份公司 | 人源化或嵌合cd3抗体 |
| US20160355588A1 (en) * | 2013-07-12 | 2016-12-08 | Zymeworks Inc. | Bispecific CD3 and CD19 Antigen Binding Constructs |
| MA38873B1 (fr) * | 2013-07-31 | 2018-11-30 | Amgen Inc | Constructions contenant le facteur 15 de différentiation de croissance (gdf-15) |
| EP3050896B1 (en) * | 2013-09-27 | 2021-07-07 | Chugai Seiyaku Kabushiki Kaisha | Method for producing polypeptide heteromultimer |
| JP6422956B2 (ja) | 2013-10-11 | 2018-11-14 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性ドメイン交換共通可変軽鎖抗体 |
| PL3065774T3 (pl) | 2013-11-06 | 2021-12-13 | Janssen Biotech, Inc | Przeciwciała anty-ccl17 |
| JPWO2015068847A1 (ja) | 2013-11-11 | 2017-03-09 | 中外製薬株式会社 | 改変された抗体可変領域を含む抗原結合分子 |
| WO2015073721A1 (en) * | 2013-11-13 | 2015-05-21 | Zymeworks Inc. | Monovalent antigen binding constructs targeting egfr and/or her2 and uses thereof |
| RU2737882C2 (ru) | 2013-11-27 | 2020-12-04 | Займворкс Инк. | Биспецифические антигенсвязывающие конструкции против her2 |
| DK3736292T3 (da) | 2013-12-17 | 2024-07-22 | Genentech Inc | Anti-CD3-antistoffer og fremgangsmåder til anvendelse |
| BR112016013562A2 (pt) | 2013-12-20 | 2017-10-03 | Hoffmann La Roche | Anticorpos anti-tau(ps422) humanizados, seus usos, e formulações farmacêuticas |
| CA2933384A1 (en) | 2014-01-03 | 2015-07-09 | F. Hoffmann-La Roche Ag | Bispecific anti-hapten/anti-blood brain barrier receptor antibodies, complexes thereof and their use as blood brain barrier shuttles |
| EP3851452A1 (en) | 2014-01-06 | 2021-07-21 | F. Hoffmann-La Roche AG | Monovalent blood brain barrier shuttle modules |
| EP2891664A1 (en) * | 2014-01-07 | 2015-07-08 | Technische Universität München | Novel methods for the stabilisation of immunoglobulin constant domains |
| CA2936785A1 (en) * | 2014-01-15 | 2015-07-23 | Zymeworks Inc. | Bi-specific cd3 and cd19 antigen-binding constructs |
| CN105899534B (zh) | 2014-01-15 | 2020-01-07 | 豪夫迈·罗氏有限公司 | 具有修饰的FCRN和保持的蛋白A结合性质的Fc区变体 |
| CN110981957A (zh) | 2014-01-15 | 2020-04-10 | 豪夫迈·罗氏有限公司 | 具有改善的蛋白A结合作用的Fc区变体 |
| KR20240042540A (ko) | 2014-02-28 | 2024-04-02 | 메뤼스 엔.페. | ErbB-2와 ErbB-3에 결합하는 항체 |
| US9732154B2 (en) | 2014-02-28 | 2017-08-15 | Janssen Biotech, Inc. | Anti-CD38 antibodies for treatment of acute lymphoblastic leukemia |
| JP6771385B2 (ja) | 2014-02-28 | 2020-10-21 | メルス ナムローゼ フェンノートシャップ | 二重特異性抗体および医薬組成物 |
| BR112016022385A2 (pt) | 2014-03-28 | 2018-06-19 | Xencor, Inc | anticorpos específicos que se ligam a cd38 e cd3 |
| UA117289C2 (uk) | 2014-04-02 | 2018-07-10 | Ф. Хоффманн-Ля Рош Аг | Мультиспецифічне антитіло |
| JP6666262B2 (ja) | 2014-04-02 | 2020-03-13 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性抗体の軽鎖誤対合を検出するための方法 |
| CA2943943C (en) | 2014-04-07 | 2023-01-10 | Chugai Seiyaku Kabushiki Kaisha | Immunoactivating antigen-binding molecule |
| JP2017518965A (ja) | 2014-05-02 | 2017-07-13 | モメンタ ファーマシューティカルズ インコーポレイテッ | エンジニアリングされたFc構築物に関連する組成物および方法 |
| SG11201609370QA (en) | 2014-05-13 | 2016-12-29 | Chugai Pharmaceutical Co Ltd | T cell-redirected antigen-binding molecule for cells having immunosuppression function |
| BR112016027888A2 (pt) | 2014-05-28 | 2017-10-24 | Zymeworks Inc | construto de polipeptídeo de ligação ao antígeno isolado, polinucleotídeo isolado ou um conjunto de polinucleotídeos isolados, vetor ou conjunto de vetores, célula isolada, composição farmacêutica, uso do construto, método para tratar um sujeito com uma doença ou distúrbio, método para obter um construto, método para preparar um construto, meio de armazenamento legível por computador, método para produzir um construto de polipeptídeo de ligação com antígeno bi-específico e método para preparar um construto de polipeptídeo de ligação com antígeno isolado |
| US10010498B2 (en) | 2014-06-04 | 2018-07-03 | Acceleron Pharma Inc. | Methods for treatment of amyotrophic lateral sclerosis with follistatin fusion proteins |
| AU2015269333B2 (en) | 2014-06-04 | 2020-05-07 | Acceleron Pharma, Inc. | Methods and compositions for treatment of disorders with follistatin polypeptides |
| TWI713453B (zh) | 2014-06-23 | 2020-12-21 | 美商健生生物科技公司 | 干擾素α及ω抗體拮抗劑 |
| AR100978A1 (es) | 2014-06-26 | 2016-11-16 | Hoffmann La Roche | LANZADERAS CEREBRALES DE ANTICUERPO HUMANIZADO ANTI-Tau(pS422) Y USOS DE LAS MISMAS |
| BR112016029935A2 (pt) | 2014-06-26 | 2017-10-31 | Hoffmann La Roche | ?anticorpos anti-brdu, complexo, formulação farmacêutica e uso de anticorpo? |
| CN107074948B (zh) | 2014-07-11 | 2022-01-28 | 根马布股份公司 | 结合axl的抗体 |
| EP2982692A1 (en) | 2014-08-04 | 2016-02-10 | EngMab AG | Bispecific antibodies against CD3epsilon and BCMA |
| PL3177643T3 (pl) | 2014-08-04 | 2019-09-30 | F.Hoffmann-La Roche Ag | Dwuswoiste cząsteczki wiążące antygen aktywujące komórki T |
| HUE048791T2 (hu) | 2014-09-05 | 2020-09-28 | Janssen Pharmaceutica Nv | CD123 kötõszerek és alkalmazásaik |
| WO2016040294A2 (en) | 2014-09-09 | 2016-03-17 | Janssen Biotech, Inc. | Combination therapies with anti-cd38 antibodies |
| AR101846A1 (es) | 2014-09-12 | 2017-01-18 | Genentech Inc | Anticuerpos anti-cll-1 e inmunoconjugados |
| MA40764A (fr) | 2014-09-26 | 2017-08-01 | Chugai Pharmaceutical Co Ltd | Agent thérapeutique induisant une cytotoxicité |
| US11952421B2 (en) | 2014-10-09 | 2024-04-09 | Bristol-Myers Squibb Company | Bispecific antibodies against CD3EPSILON and ROR1 |
| US11773166B2 (en) | 2014-11-04 | 2023-10-03 | Ichnos Sciences SA | CD3/CD38 T cell retargeting hetero-dimeric immunoglobulins and methods of their production |
| ES2749383T3 (es) | 2014-11-06 | 2020-03-20 | Hoffmann La Roche | Variantes de la región Fc con unión al FcRn modificada y procedimientos de uso |
| KR20170076697A (ko) | 2014-11-06 | 2017-07-04 | 에프. 호프만-라 로슈 아게 | 개질된 FCRN-결합 특성 및 단백질 A-결합 특성을 가진 Fc-영역 변이체 |
| TWI831044B (zh) | 2014-11-11 | 2024-02-01 | 日商中外製藥股份有限公司 | 抗原結合分子、包含抗原結合分子的醫藥組合物以及製造及選擇抗原結合分子之方法 |
| DK3789402T3 (da) | 2014-11-20 | 2022-09-19 | Hoffmann La Roche | Kombinationsbehandling med T-celleaktiverende bispecifikke antigenbindende molekyler og PD-1-aksebindende antagonister |
| EP3023437A1 (en) | 2014-11-20 | 2016-05-25 | EngMab AG | Bispecific antibodies against CD3epsilon and BCMA |
| RS60615B1 (sr) | 2014-11-20 | 2020-08-31 | Hoffmann La Roche | Zajednički laki lanci i postupci upotrebe |
| CN110894240B (zh) | 2014-11-26 | 2022-04-15 | 森科股份有限公司 | 结合cd3和肿瘤抗原的异二聚体抗体 |
| US10259887B2 (en) | 2014-11-26 | 2019-04-16 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and tumor antigens |
| AU2015353416C1 (en) | 2014-11-26 | 2022-01-27 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and CD38 |
| CA2968258A1 (en) | 2014-11-27 | 2016-06-02 | Zymeworks Inc. | Methods of using bispecific antigen-binding constructs targeting her2 |
| WO2016087416A1 (en) | 2014-12-03 | 2016-06-09 | F. Hoffmann-La Roche Ag | Multispecific antibodies |
| EP3233907B1 (en) | 2014-12-19 | 2021-03-03 | Genmab A/S | Rodent bispecific heterodimeric proteins |
| SG11201700841QA (en) | 2014-12-19 | 2017-03-30 | Chugai Pharmaceutical Co Ltd | Anti-myostatin antibodies, polypeptides containing variant fc regions, and methods of use |
| WO2016105450A2 (en) | 2014-12-22 | 2016-06-30 | Xencor, Inc. | Trispecific antibodies |
| MA41375A (fr) | 2015-01-22 | 2017-11-28 | Lilly Co Eli | Anticorps igg bispécifiques et leurs procédés de préparation |
| CN104610453A (zh) * | 2015-01-23 | 2015-05-13 | 张帆 | 一类抗her2双靶向抗体、其制备方法及用途 |
| WO2016141387A1 (en) | 2015-03-05 | 2016-09-09 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| WO2016154601A1 (en) * | 2015-03-26 | 2016-09-29 | Acceleron Pharma Inc. | Follistatin-related fusion proteins and uses thereof |
| US11142587B2 (en) | 2015-04-01 | 2021-10-12 | Chugai Seiyaku Kabushiki Kaisha | Method for producing polypeptide hetero-oligomer |
| AU2016258115A1 (en) | 2015-05-06 | 2017-11-23 | Janssen Biotech, Inc. | Prostate specific membrane antigen (PSMA) bispecific binding agents and uses thereof |
| SG11201708620QA (en) | 2015-05-08 | 2017-11-29 | Xencor Inc | Heterodimeric antibodies that bind cd3 and tumor antigens |
| KR102602754B1 (ko) | 2015-05-20 | 2023-11-14 | 얀센 바이오테크 인코포레이티드 | 경쇄 아밀로이드증 및 다른 cd38-양성 혈액학적 악성종양을 치료하기 위한 항-cd38 항체 |
| TWI773646B (zh) | 2015-06-08 | 2022-08-11 | 美商宏觀基因股份有限公司 | 結合lag-3的分子和其使用方法 |
| AR105026A1 (es) | 2015-06-16 | 2017-08-30 | Genentech Inc | ANTICUERPOS MADURADOS POR AFINIDAD Y HUMANIZADOS PARA FcRH5 Y MÉTODOS PARA SU USO |
| US10501545B2 (en) | 2015-06-16 | 2019-12-10 | Genentech, Inc. | Anti-CLL-1 antibodies and methods of use |
| ES2890783T3 (es) | 2015-06-22 | 2022-01-24 | Janssen Biotech Inc | Terapias de combinación para enfermedades malignas hematológicas con anticuerpos anti-CD38 e inhibidores de survivina |
| US9862763B2 (en) | 2015-06-24 | 2018-01-09 | Hoffmann-La Roche Inc. | Humanized anti-tau(pS422) antibodies and methods of use |
| FI3313441T3 (fi) | 2015-06-24 | 2024-03-28 | Janssen Biotech Inc | Kiinteiden kasvainten immunomodulaatio ja hoito spesifisesti cd38:aa sitovilla vasta-aineilla |
| CA2991880A1 (en) | 2015-07-10 | 2017-01-19 | Merus N.V. | Human cd3 binding antibody |
| PT3319993T (pt) | 2015-07-10 | 2020-04-22 | Genmab As | Conjugados de anticorpo-fármaco específicos de axl para tratamento de cancro |
| CN108368172B (zh) | 2015-07-15 | 2022-06-14 | 根马布股份公司 | 人源化或嵌合cd3抗体 |
| EP3322735A4 (en) | 2015-07-15 | 2019-03-13 | Zymeworks Inc. | BISPECIFIC ANTIGEN-BINDING CONSTRUCTS CONJUGATED TO A MEDICINAL PRODUCT |
| RU2737378C2 (ru) * | 2015-07-24 | 2020-11-27 | Гликник Инк. | Гибридные белки фрагментов белков человека для создания упорядоченно мультимеризованных композиций областей fc иммуноглобулинов с усиленным связыванием с системой комплемента |
| PL3328419T3 (pl) | 2015-07-30 | 2021-12-27 | Macrogenics, Inc. | Cząsteczki wiążące pd-1 i sposoby ich zastosowania |
| WO2017024146A1 (en) | 2015-08-05 | 2017-02-09 | Janssen Biotech, Inc. | Anti-cd154 antibodies and methods of using them |
| MA53750A (fr) | 2015-08-17 | 2021-09-15 | Janssen Pharmaceutica Nv | Anticorps anti-bcma, molécules de liaison d'antigène bispécifiques qui se lient au bcma et cd3 et leurs utilisations |
| CN108368510B (zh) | 2015-09-30 | 2023-09-01 | 詹森生物科技公司 | 特异性结合人cd40的激动性抗体和使用方法 |
| AR106188A1 (es) | 2015-10-01 | 2017-12-20 | Hoffmann La Roche | Anticuerpos anti-cd19 humano humanizados y métodos de utilización |
| EP3356410B1 (en) | 2015-10-02 | 2021-10-20 | F. Hoffmann-La Roche AG | Bispecific anti-ceaxcd3 t cell activating antigen binding molecules |
| WO2017055393A1 (en) | 2015-10-02 | 2017-04-06 | F. Hoffmann-La Roche Ag | Anti-cd3xtim-3 bispecific t cell activating antigen binding molecules |
| WO2017055385A1 (en) | 2015-10-02 | 2017-04-06 | F. Hoffmann-La Roche Ag | Anti-cd3xgd2 bispecific t cell activating antigen binding molecules |
| JP6734919B2 (ja) | 2015-10-02 | 2020-08-05 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 同時結合を測定するための細胞ベースのfretアッセイ法 |
| WO2017055395A1 (en) | 2015-10-02 | 2017-04-06 | F. Hoffmann-La Roche Ag | Anti-cd3xrob04 bispecific t cell activating antigen binding molecules |
| AR106199A1 (es) | 2015-10-02 | 2017-12-20 | Hoffmann La Roche | Moléculas de unión a antígeno biespecíficas activadoras de células t |
| UA124925C2 (en) | 2015-10-02 | 2021-12-15 | Hoffmann La Roche | Bispecific antibodies specific for pd1 and tim3 |
| EP3150637A1 (en) | 2015-10-02 | 2017-04-05 | F. Hoffmann-La Roche AG | Multispecific antibodies |
| CN108026179A (zh) | 2015-10-02 | 2018-05-11 | 豪夫迈·罗氏有限公司 | 结合间皮素和cd3的双特异性t细胞活化性抗原结合分子 |
| WO2017055392A1 (en) | 2015-10-02 | 2017-04-06 | F. Hoffmann-La Roche Ag | Anti-cd3xcd44v6 bispecific t cell activating antigen binding molecules |
| EP3913000A1 (en) | 2015-10-02 | 2021-11-24 | F. Hoffmann-La Roche AG | Bispecific anti-cd19xcd3 t cell activating antigen binding molecules |
| RU2731202C2 (ru) | 2015-10-08 | 2020-08-31 | Макродженикс, Инк. | Комбинированная терапия для лечения рака |
| EP3359576A4 (en) | 2015-10-08 | 2019-08-28 | Zymeworks Inc. | ANTIGENBINDING POLYPEPTIDE CONSTRUCTS WITH KAPPA AND LAMBDA LIGHT CHAINS AND USES THEREOF |
| SI3365373T1 (sl) | 2015-10-23 | 2021-08-31 | Merus N.V. | Vezne molekule, ki zaviranjo rast raka |
| IL295756A (en) | 2015-10-29 | 2022-10-01 | Hoffmann La Roche | Antibodies against fc-variable region and methods of use |
| MX2018005545A (es) | 2015-11-02 | 2019-02-20 | Janssen Pharmaceutica Nv | Anticuerpos anti-il1rap, moleculas de union a antigenos biespecificas que se unen a il1rap y cd3, y usos de estas. |
| CN108472369A (zh) | 2015-11-03 | 2018-08-31 | 詹森生物科技公司 | 抗cd38抗体的皮下制剂及其用途 |
| SG11201803520PA (en) | 2015-11-03 | 2018-05-30 | Janssen Biotech Inc | Antibodies specifically binding pd-1 and their uses |
| US11660340B2 (en) | 2015-11-18 | 2023-05-30 | Chugai Seiyaku Kabushiki Kaisha | Combination therapy using T cell redirection antigen binding molecule against cell having immunosuppressing function |
| US11649293B2 (en) | 2015-11-18 | 2023-05-16 | Chugai Seiyaku Kabushiki Kaisha | Method for enhancing humoral immune response |
| JP7058219B2 (ja) | 2015-12-07 | 2022-04-21 | ゼンコア インコーポレイテッド | Cd3及びpsmaに結合するヘテロ二量体抗体 |
| EP3178848A1 (en) | 2015-12-09 | 2017-06-14 | F. Hoffmann-La Roche AG | Type ii anti-cd20 antibody for reducing formation of anti-drug antibodies |
| AU2016368469B2 (en) | 2015-12-09 | 2023-11-02 | F. Hoffmann-La Roche Ag | Type II anti-CD20 antibody for reducing formation of anti-drug antibodies |
| KR102424513B1 (ko) | 2015-12-14 | 2022-07-25 | 마크로제닉스, 인크. | Pd-1 및 ctla-4과의 면역반응성을 가진 이중특이적 분자, 및 이것의 사용 방법 |
| CN106883297B (zh) * | 2015-12-16 | 2019-12-13 | 苏州康宁杰瑞生物科技有限公司 | 基于ch3结构域的异二聚体分子、其制备方法及用途 |
| AU2016371034A1 (en) | 2015-12-17 | 2018-05-31 | Janssen Biotech, Inc. | Antibodies specifically binding HLA-DR and their uses |
| WO2017115773A1 (ja) | 2015-12-28 | 2017-07-06 | 中外製薬株式会社 | Fc領域含有ポリペプチドの精製を効率化するための方法 |
| AR107303A1 (es) | 2016-01-08 | 2018-04-18 | Hoffmann La Roche | Métodos de tratamiento de cánceres positivos para ace utilizando antagonistas de unión a eje pd-1 y anticuerpos biespecíficos anti-ace / anti-cd3, uso, composición, kit |
| TW201730212A (zh) | 2016-02-17 | 2017-09-01 | 宏觀基因股份有限公司 | Ror1-結合分子及其使用方法 |
| MX2018010988A (es) | 2016-03-14 | 2019-01-21 | Chugai Pharmaceutical Co Ltd | Farmaco terapeutico que induce lesion celular para usarse en terapia de cancer. |
| WO2017165464A1 (en) | 2016-03-21 | 2017-09-28 | Elstar Therapeutics, Inc. | Multispecific and multifunctional molecules and uses thereof |
| SI3433280T1 (sl) | 2016-03-22 | 2023-07-31 | F. Hoffmann-La Roche Ag | S proteazo aktivirane bispecifične molekule celic T |
| MX2018012433A (es) | 2016-04-15 | 2019-03-01 | Macrogenics Inc | Moleculas de union b7-h3 novedosas, conjugados anticuerpo-farmaco de los mismos y metodos de uso de los mismos. |
| SG11201809620UA (en) | 2016-05-02 | 2018-11-29 | Hoffmann La Roche | The contorsbody - a single chain target binder |
| JP7045333B6 (ja) | 2016-05-23 | 2022-05-06 | モメンタ ファーマシューティカルズ インコーポレイテッド | 操作されたFcコンストラクトに関する組成物及び方法 |
| EP3252078A1 (en) | 2016-06-02 | 2017-12-06 | F. Hoffmann-La Roche AG | Type ii anti-cd20 antibody and anti-cd20/cd3 bispecific antibody for treatment of cancer |
| CN110603266A (zh) | 2016-06-02 | 2019-12-20 | 豪夫迈·罗氏有限公司 | 用于治疗癌症的ii型抗cd20抗体和抗cd20/cd3双特异性抗体 |
| CA3026420A1 (en) | 2016-06-07 | 2017-12-14 | Gliknik Inc. | Cysteine-optimized stradomers |
| CA3026151A1 (en) | 2016-06-14 | 2017-12-21 | Xencor, Inc. | Bispecific checkpoint inhibitor antibodies |
| CN109563124A (zh) * | 2016-06-17 | 2019-04-02 | 豪夫迈·罗氏有限公司 | 多特异性抗体的纯化 |
| US20190233533A1 (en) | 2016-06-28 | 2019-08-01 | Umc Utrecht Holding B.V. | Treatment Of IgE-Mediated Diseases With Antibodies That Specifically Bind CD38 |
| EP3475304B1 (en) | 2016-06-28 | 2022-03-23 | Xencor, Inc. | Heterodimeric antibodies that bind somatostatin receptor 2 |
| EP4410378A3 (en) | 2016-07-01 | 2024-10-09 | Resolve Therapeutics, LLC | Optimized binuclease fusions and methods |
| EP3478717B1 (en) | 2016-07-04 | 2022-01-05 | F. Hoffmann-La Roche AG | Novel antibody format |
| BR112019000512A2 (pt) | 2016-07-14 | 2019-04-24 | Genmab A/S | anticorpo, ácido nucleico, vetor de expressão, célula hospedeira, composição, métodos de tratamento de uma doença, para produzir um anticorpo biespecífico e para detectar se a reticulação entre as células que expressam cd40 e cd137 ocorre em uma amostra, uso de um anticorpo multiespecífico, e, kit |
| CN109476763B (zh) * | 2016-07-19 | 2023-11-07 | 伊班绰斯有限责任公司 | 双特异性蛋白质及其制备方法 |
| TWI781108B (zh) | 2016-07-20 | 2022-10-21 | 比利時商健生藥品公司 | 抗gprc5d抗體、結合gprc5d與cd3之雙特異性抗原結合分子及其用途 |
| WO2018026942A1 (en) * | 2016-08-02 | 2018-02-08 | Merrimack Pharmaceuticals, Inc. | Heteromeric polypeptides |
| BR112019002394B1 (pt) * | 2016-08-10 | 2021-12-21 | Ajou University Industry-Academic Cooperation Foundation | Proteína heterodimérica fundida com fc e seu uso |
| CN109863170B (zh) | 2016-08-12 | 2024-08-16 | 詹森生物科技公司 | 具有增强的激动作用和效应子功能的工程化抗体及其他含Fc结构域分子 |
| EP3497126A4 (en) | 2016-08-12 | 2020-04-08 | Janssen Biotech, Inc. | ANTIBODIES OF FC MODIFIED ANTI-TNFR SUPERFAMILY HAVING IMPROVED AGONIST ACTIVITY AND METHODS OF USE THEREOF |
| US10793632B2 (en) | 2016-08-30 | 2020-10-06 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| WO2018045110A1 (en) | 2016-08-30 | 2018-03-08 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| CA3035681A1 (en) | 2016-09-29 | 2018-04-05 | Beijing Hanmi Pharmaceutical Co., Ltd. | Heterodimeric immunoglobulin constructs and preparation methods thereof |
| WO2018060301A1 (en) | 2016-09-30 | 2018-04-05 | F. Hoffmann-La Roche Ag | Bispecific antibodies against cd3 |
| JP6785372B2 (ja) | 2016-09-30 | 2020-11-18 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性分子の機能分析のためのsprに基づく二重結合アッセイ |
| US11440949B2 (en) | 2016-10-05 | 2022-09-13 | Acceleron Pharma Inc. | TGF-beta superfamily type I and type II receptor heteromultimers and uses thereof |
| PE20191034A1 (es) | 2016-10-14 | 2019-08-05 | Xencor Inc | Proteinas de fusion heterodimericas biespecificas que contienen proteinas de fusion fc il-15/il-15r y fragmentos de anticuerpo pd-1 |
| JOP20190097A1 (ar) | 2016-10-27 | 2019-04-28 | Janssen Pharmaceutica Nv | الجلوبولينات المناعية واستخداماتها |
| BR112019008702A2 (pt) | 2016-11-01 | 2019-07-16 | Genmab B.V. | polipeptídeo, método de diminuição de uma função fc efetora de um polipeptídeo, composição, método de tratamento, kit de partes, e, uso de um polipeptídeo ou composição. |
| MX2019005438A (es) | 2016-11-15 | 2019-08-16 | Genentech Inc | Dosificacion para tratamiento con anticuerpos bispecificos anti-cd20 / anti-cd3. |
| TW201829463A (zh) | 2016-11-18 | 2018-08-16 | 瑞士商赫孚孟拉羅股份公司 | 抗hla-g抗體及其用途 |
| PE20191080A1 (es) | 2016-11-18 | 2019-08-20 | Beijing Hanmi Pharmaceutical Co Ltd | Anticuerpo biespecifico heterodimerico estructural de anticuerpo natural anti-pd-1/anti-her2 y metodo para preparar el mismo |
| AR110424A1 (es) | 2016-12-23 | 2019-03-27 | Macrogenics Inc | Moléculas de unión a adam9 y métodos de uso de las mismas |
| KR102624254B1 (ko) | 2017-01-06 | 2024-01-12 | 모멘타 파머슈티컬스 인코포레이티드 | 유전자 조작 Fc 작제물에 관한 조성물 및 방법 |
| WO2018129522A1 (en) | 2017-01-09 | 2018-07-12 | Torch Therapeutics | Conditionally effective bispecific therapeutics |
| WO2018141894A1 (en) * | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Preferred pairing of antibody domains |
| AU2018219887B2 (en) | 2017-02-08 | 2024-08-15 | Dragonfly Therapeutics, Inc. | Multi-specific binding proteins for activation of natural killer cells and therapeutic uses thereof to treat cancer |
| SG11201906961UA (en) | 2017-02-10 | 2019-08-27 | Genmab Bv | Polypeptide variants and uses thereof |
| WO2018151820A1 (en) | 2017-02-16 | 2018-08-23 | Elstar Therapeutics, Inc. | Multifunctional molecules comprising a trimeric ligand and uses thereof |
| DK3583120T5 (da) | 2017-02-17 | 2024-09-02 | Denali Therapeutics Inc | Modificerede transferrinreceptorbindende polypeptider |
| EP4273258A3 (en) | 2017-02-20 | 2024-01-17 | Dragonfly Therapeutics, Inc. | Proteins binding her2, nkg2d and cd16 |
| EP3586872A4 (en) | 2017-02-24 | 2020-12-30 | Chugai Seiyaku Kabushiki Kaisha | PHARMACEUTICAL COMPOSITION, ANTIG-BINDING MOLECULES, TREATMENT METHODS AND SCREENING METHODS |
| CA3099179A1 (en) * | 2017-02-27 | 2018-08-30 | Dragonfly Therapeutics, Inc. | Multispecific binding proteins targeting caix, ano1, mesothelin, trop2, cea, or claudin-18.2 |
| CA3055127A1 (en) | 2017-03-09 | 2018-09-13 | Genmab A/S | Antibodies against pd-l1 |
| NZ756132A (en) | 2017-03-10 | 2022-02-25 | Hoffmann La Roche | Method for producing multispecific antibodies |
| EP3596108A4 (en) | 2017-03-15 | 2020-12-23 | Pandion Operations, Inc. | TARGETED IMMUNOTOLERANCE |
| NZ757603A (en) | 2017-03-31 | 2024-05-31 | Genmab Holding B V | Bispecific anti-cd37 antibodies, monoclonal anti-cd37 antibodies and methods of use thereof |
| MX2019011660A (es) | 2017-03-31 | 2019-11-18 | Merus Nv | Anticuerpos biespecificos que se unen al receptor 2 del factor de crecimiento humano (erbb-2) y receptor 3 del factor de crecimiento humano (erbb3) para usarse en el tratamiento de celulas que tienen un gen de fusion de neuregulina-1 (nrg1). |
| JP2020512836A (ja) * | 2017-04-01 | 2020-04-30 | 北京韓美薬品有限公司 | 抗pd−l1/抗pd−1天然抗体構造様ヘテロダイマー二重特異性抗体およびその調製方法 |
| PE20191494A1 (es) | 2017-04-03 | 2019-10-21 | Hoffmann La Roche | Inmunoconjugados de un anticuerpo anti-pd-1 con un il-2 mutante o con il-15 |
| JP7247101B2 (ja) | 2017-04-03 | 2023-03-28 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | Steap-1に結合する抗体 |
| CN110382525B (zh) | 2017-04-03 | 2023-10-20 | 豪夫迈·罗氏有限公司 | 免疫缀合物 |
| TWI690538B (zh) | 2017-04-05 | 2020-04-11 | 瑞士商赫孚孟拉羅股份公司 | 特異性結合至pd1至lag3的雙特異性抗體 |
| AU2018250641A1 (en) | 2017-04-11 | 2019-10-31 | Inhibrx Biosciences, Inc. | Multispecific polypeptide constructs having constrained CD3 binding and methods of using the same |
| JOP20190222A1 (ar) | 2017-04-11 | 2019-09-24 | Zymeworks Inc | الأجسام المضادة ثنائية النوعية المضادة لـ pd-l1 والمضادة لـ tim-3 |
| KR20190136076A (ko) | 2017-04-13 | 2019-12-09 | 에프. 호프만-라 로슈 아게 | 암 치료 방법에 사용하기 위한 인터루킨-2 면역접합체, cd40 작용제 및 임의적인 pd-1 축 결합 길항제 |
| BR112019024127A2 (pt) | 2017-05-24 | 2020-06-23 | Pandion Therapeutics, Inc. | Imunotolerância alvejada |
| JP2020522254A (ja) | 2017-05-31 | 2020-07-30 | エルスター セラピューティクス, インコーポレイテッド | 骨髄増殖性白血病(mpl)タンパク質に結合する多特異性分子およびその使用 |
| CA3065171A1 (en) | 2017-06-05 | 2018-12-13 | Janssen Biotech, Inc. | Engineered multispecific antibodies and other multimeric proteins with asymmetrical ch2-ch3 region mutations |
| MA52459A (fr) | 2017-06-05 | 2021-03-10 | Janssen Biotech Inc | Anticorps se liant spécifiquement à pd-1 et leurs méthodes d'utilisation |
| CN111328335A (zh) | 2017-06-07 | 2020-06-23 | 根马布私人有限公司 | 基于突变igg六聚体的治疗性抗体 |
| JP7282383B2 (ja) | 2017-06-14 | 2023-05-29 | ディンフー バイオターゲット カンパニー リミテッド | タンパク質性ヘテロ二量体及びその用途 |
| AU2018291497A1 (en) | 2017-06-30 | 2020-01-16 | Xencor, Inc. | Targeted heterodimeric Fc fusion proteins containing IL-15/IL-15Ra and antigen binding domains |
| RU2019142330A (ru) | 2017-06-30 | 2021-07-30 | Займворкс, Инк. | Стабилизированные химерные fab |
| AR112603A1 (es) | 2017-07-10 | 2019-11-20 | Lilly Co Eli | Anticuerpos biespecíficos inhibidores de punto de control |
| WO2019025545A1 (en) | 2017-08-04 | 2019-02-07 | Genmab A/S | BINDING AGENTS BINDING TO PD-L1 AND CD137 AND THEIR USE |
| KR20200042485A (ko) | 2017-08-09 | 2020-04-23 | 메뤼스 엔.페. | EGFR 및 cMET에 결합하는 항체 |
| WO2019035938A1 (en) | 2017-08-16 | 2019-02-21 | Elstar Therapeutics, Inc. | MULTISPECIFIC MOLECULES BINDING TO BCMA AND USES THEREOF |
| JP7374091B2 (ja) | 2017-08-22 | 2023-11-06 | サナバイオ, エルエルシー | 可溶性インターフェロン受容体およびその使用 |
| WO2019057180A1 (en) * | 2017-09-25 | 2019-03-28 | Dingfu Biotarget Co., Ltd. | PROTEIN HETÉRODIMÈRE AND USE THEREOF |
| EP3697441B1 (en) | 2017-10-20 | 2023-06-07 | F. Hoffmann-La Roche AG | Method for generating multispecific antibodies from monospecific antibodies |
| BR112020007736A2 (pt) | 2017-10-30 | 2020-10-20 | F. Hoffmann-La Roche Ag | composição e método de tratamento |
| WO2019086394A1 (en) | 2017-11-01 | 2019-05-09 | F. Hoffmann-La Roche Ag | The compbody - a multivalent target binder |
| MA50505A (fr) | 2017-11-01 | 2020-09-09 | Hoffmann La Roche | Anticorps 2 + 1 bispécifiques (contorsbodies) |
| WO2019086499A1 (en) | 2017-11-01 | 2019-05-09 | F. Hoffmann-La Roche Ag | Novel tnf family ligand trimer-containing antigen binding molecules |
| AU2018358904A1 (en) | 2017-11-01 | 2020-04-16 | F. Hoffmann-La Roche Ag | TriFab-contorsbody |
| US10981992B2 (en) | 2017-11-08 | 2021-04-20 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| EP3706793A1 (en) | 2017-11-08 | 2020-09-16 | Xencor, Inc. | Bispecific and monospecific antibodies using novel anti-pd-1 sequences |
| KR20200093639A (ko) * | 2017-12-04 | 2020-08-05 | 북경한미약품 유한공사 | 천연 항체 구조-유사 헤테로다이머 형태의 항 pd-l1/항 cd47 이중특이성 항체 및 이의 제조 |
| TW201938194A (zh) | 2017-12-05 | 2019-10-01 | 日商中外製藥股份有限公司 | 包含結合cd3及cd137的改變的抗體可變區之抗原結合分子 |
| US10946068B2 (en) | 2017-12-06 | 2021-03-16 | Pandion Operations, Inc. | IL-2 muteins and uses thereof |
| US10174092B1 (en) | 2017-12-06 | 2019-01-08 | Pandion Therapeutics, Inc. | IL-2 muteins |
| MX2020006155A (es) | 2017-12-12 | 2020-08-13 | Macrogenics Inc | Moleculas de union a cd-16 biespecificas y su uso en el tratamiento de enfermedades. |
| WO2019126401A1 (en) | 2017-12-19 | 2019-06-27 | Surrozen, Inc. | Anti-lrp5/6 antibodies and methods of use |
| US11773171B2 (en) | 2017-12-19 | 2023-10-03 | Surrozen Operating, Inc. | WNT surrogate molecules and uses thereof |
| EP3728323A4 (en) | 2017-12-19 | 2022-01-26 | Surrozen Operating, Inc. | ANTI-FZD ANTIBODIES AND METHODS OF USE |
| JP2021506291A (ja) | 2017-12-19 | 2021-02-22 | ゼンコア インコーポレイテッド | 改変されたil−2 fc融合タンパク質 |
| MX2020006119A (es) | 2017-12-21 | 2020-08-24 | Hoffmann La Roche | Anticuerpos de union a hla-a2/wt1. |
| WO2019122054A1 (en) | 2017-12-22 | 2019-06-27 | F. Hoffmann-La Roche Ag | Depletion of light chain mispaired antibody variants by hydrophobic interaction chromatography |
| JP7314146B2 (ja) | 2017-12-28 | 2023-07-25 | 中外製薬株式会社 | 細胞傷害誘導治療剤 |
| WO2019145455A1 (en) | 2018-01-24 | 2019-08-01 | Genmab B.V. | Polypeptide variants and uses thereof |
| WO2019148412A1 (en) | 2018-02-01 | 2019-08-08 | Merck Sharp & Dohme Corp. | Anti-pd-1/lag3 bispecific antibodies |
| SG11202006712XA (en) | 2018-02-06 | 2020-08-28 | Hoffmann La Roche | Treatment of ophthalmologic diseases |
| AU2019218136A1 (en) | 2018-02-08 | 2020-08-13 | Dragonfly Therapeutics, Inc. | Antibody variable domains targeting the NKG2D receptor |
| MA51747A (fr) | 2018-02-08 | 2020-12-16 | Amgen Inc | Formulation d'anticorps pharmaceutique à ph faible |
| AR115360A1 (es) | 2018-02-08 | 2021-01-13 | Genentech Inc | Moléculas de unión al antígeno y métodos de uso |
| WO2019153200A1 (zh) | 2018-02-08 | 2019-08-15 | 北京韩美药品有限公司 | 抗pd-1/抗her2天然抗体结构样异源二聚体形式双特异抗体及其制备 |
| TWI829667B (zh) | 2018-02-09 | 2024-01-21 | 瑞士商赫孚孟拉羅股份公司 | 結合gprc5d之抗體 |
| KR20200120927A (ko) | 2018-02-11 | 2020-10-22 | 베이징 한미 파마슈티컬 컴퍼니 리미티드 | 항-pd-1/항-vegf 천연 항체 구조-유사 이형이량체형 이중특이성 항체 및 그의 제조 |
| JP7466442B2 (ja) | 2018-02-14 | 2024-04-12 | 中外製薬株式会社 | 抗原結合分子および組合せ |
| US11685781B2 (en) | 2018-02-15 | 2023-06-27 | Macrogenics, Inc. | Variant CD3-binding domains and their use in combination therapies for the treatment of disease |
| EP3765493A2 (en) | 2018-03-12 | 2021-01-20 | Genmab A/S | Antibodies |
| MX2020009469A (es) | 2018-03-13 | 2021-01-29 | Zymeworks Inc | Conjugados de anticuerpo y farmaco anti-her2 biparatopicos y metodos de uso. |
| WO2019178362A1 (en) | 2018-03-14 | 2019-09-19 | Elstar Therapeutics, Inc. | Multifunctional molecules that bind to calreticulin and uses thereof |
| WO2019178364A2 (en) | 2018-03-14 | 2019-09-19 | Elstar Therapeutics, Inc. | Multifunctional molecules and uses thereof |
| CA3096052A1 (en) | 2018-04-04 | 2019-10-10 | Xencor, Inc. | Heterodimeric antibodies that bind fibroblast activation protein |
| CN111954537A (zh) | 2018-04-09 | 2020-11-17 | 美国安进公司 | 生长分化因子15融合蛋白 |
| US20190330366A1 (en) | 2018-04-11 | 2019-10-31 | Inhibrx, Inc. | Multispecific polypeptide constructs having constrained cd3 binding and related methods and uses |
| US11524991B2 (en) | 2018-04-18 | 2022-12-13 | Xencor, Inc. | PD-1 targeted heterodimeric fusion proteins containing IL-15/IL-15Ra Fc-fusion proteins and PD-1 antigen binding domains and uses thereof |
| JP7516254B2 (ja) | 2018-04-18 | 2024-07-16 | ゼンコア インコーポレイテッド | Il-15/il-15raヘテロ二量体fc融合タンパク質およびその使用 |
| AR115052A1 (es) | 2018-04-18 | 2020-11-25 | Hoffmann La Roche | Anticuerpos multiespecíficos y utilización de los mismos |
| CA3097741A1 (en) | 2018-04-18 | 2019-10-24 | Xencor, Inc. | Tim-3 targeted heterodimeric fusion proteins containing il-15/il-15ra fc-fusion proteins and tim-3 antigen binding domains |
| WO2019204646A1 (en) | 2018-04-18 | 2019-10-24 | Xencor, Inc. | Lag-3 targeted heterodimeric fusion proteins containing il-15/il-15ra fc-fusion proteins and lag-3 antigen binding domains |
| MX2020011552A (es) | 2018-05-03 | 2020-11-24 | Genmab Bv | Combinaciones de variantes de anticuerpos y usos de las mismas. |
| BR112020023187A2 (pt) | 2018-05-16 | 2021-04-20 | Janssen Biotech, Inc. | métodos para tratamento de cânceres e de aumento da eficácia de agentes terapêuticos de redirecionamento de células t |
| JOP20190116A1 (ar) | 2018-05-24 | 2019-11-24 | Janssen Biotech Inc | الأجسام المضادة لتكتل التمايز 33 (cd33)، والأجسام المضادة ثنائية النوعية لتكتل التمايز 33 (cd33)/تكتل التمايز 3 (cd3) واستخداماتها |
| JP7361727B2 (ja) | 2018-05-24 | 2023-10-16 | ヤンセン バイオテツク,インコーポレーテツド | Psma結合剤及びその使用 |
| CR20200568A (es) | 2018-05-24 | 2021-02-26 | Janssen Biotech Inc | Antcuerpos anti-cd3 y usos de estos |
| JP2021524255A (ja) | 2018-05-24 | 2021-09-13 | ヤンセン バイオテツク,インコーポレーテツド | 単一特異性及び二重特異性抗体抗−tmeff2抗体並びにそれらの使用 |
| US20190382477A1 (en) | 2018-06-01 | 2019-12-19 | Compugen Ltd. | Anti-pvrig/anti-tigit bispecific antibodies and methods of use |
| US11492409B2 (en) | 2018-06-01 | 2022-11-08 | Novartis Ag | Binding molecules against BCMA and uses thereof |
| TW202016144A (zh) | 2018-06-21 | 2020-05-01 | 日商第一三共股份有限公司 | 包括cd3抗原結合片段之組成物及其用途 |
| WO2019243636A1 (en) | 2018-06-22 | 2019-12-26 | Genmab Holding B.V. | Anti-cd37 antibodies and anti-cd20 antibodies, compositions and methods of use thereof |
| MA53094A (fr) | 2018-07-02 | 2021-05-12 | Amgen Inc | Protéine de liaison à l'antigène anti-steap1 |
| AU2019297451A1 (en) | 2018-07-03 | 2021-01-28 | Marengo Therapeutics, Inc. | Anti-TCR antibody molecules and uses thereof |
| US20240254252A1 (en) | 2018-07-13 | 2024-08-01 | Genmab A/S | Trogocytosis-mediated therapy using cd38 antibodies |
| TW202019518A (zh) | 2018-07-13 | 2020-06-01 | 丹麥商珍美寶股份有限公司 | Cd38抗體之變體及其用途 |
| WO2020018556A1 (en) | 2018-07-16 | 2020-01-23 | Amgen Inc. | Method of treating multiple myeloma |
| EP3827019A1 (en) | 2018-07-24 | 2021-06-02 | Inhibrx, Inc. | Multispecific polypeptide constructs containing a constrained cd3 binding domain and a receptor binding region and methods of using the same |
| JP7523349B2 (ja) | 2018-08-29 | 2024-07-26 | 中外製薬株式会社 | 抗体半分子、および抗体半分子のホモ二量体形成を抑制する方法 |
| SG11202103192RA (en) | 2018-10-03 | 2021-04-29 | Xencor Inc | Il-12 heterodimeric fc-fusion proteins |
| US20240252635A1 (en) | 2018-10-04 | 2024-08-01 | Genmab Holding B.V. | Pharmaceutical compositions comprising bispecific anti-cd37 antibodies |
| CA3115082A1 (en) | 2018-10-11 | 2020-04-16 | Inhibrx, Inc. | B7h3 single domain antibodies and therapeutic compositions thereof |
| US20210380679A1 (en) | 2018-10-11 | 2021-12-09 | Inhibrx, Inc. | Dll3 single domain antibodies and therapeutic compositions thereof |
| WO2020077257A1 (en) | 2018-10-11 | 2020-04-16 | Inhibrx, Inc. | Pd-1 single domain antibodies and therapeutic compositions thereof |
| CA3114693A1 (en) | 2018-10-11 | 2020-04-16 | Inhibrx, Inc. | 5t4 single domain antibodies and therapeutic compositions thereof |
| MA53862A (fr) | 2018-10-12 | 2022-01-19 | Xencor Inc | Protéines de fusion fc d'il-15/il-15ralpha ciblant pd-1 et utilisations dans des polythérapies faisant intervenir celles-ci |
| SG11202104136YA (en) | 2018-10-23 | 2021-05-28 | Dragonfly Therapeutics Inc | Heterodimeric fc-fused proteins |
| AU2019370601B2 (en) | 2018-10-29 | 2024-05-23 | F. Hoffmann-La Roche Ag | Antibody formulation |
| AU2019374190B2 (en) * | 2018-11-05 | 2024-02-22 | Beijing Hanmi Pharmaceutical Co., Ltd. | Anti-TNFα/anti IL-17A natural antibody structure-like heterodimer form of bispecific antibody and preparation method therefor |
| WO2020094744A1 (en) | 2018-11-06 | 2020-05-14 | Genmab A/S | Antibody formulation |
| CA3121168A1 (en) * | 2018-11-30 | 2020-06-04 | Memorial Sloan Kettering Cancer Center | Heterodimeric tetravalency and specificity antibody compositions and uses thereof |
| US20220041719A1 (en) | 2018-12-05 | 2022-02-10 | Morphosys Ag | Multispecific antigen-binding molecules |
| CN113438961A (zh) | 2018-12-20 | 2021-09-24 | Xencor股份有限公司 | 含有IL-15/IL-15Rα和NKG2D抗原结合结构域的靶向异二聚体Fc融合蛋白 |
| SG10202105788SA (en) | 2018-12-21 | 2021-06-29 | Hoffmann La Roche | Antibodies binding to cd3 |
| US11739160B2 (en) | 2018-12-24 | 2023-08-29 | Sanofi | PseudoFab-based multispecific binding proteins |
| CN113412123A (zh) | 2018-12-28 | 2021-09-17 | 豪夫迈·罗氏有限公司 | 用于免疫应答增强的患者的治疗性用途的肽-mhc-i-抗体融合蛋白 |
| AU2020204992A1 (en) | 2019-01-04 | 2021-07-15 | Resolve Therapeutics, Llc | Treatment of sjogren's disease with nuclease fusion proteins |
| JOP20210186A1 (ar) | 2019-01-10 | 2023-01-30 | Janssen Biotech Inc | مستضدات البروستاتا المستحدثة واستخداماتها |
| US20220153827A1 (en) | 2019-01-15 | 2022-05-19 | Janssen Biotech, Inc. | Anti-TNF Antibody Compositions and Methods for the Treatment of Juvenile Idiopathic Arthritis |
| JP7303314B2 (ja) | 2019-01-18 | 2023-07-04 | ヤンセン バイオテツク,インコーポレーテツド | Gprc5dキメラ抗原受容体及びそれを発現する細胞 |
| EA202192038A1 (ru) | 2019-01-23 | 2021-10-05 | Янссен Байотек, Инк. | Композиции антител к фно для применения в способах лечения псориатического артрита |
| JP2022523197A (ja) | 2019-02-21 | 2022-04-21 | マレンゴ・セラピューティクス,インコーポレーテッド | T細胞関連のがん細胞に結合する多機能性分子およびその使用 |
| AU2020224154A1 (en) | 2019-02-21 | 2021-09-16 | Marengo Therapeutics, Inc. | Multifunctional molecules that bind to calreticulin and uses thereof |
| CN113811549A (zh) | 2019-02-21 | 2021-12-17 | Xencor股份有限公司 | 非靶向和靶向性il-10 fc融合蛋白 |
| AU2020224680A1 (en) | 2019-02-21 | 2021-09-16 | Marengo Therapeutics, Inc. | Multifunctional molecules that bind to T cells and uses thereof to treat autoimmune disorders |
| JP2022521937A (ja) | 2019-02-21 | 2022-04-13 | マレンゴ・セラピューティクス,インコーポレーテッド | NKp30に結合する抗体分子およびその使用 |
| WO2020172596A1 (en) | 2019-02-21 | 2020-08-27 | Elstar Therapeutics, Inc. | Anti-tcr antibody molecules and thereof |
| BR112021016149A2 (pt) | 2019-02-26 | 2021-10-13 | Janssen Biotech, Inc. | Terapias de combinação e estratificação de pacientes com anticorpos biespecíficos anti-egfr/c-met |
| JP2022523946A (ja) | 2019-03-01 | 2022-04-27 | ゼンコア インコーポレイテッド | Enpp3およびcd3に結合するヘテロ二量体抗体 |
| CN113874400A (zh) | 2019-03-11 | 2021-12-31 | 詹森生物科技公司 | 抗Vβ17/抗CD123双特异性抗体 |
| EP3938390A1 (en) | 2019-03-14 | 2022-01-19 | Janssen Biotech, Inc. | Manufacturing methods for producing anti-tnf antibody compositions |
| EP3938384A4 (en) | 2019-03-14 | 2022-12-28 | Janssen Biotech, Inc. | METHODS OF MANUFACTURING FOR PRODUCING ANTI-IL12/IL23 ANTIBODY COMPOSITIONS |
| CA3133388A1 (en) | 2019-03-14 | 2020-09-17 | Janssen Biotech, Inc. | Methods for producing anti-tnf antibody compositions |
| WO2020183270A1 (en) | 2019-03-14 | 2020-09-17 | Janssen Biotech, Inc. | Methods for producing anti-tnf antibody compositions |
| CN113795516A (zh) * | 2019-03-28 | 2021-12-14 | Ab工作室有限公司 | 异多聚体蛋白质及其使用方法 |
| CN113677701A (zh) | 2019-03-29 | 2021-11-19 | 豪夫迈·罗氏有限公司 | 产生亲合结合多特异性抗体的方法 |
| JP7249432B2 (ja) | 2019-03-29 | 2023-03-30 | エフ. ホフマン-ラ ロシュ アーゲー | 多価分子の機能分析のための、sprをベースとする結合アッセイ |
| CA3132275A1 (en) | 2019-04-25 | 2020-10-29 | Ulrich Brinkmann | Generation of antibody-derived polypeptides by polypeptide chain exchange |
| MX2021012872A (es) | 2019-04-25 | 2021-11-17 | Hoffmann La Roche | Polipeptidos multiespecificos terapeuticos activados mediante intercambio de cadenas polipeptidicas. |
| CA3133898A1 (en) | 2019-04-25 | 2020-10-29 | Ulrich Brinkmann | Activatable therapeutic multispecific polypeptides with extended half-life |
| CA3139508A1 (en) | 2019-05-08 | 2020-11-12 | Janssen Biotech, Inc. | Materials and methods for modulating t cell mediated immunity |
| JP2022531894A (ja) | 2019-05-09 | 2022-07-12 | ゲンマブ ビー.ブイ. | がんの処置において使用するための抗dr5抗体の組み合わせの投与レジメン |
| EP3969907A1 (en) | 2019-05-13 | 2022-03-23 | F. Hoffmann-La Roche AG | Interference-suppressed pharmacokinetic immunoassay |
| WO2020230091A1 (en) | 2019-05-14 | 2020-11-19 | Janssen Biotech, Inc. | Combination therapies with bispecific anti-egfr/c-met antibodies and third generation egfr tyrosine kinase inhibitors |
| CA3140561A1 (en) * | 2019-05-14 | 2020-11-19 | Progen Co., Ltd. | A novel modified immunoglobulin fc fusion protein and use thereof |
| EP3969119A1 (en) | 2019-05-17 | 2022-03-23 | Xencor, Inc. | Il-7-fc-fusi0n proteins |
| EP3972992A4 (en) | 2019-05-20 | 2023-07-19 | Pandion Operations, Inc. | ANTI-MADCAM IMMUNE TOLERANCE |
| WO2020236797A1 (en) | 2019-05-21 | 2020-11-26 | Novartis Ag | Variant cd58 domains and uses thereof |
| WO2020236795A2 (en) | 2019-05-21 | 2020-11-26 | Novartis Ag | Trispecific binding molecules against bcma and uses thereof |
| WO2020236792A1 (en) | 2019-05-21 | 2020-11-26 | Novartis Ag | Cd19 binding molecules and uses thereof |
| CN113939531A (zh) | 2019-06-03 | 2022-01-14 | 詹森生物科技公司 | 用于治疗银屑病关节炎的抗tnf抗体组合物和方法 |
| MX2021014433A (es) | 2019-06-05 | 2022-03-11 | Chugai Pharmaceutical Co Ltd | Molecula de union a sitio de escision de anticuerpo. |
| WO2020254357A1 (en) | 2019-06-19 | 2020-12-24 | F. Hoffmann-La Roche Ag | Method for the generation of a protein expressing cell by targeted integration using cre mrna |
| JP7450647B2 (ja) | 2019-06-26 | 2024-03-15 | エフ. ホフマン-ラ ロシュ アーゲー | Sirt-1遺伝子ノックアウトを有する哺乳類細胞株 |
| AU2020300002A1 (en) | 2019-07-01 | 2022-02-24 | Tonix Pharma Limited | Anti-CD154 antibodies and uses thereof |
| WO2021001289A1 (en) | 2019-07-02 | 2021-01-07 | F. Hoffmann-La Roche Ag | Immunoconjugates comprising a mutant interleukin-2 and an anti-cd8 antibody |
| MX2022000111A (es) | 2019-07-10 | 2022-02-10 | Chugai Pharmaceutical Co Ltd | Moleculas de union a claudina-6 y usos de las mismas. |
| CN112210005B (zh) * | 2019-07-11 | 2024-03-26 | 京天成生物技术(北京)有限公司 | 低免疫原性低adcc/cdc功能的抗c5人源化单抗及其应用 |
| CA3146913A1 (en) | 2019-07-12 | 2021-01-21 | Janssen Pharmaceutica Nv | Binding agents and uses thereof |
| AR119393A1 (es) | 2019-07-15 | 2021-12-15 | Hoffmann La Roche | Anticuerpos que se unen a nkg2d |
| CR20220025A (es) | 2019-07-26 | 2022-05-04 | Janssen Biotech Inc | Proteínas que comprenden dominios de unión al antígeno de la peptidasa 2 relacionada con la calicreína y sus usos |
| MX2022001156A (es) | 2019-07-31 | 2022-02-22 | Hoffmann La Roche | Anticuerpos que se fijan a gprc5d. |
| EP4004045A1 (en) | 2019-07-31 | 2022-06-01 | F. Hoffmann-La Roche AG | Antibodies binding to gprc5d |
| US20210102002A1 (en) | 2019-08-06 | 2021-04-08 | Xencor, Inc. | HETERODIMERIC IgG-LIKE BISPECIFIC ANTIBODIES |
| MX2022001799A (es) | 2019-08-15 | 2022-03-11 | Janssen Biotech Inc | Materiales y metodos para fragmentos variables de cadena unica mejorados. |
| CA3157024A1 (en) | 2019-10-03 | 2021-04-08 | Xencor, Inc. | Targeted il-12 heterodimeric fc-fusion proteins |
| TW202128757A (zh) | 2019-10-11 | 2021-08-01 | 美商建南德克公司 | 具有改善之特性的 PD-1 標靶 IL-15/IL-15Rα FC 融合蛋白 |
| EP4055046A1 (en) | 2019-11-06 | 2022-09-14 | Genmab B.V. | Antibody variant combinations and uses thereof |
| CA3161825A1 (en) | 2019-11-18 | 2021-05-27 | Janssen Biotech, Inc. | Anti-cd79 chimeric antigen receptors, car-t cells, and uses thereof |
| US12076400B2 (en) | 2019-12-06 | 2024-09-03 | Zymeworks Bc Inc. | Methods of using a bispecific antigen-binding construct targeting HER2 in combination with CDK4/6 inhibitors for the treatment of breast cancer |
| KR20220130687A (ko) | 2019-12-11 | 2022-09-27 | 시락 게엠베하 인터내셔날 | Ltbr 및 edb 결합 도메인을 포함하는 다중특이성 결합 분자 및 이의 용도 |
| TW202128767A (zh) | 2019-12-13 | 2021-08-01 | 美商建南德克公司 | 抗ly6g6d抗體及其使用方法 |
| WO2021122866A1 (en) | 2019-12-17 | 2021-06-24 | Ose Immunotherapeutics | Bifunctional molecules comprising an il-7 variant |
| PE20221282A1 (es) | 2019-12-18 | 2022-09-05 | Hoffmann La Roche | Anticuerpos que se unen a hla-a2/mage-a4 |
| CA3164818A1 (en) | 2019-12-18 | 2021-06-24 | F. Hoffmann-La Roche Ag | Bispecific anti-ccl2 antibodies |
| GB201919062D0 (en) | 2019-12-20 | 2020-02-05 | Ucb Biopharma Sprl | Antibody |
| GB201919061D0 (en) | 2019-12-20 | 2020-02-05 | Ucb Biopharma Sprl | Multi-specific antibody |
| CN115151567A (zh) | 2019-12-23 | 2022-10-04 | 索特里亚生物治疗药物公司 | 治疗性Fc组合物的化学诱导结合和解离以及T细胞接合器与人血清白蛋白的化学诱导二聚化 |
| IL294226A (en) | 2019-12-27 | 2022-08-01 | Chugai Pharmaceutical Co Ltd | Anti-ctla-4 antibodies and their use |
| WO2021136772A1 (en) | 2020-01-02 | 2021-07-08 | F. Hoffmann-La Roche Ag | Method for determining the amount of a therapeutic antibody in the brain |
| WO2021138407A2 (en) | 2020-01-03 | 2021-07-08 | Marengo Therapeutics, Inc. | Multifunctional molecules that bind to cd33 and uses thereof |
| WO2021144457A1 (en) | 2020-01-16 | 2021-07-22 | Genmab A/S | Formulations of cd38 antibodies and uses thereof |
| MX2022009306A (es) | 2020-01-29 | 2022-09-26 | Inhibrx Inc | Loseta de nucleo de espuma densificada (dfc) con linea de anticuerpos de dominio individual de cd28 y constructos multivalentes y multiespecíficas de los mismos. |
| IL295129A (en) | 2020-01-30 | 2022-09-01 | Umoja Biopharma Inc | Bispecific transduction enhancer |
| GB202001447D0 (en) | 2020-02-03 | 2020-03-18 | Ucb Biopharma Sprl | Antibodies |
| WO2021155916A1 (en) | 2020-02-04 | 2021-08-12 | BioNTech SE | Treatment involving antigen vaccination and binding agents binding to pd-l1 and cd137 |
| TW202144388A (zh) | 2020-02-14 | 2021-12-01 | 美商健生生物科技公司 | 在卵巢癌中表現之新抗原及其用途 |
| TW202144389A (zh) | 2020-02-14 | 2021-12-01 | 美商健生生物科技公司 | 在多發性骨髓瘤中表現之新抗原及其用途 |
| US11981715B2 (en) | 2020-02-21 | 2024-05-14 | Pandion Operations, Inc. | Tissue targeted immunotolerance with a CD39 effector |
| IL302351A (en) | 2020-03-13 | 2023-06-01 | Janssen Biotech Inc | Materials and methods for binding SIGLEC-3/CD33 |
| AR121599A1 (es) | 2020-03-18 | 2022-06-22 | Genmab As | Anticuerpos |
| EP4126241A1 (en) | 2020-03-27 | 2023-02-08 | Novartis AG | Bispecific combination therapy for treating proliferative diseases and autoimmune disorders |
| KR102505383B1 (ko) | 2020-03-31 | 2023-03-02 | 추가이 세이야쿠 가부시키가이샤 | Dll3 표적 다중 특이성 항원 결합 분자 및 그의 사용 |
| KR20220161375A (ko) | 2020-03-31 | 2022-12-06 | 추가이 세이야쿠 가부시키가이샤 | 다중 특이성 항원 결합 분자를 제조하기 위한 방법 |
| CR20220512A (es) | 2020-04-15 | 2022-11-07 | Hoffmann La Roche | Inmunoconjugados |
| WO2021209953A1 (en) | 2020-04-16 | 2021-10-21 | Janssen Biotech, Inc. | Systems, materials, and methods for reversed-phase high performance liquid chromatography (rp-hplc) for monitoring formation of multi-specific molecules |
| GB202005879D0 (en) * | 2020-04-22 | 2020-06-03 | Petmedix Ltd | Heterodimeric proteins |
| JP2023523011A (ja) | 2020-04-24 | 2023-06-01 | マレンゴ・セラピューティクス,インコーポレーテッド | T細胞関連のがん細胞に結合する多機能性分子およびその使用 |
| KR20230007384A (ko) | 2020-04-30 | 2023-01-12 | 브리스톨-마이어스 스큅 컴퍼니 | 치료 방법 |
| IL298046A (en) | 2020-05-11 | 2023-01-01 | Janssen Biotech Inc | Treatment methods for multiple myeloma |
| AU2021272340A1 (en) | 2020-05-11 | 2022-12-08 | F. Hoffmann-La Roche Ag | Combination therapy with modified pbmcs and an immunoconjugate |
| US20220106403A1 (en) | 2020-05-14 | 2022-04-07 | Xencor, Inc. | Heterodimeric antibodies that bind msln and cd3 |
| WO2021231976A1 (en) | 2020-05-14 | 2021-11-18 | Xencor, Inc. | Heterodimeric antibodies that bind prostate specific membrane antigen (psma) and cd3 |
| TW202210510A (zh) | 2020-05-27 | 2022-03-16 | 美商健生生物科技公司 | 包含cd3抗原結合域之蛋白質及其用途 |
| WO2021246720A1 (ko) * | 2020-06-01 | 2021-12-09 | 머스트바이오 주식회사 | 이중특이 항체 또는 그의 항원-결합 단편 및 이를 제조하는 방법 |
| AU2021290997C1 (en) * | 2020-06-17 | 2024-01-04 | Medimmune Limited | Heterodimeric relaxin fusions and uses thereof |
| WO2021255146A1 (en) | 2020-06-19 | 2021-12-23 | F. Hoffmann-La Roche Ag | Antibodies binding to cd3 and cea |
| PE20230616A1 (es) | 2020-06-19 | 2023-04-14 | Hoffmann La Roche | Anticuerpos que se unen a cd3 y folr1 |
| CA3153085A1 (en) | 2020-06-19 | 2021-12-23 | F. Hoffmann-La Roche Ag | Antibodies binding to cd3 and cd19 |
| AU2021291407A1 (en) | 2020-06-19 | 2022-09-29 | F. Hoffmann-La Roche Ag | Antibodies binding to CD3 |
| EP4168445A1 (en) | 2020-06-19 | 2023-04-26 | F. Hoffmann-La Roche AG | Immune activating fc domain binding molecules |
| EP4171614A1 (en) | 2020-06-29 | 2023-05-03 | Resolve Therapeutics, LLC | Treatment of sjogren's syndrome with nuclease fusion proteins |
| JP2023534726A (ja) | 2020-07-23 | 2023-08-10 | ジェンマブ ビー.ブイ. | 多発性骨髄腫の治療に使用するための抗dr5抗体と免疫調節イミド薬との併用 |
| CA3190307A1 (en) | 2020-07-29 | 2022-02-03 | Janssen Biotech, Inc. | Proteins comprising hla-g antigen binding domains and their uses |
| JPWO2022025220A1 (ko) | 2020-07-31 | 2022-02-03 | ||
| US20230287088A1 (en) | 2020-08-06 | 2023-09-14 | BioNTech SE | Binding agents for coronavirus s protein |
| JP2023538891A (ja) | 2020-08-19 | 2023-09-12 | ゼンコア インコーポレイテッド | 抗cd28組成物 |
| CN116917316A (zh) | 2020-08-26 | 2023-10-20 | 马伦戈治疗公司 | 与NKp30结合的抗体分子及其用途 |
| CN116249718A (zh) | 2020-08-26 | 2023-06-09 | 马伦戈治疗公司 | 结合至钙网蛋白的多功能性分子及其用途 |
| CN116761818A (zh) | 2020-08-26 | 2023-09-15 | 马伦戈治疗公司 | 检测trbc1或trbc2的方法 |
| JPWO2022044248A1 (ko) * | 2020-08-28 | 2022-03-03 | ||
| IL300835A (en) | 2020-09-02 | 2023-04-01 | Genmab As | Antibody therapy |
| IL301085A (en) | 2020-09-10 | 2023-05-01 | Genmab As | A bispecific antibody against CD3 and CD20 in combination therapy for the treatment of diffuse large B-cell lymphoma |
| CN116437956A (zh) | 2020-09-10 | 2023-07-14 | 健玛保 | 用于治疗慢性淋巴细胞白血病的针对cd3和cd20的双特异性抗体 |
| US11965024B2 (en) | 2020-09-11 | 2024-04-23 | Janssen Biotech, Inc. | Methods and compositions for modulating beta chain mediated immunity |
| AU2021347580A1 (en) | 2020-09-24 | 2023-04-06 | F. Hoffmann-La Roche Ag | Mammalian cell lines with gene knockout |
| US20230365714A1 (en) | 2020-10-02 | 2023-11-16 | Genmab A/S | Antibodies capable of binding to ror2 and bispecific antibodies binding to ror2 and cd3 |
| KR20230086765A (ko) | 2020-10-13 | 2023-06-15 | 얀센 바이오테크 인코포레이티드 | 분화 클러스터 iv 및/또는 viii을 조절하기 위한 바이오-조작된 t 세포 매개 면역, 물질 및 기타 방법 |
| US20220135684A1 (en) | 2020-10-14 | 2022-05-05 | Xencor, Inc. | Bispecific antibodies that bind pd-l1 and cd28 |
| IL302277A (en) | 2020-10-22 | 2023-06-01 | Janssen Biotech Inc | Proteins containing delta-like ligand antigen binding domains (DLL3) and uses thereof |
| UY39488A (es) | 2020-10-28 | 2022-04-29 | Janssen Biotech Inc | Composiciones y métodos para modular la inmunidad mediada por la cadena delta gamma |
| WO2022097060A1 (en) | 2020-11-06 | 2022-05-12 | Novartis Ag | Cd19 binding molecules and uses thereof |
| US20220144956A1 (en) | 2020-11-06 | 2022-05-12 | Xencor, Inc. | HETERODIMERIC ANTIBODIES THAT BIND TGFbetaRII |
| EP4240494A1 (en) | 2020-11-06 | 2023-09-13 | Novartis AG | Anti-cd19 agent and b cell targeting agent combination therapy for treating b cell malignancies |
| JP2023548249A (ja) | 2020-11-10 | 2023-11-15 | 上海齊魯制藥研究中心有限公司 | クローディン18a2及びcd3に対する二重特異性抗体及びその使用 |
| CA3167854A1 (en) * | 2020-12-03 | 2022-06-09 | Eric Escobar-Cabrera | Heterodimeric iga fc constructs and methods of use thereof |
| IL303295A (en) | 2020-12-07 | 2023-07-01 | UCB Biopharma SRL | Multispecific antibodies and antibody combinations |
| JP2023551983A (ja) | 2020-12-07 | 2023-12-13 | ユーシービー バイオファルマ エスアールエル | インターロイキン-22に対する抗体 |
| EP4259194A1 (en) * | 2020-12-10 | 2023-10-18 | Invenra, Inc. | Orthogonal mutations for heterodimerization |
| WO2022129512A1 (en) | 2020-12-17 | 2022-06-23 | Ose Immunotherapeutics | Bifunctional anti-pd1/il-7 molecules |
| AU2021399841A1 (en) | 2020-12-17 | 2023-07-06 | F. Hoffmann-La Roche Ag | Anti-hla-g antibodies and use thereof |
| WO2022129313A1 (en) | 2020-12-18 | 2022-06-23 | F. Hoffmann-La Roche Ag | Precursor proteins and kit for targeted therapy |
| WO2022136140A1 (en) | 2020-12-22 | 2022-06-30 | F. Hoffmann-La Roche Ag | Oligonucleotides targeting xbp1 |
| WO2022140701A1 (en) | 2020-12-24 | 2022-06-30 | Xencor, Inc. | Icos targeted heterodimeric fusion proteins containing il-15/il-15ra fc-fusion proteins and icos antigen binding domains |
| US20240034795A1 (en) * | 2020-12-31 | 2024-02-01 | Innovent Biologics (Suzhou) Co., Ltd. | Protein containing heterodimer antibody fc, and preparation method therefor |
| KR20230117406A (ko) | 2021-01-06 | 2023-08-08 | 에프. 호프만-라 로슈 아게 | Pd1-lag3 이중특이성 항체와 cd20 t 세포 이중특이성항체를 이용한 조합 요법 |
| CN116963750A (zh) | 2021-01-06 | 2023-10-27 | 通尼克斯制药有限公司 | 用经修饰的抗-cd154抗体诱导免疫耐受的方法 |
| WO2022148853A1 (en) | 2021-01-11 | 2022-07-14 | F. Hoffmann-La Roche Ag | Immunoconjugates |
| MX2023008909A (es) | 2021-01-28 | 2023-10-23 | Janssen Biotech Inc | Proteínas de unión a psma y usos de estas. |
| CA3211114A1 (en) | 2021-02-16 | 2022-08-25 | Janssen Biotech, Inc. | Materials and methods for enhanced linker targeting |
| CR20230398A (es) | 2021-02-16 | 2023-11-15 | Janssen Pharmaceutica Nv | Anticuerpo triespecífico dirigido a bcma, gprc5d, y cd3 |
| JP2024512240A (ja) | 2021-02-18 | 2024-03-19 | エフ. ホフマン-ラ ロシュ アーゲー | 複雑な多段階の抗体相互作用を解明するための方法 |
| AU2022232375A1 (en) | 2021-03-09 | 2023-09-21 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and cldn6 |
| EP4304644A1 (en) | 2021-03-09 | 2024-01-17 | Janssen Biotech, Inc. | Treatment of cancers lacking egfr-activating mutations |
| KR20230154311A (ko) | 2021-03-10 | 2023-11-07 | 젠코어 인코포레이티드 | Cd3 및 gpc3에 결합하는 이종이량체 항체 |
| CA3210971A1 (en) | 2021-03-12 | 2022-09-15 | Bart-Jan DE KREUK | Non-activating antibody variants |
| IL306103A (en) | 2021-03-24 | 2023-11-01 | Janssen Biotech Inc | The antibody targets CD22 and CD79B |
| AU2022242125A1 (en) | 2021-03-24 | 2023-11-09 | Janssen Biotech, Inc. | Proteins comprising cd3 antigen binding domains and uses thereof |
| KR20230160874A (ko) | 2021-03-24 | 2023-11-24 | 얀센 바이오테크 인코포레이티드 | CD79b, CD20 및 CD3을 표적으로 하는 삼중특이적 항체 |
| CN116897159A (zh) | 2021-03-31 | 2023-10-17 | 江苏恒瑞医药股份有限公司 | 截短的taci多肽及其融合蛋白和用途 |
| CA3214757A1 (en) | 2021-04-08 | 2022-10-13 | Andreas Loew | Multifuntional molecules binding to tcr and uses thereof |
| AU2022253351A1 (en) | 2021-04-09 | 2023-10-12 | Ose Immunotherapeutics | New scaffold for bifunctional molecules with improved properties |
| WO2022214652A1 (en) | 2021-04-09 | 2022-10-13 | Ose Immunotherapeutics | Scaffold for bifunctioanl molecules comprising pd-1 or cd28 and sirp binding domains |
| JP2024509664A (ja) | 2021-04-30 | 2024-03-05 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | 抗cd20/抗cd3二重特異性抗体による治療のための投薬 |
| AU2021443318A1 (en) | 2021-04-30 | 2023-09-07 | F. Hoffmann-La Roche Ag | Dosing for combination treatment with anti-cd20/anti-cd3 bispecific antibody and anti-cd79b antibody drug conjugate |
| JP2024516305A (ja) | 2021-05-03 | 2024-04-12 | ユーシービー バイオファルマ エスアールエル | 抗体 |
| MX2023012351A (es) | 2021-05-07 | 2023-10-31 | Genmab As | Composiciones farmaceuticas que comprenden anticuerpos biespecificos que se unen al inhibidor de la activacion de celulas t que contiene un dominio v-set 1 (b7h4) y cumulo de diferenciacion 3 (cd3). |
| JP2024519324A (ja) * | 2021-05-10 | 2024-05-10 | メディミューン,エルエルシー | 改善された半減期を有する改変fcrn結合フラグメント |
| KR20240006586A (ko) | 2021-05-12 | 2024-01-15 | 지앙수 헨그루이 파마슈티컬스 컴퍼니 리미티드 | Rankl 및 ngf에 특이적으로 결합하는 항원 결합 분자, 및 이의 의학적 용도 |
| WO2022237882A1 (zh) | 2021-05-14 | 2022-11-17 | 江苏恒瑞医药股份有限公司 | 一种抗原结合分子 |
| TW202309094A (zh) | 2021-05-18 | 2023-03-01 | 美商健生生物科技公司 | 用於識別癌症患者以進行組合治療之方法 |
| KR20240035444A (ko) | 2021-06-11 | 2024-03-15 | 세이지 테라퓨틱스, 인크. | 알츠하이머병 치료를 위한 신경활성 스테로이드 |
| JP2024523166A (ja) | 2021-06-15 | 2024-06-28 | ゼンコア インコーポレイテッド | クローディン18.2及びcd3に結合するヘテロ二量体抗体 |
| EP4355786A1 (en) | 2021-06-16 | 2024-04-24 | Alector LLC | Bispecific anti-mertk and anti-pdl1 antibodies and methods of use thereof |
| JP2024527493A (ja) | 2021-06-16 | 2024-07-25 | アレクトル エルエルシー | 一価の抗MerTK抗体及びその使用方法 |
| AU2022295067A1 (en) | 2021-06-18 | 2023-12-21 | F. Hoffmann-La Roche Ag | Bispecific anti-ccl2 antibodies |
| BR112023027006A2 (pt) | 2021-06-21 | 2024-03-12 | BioNTech SE | Método para reduzir ou prevenir a progressão de um tumor ou tratar um câncer em um sujeito, e, agente de ligação |
| CA3220353A1 (en) | 2021-06-25 | 2022-12-29 | Chugai Seiyaku Kabushiki Kaisha | Use of anti-ctla-4 antibody |
| CA3221833A1 (en) | 2021-06-25 | 2022-12-29 | Chugai Seiyaku Kabushiki Kaisha | Anti-ctla-4 antibody |
| BR112023026966A2 (pt) | 2021-07-02 | 2024-03-12 | Hoffmann La Roche | Métodos para tratar um indivíduo com melanoma, para alcançar uma resposta clínica, para tratar um indivíduo com linfoma não hodgkin, para tratar uma população de indivíduos com linfoma não hodgkin e para tratar um indivíduo com câncer colorretal metastático |
| AU2022306973A1 (en) | 2021-07-09 | 2024-02-22 | Janssen Biotech, Inc. | Manufacturing methods for producing anti-il12/il23 antibody compositions |
| EP4367136A1 (en) | 2021-07-09 | 2024-05-15 | Janssen Biotech, Inc. | Manufacturing methods for producing anti-tnf antibody compositions |
| JP2024526315A (ja) | 2021-07-09 | 2024-07-17 | ヤンセン バイオテツク,インコーポレーテツド | 抗tnf抗体組成物を製造するための製造方法 |
| TW202317635A (zh) | 2021-07-14 | 2023-05-01 | 大陸商江蘇恆瑞醫藥股份有限公司 | 特異性結合hgfr和egfr的抗原結合分子及其醫藥用途 |
| EP4373859A1 (en) | 2021-07-22 | 2024-05-29 | F. Hoffmann-La Roche AG | Heterodimeric fc domain antibodies |
| US20230146665A1 (en) | 2021-07-27 | 2023-05-11 | Xencor, Inc. | Il-18-fc fusion proteins |
| CA3227537A1 (en) | 2021-07-27 | 2023-02-02 | Morphosys Ag | Combinations of antigen binding molecules |
| EP4377351A1 (en) | 2021-07-28 | 2024-06-05 | F. Hoffmann-La Roche AG | Methods and compositions for treating cancer |
| GB202111905D0 (en) | 2021-08-19 | 2021-10-06 | UCB Biopharma SRL | Antibodies |
| WO2023028612A2 (en) | 2021-08-27 | 2023-03-02 | Board Of Regents, The University Of Texas System | Anti-tslpr (crlf2) antibodies |
| KR20240051280A (ko) | 2021-09-06 | 2024-04-19 | 젠맵 에이/에스 | Cd27과 결합할 수 있는 항체, 그의 변이체 및 그의 용도 |
| WO2023037333A1 (en) | 2021-09-13 | 2023-03-16 | Janssen Biotech, Inc | CD33 X Vδ2 MULTISPECIFIC ANTIBODIES FOR THE TREATMENT OF CANCER |
| KR20230041210A (ko) * | 2021-09-17 | 2023-03-24 | 고려대학교 산학협력단 | Fc 감마 수용체와의 결합력이 증대된 Fc 변이체 |
| KR20240067092A (ko) | 2021-09-23 | 2024-05-16 | 지앙수 헨그루이 파마슈티컬스 컴퍼니 리미티드 | 항-klb 항체 및 용도 |
| EP4405392A1 (en) | 2021-09-24 | 2024-07-31 | Janssen Biotech, Inc. | Proteins comprising cd20 binding domains, and uses thereof |
| EP4408889A1 (en) | 2021-09-27 | 2024-08-07 | Xencor, Inc. | B-cell maturation antigen (bcma) binding domain compositions |
| JPWO2023053282A1 (ko) | 2021-09-29 | 2023-04-06 | ||
| WO2023051798A1 (zh) | 2021-09-30 | 2023-04-06 | 江苏恒瑞医药股份有限公司 | 抗il23抗体融合蛋白及用途 |
| AR127269A1 (es) | 2021-10-08 | 2024-01-03 | Chugai Pharmaceutical Co Ltd | Formulación de anticuerpo anti-hla-dq2.5 |
| AR127298A1 (es) | 2021-10-08 | 2024-01-10 | Genmab As | Anticuerpos que se unen a cd30 y cd3 |
| CN118139648A (zh) | 2021-10-14 | 2024-06-04 | 豪夫迈·罗氏有限公司 | 用于治疗癌症的替代的PD1-IL7v免疫缀合物 |
| CA3234731A1 (en) | 2021-10-14 | 2023-04-20 | F. Hoffmann-La Roche Ag | New interleukin-7 immunoconjugates |
| EP4419545A2 (en) | 2021-10-20 | 2024-08-28 | Synthekine, Inc. | Heterodimeric fc cytokines and uses thereof |
| CA3237038A1 (en) | 2021-11-01 | 2023-05-04 | Janssen Biotech, Inc. | Compositions and methods for the modulation of beta chain-mediated immunity |
| WO2023081705A1 (en) | 2021-11-03 | 2023-05-11 | Janssen Biotech, Inc. | Methods of treating cancers and enhancing efficacy of bcmaxcd3 bispecific antibodies |
| WO2023086772A1 (en) | 2021-11-12 | 2023-05-19 | Xencor, Inc. | Bispecific antibodies that bind to b7h3 and nkg2d |
| MX2024006205A (es) | 2021-11-22 | 2024-08-19 | Janssen Biotech Inc | Composiciones que comprenden agentes de unión multiespecíficos potenciados para una respuesta inmunitaria. |
| WO2023094282A1 (en) | 2021-11-25 | 2023-06-01 | F. Hoffmann-La Roche Ag | Quantification of low amounts of antibody sideproducts |
| US20230183360A1 (en) | 2021-12-09 | 2023-06-15 | Janssen Biotech, Inc. | Use of Amivantamab to Treat Colorectal Cancer |
| AR127887A1 (es) | 2021-12-10 | 2024-03-06 | Hoffmann La Roche | Anticuerpos que se unen a cd3 y plap |
| WO2023111112A1 (en) * | 2021-12-15 | 2023-06-22 | Medimmune Limited | Treatment using heterodimeric relaxin fusions |
| AU2023208426A1 (en) | 2022-01-24 | 2024-07-25 | Novimmune Sa | Composition and methods for the selective activation of cytokine signaling pathways |
| CN118574855A (zh) | 2022-02-07 | 2024-08-30 | 江苏恒瑞医药股份有限公司 | 特异性结合psma和cd3的抗原结合分子及其医药用途 |
| TW202342057A (zh) | 2022-02-07 | 2023-11-01 | 美商健生生物科技公司 | 用於減少用egfr/met雙特異性抗體治療之患者的輸注相關反應之方法 |
| WO2023151661A1 (zh) | 2022-02-11 | 2023-08-17 | 江苏恒瑞医药股份有限公司 | 免疫缀合物及其用途 |
| US20230265218A1 (en) | 2022-02-23 | 2023-08-24 | Xencor, Inc. | Anti-cd28 x anti-psma antibodies |
| WO2023164627A1 (en) | 2022-02-24 | 2023-08-31 | Xencor, Inc. | Anti-cd28 x anti-msln antibodies |
| WO2023164640A1 (en) | 2022-02-24 | 2023-08-31 | Xencor, Inc. | Anti-cd28 x anti-trop2 antibodies |
| IL314916A (en) | 2022-03-07 | 2024-10-01 | Novimmune Sa | Bispecific CD28 antibodies for targeted T cell activation |
| WO2023174925A1 (en) | 2022-03-14 | 2023-09-21 | Novimmune Sa | Bispecific gpc3xcd28 and gpc3xcd3 antibodies and their combination for targeted killing of gpc3 positive malignant cells |
| WO2023174521A1 (en) | 2022-03-15 | 2023-09-21 | Genmab A/S | Binding agents binding to epcam and cd137 |
| WO2023180353A1 (en) | 2022-03-23 | 2023-09-28 | F. Hoffmann-La Roche Ag | Combination treatment of an anti-cd20/anti-cd3 bispecific antibody and chemotherapy |
| WO2023192850A1 (en) | 2022-03-29 | 2023-10-05 | Ngm Biopharmaceuticals, Inc. | Ilt3 and cd3 binding agents and methods of use thereof |
| US20240025968A1 (en) | 2022-04-07 | 2024-01-25 | Xencor, Inc. | LAG-3 TARGETED HETERODIMERIC FUSION PROTEINS CONTAINING IL-15/IL-15RA Fc-FUSION PROTEINS AND LAG-3 ANTIGEN BINDING DOMAINS |
| TW202404637A (zh) | 2022-04-13 | 2024-02-01 | 瑞士商赫孚孟拉羅股份公司 | 抗cd20/抗cd3雙特異性抗體之醫藥組成物及使用方法 |
| WO2023201309A1 (en) | 2022-04-13 | 2023-10-19 | Xencor, Inc. | Antibodies that bind pd-l1, pd-l2 and/or cd28 |
| WO2023202967A1 (en) | 2022-04-19 | 2023-10-26 | F. Hoffmann-La Roche Ag | Improved production cells |
| WO2023218046A1 (en) | 2022-05-12 | 2023-11-16 | Genmab A/S | Binding agents capable of binding to cd27 in combination therapy |
| WO2023218051A1 (en) | 2022-05-12 | 2023-11-16 | Genmab A/S | Binding agents capable of binding to cd27 in combination therapy |
| WO2023227641A1 (en) | 2022-05-27 | 2023-11-30 | Glaxosmithkline Intellectual Property Development Limited | Use of tnf-alpha binding proteins and il-7 binding proteins in medical treatment |
| WO2023232961A1 (en) | 2022-06-03 | 2023-12-07 | F. Hoffmann-La Roche Ag | Improved production cells |
| US20240317866A1 (en) | 2022-06-30 | 2024-09-26 | Janssen Biotech, Inc. | Use of Anti-EGFR/Anti-Met Antibody to Treat Gastric or Esophageal Cancer |
| WO2024003376A1 (en) | 2022-07-01 | 2024-01-04 | Alk-Abelló A/S | Displacers of ige-fceri |
| WO2024026471A1 (en) | 2022-07-29 | 2024-02-01 | Alector Llc | Cd98hc antigen-binding domains and uses therefor |
| WO2024026472A2 (en) | 2022-07-29 | 2024-02-01 | Alector Llc | Transferrin receptor antigen-binding domains and uses therefor |
| WO2024028386A1 (en) | 2022-08-02 | 2024-02-08 | Ose Immunotherapeutics | Multifunctional molecule directed against cd28 |
| CN115353552B (zh) * | 2022-08-19 | 2023-07-18 | 山东大学 | 一种降低蛋白质变性温度的方法及其突变体与应用 |
| WO2024079015A1 (en) | 2022-10-10 | 2024-04-18 | F. Hoffmann-La Roche Ag | Combination therapy of a gprc5d tcb and imids |
| TW202423970A (zh) | 2022-10-10 | 2024-06-16 | 瑞士商赫孚孟拉羅股份公司 | Gprc5d tcb及cd38抗體之組合療法 |
| TW202423969A (zh) | 2022-10-10 | 2024-06-16 | 瑞士商赫孚孟拉羅股份公司 | Gprc5d tcb及蛋白酶體抑制劑之組合療法 |
| WO2024079069A1 (en) | 2022-10-12 | 2024-04-18 | F. Hoffmann-La Roche Ag | Method for classifying cells |
| US20240254234A1 (en) | 2022-10-21 | 2024-08-01 | Novimmune Sa | PD-L1xCD28 BISPECIFIC ANTIBODIES FOR IMMUNE CHECKPOINT-DEPENDENT T CELL ACTIVATION |
| WO2024092038A2 (en) | 2022-10-25 | 2024-05-02 | Ablexis, Llc | Anti-cd3 antibodies |
| WO2024089551A1 (en) | 2022-10-25 | 2024-05-02 | Janssen Biotech, Inc. | Msln and cd3 binding agents and methods of use thereof |
| WO2024094660A1 (en) | 2022-10-31 | 2024-05-10 | Genmab A/S | Cd38 antibodies and uses thereof |
| WO2024095173A1 (en) | 2022-11-02 | 2024-05-10 | Janssen Biotech, Inc. | Methods of treating cancers |
| WO2024102693A2 (en) | 2022-11-07 | 2024-05-16 | Xencor, Inc. | Il-18-fc fusion proteins |
| WO2024102636A1 (en) | 2022-11-07 | 2024-05-16 | Xencor, Inc. | Bispecific antibodies that bind to b7h3 and mica/b |
| WO2024100170A1 (en) | 2022-11-11 | 2024-05-16 | F. Hoffmann-La Roche Ag | Antibodies binding to hla-a*02/foxp3 |
| WO2024102948A1 (en) | 2022-11-11 | 2024-05-16 | Celgene Corporation | Fc receptor-homolog 5 (fcrh5) specific binding molecules and bispecific t-cell engaging antibodies including same and related methods |
| WO2024107731A2 (en) | 2022-11-14 | 2024-05-23 | Ablexis, Llc | Anti-pd-l1 antibodies |
| WO2024104933A1 (en) | 2022-11-15 | 2024-05-23 | F. Hoffmann-La Roche Ag | Antigen binding molecules |
| WO2024104988A1 (en) | 2022-11-15 | 2024-05-23 | F. Hoffmann-La Roche Ag | Recombinant binding proteins with activatable effector domain |
| WO2024143442A1 (ja) * | 2022-12-27 | 2024-07-04 | 中外製薬株式会社 | 会合が制御されたポリペプチド |
| WO2024153722A1 (en) | 2023-01-20 | 2024-07-25 | F. Hoffmann-La Roche Ag | Immunoconjugates |
| WO2024156672A1 (en) | 2023-01-25 | 2024-08-02 | F. Hoffmann-La Roche Ag | Antibodies binding to csf1r and cd3 |
| WO2024163009A1 (en) | 2023-01-31 | 2024-08-08 | Genentech, Inc. | Methods and compositions for treating urothelial bladder cancer |
| WO2024163494A1 (en) | 2023-01-31 | 2024-08-08 | F. Hoffmann-La Roche Ag | Methods and compositions for treating non-small cell lung cancer and triple-negative breast cancer |
| WO2024166047A1 (en) | 2023-02-09 | 2024-08-15 | Janssen Biotech, Inc. | Anti-v beta 17/anti-cd123 bispecific antibodies |
| WO2024184206A1 (en) * | 2023-03-03 | 2024-09-12 | Astrazeneca Ab | Pharmaceutical formulation comprising heterodimeric relaxin fusion proteins and uses thereof |
| WO2024184287A1 (en) | 2023-03-06 | 2024-09-12 | F. Hoffmann-La Roche Ag | Combination therapy of an anti-egfrviii/anti-cd3 antibody and an tumor-targeted 4-1bb agonist |
| WO2024188965A1 (en) | 2023-03-13 | 2024-09-19 | F. Hoffmann-La Roche Ag | Combination therapy employing a pd1-lag3 bispecific antibody and an hla-g t cell bispecific antibody |
| WO2024189544A1 (en) | 2023-03-13 | 2024-09-19 | Janssen Biotech, Inc. | Combination therapies with bi-specific anti-egfr/c-met antibodies and anti-pd-1 antibodies |
| WO2024192308A2 (en) | 2023-03-14 | 2024-09-19 | Xencor, Inc. | Anti-cd28 compositions |
| WO2024208776A1 (en) | 2023-04-03 | 2024-10-10 | F. Hoffmann-La Roche Ag | Agonistic split antibodies |
| WO2024208777A1 (en) | 2023-04-03 | 2024-10-10 | F. Hoffmann-La Roche Ag | All-in-one agonistic antibodies |
| WO2024208898A1 (en) | 2023-04-05 | 2024-10-10 | Genmab A/S | Pharmaceutical compositions comprising antibodies binding to cd30 and cd3 |
Family Cites Families (168)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2413974A1 (fr) | 1978-01-06 | 1979-08-03 | David Bernard | Sechoir pour feuilles imprimees par serigraphie |
| US4347935A (en) | 1979-05-16 | 1982-09-07 | The United States Of America As Represented By The United States Department Of Energy | Method and apparatus for electrostatically sorting biological cells |
| US4474893A (en) | 1981-07-01 | 1984-10-02 | The University of Texas System Cancer Center | Recombinant monoclonal antibodies |
| US4714681A (en) | 1981-07-01 | 1987-12-22 | The Board Of Reagents, The University Of Texas System Cancer Center | Quadroma cells and trioma cells and methods for the production of same |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| GB2183662B (en) | 1985-04-01 | 1989-01-25 | Celltech Ltd | Transformed myeloma cell-line and a process for the expression of a gene coding for a eukaryotic polypeptide employing same |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| WO1988007089A1 (en) | 1987-03-18 | 1988-09-22 | Medical Research Council | Altered antibodies |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| US5336603A (en) | 1987-10-02 | 1994-08-09 | Genentech, Inc. | CD4 adheson variants |
| US4925648A (en) | 1988-07-29 | 1990-05-15 | Immunomedics, Inc. | Detection and treatment of infectious and inflammatory lesions |
| US5601819A (en) | 1988-08-11 | 1997-02-11 | The General Hospital Corporation | Bispecific antibodies for selective immune regulation and for selective immune cell binding |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| KR900005995A (ko) | 1988-10-31 | 1990-05-07 | 우메모또 요시마사 | 변형 인터류킨-2 및 그의 제조방법 |
| DE68913658T3 (de) | 1988-11-11 | 2005-07-21 | Stratagene, La Jolla | Klonierung von Immunglobulin Sequenzen aus den variablen Domänen |
| DE69029036T2 (de) | 1989-06-29 | 1997-05-22 | Medarex Inc | Bispezifische reagenzien für die aids-therapie |
| US5112946A (en) | 1989-07-06 | 1992-05-12 | Repligen Corporation | Modified pf4 compositions and methods of use |
| FR2650598B1 (fr) | 1989-08-03 | 1994-06-03 | Rhone Poulenc Sante | Derives de l'albumine a fonction therapeutique |
| WO1991006570A1 (en) | 1989-10-25 | 1991-05-16 | The University Of Melbourne | HYBRID Fc RECEPTOR MOLECULES |
| US5314995A (en) | 1990-01-22 | 1994-05-24 | Oncogen | Therapeutic interleukin-2-antibody based fusion proteins |
| US5349053A (en) | 1990-06-01 | 1994-09-20 | Protein Design Labs, Inc. | Chimeric ligand/immunoglobulin molecules and their uses |
| FI85768C (fi) | 1990-07-04 | 1992-05-25 | Valtion Teknillinen | Foerfarande foer utfoerning av ytplasmonresonansmaetning samt i foerfarandet anvaendbar givare. |
| AU667460B2 (en) | 1990-10-05 | 1996-03-28 | Medarex, Inc. | Targeted immunostimulation with bispecific reagents |
| ATE160379T1 (de) | 1990-10-29 | 1997-12-15 | Chiron Corp | Bispezifische antikörper, verfahren zu ihrer herstellung und deren verwendungen |
| DE69123241T2 (de) | 1990-12-14 | 1997-04-17 | Cell Genesys Inc | Chimärische ketten zur transduktion von rezeptorverbundenen signalwegen |
| WO1992019973A1 (en) | 1991-04-26 | 1992-11-12 | Surface Active Limited | Novel antibodies, and methods for their use |
| JPH06507398A (ja) | 1991-05-14 | 1994-08-25 | リプリジェン コーポレーション | Hiv感染治療のための異種複合抗体 |
| DE69110032T2 (de) | 1991-06-08 | 1995-12-21 | Hewlett Packard Gmbh | Verfahren und Gerät zur Feststellung und/oder Konzentrationsbestimmung von Biomolekülen. |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| US5622929A (en) | 1992-01-23 | 1997-04-22 | Bristol-Myers Squibb Company | Thioether conjugates |
| FR2686901A1 (fr) | 1992-01-31 | 1993-08-06 | Rhone Poulenc Rorer Sa | Nouveaux polypeptides antithrombotiques, leur preparation et compositions pharmaceutiques les contenant. |
| FR2686899B1 (fr) | 1992-01-31 | 1995-09-01 | Rhone Poulenc Rorer Sa | Nouveaux polypeptides biologiquement actifs, leur preparation et compositions pharmaceutiques les contenant. |
| CA2452130A1 (en) | 1992-03-05 | 1993-09-16 | Francis J. Burrows | Methods and compositions for targeting the vasculature of solid tumors |
| US5447851B1 (en) | 1992-04-02 | 1999-07-06 | Univ Texas System Board Of | Dna encoding a chimeric polypeptide comprising the extracellular domain of tnf receptor fused to igg vectors and host cells |
| ZA932522B (en) | 1992-04-10 | 1993-12-20 | Res Dev Foundation | Immunotoxins directed against c-erbB-2(HER/neu) related surface antigens |
| WO1994004690A1 (en) | 1992-08-17 | 1994-03-03 | Genentech, Inc. | Bispecific immunoadhesins |
| WO1994004670A1 (en) | 1992-08-26 | 1994-03-03 | President And Fellows Of Harvard College | Use of the cytokine ip-10 as an anti-tumor agent |
| US5885573A (en) | 1993-06-01 | 1999-03-23 | Arch Development Corporation | Methods and materials for modulation of the immunosuppressive activity and toxicity of monoclonal antibodies |
| US5483469A (en) | 1993-08-02 | 1996-01-09 | The Regents Of The University Of California | Multiple sort flow cytometer |
| US5464581A (en) | 1993-08-02 | 1995-11-07 | The Regents Of The University Of California | Flow cytometer |
| US5837458A (en) | 1994-02-17 | 1998-11-17 | Maxygen, Inc. | Methods and compositions for cellular and metabolic engineering |
| US5834252A (en) | 1995-04-18 | 1998-11-10 | Glaxo Group Limited | End-complementary polymerase reaction |
| US5605793A (en) | 1994-02-17 | 1997-02-25 | Affymax Technologies N.V. | Methods for in vitro recombination |
| HUT76369A (en) | 1994-07-29 | 1997-08-28 | Smithkline Beecham Corp | Novel soluble protein compounds |
| US5602039A (en) | 1994-10-14 | 1997-02-11 | The University Of Washington | Flow cytometer jet monitor system |
| US5643796A (en) | 1994-10-14 | 1997-07-01 | University Of Washington | System for sensing droplet formation time delay in a flow cytometer |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| AU5711196A (en) | 1996-03-14 | 1997-10-01 | Human Genome Sciences, Inc. | Apoptosis inducing molecule i |
| EP0904107B1 (en) | 1996-03-18 | 2004-10-20 | Board Of Regents, The University Of Texas System | Immunoglobin-like domains with increased half lives |
| EP0904278A4 (en) | 1996-03-22 | 1999-09-15 | Human Genome Sciences Inc | MOLECULE II INDUCER OF APOPTOSIS |
| GB9623820D0 (en) | 1996-11-16 | 1997-01-08 | Secr Defence | Surface plasma resonance sensor |
| US7951917B1 (en) | 1997-05-02 | 2011-05-31 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| US20020062010A1 (en) | 1997-05-02 | 2002-05-23 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| CN1174993C (zh) | 1997-11-03 | 2004-11-10 | 人体基因组科学有限公司 | Vegi,一种血管发生和肿瘤生长的抑制剂 |
| DE69922159T2 (de) | 1998-01-23 | 2005-12-01 | Vlaams Interuniversitair Instituut Voor Biotechnologie | Mehrzweck-antikörperderivate |
| US6211477B1 (en) | 1998-02-26 | 2001-04-03 | Becton Dickinson And Company | Electrostatic deceleration system for flow cytometer |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| DK2180007T4 (da) | 1998-04-20 | 2017-11-27 | Roche Glycart Ag | Glycosyleringsteknik for antistoffer til forbedring af antistofafhængig cellecytotoxicitet |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| AU771043B2 (en) | 1998-05-20 | 2004-03-11 | Fraunhofer-Gesellschaft Zur Forderung Der Angewandten Forschung E.V. | Surface plasmon resonance sensor for the simultaneous measurement of a plurality of samples in fluid form |
| US6289286B1 (en) | 1998-05-29 | 2001-09-11 | Biacore Ab | Surface regeneration of biosensors and characterization of biomolecules associated therewith |
| US7183387B1 (en) | 1999-01-15 | 2007-02-27 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| KR20060067983A (ko) | 1999-01-15 | 2006-06-20 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| EP2275541B1 (en) | 1999-04-09 | 2016-03-23 | Kyowa Hakko Kirin Co., Ltd. | Method for controlling the activity of immunologically functional molecule |
| US7504256B1 (en) | 1999-10-19 | 2009-03-17 | Kyowa Hakko Kogyo Co., Ltd. | Process for producing polypeptide |
| EP1094110A1 (en) | 1999-10-21 | 2001-04-25 | Leadd B.V. | Apoptosis inducing proteinaceous substance |
| US6926898B2 (en) | 2000-04-12 | 2005-08-09 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| EP1333032A4 (en) | 2000-10-06 | 2005-03-16 | Kyowa Hakko Kogyo Kk | METHOD FOR PURIFYING ANTIBODIES |
| US6946292B2 (en) | 2000-10-06 | 2005-09-20 | Kyowa Hakko Kogyo Co., Ltd. | Cells producing antibody compositions with increased antibody dependent cytotoxic activity |
| AU1632002A (en) | 2000-10-13 | 2002-04-22 | Richard Boyd | Hematopoietic stem cell gene therapy |
| ATE489395T1 (de) | 2000-12-12 | 2010-12-15 | Medimmune Llc | Moleküle mit längeren halbwertszeiten, zusammensetzungen und deren verwendung |
| JP2004536786A (ja) | 2001-03-02 | 2004-12-09 | メディミューン,インコーポレイテッド | インテグリンαvβ3拮抗薬を他の予防薬もしくは治療薬と組み合わせて投与することによる炎症性疾患または自己免疫疾患の予防または治療方法 |
| EP1383800A4 (en) | 2001-04-02 | 2004-09-22 | Idec Pharma Corp | RECOMBINANT ANTIBODIES CO-EXPRESSED WITH GNTIII |
| US20060073141A1 (en) | 2001-06-28 | 2006-04-06 | Domantis Limited | Compositions and methods for treating inflammatory disorders |
| CN102180944A (zh) | 2001-10-10 | 2011-09-14 | 诺和诺德公司 | 肽的重构和糖缀合 |
| ITMI20012110A1 (it) | 2001-10-12 | 2003-04-12 | Keryos Spa | Vettori multi-cistronici utilizzabili in protocolli di trsferimento genico |
| AU2002337935B2 (en) | 2001-10-25 | 2008-05-01 | Genentech, Inc. | Glycoprotein compositions |
| EP2075256A2 (en) | 2002-01-14 | 2009-07-01 | William Herman | Multispecific binding molecules |
| JP2005533001A (ja) | 2002-03-04 | 2005-11-04 | メディミューン,インコーポレーテッド | インテグリンαvβ3アンタゴニストを他の物質と併用投与する癌の予防または治療方法 |
| US7332580B2 (en) | 2002-04-05 | 2008-02-19 | The Regents Of The University Of California | Bispecific single chain Fv antibody molecules and methods of use thereof |
| EP3502133A1 (en) | 2002-09-27 | 2019-06-26 | Xencor, Inc. | Optimized fc variants and methods for their generation |
| US7960512B2 (en) | 2003-01-09 | 2011-06-14 | Macrogenics, Inc. | Identification and engineering of antibodies with variant Fc regions and methods of using same |
| US7461263B2 (en) | 2003-01-23 | 2008-12-02 | Unspam, Llc. | Method and apparatus for a non-revealing do-not-contact list system |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| US20070041987A1 (en) | 2003-03-19 | 2007-02-22 | Daniel Carter | Fragments or polymers of albumin with tunable vascular residence time for use in therapeutic delivery and vaccine development |
| EP2395016A3 (en) | 2003-05-30 | 2012-12-19 | Merus B.V. | Design and use of paired variable regions of specific binding molecules |
| AU2004242846A1 (en) | 2003-05-31 | 2004-12-09 | Micromet Ag | Pharmaceutical compositions comprising bispecific anti-CD3, anti-CD19 antibody constructs for the treatment of B-cell related disorders |
| AU2003264053A1 (en) | 2003-08-12 | 2005-03-10 | William M. Yarbrough | Treatment for acne vulgaris and method of use |
| AU2004309347B2 (en) | 2003-12-19 | 2010-03-04 | Genentech, Inc. | Monovalent antibody fragments useful as therapeutics |
| WO2006023420A2 (en) | 2004-08-16 | 2006-03-02 | Medimmune, Inc. | Integrin antagonists with enhanced antibody dependent cell-mediated cytotoxicity activity |
| WO2006031994A2 (en) * | 2004-09-14 | 2006-03-23 | Xencor, Inc. | Monomeric immunoglobulin fc domains |
| US7563443B2 (en) | 2004-09-17 | 2009-07-21 | Domantis Limited | Monovalent anti-CD40L antibody polypeptides and compositions thereof |
| US20060106905A1 (en) | 2004-11-17 | 2006-05-18 | Chren William A Jr | Method for reducing memory size in logarithmic number system arithmetic units |
| US20110123440A1 (en) | 2005-03-29 | 2011-05-26 | Genevieve Hansen | Altered Antibody FC Regions and Uses Thereof |
| EP3050963B1 (en) | 2005-03-31 | 2019-09-18 | Chugai Seiyaku Kabushiki Kaisha | Process for production of polypeptide by regulation of assembly |
| US20090226466A1 (en) | 2005-11-03 | 2009-09-10 | Sherman Fong | Therapeutic anti-her2 antibody fusion polypeptides |
| JP5374359B2 (ja) | 2006-03-17 | 2013-12-25 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 安定化されたポリペプチド化合物 |
| US20070278170A1 (en) | 2006-03-17 | 2007-12-06 | John Wiebe | Audio equipment storage device |
| JP5474531B2 (ja) * | 2006-03-24 | 2014-04-16 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 操作されたヘテロ二量体タンパク質ドメイン |
| ES2654040T3 (es) | 2006-03-31 | 2018-02-12 | Chugai Seiyaku Kabushiki Kaisha | Método de modificación de anticuerpos para la purificación de anticuerpos biespecíficos |
| JP5189082B2 (ja) | 2006-05-25 | 2013-04-24 | バイエル・ファルマ・アクチェンゲゼルシャフト | 二量体分子複合体 |
| US7769573B2 (en) | 2006-05-26 | 2010-08-03 | Zymeworks Inc. | System and method for modeling interactions |
| US20070274985A1 (en) | 2006-05-26 | 2007-11-29 | Stefan Dubel | Antibody |
| EP2035456A1 (en) | 2006-06-22 | 2009-03-18 | Novo Nordisk A/S | Production of bispecific antibodies |
| US20080147360A1 (en) | 2006-10-16 | 2008-06-19 | Anthony Peter Fejes | System and method for simulating the time-dependent behaviour of atomic and/or molecular systems subject to static or dynamic fields |
| WO2008140493A2 (en) | 2006-11-21 | 2008-11-20 | The Regents Of The University Of Californina | Anti-egfr family antibodies, bispecific anti-egfr family antibodies and methods of use thereof |
| EP2626372B1 (en) | 2007-03-29 | 2018-03-21 | Genmab A/S | Bispecific antibodies and methods for production thereof |
| EP2144930A1 (en) | 2007-04-18 | 2010-01-20 | ZymoGenetics, Inc. | Single chain fc, methods of making and methods of treatment |
| CA2588106A1 (en) | 2007-05-18 | 2008-11-18 | Nrc - Institute For Biological Sciences | Single-domain antibodies and heavy chain antibody against egfr and uses thereof |
| KR20120125601A (ko) | 2007-05-24 | 2012-11-16 | 아블린쓰 엔.브이. | Rank-l에 대한 아미노산 서열, 및 이를 포함하는 골 질환 및 장애 치료용 폴리펩티드 |
| EP2207881A1 (en) | 2007-10-12 | 2010-07-21 | F. Hoffmann-Roche AG | Protein expression from multiple nucleic acids |
| TW200944231A (en) | 2007-11-30 | 2009-11-01 | Glaxo Group Ltd | Antigen-binding constructs |
| US8242247B2 (en) | 2007-12-21 | 2012-08-14 | Hoffmann-La Roche Inc. | Bivalent, bispecific antibodies |
| US9266967B2 (en) | 2007-12-21 | 2016-02-23 | Hoffmann-La Roche, Inc. | Bivalent, bispecific antibodies |
| HUE028536T2 (en) * | 2008-01-07 | 2016-12-28 | Amgen Inc | Method for producing antibody to FC heterodimer molecules using electrostatic control effects |
| WO2009094551A1 (en) | 2008-01-25 | 2009-07-30 | Amgen Inc. | Ferroportin antibodies and methods of use |
| WO2009098596A2 (en) | 2008-02-05 | 2009-08-13 | Zymeworks Inc. | Methods for determining correlated residues in a protein or other biopolymer using molecular dynamics |
| US10981998B2 (en) | 2008-10-01 | 2021-04-20 | Amgen Research (Munich) Gmbh | Cross-species-specific single domain bispecific single chain antibody |
| KR20110112301A (ko) | 2008-11-18 | 2011-10-12 | 메리맥 파마슈티컬즈, 인크. | 인간 혈청 알부민 링커 및 그 콘쥬게이트 |
| WO2010068722A1 (en) | 2008-12-12 | 2010-06-17 | Medimmune, Llc | Crystals and structure of a human igg fc variant with enhanced fcrn binding |
| BRPI1006998A2 (pt) | 2009-01-23 | 2015-08-25 | Biogen Idec Inc | Polipeptídeos fc estabilizados com função efetora reduzida e métodos de uso |
| RU2598248C2 (ru) | 2009-04-02 | 2016-09-20 | Роше Гликарт Аг | Полиспецифичные антитела, включающие антитела полной длины и одноцепочечные фрагменты fab |
| WO2010115553A1 (en) * | 2009-04-07 | 2010-10-14 | Roche Glycart Ag | Bispecific anti-erbb-2/anti-c-met antibodies |
| AU2010234459A1 (en) | 2009-04-08 | 2011-11-03 | The Regents Of The University Of California | Human protein scaffold with controlled serum pharmacokinetics |
| CA2761233A1 (en) | 2009-05-27 | 2010-12-02 | F. Hoffmann-La Roche Ag | Tri- or tetraspecific antibodies |
| US8703132B2 (en) | 2009-06-18 | 2014-04-22 | Hoffmann-La Roche, Inc. | Bispecific, tetravalent antigen binding proteins |
| EP3916011A1 (en) | 2009-06-26 | 2021-12-01 | Regeneron Pharmaceuticals, Inc. | Readily isolated bispecific antibodies with native immunoglobulin format |
| JP2012532608A (ja) | 2009-07-08 | 2012-12-20 | アムジェン インコーポレイテッド | CH3ドメイン界面操作を通じた、安定でそして凝集しない抗体Fc分子の設計 |
| US9493578B2 (en) | 2009-09-02 | 2016-11-15 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| WO2011056124A1 (en) | 2009-11-04 | 2011-05-12 | Affibody Ab | Her3 binding polypeptides |
| MX340971B (es) * | 2009-11-23 | 2016-08-02 | Amgen Inc * | Fragmento cristalizable (fc) de anticuerpo monomerico. |
| US20120303289A1 (en) | 2009-12-02 | 2012-11-29 | Anders Ohrn | Combined on-lattice/off-lattice optimization method for rigid body docking |
| TW201138821A (en) | 2010-03-26 | 2011-11-16 | Roche Glycart Ag | Bispecific antibodies |
| JP2013523098A (ja) | 2010-03-29 | 2013-06-17 | ザイムワークス,インコーポレイテッド | 強化又は抑制されたエフェクター機能を有する抗体 |
| CA2796633C (en) | 2010-04-23 | 2020-10-27 | Genentech, Inc. | Production of heteromultimeric proteins |
| JP6022444B2 (ja) | 2010-05-14 | 2016-11-09 | ライナット ニューロサイエンス コーポレイション | ヘテロ二量体タンパク質ならびにそれを生産および精製するための方法 |
| JP6082344B2 (ja) | 2010-05-27 | 2017-02-15 | ゲンマブ エー/エス | Her2エピトープに対するモノクローナル抗体 |
| WO2012006635A1 (en) | 2010-07-09 | 2012-01-12 | Biogen Idec Hemophilia Inc. | Processable single chain molecules and polypeptides made using same |
| JP5937077B2 (ja) | 2010-09-24 | 2016-06-22 | ザイムワークス,インコーポレイテッド | 分子パッキング計算システム |
| CA2812721C (en) | 2010-09-30 | 2019-01-15 | Zymeworks Inc. | Simplifying residue relationships in protein design |
| RS59589B1 (sr) * | 2010-11-05 | 2019-12-31 | Zymeworks Inc | Dizajniranje stabilnog heterodimernog antitela sa mutacijama u fc domenu |
| JP6101638B2 (ja) | 2011-03-03 | 2017-03-22 | ザイムワークス,インコーポレイテッド | 多価ヘテロマルチマー足場設計及び構築物 |
| CA2832387A1 (en) | 2011-04-20 | 2012-10-26 | Genmab A/S | Bispecifc antibodies against her2 |
| BR112013032630B1 (pt) | 2011-06-30 | 2022-06-14 | Chugai Seiyaku Kabushiki Kaisha | Polipeptídeo heterodimerizado compreendendo região fc de igg |
| PE20141521A1 (es) | 2011-08-23 | 2014-10-25 | Roche Glycart Ag | Moleculas biespecificas de union a antigeno activadoras de celulas t |
| JP6326371B2 (ja) | 2011-11-04 | 2018-05-16 | ザイムワークス,インコーポレイテッド | Fcドメインにおける変異を有する安定なヘテロ二量体抗体デザイン |
| SI2794905T1 (sl) | 2011-12-20 | 2020-08-31 | Medimmune, Llc | Modificirani polipeptidi za ogrodja bispecifičnega protitelesa |
| EP2828779B1 (en) | 2012-03-21 | 2019-05-08 | Zymeworks Inc. | Systems and methods for making two dimensional graphs of macromolecules |
| JP6351572B2 (ja) | 2012-05-10 | 2018-07-04 | ザイムワークス,インコーポレイテッド | Fcドメインに突然変異を有する免疫グロブリン重鎖のヘテロ多量体構築物 |
| CA2873720A1 (en) | 2012-05-10 | 2013-11-14 | Zymeworks Inc. | Single-arm monovalent antibody constructs and uses thereof |
| EP2864917B8 (en) | 2012-06-21 | 2021-01-06 | Zymeworks Inc. | Systems and methods for identifying thermodynamically relevant polymer conformations |
| US9499634B2 (en) | 2012-06-25 | 2016-11-22 | Zymeworks Inc. | Process and methods for efficient manufacturing of highly pure asymmetric antibodies in mammalian cells |
| WO2014012082A2 (en) | 2012-07-13 | 2014-01-16 | Zymeworks Inc. | Multivalent heteromultimer scaffold design an constructs |
| CN104640562A (zh) | 2012-07-13 | 2015-05-20 | 酵活有限公司 | 包含抗-cd3构建体的双特异性不对称异二聚体 |
| CA2878587A1 (en) | 2012-07-23 | 2014-01-30 | Zymeworks Inc. | Immunoglobulin constructs comprising selective pairing of the light and heavy chains |
| CA2881934C (en) | 2012-08-17 | 2021-06-29 | Zymeworks Inc. | Systems and methods for sampling and analysis of polymer conformational dynamics |
| US9771573B2 (en) | 2012-10-03 | 2017-09-26 | Zymeworks Inc. | Methods of quantitating heavy and light chain polypeptide pairs |
| AU2013337578C1 (en) | 2012-11-02 | 2018-04-12 | Zymeworks Inc. | Crystal structures of heterodimeric Fc domains |
| JP6571527B2 (ja) | 2012-11-21 | 2019-09-04 | ウーハン ワイゼットワイ バイオファルマ カンパニー リミテッドWuhan Yzy Biopharma Co., Ltd. | 二重特異性抗体 |
| CA3206122A1 (en) | 2012-11-28 | 2014-06-05 | Zymeworks Bc Inc. | Engineered immunoglobulin heavy chain-light chain pairs and uses thereof |
| US9914785B2 (en) | 2012-11-28 | 2018-03-13 | Zymeworks Inc. | Engineered immunoglobulin heavy chain-light chain pairs and uses thereof |
| US10239951B2 (en) | 2013-05-08 | 2019-03-26 | Zymeworks Inc. | Bispecific HER2 and HER3 antigen binding constructs |
| CA2913363A1 (en) | 2013-05-24 | 2014-11-27 | Zymeworks Inc. | Modular protein drug conjugate therapeutic |
| US20160355588A1 (en) | 2013-07-12 | 2016-12-08 | Zymeworks Inc. | Bispecific CD3 and CD19 Antigen Binding Constructs |
| BR112016027888A2 (pt) | 2014-05-28 | 2017-10-24 | Zymeworks Inc | construto de polipeptídeo de ligação ao antígeno isolado, polinucleotídeo isolado ou um conjunto de polinucleotídeos isolados, vetor ou conjunto de vetores, célula isolada, composição farmacêutica, uso do construto, método para tratar um sujeito com uma doença ou distúrbio, método para obter um construto, método para preparar um construto, meio de armazenamento legível por computador, método para produzir um construto de polipeptídeo de ligação com antígeno bi-específico e método para preparar um construto de polipeptídeo de ligação com antígeno isolado |
-
2011
- 2011-11-04 RS RS20191530A patent/RS59589B1/sr unknown
- 2011-11-04 RU RU2013124423/10A patent/RU2604490C2/ru active
- 2011-11-04 JP JP2013536966A patent/JP6167040B2/ja active Active
- 2011-11-04 BR BR112013011811A patent/BR112013011811A2/pt active Search and Examination
- 2011-11-04 EP EP11837370.3A patent/EP2635607B1/en active Active
- 2011-11-04 KR KR1020137014071A patent/KR20130135866A/ko active Search and Examination
- 2011-11-04 PT PT118373703T patent/PT2635607T/pt unknown
- 2011-11-04 CN CN201180064119.XA patent/CN103429620B/zh active Active
- 2011-11-04 US US13/289,934 patent/US9562109B2/en active Active
- 2011-11-04 AU AU2011325833A patent/AU2011325833C1/en active Active
- 2011-11-04 DK DK11837370T patent/DK2635607T3/da active
- 2011-11-04 HU HUE11837370A patent/HUE047228T2/hu unknown
- 2011-11-04 CN CN201810134850.9A patent/CN108341868B/zh active Active
- 2011-11-04 WO PCT/CA2011/001238 patent/WO2012058768A1/en active Application Filing
- 2011-11-04 PL PL11837370T patent/PL2635607T3/pl unknown
- 2011-11-04 CA CA2815266A patent/CA2815266C/en active Active
- 2011-11-04 KR KR1020197002645A patent/KR101973930B1/ko active IP Right Grant
- 2011-11-04 ES ES11837370T patent/ES2758994T3/es active Active
- 2011-11-04 MX MX2013004997A patent/MX352929B/es active IP Right Grant
-
2017
- 2017-01-18 US US15/409,456 patent/US10875931B2/en active Active
-
2019
- 2019-11-12 HR HRP20192045TT patent/HRP20192045T1/hr unknown
- 2019-12-02 CY CY20191101259T patent/CY1122409T1/el unknown
-
2020
- 2020-11-30 US US17/107,217 patent/US20210277150A1/en active Pending
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11286311B2 (en) | 2012-11-27 | 2022-03-29 | Ajou University Industry-Academic Cooperation Foundation | CH3 domain variant pair inducing formation of heterodimer of heavy chain constant region of antibody at high efficiency, method for preparing same, and use thereof |
| US12060436B2 (en) | 2012-11-28 | 2024-08-13 | Zymeworks Bc Inc. | Engineered immunoglobulin heavy chain-light chain pairs and uses thereof |
| US11155639B2 (en) | 2015-10-12 | 2021-10-26 | Ajou University Industry—Academic Cooperation Foundation | Method for producing antibody CH3 domain heterodimeric mutant pair using yeast mating and CH3 mutant pair produced thereby |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210277150A1 (en) | STABLE HETERODIMERIC ANTIBODY DESIGN WITH MUTATIONS IN THE Fc DOMAIN | |
| AU2017245451B9 (en) | Stable heterodimeric antibody design with mutations in the Fc domain | |
| JP6351572B2 (ja) | Fcドメインに突然変異を有する免疫グロブリン重鎖のヘテロ多量体構築物 | |
| RU2810540C2 (ru) | РАЗРАБОТКА СТАБИЛЬНОГО ГЕТЕРОДИМЕРНОГО АНТИТЕЛА С МУТАЦИЯМИ В ДОМЕНЕ Fc |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| AMND | Amendment |