CN103298935A - 用于改善生物活性多肽性能的组合物和方法 - Google Patents
用于改善生物活性多肽性能的组合物和方法 Download PDFInfo
- Publication number
- CN103298935A CN103298935A CN2008801033448A CN200880103344A CN103298935A CN 103298935 A CN103298935 A CN 103298935A CN 2008801033448 A CN2008801033448 A CN 2008801033448A CN 200880103344 A CN200880103344 A CN 200880103344A CN 103298935 A CN103298935 A CN 103298935A
- Authority
- CN
- China
- Prior art keywords
- polypeptide
- amino acid
- additional
- composition
- additional polypeptide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/24—Drugs for disorders of the endocrine system of the sex hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/53—Colony-stimulating factor [CSF]
- C07K14/535—Granulocyte CSF; Granulocyte-macrophage CSF
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/555—Interferons [IFN]
- C07K14/56—IFN-alpha
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
- C07K14/61—Growth hormones [GH] (Somatotropin)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/40—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/22—Immunoglobulins specific features characterized by taxonomic origin from camelids, e.g. camel, llama or dromedary
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/626—Diabody or triabody
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
Abstract
本发明涉及与一个或多个附加多肽连接的生物活性多肽。本发明还提供包括编码本发明蛋白质体的载体的重组多肽,以及包含该载体的宿主细胞。本发明的组合物具有多种用途,包括多种药学应用。
Description
相关申请的交叉引用
本申请要求待决的2007年8月15日提交的美国临时申请60/956,109号、2007年10月18日提交的美国临时申请60/981,073号和2007年11月8日提交的美国临时申请60/986,569号的优先权,其在此通过引用全文并入本申请。
背景技术
重组蛋白质已成为用于开发新型疗法的非常有吸引力的候选物。但是蛋白质药物的生产需要工艺的显著优化以获得特定的生物活性多肽的足够产量。已经很好地确认,在大肠杆菌的胞质中表达重组蛋白质,特别是哺乳动物重组蛋白质,常常导致形成称为包含体的不溶性聚集体。来自大肠杆菌包含体的重组蛋白质的高细胞密度发酵和纯化是经济地制备治疗蛋白质的两个主要瓶颈(Panda,A.K,2003,Adv.Biochem.Eng.Biotechnol.,85,43)。类似地,出于研究目的,在可能需要对数百种蛋白质进行各种不同活性的筛选的情况下,希望表达可溶性的活性蛋白,从而避免首先纯化包含体而然后必须各个地变性和重折叠蛋白质的步骤。
许多在大肠杆菌的胞质空间中表达时形成不溶性包含体的药学上重要的蛋白质的实例包括人生长激素(hGH)(Patra,A.K.等,2000,Protein Expr.Purif,18,182;Khan,R.H等,1998,Biotechnol.Prog.,14,722)、人粒细胞集落刺激因子(G-CSF)(Zaveckas,M.等2007,JChromatogr B Analyt Technol Biomed Life Sci.852,409;Lee,A.Y.等,2003,Biotechnol Lett.,25,205)和干扰素α(IFN-α;Valente,C.A.等,2006,Protein.Expr.Purif.45,226)。另外,抗体的免疫球蛋白域及其片段,包括域抗体片段(dAb)、Fv片段、单链Fv片段(scFv)、Fab片段、Fab’2片段和许多非抗体蛋白质(如FnIII结构域)一般在细菌宿主的胞质中表达时形成包含体(Kou,G.等,2007,Protein Expr Purif.52,131;Cao,P.等2006,Appl Microbiol Biotechnol.,73,151;Chen,L.H等,2006,Protein Expr Purif.;46,495)。
人蛋白质通常利用包含大量疏水氨基酸的疏水核心折叠。研究表明蛋白质可能聚集和形成包含体,特别是当来自一种生物的基因在另一表达宿主中表达时,这样蛋白质的天然结合伴体不存在,因而没有折叠帮助物且疏水补充保持暴露。在跨越大的进化距离时特别是如此:例如从真核生物分离的cDNA在原核生物中作为重组基因表达时具有聚集和形成包含体的高风险。尽管cDNA可以正确地编码可翻译mRNA,所得到的蛋白质将出现在外源微环境中。这常常导致错误折叠的、失活蛋白质,如果浓度足够高的话其通常积聚为聚集体。其它因素如原核细胞的内部微环境(pH,克分子渗透压浓度)可能与基因原始来源不同并影响蛋白质折叠。折叠蛋白质的机制也可能是宿主依赖性的并因此在异源宿主中不存在,和正常情况下作为疏水核心的部分保持包埋的疏水性残基则保持暴露并可与其它蛋白质上的疏水位点相互作用。用于切割和除去表达的蛋白质的内含肽的加工系统也可能在细菌中不存在。另外,可能将蛋白质浓度保持在低水平的精细控制也在原核细胞中丧失,且过表达可以导致细胞被通过饱和其环境而沉淀的蛋白质(即使其正确地折叠)充满。
从包含体中发现的聚集状态回收生物活性产物通常通过用离液剂或酸展开折叠,随后稀释或透析到优化的重折叠缓冲液中来完成。但是,许多多肽(特别是结构上复杂的低聚蛋白质和包含多个二硫键的多肽)不容易在化学变性后采取活性构象。
初级结构的小变化可能影响溶解性,据推测是通过改变折叠途径(Mitraki,A.等(1989)Bio/Technology 7,690;Baneyx,F等2004NatBiotechnol,22,1399;Ventura,S.2005Microb Cell Fact,4,11)。为在高密度发酵过程中减少不溶性聚集体的形成,一些小组将异源融合蛋白质连接到目标蛋白质。这类融合序列的例子是谷胱甘肽-S-转移酶(GST)、蛋白质二硫键异构酶(PDI)、硫氧还蛋白(TRX)、麦芽糖结合蛋白(MBP)、His6标签、几丁质结合域(CBD)和纤维素结合域(CBD)(Sahadev,S.等2007,Mol.Cell.Biochem.;Dysom,M.R.等2004,BMCBiotechnol,14,32)。总之,这些途径被发现是蛋白质特异性的,因为它们不是对所有蛋白质有效。
在设计各种融合蛋白质以改善折叠的同时,蛋白质的化学PEG化也已报道增强蛋白质溶解性、减少聚集、降低免疫原性和减少蛋白质水解。虽然如此,过度产生的多肽的正确折叠在细胞质的高浓缩和粘性的环境中仍然存在问题,在这种环境中聚集以浓度依赖性的方式发生。在细菌宿主中表达哺乳动物蛋白质的另一个途径避免前导肽并在宿主的胞质中直接表达活性蛋白质。但是,这一过程倾向于导致聚集和包含体形成。
一种广泛使用的在细菌中表达活性形式的哺乳动物蛋白质的途径是通常使用信号肽或前导肽指导分泌而将蛋白质导入细菌宿主如大肠杆菌的壁膜间隙的非还原(non-reducing)环境中。分泌到周质中(且很少见地分泌到培养基中)表现为模拟蛋白质分泌、折叠和二硫键形成的天然真核生物过程并沉淀产生活性蛋白质。这一途径具有许多严重的缺陷。周质倾向于提供低产量;该过程一般局限于较小的蛋白质;该过程倾向于是蛋白质特异性的;而且用于提取周质蛋白质的过程不象从胞质提取一样稳定,这造成低产量。由于这些原因,在细菌周质中的蛋白质表达不适用于大多数通常在酵母或哺乳动物细胞系中商业上表达的药物蛋白质。
已尝试使得哺乳动物蛋白质在细菌的胞质中表达而不形成包含体的另一个途径是超表达折叠辅助蛋白质,如在大范围的生物技术应用中发挥作用的分子伴侣(Mogk等2002Chembiochem 3,807)。至今,已报道了几个不同的伴侣家族。它们所有都是以其结合未折叠或部分折叠的蛋白质和释放正确折叠的蛋白质到细菌的胞质中为特征的。良好表征的实例是蛋白质的热休克家族(Hsp),其是按照它们的相对分子量命名的,如由Buchner,J.,Faseb J.1996 10,10及由Beissinger,M.和Buchner,1998.J.Biol.Chem.379,245描述的。尽管许多细菌和真核生物伴侣蛋白已尝试用于蛋白质在细菌中或在更小的程度上在哺乳动物细胞中的过表达,但这一途径一般具有很少或没有效果且这更少实际用于表达优化。
因此仍然非常需要用于产生生物活性蛋白质和用于提高其溶解性以实现利用宿主细胞(如原核生物)的大规模生产的方法和组合物。
发明内容
本发明提供制备生物活性多肽的方法。该方法通常包括步骤:a)提供编码一种修饰多肽的多核苷酸序列,该修饰多肽包含与附加多肽连接的生物活性多肽,从而在宿主细胞中该修饰多肽的表达与生物活性多肽本身(例如,没有所述附加多肽)的表达相比产生更高量的可溶形式的生物活性多肽;和b)使得修饰多肽在所述宿主细胞中表达,从而制备生物活性多肽。在一个实施方式中,可溶的活性形式的生物活性多肽的表达为该蛋白质总量的大约1%、5%、25%、50%、75%、95%或99%。在一个实施方式中,修饰多肽在宿主细胞中的表达与生物活性多肽本身的表达相比产生至少大约2倍多的可溶形式的生物活性多肽。在另一个实施方式中,生物活性多肽通过蛋白酶(proteinease)切割位点连接附加多肽。在需要时,切割位点可以选自TEV蛋白酶、肠激酶、Xa因子、凝血酶、PreScissionTM蛋白酶、3C蛋白酶、转肽酶(sortase)A和颗粒酶(granzyme)B。在某些实施方式中,修饰多肽在宿主细胞中的表达产生至少大约2倍、5倍、10倍、30倍或100倍,或者更多的可溶形式的生物活性多肽。
本发明还提供用于表达修饰的多核苷酸序列的宿主细胞。该宿主细胞通常是原核的,包括但不限于大肠杆菌,且它也可以是真核的如酵母细胞及哺乳动物细胞(例如,CHO细胞)。
本发明还提供包含编码与附加多肽连接或未连接的生物活性多肽的所述多核苷酸序列的遗传载体。
本发明进一步提供包含与附加多肽连接的可溶形式的生物活性多肽的组合物,其中所述附加多肽与生物活性多肽连接时提高生物活性多肽在其中表达连接的生物活性多肽的宿主细胞的细胞溶胶部分中的溶解性。在需要的情况下,生物活性多肽通过蛋白酶切割位点连接到附加多肽。切割位点可以选自TEV蛋白酶、肠激酶、Xa因子、凝血酶、PreScissionTM蛋白酶、3C蛋白酶、转肽酶A和颗粒酶B。
用于本发明的方法或组合物中的附加多肽可全部或部分地通过以下方式表征。在一个实施方式中,所述附加多肽提供大约+0.025、+0.05、+0.075、+0.1、+0.2、+0.3、+0.4、+0.5、+0.6、+0.7、+0.8、+0.9或甚至+1.0电荷每氨基酸残基的被修饰生物活性多肽的平均净正电荷密度。在另一个实施方式中,所述附加多肽提供大约-0.25、-0.5、-0.075、-0.1、-0.2、-0.3、-0.4、-0.5、-0.6、-0.7、-0.8、-0.9或甚至-1.0电荷每氨基酸残基的被修饰生物活性多肽的平均净负电荷密度。在一个实施方式中,所述附加多肽提供大约+3、+4、+5、+6、+7、+8、+9、+10、+12、+14、+16、+18、+20、+25、+30、+35、+40、+50或更高的被修饰生物活性多肽的净正电荷。在一个实施方式中,所述附加多肽提供大约-3、-4、-5、-6、-7、-8、-9、-10、-12、-14、-16、-18、-20、-25、-30、-35、-40、-50或更高的被修饰生物活性多肽的净负电荷。
在再另一实施方式中,本发明的附加多肽可以包含超过大约10、30、50或100个氨基酸。在一个实施方式中,附加多肽包含至少40个连续氨基酸且基本上不能非特异性地结合血清蛋白质。在某些实施方式中,附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)和赖氨酸(K)残基的总和超过附加多肽总氨基酸的大约80%;和/或通过仇-法斯门算法(Chou-Fasman algorithm)确定的,附加多肽中的至少50%的氨基酸缺乏二级结构。在相关的实施方式中,附加多肽包含至少40个连续氨基酸且附加多肽具有大于约4小时、5小时、10小时、15小时或24小时的体外血清半衰期。进一步其中(a)附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)和赖氨酸(K)残基的总和超过附加多肽总氨基酸的大约80%;和/或(b)通过仇-法斯门算法确定的,附加多肽中的至少50%的氨基酸缺乏二级结构。在某些实施方式中,从中选出总氨基酸的80%(或者50、60、70或90%)的氨基酸组是G/S/E/D、G/S/K/R、G/S/E/D/K/R或G/A/S/T/Q。
在某些实施方式中,附加多肽包含至少50%的甘氨酸残基(即,所有残基的50%是甘氨酸)。或者,附加多肽可以包含少于50%的甘氨酸残基。在某些实施方式中,附加多肽包含至少50%的丝氨酸残基。其它实施方式提供包含至少50%的丝氨酸和甘氨酸残基的附加多肽。进一步的实施方式提供包含至少5%的谷氨酸的附加多肽,或者可选择地至少10、20或30%的谷氨酸。
在一个实施方式中,附加多肽也可能特征在于(a)它由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和(b)它包含10、25、50、100或更多的氨基酸。在相关的实施方式中,附加多肽由三种类型的氨基酸组成,各类型选自D、E、G、K、P、R、S和T。附加多肽还可以由三种类型的氨基酸组成,各类型选自E、G和S。
本发明还提供特征如下的附加多肽:(i)它由三种类型的氨基酸组成,其中两种是丝氨酸(S)和甘氨酸(G)且另一类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、甘氨酸(G)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和(ii)它包含十个或更多的氨基酸残基,其中50%或以上是丝氨酸或甘氨酸。
在另一个实施方式中,附加多肽特征在于:(a)它由两种类型的氨基酸组成,其中一种类型是甘氨酸(G)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和(b)它包含十个或更多的氨基酸残基,其中50%或更少的是甘氨酸。
或者,附加多肽由两种类型的氨基酸组成,其中总氨基酸的50%或更少的选自A、S、T、D、E、K和H。
在又另一实施方式中,附加多肽特征在于:(a)它包含50个或更多的氨基酸;(b)它由两种类型的氨基酸组成,和(c)总氨基酸的50%或更少的选自A、S、T、D、E、K和H。
附加多肽可以包含1、2、5或10或更多的重复基序,其中各重复基序可以包含200-500个氨基酸。在某些情况中,重复基序由两或三种或更多的不同类型的氨基酸组成。可以使用多个附加多肽。附加多肽还可以包含带电的氨基酸。
在某些实施方式中,附加多肽包含氨基酸序列(GGEGGS)n,其中n是2、3、4、5、6、7、8、9、10或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(GES)n,其中G、E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。或者,附加多肽包含氨基酸序列(GGSGGE)n,其中G、E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在再另一实施方式中,附加多肽包含氨基酸序列(GEGGGEGGE)n,其中n是1、2、3、4、5、6、7、8、9、10或更大的整数。在再另一实施方式中,附加序列包含小的酸序列(minor acid sequence)(GE)n,其中G和E可以是任何顺序且n是1、2、3、4、5、6、7、8、9、10或更大的整数。
在某些实施方式中,附加多肽包含氨基酸序列(S)n,其中n是10、15、20、50或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSSSSE)n,其中E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSSE)n,其中E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在再其它实施方式中,附加多肽包含氨基酸序列(SESSSESSE)n,其中E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在某些实施方式中,附加多肽包含氨基酸序列(SSESSSSESSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSESSSSSESSSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。在又其它的实施方式中,附加多肽包含氨基酸序列(SSSSESSSSSSESSSSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。
在某些实施方式中附加多肽不是由3、4、5、6或7个氨基酸的肽基序的重复单元构成,或不是由任何单多肽基序的重复单元构成。在某些实施方式中附加多肽是由超过2、5、10或20个固定长度的不同重复基序构成。在某些实施方式中附加多肽是由超过2、5、10或20个任意长度的不同重复基序组成。
另外,本发明描述了制备药物组合物的方法,包括:(a)提供修饰多肽;(b)混合所述修饰多肽和聚合物基质。
通过所述方法制备的或存在于所述组合物中的生物活性多肽可以是人生长激素(hGH)、胰高血糖素样肽-1(GLP-1)、艾塞那肽(exenatide)、普兰林肽(pramlitide)、尿酸酶、粒细胞集落刺激因子(G-CSF)、干扰素-α、干扰素-β、干扰素-γ、胰岛素、白介素1受体拮抗剂(IL-1RA)、红细胞生成素或肿瘤坏死因子-α(TFN-α)。
本发明涉及包含(a)缓释剂和(b)包含与附加多肽连接的生物活性多肽的修饰多肽的药物组合物。修饰多肽可以产生大于1的表观分子量因子。表观分子量因子可以确定为相对于修饰多肽的预测分子量的通过尺寸排阻色谱法测量的修饰多肽的表观分子量。在一个实施方式中,修饰多肽的表观分子量因子大于3。在另一个实施方式中,修饰多肽的表观分子量因子大于5。在再另一实施方式中,修饰多肽的表观分子量因子大于7。在又另一实施方式中,修饰多肽的表观分子量因子大于9。
附加多肽可提高生物活性多肽的血清半衰期。或者,附加多肽可提高生物活性多肽的蛋白酶抗性。在其它的情况中,附加多肽可提高生物活性多肽的溶解性。在其它的情况中,附加多肽可降低生物活性多肽的免疫原性。本发明的附加多肽可以包含超过大约10、30、50或100个氨基酸。在某些实施方式中,生物活性多肽可以是人生长激素(hGH)、胰高血糖素样肽-1(GLP-1)、艾塞那肽、普兰林肽、尿酸酶、粒细胞集落刺激因子(G-CSF)、干扰素-α、干扰素-β、干扰素-γ、胰岛素、白介素1受体拮抗剂(IL-1RA)、红细胞生成素或肿瘤坏死因子-α(TNF-α)。
在一个实施方式中,附加多肽包含至少40个连续氨基酸且其基本上不能非特异性地结合血清蛋白质。在某些实施方式中,附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过附加多肽总氨基酸的大约80%;和/或按照仇-法斯门算法确定,附加多肽中氨基酸的至少50%缺乏二级结构。在相关的实施方式中,附加多肽包含至少40个连续氨基酸和附加多肽具有大于大约4小时、5小时、10小时、15小时或24小时的体外血清半衰期。进一步其中(a)附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过附加多肽总氨基酸的大约80%;和/或按照仇-法斯门算法确定,附加多肽中氨基酸的至少50%缺乏二级结构。
在某些实施方式中,附加多肽包含至少50%的甘氨酸残基(即,所有残基的50%是甘氨酸)。或者,附加多肽可以包含少于50%的甘氨酸残基。在某些实施方式中,附加多肽包含至少50%的丝氨酸残基。其它实施方式提供包含至少50%的丝氨酸和甘氨酸残基的附加多肽。进一步的实施方式提供包含至少5%的谷氨酸或者至少10、20或30%的谷氨酸的附加多肽。
在一个实施方式中,附加多肽还可以特征在于(a)它由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和(b)它包含10、25、50、100或更多的氨基酸。在相关的实施方式中,附加多肽由三种类型的氨基酸组成,各类型选自D、E、G、K、P、R、S和T。附加多肽还可以由三种类型的氨基酸组成,各类型选自E、G和S。
本发明还提供特征如下的附加多肽:(i)它由三种类型的氨基酸组成,其中两种是丝氨酸(S)和甘氨酸(G)且另一类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、甘氨酸(G)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和(ii)它包含十个或更多的氨基酸残基,其中50%或更多的是丝氨酸或甘氨酸。
在另一个实施方式中,附加多肽特征在于:(a)它由两种类型的氨基酸组成,其中一种是甘氨酸(G)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和(b)它包含十个或更多的氨基酸残基,其中50%或更少的是甘氨酸。
或者,附加多肽由两种类型的氨基酸组成,其中总氨基酸的50%或更少的选自A、S、T、D、E和H.
在又另一实施方式中,附加多肽特征在于:(a)它包含50个或更多的氨基酸;(b)它由两种类型的氨基酸组成,和(c)总氨基酸的50%或更少的选自A、S、T、D、E和H。
附加多肽可以包含1、2、5或10或者更多的重复基序,其中各重复基序可以包含两百至五百个氨基酸。在某些情况中,重复基序由两或三种或者更多的不同类型的氨基酸组成。可以使用多个附加多肽。附加多肽也可以包含带电氨基酸。
在某些实施方式中,附加多肽包含氨基酸序列(GGEGGS)n,其中n是2、3、4、5、6、7、8、9、10或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(GES)n,其中G、E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。或者,附加多肽包含氨基酸序列(GGSGGE)n,其中G、E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在再另一实施方式中,附加多肽包含氨基酸序列(GEGGGEGGE)n,其中n是1、2、3、4、5、6、7、8、9、10或更大的整数。在再另一实施方式中,附加序列包含较小的酸序列(GE)n,其中G和E可以是任何顺序且n是1、2、3、4、5、6、7、8、9、10或更大的整数。
在某些实施方式中,附加多肽包含氨基酸序列(S)n,其中n是10、15、20、50或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSSSSE)n,其中E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSSE)n,其中E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在再其它的实施方式中,附加多肽包含氨基酸序列(SESSSESSE)n,其中E和S可以是任何顺序且n是2、3、4、5、6、7、8、9、10或更大的整数。在某些实施方式中,附加多肽包含氨基酸序列(SSESSSSESSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSESSSSSESSSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。在又其它的实施方式中,附加多肽包含氨基酸序列(SSSSESSSSSSESSSSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。
在某些实施方式中附加多肽不是由3、4、5、6或7个氨基酸的肽基序的重复单元构成,或不是由任何单多肽基序的重复单元构成。在某些实施方式中附加多肽由超过2、5、10或20个固定长度的不同重复基序构成。在某些实施方式中附加多肽由超过2、5、10或20个任意长度的不同重复基序构成。
缓释剂可以包括聚合物基质。在某些实施方式中,聚合物基质是带电的。在特定的实施方式中,聚合物基质可以是聚-d,1-丙交酯(PLA)、聚-(d,1-丙交酯-共-乙交酯)(PLGA)、PLGA-PEG共聚物、藻酸盐、葡聚糖和/或脱乙酰壳多糖。缓释剂还可以被包装,包括透皮贴片。
本发明还提供制备修饰多肽的方法,包括:a)提供编码修饰多肽的多核苷酸序列;b)使得所述修饰多肽在宿主细胞中表达,从而制备所述修饰多肽。还提供了包含编码修饰多肽的核酸序列的遗传载体,以及表达本发明的修饰多肽的宿主细胞。
另外,本发明描述了制备药物组合物的方法,包括:(a)提供修饰多肽;(b)混合所述修饰多肽和聚合物基质。
本发明的药物组合物可以包含a)缓释剂,b)包含与大小大于5kD的PEG基团连接的生物活性多肽的修饰多肽。
在再其它的实施方式中附加多肽基本上缺乏二级结构。在又其它的实施方式中,与没有附加多肽的相应的多肽相比,附加多肽表现出两倍长的血清半衰期。生物活性多肽和附加多肽可以通过肽键连接。
在某些实施方式中,修饰多肽进一步包含至少一个储存模块(depot module)。储存模块长度为至少10个氨基酸,优选长度为至少100个氨基酸。带正电的储存模块(例如,富含赖氨酸或富含精氨酸的多肽)可用于与带负电的聚合物结合。带负电的储存模块可用于与带正电的聚合物结合。包括聚-His序列的储存模块可用于与螯合水凝胶结合。在某些情况中,储存模块可以是蛋白酶敏感的,例如但非限制性的,对血清蛋白酶或其它蛋白酶敏感的。可以采用多个和/或不同的储存模块。任何储存模块、生物活性多肽和附加多肽的组合可以潜在地用于制备延释的药物。在特别的实施方式中,缓释剂是与修饰多肽连接的储存模块。
另外,提供了包含编码本发明的API的核酸序列的遗传载体。在另一个实施方式中,宿主细胞描述为表达该多肽。
本发明涉及可用于改变生物活性多肽的性质的附加多肽。在一个实施方式中,本发明提供包含生物活性多肽和附加多肽的分离的多肽,其中所述附加多肽特征在于它(i)由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和(ii)它包含十个或更多的氨基酸。在相关的实施方式中,附加多肽由三种类型的氨基酸组成,且各类型选自D、E、G、K、P、R、S和T。在另一相关的实施方式中,附加多肽由三种类型的氨基酸组成,且各类型选自E、S、G、R和A。在另一相关的实施方式中,附加多肽由三种类型的氨基酸组成,且各类型选自E、S、G、R和A。在再另一实施方式中,附加多肽由三种类型的氨基酸组成,且各类型选自E、G和S。分离的多肽可以是治疗性多肽。
本发明还提供包含生物活性多肽和附加多肽的分离的多肽,其中附加多肽特征在于:(i)为聚-丝氨酸和(ii)它包含十个或更多的氨基酸。在相关的实施方式中,分离的多肽(i)由两种类型的氨基酸组成,其中大部分是丝氨酸,和(ii)它包含十个或更多的氨基酸。
在另一个实施方式中,附加多肽由两种类型的氨基酸组成,其中一种是甘氨酸(G)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和(ii)它包含十个或更多的氨基酸残基,其中50%或更少的是甘氨酸。
本发明还提供包含生物活性多肽和附加多肽的分离的多肽,其中附加多肽肽特征在于:(i)它由两种类型的氨基酸组成,其中一种是丝氨酸(S)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、甘氨酸(G)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和(ii)它包含十个或更多的氨基酸残基,其中50%或更多的是丝氨酸。
或者,本发明描述了包含生物活性多肽和附加多肽的分离的多肽,其中附加多肽特征在于:(i)它包含十个或更多的氨基酸;(ii)它由两种类型的氨基酸组成,其中总氨基酸的50%或以下选自A、S、T、D、E和H。
在再另一实施方式中,本发明描述了包含生物活性多肽和附加多肽的分离的多肽,其中附加多肽特征在于:(i)它包含十个或更多的氨基酸;(ii)它由两种类型的氨基酸组成,其中总氨基酸的50%或以下选自A、G、T、D、E和H。
在某些实施方式中,提供包含生物活性多肽和附加多肽的分离的多肽,其中附加多肽特征在于:(i)它由两种类型的氨基酸组成,其中一种选自P、R、L、V、Y、W、M、F、I、K和C;和(ii)它包含十个或更多的氨基酸。
在其它实施方式中,提供包含生物活性多肽和附加多肽的分离的多肽,其中附加多肽在长度上包含至少10个氨基酸且由以相同数目存在的两种不同类型的氨基酸组成。或者,这两种不同类型的氨基酸以1∶2、2∶3或3∶4的比例存在。附加多肽可以另外包含四个或更多的重复基序,其中各重复基序包含两百至五百个氨基酸且由两种不同类型的氨基酸构成。重复基序可以包含超过8个氨基酸,且在某些实施方式中四个或更多的重复基序是相同的。所述四个或更多的重复基序可以包含不同的氨基酸序列。在相关的实施方式中,附加多肽包含至少十个重复基序。
再其它的实施方式提供用基本上缺乏二级结构的附加多肽修饰的生物活性多肽。或者,分离的多肽的表观分子量大于没有附加多肽的相应多肽的表观分子量。在特别的实施方式中,附加多肽的表观分子量大于其实际分子量至少3倍。在又其它的实施方式中,与没有附加多肽的相应多肽相比,附加多肽表现出两倍长的血清半衰期。生物活性多肽和附加多肽可以通过肽键连接。
在某些实施方式中,附加多肽包含氨基酸序列(GGEGGS)n,其中n是3或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(GES)n,其中G、E和S可以是任何顺序且n是3或更大的整数。或者,附加多肽包含氨基酸序列(GGSGGE)n,其中G、E和S可以是任何顺序且n是3或更大的整数。在再另一实施方式中,附加多肽包含氨基酸序列(GGEGGEGGES)n,其中n是1或更大的整数。在再另一实施方式中,附加序列包含较小的酸序列(GE)n,其中G和E可以是任何顺序。
在某些实施方式中,附加多肽包含氨基酸序列(S)n,其中n是10或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSSSSE)n,其中E和S可以是任何顺序且n是2或更大的整数。在再其它的实施方式中,附加多肽包含氨基酸序列(SESSSESSE)n,其中E和S可以是任何顺序且n是3或更大的整数。在某些实施方式中,附加多肽包含氨基酸序列(SSESSSSESSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。在其它实施方式中,附加多肽包含氨基酸序列(SSSESSSSSESSSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。在又其它的实施方式中附加多肽包含氨基酸序列(SSSSESSSSSSESSSSSE)n,其中E和S可以是任何顺序且n是3或更大的整数。
本发明还提供制备分离的多肽的方法,包括:a)提供编码权利要求1、6、7、8或9中任一项的分离的多肽的多核苷酸序列;b)使得所述多肽在宿主细胞中表达,从而制备所述多肽。
另外,提供了包含编码本发明分离的多肽的核酸序列的遗传载体。在另一个实施方式中,宿主细胞描述为表达所述多肽。本发明还预想所述多肽的文库。在特别的实施方式中,多肽文库在噬菌体颗粒上展示。
通过引用方式的并入
在本说明书中提到的所有出版物和专利申请通过引用的方式并入本申请,其程度就如具体地和各个地表示将各个出版物或专利申请以引用的方式并入一样。
附图说明
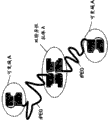
本发明的新特征在所附的权利要求中详细地给出。通过参考下面给出利用了本发明的原理的示例性实施方式的详细说明和附图可以更好地理解本发明的特征和优势。附图中:
图1是附加多肽修饰生物活性蛋白质的示意图。
图2和3显示了包含在本发明的修饰多肽中的可能模块:附加多肽、生物活性多肽、任选的储存模块和任选的一种或多种聚合物基质。
图4显示各种产物构型的实例。在同一产物中可使用模块数次以例如提高生物活性蛋白质对其靶标的亲和性、通过延伸rPEG模块提高半衰期或改变长效制剂(depot formulation)的性质。
图5给出包含允许位点特异性生物素化的储存模块的四聚修饰多肽的具体实施例。加入抗生物素蛋白链菌素诱导形成高度稳定的-但非共价的-修饰多肽四聚体。多价多肽也可以通过将多个模块组合成单个蛋白质链或通过化学连接多个包含特定模块的蛋白质链产生。
图6图示了可引入藻酸盐微球聚合物基质中的富含赖氨酸或精氨酸的储存模块(描绘为矩形)。基质模块描绘为较大的圆形。富含赖氨酸或精氨酸的储库(depot)在生理pH下将携带净正电荷,且这一特性可用于将修饰多肽与带负电的藻酸盐聚合物结合。结合可以以多价方式发生。
图7图示了以与聚合物结合的二价阳离子Cu2+为例的二价阳离子螯合水凝胶(基质模块)。聚组氨酸储存模块(矩形模块)以高亲和力结合Cu2+阳离子.
图8描绘了蛋白酶敏感的多聚体修饰多肽。储存模块(描绘为矩形)将单个的修饰多肽单元连接成延伸的聚合物。储存模块设计为使得其特别地对血清蛋白酶敏感。蛋白酶切割储存模块释放单独的活性修饰多肽。
图9显示表达载体pCW0150的设计。
图10显示与GFP融合的附加多肽rPEG(L288)的设计和构造。
图11显示rPEG_L288多肽的氨基酸和核苷酸序列。
图12显示hGH-rPEG(L288)和GLP-1-rPEG(L288)构建体的设计。
图13显示与附加多肽偶联的生物活性蛋白质的实施例。
图14和15描述用于附加多肽序列优化(sequence optimization)的示例性准则。
图16描述包含与GFP融合的rPEG_J288附加多肽序列的载体的结构。
图17显示rPEG_J288多肽的氨基酸和核苷酸序列。
图18显示适用于本发明中的填充载体(stuffer vector)的设计。
图19显示rPEG_J288-修饰的GFP的纯化。
图20显示测定rPEG_J288-修饰的GFP的血清稳定性。
图21显示附加-修饰多肽与细胞靶标的相互作用。
图22图示了交联附加多肽的概念。
图23描述了交联成分的实例。
图24列举了交联的附加多肽的几个实例。
图25显示其中抗生物素蛋白链菌素用作接头的实施例。
图26描述了构建交联的附加多肽的不同模式。
图27给出交联的附加多肽的几种可能的形式的图示。
图28描述了另外用结合域或其它基团修饰的附加多肽。
图29图示了缓释附加多肽的概念。
图30显示通用的附加多肽。
图31显示来自人IgG1的抗体Fc片段,但它也可能来自IgG2、IgG3、IgG4、IgA、IgD或IgE。该Fc可能具有来自IgG1、IgG2、IgG3、IgG4、IgA、IgD或IgE的天然铰链。在铰链二硫键的数目是存在天然的多样性,但这也可能通过铰链,特别是半胱氨酸残基的突变、缺失或截断产生。可用的变体具有三个二硫键(未显示)、两个二硫键、一个二硫键(IgG1的第一个二硫键或第二个天然二硫键的选择)或没有二硫键。
图32图示了包含亲和性标签、溶解性标签和/或蛋白酶切割位点的修饰多肽的各种构型。
图33图示了使用特定附加多肽提高修饰多肽的表达水平。
图34图示了附加-修饰的hGH多肽相对于未修饰的hGH的活性。
图35显示了通过阴离子交换和尺寸排阻色谱法纯化附加-修饰多肽。
图36显示了由SDS-PAGE确认的通过纯化rPEG-修饰的GFP获得的纯产物。
图37显示了由分析型尺寸排阻色谱法确定的rPEG-连接的GLP1的纯度。
图38显示了通过分析型反相HPLC监测的rPEG_L288-GFP修饰多肽的纯度。
图39为rPEG_J288-GFP的质谱。
图40表明在修饰多肽和血清蛋白质之间观察到很少的非特异性结合。
图41描述了在将生物活性多肽连接到附加多肽时观察到的表观分子量的增加。
图42显示了修饰多肽在大鼠和人血清中的稳定性。
图43图示了rPEG_K288-GFP多肽在大鼠血清中的PK特性。
图44显示了如对于rPEG_J288-GFP、rPEG_K288-GFP和rPEG_L288-GFP的动物试验中确定的rPEG多肽免疫原性的相对缺失。
图45图示了表达与附加多肽连接的生物活性多肽的优点。
图46图示了附加-修饰多肽的延缓释放。
图47显示了通过尺寸排阻色谱法(每次试验多次注射)确定的rPEG_J288-GLP1多肽的纯度。
图48显示了通过尺寸排阻色谱法(每次试验多次注射)确定的rPEG_K288-GLP1多肽的纯度。
图49描述了在将生物活性多肽(GLP1)连接到rPEG_J288、rPEG_K288和rPEG_L288附加多肽时观察到的表观分子量的增加。
图50显示了通过包含亲和性标签、附加多肽和作为生物活性多肽的hGH的多肽(rPEG_K288-hGH)的蛋白酶切割获得的产物。蛋白酶除去标签,而同时留下最终产物,其为与rPEG_K288附加多肽连接的hGH。
图51显示了蛋白酶切割和进一步纯化后rPEG_K288-hGH的纯度。
图52显示了完全IgG1的结构,但IgG2、IgG3、IgG4、IgE、IgD、IgA和IgM可类似地用作起始点。由于dAb-dAb-Fc融合蛋白质的四价性,它也是可使用的;其未显示。
图53显示了用rPEG分隔Fc和抗原结合域,且Fc在C-末端的构建体:(dAb/scFv)-rPEG-Fc和(dAb/scFv)-(dAb/scFv)-rPEG-Fc。但是,具有不同顺序的相同元件的形式也是可用的,如rPEG-Fc-(dAb/scFv)、rPEG-Fc-(dAb/scFv)-(dAb/scFv)、Fc-rPEG-(dAb/scFv)、Fc-rPEG-(dAb/scFv)-(dAb/scFv)、Fc-(dAb/scFv)-rPEG、Fc-(dAb/scFv)-(dAb/scFv)-rPEG、dAb/scFv)-Fc-rPEG和(dAb/scFv)-(dAb/scFv)-Fc-rPEG。也可以将scFv与dAbs混合,如dAb-scFv或scFv-dAb或者组合具有不同特异性的两个scFvs或两个dAbs:scFv1-scFv2或dAb1-dAb2。
图53a显示了scFv-Fc融合蛋白质。图53b显示了dAb-Fc融合蛋白质。图53c显示了scFv-scFv-Fc融合蛋白质,其为四价的。
图54显示了scFv片段的二聚体。异质二聚体和同型二聚体都可以构建。
图55为单链二链抗体(diabody)。
图56显示了单链Fc片段的实例。任选地,生物活性蛋白质可与这一构建体的任一末端融合。
图57为由蛋白质链的单拷贝组成的产物。
图58:AFBT的结构。58a:单价AFBT;58b:双特异性AFBT的结构。
图59:AFBT与目标抗原的多价结合。
图60a:包含源自两个母本抗体的抗体片段的多价AFBT。
图60b:包含二链抗体和有效载荷的AFBT的结构。
图61:半合成AFBT的制备。
图62:与rPEG50融合的抗Her-2scFv的纯化、鉴定和结合活性。62a:结合活性。实心菱形:与包被的Her-2结合;空心菱形:与包被的IgG结合。62b:尺寸排阻色谱法;62c:游离SH基团的检测。
图63:抗Her-2二链抗体aHer203-rPEG50的纯化、鉴定和结合活性。63a:结合活性。实心菱形:与包被的Her-2结合;空心菱形:与包被的IgG结合。63b:二链抗体aHer203-rPEG50和scFv aHer230-rPEG50的尺寸排阻色谱;63c:aHer203-rPEG50随时间的SEC未显示较高多聚体的增加。
图64:scFv-rPEG50融合蛋白质的结构、序列和表达。64a:蛋白质结构草图;64b:具有对Her-2的特异性的AFBT序列;64c:显示scFv-rPEG50融合蛋白质的表达的SDS/PAGE;7d:具有对EGFR的特异性的AFBT序列。
图65:二链抗体-rPEG50融合蛋白质aHer203-rPEG的结构、序列和表达。65a:蛋白质结构草图;65b:蛋白质序列;65c:表明融合蛋白质在大肠杆菌的细胞溶胶中表达的SDS/PAGE。
图66:用于细菌表达的Fc结构域的密码子优化;66a:过程和寡核苷酸设计的图示。编码人Fc的序列由半随机寡核苷酸装配的并在rPEG25和按报道使用的GFP之前克隆。66b:从库中选择的克隆的SDS/PAGE。箭头表示希望的融合蛋白质的带。66c:氨基酸的核苷酸序列和优化的人Fc基因。
图67:表明Fab-rPEG融合蛋白质的表达构建体的草图。
图68:来自抗血清的AFBTF发现过程的流程图。
图69:GFP-rPEG50的氨基酸序列。GFP序列加下划线。
图70:GFP-rPEG50和Ex4-rPEG50在食蟹猴(cynomologos monkeys)中的药代动力学。
图71a:CDB-Ex4-rPEG50融合蛋白质的氨基酸序列。图71b:用于从图14a所示的融合序列释放Ex4-rPEG50的方法的图示。
图72:Ex4-rPEG50在小鼠中的免疫原性。图72a图示注射和样品分析的时间过程。图72b显示以1∶500稀释的血液样品的ELISA分析。图72c显示以1∶12,500稀释的血液样品的ELISA分析。
图73:GFP-rPEG25和GFP-rPEG50的尺寸排阻色谱。灰线表示使用球状蛋白质的分子量标准。
图74:重复和非重复URP与B细胞的相互作用的比较。图74a显示由多个相同的重复序列构成的重复URP。这种重复URP可以与识别该重复序列的B细胞形成多价接触,这引发B细胞增殖。图74b显示由多个不同的序列构成的非重复URP。各序列可被特定亚群的具有同源特异性的B细胞识别。但是,非重复URP的单个分子只能与任何特定的B细胞形成一个或很少相互作用,这不太可能引发增殖。
图75:评价氨基酸序列重复性的算法。
图76:设计具有非常低的重复性的nrURP的计算机算法。
图77:来自URP片段库的nrURP的构造。
图78:用于构建体rPEG_Y的氨基酸序列。该图也指示用于构建片段库的寡核苷酸的相对浓度。
图79:来自合成寡核苷酸的URP片段的装配。图79a显示连接反应。重复片段通过磷酸化的部分重叠寡核苷酸编码。添加第二对退火寡核苷酸以终止链延长。这些加帽寡核苷酸之一不是磷酸化的,这防止在一端连接。图79b显示连接反应的琼脂糖凝胶。
图80:URP_Y144序列的例子。
图81:质粒pCW0279编码的氨基酸序列。可译框编码Flag-URP_Y576-GFP的融合蛋白质。URP_Y576的基酸序列加下划线。
图82显示了制备“rPEG连接的结合对”的一般途径,其优势是不具有初始活性并因此没有突释效应(burst release effect)(提高可以施用的剂量而不引起毒性)和初始受体介导清除率降低。一般的结合对可以是受体-配体、抗体-配体或一般地是结合蛋白1-结合蛋白2。构建体可以具有切割位点,其可以在注射前、在注射后(在血清中通过蛋白酶)切割且可以定位以使得rPEG与治疗产物末端(活性蛋白质)保持在一起,其可以是配体、受体或抗体。
图83a显示了在N-末端具有药物模块,随后是与抗体Fc片段连接的rPEG的构建体,包括铰链。Fc片段提供长的半衰期且rPEG允许Fc片段在大肠杆菌胞质以可溶和活性形式表达。
图83b显示了在N-末端具有药物模块,随后是与抗体Fc片段连接的rPEG的构建体,但没有铰链。Fc片段提供长的半衰期且rPEG允许Fc片段在大肠杆菌胞质以可溶和活性形式表达。
图84a当VH和VL结构域之间的单链连接体短于大约10-20AA时形成二链抗体从而阻止形成单链Fv片段。二链抗体具有两个蛋白质链且可以在一个或两个C-末端和/或在一个或两个N-末端具有rPEG。二链抗体具有两个结合位点,其中零个、一个或两个可以结合到药物靶标或结合到半衰靶标(halflife target)(即HAS、IgG、红细胞、胶原蛋白等)或不结合到靶标。
图84b二链抗体或以包含零个、一个或多个位于零个、一个或两个蛋白质链的N-末端或C-末端的药物模块。
图85a显示单链Fv片段,药物模块(如IFNa、hGH等)可以在N-和/或C-末端中的一个或两个与其融合。scFv具有一个结合位点,其可以结合或不结合药物靶标或结合半衰靶标(即HSA(参见图85b)、IgG、红细胞等)。
图86显示rPEG与属于同一复合物的两个蛋白质结合的用途。这种蛋白质之间的亲和性通常不足以保持它们结合,但rPEG的加入稳定了它们的相互作用并降低它们形成聚合物的趋势。
图87显示结合细胞表面靶标的Fab片段;H链可以与Fc融合(如在全抗体中)或与许多种其它蛋白质、结构域和肽融合。天然连接体的长度在VH和CH结构域之间及VL和CL结构域之间从通常的2-6个氨基酸延长到4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、24、26、28、30、35、40、45、50、60、70、80、100个或更多的氨基酸提高了一个Fab通过域交换与另一个Fab连接的能力,从而形成具有更高配价的结合复合体,产生更高的表观亲和力(亲合力)。连接体可以是rPEG或不同的组成。这一“延长的连接体”形式允许在具有更高密度靶标(如肿瘤细胞上的(部分)肿瘤特异性的抗原)的位点以更高的亲和力特异性地结合。
图88显示了以反平行方向与相同序列的另一拷贝结合的结合肽(association peptide)如SKVILF(E)或RARADADA如何可以用于产生前药,在这种情况中,药物在最后的制备步骤中被蛋白酶切割,但切割不活化药物,因为两个链仍然由结合肽结合。只有在药物注射到血液中且浓度极大地降低后,小的不含rPEG的蛋白质链脱离复合物(以取决于亲和力的速率,特别是解离率)且很可能通过肾脏清除,从而活化含r-PEG的药物模块。
图89显示了将制备的单链蛋白质转化成两个蛋白质链的复合物的蛋白水解切割。这一切割可以通过患者血液中的蛋白酶作为最后的制备步骤(在注射之前)发生或它可以在注射后发生。
图90a显示了抗体Fc片段,具有(任选地)在一个末端与药物模块(例如,IFNa、hGH等融合)和(任选地)在另一末端与rPEG融合的铰链区。CH2和CH3之间的序列介导与FcRn(新生儿Fc受体)的结合,除非该功能通过突变除去。图90b显示了类似的构建体,但没有所述铰链区。
图91a显示了包配对的CH3结构域对的蛋白质构建体;这些链中的零个、一个或两个可以与在N-末端和/或C-末端的rPEG、在另一末端上的一个或多个药物模块融合。FcRn结合序列可以保留或删除;保留将产生更长的血清半衰期。
图91b显示了类似的蛋白质,但CH2完全除去从而Fc与FcRn受体的结合不再功能性的,从而减小半衰期。
图92a显示了作为完全Fc的蛋白质,包括在C-末端与rPEG融合的铰链、CH2和CH3结构域,具有位于C-末端的药物/药效团。
图92b显示了完全Fc。但没有在C-末端与rPEG融合的铰链,具有位于C-末端的药物/药效团;这些分子可以链交换,潜在地产生异二聚体。
图93a显示了部分Fc,没有铰链而具有截短但保留FcRn结合的CH2和具有位于C-末端的药物/药效团。
图93b显示了部分,没有铰链和CH2,但保留CH3和具有位于C-末端的药物/药效团。这不结合FcRn但可以通过CH3结构域二聚化。
图94a显示了相同受体域(或具有相同结合功能的结构域,或可以同时结合相同靶标的结构域)侧邻的rPEG。如果两种受体可以同时结合靶标,则一种受体的结合稳定第二受体和结合且有效/表观亲和力/亲合力提高通常10-100倍,但至少是3倍。rPEG提供血清半衰期。一种选择是用配体预加载产物。在该情况中,注射的产物只要在它与配体保持结合的时间内是灭活的。这一途径降低了峰剂量毒性且还降低受体介导的清除率,并可能因此用于降低受体介导的清除率重要的应用中。
图94b显示了具有由可以同时结合配体的两种不同受体侧邻的rPEG的产物,这导致复合物的相互稳定和表观亲和力(亲合力)提高,使得rPEG用作提高受体的有效浓度的价桥(valency bridge)。
图94c一种选择是用配体预加载产物。在该情况中,注射的产物只要在它与配体保持结合的时间内是灭活的。在配体释放时,其很可能通过肾脏快速清除,从而导致产物的活化,产物由于具有rPEG尾而具有长的半衰期。这一途径降低了峰剂量毒性且还降低受体介导的清除率,并可能因此用于降低受体介导的清除率重要的应用中。
如图94中所示,某些前药形式不需要切割或其它活化位点。单蛋白质链可憎包含由rPEG分隔的两个(或更多)药物模块;这些模块可以相同(单一类型的)或两种或多种不同类型的。所有药物模块是受体或全部是配体。这一含rPEG的产物与第二、互补蛋白质复合以形成受体-配体-受体相互作用。在这一形式中,配体很可能是二聚的或多聚的,但也可以是单体的,特别是如果该两个药物模块不同。两个模块都结合第三蛋白质。X和Y可以相同或不同,且X和Y可以是药物模块或与药物模块结合。在图94中的各种情况中,X和Y(和rPEG)包含一个蛋白质链,且它们所结合的分子是单独的分子,通常是蛋白质或小分子。有可能超过两个结合蛋白组合在单蛋白质链中。其概念是大的含rPEG的蛋白质和不含rPEG的蛋白质的复合物在注射时是无活性的,但经过2-24小时的时间,较小的不含rPEG的蛋白质脱离复合物并通过肾脏排泄,从而活化药物模块。这一形式的益处是药物浓度的初始尖峰及相关的问题减轻或消除,且复合物使得在其被复合时受体介导的清除率最小,从而延长血清分泌半衰期。
图95显示了两侧与VEGF-受体侧邻的rPEGs。由于VEGF是二聚化的,在rPEG两侧可能是相同的受体或者不同受体(优选VEGF-R1和VEGF-R2),但也可以使用VEGFR3。
图96显示了作为无活性前药制备(在注射前切割)或施用(在血液中在注射后切割)的产物。药物的灭活由通过rPEG连接到药物上的结合蛋白介导,从而三个模块作为单蛋白质链制备。如果该药物是受体,则结合蛋白是该受体配体(肽或蛋白质);如果药物是抗体片段,则结合位点是肽或蛋白质配体在这些实施例中,药物通过两个结合域(称为X和Y)之间的位点的蛋白酶切割活化。如果蛋白质Y是活性产物,则Y必须保留rPEG且蛋白酶切割位点必须(在X和Y之间,但)靠近X。如果蛋白质X是活性产物,则X必须保留rPEG且蛋白酶切割位点必须靠近Y。可能存在一个或多个切割位点如蓝色横条所示。药物模块可以是受体、配体、一个或多个Ig结构域、抗体片段、肽、微生物蛋白(microprotein)、抗体的表位。结合药物模块的蛋白质可以是结合蛋白、受体、配体、一个或多个Ig结构域、抗体片段、肽、微生物蛋白、抗体的表位。
图97显示了无活性的前药可以如何通过将结合肽加到药物模块上产生。肽必须中和药物的靶标结合能力且肽以比含rPEG的药物高的速率逐步地从血液中清除。这种肽可以是天然的,但更经常通过随机肽库针对药物模块的淘筛获得。肽优选通过合成方法制备,但它可以是重组的。
图98显示了包含多个生物活性肽的单链蛋白质药物,该多个生物活性肽可以在与rPEG相同的端或在与rPEG相对的端。这些肽可以具有相同的活性或不同的活性。在单链具有多个肽的目的是通过结合亲合力提高其效能而不使制备复杂化。
图99显示了前药-rPEG可以如何通过避免受体介导的清除率而提高血清半衰期。
图100显示了药物浓度如何在IV注射后随时间变化。典型疗法中的目标是维持药物在高于治疗剂量但低于毒性剂量的浓度。具有短的半衰期的药物的典型快速推注(IV、IM、SC、IP或类似方式)产生远高于毒性剂量的峰浓度,接头是使得药物浓度快速下降到治疗剂量以下的消除相。这一PK特征倾向于引起毒性和较长时间的无效治疗,而药物仅在短时间内(蓝线)以治疗浓度存在。将rPEG加到药物上降低了峰浓度并因此降低了毒性,且增加了药物以治疗的非毒性剂量存在的时间。通过加入rPEG加药物-结合蛋白产生前药可以防止“突释”或毒性峰剂量(红线),因为药物仅在几个小时的时间内逐步地活化且毒性剂量和治疗剂量之间的时间长度与其它形式增加。
图101显示了N-末端药物模块,接头是rPEG和C-末端Fc片段(具有铰链)。这是可用于药物模块的半衰期延长的有利形式,药物模块仍可以在大肠杆菌胞质中制备。
图102a显示了包含Fc片段的前药的替代形式。该形式类似于图101中描述的,(在N-末端)加入结合并抑制药物序列(红色)的抑制性序列(蓝色),如前所述的,药物通过切割位点与抑制性序列分隔。N-末端抑制性结合序列之后是切割位点,这之后是药物序列(红色)。在切割前,药物结合抑制性序列并因此是无活性的(前药)。在切割后,抑制性结合序列(蓝色)逐步释放和清除,从而逐步增加药物活化的时间量。
图102b显示了包含Fc片段的替代的前药形式。该形式类似于图101中描述的形式,也加入抑制性结合序列(肽或结构域,以红色示出,通常位于rPEG中或靠近rPEG),其通过切割位点与药物(以蓝色显示)分隔。在切割前,药物结合抑制性序列并因此是无活性的(前药)。在切割后,抑制性结合序列(蓝色)逐步释放和清除,从而逐步增加药物活化的时间量。
图103a-d显示了用于将rPEG融合到完整的、全抗体(包括IgG1、2、3、4、IgE、IgA、IgD、IgM)的优选的融合位点。这些显示的位点是优选的因为它们在结构化序列如结构域、铰链等的边界上而不干扰这些功能域的折叠。因此rPEG可以在1、2、3、4、5、6、7或甚至8个不同的位置加到抗体上(且对于IgM和IgG3超过8个)且单抗体可以在不同位置和以所示的8个位置的任意组合具有1、2、3、4、5、6、7、8或更多rPEG。
图103e显示了用于将rPEG融合到抗体(IgG1、2、3、4、IgE、IgA、IgD、IgM)的结构域和片段的优选的融合位点。用于N-末端和/或C-末端加入rPEG的融合位点用红箭头或红线表示。
图104显示了用于改正Fc片段的折叠的分析方法。
图105显示了无活性蛋白质通过位点特异性的蛋白酶转化成活性蛋白质,或在血清中或在注射前。在这一实施例中红色序列是活性治疗剂。
图106显示了无活性药物通过位点特异性的蛋白酶转化成活性药物。在这一实施例中蓝色结构域(dAb、scFv、其它)是治疗体。
具体实施方式
本发明利用了以附加多肽修饰的生物活性多肽可以具有保持可溶于胞质和折叠成活性形式的性质的意外的发现,而没有这种修饰的生物活性多肽将聚集并形成包含体。本发明的方法可以在其它的应用中特别用于在设计阶段中的高通量蛋白质筛选、制备当前需要周质表达的蛋白质和用于制备难于从聚集体(如包括包含体)重折叠的蛋白质。本发明公开了设计附加蛋白质序列的方法、编码修饰多肽的重组DNA分子、这种多肽的表达载体、用于表达这种多肽的宿主细胞和纯化方法。例如,长的亲水多肽序列与蛋白质(其可以包括肽、蛋白质、抗体和疫苗且可以是真核或哺乳动物蛋白质)的融合导致显示改善的在胞质中以活性形式折叠的可溶性融合蛋白质。
本发明的附加多肽可以连接药物蛋白质(包括GCSF、生长激素、干扰素α)和连接抗体片段。这四种蛋白质或蛋白质种类通常在大肠杆菌胞质中表达时形成包含体。但是,当连接长的亲水附加多肽序列时,生物活性多肽的折叠特性可以极大地改善,导致极大地提高能够在细胞内正确折叠成活性蛋白质的部分,这与真核蛋白质在不存在附加蛋白质的情况中通常发生的直接和不可逆地聚集成包含体相反。附加多肽可以额外地包含单独的或与其它已知标签(如几丁质结合域、纤维素结合域、MBP、GST或His-tag)组合的用于通过纯化离子交换的蛋白质纯化的亲和标签。
本发明的这一方面和其它方面在下面更详细地描述。
一般技术:
本发明的实施,除非另外表明,采用常规的免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组DNA技术,其在本领域的技能范围内。参见Sambrook,Fritsch和Maniatis,MOLECULAR CLONING:A LAB ORATORY MANUAL,第二版(1989);CURRENT PROTOCOLS IN MOLECULAR BIOLOGY(F.M.Ausubel等编辑,(1987));the series METHODS IN ENZYMOLOGY(Academic Press,Inc.):PCR 2:A PRACTICAL APPROACH(M.J.MacPherson,B.D.Hames和G.R.Taylor编辑(1995)),Harlow和Lane编辑(1988)ANTIBODIES,A LABORATORY MANUAL,andANIMAL CELL CULTURE(R.I.Freshney编辑(1987)).
定义:
如说明书和权利要求中所用的,单数形式“一”、“一种”和“该”包括复数的指代,除非上下文清楚地指示并非如此。例如,术语“一细胞”包括多个细胞,包括其混合物。
术语“多肽”、“肽”、“氨基酸序列”和“蛋白质”可在本文中互换使用以指任何长度的氨基酸聚合物。该聚合物可以是线性的或分支的,它可以包括修饰的氨基酸,且它可以被非氨基酸中断。这些术语还包含被修饰的氨基酸聚合物,例如,通过形成二硫键、糖基化、脂化、乙酰化、磷酸化或任何其它操作(如与标记成分偶联)修饰。如本文中所用的术语“氨基酸”指天然的和/或未天然或合成氨基酸,包括但不限于甘氨酸和D或L两种光学异构体,及氨基酸类似物和拟肽。标准的单或三字母代码用于命名氨基酸。
术语“生物活性多肽”指表现出与一个或多个给定靶标的结合特异性的任何长度的多肽,所述靶标可以是治疗靶标和/或附加靶标,如用于细胞-、组织-或器官导向的靶标。可选择地或者额外地,它指在体外或体内使用时表现出希望的生物特性的多肽。举例来说,生物活性多肽包括结合治疗或诊断枝标的功能性治疗剂或体内诊断蛋白质。术语“生物活性多肽”和“结合模块”或“BM”可在本文中互换使用。生物活性多肽可以是,例如但不限于线性或环状肽、半胱氨酸-限制的肽、微生物蛋白、支架蛋白样纤连蛋白、锚蛋白、晶体、抗生物素蛋白链菌素、抗体片段、域抗体、肽类激素、生长因子、细胞因子或任何类型的蛋白质域(人或非人的,天然的或非天然),且它们可以基于天然支架或不基于天然支架(即,经过工程化或经过选择),或者基于上述任一种的组合或片段。任选地,生物活性多肽可以通过添加、移除或取代一个或多个氨基酸进行工程化以增强其结合性能、其稳定性或其它需要的性能。结合模块可以通过设计或通过遗传包展示(geneticpackage display)由天然蛋白质获得,包括噬菌体展示、细胞展示,核糖体展示或其它展示方法,例如结合模块可以结合产生亲合力的同一靶标的相同副本,或者它们可以结合同一靶标的不同副本(如果这些副本一定程度上通过例如细胞膜结合或连接,其可以产生亲合力),或者它们可以不相关靶标(如果这些靶标一定程度上通过例如膜连接,其产生亲合力)。结合模块可以通过筛选或另外地分析肽或蛋白质的随机库鉴别。
“重组PEG”、“rPEG””或“rPEG多肽”或者“重组PK增强基团”是包含可用于修饰生物活性多肽的一类多肽的通称,从而修饰导致希望的生物特性如血清半衰期或体内清除率的改变。一般,rPEG多肽缺乏与该生物活性多肽所结合的相同的特定靶标的结合特异性。在一些方面,rPEG是可能模拟某些-但不是必须所有-PEG的公知特性的PEG功能类似物。在下面更详细地描述的这些特性包括更强的增加流体动力学半径的能力、对蛋白酶的更高抗性、降低的免疫原性和降低的特定活性。尽管rPEG分子可能与PEG共有广泛的结构和功能特征,如线性或缺乏三级结构,但与PEG的严格化学相似性不是rPEG的必要特征。
“附加多肽”或“附加蛋白质”指当与生物活性多肽结合使用(例如通过连接生物活性多肽)时导致整个连接的多肽的生物特性发生希望的改变的多肽。附加多肽的非限制性的例子包括rPEG和能够增加流体动力学半径、延长血清半衰期和/或改变体内清除率的任何其它多肽。在需要时,附加多肽引起预测分子量的小的增加,但表观分子量增加大得多。虽然不同的名称强调不同的特征,但它们指相同的模块并可以互换使用。
术语“修饰多肽”和“附加-修饰多肽”互换使用以指用本发明的附加多肽修饰的生物活性多肽。这些术语也可以指包含用按照本发明的附加多肽修饰的生物活性多肽的缓释或其它类型的制剂。
“重复序列”或“重复基序”在本文中互换使用并指可描述为重复肽序列的寡聚物(“重复序列”)的氨基酸序列,形成同向重复序列或者反向重复序列或者多个序列基序的交替重复序列。这些重复的寡聚物序列可以彼此相同或同源,但也可能存在多个重复基序。重复序列特征在于非常低的信息含量。重复序列不是附加多肽必需的特征且在某些情况中非重复序列事实上是优选的。
氨基酸可以基于其疏水性表征。已开发出多种标度。一个实例是由Levitt,M等建立的标度(参见Levitt,M(1976)J Mol Biol 104,59,#3233,其列于Hopp,TP等(1981)Proc Natl Acad Sci U S A 78,3824,#3232中)。“亲水氨基酸”的例子是精氨酸、赖氨酸、苏氨酸、丙氨酸、天冬酰胺和谷氨酰胺。特别关注的是亲水氨基酸天冬氨酸、谷氨酸和丝氨酸,及甘氨酸。“疏水氨基酸”的例子是色氨酸、酪氨酸、苯丙氨酸、甲硫氨酸、亮氨酸、异亮氨酸和缬氨酸。
本文中使用的术语“细胞表面蛋白质”指细胞的质膜组分。它包含构成质膜的整合的和外周膜蛋白、糖蛋白、多糖和脂类。内在膜蛋白是跨越细胞的质膜脂双层延伸的跨膜蛋白。典型的内在膜蛋白由通常包含疏水氨基酸残基的至少一个跨膜片段组成。外周膜蛋白质不延伸到脂双层的疏水性内部且它们通过直接或间接地与其它膜表面组分的共价或非共价相互作用结合膜表面。
用于细胞蛋白的术语“膜表面”、“细胞溶胶的”、“核”和“分泌的”说明了细胞蛋白大部分、主要或优先定位的细胞外和/或亚细胞位置。
“细胞表面受体”表示能够结合其相应配体的膜表面蛋白质的亚群。细胞表面受体是锚定在细胞质膜上或插入细胞质膜中的分子。它们构成蛋白质、糖蛋白、多糖和脂类的一个大家族,其不仅作为质膜的结构成分发挥作用,而且还作为控制多种生物功能的调节元件发挥作用。
用于蛋白质的“非天然发生的”意味着该蛋白质包含至少一个与对应的野生型或天然蛋白不同的氨基酸。非天然序列可以利用BLAST2.0通过使用例如在比较窗口是目标序列(查询的)的长度的情况下和在与Genbank的非冗余(″nr″)数据库比较时的最低的最小总和概率进行BLAST检索。BLAST2.0算法分别在Altschul等(1990)J.Mol.Biol.215:403-410中描述。用于进行BLAST分析的软件通过国家生物技术信息中心(National Center for Biotechnology Information)公开获得。
“宿主细胞”包括可以是或已成为对象载体的受体的单个细胞或细胞培养物。宿主细胞包括单宿主细胞的后代。后代可能由于天然、偶然或有意的突变而不必然是与原始母细胞完全相同的(在形态上或在全DNA组的基因组中)。宿主细胞包括用本发明的载体体内转化的细胞。
本文中使用的术语“分离的”意味着与多核苷酸、肽、多肽、蛋白质、抗体或其片段通常天然地关联的成分、细胞和其它物质分离。本领域技术人员很清楚,非天然发生的多核苷酸、肽、多肽、蛋白质、抗体或其片段不需要“分离”以将它与其天然发生的对应部分区分开。另外,“浓缩的”、“分开的”或“稀释的”多核苷酸、肽、多肽、蛋白质、抗体或其片段与其天然发生的对应部分相区别,与其天然发生的对应部分相比每体积的分子浓度或分子数较高(″浓缩的″)或较低(″分开的″)。一般,通过重组方式制备并在宿主细胞中表达的多肽被认为是“分离的”。
“偶联的”、“连接的”和“融合的”或“融合”在本文中可互换使用。这些术语指两个以上的化学元件或成分通过任何方式(包括化学偶联或重组方式)结合在一起。“框架内融合”指两个或多个可译框架(ORF)连接以按保持原始ORF的正确阅读框的方式形成连续的更长的ORF。因此,所得到的重组融合蛋白质是包含对应于原始ORF编码的多肽的两个或多个片段(该片段自然状态下通常不如此连接)的单蛋白质。
在说到多肽时,“线性序列”或“序列”是在多肽中按氨基到羧基末端的方向的氨基酸顺序,其中在序列中彼此相邻的残基在多肽的一级结构中是连续的。“部分序列”是已知包含一个或两个方向的额外残基的多肽之一部分的线性序列。
“异源的”意味着源自与所比较的实体的其余部分基因型不同的实体。例如,由其天然编码序列除去并操作性地连接天然序列以外的编码序列的富含甘氨酸的序列是异源的富含甘氨酸的序列。用于多核苷酸、多肽的术语“异源的”意思是多核苷酸或多肽源自与所比较的实体的其余部分基因型不同的实体。
术语“多核苷酸”、“核酸”、“核苷酸”和“寡核苷酸”可互换使用。它们指任何长度的核苷酸多聚形式,脱氧核糖核苷酸或核糖核苷酸,或其类似物。多核苷酸可以具有三维结构且可以执行任何已知和未知的功能。以下是多核苷酸的非限制性的例子:基因或基因片段的编码或非编码区域、由连锁分析确定的基因座(位点)、外显子、内含子、信使RNA(mRNA)、转运RNA、核糖体RNA、核酶、cDNA、重组多核苷酸、分支的多核苷酸、质粒、载体、任何序列的分离DNA、任何序列的分离RNA、核酸探针和引物。多核苷酸可以包含修饰核苷酸如甲基化核苷酸和核苷酸类似物。如果存在的话,可以聚合物组装之前或之后施加在对核苷酸结构的修饰。核苷酸序列可以被非核苷酸成分中断。多核苷酸可以进一步在聚合后修饰,如通过与标记成分偶联。
用于多核苷酸的“重组”意味着多核苷酸是克隆、限制和/或接合步骤及其它产生可潜在地在宿主细胞表达的构建体的过程的各种组合的产物。
术语“基因”或“基因片段”在本文中可互换使用。它们指包含能够在转录和翻译后编码特定蛋白质的至少一个可译框架的多核苷酸。基因或基因片段可以是基因组的或cDNA,只要该核苷酸包含至少一个可译框架,其可以覆盖整个编码区域或其片段。″融合基因″是由至少两个连接到一起的异源多核苷酸构成的基因。
“载体”是核酸分子,优选为自身复制的,其将插入的核酸分子转运到宿主细胞中和/或宿主细胞之间。该术语包括主要起到将DNA或RNA插入细胞的功能的载体、主要起到复制DNA或RNA的功能的复制载体和主要起到转录和/或翻译DNA或RNA的功能的表达载体。还包括提供超过一种以上功能的载体。″表达载体″是在引入适宜宿主细胞中时可转录和翻译成多肽的多核苷酸。“表达系统”通常表示包含可以起到产生需要的表达产物的功能的表达载体的适宜宿主细胞。
用于附加多肽上下文中的“靶标”是生物活性多肽可以结合和结合事件产生希望的生物活性的生物化学分子。靶标可以是被t蛋白抑制、激活或另外地作用的蛋白质配体或受体。靶标的例子是激素、细胞因子、抗体或抗体片段、细胞表面受体、激酶、生长因子和其它具有生物活性的生物化学结构。
“血清降解抗性(Serum degradation resistance)”-蛋白质可以通过在血液中降解而清除,其通常涉及血清或血浆中的蛋白酶。血清降解抗性通过在37℃将蛋白质与人(或适当的小鼠、大鼠、猴)血清或血浆混合通常数天(即0.25、0.5、1、2、4、8、16天)来测量。这些时间点的样品然后进行蛋白质印迹分析且蛋白质用抗体检测。抗体可以是针对蛋白质中的标签。如果蛋白质在蛋白质印迹分析中显示单一带,在蛋白质的大小与所注入的蛋白质相同的情况下,则未发生降解。按照蛋白质印迹分析或相当的技术确定的50%的蛋白质降解的时间点是蛋白质的血清降解半衰期或“血清半衰期”。
“表观分子量因子”或“表观分子量”是涉及特定氨基酸序列表现的表观分子量相对增加或降低的量度的相关术语。表观分子量使用可以用球状蛋白质标准物校准的尺寸排阻柱测定且以“表观kD”单位计量。表观分子量因子作为在用球状蛋白质标准物校准的尺寸排阻柱上测定的表观分子量与实际分子量(即,通过基于氨基酸组成将氨基酸组成中各种类型的氨基酸的计算分子量相加预测的)之间的比率确定。例如,20kD的聚甘氨酸序列具有通过尺寸排阻色谱法测定的200kD的表观分子量,对应于10x的表观分子量因子。“比流体动力学半径”是每单位分子量(kD)的流体动力学半径,是半衰期延长剂性能的量度,其作为每单位质量的血清分泌半衰期(小时/kD)测量。这两种测量都与“表观分子量因子”相关,表观分子量因子是更直观的测量。
蛋白质的“流体动力学半径”影响其在水溶液中的扩散速率以及其在大分子凝胶中迁移的能力。蛋白质的流体动力学半径通过其分子量以及其结构确定,包括形状和紧密度。大多数蛋白质具有球形结构,即具有最小流体动力学半径的蛋白质可能具有的最紧密的三维结构。某些蛋白质采用随机和开放、未结构化的或“线性”构象且因此具有与相似分子量的典型球状蛋白质大得多的流体动力学半径。
“生理状态”指模拟有生命受试者中的状态的一系列条件,包括温度、盐浓度、pH。已经建立了用于体外分析的一组生理相关条件。一般地,生理缓冲液包含生理浓度的盐并处于调节到大约6.5-大约7.8范围内的中性pH,且优选从大约7.0-大约7.5。多种生理缓冲液列于Sambrook等(1989)(同上)中并因此在此不再详细说明。生理相关温度范围为大约250℃-大约380℃,且优选从大约300℃-大约370℃.
“反应基团”是可以偶联第二反应基团的化学结构。反应基团的例子是氨基、羧基、巯基、羟基、醛基、叠氮基。某些反应基团可以活化以利于与第二反应基团偶联。用于活化的例子是羧基与碳二亚胺的反应、羧基转化成活性酯或羧基转化成叠氮官能团。
“交联成分”包括包含一个或多个反应基团的化学结构。这些反应基团的化学结构可以相同以使得能够直接构建交联的附加多肽。交联成分可以包含由保护基团封闭的反应基团。这使得能够以受控的连串反应将几个不同的非交联成分与一个交联成分偶联。交联成分可以包含多个结构不同且可以选择性地与不同非交联成分偶联的反应基团。包含多个高亲和力结合位点的蛋白质也可以用作交联剂。其例子是抗生物素蛋白链菌素,其可以结合四个分子的生物素化的非交联成分。分支的多功能聚乙二醇(PEG)分子可以用作交联成分。具有两个至八个官能团的多种试剂和各种不同长度的PEG以及各种反应基团可商购得到。供应商包括NOF America Corporation和SunBio。
“非交联成分”包括包含允许与交联成分偶联的反应基团的化学结构。非交联成分可以包含多种模块,包括一个或多个生物活性多肽和/或一个或多个附加多肽。另外,非交联成分可以包含有助于纯化和/或检测的亲和标签,如标记-标签、E-标签、Myc-标签、HA-标签、His6-标签、绿色荧光蛋白等。
“交联的rPEG多肽”、“交联的附加多肽”、“交联的rPEG”、“CL-rPEG多肽”、“CL-rPEG”是指一个或多个非交联成分与交联成分的偶联物的术语。
“控释剂”、“缓释剂”、“长效制剂”或“延释剂”可互换使用以指能够相对于修饰多肽在没有上述物质的情况下施用时的释放时间,延长本发明修饰多肽的释放时间的物质。本发明的不同实施方式可以具有不同的释放率,从而导致不同的治疗量。
“vL结构域”指抗体轻链的可变域。
“vH结构域”指抗体重链的可变域。
“可变片段”(Fv)指包含两个非共价结合的VL和VH结构域的抗体部分。
“单链可变片段”(scFv)指包含一个通过非天然肽连接体与一个vL结构域连接的vH的抗体部分,为单链。scFvs可具有结构vH-连接体-vL或vL-连接体-vH,其中连接体可以是包含各种不同数目氨基酸的任何肽序列。scFv在生理状态下优先以单体结构发生,其需要优选超过12个氨基酸的肽连接体。
二硫键稳定的抗体Fv片段(dFv)指其中VH-VL异质二聚体由在远离互补决定区(CDR)的结构保守框架位置进行工程化的链间二硫键稳定的分子。这一稳定方法可用于许多抗体Fvs的稳定。
“可变域”指形成抗体的抗原结合位点的结构域。可变域可以是vH或vL;可变域之间的差异位于称作高变区的三个环(HV-1、HV-2和HV-3)或CDR1、CDR2和CDR3上。CDR由保守框架区支持在可变域内。
“域抗体”(dAb)指作为单体的能够结合靶标的抗体部分。域抗体对应于抗体重(VH)或轻(VL)链的可变区。dAb与靶标结合通常不需要第二可变域(vH或vL)。dAb可以通过噬菌体展示或其它体外方法产生。可选择地,dAb结构域可以从产生缺乏的轻链的抗体免疫羊驼或鲨鱼或者其它物种获得。
“二链抗体”指具有两个Fv头部的重组抗体,各Fv头部由与来自另一多肽的VI结构域配对的来自一个多肽的VH结构域组成。二链抗体通常包含两个vH-vL(或vL-vH)链。二链抗体可以通过由肽连接体连接抗体的vL和vH结构域构建。肽(peptiode)连接体长度包含各种氨基酸数目,优选在2和12个氨基酸之间。二链抗体可以是单特异性的或双特异性的。
“三链抗体(triabody)”指具有三个Fv头部的重组抗体,各Fv头部由与来自另一多肽的VI结构域配对的来自一个多肽的VH结构域组成。三链抗体包含三个vH-vL(或vL-vH)链。三链抗体可以通过由肽连接体连接抗体的vL和vH结构域构建。肽连接体长度包含各种氨基酸数目,优选0和2个氨基酸之间。三链抗体可以是单特异性的、双特异性的或三特异性的。
“四链抗体(tetrabody)”包含四个vH-vL(或vL-vH)链。四链抗体可以通过由肽连接体连接抗体的vL和vH结构域构建。肽连接体长度包含各种氨基酸数目,优选0和2个氨基酸之间。四链抗体可以通过从vL和vH结构域的连接端部截断不同数目的氨基酸,优选1-10个氨基酸获得。
“Fab片段”指抗体上结合抗原的区域。Fab片段由各重链和轻链的一个恒定域和一个可变域组成。这些结构域在单体的氨基末端形成互补位(paratope)-抗原结合位点。两个可变域结合它们的特异性抗原上的表位。Fab片段可以在C-末端通过二硫键连接。Fab片段可以体外产生。木瓜蛋白酶可用于将免疫球蛋白单体切割成两个Fab片段和一个Fc片段。胃蛋白酶在铰链区下面切割,因而形成F(ab′)2片段和Fc片段。重链和轻链的可变区可以融合到一起以形成单链可变片段(scFv),其保持母本免疫球蛋白的原始特异性。
本文中使用的术语“抗体片段”包括所有本发明中描述的片段,包括下面详细定义的任何形式的抗原结合单元如dAb、Fv、Fab和Fc。抗体片段可以包含额外的抗体结构域。抗体片段也包含完整或全抗体。
本文中使用的术语“母抗体”指作为抗体片段构建的基础的抗体。
“基于抗体片段的治疗剂”(AFBT)指任何基于本文中描述的抗体片段的治疗剂或药物组合物。AFBT可以包含多个可能源自多种不同母抗体的抗体片段。多特异性的AFBT可以包含多个具有针对多个不同表位的特异性的抗体片段。这些表位可以是同一目标抗原的部分或在多种不同的目标抗原上。双特异性AFBT可以包含具有两种不同结合特异性的结合位点(通常两种或多种,但可以是一种)。
术语“抗原”、“目标抗原”或“免疫原”在本文中可互换使用以指抗体片段或基于抗体片段的治疗剂与其结合或对其具有特异性的结构或结合决定簇。
术语“结构域重配”和“结构域交换”在本文中可互换使用以指改变抗体片段或基于抗体片段的治疗剂的配价的过程。例如,单链可变片段(scFv)可以重配以形成二聚体、三聚体等以及二链抗体(diabody)、三链抗体、四链抗体等。Fab可以与其它Fab或甚至全抗体交换全链,从而潜在地产生导致丧失一种或两种结合活性的失配链。形成轻链二聚体,称为Bence-Jones蛋白质,是另一个例子。重配的另一个例子是在不具有阻止这种交换的二硫键键合铰链的IgG4抗体之间的重链重配,其可导致双特异性IgG4抗体。结构域重配率取决于反应条件如盐浓度、pH、温度和目标抗原的存在。
本文中使用的术语“有效载荷”(payload)指具有生物或治疗活性的蛋白质或肽序列,等同于小分子的药效团。有效载荷的例子包括,但不限于细胞因子、酶和生长因子。有效载荷可以包含遗传融合或化学偶联的部分。这类化学偶联部分的例子包括,但不限于治疗剂、抗病毒化合物或造影剂。这些偶联的部分可以通过可切割或非切割的连接体与AFBT的其余部分连接。
“胶原结合域”(CBD指结合胶原蛋白或具有对胶原蛋白的特异性的蛋白质结构域。CBD可以对任何特定类型的胶原蛋白如胶原蛋白I有特异性。可选择地,CBD可以结合多种胶原蛋白类型。例子是其中四个蛋白质域足以用于胶原蛋白结合的纤连蛋白。
用于多肽(例如附加多肽PEG)的术语“重复性”指肽序列中的内部同源性程度。重复序列可以包含多个相同或同系的氨基酸序列的拷贝。重复性可以通过分析相同子序列的频率测量。例如,目标多肽序列可以分成n聚体(n-mer)子序列且可以计算相同子序列的数目。高度重复序列包含大部分的相同的子序列。
本文中使用的“总电荷密度”通过将带负电氨基酸的数目与带正电氨基酸的数目相加并用该和除以多肽中氨基酸的总数而计算。例如,hIgG 1Fc序列:
(MDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTIPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSL)
带负电残基的数目:24;带正电残基的数目:22;残基总数:224;单独Fc的总电荷密度:(22+24)/224=46/224=20.5%。
本文中使用的“净电荷密度”通过从带负电氨基酸的数目减去带正电氨基酸的数目并用该差除以多肽中氨基酸的总数而计算。例如,hIgG1Fc序列:
(MDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTIPPVLDSDGSFFLYSKLTVDKSRWQQGNVF SCSVMHEALHNHYTQKSLSL)
带负电残基的数目:24;带正电残基的数目:22;残基总数:224;单独Fc的净电荷密度:(24-22)/224=2/224=0.9%。
本文中使用的“预测溶解度”通过将折叠蛋白质的净电荷加到未结构化的蛋白质(例如,rPEG)净电荷并用该和除以蛋白质中氨基酸的总数而计算。例如,Fc-rPEG50的预测溶解度是(-2+192)/(224+576)=190/800=23.75%。
用于改善生物活性多肽表达过程中的溶解性的附加多肽的设计
可溶性修饰生物活性多肽的表达可以通过改变修饰多肽的净电荷密度进行优化。在某些情况中,净电荷密度高于+0.1或低于-0.1电荷/残基。在其它的情况中,电荷密度高于+0.2或低于-0.2电荷/残基。电荷密度可以通过改变与生物活性多肽连接的附加多肽中带电氨基酸(如精氨酸、赖氨酸、谷氨酸和天冬氨酸)的含量进行控制。如果需要,附加多肽可以专门由短的带电残基段构成。可选择地,附加多肽可以包含由其它残基(如丝氨酸或甘氨酸)分隔的带电残基,这可以导致更好的表达或纯化性能。可以获得更高的表达。使用丝氨酸可以导致更高的表达水平。
附加蛋白质使得融合蛋白质可溶和在胞质中折叠所需的净电荷取决于生物活性多肽,具体地说其大小和净电荷。修饰多肽的净电荷可以是正的或负的。在一些应用中,可能需要富含带负电的氨基酸(如谷氨酸或天冬氨酸)的附加多肽序列。在其它的应用中,富含带正电的氨基酸(如赖氨酸或精氨酸)的附加多肽序列可能是优选的。同时使用带正电的和带负电的氨基酸可能导致电中性,这可能潜在地抵消本发明的优势。例如,具有16%、25%或33%的带负电残基的288个氨基酸的附加蛋白质可以提供高达96个总电荷,其对于高达960个氨基酸的中性融合蛋白质或672个氨基酸的非融合蛋白质足以获得0.1的电荷密度。在一个特定的实施例中,包含33%的谷氨酸残基的附加多肽可用于使得其甚至非常大和难以表达可溶性蛋白质。
为赋予结合蛋白溶解性,附加多肽的净正或负电荷可以大于5、10、15或20或者甚至大于30、40、50、60、70、80、90或100。电荷可以集中于5、10、15、20、25、30、40、50个氨基酸的短序列中,或可以间隔在60、80、100、150、200、250、300、400或500或者更多氨基酸的较长序列上。带负电附加多肽的序列可以包含超过5、10、15、25、30、40、50、60、70、80、90或100%的谷氨酸或天冬氨酸,而带正电的附加多肽可以包含超过5、10、15、20、25、30、40、50、60、70、80、90或100%的精氨酸或赖氨酸。可以使用非带电的残基,如相对亲水的残基丝氨酸和甘氨酸。
附加多肽设计中的额外因素:
本发明的一个方面是用于修饰生物活性多肽的附加多肽(如rPEG附加多肽等)(图1)的设计。附加多肽特别用于产生具有治疗和/或诊断价值的重组蛋白质。
可以设计多种附加多肽序列且它们可以富含甘氨酸和/或丝氨酸以及其它氨基酸,如谷氨酸、天冬氨酸、丙氨酸或脯氨酸。附加多肽序列可以富含亲水氨基酸且包含低百分比的疏水性或芳香氨基酸。附加多肽序列可以设计为具有至少30、40、50、60、70、80、90或100%甘氨酸和/或丝氨酸残基。在某些情况中,附加多肽序列包含至少50、55、60、65%甘氨酸和/或丝氨酸。在其它的情况中,附加多肽序列可以包含至少70、75、80、85、90%甘氨酸和/或丝氨酸残基。
本发明的组合物通常包含由至少40个氨基酸组成的附加多肽序列。但是,产物可以包含多个附加多肽序列且这些单独的附加多肽序列的一部分或全部可以短于40个氨基酸,只要产物的所有附加多肽序列的组合长度为至少40个氨基酸。在某些实施方式中,连接到蛋白质上的附加多肽序列的组合长度可以是20、25、35、50、60、70、80、90、100、120、140、160、180、200、250、300、350、400、500、600、700、800、900或越过1000或2000个氨基酸。在某些修饰的生物活性多肽中,附加多肽序列的组合长度超过60、70、80、90或更多氨基酸。在其它修饰多肽中,附加多肽序列的组合长度超过100、120、140、160或180个氨基酸,且甚至达到200、250、300、350、400、500、600、700、800或甚至超过1000个氨基酸。
一个或几个附加多肽序列可以与生物活性多肽融合,例如融合到生物活性多肽的N-或C-末端或插入目标多肽的环中以给出相对于未修饰多肽具有修改的性能的所得到的修饰多肽。附加序列与(治疗)蛋白质的融合导致所得到的融合蛋白质的流体动力学半径相对于未修饰蛋白质显著增加,这可以通过例如超速离心、尺寸排阻色谱法或光散射检测。
附加多肽序列可以设计为避免一种或多种类型的氨基酸以产生希望的性能。例如,可以设计附加多肽序列包含很少或没有以下氨基酸:半胱氨酸(以避免二硫键形成和氧化)、甲硫氨酸(以避免氧化)、天冬酰胺和谷氨酰胺(以避免脱脱酰胺作用)和天冬氨酸。附加多肽序列可以设计为包含倾向于降低对蛋白水解性降解的敏感性的脯氨酸残基。
附加多肽序列可以进行设计以优化为蛋白质产生。这可以通过避免或最小化编码DNA的重复性珲实现。附加多肽序列(如聚甘氨酸或聚丝氨酸)可以具有非常需要的药物性能,但由于编码聚甘氨酸的DNA序列的高GC-含量和由于存在可能导致重组的重复的DNA序列,它们的制备可能很困难。
附加多肽(包括由短的、重复的富含G、S和E的序列较多的基序组成的简单序列)可以在多个物种中引起>1,000的相对高的抗体效价,尽管这些序列中不存在T-细胞表位。这可能是由附加多肽中的征程选择性引起,因为具有重复表位的免疫原(包括蛋白质聚焦体、交联的免疫原和重复碳水化合物)是高免疫原性的(Johansson,J.等(2007)Vaccine,25:1676-82,Yankai,Z.等(2006)Biochem Biophys Res Commun,345:1365-71,Hsu,C.T.等(2000)Cancer Res,60:3701-5)。即使免疫原对IgM的单价结合亲和力非常低(如在微摩尔浓度),呈递五价IgM分子的B-细胞也受到重复免疫原的刺激(图74)。连接的重复序列与位于同一分子上或在同一细胞上的多个连接的IgM结构域同时结合可引起相互作用的表观(有效)亲和力的大的(千、百万或也许甚至十亿倍的)增加,其可以刺激B-细胞。为避免管种类型的效应,附加多肽可以在多个动物物种(如大鼠、兔、小鼠或豚鼠。可以进行多次注射,在免疫前和免疫后在相同动物中测量药代动力学性能)中对免疫原性(以及对半衰期和其它性能的影响)进行筛选。另外,附加多肽序列可以设计为非重复的(仅包含各序列基序的一个相同拷贝)或具有各序列基序的最小数目的拷贝。低重复性的附加多肽序列可以包含对不同IgM的结合位点,但它们可能不太能够多价地结合相同IgM分子或相同B-细胞,因为各B-细胞通常仅分泌一种类型的IgM且各IgM通常仅具有一种类型的结合位点。这一机理在图74a和b中说明。在某些实施方式中,附加多肽可以专门包含每附加多肽以1、2、3、4、5左右的拷贝出现的序列。具有低数目的重复序列的多肽可能具有较低的预期亲合力,可能较少可能引起实质的免疫应答。这种序列可以包含多种类型的氨基酸,例如两种类型(例如,G和E或者S和E),三种类型的氨基酸(如G、E和S)或甚至四种或更多类型。这种附加多肽还可以包含例如,总氨基酸组成的30-80%的甘氨酸、10-40%的丝氨酸和15-50%的谷氨酸。这种序列可以提供需要的性能的最佳平衡,如表达水平、血清和大肠杆菌蛋白酶抗性、溶解性、聚集和免疫原性。
图74比较了重复(74a)和非重复附加多肽序列(74b)与识别所述序列中表位的B细胞的相互作用。重复序列被生物体很少的B细胞识别,因为它包含相对较少数目的不同表位。但是,重复序列可以与这些很少的B细胞形成多价接触并因此它可以刺激它们的增殖,如图74a中所示。重复序列可以与许多不同的B细胞形成接触,因为它包含许多不同表位。但是,由于缺乏重复性,各单个B细胞只可能与单个非重复附加多肽(“nrURP”)形成一个或很少数目的接触,如图74b中所示。结果,非重复附加多肽可能具有低得多的刺激B细胞增殖并因此激发免疫应答的倾向。
非重复附加多肽相对于重复附加多肽另外的优势是非重复附加多肽相对于重复附加多肽与抗体形成较弱的接触。抗体是多价分子。例如,IgG具有两个相同的结合位点和IgM包含10个相同的结合位点。因此,抗重复序列的抗体可以与这种重复序列以高亲合力形成多价接触,其可以影响这种重复序列的效能和/或清除。相反,抗非重复附加多肽的抗体倾向于主要与抗体形成单价相互作用,因为所述非重复附加多肽包含很少的各表位的重复序列。
重复性描述了肽序列中内部同源性的程度。在极端的情况中,重复序列可以包含氨基酸序列的多个相同的拷贝。重复性可以通过分析相同的子序列的频率测量。例如,可以将目标序列分成n-聚体子序列并计算相同或同源的子序列的数目。高度重复序列包含大部分的相同或同源的子序列。
基因的重复性可以通过计算机算法测量。图75中显示了一个例子。可以基于查询序列进行特定长度的子序列的逐对比较。这些子序列可以进行同一性或同源性比较。图75中的例子比较4个氨基酸的子序列的同一性。在该例子中,大多数4-聚体的子序列只在查询序列出现一次且3个4聚体的子序列出现两次。可以平均基因中的重复性。可以调节子序列的长度。在需要的情况下,子序列的长度可以反应可被免疫系统识别的序列表位的长度。因此,可以进行4-15个氨基酸的子序列的分析。编码非重复附加多肽的基因可以使用基因合成的标准技术由寡核苷酸组装。基因设计可以使用优化密码子选择和氨基酸组成的算法进行。另外,可以避免蛋白酶敏感的或已知是可被人免疫系统轻易识别的表位的氨基酸序列。计算机算法可应用于在序列设计中以最小化所得到的氨基酸序列的重复性。可以评估满足预定标准(例如氨基酸组成、密码子选择、避免蛋白酶敏感子序列、避免表位及选择用于合成和后续评价的最少重复序列)的大量基因设计的重复性。
非重复附加多肽基因设计的替代途径是分析显示出高水平表达、低聚集倾向、高溶解性和对蛋白酶的良好抗性的非重复附加多肽的现有集合的序列。计算机算法可以基于这种预先存在的非重复附加多肽序列通过重组装序列片段来设计非重复附加多肽序列。该算法从这些非重复附加多肽序列产生子序列的集合并评价从这种子序列组装非重复附加多肽序列的多种途径。这些装配的序列可以评价重复性以鉴别仅由预先确定的非重复附加多肽的子序列构成的非重复附加多肽序列。
非重复附加多肽编码基因可以由短附加多肽片段的库组装,如图77中所示。可以首先产生大的附加多肽片段库。这些库可以由部分随机化的寡核苷酸组装。可以优化随机化方案以控制各位置的氨基酸选择以及密码子选择。可以将附加多肽片段库克隆到表达载体中。可选择地,可以将附加多肽片段库克隆到与指示基因如GFP融合的表达载体中。随后,可以筛选库成员的多种性能如表达水平、蛋白酶稳定性、与抗血清的结合。可以确定库成员的氨基酸序列以鉴别具有特别希望的氨基酸组成、片段长度的片段或鉴别具有低频率内部重复序列的片段。随后,可以通过随机二聚化或多聚化从附加多肽片段的集合组装非重复附加多肽序列。二聚化或多聚化可以通过接合或PCR组装实现。这一过程产生可对多种性能进行评价以鉴别具有最佳性能的非重复附加多肽序列的非重复附加多肽序列库。可以重复该二聚化或多聚化过程以进一步增加非重复附加多肽序列的长度。
在特定的实施方式中,附加多肽包含以下8个氨基酸基序的混合:GEGSGEGSE、GEGGSEGSE、GEGSEGSGE、GEGSEGGSE、GEGSGEGGE、GEGGSEGGE、GEGGGEGSE、GEGGEGSGE、GEGGEGGSE或GEGSEGGGE。这一设计具有平均33%的E和11-22%的丝氨酸含量,取决于基序数目相对于彼此的比例。在另一特定的实施方式中,附加多肽包含以下12个氨基酸基序的混合:GXEGSGEGXGXE、GXEGGSEGXGXE、GXEGSGEGGSGE、GXEGGSEGGSGE、GSGEGXEGXGXE、GGSEGXEGXGXE、GSGEGXEGGSGE或GGSEGXEGGSGE,其中X代表具有同等可能性的S或E。这一设计具有平均25%的E和大约1%的S,取决于所选择的比率。合适的比率可以是1∶1∶1∶1∶1∶1∶1∶1比或任何其它比率,且可以微调到该组成。
附加多肽序列可以设计为在氨基酸水平上是高度重复的、低重复性的或非重复的。例如,高度重复附加多肽序列可以仅包含少数的重叠9-聚体肽序列且通过这种方式可以降低引发免疫反应的风险。
单氨基酸型附加多肽序列的例子是:聚甘氨酸、聚-谷氨酸、聚天冬氨酸、聚丝氨酸、聚苏氨酸,其中长度为至少20个残基。具有两种类型氨基酸的附加多肽的例子是(GX)n、(SX)n,其中G是甘氨酸和S是丝氨酸,和X是天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少10。另一个例子是(GGX)n或(SSX)n,其中X是天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少7。另一个例子是(GGGX)n或(SSSX)n,其中X是天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少5。另一个例子是是(GGGGX)n或(SSSSX)n,其中X是天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少4。其它的例子是(GzX)n和(SzX)n且其中X是天冬氨酸、谷氨酸、苏氨酸或脯氨酸,n是至少10,和z为1-20。
这些重复序列的数目可以是5-300之间或更大的任何数目。本发明的产物可以包含作为半随机序列的附加多肽序列。例子是包含至少30、40、50、60或70%的甘氨酸的半随机序列,其中甘氨酸适当地分散且其中色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸和异亮氨酸的组合总浓度低于70、60、50、40、30、20或10%。优选的半随机附加多肽序列包含至少40%的甘氨酸且色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸和异亮氨酸的总浓度低于10%。更优选的随机附加多肽序列包含至少50%的甘氨酸,且色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸的异亮氨酸的总浓度低于5%。附加多肽序列可以通过组合两个或多个较短的附加多肽序列或附加多肽序列片段的序列进行设计。这种组合允许更好地调整包含该附加多肽序列的产物的药学性能并允许降低编码该附加多肽序列的DNA序列的重复性,这可以提高表达并减少附加多肽序列编码序列的重组。
在需要记水平的溶解性的情况中,可以采用高部分的带电残基,优选>25%的谷氨酸(E),其余主要是甘氨酸或丝氨酸。高水平表达利益于10-50%的丝氨酸(E),因为丝氨酸具有6个密码子,其通常产生比甘氨酸(4密码子)高得多的表达水平。当在序列中利用高谷氨酸含量时,在溶解性和快速清除中通常存在平衡(trade-off)。在需要的情况下,低于50%,优选低于30%的谷氨酸含量用于在动物中提供希望的溶解性和避免快速清除。
可选择非甘氨酸残基以优化性能
特别关注的是富含的甘氨酸和/或丝氨酸附加多肽序列。可以选择这些富含gly或富含ser的序列中非gly、非ser残基的序列以优化蛋白质的性能。例如,可以优化附加多肽的序列以增强生物活性多肽对于特定组织的选择性。这种组织选择性的附加多肽序列可以通过产生随机或半随机附加多肽序列库并在组织样品中确定具有希望的组织选择性的序列而获得。序列确定可以通过质谱进行。可以使用类似的方法选择有助于口服、含服、肠、鼻腔、鞘、腹膜、直肠或皮肤吸收的附加多肽序列。特别关注的是包含富含利于细胞摄取或过膜转运的带正电的氨基酸精氨酸或赖氨酸的区域的附加多肽序列;这类附加多肽可用于细胞内递送蛋白质。
如下面更详细地说明的,附加多肽序列可以设计为包含一个或几个蛋白酶敏感序列。这种附加多肽序列可以在本发明的产物到达其目标位置时进行切割。这一切割可以引发药物活性结构域效能的提高(前药活化)或者它可以增强切割产物与受体的结合。目前这对于抗体是不可能的。但是,在PEG化的或附加蛋白质修饰的生物活性多肽的情况中,打通提供异种蛋白酶(番茄蚀刻病毒蛋白酶或类似的位点特异性的非人蛋白酶)的切割位点。如果蛋白酶位点在附加蛋白质和治疗蛋白质之间或靠近治疗蛋白质,则蛋白酶的注射将从药物上除去附加蛋白质尾,因而产生更短的半衰期和从患者的系统中清除。药物在血清中的浓度下降10-100倍,从而有效地终止治疗。例如,如果治疗需要突然停止,如由于在治疗过程中被TNF-抑制性微生物蛋白感染(如TNFa-受体-rPEG),这将是理想的。实例是将切除附加蛋白质的蛋白酶加到治疗方案中,从而急剧地降低蛋白质的活性TNF-抑制性部分的半衰期,该部分然后迅速地清除。这一途径使得感染得到控制。
附加多肽序列还可以设计为通过引入天冬氨酸或谷氨酸残基携带过量的负电荷。特别关注的是包含8、10、15、20、25、30、40或甚至50%的谷氨酸和低于2%的赖氨酸或精氨酸的附加多肽。这种附加多肽携带的净负电荷并因此它们具有由于肽的单个负电荷之间的静电排斥而采取开放构象的倾向。这种净负电荷导致其流体动力学半径的有效增加并因此可以导致这类分的肾清除率下降。因此,可以通过控制带负电的氨基酸在附加多肽序列中的频率和分布而调整附加多肽序列的有效净电荷和流体动力学半径。人或动物中的大多数组织和表面具有净负电荷。通过设计附加多肽序列使其具有净负电荷,可以使附加多肽-治疗蛋白质和各种表面(如血管、健康组织或各种受体)之间的非特异性相互作用最小化。
用于本发明中的其它附加多肽表现出一个或多个以下特征。
附加多肽可能特征在于增大的流体动力学半径,其中附加多肽增加其所连接的生物活性多肽的表观分子量因子。因为表观分子量因子是血清分泌半衰期的预测值(假定预测分子量是恒定的),具有较高表观分子量因子的附加多肽预期显示更长的血清半衰期。在某些实施方式中,附加多肽的表观分子量因子可以大于3、5、7或甚至9。表观分子量因子可以通过多种方法测量,包括但不限于通过具有受控孔径的膜的超滤或通过尺寸排阻凝胶过滤(SEC)。表观分子量因子可以受到盐和其它溶质的浓度影响。其通常在类似于生理状态的条件下测量,如在血液或盐水中。
附加多肽也可以用其中在其引入生物活性多肽中时的效应表征,生物活性多肽表现出现出与缺乏附加多肽的相应蛋白质相比更长的血清半衰期。确定血清半衰期的方法是现有技术中已知的(参见例如Alvarez,P.等(2004)JBiol Chem,279:3375-81)。可以很容易地通过实施现有技术中提供的或本文中举例的任何方法确定是否得到的蛋白质与未修饰蛋白质相比具有更长的血清半衰期。
附加多肽也可以提高其所连接的蛋白质的溶解性。例如,尽管人干扰素-α、人生长激素和人G-CSF在大肠杆菌胞质中表达时通常形成包含体,连接附加多肽(如(SSGSSE)48或(SSESSSSESSSE)24、(GEGGGEGGE)36或其它)提高表达的多肽的溶解性,从而它不再形成包含体而是在胞质中保持可溶性,它可以容易地从胞质中以活性形式并以高表达水平和效率进行纯化,不需要从包含体重折叠。
附加多肽在生理状态下可以具有高度的构象灵活性且它们与具有相似分子量的球状蛋白质相比倾向于具有大的流体动力学半径(斯托克斯半径,从而导致大的“比容”(体积/单位质量)。因此,附加多肽在生理状态下可以如缺乏良好的二级和三级结构的变性肽序列一样表现。变性的构象描述了肽在溶液中的状态,特征在于肽骨架的大的构象自由度。大多数肽和蛋白质在存在高浓度的变性剂时或在更高的温度下采取变性的构象。处于变性构象的肽具有特征性的CD谱且它们特征在于缺乏通过NMR确定的长范围相互作用。“变性的构象”和“未折叠构象”在本文中意思相同。现有技术中已经建立了多种方法来鉴别给定多肽的二级和三级结构是否存在。例如,多肽的二级结构可以通过在″远-UV″光谱区(190-250nm)中的CD光谱确定。二级结构元件,如α-螺旋、β-折叠和无规卷曲结构各产生CD光谱的特征性形态和幅度。二级结构也可以通过特定的计算机程序或算法(如仇-法斯门算法)确定(Chou,P.Y.等(1974)Biochemistry,13:222-45)。对于给定的附加序列,该算法可以预测是否存在部分二级结构或完全没有二级结构。在许多情况中,附加序列由于其低水平的二级和三级结构而具有类似变性序列的光谱。在其它的情况中,附加序列可以采取二级结构,特别是螺旋如α-螺旋或折叠如β-折叠。尽管未结构化的氨基酸聚合物通常对于本发明是优选的,使用采取某些二级结构(特别是α-螺旋和更低程度的β-折叠)的氨基酸序列是可能的。三级结构由于其低的比流体动力学半径而通常是不需要的。具有二级结构的序列很可能比较少二级结构的序列具有较低的流体动力学半径,但它们仍然可能是有用的。如果附加序列采取三级结构(如在蛋白质域中),流体动力学半径预计甚至更小。聚甘氨酸具有最高的流体动力学半径-质量(甘氨酸仅为70D)比,而球状蛋白质具有最小的流体动力学半径-质量比。例外情况是在附加多肽中包含结合血清暴露靶标并通过不同机制提高血清分泌半衰期的具有0、1、2、3或4个二硫键且具有不同程度的二级和三级结构的肽。
附加多肽可以是具有低免疫原性的序列。低免疫原性可以是附加序列构象灵活性的直接结果。许多抗体识别所谓的蛋白质抗原中的构象表位。构象表位通过由蛋白质抗原的多个不连续氨基酸序列构成的蛋白质表面区域形成。蛋白质的精确折叠使得这些序列形成可以被抗体识别的明确的特殊构型。优选的附加多肽设计为避免形成构象表位。例如,特别关注的是具有较低的在水溶液中采取紧密折叠构象的倾向的附加序列。特别是,低免疫原性可以通过选择抵抗抗原呈递细胞中的抗原加工的序列、选择未很好地结合MHC的序列和/或选择源自人序列的序列获得。附加多肽序列也可以降低生物活性多肽的免疫原性。
附加多肽可以是具有高水平蛋白酶抗性的序列。蛋白酶抗性也可以是附加序列构象灵活性的结果,例如由于它们的高熵。蛋白酶抗性可以通过避免对于内源和外源蛋白酶的已知蛋白酶识别位点并包括高甘氨酸含量来设计。可选择地,蛋白酶抗性序列可以通过噬菌体展示或相关技术从随机或半随机序列库选择。在用于特殊应用的需要情况下,如长效蛋白质的缓释,血清蛋白酶切割位点可以构建在附加多肽中。在这些情况中,本发明的组合物可以在使用过程中溶解或降解(或可以确定为溶解或降解),一般,归因于生物降解性的降解包括聚合物降解成其成分(包括但不限于修饰多肽和得到的降解产物)。聚合物的降解率通常部分取决于多种因素,包括形成该聚合物的任何成分的特性(如蛋白酶敏感位点)、任何成分的比率及该组合物如何形成或处理(如,成分是否被保护)。但是,关注的还是在血液或在与该应用相关的身体组织中具有高稳定性的附加序列(例如,长的血清半衰期,不易被存在于体液中的蛋白酶切割)。附加多肽还可以改善蛋白质的蛋白酶抗性,因为它们屏蔽蛋白酶的攻击。一个由3个氨基酸构成的天然的未结构化的,重复序列的例子是M13噬菌体的pIII蛋白质中的连接体,其具有重复序列(GGGSE)n并已知对于大量的蛋白酶异常稳定。具有基序(GGGSE)n的附加蛋白质据预测是非常有用的。对于长的序列,可能更优选(GGSE)n以获得更高的溶解性,这在长度增加时可能是需要的。
在生理状态下在水、血液和其它体液中具有良好的溶解性的附加多肽也是需要以利于生物利用度。这种序列可以通过设计富含亲水氨基酸(如甘氨酸、丝氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸、苏氨酸)和包含很少疏水氨基酸(如色氨酸、苯丙氨酸、酪氨酸、亮氨酸、异亮氨酸、缬氨酸、甲硫氨酸)的序列进行设计。由于其氨基酸组成,附加多肽具有低的在水性制剂中形成聚集体的倾向且附加多肽与其它蛋白质或肽的融合倾向于增强它们的溶解性并降低它们形成聚集体的倾向,这是降低免疫原性的独立的机制。
在某些情况中,附加多肽可以显示出与组织或血清蛋白质的增强的非特异性结合(图28),这可以起到延长其血清半衰期的作用。血清蛋白质结合可以多种方法使用测量。用于结合分析的例子是ELISA、Biacore、Kinexa或Forte Bio。由于大多数动物组织表面具有(净)弱负电荷,具有净负电荷的蛋白质比具有净正电荷的蛋白质显示出较少的非特异性组织结合。通过添加负电荷或通过除去正电荷产生净弱负电荷可以使得蛋白质更特异性地结合或至少减少非特异性结合。
但是,如果净负电荷(或净电荷密度)太高,它可以导致与具有局部正电荷斑块的表面(如结合细胞外基质的部分或蛋白质)或与DNA或RNA(例如,VEGF、组蛋白)的非特异性结合。相反,通过添加正电荷(如K、R)或通过除去负电荷产生具有净正电荷的蛋白质可以使得蛋白质非特异性地与组织结合,这导致半衰期的延长。
附加多肽本身的电荷类型和密度可以改变。带负电的氨基酸是E、D、(C)和带正电的氨基酸是R、K、(H)。变化通常涉及将一个带负电的残基与另一个残基交换,如E换成D或相反。在某些情况中,E是优选的,因为D可能异构化而导致制备中不希望的化学不稳定性。电荷类型的峰峦(从正电荷变成负电荷或相反)涉及用E或D置换K或R(正电荷被负电荷取代)。电荷的变换也包括用带电的氨基酸(E、D、K、R)取代非带电或弱带电的氨基酸(A、C、F、G、H、I、L、M、N、P、Q、S、T、V、W、Y)或相反。“电荷密度”是带电的氨基酸作为总残基的百分比的数量。改变电荷密度涉及提高或降低作为总残基的百分比的带负电的氨基酸(特别是E、D)或带正电的氨基酸(K、R)的数目。相反,“净电荷密度”是作为总残基的百分比的所有带正电的氨基酸的总和减去所有带负电的氨基酸的总和(“有效净电荷”)。
“有效净电荷”和“净电荷密度(每AA的有效净电荷)”可以影响附加多肽和附加-修饰多肽的溶解性及其结合其它分子的能力。附加多肽可以改变融合蛋白质的电荷类型和密度,这可以增强血清半衰期并可以用于增强融合蛋白质与其它蛋白质或物质的希望的相互作用或减少不希望的相互作用。
在某些情况中,附加多肽或以显示增强的与组织或血清蛋白质的非特异性结合,这可以起到选自它们的血清半衰期的作用。这可以作为与不显示非特异性结合的附加序列相比的血清半衰期的延长进行测量,或者它可以作为对具有高密度相反电荷的蛋白质的弱结合亲和力通过ELISA显示。
附加多肽可以部分地或全部地由单氨基酸(如E(n)、(G)n或(S)n(也称为聚-E、EEEEE、聚-G、GGGGG或聚-S、SSSSS)或者甚至一种A、C、D、F、H、I、K、L、M、N、P、Q、R、S、T、V、W、Y的同聚物;即AAAAA)。最佳的单氨基酸基序(E、G、S)是免疫学上的最低复合物(仅可能产生一种类型的9氨基酸肽),但各具有一些缺陷。甘氨酸是弱疏水性的和聚-G具有有限的溶解性。甘氨酸的优势是其高熵。在某些情况中,丝氨酸或以比甘氨酸更优选因为相应的DNA序列很容易具有更平衡的GC-比且通常提供更高的表达水平,可能由于其6密码子。四种带电的氨基酸,包括谷氨酸(E),具有20种天然氨基酸的最高的溶解性,随后是甘氨酸和丝氨酸。但是,在高负净电荷密度下,蛋白质开始非特异性地与带正电的蛋白质和表面(如VEGF(结合ECM的基本外显子)、组蛋白、DNA/RNA-结合蛋白)结合及还与骨结合。其它人已经报道,长链聚-E引起半衰期缩短,而不是希望的半衰期延长。
丝氨酸和聚丝氨酸以最好密码子使用的和表达水平提供高溶解性而没有聚集的风险。用于丝氨酸的六个密码子提供平衡的GC含量,但更重要地,它们允许聚-S或富含S的序列由比其它氨基酸(如聚-E或聚-G)提供更高程度的密码子选择优化和表达水平优化的异常多样的DNA序列编码(图14和15)。
附加多肽可以是实现上述的功能改变必要的任何长度。仅包含1、2、3或更多类型的氨基酸的附加序列的长度可具有10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90或100个氨基酸的下限和30、40、50、60、70、80、90、100、125、150、175、200、250、300、350、400、500、600或甚至1000个氨基酸的上限。
附加多肽的氨基酸组成可以进行选择以使得所得到的多肽的需要性能最大化。例如,对于血清半衰期的延长,表观分子量与预测分子量的高比率是优选的。对相同的质量提供更大的流体动力学半径的未结构化附加多肽用不支持如α螺旋或β-折叠的结构的氨基酸构成。按照通过仇-法斯门算法的氨基酸残基的分级,残基A、D、E、Q、I、L、K、M、F、W、V支持α-螺旋结构和残基C、Q、I、L、M、F、T、W、Y、V支持β-折叠结构。由于形成转角,仇-法斯门算法认为最不结构化的氨基酸(按照最高非结构化到最低非结构化的顺序)是:G、N、P、D、S、C、Y、K。产的说来,最少支持结构的残基是G、N、P、S。
为了更好地精细调节聚合物的性能,特别是溶解性和电荷密度,由两种或三种氨基酸构成的附加多肽通常比单氨基酸构成的附加多肽更加优选。由两种或三种类型的氨基酸构成的附加多肽是优选的因为它们提供免疫学简单性(仅产生少量的可结合MHC复合体的不同9-聚体肽或形成用于抗体结合表位的8-聚体肽)与溶解性、蛋白酶抗性、电荷类型和密度的优化、结构缺失、高熵和与组织的非特异性结合(其可能是不需要的,但也可以用作半衰期机制)之间的平衡。一般,可由附加蛋白质序列产生的非人8-聚体或9-聚体肽的数目越多,免疫原性的风险越高。因此,在一些方面,附加多肽包含少量的不同8-聚体或9-聚体,且其中这些肽序列所有或大部分存在于人蛋白质组中,优选以许多拷贝存在。
在需要的情况下,两种或三种氨基酸类似的混合可以进行优化以获得希望的性能平衡。20种天然氨基酸(AA)可以分成具有相关性能的组。残基E、D(和更小程度的C)是在生理(中性)pH下是带负电的,且残基K、R和更小程度的H在中性pH是带正电的。带电的残基E、D、K的R的存在对于长多肽的水溶性最大化可能是需要的。对于某些生物应用,希望具有高的但相同或类似频率的带负电和带正电的残基,这导致具有高电荷密度但低有效净电荷的不带电的或几乎不带电的多肽,这种多肽倾向于具有低的与结合带电聚合物(如肝素)的受体的非特异性相互作用的趋势。对于某些生物应用,单一电荷类型(负)(其与D不同)是化学稳定的;因此利于E(谷氨酸)。问题是氨基酸的多大百分比应当是E,及是否大多数非带电氨基酸应当是G或S和是否序列应当是高度重复的或低重复性的。
带负电的残基E、D的高频率很容易使得聚合物结合具有大量正电荷的分子,如DNA结合蛋白、组蛋白和其它富含R、K的序列。带正电的残基K、R的高频率很容易使得聚合物结合具有大量负电荷的表面,其包括大多数细胞表面。与细胞表面结合通常是不希望的,但低水平的这种非特异性结合可用于增加半衰期。极性亲水氨基酸N、Q、S、T、K、R、H、D、E和额外的氨基酸C或Y可以用于制备相对水溶性的附加多肽。Q和N可以是糖基化位点,从而提供独立的增加流体动力学半径并因此增加半衰期的机制。非极性疏水性残基如A、V、L、I、P、Y、F、W、M、C在制备具有高水溶解性的序列时是较不利的,但可能希望以低频率并入一个或多个这些残基,从而它们占到低于总数的10-20%。例如,有限数目的疏水性残基成分可以通过增加与血清暴露位点的非特异性结合提高半衰期。类似地,来自半胱氨酸残基的游离硫醇可以通过与其它游离硫醇(如人血清白蛋白中的游离硫醇)结合直到半衰期延长机制的作用。另外,这些较不优选的氨基酸可以用于产生结合血清暴露蛋白质的肽,从而对附加蛋白质添加流体动力学半径以外的第二半衰期延长机制。
甘氨酸由于其高的流体动力学半径与质量或表观分子量与预测分子量的比率是优选的可用于附加多肽中的残基。甘氨酸不具有侧链并因此是最小的残基,70Da。由于其小的尺寸,它提供最大的旋转自由度和最高的熵。这使得蛋白质难以结合具有较高频率的甘氨酸的序列且富含甘氨酸的序列是高蛋白酶抗性的。
残基C、W、N、Q、S、T、Y、K、R、H、D、E可以与其它残基形成氢键并因此支持结构(分子间氢键)和与其它蛋白质结合(分子间氢键)。这些可以在不需要结构的地方排除,或如果需要某种程度的结合(特异性或非特异性)以延长半衰期时包括。含硫残基C和M通常在附加多肽避免,但可以包括半胱氨酸以通过其游离硫醇基提供半衰期且,也可以作为低免疫原性结合元件用于环状肽中以通过结合血清暴露蛋白质延长半衰期或通过结合组织特异性位点获得组织靶向或调整的体内分布。
在一个实施方式中,附加多肽不包含重复序列或包含最少的重复序列。IgM是五价的并表现出识别重复序列的倾向。由于IgM的五价,即使与IgM的低亲和力接触可以导致显著的表观亲和力(亲合力)。构建具有较低程度的重复性和较低的IgM结合可能性的序列的一个途径是使用长的(即,重复长度为7、8、9、10、12、14、16、20、30、40、50、70、100、150、200氨基酸)的序列。具有较低程度的重复性的序列是(SESSSESSE)n、(SSESSSSESSSE)n、(SSSESSSSSESSSSE)n 或(SSSSESSSSSSE)n,其中具有类似和整体组成的重复序列是(SSE)n、(SSSE)n、(SSSSE)n、(SSSSSE)n或(SSSSSSE)n。另一途径包括使用多个基序和/或在同一附加多肽中混杂的一个或多个基序的变体(如基序的序列变体、间隔变体和在分隔基序的序列中的变体)。本发明的另一方面提供主要非重复的并具有希望的氨基酸组成的长的完全人或人源化序列的用途。在相关的实施方式中,其它类型的氨基酸或基于其它类型的氨基酸的基序可以穿插布置。一个例子是:GEGESEGEGEGESEGEGESGE。
包含三种不同类型氨基酸的附加多肽序列:
在一个实施方式中,附加多肽包含含有三种不同类型的氨基酸的序列。与一种或两种氨基酸相比,三种氨基酸的优势是提高精细调节所得到的聚合物的性能以用于预定的商业应用的能力。
本发明的一个特别的实施方式提供包含三种不同类型氨基酸的非重复序列。本发明的进一步的实施方式提供三种不同类型氨基酸的非重复序列,其中氨基酸选自A、D、E、G、H、K、N、P、Q、R、S、T和Y。用于这一实施方式的示例性序列显示于表1中。在优选的实施方式中,氨基酸选自D、E、G、K、P、R、S和T。在更优选的实施方式中,氨基酸选自E、S、G、R和A。在最优选的实施方式中,氨基酸是E、G和S。在这种蛋白质中,优选的组成具有30-70%(最好:50-60%)范围的G、20-40%(最好:25-30%)范围的E和10-25%范围的S,且优选仅具有超过9-15AA的各序列的1、2、3、4或5个拷贝(重复序列)。
在独立的实施方式中,附加多肽包含含有序列基序的重复序列,其中各重复序列基序包含三种不同类型的氨基酸,其中氨基酸选自A、D、E、G、H、K、N、P、Q、R、S、T和Y。用于这一实施方式的示例性序列显示于表1中。在一个实施方式中,氨基酸选自D、E、G、K、P、R、S和T。在另一个实施方式中,氨基酸选自E、S、G、R和A。在再另一实施方式中,氨基酸是E、G和S(以任何顺序)。
在相关的实施方式中,本发明的附加多肽包含组织在重复序列基序中的三种不同类型的氨基酸,其中各重复序列基序比三个连续的氨基酸长。用于这一实施方式的示例性序列显示于表1中。重复序列基序可以是正向的或反向的且1、2、3、4或更多不同类型的基序可以在同一蛋白质中独立地或混杂地存在。重复序列可以是完全的或不完全的,具有1、2、3、4、5或更多失配残基,且重复序列可以是连续的或分散的,意思是被其它不是由相同基序构成的不相关序列分隔。在某些实施方式中,重复序列构成附加多肽的大部,而非重复序列在其它实施方式中占优势。在一个特别的实施方式中,重复序列包含散置的单个氨基酸,其破坏序列的严格重复特性。用于这一实施方式的示例性序列显示于表1中。在另一相关的实施方式中,附加多肽主要包含三种类型的氨基酸,与较少数目的不同类型的氨基酸组织在重复或非重复序列中,其中所述三种类型的氨基酸占到整个序列的超过50%、60%、70%、80%、90%、95%、98%或>99%。
包含多种类型的重复基序的序列的另一个例子是GGGGGGGGGGEEEEEEEEEEGGGGGGGGGGEEEEEEEEEE。其它优选的例子是具有2、3、4、5或更多基序的各种不同组合的序列,其中基序选自E、S、G、GE、GS、SE、GES、GSE、ESG、EGS、SGE和SEG,导致组成(E)n、(S)n、(G)n、(GE)n、(GS)n、(SE)n、(GES)n、(GSE)n、(ESG)n、(EGS)n、(SGE)n和(SEG)以及许多附加序列。
基序中或多聚序列中氨基酸的组成可以是平衡的(例如,50%G和50%E;或33%G、33%E和33%S,及其它类似例子)或不平衡的(即,75%S和25%E)。
附加序列重复序列可以位于蛋白质的N-末端、蛋白质的C-末端或者距N-末端或C-末端1、2、3、4、5、6、10、20、30或更多氨基酸残基处。聚氨基酸也可以位于两个蛋白质域之间。
聚氨基酸中基序的重复序列的数目可以具有4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100的下限和10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150、200、250、300、400、500或甚至600的上限。
重复基序可以具有主要氨基酸类型和次要氨基酸类型。对于给定的重复基序,主要氨基酸类型比次要类型具有更多的残基。例如,在附加多肽(GGGEE)n中,G是主要的和E是次要的氨基酸类型。这些序列按定义是不平衡的。在这些基序中,有可能具有2、3、4或更多类型的主要氨基酸。在优选的实施方式中,主要氨基酸是G、E、S和次要氨基酸是A、D、E、F、G、H、I、K、L、M、N、P、Q、R、S、T、V、W、Y,额外的限制是相同氨基酸类型不能同时在基序中存在的主要和次要组中。在这些基序中,也有可能具有两种或更多类型的次要氨基酸;例子是(GGEGGS)n,其中G是主要类型和E和S是次要类型的氨基酸。其它例子是(EGGSGG)n、(GEGGSG)n、(GGSGGE)n、(SGGEGG)n、(GSGGEG)n、(GEEGSS)n、(GSSGEE)n、(SGSEGE)n、(SSGEEG)n。
与特定的序列无关,附加序列中氨基酸残基的总数具有10、12、14、16、18、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、45、50、55、60、65、70、75、80、85、90、95、100、120、140、160、180、200、250或300氨基酸的下限和30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、220、240、260、280、300、350、400、450、500、550或甚至超过600、700、800、900或1000氨基酸的上限。这些数目可以指单一连续序列的长度或由不连续存在的多个基序构成的多个序列累积长度总数,意思是这些重复序列是分散的且被其它序列(包括不同基序的重复序列)分隔。
表1.包含三种不同类型氨基酸的附加多肽序列
| (DEG)n,(DEK)n,(DEP)n,(DER)n,(DES)n,(DET)n,(DGK)n,(DGP)n,(DGR)n,(DGS)n,(DET)n,(DKP)n,(DKR)n,(DKS)n,(DKT)n,(DPR)n,(DPS)n,(DPT)n,(DRK)n,(DRS)n,(DSE)n,(DSP)n,(DTE)n,(DTG)n,(DTK)n,(DTP)n,(DTR)n,(DTS)n,(EGD)n,(EGK)n,(EGP)n,(EGR)n,(EGS)n,(EGT)n,(EKD)n,(EKG)n,(EKP)n,(EKR)n,(EKS)n,(EKT)n,(EPD)n,(EPG)n,(EPK)n,(EPR)n,(EPS)n,(EPT)n,(ERD)n,(ERG)n,(ERK)n,(ERP)n,(ERS)n,(ERT)n,(ESD)n,(ESG)n,(ESK)n,(ESP)n,(ESR)n,(EST)n,(ETD)n,(ETG)n,(ETK)n,(ETP)n,(ETR)n,(ETS)n,(GKD)n,(GKE)n,(GKP)n,(GKR)n,(GKS)n,(GKT)n,(GPK)n,(GPD)n,(GPE)n,(GPR)n,(GPS)n,(GPT)n,(GRD)n,(GRE)n,(GRK)n,(DRP)n,(DRS)n,(DRT)n,(GSD)n,(GSE)n,(GSK)n,(GSP)n,(GST)n,(GTE)n,(GTD)n,(GTK)n,(GTP)n,(GTR)n,(GTS)n,(KPD)n,(KPE)n,(KPG)n,(KPR)n,(KPS)n,(KPT)n,(KRD)n,(KRE)n,(KRG)n,(KRP)n,(KRS)n,(KRT)n,(KSD)n,(KSE)n,(KSG)n,(KSP)n,(KSR)n,(KST)n,(KTD)n,(KTE)n,(KTG)n,(KTP)n,(KTR)n,(KTS)n,(PRD)n,(PRE)n,(PRG)n, |
| (PRK)n,(PRS)n,(PRT)n,(PSD)n,(PSE)n,(PSG)n,(PSK)n,(PSP)n,(PSR)n,(PST)n,(PTD)n,(PTE)n,(PTG)n,(PTK)n,(PTR)n,(PTS)n,(RSD)n,(RSE)n,(RSG)n,(RSK)n,(RSP)n,(RST)n,(RTD)n,(RTE)n,(RTG)n,(RTK)n,(RTP)n,(RTS)n,(SED)n,(SEG)n,(SEK)n,(SEP)n,(SER)n,(SET)n,(STD)n,(STE)n,(STG)n,(STK)n,(STP)n,(STR)n. |
| ...EEEGGGSSSGEGGSSSGSEE......ESGGSSEGSSEESGSSEGSE... |
| (EEESSSGGG)n,(EESSGG)n,(ESGSE)n,(EESGS)n,(ESGGSE)n |
| (ESG)n(E)(ESG)n |
| (ESG)n(P)(ESG)n |
包含两种不同类型氨基酸的附加多肽:
在一个实施方式中,附加多肽包含含有两种不同类型的氨基酸的序列。
在特别的实施方式中,附加多肽包含含有两种不同类型的氨基酸的序列,其中氨基酸之一是甘氨酸且其它氨基酸是D、E、K、P、R、S、T、A、H、N、Y、L、V、W、M、F、I或C。更特别的实施方式提供包含含有两种不同类型氨基酸的序列的附加多肽,其中一种氨基酸是甘氨酸,且其中甘氨酸占整个序列的0%、一半或低于一半。在相关的实施方式,附加多肽包含10%、20%、30%、40%、50%、60%、70%、80%、90%或甚至100%的甘氨酸残基。
在不同的实施方式,附加多肽包含含有两种不同类型的氨基酸的序列,其中一种氨基酸是丝氨酸且其它氨基酸是D、E、K、P、R、G、T、A、H、N、Y、L、V、W、M、F、I或C。更特别的实施方式提供包含含有两种不同类型的氨基酸的序列的附加多肽,其中一种氨基酸是丝氨酸且其中丝氨酸占整个序列的0%、一半或低于一半。在相关的实施方式,附加多肽包含10%、20%、30%、40%、50%、60%、70%、80%、90%或甚至100%的丝氨酸残基。
在相关的实施方式中,附加多肽包含两种不同类型的氨基酸,其中氨基酸以相等或大致相等(1∶1的比率)的量存在。在相关的实施方式,两种类型的氨基酸以1∶2、1∶3、2∶3、3∶4的比存在。序列例子显示于表2中。
本发明的替代实施方式提供包含含有两种不同类型的氨基酸的序列的附加多肽,其中总氨基酸的一半或低于是A、T、G、D、E或H。
本发明的替代实施方式提供包含含有两种不同类型的氨基酸的序列的附加多肽,其中一半或更多的氨基酸是G且总氨基酸的一半或低于一半是A、S、T、D、E或H。
本发明的另一实施方式提供包含含有两种不同类型的氨基酸的序列的附加多肽,其中一半或更多的氨基酸是S且总氨基酸的一半或低于一半是A、T、G、D、E或H。
本发明的另一实施方式提供包含含有两种不同类型的氨基酸的序列的附加多肽,其中总氨基酸的一半或低于一半是P、R、L、V、Y、W、M、F、I、K或C。
附加多肽也预想包含重复的序列基序,其中序列基序可以由2、3、4、5、6、7、8、9或更多氨基酸组成。
在基序中或在多聚序列中的氨基酸组成可以是平衡的(例如,50%S和50%E)或不平衡的(即,75%S和25%E)。
附加多肽重复序列可以位于蛋白质的N-末端、蛋白质的C-末端或距N-末端或C-末端1、2、3、4、5、6、10、20、30或更多氨基酸残基处。聚氨基酸也可以位于两个蛋白质域之间。
聚氨基酸中基序的重复序列的数目可以具有4、5、6、7、8、9、10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100的下限和10、12、14、16、18、20、25、30、35、40、45、50、60、70、80、90、100、150、200、250、300、400、500或甚至600的上限。
附加多肽中的氨基酸残基总数可以具有20、21、22、23、24、25、26、27、28、29、30、31、32、34、35、36、37、38、39、40、45、50、55、60、65、70、75、80、85、90、95、100、120、140、160、180、200、250或300氨基酸的下限和30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、220、240、260、280、300、350、400、450、500、550或甚至超过600、700、800、900或1000氨基酸的上限。这一数目可以指单一连续序列的长度或由不连续存在的多个序列的累积长度总数,意思是这些重复序列是分散的且被其它序列(包括不同基序的重复序列)分隔。
包含两种氨基酸的可能的基序是AD、AE、AF、AG、AH、AI、AK、AL、AM、AN、AP、AQ、AR、AS、AT、AV、AW、AY、DA、DE、DF、DG、DH、DI、DK、DL、DM、DN、DP、DQ、DR、DS、DT、DV、DW、DY、EA、ED、EF、EG、EH、EI、EK、EL、EM、EN、EP、EQ、ER、ES、ET、EV、EW、EY、FA、FD、FE、FG、FH、FI、FK、FL、FM、FN、FP、FQ、FR、FS、FT、FV、FW、FY、GA、GD、GE、GF、GH、GI、GK、GL、GM、GN、GP、GQ、GR、GS、GT、GV、GW、GY、HA、HD、HE、HF、HG、HI、HK、HL、HM、HN、HP、HQ、HR、HS、HT、HV、HW、HY、IA、ID、IE、IF、IG、IH、IK、IL、IM、IN、IP、IQ、IR、IS、IT、IV、IW、IY、KA、KD、KE、KF、KG、KH、KI、KL、KM、KN、KP、KQ、KR、KS、KT、KV、KW、KY、LA、LD、LE、LF、LG、LH、LI、LK、LM、LN、LP、LQ、LR、LS、LT、LV、LW、LY、MA、MD、ME、MF、MG、MH、MI、MK、ML、MN、MP、MQ、MR、MS、MT、MV、MW、MY、NA、ND、NE、NF、NG、NH、NI、NK、NL、NM、NN、NP、NQ、NR、NS、NT、NV、NW、NY、PA、PD、PE、PF、PG、PH、PI、PK、PL、PM、PN、PQ、PR、PS、PT、PV、PW、PY、QA、QD、QE、QF、QG、QH、QI、QK、QL、QM、QN、QP、QR、QS、QT、QV、QW、QY、RA、RD、RE、RF、RG、RH、RI、RK、RL、RM、RN、RP、RQ、RR、RS、RT、RV、RW、RY、SA、SD、SE、SF、SG、SH、SI、SK、SL、SM、SN、SP、SQ、SR、SS、ST、SV、SW、SY、TA、TD、TE、TF、TG、TH、TI、TK、TL、TM、TN、TP、TQ、TR、TS、TV、TW、TY、VA、VD、VE、VF、VG、VH、VI、VK、VL、VM、VN、VP、VQ、VR、VS、VT、VW、VY、WA、WD、WE、WF、WG、WH、WI、WK、WL、WM、WN、WP、WQ、WR、WS、WT、WV、WY、YA、YD、YE、YF、YG、YH、YI、YK、YL、YM、YN、YP、YQ、YR、YS、YT、YV、YW。其中,优选的2种氨基酸基序是EG和GE(形成聚合物EGEGEGEGEGE和其它变体)、GS和SG(形成聚合物GSGSGSGSGSGSGS和其它变体)、ES和SE(形成聚合物SESESESESESESESES和其它变体)。重复序列也可以包含3、4、5、6或7种氨基酸残基。也有可能重复序列包含8、9、10、11、12、13、14、15、16、17、18、19、20或甚至>20残基。各个这种重复序列可以包含2、3、4、5或更多类型的氨基酸,最高是该重复序列中存在的残基的数目。
一种优选的附加物类型仅包含两种氨基酸类型,但50%或更多的残基是优选的残基(A、S、T、D、E、H)之一。在某些情况中,附加多肽仅包含两种主要类型的氨基酸,但P、R、L、V、Y、W、M、F、I、K或C可以以较低的比率添加以获得附加多肽性能的最佳微调(参见表2)。
表2.包含两种不同类型氨基酸的附加多肽
| (DE),(DG),(DK),(DP),(DR),(DS),(DT),(ED),(EG),(EK),(EP),(ER),(ES),(ET),(GD),(GE),(GK),(GP),(GR),(GS),(GT),(KD),(KE),(KG),(KP),(KR),(KS),(KT),(PD),(PE),(PG),(PK),(PR),(PS),(PT),(RD),(RE),(RG),(RK),(RP),(RS),(RT),(SD),(SE),(SG),(SK),(SP),(SR),(ST),(TD),(TE),(TG),(TK),(TP,(TR),(TS); |
| (DEE),(DGG),(DKK),(DPP),(DRR),(DSS),(DTT),(EDD),(EKK),(EPP),(ERR),(ESS),(ETT),(GDD), |
| (GEE),(GKK),(GPP),(GRR),(GSS),(GTT),(KDD),(KEE),(KGG),(KPP),(KRR),(KSS),(KTT),(PDD),(PEE),(PGG),(PKK),(PRR),(PSS),(PTT),(RDD),(REE),(RGG),(RKK),(RPP),(RSS),(RTT),(SDD),(SEE),(SKK),(SPP),(SRR),(STT),(TDD),(TEE),(TKK),(TPP),(TRR),(TSS); |
| (DDDEE),(DDDGG),(DDDKK),(DDDPP),(DDDRR),(DDDSS),(DDDTT),(EEEDD),(EEEGG),(EEEKK),(EEEPP),(EEERR),(EEESS),(EEETT),(GGGDD),(GGGEE),(GGGKK),(GGGPP),(GGGRR),(KKKDD),(KKKEE),(KKKGG),(KKKPP),(KKKRR),(KKKSS),(KKKTT),(PPPDD),(PPPEE),(PPPGG),(PPPKK),(PPPRR),(PPPSS),(PPPTT),(RRRDD),(RRREE),(RRRGG),(RRRKK),(RRRPP),(RRRSS),(RRRTT),(SSSDD),(SSSEE),(SSSGG),(SSSKK),(SSSPP),(SSSRR),(SSSTT),(TTTDD),(TTTEE),(TTTGG),(TTTKK),(TTTPP),(TTTRR),(TTTSS). |
| (DDDDEEE),(DDDDGGG),(DDDDKKK),(DDDDPPP),(DDDDRRR),(DDDDSSS),(DDDDTTT),(EEEEDDD),(EEEEGGG),(EEEEKKK),(EEEEPPP),(EEEERRR),(EEEESSS),(EEEETTT),(KKKKDDD),(KKKKEEE),(KKKKGGG),(KKKKPPP),(KKKKRRR),(KKKSSSS),(KKKKTTT),(PPPPDDD),(PPPPEEE),(PPPPGGG),(PPPKKKK),(PPPPRRR),(PPPPSSS),(PPPTTT),(RRRRDDD),(RRRREEE),(RRRRGGG),(RRRRKKK),(RRRRPPP),(RRRRSSS),(RRRRTTT),(SSSSDDD),(SSSSEEE),(SSSSGGG),(SSSSKKK),(SSSSPPP),(SSSSRRR),(SSSSTTT),(TTTTDDD),(TTTTEEE),(TTTTGGG),(TTTTKKK),(TTTTPPP),(TTTTRRR), |
| (TTTTSSS). |
| (DE)n,(DG)n,(DK)n,(DP)n,(DR)n,(DS)n,(DT)n,(ED)n,(EG)n,(EK)n,(EP)n,(ER)n,(ES)n,(ET)n,(GD)n,(GE)n,(GK)n,(GP)n,(GR)n,(GS)n,(GT)n,(KD)n,(KE)n,(KG)n,(KP)n,(KR)n,(KS)n,(KT)n,(PD)n,(PE)n,(PG)n,(PK)n,(PR)n,(PS)n,(PT)n,(RD)n,(RE)n,(RG)n,(RK)n,(RP)n,(RS)n,(RT)n,(SD)n,(SE)n,(SG)n,(SK)n,(SP)n,(SR)n,(ST)n,(TD)n,(TE)n,(TG)n,(TK)n,(TP)n,(TR)n,(TS)n.(DEE)n,(DGG)n,(DKK)n,(DPP)n,(DRR)n,(DSS)n,(DTT)n,(EDD)n,(EGG)n,(EKK)n,(EPP)n,(ERR)n,(ESS)n,(ETT)n,(GDD)n,(GEE)n,(GKK)n,(GPP)n,(GRR)n,(GSS)n,(GTT)n,(KDD)n,(KEE)n,(KGG)n,(KPP)n,(KRR)n,(KSS)n,(KTT)n,(PDD)n,(PEE)n,(PGG)n,(PKK)n,(PRR)n,(PSS)n,(PTT)n,(RDD)n,(REE)n,(RGG)n,(RKK)n,(RPP)n,(RSS)n,(RTT)n,(SDD)n,(SEE)n,(SGG)n,(SKK)n,(SPP)n,(SRR)n,(STT)n,(TDD)n,(TEE)n,(TGG)n,(TKK)n,(TPP)n,(TRR)n,(TSS)n. |
| (DDE)n,(DDG)n,(DDK)n,(DDP)n,(DDR)n,(DDS)n,(DDT)n,(EED)n,(EEG)n,(EEK)n,(EEP)n,(EER)n,(EES)n,(EET)n,(GGD)n,(GGE)n,(GGK)n,(GGP)n,(GGR)n,(GGS)n,(GGT)n,(KKD)n,(KKE)n,(KKG)n,(KKP)n,(KKR)n,(KKS)n,(KKT)n,(PPD)n,(PPE)n,(PPG)n,(PPK)n,(PPR)n,(PPS)n,(PPT)n,(RRD)n,(RRE)n,(RRG)n,(RRK)n,(RRP)n,(RRS)n,(RRT)n,(SSD)n,(SSE)n,(SSG)n,(SSK)n,(SSP)n,(SSR)n,(SST)n,(TTD)n,(TTE)n,(TTG)n,(TTK)n,(TTP)n,(TTR)n,(TTS)n.(DDEE)n,(DDGG)n,(DDKK)n,(DDPP)n,(DDRR)n,(DDSS)n,(DDTT)n,(EEDD)n,(EEGG)n,(EEKK)n, |
| (EEPP)n,(EERR)n,(EESS)n,(EETT)n,(GGDD)n,(GGEE)n,(GGKK)n,(GGPP)n,(GGRR)n,(GGSS)n,(GGTT)n,(KKDD)n,(KKEE)n,(KKGG)n,(KKPP)n,(KKRR)n,(KKSS)n,(KKTT)n,(PPDD)n,(PPEE)n,(PPGG)n,(PPKK)n,(PPRR)n,(PPSS)n,(PPTT)n,(RRDD)n,(RREE)n,(RRGG)n,(RRKK)n,(RRPP)n,(RRSS)n,(RRTT)n,(SSDD)n,(SSEE)n,(SSGG)n,(SSKK)n,(SSPP)n,(SSRR)n,(SSTT)n,(TTDD)n,(TTEE)n,(TTGG)n,(TTKK)n,(TTPP)n,(TTRR)n,(TTSS)n,(DDDEE)n,(DDDGG)n,(DDDKK)n,(DDDPP)n,(DDDRR)n,(DDDSS)n,(DDDTT)n,(EEEDD)n,(EEEGG)n,(EEEKK)n,(EEEPP)n,(EEERR)n,(EEESS)n,(EEETT)n,(GGGDD)n,(GGGEE)n,(GGGKK)n,(GGGPP)n,(GGGRR)n,(GGGSS)n,(GGGTT)n,(KKKDD)n,(KKKEE)n,(KKKGG)n,(KKKPP)n,(KKKRR)n,(KKKSS)n,(KKKTT)n,(PPPDD)n,(PPPEE)n,(PPPGG)n,(PPPKK)n,(PPPRR)n,(PPPSS)n,(PPPTT)n,(RRRDD)n,(RRREE)n,(RRRGG)n,(RRRKK)n,(RRRPP)n,(RRRSS)n,(RRRTT)n,(SSSDD)n,(SSSEE)n,(SSSGG)n,(SSSKK)n,(SSSPP)n,(SSSRR)n,(SSSTT)n,(TTTDD)n,(TTTEE)n,(TTTGG)n,(TTTKK)n,(TTTPP)n,(TTTRR)n,(TTTSS)n.(DDEEE)n,(DDGGG)n,(DDKKK)n,(DDPPP)n,(DDRRR)n,(DDSSS)n,(DDTTT)n,(EEDDD)n,(EEGGG)n,(EEKKK)n,(EEPPP)n,(EERRR)n,(EESSS)n,(EETTT)n,(GGDDD)n,(GGEEE)n,(GGKKK)n,(GGPPP)n,(GGRRR)n,(GGSSS)n,(GGTTT)n,(KKDDD)n,(KKEEE)n,(KKGGG)n,(KKPPP)n,(KKRRR)n,(KKSSS)n,(KKTTT)n,(PPDDD)n,(PPEEE)n, |
| (PPGGG)n,(PPKKK)n,(PPRRR)n,(PPSSS)n,(PPTTT)n,(RRDDD)n,(RREEE)n,(RRGGG)n,(RRKKK)n,(RRPPP)n,(RRSSS)n,(RRTTT)n,(SSDDD)n,(SSEEE)n,(SSGGG)n,(SSKKK)n,(SSPPP)n,(SSRRR)n,(SSTTT)n,(TTDDD)n,(TTEEE)n,(TTGGG)n,(TTKKK)n,(TTPPP)n,(TTRRR)n,(TTSSS)n.(DDDEEE)n,(DDDGGG)n,(DDDKKK)n,(DDDPPP)n,(DDDRRR)n,(DDDSSS)n,(DDDTTT)n,(EEEDDD)n,(EEEGGG)n,(EEEKKK)n,(EEEPPP)n,(EEERRR)n,(EEESSS)n,(EEETTT)n,(GGGDDD)n,(GGGEEE)n,(GGGKKK)n,(GGGPPP)n,(GGGRRR)n,(GGGSSS)n,(GGGTTT)n,(KKKDDD)n,(KKKEEE)n,(KKKGGG)n,(KKKPPP)n,(KKKRRR)n,(KKKSSS)n,(KKKTTT)n,(PPPDDD)n,(PPPEEE)n,(PPPGGG)n,(PPPKKK)n,(PPPRRR)n,(PPPSSS)n,(PPPTTT)n,(RRRDDD)n,(RRREEE)n,(RRRGGG)n,(RRRKKK)n,(RRRPPP)n,(RRRSSS)n,(RRRTTT)n,(SSSDDD)n,(SSSEEE)n,(SSSGGG)n,(SSSKKK)n,(SSSPPP)n,(SSSRRR)n,(SSSTTT)n,(TTTDDD)n,(TTTEEE)n,(TTTGGG)n,(TTTKKK)n,(TTTPPP)n,(TTTRRR)n,(TTTSSS)n.(DDDDEEE)n,(DDDDGGG)n,(DDDDKKK)n,(DDDDPPP)n,(DDDDRRR)n,(DDDDSSS)n,(DDDDTTT)n,(EEEEDDD)n,(EEEEGGG)n,(EEEEKKK)n,(EEEEPPP)n,(EEEERRR)n,(EEEESSS)n,(EEEETTT)n,(GGGGDDD)n,(GGGGEEE)n,(GGGGKKK)n,(GGGGPPP)n,(GGGGRRR)n,(GGGGSSS)n,(GGGGTTT)n,(KKKKDDD)n,(KKKKEEE)n,(KKKKGGG)n,(KKKKPPP)n,(KKKKRRR)n,(KKKSSSS)n,(KKKKTTT)n, |
| (PPPPDDD)n,(PPPPEEE)n,(PPPPGGG)n,(PPPKKKK)n,(PPPPRRR)n,(PPPPSSS)n,(PPPPTTT)n,(RRRRDDD)n,(RRRREEE)n,(RRRRGGG)n,(RRRRKKK)n,(RRRRPPP)n,(RRRRSSS)n,(RRRRTTT)n,(SSSSDDD)n,(SSSSEEE)n,(SSSSGGG)n,(SSSSKKK)n,(SSSSPPP)n,(SSSSRRR)n,(SSSSTTT)n,(TTTTDDD)n,(TTTTEEE)n,(TTTTGGG)n,(TTTTKKK)n,(TTTTPPP)n,(TTTTRRR)n,(TTTTSSS)n |
| (SSSESSESSSSE)n,(GGEGEGGGE)n |
与人序列相关的附加多肽序列
与人蛋白质序列密切相关的附加多肽序列在某些应用中是希望的,因为它们具有降低的在患者体内引起免疫反应的风险。这种序列可以在本发明的某些实施方式中用作附加多肽。附加序列与人序列的关系可以通过确定所述附加(assessory)多肽序列的部分序列在人类基因组中的丰度进行评估。表3显示了8聚体部分序列存在的例子。附加多肽可以切割成如表示中所示的少数的8聚体序列,其中8聚体序列加下划线。可以对各8聚体序列进行数据库检索以确认在人蛋白质序列数据库中匹配的数目。类似的分析可以对7聚体、9聚体、10聚体、11聚体或更多的寡聚物进行。可以对这些部分序列的完全匹配进行数据库分析检索或可以对密切同源物进行检索。因此,检索的严格性可以进行调整以允许就附加多肽与人蛋白质的关系对附加多肽进行分级。表3中的数据显示了基于附加多肽与人蛋白质的密切相关性选择的附加多肽的几个例子。特别关注的是序列(SSSSE)n、(SSSSSSE)n和(SSSSESSSSSSE)n的附加蛋白质,其中所有8聚体子序列可以在几种人蛋白质中发现。
表3.根据其与人蛋白质序列的相关性分级序列
未结构化重组聚合物(Unstructured Recombinant Pomer)(URPs):
本发明的一个方面是非结构化重组聚合物(URPs)作为附加多肽的用途。所述URP特别用于产生具有治疗和/或诊断价值的重组蛋白质。所述URP表现出一个或多个以下特征。
所述URP包含通常共有在生理状态下变性肽序列的共性的氨基酸序列。URP序列在生理状态下的表现通常如的变性肽序列。URP序列在生理状态下缺乏良好的二级和三级结构。现有技术中已建立多种方法确定给定多肽的二级和三级结构。例如,多肽的二级结构可以通过″远-UV″光谱区(190-250nm)中的CD光谱分析确定。α-螺旋、β-折叠和无规卷曲结构各赋予CD光谱特征性的形状和幅度。二级结构也可以通过特定的计算机程序或算法(如仇-法斯门算法)确定(Chou,P.Y.等(1974)Biochemistry,13:222-45)。对于给定的URP序列,该算法可以预测是否存在部分二级结构或完全没有二级结构。一般,URP序列由于其低水平的二级和三级结构而具有类似变性序列的光谱。在需要的情况下,URP序列可以设计为在生理状态下主要具有变性的构象。URP序列通常在生理状态下具有高水平的构象灵活性且它们与具有相似分子量的球状蛋白质相比倾向于具有大的流体动力学半径(斯托克斯半径)。如本文中使用的,生理状态指模拟有生命的受试者体内的条件的一系列条件,包括温度、盐浓度、pH。已经建立了用于体外分析的具有生理相关条件的宿主。一般地,生理缓冲液包含生理浓度的盐和处于调节到在大约6.5-大约7.8,优选大约7.0-大约7.5的范围内的中性pH。多种生理缓冲液列于Sambrook等(1989)(同上)中而因此要本文中不再详细说明。生理相关温度在大约25℃-大约38℃,和优选大约30℃-大约37℃的范围内。
所述URP可以是具有低免疫原性的序列。低免疫原性可以是URP序列构象灵活性的直接结果。许多抗体识别蛋白质抗原中的所谓构象表位。构象表位通过由蛋白质抗原的多个不连续氨基酸序列构成的蛋白质表面区域形成。蛋白质的精确折叠使得这些序列形成可以被抗体识别的明确的特殊构型。优选的URP设计为避免形成构象表位。例如,特别关注的是具有低的在水溶液中采取紧密折叠构象的倾向的URP序列。特别是,低免疫原性可以通过选择抵抗抗原呈递细胞中的抗原加工的序列、选择未很好地结合MHC的序列和/或选择源自人序列的序列获得。
所述URP可以是具有高水平蛋白酶抗性的序列。蛋白酶抗性也可以是URP序列构象灵活性的结果。蛋白酶抗性可以通过避免已知蛋白酶识别位点设计。可选择地,蛋白酶抗性序列可以通过噬菌体展示或相关技术从随机或半随机序列库选择。在用于特殊应用的需要情况下,如长效蛋白质的缓释,血清蛋白酶切割位点可以构建在附加多肽中。特别关注的是在血液中具有高稳定性(例如,长的血清半衰期,不易被存在于体液中的蛋白酶切割)的URP序列。
所述URP也可以通过其中在其引入生物活性多肽中时的效应表征,修饰多肽表现出现比未修饰多肽相比更长的血清半衰期和/或更高的稳定性。所述URP可以是实现以下功能必要的任何长度:(a)包含该URP的蛋白质的血清半衰期延长;(b)得到的蛋白质的溶解性提高;(c)对蛋白酶的抗性提高和/或(d)得到的包含该URP的蛋白质的免疫原性降低。通常,所述URP具有大约30、40、50、60、70、80、90、100、150、200、300、400或更多的连续氨基酸。当并入蛋白质中时,URP可以发生断裂从而得到的蛋白质包含多个URP或多个URP的片段这些单独的URP序列的部分或全部可以短于40个氨基酸,只要得到的蛋白质中所有URP序列的组合长度是至少40个氨基酸。优选,得到的蛋白质具有超过40、50、60、70、80、90、100、150、200或更多氨基酸的URP序列组合长度。
URP可以具有1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5或甚至13.0的等电点(pI)。
一般,URP序列富含亲水氨基酸并包含低百分比的疏水性或芳香氨基酸。合适的亲水残基包括但不限于甘氨酸、丝氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和苏氨酸。在URP结构中较不得的疏水性残基包括色氨酸、苯丙氨酸、酪氨酸、亮氨酸、异亮氨酸、缬氨酸和甲硫氨酸。URP序列可以富含甘氨酸,但URP序列也可以富含如谷氨酸、天冬氨酸、丝氨酸、苏氨酸、丙氨酸或脯氨酸的氨基酸。因此,主要的氨基酸可以是G、E、D、S、T、A或P。包含脯氨酸残基倾向于降低对蛋白水解性降解的敏感性。
包含亲水的残基通常在生理状态下提高URP在水或水性介质中的溶解性。由于其氨基酸组成,URP序列具有低的在水性制剂中形成聚集体的倾向,且URP序列与其它生物活性多肽或肽的融合倾向于增强它们的溶解性并降低它们形成聚集体的倾向,这是降低免疫原性的独立机制。
URP序列可以设计为避免特定的赋予生物活性多肽不需要的特性的氨基酸。例如,可以设计URP序列包含很少或不包含以下氨基酸:半胱氨酸(避免二硫键形成和氧化)、甲硫氨酸(避免氧化)、天冬酰胺和谷氨酰胺(避免脱酰胺作用)。
富含甘氨酸的URP:
在一个实施方式中,所述URP包含富含甘氨酸的序列(GRS)。例如,可以主要存在甘氨酸以使得它是目标序列中存在的最普遍的残基。在另一实例中,URP序列可以设计为甘氨酸残基占总氨基酸的至少大约30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%。URP也可以包含100%甘氨酸。在再另一实例中,URP包含至少30%甘氨酸且色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸和异亮氨酸的总浓度低于20%。在再另一实例中,URP包含至少40%甘氨酸且色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸和异亮氨酸的总浓度低于10%。在仍再另一实例中,URP包含至少大约50%甘氨酸且色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸和异亮氨酸的总浓度低于5%。
GRS的长度可以在大约5氨基酸至200氨基酸或更多之间变化。例如,单个的连续GRS的长度可以包含5、10、15、20、25、30、35、40、45、50、55、60、70、80、90、100、120、140、160、180、200、240、280、320或400或者更多的氨基酸。GRS可以在两端包含甘氨酸残基。
GRS也可以具有相当含量的其它氨基酸,例如Ser、Thr、Ala或Pro。GRS可以包含相当部分的带负电的氨基酸,包括但不限于Asp和Glu。GRS可以包含相当部分的带正电的氨基酸,包括但不限于Arg或Lys。在需要的情况下,URP可以设计为仅包含单一类型的氨基酸(即,Gly或Glu),有时仅少数类型的氨基酸,例如2-5种类型的氨基酸(例如,选自G、E、D、S、T、A和P),与通常由20种氨基酸中的大多数构成的典型蛋白质和典型连接体相反。URP可以在30、25、20、15、12、10、9、8、7、6、5、4、3、2或1%的氨基酸位置包含带负电的残基(Asp、Glu)。
通常,包含所述GRS的URP具有大约30、40、50、60、70、80、90、100或更多连续氨基酸。当并入生物活性多肽中时,URP可以发生断裂从而所得到的修饰多肽包含多个URP或多个URP片段。这些单独的URP序列的部分或全部可以短于40个氨基酸,只要所得到的多肽中的所有URP序列的组合长度是至少30个氨基酸。优选,所得到的多肽具有超过40、50、60、70、80、90、100或更多氨基酸的URP序列组合长度。
部分地由于含甘氨酸的肽的构象自由度提高,包含GRS的URP特别受到关注。在溶液中变性的肽具有高水平的构象自由度。该构象自由度大多在所述肽与靶标(如受体、抗体或蛋白酶)结合时丧失。这种熵的丧失需要通过肽与其靶标之间相互作用的能量抵消。变性肽的构象自由度水平于其氨基酸序列。包含许多具有小侧链的氨基酸组成的肽倾向于具有比由具有较大侧链的氨基酸组成的肽更高的构象自由度。甘氨酸氨基酸的肽具有特别大的自由度。据估计,含甘氨酸的肽键在溶液中具有与相应的含丙氨酸的序列相比大约3.4倍高的熵(D′Aquino,J.A.等(1996)Proteins,25:143-56)。这一系数随着序列中甘氨酸残基的数目提高。结果,这种肽倾向于在结合靶标时丧失更多的熵,这降低它们与其它蛋白质相互作用的整体能力以及它们采取确定的三维结构的能力。甘氨酸-肽键的大的构象灵活性也在分析蛋白质结构的拉马钱德兰图(Ramachandran plot)时得到证明,其中甘氨酸肽键占据其它肽键很少占据的区域(Venkatachalam,C.M.,等(1969)AnnuRev Biochem,38:45-82)。Stites等研究了来自61个非同源的高分辨率晶体结构的12,320残基的数据库以确定各20个氨基酸的phi,psi构象偏好(conformational preference)。观察到的蛋白质天然状态的分布假定也反映变性状态中发现的分布。该分布用于估计各残基能面,从而允许计算各残基相对于甘氨酸的相对构象熵。在最极端的情况中,甘氨酸被脯氨酸取代,构象熵变化将在20℃以-0.82+/-0.08kcal/mol相对于变性状态稳定天然状态(Stites,W.E.等(1995)Proteins,22:132)。这些观察现象确认了甘氨酸在20种天然氨基酸中的特殊地位。
在设计所述URP时,可以使用天然或非天然序列。例如,包含高甘氨酸含量的天然序列的宿主提供在表4、表5、表6和表7中。本领域技术人员可以采用任一序列作为URP,或改变该序列以获得预想的性能。在关心对于宿主对象的免疫原性时,优选基于源自该宿主的富含甘氨酸的序列设计含GRS的URR。优选的含GRS的URP是来自与标准人蛋白质中的相应富含甘氨酸的序列共有实质同源性的人蛋白质或序列的序列。
表4.包含富含甘氨酸的序列的蛋白质的结构分析
| PDB文件 | 蛋白质功能 | 富含甘氨酸的序列 |
| 1K3V | 猪细小病毒衣壳 | sgggggggggrgagg |
| 1FPV | 猫全白细胞减少病毒 | tgsgngsgggggggsgg |
| 1IJS | CpV株D,突变体A300d | tgsgngsgggggggsgg |
| 1MVM | Mvm(株I)病毒 | ggsggggsgggg |
表5:编码300或更多甘氨酸残基的GRS的可译框架
Gly GRS长 基因长
登记号 生物机 (%) 度 度 预测功能
NP_974499 拟南芥(Arabidopsis 64 509 579 未知
thaliana)
ZP_0045807 Burkholderia 66 373 51 8 推定的脂蛋白
7cenocopacia
XP_477841 水稻(Oryza sativa) 74 371 422 未知
NP_910409 水稻 75 368 400 推定的细胞壁前
体
NP_610660 果蝇(Drosophila 66 322 610 转座元件
melanogaster)
表6.人GRS的例子
Gly GRS长 基因
登记号 (%) 度 长度 疏水性 预测功能
NP_000217 62 135 622 是 角蛋白9
TBP-相关因子15
NP_631961 61 73 592 是 同种型1
NP_476429 65 70 629 是 角蛋白3
兜甲蛋白(loricrin),
NP_000418 70 66 316 是 胞外被膜
NP_056932 60 66 638 是 细胞角蛋白2
表7.人GRS的另外例子
登记号 序列 氨基酸
数目
NP_006228 GPGGGGGPGGGGGPGGGGPGGGGGGGPGGGG 37
GGPGGG
NP_787059 GAGGGGGGGGGGGGGSGGGGGGGGAGAGGAG 33
AG
NP_009060 GGGSGSGGAGGGSGGGSGSGGGGGGAGGGGG 32
G
NP_031393 GDGGGAGGGGGGGGSGGGGSGGGGGGG 27
NP_005850 GSGSGSGGGGGGGGGGGGSGGGGGG 25
NP_061856 GGGRGGRGGGRGGGGRGGGRGGG 22
NP_787059 GAGGGGGGGGGGGGGSGGGGGGGGAGAGGAG 33
AG
NP_009060 GGGSGSGGAGGGSGGGSGSGGGGGGAGGGGG 32
G
NP_031393 GDGGGAGGGGGGGGSGGGGSGGGGGGG 27
NP_115818 GSGGSGGSGGGPGPGPGGGGG 21
XP_376532 GEGGGGGGEGGGAGGGSG 18
NP_065104 GGGGGGGGDGGG 12
GGGSGSGGAGGGSGGGSGSGGGGGGAGGGGGGSSGGGSGTAGG
HSG
POU结构域,4类,转录因子1[人类]
GPGGGGGPGGGGGPGGGGPGGGGGGGPGGGGGGPGGG
YEATS结构域含2[人类]
GGSGAGGGGGGGGGGGSGSGGGGSTGGGGGTAGGG
富含AT相互作用结构域1B(SWI 1-样)同种型3;BRG1-结合蛋白ELD/OSA1;Eld(眼睑)/Osa蛋白[人类]
GAGGGGGGGGGGGGGSGGGGGGGGAGAGGAGAG
富含AT相互作用结构域1B(SWI 1-样)同种型2;BRG 1-结合蛋白ELD/OSA1;Eld(眼睑)/Osa蛋白[人类]
GAGGGGGGGGGGGGGSGGGGGGGGAGAGGAGAG
富含AT相互作用结构域1B(SWI1-样)同种型1;BRG 1-结合蛋白ELD/OSA1;Eld(眼睑)/Osa蛋白[人类]
GAGGGGGGGGGGGGGSGGGGGGGGAGAGGAGAG
富含嘌呤的转座元件结合蛋白A;富含嘌呤的单链DNA-结合蛋白α;转录激活物蛋白PUR-α[人类]
GHPGSGSGSGGGGGGGGGGGGSGGGGGGAPGG
调节因子X1;反式作用调节因子1;增强因子C;MHC II类调节因子RFX[人类]
GGGGSGGGGGGGGGGGGGGSGSTGGGGSGAG
白血病中破坏的含“溴”结构域蛋白[人类]
GGRGRGGRGRGSRGRGGGGTRGRGRGRGGRG
未知蛋白[人类]
GSGGSGGSGGGPGPGPGGGGGPSGSGSGPG
预测:假定蛋白XP 059256[人类]
GGGGGGGGGGGRGGGGRGGGRGGGGEGGG
锌指蛋白281;ZNP-99转录因子[人类]
GGGGTGSSGGSGSGGGGSGGGGGGGSSG
RNA结合蛋白(自身抗原性,hnRNP-与致死黄色相关)短的同种型;RNA-结合蛋白(自身抗原性);RNA-结合蛋白(自身抗原性,hnRNP-与致死黄色相关)[人类]
GDGGGAGGGGGGGGSGGGGSGGGGGGG
信号识别颗粒68kDa[人类]
GGGGGGGSGGGGGSGGGGSGGGRGAGG
KIAA0265蛋白[人类]
GGGAAGAGGGGSGAGGGSGGSGGRGTG
锯齿同系物(engrailed homolog)2;Engrailed-2[人类]
GAGGGRGGGAGGEGGASGAEGGGGAGG
RNA结合蛋白(自身抗原性,hnRNP-与致死黄色相关)长的同种型;RNA-结合蛋白(自身抗原性);RNA-结合蛋白(自身抗原性,hnRNP-与致死黄色相关)[人类]
GDGGGAGGGGGGGGSGGGGSGGGGGGG
雄激素受体;二氢睾酮受体[人类]
GGGGGGGGGGGGGGGGGGGGGGGEAG
同源异形框(homeo box)D 11;同源异形框4F;Hox-4.6,小鼠,同源物;同源异形框蛋白Hox-D11[人类]
GGGGGGSAGGGSSGGGPGGGGGGAGG
卷曲(frizzled)8;卷曲(果蝇)同源物8[人类]
GGGGGPGGGGGGGPGGGGGPGGGGG
眼发育相关基因[人类]
GRGGAGSGGAGSGAAGGTGSSGGGG
同源异形框B3;同源异形框2G;同源异形框蛋白Hox-B3[人类]
GGGGGGGGGGGSGGSGGGGGGGGGG
染色体2可译框架29[人类]
GGSGGGRGGASGPGSGSGGPGGPAG
DKFZP564F0522蛋白[人类]
GGHHGDRGGGRGGRGGRGGRGGRAG
预测:类似于同源异形框偶数-遗漏(even-skipped)同源物蛋白2(EVX-2)[人类]
GSRGGGGGGGGGGGGGGGGAGAGGG
ras同源基因家族,成员U;Ryu GTP酶;Wnt-1反应性Cdc42同源物;2310026M05Rik;GTP-结合蛋白样1;CDC42-样GTP酶[人类]
GGRGGRGPGEPGGRGRAGGAEGRG
划痕(scratch)2蛋白;转录阻遏物划痕2;划痕(果蝇同源物)2,锌指蛋白[人类]
GGGGGDAGGSGDAGGAGGRAGRAG
核仁蛋白家族A,成员1;GAR1蛋白[人类]
GGGRGGRGGGRGGGGRGGGRGGG
角蛋白1;角蛋白-1;细胞角蛋白1;毛发α蛋白[人类]
GGSGGGGGGSSGGRGSGGGSSGG
假定蛋白FLJ31413[人类]
GSGPGTGGGGSGSGGGGGGSGGG
one cut结构域,家族成员2;onecut 2[人类]
GARGGGSGGGGGGGGGGGGGGPG
POU结构域,3类,转录因子2[人类]
GGGGGGGGGGGGGGGGGGGGGDG
预测:类似于THO复合物亚基4(Tho4)(RNA和输出因子结合蛋白1)(REF1-I)(AML-1和LEF-1的等位)(Aly/REF)[人类]
GGTRGGTRGGTRGGDRGRGRGAG
预测:类似于THO复合物亚基4(Tho4)(RNA和输出因子结合蛋白1)(REF 1-I)(AML-1和LEF-1的等位)(Aly/REF)[人类]
GGTRGGTRGGTRGGDRGRGRGAG
POU结构域,3类,转录因子3[人类]
GAGGGGGGGGGGGGGGAGGGGGG
核仁蛋白家族A,成员1;GAR1蛋白[人类]
GGGRGGRGGGRGGGGRGGGRGGG
纤维蛋白;34-kD核仁硬皮病抗原;RNA,U3小核仁相互作用蛋白1[人类]
GRGRGGGGGGGGGGGGGRGGGG
锌指蛋白579[人类]
GRGRGRGRGRGRGRGRGRGGAG
钙蛋白酶(calpain),小亚基1;钙激活中性蛋白酶;钙蛋白酶,小多肽;钙蛋白酶4,小亚基(30K);钙依赖性蛋白酶,小亚基[人类]
GAGGGGGGGGGGGGGGGGGGGG
角蛋白9[人类]
GGGSGGGHSGGSGGGHSGGSGG
叉头框(forkhead box)D1;叉头相关激活剂4;叉头,果蝇,同源物-样8;叉头(果蝇)-样8[人类]
GAGAGGGGGGGGAGGGGSAGSG
预测:类似于RIKEN cDNA C230094B 15[人类]
GGPGTGSGGGGAGTGGGAGGPG
GGGGGGGGGAGGAGGAGSAGGG
钙粘蛋白(cadherin)22前体;大鼠PB-钙粘蛋白的直系同源物[人类]
GGDGGGSAGGGAGGGSGGGAG
AT-结合转录因子1;AT基序结合因子1[人类]
GGGGGGSGGGGGGGGGGGGGG
eomesodermin;t box,脑,2;eomesodermin(爪蟾)同源物[人类]
GPGAGAGSGAGGSSGGGGGPG
磷脂酰肌醇转移蛋白,膜关联2;PYK2N-末端结构域-相互作用受体3;视网膜变性B α2(果蝇)[人类]
GGGGGGGGGGGSSGGGGSSGG
精子相关抗原8同种型2;精子膜蛋白1[人类]
GSGSGPGPGSGPGSGPGHGSG
预测:RNA结合基序蛋白27[人类]
GPGPGPGPGPGPGPGPGPGPG
AP1γ亚基结合蛋白1同种型1;γ-synergin;接头-相关蛋白复合物1γ亚基-结合蛋白1[人类]
GAGSGGGGAAGAGAGSAGGGG
AP1γ亚基结合蛋白1同种型2;γ-synergin;接头-相关蛋白复合物1γ亚基-结合蛋白1[人类]
GAGSGGGGAAGAGAGSAGGGG
锚蛋白重复序列和不育α基序结构域含1;锚蛋白重复序列和SAM结构域含1[人类]
GGGGGGGSGGGGGGSGGGGGG
甲基-CpG结合域蛋白2同种型1[人类]
GRGRGRGRGRGRGRGRGRGRG
三重功能域(PTPRF相互作用)[人类]
GGGGGGGSGGSGGGGGSGGGG
叉头框D3[人类]
GGEEGGASGGGPGAGSGSAGG
精子相关抗原8同种型1;精子膜蛋白1[人类]
GSGSGPGPGSGPGSGPGHGSG
甲基-CpG结合域蛋白2睾丸特异性同种型[人类]
GRGRGRGRGRGRGRGRGRGRG
细胞死亡调节剂aven;程序化细胞死亡12[人类]
GGGGGGGGDGGGRRGRGRGRG
无义转录物调节剂1;δ解螺旋酶;up-frameshift突变1同源物(啤酒酵母);无义mRNA抑制因子(reducing factor)1;酵母Upf1p同源物[人类]
GGPGGPGGGGAGGPGGAGAG
小电导钙激活钾通道蛋白2同种型a;蜂毒明肽敏感小电导钙激活钾通道[人类]
GTGGGGSTGGGGGGGGSGHG
SRY(性别决定区Y)-box 1;SRY-相关HMG-box基因1[人类]
GPAGAGGGGGGGGGGGGGGG
转录因子20同种型2;溶基质蛋白(stromelysin)-1血小板源生长因子-反应元件结合蛋白;溶基质蛋白1PDGF-反应性转座元件-结合蛋白;SPRE-结合蛋白;核因子SPBP[人类]
GGTGGSSGSSGSGSGGGRRG
转录因子20同种型1;溶基质蛋白-1血小板源生长因子-反应元件结合蛋白;溶基质蛋白1PDGF-反应性转座元件-结合蛋白;SPRE-结合蛋白;核因子SPBP[人类]
GGTGGSSGSSGSGSGGGRRG
Ras-相互作用蛋白1[人类]
GSGTGTTGSSGAGGPGTPGG
BMP-2诱导激酶同种型b[人类]
GGSGGGAAGGGAGGAGAGAG
BMP-2诱导激酶同种型a[人类]
GGSGGGAAGGGAGGAGAGAG
叉头框C1;叉头-相关激活剂3;叉头,果蝇,同系物-样7;叉头(果蝇)-样7;虹膜角膜发育不良(iridogoniodysgenesis)1型[人类]
GSSGGGGGGAGAAGGAGGAG
剪接因子p54;富含精氨酸54kDa核蛋白[人类]
GPGPSGGPGGGGGGGGGGGG
v-maf肌腱膜纤维肉瘤癌基因同源物;鸟肌腱膜纤维肉瘤(MAF)原癌基因;v-maf肌腱膜纤维肉瘤(鸟)癌基因同源物[人类]
GGGGGGGGGGGGGGAAGAGG
小的核核糖核蛋白D1多肽16kDa;snRNP核蛋白D1;Sm-D自身抗原;小的核核糖核蛋白D1多肽(16kD)[人类]
GRGRGRGRGRGRGRGRGRGG
假定蛋白H41[人类]
GSAGGSSGAAGAAGGGAGAG
包含非甘氨酸残基(NGR)的URP:
可以选择这些GRS中非甘氨酸残基的序列以优化URP的性能并因此优化包含该希望的URP的生物活性多肽的性能。例如,可以优化URP的序列以增加所得到的修饰多肽对特定组织、特定的细胞类型或细胞系的选择性。例如,可以并入不是广泛表达而是在一个或多个身体组织(包括心脏、肝脏、前列腺、肺、肾、骨髓、血液、皮肤、膀胱、脑、肌肉、神经和所选择的被疾病影响的组织,所述疾病如感染疾病、自身免疫性疾病、肾、神经元、心脏障碍和癌症)中差异表达的蛋白质序列。可以采用代表特定发育起源的序列,如在多细胞有机体的外胚层、内胚层或中胚层形成中在胚胎和成体中表达的那些。可以利用参与特定生物学过程的序列,包括但不限于细胞周期调节、细胞分化、细胞凋亡、趋化性、细胞分化运动和细胞骨架重排。也可以利用其它非广泛表达的蛋白质序列经指引所得到的蛋白质到特定的亚细胞位置:细胞外基质、细胞核、胞质、细胞骨架、原生质和/或细胞内膜状结构,其包括但不限于有被小窝、高尔基体、内质网、核内体、溶酶体和线粒体。
许多种的这些组织特异性的、细胞类型特异性的、亚细胞位置特异性的序列是已知的且可以从多种蛋白质数据库获得。这种选择性URP序列可以通过产生随机或半随机URP序列库、将它们注入动物或患者体内并确定在组织样品中具有希望的组织选择性的序列而获得。序列测定可以通过质谱进行。可以使用类似方法选择利于口服、口腔、肠、鼻腔、鞘、腹膜、肺、直肠或皮肤吸收的URP序列。
受到特别关注的是包含富含利于细胞摄取或过膜转运的带正电的氨基酸(精氨酸或赖氨酸)的区域的URP序列。URP序列可以设计为包含一个或多个蛋白酶敏感序列。一旦本发明的产物到达其目标位置,这种URP序列就可以进行切割。这一切割可以引发药物活性结构域效能的提高(前药活化)或它可以增强切割产物与受体的结合。URP序列可以设计为通过引入天冬氨酸或谷氨酸残基而携带过量的负电荷。特别受关注的是包含大于5%、大于6%、7%、8%、9%、10%、15%、30%或更多的谷氨酸和低于2%的赖氨酸或精氨酸的URP。这种URP携带过量负电荷且结果它们由于肽的单个负电荷之间的静电排斥而具有采取开放构象的趋势。这种过量负电荷导致它们的流体动力学半径的有效增加并因此它可以导致这类分子肾清除率的降低。因此,可以通过控制带负电的氨基酸在URP序列中的频率和分布来调节URP序列的有效净电荷和流体动力学半径。人或动物中的大多数组织和表面携带过量的负电荷。通过设计URP序列携带过量的负电荷,可以使所得到的包含该URP的修饰多肽与各种表面(如血管、健康组织或各种受体)之间的非特异性相互作用最小化。
URP可以具有(Motif)x形式的重复氨基酸序列,其中序列基序形成同向重复序列(即ABCABCABCABC)或反向重复序列(ABCCBAABCCBA)且这些重复序列的数目可以是2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、26、28、30、35、40、50或更多。URP或URP中的重复序列通常仅包含1、2、3、4、5或6种不同类型的氨基酸。URP通常由4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、22、24、26、28、30、32、34、36或更多的氨基酸长的人氨基酸序列的重复序列组成,但URP也可以由20、22、24、26、28、30、32、34、36、38、40、42、44、46、48、50个氨基酸长的非人氨基酸序列组成。
源自人序列的UR:
URP可以源自人序列。人类基因组包含许多的富含一种特定氨基酸的子序列。受到特别关注的是富含亲水氨基酸(如丝氨酸、苏氨酸、谷氨酸、天冬氨酸或甘氨酸)的这种氨基酸序列。受到特别关注的是包含很少疏水氨基酸的这种子序列。这种子序列预计是未结构化的和在水溶液中高度可溶的。这种人子序列可以改变以进一步提高其功效。例如,牙本质涎磷蛋白包含670-氨基酸的子序列,其中64%的残基是丝氨酸且大多数其它位置是亲水氨基酸如天冬氨酸、天冬酰胺和谷氨酸。该序列是极端重复的且结果它具有低信息含量。可以直接利用这种人蛋白质的子序列。在需要的情况下,可以以保护其整体特性的方式改变序列,但这使得它更适合于药物应用。与牙本质涎磷蛋白相关的序列的例子是(SSD)n、(SSDSSN)n、(SSE)n,其中n是大约4-200。
来自人蛋白质的序列特别希望用于设计在人类受试者中具有较低免疫原性的URP。引发对外源蛋白质的免疫应答的关键步骤是由MHC II类受体呈递所述蛋白质的肽片段。这些MHC II-结合片段然后可以通过T细胞受体检测,这引发辅助T细胞的增殖并启动免疫应答。从药物蛋白质消除T细胞表位已被公认为是降低引发免疫反应的风险的手段(Stickler,M.等(2003)JImmunol Methods,281:95-108)。MHC II受体通常与具有例如呈现的肽的9-氨基酸的长区域的肽表位相互作用。因此,如果蛋白质的所有或大多数可能的9聚体子序列可以在人蛋白质中找到,如此则这些序列和这些序列的重复序列将不被患者识别为外源序列,因而可以降低在患者中引发对蛋白质免疫应答的风险。可以通过寡聚或连接具有合适的氨基酸组成的人序列将人序列引入URP序列的设计中。这可以是同向重复序列或反向重复序列或不同重复序列的混合。例如,可以寡聚表5中所示的序列。这些寡聚物具有降低的免疫原性风险。但是,单体单元之间的联合序列可能仍然包含可以触发免疫反应的T细胞表位。可以通过设计基于多个重叠的人序列的URP序列进一步降低引发免疫应答的风险。URP序列可以设计为基于多个人序列的寡聚物,从而寡聚物的各9聚体子序列可以在人蛋白质中找到。在这些设计中,每一个9-聚体子序列是人序列。例如,URP序列可以基于三个人序列。有可能设计基于单个人序列的URP序列从而低聚URP序列中所有可能的9聚体子序列在相同的人蛋白质中出现。非低聚URP序列也可以基于人蛋白质设计。主要的是所有9聚体子序列可以在人序列中找到。序列的氨基酸组成优选包含很少的疏水性残基。特别关注的是基于人序列设计的且包含大部分的甘氨酸残基的URP序列。
利用这一或类似的方案,可以设计一类包含具有对目标宿主的低免疫原性的重复序列的URP。目标宿主可以是任何动物,包括脊椎动物和无脊椎动物。优选的宿主中哺乳动物如灵长类(例如黑猩猩和人)、鲸目动物(例如鲸鱼和海豚)、翼手目动物(例如蝙蝠)、奇蹄目动物(例如马和犀牛)、啮齿目动物(例如大鼠)和特别种类的食虫目动物如鼩鼱、鼹鼠和刺猬。在选择人作为的情况中,URP通常包含重复序列或单元的多个副本,其中包含大约6-大约15个连续氨基酸的大多数片段存在于一个或多个天然人蛋白质中。也可以设计其中大约5-大约15个连续氨基酸的大多数片段在一个或多个天然人蛋白质中发现的URP。如本文中使用的,大多数片段指超过大约50%,优选60%,优选70%,优选80%,优选90%,优选100%。在需要的情况下重复单元内大约6-15氨基酸,优选大约9-15氨基酸的各可能的片段存在于一个或多个天然人蛋白质中。URP可以包含多个重复单元或序列,例如具有2、3、4、5、6、7、8、9、10或更多重复单元。
基本不含人T细胞表位的URP的设计:
URP序列可以设计为基本不含被人T细胞识别的表位。例如,可以合成一系列具有利于变性的非结构化构象的氨基酸组成的半随机序列,并评估这些序列中人T细胞表位的存在和是否它们是人序列。已经描述了用于人T细胞表位的分析方法(Stickler,M.等(2003)JImmunol Methods,281:95-108)。特别关注的是可以寡聚化而不产生T细胞表位或非人序列的肽序列。这或以通过测试这些序列的同向重复序列中T细胞表位的存在和非人的6-15-聚体,特别是9-聚体子序列的存在而实现。替代方式是评估可以组装成如前面章节中描述的重复单元的多个肽序列的人序列组装。另一替代方式是设计使用表位预测算法如TEPITOPE设计产生低得分的URP序列(Sturniolo,T.等(1999)Nat Biotechnol,17:555-61)。避免T细胞表位的另一途径是避免可以在MHC中的肽展示过程中用作锚着残基的氨基酸,如M、I、L、V、F。疏水氨基酸和带正电的氨基酸可以经常用作这种锚着残基,因而使它们在URP序列中的频率最小化减小了产生T细胞表位的机会并因此消除了免疫反应。所选择的URP通常包含在至少一个人蛋白质中发现的子序列并具有较低含量的疏水氨基酸。
URP序列可以设计为优化蛋白质产生。这可以通过避免或最小化编码DNA的重复性实现。URP序列如聚甘氨酸可以具有非常需要的药用特性,但它们的制备由于编码GRS的DNA序列的高GC-含量和由于可能导致重组的重复DNA序列的存在而可能非常困难。
如上面说到的,URP序列可以设计为在氨基酸水平高度重复的。结果URP序列具有非常低的信息含量且可以降低引发免疫反应的风险。
包含重复氨基酸的URP的非限制性的例子是:聚甘氨酸、聚谷氨酸、聚天冬氨酸、聚丝氨酸、聚苏氨酸、(GX)n其中G是甘氨酸和X是丝氨酸、天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少20、(GGX)n其中X是丝氨酸、天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少13、(GGGX)n其中X是丝氨酸、天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少10、(GGGGX)n其中X是丝氨酸、天冬氨酸、谷氨酸、苏氨酸或脯氨酸且n是至少8、(GzX)n其中X是丝氨酸、天冬氨酸、谷氨酸、苏氨酸或脯氨酸,n是至少15,且z是1-20。
这些重复序列的数目可以是10和100之间的任何数目。本发明的产物可以包含作为半随机序列的URP序列。例子是包含至少30、40、50、60或70%的甘氨酸的半随机序列,其中甘氨酸良好分散且其中色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸和异亮氨酸组合的总浓度低于70、60、50、40、30、20或10%。优选的半随机URP序列馀至少40%的甘氨酸且色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸的异亮氨酸的总浓度低于10%。更优选的随机URP序列包含至少50%的甘氨酸且色氨酸、苯丙氨酸、酪氨酸、缬氨酸、亮氨酸和异亮氨酸总浓度低于5%。URP序列可以通过组合或更多较短的URP序列或URP序列的片段的序列进行设计。这种组合使得能够更好地调节包含该URP序列的产物的药用性能并且它允许降低编码该URP序列的DNA序列的重复性,这可以改善表达并减少URP编码序列的重组。
可以设计和选择URP序列以具有几种以下性能:a)编码序列在生产宿主中的高遗传稳定性,b)高水平的表达,c)低的(预测/计算)免疫原性,d)在血清蛋白酶和/或其它组织蛋白酶存在的情况下的高稳定性,e)在生理状态下的大流体动力学半径。获得符合多个标准的URP序列的一个示例性途径是构建候选序列的文库和从该文库鉴别合适的子序列。文库可以包含随机和/或半随机序列。特别有用的是密码子库,其是包含用于同一氨基酸残基的多个密码子的DNA分子库。密码子随机化可应用于所选择的特定类型的氨基酸位置或应用于大多数或所有位置。真密码子库仅编码单一氨基酸序列,但它们可以轻易地与氨基酸库组合,其是在相同残基位置编码(相关或不相关)氨基酸的混合的DNA分子群。密码子库允许鉴别在DNA水平具有相对低重复性但编码高度重复的氨基酸序列的基因。这是有利的,因为重复DNA序列倾向于重组,从而导致不稳定性。也可以构建编码有限的氨基酸多样性的密码子库。这些库允许在序列的某些位置引入有限数目的氨基酸而其它位置允许密码子变异,但所有密码子编码相同的氨基酸。可以通过在寡核苷酸合成过程中加入核苷酸混合物而合成部分随机寡核苷酸。这种部分随机寡核苷酸可以通过重叠PCR或基于连接的途径进行融合。特别地,可以多聚化富含甘氨酸的序列的半随机寡核苷酸。这些寡核苷酸可以在长度和序列及密码子选择上不同。结果,获得了候选URP序列的库。产生库的另一方法是合成启动序列并随后使所述序列部分随机化。这可以通过在增变株中培养编码URP序列的基因或通过在诱变条件下扩增编码基因完成(Leung,D.等(1989)Technique,1:11-15)。具有需要的性能的URP序列可以使用多种方法从库中鉴别。具有高度遗传稳定性的序列可以通过在生产宿主中培养该库而富集。不稳定的序列将累积突变,这可以通过DNA测序鉴别。可以以高水平表达的URP序列变异体可以通过使用本领域技术人员已知的多种方案进行筛选或选择而鉴别。例如,可以培养来自文库的多个分离物并比较表达水平。表达水平可以通过凝胶分析、分析型色谱或各种基于ELISA的方法测量。通过将候选URP序列的库与序列标签(如myc-标签、His-标签、HA-标签)融合可以帮助单个序列变异体表达水平的确定。另一途径是将该库与酶或其它报道蛋白(如绿色荧光蛋白)融合。特别关注的是库与选择性标志物如β-内酰胺酶或卡那霉素-酰基转移酶的融合。可以使用抗生素选择富集具有高水平表达和良好的遗传稳定性的变异体。具有良好蛋白酶抗性的变异体可以在与蛋白酶一起孵育后筛选完整序列而鉴别。鉴别蛋白酶抗性URP序列的有效途径是细菌噬菌体展示或相关展示方法。已经描述了其中可发生快速蛋白水解的序列可以通过噬菌体展示富集的多种系统。这些方法可以轻易地用于富集蛋白酶抗性序列。例如可以克隆候选URP序列的库到亲和标签和M13噬菌体的pIII蛋白之间。该库然后可以暴露于蛋白酶或含蛋白酶的生物样品如血液或溶酶体制剂。包含蛋白酶抗性序列的噬菌体可以在蛋白酶处理后通过结合亲和标签捕获。对抗溶酶体制剂降解的序列受到特别关注,因为溶酶体降解是在枝状细胞和其它抗原呈递细胞中的抗原呈递过程中的关键步骤。噬菌体展示可用于鉴别不结合特定免疫血清的候选URP序列以鉴别具有低免疫原性的URP序列。可以用候选URP序列或URP序列的库免疫动物以产生抗库中的URP序列的抗体。所得到的血清然后可以用于噬菌体淘筛以除去或鉴别被所得到的免疫血清中的抗体识别的序列。其它方法如细菌展示、酵母展示、核糖体展示可以用于鉴别具有需要的选择性的URP序列变异体另一途径是通过质谱鉴别目标URP序列。例如,可以与蛋白酶或感兴趣的生物样品一起孵育候选URP序列的库并通过质谱鉴别抗降解的序列。在类似的途径中可以鉴别利于口服吸收的URP序列。可以将候选URP序列的混合物供给动物或人并通过质谱鉴别具有最高的跨某些组织屏障(即,皮肤等)转移或吸收的效率的变异体。以类似的方式,可以鉴别利于其它吸收机制的URP序列,如肺、鼻内、直肠、透皮递送。也可以鉴别利于细胞摄取的URP序列或抵抗细胞摄取的URP序列。
URP序列可以通过组合按上述任何方法设计的URP序列或URP序列的片段进行设计。另外,可应用半随机方法以优化基于上述规则设计的序列。特别关注的是以改善增强多肽的表达为目的的密码子优化并改善编码基因在产生宿主中的遗传稳定性。密码子优化对于富含甘氨酸或具有非常重复的氨基酸序列的URP序列是特别重要的。密码子优化可以使用计算机程序进行(Gustafsson,C.等(2004)TrendsBiotechnol,22:346-53),其中一些使核糖体中止(ribosomal pausing)最小化(Coda Genomics Inc.)。在设计URP序列时,可以考虑多种性能。可以使编码DNA序列中的重复性最小化。另外,可以避免或最小化生产宿主很少使用的密码子选择(即大肠杆菌中的AGG和AGA精氨酸密码子和一种亮氨酸密码子)。具有高水平甘氨酸的DNA序列倾向于具有可导致不稳定性或低表达水平的高GC含量。因此,当可能时,优选选择密码子以使得URP-编码序列的GC-含量适合用于产生该URP的生产宿主。
URP编码基因可以以一个或多个步骤产生,或者完全合成或者通过与酶过程(如限制性酶-介导的克隆、PCR和重叠延伸)组合的合成。URP附加多肽可以构建以使得URP附加多肽-编码基因具有低重复性而编码的氨基酸序列具有高水平的重复性,作为第一步骤,可以构建相对短URP序列的库。这可以是纯密码子库以使得各库成员具有相同的氨基酸序列,但许多不同的编码序列是可能的。为利于鉴别良好表达的库成员,可以构建作为与报道蛋白的融合的库。合适的报道基因的例子是绿色荧光蛋白、荧光素酶、碱性磷酸酶、β-半乳糖苷酶。通过筛选,可以鉴别可在选择的宿主生物体中以高浓度表达的短URP序列。随后,可以产生随机URP二聚体的库并重复高水平表达的筛选。可以通过接合、重叠延伸或类似的克隆技术进行二聚化。这一二聚化过程和随后的筛选可以重复多次直到所得到的URP序列达到希望的长度。任选地,可以测序库中的克隆以消除包含不需要的序列的分离物。短URP序列的初始库可以允许氨基酸序列中的某些变异。例如,可以随机化某些密码子以使得多种亲水氨基酸可以存在于所述位置。在重复多聚化过程中,除了筛选高水平表达外,可以筛选库成员的其它特性如溶解性或蛋白酶抗性。可以产生更长的多聚体而不是二聚化URP序列。这允许更快地增加URP附加多肽的长度。
许多URP序列以高比例包含特定氨基酸。这种序列可能难以通过重组技术产生,因为它们的编码基因可以包含发生重组的重复序列。另外,以非常高的频率包含特定密码子的基因可能限制表达,因为在生产宿主中加载的tRNA受到限制。例子是重组产生GRS。甘氨酸残基通过4种三联体(GGG、GGC、GGA和GGT)编码。结果,编码GRS的基因倾向于具有高GC-含量并倾向于是特别重复性的。另外的难题可能由生产宿主的密码子偏倚性(codon bias)引起。在大肠杆菌的情况中,两种甘氨酸密码子GGA和GGG很少用于高表达的蛋白质。因此编码URP序列的基因的密码子优化可能是非常需要的。可以通过采用考虑生产宿主的密码子偏倚性的计算机程序优化密码子选择(Gustafsson,C.等(2004)Trends Biotechnol,22:346-53)。作为替代方式,可以构建其中所有库成员编码相同的氨基酸序列但其中密码子选择发生变化的密码子库。这些库可以筛选高表达的和遗传稳定的成员,其特别适合含URP的产物的大规模生产。
多价未结构化的重组蛋白质(MURPs):
如上所述,所述URP可特别用作用于修饰生物活性多肽的附加多肽。因此,本发明提供包含一个或多个所述URP的蛋白质。这种蛋白质在本文中称为多价的未结构化的重组蛋白质(MURP)。
为构建MURP,一个或多个URP序列可与蛋白质的N-末端或C-末端融合或插入蛋白质的中间,例如插入蛋白质环中或在目标生物活性多肽的模块之间,以赋予所得到的修饰多肽相对于未修饰蛋白质改善的性能。与蛋白质连接的URP序列的组合长度可以是40、50、60、70、80、90、100、150、200或更多氨基酸。
所述MURP表现出一个或多个下面详细描述的改善性能。
改善的半衰期:
向生物活性多肽加上URP序列可以改善该蛋白质的许多性能。特别地,加入长URP序列可以显著提高蛋白质的血清半衰期。这种URP通常包含至少大约40、50、60、70、80、90、100、150、200或更多氨基酸的氨基酸序列。
URP可以断裂从而得到的蛋白质包含多个URP或多个URP片段这些单独的URP序列的部分或全部可以短于40个氨基酸,只要得到的蛋白质中所有URP序列的组合长度是至少30个氨基酸。优选得到的蛋白质具有超过40、50、60、70、80、90、100、150、200或更多氨基酸的URP序列组合长度。在一个方面中,融合的URPS可以提高蛋白质的流体动力学半径并因此减少其通过肾脏从血液清除。所得到的融合蛋白质相对于未修饰蛋白质的流体动力学半径的提高可以通过超速离心、尺寸排阻色谱法或光散射检测。
改善的组织选择性:
提高流体动力学半径也可以导致降低对组织的渗透,这可以用于使生物活性多肽的副作用最小化。已经很好地证明,亲水聚合物具有在肿瘤组织中选择性地累积的倾向,这是由渗透和保留(EPR)效应增强引起的。EPR效应的基本原因是肿瘤脉管系统的渗漏特性(McDonald,D.M.等(2002)Cancer Res,62:5381-5)的在肿瘤组织中缺乏淋巴引流。因此,生物活性多肽对肿瘤组织的选择性可以通过添加亲水聚合物增强。如此,给定生物活性多肽的治疗指数可以通过引入所述URPS提高。
降解的保持和降低的免疫原性:
添加URP序列可以显著改善蛋白质的蛋白酶抗性。URP序列本身可以设计为蛋白酶抗性的且通过连接它们到蛋白质可以屏障该蛋白质不被降解酶接触。URP序列可以加到生物活性多肽中以减少蛋白质与其它受体或表面的不希望的相互作用。为达到这一目的,可能有利的是将URP序列加到生物活性多肽上形成不希望的接触的蛋白质位点的附近。特别地,可以添加URP序列到生物活性多肽上以减少它们与免疫系统的任何成分的相互作用而防止对本发明的产物的免疫应答。添加URP序列到生物活性多肽上可以减少与预先存在的抗体或B-细胞受体的相互作用。另外,添加URP序列可以降低抗原呈递细胞对本发明的产物的吸收和加工。添加一个或多个URP序列到蛋白质旧降低免疫原性的优选方式,因为它在许多物种中抑制免疫应答,从而允许基于动物数据预测产物在患者体内的预期免疫原性。免疫原性的这种物种无关性测试对于基于人T细胞表位的鉴别和清除或与人序列的序列比较的途径是不可能的。
T细胞表位的中断:
URP序列可以引入蛋白质中以中断T细胞表位。这特别可用于组合多个单独的功能模块的蛋白质。T细胞表位的形成需要蛋白质抗原的肽片段结合MHC。MHC分子与呈递的肽的通常9个连续残基的氨基酸短片段相互作用。蛋白质分子中不同结合模块的直接融合可以导致跨两个邻近结构域的T细胞表位。通过用URP附加多肽分隔功能模块阻止这种跨模块T细胞表位的产生。URP序列插入功能模块之间也可能干扰抗原呈递细胞中的蛋白水解处理,其导致免疫原性的进一步降低。
改善的溶解性:
蛋白质的功能模块可以具有有限的溶解性。特别地,结合模块倾向于在它们的表面上携带疏水性残基,这可能限制它们的溶解性并导致聚集。通过用URP附加多肽间隔或侧邻这种功能模块可以改善所得到的产物的整体溶解性。携带相当百分比的亲水或带电的残基的URP附加多肽尤其是如此。通过用可溶性URP模块分隔功能模块可以减少这些功能模块之间的分子内相互作用。
改善的pH特征和产物电荷的均匀性:
URP序列可以设计为携带过量的负或正电荷。结果它们赋予任何融合伴体静电场,这可以用于改变酶的pH特征或结合相互作用。另外,带电的URP序列的静电场可以提高蛋白质产物表面电荷的pKa值的均匀性,这导致配体相互作用的锐化pH特征和通过等电聚焦或色谱聚焦的锐化分离。
由于更尖锐的产物pKa而改善的纯化性能:
溶液中各氨基酸本身具有单一的固定pKa,其是的功能团一半质子化时的pH。在典型的蛋白质中,具有许多类型的残基且由于接近和蛋白质喘息效应(breathing effects),它们也以可变的方式改变彼此的有效pKa。由于这一原因,在大范围的pH条件下,由于大量的带电的和中性的氨基酸残基的组合,典型蛋白质可采取数百种不同离子化的种类,各具有不同的分子量和有效净电荷。这称作广泛离子化谱(broad ionization spectrum)并使得这种蛋白质的分析(例如通过质谱)和纯化更加困难。
PEG是不带电的且不影响基所连接的蛋白质的离子化谱。但是,具有高含量的Gly和Glu的URP原则上仅存在于两种状态中:当pH低于谷氨酸的pKa时的中性(-COOH)状态和当pH高于谷氨酸的pKa时的带负电的(-COO-)状态。URP附加多肽可以形成单一的均匀离子化的分子类型并在质谱中产生单一质量。
在需要的情况下,MURP可以表达为与具有以恒定间隔分布在整个URP附加多肽中的单一类型电荷(Glu)的URP的融合体。可以选择每20kD URP加入25-50个Glu残基且所有这25-50个残基具有非常类似的pKa。
另外,向小蛋白质如IFN、hGH或GCSF(仅具有20个带电的残基)添加25-50个负电荷提高了产物的电荷均匀性并锐化其等电点,其非常接近于游离谷氨酸的pKa。
蛋白质群的电荷均匀性的提高在如离子交换、等电聚焦、质谱等方面与传统PEG化相比具有有利的加工特性。
生物活性多肽
可以连接附加多肽的合适的多肽包括所有在体外或体内使用时表现出对给定靶标的结合特异性或另一种希望的生物学特性的生物活性多肽。特别地,任何具有或诊断价值的蛋白质可以通过附加多肽修饰。特别关注的是希望对特定性能如血清半衰期或体内清除率进行改变的多肽。这种改变可以在应用的环境中预想到,例如如果希望延长施用的蛋白质治疗药物的半衰期。用附加多肽进行修饰也可以显示在诊断应用中的用途,例如减少诊断蛋白质或成像剂与其它分子的非特异性结合。
生物活性多肽可以包括,但不限于细胞因子趋化因子、淋巴因子、配体、受体、激素、酶、抗体和抗体片段及生长因子。受体的例子包括TNF I型受体、IL-1受体II型、IL-1受体拮抗剂、IL-4受体和任何化学或遗传修饰的可溶性受体。酶的例子包括活化的蛋白质C、因子VII、胶原酶(例如,由Advance Biofactures Corporation以Santyl的名称销售);阿加糖酶-β(例如,由Genzyme以Fabrazyme的名称销售);链球菌DNA酶-α(例如,由Genentech以Pulmozyme的名称销售);阿替普酶(例如,由Genentech以Activase的名称销售);PEG化天冬酰胺酶(例如,由Enzon以Oncaspar的名称销售);天冬酰胺酶(例如,由Merck以Elspar的名称销售)和伊不、米苷酶(imiglucerase)(例如,由Genzyme以Ceredase的名称销售)。特定多肽或蛋白质的例子包括,但不限于粒细胞巨噬细胞集落刺激因子(GM-CSF)、粒细胞集落刺激因子(G-CSF)、巨噬细胞集落刺激因子(M-CSF)、集落刺激因子(CSF)、干扰素β(IFN-β)、干扰素γ(IFN-γ)、干扰素γ诱导因子I(IGIF)、转化生长因子β(TGF-β)、RANTES(调节激活正常T细胞表达和推测分泌)、巨噬细胞炎性蛋白质(例如,MIP-1-和MIP-1-β)、利什曼延长启动因子(Leishmania elongation initiating factor)(LEIF)、血小板源转化生长因子(PDGF)、肿瘤坏死因子(TNF)、生长因子如表皮转化生长因子(EGF)、血管内皮转化生长因子(VEGF)、成纤维细胞生长因子(FGF)、神经生长因子(NGF)、脑源性神经营养因子(BDNF)、神经营养因子-2(NT-2)、神经营养因子-3(NT-3)、神经营养因子-4(NT-4)、神经营养因子-5(NT-5)、源自神经胶质细胞系的神经营养因子(GDNF)、睫状神经营养因子(CNTF)、TNFII型受体、红细胞生成素(EPO)、胰岛素和可溶性糖蛋白如gpl20和gpl60糖蛋白。gpl20糖蛋白是人类免疫缺陷病毒(HIV)包膜蛋白质和gpl60糖蛋白是gpl20糖蛋白的已知前体。
举例来说,下面是适合于按照本发明的修饰的生物活性多肽的几个例子。
在一个实施方式中,生物活性多肽是GLP-1。GLP-1是目前正作为可能的糖尿病治疗途径进行研究的大约30个氨基酸的多肽。GLP-1抑制胰高血糖素释放并增加胰岛素释放。对GLP-1的两种反应都导致葡萄糖血清浓度降低。GLP-1在体内迅速被二肽基肽酶-4切割并因此具有极短的血清半衰期,~2min。GLP-1成功开发为治疗蛋白质需要配制以增加血清半衰期和蛋白质的递送。这一例子描述了基于rPEG(L288)的rPEG-GLP-1融合蛋白质的制备及其在聚合物基质中的包封以增加GLP-1用于治疗用途的半衰期。
在另一个实施方式中,生物活性多肽是奈西立肽(nesiritide),人B-型利钠肽(hBNP)。奈西立肽可以使用重组DNA技术在大肠杆菌中制备。在特定的实施方式中,奈西立肽由32个氨基酸序列组成,分子量为3464g/mol。
在再另一实施方式中,生物活性多肽是促胰液素,其是由与天然发生的27个氨基酸猪促胰液素相同的氨基酸序列构成的肽激素。在静脉内推注施用0.4mcg/kg的未修饰多肽后,合成的人促胰液素浓度在90-120分钟内迅速上升到基础分泌水平。合成人促胰液素(未用附加多肽修饰)的消除半衰期大约是45分钟。
在替代实施方式中,生物活性多肽是恩夫韦地(enfuvirtide),一种线性的36-氨基酸合成多肽,其是HIV-1与CD4+细胞融合的拮抗剂。
在另外的实施方式中,生物活性多肽是比伐卢定(bivalirudin),一种特异性的和可逆性的直接凝血酶抑制剂。更特别的实施方式提供为合成的20个氨基酸的肽(分子量1280道尔顿)的生物活性多肽。
可选择地,抗血友病因子(AHF)可以选择为生物活性多肽。AHF是易于在遗传工程化的中国仓鼠卵巢(CHO)细胞系中合成的糖蛋白。其也称为HEMOFIL MTM AHF(Baxter)或抗血友病因子(人)[AHF(人)]。HEMOFIL MTM AHF的平均体内半衰期已知是14.7±5.1小时(n=61)。
在另一个实施方式中,红细胞生成素是生物活性多肽。红细胞生成素是通过重组DNA技术制备的并具有与内源红细胞生成素相同的生物效应的165个氨基酸的糖蛋白。在特定的实施方式中,红细胞生成素具有30,400道尔顿的分子量并由已经引入人红细胞生成素基因的哺乳动物细胞产生。产物可以包含与分离的天然红细胞生成素相同的氨基酸序列。在患有慢性肾衰竭的成人或小儿患者中,未修饰血浆红细胞生成素在静脉内施用后的清除半衰期已知是在4-13小时的范围内。
在又另一实施方式中,生物活性多肽是瑞替普酶(Reteplase)。瑞替普酶是组织纤维蛋白溶酶原激活剂(tPA)的非糖基化的缺失突变蛋白,包含kringle 2和人tPA的蛋白酶结构域。瑞替普酶包含天然tPA的527个氨基酸中的355个(氨基酸1-3和176-527)。多肽可以通过重组DNA技术在大肠杆菌中产生并可以作为无活性的包含体从大肠杆菌中分离,通过体外折叠过程转化成其活性形式并通过色谱分离纯化。未修饰瑞替普酶的分子量是39,571道尔顿,基于溶栓活性的测量,未修饰瑞替普酶的有效半衰期已知是大约15分钟。
进一步的实施方式提供作为阿那白滞素(Anakirna)-人白介素-1受体拮抗剂(IL-IRa)的重组的、非糖基化的形式-的生物活性多肽。在一种情况中,阿那白滞素由153个氨基酸组成并具有17.3千道尔顿的分子量。它可以通过重组DNA技术使用大肠杆菌细菌表达系统产生。未修饰阿那白滞素的体内半衰期已知是在4-6小时的范围内。
贝卡普勒明(becaplermin)也可以选择为生物活性多肽。贝卡谱勒明是用于局部施用的重组人血小板源生长因子(rhPDGF-BB)。贝卡谱勒明可以利用重组DNA技术通过将血小板源生长因子(PDGF)B链的基因插入酵母菌株酿酒酵母(Saccharomyces cerevisiae)产生。贝卡谱勒明的一种形式具有大约25kD的分子量且是由通过二硫键结合在一起的两个相同多肽链构成的同型二聚体。
生物活性多肽可以是奥普瑞白介素(Oprelvekin),其是通过重组DNA技术在大肠杆菌(E.Coli)中产生的白介素11(IL-11)的重组体形式。在一个实施方式中,选择的生物活性多肽具有大约19,000道尔顿的分子量,且是非糖基化的。多肽长度是177氨基酸且与天然IL-11的178个氨基酸长度不同在于缺乏氨基末端脯氨酸残基,这已知不会导致体外或体内生物活性的可测量的差异。未修饰奥普瑞白介素的末端半衰期已知是大约7hrs。
再另一实施方式提供为胰高血糖素-与增加血液葡萄糖并松弛胃肠道的平滑肌的人胰高血糖素相同的多肽激素-的生物活性多肽。胰高血糖素可以在通过加入胰高血糖素基因遗传改变的特殊的大肠杆菌非病原性实验室菌株中合成。在特定的实施方式中,胰高血糖素是包含29个氨基酸残基并具有3,483的分子量的单链多肽。体内半衰期已知是短的,在8-18分钟的范围内。
G-CSF也可以选择为生物活性多肽。重组粒细胞集落刺激因子或G-CSF按照各种化疗方法使用以刺激白细胞的恢复。报告的重组G-CSF的半衰期仅为3.5小时。
可选择地,生物活性多肽可以是干扰素α(IFNα)。化学地PEG修饰的干扰素-α2a批准临床用于治疗丙型肝炎。这种PEG化的蛋白质需要每周注射因而具有较长半衰期的缓释制剂是理想的。
可以用附加多肽修饰的或生物活性多肽可能靶向的另外的细胞蛋白是VEGF、VEGF-R1、VEGF-R2、VEGF-R3、Her-1、Her-2、Her-3、EGF-1、EGF-2、EGF-3、A3、cMet、ICOS、CD40L、LFA-1、c-Met、ICOS、LFA-1、IL-6、B7.1、B7.2、OX40、IL-1b、TACI、IgE、BAFF或Blys、TPO-R、CD19、CD20、CD22、CD33、CD28、IL-1-R1、TNFα、TRAIL-R1、补体受体1、FGFa、骨桥蛋白(Osteopontin)、玻璃粘连蛋白(Vitronectin)、Ephrin A1-A5、Ephrin B1-B3、α-2-巨球蛋白、CCL1、CCL2、CCL3、CCL4、CCL5、CCL6、CCL7、CXCL8、CXCL9、CXCL10、CXCL11、CXCL12、CCL13、CCL14、CCL15、CXCL16、CCL16、CCL17、CCL18、CCL19、CCL20、CCL21、CCL22、PDGF、TGFb、GMCSF、SCF、p40(IL12/IL23)、IL1b、IL1a、IL1ra、IL2、IL3、IL4、IL5、IL6、IL8、IL10、IL 12、IL15、IL23、Fas、FasL、Flt3配体、41BB、ACE、ACE-2、KGF、FGF-7、SCF、神经突起生长导向因子(Netrin)1,2、IFNa,b,g、半胱氨酸蛋白酶(Caspase)2,3,7,8,10、ADAMS 1,S5,8,9,15,TS1,TS5;脂肪细胞因子(Adiponectin)、ALCAM、ALK-1、APRIL、膜联蛋白(Annexin)V、血管生成素、双调蛋白(Amphiregulin)、促血管生成素(Angiopoietin)1,2,4、B7-1/CD80、B7-2/CD86、B7-H1、B7-H2、B7-H3、Bcl-2、BACE-1、BAK、BCAM、BDNF、bNGF、bECGF、BMP2,3,4,5,6,7,8;CRP、钙粘蛋白6,8,11;组织蛋白酶A,B,C,D,E,L,S,V,X;CD11a/LFA-1、LFA-3、GP2b3a、GH受体、RSVF蛋白质、IL-23(p40,p19)、IL-12、CD80、CD86、CD28、CTLA-4,α4β1,α4β7、TNF/淋巴毒素、IgE、CD3、CD20、IL-6、IL-6R、BLYS/BAFF、IL-2R、HER2、EGFR、CD33、CD52、地高辛、Rho(D)、水痘、肝炎、CMV、破伤风、牛痘、抗蛇毒素、肉毒杆菌、Trail-R1、Trail-R2、cMet、TNF-R家族如LA NGF-R、CD27、CD30、CD40、CD95、淋巴毒素a/b受体、Wsl-1、TL1A/TNFSF15、BAFF、BAFF-R/TNFRSF13C、TRAIL R2/TNFRSF10B、TRAILR2/TNFRSF10B、Fas/TNFRSF6 CD27/TNFRSF7、DR3/TNFRSF25、HVEM/TNFRSF14、TROY/TNFRSF19、CD40配体/TNFSF5、BCMA/TNFRSF17、CD30/TNFRSF8、LIGHT/TNFSF14、4-1BB/TNFRSF9、CD40/TNFRSF5、GITR/TNFRSF18、骨保护素/TNFRSF11B、RANK/TNFRSF11A、TRAIL R3/TNFRSF10C、TRAIL/TNFSF10、TRANCE/RANK L/TNFSF11、4-1BB 配体/TNFSF9、TWEAK/TNFSF12、CD40配体/TNFSF5、Fas配体/TNFSF6、RELT/TNFRSF19L、APRIL/TNFSF13、DcR3/TNFRSF6B、TNF RI/TNFRSF1A、TRAIL R1/TNFRSF10A、TRAIL R4/TNFRSF10D、CD30配体/TNFSF8、GITR 配体/TNFSF18、TNFSF18、TACI/TNFRSF13B、NGF R/TNFRSF16、OX40配体/TNFSF4、TRAILR2/TNFRSF10B、TRAIL R3/TNFRSF10C、TWEAK R/TNFRSF12、BAFF/BLyS/TNFSF13、DR6/TNFRSF21、TNF-α/TNFSF1A、原-TNF-α/TNFSF1A、淋巴毒素βR/TNFRSF3、淋巴毒素βR(LTbR)/Fc嵌合体、TNF RI/TNFRSF1A、TNF-β/TNFSF1B、PGRP-S、TNFRI/TNFRSF1A、TNF RII/TNFRSF1B、EDA-A2、TNF-α/TNFSF1A、EDAR、XEDAR、TNFRI/TNFRSF1A。
特别关注的是可以以纯化的形式商业获得的人目标蛋白质以及结合这些目标蛋白质的蛋白质。例子是:4EBP1、14-3-3ζ、53BP1、2B4/SLAMF4、CCL21/6Ckine、4-1BB/TNFRSF9、8D6A、4-1BB配体/TNFSF9、8-氧代-dG、4-氨基-1,8-naphthalimide、A2B5、氨肽酶LRAP/ERAP2,A33、氨肽酶N/ANPEP,Aag、氨肽酶P2/XPNPEP2,ABCG2、氨肽酶P1/XPNPEP1,ACE、氨肽酶PILS/ARTS1,ACE-2、无羊膜(Amnionless)、肌动蛋白、双调蛋白、β-肌动蛋白、AMPK α1/2、激活素(Activin)A、AMPKα1、激活素AB、AMPKα2、激活素B、AMPKβ1、激活素C、AMPKβ2、激活素RIA/ALK-2、雄激素R/NR3C4、激活素RIB/ALK-4、血管生成素、激活素RIIA、促血管生成素-1、激活素RIIB、促血管生成素-2、ADAM8、促血管生成素-3、ADAM9、促血管生成素-4、ADAM10、促血管生成素-样1、ADAM12、促血管生成素-样2、ADAM15、促血管生成素-样3、TACE/ADAM17、促血管生成素-样4、ADAM19、促血管生成素-样7/CDT6、ADAM33、血管增生抑制素(Angiostatin)、ADAMTS4、膜联蛋白A 1/膜联蛋白I、ADAMTS5、膜联蛋白A7、ADAMTS1、膜联蛋白A10、ADAMTSL-1/Punctin、膜联蛋白V、脂肪细胞因子/Acrp30、ANP、AEBSF、AP位点、聚集蛋白聚糖(Aggrecan)、APAF-1、集聚蛋白(Agrin)、APC、AgRP、APE、AGTR-2、APJ、AIF、APLP-1、Akt、APLP-2、Akt1、载脂蛋白AI、Akt2、载脂蛋白B、Akt3、APP、血清白蛋白、APRIL/TNFSF13、ALCAM、ARC、ALK-1、Artemin、ALK-7、芳基硫酸酯酶(Arylsulfatase)A/ARSA、碱性磷酸酶、ASAH2/N-酰基鞘氨醇酰胺水解酶(acylsphingosineAmidohydrolase)-2、α2u-球蛋白、ASC、α-1-酸糖蛋白、ASGR1、α-胎蛋白、ASK1、ALS、ATM、成釉细胞、ATRIP、AMICA/JAML、Aurora A、AMIGO、Aurora B、AMIGO2、Axin-1、AMIGO3、Axl、酰化氨基酸水解酶/ACY 1、天青杀素(Azurocidin)/CAP37/HBP、氨肽酶A/ENPEP、B4GALT1、BIM、B7-1/CD80、6-生物素-17-NAD、B7-2/CD86、BLAME/SLAMF8、B7-H1/PD-L1、CXCL13/BLC/BCA-1、B7-H2、BLIMP1、B7-H3、Blk、B7-H4、BMI-1、BACE-1、BMP-1/PCP、BACE-2、BMP-2、Bad、BMP-3、BAFF/TNFSF 13B、BMP-3b/GDF-10、BAFF R/TNFRSF13C、BMP-4、Bag-1、BMP-5、BAK、BMP-6、BAMBI/NMA、BMP-7、BARD1、BMP-8、Bax、BMP-9、BCAM、BMP-10、Bcl-10、BMP-15/GDF-9B、Bcl-2、BMPR-IA/ALK-3、Bcl-2相关蛋白A1、BMPR-IB/ALK-6、Bcl-w、BMPR-II、Bcl-x、BNIP3L、Bcl-xL、BOC、BCMA/TNFRSF17、BOK、BDNF、BPDE、苯甲酰胺(Benzamide)、Brachyury、共同β链、B-Raf、βIG-H3、CXCL14/BRAK、β动物纤维素(Bcellulin)、BRCA1、β-防御素(Defensin)2、BRCA2、BID、BTLA、双糖链蛋白多糖(Biglycan)、Bub-1、Bik-样杀手蛋白质、c-jun、CD90/Thy1、c-Rel、CD94、CCL6/C10、CD97、C1q R1/CD93、CD151、C1qTNF1、CD160、C1qTNF4、CD163、C1qTNF5、CD164、补体成分C1r、CD200、补体成分C1s、CD200R1、补体成分C2、CD229/SLAMF3、补体成分C3a、CD23/FcεRII、补体成分C3d、CD2F-10/SLAMF9、补体成分C5a、CD5L、钙粘蛋白-4/R-钙粘蛋白、CD69、钙粘蛋白-6、CDC2、钙粘蛋白-8、CDC25A、钙粘蛋白-11、CDC25B、钙粘蛋白-12、CDCP1、钙粘蛋白-13、CDO、钙粘蛋白-17、CDX4、E-钙粘蛋白、CEACAM-1/CD66a、N-钙粘蛋白、CEACAM-6、P-钙粘蛋白、Cerberus 1、VE-钙粘蛋白、CFTR、钙结合蛋白D、cGMP、钙依赖磷酸酶(Calcineurin)A、Chem R23、钙依赖磷酸酶B、凯莫瑞(Chemerin)、钙网蛋白-2、趋化因子采样包(chemokine sampler pack)、CaM激酶II、几丁质酶3-样1、cAMP、壳三糖酶/CHIT1、大麻素R1、Chk1、大麻素R2/CB2/CNR2、Chk2、CAR/NR1I3、CHL-1/L1CAM-2、碳酸酐酶I、胆碱乙酰基转移酶/ChAT、碳酸酐酶II、软骨凝集蛋白(Chondrolectin)、碳酸酐酶III、腱蛋白(Chordin)、碳酸酐酶IV、腱蛋白-样1、碳酸酐酶VA、腱蛋白-样2、碳酸酐酶VB、CINC-1、碳酸酐酶VI、CINC-2、碳酸酐酶VII、CINC-3、碳酸酐酶VIII、Claspin、碳酸酐酶IX、紧密连接蛋白(Claudin)-6、碳酸酐酶X、CLC、碳酸酐酶XII、CLEC-1、碳酸酐酶XIII、CLEC-2、碳酸酐酶XIV、CLECSF13/CLEC4F、羧甲基赖氨酸、CLECSF8、羧肽酶A1/CPA1、CLF-1、羧肽酶A2、CL-P1/COLEC12、羧肽酶A4、丛生蛋白(Clusterin)、羧肽酶B1、丛生蛋白-样1、羧肽酶E/CPE、CMG-2、羧肽酶X1、CMV UL146、心脏营养素(Cardiotrophin)-1、CMVUL147、肌肽二肽酶(Carnosine Dipeptidase)1、CNP、Caronte、CNTF、CART、CNTF Rα、半胱氨酸蛋白酶、凝血因子II/凝血酶、半胱氨酸蛋白酶-1、凝血因子III/组织因子、半胱氨酸蛋白酶-2、凝血因子VII、半胱氨酸蛋白酶-3、凝血因子X、半胱氨酸蛋白酶-4、凝血因子XI、半胱氨酸蛋白酶-6、凝血因子XIV/蛋白质C、半胱氨酸蛋白酶-7、COCO、半胱氨酸蛋白酶-8、粘合素、半胱氨酸蛋白酶-9、胶原蛋白I、半胱氨酸蛋白酶-10、胶原蛋白II、半胱氨酸蛋白酶-12、胶原蛋白IV、半胱氨酸蛋白酶-13、共同γ链/IL-2Rγ、半胱氨酸蛋白酶肽抑制剂、COMP/凝血酶致敏蛋白-5、过氧化氢酶(Catalase)、补体成分C1rLP、β-连环蛋白、补体成分C1qA、组织蛋白酶1、补体成分C1qC、组织蛋白酶3、补体因子D、组织蛋白酶6、补体因子I、组织蛋白酶A、补体MASP3、组织蛋白酶B、联接蛋白43、组织蛋白酶C/DPPI、接触蛋白-1、组织蛋白酶D、接触蛋白-2/TAG1、组织蛋白酶E、接触蛋白-4、组织蛋白酶F、接触蛋白-5、组织蛋白酶H、Corin、组织蛋白酶L、Cornulin、组织蛋白酶O、CORS26/C1qTNF,3、组织蛋白酶S、大鼠皮层干细胞、组织蛋白酶V、考的索、组织蛋白酶X/Z/P、COUP-TF I/NR2F1、CBP、COUP-TFII/NR2F2、CCI、COX-1、CCK-A R、COX-2、CCL28、CRACC/SLAMF7、CCR1、C-反应蛋白质、CCR2、肌酸激酶、肌肉/CKMM、CCR3、肌氨酸酐、CCR4、CREB、CCR5、CREG、CCR6、CRELD1、CCR7、CRELD2、CCR8、CRHBP、CCR9、CRHR-1、CCR10、CRIM1、CD155/PVR、Cripto、CD2、CRISP-2、CD3、CRISP-3、CD4、无横脉(Crossveinless)-2、CD4+/45RA-、CRTAM、CD4+/45RO-、CRTH-2、CD4+/CD62L-/CD44、CRY1、CD4+/CD62L+/CD44、隐含的(Cryptic)、CD5、CSB/ERCC6、CD6、CCL27/CTACK、CD8、CTGF/CCN2、CD8+/45RA-、CTLA-4、CD8+/45RO-、Cubilin、CD9、CX3CR1、CD14、CXADR、CD27/TNFRSF7、CXCL16、CD27配体/TNFSF7、CXCR3、CD28、CXCR4、CD30/TNFRSF8、CXCR5、CD30配体/TNFSF8、CXCR6、CD31/PECAM-1、亲环蛋白A、CD34、Cyr61/CCN1、CD36/SR-B3、半胱氨酸蛋白酶抑制剂(Cystatin)A、CD38、半胱氨酸蛋白酶抑制剂B、CD40/TNFRSF5、半胱氨酸蛋白酶抑制剂C、CD40配体/TNFSF5、半胱氨酸蛋白酶抑制剂D、CD43、半胱氨酸蛋白酶抑制剂E/M、CD44、半胱氨酸蛋白酶抑制剂F、CD45、半胱氨酸蛋白酶抑制剂H、CD46、半胱氨酸蛋白酶抑制剂H2、CD47、半胱氨酸蛋白酶抑制剂S、CD48/SLAMF2、半胱氨酸蛋白酶抑制剂SA、CD55/DAF、半胱氨酸蛋白酶抑制剂SN、CD58/LFA-3、细胞色素c、CD59、脱血红素细胞色素(Apocytochrome)c、CD68、全细胞色素(Holocytochrome)c、CD72、细胞角蛋白8、CD74、细胞角蛋白14、CD83、细胞角蛋白19、CD84/SLAMF5、Cytonin、D6、DISP1、DAN、Dkk-1、DANCE、Dkk-2、DARPP-32、Dkk-3、DAX1/NR0B1、Dkk-4、DCC、DLEC、DCIR/CLEC4A、DLL1、DCAR、DLL4、DcR3/TNFRSF6B、d-荧光素、DC-SIGN、DNA连接酶IV、DC-SIGNR/CD299、DNA聚合酶β、DcTRAIL R1/TNFRSF23、DNAM-1、DcTRAIL R2/TNFRSF22、DNA-PKcs、DDR1、DNER、DDR2、多巴脱羧酶/DDC、DEC-205、DPCR-1、Decapentaplegic、DPP6、核心蛋白聚糖(Decorin)、DPPA4、Dectin-1/CLEC7A、DPPA5/ESG1、Dectin-2/CLEC6A、DPPII/QPP/DPP7、DEP-1/CD148、DPPIV/CD26、沙漠刺猬(DesertHedgehog)、DR3/TNFRSF25、肌间线蛋白、DR6/TNFRSF21、桥粒核心糖蛋白(Desmoglein)-1、DSCAM、桥粒核心糖蛋白-2、DSCAM-L1、桥粒核心糖蛋白-3、DSPG3、蓬乱蛋白-1、Dtk、蓬乱蛋白-3、发动蛋白(Dynamin)、EAR2/NR2F6、EphA5、ECE-1、EphA6、ECE-2、EphA7、ECF-L/CHI3L3、EphA8、ECM-1、EphB1、Ecotin、EphB2、EDA、EphB3、EDA-A2、EphB4、EDAR、EphB6、EDG-1、Ephrin、EDG-5、Ephrin-A1、EDG-8、Ephrin-A2、eEF-2、Ephrin-A3、EGF、Ephrin-A4、EGF R、Ephrin-A5、EGR1、Ephrin-B、EG-VEGF/PK 1、Ephrin-B1、eIF2α、Ephrin-B2、eIF4E、Ephrin-B3、Elk-1、Epigen、EMAP-II、表皮形态发生素(Epimorphin)/突触融合蛋白(Syntaxin)2、EMMPRIN/CD147、表皮调节素(Epiregulin)、CXCL5/ENA、EPR-1/Xa受体、Endocan、ErbB2、内皮因子(Endoglin)/CD105、ErbB3、四聚糖(Endoglycan)、ErbB4、核酸内切酶III、ERCC1、核酸内切酶IV、ERCC3、核酸内切酶V、ERK1/ERK2、核酸内切酶VIII、ERK1、Endorepellin/基底膜蛋白多糖(Perlecan)、ERK2、内皮抑素(Endostatin)、ERK3、内皮缩血管肽-1、ERK5/BMK1、Engrailed-2、ERRα/NR3B1、EN-RAGE、ERRβ/NR3B2、肠肽酶/肠激酶、ERRγ/NR3B3、CCL11/嗜酸细胞活化趋化因子(Eotaxin)、红细胞生成素,CCL24/嗜酸细胞活化趋因子-2、红细胞生成素R、CCL26/嗜酸细胞活化趋因子-3、ESAM、EpCAM/TROP-1、ERα/NR3A1、EPCR、ERβ/NR3A2、Eph、核酸外切酶III、EphA1、Exostosin-样2/EXTL2、EphA2、Exostosin-样3/EXTL3、EphA3、FABP1、FGF-BP、FABP2、FGF R1-4、FABP3、FGF R1、FABP4、FGF R2、FABP5、FGF R3、FABP7、FGF R4、FABP9、FGF R5、补体因子B、Fgr、FADD、FHR5、FAM3A、纤连蛋白、FAM3B、纤维胶凝蛋白(Ficolin)-2、FAM3C、纤维胶凝蛋白-3、FAM3D、FITC、成纤维细胞激活蛋白质α/FAP、FKBP38、Fas/TNFRSF6、Flap、Fas配体/TNFSF6、FLIP、FATP1、FLRG、FATP4、FLRT1、FATP5、FLRT2、Fc γRI/CD64、FLRT3、Fc γRIIB/CD32b、Flt-3、Fc γRIIC/CD32c、Flt-3配体、Fc γRIIA/CD32a、卵泡抑素(Follistatin)、Fc γRIII/CD16、卵泡抑素-样1、FcRH1/IRTA5、FosB/G0S3、FcRH2/IRTA4、FoxD3、FcRH4/IRTA1、FoxJ1、FcRH5/IRTA2、FoxP3、Fc受体-样3/CD16-2、Fpg、FEN-1、FPR1、胎球蛋白A、FPRL1、胎球蛋白B、FPRL2、FGF酸性、CX3CL1/曲动蛋白(Fractalkine)、FGF碱性、卷曲-1、FGF-3、卷曲-2、FGF-4、卷曲-3、FGF-5、卷曲-4、FGF-6、卷曲-5、FGF-8、卷曲-6、FGF-9、卷曲-7、FGF-10、卷曲-8、FGF-11、卷曲-9、FGF-12、Frk、FGF-13、sFRP-1、FGF-16、sFRP-2、FGF-17、sFRP-3、FGF-19、sFRP-4、FGF-20、弗林蛋白酶(Furin)、FGF-21、FXR/NR 1H4、FGF-22、Fyn、FGF-23、G9a/EHMT2、GFRα-3/GDNF Rα-3、GABA-A-R α1、GFR α-4/GDNF R α-4、GABA-A-R α2、GITR/TNFRSF18、GABA-A-R α4、GITR配体/TNFSF18、GABA-A-Rα5、GLI-1、GABA-A-Rα6、GLI-2、GABA-A-Rβ1、GLP/EHMT1、GABA-A-Rβ2、GLP-1R、GABA-A-Rβ3、胰高血糖素、GABA-A-Rγ2、葡糖胺(N-乙酰基)-6-硫酸酯酶/GNS、GABA-B-R2、GluR1、GAD1/GAD67、GluR2/3、GAD2/GAD65、GluR2、GADD45α、GluR3、GADD45β、Glut1、GADD45γ、Glut2、半乳凝素(Galectin)-1、Glut3、半乳凝素-2、Glut4、半乳凝素-3、Glut5、半乳凝素-3BP、谷氧还蛋白(Glutaredoxin)1、半乳凝素-4、甘氨酸R、半乳凝素-7、血型糖蛋白A、半乳凝素-8、磷脂酰肌醇蛋白聚糖(Glypican)2、半乳凝素-9、磷脂酰肌醇蛋白聚糖3、GalNAc4S-6ST、磷脂酰肌醇蛋白聚糖5、GAP-43、磷脂酰肌醇蛋白聚糖6、GAPDH、GM-CSF、Gas1、GM-CSF Rα、Gas6、GMF-β、GASP-1/WFIKKNRP、gpl30、GASP-2/WFIKKN、糖原磷酸化酶BB/GPBB、GATA-1、GPR15、GATA-2、GPR39、GATA-3、GPVI、GATA-4、GR/NR3C1、GATA-5、Gr-1/Ly-6G、GATA-6、粒溶素(Granulysin)、GBL、颗粒酶A、GCNF/NR6A1、颗粒酶B、CXCL6/GCP-2、颗粒酶D、G-CSF、颗粒酶G、G-CSF R、颗粒酶H、GDF-1、GRASP、GDF-3 GRB2、GDF-5、Gremlin、GDF-6、GRO、GDF-7、CXCL 1/GRO α、GDF-8、CXCL2/GROβ、GDF-9、CXCL3/GROγ、GDF-11、生长激素、GDF-15、生长激素R、GDNF、GRP75/HSPA9B、GFAP、GSK-3α/β、GFI-1、GSK-3α、GFR α-1/GDNF Rα-1、GSK-3β、GFRα-2/GDNF Rα-2、EZFIT、H2AX、组氨酸、H60、HM74A、HAI-1、HMGA2、HAI-2、HMGB1、HAI-2A、TCF-2/HNF-1β、HAI-2B、HNF-3β/FoxA2、HAND1、HNF-4α/NR2A1、HAPLN1、HNF-4γ/NR2A2、气道胰蛋白酶-样蛋白酶/HAT、HO-1/HMOX1/HSP32、HB-EGF、HO-2/HMOX2、CCL14a/HCC-1、HPRG、CCL14b/HCC-3、Hrk、CCL16/HCC-4、HRP-1、αHCG、HS6ST2、Hck、HSD-1、HCR/CRAM-A/B、HSD-2、HDGF、HSP10/EPF、血红蛋白、HSP27、生肝素(Hepassocin)、HSP60、HES-1、HSP70、HES-4、HSP90、HGF、HTRA/蛋白酶Do、HGF激活剂、HTRA1/PRSS11、HGF R、HTRA2/Omi、HIF-1α、HVEM/TNFRSF14、HIF-2α、透明质烷(Hyaluronan)、HIN-1/Secretoglobulin 3A1、4-羟基壬烯酸(Hydroxynonenal)、Hip、CCL 1/I-309/TCA-3、IL-10、cIAP(泛)、IL-10Rα、cIAP-1/HIAP-2、IL-10Rβ、cIAP-2/HIAP-1、IL-11、IBSP/涎蛋白(Sialoprotein)II、IL-11Rα、ICAM-1/CD54、IL-12、ICAM-2/CD102、IL-12/IL-23p40、ICAM-3/CD50、IL-12Rβ1、ICAM-5、IL-12Rβ2、ICAT、IL-13、ICOS、IL-13Rα1、艾杜糖酸2-硫酸酯酶/IDS、IL-13Rα2、IFN、IL-15、IFN-α、IL-15R α、IFN-α1、IL-16、IFN-α2、IL-17、IFN-α4b、IL-17R、IFN-αA、IL-17RC、IFN-αB2、IL-17RD、IFN-αC、IL-17B、IFN-αD、IL-17B R、IFN-αF、IL-17C、IFN-αG、IL-17D、IFN-αH2、IL-17E、IFN-αI、IL-17F、IFN-αJ1、IL-18/IL-1F4、IFN-αK、IL-18BPa、IFN-αWA、IL-18BPc、IFN-α/βR1、IL-18BPd、IFN-α/βR2、IL-18Rα/IL-1R5、IFN-β、IL-18Rβ/IL-1R7、IFN-γ、IL-19、IFN-γR1、IL-20、IFN-γR2、IL-20Rα、IFN-ω、IL-20Rβ、IgE、IL-21、IGFBP-1、IL-21R、IGFBP-2、IL-22、IGFBP-3、IL-22R、IGFBP-4、IL-22BP、IGFBP-5、IL-23、IGFBP-6、IL-23R、IGFBP-L 1、IL-24、IGFBP-rp1/IGFBP-7、IL-26/AK155、IGFBP-rP 10、IL-27、IGF-I、IL-28A、IGF-I R、IL-28B、IGF-II、IL-29/IFN-λ1、IGF-II R、IL-31、IgG、IL-31RA、IgM、IL-32α、IGSF2、IL-33、IGSF4A/SynCAM、ILT2/CD85j、IGSF4B、ILT3/CD85k、IGSF8、ILT4/CD85d、IgY、ILT5/CD85a、IkB-β、ILT6/CD85e、IKKα、印度刺猬(Indian Hedgehog)、IKKε、INSRR、IKKγ、胰岛素、IL-1α/IL-1F1、胰岛素R/CD220、IL-1β/IL-1F2、胰岛素原、IL-1ra/IL-1F3、胰岛素溶酶(Insulysin)/IDE、IL-1F5/FIL1δ、整联蛋白α2/CD49b、IL-1F6/FIL1ε、整联蛋白α3/CD49c、IL-1F7/FIL1ζ、整联蛋白α3β1/VLA-3、IL-1F8/FIL1η、整联蛋白α4/CD49d、IL-1F9/IL-1H1、整联蛋白α5/CD49e、IL-1F10/IL-1HY2、整联蛋白α5β1、IL-1RI、整联蛋白α6/CD49f、IL-1RII、整联蛋白α7、IL-1R3/IL-1R AcP、整联蛋白α9、IL-1R4/ST2、整联蛋白αE/CD 103、IL-1R6/IL-1R rp2、整联蛋白αL/CD 11a、IL-1R8、整联蛋白αLβ2、IL-1R9、整联蛋白αM/CD11b、IL-2、整联蛋白αMβ2、IL-2Rα、整联蛋白αV/CD51、IL-2Rβ、整联蛋白αVβ5、IL-3、整联蛋白αVβ3、IL-3Rα、整联蛋白αVβ6、IL-3Rβ、整联蛋白αX/CD11c、IL-4、整联蛋白β1/CD29、IL-4R、整联蛋白β2/CD18、IL-5、整联蛋白β3/CD61、IL-5Rα、整联蛋白β5、IL-6、整联蛋白β6、IL-6R、整联蛋白β7、IL-7、CXCL10/IP-10/CRG-2、IL-7Rα/CD127、IRAK1、CXCR1/IL-8RA、IRAK4、CXCR2/IL-8RB、IRS-1、CXCL8/IL-8、胰岛-1、IL-9、CXCL11/I-TAC、IL-9R、Jagged1、JAM-4/IGSF5、Jagged 2、JNK、JAM-A、JNK1/JNK2、JAM-B/VE-JAM、JNK1、JAM-C、JNK2、激肽原、激肽释放酶3/PSA、Kininostatin、激肽释放酶4、KIR/CD158、激肽释放酶5、KIR2DL1、激肽释放酶6/神经脉蛋白(Neurosin)、KIR2DL3、激肽释放酶7、KIR2DL4/CD158d、激肽释放酶8/神经视蛋白(Neuropsin)、KIR2DS4、激肽释放酶9、KIR3DL1、血浆激肽释放酶/KLKB 1、KIR3DL2、激肽释放酶10、Kirrel2、激肽释放酶11、KLF4、激肽释放酶12、KLF5、激肽释放酶13、KLF6、激肽释放酶14、Klotho、激肽释放酶15、Klothoβ、KC、KOR、Keap1、Kremen-1、Kell、Kremen-2、KGF/FGF-7、LAG-3、LINGO-2、LAIR1、Lipin 2、LAIR2、载脂蛋白(Lipocalin)-1、层粘连蛋白α4、载脂蛋白-2/NGAL、层粘连蛋白γ1、5-脂氧合酶、层粘连蛋白I、LXRα/NR1H3、层粘连蛋白S、LXRβ/NR1H2、层粘连蛋白-1、Livin、层粘连蛋白-5、LIX、LAMP、LMIR1/CD300A、胰岛蛋白(Langerin)、LMIR2/CD300c、LAR、LMIR3/CD300LF、Latexin、LMIR5/CD300LB、排卵蛋白(Layilin)、LMIR6/CD300LE、LBP、LMO2、LDL R、LOX-1/SR-E1、LECT2、LRH-1/NR5A2、LEDGF、LRIG1、Lefty、LRIG3、Lefty-1、LRP-1、Lefty-A、LRP-6、豆荚蛋白(Legumain)、LSECtin/CLEC4G、瘦素(Leptin)、内腔蛋白(Lumican)、瘦素R、CXCL15/Lungkine、白三烯B4、XCL1/淋巴细胞趋化因子(Lymphotactin)、白三烯B4R1、淋巴毒素、LIF、淋巴毒素β/TNFSF3、LIF Rα、淋巴毒素βR/TNFRSF3、LIGHT/TNFSF14、Lyn、Limitin、Lyp、LIMPII/SR-B2、赖氨酰氧化酶同源物2、LIN-28、LYVE-1、LINGO-1、α2-巨球蛋白、CXCL9/MIG、MAD2L1、Mimecan、MAdCAM-1、Mindin、MafB、盐皮质激素(Mineralocorticoid)R/NR3C2、MafF、CCL3L1/MIP-1α同种型LD78β、MafG、CCL3/MIP-1α、MafK、CCL4L1/LAG-1、MAG/Siglec-4a、CCL4/MIP-1β、MANF、CCL15/MIP-1δ、MAP2、CCL9/10/MIP-1γ、MAPK、MIP-2、Marapsin/Pancreasin、CCL19/MIP-3β、MARCKS、CCL20/MIP-3α、MARCO、MIP-I、Mash1、MIP-II、母系蛋白(Matrilin)-2、MIP-III、母系蛋白-3、MIS/AMH、母系蛋白-4、MIS RII、蛋白裂解酶(Matriptase)/ST14、MIXL1、MBL、MKK3/MKK6、MBL-2、MKK3、黑皮素(Melanocortin)3R/MC3R、MKK4、MCAM/CD146、MKK6、MCK-2、MKK7、Mcl-1、MKP-3、MCP-6、MLH-1、CCL2/MCP-1、MLK4α、MCP-11、MMP、CCL8/MCP-2、MMP-1、CCL7/MCP-3/MARC、MMP-2、CCL 13/MCP-4、MMP-3、CCL12/MCP-5、MMP-7、M-CSF、MMP-8、M-CSF R、MMP-9、MCV-II型、MMP-10、MD-1、MMP-11、MD-2、MMP-12、CCL22/MDC、MMP-13、MDL-1/CLEC5A、MMP-14、MDM2、MMP-15、MEA-1、MMP-16/MT3-MMP、MEK1/MEK2、MMP-24/MT5-MMP、MEK1、MMP-25/MT6-MMP、MEK2、MMP-26、Melusin、MMR、MEPE、MOG、安眠蛋白(Meprin)α、CCL23/MPIF-1、安眠蛋白β、M-Ras/R-Ras3、Mer、Mre11、间皮素(Mesothelin)、MRP1镍纹蛋白(Meteorin)、MSK1/MSK2、甲硫氨酸氨肽酶1、MSK1、甲硫氨酸氨肽酶、MSK2、甲硫氨酸氨肽酶2、MSP、MFG-E8、MSP R/Ron、MFRP、Mug、MgcRacGAP、MULT-1、MGL2、Musashi-1、MGMT、Musashi-2、MIA、MuSK、MICA、MutY DNA糖基化酶、MICB、MyD88、MICL/CLEC12A、髓过氧物酶、β2微球蛋白、心肌蛋白(Myocardin)、Midkine、肌纤蛋白(Myocilin)、MIF、肌红蛋白、NAIPNGFI-B γ/NR4A3、Nanog、NgR2/NgRH1、CXCL7/NAP-2、NgR3/NgRH2、Nbs1、巢蛋白-1/内动蛋白(Entactin)、NCAM-1/CD56、巢蛋白-2、NCAM-L1、一氧化氮、结合素(Nectin)-1、硝基酪氨酸、结合素-2/CD112、NKG2A、结合素-3、NKG2C、结合素-4、NKG2D、再生蛋白(Neogenin)、NKp30、脑啡肽酶(Neprilysin)/CD10、NKp44、脑啡肽酶-2/MMEL1/MMEL2、NKp46/NCR1、神经巢蛋白(Nestin)、NKp80/KLRF1、NETO2、NKX2.5、神经突起生长导向因子-1、NMDAR、NR1亚基、神经突起生长导向因子-2、NMDA R、NR2A亚基、神经突起生长导向因子-4、NMDA R、NR2B亚基、神经突起生长导向因子-G1a、NMDA R、NR2C亚基、神经突起生长导向因子-G2a、N-Me-6,7-diOH-TIQ、神经调节蛋白(Neuregulin)-1/NRG1、Nodal、神经调节蛋白-3/NRG3、Noggin、神经突蛋白(Neuritin)、Nogo受体、NeuroD1、Nogo-A、神经束蛋白(Neurofascin)、NOMO、神经元素(Neurogenin)-1、Nope、神经元素-2、Norrin、神经元素-3、eNOS、溶神经素、iNOS、后叶激素运载蛋白II、nNOS、神经菌毛素(Neuropilin)-1、Notch-1、神经菌毛素-2、Notch-2、神经生成素(Neuropoietin)、Notch-3、Neurotrimin、Notch-4、神经秩蛋白(Neurturin)、NOV/CCN3、NFAM1、NRAGE、NF-H、NrCAM、NFkB1、NRL、NFkB2、NT-3、NF-L、NT-4、NF-M、NTB-A/SLAMF6、NG2/MCSP、NTH1、NGFR/TNFRSF16、核干细胞因子(Nucleostemin)、β-NGF、Nurr-1/NR4A2、NGFI-Bα/NR4A1、OAS2、食欲素(Orexin)B、OBCAM、OSCAR、OCAM、OSF-2/骨膜蛋白(Periostin)、OCIL/CLEC2d、制瘤素M/OSM、OCILRP2/CLEC2i、OSM Rβ、Oct-3/4、骨活素/GPNMB、OGG1、Osteoadherin、Olig 1,2,3、骨钙素、Olig1、骨织素(Osteocrin)、Olig2、骨桥蛋白、Olig3、骨保护素/TNFRSF11B、少突细胞标志物O1、Otx2,少突细胞标志物O4,OV-6,OMgp,OX40/TNFRSF4,Opticin,OX40配体/TNFSF4,食欲素A,OAS2,食欲素B,OBCAM,OSCAR,OCAM,OSF-2/骨膜蛋白,OCIL/CLEC2d,制瘤素M/OSM,OCILRP2/CLEC2i,OSM R β,Oct-3/4,骨活素/GPNMB,OGG1,Osteoadherin,Olig 1,2,3,骨钙素,Olig1,骨织素,Olig2,骨桥蛋白,Olig3,骨保护素/TNFRSF11B,少突细胞标志物O1、Otx2、少突细胞标志物O4、OV-6、OMgp、OX40/TNFRSF4、旋光蛋白(Opticin)、OX40配体/TNFSF4、食欲素A、RACK1、Ret、Rad1、REV-ERBα/NR1D 1、Rad17、REV-ERB β/NR1D2、Rad51、Rex-1、Rae-1、RGM-A、Rae-1α、RGM-B、Rae-1β、RGM-C、Rae-1δ、Rheb、Rae-1ε、核糖体蛋白质S6、Rae-1γ、RIP1、Raf-1、ROBO1、RAGE、ROBO2、RalA/RalB、ROBO3、RalA、ROBO4、RalB、ROR/NR1F1-3(泛)、RANK/TNFRSF11A、RORα/NR1F1、CCL5/RANTES、RORγ/NR1F3、Rap1A/B、RTK-样孤儿受体1/ROR1、RARα/NR1B1、RTK-样孤儿受体2/ROR2、RAR β/NR1B2、RP105、RARγ/NR1B3、RPA2、Ras、RSK(泛)、RBP4、RSK1/RSK2、RECK、RSK1、Reg 2/PAP、RSK2、Reg I、RSK3、Reg II、RSK4、Reg III、R-脊椎蛋白(Spondin)1、RegIIIa、R-脊椎蛋白2、Reg IV、R-脊椎蛋白3、松弛素-1、RUNX1/CBFA2、松弛素-2、RUNX2/CBFA1、松弛素-3、RUNX3/CBFA3、RELMα、RXRα/NR2B1、RELMβ、RXRβ/NR2B2、RELT/TNFRSF19L、RXRγ/NR2B3、抵抗素、S100A10、SLITRK5、S100A8、SLPI、S100A9、SMAC/Diablo、S100B、Smad1、S100P、Smad2、SALL1、Smad3、δ-Sarcoglycan、Smad4、Sca-1/Ly6、Smad5、SCD-1、Smad7、SCF、Smad8、SCF R/c-kit、SMC1、SCGF、α-平滑肌肌动蛋白、SCL/Tal1、SMUG1、SCP3/SYCP3、Snail、CXCL12/SDF-1、钠钙交换剂1、SDNSF/MCFD2、Soggy-1、α-分泌酶(Secretase)、SonicHedgehog、γ-分泌酶、SorCS1、β-分泌酶、SorCS3、E-选择蛋白、分拣蛋白(Sortilin)、L-选择蛋白、SOST、P-选择蛋白、SOX1、臂板蛋白(Semaphorin)3A、SOX2、臂板蛋白3C、SOX3、臂板蛋白3E、SOX7、臂板蛋白3F、SOX9、臂板蛋白6A、SOX10、臂板蛋白6B、SOX17、臂板蛋白6C、SOX21臂板蛋白6D,SPARC、臂板蛋白7A、SPARC-样1、分离酶(Separase)、SP-D、丝氨酸/苏氨酸磷酸酶底物I、脊骨蛋白(Spinesin)、Serpin A1、F-脊椎蛋白,丝氨酸蛋白酶抑制剂(Serpin)A3、SR-AI/MSR、丝氨酸蛋白酶抑制剂A4/Kallistatin、Src、丝氨酸蛋白酶抑制剂A5/蛋白质C抑制剂、SREC-I/SR-F1、丝氨酸蛋白酶抑制剂A8/血管紧张素原、SREC-II、丝氨酸蛋白酶抑制剂B5、SSEA-1、丝氨酸蛋白酶抑制剂C1/抗凝血酶-III、SSEA-3、丝氨酸蛋白酶抑制剂D1/肝素辅因子II、SSEA-4、丝氨酸蛋白酶抑制剂E1/PAI-1、ST7/LRP12、丝氨酸蛋白酶抑制剂E2、Stabilin-1、丝氨酸蛋白酶抑制剂F1、Stabilin-2、丝氨酸蛋白酶抑制剂F2、锡钙蛋白(Stanniocalcin)1、丝氨酸蛋白酶抑制剂G1/C1抑制剂、锡钙蛋白2、丝氨酸蛋白酶抑制剂I2、STAT1、血清淀粉样蛋白A1、STAT2、SF-1/NR5A1、STAT3、SGK、STAT4、SHBG、STAT5a/b、SHIP、STAT5a、SHP/NR0B2、STAT5b、SHP-1、STAT6、SHP-2、VE-抑制素、SIGIRR、Stella/Dppa3、Siglec-2/CD22、STRO-1、Siglec-3/CD33、P物质、Siglec-5、磺酰胺酶/SGSH、Siglec-6、硫酸酯酶修饰因子1/SUMF1、Siglec-7、硫酸酯酶修饰因子2/SUMF2、Siglec-9、SUMO1、Siglec-10、SUMO2/3/4、Siglec-11、SUMO3、Siglec-F、超氧物歧化酶、SIGNR1/CD209、超氧物歧化酶-1/Cu-Zn SOD、SIGNR4、超氧物歧化酶-2/Mn-SOD、SIRPβ1、超氧物歧化酶-3/EC-SOD、SKI、存活素(Survivin)、SLAM/CD150、突触蛋白(Synapsin)I、睡美人转座酶(Sleeping Beauty Transposase)、多配体聚糖(Syndecan)-1/CD138、Slit3、多配体聚糖-2、SLITRK1、多配体聚糖-3、SLITRK2、多配体聚糖-4、SLITRK4、TACI/TNFRSF 13B、TMEFF1/Tomoregulin-1、TAO2、TMEFF2、TAPP1、TNF-α/TNFSF1A、CCL17/TARC、TNF-β/TNFSF1B、Tau、TNF RI/TNFRSF1A、TC21/R-Ras2、TNF RII/TNFRSF1B、TCAM-1、TOR、TCCR/WSX-1、TP-1、TC-PTP、TP63/TP73L、TDG、TR、CCL25/TECK、TRα/NR1A1、腱生蛋白(Tenascin)C、TR β1/NR1A2、腱生蛋白R、TR2/NR2C1、TER-119、TR4/NR2C2、TERT、TRA-1-85、睾素(Testican)1/SPOCK1、TRADD、睾素2/SPOCK2、TRAF-1、睾素3/SPOCK3、TRAF-2、TFPI、TRAF-3、TFPI-2、TRAF-4、TGF-α、TRAF-6、TGF-β、TRAIL/TNFSF10、TGF-β1、TRAILR1/TNFRSF10A、LAP(TGF-β1)、TRAIL R2/TNFRSF10B、隐性TGF-β1、TRAIL R3/TNFRSF10C、TGF-β1.2、TRAIL R4/TNFRSF10D、TGF-β2、TRANCE/TNFSF11、TGF-β3、TfR(转铁蛋白R)、TGF-β5,Apo-转铁蛋白、隐性TGF-βbp1、Holo-转铁蛋白、隐性TGF-βbp2、Trappin-2/Elafin、隐性TGF-βbp4、TREM-1、TGF-βRI/ALK-5、TREM-2、TGF-βRII、TREM-3、TGF-βRIIb、TREML1/TLT-1、TGF-βRIII、TRF-1、Thermolysin、TRF-2、硫氧还蛋白-1、TRH-降解胞外酶/TRHDE、硫氧还蛋白-2、TRIM5、硫氧还蛋白-80、三肽基肽酶(Tripeptidyl-Peptidase)I、硫氧还蛋白-样5/TRP 14、TrkA、THOP 1、TrkB、血栓调节素(Thrombomodulin)/CD141、TrkC、血栓形成素、TROP-2、血栓形成素R、肌钙蛋白I肽3、凝血栓蛋白-1、肌钙蛋白T、凝血栓蛋白-2、TROY/TNFRSF19、凝血栓蛋白-4、胰蛋白酶1、胸腺生成素、胰蛋白酶2/PRSS2、胸腺趋化因子-1、胰蛋白酶3/PRSS3、Tie-1、类胰蛋白酶-5/Prss32、Tie-2、类胰蛋白酶α/TPS1、TIM-1/KIM-1/HAVCR、类胰蛋白酶β-1/MCPT-7、TIM-2、类胰蛋白酶β-2/TPSB2、TIM-3、类胰蛋白酶ε/BSSP-4、TIM-4、类胰蛋白酶γ-1/TPSG1、TIM-5、色氨酸羟化酶、TIM-6、TSC22、TIMP-1、TSG、TIMP-2、TSG-6、TIMP-3、TSK、TIMP-4、TSLP、TL1A/TNFSF15、TSLP R、TLR1、TSP50、TLR2、β-III 微管蛋白、TLR3、TWEAK/TNFSF12、TLR4、TWEAK R/TNFRSF12、TLR5、Tyk2、TLR6、磷酸-酪氨酸、TLR9、酪氨酸羟化酶、TLX/NR2E1、酪氨酸磷酸酸底物I、泛素、UNC5H3、Ugi、UNC5H4、UGRP1、UNG、ULBP-1、uPA、ULBP-2、uPAR、ULBP-3、URB、UNC5H1、UVDE、UNC5H2,辣椒素(Vanilloid)R1、VEGF R、VASA、VEGF R1/Flt-1、血管抑制蛋白(Vasohibin)、VEGF R2/KDR/Flk-1、Vasorin、VEGF R3/Flt-4、血管抑素(Vasostatin)、多功能蛋白聚糖(Versican)、Vav-1、VG5Q、VCAM-1、VHR、VDR/NR1I1、波形蛋白、VEGF、玻璃粘连蛋白、VEGF-B、VLDLR、VEGF-C、vWF-A2、VEGF-D、同型核蛋白(Synuclein)-α、Ku70、WASP、Wnt-7b、WIF-1、Wnt-8a WISP-1/CCN4、Wnt-8b、WNK1、Wnt-9a、Wnt-1、Wnt-9b、Wnt-3a、Wnt-10a、Wnt-4、Wnt-10b、Wnt-5a、Wnt-11、Wnt-5b、wnvNS3、Wnt7a、XCR1、XPE/DDB1、XEDAR、XPE/DDB2、Xg、XPF、XIAP、XPG、XPA、XPV、XPD、XRCC1、Yes、YY1、EphA4。
多种人离子通道是受到特别关注的靶标。非限制性的例子包括5-羟色胺3受体B亚基、5-羟色胺3受体前体、5-羟色胺受体3亚基C、AAD 14蛋白质、乙酰胆碱受体蛋白质、α亚基前体、乙酰胆碱受体蛋白质、β亚基前体、乙酰胆碱受体蛋白质、δ亚基前体、乙酰胆碱受体蛋白质、ε亚基前体、乙酰胆碱受体蛋白质、γ亚基前体、酸感受离子通道3剪接变异体b、酸感受离子通道3剪接变异体c、酸感受离子通道4、ADP-核糖焦磷酸酶、线粒体前体、A1A-电压依赖性钙通道、氨氯吡脒敏感阳离子通道(Amiloride-sensitive cation channel)1、神经元氨氯吡脒敏感阳离子通道2、神经元氨氯吡脒敏感阳离子通道4同种型2、氨氯吡脒敏感钠通道、氨氯吡脒敏感钠通道α-亚基、氨氯吡脒敏感钠通道β-亚基、氨氯吡脒敏感钠通道δ-亚基、氨氯吡脒敏感钠通道γ-亚基、膜联蛋白A7、Apical-样蛋白质、ATP敏感内向整流钾通道1、ATP敏感内向整流钾通道10、ATP敏感内向整流钾通道11、ATP敏感内向整流钾通道14、ATP敏感内向整流钾通道15、ATP敏感内向整流钾通道8、钙通道α12.2亚基、钙通道α12.2亚基、钙通道α1E亚基、δ19δ40δ46剪接变异体、钙激活钾通道α亚基1、钙激活钾通道β亚基1、钙激活钾通道β亚基2、钙激活钾通道β亚基3、钙依赖氯离子通道-1、阳离子通道TRPM4B、CDNA FLJ90453fis、克隆NT2RP3001542、高度类似钾通道四聚结构域6、CDNA FLJ90663fis、克隆PLACE 1005031、高度类似细胞内氯通道蛋白质5、CGMP-gated阳离子通道β亚基、氯离子通道蛋白质、氯离子通道蛋白质2、氯离子通道蛋白质3、氯离子通道蛋白质4、氯离子通道蛋白质5、氯离子通道蛋白质6、氯离子通道蛋白质ClC-Ka、氯离子通道蛋白质ClC-Kb、氯离子通道蛋白质、骨骼肌细胞内氯通道6、细胞内氯通道蛋白质3、细胞内氯通道蛋白质4、细胞内氯通道蛋白质5、CHRNA3蛋白质、Clcn3e蛋白质、CLCNKB蛋白质、CNGA4蛋白质、Cullin-5、环GMP门控钾通道、环核苷酸门控阳离子通道4、环核苷酸门控阳离子通道α3、环核苷酸门控阳离子通道β3、环核苷酸门控嗅通道(olfactory channel)、囊性纤维化跨膜电导调节因子(Cystic fibrosis transmembrane conductanceregulator)、细胞色素B-245重链、二氢吡啶敏感L型钙通道α-2/δ亚基前体、含FXYD结构域的离子转运调节因子3前体、含FXYD结构域的离子转运调节因子5前体、含FXYD结构域的离子转运调节因子6前体、含FXYD结构域的离子转运调节因子7、含FXYD结构域的离子转运调节因子8前体、G蛋白质-激活内向整流钾通道1、G蛋白质-激活内向整流钾通道2、G蛋白质-激活内向整流钾通道3、G蛋白质-激活内向整流钾通道4、γ-氨基丁酸受体α-1亚基前体、γ-氨基丁酸受体α-2亚基前体、γ-氨基丁酸受体α-3亚基前体、γ-氨基丁酸受体α-4亚基前体、γ-氨基丁酸受体α-5亚基前体、γ-氨基丁酸受体α-6亚基前体、γ-氨基丁酸受体β-1亚基前体、γ-氨基丁酸受体β-2亚基前体、γ-氨基丁酸受体β-3亚基前体、γ-氨基丁酸受体δ亚基前体、γ-氨基丁酸受体ε亚基前体、γ-氨基丁酸受体γ-1亚基前体、γ-氨基丁酸受体γ-3亚基前体、γ-氨基丁酸受体pi 基前体、γ-氨基丁酸受体rho-1亚基前体、γ-氨基丁酸受体rho-2亚基前体、γ-氨基丁酸受体θ亚基前体、GluR6红藻氨酸(kainate)受体、谷氨酸受体1前体、谷氨酸受体2前体、谷氨酸受体3前体、谷氨酸受体4前体、谷氨酸受体7、谷氨酸受体B、谷氨酸受体δ-1亚基前体、谷氨酸受体、离子移变的红藻氨酸1前体、谷氨酸受体、离子移变的红藻氨酸2前体、谷氨酸受体、离子移变的红藻氨酸3前体、谷氨酸受体、离子移变的红藻氨酸4前体、谷氨酸受体、离子移变的红藻氨酸5前体、谷氨酸[NMDA]受体亚基3A前体、谷氨酸[NMDA]受体亚基3B前体、谷氨酸[NMDA]受体亚基ε1前体、谷氨酸[NMDA]受体亚基ε2前体、谷氨酸[NMDA]受体亚基ε4前体、谷氨酸[NMDA]受体亚基ζ1前体、甘氨酸受体α-1链前体、甘氨酸受体α-2链前体、甘氨酸受体α-3链前体、甘氨酸受体β链前体、H/ACA核糖核蛋白复合物亚基1、高亲和力免疫球蛋白ε受体β-亚基、假定蛋白质DKFZp313I0334、假定蛋白质DKFZp761M1724、假定蛋白质FLJ12242、假定蛋白质FLJ14389、假定蛋白质FLJ14798、假定蛋白质FLJ14995、假定蛋白质FLJ16180、假定蛋白质FLJ16802、假定蛋白质FLJ32069、假定蛋白质FLJ37401、假定蛋白质FLJ38750、假定蛋白质FLJ40162、假定蛋白质FLJ41415、假定蛋白质FLJ90576、假定蛋白质FLJ90590、假定蛋白质FLJ90622、假定蛋白质KCTD15、假定蛋白质MGC15619、肌醇1,4,5-三磷酸受体1型、肌醇1,4,5-三磷酸受体2型、肌醇1,4,5-三磷酸受体3型、中电导钙激活钾通道蛋白质4、内向整流钾通道13、内向整流钾通道16、内向整流钾通道4、内向整流K(+)钾通道反向调节因子Kir2.2v、红藻氨酸受体亚基KA2a、KCNH5蛋白质、KCTD 17蛋白质、KCTD2蛋白质、角化细胞相关跨膜蛋白1、Kv通道-相互作用蛋白质4、Melastatin 1、膜蛋白质MLC1、MGC15619蛋白质、粘脂蛋白(Mucolipin)-1、粘脂蛋白-2、粘脂蛋白-3、耐多药性相关蛋白质4、N-甲基-D-天冬氨酸受体2C基前体、NADPH氧化酶同源物1、Nav1.5、神经元乙酰胆碱受体蛋白质,α-10亚基前体、神经元乙酰胆碱受体蛋白质,α-2亚基前体、神经元乙酰胆碱受体蛋白质,α-3亚基前体、神经元乙酰胆碱受体蛋白质,α-4亚基前体、神经元乙酰胆碱受体蛋白质,α-5亚基前体、神经元乙酰胆碱受体蛋白质,α-6亚基前体、神经元乙酰胆碱受体蛋白质,α-7亚基前体、神经元乙酰胆碱受体蛋白质,α-9亚基前体、神经元乙酰胆碱受体蛋白质,β-2亚基前体、神经元乙酰胆碱受体蛋白质,β-3基前体、神经元乙酰胆碱受体蛋白质,β-4亚基前体、神经元电压依赖性钙通道α2D亚基、P2X嘌呤受体(purinoceptor)1、P2X嘌呤受体2、P2X嘌呤受体3、P2X嘌呤受体4、P2X嘌呤受体5、P2X嘌呤受体6、P2X嘌呤受体7、胰腺钾通道TALK-1b、胰腺钾通道TALK-1c、胰腺钾通道TALK-1d、Phospholemman前体、浆脂蛋白(Plasmolipin)、多囊肾病2相关蛋白、多囊肾病2-样1蛋白质、多囊肾病2-样2蛋白质、多囊肾病和卵胶受体相关蛋白前体、多囊蛋白(Polycystin)-2、钾通道调节剂、钾通道亚家族K成员1、钾通道亚家族K成员10、钾通道亚家族K成员12、钾通道亚家族K成员13、钾通道亚家族K成员15、钾通道亚家族K成员16、钾通道亚家族K成员17、钾通道亚家族K成员2、钾通道亚家族K成员3、钾通道亚家族K成员4、钾通道亚家族K成员5、钾通道亚家族K成员6、钾通道亚家族K成员7、钾通道亚家族K成员9、钾通道四聚结构域含(钾通道四聚结构域含)3、钾通道四聚结构域蛋白质12、钾通道四聚结构域蛋白质14、钾通道四聚结构域蛋白质2、钾通道四聚结构域蛋白质4、钾通道四聚结构域蛋白质5、钾通道四聚结构域10、钾通道四聚结构域蛋白质13、钾通道四聚结构域1、钾电压门控通道亚家族A成员1、钾电压门控通道亚家族A成员2、钾电压门控通道亚家族A成员4、钾电压门控通道亚家族A成员5、钾电压门控通道亚家族A成员6、钾电压门控通道亚家族B成员1、钾电压门控通道亚家族B成员2、钾电压门控通道亚家族C成员1、钾电压门控通道亚家族C成员3、钾电压门控通道亚家族C成员4、钾电压门控通道亚家族D成员1、钾电压门控通道亚家族D成员2、钾电压门控通道亚家族D成员3、钾电压门控通道亚家族E成员1、钾电压门控通道亚家族E成员2、钾电压门控通道亚家族E成员3、钾电压门控通道亚家族E成员4、钾电压门控通道亚家族F成员1、钾电压门控通道亚家族G成员1、钾电压门控通道亚家族G成员2、钾电压门控通道亚家族G成员3、钾电压门控通道亚家族G成员4、钾电压门控通道亚家族H成员1、钾电压门控通道亚家族H成员2、钾电压门控通道亚家族H成员3、钾电压门控通道亚家族H成员4、钾电压门控通道亚家族H成员5、钾电压门控通道亚家族H成员6、钾电压门控通道亚家族H成员7、钾电压门控通道亚家族H成员8、钾电压门控通道亚家族KQT成员1、钾电压门控通道亚家族KQT成员2、钾电压门控通道亚家族KQT成员3、钾电压门控通道亚家族KQT成员4、钾电压门控通道亚家族KQT成员5、钾电压门控通道亚家族S成员1、钾电压门控通道亚家族S成员2、钾电压门控通道亚家族S成员3、钾电压门控通道亚家族V成员2、钾电压门控通道亚家族H成员7,同种型2、钾/钠超极化激活环核苷酸门控通道1、钾/钠超极化激活环核苷酸门控通道2、钾/钠超极化激活环核苷酸门控通道3、钾/钠超极化激活环核苷酸门控通道4、可能线粒体输入受体亚基TOM40同源物、嘌呤能(Purinergic)受体P2X5,同种型A、推定的4重复电压门控离子通道、推定的氯离子通道蛋白质7、推定的GluR6红藻氨酸受体、推定的离子通道蛋白质CATSPER2变异体1、推定的离子通道蛋白质CATSPER2变异体2、推定的离子通道蛋白质CATSPER2变异体3、推定的钾通道调节因子蛋白质变异体1、推定的酪氨酸-蛋白质磷酸酶TPTE、利阿诺定(Ryanodine)受体1、Ryanodine受体2、利阿诺定受体3、SH3KBP 1结合蛋白1、短瞬时受体电位通道1、短瞬时受体电位通道4、短瞬时受体电位通道5、短瞬时受体电位通道6、短瞬时受体电位通道7、小电导钙激活钾通道蛋白质1、小电导钙激活钾通道蛋白质2,同种型b、小电导钙激活钾通道蛋白质3,同种型b、小电导钙激活钾通道SK2、小电导钙激活钾通道SK3、钠通道、钠通道β-1亚基前体、钠通道蛋白质II型α亚基、钠通道蛋白质III型α亚基、钠通道蛋白质IV型α亚基、钠通道蛋白质IX型α亚基、钠通道蛋白质V型α亚基、钠通道蛋白质VII型α亚基、钠通道蛋白质VIII型α亚基、钠通道蛋白质X型α亚基、钠通道蛋白质XI型α亚基、钠和氯激活ATP-敏感钾通道、钠/钾转运ATP酶γ链、精子相关阳离子通道1、精子相关阳离子通道2,同种型4、突触融合蛋白-1B 1、瞬时受体电位阳离子通道亚家族A成员1、瞬时受体电位阳离子通道亚家族M成员2、瞬时受体电位阳离子通道亚家族M成员3、瞬时受体电位阳离子通道亚家族M成员6、瞬时受体电位阳离子通道亚家族M成员7、瞬时受体电位阳离子通道亚家族V成员1、瞬时受体电位阳离子通道亚家族V成员2、瞬时受体电位阳离子通道亚家族V成员3、瞬时受体电位阳离子通道亚家族V成员4、瞬时受体电位阳离子通道亚家族V成员5、瞬时受体电位阳离子通道亚家族V成员6、瞬时受体电位通道4ε剪接变异体、瞬时受体电位通道4ζ剪接变异体、瞬时受体电位通道7γ剪接变异体、肿瘤坏死因子、α-诱导蛋白质1、内皮,两孔(Two-pore)钙通道蛋白质2、VDAC4蛋白质、电压门控钾通道Kv3.2b、电压门控1钠通道β1B亚基、电压依赖性阴离子通道、电压依赖性阴离子通道2、电压依赖性阴离子选择性通道蛋白质1、电压依赖性阴离子选择性通道蛋白质2、电压依赖性阴离子选择性通道蛋白质3、电压依赖性钙通道γ-1亚基、电压依赖性钙通道γ-2亚基、电压依赖性钙通道γ-3亚基、电压依赖性钙通道γ-4亚基、电压依赖性钙通道γ-5亚基、电压依赖性钙通道γ-6亚基、电压依赖性钙通道γ-7亚基、电压依赖性钙通道γ-8亚基、电压依赖性L型钙通道α-1C亚基、电压依赖性L型钙通道α-1D亚基、电压依赖性L型钙通道α-1S亚基、电压依赖性L型钙通道β-1亚基、电压依赖性L型钙通道β-2亚基、电压依赖性L型钙通道β-3亚基、电压依赖性L型钙通道β-4亚基、电压依赖性N型钙通道α-1B亚基、电压依赖性P/Q型钙通道α-1A亚基、电压依赖性R型钙通道α-1E亚基、电压依赖性T型钙通道α-1G亚基、电压依赖性T型钙通道α-1H亚基、电压依赖性T型钙通道α-1I亚基、电压门控L型钙通道α-1亚基、电压门控钾通道β-1亚基、电压门控钾通道β-2亚基、电压门控钾通道β-3亚基、电压门控钾通道KCNA7。人电压门控钠通道的Nav1.x家族也是特别有希望的靶标。这一家族包括例如,通道Nav 1.6和Nav1.8。
在该应用中用作支架的许多微生物蛋白具有抗G-蛋白质偶联受体(GPCR)的天然活性并提供建立新型GPCR调节剂(包括GPCR任何性能的激动剂、拮抗剂和调节剂)的理想起点。示例性GPCR包括但不限于A类视紫质样受体如毒蕈碱型(Musc.)乙酰胆碱脊椎动物1型、Musc.乙酰胆碱脊椎动物2型、Musc.乙酰胆碱脊椎动物3型、Musc.乙酰胆碱脊椎动物4型;肾上腺素受体(α肾上腺素受体1型、α肾上腺素受体2型、β肾上腺素受体1型、β肾上腺素受体2型、β肾上腺素受体3型、多巴胺脊椎动物1型、多巴胺脊椎动物2型、多巴胺脊椎动物3型、多巴胺脊椎动物4型、组胺1型、组胺2型、组胺3型、组胺4型、5-羟色胺1型、5-羟色胺2型、5-羟色胺3型、5-羟色胺4型、5-羟色胺5型、5-羟色胺6型、5-羟色胺7型、5-羟色胺8型、其它5-羟色胺类型、示踪胺(Trace amine)、血管紧张素1型、血管紧张素2型、铃蟾肽、缓激肽、C5a过敏毒素、Fmet-leu-phe、APJ样、白介素-8A型、白介素-8B型、白介素-8其它型、C-C趋化因子1型-11型及其它型、C-X-C趋化因子(2型-6型及其它)、C-X3-C趋化因子、胆囊收缩素CCK、CCK A型、CCK B型、CCK其它、内皮缩血管肽、黑皮素(促黑素细胞激素、促肾上腺皮质激素、黑皮素激素)、Duffy抗原、促乳素释放肽(GPR10)、神经肽Y(1型-7型)、神经肽Y、神经肽Y其它、神经加压素、阿片样物质(D,K,M,X型)、生长激素抑制素(1型-5型)、速激肽(P物质(NK1)、K物质(NK2)、神经介素(Neuromedin)K(NK3)、速激肽样1、速激肽样2、后叶加压素/加压催产素(1型-2型)、加压催产素、催产素/中催产素、芋螺升压肽(Conopressin)、甘丙肽(Galanin)样、蛋白酶-激活样、食欲素&神经肽FF、QRFP、趋化因子受体-样、神经介素U样(神经介素U,PRXamide)、激素蛋白质(促卵泡激素、促黄体素绒膜促性腺素激素、促甲状腺激素、促性腺激素I型、促性腺激素II型)、视紫红质、视紫质脊椎动物(1-5型)、视紫质脊椎动物5型、视紫质节肢动物、视紫质节肢动物1型、视紫质节肢动物2型、视紫质节肢动物3型、视紫质软体动物、视紫质,嗅觉(嗅觉II fam 1-13)、前列腺素(前列腺素E2亚型EP 1、前列腺素E2/D2亚型EP2、前列腺素E2亚型EP3、前列腺素E2亚型EP4、前列腺素F2-α、环前列腺素、血栓烷、腺苷1型-3型、嘌呤受体、嘌呤受体P2RY1-4,6,11GPR91、嘌呤受体P2RY5,8,9,10GPR35,92,174、嘌呤受体P2RY12-14GPR87(UDP-葡萄糖)、大麻素、血小板活化因子、促性腺激素释放激素、I型促性腺激素释放激素、II型促性腺激素释放激素、脂肪酸释放激素样、Corazonin、促甲状腺素释放激素&促分泌素、促甲状腺素释放激素、生长激素促分泌素、生长激素促分泌素样、蜕壳启动激素(ETHR)、褪黑激素、溶性鞘脂(Lysosphingolipid)&LPA(EDG)、鞘氨醇1-磷酸Edg-1、溶血磷脂酸Edg-2、鞘氨醇1-磷酸Edg-3、溶血磷脂酸Edg-4、鞘氨醇1-磷酸Edg-5、鞘氨醇1-磷酸Edg-6、溶血磷脂酸Edg-7、鞘氨醇1-磷酸Edg-8、Edg其它白三烯B4受体、白三烯B4受体BLT1、白三烯B4受体BLT2、A类孤儿/其它、推定的神经递质、SREB、Mas原癌基因&Mas相关(MRGs)、GPR45样、半胱氨酸基白三烯、G-蛋白质偶联胆酸受体、游离脂肪酸受体(GP40,GP41,GP43)、B类促胰液素样、降血钙素、促皮质释放因子、抑胃肽、胰高血糖素、生长激素-释放激素、甲状旁腺素、PACAP、促胰液素、血管活性肠多肽、蛛毒素受体(Latrophilin)、蛛毒素受体1型、蛛毒素受体2型、蛛毒素受体3型、ETL受体、脑特异性血管生成抑制剂(BAI)、Methuselah-样蛋白质(MTH)、钙粘蛋白EGF LAG(CELSR)、极大G-蛋白质偶联受体、C类促代谢型(Metabotropic)谷氨酸/信息素、促代谢型谷氨酸I-III组、钙感受样、细胞外钙感受信息素、钙感受样其它、推定的信息素受体、GABA-B、GABA-B亚型1、GABA-B亚型2、GABA-B样、孤儿GPRC5、孤儿GPCR6、Bride of sevenless蛋白质(BOSS)、味觉感受器(T1R)、D类真菌信息素、真菌信息素A-因子样(STE2,STE3)、真菌信息素B样(BAR,BBR,RCB,PRA)、E类cAMP受体、眼白化蛋白质、卷曲/平滑家族、卷曲A组(Fz 1&2&4&5&7-9)、卷曲B组(Fz 3&6)、卷曲C组(其它)、犁鼻受体、线虫化学感受器、昆虫芳香感受器和Z类古细菌(Archaeal)/细菌/真菌视蛋白。
特别有用的是附加序列与任何以下活性多肽的融合物:BOTOX、B型肉毒毒素(Myobloc)、B型肉毒毒素(Neurobloc)、A型肉毒毒素(Dysport)(或肉毒杆菌神经毒素的其它血清型)、葡糖苷酶α、达托霉素、YH-16、绒毛膜促性腺激素α、非格司亭、西曲瑞克(cetrorelix)、白介素-2、阿地白介素(aldesleukin)、替西白介素(teceleukin)、地尼白介素-毒素连接物(denileukin diftitox)、干扰素α-n3(注射剂)、干扰素α-n1、DL-8234、干扰素,Suntory(γ-1a)、干扰素γ、胸腺素α1、他索纳明(tasonermin)、DigiFab、ViperaTAb、EchiTAb、CroFab、奈西立肽、阿巴西普(abatacept)、阿法赛特(alefacept)、利比(Rebif)、eptoterminα、特立帕肽(teriparatide)(骨质疏松症)、降血钙素注射剂(骨病)、降血钙素(鼻腔,骨质疏松症)、依那西普(etanercept)、谷他血红蛋白(hemoglobin glutamer)250(牛)、人重组活化蛋白C(drotrecoginα)、胶原酶、卡培立肽(carperitide)、重组人表皮生长因子(局部凝胶,伤口愈合)、DWP-401、达贝泊汀(darbepoetin)α、依泊汀ω、依泊汀β、依泊汀α、地西卢定(desirudin)、来匹卢定(lepirudin)、比伐卢定、诺那凝血素(nonacog)α、Mononine、依他凝血素(eptacog)α(活化的)、重组的因子VIII+VWF、浓缩的重组抗血友病因子(Recombinate)、重组的因子VIII、因子VIII(重组体)、Alphanate、辛凝血素(octocog)α、因子VIII、帕利夫明(palifermin)、Indikinase、替奈普酶(tenecteplase)、阿替普酶、帕米普酶(pamiteplase)、瑞替普酶、那替普酶(nateplase)、孟替普酶(monteplase)、促滤泡素α、rFSH、hpFSH、米卡凡金(micafungin)、乙二醇化非格司亭、来诺拉提(lenograstim)、那托司亭(nartograstim)、舍莫瑞林(sermorelin)、胰高血糖素、艾塞那肽、普兰林肽(pramlintide)、伊米苷酶、加硫酶(galsulfase)、Leucotropin、莫拉司亭(molgramostim)、醋酸曲普瑞林(triptorelinacetate)、组氨瑞林(histrelin)(皮下植入,Hydron)、地洛瑞林(deslorelin)、组氨瑞林、那法瑞林(nafarelin)、亮丙瑞林(leuprolide)延释储库(ATRIGEL)、亮丙瑞林植入剂(DUROS)、戈舍瑞林(goserelin)、促生长激素、Eutropin、KP-102程序、促生长激素、促生长激素、美卡舍明(mecasermin)(生长障碍)、恩夫韦地、Org-33408、甘精胰岛素(glargine)、赖谷胰岛素(glulisine)、胰岛素(吸入)、赖脯胰岛素(lispro)、地特胰岛素(detemir)、胰岛素(含服,RapidMist)、美卡舍明-林菲培(mecasermin rinfabate)、阿那白滞素、西莫白介素(celmoleukin)、99mTc-阿西肽(apcitide)注射剂、myelopid、重组干扰素β-1b(Betaseron)、醋酸格拉替雷(glatiramer acetate)、Gepon、沙格司亭(sargramostim)、奥普瑞白介素(oprelvekin)、人白细胞源的α干扰素、倍尔来福(Bilive)、胰岛素(重组体)、重组人胰岛素、门冬胰岛素(aspart)、美卡舍明(mecasermin)、罗扰素(Roferon)-A、干扰素-α2、干扰素(Alfaferone)、复合α干扰素(alfacon)-1、干扰素α、Avonex的重组人黄体生成素、链球菌DNA酶α、曲弗明(trafermin)、齐考诺肽(ziconotide)、他替瑞林(taltirelin)、dibotermin α、阿托西班(atosiban)、贝卡普勒明、埃替非巴肽(eptifibatide)、泽美拉(Zemaira)、CTC-111、Shanvac-B、HPV疫苗(四价体)、NOV-002、奥曲肽(octreotide)、兰瑞肽(lanreotide)、安西司亭(ancestim)、阿加糖酶(agalsidase)β、阿加糖酶α、拉罗尼酶(laronidase)、醋肽铜(prezatide copper acetate)(局部凝胶)、拉布立酶(rasburicase)、兰尼单抗、干扰素γ-1b(Actimmune)、佩乐能(PEG-Intron)、Tricomin、重组屋尘螨过敏脱敏注射剂、重组甲状旁腺素(PTH)1-84(sc,骨质疏松症)、依泊汀(epoetin)δ、转基因抗凝血酶III、Granditropin、透明质酸酶(Vitrase)、重组胰岛素、干扰素-α(口服锭剂)、GEM-21S、伐普肽(vapreotide)、艾度硫酸酯酶(idursulfase)、奥马曲拉(omapatrilat)、重组血清白蛋白、赛妥珠单抗(certolizumab pegol)、glucarpidase、人重组C1酯酶抑制剂(血管性水肿)、拉诺替普酶(lanoteplase)、重组人生长激素、恩夫韦地(无针注射,Biojector 2000)、VGV-1、干扰素(α)、lucinactant、阿肽地尔(aviptadil)(吸入,肺病)、艾替班特(icatibant)、ecallantide、omiganan、Aurograb、乙酸培西加南(pexiganan acetate)、ADI-PEG-20、LDI-200、地盖瑞利(degarelix)、cintredekin besudotox、FavId、MDX-1379、ISAtx-247、利拉鲁肽(liraglutide)、特立帕肽(teriparatide)(骨质疏松症)、替法可近(tifacogin)、AA-4500、T4N5脂质体洗剂、catumaxomab、DWP-413、ART-123、Chrysalin、去氨普酶(desmoteplase)、安地普酶(amediplase)、corifollitropin α、TH-9507、替度鲁肽(teduglutide)、Diamyd、DWP-412、生长激素(延释注射剂)、重组G-CSF、胰岛素(吸入,AIR)、胰岛素(吸入,Technosphere)、胰岛素(吸入,AERx)、RGN-303、DiaPep277、干扰素β(丙型肝炎病毒感染(HCV))、干扰素α-n3(口服)、belatacept、透皮胰岛素贴片、AMG-531、MBP-8298、Xerecept、奥培巴坎(opebacan)、AIDSVAX、GV-1001、LymphoScan、豹蛙酶(ranpirnase)、Lipoxysan、卢舒普肽(lusupultide)、MP52(β-磷酸三钙载体,骨再生)、黑素瘤疫苗、sipuleucel-T、CTP-37、Insegia、维特斯朋(vitespen)、人凝血酶(冷冻,外科出血)、凝血酶、TransMID、蛇毒纤溶酶(alfimeprase)、普瑞凯希(Puricase)、特利加压素(terlipressin)(静脉内,肝肾综合征)、EUR-1008M、重组FGF-1(注射剂,血管疾病)、BDM-E、rotigaptide、ETC-216、P-113、MBI-594AN、耐久霉素(吸入,囊肿性纤维化)、SCV-07、OPI-45、内皮他丁(Endostatin)、血管增生抑制素、ABT-510、Bowman Birk拮抗剂浓缩剂、XMP-629、99mTc-Hynic-膜联蛋白V、kahalalide F、CTCE-9908、替维瑞克(teverelix)(延释)、ozarelix、romidepsin、BAY-50-4798、白介素-4、PRX-321、Pepscan、iboctadekin、rh乳铁蛋白、TRU-015、IL-21、ATN-161、西仑吉肽(cilengitide)、白蛋白干扰素(Albuferon)、Biphasix、IRX-2、ω干扰素、PCK-3145、CAP-232、帕瑞肽(pasireotide)、huN901-DM1、卵巢癌免疫治疗疫苗、SB-249553、Oncovax-CL、OncoVax-P、BLP-25、CerVax-16、多表位肽黑素瘤疫苗(MART-1,gp100,酪氨酸酶)、奈米非肽(nemifitide)、rAAT(吸入)、rAAT(皮肤病)、CGRP(吸入,哮喘)、培那西普(pegsunercept)、胸腺素β-4、plitidepsin、GTP-200、雷冒拉宁(ramoplanin)、GRASPA、OBI-1、AC-100、鲑鱼降血钙素(口服,eligen)、降血钙素(口服,骨质疏松症)、艾沙瑞林(examorelin)、卡普瑞林(capromorelin)、Cardeva、velafermin、131I-TM-601、KK-220、TP-10、乌拉立肽(ularitide)、地来司他(depelestat)、hematide、Chrysalin(局部)、rNAPc2、重组的因子VIII(PEG化脂质体)、bFGF、PEG化的重组葡萄球菌激酶变异体、V-10153、SonoLysis Prolyse、NeuroVax、CZEN-002、岛细胞新生疗法、rGLP-1、BIM-51077、LY-548806、艾塞那肽(控释,Medisorb)、AVE-0010、GA-GCB、阿伏瑞林(avorelin)、AOD-9604、linaclotide醋酸盐、CETi-1、Hemospan、VAL(注射剂)、快速作用胰岛素(注射剂,Viadel)、鼻内胰岛素、胰岛素(吸入)、胰岛素(口服,eligen)、重组甲硫氨酰人瘦素、pitrakinra(皮下注射,湿疹)、pitrakinra(吸入干粉,哮喘)、Multikine、RG-1068、MM-093、NBI-6024、AT-001、PI-0824、Org-39141、Cpn10(自身免疫疾病/炎症)、talactoferrin(局部)、rEV-131(眼科)、rEV-131(呼吸疾病)、口服重组人胰岛素(糖尿病)、RPI-78M、奥普瑞白介素(口服)、CYT-99007CTLA4-Ig、DTY-001、valategrast、干扰素α-n3(局部)、IRX-3、RDP-58、Tauferon、胆盐刺激脂酶、Merispase、碱性磷酸酶、EP-2104R、美拉诺坦(Melanotan)-II、布雷默浪丹(bremelanotide)、ATL-104、重组人微纤溶酶(microplasmin)、AX-200、SEMAX、ACV-1、Xen-2174、CJC-1008、强啡肽A、SI-6603、LAB GHRH、AER-002、BGC-728、疟疾疫苗(病毒颗粒,PeviPRO)、ALTU-135、细小病毒B19疫苗、流感疫苗(重组神经氨酸酶)、疟疾/HBV疫苗、炭疽疫苗、Vacc-5q、Vacc-4x、HIV疫苗(口服)、HPV疫苗、Tat类毒素、YSPSL、CHS-13340、PTH(1-34)脂质体膏(Novasome)、Ostabolin-C、PTH类似物(局部,牛皮癣)、MBRI-93.02、MTB72F疫苗(结核)、MVA-Ag85A疫苗(结核)、FAR-404、BA-210、重组鼠疫F1V疫苗、AG-702、OxSODrol、rBetV1、Der-p1/Der-p2/Der-p7变应原靶向疫苗(尘螨过敏)、PR1肽抗原(白血病)、突变ras疫苗、HPV-16E7脂肽疫苗、迷路(labyrinthin)疫苗(腺癌)、CML疫苗、WT1-肽疫苗(癌症)、IDD-5、CDX-110、Pentrys、Norelin、CytoFab、P-9808、VT-111、艾罗卡肽(icrocaptide)、替柏明(telbermin)(皮肤病,糖尿病足溃疡)、芦平曲韦(rupintrivir)、reticulose、rGRF,P1A、α-半乳糖苷酶A、ACE-011、ALTU-140、CGX-1160、血管紧张素治疗疫苗、D-4F、ETC-642、APP-018、rhMBL、SCV-07(口服,结核)、DRF-7295、ABT-828、ErbB2-特异性免疫毒素(抗癌)、DT388IL-3、TST-10088、PRO-1762、Combotox、缩胆囊素-B/胃泌素-受体结合肽、111In-hEGF、AE-37、曲妥珠单抗(trastuzumab)-DM1、拮抗剂G、IL-12(重组体)、PM-02734、IMP-321、rhIGF-BP3、BLX-883、CUV-1647(局部)、基于L-19的放射免疫治疗剂(癌症)、Re-188-P-2045、AMG-386、DC/I540/KLH疫苗(癌症)、VX-001、AVE-9633、AC-9301、NY-ESO-1疫苗(肽)、NA17.A2肽、黑素瘤疫苗(致敏抗原治疗(pulsed antigen therapeutic))、前列腺癌疫苗、CBP-501、重组人乳铁蛋白(干眼)、FX-06、AP-214、WAP-8294A2(注射剂)、ACP-HIP、SUN-11031、肽YY[3-36](肥胖,鼻内)、FGLL、阿塞西普(atacicept)、BR3-Fc、BN-003、BA-058、人甲状旁腺素1-34(鼻腔,骨质疏松症)、F-18-CCR1、AT-1001(脂泻病/糖尿病)、JPD-003、PTH(7-34)脂质体膏(Novasome)、耐久霉素(眼科,干眼)、CAB-2、CTCE-0214、GlycoPEG化红细胞生成素、EPO-Fc、CNTO-528、AMG-114、JR-013、因子XIII、aminocandin、PN-951,716155、SUN-E7001、TH-0318、BAY-73-7977、替维瑞克(teverelix)(速释)、EP-51216、hGH(控释,Biosphere)、OGP-I、西夫韦肽(sifuvirtide)、TV-4710、ALG-889、Org-41259、rhCC10、F-991、胸腺喷丁(thymopentin)(肺病)、r(m)CRP、肝选择性(hepatoselective)胰岛素、subalin、L19-IL-2融合蛋白质、内生多肽(elafin)、NMK-150、ALTU-139、EN-122004、rhTPO、血栓形成素受体激动剂(thrombocytopenic disorders)、AL-108、AL-208、神经生长因子拮抗剂(疼痛)、SLV-317、CGX-1007、INNO-105、口服特立帕肽(eligen)、GEM-OS1、AC-162352、PRX-302、LFn-p24融合疫苗(Therapore)、EP-1043、S肺炎儿童疫苗、疟疾疫苗、奈瑟氏脑膜炎菌B驵疫苗、新生儿B组链球菌疫苗、炭疽疫苗、HCV疫苗(gpE1+gpE2+MF-59)、中耳炎治疗、HCV疫苗(核心抗原+ISCOMATRIX)、hPTH(1-34)(透皮,ViaDerm)、768974、SYN-101、PGN-0052、aviscumine、BIM-23190、结核疫苗、多表位酪氨酸酶肽、癌症疫苗、enkastim、APC-8024、GI-5005、ACC-001、TTS-CD3、血管靶向TNF(实体肿瘤)、去氨加压素(desmopressin)(口腔控释)、奥那西普(onercept)、TP-9201。
非重复URP(nrURPs)
本发明还包括非重复URP(nrURPs)。nrURP是主要由小的亲水氨基酸组成并具有低的在体内形成二级结构的倾向的氨基酸序列。nrURP的特征是包括URP由于其构象灵活性而在生理状态下缺乏良好的二级和三级结构、高水平的蛋白酶抗性,在将URP序列引入生物活性多肽时提高生物活性多肽的半衰期和/或溶解性的能力。nrURP的特别性质是它们的低水平内部重复性。nrURP包含多个不同的肽子序列。这些子序列具有URP-样氨基酸组成但其氨基酸序列和长度彼此不同。
nrURP与具有相似氨基酸组成的重复URP(rURP)相比倾向于具有改善的溶解性。一般,重复氨基酸序列具有聚集的倾向,以天然重复序列如胶原蛋白和亮氨酸拉链为例。重复序列可以形成高阶结构从而来自相似接触的相同的子序列产生晶体或假晶体结构。nrURP具有低得多的形成这种假晶体结构的倾向,因为它们包含阻止形成任何重复的高阶结构的多个不同的子序列。非重复序列低的聚集倾向使得能够以相对低频率的带电氨基酸(其在重复URP中很容易聚集)设计URP。nrURP的低聚集倾向有助于形成含nrURP的药物制剂,特别是使包含超过100mg/ml的极高药物浓度的制剂成为可能。
(a)具有低免疫原性的nrURP
比较重复的和非重复的URP序列与识别所述序列中的表位的B细胞的相互作用并显示于图74中。rURP在生物体中被少数B细胞识别因为它包含相对少量的不同表位。但是,rURP可以与该少数B细胞形成多价接触并因此它可以刺激B细胞增殖,如图74a中所示。相反,nrURP可以与许多不同的B细胞形成接触,因为它包含许多不同表位。但是由于缺乏重复性,各单个B细胞只能与单个nrURP形成一个或少量接触,如图74b中所示。结果,nrURP具有低得多的刺激B细胞增殖并因此刺激免疫应答的倾向。
nrURP相对于rURP的另一优势是nrURP相对于rURP与抗体形成较弱的接触。抗体是多价分子。例如,IgG具有两个相同的结合位点和IgM包含10个相同的结合位点。因此,抗重复序列的抗体可以以高亲合力与重复序列形成多价接触,这可以影响这种重复序列的效能和/或滁。相反,抗nrURP的抗体主要与抗体形成单价相互作用,因为所述nrURP包含很少的各表位的重复序列。
(b)重复性的检测
基因的重复性可以通过计算机算法测量。例子示于图75中。基于查询序列,可以进行特定长度的子序列的逐对比较。这些子序列可以进行同一性或同源性比较。图75中的例子比较4个氨基酸的子序列的同一性。在该例子中,大多数4-聚体的子序列只在查询序列出现一次且3个4聚体的子序列出现两次。可以平均基因中的重复性。可以调节子序列的长度。子序列的长度反映可被免疫系统识别的序列表位的长度。因此,4-15个氨基酸的子序列的分析可能是最有利的
(3)nrURP序列的设计
编成nrURP的基因可以使用基因合成的标准技术由寡核苷酸组装。基因设计可以使用优化密码子选择和氨基酸组成的算法进行。另外,可以避免对蛋白酶敏感的或已知包含可被人免疫系统轻易识别的表位的氨基酸序列。计算机算法可以在序列设计过程中应用以最小化所得到的氨基酸序列的重复性。可以评估满足预定标准(如氨基酸组成、密码子选择、避免蛋白酶敏感子序列、避免表位)的大量基因设计的重复性并选择最低重复序列进行合成和后续评价。
设计nrURP基因的替代途径是分析显示出高水平表达、低聚集倾向、高溶解性和对蛋白酶的良好抗性的nrURP现有集合的序列。计算机算法可以基于这种预先存在的nrURP序列通过重组装序列片段来设计nrURP序列,如图76中所示。该算法从这些nrURP序列产生子序列的集合并随后评价从这种子序列组装nrURP序列的多种途径。这些装配的序列可以评价重复性以鉴别仅由预先确定的nrURP构成的但与所有母本nrURP相比具有较低重复性的nrURP序列。
(d)由库构建nrURP序列
nrURP-编码基因可以从短URP片段库组装,如图77所示。可以首先产生大的URP片段库。这些库可以由部分随机化的寡核苷酸组装。可以优化随机化方案以控制各位置的氨基酸选择以及密码子选择。在一个实施方式中,URP片段库克隆到表达载体中。在另一个实施方式中,URP片段库克隆到与指示基因如GFP融合的表达载体中。随后,可以筛选库成员的多种性能如表达水平、蛋白酶稳定性、与抗血清的结合。可以筛选结合抗血清的URP片段以消除对所述血清具有高亲和力的片段。特别,可以筛选库成员以确认和避免结合具有对URP序列的反应性的抗血清。可以确定库成员的氨基酸序列以鉴别具有特别希望的氨基酸组成、片段长度的片段或鉴别具有低频率内部重复序列的片段。随后,可以通过随机二聚化或多聚化从URP片段的集合组装nrURP序列。二聚化或多聚化可以通过接合或PCR组装实现。这一过程产生可对多种性能进行评价以鉴别具有最佳性能的nrURP序列的nrURP序列库。可以重复该二聚化或多聚化过程以进一步增加nrURP序列的长度。
交联的附加多肽的设计
本发明还涉及包含交联的附加多肽的具有增强性能的多肽(如增加的流体动力学半径或延长的血清半衰期)。交联的附加多肽可以通过偶联一个或多个非交联成分和一个或多个交联成分产生。
这一途径的优势是可以使用高表达的中等长度的附加多肽以高效地产生具有希望的性能的较大分子。例如,可以使用化学偶联产生包含五个200氨基酸长度的单元的分子,这比表达为单个蛋白质的单个1000氨基酸长度的多肽效率高得多。
任何数目的非交联成分,如2、3、4、5、6、7、8、9、10或更多的成分可以连接到一起。些成分可以是相同的或有2、3、4、5、6、7、8、9或10或者更多不同的种类。在优选的实施方式中,各成分具有预定的结合特异性,其对于各成分可以是相同的或是2、3、4、5、6、7、8、9或10种或更多不同的类型。非交联成分的序列也可以相同或可以包含1-10个不同序列。
本发明的优选的实施方式提供单反应性的(monoreactive)非交联成分的1、2、3、4、5、6、7、8或更多副本与一个副本的多反应性交联成分反应,多反应性交联成分任选地包含聚乙二醇、附加多肽或另一水溶性聚合物,从而导致精确地包含(例如)四个副本非交联成分的预定聚合物,各副本与交联剂连接。非交联成分可以包含具有结合特异性的结构域。
可以使用多种连接化学作用进行偶联。在优选的实施方式中,标准的氨基-羧基偶联,且特别是通过赖氨酸基团的或N-末端的氨基连接或通过谷氨酸的或C-末端的羧基连接对于交联的附加多肽的交联是特别有利的。
在某些实施方式中,交联成分可以是合成的多肽。例如,这种多肽可以包含5个羧基残基(即4个谷氨酸加C-末端羧基),任选地被插入羧基之间的序列(‘连接肽’)间隔。该连接肽的氨基端可以封闭,例如通过酰胺化作用,以防止形成另外的变异体(图27)。第二反应基团是包含附加多肽的蛋白质的氨基端。任选地,可以保留一个或多个赖氨酸偶联连接肽中的羧基。在完全化学连接后,可以获得均质的单一产物,其是包含5个附加多肽(任选包含结合域)以及连接肽的分子。一种变化是使得连接肽包含氨基并使用其它蛋白质(其通常携带结合域)上的羧基。
除了这种分支结构,也可能通过连接一个蛋白质的氨基端到另一蛋白质的羧基-末端而产生2、3、4、5、6、7、8或更多单独表达的多肽的线性聚合物。并且,这些多肽可以是或不同的,如上所述。
优选的连接是氨基-羧基。如果使用的羧基位于化学交联剂上,则可用于偶联的氨基位于重组蛋白质上。可选择地,则可用于偶联的氨基位于化学交联剂上,如果使用的羧基位于重组蛋白质上。
交联剂上使用的偶联部位的数目决定了是否产物包含1、2、3、4、5、6、7、8、9或10或更多重组蛋白质,各重组蛋白质通常包含1、2、3、4、5或更多结合域。交联成分通常是小的FDA批准的化学物质,但也可以是重组多肽并任选包含至少0、1、2、3、4、5、6、7、8、9、10、20、30、40、50、75、100单元的重复基序,和最多10、20、30、40、50、75、100、150、200、250、300、350、400、450或500单元的重复基序。
使用可以通过不同条件差示清除的保护基团,有可能进行分别添加不同蛋白质到偶联物上的几个步骤。这允许产生具有按预先设计的化学计量比的多种不同蛋白质链的偶联物。二价交联剂与具有一个可连接位置(如N-末端)的两个蛋白质链的偶联产生二聚体。具有两个连接位点的蛋白质的交联产生线性聚合物。三价交联剂与在两个末端包含连接位点的蛋白质的交联产生枝状大分子(图26)。
在某些实施方式中,非交联成分可以包含一个或多个具有对目标受体的亲和力生物活性多肽。这些生物活性多肽可以结合不同的目标受体,从而允许产生结合几种不同目标受体的几个副本的交联附加多肽。可选择地,非交联成分可以包含多个结合相同目标受体的几个不同表位的生物活性多肽。所得到的交联的附加多肽可以结合多个副本的目标受体同时与各目标受体形成多个结合接触,从而导致非常高的亲合力另一种选择是使用包含多个相同结合元件的非交联成分以构建具有非常大量相同结合位点的交联的附加多肽。
在其它实施方式中,非交联成分可以包含一个或多个附加多肽模块这些rPEG模块赋予所得到的交联的附加多肽大的流体动力学半径并因此低的肾清除率。另外,附加多肽模块提高各种结构域在所得到的交联附加多肽内的运动性。这可以具有多种应用。例如,构象运动性可以允许交联的附加多肽结合靶标(如细胞、组织或传染物)上的多个目标受体,甚至在所述目标受体彼此位置并不接近时也是如此。附加多肽模块也可以用于调节交联的附加多肽的组织分布。例如,可以将附加多肽模块包括在交联的附加多肽中以限制所述交联的附加多肽渗透到健康组织(特征为对大蛋白质具有低渗透性的完整脉管系统)中。
在再其它实施方式中,非交联成分可以包含增加所得到的交联附加多肽的血清半衰期的结合元件。这种结合元件可以结合一种或多种血清成分如HAS、IgG、红细胞或其它高丰度的血清成分。
在又其它实施方式中,非交联成分可以与一个或多个小分子药物分子偶联药物分子的例子是阿霉素、美法仑、紫杉醇、美登素、duocarmycines、刺孢霉素(calicheamycin)、auristatin和其它细胞毒性、细胞抑制性、抗感染药物。
在某些实施方式中,非交联成分可以包含亲和标签。可用的亲和标签的例子是标记(Flag)、HA-标签、六组氨酸。这些亲和标签有助于非交联成分以及所得到的交联的附加多肽的纯化。另外,亲和标签有助于交联的附加多肽在生物样品中的检测。特别地,亲和标签可用于监测血清半衰期和/或交联的附加多肽在患者或动物体内的组织分布。
在其它实施方式中,非交联成分可以包含允许结合域、活性药物或具有生物学活性的其它子序列缓释的蛋白酶位点。
特别有用的是不含赖氨酸残基的非交联成分。这种序列在其N-末端包含单氨基,其可用于偶联交联成分。包含单个游离半胱氨酸残基的非交联成分也是有用的,因为存在许多允许游离半胱氨酸残基的侧链进行可控的偶联的化学作用。另一途径是利用非交联成分的C-末端羧基作为反应基团。
许多包含多个反应基团的分子可以用作有利的交联成分。许多可用的交联剂可从如Sigma-Aldrich或Pierce的公司购得。特别有用的是以活化形式提供并可直接用于偶联的交联成分。其例子示于图22中。交联成分可以包含具有类似或相同化学结构的多个反应基团(图23)。这类反应基团可以同时激活并与多个相同的非交联成分偶联,导致直接形成同源多聚产物。具有多个类似的反应基团的交联成分的例子是柠檬酸、EDTA、TSAT。特别关注的是包含多个相同反应基团的分支的PEG分子。
存在基于以下少量基本反应方案发挥作用的大量特异性化学产品,所有本反应方案在www.piercenet.com上有详细描述。可用的交联剂的例子是亚氨酸酯(imidoester)、活性卤素、马来酰亚胺、吡啶二硫化物和NHS-酯。同型双功能交联剂具有两个相同的反应基团且经常用于单步的化学交联过程中。其例子是BS3(非可切割的水溶性DSS类似物)、BSOCOES(碱可逆的)、DMA(二甲基己二亚氨酸-2HCl)、DMP(二甲基庚二亚氨酸-2HCl)、DMS(二甲基辛二亚氨酸-2HCl)、DSG(DSS的5-碳类似物)、DSP(Lomant’s试剂)、DSS(非可切割的)、DST(可被氧化剂切割)、DTBP(二甲基3,3’-二硫代双丙亚氨酸-2HCl)、DTSSP、EGS、磺基-EGS、THPP、TSAT,DFDNB(1,5-二氟-2,4-二硝基苯)特别用于在小的空间距离之间进行交联(Kornblatt,J.A.和Lake,D.F.(1980).Cross-linking of cytochrome oxidase subunits withdifluorodinitrobenzene.Can J.Biochem.58,219-224).
巯基反应性同型双功能交联剂是与巯基反应的同型双功能蛋白质交联剂且经常基于马来酰亚胺其在pH 6.5-7.5与-SH其反应,从而形成稳定的硫酯键。BM[PEO]3是在巯基-巯基交联应用中降低偶联物沉淀的可能性的8-原子聚酯间隔基。BM[PEO]4是类似的但具有11-原子间隔基。BMB是具有四碳间隔基的非可切割的交联剂。BMDB形成可被高碘酸盐切割的键。BMH是广泛使用的同型双功能巯基反应性交联剂。BMOE具有特别短的连接体。DPDPB和DTME是可切割的交联剂。HVBS不具有马来酰亚胺的水解能力。TMEA是另一种选择。异型双功能交联剂具有两个不同的反应基团。其例子是NHS-酯和经EDC活化的胺/肼、AEDP、ASBA(光反应,可碘化)、EDC(水溶性碳二亚胺)。胺-巯基反应性双功能交联剂是AMAS、APDP、BMPS、EMCA、EMCS、GMBS、KMUA、LC-SMCC、LC-SPDP、MBS、SBAP、SIA(特别短)、SIAB、SMCC、SMPB、SMPH、SMPT、SPDP、磺基-EMCS、磺基-GMB S、磺基-KMUS、磺基-LC-SMPT、磺基-LC-SPDP、磺基-MBS、磺基-SIAB、磺基-SMCC、磺基-SMPB。氨基反应异型双功能交联剂是ANB-NOS、MSA、NHS-ASA、SADP、SAED、SAND、SANPAH、SASD、SFAD、磺基-HSAB、磺基-NHS-LC-ASA、磺基-SADP、磺基-SANPAH、TFCS。精氨酸-反应交联剂是例如APG,其特别地在pH 7-8与精氨酸反应。
多肽可以设计为用途交联成分。这种多肽可以通过化学合成或使用重组技术产生。其例子是包含多个天冬氨酸或谷氨酸残基的多肽。这些残基的侧链以及C-末端羧基可以用于偶联非交联成分。通过在天冬氨酸或谷氨酸残基之间添加一个或几个氨基酸,可以控制反应基团之间的距离,这可以影响偶联的效率以及所得到的交联的附加多肽的整体性能。特别有用的是包含多个天冬氨酸或谷氨酸残基并在其N-末端氨基带有保护基团的多肽。合适的保护方案的例子是乙酰化、琥珀酰化和其它降低肽N-末端氨基的反应性的修饰。
特别用作交联成分的是枝状构建体。许多枝状结构是现有技术中已知的且它们可以设计为包含大量反应基团。交联的附加多肽的例子显示于图24中。
附加多肽的进一步修饰
可以在附加多肽以及交联的附加多肽的设计中采用由具有对血清暴露分子的结合亲和力的肽介导的另外的机制。通过结合这种靶标,本发明多肽的半衰期进一步增加。例如,交联的附加多肽可以包含含有具有对血清暴露分子的结合亲和力的多肽的非交联单元。可选择地,附加多肽可以包含编码具有这种结合亲和力的多肽的序列长度。肽或蛋白质域可以形成结合以实现半衰期延长的优选血清暴露靶标是(人、小鼠、大鼠、猴)血清白蛋白、免疫球蛋白如IgG(IgG 1,2,3,4)、IgM、IgA、IgE以及红细胞(RBC)或内皮细胞。附加多肽也可以包含举例来说,靶向细胞外基质、插入膜中的序列或其它靶向肽和结构域(图28)。
在另一个实施方式中,附加多肽或交联的附加多肽可以包含分隔的多个生物活性多肽以及包含血清蛋白酶的特异性切割位点的序列(图29)。在施用或暴露于血清后,血清蛋白酶作用于切割位点而导致生物活性多肽或附加多肽逐步的蛋白水解并释放到血液中。
附加多肽或交联的附加多肽也可以进行合成后修饰。在一个实施方式中,表达包含一个或多个赖氨酸残基的附加多肽(图30)。在表达后,多肽与连接到至少一个第二功能单元上的Lys-反应部分反应,第二功能单元可以是例如生物活性多肽。在相关的实施方式中,该功能单元是具有对血清暴露靶标(例如,血清白蛋白、免疫球蛋白如IgG(IgG1,2,3,4)、IgM、IgA、IgE以及红细胞(RBC)或内皮细胞)的结合亲和力的多肽。
与抗原结合单元连接的附加多肽
本发明包括与抗原结合单元连接的附加多肽。术语“抗原结合单元”统指免疫球蛋白分子和免疫球蛋白分子的任何形式的免疫活性部分,即,包含特异性结合抗原或与抗原免疫反应的抗原结合位点的分子。结构上,最简单的天然发生的抗体(例如,IgG)四个多肽链,通过二硫键相互连接的两个重(H)链和两个轻(L)链。免疫球蛋白代表包括几种分子类型的一大族分子如IgD、IgG、IgA、IgM和IgE。术语″免疫球蛋白分子″包括例如,杂交抗体可改变的抗体及其片段。抗体结合单元可以大体分成″单链″(″Sc″)和″非单链″(″Nsc″)类型,其包括但不限于Fv、scFv、dFv、dAb、二链抗体、三链抗体、四链抗体、结构域Ab、Fab片段、Fab’、(Fab’)2、双特异性Ab和多特异性的Ab。
术语“抗原结合单元”还包括多物种来源的免疫球蛋白分子,包括无脊椎动物和脊椎动物。应用于抗原结合单元的术语″人″指由人类基因或其片段表达的免疫球蛋白分子。应用于非人(例如啮齿动物或灵长动物)抗体的术语“人源化”是包含源自非人免疫球蛋白的最小序列的杂交免疫球蛋白、免疫球蛋白链或其片段。对于其大部分,人源化抗体是人免疫球蛋白(受者抗体(recipient antibody)),其中来自受者互补决定区(CDR)的残基被来自具有希望的特异性、亲和力和容量的非人物种(如小鼠、大鼠、兔或灵长动物)的CDR(供者抗体)的残基取代。在某些情况中,非人免疫球蛋白的Fv框架区(FR)残基被相应的非人残基取代。另外,人源化抗体可以包含既不在受者抗体也不在输入的CDR或框架序列中发现的残基。进行这些修饰以进一步完善和优化抗体性能和在引入人体时使免疫原性最小化。一般,人源化抗体包含基本上全部的至少一个和通常两个可变域,其中全部或基本上全部CDR区域对应于非人免疫球蛋白的CDR区域且全部或基本上全部FR区域为非人免疫球蛋白序列的FR区域。人源化抗体不可以包含至少一部分免疫球蛋白恒定区(Fc),通常是非人免疫球蛋白的免疫球蛋白恒定区。
″非单链抗原结合单元″是包含轻链多肽和重链多肽的异源多聚体。非单链抗原结合单元的例子包括,但不限于(i)ccFv片段,其是由VL和VH区域构成的二聚体蛋白质,它通过与VL和VH区域框内融合的第一和第二异二聚化序列的成对亲和力二聚化;(ii)包含至少一个ccFv片段的其它任何单价和多价分子;(iii)由VL、VH、CL和CH 1结构域组成的Fab片段;(iv)由VH和CH1结构域组成的Fd片段;(v)由抗体单臂的VL和VH区域组成的Fv片段;(vi)F(ab′)2片段,包含通过在铰链区以二硫桥连接的两个Fab片段的双价片段;(vii)二链抗体和(viii)现有技术中已经描述和已知的其它任何非单链抗原结合单元。
如上所述,非单链抗原结合单元或以是″单价的″或″多价的″。前者每抗原结合单元具有一个结合位点,而后者包含能够结合或不同种类的一个抗原以上的多个结合位点。根据结合位点的,非单链抗原结合单元可以是二价的(具有两个抗原结合位点)、三价的(具有三个抗原结合位点)、四价的(具有四个抗原结合位点)等等。多价的非单链抗原结合单元可以进一步根据其结合特异性划分。″单特异性″非单链抗原结合单元是能够结合相同种类的一个或多个抗原的分子。″多特异性的″非单链抗原结合单元是具有对至少两种不同抗原的结合特异性的分子。尽管这类分子通常仅结合两种明显不同的抗原,具有额外的特异性的抗体如三特异性抗体也包括在本发明中。
“单链抗原结合单元”指单体的抗原结合单元。虽然Fv片段的两个结构域由单独的基因编码,可以通过重组方法制备使得它们以单一蛋白质链形式(即如Bird等(1988)Science 242:423-426和Huston等(1988)PNAS 85:5879-5883中所述的单链Fv(″scFv″))产生的合成连接体。其它单链抗原结合单元包括由所述异二聚化序列稳定化的抗原结合分子及由VH结构域和分离的互补决定区(CDR)组成的dAb片段(Ward等(1989)Nature 341:544-546)。优选的单链抗原结合单元包含连接到一起的并通过一对所述的异二聚化序列稳定的VL和VH区。scFvs可以以任何顺序组装,例如VH-(第一异二聚化序列)-(第二异二聚化序列)-VL或VL-(第一异二聚化序列)-(第二异二聚化序列)-VH。
如果抗原结合单元以比其它参考抗原(包括多肽或其它物质)更高的亲和力或亲合力结合抗原,则抗原结合单元特异性地结合抗原或与抗原免疫反应。抗原结合单元可以直接连接到宿主细胞的外表面或可以通过宿主细胞结合遗传包如噬菌体颗粒间接连接到宿主细胞。
连接抗原结合单元的附加多肽包括,但不限于rPEGs、nrPEGs和任何能够增加流体动力学半径、延长血清半衰期和/或改变体内清除率的其它多肽。当需要时,附加多肽引起预测分子量的小的增加,但表观分子量有较大增加。
本发明的另一实施方式包括在两端连接到结合对(binding pair)上的附加多肽如rPEG。这种结合对一般地由通过rPEG连接的结合蛋白1和结合蛋白2组成。这种结合对的例子包括,但不限于受体-配体对、抗体-抗原对或任何两个能够彼此相互作用的多肽。图82显示了形成这种rPEG连接的结合对的一般方法,其具有无初始活性并因此没有突释效应(提高可以施用的剂量而不引起毒性)和初始受体介导的清除率降低的优势。一般的结合对可以是受体-配体、抗体-配体或通常结合蛋白1-结合蛋白2。体可以具有切割位点,其可以在注射前、注射后(在血清通过蛋白酶)切割并可以定位以使得rPEG与治疗产物末端(活性蛋白质)保持在一起,治疗产物末端可以是配体、受体或抗体。
基于抗体片段的治疗剂(AFBT)
本发明的另一实施方式包括基于抗体片段的治疗剂(AFBT)。AFBT包含至少一个抗原结合单元或抗体片段和一个附加多肽如rPEG结构域。AFBT也可以包含一个或多个有效载荷,其包括具有生物学活性的部分如细胞因子、酶和生长因子,以及可具有治疗能力的物质如细胞毒性剂、治疗剂、抗病毒化合物或造影剂。AFBT也可以包括额外的结构域,例如多聚化结构域如Fc区域或亮氨酸拉链。图58a显示了AFBT的一个例子,其示出了AFBT的主要成分。抗体片段提供对目标抗原具有特异性的AFBT(也一般地在图21中示出)。rPEG结构域对抗体片段以及提供有效载荷多种益处。这些益处包括,但不限于延长的体内半衰期、提高的溶解性、提高的热稳定性、提高的蛋白酶稳定性、改善的蛋白质、减少的链重配(chain reassortment),降低的有效载荷免疫原性和避免对化学PEG的预存免疫应答。rPEG结构域了有助于生产和纯化。rPEG结构域的高溶解性赋予AFBT可以以低的形成聚焦体的倾向在高浓度下配制的高溶解性。应当理解,AFBT可以包含未在该图中特别示出的其它成分。
基于vH/vL结构域的结构
在本发明的一个实施方式中,AFBT还包含一个或多个源自抗体的免疫球蛋白(Ig)结构域或片段,包括单链可变片段(scFv)。scFv由通过vH和vL结构域之间的肽连接体与vL结构域连接的vH结构域组成。选择scFv中的连接体以使得它形成单分子类型,其包括scFv、二链抗体、三链抗体或四链抗体(图53、54、55),其与全长度(即全抗体)(图52)相比。通常所得到的AFBT的配价在一和四之间,虽然不排除更高配价。主要形成单一的均质类型的设计是优选的。Fv片段可以包括接触的vH和vL结构域之间的二硫键以降低结构域重配的风险。可以获得的希望类型的部分在抗体片段混合物的低于1%至100%的范围内。初步控制是连接体长度(其控制形式)和rPEG(其减少抗体片段链重配)。优选的实施方式包括从采用至少12个氨基酸的连接体的单vH-vL链形成单体的scFv。更优选的实施方式包括至少15,至少20,至少30,至少50,至少100,至少200或至少288个氨基酸的连接体长度。特别有用的是优选形成二链抗体的vH-vL链,其需要少于10-20个氨基酸,优选1、2、3、4、5、6、7、8、9或10个氨基酸的连接体(图84)。二链抗体具有两个蛋白质链并可以在一个或两个C-末端和/或一个或两个N-末端具有rPEG。二链抗体具有两个结合位点,其中零个、一个或两个可以结合药物靶标结合结合半衰期靶标(例如HAS、IgG、红细胞、胶原蛋白等)或不与靶标结合。二链抗体可以包含位于蛋白质链的零个、一个或两个N-末端或C-末端的零个、一个或多个药物模块。包含二链抗体的AFBT由于它们的二聚体结构而具有增加的分子量,这降低了肾清除。在一个实施方式中,从一个物种到另一个物种的抗体片段链重配的程度在固定的温度(例如4℃、25℃或37℃)下每天或每周低于蛋白质质量的50%、40%、30%、20%或10%,优选低于5%、2%、1%或0.1%。
在另一个实施方式中,AFBT包括三链抗体,其包含三个多肽链,各包含通过少于10个氨基酸,优选少于5个氨基酸的连接体连接的vH和vL结构域。三链抗体的频率可以通过从vH和vL结构域的一个或两个接合末端消除一个或多个氨基酸而增加,从而缩短该连接序列以使得三链抗体顺利形成。从抗体的一个或两个融合末端除去的残基的数目可以在1-10个氨基酸的范围内。
在再另一实施方式中,AFBT包括四链抗体,其包含四个多肽链,各具有通过少于5个氨基酸的连接体连接的一个vH结构域和vL结构域,或者作为从抗体的一个或两个融合末端除去1-10个残基的结果。可以调整从vH和vL结构域的一个或两个接合末端消除的氨基酸的数目以确保最希望的结果。
由多肽链的单一组成的各种类型的单链(scFv)组合的例子包括但不限于scFv-scFv、scFab-scFc、dAb-scFc、scFc-scFc、scFc-scFab和scFc-dAb(图57)。scFv片段可以在一个或两个N-和/或C-末端与药物模块如IFNα、hGH等融合(图85)。scFv具有一个结合位点,其可以结合或不结合药物靶标,或结合半衰期靶标,例如HSA(图85b)、IgG、红细胞等。
包含Ig结构域的AFBT可以具有多种结构。特别有用的构建体包括,但不限于以下:vL-连接体-vH-rPEG、vH-连接体-vL-rPEG、vL-连接体-vH-rPEG-有效载荷、vH-连接体-vL-rPEG-有效载荷、vL-连接体-vH-有效载荷-rPEG、vH-连接体-vL-有效载荷-rPEG、rPEG-vL-连接体-vH、rPEG-vH-连接体-vL、有效载荷-rPEG-vL-连接体-vH、有效载荷-rPEG-vH-连接体-vL、rPEG-有效载荷-vL-连接体-vH、rPEG-有效载荷-vH-连接体-vL。这些AFBT可以包含可插入结构域之间或rPEG结构域中任何地方的另外的结构域。也可以存在几个有效载荷模块。
接合vH和vL的连接序列可以优化以获得最佳蛋白质折叠和稳定性以及高水平表达和大部分的希望类型。优选的实施方式包括富含甘氨酸和其它小的亲水氨基酸(如丝氨酸、苏氨酸、谷氨酸、天冬氨酸、赖氨酸、精氨酸和丙氨酸)(例如大于50%)的连接序列。rPEG特别适合作为vH和vL结构域之间的连接体。具有改善性能的连接体可以通过库选择或筛选获得。
具有rPEG连接体的scFv
在再另一实施方式中,scFv包含rPEG序列作为vH和vL结构域之间的连接体。优选的实施方式包括含有相当负净电荷的rPEG连接体,这导致scFv结构域的溶解性和折叠得到改善。优选的实施方式包含具有至少15,至少20,至少30,至少50,至少100,至少200或至少288个残基的连接体。
产生稳定AFBT抗体片段的方法
本发明还涉及产生和工程化AFBT的抗原结合单元的方法。许多方法已知产生具有对目标抗原.的特异性的抗体,其例子包括单克隆抗体,特别是产生人抗体的转基因动物;Fab或scFv库的噬菌体展示;核糖体展示和单克隆抗体的人源化。也已描述了对scFv的稳定性进行的多种方法[Worn,A.等(2001)J Mol Biol,305:989]。已经证明,在scFv的vH和vL结构域之间加入二硫键可以导致显著的稳定[Dooley,H等(1998)Biotechnol Appl Biochem 28(Pt 1),77,#2802]。替代方式是引入共有突变(consensus mutation)。已经分析了抗体框架残基中各个不同位置的氨基酸频率。已经证明,玻耳兹曼方程(Boltzmannequation)可以预测某些共有突变的稳定效应[Steipe,B等(1994)J MolBiol 240,188,#2026]。已经描述了允许同时将多个共有突变引入单链抗体片段中的组合方法[Roberge,M.等(2006)Protein Eng Des Sel,19:141]。产生更稳定的抗体片段导致体内靶向作用的改善[Worn,A.等(2000)J Biol Chem,275:2795]。
某些scFv已经以可溶形式在大肠杆菌的细胞溶胶中表达。一般,在细胞溶胶中不形成二硫键,但它们可以在细胞溶解后自动形成[Tavladoraki,P.等(1999)Eur J Biochem,262:617]。一般,抗体的细胞溶胶表达与抗体稳定性非常相关[Worn,A.等(2001)J Mol Biol,305:989]。抗体片段的突变体库可以进行细胞溶胶表达改善的选择[Martineau,P.等(1998)J Mol Biol,280:117]。大肠杆菌的氧化还原工程化的菌株可以用于提高Fab片段的细胞溶胶表达[Levy,R.等(2007)J Immunol Methods,321:164]。已经优化了培养条件以提高可溶性scFv在大肠杆菌细胞溶胶中的表达,导致高达培养物的35mg/L的表达水平[Padiolleau-Lefevre,S.等(2007)Mol Immunol,44:1888]提高scFv的细胞溶胶表达的另一途径是基因组文库的筛选和选择以鉴别有助于表达的伴体或其它因子。这一途径已经使用λ噬菌体评价。scFv中的二硫键已除去以形成细胞内抗体(intrabodies)。可以鉴别这种细胞内抗体的变异体,其导致细胞溶胶表达提高[der Maur,A.A.等(2002)J Biol Chem,277:45075]。但是,二硫键对于大多数抗体片段的整体稳定性是重要的且在大多数情况中细胞内抗体具有有限的作用。
互补决定区(CDR)移植
抗体或抗体片段与其靶标之间的结合相互作用主要由互补决定区(CDRs)决定。已经证明,CDR可以在不同抗体的可变域之间移植[Jones,P.T.等(1986)Nature,321:522]。在许多情况中,除了CDR残基之外还需要移植抗体框架中的其它残基以保持抗原结合。CDR移植可用于通过将来自稳定性较低的可变域的CDR移植为更加稳定的可变域而改善抗体的稳定性。一个例子是来自荧光素结合scFv的CDR移植到用作“支架”的良好表达的scFv中,从而改善表达和提高折叠稳定性[Jung,S.等(1997)Protein Eng,10:959]。CDR移植到抗体片段中的进一步的例子在[Leong,S.R.等(2001)Cytokine,16:106]和[Werther,W.A.等(1996)J Immunol,157:4986]中描述。CDR移植可用于通过移植来自鼠抗体的CDR到人框架残基上而降低抗体在患者体内的免疫原性[Winter,G.等(1993)Trends Pharmacol Sci,14:139]。
AFBT抗原结合单元的亲和力
本发明还包括提高AFBT抗原结合单元的亲和力的方法。已经描述了允许鉴别具有改善的亲和力的抗体和抗体片段的多种方法。例如,Pastan制备了集中在天然倾向于高突变的热点的1000-10000克隆的微型库。噬菌体淘筛产生具有15-55折叠改善的变异体[Chowdhury,PS等(1999)Nat Biotechnol 17,568,#2800]。噬菌体展示和其它展示方法可用于鉴别具有改善的亲和力的抗体片段变异体。不同载体可用于噬菌体展示[Corisdeo,S.等(2004)Protein Expr Purif,34:270]。参与抗原结合的残基可以使用丙氨酸扫描诱变鉴别。随后,这些位置可以作为诱变的靶标以鉴别具有改善的亲和力的变异体[Leong,S.R.等(2001)Cytokine,16:106]。另一策略是可鉴别具有高靶标结合亲和力的抗体片段的CDR步移诱变(walking mutagenesis)[Yang,W.P.等(1995)J Mol Biol,254:392]。改善的亲和力可导致抗体片段的改善的肿瘤选择性[Adams,G.P.等(1998)Cancer Res,58:485]。高亲和力可以限制scFv渗入肿瘤[Adams,G.P.等(2001)Cancer Res,61:4750][Graff,C.P.等(2003)Cancer Res,63:1288]。具有改善的亲和力的抗体片段可以使用酵母展示与FACS分选结合来鉴别[Boder,E.T.等(2000)Proc Natl Acad Sci U SA,97:10701]。
各种IgG结构域
AFBTs可以包含多种免疫球蛋白域。这些结构域可以影响蛋白质表达、多聚化且可以用作效应子。下面的提供用于说明Ig结构域种类的非穷尽的列表可应用于与任何抗体同种型的融合,包括来自任何物种(包括人)的IgG1、IgG2、IgG3、IgG4、IgE、IgM、IgA和IgD。用于rPEG与免疫球蛋白家族序列的融合的位点包括但不限于以下:
·N-末端到CL1结构域,在链间半胱氨酸之前
·N-末端到CL1结构域,在链间半胱氨酸之后
·C-末端到CL1结构域,在链间半胱氨酸之前
·C-末端到CL1结构域,在链间半胱氨酸之后
·N-末端到CH1结构域,在链间半胱氨酸之前
·N-末端到CH1结构域,在链间半胱氨酸之后
·C-末端到CH1结构域,在链间半胱氨酸之前
·C-末端到CH1结构域,在铰链半胱氨酸之前
·C-末端到CH1结构域,在铰链半胱氨酸之后
·N-末端到铰链半胱氨酸
·C-末端到铰链半胱氨酸,在CH2之前
·N-末端到CH2结构域
·C-末端到CH2结构域
·N-末端到CH3结构域
·C-末端到CH3结构域
·N-末端到CH4结构域
·C-末端到CH4结构域
·N-末端到源自CDRH1-3和/或CDRL1-3(λ和κ)的肽
·N-末端到源自CDRH1-3和/或CDRL1-3(λ和κ)的肽
基于Fab结构域的AFBT
本发明的又另一实施方式包括基于Fab结构域的AFBT(图56)。Fab结构域包含两个肽链,各源自抗体的重链和轻链。rPEG和有效载荷及其它结构域可以融合到Fab片段的任一链。可选择地,rPEG和有效载荷可以融合到Fab的两个链。Fab结构域可以设计为利于得到的蛋白质的二聚化,从而最终蛋白质包含四个肽链。下面是包含至少一个Fab结构域的AFBT的列表:
| 轻链 | 重链 |
| vL-CL-rPEG | vH-CH1 |
| vL-CL-rPEG-有效载荷 | vH-CH1 |
| vL-CL-有效载荷-rPEG | vH-CH1 |
| rPEG-vL-CL | vH-CH1 |
| 有效载荷-rPEG-vL-CL | vH-CH1 |
| rPEG-有效载荷-vL-CL | vH-CH1 |
| vL-CL-rPEG | vH-CH1-rPEG |
| vL-CL-rPEG-有效载荷 | vH-CH1-rPEG |
| vL-CL-有效载荷-rPEG | vH-CH1-rPEG |
| rPEG-vL-CL | vH-CH1-rPEG |
| 有效载荷-rPEG-vL-CL | vH-CH1-rPEG |
| rPEG-有效载荷-vL-CL | vH-CH1-rPEG |
| vL-CL-rPEG | vH-CH1-rPEG-有效载荷 |
| vL-CL-rPEG-有效载荷 | vH-CH1-rPEG-有效载荷 |
| vL-CL-有效载荷-rPEG | vH-CH1-rPEG-有效载荷 |
| rPEG-vL-CL | vH-CH1-rPEG-有效载荷 |
| 有效载荷-rPEG-vL-CL | vH-CH1-rPEG-有效载荷 |
| rPEG-有效载荷-vL-CL | vH-CH1-rPEG-有效载荷 |
| vL-CL-rPEG | vH-CH1-有效载荷-rPEG |
| vL-CL-rPEG-有效载荷 | vH-CH1-有效载荷-rPEG |
| vL-CL-有效载荷-rPEG | vH-CH1-有效载荷-rPEG |
| rPEG-vL-CL | vH-CH1-有效载荷-rPEG |
| 有效载荷-rPEG-vL-CL | vH-CH1-有效载荷-rPEG |
| rPEG-有效载荷-vL-CL | vH-CH1-有效载荷-rPEG |
| vL-CL-rPEG | rPEG-vH-CH1 |
| vL-CL-rPEG-有效载荷 | rPEG-vH-CH1 |
| vL-CL-有效载荷-rPEG | rPEG-vH-CH1 |
| rPEG-vL-CL | rPEG-vH-CH1 |
| 有效载荷-rPEG-vL-CL | rPEG-vH-CH1 |
| rPEG-有效载荷-vL-CL | rPEG-vH-CH1 |
| vL-CL-rPEG | 有效载荷-rPEG-vH-CH1 |
| vL-CL-rPEG-有效载荷 | 有效载荷-rPEG-vH-CH1 |
| vL-CL-有效载荷-rPEG | 有效载荷-rPEG-vH-CH1 |
| rPEG-vL-CL | 有效载荷-rPEG-vH-CH1 |
| 有效载荷-rPEG-vL-CL | 有效载荷-rPEG-vH-CH1 |
| rPEG-有效载荷-vL-CL | 有效载荷-rPEG-vH-CH1 |
| vL-CL-rPEG | rPEG-有效载荷-vH-CH1 |
| vL-CL-rPEG-有效载荷 | rPEG-有效载荷-vH-CH1 |
| vL-CL-有效载荷-rPEG | rPEG-有效载荷-vH-CH1 |
| rPEG-vL-CL | rPEG-有效载荷-vH-CH1 |
| 有效载荷-rPEG-vL-CL | rPEG-有效载荷-vH-CH1 |
| rPEG-有效载荷-vL-CL | rPEG-有效载荷-vH-CH1 |
全长抗体
rPEG和有效载荷及其它结构域可以融合到抗体的轻链或重链,或融合到抗体的两个链。下面的表示出了基于全长抗体的AFBT的一些例子:
| 轻链 | 重链 |
| 轻链-rPEG | 重链 |
| 轻链-rPEG-有效载荷 | 重链 |
| 轻链-有效载荷-rPEG | 重链 |
| rPEG-轻链 | 重链 |
| 有效载荷-rPEG-轻链 | 重链 |
| rPEG-有效载荷-轻链 | 重链 |
| 轻链-rPEG | 重链-rPEG |
| 轻链-rPEG-有效载荷 | 重链-rPEG |
| 轻链-有效载荷-rPEG | 重链-rPEG |
| rPEG-轻链 | 重链-rPEG |
| 有效载荷-rPEG-轻链 | 重链-rPEG |
| rPEG-有效载荷-轻链 | 重链-rPEG |
| 轻链-rPEG | 重链-rPEG-有效载荷 |
| 轻链-rPEG-有效载荷 | 重链-rPEG-有效载荷 |
| 轻链-有效载荷-rPEG | 重链-rPEG-有效载荷 |
| rPEG-轻链 | 重链-rPEG-有效载荷 |
| 有效载荷-rPEG-轻链 | 重链-rPEG-有效载荷 |
| rPEG-有效载荷-轻链 | 重链-rPEG-有效载荷 |
| 轻链-rPEG | rPEG-重链 |
| 轻链-rPEG-有效载荷 | rPEG-重链 |
| 轻链-有效载荷-rPEG | rPEG-重链 |
| rPEG-轻链 | rPEG-重链 |
| 有效载荷-rPEG-轻链 | rPEG-重链 |
| rPEG-有效载荷-轻链 | rPEG-重链 |
| 轻链-rPEG | 有效载荷-rPEG-重链 |
| 轻链-rPEG-有效载荷 | 有效载荷-rPEG-重链 |
| 轻链-有效载荷-rPEG | 有效载荷-rPEG-重链 |
| rPEG-轻链 | 有效载荷-rPEG-重链 |
| 有效载荷-rPEG-轻链 | 有效载荷-rPEG-重链 |
| rPEG-有效载荷-轻链 | 有效载荷-rPEG-重链 |
| 轻链-rPEG | rPEG-有效载荷-重链 |
| 轻链-rPEG-有效载荷 | rPEG-有效载荷-重链 |
| 轻链-有效载荷-rPEG | rPEG-有效载荷-重链 |
| rPEG-轻链 | rPEG-有效载荷-重链 |
| 有效载荷-rPEG-轻链 | rPEG-有效载荷-重链 |
| rPEG-有效载荷-轻链 | rPEG-有效载荷-重链 |
全长抗体或本文中定义的抗体片段上的特定位点是优选的rPEG与全长抗体(包括IgG1、2、3、4、IgE、IgA、IgD和IgM)或抗体片段的融合位点。这些优选的位点处于结构化序列的边界,如结构域、铰链等,而不干扰这些功能域的折叠。rPEG可以在1、2、3、4、5、6、7或甚至8个不同的位置加到抗体上(且对于IgM和IgG3超过8个)且单个抗体可以在不同的位置和以图103中所示的8个位置的任意组合具有1、2、3、4、5、6、7、8或更多rPEG。图103e显示了rPEG与抗体结构域和片段的优选的融合位点。
基于域抗体的AFBTs
在再另一实施方式中,rPEG和有效载荷及其它结构域可以与域抗体(dAb)融合。为产生具有合适的结合选择性的域抗体,可以使用在骆驼和鲨鱼的免疫组库中发现的天然单体vH结构域(称为vHH),其天然地缺乏轻链[Hamers-Casterman,C.等(1993)Nature,363:446]。可选择地,可以对人vH或vL结构域的vH-vL界面进行工程化以改善溶解性并减少二聚化和聚集。这种突变具有提高所得到的域抗体的免疫原性的风险。本发明描述了将人vH或vL Ig结构域与rPEG融合,这改善了溶解性和折叠、减少了聚集且还不诱导由人框架残基的突变触发的免疫应答。基于dAb结构域的AFBT的例子包括,但不限于dAb-rPEG、dAb-rPEG-有效载荷、dAb-有效载荷-rPEG、rPEG-dAb、有效载荷-rPEG-dAb、rPEG-有效载荷-dAb。dAb结构域可以源自抗体分子的vH或vL结构域。
多特异性的AFBTs
本发明还包括包含源自具有不同结合特异性的多种不同抗体的片段的AFBT。一个例子显示于图58b中。这种AFBT组合了两种或多种母本抗体的结合特异性。可以选择母本抗体以使所得到的AFBT结合多个不同目标抗原。可选择地,母本抗体可以结合相同目标抗原的不同表位。如果AFBT可以通过结合同一目标抗原上的多个位点形成多价的相互作用,则它们非常牢固地结合靶标,如图59中所示。多特异性的AFBT可形成相同蛋白质链的多聚体。例如,图58b显示了作为包含基于vH-vL链A的两个结合位点和基于vH-vL链B的两个另外的结合位点的两个多肽链的二聚体的多特异性AFBT。本领域技术人员可以理解产生包含许多不同结合域或结合模块的组合的多特异性的AFBT的可能性。除了不同的可变域外,多价的AFBT可以包括一个或多个有效载荷结构域、rPEG模块和可以选择以增强功效或生产和纯化的其它蛋白质域。一个实施方式包括与涉及相同疾病症状、相同病原体或病因相同或者相同的生理路径或过程的多个目标抗原相互作用的多特异性的AFBT。这种多特异性的AFBT的例子包括但不限于阻断参与相关生物过程的多种细胞因子的多特异性AFBT。优选的实施方式包括阻断参与生管生成的多种生长因子(如VEGF、PDGF和PIGF)的多特异性AFBT。图95显示了两侧与VEGF-受体相邻的rPEG。由于VEGF是二聚体的,它可以在rPEG的两侧是相同的受体或不同的受体,优选VEGF-R1和VEGF-R2,但VEGFR3也可以使用。另一优选的实施方式包括阻断参与炎性疾病的多种细胞因子(如TNF-α、IL-1、IL-6、IL12、IL-13、IL17和IL-23)的多特异性的AFBT。再另一优选的实施方式包括结合多种肿瘤抗原(如Her1、Her2、Her3、EGFR、TF抗原、CEA、A33、PSMA、MUC1、αv/β3整联蛋白、αv/β5整联蛋白和α5/β1整联蛋白)的多特异性的AFBT。又另一优选的实施方式包括结合与传染性疾病相关的多种抗原的多特异性AFBT。所述多特异性的AFBT可以与传染物形成多价的相互作用,从而导致治疗效果的改善。多特异性的AFBT可以进行工程化以包含肿瘤抗原的结合位点和免疫细胞上的抗原的结合位点。例子包括结合肿瘤抗原和可以募集和激活自然杀伤(NK)细胞的CD3或CD 16的AFBT。为进一步提高效能,可以诱导细胞因子结构域如IL-2以激活肿瘤细胞附近的免疫细胞。
包含相同抗体的多个片段的AFBT
AFBT可以进行工程化以使得各多肽链包含相同母本抗体的多个可变片段。这些片段可以相同或它们可以进行工程化以利用正确的结构域装配。一个例子显示于图60a中。这一AFBT包含二链抗体结构域和基于相同母本抗体的单价的scFv结构域。结果,AFBT组装成包含总共4个等价靶标结合位点的二聚体结构。这种多价的AFBT可以由于亲合力而具有改善的效能。
基于二链抗体的双特异性AFBT
可以构建AFBT以组合一个二链抗体和可变域及至少一个rPEG结构域。该构建体形成二聚体包含总共4个抗原结合位点。图58b显示了双特异性AFBT的例子。在这种构建体中的可变域A可以是scFv结构域或dAb结构域。可变域A可以在二链抗体域B的C-末端侧。可选择地,可变域A可以在二链抗体域B的N-末端侧。双特异性AFBT可以包含另外的rPEG结构域或其它结构域如激素、细胞因子或酶。如果中双特异性AFBT的可变域是scFv结构域,该scFv结构域可以具有结构vH-连接体-vL或结构vL-连接体-vH。
在优选的实施方式中,双特异性AFBT包含二链抗体B和scFvA,其中二链抗体和scFv结构域经优化以减少这些构建体中的4个Ig结构域的不正确配对。结构域可以优化以使得vL-A和vH-A以及vL-B和vH-B形成比不正确配对vL-A和vH-B及vL-B和vH-A更紧密的相互作用。这可以通过选择vH和vL结构域两者的框架以使得scFv结构域A的vH/vL接触表面与二链抗体域B的vH/vL接触表面具有显著差异而完成。可以通过工程化scFv结构域A和二链抗体域B的vH/vL接触区域则进一步增强这些差异,从而使发生不希望的接触的可能最小化。例如,可以设计电荷差异以使得形成用于正确vH/vL配对的离子对,但在双特异性AFBT中的vH和vL结构域不正确配对的过程中不能形成相同的离子对。另一途径是将氢键伴体引入不能形成vH和vL结构域不正确配对的希望的vH/vL接触表面中。再另一途径是改变接触vL/vH接触表面的形状以使得不正确的vL/vH配对不稳定。
基于二链抗体的双特异性AFBT是特别有用的,因为它们每二价复合物包含两个rPEG结构域这导致肾过滤降低和体内半衰期提高。AFBT可以进行工程化以每多肽链包含二链抗体域和两个额外的可变域。这种蛋白质可以形成包含总共6个抗原结合位点的二聚体复合物。其它的可变片段或有效载荷结构域可以加入以提高效能。包含有效载荷的二聚体的AFBT
图60b显示了包含二链抗体域和有效载荷结构域的二聚体AFBT。这种蛋白质形成二聚体的复合物以使得各复合物包含两个靶标结合位点、两个rPEG和两个有效载荷结构域。另外的蛋白质域可以加入以提高效能。每蛋白质复合物具有两个rPEG降低肾过滤并增加体内半衰期。具有两个有效载荷结构域提高了效能。二链抗体域的靶标结合位点可以进行工程化以进一步通过结合血液的成分(如红细胞、人血清白蛋白、IgG、胶原蛋白或其它蛋白质)或血液中的细胞增加体内半衰期。
结合抗体片段和有效载荷
本发明还包括包含一个或多个有效载荷的AFBT。一个优选的实施方式包括作为蛋白质域且可直接与包含AFBT的其它结构域融合的有效载荷。这种有效载荷结构域的例子包括,但不限于细胞因子、激素、生长因子和酶。这种AFBT结合抗体的特异性和有效载荷的效力,而rPEG结构域提供半衰期并利用生产和配制。另一优选的实施方式包括组合具有对特定组织的特异性的抗体片段和在相同组织中发挥活性的有效载荷的AFBT。一个例子包括与细胞抑制性或细胞毒性有效载荷结合的对肿瘤具有特异性的抗体片段。另一个例子包含与抗感染有效载荷结合的对感染的细胞或传染物具有特异性的抗体片段。再另一种可用的组合包含与具有抗炎活性的有效载荷结合的对发炎组织具有特异性的抗体片段。可以连接附加多肽的抗体包括,但不限于阿昔单抗(abciximab)、阿达木单抗(adalimumab)、阿伦单抗(alemtuzumab)、巴利昔单抗(basiliximab)、贝伐单抗(bevacizumab)、西妥昔单抗(cetuximab)、达克珠单抗(daclizumab)、艾库组单抗(eculizumab)、依法珠单抗(efalizumab)、替伊莫单抗(ibritumomab,tiuxetan)、英夫利昔单抗(infliximab)、莫罗单抗(muromonab)-CD3、那他珠单抗(natalizumab)、奥马珠单抗(omalizumab)、帕利珠单抗(palivizumab)、帕尼单抗(panitumumab)、兰尼单抗(ranibizumab)、吉妥单抗(gemtuzumab ozogamicin)、利妥昔单抗(rituximab)、托西莫单抗(tositumomab)、曲妥单抗(trastuzumab)和对抗原特异性的任何抗体片段包括补体C5、CBL、CD147、IL8、gp120、VLA4、CD11a、CD18、VEGF、CD40L、抗-Id、ICAM1、CD2、EGFR、TGF-β2、TNFα、E-选择蛋白、FactII、Her2/neu、F gp、CD11/18、CD14、CD80、ICAM3、CD4、CD23、β2-整联蛋白、α4β7、CD52、CD22、HLA-DR、CD64(FcR)、TCR αβ、CD3、Hep B、CD125、EpCAM、gpIIbIIIa、IgE、CD20、IL5、IL4、CD25、CD33、HLA、F gp和VNR整联蛋白。
酶可以用作肿瘤特异性AFBT的有效载荷。可以选择酶以从肿瘤环境中消除需要的营养物或代谢产物,如天冬酰胺酶、精氨酸酶、组氨酸酶或蛋氨酸酶。可选择地,可以利用发挥细胞毒性活性的酶。一个例子包括包含肿瘤特异性抗体片段和在内化到细胞中时诱导细胞凋亡的RNA酶的AFBT。
可用于抗癌、抗细菌和/或抗炎治疗剂中的有效载荷包括毒素,如假单胞菌外毒素、篦麻毒素、肉毒杆菌毒素和其它植物或细菌毒素。其它生物毒素包括,但不限于相思豆毒素、气单胞菌溶素(aerolysin)、肉毒杆菌毒素A,B,C1,C2,D,E,F、b-银环蛇毒素、蓝环蛇毒素(Caeruleotoxin)、Cereolysin、霍乱毒素、芽胞杆菌肠毒素A和B、魏氏杆菌卵磷脂酶、魏氏杆菌κ毒素、魏氏杆菌溶血素(perfringolysin)O、魏氏杆菌肠毒素、魏氏杆菌β毒素、魏氏杆菌δ毒素、魏氏杆菌ε毒素、芋螺毒素(Conotoxin)、响尾蛇毒素、白喉毒素、李斯德氏菌细胞溶素(Listeriolysin)、杀白细胞素、蒴莲根毒素(Modeccin)、刺丝囊(Nematocyst)毒素、虎蛇毒素、百日咳毒素、肺炎球菌溶血素、绿脓杆菌毒素A、石房蛤毒素、志贺(氏)毒素(Shiga toxin)、痢疾杆菌神经毒素、链球菌溶血素O、葡萄球菌肠毒素B和F、链球菌溶血素S、泰攀蛇毒素、破伤风毒素、河豚毒素、Viscuminm、蒴莲素(Volkensin)和鼠疫耶尔森氏菌鼠毒素。
可以选择有效载荷以消除毒性代谢产物。其例子是用于治疗痛风的尿酸氧化酶和用于治疗苯丙酮酸尿症的苯丙氨酸解氨酶。有效载荷可以包含化学偶联的小分子。这种有效载荷可以偶联AFBT,从而产生半合成的AFBT。半合成AFBT的蛋白质部分可以进行工程化以利于通过完全结合控制化学偶联,如图61中所示。蛋白质部分可以进行工程化以具有限定数目的偶联部位。这使得能够使用超过偶联部位浓度的偶联试剂,从而结合效率可以接近于完全,这导致特定的偶联产物,可用的偶联部位可以是氨基。这种半合成AFBT的蛋白质部分可以进行工程化以使得抗体片段中的全部或大部分赖氨酸残基被与折叠和靶标结合相容的其它残基取代。在许多蛋白质中,可以用精氨酸、谷氨酸、天冬氨酸、丝氨酸、苏氨酸或另一氨基酸取代赖氨酸残基。指定的偶联部位可以引入rPEG结构域中或该蛋白质的任何其它蛋白质部分中。另外,各蛋白质链的N-末端可以用作偶联位点。半胱氨酸残基也可以用作偶联位点。可以与AFBT偶联的示例性有效载荷包括细胞毒性药物如阿霉素、auristatin、美登素和可以与具有肿瘤特异性抗体片段的AFBT融合的相关分子。其它用于偶联的感兴趣的有效载荷包括可用放射性核素标记以产生显象剂或用于放射治疗的AFBT的抗病毒化合物、成像试剂和螯合剂。
rPEG尾中的硫醇基
本发明的另一实施方式包括包含具有一个或多个半胱氨酸残基的rPEG序列的AFBT。这些半胱氨酸侧链可以在注射到患者体内后与其它蛋白质形成二硫桥。这些二硫桥可以导致体内半衰期增加。在其它实施方式中,形成二硫键可导致AFBT在注射部位停留延长,从而得到缓释PK特征。包含游离半胱氨酸的AFBT也可以进行工程化以提高口服、鼻内和皮内施用的AFBT的生物利用度。这可以通过与上皮细胞表面的蛋白质形成二硫桥实现,从而导致AFBT吸收增强。
rPEG中的RGD-肽
AFBT也可以包含一个或多个已知与整联蛋白以及细胞外基质的成分相互作用的RGD序列或相关序列。这些RGD-相关序列可以邻接半胱氨酸残基以产生二硫键介导的环化。可选择地,RGD-相关序列可以邻接选择为增强与特定整联蛋白相互作用的亲和力和/或特异性的另外的氨基酸。一个优选的实施方式包括包含RGD序列并与在多种肿瘤细胞上过表达的整联蛋白αvβ3、αvβ5、α5β1相互作用的AFBT。
增加半衰期的抗体片段
本发明也包括包含增加AFBT体内半衰期的抗体片段的AFBT。这可以通过并入与具有长体内半衰期的靶标结合的抗体片段实现。这种增加体内半衰期的靶标的例子包括但不限于血清蛋白质,特别是血清白蛋白、免疫球蛋白和其它高丰度蛋白质。AFBT也可以引入对血液细胞或血管壁具有特异性的抗体片段。特别关注的是红细胞(RBC),其是极丰富的,具有4个月的平均寿命和特征在于最小代谢活性。AFBT可以工程化以结合RBC表面上的蛋白质。优选的实施方式包括结合血型糖蛋白A的AFBT,其在RBC表面上以高丰度表达。AFBT可以进行工程化以结合可以在体内与AFBT接触的任何细胞表面靶标,从而导致AFBT停留时间延长。另一实施方式包括结合细胞外基质(ECM)成分的AFBT。ECM包含许多蛋白质,包括但不限于集聚蛋白、α弹性蛋白(elstin)、amisyn、bestrophin、胶原蛋白、接触蛋白1、CRIPT、drebrin、内动蛋白、胎球蛋白A、HAS3、HCAP-G、多配体聚糖、KAL1、1Afadin、层粘连蛋白、Mint3、MMP24、NCAM、神经蛋白聚糖(neurocan)、巢蛋白2、optimedin、前胶原IIA型、PSCDBP、络丝蛋白(reelin)、SIRP、突触结合蛋白(synaptotagmin)、synCAM、多配体聚糖、互生蛋白(syntrophin)、TAG 1、腱生蛋白C和斑联蛋白(zyxin)。再另一实施方式包括包含结合FcRn受体的抗体片段的AFBT,这导致内吞AFBT的再循环。其例子包括与FcRn pH依赖性结合的抗体片段,其中抗体片段在大致中性pH以低亲和力结合FcRn但在低pH(例如pH 5,这是主要在溶酶体区中发现的pH范围)以高亲和力结合FcRn。提供增加的半衰期的AFBT显示于图58a和60b中。应当注意,其它结构可以设计为包含有效载荷结构域和提供半衰期延长的抗体片段。
本发明还包括包含与rPEG融合的Fc片段的融合蛋白质。图83显示了在N-末端具有药物模块随后是与抗体Fc片段融合的rPEG,具有或没有铰链。Fc片段提供长的半衰期且rPEG允许Fc片段在大肠杆菌胞质中以可溶溶和活性形式表达。在另一个实施方式中,具有或没有铰链区的抗体Fc片段任选地与药物模块(例如IFNa、hGH等)在一个末端融合并任选地在在另一端与rPEG融合。CH2和CH3之间的序列与FcRn(神经元Fc受体)的结合(图90)。再另一实施方式包括蛋白质包含一对CH3结构域的构建体(图91)。两个多肽链中的零个、一个或两个可以与rPEG在N-末端和/或C-末端融合并在在另一端与零个、一个或多个药物模块融合。FcRn结合序列可以保留或除去。保留FcRn结合序列产生了更长的血清半衰期。又另一实施方式描述了在C-末端与具有位于C-末端的药物/药效团的rPEG融合作为全Fc的蛋白质,包括CH2和CH3结构域(有或没有铰链)(图92)。这些分子能够进行多肽链交换,产生异质二聚体。再另一实施方式描述了截短但保持FcRn结合和具有位于C-末端的药物/药效团不具有铰链而具有CH2结构域的部分Fc(图93a)。图93b显示了不具有铰链和CH2结构域但保留CH3结构域和具有位于C-末端的药物/药效团的部分Fc。这种Fc片段不结合FcRn但可以通过CH3结构域二聚化。
又另一实施方式采用N-末端药物模块,接着是rPEG和具有铰链的C-末端Fc片段(图101)。这是可以在大肠杆菌胞质中产生的用于延长药物模块半衰期的有利形式。本文中描述了用于包含Fc片段的前药的替代形式(图102)。这种形式类似于在图101描述的形式,添加了结合和抑制药物序列的抑制性序列。药物通过切割位点与抑制性序列分隔。N-末端抑制性结合序列之后是切割位点,这之后是药物序列。切割前,前药结合抑制性序列并因此是无活性的。在切割后,抑制性结合序列逐步释放并清除,逐渐增加药物活性的时间量。用于评价与rPEG融合的Fc片段的正确折叠的分析方法(包括用于铰链二硫键形成的SDS-PAGE和用于CH3二聚化的尺寸排阻色谱法)示于图104中。
导致缓释的抗体片段
AFBT可以进行工程化以从注射部位缓慢释放,从而导致长期的药物接触。本发明的一个实施方式包括引入结合在注射部位以高丰度表达的分子的抗体片段。例如,这种抗体片段可以结合目标抗原,包括但不限于胶原蛋白、透明质酸、硫酸乙酰肝素、层粘连蛋白、弹性蛋白、硫酸软骨素、硫酸角质素、纤连蛋白和整联蛋白通过对抗体片段与目标抗原的亲和力和/或亲合力进行设计,AFBT从注射部位的释放率可以得到控制。另一实施方式包括引入一个或多个可以在注射部位被蛋白酶切割的蛋白酶位点以控制AFBT在注射部位释放速度。
影响组织分布的抗体片段
本发明还包括整合了与存在于特定细胞或组织或者特定的系列组织中的目标抗原结合的抗体片段的AFBT。这些构建体可以通过实现AFBT的局部组织特异性的聚集而提高活性药物的治疗窗口。其例子包括包含具有对在肿瘤组织或肿瘤微环境(如肿瘤脉管系统)中过表达的肿瘤抗原特异性的抗体片段的AFBT。可以选择有效地被细胞内化的肿瘤抗原作为包含具有细胞内活性的有效载荷的AFBT的靶标。例如,AFBT包含具有对能够成结合时内化的肿瘤抗原具有特异性的抗体片段和细胞毒性有效载荷。其它例子包括具有病毒靶标特异性的AFBT。
胶原结合域(CBDs)
本发明的另一实施方式包括CBD作为结构域在AFBT和其它蛋白质药物中的用途。胶原蛋白在许多组织中特别是在细胞外空间中是非常丰富的。包含CBD的蛋白质药物可以在注射部位或在注射部位附近结合胶原蛋白,从而形成AFBT然后缓慢释放的储库形式。释放速度可以通过引入蛋白酶位点或通过选择具有与胶原蛋白的适当亲和力的CBD进行控制。通过选择具有与胶原蛋白的低亲和力的CBD,AFBT的释放速度增加。可选择地,AFBT的释放速度可以通过以非常高亲和力结合胶原蛋白的CBD或通过包括多个CBD在AFBT中以获得亲合力布减缓。CBD序列可以从天然发生的CBD获得。结合胶原蛋白和包含CBD的蛋白质的例子包括,但不限于整联蛋白,特别是α1β1整联蛋白、α2β1整联蛋白、αvβ3整联蛋白、血管生成抑制剂、胶原蛋白V、C-蛋白酶、核心蛋白多糖、纤连蛋白、白介素-2、基质金属蛋白酶1,2,9和13、磷蛋白、凝血栓蛋白、双糖链蛋白多糖、胆红素、BM40/SPARC、MRP8、MRP-14、来自水蛭的、DDR1、DDR2、纤维调节素、Gla蛋白质、糖蛋白46、热震蛋白质47、内腔蛋白、髓磷脂相关糖蛋白、血小板受体、金黄色葡萄球菌表面分子和其它微生物粘附分子、多配体聚糖-1、腱生蛋白-C、玻璃粘连蛋白、血管假性血友病因子(von Willebrand factor)和因子XII。结合胶原蛋白和包含CBD的蛋白质的其它例子列于[Di Lullo,G.A.等(2002)JBiolChem,277:4223]中。来自天然蛋白质的CBD可进一步工程化以提高其治疗功效和改善它们的稳定性。含CBD的蛋白质的免疫原性可以通过除去被B和/或T细胞识别的表位而降低。CBD序列也可以优化以蛋白质最大化生产和/或改善蛋白质溶解性。
尾部中的HSA-结合肽
包含增加体内半衰期的肽序列的AFBT也可以通过利用结合血清蛋白质或血液细胞表面的肽序列获得。其例子包括结合人血清白蛋白(HSA)的肽序列。这种序列可以通过随机肽序列的噬菌体展示或筛选途径的类似选择获得。AFBT可以包含一个或多个,相同或不同的,这种肽序列的副本。
目标抗原
本发明的再另一实施方式包括结合与治疗或诊断相关的目标抗原的抗体片段。图87显示了结合细胞表面靶标的Fab片段。在VH与CH结构域之间和VL与CL结构域之间,天然连接体的长度从通常的2-6氨基酸延长到4-100或更多氨基酸提高了一个Fab通过结构域交换交联另一个Fab的能力,从而形成具有更高效价的结合复合物,导致更高的表观亲和力(亲合力)。连接体可以是rPEG或不同的组合物。延长的连接体形式允许以更高的亲和力在具有更高密度靶标的部位特异性地结合。AFBT的抗体片段可以血液成分结合以增加AFBT在循环系统中的半衰期。AFBT的抗体片段也可以结合利于溶酶体循环的受体。一个例子是可以在溶酶体摄取后再输出蛋白质的FcRn受体。特别关注的是以空间或时间依赖性的亲和力与利于溶酶体循环的受体结合的抗体片段,从而该抗体片段在溶酶体中存在的条件下以高亲和力结合,但细胞表面的条件下以低亲和力与相同受体结合。AFBT的抗体片段可以结合主要在疾病相关组织中存在的目标抗原。结果,这些AFBT可以积聚在特定疾病相关组织中。其例子包括结合肿瘤组织或病毒感染组织的AFBT。AFBT的抗体片段可以结合有助于在疾病相关组织中的细胞内化的目标抗原。AFBT的抗体片段也可以结合有助于AFBT吸收到身体的特定腔室中的目标抗原,例如,利于AFBT的口腔、鼻、粘膜或肺摄取的目标抗原和利于AFBT的跨血脑屏障转运的目标抗原。特别感兴趣的目标抗原的例子包括,但不限于IL1、IL4、IL6、Il12、IL13、IL17、IL23、CD22、BAFF和TNFα。
AFBT中rPEG的优势
AFBT结合了rPEG和抗体片段的有利特性。AFBT的rPEG部分导致低的AFBT整体免疫原性。这通过用rPEG空间屏蔽AFBT的抗体片段和其它潜在免疫原性部分实现。rPEG是高度柔性的且因此它们缺乏构象表位。由于其高亲水性和高熵,rPEG具有非常低的内在免疫原可能潜力。
AFBT的rPEG也导致其它AFBT结构域的稳定性。由于其亲水特性,rPEG结构域减少AFBT的聚集。这极大地简化了AFBT制剂开发。另外,rPEG的空间屏蔽保护了AFBT的其它部分免于疏水水解。这对于易于发生蛋白水解性降解的有效载荷和抗体片段是特别重要的。
在全长抗体上使用AFBT的另一优势是与全长抗体相关的不希望的效应子功能的最小化或消除。全长抗体分子具有多种显著限制其用于适应症(其中效应子功能是不希望的)的治疗用途的效应子功能如抗体依赖性细胞介导的细胞毒性(ADCC)以及补体激活(CDC)。例如,许多适应症需要结合和隔绝分子(如细胞因子或激素)的物质。一般不希望利用对于这类适应症的,因为它们的效应子功能产生不希望的毒性。抗体许多依赖性效应子功能通过Fc部分介导。在本文描述的许多实施方式中,AFBT利用负责靶标结合的抗体可变域而取代负责效应子功能的Fc。AFBT可以工程化以结合和激活细胞表面受体如死亡受体DR4和DR5。活化可以通过受体多聚化实现。虽然全长抗体能够激活这些受体,也诱导由与表达相同目标受体的健康细胞结合的抗体引起的毒性。AFBT可以激活细胞表面受体而不引发引起毒性的效应子功能。
rPEG的再另一优势是它有助于缔合属于相同复合物的两个蛋白质,如图86中所示。这种蛋白质之间的亲和力通常不足以保持它们缔合,但加入rPEG稳定了它们的相互作用并降低它们形成聚合物的倾向。
AFBT的制备和产生
本发明还涉及AFBT的产生。AFBT中的rPEG结构域有助于蛋白质折叠并降低蛋白质聚集。这一性能有助于AFBT的微生物生产。大多数文献中描述的抗体片段需要从包含体重折叠或分泌到周质空间中,这导致低的产量。相反,大多数AFBT可以以可溶形式在微生物表达宿主的细胞溶胶中以高浓度产生。优选的用于AFBT的表达宿主是大肠杆菌(图45)。但是,AFBT的性能使得它们适合于在大多数微生物以及真核表达系统中表达。AFBT的N-末端序列可以优化以控制翻译后加工。特别是,紧随起始密码子的氨基酸可以确定N-末端甲硫氨酸的后续加工[Hirel,P.H.等(1989)Proc Natl Acad Sci U SA,86:8247]。一个实施方式包括产生均一产物的N-末端序列。通过选择gly、ala、pro、ser、thr或val作为紧随N-末端met的氨基酸,可以实现N-末端met的有效加工和去除。另一实施方式包括his、gln、glu、phe、met、lys、tyr、trp或arg作为紧随N-末端met的氨基酸,这阻止N-末端met除去并产生均质的产物。AFBT也利于在高蛋白质浓度条件下的重折叠,而大多数未修饰蛋白质产生聚集体。rPEG在制备AFBT的过程中的优势是重要的,因为AFBT包含多个具有形成聚集体倾向的蛋白质域。这些蛋白质域可以在AFBT中被rPEG序列分隔以在折叠过程中使得单个蛋白质域之间的聚集最小化。疾病相关和/或患者特异性AFBT的产生和生产
本发明还包括产生和生产疾病相关的AFBT,即与附加多肽如rPEG融合的抗体片段。抗体基因可以直接从感染的或以别的方式暴露的患者中分离[Wrammert,J.等(2008)Nature]。各种形式的与rPEG融合的抗体片段可以迅速地由这种抗体基因产生。所得到的融合蛋白质可以使用标准方案制备和纯化,而能够快速产生疾病相关的AFBT。这类方法的一个例子示于图68中。快速发现过程使得能够应对急性疾病爆发如细菌或病毒感染而找到和准备特别的治疗。在抗体片段和rPEG之间快速产生融合蛋白质也使得能够产生患者特异性的治疗,这包括但不限于从患者分离免疫细胞,从免疫细胞克隆疾病特异性的抗体基因,构建和后续生产抗体片段-rPEG融合体(即疾病相关的AFBT)和治疗患该疾病的患者。
多克隆和多功能AFBT
本发明还涉及包含超过一种AFBT的药物组合物。这种AFBT混合物的组合可以具有相对于单个AFBT更高的性能。基于AFBT的产物可以是多功能,从而它们包含两个、三个或更多确定的AFBT。可选择地,AFBT可以是包含多个AFBT的多克隆。这种多克隆AFBT可以通过克隆来自富集具有有利特异性的抗体或抗体片段的来源的抗体片段。一个例子是克隆来自感染患者的抗体片段组库。另一个例子包括通过对目标靶的淘筛而富集的展示库。
rPEG融合产物
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的人生长激素(hGH)或人生长激素受体(hGH-R)基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的本领域技术人员公知的标准技术诱导并使用标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:成人生长激素缺乏、小儿生长激素缺乏、特纳综合征、慢性肾衰竭、特发性矮小(idiopathic short stature)、移植后生长障碍(post-transplant growthfailure)、低磷酸盐血症性佝偻病(hypophosphatemic rickets)、炎性肠病、努南综合征、小儿乳糜泄、AIDS消瘦、肥胖、老化或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的人生长激素片段176-191或177-191基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:成人生长激素缺乏、小儿生长激素缺乏、特纳综合征、慢性肾衰竭、特发性矮小、移植后生长障碍、低磷酸盐血症性佝偻病、炎性肠病、努南综合征、小儿乳糜泄、AIDS消瘦、肥胖、老化或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的艾塞那肽基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:II型糖尿病或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。由于艾塞那肽的N-末端对保持体内效力的敏感性,在重组体表达和纯化时需要特别考虑保持天然N-末端结构,且优选的实施方式包含rPEG与艾塞那肽序列C-末端的融合。可以采用在体外或体内被蛋白酶切割的N-末端前导序列以提高的生产率和/或改善活性分子在体内的递送。替代策略包括突变艾塞那肽的内部甲硫氨酸为相容的氨基酸(例如亮氨酸,其存在于GLP-1序列中的相应位置上)并使用溴化氰或类似化学方法除去N-末端前导序列以产生天然艾塞那肽N-末端。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的GLP-1基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:II型糖尿病或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。由于GLP-1的N-末端对保持体内效力的敏感性,在重组体表达和纯化时需要特别考虑保持天然N-末端结构,且优选的实施方式包含rPEG与GLP-1序列C-末端的融合。可以采用在体外或体内被蛋白酶切割的N-末端前导序列以提高的生产率和/或改善活性分子在体内的递送。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的IL 1-RA基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:风湿性关节炎、银屑病关节炎、牛皮癣、炎性肠病、克罗恩病或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的干扰素α、β或γ基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:毛细胞白血病、AIDS相关卡波氏综合征、pH染色体阳性CML、慢性丙型肝炎、尖锐湿疣、慢性乙型肝炎、恶性黑素瘤、滤泡性淋巴瘤、多发性硬化、非霍奇金淋巴瘤、骨硬化病、慢性肉芽肿病-相关感染、耐多药肺结核或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的G-CSF基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:化疗引起的发热性中性粒细胞减少症(febrileneutropenia)、骨髓移植、先天性中性白细胞减少症(congenitalneutropenia)、周期性中性白细胞症减少症(cyclic neutropenia)、特发性中性白细胞症减少症(idiopathic neutropenia)、AIDS相关中性白细胞症减少症、骨髓发育异常综合征或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的FGF21基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:糖尿病、肥胖或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的降血钙素基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:绝经后骨质疏松症、佩吉特病、高钙血症或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的甲状旁腺素(PTH)基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:骨质疏松症或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的人绒毛膜促性腺素(hCG)基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:不孕(infertiliy)、卡波济氏肉瘤、哮喘、动脉病(artheriopathy)、地中海贫血症、骨质减少、青光眼、肥胖或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的Fuzeon(恩福韦地(enfurvitide))基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:HIV-1感染或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的瘦素或瘦素受体基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:乳腺癌、骨关节炎、骨质疏松症、脓毒性关节炎、肥胖或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的TNF结合蛋白1(TNF-BP1;p55)基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:风湿性关节炎、银屑病关节炎、牛皮癣、炎性肠病、克罗恩病或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
在一个实施方式中,rPEG序列与在适当转录和翻译序列的控制下的胰高血糖素基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:II型糖尿病、幼年型糖尿病或其它未修饰蛋白质已表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。由于胰高血糖素的N-末端对保持体内效力的敏感性,需要特别考虑维持重组体表达和纯化时的天然N-末端结构,且优选的实施方式包含rPEG与GLP-1序列的C-末端的融合体。可以在体外或体内被蛋白酶切割的N-末端前导序列可以用于提高生产量和/或改善活性分子的体内递送。
在一个实施方式中,rPEG序列与在适宜的转录和翻译序列的控制下的IGF-1基因的N-或C-末端遗传融合以在生物系统(例如大肠杆菌、毕赤酵母、CHO-S等)中获得高水平蛋白质表达。蛋白质表达使用所采用的表达系统的标准技术诱导并使用本领域技术人员公知的标准程序(例如离子交换色谱、尺寸排阻色谱法、亲和色谱、示差沉淀、相萃取等)纯化。纯化的蛋白质然后可以施用于人类患者以治疗适应症,包括但不限于:IGF-1缺乏、由基因缺失或形成抗GH抗体引起的hGH缺乏或其它未修饰蛋白质表明提供治疗效果的适应症。添加rPEG序列赋予延长血清半衰期、改善患者接触/效率和/或改善生产效率的性能。
储存模块
本发明的组合物可以任选地包括储存模块。储存模块可以是天然发生的多肽、人工多肽或由噬菌体展示选择。在一个实施方式中,储存模块直接结合下面说明的聚合物基质。储存模块可以结合在修饰多肽中的任何位置并可以以一个或多个副本存在,如图2和3中所示。
储存模块可以以多种方式连接修饰多肽。例如,在一个实施方式中(图4),修饰多肽包含如下的重复单元:附加多肽-生物活性多肽-储存模块、生物活性多肽-附加多肽-储存模块、储存模块-附加多肽-生物活性多肽或储存模块-生物活性多肽-附加多肽。
在本发明的另一方面中,储存模块包含对血清蛋白酶特别敏感的多肽(图8)。储存模块的蛋白酶切割释放生物活性多肽。蛋白酶位点可以进行工程化以对特定的蛋白酶如血清蛋白酶敏感或显示不同的蛋白酶切割率。因此释放速度或部位可以通过对储存模块的蛋白酶切割位点进行工程化而进行控制。如此工程化的修饰多肽可以与本文描述的聚合物基质一起配制。
在本发明的进一步的方面中,也可以修饰储存模块产生高亲合力结合模块这可以通过用蛋白酶抗性模块取代某些蛋白酶敏感模块而实现。例如,通过产生在每第四生物活性多肽之间具有蛋白酶敏感的储存模块的附加多肽-生物活性多肽融合蛋白质,融合蛋白质的蛋白水解将释放四价结合模块。四价类型相对于单体结合模块具有显著提高的目标亲合力且特别理想于靶向细胞表面受体(图53a-c)。
在本发明再进一步的方面中,储存模块设计为提供四价附加蛋白质-生物活性多肽融合蛋白质,例如提高目标亲合力和/或用于缓释应用。储存模块设计为包含用于与小分子生物素位点特异性偶联的一个或多个氨基酸。生物素是在非处方营养补充剂中常见的维生素。其用作几种酶的“辅因子”,包括参与脂肪酸生物合成的酶。生物素也广泛地用于生物技术应用中,因为它与蛋白质(抗生物素蛋白、中性亲和素(neutravidin)和抗生物素蛋白链菌素)形成非常高亲和力的复合物。在这一实施方式中,各结合四分子生物素的抗生物素蛋白、抗生物素蛋白链菌素或中性亲和素可以用于形成高度稳定的附加多肽-生物活性多肽融合蛋白质四聚体(图5)。
赖氨酸(K)半胱氨酸(C)残基可以通过在温和条件下以高产率和特异性分别与琥珀酰亚胺基酯或马来酰亚胺进行化学反应而修饰。当附加多肽不包含任何赖氨酸(K)或半胱氨酸(C)残基时,它们可以很容易地引入储存模块中。储存模块可以包含一个、两个或多个赖氨酸或半胱氨酸残基。
储存模块也可以包括使用“热点半胱氨酸(hot cysteine)”以确保位点特异性的修饰。“热点半胱氨酸”与赖氨酸残基侧邻,例如(KCKK),其中K是赖氨酸且C是半胱氨酸。近邻的赖氨酸残基改变半胱氨酸的pKa,从而提高其亲核性并使得这一残基具有更高的反应性。几个小组已经证明,“热点半胱氨酸”可以优先修饰(大于90%),即使在23个其它半胱氨酸残基存在于同一蛋白质上的情况下[Okten,Z.等(2004)Nat Struct Mol Biol,11:884-7]。因此,储存模块可以在体外产生附加多肽或附加多肽-生物活性多肽融合体的位点特异性的有效修饰。与这些反应基团中任一种偶联的生物素可商购得到。
加入生物素-结合蛋白(如抗生物素蛋白、抗生物素蛋白链菌素或中性亲和素)可以诱导形成非常稳定的附加多肽-结合蛋白多肽四聚体。附加多肽-结合蛋白多肽四聚体然后可以与下面所述的聚合物基质一起配制(例如,包封在微球中)。附加多肽-结合蛋白多肽四聚体表现出非常大的流体动力学半径,从而确保从聚合物基质(例如,微球)的缓释作用。附加多肽-结合蛋白多肽四聚体也对其生物靶标具有更高的亲合力。因为附加多肽-结合蛋白多肽四聚体可以与四个靶分子(例如在细胞质膜上)相互作用,附加多肽-结合蛋白多肽的解离速度下降。更高的亲合力可以增强生物活性或降低附加多肽-结合蛋白多肽的所需剂量。
在本发明的进一步的方面中,具有相同活性残基的储存模块可以用聚乙二醇而不是反应性生物素修饰。特别关注的是四或八臂的PEG分子。这些PEG分子可以共价连接到本文中描述的储存模块,因此产生均质的四聚体和八聚体类型。以这种方式偶联的蛋白质治疗剂对其生物靶标具有显著增强的亲合力,特别是对细胞表面蛋白质。
用于产生蛋白质沉淀物的反离子
本发明还涉及使用反离子调节目标蛋白质的溶解性,即为长效制剂形成蛋白质沉淀物。反离子是一种离子,其存在使得形成整体电中性的物质。例如。在(中性)物质NaCl中,钠阳离子与氯阴离子相反,反之亦然。用阳离子交换剂形成低水溶性盐的机理由下式表示:rPEGn++nC-→rPEG·Cn(不溶性),其中rPEGn+代表带正电的肽离子而C-代表带负电的反离子。参与这一反应的氨基酸残基包括Arg、Lys和N-末端。用阴离子交换剂形成低水溶性盐的机理由下式表示:rPEGn-+nC+→rPEG·Cn(不溶性),其中rPEGn-代表带负电的肽离子而C+代表带正电的反离子。参与这一反应的氨基酸残基包括Asp、Glu和C-末端。
在优选的实施方式中,反离子显示出混合的疏水性和离子特性。因此,一旦反离子的电荷通过与目标蛋白质形成复合物而中和,反离子的疏水特性在所得到复合物中占优势,从而使得其水溶性显著降低。另外,反离子必须在目标蛋白质的临床适用症中在急性和慢性毒性、致癌性和重复性等方面与体内施用相容。下面给出适合于这一应用的混合反离子的非限制性的例子:
阴离子:
·山嵛酸盐
·硫酸胆甾醇(Cholesteryl sulfate)
·脱氧胆酸
·十二烷磺酸
·表没食子儿茶素没食子酸酯(Epigallocatechin gallate)
·十六烷磺酸
·双羟萘酸盐
·黄锫酰单宁(Pentagalloyl Glucose)
·硬脂酸盐
·丹宁酸盐
阳离子:
·胆碱衍生物
·肽反离子:例如H-Lys-(Leu)n-NH2;H-(Leu)n-NH2
脂类:
·磷脂酰胆碱
聚合物材料:
·脱乙酰壳多糖
·胶原蛋白
·透明质酸
·聚β-氨基酯
·PLA/PLGA
·聚(乙二醇)双(2-氨乙基)
在一个实施方式中,目标蛋白质以确定的比率与如上所述的包含疏水性和带电特性的反离子混合。在相互作用时,蛋白质和反离子形成从溶液中沉淀的不溶性复合物。在优选的实施方式中,大于或等于20%、40%、60%或80%的总蛋白质在这些条件下沉淀,其可以通过对保留在溶液中的蛋白质的定量分析确定。蛋白质:反离子的优化、包含有机溶剂、pH调节、离子强度和/或温度调节可以用于调节沉淀反应的效率。沉淀物可以使用标准方法(即过滤、离心)与液相分离且可以以干燥形式戒作为悬浮液储存。对于药物组合物,储存时的蛋白质稳定性是确定给定制剂的耐久性的关键参数。在一个实施方式中,蛋白质在确定的储存条件和制剂下大于1、2、3、6、12、18或24月的时间是稳定的。
本发明还包括方法施用蛋白质复合物到受试者体内。本发明的组合物可以作为药物制剂施用,包括适用于口服(包括含服和舌下)、直肠、鼻腔、局部、透皮贴片、肺、阴道、栓剂或肠胃外(包括肌肉内、动脉内、鞘内、皮内、腹膜内、皮下和静脉内)施用的制剂或适合于通过气溶胶化、吸入或吹入施用的形式。在优选的实施方式中,蛋白质复合物通过肠胃外注射施用于受试者。本文中使用的术语“肠胃外”指不通过肠将复合物引入身体,而是通过经静脉内(i.v.)、动脉内(i.a.)、腹膜内(i.p.)、肌肉内(i.m.)、心室内、支气管内和皮下(s.c.)途径的注射。为通过肠胃外注射(例如,快速推注或连续输注)施用。沉淀物重悬于与施用途径相容的缓冲液中。在优选的实施方式中,沉淀物作为能够以最小阻塞流过18、22、25、26、27或28号针头的均匀悬浮液重悬。可以进行研磨或类似加工以改善重悬性能及减小颗粒尺寸以使得能够有效地通过更高规格的针。去垢剂和能够改变表面张力、粘性和润湿性质的其它赋形剂也可以用于改善用于注射的沉淀物悬液的均匀性。
本发明还涉及在通过例如肠胃外注射将沉淀物引入体内环境中时长效制剂的蛋白质释放速度。蛋白质释放速度可以通过蛋白质:反离子沉淀物悬浮在等渗缓冲液(例如磷酸盐缓冲盐水)并测量可溶性蛋白承时间变化的浓度在体外准确地估算。优选的实施方式使用生理温度以更好地模拟体内条件,虽然可以采用较高或较低的温度以根据试验设置改变再溶解速率。给定蛋白质的最佳释放速度取决于其体内清除速率和机制以及为达到体内效力需要的暴露量。为了达到蛋白质的显著积聚,再溶解速率应快于自然清除率。蛋白质的血清浓度预计与再溶解速率和清除率的比成比例。蛋白质复合物在其溶解和沉淀状态之间的动力学示于下式中:
假定沉淀成复合物的速率可忽略:[蛋白质n-]大致等于k溶解/k清除(即再溶解速率与清除率的比)。
体内获得的实际血清浓度也取决于多种其它因素,包括注射的复合物的总量、沉淀物颗粒的表面积、蛋白质吸收率、蛋白质与其同源受体的结合和再循环机制。
沉淀物的再溶解性质可以通过沉淀物的各种处理改变。例如,热处理或反离子的紫外交联可用于改变沉淀物的化学(和再溶解)性质。沉淀物也可以通过直接除去溶剂(例如喷雾干燥、冻干),接着用反离子或涂层材料处理以获得希望的长效特性而形成。
赋形剂可以包括在复合物形成反应中以控制复合物形成的速度和效率,以及调节蛋白质:反离子复合物在输送到体内环境时的再溶解速率。赋形剂通常是不带电的惰性分子,其包括在复合物形成反应缓冲液中并包含不同水平的最终沉淀物质量。赋形剂也可以包含应用到沉淀物颗粒表面上的涂层,其用于调节沉淀物颗粒对溶剂的表面积并因此调节蛋白质的再溶解速率和/或稳定性。赋形剂的例子包括,但不限于以下:
聚合物
·聚乙二醇500
·聚乙二醇2000
·聚乙二醇5000
·聚乙二醇8000
·聚乙二醇20000
·聚赖氨酸
·PLA/PLGA
去垢剂
·聚山梨醇酯20(Tween 20)
·聚山梨醇酯80(Tween 80)
·Triton X-100
糖/多元醇
·葡萄糖
·甘油
·丙三醇
·甘露醇
·甘露糖
·山梨醇
·蔗糖
·海藻糖
本发明的另一实施方式包括制剂以使得在注射时原位形成储库。例如,选择蛋白质和反离子以使得沉淀物在接近于生理pH(即pH7.4)时形成沉淀。蛋白质和反离子以相对于彼此的最佳浓度比配制,但在与生理pH差异足够大的pH(例如pH 4或pH 10)下以不发生复合物的形成。在肠胃外注射时,优选皮下或肌肉注射,组织的内在缓冲能力使得溶液调节到pH 7.4,导致蛋白质:反离子复合物在注射部位沉淀及获得其缓释效果。改变在注射和注射的蛋白质与体内存在的天然反离子形成复合物时的温度也是可以原位形成缓释蛋白质储库的方法。
附加物连接的多肽的生产
本发明提供生产生物活性多肽的方法,包括a)提供编码包含与附加多肽连接的生物活性多肽的修饰多肽的多核苷酸序列以使得修饰多肽在宿主细胞中的表达与生物活性多肽本身的表达相比产生更高量的可溶形式的生物活性多肽;和b)使得修饰多肽所述宿主细胞中表达,从而产生生物活性多肽。修饰生物活性多肽的表达可以与生物活性多肽本身的表达相比多产生至少大约100%、200%、500%或1000%的可溶形式的生物活性多肽。在某些实施方式中,修饰生物活性多肽的表达可以与生物活性多肽本身的表达相比多产生至少100%和1000%之间的可溶形式的生物活性多肽。
本发明的方法可包括在DNA进行表达的条件下培养用编码附加多肽的嵌合DNA分子转化的细胞,从而产生附加物连接的多肽;和从细胞或培养基提取嵌合DNA分子的表达产物。
分子生物学中的标准重组技术可用于制备本发明的附加物连接的多肽。在一个实施方式中,首先制备包含对应于附加多肽的DNA序列的构建体。例如,编码生物活性蛋白质的基因或多核苷酸可以首先克隆到构建体中,其可以是质粒或其它载体。在后面的步骤中,编码附加多肽的第二基因或多核苷酸邻近编码生物活性多肽的基因或与其处于同框架地克隆到构建体中。这一第二步骤可以通过接合或多聚化步骤发生。
以这种方式,编码修饰多肽的嵌合DNA分子在构建体内产生。任选地,这一嵌合的DNA分子可以转移或克隆到作为更适宜的表达载体的另一构建体中。在这一点,能够表达嵌合的DNA分子的宿主细胞用嵌合的DNA分子转化。转化可以利用或不利用载体(如表达载体)进行。然后,转化的宿主细胞在适合嵌合的DNA分子表达的条件下培养,导致附加多肽的编码。可用于本发明中的接合或多聚化的方法是公知的。参见Joseph Sambrook等,Molecular Cloning:ALaboratory Manual,2nd ed.,1.53(Cold Spring Harbor Laboratory Press1989)。
可以预见,几种克隆策略适用于实施本发明,其中许多可以用于产生包含编码本发明附加多肽的基因的构建体。
包含目标DNA片段的载体可以根据细胞宿主的类型通过公知方法转移到宿主细胞中。例如,氯化钙转染通常用于原核细胞,而磷酸钙处理、脂质转染(lipofection)或电穿孔可以用于其它细胞宿主。用于转化哺乳动物细胞的其它方法包括使用聚凝胺(polybrene)、原生质体融合、脂质体、电穿孔和微注射(一般地参见Sambrook等,同上)。原核或真核细胞预计作为宿主。附加多肽可以在多种表达系统(包括原核和真核系统)产生。合适的表达宿主是例如酵母、真菌、哺乳动物细胞培养物和昆虫细胞。
可用的有益表达载体包括例如,染色体、非染色体和合成DNA序列的片段。合适的载体包括,但不限于SV40和pcDNA的衍生物及已知的细菌质粒如col EI、pCRl、pBR322、pMal-C2、pET、pGEX(如Smith等,Gene 57:31-40(1988)所述),pMB9及其衍生物,质粒如RP4,噬菌体DNA如多种噬菌体I的衍生物,如NM989,以及其它噬菌体DNA如M13和丝状单链噬菌体DNA;酵母质粒如2微米质粒或2m质粒的衍生物,以及着丝粒的(centomeric)和整合的酵母穿梭载体;可用于真核细胞中的载体如可用于昆虫或哺乳动物细胞中的载体;源自质粒和噬菌体DNA的组合的载体,如经修饰以利用噬菌体DNA或表达控制序列的质粒,等等。条件是载体在选择的宿主细胞中可复制和可存活。可以根据需要使用低或高拷贝数的载体。
例如在杆状病毒表达系统中,非融合转移载体(例如但不限于pVL941(BamHI克隆位点,由Summers等,Virology 84:390-402(1978)提供)、pVL1393(BamHI、Smal、Xbal、EcoRI、IVotl、Xmalll、BgIII和Pstl克隆位点;Invitrogen)、pVL1392(BgIII、Pstl、NotI、XmaIII、EcoRI、Xball、Smal和BamHI克隆位点;Summers等,Virology84:390-402(1978)和Invitrogen)及pBlueBacIII(BamHI、BgIII、Pstl、Ncol和HindiII克隆位点,蓝/白重组体筛选,Invitrogen))和融合转移载体(例如但不限于pAc700(BamHI和Kpnl克隆位点,其中BamHI识别位点以起始密码子开始;Summers等,Virology 84:390-402(1978))、pAc701和pAc70-2(与pAc700相同,具有不同的阅读框)、pAc360[多角体蛋白起始密码子下游36个碱基对的BamHI克隆位点;Invitrogen(1995))及pBlueBacHisA,B,C(具有BamH I、BgI II、Pstl、Nco l和Hind III克隆位点的三个不同阅读框,用于噬斑的ProBond纯化和蓝/白重组体筛选的N-末端肽;Invitrogen(220))都可以使用。
哺乳动物表达载体可以包含复制起点、合适的启动子和增强子,及任何必要的核糖体结合位点、多腺苷酸化位点、剪接供体和受体部位、转录终止序列和5′侧非转录序列。源自SV40剪接的DNA序列,且多腺苷酸化位点可用于提供需要的非转录的遗传元件。预想用于本发明中的哺乳动物表达载体包括具有诱导型启动子(如二氢叶酸还原酶启动子)的载体、任何具有DHFR表达盒或DHFR/氨甲喋呤共扩增(co-amplification)载体如pED(Pstl、Sail、Sbal、Smal和EcoRI克隆位点,使载体表达克隆的基因和DHFR;Randal.Kaufman,1991,RandalJ.Kaufman,Current Protocols in Molecular Biology,16,12(1991))的表达载体。可选择地,谷氨酰胺合成酶/蛋氨酸亚砜亚胺共扩增载体,如pEE14(Hindlll、Xball、Smal、Sbal、EcoRI和Sell克隆位点,其中载体表达谷氨酰胺合成酶和克隆的基因;Celltech)。可以使用在EB病毒(EBV)或核抗原(EBNA)的控制下指引附加体表达的载体如pREP4(BamHI r SfH、Xhol、NotI、Nhel、Hindi II、NheI、PvuII和Kpnl克隆位点,组成型RSV-LTR启动子,组成型选择标志物;Invitrogen)、pCEP4(BamHI、SfH、Xhol、NotI、Nhel、Hindlll、Nhel、PvuII和Kpnl克隆位点,组成型hCMV即早期基因启动子,组成型选择标志物;Invitrogen)、pMEP4(Kpnl、Pvul、Nhel、Hindlll、NotI、Xhol、Sfil、BamHI克隆位点,诱导型金属硫蛋白(methallothionein)H a基因启动子,组成型选择标志物,Invitrogen)、pREP8(BamHI、Xhol、NotI、Hindlll、Nhel和Kpnl克隆位点,RSV-LTR启动子,组氨醇选择标志物;Invitrogen)、pREP9(Kpnl、Nhel、Hind lll、NotI、Xho l、Sfi l、BamHI克隆位点,RSV-LTR启动子,G418选择标志物;Invitrogen)和pEBVHis(RSV-LTR启动子,组成型选择标志物,可通过ProBond树脂纯化并通过肠激酶切割的N-末端肽;Invitrogen)。
可选择用于本发明的哺乳动物表达载体包括,但不限于pRc/CMV(Hind lll、BstXI、NotI、Sbal和Apal克隆位点,G418选择,Invitrogen)、pRc/RSV(Hind II、Spel、BstXI、NotI、Xbal克隆位点,G418选择,Invitrogen)等等。可以用于本发明中的牛痘病毒哺乳动物表达载体(参见例如,Randall J.Kaufman,Current Protocols in MolecularBiology 16.12(Frederick M.Ausubel等,eds.Wiley 1991)包括,但不限于pSC11(Smal克隆位点,TK-和β-gal选择)、pMJ601(Sall、Sma l、A flI、Narl、BspMlI、BamHI、Apal、Nhel、SacII、Kpnl和Hindlll克隆位点;TK-和-gal选择)、pTKgptFlS(EcoRI、Pstl、SaIII、Accl、HindII、Sbal、BamHI和Hpa克隆位点,TK或XPRT选择)等等。
可以用于本发明中的酵母表达系统包括,但不限于非融合pYES2载体(XJbal、Sphl、Shol、NotI、GstXI、EcoRI、BstXI、BamHI、Sad、Kpnl和Hindlll克隆位点,Invitrogen)、融合体pYESHisA,B,C(Xball、Sphl、Shol、NotI、BstXI、EcoRI、BamHI、Sad、Kpnl和HindiII克隆位点,通过ProBond树脂纯化并通过肠激酶切割的N-末端肽;Invitrogen)、pRS载体等等。
另外,包含嵌合DNA分子的表达载体可以包括药物选择标志物。这种标志物有助于包含嵌合DNA分子的载体的克隆和选择或鉴别。例如,赋予对新霉素、嘌呤霉素、潮霉素、二氢叶酸还原酶(DHFR)、鸟嘌呤磷酸核糖转移酶(GPT)、硫酸博来霉素(zeocin)和组氨醇的抗性的基因是可用的选择标志物。可选择地,可以采用酶如单纯疱疹病毒胸苷激酶(tk)或氯霉素乙酰转移酶(CAT)。也可以采用免疫标志物。可以采用任何已知的选择标志物只要它能够与编码基因产物的核酸同时表达。选择标志物的进一步的例子是本领域技术人员公知的并包括报道体如增强绿色荧光蛋白(EGFP)、β-半乳糖苷酶(β-gal)或氯霉素乙酰转移酶(CAT)。
因此,哺乳动物和典型地人体细胞以及细菌、酵母、真菌、昆虫、线虫和植物细胞可以作为宿主细胞用于本发明中并用本文中定义的表达载体转化。
合适的细胞的例子包括,但不限于VERO细胞、HELA细胞如ATCC No.CCL2、CHO细胞系、COS细胞、WI38细胞、BHK细胞、HepG2细胞、3T3细胞、A549细胞、PC12细胞、K562细胞、293细胞、Sf9细胞和CvI细胞。
其它可以用于本发明中的合适的细胞包括,但不限于原核宿主细胞株,如大肠杆菌(例如,菌株DH5-α)、枯草杆菌(Bacillus subtilis)、鼠伤寒沙门氏菌(Salmonella typhimurium)或假单胞菌属、链霉菌属和葡萄球菌属的菌株。合适的原核生物的非限制性的例子包括来自以下属的那些:游动放线菌属(Actinoplanes);古生球菌属(Archaeoglobus);蛭弧菌属(Bdellovibrio);包柔氏螺旋体属(Borrelia);绿屈挠菌属(Chloroflexus);肠球菌属(Enterococcus);埃希氏菌属(Escherichia);乳杆菌属(Lactobacillus);李司特氏菌属(Listeria);海洋芽胞杆菌属(Oceanobacillus);副球菌属(Paracoccus);假单胞菌属(Pseudomonas);葡萄球菌属(Staphylococcus);链球菌属(Streptococcus);链霉菌属(Streptomyces);热原体属(Thermoplasma)和弧菌属(Vibrio)。特定菌株的非限制性的例子包括:发光古球菌(Archaeoglobus fulgidus);食菌蛭弧菌(Bdellovibrio bacteriovorus);伯氏包柔氏螺旋体(Borreliaburgdorferi);橙色绿屈挠菌(Chloroflexus aurantiacus);粪肠球菌(Enterococcus faecalis);屎肠球菌(Enterococcus faecium);约氏乳杆菌(Lactobacillus johnsonii);胚牙乳杆菌(Lactobacillus plantarum);乳酸乳球菌(Lactococcus lactis);无害李斯特(氏)菌(Listeria innocua);单核细胞增多性李司特氏菌(Listeria monocytogenes);Oceanobacillusiheyensis;Paracoccus zeaxanthinifaciens;Pseudomonas mevalonii;金黄色葡萄球菌(Staphylococcus aureus);表皮葡萄球菌(Staphylococcusepidermidis);溶血性葡萄球菌(Staphylococcushaemolyticus);无乳链球菌(Streptococcus agalactiae);Streptomyces griseolosporeus;变形链球菌(Streptococcus mutans);肺炎链球菌(Streptococcus pneumoniae);酿脓链球菌(Streptococcus pyogenes);嗜酸热原体(Thermoplasmaacidophilum);火山热原体(Thermoplasma volcanium);霍乱弧菌(Vibrio cholerae);副溶血弧菌(Vibrio parahaemolyticus)和创伤弧菌(Vibrio vulnificus)。
可以用于本发明中的其它合适细胞包括酵母细胞,例如酵母属(Saccharomyces)的细胞如酿酒酵母。
使用细菌表达实施本发明的一个重要优势是不存在糖基化。尽管附加多肽的糖基化提高其分子量且通常增加其血清半衰期,糖基化产物的质量控制是特别难于进行。当存在许多糖基化位点且蛋白质的表达水平较高时,糖基化机构可能不能保持在高水准上且糖基化很可能由于不完全处理而不能完成,产生异质化的糖结构,这使得纯化、鉴定、质量控制和再现性高度复杂化。
根据蛋白质如何在细菌中表达(分泌到培养基、分泌到周质、溶解于胞质或作为胞质中的不溶性包含体),产物或中间体可以包含甲酰化N-末端。
本发明的附加多肽和附加-修饰多肽可以进行的另外的后修饰包括,但不限于酰化、乙酰化、烷化、脱甲基化、酰胺化、生物素化、甲酰化、γ-羧基化、谷氨酰化(glutamylation)、糖基化、甘氨酰化(glycylation)、连接血红素、羟基化、碘化、异戊二烯化(isoprenylation)、脂化(lipoylation)、异戊烯化、豆蔻酰化、法尼基化(farnesylation)、香叶酰香叶酰化(geranylgeranylation)、ADP-核糖基化、连接核黄素、氧化、聚乙二醇化、连接磷脂酰肌醇转移、磷酸泛酰巯基己胺化(phosphopantetheinylation)、磷酸化、形成焦谷氨酸、脯氨酸通过脯氨酰异松酶的消旋化、tRNA-的氨基酸添加如精氨酰化(arginylation)、硫酸化(sulfation)和硒酰化(selenoylation)。
包含目标多核苷酸的宿主细胞可以在适当改良以激活启动子、选择转化体或扩增基因的常规营养培养基(例如,Ham′s营养混合物)中培养。培养条件如温度、pH等等是先前用于所选择用于表达的宿主细胞的条件,且对于本领域技术人员是显而易见的。细胞通常通过离心收获,通过物理或化学方式破坏,且保留所得到的粗提取物以进行进一步纯化。蛋白质表达中采用的微生物细胞可以通过方便的方法破裂,包括冻-融循环、超声降解或使用细胞裂解剂,它们都是本领域技术人员公知的。包括细胞溶解的实施方式可能有必要在嵌合的DNA分子表达后使用包含限制降解的蛋白酶抑制剂的缓冲液。合适的蛋白酶抑制剂包括亮肽素(leupeptin)、胃酶抑素或抑肽酶。然后上清液可以在饱和硫酸铵的连续提高的浓度中沉淀。
附加多肽可以通过本领域技术人员的方法纯化。可以使用如凝胶过滤、亲和纯化、盐分级分离、离子交换色谱、尺寸排阻色谱法、羟磷灰石吸附层析、疏水相互作用色谱和凝胶电泳的过程。某些附加多肽可能需要重折叠。纯化方法描述于Robert K.Scopes,ProteinPurification:Principles and Practice(Charles R.Castor,ed.,Springer-Verlag 1994)和Joseph Sambrook,Molecular Cloning:ALaboratory Manual,2nd edition(Cold Spring Harbor Laboratory Press1989)中。多步骤纯化分离也描述于Baron等,Crit.Rev.Biotechnol.10:179-90(1990)和Below等,J.Chromatogr.A.679:67-83(1994)中。
交联的附加多肽的产生
交联的附加多肽可以通过多种方法产生。非交联和交联成分都可以通过化学合成或使用重组技术产生。特别有用的是非交联成分的重组制备,其可以在多种微生物以及真核表达系统中获得,例如如上所述的系统。非交联成分可以进行纯化以在交联前除去干扰或污染副产物。特别有用的是可以活化以偶联的化学交联剂。其例子显示于图22中。所得到的偶联产物可以进一步通过多种多种方法纯化,特别是尺寸排阻色谱法和离子交换色谱。
多种不同非交联成分可以使用允许控制产物结构的方法与交联成分偶联。例如可以使用携带允许进行不同的偶联化学作用的几个不同反应基团的交联成分。可选择地,可以使用在其部分反应基团上携带保护基团的交联成分。这种部分保护的交联成分非唯心与一个或多个非交联成分偶联。随后可以从交联成分除去保护基团并将另外的非交联成分偶联到交联成分上,这一过程可以通过使用允许选择性去除的多个不同保护基团重复进行。
在本发明的另一个实施方式中,可以使用重组交联成分。交联成分可以是可使用多种表达系统通过重组技术制备的氨基酸序列。例如,引入非交联成分序列中的fMet氨基酸可以与成分重组交联成分中的氨基偶联。
一个优选的实施方式提供包含包含可用作反应基团的侧链的一个或多个谷氨酸和/或天冬氨酸残基并可有效地与具有游离氨基作为反应基团的非交联成分偶联的交联成分。多种碳二亚胺可用于激活游离羧基,但许多其它的化学作用是适合的。重组交联成分中的游离氨基可以通过乙酰化或琥珀酰化封闭。
可选择地,交联成分可以是具有多个高亲和力结合位点的蛋白质。其例子是抗生物素蛋白、抗生物素蛋白链菌素、IgG或gM。例如可以通过生物素化的非交联成分与抗生物素蛋白链菌素接触形成交联的附加多肽,这导致形成四价复合物。该过程显示于图25。以类似的方式,可以使用例如对肽表位具有特异性的IgM或IgG与包含所述肽表位的非交联成分结合。
本发明的附加多肽可以进行分析以确定其对生物活性多肽的效应。分析生物活性多肽的方法是本领域中公知的。例如,血清半衰期可以通过在37℃将蛋白质与人(或适宜的小鼠、大鼠、猴)血清或血浆混合通常数天的时间(即0.25、0.5、1、2、4、8、16天)。然后这些时间点的样品可以进行蛋白质印迹分析且蛋白质用抗体检测。抗体可以是蛋白质中的标签。如果蛋白质在蛋白质印迹分析中显示出单带,其中蛋白质的大小与所注射的蛋白质相同,则没有发生降解。通过蛋白质印迹分析或等同技术确定的50%蛋白质降解的时间点确定为蛋白质的血清降解半衰期或“血清半衰期”。
本发明的附加多肽可以用于调节多种细胞靶标的表达或活性,包括但不限于“生物活性多肽”部分中命名的那些。在某些实施方式中,靶标的表达通过施用附加多肽而降低,而在其它实施方式中将增加。附加多肽可以通过与靶标上的功能位点的相互作用干扰细胞靶标的活性。
缓释剂
本发明的修饰多肽可以掺入、包封、配制或以其它方式包括在允许多肽在希望的应用中控制释放的组合物中。一般地,本发明的修饰多肽可以以各种方式与本发明的缓释剂相互作用,包括但不限于共价连接、离子相互作用或包封在聚合物或制剂中。
适合用于本发明中的各种类型的缓释剂在下面描述。
聚合物基质
一般,微球是具有大约1微米或更大的达大约1000微米范围的大小的基本球形胶体结构。微胶囊一般地描述为其中如聚合物制剂的物质被某些类型的涂层覆盖的结构。术语″微粒″可以用于描述不可能方便地分入上面两类中的任一种中或作为两者的通称的结构。对于直径低于大约1微米的结构,可以使用相应的术语″纳米球″/″纳米胶囊″和″纳米颗粒″,但分别包含在术语″微球″、“微胶囊″和″微粒″中。在特定的实施方式中,纳米球、纳米胶囊或纳米颗粒具有大约500、200、100、50或10nm的大小。
本发明的缓释制剂也可以采用微粒的形式,其可以包括微胶囊或微球。
在微粒中,修饰多肽可以在由聚合物分子形成的膜内位于中心或者可以分散在整个微粒中。内部结构可以包括修饰多肽的基质和聚合物赋形剂。通常,微球的外表面是水可渗透的(这使得水性流体能够进入微球)以及允许溶解的修饰多肽和聚合物排出微球。在一个实施方式中,聚合物膜包含交联的聚合物。修饰多肽可以通过扩散和/或通过聚合物膜的降解而释放。
用于微粒外层的可能物质包括以下种类的聚合物:(1)基于碳水化合物的聚合物,如甲基纤维素、基于羧甲基纤维素的聚合物、葡聚糖、聚葡萄糖、几丁质、脱乙酰壳多糖和淀粉(包括羟乙基淀粉)及其衍生物;(2)聚脂族醇类,如聚环氧乙烷及其衍生物,包括聚乙二醇(PEG)、PEG-丙烯酸酯、聚乙烯亚胺、聚醋酸乙烯酯及其衍生物;(3)聚(乙烯基)聚合物,如聚乙烯醇、聚乙烯吡咯烷酮、聚乙烯磷酸酯、聚乙烯膦酸及其衍生物;(4)聚丙烯酸及其衍生物;(5)聚有机酸,如聚顺丁烯二酸及其衍生物;(6)聚氨基酸如聚赖氨酸,和聚-亚氨酸如聚亚氨酪氨酸及其衍生物;(7)共聚物和嵌段共聚物,如泊洛沙姆407或Pluronic L-101TM聚合物及其衍生物;(8)三元聚合物及其衍生物;(9)聚酯,如聚(四亚甲基醚二醇)(poly(tetramethylene ether glycol))及其衍生物;(10)天然存在的聚合物,如玉米蛋白、脱乙酰壳多糖和支链淀粉及其衍生物;(11)聚酰亚胺,如聚n-三(羟甲基)甲基甲基丙烯酸酯及其衍生物;(12)表面活性剂,如聚氧乙烯山梨聚糖及其衍生物;(13)聚酯,如聚(乙二醇)(n)单甲基酯单(琥珀酰亚胺琥珀酸)酯及其衍生物;(14)分支或环状聚合物,如分支的PEG和环糊精及其衍生物;和(15)聚醛,如聚(全氟环氧丙烷-b-全氟甲醛)及其衍生物,如美国专利6,268,053中所公开的,其内容通过引用并入本申请中。其它本领域技术人员已知的典型聚合物包括聚(丙交酯-共-乙交酯、聚丙交酯同聚物、聚乙交酯同聚物、聚己酸内酯、聚羟基丁酸-聚羟基戊酸共聚物、聚(丙交酯-共-己内酯)、聚酰胺酯、聚原酸酯、聚13-羟基丁酸和聚酐,如美国专利6,517,859中所公开的,其内容通过引用并入本申请中。在某些实施方式中,聚合物可以包含藻酸盐聚合物、(羟乙基)甲基丙烯酸化的葡聚糖聚合物,或可以使用脱乙酰壳多糖聚合物。
本发明的修饰多肽可以以冻干块或水溶液的形式与生理可接受的载体、赋形剂或稳定剂(Remington′s Pharmaceutical Sciences,16thedition,Oslo,A.,Ed.,1980)混合。用于制备微粒的可接受的载体、赋形剂或稳定剂在采用的剂量和浓度下对于接受者是非毒性的,并包括缓冲液如磷酸盐、柠檬酸盐和其它有机酸;抗氧化剂包括抗坏血酸;低分子量(少于大约10残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水聚合物如乙烯吡咯烷酮;氨基酸如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖和其它糖类,包括葡萄糖、甘露糖或糊精;螯合剂如EDTA;糖醇如甘露醇或山梨醇;成盐反离子如钠;和/或非离子表面活性剂如Tween、Pluronics或聚乙二醇(PEG)。
本发明的微球通过标准技术制造。例如,在一个实施方式中,通过在能量源存在的情况下将溶液中的活性剂与溶液中的聚合物或混合物聚合物混合进行体积排阻足够的时间以形成颗粒,如美国专利6,268,053中所公开的。溶液的pH调节到希望的pH。接着,溶液暴露于单独或与超声、涡流、混合或搅拌结合的能量源(如热、辐射或离子化)以形成颗粒。所得到的颗粒然后通过本领域技术人员公知的物理分离方法与存在于溶液中的任何未结合的成分分离,且然后可以洗涤。
在某些实施方式中,微粒的悬浮液通过剧烈混合包含修饰多肽的水溶液和其中溶解聚合物的有机溶液(通常是二氯甲烷)制备。这一油包水悬浮液然后稀释到包含利泄剂(emulgent)(通常是聚乙烯醇)的水性缓冲液中。最后,微球从这一水包油包水(W/O/W)的乳液中除去并冻干。这一公知的和经过测试的W/O/W工艺通常产生直径0.1-100μm的微球。这些尺寸的微球很容易制备成用于皮下注射的悬浮液。可选择地,微球可以通过单乳化溶剂提取/蒸发(O/W)、固体/油/油方法(S/O/O)和文献中描述的这些方法的所有变型形式制备。
已知的制备过程也在美国专利6,669,961;6,517,859;6,458,387;6,395,302;6,303,148;6,268,053;6,090,925;6,024,983;5,942,252;5,981,719;5,578,709;5,554,730;5,407,609;4,897,268和4,542,025号中描述,其内容通过引用全文并入本申请中。微粒的制备和配制也在以下公开出处物中描述:(Bittner,B.等(1998)Eur J Pharm Biopharm,45:295-305;Rosa,G.D.等(2000)J Control Release,69:283-95;Kissel,T.等(2002)Adv Drug Deliv Rev,54:99-134;Kwon,Y.M.和Kim,S.W.(2004)Pharm Res,21:339-43;Lane,M.E.等(2006)Int J Pharm,307:16-22;Jackson,J.K.等(2007)Int J Pharm)。
微粒也是本领域技术人员公知的且容易从提供这种延释药物递送技术的公司得到。例如,Epic Therapeutics,Baxter Healthcare Corp.的子公司,开发了PROMAXXTM,在完全基于水的中产生可生物蚀解的蛋白质微球的蛋白质基质药物递送系统;OctoPlus开发了OctoDEXTM,基于基质的本体降解而不是基于表面侵蚀释放活性成分的交联葡聚糖微球;和Brookwood Pharmaceuticals公布了其微粒技术用于药物递送的可行性。
专利、公开的专利申请和相关公开文献的检索也为阅读本说明书的本领域技术人员提供了众多可能的微粒技术。例如,美国专利6,669,961;6,517,859;6,458,387;6,395,302;6,303,148;6,268,053;6,090,925;6,024,983;5,942,252;5,981,719;5,578,709;5,554,730;5,407,609;4,897,268和4,542,025,其内容通过引用全文并入本申请中,描述了微球及其制备方法。本领域技术人员在考虑了本发明的公开和这些另外的专利的公开后可以制备和使用微粒于本发明修饰多肽的延释。
本发明提供进一步的改进。因为微粒如PLGA珠仍然在施用后立即释放相当水平的药物,本发明通过包括附加多肽和任选的储存模块作为修饰多肽的部分而提供改善这种推注效应的方法,如上所述。
如果需要,治疗蛋白质的释放可以进一步控制,如果使用具有两个或多个层的微粒。在一个实施方式中,微球具有内层以及外层。外层的组成和厚度可以改变以在暴露微球的包含修饰多肽的中心所花的时间上产生差异。在一个实施方式中,微球可以具有以高浓度包含修饰多肽的内层,而外层可以包含较低浓度的修饰多肽或没有修饰多肽。可选择地,在不同微球之间外层的厚度发生变化。具有薄外层的微球珊较早地释放修饰多肽(例如,在第1-5天的时间内),而具有中等厚度外层的微球在较晚的时间释放修饰多肽(例如在第4-8天),且具有较厚外层的微球甚至更晚释放修饰多肽(例如,在第7-11)。因此,在这一实施方式中获得更加恒定的释放速度。
聚合物基质制剂的药物释放率可取决于连接生物活性肽的附加多肽。附加多肽显著增加修饰多肽的流体动力学半径。因此,附加多肽模块提供控制微粒的药物释放率的手段。任何本文中描述的附加多肽可以用聚合物基质配制以实现控释、血清半衰期稳定性和其它本文中描述的希望的性能方面的有益效果。
在本发明的进一步的方面中,本文中描述的储存模块可以设计为增强附加多肽-生物活性多肽和聚合物基质之间的非共价相互作用并降低修饰多肽从基质微球的释放速度。例如,藻酸盐是由甘露糖醛酸和古罗糖醛酸组成的聚合物且藻酸盐微球可以通过水/油乳化方法制备[Srivastava,R.等(2005)J Microencapsul,22:397-411],类似于PLGA微球的制备。与PLGA微球不同。藻酸盐形成高度多孔的微球,蛋白质由此释放通常在数天内完成。本发明提供储存模块与体积增大模块和生物活性多肽结合以增加藻酸盐微球内的融合蛋白质的扣留时间的用途。
各单元的藻酸盐聚合物基质包含在生理pH下具有-1电荷的羧基。因此藻酸盐聚合物在生理状态下具有大的净负电荷。储存模块设计为具有碱性等电点(其在生理pH下带正电的)并因此在藻酸盐微球内保留长得多的时间(图6)。例如,这一储存模块包含具有多个赖氨酸(K)和/或精氨酸(R)残基的人多肽。在生理pH下赖氨酸氨基酸将携带净正电荷,因此增加其与藻酸盐聚合物的非共价结合。储存模块可以包括天然存在的多肽或者经过设计/工程化或选择的多肽。潜在的储存模块可以迅速地对于其与藻酸盐相互作用的能力进行评价。另外,仅与藻酸盐弱结合的多肽可以结合以形成重复的储存模块单元了增强其与聚合物的相互作用。
在本发明的进一步实施方式中,与结合二价阳离子的储存模块结合使用二价阳离子螯合聚合物基质(例如水凝胶;Lin,C.C.和Metters,A.T.(2007)J Biomed Mater Res A)。例如,储存模块和螯合聚合物基质都结合Cu2+、Co2+和Ni2+阳离子且储存模块和二价阳离子之间的强非共价相互作用用作治疗蛋白质实现从水凝胶延释的高效机制(图7)。图46显示了附加-修饰多肽的延释。例如,储存模块可以引入以聚组氨酸为标签的蛋白质。聚组氨酸序列常规地用作纯化标签,因为这种序列紧密结合固体载体上的Ni2+阳离子。替代的储存模块可以参照上面的教导类似地设计。储存模块可以直接连接附加多肽而不是连接生物活性多肽,如果聚组氨酸序列可能以另外的方式干扰治疗多肽的生物学活性。
因此,可以组合聚合物基质、附加多肽、储存模块和/或生物活性多肽的任何数目的变异体和选择以在患者中获得希望的效应。
本发明提供包含修饰多肽的药物组合物。它们可以口服、鼻内、肠胃外或通过吸入疗法施用,且可以采用片剂、锭剂、颗粒、胶囊、丸剂、安瓿剂、栓剂的形式或气溶胶形式。它们也可以采取活性成分在水性或非水性稀释剂、糖浆、微粒或粉末中的悬浮液、溶液和乳液的形式。另外,药物组合物也可以包含其它药物活性化合物或多种本发明的化合物。
本发明的组合物也可以与各种液相载体(如无菌或水性溶液)、药学上可接受的载体、悬浮液和乳液结合。非水性溶剂的例子包括丙基乙二醇(propyl ethylene glycol)、聚乙二醇和植物油。
更特别地,本发明的药物组合物可以通过任何合适的途径施用以进行治疗,包括口服、直肠、鼻腔、局部(包括透皮、气溶胶、含服和舌下)、阴道、肠胃外(包括皮下、肌肉内、静脉内和皮内)和肺。应当理解,优选的途径将随接受者的状态和年龄、需要的疾病进行变化。
用于本发明中的延释制剂可以是包含基质和包衣组合物的口服制剂。合适的基质材料可以包括蜡(例如,棕榈蜡(camauba)、蜂蜡、石蜡、纯地蜡、虫胶蜡、脂肪酸和脂肪醇)、油、硬化油或脂(例如硬化菜子油、蓖麻油、牛脂、棕榈油和大豆油)和聚合物(例如羟丙基纤维素、聚乙烯吡咯烷酮、羟丙基甲基纤维素和聚乙二醇)。其它合适的基质压片材料是微晶纤维素、粉末纤维素、羟丙基纤维素、乙基纤维素,以及其它载体和填充剂。片剂也可以包含颗粒、涂层粉末或小球。片剂也可以是多层的。多层片剂在活性成分具有明显不同的药代动力学特征时是特别优选的。任选地,完成的片剂可以包衣或不包衣。
包衣组合物可以包含不溶性基质聚合物和/或水溶性材料。水溶性材料可以是聚合物如聚乙二醇、羟丙基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、聚乙烯醇或单体的物质如糖(例如乳糖、蔗糖、果糖、甘露醇等等)、盐(例如氯化钠、氯化钾等等)、有机酸(例如富马酸、琥珀酸、乳酸和酒石酸)及其混合物。任选地,肠溶聚合物可以加入包衣组合物中。合适的肠溶聚合物包括羟丙基甲基纤维素、醋酸琥珀酸酯(acetate succinate)、羟丙基甲基纤维素、邻苯二甲酸酯、聚醋酸乙烯邻苯二甲酸酯、邻苯二甲酸乙酸纤维素、乙酸纤维素偏苯三酸酯(cellulose acetate trimellitate)、紫胶、玉米蛋白和包含羧基的聚甲基丙烯酸酯。包衣组合物可以通过加入合适的增塑剂例如,邻苯二甲酸二乙酯、柠檬酸酯、聚乙二醇、丙三醇、乙酰甘油、乙酰柠檬酸酯、二丁基癸二酸酯和蓖麻油。包衣组合物还可以包括填充剂,其可以是不溶性物质如二氧化硅、二氧化钛、滑石粉、高岭土、氧化铝、淀粉、粉末纤维素、MCC或聚克立林钾。包衣组合物可作为有机溶剂或水性溶剂或其混合物中的溶液或乳胶应用。可以使用溶剂如水、低级醇、低级氯化烃、酮或其混合物。
本发明的修饰多肽可以使用多种赋形剂配制。合适的赋形剂包括微晶纤维素(例如Avicel PH 102、Avicel PH101)、聚甲基丙烯酸酯、聚乙基丙烯酸酯、甲基丙烯酸甲酯、氯化甲基丙烯酸三甲基氨乙基酯(trimethylammonioethyl methacrylate chloride)(如Eudragit RS-30D)、羟丙基甲基纤维素(Methocel K100M、Premium CR Methocel K100M、Methocel E5、)、硬脂酸镁、滑石粉、柠檬酸三乙酯、水性乙基纤维素分散液缓释剂也可以包含载体,其可以包含例如,溶剂、分散介质、包衣、抗菌和抗真菌、等渗和吸收延迟剂。药学上可接受的盐也可以用于这些缓释剂中,例如矿物盐(如盐酸盐、氢溴酸盐、磷酸盐或硫酸盐)以及有机酸的盐(如醋酸盐、丙酸盐、丙二酸盐或苯甲酸盐)。组合物还可以包含液体(如水、盐水、丙三醇和乙醇)以及如湿润剂、乳化剂或pH缓冲剂的物质。脂质体也可以用作载体。
通过透皮制剂施用可以使用本领域中已知的方法进行,包括一般地在例如美国专利5,186,938和6,183,770,4,861,800,6,743,211,6,945,952,4,284,444及WO 89/09051中描述的那些方法,这些专利文献通过引用全文并入本申请中。透皮贴片对于具有吸收问题的多肽是特别有利的实施方式。可以使得贴片控制皮肤渗透性活性成分在12小时、24小时、3天和7天时间内的释放。在一个实施例中,2倍日剂量过量的本发明多肽置于非挥发的流体中。本发明的组合物以粘性、非挥发液体的形式提供。特定制剂通过皮肤的渗透可以通过本领域中的标准方法测量(例如,Franz等,J.Invest.Derm.64:194-195(1975))。合适贴片的例子是被动转移皮肤贴片、离子电渗皮肤贴片或具有微针状体的贴片如Nicoderm。
在其它实施方式中,组合物可以通过鼻内、口腔或舌下途径递送到脑以使得活性剂能够经嗅通道到CNS中并减少全身性施用。通常用于这一施用途径的装置包括在美国专利6,715,485中。通过这一途径递送的组合物使得能够提高CNS复旦或降低训的身体负担,从而降低与特定药物相关的系统毒性风险。用于以皮下植入装置递送的药物组合物的制备可以使用本领域中已知的方法进行,例如在如美国专利3,992,518;5,660,848和5,756,115描述的方法。
渗透泵可以作为片剂、丸剂、胶囊或植入装置形式的缓释剂使用。渗透泵是本领域中公知的且本领域技术人员可以很容易从提供用于延释药物递送的渗透泵公司得到。其例子是ALZA′s DUROSTM;ALZA′s OROSTM;Osmotica Pharmaceutical′s OsmodexTM system;ShireLaboratories′EnSoTrolTM system和AlzetTM。描述渗透泵技术的专利是美国专利6,890,918;6,838,093;6,814,979;6,713,086;6,534,090;6,514,532;6,361,796;6,352,721;6,294,201;6,284,276;6,110,498;5,573,776;4,200,0984和4,088,864,其内容通过引用并入本申请中。本领域技术人员在考虑了本申请的公开和其它这些专利的公开后能够制备用于本发明多肽的延释的渗透泵。
注射泵也可以用作缓释剂。注射泵是本领域技术人员公知的且很容易得到。这样的装置描述于美国专利4,976,696;4,933,185;5,017,378;6,309,370;6,254,573;4,435,173;4,398,908;6,572,585;5,298,022;5,176,502;5,492,534;5,318,540和4,988,337中,其内容通过引用并入本申请中。本领域技术人员在考虑了本申请的公开和其它这些专利的公开后能够制备用于本发明多肽的延释的注射泵。
在另一个实施方式中,本发明的修饰多肽封装在脂质体中,其已证明在以可控方式在较长时间内递送有益活性物质方面的功用。脂质体是包含圈闭的水相体积的封闭双层膜。脂质体也可以是具有单膜双层的单层囊泡或具有多个膜双层的多层囊泡,各膜双层由水层与下一层分隔。所得到的膜双层的结构使得脂质的疏水性(非极性)尾部朝向双层的中心定向而亲水性(极性)头部朝向水相定向。在一个实施方式中,脂质体可以用避免单核吞噬细胞系统的器官(主要是肝脏和脾)吸收的柔性水溶性聚合物包被。用于环绕脂质体的合适的亲水聚合物包括,但不限于PEG、聚乙烯吡咯烷酮、聚乙烯基甲基酯、聚甲基噁唑啉、聚乙基噁唑啉、聚羟丙基噁唑啉、聚羟丙基甲基丙烯酰胺、聚甲基丙烯酰胺、聚二甲基丙烯酰胺、聚羟丙基甲基丙烯酸酯、聚羟乙基丙烯酸酯、羟甲基纤维素、羟乙基纤维素、聚乙二醇、聚天冬酰胺(polyaspartamide)和亲水肽序列,如美国专利6,316,024;6,126,966;6,056,973;6,043,094中所述,其内容通过引用全文并入本申请中。
脂质体可以由本领域中已知的任何脂质或脂质组合组成。例如,形成泡囊的脂类可以是天然存在的或合成的脂类,包括磷脂如磷脂酰胆碱、磷脂酰乙醇胺、磷脂酸、磷脂酰丝氨酸、磷脂酰甘油、磷脂酰肌醇转移和鞘磷脂,如美国专利6,056,973和5,874,104中公开的。形成泡囊的脂类也可以是糖脂、脑苷脂或阳离子脂类如同样在美国专利6,056,973中公开的1,2-二油烯氧基(dioleyloxy-3-(三甲基氨基)丙烷(DOTAP);溴化N-[1-(2,3-二(十四氧基)(ditetradecyloxy))丙基]-N,N-二甲基-N-羟乙铵(DMRIE);溴化N-[1[(2,3-二油烯氧基)丙基]-N,N-二甲基-N-羟乙铵(DORIE);氯化N-[1-(2,3-二油烯氧基)丙基]-N,N,N-三甲铵(DOTMA);3[N-(N′,N′-二甲基氨基乙烷)氨基甲酰基]胆固醇(DC-Chol)或二甲基二(十八铵)(DDAB)。胆固醇也可以以适当的量存在以赋予囊泡稳定性,如美国专利5,916,588and 5,874,104中所描述的。
脂质体也是本领域技术人员公知的且很容易从提供用于延释药物递送的脂质体的公司得到。例如,ALZA′s(原Sequus Pharmaceuticals′)用于静脉内药物递送的STEALTHTM脂质体技术在脂质体上使用聚乙二醇涂层以规避免疫系统的识别;Gilead Sciences(原Nexstar′s)脂质体技术结合到AmBisomeTM中且FDA批准用于真菌感染的治疗;且NOF Corp.提供许多种GMP-级磷脂、磷脂衍生物和PEG-磷脂,商品名为COATSOMETM和SUNBRIGHTTM。
其它可能的脂质体技术描述于美国专利6,759,057;6,406,713;6,352,716;6,316,024;6,294,191;6,126,966;6,056,973;6,043,094;5,965,156;5,916,588;5,874,104;5,215,680和4,684,479,其内容通过引用并入本申请中。它们描述了脂质体和脂包被的微泡及其制备方法。因此,本领域技术人员在考虑了本申请的公开和其它这些专利的公开后能够制备用于本发明多肽的延释的脂质体。
可通过施用本发明的组合物治疗的疾病包括但不限于癌症、炎性疾病、关节炎、骨质疏松症、传染病特别是肝炎、细菌感染、病毒感染、遗传病、肺病、糖尿病、激素相关疾病、阿尔茨海默氏病、心脏病、心肌梗塞、深静脉血栓形成、循环系统疾病、高血压、低血压、过敏症、疼痛缓解、侏儒症和其它生长障碍、中毒、血凝疾病(blotclotting diseases)、先天免疫系统系统、栓塞、伤口愈合、烧伤愈合、克罗恩病、哮喘、溃疡、败血症、青光眼、脑血管局部缺血、呼吸窘迫综合征、角膜溃疡、肾病、糖尿病足溃疡、贫血症、因子IX缺陷、因子VIII缺陷、因子VII缺陷、粘膜炎、吞咽困难、血小板障碍、肺栓塞、不孕、性腺机能减退、白血球减少症、中性白细胞减少症、子宫内膜异位、戈谢病、肥胖、溶酶体贮积病、AIDS、经前期综合征、特纳氏综合症、恶病体质、肌肉萎缩症、亨廷顿病、结肠炎、SARS、卡波济氏肉瘤、肝癌、乳腺癌、神经胶质瘤、非霍奇金淋巴瘤、慢性髓细胞性白血病;毛细胞白血病;肾细胞癌;肝肿瘤;淋巴瘤;黑素瘤、多发性硬化、卡波济氏肉瘤、乳头瘤病毒、肺气肿、支气管炎、牙周病、痴呆、分娩、非小细胞肺癌、胰腺癌、前列腺癌、肢端肥大症、牛皮癣、卵巢癌、法布里病、溶酶体贮积病。
精确调节任何物质(蛋白质或报道剂或其它)的分泌半衰期的能力和调节组织分布的能力对于体内诊断应用如PET成象、超声、NMR、计算机断层扫描或放射性核成像(radionuclear imaging)是特别有用的。因此,本发明的组合物也可以用于产生显象剂其例子是用于胃肠成像的试剂、心肌灌注显象剂、MRI显象剂、钆螯合剂、用于心脏壁运动异常和其它超声应用的超声剂,或用于对比度增强计算机断层扫描的试剂。
修饰多肽产生的优化
另外,本发明的附加多肽可以包含允许在表达过程中改善折叠和纯化的附加序列。这一概念一般地描述于图32中。例如,附加多肽可以连接亲和或溶解性标签以帮助纯化。非限制性的例子包括His-标签、FLAG、Streptag II、HA-标签、Softag1、Softag 3、c-myc、T7-标签、S-标签、弹性蛋白样肽、Chitin-结合域、硫氧还蛋白、Xylanase10A、谷胱甘肽S-转移酶(GST)、麦芽糖结合蛋白(MBP)、NusA和纤维素结合蛋白。
附加多肽还可以包含蛋白酶切割位点或允许修饰多肽在表达后切割的其它序列。这样的一个或多个位点可以修饰多肽位于中的任何位置。例如,蛋白酶切割位点可以在改善溶解性的序列和包含亲和标签的另一序列之间引入,从而亲和标签通过蛋白酶处理除去。可选择地,切割位点可以位于生物活性蛋白质和附加多肽之间,从而特定的蛋白酶切除整个附加多肽序列。用于切割蛋白质各种酶方法是已知的。这类方法包括肠激酶(DDDK)、Xa因子(IDGR)、凝血酶(LVPR/GS)、PreScissionTM(LEVLFQ/GP)、TEV蛋白酶(EQLYFQ/G)、3C蛋白酶(ETLFQ/GP)、转肽酶A(LPET/G)、颗粒酶B(D/X,N/X,M/N或S/X)、内含肽、SUMO、DAPase(TAGZymeTM)、气单胞菌属(Aeromonas)氨肽酶、氨肽酶M和羧肽酶A和B。另外的方法公开于Arnau等,ProtExpr and Purif(2006)48,1-13中。
蛋白质表达的分析
可以测量表达蛋白质的活性以确定正确折叠的程度。这类取决于表达的特定多肽的分析方法是本领域公知的。这类分析方法包括基于细胞的分析,包括分析增殖、细胞死亡、细胞凋亡和细胞迁移。其它可能的分析方法可以确定表达多肽的受体结合,其中分析可以包括受体分子或可以确定与细胞表达的受体的结合。另外,如流式细胞术或表面等离子体共振的技术可用于检测结合事件。特定的体内生物分析可以用于评价本发明的各生物活性多肽的活性。例如,hGH性能可以使用ESTA生物分析确定或可选择地通过测量rhGH诱导的剂量依赖性体重增加和骨生长或者受体结合确定。另外的方法公开于Dattani,M.T.等(1996)Horm Res,46:64-73;Alam,K.S.等(1998)JBiotechnol,65:183-90;Clark,R.等(1996)J Biol Chem,271:21969-77;Clarg RG等,(1996)Endocrinology.137:4308-15中。
用于测量表达的蛋白质的物理性能的特定方法在下面描述。用于确定如蛋白质聚集、折叠状态、熔融性能、污染和水含量的性能的多种方法是现有技术中已知的且可以应用于本发明。这些方法包括分析离心、EPR、HPLC-离子交换、HPLC-尺寸排阻凝胶过滤、HPLC-反相、光散射、毛细管电泳、圆二色性、差示扫描量热法、荧光分析、HPLC-离子交换、HPLC-尺寸排阻凝胶过滤、IR、NMR、拉曼光谱、量测折射术和UV/可见光谱。另外的方法公开于Arnau等,Prot Exprand Purif(2006)48,1-13。这些方法在本发明中的应用是本领域技术人员的能力范围内。
更特别地,本发明表达多肽的细胞定位可以通过上面提到的任何方法确定。例如,从表达目标多肽的细胞获得的粗溶解产物可以离心以分离细胞溶胶部分中的可溶性表达蛋白质和包含体中的不溶性蛋白质。如果需要,可溶性(细胞溶胶)和不溶性(包含体)部分然后可以通过蛋白质印迹或类似的技术进行分析以确定可溶性蛋白质对不溶性蛋白质的表达比。
溶解产物中的可溶性蛋白质可以进一步通过如阴离子交换或尺寸排阻色谱法的技术纯化,春可以制备性地或分析性地应用(图35-39,47,48,50和51)。最终产物纯度和确认可以通过本领域中已知的技术如SDS-PAGE、HPLC(例如反相或尺寸排阻凝胶过滤)或质谱获得。纯化步骤可以在蛋白酶切割步骤除去亲和/溶解性标签和/或附加多肽之前或之后,或者在其之前和之后都进行纯化。可能需要通过上面给出的任何方法的进一步纯化步骤以除去例如来自消化混合物的用过的蛋白酶。这些步骤在本领域技术人员的能力范围内。几种这类方法也在实施例部分中更详细地描述。
rPEG融合产物的制剂、药代动力学和施用
本发明还涉及对rPEG融合产物进行工程化以施用到受试者中的组合物和方法。以反平行方向结合相同序列的另一个肽的结合肽如SKVILF(E)或RARADADA可以用于产生前药,如图88a-c中所示。在一个实施方式中,药物在制备的最后步骤中蛋白酶切割,但切割不激活药物,因为两个链通过结合肽结合。仅在药物注射到受试者中且浓度显著降低后,小的、非含rPEG的蛋白质链以取决于亲和力的速率脱离复合物并很可能通过肾清除,从而激活含r-PEG的药物模块。
在另一个实施方式中,rPEG50包含蛋白水解位点且蛋白水解切割将制备的单链蛋白质转化成两个蛋白质链的复合物(图89a-c)。这一切割可以作为注射到受试者中之前的最后制备步骤进行中可以在注射到受试者体内后通过存在于受试者中的蛋白酶进行。
另一实施方式包括侧邻具有相同结合功能的相同受体域或结构域或可同时结合相同靶标的结构域的rPEG(图94a-c)。如果两个受体可以同时结合靶标,则一个受体受体的结合稳定第二受体的结合,导致复合物的相互稳定,从而通常提高表观亲和力(亲合力)10-100倍,但至少是3倍,用rPEG作为提高受体有效浓度的价桥(图94b)。在一个实施方式中,rPEG产物用配体预加载(图94c)。当施用到受试者中时,注射的产物只要保持与配体结合就是无活性的。当配体解离时,它很可能通过肾快速清除,导致产物的激活,其由于rPEG尾而具有长的半衰期。这一方法降低了峰剂量毒性和受体介导的清除率,从而延长血清分泌半衰期,如图99中所示。
如图94中所示,替代的前药形式不需要切割或其它活化位点。单蛋白质链可以包含由rPEG分隔的两个或多个药物模块。这些模块可以是单一类型或两种或多种不同类型。这一包含rPEG的产物与第二互补蛋白质复合以形成受体-配体-受体相互作用。通过这种方式,配体可以是二聚体的或多聚体的,但也可以是单体的,特别是如果药物模块不同。两个模块都结合第三蛋白质。X和Y可以相同或不同且X和Y可以是药物模块或结合药物模块。在图94a-c的各情况中,X和Y(及rPEG)包含一个蛋白质链,它们结合分子是单独的分子,通常是蛋白质或小分子。有可能具有组合在单一蛋白质链中的.两个结合蛋白。
通常在治疗中希望药物保持在高于治疗剂量但低于毒性剂量的浓度。具有短半衰期的药物的典型快速推注(IV、IM、SC、IP或类似方式)导致远高于毒性剂量的峰浓度,随后是使得药物浓度迅速降到治疗剂量以下的消除期。图100显示了与连接rPEG的药物相比单独的药物i.v.注射后药物浓度随时间的变化。单独的药物在治疗浓度仅存在很短的时间(蓝线)。向药物添加rPEG降低了峰浓度并因此降低了毒性,且增加了药物处于治疗的非毒性剂量下的时间。通过添加rPEG加药物-结合蛋白产生前药可以防止“突释”或毒性峰剂量(红线),因为药物仅随时间逐步地激活且毒性剂量和治疗剂量之间的时间长度与其它方法相比增加。
在另一个实施方式中,rPEG融合产物在施用到受试者中之前切割或作为无活性的前药施用(即在施用到受试者中之后切割并要体内激活)。这一过程显示于图96a-h中。药物的失活是由通过rPEG连接药物的结合蛋白的,从而所有三个模块作为单一蛋白质链产生。如果药物是受体,则结合蛋白可以是该受体的配体;如果药物是抗体片段,则结合位点可以是抗原。在这些实例中,药物通过在两个结合域(这里称为X和Y)之间的位点进行蛋白酶切割激活。如果蛋白质Y是活性产物,则Y保留rPEG且蛋白酶切割位点需要靠近X。如果蛋白质Y是活性产物,则X保留rPEG且切割位点靠近Y。可以存在一个或多个切割位点,如蓝十字所示(图96a-g)。药物模块包括但不限于受体、配体、一个或多个Ig结构域、抗体片段、肽、微生物蛋白或用于抗体的表位。结合药物模块的蛋白质包括但不限于结合蛋白、受体、配体、一个或多个Ig结构域、抗体片段、肽、微生物蛋白或用于抗体的表位。图105和106显示了通过存在于受试者血清中的或在施用于受试者前结合给予的位点特异性蛋白酶将无活性蛋白质(即前药)转化为活性蛋白质(即活性肽或dAb或scFv)。
另一实施方式描述了通过向药物模块添加结合肽产生的无活性的前药(图97)。肽品种了药物的靶标结合能力且肽(其与前药一起施用)以比含rPEG药物更高的速率逐步地从受试者的系统中清除。这种肽可以是天然的或通过药物模块的随机肽库噬菌体淘筛获得。肽优选通过合成方式制备,但它可以是重组肽。
单链蛋白质药物也可以包含多个生物活性肽,其可以与rPEG处于同一末端或在rPEG的相对端(图98)。这些肽可以具有相同或不同的活性。在中单链包含多个肽通过结合亲合力提高其有效效能而不使其制备复杂化。
实施例
实施例1:融合附加多肽的人生长激素(hGH)的设计
本实施例描述了制备具有更高的活性胞质产量并具有改善的血清半衰期的rPEG-hGH融合蛋白质的制备。人生长激素产品通常需要每日或每日两次注射,因为hGH在血清中的半衰期仅为大约30分钟。通过PEG延长半衰期是不可行的,因为hGH包含治疗活性需要的多个赖氨酸,它们不能用于偶联。hGH通常通过在大肠杆菌胞质中表达制备,它可以在此处聚集并形成包含失活蛋白质的包含体。通常,这些包含体被溶解并且蛋白质重折叠以获得活性蛋白质。在本实施例中,rPEG-hGH在胞质中以可溶和活性形式表达,避免了包含体重折叠的步骤。
用于该试验中的hGH 的氨基酸序列是:FPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQTSLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANSLVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNSHNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRSVEGSCGF.
hGH包含191个氨基酸,具有pI 5.27和分子量22.130kD。hGH包含13个谷氨酸残基,11个天冬氨酸残基(总共24个负残基),8个赖氨酸残基和11个精氨酸残基(总共19个正残基),具有净电荷-5和净电荷密度-0.026(计算为-5/191氨基酸)。这一净电荷密度与性pI值5.27相关。
各种hGH-rPEG融合蛋白质如下设计。
设计1.具有净电荷密度-0.1的PEG-修饰hGH的构建
这一设计描述了用短长度的附加多肽修饰的多肽且净电荷密度为-0.1。
这一设计的目的是产生具有净电荷密度为-0.1的蛋白质而仅添加少数氨基酸。产生具有-0.1的电荷密度的hGH蛋白质的电荷数目是14.1(19.1-5=14.1)(不考虑由于添加的带电氨基酸导致的总长度的增加)。加入16个带负电的氨基酸对修饰的hGH多肽产生-0.1的净电荷密度(计算为(16+5)/(191+16)氨基酸)。
设计2.具有净电荷密度-0.2的PEG-修饰hGH的构建
这一设计描述了用短长度的附加多肽修饰的多肽且净电荷密度为-0.2。
这一设计向附加蛋白质添加41个负电荷,在整个多肽中带负电的氨基酸残基的总数为46。修饰多肽的总长度是232个氨基酸(计算为191+41氨基酸)。因此,电荷密度-0.2需要总共46个带负电的氨基酸残基(计算为0.2×232氨基酸)这意味着附加蛋白质包含41个带负电的残基(计算为46-5)。
设计3.具有净电荷密度+0.1的PEG-修饰hGH的构建
这一设计描述了用短长度的附加多肽修饰的多肽且净电荷密度为+0.1。
具有带正电的氨基酸的附加蛋白质可以设计为达到净电荷密度+0.1。这一融合蛋白质包括+22的净正电荷,这可以通过添加包含27个正电荷的附加蛋白质获得(计算为27-5=22氨基酸),产生287个氨基酸的组合多肽长度(计算为191+27氨基酸)。
设计4.rPEG_J288-GFP,rPEG_J288-hGH和rPEG_J288-GLP1修饰多肽的构建
这一设计描述了用包含16.6%谷氨酸残基的288个氨基酸的长亲水性附加多肽修饰的多肽。
rPEG_J288具有序列(GGSGGE)48并包含48个E残基(图17)。当rPEG_J288添加到hGH上时,修饰多肽的总长度变成479个氨基酸(计算为191+288)且净电荷变成53(计算为48+5),因此产生-0.11的净电荷密度(计算为53/479=0.11)。这一设计中,附加多肽本身由于许多甘氨酸和丝氨酸残基的存在具有16%的净电荷密度,而在设计1中,附加多肽完全由带电的残基构成。试验结果表明,这一设计产生高度可溶和活性的多肽。-0.11的净电荷密度表现为足以保持蛋白质在溶液中,如果电荷通过添加丝氨酸和/或甘氨酸扩展开。
本实施例描述了编码144个氨基酸的附加多肽和序列(GGSGGE)48的融合基因的构建。填充载体pCW0051如图16所示构建。pCW0051中表达盒的序列示于图18中。插入片段基本如对rPEG_L288所述获得但通过编码rPEG序列rPEG_J288的合成寡核苷酸(图11)与一对编码KpnI位点的接头的寡核苷酸一起退火。以下寡核苷酸用作正向和反向引物:
pr_LCW0057for:
AGGTAGTGGWGGWGARGGWGGWTCYGGWGGAGAAGG,
pr_LCW0057rev:
ACCTCCTTCTCCWCCRGAWCCWCCYTCWCCWCCACT,
以下寡核苷酸用作终止引物(stopper primer):
pr_3KpnIstopperFor:AGGTTCGTCTTCACTCGAGGGTAC,
pr_3KpnIstopperRev:CCTCGAGTGAAGACGA。
通过改变正向/反向引物与终止引物的比例,可以控制所得到的PCR产物的大小。插入片段用于产生编码rPEG_J288修饰的GFP的质粒和以类似于rPEG_L288-修饰GFP的方式表达这一质粒的细胞(图10)。类似的插入片段用于产生编码rPEG_J288-修饰hGH和rPEG_J288-修饰GLP1的质粒和以类似于rPEG_L288-修饰GFP的方式表达这一质粒的细胞(图12)。
rPEG_J288-修饰GFP的纯度通过SDS-PAGE(图36)、分析型尺寸排阻色谱法(参见图37)、质谱(图39)确定。rPEG_J288-修饰GFP的表观分子量也如上所述进行测量(图41)。图49显示了在将生物活性多肽(GLP1)连接到rPEG_J288附加多肽时观察到的表观分子量的增加。在体内试验中这一多肽可以观察到很少的免疫原性(图44)。
设计5.rPEG_L288-GFP,rPEG_L288-hGH和rPEG_L288-GLP1修饰多肽的构建
这一设计描述了用包含25%谷氨酸残基的288个氨基酸的长亲水性附加多肽修饰的多肽。rPEG_L288具有序列(SSESSSSESSSE)24并包含72个E残基。当rPEG_L288加到hGH,融合体的总长度变成479氨基酸(计算为191+288氨基酸)且净电荷变成77(计算为72+5),产生0.16的净电荷密度(计算为77/479氨基酸)。如下面描述的试验结果表明的,这一具有净电荷密度-0.16的设计显示出极佳的溶解性且蛋白质是活性的。在低温下观察到一些凝胶形成,但这不成为问题。
这一部分描述了编码附加多肽、具有288氨基酸的rPEG_L288和序列(SSSESSESSSSE)24的密码子优化的基因的构建。基于pET载体并包含T7启动子的填充载体pCW0150如图9中所示构建。载体编码Flag序列,接头是侧邻BsaI、BbsI和KpnI位点的填充序列。填充序列之后是His6标签和绿色荧光蛋白(GFP)基因。GFP选择为生物活性蛋白质且可以用于成象应用中或作为选择标志物。填充序列包含终止密码子并因此携带填充质粒(stuffer plasmid)pCW0150的大肠杆菌细胞形成非荧光的集落。填充载体pCW015用BsaI和KpnI消化。构建编码36个氨基酸长度附加多肽的密码子库。设计附加多肽rPEG_L36并具有氨基酸序列(SSSESSESSSSE)3。插入片段通过编码氨基酸序列SSESSESSSSES的合成寡核苷酸对及一对编码KpnI位点的接头的寡核苷酸一起退火获得。以下寡核苷酸用作正向和反向引物:
pr_LCW0148for:
TTCTAGTGARTCYAGYGARTCYAGYTCYAGYGAATC,
pr_LCW0148rev:
AGAAGATTCRCTRGARCTRGAYTCRCTRGAYTCACT,
以下寡核苷酸用作终止引物:
pr_3KpnIstopperForTTCT:
TTCTTCGTCTTCACTCGAGGGTAC,
pr_3KpnIstopperRev:CCTCGAGTGAAGACGA.
通过改变正向/反向引物与终止引物的比例,可以控制所得到的PCR产物的大小。连接退火的寡核苷酸对,这产生具有代表(SSSESSESSSSE)重复序列的不同数目的可变长度的产物的混合物。对应于rPEG_L36长度的产物通过琼脂糖凝胶电泳从混合物中分离并接合到BsaI/KpnI消化的填充载体pCW0150中。载体转化的细胞在诱导后显示绿色荧光,这表明rPEG_L36的序列已结合到GFP基因框架中。所得到的库命名为LCW0148。库LCW0148的分离物(例如,312个分离物)对高水平荧光进行筛选。具有强荧光的分离物(例如,70个分离物)通过PCR进行分析以核实rPEG_L片段的长度且鉴别了具有预期的rPEG_L36长度的34个克隆。这一过程产生34个显示出高表达且密码子选择不同的rPEG_L36分离物的集合。质粒混合物用BsaI/NcoI消化且分离包含rPEG_L36序列和GFP的部分的片段。相同的质粒混合物用BbsI/NcoI消化且分离包含rPEG_L36、大部分的质粒载体和GFP基因的剩余部分的载体片段。混合、接合两种片段并转化到BL21Gold(DE3)中,且对分离物筛选荧光。这一二聚化过程重复两次或多次。这各过程中,rPEG_L基因长度加倍并最终获得编码rPEG_L288的基因的集合。rPEG_L288模块包含核苷酸序列不同的rPEG_L36片段(尽管它们具有相同的氨基酸序列)。因此,基因中的内部同源性最小化并因此自发重组的风险降低。编码rPEG_L288的大肠杆菌BL21Gold(DE3)携带质粒(harboring plasmid)培养至少20倍时(doubling)没有观察到自发重组。
携带编码rPEG_L288的质粒的大肠杆菌BL21Gold(DE3)细胞在Terrific Broth(TB)中培养且第二天在新鲜TB中稀释200倍。当培养物达到A600nm=0.6时,通过添加IPTG至0.2mM最终浓度诱导rPEG_L288-GFP表达。细胞在26C下18hr小时后收获且可以储存在-80C直至进一步处理。细胞重悬于90ml的50mM Tris-HCl,200mM氯化钠,0.1%Tween-20,10%丙三醇,pH 8.0/升细菌培养物中。蛋白酶抑制剂、溶菌酶(最终20ug/ml)和benzonase核酸酶在溶解之前加入到细菌悬液中。细胞在冰上通过超声溶解四分钟,接着在80℃热处理20min。溶解产物随后在冰上冷却并在Sorvall SS-34离心机中以15000rpm离心20min。可溶性重组蛋白质通过上清液的固定金属离子亲和色谱(IMAC)。蛋白质进一步通过离子交换色谱(IEC)和凝胶过滤色谱纯化。任选地,蛋白质可以进一步使用标准技术通过具有固定的抗-FLAG抗体的柱纯化。蛋白质的纯度和均质性使用标准生物化学方法包括SDS-PAGE、天然-PAGE、分析型凝胶过滤色谱、光散射和质谱测定。获得至少90%的纯度。另外,修饰多肽rPEG_L288-hGH和rPEG_L288-GLP1以相似的方式获得。
rPEG_L288-修饰的GFP的纯度通过SDS-PAGE(图36)、分析型反相HPLC(图38)确认。rPEG_L288-修饰的GFP的表观分子量也如先前所述进行测量(图41)。图49显示在将生物活性多肽(GLP1)连接到rPEG_L288附加多肽时观察到的表观分子量提高。在大鼠和人血清中的体内稳定性如图42中所示确定。rPEG在大鼠和人血清中是稳定的且rPEG288在大鼠中具有大约10-20小时的半衰期(图43)。在体内试验中这一多肽可以观察到很少的免疫原性(图44)。
设计6.rPEG_K288-GFP,rPEG_K288-hGH和rPEG_K288-GLP1附加多肽的构建
这一设计描述了用包含33%谷氨酸残基的288氨基酸长亲水性附加多肽修饰的多肽。rPEG_K288具有序列(GEGGGEGGE)32并包含96个E残基。当rPEG_K288加到hGH时,融合体的总长度变成479氨基酸(计算为191+288)和净电荷变成101(计算为96+5),产生净电荷密度0.21(计算为101/479。如所预测的和通过下面描述的试验结果确认的,这一具有净电荷密度-0.21的设计显示出高水平的溶解性且蛋白质是活性的。在测试温度或盐浓度下未观察到凝胶形成。
这一部分描述了编码序列(GEGGGEGGE)32的附加多肽的融合基因的构建。插入片段基本如对rPEG_L288所述的获得但通过编码rPEG序列rPEG_K288的合成寡核苷酸及一对编码KpnI位点的接头的寡核苷酸一起退火。以下寡核苷酸用作正向和反向引物:
pr_LCW0147for:
AGGTGAAGGWGARGGWGGWGGWGAAGG
pr_LCW0147rev:ACCTCCTTCWCCWCCWCCYTCWCCTTC
以下寡核苷酸用作终止引物:
pr_3KpnIstopperFor:AGGTTCGTCTTCACTCGAGGGTAC
pr_3KpnIstopperRev:CCTCGAGTGAAGACGA.
通过改变正向/反向引物与终止引物的比例,可以控制所得到的PCR产物的大小。插入片段用于产生编码rPEG_K288-修饰GFP的质粒和以类似于rPEG_L288-修饰GFP的方式表达这一质粒的细胞。另外,修饰多肽rPEG_K288-hGH和rPEG_K288-GLP1以类似的方式获得。
rPEG_K288-修饰GFP的纯度通过SDS-PAGE(图36)、分析型尺寸排阻色谱法(参见图37)、质谱(图39)确定。rPEG_K288-修饰GFP的表观分子量也如上所述进行测量(图41)。图49显示了在将生物活性多肽(GLP1)连接到rPEG_K288附加多肽时观察到的表观分子量的增加。在大鼠和人血清中的体内稳定性如图42中所示确定,且体内药代动力学特性示于图43中。rPEG在大鼠和人血清是稳定的,且rPEG288在大鼠中具有大约10-20小时的半衰期(图43)。在体内试验中这一多肽可以观察到很少的免疫原性(图44)。
蛋白质表达
构建设计4、5和6且蛋白质如下表达和鉴定。简单地说,hGH基因与携带T7启动子和如上所述的288氨基酸的rPEG-J、-K或-L的编码序列(分别为设计4,5或6)的质粒的rPEG序列融合,取代GFP基因。在本实施例中,rPEG之后是hGH基因,虽然可以预期其它形式,如在修饰多肽C末端具有rPEG。质粒转化到BL21(DE3)-star大肠杆菌菌株(Novagen)并接种在具有适宜的抗生素的LB-琼脂培养板上和在37℃生长过夜。单个集落接种在5ml的TB 125培养基中并在37℃生长过夜。下一天,接种体转移到具有500ml的TB125的2L容器中并生长至达到OD=0.6,随后在26℃以100mM IPTG继续生长16hr。
细胞通过离心收集且细胞沉淀重悬于50ml缓冲液中(包含50mM Tris pH=8.0,100mM NaCl,蛋白酶抑制剂,10%(v/v)甘油,0.1%Triton X-100和DNAse)。细胞使用超声波的超声细胞粉碎机破碎且细胞碎片通过在4℃以15000RPM离心除去。细胞上清液应用到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用具有1M NaCl的同一缓冲液的线性梯度从柱中洗脱。蛋白质在大约500mM NaCl下洗脱。洗脱的融合蛋白质进行冷却、透析并加载到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mMTris pH=8.0)洗涤并使用具有1M NaCl的同一缓冲液的浅线性梯度从柱中洗脱。洗脱的融合蛋白质进行冷却、以缓冲液A透析、浓缩并通过作为最终纯化的尺寸排阻色谱(SEC)纯化。蛋白质纯度估计高于98%,考虑到只使用离子交换和SEC以rPEG-特异性的方式从全细胞纯化蛋白质,这一结果是出人意料的。洗脱的融合蛋白质的质量SDS-PAGE分析和通过测量总蛋白质浓度测定。洗脱融合蛋白质的高质量反映了融合蛋白质相对于单独hGH的更高的溶解性。
附加多肽-修饰hGH在hGH受体结合分析中的测试
为确定是否纯化的hGH-rPEG_K288是处于其活性的天然构象,我们测试了其结合人生长激素受体的能力。简单地说,溶解于磷酸盐缓冲盐水(PBS)中的500ng重组hGH受体(购自R&D Systems)在4℃吸附到微孔板的孔中过夜。未结合的受体随后通过用含0.5%Tween-20的PBS(PBST)洗涤除去。进一步的非特异性结合通过加入PBS(结合缓冲液)中的1%牛血清白蛋白阻止。在用PBST进一步洗涤后,稀释在结合缓冲液中的200nM的hGH-rPEG_K288或重组hGH(购自R&D Systems)加入到hGH受体涂覆的板上。结合的hGH-rPEG_K288和hGH用多克隆兔抗-hGH抗体和辣根过氧化物酶(HRP)偶联的抗兔第二抗体检测。加入HRP底物,2,2′-连氮基-双(3-乙基苯并噻唑-6-磺酸)并在30分钟后测量405nm处的吸光度,如图34中所示,hGH-rPEG_K288结合hGH受体及重组hGH。这一结果表明,hGH在胞质中表达为rPEG融合蛋白质是可溶的、正确折叠并处于其活性构象。这一结果与天然人生长激素(hGH)(其通常在大肠杆菌胞质中形成由失活蛋白质构成的包含体且必须展开和重折叠以活性的)形成对比。这表明当与rPEG多肽融合时,hGH可以以可溶的活性形式在的大肠杆菌胞质中表达。数据表明,0.1电荷/AA的净电荷密度(如同hGH-rPEG_J288)足以使融合蛋白质可溶,0.16的净电荷密度(如hGH-rPEG_L288获得的)产生具有更高可溶性的蛋白质且0.21的净电荷密度(hGH-rPEG_K288获得的)类似地提高溶解性。
设计1、2和3类似地制备,但分别包括16个带负电的氨基酸(在所有三种情况中是谷氨酸),41个带负电的氨基酸或27个带正电的氨基酸而不是rPEG-J、-K和-L序列,且可以具有改善的溶解性。
在设计附加多肽序列时,可以考虑治疗蛋白质的整体理想性能,包括例如血清稳定性、表达水平和免疫原性,其如上所述也可以受选择引入到附加多肽中的氨基酸的影响。
实施例2:人生长激素(hGH)-可切割的rPEG修饰多肽的表达
本实施例如图13中所示描述了在治疗蛋白质和附加多肽之间具有蛋白酶切割序列的rPEG_K288-连接的人生长激素多肽的制备。附加多肽部分在重组体表达过程中改善溶解性达到活性蛋白质可以轻易地大量分离的程度,而蛋白酶切割位点允许任选地通过蛋白酶消化除去rPEG。最终蛋白质产物是纯的和活性的hGH.
携带hGH、N-末端融合rPEG-K288的288个氨基酸、具有重复序列(GEGGGEGGE)32和TEV蛋白酶切割位点(ENLYFQ/X),伴随T7启动子的质粒(即T7启动子-hGH-TEV-rPEG_K288)转化到BL21(DE3)-star大肠杆菌菌株中并如上所述生长。细胞通过离心收集且细胞沉淀重悬于50ml缓冲液中(包含50mM Tris pH=8.0,100mMNaCl,蛋白酶抑制剂,10%(v/v)甘油,0.1%Triton X-100和DNAse)。细胞使用超声波的超声细胞粉碎机破碎且细胞碎片通过在4℃以15000RPM离心除去。细胞上清液应用到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用具有1MNaCl的同一缓冲液的线性梯度从柱中洗脱。蛋白质在大约500mMNaCl下洗脱。汇合洗脱的融合蛋白质、透析和TEV消化。消化混合物重新加载到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用具有1M NaCl的同一缓冲液的浅线性梯度从柱中洗脱。洗脱的hGH蛋白质进行冷却、以缓冲液A透析、浓缩并通过作为最终纯化的尺寸排阻色谱(SEC)纯化。蛋白质纯度估计高于98%。
实施例3:融合CBD和rPEG_K288的人生长激素(hGH)的表达
本实施例描述了CBD-TEV-rPEG_K288-hGH融合蛋白质的制备。在用TEV蛋白酶消化和纯化后,最终蛋白质产物是-rPEG_K288-hGH。
pET-系列载体用T7启动子构建,其表达在N-末端包含纤维素结合域(CBD),之后是番茄蚀刻病毒(TEV)蛋白酶切割位点,之后是hGH编码序列和rPEG K288编码序列:CBD-TEV-rPEG-K288-hGH的蛋白质。rPEG_K288具有重复序列(GEGGGEGGE)32。使用的CBD序列显示于Swissprot文件Q06851中且CBD融合蛋白质的纯化在Ofir,K.等(2005)Proteomics 5:1806中描述。TEV切割位点的序列是ENLYFQ/X;G用于X位置。这一构建体转化到BL21(DE3)-star大肠杆菌菌株中并基本如上所述生长,除了CBD序列加到rPEG序列的N-末端。细胞基本如上所述收集和破碎。细胞上清液加到球状纤维素树脂(Perloza 100)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用20mM NaOH从柱中洗脱。pH通过用1M Tris缓冲液pH=8.0重处理(reutilizing)样品进行调节。蛋白质纯度估计高于90%。
在如实施例2中所述进行TEV消化后,消化的样品回到球状纤维素树脂(Perloza 100)上,其中CBD保留在柱上而rPEG_K288-hGH在柱流中发现。汇合的柱流加载到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用具有1MNaCl的同一缓冲液的浅线性梯度从柱中洗脱。汇合洗脱的融合蛋白质、以缓冲液A透析、浓缩并通过作为最终纯化的尺寸排阻色谱(SEC)纯化。蛋白质纯度估计高于98%(图50和51)。最终蛋白质是rPEG_K288-hGH。
实施例4:融合rPEG_K288的CBD-人生长激素(hGH)的表达
本实施例描述了CBD-rPEG_K288-TEV-hGH融合蛋白质的制备。在TEV蛋白酶消化和纯化后,最终蛋白质产物是纯的hGH。
携带hGH、N-末端融合TEV蛋白酶识别位点和伴随T7启动子的CBD且C-末端融合具有重复序列(GEGGGEGGE)32的rPEG-K288的质粒(产生包含CBD-rPEG_K288-TEV-hGH的载体转化到BL21(DE3)-star大肠杆菌菌株(Novagen)中并基本如实施例3中所述生长。细胞基本如实施例3中所述收集和破碎。细胞上清液加到球状纤维素树脂(Perloza 100;Iontosorb Inc.)上,用缓冲液A(25mM TrispH=8.0)洗涤。在基本如实施例3中所述进行TEV消化后,hGH在柱流中发现,而CBD-rPEG_K288保留在柱上。汇合的柱流加载到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用具有1M NaCl的同一缓冲液的浅线性梯度从柱中洗脱。汇合洗脱的hGH蛋白质、以缓冲液A透析、浓缩并通过作为最终纯化的尺寸排阻色谱(SEC)纯化。蛋白质纯度估计高于98%。最终蛋白质产物是纯的和活性的hGH。
实施例5:rPEG_K288-VHH结合溶菌酶的域抗体的表达
本实施例描述了融合VHH域抗体(dAb)的rPEG_K288的制备。
携带hGH、N-末端融合288氨基酸的rPEG-K、具有伴随T7启动子的重复序列(GEGGGEGGE)32的质粒基本如实施例1中所述制备,但用域抗体编码序列取代hGH编码序列。域抗体编码序列在Dumoulin,M.等,Protein Science 11:500-505(2002)中提供。克隆dAb-Lys3的氨基酸残基1-113引入rPEG构建体中。这一序列是以11nM的Kd结合鸡蛋溶菌酶的域抗体。这一域抗体序列在没有另外的溶解性增强序列存在情况下在大肠杆菌胞质中表达时仅产生由失活蛋白质构成的包含体。可选择地,如果通过前导序列引导,它可以以活性形式在周质中表达。VHH dAb序列插入rPEG_K288序列的上游且所得到的质粒转化到BL21(DE3)-star大肠杆菌菌株(Novagen)。细胞基本如上所述生长、收集和破碎。细胞上清液加到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用具有1M NaCl的同一缓冲液的线性梯度从柱中洗脱。蛋白质在大约500mM NaCl下洗脱。合并洗脱的融合蛋白质,透析并加载到阴离子交换剂(Q-sepharose,Pharmacia)上,用缓冲液A(25mM Tris pH=8.0)洗涤并使用具有1M NaCl的同一缓冲液的浅线性梯度从柱中洗脱。合并洗脱的融合蛋白质、以缓冲液A透析、浓缩并通过作为最终纯化的尺寸排阻色谱(SEC)纯化。蛋白质纯度估计高于98%。
所得到的VHH-rPEG_K288蛋白质通过ELISA分析其结合靶标(鸡蛋溶菌酶(Sigma))的能力。该蛋白质显示出对溶菌酶的特异性,但三种对照蛋白质没有这种特异性,表明将rPEG_K288加到VHH使其以可溶的活性形式在大肠杆菌胞质中表达。
实施例6:IFNa2a-rPEG的表达
本实施例描述了IFNa2a-rPEG融合蛋白质的制备。
干扰素α2a具有165个氨基酸,pI为5.99且分子量为19241.62,对应于序列:
CDLPQTHSLGSRRTLMLLAQMRKISLFSCLKDRHDFGFPQEEFGNQ
FQKAETIPVLHEMIQQIFNLFSTKDSSAAWDETLLDKFYTELYQQL
NDLEACVIQGVGVTETPLMKEDSILAVRKYFQRITLYLKEKKYSPC
AWEVVRAEIMRSFSLSTNLQESLRSKE
该多肽具有14个谷氨酸残基和8个天冬氨酸残基,总共22个负残基。类似地,11个赖氨酸和8个精氨酸残基向蛋白质添加19个正电荷,得到净电荷-3。因此电荷密度-0.018(计算为-3/165氨基酸)。这一净电荷密度与试验pI值5.99非常相关。改善的溶解性需要的电荷密度选择为0.1负电荷/氨基酸。为实现这一电荷密度,不需要另外的13.5负电荷,计算为(16.5-3)。
向干扰素α添加15个带负电的氨基酸使融合蛋白质的净电荷密度为-0.1(计算为(15+3)/(165+15)),其对于提高溶解性是理想的。-0.2电荷/氨基酸的较高电荷密度可以通过在蛋白质包含大约26个额外的带负电的氨基酸残基达到总共41个带负电的氨基酸残基获得。因为组合长度是206氨基酸(计算为165+41),电荷密度-0.2需要总共41个带负电的氨基酸残基(计算为0.2×205氨基酸),这意味着附加蛋白质可以包含38个带负电的残基(计算为41-3)。
通过类似的推理,为达到净电荷密度+0.1,附加多肽可以包含15+6=21个带正电的氨基酸。
rPEG J288具有序列GGSGGE并包含48个E残基,且因此可以用于增加IFNa2a的电荷密度。当rPEG_J288加到IFNa2a上时,融合蛋白质的总长度是453氨基酸(计算为165+288氨基酸)且净电荷是51(48+3),从而产生净电荷密度0.11(计算为51/453),这允许IFNa2a以可溶的活性形式在细胞质中表达。构建体、表达和纯化方法基本上如实施例1中所述制备和完成。融合蛋白质证明是可溶的和活性的,虽然在某些条件下仍可观察到一些聚集的倾向。这可以通过增加净电荷密度克服而保持蛋白质在溶液中。相同大小但具有更多电荷的rPEG,如rPEG_L(288AA,25%E)和rPEG_K(288AA,33%E)可能能够使得IFNa2a-rPEG融合蛋白质完全可溶和活性折叠。对于IFNa2a-rPEG_K288,附加多肽中带负电的氨基酸残基的是96个,从而融合蛋白质的总净电荷是99(计算为96+3),这意味着净电荷密度是0.218(计算为99/(288+165))。
实施例7:G-CSF-rPEGJ-288的表达
本实施例描述了G-CSF-rPEG融合蛋白质的制备。
G-CSF具有174氨基酸的长度,pI为5.65且分子量为18672.29,对应于序列:
TPLGPAS SLPQSFLLKCLEQVRKIQGDGAALQEKLCATYKLCHPEE
LVLLGHSLGIPWAPLSSCPSQALQLAGCLSQLHSGLFLYQGLLQAL
EGISPELGPTLDTLQLDVADFATTIWQQMEELGMAPALQPTQGAM
PAFASAFQRRAGGVLVASHLQSFLEVSYRVLRHLAQP.
该多肽具有9个谷氨酸残基和4个天冬氨酸残基,总共13个负残基。类似地,4个赖氨酸和5个精氨酸残基为蛋白质添加总共9个正电荷,得到净电荷-4。因此电荷密度是-0.023(计算为-4/174氨基酸)。这一净电荷密度与试验pI值5.65非常相关。
改善溶解性需要的电荷密度选择的0.1负电荷/氨基酸。为达到这一电荷密度,需要另外的13.4个带负电的氨基酸残基(计算为17.4-4)。
对于GCSF,添加14个带负电的氨基酸使融合蛋白质净电荷密度达到大约-0.1(计算为(14+4)/(174+14)),这通常对于溶解性是理想的。优选的电荷密度-0.2需要大约26个额外的带负电的氨基酸残基,总共41个带负电的氨基酸残基,因为组合长度是217氨基酸(计算为174+43)。可选的电荷密度-0.2需要总共43个带负电的氨基酸残基(计算为0.2×217氨基酸),这意味着附加蛋白质包含39个带负电的残基(计算为43-4)。
在替代设计中,需要达到+0.1的净电荷密度的具有带正电氨基酸的附加蛋白质,其需要净正电荷+21。这可以通过添加包含25个正电荷的附加蛋白质实现(计算为25-4=21),导致209氨基酸的组合融合蛋白质长度。
试验结果:
rPEG_J288具有序列GGSGGE并包含48个E残基。当rPEG_J288加到GCSF上时,融合体总长度变为174+288=462氨基酸且净电荷变成48+3=51,产生净电荷密度0.11(计算为51/462)。这一电荷预计足以将GCSF从>80%聚集转化为>80%的可溶性蛋白质。也可以使用较高的电荷密度0.15或0.2。
使用标准分子生物学技术,上述任何实施例可以改变为使用与治疗蛋白质融合的不同的rPEG模块。本发明已经证明,净电荷密度0.1提供了蛋白质在胞质中的改善的溶解性(例如,对于GFP、hGH和IFNa2a),而大约0.2的净电荷密度提供高度可溶性蛋白质而没有聚集的倾向。
实施例8.与GFP融合的不同rPEG序列在在大肠杆菌胞质中重组表达时的溶解性
在本试验中制备和测试以下蛋白质序列:
rPEG_J288-GFP-表示由融合GFP的重复序列(GSGGEG)48构成的蛋白质序列。
rPEG_K288-GFP-(GEGEGGGEG)32构成的蛋白质序列。
rPEG_L288-GFP-表示由融合GFP序列的重复序列(SSESSESSSSES)24构成的的蛋白质序列。
rPEG_O336-GFP-表示由融合GFP序列的重复序列(SSSSSESSSSSSES)24构成的的蛋白质序列。
rPEG_P320-GFP-表示由融合GFP序列的重复序列(SSSESSSSES)32构成的的蛋白质序列。
各融合GFP的N-末端的rPEG_J288、K288、L288、O336和P320被引入大肠杆菌菌株BL21-Star中,在LB-Kan琼脂培养板上生长并在37℃孵育16小时。第二天,各构建体的单集落接种在2mL的TB 125生长培养基上并生长5hr。100ul的各细菌液体培养基转移到具有TB125培养基+Kan的10ml烧瓶中并生长到OD600达到~0.6。生长烧瓶转移到26C并在振摇条件下用100uM IPTG诱导16小时。细菌细胞离心并重悬于10ml的PBS中并随后通过超声破碎。对100μl等份的各样品离心并收集上清液。最后,读取100μl细胞溶解产物和可溶性部分的GFP荧光并进行比较。
结果示于图33中。用rPEG附加多肽J、K和L修饰的GFP具有可溶形式中的大部分GFP信号,而在rPEG O和rPEG P融合序列中GFP荧光的实质部分保留在不溶性形式中。另外,与富含Ser的rPEG序列融合的GFP比富含Gly的序列表达得更好,而富含Gly的rPEG序列保留大部分的荧光在可溶形式中。
实施例9.附加物连接的多肽性能的测定
附加物连接的多肽血清稳定性的测定
融合蛋白质Flag-rPEG_J288-H6-GFP(如图19中所示纯化,包含N-末端Flag标签和与绿色荧光蛋白N-末端融合的附加序列rPEG_J288)在37C下50%小鼠血清中孵育3天,在不同的时间的提取样品并SDS PAGE分析,随后使用蛋白质印迹分析进行检测。抗N-末端flag标签的抗体用于蛋白质印迹检测。图20显示,附加蛋白质在血清中至少三天是稳定的。
附加物连接的多肽血浆半衰期的测定
附加物连接的多肽的血浆半衰期可以在i.v.或i.p.注射附加多肽到插导管的大鼠后测量,基本上如[Pepinsky,R.B.等(2001)JPharmacol Exp Ther,297:1059-66]所述。可以在不同的时间的提取血液样品(5min,15min,30min,1h,3h,5h,1d,2d,3d)并可以使用ELISA测量附加多肽的血浆浓度。药代动力学参数可以使用WinNonlinversion 2.0(Scientific Consulting Inc.,Apex,NC)计算。为分析rPEG-连接的多肽的效应,可以比较包含rPEG多肽的蛋白质的血浆半衰期和缺乏rPEG多肽的蛋白质的血浆半衰期。
在大鼠中研究LCW0057和LCW0066的体内半衰期。两种蛋白质静脉注射到大鼠体内。在注射后5分钟至3天分析血清样本中GFP的存在。对于注射LCW0057的大鼠,蛋白质注射后24h检测不到GFP。这表明蛋白质半衰期为1-3h。相反对于LCW0066,甚至在注射后48h可检测到且一只大鼠中甚至在注射后3天可检测到GFP。这表明LCW0066在大鼠中具有大约10小时的血清半衰期,这远大于具有52kDa计算分子量的蛋白质的预期血清半衰期。
附加物连接的多肽的溶解性测试
附加物连接的多肽的溶解性可以通过在生理缓冲液如磷酸盐缓冲盐水中浓缩附加物连接的多肽的纯化样品到0.01mg/ml-10mg/ml范围内的各种浓度测定。样品可以孵育最多几周。浓度超过附加物连接的多肽溶解性的样品表现为混浊的沉淀,其可以在光度仪中测量。可以通过离心或过滤隐去沉淀物质并使用蛋白质分析方法如在280nm测量吸光度的Bradford分析测量保留在上清液中的浓度。溶解性研究可以通过-20C冷冻样品然后融解而加速。这一过程常导致弱溶解性蛋白质的沉淀。
附加多肽修饰的GFP的尺寸排阻色谱法
具有序列(GGSGGE)48的rPEG与绿色荧光蛋白(GFP)融合以产生克隆LCW0066。该融合蛋白质还在rPEG和GFP之间携带N-末端Flag标签和His6标签。融合蛋白质在大肠杆菌中使用标准T7表达载体表达。细胞在LB培养基中培养且用IPTG诱导表达。在表达后,细胞通过加热沉淀到70℃15min溶解。大多数大肠杆菌蛋白质在这一热处理步骤中变性并可以通过离心除去。通过IMAC色谱从上清液纯化融合蛋白质,然后通过固定抗Flag(Sigma)纯化。融合蛋白质使用10/30Superdex-200(GE,Amersham)通过尺寸排阻色谱法(SEC)进行分析。柱用球状蛋白质(菱形)校准。包含rPEG_J288和GFP的融合蛋白质比按照其计算分子量预测的时间显著更早地洗脱。按照球状蛋白质的校准,SEC测得融合蛋白质的表观分子量为243kDa,其是52kDa的计算分子量的几乎5倍。相关融合蛋白质(LCW0057)包含rPEG36并具有55kDa表观分子量(相对于32kDa的计算分子量)。LCW0066与LCW0057的对比表明189kDa的表观分子量差异,这是由于添加具有20kDa计算分子量的rPEG链引起的。因此,可以算出添加具有20kDa计算分子量的rPEG尾导致189kDa的分子量增加。
实施例10.修饰多肽的控释制剂
rPEG-GFP融合蛋白质的包封
Resomer-PEG共聚物可商购得到(例如Boehringer-Ingelheim)。包含rPEG(L288)-GFP或单独GFP的微球通过双重乳化溶剂提取/蒸发(W/O/W,水包油包水)方法制备。蛋白质(1%重量/体积)和Resomer-PEG共聚物(9%重量/体积)溶解于二氯甲烷中。因此,理论的微球加载效率是10%重量/重量蛋白质。蛋白质聚合物混合物然后剧烈搅拌5分钟。混合物在包含1%聚乙烯醇的水溶液中稀释50倍并在室温下剧烈搅拌几小时。硬化的微球用超纯水洗涤几次、干燥并在4℃储存在干燥器中。
可以对这一方案进行改进。包括改变蛋白质∶共聚物比率,使用水溶液中的蛋白质样品而不是冻干的蛋白质样品和冻干硬化的微球。也可以使用不同的聚合物基质,例如用二嵌段(PLGA-PEG)或嵌段(PLGA-PEG-PLGA)共聚物取代Resomer-PEG共聚物。类似地,微球可以储存在各种条件下,例如-20C或-80C。也可以利用多个微粒涂层以获得药物浓度梯度,从而具有较小表面积的内层由于更高的药物浓度而产生相同的药物释放/单位。
包封效率的测量
为评价rPEG(L288)-GFP包封到微球中的包封效率,200mg微球溶解于二氯甲烷中。然后rPEG(L288)-GFP在3体积的磷酸盐缓冲盐水(PBS)中提取。从微球提取的rPEG(L288)-GFP的量使用纯化的重组rPEG(L288)-GFP作为标准通过夹心ELISA分析测量。简单地说,释放的rPEG(L288)-GFP在涂覆有α-FLAG抗体的微滴定板孔中捕获。捕获的蛋白质用多克隆α-GFP抗体和与辣根过氧化物酶(HRP)偶联的第二抗体检测。孔中的蛋白质的量通过与用纯化rPEG(L288)-GFP产生的标准曲线进行比较进行定量。
测量rPEG-GFP从微球的体外释放
rPEG-GFP融合体和GFP的体外释放通过以下程序测量。首先,微球(200mg)悬浮于1ml的PBS中。微球悬浮液在37℃缓慢搅拌下温育。每24小时取出等分样品(10-100μL)至少两周的时间。释放的rPEG-GFP和GFP的量如上所述通过夹心ELISA测量。对该过程的可能改进包括测量rPEG-GFP从悬浮于血清或血清/PBS混合物中的微球的释放。
包封蛋白质皮下注射注射后rPEG-GFP血清浓度的测定
rPEG-GFP和GFP的血清浓度可以在实验动物模型中分别单次皮下注射rPEG-GFP微球或GFP微球后测试。包封的rPEG-GFP或包封的GFP注射到小鼠、大鼠、兔或其它模型动物中(1mL/kg体重)测定体内释放速度。每天收集血清样本,进行一个月的时间。rPEG-GFP的血清浓度使用如上所述的夹心ELISA分析方法测量。rPEG-GFP融合多肽以比GFP高得多的浓度存在,因为从微球更慢释放和后续半衰期更长。
实施例11:聚合物包封的连接附加多肽的干扰素-α(IFN-α)
本实施例描述了rPEG-IFN-α的长效制剂,其延长该多肽的给药间隔。rPEG-融合IFN-α基本如实施例3中的hGH-rPEG融合构建体所述构建,除了GLP-1编码序列被IFN-α编码序列取代,所有其它方法和技术包括包封方法基本如实施例10中所述。
使用标准分子生物学技术,上述任何实施例可以改变为使用与生物活性多肽融合的不同的附加多肽。附加多肽可以包括前面描述的任何序列且可以达到几百个氨基酸的长度。类似地,实施例可以改进以应用本文中描述的任何治疗蛋白质,例如但不限于rPEG-胰岛素、rPEG-IFN-β、rPEG-红细胞生成素和rPEG-肿瘤坏死因子-α。这些实施例中描述的重组蛋白质可以按照标准生物化学技术在大肠杆菌中表达或纯化。如本领域技术人员已知的,例如rPEG-红细胞生成素和rPEG-肿瘤坏死因子-α需要翻译后糖基化且因此必须在人组织培养细胞中产生。在这些情况中,附加多肽可以在人体细胞中表达并可以进行密码子优化以在人体细胞中更好地表达。密码子优化可以使用标准分子生物学方法进行。
实施例12:非重复附加多肽的构建
本实施例描述了从合成寡核苷酸构建附加多肽片段库。图78列出了由合成寡核苷酸编码的氨基酸序列。对于各氨基酸序列,我们使用了两个互补寡核苷酸。序列设计为密码子库,即允许多个不同的密码子但所有序列只编码一个氨基酸序列。互补寡核苷酸通过加热之后冷却进行退火。寡核苷酸设计为在退火中产生4碱基对重叠,如图79中所示。也加入两个另外的退火寡核苷酸作为连接反应的多聚化过程中的终止子。图79显示了产生编码可变长度附加多肽片段的基因片段的退火寡核苷酸的连接。所得到的连接混合物通过电泳分离,如图79中所示,且分离编码URP36的连接产物。这一连接产物连接在表达载体中且URP36片段库表达为GFP的融合蛋白质。
以这种方式制备的附加多肽序列示于图80。更多序列公开如下:
LCW0219.040
GEGSGEGSEGEGSEGSGEGEGSEGSGEGEGGSEGSEGEGGSEGSEG
EGGSEGSEGEGSGEGSEGEGGSEGSEGEGSGEGSEGEGSEGGSEGE
GGSEGSEGEGSGEGSEGEGGEGGSEGEGSEGSGEGEGSGEGSEGE
GSEGSGEGEGSGEGSEGEGSEGSGEGEGSEGSGEGEGGSEGSEGEG
SEGSGEGEGGEGSGEGEGSGEGSEGEGGGEGSEGEGSGEGGEGEG
SEGGSEGEGGSEGGEGEGSEGSGEGEGSEGGSEGEGSEGGSEGEGS
EGSGEGEGSEGSGE
LCW0219.068
GEGSGEGSEGEGSEGSGEGEGSEGGSEGEGSEGSGEGEGSEGSGEG
EGGEGSGEGEGSGEGSEGEGGGEGSEGEGGSEGSEGEGGSEGSEG
EGGEGSGEGEGSEGSGEGEGSGEGSEGEGSEGSGEGEGSEGSGEGE
GGSEGSEGEGSGEGSEGEGSEGSGEGEGSEGSGEGEGGSEGSEGEG
GSEGSEGEGGSEGSEGEGSGEGSEGEGGSEGSEGEGSGEGSEGEGS
EGGSEGEGGSEGSEGEGSGEGSEGEGGEGGSEGEGSEGSGEGEGS
GEGSEGEGSEGSGE
LCW0220.038
SEGESEESSESGGESSSGGGSEESSEEGSGGGSEGEGEESSGSEGGG
GSGEGSEGGSEEGSEESSEGESEESSESGGESSSGGGSEESSEEGSG
GGSGESGSGSSGSESEGGSEGESEESSGGGGSEGSEGESEESSESGG
ESSSGGGSEESSEEGSGGGSEEESGEGSGEGSEGSSGEGSEESSGGS
EGGGSGGSGGEGSGESGSGSSGSESEGGSEGESEESSGGGGSEGSS
EESGGSSEEGSEGSSGGESEESSEGESGGGSGGGSEGS
LCW0220.055
SEGESEESSESGGESSSGGGSEESSEEGSGGGSEGESEESSESGGESS
SGGGSEESSEEGSGGGSGESGSGSSGSESEGGSEGESEESSGGGGSE
GSESEGEEGSEEGSGEGSGEGGGESSEEGESESSGESGSGSSGSESE
GGSEGESEESSGGGGSEGSGESGSGSSGSESEGGSEGESEESSGGGG
SEGSGESGSGSSGSESEGGSEGESEESSGGGGSEGSSEESGGSSEEG
SEGSSGGESEESSEGESGGGSGGGSEGS
LCW0220.064
SEGESEESSESGGESSSGGGSEESSEEGSGGGSEGEGEESSGSEGGG
GSGEGSEGGSEEGSEESSEGESEESSESGGESSSGGGSEESSEEGSG
GGSGESGSGSSGSESEGGSEGESEESSGGGGSEGSGESGSGSSGSES
EGGSEGESEESSGGGGSEGSESEGEEGSEEGSGEGSGEGGGESSEE
GESESSEGESEESSESGGESSSGGGSEESSEEGSGGGSSEESGGSSEE
GSEGSSGGESEESSEGESGGGSGGGSEGS
LCW0220.093
SEGESEESSESGGESSSGGGSEESSEEGSGGGSGESGSGSSGSESEG
GSEGESEESSGGGGSEGSEGESEESSESGGESSSGGGSEESSEEGSG
GGSEEGSGESSGGSESEGSGGESEGGSGGEGGEGSGESGSGSSGSE
SEGGSEGESEESSGGGGSEGSSEESGGSSEEGSGGGSESGEESGSGE
ESEGGSGGSGGEGSGESGSGSSGSESEGGSEGESEESSGGGGSEGSS
GEGEESSEGEGGESSEEGSGGSSEEGSGEG
实施例13:rPEG Y576的构建
本实施例描述了URP片段库从合成寡核苷酸的构建。图78列出了合成寡核苷酸编码的氨基酸序列。对于各氨基酸序列,我们使用了两个互补寡核苷酸。序列设计为密码子库,即允许多个不同的密码子但所有序列只编码一个氨基酸序列。互补寡核苷酸通过加热之后冷却进行退火。寡核苷酸设计为在退火中产生4碱基对重叠,如图79a中所示。也加入两个另外的退火寡核苷酸作为连接反应的多聚化过程中的终止子。图79b显示了产生编码可变长度URP片段的基因片段的退火寡核苷酸的连接。所得到的连接混合物通过电泳分离,如图79b中所示,且分离编码URP36的连接产物。这一连接产物连接在表达载体中且URP36片段库表达为GFP的融合蛋白质(图81)。具有良好表达的库成员基于其强荧光强度鉴别。
URP36的库成员进行二聚化且对所得到的URP72库筛选高水平表达。这一二聚化和筛选过程再重复一次以产生URP_144。图80显示了序列的集合。序列符合库的设计,但大部分库成员的实际序列不同。这一URP_Y144的集合再二聚化两次以产生URP_Y288和URP_Y576的集合。URP_Y576的一个分离物的氨基酸序列显示于图80中。评价所得到的分离物的表达、聚集和免疫原性以鉴别最适合与药物蛋白质融合的URP。
实施例14:scFv-rPEG50融合体的构建
抗-Her2和抗-EGFR的构建
本实施例描述了scFv-rPEG50融合体的构建。制得两个scFvs,一个结合Her2,一个结合表皮生长因子受体(EGFR)。每个scFv分别与rPEG50的N-末端遗传融合。scFv构建体克隆到具有T7启动子并编码rPEG50-FLAG-标签-六组氨酸的表达载体中,产生表达scFv-rPEG50-FLAG-His6的构建体。填充片段使用NdeI和BsaI核酸内切酶通过限制性消化除去。合成的scFv片段通过聚合酶链式反应(PCR)扩增,其引入与填充构建体相容的NdeI和BbsI限制性位点。限制性消化的scFv片段和填充构建体使用T4DNA连接酶连接并电转化到大肠杆菌BL21(DE3)Gold中。所得到的DNA构建体显示于图64a中,其中轻链(vL)和重链(vH)可变片段由rPEGY30(30个氨基酸的序列(SGEGSEGEGGGEGSEGEGSGEGGEGEGS))分隔。Y30-氨基酸-编码序列侧邻AgeI和KpnI限制性位点以便于除去或取代vL和vH之间的连接序列。构建体通过DNA测序确认。aHer230-rPEG(M.W.=80,044Da)和aEGFR30-rPEG(M.W.=80,102Da)构建体的蛋白质序列分别显示于图64b和d中。
在大肠杆菌BL21(DE3)Gold中抗-Her230-rPEG和aEGFR30-rPEG融合体通过0.2mM异丙基-β-D-1-硫代半乳糖苷(IPTG)在20℃诱导进行表达。细胞通过离心收获并在磷酸盐缓冲盐水中通过BugBuste加Benzonase溶解。溶解产物通过离心净化且上清液(可溶性部分)加载到4-12%SDS PAGE凝胶上。scFv-rPEG融合体过表达且在大肠杆菌溶解产物中以80kDa观察到(图64c)。
实施例15:scFv-rPEG50融合体aHer230-rPEG的鉴定
纯化
单链片段可变(scFv)抗体片段靶向于Her2受体并融合rPEG以产生aHer230-rPEG,其从大肠杆菌细胞溶胶表达和纯化。aHer230-rPEG质粒转化到BL21(DE3)-Gold中且重组抗体片段的表达用0.2mM异丙基-β-D-1-硫代半乳糖苷(IPTG)在20℃诱导。细胞通过离心并重悬在30mM磷酸钠,0.3M氯化钠,10%甘油和20mM咪唑,pH 7.5。通过超声进行溶解且可溶性蛋白质通过标准色谱方法纯化,包括固定金属亲和色谱(IMAC)、疏水相互作用色谱(HIC)和离子交换色谱(IEC)。
结合
为评价靶标(Her2)结合,如上所述aHer230-rPEG在BL21(DE3)-Gold中表达。细胞通过重悬于包含BugBuster试剂和5U/ml的benzonase(Novagen)的磷酸盐缓冲盐水(PBS)进行溶解。悬浮液在室温下孵育20分钟,然后以10000rpm离心10分钟。可溶性部分然后在含1%牛血清白蛋白(BSA)和0.05%Tween-20的PBS中系列稀释5倍。系列稀释的aHer230-rPEG加到用Her2-Fc融合蛋白质(R&DSystems)涂覆并用1%BSA封闭的96-孔板的孔中。结合反应物在室温下缓慢搅拌温育2小时。孔用含0.05%Tween-20的PBS彻底清洗且结合的aHer230-rPEG用HRP-偶联的抗-FLAG抗体(Sigma)检测。图62a显示aHer230-rPEG结合Her2-Fc融合蛋白质且不非特异性地与人IgG结合。结合数据作为样品稀释度的函数给出。半最大结合(EC50)估计为大约10nM aHer230-rPEG。
纯化的aHer230-rPEG通过尺寸排阻HPLC(SE-HPLC)进行分析以确定其低聚状态。aHer230-rPEG的SE-HPLC分析在TSK-gelG4000SWXL柱上进行。aHer230-rPEG仅形成单体,如图62b中所示、向抗-Her2scFv添加rPEG附加多肽有效地消除通常在非rPEG融合的scFv上观察到的二聚体的形成。
SS-键氧化
包含二硫键的蛋白质在大肠杆菌胞质中的表达通常是不成功的,因为胞质的高度还原特性抑制二硫键形成。但是,二硫键可以在细胞溶解后当蛋白质暴露于更氧化性的条件时形成。如上所述,在大肠杆菌中表达的aHer230-rPEG结合其靶标,Her2,表明蛋白质正确折叠。为测试是否aHer230-rPEG的两个二硫键(在vH和vL结构域中各一个)在纯化的蛋白质中正确形成,变性的纯化蛋白质中的游离巯基的数目与完全还原形式的scFv进行了比较。纯化的aHer230-rPEG在6M尿素或补充有10mM三[2-羧乙基]磷化氢(TCEP)的6M尿素中室温下1小时变性。然后样品在Sephadex G-25树脂上脱盐以除去尿素和TCEP。立即加入Ellman’s试剂(5,5’-二硫代-双-[2-硝基苯甲酸)到最终浓度20mM且反应进行15分钟。最后,各溶液的吸光度在412nm测量。变性的aHer230-rPEG表现出非常低的吸光度,这表明纯化的样品完全氧化(图62c)。变性和还原反应(图62c)显示如aHer230-rPEG中的所有半胱氨酸处于还原状态时所预期的信号。因此,抗-Her2scFv中的所有二硫键正确的形成。
实施例16:二链抗体aHer203-rPEG的构建
二链抗体可以通过以少于10氨基酸的连接体连接vH和vL结构域形成。短连接体不允许形成scFv且因此vH和vL结构域结合互补的第二vH-vL链,从而形成4-结构域、2链的50kD复合物。二链抗体由结合Her2的单链片段(scFv)抗体片段构建,其与rPEG50的N-末端遗传融合。构建体通过用三个氨基酸(SGE)取代来自实施例1的Y30scFv连接序列产生以允许二链抗体形式(图65a)。SGE序列通过聚合酶链式反应(PCR)引入,也引入与rPEG填充构建体相容的NdeI和BbsI限制性位点。二链抗体编码片段然后如实施例1中克隆。构建体通过DNA测序确认。aHer203-rPEG二链抗体(M.W.=156,598Da作为二链抗体或78,299Da单体序列,包括rPEG)的蛋白质序列显示于图65b中。
aHer203-rPEG在BL21(DE3)Gold中通过用0.2mM异丙基-β-D-1-硫代半乳糖苷(IPTG)在20℃诱导表达。细胞通过离心收获并在磷酸盐缓冲盐水中由BugBuster/Benzonase溶解,溶解产物通过离心净化且上清液(可溶性部分)加载到4-12%SDS PAGE凝胶上。aHer203-rPEG二链抗体在大肠杆菌溶解产物中检测为大约90kDa(图65c)。
实施例17:二链抗体-rPEG50融合体aHer203-rPEG的鉴定
纯化
二链抗体可以通过以少于10氨基酸的连接体连接vH和vL结构域形成。短连接体不允许形成scFv且因此vH和vL结构域结合互补的第二vH-vL链。二链抗体是产生二价的、且可能双特异性的缺乏效应子Fc功能的治疗剂的有利形式。
结合Her2的二链抗体如上所述进行设计。为评价靶标(Her2)结合,重组aHer203-rPEG二链抗体如上对aHer230-rPEG所述进行表达和纯化。aHer203-rEPG50转化到BL21(DE3)-Gold中且重组抗体片段的表达通过用0.2mM异丙基-β-D-1-硫代半乳糖苷(IPTG)在20℃诱导。细胞通过离心并重悬在30mM磷酸钠,0.3M氯化钠,10%甘油和20mM咪唑,pH 7.5中。通过超声进行溶解且可溶性蛋白质通过标准色谱方法纯化,包括固定金属亲和色谱(IMAC)、疏水相互作用色谱(HIC)和离子交换色谱(IEC)。
结合
aHer203-rPEG二链抗体与其靶标的结合如对aHer230-rPEG所述进行。细胞通过重悬于包含BugBuster试剂和5U/ml的benzonase(Novagen)的磷酸盐缓冲盐水(PBS)进行溶解。悬浮液在室温下孵育20分钟,然后以10000rpm离心10分钟。可溶性部分然后在含1%牛血清白蛋白(BSA)和0.05%Tween-20的PBS(下面称作ELISA结合缓冲液)中系列稀释5倍。系列稀释的aHer203-rPEG二链抗体加到用Her2-Fc融合蛋白质(R&D Systems)涂覆并用1%BSA封闭的96-孔板的孔中。结合反应物在室温下缓慢搅拌温育2小时。孔用含0.05%Tween-20的PBS彻底清洗且结合的aHer203-rPEG二链抗体用HRP-偶联的抗-FLAG抗体(M2,Sigma)检测。图63a显示aHer203-rPEG二链抗体结合Her2-Fc融合蛋白质且不非特异性地与人IgG结合。结合数据作为样品稀释度的函数给出。半最大结合(EC50)估计为大约10nM aHer203-rPEG二链抗体。因此,具有rPEG附加多肽的aHer203二链抗体可以在大肠杆菌细胞溶胶中表达
SE-HPLC
二链抗体已研究用作潜在的二价治疗剂,但是它们重配成高阶寡聚物-三聚体、四聚体等-的倾向限制了它们的用途。对于制备来说重配特别造成问题,因为在纯化单体scFv后,在以液体形式储存时,它将缓慢但可预见地产生二聚体和更高的多聚体,这不仅导致最终可获得的正确形式的蛋白质极大减少,而且导致储存时产物的异质性及药代动力学和效力上的异质性。scFv单体和多聚体之间的平衡可受到vH和vL结构域之间的连接体的长度影响。一般具有超过12-14个氨基酸的连接体的构建体主要以单体形式存在而具有短于12氨基酸的连接体的scFv主要以多聚体的形式存在[Desplancq,D.等(1994)Protein Eng,7:1027][Whitlow,M.等(1994)Protein Eng,7:1017][Hudson,P.J.等(1999)J Immunol Methods,231:177]。增加vH和vL之间的连接体的长度到30个氨基酸使该平衡转变到单体的方向[Desplancq,D.等(1994)Protein Eng,7:1027]。3-7氨基酸之间的连接体长度有利于二链抗体的形成[Dolezal,O.等(2000)Protein Eng,13:565][Kortt,A.A.等(1997)Protein Eng,10:423]。5-10个氨基酸的连接体主要产生二聚体。抗原存在和离子强度可以影响单体-二聚体转换[Arndt,K.M.等(1998)Biochemistry,37:12918]。短于3个氨基酸的连接体利于形成三链抗体和四链抗体[Le Gall,F.等(1999)FEBS Lett,453:164][Dolezal,O.等(2000)Protein Eng,13:565][Kortt,A.A.等(1997)Protein Eng,10:423]。
aHer203-rPEG二链抗体的低聚状态通过SE-HPLC评价并表明它不重配。图63b显示了aHer230-rPEG单链和aHer203-rPEG二链抗体的尺寸排阻色谱分析。它表明二链抗体主要是二聚体的且明显地它包含低于3%的三聚体或四聚体形式。aHer203-rPEG二链抗体的低聚状态也在4℃储存过程中进行监测,且没有观察到重配(图63c)。rPEG附加多肽有助于防止二链抗体的重配,因此使得能够进行均质产物的纯化和配制。
实施例18:用于细菌表达的Fc结构域密码子优化
合成人IgG1恒定片段(Fc)并与rPEG25-绿色荧光蛋白(GFP)融合以产生Fc-rPEG25-GFP,如图66a中所示。编码Fc序列的DNA在体外使用大肠杆菌优化密码子构建。Fc密码子库使用具有20核苷酸重叠(退火)区域的60-聚体寡核苷酸组装。多个密码子引入合成寡核苷酸的非重叠区域。所得到的密码子库具有大约10,000的理论大小,从而所有核苷酸序列编码希望的Fc序列。总共18个寡核苷酸在dNTP和DNA聚合酶存在下组装到684bp的最终大小。Fc密码子库使用产生NdeI和BbsI相容末端的引物通过PCR扩增。DNA片段进行限制性消化并在NdeI和BsaI限制性消化位点连接到rPEG25-GFP载体中。连接的DNA转化到BL21(DE3)Gold中。分离总共1000个克隆,以96-孔形式生长并并复制到含0.2mM IPTG以诱导表达的培养板上。良好表达的构建体在紫外线下显示高水平的荧光。总共17个克隆鉴定为高荧光的。这些克隆在1ml培养中用0.2mM IPTG进行表达,细胞通过离心收获,并用Bugbuster+Benzonase在磷酸盐缓冲盐水中溶解。可溶性部分加载到4-12%SDS PAGE凝胶上(图66b)。重组Fc-rPEG融合体在SDS-PAGE上具有大约80-90kDa的观测分子量(预测的MW大约是80,但rPEG使得蛋白质跑得更高)。密码子优化的Fc的DNA序列显示于图66c中。
实施例19:Fc-rPEG融合蛋白质的表达和鉴定
如实施例5中详细所述的,IgG1的Fc片段与rPEG融合(且变型显示于图31中)并在大肠杆菌胞质中表达。表达融合蛋白质的细胞重悬于缓冲液(在本情况中为20mM磷酸钠pH 7.0)中,且细胞通过超声溶解。不溶性物质通过离心除去且Fc-rPEG-GFP从可溶性部分纯化。完整的折叠Fc片段结合蛋白质A并因此可以方便地使用固定的重组蛋白质A通过亲和色谱纯化。包含Fc融合体的可溶性溶解产物加到蛋白质A柱(GE Healthcare)上且通过用磷酸盐缓冲液深度清洗除去微生物蛋白质。Fc-rPEG-GFP融合蛋白质使用甘氨酸缓冲液或柠檬酸钠缓冲液pH 3.0从蛋白质A柱洗脱。洗脱部分的pH用等量的Tris缓冲液pH 8.5即时调节。纯化的蛋白质通过SDS-PAGE在还原和氧化条件下进行分析。在还原条件下检测到大约80kDa的单带而在氧化条件下检测到160kDa(氧化铰链)和80kDa(还原铰链)的带。CuSO4、脱氢抗坏血酸或其它氧化试剂的加入用于催化铰链半胱氨酸的完全氧化。
实施例20:Fab-rPEG融合蛋白质的构建和细菌表达
本实施例描述了Fab-rPEG融合蛋白质的构建和细菌表达。IgG的抗原结合片段(Fab)可以与rPEG融合作为改善可溶性Fab表达及半衰期延长的手段。表达构建体设计为在诱导型阿拉伯糖启动子控制下的双顺反子RNA信使(图67)。双顺反子信使终止于必夹终止子如T7终止序列。各顺反子或基因具有启动翻译的核糖体结合位点(RBS)和停止翻译的终止密码子(TAA,TGA或TAG)。轻链(vL/cL)或重链(vH/cH)序列可以与rPEG遗传融合,且之后是亲和标签如HA(血凝素)、H(六组氨酸)和/或FLAG标签。DNA构建体可以编码首先重链或最后轻链(HL)或者首先轻链和最后重链(LH),如图67中所示。从这一类型构建体的蛋白质表达产生两个大约50kDa的链,其形成大约100kDa大小的全Fab片段,其包括总共50kDa的rPEG序列。
实施例21:GFP-rPEG50的PK分析
GFP-rPEG50的氨基酸序列显示于图69中。该蛋白质在BL21(DE3)中使用T7启动子表达,类似于实施例1。蛋白质通过离子交换色谱和疏水相互作用色谱纯化。GFP-rPEG50的药代动力学在s.c.和i.v.注射后在食蟹猴中进行研究。三只食蟹猴分成2组,2只动物i.v和一只动物s.c.给药,GFP-rPEG50剂量为0.15mg/kg。对各猴采集系列血液样品,分离血浆并通过ELISA测量检品血浆浓度。i.v.给药动物的半衰期是17.4小时和s.c.给药动物的半衰期是13.8小时。检品的生物利用度是大约54.6%,如图70中所示。
实施例22:Ex4-rPEG50的PK分析
Ex4-rPEG50是exendin-4和rPEG50之间的融合蛋白质。它产生为具有纤维素结合域(CBD)的融合蛋白质,纤维素结合域设计为通过用TEV蛋白酶切割除去,如图71b中所示。融合蛋白质的氨基酸序列显示于图71中。表达质粒和纯化蛋白质与实施例1中类似,添加了TEV蛋白水解的步骤。切割的CBD通过与球状纤维素一起温育除去。Ex4-rPEG50的药代动力学在食蟹猴中进行研究。四只食蟹猴分成2组,每组2只动物并以0.15mg/kg剂量s.c.和i.v.施用Ex4-rPEG50。对各猴采集系列血液样品并通过ELISA测量检品血浆浓度。对于s.c.和i.v.给药,半衰期分别是9.5小时和9.1小时,如图70中所示。
实施例23:GFP-rPEG50在啮齿动物中的PK分析
本实施例比较GFP-rPEG25和GFP-rPEG50的s.c.和i.v.药代动力学。15只大鼠分成5组,每组3只大鼠并以1.67mg/kg的剂量s.c.和i.v.施用GFP-rPEGY25和GFP-rPEG_Y288中的任一种。GFP-rPEG25在s.c时具有大约8-9hr的t0.5,而GFP-rPEG50具有11-15hr的t0.5。GFP-rPEG25在s.c注射时的生物利用度大约是25%,而GFP-rPEG50s.c注射的生物利用度是11%。在小鼠中,125I-GFP-rPEG50施用于裸鼠。半衰期为13.4小时。
实施例24:与rPEG50融合的人生长激素的PK分析
rPEG50与人生长激素(hGH)的C-或N-末端融合。蛋白质如实施例8中所述进行纯化。药代动力学在食蟹猴中进行研究,两只食蟹猴分成2组,每组一只动物。各猴以0.15mg/kg的剂量i.v.施用一种生长激素构建体,hGH-rPEG50或rPEG50-hGH。这两种生长激素构建体分别具有7和10.5小时的半衰期。
实施例25:Ex4-rPEG50的小鼠免疫原性和毒性研究
本实施例描述了在小鼠中与十次s.c.50μg Ex4-rPEG50(1次/周)相关的免疫原性和潜在毒性。总共20只小鼠(Swiss Webster),各30-40g,10只小鼠/组,5只雄性和5只雌性/组,用2组每周给予Ex4-rPEG50或作为对照的ELSPAR,如图72a中所示。在各次给药前采集血液样品且通过ELISA测量IgG,如图72b和72c中所示。ELSPAR导致随时间增强的的免疫应答。相反,Ex4-rPEG50产生非常弱的反应,在6次抗原注射达到最大并在10次抗原注射后获得的样品中下降。所有小鼠在研究期间体重增加并且不显示出毒性的行为迹象,且尸检表明在器官形态上没有不寻常的发现。在完成存活部分后,血液样品、血斑和血浆及组织样品被运送到RADIL(Columbia,MO)进行毒理学分析。组织学分析表明在远端和近端小管中没有明显的空泡化,这是PEG化学偶联的主要关注点。肝脏组织学评价显示出所有四个分析样品中的中度炎症。这是在显然健康动物的肝脏中的普遍发现。脾的分析表明,所有四只小鼠具有中度到明显的巨核细胞增多症和中度血细胞生成。临床化学分析表明对于显示肝细胞损害/坏死的动物适度高的ALT和ALP水平。基于观察,它不是严重或慢性的。血液学表明所有四只小鼠具有血液细胞计数、血红蛋白、血细胞比容百分比或血液总蛋白浓度中至少一项轻微上升。总的说来,多次注射rPEG融合蛋白质产生非常小的免疫原性和毒性。
实施例26:GFP-rPEG融合蛋白质的尺寸排阻色谱法
与rPEG_Y25和rPEG_Y50融合的GFP如实施例8中所述进行表达。蛋白质通过分析型SEC使用TSK G4000SWXL(Tosoh,GroveCity,OH)进行分析,如图73中所示。柱使用商购的标准球状蛋白质校准,且对照的分子量显示于图73中。GFP-rPEG25以500kDa的表观分子量洗脱,而GFP-rPEG50以1500kDa的表观分子量洗脱。
实施例27:GFP-rPEGY融合蛋白质的配制和体内施用
GFP-rPEGY在PBS中的溶液(10mg/mL)与相同体积的PBS中的5mg/mL脱乙酰壳多糖混合并在室温下孵育30分钟。通过5,000xg离心10分钟收集沉淀,并用0.1体积无菌PBS快速洗涤一次。然后沉淀冻干以除去过量液体并研磨成细粉。15mg粉末然后重悬于1mL无菌PBS中并通过吸打均浆。均浆在37℃旋转储存2周,定期取出10uL样品。立即通过离心制备样品以除去不溶性物质,且重新溶解的蛋白质通过GFP荧光、光密度和rPEGY ELISA在上清液中定量。上清液浓度作为时间的函数作图并拟合单指数过程以确定重溶解速率。为确定体内释放速度,Sprague-Dawly大鼠以1mL/kg的剂量(5mg/kg有效剂量)皮下注射新制备的20mg粉末在1mL PBS中的悬浮液。未复合GFP-rPEGY的静脉内和皮下注射剂以5mg/kg剂量平行地注射于动物的独立分组。定期采集血液样品并通过GFP和rPEGYELISA测定蛋白质血清浓度。药代动力学参数包括清除率、Cmax、Css、VD、AUC和血清半衰期通过标准方法(即WinNonLin分析)测定。皮下和长效制剂的生物利用度和有效剂量通过与静脉内给药进行比较而确定。
因此,尽管相文中显示和描述了本发明的优选的实施方式,本领域技术人员很清楚,这些实施方式仅以举例的方式提供。许多变型、改变和替代是本领域技术人员可以想到的而不脱离本发明。应当理解,本文中描述的本发明实施方式的各种替代方式可以用于实施本发明。下面的权利要求用于限定本发明的范围,且在这些权利要求范围内的方法和结构被本发明覆盖。
Claims (148)
1.一种制备生物活性多肽的方法,包括:
a)提供编码一种修饰多肽的多核苷酸序列,其中所述修饰多肽包含与附加多肽连接的生物活性多肽,使得该修饰多肽在宿主细胞中的表达产生与生物活性多肽本身的表达相比更高量的可溶形式的生物活性多肽;
b)使得该修饰多肽在所述宿主细胞中表达,从而产生所述生物活性多肽。
2.权利要求1的方法,其中所述修饰多肽在宿主细胞中的表达与生物活性多肽本身的表达相比产生至少约2倍的可溶形式的生物活性多肽。
3.权利要求1的方法,其中所述修饰多肽在宿主细胞中的表达与生物活性多肽本身的表达相比产生至少约5倍的可溶形式的生物活性多肽。
4.权利要求1的方法,其中所述修饰多肽在宿主细胞中的表达与生物活性多肽本身的表达相比产生至少约10倍的可溶形式的生物活性多肽。
5.权利要求1的方法,其中所述修饰多肽在宿主细胞中的表达与生物活性多肽本身的表达相比产生约2倍至约10倍的可溶形式的生物活性多肽。
6.权利要求1的方法,其中所述附加多肽包含超过约50个氨基酸。
7.权利要求1的方法,其中所述附加多肽包含超过约100个氨基酸。
8.权利要求1的方法,其中所述生物活性多肽选自人生长激素(hGH)、胰高血糖素样肽-1(GLP-1)、粒细胞集落刺激因子(G-CSF)、干扰素-α、干扰素-β、干扰素-γ、胰岛素、红细胞生成素、肿瘤坏死因子-α(TFN-α)、IL-1RA、艾塞那肽、尿酸酶和普兰林肽。
9.权利要求1的方法,其中所述附加多肽包含至少40个连续氨基酸且进一步其中
(a)附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和占附加多肽的总氨基酸的大约80%以上;和/或
(b)通过仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
10.权利要求1的方法,其中所述附加多肽包含至少40个连续氨基酸且其中所述附加多肽在受试者中具有大于约4小时的体外血清半衰期,且进一步其中
(a)附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和占附加多肽的总氨基酸的大约80%以上;和/或
(b)通过仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
11.权利要求1的方法,其中附加多肽的所有残基的至少50%是甘氨酸(G)残基。
12.权利要求1的方法,其中附加多肽的所有残基的至少80%选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
13.权利要求1的方法,其中附加多肽的所有残基的少于50%是甘氨酸(G)残基。
14.权利要求1的方法,其中附加多肽的所有残基的至少50%是丝氨酸(S)残基。
15.权利要求1的方法,其中附加多肽的所有残基的至少50%是丝氨酸(S)和甘氨酸(G)残基的任一种。
16.权利要求1的方法,其中所述附加多肽特征在于:
(a)它由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和
(b)它包含十个或更多的氨基酸。
17.权利要求16的方法,其中所述附加多肽由三种类型的氨基酸组成,且各类型选自天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)和苏氨酸(T)。
18.权利要求16的方法,其中所述附加多肽由三种类型的氨基酸组成,各类型选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
19.权利要求1的方法,其中所述附加多肽特征在于:
(a)它由两种类型的氨基酸组成,其中一种是甘氨酸(G)且另一种选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和
(b)它包含十个或更多的氨基酸残基,其中50%或更少是甘氨酸。
20.权利要求1的方法,其中所述附加多肽特征在于:
(a)它包含50个或更多的氨基酸;
(b)它由两种类型的氨基酸组成,和
(c)总氨基酸的50%或更少选自丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、天冬氨酸(D)、谷氨酸(E)和组氨酸(H)。
21.权利要求1的方法,其中所述附加多肽包含十个或更多的重复基序。
22.权利要求1的方法,包括多个附加多肽。
23.表达权利要求1所述的修饰多肽的宿主细胞。
24.包含权利要求1所述的多核苷酸序列的遗传载体。
25.权利要求1的方法,其中所述附加多肽由最多10个拷贝的重复序列组成,其中各重复序列具有大约8至大约12个氨基酸。
26.权利要求1的方法,其中所述修饰多肽经由蛋白酶切割位点连接到附加蛋白质。
27.权利要求25的方法,其中所述蛋白酶切割位点不是编码生物活性多肽的序列的部分。
28.权利要求26的方法,其中所述蛋白酶切割位点选自TEV蛋白酶、肠激酶、Xa因子、凝血酶、PreScissionTM蛋白酶、3C蛋白酶、转肽酶A和颗粒酶B。
29.权利要求1的方法,其中所述附加多肽包含亲和标签。
30.权利要求28的方法,其中所述亲和标签选自FLAG、His-标签、CBD、GST、MBP和TRX。
31.权利要求1的方法,其中所述宿主细胞是原核细胞。
32.权利要求1的方法,其中所述宿主细胞是大肠杆菌。
33.权利要求1的方法,其中所述宿主细胞是真核细胞。
34.权利要求1的方法,其中所述宿主细胞选自哺乳动物细胞和酵母细胞。
35.一种组合物,其包含与附加多肽连接的可溶形式的生物活性多肽,其中所述附加多肽与所述生物活性多肽连接时提高该生物活性多肽在表达该连接的生物活性多肽的宿主细胞的细胞溶胶部分中的溶解性。
36.权利要求35的组合物,其中所述生物活性多肽经由蛋白酶切割位点连接到所述附加多肽。
37.权利要求35的组合物,其中所述生物活性多肽选自人生长激素(hGH)、胰高血糖素样肽-1(GLP-1)、粒细胞集落刺激因子(G-CSF)、干扰素-α、干扰素-β、干扰素-γ、胰岛素、红细胞生成素、肿瘤坏死因子-α(TFN-α)、IL-1RA、艾塞那肽、尿酸酶和普兰林肽。
38.权利要求35的组合物,其中所述附加多肽包含至少40个连续氨基酸且进一步其中
(a)所述附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过附加多肽的总氨基酸的大约80%;和/或
(b)按照仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
39.权利要求35的组合物,其中所述附加多肽包含至少40个连续氨基酸且其中所述附加多肽在受试者中具有大于大约4小时的体外血清半衰期,且进一步其中
(a)所述附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过附加多肽的总氨基酸的大约80%;和/或
(b)按照仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
40.权利要求35的组合物,其中所述附加多肽的所有残基的至少50%是甘氨酸(G)残基。
41.权利要求35的组合物,其中所述附加多肽的所有残基至少80%选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
42.权利要求35的组合物,其中所述附加多肽的所有残基的不到50%是甘氨酸(G)残基。
43.权利要求35的组合物,其中所述附加多肽的所有残基的至少50%是丝氨酸(S)残基。
44.权利要求35的组合物,其中所述附加多肽的所有残基的至少50%是丝氨酸(S)和甘氨酸(G)残基中的任一种。
45.权利要求35的组合物,其中所述附加多肽特征在于:
(a)它由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和
(b)它包含十个或更多的氨基酸。
46.权利要求45的组合物,其中所述附加多肽由三种类型的氨基酸组成,各类型选自天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)和苏氨酸(T)。
47.权利要求45的组合物,其中所述附加多肽由三种类型氨基酸组成,各类型选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
48.权利要求35的组合物,其中所述附加多肽特征在于:
(a)它由两种类型的氨基酸组成,其中一种类型是甘氨酸(G)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和
(b)它包含十个或更多的氨基酸残基,其中50%或更少的是甘氨酸。
49.权利要求35的组合物,其中所述附加多肽特征在于:
(a)它包含50个或更多的氨基酸;
(b)它由两种类型的氨基酸组成;和
(c)总氨基酸的50%或更少选自丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、天冬氨酸(D)、谷氨酸(E)和组氨酸(H)。
50.权利要求35的组合物,其中所述附加多肽包含十个或更多的重复基序。
51.权利要求35的组合物,其中所述附加多肽为所连接的生物活性多肽提供大约+0.1或以上的净正电荷。
52.权利要求35的组合物,其中所述附加多肽为所连接的生物活性多肽提供大约-0.1或更低的净负电荷。
53.权利要求1的方法,其中所述附加多肽为修饰多肽提供大约+0.1或以上的净正电荷。
54.权利要求1的方法,其中所述附加多肽为修饰多肽提供大约-0.1或更低的净负电荷。
55.一种药物组合物,其包含
a)缓释剂,
b)包含与附加多肽连接的生物活性多肽的修饰多肽,其中所述附加多肽提高所述生物活性多肽的蛋白酶抗性。
56.权利要求55的药物组合物,其中所述修饰多肽产生大于3的表观分子量因子,且进一步其中所述表观分子量因子确定为通过尺寸排阻色谱法测量的修饰多肽表观分子量相对于修饰多肽的预测分子量的比率。
57.权利要求55的组合物,其中所述修饰多肽的表观分子量因子大于5。
58.权利要求55的组合物,其中所述修饰多肽的表观分子量因子大于7。
59.权利要求55的组合物,其中所述修饰多肽的表观分子量因子大于9。
60.权利要求55的组合物,其中所述附加多肽包含超过大约50个氨基酸。
61.权利要求55的组合物,其中所述附加多肽包含超过大约100个氨基酸。
62.权利要求55的组合物,其中所述生物活性多肽选自人生长激素(hGH)、胰高血糖素样肽-1(GLP-1)、粒细胞集落刺激因子(G-CSF)、干扰素-α、干扰素-β、干扰素-γ、胰岛素、红细胞生成素、肿瘤坏死因子-α(TFN-α)、IL-1RA、艾塞那肽、尿酸酶和普兰林肽。
63.权利要求55的组合物,其中所述附加多肽包含至少40个连续氨基酸且进一步其中
(a)所述附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过所述附加多肽总氨基酸的大约80%;和/或
(b)按照仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
64.权利要求55的组合物,其中所述附加多肽包含至少40个连续氨基酸且其中所述附加多肽在受试者中具有大于大约24小时的体外血清半衰期,且进一步其中
(a)所述附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过所述附加多肽总氨基酸的大约80%;和/或
(b)按照仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
65.权利要求55的组合物,其中所述附加多肽所有残基的至少50%是甘氨酸(G)残基。
66.权利要求55的组合物,其中所述附加多肽所有残基的至少80%选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
67.权利要求55的组合物,其中所述附加多肽所有残基的不到50%是甘氨酸(G)残基。
68.权利要求55的组合物,其中所述附加多肽所有残基的至少50%是丝氨酸(S)残基。
69.权利要求55的组合物,其中所述附加多肽所有残基的至少50%是丝氨酸(S)和甘氨酸(G)残基中的任一种。
70.权利要求55的组合物,其中所述附加多肽特征在于:
(a)它由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和
(b)它包含十个或更多的氨基酸。
71.权利要求70的组合物,其中所述附加多肽由三种类型的氨基酸组成,各类型选自天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)和苏氨酸(T)。
72.权利要求70的组合物,其中所述附加多肽由三种类型的氨基酸组成,各类型选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
73.权利要求55的组合物,其中所述附加多肽特征在于:
(a)它由两种类型的氨基酸组成,其中一种类型是甘氨酸(G)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和
(b)它包含十个或更多的氨基酸残基,其中50%或更少是甘氨酸。
74.权利要求55的组合物,其中所述附加多肽特征在于:
(a)它包含50个或更多的氨基酸;
(b)它由两种类型的氨基酸组成,和
(c)总氨基酸的50%或更少选自丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、天冬氨酸(D)、谷氨酸(E)和组氨酸(H)。
75.权利要求55的组合物,其中所述附加多肽包含十个或更多的重复基序。
76.权利要求55的组合物,包含多个附加多肽。
77.权利要求55的组合物,其中所述缓释剂是聚合物基质。
78.权利要求77的组合物,其中所述聚合物基质选自聚-d,l-丙交酯(PLA)、聚-(d,l-丙交酯-共-乙交酯)(PLGA)、PLGA-PEG共聚物、藻酸盐、葡聚糖和脱乙酰壳多糖。
79.权利要求55的组合物,其中所述缓释剂是透皮贴片。
80.权利要求55的组合物,其中所述附加多肽包含带电的氨基酸。
81.权利要求55的组合物,其中所述附加多肽包含带电的氨基酸,且进一步其中所述缓释剂包含带电的聚合物基质。
82.一种制备修饰多肽的方法,包括:
(a)提供编码权利要求55的修饰多肽的多核苷酸序列;
(b)使得所述修饰多肽在宿主细胞中表达,从而制备所述修饰多肽。
83.一种遗传载体,包含编码权利要求55的修饰多肽的核酸序列。
84.一种表达权利要求55的修饰多肽的宿主细胞。
85.一种制备控释组合物的方法,所述方法包括:
(a)提供权利要求55的修饰多肽;
(b)将所述修饰多肽与聚合物基质混合。
86.一种药物组合物,包含
a)缓释剂,
b)包含与附加多肽连接的生物活性多肽的修饰多肽,其中所述附加多肽提高所述生物活性多肽的溶解度。
87.权利要求86的药物组合物,其中所述修饰多肽产生大于3的表观分子量因子,且进一步其中所述表观分子量因子确定为按照尺寸排阻色谱法测量的修饰多肽表观分子量相对于修饰多肽的预测分子量的比率。
88.权利要求86的组合物,其中所述修饰多肽的表观分子量因子大于5。
89.权利要求86的组合物,其中所述修饰多肽的表观分子量因子大于7。
90.权利要求86的组合物,其中所述修饰多肽的表观分子量因子大于9。
91.权利要求86的组合物,其中所述附加多肽包含超过大约50个氨基酸。
92.权利要求86的组合物,其中所述附加多肽包含超过大约100个氨基酸。
93.权利要求86的组合物,其中所述生物活性多肽选自人生长激素(hGH)、胰高血糖素样肽-1(GLP-1)、粒细胞集落刺激因子(G-CSF)、干扰素-α、干扰素-β、干扰素-γ、胰岛素、红细胞生成素、肿瘤坏死因子-α(TFN-α)、IL-1RA、艾塞那肽、尿酸酶和普兰林肽。
94.权利要求86的组合物,其中所述附加多肽包含至少40个连续氨基酸且进一步其中
(a)所述附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过所述附加多肽总氨基酸的大约80%;和/或
(b)按照仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
95.权利要求86的组合物,其中所述附加多肽包含至少40个连续氨基酸且其中所述附加多肽在受试者中具有大于大约24小时的体外血清半衰期,且进一步其中
(a)所述附加多肽中包含的甘氨酸(G)、天冬氨酸(D)、丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、谷氨酸(E)和脯氨酸(P)残基的总和超过所述附加多肽总氨基酸的大约80%;和/或
(b)按照仇-法斯门算法确定,至少50%的氨基酸缺乏二级结构。
96.权利要求86的组合物,其中所述附加多肽所有残基的至少50%是甘氨酸(G)残基。
97.权利要求86的组合物,其中所述附加多肽所有残基的至少80%选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
98.权利要求86的组合物,其中所述附加多肽所有残基的少于50%是甘氨酸(G)残基。
99.权利要求86的组合物,其中所述附加多肽所有残基的至少50%是丝氨酸(S)残基。
100.权利要求86的组合物,其中所述附加多肽所有残基的至少50%是丝氨酸(S)和甘氨酸(G)残基中的任一种。
101.权利要求86的组合物,其中所述附加多肽特征在于:
(a)它由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和
(b)它包含十个或更多的氨基酸。
102.权利要求101的组合物,其中所述附加多肽由三种类型的氨基酸组成,各类型选自天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)和苏氨酸(T)。
103.权利要求101的组合物,其中所述附加多肽由三种类型的氨基酸组成,各类型选自谷氨酸(E)、甘氨酸(G)和丝氨酸(S)。
104.权利要求86的组合物,其中所述附加多肽特征在于:
(a)它由两种类型的氨基酸组成,其中一种类型是甘氨酸(G)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和
(b)它包含十个或更多的氨基酸残基,其中50%或更少是甘氨酸。
105.权利要求86的组合物,其中所述附加多肽特征在于:
(a)它包含50个或更多的氨基酸;
(b)它由两种类型的氨基酸组成,和
(c)总氨基酸的50%或更少选自丙氨酸(A)、丝氨酸(S)、苏氨酸(T)、天冬氨酸(D)、谷氨酸(E)和组氨酸(H)。
106.权利要求86的组合物,其中所述附加多肽包含十个或更多的重复基序。
107.权利要求86的组合物,包含多个附加多肽。
108.权利要求86的组合物,其中所述缓释剂是聚合物基质。
109.权利要求108的组合物,其中所述聚合物基质选自聚-d,l-丙交酯(PLA)、聚-(d,l-丙交酯-共-乙交酯)(PLGA)、PLGA-PEG共聚物、藻酸盐、葡聚糖和脱乙酰壳多糖。
110.权利要求86的组合物,其中所述缓释剂是透皮贴片。
111.权利要求86的组合物,其中所述附加多肽包含带电的氨基酸。
112.权利要求86的组合物,其中所述附加多肽包含带电的氨基酸,且进一步其中所述缓释剂包含带电的聚合物基质。
113.一种制备修饰多肽的方法,包括:
(a)提供编码权利要求86的修饰多肽的多核苷酸序列;
(b)使得所述修饰多肽在宿主细胞中表达,从而制备所述修饰多肽。
114.一种遗传载体,其包含编码权利要求86的修饰多肽的核酸序列。
115.一种宿主细胞,其表达权利要求86的修饰多肽。
116.一种制备控释组合物的方法,所述方法包括:
(a)提供权利要求86的修饰多肽;
(b)将所述修饰多肽与聚合物基质混合。
117.一种包含生物活性多肽和附加多肽的分离的多肽,其中所述附加多肽特征在于:
(i)它由三种类型的氨基酸组成,且各类型选自丙氨酸(A)、天冬氨酸(D)、谷氨酸(E)、甘氨酸(G)、组氨酸(H)、赖氨酸(K)、天冬酰胺(N)、脯氨酸(P)、谷氨酰胺(Q)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)和酪氨酸(Y);和
(ii)它包含十个或更多的氨基酸。
118.权利要求117的分离的多肽,其中所述附加多肽由三种类型的氨基酸组成,且各类型选自D、E、G、K、P、R、S和T。
119.权利要求117的分离的多肽,其中所述附加多肽由三种类型的氨基酸组成,且各类型选自E、S、G、R和A。
120.权利要求117的分离的多肽,其中所述生物活性多肽是治疗性多肽。
121.权利要求117的分离的多肽,其中所述附加多肽由三种类型的氨基酸组成,且各类型选自E、G和S。
122.一种包含生物活性多肽和附加多肽的分离的多肽,其中所述附加多肽特征在于:
(i)它由两种类型的氨基酸组成,其中一种类型是甘氨酸(G)且另一种类型选自天冬氨酸(D)、谷氨酸(E)、赖氨酸(K)、脯氨酸(P)、精氨酸(R)、丝氨酸(S)、苏氨酸(T)、丙氨酸(A)、组氨酸(H)、天冬酰胺(N)、酪氨酸(Y)、亮氨酸(L)、缬氨酸(V)、色氨酸(W)、甲硫氨酸(M)、苯丙氨酸(F)、异亮氨酸(I)和半胱氨酸(C);和
(ii)它包含十个或更多的氨基酸残基,其中50%或更少是甘氨酸。
123.一种包含生物活性多肽和附加多肽的分离的多肽,其中所述附加多肽特征在于:
(i)它包含十个或更多的氨基酸;
(ii)它由两种类型的氨基酸组成氨基酸组成,总氨基酸的50%或更少选自A、S、T、D、E和H。
124.一种包含生物活性多肽和附加多肽的分离的多肽,其中所述附加多肽特征在于:
(i)它由两种类型的氨基酸组成氨基酸组成,其中一种类型选自P、R、L、V、Y、W、M、F、I、K和C;和
(ii)它包含十个或更多的氨基酸。
125.一种包含生物活性多肽和附加多肽的分离的多肽,其中所述附加多肽长度包含至少10个氨基酸且由以相同数目存在的两种不同类型的氨基酸组成。
126.权利要求121、122和123中任一项的分离的多肽,其中所述两种不同类型的氨基酸以1∶2的比例存在。
127.权利要求121、122和123中任一项的分离的多肽,其中所述两种不同类型的氨基酸以2∶3的比例存在。
128.权利要求121、122和123中任一项的分离的多肽,其中所述两种不同类型的氨基酸以3∶4的比例存在。
129.权利要求128的分离的多肽,其中所述附加多肽包含四个或更多的重复基序,其各包含两至五百个氨基酸且由两种不同类型的氨基酸构成。
130.权利要求128的分离的多肽,其中所述重复基序包含超过8个氨基酸。
131.权利要求128的分离的多肽,其中所述四个或更多的重复基序是相同的。
132.权利要求128的分离的多肽,其中所述四个或更多的重复基序包含不同的氨基酸序列。
133.权利要求128的分离的多肽,其中所述附加多肽包含至少十个重复基序。
134.权利要求128的分离的多肽,其中所述附加多肽基本缺乏二级结构。
135.权利要求128的分离的多肽,其中所述分离的多肽的表观分子量大于缺乏所述附加多肽的相应多肽的表观分子量。
136.权利要求128的分离的多肽,其中所述附加多肽的表观分子量大于其实际分子量的至少3倍。
137.权利要求128的分离的多肽,其表现出与缺乏所述附加多肽的相应多肽相比两倍长的血清半衰期。
138.权利要求128的分离的多肽,其中所述生物活性多肽和附加多肽通过肽键连接。
139.权利要求117任一项的分离的多肽,其中所述附加多肽包含氨基酸序列(GGEGGS)n,其中n是3或更大的整数。
140.权利要求117任一项的分离的多肽,其中所述附加多肽包含氨基酸序列(GES)n,其中G、E和S可以是任何次序且n是3或更大的整数。
141.权利要求117任一项的分离的多肽,其中所述附加多肽包含氨基酸序列(GGSGGE)n,其中G、E和S可以是任何次序且n是3或更大的整数。
142.权利要求117任一项的分离的多肽,其中所述附加多肽包含氨基酸序列(GGEGGEGGES)n,其中n是1或更大的整数。
143.一种制备分离的多肽的方法,包括
a)提供编码权利要求117、121、122、123或124中任一项的分离的多肽的多核苷酸序列;
b)使得所述多肽在宿主细胞中表达,从而制备所述多肽。
144.一种遗传载体,其包含编码权利要求117、121、122、123或124中任一项的分离的多肽的核酸序列。
145.一种表达权利要求117、121、122、123或124中任一项的分离的多肽的宿主细胞。
146.权利要求117、121、122、123或124中任一项的分离的多肽的文库。
147.在噬菌体颗粒上展示的权利要求145的文库。
148.一种药物组合物,其包含
a)缓释剂,
b)一种修饰多肽,其包含具有与大小大于5kD的PEG基团连接的生物活性多肽的修饰多肽。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US95610907P | 2007-08-15 | 2007-08-15 | |
| US60/956,109 | 2007-08-15 | ||
| US98107307P | 2007-10-18 | 2007-10-18 | |
| US60/981,073 | 2007-10-18 | ||
| US98656907P | 2007-11-08 | 2007-11-08 | |
| US60/986,569 | 2007-11-08 | ||
| PCT/US2008/009787 WO2009023270A2 (en) | 2007-08-15 | 2008-08-15 | Compositions and methods for modifying properties of biologically active polypeptides |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103298935A true CN103298935A (zh) | 2013-09-11 |
Family
ID=40351372
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2008801033448A Pending CN103298935A (zh) | 2007-08-15 | 2008-08-15 | 用于改善生物活性多肽性能的组合物和方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (4) | US8933197B2 (zh) |
| EP (1) | EP2185701A4 (zh) |
| JP (1) | JP2010536341A (zh) |
| KR (1) | KR20100058541A (zh) |
| CN (1) | CN103298935A (zh) |
| AU (1) | AU2008287340A1 (zh) |
| BR (1) | BRPI0815416A2 (zh) |
| CA (1) | CA2695374A1 (zh) |
| MX (1) | MX2010001684A (zh) |
| WO (1) | WO2009023270A2 (zh) |
Cited By (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103709253A (zh) * | 2013-12-20 | 2014-04-09 | 南开大学 | 一种生物合成制备glp-1及其类似物的方法 |
| CN104844711A (zh) * | 2014-02-18 | 2015-08-19 | 南通表源生物技术有限公司 | 一种多聚体荧光蛋白复合物及其应用 |
| CN107531753A (zh) * | 2015-07-08 | 2018-01-02 | 成均馆大学校产学协力团 | 吡咯烷酰胺衍生物及其制备和使用方法 |
| CN107743494A (zh) * | 2015-06-02 | 2018-02-27 | 诺和诺德股份有限公司 | 具有极性重组延伸体的胰岛素 |
| CN108061804A (zh) * | 2016-11-09 | 2018-05-22 | 北京大学人民医院 | 用于诊断子宫内膜异位症的生物标志物 |
| CN109374897A (zh) * | 2018-11-22 | 2019-02-22 | 大连大学 | 一种用于肝癌检测的试剂盒 |
| CN109371052A (zh) * | 2018-12-04 | 2019-02-22 | 安徽农业大学 | 提高高gc含量噬铜菌属细菌电转化效率的方法 |
| CN109627300A (zh) * | 2019-02-18 | 2019-04-16 | 浙江新银象生物工程有限公司 | Nisin溶液稳定剂开发及应用 |
| CN110075280A (zh) * | 2019-04-30 | 2019-08-02 | 王丛飞 | 一种层粘连蛋白肽复合口服剂及其制备方法 |
| CN110244053A (zh) * | 2019-05-09 | 2019-09-17 | 北京大学第三医院(北京大学第三临床医学院) | 用于诊断狼疮肾炎并肺动脉高压疾病的分子标志物及其用途 |
| CN110914455A (zh) * | 2017-03-15 | 2020-03-24 | 朱诺生物科学有限责任公司 | 使用与子宫内膜异位症相关的遗传标志物的方法 |
| CN111032873A (zh) * | 2017-06-26 | 2020-04-17 | 国立研究开发法人理化学研究所 | 融合蛋白 |
| CN111499759A (zh) * | 2019-01-31 | 2020-08-07 | 上海科技大学 | 一种具有细胞穿膜性的锌指蛋白-乳铁蛋白融合蛋白质及其制备与应用 |
| CN111620942A (zh) * | 2020-06-12 | 2020-09-04 | 中国科学院昆明动物研究所 | 布氏鼠耳蝠白三烯A4水解酶抑制剂Motistin的成熟肽及其应用 |
| CN111705032A (zh) * | 2020-07-09 | 2020-09-25 | 科赫生物科技(北京)有限公司 | 一种原核表达细胞及其制备方法和应用 |
| CN111870688A (zh) * | 2020-07-09 | 2020-11-03 | 沣潮医药科技(上海)有限公司 | ACE2蛋白与IL-6或TNFα拮抗剂组合及其应用 |
| CN111876371A (zh) * | 2014-07-11 | 2020-11-03 | 玛土撤拉有限公司 | 心脏细胞培养材料 |
| CN111944021A (zh) * | 2020-08-24 | 2020-11-17 | 郑州大学 | Cd47亲和肽及其应用 |
| CN111971295A (zh) * | 2018-09-17 | 2020-11-20 | Gi 医诺微新 | 包含il-2蛋白和cd80蛋白的融合蛋白及其用途 |
| CN112088310A (zh) * | 2018-04-12 | 2020-12-15 | 皇家飞利浦有限公司 | 牙龈炎诊断方法、用途和试剂盒 |
| CN112375712A (zh) * | 2020-11-25 | 2021-02-19 | 昆明理工大学 | 一株乳酸乳球菌及其应用 |
| CN111437444B (zh) * | 2020-04-12 | 2021-03-12 | 南方医科大学 | 一种抗肠粘连双层生物凝胶制备方法及双层生物凝胶 |
| CN112654636A (zh) * | 2018-05-14 | 2021-04-13 | 狼人治疗公司 | 可活化白介素12多肽及其使用方法 |
| CN113358866A (zh) * | 2021-04-22 | 2021-09-07 | 四川大学华西医院 | 基于三重并联杂交链式反应的破伤风抗原的均相超灵敏二维可视化和荧光分析方法及应用 |
| CN114133441A (zh) * | 2021-11-15 | 2022-03-04 | 同济大学 | 一种促进牙本质矿化的活性短肽及其应用 |
| CN114380902A (zh) * | 2021-12-29 | 2022-04-22 | 江苏诺泰澳赛诺生物制药股份有限公司 | 一种hgh(176-191)的制备方法 |
| CN114891116A (zh) * | 2015-09-11 | 2022-08-12 | 生物权威(英国)有限公司 | 嵌合抗原受体及其用途 |
| CN114945586A (zh) * | 2020-01-21 | 2022-08-26 | 张晋宇 | 一种药物组合物及其用途 |
| CN116218711A (zh) * | 2022-12-21 | 2023-06-06 | 陕西省微生物研究所 | 一株乳酸乳球菌pz1及其在制备富硒低聚肽中的应用 |
Families Citing this family (224)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8981061B2 (en) | 2001-03-20 | 2015-03-17 | Novo Nordisk A/S | Receptor TREM (triggering receptor expressed on myeloid cells) and uses thereof |
| DK3404102T3 (da) | 2004-04-21 | 2021-09-06 | Alexion Pharma Inc | Knogletilførselskonjugater og fremgangsmåde til anvendelse heraf til målretning af proteiner mod knogle |
| EP2409753B1 (en) * | 2005-07-28 | 2017-07-19 | Carbon Sink Inc. | Removal of carbon dioxide from air |
| WO2007038619A2 (en) * | 2005-09-27 | 2007-04-05 | Amunix, Inc. | Proteinaceous pharmaceuticals and uses thereof |
| US7846445B2 (en) * | 2005-09-27 | 2010-12-07 | Amunix Operating, Inc. | Methods for production of unstructured recombinant polymers and uses thereof |
| US20090099031A1 (en) * | 2005-09-27 | 2009-04-16 | Stemmer Willem P | Genetic package and uses thereof |
| US7855279B2 (en) * | 2005-09-27 | 2010-12-21 | Amunix Operating, Inc. | Unstructured recombinant polymers and uses thereof |
| US20130172274A1 (en) | 2005-12-20 | 2013-07-04 | Duke University | Methods and compositions for delivering active agents with enhanced pharmacological properties |
| JP2009525946A (ja) | 2005-12-20 | 2009-07-16 | デューク・ユニヴァーシティ | 増強された薬理学的性質を有する活性物質を送達するための方法および組成物 |
| US8841255B2 (en) * | 2005-12-20 | 2014-09-23 | Duke University | Therapeutic agents comprising fusions of vasoactive intestinal peptide and elastic peptides |
| JP5173838B2 (ja) | 2006-02-13 | 2013-04-03 | アレシア・バイオセラピューティクス・インコーポレーテッド | 骨リモデリングのプロセスと関係があるポリヌクレオチドおよびポリペプチド配列 |
| US8168181B2 (en) * | 2006-02-13 | 2012-05-01 | Alethia Biotherapeutics, Inc. | Methods of impairing osteoclast differentiation using antibodies that bind siglec-15 |
| MX2010001684A (es) | 2007-08-15 | 2010-04-21 | Amunix Inc | Composiciones y metodos para modificar propiedades de polipeptidos biologicamente activos. |
| US10004799B2 (en) | 2007-08-27 | 2018-06-26 | Longhorn Vaccines And Diagnostics, Llc | Composite antigenic sequences and vaccines |
| CA2976814C (en) | 2007-08-27 | 2022-12-13 | Longhorn Vaccines & Diagnostics, Llc | Immunogenic compositions and methods for treating influenza |
| EP4074327A1 (en) | 2008-06-27 | 2022-10-19 | Duke University | Therapeutic agents comprising elastin-like peptides |
| SG172291A1 (en) | 2008-12-19 | 2011-07-28 | Univ Indiana Res & Tech Corp | Amide based glucagon superfamily peptide prodrugs |
| EP2376521B1 (en) | 2008-12-19 | 2016-04-13 | Indiana University Research and Technology Corporation | Amide-based insulin prodrugs |
| US8680050B2 (en) * | 2009-02-03 | 2014-03-25 | Amunix Operating Inc. | Growth hormone polypeptides fused to extended recombinant polypeptides and methods of making and using same |
| US8703717B2 (en) | 2009-02-03 | 2014-04-22 | Amunix Operating Inc. | Growth hormone polypeptides and methods of making and using same |
| HUE031840T2 (en) * | 2009-02-03 | 2017-08-28 | Amunix Operating Inc | Longer recombinant polypeptides and compositions containing them |
| CN102427823A (zh) * | 2009-03-24 | 2012-04-25 | 拜耳医药保健有限公司 | 因子viii变体及使用方法 |
| US9849188B2 (en) | 2009-06-08 | 2017-12-26 | Amunix Operating Inc. | Growth hormone polypeptides and methods of making and using same |
| CN103140236B (zh) * | 2009-06-08 | 2017-04-19 | 阿穆尼克斯运营公司 | 生长激素多肽及其制备和使用方法 |
| KR101813727B1 (ko) | 2009-06-08 | 2018-01-02 | 아뮤닉스 오퍼레이팅 인코포레이티드 | 성장 호르몬 폴리펩타이드 및 이를 제조하고 사용하는 방법 |
| JP5839597B2 (ja) * | 2009-06-08 | 2016-01-06 | アムニクス オペレーティング インコーポレイテッド | グルコース調節ポリペプチド並びにその作成及び使用方法 |
| EP3366692A1 (en) | 2009-06-22 | 2018-08-29 | Amgen, Inc | Refolding proteins using a chemically controlled redox state |
| MX2011013417A (es) | 2009-06-25 | 2012-03-29 | Amgen Inc | Procesos de purificacion por captura para proteinas expresadas en un sistema no mamifero. |
| US9029505B2 (en) | 2009-08-14 | 2015-05-12 | Phasebio Pharmaceuticals, Inc. | Modified vasoactive intestinal peptides |
| WO2011028228A1 (en) | 2009-08-24 | 2011-03-10 | Amunix Operating Inc. | Coagulation factor vii compositions and methods of making and using same |
| EP2501714A4 (en) * | 2009-11-17 | 2015-10-07 | Univ Montreal | USEFUL HETEROPPTIDES TO REDUCE NON-SPECIFIC ADSORPTION |
| JP6184695B2 (ja) | 2009-12-04 | 2017-08-23 | ジェネンテック, インコーポレイテッド | 多重特異性抗体、抗体アナログ、組成物、及び方法 |
| NO2506868T3 (zh) | 2009-12-06 | 2018-04-14 | ||
| US20110183891A1 (en) * | 2009-12-16 | 2011-07-28 | Jordan Tang | Methods and Compositions for Inhibiting Fungal Infection and Disease |
| EP2512503A4 (en) | 2009-12-18 | 2013-08-21 | Univ Indiana Res & Tech Corp | COAGONISTS OF GLUCAGON / GLP-1 RECEPTOR |
| WO2011077309A2 (en) * | 2009-12-22 | 2011-06-30 | Pfizer Vaccines Llc | Vaccine compositions |
| IN2012DN06437A (zh) | 2010-01-27 | 2015-10-09 | Univ Indiana Res & Tech Corp | |
| PL3095871T3 (pl) | 2010-02-08 | 2019-10-31 | Regeneron Pharma | Mysz zawierająca wspólny łańcuch lekki |
| US20130045492A1 (en) | 2010-02-08 | 2013-02-21 | Regeneron Pharmaceuticals, Inc. | Methods For Making Fully Human Bispecific Antibodies Using A Common Light Chain |
| US9796788B2 (en) | 2010-02-08 | 2017-10-24 | Regeneron Pharmaceuticals, Inc. | Mice expressing a limited immunoglobulin light chain repertoire |
| WO2011109556A2 (en) | 2010-03-04 | 2011-09-09 | Pfenex Inc. | Method for producing soluble recombinant interferon protein without denaturing |
| PL2552949T3 (pl) | 2010-04-01 | 2017-01-31 | Pfenex Inc. | Sposoby wytwarzania G-CSF w komórce gospodarza Pseudomonas |
| WO2011123830A2 (en) | 2010-04-02 | 2011-10-06 | Amunix Operating Inc. | Alpha 1-antitrypsin compositions and methods of making and using same |
| WO2011123813A2 (en) * | 2010-04-02 | 2011-10-06 | Amunix Operating Inc. | Binding fusion proteins, binding fusion protein-drug conjugates, xten-drug conjugates and methods of making and using same |
| JP6121323B2 (ja) | 2010-05-13 | 2017-05-10 | インディアナ ユニバーシティー リサーチ アンド テクノロジー コーポレーションIndiana University Research And Technology Corporation | 核内ホルモン受容体の活性を示すグルカゴンスーパーファミリーのペプチド |
| CN102260697A (zh) * | 2010-05-26 | 2011-11-30 | 重庆富进生物医药有限公司 | 融合表达重组制备人β干扰素 |
| JP5969469B2 (ja) | 2010-06-16 | 2016-08-17 | インディアナ ユニバーシティー リサーチ アンド テクノロジー コーポレーションIndiana University Research And Technology Corporation | インスリン受容体に対して高い活性を示す単鎖インスリンアゴニスト |
| JP2013540102A (ja) | 2010-06-24 | 2013-10-31 | インディアナ ユニバーシティー リサーチ アンド テクノロジー コーポレーション | アミド結合を介して修飾されたグルカゴンスーパーファミリーのペプチドプロドラッグ |
| US8946147B2 (en) | 2010-06-24 | 2015-02-03 | Indiana University Research And Technology Corporation | Amide-based insulin prodrugs |
| ES2650689T3 (es) | 2010-06-25 | 2018-01-19 | Shire Human Genetic Therapies, Inc. | Administración de agentes terapéuticos al sistema nervioso central |
| RU2012154576A (ru) | 2010-06-25 | 2014-07-27 | Шир Хьюман Дженетик Терапис, Инк. | Способы и композиции для доставки к цнс гепаран-n-сульфатазы |
| AU2011270670B2 (en) * | 2010-06-25 | 2017-01-12 | Takeda Pharmaceutical Company Limited | Methods and compositions for CNS delivery of arylsulfatase A |
| PE20180801A1 (es) | 2010-06-25 | 2018-05-09 | Shire Human Genetic Therapies | Composiciones y metodos para suministro al sistema nervioso central de iduronato-2-sulfatasa |
| WO2012006624A2 (en) | 2010-07-09 | 2012-01-12 | Biogen Idec Hemophilia Inc. | Factor ix polypeptides and methods of use thereof |
| WO2012009580A1 (en) | 2010-07-14 | 2012-01-19 | The Trustees Of Columbia University In The City Of New York | Force-clamp spectrometer and methods of use |
| EP2593472B1 (en) * | 2010-07-15 | 2018-05-16 | The Trustees of Columbia University in the City of New York | Ancestral proteins |
| CN103221422B (zh) | 2010-07-29 | 2017-03-29 | 十一生物治疗股份有限公司 | 嵌合il‑1受体i型激动剂和拮抗剂 |
| AU2011349331A1 (en) | 2010-12-22 | 2013-07-11 | Indiana University Research And Technology Corporation | Glucagon analogs exhibiting GIP receptor activity |
| RU2013133803A (ru) | 2010-12-22 | 2015-01-27 | Маркадиа Байотек, Инк. | Способы лечения метаболических нарушений и ожирения при помощи пептидов на основе глюкагона, активных по отношению к рецепторам гип и гпп |
| JP6055779B2 (ja) | 2010-12-27 | 2016-12-27 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | ナトリウム利尿ペプチドを含む組成物およびその使用方法 |
| EP3604339B1 (en) | 2011-01-14 | 2021-03-10 | The Regents Of The University Of California | Therapeutic antibodies against ror-1 protein and methods for use of same |
| WO2012103240A2 (en) | 2011-01-25 | 2012-08-02 | Eleven Biotherapeutics, Inc. | Receptor binding agents |
| ES2669190T3 (es) | 2011-06-06 | 2018-05-24 | Phasebio Pharmaceuticals, Inc. | Uso de péptidos intestinales vasoactivos modificados en el tratamiento de la hipertensión |
| WO2012170969A2 (en) | 2011-06-10 | 2012-12-13 | Biogen Idec Ma Inc. | Pro-coagulant compounds and methods of use thereof |
| RS56173B1 (sr) | 2011-06-22 | 2017-11-30 | Univ Indiana Res & Tech Corp | Koagonisti receptora za glukagon/glp-1 receptora |
| WO2013006656A2 (en) * | 2011-07-05 | 2013-01-10 | The Regents Of The University Of California | Appetite stimulating protein |
| EP2729496B8 (en) * | 2011-07-06 | 2017-10-18 | Genmab A/S | Modulation of complement-dependent cytotoxicity through modifications of the c-terminus of antibody heavy chains |
| KR101829603B1 (ko) | 2011-07-08 | 2018-02-19 | 바이오버라티브 테라퓨틱스 인크. | Viii 인자 키메라 및 하이브리드 폴리펩타이드, 그리고 이들의 사용 방법 |
| US10656167B2 (en) | 2011-07-25 | 2020-05-19 | Bioverativ Therapeutics Inc. | Assays to monitor bleeding disorders |
| BR112014002173A2 (pt) | 2011-07-29 | 2017-03-01 | Eleven Biotherapeutics Inc | proteínas purificadas |
| HUE055276T2 (hu) | 2011-08-05 | 2021-11-29 | Regeneron Pharma | Humanizált univerzális könnyûláncú egerek |
| BR112014003268A2 (pt) * | 2011-08-11 | 2017-03-14 | Huntsman Petrochemical Llc | composição de catalisador amina, formulação de espuma de poliuretano, e, método para a produção de uma de poliuretano |
| WO2013033513A1 (en) | 2011-08-31 | 2013-03-07 | University Of Georgia Research Foundation, Inc. | Apoptosis-targeting nanoparticles |
| WO2013067133A1 (en) * | 2011-11-04 | 2013-05-10 | The Texas A & M University System | Production of tsg-6 protein |
| US10206997B2 (en) * | 2011-11-10 | 2019-02-19 | Bin Wang | Facilitator-DNA combination vaccine |
| WO2013074910A1 (en) | 2011-11-17 | 2013-05-23 | Indiana University Research And Technology Corporation | Glucagon superfamily peptides exhibiting glucocorticoid receptor activity |
| JP6392123B2 (ja) | 2011-12-20 | 2018-09-19 | インディアナ ユニバーシティー リサーチ アンド テクノロジー コーポレーションIndiana University Research And Technology Corporation | 糖尿病治療のためのctp系インスリンアナローグ |
| EP2793922B1 (en) | 2011-12-23 | 2019-10-30 | Shire Human Genetic Therapies, Inc. | Stable formulations for cns delivery of arylsulfatase a |
| CA2863328A1 (en) * | 2012-01-12 | 2013-07-18 | Biogen Idec Ma Inc. | Chimeric factor viii polypeptides and uses thereof |
| US20130210747A1 (en) | 2012-02-13 | 2013-08-15 | University Of Southern California | Methods and Therapeutics Comprising Ligand-Targeted ELPs |
| EP2814844B1 (en) | 2012-02-15 | 2017-08-02 | Novo Nordisk A/S | Antibodies that bind and block triggering receptor expressed on myeloid cells-1 (trem-1) |
| EP2822577B1 (en) | 2012-02-15 | 2019-02-06 | Bioverativ Therapeutics Inc. | Recombinant factor viii proteins |
| US9550830B2 (en) | 2012-02-15 | 2017-01-24 | Novo Nordisk A/S | Antibodies that bind and block triggering receptor expressed on myeloid cells-1 (TREM-1) |
| SI3564260T1 (sl) | 2012-02-15 | 2023-02-28 | Bioverativ Therapeutics Inc. | Sestavki faktorja VIII in postopki njegove izdelave in uporabe |
| EP2814842B1 (en) | 2012-02-15 | 2018-08-22 | Novo Nordisk A/S | Antibodies that bind peptidoglycan recognition protein 1 |
| US10416167B2 (en) | 2012-02-17 | 2019-09-17 | University Of Georgia Research Foundation, Inc. | Nanoparticles for mitochondrial trafficking of agents |
| MX366864B (es) | 2012-02-27 | 2019-07-26 | Amunix Operating Inc | Composiciones de conjugados de xten y métodos para realizarlas. |
| JP6426599B2 (ja) * | 2012-03-19 | 2018-11-21 | ミレウティス リミテッド. | 乳汁分泌の管理用のペプチド |
| JP6393255B2 (ja) | 2012-04-20 | 2018-09-19 | メルス ナムローゼ フェンノートシャップ | ヘテロ二量体のIgG様分子を生産する方法、ヘテロ二量体のIgG様分子、ヘテロ二量体の抗体、組み換え宿主細胞、医薬組成物、宿主細胞を作成する方法、および培養物 |
| US20130302366A1 (en) | 2012-05-09 | 2013-11-14 | Christopher Marshall | Conformationally Specific Viral Immunogens |
| CN104507489B (zh) | 2012-05-11 | 2016-07-13 | 杰姆维克斯&凯尔有限公司 | 用于预防和治疗类风湿性关节炎的组合物 |
| KR20210025132A (ko) | 2012-05-11 | 2021-03-08 | 주식회사 젬백스앤카엘 | 항염증 활성을 갖는 펩티드 및 이를 포함하는 조성물 |
| US10052366B2 (en) | 2012-05-21 | 2018-08-21 | Alexion Pharmaceuticsl, Inc. | Compositions comprising alkaline phosphatase and/or natriuretic peptide and methods of use thereof |
| EP2863940A4 (en) | 2012-06-08 | 2016-08-10 | Biogen Ma Inc | CHIMERIC COAGULATION FACTORS |
| HUE037849T2 (hu) * | 2012-06-08 | 2018-09-28 | Alkermes Pharma Ireland Ltd | Cirkuláris permutációval módosított ligandumok agonistaként és antagonistaként |
| EP4079316A1 (en) | 2012-06-08 | 2022-10-26 | Bioverativ Therapeutics Inc. | Procoagulant compounds |
| PL2864350T3 (pl) | 2012-06-21 | 2019-01-31 | Indiana University Research And Technology Corporation | Analogi glukagonu wykazujące aktywność wobec receptora GIP |
| AR091477A1 (es) | 2012-06-21 | 2015-02-04 | Univ Indiana Res & Tech Corp | Analogos de glucagon que presentan actividad de receptor de gip |
| US10023628B2 (en) | 2012-07-06 | 2018-07-17 | Bioverativ Therapeutics Inc. | Cell line expressing single chain factor VIII polypeptides and uses thereof |
| SG10201913893XA (en) | 2012-07-11 | 2020-03-30 | Bioverativ Therapeutics Inc | Factor viii complex with xten and von willebrand factor protein, and uses thereof |
| KR101799904B1 (ko) | 2012-07-11 | 2017-11-22 | 주식회사 젬백스앤카엘 | 세포 투과성 펩티드, 그를 포함한 컨쥬게이트 및 그를 포함한 조성물 |
| CN104507969A (zh) | 2012-07-19 | 2015-04-08 | 阿莱斯亚生物疗法股份有限公司 | 抗siglec-15抗体 |
| US20150218280A1 (en) | 2012-08-10 | 2015-08-06 | University Of Southern California | CD20 scFv-ELPs METHODS AND THERAPEUTICS |
| EP2892919A1 (en) * | 2012-09-07 | 2015-07-15 | Sanofi | Fusion proteins for treating a metabolic syndrome |
| EP2900328A4 (en) | 2012-09-25 | 2016-05-11 | Biogen Ma Inc | PROCESS FOR USE OF FIXED POLYPEPTIDES |
| WO2014051433A1 (en) | 2012-09-27 | 2014-04-03 | Merus B.V. | BISPECIFIC IgG ANTIBODIES AS T CELL ENGAGERS |
| WO2014100913A1 (en) * | 2012-12-24 | 2014-07-03 | Beijing Anxinhuaide Biotech. Co., Ltd | Improving the half life of a therapeutic polypeptide by fusing with a trimeric scaffold protein via a spacer |
| ES2884813T3 (es) | 2013-03-13 | 2021-12-13 | Buzzard Pharmaceuticals AB | Formulaciones de citoquina quimérica para administración ocular |
| TWI745671B (zh) | 2013-03-15 | 2021-11-11 | 美商百歐維拉提夫治療公司 | 因子ix多肽調配物 |
| WO2014171792A1 (ko) | 2013-04-19 | 2014-10-23 | 주식회사 카엘젬백스 | 허혈성 손상 치료 및 예방용 조성물 |
| ES2927473T3 (es) | 2013-06-07 | 2022-11-07 | Gemvax & Kael Co Ltd | GV1001, gemcitabina y capecitabina para su uso en el tratamiento del cáncer de páncreas en pacientes con un nivel inicial de eotaxina elevado |
| TWI539960B (zh) | 2013-06-21 | 2016-07-01 | 凱爾傑姆維克斯有限公司 | 激素分泌調節劑、包括其的組成物以及其用途 |
| WO2015006626A1 (en) * | 2013-07-10 | 2015-01-15 | President And Fellows Of Harvard College | Compositions and methods relating to nucleic acid-protein complexes |
| US10383921B2 (en) | 2013-08-13 | 2019-08-20 | President And Fellows Of Harvard College | Leveraging oxidative stress pathways in lactic acid bacteria to promote gut homeostasis |
| WO2015023268A1 (en) * | 2013-08-13 | 2015-02-19 | President And Fellows Of Harvard College | Leveraging oxidative stress pathways in lactic acid bacteria to promote gut homeostasis |
| WO2015023891A2 (en) | 2013-08-14 | 2015-02-19 | Biogen Idec Ma Inc. | Factor viii-xten fusions and uses thereof |
| BR112016008331B1 (pt) | 2013-10-23 | 2023-01-31 | Sang Jae Kim | Composição para tratar e prevenir hiperplasia prostática benigna (bhp) e uso da dita composição para tratar e prevenir bhp |
| EP3065769A4 (en) | 2013-11-08 | 2017-05-31 | Biogen MA Inc. | Procoagulant fusion compound |
| KR102494803B1 (ko) | 2013-11-22 | 2023-02-06 | 주식회사 젬백스앤카엘 | 혈관 신생 억제 활성을 가지는 펩티드 및 이를 포함하는 조성물 |
| CN104711217B (zh) * | 2013-12-13 | 2018-02-27 | 天津科技大学 | 一种新型的促进乳酸菌生长的生物活性肽 |
| EP3085380B1 (en) | 2013-12-17 | 2020-06-17 | Gemvax & Kael Co., Ltd. | Composition for treating prostate cancer |
| EP3102224B1 (en) * | 2013-12-20 | 2019-02-20 | NephroGenesis, LLC. | Apparatuses for kidney dialysis and lipocalin protein for use in the prevention or treatment of uremia by dialysis |
| SG10201913697UA (en) | 2014-01-10 | 2020-03-30 | Bioverativ Therapeutics Inc | Factor viii chimeric proteins and uses thereof |
| US9999704B2 (en) * | 2014-02-26 | 2018-06-19 | University Of Massachusetts | Amphiphilic degradable polymers for immobilization and sustained delivery of biomolecules |
| WO2015138992A1 (en) | 2014-03-14 | 2015-09-17 | University Of Georgia Research Foundation, Inc. | Mitochondrial delivery of 3-bromopyruvate |
| KR20210088756A (ko) | 2014-03-21 | 2021-07-14 | 리제너론 파마슈티칼스 인코포레이티드 | 단일 도메인 결합 단백질을 생산하는 비-인간 동물 |
| KR102373603B1 (ko) | 2014-04-11 | 2022-03-14 | 주식회사 젬백스앤카엘 | 섬유증 억제 활성을 가지는 펩티드 및 이를 포함하는 조성물 |
| EP3139955B1 (en) | 2014-04-30 | 2024-03-20 | President and Fellows of Harvard College | Fusion proteins for treating cancer and related methods |
| ES2962532T3 (es) | 2014-04-30 | 2024-03-19 | Gemvax & Kael Co Ltd | Composición para el trasplante de órganos, tejidos o células, kit y procedimiento de trasplante |
| WO2015172046A1 (en) | 2014-05-08 | 2015-11-12 | Phasebio Pharmaceuticals, Inc. | Methods and compositions for treating cystic fibrosis |
| JP6759109B2 (ja) * | 2014-05-21 | 2020-09-23 | プレジデント アンド フェローズ オブ ハーバード カレッジ | Ras抑制性ペプチドおよびその使用 |
| WO2015195531A2 (en) | 2014-06-18 | 2015-12-23 | Albert Einstein College Of Medicine, Inc. | Syntac polypeptides and uses thereof |
| CA2952293A1 (en) | 2014-06-24 | 2015-12-30 | Novo Nordisk A/S | Mic-1 fusion proteins and uses thereof |
| WO2016007873A1 (en) | 2014-07-11 | 2016-01-14 | The Regents Of The University Of Michigan | Compositions and methods for treating craniosynostosis |
| MX2017000484A (es) | 2014-07-17 | 2017-05-01 | Novo Nordisk As | Mutagenesis dirigida al sitio anticuerpos receptor desencadenante expresado en las celulas mieloides de tipo 1 (trem-1) para reducir la viscosidad. |
| JP6851965B2 (ja) | 2014-09-26 | 2021-03-31 | サハイ バートナガール ラジェンドラ | 疾患及び障害の治療のためのnfカッパb活性の阻害剤 |
| BR112017007765B1 (pt) | 2014-10-14 | 2023-10-03 | Halozyme, Inc | Composições de adenosina deaminase-2 (ada2), variantes do mesmo e métodos de usar o mesmo |
| MA40835A (fr) | 2014-10-23 | 2017-08-29 | Biogen Ma Inc | Anticorps anti-gpiib/iiia et leurs utilisations |
| MA40861A (fr) | 2014-10-31 | 2017-09-05 | Biogen Ma Inc | Anticorps anti-glycoprotéines iib/iiia |
| BR112017011900A2 (pt) | 2014-12-05 | 2018-02-27 | Alexion Pharma Inc | tratamento de ataques com fosfatase alcalina recombinante |
| CA2970478A1 (en) | 2014-12-10 | 2016-06-16 | S-Aima Holding Company, Llc | Generation of hemoglobin-based oxygen carriers using elastin-like polypeptides |
| KR102413243B1 (ko) | 2014-12-23 | 2022-06-27 | 주식회사 젬백스앤카엘 | 안질환 치료 펩티드 및 이를 포함하는 안질환 치료용 조성물 |
| WO2016118577A1 (en) * | 2015-01-22 | 2016-07-28 | Medimmune, Llc | Thymosin-beta-four fusion proteins |
| CA2973883A1 (en) | 2015-01-28 | 2016-08-04 | Alexion Pharmaceuticals, Inc. | Methods of treating a subject with an alkaline phosphatase deficiency |
| ES2822598T3 (es) | 2015-02-09 | 2021-05-04 | Phasebio Pharmaceuticals Inc | Métodos y composiciones para tratar enfermedades y trastornos musculares |
| US10835582B2 (en) | 2015-02-27 | 2020-11-17 | Gemvax & Kael Co. Ltd. | Peptide for preventing hearing loss, and composition comprising same |
| JP2018511594A (ja) * | 2015-03-18 | 2018-04-26 | マサチューセッツ インスティテュート オブ テクノロジー | 選択的mcl−1結合ペプチド |
| WO2016149678A1 (en) | 2015-03-19 | 2016-09-22 | Regeneron Pharmaceuticals, Inc. | Non-human animals that select for light chain variable regions that bind antigen |
| EP3318265B1 (en) | 2015-07-02 | 2021-08-18 | Gemvax & Kael Co., Ltd. | Peptide having anti-viral effect and composition containing same |
| CN108026174B (zh) | 2015-07-10 | 2023-02-17 | 美勒斯公司 | 人cd3结合抗体 |
| MX2018001497A (es) | 2015-08-03 | 2018-05-15 | Bioverativ Therapeutics Inc | Proteinas de fusion de factor ix y metodos para producirlas y usarlas. |
| CN108350440A (zh) | 2015-08-17 | 2018-07-31 | 阿雷克森制药公司 | 碱性磷酸酯的制造 |
| MX2018002226A (es) | 2015-08-28 | 2018-03-23 | Amunix Operating Inc | Ensamble de polipeptido quimerico y metodos para hacer y usar el mismo. |
| EP3355904A4 (en) | 2015-09-28 | 2019-06-12 | Alexion Pharmaceuticals, Inc. | IDENTIFICATION OF EFFECTIVE DOSE SHEETS FOR TISSUE-SPECIFIC ALKALINE PHOSPHATASE ENZYMERSAT THERAPY OF HYPOPHOSPHATASIA |
| MA43348A (fr) | 2015-10-01 | 2018-08-08 | Novo Nordisk As | Conjugués de protéines |
| WO2017060857A1 (en) | 2015-10-08 | 2017-04-13 | The Governors Of The University Of Alberta | Hepatitis c virus e1/e2 heterodimers and methods of producing same |
| JP2018533571A (ja) | 2015-10-30 | 2018-11-15 | アレクシオン ファーマシューティカルズ, インコーポレイテッド | 患者の頭蓋縫合早期癒合症を治療するための方法 |
| WO2017120890A1 (zh) | 2016-01-15 | 2017-07-20 | 江南大学 | 一种利用磷脂酶融合表达以提高外源蛋白表达量的方法 |
| US11065306B2 (en) | 2016-03-08 | 2021-07-20 | Alexion Pharmaceuticals, Inc. | Methods for treating hypophosphatasia in children |
| US11186832B2 (en) | 2016-04-01 | 2021-11-30 | Alexion Pharmaceuticals, Inc. | Treating muscle weakness with alkaline phosphatases |
| WO2017173395A1 (en) | 2016-04-01 | 2017-10-05 | Alexion Pharmaceuticals, Inc. | Methods for treating hypophosphatasia in adolescents and adults |
| CN109328068A (zh) | 2016-04-07 | 2019-02-12 | 珍白斯凯尔有限公司 | 具有增加端粒酶活性和延长端粒的效果的肽以及包含该肽的组合物 |
| CN109689096A (zh) | 2016-05-18 | 2019-04-26 | 阿尔伯特爱因斯坦医学院公司 | 变体pd-l1多肽、t细胞调节性多聚体多肽及其使用方法 |
| AU2017268348A1 (en) | 2016-05-18 | 2018-10-25 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptides and methods of use thereof |
| WO2017214130A1 (en) | 2016-06-06 | 2017-12-14 | Alexion Pharmaceuticals, Inc. | Metal impact on manufacturing of alkaline phosphatases |
| EA037848B1 (ru) * | 2016-07-14 | 2021-05-27 | Общество С Ограниченной Ответственностью "Биохимический Агент" | Гибридный белок, полинуклеотид, генетическая конструкция, продуцент, препарат для регенерации хряща (варианты) |
| WO2018017922A2 (en) | 2016-07-22 | 2018-01-25 | Massachusetts Institute Of Technology | Selective bfl-1 peptides |
| EP3500289A4 (en) | 2016-08-18 | 2020-05-06 | Alexion Pharmaceuticals, Inc. | METHODS OF TREATING TRACHEOBRONCHOMALACIA |
| EP3519431A1 (en) | 2016-09-28 | 2019-08-07 | Cohbar Inc. | Therapeutic mots-c related peptides |
| US10738338B2 (en) | 2016-10-18 | 2020-08-11 | The Research Foundation for the State University | Method and composition for biocatalytic protein-oligonucleotide conjugation and protein-oligonucleotide conjugate |
| WO2018119114A1 (en) | 2016-12-22 | 2018-06-28 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptides and methods of use thereof |
| US11851471B2 (en) | 2017-01-09 | 2023-12-26 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptides and methods of use thereof |
| CN110944651A (zh) | 2017-02-08 | 2020-03-31 | 蜻蜓疗法股份有限公司 | 用于自然杀伤细胞激活的多特异性结合蛋白及其治疗癌症的治疗性用途 |
| US11884732B2 (en) | 2017-02-20 | 2024-01-30 | Dragonfly Therapeutics, Inc. | Proteins binding HER2, NKG2D and CD16 |
| EP3585411A4 (en) * | 2017-02-21 | 2020-12-16 | The Regents Of The University Of Michigan | IL-22BP COMPOSITIONS AND METHODS OF TREATMENT OF DISEASES THEREOF |
| WO2018156892A1 (en) | 2017-02-23 | 2018-08-30 | Adrx, Inc. | Peptide inhibitors of transcription factor aggregation |
| AU2018239352A1 (en) * | 2017-03-22 | 2019-10-10 | Pharmain Corporation | NPRA agonists, compositions, and uses thereof |
| US11224637B2 (en) | 2017-03-31 | 2022-01-18 | Alexion Pharmaceuticals, Inc. | Methods for treating hypophosphatasia (HPP) in adults and adolescents |
| EP3606560A2 (en) | 2017-04-05 | 2020-02-12 | Novo Nordisk A/S | Oligomer extended insulin-fc conjugates |
| CN107098978A (zh) * | 2017-05-05 | 2017-08-29 | 中国药科大学 | 一种抗肿瘤和免疫增强双重功效融合蛋白 |
| TWI710377B (zh) | 2017-05-23 | 2020-11-21 | 丹麥商諾佛 儂迪克股份有限公司 | Mic-1化合物及其用途 |
| WO2018226992A1 (en) | 2017-06-07 | 2018-12-13 | Adrx, Inc. | Tau aggregation inhibitors |
| CA3066645A1 (en) * | 2017-06-08 | 2018-12-13 | The Brigham And Women's Hospital, Inc | Methods and compositions for identifying epitopes |
| US10889627B2 (en) * | 2017-06-29 | 2021-01-12 | Ureka Sarl | Pro-drug peptide with improved pharmaceutical properties |
| AU2018318319A1 (en) | 2017-08-18 | 2020-02-20 | Adrx, Inc. | Tau aggregation peptide inhibitors |
| US20210139920A1 (en) * | 2017-08-21 | 2021-05-13 | Indiana University Research And Technology Corporation | Solubility enhancing protein expression systems |
| CA3074839A1 (en) | 2017-09-07 | 2019-03-14 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptide with conjugation sites and methods of use thereof |
| KR101930399B1 (ko) * | 2017-09-20 | 2018-12-18 | 한국과학기술연구원 | 종양세포 특이적 감응형 자가조립 나노약물복합체 |
| CN111886241A (zh) | 2018-01-09 | 2020-11-03 | 库尔生物制药有限公司 | 多聚体t细胞调节多肽及其使用方法 |
| CN110028587B (zh) * | 2018-01-11 | 2021-10-08 | 安源医药科技(上海)有限公司 | 用于调节血糖和脂质的增效型双功能蛋白 |
| SG11202007482WA (en) | 2018-02-08 | 2020-09-29 | Dragonfly Therapeutics Inc | Antibody variable domains targeting the nkg2d receptor |
| WO2019190752A1 (en) | 2018-03-30 | 2019-10-03 | Alexion Pharmaceuticals, Inc. | Manufacturing of glycoproteins |
| PE20201343A1 (es) | 2018-04-02 | 2020-11-25 | Bristol Myers Squibb Co | Anticuerpos anti-trem-1 y usos de los mismos |
| CN112041333A (zh) * | 2018-04-26 | 2020-12-04 | 古德T细胞有限公司 | 新型融合蛋白和用于预防或治疗癌症的包含该融合蛋白的药物组合物 |
| WO2019217332A1 (en) * | 2018-05-07 | 2019-11-14 | Dragonfly Therapeutics, Inc. | A protein binding nkg2d, cd16 and a tumor-associated antigen |
| CN108373496A (zh) * | 2018-05-17 | 2018-08-07 | 安徽工程大学 | 抗氧化性多肽gtmgavgprg及其制备方法 |
| WO2020033129A1 (en) * | 2018-08-07 | 2020-02-13 | Purdue Research Foundation | Rejuvenation of car t cell |
| CN109053862A (zh) * | 2018-08-07 | 2018-12-21 | 复旦大学附属肿瘤医院 | 靶向PD-L1的多肽衍生物及其99mTc配合物的制备和应用 |
| US11286299B2 (en) | 2018-09-17 | 2022-03-29 | Massachusetts Institute Of Technology | Peptides selective for Bcl-2 family proteins |
| EA202191179A1 (ru) | 2018-10-29 | 2021-09-09 | Байоджен Ма Инк. | Гуманизированные и стабилизированные варианты fc5 для улучшения транспорта через гематоэнцефалический барьер |
| TW202039542A (zh) | 2018-12-19 | 2020-11-01 | 美商庫爾生物製藥有限公司 | 多聚體t細胞調節多肽及其使用方法 |
| CA3127336A1 (en) | 2019-01-28 | 2020-08-06 | Cohbar, Inc. | Therapeutic peptides |
| WO2020181062A1 (en) | 2019-03-06 | 2020-09-10 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptides and methods of use thereof |
| US11767524B2 (en) * | 2019-09-24 | 2023-09-26 | Abclonal Science, Inc. | His-MBP tagged DNA endonuclease for facilitated enzyme removal |
| CN110658296A (zh) * | 2019-10-30 | 2020-01-07 | 海南通用三洋药业有限公司 | 一种醋酸阿托西班注射液中高分子聚合物的检测方法 |
| EP4058465A1 (en) | 2019-11-14 | 2022-09-21 | Cohbar Inc. | Cxcr4 antagonist peptides |
| WO2021136223A1 (en) | 2019-12-31 | 2021-07-08 | Beijing Ql Biopharmaceutical Co., Ltd. | Fusion proteins of glp-1 and gdf15 and conjugates thereof |
| CN115322794A (zh) | 2020-01-11 | 2022-11-11 | 北京质肽生物医药科技有限公司 | Glp-1和fgf21的融合蛋白的缀合物 |
| WO2021231376A2 (en) | 2020-05-12 | 2021-11-18 | Cue Biopharma, Inc. | Multimeric t-cell modulatory polypeptides and methods of use thereof |
| CN113773400B (zh) * | 2020-06-09 | 2023-08-18 | 宁波鲲鹏生物科技有限公司 | 一种门冬胰岛素衍生物及其应用 |
| CN111875711A (zh) * | 2020-07-31 | 2020-11-03 | 广东昭泰体内生物医药科技有限公司 | 一种增强型免疫细胞及其应用 |
| JP2023538533A (ja) | 2020-08-07 | 2023-09-08 | ブリストル-マイヤーズ スクイブ カンパニー | 線維症の処置のための、ccr2/5拮抗剤と組み合わせたfgf21 |
| CA3190707A1 (en) * | 2020-08-28 | 2022-03-03 | Torigen Pharmaceuticals, Inc. | Immune memory enhanced preparations and uses thereof |
| CN115925995A (zh) | 2020-09-30 | 2023-04-07 | 北京质肽生物医药科技有限公司 | 多肽缀合物和使用方法 |
| WO2022115597A1 (en) | 2020-11-25 | 2022-06-02 | Bristol-Myers Squibb Company | Methods of treating liver diseases |
| CN112457399B (zh) * | 2020-12-19 | 2023-09-01 | 上海佰君生物科技有限公司 | 一种人免疫球蛋白g的提纯方法 |
| CN113243512A (zh) * | 2021-02-10 | 2021-08-13 | 渤海大学 | 一种鲜味肽 |
| CN113024634B (zh) * | 2021-03-01 | 2022-05-10 | 浙江大学 | 类肽化合物及其在制备抗生素中的应用 |
| CN117580584A (zh) * | 2021-04-29 | 2024-02-20 | 禧尔公司 | 用于富集特定蛋白质子集的肽修饰纳米颗粒 |
| CN113577237B (zh) * | 2021-05-25 | 2023-12-26 | 浙江大学 | 类肽化合物在抗多耐药菌、泛耐药菌或全耐药菌中的应用 |
| WO2023008415A1 (ja) | 2021-07-27 | 2023-02-02 | STAND Therapeutics株式会社 | ペプチドタグおよび当該ペプチドタグをコードする核酸 |
| WO2023212298A1 (en) | 2022-04-29 | 2023-11-02 | Broadwing Bio Llc | Bispecific antibodies and methods of treating ocular disease |
| WO2023212294A1 (en) | 2022-04-29 | 2023-11-02 | Broadwing Bio Llc | Angiopoietin-related protein 7-specific antibodies and uses thereof |
| WO2023212293A1 (en) | 2022-04-29 | 2023-11-02 | Broadwing Bio Llc | Complement factor h related 4-specific antibodies and uses thereof |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1187120A (zh) * | 1995-06-07 | 1998-07-08 | 阿尔克姆斯控制治疗公司 | 人生长激素的延续释放组合物 |
| US20030022308A1 (en) * | 1992-01-31 | 2003-01-30 | Aventis Behring L.L.C. | Fusion polypeptides of human serum albumin and a therapeutically active polypeptide |
| US20030171267A1 (en) * | 2000-04-12 | 2003-09-11 | Rosen Craig A. | Albumin fusion proteins |
| US20050042721A1 (en) * | 2003-06-03 | 2005-02-24 | Jianmin Fang | Compositions and methods for enhanced expression of recombinant polypeptides from a single vector using a peptide cleavage site |
| US20060026719A1 (en) * | 2004-01-14 | 2006-02-02 | Kieliszewski Marcia J | Methods of producing peptides/proteins in plants and peptides/proteins produced thereby |
| US20080039341A1 (en) * | 2005-09-27 | 2008-02-14 | Volker Schellenberger | Unstructured recombinant polymers and uses thereof |
| WO2007103515A3 (en) * | 2006-03-06 | 2008-04-03 | Amunix Inc | Unstructured recombinant polymers and uses thereof |
| US20080286808A1 (en) * | 2005-09-27 | 2008-11-20 | Volker Schellenberger | Methods for production of unstructured recombinant polymers and uses thereof |
Family Cites Families (110)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3992518A (en) | 1974-10-24 | 1976-11-16 | G. D. Searle & Co. | Method for making a microsealed delivery device |
| GB1478759A (en) | 1974-11-18 | 1977-07-06 | Alza Corp | Process for forming outlet passageways in pills using a laser |
| US4284444A (en) | 1977-08-01 | 1981-08-18 | Herculite Protective Fabrics Corporation | Activated polymer materials and process for making same |
| US4200984A (en) | 1979-03-12 | 1980-05-06 | Fink Ray D | Detachable tool combining bracket and method |
| DE3006377C2 (de) * | 1980-02-20 | 1983-11-24 | Franz Josef 6233 Kelkheim Lang | Etagenturm |
| US4398908A (en) | 1980-11-28 | 1983-08-16 | Siposs George G | Insulin delivery system |
| US4435173A (en) | 1982-03-05 | 1984-03-06 | Delta Medical Industries | Variable rate syringe pump for insulin delivery |
| US4542025A (en) | 1982-07-29 | 1985-09-17 | The Stolle Research And Development Corporation | Injectable, long-acting microparticle formulation for the delivery of anti-inflammatory agents |
| US5916588A (en) | 1984-04-12 | 1999-06-29 | The Liposome Company, Inc. | Peptide-containing liposomes, immunogenic liposomes and methods of preparation and use |
| US5231112A (en) | 1984-04-12 | 1993-07-27 | The Liposome Company, Inc. | Compositions containing tris salt of cholesterol hemisuccinate and antifungal |
| EP0190262B1 (en) | 1984-07-24 | 1990-12-27 | Key Pharmaceuticals, Inc. | Adhesive transdermal dosage layer |
| US4684479A (en) | 1985-08-14 | 1987-08-04 | Arrigo Joseph S D | Surfactant mixtures, stable gas-in-liquid emulsions, and methods for the production of such emulsions from said mixtures |
| US6759057B1 (en) | 1986-06-12 | 2004-07-06 | The Liposome Company, Inc. | Methods and compositions using liposome-encapsulated non-steroidal anti-inflammatory drugs |
| IE60901B1 (en) | 1986-08-21 | 1994-08-24 | Vestar Inc | Improved treatment of systemic fungal infections with phospholipid particles encapsulating polyene antifungal antibiotics |
| US4933185A (en) | 1986-09-24 | 1990-06-12 | Massachusetts Institute Of Technology | System for controlled release of biologically active compounds |
| US6024983A (en) | 1986-10-24 | 2000-02-15 | Southern Research Institute | Composition for delivering bioactive agents for immune response and its preparation |
| US6406713B1 (en) | 1987-03-05 | 2002-06-18 | The Liposome Company, Inc. | Methods of preparing low-toxicity drug-lipid complexes |
| US4897268A (en) | 1987-08-03 | 1990-01-30 | Southern Research Institute | Drug delivery system and method of making the same |
| US4976696A (en) | 1987-08-10 | 1990-12-11 | Becton, Dickinson And Company | Syringe pump and the like for delivering medication |
| US4861800A (en) | 1987-08-18 | 1989-08-29 | Buyske Donald A | Method for administering the drug deprenyl so as to minimize the danger of side effects |
| AU598958B2 (en) | 1987-11-12 | 1990-07-05 | Vestar, Inc. | Improved amphotericin b liposome preparation |
| US5270176A (en) | 1987-11-20 | 1993-12-14 | Hoechst Aktiengesellschaft | Method for the selective cleavage of fusion proteins with lysostaphin |
| GB8807504D0 (en) | 1988-03-29 | 1988-05-05 | Sandoz Ltd | Improvements in/relating to organic compounds |
| JP2717808B2 (ja) | 1988-08-10 | 1998-02-25 | テルモ株式会社 | シリンジポンプ |
| US5223409A (en) * | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5017378A (en) | 1989-05-01 | 1991-05-21 | The University Of Virginia Alumni Patents Foundation | Intraorgan injection of biologically active compounds contained in slow-release microcapsules or microspheres |
| EP0471036B2 (en) | 1989-05-04 | 2004-06-23 | Southern Research Institute | Encapsulation process |
| US5599907A (en) | 1989-05-10 | 1997-02-04 | Somatogen, Inc. | Production and use of multimeric hemoglobins |
| US5298022A (en) | 1989-05-29 | 1994-03-29 | Amplifon Spa | Wearable artificial pancreas |
| FR2647677B1 (fr) | 1989-05-31 | 1991-09-27 | Roussel Uclaf | Nouvelles micro-proteines, procede de preparation et application a titre de medicaments de ces nouvelles micro-proteines |
| US7413537B2 (en) | 1989-09-01 | 2008-08-19 | Dyax Corp. | Directed evolution of disulfide-bonded micro-proteins |
| US5492534A (en) | 1990-04-02 | 1996-02-20 | Pharmetrix Corporation | Controlled release portable pump |
| US5318540A (en) | 1990-04-02 | 1994-06-07 | Pharmetrix Corporation | Controlled release infusion device |
| US5176502A (en) | 1990-04-25 | 1993-01-05 | Becton, Dickinson And Company | Syringe pump and the like for delivering medication |
| US6517859B1 (en) | 1990-05-16 | 2003-02-11 | Southern Research Institute | Microcapsules for administration of neuroactive agents |
| US5215680A (en) | 1990-07-10 | 1993-06-01 | Cavitation-Control Technology, Inc. | Method for the production of medical-grade lipid-coated microbubbles, paramagnetic labeling of such microbubbles and therapeutic uses of microbubbles |
| US5089938A (en) * | 1991-04-24 | 1992-02-18 | General Motors Corporation | Component mounting assembly |
| US5573776A (en) | 1992-12-02 | 1996-11-12 | Alza Corporation | Oral osmotic device with hydrogel driving member |
| PT674506E (pt) * | 1992-12-02 | 2001-01-31 | Alkermes Inc | Microsferas contendo hormona de crescimento com libertacao controlada |
| PT809110E (pt) | 1993-03-09 | 2004-06-30 | Baxter Int | Microparticulas macromoleculares e metodos de producao |
| US5554730A (en) | 1993-03-09 | 1996-09-10 | Middlesex Sciences, Inc. | Method and kit for making a polysaccharide-protein conjugate |
| US5981719A (en) | 1993-03-09 | 1999-11-09 | Epic Therapeutics, Inc. | Macromolecular microparticles and methods of production and use |
| US6090925A (en) | 1993-03-09 | 2000-07-18 | Epic Therapeutics, Inc. | Macromolecular microparticles and methods of production and use |
| US20020042079A1 (en) | 1994-02-01 | 2002-04-11 | Sanford M. Simon | Methods and agents for measuring and controlling multidrug resistance |
| US5739276A (en) | 1994-10-07 | 1998-04-14 | University Of Utah Research Foundation | Conotoxin peptides |
| US5660848A (en) | 1994-11-02 | 1997-08-26 | The Population Council, Center For Biomedical Research | Subdermally implantable device |
| US7846455B2 (en) | 1996-07-15 | 2010-12-07 | The United States Of America As Represented By The Department Of Health And Human Services | Attenuated chimeric respiratory syncytial virus |
| GB9526733D0 (en) | 1995-12-30 | 1996-02-28 | Delta Biotechnology Ltd | Fusion proteins |
| DE69735057T2 (de) | 1996-03-12 | 2006-08-31 | PG-TXL Co., L.P., Houston | Wasserlösliche paclitaxel-prodrogen |
| US6441025B2 (en) | 1996-03-12 | 2002-08-27 | Pg-Txl Company, L.P. | Water soluble paclitaxel derivatives |
| DK0929293T3 (da) | 1996-08-23 | 2004-02-02 | Sequus Pharm Inc | Liposomer indeholdende en cisplatinforbindelse |
| US6056973A (en) | 1996-10-11 | 2000-05-02 | Sequus Pharmaceuticals, Inc. | Therapeutic liposome composition and method of preparation |
| AU4907897A (en) | 1996-10-11 | 1998-05-11 | Sequus Pharmaceuticals, Inc. | Therapeutic liposome composition and method |
| NZ514133A (en) | 1996-10-15 | 2001-09-28 | Liposome Co Inc | N-acyl phosphatidylethanolamine-mediated liposomal drug delivery |
| EP0954291B1 (en) | 1996-10-25 | 2005-12-28 | Shire Laboratories Inc. | Soluble form osmotic dose delivery system |
| US6361796B1 (en) | 1996-10-25 | 2002-03-26 | Shire Laboratories, Inc. | Soluble form osmotic dose delivery system |
| EP0842657A1 (en) | 1996-11-19 | 1998-05-20 | OctoPlus B.V. | Microspheres for controlled release and processes to prepare these microspheres |
| US6395302B1 (en) | 1996-11-19 | 2002-05-28 | Octoplus B.V. | Method for the preparation of microspheres which contain colloidal systems |
| US6294170B1 (en) | 1997-08-08 | 2001-09-25 | Amgen Inc. | Composition and method for treating inflammatory diseases |
| AT405516B (de) | 1997-02-27 | 1999-09-27 | Immuno Ag | Faktor x-analoge mit modifizierter proteasespaltstelle |
| DE19747261A1 (de) | 1997-10-25 | 1999-04-29 | Bayer Ag | Osmotisches Arzneimittelfreisetzungssystem |
| ES2255155T3 (es) | 1998-02-05 | 2006-06-16 | Biosense Webster, Inc. | Dispositivo para la administracion intracardiaca de farmacos. |
| US20050260605A1 (en) | 1998-02-11 | 2005-11-24 | Maxygen, Inc. | Targeting of genetic vaccine vectors |
| AU3289199A (en) | 1998-02-11 | 1999-08-30 | Maxygen, Inc. | Antigen library immunization |
| US7090976B2 (en) | 1999-11-10 | 2006-08-15 | Rigel Pharmaceuticals, Inc. | Methods and compositions comprising Renilla GFP |
| US20030190740A1 (en) * | 1998-10-13 | 2003-10-09 | The University Of Georgia Research Foundation, Inc | Stabilized bioactive peptides and methods of identification, synthesis, and use |
| US6329186B1 (en) | 1998-12-07 | 2001-12-11 | Novozymes A/S | Glucoamylases with N-terminal extensions |
| US6713086B2 (en) | 1998-12-18 | 2004-03-30 | Abbott Laboratories | Controlled release formulation of divalproex sodium |
| EP1161274B1 (en) | 1999-03-03 | 2004-12-29 | Optinose AS | Nasal delivery device |
| US6183770B1 (en) | 1999-04-15 | 2001-02-06 | Acutek International | Carrier patch for the delivery of agents to the skin |
| US7666400B2 (en) | 2005-04-06 | 2010-02-23 | Ibc Pharmaceuticals, Inc. | PEGylation by the dock and lock (DNL) technique |
| US6743211B1 (en) | 1999-11-23 | 2004-06-01 | Georgia Tech Research Corporation | Devices and methods for enhanced microneedle penetration of biological barriers |
| DE60020366T2 (de) | 1999-06-14 | 2006-02-02 | Genentech Inc., San Francisco | Strukturiertes peptidgerüst zur ausstellung von drehung-bibliotheken auf phage |
| US6458387B1 (en) | 1999-10-18 | 2002-10-01 | Epic Therapeutics, Inc. | Sustained release microspheres |
| US20030109428A1 (en) | 1999-12-01 | 2003-06-12 | John Bertin | Novel molecules of the card-related protein family and uses thereof |
| US20050287153A1 (en) | 2002-06-28 | 2005-12-29 | Genentech, Inc. | Serum albumin binding peptides for tumor targeting |
| US6352721B1 (en) | 2000-01-14 | 2002-03-05 | Osmotica Corp. | Combined diffusion/osmotic pumping drug delivery system |
| DE60140625D1 (de) | 2000-08-15 | 2010-01-07 | Univ Illinois | Verfahren zur herstellung von mikropartikeln |
| DE10053224A1 (de) | 2000-10-26 | 2002-05-08 | Univ Goettingen Georg August | Verfahren zur Exposition von Peptiden und Polypeptiden auf der Zelloberfläche von Bakterien |
| US20030049689A1 (en) | 2000-12-14 | 2003-03-13 | Cynthia Edwards | Multifunctional polypeptides |
| IN190699B (zh) | 2001-02-02 | 2003-08-16 | Sun Pharmaceutical Ind Ltd | |
| US20020169125A1 (en) | 2001-03-21 | 2002-11-14 | Cell Therapeutics, Inc. | Recombinant production of polyanionic polymers and uses thereof |
| US20050048512A1 (en) | 2001-04-26 | 2005-03-03 | Avidia Research Institute | Combinatorial libraries of monomer domains |
| WO2002087621A1 (en) | 2001-04-30 | 2002-11-07 | Shire Laboratories Inc. | Pharmaceutical composition including ace/nep inhibitors and bioavailability enhancers |
| US6838093B2 (en) | 2001-06-01 | 2005-01-04 | Shire Laboratories, Inc. | System for osmotic delivery of pharmaceutically active agents |
| KR100407467B1 (ko) | 2001-07-12 | 2003-11-28 | 최수봉 | 리모컨 방식의 인슐린 자동주사기 |
| US20040259780A1 (en) | 2001-07-30 | 2004-12-23 | Glasebrook Andrew Lawrence | Method for treating diabetes and obesity |
| US7125843B2 (en) | 2001-10-19 | 2006-10-24 | Neose Technologies, Inc. | Glycoconjugates including more than one peptide |
| PT2279753E (pt) | 2001-10-10 | 2016-01-15 | Novo Nordisk As | Remodelação e glicoconjugação de péptidos |
| EP1451297A4 (en) | 2001-12-07 | 2006-06-28 | Toolgen Inc | PHENOTYPIC SCANNING OF CHIMERIC PROTEINS |
| WO2005077042A2 (en) | 2004-02-09 | 2005-08-25 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| US20080167238A1 (en) | 2001-12-21 | 2008-07-10 | Human Genome Sciences, Inc. | Albumin Fusion Proteins |
| US6945952B2 (en) | 2002-06-25 | 2005-09-20 | Theraject, Inc. | Solid solution perforator for drug delivery and other applications |
| US20070161087A1 (en) | 2003-05-29 | 2007-07-12 | Wolfgang Glaesner | Glp-1 fusion proteins |
| US20050152979A1 (en) | 2003-09-05 | 2005-07-14 | Cell Therapeutics, Inc. | Hydrophobic drug compositions containing reconstitution enhancer |
| CA2539253A1 (en) | 2003-09-19 | 2005-03-31 | Novo Nordisk A/S | Albumin-binding derivatives of therapeutic peptides |
| EP1682106A4 (en) | 2003-10-30 | 2008-06-11 | Univ Emory | MODIFIED FVIII FACTOR WITH REDUCED IMMUNOGENICITY THROUGH MUTAGENESIS OF A2 AND C2 EPITOPES |
| CA2546580A1 (en) | 2003-11-18 | 2005-06-09 | Iconic Therapeutics, Inc. | Homogeneous preparations of chimeric proteins |
| US8076288B2 (en) | 2004-02-11 | 2011-12-13 | Amylin Pharmaceuticals, Inc. | Hybrid polypeptides having glucose lowering activity |
| MX2007003320A (es) | 2004-09-24 | 2007-05-18 | Amgen Inc | Moleculas fc modificadas. |
| RU2007132188A (ru) | 2005-01-25 | 2009-03-10 | Селл Терапьютикс, Инк. (Us) | Конъюгаты биологически активных белков, имеющие модифицированное время полужизни in vivo |
| US8263545B2 (en) | 2005-02-11 | 2012-09-11 | Amylin Pharmaceuticals, Inc. | GIP analog and hybrid polypeptides with selectable properties |
| WO2007038619A2 (en) | 2005-09-27 | 2007-04-05 | Amunix, Inc. | Proteinaceous pharmaceuticals and uses thereof |
| US20090099031A1 (en) | 2005-09-27 | 2009-04-16 | Stemmer Willem P | Genetic package and uses thereof |
| BRPI0708832A2 (pt) | 2006-03-31 | 2011-06-14 | Baxter Int | construÇço proteinÁcea |
| US7812121B2 (en) | 2006-08-31 | 2010-10-12 | Baker Audrey E | GLP-2 mimetibodies, polypeptides, compositions, methods and uses |
| WO2008049711A1 (en) | 2006-10-27 | 2008-05-02 | Novo Nordisk A/S | Peptide extended insulins |
| US8563521B2 (en) | 2007-06-21 | 2013-10-22 | Technische Universitat Munchen | Biological active proteins having increased in vivo and/or in vitro stability |
| MX2010001684A (es) * | 2007-08-15 | 2010-04-21 | Amunix Inc | Composiciones y metodos para modificar propiedades de polipeptidos biologicamente activos. |
| HUE031840T2 (en) | 2009-02-03 | 2017-08-28 | Amunix Operating Inc | Longer recombinant polypeptides and compositions containing them |
-
2008
- 2008-08-15 MX MX2010001684A patent/MX2010001684A/es active IP Right Grant
- 2008-08-15 KR KR1020107005458A patent/KR20100058541A/ko not_active Application Discontinuation
- 2008-08-15 AU AU2008287340A patent/AU2008287340A1/en not_active Abandoned
- 2008-08-15 US US12/228,859 patent/US8933197B2/en active Active
- 2008-08-15 CN CN2008801033448A patent/CN103298935A/zh active Pending
- 2008-08-15 CA CA2695374A patent/CA2695374A1/en not_active Abandoned
- 2008-08-15 EP EP08795371A patent/EP2185701A4/en not_active Withdrawn
- 2008-08-15 BR BRPI0815416-3A2A patent/BRPI0815416A2/pt not_active IP Right Cessation
- 2008-08-15 JP JP2010521048A patent/JP2010536341A/ja active Pending
- 2008-08-15 WO PCT/US2008/009787 patent/WO2009023270A2/en active Application Filing
-
2009
- 2009-12-23 US US12/646,566 patent/US20100260706A1/en not_active Abandoned
-
2012
- 2012-05-11 US US13/469,902 patent/US20130039884A1/en not_active Abandoned
-
2014
- 2014-10-22 US US14/521,388 patent/US20150259431A1/en not_active Abandoned
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030022308A1 (en) * | 1992-01-31 | 2003-01-30 | Aventis Behring L.L.C. | Fusion polypeptides of human serum albumin and a therapeutically active polypeptide |
| CN1187120A (zh) * | 1995-06-07 | 1998-07-08 | 阿尔克姆斯控制治疗公司 | 人生长激素的延续释放组合物 |
| US20030171267A1 (en) * | 2000-04-12 | 2003-09-11 | Rosen Craig A. | Albumin fusion proteins |
| US20050042721A1 (en) * | 2003-06-03 | 2005-02-24 | Jianmin Fang | Compositions and methods for enhanced expression of recombinant polypeptides from a single vector using a peptide cleavage site |
| US20060026719A1 (en) * | 2004-01-14 | 2006-02-02 | Kieliszewski Marcia J | Methods of producing peptides/proteins in plants and peptides/proteins produced thereby |
| US20080039341A1 (en) * | 2005-09-27 | 2008-02-14 | Volker Schellenberger | Unstructured recombinant polymers and uses thereof |
| US20080286808A1 (en) * | 2005-09-27 | 2008-11-20 | Volker Schellenberger | Methods for production of unstructured recombinant polymers and uses thereof |
| WO2007103515A3 (en) * | 2006-03-06 | 2008-04-03 | Amunix Inc | Unstructured recombinant polymers and uses thereof |
Non-Patent Citations (1)
| Title |
|---|
| PAULA ALVAREZ ET AL.: "Improving Protein Pharmacokinetics by Genetic Fusion to Simple Amino Acid Sequences", 《THE JOURNAL OF BIOLOGICAL CHEMISTRY》 * |
Cited By (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103709253A (zh) * | 2013-12-20 | 2014-04-09 | 南开大学 | 一种生物合成制备glp-1及其类似物的方法 |
| CN104844711B (zh) * | 2014-02-18 | 2018-07-06 | 南通表源生物技术有限公司 | 一种多聚体荧光蛋白复合物及其应用 |
| CN104844711A (zh) * | 2014-02-18 | 2015-08-19 | 南通表源生物技术有限公司 | 一种多聚体荧光蛋白复合物及其应用 |
| CN111876371A (zh) * | 2014-07-11 | 2020-11-03 | 玛土撤拉有限公司 | 心脏细胞培养材料 |
| CN107743494B (zh) * | 2015-06-02 | 2022-04-29 | 诺和诺德股份有限公司 | 具有极性重组延伸体的胰岛素 |
| CN107743494A (zh) * | 2015-06-02 | 2018-02-27 | 诺和诺德股份有限公司 | 具有极性重组延伸体的胰岛素 |
| CN107531753A (zh) * | 2015-07-08 | 2018-01-02 | 成均馆大学校产学协力团 | 吡咯烷酰胺衍生物及其制备和使用方法 |
| CN114891116A (zh) * | 2015-09-11 | 2022-08-12 | 生物权威(英国)有限公司 | 嵌合抗原受体及其用途 |
| CN108061804A (zh) * | 2016-11-09 | 2018-05-22 | 北京大学人民医院 | 用于诊断子宫内膜异位症的生物标志物 |
| CN110914455A (zh) * | 2017-03-15 | 2020-03-24 | 朱诺生物科学有限责任公司 | 使用与子宫内膜异位症相关的遗传标志物的方法 |
| CN111032873A (zh) * | 2017-06-26 | 2020-04-17 | 国立研究开发法人理化学研究所 | 融合蛋白 |
| CN112088310A (zh) * | 2018-04-12 | 2020-12-15 | 皇家飞利浦有限公司 | 牙龈炎诊断方法、用途和试剂盒 |
| CN112654636A (zh) * | 2018-05-14 | 2021-04-13 | 狼人治疗公司 | 可活化白介素12多肽及其使用方法 |
| CN111971295A (zh) * | 2018-09-17 | 2020-11-20 | Gi 医诺微新 | 包含il-2蛋白和cd80蛋白的融合蛋白及其用途 |
| CN109374897A (zh) * | 2018-11-22 | 2019-02-22 | 大连大学 | 一种用于肝癌检测的试剂盒 |
| CN109374897B (zh) * | 2018-11-22 | 2021-11-02 | 大连大学 | 一种用于肝癌检测的试剂盒 |
| CN109371052B (zh) * | 2018-12-04 | 2022-02-22 | 安徽农业大学 | 提高高gc含量噬铜菌属细菌电转化效率的方法 |
| CN109371052A (zh) * | 2018-12-04 | 2019-02-22 | 安徽农业大学 | 提高高gc含量噬铜菌属细菌电转化效率的方法 |
| CN111499759A (zh) * | 2019-01-31 | 2020-08-07 | 上海科技大学 | 一种具有细胞穿膜性的锌指蛋白-乳铁蛋白融合蛋白质及其制备与应用 |
| CN111499759B (zh) * | 2019-01-31 | 2022-12-20 | 上海科技大学 | 一种具有细胞穿膜性的锌指蛋白-乳铁蛋白融合蛋白质及其制备与应用 |
| CN109627300A (zh) * | 2019-02-18 | 2019-04-16 | 浙江新银象生物工程有限公司 | Nisin溶液稳定剂开发及应用 |
| CN110075280A (zh) * | 2019-04-30 | 2019-08-02 | 王丛飞 | 一种层粘连蛋白肽复合口服剂及其制备方法 |
| CN110244053A (zh) * | 2019-05-09 | 2019-09-17 | 北京大学第三医院(北京大学第三临床医学院) | 用于诊断狼疮肾炎并肺动脉高压疾病的分子标志物及其用途 |
| CN114945586A (zh) * | 2020-01-21 | 2022-08-26 | 张晋宇 | 一种药物组合物及其用途 |
| CN111437444B (zh) * | 2020-04-12 | 2021-03-12 | 南方医科大学 | 一种抗肠粘连双层生物凝胶制备方法及双层生物凝胶 |
| CN111620942B (zh) * | 2020-06-12 | 2021-10-15 | 中国科学院昆明动物研究所 | 布氏鼠耳蝠白三烯A4水解酶抑制剂Motistin的成熟肽及其应用 |
| CN111620942A (zh) * | 2020-06-12 | 2020-09-04 | 中国科学院昆明动物研究所 | 布氏鼠耳蝠白三烯A4水解酶抑制剂Motistin的成熟肽及其应用 |
| CN111705032A (zh) * | 2020-07-09 | 2020-09-25 | 科赫生物科技(北京)有限公司 | 一种原核表达细胞及其制备方法和应用 |
| CN111870688A (zh) * | 2020-07-09 | 2020-11-03 | 沣潮医药科技(上海)有限公司 | ACE2蛋白与IL-6或TNFα拮抗剂组合及其应用 |
| CN111944021A (zh) * | 2020-08-24 | 2020-11-17 | 郑州大学 | Cd47亲和肽及其应用 |
| CN111944021B (zh) * | 2020-08-24 | 2022-03-22 | 郑州大学 | Cd47亲和肽及其应用 |
| CN112375712A (zh) * | 2020-11-25 | 2021-02-19 | 昆明理工大学 | 一株乳酸乳球菌及其应用 |
| CN113358866A (zh) * | 2021-04-22 | 2021-09-07 | 四川大学华西医院 | 基于三重并联杂交链式反应的破伤风抗原的均相超灵敏二维可视化和荧光分析方法及应用 |
| CN114133441A (zh) * | 2021-11-15 | 2022-03-04 | 同济大学 | 一种促进牙本质矿化的活性短肽及其应用 |
| CN114133441B (zh) * | 2021-11-15 | 2024-02-06 | 同济大学 | 一种促进牙本质矿化的活性短肽及其应用 |
| CN114380902A (zh) * | 2021-12-29 | 2022-04-22 | 江苏诺泰澳赛诺生物制药股份有限公司 | 一种hgh(176-191)的制备方法 |
| CN116218711A (zh) * | 2022-12-21 | 2023-06-06 | 陕西省微生物研究所 | 一株乳酸乳球菌pz1及其在制备富硒低聚肽中的应用 |
| CN116218711B (zh) * | 2022-12-21 | 2024-02-06 | 陕西省微生物研究所 | 一株乳酸乳球菌pz1及其在制备富硒低聚肽中的应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20100058541A (ko) | 2010-06-03 |
| US20090092582A1 (en) | 2009-04-09 |
| EP2185701A4 (en) | 2011-03-02 |
| CA2695374A1 (en) | 2009-02-19 |
| EP2185701A2 (en) | 2010-05-19 |
| BRPI0815416A2 (pt) | 2014-10-21 |
| US20150259431A1 (en) | 2015-09-17 |
| US20130039884A1 (en) | 2013-02-14 |
| WO2009023270A2 (en) | 2009-02-19 |
| AU2008287340A1 (en) | 2009-02-19 |
| WO2009023270A3 (en) | 2009-05-07 |
| MX2010001684A (es) | 2010-04-21 |
| US8933197B2 (en) | 2015-01-13 |
| US20100260706A1 (en) | 2010-10-14 |
| JP2010536341A (ja) | 2010-12-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11203630B2 (en) | Serum albumin-binding fibronectin type III domains | |
| US8933197B2 (en) | Compositions comprising modified biologically active polypeptides | |
| US20230145413A1 (en) | Fast-off rate serum albumin binding fibronectin type iii domains | |
| CN103003301B (zh) | 血清白蛋白结合分子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20130911 |