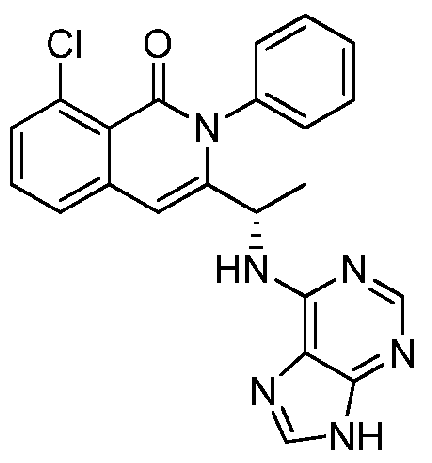
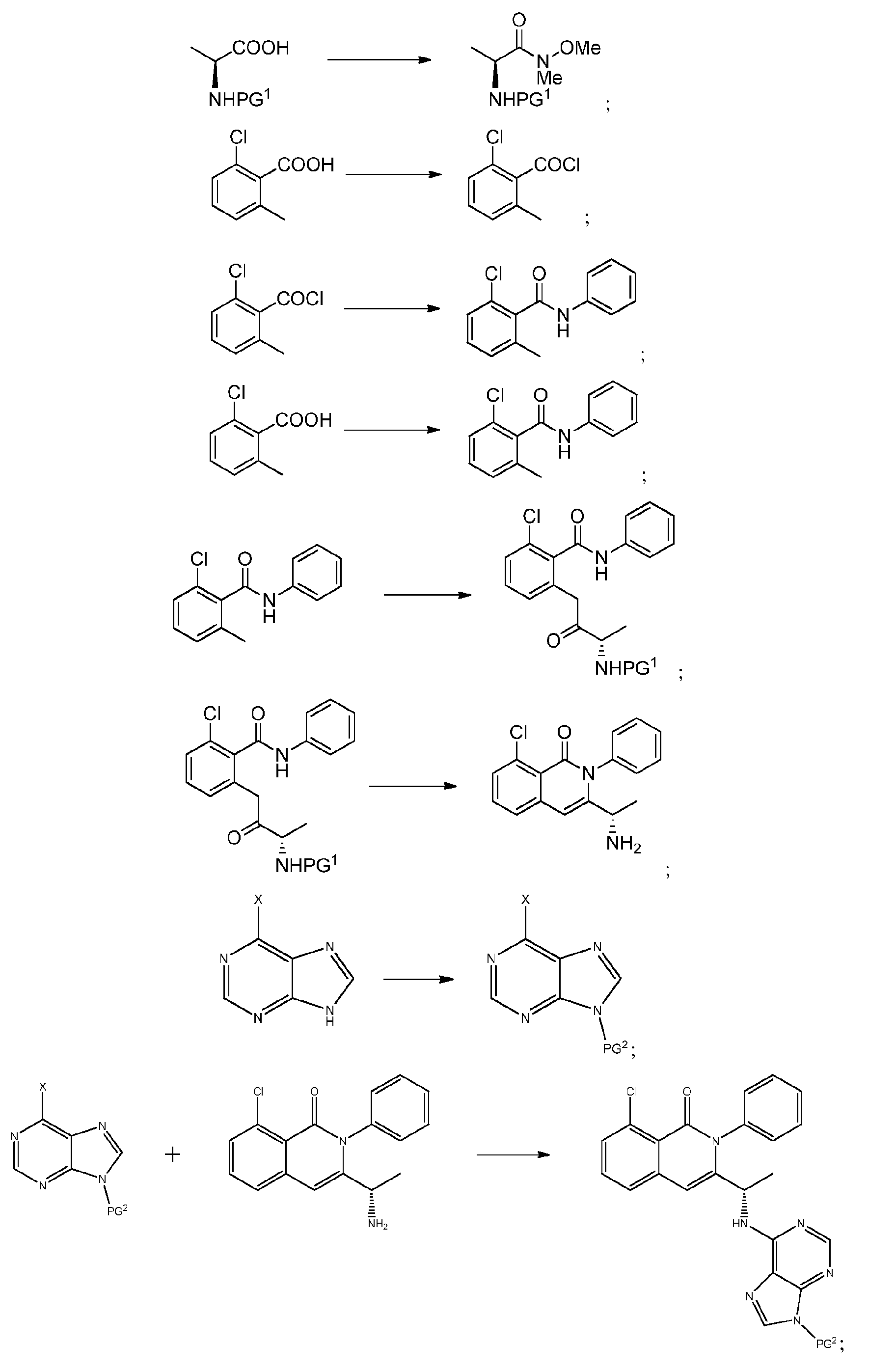
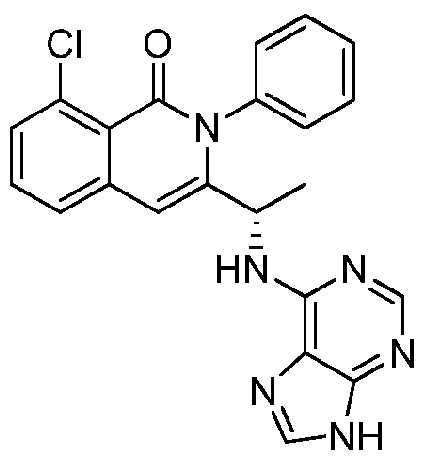
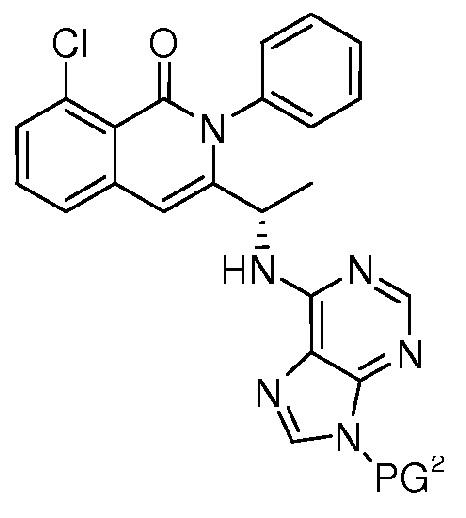
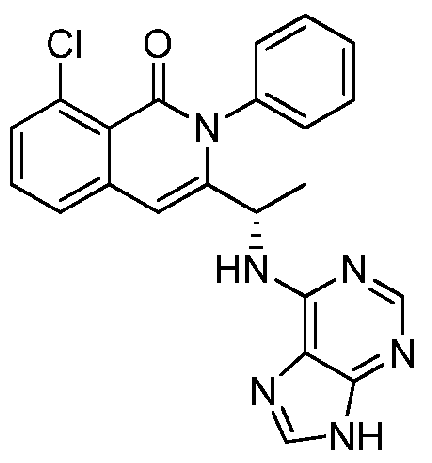
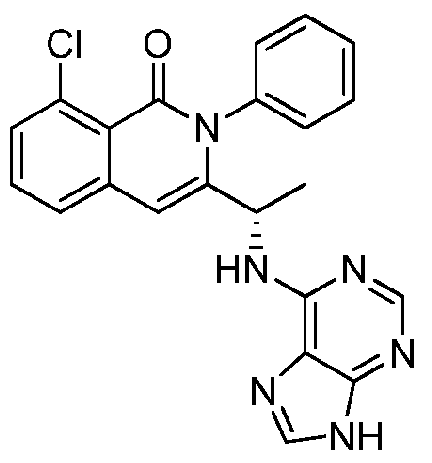
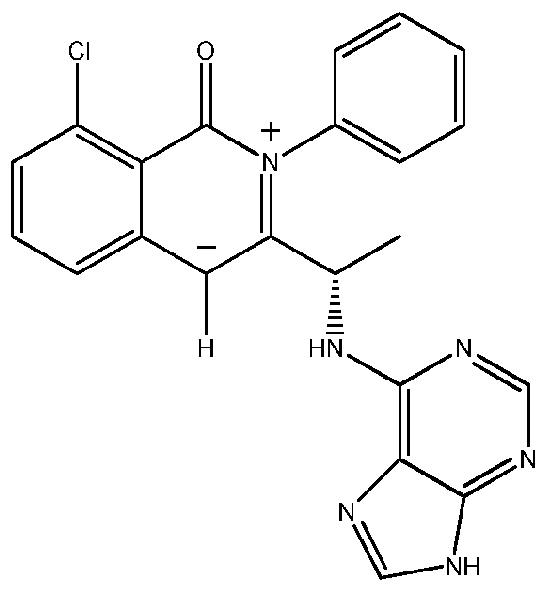
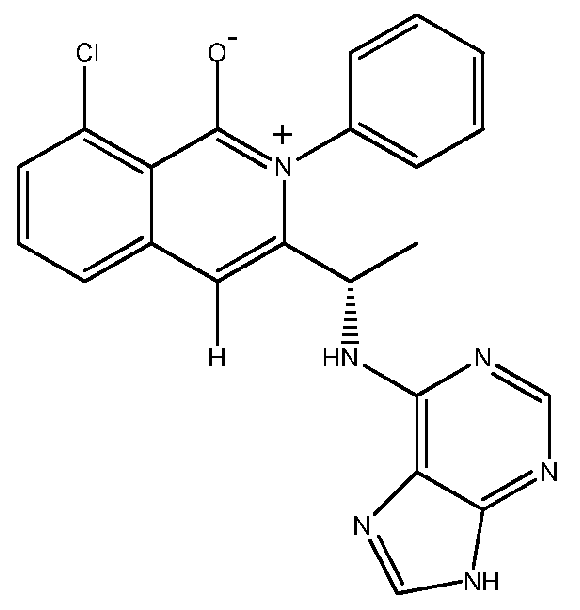
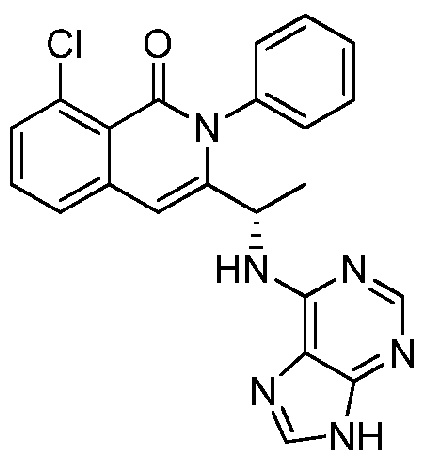
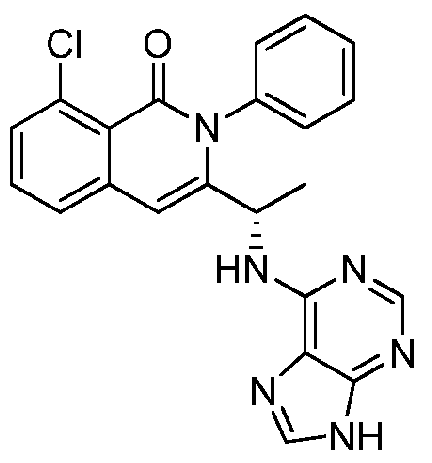
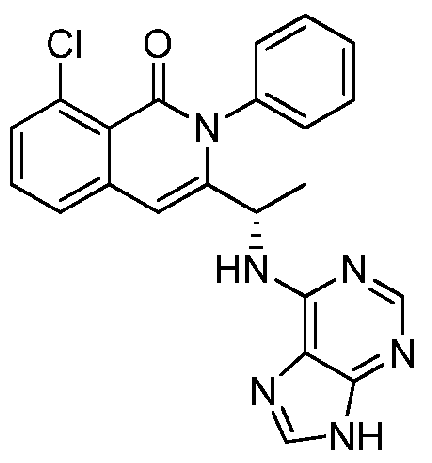
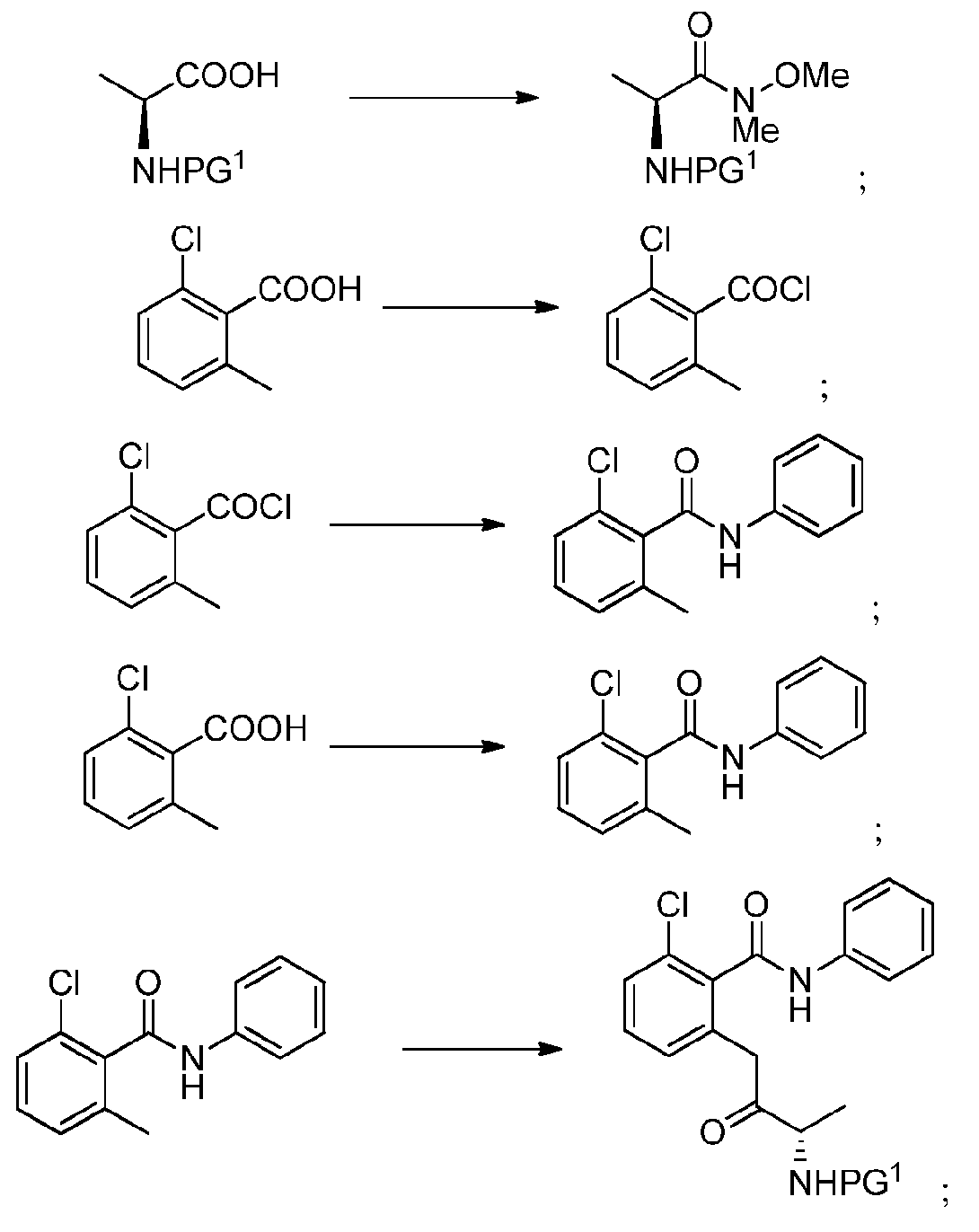
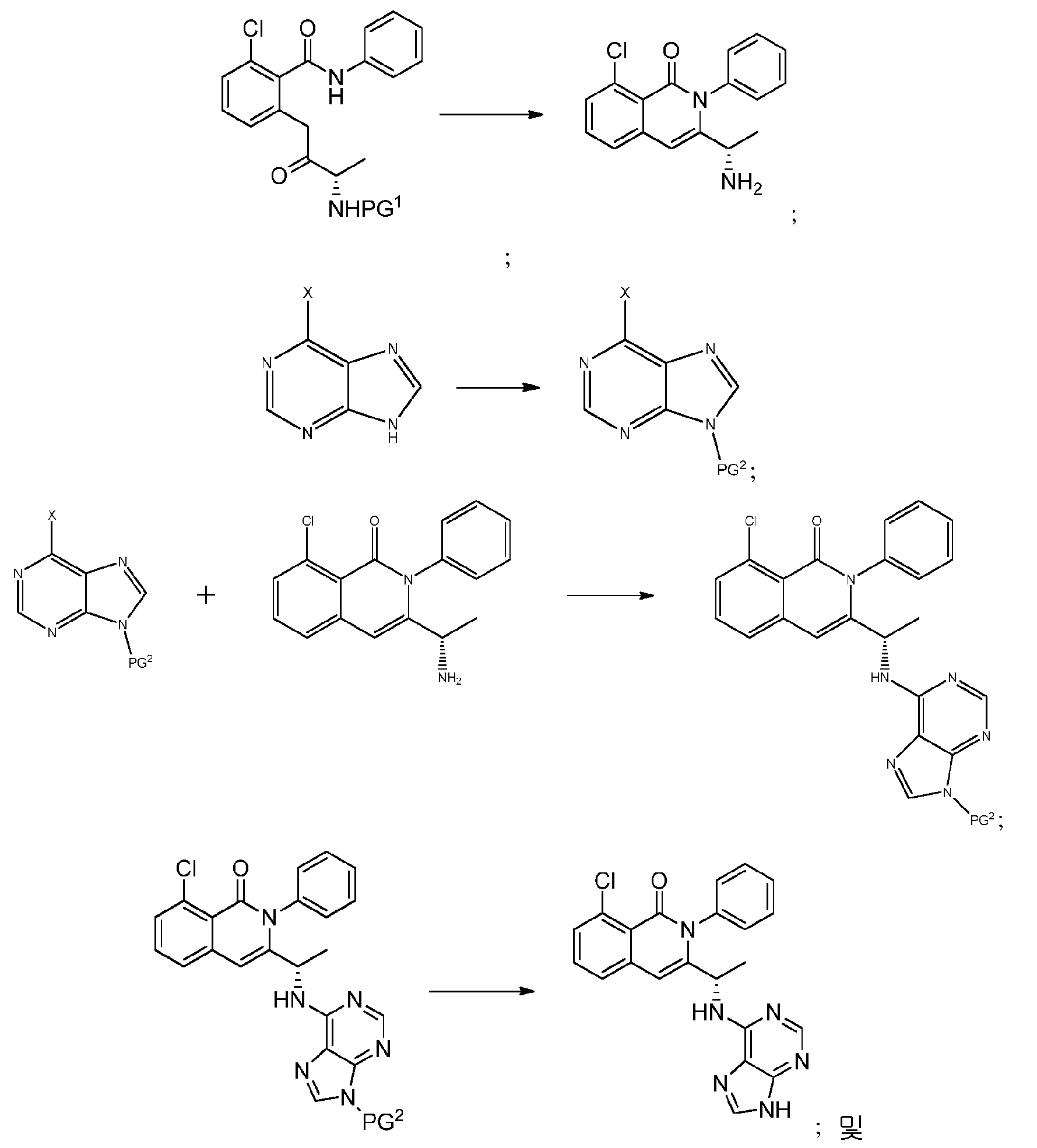
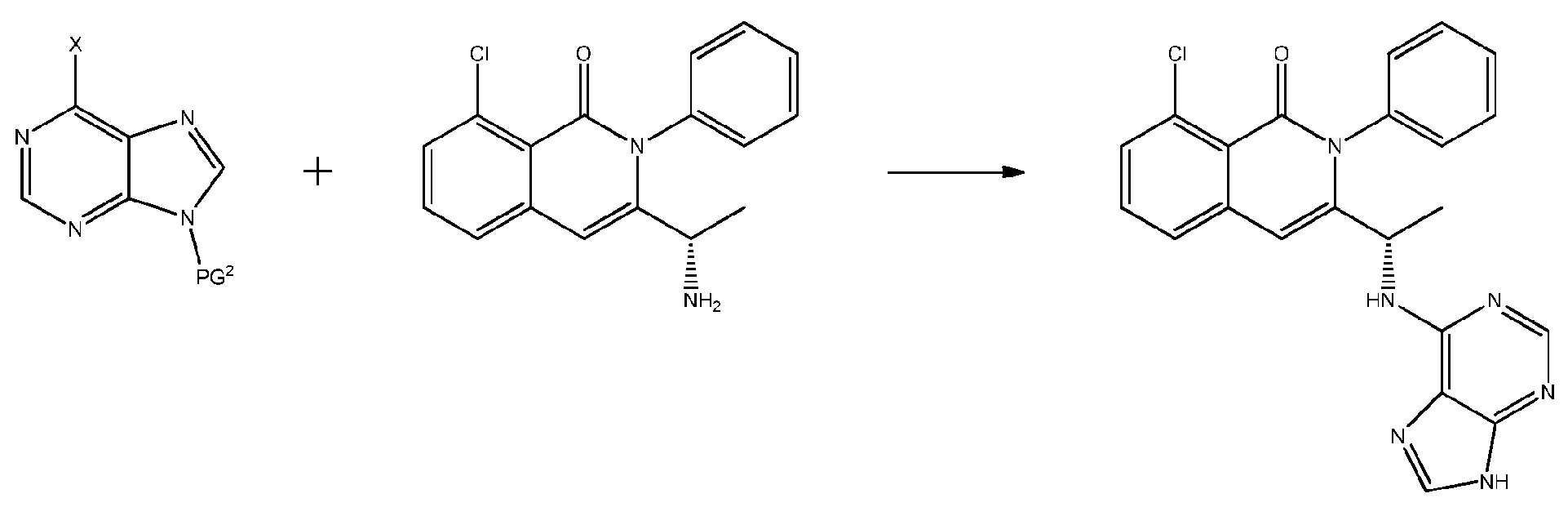
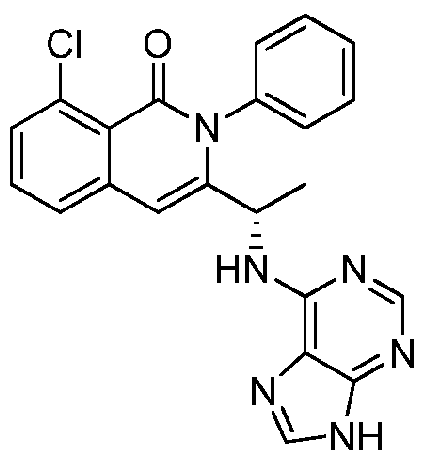
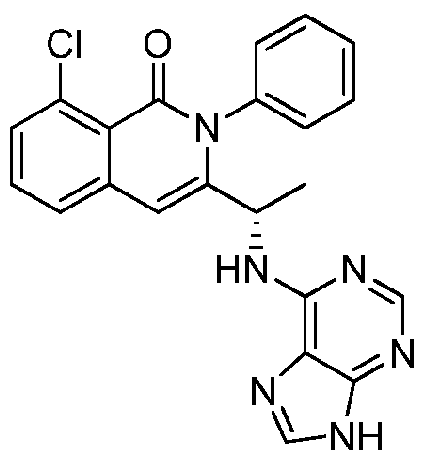
KR20140020249A - 이소퀴놀린온 및 이의 고체 형태의 제조 방법 - Google Patents
이소퀴놀린온 및 이의 고체 형태의 제조 방법 Download PDFInfo
- Publication number
- KR20140020249A KR20140020249A KR1020137021000A KR20137021000A KR20140020249A KR 20140020249 A KR20140020249 A KR 20140020249A KR 1020137021000 A KR1020137021000 A KR 1020137021000A KR 20137021000 A KR20137021000 A KR 20137021000A KR 20140020249 A KR20140020249 A KR 20140020249A
- Authority
- KR
- South Korea
- Prior art keywords
- polymorph
- formula
- compound
- polymorph form
- xrpd peaks
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 238000000034 method Methods 0.000 title claims abstract description 130
- 239000007787 solid Chemical group 0.000 title claims description 49
- 230000008569 process Effects 0.000 title description 16
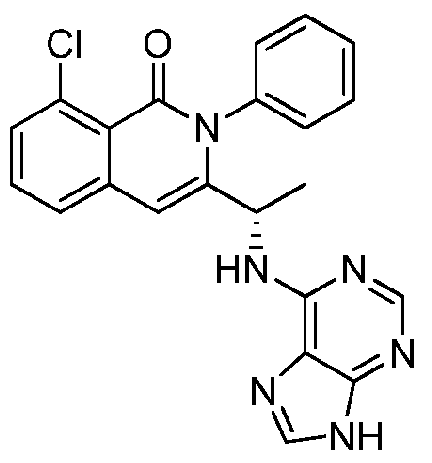
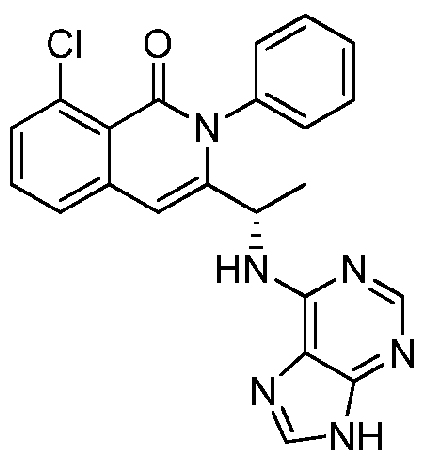
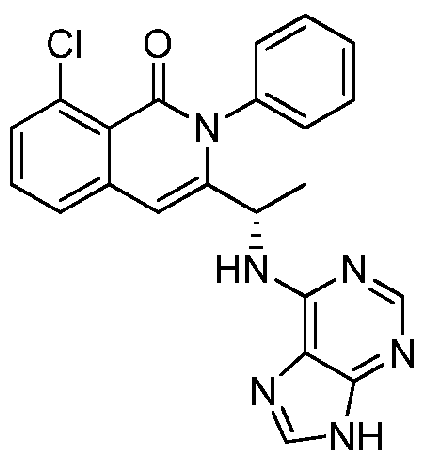
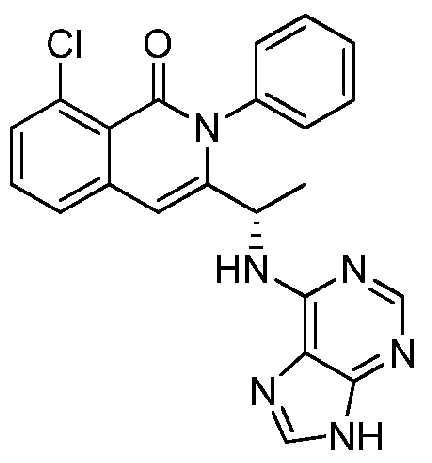
- VDBNYAPERZTOOF-UHFFFAOYSA-N isoquinolin-1(2H)-one Chemical group C1=CC=C2C(=O)NC=CC2=C1 VDBNYAPERZTOOF-UHFFFAOYSA-N 0.000 title description 4
- 150000001875 compounds Chemical class 0.000 claims abstract description 402
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 44
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 27
- 201000010099 disease Diseases 0.000 claims abstract description 22
- -1 2,2,2-trichloroethoxycarbonyl Chemical group 0.000 claims description 340
- 239000000203 mixture Substances 0.000 claims description 303
- 150000003839 salts Chemical class 0.000 claims description 191
- 239000002904 solvent Substances 0.000 claims description 178
- 239000012453 solvate Substances 0.000 claims description 147
- 238000000634 powder X-ray diffraction Methods 0.000 claims description 139
- 125000000217 alkyl group Chemical group 0.000 claims description 105
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 91
- 125000001072 heteroaryl group Chemical group 0.000 claims description 90
- 125000003118 aryl group Chemical group 0.000 claims description 89
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 68
- 125000003342 alkenyl group Chemical group 0.000 claims description 66
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 claims description 64
- 125000000304 alkynyl group Chemical group 0.000 claims description 63
- 125000004446 heteroarylalkyl group Chemical group 0.000 claims description 63
- 150000004677 hydrates Chemical class 0.000 claims description 62
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 claims description 61
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 57
- 125000004404 heteroalkyl group Chemical group 0.000 claims description 56
- 125000001424 substituent group Chemical group 0.000 claims description 50
- 125000000623 heterocyclic group Chemical group 0.000 claims description 46
- 125000003545 alkoxy group Chemical group 0.000 claims description 44
- 150000002148 esters Chemical class 0.000 claims description 36
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 claims description 35
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 claims description 35
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 34
- 229910019142 PO4 Inorganic materials 0.000 claims description 33
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 33
- 125000003368 amide group Chemical group 0.000 claims description 32
- 239000007788 liquid Substances 0.000 claims description 32
- 239000010452 phosphate Substances 0.000 claims description 32
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 claims description 32
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 claims description 32
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 claims description 31
- 125000002252 acyl group Chemical group 0.000 claims description 31
- 125000004104 aryloxy group Chemical group 0.000 claims description 31
- 239000004202 carbamide Substances 0.000 claims description 31
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 31
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims description 31
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 claims description 30
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 30
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 27
- 238000004519 manufacturing process Methods 0.000 claims description 27
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 22
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 claims description 22
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 claims description 22
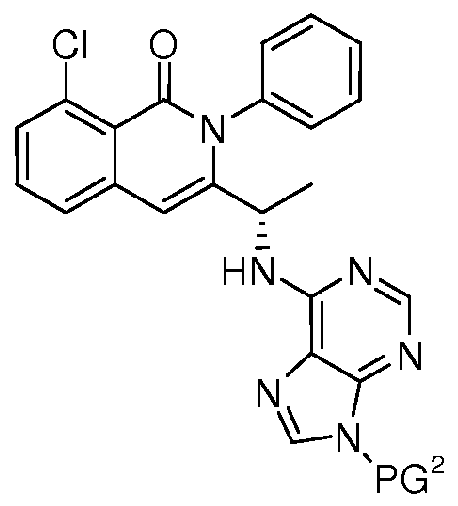
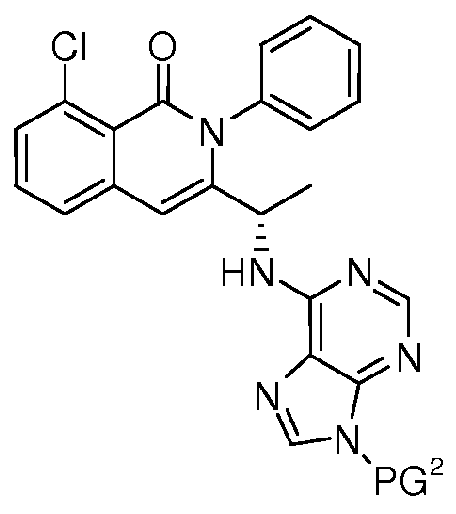
- 125000006239 protecting group Chemical group 0.000 claims description 20
- 125000004423 acyloxy group Chemical group 0.000 claims description 19
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 claims description 18
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 claims description 17
- 108091007960 PI3Ks Proteins 0.000 claims description 16
- 239000003153 chemical reaction reagent Substances 0.000 claims description 16
- 125000000446 sulfanediyl group Chemical group *S* 0.000 claims description 15
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 claims description 14
- 125000000000 cycloalkoxy group Chemical group 0.000 claims description 14
- MGNZXYYWBUKAII-UHFFFAOYSA-N cyclohexa-1,3-diene Chemical compound C1CC=CC=C1 MGNZXYYWBUKAII-UHFFFAOYSA-N 0.000 claims description 14
- 125000005553 heteroaryloxy group Chemical group 0.000 claims description 14
- 125000005844 heterocyclyloxy group Chemical group 0.000 claims description 14
- 229940124530 sulfonamide Drugs 0.000 claims description 14
- 150000003456 sulfonamides Chemical class 0.000 claims description 14
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 claims description 13
- 239000002002 slurry Substances 0.000 claims description 13
- 239000011734 sodium Substances 0.000 claims description 13
- 125000004849 alkoxymethyl group Chemical group 0.000 claims description 11
- 125000006222 dimethylaminomethyl group Chemical group [H]C([H])([H])N(C([H])([H])[H])C([H])([H])* 0.000 claims description 11
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 claims description 11
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 claims description 11
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 11
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical group C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 claims description 11
- 125000000025 triisopropylsilyl group Chemical group C(C)(C)[Si](C(C)C)(C(C)C)* 0.000 claims description 11
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 claims description 10
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 claims description 10
- 239000008101 lactose Substances 0.000 claims description 10
- 229960001375 lactose Drugs 0.000 claims description 10
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 claims description 10
- 229920002472 Starch Polymers 0.000 claims description 9
- 239000008107 starch Substances 0.000 claims description 9
- 235000019698 starch Nutrition 0.000 claims description 9
- 229940032147 starch Drugs 0.000 claims description 9
- CETVQRFGPOGIQJ-UHFFFAOYSA-N lithium;hexane Chemical compound [Li+].CCCCC[CH2-] CETVQRFGPOGIQJ-UHFFFAOYSA-N 0.000 claims description 8
- 229920000168 Microcrystalline cellulose Polymers 0.000 claims description 7
- 239000003814 drug Substances 0.000 claims description 7
- 229940016286 microcrystalline cellulose Drugs 0.000 claims description 7
- 235000019813 microcrystalline cellulose Nutrition 0.000 claims description 7
- 239000008108 microcrystalline cellulose Substances 0.000 claims description 7
- 238000011282 treatment Methods 0.000 claims description 7
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 6
- 229930006000 Sucrose Natural products 0.000 claims description 6
- WXZIKFXSSPSWSR-UHFFFAOYSA-N [Li]CCCCC Chemical compound [Li]CCCCC WXZIKFXSSPSWSR-UHFFFAOYSA-N 0.000 claims description 6
- XMPZTFVPEKAKFH-UHFFFAOYSA-P ceric ammonium nitrate Chemical compound [NH4+].[NH4+].[Ce+4].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O XMPZTFVPEKAKFH-UHFFFAOYSA-P 0.000 claims description 6
- BLHLJVCOVBYQQS-UHFFFAOYSA-N ethyllithium Chemical compound [Li]CC BLHLJVCOVBYQQS-UHFFFAOYSA-N 0.000 claims description 6
- 238000001914 filtration Methods 0.000 claims description 6
- XBEREOHJDYAKDA-UHFFFAOYSA-N lithium;propane Chemical compound [Li+].CC[CH2-] XBEREOHJDYAKDA-UHFFFAOYSA-N 0.000 claims description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 6
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 claims description 6
- 239000005720 sucrose Substances 0.000 claims description 6
- 229960004793 sucrose Drugs 0.000 claims description 6
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 claims description 6
- 206010028980 Neoplasm Diseases 0.000 claims description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 5
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 claims description 5
- 235000019359 magnesium stearate Nutrition 0.000 claims description 5
- 235000019333 sodium laurylsulphate Nutrition 0.000 claims description 5
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 claims description 4
- 201000011510 cancer Diseases 0.000 claims description 4
- 229920000136 polysorbate Polymers 0.000 claims description 4
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 3
- 229930195725 Mannitol Natural products 0.000 claims description 3
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 claims description 3
- 239000001506 calcium phosphate Substances 0.000 claims description 3
- 229960000913 crospovidone Drugs 0.000 claims description 3
- 239000000594 mannitol Substances 0.000 claims description 3
- 235000010355 mannitol Nutrition 0.000 claims description 3
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 claims description 3
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 claims description 3
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 claims description 3
- 235000012239 silicon dioxide Nutrition 0.000 claims description 3
- 239000000454 talc Substances 0.000 claims description 3
- 229910052623 talc Inorganic materials 0.000 claims description 3
- 229940033134 talc Drugs 0.000 claims description 3
- 235000012222 talc Nutrition 0.000 claims description 3
- 208000023275 Autoimmune disease Diseases 0.000 claims description 2
- 229920002785 Croscarmellose sodium Polymers 0.000 claims description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 claims description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 claims description 2
- 235000019739 Dicalciumphosphate Nutrition 0.000 claims description 2
- 235000021355 Stearic acid Nutrition 0.000 claims description 2
- 229960001681 croscarmellose sodium Drugs 0.000 claims description 2
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 claims description 2
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 claims description 2
- 229940038472 dicalcium phosphate Drugs 0.000 claims description 2
- 229910000390 dicalcium phosphate Inorganic materials 0.000 claims description 2
- MVPICKVDHDWCJQ-UHFFFAOYSA-N ethyl 3-pyrrolidin-1-ylpropanoate Chemical compound CCOC(=O)CCN1CCCC1 MVPICKVDHDWCJQ-UHFFFAOYSA-N 0.000 claims description 2
- 208000027866 inflammatory disease Diseases 0.000 claims description 2
- 239000000391 magnesium silicate Substances 0.000 claims description 2
- 229910052919 magnesium silicate Inorganic materials 0.000 claims description 2
- 235000019792 magnesium silicate Nutrition 0.000 claims description 2
- 229960002366 magnesium silicate Drugs 0.000 claims description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 claims description 2
- 229920001983 poloxamer Polymers 0.000 claims description 2
- 239000000377 silicon dioxide Substances 0.000 claims description 2
- 229960001866 silicon dioxide Drugs 0.000 claims description 2
- 229920003109 sodium starch glycolate Polymers 0.000 claims description 2
- 239000008109 sodium starch glycolate Substances 0.000 claims description 2
- 229940079832 sodium starch glycolate Drugs 0.000 claims description 2
- 229940045902 sodium stearyl fumarate Drugs 0.000 claims description 2
- 235000010356 sorbitol Nutrition 0.000 claims description 2
- 239000000600 sorbitol Substances 0.000 claims description 2
- 229960002920 sorbitol Drugs 0.000 claims description 2
- 239000008117 stearic acid Substances 0.000 claims description 2
- 102000010400 1-phosphatidylinositol-3-kinase activity proteins Human genes 0.000 claims 2
- 230000001404 mediated effect Effects 0.000 claims 2
- GUBGYTABKSRVRQ-UHFFFAOYSA-N 2-(hydroxymethyl)-6-[4,5,6-trihydroxy-2-(hydroxymethyl)oxan-3-yl]oxyoxane-3,4,5-triol Chemical compound OCC1OC(OC2C(O)C(O)C(O)OC2CO)C(O)C(O)C1O GUBGYTABKSRVRQ-UHFFFAOYSA-N 0.000 claims 1
- FSBVERYRVPGNGG-UHFFFAOYSA-N dimagnesium dioxido-bis[[oxido(oxo)silyl]oxy]silane hydrate Chemical compound O.[Mg+2].[Mg+2].[O-][Si](=O)O[Si]([O-])([O-])O[Si]([O-])=O FSBVERYRVPGNGG-UHFFFAOYSA-N 0.000 claims 1
- 125000001475 halogen functional group Chemical group 0.000 claims 1
- 229940057948 magnesium stearate Drugs 0.000 claims 1
- 229960001855 mannitol Drugs 0.000 claims 1
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 abstract description 14
- 230000000694 effects Effects 0.000 abstract description 14
- 108091000080 Phosphotransferase Proteins 0.000 abstract description 12
- 102000020233 phosphotransferase Human genes 0.000 abstract description 12
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 abstract description 2
- 229910052799 carbon Inorganic materials 0.000 description 66
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 61
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 59
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 58
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 56
- 125000001188 haloalkyl group Chemical group 0.000 description 51
- 238000002425 crystallisation Methods 0.000 description 49
- 230000008025 crystallization Effects 0.000 description 49
- 125000005842 heteroatom Chemical group 0.000 description 43
- 125000004432 carbon atom Chemical group C* 0.000 description 40
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 39
- 229910052739 hydrogen Inorganic materials 0.000 description 38
- 239000001257 hydrogen Substances 0.000 description 38
- 239000002585 base Substances 0.000 description 34
- 125000005843 halogen group Chemical group 0.000 description 34
- 150000003254 radicals Chemical class 0.000 description 34
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 33
- 125000005885 heterocycloalkylalkyl group Chemical group 0.000 description 32
- 235000021317 phosphate Nutrition 0.000 description 32
- 239000000126 substance Substances 0.000 description 32
- 238000009472 formulation Methods 0.000 description 31
- 235000013877 carbamide Nutrition 0.000 description 30
- 150000002431 hydrogen Chemical class 0.000 description 30
- 239000002253 acid Substances 0.000 description 29
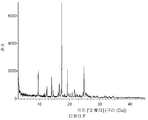
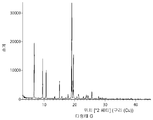
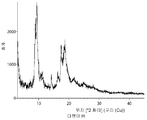
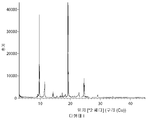
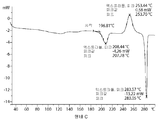
- 238000000113 differential scanning calorimetry Methods 0.000 description 29
- 238000002411 thermogravimetry Methods 0.000 description 29
- 229910052757 nitrogen Inorganic materials 0.000 description 28
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 27
- 238000006243 chemical reaction Methods 0.000 description 25
- 235000019441 ethanol Nutrition 0.000 description 25
- 229940002612 prodrug Drugs 0.000 description 25
- 239000000651 prodrug Substances 0.000 description 25
- 239000000243 solution Substances 0.000 description 25
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 24
- 150000001412 amines Chemical class 0.000 description 24
- 239000003795 chemical substances by application Substances 0.000 description 24
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 23
- 125000006413 ring segment Chemical group 0.000 description 23
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 21
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 21
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 21
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- 239000012296 anti-solvent Substances 0.000 description 20
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 20
- 238000001816 cooling Methods 0.000 description 20
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 20
- 125000004429 atom Chemical group 0.000 description 19
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 19
- 229910052760 oxygen Inorganic materials 0.000 description 19
- 239000001301 oxygen Substances 0.000 description 19
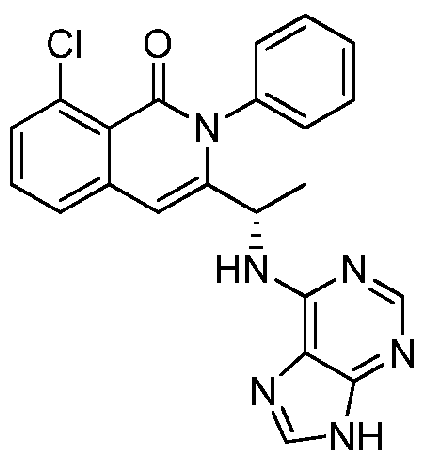
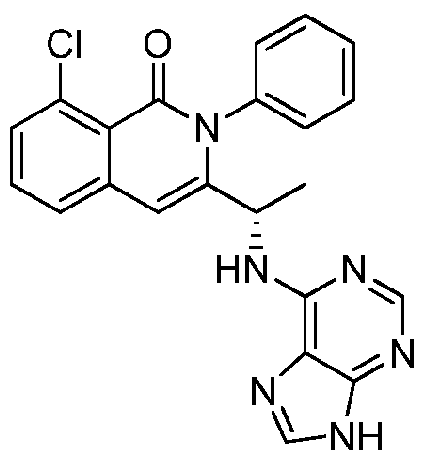
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 18
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 18
- 125000004438 haloalkoxy group Chemical group 0.000 description 18
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 18
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 17
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 17
- 125000004414 alkyl thio group Chemical group 0.000 description 17
- 125000005110 aryl thio group Chemical group 0.000 description 17
- 125000004093 cyano group Chemical group *C#N 0.000 description 17
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 17
- 125000002877 alkyl aryl group Chemical group 0.000 description 16
- 125000005884 carbocyclylalkyl group Chemical group 0.000 description 16
- 239000013078 crystal Substances 0.000 description 16
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 16
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 16
- 125000004043 oxo group Chemical group O=* 0.000 description 16
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 16
- 125000005864 sulfonamidyl group Chemical group 0.000 description 16
- TVPVAGUBJCNUSJ-UHFFFAOYSA-N 1,1-diazidoguanidine Chemical compound [N-]=[N+]=NN(C(=N)N)N=[N+]=[N-] TVPVAGUBJCNUSJ-UHFFFAOYSA-N 0.000 description 15
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 15
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 15
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 15
- 125000004452 carbocyclyl group Chemical group 0.000 description 15
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 15
- ACVYVLVWPXVTIT-UHFFFAOYSA-M phosphinate Chemical compound [O-][PH2]=O ACVYVLVWPXVTIT-UHFFFAOYSA-M 0.000 description 15
- 229910052698 phosphorus Inorganic materials 0.000 description 15
- 239000011574 phosphorus Substances 0.000 description 15
- 238000002360 preparation method Methods 0.000 description 15
- 238000010583 slow cooling Methods 0.000 description 15
- 229910052717 sulfur Inorganic materials 0.000 description 15
- 239000011593 sulfur Substances 0.000 description 15
- 230000004580 weight loss Effects 0.000 description 15
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 14
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 14
- 102000038030 PI3Ks Human genes 0.000 description 14
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 14
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 14
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 14
- 125000004962 sulfoxyl group Chemical group 0.000 description 14
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 14
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 13
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 13
- 239000000463 material Substances 0.000 description 13
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 13
- 108090000623 proteins and genes Proteins 0.000 description 13
- 102000004169 proteins and genes Human genes 0.000 description 13
- 238000003419 tautomerization reaction Methods 0.000 description 13
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 12
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 12
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 12
- 239000003826 tablet Substances 0.000 description 12
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 12
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 11
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 11
- 239000004480 active ingredient Substances 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 11
- 239000002775 capsule Substances 0.000 description 11
- 125000004122 cyclic group Chemical group 0.000 description 11
- 125000001153 fluoro group Chemical group F* 0.000 description 11
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 11
- 230000009471 action Effects 0.000 description 10
- 230000008901 benefit Effects 0.000 description 10
- 125000001309 chloro group Chemical group Cl* 0.000 description 10
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 10
- 125000004433 nitrogen atom Chemical group N* 0.000 description 10
- 238000001556 precipitation Methods 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 10
- 238000001953 recrystallisation Methods 0.000 description 10
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 10
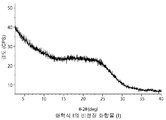
- 238000001757 thermogravimetry curve Methods 0.000 description 10
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 9
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical group O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 9
- 150000007513 acids Chemical class 0.000 description 9
- 150000001408 amides Chemical class 0.000 description 9
- 150000002632 lipids Chemical class 0.000 description 9
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 8
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 8
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 8
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 8
- 150000008064 anhydrides Chemical class 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 8
- 150000002500 ions Chemical class 0.000 description 8
- 229910052744 lithium Inorganic materials 0.000 description 8
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 8
- 229940098779 methanesulfonic acid Drugs 0.000 description 8
- 150000007522 mineralic acids Chemical class 0.000 description 8
- XTEGVFVZDVNBPF-UHFFFAOYSA-N naphthalene-1,5-disulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1S(O)(=O)=O XTEGVFVZDVNBPF-UHFFFAOYSA-N 0.000 description 8
- 238000011084 recovery Methods 0.000 description 8
- 230000019491 signal transduction Effects 0.000 description 8
- 239000000725 suspension Substances 0.000 description 8
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 7
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 7
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 7
- 239000002246 antineoplastic agent Substances 0.000 description 7
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 7
- 210000004027 cell Anatomy 0.000 description 7
- 239000003937 drug carrier Substances 0.000 description 7
- 235000019439 ethyl acetate Nutrition 0.000 description 7
- 239000003921 oil Substances 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- 229910052708 sodium Inorganic materials 0.000 description 7
- 239000007858 starting material Substances 0.000 description 7
- 239000000758 substrate Substances 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 6
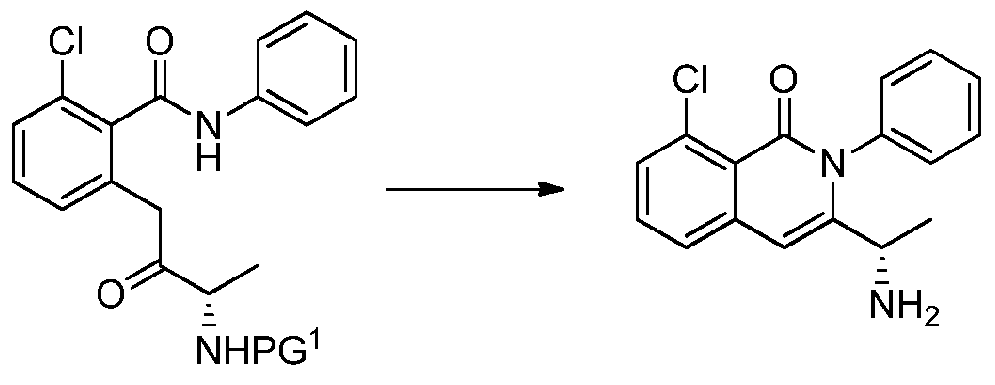
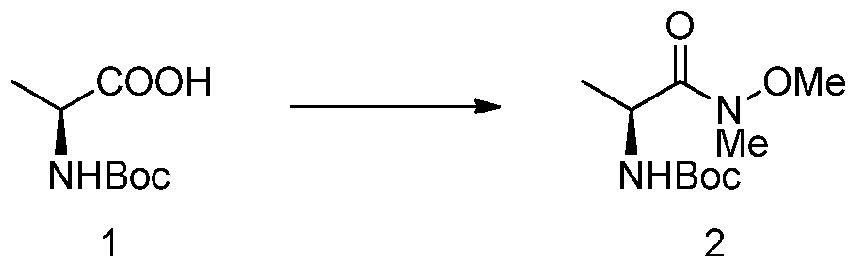
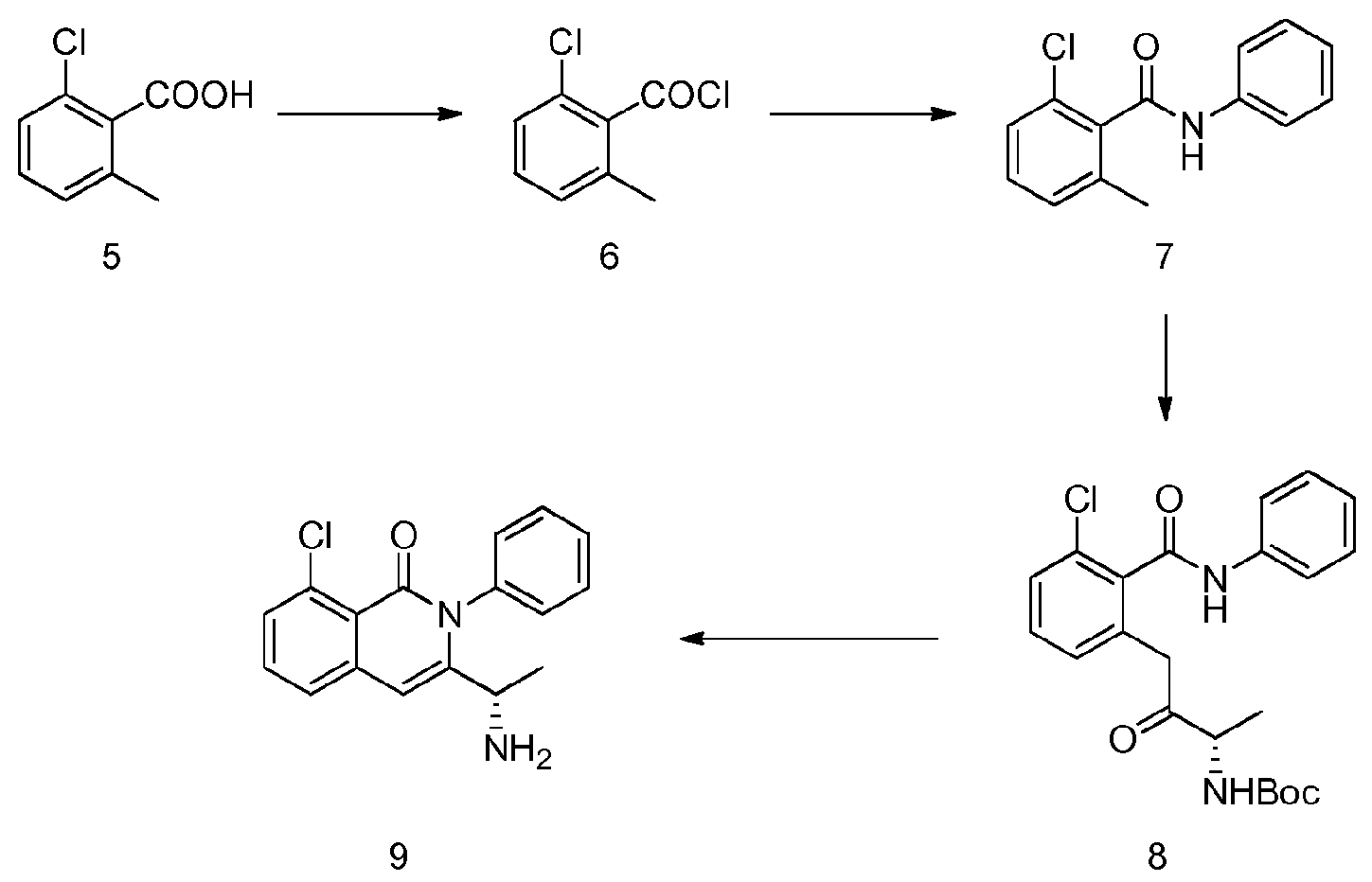
- CPCKYTVKZDZSBA-UHFFFAOYSA-N 2-chloro-6-methyl-n-phenylbenzamide Chemical compound CC1=CC=CC(Cl)=C1C(=O)NC1=CC=CC=C1 CPCKYTVKZDZSBA-UHFFFAOYSA-N 0.000 description 6
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 6
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 6
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 6
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 6
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 6
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 6
- 230000001476 alcoholic effect Effects 0.000 description 6
- BTANRVKWQNVYAZ-UHFFFAOYSA-N butan-2-ol Chemical compound CCC(C)O BTANRVKWQNVYAZ-UHFFFAOYSA-N 0.000 description 6
- 239000011575 calcium Substances 0.000 description 6
- 229910052791 calcium Inorganic materials 0.000 description 6
- 150000001721 carbon Chemical group 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 229960004106 citric acid Drugs 0.000 description 6
- 235000015165 citric acid Nutrition 0.000 description 6
- 238000000576 coating method Methods 0.000 description 6
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 6
- 238000004090 dissolution Methods 0.000 description 6
- 239000007903 gelatin capsule Substances 0.000 description 6
- 239000008187 granular material Substances 0.000 description 6
- 229940093915 gynecological organic acid Drugs 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 239000006193 liquid solution Substances 0.000 description 6
- 239000000314 lubricant Substances 0.000 description 6
- 239000011976 maleic acid Substances 0.000 description 6
- 235000019198 oils Nutrition 0.000 description 6
- 150000007524 organic acids Chemical class 0.000 description 6
- 235000005985 organic acids Nutrition 0.000 description 6
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 6
- 239000011591 potassium Substances 0.000 description 6
- 229910052700 potassium Inorganic materials 0.000 description 6
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 6
- 238000003860 storage Methods 0.000 description 6
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 6
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 6
- ZHGNHOOVYPHPNJ-UHFFFAOYSA-N Amigdalin Chemical compound FC(F)(F)C(=O)OCC1OC(OCC2OC(OC(C#N)C3=CC=CC=C3)C(OC(=O)C(F)(F)F)C(OC(=O)C(F)(F)F)C2OC(=O)C(F)(F)F)C(OC(=O)C(F)(F)F)C(OC(=O)C(F)(F)F)C1OC(=O)C(F)(F)F ZHGNHOOVYPHPNJ-UHFFFAOYSA-N 0.000 description 5
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 5
- 239000012828 PI3K inhibitor Substances 0.000 description 5
- 102000001253 Protein Kinase Human genes 0.000 description 5
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 5
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 5
- 239000013543 active substance Substances 0.000 description 5
- 235000010443 alginic acid Nutrition 0.000 description 5
- 229920000615 alginic acid Polymers 0.000 description 5
- 125000000266 alpha-aminoacyl group Chemical group 0.000 description 5
- 125000003277 amino group Chemical class 0.000 description 5
- 239000005557 antagonist Substances 0.000 description 5
- 239000003125 aqueous solvent Substances 0.000 description 5
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 5
- 239000011230 binding agent Substances 0.000 description 5
- 125000001246 bromo group Chemical group Br* 0.000 description 5
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 5
- 239000007822 coupling agent Substances 0.000 description 5
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 5
- 208000035475 disorder Diseases 0.000 description 5
- 239000000945 filler Substances 0.000 description 5
- 239000001530 fumaric acid Substances 0.000 description 5
- 229960002598 fumaric acid Drugs 0.000 description 5
- 235000011087 fumaric acid Nutrition 0.000 description 5
- 238000005984 hydrogenation reaction Methods 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 5
- 238000001802 infusion Methods 0.000 description 5
- 125000002346 iodo group Chemical group I* 0.000 description 5
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 5
- 125000002950 monocyclic group Chemical group 0.000 description 5
- 230000003287 optical effect Effects 0.000 description 5
- 229940043441 phosphoinositide 3-kinase inhibitor Drugs 0.000 description 5
- 239000006187 pill Substances 0.000 description 5
- 125000003367 polycyclic group Chemical group 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- 108060006633 protein kinase Proteins 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 4
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 4
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 4
- ULQISTXYYBZJSJ-UHFFFAOYSA-N 12-hydroxyoctadecanoic acid Chemical compound CCCCCCC(O)CCCCCCCCCCC(O)=O ULQISTXYYBZJSJ-UHFFFAOYSA-N 0.000 description 4
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 4
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 4
- 108010010803 Gelatin Proteins 0.000 description 4
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 4
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 4
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 4
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 4
- 239000008186 active pharmaceutical agent Substances 0.000 description 4
- 125000003158 alcohol group Chemical group 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 4
- 239000001768 carboxy methyl cellulose Substances 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 239000002178 crystalline material Substances 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 229940126534 drug product Drugs 0.000 description 4
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 4
- 229920000159 gelatin Polymers 0.000 description 4
- 239000008273 gelatin Substances 0.000 description 4
- 229940014259 gelatin Drugs 0.000 description 4
- 235000019322 gelatine Nutrition 0.000 description 4
- 235000011852 gelatine desserts Nutrition 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 239000000543 intermediate Substances 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 239000011777 magnesium Substances 0.000 description 4
- 229910052749 magnesium Inorganic materials 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 4
- 229910017604 nitric acid Inorganic materials 0.000 description 4
- 150000007530 organic bases Chemical class 0.000 description 4
- 239000003960 organic solvent Substances 0.000 description 4
- 235000006408 oxalic acid Nutrition 0.000 description 4
- 239000007800 oxidant agent Substances 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 239000000825 pharmaceutical preparation Substances 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 238000007711 solidification Methods 0.000 description 4
- 230000008023 solidification Effects 0.000 description 4
- 229960001367 tartaric acid Drugs 0.000 description 4
- 239000011975 tartaric acid Substances 0.000 description 4
- 235000002906 tartaric acid Nutrition 0.000 description 4
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 4
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 4
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 3
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 3
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 3
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 3
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 3
- CEFMMQYDPGCYMG-UHFFFAOYSA-N 2-chloro-6-methylbenzoic acid Chemical compound CC1=CC=CC(Cl)=C1C(O)=O CEFMMQYDPGCYMG-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 239000005711 Benzoic acid Substances 0.000 description 3
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 3
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 3
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 240000008168 Ficus benjamina Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 150000001204 N-oxides Chemical class 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 3
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 3
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 3
- 235000010233 benzoic acid Nutrition 0.000 description 3
- 229960004365 benzoic acid Drugs 0.000 description 3
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 3
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 3
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 3
- 229940105329 carboxymethylcellulose Drugs 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 235000013985 cinnamic acid Nutrition 0.000 description 3
- 229930016911 cinnamic acid Natural products 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 3
- 239000002270 dispersing agent Substances 0.000 description 3
- 229940088679 drug related substance Drugs 0.000 description 3
- 150000002081 enamines Chemical class 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 239000012458 free base Substances 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 230000014509 gene expression Effects 0.000 description 3
- 238000010438 heat treatment Methods 0.000 description 3
- 150000003949 imides Chemical class 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 3
- 239000003701 inert diluent Substances 0.000 description 3
- 239000004615 ingredient Substances 0.000 description 3
- 150000007529 inorganic bases Chemical class 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 239000003456 ion exchange resin Substances 0.000 description 3
- 229920003303 ion-exchange polymer Polymers 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 159000000003 magnesium salts Chemical class 0.000 description 3
- 229960002510 mandelic acid Drugs 0.000 description 3
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 3
- 238000000048 melt cooling Methods 0.000 description 3
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 3
- 125000006574 non-aromatic ring group Chemical group 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 3
- 150000003141 primary amines Chemical class 0.000 description 3
- 235000019260 propionic acid Nutrition 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 229940107700 pyruvic acid Drugs 0.000 description 3
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 3
- 230000005855 radiation Effects 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 229960004889 salicylic acid Drugs 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 150000003462 sulfoxides Chemical class 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 125000003396 thiol group Chemical group [H]S* 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 3
- 239000000080 wetting agent Substances 0.000 description 3
- 229910052725 zinc Inorganic materials 0.000 description 3
- 239000011701 zinc Substances 0.000 description 3
- GNLJBJNONOOOQC-UHFFFAOYSA-N $l^{3}-carbane;magnesium Chemical compound [Mg]C GNLJBJNONOOOQC-UHFFFAOYSA-N 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 2
- 125000005869 (methoxyethoxy)methanyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])OC([H])([H])* 0.000 description 2
- 125000005867 (methoxymethoxy)ethanyl group Chemical group [H]C([H])([H])OC([H])([H])OC([H])([H])C([H])([H])* 0.000 description 2
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- 229940114072 12-hydroxystearic acid Drugs 0.000 description 2
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 2
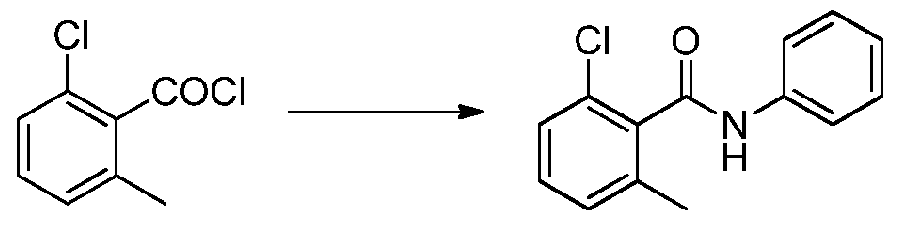
- NPRWNQSMJBAKCL-UHFFFAOYSA-N 2-chloro-6-methylbenzoyl chloride Chemical compound CC1=CC=CC(Cl)=C1C(Cl)=O NPRWNQSMJBAKCL-UHFFFAOYSA-N 0.000 description 2
- MSXVEPNJUHWQHW-UHFFFAOYSA-N 2-methylbutan-2-ol Chemical compound CCC(C)(C)O MSXVEPNJUHWQHW-UHFFFAOYSA-N 0.000 description 2
- GCNTZFIIOFTKIY-UHFFFAOYSA-N 4-hydroxypyridine Chemical compound OC1=CC=NC=C1 GCNTZFIIOFTKIY-UHFFFAOYSA-N 0.000 description 2
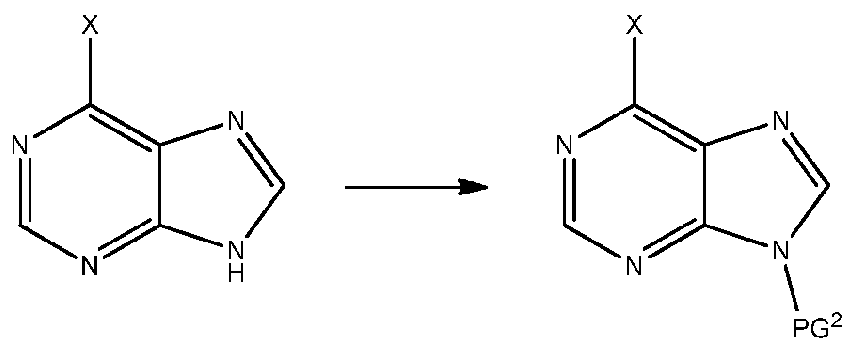
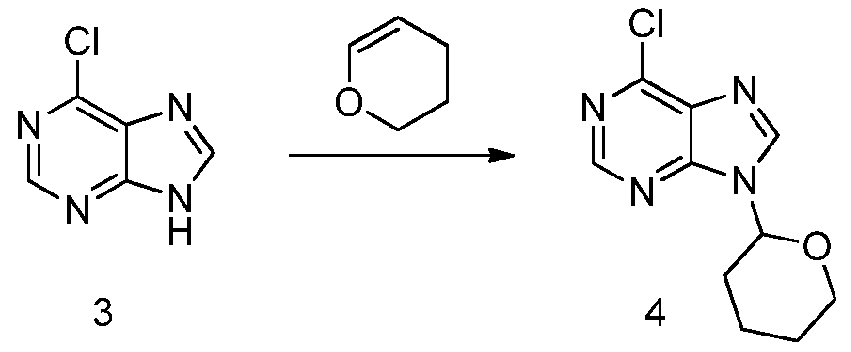
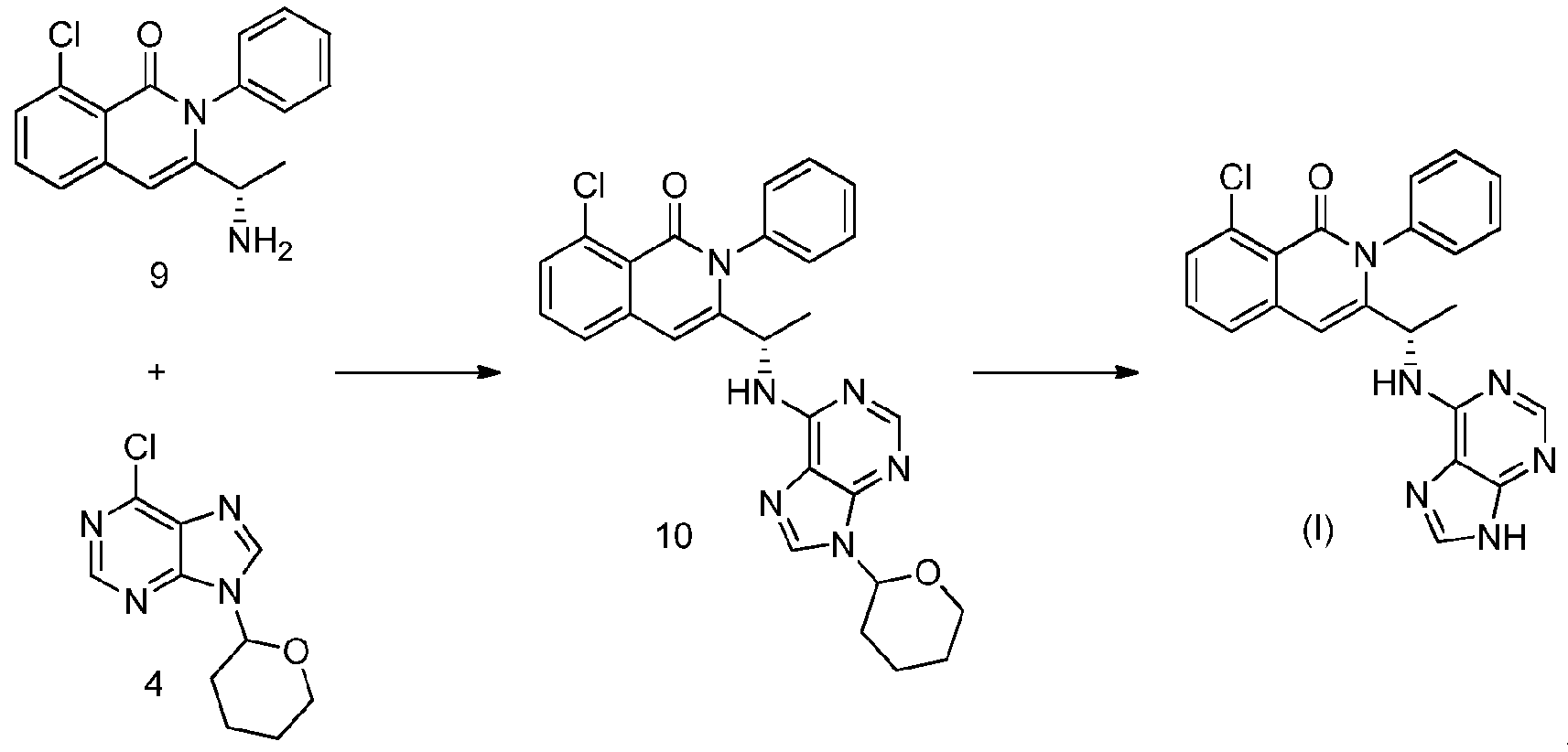
- QSTASPNCKDPSAH-UHFFFAOYSA-N 6-chloro-9-(oxan-2-yl)purine Chemical compound C1=NC=2C(Cl)=NC=NC=2N1C1CCCCO1 QSTASPNCKDPSAH-UHFFFAOYSA-N 0.000 description 2
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- PDBXHPORMXSXKO-UHFFFAOYSA-N 8-benzyl-7-[2-[ethyl(2-hydroxyethyl)amino]ethyl]-1,3-dimethylpurine-2,6-dione;hydron;chloride Chemical class Cl.N=1C=2N(C)C(=O)N(C)C(=O)C=2N(CCN(CCO)CC)C=1CC1=CC=CC=C1 PDBXHPORMXSXKO-UHFFFAOYSA-N 0.000 description 2
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 2
- 208000004476 Acute Coronary Syndrome Diseases 0.000 description 2
- 241000272517 Anseriformes Species 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 2
- 108091006146 Channels Proteins 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 229920000858 Cyclodextrin Polymers 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical group [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 2
- 239000007821 HATU Substances 0.000 description 2
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 2
- 240000007472 Leucaena leucocephala Species 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 241000286209 Phasianidae Species 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 2
- 239000012317 TBTU Substances 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical group [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 238000002441 X-ray diffraction Methods 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- ADSXDBCZNVXTRD-UHFFFAOYSA-N [Mg]C1=CC=CC=C1 Chemical compound [Mg]C1=CC=CC=C1 ADSXDBCZNVXTRD-UHFFFAOYSA-N 0.000 description 2
- CLZISMQKJZCZDN-UHFFFAOYSA-N [benzotriazol-1-yloxy(dimethylamino)methylidene]-dimethylazanium Chemical compound C1=CC=C2N(OC(N(C)C)=[N+](C)C)N=NC2=C1 CLZISMQKJZCZDN-UHFFFAOYSA-N 0.000 description 2
- YRKCREAYFQTBPV-UHFFFAOYSA-N acetylacetone Chemical compound CC(=O)CC(C)=O YRKCREAYFQTBPV-UHFFFAOYSA-N 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 150000001266 acyl halides Chemical class 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 229940072056 alginate Drugs 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 150000001335 aliphatic alkanes Chemical class 0.000 description 2
- 150000001336 alkenes Chemical class 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000000844 anti-bacterial effect Effects 0.000 description 2
- 229940121375 antifungal agent Drugs 0.000 description 2
- 239000003429 antifungal agent Substances 0.000 description 2
- 238000011914 asymmetric synthesis Methods 0.000 description 2
- 150000001540 azides Chemical class 0.000 description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000002619 bicyclic group Chemical group 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 2
- 125000002837 carbocyclic group Chemical group 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 230000012292 cell migration Effects 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 239000013522 chelant Substances 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 238000011260 co-administration Methods 0.000 description 2
- 239000000306 component Substances 0.000 description 2
- 229940125904 compound 1 Drugs 0.000 description 2
- 229940125773 compound 10 Drugs 0.000 description 2
- 229940125782 compound 2 Drugs 0.000 description 2
- 229940126214 compound 3 Drugs 0.000 description 2
- 229940125898 compound 5 Drugs 0.000 description 2
- 229940125890 compound Ia Drugs 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- NNBZCPXTIHJBJL-UHFFFAOYSA-N decalin Chemical compound C1CCCC2CCCCC21 NNBZCPXTIHJBJL-UHFFFAOYSA-N 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- VILAVOFMIJHSJA-UHFFFAOYSA-N dicarbon monoxide Chemical compound [C]=C=O VILAVOFMIJHSJA-UHFFFAOYSA-N 0.000 description 2
- 238000001938 differential scanning calorimetry curve Methods 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 2
- 229940043264 dodecyl sulfate Drugs 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000008298 dragée Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 239000002702 enteric coating Substances 0.000 description 2
- 238000009505 enteric coating Methods 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 229940083124 ganglion-blocking antiadrenergic secondary and tertiary amines Drugs 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 238000001030 gas--liquid chromatography Methods 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 238000011194 good manufacturing practice Methods 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- 238000000227 grinding Methods 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 150000003840 hydrochlorides Chemical class 0.000 description 2
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 238000000099 in vitro assay Methods 0.000 description 2
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 2
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 2
- 229940116298 l- malic acid Drugs 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- FEWJPZIEWOKRBE-LWMBPPNESA-N levotartaric acid Chemical compound OC(=O)[C@@H](O)[C@H](O)C(O)=O FEWJPZIEWOKRBE-LWMBPPNESA-N 0.000 description 2
- 238000004811 liquid chromatography Methods 0.000 description 2
- IUYHWZFSGMZEOG-UHFFFAOYSA-M magnesium;propane;chloride Chemical compound [Mg+2].[Cl-].C[CH-]C IUYHWZFSGMZEOG-UHFFFAOYSA-M 0.000 description 2
- 229940098895 maleic acid Drugs 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 238000003801 milling Methods 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 2
- 238000000465 moulding Methods 0.000 description 2
- KRKPYFLIYNGWTE-UHFFFAOYSA-N n,o-dimethylhydroxylamine Chemical compound CNOC KRKPYFLIYNGWTE-UHFFFAOYSA-N 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 125000002734 organomagnesium group Chemical group 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 125000000466 oxiranyl group Chemical group 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- 238000003921 particle size analysis Methods 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 229950008882 polysorbate Drugs 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000007493 shaping process Methods 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 239000011343 solid material Substances 0.000 description 2
- 239000008247 solid mixture Substances 0.000 description 2
- 238000000935 solvent evaporation Methods 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 239000008227 sterile water for injection Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000000859 sublimation Methods 0.000 description 2
- 230000008022 sublimation Effects 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 125000005420 sulfonamido group Chemical group S(=O)(=O)(N*)* 0.000 description 2
- 229940032330 sulfuric acid Drugs 0.000 description 2
- 229960003080 taurine Drugs 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- 238000010626 work up procedure Methods 0.000 description 2
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 description 1
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 1
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 description 1
- 125000005859 (C1-C6)alkanoyloxymethyl group Chemical group 0.000 description 1
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 description 1
- 125000005845 (C2-C12)alkanoyloxymethyl group Chemical group 0.000 description 1
- 125000006729 (C2-C5) alkenyl group Chemical group 0.000 description 1
- 125000006730 (C2-C5) alkynyl group Chemical group 0.000 description 1
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 1
- PMJHHCWVYXUKFD-SNAWJCMRSA-N (E)-1,3-pentadiene Chemical compound C\C=C\C=C PMJHHCWVYXUKFD-SNAWJCMRSA-N 0.000 description 1
- 125000005868 (methoxymethoxy)methanyl group Chemical group [H]C([H])([H])OC([H])([H])OC([H])([H])* 0.000 description 1
- MHCVCKDNQYMGEX-UHFFFAOYSA-N 1,1'-biphenyl;phenoxybenzene Chemical group C1=CC=CC=C1C1=CC=CC=C1.C=1C=CC=CC=1OC1=CC=CC=C1 MHCVCKDNQYMGEX-UHFFFAOYSA-N 0.000 description 1
- GLUABPSZMHYCNO-UHFFFAOYSA-N 1,2,3,3a,4,5,6,6a-octahydropyrrolo[3,2-b]pyrrole Chemical compound N1CCC2NCCC21 GLUABPSZMHYCNO-UHFFFAOYSA-N 0.000 description 1
- 125000005904 1,2,3,4-tetrahydro-1,6-naphthyridinyl group Chemical group 0.000 description 1
- 125000005871 1,3-benzodioxolyl group Chemical group 0.000 description 1
- 125000005877 1,4-benzodioxanyl group Chemical group 0.000 description 1
- 125000005860 1-((C1-C6)alkanoyloxy)ethyl group Chemical group 0.000 description 1
- 125000005851 1-(N-(alkoxycarbonyl)amino)ethyl group Chemical group 0.000 description 1
- 125000005846 1-(alkanoyloxy)ethyl group Chemical group 0.000 description 1
- 125000005848 1-(alkoxycarbonyloxy)ethyl group Chemical group 0.000 description 1
- 102000001556 1-Phosphatidylinositol 4-Kinase Human genes 0.000 description 1
- 125000005847 1-methyl-1-(alkanoyloxy)-ethyl group Chemical group 0.000 description 1
- 125000005849 1-methyl-1-(alkoxycarbonyloxy)ethyl group Chemical group 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000005894 1H-benzo[e][1,4]diazepinyl group Chemical group 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- 125000005900 2,3-dihydrofuro[2,3-b]pyridinyl group Chemical group 0.000 description 1
- JBMBVWROWJGFMG-UHFFFAOYSA-N 2-chloro-7h-purine Chemical compound ClC1=NC=C2NC=NC2=N1 JBMBVWROWJGFMG-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- 125000003229 2-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000005916 2-methylpentyl group Chemical group 0.000 description 1
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 1
- 229940080296 2-naphthalenesulfonate Drugs 0.000 description 1
- ZSLUVFAKFWKJRC-IGMARMGPSA-N 232Th Chemical compound [232Th] ZSLUVFAKFWKJRC-IGMARMGPSA-N 0.000 description 1
- 125000004080 3-carboxypropanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C(O[H])=O 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- 125000003469 3-methylhexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005917 3-methylpentyl group Chemical group 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-M 3-phenylpropionate Chemical compound [O-]C(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-M 0.000 description 1
- 125000005901 4,5,6,7-tetrahydro-1H-pyrrolo[2,3-b]pyridinyl group Chemical group 0.000 description 1
- 125000005902 4,5,6,7-tetrahydrofuro[3,2-c]pyridinyl group Chemical group 0.000 description 1
- 125000005903 4,5,6,7-tetrahydrothieno[3,2-b]pyridinyl group Chemical group 0.000 description 1
- MBVFRSJFKMJRHA-UHFFFAOYSA-N 4-fluoro-1-benzofuran-7-carbaldehyde Chemical compound FC1=CC=C(C=O)C2=C1C=CO2 MBVFRSJFKMJRHA-UHFFFAOYSA-N 0.000 description 1
- POILWHVDKZOXJZ-UHFFFAOYSA-N 4-hydroxypent-3-en-2-one Chemical compound CC(O)=CC(C)=O POILWHVDKZOXJZ-UHFFFAOYSA-N 0.000 description 1
- AWXUIFLUJGSDHB-UHFFFAOYSA-N 5,6-dihydrobenzo[h]cinnoline Chemical compound C1=CC=C2CCC3=CC=NN=C3C2=C1 AWXUIFLUJGSDHB-UHFFFAOYSA-N 0.000 description 1
- 125000005898 5,7-dihydro-4H-thieno[2,3-c]pyranyl group Chemical group 0.000 description 1
- 125000005897 6,7-dihydro-5H-furo[3,2-b]pyranyl group Chemical group 0.000 description 1
- ZKBQDFAWXLTYKS-UHFFFAOYSA-N 6-Chloro-1H-purine Chemical compound ClC1=NC=NC2=C1NC=N2 ZKBQDFAWXLTYKS-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 240000000662 Anethum graveolens Species 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- 125000006374 C2-C10 alkenyl group Chemical group 0.000 description 1
- 125000005865 C2-C10alkynyl group Chemical group 0.000 description 1
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 1
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 description 1
- GJSHVRGCRNGDOR-UHFFFAOYSA-N C=CC=C.C1CCCCCC1 Chemical compound C=CC=C.C1CCCCCC1 GJSHVRGCRNGDOR-UHFFFAOYSA-N 0.000 description 1
- FLAKGKCBSLMHQU-UHFFFAOYSA-N CC[Mg] Chemical compound CC[Mg] FLAKGKCBSLMHQU-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 108091007958 Class I PI3Ks Proteins 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- 206010012442 Dermatitis contact Diseases 0.000 description 1
- 108010062677 Diacylglycerol Kinase Proteins 0.000 description 1
- 102000011107 Diacylglycerol Kinase Human genes 0.000 description 1
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical compound C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 1
- 102000001301 EGF receptor Human genes 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 1
- 238000001157 Fourier transform infrared spectrum Methods 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 102000013446 GTP Phosphohydrolases Human genes 0.000 description 1
- 108091006109 GTPases Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 239000007818 Grignard reagent Substances 0.000 description 1
- 229920002907 Guar gum Polymers 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000600756 Homo sapiens 3-phosphoinositide-dependent protein kinase 1 Proteins 0.000 description 1
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 1
- 101001117146 Homo sapiens [Pyruvate dehydrogenase (acetyl-transferring)] kinase isozyme 1, mitochondrial Proteins 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 229930194542 Keto Natural products 0.000 description 1
- 150000008575 L-amino acids Chemical class 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 241000282567 Macaca fascicularis Species 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- 102000009308 Mechanistic Target of Rapamycin Complex 2 Human genes 0.000 description 1
- 108010034057 Mechanistic Target of Rapamycin Complex 2 Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- LSDPWZHWYPCBBB-UHFFFAOYSA-N Methanethiol Chemical compound SC LSDPWZHWYPCBBB-UHFFFAOYSA-N 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- 101100268648 Mus musculus Abl1 gene Proteins 0.000 description 1
- 125000005855 N,N-di(C1-C2)alkylcarbamoyl-(C1-C2)alkyl group Chemical group 0.000 description 1
- 125000005850 N-(alkoxycarbonyl)aminomethyl group Chemical group 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N Nitrogen dioxide Chemical compound O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 1
- 125000005861 N—(C1-C6)alkoxycarbonylaminomethyl group Chemical group 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108091008606 PDGF receptors Proteins 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102100038332 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform Human genes 0.000 description 1
- 102100036061 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit beta isoform Human genes 0.000 description 1
- 102100036056 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit delta isoform Human genes 0.000 description 1
- 102100036052 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit gamma isoform Human genes 0.000 description 1
- 101710115400 Phosphatidylinositol 4-kinase LSB6 Proteins 0.000 description 1
- 101710140706 Phosphatidylinositol 4-kinase PIK1 Proteins 0.000 description 1
- 101710185028 Phosphatidylinositol 4-kinase stt4 Proteins 0.000 description 1
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 238000001069 Raman spectroscopy Methods 0.000 description 1
- 238000001237 Raman spectrum Methods 0.000 description 1
- 108091078243 Rho family Proteins 0.000 description 1
- 102000042463 Rho family Human genes 0.000 description 1
- 101150001535 SRC gene Proteins 0.000 description 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- SSZBUIDZHHWXNJ-UHFFFAOYSA-N Stearinsaeure-hexadecylester Natural products CCCCCCCCCCCCCCCCCC(=O)OCCCCCCCCCCCCCCCC SSZBUIDZHHWXNJ-UHFFFAOYSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- RAHZWNYVWXNFOC-UHFFFAOYSA-N Sulphur dioxide Chemical compound O=S=O RAHZWNYVWXNFOC-UHFFFAOYSA-N 0.000 description 1
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- 229910052776 Thorium Inorganic materials 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- IEKGDINDKNPCJC-UHFFFAOYSA-N [1-[methoxy(methyl)amino]-1-oxopropan-2-yl] carbamate Chemical compound C(N)(OC(C(=O)N(C)OC)C)=O IEKGDINDKNPCJC-UHFFFAOYSA-N 0.000 description 1
- PNDPGZBMCMUPRI-XXSWNUTMSA-N [125I][125I] Chemical compound [125I][125I] PNDPGZBMCMUPRI-XXSWNUTMSA-N 0.000 description 1
- JSTADIGKFYFAIY-GJNDDOAHSA-K [2-[bis[[hydroxy(oxido)phosphoryl]methyl]amino]ethyl-(phosphonomethyl)amino]methyl-hydroxyphosphinate;samarium-153(3+) Chemical compound [H+].[H+].[H+].[H+].[H+].[153Sm+3].[O-]P([O-])(=O)CN(CP([O-])([O-])=O)CCN(CP([O-])([O-])=O)CP([O-])([O-])=O JSTADIGKFYFAIY-GJNDDOAHSA-K 0.000 description 1
- VGUWRYCAHYUCNH-UHFFFAOYSA-N [Mg]CC1CCCCC1 Chemical compound [Mg]CC1CCCCC1 VGUWRYCAHYUCNH-UHFFFAOYSA-N 0.000 description 1
- 102100024148 [Pyruvate dehydrogenase (acetyl-transferring)] kinase isozyme 1, mitochondrial Human genes 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000003655 absorption accelerator Substances 0.000 description 1
- 239000003070 absorption delaying agent Substances 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 229910052767 actinium Inorganic materials 0.000 description 1
- QQINRWTZWGJFDB-UHFFFAOYSA-N actinium atom Chemical compound [Ac] QQINRWTZWGJFDB-UHFFFAOYSA-N 0.000 description 1
- 239000012042 active reagent Substances 0.000 description 1
- 238000011374 additional therapy Methods 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000005206 alkoxycarbonyloxymethyl group Chemical group 0.000 description 1
- 125000000278 alkyl amino alkyl group Chemical group 0.000 description 1
- 150000008055 alkyl aryl sulfonates Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 208000002029 allergic contact dermatitis Diseases 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- LBDSXVIYZYSRII-IGMARMGPSA-N alpha-particle Chemical compound [4He+2] LBDSXVIYZYSRII-IGMARMGPSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 230000002362 anti-crystal effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 229940027983 antiseptic and disinfectant quaternary ammonium compound Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 125000005251 aryl acyl group Chemical group 0.000 description 1
- 125000005018 aryl alkenyl group Chemical group 0.000 description 1
- 125000005015 aryl alkynyl group Chemical group 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 230000035578 autophosphorylation Effects 0.000 description 1
- 125000003725 azepanyl group Chemical group 0.000 description 1
- 125000002785 azepinyl group Chemical group 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000004069 aziridinyl group Chemical group 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 150000003936 benzamides Chemical class 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000005870 benzindolyl group Chemical group 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 125000005875 benzo[b][1,4]dioxepinyl group Chemical group 0.000 description 1
- 125000005876 benzo[b][1,4]oxazinyl group Chemical group 0.000 description 1
- 125000005873 benzo[d]thiazolyl group Chemical group 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 125000005878 benzonaphthofuranyl group Chemical group 0.000 description 1
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N beta-phenylpropanoic acid Natural products OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- 125000002618 bicyclic heterocycle group Chemical group 0.000 description 1
- BVCRERJDOOBZOH-UHFFFAOYSA-N bicyclo[2.2.1]heptanyl Chemical group C1C[C+]2CC[C-]1C2 BVCRERJDOOBZOH-UHFFFAOYSA-N 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- FATUQANACHZLRT-KMRXSBRUSA-L calcium glucoheptonate Chemical compound [Ca+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O FATUQANACHZLRT-KMRXSBRUSA-L 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 239000007963 capsule composition Substances 0.000 description 1
- 125000003739 carbamimidoyl group Chemical group C(N)(=N)* 0.000 description 1
- 150000001722 carbon compounds Chemical class 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 1
- 229920003123 carboxymethyl cellulose sodium Polymers 0.000 description 1
- 229940084030 carboxymethylcellulose calcium Drugs 0.000 description 1
- 229940063834 carboxymethylcellulose sodium Drugs 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 229910052729 chemical element Inorganic materials 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000012069 chiral reagent Substances 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 229940121657 clinical drug Drugs 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000007891 compressed tablet Substances 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- CHVJITGCYZJHLR-UHFFFAOYSA-N cyclohepta-1,3,5-triene Chemical compound C1C=CC=CC=C1 CHVJITGCYZJHLR-UHFFFAOYSA-N 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 125000005892 decahydro-1,8-naphthyridinyl group Chemical group 0.000 description 1
- 125000004652 decahydroisoquinolinyl group Chemical group C1(NCCC2CCCCC12)* 0.000 description 1
- 125000005891 decahydronaphthyridinyl group Chemical group 0.000 description 1
- 125000004856 decahydroquinolinyl group Chemical group N1(CCCC2CCCCC12)* 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000004807 desolvation Methods 0.000 description 1
- 125000005852 di-N,N—(C1-C2)alkylamino(C2-C3)alkyl group Chemical group 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 125000005509 dibenzothiophenyl group Chemical group 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- 125000000723 dihydrobenzofuranyl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 description 1
- 125000004582 dihydrobenzothienyl group Chemical group S1C(CC2=C1C=CC=C2)* 0.000 description 1
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 description 1
- 125000004655 dihydropyridinyl group Chemical group N1(CC=CC=C1)* 0.000 description 1
- 125000005057 dihydrothienyl group Chemical group S1C(CC=C1)* 0.000 description 1
- 229940113088 dimethylacetamide Drugs 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 125000005411 dithiolanyl group Chemical group S1SC(CC1)* 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-M dodecanoate Chemical compound CCCCCCCCCCCC([O-])=O POULHZVOKOAJMA-UHFFFAOYSA-M 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 238000002003 electron diffraction Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 150000002085 enols Chemical class 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 150000002170 ethers Chemical group 0.000 description 1
- 125000005745 ethoxymethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])* 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000004428 fluoroalkoxy group Chemical group 0.000 description 1
- 125000003709 fluoroalkyl group Chemical group 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 125000003844 furanonyl group Chemical group 0.000 description 1
- 125000003838 furazanyl group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 125000003147 glycosyl group Chemical group 0.000 description 1
- 239000003979 granulating agent Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 235000010417 guar gum Nutrition 0.000 description 1
- 239000000665 guar gum Substances 0.000 description 1
- 229960002154 guar gum Drugs 0.000 description 1
- 125000000262 haloalkenyl group Chemical group 0.000 description 1
- 125000000232 haloalkynyl group Chemical group 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 235000015220 hamburgers Nutrition 0.000 description 1
- IXCSERBJSXMMFS-UHFFFAOYSA-N hcl hcl Chemical compound Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 1
- 150000002373 hemiacetals Chemical group 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004366 heterocycloalkenyl group Chemical group 0.000 description 1
- 239000008241 heterogeneous mixture Substances 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 125000001841 imino group Chemical group [H]N=* 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000001965 increasing effect Effects 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000010189 intracellular transport Effects 0.000 description 1
- 229940044173 iodine-125 Drugs 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 description 1
- 229940011051 isopropyl acetate Drugs 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- GWYFCOCPABKNJV-UHFFFAOYSA-M isovalerate Chemical compound CC(C)CC([O-])=O GWYFCOCPABKNJV-UHFFFAOYSA-M 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 150000003951 lactams Chemical class 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229940099584 lactobionate Drugs 0.000 description 1
- JYTUSYBCFIZPBE-AMTLMPIISA-M lactobionate Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O JYTUSYBCFIZPBE-AMTLMPIISA-M 0.000 description 1
- 229940070765 laurate Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000012669 liquid formulation Substances 0.000 description 1
- 238000000786 liquid-assisted grinding Methods 0.000 description 1
- HCWCAKKEBCNQJP-UHFFFAOYSA-N magnesium orthosilicate Chemical compound [Mg+2].[Mg+2].[O-][Si]([O-])([O-])[O-] HCWCAKKEBCNQJP-UHFFFAOYSA-N 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- FJQXCDYVZAHXNS-UHFFFAOYSA-N methadone hydrochloride Chemical compound Cl.C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 FJQXCDYVZAHXNS-UHFFFAOYSA-N 0.000 description 1
- 125000005866 methoxyethanyl group Chemical group 0.000 description 1
- GJDICGOCZGRDFM-LURJTMIESA-N methyl (2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoate Chemical compound COC(=O)[C@H](C)NC(=O)OC(C)(C)C GJDICGOCZGRDFM-LURJTMIESA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 239000007932 molded tablet Substances 0.000 description 1
- 125000005858 morpholino(C2-C3)alkyl group Chemical group 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-M naphthalene-2-sulfonate Chemical compound C1=CC=CC2=CC(S(=O)(=O)[O-])=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-M 0.000 description 1
- 125000005893 naphthalimidyl group Chemical group 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- OIPZNTLJVJGRCI-UHFFFAOYSA-M octadecanoyloxyaluminum;dihydrate Chemical compound O.O.CCCCCCCCCCCCCCCCCC(=O)O[Al] OIPZNTLJVJGRCI-UHFFFAOYSA-M 0.000 description 1
- 125000005889 octahydrochromenyl group Chemical group 0.000 description 1
- 125000005890 octahydroisochromenyl group Chemical group 0.000 description 1
- UZGLIIJVICEWHF-UHFFFAOYSA-N octogen Chemical compound [O-][N+](=O)N1CN([N+]([O-])=O)CN([N+]([O-])=O)CN([N+]([O-])=O)C1 UZGLIIJVICEWHF-UHFFFAOYSA-N 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229940049964 oleate Drugs 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 150000002895 organic esters Chemical class 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 125000005882 oxadiazolinyl group Chemical group 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000005880 oxathiolanyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003551 oxepanyl group Chemical group 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 229940021222 peritoneal dialysis isotonic solution Drugs 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- 150000003905 phosphatidylinositols Chemical class 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000000865 phosphorylative effect Effects 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 125000005545 phthalimidyl group Chemical group 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 229940075930 picrate Drugs 0.000 description 1
- OXNIZHLAWKMVMX-UHFFFAOYSA-M picrate anion Chemical compound [O-]C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O OXNIZHLAWKMVMX-UHFFFAOYSA-M 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000005856 piperidino(C2-C3)alkyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-M pivalate Chemical compound CC(C)(C)C([O-])=O IUGYQRQAERSCNH-UHFFFAOYSA-M 0.000 description 1
- 229950010765 pivalate Drugs 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000005857 pyrrolidino(C2-C3)alkyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 230000006340 racemization Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- VMXUWOKSQNHOCA-LCYFTJDESA-N ranitidine Chemical compound [O-][N+](=O)/C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 VMXUWOKSQNHOCA-LCYFTJDESA-N 0.000 description 1
- 229960000620 ranitidine Drugs 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 239000012925 reference material Substances 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 238000007790 scraping Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 230000008054 signal transmission Effects 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 238000004467 single crystal X-ray diffraction Methods 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- AWUCVROLDVIAJX-GSVOUGTGSA-N sn-glycerol 3-phosphate Chemical compound OC[C@@H](O)COP(O)(O)=O AWUCVROLDVIAJX-GSVOUGTGSA-N 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- KYITYFHKDODNCQ-UHFFFAOYSA-M sodium;2-oxo-3-(3-oxo-1-phenylbutyl)chromen-4-olate Chemical compound [Na+].[O-]C=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 KYITYFHKDODNCQ-UHFFFAOYSA-M 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 108010035597 sphingosine kinase Proteins 0.000 description 1
- 238000001694 spray drying Methods 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- CIOAGBVUUVVLOB-OUBTZVSYSA-N strontium-89 Chemical compound [89Sr] CIOAGBVUUVVLOB-OUBTZVSYSA-N 0.000 description 1
- 229940006509 strontium-89 Drugs 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical compound [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- PWQIGBOSLQHOBT-ZETCQYMHSA-N tert-butyl n-[(2s)-1-[methoxy(methyl)amino]-1-oxopropan-2-yl]carbamate Chemical group CON(C)C(=O)[C@H](C)NC(=O)OC(C)(C)C PWQIGBOSLQHOBT-ZETCQYMHSA-N 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- NYBWUHOMYZZKOR-UHFFFAOYSA-N tes-adt Chemical class C1=C2C(C#C[Si](CC)(CC)CC)=C(C=C3C(SC=C3)=C3)C3=C(C#C[Si](CC)(CC)CC)C2=CC2=C1SC=C2 NYBWUHOMYZZKOR-UHFFFAOYSA-N 0.000 description 1
- 125000005887 tetrahydrobenzofuranyl group Chemical group 0.000 description 1
- 125000005886 tetrahydrobenzothienyl group Chemical group 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000005888 tetrahydroindolyl group Chemical group 0.000 description 1
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000003507 tetrahydrothiofenyl group Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 125000005305 thiadiazolinyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000005458 thianyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 238000003354 tissue distribution assay Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000005881 triazolinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- ZDPHROOEEOARMN-UHFFFAOYSA-N undecanoic acid Chemical compound CCCCCCCCCCC(O)=O ZDPHROOEEOARMN-UHFFFAOYSA-N 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 229960002647 warfarin sodium Drugs 0.000 description 1
- 125000005853 β-dimethylaminoethyl group Chemical group 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/32—Nitrogen atom
- C07D473/34—Nitrogen atom attached in position 6, e.g. adenine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/04—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/472—Non-condensed isoquinolines, e.g. papaverine
- A61K31/4725—Non-condensed isoquinolines, e.g. papaverine containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
- A61K31/52—Purines, e.g. adenine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/24—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 one nitrogen and one sulfur atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
도 2는 다형태 B에 대한 XRPD를 도시한다.
도 3은 다형태 C에 대한 XRPD를 도시한다.
도 4는 다형태 D에 대한 XRPD를 도시한다.
도 5는 다형태 E에 대한 XRPD를 도시한다.
도 6은 다형태 F에 대한 XRPD를 도시한다.
도 7은 다형태 G에 대한 XRPD를 도시한다.
도 8은 다형태 H에 대한 XRPD를 도시한다.
도 9는 다형태 I에 대한 XRPD를 도시한다.
도 10은 다형태 J에 대한 XRPD를 도시한다.
도 11은 화학식 I의 비정질 화합물에 대한 XRPD를 도시한다.
도 12는 다형태 A에 대한 시차 주사 열량 측정법(DSC) 서모그램을 도시한다.
도 13은 다형태 B에 대한 DSC를 도시한다.
도 14는 다형태 C에 대한 DSC를 도시한다.
도 15는 다형태 D에 대한 DSC를 도시한다.
도 16은 다형태 E에 대한 DSC를 도시한다.
도 17은 다형태 F에 대한 DSC를 도시한다.
도 18은 다형태 G에 대한 DSC를 도시한다.
도 19는 다형태 H에 대한 DSC를 도시한다.
도 20은 다형태 I에 대한 DSC를 도시한다.
도 21은 다형태 J에 대한 DSC를 도시한다.
도 22는 다형태 A에 대한 DSC 서모그램 및 열중량 분석(TGA)을 도시한다.
도 23은 다형태 C에 대한 2개의 DSC 서모그램을 도시한다.
도 24는 다형태 F에 대한 DSC 및 TGA를 도시한다.
도 25는 다양한 용매 중의 결정질 고체의 형태화에 대해 시험된 염의 패널을 도시한다.
도 26은 화학식 I의 화합물의 다형태 G MTBE(t-부틸 메틸 에터) 용매화물의 단일 결정 X선 구조를 도시한다.
도 27은 다형태 C의 FT-IR 스펙트럼을 도시한다.
도 28은 다형태 C의 1H-NMR 스펙트럼을 도시한다.
도 29는 다형태 C의 13C-NMR 스펙트럼을 도시한다.
도 30은 다형태 C의 동적 증기 흡착(DVS) 분석을 도시한다.
도 31은 다형태 C를 함유하는 캡슐의 대표적 용해 프로파일을 도시한다.
Claims (68)
- 제 2 항에 있어서,
상기 혼합물이 다형체 형태 C, 또는 이의 염, 용매화물 또는 수화물을 50 중량% 이상 포함하는, 혼합물. - 제 5 항에 있어서,
2θ = 10.4°(±0.2°), 13.3°(±0.2°), 및 24.3°(±0.2°)의 특정 X선 분말 회절(XRPD) 피크를 갖는, 다형체 형태 C. - 제 6 항에 있어서,
2θ = 6.6°(±0.2°) 및 12.5°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 C. - 제 5 항에 있어서,
2θ = 8.8°(±0.2°), 9.9°(±0.2°), 13.4°(±0.2°), 15.5°(±0.2°), 16.9°(±0.2°), 19.8°(±0.2°), 21.3°(±0.2°), 23.6°(±0.2°), 25.3°(±0.2°), 및 27.9°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 6.6°(±0.2°), 10.4°(±0.2°), 12.5°(±0.2°), 13.3°(±0.2°), 및 24.3°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 C. - 제 5 항에 있어서,
도 3에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 C. - 제 10 항에 있어서,
2θ = 7.9°(±0.2°), 13.4°(±0.2°), 및 23.4°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 B. - 제 11 항에 있어서,
2θ = 14.0°(±0.2°) 및 15.0°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 B. - 제 10 항에 있어서,
2θ = 9.5°(±0.2°), 12.7°(±0.2°), 13.6°(±0.2°), 14.2°(±0.2°), 15.7°(±0.2°), 19.0°(±0.2°), 22.3°(±0.2°), 24.2°(±0.2°), 24.8°(±0.2°), 및 26.9°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 7.9°(±0.2°), 13.4°(±0.2°), 14.0°(±0.2°), 15.0°(±0.2°), 및 23.4°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 B. - 제 10 항에 있어서,
도 2에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 B. - 제 15 항에 있어서,
2θ = 11.4°(±0.2°), 17.4°(±0.2°), 및 22.9°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 D. - 제 16 항에 있어서,
2θ = 9.2°(±0.2°) 및 18.3°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 D. - 제 15 항에 있어서,
2θ = 9.8°(±0.2°), 12.2°(±0.2°), 15.8°(±0.2°), 16.2°(±0.2°), 16.8°(±0.2°), 18.9°(±0.2°), 19.9°(±0.2°), 20.0°(±0.2°), 24.9°(±0.2°), 및 29.3°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 9.2°(±0.2°), 11.4°(±0.2°), 17.4°(±0.2°), 18.3°(±0.2°), 및 22.9°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 D. - 제 15 항에 있어서,
도 4에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 D. - 제 20 항에 있어서,
2θ = 6.7°(±0.2°), 9.3°(±0.2°), 및 24.4°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 E. - 제 21 항에 있어서,
2θ = 12.7°(±0.2°) 및 13.9°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 E. - 제 20 항에 있어서,
2θ = 12.4°(±0.2°), 13.3°(±0.2°), 14.3°(±0.2°), 15.5°(±0.2°), 17.4°(±0.2°), 18.5°(±0.2°), 22.0°(±0.2°), 23.9°(±0.2°), 24.1°(±0.2°), 및 26.4°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 6.7°(±0.2°), 9.3°(±0.2°), 12.7°(±0.2°), 13.9°(±0.2°), 및 24.4°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 E. - 제 20 항에 있어서,
도 5에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 E. - 제 25 항에 있어서,
2θ = 9.6°(±0.2°), 17.3°(±0.2°), 및 24.6°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 F. - 제 26 항에 있어서,
2θ = 14.0°(±0.2°) 및 19.2°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 F. - 제 25 항에 있어서,
2θ = 12.4°(±0.2°), 16.1°(±0.2°), 16.6°(±0.2°), 17.1°(±0.2°), 20.8°(±0.2°), 21.5°(±0.2°), 22.0°(±0.2°), 24.3°(±0.2°), 25.2°(±0.2°), 및 25.4°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 9.6°(±0.2°), 14.0°(±0.2°), 17.3°(±0.2°), 19.2°(±0.2°), 및 24.6°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 F. - 제 25 항에 있어서,
도 6에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 F. - 제 30 항에 있어서,
2θ = 6.7°(±0.2°), 9.5°(±0.2°), 및 19.0°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 G. - 제 31 항에 있어서,
2θ = 10.6°(±0.2°) 및 19.6°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 G. - 제 30 항에 있어서,
2θ = 13.4°(±0.2°), 15.0°(±0.2°), 15.8°(±0.2°), 17.8°(±0.2°), 20.7°(±0.2°), 21.2°(±0.2°), 22.8°(±0.2°), 23.8°(±0.2°), 24.3°(±0.2°), 및 25.6°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 6.7°(±0.2°), 9.5°(±0.2°), 10.6°(±0.2°), 19.0°(±0.2°), 및 19.6°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 G. - 제 30 항에 있어서,
도 7에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 G. - 제 35 항에 있어서,
2θ = 8.9°(±0.2°), 9.2°(±0.2°), 및 14.1°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 H. - 제 36 항에 있어서,
2θ = 17.3°(±0.2°) 및 18.53°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 H. - 제 35 항에 있어서,
2θ = 7.1°(±0.2°), 10.6°(±0.2°), 11.3°(±0.2°), 11.6°(±0.2°), 16.2°(±0.2°), 18.3°(±0.2°), 18.8°(±0.2°), 20.3°(±0.2°), 21.7°(±0.2°), 및 24.7°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 8.9°(±0.2°), 9.2°(±0.2°), 14.1°(±0.2°), 17.3°(±0.2°), 및 18.5°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 H. - 제 35 항에 있어서,
도 8에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 H. - 제 40 항에 있어서,
2θ = 9.7°(±0.2°), 19.3°(±0.2°), 및 24.5°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 I. - 제 41 항에 있어서,
2θ = 11.4°(±0.2°) 및 14.2°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크를 추가로 포함하는, 다형체 형태 I. - 제 40 항에 있어서,
2θ = 9.2°(±0.2°), 14.7°(±0.2°), 15.5°(±0.2°), 16.7°(±0.2°), 17.3°(±0.2°), 18.4°(±0.2°), 21.4°(±0.2°), 22.9°(±0.2°), 29.1°(±0.2°), 및 34.1°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 9.7°(±0.2°), 11.4°(±0.2°), 14.2°(±0.2°), 19.3°(±0.2°), 및 24.5°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 I. - 제 40 항에 있어서,
도 9에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 I. - 제 45 항에 있어서,
2θ = 9.1°(±0.2°), 17.3°(±0.2°), 및 18.3°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 J. - 제 46 항에 있어서,
2θ = 16.4°(±0.2°) 및 17.9°(±0.2°)로부터 선택된 하나 이상의 특정 XRPD 피크를 추가로 포함하는, 다형체 형태 J. - 제 45 항에 있어서,
2θ = 9.4°(±0.2°), 10.1°(±0.2°), 10.7°(±0.2°), 14.0°(±0.2°), 14.3°(±0.2°), 15.5°(±0.2°), 16.9°(±0.2°), 19.9°(±0.2°), 24.0°(±0.2°), 및 24.7°(±0.2°)로부터 선택된 하나 이상의 XRPD 피크와 조합된 2θ = 9.1°(±0.2°), 16.4°(±0.2°), 17.3°(±0.2°), 17.9°(±0.2°), 및 18.3°(±0.2°)의 특정 XRPD 피크를 갖는, 다형체 형태 J. - 제 45 항에 있어서,
도 10에 도시된 XRPD 패턴에서의 피크를 실질적으로 모두 갖는, 다형체 형태 J. - 제 51 항에 있어서,
상기 비-무수 조건이 액체 수를 포함하는, 방법. - 제 52 항에 있어서,
상기 비-무수 조건이 물-혼화성 용매 및 액체 수 용매계를 포함하는, 방법. - 제 53 항에 있어서,
상기 액체 수가 용매계의 약 1 부피%, 약 5 부피%, 약 10 부피%, 약 15 부피%, 약 20 부피%, 약 25 부피%, 약 30 부피%, 약 35 부피%, 약 40 부피%, 약 45 부피%, 약 50 부피%, 약 55 부피%, 약 60 부피%, 약 65 부피%, 약 70 부피%, 약 75 부피%, 약 80 부피%, 약 85 부피%, 약 90 부피%, 약 95 부피%, 및 약 100 부피%로부터 선택된 양으로 존재하는, 방법. - 제 54 항에 있어서,
상기 액체 수가 용매계의 약 85 내지 약 95 부피%의 양으로 존재하는, 방법. - 제 51 항에 있어서,
하나 이상의 비-형태 C 다형체가 형태 A, 형태 B, 형태 D, 형태 E, 형태 F, 형태 G, 형태 H, 형태 I, 형태 J, 비정질 형태, 또는 이들의 염, 용매화물, 수화물, 및 이들의 혼합물로 이루어진 군으로부터 선택되는, 방법. - 제 56 항에 있어서,
하나 이상의 비-형태 C 다형체가 다형체 형태 A를 약 50 중량% 이상 포함하는, 방법. - i) 하기 화학식 Ia의 화합물을 하나 이상의 시약과 조합해 보호기 PG2를 제거하여 화학식 I의 화합물을 형성하는 단계; 및
ii) 화학식 I의 화합물의 다형체 형태 C를 회수하는 단계
를 포함하되, 상기 단계 i) 및 ii) 중 하나 이상은 비-무수 조건에서 일어나는, 하기 화학식 I의 화합물의 다형체 형태 C의 제조 방법:
[화학식 Ia]
[화학식 I]
상기 식에서,
PG2는 메틸설폰일, 치환된 메틸설폰일, 벤젠설폰일, 치환된 벤젠설폰일, 벤질옥시카본일, 치환된 벤질옥시카본일, 2,2,2-트라이클로로에톡시카본일, 2-트라이메틸실일에톡시카본일, t-부톡시카본일, 1-아다만틸옥시카본일, 2-아다만틸옥시카본일, 알킬, 치환된 알킬, t-부틸다이메틸실일, 트라이이소프로필실일, 알릴, 벤질, 치환된 벤질, 하이드록시메틸, 메톡시메틸, 다이에톡시메틸, (2-클로로에톡시)메틸, t-부톡시메틸, t-부틸다이메틸실옥시메틸, 피발로일옥시메틸, 벤질옥시메틸, 다이메틸아미노메틸, 2-테트라하이드로피란일, 치환된 알콕시메틸 및 치환된 아릴옥시메틸로부터 선택된 보호기이고,
이때, 치환체는 알킬, 헤테로알킬, 알켄일, 알킨일, 사이클로알킬, 헤테로사이클일, 아릴, 아릴알킬, 헤테로아릴, 헤테로아릴알킬, 알콕시, 사이클로알콕시, 헤테로사이클일옥시, 아릴옥시, 헤테로아릴옥시, 아마이도, 아미노, 아실, 아실옥시, 알콕시카본일, 에스터, 에터, 티오, 설핀일, 설폰일, 설폰아마이도, 할로, 시아노, 하이드록실, 니트로, 포스페이트, 우레아, 카바메이트 및 카본에이트로부터 선택된다. - 제 58 항에 있어서,
보호기 PG2를 제거하기 위한 하나 이상의 시약이 HCl, HBr, TFA, Na2CO3 및 K2CO3, NaOH, KOH, 메틸 리튬, 에틸 리튬, 프로필 리튬, n-부틸 리튬, n-펜틸 리튬, n-헥실 리튬, 세륨 암모늄 니트레이트, 사이클로헥사다이엔/Pd 블랙, H2/Pd/C, TBAF, 및 BF3ㆍEt2O로부터 선택된, 방법. - i) 제 1 항 또는 제 50 항에 따른 화합물,
ii) 제 2 항 내지 제 4 항 중 어느 한 항에 따른 혼합물, 또는
iii) 제 5 항 내지 제 49 항 중 어느 한 항에 따른 다형체
및 하나 이상의 약학적으로 허용가능한 부형제를 포함하는 약학 조성물. - 제 62 항에 있어서,
화학식 I의 화합물의 다형체 형태 A, 형태 B, 형태 D, 형태 E, 형태 F, 형태 G, 형태 H, 형태 I, 형태 J, 또는 비정질 형태로부터 선택된 하나 이상의 비-형태 C 다형체, 또는 이의 염, 용매화물 또는 수화물을 추가로 포함하는, 약학 조성물. - 제 63 항에 있어서,
약 9:1 초과의 형태 C:형태 A 비율로 다형체 형태 C 및 다형체 형태 A를 포함하는, 약학 조성물. - 제 62 항에 있어서,
규화된 미정질 셀룰로스, 락토스, 만니톨, 전분, 소르비톨, 수크로스, 인산 이칼슘, 미정질 셀룰로스, 크로스포비돈, 크로스카멜로스 나트륨, 및 나트륨 전분 글리콜레이트, 이산화규소, 규산 마그네슘, 활석, 마그네슘 스테아레이트, 나트륨 스테아릴 푸마레이트, 스테아르산, 나트륨 라우릴 설페이트, 나트륨 도데실 설페이트, 트윈® 80, 및 루트롤(Lutrol)®로부터 선택된 하나 이상의 약학적으로 허용가능한 부형제를 포함하는, 약학 조성물. - 개체에게 하기를 치료 효과량 투여하는 것을 포함하는 PI3K 매개된 질환의 치료 방법:
i) 제 1 항 또는 제 50 항에 따른 화합물,
ii) 제 2 항 내지 제 4 항 중 어느 한 항에 따른 혼합물,
iii) 제 5 항 내지 제 49 항 중 어느 한 항에 따른 다형체, 또는
iv) 제 61 항 내지 제 65 항 중 어느 한 항에 따른 약학 조성물. - 제 66 항에 있어서,
상기 질환이 암, 염증성 질환 또는 자가-면역 질환인, 방법. - 개체에서 PI3K 매개된 질환의 치료용 약제의 제조를 위한 하기의 용도:
i) 제 1 항 또는 제 50 항에 따른 화합물,
ii) 제 2 항 내지 제 4 항 중 어느 한 항에 따른 혼합물,
iii) 제 5 항 내지 제 49 항 중 어느 한 항에 따른 다형체, 또는
iv) 제 61 항 내지 제 65 항 중 어느 한 항에 따른 약학 조성물.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161431304P | 2011-01-10 | 2011-01-10 | |
| US61/431,304 | 2011-01-10 | ||
| US201161578655P | 2011-12-21 | 2011-12-21 | |
| US61/578,655 | 2011-12-21 | ||
| PCT/US2012/020831 WO2012097000A1 (en) | 2011-01-10 | 2012-01-10 | Processes for preparing isoquinolinones and solid forms of isoquinolinones |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187018781A Division KR20180080358A (ko) | 2011-01-10 | 2012-01-10 | 이소퀴놀린온 및 이의 고체 형태의 제조 방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20140020249A true KR20140020249A (ko) | 2014-02-18 |
| KR101875720B1 KR101875720B1 (ko) | 2018-07-09 |
Family
ID=46491229
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187018781A Ceased KR20180080358A (ko) | 2011-01-10 | 2012-01-10 | 이소퀴놀린온 및 이의 고체 형태의 제조 방법 |
| KR1020137021000A Active KR101875720B1 (ko) | 2011-01-10 | 2012-01-10 | 이소퀴놀린온 및 이의 고체 형태의 제조 방법 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187018781A Ceased KR20180080358A (ko) | 2011-01-10 | 2012-01-10 | 이소퀴놀린온 및 이의 고체 형태의 제조 방법 |
Country Status (23)
| Country | Link |
|---|---|
| US (8) | US8809349B2 (ko) |
| EP (3) | EP3238722B1 (ko) |
| JP (2) | JP2014501790A (ko) |
| KR (2) | KR20180080358A (ko) |
| CN (1) | CN103648499B (ko) |
| AR (1) | AR084824A1 (ko) |
| AU (1) | AU2012205669B2 (ko) |
| BR (1) | BR112013017670B1 (ko) |
| CA (1) | CA2824197C (ko) |
| CL (1) | CL2013002007A1 (ko) |
| DK (1) | DK2663309T3 (ko) |
| ES (1) | ES2637113T3 (ko) |
| HK (1) | HK1245110B (ko) |
| IL (1) | IL227387B (ko) |
| MX (1) | MX347708B (ko) |
| NZ (1) | NZ612909A (ko) |
| PE (2) | PE20141303A1 (ko) |
| PH (2) | PH12013501465A1 (ko) |
| SG (2) | SG10201600179RA (ko) |
| TW (3) | TWI546305B (ko) |
| UA (1) | UA115767C2 (ko) |
| WO (1) | WO2012097000A1 (ko) |
| ZA (1) | ZA201305150B (ko) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019139399A1 (ko) * | 2018-01-12 | 2019-07-18 | 보령제약 주식회사 | Pi3 키나아제 억제제 및 세포독성 항암제를 포함하는 암의 예방 또는 치료용 약학적 조성물 |
| WO2020225782A1 (ko) * | 2019-05-09 | 2020-11-12 | 보령제약 주식회사 | 무정형의 pi3k 저해제 및 이를 포함하는 약학적 조성물 |
| WO2020225783A1 (ko) * | 2019-05-09 | 2020-11-12 | 보령제약 주식회사 | Pi3k 저해제의 결정다형 및 이의 제조방법 |
| WO2020234756A1 (ko) * | 2019-05-20 | 2020-11-26 | 보령제약 주식회사 | 피리도-피리미딘 유도체 및 이를 유효성분으로 포함하는 pi3k 관련 질환의 예방 또는 치료용 약학적 조성물 |
Families Citing this family (90)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004060403A2 (en) | 2003-01-06 | 2004-07-22 | Angiochem Inc. | Aprotinin and anglos as carriers across the blood-brain barrier |
| US9365634B2 (en) | 2007-05-29 | 2016-06-14 | Angiochem Inc. | Aprotinin-like polypeptides for delivering agents conjugated thereto to tissues |
| US8193182B2 (en) | 2008-01-04 | 2012-06-05 | Intellikine, Inc. | Substituted isoquinolin-1(2H)-ones, and methods of use thereof |
| EP2240451B1 (en) | 2008-01-04 | 2017-08-09 | Intellikine, LLC | Isoquinolinone derivatives substituted with a purine useful as PI3K inhibitors |
| PT2279008T (pt) | 2008-04-18 | 2019-05-20 | Angiochem Inc | Composições farmacêuticas de paclitaxel, análogos de paclitaxel ou conjugados de paclitaxel e métodos relacionados de preparação e utilização |
| CA2738429C (en) | 2008-09-26 | 2016-10-25 | Intellikine, Inc. | Heterocyclic kinase inhibitors |
| JP5705118B2 (ja) | 2008-10-15 | 2015-04-22 | アンジオケム インコーポレーテッド | 薬物送達のためのエトポシドおよびドキソルビシン複合体 |
| AU2009304560A1 (en) | 2008-10-15 | 2010-04-22 | Angiochem Inc. | Conjugates of GLP-1 agonists and uses thereof |
| US9914754B2 (en) | 2008-12-05 | 2018-03-13 | Angiochem Inc. | Conjugates of neurotensin or neurotensin analogs and uses thereof |
| RU2586212C2 (ru) | 2008-12-08 | 2016-06-10 | Мандифарма Интернэшнл Корпорейшн Лимитед | Композиции ингибиторов тирозинкиназных рецепторов белков |
| WO2010069074A1 (en) | 2008-12-17 | 2010-06-24 | Universite Du Quebec A Montreal | Membrane type-1 matrix metalloprotein inhibitors and uses thereof |
| AU2010239069B2 (en) | 2009-04-20 | 2015-05-14 | Angiochem Inc | Treatment of ovarian cancer using an anticancer agent conjugated to an Angiopep-2 analog |
| JP5789252B2 (ja) | 2009-05-07 | 2015-10-07 | インテリカイン, エルエルシー | 複素環式化合物およびその使用 |
| CA2766100C (en) | 2009-06-29 | 2018-05-22 | Incyte Corporation | Pyrimidinones as pi3k inhibitors |
| JP5932642B2 (ja) | 2009-07-02 | 2016-06-08 | アンジオケム インコーポレーテッド | 多量体ペプチドコンジュゲートおよびその使用 |
| WO2011075643A1 (en) | 2009-12-18 | 2011-06-23 | Incyte Corporation | Substituted heteroaryl fused derivatives as pi3k inhibitors |
| WO2011130342A1 (en) | 2010-04-14 | 2011-10-20 | Incyte Corporation | FUSED DERIVATIVES AS ΡI3Κδ INHIBITORS |
| AU2011255218B2 (en) | 2010-05-21 | 2015-03-12 | Infinity Pharmaceuticals, Inc. | Chemical compounds, compositions and methods for kinase modulation |
| WO2011163195A1 (en) | 2010-06-21 | 2011-12-29 | Incyte Corporation | Fused pyrrole derivatives as pi3k inhibitors |
| AU2011326427B2 (en) | 2010-11-10 | 2016-01-07 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| ES2764848T3 (es) | 2010-12-20 | 2020-06-04 | Incyte Holdings Corp | N-(1-(fenilo sustituido)etilo)-9H-purina-6-aminas como inhibidores de PI3K |
| AR084824A1 (es) | 2011-01-10 | 2013-06-26 | Intellikine Inc | Procesos para preparar isoquinolinonas y formas solidas de isoquinolinonas |
| WO2012125629A1 (en) | 2011-03-14 | 2012-09-20 | Incyte Corporation | Substituted diamino-pyrimidine and diamino-pyridine derivatives as pi3k inhibitors |
| US9126948B2 (en) | 2011-03-25 | 2015-09-08 | Incyte Holdings Corporation | Pyrimidine-4,6-diamine derivatives as PI3K inhibitors |
| HK1198443A1 (en) | 2011-07-19 | 2015-04-24 | 无限药品股份有限公司 | Heterocyclic compounds and uses thereof |
| WO2013012918A1 (en) | 2011-07-19 | 2013-01-24 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| EA027970B1 (ru) * | 2011-08-11 | 2017-09-29 | ИНТЕЛЛАЙКИН, ЭлЭлСи | Полиморфы ингибитора киназы |
| WO2013032591A1 (en) | 2011-08-29 | 2013-03-07 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| KR102131612B1 (ko) | 2011-09-02 | 2020-07-08 | 인사이트 홀딩스 코포레이션 | Pi3k 억제제로서 헤테로시클릴아민 |
| ES2661510T3 (es) | 2011-12-15 | 2018-04-02 | Novartis Ag | Uso de inhibidores de la actividad o función de PI3K |
| AR090548A1 (es) | 2012-04-02 | 2014-11-19 | Incyte Corp | Azaheterociclobencilaminas biciclicas como inhibidores de pi3k |
| US8940742B2 (en) | 2012-04-10 | 2015-01-27 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| US8828998B2 (en) | 2012-06-25 | 2014-09-09 | Infinity Pharmaceuticals, Inc. | Treatment of lupus, fibrotic conditions, and inflammatory myopathies and other disorders using PI3 kinase inhibitors |
| CN102850271A (zh) * | 2012-09-10 | 2013-01-02 | 盛世泰科生物医药技术(苏州)有限公司 | 3-(1-氨乙基)-2-环丁基-2-氢-异喹啉-1-酮类化合物的合成 |
| US20140120060A1 (en) | 2012-11-01 | 2014-05-01 | Infinity Pharmaceuticals, Inc. | Treatment of rheumatoid arthritis and asthma using pi3 kinase inhibitors |
| RU2702908C2 (ru) * | 2012-11-01 | 2019-10-14 | Инфинити Фармасьютикалз, Инк. | Лечение злокачественных опухолей с использованием модуляторов изоформ pi3-киназы |
| JP6434416B2 (ja) | 2012-11-08 | 2018-12-05 | ライゼン・ファーマシューティカルズ・エスアー | PDE4阻害剤とPI3δ阻害剤または二重PI3δ−γキナーゼ阻害剤とを含有する薬学的組成物 |
| NZ708870A (en) | 2012-12-21 | 2016-09-30 | Gilead Calistoga Llc | Isoquinolinone or quinazolinone phosphatidylinositol 3-kinase inhibitors |
| JP6125663B2 (ja) | 2012-12-21 | 2017-05-10 | ギリアード カリストガ エルエルシー | ホスファチジルイノシトール3−キナーゼ阻害剤としての置換ピリミジンアミノアルキル−キナゾロン |
| US11407721B2 (en) | 2013-02-19 | 2022-08-09 | Amgen Inc. | CIS-morpholinone and other compounds as MDM2 inhibitors for the treatment of cancer |
| US9481667B2 (en) | 2013-03-15 | 2016-11-01 | Infinity Pharmaceuticals, Inc. | Salts and solid forms of isoquinolinones and composition comprising and methods of using the same |
| US8999992B2 (en) | 2013-03-15 | 2015-04-07 | Vm Pharma Llc | Crystalline forms of tryosine kinase inhibitors and their salts |
| MX373584B (es) * | 2013-05-30 | 2020-05-05 | Infinity Pharmaceuticals Inc | Tratamiento de cánceres utilizando moduladores de la isoforma pi3 cinasa. |
| JOP20200296A1 (ar) * | 2013-06-10 | 2017-06-16 | Amgen Inc | عمليات صنع وأشكال بلورية من mdm2 مثبط |
| HK1223911A1 (zh) | 2013-06-14 | 2017-08-11 | Gilead Sciences, Inc. | 磷脂醯肌醇3-激酶抑制剂 |
| EA201690713A1 (ru) | 2013-10-04 | 2016-08-31 | Инфинити Фармасьютикалз, Инк. | Гетероциклические соединения и их применения |
| WO2015051241A1 (en) | 2013-10-04 | 2015-04-09 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| WO2015061204A1 (en) * | 2013-10-21 | 2015-04-30 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| CA2931431A1 (en) | 2013-12-05 | 2015-06-11 | Acerta Pharma B.V. | Therapeutic combination of a pi3k inhibitor and a btk inhibitor |
| CN104817559B (zh) | 2014-01-30 | 2021-05-25 | 苏州泽璟生物制药股份有限公司 | 氘代喹唑啉酮化合物以及包含该化合物的药物组合物 |
| SG11201607705XA (en) | 2014-03-19 | 2016-10-28 | Infinity Pharmaceuticals Inc | Heterocyclic compounds for use in the treatment of pi3k-gamma mediated disorders |
| US20150320755A1 (en) | 2014-04-16 | 2015-11-12 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| US20150320754A1 (en) | 2014-04-16 | 2015-11-12 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| WO2015191677A1 (en) | 2014-06-11 | 2015-12-17 | Incyte Corporation | Bicyclic heteroarylaminoalkyl phenyl derivatives as pi3k inhibitors |
| TWI705814B (zh) * | 2014-06-20 | 2020-10-01 | 美商梅琳塔有限責任公司 | 醫藥組成物及其用途 |
| KR20170082490A (ko) | 2014-07-04 | 2017-07-14 | 루핀 리미티드 | Pi3k 억제제로서 퀴놀리지논 유도체 |
| TW201618773A (zh) | 2014-08-11 | 2016-06-01 | 艾森塔製藥公司 | Btk抑制劑、pi3k抑制劑、jak-2抑制劑、及/或cdk4/6抑制劑的治療組合物 |
| PL3179991T3 (pl) | 2014-08-11 | 2022-02-14 | Acerta Pharma B.V. | Kombinacje terapeutyczne inhibitora btk i inhibitora bcl-2 |
| US20170239351A1 (en) | 2014-08-11 | 2017-08-24 | Acerta Pharma B.V. | Therapeutic Combinations of a BTK Inhibitor, a PI3K Inhibitor, a JAK-2 Inhibitor, a PD-1 Inhibitor, and/or a PD-L1 Inhibitor |
| RS60450B1 (sr) | 2014-09-03 | 2020-07-31 | Rhizen Pharmaceuticals Sa | Postupak za tretiranje i kompozicije koje sadrže dvojni inhibitor pi3k delta-gama kinaze i kortikosteroid |
| MX2017003439A (es) * | 2014-09-17 | 2017-12-04 | Mundipharma International Corporation Ltd | Formas cristalinas de inhibidores de tirosina cinasa y sus sales. |
| US9708348B2 (en) | 2014-10-03 | 2017-07-18 | Infinity Pharmaceuticals, Inc. | Trisubstituted bicyclic heterocyclic compounds with kinase activities and uses thereof |
| US10196395B2 (en) * | 2015-02-12 | 2019-02-05 | Crystal Pharmatech Co., Ltd | Crystalline form alpha of IPI-145 and preparation method thereof |
| SI3831833T1 (sl) | 2015-02-27 | 2023-03-31 | Incyte Holdings Corporation | Postopki za pripravo inhibitorja PI3K |
| WO2016183060A1 (en) | 2015-05-11 | 2016-11-17 | Incyte Corporation | Process for the synthesis of a phosphoinositide 3-kinase inhibitor |
| WO2016183063A1 (en) | 2015-05-11 | 2016-11-17 | Incyte Corporation | Crystalline forms of a pi3k inhibitor |
| EP3307326B9 (en) | 2015-06-15 | 2021-02-24 | Angiochem Inc. | Methods for the treatment of leptomeningeal carcinomatosis |
| CN114230571B (zh) | 2015-09-14 | 2025-07-08 | 无限药品股份有限公司 | 异喹啉酮的固体形式、其制备方法、包含其的组合物及其使用方法 |
| WO2017161116A1 (en) | 2016-03-17 | 2017-09-21 | Infinity Pharmaceuticals, Inc. | Isotopologues of isoquinolinone and quinazolinone compounds and uses thereof as pi3k kinase inhibitors |
| US10919914B2 (en) | 2016-06-08 | 2021-02-16 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| CN109640999A (zh) | 2016-06-24 | 2019-04-16 | 无限药品股份有限公司 | 组合疗法 |
| EP3665179B1 (en) * | 2017-08-09 | 2021-06-09 | Prelude Therapeutics, Incorporated | Selective inhibitors of protein arginine methyltransferase 5 (prmt5) |
| JP7200235B2 (ja) * | 2017-09-27 | 2023-01-06 | Meiji Seikaファルマ株式会社 | ジアザビシクロオクタン誘導体の剤形およびその製造法 |
| AU2019268583B2 (en) | 2018-05-18 | 2022-01-27 | Novartis Ag | Crystalline forms of a TLR7/TLR8 inhibitor |
| US12030867B2 (en) | 2018-05-30 | 2024-07-09 | University Of Notre Dame Du Lac | Hsp90β selective inhibitors |
| IL278889B2 (en) | 2018-06-01 | 2025-11-01 | Incyte Corp | Dosing regimen for the treatment of pi3k related disorders |
| CN108982465B (zh) * | 2018-06-06 | 2020-10-02 | 上海应用技术大学 | 酒中二氧化硫高通量sers在线检测方法 |
| CN109364601B (zh) * | 2018-12-21 | 2021-05-28 | 山东京博众诚清洁能源有限公司 | 一种炼厂废气的处理方法 |
| GB201915447D0 (en) * | 2019-10-24 | 2019-12-11 | Johnson Matthey Plc | Polymorphs of avapritinib and methods of preparing the polymorphs |
| US20250345384A1 (en) * | 2020-01-10 | 2025-11-13 | Amgen Inc. | Stable cyclodextrin free carfilzomib formulation |
| CN111635404B (zh) * | 2020-07-17 | 2023-11-07 | 苏州明锐医药科技有限公司 | 一种度维尼西的制备方法 |
| CN111675710B (zh) * | 2020-07-17 | 2023-08-18 | 上海奥萝拉医药科技有限公司 | 度维尼西的制备方法 |
| WO2022044040A1 (en) * | 2020-08-25 | 2022-03-03 | Msn Laboratories Private Limited, R&D Center | Novel polymorphs of (s)-3-(1-(9h-purin-6-yl-amino)ethyl)-8-chloro-2-phenylisoquinolin-1(2h)-one |
| CN112595691B (zh) * | 2020-11-16 | 2024-09-27 | 伊犁紫苏丽人生物科技有限公司 | 基于近红外拉曼光谱融合的薰衣草精油特征组分定量分析模型的建立方法和定量分析方法 |
| CN112410355B (zh) * | 2020-11-23 | 2022-03-25 | 昆明理工大学 | 一种酰基辅酶a氧化酶2基因rkacox2及其应用 |
| EP4356114A4 (en) * | 2021-06-18 | 2025-05-14 | Polyvalor, Limited Partnership | Methods and systems for interrogating a saliva droplet using Raman spectroscopy |
| EP4436581A4 (en) * | 2021-11-22 | 2025-08-13 | Secura Bio Inc | METHODS OF TREATING PERIPHERAL T-CELL LYMPHOMA |
| WO2024163039A1 (en) | 2023-01-30 | 2024-08-08 | The Trustees Of Princeton University | Cancer treatment using pi3k inhibitors in combination with antibiotics or purified diets |
| EP4676484A1 (en) * | 2023-03-09 | 2026-01-14 | BDR Pharmaceuticals International Private Limited | Solid oral composition of olaparib and its salts thereof |
| CN118388485B (zh) * | 2024-05-16 | 2024-11-05 | 江苏海洋大学 | 一种杜韦利西布的合成方法 |
Family Cites Families (671)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB812366A (en) | 1955-08-18 | 1959-04-22 | Wellcome Found | Improvements in and relating to derivatives of pyrimidine and the preparation thereof |
| GB937725A (en) | 1960-05-11 | 1963-09-25 | Ciba Ltd | Pyrazolo[3:4-d]pyrimidines |
| JPS4834699B1 (ko) | 1968-07-03 | 1973-10-23 | ||
| US3536809A (en) | 1969-02-17 | 1970-10-27 | Alza Corp | Medication method |
| US3598123A (en) | 1969-04-01 | 1971-08-10 | Alza Corp | Bandage for administering drugs |
| US3657744A (en) | 1970-05-08 | 1972-04-25 | Univ Minnesota | Method for fixing prosthetic implants in a living body |
| DE2139107A1 (de) | 1971-08-04 | 1973-02-15 | Merck Patent Gmbh | Heterocyclisch substituierte adenosinverbindungen |
| JPS4834699A (ko) | 1971-09-08 | 1973-05-21 | ||
| JPS5148231B2 (ko) | 1971-10-20 | 1976-12-20 | ||
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US3916899A (en) | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| US4008719A (en) | 1976-02-02 | 1977-02-22 | Alza Corporation | Osmotic system having laminar arrangement for programming delivery of active agent |
| US4270537A (en) | 1979-11-19 | 1981-06-02 | Romaine Richard A | Automatic hypodermic syringe |
| IT1153216B (it) | 1981-10-16 | 1987-01-14 | Schering Ag | Procedimento per la preparazione di composti cianoeterociclici |
| DE3244594A1 (de) | 1982-12-02 | 1984-06-07 | Hoechst Ag, 6230 Frankfurt | 1-phenylisochinolinderivate und verfahren zu ihrer herstellung, diese verbindung enthaltende pharmazeutische praeparate und deren anwendung |
| DE3406533A1 (de) | 1984-02-23 | 1985-08-29 | Boehringer Mannheim Gmbh, 6800 Mannheim | Verwendung von adenosin-derivaten als antiallergica und arzneimittel, die diese enthalten |
| US5310731A (en) | 1984-06-28 | 1994-05-10 | Whitby Research, Inc. | N-6 substituted-5'-(N-substitutedcarboxamido)adenosines as cardiac vasodilators and antihypertensive agents |
| KR890002631B1 (ko) | 1984-10-04 | 1989-07-21 | 몬산토 캄파니 | 생물학적으로 활성인 소마토트로핀을 지속적으로 유리하는 조성물 |
| US4795627A (en) | 1984-10-18 | 1989-01-03 | University Of Pittsburgh | Tritium labelled N-mustard type compounds and a process for their production |
| IE58110B1 (en) | 1984-10-30 | 1993-07-14 | Elan Corp Plc | Controlled release powder and process for its preparation |
| US4656159A (en) | 1984-10-31 | 1987-04-07 | Georgetown University | Galactose-C-6 nitrogen mustard compounds and their uses |
| JPS61109797A (ja) | 1984-11-01 | 1986-05-28 | Yuki Gosei Yakuhin Kogyo Kk | 標識化ヌクレオチドおよび標識化ポリヌクレオチド |
| US4596556A (en) | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| US4733665C2 (en) | 1985-11-07 | 2002-01-29 | Expandable Grafts Partnership | Expandable intraluminal graft and method and apparatus for implanting an expandable intraluminal graft |
| US5023252A (en) | 1985-12-04 | 1991-06-11 | Conrex Pharmaceutical Corporation | Transdermal and trans-membrane delivery of drugs |
| US5040548A (en) | 1989-06-01 | 1991-08-20 | Yock Paul G | Angioplasty mehtod |
| US5350395A (en) | 1986-04-15 | 1994-09-27 | Yock Paul G | Angioplasty apparatus facilitating rapid exchanges |
| US5061273A (en) | 1989-06-01 | 1991-10-29 | Yock Paul G | Angioplasty apparatus facilitating rapid exchanges |
| US4886499A (en) | 1986-12-18 | 1989-12-12 | Hoffmann-La Roche Inc. | Portable injection appliance |
| US4748982A (en) | 1987-01-06 | 1988-06-07 | Advanced Cardiovascular Systems, Inc. | Reinforced balloon dilatation catheter with slitted exchange sleeve and method |
| GB8704027D0 (en) | 1987-02-20 | 1987-03-25 | Owen Mumford Ltd | Syringe needle combination |
| US4992445A (en) | 1987-06-12 | 1991-02-12 | American Cyanamid Co. | Transdermal delivery of pharmaceuticals |
| US5001139A (en) | 1987-06-12 | 1991-03-19 | American Cyanamid Company | Enchancers for the transdermal flux of nivadipine |
| US4941880A (en) | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| US4940460A (en) | 1987-06-19 | 1990-07-10 | Bioject, Inc. | Patient-fillable and non-invasive hypodermic injection device assembly |
| US4790824A (en) | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| US5339163A (en) | 1988-03-16 | 1994-08-16 | Canon Kabushiki Kaisha | Automatic exposure control device using plural image plane detection areas |
| US5073543A (en) | 1988-07-21 | 1991-12-17 | G. D. Searle & Co. | Controlled release formulations of trophic factors in ganglioside-lipsome vehicle |
| WO1990003370A1 (en) | 1988-09-28 | 1990-04-05 | Microprobe Corporation | DERIVATIVES OF PYRAZOLO[3,4-d]PYRIMIDINE |
| CA1322628C (en) | 1988-10-04 | 1993-10-05 | Richard A. Schatz | Expandable intraluminal graft |
| FR2638359A1 (fr) | 1988-11-03 | 1990-05-04 | Tino Dalto | Guide de seringue avec reglage de la profondeur de penetration de l'aiguille dans la peau |
| GB8827305D0 (en) | 1988-11-23 | 1988-12-29 | British Bio Technology | Compounds |
| IT1229203B (it) | 1989-03-22 | 1991-07-25 | Bioresearch Spa | Impiego di acido 5 metiltetraidrofolico, di acido 5 formiltetraidrofolico e dei loro sali farmaceuticamente accettabili per la preparazione di composizioni farmaceutiche in forma a rilascio controllato attive nella terapia dei disturbi mentali organici e composizioni farmaceutiche relative. |
| PH30995A (en) | 1989-07-07 | 1997-12-23 | Novartis Inc | Sustained release formulations of water soluble peptides. |
| US5428125A (en) | 1989-07-17 | 1995-06-27 | The Dow Chemical Company | Mesogenic polycyanates and thermosets thereof |
| US5442039A (en) | 1989-07-17 | 1995-08-15 | The Dow Chemical Company | Mesogenic polycyanates and thermosets thereof |
| US5674278A (en) | 1989-08-24 | 1997-10-07 | Arterial Vascular Engineering, Inc. | Endovascular support device |
| US6344053B1 (en) | 1993-12-22 | 2002-02-05 | Medtronic Ave, Inc. | Endovascular support device and method |
| US5292331A (en) | 1989-08-24 | 1994-03-08 | Applied Vascular Engineering, Inc. | Endovascular support device |
| US5795977A (en) | 1989-09-15 | 1998-08-18 | Metabasis Therapeutics, Inc. | Water soluble adenosine kinase inhibitors |
| US5674998A (en) | 1989-09-15 | 1997-10-07 | Gensia Inc. | C-4' modified adenosine kinase inhibitors |
| US5506347A (en) | 1993-02-03 | 1996-04-09 | Gensia, Inc. | Lyxofuranosyl analogues of adenosine |
| US5763596A (en) | 1989-09-15 | 1998-06-09 | Metabasis Therapeutics, Inc. | C-4' modified adenosine kinase inhibitors |
| US5646128A (en) | 1989-09-15 | 1997-07-08 | Gensia, Inc. | Methods for treating adenosine kinase related conditions |
| US5721356A (en) | 1989-09-15 | 1998-02-24 | Gensia, Inc. | Orally active adenosine kinase inhibitors |
| US5763597A (en) | 1989-09-15 | 1998-06-09 | Metabasis Therapeutics, Inc. | Orally active adenosine kinase inhibitors |
| US5120548A (en) | 1989-11-07 | 1992-06-09 | Merck & Co., Inc. | Swelling modulated polymeric drug delivery device |
| US5312335A (en) | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| EP0507863A4 (en) | 1989-12-28 | 1993-07-07 | Virginia Commonwealth University | Sigma receptor ligands and the use thereof |
| JPH04211063A (ja) | 1990-03-05 | 1992-08-03 | Takeda Chem Ind Ltd | 縮合三環性複素環化合物、その製造法、用途及び中間体 |
| GB9009542D0 (en) | 1990-04-27 | 1990-06-20 | Beecham Group Plc | Novel compounds |
| US5733566A (en) | 1990-05-15 | 1998-03-31 | Alkermes Controlled Therapeutics Inc. Ii | Controlled release of antiparasitic agents in animals |
| GB9113137D0 (en) | 1990-07-13 | 1991-08-07 | Ici Plc | Thioxo heterocycles |
| US5563257A (en) | 1990-08-20 | 1996-10-08 | Boehringer Mannheim Gmbh | Phospholipid derivatives of nucleosides |
| DE4026265A1 (de) | 1990-08-20 | 1992-02-27 | Boehringer Mannheim Gmbh | Neue phospholipid-derivate von nucleosiden, deren herstellung sowie deren verwendung als antivirale arzneimittel |
| US5190521A (en) | 1990-08-22 | 1993-03-02 | Tecnol Medical Products, Inc. | Apparatus and method for raising a skin wheal and anesthetizing skin |
| US5652366A (en) | 1990-09-25 | 1997-07-29 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | DI (1R)-(-)camphosulfonic acid) salt, preparation thereof and use thereof |
| US5561134A (en) | 1990-09-25 | 1996-10-01 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | Compounds having antihypertensive, cardioprotective, anti-ischemic and antilipolytic properties |
| EP0550631B1 (en) | 1990-09-25 | 1997-01-02 | Rhone-Poulenc Rorer International (Holdings) Inc. | Compounds having antihypertensive and anti-ischemic properties |
| US5527288A (en) | 1990-12-13 | 1996-06-18 | Elan Medical Technologies Limited | Intradermal drug delivery device and method for intradermal delivery of drugs |
| GB9103839D0 (en) | 1991-02-23 | 1991-04-10 | Smithkline Beecham Plc | Pharmaceuticals |
| SG64322A1 (en) | 1991-05-10 | 1999-04-27 | Rhone Poulenc Rorer Int | Bis mono and bicyclic aryl and heteroaryl compounds which inhibit egf and/or pdgf receptor tyrosine kinase |
| US5714493A (en) | 1991-05-10 | 1998-02-03 | Rhone-Poulenc Rorer Pharmaceuticals, Inc. | Aryl and heteroaryl quinazoline compounds which inhibit CSF-1R receptor tyrosine kinase |
| US5710158A (en) | 1991-05-10 | 1998-01-20 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | Aryl and heteroaryl quinazoline compounds which inhibit EGF and/or PDGF receptor tyrosine kinase |
| US5721237A (en) | 1991-05-10 | 1998-02-24 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | Protein tyrosine kinase aryl and heteroaryl quinazoline compounds having selective inhibition of HER-2 autophosphorylation properties |
| USRE37650E1 (en) | 1991-05-10 | 2002-04-09 | Aventis Pharmacetical Products, Inc. | Aryl and heteroaryl quinazoline compounds which inhibit CSF-1R receptor tyrosine kinase |
| US5480883A (en) | 1991-05-10 | 1996-01-02 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | Bis mono- and bicyclic aryl and heteroaryl compounds which inhibit EGF and/or PDGF receptor tyrosine kinase |
| US6645969B1 (en) | 1991-05-10 | 2003-11-11 | Aventis Pharmaceuticals Inc. | Aryl and heteroaryl quinazoline compounds which inhibit CSF-1R receptor tyrosine kinase |
| GB9118204D0 (en) | 1991-08-23 | 1991-10-09 | Weston Terence E | Needle-less injector |
| SE9102652D0 (sv) | 1991-09-13 | 1991-09-13 | Kabi Pharmacia Ab | Injection needle arrangement |
| US5580578A (en) | 1992-01-27 | 1996-12-03 | Euro-Celtique, S.A. | Controlled release formulations coated with aqueous dispersions of acrylic polymers |
| MX9300141A (es) | 1992-01-13 | 1994-07-29 | Smithkline Beecham Corp | Compuestos de imidazol novedosos, procedimiento para su preparacion y composiciones farmaceuticas que lo contienen. |
| US5916891A (en) | 1992-01-13 | 1999-06-29 | Smithkline Beecham Corporation | Pyrimidinyl imidazoles |
| DE4204031A1 (de) | 1992-02-12 | 1993-08-19 | Boehringer Mannheim Gmbh | Neue lipidphosphonsaeure-nucleosid-konjugate sowie deren verwendung als antivirale arzneimittel |
| DE4204032A1 (de) | 1992-02-12 | 1993-08-19 | Boehringer Mannheim Gmbh | Neue liponucleotide, deren herstellunmg sowie deren verwendung als antivirale arzneimittel |
| DE69332019T2 (de) | 1992-02-13 | 2002-11-28 | Pharmacia & Upjohn Co., Kalamazoo | 4-oxo-und 4h-imidazo(5,1-c)(1,4)benzoxazine nützlich als benzodiazepinrezeptor-bindemittel. |
| US5328483A (en) | 1992-02-27 | 1994-07-12 | Jacoby Richard M | Intradermal injection device with medication and needle guard |
| WO1993018035A1 (en) | 1992-03-04 | 1993-09-16 | Abbott Laboratories | Angiotensin ii receptor antagonists |
| JP2737518B2 (ja) | 1992-03-16 | 1998-04-08 | 富士通株式会社 | 赤外線検知器の冷却構造 |
| US5294612A (en) | 1992-03-30 | 1994-03-15 | Sterling Winthrop Inc. | 6-heterocyclyl pyrazolo [3,4-d]pyrimidin-4-ones and compositions and method of use thereof |
| EP0637963B1 (en) | 1992-04-07 | 2004-08-04 | The Regents of the University of Michigan | Cd28 pathway immunoregulation |
| GB9208135D0 (en) | 1992-04-13 | 1992-05-27 | Ludwig Inst Cancer Res | Polypeptides having kinase activity,their preparation and use |
| DE69333955D1 (de) | 1992-04-24 | 2006-02-02 | Stanford Res Inst Int | Targeting homologer sequenzen in eukaryotenzellen |
| CA2117476C (en) | 1992-06-19 | 2000-02-22 | R. Andrew Wood | Infrared camera with thermoelectric temperature stabilization |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| US6057305A (en) | 1992-08-05 | 2000-05-02 | Institute Of Organic Chemistry And Biochemistry Of The Academy Of Sciences Of The Czech Republic | Antiretroviral enantiomeric nucleotide analogs |
| US5569189A (en) | 1992-09-28 | 1996-10-29 | Equidyne Systems, Inc. | hypodermic jet injector |
| US5334144A (en) | 1992-10-30 | 1994-08-02 | Becton, Dickinson And Company | Single use disposable needleless injector |
| TW333456B (en) | 1992-12-07 | 1998-06-11 | Takeda Pharm Ind Co Ltd | A pharmaceutical composition of sustained-release preparation the invention relates to a pharmaceutical composition of sustained-release preparation which comprises a physiologically active peptide. |
| TW444018B (en) | 1992-12-17 | 2001-07-01 | Pfizer | Pyrazolopyrimidines |
| US5455258A (en) | 1993-01-06 | 1995-10-03 | Ciba-Geigy Corporation | Arylsulfonamido-substituted hydroxamic acids |
| US5591767A (en) | 1993-01-25 | 1997-01-07 | Pharmetrix Corporation | Liquid reservoir transdermal patch for the administration of ketorolac |
| IL108523A0 (en) | 1993-02-03 | 1994-05-30 | Gensia Inc | Pharmaceutical compositions containing adenosine kinase inhibitors for preventing or treating conditions involving inflammatory responses and pain |
| GB9308957D0 (en) | 1993-04-30 | 1993-06-16 | Cancer Res Campaign Tech | Novel produgs |
| EP0700430B1 (en) | 1993-06-04 | 2005-04-20 | The United States of America as Represented by the Secretary of the Navy | Methods for selectively stimulating proliferation of t cells |
| US6087324A (en) | 1993-06-24 | 2000-07-11 | Takeda Chemical Industries, Ltd. | Sustained-release preparation |
| US5504103A (en) | 1993-08-25 | 1996-04-02 | Eli Lilly And Company | Inhibition of phosphatidylinositol 3-kinase with 17 β-hydroxywortmannin and analogs thereof |
| US5525503A (en) | 1993-09-28 | 1996-06-11 | Dana-Farber Cancer Institute, Inc. | Signal transduction via CD28 |
| AU6672794A (en) | 1993-11-05 | 1995-05-23 | Biochem Pharma Inc. | Antineoplastic heteronaphthoquinones |
| US5656643A (en) | 1993-11-08 | 1997-08-12 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | Bis mono-and bicyclic aryl and heteroaryl compounds which inhibit EGF and/or PDGF receptor tyrosine kinase |
| US5654307A (en) | 1994-01-25 | 1997-08-05 | Warner-Lambert Company | Bicyclic compounds capable of inhibiting tyrosine kinases of the epidermal growth factor receptor family |
| IL112249A (en) | 1994-01-25 | 2001-11-25 | Warner Lambert Co | Pharmaceutical compositions containing di and tricyclic pyrimidine derivatives for inhibiting tyrosine kinases of the epidermal growth factor receptor family and some new such compounds |
| WO1995024176A1 (en) | 1994-03-07 | 1995-09-14 | Bioject, Inc. | Ampule filling device |
| US5466220A (en) | 1994-03-08 | 1995-11-14 | Bioject, Inc. | Drug vial mixing and transfer device |
| US6632789B1 (en) | 1994-04-29 | 2003-10-14 | The United States Of America As Represented By The Secretary Of The Navy | Methods for modulating T cell responses by manipulating intracellular signal transduction |
| DE4418690A1 (de) | 1994-05-28 | 1996-01-11 | Boehringer Mannheim Gmbh | Neue Lipidester von Nucleosid-Monophosphaten und deren Verwendung als immunsuppressive Arzneimittel |
| IT1270594B (it) | 1994-07-07 | 1997-05-07 | Recordati Chem Pharm | Composizione farmaceutica a rilascio controllato di moguisteina in sospensione liquida |
| US6323201B1 (en) | 1994-12-29 | 2001-11-27 | The Regents Of The University Of California | Compounds for inhibition of ceramide-mediated signal transduction |
| US5599302A (en) | 1995-01-09 | 1997-02-04 | Medi-Ject Corporation | Medical injection system and method, gas spring thereof and launching device using gas spring |
| US5863949A (en) | 1995-03-08 | 1999-01-26 | Pfizer Inc | Arylsulfonylamino hydroxamic acid derivatives |
| DE69609602T2 (de) | 1995-04-03 | 2001-04-12 | Novartis Ag, Basel | Pyrazolderivate und verfahren zu deren herstellung |
| US6312894B1 (en) | 1995-04-03 | 2001-11-06 | Epoch Pharmaceuticals, Inc. | Hybridization and mismatch discrimination using oligonucleotides conjugated to minor groove binders |
| US5861510A (en) | 1995-04-20 | 1999-01-19 | Pfizer Inc | Arylsulfonyl hydroxamic acid derivatives as MMP and TNF inhibitors |
| US5977061A (en) | 1995-04-21 | 1999-11-02 | Institute Of Organic Chemistry And Biochemistry Of The Academy Of Sciences Of The Czech Republic | N6 - substituted nucleotide analagues and their use |
| JPH08295667A (ja) | 1995-04-27 | 1996-11-12 | Takeda Chem Ind Ltd | 複素環化合物、その製造法および剤 |
| US5593997A (en) | 1995-05-23 | 1997-01-14 | Pfizer Inc. | 4-aminopyrazolo(3-,4-D)pyrimidine and 4-aminopyrazolo-(3,4-D)pyridine tyrosine kinase inhibitors |
| WO1996037777A1 (en) | 1995-05-23 | 1996-11-28 | Nelson Randall W | Mass spectrometric immunoassay |
| US5730723A (en) | 1995-10-10 | 1998-03-24 | Visionary Medical Products Corporation, Inc. | Gas pressured needle-less injection device and method |
| US6403599B1 (en) | 1995-11-08 | 2002-06-11 | Pfizer Inc | Corticotropin releasing factor antagonists |
| AU6158096A (en) | 1995-06-07 | 1996-12-30 | G.D. Searle & Co. | Spironolactone and angiotensin ii antagonist combination the rapy for treatment of congestive heart failure |
| US5665721A (en) | 1995-06-07 | 1997-09-09 | Abbott Laboratories | Heterocyclic substituted cyclopentane compounds |
| WO1996040256A1 (en) | 1995-06-07 | 1996-12-19 | G.D. Searle & Co. | Method to treat cardiofibrosis with a combination of an angiotensin ii antagonist and spironolactone |
| DE69617235T2 (de) | 1995-06-07 | 2002-07-25 | G.D. Searle & Co., Chicago | Epoxysteroide aldosteronantagonist und angiotensin ii rezeptor antagonist kombinationstherapie zur behandlung von congestivem herzversagen |
| DE69632684T2 (de) | 1995-06-27 | 2005-06-09 | Takeda Pharmaceutical Co. Ltd. | Verfahren zur herstellung von zubereitungen mit verzögerter freisetzung |
| TW448055B (en) | 1995-09-04 | 2001-08-01 | Takeda Chemical Industries Ltd | Method of production of sustained-release preparation |
| JP2909418B2 (ja) | 1995-09-18 | 1999-06-23 | 株式会社資生堂 | 薬物の遅延放出型マイクロスフイア |
| US5763885A (en) | 1995-12-19 | 1998-06-09 | Loral Infrared & Imaging Systems, Inc. | Method and apparatus for thermal gradient stabilization of microbolometer focal plane arrays |
| JPH09143163A (ja) | 1995-11-29 | 1997-06-03 | Fuji Photo Film Co Ltd | 含窒素ヘテロ芳香族アミド類の製造方法 |
| DE69624081T2 (de) | 1995-12-20 | 2003-06-12 | Agouron Pharmaceuticals, Inc. | Matrix-metalloprotease Inhibitoren |
| US5893397A (en) | 1996-01-12 | 1999-04-13 | Bioject Inc. | Medication vial/syringe liquid-transfer apparatus |
| US5980945A (en) | 1996-01-16 | 1999-11-09 | Societe De Conseils De Recherches Et D'applications Scientifique S.A. | Sustained release drug formulations |
| US5747235A (en) | 1996-01-26 | 1998-05-05 | Eastman Kodak Company | Silver halide light sensitive emulsion layer having enhanced photographic sensitivity |
| CH690773A5 (de) | 1996-02-01 | 2001-01-15 | Novartis Ag | Pyrrolo(2,3-d)pyrimide und ihre Verwendung. |
| DE19603576A1 (de) | 1996-02-01 | 1997-08-07 | Bayer Ag | Acylierte 4-Amino und 4-Hydrazinopyrimidine |
| US5914488A (en) | 1996-03-05 | 1999-06-22 | Mitsubishi Denki Kabushiki Kaisha | Infrared detector |
| GB9607549D0 (en) | 1996-04-11 | 1996-06-12 | Weston Medical Ltd | Spring-powered dispensing device |
| ES2184960T3 (es) | 1996-05-15 | 2003-04-16 | Pfizer | Nuevas pirimidin-4-onas-(5,6)-heteroaril condensadas 2,3 disustituidas. |
| GB9611460D0 (en) | 1996-06-01 | 1996-08-07 | Ludwig Inst Cancer Res | Novel lipid kinase |
| BR9711805A (pt) | 1996-06-20 | 2002-01-15 | Regents The Univesity Of Texas | Compostos e métodos para providenciar preparações farmacologicamente ativas e uso dos mesmos |
| US6264970B1 (en) | 1996-06-26 | 2001-07-24 | Takeda Chemical Industries, Ltd. | Sustained-release preparation |
| JP3195756B2 (ja) | 1996-07-04 | 2001-08-06 | 公子 吉水 | 潤滑補助体 |
| EP0818442A3 (en) | 1996-07-12 | 1998-12-30 | Pfizer Inc. | Cyclic sulphone derivatives as inhibitors of metalloproteinases and of the production of tumour necrosis factor |
| EA199900036A1 (ru) | 1996-07-18 | 1999-06-24 | Пфайзер Инк | Ингибиторы металлопротеаз матрикса на основе фосфинатов, фармацевтическая композиция, способ лечения |
| PL331895A1 (en) | 1996-08-23 | 1999-08-16 | Pfizer | Arylosulphonylamino derivatives of hydroxamic acid |
| US6419961B1 (en) | 1996-08-29 | 2002-07-16 | Takeda Chemical Industries, Ltd. | Sustained release microcapsules of a bioactive substance and a biodegradable polymer |
| CA2217134A1 (en) | 1996-10-09 | 1998-04-09 | Sumitomo Pharmaceuticals Co., Ltd. | Sustained release formulation |
| US6342514B1 (en) | 1996-10-23 | 2002-01-29 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| US5922753A (en) | 1996-10-23 | 1999-07-13 | Zymogenetics, Inc. | Methods for treating bone deficit conditions with benzothiazole |
| US5994358A (en) | 1996-10-23 | 1999-11-30 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| US5990169A (en) | 1996-10-23 | 1999-11-23 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| US6251901B1 (en) | 1996-10-23 | 2001-06-26 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| US5948776A (en) | 1996-10-23 | 1999-09-07 | Zymogenetic, Inc. | Compositions and methods for treating bone deficit conditions |
| US6153631A (en) | 1996-10-23 | 2000-11-28 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| US5965573A (en) | 1996-10-23 | 1999-10-12 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| US5919808A (en) | 1996-10-23 | 1999-07-06 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| ATE272394T1 (de) | 1996-10-31 | 2004-08-15 | Takeda Chemical Industries Ltd | Zubereitung mit verzögerter freisetzung |
| US5858753A (en) | 1996-11-25 | 1999-01-12 | Icos Corporation | Lipid kinase |
| AU7624798A (en) | 1996-12-06 | 1998-06-29 | Vertex Pharmaceuticals Incorporated | Inhibitors of interleukin-1 beta converting enzyme |
| ZA9711385B (en) | 1996-12-20 | 1999-06-18 | Takeda Chemical Industries Ltd | Method of producing a sustained-release preparation |
| US6093737A (en) | 1996-12-30 | 2000-07-25 | Merck & Co., Inc. | Inhibitors of farnesyl-protein transferase |
| DK0950059T3 (da) | 1997-01-06 | 2004-11-01 | Pfizer | Cycliske sulfonderivater |
| JPH10206995A (ja) | 1997-01-21 | 1998-08-07 | Konica Corp | ハロゲン化銀写真感光材料 |
| US5891474A (en) | 1997-01-29 | 1999-04-06 | Poli Industria Chimica, S.P.A. | Time-specific controlled release dosage formulations and method of preparing same |
| ATE248812T1 (de) | 1997-02-03 | 2003-09-15 | Pfizer Prod Inc | Arylsulfonylhydroxamsäurederivate |
| JP2000507975A (ja) | 1997-02-07 | 2000-06-27 | ファイザー・インク | N−ヒドロキシ−β−スルホニルプロピオンアミド誘導体類及びそれらのマトリックスメタロプロテイナーゼ阻害薬としての使用 |
| AU755062B2 (en) | 1997-02-07 | 2002-12-05 | Princeton University | Engineered protein kinases which can utilize modified nucleotide triphosphate substrates |
| PL334997A1 (en) | 1997-02-11 | 2000-03-27 | Pfizer | Derivatives or arylosulphonyl-hydroxamic acid |
| CA2283961A1 (en) | 1997-03-19 | 1998-09-24 | Basf Aktiengesellschaft | Pyrrolo[2,3d]pyrimidines and their use as tyrosine kinase inhibitors |
| US7863444B2 (en) | 1997-03-19 | 2011-01-04 | Abbott Laboratories | 4-aminopyrrolopyrimidines as kinase inhibitors |
| US5993412A (en) | 1997-05-19 | 1999-11-30 | Bioject, Inc. | Injection apparatus |
| AU7449598A (en) | 1997-05-23 | 1998-12-11 | Nippon Shinyaku Co. Ltd. | Medicinal composition for prevention or treatment of hepatopathy |
| US6207679B1 (en) | 1997-06-19 | 2001-03-27 | Sepracor, Inc. | Antimicrobial agents uses and compositions related thereto |
| BR9811868A (pt) | 1997-08-08 | 2000-08-15 | Pfizer Prod Inc | Derivados de ácido ariloxiarilsulfonilamino hidroxâmico |
| EP1020445B1 (en) | 1997-10-02 | 2008-08-13 | Eisai R&D Management Co., Ltd. | Fused pyridine derivatives |
| US6649631B1 (en) | 1997-10-23 | 2003-11-18 | The Board Of Regents Of The University Of Texas System | Compositions and methods for treating bone deficit conditions |
| CA2309350C (en) | 1997-11-12 | 2007-04-03 | Mitsubishi Chemical Corporation | Purine derivatives and medicaments comprising the same as active ingredient |
| GB9725782D0 (en) | 1997-12-05 | 1998-02-04 | Pfizer Ltd | Therapeutic agents |
| IT1298087B1 (it) | 1998-01-08 | 1999-12-20 | Fiderm S R L | Dispositivo per il controllo della profondita' di penetrazione di un ago, in particolare applicabile ad una siringa per iniezioni |
| US6191170B1 (en) | 1998-01-13 | 2001-02-20 | Tularik Inc. | Benzenesulfonamides and benzamides as therapeutic agents |
| GB9801690D0 (en) | 1998-01-27 | 1998-03-25 | Pfizer Ltd | Therapeutic agents |
| AU756838B2 (en) | 1998-03-04 | 2003-01-23 | Bristol-Myers Squibb Company | Heterocyclo-substituted imidazopyrazine protein tyrosine kinase inhibitors |
| US6613358B2 (en) | 1998-03-18 | 2003-09-02 | Theodore W. Randolph | Sustained-release composition including amorphous polymer |
| JP4462654B2 (ja) | 1998-03-26 | 2010-05-12 | ソニー株式会社 | 映像素材選択装置及び映像素材選択方法 |
| US6127121A (en) | 1998-04-03 | 2000-10-03 | Epoch Pharmaceuticals, Inc. | Oligonucleotides containing pyrazolo[3,4-D]pyrimidines for hybridization and mismatch discrimination |
| US7715989B2 (en) | 1998-04-03 | 2010-05-11 | Elitech Holding B.V. | Systems and methods for predicting oligonucleotide melting temperature (TmS) |
| US6432970B2 (en) | 1998-04-09 | 2002-08-13 | Johns Hopkins University School Of Medicine | Inhibitors of hedgehog signaling pathways, compositions and uses related thereto |
| PA8469401A1 (es) | 1998-04-10 | 2000-05-24 | Pfizer Prod Inc | Derivados biciclicos del acido hidroxamico |
| PA8469501A1 (es) | 1998-04-10 | 2000-09-29 | Pfizer Prod Inc | Hidroxamidas del acido (4-arilsulfonilamino)-tetrahidropiran-4-carboxilico |
| KR19990085365A (ko) | 1998-05-16 | 1999-12-06 | 허영섭 | 지속적으로 약물 조절방출이 가능한 생분해성 고분자 미립구 및그 제조방법 |
| JP2000072773A (ja) | 1998-08-28 | 2000-03-07 | Zeria Pharmaceut Co Ltd | プリン誘導体 |
| CZ2001959A3 (cs) | 1998-09-18 | 2001-12-12 | Basf Aktiengesellschaft | 4-Aminopyrrolopyrimidiny jako inhibitory kinasy |
| US6362216B1 (en) | 1998-10-27 | 2002-03-26 | Array Biopharma Inc. | Compounds which inhibit tryptase activity |
| ES2213985T3 (es) | 1998-11-05 | 2004-09-01 | Pfizer Products Inc. | Derivados de hidroxiamida de acido 5-oxo-pirrolidin-2-carboxilico. |
| JP4876239B2 (ja) | 1999-01-11 | 2012-02-15 | プリンストン ユニバーシティー | 標的確認のための高親和性阻害剤およびその使用 |
| CZ27399A3 (cs) | 1999-01-26 | 2000-08-16 | Ústav Experimentální Botaniky Av Čr | Substituované dusíkaté heterocyklické deriváty, způsob jejich přípravy, tyto deriváty pro použití jako léčiva, farmaceutická kompozice a kombinovaný farmaceutický přípravek tyto deriváty obsahující a použití těchto derivátů pro výrobu léčiv |
| JP2002537397A (ja) | 1999-02-22 | 2002-11-05 | ベーリンガー インゲルハイム ファーマシューティカルズ インコーポレイテッド | 抗炎症剤としての多環ヘテロ環式誘導体 |
| US6248363B1 (en) | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| CN1156452C (zh) | 1999-03-12 | 2004-07-07 | 贝林格尔·英格海姆药物公司 | 作为消炎剂的化合物 |
| EP1040831A3 (en) | 1999-04-02 | 2003-05-02 | Pfizer Products Inc. | Use of corticotropin releasing factor (CRF) antagonists to prevent sudden death |
| SE515856C2 (sv) | 1999-05-19 | 2001-10-22 | Ericsson Telefon Ab L M | Bärare för elektronikkomponenter |
| IL146474A0 (en) | 1999-06-03 | 2002-07-25 | Knoll Gmbh | Benzothiazinone and benzoxazinone compounds |
| US6387894B1 (en) | 1999-06-11 | 2002-05-14 | Pfizer Inc. | Use of CRF antagonists and renin-angiotensin system inhibitors |
| TWI262914B (en) | 1999-07-02 | 2006-10-01 | Agouron Pharma | Compounds and pharmaceutical compositions for inhibiting protein kinases |
| PE20010306A1 (es) | 1999-07-02 | 2001-03-29 | Agouron Pharma | Compuestos de indazol y composiciones farmaceuticas que los contienen utiles para la inhibicion de proteina kinasa |
| EP1081137A1 (en) | 1999-08-12 | 2001-03-07 | Pfizer Products Inc. | Selective inhibitors of aggrecanase in osteoarthritis treatment |
| GB9919588D0 (en) | 1999-08-18 | 1999-10-20 | Hoechst Schering Agrevo Gmbh | Fungicidal compounds |
| US6559160B1 (en) | 1999-08-27 | 2003-05-06 | Chemocentryx, Inc. | Compounds and methods for modulating cxcr3 function |
| US20070021493A1 (en) | 1999-09-16 | 2007-01-25 | Curis, Inc. | Mediators of hedgehog signaling pathways, compositions and uses related thereto |
| EP1516876A1 (en) | 1999-09-16 | 2005-03-23 | Curis, Inc. | Mediators of hedgehog signalling pathways, compositions and uses related thereto |
| CN1390219A (zh) | 1999-09-17 | 2003-01-08 | 艾博特股份有限两合公司 | 作为治疗剂的吡唑并嘧啶类 |
| US6921763B2 (en) | 1999-09-17 | 2005-07-26 | Abbott Laboratories | Pyrazolopyrimidines as therapeutic agents |
| WO2001021160A2 (en) | 1999-09-23 | 2001-03-29 | Axxima Pharmaceuticals Aktiengesellschaft | Carboxymide and aniline derivatives as selective inhibitors of pathogens |
| US6506769B2 (en) | 1999-10-06 | 2003-01-14 | Boehringer Ingelheim Pharmaceuticals, Inc. | Heterocyclic compounds useful as inhibitors of tyrosine kinases |
| MXPA02003364A (es) | 1999-10-06 | 2002-08-23 | Boehringer Ingelheim Pharma | Compuestos heterociclicos utiles como inhibidores de las cinasas de tirosina. |
| ATE314362T1 (de) | 1999-10-12 | 2006-01-15 | Takeda Pharmaceutical | Pyrimidin-5-carboximidverbindungen, verfahren zur herstellung derselben und deren verwendung |
| AU781524B2 (en) | 1999-10-13 | 2005-05-26 | Johns Hopkins University School Of Medicine, The | Regulators of the hedgehog pathway, compositions and uses related thereto |
| CA2286451A1 (en) | 1999-10-14 | 2001-04-14 | Grant A. Mitchell | Hormone-sensitive lipase mediated male infertility |
| IL148972A0 (en) | 1999-10-14 | 2002-11-10 | Curis Inc | Mediators of hedgehog signaling pathways, compositions and uses related thereto |
| US6472153B1 (en) | 1999-10-26 | 2002-10-29 | Epoch Biosciences, Inc. | Hybridization-triggered fluorescent detection of nucleic acids |
| EP1095933A1 (en) | 1999-10-30 | 2001-05-02 | Aventis Pharma Deutschland GmbH | Novel N-guanidinoalkylamides, their preparation, their use, and pharmaceutical preparations comprising them |
| US6660845B1 (en) | 1999-11-23 | 2003-12-09 | Epoch Biosciences, Inc. | Non-aggregating, non-quenching oligomers comprising nucleotide analogues; methods of synthesis and use thereof |
| IL133809A0 (en) | 1999-12-30 | 2001-04-30 | Yeda Res & Dev | Steroidal alkaloids and pharmaceutical compositions comprising them |
| GB0002032D0 (en) | 2000-01-28 | 2000-03-22 | Zeneca Ltd | Chemical compounds |
| US7217722B2 (en) | 2000-02-01 | 2007-05-15 | Kirin Beer Kabushiki Kaisha | Nitrogen-containing compounds having kinase inhibitory activity and drugs containing the same |
| FR2804958B1 (fr) | 2000-02-15 | 2005-07-08 | Hoechst Marion Roussel Inc | Derives de xanthine, leur procede de preparation et les intermediaires de ce procede, leur application comme medicament et les compositions pharmaceutiques les renfermant |
| US6613798B1 (en) | 2000-03-30 | 2003-09-02 | Curis, Inc. | Small organic molecule regulators of cell proliferation |
| US7115653B2 (en) | 2000-03-30 | 2006-10-03 | Curis, Inc. | Small organic molecule regulators of cell proliferation |
| JP4808895B2 (ja) | 2000-03-30 | 2011-11-02 | キュリス,インコーポレイテッド | 細胞増殖の小型有機分子レギュレーター |
| US20020127625A1 (en) | 2000-03-31 | 2002-09-12 | Forskarpatent Is Syd Ab | Methods of diagnosing immune related diseases |
| US6667300B2 (en) | 2000-04-25 | 2003-12-23 | Icos Corporation | Inhibitors of human phosphatidylinositol 3-kinase delta |
| NZ522076A (en) | 2000-04-25 | 2005-08-26 | Icos Corp | Inhibitors of human phosphatidyl-inositol 3-kinase delta |
| CA2410514A1 (en) | 2000-05-30 | 2001-12-06 | Advanced Research & Technology Institute | Compositions and methods for identifying agents which modulate pten function and pi-3 kinase pathways |
| US6667398B2 (en) | 2000-06-22 | 2003-12-23 | Pfizer Inc | Process for the preparation of pyrazolopyrimidinones |
| NZ522839A (en) | 2000-06-27 | 2004-11-26 | Genelabs Tech Inc | Novel compounds possessing antibacterial, antifungal or antitumor activity |
| US6534691B2 (en) | 2000-07-18 | 2003-03-18 | E. I. Du Pont De Nemours And Company | Manufacturing process for α-olefins |
| AU2001292320A1 (en) | 2000-10-02 | 2002-04-15 | Tanabe Seiyaku Co., Ltd. | Benzylamine compound, process for producing the same, and intermediate therefor |
| CA2425663C (en) | 2000-10-11 | 2009-12-29 | Applera Corporation | Fluorescent nucleobase conjugates having anionic linkers |
| EP1578341A4 (en) | 2000-10-11 | 2005-09-28 | Tularik Inc | MODULATION OF THE CCR4 FUNCTION |
| FR2815346B1 (fr) | 2000-10-13 | 2004-02-20 | Servier Lab | Nouveaux composes aminotriazolones, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| JP2002131859A (ja) | 2000-10-19 | 2002-05-09 | Konica Corp | 撮影用赤外感光性ハロゲン化銀写真感光材料及び赤外感光性ハロゲン化銀乳剤 |
| US6890747B2 (en) | 2000-10-23 | 2005-05-10 | Warner-Lambert Company | Phosphoinositide 3-kinases |
| CN1575177A (zh) | 2000-12-11 | 2005-02-02 | 图拉里克公司 | Cxcr3拮抗剂 |
| CA2430978C (en) | 2000-12-28 | 2012-05-15 | Daiichi Pharmaceutical Co., Ltd. | Vla-4 inhibitors |
| WO2002053160A1 (en) | 2000-12-29 | 2002-07-11 | Alteon, Inc. | Method for treating glaucoma ivb |
| EP1359911A2 (en) | 2000-12-29 | 2003-11-12 | Alteon, Inc. | Method for treating fibrotic diseases or other indications ivc |
| US7105499B2 (en) | 2001-01-22 | 2006-09-12 | Merck & Co., Inc. | Nucleoside derivatives as inhibitors of RNA-dependent RNA viral polymerase |
| RS50236B (sr) | 2001-01-22 | 2009-07-15 | Merck & Co.Inc., | Nukleozidni derivati kao inhibitori rnk-zavisne rnk virusne polimeraze |
| GB0102239D0 (en) | 2001-01-29 | 2001-03-14 | Cancer Res Ventures Ltd | Methods of chemical synthisis |
| PA8539401A1 (es) | 2001-02-14 | 2002-10-28 | Warner Lambert Co | Quinazolinas como inhibidores de mmp-13 |
| PA8539501A1 (es) | 2001-02-14 | 2002-09-30 | Warner Lambert Co | Compuestos triazolo como inhibidores de mmp |
| MXPA03008560A (es) | 2001-03-22 | 2004-06-30 | Abbot Gmbh & Co Kg | Pirazolopirimidinas como agentes terapeuticos. |
| WO2002088025A1 (en) | 2001-04-26 | 2002-11-07 | New York University | Method for dissolving carbon nanotubes |
| DE60218458T2 (de) | 2001-05-08 | 2007-11-15 | Kudos Pharmaceuticals Ltd. | Isochinolinon derivate als parp inhibitoren |
| IL149462A0 (en) | 2001-05-09 | 2002-11-10 | Warner Lambert Co | Method of treating or inhibiting neutrophil chemotaxis by administering a mek inhibitor |
| US7144903B2 (en) | 2001-05-23 | 2006-12-05 | Amgen Inc. | CCR4 antagonists |
| CA2450625A1 (en) | 2001-06-13 | 2002-12-19 | Genesoft Pharmaceuticals, Inc. | Isoquinoline compounds having antiinfective activity |
| CA2450628A1 (en) | 2001-06-13 | 2002-12-19 | Genesoft Pharmaceuticals, Inc. | Benzothiophene compounds having antiinfective activity |
| AU2002312370A1 (en) | 2001-06-13 | 2002-12-23 | Roland W. Burli | Antipathogenic benzamide compounds |
| EP1463742A4 (en) | 2001-06-21 | 2006-05-10 | Ariad Pharma Inc | NEW PYRAZOLO AND PYRROLO PYRIMIDINES AND THEIR USES |
| DE10134721A1 (de) | 2001-07-17 | 2003-02-06 | Bayer Ag | Tetrahydrochinoxaline |
| IL159858A0 (en) | 2001-07-27 | 2004-06-20 | Curis Inc | Mediators of hedgehog signaling pathways, compositions and uses related thereto |
| WO2003011285A1 (en) | 2001-08-01 | 2003-02-13 | Merck & Co., Inc. | BENZIMIDAZO[4,5-f]ISOQUINOLINONE DERIVATIVES |
| WO2003020880A2 (en) | 2001-08-03 | 2003-03-13 | Abbott Laboratories | Method of identifying inhibitors of lck |
| DK3042894T1 (da) | 2001-08-10 | 2016-11-07 | Shionogi & Co | Antiviralt middel |
| JP2003073357A (ja) | 2001-09-03 | 2003-03-12 | Mitsubishi Pharma Corp | アミド化合物を含有するRhoキナーゼ阻害剤 |
| US20030199516A1 (en) | 2001-09-13 | 2003-10-23 | Genesoft, Inc. | Methods of treating infection by drug resistant bacteria |
| AUPR769501A0 (en) | 2001-09-14 | 2001-10-11 | Biomolecular Research Institute Limited | Cytokine receptor 1 |
| US8124625B2 (en) | 2001-09-14 | 2012-02-28 | Shionogi & Co., Ltd. | Method of enhancing the expression of apolipoprotein AI using olefin derivatives |
| US7101884B2 (en) | 2001-09-14 | 2006-09-05 | Merck & Co., Inc. | Tyrosine kinase inhibitors |
| US7269663B2 (en) | 2001-09-28 | 2007-09-11 | Intel Corporation | Tagging packets with a lookup key to facilitate usage of a unified packet forwarding cache |
| TWI330183B (ko) | 2001-10-22 | 2010-09-11 | Eisai R&D Man Co Ltd | |
| WO2003037891A1 (en) | 2001-11-01 | 2003-05-08 | Janssen Pharmaceutica N.V. | Heteroaryl amines as glycogen synthase kinase 3beta inhibitors (gsk3 inhibitors) |
| EA200400595A1 (ru) | 2001-11-09 | 2004-10-28 | Бёрингер Ингельхайм Фармасьютиклз, Инк. | Бензимидазолы, применяемые в качестве ингибиторов протеинкиназы |
| DE10159270A1 (de) | 2001-12-03 | 2003-06-12 | Bayer Ag | Verfahren zur Arylierung von Olefinen |
| DE10159269A1 (de) | 2001-12-03 | 2003-06-18 | Bayer Ag | Arylierung von Olefinen |
| WO2003048081A2 (en) | 2001-12-04 | 2003-06-12 | Bristol-Myers Squibb Company | Glycinamides as factor xa inhibitors |
| JP5082033B2 (ja) | 2001-12-21 | 2012-11-28 | エグゼリクシス パテント カンパニー エルエルシー | Lxrのモジュレーター |
| JP4085237B2 (ja) | 2001-12-21 | 2008-05-14 | 日本電気株式会社 | 携帯電話の利用契約システムと通信方法 |
| BR0207583A (pt) | 2001-12-26 | 2004-04-27 | Genelabs Tech Inc | Derivados de poliamida possuindo atividade antibacteriana, antifungo ou antitumor |
| US7414036B2 (en) | 2002-01-25 | 2008-08-19 | Muscagen Limited | Compounds useful as A3 adenosine receptor agonists |
| US20040043959A1 (en) | 2002-03-04 | 2004-03-04 | Bloom Laura A. | Combination therapies for treating methylthioadenosine phosphorylase deficient cells |
| US20030180924A1 (en) | 2002-03-22 | 2003-09-25 | Desimone Robert W. | Formulation of certain pyrazolo [3,4,-d] pyrimidines as kinase modulators |
| WO2003080582A2 (de) | 2002-03-26 | 2003-10-02 | Biofrontera Discovery Gmbh | Fredericamycin-derivate |
| US7166293B2 (en) | 2002-03-29 | 2007-01-23 | Carlsbad Technology, Inc. | Angiogenesis inhibitors |
| DE10217046A1 (de) | 2002-04-17 | 2003-11-06 | Bioleads Gmbh | Fredericamycin-Derivate |
| US7655674B2 (en) | 2002-04-22 | 2010-02-02 | The Johns Hopkins University | Modulators of hedgehog signaling pathways, compositions and uses related thereto |
| AU2003223012A1 (en) | 2002-04-26 | 2003-11-10 | Pfizer Products Inc. | Pyrimidine-2, 4, 6-trione metallo-proteinase inhibitors |
| US6794562B2 (en) | 2002-05-01 | 2004-09-21 | Stine Seed Farm, Inc. | Soybean cultivar 0332143 |
| US20050203110A1 (en) | 2002-05-23 | 2005-09-15 | Coleman Paul J. | Mitotic kinesin inhibitors |
| US7041676B2 (en) | 2002-06-14 | 2006-05-09 | Cytokinetics, Inc. | Compounds, compositions, and methods |
| US7265111B2 (en) | 2002-06-27 | 2007-09-04 | Sanofi-Aventis Deutschland Gmbh | Adenosine analogues and their use as pharmaceutical agents |
| CN1678311A (zh) | 2002-06-27 | 2005-10-05 | 诺沃挪第克公司 | 用作治疗剂的芳基羰基衍生物 |
| MXPA05000130A (es) | 2002-06-27 | 2005-02-17 | Novo Nordisk As | Derivados de aril-carbonilo como agentes terapeuticos. |
| DE10230917A1 (de) | 2002-07-09 | 2004-02-05 | Bioleads Gmbh | Fredericamycin-Derivate |
| WO2004006906A2 (en) | 2002-07-15 | 2004-01-22 | Combinatorx, Incorporated | Methods for the treatment of neoplasms |
| JP2006503008A (ja) | 2002-08-13 | 2006-01-26 | ワーナー−ランバート カンパニー リミティド ライアビリティー カンパニー | マトリクスメタロプロテイナーゼ阻害物質としての4−ヒドロキシキノリン誘導体 |
| EP1394159A1 (fr) | 2002-08-13 | 2004-03-03 | Warner-Lambert Company LLC | Nouveaux dérivés de thiophène, leur procédé de préparation et les compositions pharmaceutiques qui les contiennent |
| CA2495661C (en) | 2002-08-16 | 2011-06-14 | Kinacia Pty Ltd. | Inhibition of phosphoinositide 3-kinase beta |
| JP2005536553A (ja) | 2002-08-21 | 2005-12-02 | サイトキネティクス・インコーポレーテッド | 化合物、組成物および方法 |
| US20030139427A1 (en) | 2002-08-23 | 2003-07-24 | Osi Pharmaceuticals Inc. | Bicyclic pyrimidinyl derivatives and methods of use thereof |
| AU2003265853A1 (en) | 2002-08-29 | 2004-03-19 | Curis, Inc. | Hedgehog antagonists, methods and uses related thereto |
| GB0220319D0 (en) | 2002-09-02 | 2002-10-09 | Cancer Res Campaign Tech | Enzyme activated self-immolative nitrogen mustard drugs |
| JP4487774B2 (ja) | 2002-09-30 | 2010-06-23 | 萬有製薬株式会社 | 2−アミノベンズイミダゾール誘導体 |
| BR0315053A (pt) | 2002-10-03 | 2005-08-09 | Targegen Inc | Agentes vasculostáticos , composição, artigo e processo de preparação dos mesmos |
| US20050282814A1 (en) | 2002-10-03 | 2005-12-22 | Targegen, Inc. | Vasculostatic agents and methods of use thereof |
| US20040146941A1 (en) | 2002-11-04 | 2004-07-29 | Biliang Zhang | Chemical encoding technology for combinatorial synthesis |
| JP2004161716A (ja) | 2002-11-15 | 2004-06-10 | Takeda Chem Ind Ltd | Jnk阻害剤 |
| WO2004046128A1 (en) | 2002-11-21 | 2004-06-03 | Vicore Pharma Ab | New bicyclic angiotensin ii agonists |
| ATE496893T1 (de) | 2002-12-20 | 2011-02-15 | X Ceptor Therapeutics Inc | Isochinolinonderivate und deren verwendung als medikamente |
| US7071355B2 (en) | 2002-12-23 | 2006-07-04 | 4 Sc Ag | Compounds as anti-inflammatory, immunomodulatory and anti-proliferatory agents |
| US7247736B2 (en) | 2002-12-23 | 2007-07-24 | 4Sc Ag | Method of identifying inhibitors of DHODH |
| US7365094B2 (en) | 2002-12-23 | 2008-04-29 | 4Sc Ag | Compounds as anti-inflammatory, immunomodulatory and anti-proliferatory agents |
| FR2850022B1 (fr) | 2003-01-22 | 2006-09-08 | Centre Nat Rech Scient | Nouvelle utilisation de la mifepristone et de ses derives comme modulateurs de la voie de signalisation des proteines hedgehog et ses applications |
| WO2004075917A1 (ja) | 2003-02-28 | 2004-09-10 | Toudai Tlo, Ltd. | 器官または組織の線維化抑制剤 |
| WO2004078702A1 (en) | 2003-03-06 | 2004-09-16 | Dsm Ip Assets B.V. | PROCESS FOR THE PREPARATION OF AN α-AMINO CARBONYL COMPOUND |
| AR043633A1 (es) | 2003-03-20 | 2005-08-03 | Schering Corp | Ligandos de receptores de canabinoides |
| US20040242566A1 (en) | 2003-03-25 | 2004-12-02 | Syrrx, Inc. | Dipeptidyl peptidase inhibitors |
| GB0306907D0 (en) | 2003-03-26 | 2003-04-30 | Angiogene Pharm Ltd | Boireductively-activated prodrugs |
| WO2004087679A1 (en) | 2003-04-01 | 2004-10-14 | Aponetics Ag | 2, 4, 6-trisubstituted pyrimidine derivatives useful for the treatment of neoplastic and autoimmune diseases |
| US7217794B2 (en) | 2003-04-02 | 2007-05-15 | Daiamed, Inc. | Compounds and methods for treatment of thrombosis |
| WO2004089877A1 (en) | 2003-04-14 | 2004-10-21 | Astrazeneca Ab | New hydroxynaphthyl amides |
| US7317027B2 (en) | 2003-05-19 | 2008-01-08 | Sanofi-Aventis Deutschland Gmbh | Azaindole-derivatives as factor Xa inhibitors |
| US7223780B2 (en) | 2003-05-19 | 2007-05-29 | Sanofi-Aventis Deutschland Gmbh | Triazole-derivatives as blood clotting enzyme factor Xa inhibitors |
| EP1479675A1 (en) | 2003-05-19 | 2004-11-24 | Aventis Pharma Deutschland GmbH | Indazole-derivatives as factor Xa inhibitors |
| EP1646615B1 (en) | 2003-06-06 | 2009-08-26 | Vertex Pharmaceuticals Incorporated | Pyrimidine derivatives as modulators of atp-binding cassette transporters |
| US7429596B2 (en) | 2003-06-20 | 2008-09-30 | The Regents Of The University Of California | 1H-pyrrolo [2,3-D] pyrimidine derivatives and methods of use thereof |
| WO2005002585A1 (en) | 2003-07-02 | 2005-01-13 | Warner-Lambert Company Llc | Combination of an allosteric inhibitor of matrix metalloproteinase-13 and a ligand to an alpha-2-delta receptor |
| WO2005013800A2 (en) | 2003-07-15 | 2005-02-17 | The Johns Hopkins University | Elevated hedgehog pathway activity in digestive system tumors, and methods of treating digestive system tumors having elevated hedgehog pathway activity |
| GB0317951D0 (en) | 2003-07-31 | 2003-09-03 | Trigen Ltd | Compounds |
| US7208601B2 (en) | 2003-08-08 | 2007-04-24 | Mjalli Adnan M M | Aryl and heteroaryl compounds, compositions, and methods of use |
| US7501538B2 (en) | 2003-08-08 | 2009-03-10 | Transtech Pharma, Inc. | Aryl and heteroaryl compounds, compositions and methods of use |
| US20050054614A1 (en) | 2003-08-14 | 2005-03-10 | Diacovo Thomas G. | Methods of inhibiting leukocyte accumulation |
| US20050043239A1 (en) | 2003-08-14 | 2005-02-24 | Jason Douangpanya | Methods of inhibiting immune responses stimulated by an endogenous factor |
| MXPA06001758A (es) | 2003-08-15 | 2006-08-11 | Irm Llc | Anilino purinas sustituidas en la posicion 6 utiles como inhibidores de rtk. |
| US7390820B2 (en) | 2003-08-25 | 2008-06-24 | Amgen Inc. | Substituted quinolinone derivatives and methods of use |
| WO2005044181A2 (en) | 2003-09-09 | 2005-05-19 | Temple University-Of The Commonwealth System Of Higher Education | Protection of tissues and cells from cytotoxic effects of ionizing radiation by abl inhibitors |
| GB0322409D0 (en) | 2003-09-25 | 2003-10-29 | Astrazeneca Ab | Quinazoline derivatives |
| WO2005033288A2 (en) | 2003-09-29 | 2005-04-14 | The Johns Hopkins University | Hedgehog pathway antagonists |
| US20080095761A1 (en) | 2003-10-01 | 2008-04-24 | The Johns Hopkins University | Hedgehog Signaling in Prostate Regeneration Neoplasia and Metastasis |
| WO2005042700A2 (en) | 2003-10-20 | 2005-05-12 | The Johns Hopkins University | Use of hedgehog pathway inhibitors in small-cell lung cancer |
| TWI344364B (en) | 2003-11-10 | 2011-07-01 | Synta Pharmaceuticals Corp | Fused heterocyclic compounds |
| WO2005047289A1 (en) | 2003-11-17 | 2005-05-26 | Pfizer Products Inc. | Pyrrolopyrimidine compounds useful in treatment of cancer |
| US7449477B2 (en) | 2003-11-25 | 2008-11-11 | Eli Lilly And Company | 7-phenyl-isoquinoline-5-sulfonylamino derivatives as inhibitors of akt (protein kinase B) |
| EP1692112A4 (en) | 2003-12-08 | 2008-09-24 | Cytokinetics Inc | COMPOUNDS, COMPOSITIONS, AND METHODS |
| AU2004308974A1 (en) | 2003-12-22 | 2005-07-14 | Gilead Sciences, Inc. | Kinase inhibitor phosphonate conjugates |
| DE602004025504D1 (de) | 2003-12-23 | 2010-03-25 | Novartis Ag | Bicyclische heterocyclische p-38-kinase-inhibitoren |
| CA2552664A1 (en) | 2004-01-08 | 2005-07-28 | Michigan State University | Methods for treating and preventing hypertension and hypertension-related disorders |
| US20050214310A1 (en) | 2004-01-23 | 2005-09-29 | Seattle Genetics, Inc. | Melphalan prodrugs |
| CA2553724A1 (en) | 2004-02-03 | 2005-08-18 | Abbott Laboratories | Aminobenzoxazoles as therapeutic agents |
| KR20070039869A (ko) | 2004-02-03 | 2007-04-13 | 브루스 더블유. 스미스 | 용액을 사용한 포토리소그래피 방법 및 관련 시스템 |
| RU2358969C2 (ru) | 2004-02-13 | 2009-06-20 | Баниу Фармасьютикал Ко., Лтд. | Конденсированное 4-оксопиримидиновое производное |
| US20050187418A1 (en) | 2004-02-19 | 2005-08-25 | Small Brooke L. | Olefin oligomerization |
| CA2556589A1 (en) | 2004-02-24 | 2005-09-01 | Bioaxone Therapeutique Inc. | 4-substituted piperidine derivatives |
| EP1568698A1 (en) | 2004-02-27 | 2005-08-31 | Aventis Pharma Deutschland GmbH | Pyrrole-derivatives as factor Xa inhibitors |
| CN1926139A (zh) | 2004-02-27 | 2007-03-07 | 霍夫曼-拉罗奇有限公司 | 稠合吡唑衍生物 |
| EP1571154A1 (en) | 2004-03-03 | 2005-09-07 | Aventis Pharma Deutschland GmbH | Beta-aminoacid-derivatives as factor Xa inhibitors |
| EP2308879A1 (en) | 2004-04-02 | 2011-04-13 | OSI Pharmaceuticals, Inc. | 6,6-bicyclic ring substituted heterobicyclic protein kinase inhibitors |
| ES2389907T3 (es) | 2004-04-30 | 2012-11-02 | Takeda Pharmaceutical Company Limited | Compuesto de amida heterocíclica y uso del mismo como un inhibidor de MMP-13 |
| AU2005325267B2 (en) | 2004-04-30 | 2010-11-04 | Curis Inc. | Quinoxaline inhibitors of the hedgehog signalling pathway |
| DE102004022897A1 (de) | 2004-05-10 | 2005-12-08 | Bayer Cropscience Ag | Azinyl-imidazoazine |
| RS55551B1 (sr) | 2004-05-13 | 2017-05-31 | Icos Corp | Hinazolinoni kao inhibitori humane fosfatidilinozitol 3-kinaze delta |
| CA2730540A1 (en) | 2004-05-13 | 2005-12-01 | Vanderbilt University | Phosphoinositide 3-kinase delta selective inhibitors for inhibiting angiogenesis |
| JP2008500338A (ja) | 2004-05-25 | 2008-01-10 | イコス・コーポレイション | 造血細胞の異常増殖を治療及び/又は予防する方法 |
| CN101123968A (zh) | 2004-06-04 | 2008-02-13 | 艾科斯有限公司 | 肥大细胞病的治疗方法 |
| GB0413605D0 (en) | 2004-06-17 | 2004-07-21 | Addex Pharmaceuticals Sa | Novel compounds |
| CA2571824A1 (en) | 2004-07-01 | 2006-01-19 | Merck & Co., Inc. | Mitotic kinesin inhibitors |
| US20060019967A1 (en) | 2004-07-21 | 2006-01-26 | Su-Ying Wu | SARS CoV main protease inhibitors |
| WO2006015279A1 (en) | 2004-07-28 | 2006-02-09 | Neurogen Corporation | Heterocyclic diamine compounds as ligands of the melanin concentrating hormone receptor useful for the treatment of obesity, diabetes, eating and sexual disorders |
| ES2578728T3 (es) | 2004-08-27 | 2016-07-29 | Infinity Pharmaceuticals, Inc. | Proceso para la preparación de compuestos análogos de ciclopamina |
| CN102964294A (zh) | 2004-09-02 | 2013-03-13 | 遗传技术研究公司 | Hedgehog信号转导的吡啶基抑制剂 |
| GB0420722D0 (en) | 2004-09-17 | 2004-10-20 | Addex Pharmaceuticals Sa | Novel allosteric modulators |
| WO2006038865A1 (en) | 2004-10-01 | 2006-04-13 | Betagenon Ab | Nucleotide derivatives for the treatment of type 2 diabetes and other disorders |
| CA2583812A1 (en) | 2004-10-28 | 2006-05-11 | Irm Llc | Compounds and compositions as hedgehog pathway modulators |
| US8212012B2 (en) | 2004-11-03 | 2012-07-03 | University Of Kansas | Novobiocin analogues having modified sugar moieties |
| US7608594B2 (en) | 2004-11-03 | 2009-10-27 | University Of Kansas | Novobiocin analogues as anticancer agents |
| US7622451B2 (en) | 2004-11-03 | 2009-11-24 | University Of Kansas | Novobiocin analogues as neuroprotective agents and in the treatment of autoimmune disorders |
| US8212011B2 (en) | 2004-11-03 | 2012-07-03 | University Of Kansas | Novobiocin analogues |
| GB0425035D0 (en) | 2004-11-12 | 2004-12-15 | Novartis Ag | Organic compounds |
| JP2008520744A (ja) | 2004-11-19 | 2008-06-19 | ザ・レジェンツ・オブ・ザ・ユニバーシティ・オブ・カリフォルニア | 抗炎症性ピラゾロピリミジン |
| JP2008520742A (ja) | 2004-11-23 | 2008-06-19 | ピーティーシー セラピューティクス, インコーポレイテッド | Vegf産生の阻害に有用なカルバゾール誘導体、カルボリン誘導体およびインドール誘導体 |
| CN101098698A (zh) | 2004-12-01 | 2008-01-02 | 德福根有限公司 | 与离子通道尤其是Kv家族离子通道相互作用的5-羧酰胺基取代的噻唑衍生物 |
| US20060156485A1 (en) | 2005-01-14 | 2006-07-20 | The Procter & Gamble Company | Keratin dyeing compounds, keratin dyeing compositions containing them, and use thereof |
| GB0501999D0 (en) | 2005-02-01 | 2005-03-09 | Sentinel Oncology Ltd | Pharmaceutical compounds |
| AU2006214190A1 (en) | 2005-02-17 | 2006-08-24 | Icos Corporation | Phosphoinositide 3-kinase inhibitors for inhibiting leukocyte accumulation |
| US7579348B2 (en) | 2005-02-25 | 2009-08-25 | Pgxhealth, Llc | Derivatives of 8-substituted xanthines |
| US20090124654A1 (en) | 2005-03-01 | 2009-05-14 | Mjalli Adnan M M | Aryl and Heteroaryl Compounds, Compositions, Methods of Use |
| US7872050B2 (en) | 2005-03-14 | 2011-01-18 | Yaupon Therapeutics Inc. | Stabilized compositions of volatile alkylating agents and methods of using thereof |
| BRPI0608934A2 (pt) | 2005-04-06 | 2010-02-17 | Irm Llc | compostos e composições contendo diarilamina, e seu uso como moduladores de receptores nucleares de hormÈnios esteróides |
| KR100781704B1 (ko) | 2005-04-20 | 2007-12-03 | 에스케이케미칼주식회사 | 피리딘 유도체와 이의 제조방법, 및 이를 포함하는약제조성물 |
| JP2008538771A (ja) | 2005-04-25 | 2008-11-06 | インスティチュート オブ オーガニック ケミストリー アンド バイオケミストリー, アカデミー オブ サイエンシズ オブ ザ チェコ リパブリック | テロメラーゼのプロセッシビティーを向上させるための化合物の使用 |
| CN100526315C (zh) | 2005-06-16 | 2009-08-12 | 浙江医药股份有限公司新昌制药厂 | N2-喹啉或异喹啉取代的嘌呤衍生物及其制备方法和其用途 |
| US20070010523A1 (en) | 2005-06-22 | 2007-01-11 | Chemocentryx, Inc. | Azaindazole compounds and methods of use |
| DE602006015658D1 (de) | 2005-06-27 | 2010-09-02 | Amgen Inc | Entzündungshemmende arylnitrilverbindungen |
| WO2007006546A1 (en) | 2005-07-11 | 2007-01-18 | Devgen N.V. | Amide derivatives as kinase inhibitors |
| US20100190788A1 (en) | 2005-07-11 | 2010-07-29 | Olivier Defert | Amide derivatives as kinase inhitors |
| WO2007029121A2 (en) | 2005-07-21 | 2007-03-15 | Galderma Research & Development | Novel cyclopent-2-en-1-one derivatives which are ppar receptor modulators, and use thereof in pharmaceutical or cosmetic compositions |
| US20070017915A1 (en) | 2005-07-22 | 2007-01-25 | Weder Donald E | Collapsible and/or erectable substantially egg-shaped container |
| US7700552B2 (en) | 2005-07-29 | 2010-04-20 | Medivir Ab | Macrocyclic inhibitors of hepatitis C virus |
| GB0516723D0 (en) | 2005-08-15 | 2005-09-21 | Novartis Ag | Organic compounds |
| CN101243090A (zh) | 2005-08-25 | 2008-08-13 | 霍夫曼-拉罗奇有限公司 | p38 MAP激酶抑制剂及使用它的方法 |
| US20070049591A1 (en) | 2005-08-25 | 2007-03-01 | Kalypsys, Inc. | Inhibitors of MAPK/Erk Kinase |
| US20100022531A1 (en) | 2005-09-01 | 2010-01-28 | Renovis, Inc. | Novel compounds as p2x7 modulators and uses thereof |
| WO2007025534A1 (de) | 2005-09-01 | 2007-03-08 | Bioagency Ag | Fredericamycin-derivate |
| BRPI0616459A2 (pt) | 2005-09-29 | 2011-06-21 | Wyeth Corp | compostos das fórmulas i, ii, e iii; processos para o tratamento ou para a prevenção de: um estado de saúde com melhora devido à recaptação de monoamina; pelo menos um sintoma vasomotor; pelo menos um distúrbio depressivo; pelo menos uma disfunção sexual; para a prevenção de dor; de distúrbio gastrointestinal ou genitourinário; de sìndrome de fadiga crÈnica; de sìndrome de fibromialgia; de esquizofrenia; e uso de um composto |
| FR2892859B1 (fr) | 2005-10-27 | 2008-06-06 | Commissariat Energie Atomique | Procede de greffage de molecules d'interet sur des surfaces inorganiques, surfaces obtenues et applications |
| US20090156611A1 (en) | 2005-11-11 | 2009-06-18 | Licentia Ltd. | Mammalian hedgehog signaling modulators |
| AU2006315467B2 (en) | 2005-11-14 | 2013-02-07 | Curis, Inc. | Bisamide inhibitors of hedgehog signaling |
| RS51843B (sr) | 2005-11-17 | 2012-02-29 | Osi Pharmaceuticals Llc. | KONDENZOVANI BICIKLIČNI m TOR INHIBITORI |
| WO2007061763A2 (en) | 2005-11-22 | 2007-05-31 | Merck & Co., Inc. | Indole orexin receptor antagonists |
| US8642278B2 (en) | 2005-11-22 | 2014-02-04 | University Of South Florida | Inhibition of cell proliferation |
| US7572809B2 (en) | 2005-12-19 | 2009-08-11 | Hoffmann-La Roche Inc. | Isoquinoline aminopyrazole derivatives |
| US20080299113A1 (en) | 2005-12-19 | 2008-12-04 | Arnold Lee D | Combined treatment with and composition of 6,6-bicyclic ring substituted heterobicyclic protein kinase inhibitor and anti-cancer agents |
| CA2635231C (en) | 2005-12-29 | 2014-07-15 | Abbott Laboratories | Protein kinase inhibitors |
| CA2636275C (en) | 2006-01-06 | 2013-02-12 | Sepracor Inc. | Tetralone-based monoamine reuptake inhibitors |
| WO2007094912A2 (en) | 2006-01-13 | 2007-08-23 | University Of Kentucky | Bis-quaternary ammonium salts and methods for modulating neuronal nicotinic acetylcholine receptors |
| WO2007089669A2 (en) | 2006-01-26 | 2007-08-09 | Wyeth | Processes for the preparation of compounds which modulate cell proliferation |
| UY30118A1 (es) | 2006-01-31 | 2007-06-29 | Tanabe Seiyaku Co | Compueto amina trisustituido |
| EP2001880A2 (en) | 2006-03-07 | 2008-12-17 | Array Biopharma, Inc. | Heterobicyclic pyrazole compounds and methods of use |
| PL2650305T3 (pl) | 2006-03-24 | 2024-09-16 | Bioverativ Therapeutics Inc. | PC5 jako enzym przetwarzający propeptyd czynnika IX |
| EP2007373A4 (en) | 2006-03-29 | 2012-12-19 | Foldrx Pharmaceuticals Inc | INHIBITION OF ALPHA SYNUCLEINE TOXICITY |
| CA2909277A1 (en) | 2006-04-04 | 2007-10-11 | Kevan M. Shokat | Kinase antagonists |
| EP2007757B1 (en) | 2006-04-13 | 2012-10-03 | Vertex Pharmceuticals Incorporated | Thiophene-carboxamides useful as inhibitors of protein kinases |
| CA2648196A1 (en) | 2006-04-14 | 2007-10-25 | Novartis Ag | Use of biarylcarboxamides in the treatment of hedgehog pathway-related disorders |
| WO2007121453A2 (en) | 2006-04-17 | 2007-10-25 | The Regents Of The University Of California | 2-hydroxy-1-oxo 1,2 dihydro isoquinoline chelating agents |
| GB0607950D0 (en) | 2006-04-21 | 2006-05-31 | Novartis Ag | Organic compounds |
| RU2457209C2 (ru) | 2006-04-21 | 2012-07-27 | Новартис Аг | Производные пурина, предназначенные для применения в качестве агонистов аденозинового рецептора а2а |
| GB0607948D0 (en) | 2006-04-21 | 2006-05-31 | Novartis Ag | Organic compounds |
| EP2037931A2 (en) | 2006-04-25 | 2009-03-25 | Astex Therapeutics Limited | Pharmaceutical combinations of pk inhibitors and other active agents |
| WO2007125315A2 (en) | 2006-04-25 | 2007-11-08 | Astex Therapeutics Limited | Pharmaceutical compounds |
| DE102006020327A1 (de) | 2006-04-27 | 2007-12-27 | Bayer Healthcare Ag | Heterocyclisch substituierte, anellierte Pyrazol-Derivate und ihre Verwendung |
| UA93548C2 (uk) | 2006-05-05 | 2011-02-25 | Айерем Елелсі | Сполуки та композиції як модулятори хеджхогівського сигнального шляху |
| CN101448827A (zh) | 2006-05-22 | 2009-06-03 | 阿斯利康(瑞典)有限公司 | 吲哚衍生物 |
| GB0610242D0 (en) | 2006-05-23 | 2006-07-05 | Novartis Ag | Organic compounds |
| GB0610317D0 (en) | 2006-05-24 | 2006-07-05 | Medical Res Council | Antiparasitic compounds and compositions |
| ES2358043T3 (es) | 2006-05-24 | 2011-05-05 | Guardant S.R.L. | Anestésico local alcalinizado, en bolsa. |
| AU2007275682B2 (en) | 2006-07-20 | 2012-05-17 | Amgen Inc. | Substituted pyridone compounds and methods of use |
| PT2049502E (pt) | 2006-07-28 | 2012-04-02 | Novartis Ag | Quinazolinas 2,4-substituídas como inibidores da lípido cinase |
| WO2008020203A1 (en) | 2006-08-17 | 2008-02-21 | Astrazeneca Ab | Pyridinylquinaz0linamine derivatives and their use as b-raf inhibitors |
| CA2661307C (en) | 2006-08-22 | 2016-07-19 | Technion Research And Development Foundation Ltd. | Heterocyclic derivatives binding to the peripheral-type benzodiazepine receptor (pbr) |
| US7678803B2 (en) | 2006-08-24 | 2010-03-16 | Serenex, Inc. | Quinazoline derivatives for the treatment of cancer |
| WO2008025755A1 (de) | 2006-09-01 | 2008-03-06 | Basf Se | Verwendung von n-haltigen heterozyklen in dermokosmetika |
| ES2528316T3 (es) | 2006-09-01 | 2015-02-06 | Senhwa Biosciences, Inc. | Moduladores de la serina-treonina proteína quinasa y de PARP |
| EP1903044A1 (en) | 2006-09-14 | 2008-03-26 | Novartis AG | Adenosine Derivatives as A2A Receptor Agonists |
| ATE531727T1 (de) | 2006-09-18 | 2011-11-15 | Compugen Ltd | Bioaktive peptide und verfahren zu ihrer verwendung |
| WO2008047821A1 (en) | 2006-10-18 | 2008-04-24 | Takeda Pharmaceutical Company Limited | Fused heterocyclic compound |
| CN101616931B (zh) | 2006-10-31 | 2013-08-21 | 美国政府卫生与公共服务部 | Smoothened多肽及使用方法 |
| US7772180B2 (en) | 2006-11-09 | 2010-08-10 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| CN101605797A (zh) | 2006-11-13 | 2009-12-16 | 伊莱利利公司 | 治疗炎症疾病和癌症的噻吩并嘧啶酮 |
| AU2007323820B2 (en) * | 2006-11-20 | 2012-02-23 | Novartis Ag | Salts and crystal forms of 2-methyl-2-[4-(3-methyl-2-oxo-8-quinolin-3-yl-2,3-dihydro-imidazo[4,5-c]quinolin-1-yl)-phenyl] -propionitrile |
| WO2008063625A2 (en) | 2006-11-20 | 2008-05-29 | Adolor Corporation | Pyridine compounds and methods of their use |
| JP2010512331A (ja) | 2006-12-06 | 2010-04-22 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | グルココルチコイド模倣薬、それらの製造方法、医薬組成物、及びこれらの使用 |
| MX2009006397A (es) | 2006-12-14 | 2009-08-13 | Daiichi Sankyo Co Ltd | Derivados de imidazotiazol. |
| CA2672940A1 (en) | 2006-12-20 | 2008-07-10 | Schering Corporation | Novel jnk inhibitors |
| CN101600711A (zh) | 2006-12-22 | 2009-12-09 | 工业研究有限公司 | 核苷酶和磷酸化酶抑制剂的氮杂环丁烷类似物 |
| RS51655B (sr) * | 2006-12-27 | 2011-10-31 | Sanofi-Aventis | Derivati izohinolina i izohinolinona supstituisani cikloalkilaminom |
| TWI433674B (zh) | 2006-12-28 | 2014-04-11 | Infinity Discovery Inc | 環杷明(cyclopamine)類似物類 |
| JP2010516774A (ja) | 2007-01-26 | 2010-05-20 | アイアールエム・リミテッド・ライアビリティ・カンパニー | マラリア原虫関連疾患を処置するためのキナーゼ阻害剤としてのプリン化合物および組成物 |
| WO2008103354A2 (en) | 2007-02-20 | 2008-08-28 | Cropsolution, Inc. | Modulators of acetyl-coenzyme a carboxylase and methods of use thereof |
| CN101675054B (zh) | 2007-03-07 | 2014-05-14 | 无限发现股份有限公司 | 环杷明内酰胺类似物及其使用方法 |
| KR20090117957A (ko) | 2007-03-07 | 2009-11-16 | 인피니티 디스커버리, 인코포레이티드 | 헤테로시클릭 시클로파민 유사체 및 그의 사용 방법 |
| WO2008112715A2 (en) | 2007-03-12 | 2008-09-18 | Vm Discovery Inc. | Novel agents of calcium ion channel modulators |
| NZ579480A (en) | 2007-03-14 | 2012-03-30 | Exelixis Patent Co Llc | 2-Arylamino-quinazoline derivatives |
| AR065718A1 (es) | 2007-03-15 | 2009-06-24 | Novartis Ag | Compuestos heterociclicos nitrogenados,utiles en el diagnostico y tratamiento de trastornos hiperproliferativos. |
| US7705018B2 (en) | 2007-03-23 | 2010-04-27 | Amgen Inc. | Substituted quinolines and their uses in treatment of inflammatory and related conditions |
| PL2137186T3 (pl) | 2007-03-23 | 2016-09-30 | Związki heterocykliczne i ich zastosowania | |
| AU2008231384B2 (en) | 2007-03-23 | 2011-09-15 | Amgen Inc. | Heterocyclic compounds and their use |
| WO2008117050A1 (en) | 2007-03-27 | 2008-10-02 | Astrazeneca Ab | Pyrazolyl-amino-substituted pyrazines and their use for the treatment of cancer |
| US7867983B2 (en) | 2007-03-29 | 2011-01-11 | The University Of Connecticut | Methods to protect skeletal muscle against injury |
| CN101657422A (zh) | 2007-04-13 | 2010-02-24 | 塞诺菲-安万特股份有限公司 | 过渡金属催化的n-氨基吲哚的合成 |
| CN101636397B (zh) | 2007-04-13 | 2012-06-13 | 中国人民解放军军事医学科学院毒物药物研究所 | 脲类化合物、其制备方法及其医药用途 |
| WO2008131354A2 (en) | 2007-04-20 | 2008-10-30 | The Curators Of The University Of Missouri | Phytoestrogens as regulators of hedgehog signaling and methods of their use in cancer treatment |
| WO2008131779A1 (en) * | 2007-04-26 | 2008-11-06 | H. Lundbeck A/S | Isoquinolinone derivatives as nk3 antagonists |
| JP2010163361A (ja) | 2007-04-27 | 2010-07-29 | Dainippon Sumitomo Pharma Co Ltd | キノリン誘導体 |
| US7960353B2 (en) | 2007-05-10 | 2011-06-14 | University Of Kansas | Novobiocin analogues as neuroprotective agents and in the treatment of autoimmune disorders |
| WO2008147852A1 (en) | 2007-05-22 | 2008-12-04 | Taigen Biotechnology Co., Ltd. | Kinesin inhibitors |
| US7928111B2 (en) | 2007-06-08 | 2011-04-19 | Senomyx, Inc. | Compounds including substituted thienopyrimidinone derivatives as ligands for modulating chemosensory receptors |
| US9603848B2 (en) | 2007-06-08 | 2017-03-28 | Senomyx, Inc. | Modulation of chemosensory receptors and ligands associated therewith |
| EP2167058B1 (en) | 2007-06-18 | 2015-08-12 | University Of Louisville Research Foundation, Inc. | Family of pfkfb3 inhibitors with anti-neoplastic activities |
| US8557823B2 (en) | 2007-06-18 | 2013-10-15 | Advanced Cancer Therapeutics, Llc | Family of PFKFB3 inhibitors with anti-neoplastic activities |
| US8541593B2 (en) | 2007-06-21 | 2013-09-24 | Amgen Inc. | Process for making substituted 2-amino-thiazolones |
| ATE538120T1 (de) | 2007-06-26 | 2012-01-15 | Sanofi Sa | Regioselektive, metallkatalysierte synthese annelierter benzimidazole und azabenzimidazole |
| US8685962B2 (en) | 2007-07-02 | 2014-04-01 | Technion Research & Development Foundation Limited | Compositions, articles and methods comprising TSPO ligands for preventing or reducing tobacco-associated damage |
| RU2345996C1 (ru) | 2007-07-17 | 2009-02-10 | Андрей Александрович Иващенко | Аннелированные азагетероциклические амиды, включающие пиримидиновый фрагмент, способ их получения и применения |
| JP4834699B2 (ja) | 2007-07-30 | 2011-12-14 | 田辺三菱製薬株式会社 | 医薬組成物 |
| JP4846769B2 (ja) | 2007-07-30 | 2011-12-28 | 田辺三菱製薬株式会社 | 医薬組成物 |
| CA2696113A1 (en) | 2007-08-10 | 2009-04-02 | Burnham Institute For Medical Research | Tissue-nonspecific alkaline phosphatase (tnap) activators and uses thereof |
| MX2010001784A (es) | 2007-08-13 | 2010-03-15 | Metabasis Therapeutics Inc | Activadores novedosos de la glucocinasa. |
| WO2009029617A1 (en) | 2007-08-27 | 2009-03-05 | Kalypsys, Inc. | Diarylamine-substituted quinolones useful as inducible nitric oxide synthase inhibitors |
| JP5227965B2 (ja) | 2007-10-03 | 2013-07-03 | 独立行政法人理化学研究所 | ニトロトリアゾール誘導体、およびそれを用いる化合物の製造方法 |
| EP2217234A2 (en) | 2007-10-15 | 2010-08-18 | AstraZeneca AB | Combinations of mek inhibitors with mtor inhibitors |
| WO2009064802A2 (en) | 2007-11-13 | 2009-05-22 | Eli Lilly & Co. | Inhibitors of human phosphatidyl-inositol 3-kinase delta |
| WO2009078981A2 (en) | 2007-12-13 | 2009-06-25 | Sri International | Ppar-delta ligands and methods of their use |
| BRPI0820856A2 (pt) | 2007-12-13 | 2019-05-14 | Siena Bhiotech.S.P.A. | anatagonista da série de reação de hedgehog e aplicações terapêuticas dos mesmos |
| ES2587738T3 (es) | 2007-12-21 | 2016-10-26 | Ucb Biopharma Sprl | Derivados de quinoxalina y quinolina como inhibidores de quinasa |
| US7960397B2 (en) | 2007-12-28 | 2011-06-14 | Institute Of Experimental Botany, Academy Of Sciences Of The Czech Republic | 6,9-disubstituted purine derivatives and their use as cosmetics and cosmetic compositions |
| US7894450B2 (en) | 2007-12-31 | 2011-02-22 | Nortel Network, Ltd. | Implementation of VPNs over a link state protocol controlled ethernet network |
| US8193182B2 (en) | 2008-01-04 | 2012-06-05 | Intellikine, Inc. | Substituted isoquinolin-1(2H)-ones, and methods of use thereof |
| EP2240451B1 (en) | 2008-01-04 | 2017-08-09 | Intellikine, LLC | Isoquinolinone derivatives substituted with a purine useful as PI3K inhibitors |
| EA201001135A1 (ru) | 2008-01-09 | 2011-02-28 | ПиДжиИксХЭЛС ЭлЭлСи | Интратекальное лечение невропатической боли агонистами ar |
| JP5458893B2 (ja) | 2008-01-10 | 2014-04-02 | 旭硝子株式会社 | ガラス、発光装置用の被覆材および発光装置 |
| DE102008004644A1 (de) | 2008-01-16 | 2009-07-23 | Robert Bosch Gmbh | Monostatische Mehrstrahlradarsensorvorrichtung für ein Kraftfahrzeug |
| WO2009100406A2 (en) | 2008-02-07 | 2009-08-13 | Synta Pharmaceuticals Corp. | Topical formulations for the treatment of psoriasis |
| CN101983062A (zh) | 2008-02-07 | 2011-03-02 | 吉利德帕洛阿尔托股份有限公司 | 提高abca-1的化合物及其用途 |
| WO2009103022A1 (en) | 2008-02-13 | 2009-08-20 | Itherx Pharmaceuticals, Inc. | Derivatives of substituted fused ring cycloindoles and methods of their use |
| TWI444384B (zh) | 2008-02-20 | 2014-07-11 | Gilead Sciences Inc | 核苷酸類似物及其在治療惡性腫瘤上的用途 |
| US8673970B2 (en) | 2008-02-21 | 2014-03-18 | Sequoia Pharmaceuticals, Inc. | HIV protease inhibitor and cytochrome p450 inhibitor combinations |
| WO2009114870A2 (en) | 2008-03-14 | 2009-09-17 | Intellikine, Inc. | Kinase inhibitors and methods of use |
| US8993580B2 (en) | 2008-03-14 | 2015-03-31 | Intellikine Llc | Benzothiazole kinase inhibitors and methods of use |
| MX2010010151A (es) | 2008-03-20 | 2010-10-25 | Amgen Inc | Moduladores de cinasa aurora y metodo de uso. |
| WO2009118765A2 (en) | 2008-03-28 | 2009-10-01 | Panacea Biotec Limited | Novel monoamine re-uptake inhibitor |
| MX2010012583A (es) | 2008-05-30 | 2011-02-24 | Genentech Inc | Compuestos inhibidores de purina pi3k y métodos de uso. |
| US20090312406A1 (en) | 2008-06-12 | 2009-12-17 | Hsing-Pang Hsieh | Coumarin compounds and their use for treating viral infection |
| BRPI0915177A2 (pt) | 2008-06-20 | 2016-04-26 | Amgen Inc | processo para fazer 2-amino-tiazolonas substituídas |
| WO2010006086A2 (en) | 2008-07-08 | 2010-01-14 | Intellikine, Inc. | Kinase inhibitors and methods of use |
| US20110224223A1 (en) | 2008-07-08 | 2011-09-15 | The Regents Of The University Of California, A California Corporation | MTOR Modulators and Uses Thereof |
| EP2328897A1 (en) | 2008-07-16 | 2011-06-08 | Schering Corporation | Bicyclic heterocycle derivatives and their use as gpcr modulators |
| US8450344B2 (en) | 2008-07-25 | 2013-05-28 | Aerie Pharmaceuticals, Inc. | Beta- and gamma-amino-isoquinoline amide compounds and substituted benzamide compounds |
| JP2011530596A (ja) | 2008-08-11 | 2011-12-22 | プレジデント アンド フェロウズ オブ ハーバード カレッジ | tRNA合成酵素の阻害のためのハロフジノン類似体およびそれらの使用 |
| US20110190157A1 (en) | 2008-08-15 | 2011-08-04 | The Regents Of The University Of California | Biomarkers for Diagnosis and Treatment of Chronic Lymphocytic Leukemia |
| CN102186479A (zh) | 2008-09-10 | 2011-09-14 | 凯利普西斯公司 | 用于治疗疾病的组胺受体的氨基嘧啶抑制剂 |
| AU2009298877A1 (en) | 2008-09-23 | 2010-04-08 | Georgetown University | Viral and fungal inhibitors |
| CA2738429C (en) | 2008-09-26 | 2016-10-25 | Intellikine, Inc. | Heterocyclic kinase inhibitors |
| EP2177510A1 (en) | 2008-10-17 | 2010-04-21 | Universität des Saarlandes | Allosteric protein kinase modulators |
| US8476431B2 (en) | 2008-11-03 | 2013-07-02 | Itellikine LLC | Benzoxazole kinase inhibitors and methods of use |
| WO2010053998A1 (en) | 2008-11-05 | 2010-05-14 | Xenon Pharmaceuticals, Inc. | Spiro-condensed indole derivatives as sodium channel inhibitors |
| CN102271683B (zh) | 2008-11-13 | 2014-07-09 | 吉里德卡利斯托加公司 | 恶性血液病的治疗 |
| US20110269779A1 (en) | 2008-11-18 | 2011-11-03 | Intellikine, Inc. | Methods and compositions for treatment of ophthalmic conditions |
| AU2009322187B2 (en) | 2008-12-04 | 2015-02-19 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Phosphatidylinositol-3-kinase p110 delta-targeted drugs in the treatment of CNS disorders |
| US20120053164A1 (en) | 2008-12-19 | 2012-03-01 | Boehringer Ingelheim International Gmbh | Cyclic pyrimidin-4-carboxamides as ccr2 receptor antagonists for treatment of inflammation, asthma and copd |
| US8173670B2 (en) | 2009-01-13 | 2012-05-08 | Van Andel Research Institute | Methods of using substituted isoxazolo pyridinones as dissociated glucocorticoids |
| US20110135655A1 (en) | 2009-01-13 | 2011-06-09 | PHILADELPHIA HEALTH AND EDUCATION CORPORATION d/b/a Drexel University College of Medicine; | Role of PI3K p110 delta Signaling in Retroviral Infection and Replication |
| ES2598358T3 (es) | 2009-02-13 | 2017-01-27 | Ucb Pharma, S.A. | Derivados de quinolina como inhibidores de PI3K quinasa |
| TW201038569A (en) | 2009-02-16 | 2010-11-01 | Abbott Gmbh & Co Kg | Heterocyclic compounds, pharmaceutical compositions containing them, and their use in therapy |
| US20100280067A1 (en) | 2009-04-30 | 2010-11-04 | Pakala Kumara Savithru Sarma | Inhibitors of acetyl-coa carboxylase |
| JP5789252B2 (ja) | 2009-05-07 | 2015-10-07 | インテリカイン, エルエルシー | 複素環式化合物およびその使用 |
| AU2010249040B2 (en) * | 2009-05-13 | 2013-08-22 | Amgen Inc. | Heteroaryl compounds as PIKK inhibitors |
| GB0908957D0 (en) | 2009-05-22 | 2009-07-01 | Ucb Pharma Sa | Therapeutic agents |
| US8648066B2 (en) | 2009-05-22 | 2014-02-11 | Exelixis, Inc. | Benzoxazepines as inhibitors of PI3K/mTOR and methods of their use and manufacture |
| US8637499B2 (en) | 2009-05-26 | 2014-01-28 | Exelixis, Inc. | Benzoxazepines as inhibitors of PI3K/mTOR and methods of their use and manufacture |
| EP2451811A1 (en) | 2009-05-27 | 2012-05-16 | F. Hoffmann-La Roche AG | Bicyclic indole-pyrimidine pi3k inhibitor compounds selective for p110 delta, and methods of use |
| CN102459272B (zh) | 2009-05-27 | 2014-08-06 | 健泰科生物技术公司 | 对P110δ具有选择性的为PI3K抑制剂的二环嘧啶化合物和使用方法 |
| CN101602768B (zh) | 2009-07-17 | 2012-05-30 | 河南省农科院农副产品加工研究所 | 一种芝麻素和芝麻林素的提纯方法 |
| US9212177B2 (en) | 2009-08-05 | 2015-12-15 | Versitech Limited | Antiviral compounds and methods of making and using thereof |
| EP2483272A4 (en) | 2009-09-29 | 2013-09-18 | Xcovery Holding Co Llc | SELECTIVE PI3K (DELTA) INHIBITOR |
| US8106146B2 (en) | 2009-10-06 | 2012-01-31 | Medtronic, Inc. | Therapeutic polymers and methods of generation |
| ES2442369T3 (es) | 2009-11-12 | 2014-02-11 | Ucb Pharma, S.A. | Derivados de quinolina y quinoxalina como inhibidores de cinasa |
| WO2011058109A1 (en) | 2009-11-12 | 2011-05-19 | Ucb Pharma S.A. | Fused bicyclic pyrrole and imidazole derivatives as kinase inhibitors |
| EP2499129B1 (en) | 2009-11-12 | 2014-07-30 | UCB Pharma, S.A. | Quinoline and quinoxaline derivatives as kinase inhibitors |
| WO2011060304A2 (en) | 2009-11-13 | 2011-05-19 | Constar International, Inc. | Oxygen scavengers, compositions comprising the scavengers, and artcles made from the compositions |
| US20120238559A1 (en) | 2009-12-03 | 2012-09-20 | Glaxo Group Limited | Novel compounds |
| JP5848712B2 (ja) | 2009-12-11 | 2016-01-27 | ノノ インコーポレイテッド | 虚血性疾患および他の疾患を治療するための薬剤および方法 |
| JP2013514989A (ja) | 2009-12-18 | 2013-05-02 | アムジエン・インコーポレーテツド | 複素環式化合物およびその使用法 |
| CN102762548B (zh) | 2009-12-22 | 2014-11-26 | 沃泰克斯药物股份有限公司 | 磷脂酰肌醇3-激酶的异吲哚啉酮抑制剂 |
| WO2011094890A1 (en) | 2010-02-02 | 2011-08-11 | Argusina Inc. | Phenylalanine derivatives and their use as non-peptide glp-1 receptor modulators |
| CN102883602B (zh) | 2010-02-16 | 2017-07-18 | Uwm研究基金会有限公司 | 降低细菌的毒力的方法 |
| WO2011111880A1 (ko) | 2010-03-08 | 2011-09-15 | 주식회사 메디젠텍 | 세포핵에서 세포질로의 gsk3의 이동을 억제하는 화합물을 함유하는 세포핵에서 세포질로의 gsk3 이동에 의해 발생되는 질환의 치료 또는 예방용 약학적 조성물 |
| CN102206172B (zh) | 2010-03-30 | 2015-02-25 | 中国医学科学院医药生物技术研究所 | 一组取代双芳基化合物及其制备方法和抗病毒应用 |
| WO2011133729A2 (en) | 2010-04-23 | 2011-10-27 | Kineta, Inc. | Anti-viral compounds |
| BR112012026641A2 (pt) | 2010-04-23 | 2016-07-12 | Kineta Inc | compostos antivirais |
| ES2834973T3 (es) | 2010-05-04 | 2021-06-21 | Alkermes Pharma Ireland Ltd | Procedimiento de síntesis de compuestos de lactama oxidada |
| AU2011255218B2 (en) | 2010-05-21 | 2015-03-12 | Infinity Pharmaceuticals, Inc. | Chemical compounds, compositions and methods for kinase modulation |
| NZ603789A (en) | 2010-05-26 | 2015-03-27 | Sunovion Pharmaceuticals Inc | Heteroaryl compounds and methods of use thereof |
| US20120149715A1 (en) | 2010-05-28 | 2012-06-14 | Yi Tsun Richard Kao | Compounds and methods for the treatment of viral infections |
| NZ702485A (en) | 2010-06-03 | 2016-04-29 | Pharmacyclics Llc | The use of inhibitors of bruton’s tyrosine kinase (btk) |
| US20110306622A1 (en) | 2010-06-11 | 2011-12-15 | Calitoga Pharmaceuticals, Inc. | Methods of treating hematological disorders with quinazolinone compounds in selected subjects |
| WO2011163610A2 (en) | 2010-06-25 | 2011-12-29 | Rutgers, The State University Of New Jersey | Antimicrobial agents |
| BR112012033658A2 (pt) | 2010-07-05 | 2016-11-29 | Merck Patent Gmbh | derivados bipiridílicos úteis para o tratamento de doenças induzidas por quinases |
| WO2012019093A1 (en) | 2010-08-05 | 2012-02-09 | Human Biomolecular Research Institute | Synthetic compounds and methods to decrease nicotine self-administration |
| AR082799A1 (es) | 2010-09-08 | 2013-01-09 | Ucb Pharma Sa | Derivados de quinolina y quinoxalina como inhibidores de quinasa |
| US9670212B2 (en) | 2010-09-14 | 2017-06-06 | Exelixis, Inc. | Inhibitors of PI3K-delta and methods of their use and manufacture |
| WO2012054332A1 (en) | 2010-10-18 | 2012-04-26 | Millennium Pharmaceuticals, Inc. | Substituted hydroxamic acids and uses thereof |
| JP2013540145A (ja) | 2010-10-21 | 2013-10-31 | ウニベルシテート デス ザールランデス | コルチゾール依存性疾患の治療用の選択的cyp11b1阻害剤 |
| JP2013541591A (ja) | 2010-11-04 | 2013-11-14 | アムジエン・インコーポレーテツド | 複素環化合物およびそれらの使用 |
| AU2011326427B2 (en) | 2010-11-10 | 2016-01-07 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| WO2012068096A2 (en) | 2010-11-15 | 2012-05-24 | Exelixis, Inc. | Benzoxazepines as inhibitors of pi3k/mtor and methods of their use and manufacture |
| US20140066431A1 (en) | 2010-11-15 | 2014-03-06 | Exelixis, Inc. | Benzoxazepines as Inhibitors of PI3K/mTOR and Methods of Their Use and Manufacture |
| EP2643316A2 (en) | 2010-11-24 | 2013-10-02 | Exelixis, Inc. | Benzoxazepines as inhibitors of p13k/mtor and methods of their use and manufacture |
| EA201390766A1 (ru) | 2010-11-24 | 2013-11-29 | Экселиксис, Инк. | БЕНЗОКСАЗЕПИНЫ КАК ИНГИБИТОРЫ PI3K/mTOR И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ И ПОЛУЧЕНИЯ |
| DK2835131T3 (en) | 2010-12-14 | 2017-12-04 | Electrophoretics Ltd | Casein kinase 1 delta inhibitors (CK1 delta) |
| US8765978B2 (en) | 2010-12-16 | 2014-07-01 | Transitions Optical, Inc. | Method of making indeno-fused naphthol materials |
| US8987271B2 (en) | 2010-12-22 | 2015-03-24 | Eutropics Pharmaceuticals, Inc. | 2,2′-biphenazine compounds and methods useful for treating disease |
| AR084824A1 (es) | 2011-01-10 | 2013-06-26 | Intellikine Inc | Procesos para preparar isoquinolinonas y formas solidas de isoquinolinonas |
| EP2678342B1 (en) | 2011-02-25 | 2015-01-07 | Takeda Pharmaceutical Company Limited | N-substituted oxazinopteridines and oxazinopteridinones |
| US20140213630A1 (en) | 2011-03-08 | 2014-07-31 | Thomas Diacovo | Methods and pharmaceutical compositions for treating lymphoid malignancy |
| PH12013501855A1 (en) | 2011-03-11 | 2018-03-21 | Gilead Calistoga Llc | Combination therapies for hematologic malignancies |
| US20120238549A1 (en) | 2011-03-15 | 2012-09-20 | Abbott Laboratories | Nuclear Hormone Receptor Modulators |
| WO2012129562A2 (en) | 2011-03-24 | 2012-09-27 | The Scripps Research Institute | Compounds and methods for inducing chondrogenesis |
| CN102731492B (zh) | 2011-03-30 | 2016-06-29 | 江苏恒瑞医药股份有限公司 | 环己烷类衍生物、其制备方法及其在医药上的应用 |
| WO2012135753A1 (en) | 2011-04-01 | 2012-10-04 | Genentech, Inc. | Combinations of akt inhibitor compounds and erlotinib, and methods of use |
| JO3733B1 (ar) | 2011-04-05 | 2021-01-31 | Bayer Ip Gmbh | استخدام 3,2-دايهيدروايميدازو[1, 2 -c]كوينازولينات مستبدلة |
| KR101644051B1 (ko) | 2011-05-20 | 2016-08-01 | 삼성전자 주식회사 | 광전자 소자 및 적층 구조 |
| JP5832647B2 (ja) | 2011-07-01 | 2015-12-16 | ノバルティス アーゲー | がんの治療における使用のためのcdk4/6阻害剤およびpi3k阻害剤を含む併用療法 |
| HK1198443A1 (en) | 2011-07-19 | 2015-04-24 | 无限药品股份有限公司 | Heterocyclic compounds and uses thereof |
| WO2013012918A1 (en) | 2011-07-19 | 2013-01-24 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| EP2738156B1 (en) | 2011-07-26 | 2018-01-03 | Kbp Biosciences Usa Inc. | 9-aminomethyl substituted tetracycline compounds |
| WO2013013504A1 (zh) | 2011-07-26 | 2013-01-31 | 山东亨利医药科技有限责任公司 | 替加环素衍生物 |
| CA2844670A1 (en) | 2011-08-12 | 2013-02-21 | Salk Institute For Biological Studies | Neuroprotective polyphenol analogs |
| WO2013032591A1 (en) | 2011-08-29 | 2013-03-07 | Infinity Pharmaceuticals Inc. | Heterocyclic compounds and uses thereof |
| KR20140072028A (ko) | 2011-08-31 | 2014-06-12 | 노파르티스 아게 | Pi3k- 및 mek-억제제의 상승작용적 조합물 |
| WO2013044169A1 (en) | 2011-09-21 | 2013-03-28 | Nestec S.A. | Methods for determining combination therapy with il-2 for the treatment of cancer |
| MX391121B (es) | 2011-10-19 | 2025-03-19 | Pharmacyclics Llc | Uso de inhibidores de la tirosina cinasa de bruton (btk). |
| WO2013074583A1 (en) | 2011-11-14 | 2013-05-23 | The Broad Institute, Inc. | Treatment and prognosis of lymphangioleiomyomatosis |
| WO2013086131A1 (en) | 2011-12-06 | 2013-06-13 | The Trustees Of The University Of Pennsylvania | Inhibitors targeting drug-resistant influenza a |
| US8772541B2 (en) | 2011-12-15 | 2014-07-08 | University of Pittsburgh—of the Commonwealth System of Higher Education | Cannabinoid receptor 2 (CB2) inverse agonists and therapeutic potential for multiple myeloma and osteoporosis bone diseases |
| US20150011569A1 (en) | 2011-12-15 | 2015-01-08 | Philadelphia Health & Education Corporation D/B/A Drexel University College Of Medicine | NOVEL P13K p110 INHIBITORS AND METHODS OF USE THEREOF |
| TWI573792B (zh) | 2012-02-01 | 2017-03-11 | 歐陸斯迪公司 | 新穎治療劑 |
| US8940742B2 (en) | 2012-04-10 | 2015-01-27 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| JP6427097B2 (ja) | 2012-06-15 | 2018-11-21 | ザ ブリガム アンド ウィメンズ ホスピタル インコーポレイテッドThe Brigham and Women’s Hospital, Inc. | 癌を処置するための組成物および該組成物を製造するための方法 |
| US8828998B2 (en) | 2012-06-25 | 2014-09-09 | Infinity Pharmaceuticals, Inc. | Treatment of lupus, fibrotic conditions, and inflammatory myopathies and other disorders using PI3 kinase inhibitors |
| MX2015001081A (es) | 2012-07-24 | 2015-10-14 | Pharmacyclics Inc | Mutaciones asociadas a resistencia a inhibidores de la tirosina cinasa de bruton (btk). |
| EP2880448B1 (en) | 2012-08-03 | 2022-06-29 | Foundation Medicine, Inc. | Human papilloma virus as predictor of cancer prognosis |
| WO2014046617A1 (en) | 2012-09-19 | 2014-03-27 | Agency For Science, Technology And Research | Compositions and methods for treating cancer |
| US20140120060A1 (en) | 2012-11-01 | 2014-05-01 | Infinity Pharmaceuticals, Inc. | Treatment of rheumatoid arthritis and asthma using pi3 kinase inhibitors |
| RU2702908C2 (ru) | 2012-11-01 | 2019-10-14 | Инфинити Фармасьютикалз, Инк. | Лечение злокачественных опухолей с использованием модуляторов изоформ pi3-киназы |
| US20140120083A1 (en) | 2012-11-01 | 2014-05-01 | Infinity Pharmaceuticals, Inc. | Treatment of cancers using pi3 kinase isoform modulators |
| US20150283142A1 (en) | 2013-03-15 | 2015-10-08 | Infinity Pharmaceuticals, Inc. | Treatment of cancers using pi3 kinase isoform modulators |
| JP6437441B2 (ja) | 2012-11-02 | 2018-12-12 | ティージー セラピューティクス インコーポレイテッド | 抗cd20抗体およびpi3キナーゼ選択的阻害剤の組み合わせ |
| JP6434416B2 (ja) | 2012-11-08 | 2018-12-05 | ライゼン・ファーマシューティカルズ・エスアー | PDE4阻害剤とPI3δ阻害剤または二重PI3δ−γキナーゼ阻害剤とを含有する薬学的組成物 |
| CA2891013A1 (en) | 2012-11-16 | 2014-05-22 | Abdelghani Abe Achab | Purine inhibitors of human phosphatidylinositol 3-kinase delta |
| NZ710444A (en) | 2013-02-11 | 2020-08-28 | Univ California | Compositions and methods for treating neurodegenerative diseases and cardiomyopathy |
| US20160024051A1 (en) | 2013-03-15 | 2016-01-28 | Infinity Pharmaceuticals, Inc. | Salts and solid forms of isoquinolinones and composition comprising and methods of using the same |
| US9481667B2 (en) | 2013-03-15 | 2016-11-01 | Infinity Pharmaceuticals, Inc. | Salts and solid forms of isoquinolinones and composition comprising and methods of using the same |
| JP2016517404A (ja) | 2013-03-15 | 2016-06-16 | ユニベルシテ ドゥ ジュネーブ | インスリン産生の誘導方法およびその使用 |
| MX369503B (es) | 2013-04-08 | 2019-11-11 | Pharmacyclics Llc | Combinaciones que comprenden ibrutinib y abt-199 para tratar trastornos proliferativos de células b y métodos de uso de las mismas. |
| JP6227889B2 (ja) | 2013-04-23 | 2017-11-08 | 関東化學株式会社 | 新規な有機金属錯体およびアミン化合物の製造方法 |
| MX373584B (es) | 2013-05-30 | 2020-05-05 | Infinity Pharmaceuticals Inc | Tratamiento de cánceres utilizando moduladores de la isoforma pi3 cinasa. |
| EP3632208A1 (en) | 2013-06-13 | 2020-04-08 | Biomatrica, INC. | Cell stabilization |
| HK1223911A1 (zh) | 2013-06-14 | 2017-08-11 | Gilead Sciences, Inc. | 磷脂醯肌醇3-激酶抑制剂 |
| EP3012327B1 (en) | 2013-06-20 | 2020-12-16 | Taiho Pharmaceutical Co., Ltd. | METHOD FOR PREDICTING THERAPEUTIC EFFICACY OF PI3K/AKT/mTOR INHIBITOR ON BASIS OF PHLDA1 OR PIK3C2B EXPRESSION |
| UY35675A (es) | 2013-07-24 | 2015-02-27 | Novartis Ag | Derivados sustituidos de quinazolin-4-ona |
| US20150065431A1 (en) | 2013-08-27 | 2015-03-05 | Northwestern University | Reducing cutaneous scar formation and treating skin conditions |
| AU2014319921A1 (en) | 2013-09-11 | 2016-03-17 | Compugen Ltd. | Anti-VSTM5 antibodies and the use thereof in therapy and diagnosis |
| WO2015051252A1 (en) | 2013-10-03 | 2015-04-09 | Duke University | Compositions and methods for treating cancer with jak2 activity |
| WO2015051241A1 (en) | 2013-10-04 | 2015-04-09 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| EA201690713A1 (ru) | 2013-10-04 | 2016-08-31 | Инфинити Фармасьютикалз, Инк. | Гетероциклические соединения и их применения |
| JP6626437B2 (ja) | 2013-10-08 | 2019-12-25 | アセチロン ファーマシューティカルズ インコーポレイテッドAcetylon Pharmaceuticals,Inc. | ヒストンデアセチラーゼ阻害剤とHer2阻害剤またはPI3K阻害剤のいずれかの組み合わせ |
| US20150105383A1 (en) | 2013-10-10 | 2015-04-16 | Acetylon Pharmaceuticals, Inc. | HDAC Inhibitors, Alone Or In Combination With PI3K Inhibitors, For Treating Non-Hodgkin's Lymphoma |
| AU2014354769A1 (en) | 2013-11-26 | 2016-05-26 | Gilead Sciences, Inc. | Therapies for treating myeloproliferative disorders |
| CA2931431A1 (en) | 2013-12-05 | 2015-06-11 | Acerta Pharma B.V. | Therapeutic combination of a pi3k inhibitor and a btk inhibitor |
| EP3082800B1 (en) | 2013-12-20 | 2022-02-02 | Biomed Valley Discoveries, Inc. | Cancer treatment using combinations of erk and raf inhibitors |
| AU2014368925A1 (en) | 2013-12-20 | 2016-07-21 | Biomed Valley Discoveries, Inc. | Cancer treatments using combinations of MEK type I and ERK inhibitors |
| EP3984537B1 (en) | 2013-12-20 | 2024-03-20 | Biomed Valley Discoveries, Inc. | Cancer treatments using combinations of type 2 mek and erk inhibitors |
| US11007183B2 (en) | 2013-12-20 | 2021-05-18 | Biomed Valley Discoveries, Inc. | Cancer treatments using combinations of PI3K/Akt pathway and ERK inhibitors |
| WO2015095842A2 (en) | 2013-12-20 | 2015-06-25 | Biomed Valley Discoveries, Inc. | Methods and compositions for treating non-erk mapk pathway inhibitor-resistant cancers |
| WO2015095834A2 (en) | 2013-12-20 | 2015-06-25 | Biomed Valley Discoveries, Inc. | Cancer treatments using erk1/2 and bcl-2 family inhibitors |
| WO2015095807A1 (en) | 2013-12-20 | 2015-06-25 | Biomed Valley Discoveries, Inc. | Cancer treatments using combinations of egfr and erk inhibitors |
| WO2015095831A1 (en) | 2013-12-20 | 2015-06-25 | Biomed Valley Discoveries, Inc. | Cancer treatments using combinations of mtor and erk inhibitors |
| WO2015095840A1 (en) | 2013-12-20 | 2015-06-25 | Biomed Valley Discoveries, Inc. | Cancer treatments using combinations of cdk and erk inhibitors |
| AU2015206194A1 (en) | 2014-01-20 | 2016-07-28 | Gilead Sciences, Inc. | Therapies for treating cancers |
| SG11201607705XA (en) | 2014-03-19 | 2016-10-28 | Infinity Pharmaceuticals Inc | Heterocyclic compounds for use in the treatment of pi3k-gamma mediated disorders |
| KR20220025946A (ko) | 2014-03-21 | 2022-03-03 | 애브비 인코포레이티드 | 항-egfr 항체 및 항체 약물 접합체 |
| US20150320754A1 (en) | 2014-04-16 | 2015-11-12 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| US20150320755A1 (en) | 2014-04-16 | 2015-11-12 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| US10632121B2 (en) | 2014-05-16 | 2020-04-28 | Memorial Sloan Kettering Cancer Center | Platelet-derived growth factor receptor mutations and compositions and methods relating thereto |
| WO2015179772A1 (en) | 2014-05-23 | 2015-11-26 | Concert Pharmaceuticals, Inc. | Deuterated phenylquinazolinone and phenylisoquinolinone compounds |
| WO2015181053A1 (en) | 2014-05-27 | 2015-12-03 | Almirall, S.A. | Medical use |
| SG10201810723VA (en) | 2014-06-06 | 2018-12-28 | Bluebird Bio Inc | Improved t cell compositions |
| ES2774448T3 (es) | 2014-10-03 | 2020-07-21 | Novartis Ag | Terapias de combinación |
| US9708348B2 (en) | 2014-10-03 | 2017-07-18 | Infinity Pharmaceuticals, Inc. | Trisubstituted bicyclic heterocyclic compounds with kinase activities and uses thereof |
| CN114230571B (zh) | 2015-09-14 | 2025-07-08 | 无限药品股份有限公司 | 异喹啉酮的固体形式、其制备方法、包含其的组合物及其使用方法 |
-
2012
- 2012-01-10 AR ARP120100083A patent/AR084824A1/es unknown
- 2012-01-10 KR KR1020187018781A patent/KR20180080358A/ko not_active Ceased
- 2012-01-10 ES ES12734039.6T patent/ES2637113T3/es active Active
- 2012-01-10 CN CN201280012635.2A patent/CN103648499B/zh active Active
- 2012-01-10 CA CA2824197A patent/CA2824197C/en active Active
- 2012-01-10 MX MX2013008065A patent/MX347708B/es active IP Right Grant
- 2012-01-10 PH PH1/2013/501465A patent/PH12013501465A1/en unknown
- 2012-01-10 SG SG10201600179RA patent/SG10201600179RA/en unknown
- 2012-01-10 EP EP17160958.9A patent/EP3238722B1/en active Active
- 2012-01-10 EP EP12734039.6A patent/EP2663309B1/en active Active
- 2012-01-10 JP JP2013548626A patent/JP2014501790A/ja not_active Withdrawn
- 2012-01-10 KR KR1020137021000A patent/KR101875720B1/ko active Active
- 2012-01-10 TW TW101100966A patent/TWI546305B/zh active
- 2012-01-10 NZ NZ612909A patent/NZ612909A/en unknown
- 2012-01-10 SG SG2013052568A patent/SG191897A1/en unknown
- 2012-01-10 EP EP19161632.5A patent/EP3581574A1/en not_active Withdrawn
- 2012-01-10 US US13/347,423 patent/US8809349B2/en not_active Ceased
- 2012-01-10 BR BR112013017670-9A patent/BR112013017670B1/pt active IP Right Grant
- 2012-01-10 WO PCT/US2012/020831 patent/WO2012097000A1/en not_active Ceased
- 2012-01-10 TW TW105115089A patent/TWI659956B/zh active
- 2012-01-10 AU AU2012205669A patent/AU2012205669B2/en active Active
- 2012-01-10 UA UAA201309964A patent/UA115767C2/uk unknown
- 2012-01-10 TW TW107124155A patent/TWI674262B/zh active
- 2012-01-10 DK DK12734039.6T patent/DK2663309T3/en active
- 2012-01-10 PE PE2013001545A patent/PE20141303A1/es active IP Right Grant
- 2012-01-10 PE PE2017002336A patent/PE20180318A1/es unknown
-
2013
- 2013-07-09 CL CL2013002007A patent/CL2013002007A1/es unknown
- 2013-07-09 IL IL227387A patent/IL227387B/en active IP Right Grant
- 2013-07-09 ZA ZA2013/05150A patent/ZA201305150B/en unknown
-
2014
- 2014-07-09 US US14/327,499 patent/US9290497B2/en active Active
-
2016
- 2016-02-04 US US15/016,117 patent/US9840505B2/en active Active
- 2016-02-23 US US15/051,529 patent/USRE46621E1/en active Active
- 2016-11-30 JP JP2016232909A patent/JP6454672B2/ja active Active
-
2017
- 2017-10-31 US US15/799,612 patent/US10550122B2/en active Active
-
2018
- 2018-04-09 HK HK18104605.9A patent/HK1245110B/en unknown
- 2018-05-03 PH PH12018500960A patent/PH12018500960A1/en unknown
-
2020
- 2020-01-03 US US16/734,135 patent/US11312718B2/en active Active
-
2022
- 2022-03-21 US US17/699,582 patent/US20230108157A1/en not_active Abandoned
-
2024
- 2024-07-03 US US18/763,528 patent/US20250197400A1/en active Pending
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019139399A1 (ko) * | 2018-01-12 | 2019-07-18 | 보령제약 주식회사 | Pi3 키나아제 억제제 및 세포독성 항암제를 포함하는 암의 예방 또는 치료용 약학적 조성물 |
| WO2020225782A1 (ko) * | 2019-05-09 | 2020-11-12 | 보령제약 주식회사 | 무정형의 pi3k 저해제 및 이를 포함하는 약학적 조성물 |
| WO2020225783A1 (ko) * | 2019-05-09 | 2020-11-12 | 보령제약 주식회사 | Pi3k 저해제의 결정다형 및 이의 제조방법 |
| WO2020234756A1 (ko) * | 2019-05-20 | 2020-11-26 | 보령제약 주식회사 | 피리도-피리미딘 유도체 및 이를 유효성분으로 포함하는 pi3k 관련 질환의 예방 또는 치료용 약학적 조성물 |
| KR20200133528A (ko) * | 2019-05-20 | 2020-11-30 | 보령제약 주식회사 | 피리미도-피리미딘 유도체 및 이를 유효성분으로 포함하는 pi3k 관련 질환의 예방 또는 치료용 약학적 조성물 |
| CN114144415A (zh) * | 2019-05-20 | 2022-03-04 | 保宁制药株式会社 | 吡啶并嘧啶衍生物和包含其作为活性成分的用于预防或治疗pi3激酶相关疾病的药物组合物 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20250197400A1 (en) | Processes for preparing isoquinolinones and solid forms of isoquinolinones | |
| HK1245110A1 (en) | Solid forms of isoquinolinones | |
| KR20140063605A (ko) | 헤테로사이클릭 화합물 및 그의 용도 | |
| EP2637669A2 (en) | Heterocyclic compounds and uses thereof | |
| AU2015258280B2 (en) | Processes for preparing isoquinolinones and solid forms of isoquinolinones | |
| HK40018195A (en) | A composition for oral administration for use in the treatment of cancer, an inflammatory disease or an auto-immune disease | |
| HK1191251B (en) | Processes for preparing isoquinolinones and solid forms of isoquinolinones | |
| HK1191251A (en) | Processes for preparing isoquinolinones and solid forms of isoquinolinones |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20130808 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| N231 | Notification of change of applicant | ||
| PN2301 | Change of applicant |
Patent event date: 20131014 Comment text: Notification of Change of Applicant Patent event code: PN23011R01D |
|
| PG1501 | Laying open of application | ||
| A201 | Request for examination | ||
| PA0201 | Request for examination |
Patent event code: PA02012R01D Patent event date: 20170110 Comment text: Request for Examination of Application |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20170710 Patent event code: PE09021S01D |
|
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration |
Patent event code: PE07011S01D Comment text: Decision to Grant Registration Patent event date: 20180330 |
|
| A107 | Divisional application of patent | ||
| GRNT | Written decision to grant | ||
| PA0104 | Divisional application for international application |
Comment text: Divisional Application for International Patent Patent event code: PA01041R01D Patent event date: 20180702 |
|
| PR0701 | Registration of establishment |
Comment text: Registration of Establishment Patent event date: 20180702 Patent event code: PR07011E01D |
|
| PR1002 | Payment of registration fee |
Payment date: 20180703 End annual number: 3 Start annual number: 1 |
|
| PG1601 | Publication of registration | ||
| PR1001 | Payment of annual fee |
Payment date: 20220622 Start annual number: 5 End annual number: 5 |
|
| PR1001 | Payment of annual fee |
Payment date: 20240620 Start annual number: 7 End annual number: 7 |