JP6178317B2 - リチウムイオン電池 - Google Patents
リチウムイオン電池 Download PDFInfo
- Publication number
- JP6178317B2 JP6178317B2 JP2014528660A JP2014528660A JP6178317B2 JP 6178317 B2 JP6178317 B2 JP 6178317B2 JP 2014528660 A JP2014528660 A JP 2014528660A JP 2014528660 A JP2014528660 A JP 2014528660A JP 6178317 B2 JP6178317 B2 JP 6178317B2
- Authority
- JP
- Japan
- Prior art keywords
- positive electrode
- lithium
- carbonate
- lithium ion
- electrolyte composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G53/00—Compounds of nickel
- C01G53/40—Complex oxides containing nickel and at least one other metal element
- C01G53/42—Complex oxides containing nickel and at least one other metal element containing alkali metals, e.g. LiNiO2
- C01G53/44—Complex oxides containing nickel and at least one other metal element containing alkali metals, e.g. LiNiO2 containing manganese
- C01G53/54—Complex oxides containing nickel and at least one other metal element containing alkali metals, e.g. LiNiO2 containing manganese of the type (Mn2O4)-, e.g. Li(NixMn2-x)O4 or Li(MyNixMn2-x-y)O4
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
- H01M10/0525—Rocking-chair batteries, i.e. batteries with lithium insertion or intercalation in both electrodes; Lithium-ion batteries
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/056—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes
- H01M10/0564—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes the electrolyte being constituted of organic materials only
- H01M10/0566—Liquid materials
- H01M10/0567—Liquid materials characterised by the additives
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/056—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes
- H01M10/0564—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes the electrolyte being constituted of organic materials only
- H01M10/0566—Liquid materials
- H01M10/0569—Liquid materials characterised by the solvents
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/485—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of mixed oxides or hydroxides for inserting or intercalating light metals, e.g. LiTi2O4 or LiTi2OxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/50—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese
- H01M4/505—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese of mixed oxides or hydroxides containing manganese for inserting or intercalating light metals, e.g. LiMn2O4 or LiMn2OxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/52—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron
- H01M4/525—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron of mixed oxides or hydroxides containing iron, cobalt or nickel for inserting or intercalating light metals, e.g. LiNiO2, LiCoO2 or LiCoOxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/026—Electrodes composed of, or comprising, active material characterised by the polarity
- H01M2004/028—Positive electrodes
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- General Physics & Mathematics (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- Physics & Mathematics (AREA)
- Organic Chemistry (AREA)
- Materials Engineering (AREA)
- Secondary Cells (AREA)
- Battery Electrode And Active Subsutance (AREA)
Description
(a)筐体と;
(b)筐体中に配置され、互いに伝導性接触する負極および正極であって、正極は、スピネル構造を有するリチウム含有マンガン複合酸化物を活物質として含むマンガン正極であり、リチウム含有マンガン複合酸化物が式
LizMn1.5NixMyO4−d
(式中、Mは、Al、Cr、Fe、Ga、Zn、Co、Nb、Mo、Ti、Zr、Mg、V、およびCuからなる群から選択される少なくとも1種類の金属であり、0.38≦x<0.5、0<y≦0.12、0≦d≦0.3、および0.00<z≦1.1であり、zは、充電および放電の間のリチウムイオンおよび電子の放出および取り込みにより変化する)
で表される、負極および正極と;
(c)筐体中に配置され、負極および正極の間にイオン伝導性通路を提供する非水電解質組成物であって、少なくとも1種類の電解質塩、ならびに少なくとも1種類のフッ素化非環式カルボン酸エステルおよび/または少なくとも1種類のフッ素化非環式カーボネートを含む非水電解質組成物と;
(d)負極および正極の間の多孔質セパレータと、
を含むリチウムイオン電池が提供される。
(a)筐体と;
(b)筐体中に配置され、互いに伝導性接触する負極および正極であって、正極は、スピネル構造を有するリチウム含有マンガン複合酸化物を活物質として含むマンガン正極であり、リチウム含有マンガン複合酸化物が式
LizNixMyMn2−x−yO4−d (式IB)
(式中、zは0.03〜1.0であり;zは、充電および放電の間のリチウムイオンおよび電子の放出および取り込みにより変化し;xは0.3〜0.6であり;Mは、Cr、Fe、Co、Li、Al、Ga、Nb、Mo、Ti、Zr、Mg、Zn、V、およびCuの1つまたは複数を含み;yは0.01〜0.18であり、dは0〜0.3である)
で表される、負極および正極と;
(c)筐体中に配置され、負極および正極の間にイオン伝導性通路を提供する非水電解質組成物であって、少なくとも1種類の電解質塩、ならびに少なくとも1種類のフッ素化非環式カルボン酸エステルおよび/または少なくとも1種類のフッ素化非環式カーボネートを含む非水電解質組成物と;
(d)負極および正極の間の多孔質セパレータと、
を含むリチウムイオン電池が本発明において提供される。
(a)筐体と;
(b)筐体中に配置され、互いに伝導性接触する負極および正極であって、正極は、スピネル構造を有するリチウム含有マンガン複合酸化物を活物質として含むマンガン正極であり、リチウム含有マンガン複合酸化物が式
LiMn1.5NixMyO4
(式中、Mは、Al、Cr、Fe、Ga、およびZnからなる群から選択される少なくとも1種類の金属であり、0.4≦x<0.5、および0<y≦0.1であり)
で表される、負極および正極と;
(c)筐体中に配置され、負極および正極の間にイオン伝導性通路を提供する非水電解質組成物であって、少なくとも1種類の電解質塩、ならびに少なくとも1種類のフッ素化非環式カルボン酸エステルおよび/または少なくとも1種類のフッ素化非環式カーボネートを含む非水電解質組成物と;
(d)負極および正極の間の多孔質セパレータと、
を含むリチウムイオン電池が本発明において提供される。
R1−−−C(O)O−−−R2
(式中、R1は、CH3、CH2CH3,CH2CH2CH3、CH(CH3)2、CF3CF2H、CFH2、CF2R3、CFHR3、およびCH2Rfからなる群から選択され、R2は、独立してCH3、CH2CH3、CH2CH2CH3、CH(CH3)2、およびCH2Rfからなる群から選択され、R3は、少なくとも1つのフッ素で置換されていてもよいC1〜C3アルキル基であり、Rfは、少なくとも1つのフッ素で置換されたC1〜C3アルキル基であり、さらにR1またはR2の少なくとも1つは、少なくとも1つのフッ素を含有し、R1がCF2Hである場合、R2はCH3ではない)
で表すことができ、および/または
フッ素化非環式カーボネートは以下の構造式:
R4−−−O−C(O)O−−−R5
(式中、R4およびR5は、独立して、CH3、CH2CH3、CH2CH2CH3、CH(CH3)2、およびCH2Rfからなる群から選択され、Rfは、少なくとも1つのフッ素で置換されたC1〜C3アルキル基であり、さらにR4またはR5の少なくとも1つは少なくとも1つのフッ素を含有する)
で表すことができ;および
LizMn1.5NixMyO4−d (式IA)
(式中、Mは、Al、Cr、Fe、Ga、Zn、Co、Nb、Mo、Ti、Zr、Mg、V、およびCuからなる群から選択される少なくとも1種類の金属であり、0.38≦x<0.5、0<y≦0.12、0≦d≦0.3、0.00<z≦1.1であり、zは、充電および放電の間のリチウムイオンおよび電子の放出および取り込みにより変化する)
で表される。
LizNixMyMn2−x−yO4−d (式IB)
(式中、zは0.03〜1.0であり;zは、充電および放電の間のリチウムイオンおよび電子の放出および取り込みにより変化し;xは0.3〜0.6であり;Mは、Cr、Fe、Co、Li、Al、Ga、Nb、Mo、Ti、Zr、Mg、Zn、V、およびCuの1つまたは複数を含み;yは0.01〜0.18であり、dは0〜0.3である)
の酸化物を含む。一実施形態においては、上記式中、xは0.38〜0.48であり、yは0.03〜0.12であり、dは0〜0.1である。一実施形態においては、上記フォーマル(formal)中、Mは、Li、Cr、Fe、Co、およびGaの1つまたは複数である。
R1−−−C(O)O−−−R2 (式IIA)
(式中、R1は、CH3、CH2CH3、CH2CH2CH3、CH(CH3)2、CF3、CF2H、CFH2、CF2R3、CFHR3、およびCH2Rfからなる群から選択され、R2は、独立して、CH3、CH2CH3、CH2CH2CH3、CH(CH3)2、およびCH2Rfからなる群から選択され、R3は、少なくとも1つのフッ素で置換されていてもよいC1〜C3アルキル基であり、Rfは、少なくとも1つのフッ素で置換されたC1〜C3アルキル基であり、さらにR1またはR2の少なくとも1つは少なくとも1つのフッ素を含有し、R1がCF2Hである場合、R2はCH3ではない)
で表すことができる。
R8−−C(O)O−−R9 (式IIB)
(式中、R8およびR9は、独立して、アルキル基を表し、R8およびR9の中の炭素原子の合計は2〜7であり、R8および/またはR9の中の少なくとも2つの水素フッ素で置換されており、R8およびR9はいずれもFCH2基およびFCH基を含有しない)
で表すことができる。
CH3C(O)OCH2CF2H(酢酸2,2,−ジフルオロエチル、CAS No.1550−44−3)、
CH3C(O)OCH2CF3(酢酸2,2,2−トリフルオロエチル、CAS No.406−95−1)、および
CH3C(O)OCH2CF2CF2H(酢酸2,2,3,3−テトラフルオロプロピル、CAS No.681−58−3)
からなる群の1つまたは複数のメンバーから選択される。
R4−−−O−C(O)O−−−R5 (式III)
(式中、R4およびR5は、独立して、CH3、CH2CH3、CH2CH2CH3、CH(CH3)2、およびCH2Rfからなる群から選択され、Rfは、C1〜C3アルキル基であり、さらにR4またはR5の少なくとも1つは少なくとも1つのフッ素を含有する)
で表すことができる。
CH3OC(O)OCH2CF2H(メチル2,2−ジフルオロエチルカーボネート、CAS No.916678−13−2)、
CH3OC(O)OCH2CF3(メチル2,2,2−トリフルオロエチルカーボネート、CAS No.156783−95−8)、および
CH3OC(O)OCH2CF2CF2H(メチル2,2,3,3−テトラフルオロプロピルカーボネート、CAS No.156783−98−1)
からなる群の1つまたは複数のメンバーから選択される。
ヘキサフルオロリン酸リチウム、LiPF3(CF2CF3)3、
ビス(トリフルオロメタンスルホニル)イミドリチウム、
ビス(パーフルオロエタンスルホニル)イミドリチウム、
(フルオロスルホニル)(ノナフルオロブタンスルホニル)イミドリチウム、
ビス(フルオロスルホニル)イミドリチウム、
テトラフルオロホウ酸リチウム、
過塩素酸リチウム、
ヘキサフルオロヒ酸リチウム、
トリフルオロメタンスルホン酸リチウム、
トリス(トリフルオロメタンスルホニル)メチドリチウム、
ビス(オキサラト)ホウ酸リチウム、
ジフルオロ(オキサラト)ホウ酸リチウム、
Li2B12F12−xHx(式中、xは0〜8である)、および
フッ化リチウムとB(OC6F5)3などの陰イオン受容体との混合物
が挙げられるが、これらに限定されるものではない。
フルオロエチレンカーボネート(本明細書では4−フルオロ−1,3−ジオキソラン−2−オンと記載される場合もある、CAS No.114435−02−8)ならびにそのハロゲン化、C1〜C3、およびハロゲン化C1〜C3誘導体、
硫酸エチレン、ならびにそのハロゲン化、C1〜C3、およびハロゲン化C1〜C3誘導体、
ビニルエチレンカーボネート、ならびにそのハロゲン化、C1〜C3、およびハロゲン化C1〜C3誘導体、
ビニレンカーボネート、ならびにそのハロゲン化、C1〜C3、およびハロゲン化C1〜C3誘導体、
無水マレイン酸、ならびにそのハロゲン化、C1〜C3、およびハロゲン化C1〜C3誘導体、ならびに
酢酸ビニル
が挙げられるが、これらに限定されるものではない。
Liuら(J.Phys.Chem.C 113,15073−15079,2009)により記載される水酸化物前駆体法によって、鉄をドープしたLiMn1.5Ni0.5O4を合成した。この方法では、7.352gのMn(CH3COO)2・4H2O、2.090gのNi(CH3COO)2・4H2O、および0.278gのFe(CH3COO)2を含有する100mLの溶液に3.0MのKOH溶液200mLを滴下することによって、この溶液から水酸化物前駆体を沈殿させた。得られた沈殿物を濾過によって回収し、脱イオン水で十分に洗浄し、次にオーブン中で乾燥させて、3.591gの遷移金属水酸化物を得た。
前述のようにして作製したLiMn1.5Ni0.42Fe0.08O4(2.08g)正極活物質、0.26gのDenka black(アセチレンブラック、日本のDENKA Corp.より入手)、2.16gのポリ二フッ化ビニリデン(PVDF)溶液(N−メチルピロリドン(NMP)中12重量%、Kureha America Inc.,New York,NY、KFL#1120)、および追加の2.93gのNMPを、最初に遊星遠心ミキサー(シンキーARE−310、株式会社シンキー、日本)を2,000rpmで使用して混合し、次に剪断ミキサー(IKA(登録商標)Works,Wilmington,NC)を用いて混合して、均一なスラリーを形成した。ドクターブレードゲートを用いてこのスラリーをアルミニウム箔上にコーティングし、コンベクションオーブン中100℃で10〜15分間乾燥させた。得られた電極を周囲温度において直径102mmの鋼製ロールの間で370kgのニップ力でカレンダーした(calendared)。電極を真空オーブン中90℃で−25インチHg(−85kPa)において6時間さらに乾燥させた。
Matrix Scientific(Columbia,SC)より入手した酢酸2,2−ジフルオロエチルを、回転バンド蒸留で2回精製することで、炎イオン化検出器を用いたガスクロマトグラフィーで測定して99.99%の純度まで精製した。精製した酢酸2,2−ジフルオロエチル(7.32g)および3.10gのエチレンカーボネート(99%、無水、Sigma−Aldrich,Milwaukee,WI)を互いに混合した。得られた溶液9.0mLに、1.35gのヘキサフルオロリン酸リチウム(99.99%電池グレード、Sigma−Aldrich)を加え、固体がすべて溶解するまでその混合物を数分間振り混ぜた。
China LangChem INC(Shanghai,China)より入手した4−フルオロ−1,3−ジオキソラン−2−オンを減圧蒸留によって精製した。精製した4−フルオロ−1,3−ジオキソラン−2−オン(0.053g)を5.30gの前述の非水電解質組成物に加え、その混合物を数分間振り混ぜた。
ドライボックス中で、クロロホルメート(232.0g、Sigma−Aldrich)を、0〜15℃において2,2,2−トリフルオロエタノール(202.0g、Sigma−Aldrich)と、ピリジン(194.0g、無水、Sigma−Aldrich)と、ジクロロメタン(1.5L、無水、EMD Chemicals,Gibbstown,NJとの溶液に加えた。その混合物を室温で週末の間撹拌した。NMR分析用のサンプルを採取すると、2,2,2−トリフルオロエタノールの変換が100%であることが示された。混合物を濾過した。回収した固体をジクロロメタンで洗浄し、1つにまとめた有機液体濾液を50mLの5%HClで5回洗浄した。NMR分析用のサンプルを採取すると、ピリジンが検出された。次に有機液体濾液を25mLの5%HClでさらに4回洗浄した後には、NMRでピリジンは検出されなかった。有機液体濾液をブライン(50mL)で洗浄した。回転蒸発によってジクロロメタンを有機液体濾液から除去した。得られた粗生成物(273g)をモレキュラーシーブ上で乾燥させ、次に回転バンド蒸留塔蒸留によって2回精製した。純粋な材料(101.6g)が得られ、これを電解質組成物に使用した。
メチル2,2,2−トリフルオロエチルカーボネート(10.0g)を週末の間4Aモレキュラーシーブ(1.0g)上で乾燥させ、次に、4Aモレキュラーシーブ(1.0g)上でさらに終夜乾燥させた。乾燥させたメチル2,2,2−トリフルオロエチルカーボネートを、次にシリンジを用いてPTFE(ポリテトラフルロエチレン(polytetrafluroethylene))フィルタープレートで濾過した。乾燥させ、濾過したメチル2,2,2−トリフルオロエチルカーボネート(2.80g)をエチレンカーボネート(Novolyte、1.20g)と混合し、すべての固体が溶解するまで、得られた溶媒混合物を振り混ぜた。2mLのGCバイアル(オーブン乾燥した)にLiPF6(0.076g、Novolyte、Cleveland OH)を加え、続いて1.0mLの上記溶媒混合物を加えた。得られた混合物の正味重量は1.36gであった。すべての固体が溶解するまで混合物を振り混ぜた。上記混合物に、4−フルオロ−1,3−ジオキソラン−2−オン(14mg、LongChem、Shanghai、China、減圧蒸留により精製した)を加えた。得られた非水電解質組成物を振り混ぜし、ドライボックス中で保管した。
SynQuest Laboratories(Alachua FL)より入手した酢酸2,2,2−トリフルオロエチル(CH3C(O)OCH2CF3)を回転バンド蒸留塔蒸留で2回精製することで、炎イオン化検出器を用いたガスクロマトグラフィーで測定して99.9%の純度まで精製した。精製した酢酸2,2,2−トリフルオロエチル(10.0g)を週末の間4Aモレキュラーシーブ(1.0g)上で乾燥させ、4Aモレキュラーシーブ(1.0g)でさらに終夜乾燥させた。精製し乾燥させた酢酸2,2,2−トリフルオロエチルを、次にシリンジを用いてPTFEフィルタープレートで濾過した。濾過した材料(2.80g)をエチレンカーボネート(Novolyte、1.20g)と混合し、すべての固体が溶解するまで、得られた溶媒混合物を振り混ぜた。2mLのGCバイアル(オーブン乾燥した)にLiPF6(0.076g、Novolyte、Cleveland OH)を加え、続いて1.0mLの上記溶媒混合物を加えた。得られた混合物の正味重量は1.38gであった。すべての固体が溶解するまで混合物を振り混ぜた。この混合物に、4−フルオロ−1,3−ジオキソラン−2−オン(14mg、LongChem、Shanghai、China、減圧蒸留で精製した)を加えた。得られた非水電解質組成物を振り混ぜ、ドライボックス中で保管した。
窒素保護下で、オーバーヘット撹拌装置を取り付け水浴で冷却したオーブン乾燥済みの2Lの3口フラスコ中の2,2−ジフルオロエタノール(113.9.0g、Matrix Scientific、Columbia SC、回転バンド蒸留塔蒸留で精製した)と、ピリジン(113.9g、無水、Sigma−Aldrich)と、ジクロロメタン(0.80L、無水、EMD Chemicals、Gibbstown NJ)との溶液に、クロロホルメート(136.1g、Sigma−Aldrich)をシリンジポンプで3時間かけてゆっくりと加えた。得られた混合物を室温で終夜撹拌した。NMR分析用のサンプルを採取すると、2,2−ジフルオロエタノールが検出されないことが分かった。混合物を濾過し、濾液を100mLの10%HClで洗浄し、続いて、50mLの10%HClでさらに2回洗浄した。NMR分析用のサンプルを採取すると、ピリジンが検出されないことが分かった。次に濾液を50mLの5%Na2CO3溶液、次に100mLのブラインで洗浄した。その有機層を無水MgSO4(50g)上で2時間乾燥させ、次にモレキュラーシーブ(4A、50g)上で終夜乾燥させた。乾燥させた溶液を回転蒸発させてジクロロメタンを除去した。得られた粗生成物(208g)を回転バンド蒸留塔蒸留によって精製した。純粋な生成物(101.7g)が得られ、電解質組成物に使用した。
メチル2,2−ジフルオロエチルカーボネート(10.0g)を4Aモレキュラーシーブ(1.0g)上で終夜乾燥させ、次に4Aモレキュラーシーブ(1.0g)上でさらに終夜乾燥させた。乾燥メチル2,2−ジフルオロエチルカーボネートを、次にシリンジを用いてPTFEフィルタープレートで濾過した。濾過した材料(2.80g)をエチレンカーボネート(Novolyte、1.20g)と混合し、すべての固体が溶解するまで、得られた溶媒混合物を振り混ぜた。2mLのGCバイアル(オーブン乾燥した)にLiPF6(0.228g、Novolyte)を加え、続いて1.5mLの上記溶媒混合物を加えた。得られた混合物の正味重量は2.19gであった。すべての固体が溶解するまで混合物を振り混ぜた。1.0gのこの混合物に、4−フルオロ−1,3−ジオキソラン−2−オン(10mg、LongChem、Shanghai、China、減圧蒸留で精製した)を加えた。得られた非水電解質組成物を振り混ぜ、ドライボックス中で保管した。
SynQuestより入手した2,2−ジフルオロ酢酸メチル(HCF2C(O)OCH3)を回転バンド蒸留塔蒸留で2回精製することで、炎イオン化検出器を用いたガスクロマトグラフィーで測定して99.9%の純度まで精製した。精製した2,2−ジフルオロ酢酸メチル(10.0g)を4Aモレキュラーシーブ(1.0g)上で終夜乾燥させ、次に4Aモレキュラーシーブ(1.0g)でさらに終夜乾燥させた。精製し乾燥させた2,2−ジフルオロ酢酸メチルを、次にシリンジを用いてPTFEフィルタープレートで濾過した。濾過した材料(2.80g)をエチレンカーボネート(Novolyte、1.20g)と混合し、すべての固体が溶解するまで、得られた溶媒混合物を振り混ぜた。2mLのGCバイアル(オーブン乾燥した)にLiPF6(0.228g、Novolyte)を加え、続いて1.5mLの上記溶媒混合物を加えた。得られた混合物の正味重量は2.15gであった。すべての固体が溶解するまで混合物を振り混ぜた。1.0gの混合物に、4−フルオロ−1,3−ジオキソラン−2−オン(10mg、LongChem、Shanghai、China、減圧蒸留で精製したした)を加えた。得られた非水電解質組成物を振り混ぜ、ドライボックス中で保管した。
窒素保護下で、磁気撹拌を取り付け氷水浴で冷却したオーブン乾燥済みの0.5L丸底フラスコ中の2,2,3,3−テトラフルオロプロパノール(132.0g、97%、SynQuest)に、塩化アセチル(94.2g、Sigma−Aldrich)をシリンジポンプで3時間かけてゆっくりと加えた。管を介してフラスコに10%NaOH溶液トラップを接続して、発生したHClガスを捕捉した(吸引によってNaOH溶液が系に戻るのを回避するために漏斗を使用した)。混合物を室温で終夜撹拌した。NMR分析用のサンプルを採取すると、2,2,3,3−テトラフルオロプロパノールが検出された。塩化アセチル(0.6g)を混合物に加え、混合物を室温で2時間撹拌した。NMR分析により、2,2,3,3−テトラフルオロプロパノールが存在しないことが示された。混合物を25mLの10%Na2CO3で5回洗浄し、次に25mLの水で洗浄し、続いて25mLのブラインで洗浄した。得られた混合物を無水MgSO4(20g)上で終夜乾燥させ、次に5gの4Aモレキュラーシーブ上で2回乾燥させた。得られた粗生成物を回転バンド蒸留塔蒸留によって精製した。純粋な材料(82.7g)が得られ、電解質組成物に使用した。
酢酸2,2,3,3−テトラフルオロプロピル(10.0g)を4Aモレキュラーシーブ(1.0g)上で終夜乾燥させ、次にシリンジを用いてPTFEフィルタープレートで濾過した。乾燥させ、濾過した材料(2.80g)をエチレンカーボネート(Novolyte、1.20g)と混合し、すべての固体が溶解するまで、得られた溶媒混合物を振り混ぜた。2mLのGCバイアル(オーブン乾燥した)にLiPF6(0.076g、Novolyte、Cleveland OH)を加え、続いて1.0mLの上記溶媒混合物を加えた。得られた混合物の正味重量は1.42gであった。すべての固体が溶解するまで混合物を振り混ぜた。得られた非水電解質組成物を、シリンジを用いてPTFEフィルタープレートで濾過し、ドライボックス中に保管した。
窒素保護下で、オーバーヘット撹拌装置を取り付け水浴で冷却したオーブン乾燥済みの2Lの3口フラスコ中の2,2,3,3−テトラフルオロプロパノール(132.0g、97%、SynQuest)と、ピリジン(94.9g、無水、Sigma−Aldrich)と、ジクロロメタン(0.80L、無水、EMD Chemicals)との溶液に、クロロホルメート(113.4g、Sigma−Aldrich)をシリンジポンプで3時間かけてゆっくりと加えた。得られた混合物を室温で終夜撹拌した。NMR分析用のサンプルを採取すると、2,2,3,3−テトラフルオロプロパノールが検出されないことが分かった。混合物を濾過し、得られた濾液を100mLの10%HClで洗浄し、続いて50mLの10%HClで2回洗浄した。NMR分析より、ピリジンが検出されることが分かった。混合物を50mLの10%HClで洗浄し、NMR分析を行うと、ピリジンが検出されないことが分かった。混合物を50mLの5%Na2CO3で洗浄し、次に100mLのブラインで洗浄した。その有機層を無水MgSO4(50g)上で2時間乾燥させ、次にモレキュラーシーブ(4A、50g)上で終夜乾燥させた。乾燥させた有機層を回転蒸発させてジクロロメタンを除去した。得られた粗生成物を回転バンド蒸留塔蒸留によって精製した。純粋な材料(96.0g)が得られ、電解質組成物に使用した。
メチル2,2,3,3−テトラフルオロプロピルカーボネート(10.0g)を4Aモレキュラーシーブ(1.0g)上で終夜乾燥させた。乾燥させたメチル2,2,3,3−テトラフルオロプロピルカーボネートを、次にシリンジを用いてPTFEフィルタープレートで濾過した。乾燥させ、濾過した材料(2.80g)をエチレンカーボネート(Novolyte、1.20g)と混合し、すべての固体が溶解するまで、得られた溶媒混合物を振り混ぜた。2mLのGCバイアル(オーブン乾燥した)にLiPF6(0.076g、Novolyte、Cleveland OH)を加え、続いて1.0mLの上記溶媒混合物を加えた。得られた混合物の正味重量は1.43gであった。すべての固体が溶解するまで混合物を振り混ぜた。得られた非水電解質組成物を、シリンジを用いてPTFEフィルタープレートで濾過し、ドライボックス中に保管した。
前述のように作製したLiMn1.5Ni0.42Fe0.08O4正極、Celgard(登録商標)セパレータ2325(Celgard,LLC.Charlotte,NC)、リチウム箔負極(厚さ0.75mm)、および数滴の対象の非水電解質組成物を、2032ステンレス鋼コイン型電池缶(宝泉株式会社、日本)中に挟んで、LiMn1.5Ni0.42Fe0.08O4/Li半電池を形成した。
前述のように作製したLiMn1.5Ni0.42Fe0.08O4正極、Celgard(登録商標)セパレータ2325(Celgard,LLC.Charlotte,NC)、Li4Ti5O12負極(Farasis Energy Inc.,Hayward,California)、および数滴の対象の非水電解質組成物を2032ステンレス鋼コイン型電池缶中に挟んで、LiMn1.5Ni0.42Fe0.08O4/Li4Ti5O12フルセルを形成した。
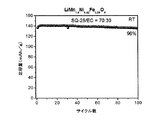
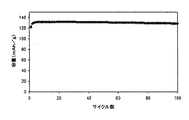
酢酸2,2−ジフルオロエチルを含む非水電解質組成物を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の室温サイクル性能
前述のように調製した酢酸2,2−ジフルオロエチルを含む非水電解質組成物を用いて、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li半電池を作製した。このLiMn1.5Ni0.42Fe0.08O4/Li半電池のサイクルを、3.5〜4.95Vの間で0.2Cのレートで25℃において行った。サイクル性能データを図1に示す。図から分かるように、酢酸2,2−ジフルオロエチルを含む非水電解質組成物を揺するLiMn1.5Ni0.42Fe0.08O4/Li半電池は、室温における100サイクルで96%の容量保持率を有した。
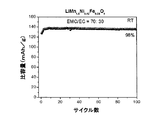
酢酸2,2−ジフルオロエチルおよびフルオロエチレンカーボネートを含む非水電解質組成物を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の室温サイクル性能
前述のように調製した酢酸2,2−ジフルオロエチルおよびフルオロエチレンカーボネート添加剤を含む非水電解質組成物を用いて、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li半電池を作製した。このLiMn1.5Ni0.42Fe0.08O4/Li半電池のサイクルを、3.5〜4.95Vの間で0.2Cのレートで25℃において行った。
標準的なEC/EMC電解質を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の室温サイクル性能
エチルカーボネート(EC)/エチルメチルカーボネート(EMC)を30:70の体積比で含有し、1MのLiPF6(Novolyte、Cleveland,OH)を含有する標準的な電解質を使用して、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li半電池を作製した。この半電池のサイクルを、3.5〜4.95Vの間で0.2Cのレートで25℃において行った。
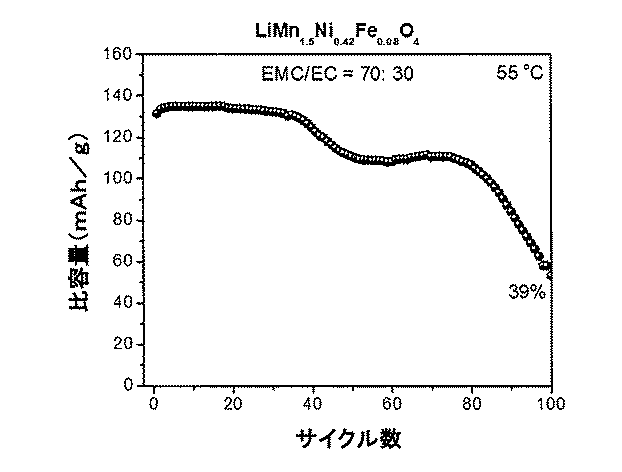
酢酸2,2−ジフルオロエチルを含む非水電解質組成物を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の高温サイクル性能
酢酸2,2−ジフルオロエチルを含む非水電解質組成物を用いて、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li半電池を作製した。このLiMn1.5Ni0.42Fe0.08O4/Li半電池のサイクルを、3.5〜4.95Vの間で0.5Cのレートで55℃において行った。
酢酸2,2−ジフルオロエチルおよびフルオロエチレンカーボネートを含む非水電解質組成物を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の高温サイクル性能
酢酸2,2−ジフルオロエチルおよびフルオロエチレンカーボネート添加剤を含む非水電解質組成物を用いて、前述のようにLiMn1.5Ni0.42Fe0.08O4/L
i半電池を作製した。このLiMn1.5Ni0.42Fe0.08O4/Li半電池のサイクルを、3.5〜4.95Vの間で0.5Cのレートで55℃において行った。
標準的なEC/EMC電解質を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の高温サイクル性能
標準的なEC/EMC電解質を用いて、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li半電池を作製した。このLiMn1.5Ni0.42Fe0.08O4/Li半電池のサイクルを、3.5〜4.95Vの間で0.5Cのレートで55℃において行った。
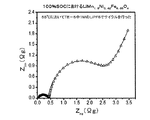
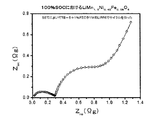
種々の電解質を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の電気化学的インピーダンス分光法
種々の電解質(表1参照)を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の電気化学的インピーダンス分光法(EIS)による研究を、55℃における100サイクル後に100%SOC(すなわち完全充電した)で行った。周波数は105Hz〜10−3Hzの範囲であった。AC電圧の大きさは10mVであった。
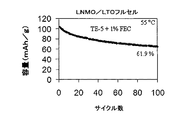
酢酸2,2−ジフルオロエチルおよびフルオロエチレンカーボネートを含む非水電解質組成物を有するLiMn1.5Ni0.42Fe0.08O4/Li4Ti5O12フルセルの高温サイクル性能
酢酸2,2−ジフルオロエチルおよびフルオロエチレンカーボネート添加剤を含む非水電解質組成物を用いて、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li4Ti5O12フルセルを作製した。このLiMn1.5Ni0.42Fe0.08O4/Li4Ti5O12フルセルのサイクルを、1.95〜3.4Vの間で0.5Cのレートで55℃において行った。
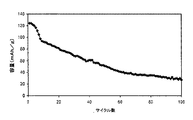
標準的なEC/EMC電解質を有するLiMn1.5Ni0.5O4/Li4Ti5O12フルセルの高温サイクル性能
標準的なエチルカーボネート(EC)/エチルメチルカーボネート(EMC)電解質を用いて、前述のようにLiMn1.5Ni0.5O4/Li4Ti5O12フルセルを作製した。このLiMn1.5Ni0.5O4/Li4Ti5O12フルセルのサイクルを、1.95〜3.4Vの間で0.5Cのレートで55℃において行った。
CH3OCO2CH2CF2H:EC(70:30)およびフルオロエチレンカーボネートを含む非水電解質組成物を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の高温サイクル性能
CH3OCO2CH2CF2H:EC(70:30)およびフルオロエチレンカーボネート添加剤(1%)を含む非水電解質組成物を使用して、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li半電池を作製した。このLiMn1.5Ni0.42Fe0.08O4/Li半電池のサイクルを、3.5〜4.95Vの間で60mA/gで55℃において行った。
CF2HCO2CH3:EC(70:30)およびフルオロエチレンカーボネートを含む非水電解質組成物を有するLiMn1.5Ni0.42Fe0.08O4/Li半電池の高温サイクル性能
CF2HCO2CH3:EC(70:30)およびフルオロエチレンカーボネート添加剤(1%)を含む非水電解質組成物を使用して、前述のようにLiMn1.5Ni0.42Fe0.08O4/Li半電池を作製した。このLiMn1.5Ni0.42Fe0.08O4/Li半電池のサイクルを、3.5〜4.95Vの間で60mA/gで55℃において行った。
種々のフッ素化溶媒を含む非水電解質組成物を有するLiMn1.5Ni0.5O4/Li4Ti5O12フルセルの高温サイクル性能
以下の作製の説明は、以降の実施例において使用される作製に典型的なものである。
Liuら(J.Phys.Chem.C 113,15073−15079,2009)により記載される水酸化物前駆体法によって、鉄をドープしたLiMn1.5Ni0.5O4を合成した。この作製のために、401gの酢酸マンガン(II)四水和物(Sigma−Aldrich)、115gの酢酸ニッケル(II)四水和物(Sigma−Aldrich)、および15.2gの酢酸鉄(II)無水物(Alfa Aesar、Ward Hill,MA)を天秤で秤量し、次に5Lの脱イオン水中に溶解させて、酢酸塩溶液を調製した。30Lの反応器中でKOHペレットを10Lの脱イオン水中に溶解させて3.0M溶液を得た。上記酢酸塩溶液を添加漏斗に移し、撹拌する上記反応器中に迅速に滴下して、混合水酸化物材料を沈殿させた。5Lすべての酢酸塩溶液を反応器に加えた後、撹拌を1時間続けた。次に、撹拌を停止し、水酸化物沈殿物を終夜沈降させた。沈降後、液体を反応器から除去し、15Lの新しい脱イオン水を加えた。反応器の内容物を撹拌し、再び沈降させ、液体を除去した。この洗浄プロセスを繰り返した。次に、沈殿物を、Dacron(登録商標)紙で覆った2つの(均等に分割)粗いガラスフリットの濾過漏斗に移した。濾液のpHが6.0(脱イオン洗浄水のpH)に到達するまで、回収した固体を脱イオン水で洗浄し、さらに20Lの脱イオン水をそれぞれの濾過ケーキに加えた。最後に、ケーキを真空オーブン120℃で終夜乾燥させた。この時点での収率は通常80〜90%であった。
前述のように作製したLiMn1.5Ni0.42Fe0.08O4スピネル正極材料を使用して正極を作製した。バインダーは、NMP中のポリフッ化ビニリデンの12%溶液(KFL #1120、Kureha America Corp,New York,NY)として入手した。カーボンブラック(0.260g、アセチレンブラック、Denka Corp.New York,NY、未圧縮)、3.88gのNMP、および上記PVDF溶液(2.16g)を、フルオロポリマーキャップ付きの15mLバイアル中で混合し、シンキーARE−310遠心分離機(株式会社シンキー、日本)を使用して、それぞれ2,000rpmで1分間の遠心分離機による混合を3回行った。乳鉢および乳棒を使用して正極材料(2.08g)を約1時間粉砕した。次に正極材料および0.70gのNMPをバイアルに加え、再びその混合物に対して、それぞれ2,000rpmで1分間の遠心分離機による混合を3回行って、正極ペーストを形成した。ペーストの全重量は9.08g(固形分28.6%)であった。バイアルを氷浴に入れ、ローター・ステーター(Model PT 10−35 GT、直径7.5mmのステーター、Kinematicia,Bohemia NY)を使用して、それぞれ6500rpmで15分間の均質化を2回行い、次にそれぞれ9500rpmで15分間の均質化をさらに2回行った。4回の均質化時間のそれぞれの間に、ホモジナイザーをペーストバイアル中の別の位置に移動させた。ゲート高さ0.25mmでドクターブレードを使用してペーストを未処理のアルミニウム箔上にキャストし、真空オーブン中100℃で15分間乾燥させた。得られた幅50mmの正極を厚さ125μmの真鍮シート上に配置し、幅38mmおよび厚さ37μmの2つの真鍮シムストリップを正極の両側の上に配置して、カレンダーの間隙厚さの調節に使用した。正極およびシムを厚さ125μmの第2の真鍮シートで覆い、その組立体を、直径100mmの鋼製ロールを用いて周囲温度において最初560kg、次に680kgのニップ力でカレンダーに通した。平均正極厚さは、カレンダー加工の前の67μmから45μmまで減少した。ドクターブレードのゲート高さを0.29mmまで増加させ、正極を乾燥させたことを除けば同様の方法でさらに正極を作製した。
カーボンブラック(0.39g、アセチレンブラック、Denka Corp.、New York NY、未圧縮)、PVDF溶液(3.00g、NMP中13%、KFL #9130、Kureha America Corp、New York NY)、および6.03gのNMPを混合し、それぞれ2,000rpmで60秒間の遠心分離機による混合を3回行った。Li4Ti5O12粉末(3.12g、Nanomyte BE−10、NEI Corporation、Somerset,NJ)および追加の1.10gのNMPを上記カーボンブラックおよびPVDFの混合物に加え、得られたペーストに対して、それぞれ2,000rpmで60秒間の遠心分離機による混合を3回行った。バイアルを氷浴に入れ、ローター・ステーターを使用して、それぞれ6500rpmで15分間の均質化を2回行い、次にそれぞれ9500rpmで15分間の均質化を2回行った。得られたペーストを乳鉢に入れ、乳棒を使用して手で缶単位粉砕して、さらに凝集物を除去した。次に、ゲート高さ0.29mmでドクターブレードを使用してペーストを厚さ25μmの未処理のアルミニウム箔上にキャストした。ペーストをコンベクションオーブン(モデルFDL−115、Binder Inc.、Great River,NY)中100℃で15分間乾燥させた。負極の厚さは71μmであった。前述の正極と類似の方法で、得られた幅50mmの負極のカレンダー加工を行った。平均負極厚さは、カレンダー加工前の71μmからカレンダー加工後の53μmまで減少した。
電気化学的評価のために、非水電解質リチウムイオンCR2032コインセルを作製した。円形の負極および正極を打抜き、グローブボックス中の副室中のヒーターにいれ、100℃でさらに終夜減圧乾燥させ、アルゴングローブボックス(Vacuum Atmospheres、Hawthorne CA、HE−493清浄器を有する)中に移した。電極直径は、14.1mmの正極を16.0mmの負極とともに使用するか、または10.1mmの正極を12.3mmの負極とともに使用した。すべてのセルは正極が制限され、チタン酸リチウム重量のFe−LNMO重量の比はすべてのセルで1.0を超えた。コインセル部品(ケース、スペーサー、波形ばね、ガスケット、および蓋)、およびコインセルクリンパーは宝泉株式会社(大阪、日本)から入手した。使用したセパレータは、厚さ25μmの微孔質ポリオレフィンセパレータ(CG2325、Celgard、Charlotte,NC)であった。各例で使用した電解質は表1に示している。
LiMn1.5Ni0.42Fe0.08O4/Li4Ti5O12フルセルについて、市販の電池試験機(Series 4000、Maccor、Tulsa、OK)を用いて55℃において1.9および3.4Vの電圧制限を用いてサイクルを行った。最初の29サイクルは、60mA/(Fe−LNMOのグラム数)のレートで定電流充電および放電を使用して行った。第30サイクルでは、レートを24mA/gまで下げた。この30サイクル(29+1)の組を10回繰り返し、合計300サイクルとした。放電容量が、第1サイクルの初期放電容量の80%に低下するまでのサイクル数を表1に示している。297〜299で残る比放電容量の平均も表2に示している。
本明細書において、他に明記される、または使用の状況によって逆のことが示されるでない場合、
(a)一連の化合物、モノマー、オリゴマー、ポリマー、および/またはその他の化学物質は、その一連の構成要素の誘導体を、任意の構成要素および/または任意のそれらの誘導体の2つ以上の混合物に加えて含み;
(b)本明細書に記載の量、サイズ、範囲、処方、パラメーター、ならびにその他の量および特徴は、特に用語「約」で修飾される場合には、限定である必要はなく、近似であったり、および/または許容範囲、換算率、丸め、測定誤差などを反映して、記載のものより大きいまたは小さい(必要に応じて)場合もあり、本発明の状況において、記載の範囲と機能的および/または動作的に同等となる、範囲外の値も記載の値に含められる場合がある。
1.リチウムイオン電池であって:
(a)ハウジングと;
(b)前記ハウジング中に配置され、互いに伝導性接触する負極および正極であって、
前記正極は、スピネル構造を有するリチウム含有マンガン複合酸化物を活物質として含むマンガン正極であり、前記リチウム含有マンガン複合酸化物が式
LizMn1.5NixMyO4−d
[式中、
Mは、Al、Cr、Fe、Ga、Zn、Co、Nb、Mo、Ti、Zr、Mg、V、およびCuからなる群から選択される少なくとも1種類の金属であり、
0.38≦x<0.5であり、
0<y≦0.12であり、
0≦d≦0.3であり、
0.00<z≦1.1であり、zは、充電および放電の間のリチウムイオンおよび電子の放出および取り込みにより変化する]
で表される、負極および正極と;
(c)前記ハウジング中に配置され、前記負極および前記正極の間にイオン伝導性通路を提供する非水電解質組成物であって、少なくとも1種類の電解質塩、ならびに少なくとも1種類のフッ素化非環式カルボン酸エステルおよび/または少なくとも1種類のフッ素化非環式カーボネートを含む非水電解質組成物と;
(d)前記負極および前記正極の間の多孔質セパレータと、
を含むリチウムイオン電池。
2.MがAl、Cr、Fe、Ga、およびZnからなる群から選択される少なくとも1種類の金属であり、
0.4≦x<0.5であり、
0<y≦0.1であり、
z=1であり、
d=0である、上記1に記載のリチウムイオン電池。
3.前記フッ素化非環式カルボン酸エステルが、CH3C(O)OCH2CF2H、CH3C(O)OCH2CF3、およびCH3C(O)OCH2CF2CF2Hからなる群の1つまたはそれ以上のメンバーから選択される、上記1に記載のリチウムイオン電池。
4.前記フッ素化非環式カーボネートが、CH3OC(O)OCH2CF2H、CH3OC(O)OCH2CF3、およびCH3OC(O)OCH2CF2CF2Hからなる群の1つまたはそれ以上のメンバーから選択される、上記1に記載のリチウムイオン電池。
5.(b)の式中のMがFeを含む、上記1に記載のリチウムイオン電池。
6.前記フッ素化非環式カルボン酸エステルがCH3CO2CH2CF2Hを含む、上記3に記載のリチウムイオン電池。
7.前記非水電解質組成物(c)が、フッ素化非環式カルボン酸エステルおよび/またはフッ素化非環式カーボネートと、少なくとも1種類の共溶媒とを含む溶媒混合物を含む、上記1に記載のリチウムイオン電池。
8.前記溶媒混合物が、フッ素化非環式カルボン酸エステルおよび/またはフッ素化非環式カーボネートを前記溶媒混合物の約50質量%〜約80質量%で含む、上記7に記載のリチウムイオン電池。
9.前記溶媒混合物が、フッ素化非環式カルボン酸エステルおよび/またはフッ素化非環式カーボネートを前記溶媒混合物の約65質量%〜約75質量%で含む、上記7に記載のリチウムイオン電池。
10.共溶媒がエチレンカーボネートを含む、上記7に記載のリチウムイオン電池。
11.前記溶媒混合物がCH3CO2CH2CF2Hおよびエチレンカーボネートを含む、上記7に記載のリチウムイオン電池。
12.CH3CO2CH2CF2Hが前記溶媒混合物の約50質量%〜約80質量%を構成する、上記11に記載のリチウムイオン電池。
13.CH3CO2CH2CF2Hが前記溶媒混合物の約65質量%〜約75質量%を構成する、上記11に記載のリチウムイオン電池。
14.前記非水電解質組成物(c)が、フルオロエチレンカーボネートおよびその誘導体
、硫酸エチレンおよびその誘導体、ビニルエチレンカーボネートおよびその誘導体、ビニレンカーボネートおよびその誘導体、無水マレイン酸およびその誘導体、ならびに酢酸ビニルからなる群から選択される添加剤をさらに含む、上記1に記載のリチウムイオン電池。
15.前記非水電解質組成物(c)がフルオロエチレンカーボネートをさらに含む、上記1に記載のリチウムイオン電池。
16.フッ素化非環式カルボン酸エステルが、以下の構造式:
R1−−−C(O)O−−−R2
[式中、R1は、CH3、CH2CH3、CH2CH2CH3、CH(CH3)2、CF3、CF2H、CFH2、CF2R3、CFHR3、およびCH2Rfからなる群から選択され、R2は、独立して、CH3、CH2CH3、CH2CH2CH3、CH(CH3)2、およびCH2Rfからなる群から選択され、R3は、少なくとも1つのフッ素で場合により置換されたC1〜C3アルキル基であり、Rfは、少なくとも1つのフッ素で置換されたC1〜C3アルキル基であり、R1またはR2の少なくとも1つは少なくとも1つのフッ素を含有し、R1がCF2Hである場合、R2はCH3ではない]
で表され、
フッ素化非環式カーボネートが、以下の構造式:
R4−−−O−C(O)O−−−R5
[式中、R4およびR5は、独立して、CH3、CH2CH3、CH2CH2CH3、CH(CH3)2、およびCH2Rfからなる群から選択され、Rfは、少なくとも1つのフッ素で置換されたC1〜C3アルキル基であり、R4またはR5の少なくとも1つは少なくとも1つのフッ素を含有する]
で表される、上記1に記載のリチウムイオン電池。
17.非水電解質組成物(c)中の電解質塩が:
ヘキサフルオロリン酸リチウム、
LiPF3(CF2CF3)3、
ビス(トリフルオロメタンスルホニル)イミドリチウム、
ビス(ペルフルオロエタンスルホニル)イミドリチウム、
(フルオロスルホニル)(ノナフルオロブタンスルホニル)イミドリチウム、
ビス(フルオロスルホニル)イミドリチウム、
テトラフルオロホウ酸リチウム、
過塩素酸リチウム、
ヘキサフルオロヒ酸リチウム、
トリフルオロメタンスルホン酸リチウム、
トリス(トリフルオロメタンスルホニル)メチドリチウム、
ビス(オキサラト)ホウ酸リチウム、
ジフルオロ(オキサラト)ホウ酸リチウム、
Li2B12F12−xHx[式中、xは0〜8である]、および
フッ化リチウムと陰イオン受容体との混合物
からなる群の1つまたはそれ以上のメンバーから選択される、上記1に記載のリチウムイオン電池。
18.前記電解質塩がヘキサフルオロリン酸リチウムを含む、上記17に記載のリチウムイオン電池。
19.前記負極が、活物質としてチタン酸リチウムまたは黒鉛を含む、上記1に記載のリチウムイオン電池。
20.上記1に記載のリチウムイオン電池を含む、電子的な動力または補助による装置。21.輸送手段、コンピュータ、通信機器、カメラ、ラジオ、または動力工具として製造される、上記20に記載の装置。
Claims (2)
- リチウムイオン二次電池であって:
(a)ハウジングと;
(b)前記ハウジング中に配置され、互いに伝導的に接続されている負極および正極であって、前記正極は、スピネル構造を有するリチウム含有マンガン複合酸化物を活物質として含み、前記リチウム含有マンガン複合酸化物が式
LizMn1.5NixMyO4-d
[式中、
Mは、Al、Cr、Fe、Ga、Zn、Co、Nb、Mo、Ti、Zr、Mg、V、およびCuからなる群から選択される少なくとも1種類の金属であり、
0.38≦x<0.5であり、
0<y≦0.12であり、
0≦d≦0.3であり、
0.00<z≦1.1であり、zは、充電および放電の間のリチウムイオンおよび電子の放出および取り込みにより変化する]
で表される、負極および正極と;
(c)前記ハウジング中に配置され、前記負極および前記正極の間にイオン伝導性通路を提供する非水電解質組成物であって、少なくとも1種類の電解質塩、ならびに少なくとも1種類の共溶媒および溶媒混合物の50質量%〜80質量%の少なくとも1種類のフッ素化非環式カルボン酸エステルを含む溶媒混合物を含み、ただし、少なくとも1種類のフッ素化非環式カルボン酸エステルはCF 2 HCO 2 CH 3 ではない、非水電解質組成物と;
(d)前記負極および前記正極の間の多孔質セパレータと、
を含むリチウムイオン二次電池。 - 請求項1に記載のリチウムイオン二次電池を含む、電子装置。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161530545P | 2011-09-02 | 2011-09-02 | |
| US61/530,545 | 2011-09-02 | ||
| US201261654184P | 2012-06-01 | 2012-06-01 | |
| US61/654,184 | 2012-06-01 | ||
| PCT/US2012/053439 WO2013033595A1 (en) | 2011-09-02 | 2012-08-31 | Lithium ion battery |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014525667A JP2014525667A (ja) | 2014-09-29 |
| JP2014525667A5 JP2014525667A5 (ja) | 2015-10-08 |
| JP6178317B2 true JP6178317B2 (ja) | 2017-08-09 |
Family
ID=46881162
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014528660A Active JP6178317B2 (ja) | 2011-09-02 | 2012-08-31 | リチウムイオン電池 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US9673450B2 (ja) |
| EP (1) | EP2751865B1 (ja) |
| JP (1) | JP6178317B2 (ja) |
| KR (1) | KR101938921B1 (ja) |
| CN (1) | CN103765659A (ja) |
| CA (1) | CA2844796C (ja) |
| ES (1) | ES2679287T3 (ja) |
| HU (1) | HUE039500T2 (ja) |
| PL (1) | PL2751865T3 (ja) |
| WO (1) | WO2013033595A1 (ja) |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6178317B2 (ja) | 2011-09-02 | 2017-08-09 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | リチウムイオン電池 |
| CN103959544A (zh) | 2011-09-02 | 2014-07-30 | 纳幕尔杜邦公司 | 氟化电解质组合物 |
| WO2013180783A1 (en) * | 2012-06-01 | 2013-12-05 | E. I. Du Pont De Nemours And Company | Fluorinated electrolyte compositions |
| KR102064194B1 (ko) | 2012-06-01 | 2020-01-09 | 솔베이(소시에떼아노님) | 리튬 이온 배터리 |
| JP6187458B2 (ja) * | 2012-06-05 | 2017-08-30 | 日本電気株式会社 | リチウム二次電池 |
| EP2924796B1 (en) | 2012-11-20 | 2018-04-18 | Nec Corporation | Lithium ion secondary battery |
| US9391322B2 (en) * | 2013-03-15 | 2016-07-12 | E I Du Pont De Nemours And Company | Cathode material and battery |
| EP3588657A1 (en) | 2013-04-04 | 2020-01-01 | Solvay SA | Nonaqueous electrolyte compositions |
| EP2800197B1 (en) * | 2013-05-02 | 2017-03-22 | Westfälische Wilhelms-Universität Münster | Fluorinated carbonates as solvent for lithium sulfonimide-based electrolytes |
| CN103682443B (zh) * | 2013-12-31 | 2016-03-16 | 东莞市杉杉电池材料有限公司 | 一种含双氟磺酰基亚胺锂的锂离子电池电解液 |
| EP3096388B1 (en) * | 2014-01-16 | 2019-03-20 | Kaneka Corporation | Nonaqueous electrolyte secondary battery and battery pack of same |
| JP2017107639A (ja) * | 2014-04-18 | 2017-06-15 | 旭硝子株式会社 | 二次電池用非水電解液およびリチウムイオン二次電池 |
| EP2945211B1 (en) * | 2014-05-15 | 2018-11-21 | Saft Groupe S.A. | Lithium titanate oxide as negative electrode in li-ion cells |
| WO2015179205A1 (en) * | 2014-05-23 | 2015-11-26 | E. I. Du Pont De Nemours And Company | Nonaqueous electrolyte compositions comprising cyclic sulfates |
| ES2686822T3 (es) * | 2014-05-23 | 2018-10-22 | Solvay Sa | Composiciones electrolíticas no acuosas que comprenden sulfatos cíclicos y boratos de litio |
| US20160087307A1 (en) * | 2014-09-19 | 2016-03-24 | E I Du Pont De Nemours And Company | Nonaqueous electrolyte compositions |
| US20160164057A1 (en) * | 2014-12-05 | 2016-06-09 | E I Du Pont De Nemours And Company | Electrochemical cell with polyimide separator and high-voltage positive electrode |
| EP3235046B1 (en) * | 2014-12-18 | 2021-06-16 | Solvay SA | Electrolyte composition comprising fluorinated carbonate, and battery comprising the same |
| CN104466249A (zh) * | 2014-12-30 | 2015-03-25 | 薛利 | 一种以钛酸锂为负极的锂离子电池的电解液 |
| CN107534182B (zh) * | 2015-02-25 | 2020-11-10 | 麻省固能控股有限公司 | 用于高压锂离子电池的电解质体系 |
| CN104766995B (zh) * | 2015-03-31 | 2017-03-15 | 宁德时代新能源科技股份有限公司 | 一种电解液添加剂及其在锂离子电池中的应用 |
| JP6834950B2 (ja) * | 2015-05-11 | 2021-02-24 | 日本電気株式会社 | リチウムイオン二次電池 |
| US9887434B2 (en) | 2015-06-22 | 2018-02-06 | Wildcat Discovery Technologies, Inc | Electrolyte formulations for lithium ion batteries |
| US20160372790A1 (en) * | 2015-06-22 | 2016-12-22 | Johnson Controls Technology Company | Electrolyte formulations for lithium ion batteries |
| US10547083B2 (en) | 2015-06-22 | 2020-01-28 | Wildcat Discovery Technologies, Inc. | Electrolyte formulations for lithium ion batteries |
| US10193152B2 (en) | 2015-09-09 | 2019-01-29 | Samsung Electronics Co., Ltd. | Cathode active material particles, lithium ion battery prepared by using the cathode active material particles, and method of preparing the cathode active material particles |
| DE112016004508T5 (de) | 2015-10-01 | 2018-07-12 | Ube Industries, Ltd. | Nicht-wässrige Elektrolyt-Lösung für eine Lithium-Sekundärbatterie oder einen Lithium-Ionen-Kondensator, und eine Lithium-Sekundärbatterie oder ein Lithium-Ionen-Kondensator, die diese verwenden |
| PL3369125T3 (pl) * | 2015-10-26 | 2020-11-02 | Solvay Sa | Niewodne kompozycje elektrolitowe zawierające fluorowany rozpuszczalnik i 2-furanon |
| KR101937898B1 (ko) * | 2015-10-29 | 2019-01-14 | 주식회사 엘지화학 | 비수 전해액 첨가제, 이를 포함하는 비수전해액 및 이를 구비한 리튬 이차전지 |
| JP6455726B2 (ja) * | 2015-11-11 | 2019-01-23 | トヨタ自動車株式会社 | 非水電解液二次電池 |
| WO2017112424A1 (en) * | 2015-12-22 | 2017-06-29 | E. I. Du Pont De Nemours And Company | Electrolyte compositions comprising metal fluoride particles |
| JP6688650B2 (ja) * | 2016-03-29 | 2020-04-28 | 三星エスディアイ株式会社SAMSUNG SDI Co., LTD. | 非水電解質二次電池用正極及び非水電解質二次電池 |
| JP6630611B2 (ja) * | 2016-04-04 | 2020-01-15 | 株式会社豊田中央研究所 | 非水電解質二次電池用正極活物質、リチウム二次電池及び非水電解質二次電池用正極活物質の製造方法 |
| PL3513448T3 (pl) * | 2016-09-14 | 2024-11-12 | Syensqo Sa | Elektrolity zawierające cykliczne siarczany o sześcioczłonowym pierścieniu |
| US11362370B2 (en) * | 2016-11-25 | 2022-06-14 | Shenzhen Capchem Technology Co., Ltd. | Non-aqueous electrolyte for lithium-ion battery and lithium-ion battery |
| WO2018116730A1 (ja) | 2016-12-20 | 2018-06-28 | ダイキン工業株式会社 | 電解液、電気化学デバイス、リチウムイオン二次電池及びモジュール |
| JP6795041B2 (ja) * | 2016-12-26 | 2020-12-02 | ダイキン工業株式会社 | 電解液、電気化学デバイス、リチウムイオン二次電池、及び、モジュール |
| JP6700166B2 (ja) * | 2016-12-26 | 2020-05-27 | トヨタ自動車株式会社 | 非水電解液、非水電解液二次電池および非水電解液二次電池の製造方法 |
| JP6779775B2 (ja) * | 2016-12-26 | 2020-11-04 | ダイキン工業株式会社 | 電解液、電気化学デバイス、リチウムイオン二次電池、及び、モジュール |
| US10978742B2 (en) * | 2016-12-27 | 2021-04-13 | Daikin Industries, Ltd. | Electrolytic solution, electrochemical device, lithium-ion secondary cell, and module |
| CN108808065B (zh) | 2017-04-28 | 2020-03-27 | 深圳新宙邦科技股份有限公司 | 锂离子电池非水电解液和锂离子电池 |
| CN108808086B (zh) | 2017-04-28 | 2020-03-27 | 深圳新宙邦科技股份有限公司 | 锂离子电池非水电解液和锂离子电池 |
| CN108808084B (zh) | 2017-04-28 | 2020-05-08 | 深圳新宙邦科技股份有限公司 | 锂离子电池非水电解液和锂离子电池 |
| CN108808066B (zh) | 2017-04-28 | 2020-04-21 | 深圳新宙邦科技股份有限公司 | 锂离子电池非水电解液和锂离子电池 |
| CN108933292B (zh) | 2017-05-27 | 2020-04-21 | 深圳新宙邦科技股份有限公司 | 锂离子电池非水电解液和锂离子电池 |
| CN109326823B (zh) | 2017-07-31 | 2020-04-21 | 深圳新宙邦科技股份有限公司 | 锂离子电池非水电解液及锂离子电池 |
| CN109326824B (zh) | 2017-07-31 | 2020-04-21 | 深圳新宙邦科技股份有限公司 | 锂离子电池非水电解液及锂离子电池 |
| KR102479725B1 (ko) * | 2017-08-03 | 2022-12-21 | 삼성에스디아이 주식회사 | 리튬 전지용 전해액 및 이를 포함하는 리튬 전지 |
| JP6944644B2 (ja) * | 2017-10-19 | 2021-10-06 | トヨタ自動車株式会社 | リチウム二次電池用電解液 |
| HUE067019T2 (hu) * | 2018-01-12 | 2024-09-28 | Syensqo Sa | Lítium-bisz(fluorszulfonil)imidet tartalmazó, nem vizes elektrolitkészítmények |
| CN110364695B (zh) * | 2018-04-11 | 2021-08-13 | 宁德新能源科技有限公司 | 锂离子电池 |
| CN109473720A (zh) * | 2018-11-01 | 2019-03-15 | 安徽兴锂新能源有限公司 | 一种锂离子电池电解液 |
| WO2020202307A1 (ja) * | 2019-03-29 | 2020-10-08 | 日立化成株式会社 | リチウムイオン二次電池 |
| CN113603155B (zh) * | 2021-07-30 | 2023-01-10 | 蜂巢能源科技有限公司 | 掺杂包覆方法、采用该方法对三元正极材料改性的方法和应用 |
| WO2023234080A1 (ja) | 2022-05-30 | 2023-12-07 | 住友化学株式会社 | アルカリ金属含有酸化物、正極活物質、電極及び電池 |
| TWI890996B (zh) * | 2023-04-19 | 2025-07-21 | 國立臺灣科技大學 | 一種可調溶劑化特性的電解質溶劑、其製造方法與應用 |
Family Cites Families (199)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2824141A (en) | 1954-01-06 | 1958-02-18 | William A Zisman | Fluoroethers |
| US3006964A (en) | 1959-09-24 | 1961-10-31 | Pennsalt Chemicals Corp | Process for fluoroalkyl sulfides |
| JPS62290072A (ja) | 1986-06-09 | 1987-12-16 | Matsushita Electric Ind Co Ltd | 有機電解質二次電池 |
| US5273840A (en) | 1990-08-01 | 1993-12-28 | Covalent Associates Incorporated | Methide salts, formulations, electrolytes and batteries formed therefrom |
| FR2683524A1 (fr) | 1991-11-08 | 1993-05-14 | Centre Nat Rech Scient | Derives des bis(perfluorosulfonyl)methanes, leur procede de preparation, et leurs utilisations . |
| JP3444607B2 (ja) | 1992-07-07 | 2003-09-08 | 三菱化学株式会社 | リチウム二次電池用電解液 |
| JP3059832B2 (ja) | 1992-07-27 | 2000-07-04 | 三洋電機株式会社 | リチウム二次電池 |
| DE69309861T2 (de) | 1992-11-18 | 1997-09-11 | Mitsui Petrochemical Ind | Carbonatverbindungen, nicht wässrige Elektrolytlösungen und nicht wässrige Elektrolytlösungen enthaltende Batterien |
| DE4333058A1 (de) | 1993-09-29 | 1995-03-30 | Hoechst Ag | Verfahren zur Herstellung von Trifluorethylschwefelverbindungen aus Thiolaten und 1-Chlor-2,2,2-trifluorethan |
| DE59408909D1 (de) | 1993-10-13 | 1999-12-16 | Ciba Sc Holding Ag | Neue Fluoreszenzfarbstoffe |
| JPH08298134A (ja) | 1995-04-25 | 1996-11-12 | Sony Corp | 非水電解液 |
| JP3606289B2 (ja) | 1995-04-26 | 2005-01-05 | 日本電池株式会社 | リチウム電池用正極活物質およびその製造法 |
| JPH09199168A (ja) | 1996-01-17 | 1997-07-31 | Fuji Photo Film Co Ltd | 非水電解質二次電池 |
| DE59707889D1 (de) | 1996-01-30 | 2002-09-12 | Ciba Sc Holding Ag | Polymerisierbare Diketopyrrolopyrrole und damit hergestellte Polymere |
| US5830600A (en) | 1996-05-24 | 1998-11-03 | Sri International | Nonflammable/self-extinguishing electrolytes for batteries |
| US6420069B2 (en) | 1996-07-22 | 2002-07-16 | Japan Storage Bottery Co., Ltd | Positive electrode for lithium battery |
| CA2212399C (en) | 1996-08-07 | 2003-03-25 | Masahiro Taniuchi | Ionically conductive polymeric gel electrolyte and solid battery containing the same |
| WO1998015024A1 (en) | 1996-10-03 | 1998-04-09 | National Research Council Of Canada | Electrolyte comprising fluoro-ethylene carbonate and propylene carbonate, for alkali metal-ion secondary battery |
| JP3311611B2 (ja) | 1996-10-11 | 2002-08-05 | 三洋電機株式会社 | リチウム二次電池 |
| US5962166A (en) | 1997-08-18 | 1999-10-05 | Covalent Associates, Inc. | Ultrahigh voltage mixed valence materials |
| JP4328915B2 (ja) | 1997-09-10 | 2009-09-09 | ダイキン工業株式会社 | 二次電池用非水電解液及びそれを用いた二次電池 |
| JP3394172B2 (ja) | 1997-12-09 | 2003-04-07 | シャープ株式会社 | 電 池 |
| DE19829030C1 (de) | 1998-06-30 | 1999-10-07 | Metallgesellschaft Ag | Lithium-bisoxalatoborat, Verfahren zu dessen Herstellung und dessen Verwendung |
| US6168878B1 (en) | 1998-10-26 | 2001-01-02 | Mitsubishi Chemical Corporation | Electrochemical cell having a controlled electrode surface and associated fabrication and chemical process |
| JP3634694B2 (ja) | 1998-12-18 | 2005-03-30 | 三洋電機株式会社 | リチウム二次電池 |
| JP2000188128A (ja) | 1998-12-24 | 2000-07-04 | Mitsubishi Chemicals Corp | 非水電解液二次電池 |
| JP4657403B2 (ja) | 1999-07-02 | 2011-03-23 | パナソニック株式会社 | 非水電解質二次電池 |
| JP2001085058A (ja) | 1999-09-20 | 2001-03-30 | Hitachi Ltd | 非水電解液及びこれを用いたリチウム1次電池及びリチウム2次電池及び電気化学キャパシタ及び高分子電解質及びこれを用いたポリマ2次電池 |
| JP2001345120A (ja) | 2000-05-31 | 2001-12-14 | Denso Corp | 非水電解液及び該電解液を用いた非水電解液二次電池 |
| US7468223B2 (en) | 2000-06-22 | 2008-12-23 | Uchicago Argonne, Llc | Lithium metal oxide electrodes for lithium cells and batteries |
| US6878492B2 (en) | 2000-07-10 | 2005-04-12 | Showa Denko Kabushiki Kaisha | Polymerizable composition and use thereof |
| US6958198B2 (en) | 2000-07-17 | 2005-10-25 | Matsushita Electric Industrial Co., Ltd. | Non-aqueous electrochemical apparatus |
| JP2002124263A (ja) | 2000-10-12 | 2002-04-26 | Daikin Ind Ltd | 電極表面被膜形成剤および電池製造方法 |
| US6534220B2 (en) | 2000-12-29 | 2003-03-18 | 3M Innovative Properties Company | High-boiling electrolyte solvent |
| US8252465B2 (en) | 2001-01-19 | 2012-08-28 | Samsung Sdi Co., Ltd. | Electrolyte for lithium secondary battery and lithium secondary battery comprising same |
| US6964828B2 (en) | 2001-04-27 | 2005-11-15 | 3M Innovative Properties Company | Cathode compositions for lithium-ion batteries |
| US6680145B2 (en) | 2001-08-07 | 2004-01-20 | 3M Innovative Properties Company | Lithium-ion batteries |
| JP2003100342A (ja) * | 2001-09-25 | 2003-04-04 | Hitachi Ltd | リチウム二次電池 |
| DE60235944D1 (de) | 2001-10-18 | 2010-05-27 | Nec Corp | Positives aktives Elektrodenmaterial, positive Elektrode und nicht-wässrige sekundäre Elektrolytbatterie diese benutzend |
| JP2003168480A (ja) * | 2001-12-04 | 2003-06-13 | Hitachi Ltd | リチウム二次電池とその電解液及びその正極 |
| JP4197237B2 (ja) | 2002-03-01 | 2008-12-17 | パナソニック株式会社 | 正極活物質の製造方法 |
| JP4307005B2 (ja) | 2002-03-25 | 2009-08-05 | 三洋電機株式会社 | 非水電解液二次電池 |
| JP2003282138A (ja) | 2002-03-26 | 2003-10-03 | Mitsubishi Chemicals Corp | 非水系電解液二次電池およびそれに用いる電解液 |
| KR100458568B1 (ko) | 2002-04-03 | 2004-12-03 | 삼성에스디아이 주식회사 | 리튬 전지용 전해질 및 이를 포함하는 리튬 전지 |
| JP2004047131A (ja) | 2002-07-08 | 2004-02-12 | Sony Corp | 非水電解質電池 |
| US7229718B2 (en) | 2002-08-22 | 2007-06-12 | Samsung Sdi Co., Ltd. | Electrolyte for rechargeable lithium battery and rechargeable lithium battery comprising same |
| KR100875112B1 (ko) | 2002-11-16 | 2008-12-22 | 삼성에스디아이 주식회사 | 비수계 전해액 및 이를 채용한 리튬 전지 |
| JP4698126B2 (ja) | 2003-02-10 | 2011-06-08 | 日本電気株式会社 | 非水電解液二次電池 |
| JP2004281185A (ja) | 2003-03-14 | 2004-10-07 | Sanyo Electric Co Ltd | 電池用非水電解液及び非水電解液電池 |
| US7491471B2 (en) | 2003-07-15 | 2009-02-17 | Samsung Sdi Co., Ltd. | Electrolyte for lithium secondary battery and lithium secondary battery comprising same |
| JP2005078820A (ja) * | 2003-08-28 | 2005-03-24 | Japan Storage Battery Co Ltd | 非水電解質二次電池 |
| US8367254B2 (en) | 2003-09-05 | 2013-02-05 | Lg Chem, Ltd. | Electrolyte for a high voltage battery and lithium secondary battery comprising the same |
| KR100657225B1 (ko) | 2003-09-05 | 2006-12-14 | 주식회사 엘지화학 | 전지의 안전성을 향상시키기 위한 전해액 용매 및 이를포함하는 리튬 이차 전지 |
| JP4022889B2 (ja) | 2004-02-12 | 2007-12-19 | ソニー株式会社 | 電解液および電池 |
| CN100449850C (zh) | 2004-02-27 | 2009-01-07 | 三洋电机株式会社 | 锂二次电池 |
| JP2005293920A (ja) | 2004-03-31 | 2005-10-20 | Sanyo Electric Co Ltd | 非水電解質電池 |
| US7381496B2 (en) | 2004-05-21 | 2008-06-03 | Tiax Llc | Lithium metal oxide materials and methods of synthesis and use |
| JP2006032300A (ja) | 2004-07-21 | 2006-02-02 | Sony Corp | 電解質および電池 |
| CN101080830B (zh) | 2004-09-03 | 2015-01-28 | 芝加哥大学阿尔贡有限责任公司 | 锂电池用氧化锰复合电极 |
| US7635536B2 (en) | 2004-09-03 | 2009-12-22 | Uchicago Argonne, Llc | Manganese oxide composite electrodes for lithium batteries |
| JP4921702B2 (ja) | 2004-09-17 | 2012-04-25 | 三菱化学株式会社 | 非水電解液二次電池及び非水電解液 |
| JP4264567B2 (ja) | 2004-11-05 | 2009-05-20 | ソニー株式会社 | 二次電池 |
| JP2006140115A (ja) | 2004-11-15 | 2006-06-01 | Hitachi Maxell Ltd | 非水電解液二次電池 |
| JP4997699B2 (ja) | 2004-12-10 | 2012-08-08 | 新神戸電機株式会社 | リチウムニ次電池 |
| JP4968614B2 (ja) | 2004-12-10 | 2012-07-04 | 日本電気株式会社 | 二次電池用電解液およびそれを用いた二次電池 |
| JP4968615B2 (ja) | 2004-12-16 | 2012-07-04 | 日本電気株式会社 | 二次電池用電解液及び二次電池 |
| CN100438198C (zh) | 2004-12-31 | 2008-11-26 | 比亚迪股份有限公司 | 一种混合添加剂以及含该添加剂的电解液和锂离子二次电池 |
| US20060216612A1 (en) | 2005-01-11 | 2006-09-28 | Krishnakumar Jambunathan | Electrolytes, cells and methods of forming passivation layers |
| JP2006210022A (ja) | 2005-01-25 | 2006-08-10 | Toyota Motor Corp | 電解質およびその利用 |
| JP4645648B2 (ja) | 2005-02-16 | 2011-03-09 | ダイキン工業株式会社 | 電解液 |
| JP5076283B2 (ja) | 2005-05-26 | 2012-11-21 | ソニー株式会社 | 非水二次電池 |
| EP1890357B1 (en) | 2005-06-10 | 2012-06-13 | Mitsubishi Chemical Corporation | Nonaqueous electrolyte solution, nonaqueous electrolyte secondary battery and carbonate compound |
| WO2006137224A1 (ja) * | 2005-06-23 | 2006-12-28 | Mitsubishi Chemical Corporation | 非水系電解液及びそれを用いた非水系電解液二次電池 |
| WO2007010915A1 (ja) | 2005-07-21 | 2007-01-25 | Matsushita Electric Industrial Co., Ltd. | 非水電解質二次電池及びその製造方法 |
| US8715852B2 (en) | 2005-08-18 | 2014-05-06 | Samsung Sdi Co., Ltd. | Electrolyte for lithium secondary battery and lithium secondary battery including the same |
| KR100908570B1 (ko) | 2005-08-23 | 2009-07-22 | 주식회사 엘지화학 | 3-플루오로-1,3-프로판설톤의 제조방법 |
| JP4902163B2 (ja) | 2005-09-26 | 2012-03-21 | 三洋電機株式会社 | 二次電池用非水電解液及び非水電解液二次電池 |
| WO2007043526A1 (ja) | 2005-10-12 | 2007-04-19 | Mitsui Chemicals, Inc. | 非水電解液及びそれを用いたリチウム二次電池 |
| JP2007220337A (ja) | 2006-02-14 | 2007-08-30 | Sanyo Electric Co Ltd | 二次電池用非水電解液及び非水電解液二次電池 |
| JP4976715B2 (ja) * | 2006-03-17 | 2012-07-18 | 三井化学株式会社 | 非水電解液及びそれを用いたリチウム二次電池 |
| CN101188282B (zh) | 2006-03-20 | 2010-09-08 | 日立麦克赛尔株式会社 | 非水二次电池及其使用方法 |
| US20070287071A1 (en) | 2006-06-11 | 2007-12-13 | Sanyo Electric Co., Ltd. | Non-aqueous electrolyte solution for secondary battery and non-aqueous electrolyte secondary battery using the electrolyte solution |
| JP4396675B2 (ja) | 2006-06-16 | 2010-01-13 | ソニー株式会社 | 非水電解質二次電池 |
| JP2008002011A (ja) | 2006-06-22 | 2008-01-10 | Toyobo Co Ltd | ポリイミド不織布およびその製造方法 |
| WO2008039808A2 (en) | 2006-09-25 | 2008-04-03 | Board Of Regents, The University Of Texas System | Cation-substituted spinel oxide and oxyfluoride cathodes for lithium ion batteries |
| JP2008123714A (ja) | 2006-11-08 | 2008-05-29 | Sony Corp | 電解液および電池 |
| CN102569892B (zh) | 2006-12-20 | 2014-10-01 | 3M创新有限公司 | 用于锂电池电解液的氟化化合物 |
| JP5321063B2 (ja) | 2006-12-22 | 2013-10-23 | ダイキン工業株式会社 | 非水系電解液 |
| JP2008159419A (ja) | 2006-12-25 | 2008-07-10 | Sony Corp | 非水電解液二次電池 |
| CN101606266A (zh) | 2007-02-06 | 2009-12-16 | 大金工业株式会社 | 非水系电解液 |
| JP5153156B2 (ja) | 2007-02-13 | 2013-02-27 | 三洋電機株式会社 | 非水電解質二次電池用正極の製造方法 |
| WO2008102493A1 (ja) | 2007-02-20 | 2008-08-28 | Sanyo Electric Co., Ltd. | 二次電池用非水電解液及び非水電解液二次電池 |
| JP5235437B2 (ja) | 2007-02-20 | 2013-07-10 | 三洋電機株式会社 | 二次電池用非水電解液及び非水電解液二次電池 |
| KR20150140855A (ko) | 2007-04-05 | 2015-12-16 | 미쓰비시 가가꾸 가부시키가이샤 | 이차 전지용 비수계 전해액 및 그것을 사용한 비수계 전해액 이차 전지 |
| JP4544270B2 (ja) | 2007-05-21 | 2010-09-15 | ソニー株式会社 | 二次電池用電解液および二次電池 |
| EP2160787B1 (en) | 2007-06-07 | 2014-04-30 | LG Chem, Ltd. | Non-aqueous electrolyte solution for lithium-ion secondary battery and lithium-ion secondary battery including the same |
| CN102522591A (zh) | 2007-06-12 | 2012-06-27 | 株式会社Lg化学 | 一种用于二次电池的非水电解质 |
| US9093718B2 (en) | 2007-07-04 | 2015-07-28 | Chemetall Gmbh | Crystalline, completely soluble lithium bis(oxalato)borate (LiBOB) |
| US8715865B2 (en) | 2007-07-11 | 2014-05-06 | Basf Corporation | Non-aqueous electrolytic solutions and electrochemical cells comprising the same |
| JP5620817B2 (ja) | 2007-08-16 | 2014-11-05 | エルジー・ケム・リミテッド | 非水電解液リチウム二次電池 |
| KR100898290B1 (ko) | 2007-09-12 | 2009-05-18 | 삼성에스디아이 주식회사 | 리튬 이차 전지 |
| JP5323837B2 (ja) | 2007-09-12 | 2013-10-23 | エルジー・ケム・リミテッド | 非水電解液リチウム二次電池 |
| CN101803101B (zh) | 2007-09-19 | 2013-01-09 | 株式会社Lg化学 | 非水电解质锂二次电池 |
| WO2009040367A1 (en) | 2007-09-28 | 2009-04-02 | Solvay (Société Anonyme) | Process for the preparation of fluorine containing organic compound |
| JP5239302B2 (ja) | 2007-11-14 | 2013-07-17 | ソニー株式会社 | リチウムイオン二次電池 |
| WO2009084928A2 (en) | 2008-01-02 | 2009-07-09 | Lg Chem, Ltd. | Pouch-type lithium secondary battery |
| JP4715848B2 (ja) | 2008-01-09 | 2011-07-06 | ソニー株式会社 | 電池 |
| JP5329638B2 (ja) | 2008-03-18 | 2013-10-30 | エルジー・ケム・リミテッド | リチウム二次電池用非水電解質及びそれを備えたリチウム二次電池 |
| FR2933240B1 (fr) | 2008-06-25 | 2010-10-22 | Commissariat Energie Atomique | Electrolyte non-aqueux pour accumulateur au lithium a tension elevee |
| JP5693222B2 (ja) | 2008-06-30 | 2015-04-01 | ダイキン工業株式会社 | リチウム二次電池 |
| KR101355356B1 (ko) | 2008-07-09 | 2014-01-23 | 다이킨 고교 가부시키가이샤 | 비수계 전해액 |
| WO2010013739A1 (ja) | 2008-07-30 | 2010-02-04 | ダイキン工業株式会社 | リチウム二次電池の電解質塩溶解用溶媒 |
| JP5461883B2 (ja) * | 2008-08-05 | 2014-04-02 | 三洋電機株式会社 | 二次電池用非水電解液及び非水電解液二次電池 |
| US8795903B2 (en) | 2008-08-19 | 2014-08-05 | California Institute Of Technology | Lithium-ion electrolytes containing flame retardant additives for increased safety characteristics |
| US8389160B2 (en) | 2008-10-07 | 2013-03-05 | Envia Systems, Inc. | Positive electrode materials for lithium ion batteries having a high specific discharge capacity and processes for the synthesis of these materials |
| US7988877B2 (en) | 2008-11-03 | 2011-08-02 | 3M Innovative Properties Company | Methods of making fluorinated ethers, fluorinated ethers, and uses thereof |
| US8668838B2 (en) | 2008-11-14 | 2014-03-11 | Daikin Industries, Ltd. | Electrical double layer capacitor |
| JP5278442B2 (ja) | 2009-01-06 | 2013-09-04 | 株式会社村田製作所 | 非水電解液二次電池 |
| KR101065381B1 (ko) | 2009-01-22 | 2011-09-16 | 삼성에스디아이 주식회사 | 리튬 이차 전지용 전해액 및 이를 포함하는 리튬 이차 전지 |
| US20100190055A1 (en) * | 2009-01-29 | 2010-07-29 | Gm Global Technology Operations, Inc. | Battery cell connection method and apparatus |
| EP2441751A4 (en) | 2009-06-09 | 2012-11-28 | Sumitomo Seika Chemicals | METHOD FOR PRODUCING ALKYL-SULPHON COMPOUNDS |
| JP2011049153A (ja) | 2009-07-28 | 2011-03-10 | Mitsubishi Chemicals Corp | 非水系電解液及びそれを用いた非水系電解液二次電池 |
| US8475959B2 (en) | 2009-08-27 | 2013-07-02 | Envia Systems, Inc. | Lithium doped cathode material |
| KR20120099375A (ko) | 2009-08-27 | 2012-09-10 | 엔비아 시스템즈 인코포레이티드 | 금속 산화물이 코팅된 리튬 기반 배터리용 양극 물질 |
| JP5699465B2 (ja) | 2009-08-31 | 2015-04-08 | 三菱化学株式会社 | 非水系電解液及びそれを用いたリチウム二次電池 |
| CN102484281A (zh) | 2009-08-31 | 2012-05-30 | 三菱化学株式会社 | 非水电解液及使用该非水电解液的非水电解质电池 |
| CN102498606A (zh) | 2009-09-11 | 2012-06-13 | 旭硝子株式会社 | 蓄电器件用非水电解液及蓄电器件 |
| KR101041127B1 (ko) | 2009-10-01 | 2011-06-13 | 삼성에스디아이 주식회사 | 리튬 이차 전지 |
| JP2011082033A (ja) | 2009-10-07 | 2011-04-21 | Mitsubishi Chemicals Corp | 非水系電解液二次電池モジュール |
| JP5201364B2 (ja) | 2009-10-13 | 2013-06-05 | ソニー株式会社 | 二次電池用電解液および二次電池 |
| JP2013508927A (ja) | 2009-10-27 | 2013-03-07 | ゾルファイ フルーオル ゲゼルシャフト ミット ベシュレンクテル ハフツング | リチウム硫黄バッテリ |
| US20110143217A1 (en) | 2009-12-15 | 2011-06-16 | E. I. Du Pont De Nemours And Company | Electrochemical cell comprising a separator comprising a nanoweb consisting essentially of nanofibers of fully aromatic polyimide |
| EP2522044A1 (en) | 2010-01-06 | 2012-11-14 | ETV Energy Ltd. | Lithium-ion secondary electrochemical cell and method of making lithium-ion secondary electrochemical cell |
| JP5645274B2 (ja) | 2010-02-10 | 2014-12-24 | Necエナジーデバイス株式会社 | 非水系電解液およびそれを備えるリチウムイオン二次電池 |
| JP5436657B2 (ja) | 2010-02-25 | 2014-03-05 | パナソニック株式会社 | リチウムイオン二次電池 |
| JP5145367B2 (ja) | 2010-03-11 | 2013-02-13 | 株式会社日立製作所 | 非水電解液及びこれを用いたリチウム二次電池 |
| US8735005B2 (en) | 2010-04-02 | 2014-05-27 | E I Du Pont De Nemours And Company | Fluorinated cyclic carbonates and compositions thereof |
| KR101930558B1 (ko) | 2010-05-12 | 2018-12-18 | 미쯔비시 케미컬 주식회사 | 비수계 전해액 및 비수계 전해액 2차 전지 |
| KR101243906B1 (ko) | 2010-06-21 | 2013-03-14 | 삼성에스디아이 주식회사 | 리튬 전지 및 상기 리튬 전지의 제조 방법 |
| US10438753B2 (en) | 2010-07-06 | 2019-10-08 | The United States Of America As Represented By The Secretary Of The Army | Electrolytes in support of 5V Li ion chemistry |
| JP5825927B2 (ja) | 2010-09-27 | 2015-12-02 | 東ソ−・エフテック株式会社 | 非水電解液用の難燃性溶媒、これを含有する難燃性非水電解液及び非引火性非水電解液 |
| JP5630189B2 (ja) | 2010-10-05 | 2014-11-26 | 新神戸電機株式会社 | リチウムイオン電池 |
| KR101165535B1 (ko) | 2010-10-06 | 2012-07-16 | 삼성에스디아이 주식회사 | 리튬 이차전지용 전해액 및 이를 포함하는 리튬 이차전지 |
| US8092942B1 (en) | 2010-12-07 | 2012-01-10 | E.I. Du Pont De Nemours And Company | Multifunctional sulfone/fluorinated ester solvents |
| US8518525B2 (en) | 2010-12-09 | 2013-08-27 | E I Du Pont De Nemours And Company | Polyimide nanoweb with amidized surface and method for preparing |
| US9123973B2 (en) | 2010-12-22 | 2015-09-01 | Samsung Sdi Co., Ltd. | Electrolyte for lithium secondary battery and lithium secondary battery comprising the same |
| EP2672560B1 (en) | 2011-01-31 | 2019-10-02 | Mitsubishi Chemical Corporation | Non-aqueous electrolytic solution, and non-aqueous electrolyte secondary battery using same |
| WO2012132060A1 (ja) | 2011-03-28 | 2012-10-04 | 日本電気株式会社 | 二次電池および電解液 |
| CN103443991B (zh) | 2011-03-28 | 2015-12-16 | 日本电气株式会社 | 二次电池和电解液 |
| WO2012165207A1 (ja) | 2011-05-31 | 2012-12-06 | 三洋電機株式会社 | 非水電解質電池 |
| CN103563155B (zh) | 2011-06-07 | 2017-07-21 | 3M创新有限公司 | 包含碳氟化合物电解质添加剂的锂离子电化学电池 |
| JP6194794B2 (ja) | 2011-06-23 | 2017-09-13 | 日本電気株式会社 | リチウム二次電池 |
| US8394539B2 (en) | 2011-06-24 | 2013-03-12 | GM Global Technology Operations LLC | Lithium salts of fluorinated borate esters for lithium-ion batteries |
| DK2734493T3 (en) | 2011-07-19 | 2015-11-30 | Bayer Ip Gmbh | METHOD OF PREPARING 2,2-DIFLUORETHANOL |
| CN103959544A (zh) | 2011-09-02 | 2014-07-30 | 纳幕尔杜邦公司 | 氟化电解质组合物 |
| JP6178317B2 (ja) | 2011-09-02 | 2017-08-09 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニーE.I.Du Pont De Nemours And Company | リチウムイオン電池 |
| CN102983358B (zh) | 2011-09-05 | 2015-04-15 | 轻工业化学电源研究所 | 一种应用于磷酸铁锂锂离子电池的非水电解质溶液 |
| JP2013084547A (ja) | 2011-09-28 | 2013-05-09 | Sanyo Electric Co Ltd | 非水電解質二次電池 |
| JP5884967B2 (ja) | 2011-10-18 | 2016-03-15 | トヨタ自動車株式会社 | 非水電解液二次電池及びその製造方法 |
| JP5754358B2 (ja) | 2011-11-22 | 2015-07-29 | トヨタ自動車株式会社 | 非水電解液二次電池およびその製造方法 |
| US9559350B2 (en) | 2011-11-24 | 2017-01-31 | Toyota Jidosha Kabushiki Kaisha | Method for producing nonaqueous electrolyte secondary battery |
| EP2827433B1 (en) | 2012-03-13 | 2019-09-25 | Envision AESC Energy Devices Ltd. | Secondary battery electrolyte and secondary battery using same |
| WO2013137273A1 (ja) | 2012-03-15 | 2013-09-19 | 株式会社 東芝 | 非水電解質二次電池および電池パック |
| JP5488768B2 (ja) | 2012-03-27 | 2014-05-14 | 旭硝子株式会社 | 二次電池用非水電解液およびリチウムイオン二次電池 |
| KR101492686B1 (ko) | 2012-05-30 | 2015-02-12 | 주식회사 엘지화학 | 리튬 이차 전지용 전해액 첨가제, 상기 전해액 첨가제를 포함하는 비수성 전해액 및 리튬 이차 전지 |
| CN104703960A (zh) | 2012-06-01 | 2015-06-10 | 纳幕尔杜邦公司 | 含氟酯及其制备方法 |
| WO2013180783A1 (en) | 2012-06-01 | 2013-12-05 | E. I. Du Pont De Nemours And Company | Fluorinated electrolyte compositions |
| US20150111112A1 (en) | 2012-06-01 | 2015-04-23 | E. I. Du Pont De Nemours And Company | Fluorine-containing esters and methods of preparation thereof |
| KR102064194B1 (ko) | 2012-06-01 | 2020-01-09 | 솔베이(소시에떼아노님) | 리튬 이온 배터리 |
| US20130337342A1 (en) | 2012-06-06 | 2013-12-19 | Peter B. Hallac | Electrolyte Formulation for High Voltage and Wide Temperature Lithium-Ion Cells |
| JP6138436B2 (ja) | 2012-08-09 | 2017-05-31 | 三洋電機株式会社 | 非水電解質二次電池及びその製造方法 |
| JP2014035951A (ja) | 2012-08-09 | 2014-02-24 | Sanyo Electric Co Ltd | 非水電解質二次電池 |
| JP2014035895A (ja) | 2012-08-09 | 2014-02-24 | Sanyo Electric Co Ltd | 非水電解質二次電池 |
| JP6105226B2 (ja) | 2012-08-09 | 2017-03-29 | 三洋電機株式会社 | 非水電解質二次電池 |
| JP2014035894A (ja) | 2012-08-09 | 2014-02-24 | Sanyo Electric Co Ltd | 非水電解質二次電池 |
| JP5911772B2 (ja) | 2012-08-09 | 2016-04-27 | 三洋電機株式会社 | 非水電解質二次電池及びその製造方法 |
| JP6165425B2 (ja) | 2012-08-09 | 2017-07-19 | 三洋電機株式会社 | 非水電解質二次電池及びその製造方法 |
| EP2924796B1 (en) | 2012-11-20 | 2018-04-18 | Nec Corporation | Lithium ion secondary battery |
| KR20140083170A (ko) | 2012-12-24 | 2014-07-04 | 삼성에스디아이 주식회사 | 리튬 이차 전지용 전해액 및 이를 포함하는 리튬 이차 전지 |
| CN103117414B (zh) | 2013-01-31 | 2016-03-23 | 中航锂电(洛阳)有限公司 | 一种负极钛酸锂电池用电解液、锂离子电池及其制备方法 |
| KR102030107B1 (ko) | 2013-02-25 | 2019-10-08 | 솔브레인 주식회사 | 리튬 이차 전지 |
| CN103165939A (zh) | 2013-03-01 | 2013-06-19 | 合肥国轩高科动力能源股份公司 | 一种锂离子电池高压电解液 |
| EP3588657A1 (en) | 2013-04-04 | 2020-01-01 | Solvay SA | Nonaqueous electrolyte compositions |
| JP6205889B2 (ja) | 2013-06-21 | 2017-10-04 | 株式会社豊田中央研究所 | リチウム二次電池 |
| JP6603219B2 (ja) | 2013-08-19 | 2019-11-06 | コーヒレント・ロジックス・インコーポレーテッド | 多数の無線環境で動作するためのパラメータ化されたラジオ波形 |
| WO2015046174A1 (ja) | 2013-09-24 | 2015-04-02 | 旭硝子株式会社 | 非水電解液二次電池 |
| JP2015064983A (ja) | 2013-09-24 | 2015-04-09 | 株式会社東芝 | 非水電解質二次電池及び電池パック |
| WO2015051141A1 (en) | 2013-10-04 | 2015-04-09 | E. I. Du Pont De Nemours And Company | Methods for preparation of fluorinated sulfur-containing compounds |
| WO2015051131A1 (en) | 2013-10-04 | 2015-04-09 | E. I. Du Pont De Nemours And Company | Methods for preparation of fluorinated ethers |
| CN103682440A (zh) | 2013-12-11 | 2014-03-26 | 宁德新能源科技有限公司 | 锂离子电池及其电解液 |
| CN103730688B (zh) | 2014-01-09 | 2016-06-08 | 宁德新能源科技有限公司 | 锂离子电池及其电解液 |
| JP6086248B2 (ja) | 2014-02-17 | 2017-03-01 | トヨタ自動車株式会社 | 非水電解液二次電池 |
| KR101561646B1 (ko) | 2014-03-12 | 2015-10-20 | 국립대학법인 울산과학기술대학교 산학협력단 | 리튬 이차 전지 |
| CN103943884A (zh) | 2014-04-08 | 2014-07-23 | 陈琛 | 一种锂离子电池电解液 |
| CN103972588B (zh) | 2014-05-20 | 2017-02-01 | 中国科学院宁波材料技术与工程研究所 | 非水电解液与锂离子电池 |
| WO2015179205A1 (en) | 2014-05-23 | 2015-11-26 | E. I. Du Pont De Nemours And Company | Nonaqueous electrolyte compositions comprising cyclic sulfates |
| ES2686822T3 (es) | 2014-05-23 | 2018-10-22 | Solvay Sa | Composiciones electrolíticas no acuosas que comprenden sulfatos cíclicos y boratos de litio |
| KR20190027957A (ko) | 2014-08-14 | 2019-03-15 | 솔베이(소시에떼아노님) | 술톤 및 플루오린화된 용매를 포함하는 비수성 전해질 조성물 |
| US20160087307A1 (en) | 2014-09-19 | 2016-03-24 | E I Du Pont De Nemours And Company | Nonaqueous electrolyte compositions |
-
2012
- 2012-08-31 JP JP2014528660A patent/JP6178317B2/ja active Active
- 2012-08-31 WO PCT/US2012/053439 patent/WO2013033595A1/en not_active Ceased
- 2012-08-31 CA CA2844796A patent/CA2844796C/en active Active
- 2012-08-31 EP EP12761848.6A patent/EP2751865B1/en active Active
- 2012-08-31 US US14/241,898 patent/US9673450B2/en active Active
- 2012-08-31 ES ES12761848.6T patent/ES2679287T3/es active Active
- 2012-08-31 HU HUE12761848A patent/HUE039500T2/hu unknown
- 2012-08-31 PL PL12761848T patent/PL2751865T3/pl unknown
- 2012-08-31 KR KR1020147008316A patent/KR101938921B1/ko active Active
- 2012-08-31 CN CN201280042457.8A patent/CN103765659A/zh active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP2751865A1 (en) | 2014-07-09 |
| US9673450B2 (en) | 2017-06-06 |
| PL2751865T3 (pl) | 2018-10-31 |
| CA2844796A1 (en) | 2013-03-07 |
| KR101938921B1 (ko) | 2019-01-15 |
| WO2013033595A1 (en) | 2013-03-07 |
| EP2751865B1 (en) | 2018-05-02 |
| JP2014525667A (ja) | 2014-09-29 |
| CA2844796C (en) | 2020-12-29 |
| KR20140060324A (ko) | 2014-05-19 |
| HUE039500T2 (hu) | 2019-01-28 |
| US20140248529A1 (en) | 2014-09-04 |
| CN103765659A (zh) | 2014-04-30 |
| ES2679287T3 (es) | 2018-08-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6178317B2 (ja) | リチウムイオン電池 | |
| JP6319305B2 (ja) | リチウムイオンバッテリ | |
| JP6178316B2 (ja) | フッ素化電解質組成物 | |
| JP6496921B2 (ja) | 高電圧リチウムイオン電池 | |
| CN106063015B (zh) | 反应性烷氧基硼酸锂在锂离子电池组用电解质中作为电解质添加剂的用途 | |
| CN109716577B (zh) | 膦酸酯基锂配合物 | |
| US10044066B2 (en) | Fluorinated electrolyte compositions | |
| US11362368B2 (en) | Nonaqueous electrolyte compositions | |
| JP2023071679A (ja) | オリゴマー性ホスホン酸シリルエステルを含む電解質組成物 | |
| CN106165184A (zh) | 作为锂基电池组用电解质添加剂的烷基苯甲酸酯衍生物 | |
| EP3605699A1 (en) | New components for electrolyte compositions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150818 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150818 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20160615 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160726 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20161025 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170125 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170613 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170713 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6178317 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |