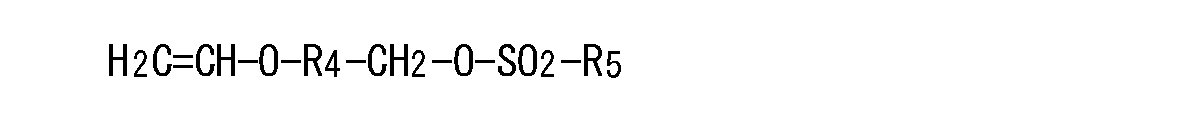JP4968614B2 - 二次電池用電解液およびそれを用いた二次電池 - Google Patents
二次電池用電解液およびそれを用いた二次電池 Download PDFInfo
- Publication number
- JP4968614B2 JP4968614B2 JP2004359152A JP2004359152A JP4968614B2 JP 4968614 B2 JP4968614 B2 JP 4968614B2 JP 2004359152 A JP2004359152 A JP 2004359152A JP 2004359152 A JP2004359152 A JP 2004359152A JP 4968614 B2 JP4968614 B2 JP 4968614B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- secondary battery
- electrolyte
- lithium
- battery according
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000003792 electrolyte Substances 0.000 title claims description 19
- -1 vinyloxy compound Chemical class 0.000 claims description 58
- 239000008151 electrolyte solution Substances 0.000 claims description 48
- 150000001875 compounds Chemical class 0.000 claims description 26
- 125000004432 carbon atom Chemical group C* 0.000 claims description 24
- 125000000217 alkyl group Chemical group 0.000 claims description 22
- VAYTZRYEBVHVLE-UHFFFAOYSA-N 1,3-dioxol-2-one Chemical compound O=C1OC=CO1 VAYTZRYEBVHVLE-UHFFFAOYSA-N 0.000 claims description 21
- 239000002904 solvent Substances 0.000 claims description 17
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 16
- 239000000010 aprotic solvent Substances 0.000 claims description 15
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 12
- 229910052799 carbon Inorganic materials 0.000 claims description 10
- 125000002947 alkylene group Chemical group 0.000 claims description 9
- 229910052717 sulfur Inorganic materials 0.000 claims description 9
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 8
- FSSPGSAQUIYDCN-UHFFFAOYSA-N 1,3-Propane sultone Chemical compound O=S1(=O)CCCO1 FSSPGSAQUIYDCN-UHFFFAOYSA-N 0.000 claims description 7
- 229910003002 lithium salt Inorganic materials 0.000 claims description 7
- 159000000002 lithium salts Chemical class 0.000 claims description 7
- 150000005678 chain carbonates Chemical class 0.000 claims description 6
- 229910002804 graphite Inorganic materials 0.000 claims description 6
- 239000010439 graphite Substances 0.000 claims description 6
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 claims description 6
- 150000007933 aliphatic carboxylic acids Chemical class 0.000 claims description 5
- 150000005676 cyclic carbonates Chemical class 0.000 claims description 5
- 150000004292 cyclic ethers Chemical class 0.000 claims description 5
- 125000004122 cyclic group Chemical group 0.000 claims description 5
- 150000002170 ethers Chemical class 0.000 claims description 5
- MHYFEEDKONKGEB-UHFFFAOYSA-N oxathiane 2,2-dioxide Chemical compound O=S1(=O)CCCCO1 MHYFEEDKONKGEB-UHFFFAOYSA-N 0.000 claims description 5
- 150000003839 salts Chemical class 0.000 claims description 5
- 125000004434 sulfur atom Chemical group 0.000 claims description 5
- 229910013063 LiBF 4 Inorganic materials 0.000 claims description 4
- 239000002253 acid Substances 0.000 claims description 4
- 229910003481 amorphous carbon Inorganic materials 0.000 claims description 4
- 125000000457 gamma-lactone group Chemical group 0.000 claims description 4
- HXJUTPCZVOIRIF-UHFFFAOYSA-N sulfolane Chemical compound O=S1(=O)CCCC1 HXJUTPCZVOIRIF-UHFFFAOYSA-N 0.000 claims description 4
- 229910010238 LiAlCl 4 Inorganic materials 0.000 claims description 3
- 229910015015 LiAsF 6 Inorganic materials 0.000 claims description 3
- 229910012513 LiSbF 6 Inorganic materials 0.000 claims description 3
- 102100031416 Gastric triacylglycerol lipase Human genes 0.000 claims description 2
- 101000941284 Homo sapiens Gastric triacylglycerol lipase Proteins 0.000 claims description 2
- 150000008065 acid anhydrides Chemical class 0.000 claims description 2
- 239000011244 liquid electrolyte Substances 0.000 claims description 2
- 229910052744 lithium Inorganic materials 0.000 description 45
- 239000010408 film Substances 0.000 description 40
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 28
- 238000000034 method Methods 0.000 description 20
- 239000000126 substance Substances 0.000 description 18
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 16
- 239000000654 additive Substances 0.000 description 13
- 230000000996 additive effect Effects 0.000 description 13
- 239000003575 carbonaceous material Substances 0.000 description 12
- 238000006243 chemical reaction Methods 0.000 description 12
- 230000000694 effects Effects 0.000 description 11
- 239000007773 negative electrode material Substances 0.000 description 11
- 239000007774 positive electrode material Substances 0.000 description 11
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 8
- HBBGRARXTFLTSG-UHFFFAOYSA-N Lithium ion Chemical compound [Li+] HBBGRARXTFLTSG-UHFFFAOYSA-N 0.000 description 8
- 239000013078 crystal Substances 0.000 description 8
- 229910001416 lithium ion Inorganic materials 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- KMTRUDSVKNLOMY-UHFFFAOYSA-N Ethylene carbonate Chemical compound O=C1OCCO1 KMTRUDSVKNLOMY-UHFFFAOYSA-N 0.000 description 7
- 229910000733 Li alloy Inorganic materials 0.000 description 7
- 229910052782 aluminium Inorganic materials 0.000 description 7
- 230000000052 comparative effect Effects 0.000 description 7
- 239000002131 composite material Substances 0.000 description 7
- 239000001989 lithium alloy Substances 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 229910013870 LiPF 6 Inorganic materials 0.000 description 6
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 6
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 6
- 210000001787 dendrite Anatomy 0.000 description 6
- 230000006866 deterioration Effects 0.000 description 6
- 230000014759 maintenance of location Effects 0.000 description 6
- 229910052751 metal Inorganic materials 0.000 description 6
- 239000002184 metal Substances 0.000 description 6
- 239000012046 mixed solvent Substances 0.000 description 6
- RUOJZAUFBMNUDX-UHFFFAOYSA-N propylene carbonate Chemical compound CC1COC(=O)O1 RUOJZAUFBMNUDX-UHFFFAOYSA-N 0.000 description 6
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 5
- 239000000956 alloy Substances 0.000 description 5
- 238000000354 decomposition reaction Methods 0.000 description 5
- 125000005843 halogen group Chemical group 0.000 description 5
- 235000002639 sodium chloride Nutrition 0.000 description 5
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- 239000004698 Polyethylene Substances 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- 229910045601 alloy Inorganic materials 0.000 description 4
- 125000003118 aryl group Chemical group 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 229910052731 fluorine Inorganic materials 0.000 description 4
- 239000011888 foil Substances 0.000 description 4
- AMXOYNBUYSYVKV-UHFFFAOYSA-M lithium bromide Chemical compound [Li+].[Br-] AMXOYNBUYSYVKV-UHFFFAOYSA-M 0.000 description 4
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 4
- 229920000573 polyethylene Polymers 0.000 description 4
- 229910052710 silicon Inorganic materials 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 3
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 3
- 125000001931 aliphatic group Chemical group 0.000 description 3
- 125000003545 alkoxy group Chemical group 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 229910052796 boron Inorganic materials 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 229920001940 conductive polymer Polymers 0.000 description 3
- 239000011889 copper foil Substances 0.000 description 3
- 230000007547 defect Effects 0.000 description 3
- 229940052303 ethers for general anesthesia Drugs 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- 229910052740 iodine Inorganic materials 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- FUJCRWPEOMXPAD-UHFFFAOYSA-N lithium oxide Chemical compound [Li+].[Li+].[O-2] FUJCRWPEOMXPAD-UHFFFAOYSA-N 0.000 description 3
- 229910001947 lithium oxide Inorganic materials 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- 229910052759 nickel Inorganic materials 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000011255 nonaqueous electrolyte Substances 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-N phosphoric acid Substances OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 3
- 239000011574 phosphorus Substances 0.000 description 3
- 229910052698 phosphorus Inorganic materials 0.000 description 3
- 239000010703 silicon Substances 0.000 description 3
- 229910052814 silicon oxide Inorganic materials 0.000 description 3
- 239000007784 solid electrolyte Substances 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 229910052723 transition metal Inorganic materials 0.000 description 3
- 150000003624 transition metals Chemical class 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- ZZXUZKXVROWEIF-UHFFFAOYSA-N 1,2-butylene carbonate Chemical compound CCC1COC(=O)O1 ZZXUZKXVROWEIF-UHFFFAOYSA-N 0.000 description 2
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 229910015643 LiMn 2 O 4 Inorganic materials 0.000 description 2
- 239000002033 PVDF binder Substances 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- 125000003172 aldehyde group Chemical group 0.000 description 2
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 2
- 150000001491 aromatic compounds Chemical class 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 239000001273 butane Substances 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 238000005229 chemical vapour deposition Methods 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 125000004093 cyano group Chemical group *C#N 0.000 description 2
- 150000001923 cyclic compounds Chemical class 0.000 description 2
- VUPKGFBOKBGHFZ-UHFFFAOYSA-N dipropyl carbonate Chemical compound CCCOC(=O)OCCC VUPKGFBOKBGHFZ-UHFFFAOYSA-N 0.000 description 2
- KLKFAASOGCDTDT-UHFFFAOYSA-N ethoxymethoxyethane Chemical compound CCOCOCC KLKFAASOGCDTDT-UHFFFAOYSA-N 0.000 description 2
- JBTWLSYIZRCDFO-UHFFFAOYSA-N ethyl methyl carbonate Chemical compound CCOC(=O)OC JBTWLSYIZRCDFO-UHFFFAOYSA-N 0.000 description 2
- FKRCODPIKNYEAC-UHFFFAOYSA-N ethyl propionate Chemical compound CCOC(=O)CC FKRCODPIKNYEAC-UHFFFAOYSA-N 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 229910000040 hydrogen fluoride Inorganic materials 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 230000002427 irreversible effect Effects 0.000 description 2
- HSZCZNFXUDYRKD-UHFFFAOYSA-M lithium iodide Inorganic materials [Li+].[I-] HSZCZNFXUDYRKD-UHFFFAOYSA-M 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000002905 metal composite material Substances 0.000 description 2
- TZIHFWKZFHZASV-UHFFFAOYSA-N methyl formate Chemical compound COC=O TZIHFWKZFHZASV-UHFFFAOYSA-N 0.000 description 2
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 125000000018 nitroso group Chemical group N(=O)* 0.000 description 2
- 150000002898 organic sulfur compounds Chemical class 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 125000004430 oxygen atom Chemical group O* 0.000 description 2
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 239000006104 solid solution Substances 0.000 description 2
- 238000004544 sputter deposition Methods 0.000 description 2
- 239000003115 supporting electrolyte Substances 0.000 description 2
- 239000010409 thin film Substances 0.000 description 2
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 2
- NAWXUBYGYWOOIX-SFHVURJKSA-N (2s)-2-[[4-[2-(2,4-diaminoquinazolin-6-yl)ethyl]benzoyl]amino]-4-methylidenepentanedioic acid Chemical compound C1=CC2=NC(N)=NC(N)=C2C=C1CCC1=CC=C(C(=O)N[C@@H](CC(=C)C(O)=O)C(O)=O)C=C1 NAWXUBYGYWOOIX-SFHVURJKSA-N 0.000 description 1
- VFRGATWKSPNXLT-UHFFFAOYSA-N 1,2-dimethoxybutane Chemical compound CCC(OC)COC VFRGATWKSPNXLT-UHFFFAOYSA-N 0.000 description 1
- CYSGHNMQYZDMIA-UHFFFAOYSA-N 1,3-Dimethyl-2-imidazolidinon Chemical compound CN1CCN(C)C1=O CYSGHNMQYZDMIA-UHFFFAOYSA-N 0.000 description 1
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 1
- PPDFQRAASCRJAH-UHFFFAOYSA-N 2-methylthiolane 1,1-dioxide Chemical compound CC1CCCS1(=O)=O PPDFQRAASCRJAH-UHFFFAOYSA-N 0.000 description 1
- VWIIJDNADIEEDB-UHFFFAOYSA-N 3-methyl-1,3-oxazolidin-2-one Chemical compound CN1CCOC1=O VWIIJDNADIEEDB-UHFFFAOYSA-N 0.000 description 1
- UAKDURJOVUATBA-UHFFFAOYSA-N 4,4-dimethyl-1,3-dioxetan-2-one;ethene Chemical compound C=C.CC1(C)OC(=O)O1 UAKDURJOVUATBA-UHFFFAOYSA-N 0.000 description 1
- LUTKACRCNQKOTM-UHFFFAOYSA-N 4-ethyl-1,3-dioxetan-2-one Chemical compound CCC1OC(=O)O1 LUTKACRCNQKOTM-UHFFFAOYSA-N 0.000 description 1
- 229920003026 Acene Polymers 0.000 description 1
- 229910001148 Al-Li alloy Inorganic materials 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 229910018871 CoO 2 Inorganic materials 0.000 description 1
- OIFBSDVPJOWBCH-UHFFFAOYSA-N Diethyl carbonate Chemical compound CCOC(=O)OCC OIFBSDVPJOWBCH-UHFFFAOYSA-N 0.000 description 1
- 229910013684 LiClO 4 Inorganic materials 0.000 description 1
- 229910013131 LiN Inorganic materials 0.000 description 1
- 229910002097 Lithium manganese(III,IV) oxide Inorganic materials 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- JFBZPFYRPYOZCQ-UHFFFAOYSA-N [Li].[Al] Chemical compound [Li].[Al] JFBZPFYRPYOZCQ-UHFFFAOYSA-N 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- 239000011149 active material Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 229910000808 amorphous metal alloy Inorganic materials 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 229910021383 artificial graphite Inorganic materials 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 229910052797 bismuth Inorganic materials 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 150000001721 carbon Chemical class 0.000 description 1
- 239000006229 carbon black Substances 0.000 description 1
- QGJOPFRUJISHPQ-NJFSPNSNSA-N carbon disulfide-14c Chemical compound S=[14C]=S QGJOPFRUJISHPQ-NJFSPNSNSA-N 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 229910021393 carbon nanotube Inorganic materials 0.000 description 1
- 239000002041 carbon nanotube Substances 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000004020 conductor Substances 0.000 description 1
- 238000000151 deposition Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- IEJIGPNLZYLLBP-UHFFFAOYSA-N dimethyl carbonate Chemical compound COC(=O)OC IEJIGPNLZYLLBP-UHFFFAOYSA-N 0.000 description 1
- 150000004862 dioxolanes Chemical class 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- QVCDGFOMYZQGIW-UHFFFAOYSA-N ethene;4-methyl-1,3-dioxetan-2-one Chemical compound C=C.CC1OC(=O)O1 QVCDGFOMYZQGIW-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- QKBJDEGZZJWPJA-UHFFFAOYSA-N ethyl propyl carbonate Chemical compound [CH2]COC(=O)OCCC QKBJDEGZZJWPJA-UHFFFAOYSA-N 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- YEJRWHAVMIAJKC-UHFFFAOYSA-N gamma-butyrolactone Natural products O=C1CCCO1 YEJRWHAVMIAJKC-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000007770 graphite material Substances 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 229910021385 hard carbon Inorganic materials 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- 229910003437 indium oxide Inorganic materials 0.000 description 1
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000004898 kneading Methods 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 229910052746 lanthanum Inorganic materials 0.000 description 1
- 229910052745 lead Inorganic materials 0.000 description 1
- 229910002102 lithium manganese oxide Inorganic materials 0.000 description 1
- VLXXBCXTUVRROQ-UHFFFAOYSA-N lithium;oxido-oxo-(oxomanganiooxy)manganese Chemical compound [Li+].[O-][Mn](=O)O[Mn]=O VLXXBCXTUVRROQ-UHFFFAOYSA-N 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000000048 melt cooling Methods 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- KKQAVHGECIBFRQ-UHFFFAOYSA-N methyl propyl carbonate Chemical compound CCCOC(=O)OC KKQAVHGECIBFRQ-UHFFFAOYSA-N 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 239000002116 nanohorn Substances 0.000 description 1
- 229910021382 natural graphite Inorganic materials 0.000 description 1
- LYGJENNIWJXYER-UHFFFAOYSA-N nitromethane Chemical compound C[N+]([O-])=O LYGJENNIWJXYER-UHFFFAOYSA-N 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 238000005268 plasma chemical vapour deposition Methods 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000767 polyaniline Polymers 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000003980 solgel method Methods 0.000 description 1
- 125000005650 substituted phenylene group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 1
- MBDNRNMVTZADMQ-UHFFFAOYSA-N sulfolene Chemical class O=S1(=O)CC=CC1 MBDNRNMVTZADMQ-UHFFFAOYSA-N 0.000 description 1
- 125000001273 sulfonato group Chemical group [O-]S(*)(=O)=O 0.000 description 1
- 150000003464 sulfur compounds Chemical class 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 229910052714 tellurium Inorganic materials 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 238000002230 thermal chemical vapour deposition Methods 0.000 description 1
- 229910052718 tin Inorganic materials 0.000 description 1
- XOLBLPGZBRYERU-UHFFFAOYSA-N tin dioxide Chemical compound O=[Sn]=O XOLBLPGZBRYERU-UHFFFAOYSA-N 0.000 description 1
- 229910001887 tin oxide Inorganic materials 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- 238000004804 winding Methods 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Secondary Cells (AREA)
- Battery Electrode And Active Subsutance (AREA)
Description
非プロトン性溶媒と、
イオウ原子を有する基R1を用いて下記一般式(1)
を具備する二次電池用電解液は充放電効率に優れサイクル特性が良好となる性質を利用したものである。
第一基R2は、置換あるいは未置換のフェニレン基、または炭素数1〜6のアルキレン基であり、
第二基R3は、水素原子、炭素数1〜6のアルキル基、ハロゲン化アルキル基、または置換あるいは未置換フェニル基であり、
第三基R4は、置換あるいは未置換のフェニレン基、または炭素数1〜6のアルキレン基であり、
第四基R5は、炭素数1〜6のアルキル基、ハロゲン化アルキル基、または置換あるいは未置換のフェニル基であり、
第五基R6は、炭素数1〜6のアルキル基、ハロゲン化アルキル基、または置換あるいは未置換のフェニル基
であることが好ましい。
からなる集合から選択される一種の溶媒または二種以上の混合溶媒が例示される。
その一般式(1)中のイオウ原子を含有する基R1がプロパンスルトン−4−イル基、
ブタンスルトン−4−イル基、またはブタンスルトン−5−イル基である化合物、
等が挙げられる。
下記一般式(10)で示されるアルカンスルホン酸無水物、
下記一般式(11)で示される環状ジスルホン酸エステル化合物、
下記化学式(12)で示される化合物、
及び、下記一般式(18)で示されるようなスルホレン誘導体
が例示される。
下記化学式(19)で表されるプロピリデンカーボネート、エチレンエチリデンカーボネート、又はエチレンイソプロピリデンカーボネート、
及び、有機ハロゲン化物を含むビニレンカーボネート、
が挙げられる。
で表される物質である。その有機イオウ化合物としては、2.5-ジメルカプト-1,3,4-チアジアゾール等の有機ジスルフィド化合物、カーボンジスルフィド、活性硫黄などが例示される。その導電性高分子としてはポリアニリン、ポリアセンなどが例示される。その有機ラジカル化合物としては、
下記化学式(22)の構造で示される官能基を有するニトロキシルラジカル化合物、
(電池の作成)
ECとDECの混合溶媒(体積比:40/60)に1mol/LのLiPF6を溶解した。これに添加剤として1.0質量%の化合物No.1を加え溶解させ、電解質溶液を得た。正極集電体が20μmのアルミニウム箔であり、正極活物質がLiMn2O4である正極を得た。負極集電体である10μmの銅箔上に、20μmのリチウム金属を蒸着した負極を得た。次に、この負極と正極を、電解液およびポリエチレンからなるセパレータを介して積層し、コイン型二次電池を作成した。
温度20℃において、充電レート0.05C、放電レート0.1C、充電終止電圧4.2V、放電終止電圧3.0V、リチウム金属負極の利用率(放電深度)は33%とし、容量維持率(%)を測定した。尚、容量維持率(%)は100サイクル後の放電容量(3.0V、リチウム金属負極の利用率(放電深度)は33%とし、容量維持率(%)を測定した。尚、容量維持率(%)は100サイクル後の放電容量(mAh)を、10サイクル目の放電容量(mAh)で割った値である。サイクル試験で得られた結果を表2に示す。
実施例1記載の添加剤の代わりに、化合物No.2を用いて電池を作成した。これ以外は、実施例1と同様にして電池を作成し評価した。実施例1と同様にサイクル特性を調べた結果を表2に示す。
電解液中に、一般式(1)で表される化合物を添加しないこと以外、実施例1と同様の電池を作成し、実施例1と同様にサイクル特性を調べた結果を表2に示す。
負極活物質として黒鉛材料を用いること以外、実施例1と同様に電池を作成し、実施例1と同様にサイクル特性(但し300サイクルまで測定)を調べた結果を表2に示す。
電解質溶媒をECとDEC混合溶媒(体積比:40/60)に代えてPCとECとDEC混合溶媒(体積比:25/25/50)を用い、負極活物質として非晶質炭素を用いること以外、実施例1と同様に電池を作成し、実施例1と同様にサイクル特性(但し300サイクルまで測定した)を調べた結果を表3に示す。
添加剤として化合物No.6を用いること以外、実施例4と同様に電池を作成し、実施例1と同様にサイクル特性(但し300サイクルまで測定した)を調べた結果を表3に示す。
添加剤を加えないこと以外は実施例3と同様にして比較例3の電池を作成した。当該電池について実施例1と同様の評価を行った。
添加剤を加えないこと以外は実施例4と同様にして比較例3の電池を作成した。当該電池について実施例1と同様の評価を行った。
(電池の作成)
本実施例の電池の作成について説明する。正極集電体に20μmのアルミニウム箔、正極中の正極活物質にLiMn2O4、負極中の負極活物質に、負極集電体の10μmの銅箔上に蒸着した20μmのリチウム金属、電解質溶液は、溶媒としてECとDEC混合溶媒(体積比:30/70)を用い、支持電解質として1mol/LのLiPF6を用いた。添加剤として、電解液中に0.5質量%の割合で化合物No.1を用いた。さらに、1,3−プロパンスルトン(以下、1,3−PSと略記)を電解液中に1質量%含ませ、本実施例6の電解液を作製した。次に、負極と正極をポリエチレンからなるセパレータを介して積層し、二次電池を作製した。
実施例1に記載の方法と同様にして測定を実施した。得られた結果を下記表4に示す。
本実施例では、添加剤として一般式(1)で表される化合物、1,3−PS、更にビニレンカーボネート(VC)を含有させた電解液を適用する。正極集電体として20μmのアルミニウム箔、正極中の正極活物質として、LiMn2O4、負極中の負極活物質として、負極集電体の10μmの銅箔上に蒸着した20μmのリチウム金属、電解質溶液は、溶媒としてECとDECの混合溶媒(体積比:40/60)を用い、この溶媒中に1mol/LのLiPF6を溶解させた。添加剤として、一般式(1)で表される化合物を電解液全体に対し0.5質量%加えた。次に1,3−PSとVCを電解液中にそれぞれ1質量%加え、本実施例の電解液を作製した。そして、負極と正極とをポリエチレンからなるセパレータを介して積層し、二次電池を作製した。
実施例1に記載の方法と同様にして測定を実施した。得られた結果を下記表5に示す。
添加剤である化合物の濃度を変える以外は実施例4と全く同様にして電池を作製、評価した。実施例4と同様にサイクル特性を調べた結果を表6に示す。
12 正極活物質を含有する層
13 負極活物質を含有する層
14 負極集電体
15 非水電解質溶液
16 多孔質セパレータ
Claims (13)
- 前記非プロトン性溶媒には、リチウム塩が溶解されている請求項2乃至4のいずれかに記載の二次電池用電解液。
- 前記リチウム塩は、LIPF6、LiBF4、LiAsF6、LiSbF6、LiCLO4、LiAlCl4、LiN(CkF2k+1SO2)2、及びLiN(CkF2k+1SO2)(CmF2m+1SO2)(k、mは独立して1または2)からなる集合から選択された少なくとも1種類の塩を含む請求項5に記載の二次電池用電解液。
- 前記ビニルオキシ化合物の電解液中における含有量が0.01〜10質量%である請求項2〜6のいずれかに記載の二次電池用電解液。
- 1,3−プロパンスルトン、1,4−ブタンスルトン、スルホラン、アルカンスルホン酸無水物、環状ジスルホン酸エステル化合物、γ―スルトン化合物、及びスルホレン化合物からなる集合から選択される少なくとも一つのスルホン化合物を更に含有する請求項2〜7のいずれかに記載の二次電池用電解液。
- ビニレンカーボネート又は前記ビニレンカーボネートの誘導体を更に含有する請求項2〜8のいずれかに記載の二次電池用電解液。
- 前記非プロトン性溶媒が、環状カーボネート類、鎖状カーボネート類、脂肪族カルボン酸エステル類、γ−ラクトン類、環状エーテル類、鎖状エーテル類、環状カーボネート類のフッ化誘導体、鎖状カーボネート類のフッ化誘導体、脂肪族カルボン酸エステル類のフッ化誘導体、γ−ラクトン類のフッ化誘導体、環状エーテル類のフッ化誘導体、及び鎖状エーテル類のフッ化誘導体からなる集合から選択された少なくとも1種類の溶媒を含有する請求項2〜9のいずれか一項に記載の二次電池用電解液。
- 請求項1〜10のいずれかに記載の二次電池用電解液と、
炭素を含む負極とを具備する
二次電池。 - 前記炭素が黒鉛である請求項11に記載の二次電池。
- 前記炭素が非晶質炭素である請求項11に記載の二次電池。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004359152A JP4968614B2 (ja) | 2004-12-10 | 2004-12-10 | 二次電池用電解液およびそれを用いた二次電池 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004359152A JP4968614B2 (ja) | 2004-12-10 | 2004-12-10 | 二次電池用電解液およびそれを用いた二次電池 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006172721A JP2006172721A (ja) | 2006-06-29 |
| JP4968614B2 true JP4968614B2 (ja) | 2012-07-04 |
Family
ID=36673258
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004359152A Expired - Lifetime JP4968614B2 (ja) | 2004-12-10 | 2004-12-10 | 二次電池用電解液およびそれを用いた二次電池 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4968614B2 (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5072056B2 (ja) * | 2005-06-07 | 2012-11-14 | 日立マクセルエナジー株式会社 | 非水電解液二次電池 |
| JP4910338B2 (ja) * | 2005-09-07 | 2012-04-04 | 三菱化学株式会社 | 非水系電解液及び非水系電解液電池 |
| JP5058538B2 (ja) * | 2006-09-13 | 2012-10-24 | Necエナジーデバイス株式会社 | リチウムイオン二次電池 |
| JP2008112722A (ja) * | 2006-10-02 | 2008-05-15 | Nec Tokin Corp | リチウムポリマー電池 |
| WO2008102493A1 (ja) * | 2007-02-20 | 2008-08-28 | Sanyo Electric Co., Ltd. | 二次電池用非水電解液及び非水電解液二次電池 |
| US9153836B2 (en) | 2007-08-23 | 2015-10-06 | Sony Corporation | Electrolytic solutions and battery |
| JP5549516B2 (ja) * | 2010-10-06 | 2014-07-16 | 日本電気株式会社 | 二次電池およびそれに用いる電解液並びに膜 |
| CA2844466C (en) | 2011-09-02 | 2021-08-17 | E. I. Du Pont De Nemours And Company | Fluorinated electrolyte compositions |
| CA2844796C (en) | 2011-09-02 | 2020-12-29 | E. I. Du Pont De Nemours And Company | Lithium ion battery with nonaqueous electrolyte comprising fluorinated acyclic carboxylic acid ester and/or fluorinated acyclic carbonate |
| JPWO2013114785A1 (ja) * | 2012-02-03 | 2015-05-11 | 日本電気株式会社 | 蓄電デバイス |
| WO2013180783A1 (en) | 2012-06-01 | 2013-12-05 | E. I. Du Pont De Nemours And Company | Fluorinated electrolyte compositions |
| CN104704657A (zh) | 2012-06-01 | 2015-06-10 | 纳幕尔杜邦公司 | 锂离子电池 |
| CN105556729B (zh) | 2013-04-04 | 2019-04-09 | 索尔维公司 | 非水电解质组合物 |
| KR102397859B1 (ko) | 2017-04-25 | 2022-05-12 | 삼성에스디아이 주식회사 | 리튬 이차 전지용 전해질 및 이를 포함하는 리튬 이차 전지 |
| KR101941401B1 (ko) * | 2018-02-07 | 2019-01-22 | 동우 화인켐 주식회사 | 전해액 조성물 및 이를 이용한 이차전지 |
| CN112701351B (zh) * | 2020-12-29 | 2022-08-19 | 中国科学院宁波材料技术与工程研究所 | 一种非水性电解液及其制备方法以及一种锂离子电池 |
| CN114361587B (zh) * | 2021-09-18 | 2024-02-09 | 华中科技大学 | 一种用于锂金属二次电池的局部高浓电解液添加剂及应用 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4726282B2 (ja) * | 2000-08-09 | 2011-07-20 | 三井化学株式会社 | 非水電解液およびそれを用いた二次電池 |
| JP4187959B2 (ja) * | 2001-10-24 | 2008-11-26 | 三井化学株式会社 | 非水電解液およびそれを用いた二次電池 |
| US7482302B2 (en) * | 2003-02-14 | 2009-01-27 | Daikin Industries, Ltd. | Fluorosulfonic acid compound, process for producing the same, and use thereof |
| JP4569128B2 (ja) * | 2004-01-14 | 2010-10-27 | 三菱化学株式会社 | リチウムイオン二次電池用非水系電解液及びリチウムイオン二次電池 |
-
2004
- 2004-12-10 JP JP2004359152A patent/JP4968614B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006172721A (ja) | 2006-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4033074B2 (ja) | 二次電池用電解液およびそれを用いた二次電池 | |
| JP5169400B2 (ja) | 非水電解液およびそれを用いた非水電解液二次電池 | |
| JP5467189B2 (ja) | 非水電解液及びそれを含む電気化学電池 | |
| JP4379567B2 (ja) | 二次電池用電解液およびそれを用いた二次電池 | |
| WO2017055282A1 (en) | Non-aqueous electrolytes for high energy lithium-ion batteries | |
| JP4465968B2 (ja) | 二次電池用電解液およびそれを用いた二次電池 | |
| JP4433163B2 (ja) | リチウム二次電池用電解液およびそれを用いたリチウム二次電池 | |
| JP4711639B2 (ja) | 非水電解液およびそれを用いたリチウム二次電池 | |
| JP5305446B2 (ja) | 非水電解液およびそれを用いた非水電解液二次電池 | |
| JP4352719B2 (ja) | リチウムイオン二次電池用電解液およびそれを用いたリチウムイオン二次電池 | |
| JP4968614B2 (ja) | 二次電池用電解液およびそれを用いた二次電池 | |
| US20070054179A1 (en) | Non-aqueous electrolyte secondary battery | |
| JP4968615B2 (ja) | 二次電池用電解液及び二次電池 | |
| JP5300054B2 (ja) | 非水電解液およびそれを用いた非水電解液二次電池 | |
| WO2014133165A1 (ja) | リチウムイオン二次電池 | |
| JP5236875B2 (ja) | 非水電解液およびそれを用いた非水電解液二次電池 | |
| JP4304570B2 (ja) | 非水電解液およびそれを用いた二次電池 | |
| JP4701601B2 (ja) | リチウム二次電池用電解液およびそれを用いたリチウム二次電池 | |
| JP4909649B2 (ja) | 非水電解液およびそれを用いた非水電解液二次電池 | |
| JP4265169B2 (ja) | 二次電池用電解液およびそれを用いた二次電池 | |
| WO2015037380A1 (ja) | 新規化合物、電解液及び二次電池 | |
| JP4525018B2 (ja) | リチウム二次電池用電解液およびそれを用いたリチウム二次電池 | |
| JP4078864B2 (ja) | 二次電池用負極および二次電池 | |
| KR20090106993A (ko) | 비수 전해액 및 이를 이용한 비수 전해액 2차 전지 | |
| CN118044034A (zh) | 锂二次电池用非水电解液及包含其的锂二次电池 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20071112 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100728 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110331 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110530 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120312 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150413 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4968614 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120325 |