KR102190198B1 - 폴리뉴클레오티드 바코드 생성 - Google Patents
폴리뉴클레오티드 바코드 생성 Download PDFInfo
- Publication number
- KR102190198B1 KR102190198B1 KR1020157024531A KR20157024531A KR102190198B1 KR 102190198 B1 KR102190198 B1 KR 102190198B1 KR 1020157024531 A KR1020157024531 A KR 1020157024531A KR 20157024531 A KR20157024531 A KR 20157024531A KR 102190198 B1 KR102190198 B1 KR 102190198B1
- Authority
- KR
- South Korea
- Prior art keywords
- delete delete
- polynucleotide
- barcode
- capsule
- sequence
- Prior art date
Links
- 0 C1C#CC2=*[C@@]12 Chemical compound C1C#CC2=*[C@@]12 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/5436—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals with ligand physically entrapped within the solid phase
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1034—Isolating an individual clone by screening libraries
- C12N15/1065—Preparation or screening of tagged libraries, e.g. tagged microorganisms by STM-mutagenesis, tagged polynucleotides, gene tags
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6806—Preparing nucleic acids for analysis, e.g. for polymerase chain reaction [PCR] assay
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6869—Methods for sequencing
- C12Q1/6874—Methods for sequencing involving nucleic acid arrays, e.g. sequencing by hybridisation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2563/00—Nucleic acid detection characterized by the use of physical, structural and functional properties
- C12Q2563/179—Nucleic acid detection characterized by the use of physical, structural and functional properties the label being a nucleic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/112—Disease subtyping, staging or classification
Abstract
본 개시내용은 폴리뉴클레오티드 프로세싱을 위한 조성물, 방법, 시스템 및 장치를 제공한다. 이러한 폴리뉴클레오티드 프로세싱은 폴리뉴클레오티드 서열결정(sequencing)을 포함하는 다양한 적용분야에 유용할 수 있다. 일부 경우, 본 개시내용은 폴리뉴클레오티드 바코드(barcode) 라이브러리를 생성하는 방법, 및 이러한 폴리뉴클레오티드를 표적 폴리뉴클레오티드에 부착시키는 방법을 제공한다.
Description
상호 참조
본원은 2013년 2월 8일자로 출원된 미국 가특허출원 제61/762,435호, 2013년 3월 15일자로 출원된 미국 가특허출원 제61/800,223호, 2013년 6월 27일자로 출원된 미국 가특허출원 제61/840,403호, 및 2013년 7월 10일자로 출원된 미국 가특허출원 제61/844,804호(상기 출원들은 모든 목적을 위해 전체로서 본원에 참고로 도입됨)의 이익을 주장한다.
폴리뉴클레오티드 바코드(barcode)는 차세대 서열결정(sequencing) 기법을 포함하는 다수의 적용분야에서 유용성을 갖는다. 이러한 바코드는 일반적으로 충분한 다양성 및 규모로 제조하기에 매우 비쌀 수 있는 독특한 식별자 서열을 함유한다. 단일 폴리뉴클레오티드 바코드를 합성하는 비용은 합성 동안 염기당 비용 및 폴리뉴클레오티드의 길이의 함수이다. 따라서, 각각 상이한 서열을 갖는 복수의 바코드를 합성하는 비용은 염기당 비용에 분자당 염기의 수를 곱하고 복수의 바코드 내의 분자의 수를 곱하여 얻은 값에 해당한다. 현재, DNA 서열을 합성하기 위해 염기당 대략 $0.10의 비용이 소요된다. 수만 내지 수백만 개의 바코드의 바코드 라이브러리의 경우, 이 비용은 엄청나게 비싸다. 따라서, 바코드의 라이브러리를 생성하는 개선된 방법에 대한 상당한 필요성이 존재한다.
본 개시내용은 폴리뉴클레오티드 바코드를 생성하는 방법, 조성물, 시스템 및 키트, 및 이러한 폴리뉴클레오티드 바코드의 용도를 제공한다. 이러한 폴리뉴클레오티드 바코드는 임의의 적합한 적용분야를 위해 사용될 수 있다.
본 개시내용의 한 양태는 바코드 서열을 각각 포함하는 하나 이상의 폴리뉴클레오티드를 포함하는 라이브러리를 제공하고, 이때 상기 폴리뉴클레오티드는 하나 이상의 구획(partition) 내에 배치되고, 상기 라이브러리는 약 1,000개 이상의 상이한 바코드 서열을 포함한다.
일부 경우, 바코드 서열은 길이에 있어서 약 5개 이상의 뉴클레오티드이다. 또한, 바코드 서열은 무작위(random) 폴리뉴클레오티드 서열일 수 있다.
더욱이, 구획은 평균 약 1개의 폴리뉴클레오티드, 평균 약 0.5개의 폴리뉴클레오티드 또는 평균 약 0.1개의 폴리뉴클레오티드를 포함할 수 있다. 상기 구획은 소적(droplet), 캡슐(capsule), 웰(well) 또는 비드(bead)일 수 있다.
나아가, 라이브러리는 약 10,000개 이상의 상이한 바코드 서열, 약 100,000개 이상의 상이한 바코드 서열, 약 500,000개 이상의 상이한 바코드 서열, 약 1,000,000개 이상의 상이한 바코드 서열, 약 2,500,00개 이상의 상이한 바코드 서열, 약 5,000,000개 이상의 상이한 바코드 서열, 약 10,000,000개 이상, 약 25,000,000개 이상, 약 50,000,000개 이상 또는 약 100,000,000개 이상의 상이한 바코드 서열을 포함할 수 있다.
일부 경우, 구획은 다수의 카피의 동일한 폴리뉴클레오티드를 포함할 수 있다.
추가로, 각각의 폴리뉴클레오티드는 고정화(immobilization) 서열, 서열결정 프라이머를 위한 어닐링(annealing) 서열, 및 표적 폴리뉴클레오티드와의 결찰(ligation)에 적합한 서열로 구성된 군으로부터 선택되는 서열을 포함할 수 있다.
일부 경우, 각각의 폴리뉴클레오티드는 MALBAC 프라이머이다.
본 개시내용의 또 다른 양태는 바코드 서열을 포함하는 폴리뉴클레오티드의 라이브러리를 합성하는 방법으로서, a) 바코드 서열을 포함하는 복수의 폴리뉴클레오티드를 합성하는 단계; b) 상기 폴리뉴클레오티드를 복수의 구획 내로 분리하여, 분할된 폴리뉴클레오티드를 생성하는 단계; c) 분할된 폴리뉴클레오티드를 증폭하여, 증폭된 폴리뉴클레오티드를 생성하는 단계; 및 d) 증폭된 폴리뉴클레오티드를 포함하는 구획을 단리하는 단계를 포함하는 방법을 제공한다. 일부 경우, 합성하는 단계는 아데닌(adenine), 타이민(thymine), 구아닌(guanine) 및 사이토신(cytosine)의 혼합물을 커플링 반응에 포함시키는 단계를 포함한다.
더욱이, 분리는 한계 희석을 수행하여 희석된 폴리뉴클레오티드를 생성하는 것을 포함할 수 있다. 일부 경우, 분리는 상기 희석된 폴리뉴클레오티드를 분할하는 것을 더 포함한다.
추가로, 증폭은 중합효소 연쇄 반응, 비대칭 중합효소 연쇄 반응, 에멀션 PCR(ePCR), 비드의 사용을 포함하는 ePCR, 하이드로겔의 사용을 포함하는 ePCR, 다중 어닐링 및 루핑(looping)에 기초한 증폭 사이클(MALBAC), 단일 프라이머 등온 증폭 및 이들의 조합으로 구성된 군으로부터 선택되는 방법에 의해 수행될 수 있다. 일부 경우, 증폭은 RNA 프라이머를 사용함으로써 수행되고 증폭된 폴리뉴클레오티드를 RNAase H에 노출시키는 것을 포함할 수 있다.
일부 경우, 바코드 서열을 포함하는 각각의 상기 폴리뉴클레오티드는 MALBAC 프라이머이다.
일부 경우, 단리는 유동 보조 분류(flow-associated sorting)에 의해 수행될 수 있다.
또한, 바코드 서열을 포함하는 폴리뉴클레오티드 및 증폭된 폴리뉴클레오티드로 구성된 군으로부터 선택되는 폴리뉴클레오티드로부터 헤어핀(hairpin) 구조체가 형성될 수 있다. 일부 경우, 방법은 어닐링되지 않은 영역 내에서 헤어핀 구조체를 절단하는 단계를 더 포함할 수 있다.
더욱이, 바코드 서열을 포함하는 상기 폴리뉴클레오티드, 상기 분할된 폴리뉴클레오티드 및 상기 증폭된 폴리뉴클레오티드로 구성된 군으로부터 선택되는 폴리뉴클레오티드를 비드에 부착시킬 수 있다.
상기 방법은 증폭된 폴리뉴클레오티드를 부분적으로 상보적인 서열과 어닐링시키는 단계를 더 포함할 수 있다. 부분적으로 상보적인 서열은 바코드 서열을 포함할 수 있다.
상기 방법은 증폭된 폴리뉴클레오티드들 중 하나 이상을 표적 서열에 부착시키는 단계를 더 포함할 수 있다. 표적 서열은 단편화될 수 있다. 일부 경우, 표적 서열은 기계적 전단 및 효소를 사용한 처리로 구성된 군으로부터 선택되는 방법에 의해 단편화된다. 기계적 전단은 초음파에 의해 유도될 수 있다. 일부 경우, 효소는 제한효소, 단편화효소(fragmentase) 및 전위효소(transposase)로 구성된 군으로부터 선택된다. 추가로, 부착은 결찰 및 증폭으로 구성된 군으로부터 선택되는 방법에 의해 수행될 수 있다.
일부 경우, 증폭은 MALBAC 프라이머로 수행되어 MALBAC 증폭 생성물을 생성하는 MALBAC 증폭이다. 일부 경우, MALBAC 프라이머는 증폭된 폴리뉴클레오티드를 포함한다. 일부 경우, MALBAC 프라이머는 상기 증폭된 폴리뉴클레오티드가 아닌 폴리뉴클레오티드를 포함한다. 이러한 경우, 상기 방법은 MALBAC 증폭 생성물을 증폭된 폴리뉴클레오티드에 부착시키는 단계를 더 포함할 수 있다.
추가로, 각각의 구획은 바코드 서열을 포함하는 폴리뉴클레오티드를 평균 약 1개, 바코드 서열을 포함하는 폴리뉴클레오티드를 평균 약 0.5개, 또는 바코드 서열을 포함하는 폴리뉴클레오티드를 평균 약 0.1개 포함할 수 있다. 더욱이, 구획은 소적, 캡슐 및 웰로 구성된 군으로부터 선택될 수 있다.
일부 경우, 라이브러리는 약 1,000개 이상의 상이한 바코드 서열, 약 10,000개 이상의 상이한 바코드 서열, 약 100,000개 이상의 상이한 바코드 서열, 약 500,000개 이상의 상이한 바코드 서열, 약 1,000,000개 이상의 상이한 바코드 서열, 약 2,500,000개 이상의 상이한 바코드 서열, 약 5,000,000개 이상의 상이한 바코드 서열, 약 10,000,000개 이상, 약 25,000,000개 이상, 약 50,000,000개 이상 또는 약 100,000,000개 이상의 상이한 바코드 서열을 포함한다.
일부 경우, 구획은 바코드 서열을 포함하는 다수의 카피의 동일한 폴리뉴클레오티드를 포함한다.
더욱이, 바코드 서열을 포함하는 폴리뉴클레오티드는 고정화 서열, 서열결정 프라이머를 위한 어닐링 서열, 및 표적 폴리뉴클레오티드와의 결찰에 적합한 서열로 구성된 군으로부터 선택되는 서열을 포함할 수 있다.
본 개시내용의 추가 양태는 약 1,000개 이상의 비드를 포함하는 라이브러리를 제공하고, 이때 약 1,000개 이상의 비드 각각은 상이한 바코드 서열을 포함한다. 일부 경우, 상이한 바코드 서열은 고정화 서열 및/또는 서열결정 프라이머를 위한 어닐링 서열을 포함하는 폴리뉴클레오티드에 포함될 수 있다. 일부 경우, 상이한 바코드 서열은 길이에 있어서 약 5개 이상의 뉴클레오티드 또는 약 10개 이상의 뉴클레오티드일 수 있다. 일부 경우, 상이한 바코드 서열은 무작위 폴리뉴클레오티드 서열일 수 있거나 조합적으로(combinatorially) 생성될 수 있다.
나아가, 1,000개의 비드 각각은 다수의 카피의 상이한 바코드 서열을 포함할 수 있다. 예를 들면, 1,000개의 비드 각각은 약 100,000개 이상, 약 1,000,000개 이상 또는 약 10,000,000개 이상의 카피의 상이한 바코드 서열을 포함할 수 있다. 일부 경우, 라이브러리는 동일한 바코드 서열을 포함하는 2개 이상의 비드를 더 포함할 수 있다. 일부 경우, 1,000개의 비드 중 2개 이상의 비드는 동일한 바코드 서열을 포함할 수 있다. 나아가, 약 1,000개 이상의 비드는 약 10,000개 이상의 비드 또는 약 100,000개 이상의 비드를 포함한다.
또한, 라이브러리는 약 1,000개 이상, 약 10,000개 이상, 약 100,000개 이상, 약 1,000,000개 이상, 약 2,500,000개 이상, 약 5,000,000개 이상, 약 10,000,000개 이상, 약 25,000,000개 이상, 약 50,000,000개 이상 또는 약 100,000,000개 이상의 상이한 바코드 서열을 포함할 수 있다.
일부 경우, 약 1,000개 이상의 비드가 복수의 구획에 분포될 수 있다. 일부 경우, 구획은 에멀션의 소적일 수 있다. 일부 경우, 1,000개의 비드 각각은 상이한 구획에 포함될 수 있다. 일부 경우, 상이한 구획은 에멀션의 소적일 수 있다. 일부 경우, 1,000개의 비드 중 2개 이상의 비드는 상이한 구획에 포함될 수 있다. 일부 경우, 상이한 구획은 에멀션의 소적일 수 있다. 일부 경우, 1,000개의 비드는 하이드로겔 비드일 수 있다.
본 개시내용의 추가 양태는 종(species)을 분할하는 데 있어서, 올리고뉴클레오티드를 분할하는 데 있어서, 구획으로부터의 종의 자극 선택적 방출에 있어서, 구획에서 반응(예를 들면, 결찰 및 증폭 반응)을 수행하는 데 있어서, 핵산 합성 반응을 수행하는 데 있어서, 핵산을 바코딩하는 데 있어서, 서열결정을 위한 폴리뉴클레오티드를 제조하는 데 있어서, 폴리뉴클레오티드를 서열결정하는 데 있어서, 돌연변이 검출에 있어서, 신경계 장애 진단에 있어서, 당뇨병 진단에 있어서, 태아 이수성(aneuploidy) 진단에 있어서, 암 돌연변이 검출 및 법의학에 있어서, 질환 검출에 있어서, 의학적 진단에 있어서, 저투입 핵산 적용분야에 있어서, 순환 종양 세포(CTC) 서열결정에 있어서, 폴리뉴클레오티드 위상조정(phasing)에 있어서, 소수의 세포로부터 폴리뉴클레오티드를 서열결정하는 데 있어서, 유전자 발현을 분석하는 데 있어서, 세포로부터 폴리뉴클레오티드를 분할하는 데 있어서 또는 이들의 조합에 있어서 본원에 기재된 라이브러리, 조성물, 방법, 장치 또는 키트의 용도를 제공한다.
참고에 의한 도입
본 명세서에서 언급된 모든 공개문헌, 특허 및 특허출원은 각각의 개별 공개문헌, 특허 또는 특허출원이 참고로 도입되는 것으로 구체적으로 및 개별적으로 표시되는 것처럼 동일한 정도로 본원에 참고로 도입된다.
본 개시내용의 방법, 조성물, 시스템 및 장치의 신규 특징은 첨부된 특허청구범위에 구체적으로 기재되어 있다. 본 개시내용의 특징 및 장점의 보다 우수한 이해는 본 개시내용의 방법, 조성물, 시스템 및 장치의 원리가 이용되는 예시적인 실시양태가 기재되어 있는 하기 상세한 설명, 및 첨부된 도면을 참조함으로써 수득될 것이다.
도 1은 예시적인 분기형(forked) 어댑터(adapter)를 도식적으로 보여준다.
도 2는 바코드 영역의 예시적인 배치를 도식적으로 보여준다.
도 3은 표적 폴리뉴클레오티드의 정반대 양 말단에 결찰된 2개의 분기형 어댑터의 예시적인 서열을 보여준다.
도 4는 실시예 1에 기재된 분기형 어댑터를 생성하는 데 사용된 도식적 예시적인 방법이다.
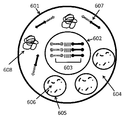
도 5는 실시예 2에 기재된 캡슐 내의 캡슐의 도식적 예이다.
도 6은 실시예 3에 기재된 캡슐 내의 캡슐의 도식적 예이다.
도 7은 실시예 4의 방법에 따라 생성될 수 있는 생성물(또는 중간체)의 도식적 예이다.
도 8a 내지 8c는 실시예 4에 기재된 예시적인 서열을 보여준다.
도 9a 내지 9j는 실시예 5에 기재된 예시적인 서열을 보여준다.
도 10a 내지 10e는 실시예 6에 기재된 예시적인 서열을 보여준다.
도 11a 내지 11d는 실시예 7에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 12는 예시적인 플로우 포커싱(flow-focusing) 방법을 통한 캡슐의 생성을 도식적으로 보여준다.
도 13은 예시적인 플로우 포커싱 방법을 통한 캡슐 내의 캡슐의 생성을 도식적으로 보여준다.
도 14a 내지 14e는 실시예 8에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 15a 내지 15e는 실시예 9에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 16은 실시예 10에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 17은 실시예 11에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 18은 실시예 12에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 19a 내지 19e는 실시예 13에 기재된 예시적인 서열을 보여준다. 도 19f는 실시예 13에 기재된 예시적인 방법 및 구조체를 기술한다.
도 20은 실시예 14에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 21a 내지 21c는 실시예 15에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 22는 실시예 16에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 23은 실시예 17에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 1은 예시적인 분기형(forked) 어댑터(adapter)를 도식적으로 보여준다.
도 2는 바코드 영역의 예시적인 배치를 도식적으로 보여준다.
도 3은 표적 폴리뉴클레오티드의 정반대 양 말단에 결찰된 2개의 분기형 어댑터의 예시적인 서열을 보여준다.
도 4는 실시예 1에 기재된 분기형 어댑터를 생성하는 데 사용된 도식적 예시적인 방법이다.
도 5는 실시예 2에 기재된 캡슐 내의 캡슐의 도식적 예이다.
도 6은 실시예 3에 기재된 캡슐 내의 캡슐의 도식적 예이다.
도 7은 실시예 4의 방법에 따라 생성될 수 있는 생성물(또는 중간체)의 도식적 예이다.
도 8a 내지 8c는 실시예 4에 기재된 예시적인 서열을 보여준다.
도 9a 내지 9j는 실시예 5에 기재된 예시적인 서열을 보여준다.
도 10a 내지 10e는 실시예 6에 기재된 예시적인 서열을 보여준다.
도 11a 내지 11d는 실시예 7에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 12는 예시적인 플로우 포커싱(flow-focusing) 방법을 통한 캡슐의 생성을 도식적으로 보여준다.
도 13은 예시적인 플로우 포커싱 방법을 통한 캡슐 내의 캡슐의 생성을 도식적으로 보여준다.
도 14a 내지 14e는 실시예 8에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 15a 내지 15e는 실시예 9에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 16은 실시예 10에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 17은 실시예 11에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 18은 실시예 12에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 19a 내지 19e는 실시예 13에 기재된 예시적인 서열을 보여준다. 도 19f는 실시예 13에 기재된 예시적인 방법 및 구조체를 기술한다.
도 20은 실시예 14에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 21a 내지 21c는 실시예 15에 기재된 방법 및 구조체를 도식적으로 보여준다.
도 22는 실시예 16에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
도 23은 실시예 17에 기재된 캡슐 내의 캡슐을 도식적으로 보여준다.
본 발명의 다양한 실시양태들이 본원에 제시되어 있고 기재되어 있지만, 이러한 실시양태들이 단지 예로서 제공된다는 것은 당업자에게 자명할 것이다. 본 발명을 벗어나지 않으면서 다수의 변경, 변화 및 치환이 당업자에게 인식될 수 있다. 본원에 기재된 본 발명의 실시양태들에 대한 다양한 대안들이 이용될 수 있다는 것을 이해해야 한다.
본 개시내용은 폴리뉴클레오티드 바코드를 생성하는 방법, 조성물, 시스템 및 키트, 및 이러한 폴리뉴클레오티드 바코드의 용도를 제공한다. 이러한 폴리뉴클레오티드 바코드는 임의의 적합한 적용분야를 위해 사용될 수 있다. 일부 경우, 본 개시내용에서 제공된 폴리뉴클레오티드 바코드는 차세대 서열결정 반응에서 사용될 수 있다. 차세대 서열결정 반응은 전체 게놈의 서열결정, 특정 서열, 예컨대, 단일 뉴클레오티드 다형성(SNP) 및 다른 돌연변이의 검출, 핵산(예를 들면, 데옥시리보핵산) 삽입의 검출 및 핵산 결실의 검출을 포함한다.
달리 표시되어 있지 않은 한, 본원에 기재된 방법, 조성물, 시스템 및 키트의 이용은 유기 화학, 중합체 기술, 마이크로플루이딕(microfluidic), 분자 생물학, 재조합 기법, 세포 생물학, 생화학 및 면역학의 임의의 보편적 기법들을 도입할 수 있다. 이러한 보편적 기법들은 웰 및 마이크로웰 구축, 캡슐 생성, 에멀션의 생성, 스폿팅(spotting), 마이크로플루이딕 장치 구축, 중합체 화학, 제한 분해, 결찰, 클로닝, 폴리뉴클레오티드 서열결정 및 폴리뉴클레오티드 서열 조립을 포함한다. 적합한 기법의 구체적인 비한정적 예는 본 개시내용 전체에 걸쳐 기재되어 있다. 그러나, 동등한 절차도 이용될 수 있다. 일부 기법들의 설명은 표준 실험실 매뉴얼, 예컨대, 매뉴얼(Genome Analysis: A Laboratory Manual Series (Vols. I-IV)), 매뉴얼(Using Antibodies: A Laboratory Manual), 매뉴얼(Cells: A Laboratory Manual), 매뉴얼(PCR Primer: A Laboratory Manual) 및 매뉴얼(Molecular Cloning: A Laboratory Manual)(모두 콜드 스프링 하버 래브러토리 프레스(Cold Spring Harbor Laboratory Press)의 매뉴얼들), 및 매뉴얼("Oligonucleotide Synthesis: A Practical Approach" 1984, IRL Press London)(이들 모두 모든 목적을 위해 전체로서 본원에 참고로 도입됨)에서 발견될 수 있다.
I. 정의
본원에서 사용된 용어는 특정 실시양태만을 기술하기 위한 것이고 한정하기 위한 것이 아니다.
본원에서 사용된 바와 같이, 문맥이 달리 명시하지 않은 한, 단수 형태는 복수 형태도 포함하기 위한 것이다. 나아가, 용어 "포함하는", "포함한다", "갖는", "갖는다", "가진", "예컨대" 또는 이들의 파생어들이 본 명세서 및/또는 특허청구범위에서 사용되는 한, 이러한 용어들은 한정하기 위한 것이 아니고 용어 "포괄하는"과 유사한 방식으로 포괄적이기 위한 것이다.
본원에서 사용된 바와 같이, 용어 "약"은 일반적으로 구체적인 사용 문맥 내에서 언급된 수치 값보다 15% 더 크거나 더 작은 범위를 지칭한다. 예를 들면, "약 10"은 8.5 내지 11.5의 범위를 포함할 것이다.
본원에서 사용된 바와 같이, 용어 "바코드"는 일반적으로 분석물에 대한 정보를 전달하기 위해 분석물에 부착될 수 있는 표지를 지칭한다. 예를 들면, 바코드는 특정 구획 내에 함유된 표적 폴리뉴클레오티드의 단편에 부착된 폴리뉴클레오티드 서열일 수 있다. 그 다음, 이 바코드는 표적 폴리뉴클레오티드의 단편으로 서열결정될 수 있다. 다수의 서열들 상의 동일한 바코드의 존재는 서열의 기원에 대한 정보를 제공할 수 있다. 예를 들면, 바코드는 서열이 특정 구획 및/또는 게놈의 근위 영역으로부터 유래하였다는 것을 표시할 수 있다. 이것은 서열결정 전 여러 구획들이 모아질 때 서열 조립에 특히 유용할 수 있다.
본원에서 사용된 바와 같이, 용어 "bp"는 일반적으로 "염기쌍"에 대한 약어를 지칭한다.
본원에서 사용된 바와 같이, 용어 "마이크로웰"은 일반적으로 1 ㎖ 미만의 부피를 갖는 웰을 지칭한다. 마이크로웰은 적용분야에 따라 다양한 부피로 제조될 수 있다. 예를 들면, 마이크로웰은 본원에 기재된 구획 부피들 중 임의의 구획 부피를 수용하기에 적합한 크기로 제조될 수 있다.
본원에서 사용된 바와 같이, 용어 "구획"은 동사 또는 명사일 수 있다. 동사로서 사용될 때(예를 들면, "분할하기 위해" 또는 "분할하는"), 상기 용어는 일반적으로 한 분획(또는 세분)을 또 다른 분획으로부터 격리시키는 데 사용될 수 있는 용기들 사이의 종 또는 샘플(예를 들면, 폴리뉴클레오티드)의 분별(예를 들면, 세분)을 지칭한다. 이러한 용기는 명사 "구획"의 사용에 의해 언급된다. 분할은 예를 들면, 마이크로플루이딕, 희석, 분배 등을 이용함으로써 수행될 수 있다. 구획은 예를 들면, 웰, 마이크로웰, 홀(hole), 소적(예를 들면, 에멀션 중의 소적), 에멀션의 연속 상, 시험 튜브, 스폿(spot), 캡슐, 비드, 희석된 용액 중의 비드의 표면, 또는 샘플의 한 분획을 또 다른 분획으로부터 격리시키기 위한 임의의 다른 적합한 용기일 수 있다. 구획은 또 다른 구획도 포함할 수 있다.
본원에서 사용된 바와 같이, 용어 "폴리뉴클레오티드" 또는 "핵산"은 일반적으로 복수의 뉴클레오티드들을 포함하는 분자를 지칭한다. 예시적인 폴리뉴클레오티드는 데옥시리보핵산, 리보핵산 및 이들의 합성 유사체(펩티드 핵산을 포함함)를 포함한다.
본원에서 사용된 바와 같이, 용어 "종"은 일반적으로 본 개시내용의 방법, 조성물, 시스템, 장치 및 키트와 함께 사용될 수 있는 임의의 물질을 지칭한다. 종의 예로는 시약, 분석물, 세포, 염색체, 태깅(tagging) 분자 또는 분자의 군, 바코드, 및 이들 종들 중 임의의 종을 포함하는 임의의 샘플이 있다. 본 개시내용 내의 다른 부분에서 보다 더 전체적으로 논의되어 있는 바와 같이, 임의의 적합한 종이 사용될 수 있다.
II. 폴리뉴클레오티드 바코딩
일부 적용분야, 예를 들면, 폴리뉴클레오티드 서열결정은 서열의 기원을 식별하기 위해 및 예를 들면, 서열결정된 단편들로부터 보다 큰 서열을 조립하기 위해 독특한 식별자("바코드")에 의존할 수 있다. 따라서, 서열결정 전 바코드를 폴리뉴클레오티드 단편에 추가하는 것이 바람직할 수 있다. 바코드는 폴리뉴클레오티드 바코드를 포함하는 다양한 상이한 포맷의 바코드일 수 있다. 바코드는 구체적인 적용분야에 따라 가역적 또는 비가역적 방식으로 폴리뉴클레오티드 단편에 부착될 수 있다. 추가로, 바코드는 서열결정 동안 개별 폴리뉴클레오티드 단편의 식별 및/또는 정량을 허용할 수 있다.
하나 이상의 바코드가 특정 구획 내로 도입되도록 바코드를 구획 내로 로딩할 수 있다. 일부 경우, 각각의 구획은 상이한 세트의 바코드를 함유할 수 있다. 이것은 바코드를 구획 내로 직접적으로 분배함으로써, 또는 바코드를 또 다른 구획 내에 함유되어 있는 구획 내에 배치함으로써 달성될 수 있다.
바코딩될 종(예를 들면, 폴리뉴클레오티드 단편, 폴리뉴클레오티드의 가닥, 세포 등)당 바코드의 예상된 또는 예측된 비로 바코드를 구획 내로 로딩할 수 있다. 일부 경우, 종당 약 0.0001개, 0.001개, 0.1개, 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 20개, 50개, 100개, 500개, 1000개, 5000개, 10000개 또는 200000개의 바코드가 로딩되도록 바코드를 구획 내로 로딩한다. 일부 경우, 종당 약 0.0001개, 0.001개, 0.1개, 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 20개, 50개, 100개, 500개, 1000개, 5000개, 10000개 또는 200000개 초과의 바코드가 로딩되도록 바코드를 구획 내로 로딩한다. 일부 경우, 종당 약 0.0001개, 0.001개, 0.1개, 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 20개, 50개, 100개, 500개, 1000개, 5000개, 10000개 또는 200000개 미만의 바코드가 로딩되도록 바코드를 구획 내로 로딩한다.
폴리뉴클레오티드 단편당 1개 초과의 바코드가 존재할 때, 이러한 바코드는 동일한 바코드의 카피일 수 있거나 상이한 바코드일 수 있다. 예를 들면, 부착 공정은 다수의 동일한 바코드들을 단일 폴리뉴클레오티드 단편에 부착시키거나 다수의 상이한 바코드들을 폴리뉴클레오티드 단편에 부착시키도록 디자인될 수 있다.
본원에서 제공된 방법은 바코드를 폴리뉴클레오티드 단편에 부착시키는 데 필요한 시약으로 구획을 로딩하는 단계를 포함할 수 있다. 결찰 반응의 경우, 제한효소, 결찰효소, 완충제, 어댑터, 바코드 등을 포함하는 시약을 구획 내로 로딩할 수 있다. 증폭에 의한 바코딩의 경우, 프라이머, DNA 중합효소, dNTP, 완충제, 바코드 등을 포함하는 시약을 구획 내로 로딩할 수 있다. 트랜스포존(transposon) 매개 바코딩(예를 들면, NEXTERA)의 경우, 트랜스포좀(transposome)(즉, 전위효소 및 트랜스포존 말단 복합체), 완충제 등을 포함하는 시약을 구획 내로 로딩할 수 있다. MALBAC 매개 바코딩의 경우, MALBAC 프라이머, 완충제 등을 포함하는 시약을 구획 내로 로딩할 수 있다. 본 개시내용 전체에 걸쳐 기재된 바와 같이, 이들 시약들을 구획 내로 직접적으로 또는 또 다른 구획을 통해 로딩할 수 있다.
스티키(sticky) 또는 블런트(blunt) 말단을 사용하여 바코드를 폴리뉴클레오티드 단편에 결찰시킬 수 있다. 바코드를 포함하는 프라이머를 사용하여 폴리뉴클레오티드 단편을 증폭함으로써 바코딩된 폴리뉴클레오티드 단편을 생성할 수도 있다. 일부 경우, 폴리뉴클레오티드 단편의 MALBAC 증폭을 이용하여 바코딩된 폴리뉴클레오티드 단편을 생성할 수 있다. MALBAC를 위해 사용된 프라이머는 바코드를 포함할 수 있거나 포함하지 않을 수 있다. MALBAC 프라이머가 바코드를 포함하지 않는 경우, 바코드를 다른 증폭 방법, 예를 들면, PCR로 MALBAC 증폭 생성물에 추가할 수 있다. 트랜스포존 매개 방법을 이용하여 바코딩된 폴리뉴클레오티드 단편을 생성할 수도 있다. 본 개시내용에서 논의된 임의의 다른 종과 마찬가지로, 이들 모듈들은 분석 또는 공정의 필요성에 따라 동일한 또는 상이한 구획 내에 함유될 수 있다.
일부 경우, 모듈 포맷으로 조립하도록 디자인된 보다 작은 성분들로부터 바코드를 조합적으로 조립할 수 있다. 예를 들면, 3개의 모듈인 1A, 1B 및 1C를 조합적으로 조립하여 바코드 1ABC를 생성할 수 있다. 이러한 조합적 조립은 복수의 바코드들을 합성하는 비용을 상당히 감소시킬 수 있다. 예를 들면, 3개의 A 모듈, 3개의 B 모듈 및 3개의 C 모듈로 구성된 조합 시스템은 단지 9개의 모듈로부터 3*3*3 = 27개의 가능한 바코드 서열을 생성할 수 있다.
일부 경우, 본 개시내용의 다른 부분에 보다 더 기재된 바와 같이, 2개의 올리고뉴클레오티드들을 혼합하고 이들을 혼성화하여 어닐링된 또는 부분적으로 어닐링된 올리고뉴클레오티드(예를 들면, 분기형 어댑터)를 생성함으로써 바코드들을 조합적으로 조립할 수 있다. 이들 바코드들은 바코딩될 폴리뉴클레오티드 단편과의 결찰을 용이하게 하기 위해 하나 이상의 뉴클레오티드의 돌출부(overhang)를 포함할 수 있다. 일부 경우, 이중 가닥 결찰을 보장하기 위해 안티센스 가닥의 5' 말단을 인산화시킬 수 있다. 이 방법을 이용하여 예를 들면, 올리고뉴클레오티드 A와 B, A와 C, A와 D, B와 C, B와 D 등을 혼합함으로써 상이한 모듈을 조립할 수 있다. 본 개시내용의 다른 부분에 보다 더 상세히 기재된 바와 같이, 어닐링된 올리고뉴클레오티드는 바코딩될 폴리뉴클레오티드와의 결찰 후 절단될 수 있는 헤어핀 루프를 갖는 단일 분자로서 합성될 수도 있다.
본 개시내용의 다른 부분에 보다 더 상세히 기재된 바와 같이, 폴리뉴클레오티드들을 서로 부착시키는 것은 혼성화 적합성 돌출부에 의존할 수 있다. 예를 들면, 종종 A와 T 사이의 혼성화를 이용하여 단편들 사이의 결찰 적합성을 보장한다. 일부 경우, 효소, 예컨대, Taq 중합효소로 처리하여 A 돌출부를 생성할 수 있다. 일부 경우, 제한효소를 사용하여 예를 들면, A 또는 T일 수 있는 단일 염기 3' 돌출부를 갖는 절단 생성물을 생성할 수 있다. 단일 염기 3' 돌출부를 남기는 제한효소의 예로는 MnII, HphI, Hpy188I, HpyAV, HpyCH4III, MboII, BciVI, BmrI, AhdI 및 XcmI이 있다. 다른 경우, 상이한 돌출부(예를 들면, 5' 돌출부, 단일 염기보다 더 큰 돌출부)를 제한효소로 생성할 수 있다. 돌출부를 생성하는 데 사용될 수 있는 추가 제한효소는 BfuCl, TaqαI, BbVI, Bccl, BceAl, BcoDI, BsmAI 및 BsmFI을 포함한다.
III. 분할된 바코드 라이브러리의 생성
일부 경우, 본 개시내용은 분할된 바코드 라이브러리를 생성하는 방법, 및 이러한 방법에 따라 생성된 라이브러리를 제공한다. 일부 경우, 본원에서 제공된 방법은 DNA 서열의 무작위 합성, 구획 내로의 분리, 분리된 서열의 증폭, 및 증폭되고 분리된 서열의 단리를 병용하여 구획 내에 함유된 바코드의 라이브러리를 제공한다.
a. 폴리뉴클레오티드 바코드의 무작위 합성
일부 경우, 본원에 기재된 방법은 무작위 DNA 합성 방법을 포함하는 무작위 폴리뉴클레오티드 합성 방법을 이용한다. 무작위 DNA 합성 동안, 커플링 단계에서 각각의 종류의 염기가 생성물의 서브세트(subset)에 커플링되도록 A, C, G 및/또는 T의 임의의 조합물을 커플링 단계에 첨가할 수 있다. A, C, G 및 T가 동등한 농도로 존재하는 경우, 생성물의 대략 4분의 1이 각각의 염기를 포함할 것이다. 연속적인 커플링 단계 및 커플링 반응의 무작위 성질은 4 n 개의 가능한 서열들이 생성될 수 있게 하고, 이때 n은 폴리뉴클레오티드 내의 염기의 수이다. 예를 들면, 길이 6의 무작위 폴리뉴클레오티드의 라이브러리는 46 = 4,096개의 구성원들이라는 다양성을 가질 수 있는 반면, 길이 10의 라이브러리는 1,048,576개의 구성원들이라는 다양성을 가질 것이다. 따라서, 매우 큰 복잡한 라이브러리를 생성할 수 있다. 이들 무작위 서열들은 바코드로서 사용될 수 있다.
임의의 적합한 합성 염기도 본 발명과 함께 사용될 수 있다. 일부 경우, 바람직한 생성물을 합성하기 위해 각각의 커플링 단계에 포함된 염기를 변경시킬 수 있다. 예를 들면, 각각의 커플링 단계에 존재하는 염기의 수는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 보다 더 큰 수일 수 있다. 일부 경우, 각각의 커플링 단계에 존재하는 염기의 수는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 또는 보다 더 큰 수일 수 있다. 일부 경우, 각각의 커플링 단계에 존재하는 염기의 수는 2, 3, 4, 5, 6, 7, 8, 9 또는 10 미만일 수 있다.
바람직한 생성물을 합성하기 위해 개별 염기의 농도를 변경시킬 수도 있다. 예를 들면, 임의의 염기는 또 다른 염기의 농도의 약 0.1배, 0.5배, 1배, 5배 또는 10배의 농도로 존재할 수 있다. 일부 경우, 임의의 염기는 또 다른 염기의 농도의 약 0.1배, 0.5배, 1배, 5배 또는 10배 이상의 농도로 존재할 수 있다. 일부 경우, 임의의 염기는 또 다른 염기의 농도의 약 0.1배, 0.5배, 1배, 5배 또는 10배 미만의 농도로 존재할 수 있다.
무작위 폴리뉴클레오티드 서열의 길이는 적용분야에 따라 임의의 적합한 길이일 수 있다. 일부 경우, 무작위 폴리뉴클레오티드 서열의 길이는 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개 또는 보다 더 많은 수의 뉴클레오티드일 수 있다. 일부 경우, 무작위 폴리뉴클레오티드 서열의 길이는 적어도 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개 또는 보다 더 많은 수의 뉴클레오티드일 수 있다. 일부 경우, 무작위 폴리뉴클레오티드 서열의 길이는 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개 또는 20개 미만의 뉴클레오티드일 수 있다.
일부 경우 라이브러리는 구성원의 수에 의해 정의된다. 일부 경우, 라이브러리는 약 256개, 1024개, 4096개, 16384개, 65536개, 262144개, 1048576개, 4194304개, 16777216개, 67108864개, 268435456개, 1073741824개, 4294967296개, 17179869184개, 68719476736개, 2.74878*1011개 또는 1.09951*1012개의 구성원들을 포함할 수 있다. 일부 경우, 라이브러리는 약 256개, 1024개, 4096개, 16384개, 65536개, 262144개, 1048576개, 4194304개, 16777216개, 67108864개, 268435456개, 1073741824개, 4294967296개, 17179869184개, 68719476736개, 2.74878*1011개 또는 1.09951*1012개 이상의 구성원들을 포함할 수 있다. 일부 경우, 라이브러리는 약 256개, 1024개, 4096개, 16384개, 65536개, 262144개, 1048576개, 4194304개, 16777216개, 67108864개, 268435456개, 1073741824개, 4294967296개, 17179869184개, 68719476736개, 2.74878*1011개 또는 1.09951*1012개 미만의 구성원들을 포함할 수 있다. 일부 경우, 라이브러리는 바코드 라이브러리이다. 일부 경우, 바코드 라이브러리는 약 1000개, 10000개, 100000개, 1000000개, 2500000개, 5000000개, 10000000개, 25000000개, 50000000개 또는 100000000개 이상의 상이한 바코드 서열을 포함할 수 있다.
무작위 바코드 라이브러리는 다른 폴리뉴클레오티드 서열도 포함할 수 있다. 일부 경우, 이 다른 폴리뉴클레오티드 서열은 성질 면에서 비무작위적이고, 예를 들면, 프라이머 결합 부위, 분기형 어댑터의 생성을 위한 어닐링 부위, 고정화 서열, 및 표적 폴리뉴클레오티드 서열과의 어닐링을 가능하게 하여 폴리뉴클레오티드 서열의 바코딩을 가능하게 하는 영역을 포함한다.
b. 구획 내로의 폴리뉴클레오티드의 분리
무작위 바코드 서열을 포함하는 폴리뉴클레오티드의 합성 후, 상기 폴리뉴클레오티드를 별개의 구획 내로 분할하여 바코드 서열을 포함하는 분할된 폴리뉴클레오티드의 라이브러리를 생성한다. 임의의 적합한 분리 방법 및 임의의 적합한 구획 또는 구획 내의 구획을 이용할 수 있다.
일부 경우, 특정 부피의 희석액이 평균 1개 미만의 폴리뉴클레오티드를 함유하도록 무작위 바코드 서열을 포함하는 폴리뉴클레오티드의 혼합물을 희석함으로써 분할을 수행한다. 그 다음, 상기 특정 부피의 희석액을 구획으로 옮길 수 있다. 따라서, 임의의 복수의 구획들에서 각각의 구획은 1개 또는 0개의 폴리뉴클레오티드 분자를 가질 가능성이 높다.
일부 경우, 각각의 구획이 약 0.001개, 0.01개, 0.1개, 0.2개, 0.3개, 0.4개, 0.5개, 0.6개, 0.7개, 0.8개, 0.9개, 1개, 2개 또는 보다 더 많은 수의 분자를 포함하도록 희석을 수행할 수 있다. 일부 경우, 각각의 구획이 적어도 약 0.001개, 0.01개, 0.1개, 0.2개, 0.3개, 0.4개, 0.5개, 0.6개, 0.7개, 0.8개, 0.9개, 1개, 2개 또는 보다 더 많은 수의 분자를 포함하도록 희석을 수행할 수 있다. 일부 경우, 각각의 구획이 약 0.001개, 0.01개, 0.1개, 0.2개, 0.3개, 0.4개, 0.5개, 0.6개, 0.7개, 0.8개, 0.9개, 1개 또는 2개 미만의 분자를 포함하도록 희석을 수행할 수 있다.
일부 경우, 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%의 구획이 특정된 수의 분자를 포함한다. 일부 경우, 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90% 이상의 구획이 특정된 수의 분자를 포함한다. 일부 경우, 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90% 미만의 구획이 특정된 수의 분자를 포함한다.
일부 경우, 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90%의 구획이 1개 이하의 폴리뉴클레오티드를 포함한다. 일부 경우, 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90% 이상의 구획이 1개 이하의 폴리뉴클레오티드를 포함한다. 일부 경우, 약 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90% 미만의 구획이 1개 이하의 폴리뉴클레오티드를 포함한다.
일부 경우, 구획은 웰, 마이크로웰, 홀, 소적(예를 들면, 에멀션 중의 소적), 에멀션의 연속 상, 시험 튜브, 스폿, 캡슐, 비드의 표면, 또는 샘플의 한 분획을 또 다른 분획으로부터 격리시키기 위한 임의의 다른 적합한 용기이다. 구획이 비드를 포함하는 경우, 증폭을 위한 프라이머를 비드에 부착시킬 수 있다. 구획은 본 개시내용의 다른 부분에 보다 더 상세히 기재되어 있다.
c. 분할된 폴리뉴클레오티드의 증폭
표적 폴리뉴클레오티드 서열의 바코딩을 위한 충분한 물질을 생성하기 위해 전술한 바와 같이 분할된 폴리뉴클레오티드를 증폭한다. 중합효소 연쇄 반응(PCR), 결찰효소 연쇄 반응(LCR), 나선분리효소(helicase) 의존적 증폭, 기하급수적 증폭 후 선형 증폭 PCR(LATE-PCR), 비대칭 증폭, 디지털 PCR, 축퇴 올리고뉴클레오티드 프라이머 PCR(DOP-PCR), 프라이머 연장 예비증폭 PCR(PEP-PCR), 결찰 매개 PCR, 롤링 서클(rolling circle) 증폭, 다중 이탈 증폭(MDA), 단일 프라이머 등온 증폭(SPIA), 에멀션 PCR(ePCR), 비드의 사용을 포함하는 ePCR, 하이드로겔의 사용을 포함하는 ePCR, 다중 어닐링 및 루핑에 기초한 증폭 사이클(MALBAC), 및 이들의 조합을 포함하는 임의의 적합한 증폭 방법이 이용될 수 있다. MALBAC 방법은 예를 들면, 전체로서 본원에 참고로 도입되는 문헌(Zong et al., Science, 338(6114), 1622-1626 (2012))에 기재되어 있다.
일부 경우, 예를 들면, 단일 가닥 생성물을 생성하는 증폭 방법(예를 들면, 비대칭 증폭, SPIA 및 LATE-PCR)이 바람직할 수 있다. 일부 경우, 이중 가닥 생성물을 생성하는 증폭 방법(예를 들면, 표준 PCR)이 바람직할 수 있다. 일부 경우, 증폭 방법은 분할된 폴리뉴클레오티드를 기하급수적으로 증폭할 수 있다. 일부 경우, 증폭 방법은 분할된 폴리뉴클레오티드를 선형적으로 증폭할 것이다. 일부 경우, 증폭 방법은 폴리뉴클레오티드를 먼저 기하급수적으로 증폭한 후 선형적으로 증폭할 것이다. 더욱이, 단일 종류의 증폭을 이용하여 폴리뉴클레오티드를 증폭할 수 있거나 상이한 종류의 증폭의 순차적 단계로 증폭을 완료할 수 있다. 예를 들면, ePCR을 추가 라운드의 ePCR과 조합할 수 있거나 상이한 종류의 증폭과 조합할 수 있다.
증폭은 바코드를 포함하는 적합한 양의 폴리뉴클레오티드가 생성될 때까지 수행된다. 일부 경우, 증폭은 10회, 15회, 20회, 25회, 30회, 35회, 40회, 45회, 50회, 55회, 60회 또는 보다 더 많은 횟수의 사이클 동안 수행될 수 있다. 일부 경우, 증폭은 적어도 10회, 15회, 20회, 25회, 30회, 35회, 40회, 45회, 50회, 55회, 60회 또는 보다 더 많은 횟수의 사이클 동안 수행될 수 있다. 일부 경우, 증폭은 10회, 15회, 20회, 25회, 30회, 35회, 40회, 45회, 50회, 55회 또는 60회 미만의 사이클 동안 수행될 수 있다.
일부 경우, 증폭은 각각의 구획에서 일정량의 폴리뉴클레오티드 생성물이 생성될 때까지 수행될 수 있다. 일부 경우, 증폭은 폴리뉴클레오티드 생성물의 양이 약 10,000,000,000개; 5,000,000,000개; 1,000,000,000개; 500,000,000개; 100,000,000개; 50,000,000개; 10,000,000개; 5,000,000개; 1,000,000개; 500,000개; 400,000개; 300,000개; 200,000개; 또는 100,000개의 분자일 때까지 수행된다. 일부 경우, 증폭은 폴리뉴클레오티드 생성물의 양이 약 100,000개; 200,000개; 300,000개; 400,000개; 500,000개; 1,000,000개; 5,000,000개; 10,000,000개; 50,000,000개; 100,000,000개; 500,000,000개; 1,000,000,000개; 5,000,000,000개; 또는 10,000,000,000개 이상의 분자일 때까지 수행된다. 일부 경우, 증폭은 폴리뉴클레오티드 생성물의 양이 약 10,000,000,000개; 5,000,000,000개; 1,000,000,000개; 500,000,000개; 100,000,000개; 50,000,000개; 10,000,000개; 5,000,000개; 1,000,000개; 500,000개; 400,000개; 300,000개; 200,000개; 또는 100,000개 미만의 분자일 때까지 수행된다.
d. 증폭된 서열을 포함하는 구획의 단리
전술한 바와 같이, 일부 경우, 바코드를 포함하는 폴리뉴클레오티드는 각각의 구획이 평균 1개 미만의 폴리뉴클레오티드 서열을 함유하도록 분할된다. 따라서, 일부 경우, 구획의 극히 일부는 폴리뉴클레오티드를 함유하지 않을 것이므로 증폭된 폴리뉴클레오티드를 함유할 수 없다. 따라서, 폴리뉴클레오티드를 포함하지 않는 구획으로부터 폴리뉴클레오티드를 포함하는 구획을 분리하는 것이 바람직할 수 있다.
한 경우, 폴리뉴클레오티드를 포함하는 구획을 식별할 수 있는 유동에 기초한 분류 방법을 이용하여 폴리뉴클레오티드를 포함하지 않는 구획으로부터 폴리뉴클레오티드를 포함하는 구획을 분리한다. 일부 경우, 폴리뉴클레오티드를 포함하지 않는 구획으로부터 폴리뉴클레오티드를 포함하는 구획을 식별하기 위해 폴리뉴클레오티드의 존재의 지표를 사용할 수 있다.
일부 경우, 핵산 염료를 사용하여 폴리뉴클레오티드를 포함하는 구획을 식별할 수 있다. 예시적인 염료는 인터칼레이팅(intercalating) 염료, 마이너 홈(minor-groove) 결합제, 메이저 홈(major groove) 결합제, 외부 결합제 및 비스-인터칼레이터(bis-intercalator)를 포함한다. 이러한 염료의 구체적인 예로는 SYBR 그린, SYBR 블루, DAPI, 프로피듐 요오다이드, SYBR 금, 에티듐 브로마이드, 아크리딘(acridines), 프로플라빈(proflavine), 아크리딘 오렌지, 아크리플라빈(acriflavine), 플루오르쿠마닌(fluorcoumanin), 엘립티신(ellipticine), 다우노마이신(daunomycin), 클로로퀸(chloroquine), 디스타마이신(distamycin) D, 크로모마이신(chromomycin), 호미듐(homidium), 미쓰라마이신(mithramycin), 루테늄 폴리피리딜, 안쓰라마이신(anthramycin), 페난쓰리딘(phenanthridines) 및 아크리딘, 에티듐 브로마이드, 프로피듐 요오다이드, 헥시듐 요오다이드, 디하이드로에티듐, 에티듐 동종이량체-1 및 동종이량체-2, 에티듐 모노아자이드, ACMA, 인돌, 이미다졸(예를 들면, 헥스트(Hoechst) 33258, 헥스트 33342, 헥스트 34580 및 DAPI), 아크리딘 오렌지(인터칼레이팅할 수도 있음), 7-AAD, 악티노마이신(actinomycin) D, LDS751, 하이드록시스틸바미딘(hydroxystilbamidine), SYTOX 블루, SYTOX 그린, SYTOX 오렌지, POPO-1, POPO-3, YOYO-1, YOYO-3, TOTO-1, TOTO-3, JOJO-1, LOLO-1, BOBO-1, BOBO-3, PO-PRO-1, PO-PRO-3, BO-PRO-1, BO-PRO-3, TO-PRO-1, TO-PRO-3, TO-PRO-5, JO-PRO-1, LO-PRO-1, YO-PRO-1, YO-PRO-3, 피코그린(PicoGreen), 올리그린(OliGreen), 리보그린(RiboGreen), SYBR 골드, SYBR 그린 I, SYBR 그린 II, SYBR DX, SYTO-40, SYTO-41, SYTO-42, SYTO-43, SYTO-44, SYTO-45(블루), SYTO-13, SYTO-16, SYTO-24, SYTO-21, SYTO-23, SYTO-12, SYTO-11, SYTO-20, SYTO-22, SYTO-15, SYTO-14, SYTO-25(그린), SYTO-81, SYTO-80, SYTO-82, SYTO-83, SYTO-84, SYTO-85(오렌지), SYTO-64, SYTO-17, SYTO-59, SYTO-61, SYTO-62, SYTO-60 및 SYTO-63(레드)이 있다.
일부 경우, 단리 방법, 예컨대, 입자의 자기 분리 또는 침강이 이용될 수 있다. 이러한 방법은 예를 들면, 증폭될 폴리뉴클레오티드, 증폭될 상기 폴리뉴클레오티드에 상응하는 프라이머 및/또는 증폭의 폴리뉴클레오티드 생성물을 비드에 부착시키는 단계를 포함할 수 있다. 일부 경우, 증폭될 폴리뉴클레오티드, 증폭될 상기 폴리뉴클레오티드에 상응하는 프라이머 및/또는 폴리뉴클레오티드 생성물은 광불안정성 링커, 예컨대, PC 아미노 C6을 통해 비드에 부착될 수 있다. 광불안정성 링커가 사용되는 경우, 광을 이용하여 비드로부터 연결된 폴리뉴클레오티드를 방출할 수 있다. 비드는 예를 들면, 자기 비드 또는 라텍스 비드일 수 있다. 그 다음, 비드는 예를 들면, 자기 분류 또는 침강에 의한 분리를 가능하게 할 수 있다. 라텍스 입자의 침강은 예를 들면, 라텍스보다 더 조밀한 액체, 예컨대, 글리세롤에서의 원심분리에 의해 수행될 수 있다. 일부 경우, 밀도 구배 원심분리가 이용될 수 있다.
비드는 균일한 크기 또는 불균일한 크기의 비드일 수 있다. 일부 경우, 비드의 직경은 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm일 수 있다. 비드는 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm 이상의 직경을 가질 수 있다. 일부 경우, 비드는 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm 미만의 직경을 가질 수 있다. 일부 경우, 비드는 약 0.001 ㎛ 내지 1 mm, 0.01 ㎛ 내지 900 ㎛, 0.1 ㎛ 내지 600 ㎛, 100 ㎛ 내지 200 ㎛, 100 ㎛ 내지 300 ㎛, 100 ㎛ 내지 400 ㎛, 100 ㎛ 내지 500 ㎛, 100 ㎛ 내지 600 ㎛, 20 ㎛ 내지 50 ㎛, 150 ㎛ 내지 200 ㎛, 150 ㎛ 내지 300 ㎛, 또는 150 ㎛ 내지 400 ㎛의 직경을 가질 수 있다.
일부 경우, 폴리뉴클레오티드를 포함하는 구획과 폴리뉴클레오티드를 포함하지 않는 구획 사이의 상이한 전하를 이용하여 예를 들면, 구획에 대해 전기영동 또는 유전영동(dielectrophoresis)을 수행함으로써 폴리뉴클레오티드를 포함하는 구획을 단리할 수 있다.
일부 경우, 삼투압의 차이에 기초한 구획의 선택적 팽창 또는 수축을 이용하여 폴리뉴클레오티드를 포함하는 입자를 식별할 수 있다. 일부 경우, 폴리뉴클레오티드를 포함하는 구획을 유동 분별, 용매 추출, (예를 들면, 핵산 프로브를 사용한) 상이한 용융 또는 동결로 단리할 수 있다.
폴리뉴클레오티드를 포함하는 구획의 단리는 1회 벌크 합성 비용만을 발생시키면서 상당한 다양성을 갖는 분할된 폴리뉴클레오티드 바코드의 라이브러리를 제공한다.
IV. 바코드를 포함하는 어댑터의 생성
본 개시내용에 기재된 바코드는 다양한 구조를 가질 수 있다. 일부 경우, 본 개시내용의 바코드는 어댑터의 일부일 수 있다. 일반적으로, "어댑터"는 바코드를 표적 폴리뉴클레오티드에 부착시킬 수 있게 하기 위해 사용되는 구조체이다. 어댑터는 예를 들면, 바코드, 표적 폴리뉴클레오티드와의 결찰에 적합한 폴리뉴클레오티드 서열, 및 기능성 서열, 예컨대, 프라이머 결합 부위 및 고정화 영역을 포함할 수 있다.
일부 경우, 어댑터는 분기형 어댑터이다. 분기형 어댑터의 한 예는 도 1에 도식적으로 표시되어 있다. 도 1을 참조하면, 2 카피의 분기형 어댑터 구조체(106)가 표적 폴리뉴클레오티드(105)의 정반대 양쪽 상에 표시되어 있다. 각각의 분기형 어댑터는 제1 고정화 영역(101), 제2 고정화 영역(102), 제1 서열결정 프라이머 영역(103), 제2 서열결정 프라이머 영역(104), 및 서로 어닐링하는 (103 및 104 내의) 한 쌍의 부분적으로 상보적인 영역을 포함한다. 서열결정 프라이머 영역 또는 고정화 영역을 사용하여 바코딩된 폴리뉴클레오티드를 예를 들면, 비드의 표면 상에 고정시킬 수 있다. 서열결정 프라이머 영역은 예를 들면, 서열결정 프라이머를 위한 어닐링 부위로서 사용될 수 있다. 일부 경우, 표적 서열과의 상용가능성을 가능하게 하도록 돌출부를 디자인할 수 있다. 도 1에서, 한 쌍의 어닐링된 폴리뉴클레오티드(103 및 104)는 표적 폴리뉴클레오티드(105) 상의 3'-A 돌출부와 상용가능한 3'-T 돌출부를 갖는다. 바코드는 분기형 어댑터의 임의의 적합한 부분에 포함될 수 있다. 바코드를 포함하는 분기형 어댑터를 표적 서열(105)에 부착시킨 후, 서열결정 프라이머 영역(103 및 104)을 사용하여 표적 폴리뉴클레오티드를 서열결정할 수 있다. 분기형 어댑터 구조체의 또 다른 예로는 뉴 잉글랜드 바이오랩스(New England Biolabs)로부터 입수가능한 일루미나(Illumina)™용 일루미나™ 라이브러리 제제 및 NEBNext® 멀티플렉스 올리고스(Multiplex Oligos)에서 사용되는 분기형 어댑터 구조체가 있다. 비분기형 어댑터의 예로는 전체로서 본원에 참고로 도입되는 문헌(Merriman et al., Electrophoresis, 33(23) 3397-3417 (2012))에 개시된 비분기형 어댑터가 있다.
도 2는 도 1에 표시된 분기형 어댑터 내에서의 바코드 영역의 배치의 3개 도식적 예를 보여준다. 한 예에서, 바코드(205)(BC1)는 제1 고정화 영역(201) 내에, 또는 제1 고정화 영역(201)과 제1 서열결정 프라이머 영역(203) 사이에 배치된다. 또 다른 예에서, 바코드(206)(BC2)는 제1 서열결정 프라이머 영역(203) 내에 또는 근처에 배치된다. 또 다른 예에서, 바코드(207)(BC3)는 제2 고정화 영역(202) 내에, 또는 제2 고정화 영역(202)과 제2 서열결정 프라이머 영역(204) 사이에 배치된다. 도 2가 표적 서열의 양 말단 상에서 바코드를 보여주지만, 일부 적용분야의 경우 표적 서열당 1개의 바코드만이 충분하기 때문에 양 말단 상에 바코드가 존재할 필요는 없다. 그러나, 본 개시내용의 다른 부분에 기재된 바와 같이, 표적 서열당 1개 초과의 바코드가 사용될 수도 있다.
도 3은 표적 폴리뉴클레오티드(NNN)의 정반대 양 말단에 결찰된 2개의 분기형 어댑터들의 예시적인 서열(서열 번호 1 및 서열 번호 2)을 제공하고 서열 수준에서 각각의 분기형 어댑터의 바코드 영역을 보여준다(굵은 글자체, 뉴클레오티드 30-37, 71-77, 81-87 및 122-129). 도 3에서, 뉴클레오티드 1-29는 제1 분기형 어댑터의 고정화 영역을 나타내고, 뉴클레오티드 38-70은 제1 분기형 어댑터의 서열결정 프라이머 영역을 나타내고, 뉴클레오티드 78-80(NNN)은 임의 길이의 표적 폴리뉴클레오티드를 나타내고, 뉴클레오티드 88-120은 제2 분기형 어댑터의 서열결정 프라이머 영역을 나타내고, 뉴클레오티드 129-153은 제2 분기형 어댑터의 고정화 영역을 나타낸다.
V. 구획
a. 구획의 일반적 특징
본 개시내용 전체에 걸쳐 기재된 바와 같이, 본 개시내용의 일부 방법, 조성물, 시스템, 장치 및 키트는 별개의 구획 내로의 일부 종의 세분(분할)을 이용할 수 있다. 구획은 예를 들면, 웰, 마이크로웰, 홀, 소적(예를 들면, 에멀션 중의 소적), 에멀션의 연속 상, 시험 튜브, 스폿, 캡슐, 비드의 표면, 또는 샘플 또는 종의 한 분획을 격리시키기 위한 임의의 다른 적합한 용기일 수 있다. 추가 프로세싱을 위해 구획을 사용하여 종을 함유할 수 있다. 예를 들면, 종이 폴리뉴클레오티드 분석물인 경우, 추가 프로세싱은 절단, 결찰, 및/또는 시약인 종을 사용한 바코딩을 포함할 수 있다. 임의의 수의 장치, 시스템 또는 용기를 사용하여 구획을 지탱할 수 있거나, 지지할 수 있거나 함유할 수 있다. 일부 경우, 마이크로웰 플레이트를를 사용하여 구획을 지탱할 수 있거나, 지지할 수 있거나 함유할 수 있다. 임의의 적합한 마이크로웰 플레이트, 예를 들면, 96웰, 384웰 또는 1536웰을 갖는 마이크로웰 플레이트를 사용할 수 있다.
각각의 구획은 임의의 다른 적합한 구획을 함유할 수도 있거나 임의의 다른 적합한 구획 내에 함유될 수도 있다. 예를 들면, 웰, 마이크로웰, 홀, 비드의 표면 또는 튜브는 소적(예를 들면, 에멀션 중의 소적), 에멀션 중의 연속 상, 스폿, 캡슐 또는 임의의 다른 적합한 구획을 포함할 수 있다. 소적은 캡슐, 비드 또는 또 다른 소적을 포함할 수 있다. 캡슐은 소적, 비드 또는 또 다른 캡슐을 포함할 수 있다. 이 설명은 단지 예시하기 위한 것이고, 모든 적합한 조합 및 복수도 예상된다. 예를 들면, 임의의 적합한 구획은 복수의 동일한 또는 상이한 구획을 포함할 수 있다. 한 예에서, 웰 또는 마이크로웰은 복수의 소적 및 복수의 캡슐을 포함한다. 또 다른 예에서, 캡슐은 복수의 캡슐 및 복수의 소적을 포함한다. 구획의 모든 조합이 예상된다. 표 1은 서로 조합될 수 있는 구획들의 비한정적 예를 보여준다.
본원에 기재된 임의의 구획은 다수의 구획을 포함할 수 있다. 예를 들면, 구획은 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개, 50개, 100개, 500개, 1000개, 1500개, 2000개, 2500개, 3000개, 3500개, 4000개, 4500개, 5000개, 5500개, 6000개, 6500개, 7000개, 7500개, 8000개, 8500개, 9000개, 9500개, 10000개 또는 50000개의 구획을 포함할 수 있다. 구획은 1개, 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개, 50개, 100개, 500개, 1000개, 1500개, 2000개, 2500개, 3000개, 3500개, 4000개, 4500개, 5000개, 5500개, 6000개, 6500개, 7000개, 7500개, 8000개, 8500개, 9000개, 9500개, 10000개 또는 50000개 이상의 구획을 포함할 수 있다. 일부 경우, 구획은 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개, 50개, 100개, 500개, 1000개, 1500개, 2000개, 2500개, 3000개, 3500개, 4000개, 4500개, 5000개, 5500개, 6000개, 6500개, 7000개, 7500개, 8000개, 8500개, 9000개, 9500개, 10000개 또는 50000개 미만의 구획을 포함할 수 있다. 일부 경우, 각각의 구획은 2개 내지 50개, 2개 내지 20개, 2개 내지 10개, 또는 2개 내지 5개의 구획을 포함할 수 있다.
구획은 임의의 적합한 종 또는 종들의 혼합물을 포함할 수 있다. 예를 들면, 일부 경우, 구획은 시약, 분석물, 샘플, 세포 및 이들의 조합물을 포함할 수 있다. 다른 구획을 포함하는 구획은 동일한 구획에서 일부 종을 포함할 수 있고 상이한 구획에서 일부 종을 포함할 수 있다. 종은 특정 공정의 필요성에 따라 임의의 적합한 구획들 사이에 분포될 수 있다. 예를 들면, 표 1에서 구획들 중 임의의 구획은 하나 이상의 제1 종을 함유할 수 있고 표 1에서 구획들 중 임의의 구획은 하나 이상의 제2 종을 함유할 수 있다. 일부 경우, 제1 종은 시약일 수 있고 제2 종은 분석물일 수 있다.
일부 경우, 종은 세포로부터 단리된 폴리뉴클레오티드이다. 예를 들면, 일부 경우, 임의의 적합한 방법(예를 들면, 상업적으로 입수가능한 키트)을 이용하여 세포로부터 폴리뉴클레오티드(예를 들면, 게놈 DNA, RNA 등)를 단리한다. 폴리뉴클레오티드를 정량할 수 있다. 그 다음, 정량된 폴리뉴클레오티드를 본원에 기재된 바와 같이 복수의 구획 내로 분할할 수 있다. 정량 및 분석의 필요성에 따라 예정된 커버리지(coverage) 양에서 폴리뉴클레오티드의 분할을 수행할 수 있다. 일부 경우, 모든 또는 대부분(예를 들면, 50%, 60%, 70%, 80%, 90% 또는 95% 이상)의 구획들이 중첩되는 폴리뉴클레오티드를 포함하지 않으므로, 비중첩 단편의 별개의 혼합물이 복수의 구획에 걸쳐 형성된다. 그 다음, 분할된 폴리뉴클레오티드를 당분야에서 공지된 또는 본 개시내용에 기재된 임의의 적합한 방법에 따라 처리할 수 있다. 예를 들면, 분할된 폴리뉴클레오티드를 단편화할 수 있고 증폭할 수 있고 바코딩할 수 있다.
다양한 방법을 이용하여 종을 분할할 수 있다. 예를 들면, 종을 희석하고 복수의 구획에 걸쳐 분배할 수 있다. 구획의 수가 종의 수를 초과하도록 종을 포함하는 매질의 최종 희석을 수행할 수 있다. 에멀션 또는 캡슐을 형성하기 전, 또는 종을 기판 상에 스폿팅하기 전 희석을 이용할 수도 있다. 종의 수 대 구획의 수의 비는 약 0.1, 0.5, 1, 2, 4, 8, 10, 20, 50, 100 또는 1000일 수 있다. 종의 수 대 구획의 수의 비는 약 0.1, 0.5, 1, 2, 4, 8, 10, 20, 50, 100 또는 1000 이상일 수 있다. 종의 수 대 구획의 수의 비는 약 0.1, 0.5, 1, 2, 4, 8, 10, 20, 50, 100 또는 1000 미만일 수 있다. 종의 수 대 구획의 수의 비는 약 0.1 내지 10, 0.5 내지 10, 1 내지 10, 2 내지 10, 10 내지 100, 100 내지 1000, 또는 보다 더 큰 범위일 수 있다.
압전 소적 생성(예를 들면, 문헌(Bransky et al., Lab on a Chip, 2009, 9, 516-520)) 또는 표면 음파(예를 들면, 문헌(Demirci and Montesano, Lab on a Chip, 2007, 7, 1139-1145))를 이용하여 분할을 수행할 수도 있다.
사용된 구획의 수는 적용분야에 따라 달라질 수 있다. 예를 들면, 구획의 수는 약 5개, 10개, 50개, 100개, 250개, 500개, 750개, 1000개, 1500개, 2000개, 2500개, 5000개, 7500개, 10,000개, 20000개, 30000개, 40000개, 50000개, 60000개, 70000개, 80000개, 90000개, 100,000개, 200000개, 300000개, 400000개, 500000개, 600000개, 700000개, 800000개, 900000개, 1,000,000개, 2000000개, 3000000개, 4000000개, 5000000개, 10000000개, 20000000개, 또는 보다 더 많은 수일 수 있다. 구획의 수는 적어도 약 5개, 10개, 50개, 100개, 250개, 500개, 750개, 1000개, 1500개, 2000개, 2500개, 5000개, 7500개, 10,000개, 20000개, 30000개, 40000개, 50000개, 60000개, 70000개, 80000개, 90000개, 100,000개, 200000개, 300000개, 400000개, 500000개, 600000개, 700000개, 800000개, 900000개, 1,000,000개, 2000000개, 3000000개, 4000000개, 5000000개, 10000000개, 20000000개, 또는 보다 더 많은 수일 수 있다. 구획의 수는 약 5개, 10개, 50개, 100개, 250개, 500개, 750개, 1000개, 1500개, 2000개, 2500개, 5000개, 7500개, 10,000개, 20000개, 30000개, 40000개, 50000개, 60000개, 70000개, 80000개, 90000개, 100,000개, 200000개, 300000개, 400000개, 500000개, 600000개, 700000개, 800000개, 900000개, 1,000,000개, 2000000개, 3000000개, 4000000개, 5000000개, 10000000개 또는 20000000개 미만일 수 있다. 구획의 수는 약 5개 내지 10000000개, 5개 내지 5000000개, 5개 내지 1,000,000개, 10개 내지 10,000개, 10개 내지 5,000개, 10개 내지 1,000개, 1,000개 내지 6,000개, 1,000개 내지 5,000개, 1,000개 내지 4,000개, 1,000개 내지 3,000개, 또는 1,000개 내지 2,000개일 수 있다.
분할되는 상이한 바코드 또는 바코드의 상이한 세트의 수는 예를 들면, 분할될 구체적인 바코드 및/또는 적용분야에 따라 달라질 수 있다. 바코드의 상이한 세트는 예를 들면, 동일한 바코드의 세트일 수 있고, 이때 동일한 바코드는 각각의 세트 사이에 상이하다. 또는, 바코드의 상이한 세트는 예를 들면, 상이한 바코드의 세트일 수 있고, 이때 각각의 세트는 그의 포함된 바코드에서 상이하다. 예를 들면, 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개, 100000000개, 또는 보다 더 많은 수의 상이한 바코드 또는 바코드의 상이한 세트가 분할될 수 있다. 일부 예에서, 적어도 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개, 100000000개, 또는 보다 더 많은 수의 상이한 바코드 또는 바코드의 상이한 세트가 분할될 수 있다. 일부 예에서, 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개 또는 100000000개 미만의 상이한 바코드 또는 바코드의 상이한 세트가 분할될 수 있다. 일부 예에서, 약 1개 내지 5개, 5개 내지 10개, 10개 내지 50개, 50개 내지 100개, 100개 내지 1000개, 1000개 내지 10000개, 10000개 내지 100000개, 100000개 내지 1000000개, 10000개 내지 1000000개, 10000개 내지 10000000개, 또는 10000개 내지 100000000개의 바코드가 분할될 수 있다.
바코드는 특정 밀도로 분할될 수 있다. 예를 들면, 바코드는 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개 또는 100000000개의 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 적어도 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개, 100000000개 또는 보다 더 많은 수의 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개 또는 100000000개 미만의 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 약 1개 내지 5개, 5개 내지 10개, 10개 내지 50개, 50개 내지 100개, 100개 내지 1000개, 1000개 내지 10000개, 10000개 내지 100000개, 100000개 내지 1000000개, 10000개 내지 1000000개, 10000개 내지 10000000개, 또는 10000개 내지 100000000개의 바코드를 함유하도록 분할될 수 있다.
바코드는 동일한 바코드가 특정 밀도로 분할되도록 분할될 수 있다. 예를 들면, 동일한 바코드는 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개 또는 100000000개의 동일한 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 적어도 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개, 100000000개, 또는 보다 더 많은 수의 동일한 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개 또는 100000000개 미만의 동일한 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 약 1개 내지 5개, 5개 내지 10개, 10개 내지 50개, 50개 내지 100개, 100개 내지 1000개, 1000개 내지 10000개, 10000개 내지 100000개, 100000개 내지 1000000개, 10000개 내지 1000000개, 10000개 내지 10000000개, 또는 10000개 내지 100000000개의 동일한 바코드를 함유하도록 분할될 수 있다.
바코드는 상이한 바코드가 특정 밀도로 분할되도록 분할될 수 있다. 예를 들면, 상이한 바코드는 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개 또는 100000000개의 상이한 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 적어도 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개, 100000000개, 또는 보다 더 많은 수의 상이한 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 20,000개, 30,000개, 40,000개, 50,000개, 60,000개, 70,000개, 80,000개, 90,000개, 100000개, 200,000개, 300,000개, 400,000개, 500,000개, 600,000개, 700,000개, 800,000개, 900,000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 6000000개, 7000000개, 8000000개, 9000000개, 10000000개, 20000000개, 50000000개 또는 100000000개 미만의 상이한 바코드를 함유하도록 분할될 수 있다. 바코드는 각각의 구획이 구획당 약 1개 내지 5개, 5개 내지 10개, 10개 내지 50개, 50개 내지 100개, 100개 내지 1000개, 1000개 내지 10000개, 10000개 내지 100000개, 100000개 내지 1000000개, 10000개 내지 1000000개, 10000개 내지 10000000개, 또는 10000개 내지 100000000개의 상이한 바코드를 함유하도록 분할될 수 있다.
바코드를 분할하는 데 사용된 구획의 수는 예를 들면, 적용분야 및/또는 분할될 상이한 바코드의 수에 따라 달라질 수 있다. 예를 들면, 바코드를 분할하는 데 사용된 구획의 수는 약 5개, 10개, 50개, 100개, 250개, 500개, 750개, 1000개, 1500개, 2000개, 2500개, 5000개, 7500개, 10,000개, 20000개, 30000개, 40000개, 50000개, 60000개, 70000개, 80000개, 90000개, 100,000개, 200000개, 300000개, 400000개, 500000개, 600000개, 700000개, 800000개, 900000개, 1,000,000개, 2000000개, 3000000개, 4000000개, 5000000개, 10000000개, 20000000개, 또는 보다 더 많은 수일 수 있다. 바코드를 분할하는 데 사용된 구획의 수는 적어도 약 5개, 10개, 50개, 100개, 250개, 500개, 750개, 1000개, 1500개, 2000개, 2500개, 5000개, 7500개, 10,000개, 20000개, 30000개, 40000개, 50000개, 60000개, 70000개, 80000개, 90000개, 100000개, 200000개, 300000개, 400000개, 500000개, 600000개, 700000개, 800000개, 900000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 10000000개, 20000000개, 또는 보다 더 많은 수일 수 있다. 바코드를 분할하는 데 사용된 구획의 수는 약 5개, 10개, 50개, 100개, 250개, 500개, 750개, 1000개, 1500개, 2000개, 2500개, 5000개, 7500개, 10,000개, 20000개, 30000개, 40000개, 50000개, 60000개, 70000개, 80000개, 90000개, 100000개, 200000개, 300000개, 400000개, 500000개, 600000개, 700000개, 800000개, 900000개, 1000000개, 2000000개, 3000000개, 4000000개, 5000000개, 10000000개 또는 20000000개 미만일 수 있다. 바코드를 분할하는 데 사용된 구획의 수는 약 5개 내지 10000000개, 5개 내지 5000000개, 5개 내지 1,000,000개, 10개 내지 10,000개, 10개 내지 5,000개, 10개 내지 1,000개, 1,000개 내지 6,000개, 1,000개 내지 5,000개, 1,000개 내지 4,000개, 1,000개 내지 3,000개, 또는 1,000개 내지 2,000개일 수 있다.
전술한 바와 같이, 상이한 바코드 또는 바코드의 상이한 세트(예를 들면, 복수의 동일한 바코드 또는 상이한 바코드를 포함하는 각각의 세트)는 각각의 구획이 상이한 바코드 또는 상이한 바코드 세트를 포함하도록 분할될 수 있다. 일부 경우, 각각의 구획은 동일한 바코드의 상이한 세트를 포함할 수 있다. 동일한 바코드의 상이한 세트가 분할되는 경우, 구획당 동일한 바코드의 수는 달라질 수 있다. 예를 들면, 각각의 구획이 동일한 바코드의 상이한 세트를 포함하도록 동일한 바코드의 약 100,000개 이상의 상이한 세트가 약 100,000개 이상의 상이한 구획에 걸쳐 분할될 수 있다. 각각의 구획에서, 바코드의 세트당 동일한 바코드의 수는 약 1,000,000개의 동일한 바코드일 수 있다. 일부 경우, 바코드의 상이한 세트의 수는 구획의 수와 동등할 수 있거나 실질적으로 동등할 수 있다. 임의의 적합한 수(본원의 다른 부분에 기재된 분할될 상이한 바코드 또는 상이한 바코드 세트의 수를 포함함)의 상이한 바코드 또는 상이한 바코드 세트, 구획당 임의의 적합한 수(본원의 다른 부분에 기재된 구획당 바코드의 수를 포함함)의 바코드 및 임의의 적합한 수(본원의 다른 부분에 기재된 구획의 수를 포함함)의 구획을 조합하여 구획당 높은 수의 바코드를 갖는 분할된 바코드의 다양한 라이브러리를 생성할 수 있다. 따라서, 인식될 바와 같이, 전술한 상이한 수들 중 임의의 상이한 수의 바코드가 전술한 구획당 바코드 밀도들 중 임의의 구획당 바코드 밀도로 전술한 수들 중 임의의 수의 구획 내에 제공될 수 있다.
구획의 부피는 적용분야에 따라 달라질 수 있다. 예를 들면, 본 개시내용에 기재된 구획들(예를 들면, 웰, 스폿, 소적(예를 들면, 에멀션 중의 소적) 및 캡슐) 중 임의의 구획의 부피는 약 1000 ㎕, 900 ㎕, 800 ㎕, 700 ㎕, 600 ㎕, 500 ㎕, 400 ㎕, 300 ㎕, 200 ㎕, 100 ㎕, 50 ㎕, 25 ㎕, 10 ㎕, 5 ㎕, 1 ㎕, 900 nl, 800 nl, 700 nl, 600 nl, 500 nl, 400 nl, 300 nl, 200 nl, 100 nl, 50 nl, 25 nl, 10 nl, 5 nl, 2.5 nl, 1 nl, 900 pl, 800 pl, 700 pl, 600 pl, 500 pl, 400 pl, 300 pl, 200 pl, 100 pl, 50 pl, 25 pl, 10 pl, 5 pl, 1 pl, 900 fl, 800 fl, 700 fl, 600 fl, 500 fl, 400 fl, 300 fl, 200 fl, 100 fl, 50 fl, 25 fl, 10 fl, 5 fl, 1 fl 또는 0.5 fl일 수 있다. 구획의 부피는 약 1000 ㎕, 900 ㎕, 800 ㎕, 700 ㎕, 600 ㎕, 500 ㎕, 400 ㎕, 300 ㎕, 200 ㎕, 100 ㎕, 50 ㎕, 25 ㎕, 10 ㎕, 5 ㎕, 1 ㎕, 900 nl, 800 nl, 700 nl, 600 nl, 500 nl, 400 nl, 300 nl, 200 nl, 100 nl, 50 nl, 25 nl, 10 nl, 5 nl, 2.5 nl, 1 nl, 900 pl, 800 pl, 700 pl, 600 pl, 500 pl, 400 pl, 300 pl, 200 pl, 100 pl, 50 pl, 25 pl, 10 pl, 5 pl, 1 pl, 900 fl, 800 fl, 700 fl, 600 fl, 500 fl, 400 fl, 300 fl, 200 fl, 100 fl, 50 fl, 25 fl, 10 fl, 5 fl, 1 fl 또는 0.5 fl 이상일 수 있다. 구획의 부피는 약 1000 ㎕, 900 ㎕, 800 ㎕, 700 ㎕, 600 ㎕, 500 ㎕, 400 ㎕, 300 ㎕, 200 ㎕, 100 ㎕, 50 ㎕, 25 ㎕, 10 ㎕, 5 ㎕, 1 ㎕, 900 nl, 800 nl, 700 nl, 600 nl, 500 nl, 400 nl, 300 nl, 200 nl, 100 nl, 50 nl, 25 nl, 10 nl, 5 nl, 2.5 nl, 1 nl, 900 pl, 800 pl, 700 pl, 600 pl, 500 pl, 400 pl, 300 pl, 200 pl, 100 pl, 50 pl, 25 pl, 10 pl, 5 pl, 1 pl, 900 fl, 800 fl, 700 fl, 600 fl, 500 fl, 400 fl, 300 fl, 200 fl, 100 fl, 50 fl, 25 fl, 10 fl, 5 fl, 1 fl 또는 0.5 fl 미만일 수 있다. 구획의 부피는 약 0.5 fl 내지 5 pl, 10 pl 내지 10 nl, 10 nl 내지 10 ㎕, 10 ㎕ 내지 100 ㎕, 또는 100 ㎕ 내지 1 ㎖일 수 있다.
상이한 구획 내의 유체의 부피는 변경될 수 있다. 보다 구체적으로, 상이한 구획의 부피는 구획의 세트에 걸쳐 + 또는 - 1%, 2%, 3%, 4%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 200%, 300%, 400%, 500% 또는 1000% 이상(또는 이하)까지 달라질 수 있다. 예를 들면, 웰(또는 다른 구획)은 제2 웰(또는 다른 구획) 내의 유체 부피의 80% 이하인 유체 부피를 포함할 수 있다.
특정 종이 특정 구획으로 표적화될 수도 있다. 예를 들면, 일부 경우, 특정 종(예를 들면, 폴리뉴클레오티드)을 포획하기 위해 포획 시약(예를 들면, 올리고뉴클레오티드 프로브)을 구획 내에 고정시킬 수 있거나 배치할 수 있다. 예를 들면, 상보적인 서열을 갖는 올리고뉴클레오티드를 포함하는 종을 포획하기 위해 포획 올리고뉴클레오티드를 비드의 표면 상에 고정시킬 수 있다.
종은 특정 밀도로 분할될 수도 있다. 예를 들면, 종은 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 100000개 또는 1000000개의 종을 함유하도록 분할될 수 있다. 종은 각각의 구획이 구획당 적어도 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 100000개, 1000000개 또는 보다 더 많은 수의 종을 함유하도록 분할될 수 있다. 종은 각각의 구획이 구획당 약 1개, 5개, 10개, 50개, 100개, 1000개, 10000개, 100000개 또는 1000000개 미만의 종을 함유하도록 분할될 수 있다. 종은 각각의 구획이 구획당 약 1개 내지 5개, 5개 내지 10개, 10개 내지 50개, 50개 내지 100개, 100개 내지 1000개, 1000개 내지 10000개, 10000개 내지 100000개, 또는 100000개 내지 1000000개의 종을 함유하도록 분할될 수 있다.
종은 하나 이상의 구획이 그 구획 내에서 유일한 종을 포함하도록 분할될 수 있다. 이것은 약 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 보다 더 높은 비율의 구획에 적용될 수 있다. 이것은 적어도 약 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% 또는 보다 더 높은 비율의 구획에 적용될 수 있다. 이것은 약 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% 또는 90% 미만의 구획에 적용될 수 있다.
b. 구획으로서의 웰
일부 경우, 웰을 구획으로서 사용한다. 웰은 마이크로웰일 수 있다. 웰은 종 또는 복수의 종을 포함하는 매질을 포함할 수 있다. 종은 다양한 배열로 웰 내에 함유될 수 있다. 한 예에서, 종을 웰에 직접적으로 분배한다. 웰 내로 직접적으로 분배된 종을 예를 들면, 용해가능하거나, 용융가능하거나 투과가능한 층으로 덮어씌울 수 있다. 이 층은 예를 들면, 오일, 왁스, 막 등일 수 있다. 상기 층은 또 다른 종을 웰 내로 도입하기 전 또는 후 용해될 수 있거나 용융될 수 있다. 웰을 임의의 시점에서, 예를 들면, 임의의 종의 첨가 후 밀봉 층으로 밀봉할 수 있다.
한 예에서, 샘플 프로세싱을 위한 시약을 웰 내로 직접적으로 분배하고 용해가능하거나, 용융가능하거나 투과가능한 층으로 덮어씌운다. 프로세싱될 분석물을 포함하는 샘플을 상기 층의 상부 상에 도입한다. 상기 층이 용해되거나 용융되거나, 분석물(또는 시약)이 층을 통해 확산한다. 웰을 밀봉하고 분석물의 프로세싱을 위해 적절한 조건 하에서 인큐베이트한다. 그 다음, 프로세싱된 분석물을 회수할 수 있다.
일부 경우, 웰은 다른 구획을 포함한다. 웰은 예를 들면, 또 다른 웰, 스폿, 소적(예를 들면, 에멀션 중의 소적), 캡슐, 비드 등을 포함하는 임의의 적합한 구획을 포함할 수 있다. 각각의 구획은 단일 구획 또는 복수의 구획으로서 존재할 수 있고, 각각의 구획은 동일한 종 또는 상이한 종을 포함할 수 있다.
한 예에서, 웰은 샘플 프로세싱을 위한 시약을 포함하는 캡슐을 포함한다. 액체 매질을 사용하여 캡슐을 웰 내로 로딩할 수 있거나, 액체 매질을 사용하지 않고(예를 들면, 본질적으로 건조된 상태로) 캡슐을 웰 내로 로딩할 수 있다. 본 개시내용의 다른 부분에 기재된 바와 같이, 캡슐은 하나 이상의 캡슐 또는 다른 구획을 함유할 수 있다. 프로세싱될 분석물을 포함하는 샘플을 웰 내로 도입할 수 있다. 웰을 밀봉할 수 있고, 웰 내로의 캡슐의 내용물의 방출을 야기하여 시약과 프로세싱될 분석물 사이의 접촉을 초래하기 위해 자극을 가할 수 있다. 분석물의 프로세싱을 위해 적절한 조건 하에서 웰을 인큐베이트할 수 있다. 그 다음, 프로세싱된 분석물을 회수할 수 있다. 이 예는 시약이 캡슐에 존재하고 분석물이 웰에 존재하는 실시양태를 기술하지만, 반대 배열, 즉 시약이 웰에 존재하고 분석물이 캡슐에 존재하는 실시양태도 가능하다.
또 다른 예에서, 웰은 에멀션을 포함하고, 에멀션의 소적은 샘플 프로세싱을 위한 시약을 포함하는 캡슐을 포함한다. 프로세싱될 분석물을 포함하는 샘플은 에멀션의 소적 내에 함유된다. 웰을 밀봉하고, 소적 내로의 캡슐의 내용물의 방출을 야기하여 시약과 프로세싱될 분석물 사이의 접촉을 초래하기 위해 자극을 가한다. 분석물의 프로세싱을 위해 적절한 조건 하에서 웰을 인큐베이트한다. 그 다음, 프로세싱된 분석물을 회수할 수 있다. 이 예는 시약이 캡슐에 존재하고 분석물이 소적에 존재하는 실시양태를 기술하지만, 반대 배열, 즉 시약이 소적에 존재하고 분석물이 캡슐에 존재하는 실시양태도 가능하다.
웰은 어레이, 예를 들면, 마이크로 어레이로서 정렬될 수 있다. 개별 웰의 치수 및 기판의 크기에 기초하여, 웰 어레이는 다양한 웰 밀도를 포함할 수 있다. 일부 경우, 웰 밀도는 10개 웰/㎠, 50개 웰/㎠, 100개 웰/㎠, 500개 웰/㎠, 1000개 웰/㎠, 5000개 웰/㎠, 10000개 웰/㎠, 50000개 웰/㎠ 또는 100000개 웰/㎠일 수 있다. 일부 경우, 웰 밀도는 10개 웰/㎠, 50개 웰/㎠, 100개 웰/㎠, 500개 웰/㎠, 1000개 웰/㎠, 5000개 웰/㎠, 10000개 웰/㎠, 50000개 웰/㎠ 또는 100000개 웰/㎠ 이상일 수 있다. 일부 경우, 웰 밀도는 10개 웰/㎠, 50개 웰/㎠, 100개 웰/㎠, 500개 웰/㎠, 1000개 웰/㎠, 5000개 웰/㎠, 10000개 웰/㎠, 50000개 웰/㎠ 또는 100000개 웰/㎠ 미만일 수 있다.
c. 구획으로서의 스폿
일부 경우, 스폿을 구획으로서 사용한다. 예를 들면, 물질을 표면 상에 분배함으로써 스폿을 제조할 수 있다. 종은 다양한 배열로 스폿 내에 함유될 수 있다. 한 예에서, 스폿을 형성하기 위해 사용된 매질 내에 종을 포함시킴으로써 종을 스폿 내로 직접적으로 분배한다. 스폿 내로 직접적으로 분배된 종을 예를 들면, 용해가능한, 용융가능한 또는 투과가능한 층으로 덮어씌울 수 있다. 이 층은 예를 들면, 오일, 왁스, 막 등일 수 있다. 상기 층은 또 다른 종을 스폿 상에 도입하기 전 또는 후 용해될 수 있거나 용융될 수 있다. 임의의 시점에서, 예를 들면, 임의의 종의 첨가 후 스폿을 덮어씌운 층으로 밀봉할 수 있다.
한 예에서, 샘플 프로세싱을 위한 시약을 예를 들면, 유리 슬라이드 상의 스폿 상에 직접적으로 분배하고, 용해가능한, 용융가능한 또는 투과가능한 층으로 덮어씌운다. 프로세싱될 분석물을 포함하는 샘플을 상기 층의 상부 상에 도입한다. 상기 층이 용해되거나 용융되거나, 분석물(또는 시약)이 상기 층을 통해 확산한다. 스폿을 밀봉하고 분석물의 프로세싱을 위해 적절한 조건 하에서 인큐베이트한다. 그 다음, 프로세싱된 분석물을 회수할 수 있다.
본 개시내용의 다른 부분(예를 들면, 표 1)에 기재된 바와 같이, 스폿은 웰 내에서 정렬되어 있을 수도 있다. 일부 경우, 복수의 스폿은 각각의 스폿의 내용물이 혼합되지 않도록 웰 내에서 정렬되어 있을 수 있다. 이러한 배열은 예를 들면, 종들이 서로 접촉하는 것을 방지하는 것이 바람직할 때 유용할 수 있다. 일부 경우, 웰은 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개, 21개, 22개, 23개, 24개, 25개, 26개, 27개, 28개, 29개, 30개 또는 보다 더 많은 수의 스폿을 포함할 수 있다. 일부 경우, 웰은 적어도 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개, 21개, 22개, 23개, 24개, 25개, 26개, 27개, 28개, 29개, 30개 또는 보다 더 많은 수의 스폿을 포함할 수 있다. 일부 경우, 웰은 2개, 3개, 4개, 5개, 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개, 15개, 16개, 17개, 18개, 19개, 20개, 21개, 22개, 23개, 24개, 25개, 26개, 27개, 28개, 29개 또는 30개 미만의 스폿을 포함할 수 있다. 일부 경우, 웰은 2개 내지 4개, 2개 내지 6개, 2개 내지 8개, 4개 내지 6개, 4개 내지 8개, 5개 내지 10개, 또는 4개 내지 12개의 스폿을 포함할 수 있다. 물질(예를 들면, 분석물을 함유하는 매질)을 웰에 첨가하였을 때, 스폿 내의 종들은 혼합될 수 있다. 더욱이, 상이한 종들(또는 종들의 조합물)을 함유하도록 별개의 스폿을 사용하는 것은 스폿을 웰 내부에 배치하는 데 사용된 장치의 교차오염을 방지하는 데 유용할 수도 있다.
일부 경우, 스폿은 다른 구획을 포함한다. 스폿은 예를 들면, 또 다른 스폿, 소적(예를 들면, 에멀션 중의 소적), 캡슐, 비드 등을 포함하는 임의의 적합한 구획을 포함할 수 있다. 각각의 구획은 단일 구획 또는 복수의 구획으로서 존재할 수 있고, 각각의 구획은 동일한 종 또는 상이한 종을 포함할 수 있다.
한 예에서, 스폿은 샘플 프로세싱을 위한 시약을 포함하는 캡슐을 포함한다. 본 개시내용의 다른 부분에 기재된 바와 같이, 캡슐은 하나 이상의 캡슐 또는 다른 구획을 함유할 수 있다. 프로세싱될 분석물을 포함하는 샘플을 스폿 내로 도입한다. 스폿을 밀봉하고, 스폿 내로의 캡슐의 내용물의 방출을 야기하여 시약과 프로세싱될 분석물 사이의 접촉을 초래하기 위해 자극을 가한다. 분석물의 프로세싱을 위해 적절한 조건 하에서 스폿을 인큐베이트한다. 그 다음, 프로세싱된 분석물을 회수할 수 있다. 이 예는 시약이 캡슐에 존재하고 분석물이 스폿에 존재하는 실시양태를 기술하지만, 반대 배열, 즉 시약이 스폿에 존재하고 분석물이 캡슐에 존재하는 실시양태도 가능하다.
또 다른 예에서, 스폿은 에멀션을 포함하고, 에멀션의 소적은 샘플 프로세싱을 위한 시약을 포함하는 캡슐을 포함한다. 프로세싱될 분석물을 포함하는 샘플은 에멀션의 소적 내에 함유된다. 스폿을 밀봉하고, 소적 내로의 캡슐의 내용물의 방출을 야기하여 시약과 프로세싱될 분석물 사이의 접촉을 초래하기 위해 자극을 가한다. 분석물의 프로세싱을 위해 적절한 조건 하에서 스폿을 인큐베이트한다. 그 다음, 프로세싱된 분석물을 회수할 수 있다. 이 예는 시약이 캡슐에 존재하고 분석물이 소적에 존재하는 실시양태를 기술하지만, 반대 배열, 즉 시약이 소적에 존재하고 분석물이 캡슐에 존재하는 실시양태도 가능하다.
스폿은 균일한 크기 또는 불균일한 크기의 스폿일 수 있다. 일부 경우, 스폿의 직경은 약 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛, 1 mm, 2 mm, 5 mm 또는 1 cm일 수 있다. 스폿은 약 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛, 1 mm, 2 mm, 5 mm 또는 1 cm 이상의 직경을 가질 수 있다. 일부 경우, 스폿은 약 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛, 1 mm, 2 mm, 5 mm 또는 1 cm 미만의 직경을 가질 수 있다. 일부 경우, 스폿은 약 0.1 ㎛ 내지 1 cm, 100 ㎛ 내지 1 mm, 100 ㎛ 내지 500 ㎛, 100 ㎛ 내지 600 ㎛, 150 ㎛ 내지 300 ㎛, 또는 150 ㎛ 내지 400 ㎛의 직경을 가질 수 있다.
스폿은 어레이, 예를 들면, 스폿 어레이로서 정렬될 수 있다. 개별 스폿의 치수 및 기판의 크기에 기초하여, 스폿 어레이는 다양한 스폿 밀도를 포함할 수 있다. 일부 경우, 스폿 밀도는 10개 스폿/㎠, 50개 스폿/㎠, 100개 스폿/㎠, 500개 스폿/㎠, 1000개 스폿/㎠, 5000개 스폿/㎠, 10000개 스폿/㎠, 50000개 스폿/㎠ 또는 100000개 스폿/㎠일 수 있다. 일부 경우, 스폿 밀도는 10개 스폿/㎠, 50개 스폿/㎠, 100개 스폿/㎠, 500개 스폿/㎠, 1000개 스폿/㎠, 5000개 스폿/㎠, 10000개 스폿/㎠, 50000개 스폿/㎠ 또는 100000개 스폿/㎠ 이상일 수 있다. 일부 경우, 스폿 밀도는 10개 스폿/㎠, 50개 스폿/㎠, 100개 스폿/㎠, 500개 스폿/㎠, 1000개 스폿/㎠, 5000개 스폿/㎠, 10000개 스폿/㎠, 50000개 스폿/㎠ 또는 100000개 스폿/㎠ 미만일 수 있다.
d. 구획으로서의
에멀션
일부 경우, 에멀션 중의 소적을 구획으로서 사용한다. 예를 들면, 당분야에서 공지된 방법을 포함하는 임의의 적합한 방법으로 에멀션을 제조할 수 있다(예를 들면, 문헌(Weizmann et al., Nature Methods, 2006, 3(7):545-550); 및 미국 특허 공보 제2012/0211084호(Weitz et al.) 참조). 일부 경우, 플루오로탄소-중-물 에멀션을 사용할 수 있다. 이 에멀션은 폴리에틸렌 글리콜(PEG)과 함께 플루오로계면활성제, 예컨대, 올리고머성 과불소화된 폴리에테르(PFPE)를 포함할 수 있다(Holtze et al., Lab on a Chip, 2008, 8(10):1632-1639). 일부 경우, 마이크로플루이딕 플로우 포커싱 장치에서 단분산 에멀션을 형성할 수 있다(Garstecki et al., Applied Physics Letters, 2004, 85(13):2649-2651).
종은 예를 들면, 소적을 형성하는 제1 상(예를 들면, 오일 또는 물) 및 제2 (연속) 상(예를 들면, 물 또는 오일)을 함유하는 에멀션 중의 소적 내에 함유될 수 있다. 에멀션은 단일 에멀션, 예를 들면, 유중수 또는 수중유 에멀션일 수 있다. 에멀션은 이중 에멀션, 예를 들면, 수중유중수 또는 유중수중유 에멀션일 수 있다. 고차 에멀션도 가능하다. 에멀션은 본 개시내용에 기재된 임의의 적합한 구획을 포함하는 임의의 적합한 용기 내에 보유될 수 있다.
일부 경우, 에멀션 중의 소적은 다른 구획을 포함한다. 에멀션 중의 소적은 예를 들면, 또 다른 소적(예를 들면, 에멀션 중의 소적), 캡슐, 비드 등을 포함하는 임의의 적합한 구획을 포함할 수 있다. 각각의 구획은 단일 구획 또는 복수의 구획으로서 존재할 수 있고, 각각의 구획은 동일한 종 또는 상이한 종을 포함할 수 있다.
한 예에서, 에멀션 중의 소적은 샘플 프로세싱을 위한 시약을 포함하는 캡슐을 포함한다. 본 개시내용의 다른 부분에 기재된 바와 같이, 캡슐은 하나 이상의 캡슐 또는 다른 구획을 함유할 수 있다. 프로세싱될 분석물을 포함하는 샘플은 소적 내에 함유된다. 소적 내로의 캡슐의 내용물의 방출을 야기하여 시약과 프로세싱될 분석물 사이의 접촉을 초래하기 위해 자극을 가한다. 분석물의 프로세싱을 위해 적절한 조건 하에서 소적을 인큐베이트한다. 그 다음, 프로세싱된 분석물을 회수할 수 있다. 이 예는 시약이 캡슐에 존재하고 분석물이 소적에 존재하는 실시양태를 기술하지만, 반대 배열, 즉 시약이 소적에 존재하고 분석물이 캡슐에 존재하는 실시양태도 가능하다.
에멀션 중의 소적은 균일한 크기 또는 불균일한 크기의 소적일 수 있다. 일부 경우, 에멀션 중의 소적의 직경은 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm일 수 있다. 소적은 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm 이상의 직경을 가질 수 있다. 일부 경우, 소적은 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm 미만의 직경을 가질 수 있다. 일부 경우, 소적은 약 0.001 ㎛ 내지 1 mm, 0.01 ㎛ 내지 900 ㎛, 0.1 ㎛ 내지 600 ㎛, 100 ㎛ 내지 200 ㎛, 100 ㎛ 내지 300 ㎛, 100 ㎛ 내지 400 ㎛, 100 ㎛ 내지 500 ㎛, 100 ㎛ 내지 600 ㎛, 150 ㎛ 내지 200 ㎛, 150 ㎛ 내지 300 ㎛, 또는 150 ㎛ 내지 400 ㎛의 직경을 가질 수 있다.
에멀션 중의 소적은 특정 밀도를 가질 수도 있다. 일부 경우, 소적은 수성 유체(예를 들면, 물)보다 덜 조밀하고; 일부 경우, 소적은 수성 유체보다 더 조밀하다. 일부 경우, 소적은 비수성 유체(예를 들면, 오일)보다 덜 조밀하고; 일부 경우, 소적은 비수성 유체보다 더 조밀하다. 소적은 약 0.05 g/㎤, 0.1 g/㎤, 0.2 g/㎤, 0.3 g/㎤, 0.4 g/㎤, 0.5 g/㎤, 0.6 g/㎤, 0.7 g/㎤, 0.8 g/㎤, 0.81 g/㎤, 0.82 g/㎤, 0.83 g/㎤, 0.84 g/㎤, 0.85 g/㎤, 0.86 g/㎤, 0.87 g/㎤, 0.88 g/㎤, 0.89 g/㎤, 0.90 g/㎤, 0.91 g/㎤, 0.92 g/㎤, 0.93 g/㎤, 0.94 g/㎤, 0.95 g/㎤, 0.96 g/㎤, 0.97 g/㎤, 0.98 g/㎤, 0.99 g/㎤, 1.00 g/㎤, 1.05 g/㎤, 1.1 g/㎤, 1.2 g/㎤, 1.3 g/㎤, 1.4 g/㎤, 1.5 g/㎤, 1.6 g/㎤, 1.7 g/㎤, 1.8 g/㎤, 1.9 g/㎤, 2.0 g/㎤, 2.1 g/㎤, 2.2 g/㎤, 2.3 g/㎤, 2.4 g/㎤ 또는 2.5 g/㎤의 밀도를 가질 수 있다. 소적은 약 0.05 g/㎤, 0.1 g/㎤, 0.2 g/㎤, 0.3 g/㎤, 0.4 g/㎤, 0.5 g/㎤, 0.6 g/㎤, 0.7 g/㎤, 0.8 g/㎤, 0.81 g/㎤, 0.82 g/㎤, 0.83 g/㎤, 0.84 g/㎤, 0.85 g/㎤, 0.86 g/㎤, 0.87 g/㎤, 0.88 g/㎤, 0.89 g/㎤, 0.90 g/㎤, 0.91 g/㎤, 0.92 g/㎤, 0.93 g/㎤, 0.94 g/㎤, 0.95 g/㎤, 0.96 g/㎤, 0.97 g/㎤, 0.98 g/㎤, 0.99 g/㎤, 1.00 g/㎤, 1.05 g/㎤, 1.1 g/㎤, 1.2 g/㎤, 1.3 g/㎤, 1.4 g/㎤, 1.5 g/㎤, 1.6 g/㎤, 1.7 g/㎤, 1.8 g/㎤, 1.9 g/㎤, 2.0 g/㎤, 2.1 g/㎤, 2.2 g/㎤, 2.3 g/㎤, 2.4 g/㎤ 또는 2.5 g/㎤의 밀도를 가질 수 있다. 다른 경우, 소적 밀도는 약 0.7 g/㎤, 0.8 g/㎤, 0.81 g/㎤, 0.82 g/㎤, 0.83 g/㎤, 0.84 g/㎤, 0.85 g/㎤, 0.86 g/㎤, 0.87 g/㎤, 0.88 g/㎤, 0.89 g/㎤, 0.90 g/㎤, 0.91 g/㎤, 0.92 g/㎤, 0.93 g/㎤, 0.94 g/㎤, 0.95 g/㎤, 0.96 g/㎤, 0.97 g/㎤, 0.98 g/㎤, 0.99 g/㎤, 1.00 g/㎤, 1.05 g/㎤, 1.1 g/㎤, 1.2 g/㎤, 1.3 g/㎤, 1.4 g/㎤, 1.5 g/㎤, 1.6 g/㎤, 1.7 g/㎤, 1.8 g/㎤, 1.9 g/㎤, 2.0 g/㎤, 2.1 g/㎤, 2.2 g/㎤, 2.3 g/㎤, 2.4 g/㎤ 또는 2.5 g/㎤ 이하일 수 있다. 이러한 밀도는 임의의 특정 유체(예를 들면, 수성, 물, 오일 등) 중의 캡슐의 밀도를 반영할 수 있다.
e. 구획으로서의 캡슐
일부 경우, 캡슐을 구획으로서 사용한다. 에멀션화 중합(미국 특허 공보 제2012/0211084호(Weitz et al.)), 다가전해질을 사용한 다층 조립(layer-by-layer assembly), 코아세르베이션(coacervation), 내부 상 분리 및 플로우 포커싱을 포함하는, 당분야에서 공지된 방법을 포함하는 임의의 적합한 방법으로 캡슐을 제조할 수 있다. 임의의 적합한 종은 캡슐 내에 함유될 수 있다. 캡슐은 본 개시내용에 기재된 임의의 적합한 구획을 포함하는 임의의 적합한 용기 내에 보유될 수 있다.
일부 경우, 캡슐은 다른 구획을 포함한다. 캡슐은 예를 들면, 또 다른 캡슐, 에멀션 중의 소적, 비드 등을 포함하는 임의의 적합한 구획을 포함할 수 있다. 각각의 구획은 단일 구획 또는 복수의 구획으로서 존재할 수 있고, 각각의 구획은 동일한 종 또는 상이한 종을 포함할 수 있다.
한 예에서, 외부 캡슐은 내부 캡슐을 포함한다. 내부 캡슐은 샘플 프로세싱을 위한 시약을 포함한다. 분석물은 내부 캡슐과 외부 캡슐 사이의 매질 내에 캡슐화된다. 외부 캡슐 내로의 내부 캡슐의 내용물의 방출을 야기하여 시약과 프로세싱될 분석물 사이의 접촉을 초래하기 위해 자극을 가한다. 분석물의 프로세싱을 위해 적절한 조건 하에서 외부 캡슐을 인큐베이트한다. 그 다음, 프로세싱된 분석물을 회수할 수 있다. 이 예는 시약이 내부 캡슐에 존재하고 분석물이 내부 캡슐과 외부 캡슐 사이의 매질에 존재하는 실시양태를 기술하지만, 반대 배열, 즉 시약이 내부 캡슐과 외부 캡슐 사이의 매질에 존재하고 분석물이 내부 캡슐에 존재하는 실시양태도 가능하다.
캡슐을 미리 형성하고 주입을 통해 시약으로 충전시킬 수 있다. 예를 들면, 문헌(Abate et al., Proc. Natl. Acad. Sci. U.S.A., 2010, 107(45), 19163-19166) 및 미국 특허 공보 제2012/0132288호(Weitz et al.)에 기재된 피코주입 방법을 이용하여 시약을 본원에 기재된 캡슐의 내부 내로 도입할 수 있다. 일반적으로, 캡슐 외피의 형성 전 예를 들면, 종을 캡슐 전구체, 예컨대, 에멀션의 소적 내로 주입함으로써 캡슐 외피의 경화 전 피코주입을 수행할 것이다.
캡슐은 균일한 크기 또는 불균일한 크기의 캡슐일 수 있다. 일부 경우, 캡슐의 직경은 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm일 수 있다. 캡슐은 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm 이상의 직경을 가질 수 있다. 일부 경우, 캡슐은 약 0.001 ㎛, 0.01 ㎛, 0.05 ㎛, 0.1 ㎛, 0.5 ㎛, 1 ㎛, 5 ㎛, 10 ㎛, 50 ㎛, 100 ㎛, 150 ㎛, 200 ㎛, 300 ㎛, 400 ㎛, 500 ㎛, 600 ㎛, 700 ㎛, 800 ㎛, 900 ㎛ 또는 1 mm 미만의 직경을 가질 수 있다. 일부 경우, 캡슐은 약 0.001 ㎛ 내지 1 mm, 0.01 ㎛ 내지 900 ㎛, 0.1 ㎛ 내지 600 ㎛, 100 ㎛ 내지 200 ㎛, 100 ㎛ 내지 300 ㎛, 100 ㎛ 내지 400 ㎛, 100 ㎛ 내지 500 ㎛, 100 ㎛ 내지 600 ㎛, 150 ㎛ 내지 200 ㎛, 150 ㎛ 내지 300 ㎛, 또는 150 ㎛ 내지 400 ㎛의 직경을 가질 수 있다.
캡슐은 특정 밀도를 가질 수도 있다. 일부 경우, 캡슐은 수성 유체(예를 들면, 물)보다 덜 조밀하고; 일부 경우, 캡슐은 수성 유체보다 더 조밀하다. 일부 경우, 캡슐은 비수성 유체(예를 들면, 오일)보다 덜 조밀하고; 일부 경우, 캡슐은 비수성 유체보다 더 조밀하다. 캡슐은 약 0.05 g/㎤, 0.1 g/㎤, 0.2 g/㎤, 0.3 g/㎤, 0.4 g/㎤, 0.5 g/㎤, 0.6 g/㎤, 0.7 g/㎤, 0.8 g/㎤, 0.81 g/㎤, 0.82 g/㎤, 0.83 g/㎤, 0.84 g/㎤, 0.85 g/㎤, 0.86 g/㎤, 0.87 g/㎤, 0.88 g/㎤, 0.89 g/㎤, 0.90 g/㎤, 0.91 g/㎤, 0.92 g/㎤, 0.93 g/㎤, 0.94 g/㎤, 0.95 g/㎤, 0.96 g/㎤, 0.97 g/㎤, 0.98 g/㎤, 0.99 g/㎤, 1.00 g/㎤, 1.05 g/㎤, 1.1 g/㎤, 1.2 g/㎤, 1.3 g/㎤, 1.4 g/㎤, 1.5 g/㎤, 1.6 g/㎤, 1.7 g/㎤, 1.8 g/㎤, 1.9 g/㎤, 2.0 g/㎤, 2.1 g/㎤, 2.2 g/㎤, 2.3 g/㎤, 2.4 g/㎤ 또는 2.5 g/㎤의 밀도를 가질 수 있다. 캡슐은 약 0.05 g/㎤, 0.1 g/㎤, 0.2 g/㎤, 0.3 g/㎤, 0.4 g/㎤, 0.5 g/㎤, 0.6 g/㎤, 0.7 g/㎤, 0.8 g/㎤, 0.81 g/㎤, 0.82 g/㎤, 0.83 g/㎤, 0.84 g/㎤, 0.85 g/㎤, 0.86 g/㎤, 0.87 g/㎤, 0.88 g/㎤, 0.89 g/㎤, 0.90 g/㎤, 0.91 g/㎤, 0.92 g/㎤, 0.93 g/㎤, 0.94 g/㎤, 0.95 g/㎤, 0.96 g/㎤, 0.97 g/㎤, 0.98 g/㎤, 0.99 g/㎤, 1.00 g/㎤, 1.05 g/㎤, 1.1 g/㎤, 1.2 g/㎤, 1.3 g/㎤, 1.4 g/㎤, 1.5 g/㎤, 1.6 g/㎤, 1.7 g/㎤, 1.8 g/㎤, 1.9 g/㎤, 2.0 g/㎤, 2.1 g/㎤, 2.2 g/㎤, 2.3 g/㎤, 2.4 g/㎤ 또는 2.5 g/㎤ 이상의 밀도를 가질 수 있다. 다른 경우, 캡슐 밀도는 약 0.7 g/㎤, 0.8 g/㎤, 0.81 g/㎤, 0.82 g/㎤, 0.83 g/㎤, 0.84 g/㎤, 0.85 g/㎤, 0.86 g/㎤, 0.87 g/㎤, 0.88 g/㎤, 0.89 g/㎤, 0.90 g/㎤, 0.91 g/㎤, 0.92 g/㎤, 0.93 g/㎤, 0.94 g/㎤, 0.95 g/㎤, 0.96 g/㎤, 0.97 g/㎤, 0.98 g/㎤, 0.99 g/㎤, 1.00 g/㎤, 1.05 g/㎤, 1.1 g/㎤, 1.2 g/㎤, 1.3 g/㎤, 1.4 g/㎤, 1.5 g/㎤, 1.6 g/㎤, 1.7 g/㎤, 1.8 g/㎤, 1.9 g/㎤, 2.0 g/㎤, 2.1 g/㎤, 2.2 g/㎤, 2.3 g/㎤, 2.4 g/㎤ 또는 2.5 g/㎤ 이하일 수 있다. 이러한 밀도는 임의의 특정 유체(예를 들면, 수성, 물, 오일 등) 중의 캡슐의 밀도를 반영할 수 있다.
1. 플로우 포커싱에 의한 캡슐의 제조
일부 경우, 캡슐을 플로우 포커싱으로 제조할 수 있다. 플로우 포커싱은 제2 유체와 혼화될 수 없는 제1 유체를 제2 유체 내로 유동시키는 방법이다. 도 12를 참조하면, 단량체, 가교제, 개시제 및 수성 계면활성제를 포함하는 제1 (예를 들면, 수성) 유체(1201)는 계면활성제 및 촉진제를 포함하는 제2 (예를 들면, 오일) 유체(1202) 내로 유동된다. 제2 유체가 마이크로플루이딕 장치(1203)의 T-연접부(junction)에서 들어간 후, 제1 유체의 소적은 제1 유체 스트림으로부터 떨어져 나오고, 캡슐 외피는 제1 유체 중의 단량체, 가교제 및 개시제, 및 제2 유체 중의 촉진제의 혼합으로 인해 1204를 형성하기 시작한다. 이로써, 캡슐이 형성된다. 캡슐이 다운스트림으로 진행함에 따라, 외피는 촉진제에의 증가된 노출로 인해 더 두꺼워지게 된다. 시약의 농도의 변경을 이용하여 캡슐 외피의 두께 및 투과성을 변경시킬 수도 있다.
예를 들면, 종을 제1 유체에 포함시킴으로써 종 또는 다른 구획, 예컨대, 소적을 캡슐화할 수 있다. 종을 제2 유체에 포함시키는 것은 종을 캡슐의 외피에 끼워 넣을 수 있다. 물론, 특정 샘플 프로세싱 방법의 필요성에 따라, 상을 역전시킬 수도 있다. 즉, 제1 상은 오일 상일 수 있고 제2 상은 수성 상일 수 있다.
2. 플로우 포커싱
에
의한 캡슐 내의 캡슐의 제조
일부 경우, 캡슐 내의 캡슐을 플로우 포커싱으로 제조할 수 있다. 도 13을 참조하면, 캡슐, 단량체, 가교제, 개시제 및 수성 계면활성제를 포함하는 제1 (예를 들면, 수성) 유체(1301)는 계면활성제 및 촉진제를 포함하는 제2 (오일) 유체(1302) 내로 유동된다. 제2 유체가 마이크로플루이딕 장치(1303)의 T-연접부에서 들어간 후, 제1 유체의 소적은 제1 유체 스트림으로부터 떨어져 나오고, 제2 캡슐은 제1 유체 중의 단량체, 가교제 및 개시제, 및 제2 유체 중의 촉진제의 혼합으로 인해 캡슐(1304) 주변에서 형성되기 시작한다. 이로써, 캡슐 내의 캡슐이 형성된다. 캡슐이 다운스트림으로 진행함에 따라, 외피는 촉진제에의 증가된 노출로 인해 더 두꺼워지게 된다. 시약의 농도의 변경을 이용하여 제2 캡슐 외피의 두께 및 투과성을 변경시킬 수도 있다.
예를 들면, 종을 제1 유체에 포함시킴으로써 종을 캡슐화할 수 있다. 종을 제2 유체에 포함시키는 것은 종을 캡슐의 제2 외피에 끼워 넣을 수 있다. 물론, 특정 샘플 프로세싱 방법의 필요성에 따라, 상을 역전시킬 수도 있다. 즉, 제1 상은 오일 상일 수 있고 제2 상은 수성 상일 수 있다.
3. 캡슐의 회분식 제조
일부 경우, 캡슐 전구체, 예컨대, 에멀션 중의 소적을 사용하여 캡슐을 회분식으로 제조할 수 있다. 임의의 적합한 방법으로, 예를 들면, 단량체, 가교제, 개시제 및 계면활성제를 포함하는 소적을 갖는 에멀션을 제조함으로써 캡슐 전구체를 형성할 수 있다. 그 다음, 촉진제를 매질에 첨가하여 캡슐을 형성할 수 있다. 플로우 포커싱 방법과 마찬가지로, 반응물의 농도 및 촉진제에의 노출 시간을 변경시킴으로써 외피의 두께를 변경시킬 수 있다. 그 다음, 캡슐을 세척하고 회수할 수 있다. 본원에 기재된 임의의 방법과 마찬가지로, 다른 구획을 비롯한 종을 캡슐 또는 적합한 경우 외피 내에 캡슐화할 수 있다.
또 다른 예에서, 에멀션의 소적을 에멀션 생성 공정 동안 출구 웰에 존재하는 촉진제에 노출시킬 수 있다. 예를 들면, 캡슐 전구체를 임의의 적합한 방법, 예컨대, 도 12에 예시된 플로우 포커싱 방법으로 형성할 수 있다. 촉진제를 제2 유체(1202)에 포함시키는 것보다는 오히려 촉진제를 T-연접부의 출구에 위치하는 매질(예를 들면, 도 12의 수평 채널의 가장 우측에 위치하는 매질)에 포함시킬 수 있다. 에멀션 소적(즉, 캡슐 전구체)은 채널을 빠져나갈 때 촉진제를 포함하는 매질(즉, 출구 매질)과 접촉한다. 캡슐 전구체가 출구 매질의 밀도보다 더 낮은 밀도를 갖는 경우, 캡슐 전구체는 매질을 통해 상승하여 촉진제에의 대류 및 확산 노출을 보장하고 채널의 출구에서의 중합의 확률을 감소시킬 것이다.
VI. 종
본 개시내용의 방법, 조성물, 시스템, 장치 및 키트는 임의의 적합한 종과 함께 사용될 수 있다. 종은 예를 들면, 샘플 프로세싱에서 사용되는 임의의 물질, 예컨대, 시약 또는 분석물일 수 있다. 예시적인 종은 전체 세포, 염색체, 폴리뉴클레오티드, 유기 분자, 단백질, 폴리펩티드, 탄수화물, 사카라이드, 당, 지질, 효소, 제한효소, 결찰효소, 중합효소, 바코드, 어댑터, 소분자, 항체, 형광단, 데옥시뉴클레오티드 트리포스페이트(dNTP), 디데옥시뉴클레오티드 트리포스페이트(ddNTP), 완충제, 산성 용액, 염기성 용액, 온도 민감성 효소, pH 민감성 효소, 광 민감성 효소, 금속, 금속 이온, 염화마그네슘, 염화나트륨, 망간, 수성 완충제, 약한 완충제, 이온성 완충제, 억제제, 사카라이드, 오일, 염, 이온, 세제, 이온성 세제, 비이온성 세제, 올리고뉴클레오티드, 뉴클레오티드, DNA, RNA, 펩티드 폴리뉴클레오티드, 상보적인 DNA(cDNA), 이중 가닥 DNA(dsDNA), 단일 가닥 DNA(ssDNA), 플라스미드 DNA, 코스미드 DNA, 염색체 DNA, 게놈 DNA, 바이러스 DNA, 세균 DNA, mtDNA(미토콘드리아 DNA), mRNA, rRNA, tRNA, nRNA, siRNA, snRNA, snoRNA, scaRNA, microRNA, dsRNA, 리보자임(ribozyme), 리보스위치(riboswitch) 및 바이러스 RNA, 전체적으로 또는 부분적으로 잠겨진 핵산(LNA), 잠겨진 핵산 뉴클레오티드, 임의의 다른 종류의 핵산 유사체, 단백질분해효소(proteases), 핵산분해효소(nucleases), 단백질분해효소 억제제, 핵산분해효소 억제제, 킬레이팅제, 환원제, 산화제, 프로브, 발색단, 염료, 유기물, 에멀션화제, 계면활성제, 안정화제, 중합체, 물, 소분자, 약제, 방사성 분자, 보존제, 항생제, 앱타머 등을 포함한다. 요약하면, 사용되는 종은 특정 샘플 프로세싱 필요성에 따라 달라질 것이다.
일부 경우, 구획은 유사한 속성을 갖는 종의 세트(예를 들면, 효소의 세트, 광물의 세트, 올리고뉴클레오티드의 세트, 상이한 바코드들의 혼합물, 동일한 바코드들의 혼합물)를 포함한다. 다른 경우, 구획은 종의 불균일한 혼합물을 포함한다. 일부 경우, 종의 불균일한 혼합물은 특정 반응을 수행하기 위해 필요한 모든 성분들을 포함한다. 일부 경우, 이러한 혼합물은 반응을 수행하기 위해 필요한 1개, 2개, 3개, 4개, 5개 또는 보다 더 많은 수의 성분을 제외하고 반응을 수행하기 위해 필요한 모든 성분들을 포함한다. 일부 경우, 이러한 추가 성분은 상이한 구획 내에, 또는 구획 내의 또는 주변의 용액 내에 함유된다.
종은 천연 생성 또는 합성 종일 수 있다. 종은 당분야에서 공지된 임의의 방법을 이용하여 수득한 샘플에 존재할 수 있다. 일부 경우, 샘플을 분석물에 대해 분석하기 전 프로세싱할 수 있다.
유기체, 임의의 유기체로부터의 전체 세포, 세포 제제 및 세포 무함유 조성물, 조직, 세포 또는 환경을 포함하는 임의의 적합한 위치로부터 종을 수득할 수 있다. 환경 샘플, 생검, 흡입물, 포르말린으로 고정되고 포매된 조직, 공기, 농업 샘플, 토양 샘플, 석유 샘플, 물 샘플 또는 먼지 샘플로부터 종을 수득할 수 있다. 일부 경우, 혈액, 소변, 대변, 혈청, 림프, 침, 점막 분비물, 땀, 중추신경계액, 질액 또는 정액을 포함할 수 있는 체액으로부터 종을 수득할 수 있다. 제조된 제품, 예컨대, 화장품, 식품, 개인 관리 제품 등으로부터 종을 수득할 수도 있다. 종은 재조합 클로닝, 폴리뉴클레오티드 증폭, 중합효소 연쇄 반응(PCR) 증폭, 정제 방법(예컨대, 게놈 DNA 또는 RNA의 정제) 및 합성 반응을 포함하는 실험 조작의 생성물일 수 있다.
일부 경우, 종은 질량에 의해 정량될 수 있다. 종은 약 1 ng, 2 ng, 3 ng, 4 ng, 5 ng, 6 ng, 7 ng, 8 ng, 9 ng, 10 ng, 11 ng, 12 ng, 13 ng, 14 ng, 15 ng, 16 ng, 17 ng, 18 ng, 19 ng, 20 ng, 50 ng, 100 ng, 500 ng, 1000 ng, 1500 ng, 2000 ng, 2500 ng, 3000 ng, 3500 ng, 4000 ng, 4500 ng, 5000 ng, 5500 ng, 6000 ng, 6500 ng, 7000 ng, 7500 ng, 8000 ng, 8500 ng, 9000 ng, 9500 ng, 10000 ng, 1 ㎍, 5 ㎍, 10 ㎍, 15 ㎍ 또는 20 ㎍의 질량으로 제공될 수 있다. 종은 약 1 ng, 2 ng, 3 ng, 4 ng, 5 ng, 6 ng, 7 ng, 8 ng, 9 ng, 10 ng, 11 ng, 12 ng, 13 ng, 14 ng, 15 ng, 16 ng, 17 ng, 18 ng, 19 ng, 20 ng, 50 ng, 100 ng, 500 ng, 1000 ng, 1500 ng, 2000 ng, 2500 ng, 3000 ng, 3500 ng, 4000 ng, 4500 ng, 5000 ng, 5500 ng, 6000 ng, 6500 ng, 7000 ng, 7500 ng, 8000 ng, 8500 ng, 9000 ng, 9500 ng, 10000 ng, 1 ㎍, 5 ㎍, 10 ㎍, 15 ㎍ 또는 20 ㎍ 이상의 질량으로 제공될 수 있다. 종은 약 2 ng, 3 ng, 4 ng, 5 ng, 6 ng, 7 ng, 8 ng, 9 ng, 10 ng, 11 ng, 12 ng, 13 ng, 14 ng, 15 ng, 16 ng, 17 ng, 18 ng, 19 ng, 20 ng, 50 ng, 100 ng, 500 ng, 1000 ng, 1500 ng, 2000 ng, 2500 ng, 3000 ng, 3500 ng, 4000 ng, 4500 ng, 5000 ng, 5500 ng, 6000 ng, 6500 ng, 7000 ng, 7500 ng, 8000 ng, 8500 ng, 9000 ng, 9500 ng, 10000 ng, 1 ㎍, 5 ㎍, 10 ㎍, 15 ㎍ 또는 20 ㎍ 미만의 질량으로 제공될 수 있다. 종은 약 1 내지 10 ng, 10 내지 50 ng, 50 내지 100 ng, 100 내지 200 ng, 200 내지 1000 ng, 1000 내지 10000 ng, 1 내지 5 ㎍, 또는 1 내지 20 ㎍의 질량으로 제공될 수 있다. 본 개시내용의 다른 부분에 기재된 바와 같이, 종이 폴리뉴클레오티드인 경우, 증폭을 이용하여 폴리뉴클레오티드의 양을 증가시킬 수 있다.
폴리뉴클레오티드는 "게놈 당량(genome equivalent)"으로서 정량될 수도 있다. 게놈 당량은 표적 폴리뉴클레오티드가 유래된 유기체의 1개 일배체 게놈과 동등한 폴리뉴클레오티드의 양이다. 예를 들면, 단일 이배체 세포는 2 게놈 당량의 DNA를 함유한다. 폴리뉴클레오티드는 약 1 내지 10, 10 내지 50, 50 내지 100, 100 내지 1000, 1000 내지 10000, 10000 내지 100000, 또는 100000 내지 1000000 게놈 당량의 양으로 제공될 수 있다. 폴리뉴클레오티드는 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 50, 100, 500, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500, 10000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000 또는 1000000 게놈 당량 이상의 양으로 제공될 수 있다. 폴리뉴클레오티드는 약 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 50, 100, 500, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500, 10000, 20000, 30000, 40000, 50000, 60000, 70000, 80000, 90000, 100000, 200000, 300000, 400000, 500000, 600000, 700000, 800000, 900000 또는 1000000 게놈 당량 미만의 양으로 제공될 수 있다.
폴리뉴클레오티드는 제공된 서열 커버리지의 양에 의해 정량될 수도 있다. 서열 커버리지의 양은 재구축된 서열에서 주어진 뉴클레오티드를 나타내는 평균 판독 수를 지칭한다. 일반적으로, 영역이 서열결정되는 횟수가 클수록 보다 더 정확한 서열 정보가 수득된다. 폴리뉴클레오티드는 약 0.1X 내지 10X, 10X 내지 50X, 50X 내지 100X, 100X 내지 200X, 또는 200X 내지 500X의 서열 커버리지의 범위를 제공하는 양으로 제공될 수 있다. 폴리뉴클레오티드는 약 0.1X, 0.2X, 0.3X, 0.4X, 0.5X, 0.6X, 0.7X, 0.8X, 0.9X, 1.0X, 5X, 10X, 25X, 50X, 100X, 125X, 150X, 175X 또는 200X 이상의 서열 커버리지를 제공하는 양으로 제공될 수 있다. 폴리뉴클레오티드는 약 0.2X, 0.3X, 0.4X, 0.5X, 0.6X, 0.7X, 0.8X, 0.9X, 1.0X, 5X, 10X, 25X, 50X, 100X, 125X, 150X, 175X 또는 200X 미만의 서열 커버리지를 제공하는 양으로 제공될 수 있다.
일부 경우, 특정 단계 전 또는 후 종을 구획 내로 도입한다. 예를 들면, 세포 샘플을 구획 내로 분할한 후 용해 완충제 시약을 구획 내로 도입할 수 있다. 일부 경우, 상이한 반응 또는 작업이 상이한 단계에서 일어나도록 시약 및/또는 시약을 포함하는 구획을 순차적으로 도입한다. 반응 또는 작업 단계 사이에 배치된 단계에서 시약(또는 시약을 포함하는 구획)을 로딩할 수도 있다. 예를 들면, 분자(예를 들면, 핵산)를 단편화하기 위한 시약을 포함하는 캡슐을 웰 내에 로딩한 후 단편화 단계를 수행할 수 있고, 이어서 바코드(또는 다른 독특한 식별자, 예를 들면, 항체)를 결찰시키기 위한 시약을 포함하는 캡슐을 로딩한 후 바코드를 단편화된 분자에 결찰시킬 수 있다.
VII. 분석물 및 다른 종의 프로세싱
일부 경우, 본 개시내용의 방법, 조성물, 시스템, 장치 및 키트를 사용하여 종, 예를 들면, 분석물을 함유하는 샘플을 프로세싱할 수 있다. 임의의 적합한 공정을 수행할 수 있다.
a. 표적 폴리뉴클레오티드의 단편화
일부 경우, 본 개시내용의 방법, 조성물, 시스템, 장치 및 키트를 폴리뉴클레오티드 단편화에 사용할 수 있다. 폴리뉴클레오티드의 단편화는 폴리뉴클레오티드 서열결정을 포함하는 다양한 방법에서 한 단계로서 사용된다. 전형적으로 (단편당 선형으로 존재하는 뉴클레오티드의 수에 의해 정량된) 길이의 관점에서 기재된 폴리뉴클레오티드 단편의 크기는 표적 폴리뉴클레오티드의 공급원, 단편화에 이용된 방법 및 원하는 적용분야에 따라 달라질 수 있다. 단일 단편화 단계 또는 복수의 단편화 단계를 이용할 수 있다.
본원에 기재된 방법을 이용하여 생성한 단편은 길이에 있어서 약 1개 내지 10개, 10개 내지 20개, 20개 내지 50개, 50개 내지 100개, 50개 내지 200개, 100개 내지 200개, 200개 내지 300개, 300개 내지 400개, 400개 내지 500개, 500개 내지 1000개, 1000개 내지 5000개, 5000개 내지 10000개, 10000개 내지 100000개, 100000개 내지 250000개, 또는 250000개 내지 500000개의 뉴클레오티드일 수 있다. 본원에 기재된 방법을 이용하여 생성한 단편은 길이에 있어서 적어도 약 10개, 20개, 100개, 200개, 300개, 400개, 500개, 1000개, 5000개, 10000개, 100000개, 250000개, 500000개 또는 보다 더 많은 수의 뉴클레오티드일 수 있다. 본원에 기재된 방법을 이용하여 생성한 단편은 길이에 있어서 약 10개, 20개, 100개, 200개, 300개, 400개, 500개, 1000개, 5000개, 10000개, 100000개, 250000개 또는 500000개 미만의 뉴클레오티드일 수 있다.
본원에 기재된 방법을 이용하여 생성한 단편은 약 1개 내지 10개, 10개 내지 20개, 20개 내지 50개, 50개 내지 100개, 50개 내지 200개, 100개 내지 200개, 200개 내지 300개, 300개 내지 400개, 400개 내지 500개, 500개 내지 1000개, 1000개 내지 5000개, 5000개 내지 10000개, 10000개 내지 100000개, 100000개 내지 250000개, 또는 250000개 내지 500000개의 뉴클레오티드의 평균 또는 중간 길이를 가질 수 있다. 본원에 기재된 방법을 이용하여 생성한 단편은 적어도 약 10개, 20개, 100개, 200개, 300개, 400개, 500개, 1000개, 5000개, 10000개, 100000개, 250000개, 500000개 또는 보다 더 많은 수의 뉴클레오티드의 평균 또는 중간 길이를 가질 수 있다. 본원에 기재된 방법을 이용하여 생성한 단편은 약 10개, 20개, 100개, 200개, 300개, 400개, 500개, 1000개, 5000개, 10000개, 100000개, 250000개 또는 500000개 미만의 뉴클레오티드의 평균 또는 중간 길이를 가질 수 있다.
다수의 단편화 방법들이 당분야에서 공지되어 있다. 예를 들면, 물리적, 기계적 또는 효소적 방법을 통해 단편화를 수행할 수 있다. 물리적 단편화는 표적 폴리뉴클레오티드를 열 또는 UV 광에 노출시키는 단계를 포함할 수 있다. 기계적 파괴를 이용하여 표적 폴리뉴클레오티드를 원하는 범위의 단편으로 기계적으로 전단시킬 수 있다. 기계적 전단은 표적 폴리뉴클레오티드의 반복적 피펫팅, (예를 들면, 초음파를 이용한) 초음파처리, 캐비테이션(cavitation) 및 분무화를 포함하는, 당분야에서 공지된 다수의 방법들을 통해 달성될 수 있다. 효소적 방법을 이용하여 표적 폴리뉴클레오티드를 단편화할 수도 있다. 일부 경우, 효소를 사용하여, 예컨대, 제한효소를 사용하여 효소적 분해를 수행할 수 있다.
이전 단락 및 본 개시내용의 일부 단락들에 기재된 단편화 방법이 "표적" 폴리뉴클레오티드에 대하여 기재되어 있지만, 이것은 본 개시내용의 상기 부분 및 임의의 부분을 한정하기 위한 것이 아니다. 본원에 기재된 또는 당분야에서 공지된 임의의 단편화 방법을 본 발명과 함께 사용되는 임의의 폴리뉴클레오티드에 적용할 수 있다. 일부 경우, 이 폴리뉴클레오티드는 표적 폴리뉴클레오티드, 예컨대, 게놈일 수 있다. 다른 경우, 이 폴리뉴클레오티드는 더 단편화하고자 하는 표적 폴리뉴클레오티드의 단편일 수 있다. 다른 경우, 추가 단편은 여전히 더 단편화될 수 있다. 임의의 적합한 폴리뉴클레오티드가 본원에 기재된 방법에 따라 단편화될 수 있다.
제한효소를 사용하여 표적 폴리뉴클레오티드의 특이적 또는 비특이적 단편화를 수행할 수 있다. 본 개시내용의 방법은 일반적으로 I형 효소, II형 효소 및/또는 III형 효소로서 기재된 1종 이상의 제한효소를 사용할 수 있다. II형 효소 및 III형 효소는 일반적으로 상업적으로 입수가능하고 당분야에서 잘 공지되어 있다. II형 효소 및 III형 효소는 이중 가닥 폴리뉴클레오티드 서열 내의 특정 뉴클레오티드 염기쌍 서열("인식 서열" 또는 "인식 부위")을 인식한다. 이 서열의 결합 및 인식 시, II형 효소 및 III형 효소는 폴리뉴클레오티드 서열을 절단한다. 일부 경우, 절단은 "스티키 말단"으로서 지칭되는 돌출 단일 가닥 DNA의 부분을 갖는 폴리뉴클레오티드 단편을 생성할 것이다. 다른 경우, 절단은 "블런트 말단"을 생성하는 돌출부를 갖는 단편을 생성하지 않을 것이다. 본 개시내용의 방법은 스티키 말단 또는 블런트 말단을 생성하는 제한효소의 사용을 포함할 수 있다.
제한효소는 표적 폴리뉴클레오티드 내의 다양한 인식 부위를 인식할 수 있다. 일부 제한효소들("정확한 절단제들")은 단일 인식 부위(예를 들면, GAATTC)만을 인식한다. 다른 제한효소들은 더 무차별적이고 1개 초과의 인식 부위 또는 다양한 인식 부위를 인식한다. 일부 효소들은 인식 부위 내의 단일 위치에서 절단하는 반면, 다른 효소들은 다수의 위치에서 절단할 수 있다. 일부 효소들은 인식 부위 내의 동일한 위치에서 절단하는 반면, 다른 효소들은 가변 위치에서 절단한다.
본 개시내용은 하나 이상의 제한효소를 선택하여 원하는 길이의 단편을 생성하는 방법을 제공한다. 가상실험(in silico)으로 폴리뉴클레오티드 단편화를 모의실험할 수 있고, 단편화를 최적화하여 바람직하지 않은 크기 범위 내의 단편의 수 또는 분율을 최소화하면서 특정 크기 범위 내의 폴리뉴클레오티드 단편의 가장 큰 수 또는 분율을 수득할 수 있다. 최적화 알고리즘을 적용하여 2개 이상의 효소들의 조합물을 선택함으로써 단편 양의 원하는 분포와 함께 원하는 단편 크기를 생성할 수 있다.
폴리뉴클레오티드를 2개 이상의 제한효소들에 동시적으로 또는 순차적으로 노출시킬 수 있다. 이것은 예를 들면, 1개 초과의 제한효소를 구획에 첨가함으로써, 또는 1개의 제한효소를 구획에 첨가하고 분해를 수행하고 제한효소를 (예를 들면, 열 처리로) 탈활성화시킨 후 제2 제한효소를 첨가함으로써 달성될 수 있다. 임의의 적합한 제한효소가 본원에서 제공된 방법에서 단독으로 또는 조합물로 사용될 수 있다.
일부 경우, 종은 "희귀 절단제(rare-cutter)"인 제한효소이다. 본원에서 사용된 바와 같이, 용어 "희귀 절단제 효소"는 일반적으로 게놈에만 희귀하게 존재하는 인식 부위를 갖는 효소를 지칭한다. 가상 무작위 게놈을 제한효소로 절단함으로써 생성한 제한 단편의 크기는 대략 4N일 수 있고, 이때 N은 효소의 인식 부위 내의 뉴클레오티드의 수이다. 예를 들면, 7개의 뉴클레오티드로 구성된 인식 부위를 갖는 효소는 47 bp마다 한번 게놈을 절단하여 약 16,384 bp의 단편을 생성할 것이다. 일반적으로, 희귀 절단제 효소는 6개 이상의 뉴클레오티드를 포함하는 인식 부위를 갖는다. 예를 들면, 희귀 절단제 효소는 6개, 7개, 8개, 9개, 10개, 11개, 12개, 13개, 14개 또는 15개의 뉴클레오티드들을 포함하거나 이들로 구성된 인식 부위를 가질 수 있다. 희귀 절단제 효소의 예로는 NotI(GCGGCCGC), XmaIII(CGGCCG), SstII(CCGCGG), SalI(GTCGAC), NruI(TCGCGA), NheI(GCTAGC), Nb.BbvCI(CCTCAGC), BbvCI(CCTCAGC), AscI(GGCGCGCC), AsiSI(GCGATCGC), FseI(GGCCGGCC), PacI(TTAATTAA), PmeI(GTTTAAAC), SbfI(CCTGCAGG), SgrAI(CRCCGGYG), SwaI(ATTTAAAT), BspQI(GCTCTTC), SapI(GCTCTTC), SfiI(GGCCNNNNNGGCC), CspCI(CAANNNNNGTGG), AbsI(CCTCGAGG), CciNI(GCGGCCGC), FspAI(RTGCGCAY), MauBI(CGCGCGCG), MreI(CGCCGGCG), MssI(GTTTAAAC), PalAI(GGCGCGCC), RgaI(GCGATCGC), RigI(GGCCGGCC), SdaI(CCTGCAGG), SfaAI(GCGATCGC), SgfI(GCGATCGC), SgrDI(CGTCGACG), SgsI(GGCGCGCC), SmiI(ATTTAAAT), SrfI(GCCCGGGC), Sse2321(CGCCGGCG), Sse83871(CCTGCAGG), LguI(GCTCTTC), PciSI(GCTCTTC), AarI(CACCTGC), AjuI(GAANNNNNNNTTGG), AloI(GAACNNNNNNTCC), BarI(GAAGNNNNNNTAC), PpiI(GAACNNNNNCTC), PsrI(GAACNNNNNNTAC) 등이 있다.
일부 경우, 폴리뉴클레오티드를 동일한 시간에 단편화하고 바코딩할 수 있다. 예를 들면, 전위효소(예를 들면, NEXTERA)를 사용하여 폴리뉴클레오티드를 단편화하고 바코드를 폴리뉴클레오티드에 추가할 수 있다.
VIII. 자극 반응성
일부 경우, 자극을 사용하여 구획으로부터의 종의 방출을 유발할 수 있다. 일반적으로, 자극은 구획의 구조, 예컨대, 웰의 벽, 스폿의 성분, 소적(예를 들면, 에멀션 중의 소적)의 안정성 또는 캡슐의 외피의 파괴를 야기할 수 있다. 이 자극은 구획이 그의 내용물을 방출하도록 유도하는 데 특히 유용하다. 구획이 또 다른 구획 내에 함유될 수 있고 각각의 구획이 상이한 자극에 반응할(또는 반응하지 않을) 수 있기 때문에, 자극 반응성을 이용하여 한 구획(예를 들면, 자극에 반응하는 구획)의 내용물을 또 다른 구획(예를 들면, 그 자극에 반응하지 않거나 그 자극에 덜 반응하는 구획) 내로 방출시킬 수 있다.
일부 경우, 내부 캡슐을 용해시켜 혼합된 샘플을 함유하는 캡슐을 초래하는 자극을 가하여 내부 캡슐의 내용물을 외부 캡슐의 내용물 내로 방출시킬 수 있다. 물론, 이 실시양태는 전적으로 예시적인 것이고, 자극 반응성을 이용하여 임의의 적합한 구획의 내용물을 임의의 다른 적합한 구획, 매질 또는 용기 내로 방출시킬 수 있다(구획 내의 구획의 보다 구체적인 예에 대해서는 예를 들면, 표 1 참조).
사용될 수 있는 자극의 예로는 이하에 보다 더 전체적으로 기재된 바와 같이 화학적 자극, 용적 변화, 생물학적 자극, 광, 열적 자극, 자기 자극, 웰 내로의 매질의 첨가 및 이들의 임의의 조합이 있다(예를 들면, 문헌(Esser-Kahn et al., (2011) Macromolecules 44: 5539-5553); 및 문헌(Wang et al., (2009) ChemPhysChem 10:2405-2409) 참조).
a. 화학적 자극 및 용적 변화
다수의 화학적 유발제를 사용하여 구획의 파괴를 유발할 수 있다(예를 들면, 문헌(Plunkett et al., Biomacromolecules, 2005, 6:632-637)). 이 화학적 변화의 예로는 구획의 성분의 무결성에 대한 pH 매개 변화, 가교연결 결합의 화학적 절단을 통한 구획의 성분의 붕괴, 및 구획의 성분의 유발된 탈중합이 있으나 이들로 한정되지 않는다. 용적 변화를 사용하여 구획의 파괴를 유발할 수도 있다.
용액의 pH의 변화, 예컨대, pH의 감소는 다수의 상이한 기작들을 통해 구획의 파괴를 유발할 수 있다. 산의 첨가는 다양한 기작들을 통해 구획의 부분의 분해 또는 해체를 야기할 수 있다. 양성자의 첨가는 구획의 성분에서 중합체의 가교결합을 해체할 수 있거나, 구획의 성분에서 이온성 또는 수소 결합을 파괴할 수 있거나, 구획의 성분에서 나노공극을 생성하여 내부 내용물이 외부로 누출되게 할 수다. pH의 변화는 에멀션을 불안정화시켜 소적의 내용물의 방출을 유발할 수도 있다.
일부 예에서, 구획은 산-분해가능한 화학적 가교제, 예컨대, 케탈을 포함하는 물질로부터 제조된다. pH의 감소, 특히 5보다 낮은 pH는 케탈이 케톤 및 2개의 알코올로 전환되게 유도할 수 있고 구획의 파괴를 용이하게 할 수 있다. 다른 예에서, 구획은 pH에 민감한 하나 이상의 다가전해질을 포함하는 물질로부터 제조될 수 있다. pH의 감소는 이러한 구획의 이온성 또는 수소 결합 상호작용을 파괴할 수 있거나 이러한 구획에서 나노공극을 생성할 수 있다. 일부 경우, 다가전해질을 포함하는 물질로부터 제조된 구획은 pH의 변화에 따라 팽창하고 수축하는 하전된 겔-기제 코어를 포함한다.
구획을 포함하는 가교연결된 물질의 파괴는 다수의 기작들을 통해 달성될 수 있다. 일부 예에서, 구획은 산화, 환원 또는 다른 화학적 변화를 유도하는 다양한 화학물질들과 접촉할 수 있다. 일부 경우, 구획의 이황화 결합이 파괴되도록 환원제, 예컨대, 베타-머캡토에탄올을 사용할 수 있다. 추가로, 효소를 첨가하여 구획을 형성하는 물질에서 펩티드 결합을 절단함으로써 구획의 무결성을 상실시킬 수 있다.
탈중합을 이용하여 구획을 파괴할 수도 있다. 화학적 유발제를 첨가하여 보호 헤드(head) 기의 제거를 용이하게 할 수 있다. 예를 들면, 유발제는 중합체 내에서 카보네이트 에스테르 또는 카바메이트의 헤드 기의 제거를 야기할 수 있고, 이러한 제거는 탈중합 및 구획의 내부로부터의 종의 방출을 야기한다.
또 다른 예에서, 화학적 유발제는 삼투압 유발제를 포함할 수 있고, 삼투압 유발제에 의한 용액 중의 이온 또는 용질 농도의 변화는 구획을 제조하는 데 사용된 물질의 팽창을 유도한다. 팽창은 구획이 파열하여 그의 내용물을 방출하도록 내부 압력의 축적을 야기할 수 있다. 팽창은 물질의 공극 크기의 증가를 야기하여 구획 내에 함유된 종이 확산되게 할 수도 있다(역의 경우도 성립한다).
구획은 용적 또는 물리적 변화, 예컨대, 압력 유도된 파열, 용융 또는 다공성의 변화를 통해 그의 내용물을 방출하도록 제조될 수도 있다.
b. 생물학적 자극
생물학적 자극을 사용하여 구획의 파괴를 유발할 수도 있다. 일반적으로, 생물학적 유발제는 화학적 유발제와 유사하지만, 많은 예들이 생체분자, 또는 살아있는 시스템에서 통상적으로 발견되는 분자, 예컨대, 효소, 펩티드, 사카라이드, 지방산, 핵산 등을 사용한다. 예를 들면, 구획은 특정 단백질분해효소에 의한 절단에 민감한 펩티드 가교연결을 갖는 중합체를 포함하는 물질로부터 제조될 수 있다. 보다 구체적으로, 한 예는 GFLGK 펩티드 가교연결을 포함하는 물질로부터 제조된 구획을 포함할 수 있다. 생물학적 유발제, 예컨대, 단백질분해효소 카텝신 B의 첨가 시, 외피 웰의 펩티드 가교연결이 절단되고 캡슐의 내용물이 방출된다. 다른 경우, 단백질분해효소를 열-불활성화시킬 수 있다. 또 다른 예에서, 구획은 셀룰로스를 포함하는 성분을 포함한다. 가수분해 효소 키토산의 첨가는 셀룰로스성 결합의 절단, 키토산을 포함하는 구획의 성분의 탈중합 및 그의 내부 내용물의 방출을 위한 생물학적 유발제로서 작용한다.
c. 열적 자극
구획은 열적 자극을 가하였을 때 그의 내용물을 방출하도록 유도될 수도 있다. 온도의 변화는 구획에 대한 다양한 변화를 야기할 수 있다. 열의 변화는 구획의 부분이 붕괴되도록 구획의 용융을 야기할 수 있거나, 에멀션의 파괴를 야기할 수 있다. 다른 경우, 열은 구획이 파열하거나 터지도록 구획의 내부 성분의 내부 압력을 증가시킬 수 있다. 다른 경우, 열은 구획을 수축된 탈수된 상태로 변환시킬 수 있다. 열은 구획을 구축하기 위한 물질로서 사용되는 열 민감성 중합체에 작용할 수도 있다.
한 예에서, 구획은 열 민감성 하이드로겔을 포함하는 물질로부터 제조된다. 열, 예컨대, 35℃ 초과의 온도를 가하였을 때, 하이드로겔 물질은 수축한다. 상기 물질의 갑작스런 수축은 압력을 증가시키고 구획을 파열시킨다.
일부 경우, 구획의 제조에 사용되는 물질은 이블록(diblock) 중합체, 또는 상이한 열 민감성을 갖는 2개의 중합체들의 혼합물을 포함할 수 있다. 한 중합체는 특히 열을 가한 후 수축할 가능성이 있을 수 있는 반면, 다른 중합체는 보다 더 높은 열 안정성을 갖는다. 열이 이러한 외피 벽에 가해질 때, 다른 중합체는 온전한 상태로 남아있는 반면, 열 민감성 중합체는 수축하여 공극이 형성되게 할 수 있다. 다른 경우, 구획의 제조에 사용되는 물질은 자기 나노입자를 포함할 수 있다. 자기장에의 노출은 열의 발생을 야기하여 구획의 파열을 유발할 수 있다.
d. 자기 자극
자기 나노입자를 구획의 제조에 사용되는 물질에 포함시키는 것은 전술한 바와 같이 구획의 유발된 파열을 허용할 수 있을 뿐만 아니라 다른 구획으로의 이들 구획들의 안내(예를 들면, 어레이에서 웰로의 캡슐의 안내)를 가능하게 할 수 있다. 한 예에서, 구획의 제조에 사용되는 물질 내로의 Fe3O4 나노입자의 도입은 진동 자기장 자극의 존재 하에서 파열을 유발한다.
e. 전기 및 광 자극
구획은 전기 자극의 결과로서 파괴될 수도 있다. 이전 단락에 기재된 자기 입자와 유사하게, 전기적 민감성 입자는 구획의 유발된 파열 및 다른 기능, 예컨대, 전기장에서의 정렬 또는 산화환원 반응 둘 다를 허용할 수 있다. 한 예에서, 전기적 민감성 물질을 포함하는 물질로부터 제조된 구획은 내부 시약의 방출이 조절될 수 있도록 전기장에서 정렬된다. 다른 예에서, 전기장은 다공성을 증가시킬 수 있는 산화환원 반응을 구획 내에서 유도할 수 있다.
광 자극을 사용하여 구획을 파괴할 수도 있다. 다수의 광 유발제들이 가능하고 특정 파장 범위의 광자를 흡수할 수 있는 다양한 분자들, 예컨대, 나노입자 및 발색단을 사용하는 시스템을 포함할 수 있다. 예를 들면, 금속 산화물 코팅을 사용하여 일부 구획들을 제조할 수 있다. SiO2/TiO2로 코팅된 구획의 UV 조사는 구획 벽의 붕괴를 초래할 수 있다. 또 다른 예에서, 광 전환가능한 물질, 예컨대, 아조벤젠 기를 구획의 제조에 사용되는 물질 내에 도입할 수 있다. UV 또는 가시광을 가하였을 때, 화학물질, 예컨대, 이들은 광자의 흡수 시 가역적 시스-대-트랜스 이성질체화를 겪는다. 이 양태에서, 광 전환의 도입은 구획의 부분의 붕괴, 또는 구획의 부분의 다공성의 증가를 초래한다.
f. 자극의 적용
본 개시내용의 장치, 방법, 조성물, 시스템 및 키트는 이러한 유발제 또는 자극을 제공하는 임의의 기구 또는 장치와 함께 사용될 수 있다. 예를 들면, 자극이 열적 자극인 경우, 장치는 웰의 가열을 허용하고 캡슐의 파열을 유도할 수 있는 가열된 또는 열적으로 조절된 플레이트와 함께 사용될 수 있다. 방사 열 전달, 대류 열 전달 또는 전도 열 전달로 열을 가하는 것을 포함하나 이들로 한정되지 않는 다수의 열 전달 방법들 중 임의의 열 전달 방법이 열적 자극을 위해 사용될 수 있다. 다른 경우, 자극이 생물학적 효소인 경우, 효소는 각각의 웰 내로 침착되도록 장치 내로 주입될 수 있다. 또 다른 양태에서, 자극이 자기장 또는 전기장인 경우, 장치는 자기 또는 전기 플레이트와 함께 사용될 수 있다.
IX. 적용분야
a. 폴리뉴클레오티드 서열결정
일반적으로, 본원에서 제공된 방법 및 조성물은 다운스트림 적용분야, 예컨대, 서열결정을 위한 폴리뉴클레오티드 단편의 제조에 유용하다. 서열결정은 임의의 이용가능한 기법에 의해 수행될 수 있다. 예를 들면, 서열결정은 고전적인 생거(Sanger) 서열결정 방법에 의해 수행될 수 있다. 서열결정 방법은 고속처리 서열결정, 피로서열결정, 합성에 의한 서열결정, 단일 분자 서열결정, 나노공극 서열결정, 결찰에 의한 서열결정, 혼성화에 의한 서열결정, RNA-Seq(일루미나), 디지털 유전자 발현(헬리코스(Helicos)), 차세대 서열결정, 합성에 의한 단일 분자 서열결정(SMSS)(헬리코스), 대량-병렬 서열결정, 클론 단일 분자 어레이(솔렉사(Solexa)), 숏건(shotgun) 서열결정, 맥심-길버트(Maxim-Gilbert) 서열결정, 프라이머 워킹(walking) 및 당분야에서 공지된 임의의 다른 서열결정 방법도 포함할 수 있다.
일부 경우, 상이한 수의 단편이 서열결정된다. 예를 들면, 일부 경우, 약 30% 내지 90%의 단편이 서열결정된다. 일부 경우, 약 35% 내지 85%, 40% 내지 80%, 45% 내지 75%, 50% 내지 70%, 55% 내지 65%, 또는 50% 내지 60%의 단편이 서열결정된다. 일부 경우, 약 30%, 40%, 50%, 60%, 70%, 80% 또는 90% 이상의 단편이 서열결정된다. 일부 경우, 30%, 40%, 50%, 60%, 70%, 80% 또는 90% 미만의 단편이 서열결정된다.
일부 경우, 단편으로부터의 서열들을 조립하여 개별 서열 판독물보다 더 긴 원래의 표적 폴리뉴클레오티드의 인접 영역에 대한 서열 정보를 제공한다. 개별 서열 판독물은 길이에 있어서 약 10개 내지 50개, 50개 내지 100개, 100개 내지 200개, 200개 내지 300개, 300개 내지 400개 또는 보다 더 많은 수의 뉴클레오티드일 수 있다.
바코드 태그의 실체(identity)는 개별 단편들로부터의 서열 판독물들을 순서대로 정돈하고 일배체들을 식별하는 데 기여할 수 있다. 예를 들면, 개별 단편들의 분할 동안 모 폴리뉴클레오티드 단편들은 상이한 구획 내로 분리될 수 있다. 구획의 수가 증가함에 따라, 동일한 구획에 함유된 모(maternal) 일배체 및 부(paternal) 일배체 둘 다로부터의 단편일 확률은 무시할만할 정도로 작게 된다. 따라서, 동일한 구획 내의 단편들로부터의 서열 판독물들을 조립하여 순서대로 정돈할 수 있다.
b. 폴리뉴클레오티드 위상조정
본 개시내용은 위상조정이 가능하도록 또는 연결 정보가 생성될 수 있도록 하는 방식으로 폴리뉴클레오티드 단편을 제조하는 방법 및 조성물도 제공한다. 이러한 정보는 폴리뉴클레오티드의 긴 스트레치(stretch)에 의해 분리되어 있는 유전적 변이(예를 들면, SNP, 돌연변이, 삽입결실(indel), 카피 수 변이, 염기전환(transversion), 전위(translocation), 역위(inversion) 등)를 포함하는, 서열 내의 연결된 유전적 변이의 검출을 허용할 수 있다. 용어 "삽입결실"은 함께 위치하는 삽입 및 결실, 및 뉴클레오티드의 순(net) 획득 또는 손실을 초래하는 돌연변이를 지칭한다. "마이크로삽입결실(microindel)"은 1개 내지 50개의 뉴클레오티드의 순 획득 또는 손실을 초래하는 삽입결실이다. 이들 변이들은 시스(cis) 또는 트랜스(trans) 관계로 존재할 수 있다. 시스 관계에서, 2개 이상의 유전적 변이들이 동일한 폴리뉴클레오티드 또는 가닥에 존재한다. 트랜스 관계에서, 2개 이상의 유전적 변이들이 다수의 폴리뉴클레오티드 분자들 또는 가닥들에 존재한다.
본원에서 제공된 방법을 이용하여 폴리뉴클레오티드 위상조정을 확인할 수 있다. 예를 들면, 구획당 1개 이하의 폴리뉴클레오티드 분자가 존재하도록 폴리뉴클레오티드 샘플(예를 들면, 주어진 좌위 또는 좌위들에 걸쳐 있는 폴리뉴클레오티드)을 분할할 수 있다. 그 다음, 폴리뉴클레오티드를 단편화하고 바코딩하고 서열결정할 수 있다. 서열을 유전적 변이에 대해 조사할 수 있다. 2개의 상이한 바코드로 태깅된 동일한 서열 내의 유전적 변이의 검출은 상기 2개의 유전적 변이가 2개의 별개의 DNA 가닥으로부터 유래된다(트랜스 관계를 반영함)는 것을 표시할 수 있다. 대조적으로, 동일한 바코드로 태깅된 2개의 상이한 유전적 변이의 검출은 2개의 유전적 변이가 동일한 DNA 가닥으로부터 유래된다(시스 관계를 반영함)는 것을 표시할 수 있다.
위상 정보는 특히 폴리뉴클레오티드 단편이 특정 질환 또는 장애(예를 들면, 열성 유전질환, 예컨대, 낭성 섬유증, 암 등)의 위험을 갖거나, 이러한 질환 또는 장애를 갖거나, 이러한 질환 또는 장애를 갖는 것으로 의심되는 대상체로부터 유래된 경우 폴리뉴클레오티드 단편의 특징규명에 중요할 수 있다. 상기 정보는 하기 가능성들을 식별할 수 있다: (1) 동일한 DNA 가닥 상의 동일한 유전자 내의 2개의 유전적 변이, 및 (2) 동일한 유전자 내에 존재하되 별개의 DNA 가닥 상에 위치하는 2개의 유전적 변이. 가능성 (1)은 1 카피의 유전자가 정상이고 개체가 질환을 갖지 않는다는 것을 표시할 수 있는 반면, 가능성 (2)는 특히 상기 2개의 유전적 변이가 동일한 유전자 카피 내에 존재할 때 유전자의 기능을 손상시키는 경우 개체가 질환을 갖거나 질환을 발달시킬 것임을 표시할 수 있다. 유사하게, 위상조정 정보는 하기 가능성들을 식별할 수도 있다: (1) 동일한 DNA 가닥 상의 상이한 유전자 내에 각각 위치하는 2개의 유전적 변이, 및 (2) 상이한 유전자 내에 각각 존재하되 별개의 DNA 가닥 상에 위치하는 2개의 유전적 변이.
c. 소수의 세포로부터의 폴리뉴클레오티드의 서열결정
본원에서 제공된 방법을 이용하여 세포 특이적 정보가 수득될 수 있게 하는 방식으로 세포 내에 함유된 폴리뉴클레오티드를 제조할 수 있다. 상기 방법은 매우 적은 샘플, 예컨대, 약 10개 내지 100개의 세포를 포함하는 샘플로부터 유전적 변이(예를 들면, SNP, 돌연변이, 삽입결실, 카피 수 변이, 염기전환, 전위, 역위 등)를 검출할 수 있게 한다. 일부 경우, 약 1개, 5개, 10개, 20개, 30개, 40개, 50개, 60개, 70개, 80개, 90개 또는 100개의 세포가 본원에 기재된 방법에서 사용될 수 있다. 일부 경우, 약 1개, 5개, 10개, 20개, 30개, 40개, 50개, 60개, 70개, 80개, 90개 또는 100개 이상의 세포가 본원에 기재된 방법에서 사용될 수 있다. 다른 경우, 약 5개, 10개, 20개, 30개, 40개, 50개, 60개, 70개, 80개, 90개 또는 100개 이하의 세포가 본원에 기재된 방법에서 사용될 수 있다.
한 예에서, 방법은 구획당 1개 이하의 세포(또는 1개 세포의 추출물)가 존재하도록 세포 샘플(또는 미정제 세포 추출물)을 분할하는 단계, 세포를 용해시키는 단계, 세포 내에 함유된 폴리뉴클레오티드를 본원에 기재된 방법들 중 임의의 방법으로 단편화하는 단계, 단편화된 폴리뉴클레오티드를 바코드에 부착시키는 단계, 모으는 단계 및 서열결정하는 단계를 포함한다.
본원의 다른 부분에 기재된 바와 같이, 바코드 및 다른 시약은 구획(예를 들면, 캡슐) 내에 함유될 수 있다. 각각의 세포가 상이한 캡슐과 접촉하도록 세포의 로딩 전 또는 후, 또는 세포의 로딩과 동시에 이 캡슐들을 또 다른 구획(예를 들면, 웰) 내로 로딩할 수 있다. 이 기법을 이용하여 독특한 바코드를 각각의 세포로부터 수득된 폴리뉴클레오티드에 부착시킬 수 있다. 그 다음, 생성된 태깅된 폴리뉴클레오티드를 모아 서열결정할 수 있고, 바코드를 사용하여 폴리뉴클레오티드의 기원을 추적할 수 있다. 예를 들면, 동일한 바코드를 갖는 폴리뉴클레오티드는 동일한 세포로부터 유래된 것으로 확인될 수 있는 반면, 상이한 바코드를 갖는 폴리뉴클레오티드는 상이한 세포로부터 유래된 것으로 확인될 수 있다.
본원에 기재된 방법을 이용하여 암성 종양 세포의 집단에 걸쳐 발암 돌연변이의 분포를 검출할 수 있다. 예를 들면, 일부 종양 세포들은 두 대립형질들에서 발암유전자(예를 들면, HER2, BRAF, EGFR, KRAS)의 돌연변이 또는 증폭을 가질 수 있고(동형접합), 다른 일부 종양 세포들은 1개의 대립형질에서 돌연변이를 가질 수 있고(이형접합), 다른 일부 종양 세포들은 돌연변이를 갖지 않을 수 있다(야생형). 본원에 기재된 방법을 이용하여 이들 차이를 검출할 수 있고 동형접합 세포, 이형접합 세포 및 야생형 세포의 상대적 수를 정량할 수도 있다. 이러한 정보를 이용하여, 예를 들면, 특정 암을 병기분류할 수 있고/있거나 시간의 경과에 따른 암 및 그의 치료의 진행을 모니터링할 수 있다.
일부 예에서, 본 개시내용은 2개의 상이한 발암유전자(예를 들면, KRAS 및 EGFR)에서 돌연변이를 확인하는 방법을 제공한다. 동일한 세포가 2개의 돌연변이를 갖는 유전자를 포함하는 경우, 이것은 보다 더 공격적인 형태의 암을 표시할 수 있다. 대조적으로, 상기 돌연변이가 2개의 상이한 세포에 위치하는 경우, 이것은 암이 보다 더 양성이거나 보다 덜 진행되어 있다는 것을 표시할 수 있다.
d. 유전자 발현의 분석
본 개시내용의 방법은 유전자 발현의 변화를 검출하기 위해 샘플을 프로세싱하는 데 적용될 수 있다. 샘플은 세포, mRNA, 또는 mRNA로부터 역전사된 cDNA를 포함할 수 있다. 샘플은 여러 상이한 세포들 또는 조직들로부터의 추출물을 포함하는 모아진 샘플, 또는 단일 세포 또는 조직으로부터의 추출물을 포함하는 샘플일 수 있다.
세포를 구획(예를 들면, 마이크로웰) 내에 직접적으로 배치하고 용해시킬 수 있다. 용해 후, 서열결정을 위해 본 발명의 방법을 이용하여 세포의 폴리뉴클레오티드를 단편화하고 바코딩할 수 있다. 폴리뉴클레오티드를 본 발명의 방법에서 사용되는 구획 내에 도입하기 전 세포로부터 추출할 수도 있다. mRNA의 역전사를 본원에 기재된 구획 내부 또는 이러한 구획의 외부에서 수행할 수 있다. cDNA의 서열결정은 시간의 경과에 따라 또는 특정 조건에의 노출 후 특정 전사체가 특정 세포에 풍부하다는 표시를 제공할 수 있다.
상기 제공된 방법은 현재의 폴리뉴클레오티드 프로세싱 방법에 비해 여러 장점을 제공한다. 첫째, 연산간 변동성(inter-operator variability)이 크게 감소된다. 둘째, 본 방법은 가격이 낮고 용이하게 제작될 수 있는 마이크로플루이딕 장치에서 수행될 수 있다. 셋째, 표적 폴리뉴클레오티드의 조절된 단편화는 사용자가 정해진 적절한 길이를 갖는 폴리뉴클레오티드 단편을 생성할 수 있게 한다. 이것은 폴리뉴클레오티드를 분할하는 데 도움을 주고 과도하게 큰 단편의 존재로 인한 서열 정보 상실의 양을 감소시킨다. 본 방법 및 시스템은 프로세싱된 폴리뉴클레오티드의 무결성을 유지하는 용이한 작업흐름(workflow)도 제공한다. 추가로, 제한효소의 사용은 사용자가 어댑터 및/또는 바코드와 상용가능하도록 디자인될 수 있는 DNA 돌출부("스티키 말단")를 생성할 수 있게 한다.
e. 세포로부터의 염색체와 같은 폴리뉴클레오티드의 분할
한 예에서, 본 개시내용에서 제공된 방법, 조성물, 시스템, 장치 및 키트를 이용하여 세포로부터의 폴리뉴클레오티드(전체 염색체를 포함함)를 분할할 수 있다. 한 예에서, 단일 세포 또는 복수의 세포들(예를 들면, 2개, 10개, 50개, 100개, 1000개, 10000개, 25000개, 50000개, 100000개, 500000개, 1000000개 또는 보다 더 많은 수의 세포들)을 용해 완충제 및 단백질분해효소 K와 함께 용기 내에 로딩하고 특정된 시간 동안 인큐베이트한다. 복수의 세포들의 사용은 예를 들면, 분석될 각각의 폴리뉴클레오티드를 그 자신의 구획 내에 분할함으로써 폴리뉴클레오티드 위상조정을 가능하게 할 것이다.
인큐베이트 후, 예를 들면, 세포 용해물을 캡슐 내로 플로우 포커싱함으로써 세포 용해물을 분할한다. 위상조정이 수행되어야 하는 경우, 각각의 캡슐이 단지 단일 분석물(예를 들면, 단일 염색체) 또는 단지 단일 카피의 임의의 특정 염색체(예를 들면, 1 카피의 제1 염색체 및 1 카피의 제2 염색체)를 포함하도록 플로우 포커싱을 수행한다. 일부 경우, 염색체들이 동일한 염색체가 아닌 한, 복수의 염색체들을 동일한 캡슐 내에 캡슐화할 수 있다. 폴리뉴클레오티드의 전단을 최소화하기 위해 캡슐화를 약한 유동 하에서 수행한다. 캡슐은 캡슐 내에서 폴리뉴클레오티드(예를 들면, 염색체)를 유지하면서 캡슐의 내용물의 세척 및 캡슐 내로의 시약의 도입을 허용하도록 다공성을 가질 수 있다. 그 다음, 캡슐화된 폴리뉴클레오티드(예를 들면, 염색체)를 본 개시내용에서 제공된 또는 당분야에서 공지된 방법들 중 임의의 방법에 따라 프로세싱할 수 있다. 캡슐 외피는 캡슐화된 폴리뉴클레오티드(예를 들면, 염색체)를 전단 및 추가 분해로부터 보호한다. 물론, 이 방법은 임의의 다른 세포 성분에도 적용될 수 있다.
전술한 바와 같이, 캡슐 외피를 사용하여 폴리뉴클레오티드를 전단으로부터 보호할 수 있다. 그러나, 캡슐은 폴리뉴클레오티드 또는 다른 분석물의 구획화된 전단을 가능하게 하기 위한 구획으로서 사용될 수도 있다. 예를 들면, 일부 경우, 폴리뉴클레오티드를 캡슐 내에 캡슐화한 후 초음파 전단 또는 임의의 다른 적합한 전단으로 처리할 수 있다. 캡슐 외피는 전단 하에서 무손상 상태로 남아있도록 구성될 수 있는 반면, 캡슐화된 폴리뉴클레오티드는 전단될 수 있으나 여전히 캡슐 내에 남아있을 것이다. 일부 경우, 하이드로겔 소적을 이용하여 동일한 결과를 달성할 수 있다.
f. 암 돌연변이 검출 및 법의학
본원에 기재된 구획에서의 증폭에 기초한 바코딩 방식을 통한 바코딩 방법은 분해된 샘플, 예를 들면, 포르말린으로 고정되고 파라핀으로 포매된(FFPE) 조직 박편으로부터 바코드 라이브러리를 생성하는 데 유용할 수 있다. 본원에 기재된 방법은 구획 내의 모든 앰플리콘들(amplicons)이 동일한 초기 분자로부터 유래되었다는 것을 확인할 수 있다. 사실상, 구획 바코딩으로 독특한 출발 폴리뉴클레오티드에 대한 정보를 보유할 수 있다. 이러한 확인은 상이한 원래의 분자들로부터의 앰플리콘들이 식별될 수 있기 때문에 라이브러리 복잡성의 측정에 도움을 줄 수 있다. 더욱이, 본원에 기재된 방법은 변이체 호출(calling) 민감성을 측정하는 데 도움을 줄 수 있는 독특한 커버리지의 평가를 허용할 수 있다. 이들 장점들은 암 돌연변이 검출 및 법의학에 특히 유용할 수 있다.
g.
저투입
DNA
적용분야(순환 종양 세포(
CTC
) 서열결정)
본원에 기재된 바코딩 방법은 낮은 폴리뉴클레오티드 투입 적용분야, 예를 들면, 순환 종양 세포(CTC)의 핵산의 서열결정에 유용할 수 있다. 예를 들면, 구획 내에서의 본원에 기재된 MALBAC 방법은 낮은 폴리뉴클레오티드 투입 적용분야에서 우수한 데이터 질을 수득하는 데 도움을 줄 수 있고/있거나 증폭 오류를 여과하여 제거하는 데 도움을 줄 수 있다.
X. 키트
일부 경우, 본 개시내용은 구획의 생성을 위한 시약을 포함하는 키트를 제공한다. 상기 키트는 구획 및 구획 내의 구획의 생성을 위한 임의의 적합한 시약 및 설명서를 포함할 수 있다.
한 예에서, 키트는 에멀션 중의 소적 내의 캡슐을 생성하기 위한 시약을 포함한다. 예를 들면, 키트는 캡슐을 생성하기 위한 시약, 에멀션을 생성하기 위한 시약, 및 캡슐을 에멀션의 소적 내로 도입하기 위한 설명서를 포함할 수 있다. 본 개시내용 전체에 걸쳐 특정된 바와 같이, 임의의 적합한 종이 소적 및/또는 캡슐 내로 도입될 수 있다. 본 개시내용의 키트는 이들 종들 중 임의의 종, 예컨대, 미리 분할된 바코드를 포함하는 폴리뉴클레오티드도 제공할 수 있다. 유사하게, 본 개시내용 전체에 걸쳐 기재된 바와 같이, 내부 캡슐은 자극을 가하였을 때 그의 내용물을 에멀션의 소적 내로 방출하도록 디자인될 수 있다.
또 다른 예에서, 키트는 캡슐 내의 캡슐을 생성하기 위한 시약을 포함한다. 예를 들면, 키트는 내부 캡슐을 생성하기 위한 시약, 외부 캡슐을 생성하기 위한 시약, 및 캡슐 내의 캡슐을 생성하기 위한 설명서를 포함할 수 있다. 본 개시내용 전체에 걸쳐 특정된 바와 같이, 임의의 적합한 종이 내부 캡슐 및/또는 외부 캡슐 내로 도입될 수 있다. 본 개시내용의 키트는 이들 종들 중 임의의 종, 예컨대, 미리 분할된 바코드를 포함하는 폴리뉴클레오티드도 제공할 수 있다. 유사하게, 본 개시내용 전체에 걸쳐 기재된 바와 같이, 내부 캡슐은 자극을 가하였을 때 그의 내용물을 외부 캡슐 내로 방출하도록 디자인될 수 있다.
XI. 장치
일부 경우, 본 개시내용은 분석물의 프로세싱을 위한 구획을 포함하는 장치를 제공한다. 장치는 본 개시내용의 다른 부분에 기재된 바와 같이 마이크로웰 어레이 또는 마이크로스폿 어레이일 수 있다. 장치는 임의의 적합한 구획을 포함하는 방식으로 형성될 수 있다. 일부 경우, 장치는 복수의 웰들 또는 복수의 스폿들을 포함한다. 물론, 장치 내의 임의의 구획은 다른 구획, 예컨대, 캡슐, 에멀션 중의 소적 등을 보유할 수도 있다.
장치는 임의의 적합한 물질로부터 형성될 수 있다. 일부 예에서, 장치는 융합된 실리카, 소다 석회 유리, 보로실리케이트 유리, 폴리(메틸 메타크릴레이트), 사파이어, 규소, 게르마늄, 환형 올레핀 공중합체, 폴리에틸렌, 폴리프로필렌, 폴리아크릴레이트, 폴리카보네이트, 플라스틱 및 이들의 조합물로 구성된 군으로부터 선택되는 물질로부터 형성된다.
일부 경우, 장치는 유체가 구획들 내로 및 구획들 사이에 유동하도록 채널을 포함한다. 임의의 적합한 채널이 사용될 수 있다. 장치는 유체 입구 및 유체 출구를 포함할 수 있다. 입구 및 출구는 종을 장치 내로 도입하도록 액체 취급 장치에 부착될 수 있다. 장치는 임의의 종의 도입 전 또는 후 밀봉될 수 있다.
친수성 및/또는 소수성을 갖는 물질이 장치의 상이한 부분에서 사용될 수 있다. 예를 들면, 일부 경우, 본 개시내용의 장치는 친수성 물질을 포함하는 내부 표면을 갖는 구획을 포함한다. 일부 경우, 구획 외부의 표면은 소수성 물질을 포함한다. 일부 경우, 유체 유동 경로는 소수성 또는 친수성 물질로 코팅된다.
인식될 바와 같이, 본 개시내용은 본원에 기재된 다양한 적용분야, 용도 및 목적을 포함하는 특정 용도 또는 목적을 위한 본원에 기재된 임의의 조성물, 라이브러리, 방법, 장치 및 키트의 용도를 제공한다. 예를 들면, 본 개시내용은 종을 분할하는 데 있어서, 올리고뉴클레오티드를 분할하는 데 있어서, 구획으로부터의 종의 자극 선택적 방출에 있어서, 구획에서 반응(예를 들면, 결찰 및 증폭 반응)을 수행하는 데 있어서, 핵산 합성 반응을 수행하는 데 있어서, 핵산을 바코딩하는 데 있어서, 서열결정을 위해 폴리뉴클레오티드를 제조하는 데 있어서, 폴리뉴클레오티드를 서열결정하는 데 있어서, 폴리뉴클레오티드 위상조정에 있어서, 소수의 세포로부터의 폴리뉴클레오티드를 서열결정하는 데 있어서, 유전자 발현을 분석하는 데 있어서, 세포로부터의 폴리뉴클레오티드를 분할하는 데 있어서, 돌연변이 검출에 있어서, 신경계 장애 진단에 있어서, 당뇨병 진단에 있어서, 태아 이수성 진단에 있어서, 암 돌연변이 검출 및 법의학에 있어서, 질환 검출에 있어서, 의학적 진단에 있어서, 저투입 핵산 적용분야, 예컨대, 순환 종양 세포(CTC) 서열결정에 있어서, 이들의 조합에 있어서, 및 본원에 기재된 임의의 다른 적용분야, 방법, 공정 또는 용도에 있어서 본원에 기재된 조성물, 방법, 라이브러리, 장치 및 키트의 용도를 제공한다.
실시예
실시예
1: 비대칭
PCR
및 부분적으로 상보적인 보편적 서열의 첨가에 의한 바코드 서열을 포함하는 분기형 어댑터의 라이브러리의 생성
본 실시예는 차세대 서열결정 기술(예를 들면, 일루미나)과 상용가능한 바코드 서열을 포함하는 분기형 어댑터의 제조 방법을 제공한다. 본 실시예에서, 바코드를 도 2에 나타낸 바와 같이 위치(207)에 배치한다.
도 4를 참조하면, 제1 고정화 영역(402), 바코드 영역(403) 및 제1 서열결정 프라이머 영역(404)을 포함하는 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(401)을 합성한다. 바코드 영역(403)은 각각의 커플링 단계에서 등몰 농도의 A, G, T 및 C를 포함시킴으로써 합성된 7 뉴클레오티드 무작위 서열이다.
합성 후, 각각의 소적이 평균 0.1개의 폴리뉴클레오티드를 포함하도록 단일 가닥 어댑터-바코드 폴리뉴클레오티드(401)를 유중수 에멀션 중의 수성 소적 내로 희석한다. 상기 소적은 비대칭 PCR에 의한 단일 가닥 어댑터-바코드 폴리뉴클레오티드(401)의 증폭을 위한 시약(예를 들면, 중합효소, 프라이머, dNTP, 완충제, 염) 및 DNA 인터칼레이팅 염료(예를 들면, 에티듐 브로마이드)도 포함한다. 역방향 프라이머는 정방향 프라이머를 초과하여 존재하거나 정방향 프라이머는 역방향 프라이머를 초과하여 존재하므로, 비대칭 증폭이 가능하다. 이중 가닥 생성물(405)을 생성하는 기하급수적 증폭기(410) 및 단일 가닥 생성물(406)을 생성하는 선형 증폭기(411)를 통해 폴리뉴클레오티드가 증폭되고 반응이 진행된다.
증폭된 폴리뉴클레오티드를 포함하는 소적을 수집하기 위해 형광 보조 세포 분류기(FACS)(412) 상에서 소적을 분류한다. 부분적으로 상보적인 보편적 서열(407)을 구획에 첨가하여 부분적으로 어닐링된 분기 구조체(413)를 생성한다. 부분적으로 상보적인 보편적 서열(407)은 제2 고정화 영역(408) 및 제2 서열결정 프라이머 영역(409)을 포함하고, 이들 중 후자는 서열결정될 폴리뉴클레오티드 표적 상의 A 돌출부와 상용가능한 T 돌출부를 포함한다.
실시예 2: 단편화효소를 사용한 단편화 및 바코딩
제1 고정화 영역(402), 바코드 영역(403) 및 제1 서열결정 프라이머 영역(404)을 포함하는 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(예를 들면, 도 4: 401)을 실시예 1에 기재된 바와 같이, 또는 본 개시내용에 기재된 임의의 다른 방법으로 합성하고 분할하고 증폭하고 분류한다. 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열을 포함하는 소적에 대한 계면 중합을 수행하여 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(406)의 라이브러리를 포함하는 복수의 캡슐을 생성하는데, 이때 라이브러리 내의 각각의 (또는 대다수의) 서열들은 그들 각각의 바코드 영역(403)의 서열에서 상이하다. 따라서, 캡슐화된 단일 가닥 어댑터-바코드 폴리뉴클레오티드의 라이브러리가 생성된다.
2개의 혼합물들을 제조한다. 혼합물 Z1은 표적 폴리뉴클레오티드(즉, 단편화되고 바코딩될 폴리뉴클레오티드), 단편화효소(예를 들면, NEBNEXT DSDNA FRAGMENTASE), 및 부분적으로 상보적인 보편적 서열(예를 들면, 도 4: 407)을 포함한다. 제2 혼합물 Z2는 전술한 바와 같이 생성된 캡슐화된 단일 가닥 어댑터-바코드 폴리뉴클레오티드의 라이브러리, 및 단편화효소를 활성화시키기에 충분한 농도의 염화마그네슘을 포함한다. 혼합물 Z1, Z2, 또는 Z1 및 Z2 둘 다가 T4 중합효소, Taq 중합효소 및 열안정성 결찰효소도 포함한다.
혼합물 Z1과 Z2를 조합하고, 캡슐 내의 캡슐을 본 개시내용의 다른 부분에 기재된 방법, 예컨대, 플로우 포커싱에 따라 형성한다. 도 5는 전술한 방법에 따라 제조된 캡슐 내의 캡슐을 예시한다. 외부 캡슐(501)은 내부 캡슐(502) 및 매질(504)을 포함한다. 내부 캡슐(502)은 캡슐화된 단일 가닥 어댑터-바코드 폴리뉴클레오티드의 라이브러리의 한 구성원이다. 따라서, 내부 캡슐(502)은 동일한 바코드를 구획, 예컨대, 외부 캡슐(501) 내의 폴리뉴클레오티드에 부착시키는 데 사용될 수 있는 다수의 카피의 단일 가닥 어댑터-바코드 폴리뉴클레오티드(503)를 포함한다.
매질(504)은 전술한 혼합물 Z1 및 Z2의 내용물을 함유한다. 보다 구체적으로, 매질(504)은 표적 폴리뉴클레오티드(505), 부분적으로 상보적인 보편적 서열(506), 및 단편화효소, T4 중합효소, Taq 중합효소, 열안정성 결찰효소, 염화마그네슘 및 적절한 완충제를 포함하는 효소 혼합물(507)을 포함한다.
캡슐 내의 캡슐을 생성하고 캡슐 내의 캡슐을 적절한 조건에 노출시킬 때, 효소는 표적 폴리뉴클레오티드를 프로세싱한다. 보다 구체적으로, 단편화효소는 표적 폴리뉴클레오티드를 단편화하고, T4 중합효소는 단편화된 표적 폴리뉴클레오티드의 말단을 블런트 말단으로 만든다. 그 다음, 단편화효소 및 T4 중합효소를 열 불활성화시키고 자극을 사용하여 내부 캡슐(502)을 파열시켜 그의 내용물을 외부 캡슐(501) 내로 방출시킨다. Taq 중합효소는 3'-A 돌출부를 단편화된 블런트 말단 표적 폴리뉴클레오티드에 추가한다. 단일 가닥 어댑터-바코드 폴리뉴클레오티드(503)는 부분적으로 상보적인 보편적 서열(506)과 혼성화하여 단편화된 표적 폴리뉴클레오티드 상의 3'-A 돌출부와 상용가능한 3'-T 돌출부를 갖는 분기형 어댑터를 형성한다. 열안정성 결찰효소는 분기형 어댑터를 단편화된 표적 폴리뉴클레오티드에 결찰시켜 바코딩된 표적 폴리뉴클레오티드를 생성한다. 그 다음, 외부 캡슐(501)을 파열시키고 모든 외부 캡슐들로부터 샘플을 모으고 표적 폴리뉴클레오티드를 서열결정한다. 그 다음, 서열결정 전 필요에 따라 추가 제조 단계(예를 들면, 벌크 증폭, 크기 선택 등)를 수행할 수 있다.
일부 경우, 혼합물 Z1은 다수의 버전의 부분적으로 상보적인 보편적 서열(506)을 포함하는데, 이때 각각의 버전은 그 자신의 샘플 특이적 바코드를 갖는다.
더욱이, 전술한 실시예가 열안정성 결찰효소를 사용하여 바코드 서열을 포함하는 분기형 어댑터를 표적 폴리뉴클레오티드에 부착시키지만, 본 개시내용의 다른 부분에 기재된 바와 같이 PCR을 이용하여 이 단계를 달성할 수도 있다.
실시예 3: 초음파처리에 의한 단편화 및 바코딩
캡슐화된 단일 가닥 어댑터-바코드 폴리뉴클레오티드의 라이브러리를 실시예 2에 기재된 바와 같이, 또는 본 개시내용에 기재된 임의의 다른 적합한 방법으로 생성한다. 표적 폴리뉴클레오티드(즉, 단편화될 폴리뉴클레오티드)를 캡슐 내로 분할한다. 표적 폴리뉴클레오티드를 포함하는 캡슐은 초음파 스트레스를 견디도록 구성된다. 표적 폴리뉴클레오티드를 포함하는 캡슐을 초음파 스트레스(예를 들면, 코바리스(COVARIS) 집속 초음파처리기)에 노출시키고 표적 폴리뉴클레오티드를 단편화하여 단편화된 표적 폴리뉴클레오티드 캡슐을 생성한다.
캡슐화된 단일 가닥 어댑터-바코드 폴리뉴클레오티드(예를 들면, 도 4: 406)의 라이브러리, 단편화된 표적 폴리뉴클레오티드 캡슐, 부분적으로 상보적인 보편적 서열(예를 들면, 도 4: 407), 효소 혼합물(T4 중합효소, Taq 중합효소 및 열안정성 결찰효소) 및 적절한 완충제를 포함하는 혼합물 Z1을 제조한다. 캡슐 내의 캡슐을 본 개시내용의 다른 부분에 기재된 방법, 예컨대, 플로우 포커싱에 따라 생성한다.
도 6은 전술한 방법에 따라 생성된 캡슐 내의 캡슐을 예시한다. 외부 캡슐(601)은 복수의 내부 캡슐들(602 및 605) 및 매질(604)을 포함한다. 내부 캡슐들(602 및 605)은 각각 단일 가닥 어댑터-바코드 폴리뉴클레오티드(603)를 포함하는 캡슐, 및 단편화된 표적 폴리뉴클레오티드(606)를 포함하는 캡슐을 포함한다. 내부 캡슐(602)은 동일한 바코드를 구획 내의 폴리뉴클레오티드, 예컨대, 내부 캡슐(605) 내에 함유된 단편화된 폴리뉴클레오티드(606)에 부착시키는 데 사용될 수 있는 다수의 카피의 단일 가닥 어댑터-바코드 폴리뉴클레오티드(603)를 포함한다.
매질(604)은 전술한 혼합물 Z1의 내용물을 함유한다. 보다 구체적으로, 매질(604)은 부분적으로 상보적인 보편적 서열(607), 효소 혼합물(T4 중합효소, Taq 중합효소 및 열안정성 결찰효소)(608) 및 적절한 완충제를 포함한다.
단편화된 표적 폴리뉴클레오티드(606)를 포함하는 내부 캡슐(605)을 자극에 노출시켜 이 캡슐을 파열시키고 그의 내용물을 외부 캡슐(601)의 내용물 내로 방출시킨다. T4 중합효소는 단편화된 표적 폴리뉴클레오티드의 말단을 블런트 말단으로 만들고, Taq 중합효소는 3'-A 돌출부를 단편화된 블런트 말단 표적 폴리뉴클레오티드에 추가한다. 그 다음, T4 중합효소 및 Taq 중합효소를 열 불활성화시키고 자극을 가하여 내부 캡슐(602)의 내용물을 외부 캡슐(601) 내로 방출시킨다. 단일 가닥 어댑터-바코드 폴리뉴클레오티드(603)는 부분적으로 상보적인 보편적 서열(607)과 혼성화하여 단편화된 표적 폴리뉴클레오티드 상의 3'-A 돌출부와 상용가능한 3'-T 돌출부를 갖는 분기형 어댑터를 형성한다. 열안정성 결찰효소는 분기형 어댑터를 단편화된 표적 폴리뉴클레오티드에 결찰시켜 바코딩된 표적 폴리뉴클레오티드를 생성한다. 그 다음, 외부 캡슐(601)을 파열시키고 모든 외부 캡슐들로부터 샘플을 모으고 표적 폴리뉴클레오티드를 서열결정한다.
실시예 2에 기재된 바와 같이, 일부 경우, Z1은 다수의 버전의 부분적으로 상보적인 보편적 서열(607)을 포함할 수 있다. 나아가, 본 실시예가 열안정성 결찰효소를 사용하여 표적 폴리뉴클레오티드의 바코딩을 입증하지만, PCR을 이용하여 이 단계를 달성할 수도 있다.
실시예 4: 단일 프라이머 등온 증폭(SPIA) 및 제한 분해에 의한 분기형 어댑터의 생성
본 실시예는 SPIA 및 제한 분해에 의한 분기형 어댑터의 합성을 입증한다. 도 7은 본 실시예의 방법에 따라 생성될 수 있는 생성물(또는 중간체)의 한 예를 제공한다. 도 7을 참조하면, 본 개시내용의 다른 부분에 기재된 바와 같이 분기형 어댑터에 대한 전구체로서 사용될 수 있는 헤어핀 어댑터(701)(서열 번호 2)가 표시되어 있다. 본 실시예에서, SPIA를 이용하여 헤어핀 어댑터를 단일 가닥 증폭 생성물로서 합성한다. 헤어핀 어댑터(701)는 이중 가닥 영역(702), AT 결찰을 위한 3'-T 돌출부(703), 및 제한효소에 의해(즉, 위치 33과 34 사이에서) 절단될 수 있는 영역(704)을 포함한다. 헤어핀 어댑터는 바코드 영역 및 기능성 영역, 예컨대, 고정화 영역 및 서열결정 프라이머의 어닐링을 위한 영역을 포함할 수 있다.
(예를 들면, 위치 33과 34 사이에서) 어댑터의 절단은 도 8a에 나타낸 분기형 어댑터(서열 번호 3 및 4)를 생성한다. 절단될 영역에 상보적인 올리고뉴클레오티드 서열을 도입하고 어닐링된 어댑터를 제한효소에 노출시킴으로써 어댑터를 절단한다. 도 8a에 나타낸 분기형 어댑터 영역을 표적 폴리뉴클레오티드에 결찰시켜 도 8b에 나타낸 구조체(서열 번호 5 및 6)를 생성한다. 도 8을 참조하면, 도 8b에서 서열의 밑줄친 부분은 도 8a에 나타낸 분기형 어댑터와의 결찰에 적합한 3'-A 돌출부를 갖는 표적 폴리뉴클레오티드를 포함한다.
그 다음, 도 8b에 나타낸 서열(서열 번호 5 및 6)을 중합효소 연쇄 반응으로 증폭하여 도 8c에 나타낸 서열 번호 7(서열 번호 5의 증폭 생성물) 및 서열 번호 8(서열 번호 6의 증폭 생성물)을 생성한다. 도 8c에서, 서열 번호 7은 제1 고정화 서열(밑줄친 5' 부분) 및 제2 고정화 서열(밑줄친 3' 부분)을 서열 번호 5에 추가하는 서열 번호 5의 증폭 생성물을 나타낸다. 서열 번호 8은 서열 번호 6의 혼성화되지 않은 부분을 상이한 서열(밑줄친 3' 부분 및 밑줄친 5' 부분)로 대체하는 서열 번호 6의 증폭 생성물을 나타낸다. 추가로, 서열 번호 8은 폴리뉴클레오티드의 혼성화되지 않은 5' 영역 내에서 6 뉴클레오티드 바코드(TAGTGC; 굵은 글자체)를 포함한다. 따라서, 증폭 생성물은 바코딩된 표적 폴리뉴클레오티드 서열(111로 표시됨), 고정화 서열 및 바코드를 포함한다.
실시예 5: 단일 프라이머 등온 증폭(SPIA) 및 제한 분해에 의한 추가의 분기형 어댑터
본 실시예는 SPIA 및 제한 분해에 의한 도 9a(서열 번호 9 및 10)에 나타낸 분기형 어댑터의 합성을 입증하는데, 이때 N은 A, T, G 또는 C를 나타낸다. 도 9b는 단일 가닥 포맷의 분기형 어댑터(서열 번호 11)를 보여주는데, 이때 단일 가닥 포맷은 헤어핀 구조체를 형성할 수 있다. 별표로 표시된 위치에서의 헤어핀 구조물의 절단은 도 9a에 나타낸 분기형 어댑터를 생성한다.
SPIA를 위한 주형은 도 9c에 나타낸 서열(서열 번호 12)일 것이다. 도 9c에서, "R"은 RNA의 영역을 나타낸다. 도 9d는 도 9c의 서열에 의해 형성된 헤어핀 구조체를 보여준다. 도 9d의 서열(서열 번호 12)을 중합효소로 처리하여 뉴클레오티드를 3' 말단에 추가함으로써 도 9e에 나타낸 서열(서열 번호 13)을 생성한다. 그 다음, 도 9e의 서열(서열 번호 13)을 DNA에 혼성화된 RNA를 분해하는 RNase H로 처리하여 도 9f의 서열(서열 번호 14)을 생성한다.
그 다음, 서열 번호 14에 대해 가닥 이탈 SPIA를 수행한다. 가닥 이탈 증폭에서 프라이머는 형태 RRRRRRRRRRRRR(즉, R13)의 프라이머이다. 이 프라이머는 서열 번호 14의 혼성화되지 않은 3' 말단(즉, N12)보다 1개 염기만큼 더 긴 RNA 프라이머이다(도 9f). 보다 구체적으로, 도 9f에 나타낸 바와 같이, 서열 번호 14의 3' 말단은 12개의 N 뉴클레오티드를 함유한다. RNA 프라이머는 13개의 뉴클레오티드를 함유한다. RNA 프라이머의 뉴클레오티드 2-13은 서열 번호 14의 혼성화되지 않은 12개 N 뉴클레오티드와 상보적이다. RNA 프라이머의 뉴클레오티드 1은 (3'에서 5' 방향으로) 제1 혼성화된 염기(이 경우 T)와 상보적이다. RNA 프라이머는 A를 이탈시키고 도 9g에 나타낸 이중 가닥 연장 생성물(서열 번호 15 및 16)을 생성한다. 1개의 프라이머만이 존재하기 때문에, 반응은 다수의 카피의 단일 가닥 생성물을 생성한다. 단일 가닥 증폭 생성물을 RNase H로 처리하여 도 9h에 나타낸 단일 가닥 증폭 생성물(서열 번호 17)을 생성한다. 도 9i는 이 서열을 5'-3' 포맷으로 보여준다(서열 번호 17). 도 9j는 이 서열을 헤어핀 포맷으로 보여준다(서열 번호 17).
그 다음, 도 9j에 나타낸 헤어핀 어댑터를, 3'-A 돌출부를 갖는 단편화된 폴리뉴클레오티드에 결찰시킨다. 헤어핀 영역에 상보적인 올리고뉴클레오티드를 첨가하고 제한효소로 절단함으로써 도 9j에서 곡선에 의해 분리된 A 잔기와 C 잔기 사이에서 헤어핀을 절단한다. 이것은 분기형 어댑터를 생성한다. 그 다음, PCR 증폭을 실시예 4에 기재된 바와 같이 수행하여 고정화 영역 및 바코드를 표적 폴리뉴클레오티드에 부착된 분기형 어댑터에 추가한다.
실시예
6: 기하급수적
PCR
및
혼성화에
의한 바코드를 포함하는 분기형 어댑터의 생성
본 실시예는 혼성화에 의한 바코드를 포함하는 분기형 어댑터의 생성을 입증한다. 도 10a는 도 8a에서 제공된 예시적인 분기형 어댑터를 보여준다. 실시예 4에 기재된 바와 같이, 이 어댑터를 표적 폴리뉴클레오티드에 결찰시킨 후 증폭 반응을 수행하여 바코드를 포함하는 추가 기능성 서열을 추가할 수 있다. 그러나, 분기형 어댑터를 표적 폴리뉴클레오티드에 부착시키기 전 바코드(및 다른 기능성 서열)를 분기형 어댑터 내로 직접적으로 도입할 수도 있다. 예를 들면, 도 10b는 제1 고정화 영역(밑줄) 및 7 뉴클레오티드 바코드 영역(굵은 글자체/밑줄; "N")이 추가된 도 10a의 분기형 어댑터를 보여준다.
먼저 서열 번호 18을 단일 가닥으로서 합성함으로써 도 10b의 바코딩된 분기형 어댑터를 생성한다. 본 개시내용 전체에 걸쳐 기재된 바와 같이 A, G, T 및 C의 등몰 혼합물을 사용하여 바코드 영역에서 다양성을 발생시킨다. 소적에 기초한 PCR을 실시예 1에 기재된 바와 같이 수행한다. 그러나, 1개의 DNA 프라이머 및 1개의 RNA 프라이머를 사용하여 소적에서 서열 번호 18을 증폭한다. 상기 증폭을 인터칼레이팅 염료의 존재 하에서 수행하고, 증폭된 서열 번호 18을 포함하는 소적을 실시예 1에 기재된 바와 같이 단리한다. 도 10c는 이중 가닥 증폭 생성물을 보여준다. 서열 번호 19의 밑줄친 부분은 RNA 프라이머로부터 유도된 RNA 가닥이다. 그 다음, 도 10c에 나타낸 서열을, 밑줄친 RNA 영역을 분해하는 RNase H로 처리하여 도 10d에 나타낸 구축물을 생성한다. 분기형 구축물을 생성하기 위해, 부분적으로 상보적인 보편적 서열(서열 번호 21)을 도 10d에 나타낸 구축물에 첨가하여 도 10e에 나타낸 생성물을 생성한다. 이 공정의 이용의 장점은 이 공정이 SPIA에 의해 제공된 폴리뉴클레오티드의 선형 증폭에 비해 기하급수적 PCR에 의해 제공된 폴리뉴클레오티드의 유의하게 더 큰 증폭을 이용한다는 점이다.
실시예 7: 이중 인덱싱(Dual Indexing) 방법
본 실시예는 이중 인덱스 판독을 위한 바코드의 합성 방법을 입증한다. 이중 인덱스 판독은 각각의 가닥에 부착된 바코드를 사용한 이중 가닥 단편의 양 가닥들의 판독이다. 도 11은 이중 인덱싱 방법을 위한 바코드의 합성의 한 예, 및 캡슐 구성에 있어서 캡슐에서의 바코드의 예시적인 사용을 보여준다.
도 11a에 나타낸 바와 같이, 제1 고정화 영역(1102), 제1 바코드 영역(1103) 및 제1 서열결정 프라이머 영역(1104)을 포함하는 제1 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(1101)을 합성한다. 동시에, 도 11b에 나타낸 바와 같이, 제2 고정화 영역(1132), 제2 바코드 영역(1133) 및 제2 서열결정 프라이머 영역(1134)을 포함하는 제2 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(1131)을 합성한다. 일부 경우, 바코드 영역(1103 및 1133)은 동일한 서열의 바코드 영역이다. 다른 경우, 바코드 영역(1103 및 1133)은 상이한 서열 또는 부분적으로 상이한 서열의 바코드 영역이다.
합성 후, 단일 가닥 어댑터-바코드 폴리뉴클레오티드(1101(도 11a) 및 1131(도 11b))를 동시에 유중수 에멀션 중의 수성 소적 내로 희석한다. 상기 소적은 비대칭 PCR에 의한 단일 가닥 어댑터-바코드 폴리뉴클레오티드(1101(도 11a) 및 1131(도 11b))의 증폭을 위한 시약(예를 들면, 중합효소, 프라이머, dNTP, 완충제, 염) 및 DNA 인터칼레이팅 염료(예를 들면, 에티듐 브로마이드)도 포함한다. 역방향 프라이머는 정방향 프라이머를 초과하여 존재하거나 정방향 프라이머는 역방향 프라이머를 초과하여 존재하므로, 비대칭 증폭이 가능하다. 이중 가닥 생성물(1105(도 11a) 및 1135(도 11b))을 생성하는 기하급수적 증폭기(1110) 및 단일 가닥 생성물(1106(도 11a) 및 1136(도 11b))을 생성하는 선형 증폭기(1111)를 통해 폴리뉴클레오티드(1101(도 11a) 및 1131(도 11b))가 증폭되고 반응이 진행된다.
소적을 형광 보조 세포 분류기(FACS)(1112) 상에서 분류하여 증폭된 폴리뉴클레오티드를 포함하는 소적을 수집한다.
그 다음, 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(1106 및 1136) 소적을 포함하는 소적에 대해 계면 중합을 수행하여 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열들 중 하나(1106 또는 1136)를 각각 포함하는 2종의 캡슐(1120(도 11a) 및 1150(도 11b))을 생성한다.
2개의 혼합물들을 제조한다. 혼합물 Z1은 표적 폴리뉴클레오티드(즉, 단편화되고 바코딩될 폴리뉴클레오티드)(1170) 및 단편화효소(예를 들면, NEBNEXT DSDNA FRAGMENTASE)를 포함한다. 제2 혼합물 Z2는 전술한 바와 같이 생성된 캡슐(1120 및 1180), 및 단편화효소를 활성화시키기에 충분한 농도의 염화마그네슘을 포함한다. 혼합물 Z1, Z2, 또는 Z1 및 Z2 둘 다가 T4 중합효소, Taq 중합효소 및 열안정성 결찰효소도 포함한다.
혼합물 Z1과 Z2를 조합하고, 캡슐 내의 캡슐을 본 개시내용의 다른 부분에 기재된 방법, 예컨대, 플로우 포커싱에 따라 형성한다. 도 11c는 전술한 방법에 따라 생성된 캡슐 내의 캡슐을 예시한다. 외부 캡슐(1160)은 캡슐(1120 및 1150) 및 매질(1190)을 포함한다. 따라서, 캡슐(1120 및 1150)은 각각 다수의 카피의 단일 가닥 어댑터-바코드 폴리뉴클레오티드(1106 및 1136)를 포함하고, 바코드(1103 및 1133)를 구획 내의 폴리뉴클레오티드, 예컨대, 외부 캡슐(1160)의 매질(1190) 내의 표적 폴리뉴클레오티드(1170)에 부착시키는 데 사용될 수 있다.
매질(1190)은 전술한 혼합물 Z1 및 Z2의 내용물을 함유한다. 보다 구체적으로, 매질(1190)은 표적 폴리뉴클레오티드(1170), 및 단편화효소, T4 중합효소, Taq 중합효소, 열안정성 결찰효소, 염화마그네슘 및 적절한 완충제를 포함하는 효소 혼합물(1180)을 포함한다.
캡슐 내의 캡슐을 생성하고 캡슐 내의 캡슐을 적절한 조건에 노출시킬 때, 효소는 표적 폴리뉴클레오티드를 프로세싱한다. 보다 구체적으로, 단편화효소는 표적 폴리뉴클레오티드를 단편화하고, T4 중합효소는 단편화된 표적 폴리뉴클레오티드의 말단을 블런트 말단으로 만든다. 그 다음, 단편화효소 및 T4 중합효소를 열 불활성화시키고 자극을 사용하여 캡슐(1120 및 1150)을 파열시켜 그들의 내용물을 외부 캡슐(1160)의 매질(1190) 내로 방출시킨다. Taq 중합효소는 3'-A 돌출부를 단편화된 블런트 말단 표적 폴리뉴클레오티드에 추가한다. 단일 가닥 어댑터-바코드 폴리뉴클레오티드(1106)는 단일 가닥 어댑터-바코드 폴리뉴클레오티드(1136)와 혼성화하여, 단편화된 표적 폴리뉴클레오티드 상의 3'-A 돌출부(표시되어 있지 않음)와 상용가능한 3'-T 돌출부를 갖는, 바코드 영역(1103 및 1133)을 포함하는 분기형 어댑터를 형성한다. 열안정성 결찰효소는 분기형 어댑터를 단편화된 표적 폴리뉴클레오티드에 결찰시켜 바코딩된 표적 폴리뉴클레오티드를 생성한다. 그 다음, 외부 캡슐(1160)을 파열시키고 모든 외부 캡슐들로부터 샘플을 모으고 표적 폴리뉴클레오티드를 서열결정한다.
더욱이, 전술한 실시예가 열안정성 결찰효소를 사용하여 바코드 서열을 포함하는 분기형 어댑터를 표적 폴리뉴클레오티드에 부착시키지만, 본 개시내용의 다른 부분에 기재된 바와 같이 PCR을 이용하여 이 단계를 달성할 수도 있다.
실시예
8:
비드
에멀션
PCR
및 부분적으로 상보적인 보편적 서열의 첨가에 의한 바코드 서열을 포함하는 분기형 어댑터의 생성
도 14a에 나타낸 바와 같이, 제1 고정화 영역(1402), 바코드 영역(1403) 및 제1 서열결정 프라이머 영역(1404)을 포함하는 단일 가닥 어댑터-바코드 서열(1401)을 합성한다. 합성 후, 각각의 소적이 평균 1개의 폴리뉴클레오티드를 포함하도록 단일 가닥 어댑터-바코드 서열(1401)을 유중수 에멀션 중의 수성 소적 내로 희석한다. 상기 소적은 제1 서열결정 프라이머 영역(1404)에 포함된 서열에 상보적인 하나 이상의 카피의 RNA 프라이머(1406)에 광불안정성 링커를 통해 연결된 제1 비드(1405); 제1 고정화 영역(1402)에 포함된 서열에 상보적인 DNA 프라이머(표시되어 있지 않음); 및 단일 가닥 어댑터-바코드 서열(1401)의 증폭에 필요한 시약(예를 들면, 중합효소, dNTP, 완충제, 염)도 포함한다. 폴리뉴클레오티드를 증폭함으로써(1407), 제1 비드(1405)에 부착되어 구조체(1420)를 형성하는 이중 가닥 생성물(1408)을 용액 상태(표시되어 있지 않음)로 생성한다.
그 다음, 에멀션을 파괴하고 에멀션 성분을 모아 생성물 혼합물을 형성한다. 그 다음, 도 14b에 나타낸 바와 같이, 유리된 비드를 적절한 매질로 수회 (원심분리를 통해) 세척하고(1409) 수산화나트륨(NaOH)으로 처리하여(1410) 제1 비드(1405)에 부착된 이중 가닥 생성물을 변성시킨 후 더 세척한다(1411). 구조체(1420)의 변성(1410) 및 세척(1411) 후, 생성된 구조체(1430)는 상보적인 고정화 영역(1413), 상보적인 바코드 영역(1414) 및 상보적인 서열결정 프라이머 영역(1415)을 포함하는, 단일 가닥 어댑터-바코드 서열(1401)에 대한 단일 가닥 상보체(1412)를 포함한다. 나타낸 바와 같이, 상보적인 서열결정 프라이머 영역(1415)은 RNA 프라이머(1406)를 포함한다. 그 다음, 구조체(1430)를 적절한 매질에 재현탁한다.
다음으로, 도 14c에 나타낸 바와 같이, 상보적인 고정화 영역(1413)에 상보적인 하나 이상의 카피의 DNA 폴리뉴클레오티드(1417)를 포함하는 제2 비드(1416)를 매질에 첨가한다. 제2 비드(1416)는 단일 가닥 상보체(1412)의 상보적인 DNA 폴리뉴클레오티드(1417) 및 상보적인 고정화 영역(1413)을 통해 단일 가닥 상보체(1412)에 결합한다. 이로써 상기 단일 가닥 상보체는 한 말단에서 제1 비드(1405)에 결합되고 그의 다른 말단에서 제2 비드(1416)에 결합되어 구조체(1440)를 형성한다.
그 다음, 도 14d에 나타낸 바와 같이, 글리세롤 구배를 이용하여 구조체(1440)를 원심분리하여(1418) 구조체(1440)에 포함되지 않는 구조체(1430)로부터 구조체(1440)를 분리한다. 제2 비드(1416)가 자기 비드인 경우, 자기 분리를 대안적 방법으로서 이용할 수 있다. 그 다음, 생성물을 NaOH로 처리하여(1419) 제2 비드(1416)로부터 단일 가닥 상보체(1412)를 변성시킴으로써 구조체(1430)를 재생시킨다. 그 다음, (원심분리를 통해) 구조체(1430)를 수회 세척하여 제2 비드(1416)를 제거한다. 구조체(1430)에 부착된 단일 가닥 상보체(1412)는 단일 가닥 바코드 어댑터를 나타낸다.
도 14e에 나타낸 바와 같이, 단일 가닥 상보체(1412)를 사용하여 분기형 어댑터를 생성할 수 있다. 분기형 어댑터(1450)를 생성하기 위해, 광을 이용하여 구조체(1430)로부터 단일 가닥 상보체(1412)를 방출시킨(1424) 후 상보적인 보편적 서열(1426)과 조합하거나(1425), 먼저 상보적인 보편적 서열(1426)과 조합한(1425) 후 구조체(1430)로부터 방출시킨다(1424). 결찰가능한 말단을 생성하기 위해, RNAase H를 사용하여 단일 가닥 상보체(1412)의 RNA 프라이머(1406)를 분해하고, II형 제한효소를 사용하여 상보적인 보편적 서열(1426) 상에서 단일 염기 T 돌출부를 생성한다. T 돌출부는 서열결정될 폴리뉴클레오티드 표적 상의 A 돌출부(표시되어 있지 않음)와 상용가능하다.
실시예 9: 비드 에멀션 PCR 및 부분적으로 상보적인 보편적 서열의 첨가에 의한 바코드 서열을 포함하는 분기형 어댑터의 생성
도 15a에 나타낸 바와 같이, 제1 고정화 영역(1502), 바코드 영역(1503) 및 제1 서열결정 프라이머 영역(1504)을 포함하는 단일 가닥 어댑터-바코드 서열(1501)을 합성한다. 합성 후, 각각의 소적이 평균 1개의 폴리뉴클레오티드를 포함하도록 단일 가닥 어댑터-바코드 서열(1501)을 유중수 에멀션 중의 수성 소적 내로 희석한다. 상기 소적은 제1 고정화 영역(1502)에 포함된 서열에 상보적인 하나 이상의 카피의 RNA 프라이머(1506)에 광불안정성 링커를 통해 연결된 제1 비드(1505); 제1 서열결정 프라이머 영역(1502)에 포함된 서열(표시되어 있지 않음)에 상보적인 DNA 프라이머; 및 단일 가닥 어댑터-바코드 서열(1501)의 증폭에 필요한 시약(예를 들면, 중합효소, dNTP, 완충제, 염)도 포함한다. 폴리뉴클레오티드를 증폭함으로써(1507), 제1 비드(1505)에 부착되어 구조체(1520)를 형성하는 이중 가닥 생성물(1508)을 용액 상태(표시되어 있지 않음)로 생성한다.
그 다음, 에멀션을 파괴하고 에멀션 성분을 모아 생성물 혼합물을 형성한다. 그 다음, 도 15b에 나타낸 바와 같이, (원심분리를 통해) 적절한 매질로 유리된 비드를 수회 세척하고(1509) 수산화나트륨(NaOH)으로 처리하여(1510) 제1 비드(1505)에 부착된 이중 가닥 생성물을 변성시킨 후 더 세척한다(1511). 구조체(1520)의 변성(1510) 및 세척(1511) 후, 생성된 구조체(1530)는 상보적인 고정화 영역(1513), 상보적인 바코드 영역(1514) 및 상보적인 서열결정 프라이머 영역(1515)을 포함하는, 단일 가닥 어댑터-바코드 서열(1501)에 대한 단일 가닥 상보체(1512)를 포함한다. 나타낸 바와 같이, 상보적인 서열결정 프라이머 영역(1515)은 RNA 프라이머(1506)를 포함한다. 그 다음, 구조체(1530)를 적절한 매질에 재현탁한다.
다음으로, 도 15c에 나타낸 바와 같이, 상보적인 서열결정 프라이머 영역(1515)에 상보적인 하나 이상의 카피의 DNA 폴리뉴클레오티드(1517)를 포함하는 제2 비드(1516)를 매질에 첨가한다. 제2 비드(1516)는 단일 가닥 상보체(1512)의 상보적인 DNA 폴리뉴클레오티드(1517) 및 상보적인 서열결정 프라이머 영역(1515)을 통해 단일 가닥 상보체(1512)에 결합한다. 이로써 상기 단일 가닥 상보체는 한 말단에서 제1 비드(1505)에 결합되고 그의 다른 말단에서 제2 비드(1516)에 결합되어 구조체(1540)를 형성한다.
그 다음, 도 15d에 나타낸 바와 같이, 글리세롤 구배를 이용하여 구조체(1540)를 원심분리하여(1518) 구조체(1540)에 포함되지 않는 구조체(1530)로부터 구조체(1540)를 분리한다. 제2 비드(1516)가 자기 비드인 경우, 자기 분리를 대안적 방법으로서 이용할 수 있다. 그 다음, 생성물을 NaOH로 처리하여(1519) 제2 비드(1516)로부터 단일 가닥 상보체(1512)를 변성시킴으로써 구조체(1530)를 재생시킨다. 그 다음, (원심분리를 통해) 구조체(1530)를 수회 세척하여 제2 비드(1516)를 제거한다. 구조체(1530)에 부착된 단일 가닥 상보체(1512)는 단일 가닥 바코드 어댑터를 나타낸다.
도 15e에 나타낸 바와 같이, 단일 가닥 상보체(1512)를 사용하여 분기형 어댑터를 생성할 수 있다. 분기형 어댑터(1550)를 생성하기 위해, 임의적으로 광을 이용하여 구조체(1530)로부터 단일 가닥 상보체(1512)를 방출시킨(1512) 후 상보적인 보편적 서열(1526)과 조합한다(1525). 결찰가능한 말단을 생성하기 위해, II형 제한효소를 사용하여 상보적인 보편적 서열(1526) 상에서 단일 염기 T 돌출부를 생성한다. 상기 T 돌출부는 서열결정될 폴리뉴클레오티드 표적 상의 A 돌출부(표시되어 있지 않음)와 상용가능하다.
실시예 10: 비드 에멀션 PCR에 의한 분기형 어댑터 주형 바코드 서열의 생성 및 이로부터 유도된 어댑터
도 16에 나타낸 바와 같이, 자기 비드(1601)-결합된 단일 가닥 어댑터-바코드 서열(1602)을 포함하는 구조체(1600)를 실시예 8 또는 실시예 9에 기재된 방법, 또는 본원에 기재된 임의의 다른 방법에 따라 생성한다. 다음으로, 구조체(1600)를 본원에 기재된 방법, 예를 들면, 계면 중합으로 캡슐(또는 대안적으로 또 다른 에멀션)(1620) 내로 분할한다. 캡슐(1620)은 비대칭 PCR에 의한 단일 가닥 어댑터-바코드 서열(1602)의 증폭을 위한 시약(예를 들면, 중합효소, 프라이머, dNTP, 완충제, 염)도 포함한다. 역방향 프라이머는 정방향 프라이머를 초과하여 존재하거나 정방향 프라이머는 역방향 프라이머를 초과하여 존재하므로, 비대칭 증폭이 가능하다. 단일 가닥 바코드 어댑터-주형(1602)에 상보적인 단일 가닥 어댑터 생성물(1605)을 생성하는 선형 증폭기(1604)를 통해 단일 가닥 어댑터-바코드 서열(1602)이 증폭되고(1603) 반응이 진행된다. 이 연접부에서 캡슐(1620)은 용액 상태의 단일 가닥 어댑터(1605) 및 자기 비드(1601)-결합된 단일 가닥 어댑터-바코드 서열(1602) 둘 다를 포함한다. 그 다음, 자기 분리(1606)로 비드(및 이로써 주형(1602) 및 단일 가닥 어댑터(1605))를 포함하지 않는 캡슐로부터 캡슐(1620)을 분리한다. 그 다음, 실시예 9에 기재된 바와 같이 캡슐(1620)을 파열시키고 분기형 어댑터를 생성할 수 있다.
실시예
11:
비드
에멀션
PCR을
이용한
바코딩
및 단편화효소를 사용한 단편화
도 17에 나타낸 바와 같이, 자기 비드(1701)-결합된 단일 가닥 어댑터-바코드 서열(1702)을 포함하는 구조체(1700)를 실시예 8 또는 실시예 9에 기재된 방법, 또는 본원에 기재된 임의의 다른 방법에 따라 생성한다. 구조체(1700)를 포함하는 소적에 대해 계면 중합을 수행하여, 광불안정성 링커를 통해 비드(1701)에 부착된 단일 가닥 어댑터-바코드 서열(1702)을 포함하는 캡슐(1704)을 생성한다.
2개의 혼합물들을 제조한다. 혼합물 Z1은 표적 폴리뉴클레오티드(즉, 단편화되고 바코딩될 폴리뉴클레오티드), 단편화효소(예를 들면, NEBNEXT DSDNA FRAGMENTASE) 및 부분적으로 상보적인 보편적 서열을 포함한다. 제2 혼합물 Z2는 전술한 바와 같이 생성된 캡슐(1704), 및 단편화효소를 활성화시키기에 충분한 농도의 염화마그네슘을 포함한다. 혼합물 Z1, Z2, 또는 Z1 및 Z2 둘 다가 T4 중합효소, Taq 중합효소 및 열안정성 결찰효소도 포함한다.
혼합물 Z1과 Z2를 조합하고, 캡슐 내의 캡슐을 본 개시내용의 다른 부분에 기재된 방법, 예컨대, 플로우 포커싱에 따라 형성한다. 도 17은 전술한 방법에 따라 생성된 캡슐 내의 캡슐을 예시한다. 외부 캡슐(1703)은 내부 캡슐(1704) 및 매질(1705)을 포함한다. 내부 캡슐(1704)은 캡슐화된 비드-결합된 단일 가닥 바코드 어댑터의 라이브러리의 한 구성원이다. 따라서, 내부 캡슐(1704)은 자유 단일 가닥 어댑터-바코드 서열(1702)을 생성하고 상기 바코드 어댑터를 구획, 예컨대, 외부 캡슐(1703) 내의 폴리뉴클레오티드에 부착시키는 데 사용될 수 있는 다수의 카피의 구조체(1700)를 포함한다.
매질(1705)은 전술한 혼합물 Z1 및 Z2의 내용물을 함유한다. 보다 구체적으로, 매질(1705)은 표적 폴리뉴클레오티드(1706), 부분적으로 상보적인 보편적 서열(1707), 및 단편화효소, T4 중합효소, Taq 중합효소, 열안정성 결찰효소, 염화마그네슘 및 적절한 완충제를 포함하는 효소 혼합물(1708)을 포함한다.
캡슐 내의 캡슐을 생성하고 캡슐 내의 캡슐을 적절한 조건에 노출시킬 때, 효소는 표적 폴리뉴클레오티드를 프로세싱한다. 보다 구체적으로, 단편화효소는 표적 폴리뉴클레오티드를 단편화하고, T4 중합효소는 단편화된 표적 폴리뉴클레오티드의 말단을 블런트 말단으로 만든다. 그 다음, 단편화효소 및 T4 중합효소를 열 불활성화시키고 자극을 사용하여 내부 캡슐(1704)을 파열시켜 그의 내용물을 외부 캡슐(1703) 내로 방출시킨다. Taq 중합효소는 3'-A 돌출부를 단편화된 블런트 말단 표적 폴리뉴클레오티드에 추가한다. 단일 가닥 어댑터-바코드 서열(1702)은 부분적으로 상보적인 보편적 서열(1707)과 혼성화하고 광에 의해 비드로부터 방출되어, 단편화된 표적 폴리뉴클레오티드 상의 3'-A 돌출부와 상용가능한 3'-T 돌출부를 갖는 분기형 어댑터를 형성한다. 열안정성 결찰효소는 분기형 어댑터를 단편화된 표적 폴리뉴클레오티드에 결찰시켜 바코딩된 표적 폴리뉴클레오티드를 생성한다. 그 다음, 외부 캡슐(1703)을 파열시키고 모든 외부 캡슐들로부터 샘플을 모으고 표적 폴리뉴클레오티드를 서열결정한다. 서열결정 전 필요에 따라 추가 제조 단계(예를 들면, 벌크 증폭, 크기 선택 등)를 수행할 수 있다.
일부 경우, Z1은 다수의 버전의 부분적으로 상보적인 보편적 서열(1707)을 포함할 수 있다. 나아가, 본 실시예는 열안정성 결찰효소의 사용에 의한 표적 폴리뉴클레오티드의 바코딩을 입증하지만, PCR을 이용하여 이 단계를 달성할 수도 있다.
실시예
12:
비드
에멀션
PCR을
이용한
바코딩
및 초음파처리에 의한 단편화
도 18에 나타낸 바와 같이, 자기 비드(1801)-결합된 단일 가닥 어댑터-바코드 서열(1802)을 포함하는 구조체(1800)를 실시예 8 또는 실시예 9에 기재된 방법, 또는 본원에 기재된 임의의 다른 방법에 따라 생성한다. 구조체(1800)를 포함하는 소적에 대해 계면 중합을 수행하여 광불안정성 링커를 통해 비드(1801)에 부착된 단일 가닥 어댑터-바코드 서열(1802)을 포함하는 캡슐(1803)을 생성한다. 표적 폴리뉴클레오티드(즉, 단편화될 폴리뉴클레오티드)를 캡슐(1804) 내로 분할한다. 표적 폴리뉴클레오티드를 포함하는 캡슐(1804)은 초음파 스트레스를 견디도록 구성된다. 표적 폴리뉴클레오티드를 포함하는 캡슐(1804)을 초음파 스트레스(예를 들면, 코바리스 집속 초음파처리기)에 노출시키고 표적 폴리뉴클레오티드를 단편화하여 단편화된 표적 폴리뉴클레오티드 캡슐을 생성한다.
캡슐(1803), 단편화된 표적 폴리뉴클레오티드 캡슐(1804), 부분적으로 상보적인 보편적 서열(1805), 효소 혼합물(T4 중합효소, Taq 중합효소 및 열안정성 결찰효소)(1806) 및 적절한 완충제를 포함하는 혼합물 Z1을 제조한다. 캡슐 내의 캡슐을 본 개시내용의 다른 부분에 기재된 방법, 예컨대, 플로우 포커싱에 따라 생성한다.
도 18은 전술한 방법에 따라 생성된 캡슐 내의 캡슐을 예시한다. 외부 캡슐(1807)은 캡슐들(1803 및 1804) 및 매질(1808)을 포함한다. 내부 캡슐들(1803 및 1804)은 각각 구조체(1800)를 포함하는 캡슐, 및 단편화된 표적 폴리뉴클레오티드(1809)를 포함하는 캡슐을 포함한다. 내부 캡슐(1803)은 자유 단일 가닥 바코드 어댑터(1802)를 생성하고 상기 바코드 어댑터를 구획 내의 폴리뉴클레오티드, 예컨대, 내부 캡슐(1804)에 함유된 단편화된 폴리뉴클레오티드(1809)에 부착시키는 데 사용될 수 있는 다수의 카피의 구조체(1800)를 포함한다.
매질(1808)은 전술한 혼합물 Z1의 내용물을 함유한다. 보다 구체적으로, 매질(1808)은 부분적으로 상보적인 보편적 서열(1805), 효소 혼합물(T4 중합효소, Taq 중합효소 및 열안정성 결찰효소)(1806) 및 적절한 완충제를 포함한다.
단편화된 표적 폴리뉴클레오티드(1809)를 포함하는 내부 캡슐(1804)을 자극에 노출시켜 이 캡슐을 파열시키고 그의 내용물을 외부 캡슐(1807)의 내용물 내로 방출시킨다. T4 중합효소는 단편화된 표적 폴리뉴클레오티드의 말단을 블런트 말단으로 만들고; Taq 중합효소는 3'-A 돌출부를 단편화된 블런트 말단 표적 폴리뉴클레오티드에 추가한다. 그 다음, T4 중합효소 및 Taq 중합효소를 열 불활성화시키고 자극을 가하여 내부 캡슐(1803)의 내용물을 외부 캡슐(1807) 내로 방출시킨다. 단일 가닥 어댑터-바코드 서열(1802)은 부분적으로 상보적인 보편적 서열(1805)과 혼성화하고 광을 이용하여 비드로부터 어댑터를 방출시켜 단편화된 표적 폴리뉴클레오티드 상의 3'-A 돌출부와 상용가능한 3'-T 돌출부를 갖는 분기형 어댑터를 형성한다. 열안정성 결찰효소는 분기형 어댑터를 단편화된 표적 폴리뉴클레오티드에 결찰시켜 바코딩된 표적 폴리뉴클레오티드를 생성한다. 그 다음, 외부 캡슐(1807)을 파열시키고 모든 외부 캡슐들로부터 샘플을 모으고 표적 폴리뉴클레오티드를 서열결정한다.
일부 경우, Z1은 다수의 버전의 부분적으로 상보적인 보편적 서열(1807)을 포함할 수 있다. 나아가, 본 실시예는 열안정성 결찰효소의 사용에 의한 표적 폴리뉴클레오티드의 바코딩을 입증하지만, PCR을 이용하여 이 단계를 달성할 수도 있다.
실시예
13: 다중
어닐링
및
루핑에 기초한
증폭(
MALBAC
)을 이용한
바코딩
도 19a에 나타낸 바와 같이, 서열 번호 22를 포함하는 프라이머를 제조한다. 상기 프라이머는 바코드 영역("바코드"로 표시됨), 프라이머 서열결정 영역("PrimingSeq"로 표시됨), 및 A, T, C 또는 G의 임의의 조합물을 포함할 수 있는 8-뉴클레오티드 가변 영역("NNNNNNNN"로 표시됨)을 포함한다. 도 19에 나타낸 프라이머를, 구획(예를 들면, 캡슐, 에멀션의 소적 등) 내로의 가닥 이탈 활성을 보유하는 중합효소(예를 들면, Vent, exo + DeepVent, exo - DeepVent)와 함께 (도 19에서 루프로 표시된) 표적 폴리뉴클레오티드와 조합한다. 일부 경우, 비-가닥 이탈 중합효소(예를 들면, Taq, PfuUltra)를 사용한다. 그 다음, 구획에 대해 MALBAC 증폭을 수행한다. 적절한 MALBAC 순환 조건은 공지되어 있고, 예를 들면, 전체로서 본원에 참고로 도입되는 문헌(Zong et al., Science, 338(6114), 1622-1626 (2012))에 기재되어 있다.
루핑된 MALBAC 생성물을 도 19b에 나타낸 바와 같이 서열 번호 23으로서 생성한다. 루핑된 MALBAC 생성물은 도 19a에 나타낸 원래의 프라이머, 루프 내에 배향된 바코딩될 표적 폴리뉴클레오티드, 및 원래의 프라이머 서열에 상보적이고 혼성화되는 영역을 포함한다. 구획을 파괴하고 내용물을 회수한다. 일부 경우, 복수의 구획들을 생성한다. 구획들을 총체적으로 파괴하고 각각의 내용물을 회수한 후 모은다.
다음으로, 도 19b에 나타낸 생성된 MALBAC 생성물을 제한효소(예를 들면, BfuCl 또는 유사한 효소)로 처리하여 MALBAC 생성물 상에서 4-염기쌍 돌출부(이 경우, 이탤릭체로 나타낸 GATC)를 생성한다. 이 구조체는 서열 번호 24로 표시되고 도 19c에 나타나 있다. 도 19d에서 서열 번호 25로서 나타낸 분기형 어댑터는 MALBAC 생성물 상에서 생성된 돌출부에 상보적인 돌출부(이 경우, 굵은 글자체로 나타낸 CTAG)를 포함한다. 분기형 어댑터는 도 19c의 MALBAC 생성물과 혼합되고 상보적인 영역들이 혼성화한다. 열안정성 결찰효소를 사용하여 분기형 어댑터와 MALBAC 생성물을 함께 결찰시켜 도 19e에서 서열 번호 26으로서 나타낸 원하는 구조체를 형성한다. 추가 증폭 방법(예를 들면, PCR)을 이용하여 추가 영역(예를 들면, 고정화 영역, 추가 바코드 등)을 분기형 어댑터에 추가할 수 있다.
일부 경우, 다른 염기쌍 돌출부들(예를 들면, 1 염기쌍 돌출부 내지 10 염기쌍 돌출부)이 요구될 수 있다. 원하는 경우, 본원에 기재된 제한효소를 포함하는, 이들 돌출부들을 생성하는 데 사용되는 제한효소를 대체물로서 사용할 수 있다. 한 예에서, TaqαI을 사용하여 MALBAC 생성물 상에서 2 염기쌍 돌출부를 생성한다.
대안으로서, 도 19a에 나타낸 프라이머는 RNA 프라이머 서열이 바코드 영역의 5'에 배치되어 RNAase가 돌출부를 생성하는 데 사용되도록 디자인될 수 있다. 도 19f에 나타낸 바와 같이, MALBAC 생성물(1900)은 바코드 영역(1902)의 5'에 배치된 RNA 프라이머 서열(1901)을 포함한다. MALBAC 생성물(1900)은 서열결정 프라이머 영역(1903), 표적 폴리뉴클레오티드(1904), 상보적인 서열결정 프라이머 영역(1905), 상보적인 바코드 영역(1906), 및 RNA 프라이머 서열(1901)에 상보적인 영역(1907)도 포함한다. MALBAC 생성물(1900)을 RNAse H(1908)로 처리하고, RNA 프라이머 영역 서열(1901)을 분해하여 MALBAC 생성물(1900) 상에서 2 내지 6 염기쌍 돌출부(1909)를 생성함으로써 구조체(1920)를 제공한다. 그 다음, 구조체(1920) 상의 돌출부에 상보적인 영역을 포함하는 상보적인 보편적 영역(1910)을 구조체(1920)에 첨가한다. 그 다음, 상보적인 보편적 영역(1910)은 구조체(1920)와 혼성화하고, 열안정성 결찰효소를 사용하여 상보적인 보편적 영역(1910)을 구조체(1920)에 결찰시킨다.
실시예
14: 다중
어닐링
및
루핑에 기초한
증폭(
MALBAC
)을 이용한
바코딩
도 20에 나타낸 바와 같이, 예를 들면, 계면 중합 또는 본원에 기재된 임의의 다른 방법을 이용하여 바코드 영역을 포함하는 주형(2000)을 PCR에 필요한 물질(2001)과 캡슐(2002) 내로 조합한다. PCR을 이용하여 주형(2000)으로부터 MALBAC 프라이머를 생성한다. 다음으로, 캡슐(2000)을, 바코딩될 표적 폴리뉴클레오티드(2005) 및 MALBAC 증폭에 필요한 시약(2006)(예를 들면, DeepVent 중합효소, dNTP, 완충제)을 포함하는 혼합물(2004)도 포함하는 외부 캡슐(2003) 내로 캡슐화한다. 캡슐(2002)을 파열시키도록 디자인된 자극에 캡슐(2002)을 적절히 노출시킬 때 캡슐(2002)이 파괴되고, 캡슐(2002)의 내용물이 혼합물(2004)의 내용물과 혼합된다. 표적 폴리뉴클레오티드(2005)의 MALBAC 증폭이 시작되어 도 19f에서 1900으로서 나타낸 생성물로서 기재된 생성물과 유사한 MALBAC 생성물을 생성한다.
그 다음, 외부 캡슐(2003)을 적절한 자극으로 파괴하고 내용물을 회수한다. 그 다음, MALBAC 생성물을 적절한 제한효소로 처리하고 실시예 13에 기재된 바와 같은 물질로 분기형 어댑터에 커플링시킨다. 그 다음, 필요에 따라 추가 다운스트림 제조 단계(예를 들면, 벌크 증폭, 크기 선택 등)를 수행한다.
실시예
15: 다중
어닐링
및
루핑에 기초한
증폭(
MALBAC
)을 이용한
바코딩
도 21a에 나타낸 바와 같이, MALBAC 프라이머(2100)를 제조한다. MALBAC 프라이머(2100)는 서열 프라이밍 영역(2101) 및 8-뉴클레오티드 가변 영역(1902)을 포함한다. 프라이머(2100)를, 구획(예를 들면, 캡슐, 에멀션 등) 내로의 가닥 이탈 활성을 보유하는 중합효소(예를 들면, Vent, exo + DeepVent, exo - DeepVent)와 함께 표적 폴리뉴클레오티드(2103)와 조합한다. 일부 경우, 비-가닥 이탈 중합효소(예를 들면, Taq, PfuUltra)를 사용한다. 그 다음, 구획에 대해 MALBAC 증폭(2104)을 수행한다.
루핑된 MALBAC 생성물(2110)이 생성되고 서열 프라이밍 영역(2101), 표적 폴리뉴클레오티드(2103) 및 상보적인 서열 프라이밍 영역(2105)을 포함한다. 그 다음, 도 21b에서 선형 형태(2120)로 나타낸 MALBAC 생성물(2110)을, 서열결정 프라이머 영역(2106), 바코드 영역(2107) 및 고정화 영역(2108)을 포함하는 또 다른 프라이머(2130)와 접촉시킨다. 비대칭 디지털 PCR을 이용하여 프라이머(2130)를 생성한다. 단일 사이클의 PCR을 이용할 때, 상기 프라이머를 사용하여 프라이머(2130) 및 이로써 바코드 영역(2107)을 포함하는 이중 가닥 생성물(2140)을 생성한다.
그 다음, 이중 가닥 생성물(2140)을 변성시킨 후 도 21c에 나타낸 또 다른 프라이머(2150)와 접촉시킬 수 있다. 프라이머(2150)는 바코드 영역(2109), 서열결정 프라이머 영역(2111) 및 고정화 영역(2112)을 포함한다. 프라이머(2113 및 2114)의 존재 하에서, 추가 라운드의 PCR은 바코드 영역(2109)을 바코드 영역(2107)에 부착된 표적 폴리뉴클레오티드의 말단에 추가할 수 있다. 그 다음, 필요에 따라 추가 다운스트림 제조 단계(예를 들면, 벌크 증폭, 크기 선택 등)를 수행한다.
실시예
16: 다중
어닐링
및
루핑에 기초한
증폭(
MALBAC
)을 이용한
바코딩
도 22에 나타낸 바와 같이, 예를 들면, 계면 중합 또는 본원에 기재된 임의의 다른 방법을 이용하여 바코드 영역을 포함하는 프라이머 주형(2200)을 PCR에 필요한 물질(2201)과 캡슐(2202) 내로 조합한다. 그 다음, PCR을 이용하여 주형(2200)으로부터 프라이머를 생성한다. 다음으로, 캡슐(2200)을, 바코딩될 표적 폴리뉴클레오티드(2205), MALBAC 증폭에 필요한 시약(2206)(예를 들면, DeepVent 중합효소, dNTP, 완충제), 및 (실시예 15에 기재된 MALBAC 프라이머(2100)와 유사하게) 바코드를 포함하지 않는 MALBAC 프라이머(2207)를 포함하는 혼합물(2204)도 포함하는 외부 캡슐(2003) 내로 캡슐화한다. 표적 폴리뉴클레오티드(2205)의 MALBAC 증폭이 시작되어 도 21a에서 2110으로서 나타낸 생성물로서 기재된 생성물과 유사한 MALBAC 생성물을 생성한다. 그 다음, 캡슐(2202)을 파열시키도록 디자인된 자극에 캡슐(2202)을 적절히 노출시킬 때 캡슐(2202)이 파괴되고, 캡슐(2202)의 내용물이 혼합물(2004)의 내용물과 혼합된다. 주형(2200)으로부터 생성된 프라이머를 사용하여 단일 사이클의 PCR을 시작하여 실시예 15에 기재된 바코딩된 생성물과 유사한 바코딩된 생성물을 생성한다.
그 다음, 외부 캡슐(2203)을 적절한 자극으로 파괴하고 내용물을 회수한다. 그 다음, 필요에 따라 추가 다운스트림 제조 단계(예를 들면, 벌크 증폭, 크기 선택, 추가 바코드의 추가 등)를 수행한다.
실시예
17: 전위효소 및
태그멘테이션(Tagmentation)을
이용한
바코딩
도 23에 나타낸 바와 같이, 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(2300)을 실시예 1에 기재된 바와 같이 또는 본 개시내용에 기재된 임의의 다른 방법으로 합성하고 분할하고 증폭하고 분류한다. 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열을 포함하는 소적에 대해 계면 중합을 수행하여 캡슐(2301)을 생성한다.
2개의 혼합물들을 제조한다. 혼합물 Z1은 표적 폴리뉴클레오티드(2302)(즉, 단편화되고 바코딩될 폴리뉴클레오티드), 트랜스포좀(2303) 및 부분적으로 상보적인 보편적 서열(2304)을 포함한다. 제2 혼합물 Z2는 전술한 바와 같이 생성된 캡슐(2301), 및 본원의 다른 부분에 기재된 바와 같이 PCR에 필요한 시약(2305)을 포함한다.
혼합물 Z1과 Z2를 조합하고, 캡슐 내의 캡슐을 본 개시내용의 다른 부분에 기재된 방법, 예컨대, 플로우 포커싱에 따라 형성한다. 도 23은 전술한 방법에 따라 생성된 캡슐 내의 캡슐을 예시한다. 외부 캡슐(2306)은 캡슐(2301) 및 매질(2307)을 포함한다. 캡슐(2301)은 캡슐화된 단일 가닥 어댑터-바코드 폴리뉴클레오티드의 라이브러리의 한 구성원이다. 따라서, 캡슐(2301)은 동일한 바코드를 구획, 예컨대, 외부 캡슐(2306) 내의 폴리뉴클레오티드에 부착시키는 데 사용될 수 있는 다수의 카피의 단일 가닥 어댑터-바코드 폴리뉴클레오티드(2300)를 포함한다.
매질(2307)은 전술한 혼합물 Z1 및 Z2의 내용물을 함유한다. 보다 구체적으로, 매질(2307)은 표적 폴리뉴클레오티드(2302), 부분적으로 상보적인 보편적 서열(2304), 및 PCR에 필요한 시약(2305)(핫 스타트(hot start) Taq를 포함함)을 포함한다.
캡슐 내의 캡슐을 생성하고 캡슐 내의 캡슐을 적절한 조건에 노출시킬 때, 트랜스포좀이 표적 폴리뉴클레오티드를 프로세싱한다. 보다 구체적으로, 전위효소는 태그멘테이션을 통해 표적 폴리뉴클레오티드를 단편화하고 이를 공통된 프라이밍 서열로 태깅한다. 그 다음, 태깅된 표적 폴리뉴클레오티드를 가열하여 전위효소에 의해 생성된 표적 뉴클레오티드 내의 임의의 갭(gap)을 채운다. 그 다음, 전위효소를 열 불활성화시키고 자극을 사용하여 내부 캡슐(2301)을 파열시켜 그의 내용물을 외부 캡슐(2306) 내로 방출시킨다. 외부 캡슐(2306)을 95℃까지 가열하여 핫 스타트 Taq를 활성화시킨다. 반응은 한정된 사이클 PCR에 의해 진행되어 단일 가닥 어댑터-바코드 폴리뉴클레오티드 서열(2300)을 표적 폴리뉴클레오티드(2302)에 추가한다. 그 다음, 외부 캡슐(2306)을 파열시키고 표적 폴리뉴클레오티드를 서열결정한다.
구체적인 실시가 예시되고 기재되어 있지만, 그에 대한 다양한 변형을 만들 수 있고 이러한 변형은 본원에서 예상된다는 것을 상기 설명으로부터 이해해야 한다. 또한, 본 발명은 본 명세서 내에 제공된 특정 실시예에 의해 한정되지 않는다. 본 발명이 전술한 명세서에 대하여 기재되어 있지만, 본원에서 바람직한 실시양태들의 설명 및 예시는 한정 의미로 해석되어서는 안 된다. 나아가, 본 발명의 모든 양태들은 다양한 조건 및 변수에 의존하는 본원에 기재된 특정 묘사, 구성 또는 상대적 비율로 한정되지 않는다는 것을 이해할 것이다. 본 발명의 실시양태들의 형태 및 세부사항 면에서의 다양한 변형이 당업자에게 명확할 것이다. 따라서, 본 발명은 임의의 이러한 변형, 변경 및 등가물도 포괄할 것으로 예상된다. 하기 특허청구범위는 본 발명의 범위를 정의하고, 이 특허청구범위 내의 방법 및 구조체, 및 이들의 등가물이 이 특허청구범위에 의해 포괄된다.
SEQUENCE LISTING
<110> 10X TECHNOLOGIES, INC.
<120> POLYNUCLEOTIDE BARCODE GENERATION
<130> 43487-706.601
<140> PCT/US2014/015427
<141> 2014-02-07
<150> 61/844,804
<151> 2013-07-10
<150> 61/840,403
<151> 2013-06-27
<150> 61/800,223
<151> 2013-03-15
<150> 61/762,435
<151> 2013-02-08
<160> 37
<170> PatentIn version 3.5
<210> 1
<211> 77
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 1
aatgatacgg cgaccaccga gatctacact agatcgcaca ctctttccct acacgacgct 60
cttccgatct gatctaa 77
<210> 2
<211> 66
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 2
gatcggaaga gcacacgtct gaactccagt cacacactct ttccctacac gacgctcttc 60
cgatct 66
<210> 3
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 3
acactctttc cctacacgac gctcttccga tct 33
<210> 4
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 4
gatcggaaga gcacacgtct gaactccagt cac 33
<210> 5
<211> 67
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (33)..(34)
<223> The nucleotides at these positions are separated by an
undisclosed barcoded target polynucleotide sequence
<400> 5
acactctttc cctacacgac gctcttccga tctagatcgg aagagcacac gtctgaactc 60
cagtcac 67
<210> 6
<211> 67
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (33)..(34)
<223> The nucleotides at these positions are separated by an
undisclosed barcoded target polynucleotide sequence
<400> 6
acactctttc cctacacgac gctcttccga tctagatcgg aagagcacac gtctgaactc 60
cagtcac 67
<210> 7
<211> 122
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<220>
<221> misc_feature
<222> (58)..(59)
<223> The nucleotides at these positions are separated by an
undisclosed barcoded target polynucleotide sequence
<400> 7
aatgatacgg cgaccaccga gatctacact ctttccctac acgacgctct tccgatctag 60
atcggaagag cacacgtctg aactccagtc acatcacgat ctcgtatgcc gtcttctgct 120
tg 122
<210> 8
<211> 122
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<220>
<221> misc_feature
<222> (64)..(65)
<223> The nucleotides at these positions are separated by an
undisclosed barcoded target polynucleotide sequence
<400> 8
caagcagaag acggcatacg agatcgtgat gtgactggag ttcagacgtg tgctcttccg 60
atctagatcg gaagagcgtc gtgtagggaa agagtgtaga tctcggtggt cgccgtatca 120
tt 122
<210> 9
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (34)..(41)
<223> a, c, t or g
<400> 9
acactctttc cctacacgac gctcttccga tctnnnnnnn nt 42
<210> 10
<211> 42
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(8)
<223> a, c, t or g
<400> 10
nnnnnnnnag atcggaagag cacacgtctg aactccagtc ac 42
<210> 11
<211> 84
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(8)
<223> a, c, t or g
<220>
<221> modified_base
<222> (76)..(83)
<223> a, c, t or g
<400> 11
nnnnnnnnag atcggaagag cacacgtctg aactccagtc acacactctt tccctacacg 60
acgctcttcc gatctnnnnn nnnt 84
<210> 12
<211> 88
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(12)
<223> a, c, u or g
<220>
<221> modified_base
<222> (14)..(21)
<223> a, c, t or g
<400> 12
nnnnnnnnnn nnannnnnnn nagatcggaa gagcgtcgtg tagggaaaga gtgtgtgact 60
ggagttcaga cgtgtgctct tccgatct 88
<210> 13
<211> 109
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(12)
<223> a, c, u or g
<220>
<221> modified_base
<222> (14)..(21)
<223> a, c, t or g
<220>
<221> modified_base
<222> (89)..(96)
<223> a, c, t or g
<220>
<221> modified_base
<222> (98)..(109)
<223> a, c, t or g
<400> 13
nnnnnnnnnn nnannnnnnn nagatcggaa gagcgtcgtg tagggaaaga gtgtgtgact 60
ggagttcaga cgtgtgctct tccgatctnn nnnnnntnnn nnnnnnnnn 109
<210> 14
<211> 97
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (2)..(9)
<223> a, c, t or g
<220>
<221> modified_base
<222> (77)..(84)
<223> a, c, t or g
<220>
<221> modified_base
<222> (86)..(97)
<223> a, c, t or g
<400> 14
annnnnnnna gatcggaaga gcgtcgtgta gggaaagagt gtgtgactgg agttcagacg 60
tgtgctcttc cgatctnnnn nnnntnnnnn nnnnnnn 97
<210> 15
<211> 96
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (2)..(9)
<223> a, c, t or g
<220>
<221> modified_base
<222> (76)..(83)
<223> a, c, t or g
<220>
<221> modified_base
<222> (85)..(96)
<223> a, c, t or g
<400> 15
annnnnnnng atcggaagag cacacgtctg aactccagtc acacactctt tccctacacg 60
acgctcttcc gatctnnnnn nnntnnnnnn nnnnnn 96
<210> 16
<211> 96
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<223> Description of Combined DNA/RNA Molecule: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(13)
<223> a, c, u or g
<220>
<221> modified_base
<222> (14)..(21)
<223> a, c, t or g
<220>
<221> modified_base
<222> (88)..(95)
<223> a, c, t or g
<400> 16
nnnnnnnnnn nnnnnnnnnn nagatcggaa gagcgtcgtg tagggaaaga gtgtgtgact 60
ggagttcaga cgtgtgctct tccgatcnnn nnnnnt 96
<210> 17
<211> 83
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (1)..(8)
<223> a, c, t or g
<220>
<221> modified_base
<222> (75)..(82)
<223> a, c, t or g
<400> 17
nnnnnnnnag atcggaagag cgtcgtgtag ggaaagagtg tgtgactgga gttcagacgt 60
gtgctcttcc gatcnnnnnn nnt 83
<210> 18
<211> 70
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (30)..(36)
<223> a, c, t or g
<400> 18
aatgatacgg cgaccaccga gatctacacn nnnnnnacac tctttcccta cacgacgctc 60
ttccgatctt 70
<210> 19
<211> 70
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (35)..(41)
<223> a, c, t or g
<400> 19
aagatcggaa gagcgtcgtg tagggaaaga gtgtnnnnnn ngtgtagatc tcggtggtcg 60
ccgtatcatt 70
<210> 20
<211> 56
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (21)..(27)
<223> a, c, t or g
<400> 20
gtcgtgtagg gaaagagtgt nnnnnnngtg tagatctcgg tggtcgccgt atcatt 56
<210> 21
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 21
agatcggaag agcacacgtc tgaactccag tcac 34
<210> 22
<211> 73
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 22
ttagatcaga tcggaagagc acacgtctga actccagtca ctaaggcgaa tctcgtatgc 60
cgtcttctgc ttg 73
<210> 23
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (18)..(19)
<223> The nucleotides at these positions are separated by
undisclosed barcode and primer sequencing regions
<400> 23
acgacgctct tccgatctag atcggaagag cgtcgt 36
<210> 24
<211> 6
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (5)..(6)
<223> The nucleotides at these positions are separated by
undisclosed barcode and primer sequencing regions
<400> 24
gatcta 6
<210> 25
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 25
gatcggaaga gcacacgtct gaactccagt cac 33
<210> 26
<211> 67
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (33)..(34)
<223> The nucleotides at these positions are separated by
undisclosed barcode and primer sequencing regions
<400> 26
acactctttc cctacacgac gctcttccga tctagatcgg aagagcacac gtctgaactc 60
cagtcac 67
<210> 27
<211> 13
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (5)..(9)
<223> a, c, t, g, unknown or other
<400> 27
ggccnnnnng gcc 13
<210> 28
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (4)..(8)
<223> a, c, t, g, unknown or other
<400> 28
caannnnngt gg 12
<210> 29
<211> 14
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (4)..(10)
<223> a, c, t, g, unknown or other
<400> 29
gaannnnnnn ttgg 14
<210> 30
<211> 13
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (5)..(10)
<223> a, c, t, g, unknown or other
<400> 30
gaacnnnnnn tcc 13
<210> 31
<211> 13
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (5)..(10)
<223> a, c, t, g, unknown or other
<400> 31
gaagnnnnnn tac 13
<210> 32
<211> 12
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (5)..(9)
<223> a, c, t, g, unknown or other
<400> 32
gaacnnnnnc tc 12
<210> 33
<211> 13
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> modified_base
<222> (5)..(10)
<223> a, c, t, g, unknown or other
<400> 33
gaacnnnnnn tac 13
<210> 34
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 34
Gly Phe Leu Gly Lys
1 5
<210> 35
<211> 153
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<220>
<221> modified_base
<222> (78)..(80)
<223> a, c, t, g, unknown or other
<400> 35
aatgatacgg cgaccaccga gatctacact agatcgcaca ctctttccct acacgacgct 60
cttccgatct gatctaannn ttagatcaga tcggaagagc acacgtctga actccagtca 120
ctaaggcgaa tctcgtatgc cgtcttctgc ttg 153
<210> 36
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<220>
<221> misc_feature
<222> (18)..(19)
<223> The nucleotides at these positions are separated by
undisclosed barcode and primer sequencing regions
<220>
<221> modified_base
<222> (19)..(26)
<223> a, c, t or g
<400> 36
acgacgctct tccgatctnn nnnnnn 26
<210> 37
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 37
acactctttc cctacacgac gctcttcc 28
Claims (72)
- 복수의 바코드 서열을 포함하는 복수의 핵산 분자를 합성하는 단계;
상기 복수의 핵산 분자를, 복수의 비드를 포함하는 복수의 구획 내로 분리하는 단계로서, 상기 복수의 구획의 각 구획은, 상기 복수의 핵산 분자의 단일 핵산 분자와 상기 복수의 비드의 단일 비드를 포함하는 것인 단계;
상기 구획에서, 상기 단일 핵산 분자에 대해 핵산 증폭을 실시하여, 상기 단일 비드에 부착된 적어도 1,000개의 핵산 분자를 생성하는 단계로서, 상기 적어도 1,000개의 핵산 분자는 상기 복수의 바코드 서열 중 하나의 바코드 서열을 포함하고, 상기 적어도 1,000개의 핵산 분자에 있어서 상기 바코드 서열이 동일한 것인 단계; 및
상기 구획으로부터, 상기 단일 비드에 부착된 상기 적어도 1,000개의 핵산 분자를 회수하는 단계
를 포함하는, 바코드 서열을 포함하는 복수의 핵산 분자를 생성하는 방법. - 제1항에 있어서, 상기 단일 비드가 겔 비드인 방법.
- 제2항에 있어서, 상기 겔 비드가 분해 가능한 겔 비드인 방법.
- 제1항에 있어서, 상기 적어도 1,000개의 핵산 분자가 상기 단일 비드에 방출 가능하게 부착되는 것인 방법.
- 제1항에 있어서, 상기 복수의 바코드 서열이 1,000개의 상이한 바코드 서열을 포함하는 것인 방법.
- 제1항에 있어서, 상기 복수의 바코드 서열이 10,000개의 상이한 바코드 서열을 포함하는 것인 방법.
- 제1항에 있어서, 상기 복수의 바코드 서열이 100,000개의 상이한 바코드 서열을 포함하는 것인 방법.
- 제1항에 있어서, 상기 복수의 바코드 서열이 1,000,000개의 상이한 바코드 서열을 포함하는 것인 방법.
- 제1항에 있어서, 상기 단일 비드에 부착된 상기 적어도 1,000개의 핵산 분자가 적어도 10,000개의 핵산 분자인 방법.
- 제1항에 있어서, 상기 단일 비드에 부착된 상기 적어도 1,000개의 핵산 분자가 적어도 100,000개의 핵산 분자인 방법.
- 제1항에 있어서, 상기 단일 비드에 부착된 상기 적어도 1,000개의 핵산 분자가 적어도 1,000,000개의 핵산 분자인 방법.
- 제1항에 있어서, 상기 단일 비드에 부착된 상기 적어도 1,000개의 핵산 분자가 적어도 10,000,000개의 핵산 분자인 방법.
- 제1항에 있어서, 상기 복수의 핵산 분자의 각각의 핵산 분자가 고정화 서열을 더 포함하고, 상기 복수의 비드가 상기 고정화 서열에 상보적인 서열을 포함하는 핵산 분자에 커플링되어 있는 것인 방법.
- 제13항에 있어서, 상기 복수의 핵산 분자의 각각의 핵산 분자가 표적 핵산 분자에 커플링될 수 있는 어댑터 서열을 더 포함하는 것인 방법.
- 제13항에 있어서, 상기 복수의 핵산 분자의 각각의 핵산 분자가 서열결정 프라이머 서열을 더 포함하는 것인 방법.
- 제1항에 있어서, 상기 복수의 구획이 복수의 웰인 방법.
- 제1항에 있어서, 상기 복수의 구획이 에멀션 중의 복수의 수성 소적(droplets)인 방법.
- 제1항에 있어서, 상기 분리가, 한계 희석을 수행함으로써 희석된 폴리뉴클레오티드를 생성하는 것을 포함하는 것인 방법.
- 제18항에 있어서, 상기 분리가 상기 희석된 폴리뉴클레오티드를 분할하는 것을 더 포함하는 것인 방법.
- 제1항에 있어서, 상기 복수의 구획의 5% 초과가, 그 구획 내에서 유일한, 상기 복수의 핵산 분자의 단일 핵산 분자를 포함하는 것인 방법.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361762435P | 2013-02-08 | 2013-02-08 | |
| US61/762,435 | 2013-02-08 | ||
| US201361800223P | 2013-03-15 | 2013-03-15 | |
| US61/800,223 | 2013-03-15 | ||
| US201361840403P | 2013-06-27 | 2013-06-27 | |
| US61/840,403 | 2013-06-27 | ||
| US201361844804P | 2013-07-10 | 2013-07-10 | |
| US61/844,804 | 2013-07-10 | ||
| PCT/US2014/015427 WO2014124338A1 (en) | 2013-02-08 | 2014-02-07 | Polynucleotide barcode generation |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207035026A Division KR20200140929A (ko) | 2013-02-08 | 2014-02-07 | 폴리뉴클레오티드 바코드 생성 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20150119047A KR20150119047A (ko) | 2015-10-23 |
| KR102190198B1 true KR102190198B1 (ko) | 2020-12-14 |
Family
ID=51297676
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157024531A KR102190198B1 (ko) | 2013-02-08 | 2014-02-07 | 폴리뉴클레오티드 바코드 생성 |
| KR1020227044551A KR20230003659A (ko) | 2013-02-08 | 2014-02-07 | 폴리뉴클레오티드 바코드 생성 |
| KR1020207035026A KR20200140929A (ko) | 2013-02-08 | 2014-02-07 | 폴리뉴클레오티드 바코드 생성 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020227044551A KR20230003659A (ko) | 2013-02-08 | 2014-02-07 | 폴리뉴클레오티드 바코드 생성 |
| KR1020207035026A KR20200140929A (ko) | 2013-02-08 | 2014-02-07 | 폴리뉴클레오티드 바코드 생성 |
Country Status (10)
| Country | Link |
|---|---|
| US (8) | US9388465B2 (ko) |
| EP (4) | EP2954065B1 (ko) |
| JP (4) | JP2016511243A (ko) |
| KR (3) | KR102190198B1 (ko) |
| CN (2) | CN105102697A (ko) |
| AU (1) | AU2014214682B2 (ko) |
| BR (1) | BR112015019159A2 (ko) |
| CA (2) | CA2900481A1 (ko) |
| DK (1) | DK2954065T3 (ko) |
| WO (2) | WO2014124338A1 (ko) |
Families Citing this family (230)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008109176A2 (en) | 2007-03-07 | 2008-09-12 | President And Fellows Of Harvard College | Assays and other reactions involving droplets |
| CN101946010B (zh) | 2007-12-21 | 2014-08-20 | 哈佛大学 | 用于核酸测序的系统和方法 |
| US20110218123A1 (en) | 2008-09-19 | 2011-09-08 | President And Fellows Of Harvard College | Creation of libraries of droplets and related species |
| EP3150724A1 (en) | 2008-12-19 | 2017-04-05 | President and Fellows of Harvard College | Particle-assisted nucleic acid sequencing |
| WO2010104597A2 (en) | 2009-03-13 | 2010-09-16 | President And Fellows Of Harvard College | Scale-up of microfluidic devices |
| US20120211084A1 (en) | 2009-09-02 | 2012-08-23 | President And Fellows Of Harvard College | Multiple emulsions created using jetting and other techniques |
| CA2778816C (en) | 2009-10-27 | 2018-07-31 | President And Fellows Of Harvard College | Droplet creation techniques |
| US8835358B2 (en) | 2009-12-15 | 2014-09-16 | Cellular Research, Inc. | Digital counting of individual molecules by stochastic attachment of diverse labels |
| US9315857B2 (en) | 2009-12-15 | 2016-04-19 | Cellular Research, Inc. | Digital counting of individual molecules by stochastic attachment of diverse label-tags |
| US20140057799A1 (en) | 2010-12-16 | 2014-02-27 | Gigagen | System and Methods for Massively Parallel Analysis of Nucleic Acids in Single Cells |
| GB201106254D0 (en) | 2011-04-13 | 2011-05-25 | Frisen Jonas | Method and product |
| AU2012249759A1 (en) | 2011-04-25 | 2013-11-07 | Bio-Rad Laboratories, Inc. | Methods and compositions for nucleic acid analysis |
| JP6122843B2 (ja) | 2011-05-23 | 2017-04-26 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 多重エマルジョンを含むエマルジョンの制御 |
| US11177020B2 (en) | 2012-02-27 | 2021-11-16 | The University Of North Carolina At Chapel Hill | Methods and uses for molecular tags |
| AU2013226081B2 (en) | 2012-02-27 | 2018-06-14 | Becton, Dickinson And Company | Compositions and kits for molecular counting |
| WO2013134261A1 (en) | 2012-03-05 | 2013-09-12 | President And Fellows Of Harvard College | Systems and methods for epigenetic sequencing |
| US11591637B2 (en) | 2012-08-14 | 2023-02-28 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| US10323279B2 (en) | 2012-08-14 | 2019-06-18 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9388465B2 (en) | 2013-02-08 | 2016-07-12 | 10X Genomics, Inc. | Polynucleotide barcode generation |
| US10584381B2 (en) | 2012-08-14 | 2020-03-10 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9951386B2 (en) | 2014-06-26 | 2018-04-24 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10221442B2 (en) | 2012-08-14 | 2019-03-05 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| CN114891871A (zh) | 2012-08-14 | 2022-08-12 | 10X基因组学有限公司 | 微胶囊组合物及方法 |
| US10273541B2 (en) | 2012-08-14 | 2019-04-30 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10752949B2 (en) | 2012-08-14 | 2020-08-25 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9701998B2 (en) | 2012-12-14 | 2017-07-11 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10533221B2 (en) | 2012-12-14 | 2020-01-14 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| EP3567116A1 (en) | 2012-12-14 | 2019-11-13 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| DK3553175T3 (da) | 2013-03-13 | 2021-08-23 | Illumina Inc | Fremgangsmåde til fremstilling af et nukleinsyresekvenseringsbibliotek |
| DK3013983T3 (da) | 2013-06-25 | 2023-03-06 | Prognosys Biosciences Inc | Spatialt kodede biologiske assays ved brug af en mikrofluidisk anordning |
| KR102402446B1 (ko) | 2013-08-28 | 2022-05-30 | 벡톤 디킨슨 앤드 컴퍼니 | 대량의 동시 단일 세포 분석 |
| US10395758B2 (en) | 2013-08-30 | 2019-08-27 | 10X Genomics, Inc. | Sequencing methods |
| US9582877B2 (en) | 2013-10-07 | 2017-02-28 | Cellular Research, Inc. | Methods and systems for digitally counting features on arrays |
| WO2015069634A1 (en) | 2013-11-08 | 2015-05-14 | President And Fellows Of Harvard College | Microparticles, methods for their preparation and use |
| US9824068B2 (en) | 2013-12-16 | 2017-11-21 | 10X Genomics, Inc. | Methods and apparatus for sorting data |
| US9694361B2 (en) | 2014-04-10 | 2017-07-04 | 10X Genomics, Inc. | Fluidic devices, systems, and methods for encapsulating and partitioning reagents, and applications of same |
| US20150298091A1 (en) | 2014-04-21 | 2015-10-22 | President And Fellows Of Harvard College | Systems and methods for barcoding nucleic acids |
| CN114214314A (zh) | 2014-06-24 | 2022-03-22 | 生物辐射实验室股份有限公司 | 数字式pcr条码化 |
| WO2015200891A1 (en) | 2014-06-26 | 2015-12-30 | 10X Technologies, Inc. | Processes and systems for nucleic acid sequence assembly |
| US10017759B2 (en) | 2014-06-26 | 2018-07-10 | Illumina, Inc. | Library preparation of tagged nucleic acid |
| CN113249435A (zh) | 2014-06-26 | 2021-08-13 | 10X基因组学有限公司 | 分析来自单个细胞或细胞群体的核酸的方法 |
| CA2997906A1 (en) | 2014-09-09 | 2016-03-17 | The Broad Institute, Inc. | A droplet-based method and apparatus for composite single-cell nucleic acid analysis |
| ES2925014T3 (es) * | 2014-09-12 | 2022-10-13 | Univ Leland Stanford Junior | Identificación y uso de ácidos nucleicos circulantes |
| WO2016061517A2 (en) * | 2014-10-17 | 2016-04-21 | Illumina Cambridge Limited | Contiguity preserving transposition |
| BR112017008877A2 (pt) | 2014-10-29 | 2018-07-03 | 10X Genomics Inc | métodos e composições para sequenciamento de ácido nucleico-alvo |
| US10060913B2 (en) | 2016-09-19 | 2018-08-28 | Massachusetts Institute Of Technology | Systems including janus droplets capable of binding an analyte and changing orientation to provide a detectable change |
| US10005058B2 (en) * | 2014-10-31 | 2018-06-26 | Massachusetts Institute Of Technology | Compositions and methods for arranging colloid phases |
| US11119098B2 (en) | 2014-10-31 | 2021-09-14 | Massachusetts Institute Of Technology | Systems including Janus droplets |
| JP6914192B2 (ja) | 2014-10-31 | 2021-08-04 | マサチューセッツ インスティテュート オブ テクノロジー | 乳剤形成のための組成および方法 |
| US9975122B2 (en) | 2014-11-05 | 2018-05-22 | 10X Genomics, Inc. | Instrument systems for integrated sample processing |
| US10900065B2 (en) | 2014-11-14 | 2021-01-26 | University Of Washington | Methods and kits for labeling cellular molecules |
| AU2016207023B2 (en) | 2015-01-12 | 2019-12-05 | 10X Genomics, Inc. | Processes and systems for preparing nucleic acid sequencing libraries and libraries prepared using same |
| CN107209814B (zh) | 2015-01-13 | 2021-10-15 | 10X基因组学有限公司 | 用于使结构变异和相位信息可视化的系统和方法 |
| MX2017010142A (es) | 2015-02-09 | 2017-12-11 | 10X Genomics Inc | Sistemas y metodos para determinar variacion estructural y ajuste de fases con datos de recuperacion de variantes. |
| KR20170135834A (ko) * | 2015-02-10 | 2017-12-08 | 일루미나, 인코포레이티드 | 세포 성분을 분석하기 위한 방법 및 조성물 |
| US20180010176A1 (en) * | 2015-02-13 | 2018-01-11 | Abhijit Ajit Patel | Methods for highly parallel and accurate measurement of nucleic acids |
| WO2016134078A1 (en) | 2015-02-19 | 2016-08-25 | Becton, Dickinson And Company | High-throughput single-cell analysis combining proteomic and genomic information |
| WO2016137973A1 (en) | 2015-02-24 | 2016-09-01 | 10X Genomics Inc | Partition processing methods and systems |
| CN115651972A (zh) | 2015-02-24 | 2023-01-31 | 10X 基因组学有限公司 | 用于靶向核酸序列覆盖的方法 |
| EP3262192B1 (en) | 2015-02-27 | 2020-09-16 | Becton, Dickinson and Company | Spatially addressable molecular barcoding |
| WO2016145416A2 (en) * | 2015-03-11 | 2016-09-15 | The Broad Institute, Inc. | Proteomic analysis with nucleic acid identifiers |
| WO2016145409A1 (en) | 2015-03-11 | 2016-09-15 | The Broad Institute, Inc. | Genotype and phenotype coupling |
| WO2016149096A1 (en) | 2015-03-13 | 2016-09-22 | President And Fellows Of Harvard College | Determination of cells using amplification |
| CN113846144B (zh) | 2015-03-17 | 2023-09-26 | 生物辐射实验室股份有限公司 | 检测基因组编辑 |
| US20180073073A1 (en) * | 2015-03-18 | 2018-03-15 | Cellular Research, Inc. | Methods and compositions for labeling targets and haplotype phasing |
| WO2016160844A2 (en) | 2015-03-30 | 2016-10-06 | Cellular Research, Inc. | Methods and compositions for combinatorial barcoding |
| JP6828007B2 (ja) | 2015-04-10 | 2021-02-10 | スペーシャル トランスクリプトミクス アクチボラグ | 生物学的試料の空間識別されるマルチプレックスな核酸分析 |
| WO2016168351A1 (en) * | 2015-04-15 | 2016-10-20 | The Board Of Trustees Of The Leland Stanford Junior University | Robust quantification of single molecules in next-generation sequencing using non-random combinatorial oligonucleotide barcodes |
| JP2018511341A (ja) | 2015-04-17 | 2018-04-26 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 遺伝子配列決定および他の適用のためのバーコード化システムおよび方法 |
| CN114015569A (zh) | 2015-04-21 | 2022-02-08 | 通用自动化实验技术公司 | 用于高通量微生物学应用的高分辨率系统、试剂盒、设备和方法 |
| EP3286326A1 (en) | 2015-04-23 | 2018-02-28 | Cellular Research, Inc. | Methods and compositions for whole transcriptome amplification |
| JP2018518157A (ja) | 2015-05-11 | 2018-07-12 | イラミーナ インコーポレーテッド | 治療薬剤の発見および分析のためのプラットフォーム |
| US11124823B2 (en) | 2015-06-01 | 2021-09-21 | Becton, Dickinson And Company | Methods for RNA quantification |
| US9771575B2 (en) | 2015-06-19 | 2017-09-26 | Agilent Technologies, Inc. | Methods for on-array fragmentation and barcoding of DNA samples |
| CN114350752A (zh) | 2015-07-17 | 2022-04-15 | 纳米线科技公司 | 在横切面组织的用户定义区域中的基因表达的同时定量 |
| EP3347465B1 (en) | 2015-09-11 | 2019-06-26 | Cellular Research, Inc. | Methods and compositions for nucleic acid library normalization |
| JP2018537414A (ja) | 2015-10-13 | 2018-12-20 | プレジデント アンド フェローズ オブ ハーバード カレッジ | ゲルマイクロスフェアの作製及び使用のためのシステム及び方法 |
| CN108368522A (zh) | 2015-10-20 | 2018-08-03 | 10X 基因组学有限公司 | 用于高通量单细胞遗传操作的方法和系统 |
| US11111487B2 (en) * | 2015-10-28 | 2021-09-07 | Silicon Valley Scientific, Inc. | Method and apparatus for encoding cellular spatial position information |
| WO2017075297A1 (en) | 2015-10-28 | 2017-05-04 | The Broad Institute Inc. | High-throughput dynamic reagent delivery system |
| WO2017075265A1 (en) | 2015-10-28 | 2017-05-04 | The Broad Institute, Inc. | Multiplex analysis of single cell constituents |
| US11371094B2 (en) | 2015-11-19 | 2022-06-28 | 10X Genomics, Inc. | Systems and methods for nucleic acid processing using degenerate nucleotides |
| SG11201803983UA (en) * | 2015-11-19 | 2018-06-28 | 10X Genomics Inc | Transformable tagging compositions, methods, and processes incorporating same |
| EP3384048B1 (en) | 2015-12-04 | 2021-03-24 | 10X Genomics, Inc. | Methods and compositions for nucleic acid analysis |
| EP3387128A4 (en) * | 2015-12-07 | 2019-12-04 | Bio-Rad Laboratories, Inc. | MULTIPLEXING IN PARTITIONS USING MICROPARTICLES |
| CN105567562B (zh) * | 2015-12-30 | 2017-10-03 | 中国科学院合肥物质科学研究院 | 用于单细胞超声波基因导入的微流体系统及其导入方法 |
| JP6735348B2 (ja) | 2016-02-11 | 2020-08-05 | 10エックス ジェノミクス, インコーポレイテッド | 全ゲノム配列データのデノボアセンブリのためのシステム、方法及び媒体 |
| US10633648B2 (en) | 2016-02-12 | 2020-04-28 | University Of Washington | Combinatorial photo-controlled spatial sequencing and labeling |
| US20170283864A1 (en) * | 2016-03-31 | 2017-10-05 | Agilent Technologies, Inc. | Use of transposase and y adapters to fragment and tag dna |
| US11162134B2 (en) * | 2016-04-01 | 2021-11-02 | Baylor College Of Medicine | Methods of whole transcriptome amplification |
| US20190127789A1 (en) * | 2016-04-19 | 2019-05-02 | President And Fellows Of Harvard College | Immobilization-based systems and methods for genetic analysis and other applications |
| ES2956757T3 (es) | 2016-05-02 | 2023-12-27 | Becton Dickinson Co | Codificación con códigos de barras moleculares precisa |
| WO2017197338A1 (en) | 2016-05-13 | 2017-11-16 | 10X Genomics, Inc. | Microfluidic systems and methods of use |
| WO2017204294A1 (ja) * | 2016-05-25 | 2017-11-30 | 株式会社ニコン | 標的生体分子の特定方法、標的生体分子特定用ビーズ、ビーズのセット、及び標的生体分子特定装置 |
| US10301677B2 (en) | 2016-05-25 | 2019-05-28 | Cellular Research, Inc. | Normalization of nucleic acid libraries |
| WO2017205691A1 (en) | 2016-05-26 | 2017-11-30 | Cellular Research, Inc. | Molecular label counting adjustment methods |
| US10202641B2 (en) | 2016-05-31 | 2019-02-12 | Cellular Research, Inc. | Error correction in amplification of samples |
| US10640763B2 (en) | 2016-05-31 | 2020-05-05 | Cellular Research, Inc. | Molecular indexing of internal sequences |
| CN113151423A (zh) | 2016-08-05 | 2021-07-23 | 生物辐射实验室股份有限公司 | 第二链引导 |
| WO2018031631A1 (en) * | 2016-08-10 | 2018-02-15 | President And Fellows Of Harvard College | Methods of de novo assembly of barcoded genomic dna fragments |
| WO2018039338A1 (en) | 2016-08-23 | 2018-03-01 | 10X Genomics, Inc. | Microfluidic surface-mediated emulsion stability control |
| CA3034924A1 (en) | 2016-09-26 | 2018-03-29 | Cellular Research, Inc. | Measurement of protein expression using reagents with barcoded oligonucleotide sequences |
| ES2870639T3 (es) | 2016-10-24 | 2021-10-27 | Geneinfosec Inc | Ocultación de información presente en los ácidos nucleicos |
| EP3538672A1 (en) | 2016-11-08 | 2019-09-18 | Cellular Research, Inc. | Methods for cell label classification |
| EP3539035B1 (en) | 2016-11-08 | 2024-04-17 | Becton, Dickinson and Company | Methods for expression profile classification |
| WO2018089641A2 (en) * | 2016-11-10 | 2018-05-17 | The Scripps Research Institute | Encode solid phase compound library with polynucleotide based barcoding |
| EP3555290B1 (en) | 2016-12-19 | 2022-11-02 | Bio-Rad Laboratories, Inc. | Droplet tagging contiguity preserved tagmented dna |
| US10815525B2 (en) | 2016-12-22 | 2020-10-27 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10011872B1 (en) | 2016-12-22 | 2018-07-03 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10550429B2 (en) | 2016-12-22 | 2020-02-04 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| EP3568234B1 (en) | 2017-01-13 | 2023-09-06 | Cellular Research, Inc. | Hydrophilic coating of fluidic channels |
| JP7033602B2 (ja) | 2017-01-27 | 2022-03-10 | エフ.ホフマン-ラ ロシュ アーゲー | ロングレンジ配列決定のためのバーコードを付けられたdna |
| CN117512066A (zh) | 2017-01-30 | 2024-02-06 | 10X基因组学有限公司 | 用于基于微滴的单细胞条形编码的方法和系统 |
| WO2018144240A1 (en) | 2017-02-01 | 2018-08-09 | Cellular Research, Inc. | Selective amplification using blocking oligonucleotides |
| US10995333B2 (en) | 2017-02-06 | 2021-05-04 | 10X Genomics, Inc. | Systems and methods for nucleic acid preparation |
| EP3391958B1 (en) | 2017-04-19 | 2020-08-12 | The Procter & Gamble Company | Method of making surface-coated water-absorbing polymer particles in a microfluidic device |
| US11072816B2 (en) | 2017-05-03 | 2021-07-27 | The Broad Institute, Inc. | Single-cell proteomic assay using aptamers |
| JP7197567B2 (ja) | 2017-05-05 | 2022-12-27 | スキピオ バイオサイエンス | ハイドロゲル中の個別の生物学的単位を捕捉およびバーコード付与するための方法 |
| US10544413B2 (en) | 2017-05-18 | 2020-01-28 | 10X Genomics, Inc. | Methods and systems for sorting droplets and beads |
| EP4215616A1 (en) | 2017-05-18 | 2023-07-26 | 10X Genomics, Inc. | Methods and systems for sorting droplets and beads |
| CN110870018A (zh) | 2017-05-19 | 2020-03-06 | 10X基因组学有限公司 | 用于分析数据集的系统和方法 |
| CN109526228B (zh) | 2017-05-26 | 2022-11-25 | 10X基因组学有限公司 | 转座酶可接近性染色质的单细胞分析 |
| US10400235B2 (en) | 2017-05-26 | 2019-09-03 | 10X Genomics, Inc. | Single cell analysis of transposase accessible chromatin |
| WO2018226546A1 (en) | 2017-06-05 | 2018-12-13 | 10X Genomics, Inc. | Gaskets for the distribution of pressures in a microfluidic system |
| US10676779B2 (en) | 2017-06-05 | 2020-06-09 | Becton, Dickinson And Company | Sample indexing for single cells |
| SG11201912824YA (en) | 2017-06-20 | 2020-01-30 | 10X Genomics Inc | Methods and systems for improved droplet stabilization |
| CN111094585A (zh) * | 2017-08-01 | 2020-05-01 | 伊鲁米纳公司 | 用于核苷酸测序的水凝胶珠 |
| US20210032693A1 (en) | 2017-08-10 | 2021-02-04 | Rootpath Genomics, Inc. | Improved Method to Analyze Nucleic Acid Contents from Multiple Biological Particles |
| US10357771B2 (en) | 2017-08-22 | 2019-07-23 | 10X Genomics, Inc. | Method of producing emulsions |
| WO2019040546A1 (en) * | 2017-08-23 | 2019-02-28 | Roche Sequencing Solutions, Inc | ENZYME SCREENING METHODS |
| US10636761B2 (en) * | 2017-08-29 | 2020-04-28 | Electronics And Telecommunications Reearch Institute | Method of fabricating a semiconductor package |
| US10748643B2 (en) | 2017-08-31 | 2020-08-18 | 10X Genomics, Inc. | Systems and methods for determining the integrity of test strings with respect to a ground truth string |
| CN109486923B (zh) * | 2017-09-11 | 2022-02-18 | 广州永诺生物科技有限公司 | 多重扩增子测序用引物系统、其应用以及测序文库的构建方法 |
| US10837047B2 (en) | 2017-10-04 | 2020-11-17 | 10X Genomics, Inc. | Compositions, methods, and systems for bead formation using improved polymers |
| US10590244B2 (en) | 2017-10-04 | 2020-03-17 | 10X Genomics, Inc. | Compositions, methods, and systems for bead formation using improved polymers |
| US11402400B2 (en) | 2017-10-13 | 2022-08-02 | Hewlett-Packard Development Company, L.P. | Partition liquid into samples |
| WO2019083852A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | MICROFLUIDIC CHANNEL NETWORKS FOR PARTITIONING |
| WO2019084043A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | METHODS AND SYSTEMS FOR NUCLEIC ACID PREPARATION AND CHROMATIN ANALYSIS |
| WO2019084165A1 (en) | 2017-10-27 | 2019-05-02 | 10X Genomics, Inc. | METHODS AND SYSTEMS FOR SAMPLE PREPARATION AND ANALYSIS |
| EP3704247B1 (en) | 2017-11-02 | 2023-01-04 | Bio-Rad Laboratories, Inc. | Transposase-based genomic analysis |
| SG11201913654QA (en) | 2017-11-15 | 2020-01-30 | 10X Genomics Inc | Functionalized gel beads |
| US10829815B2 (en) | 2017-11-17 | 2020-11-10 | 10X Genomics, Inc. | Methods and systems for associating physical and genetic properties of biological particles |
| WO2019108851A1 (en) | 2017-11-30 | 2019-06-06 | 10X Genomics, Inc. | Systems and methods for nucleic acid preparation and analysis |
| JP7049103B2 (ja) * | 2017-12-11 | 2022-04-06 | 株式会社日立製作所 | 単一細胞の網羅的3’末端遺伝子発現解析法 |
| WO2019126209A1 (en) | 2017-12-19 | 2019-06-27 | Cellular Research, Inc. | Particles associated with oligonucleotides |
| WO2019148042A1 (en) * | 2018-01-26 | 2019-08-01 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| EP4324962A2 (en) | 2018-01-31 | 2024-02-21 | Bio-Rad Laboratories, Inc. | Methods and compositions for deconvoluting partition barcodes |
| KR20200121329A (ko) | 2018-02-12 | 2020-10-23 | 나노스트링 테크놀로지스, 인크. | 유전자 및 단백질 발현을 검출하는 생체 분자 프로브 및 방법 |
| CN112005115A (zh) | 2018-02-12 | 2020-11-27 | 10X基因组学有限公司 | 表征来自单个细胞或细胞群体的多种分析物的方法 |
| US11639928B2 (en) | 2018-02-22 | 2023-05-02 | 10X Genomics, Inc. | Methods and systems for characterizing analytes from individual cells or cell populations |
| WO2019191900A1 (en) * | 2018-04-03 | 2019-10-10 | Burning Rock Biotech | Compositions and methods for preparing nucleic acid libraries |
| EP3775271A1 (en) | 2018-04-06 | 2021-02-17 | 10X Genomics, Inc. | Systems and methods for quality control in single cell processing |
| ES2945191T3 (es) | 2018-05-03 | 2023-06-29 | Becton Dickinson Co | Análisis de muestras multiómicas de alto rendimiento |
| EP3788170A1 (en) | 2018-05-03 | 2021-03-10 | Becton, Dickinson and Company | Molecular barcoding on opposite transcript ends |
| DE102018207098A1 (de) * | 2018-05-08 | 2019-11-14 | Robert Bosch Gmbh | Mikrofluidische Vorrichtung und Verfahren zur Nanostruktur-Sequenzierung von Nukleotidsträngen |
| US11654404B2 (en) | 2018-05-18 | 2023-05-23 | Massachusetts Institute Of Technology | Light emitting droplets and related methods |
| US11932899B2 (en) | 2018-06-07 | 2024-03-19 | 10X Genomics, Inc. | Methods and systems for characterizing nucleic acid molecules |
| US11703427B2 (en) | 2018-06-25 | 2023-07-18 | 10X Genomics, Inc. | Methods and systems for cell and bead processing |
| US20200032335A1 (en) | 2018-07-27 | 2020-01-30 | 10X Genomics, Inc. | Systems and methods for metabolome analysis |
| EP3841202B1 (en) | 2018-08-20 | 2023-10-04 | Bio-Rad Laboratories, Inc. | Nucleotide sequence generation by barcode bead-colocalization in partitions |
| CN112805389A (zh) | 2018-10-01 | 2021-05-14 | 贝克顿迪金森公司 | 确定5’转录物序列 |
| EP3877520A1 (en) | 2018-11-08 | 2021-09-15 | Becton Dickinson and Company | Whole transcriptome analysis of single cells using random priming |
| US11459607B1 (en) | 2018-12-10 | 2022-10-04 | 10X Genomics, Inc. | Systems and methods for processing-nucleic acid molecules from a single cell using sequential co-partitioning and composite barcodes |
| US11492660B2 (en) | 2018-12-13 | 2022-11-08 | Becton, Dickinson And Company | Selective extension in single cell whole transcriptome analysis |
| TWI725686B (zh) | 2018-12-26 | 2021-04-21 | 財團法人工業技術研究院 | 用於產生液珠的管狀結構及液珠產生方法 |
| US11926867B2 (en) | 2019-01-06 | 2024-03-12 | 10X Genomics, Inc. | Generating capture probes for spatial analysis |
| US11649485B2 (en) | 2019-01-06 | 2023-05-16 | 10X Genomics, Inc. | Generating capture probes for spatial analysis |
| US11845983B1 (en) | 2019-01-09 | 2023-12-19 | 10X Genomics, Inc. | Methods and systems for multiplexing of droplet based assays |
| WO2020150356A1 (en) | 2019-01-16 | 2020-07-23 | Becton, Dickinson And Company | Polymerase chain reaction normalization through primer titration |
| EP4242322A3 (en) | 2019-01-23 | 2023-09-20 | Becton, Dickinson and Company | Oligonucleotides associated with antibodies |
| US11467153B2 (en) | 2019-02-12 | 2022-10-11 | 10X Genomics, Inc. | Methods for processing nucleic acid molecules |
| SG11202108788TA (en) | 2019-02-12 | 2021-09-29 | 10X Genomics Inc | Methods for processing nucleic acid molecules |
| US11851683B1 (en) | 2019-02-12 | 2023-12-26 | 10X Genomics, Inc. | Methods and systems for selective analysis of cellular samples |
| EP3923977A1 (en) | 2019-02-12 | 2021-12-22 | TheryCell GmbH | Reverse immunosuppression |
| US11655499B1 (en) | 2019-02-25 | 2023-05-23 | 10X Genomics, Inc. | Detection of sequence elements in nucleic acid molecules |
| WO2020185791A1 (en) | 2019-03-11 | 2020-09-17 | 10X Genomics, Inc. | Systems and methods for processing optically tagged beads |
| EP3953489A1 (en) | 2019-04-12 | 2022-02-16 | Miltenyi Biotec B.V. & Co. KG | Conjugates having an enzymatically releasable detection moiety and a barcode moiety |
| CN113454018A (zh) * | 2019-04-30 | 2021-09-28 | 惠普发展公司,有限责任合伙企业 | 微流体装置 |
| US11939622B2 (en) | 2019-07-22 | 2024-03-26 | Becton, Dickinson And Company | Single cell chromatin immunoprecipitation sequencing assay |
| EP4018001A4 (en) * | 2019-08-19 | 2023-09-13 | Universal Sequencing Technology Corporation | METHODS AND COMPOSITIONS FOR TRACKING THE ORIGIN OF NUCLEIC ACID FRAGMENTS FOR NUCLEIC ACID SEQUENCING |
| US11919000B2 (en) | 2019-10-10 | 2024-03-05 | 1859, Inc. | Methods and systems for microfluidic screening |
| EP4025711A2 (en) | 2019-11-08 | 2022-07-13 | 10X Genomics, Inc. | Enhancing specificity of analyte binding |
| EP4055185A1 (en) | 2019-11-08 | 2022-09-14 | 10X Genomics, Inc. | Spatially-tagged analyte capture agents for analyte multiplexing |
| US11773436B2 (en) | 2019-11-08 | 2023-10-03 | Becton, Dickinson And Company | Using random priming to obtain full-length V(D)J information for immune repertoire sequencing |
| CN114729393A (zh) | 2019-11-15 | 2022-07-08 | 美天施生物科技有限两合公司 | 用于单细胞索引的颜色和条码化珠 |
| US11857981B2 (en) | 2019-12-23 | 2024-01-02 | 10X Genomics, Inc. | Magnetic separator for an automated single cell sequencing system |
| CN114885610A (zh) | 2019-12-23 | 2022-08-09 | 10X基因组学有限公司 | 使用rna模板化连接进行空间分析的方法 |
| AU2021208466A1 (en) | 2020-01-13 | 2022-08-11 | Fluent Biosciences Inc. | Single cell sequencing |
| US11649497B2 (en) | 2020-01-13 | 2023-05-16 | Becton, Dickinson And Company | Methods and compositions for quantitation of proteins and RNA |
| US11512337B2 (en) | 2020-01-13 | 2022-11-29 | Fluent Biosciences Inc. | Emulsion based drug screening |
| US11827936B2 (en) | 2020-01-13 | 2023-11-28 | Fluent Biosciences Inc. | Methods and systems for single cell gene profiling |
| US11702693B2 (en) | 2020-01-21 | 2023-07-18 | 10X Genomics, Inc. | Methods for printing cells and generating arrays of barcoded cells |
| US11732299B2 (en) | 2020-01-21 | 2023-08-22 | 10X Genomics, Inc. | Spatial assays with perturbed cells |
| US11821035B1 (en) | 2020-01-29 | 2023-11-21 | 10X Genomics, Inc. | Compositions and methods of making gene expression libraries |
| US11898205B2 (en) | 2020-02-03 | 2024-02-13 | 10X Genomics, Inc. | Increasing capture efficiency of spatial assays |
| EP3859012A1 (en) * | 2020-02-03 | 2021-08-04 | Albert-Ludwigs-Universität Freiburg | Methods for amplification of genomic dna and preparation of sequencing libraries |
| US11732300B2 (en) | 2020-02-05 | 2023-08-22 | 10X Genomics, Inc. | Increasing efficiency of spatial analysis in a biological sample |
| US11835462B2 (en) | 2020-02-11 | 2023-12-05 | 10X Genomics, Inc. | Methods and compositions for partitioning a biological sample |
| US11891654B2 (en) | 2020-02-24 | 2024-02-06 | 10X Genomics, Inc. | Methods of making gene expression libraries |
| US11926863B1 (en) | 2020-02-27 | 2024-03-12 | 10X Genomics, Inc. | Solid state single cell method for analyzing fixed biological cells |
| CN115461470A (zh) | 2020-02-28 | 2022-12-09 | 10X基因组学有限公司 | 用于从组织中分离核和细胞的方法 |
| US11768175B1 (en) | 2020-03-04 | 2023-09-26 | 10X Genomics, Inc. | Electrophoretic methods for spatial analysis |
| EP4121016A1 (en) | 2020-03-16 | 2023-01-25 | Fluent Biosciences Inc. | Multi-omic analysis in monodisperse droplets |
| CN115916972A (zh) | 2020-04-16 | 2023-04-04 | 10X基因组学有限公司 | 用于被固定样品的组合物和方法 |
| CN115916999A (zh) | 2020-04-22 | 2023-04-04 | 10X基因组学有限公司 | 用于使用靶向rna耗竭进行空间分析的方法 |
| US11701668B1 (en) | 2020-05-08 | 2023-07-18 | 10X Genomics, Inc. | Methods and devices for magnetic separation |
| US11851700B1 (en) | 2020-05-13 | 2023-12-26 | 10X Genomics, Inc. | Methods, kits, and compositions for processing extracellular molecules |
| US11661625B2 (en) | 2020-05-14 | 2023-05-30 | Becton, Dickinson And Company | Primers for immune repertoire profiling |
| EP4153775A1 (en) | 2020-05-22 | 2023-03-29 | 10X Genomics, Inc. | Simultaneous spatio-temporal measurement of gene expression and cellular activity |
| AU2021275906A1 (en) | 2020-05-22 | 2022-12-22 | 10X Genomics, Inc. | Spatial analysis to detect sequence variants |
| US11946038B1 (en) | 2020-05-29 | 2024-04-02 | 10X Genomics, Inc. | Methods and systems including flow and magnetic modules |
| AU2021283174A1 (en) | 2020-06-02 | 2023-01-05 | 10X Genomics, Inc. | Nucleic acid library methods |
| CN116249785A (zh) | 2020-06-02 | 2023-06-09 | 10X基因组学有限公司 | 用于抗原-受体的空间转录组学 |
| WO2021252499A1 (en) | 2020-06-08 | 2021-12-16 | 10X Genomics, Inc. | Methods of determining a surgical margin and methods of use thereof |
| CN116034166A (zh) | 2020-06-25 | 2023-04-28 | 10X基因组学有限公司 | Dna甲基化的空间分析 |
| EP4176437A1 (en) | 2020-07-02 | 2023-05-10 | 10X Genomics, Inc. | Systems and methods for detection of low-abundance molecular barcodes from a sequencing library |
| US11761038B1 (en) | 2020-07-06 | 2023-09-19 | 10X Genomics, Inc. | Methods for identifying a location of an RNA in a biological sample |
| US11932901B2 (en) | 2020-07-13 | 2024-03-19 | Becton, Dickinson And Company | Target enrichment using nucleic acid probes for scRNAseq |
| US20220017892A1 (en) * | 2020-07-15 | 2022-01-20 | Fluent Biosciences Inc. | Tiered ligation oligos |
| CN115997126A (zh) | 2020-09-07 | 2023-04-21 | 美天施生物科技有限两合公司 | 具有可酶促释放的检测部分和条形码部分的缀合物 |
| US11926822B1 (en) | 2020-09-23 | 2024-03-12 | 10X Genomics, Inc. | Three-dimensional spatial analysis |
| US11827935B1 (en) | 2020-11-19 | 2023-11-28 | 10X Genomics, Inc. | Methods for spatial analysis using rolling circle amplification and detection probes |
| US11739443B2 (en) | 2020-11-20 | 2023-08-29 | Becton, Dickinson And Company | Profiling of highly expressed and lowly expressed proteins |
| AU2021409136A1 (en) | 2020-12-21 | 2023-06-29 | 10X Genomics, Inc. | Methods, compositions, and systems for capturing probes and/or barcodes |
| EP4298244A1 (en) | 2021-02-23 | 2024-01-03 | 10X Genomics, Inc. | Probe-based analysis of nucleic acids and proteins |
| EP4301870A1 (en) | 2021-03-18 | 2024-01-10 | 10X Genomics, Inc. | Multiplex capture of gene and protein expression from a biological sample |
| WO2023014303A2 (en) * | 2021-08-05 | 2023-02-09 | Agency For Science, Technology And Research | A method of amplification of a nucleic acid |
| EP4196605A1 (en) | 2021-09-01 | 2023-06-21 | 10X Genomics, Inc. | Methods, compositions, and kits for blocking a capture probe on a spatial array |
| EP4272764A1 (en) | 2022-05-03 | 2023-11-08 | Scipio Bioscience | Method of complexing biological units with particles |
| KR102578493B1 (ko) | 2023-04-26 | 2023-09-14 | 대한민국 | 적재용 선반 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009513948A (ja) | 2005-09-16 | 2009-04-02 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 検体検出のための比色バイオバーコード増幅アッセイ |
| WO2012048341A1 (en) | 2010-10-08 | 2012-04-12 | President And Fellows Of Harvard College | High-throughput single cell barcoding |
| JP2012522517A (ja) | 2009-04-02 | 2012-09-27 | フリューダイム・コーポレイション | 標的核酸にバーコードを付加するためのマルチプライマー増幅方法 |
Family Cites Families (775)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1007137A (en) | 1908-06-08 | 1911-10-31 | Theodore D Palmer | Cloth-pressing machine. |
| US1004111A (en) | 1908-10-17 | 1911-09-26 | Westinghouse Air Brake Co | Fluid-pressure brake. |
| US1003026A (en) | 1911-04-12 | 1911-09-12 | Bernard Bartmann | Bobbin-holder. |
| US1005998A (en) | 1911-07-10 | 1911-10-17 | Arthur Munchausen | Berry-carrier. |
| US1005372A (en) | 1911-08-11 | 1911-10-10 | Albert Gay | Plow-fender. |
| US2797149A (en) | 1953-01-08 | 1957-06-25 | Technicon International Ltd | Methods of and apparatus for analyzing liquids containing crystalloid and non-crystalloid constituents |
| US3047367A (en) | 1959-12-01 | 1962-07-31 | Technicon Instr | Automatic analysis with fluid segmentation |
| US3479141A (en) | 1967-05-17 | 1969-11-18 | Technicon Corp | Method and apparatus for analysis |
| US4124638A (en) | 1977-09-12 | 1978-11-07 | Hansen John N | Solubilizable polyacrylamide gels containing disulfide cross-linkages |
| US4253846A (en) | 1979-11-21 | 1981-03-03 | Technicon Instruments Corporation | Method and apparatus for automated analysis of fluid samples |
| GB2097692B (en) | 1981-01-10 | 1985-05-22 | Shaw Stewart P D | Combining chemical reagents |
| DE3230289A1 (de) | 1982-08-14 | 1984-02-16 | Bayer Ag, 5090 Leverkusen | Herstellung von pharmazeutischen oder kosmetischen dispersionen |
| US4582802A (en) | 1983-09-30 | 1986-04-15 | The United States Of America As Represented By The Department Of Health And Human Services | Stimulation of enzymatic ligation of DNA by high concentrations of nonspecific polymers |
| JPS60227826A (ja) | 1984-04-27 | 1985-11-13 | Sogo Yatsukou Kk | pHに応答するグラフトカプセル |
| KR890003947B1 (ko) * | 1985-12-11 | 1989-10-13 | 가부시기가이샤 시마즈세이사구쇼 | 세포융합장치 |
| US4916070A (en) | 1986-04-14 | 1990-04-10 | The General Hospital Corporation | Fibrin-specific antibodies and method of screening for the antibodies |
| US5418149A (en) | 1990-07-24 | 1995-05-23 | Hoffmann-La Roche Inc. | Reduction of non-specific amplification glycosylase using DUTP and DNA uracil |
| US5618711A (en) | 1986-08-22 | 1997-04-08 | Hoffmann-La Roche Inc. | Recombinant expression vectors and purification methods for Thermus thermophilus DNA polymerase |
| US4872895A (en) | 1986-12-11 | 1989-10-10 | American Telephone And Telegraph Company, At&T Bell Laboratories | Method for fabricating articles which include high silica glass bodies |
| US5202231A (en) | 1987-04-01 | 1993-04-13 | Drmanac Radoje T | Method of sequencing of genomes by hybridization of oligonucleotide probes |
| US5525464A (en) | 1987-04-01 | 1996-06-11 | Hyseq, Inc. | Method of sequencing by hybridization of oligonucleotide probes |
| US5149625A (en) | 1987-08-11 | 1992-09-22 | President And Fellows Of Harvard College | Multiplex analysis of DNA |
| US5137829A (en) | 1987-10-05 | 1992-08-11 | Washington University | DNA transposon TN5SEQ1 |
| US5185099A (en) | 1988-04-20 | 1993-02-09 | Institut National De Recherche Chimique Appliquee | Visco-elastic, isotropic materials based on water, fluorinate sufactants and fluorinated oils, process for their preparation, and their use in various fields, such as optics, pharmacology and electrodynamics |
| US5237016A (en) | 1989-01-05 | 1993-08-17 | Siska Diagnostics, Inc. | End-attachment of oligonucleotides to polyacrylamide solid supports for capture and detection of nucleic acids |
| US6176962B1 (en) | 1990-02-28 | 2001-01-23 | Aclara Biosciences, Inc. | Methods for fabricating enclosed microchannel structures |
| US5756334A (en) | 1990-04-26 | 1998-05-26 | New England Biolabs, Inc. | Thermostable DNA polymerase from 9°N-7 and methods for producing the same |
| US5489523A (en) | 1990-12-03 | 1996-02-06 | Stratagene | Exonuclease-deficient thermostable Pyrococcus furiosus DNA polymerase I |
| US6582908B2 (en) | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| US5270183A (en) | 1991-02-08 | 1993-12-14 | Beckman Research Institute Of The City Of Hope | Device and method for the automated cycling of solutions between two or more temperatures |
| US5994056A (en) | 1991-05-02 | 1999-11-30 | Roche Molecular Systems, Inc. | Homogeneous methods for nucleic acid amplification and detection |
| DE69213240T2 (de) | 1991-07-04 | 1997-04-24 | Immunodex K S | Wasserlösliche reagenzien und konjugate auf polymerbasis, die vom divinylsulfon abgeleitete reste enthalten |
| DK0597960T3 (da) | 1991-08-10 | 1999-09-13 | Medical Res Council | Behandling af cellepopulationer |
| EP0604552B1 (en) | 1991-09-18 | 1997-02-12 | Affymax Technologies N.V. | Method of synthesizing diverse collections of oligomers |
| US5413924A (en) | 1992-02-13 | 1995-05-09 | Kosak; Kenneth M. | Preparation of wax beads containing a reagent for release by heating |
| AU3816993A (en) | 1992-03-19 | 1993-10-21 | Regents Of The University Of California, The | Multiple tag labeling method for DNA sequencing |
| US5587128A (en) | 1992-05-01 | 1996-12-24 | The Trustees Of The University Of Pennsylvania | Mesoscale polynucleotide amplification devices |
| CA2134475C (en) | 1992-05-01 | 1999-07-06 | Peter Wilding | Polynucleotide amplification analysis using a microfabricated device |
| US5840865A (en) | 1992-09-14 | 1998-11-24 | Institute Of Molecular Biology And Biotechnology/Forth | Eukaryotic transposable element |
| US5897783A (en) | 1992-09-24 | 1999-04-27 | Amersham International Plc | Magnetic separation method |
| US5569364A (en) | 1992-11-05 | 1996-10-29 | Soane Biosciences, Inc. | Separation media for electrophoresis |
| WO1994018218A1 (en) | 1993-02-01 | 1994-08-18 | Seq, Ltd. | Methods and apparatus for dna sequencing |
| WO1994019101A1 (en) | 1993-02-16 | 1994-09-01 | Alliance Pharmaceutical Corp. | Method of microemulsifying fluorinated oils |
| WO1994023699A1 (en) | 1993-04-19 | 1994-10-27 | Medisorb Technologies International L.P. | Long-acting treatment by slow-release delivery of antisense oligodeoxyribonucleotides from biodegradable microparticles |
| US5456986A (en) * | 1993-06-30 | 1995-10-10 | Carnegie Mellon University | Magnetic metal or metal carbide nanoparticles and a process for forming same |
| DE69429038T2 (de) | 1993-07-28 | 2002-03-21 | Pe Corp Ny Norwalk | Vorrichtung und Verfahren zur Nukleinsäurevervielfältigung |
| EP0711303B2 (en) | 1993-07-30 | 2009-06-10 | Affymax, Inc. | Biotinylation of proteins |
| EP0723549B1 (en) | 1993-08-30 | 2003-12-17 | Promega Corporation | Nucleic acid purification compositions and methods |
| US5512131A (en) | 1993-10-04 | 1996-04-30 | President And Fellows Of Harvard College | Formation of microstamped patterns on surfaces and derivative articles |
| US20030044777A1 (en) | 1993-10-28 | 2003-03-06 | Kenneth L. Beattie | Flowthrough devices for multiple discrete binding reactions |
| US5605793A (en) * | 1994-02-17 | 1997-02-25 | Affymax Technologies N.V. | Methods for in vitro recombination |
| US5558071A (en) | 1994-03-07 | 1996-09-24 | Combustion Electromagnetics, Inc. | Ignition system power converter and controller |
| US5648211A (en) | 1994-04-18 | 1997-07-15 | Becton, Dickinson And Company | Strand displacement amplification using thermophilic enzymes |
| WO1995031726A1 (en) | 1994-05-11 | 1995-11-23 | Genera Technologies Limited | Methods of capturing species from liquids and assay procedures |
| US5705628A (en) | 1994-09-20 | 1998-01-06 | Whitehead Institute For Biomedical Research | DNA purification and isolation using magnetic particles |
| US5846719A (en) | 1994-10-13 | 1998-12-08 | Lynx Therapeutics, Inc. | Oligonucleotide tags for sorting and identification |
| US5585069A (en) | 1994-11-10 | 1996-12-17 | David Sarnoff Research Center, Inc. | Partitioned microelectronic and fluidic device array for clinical diagnostics and chemical synthesis |
| WO1996029629A2 (en) | 1995-03-01 | 1996-09-26 | President And Fellows Of Harvard College | Microcontact printing on surfaces and derivative articles |
| US5700642A (en) | 1995-05-22 | 1997-12-23 | Sri International | Oligonucleotide sizing using immobilized cleavable primers |
| HUP9900910A2 (hu) | 1995-06-07 | 1999-07-28 | Lynx Therapeutics, Inc. | Oligonukleotid jelzések osztályozáshoz és azonosításhoz |
| ATE375402T1 (de) | 1995-06-07 | 2007-10-15 | Solexa Inc | Oligonukleotid-tags zur sortierung und identifizierung |
| US5856174A (en) | 1995-06-29 | 1999-01-05 | Affymetrix, Inc. | Integrated nucleic acid diagnostic device |
| US6866760B2 (en) | 1998-08-27 | 2005-03-15 | E Ink Corporation | Electrophoretic medium and process for the production thereof |
| US5872010A (en) | 1995-07-21 | 1999-02-16 | Northeastern University | Microscale fluid handling system |
| US6057149A (en) | 1995-09-15 | 2000-05-02 | The University Of Michigan | Microscale devices and reactions in microscale devices |
| US5851769A (en) | 1995-09-27 | 1998-12-22 | The Regents Of The University Of California | Quantitative DNA fiber mapping |
| US5736330A (en) | 1995-10-11 | 1998-04-07 | Luminex Corporation | Method and compositions for flow cytometric determination of DNA sequences |
| US6051377A (en) | 1995-11-30 | 2000-04-18 | Pharmaseq, Inc. | Multiplex assay for nucleic acids employing transponders |
| US5736332A (en) | 1995-11-30 | 1998-04-07 | Mandecki; Wlodek | Method of determining the sequence of nucleic acids employing solid-phase particles carrying transponders |
| US6001571A (en) | 1995-11-30 | 1999-12-14 | Mandecki; Wlodek | Multiplex assay for nucleic acids employing transponders |
| US6355198B1 (en) | 1996-03-15 | 2002-03-12 | President And Fellows Of Harvard College | Method of forming articles including waveguides via capillary micromolding and microtransfer molding |
| WO1997039359A1 (en) | 1996-04-15 | 1997-10-23 | Dade International Inc. | Apparatus and method for analysis |
| JP4468488B2 (ja) | 1996-05-29 | 2010-05-26 | コーネル・リサーチ・ファンデーション・インコーポレイテッド | 組み合せたリガーゼ検出およびポリメラーゼ連鎖反応を用いる核酸配列相違の検出 |
| US5846727A (en) | 1996-06-06 | 1998-12-08 | Board Of Supervisors Of Louisiana State University And Agricultural & Mechanical College | Microsystem for rapid DNA sequencing |
| ATE206633T1 (de) | 1996-07-15 | 2001-10-15 | Calcitech Ltd | Herstellung von pulvern |
| US5965443A (en) | 1996-09-09 | 1999-10-12 | Wisconsin Alumni Research Foundation | System for in vitro transposition |
| US5900481A (en) | 1996-11-06 | 1999-05-04 | Sequenom, Inc. | Bead linkers for immobilizing nucleic acids to solid supports |
| US6133436A (en) | 1996-11-06 | 2000-10-17 | Sequenom, Inc. | Beads bound to a solid support and to nucleic acids |
| US6379929B1 (en) | 1996-11-20 | 2002-04-30 | The Regents Of The University Of Michigan | Chip-based isothermal amplification devices and methods |
| US5958703A (en) | 1996-12-03 | 1999-09-28 | Glaxo Group Limited | Use of modified tethers in screening compound libraries |
| US20020172965A1 (en) | 1996-12-13 | 2002-11-21 | Arcaris, Inc. | Methods for measuring relative amounts of nucleic acids in a complex mixture and retrieval of specific sequences therefrom |
| US20050042625A1 (en) | 1997-01-15 | 2005-02-24 | Xzillion Gmbh & Co. | Mass label linked hybridisation probes |
| US6297006B1 (en) | 1997-01-16 | 2001-10-02 | Hyseq, Inc. | Methods for sequencing repetitive sequences and for determining the order of sequence subfragments |
| US20020034737A1 (en) | 1997-03-04 | 2002-03-21 | Hyseq, Inc. | Methods and compositions for detection or quantification of nucleic acid species |
| CN1251609A (zh) | 1997-02-12 | 2000-04-26 | 尤金·Y·查恩 | 分析聚合物的方法和产品 |
| US7622294B2 (en) | 1997-03-14 | 2009-11-24 | Trustees Of Tufts College | Methods for detecting target analytes and enzymatic reactions |
| US6327410B1 (en) | 1997-03-14 | 2001-12-04 | The Trustees Of Tufts College | Target analyte sensors utilizing Microspheres |
| US20030027203A1 (en) | 1997-03-24 | 2003-02-06 | Fields Robert E. | Biomolecular processor |
| US6391622B1 (en) | 1997-04-04 | 2002-05-21 | Caliper Technologies Corp. | Closed-loop biochemical analyzers |
| US6143496A (en) | 1997-04-17 | 2000-11-07 | Cytonix Corporation | Method of sampling, amplifying and quantifying segment of nucleic acid, polymerase chain reaction assembly having nanoliter-sized sample chambers, and method of filling assembly |
| WO1998050583A1 (en) | 1997-05-02 | 1998-11-12 | Gen-Probe Incorporated | Two-step hybridization and capture of a polynucleotide |
| CA2286601A1 (en) | 1997-05-16 | 1998-11-26 | Alberta Research Council | Microfluidic system and methods of use |
| US6969488B2 (en) | 1998-05-22 | 2005-11-29 | Solexa, Inc. | System and apparatus for sequential processing of analytes |
| JP4294740B2 (ja) | 1997-05-23 | 2009-07-15 | ソレクサ・インコーポレイテッド | 分析物の系列的プロセシングのためのシステムおよび装置 |
| US20040241759A1 (en) | 1997-06-16 | 2004-12-02 | Eileen Tozer | High throughput screening of libraries |
| DK1496120T3 (da) | 1997-07-07 | 2007-07-30 | Medical Res Council | In vitro-sorteringsmetode |
| GB9714716D0 (en) | 1997-07-11 | 1997-09-17 | Brax Genomics Ltd | Characterising nucleic acids |
| FI103809B1 (fi) | 1997-07-14 | 1999-09-30 | Finnzymes Oy | In vitro -menetelmä templaattien tuottamiseksi DNA-sekventointia varten |
| US6974669B2 (en) | 2000-03-28 | 2005-12-13 | Nanosphere, Inc. | Bio-barcodes based on oligonucleotide-modified nanoparticles |
| US20050037397A1 (en) | 2001-03-28 | 2005-02-17 | Nanosphere, Inc. | Bio-barcode based detection of target analytes |
| US6368871B1 (en) | 1997-08-13 | 2002-04-09 | Cepheid | Non-planar microstructures for manipulation of fluid samples |
| JP2001514906A (ja) | 1997-08-15 | 2001-09-18 | ハイセック,インコーポレーテッド | 核酸種を検出または定量するための方法および組成物 |
| WO1999014368A2 (en) | 1997-09-15 | 1999-03-25 | Whitehead Institute For Biomedical Research | Methods and apparatus for processing a sample of biomolecular analyte using a microfabricated device |
| US20020092767A1 (en) | 1997-09-19 | 2002-07-18 | Aclara Biosciences, Inc. | Multiple array microfluidic device units |
| US7214298B2 (en) | 1997-09-23 | 2007-05-08 | California Institute Of Technology | Microfabricated cell sorter |
| US6103537A (en) | 1997-10-02 | 2000-08-15 | Aclara Biosciences, Inc. | Capillary assays involving separation of free and bound species |
| US5842787A (en) | 1997-10-09 | 1998-12-01 | Caliper Technologies Corporation | Microfluidic systems incorporating varied channel dimensions |
| US6485944B1 (en) | 1997-10-10 | 2002-11-26 | President And Fellows Of Harvard College | Replica amplification of nucleic acid arrays |
| EP1028970A1 (en) | 1997-10-10 | 2000-08-23 | President And Fellows Of Harvard College | Replica amplification of nucleic acid arrays |
| US6511803B1 (en) | 1997-10-10 | 2003-01-28 | President And Fellows Of Harvard College | Replica amplification of nucleic acid arrays |
| EP1023464B1 (en) | 1997-10-14 | 2017-07-26 | Luminex Corporation | Precision fluorescently dyed particles and methods of making and using same |
| EP1025434A4 (en) | 1997-10-24 | 2006-10-18 | Univ Northeastern | MINIATURIZED MULTICHANNEL DEVICE FOR PREPARATORY SEPARATION WITH HIGH THROUGHPUT AND COMPREHENSIVE COLLECTION AND ANALYSIS |
| EP1036332B1 (en) | 1997-12-04 | 2005-07-13 | Amersham Biosciences UK Limited | Multiple assay method |
| WO1999033963A1 (en) | 1997-12-31 | 1999-07-08 | Chiron Corporation | Metastatic cancer regulated gene |
| AU765378B2 (en) | 1998-02-19 | 2003-09-18 | President And Fellows Of Harvard College | Monovalent, multivalent, and multimeric MHC binding domain fusion proteins and conjugates, and uses therefor |
| AU3196099A (en) | 1998-03-27 | 1999-10-18 | President And Fellows Of Harvard College | Systematic identification of essential genes by (in vitro) transposon mutagenesis |
| US6022716A (en) | 1998-04-10 | 2000-02-08 | Genset Sa | High throughput DNA sequencing vector |
| WO1999052708A1 (en) | 1998-04-13 | 1999-10-21 | Luminex Corporation | Liquid labeling with fluorescent microparticles |
| US5997636A (en) | 1998-05-01 | 1999-12-07 | Instrumentation Technology Associates, Inc. | Method and apparatus for growing crystals |
| US6780591B2 (en) | 1998-05-01 | 2004-08-24 | Arizona Board Of Regents | Method of determining the nucleotide sequence of oligonucleotides and DNA molecules |
| US6123798A (en) | 1998-05-06 | 2000-09-26 | Caliper Technologies Corp. | Methods of fabricating polymeric structures incorporating microscale fluidic elements |
| US6534262B1 (en) | 1998-05-14 | 2003-03-18 | Whitehead Institute For Biomedical Research | Solid phase technique for selectively isolating nucleic acids |
| US6306590B1 (en) | 1998-06-08 | 2001-10-23 | Caliper Technologies Corp. | Microfluidic matrix localization apparatus and methods |
| EP2360271A1 (en) | 1998-06-24 | 2011-08-24 | Illumina, Inc. | Decoding of array sensors with microspheres |
| WO2000008212A1 (en) | 1998-08-07 | 2000-02-17 | Cellay, Llc | Gel microdrops in genetic analysis |
| US6159736A (en) | 1998-09-23 | 2000-12-12 | Wisconsin Alumni Research Foundation | Method for making insertional mutations using a Tn5 synaptic complex |
| AR021833A1 (es) | 1998-09-30 | 2002-08-07 | Applied Research Systems | Metodos de amplificacion y secuenciacion de acido nucleico |
| CA2347182C (en) | 1998-10-13 | 2004-06-15 | Biomicro Systems, Inc. | Fluid circuit components based upon passive fluid dynamics |
| US6489096B1 (en) | 1998-10-15 | 2002-12-03 | Princeton University | Quantitative analysis of hybridization patterns and intensities in oligonucleotide arrays |
| SE9803614L (sv) | 1998-10-19 | 2000-04-20 | Muhammed Mamoun | Förfarande och anordning för framställning av nanopartiklar |
| WO2000026412A1 (en) | 1998-11-02 | 2000-05-11 | Kenneth Loren Beattie | Nucleic acid analysis using sequence-targeted tandem hybridization |
| US6569631B1 (en) | 1998-11-12 | 2003-05-27 | 3-Dimensional Pharmaceuticals, Inc. | Microplate thermal shift assay for ligand development using 5-(4″dimethylaminophenyl)-2-(4′-phenyl)oxazole derivative fluorescent dyes |
| US5942609A (en) | 1998-11-12 | 1999-08-24 | The Porkin-Elmer Corporation | Ligation assembly and detection of polynucleotides on solid-support |
| WO2000034527A2 (en) | 1998-12-11 | 2000-06-15 | The Regents Of The University Of California | Targeted molecular bar codes |
| NO986133D0 (no) | 1998-12-23 | 1998-12-23 | Preben Lexow | FremgangsmÕte for DNA-sekvensering |
| GB9900298D0 (en) | 1999-01-07 | 1999-02-24 | Medical Res Council | Optical sorting method |
| US6416642B1 (en) | 1999-01-21 | 2002-07-09 | Caliper Technologies Corp. | Method and apparatus for continuous liquid flow in microscale channels using pressure injection, wicking, and electrokinetic injection |
| US6635419B1 (en) | 1999-02-16 | 2003-10-21 | Applera Corporation | Polynucleotide sequencing method |
| US20030027214A1 (en) | 1999-02-17 | 2003-02-06 | Kamb Carl Alexander | Methods for substrate-ligand interaction screening |
| ATE556149T1 (de) | 1999-02-23 | 2012-05-15 | Caliper Life Sciences Inc | Manipulation von mikropartikeln in mikrofluidischen systemen |
| US7615373B2 (en) | 1999-02-25 | 2009-11-10 | Virginia Commonwealth University Intellectual Property Foundation | Electroprocessed collagen and tissue engineering |
| US6171850B1 (en) | 1999-03-08 | 2001-01-09 | Caliper Technologies Corp. | Integrated devices and systems for performing temperature controlled reactions and analyses |
| US6303343B1 (en) | 1999-04-06 | 2001-10-16 | Caliper Technologies Corp. | Inefficient fast PCR |
| US6908737B2 (en) | 1999-04-15 | 2005-06-21 | Vitra Bioscience, Inc. | Systems and methods of conducting multiplexed experiments |
| EP1923472B1 (en) | 1999-04-20 | 2012-04-11 | Illumina, Inc. | Detection of nucleic acid reactions on bead arrays |
| US20060275782A1 (en) | 1999-04-20 | 2006-12-07 | Illumina, Inc. | Detection of nucleic acid reactions on bead arrays |
| JP2002542781A (ja) | 1999-04-28 | 2002-12-17 | ザ、ボード、オブ、トラスティーズ、オブ、ザ、リーランド、スタンフォード、ジュニア、ユニバーシティ | P因子由来ベクター及びその使用法 |
| CA2373537A1 (en) | 1999-05-12 | 2000-11-16 | Aclara Biosciences, Inc. | Multiplexed fluorescent detection in microfluidic devices |
| WO2000070095A2 (en) | 1999-05-17 | 2000-11-23 | Dade Behring Inc. | Homogeneous isothermal amplification and detection of nucleic acids using a template switch oligonucleotide |
| US20020051971A1 (en) | 1999-05-21 | 2002-05-02 | John R. Stuelpnagel | Use of microfluidic systems in the detection of target analytes using microsphere arrays |
| US6846622B1 (en) | 1999-05-26 | 2005-01-25 | Oregon Health & Science University | Tagged epitope protein transposable element |
| US20030124509A1 (en) | 1999-06-03 | 2003-07-03 | Kenis Paul J.A. | Laminar flow patterning and articles made thereby |
| US6372813B1 (en) | 1999-06-25 | 2002-04-16 | Motorola | Methods and compositions for attachment of biomolecules to solid supports, hydrogels, and hydrogel arrays |
| AU6068300A (en) | 1999-07-06 | 2001-01-22 | Caliper Technologies Corporation | Microfluidic systems and methods for determining modulator kinetics |
| US6977145B2 (en) | 1999-07-28 | 2005-12-20 | Serono Genetics Institute S.A. | Method for carrying out a biochemical protocol in continuous flow in a microreactor |
| US6524456B1 (en) | 1999-08-12 | 2003-02-25 | Ut-Battelle, Llc | Microfluidic devices for the controlled manipulation of small volumes |
| WO2001013086A2 (en) | 1999-08-13 | 2001-02-22 | Brandeis University | Detection of nucleic acids |
| AU6788100A (en) | 1999-08-20 | 2001-03-19 | Luminex Corporation | Liquid array technology |
| EP1208238B1 (en) | 1999-08-27 | 2008-11-12 | Matrix Technologies Corporation | Methods of immobilizing ligands on solid supports |
| US6982146B1 (en) | 1999-08-30 | 2006-01-03 | The United States Of America As Represented By The Department Of Health And Human Services | High speed parallel molecular nucleic acid sequencing |
| IL149001A0 (en) | 1999-10-13 | 2002-11-10 | Signature Bioscience Inc | System and method for detecting and identifying molecular events in test sample |
| US6958225B2 (en) | 1999-10-27 | 2005-10-25 | Affymetrix, Inc. | Complexity management of genomic DNA |
| WO2001030965A2 (en) | 1999-10-28 | 2001-05-03 | The Board Of Trustees Of The Leland Stanford Junior University | Methods of in vivo gene transfer using a sleeping beauty transposon system |
| JP4721603B2 (ja) | 1999-11-08 | 2011-07-13 | 栄研化学株式会社 | 変異および/または多型の検出方法 |
| US6432290B1 (en) | 1999-11-26 | 2002-08-13 | The Governors Of The University Of Alberta | Apparatus and method for trapping bead based reagents within microfluidic analysis systems |
| US20010051348A1 (en) | 2000-01-28 | 2001-12-13 | Lee Chee Wee | Novel ligands and methods for preparing same |
| ATE382858T1 (de) | 2000-02-23 | 2008-01-15 | Caliper Life Sciences Inc | Mehrfach-reservoir-drucksteuersystem |
| EP1261689A4 (en) | 2000-02-23 | 2005-06-29 | Zyomyx Inc | CHIPS WITH INCREASED SAMPLE SURFACE |
| IL134830A0 (en) | 2000-03-01 | 2001-05-20 | Chay 13 Medical Res Group N V | Peptides and immunostimulatory and anti-bacterial pharmaceutical compositions containing them |
| AU2001252201A1 (en) | 2000-03-14 | 2001-09-24 | Amylin Pharmaceuticals, Inc. | Effects of glucagon-like peptide-1 (7-36) on antro-pyloro-duodenal motility |
| JP4927287B2 (ja) | 2000-03-31 | 2012-05-09 | マイクロニックス、インコーポレーテッド | タンパク質の結晶化のマイクロ流動体装置 |
| US20020001856A1 (en) | 2000-04-06 | 2002-01-03 | Chow Andrea W. | Methods and devices for achieving long incubation times in high-throughput systems |
| EP2278030B1 (en) | 2000-04-10 | 2017-05-24 | Taxon Biosciences, Inc. | Methods for the survey and genetic analysis of populations |
| US6481453B1 (en) | 2000-04-14 | 2002-11-19 | Nanostream, Inc. | Microfluidic branch metering systems and methods |
| US6800298B1 (en) | 2000-05-11 | 2004-10-05 | Clemson University | Biological lubricant composition and method of applying lubricant composition |
| US20060008799A1 (en) | 2000-05-22 | 2006-01-12 | Hong Cai | Rapid haplotyping by single molecule detection |
| US20020003001A1 (en) | 2000-05-24 | 2002-01-10 | Weigl Bernhard H. | Surface tension valves for microfluidic applications |
| US6645432B1 (en) | 2000-05-25 | 2003-11-11 | President & Fellows Of Harvard College | Microfluidic systems including three-dimensionally arrayed channel networks |
| US20060263888A1 (en) | 2000-06-02 | 2006-11-23 | Honeywell International Inc. | Differential white blood count on a disposable card |
| US6632606B1 (en) | 2000-06-12 | 2003-10-14 | Aclara Biosciences, Inc. | Methods for single nucleotide polymorphism detection |
| ES2259666T3 (es) | 2000-06-21 | 2006-10-16 | Bioarray Solutions Ltd | Analisis molecular de multiples analitos usando series de particulas aleatorias con especificidad de aplicacion. |
| WO2002011888A2 (en) | 2000-08-07 | 2002-02-14 | Nanostream, Inc. | Fluidic mixer in microfluidic system |
| US6610499B1 (en) | 2000-08-31 | 2003-08-26 | The Regents Of The University Of California | Capillary array and related methods |
| US6773566B2 (en) | 2000-08-31 | 2004-08-10 | Nanolytics, Inc. | Electrostatic actuators for microfluidics and methods for using same |
| ATE448875T1 (de) | 2000-09-14 | 2009-12-15 | Caliper Life Sciences Inc | Mikrofluidische vorrichtungen und methoden um temperatur-vermittelte reaktionen durchzuführen |
| AU2001290879A1 (en) | 2000-09-15 | 2002-03-26 | California Institute Of Technology | Microfabricated crossflow devices and methods |
| EP1322936A2 (en) | 2000-10-03 | 2003-07-02 | California Institute Of Technology | Microfluidic devices and methods of use |
| CA2393374A1 (en) | 2000-10-10 | 2002-04-18 | Diversa Corporation | High throughput or capillary-based screening for a bioactivity or biomolecule |
| JP2002155305A (ja) | 2000-11-14 | 2002-05-31 | Akira Kawasaki | 単分散粒子の製造装置及び単分散粒子の製造方法及びその製造方法で製造された単分散粒子 |
| US6492154B2 (en) | 2001-01-31 | 2002-12-10 | Applera Corporation | Isolated human kinase proteins, nucleic acid molecules encoding human kinase proteins, and uses thereof |
| CA2332186A1 (en) | 2001-02-08 | 2002-08-08 | Her Majesty In Right Of Canada As Represented By The Minister Of Agricul Ture And Agri-Food Canada | Replicative in vivo gene targeting |
| US7670559B2 (en) | 2001-02-15 | 2010-03-02 | Caliper Life Sciences, Inc. | Microfluidic systems with enhanced detection systems |
| ATE312076T1 (de) | 2001-02-22 | 2005-12-15 | Anika Therapeutics Inc | Thiol-modifizierte hyaluronan-derivate |
| DE60211857T2 (de) | 2001-02-23 | 2006-12-21 | Japan Science And Technology Agency, Kawaguchi | Verfahren zur herstellung einer emulsion und vorrichtung dafür |
| US7211654B2 (en) | 2001-03-14 | 2007-05-01 | Regents Of The University Of Michigan | Linkers and co-coupling agents for optimization of oligonucleotide synthesis and purification on solid supports |
| US20150329617A1 (en) | 2001-03-14 | 2015-11-19 | Dynal Biotech Asa | Novel MHC molecule constructs, and methods of employing these constructs for diagnosis and therapy, and uses of MHC molecules |
| JP3949056B2 (ja) | 2001-04-03 | 2007-07-25 | マイクロニクス, インコーポレイテッド | スプリット集中サイトメーター |
| US7138267B1 (en) | 2001-04-04 | 2006-11-21 | Epicentre Technologies Corporation | Methods and compositions for amplifying DNA clone copy number |
| US20030027221A1 (en) * | 2001-04-06 | 2003-02-06 | Scott Melissa E. | High-throughput screening assays by encapsulation |
| US7572642B2 (en) | 2001-04-18 | 2009-08-11 | Ambrigen, Llc | Assay based on particles, which specifically bind with targets in spatially distributed characteristic patterns |
| JP4194934B2 (ja) | 2001-05-26 | 2008-12-10 | ワン セル システムズ インコーポレイテッド | カプセル化細胞によるタンパク質の分泌法 |
| US6880576B2 (en) | 2001-06-07 | 2005-04-19 | Nanostream, Inc. | Microfluidic devices for methods development |
| US7179423B2 (en) | 2001-06-20 | 2007-02-20 | Cytonome, Inc. | Microfluidic system including a virtual wall fluid interface port for interfacing fluids with the microfluidic system |
| US7262063B2 (en) | 2001-06-21 | 2007-08-28 | Bio Array Solutions, Ltd. | Directed assembly of functional heterostructures |
| US6613523B2 (en) | 2001-06-29 | 2003-09-02 | Agilent Technologies, Inc. | Method of DNA sequencing using cleavable tags |
| US7682353B2 (en) | 2001-06-29 | 2010-03-23 | Coloplast A/S | Catheter device |
| US7077152B2 (en) | 2001-07-07 | 2006-07-18 | Nanostream, Inc. | Microfluidic metering systems and methods |
| EP1427746A4 (en) | 2001-07-20 | 2005-09-28 | California Inst Of Techn | SYSTEMS FOR THE EXPRESSION OF PROTEINS AND NUCLEIC ACIDS |
| US6767731B2 (en) | 2001-08-27 | 2004-07-27 | Intel Corporation | Electron induced fluorescent method for nucleic acid sequencing |
| WO2003031591A2 (en) | 2001-10-10 | 2003-04-17 | Superarray Bioscience Corporation | Detecting targets by unique identifier nucleotide tags |
| US7297485B2 (en) | 2001-10-15 | 2007-11-20 | Qiagen Gmbh | Method for nucleic acid amplification that results in low amplification bias |
| US6783647B2 (en) | 2001-10-19 | 2004-08-31 | Ut-Battelle, Llc | Microfluidic systems and methods of transport and lysis of cells and analysis of cell lysate |
| WO2003044221A1 (en) | 2001-10-19 | 2003-05-30 | West Virginia University Research Corporation | Microfluidic system for proteome analysis |
| US20030149307A1 (en) | 2001-10-24 | 2003-08-07 | Baxter International Inc. | Process for the preparation of polyethylene glycol bis amine |
| AU2002365140A1 (en) | 2001-10-26 | 2003-07-15 | Aclara Biosciences Inc. | System and method for injection molded micro-replication of micro-fluidic substrates |
| US20030182068A1 (en) | 2001-10-30 | 2003-09-25 | Battersby Bronwyn J. | Device and methods for directed synthesis of chemical libraries |
| US7262056B2 (en) | 2001-11-08 | 2007-08-28 | Mirus Bio Corporation | Enhancing intermolecular integration of nucleic acids using integrator complexes |
| GB0127564D0 (en) | 2001-11-16 | 2002-01-09 | Medical Res Council | Emulsion compositions |
| EP1456409B1 (en) | 2001-11-28 | 2010-02-24 | Bio-Rad Laboratories, Inc. | Parallel polymorphism scoring by amplification and error correction |
| US7335153B2 (en) | 2001-12-28 | 2008-02-26 | Bio Array Solutions Ltd. | Arrays of microparticles and methods of preparation thereof |
| AU2003210438A1 (en) | 2002-01-04 | 2003-07-24 | Board Of Regents, The University Of Texas System | Droplet-based microfluidic oligonucleotide synthesis engine |
| AU2003202026A1 (en) | 2002-01-16 | 2003-09-02 | Dynal Biotech Asa | Method for isolating nucleic acids and protein from a single sample |
| KR100459870B1 (ko) | 2002-02-22 | 2004-12-04 | 한국과학기술원 | 트랜스포존과 Cre/loxP 부위 특이적 재조합 방법을 이용하는 염색체의 특정부위가 제거된 미생물 변이주 제조방법 |
| CN1656234B (zh) * | 2002-03-20 | 2012-02-01 | 创新生物公司 | 包囊化核酸扩增反应混合物的微胶囊及其作为反应隔间进行平行反应的用途 |
| US7901939B2 (en) | 2002-05-09 | 2011-03-08 | University Of Chicago | Method for performing crystallization and reactions in pressure-driven fluid plugs |
| EP2282214B1 (en) | 2002-05-09 | 2022-10-05 | The University of Chicago | Device and method for pressure-driven plug transport and reaction |
| US7527966B2 (en) | 2002-06-26 | 2009-05-05 | Transgenrx, Inc. | Gene regulation in transgenic animals using a transposon-based vector |
| JP2006507921A (ja) | 2002-06-28 | 2006-03-09 | プレジデント・アンド・フェロウズ・オブ・ハーバード・カレッジ | 流体分散のための方法および装置 |
| US7927791B2 (en) | 2002-07-24 | 2011-04-19 | Ptc Therapeutics, Inc. | Methods for identifying small molecules that modulate premature translation termination and nonsense mediated mRNA decay |
| IL151660A0 (en) | 2002-09-09 | 2003-04-10 | Univ Ben Gurion | Method for isolating and culturing unculturable microorganisms |
| ES2315397T3 (es) | 2002-09-30 | 2009-04-01 | F. Hoffmann-La Roche Ag | Oligonucleotidos para obtener el genotipo del gen de timidilato sintasa. |
| US20040081962A1 (en) | 2002-10-23 | 2004-04-29 | Caifu Chen | Methods for synthesizing complementary DNA |
| US6979713B2 (en) | 2002-11-25 | 2005-12-27 | 3M Innovative Properties Company | Curable compositions and abrasive articles therefrom |
| US20050266582A1 (en) | 2002-12-16 | 2005-12-01 | Modlin Douglas N | Microfluidic system with integrated permeable membrane |
| US20040248299A1 (en) | 2002-12-27 | 2004-12-09 | Sumedha Jayasena | RNA interference |
| DE602004021902D1 (de) | 2003-01-17 | 2009-08-20 | Univ Boston | Haplotypanalyse |
| US7244567B2 (en) | 2003-01-29 | 2007-07-17 | 454 Life Sciences Corporation | Double ended sequencing |
| DK1594973T3 (da) | 2003-02-10 | 2012-02-13 | Max Delbrueck Centrum | Transposonbaseret målretningssystem |
| US20100022414A1 (en) | 2008-07-18 | 2010-01-28 | Raindance Technologies, Inc. | Droplet Libraries |
| US7041481B2 (en) | 2003-03-14 | 2006-05-09 | The Regents Of The University Of California | Chemical amplification based on fluid partitioning |
| US7316903B2 (en) | 2003-03-28 | 2008-01-08 | United States Of America As Represented By The Department Of Health And Human Services | Detection of nucleic acid sequence variations using phase Mu transposase |
| GB0307428D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Compartmentalised combinatorial chemistry |
| US20060078893A1 (en) | 2004-10-12 | 2006-04-13 | Medical Research Council | Compartmentalised combinatorial chemistry by microfluidic control |
| GB0307403D0 (en) | 2003-03-31 | 2003-05-07 | Medical Res Council | Selection by compartmentalised screening |
| DK1613346T3 (da) * | 2003-04-04 | 2013-01-07 | Pah Usa 15 Llc | Mikrofluidiske olie-i-vand-emulsioner og vaccinesammensætninger |
| US20100035254A1 (en) | 2003-04-08 | 2010-02-11 | Pacific Biosciences Of California, Inc. | Composition and method for nucleic acid sequencing |
| CA2784762A1 (en) | 2003-04-10 | 2004-10-28 | President And Fellows Of Harvard College | Formation and control of fluidic species |
| EP1629286A1 (en) | 2003-05-16 | 2006-03-01 | Global Technologies (NZ) Ltd. | Method and apparatus for mixing sample and reagent in a suspension fluid |
| DE112004001376D2 (de) | 2003-05-19 | 2006-04-13 | Knoell Hans Forschung Ev | Vorrichtung und Verfahren zur Strukturierung von Flüssigkeiten und zum zudosieren von Reaktionsflüssigkeiten zu in Separationsmedium eingebetteten Flüssigkeitskompartimenten |
| WO2004105734A1 (en) | 2003-05-28 | 2004-12-09 | Valorisation Recherche, Societe En Commandite | Method of preparing microcapsules |
| GB0313170D0 (en) | 2003-06-09 | 2003-07-16 | Qinetiq Ltd | Method and apparatus for spore disruption and/or detection |
| JP2007503597A (ja) | 2003-06-13 | 2007-02-22 | ザ ジェネラル ホスピタル コーポレーション | 血液から赤血球および血小板をサイズに基づいて除去するための微少流体システム |
| GB2403475B (en) | 2003-07-01 | 2008-02-06 | Oxitec Ltd | Stable integrands |
| GB0315438D0 (en) | 2003-07-02 | 2003-08-06 | Univ Manchester | Analysis of mixed cell populations |
| EP1641809B2 (en) | 2003-07-05 | 2018-10-03 | The Johns Hopkins University | Method and compositions for detection and enumeration of genetic variations |
| EP2662135A3 (en) | 2003-08-27 | 2013-12-25 | President and Fellows of Harvard College | Method for mixing droplets in a microchannel |
| JP4988345B2 (ja) | 2003-09-04 | 2012-08-01 | ザ・ユナイテッド・ステイツ・オブ・アメリカ・アズ・リプレゼンティッド・バイ・ザ・デパートメント・オブ・ヴェテランズ・アフェアーズ | 眼用ハイドロゲルナノコンポジット |
| WO2005023427A1 (en) | 2003-09-05 | 2005-03-17 | Stokes Bio Limited | A microfluidic analysis system |
| US7354706B2 (en) | 2003-09-09 | 2008-04-08 | The Regents Of The University Of Colorado, A Body Corporate | Use of photopolymerization for amplification and detection of a molecular recognition event |
| WO2005028646A1 (ja) | 2003-09-22 | 2005-03-31 | Riken | 効率的なdna逆位反復構造の調製方法 |
| KR101111231B1 (ko) | 2003-09-25 | 2012-02-17 | 비바리스 | 마이크로 웰 어레이 칩 및 그 제조방법 |
| JP2007512811A (ja) | 2003-11-10 | 2007-05-24 | インベスチゲン, インコーポレイテッド | 検出のための核酸を調製する方法 |
| WO2005049787A2 (en) | 2003-11-24 | 2005-06-02 | Yeda Research And Development Co.Ltd. | Compositions and methods for in vitro sorting of molecular and cellular libraries |
| US20050136417A1 (en) | 2003-12-19 | 2005-06-23 | Affymetrix, Inc. | Amplification of nucleic acids |
| US8071364B2 (en) | 2003-12-24 | 2011-12-06 | Transgenrx, Inc. | Gene therapy using transposon-based vectors |
| ES2432040T3 (es) | 2004-01-28 | 2013-11-29 | 454 Life Sciences Corporation | Amplificación de ácido nucleico con emulsión de flujo continuo |
| US20050181379A1 (en) | 2004-02-18 | 2005-08-18 | Intel Corporation | Method and device for isolating and positioning single nucleic acid molecules |
| AU2005216549A1 (en) | 2004-02-27 | 2005-09-09 | President And Fellows Of Harvard College | Polony fluorescent in situ sequencing beads |
| US20100216153A1 (en) | 2004-02-27 | 2010-08-26 | Helicos Biosciences Corporation | Methods for detecting fetal nucleic acids and diagnosing fetal abnormalities |
| KR100552706B1 (ko) | 2004-03-12 | 2006-02-20 | 삼성전자주식회사 | 핵산 증폭 방법 및 장치 |
| US8741192B2 (en) | 2004-03-23 | 2014-06-03 | Japan Science And Technology Agency | Method and device for producing micro-droplets |
| US20050221339A1 (en) | 2004-03-31 | 2005-10-06 | Medical Research Council Harvard University | Compartmentalised screening by microfluidic control |
| WO2005099419A2 (en) | 2004-04-13 | 2005-10-27 | President And Fellows Of Harvard College | Manipulation and/or detection of biological samples or other objects |
| US20050250147A1 (en) | 2004-05-10 | 2005-11-10 | Macevicz Stephen C | Digital profiling of polynucleotide populations |
| US20080268507A1 (en) | 2004-05-25 | 2008-10-30 | Airbus Deutschland Gmbh | Recombinant Dna Nicking Endonuclease and Uses Thereof |
| US7799553B2 (en) | 2004-06-01 | 2010-09-21 | The Regents Of The University Of California | Microfabricated integrated DNA analysis system |
| US7700281B2 (en) | 2004-06-30 | 2010-04-20 | Usb Corporation | Hot start nucleic acid amplification |
| US7968085B2 (en) | 2004-07-05 | 2011-06-28 | Ascendis Pharma A/S | Hydrogel formulations |
| CN1648671B (zh) * | 2005-02-06 | 2012-09-26 | 成都夸常医学工业有限公司 | 多反应器分析芯片检测方法和分析芯片及检测装置 |
| US7608434B2 (en) | 2004-08-04 | 2009-10-27 | Wisconsin Alumni Research Foundation | Mutated Tn5 transposase proteins and the use thereof |
| US20080268431A1 (en) | 2004-09-14 | 2008-10-30 | Jin-Ho Choy | Information Code System Using Dna Sequences |
| US7892731B2 (en) | 2004-10-01 | 2011-02-22 | Radix Biosolutions, Ltd. | System and method for inhibiting the decryption of a nucleic acid probe sequence used for the detection of a specific nucleic acid |
| US7968287B2 (en) | 2004-10-08 | 2011-06-28 | Medical Research Council Harvard University | In vitro evolution in microfluidic systems |
| US9492400B2 (en) | 2004-11-04 | 2016-11-15 | Massachusetts Institute Of Technology | Coated controlled release polymer particles as efficient oral delivery vehicles for biopharmaceuticals |
| WO2006051552A2 (en) | 2004-11-15 | 2006-05-18 | Yeda Research And Development Co. Ltd. At The Weizmann Institute Of Science | Directed evolution and selection using in vitro compartmentalization |
| US7329493B2 (en) | 2004-12-22 | 2008-02-12 | Asiagen Corporation | One-tube nested PCR for detecting Mycobacterium tuberculosis |
| EP2418018B1 (en) | 2004-12-23 | 2013-05-22 | Abbott Point of Care Inc. | Methods for the separation nucleic acids |
| US20080213593A1 (en) | 2005-01-21 | 2008-09-04 | President And Fellows Of Harvard College | Systems And Methods For Forming Fluidic Droplets Encapsulated In Particles Such As Colloidal Particles |
| US7579153B2 (en) | 2005-01-25 | 2009-08-25 | Population Genetics Technologies, Ltd. | Isothermal DNA amplification |
| US7407757B2 (en) | 2005-02-10 | 2008-08-05 | Population Genetics Technologies | Genetic analysis by sequence-specific sorting |
| US7393665B2 (en) | 2005-02-10 | 2008-07-01 | Population Genetics Technologies Ltd | Methods and compositions for tagging and identifying polynucleotides |
| AU2006214085A1 (en) | 2005-02-18 | 2006-08-24 | Canon U.S. Life Sciences, Inc. | Devices and methods for identifying genomic DNA of organisms |
| EP1867702B1 (en) * | 2005-02-21 | 2011-09-28 | Kagoshima University | Method for purifying biodiesel fuel |
| EP2248578B1 (en) | 2005-03-04 | 2012-06-06 | President and Fellows of Harvard College | Method for forming multiple emulsions |
| US20070054119A1 (en) | 2005-03-04 | 2007-03-08 | Piotr Garstecki | Systems and methods of forming particles |
| US9040237B2 (en) | 2005-03-04 | 2015-05-26 | Intel Corporation | Sensor arrays and nucleic acid sequencing applications |
| JP2006289250A (ja) | 2005-04-08 | 2006-10-26 | Kao Corp | マイクロミキサー及びそれを用いた流体混合方法 |
| US8407013B2 (en) | 2005-06-07 | 2013-03-26 | Peter K. Rogan | AB initio generation of single copy genomic probes |
| US8445194B2 (en) | 2005-06-15 | 2013-05-21 | Callida Genomics, Inc. | Single molecule arrays for genetic and chemical analysis |
| JP2006349060A (ja) | 2005-06-16 | 2006-12-28 | Ntn Corp | ボールねじ |
| US8828209B2 (en) | 2005-06-22 | 2014-09-09 | The Research Foundation For The State University Of New York | Massively parallel 2-dimensional capillary electrophoresis |
| WO2007002567A2 (en) | 2005-06-23 | 2007-01-04 | Nanosphere, Inc. | Selective isolation and concentration of nucleic acids from complex samples |
| ATE537254T1 (de) | 2005-07-05 | 2011-12-15 | Chemo Sero Therapeut Res Inst | Mutanter transposonvektor und verwendung davon |
| JP5051490B2 (ja) | 2005-07-08 | 2012-10-17 | 独立行政法人産業技術総合研究所 | マクロ生体材料を内包する無機マイクロカプセルおよびその製造方法 |
| US20070020640A1 (en) | 2005-07-21 | 2007-01-25 | Mccloskey Megan L | Molecular encoding of nucleic acid templates for PCR and other forms of sequence analysis |
| FR2888912B1 (fr) | 2005-07-25 | 2007-08-24 | Commissariat Energie Atomique | Procede de commande d'une communication entre deux zones par electromouillage, dispositif comportant des zones isolables les unes des autres et procede de realisation d'un tel dispositif |
| ATE510930T1 (de) | 2005-08-02 | 2011-06-15 | Rubicon Genomics Inc | Zusammensetzungen und verfahren zur bearbeitung und amplifikation von dna mit verwendung mehrerer enzyme in einer einzigen reaktion |
| DE102005037401B4 (de) | 2005-08-08 | 2007-09-27 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Bildung einer Emulsion in einem fluidischen Mikrosystem |
| WO2007024840A2 (en) | 2005-08-22 | 2007-03-01 | Critical Therapeutics, Inc. | Method of quantitating nucleic acids by flow cytometry microparticle-based array |
| US7556776B2 (en) | 2005-09-08 | 2009-07-07 | President And Fellows Of Harvard College | Microfluidic manipulation of fluids and reactions |
| JP2007074967A (ja) | 2005-09-13 | 2007-03-29 | Canon Inc | 識別子プローブ及びそれを用いた核酸増幅方法 |
| US7960104B2 (en) | 2005-10-07 | 2011-06-14 | Callida Genomics, Inc. | Self-assembled single molecule arrays and uses thereof |
| WO2007133831A2 (en) | 2006-02-24 | 2007-11-22 | Callida Genomics, Inc. | High throughput genome sequencing on dna arrays |
| US20070111241A1 (en) | 2005-10-14 | 2007-05-17 | Nezih Cereb | System and method for accessing, tracking, and editing sequence analysis and software to accomplish the same |
| US7709544B2 (en) | 2005-10-25 | 2010-05-04 | Massachusetts Institute Of Technology | Microstructure synthesis by flow lithography and polymerization |
| US20070190543A1 (en) * | 2005-11-14 | 2007-08-16 | Applera Corporation | Coded Molecules for Detecting Target Analytes |
| US20070134277A1 (en) | 2005-12-09 | 2007-06-14 | Children's Medical Center Corporation | Pharmaceutical formulation for sulfur-containing drugs in liquid dosage forms |
| US20070141584A1 (en) | 2005-12-20 | 2007-06-21 | Roberts Douglas N | Methods for assessment of native chromatin on microarrays |
| US7932037B2 (en) | 2007-12-05 | 2011-04-26 | Perkinelmer Health Sciences, Inc. | DNA assays using amplicon probes on encoded particles |
| WO2007081386A2 (en) | 2006-01-11 | 2007-07-19 | Raindance Technologies, Inc. | Microfluidic devices and methods of use |
| EP1987162A4 (en) | 2006-01-23 | 2009-11-25 | Population Genetics Technologi | NUCLEIC ACID ANALYSIS ABOUT SEQUENCE TOKENS |
| WO2007087312A2 (en) | 2006-01-23 | 2007-08-02 | Population Genetics Technologies Ltd. | Molecular counting |
| EP2263787A3 (en) | 2006-01-27 | 2012-02-22 | President and Fellows of Harvard College | Fluidic droplet coalescence |
| ES2595373T3 (es) | 2006-02-02 | 2016-12-29 | The Board Of Trustees Of The Leland Stanford Junior University | Prueba genética no invasiva mediante análisis digital |
| WO2007092538A2 (en) | 2006-02-07 | 2007-08-16 | President And Fellows Of Harvard College | Methods for making nucleotide probes for sequencing and synthesis |
| GB0603251D0 (en) | 2006-02-17 | 2006-03-29 | Isis Innovation | DNA conformation |
| SG10201405158QA (en) | 2006-02-24 | 2014-10-30 | Callida Genomics Inc | High throughput genome sequencing on dna arrays |
| US20070231823A1 (en) | 2006-03-23 | 2007-10-04 | Mckernan Kevin J | Directed enrichment of genomic DNA for high-throughput sequencing |
| JP4921829B2 (ja) | 2006-03-30 | 2012-04-25 | 株式会社東芝 | 微粒子の製造装置、乳化剤保持部、微粒子の製造方法および分子膜の製造方法 |
| US20090181864A1 (en) | 2006-03-31 | 2009-07-16 | Nam Trung Nguyen | Active control for droplet-based microfluidics |
| JP2009538123A (ja) | 2006-04-19 | 2009-11-05 | アプライド バイオシステムズ, エルエルシー | ゲル非含有ビーズベースの配列決定のための試薬、方法およびライブラリー |
| US7811603B2 (en) | 2006-05-09 | 2010-10-12 | The Regents Of The University Of California | Microfluidic device for forming monodisperse lipoplexes |
| JP2010506136A (ja) | 2006-05-11 | 2010-02-25 | レインダンス テクノロジーズ, インコーポレイテッド | 微小流体デバイス |
| ES2620398T3 (es) | 2006-05-22 | 2017-06-28 | Nanostring Technologies, Inc. | Sistemas y métodos para analizar nanoindicadores |
| RU2321638C2 (ru) | 2006-05-23 | 2008-04-10 | Закрытое акционерное общество "Молекулярно-медицинские технологии" | Способ изготовления многофункционального мультичипа, мультичип для последовательного или параллельного скрининга биополимеров, способ анализа биополимеров и набор для осуществления способа |
| EP2029781A4 (en) | 2006-05-26 | 2010-06-30 | Althea Technologies Inc | BIOCHEMICAL ANALYSIS OF PARTITIONED CELLS |
| FR2901717A1 (fr) | 2006-05-30 | 2007-12-07 | Centre Nat Rech Scient | Procede de traitement de gouttes dans un circuit microfluidique. |
| AU2007260676A1 (en) | 2006-06-14 | 2007-12-21 | Artemis Health, Inc. | Rare cell analysis using sample splitting and DNA tags |
| WO2007149432A2 (en) | 2006-06-19 | 2007-12-27 | The Johns Hopkins University | Single-molecule pcr on microparticles in water-in-oil emulsions |
| US20080076909A1 (en) | 2006-06-30 | 2008-03-27 | Applera Corporation | Emulsion pcr and amplicon capture |
| EP1878501A1 (en) | 2006-07-14 | 2008-01-16 | Roche Diagnostics GmbH | Instrument for heating and cooling |
| US8394590B2 (en) | 2006-08-02 | 2013-03-12 | California Institute Of Technology | Capture agents and related methods and systems for detecting and/or sorting targets |
| EP3536396B1 (en) | 2006-08-07 | 2022-03-30 | The President and Fellows of Harvard College | Fluorocarbon emulsion stabilizing surfactants |
| US9278321B2 (en) | 2006-09-06 | 2016-03-08 | Canon U.S. Life Sciences, Inc. | Chip and cartridge design configuration for performing micro-fluidic assays |
| WO2008037082A1 (en) | 2006-09-25 | 2008-04-03 | Archer-Daniels-Midland Company | Superabsorbent surface-treated carboxyalkylated polysaccharides and process for producing same |
| US7935518B2 (en) | 2006-09-27 | 2011-05-03 | Alessandra Luchini | Smart hydrogel particles for biomarker harvesting |
| US20080166720A1 (en) | 2006-10-06 | 2008-07-10 | The Regents Of The University Of California | Method and apparatus for rapid nucleic acid analysis |
| US8841116B2 (en) | 2006-10-25 | 2014-09-23 | The Regents Of The University Of California | Inline-injection microdevice and microfabricated integrated DNA analysis system using same |
| US7910302B2 (en) | 2006-10-27 | 2011-03-22 | Complete Genomics, Inc. | Efficient arrays of amplified polynucleotides |
| US8765076B2 (en) | 2006-11-14 | 2014-07-01 | Handylab, Inc. | Microfluidic valve and method of making same |
| ES2679996T3 (es) | 2006-11-15 | 2018-09-03 | Biospherex Llc | Secuenciación multi-etiqueta y análisis ecogenómico |
| CN101583879A (zh) * | 2006-11-20 | 2009-11-18 | 纳提维斯公司 | 利用低频信号转导体外系统或者哺乳动物系统的设备和方法 |
| US20080242560A1 (en) | 2006-11-21 | 2008-10-02 | Gunderson Kevin L | Methods for generating amplified nucleic acid arrays |
| WO2008072540A1 (ja) | 2006-12-13 | 2008-06-19 | National University Corporation Nagoya University | Tol1因子のトランスポザーゼ及びそれを用いたDNA導入システム |
| CA2672315A1 (en) | 2006-12-14 | 2008-06-26 | Ion Torrent Systems Incorporated | Methods and apparatus for measuring analytes using large scale fet arrays |
| US8338166B2 (en) * | 2007-01-04 | 2012-12-25 | Lawrence Livermore National Security, Llc | Sorting, amplification, detection, and identification of nucleic acid subsequences in a complex mixture |
| JP2008167722A (ja) | 2007-01-15 | 2008-07-24 | Konica Minolta Medical & Graphic Inc | 磁性支持体上での加熱による核酸単離方法 |
| US7844658B2 (en) | 2007-01-22 | 2010-11-30 | Comcast Cable Holdings, Llc | System and method for providing an application to a device |
| US20080176768A1 (en) | 2007-01-23 | 2008-07-24 | Honeywell Honeywell International | Hydrogel microarray with embedded metal nanoparticles |
| EP2121983A2 (en) | 2007-02-02 | 2009-11-25 | Illumina Cambridge Limited | Methods for indexing samples and sequencing multiple nucleotide templates |
| US8003312B2 (en) | 2007-02-16 | 2011-08-23 | The Board Of Trustees Of The Leland Stanford Junior University | Multiplex cellular assays using detectable cell barcodes |
| FI20075124A0 (fi) | 2007-02-21 | 2007-02-21 | Valtion Teknillinen | Menetelmä ja testikitti nukleotidivariaatioiden toteamiseksi |
| WO2008109176A2 (en) | 2007-03-07 | 2008-09-12 | President And Fellows Of Harvard College | Assays and other reactions involving droplets |
| US20080228268A1 (en) | 2007-03-15 | 2008-09-18 | Uluru, Inc. | Method of Formation of Viscous, Shape Conforming Gels and Their Uses as Medical Prosthesis |
| US7943330B2 (en) | 2007-03-23 | 2011-05-17 | Academia Sinica | Tailored glycoproteomic methods for the sequencing, mapping and identification of cellular glycoproteins |
| EP2136786B8 (en) | 2007-03-28 | 2012-11-14 | President and Fellows of Harvard College | Apparatus for forming droplets |
| US9222936B2 (en) | 2007-04-18 | 2015-12-29 | Solulink, Inc. | Methods and/or use of oligonucleotide conjugates for suppressing background due to cross-hybridization |
| US20100130369A1 (en) | 2007-04-23 | 2010-05-27 | Advanced Liquid Logic, Inc. | Bead-Based Multiplexed Analytical Methods and Instrumentation |
| CN101293191B (zh) | 2007-04-25 | 2011-11-09 | 中国科学院过程工程研究所 | 一种琼脂糖凝胶微球的制备方法 |
| WO2008135512A2 (en) | 2007-05-02 | 2008-11-13 | Jerzy Paszkowski | Dna amplification method |
| US20080295909A1 (en) | 2007-05-24 | 2008-12-04 | Locascio Laurie E | Microfluidic Device for Passive Sorting and Storage of Liquid Plugs Using Capillary Force |
| WO2008150432A1 (en) | 2007-06-01 | 2008-12-11 | 454 Life Sciences Corporation | System and meth0d for identification of individual samples from a multiplex mixture |
| US8476382B2 (en) | 2007-06-05 | 2013-07-02 | Eugenia Kumacheva | Multiple continuous microfluidic reactors for the scaled up synthesis of gel or polymer particles |
| WO2009005680A1 (en) | 2007-06-29 | 2009-01-08 | President And Fellows Of Harvard College | Methods and apparatus for manipulation of fluidic species |
| WO2009011808A1 (en) | 2007-07-13 | 2009-01-22 | President And Fellows Of Harvard College | Droplet-based selection |
| WO2009015296A1 (en) | 2007-07-24 | 2009-01-29 | The Regents Of The University Of California | Microfabricated dropley generator |
| US20130084243A1 (en) | 2010-01-27 | 2013-04-04 | Liliane Goetsch | Igf-1r specific antibodies useful in the detection and diagnosis of cellular proliferative disorders |
| EP2179285A4 (en) | 2007-08-15 | 2010-08-18 | Opgen Inc | METHOD, SYSTEM AND SOFTWARE ARRANGEMENT FOR COMPARATIVE ANALYSIS AND PHYLOGENIA WITH OPTICAL TOTAL GENERIC CARD |
| US8563527B2 (en) | 2007-08-20 | 2013-10-22 | Pharmain Corporation | Oligonucleotide core carrier compositions for delivery of nucleic acid-containing therapeutic agents, methods of making and using the same |
| US8268564B2 (en) | 2007-09-26 | 2012-09-18 | President And Fellows Of Harvard College | Methods and applications for stitched DNA barcodes |
| WO2009048532A2 (en) | 2007-10-05 | 2009-04-16 | President And Fellows Of Harvard College | Formation of particles for ultrasound application, drug release, and other uses, and microfluidic methods of preparation |
| US20090099040A1 (en) | 2007-10-15 | 2009-04-16 | Sigma Aldrich Company | Degenerate oligonucleotides and their uses |
| US20100086914A1 (en) | 2008-10-03 | 2010-04-08 | Roche Molecular Systems, Inc. | High resolution, high throughput hla genotyping by clonal sequencing |
| US8334013B2 (en) | 2007-11-02 | 2012-12-18 | Stc.Unm | Mesoporous metal oxide microspheres and method for forming same |
| WO2009061372A1 (en) | 2007-11-02 | 2009-05-14 | President And Fellows Of Harvard College | Systems and methods for creating multi-phase entities, including particles and/or fluids |
| US8592150B2 (en) | 2007-12-05 | 2013-11-26 | Complete Genomics, Inc. | Methods and compositions for long fragment read sequencing |
| US20110008775A1 (en) | 2007-12-10 | 2011-01-13 | Xiaolian Gao | Sequencing of nucleic acids |
| US7771944B2 (en) | 2007-12-14 | 2010-08-10 | The Board Of Trustees Of The University Of Illinois | Methods for determining genetic haplotypes and DNA mapping |
| CN101946010B (zh) | 2007-12-21 | 2014-08-20 | 哈佛大学 | 用于核酸测序的系统和方法 |
| EP3699291A1 (en) | 2008-01-17 | 2020-08-26 | Sequenom, Inc. | Single molecule nucleic acid sequence analysis processes and compositions |
| KR20090081260A (ko) | 2008-01-23 | 2009-07-28 | 삼성전자주식회사 | 마이크로 어레이 혼성화 검출 방법 |
| CA2714630A1 (en) | 2008-02-07 | 2009-08-13 | Pacific Biosciences Of California, Inc. | Cis reactive oxygen quenchers integrated into linkers |
| JP5468271B2 (ja) | 2008-02-08 | 2014-04-09 | 花王株式会社 | 微粒子分散液の製造方法 |
| US8034568B2 (en) | 2008-02-12 | 2011-10-11 | Nugen Technologies, Inc. | Isothermal nucleic acid amplification methods and compositions |
| CN101918597B (zh) | 2008-03-11 | 2013-09-18 | 国立癌中心 | 应用snp阵列测量染色体、基因或特定核苷酸序列拷贝数的方法 |
| US9011777B2 (en) | 2008-03-21 | 2015-04-21 | Lawrence Livermore National Security, Llc | Monodisperse microdroplet generation and stopping without coalescence |
| US8961902B2 (en) | 2008-04-23 | 2015-02-24 | Bioscale, Inc. | Method and apparatus for analyte processing |
| US9068181B2 (en) | 2008-05-23 | 2015-06-30 | The General Hospital Corporation | Microfluidic droplet encapsulation |
| DE102008025656B4 (de) | 2008-05-28 | 2016-07-28 | Genxpro Gmbh | Verfahren zur quantitativen Analyse von Nukleinsäuren, Marker dafür und deren Verwendung |
| GB0810051D0 (en) | 2008-06-02 | 2008-07-09 | Oxford Biodynamics Ltd | Method of diagnosis |
| EP2303246A1 (en) | 2008-06-05 | 2011-04-06 | President and Fellows of Harvard College | Polymersomes, colloidosomes, liposomes, and other species associated with fluidic droplets |
| US8198028B2 (en) | 2008-07-02 | 2012-06-12 | Illumina Cambridge Limited | Using populations of beads for the fabrication of arrays on surfaces |
| WO2010004018A2 (en) | 2008-07-11 | 2010-01-14 | Eth Zurich | Degradable microcapsules |
| US10722562B2 (en) | 2008-07-23 | 2020-07-28 | Immudex Aps | Combinatorial analysis and repair |
| US20100062494A1 (en) | 2008-08-08 | 2010-03-11 | President And Fellows Of Harvard College | Enzymatic oligonucleotide pre-adenylation |
| US8383345B2 (en) | 2008-09-12 | 2013-02-26 | University Of Washington | Sequence tag directed subassembly of short sequencing reads into long sequencing reads |
| US20110218123A1 (en) | 2008-09-19 | 2011-09-08 | President And Fellows Of Harvard College | Creation of libraries of droplets and related species |
| US9417190B2 (en) | 2008-09-23 | 2016-08-16 | Bio-Rad Laboratories, Inc. | Calibrations and controls for droplet-based assays |
| US8709762B2 (en) | 2010-03-02 | 2014-04-29 | Bio-Rad Laboratories, Inc. | System for hot-start amplification via a multiple emulsion |
| US20120252015A1 (en) | 2011-02-18 | 2012-10-04 | Bio-Rad Laboratories | Methods and compositions for detecting genetic material |
| US20110159499A1 (en) | 2009-11-25 | 2011-06-30 | Quantalife, Inc. | Methods and compositions for detecting genetic material |
| US9156010B2 (en) | 2008-09-23 | 2015-10-13 | Bio-Rad Laboratories, Inc. | Droplet-based assay system |
| US8663920B2 (en) | 2011-07-29 | 2014-03-04 | Bio-Rad Laboratories, Inc. | Library characterization by digital assay |
| US9764322B2 (en) | 2008-09-23 | 2017-09-19 | Bio-Rad Laboratories, Inc. | System for generating droplets with pressure monitoring |
| AU2009296734B2 (en) | 2008-09-25 | 2016-02-18 | Cephalon Llc | Liquid formulations of bendamustine |
| US8361299B2 (en) | 2008-10-08 | 2013-01-29 | Sage Science, Inc. | Multichannel preparative electrophoresis system |
| US9080211B2 (en) | 2008-10-24 | 2015-07-14 | Epicentre Technologies Corporation | Transposon end compositions and methods for modifying nucleic acids |
| DK2376517T3 (da) | 2008-10-24 | 2013-02-11 | Epict Technologies Corp | Transposon-ende-sammensætninger og fremgangsmåder til at modificere nukleinsyrer |
| US20100113296A1 (en) | 2008-11-05 | 2010-05-06 | Joel Myerson | Methods And Kits For Nucleic Acid Analysis |
| US8748103B2 (en) | 2008-11-07 | 2014-06-10 | Sequenta, Inc. | Monitoring health and disease status using clonotype profiles |
| US20100203647A1 (en) | 2008-11-21 | 2010-08-12 | The Rockefeller University | Chemical Reporters of Protein Acylation |
| SG171916A1 (en) | 2008-12-02 | 2011-07-28 | Bio Rad Laboratories | Chromatin structure detection |
| EP3150724A1 (en) | 2008-12-19 | 2017-04-05 | President and Fellows of Harvard College | Particle-assisted nucleic acid sequencing |
| WO2010075570A2 (en) | 2008-12-24 | 2010-07-01 | New York University | Methods, computer-accessible medium, and systems for score-driven whole-genome shotgun sequence assemble |
| KR101065807B1 (ko) | 2009-01-23 | 2011-09-19 | 충남대학교산학협력단 | 액적 기반의 미세유체 칩을 이용한 마이크로 캡슐 제조방법 |
| JP5457222B2 (ja) * | 2009-02-25 | 2014-04-02 | エフ.ホフマン−ラ ロシュ アーゲー | 小型化ハイスループット核酸分析 |
| US9347092B2 (en) | 2009-02-25 | 2016-05-24 | Roche Molecular System, Inc. | Solid support for high-throughput nucleic acid analysis |
| WO2010104597A2 (en) | 2009-03-13 | 2010-09-16 | President And Fellows Of Harvard College | Scale-up of microfluidic devices |
| WO2010104604A1 (en) | 2009-03-13 | 2010-09-16 | President And Fellows Of Harvard College | Method for the controlled creation of emulsions, including multiple emulsions |
| EP2230312A1 (en) | 2009-03-19 | 2010-09-22 | Helmholtz-Zentrum für Infektionsforschung GmbH | Probe compound for detecting and isolating enzymes and means and methods using the same |
| US8528589B2 (en) | 2009-03-23 | 2013-09-10 | Raindance Technologies, Inc. | Manipulation of microfluidic droplets |
| DK2414548T3 (en) | 2009-03-30 | 2015-12-21 | Illumina Inc | Gene expression in single cells |
| US9085798B2 (en) | 2009-04-30 | 2015-07-21 | Prognosys Biosciences, Inc. | Nucleic acid constructs and methods of use |
| EP2427572B1 (en) | 2009-05-01 | 2013-08-28 | Illumina, Inc. | Sequencing methods |
| US9334531B2 (en) | 2010-12-17 | 2016-05-10 | Life Technologies Corporation | Nucleic acid amplification |
| FR2945545B1 (fr) | 2009-05-14 | 2011-08-05 | Univ Aix Marseille Ii | Methode de detection d'adn procaryote extrait d'un echantillon de selles |
| FR2945819B1 (fr) | 2009-05-19 | 2011-06-17 | Commissariat Energie Atomique | Dispositif et procede d'isolement de cibles biologiques ou chimiques |
| US8574835B2 (en) | 2009-05-29 | 2013-11-05 | Life Technologies Corporation | Scaffolded nucleic acid polymer particles and methods of making and using |
| CN102459592B (zh) | 2009-06-15 | 2017-04-05 | 考利达基因组股份有限公司 | 用于长片段阅读测序的方法和组合物 |
| US9524369B2 (en) | 2009-06-15 | 2016-12-20 | Complete Genomics, Inc. | Processing and analysis of complex nucleic acid sequence data |
| AU2010266010B2 (en) | 2009-06-26 | 2015-08-20 | President And Fellows Of Harvard College | Fluid injection |
| US20110028412A1 (en) | 2009-08-03 | 2011-02-03 | Cappellos, Inc. | Herbal enhanced analgesic formulations |
| US20110033548A1 (en) | 2009-08-05 | 2011-02-10 | E.I. Du Pont De Nemours And Company | Degradable crosslinked aminated dextran microspheres and methods of use |
| EP2467479B1 (en) | 2009-08-20 | 2016-01-06 | Population Genetics Technologies Ltd | Compositions and methods for intramolecular nucleic acid rearrangement |
| RU2552215C2 (ru) | 2009-09-01 | 2015-06-10 | Конинклейке Филипс Электроникс Н.В. | Устройство и способ отбора нуклеиновых кислот с помощью микроматриц |
| JP6155418B2 (ja) | 2009-09-02 | 2017-07-05 | バイオ−ラッド・ラボラトリーズ・インコーポレーテッド | 多重エマルジョンの合体による、流体を混合するためのシステム |
| US20120211084A1 (en) | 2009-09-02 | 2012-08-23 | President And Fellows Of Harvard College | Multiple emulsions created using jetting and other techniques |
| US9625454B2 (en) | 2009-09-04 | 2017-04-18 | The Research Foundation For The State University Of New York | Rapid and continuous analyte processing in droplet microfluidic devices |
| GB0918564D0 (en) | 2009-10-22 | 2009-12-09 | Plasticell Ltd | Nested cell encapsulation |
| CA2778816C (en) | 2009-10-27 | 2018-07-31 | President And Fellows Of Harvard College | Droplet creation techniques |
| US10207240B2 (en) | 2009-11-03 | 2019-02-19 | Gen9, Inc. | Methods and microfluidic devices for the manipulation of droplets in high fidelity polynucleotide assembly |
| JP5823405B2 (ja) | 2009-11-04 | 2015-11-25 | ザ ユニバーシティ オブ ブリティッシュ コロンビア | 核酸含有脂質粒子および関連方法 |
| CN102985552B (zh) * | 2009-11-25 | 2016-02-17 | 伯乐生命医学产品有限公司 | 用于检测遗传物质的方法和组合物 |
| US9023769B2 (en) | 2009-11-30 | 2015-05-05 | Complete Genomics, Inc. | cDNA library for nucleic acid sequencing |
| US8835358B2 (en) | 2009-12-15 | 2014-09-16 | Cellular Research, Inc. | Digital counting of individual molecules by stochastic attachment of diverse labels |
| EP2513333B1 (en) | 2009-12-17 | 2013-10-02 | Keygene N.V. | Restriction enzyme based whole genome sequencing |
| US10837883B2 (en) | 2009-12-23 | 2020-11-17 | Bio-Rad Laboratories, Inc. | Microfluidic systems and methods for reducing the exchange of molecules between droplets |
| EP3392349A1 (en) | 2010-02-12 | 2018-10-24 | Raindance Technologies, Inc. | Digital analyte analysis |
| JP5901046B2 (ja) | 2010-02-19 | 2016-04-06 | 国立大学法人 千葉大学 | OATP1B3mRNAの新規な選択的スプライシングバリアント |
| US20110257889A1 (en) | 2010-02-24 | 2011-10-20 | Pacific Biosciences Of California, Inc. | Sequence assembly and consensus sequence determination |
| EP2539450B1 (en) | 2010-02-25 | 2016-02-17 | Advanced Liquid Logic, Inc. | Method of making nucleic acid libraries |
| US8236574B2 (en) | 2010-03-01 | 2012-08-07 | Quanterix Corporation | Ultra-sensitive detection of molecules or particles using beads or other capture objects |
| US10500156B2 (en) | 2010-03-24 | 2019-12-10 | Northeastern University | Multi-compartmental macrophage delivery |
| JP2013524171A (ja) | 2010-03-25 | 2013-06-17 | クァンタライフ・インコーポレーテッド | 液滴ベースのアッセイのための液滴の発生 |
| FR2958186A1 (fr) | 2010-03-30 | 2011-10-07 | Ecole Polytech | Dispositif de formation de gouttes dans un circuit microfluide. |
| US9255291B2 (en) | 2010-05-06 | 2016-02-09 | Bioo Scientific Corporation | Oligonucleotide ligation methods for improving data quality and throughput using massively parallel sequencing |
| US20110287947A1 (en) | 2010-05-18 | 2011-11-24 | University Of Southern California | Tethered Conformation Capture |
| CN105194665A (zh) | 2010-05-26 | 2015-12-30 | 西莱克塔生物科技公司 | 具有不偶合的佐剂的纳米载体组合物 |
| US20120000777A1 (en) | 2010-06-04 | 2012-01-05 | The Regents Of The University Of California | Devices and methods for forming double emulsion droplet compositions and polymer particles |
| EP2580378A4 (en) | 2010-06-08 | 2014-01-01 | Nugen Technologies Inc | MULTIPLEX SEQUENCING METHODS AND COMPOSITION |
| US8703493B2 (en) | 2010-06-15 | 2014-04-22 | Src, Inc. | Location analysis using fire retardant-protected nucleic acid-labeled tags |
| US20120003657A1 (en) | 2010-07-02 | 2012-01-05 | Samuel Myllykangas | Targeted sequencing library preparation by genomic dna circularization |
| WO2012012037A1 (en) * | 2010-07-19 | 2012-01-26 | New England Biolabs, Inc. | Oligonucleotide adaptors: compositions and methods of use |
| US20120034603A1 (en) | 2010-08-06 | 2012-02-09 | Tandem Diagnostics, Inc. | Ligation-based detection of genetic variants |
| CN103202812B (zh) | 2010-08-09 | 2015-10-28 | 南京大学 | 一种制备用于体内递送药理活性物质的蛋白纳米粒的方法 |
| WO2012019765A1 (en) | 2010-08-10 | 2012-02-16 | European Molecular Biology Laboratory (Embl) | Methods and systems for tracking samples and sample combinations |
| US20130203675A1 (en) | 2010-09-16 | 2013-08-08 | Joseph M. DeSimone | Asymmetric biofunctional silyl monomers and particles thereof as prodrugs and delivery vehicles for pharmaceutical, chemical and biological agents |
| CN102409048B (zh) * | 2010-09-21 | 2013-10-23 | 深圳华大基因科技服务有限公司 | 一种基于高通量测序的dna标签文库构建方法 |
| WO2012038839A2 (en) | 2010-09-21 | 2012-03-29 | Population Genetics Technologies Ltd. | Increasing confidence of allele calls with molecular counting |
| US9187783B2 (en) | 2010-10-04 | 2015-11-17 | Genapsys, Inc. | Systems and methods for automated reusable parallel biological reactions |
| US9999886B2 (en) | 2010-10-07 | 2018-06-19 | The Regents Of The University Of California | Methods and systems for on demand droplet generation and impedance based detection |
| EP2625295B1 (en) | 2010-10-08 | 2019-03-13 | President and Fellows of Harvard College | High-throughput immune sequencing |
| CN102050953B (zh) | 2010-10-18 | 2012-11-07 | 武汉理工大学 | 一种可还原降解超分子水凝胶的制备方法 |
| WO2012055929A1 (en) | 2010-10-26 | 2012-05-03 | Illumina, Inc. | Sequencing methods |
| US20130225623A1 (en) | 2010-10-27 | 2013-08-29 | Mount Sinai School Of Medicine | Methods of Treating Psychiatric or Neurological Disorders with MGLUR Antagonists |
| DE202011110979U1 (de) | 2010-11-01 | 2017-12-04 | Bio-Rad Laboratories, Inc. | System zum Bilden von Emulsionen |
| US9074251B2 (en) | 2011-02-10 | 2015-07-07 | Illumina, Inc. | Linking sequence reads using paired code tags |
| EP2635679B1 (en) | 2010-11-05 | 2017-04-19 | Illumina, Inc. | Linking sequence reads using paired code tags |
| US8829171B2 (en) | 2011-02-10 | 2014-09-09 | Illumina, Inc. | Linking sequence reads using paired code tags |
| CN102115789B (zh) * | 2010-12-15 | 2013-03-13 | 厦门大学 | 用于第二代高通量测序的核酸标签及其设计方法 |
| US20140057799A1 (en) | 2010-12-16 | 2014-02-27 | Gigagen | System and Methods for Massively Parallel Analysis of Nucleic Acids in Single Cells |
| US9163281B2 (en) | 2010-12-23 | 2015-10-20 | Good Start Genetics, Inc. | Methods for maintaining the integrity and identification of a nucleic acid template in a multiplex sequencing reaction |
| WO2012088348A2 (en) | 2010-12-23 | 2012-06-28 | Sequenom, Inc. | Fetal genetic variation detection |
| WO2012100216A2 (en) | 2011-01-20 | 2012-07-26 | Knome, Inc. | Methods and apparatus for assigning a meaningful numeric value to genomic variants, and searching and assessing same |
| GB201101429D0 (en) | 2011-01-27 | 2011-03-16 | Biocompatibles Uk Ltd | Drug delivery system |
| US8765455B2 (en) * | 2011-01-27 | 2014-07-01 | Lawrence Livermore National Security, Llc | Chip-based droplet sorting |
| DK3037536T3 (da) | 2011-01-28 | 2020-01-13 | Illumina Inc | Oligonukleotiderstatning for di-taggede og retnings biblioteker |
| WO2012106385A2 (en) | 2011-01-31 | 2012-08-09 | Apprise Bio, Inc. | Methods of identifying multiple epitopes in cells |
| AU2012212148B8 (en) * | 2011-02-02 | 2017-07-06 | University Of Washington Through Its Center For Commercialization | Massively parallel contiguity mapping |
| JP2014506465A (ja) * | 2011-02-09 | 2014-03-17 | バイオ−ラド ラボラトリーズ,インコーポレイティド | 核酸の分析 |
| WO2012109604A1 (en) | 2011-02-11 | 2012-08-16 | Raindance Technologies, Inc. | Thermocycling device for nucleic acid amplification and methods of use |
| EP3412778A1 (en) | 2011-02-11 | 2018-12-12 | Raindance Technologies, Inc. | Methods for forming mixed droplets |
| WO2012112804A1 (en) | 2011-02-18 | 2012-08-23 | Raindance Technoligies, Inc. | Compositions and methods for molecular labeling |
| CA2824431A1 (en) | 2011-02-25 | 2012-08-30 | Illumina, Inc. | Methods and systems for haplotype determination |
| WO2012116250A1 (en) | 2011-02-25 | 2012-08-30 | University Of Massachusetts Medical School | Monomers and polymers for functional polycarbonates and poly (ester-carbonates) and peg-co-polycarbonate hydrogels |
| EP2681196B1 (en) | 2011-03-04 | 2015-09-09 | Life Technologies Corporation | Compounds and methods for conjugation of biomolecules |
| WO2012122555A2 (en) | 2011-03-09 | 2012-09-13 | Lawrence Ganeshalingam | Biological data networks and methods therefor |
| WO2012129187A1 (en) * | 2011-03-18 | 2012-09-27 | Bio-Rad Laboratories, Inc. | Multiplexed digital assays with combinatorial use of signals |
| WO2012129363A2 (en) | 2011-03-24 | 2012-09-27 | President And Fellows Of Harvard College | Single cell nucleic acid detection and analysis |
| GB2489714B (en) | 2011-04-05 | 2013-11-06 | Tracesa Ltd | Fluid Identification Method |
| CN107368705B (zh) | 2011-04-14 | 2021-07-13 | 完整基因有限公司 | 分析生物体的基因组dna的方法和计算机系统 |
| AU2012249759A1 (en) | 2011-04-25 | 2013-11-07 | Bio-Rad Laboratories, Inc. | Methods and compositions for nucleic acid analysis |
| EP2702170B1 (en) | 2011-04-28 | 2015-12-16 | Life Technologies Corporation | Methods and compositions for multiplex pcr |
| SI3415619T1 (sl) | 2011-04-28 | 2021-04-30 | The Board of Trustees of the Leland Stanford Junior University Office of the General Counsel Building 170, Third Floor, Main Quad | Identifikacija polinukleotidov, povezanih z vzorcem |
| EP2705156B1 (en) | 2011-05-05 | 2015-08-26 | Institut National de la Santé et de la Recherche Médicale (INSERM) | Linear dna amplification |
| US20140227706A1 (en) * | 2011-05-16 | 2014-08-14 | Dna Chip Research Inc. | Method for assessing progression of clinical state of malignant neoplasm by quantitative detection of DNA in blood |
| JP5993940B2 (ja) | 2011-05-16 | 2016-09-21 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 生体直交型薬物活性化 |
| US9005935B2 (en) | 2011-05-23 | 2015-04-14 | Agilent Technologies, Inc. | Methods and compositions for DNA fragmentation and tagging by transposases |
| JP6122843B2 (ja) | 2011-05-23 | 2017-04-26 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 多重エマルジョンを含むエマルジョンの制御 |
| WO2012166425A2 (en) | 2011-05-27 | 2012-12-06 | President And Fellows Of Harvard College | Methods of amplifying whole genome of a single cell |
| EP3709018A1 (en) | 2011-06-02 | 2020-09-16 | Bio-Rad Laboratories, Inc. | Microfluidic apparatus for identifying components of a chemical reaction |
| US8841071B2 (en) | 2011-06-02 | 2014-09-23 | Raindance Technologies, Inc. | Sample multiplexing |
| US9150916B2 (en) | 2011-06-24 | 2015-10-06 | Beat Christen | Compositions and methods for identifying the essential genome of an organism |
| US8927218B2 (en) | 2011-06-27 | 2015-01-06 | Flir Systems, Inc. | Methods and compositions for segregating target nucleic acid from mixed nucleic acid samples |
| US8975302B2 (en) | 2011-07-07 | 2015-03-10 | Life Technologies Corporation | Polymer particles, nucleic acid polymer particles and methods of making and using the same |
| US20130017978A1 (en) | 2011-07-11 | 2013-01-17 | Finnzymes Oy | Methods and transposon nucleic acids for generating a dna library |
| US8658430B2 (en) | 2011-07-20 | 2014-02-25 | Raindance Technologies, Inc. | Manipulating droplet size |
| US9605304B2 (en) | 2011-07-20 | 2017-03-28 | The Hong Kong Polytechnic University | Ultra-stable oligonucleotide-gold and-silver nanoparticle conjugates and method of their preparation |
| US20130189700A1 (en) * | 2011-07-25 | 2013-07-25 | Bio-Rad Laboratories, Inc. | Breakage of an emulsion containing nucleic acid |
| WO2013020089A2 (en) | 2011-08-04 | 2013-02-07 | Sage Science, Inc. | Systems and methods for processing fluids |
| US10364464B2 (en) | 2011-08-08 | 2019-07-30 | The Broad Institute, Inc. | Compositions and methods for co-amplifying subsequences of a nucleic acid fragment sequence |
| US8846883B2 (en) | 2011-08-16 | 2014-09-30 | University Of Southhampton | Oligonucleotide ligation |
| WO2013035114A1 (en) | 2011-09-08 | 2013-03-14 | Decode Genetics Ehf | Tp53 genetic variants predictive of cancer |
| GB2496016B (en) | 2011-09-09 | 2016-03-16 | Univ Leland Stanford Junior | Methods for obtaining a sequence |
| CN103945931B (zh) | 2011-09-26 | 2017-03-22 | 基因技术股份公司 | 高效的小体积核酸合成 |
| WO2013095737A2 (en) | 2011-09-28 | 2013-06-27 | President And Fellows Of Harvard College | Systems and methods for droplet production and/or fluidic manipulation |
| WO2013055955A1 (en) | 2011-10-12 | 2013-04-18 | Complete Genomics, Inc. | Identification of dna fragments and structural variations |
| US9469874B2 (en) | 2011-10-18 | 2016-10-18 | The Regents Of The University Of California | Long-range barcode labeling-sequencing |
| US20130109576A1 (en) | 2011-10-28 | 2013-05-02 | Anthony P. Shuber | Methods for detecting mutations |
| JP2014534771A (ja) | 2011-11-04 | 2014-12-18 | インテル コーポレイション | 下りリンク協調マルチポイント通信の構成のためのシグナリング |
| WO2013072790A1 (en) | 2011-11-16 | 2013-05-23 | International Business Machines Corporation | Microfluidic device with deformable valve |
| US10689643B2 (en) | 2011-11-22 | 2020-06-23 | Active Motif, Inc. | Targeted transposition for use in epigenetic studies |
| US9938524B2 (en) | 2011-11-22 | 2018-04-10 | Active Motif, Inc. | Multiplex isolation of protein-associated nucleic acids |
| CN104245917B (zh) | 2011-12-03 | 2017-07-21 | Emd密理博公司 | 用于微流体细胞培养的微型培育系统和方法 |
| US10227639B2 (en) | 2011-12-22 | 2019-03-12 | President And Fellows Of Harvard College | Compositions and methods for analyte detection |
| WO2013096643A1 (en) | 2011-12-23 | 2013-06-27 | Gigagen | Methods and apparatuses for droplet mixing |
| RU2643034C2 (ru) | 2012-02-09 | 2018-01-30 | Лайф Текнолоджис Корпорейшн | Гидрофильные полимерные частицы и способы их получения |
| CN104271768A (zh) | 2012-02-14 | 2015-01-07 | 约翰霍普金斯大学 | miRNA分析方法 |
| CA2864287C (en) | 2012-02-15 | 2021-01-12 | Wisconsin Alumni Research Foundation | Dithioamine reducing agents |
| EP3854873A1 (en) | 2012-02-17 | 2021-07-28 | Fred Hutchinson Cancer Research Center | Compositions and methods for accurately identifying mutations |
| US10202628B2 (en) | 2012-02-17 | 2019-02-12 | President And Fellows Of Harvard College | Assembly of nucleic acid sequences in emulsions |
| US9176031B2 (en) | 2012-02-24 | 2015-11-03 | Raindance Technologies, Inc. | Labeling and sample preparation for sequencing |
| WO2013134261A1 (en) | 2012-03-05 | 2013-09-12 | President And Fellows Of Harvard College | Systems and methods for epigenetic sequencing |
| NO2694769T3 (ko) | 2012-03-06 | 2018-03-03 | ||
| US9552458B2 (en) | 2012-03-16 | 2017-01-24 | The Research Institute At Nationwide Children's Hospital | Comprehensive analysis pipeline for discovery of human genetic variation |
| US20150125904A1 (en) | 2012-03-30 | 2015-05-07 | Massachusetts Institute Of Technology | Probe incorporation mediated by enzymes |
| EP2647426A1 (en) | 2012-04-03 | 2013-10-09 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Replication of distributed nucleic acid molecules with preservation of their relative distribution through hybridization-based binding |
| US8209130B1 (en) | 2012-04-04 | 2012-06-26 | Good Start Genetics, Inc. | Sequence assembly |
| CA2870160C (en) | 2012-04-16 | 2021-08-24 | Biological Dynamics, Inc. | Nucleic acid sample preparation |
| US20130296173A1 (en) | 2012-04-23 | 2013-11-07 | Complete Genomics, Inc. | Pre-anchor wash |
| EP3514243B1 (en) | 2012-05-21 | 2022-08-17 | The Scripps Research Institute | Methods of sample preparation |
| ES2774165T3 (es) | 2012-06-15 | 2020-07-17 | Univ Texas | Secuenciación de alto rendimiento de múltiples transcritos de una única célula |
| SG11201500313YA (en) | 2012-07-24 | 2015-02-27 | Sequenta Inc | Single cell analysis using sequence tags |
| JP6525872B2 (ja) | 2012-08-08 | 2019-06-05 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 細胞中の複数のエピトープを同定するためのダイナミックレンジを高めること |
| CN110643681A (zh) | 2012-08-13 | 2020-01-03 | 加利福尼亚大学董事会 | 用于检测生物组分的方法和系统 |
| US9388465B2 (en) | 2013-02-08 | 2016-07-12 | 10X Genomics, Inc. | Polynucleotide barcode generation |
| CN114891871A (zh) | 2012-08-14 | 2022-08-12 | 10X基因组学有限公司 | 微胶囊组合物及方法 |
| US20140378345A1 (en) | 2012-08-14 | 2014-12-25 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US11591637B2 (en) | 2012-08-14 | 2023-02-28 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| US20150005200A1 (en) | 2012-08-14 | 2015-01-01 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US10584381B2 (en) | 2012-08-14 | 2020-03-10 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9701998B2 (en) | 2012-12-14 | 2017-07-11 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10221442B2 (en) | 2012-08-14 | 2019-03-05 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| US10752949B2 (en) | 2012-08-14 | 2020-08-25 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US20140378349A1 (en) | 2012-08-14 | 2014-12-25 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US10323279B2 (en) | 2012-08-14 | 2019-06-18 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US9951386B2 (en) | 2014-06-26 | 2018-04-24 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US20140378322A1 (en) * | 2012-08-14 | 2014-12-25 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US20150005199A1 (en) | 2012-08-14 | 2015-01-01 | 10X Technologies, Inc. | Compositions and methods for sample processing |
| US10273541B2 (en) | 2012-08-14 | 2019-04-30 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| WO2014047561A1 (en) * | 2012-09-21 | 2014-03-27 | The Broad Institute Inc. | Compositions and methods for labeling of agents |
| US9644199B2 (en) * | 2012-10-01 | 2017-05-09 | Agilent Technologies, Inc. | Immobilized transposase complexes for DNA fragmentation and tagging |
| GB201217772D0 (en) | 2012-10-04 | 2012-11-14 | Base4 Innovation Ltd | Sequencing method |
| FR2996545B1 (fr) | 2012-10-08 | 2016-03-25 | Ecole Polytech | Procede microfluidique de traitement et d'analyse d'une solution contenant un materiel biologique, et circuit microfluidique correspondant. |
| FR2996544B1 (fr) | 2012-10-08 | 2015-03-13 | Ecole Polytech | Circuit microfluidique permettant la mise en contact de gouttes de plusieurs fluides, et procede microfluidique correspondant. |
| CN104838014B (zh) | 2012-10-15 | 2017-06-30 | 生命技术公司 | 用于标靶核酸富集的组合物、方法、系统和试剂盒 |
| EP2914745B1 (en) | 2012-11-05 | 2017-09-06 | Rubicon Genomics, Inc. | Barcoding nucleic acids |
| EP2917366B1 (en) | 2012-11-06 | 2017-08-02 | Oxford Nanopore Technologies Limited | Quadruplex method |
| US20140127688A1 (en) | 2012-11-07 | 2014-05-08 | Good Start Genetics, Inc. | Methods and systems for identifying contamination in samples |
| US20150299772A1 (en) | 2012-12-03 | 2015-10-22 | Elim Biopharmaceuticals, Inc. | Single-stranded polynucleotide amplification methods |
| EP2931899A1 (en) | 2012-12-12 | 2015-10-21 | The Broad Institute, Inc. | Functional genomics using crispr-cas systems, compositions, methods, knock out libraries and applications thereof |
| PT2921557T (pt) | 2012-12-12 | 2016-10-19 | Massachusetts Inst Technology | Engenharia de sistemas, métodos e composições guia otimizadas para a manipulação de sequências |
| US10533221B2 (en) | 2012-12-14 | 2020-01-14 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| EP3567116A1 (en) | 2012-12-14 | 2019-11-13 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| EP2749653A1 (en) | 2012-12-28 | 2014-07-02 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Molecular coding for analysis of composition of macromolecules and molecular complexes |
| EP2752664A1 (en) | 2013-01-07 | 2014-07-09 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Label-free method for the detection of analytes |
| US9683230B2 (en) | 2013-01-09 | 2017-06-20 | Illumina Cambridge Limited | Sample preparation on a solid support |
| EP2994749A4 (en) | 2013-01-17 | 2017-07-19 | Edico Genome Corp. | Bioinformatics systems, apparatuses, and methods executed on an integrated circuit processing platform |
| KR101984699B1 (ko) | 2013-01-24 | 2019-05-31 | 삼성전자주식회사 | 핵산 분석용 미세 유체 시스템 |
| EP3473905B1 (en) | 2013-01-25 | 2020-07-29 | Bio-rad Laboratories, Inc. | System and method for performing droplet inflation |
| US10381106B2 (en) | 2013-01-28 | 2019-08-13 | Hasso-Plattner-Institut Fuer Softwaresystemtechnik Gmbh | Efficient genomic read alignment in an in-memory database |
| WO2014121241A1 (en) | 2013-02-01 | 2014-08-07 | Bio-Rad Laboratories, Inc. | System for detection of spaced droplets |
| JP2016514047A (ja) | 2013-03-06 | 2016-05-19 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 比較的単分散の液滴を形成するためのデバイスおよび方法 |
| WO2014138711A1 (en) | 2013-03-08 | 2014-09-12 | Bio-Rad Laboratories, Inc. | Compositions, methods and systems for polymerase chain reaction assays |
| DK3553175T3 (da) | 2013-03-13 | 2021-08-23 | Illumina Inc | Fremgangsmåde til fremstilling af et nukleinsyresekvenseringsbibliotek |
| US10612088B2 (en) | 2013-03-14 | 2020-04-07 | The Broad Institute, Inc. | Massively multiplexed RNA sequencing |
| US9273349B2 (en) | 2013-03-14 | 2016-03-01 | Affymetrix, Inc. | Detection of nucleic acids |
| JP6587544B2 (ja) | 2013-03-15 | 2019-10-09 | シグニス バイオテク エセ.エレ.ウ.Sygnis Biotech S.L.U. | 熱安定なTthPrimPolを用いた増幅及び配列決定方法 |
| US20140274729A1 (en) | 2013-03-15 | 2014-09-18 | Nugen Technologies, Inc. | Methods, compositions and kits for generation of stranded rna or dna libraries |
| US9328382B2 (en) | 2013-03-15 | 2016-05-03 | Complete Genomics, Inc. | Multiple tagging of individual long DNA fragments |
| US11231419B2 (en) | 2013-03-15 | 2022-01-25 | Prognosys Biosciences, Inc. | Methods for detecting peptide/MHC/TCR binding |
| WO2014145760A1 (en) | 2013-03-15 | 2014-09-18 | Bio-Rad Laboratories, Inc. | Droplet generator with collection tube |
| CA2906818C (en) | 2013-03-15 | 2022-08-16 | Verinata Health, Inc. | Generating cell-free dna libraries directly from blood |
| WO2014144495A1 (en) | 2013-03-15 | 2014-09-18 | Abvitro, Inc. | Single cell bar-coding for antibody discovery |
| EP2981349A4 (en) | 2013-04-02 | 2016-11-16 | Raindance Technologies Inc | SYSTEMS AND METHODS FOR HANDLING MICROFLUIDIC DROPLETS |
| EP2994559B1 (en) | 2013-05-09 | 2020-07-08 | Bio-rad Laboratories, Inc. | Magnetic immuno digital pcr assay |
| EP4321628A2 (en) | 2013-05-23 | 2024-02-14 | The Board of Trustees of the Leland Stanford Junior University | Transposition into native chromatin for personal epigenomics |
| US20160122753A1 (en) | 2013-06-12 | 2016-05-05 | Tarjei Mikkelsen | High-throughput rna-seq |
| EP3587585B1 (en) | 2013-06-12 | 2021-03-24 | The General Hospital Corporation | Methods, kits, and systems for multiplexed detection of target molecules and uses thereof |
| DK3011031T3 (da) | 2013-06-17 | 2020-12-21 | Broad Inst Inc | Fremføring og anvendelse af crispr-cas-systemerne, vektorer og sammensætninger til levermålretning og -terapi |
| US20160208323A1 (en) | 2013-06-21 | 2016-07-21 | The Broad Institute, Inc. | Methods for Shearing and Tagging DNA for Chromatin Immunoprecipitation and Sequencing |
| CA2915499A1 (en) | 2013-06-27 | 2014-12-31 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| EP3019618B1 (en) | 2013-07-12 | 2018-10-31 | University of South Alabama | Minimal piggybac vectors for genome integration |
| CN103394410B (zh) | 2013-07-25 | 2016-04-20 | 博奥生物集团有限公司 | 一种位置可调节的智能磁力架 |
| GB2516684A (en) | 2013-07-30 | 2015-02-04 | Sphere Fluidics Ltd | Microfluidic devices and systems |
| KR102402446B1 (ko) | 2013-08-28 | 2022-05-30 | 벡톤 디킨슨 앤드 컴퍼니 | 대량의 동시 단일 세포 분석 |
| US10395758B2 (en) | 2013-08-30 | 2019-08-27 | 10X Genomics, Inc. | Sequencing methods |
| CA2959978A1 (en) | 2013-09-24 | 2015-04-02 | The Regents Of The University Of California | Encapsulated sensors and sensing systems for bioassays and diagnostics and methods for making and using them |
| GB201317301D0 (en) | 2013-09-30 | 2013-11-13 | Linnarsson Sten | Method for capturing and encoding nucleic acid from a plurality of single cells |
| EP3055431B1 (en) | 2013-10-09 | 2020-06-24 | Stc.Unm | Synthetic long read dna sequencing |
| WO2015065924A2 (en) | 2013-10-28 | 2015-05-07 | Massachusetts Institute Of Technology | Hydrogel microstructures with immiscible fluid isolation for small reaction volumes |
| US9824068B2 (en) | 2013-12-16 | 2017-11-21 | 10X Genomics, Inc. | Methods and apparatus for sorting data |
| US20140315755A1 (en) | 2013-12-26 | 2014-10-23 | Tao Chen | Genome-wide Antisense Oligonucleotide and RNAi |
| AU2014373757B2 (en) | 2013-12-30 | 2019-12-12 | Atreca, Inc. | Analysis of nucleic acids associated with single cells using nucleic acid barcodes |
| KR101464100B1 (ko) | 2014-01-29 | 2014-11-21 | 성균관대학교산학협력단 | 생체 적용 가능한 리포솜-핵산형광 나노 융합체, 이의 응용, 및 이의 제조방법 |
| EP3102691B1 (en) | 2014-02-03 | 2019-09-11 | Thermo Fisher Scientific Baltics UAB | Method for controlled dna fragmentation |
| EP2986761B1 (en) | 2014-02-13 | 2018-08-15 | Bio-rad Laboratories, Inc. | Chromosome conformation capture in droplet partitions |
| CA2940669C (en) | 2014-02-27 | 2023-10-03 | Igenomx International Genomics Corporation | Methods for analysis of somatic mobile elements, and uses thereof |
| US9694361B2 (en) | 2014-04-10 | 2017-07-04 | 10X Genomics, Inc. | Fluidic devices, systems, and methods for encapsulating and partitioning reagents, and applications of same |
| CN113005108A (zh) | 2014-04-15 | 2021-06-22 | 伊鲁米那股份有限公司 | 用于改进插入序列偏倚和增加dna输入耐受性的修饰的转座酶 |
| US20150298091A1 (en) | 2014-04-21 | 2015-10-22 | President And Fellows Of Harvard College | Systems and methods for barcoding nucleic acids |
| LT3456846T (lt) | 2014-04-21 | 2022-09-12 | President And Fellows Of Harvard College | Nukleorūgšties unikalios sekos įvedimo sistemos ir būdai |
| US10975371B2 (en) | 2014-04-29 | 2021-04-13 | Illumina, Inc. | Nucleic acid sequence analysis from single cells |
| US10526601B2 (en) | 2014-05-23 | 2020-01-07 | Digenomix Corporation | Haploidome determination by digitized transposons |
| EP3628684A1 (en) | 2014-06-06 | 2020-04-01 | Herlev Hospital | Determining antigen recognition through barcoding of mhc multimers |
| WO2015191877A1 (en) | 2014-06-11 | 2015-12-17 | Life Technologies Corporation | Systems and methods for substrate enrichment |
| US10704080B2 (en) | 2014-06-11 | 2020-07-07 | Samplix Aps | Nucleotide sequence exclusion enrichment by droplet sorting (NEEDLS) |
| EP3155426B1 (en) | 2014-06-13 | 2023-07-19 | Immudex ApS | General detection and isolation of specific cells by binding of labeled molecules |
| US10480021B2 (en) | 2014-06-23 | 2019-11-19 | Yale University | Methods for closed chromatin mapping and DNA methylation analysis for single cells |
| CN114214314A (zh) | 2014-06-24 | 2022-03-22 | 生物辐射实验室股份有限公司 | 数字式pcr条码化 |
| EP3161162A4 (en) | 2014-06-26 | 2018-01-10 | 10X Genomics, Inc. | Analysis of nucleic acid sequences |
| US10017759B2 (en) | 2014-06-26 | 2018-07-10 | Illumina, Inc. | Library preparation of tagged nucleic acid |
| WO2015200871A1 (en) | 2014-06-26 | 2015-12-30 | 10X Genomics, Inc. | Methods and compositions for sample analysis |
| CN113249435A (zh) | 2014-06-26 | 2021-08-13 | 10X基因组学有限公司 | 分析来自单个细胞或细胞群体的核酸的方法 |
| WO2015200891A1 (en) | 2014-06-26 | 2015-12-30 | 10X Technologies, Inc. | Processes and systems for nucleic acid sequence assembly |
| EP3940703A1 (en) | 2014-07-18 | 2022-01-19 | Illumina, Inc. | Non-invasive prenatal diagnosis of fetal genetic conditions using cellular dna and cell free dna |
| US20160024558A1 (en) | 2014-07-23 | 2016-01-28 | 10X Genomics, Inc. | Nucleic acid binding proteins and uses thereof |
| CN105335116B (zh) | 2014-07-30 | 2018-11-09 | 联想(北京)有限公司 | 一种显示控制方法及电子设备 |
| WO2016033251A2 (en) | 2014-08-26 | 2016-03-03 | Nugen Technologies, Inc. | Compositions and methods for targeted nucleic acid sequence enrichment and high efficiency library generation |
| CA2997906A1 (en) | 2014-09-09 | 2016-03-17 | The Broad Institute, Inc. | A droplet-based method and apparatus for composite single-cell nucleic acid analysis |
| MX2017003382A (es) | 2014-09-15 | 2017-11-20 | Abvitro Llc | Secuenciacion de bibliotecas de nucleotidos de alto rendimiento. |
| WO2016061517A2 (en) | 2014-10-17 | 2016-04-21 | Illumina Cambridge Limited | Contiguity preserving transposition |
| BR112017008877A2 (pt) * | 2014-10-29 | 2018-07-03 | 10X Genomics Inc | métodos e composições para sequenciamento de ácido nucleico-alvo |
| US9975122B2 (en) | 2014-11-05 | 2018-05-22 | 10X Genomics, Inc. | Instrument systems for integrated sample processing |
| US20180320241A1 (en) | 2014-12-19 | 2018-11-08 | Roche Sequencing Solutions, Inc. | Methods for identifying multiple epitopes in selected sub-populations of cells |
| AU2016207023B2 (en) | 2015-01-12 | 2019-12-05 | 10X Genomics, Inc. | Processes and systems for preparing nucleic acid sequencing libraries and libraries prepared using same |
| CN107209814B (zh) | 2015-01-13 | 2021-10-15 | 10X基因组学有限公司 | 用于使结构变异和相位信息可视化的系统和方法 |
| WO2016126882A1 (en) | 2015-02-04 | 2016-08-11 | Twist Bioscience Corporation | Methods and devices for de novo oligonucleic acid assembly |
| CN107530654A (zh) | 2015-02-04 | 2018-01-02 | 加利福尼亚大学董事会 | 通过在离散实体中条形码化对核酸进行测序 |
| MX2017010142A (es) | 2015-02-09 | 2017-12-11 | 10X Genomics Inc | Sistemas y metodos para determinar variacion estructural y ajuste de fases con datos de recuperacion de variantes. |
| KR20170135834A (ko) | 2015-02-10 | 2017-12-08 | 일루미나, 인코포레이티드 | 세포 성분을 분석하기 위한 방법 및 조성물 |
| CN115651972A (zh) | 2015-02-24 | 2023-01-31 | 10X 基因组学有限公司 | 用于靶向核酸序列覆盖的方法 |
| WO2016137973A1 (en) | 2015-02-24 | 2016-09-01 | 10X Genomics Inc | Partition processing methods and systems |
| EP3262192B1 (en) | 2015-02-27 | 2020-09-16 | Becton, Dickinson and Company | Spatially addressable molecular barcoding |
| WO2016145409A1 (en) | 2015-03-11 | 2016-09-15 | The Broad Institute, Inc. | Genotype and phenotype coupling |
| WO2016149661A1 (en) | 2015-03-18 | 2016-09-22 | The Broad Institute, Inc. | Massively parallel on-chip coalescence of microemulsions |
| WO2016160908A1 (en) | 2015-03-30 | 2016-10-06 | Verily Life Sciences Llc | Methods for combining single cell profiling with combinatorial nanoparticle conjugate library screening |
| JP2018511341A (ja) | 2015-04-17 | 2018-04-26 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 遺伝子配列決定および他の適用のためのバーコード化システムおよび方法 |
| CN107250447B (zh) | 2015-04-20 | 2020-05-05 | 深圳华大生命科学研究院 | 一种长片段dna文库构建方法 |
| EP3708256B1 (en) | 2015-04-22 | 2022-11-30 | Stilla Technologies | Contact-less priming method for loading a solution in a microfluidic device and associated system |
| US20160314242A1 (en) | 2015-04-23 | 2016-10-27 | 10X Genomics, Inc. | Sample indexing methods and compositions for sequencing applications |
| WO2016187256A2 (en) | 2015-05-18 | 2016-11-24 | 10X Genomics, Inc. | Mobile solid phase compositions for use in biochemical reactions and analyses |
| WO2016187179A1 (en) | 2015-05-18 | 2016-11-24 | 10X Genomics, Inc. | Stabilized reducing agents and methods using same |
| WO2016191380A1 (en) | 2015-05-26 | 2016-12-01 | Pacific Biosciences Of California, Inc. | De novo diploid genome assembly and haplotype sequence reconstruction |
| WO2016187717A1 (en) | 2015-05-26 | 2016-12-01 | Exerkine Corporation | Exosomes useful for genome editing |
| WO2016191618A1 (en) | 2015-05-27 | 2016-12-01 | Jianbiao Zheng | Methods of inserting molecular barcodes |
| AU2016281766B2 (en) | 2015-06-24 | 2019-05-09 | Oxford BioDynamics PLC | Epigenetic chromosome interactions |
| MX2018000729A (es) | 2015-07-17 | 2018-09-06 | Harvard College | Métodos para amplificar las secuencias de ácido nucleico. |
| US10934636B2 (en) | 2015-08-12 | 2021-03-02 | CeMM—FORSCHUNGSZENTRUM FÜR MOLEKULARE MEDIZIN GmbH | Methods for studying nucleic acids |
| US11479805B2 (en) | 2015-08-21 | 2022-10-25 | The General Hospital Corporation | Combinatorial single molecule analysis of chromatin |
| AU2016326737B2 (en) | 2015-09-24 | 2023-01-12 | Abvitro Llc | Affinity-oligonucleotide conjugates and uses thereof |
| US10900031B2 (en) | 2015-10-19 | 2021-01-26 | Zhejiang Annoroad Bio-Technology Co. Ltd. | Method for constructing high-resolution single cell Hi-C library with a lot of information |
| CN108368522A (zh) | 2015-10-20 | 2018-08-03 | 10X 基因组学有限公司 | 用于高通量单细胞遗传操作的方法和系统 |
| WO2017075265A1 (en) | 2015-10-28 | 2017-05-04 | The Broad Institute, Inc. | Multiplex analysis of single cell constituents |
| WO2017075294A1 (en) | 2015-10-28 | 2017-05-04 | The Board Institute Inc. | Assays for massively combinatorial perturbation profiling and cellular circuit reconstruction |
| CA3004310A1 (en) | 2015-11-04 | 2017-05-11 | Atreca, Inc. | Combinatorial sets of nucleic acid barcodes for analysis of nucleic acids associated with single cells |
| SG11201803983UA (en) | 2015-11-19 | 2018-06-28 | 10X Genomics Inc | Transformable tagging compositions, methods, and processes incorporating same |
| EP3384048B1 (en) | 2015-12-04 | 2021-03-24 | 10X Genomics, Inc. | Methods and compositions for nucleic acid analysis |
| WO2017117358A1 (en) | 2015-12-30 | 2017-07-06 | Bio-Rad Laboratories, Inc. | Digital protein quantification |
| US20170260584A1 (en) | 2016-02-11 | 2017-09-14 | 10X Genomics, Inc. | Cell population analysis using single nucleotide polymorphisms from single cell transcriptomes |
| JP6735348B2 (ja) | 2016-02-11 | 2020-08-05 | 10エックス ジェノミクス, インコーポレイテッド | 全ゲノム配列データのデノボアセンブリのためのシステム、方法及び媒体 |
| US20190078150A1 (en) | 2016-03-01 | 2019-03-14 | Universal Sequencing Technology Corporation | Methods and Kits for Tracking Nucleic Acid Target Origin for Nucleic Acid Sequencing |
| US11680253B2 (en) | 2016-03-10 | 2023-06-20 | The Board Of Trustees Of The Leland Stanford Junior University | Transposase-mediated imaging of the accessible genome |
| WO2017180420A1 (en) | 2016-04-11 | 2017-10-19 | Board Of Regents, The University Of Texas System | Methods and compositions for detecting single t cell receptor affinity and sequence |
| WO2017197343A2 (en) | 2016-05-12 | 2017-11-16 | 10X Genomics, Inc. | Microfluidic on-chip filters |
| WO2017197338A1 (en) | 2016-05-13 | 2017-11-16 | 10X Genomics, Inc. | Microfluidic systems and methods of use |
| WO2018031631A1 (en) | 2016-08-10 | 2018-02-15 | President And Fellows Of Harvard College | Methods of de novo assembly of barcoded genomic dna fragments |
| WO2018039338A1 (en) | 2016-08-23 | 2018-03-01 | 10X Genomics, Inc. | Microfluidic surface-mediated emulsion stability control |
| WO2018044831A1 (en) | 2016-08-30 | 2018-03-08 | Integrated Dna Technologies, Inc. | Cleavable hairpin primers |
| GB2569252A (en) | 2016-08-31 | 2019-06-12 | Harvard College | Methods of combining the detection of biomolecules into a single assay using fluorescent in situ sequencing |
| WO2018039969A1 (en) | 2016-08-31 | 2018-03-08 | President And Fellows Of Harvard College | Methods of whole genome digital amplification |
| US20180080021A1 (en) | 2016-09-17 | 2018-03-22 | The Board Of Trustees Of The Leland Stanford Junior University | Simultaneous sequencing of rna and dna from the same sample |
| CA3034924A1 (en) | 2016-09-26 | 2018-03-29 | Cellular Research, Inc. | Measurement of protein expression using reagents with barcoded oligonucleotide sequences |
| EP4026905B1 (en) | 2016-10-19 | 2024-04-17 | 10X Genomics, Inc. | Methods for barcoding nucleic acid molecules from individual cells or cell populations |
| DK3553180T3 (da) | 2016-12-07 | 2022-07-25 | Mgi Tech Co Ltd | Fremgangsmåde til konstruktion af enkeltcellesekventeringsbibliotek og anvendelse deraf |
| EP3555290B1 (en) | 2016-12-19 | 2022-11-02 | Bio-Rad Laboratories, Inc. | Droplet tagging contiguity preserved tagmented dna |
| AU2017382905A1 (en) | 2016-12-21 | 2019-07-04 | The Regents Of The University Of California | Single cell genomic sequencing using hydrogel based droplets |
| US10011872B1 (en) | 2016-12-22 | 2018-07-03 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US10815525B2 (en) | 2016-12-22 | 2020-10-27 | 10X Genomics, Inc. | Methods and systems for processing polynucleotides |
| US20190177800A1 (en) | 2017-12-08 | 2019-06-13 | 10X Genomics, Inc. | Methods and compositions for labeling cells |
| EP3565904A1 (en) | 2016-12-29 | 2019-11-13 | Illumina, Inc. | Analysis system for orthogonal access to and tagging of biomolecules in cellular compartments |
| WO2018129368A2 (en) | 2017-01-06 | 2018-07-12 | Editas Medicine, Inc. | Methods of assessing nuclease cleavage |
| EP3568508A4 (en) | 2017-01-12 | 2020-12-16 | Massachusetts Institute Of Technology | METHODS FOR T-LYMPHOCYTE RECEPTOR AND B-LYMPHOCYTE RECEPTOR ANALYSIS |
| CN117512066A (zh) | 2017-01-30 | 2024-02-06 | 10X基因组学有限公司 | 用于基于微滴的单细胞条形编码的方法和系统 |
| US10347365B2 (en) | 2017-02-08 | 2019-07-09 | 10X Genomics, Inc. | Systems and methods for visualizing a pattern in a dataset |
| GB201704402D0 (en) | 2017-03-20 | 2017-05-03 | Blacktrace Holdings Ltd | Single cell DNA sequencing |
| CN110462058A (zh) | 2017-03-24 | 2019-11-15 | 新加坡国立大学 | 用于多重检测分子的方法 |
| CA3059370C (en) | 2017-04-12 | 2022-05-10 | Karius, Inc. | Methods for concurrent analysis of dna and rna in mixed samples |
| WO2018191701A1 (en) | 2017-04-14 | 2018-10-18 | The Broad Institute, Inc. | High-throughput screens for exploring biological functions of microscale biological systems |
| US20180312822A1 (en) | 2017-04-26 | 2018-11-01 | 10X Genomics, Inc. | Mmlv reverse transcriptase variants |
| US10544413B2 (en) | 2017-05-18 | 2020-01-28 | 10X Genomics, Inc. | Methods and systems for sorting droplets and beads |
| EP4215616A1 (en) | 2017-05-18 | 2023-07-26 | 10X Genomics, Inc. | Methods and systems for sorting droplets and beads |
| CN110870018A (zh) | 2017-05-19 | 2020-03-06 | 10X基因组学有限公司 | 用于分析数据集的系统和方法 |
| US10914729B2 (en) | 2017-05-22 | 2021-02-09 | The Trustees Of Princeton University | Methods for detecting protein binding sequences and tagging nucleic acids |
| US10400235B2 (en) | 2017-05-26 | 2019-09-03 | 10X Genomics, Inc. | Single cell analysis of transposase accessible chromatin |
| US10676779B2 (en) | 2017-06-05 | 2020-06-09 | Becton, Dickinson And Company | Sample indexing for single cells |
| WO2018226546A1 (en) | 2017-06-05 | 2018-12-13 | 10X Genomics, Inc. | Gaskets for the distribution of pressures in a microfluidic system |
| SG11201912824YA (en) | 2017-06-20 | 2020-01-30 | 10X Genomics Inc | Methods and systems for improved droplet stabilization |
| EP3642358A1 (en) | 2017-06-21 | 2020-04-29 | Bluedot LLC | Systems and methods for identification of nucleic acids in a sample |
| CN108336542B (zh) | 2017-06-23 | 2020-02-21 | 番禺得意精密电子工业有限公司 | 电连接器 |
| CN111094585A (zh) | 2017-08-01 | 2020-05-01 | 伊鲁米纳公司 | 用于核苷酸测序的水凝胶珠 |
| US9946577B1 (en) | 2017-08-14 | 2018-04-17 | 10X Genomics, Inc. | Systems and methods for distributed resource management |
| US10357771B2 (en) | 2017-08-22 | 2019-07-23 | 10X Genomics, Inc. | Method of producing emulsions |
| CN111386134B (zh) | 2017-10-04 | 2023-11-03 | 10X基因组学有限公司 | 使用改进的聚合物形成珠的组合物、方法和系统 |
| US10590244B2 (en) | 2017-10-04 | 2020-03-17 | 10X Genomics, Inc. | Compositions, methods, and systems for bead formation using improved polymers |
| US20190127731A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | Methods for preparing nucleic acid molecules |
| WO2019083852A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | MICROFLUIDIC CHANNEL NETWORKS FOR PARTITIONING |
| WO2019084043A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | METHODS AND SYSTEMS FOR NUCLEIC ACID PREPARATION AND CHROMATIN ANALYSIS |
| WO2019084328A1 (en) | 2017-10-26 | 2019-05-02 | 10X Genomics, Inc. | METHODS FOR PREPARING NUCLEIC ACID MOLECULES |
| WO2019084165A1 (en) | 2017-10-27 | 2019-05-02 | 10X Genomics, Inc. | METHODS AND SYSTEMS FOR SAMPLE PREPARATION AND ANALYSIS |
| SG11201913654QA (en) | 2017-11-15 | 2020-01-30 | 10X Genomics Inc | Functionalized gel beads |
| US10829815B2 (en) | 2017-11-17 | 2020-11-10 | 10X Genomics, Inc. | Methods and systems for associating physical and genetic properties of biological particles |
| WO2019108851A1 (en) | 2017-11-30 | 2019-06-06 | 10X Genomics, Inc. | Systems and methods for nucleic acid preparation and analysis |
| WO2019113235A1 (en) | 2017-12-06 | 2019-06-13 | 10X Genomics, Inc. | Methods and systems for processing nucleic acid molecules |
| EP3724658A1 (en) | 2017-12-12 | 2020-10-21 | 10X Genomics, Inc. | Systems and methods for single cell processing |
| EP3728631A1 (en) | 2017-12-22 | 2020-10-28 | 10X Genomics, Inc. | Systems and methods for processing nucleic acid molecules from one or more cells |
| WO2019148042A1 (en) | 2018-01-26 | 2019-08-01 | 10X Genomics, Inc. | Compositions and methods for sample processing |
| CN112004920A (zh) | 2018-02-05 | 2020-11-27 | 斯坦福大学托管董事会 | 用于单细胞和集合细胞的多重测量的系统和方法 |
| CN112005115A (zh) | 2018-02-12 | 2020-11-27 | 10X基因组学有限公司 | 表征来自单个细胞或细胞群体的多种分析物的方法 |
| SG11202008080RA (en) | 2018-02-22 | 2020-09-29 | 10X Genomics Inc | Ligation mediated analysis of nucleic acids |
| WO2019169028A1 (en) | 2018-02-28 | 2019-09-06 | 10X Genomics, Inc. | Transcriptome sequencing through random ligation |
| WO2019169347A1 (en) | 2018-03-02 | 2019-09-06 | 10X Genomics, Inc. | Systems and apparatus for holding plates |
| WO2019191321A1 (en) | 2018-03-28 | 2019-10-03 | 10X Genomics, Inc. | Nucleic acid enrichment within partitions |
| EP3775271A1 (en) | 2018-04-06 | 2021-02-17 | 10X Genomics, Inc. | Systems and methods for quality control in single cell processing |
| US20190345636A1 (en) | 2018-05-10 | 2019-11-14 | 10X Genomics, Inc. | Methods and systems for molecular library generation |
| WO2019217758A1 (en) | 2018-05-10 | 2019-11-14 | 10X Genomics, Inc. | Methods and systems for molecular library generation |
| US20190352717A1 (en) | 2018-05-18 | 2019-11-21 | 10X Genomics, Inc. | Targeted non-invasive prenatal testing |
| US11932899B2 (en) | 2018-06-07 | 2024-03-19 | 10X Genomics, Inc. | Methods and systems for characterizing nucleic acid molecules |
| US11703427B2 (en) | 2018-06-25 | 2023-07-18 | 10X Genomics, Inc. | Methods and systems for cell and bead processing |
| US11574706B2 (en) | 2018-06-28 | 2023-02-07 | 10X Genomics, Inc. | Systems and methods for visualization of single-cell resolution characteristics |
| US20200033366A1 (en) | 2018-07-27 | 2020-01-30 | 10X Genomics, Inc. | Systems and methods for metabolome analysis |
| US20200032335A1 (en) | 2018-07-27 | 2020-01-30 | 10X Genomics, Inc. | Systems and methods for metabolome analysis |
| CN112703252A (zh) | 2018-08-03 | 2021-04-23 | 10X基因组学有限公司 | 用于最小化条形码交换的方法和系统 |
| US20200056223A1 (en) | 2018-08-20 | 2020-02-20 | 10X Genomics, Inc. | Compositions and methods for cellular processing |
| WO2020142779A1 (en) | 2019-01-06 | 2020-07-09 | 10X Genomics, Inc. | Methods and systems for enrichment of barcodes |
-
2014
- 2014-02-07 US US14/175,973 patent/US9388465B2/en active Active
- 2014-02-07 CN CN201480020238.9A patent/CN105102697A/zh active Pending
- 2014-02-07 EP EP14748569.2A patent/EP2954065B1/en active Active
- 2014-02-07 EP EP14749595.6A patent/EP2954104B1/en active Active
- 2014-02-07 KR KR1020157024531A patent/KR102190198B1/ko active IP Right Grant
- 2014-02-07 DK DK14748569.2T patent/DK2954065T3/da active
- 2014-02-07 EP EP21180222.8A patent/EP3998342A1/en active Pending
- 2014-02-07 WO PCT/US2014/015427 patent/WO2014124338A1/en active Application Filing
- 2014-02-07 EP EP20196181.0A patent/EP3862435A1/en active Pending
- 2014-02-07 KR KR1020227044551A patent/KR20230003659A/ko not_active Application Discontinuation
- 2014-02-07 CN CN201810642847.8A patent/CN108753766A/zh active Pending
- 2014-02-07 US US14/175,935 patent/US9644204B2/en active Active
- 2014-02-07 KR KR1020207035026A patent/KR20200140929A/ko active Application Filing
- 2014-02-07 CA CA2900481A patent/CA2900481A1/en active Pending
- 2014-02-07 BR BR112015019159A patent/BR112015019159A2/pt not_active Application Discontinuation
- 2014-02-07 JP JP2015557149A patent/JP2016511243A/ja active Pending
- 2014-02-07 WO PCT/US2014/015424 patent/WO2014124336A2/en active Application Filing
- 2014-02-07 CA CA2900543A patent/CA2900543C/en active Active
- 2014-02-07 AU AU2014214682A patent/AU2014214682B2/en active Active
- 2014-04-11 US US14/250,701 patent/US20140235506A1/en not_active Abandoned
-
2016
- 2016-07-01 US US15/200,928 patent/US20160304860A1/en not_active Abandoned
-
2017
- 2017-03-27 US US15/470,814 patent/US10150963B2/en active Active
- 2017-08-31 US US15/693,374 patent/US10150964B2/en active Active
-
2018
- 2018-10-25 US US16/170,980 patent/US11193121B2/en active Active
-
2019
- 2019-04-10 JP JP2019074785A patent/JP2019107035A/ja active Pending
-
2020
- 2020-12-14 JP JP2020206665A patent/JP2021038272A/ja active Pending
-
2021
- 2021-11-02 US US17/517,287 patent/US20220154175A1/en active Pending
-
2023
- 2023-03-07 JP JP2023034686A patent/JP2023063359A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009513948A (ja) | 2005-09-16 | 2009-04-02 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 検体検出のための比色バイオバーコード増幅アッセイ |
| JP2012522517A (ja) | 2009-04-02 | 2012-09-27 | フリューダイム・コーポレイション | 標的核酸にバーコードを付加するためのマルチプライマー増幅方法 |
| WO2012048341A1 (en) | 2010-10-08 | 2012-04-12 | President And Fellows Of Harvard College | High-throughput single cell barcoding |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102190198B1 (ko) | 폴리뉴클레오티드 바코드 생성 | |
| US11473138B2 (en) | Methods and systems for processing polynucleotides | |
| US20230399691A1 (en) | Probe-based analysis of nucleic acids and proteins | |
| WO2014165762A1 (en) | Rare cell analysis after negative selection | |
| CN116848263A (zh) | 用于分析物检测的方法和组合物 | |
| US20240019422A1 (en) | Probe-based analysis of nucleic acids and proteins | |
| WO2023060270A1 (en) | Single cell analysis for epigenomic profiling | |
| CN117015617A (zh) | 基于探针的核酸和蛋白质分析 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| A107 | Divisional application of patent | ||
| GRNT | Written decision to grant |