RU2355680C2 - Производные 2-оксо-1-пирролидина, способ их получения - Google Patents
Производные 2-оксо-1-пирролидина, способ их получения Download PDFInfo
- Publication number
- RU2355680C2 RU2355680C2 RU2006125756/04A RU2006125756A RU2355680C2 RU 2355680 C2 RU2355680 C2 RU 2355680C2 RU 2006125756/04 A RU2006125756/04 A RU 2006125756/04A RU 2006125756 A RU2006125756 A RU 2006125756A RU 2355680 C2 RU2355680 C2 RU 2355680C2
- Authority
- RU
- Russia
- Prior art keywords
- formula
- alkyl
- methyl
- aryl
- vol
- Prior art date
Links
- 0 CC(C(*)C1*)NC1=O Chemical compound CC(C(*)C1*)NC1=O 0.000 description 5
- MSYKRHVOOPPJKU-IUCAKERBSA-N CCC[C@@H](C1)CN([C@@H](CC)C(N)=O)C1=O Chemical compound CCC[C@@H](C1)CN([C@@H](CC)C(N)=O)C1=O MSYKRHVOOPPJKU-IUCAKERBSA-N 0.000 description 1
- HPVDPSIBKNDZKE-VLLRMEKGSA-N CCCc1c(C([C@@H](C)P(c2ccccc2)c2ccccc2)c2ccccc2C=C)c(P(c2ccccc2)c2ccccc2)ccc1C=C Chemical compound CCCc1c(C([C@@H](C)P(c2ccccc2)c2ccccc2)c2ccccc2C=C)c(P(c2ccccc2)c2ccccc2)ccc1C=C HPVDPSIBKNDZKE-VLLRMEKGSA-N 0.000 description 1
- HPHUVLMMVZITSG-LURJTMIESA-N CC[C@@H](C(N)=O)N(CCC1)C1=O Chemical compound CC[C@@H](C(N)=O)N(CCC1)C1=O HPHUVLMMVZITSG-LURJTMIESA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N CN(CCC1)C1=O Chemical compound CN(CCC1)C1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- HEOPUKMQAGRWRW-UHFFFAOYSA-N COc1c(C(CCCP(c2ccccc2)c2ccccc2OC)c2ccccc2)cccc1 Chemical compound COc1c(C(CCCP(c2ccccc2)c2ccccc2OC)c2ccccc2)cccc1 HEOPUKMQAGRWRW-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/18—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D207/22—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/24—Oxygen or sulfur atoms
- C07D207/26—2-Pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4015—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil having oxo groups directly attached to the heterocyclic ring, e.g. piracetam, ethosuximide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/02—Nasal agents, e.g. decongestants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/08—Bronchodilators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/16—Central respiratory analeptics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C237/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups
- C07C237/02—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton
- C07C237/04—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated
- C07C237/12—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by amino groups having the carbon atoms of the carboxamide groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being acyclic and saturated having the nitrogen atom of at least one of the carboxamide groups bound to an acyclic carbon atom of a hydrocarbon radical substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/18—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D207/22—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/24—Oxygen or sulfur atoms
- C07D207/26—2-Pyrrolidones
- C07D207/263—2-Pyrrolidones with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms
- C07D207/27—2-Pyrrolidones with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms with substituted hydrocarbon radicals directly attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/18—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D207/22—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/24—Oxygen or sulfur atoms
- C07D207/26—2-Pyrrolidones
- C07D207/273—2-Pyrrolidones with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to other ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/18—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member
- C07D207/22—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/24—Oxygen or sulfur atoms
- C07D207/26—2-Pyrrolidones
- C07D207/273—2-Pyrrolidones with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to other ring carbon atoms
- C07D207/277—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/34—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/44—Radicals substituted by doubly-bound oxygen, sulfur, or nitrogen atoms, or by two such atoms singly-bound to the same carbon atom
- C07D213/46—Oxygen atoms
- C07D213/50—Ketonic radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/26—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D307/30—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D307/32—Oxygen atoms
- C07D307/33—Oxygen atoms in position 2, the oxygen atom being in its keto or unsubstituted enol form
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/06—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to the ring carbon atoms
- C07D333/14—Radicals substituted by singly bound hetero atoms other than halogen
- C07D333/20—Radicals substituted by singly bound hetero atoms other than halogen by nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Pulmonology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Addiction (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Psychology (AREA)
- Epidemiology (AREA)
- Urology & Nephrology (AREA)
- Immunology (AREA)
- Anesthesiology (AREA)
- Otolaryngology (AREA)
- Vascular Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Pyrrole Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
Изобретение относится к левовращающему энантиомеру соединения формулы (В) и его фармацевтически приемлемым солям, где R1 представляет собой метил; Х представляет собой -СООМе, а также к левовращающему энантиомеру соединения формулы (В) и его фармацевтически приемлемым солям, где R1 представляет собой метил; Х представляет собой -COOEt. Кроме того, изобретение относится к способам получения вышеуказанных энантиомеров путем ассиметричного гидрирования соответствующих исходных соединений в форме Z и Е изомеров. Предложенные соединения являются промежуточными соединениями для получения препарата леветирацетама. 4 н.п.ф-лы, 4 табл.
Description
Изобретение касается 2-оксо-1-пирролидиновых производных, способа их получения, а также применения. Изобретение также касается способа получения производных α-этил-2-оксо-1-пирролидинацетамида из ненасыщенных 2-оксо-1-пирролидиновых производных.
Особенно изобретение касается новых промежуточных продуктов и их применения для получения (S)-(-)-α-этил-2-оксо-1-пирролидинацетамида, который имеет международное, незапатентованное название Леветирацетам (Levetiracetam), a также его правовращающего энантиомера и родственных соединений. Леветирацетам, как показано, имеет следующую структуру:
Леветирацетам, левовращающее соединение, описано в качестве защитного агента для лечения и профилактики гипоксийного и ишемического типа заболеваний центральной нервной системы в ЕР 162036. Указанное соединение также эффективно при лечении эпилепсии, но терапевтическое проявление его, как было продемонстрировано, полностью исчезает в случае правовращающего энантиомера (R)-(+)-α-этил-2-оксо-1-пирролидинацетамида (A.J.GOWER et al, Eur. J.Pharmacol., 222. (1992), 193-203). И наконец, в ЕР 0645139 было показано, что указанное соединение обладает анксиолитической активностью.
Ассиметрический атом углерода несет атом водорода (не показано), находящийся выше листа бумаги. Получение Леветирацетама было описано в ЕР 0162036 и в патенте GB 2225322. Получение правовращающего энантиомера (R)-(+)-α-этил-2-оксо-1-пирролидинацетамида было описано в ЕР 0165919. Тем не менее, указанные подходы не полностью удовлетворяют требованиям промышленного способа. Поэтому был разработан новый путь через ассиметрическое гидрирование новых исходных продуктов.
В одном аспекте изобретение представляет собой соединение, имеющее общую формулу (А) и его фармацевтически приемлемые соли,
где Х представляет собой -CONR5R6 или -COOR7 или -CO-R8 или CN;
R1 является водородом или алкилом, арилом, гетероциклоалкилом, гетероарилом, галогеном, гидрокси, амино, нитро, циано;
R2, R3 R4 являются одинаковыми или различными и каждый независимо представляет собой водород или галоген, гидрокси, амино, нитро, циано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, простой эфир, сложный эфир, амидо, сульфоновую кислоту, сульфонамид, алкилсульфонил, арилсульфонил, алкоксикарбонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, алкил, алкокси, оксисложный эфир, оксиамидо, арил, ариламино, арилокси, гетероциклоалкил, гетероарил, винил;
R5, R6, R7 являются одинаковыми или различными и каждый независимо представляет собой водород, гидрокси, алкил, арил, гетероциклоалкил, гетероарил, алкокси, арилокси; и
R8 представляет собой водород, гидрокси, тиол, галоген, алкил, арил, гетероциклоалкил, гетероарил, алкилтио, арилтио.
Термин "алкил" включает насыщенные одновалентные углеводородные радикалы, имеющие линейные, разветвленные или циклические остатки или их комбинациии, содержащие 1-20 атомов углерода, предпочтительно 1-5 атомов углерода. Алкильная группа может быть необязательно замещенной от 1 до 5 заместителями, независимо выбранными из группы, включающей галоген, гидрокси, тиол, амино, нитро, циано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, простой эфир, сложный эфир, амидо, сульфоновую кислоту, сульфонамид, алкилсульфонил, арилсульфонил, алкоксикарбонил, алкилсульфинил, арилсульфинил, алкилтио, арилтио, оксисложный эфир, оксиамидо, гетероциклоалкил, гетероарил, винил, (С1-С5)алкокси, (С6-С10) арилокси, (С6-С10)арил. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере группой, выбранной из галогена, гидрокси, тиола, амино, нитро, циано, такие как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил.
Термин "гетероциклоалкил" представляет собой "(С1-С6)циклоалкил", как определено выше, имеющий по крайней мере один О, S и/или N атом, прерывающий карбоциклическую кольцевую структуру, такой как тетрагидрофуранил, тетрагидропиранил, пиперидинил, пиперазинил, морфолино и пирролидинильные группы или те же группы, замещенные по крайней мере группой, выбранной из галогена, гидрокси, тиола, амино, нитро, циано,
Термин "алкокси" включает -O-алкильные группы, где "алкил" определен выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такие как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил.
Термин "алкилтио" включает -S-алкильные группы, где "алкил" определен выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такой как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил.
Термин "алкиламино" включает -NHалкил или -N(алкил)2 группы, где "алкил" имеет значение, как определено выше. Предпочтительными алкильными группами являются метил, этил, н-пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой.
Термин "арил" включает органический радикал, полученный из ароматического углеводорода путем удаления одного водорода, такой как фенил, фенокси, нафтил, арилалкил, бензил, необязательно замещенный от 1 до 5 заместителями независимо выбранными из группы, такой как галоген, гидрокси, тиол, амино, нитро, циано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, простой эфир, сложный эфир, амидо, сульфоновая кислота, сульфонамид, алкилсульфонил, алкоксикарбонил, алкилсульфинил, алкилтио, оксисложный эфир, оксиамидо, арил, (С1-С6)алкокси, (С6-С10)арилокси и (С1-С6)алкил. Арильный радикал состоит из 1-3 колец, предпочтительно из одного кольца, и содержит 2-30 атомов углерода, предпочтительно 6-10 атомов углерода. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, нафтил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "ариламино" включает -NHарил или -N(арил)2 группы, где "арил" определен выше. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "арилокси" включает -O-арильные группы, где "арил" определен выше. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "арилтио" включает -S-арильные группы, где "арил" определен выше. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "галоген" включает атом Cl, Br, F, I.
Термин "гидрокси" представляет собой группу формулы -ОН.
Термин "тиол" представляет собой группу формулы -SH.
Термин "циано" представляет собой группу формулы -CN.
Термин "нитро" представляет собой группу формулы -NO2.
Термин "амино" представляет собой группу формулы -NH2.
Термин "карбокси" представляет собой группу формулы -СООН.
Термин "сульфоновая кислота" представляет собой группу формулы -SO3Н.
Термин "сульфонамид" представляет собой группу формулы -SO3NH2.
Термин "гетероарил" представляет собой "арил" как он определен выше, имеющий по крайней мере один О, S и/или N атом, прерывающий карбоциклическую кольцевую структуру, такой как пиридил, фурил, пирролил, тиенил, изотиазолил, имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил, пуринил, карбазолил, изоксазолил, тиазолил, оксазолил, бензтиазолил или бензоксазолил, необязательно замещенный от 1 до 5 заместителями, независимо выбранными из группы, включающей гидрокси, галоген, тиол, амино, нитро, циано, ацил, ацилокси, сульфонил, сульфинил, алкиламино, карбокси, сложный эфир, простой эфир, амидо, сульфоновую кислоту, сульфонамид, алкилсульфонил, алкоксикарбонил, оксисложный эфир, оксиамидо, алкоксикарбонил, (С1-С5)алкокси и (С1-С5)алкил.
Термин "арилалкил" представляет собой группу формулы арил-(С1-С4 алкил)-. Предпочтительными арилалкильными группами являются, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил, дифенилметил, (4-метоксифенил)дифенилметил.
Термин "ацил" представляет собой радикал карбоновой кислоты и, таким образом он включает группы формулы алкил-СО-, арил-СО-, гетероарил-СО-, арилалкил-СО-, где различные углеводородные радикалы определены в данной части описания. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "оксиацил" представляет собой радикал карбоновой кислоты и, таким образом, он включает группы формулы алкил-CO-O-, арил-CO-O-, гетероарил-CO-O-, арилалкил-CO-O-, где различные углеводородные радикалы определены в данной части описания. Предпочтительными алкильными и арильными группами являются те же, что определены для ацильной группы.
Термин "сульфонил" представляет собой группу формулы -SO2-алкил или -SO2-арил, где "алкил" и "арил" определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "сульфинил" представляет собой группу формулы -SO-алкил или -SO-арил, где "алкил" и "арил" определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил. бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "сложный эфир" означает группу формулы -COO-алкил, или -COO-арил, где "алкил" и "арил" определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "оксисложный эфир" означает группу формулы -O-COO-алкил или -O-COO-арил, где "алкил" и "арил" определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "простой эфир" означает группу формулы алкил-O-алкил или алкил-O-арил или арил-O-арил, где "алкил" и "арил" определены выше. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "амидо" означает группу формулы -CONH2 или -CONHалкил или -CON(алкил)2 или -CONHарил или -CON(арил)2, где "алкил" и "арил" определены выше. Предпочтительно алкил имеет 1-4 атомов углерода и арил имеет 6-10 атомов углерода. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются, фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Термин "оксиамидо" означает группу формулы -O-CONH2 или -O-CCNHалкил или -O-CON(алкил)2 или -O-CONHарил или -O-CON(арил)2, где "алкил" и "арил" определены выше. Предпочтительно алкил имеет 1-5 атомов углерода и арил имеет 6-8 атомов углерода. Предпочтительными алкильными группами являются метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой. Предпочтительными арильными группами являются фенил, галогенфенил, цианофенил, нитрофенил, метоксифенил, бензил, галогенбензил, цианобензил, метоксибензил, нитробензил, 2-фенилэтил.
Предпочтительно R1 представляет собой метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такой как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил.
Предпочтительно R2, R3 и R4 независимо представляют собой водород или галоген или метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил или те же группы, замещенные по крайней мере галогенной группой, такую как трифторметил, трихлорметил, 2,2,2-трихлорэтил, 1,1-диметил-2,2-дибромэтил, 1,1-диметил-2,2,2-трихлорэтил.
Предпочтительно R5 и R6 независимо представляют собой водород, метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил.
Предпочтительно R7 представляет собой водород, метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил, метокси, этокси, фенил, бензил или те же группы, замещенные по крайней мере галогенной группой, такие как трифторметил, хлорфенил.
Предпочтительно R8 представляет собой водород, метил, этил, пропил, изопропил, бутил, изо или трет-бутил, 2,2,2-триметилэтил, фенил, бензил или те же группы, замещенные по крайней мере галогенной группой, такие как трифторметил, хлорбензил или, те, в которых Х является -CN.
Если другое не отмечено, в отношении соединений общей формулы (А) либо индивидуально, либо их смеси подразумевается, что они включают геометрические изомеры, т.е. оба Z и Е изомеры и их смеси (рацематы).
Что касается способа ассиметрического гидрирования, описанного ниже, лучшие результаты были получены для Z и Е изомеров соединений формулы (А), где R1 представляет собой метил, R2 и R4 представляет собой Н и Х является -CONH2, или -COOMe, или -COOEt, или -СООН. В указанной группе соединения 1, в которых R3 представляет собой водород, алкил (особенно пропил) или галогеналкенил (особенно дифторвинил) особенно хорошо пригодны.
Аспект изобретения касается способа получения соединения, имеющего общую формулу (А). Указанный способ включает следующие реакции:
Соединения, имеющие общую формулу (А), где Х является -CONR5R6 или -COOR7, или -CO-R8, или CN, могут быть приемлемо получены путем взаимодействия производного α-кетокарбоновой кислоты общей формулы (С), где R1 и Х определены выше, с пирролидиноном общей формулы (D), где R2, R3, R4 определены выше, согласно следующей схеме (I):
Соединения, имеющие общую формулу (А), где Х представляет собой -COOR7, могут быть приемлемо получены путем взаимодействия производного α-кетокарбоновой кислоты общей формулы (С'), где Х является -COOR7 с пирролидиноном общей формулы (D) согласно следующей схеме (2):
Пригодные условия реакции включают применение толуола при кипении с обратным холодильником. В полученном соединении (A) R7 может легко быть превращенным из Н в алкил или из алкила в Н.
Производные общей формулы (С) или (С') и пирролидоны общей формулы (D) хорошо известны специалисту в этой области и могут быть получены согласно синтезу, приведенному в литературе, такой как в "Handbook of Heterocyclic Chemistry" by A.Katrisky. Pergamon, 1985 (Chapter 4.) и в "Comprehensive Heterocyclic Chemistry" by A.Katrisky & C.W.Rees, Pergamon, 1984 (Volume 4, Chapters 3.03 & 3.06).
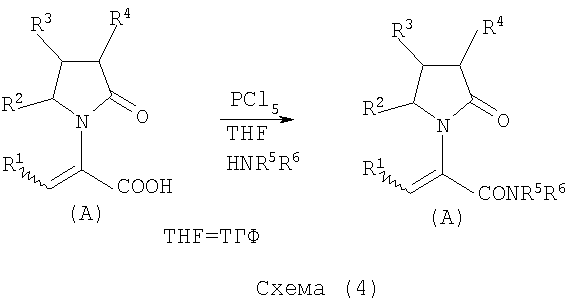
Соединения общей формулы (А), где Х представляет собой -CONH2 или -CONR5R6 могут быть приемлемо получены путем превращения соответствующей кислоты (соединение формулы (А), где Х представляет собой СО2Н) в хлорангидрид кислоты с последующим аммонолизом или реакцией с первичным или вторичным амином общей формулы HNR5R6. Следующие две схемы (3 и 4) описывают такой способ:
Указанные реакции предпочтительно осуществляют, используя PCl5, что дает хлорангидрид кислоты, а затем безводный аммиак или первичный или вторичный амин формулы HNR5R6, что дает желаемый енамид амида.
Соединения общей формулы (А), где Х представляет собой -COOR7, могут быть приемлемо получены путем превращения соответствующей кислоты (соединение (А), где Х представляет собой COOH), полученной по схеме (2), в хлорангидрид кислоты с последующим алкоголизом с соединением формулы R7-OH (спирт), где R7 определен выше, (смотри схему 5)
Указанные реакции предпочтительно осуществляют, используя PCl5, что дает хлорангидрид кислоты, с последующим алкоголизом с R7-OH, что дает желаемый сложный эфир.
Условия вышеупомянутых реакций хорошо известны специалистам в этой области.
В другом аспекте изобретение касается применения соединения формулы (А) для синтеза промежуточных продуктов.
Соединение формулы (А), где Х представляет собой -CONH2 особенно интересно, поскольку каталитическое гидрирование указанного соединения приводит непосредственно к Леветирацетаму. Оба Z и E изомера указанных соединений подвергаются быстрому и селективному ассиметричному гидрированию до любого энантиомера желаемого продукта. Положение связи, присоединяющей группу R1 к молекуле, определяет либо Z изомер, либо Е изомер.
Как частный пример, применение соединений (А) для синтеза соединений (В) может быть проиллюстрирован согласно следующей схеме 6):
где R1, R2, R3, R4 и X определены выше.
Предпочтительно, R1 представляет собой метил, этил, пропил, изопропил, бутил, или изобутил; наиболее предпочтительно метил, этил или н-пропил.
Предпочтительно, R2 и R4 независимо представляют собой водород или галоген или метил, этил, пропил, изопропил, бутил, изобутил; и, наиболее предпочтительно, каждый является водородом.
Предпочтительно, R3 представляет собой С1-5алкил, С2-5алкенил, С2-С5алкинил, циклопропил, азидо, каждый необязательно замещен одним или более галогеном, циано, тиоциано, азидо, алкилтио, циклопропилом, ацилом и/или фенилом; фенил; фенилсульфонил; фенилсульфонилокси, тетразол, тиазол, тиенил, фурил, пиррол, пиридин, где любая фенильная часть может быть замещена от одного или более галогеном, алкилом, галогеналкилом, алкокси, нитро, амино, и/или фенилом; наиболее предпочтительными являются метил, этил, пропил, изопропил, бутил или изобутил.
Предпочтительно, Х представляет собой -СООН или -COOMe или -COOEt или -CONH2: наиболее предпочтительно -CONH2
Соединения формулы (В) могут быть выделены в свободный форме или преобразованы в их фармацевтически приемлемые соли, или наоборот, обычным путем.
Предпочтительные индивидуальные соединения среди соединений, имеющих общую формулу (В), имеют формулы (В′), (В′′) и (В′′′).
Соединения формулы (В) являются подходящими для применения при лечении эпилепсии и родственных заболеваний. Согласно другому воплощению изобретение соответственно касается способа получения соединения, имеющего формулу (В)
где R1, R2, R3 R4 и X определены выше, через каталитическое ассиметрическое гидрирование соответствующего соединения, имеющего формулу (А), как проиллюстрированно и определено выше. Каталитическое гидрирование описано во многих публикациях или книгах, таких как "Synthese et catalyse asymetriques - auxiliaires et ligandas chiraux" Jacqueline Seyden-Penne (1994) - Savoirs actuel. interEdition/CNRS Edition - CH 7.1 "hydrogenation catalytique", page 287-300.
Если другое не отмечено, в отношении соединений общей формулы (В) либо индивидуальных либо их смесей, то предполагается, что они включают геометрические изомеры, т.е. оба Z и Е изомеры, также как энантиомеры, диастериоизомеры и их смеси (рацематы).
Предпочтительно, способ по изобретению касается получения соединения формулы (В), в которой R2 и R4 представляет собой водород и Х представляет собой -СООН или -COOMe или -COOEt или -CONH2 и R1 представляет собой метил, особенно те, в которых R3 является водородом, алкилом (особенно пропилом) или галогеналкенилом (особенно дифторвинилом). Лучшие результаты были получены в способе получения леветирацетама, соединения формулы (В), в котором R1 представляет собой метил, R2 и R4 представляет собой водород, R3 представляет собой водород, пропил или дифторвинил и Х представляет собой -CONH2.
Как правило, указанный способ содержит стадию каталитического гидрирования соединения формулы (А), как описано выше. Предпочтительно соединение формулы (А) подвергается ассиметричному гидрированию путем использования хирального катализатора, основанного на хелате родия (Rh) или рутения (Ru). Методики ассиметричного гидрирования описаны во многих публикациях или книгах, таких как "Asymmetric Synthesis" RA Aitken и S.N.Kilenyi (1992) - Blackie Academic & Professional или "Synthesis of Optically active - Ammo Acids" Robert M.Willimas (1989) - Pergamon Press.
Rh(I)- и Ru(II)- комплексы хиральных хелатирующих лигандов, как правило, представляют собой дифосфины, и они имеют большой успех в процессе ассиметричного гидрирования олефинов. Много хиральных бидентантных лигандов, таких как дифосфиниты, бис(аминофосфин) и аминофосфинфосфиниты или хиральные каталитические комплексы, описаны в литературе или являются коммерчески доступными. Хиральный катализатор может также быть ассоциатирован с противоионом и/или олефином.
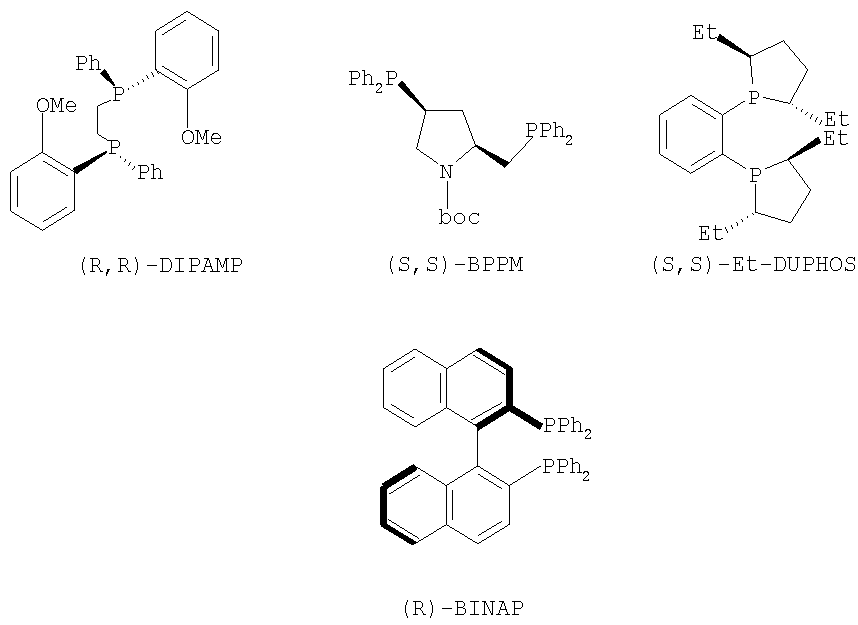
Хотя было накоплено много информации относительно каталитической активности и стереоселективности хиральных катализаторов, выбор лигандов, хиральных катализаторов и условий реакции все еще осуществляют опытным путем для каждого индивидуального соединения. Как правило, основанные на Rh(I) системы в большинстве случаев используют для получения аминокислотных производных, в то время как Ru(II) катализаторы дают хорошие или отличные результаты с намного более широкой группой олефиновых субстратов. Хелаты хиральных катализаторов, которые могут быть использованы в настоящем изобретении, представляют собой DUPHOS, BPPM, BICP, BINAP, DIPAMP, SKEWPHOS, BPPFA, DIOP, NORPHOS, PROPHOS, PENNPHOS, QUPHOS, ВРРМС, BPPFA. В дополнение к сказанному могут быть получены из приведенных хелатов и использованы в соответствии с изобретением катализаторы на подложке или же иммобилизованные катализаторы, что дает либо улучшенные превращения, либо улучшенные селективность в дополнение к улучшенному восстановлению катализатора и рециклу. Предпочтительными хелатами хиральных катализаторов, пригодными для применения для методики указанного изобретения, являются из DUPHOS или Метил, Диэтил, Диизопропил-DUPHOS
(1,2-бис-(2,5-диметилфосфолано)бензол - US 5171892), DIPAMP (Фосфин, 1,2-этандиилбис ((2-метоксифенил)фенил - патенты US 4008281 и 4142992), BPPM (1-пирролидинкарбоновая кислота, 4-(дифенилфосфино)-2-((дифенилфосфино)метил)-1,1-диметилэтиловый сложный эфир - Японский патент 87045238) и BINAP (Фосфин, (1,1′-бинафтален)-2,2'-диилбис(дифенил) - ЕР 0366390). Структуры указанных хелатов приведены ниже.
Предпочтительные растворители для применения в методике указанного изобретения выбраны из тетрагидрофурана (ТГФ=THF), диметилформамида (ДМФА), этанола, метанола, дихлорметана (ДХМ), изопропанола (IPA), толуола, этилацетата (AcOEt).
Противоион выбирают из галоида (галоген(-)), BPh4(-), ClO4(-), BF4(-), PF6(-), PCl6(-), ОАс(-), трифлата (OTf(-)), мезилата или тозилата. Предпочтительные противоионы для применения с указанным хиральными катализаторами выбирают из OTf(-), BF4(-) или ОАс(-).
Олефин выбирают из этилена, 1,3-бутадиена, бензола, циклогексадиена, норборнадиена или циклоокта-1,5-диена (COD).
Используя указанные хиральные катализаторы в комбинации с набором противоионов и при соотношениях катализатор-субстрат, находящихся в интервале 1:20 до 1:20,000, в наборе с коммерчески доступными растворителями, возможно превратить соединения формулы (А) в левовращающие или правовращающие энантиомеры соединений формулы (В), имеющие высокий % энантиомерного избытка (е.е.) и отличный выход, а также высокую степень чистоты. Более того, указанный путь использует стандартные промышленные установки и оборудование, а также более дешев.
Указанный ассиметричный синтетический способ также более дешев благодаря возможности рецикла и возможности отделения ненужного энантиомера, полученного в соответствующем синтетическом процессе.
Лучшие результаты были достигнуты в способе получения (S)-α-этил-2-оксо-1-пирролидинацетамида или (R)-α-этил-2-оксо-1-пирролидинацетамида, который включает введение во взаимодействие соединения формулы А1 в форме Z изомера или Е изомера в ассиметричное гидрирование, используя хиральный катализатор согласно следующей схеме:
Следуя указанному, сделана отсылка, в особенности к четырем соединениям формулы (А), в которых R1 представляет собой метил, R2, R3 и R4 представляют собой водород и,
для соединения, которое далее определяется как исходное A1, X представляет собой -СООН;
для соединения, которое далее определяется как исходное А2, Х представляет собой -COOMe;
для соединения, которое далее определяется как исходное А2′, Х представляет собой -COOEt; и
для соединения, которое далее определяется как исходное A3, Х представляет собой -CONH2.
Как будет понятно специалисту в этой области, в зависимости от заместителя, не все соединения общей формулы (А) и (В) способны образовывать соли так, что ссылку к фармацевтически приемлемым солям применяют только к таким соединениям общей формулы (А) или (В), которые имеют указанную способность.
Следующие примеры должны обеспечить иллюстрацию изобретения, и они не должны рассматриваться как его ограничение. Специалисту в данной области понятно, что различные варианты и модификации следующих примеров могут быть осуществлены без выхода за границы изобретения.
Пример 1
Получение исходного A1 осуществляют с 70% выходом сырого продукта путем взаимодействия α-кетомасляной кислоты и пирролидинона при кипении с обратным холодильником в толуоле, смотри схему 7. Под Z, Е подразумевают соотношение количества Z изомера к количеству Е изомера.
Сырой продукт перекристаллизовывают из ацетона с 70% выходом. Геометрия двойной связи является Z, как определяют на базе корреляции спектральных данных 1Н-ЯМР (Ядерный Магнитный Резонанс) для известных соединений с аналогичной структурой.
Пример 2
Исходный продукт А2 получают из A1 с диазометаном в ТГФ. Наблюдали Z-E изменения соотношения с 80:1 до 29:1 во время перегонки (смотри схему 8).
Е-изомер исходного A21 получают, как показано на схеме 9 из Z-изомера исходного А1 с этанолом, дициклогексилкарбодимидом (DCC) и диметиламинопиридином (DMAP).
Этерификацию исходного А1 также выполняют в небольших масштабах с PCl5 в ТГФ, затем СН3ОН, в результате чего образуются желаемые метиловые сложные эфиры (E:Z=5:1), смотри Схему 10.
Пример 3
Исходное А2 также получают путем взаимодействия метилового эфира кетомасляной кислоты и пирролидинона при кипении с обратным холодильником в толуоле в присутствии каталитического количества POCl3, смотри схему 11.
Этерификацию кетомасляной кислоты осуществляют либо с метанолом, следуя известной методике, либо с диазометаном. Последующие конденсирование дает исходное А2 с 60% выходом. Указанная методика приводит к более высокому содержанию Е-изомера по сравнению с использованием пути синтеза через исходное А1 (схема 8). Оба пути позволяют получить другие производные эфирного исходного А2.
Пример 4
Синтез исходного A3 активируют путем взаимодействия енамида кислоты с PCl5. что дает хлорангидрид кислоты, и затем вводят газообразный аммиак, чтобы получить желаемый енамид амида A3. Продукт был определен как Z-изомер.
Сырой енамид амида A3 выделяют из реакционной смеси растворением его в ТГФ-СН3ОН и фильтрованием, для того чтобы удалить неорганические остатки. После упаривания растворителя получают твердое вещество желтого цвета. Сырой продукт очищают с помощью сухой флэш-хроматографии с последующей перекристаллизацией из изо-PrOH, что обеспечивает получение чистого продукта. Указанная процедура успешно применяется для практического производства одной порции А3 (118 г, 54%, >99% максимальный пик) и она отражена на схеме 12.
В большинстве случаев ассиметричного гидрирования исходных катализатор получают in situ путем взаимодействия [Rh(COD)2]+OTf- и соответствующего хирального лиганда в растворителе по выбору с последующем добавлением субстрата. Некоторые катализаторы являются коммерчески доступными и их используют без дальнейшей очистки.
Пример 5
Результаты ассиметричного гидрирования исходных А1 и А2 при использовании ряда основанных на родии каталитических систем, суммированы в следующей Таблице 1. Эти реакции осуществляют с количеством катализатора, находящимся между 0.005 моль % и 5 моль % катализатора и 100 мг или 200 мг субстрата при температуре окружающей среды (комнатная температура: rt) в течение 24 часов. Условия реакции, такие как давление H2, разновидность растворителей, количество исходного, модифицируют надлежащим образом, чтобы получить оптимальные условия. Все продукты выделяют упариванием растворителя из реакционной смеси и анализируют без дальнейшей очистки с помощью 1Н-ЯМР спектроскопии.
HPLC (Высоко - Эффективная Жидкостная Хроматография) метод определения энантиомерного избытка в % (е.е.), полученного в результате гидрирования исходного A1, вызывает обоснованные трудности. Таким образом, проводят превращение сырых продуктов в их сложные метиловые эфиры, используя диазометан в растворе ТГФ.
Затем эфирные производные анализируют, используя хиральный метод HPLC для отслеживания гидрирования енамида эфира А2. Для HPLC метода используют Chiracel OD 4.6×250 мм колонку и IPA/н-гексан (95:05) в качестве элюента.
Для гидрированного продукта исходного А2 результаты были получены с помощью следующей хиральной HPLC методики: Chiralcel OD 4.6×250 мм, IPA-Гексан (5:95 об/об), 205 нм, 1 мл/мин, при температуре окружающей среды (rt), образец 1 мг/мл, 13 мин (S-энантиомер), 16 мин (R-энантиомер). Сначала скрининг осуществляют на 100 мг шкале с 5 мол.% катализатора.
Результаты в % энантиомерного избытка (е.е.) положительны при выражениях процентного содержания левовращающего S-энантиомера и отрицательны при выражениях процентного содержания правовращающего R-энантиомера.
Пример 5.1. Получение метил(2S)-2-[2-оксо-(4S)-4-пропил-1-пирролидинил]бутеоната
В колбу помещают 2 г метил(Z)-2-[2-оксо-(4S)-4-пропил-1-пирролидинил]-2-бутеоната, 20 мл безводного и дегазированного метанола и 27 мг (S,S)-Me-DUPHOS/Rh(BF4). Колбу продувают водородом и давление водорода доводят до желаемого уровня. Реакционную смесь перемешивают в течение 20 ч при комнатной температуре, а затем концентрируют. Получают 1,96 г метил(2S)-2-[2-оксо-(4S)-4-пропил-1-пирролидинил]бутеоната.
Пример 6: Ассиметричное гидрирование исходного A3
Используя тот же подход, что и в примере 5; ряд родиевых и рутениевых катализаторов анализируют, смотри схему 13 и Таблицу 2, получая следующие результаты.
Как показано выше, родиевые катализаторы получают in situ или покупают и используют без дальнейшей очистки. Рутениевые катализаторы получают согласно известных в литературе процессов. Большинство экспериментов проводят на уровне от 100 мг до 15 г продукта и от 0.001 до 5 мол.% катализатора. Сырые продукты анализируют с помощью 1Н, 13С ЯМР спектроскопии и хирального HPLC анализа.
Пример 7: Ассиметричное гидрирование исходного A3 с Rh-(Et,Et)-DUPHOS. Результаты гидрирования A3 с Rh-DUPHOS катализатором приведены в Таблице 3. Эти реакции осуществляют аналогично примерам 5 и 6, с давлением водорода в 4 атмосферы.
Обычно на энантиселективность в процессах гидрирования на Rh-DUPHOS катализаторах производных α-ациламиноакриловой кислоты растворители оказывают очень небольшой эффект. Однако остается невозможным предсказать опытным путем, какой эффект растворитель окажет на энантиселективность и скорость реакции для данного субстрата. При наблюдении установлено, что гидрирование A3 зависит от эффективности растворителя. Некоординированный апротоновый растворитель ДХМ был найден как наилучший. Гидрирование в протонных спиртовых растворителях приводит к замедлению реакции и снижению селективности. Аналогично, сниженные конверсии наблюдают в полярных апротонных растворителях, таких как EtOAc и ТГФ, оба из которых могут, как ожидается, координироваться с металлом, что препятствует катализу. Ингибирование координированных растворителей вероятно предлагает, что A3 является плохо координирующим субстратом, особенно в сравнении с другими производными α-ациламиноакриловой кислоты.
Тем не менее, отличные результаты были получены в ДХМ (дихлорметане). Как можно увидеть, энантиселективности от 97 до 98% е.е. постоянно достигают на субстрате на шкале в количестве от 0.5 до 15 г в указанном растворителе. Другие многообещающие результаты достигнуты в EtOAc-ДХМ смеси растворителей и в толуоле.
А. Получение исходного А1:(Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-6утеновой кислоты (Исходное А1)
В колбу, объемом 1 л, оснащенную магнитной мешалкой и ловушкой Дина-Старка, загружают 2-оксобутановую кислоту (25 г, 245 ммоль), толуол (500 мл, 20 об.) и 2-пирролидинон (37.2 мл, 490 ммоль, 2 экв.). Реакционную смесь перемешивают при кипении с обратным холодильником с азеотропной отгонкой воды через ловушку Дина-Старка в течение 5.5 часов. Раствор затем концентрируют примерно до 90 мл (3.6 об.) и дают остыть медленно до температуры окружающей среды. Грязно-белое твердое вещество высаживается из раствора примерно при 55°С. Твердое вещество фильтруют, пирог промывают толуолом (2×1 об.) затем дихлорметаном (3×1 об.) и сушат на фильтре под вакуумом в течение 5 мин, что дает сырой продукт (28 г, 70% выходом). Сырой продукт растворяют в ацетоне (450 мл, 16 об.) при кипении с обратным холодильником, охлаждают медленно до температуры окружающей среды и дают кристаллизоваться более 12 часов при температре от -15 до -20°С. Чистый продукт получают в виде белого кристаллического твердого вещества (21 г, 51% общий выход).
Точка плавления (т.пл.). 165.5-166°С.
1Н ЯМР (CDCl3): δ (химический сдвиг) 2.13 (5Н, дублет (д) и мультиплет). 2.51 (2Н, триплет (т)), 3.61 (2Н, т), 6.27 (1Н. квадроплет (кв)), 8 до 10 (1Н, широкий); сигналы для Е-изомера, δ 1.85 (3Н, т), 7.18 (1Н, кв).
13С ЯМР(СН3ОН-d4): δ 14.7, 19.6, 32.1, 51.4, 130.8, 137.7, 166.6, 177.9. Z:E соотношение 149:1. по 1Н ЯМР.
Тонкослойная хроматография (ТСХ): SiO2. Толуол/АсОН/СН3ОН (4:1:0.5). УФ и анисальдегидное пятно.
В. Получение исходного А2: Метил (Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутеноата (Исходное А2)
Исходное А1 (12 г, 71 ммоль) растворяют в ТГФ (240 мл, 20 об.) при 0-5°С. Раствор диазометана в этиловом эфире (200 мл, ~78 ммоль, 1,1 экв.) добавляют порциями к реакционной смеси, поддерживая температуру ниже 5°С. Реакционная смесь желтеет с последней порцией реагента. Указанную смесь перемешивают дополнительно 30 мин при низкой температуре и затем ей дают нагреться. Оставшиеся следы диазометана разрушают добавлением капли разбавленной уксусной кислоты в ТГФ, пока желтый раствор не станет бесцветным. Реакционную смесь концентрируют в вакууме и сырой продукт перегоняют (93-94°С, 0.01 мм Hg), что дает чистый продукт (9.44 г, 73%) в виде бесцветного масла, которое затвердевает при охлаждении ниже 10°С. 1Н ЯМР (CDCl3): δ 2.0 (3Н, д), 2.1 (2Н, м), 2.43 (2Н, т), 3.54 (2Н, т), 3.76 (3Н, с), 5.96 (1Н, кв); сигналы для Е-изомера, 8 1.75 (3Н, д) и 7.05 (1Н, кв).
13С ЯМР (СН3ОН-d4): δ 14.4, 19.7, 32, 51, 52.6, 130.1, 134.4, 165.6, 177.4. Z:E соотношение 29:1 по 1Н ЯМР.
С. Получение метил 2-оксобутаноата.
2-Оксобутановую кислоту (15 г) перегоняют при пониженном давлении, используя аппарат Кюгельруха (Kugelruhr) (84°C, 20 мм Hg) с выходом 14 г чистого продукта. Перегнанную 2-оксобутановую кислоту (14 г) растворяют в метаноле (безводный, 20 мл, 1.4 об.) и дихлорэтане (безводный, 80 мл, 5.7 об.) в присутствии нескольких капель этансульфоновой кислоты. Реакционную смесь перемешивают при кипении с обратным холодильником в течение 18 часов в инертной атмосфере. Затем ей дают дают остыть, сушат над MgSO4, фильтруют и концентрируют в вакууме. Сырой продукт очищают дистилляцией (т.кипения 76°С, 20 мм Hg), что дает чистый продукт в виде бесцветного масла (7.53 г, 48% выходом).
1Н ЯМР (CDCl3): δ 0.88 (3Н, т), 2.66 (2Н, кв), 3.63 (3Н, с) ссылка Biochemistry, 2670, 1971.
D. Получение метил (Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутеноата (Исходное А2)
В колбу объемом 100 мл, оснащенную магнитной мешалкой и ловушкой Дина-Старка, загружают метил 2-оксобутаноат (7.5 г, 73 ммоль), толуол (50 мл, 7 об.) и 2-пирролидинон (8.4 мл, 111 ммоль, 1.5 экв.) с последующей добавлением по каплям POCl3 (1.6 мл, 20 ммоль, 0.27 экв.). Реакционную смесь перемешивают при кипении с обратным холодильником с азотропной отгонкой воды через ловушку Дина-Старка в течение 8 часов. После охлаждения раствор промывают 10% водный раствор KHSO4 (2×3 об.). Водную фазу насыщают NaCl и снова экстрагируют толуолом (1×6 об.). Объединенные органические фазы сушат над MgSO4, фильтруют и концентрируют в вакууме, что дает сырой продукт (7.5 г) в виде оранжевого подвижного масла. Сырое масло перегоняют (92-94°С, 0.1 мм Hg), что дает чистый продукт (4.7 г, 60%) в виде бесцветного масла. Z:E соотношение 6:1 при 1Н ЯМР.
Е. Получение метил (Е)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутеноата (Исходное А2)
В сухую колбу, объемом 100 мл, оснащенную магнитной мешалкой, загружают Z-A1 (2 г, 11.8 ммоль), этанол (2.2 мл, 37.3 ммоль), тетрагидрофуран (ТГФ. 40 мл, 20 об.) и диметиламинопиридин (DMAP, 150 мг, 1.23 ммоль) в атмосфере азота. Реакционную смесь охлаждают до 0°С перед добавлением дициклогексилкарбодимида (DCC, 2.46 г, 11.9 ммоль), затем нагревают до температуры окружающей среды. Реакционную смесь перемешивают энергично в течение 21 часа. После чего добавляют гексан (40 мл), чтобы высадить твердое вещество. Осадок отфильтровывают и фильтрат концентрируют в вакууме, что дает 3.03 г бесцветного жидкого масла. Масло в воде (40 мл) промывают дихлорметаном (ДХМ, 40 мл, затем 2×20 мл), растворитель сушат с помощью Na2SO4 и концентрируют в вакууме, что дает 2 г Е-А2 этиловый эфир (100% выходом).
F. Получение исходного A3: (Z)-2-(2-оксотетрагидро-1Н-1-пирролил)-2-бутенамида (Исходное A3).
В 20-литровую фланцевую колбу, снабженную мешалкой, в инертной атмосфере загружают А1 (222 г, 1.313 моль, 1 вес) и безводный ТГФ (7.0 литров, 30 об.). Реакционной смеси дают охладиться ниже 5°С и добавляют порциями PCl5 (300 г, 1.44 моль, 1,1 экв.), поддерживая температуру реакции ниже 10°С. Реакционную смесь перемешивают при температуре от -5 до 0°С в течение одного часа, дают нагреться до 15°С, чтобы растворить оставшийся PCl5, и затем охлаждают снова ниже 0°С. Конденсат заполняют сухим льдом/ацетоном и пробулькивают газообразный аммиак (-200 г) медленно через раствор, поддерживая температуру ниже 15°С. Суспензию перемешивают в течение дополнительных 15 мин и избыток аммиака удаляют пробулькивая газообразный азот в течение нескольких минут. Добавляют метанол (3.7 литра, 17 об.), реакционную смесь нагревают при кипении с обратным холодильником в течение 1.5 часов, затем охлаждают - ниже 30°С, фильтруют и промывают с помощью ТГФ/СН3ОН (2:1, 600 мл, ~3 об.). Фильтрат упаривают, что дает желтое твердое вещество. Указанное вещество растворяют в метаноле (640 мл, ~3 об.) и этилацетате (440 мл, 2 об.) и очищают, используя сухую флэш-хроматографию (SiO2, 11 вес, 3.4 Kg) с EtOAc/СН3ОН (6:1), что дает сырой продукт (288 г). Сырой продукт перекристаллизовывают из изопропанола (1.9 литров, - 8.5 об.), что дает белые кристаллы (127 г). Твердое вещество сушат в вакууме в духовом шкафу при температуре окружающей среды в течение 2 дней с выходом A3 (118 г.54%).
1Н ЯМР (CDCl3+несколько капель MeOD): δ 6.75 (1Н,кв) 3.5 (2Н,т) 2.5 (2Н,т) 2.15 (2Н,м) 1.7 (3Н, д), следы примесей.
Элементный анализ (% м/м): С 56.90 (57.13% теория); Н 7.19 (7.19% теория); N 16.32 (16.66% теория).
A3 (108 г) перекристаллизовывают снова из IPA (1 л, 9.3 об.), что дает заключительную загрузку, которую используют на стадии гидрирования (100 г, 93%). т.пл. 172.0°С-174.2°С.
Элементный анализ (% м/м): С 56.95 (57.13% теория); Н 7.10 (7.19% теория); N 16.38. (16.66% теория).
ТСХ: SiO2, Толуол/АсОН/СН3ОН (4:1:0.5). УФ и пятно анисового альдегида.
G. Получение хиральных родиевых и рутениевых катализаторов - Получение [Rh(I)L*COD]+OTf- (0.15 М растворы)
[Rh(I)COD2]+OTf- (35 мг, 0.075 ммоль) и хиральный лиганд (L*. 0.083 ммоль, 1,1 экв.) быстро взвешивают на воздухе и загружают в колбу. Колбу герметизируют с помощью каучуковой мебраны и продувают аргоном. Безводный, дегазированный растворитель (5 мл, 143 об.) добавляют через мебрану. Реакционную смесь дегазируют (3×вакуум/аргон) и перемешивают в течение 30 мин или пока все твердые вещества не растворятся.
Н. Получение Rh(I)(СН3ОН)2[(R)-Binap]
В сухую трубку Шленка, объемом 200 мл, оснащенную магнитной мешалкой, загружают [Rh(I)(nbd)2]ClO4 (251 мг, 0.649 ммоль) и (R)-Binap (405 мг, 0.65 ммоль) в атмосфере аргона. Дихлорметан (безводный, дегазированный, 5 мл, 20 об.) добавляют с помощью шприца и реакционную смесь дегазируют (3×вакуум/аргон). Медленно добавляют тетрагидрофуран (безводный, дегазированный, 10 мл, 40 об.), а затем гексан (безводный, дегазированный, 20 мл, 80 об.). Полученную суспензию выдерживают при 0-5°С в течение 16 часов. Растворители декандируют под аргоном и добавляют метанол (безводный, дегазированный, 5 мл, 20 об.). Шленковую трубку продувают водородом (5×вакуум/водород) и перемешивают при температуре окружающей среды в течение 1.5 часов. Светло-красный оранжевый раствор переносят с помощью шприца в другую Шленковую трубку (продутую аргоном). Раствор катализатора сохраняют в аргоне при 0-5°С и используют непосредственно для гидрирования (Terpahedron, 1245, 1984).
I. Получение [RuCl(R)-Binap)(С6Н6)l+Cl-
В сухую трубку Шленка (Schlenk), объемом 200 мл, оснащенную магнитной мешалкой загружают [RuCl2(C6Hg)]2 (0.33 г.0.66 ммоль) и (R)-Binap (0.815 г, 1.3 ммоль) в атмосферуе аргона. Добавляют дегазированный безводный бензол (20 мл, 60 об.) и этанол (130 мл, 330 об.) и раствор дегазируют (3×вакуум/аргон). Красно-коричневую суспензию нагревают до 50-55°С в течение 45 мин, получая прозрачный коричневый раствор. Полученный раствор фильтруют через целитовую подушку и в атмосфере аргона в другую трубку Шленка. Растворители упаривают в вакууме, что дает катализатор в виде желто-оранжевого твердого вещества (1.08 г, 86%), которое сохраняют в атмосфере аргоне при 0-5°С (J.Org.Chem., 3064, 1994).
J. Получение [RuCl(R)-Binap)(С6Н6)]+BF4 -
В сухую трубку Шленка, объемом 100 мл, оснащенную магнитной мешалкой, загружают [RuCl(R)-Binap)(С6Н6)]+ Cl- (0.45 г.0.52 ммоль) и дегазированный безводный дихлорметан (20 мл, 44 об.) в атмосфере аргона. Полученный раствор дегазируют (3×вакуум/аргон) и переносят с помощью шприца в другую трубку Шленка, содержащую дегазированную суспензию AgBF4 (0.15 г, 0.77 ммоль. 1.5 экв.) в дихлорметане (10 мл, 22 об.). Смесь перемешивают энергично в течение 0.5 час и затем фильтруют через целитовую подушку в атмосфере аргона. Фильтрат концентрируют в вакууме, что дает катализатор в виде зеленого твердого вещества (0.42 г, 88%), которое сохраняют в атмосфере аргоне при 0-5°С (J.Org. Chem., 3064, 1994).
К. Получение Ru(OCOCH3)2[(R)-Binap]
В сухую трубку Шленка, объемом 200 мл, оснащенную магнитной мешалкой, загружают [RuCl(C6H6)]2 (0.805 г, 1.60 ммоль) и (R)-Binap (1.89 г, 3.03 ммоль, 0.95 экв.) в атмосфере аргона. Добавляют сухой, дегазированный диметилформамид (30 мл, 38 об.) и раствор дегазируют (3×вакуум/аргон). Реакционную смесь нагревают до 100°С в течение 10 мин, что дает темно-красный раствор, который затем охлаждают до температуры окружающей среды. Дегазированный раствор ацетата натрия (5.2 г, 63.4 ммоль, 20 экв.) в метаноле (50 мл, 60 об.) загружают в реакционный сосуд и перемешивают в течение 5 мин. Добавляют дегазированную воду (50 мл, 60 об.) и толуол (25 мл, 30 об.) и реакционную смесь перемешивают энергично в течение 5 мин. Слой толуола переносят с помощью шприца в другую сухую трубку Шленка (продувают аргоном) и водную фазу экстрагируют толуолом (2×25 мл). Объединенные толуоловые растворы промывают водой (4×10 мл), растворитель концентрируют в вакууме при 45°С и сушат в течение 12 часов под вакуумом (0.1 мм Hg). Желто-коричневое твердое вещество растворяют в толуоле (25 мл) без перемешивания и добавляют медленно гексан (75 мл) для формирования сверху второго слоя. Двухфазную смесь оставляют стоять при температуре окружающей среды в течение 7 часов и затем при 0-5°С в течение 3 дней. Катализатор выкристаллизовывается. Растворители удаляют с помощью шприца в атмосфере аргона, твердое вещество промывают гексаном (20 мл) и сушат под вакуумом в течение 2 часов, что дает катализатор в виде желтого коричневого твердого вещества (1.76, 70%), которое сохраняют в аргоне при 0-5°С (J.Org. Chem., 4053,1992).
L. Ассиметричное гидрирование исходных A1, A2, A3.
Ассиметричное гидрирование осуществляют по одной методике для каждого исходного. Таким образом, только ассиметричное гидрирование A3 описано ниже.
Ассиметричное гидрирование исходных A3.
Гидрирование при атмосферном давлении Н2.
В сухую трубку Шленка, объемом 100 мл, оснащенную магнитной мешалкой, загружают субстрат (500 мг, 3 ммоль) и продувают газообразным аргоном Дегазированный растворитель добавляют с помощью шприца с последующим добавлением раствора катализатора (от 0.5 до 2.5 моль%). Реакционную смесь дегазируют (3×вакуум/аргон) и затем продувают водородом (5×вакуум/водород), используя баллонный водород. Реакционную массу перемешивают в течение 16-65 часов при температуре окружающей среды. Атмосферу водорода заменяют на атмосферу азота и растворитель упаривают в вакууме, чтобы получить сырой продукт, который анализируют с помощью ЯМР спектроскопического анализа и хирального HPLC анализа. Гидрирование при давлении в 4 атм.
Все манипуляции выполняют в AtmosBagTM (Aldrich Chemical CO,) в атмосфере аргона. Субстрат (500-10000 мг) был помещен в реакционный сосуд из нержавеющей стали высокого давления (Vinci Technologies Ltd, France), оснащенный тефлоновой мензуркой (или стеклянной плошкой) и магнитной мешалкой, покрытой тефлоном. Добавляют дегазированный растворитель и катализатор или раствор катализатора (от 0.25 до 2.5 моль%). Реакционный сосуд герметизируют и продувают водородом под давлением в реакционном сосуде - 4.5-5.5 атм и затем снижают давление (в 5 раз). И наконец, давление регулируют до желаемого уровня и реакционную смесь перемешивают при температуре окружающей среды в течение 16-65 часов. По завершении атмосферу водорода заменяют на атмосферу азота и растворитель упаривают в вакууме, что дает сырой продукт, который анализируют с помощью ЯМР спектроскопического анализа и хирального HPLC анализа.
Очистка конечного соединения: Очистка (S)-α-этил-2-оксо-1-пирролидинацетамида (Леветирацетама).
Леветирацетам, полученный ассиметричным гидрированием, описанным выше (5 г, 98% е.е.), растворяют в воде (20 мл, 4 об.) и экстрагируют этилацетатом (3×10 мл, 3×2 об.). Органическую фазу затем снова экстрагируют водой (10 мл, 2 об.) и водную фазу упаривают, что дает бледно-желтое твердое вещество (4.83 г, 80%). Полученное твердое вещество (4 г) растворяют в ацетоне (24 мл, 6 об.) и нагревают при кипении с обратным холодильником в течение одного часа. Раствору дают медленно остыть до 0°С со скоростью 5-10°С/час. Кристаллы фильтруют, промывают ацетоном (1.6 мл, 0.4 об.) и сушат, что дает белое твердое вещество (3.23 г, 81%, >99.8% е.е., 54 частей на миллн. Rh).
Очистка (S)-α-этил-2-оксо-1-пирролидинацетамида (Леветирацетама):
Леветирацетам, полученный ассиметричным гидрированием, описанным выше (5 г, 98% е.е.), перекристаллизовывают из ацетона (30 мл, 6 об.), как описано выше, с получением белого кристаллического твердого вещества (3.94 г, 81%, >99.8% е.е., 52 частей на миллн. Rh). Указанное вещество-(3 г) перекристаллизовывают снова, как описано выше, что дает белое кристаллическое твердое вещество (2.31 г, 77%, >99.8% е.е., 23 частей на миллн. Rh). т.пл. - 118.4-119.9°С.
Пример 8.
Катализаторы: (R, R)-Rh-DIPAMP (вход 1)
(S, S)-Rh-Me-DUPHOS (вход 2)
Субстрат, катализаторы и растворитель были загружены под атмосферой азота. Субстрат А2 (100 мг) был помещен в сосуд высокого давления из нержавеющей стали, снабженный магнитной мешалкой. Катализатор (1 мг, 1% вес/вес) и метанол (5 мл) были добавлены.
Сосуд был герметично укупорен и прочищен водородом под давлением 5 бар и затем разгерметизирован. После этого давление водорода было восстановлено до 5 бар и реакция при перемешивании смеси происходила в течение 20 часов при температуре 25°С. Реакция была остановлена продувкой сосуда азотом и реакционная смесь была подвергнута хиральному HPLC анализу. Результаты анализа представлены в таблице 4.
Claims (4)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0004297.8 | 2000-02-23 | ||
| GBGB0004297.8A GB0004297D0 (en) | 2000-02-23 | 2000-02-23 | 2-oxo-1 pyrrolidine derivatives process for preparing them and their uses |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002124865/04A Division RU2292336C2 (ru) | 2000-02-23 | 2001-02-21 | Производные 2-оксо-1-пирролидина, способ их получения и применения |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2006125756A RU2006125756A (ru) | 2008-01-27 |
| RU2355680C2 true RU2355680C2 (ru) | 2009-05-20 |
Family
ID=9886259
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2006125756/04A RU2355680C2 (ru) | 2000-02-23 | 2001-02-21 | Производные 2-оксо-1-пирролидина, способ их получения |
| RU2002124522A RU2291860C3 (ru) | 2000-02-23 | 2001-02-21 | Производные 2-оксо-1-пирролидина, способ их получения и применения |
| RU2002124865/04A RU2292336C2 (ru) | 2000-02-23 | 2001-02-21 | Производные 2-оксо-1-пирролидина, способ их получения и применения |
| RU2005125569/04A RU2005125569A (ru) | 2000-02-23 | 2005-08-11 | Производное 2-оксо-1-пирролидина и его применение |
| RU2005125645/04A RU2005125645A (ru) | 2000-02-23 | 2005-08-12 | Производное 2-оксо-1-пирролидина и его применение |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002124522A RU2291860C3 (ru) | 2000-02-23 | 2001-02-21 | Производные 2-оксо-1-пирролидина, способ их получения и применения |
| RU2002124865/04A RU2292336C2 (ru) | 2000-02-23 | 2001-02-21 | Производные 2-оксо-1-пирролидина, способ их получения и применения |
| RU2005125569/04A RU2005125569A (ru) | 2000-02-23 | 2005-08-11 | Производное 2-оксо-1-пирролидина и его применение |
| RU2005125645/04A RU2005125645A (ru) | 2000-02-23 | 2005-08-12 | Производное 2-оксо-1-пирролидина и его применение |
Country Status (43)
Families Citing this family (157)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7365093B2 (en) * | 1994-08-19 | 2008-04-29 | Abbott Laboratories | Endothelin antagonists |
| GB0004297D0 (en) * | 2000-02-23 | 2000-04-12 | Ucb Sa | 2-oxo-1 pyrrolidine derivatives process for preparing them and their uses |
| US6686477B2 (en) | 2000-09-29 | 2004-02-03 | Eastman Chemical Company | Highly enantiomerically pure lactam-substituted propanoic acid derivatives and methods of making and using same |
| JP2004523557A (ja) * | 2001-02-23 | 2004-08-05 | ジョンズ・ホプキンス・ユニバーシティ | チック、振せん、および関連疾患の治療 |
| ATE410412T1 (de) | 2001-08-10 | 2008-10-15 | Ucb Pharma Sa | Oxopyrrolidin verbindungen, verfahren zur herstellung dieser verbindungen und deren verwendung zur herstellung von levetiracetam und analogen |
| CA2461961A1 (en) * | 2001-10-08 | 2003-04-17 | Ucb, S.A. | Use of 2-oxo-1-pyrrolidine derivatives for the treatment of dyskinesia and movement disorders |
| CN1604776A (zh) | 2001-10-16 | 2005-04-06 | 记忆药物公司 | 作为用于治疗神经病综合症的pde-4抑制剂的4-(4-烷氧基-3-羟基苯基)-2-吡咯烷酮衍生物 |
| AU2003242538A1 (en) * | 2002-05-14 | 2003-11-11 | Ucb, S.A. | Use of 2-oxo-1-pyrrolidone derivatives for the preparation of a drug |
| AU2004204338A1 (en) * | 2003-01-13 | 2004-07-29 | Ucb | Hydrogenation catalysts |
| EP1517893A2 (en) * | 2003-02-03 | 2005-03-30 | Teva Pharmaceutical Industries Limited | Process for producing levetiracetam |
| ES2214147B1 (es) | 2003-02-28 | 2005-10-01 | Farma-Lepori S.A. | Procedimiento de obtencion de un agente antiepileptico. |
| TR200503397T1 (tr) * | 2003-03-18 | 2007-03-21 | Hetero Drugs Limited | Levetirasetam'ın yeni kristal formları. |
| RU2232578C1 (ru) * | 2003-04-10 | 2004-07-20 | Ахапкина Валентина Ивановна | Вещество, обладающее антидепрессивной активностью |
| SG169900A1 (en) | 2003-04-16 | 2011-04-29 | Memory Pharm Corp | 4 - (3,4 - disubstituted phenyl) - pyrrolidin-2-one compounds as phosphodiesterase 4 inhibitors |
| US7034051B2 (en) * | 2003-08-28 | 2006-04-25 | Adolor Corporation | Fused bicyclic carboxamide derivatives and methods of their use |
| EP1663968A1 (en) * | 2003-09-05 | 2006-06-07 | Ranbaxy Laboratories Limited | Process for the preparation of pure levetiracetam |
| US7629474B2 (en) * | 2003-09-24 | 2009-12-08 | Ucb Pharma S.A. | Process for preparing 2-oxo-1-pyrrolidine derivatives |
| BRPI0417157A (pt) * | 2003-12-02 | 2007-03-06 | Ucb Sa | composto, composição farmacêutica, e, uso de um composto ou de uma composição farmacêutica |
| KR101159870B1 (ko) | 2004-06-11 | 2012-06-25 | 유씨비 소시에떼아노님 | 분자내 알릴화에 의해 2-옥소-1-피롤리딘 유도체를제조하는 방법 |
| EP1831154B1 (en) * | 2004-06-21 | 2010-01-13 | Warner-Lambert Company LLC | Preparation of pregabalin and related compounds |
| US7427601B2 (en) * | 2004-06-24 | 2008-09-23 | Schwarz Pharma Ag | Method for treating tremor |
| WO2006044955A1 (en) * | 2004-10-20 | 2006-04-27 | Memory Pharmaceuticals Corporation | Phosphodiesterase 4 inhibitors |
| CA2488325C (en) * | 2004-11-22 | 2010-08-24 | Apotex Pharmachem Inc. | Improved process for the preparation of (s)-alpha-ethyl-2-oxo-1-pyrrolidineacetamide and (r)-alpha-ethyl-2-oxo-1-pyrrolidineacetamide |
| CA2610695A1 (en) | 2005-06-01 | 2006-12-07 | Ucb Pharma, S.A. | 2-oxo-1-pyrrolidine derivatives and their therapeutic use on the central nervous system |
| EP1731149A1 (en) * | 2005-06-08 | 2006-12-13 | Ucb S.A. | Use of 2-oxo-1-pyrrolidone derivatives for the treatment of diseases characterized by progressive myoclonic epilepsy |
| MY143249A (en) * | 2005-09-15 | 2011-04-15 | Ucb Pharma Sa | 4-substituted pyrrolidin-2-ones and their use |
| JP2007153755A (ja) * | 2005-12-01 | 2007-06-21 | Gifu Univ | プロリン類縁体 |
| WO2007065634A1 (en) * | 2005-12-07 | 2007-06-14 | Ucb Pharma, S.A. | 3-carboxy- 2-oxo-1 -pyrrolidine derivatives and their uses |
| US8338621B2 (en) | 2005-12-21 | 2012-12-25 | Ucb S.A. | Process for the preparation of 2-oxo-1-pyrrolidine derivatives |
| LV13630B (en) * | 2006-03-16 | 2007-12-20 | Olainfarm As | Method of preparation and use of pharmaceutically active n-carbamoylmethyl-4(r)-phenyl-2-pyrrolidinone |
| BRPI0712325A2 (pt) * | 2006-06-08 | 2012-01-10 | Ucb Pharma Sa | processo para a preparação de co-cristais de pirrolidinonas, co-cristal, composição farmacêutica, e, uso de um co-cristal |
| KR101518427B1 (ko) | 2006-06-15 | 2015-05-08 | 유씨비 파르마 게엠베하 | 상승적 항경련 효과를 갖는 약제학적 조성물 |
| WO2008021666A2 (en) * | 2006-08-18 | 2008-02-21 | Morton Grove Pharmaceuticals, Inc. | Stable liquid levetiracetam compositions and methods |
| KR101181194B1 (ko) * | 2006-10-18 | 2012-09-18 | 화이자 프로덕츠 인코포레이티드 | 바이아릴 에터 우레아 화합물 |
| WO2008103319A2 (en) | 2007-02-16 | 2008-08-28 | Ark Diagnostics, Inc. | Compounds and methods for use in detecting gabapentin |
| WO2008132139A2 (en) * | 2007-04-27 | 2008-11-06 | Ucb Pharma S.A. | New heterocyclic derivatives useful for the treatment of cns disorders |
| US20090082422A1 (en) * | 2007-09-26 | 2009-03-26 | Protia, Llc | Deuterium-enriched levetiracetam |
| CA2715685C (en) * | 2008-03-03 | 2015-04-28 | Eric Schenkel | Pharmaceutical solutions, process of preparation and therapeutic uses |
| US7741327B2 (en) | 2008-04-16 | 2010-06-22 | Hoffmann-La Roche Inc. | Pyrrolidinone glucokinase activators |
| US20110212944A1 (en) * | 2008-07-01 | 2011-09-01 | Julie Liu | 2-oxo-1-pyrrolidine derivatives |
| EP2147911A1 (en) | 2008-07-24 | 2010-01-27 | ZaCh System S.p.A. | Process for the preparation of levetiracetam |
| JP4644881B2 (ja) * | 2008-09-19 | 2011-03-09 | 高砂香料工業株式会社 | ルテニウム錯体の製造方法 |
| CN102227217A (zh) | 2008-10-16 | 2011-10-26 | 约翰斯.霍普金斯大学 | 改善认知功能的方法和组合物 |
| US8168756B2 (en) | 2008-10-24 | 2012-05-01 | Ark Diagnostics, Inc. | Levetiracetam immunoassays |
| EP2341777B1 (en) * | 2008-11-07 | 2015-01-21 | NovaBay Pharmaceuticals, Inc. | Antimicrobial oxazolidinone, hydantoin and imidazolidinone compositions |
| ES2602606T3 (es) * | 2008-11-18 | 2017-02-21 | Ucb Biopharma Sprl | Formulaciones de liberación prolongada que comprenden un derivado de 2-oxo-1-pirrolidina |
| KR101689688B1 (ko) * | 2008-11-18 | 2016-12-26 | 유씨비 파마, 에스.에이. | 2옥소1피롤리딘 유도체를 포함하는 지연 방출형 제형 |
| FR2939311A1 (fr) * | 2008-12-08 | 2010-06-11 | Oreal | Utilisation d'un derive diester de pyrrolidinone 4-carboxy comme solvant dans les compositions cosmetiques ; compositions cosmetiques les contenant |
| US8563036B2 (en) | 2009-02-09 | 2013-10-22 | Ucb Pharma, S.A. | Pharmaceutical compositions comprising Brivaracetam |
| US8846411B2 (en) * | 2009-06-11 | 2014-09-30 | Microgenics Corporation | Derivatives, reagents, and immunoassay for detecting levetiracetam |
| US20120171125A1 (en) | 2009-08-07 | 2012-07-05 | Ucb Pharma, S.A. | Methods for Enhancing the Cognitive Function |
| US7939676B2 (en) | 2009-09-17 | 2011-05-10 | Zach System S.P.A. | Process for the preparation of levetiracetam |
| US8487591B1 (en) | 2009-12-31 | 2013-07-16 | Cirrus Logic, Inc. | Power control system with power drop out immunity and uncompromised startup time |
| SI2491045T1 (sl) | 2009-10-23 | 2016-04-29 | Ucb Biopharma Sprl | 2-okso-1-pirolidinil imidazotiadiazolni derivati |
| PL389364A1 (pl) | 2009-10-23 | 2011-04-26 | Uniwersytet Jagielloński | Nowe zastosowanie pochodnych 2-pirolidonu |
| EP2533645B1 (en) | 2010-02-09 | 2016-07-27 | The Johns Hopkins University | Methods and compositions for improving cognitive function |
| FR2961099B1 (fr) | 2010-06-09 | 2012-06-15 | Oreal | Derives de 2-pyrrolidone fonctionnalisee par un radical ester, acide ou amide, la composition cosmetique les comprenant et leur utilisation pour le conditionnement des matieres keratiniques |
| FR2961098A1 (fr) | 2010-06-09 | 2011-12-16 | Oreal | Composition comprenant au moins une 2-pyrrolidone fonctionnalisee en position 4 par un acide carboxylique ou amide, et au moins un colorant direct ou un pigment pour la teinture des fibres keratiniques |
| FR2961101B1 (fr) | 2010-06-09 | 2013-01-25 | Oreal | Composition comprenant au moins une 2-pyrrolidone fonctionnalisee par un radical ester ou amide, et au moins un pigment ou un colorant direct pour la teinture des matieres keratiniques |
| US8866452B1 (en) | 2010-08-11 | 2014-10-21 | Cirrus Logic, Inc. | Variable minimum input voltage based switching in an electronic power control system |
| US9510401B1 (en) | 2010-08-24 | 2016-11-29 | Cirrus Logic, Inc. | Reduced standby power in an electronic power control system |
| US8466297B2 (en) | 2010-11-01 | 2013-06-18 | Milan Soukup | Manufacturing process for (S)-Pregabalin |
| CA2818025A1 (en) | 2010-11-15 | 2012-05-24 | Agenebio, Inc. | Pyridazine derivatives, compositions and methods for treating cognitive impairment |
| US20120214859A1 (en) * | 2011-02-09 | 2012-08-23 | Michela Gallagher | Methods and compositions for improving cognitive function |
| ME02351B (me) | 2011-04-18 | 2016-06-20 | Ucb Biopharma Sprl | Derivati 2 -oxo- 1-imidazolidinil imidazotiadiazol |
| CN103636109B (zh) | 2011-06-03 | 2016-08-17 | 塞瑞斯逻辑公司 | 用于操作开关电力转换器的方法和装置以及电力分配系统 |
| IN2014CN03043A (ru) | 2011-09-30 | 2015-07-03 | Univ Tufts | |
| WO2013100568A1 (en) * | 2011-12-27 | 2013-07-04 | Bio-Pharm Solutions Co., Ltd. | Phenyl carbamate compounds for use in preventing or treating stroke |
| TW201408293A (zh) * | 2012-07-05 | 2014-03-01 | Merz Pharma Gmbh & Co Kgaa | (r)-苯基披喇瑟盪於治療疾病相關疲勞之用途 |
| TW201408294A (zh) * | 2012-07-05 | 2014-03-01 | Merz Pharma Gmbh & Co Kgaa | (r)-苯基披喇瑟盪於治療帕金森氏症之用除 |
| CA2885369A1 (en) | 2012-09-28 | 2014-04-03 | Tufts University | Uridine diphosphate derivatives, prodrugs, compositions and uses thereof |
| EP2919788A4 (en) | 2012-11-14 | 2016-05-25 | Univ Johns Hopkins | METHODS AND COMPOSITIONS FOR THE TREATMENT OF SCHIZOPHRENIA |
| DK2928865T3 (en) | 2012-12-07 | 2018-06-18 | Merck Sharp & Dohme | BIOCATALYTIC TRANSAMINATION PROCEDURE |
| WO2014087367A2 (en) * | 2012-12-09 | 2014-06-12 | Mahesh Kandula | Compositions and methods for the treatment of neurological diseases and its associated complications |
| EP2945942B1 (en) | 2013-01-18 | 2018-05-09 | ARK Diagnostics, Inc. | Voriconazole immunoassays |
| ES2674704T3 (es) | 2013-02-13 | 2018-07-03 | Ark Diagnostics, Inc. | Inmunoensayos de posaconazol |
| CA2904180C (en) | 2013-03-13 | 2022-05-10 | Tufts University | Uridine nucleoside derivatives, compositions and methods of use |
| AR095442A1 (es) | 2013-03-13 | 2015-10-14 | Univ Tufts | Derivados de nucleósido de uridina, composiciones y métodos de uso |
| EP2968237A4 (en) | 2013-03-15 | 2016-08-31 | Univ Johns Hopkins | METHOD AND COMPOSITIONS FOR IMPROVING COGNITIVE FUNCTION |
| DK2968220T3 (da) | 2013-03-15 | 2021-06-14 | Agenebio Inc | Fremgangsmåder og sammensætninger til forbedring af kognitiv funktion |
| CN103342672B (zh) * | 2013-07-02 | 2015-12-23 | 扬州大学 | 取代吡咯烷-2-酮的新合成方法 |
| JP6465634B2 (ja) * | 2013-12-05 | 2019-02-06 | 株式会社日本触媒 | 環状アミド基含有重合体 |
| JP6453632B2 (ja) * | 2013-12-05 | 2019-01-16 | 株式会社日本触媒 | 環状アミドアクリレート含有組成物およびその製造方法 |
| EP3083569B1 (en) | 2013-12-20 | 2022-01-26 | Agenebio, Inc. | Benzodiazepine derivatives, compositions, and methods for treating cognitive impairment |
| ME03518B (me) | 2014-01-21 | 2020-04-20 | Janssen Pharmaceutica Nv | Kombinacije koje obuhvataju pozitivne alosterične modulatore ili ortosterične agoniste metabotropnog glutamatergičnog receptora podtipa 2 i njihova primjena |
| WO2015110435A1 (en) | 2014-01-21 | 2015-07-30 | Janssen Pharmaceutica Nv | Combinations comprising positive allosteric modulators or orthosteric agonists of metabotropic glutamatergic receptor subtype 2 and their use |
| CN104098497B (zh) * | 2014-06-17 | 2016-04-13 | 王庚禹 | 一种新的酰胺类化合物 |
| WO2016075082A1 (en) | 2014-11-10 | 2016-05-19 | Sandoz Ag | Stereoselective reductive amination of alpha-chiral aldehydes using omega-transaminases for the synthesis of precursors of pregabalin and brivaracetam |
| US20180021307A1 (en) | 2015-02-20 | 2018-01-25 | Ucb Biopharma Sprl | Combination Treatment |
| WO2016191435A1 (en) * | 2015-05-25 | 2016-12-01 | Peng Wang | Processes to produce brivaracetam |
| CN108689968B (zh) * | 2015-05-25 | 2020-09-15 | 苏州鹏旭医药科技有限公司 | 两种化合物及其制备方法和在合成布瓦西坦中的用途 |
| CN106365986B (zh) * | 2015-07-21 | 2019-01-08 | 苏州鹏旭医药科技有限公司 | 化合物及其制备方法和在合成布瓦西坦中的用途 |
| CN107922457B (zh) | 2015-06-19 | 2022-05-13 | 森托瑞恩生物制药公司 | 用于控制药物释放的递送系统 |
| WO2016205739A1 (en) | 2015-06-19 | 2016-12-22 | Belew Mekonnen | Benzodiazepine derivatives, compositions, and methods for treating cognitive impairment |
| WO2017076737A1 (en) | 2015-11-03 | 2017-05-11 | Ucb Biopharma Sprl | Continuous process for preparing brivaracetam |
| SI3371150T1 (sl) | 2015-11-03 | 2021-11-30 | UCB Biopharma SRL | Postopek za pripravo brivaracetama |
| CN106748748B (zh) * | 2015-11-10 | 2021-08-24 | 成都国为生物医药有限公司 | 一种布瓦西坦的制备方法及其中间体 |
| EP3397253A1 (en) | 2015-12-30 | 2018-11-07 | Adamas Pharmaceuticals, Inc. | Methods and compositions for the treatment of seizure-related disorders |
| CN105646319B (zh) * | 2015-12-30 | 2018-05-18 | 佛山市隆信医药科技有限公司 | 一种布瓦西坦的制备方法 |
| EP3452447A4 (en) | 2016-05-03 | 2019-12-18 | The Regents of The University of California | IRES-MEDIATED PROTEIN SYNTHESIS INHIBITORS |
| RU2629117C1 (ru) * | 2016-06-14 | 2017-08-24 | Сизов Владимир Владимирович | Способ получения 4-замещенного 2-[2-оксо-1-пирролидинил] ацетамида |
| CN107513031B (zh) * | 2016-06-16 | 2022-08-02 | 上海医药集团股份有限公司 | 一种2-氧代-1-吡咯烷手性衍生物的制备方法 |
| BR112019012821A2 (pt) | 2016-12-19 | 2019-11-26 | Agenebio Inc | derivados de benzodiazepina, composições e métodos para o tratamento do comprometimento cognitivo |
| US20180170941A1 (en) | 2016-12-19 | 2018-06-21 | Agenebio, Inc. | Benzodiazepine derivatives, compositions, and methods for treating cognitive impairment |
| AU2018210393A1 (en) | 2017-01-20 | 2019-07-25 | The Regents Of The University Of California | Inhibitors of the N-terminal domain of the androgen receptor |
| WO2018141276A1 (zh) * | 2017-02-05 | 2018-08-09 | 苏州鹏旭医药科技有限公司 | 布瓦西坦中间体的晶型a及其制备方法和布瓦西坦的晶型c及其制备方法 |
| CN106866483A (zh) * | 2017-02-05 | 2017-06-20 | 苏州鹏旭医药科技有限公司 | 布瓦西坦的晶型c及其制备方法 |
| CN108503610B (zh) | 2017-02-24 | 2019-09-13 | 北京艾百诺医药股份有限公司 | 一种光学纯的(r)-4-正丙基-二氢呋喃-2(3h)-酮的制备方法 |
| CN108658831B (zh) * | 2017-03-30 | 2021-11-05 | 江苏豪森药业集团有限公司 | 2-氧代-1-吡咯烷衍生物或其盐的制备方法 |
| EP3615513B1 (en) | 2017-04-24 | 2022-07-20 | Tesaro, Inc. | Methods of manufacturing of niraparib |
| JP7221227B2 (ja) | 2017-06-30 | 2023-02-13 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 発毛を調節するための組成物及び方法 |
| CN107793342A (zh) * | 2017-10-19 | 2018-03-13 | 丽珠集团新北江制药股份有限公司 | 一种布瓦西坦的制备方法 |
| CN107721896A (zh) * | 2017-10-19 | 2018-02-23 | 丽珠集团新北江制药股份有限公司 | 一种布瓦西坦的中间体的制备方法 |
| MX2020005472A (es) | 2017-11-30 | 2020-11-11 | Centurion Biopharma Corp | Sistemas de administración de fármacos a base de maitansinoide. |
| CN111712511B (zh) | 2017-11-30 | 2024-07-16 | 拉德克斯公司 | 澳瑞他汀e衍生物的白蛋白结合产物 |
| WO2019152536A1 (en) | 2018-01-30 | 2019-08-08 | The Regents Of The University Of California | Inhibitors of the wnt/beta-catenin pathway |
| CN108147988B (zh) * | 2018-02-13 | 2020-10-02 | 扬州奥锐特药业有限公司 | 一种高手性纯度内酰胺化合物的制备方法 |
| CN108530402B (zh) * | 2018-04-10 | 2020-06-26 | 浙江工业大学 | 一种(R)-3-丙基-γ-丁内酯的制备方法 |
| EP3566760A1 (en) * | 2018-05-07 | 2019-11-13 | Universite Libre De Bruxelles | Method for nucleating crystals from a solution in a capillary tube |
| ES2947618T3 (es) | 2018-05-08 | 2023-08-14 | UCB Biopharma SRL | Derivados de 1-imidazotiadiazolo-2H-pirrol-5-ona |
| CN112601749B (zh) | 2018-06-19 | 2024-03-26 | 艾吉因生物股份有限公司 | 用于治疗认知损害的苯并二氮杂环庚三烯衍生物,组合物和方法 |
| CN110615744B (zh) * | 2018-06-20 | 2023-01-06 | 上海朴颐化学科技有限公司 | 一种布瓦西坦中间体及其制备方法 |
| WO2020006489A1 (en) | 2018-06-29 | 2020-01-02 | The Regents Of The University Of California | New molecular tweezers against neurological disorders and viral infections |
| RU2699669C1 (ru) * | 2018-07-04 | 2019-09-09 | Общество С Ограниченной Ответственностью "Валента - Интеллект" | Новые составы N-карбамоилметил-4-фенил-2-пирролидона |
| SG11202100429TA (en) | 2018-07-27 | 2021-02-25 | California Inst Of Techn | Cdk inhibitors and uses thereof |
| US11214568B2 (en) | 2018-10-18 | 2022-01-04 | California Institute Of Technology | Gem-disubstituted pyrrolidines, piperazines, and diazepanes, and compositions and methods of making the same |
| US20220047548A1 (en) | 2018-12-04 | 2022-02-17 | Metys Pharmaceuticals AG | SYNERGISTIC COMPOSITIONS COMPRISING (R)-2-(2-OXOPYRROLIDIN-1-YL)BUTANAMIDE AND (S)-2-(2-e OXOPYRROLEDIN-1-YL)BUTANAMEDE IN A NON-RACEMIC RATIO |
| CN109932442A (zh) * | 2019-03-04 | 2019-06-25 | 成都美域高制药有限公司 | 一种布瓦西坦异构体的检测方法 |
| WO2020198323A1 (en) | 2019-03-25 | 2020-10-01 | California Institute Of Technology | Prmt5 inhibitors and uses thereof |
| SG11202112827QA (en) | 2019-06-04 | 2021-12-30 | Hager Biosciences Llc | Imidazolo derivatives, compositions and methods as orexin antagonists |
| CN110357752A (zh) * | 2019-08-15 | 2019-10-22 | 中国工程物理研究院化工材料研究所 | 一种快速制备均匀包覆含能材料的方法 |
| RU2732245C1 (ru) * | 2019-08-30 | 2020-09-14 | Ооо "Валента-Интеллект" | Новые составы n-карбамоилметил-4-фенил-2-пирролидона для лечения и профилактики ожирения |
| CN110551050A (zh) * | 2019-09-02 | 2019-12-10 | 南通大学 | 一种2-[3’-(N-Boc-吡咯基)]-苯甲酸的合成方法 |
| US10781170B1 (en) | 2019-10-21 | 2020-09-22 | Divi's Laboratories Ltd. | Process for preparing Brivaracetam |
| US20230100559A1 (en) | 2020-01-07 | 2023-03-30 | The Trustees Of Princeton University | Compositions and Methods for Treatment of Disease by Manipulation of Serine Metabolism |
| EP4087847A4 (en) | 2020-01-10 | 2024-02-28 | The Regents of the University of California | COMPOSITIONS AND METHODS FOR TREATING NEURODEGENERATIVE DISEASES |
| US20230174460A1 (en) | 2020-04-21 | 2023-06-08 | President And Fellowes Of Harvard College | Afmt analogs and their use in methods of treating parkinson's disease |
| LV15614A (lv) | 2020-07-30 | 2022-02-20 | Latvijas Organiskās Sintēzes Institūts | 2-(2-okso-3-pirolin-1-il)acetamīdi kā pretkrampju līdzekļi |
| US20230265082A1 (en) | 2020-08-10 | 2023-08-24 | Dana-Farber Cancer Institute, Inc. | Substituted 1,2,4-oxadiazoles as small molecule inhibitors of ubiquitin-specific protease 28 |
| CA3191166A1 (en) | 2020-08-10 | 2022-02-17 | Dana-Farber Cancer Institute, Inc. | Substituted 3-amino-4-methylbenzenesulfonamides as small molecule inhibitors of ubiquitin-specific protease 28 |
| WO2022035806A1 (en) | 2020-08-10 | 2022-02-17 | Dana-Farber Cancer Institute, Inc. | Fused tricyclic pyrimidine-thieno-pyridine small molecule inhibitors of ubiquitin-specific protease 28 |
| CN116323571A (zh) | 2020-10-23 | 2023-06-23 | 丹娜法伯癌症研究院 | 肌酸激酶(ck)的共价抑制剂以及其用于治疗和预防癌症的用途 |
| WO2022133237A2 (en) | 2020-12-18 | 2022-06-23 | Cornell University | Methods of treating neurodegenerative disorders and stat3-linked cancers using suppressors of electron leak |
| WO2022140289A1 (en) | 2020-12-21 | 2022-06-30 | Cornell University | Peptide-linked drug delivery system |
| US20240132480A1 (en) | 2021-01-08 | 2024-04-25 | Cornell University | Inhibitors of mycobacterium tuberculosis lipoamide dehydrogenase |
| US11400074B1 (en) | 2021-02-01 | 2022-08-02 | Divi's Laboratories Ltd. | Enzymatic process for the preparation of (2S)-2-[(4R)-2-oxo-4-propyl-pyrrolidin-1-yl]butyric acid and its conversion into brivaracetam |
| US11384050B1 (en) | 2021-02-03 | 2022-07-12 | Vitaworks Ip, Llc | Method for preparing levetiracetam and intermediates thereof |
| CN114948953A (zh) * | 2021-06-29 | 2022-08-30 | 四川大学华西医院 | 一种杂原子取代芳香类化合物及其盐的用途 |
| CN113511994B (zh) * | 2021-08-16 | 2023-03-21 | 江苏八巨药业有限公司 | 一种左乙拉西坦的制备方法 |
| CN114634437B (zh) * | 2022-03-29 | 2023-05-30 | 武汉氟本氘合新材料科技有限公司 | 一种布瓦西坦的简易制备方法 |
| US11884623B2 (en) | 2022-05-23 | 2024-01-30 | Divi's Laboratories Ltd. | Process for the preparation of (R)-4-propyl pyrrolidine-2-one, a key intermediate for synthesis of brivaracetam |
| WO2023250157A1 (en) | 2022-06-24 | 2023-12-28 | Cornell University | Inhibitors of mycobacterium tuberculosis lipoamide dehydrogenase |
| WO2024013209A1 (en) | 2022-07-13 | 2024-01-18 | Astrazeneca Ab | Pcsk9 inhibitors and methods of use thereof |
| WO2024039886A1 (en) | 2022-08-19 | 2024-02-22 | Agenebio, Inc. | Benzazepine derivatives, compositions, and methods for treating cognitive impairment |
| WO2024049236A1 (ko) * | 2022-08-31 | 2024-03-07 | 고려대학교 산학협력단 | 키랄 감마 락탐 유도체 또는 이의 약학적으로 허용가능한 염 및 이의 제조방법 |
| WO2024163711A1 (en) | 2023-02-02 | 2024-08-08 | Osmoses Inc. | Norbornyl benzocyclobutene ladder polymer composite membranes for fluid separation |
| EP4431086A1 (en) | 2023-03-16 | 2024-09-18 | Adalvo Limited | Pharmaceutical composition comprising (2s)-2-[(4r)-2-oxo-4-propyltetrahydro-1h-pyrrol-1-yl]butanamide |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE92031C (ru) | ||||
| DD92031A (ru) * | ||||
| US2836599A (en) * | 1957-03-07 | 1958-05-27 | Aerojet General Co | Nu-(carboxyalkyl) dinitro lactams |
| GB1309692A (en) * | 1970-02-13 | 1973-03-14 | Ucb Sa | N-substituted lactams |
| GB1039113A (en) | 1964-08-06 | 1966-08-17 | Ucb Sa | New n-substituted lactams |
| US4008281A (en) | 1973-12-03 | 1977-02-15 | Monsanto Company | Asymmetric catalysis |
| HU177239B (hu) | 1974-10-15 | 1981-08-28 | Monsanto Co | Eljárás N-acetamido-L-alanin-származékok előállítására α-acetamido-akrilsav-származékok aszimmetrikus katalitikus hídrogénezésével |
| GB8412358D0 (en) | 1984-05-15 | 1984-06-20 | Ucb Sa | Pharmaceutical composition |
| CN1015542B (zh) * | 1984-05-15 | 1992-02-19 | 尤西比公司 | (R)-α-乙基-2-氧代-1-吡咯烷乙酰胺的制备方法 |
| GB8412357D0 (en) * | 1984-05-15 | 1984-06-20 | Ucb Sa | Pharmaceutical composition |
| JPS60166692A (ja) | 1984-09-28 | 1985-08-29 | Kazuo Achinami | 新規不斉還元試薬 |
| CH666891A5 (de) * | 1985-11-26 | 1988-08-31 | Lonza Ag | 4-alkoxy-2-oxo-pyrrolidin-1-yl-essigsaeure-c(1)-c(4)-alkylester, deren herstellung und verwendung. |
| DE3719873A1 (de) * | 1987-06-13 | 1988-12-29 | Basf Ag | Verfahren zur herstellung von itaconsaeurediestern und itaconsaeure |
| JPH0757758B2 (ja) | 1988-10-24 | 1995-06-21 | 高砂香料工業株式会社 | ルテニウム―ホスフィン錯体 |
| GB8827389D0 (en) | 1988-11-23 | 1988-12-29 | Ucb Sa | Process for preparation of(s)alpha-ethyl-2-oxo-1-pyrrolidineacetamide |
| SK279285B6 (sk) * | 1991-05-02 | 1998-09-09 | Daiichi Pharmaceutical Co. | Použitie n-(2,6-dimetylfenyl)-2-(2-oxo-1-pyrolidin |
| US5171892A (en) | 1991-07-02 | 1992-12-15 | E. I. Du Pont De Nemours And Company | Chiral phospholanes via chiral 1,4-diol cyclic sulfates |
| GB9319732D0 (en) | 1993-09-24 | 1993-11-10 | Ucb Sa | Use of (s)-alpha-ethyl-2-oxo-l-pyrrolidineacetamide for the treatment of anxiety |
| JPH1180027A (ja) * | 1997-09-12 | 1999-03-23 | Dai Ichi Seiyaku Co Ltd | 向知性薬 |
| TW544311B (en) * | 1998-08-06 | 2003-08-01 | Daiichi Seiyaku Co | Therapeutic or preventive agent for intractable epilepsies |
| CZ20001055A3 (cs) * | 1998-10-02 | 2000-08-16 | Dupont Pharmaceuticals Company | Nové laktamové inhibitory metaloproteázy |
| ATE361751T1 (de) | 1999-12-01 | 2007-06-15 | Ucb Sa | Ein pyrrolidinacetatderivat zur behandlung von chronischem oder neuropathischem schmerz |
| GB0004297D0 (en) * | 2000-02-23 | 2000-04-12 | Ucb Sa | 2-oxo-1 pyrrolidine derivatives process for preparing them and their uses |
| US6686477B2 (en) | 2000-09-29 | 2004-02-03 | Eastman Chemical Company | Highly enantiomerically pure lactam-substituted propanoic acid derivatives and methods of making and using same |
-
2000
- 2000-02-23 GB GBGB0004297.8A patent/GB0004297D0/en not_active Ceased
-
2001
- 2001-02-21 AU AU5214401A patent/AU5214401A/xx active Pending
- 2001-02-21 MX MXPA02008056A patent/MXPA02008056A/es active IP Right Grant
- 2001-02-21 ES ES04008270T patent/ES2355140T3/es not_active Expired - Lifetime
- 2001-02-21 AU AU2001252144A patent/AU2001252144C1/en not_active Expired
- 2001-02-21 PT PT04007878T patent/PT1452524E/pt unknown
- 2001-02-21 RS YUP-632/02A patent/RS50455B/sr unknown
- 2001-02-21 HU HU0204526A patent/HU229514B1/hu unknown
- 2001-02-21 PL PL359388A patent/PL212197B1/pl not_active IP Right Cessation
- 2001-02-21 RU RU2006125756/04A patent/RU2355680C2/ru not_active IP Right Cessation
- 2001-02-21 KR KR1020027010960A patent/KR100816185B1/ko active Protection Beyond IP Right Term
- 2001-02-21 ES ES01925354T patent/ES2248307T3/es not_active Expired - Lifetime
- 2001-02-21 CZ CZ2005-763A patent/CZ304702B6/cs unknown
- 2001-02-21 AT AT01940256T patent/ATE282592T1/de active
- 2001-02-21 PT PT04007733T patent/PT1447399E/pt unknown
- 2001-02-21 ES ES04007733T patent/ES2264060T3/es not_active Expired - Lifetime
- 2001-02-21 AU AU73896/01A patent/AU778510B2/en not_active Ceased
- 2001-02-21 CN CNB2005100713086A patent/CN1303066C/zh not_active Expired - Fee Related
- 2001-02-21 EP EP05012174A patent/EP1577296A1/en not_active Withdrawn
- 2001-02-21 WO PCT/EP2001/001992 patent/WO2001062726A2/en active Application Filing
- 2001-02-21 NZ NZ520448A patent/NZ520448A/en not_active IP Right Cessation
- 2001-02-21 CZ CZ20022849A patent/CZ20022849A3/cs unknown
- 2001-02-21 DK DK04007733T patent/DK1447399T3/da active
- 2001-02-21 ES ES04007878T patent/ES2334998T3/es not_active Expired - Lifetime
- 2001-02-21 AT AT04007733T patent/ATE325093T1/de active
- 2001-02-21 CN CNB018055079A patent/CN1179944C/zh not_active Expired - Fee Related
- 2001-02-21 CO CO01013823A patent/CO5280059A1/es not_active Application Discontinuation
- 2001-02-21 KR KR1020057016175A patent/KR100720784B1/ko active Protection Beyond IP Right Term
- 2001-02-21 MY MYPI20010775A patent/MY138966A/en unknown
- 2001-02-21 EP EP04007733A patent/EP1447399B9/en not_active Expired - Lifetime
- 2001-02-21 ME MEP-2009-61A patent/ME00595B/me unknown
- 2001-02-21 BR BRPI0108664A patent/BRPI0108664B8/pt not_active IP Right Cessation
- 2001-02-21 PL PL380061A patent/PL213669B1/pl unknown
- 2001-02-21 DE DE60113514T patent/DE60113514T2/de not_active Expired - Lifetime
- 2001-02-21 BR BR0108657-0A patent/BR0108657A/pt not_active IP Right Cessation
- 2001-02-21 RU RU2002124522A patent/RU2291860C3/ru active
- 2001-02-21 EP EP01925354A patent/EP1265862B1/en not_active Expired - Lifetime
- 2001-02-21 EP EP04007878A patent/EP1452524B1/en not_active Expired - Lifetime
- 2001-02-21 RO ROA200201141A patent/RO121597B1/ro unknown
- 2001-02-21 CN CNA2005100999524A patent/CN1740151A/zh active Pending
- 2001-02-21 EP EP01940256A patent/EP1263727B1/en not_active Expired - Lifetime
- 2001-02-21 MY MYPI20053631A patent/MY139420A/en unknown
- 2001-02-21 CZ CZ2002-2850A patent/CZ304420B6/cs not_active IP Right Cessation
- 2001-02-21 HU HU0300196A patent/HUP0300196A3/hu unknown
- 2001-02-21 MX MXPA02008206A patent/MXPA02008206A/es active IP Right Grant
- 2001-02-21 EP EP05013657A patent/EP1604979A1/en not_active Withdrawn
- 2001-02-21 JP JP2001561734A patent/JP4121744B2/ja not_active Expired - Lifetime
- 2001-02-21 DE DE60143493T patent/DE60143493D1/de not_active Expired - Lifetime
- 2001-02-21 DE DE60140222T patent/DE60140222D1/de not_active Expired - Lifetime
- 2001-02-21 CN CNA2005100999539A patent/CN1740150A/zh active Pending
- 2001-02-21 EP EP04030940A patent/EP1577295A1/en not_active Withdrawn
- 2001-02-21 SI SI200130451T patent/SI1265862T1/sl unknown
- 2001-02-21 MY MYPI20010763A patent/MY127149A/en unknown
- 2001-02-21 RS YUP-631/02A patent/RS50454B/sr unknown
- 2001-02-21 RU RU2002124865/04A patent/RU2292336C2/ru not_active IP Right Cessation
- 2001-02-21 AT AT04008270T patent/ATE488500T1/de not_active IP Right Cessation
- 2001-02-21 IL IL15075701A patent/IL150757A0/xx not_active IP Right Cessation
- 2001-02-21 ES ES01940256T patent/ES2231501T3/es not_active Expired - Lifetime
- 2001-02-21 DK DK04007878.4T patent/DK1452524T3/da active
- 2001-02-21 EG EG20010172A patent/EG24375A/xx active
- 2001-02-21 DK DK01925354T patent/DK1265862T3/da active
- 2001-02-21 KR KR1020057016174A patent/KR100681580B1/ko not_active IP Right Cessation
- 2001-02-21 AT AT04007878T patent/ATE445597T1/de active
- 2001-02-21 IL IL15084201A patent/IL150842A0/xx active IP Right Grant
- 2001-02-21 CA CA002401033A patent/CA2401033C/en not_active Expired - Lifetime
- 2001-02-21 US US10/204,275 patent/US6713635B2/en not_active Expired - Fee Related
- 2001-02-21 KR KR1020027010984A patent/KR100759145B1/ko not_active IP Right Cessation
- 2001-02-21 DE DE60119397T patent/DE60119397T2/de not_active Expired - Lifetime
- 2001-02-21 CO CO01013822A patent/CO5271667A1/es not_active Application Discontinuation
- 2001-02-21 WO PCT/EP2001/001956 patent/WO2001064637A1/en active Application Filing
- 2001-02-21 DE DE60107216T patent/DE60107216T2/de not_active Expired - Lifetime
- 2001-02-21 CN CNB018054455A patent/CN1208319C/zh not_active Expired - Lifetime
- 2001-02-21 HU HU0500902A patent/HU230270B1/hu active Protection Beyond IP Right Term
- 2001-02-21 PL PL365159A patent/PL210121B1/pl unknown
- 2001-02-21 MY MYPI20052965A patent/MY140593A/en unknown
- 2001-02-21 EP EP04008270A patent/EP1477478B1/en not_active Expired - Lifetime
- 2001-02-21 JP JP2001563480A patent/JP4081275B2/ja not_active Expired - Fee Related
- 2001-02-21 RO ROA200201076A patent/RO121559B1/ro unknown
- 2001-02-21 CA CA002401048A patent/CA2401048C/en not_active Expired - Fee Related
- 2001-02-21 AT AT01925354T patent/ATE304999T1/de active
- 2001-03-13 TW TW095112075A patent/TW200626545A/zh unknown
- 2001-03-13 TW TW095112074A patent/TW200626544A/zh unknown
- 2001-04-01 SA SA01220027A patent/SA01220027B1/ar unknown
- 2001-04-24 SA SA01220078A patent/SA01220078B1/ar unknown
-
2002
- 2002-02-21 US US10/204,266 patent/US6784197B2/en not_active Expired - Lifetime
- 2002-07-16 ZA ZA200205671A patent/ZA200205671B/en unknown
- 2002-07-16 IS IS6472A patent/IS2119B/is unknown
- 2002-07-22 ZA ZA200205837A patent/ZA200205837B/en unknown
- 2002-07-22 IL IL150842A patent/IL150842A/en unknown
- 2002-07-23 IS IS6481A patent/IS2176B/is unknown
- 2002-08-14 BG BG107004A patent/BG65923B1/bg unknown
- 2002-08-20 BG BG107016A patent/BG65783B1/bg unknown
- 2002-08-20 BG BG109297A patent/BG109297A/en unknown
- 2002-08-22 NO NO20023995A patent/NO324051B1/no not_active IP Right Cessation
- 2002-08-22 NO NO20023997A patent/NO324485B1/no active Protection Beyond IP Right Term
- 2002-08-26 CU CU20020181A patent/CU23293B7/es not_active IP Right Cessation
- 2002-08-26 CU CU20020180A patent/CU23201A3/es unknown
-
2003
- 2003-07-01 US US10/609,544 patent/US6858740B2/en not_active Expired - Fee Related
- 2003-07-09 HK HK03104916.0A patent/HK1052516B/zh not_active IP Right Cessation
- 2003-07-09 HK HK03104935.7A patent/HK1052695B/zh not_active IP Right Cessation
- 2003-10-28 US US10/694,090 patent/US6806287B2/en not_active Expired - Lifetime
- 2003-10-28 US US10/693,917 patent/US6911461B2/en active Active
-
2004
- 2004-04-15 US US10/824,345 patent/US6969770B2/en not_active Expired - Fee Related
-
2005
- 2005-01-04 US US11/028,039 patent/US7217826B2/en not_active Expired - Fee Related
- 2005-01-27 US US11/043,176 patent/US7358276B2/en not_active Expired - Lifetime
- 2005-01-27 US US11/043,145 patent/US20050171187A1/en not_active Abandoned
- 2005-02-09 IL IL166768A patent/IL166768A/en not_active IP Right Cessation
- 2005-02-17 AU AU2005200718A patent/AU2005200718B2/en not_active Ceased
- 2005-02-17 AU AU2005200717A patent/AU2005200717B2/en not_active Ceased
- 2005-06-29 IS IS7919A patent/IS7919A/is unknown
- 2005-06-29 IS IS7921A patent/IS7921A/is unknown
- 2005-06-29 IS IS7923A patent/IS7923A/is unknown
- 2005-06-29 IS IS7918A patent/IS7918A/is unknown
- 2005-06-29 IS IS7920A patent/IS7920A/is unknown
- 2005-06-29 IS IS7922A patent/IS2754B/is unknown
- 2005-07-27 JP JP2005217433A patent/JP2006022107A/ja active Pending
- 2005-07-27 NO NO20053644A patent/NO20053644L/no not_active Application Discontinuation
- 2005-07-27 NO NO20053645A patent/NO20053645L/no not_active Application Discontinuation
- 2005-07-27 JP JP2005217442A patent/JP4938259B2/ja not_active Expired - Lifetime
- 2005-08-09 IL IL170181A patent/IL170181A/en active Protection Beyond IP Right Term
- 2005-08-11 RU RU2005125569/04A patent/RU2005125569A/ru not_active Application Discontinuation
- 2005-08-12 RU RU2005125645/04A patent/RU2005125645A/ru not_active Application Discontinuation
- 2005-09-16 BG BG109297A patent/BG65803B1/bg unknown
-
2006
- 2006-07-28 CY CY20061101045T patent/CY1105517T1/el unknown
-
2007
- 2007-04-10 JP JP2007102379A patent/JP4769756B2/ja not_active Expired - Fee Related
- 2007-12-13 US US12/000,512 patent/US7692028B2/en not_active Expired - Fee Related
-
2010
- 2010-01-11 CY CY20101100031T patent/CY1109718T1/el unknown
- 2010-02-17 US US12/656,808 patent/US8034958B2/en not_active Expired - Fee Related
-
2011
- 2011-08-31 US US13/222,477 patent/US8492416B2/en not_active Expired - Lifetime
-
2016
- 2016-03-08 NO NO2016005C patent/NO2016005I1/no unknown
- 2016-03-09 BE BE2016C012C patent/BE2016C012I2/fr unknown
- 2016-03-11 LU LU92993C patent/LU92993I2/xx unknown
- 2016-04-13 HU HUS1600017C patent/HUS1600017I1/hu unknown
- 2016-05-04 LT LTPA2016013C patent/LTC1265862I2/lt unknown
- 2016-05-25 FR FR16C1001C patent/FR16C1001I2/fr active Active
- 2016-05-27 NL NL300815C patent/NL300815I2/nl unknown
- 2016-06-30 CY CY2016022C patent/CY2016022I2/el unknown
-
2023
- 2023-06-20 NO NO2023025C patent/NO2023025I1/no unknown
Non-Patent Citations (3)
| Title |
|---|
| & * |
| пример 4. * |
| реферат. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2355680C2 (ru) | Производные 2-оксо-1-пирролидина, способ их получения | |
| KR101124098B1 (ko) | 2-옥소-1-피롤리딘 유도체를 제조하는 방법 | |
| AU2008265181A1 (en) | Process for the synthesis of intermediates of renin inhibitors such as aliskiren | |
| Yakura et al. | Synthesis of an immunomodulator (+)-conagenin and its analogs | |
| TWI308912B (en) | Process for preparing 2-oxo-1-pyrrolidine derivatives | |
| TW200536828A (en) | 2-oxo-1-pyrrolidine derivatives, process for preparing them and their uses | |
| JPH05255285A (ja) | 環状アミンの立体選択的製造方法 | |
| MXPA06003024A (en) | Process for preparing 2-oxo-1-pyrrolidine derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20140222 |