KR20110104074A - 퓨린 뉴클레오시드의 합성 - Google Patents
퓨린 뉴클레오시드의 합성 Download PDFInfo
- Publication number
- KR20110104074A KR20110104074A KR1020117017244A KR20117017244A KR20110104074A KR 20110104074 A KR20110104074 A KR 20110104074A KR 1020117017244 A KR1020117017244 A KR 1020117017244A KR 20117017244 A KR20117017244 A KR 20117017244A KR 20110104074 A KR20110104074 A KR 20110104074A
- Authority
- KR
- South Korea
- Prior art keywords
- formula
- alkyl
- compound
- cycloalkyl
- lower alkyl
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/20—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7076—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines containing purines, e.g. adenosine, adenylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H1/00—Processes for the preparation of sugar derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H15/00—Compounds containing hydrocarbon or substituted hydrocarbon radicals directly attached to hetero atoms of saccharide radicals
- C07H15/02—Acyclic radicals, not substituted by cyclic structures
- C07H15/04—Acyclic radicals, not substituted by cyclic structures attached to an oxygen atom of the saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/167—Purine radicals with ribosyl as the saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H19/00—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof
- C07H19/02—Compounds containing a hetero ring sharing one ring hetero atom with a saccharide radical; Nucleosides; Mononucleotides; Anhydro-derivatives thereof sharing nitrogen
- C07H19/04—Heterocyclic radicals containing only nitrogen atoms as ring hetero atom
- C07H19/16—Purine radicals
- C07H19/20—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids
- C07H19/213—Purine radicals with the saccharide radical esterified by phosphoric or polyphosphoric acids containing cyclic phosphate
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H5/00—Compounds containing saccharide radicals in which the hetero bonds to oxygen have been replaced by the same number of hetero bonds to halogen, nitrogen, sulfur, selenium, or tellurium
- C07H5/02—Compounds containing saccharide radicals in which the hetero bonds to oxygen have been replaced by the same number of hetero bonds to halogen, nitrogen, sulfur, selenium, or tellurium to halogen
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Crystallography & Structural Chemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
Abstract
본 발명은 화합물, 그의 입체이성체, 그의 염(산 또는 염기 부가염), 수화물, 용매화물 또는 결정질 형태인 뉴클레오시드 유도체의 포스포르아미데이트 프로드러그 또는 사이클릭 포스페이트 전구약물의 제조방법에 관한 것이다.
Description
본 발명은 미국을 제외한 모든 국가에서 출원인으로서 지정된 미국 국립 법인인 파마셋 인코포레이티드(Pharmasset, Inc.); 대한민국 국적의 천병권; 미국 국적의 두 진파(Jinfa Du); 인도 국적의 라차콘다 수구나(Suguna Rachakonda); 미국 국적의 로스 브루스 에스.(Bruce S. Ross); 미국 국적의 소피아 마이클 조셉(Michael Joseph Sofia); 인도 국적의 파물라파티 가나파티 레디(Ganapati Reddy Pamulapati); 대한민국 국적의 장원석; 미국 국적의 쟝 하이-렌(Hai-Ren Zhang); 미국 국적의 나가라트남 다나팔란(Dhanapalan Nagarathnam)의 명의를 갖는 PCT 국제 특허 출원으로서 2009년 12월 23일자로 출원되었으며, 전문이 인용에 의해 본 발명에 포함되는 2008년 12월 23일자로 출원된 미국 가특허 출원 제61/140,317호의 우선권을 주장한다.
C형 간염 바이러스(HCV) 감염은 세계 인구의 2 내지 15%로 추정되는 감염된 사람 중의 상당수에서 간경변 및 간세포 암종과 같은 만성 간 질환을 유도하는 주요한 보건 문제이다. 미국 질병통제센터에 따르면 미국에서만 4백 50만명의 사람이 감염된 것으로 추정된다. 세계보건기구에 따르면, 전세계적으로 감염된 사람이 2억명 이상이고, 매년 3백만 내지 4백만명이 감염된다. 일단 감염되면, 약 20%의 사람은 바이러스를 없애지만, 나머지 사람들은 여생 동안 HCV를 보유할 수 있다. 만성 감염된 사람의 10 내지 20%는 결국 간을 파괴하는 간경변 또는 암이 발병한다. 상기 바이러스 질환은 오염된 혈액 및 혈액 제품, 오염된 바늘에 의해, 또는 성적으로 비경구적으로 전염되거나, 감염된 엄마 또는 보균자 엄마로부터 이들의 자녀에게 직접 전염된다. HCV 감염에 대한 현행 치료법은 재조합 인터페론-α 단독으로 또는 그 뉴클레오시드 동족체인 리바비브린과 조합한 면역치료에 한정되며 제한된 임상적 이점을 갖는다. 더욱이, HCV에 대한 백신은 전혀 확립되어 있지 않다. 결과적으로, 만성 HCV 감염을 효과적으로 방지하는 개선된 치료제가 긴급하게 요구된다.
퓨린 포스포르아미데이트는 HCV 바이러스의 강력한 억제제인 것으로 밝혀졌다(미국 특허 출원 제12/053,015호, 또한 WO2008/121634 참조). 그러나, 이들 화합물은 제조하기가 어려운데, 그 이유는 상기 퓨린 염기에 대한 리보스 당의 커플링과 관련한 수율이 불량하고 퓨린 염기에 대한 리보스 커플링 단계와 관련하여 C-1' 베타-입체선택성(stereoselectivity)이 불량하기 때문이다.
일반적으로, 뉴클레오시드 동족체를 제조하는 두 가지 방법이 있다. 첫번째 방식은 선형 합성 순서를 따르는데, 여기서 표적 뉴클레오시드는 적합한 뉴클레오시드로부터 제조된다. 이러한 접근법에서는, 통상, 전부는 아니더라도 대부분의 입체중심(stereocenter)이 설정되므로 입체선택적 화학반응에 대한 우려는 적다. 그러나, 상기 합성은 당의 광범위한 개질이 요구되는 경우 너무 길어질 수 있다.
신규한 뉴클레오시드를 합성하는 다른 접근법은 당 부분이 별도로 개질되고 나중에 적합한 실릴화 염기와 커플링되는 수렴형 합성을 이용한다(Vorbrueggen et al., J. Org. Chem. 1976, 41, 2084). 2-α-O-아실기가 존재하는 리보스 유도체의 경우, 1'-위치에서 목적하는 β 입체화학구조는 SnCl4 또는 TMSOTf와 같은 루이스산의 존재하의 이웃 기의 참여에 의해 고정된다. 그러나, 상기 당이 2-데옥시 뉴클레오시드에 대해 2-α-O-아실기를 갖지 않는 경우, 보르브루에겐(Vorbrueggen) 조건이 이성체성(isomeric) 혼합물을 생성시킬 것으로 기대되는데, 상기 혼합물은 분리하기 어려운 경우가 종종 있다. 이러한 입체화학적 문제를 피하는 일반적인 방식은 퓨린 염기 또는 실릴화 피리미딘 염기의 염과의 SN2형 커플링이 목적하는 β 이성체(isomer)가 풍부한 혼합물을 생성시키도록 α-할로당(halosugar)을 사용하는 방식이다(Kazimierczuk, Z. et al. J. Am. Chem. Soc. 1984, 106, 6379-6382; Chun, B. K. et al J. Org. Chem, 2000, 65, 685-693; Zhong, M. et al. J. Org. Chem. 2006, 71, 7773-7779). 그러나, 공정 화학 관점으로부터 이러한 접근법의 주요한 문제는, 많은 경우, 어떠한 어려운 정제 단계도 없이 양호한 수율로 목적하는 반응성 α-할로당을 수득하는 것이 어렵다는 것이다. 퓨린 염기의 염을 α-할로당과 반응시키는 예가 문헌 및 특허에 다수 있다.
SN2형 커플링을 수행하는 다른 가능한 방식은 단리된 효소 또는 전체 세포를 사용하여 상기 당-1-α-O-포스페이트를 퓨린 염기와 커플링시키는 효소적 글리코실화이다. 상기 포스페이트 중간체는 목적하는 당을 함유하는 다른 뉴클레오시드로부터 효소적으로 생성될 수 있다. 이러한 커플링된 반응은 글리코실전이반응(transglycosylation)이라 불린다. 이러한 전환은 고도로 입체특이적이다. 안타깝게도, 천연 효소는 제한된 수의 개질된 당으로서만 작용한다. 통상적인 당의 경우, 미생물 범위의 기존 효소는 활성에 대해 또는 광범위한 연구를 통해 선별될 필요가 있으며, 돌연변이 효소가 유전공학을 통해 선택 및 생성될 수 있는 가능성이 있다(Komatsu, H. et al Tetrahedron Lett. 2003, 44, 2899-2901; Okuyama, K. et al. Biosci. Biotechnol. Biochem. 2003, 67(5), 989-995). 2'-불소화 뉴클레오시드는 효소적으로 글리코실화하기 어렵지만, 특수한 천연 효소(Krenitsky et al., J. Med. Chem. 1993, 36, 119-12) 또는 독점적(proprietary) 유전자조작 효소(Metkinen Chemistry, Kuusisto, Finland)를 사용하여 달성하여 왔다. 2'-플루오로-2'-C-메틸 당에 대한 효소적 글리코실화를 사용하는 문헌 보고는 전혀 없다. 이것이 가능하다면, 이는 글리코실전이반응을 위해 2'-플루오로-2'-C-메틸우리딘을 사용하여 출발하거나 글리코실화를 위해 상기 당의 1-O-α-포스페이트를 사용하여 출발할 필요가 있을 것이다. 이들 출발 물질의 합성 비용은 제안된 경로에 의해 화학적으로 제조된 최종 퓨린의 비용에 근접한다.
당을 퓨린 염기와 커플링하는 마지막 대안적인 방법은 미츠노부(Mitsunobu) 화학을 사용하는 방법이다. 이러한 접근법은 N,N-디사이클로헥실카보디이오마이드(DCC) 및 트리페닐포스핀과 같은 축합 시약을 사용한다. 이러한 반응은 다양한 기질을 수용하지만, 수율은 통상 더 낮으며 입체특이성이 없다. 미츠노부 시약 및 부산물로부터 생성물을 정제하는 것 또한 종종 문제가 된다.
2'-데옥시-2'-플루오로-2'-C-메틸 퓨린 뉴클레오시드 및 이들의 상응하는 뉴클레오티드 포스포르아미데이트는 2'-위치에서 지향성 α-아실옥시기가 없기 때문에 2'-데옥시 뉴클레오시드 범주에 속한다. 상기 퓨린 동족체의 밀접한 유도체는 2'-4급(quaternary) 중심을 형성하는 복잡성으로 인해 5% 미만의 총 수율로 상기 선형 뉴클레오시드 경로를 사용하여 처음에 제조되었다. 최저 수율 단계인 불소화 단계는 상기 순서에서 늦게 수행되었다. 이러한 경로는 대규모 합성에 적합하지 않다(Clark, J. L. et al. Bioorg. Med. Chem. Lett. 2006, 16, 1712-1715).
화학식 Ⅰ의 화합물 또는 그의 염, 또는 화학식 Ⅱ의 화합물 또는 그의 염이 기술된다:
화학식 Ⅰ
화학식 Ⅱ
상기에서,
(a) R1은 수소, n-알킬; 분지형 알킬; 사이클로알킬; 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며,
상기 페닐 또는 나프틸은 선택적으로 C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 알콕시, F, Cl, Br, I, 니트로, 시아노, C1 -6 할로알킬, -N(R1')2, C1 -6 아실아미노, -NHSO2C1 -6 알킬, -SO2N(R1')2, COR1 ", 및 -SO2C1 -6 알킬(여기서, R1'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1-6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R1 "는 -OR' 또는 -N(R1')2이다) 중의 적어도 하나로 치환되고;
(b) R2는 수소 또는 C1 -10 알킬이거나, R3a 또는 R3b와 R2는 함께 (CH2)n(여기서, n은 2 내지 4이다)이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하고;
(c) R3a 및 R3b는
(ⅰ) 독립적으로 수소, C1 -10 알킬, 사이클로알킬, -(CH2)c(NR3')2, C1 -6 하이드록시알킬, -CH2SH, -(CH2)2S(O)dMe, -(CH2)3NHC(=NH)NH2,(1H-인돌-3-일)메틸,(1H-이미다졸-4-일)메틸, -(CH2)eCOR3 ", 아릴 및 아릴 C1 -3 알킬(상기 아릴기는 선택적으로 하이드록실, C1 -10 알킬, C1 -6 알콕시, 할로겐, 니트로 및 시아노로부터 선택된 기로 치환된다)로부터 선택되거나;
(ⅱ) R3a 및 R3b가 둘 다 C1 -6 알킬이거나;
(ⅲ) R3a와 R3b가 함께 (CH2)f이어서 스피로 환을 형성하거나;
(ⅳ) R3a가 수소이고 R3b와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나;
(ⅴ) R3b가 수소이고 R3a와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나(여기서, c는 1 내지 6이고, d는 0 내지 2이며, e는 0 내지 3이고, f는 2 내지 5이며, n은 2 내지 4이고, R3'는 독립적으로 수소 또는 C1 -6 알킬이며, R3 "는 -OR' 또는 -N(R3')2이다);
(ⅵ) R3a가 H이고, R3b가 H, CH3, CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이거나;
(ⅶ) R3a가 CH3, -CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이고, R3b가 H이며(상기 R3'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1 -6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R3 "는 -OR' 또는 -N(R3')2이다);
(d) R4는 수소, C1 -10 알킬; 저급 알킬, 알콕시, 디(저급 알킬)-아미노, 또는 할로겐으로 선택적으로 치환된 C1 -10 알킬; C1 -10 할로알킬, C3 -10 사이클로알킬, 사이클로알킬 알킬, 사이클로헤테로알킬, 아미노아실, 페닐과 같은 아릴, 피리디닐과 같은 헤테로아릴, 치환된 아릴 또는 치환된 헤테로아릴이고;
(e) R5는 H, 저급 알킬, CN, 비닐, O-(저급 알킬), 하이드록실 저급 알킬, 즉, 하이드록실 메틸(CH2OH)을 포함하는 -(CH2)pOH(여기서, p는 1 내지 6이다), CH2F, N3, CH2CN, CH2NH2, CH2NHCH3, CH2N(CH3)2, 알킨(선택적으로 치환됨), 또는 F, Cl, Br 또는 I를 포함하는 할로겐이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, F, CN, 비닐 또는 에티닐이고;
(g) R7은 수소, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아닌 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이다) 중의 적어도 하나로 치환되고;
(h) X는 H, OH, OMe, 할로겐, CN, NH2 또는 N3이고;
(i) Y는 OH이고;
(j) Z는 N 또는 CR10이고;
(k) R8 및 R9는 독립적으로 H, F, Cl, Br, I, OH, OR', SH, SR', NH2, NHR', NR'2, 질소 헤테로사이클, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 저급 알케닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H 또는 CH=CHCO2R'이고; 및
(l) R10은 H, 할로겐(F, Cl, Br, I 포함), OH, OR', SH, SR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 저급 알케닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 선택적으로 치환된 C1 -20 알킬, 선택적으로 치환된 C1 -10 알킬, 선택적으로 치환된 저급 알킬을 포함하지만 이에 한정되지는 않는 선택적으로 치환된 알킬; 선택적으로 치환된 사이클로알킬; 알크아릴; C2-C6의 선택적으로 치환된 알키닐; C2-C6의 선택적으로 치환된 저급 알케닐; 또는 C(O)알킬, C(O)(C1 -20 알킬), C(O)(C1 -10 알킬), 또는 C(O)(저급 알킬)을 포함하지만 이에 한정되지는 않는 선택적으로 치환된 아실이다.
또한, 상기 정의한 바와 같은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 제조방법이 기술되며, 상기 방법은
(a) 화학식 Ⅲ의 보호된 리보노락톤을 하이드라이드 환원제를 사용하여 입체선택적으로 환원시켜 화학식 Ⅳ의 베타-락톨 유도체를 제공하는 단계; 및
(b) 화학식 Ⅳ의 베타-락톨 유도체를 시약을 사용하여 입체선택적으로 전환시켜 화학식 Ⅴ의 아노머성(anomeric) 알파-유도체를 수득하는 단계를 포함한다.
화학식 Ⅲ
화학식 Ⅳ
화학식 Ⅴ
상기에서,
R5, R6 및 X는 상기 정의한 바와 같고, X'는 이탈기이며, R11은 보호기이다.
정의
본 발명에서 단수 표현을 사용하였더라도 이는 하나 이상의 존재를 나타낸다. 예를 들면, 화합물은 하나 이상의 화합물 또는 적어도 한 화합물을 나타낸다. 따라서, 본 발명에서 어느 한 대상에 대한 단수 표현은 "하나 이상" 및 "적어도 하나"라는 표현과 상호 교환적으로 사용될 수 있다.
치환기와 관련하여 "본 발명에서 상기 정의한 바와 같은" 또는 "상기 정의한 바와 같은"이란 구절은 발명의 요약에서 제공된 최초의 정의를 나타내거나, 거기에 정의가 없는 경우에는 정의에 제공된 정의를 나타내고, 여기에도 없는 경우에는 통상의 지식을 가진 자에 의해 이해되는 의미를 나타낸다.
본 발명에서 사용되는 용어 "선택적" 또는 "선택적으로"는 이 용어 뒤에 기술되는 사건 또는 상황이 일어날 수는 있지만 반드시 일어날 필요는 없음을 의미하며, 상기 설명은 상기 사건 또는 상황이 일어나는 경우와 일어나지 않는 경우를 포함한다. 예를 들면, "선택적 결합"은, 상기 결합이 존재할 수도 있고 존재하지 않을 수도 있음을 의미하고, 상기 설명은 단일결합, 이중결합 또는 삼중결합을 포함한다.
용어 "약"(이는 또한 ∼ 으로도 나타낸다)은 언급되는 수치가 표준 실험 오차의 범위 내에서 가변적인 범위의 일부임을 의미한다.
본 발명에서 사용되는 용어 "할로"는 클로로, 브로모, 요오도 및 플루오로를 포함한다.
용어 "독립적으로"는 본 발명에서 한 변수가 동일한 화합물 내의 동일하거나 상이한 정의를 갖는 변수의 존재 또는 부재와 상관 없이 임의의 한 예에 적용됨을 지시하기 위해 사용된다. 따라서, R이 2회 나타나고 "독립적으로 탄소 또는 질소"로 정의되는 화합물에서, 상기 R은 둘 다 탄소일 수 있거나, 상기 R은 둘 다 질소일 수 있거나, 하나의 R은 탄소이고 나머지 R은 질소일 수 있다.
본 발명에서 기술된 용어 "정제된"은 소정의 화합물의 순도를 나타낸다. 예를 들면, 소정의 화합물이 상기 조성물의 주요 성분인 경우, 즉 적어도 50% w/w의 순도인 경우 화합물은 "정제된" 것이다. 따라서, "정제된"은 적어도 50% w/w의 순도. 적어도 60% w/w의 순도, 적어도 70%의 순도, 적어도 80%의 순도, 적어도 85%의 순도, 적어도 90%의 순도, 적어도 92%의 순도, 적어도 94%의 순도, 적어도 96%의 순도, 적어도 97%의 순도, 적어도 98%의 순도 및 적어도 99%의 순도를 포함한다.
용어 "호변성(tautomerism)" 또는 "호변이성체(tautomer)"는 허용되는 통상의 의미를 갖는다.
용어 "P*"는 상기 인 원자가 키랄성이고 허용되는 통상의 의미를 갖는 "R" 또는 "S"의 상응하는 칸-인골드-프리로그(Cahn-Ingold-Prelog) 정의를 가짐을 의미한다. 포스포르아미데이트 뉴클레오시드 I 및 사이클릭 포스페이트 뉴클레오티드 Ⅱ는 인에서의 키랄성으로 인해 부분입체이성체(diastereomer)의 혼합물로서 존재할 수 있는 것으로 고려된다. 출원인은 부분입체이성체의 혼합물 및/또는 분해된 부분입체이성체의 용도를 고려한다. 일부 경우, 별표는 포스포로아미데이트 또는 사이클릭 포스페이트 인 원자의 바로 옆에 나타나지 않는다. 이들 경우, 상기 인 원자는 키랄성이라는 사실과 통상의 기술을 가진 자라면 상기 인에 결합된 치환기가 P(O)Cl3에서와 같이 인에서의 키랄성 가능성이 배제되지 않는 한 상기 사실을 이해한다는 점이 이해된다.
또한, 화학식 Ⅰ의 화합물 및 화학식 Ⅱ의 화합물의 동위원소적으로 풍부한 동족체가 고려된다. "동위원소적으로 풍부한"이란 용어는 화학식 Ⅰ의 화합물과 화학식 Ⅱ의 화합물 중의 하나 이상의 원자가, 예를 들면, 2H, 3H, 13C, 15N, 32P 등과 같은 특정 동위원소를 다량 함유함을 의미한다. "중수소화 동족체"라는 용어는 수소 원자의 다수가 그의 2H-동위원소, 즉 중수소(D)인 본 발명에 기술된 화합물 또는 그의 염을 의미한다. 중수소 치환은 부분적이거나 완전할 수 있다. 부분 중수소 치환은 하나 이상의 수소가 하나 이상의 중수소로 치환됨을 의미한다. 예를 들면, 화학식 Ⅱ의 화합물의 경우, 통상의 지식을 가진 자는 적어도 하기 부분 중수소화 동족체(여기서, "dn"는 중수소 원자가 n개임을 나타내며, 예를 들면, 이소프로필기의 경우 n = 1 내지 7인 반면, 페닐기의 경우 n = 1 내지 5이다)를 고려할 수 있다. 하기 도시된 메틸기는 완전히 중수소화된 것으로 도시되어 있지만, 누구나 -CDH2 및 CD2H와 같이 부분적 중수소화 변형태 또한 가능함을 인지할 것이다.
이들은 통상의 기술을 가진 자에게 공지된 과정 및 시약에 의한 합성에 의해 수득할 수 있는 몇 가지 중수소화 동족체에 불과하다.
용어 "알케닐"은 1개 또는 2개의 올레핀성 이중결합, 바람직하게는 1개의 올레핀성 이중결합을 갖는 탄소수 2 내지 10의 치환되지 않은 탄화수소쇄 라디칼을 나타낸다. 용어 "C2 -N 알케닐"은 탄소수 2 내지 N의 알케닐을 나타내며, 여기서 N은 3, 4, 5, 6, 7, 8, 9 또는 10의 값을 갖는 정수이다. 용어 "C2-10 알케닐"은 탄소수 2 내지 10의 알케닐을 나타낸다. 용어 "C2 -4 알케닐"은 탄소수 2 내지 4의 알케닐을 나타낸다. 그의 예는 비닐, 1-프로페닐, 2-프로페닐(알릴) 또는 2-부테닐(크로틸)을 포함하지만 이에 한정되는 것은 아니다.
용어 "할로겐화 알케닐"은 하나 이상의 F, Cl, Br 및 I를 포함하는 알케닐을 나타낸다.
용어 "알킬"은 탄소수 1 내지 30의 비분지쇄 또는 분지쇄의 포화된 1가의 탄화수소 잔기를 나타낸다. 용어 "C1 -M 알킬"은 탄소수 1 내지 M의 알킬을 나타내며, 여기서 M은 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30의 값을 갖는 정수이다. 용어 "C1 -4 알킬"은 탄소수 1 내지 4의 알킬을 나타낸다. 용어 "저급 알킬"은 탄소수 1 내지 6의 직쇄 또는 분지쇄 탄화수소 잔기를 나타내며, 이는 또한 "C1 -6-알킬"이라는 표현으로도 지정된다. 본 발명에서 사용되는 "C1 -20 알킬"은 탄소수 1 내지 20의 알킬을 나타낸다. 본 발명에서 사용되는 "C1-10 알킬"은 탄소수 1 내지 10의 알킬을 나타낸다. 알킬기의 예는 메틸, 에틸, 프로필, i-프로필, n-부틸, i-부틸, t-부틸, 펜틸, 이소펜틸, 네오펜틸, 헥실, 헵틸, 옥틸, 노닐, 데실 등을 포함하지만 이에 한정되지 않는다. 저급 알킬기의 예는 메틸, 에틸, 프로필, i-프로필, n-부틸, i-부틸, t-부틸, 펜틸, 이소펜틸, 네오펜틸, 헥실 등을 포함하지만 이에 한정되는 것은 아니다. 용어(아르)알킬 또는 (헤테로아릴)알킬은 상기 알킬기가 각각 아릴 또는 헤테로아릴기에 의해 선택적으로 치환됨을 나타낸다.
용어 "할로겐화 알킬"(또는 "할로알킬")은 하나 이상의 F, Cl, Br 및 I를 포함하는 비분지쇄 또는 분지쇄 알킬을 나타낸다. 용어 "C1 -M 할로알킬"은 하나 이상의 F, Cl, Br 및 I를 포함하는 탄소수 1 내지 M의 알킬을 나타내며, 여기서 M은 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 또는 30의 값을 갖는 정수이다. "C1-3 할로알킬"은 하나 이상의 F, Cl, Br 및 I를 포함하는 탄소수 1 내지 3의 할로알킬이다. 용어 "할로겐화 저급 알킬"(또는 "저급 할로알킬")은 하나 이상의 F, Cl, Br 및 I를 포함하는 탄소수 1 내지 6의 할로알킬을 나타낸다. 그의 예는 플루오로메틸, 클로로메틸, 브로모메틸, 요오도메틸, 디플루오로메틸, 디클로로메틸, 디브로모메틸, 디요오도메틸, 트리플루오로메틸, 트리클로로메틸, 트리브로모메틸, 트리요오도메틸, 1-플루오로에틸, 1-클로로에틸, 1-브로모에틸, 1-요오도에틸, 2-플루오로에틸, 2-클로로에틸, 2-브로모에틸, 2-요오도에틸, 2,2-디플루오로에틸, 2,2-디클로로에틸, 2,2-디브로모메틸, 2-2-디요오도메틸, 3-플루오로프로필, 3-클로로프로필, 3-브로모프로필, 2,2,2-트리플루오로에틸 또는 1,1,2,2,2-펜타플루오로에틸을 포함하지만 이에 한정되는 것은 아니다.
용어 "알키닐"은 하나의 삼중결합을 갖는 탄소수 2 내지 10, 바람직하게는 2 내지 5의 비분지형 또는 분지형 탄화수소쇄 라디칼을 나타낸다. 용어 "C2 -N 알키닐"은 탄소수 2 내지 N의 알키닐을 나타내며, 여기서 N은 3, 4, 5, 6, 7, 8, 9 또는 10의 값을 갖는 정수이다. 용어 "C2 -4 알키닐"은 탄소수 2 내지 4의 알키닐을 나타낸다. 용어 "C2-10 알키닐"은 탄소수 2 내지 10의 알키닐을 나타낸다. 그의 예는 에티닐(즉, -C≡CH), 1-프로피닐, 2-프로피닐, 1-부티닐, 2-부티닐 또는 3-부티닐을 포함하지만 이에 한정되는 것은 아니다.
용어 "할로겐화 알키닐"은 하나의 삼중결합과 하나 이상의 F, Cl, Br 및 I를 갖는 탄소수 2 내지 10, 바람직하게는 2 내지 5의 비분지형 또는 분지형 탄화수소 쇄 라디칼을 나타낸다.
용어 "알콕시"는 -O-알킬기, -O-사이클로알킬기, -O-저급 사이클로알킬을 나타내고, 상기 알킬, 사이클로알킬 및 저급 사이클로알킬은 위에서 정의한 바와 같다. -O-알킬기는 메톡시, 에톡시, n-프로필옥시, i-프로필옥시, n-부틸옥시, i-부틸옥시, t-부틸옥시를 포함하지만 이에 한정되는 것은 아니다. 본 발명에서 사용되는 "저급 알콕시"는 앞에서 정의한 바와 같은 "저급 알킬"기를 갖는 알콕시기를 나타낸다. "C1-10 알콕시"는 알킬이 C1 -10인 -O-알킬을 나타낸다. -O-사이클로알킬기의 예는 -O-c-프로필, -O-c-부틸, -O-c-펜틸 및 -O-c-헥실을 포함하지만 이에 한정되는 것은 아니다.
용어 "할로겐화 알콕시"는 알킬기가 하나 이상의 F, Cl, Br 및 I를 포함하는 -O-알킬기를 나타낸다.
용어 "할로겐화 저급 알콕시"은 저급 알킬기가 하나 이상의 F, Cl, Br 및 I를 포함하는 -O-(저급 알킬)기를 나타낸다.
용어 "사이클로알킬"은 치환되지 않거나 치환된 카보사이클을 나타내며, 여기서 상기 카보사이클은 탄소수 3 내지 10, 바람직하게는 탄소수 3 내지 8, 보다 바람직하게는 3 내지 6(즉, 저급 사이클로알킬)이다. 사이클로알킬기의 예는 사이클로프로필, 2-메틸-사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헵틸 또는 사이클로옥틸을 포함하지만 이에 한정되는 것은 아니다. 본 발명에서 사용되는 용어 "C3 -7 사이클로알킬"은 카보사이클릭 환의 탄소수가 3 내지 7인 사이클로알킬을 나타낸다. 용어 "저급 사이클로알킬"은 C3 -6 사이클로알킬 환을 나타내며, 이는 사이클로프로필(cPr), 2-메틸-사이클로프로필 등, 사이클로부틸(cBu), 2-메틸-사이클로부틸, 3-메틸-사이클로부틸 등, 사이클로펜틸(cPn), 2-메틸-사이클로펜틸, 3-메틸-사이클로펜틸, 4-메틸-사이클로펜틸 등, 사이클로헥실(cHx) 등을 포함하지만 이에 한정되는 것은 아니다.
용어 "사이클로알킬 알킬"은 저급 사이클로알킬에 의해 치환되고 추가로 치환되지 않거나 치환된 알킬을 나타낸다. 사이클로알킬 알킬의 예는 에틸, 프로필, i-프로필, n-부틸, i-부틸, t-부틸 또는 펜틸, 이소펜틸, 네오펜틸, 헥실, 헵틸 및 옥틸 중의 하나가 사이클로프로필, 2-메틸-사이클로프로필, 사이클로부틸, 사이클로펜틸 및 사이클로헥실메틸로 치환된 것을 포함하지만 이에 한정되는 것은 아니다.
용어 "사이클로헤테로알킬"은 치환되지 않거나 치환된 헤테로사이클을 나타내며, 상기 헤테로사이클은 탄소수가 2 내지 9, 바람직하게는 2 내지 7, 보다 바람직하게는 2 내지 5이다. 사이클로헤테로알킬의 예는 아지리딘-2-일, N-C1 -3-알킬-아지리딘-2-일, 아제티디닐, N-C1 -3-알킬-아제티딘-m'-일, 피롤리딘-m'-일, N-C1 -3-알킬-피롤리딘-m'-일, 피페리딘-m'-일 및 N-C1 -3-알킬-피페리딘-m'-일(여기서, m'는 상기 사이클로헤테로알킬에 따라 2, 3 또는 4이다)을 포함하지만 이에 한정되는 것은 아니다. N-C1 -3-알킬-사이클로헤테로알킬의 특정 예는 N-메틸-아지리딘-2-일, N-메틸-아제티딘-3-일, N-메틸-피롤리딘-3-일, N-메틸-피롤리딘-4-일, N-메틸-피페리딘-2-일, N-메틸-피페리딘-3-일, 및 N-메틸-피페리딘-4-일을 포함하지만 이에 한정되는 것은 아니다. R4의 경우, 상기 사이클로헤테로알킬 환 탄소와 산소 사이의 접착점은 m' 중의 어느 한 곳에서 나타난다.
용어 "아실"은 카보닐 잔기 및 비-카보닐 잔기를 함유하는 치환기를 나타낸다. 상기 카보닐 잔기는 카보닐 탄소와 헤테로원자 사이에 이중결합을 함유하며, 상기 헤테로원자는 O, N 및 S로부터 선택된다. 상기 헤테로원자가 N인 경우, 상기 N은 저급 알킬에 의해 치환된다. 상기 비-카보닐 잔기는 선형, 분지형 또는 사이클릭 알킬(이는 선형, 분지형 또는 사이클릭 C1 -20 알킬, C1 -10 알킬 또는 저급 알킬을 포함하지만 이에 한정되는 것은 아니다); 메톡시메틸을 포함하는 알콕시알킬; 벤질을 포함하는 아르알킬; 페놀시메틸과 같은 아릴옥시알킬; 할로겐(F, Cl, Br, I), 하이드록실, C1 내지 C4 알킬 또는 C1 내지 C4 알콕시로 선택적으로 치환된 페닐을 포함하는 아릴; 메탄설포닐을 포함하는 알킬 또는 아르알킬 설포닐과 같은 설포네이트 에스테르; 모노, 디 또는 트리포스페이트 에스테르, 트리틸 또는 모노메톡시트리틸, 치환된 벤질, 트리알킬실릴(예: 디메틸-t-부틸실릴) 또는 디페닐메틸실릴로부터 선택된다. 하나 이상의 아릴기가 상기 비-카보닐 잔기에 존재하는 경우, 상기 아릴기가 페닐기를 포함하는 것이 바람직하다.
용어 "저급 아실"은 비-카보닐 잔기가 저급 알킬인 아실기를 나타낸다.
본 발명에서 사용되는 용어 "아릴"은, 달리 특정하지 않는 한, 치환되거나 치환되지 않은 페닐(Ph), 비페닐 또는 나프틸을 나타내며, 바람직하게는 상기 용어 아릴은 치환되거나 치환되지 않은 페닐을 나타낸다. 상기 아릴기는 하이드록실, F, Cl, Br, I, 아미노, 알킬아미노, 아릴아미노, 알콕시, 아릴옥시, 니트로, 시아노, 설폰산, 설페이트, 포스폰산, 포스페이트 및 포스포네이트로부터 선택된 하나 이상의 잔기로 치환될 수 있으며, 이는 보호되지 않거나, 예를 들면, 문헌[T.W. Greene 및 P.G. M. Wuts, "Protective Groups in Organic Synthesis," 3rd ed., John Wiley & Sons, 1999]에 교시된 바와 같이 본 기술분야의 숙련가에게 공지된 바와 같이 필요에 따라 보호된다.
용어 "알크아릴" 또는 "알킬아릴"은 벤젠과 같이 아릴 치환기를 갖는 알킬기를 나타낸다. 용어 "저급 알크아릴" 또는 "저급 알킬아릴"은 벤젠과 같이 아릴 치환기를 갖는 저급 알킬기를 나타낸다. 용어 "아르알킬" 또는 "아릴알킬"은 알킬 치환기를 갖는 아릴기를 나타낸다.
용어 "디(저급 알킬)아미노-저급 알킬"은 2개의 저급 알킬기에 의해 치환된 아미노기에 의해 치환된 저급 알킬을 나타낸다. 그의 예는 (CH3)2NCH2, (CH3)2NCH2CH2, (CH3)2NCH2CH2CH2를 포함하지만 이에 한정되는 것은 아니다. 상기 예는 말단 탄소 원자에서 N,N-디메틸-아미노 치환기로 치환된 저급 알킬을 보여준다. 이들은 단지 예시용이며, 이들을 요구하도록 용어 "디(저급 알킬)아미노-저급 알킬"의 의미를 제한할 의도는 없다. 상기 저급 알킬 쇄는, 예를 들면, CH3CH(N-(저급 알킬)2)CH2CH2와 같이, 상기 쇄의 임의 지점에서 N,N-디(저급 알킬)-아미노로 치환될 수 있다.
용어 "헤테로사이클"은 탄소, 수소, 및 하나 이상의 N, O 및 S를 함유하는 치환되지 않거나 치환된 헤테로사이클을 나타내며, 상기 C 및 N은 3가 또는 4가, 즉 sp2- 또는 sp3-혼성화될 수 있다. 헤테로사이클의 예는 아지리딘, 아제티딘, 피롤리딘, 피페리딘, 이미다졸, 옥사졸, 피페라진 등을 포함하지만 이에 한정되는 것은 아니다. R8 및 R9에 대해 사용되는 용어 "질소 헤테로사이클"은 질소를 함유하는 헤테로사이클을 나타내며, 여기서 상기 질소는 퓨린에 대한 접착점이다. R8 또는 R9에 대해 사용되는 질소 헤테로사이클의 예는 -N(-CH2CH2-)(아지리딘-1-일), -N(-CH2CH2CH2-)(아제티딘-1-일), -N(-CH2CH2CH2CH2-)(피롤리딘-1-일) 등을 포함하지만 이에 한정되는 것은 아니다. NR'2에 대해 R10과 관련되는 바와 같은 피페라진의 경우, 상기 피페라지닐의 상응하는 맞은 편 질소 원자는 하기 구조식으로 나타낸 저급 알킬에 의해 치환된다:
바람직하게는, 상기 피페라지닐의 맞은 편 질소는 메틸기에 의해 치환된다.
용어 "아미노산"은 천연 및 합성 α, β, γ 또는 δ 아미노산을 포함하며, 단백질에서 발견되는 아미노산, 즉 글리신, 알라닌, 발린, 루이신, 이소루이신, 메티오닌, 페닐알라닌, 트립토판, 프롤린, 세린, 트레오닌, 시스테인, 티로신, 아스파라긴, 글루타민, 아스파테이트, 글루타메이트, 리신, 아르기닌 및 히스티딘을 포함하지만 이에 한정되는 것은 아니다. 바람직한 구현예에서, 상기 아미노산은 L-배위이다. 다른 한편으로, 상기 아미노산은 알라닐, 발리닐, 루이시닐, 이소루이시닐, 플롤리닐, 페닐알라니닐, 트립토파닐, 메티오니닐, 글리시닐, 세리닐, 트레오니닐, 시스테이닐, 티로시닐, 아스파라기닐, 글루타미닐, 아스파토일, 글루타로일, 리시닐, 아르기니닐, 히스티디닐, β-알라닐, β-발리닐, β-루이시닐, β-이소루이시닐, β-프롤리닐, β-페닐알라니닐, β-트립토파닐, β-메티오니닐, β-글리시닐, β-세리닐, β-트레오니닐, β-시스테이닐, β-티로시닐, β-아스파라기닐, β-글루타미닐, β-아스파토일, β-글루타로일, β-리시닐, β-아르기니닐 또는 β-히스티디닐의 유도체일 수 있다. 용어 아미노산이 사용되는 경우, 이는 D-배위 및 L-배위의 α, β, γ 또는 δ 글리신, 알라닌, 발린, 루이신, 이소루이신, 메티오닌, 페닐알라닌, 트립토판, 프롤린, 세린, 트레오닌, 시스테인, 티로신, 아스파라긴, 글루타민, 아스파테이트, 글루타메이트, 리신, 아르기닌 및 히스티딘의 에스테르 각각을 특정하고 독립적으로 기술한 것으로 간주된다.
용어 "아미노아실"은 천연 및 합성 α, β, γ 또는 δ 아미노아실의 치환되지 않거나, N-일치환되거나, N,N-이치환된 유도체를 포함하며, 여기서 상기 아미노 아실은 아미노산으로부터 유도된다. 상기 아미노-질소는 치환되거나 치환되지 않을 수 있다. 상기 아미노-질소가 치환된 경우, 상기 질소는 일치환되거나 이치환되고, 여기서 상기 아미노-질소에 결합된 치환기는 저급 알킬 또는 알크아릴이다.
용어 "알킬아미노" 또는 "아릴아미노"는 각각 1개 또는 2개의 알킬 또는 아릴 치환기를 갖는 아미노기를 나타낸다.
본 발명에서 사용되는 용어 "보호된"은, 별도로 한정하지 않는 한, 추가적인 반응을 방지하거나 기타 목적을 위해 산소, 질소 또는 인 원자에 첨가된 기를 나타낸다. 광범위한 산소 및 질소 보호기가 유기 합성 분야의 숙련가들에게 공지되어 있다. 비제한적인 예는 C(O)-알킬, C(O)Ph, C(O)아릴, CH3, CH2-알킬, CH2-알케닐, CH2Ph, CH2-아릴, CH2O-알킬, CH2O-아릴, SO2-알킬, SO2-아릴, 3급-부틸디메틸실릴, 3급-부틸디페닐실릴, 및 1,3-(1,1,3,3-테트라이소프로필디실록사닐리덴)을 포함한다.
용어 "퓨린" 또는 "피리미딘" 염기는 아데닌, N6-알킬퓨린, N6-아실퓨린(여기서, 아실은 C(O)(알킬, 아릴, 알킬아릴 또는 아릴알킬)이다), N6-벤질퓨린, N6-할로퓨린, N6-비닐퓨린, N6-아세틸렌성 퓨린, N6-아실 퓨린, N6-하이드록시알킬 퓨린, N6-알킬아미노퓨린, N6-티오알킬 퓨린, N2-알킬퓨린, N2-알킬-6-티오퓨린, 티민, 시토신, 5-플루오로시토신, 5-메틸시토신, 6-아자피리미딘(6-아자시토신 포함), 2- 및/또는 4-머캅토피르미딘, 우라실, 5-할로우라실(5-플루오로우라실 포함), C5-알킬피리미딘, C5-벤질피리미딘, C5-할로피리미딘, C5-비닐피리미딘, C5-아세틸렌성 피리미딘, C5-아실 피리미딘, C5-하이드록시알킬 퓨린, C5-아미도피리미딘, C5-시아노피리미딘, C5-요오도피리미딘, C6-요오도-피리미딘, C5-Br-비닐 피리미딘, C6-Br-비닐 피리미딘, C5-니트로피리미딘, C5-아미노-피리미딘, N2-알킬퓨린, N2-알킬-6-티오퓨린, 5-아자시티디닐, 5-아자우라실릴, 트리아졸로피리디닐, 이미다졸로피리디닐, 피롤로피리미디닐 및 피라졸로피리미디닐을 포함하지만 이에 한정되는 것은 아니다. 퓨린 염기는 구아닌, 아데닌, 히포크산틴, 2,6-디아미노퓨린 및 6-클로로퓨린을 포함하지만 이에 한정되는 것은 아니다. 염기 상의 관능성 산소 및 질소기는 필요에 따라 또는 바람직하다면 보호될 수 있다. 적합한 보호기는 본 기술분야의 숙련가들에게 잘 공지되어 있으며, 트리메틸실릴, 디메틸헥실실릴, t-부틸디메틸실릴, t-부틸디페닐실릴, 트리틸, 알킬기, 아세틸 및 프로피오닐과 같은 아실기, 메탄설포닐 및 p-톨루엔설포닐을 포함한다.
용어 "보호기"는 하기 특징을 나타내는 화학적 기를 나타낸다. 상기 기는 양호한 수율로 선택적으로 반응하여 예정된 반응에 대해 안정한 보호된 기질을 제공해야만 하며, 상기 보호기는 이러한 예정된 반응에서 생성되는 관능기(들)를 공격하지 않는 용이하게 입수 가능하고 바람직하게는 무독성인 시약에 의해 양호한 수율로 선택적으로 제거될 수 있어야 한다(Protective Groups in Organic Synthesis, 3nd ed. T. W. Greene 및 P. G. M. Wuts, John Wiley & Sons, New York, N.Y., 1999 참조). 보호기의 예는 벤조일, 치환된 벤조일, 아세틸, 페닐-치환된 벤조일, 트리틸, DMT(4,4'-디메톡시트리틸), MMT(4-모노메톡시트리틸), 픽실(9-페닐크산텐-9-일)기, 티오픽실(9-페닐티오크산텐-9-일)을 포함하지만 이에 한정되는 것은 아니다. 상기 치환된 벤조일기는 부분적으로 치환되거나 완전히 치환될 수 있다. 예를 들면, 통상적인 기술을 가진 자는 상기 벤조일 환의 2-, 3-, 4-, 5-, 및 6-위치가 수소(치환되지 않은 위치) 또는 상기한 바와 본 명세서 전반에 걸쳐서 고려되는 치환기와 같은 다른 치환기(치환된 위치)로 치환될 수 있음을 인지할 것이다. 치환된 벤조일기의 예는 2-할로-벤조일, 3-할로-벤조일, 4-할로-벤조일; 2,4-디할로-벤조일, 3,4-디할로-벤조일, 및 3,5-디할로-벤조일; 2-(C1 -6-알킬)-벤조일, 3-(C1 -6-알킬)-벤조일, 및 4-(C1 -6-알킬)-벤조일; 2,4-(디C1 -6-알킬)-벤조일, 3,4-(디C1 -6-알킬)-벤조일, 및 3,5-(디C1 -6-알킬)-벤조일; 2-니트로-벤조일, 3-니트로-벤조일, 4-니트로-벤조일; 2,4-(디니트로)-벤조일, 3,4-(디니트로)-벤조일, 및 3,5-(디니트로)-벤조일 등을 포함하지만 이에 한정되는 것은 아니다.
본 발명에서 사용되는 용어 "이탈기"(또한 "Lv"라고도 함)는 본 기술분야의 숙련가들에게 동일한 의미를 가지고(Advanced Organic Chemistry: reactions, mechanisms and structure-Fourth Edition by Jerry March, John Wiley 및 Sons Ed.; 1992 pages 351-357), 기질 분자의 일부이거나 기질 분자에 부착된 기를 나타내며; 상기 기질 분자가(예를 들면, 친핵성 시약을 사용하여) 변위반응(displacement reaction)을 겪는 반응에서, 상기 이탈기도 변위된다. 이탈기의 예는 할로겐(F, Cl, Br 및 I), 바람직하게는 Cl, Br 또는 I; 토실레이트, 메실레이트, 트리플레이트, 아세테이트 등을 포함하지만 이에 한정되지 않는다.
본 발명에서 사용되는 용어 "하이드라이드 환원제"는 상기 락톤의 카보닐(C=O)기를 하이드록시기(C-OH)으로 환원시킬 수 있는 하나 이상의 화합물을 의미한다. 하이드라이드 환원제는(tBuO)3AlH, 나트륨(비스(2-메톡시에톡시)(2,2,2-트리플루오로-에톡시)알루미늄 하이드라이드, Red-Al(나트륨 비스(2-메톡시에톡시)알루미늄 하이드라이드), 나트륨 보로하이드라이드, 수소화리튬알루미늄, 디보란, 보란-테트라하이드로푸란 착물, 보란-디메틸설파이드 착물, 알루미늄 트리-이소프로폭사이드, 붕소 트리아세톡시 하이드라이드, 알코올 탈수소 효소,(-)- 또는 (+)-디이소피노캄페일클로로보란, 리튬(2,3-디메틸-2-부틸)-t-부톡시보로하이드라이드, 디이소부틸알루미늄 2,6-디-t-부틸-4-메틸페녹사이드를 포함하지만 이에 한정되는 것은 아니다. 바람직하게는, 상기 하이드라이드 환원제는 (tBuO)3AlH 또는 나트륨(비스(2-메톡시에톡시)(2,2,2-트리플루오로-에톡시)알루미늄 하이드라이드이다.
본 발명에서 사용되는, 독립된 용어 "시약"은 아노머성 탄소 원자에서 이탈기를 도입함으로써 락톨 유도체와 반응할 수 있는 하나 이상의 화합물을 의미한다. 상기 하나 이상의 화합물은 Ph3P/CBr4, Ph3P/CHBr3, Ph3P/CHBr3/이미다졸, Ph3P/Br2, Ph3P/Br2/이미다졸, N-브로모숙신이미드/ Ph3P, 아세트산 중의 HBr, PBr3/DMF, PBr3/중탄산나트륨, PBr3/이미다졸, PBr5/DMF, PBr5/중탄산나트륨, PBr5/이미다졸, N-클로로숙신이미드/Ph3P, POBr3/이미다졸, POCl3/이미다졸, SOCl2, SO2Cl2, N-클로로숙신이미드, Ph3P/CCl4, HCl(g)/에테르, 아세틸 클로라이드, 아세트산 무수물, 벤조일 클로라이드, 벤조산 무수물, 트리프산 무수물 및 트리클로로아세토니트릴/DBU와 같은 산 클로라이드 및 무수물을 포함하지만 이에 한정되는 것은 아니다. 기타 3가 인 화합물은 트리페닐 포스파이트 및(4-디메틸아미노페닐)디페닐포스핀과 같은 트리페닐 포스핀 대신 사용될 수 있다.
본 발명에서 사용되는 용어 "염기성 시약"은 퓨린 염기와 같은 산성 시약으로부터 양성자를 추출할 수 있는 화합물을 의미하며, 이로써 상기 퓨린 염기의 "산성" 관능기는 상기 융합된 이미다졸 환의 N-H를 포함한다. 염기성 시약의 예는 알코올성 용매와 조합된 (저급 알크)옥사이드((저급 알킬)OM)를 포함하지만 이에 한정되지는 않으며, 여기서 (저급 알크)옥사이드는 MeO-, EtO-, nPrO-, iPrO-, tBuO-, iAmO-(이소-아밀옥사이드) 등을 포함하지만 이에 한정되지는 않고, M은 Li+, Na+, K+ 등과 같은 알칼리 금속 양이온이다. 알코올성 용매는, 예를 들면, MeOH, EtOH, nPrOH, iPrOH, tBuOH, iAmOH 등과 같은 (저급 알킬)OH를 포함한다. 또한, 수소화나트륨, 나트륨 헥사메틸디실라잔, 리튬 헥사메틸디실라잔, 리튬 디이소프로필아미드, 수소화칼슘, 탄산나트륨, 탄산칼륨, 탄산세슘, DBU 및 DBN과 같은 비-알콕시 염기가 사용될 수 있다.
본 발명에서 사용되는 용어 "친핵성 시약"은, 예를 들면, 친핵성-치환반응에 의해 다른 라디칼을 대체할 수 있는 라디칼을 함유하는 화합물을 의미한다. 친핵성 시약의 예는 알코올성 용매와 조합된 (저급 알크)옥사이드((저급 알킬)OM)을 포함하지만 이에 한정되지는 않으며, 여기서 (저급 알크)옥사이드는 MeO-, EtO-, nPrO-, iPrO-, tBuO- 등을 포함하지만 이에 한정되지는 않고, M은 Li+, Na+, K+ 등과 같은 알칼리 금속 양이온이다. 알코올성 용매는, 예를 들면, MeOH, EtOH, nPrOH, iPrOH, tBuOH 등과 같은 (저급 알킬)OH를 포함한다. 친핵성 시약의 다른 예는 아르알칸올 용매와 조합된 (아르알킬)옥사이드, 예를 들면, BnONa/BnOH(여기서, "Bn"은 벤질 라디칼(C6H5CH2-)을 나타낸다)를 포함하지만 이에 한정되는 것은 아니다. 친핵성 시약의 다른 예는 탄소, 수소 및 하나 이상의 N, O 및 S를 함유하는 치환되지 않거나 치환된 헤테로사이클을 포함하지만 이에 한정되지는 않으며, 여기서 상기 C 및 N은 3가 또는 4가이다. 즉, 염기성 시약 또는 트리에틸아민 또는 디이소프로필 에틸 아민과 같은 저급 알킬 아민의 존재하에 sp2- 또는 sp3-혼성화된다. 헤테로사이클의 특정 예는 아지리딘, 아제티딘, 피롤리딘, 피페리딘, 이미다졸, 옥사졸, 피페라진 등을 포함하지만(앞 단락을 또한 참조한다), 이에 한정되는 것은 아니다. 따라서, 아지리딘, 아제티딘, 피롤리딘, 피페리딘, 이미다졸, 옥사졸, 피페라진 중의 어느 하나를 트리에틸아민 또는 디이소프로필 에틸 아민 등과 조합하여 사용될 수 있다. 친핵성 시약의 다른 예는 1급 및 2급 아민을 포함하며, 이는 H2NR' 또는 HNR'2를 포함하지만 이에 한정되지는 않고, 상기 R'는 선택적으로 치환된 알킬이며, 이는 선택적으로 치환된 C1 -20 알킬, 선택적으로 치환된 C1 -10 알킬, 선택적으로 치환된 저급 알킬; 또는 선택적으로 치환된 사이클로알킬을 포함하지만 이에 한정되는 것은 아니다. 용어 "친핵성 시약"은 또한 상기 퓨린 잔기의 6 위치에 도입되는 경우 하이드록시기로 전화될 수 있는 관능기를 제공한다. 본 발명에서 기술된 방법에서 사용되는 용어 "OH로 전환될 수 있는 기"는 특정한 화학적 시약에 노출시 -OH로 전환되는 -OZ로 구성된 치환기를 의미한다. Z는 벤질 또는 p-메톡시-벤질과 같은 치환되지 않거나 치환된 벤질; 트리메틸실릴-, t-부틸-디페닐실릴-, t-부틸-디메틸실릴 등과 같은 실릴; 및 -CH2CH=CH2와 같은 치환되지 않거나 치환된 알릴을 포함하지만 이에 한정되는 것은 아니다.
본 발명에서 기술된 방법에서 사용되는 용어 P(Ⅲ)-시약은 인 원자가 +3-산화 상태를 갖는 화학적 시약을 의미한다. 이러한 P(Ⅲ)-시약의 예는 P(Lv)3, R7OP(Lv)2, R7OP(Lv)(N(C1 -6 알킬)2), R7OP[N(C1 -6 알킬)2]2, 및 이들의 혼합물(여기서, Lv는 이탈기이고, R7 및 C1 -6 알킬은 본 발명에서 정의한 바와 같다)을 포함하지만 이에 한정되는 것은 아니다.
본 발명에 기술된 방법에서 사용되는 용어 활성제 시약은 P(Ⅲ)-시약을 수반하는 반응을 촉진시키는 화합물을 의미한다. 활성제의 예는 1H-테트라졸, 5-에틸티오테트라졸, 이미다졸륨 트리플레이트 및 4,5-디시아노-이미다졸 뿐만 아니라 미국 특허 제6,274,725호에 기술된 것들도 포함하지만 이에 한정되는 것은 아니다.
본 발명에 기술된 방법에서 사용되는 용어 P(Ⅴ)-시약은 추가의 옥소(P=O, 또한 -P(O)-로도 나타냄) 치환기를 갖는 P(Ⅲ)-시약을 의미하며, 이로써 상기 P 원자는 +5-산화 상태를 갖는다. 이러한 P(Ⅴ)-시약의 예는 P(O)(Lv)3, R7OP(O)(Lv)2, R7OP(O)(Lv)(N(C1-6 알킬)2), R7OP(O)[N(C1 -6 알킬)2]2, 및 이들의 혼합물(여기서, Lv는 이탈기이고, R7 및 C1 -6 알킬은 본 발명에서 정의한 바와 같다)을 포함하지만 이에 한정되는 것은 아니다.
본 발명에 기술된 방법에서 사용되는 용어 산화제는 원자의 산화 상태를 증가시키는 화학적 시약을 의미한다. 즉, 산화제는 "산화"를 촉진시킨다. 특정 구현예에서, 산화되는 원자는 화학식 Ⅱ의 화합물의 포스파이트 유도체에서와 같이 인이다. 산화제의 예는 과산화수소, 하이드로퍼옥사이드, 퍼옥사이드, 과산, 요오드 및 이들의 혼합물을 포함하지만 이에 한정되는 것은 아니다. 과산화수소는 문헌에 기재된 바와 같이 아세토니트릴과 같은 용매의 존재하에 사용될 수 있다(Cvetovich, R. J. Organic Process Research & Development, Article ASAP, Publication Date(Web): May 11, 2009). 하이드로퍼옥사이드인 ROOH는 R이 알킬 또는 아릴인 퍼옥사이드 및 그의 염을 포함하며, 이는 t-부틸퍼옥사이드(tBuOOH)를 포함하지만 이에 한정되는 것은 아니다. 퍼옥사이드는 알킬, 아릴, 또는 혼합된 알킬/아릴 퍼옥사이드 및 이들의 염을 포함한다. 과산(peracid)은 알킬 및 아릴 과산을 포함하며, 이는 m-클로로퍼옥시벤조산(mCPBA)을 포함하지만 이에 한정되는 것은 아니다. 브롬(Br2), 염소(Cl2) 또는 요오드(I2)와 같은 원소상 할로겐의 사용은 피리딘, 테트라하이드로푸란 및 물과 같은 물 및 기타 성분의 존재하에 수행될 수 있다. 다른 한편으로, TEMPO의 존재하에 Cl2 수용액이 마찬가지로 고려된다.
본 발명에서 사용되는 "화학식 Ⅱ의 화합물의 포스파이트 유도체가 평형을 이루게 함"이라는 표현은 화학식 Ⅱ의 화합물의 포스파이트 유도체의 2개의 이성체(시스 및 트랜스)를 포함하는 조성물이 하기 등식에 도시된 바와 같이 평형을 이루게 하는 방법을 나타낸다.
용어 시스 및 트랜스는 푸라노스 환 시스템 상의 뉴클레오염기의 공간 위치에 대한 -OR7 치환기의 공간 위치를 나타낸다. 본 기술분야에서 통상의 지식을 가진 자는 상기 평형 위치, 즉 시스-대-트랜스의 비가 용매 및 온도 등에 의해 영향을 받을 수 있다는 점과 특정한 평형 위치를 수득하기 위한 조건이 실험적으로 측정될 수 있음을 인식할 것이며, 이러한 실험 기술은 1H- 또는 31P-NMR 분광계를 포함하지만 이에 한정되는 것은 아니다.
본 발명에서 사용되는 용어 아민 시약은 양성자화되거나 양성자화되지 않는 형태로 질소를 포함하는 하나 이상의 화합물을 함유하는 조성물을 의미한다. 본 기술분야에서 통상의 지식을 가진 자라면 상기 용어가 암모니아, 메틸 아민, 디-이소프로필 아민, 사이클로펜틸-아민과 같은 일치환되거나 이치환된 알킬 아민을 포함할 뿐만 아니라, 피롤리딘, 피페리딘, 모르폴린 등, 이미다졸, N-메틸-이미다졸과 같은 N-(C1 -6 알킬)-이미다졸, 피라졸, N-메틸-피라졸과 같은 N-(C1 -6 알킬)-피라졸, 트리아졸, N-메틸-트리아졸과 같은 N-(C1 -6 알킬)-트리아졸, 테트라졸, N-메틸-테트라졸과 같은 N-(C1 -6 알킬)-테트라졸, 옥사졸 등을 포함하지만 이에 한정되지는 않는 헤테로사이클릭 화합물을 포함함을 이해할 것이다. 헤테로사이클릭 아민의 추가 예는 인용에 의해 본 발명에 포함되는 문헌에 기술되어 있다(T.L. Gilchrist, Heterocyclic Chemistry, 1985, Longman Scientific & Technical).
본 발명에 기술된 방법에서 사용되는 용어 "퓨린" 또는 "유도체화 퓨린"은, 앞 단락에서 특정하게 기술된 화합물들 이외에도, 화학식 Ⅰ 및 화학식 Ⅱ의 구조로 나타낸 화합물의 "염기"의 전구체 화합물을 의미한다.
용어 "이의 염"은 산성 또는 염기성 부가염 뿐만 아니라 약학적으로 허용되는 염을 포함한다. 용어 "약학적으로 허용되는 염"은 약학적으로 허용되고 모 화합물의 목적하는 약리학적 활성을 갖는 염을 의미한다. 이러한 염은 (1) 염산, 브롬화수소산, 황산, 질산 및 인산 등과 같은 무기산으로 형성되거나, 글리콜산, 피루브산, 락트산, 말론산, 말산, 말레산, 푸마르산, 타르타르산, 시트르산, 벤조산, 3-(4-하이드록시벤조일)벤조산, 신남산, 만델산, 메탄설폰산, 에탄설폰산, 1,2-에탄-디설폰산, 2-하이드록시에탄설폰산, 벤젠설폰산, 4-클로로벤젠설폰산, 2-나프탈렌설폰산, 4-톨루엔설폰산, 캄포르설폰산, 라우릴 황산, 글루콘산, 글루탐산, 살리실산, 무콘산 등과 같은 유기산으로 형성되는 산부가염; 또는 (2) 상기 열거된 무기산 중의 어느 하나의 공액 염기로 형성된 염기성 부가염(여기서, 상기 공액 염기는 Na+, K+, Mg2 +, Ca2 +, NHgR"'4-g +로부터 선택된 양이온성 성분을 포함하며, 상기 R"'은 C1 -3 알킬이고, g는 0, 1, 2, 3 또는 4로부터 선택된 수이다)을 포함하지만 이에 한정되는 것은 아니다. 약학적으로 허용되는 염에 대한 모든 참조는 동일한 산 부가염의 본 발명에서 정의된 바와 같은 용매 부가 형태(용매화물) 또는 결정 형태(다형체)를 포함한다.
용어 "제제" 또는 "제형"은 활성 화합물의 고체 및 액체 둘 다의 제형물을 포함하며, 본 기술분야의 숙련가는 목적하는 투여량 및 약동학적 파라미터에 따라 상이한 제제에 존재할 수 있음을 이해할 것이다.
본 발명에서 사용되는 용어 "부형제"는 약학적 조성물을 제조하는데 사용되는 화합물을 나타내며, 일반적으로 안전하고 무독성이며 생물학적으로 또는 기타 다른 면에서 바람직하고, 수의용뿐만 아니라 사람 약학적 용도에서도 허용되는 부형제를 포함한다.
용어 "결정질"은 화학식 Ⅰ 또는 Ⅱ의 고체 샘플이 X-선 분말 회절 또는 단결정 X-선 기술에 의해 측정되는 경우 결정질 특성을 갖는 상황을 나타낸다.
용어 "결정-유사형"은 화학식 Ⅰ 또는 Ⅱ의 고체 샘플이 한 수단, 예를 들면, 육안 또는 광학 또는 편광 현미경에 의해 측정하는 경우 결정질 특성을 갖지만 다른 수단, 예를 들면, X-선 분말 회절에 의해 측정하는 경우 결정질 형태를 갖지 않는 상황을 나타낸다. 육안에 의해 또는 광학 또는 편광 현미경에 의해 고체 샘플의 결정성을 가시적으로 측정하는 방법은 USP <695> 및 <776>에 기술되며, 이들은 둘 다 인용에 의해 본 발명에 포함된다. "결정-유사형"인 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 고체 샘플은 특정 조건하에서는 결정질일 수 있지만, 기타 조건에 있는 경우 비결정질이 될 수 있다.
용어 "무정형"은, 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 고체 샘플이 결정형도 아니고 결정형과 유사하지도 않는 상태를 나타낸다.
용어 "공-결정화물"은 약학적으로 허용되는 염을 포함하는 염과 조합된 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 공-결정화물을 포함한다.
용어 "실질적으로 무수"는 물질이 물을 10중량% 이하, 바람직하게는 1중량% 이하, 보다 바람직하게는 0.5중량% 이하, 가장 바람직하게는 0.1중량% 이하 함유함을 의미한다.
(격자 또는 흡착된) 용매(어떤 경우에는 기호 S로 나타냄) 또는 역-용매(anti-solvent)는 C1 내지 C8 알코올, C2 내지 C8 에테르, C3 내지 C7 케톤, C3 내지 C7 에스테르, C1 내지 C2 클로로카본, C5 내지 C12 포화 탄화수소, 및 C6 내지 C12 방향족 탄화수소 중의 하나 이상을 포함한다.
발명의 상세한 설명
화학식 Ⅰ의 화합물 또는 그의 염, 또는 화학식 Ⅱ의 화합물 또는 그의 염이 기술된다:
화학식 Ⅰ
화학식 Ⅱ
상기에서,
(a) R1은 수소, n-알킬; 분지형 알킬; 사이클로알킬; 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며,
상기 페닐 또는 나프틸은 선택적으로 C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 알콕시, F, Cl, Br, I, 니트로, 시아노, C1 -6 할로알킬, -N(R1')2, C1 -6 아실아미노, -NHSO2C1-6 알킬, -SO2N(R1')2, COR1 ", 및 -SO2C1 -6 알킬(여기서, R1'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1 -6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R1 "는 -OR' 또는 -N(R1')2이다) 중의 적어도 하나로 치환되고;
(b) R2는 수소 또는 C1 -10 알킬이거나, R3a 또는 R3b와 R2는 함께 (CH2)n(여기서, n은 2 내지 4이다)이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하고;
(c) R3a 및 R3b는
(ⅰ) 독립적으로 수소, C1 -10 알킬, 사이클로알킬, -(CH2)c(NR3')2, C1 -6 하이드록시알킬, -CH2SH, -(CH2)2S(O)dMe, -(CH2)3NHC(=NH)NH2,(1H-인돌-3-일)메틸,(1H-이미다졸-4-일)메틸, -(CH2)eCOR3 ", 아릴 및 아릴 C1 -3 알킬(상기 아릴기는 선택적으로 하이드록실, C1 -10 알킬, C1 -6 알콕시, 할로겐, 니트로 및 시아노로부터 선택된 기로 치환된다)로부터 선택되거나;
(ⅱ) R3a 및 R3b가 둘 다 C1 -6 알킬이거나;
(ⅲ) R3a와 R3b가 함께 (CH2)f이어서 스피로 환을 형성하거나;
(ⅳ) R3a가 수소이고 R3b와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나;
(ⅴ) R3b가 수소이고 R3a와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나(여기서, c는 1 내지 6이고, d는 0 내지 2이며, e는 0 내지 3이고, f는 2 내지 5이며, n은 2 내지 4이고, R3'는 독립적으로 수소 또는 C1 -6 알킬이며, R3 "는 -OR' 또는 -N(R3')2이다);
(ⅵ) R3a가 H이고, R3b가 H, CH3, CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이거나;
(ⅶ) R3a가 CH3, -CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이고, R3b가 H이며(상기 R3'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1 -6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R3 "는 -OR' 또는 -N(R3')2이다);
(d) R4는 수소, C1 -10 알킬; 저급 알킬, 알콕시, 디(저급 알킬)-아미노, 또는 할로겐으로 선택적으로 치환된 C1 -10 알킬; C1 -10 할로알킬, C3 -10 사이클로알킬, 사이클로알킬 알킬, 사이클로헤테로알킬, 아미노아실, 페닐과 같은 아릴, 피리디닐과 같은 헤테로아릴, 치환된 아릴 또는 치환된 헤테로아릴이고;
(e) R5는 H, 저급 알킬, CN, 비닐, O-(저급 알킬), 하이드록실 저급 알킬, 즉, 하이드록실 메틸(CH2OH)을 포함하는 -(CH2)pOH(여기서, p는 1 내지 6이다), CH2F, N3, CH2CN, CH2NH2, CH2NHCH3, CH2N(CH3)2, 알킨(선택적으로 치환됨), 또는 F, Cl, Br 또는 I를 포함하는 할로겐이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, F, CN, 비닐 또는 에티닐이고;
(g) R7은 수소, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아닌 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이다) 중의 적어도 하나로 치환되고;
(h) X는 H, OH, OMe, 할로겐, CN, NH2 또는 N3이고;
(i) Y는 OH이고;
(j) Z는 N 또는 CR10이고;
(k) R8 및 R9는 독립적으로 H, F, Cl, Br, I, OH, OR', SH, SR', NH2, NHR', NR'2, 질소 헤테로사이클, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 저급 알케닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H 또는 CH=CHCO2R'이고; 및
(l) R10은 H, 할로겐(F, Cl, Br, I 포함), OH, OR', SH, SR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 저급 알케닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 선택적으로 치환된 C1 -20 알킬, 선택적으로 치환된 C1 -10 알킬, 선택적으로 치환된 저급 알킬을 포함하지만 이에 한정되지는 않는 선택적으로 치환된 알킬; 선택적으로 치환된 사이클로알킬; 알크아릴; C2-C6의 선택적으로 치환된 알키닐; C2-C6의 선택적으로 치환된 저급 알케닐; 또는 C(O)알킬, C(O)(C1 -20 알킬), C(O)(C1-10 알킬), 또는 C(O)(저급 알킬)을 포함하지만 이에 한정되지는 않는 선택적으로 치환된 아실이다.
또한, 상기 정의한 바와 같은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 제조방법이 기술되며, 상기 방법은
(a) 화학식 Ⅲ의 보호된 리보노락톤을 하이드라이드 환원제를 사용하여 입체선택적으로 환원시켜 화학식 Ⅳ의 베타-락톨 유도체를 제공하는 단계; 및
(b) 화학식 Ⅳ의 베타-락톨 유도체를 시약을 사용하여 입체선택적으로 전환시켜 화학식 Ⅴ의 아노머성 알파-유도체를 수득하는 단계를 포함한다.
화학식 Ⅲ
화학식 Ⅳ
화학식 Ⅴ
상기에서, R5, R6 및 X는 상기 정의한 바와 같고, X'는 이탈기이며, R11은 보호기이다.
제1 구현예는 화학식 Ⅰ의 화합물에 관한 것으로서,
(a) (a) R1은 수소, n-알킬; 분지형 알킬; 사이클로알킬; 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 알콕시, F, Cl, Br, I, 니트로, 시아노, C1 -6 할로알킬, -N(R1')2, C1 -6 아실아미노, -NHSO2C1-6 알킬, -SO2N(R1')2, COR1 ", 및 -SO2C1 -6 알킬(여기서, R1'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1 -6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R1 "는 -OR' 또는 -N(R1')2이다) 중의 적어도 하나로 치환되고;
(b) R2는 수소 또는 CH3이고;
(c) R3a 및 R3b는 (ⅰ) 독립적으로 수소, C1 -10 알킬, 사이클로알킬, -(CH2)c(NR3')2, C1 -6 하이드록시알킬, -CH2SH, -(CH2)2S(O)dMe, -(CH2)3NHC(=NH)NH2,(1H-인돌-3-일)메틸,(1H-이미다졸-4-일)메틸, -(CH2)eCOR3 ", 아릴 및 아릴 C1 -3 알킬(상기 아릴기는 선택적으로 하이드록실, C1 -10 알킬, C1 -6 알콕시, 할로겐, 니트로 및 시아노로부터 선택된 기로 치환된다)로부터 선택되거나; (ⅱ) R3a 및 R3b가 둘 다 C1 -6 알킬이거나; (ⅲ) R3a와 R3b가 함께 (CH2)f이어서 스피로 환을 형성하거나; (ⅳ) R3a가 수소이고 R3b와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나; (ⅴ) R3b가 수소이고 R3a와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나(여기서, c는 1 내지 6이고, d는 0 내지 2이며, e는 0 내지 3이고, f는 2 내지 5이며, n은 2 내지 4이고, R3'는 독립적으로 수소 또는 C1 -6 알킬이며, R3 "는 -OR' 또는 -N(R3')2이다); (ⅵ) R3a가 H이고, R3b가 H, CH3, CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이거나; (ⅶ) R3a가 CH3, -CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이고, R3b가 H이며(상기 R3'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1 -6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R3 "는 -OR' 또는 -N(R3')2이다);
(d) R4는 수소, C1 -10 알킬; 저급 알킬, 알콕시 또는 할로겐으로 선택적으로 치환된 C1 -10 알킬; C1 -10 할로알킬, C3 -10 사이클로알킬, 사이클로알킬 알킬, 사이클로헤테로알킬, 아미노아실, 디(저급 알킬)아미노-저급 알킬, 아릴(예: 페닐), 헤테로아릴(예: 피리디닐), 치환된 아릴 또는 치환된 헤테로아릴이고;
(e) R5는 H, 저급 알킬, CN, 비닐, O-(저급 알킬), 하이드록실 저급 알킬[즉, -(CH2)pOH(여기서, p는 1 내지 6이다)이며, 하이드록실 메틸(CH2OH)을 포함한다], CH2F, N3, CH2CN, CH2NH2, CH2NHCH3, CH2N(CH3)2, 알킨(선택적으로 치환됨), 또는 F, Cl, Br 또는 I를 포함하는 할로겐이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, CN, 비닐 또는 에티닐이고;
(g) X는 H, OH, OMe, CN, F, Cl, Br, I, NH2 또는 N3이고;
(h) Y는 OH이고;
(i) R8 및 R9는 독립적으로 H, F, Br, I, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H 또는 CH=CHCO2R'이고;
(j) Z는 N 또는 CR10이고;
(k) R10은 H, 할로겐(F, Cl, Br, I 포함), OR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, -C≡CH, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴 또는 C(O)(저급 알킬)이다.
상기 제1 구현예의 제1 측면은
(a) R1은 수소, 메틸, 에틸, n-프로필, i-프로필, 페닐, p-톨릴, p-브로모-페닐, p-클로로-페닐, p-플루오로페닐이고;
(b) R2는 수소 또는 CH3이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, tBu, 벤질, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, N-메틸-아지리딘-2-일, N-메틸-아제티딘-3-일, N-메틸-피롤리딘-3-일, N-메틸-피롤리딘-4-일, N-메틸-피페리딘-4-일, 저급 할로알킬, 또는 디(저급 알킬)아미노-저급 알킬이고;
(e) R5는 H, CN, CH3, OCH3, CH2OH, CH2F, N3, 할로겐(F, Cl, Br 또는 I 포함)이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, CN, 비닐 또는 에티닐이고;
(g) X는 H, OH, OCH3, CN, F, Cl, Br, I, NH2 또는 N3이고;
(h) Y는 OH이고;
(i) R8 및 R9는 독립적으로 H, F, Br, I, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
(j) Z는 N 또는 CR10이고;
(k) R10은 H, 할로겐(F, Cl, Br 또는 I 포함), OR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, -C≡CH, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H 또는 CH=CHCO2R'이고;
R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제2 측면은
(a) R1은 수소, 메틸, 에틸, n-프로필, i-프로필, 페닐, p-톨릴, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고;
(b) R2는 수소 또는 CH3이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph 또는 저급 사이클로알킬이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, tBu, 벤질, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, N-메틸-아지리딘-2-일, N-메틸-아제티딘-3-일, N-메틸-피롤리딘-3-일, N-메틸-피롤리딘-4-일, N-메틸-피페리딘-4-일, 저급 할로알킬, 또는 디(저급 알킬)아미노-저급 알킬이고;
(e) R5는 H, CN, CH2F, N3, F, Cl, Br 또는 I이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, F, 비닐 또는 에티닐이고;
(g) X는 H, OH, OCH3, CN, F, Cl, Br, I, NH2 또는 N3이고;
(h) Y는 OH이고;
(i) R8 및 R9는 독립적으로 H, F, Br, I, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
(j) Z는 N 또는 CR10이고;
(k) R10은 H, 할로겐(F, Cl, Br, I 포함), OR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, -C≡CH, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제3 측면은
(a) R1은 수소, 메틸, 에틸, n-프로필, i-프로필, 페닐, p-톨릴, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고;
(b) R2는 수소이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, 또는 저급 사이클로알킬이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, tBu, 벤질, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, N-메틸-아지리딘-2-일, N-메틸-아제티딘-3-일, N-메틸-피롤리딘-3-일, N-메틸-피롤리딘-4-일, N-메틸-피페리딘-4-일, 저급 할로알킬, 또는 디(저급 알킬)아미노-저급 알킬이고;
(e) R5는 H 또는 N3이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, 비닐 또는 에티닐이고;
(g) X는 H, OH, OCH3, CN, F, NH2 또는 N3이고;
(h) Y는 OH이고;
(i) R8 및 R9는 독립적으로 H, F, Br, I, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
(j) Z는 N 또는 CR10이고;
(k) R10은 H, 할로겐(F, Cl, Br, I 포함), OR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, -C≡CH, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제4 측면은
(a) R1은 수소, 메틸, 페닐, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고;
(b) R2는 수소이고;
(c) R3a는 H이고 R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, 또는 저급 사이클로알킬이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, tBu, 벤질, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, N-메틸-아지리딘-2-일, N-메틸-아제티딘-3-일, N-메틸-피롤리딘-3-일, N-메틸-피롤리딘-4-일, N-메틸-피페리딘-4-일, 저급 할로알킬, 또는 디(저급 알킬)아미노-저급 알킬이고;
(e) R5는 H 또는 N3이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, 비닐, 또는 에티닐이고;
(g) X는 H, OH, OCH3, CN, F, NH2 또는 N3이고;
(h) Y는 OH이고;
(i) R8 및 R9는 독립적으로 H, F, Br, I, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
(j) Z는 N 또는 CR10이고;
(k) R10은 H, 할로겐(F, Cl, Br, I 포함), OR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, -C≡CH, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'은 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제5 측면은
(a) R1은 수소, 메틸, 페닐, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고;
(b) R2는 수소이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, 또는 저급 사이클로알킬이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, tBu, 벤질, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, N-메틸-아지리딘-2-일, N-메틸-아제티딘-3-일, N-메틸-피롤리딘-3-일, N-메틸-피롤리딘-4-일, N-메틸-피페리딘-4-일, 저급 할로알킬, 또는 디(저급 알킬)아미노-저급 알킬이고;
(e) R5는 H 또는 N3이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, 비닐, 또는 에티닐이고;
(g) X는 H, OH, OCH3, CN, F, NH2 또는 N3이고;
(h) Y는 OH이고;
(i) R8 및 R9는 독립적으로 H, F, Br, I, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
(j) Z는 N 또는 CR10이고;
(k) R10은 H, 할로겐(F, Cl, Br, I 포함), OR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, -C≡CH, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알킬, 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제6 측면은
(a) R1은 수소, 페닐, p-톨릴, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고;
(b) R2는 수소 또는 CH3이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2OH, CH2((4'-OH)-Ph), 또는 저급 사이클로알킬이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, tBu, 벤질, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 또는 사이클로헥실이고;
(e) R5는 H 또는 N3이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, CN, 비닐 또는 에티닐이고;
(g) X는 H, OH, OCH3, CN, F, Cl, Br, I, NH2, 또는 N3이고;
(h) Y는 OH이고;
(i) R9는 NH2이고, R8은 H, F, Br, I, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
(j) Z는 N 또는 CR10이고;
(k) R10은 H, F, Cl, Br, I, OR', NH2, NHR', NR'2, 또는 C1-C6의 저급 알킬, 또는 -C≡CH이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제7 측면은
(a) R1은 수소, 페닐, p-톨릴, p-브로모-페닐, 또는 p-클로로-페닐이고;
(b) R2는 수소 또는 CH3이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2OH, 또는 저급 사이클로알킬이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, tBu, 벤질, 사이클로프로필, 사이클로부틸, 사이클로펜틸, 또는 사이클로헥실이고;
(e) R5는 H 또는 N3이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, CN, 비닐 또는 에티닐이고;
(g) X는 H, OH, OCH3, CN, F, Cl, Br 또는 N3이고;
(h) Y는 OH이고;
(i) R9는 NH2이고, R8는 H, F, OH, O(저급 알킬), O(저급 알크아릴), NH2, NHR', NR'2, 또는 질소 헤테로사이클이고;
(j) Z는 N이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제8 측면은
(a) R1은 수소, 페닐, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고;
(b) R2는 수소이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, CH2CH(CH3)2, 또는 CH(CH3)CH2CH3이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, 또는 사이클로펜틸이고;
(e) R5는 H 또는 N3이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, CN, 비닐 또는 에티닐이고;
(g) X는 H, OH, CN, F 또는 N3이고;
(h) Y는 OH이고;
(i) R9는 NH2이고, R8은 H, F, OH, O(저급 알킬), O(저급 알크아릴), NH2, NHR', NR'2 또는 질소 헤테로사이클이고;
(j) Z는 N이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제9 측면은
(a) R1은 수소, 페닐, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고;
(b) R2는 수소이고;
(c) R3a는 H이고, R3b는 H, CH3, CH(CH3)2, 또는 CH2CH(CH3)2이고;
(d) R4는 수소, CH3, Et, iPr, nPr, nBu, 2-부틸, 또는 사이클로펜틸이고;
(e) R5는 H이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, CN, 비닐 또는 에티닐이고;
(g) X는 H, OH, CN, F 또는 N3이고;
(h) Y는 OH이고;
(i) R9는 NH2이고, R8은 H, F, OH, O(저급 알킬), O(저급 알크아릴), NH2, NHR', NR'2, 또는 질소 헤테로사이클이고;
(j) Z는 N이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, 또는 C(O)(저급 알킬)인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제10 측면은 (a) R1은 수소, 페닐, p-브로모-페닐, p-클로로-페닐, 또는 p-플루오로페닐이고; (b) R2는 수소이고; (c) R3a는 H이고, R3b는 CH3이고; (d) R4는 수소, CH3, iPr, 또는 사이클로펜틸이고; (e) R5는 H이고; (f) R6은 CH3이고; (g) X는 F이고; (h) Y는 OH이고; (i) R8은 독립적으로 OH, OMe, OEt, OiPr, OBn, 또는 -N(-CH2CH2CH2-)(아제티딘-1-일)이고, R9는 NH2이고; (j) Z는 N인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제11 측면은 (a) R1은 페닐이고; (b) R2는 수소이고; (c) R3a는 H이고, R3b는 CH3이고; (d) R4는 iPr이고; (e) R5는 H이고; (f) R6은 CH3이고; (g) X는 F이고; (h) Y는 OH이고; R8은 OMe이고; (j) Z는 N인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제12 측면은 (a) R1은 페닐이고; (b) R2는 수소이고; (c) R3a는 H이고, R3b는 CH3이고; (d) R4는 iPr이고; (e) R5는 H이고; (f) R6은 CH3이고; (g) X는 F이고; (h) Y는 OH이고; R8은 OEt이고; (j) Z는 N인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제13 측면은 (a) R1은 페닐이고; (b) R2는 수소이고; (c) R3a는 H이고, R3b는 CH3이고; (d) R4는 iPr이고; (e) R5는 H이고; (f) R6은 CH3이고; (g) X는 F이고; (h) Y는 OH이고; R8은 OiPr이고; (j) Z는 N인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제14 측면은 (a) R1은 페닐이고; (b) R2는 수소이고; (c) R3a는 H이고, R3b는 CH3이고; (d) R4는 CH3이고; (e) R5는 H이고; (f) R6은 CH3이고; (g) X는 F이고; (h) Y는 OH이고, R8은 -N(-CH2CH2CH2-)(아제티딘-1-일)이고, R9는 NH2이고; (j) Z는 N인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제15 측면은 (a) R1은 페닐이고; (b) R2는 수소이고; (c) R3a는 H이고, R3b는 CH3이고; (d) R4는 사이클로펜틸이고; (e) R5는 H이고; (f) R6은 CH3이고; (g) X는 F이고; (h) Y는 OH이고; R8은 독립적으로 OBn이고, R9는 NH2이고; (j) Z는 N인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 제16 측면은 (a) R1은 페닐이고; (b) R2는 수소이고; (c) R3a는 H이고, R3b는 CH3이고; (d) R4는 사이클로펜틸이고; (e) R5는 H이고; (f) R6은 CH3이고; (g) X는 F이고; (h) Y는 OH이고; R8은 OH이고, R9는 NH2이고; (j) Z는 N인 화학식 Ⅰ의 화합물에 관한 것이다.
상기 제1 구현예의 바람직한 화합물은 하기 구조로 나타낸 화합물을 포함한다.
상기에서, R4는 저급 알킬이고, R8은 O(저급 알킬)이다. 추가적인 바람직한 화합물은 다음을 포함한다:
상기 바람직한 화합물 중에서, 화합물 11이 특히 바람직하다. 통상적인 기술을 가진 자는 화합물 11이 SP-11 및 RP-11로 지정된 부분입체이성체의 혼합물을 포함함을 인지할 것이다. 본 발명에서는 SP-11, RP-11 또는 이들의 혼합물을 포함하는 조성물이 고려된다.
SP-11, RP-11 또는 이들의 혼합물을 포함하는 조성물은 또한 용매화물, 수화물 또는 혼합 용매화물/수화물의 일부일 수 있다. 상기 용매화물은 SP-11ㆍnS, RP-11ㆍnS, 또는 11ㆍnS로도 지정되며; 상기 수화물은 SP-11ㆍmH2O, RP-11ㆍmH2O, 또는 11ㆍmH2O로도 지정되고, 여기서 S는 격자 용매이고, n은 약 0 내지 약 3 범위의 정수이거나 정수가 아닌 양이고, m은 약 0 내지 약 5 범위의 정수이거나 정수가 아닌 양이다. SP-11, RP-11, 또는 이들의 혼합물 및 이들의 염, 용매화물 및 수화물을 포함하는 조성물은 결정질, 결정-유사형 또는 무정형이다.
제2 구현예는 화학식 Ⅱ의 화합물에 관한 것으로서,
(a) R5는 H, 저급 알킬, 시아노(CN), 비닐, O-(저급 알킬)[OCH3, OCH2CH3 포함], 하이드록실 저급 알킬[즉, -(CH2)pOH(여기서, p는 1 내지 6이다)이며, 하이드록실 메틸(CH2OH)을 포함한다], 플루오로메틸(CH2F), 아지도(N3), CH2CN, CH2N3, CH2NH2, CH2NHCH3, CH2N(CH3)2, F, Cl, Br 또는 I이고;
(b) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3, F, 비닐 또는 에티닐이고;
(c) R7은 H, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴, 알케닐 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, -C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이고, 이는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아니다) 중의 적어도 하나로 치환되고;
(d) X는 H, OH, F, OMe, NH2 또는 N3이고;
(e) R8 및 R9는 독립적으로 H, F, Cl, Br, I, OH, OR', SH, SR', NH2, NHR', NR'2, 질소 헤테로사이클, CH3, CH3 -qXq(여기서, X가 F, Cl, Br 또는 I이고, q가 1 내지 3이다), 비닐, CO2H, CO2CH3, CONH2, CONHCH3, CON(CH3)2이고;
(f) Z는 N 또는 CR10이고;
(g) R10은 H, 할로겐(F, Cl, Br, I 포함), OH, OR', SH, SR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 저급 알케닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 C1 -20 알킬; C1 -20 사이클로알킬; 알크아릴, C2-C6 알케닐, C2-C6 알키닐이다.
상기 제2 구현예의 제1 측면은
(a) R5는 H, 저급 알킬, 시아노(CN), 비닐, O-(저급 알킬)[OCH3, OCH2CH3 포함], 하이드록실 저급 알킬[즉, -(CH2)pOH(여기서, p는 1 내지 6이다)이며, 하이드록실 메틸(CH2OH)을 포함한다], 플루오로메틸(CH2F), 아지도(N3), CH2CN, CH2N3, CH2NH2, CH2NHCH3, CH2N(CH3)2, F, Cl, Br 또는 I이고;
(b) R6은 H, CH3, CH2F, CHF2, CF3, CH2CH3 또는 F이고;
(c) R7은 H, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴, 알케닐 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, -C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이고, 이는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아니다) 중의 적어도 하나로 치환되고;
(d) X는 H, OH, F, OMe, NH2 또는 N3이고;
(e) R8 및 R9는 독립적으로 H, F, Cl, Br, I, OH, OR', SH, SR', NH2, NHR', NR'2, 질소 헤테로사이클, CH3, CH3 -qXq(여기서, X가 F, Cl, Br 또는 I이고, q가 1 내지 3이다), 비닐, CO2H, CO2CH3, CONH2, CONHCH3, CON(CH3)2이고;
(f) Z는 N 또는 CR10이고;
(g) R10은 H, F, OH, OR', NH2, NHR', NR'2, NR"2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, 또는 -C≡CH이고;
상기 R'는 C1 -20 알킬; C1 -20 사이클로알킬; 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제2 측면은
(a) R5는 H, 저급 알킬, 시아노(CN), 비닐, O-(저급 알킬)[OCH3, OCH2CH3 포함], 하이드록실 저급 알킬[즉, -(CH2)pOH(여기서, p는 1 내지 6이다)이며, 하이드록실 메틸(CH2OH)을 포함한다], 플루오로메틸(CH2F), 아지도(N3), CH2CN, CH2N3, CH2NH2, CH2NHCH3, CH2N(CH3)2, F, Cl, Br 또는 I이고;
(b) R6은 H, CH3, CH2F, CHF2, CF3, 또는 CH2CH3이고;
(c) R7은 H, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴, 알케닐 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, -C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이고, 이는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아니다) 중의 적어도 하나로 치환되고;
(d) X는 H, OH, F, OMe, NH2 또는 N3이고;
(e) R8 및 R9는 독립적으로 H, F, Br, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CH3, CH3 - qXq(여기서, X가 F, Cl, Br 또는 I이고, q가 1 내지 3이다), 비닐, CO2CH3, CONH2, CONHCH3, CON(CH3)2이고;
(f) Z는 N 또는 CR10이고;
(g) R10은 H, F, OH, OR', NH2, NHR', NR'2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, 또는 -C≡CH이고;
상기 R'는 C1 -20 알킬; C1 -20 사이클로알킬; 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제3 측면은
(a) R5는 H, 저급 알킬, 시아노(CN), 비닐, O-(저급 알킬)[OCH3, OCH2CH3 포함], 하이드록실 저급 알킬[즉, -(CH2)pOH(여기서, p는 1 내지 6이다)이며, 하이드록실 메틸(CH2OH)을 포함한다], 플루오로메틸(CH2F), 아지도(N3), CH2CN, CH2N3, CH2NH2, CH2NHCH3, CH2N(CH3)2, F, Cl, Br 또는 I이고;
(b) R6은 H, CH3, CH2F, CHF2, CF3, 또는 CH2CH3이고;
(c) R7은 H, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴, 알케닐 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, -C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이고, 이는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아니다) 중의 적어도 하나로 치환되고;
(d) X는 F이고;
(e) R8 및 R9는 독립적으로 H, F, Br, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CH3, CH3 - qXq(여기서, X가 F, Cl, Br 또는 I이고, q가 1 내지 3이다), 비닐, CO2CH3, CONH2, CONHCH3, CON(CH3)2이고;
(f) Z는 N 또는 CR10이고;
(g) R10은 H, F, OH, OR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, 또는 -C≡CH이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제4 측면은
(a) R5는 H, -CH3, 시아노(CN), 비닐, -OCH3, -CH2OH, -CH2F, 아지도(N3), CH2CN, CH2N3, CH2NH2, CH2NHCH3, CH2N(CH3)2, F, Cl, Br 또는 I이고;
(b) R6은 H, CH3 또는 CH2CH3이고;
(c) R7은 H, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴, 알케닐 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, -C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이고, 이는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아니다) 중의 적어도 하나로 치환되고;
(d) X는 F이고;
(e) R8 및 R9는 독립적으로 H, F, OH, OR', SH, SCH3, NH2, NHR', NR'2, 질소 헤테로사이클, CH3, CH3 - qXq(여기서, X가 F, Cl, Br 또는 I이고, q가 1 내지 3이다), 비닐, CO2H, CO2CH3, CONH2, CONHCH3, CON(CH3)2이고;
(f) Z는 N 또는 CR10이고;
(g) R10은 H, F, OH, OR', NH2, NHR', NR'2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, 또는 -C≡CH이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제5 측면은
(a) R5는 H, -CH3, 시아노(CN), 비닐, -OCH3, -CH2OH, -CH2F, 아지도(N3), CH2CN, CH2N3, CH2NH2, CH2NHCH3, CH2N(CH3)2, F, Cl, Br 또는 I이고;
(b) R6은 H 또는 CH3이고;
(c) R7은 H, 저급 알킬, 저급 알킬아릴, 저급 사이클로알킬, 저급 알케닐 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시(여기서, R7'는 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이고, 이는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아니다) 중의 적어도 하나로 치환되고;
(d) X는 F이고;
(e) R8 및 R9는 독립적으로 H, F, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CH3, CH3 - qXq(여기서, X가 F, Cl, Br 또는 I이고, q가 1 내지 3이다), 비닐, CO2H, CO2CH3, CONH2, CONHCH3, CON(CH3)2이고;
(f) Z는 N 또는 CR10이고;
(g) R10은 H, F, OH, OR', NH2, NHR', NR'2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, 또는 -C≡CH이고;
상기 R'는 저급 알킬; 저급 사이클로알킬; 저급 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제6 측면은
(a) R5는 H 또는 N3이고;
(b) R6은 H, CH3 또는 CH2CH3이고;
(c) R7은 H, 저급 알킬, 저급 알킬아릴, 저급 사이클로알킬, 저급 알케닐 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시(여기서, R7'는 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이고, 이는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아니다) 중의 적어도 하나로 치환되고;
(d) X는 F이고;
(e) R8 및 R9는 독립적으로 H, F, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클, CH3, CH3 - qXq(여기서, X가 F, Cl, Br 또는 I이고, q가 1 내지 3이다), 비닐, CO2H, CO2CH3, CONH2, CONHCH3, CON(CH3)2이고;
(f) Z는 N 또는 CR10이고;
(g) R10은 H, F, OH, OR', NH2, NHR', NR'2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, 또는 -C≡CH이고;
상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제7 측면은 (a) R5는 H이고; (b) R6은 H, CH3, 또는 CH2CH3; (c) R7은 저급 알킬 또는 저급 사이클로알킬이고; (d) X는 F이고; (e) R8 및 R9는 독립적으로 H, F, OH, OR', NH2, NHR', NR'2, 질소 헤테로사이클이고; (f) Z는 N이고; 상기 R'는 저급 알킬; 저급 사이클로알킬; 저급 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제8 측면은 (a) R5는 H이고; (b) R6은 H, CH3, 또는 CH2CH3이고; (c) R7은 저급 알킬 또는 저급 사이클로알킬이고; (d) X는 F이고; (e) R9는 NH2이고, R8은 OH, OR' 또는 질소 헤테로사이클이고; (f) Z는 N이고; 상기 R'는 저급 알킬, 저급 사이클로알킬, 저급 알크아릴, C2-C6 알케닐, C2-C6 알키닐인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제9 측면은 (a) R5는 H이고; (b) R6은 H, CH3, 또는 CH2CH3 이고; (c) R7은 저급 알킬 또는 저급 사이클로알킬이고; (d) X는 F이고; (e) R9는 NH2이고, R8은 O(저급 알킬), O(저급 사이클로알킬), 또는 질소 헤테로사이클이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제10 측면은 (a) R5은 H이고; (b) R6은 CH3이고; (c) R7은 저급 알킬 또는 저급 사이클로알킬이고; (d) X는 F이고; (e) R9는 NH2이고, R8은 O(저급 알킬), O(저급 사이클로알킬), 또는 질소 헤테로사이클이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제11 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 저급 알킬 또는 저급 사이클로알킬이고; (d) X는 F이고; (e) R9는 NH2이고, R8은 O(저급 알킬), O(저급 사이클로알킬), 또는 -N(-CH2CH2CH2-)(아제티딘-1-일)이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제12 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3, iPr, cBu 또는 CPn이고; (d) X는 F이고; (e) R9는 NH2이고, R8은 O(저급 알킬), 또는 -N(-CH2CH2CH2-)(아제티딘-1-일)이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제13 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3, iPr, cBu 또는 CPn이고; (d) X는 F이고; (e) R9는 NH2이고, R8은 OMe, OEt, OiPr, 또는 -N(-CH2CH2CH2-)(아제티딘-1-일)이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제14 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3, iPr, cBu 또는 CPn이고; (d) X는 F이고; (e) R9는 NH2이고, R8은 OMe, OEt 또는 OiPr이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제15 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3, iPr, cBu 또는 CPn이고; (d) X는 F이고; (e) R8은 OMe이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제16 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3, iPr, cBu 또는 CPn이고; (d) X는 F이고; (e) R8은 OEt이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제17 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3, iPr, cBu 또는 CPn이고; (d) X는 F이고; (e) R8은 iOPr이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제18 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3이고; (d) X는 F이고; (e) R8은 -N(-CH2CH2CH2-)(아제티딘-1-일)이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제19 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 CH3이고; (d) X는 F이고; (e) R8은 OEt이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제20 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 iPr이고; (d) X는 F이고; (e) R8은 OEt이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제21 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 cBu이고; (d) X는 F이고; (e) R8은 OMe이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제22 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 cPn이고; (d) X는 F이고; (e) R8은 OMe이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제23 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 cBu이고; (d) X는 F이고; (e) R8은 OEt이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
상기 제2 구현예의 제24 측면은 (a) R5는 H이고; (b) R6은 CH3이고; (c) R7은 cPn이고; (d) X는 F이고; (e) R8은 OEt이고, R9는 NH2이고; (f) Z는 N인 화학식 Ⅱ의 화합물에 관한 것이다.
제2 구현예에 의해 또는 다른 적합한 방법에 의해 제조되는 바람직한 화합물은 하기 구조로 나타낸 화합물을 포함한다.
상기에서, R7은 저급 알킬 또는 저급 사이클로알킬이고, R8은 O(저급 알킬)이다. 추가적인 바람직한 화합물은 하기 화합물을 포함한다:
상기 바람직한 화합물 중에서, 화합물 17이 특히 바람직하다. 본 기술분야의 숙련가들은 화합물 17이 RP-17 및 SP-17로서 지정된 부분입체이성체들의 혼합물을 포함함을 인지할 것이다. SP-17, RP-17, 또는 이들의 혼합물을 포함하는 조성물이 본 발명에서 고려된다. 상기 조성물은 정제된 RP-17을 포함하는 것이 바람직하다. 상기 조성물은 실질적으로 순수한 RP-17을 포함하는 것이 추가로 바람직하다.
SP-17, RP-17, 또는 이들의 혼합물을 포함하는 조성물은 또한 용매화물, 수화물, 또는 혼합된 용매화물/수화물의 일부일 수 있다. 상기 용매화물은 SP-17ㆍnS, RP-17ㆍnS, 또는 17ㆍnS로도 지정되며; 상기 수화물은 SP-17ㆍmH2O, RP-17ㆍmH2O, 또는 17ㆍmH2O로도 지정되고, 여기서 S는 격자 용매이고, n은 약 0 내지 약 3 범위의 정수이거나 정수가 아닌 양이고, m은 약 0 내지 약 5 범위의 정수이거나 정수가 아닌 양이다. SP-17, RP-17, 또는 이들의 혼합물 및 이들의 염, 용매화물 및 수화물을 포함하는 조성물은 결정질, 결정-유사형 또는 무정형이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제1 측면은 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제2 측면은 약 12.2에서 XRD 2θ-반사도(°)를 갖는 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제3 측면은 약 12.2, 14.3, 15.5 및 19.9에서 XRD 2θ-반사도(°)를 갖는 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제4 측면은 약 12.2, 14.3, 15.5, 17.4, 18.1, 19.9, 22.8, 23.6, 24.5, 25.1 및 27.35에서 XRD 2θ-반사도(°)를 갖는 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제5 측면은 실질적으로 도 1에 도시한 바와 같은 XRD 회절 패턴을 갖는 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제6 측면은 사방정계(orthorhombic) 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제6 측면은 a ∼ 11.4 Å, b ∼ 12.4 Å 및 c ∼ 14.2 Å의 사방정계(P212121) 단위 셀 파라미터를 갖는 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제7 측면은 하기 FT-IR 피크(㎝-1)를 갖는 결정질 RP-17에 관한 것이다: ∼1581, ∼1295, ∼1065, ∼999, ∼798, 및 ∼79'.
상기 화학식 Ⅱ의 바람직한 화합물의 제8 측면은 실질적으로 도 2에 도시한 바와 같은 FT-IR 스펙트럼을 갖는 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제9 측면은 실질적으로 순수한 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제10 측면은 실질적으로 순수한 결정질 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제11 측면은 실질적으로 순수한 결정-유사형 RP-17에 관한 것이다.
상기 화학식 Ⅱ의 바람직한 화합물의 제12 측면은 실질적으로 순수한 무정형 RP-1에 관한 것이다.
제3 구현예는 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법에 관한 것으로서, 상기 방법은
(a) 화학식 Ⅲ의 보호된 리보노락톤을 하이드라이드 환원제를 사용하여 입체선택적으로 환원시켜 화학식 Ⅳ의 베타-락톨 유도체를 제공하는 단계; 및
화학식 Ⅲ
화학식 Ⅳ
(b) 화학식 Ⅳ의 베타-락톨 유도체를 시약을 사용하여 입체선택적으로 전환시켜 화학식 Ⅴ의 아노머성 알파-유도체를 수득하는 단계를 포함한다.
화학식 Ⅴ
상기에서, R5, R6 및 X는 상기 정의한 바와 같고, X'는 이탈기이며, R11은 보호기이다.
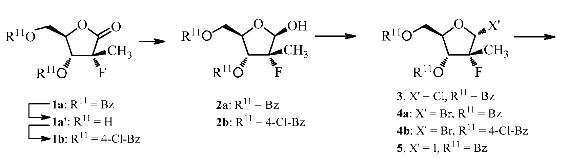
상기 제3 구현예의 제1 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법으로서, 화학식 Ⅲ의 화합물 또는 화학식 Ⅳ의 화합물에서, R11은 벤조일 또는 치환된 벤조일(바람직하게는, R11은 4-클로로-벤조일이다)이고, R5는 H이며, R6은 CH3이고, X는 F인 방법에 관한 것이다. 상기 하이드라이드 환원제는 (tBuO)3AlH, 나트륨(비스(2-메톡시에톡시)(2,2,2-트리플루오로-에톡시)알루미늄 하이드라이드, 또는 Red-Al(나트륨 비스(2-메톡시에톡시)알루미늄 하이드라이드)이다. 상기 입체선택성 환원은 테트라하이드로푸란(THF) 또는 디에틸 에테르를 포함하는 용매 중에서 수행될 수 있으며, 바람직하게는 상기 용매는 약 (-78℃) 내지 약 25℃ 범위의 온도에서, 바람직하게는 약 (-78℃) 내지 약 0℃ 범위의 온도에서, 가장 바람직하게는 약 (-30℃) 내지 약 0℃ 범위의 온도에서 THF이다.
상기 제3 구현예의 제2 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법에 관한 것으로서, 상기 방법은
화학식 Ⅲ의 보호된 리보노락톤을 하이드라이드 환원제를 사용하여 입체선택적으로 환원시켜 화학식 Ⅳ의 베타-락톨 유도체 및 화학식 Ⅳ-α의 알파-락톨 유도체를 포함하는 혼합물을 제공하는 단계: 및
화학식 Ⅳ의 베타-락톨 유도체 및 화학식 Ⅳ-α의 알파-락톨 유도체를 포함하는 혼합물로부터 화학식 Ⅳ의 베타-락톨 유도체를 결정화하는 단계를 포함한다.
상기에서, R5, R6 및 X는 본 발명에서 정의한 바와 같고, R11은 보호기이다.
상기 제3 구현예의 제3 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법으로서, 화학식 Ⅲ의 화합물, 화학식 Ⅳ의 화합물, 또는 화학식 Ⅳ-α의 화합물에서, R5는 H이고, R6은 CH3이며, R11은 벤조일 또는 치환된 벤조일(바람직하게는 R11은 4-클로로-벤조일이다)이고, X는 F인 방법에 관한 것이다. 상기 하이드라이드 환원제는 (tBuO)3AlH, 나트륨(비스(2-메톡시에톡시)(2,2,2-트리플루오로-에톡시)알루미늄 하이드라이드, 또는 Red-Al(나트륨 비스(2-메톡시에톡시)알루미늄 하이드라이드)이다. 상기 입체선택성 환원은 테트라하이드로푸란(THF) 또는 디에틸 에테르를 포함하는 용매 중에서 수행될 수 있으며, 바람직하게는 상기 용매는 약 (-78℃) 내지 약 25℃ 범위의 온도에서, 바람직하게는 약 (-78℃) 내지 약 0℃ 범위의 온도에서, 가장 바람직하게는 약 (-30℃) 내지 약 0℃ 범위의 온도에서 THF이다. 상기 결정화는 상기 혼합물에 베타-락톨 유도체의 시드 결정을 첨가한 다음, 베타-락톨 유도체의 시드 결정을 포함하는 혼합물을 약 25℃ 내지 약 80℃, 바람직하게는 약 50℃의 온도에서 (약 0.2 mmHg)으로 또는 진공의 도입없이 가열하는 단계를 포함하는 방법에 의해 일어난다.
상기 제3 구현예의 제4 측면은 화학식 Ⅳ의 락톨 유도체를 시약을 사용하여 입체선택적으로 전환시켜 화학식 Ⅴ의 아노머성 알파-유도체 Ⅴ를 수득하는 단계를 포함하는, 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법에 관한 것이다.
상기에서, R5, R6 및 X는 본 발명에서 상기 정의한 바와 같고, R11은 보호기이며, X'는 이탈기이다.
상기 제3 구현예의 제5 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법으로서, 화학식 Ⅳ의 화합물 또는 화학식 Ⅴ의 화합물에서, R5는 H이고, R6은 CH3이며, R11은 벤조일 또는 치환된 벤조일(바람직하게는 R11은 4-클로로-벤조일이다)이고, X는 F이며, X"는 Br인 방법에 관한 것이다. 상기 시약은 상기 정의한 바와 같다. 바람직하게는, 상기 시약은 Ph3P/CBr4, Ph3P/CHBr3, Ph3P/CHBr3/이미다졸, Ph3P/Br2, Ph3P/Br2/이미다졸, N-브로모숙신이미드/ Ph3P, 아세트산 중의 HBr, PBr3/DMF, PBr3/중탄산나트륨, PBr3/이미다졸, PBr5/DMF, PBr5/중탄산나트륨, PBr5/이미다졸, 및 POBr3/이미다졸 중의 적어도 하나이다. 보다 바람직하게는, 상기 시약은 Ph3P/CBr4이다. 상기 입체선택성 전환은 CH2Cl2, 1,2-디클로로에탄, 톨루엔, 클로로벤젠, 테트라하이드로푸란, 디옥산, 디에틸 에테르, 디메틸포름아미드, 아세토니트릴, N-메틸피롤리딘, 디메톡시에탄을 포함하지만 이에 한정되지는 않는 특정한 용매의 존재하에 수행될 수 있다. 바람직하게는, 사용된 용매는 CH2Cl2이다. 상기 입체선택적 전환은 약 (-78℃) 내지 약 0℃ 범위의 온도에서, 바람직하게는 약 (-78℃) 내지 약 (-10℃) 범위의 온도에서, 가장 바람직하게는 약 (-30℃) 내지 약 (-10℃) 범위의 온도에서 수행될 수 있다.
제4 구현예는 화학식 Ⅳ의 화합물에 관한 것이다.
화학식 Ⅳ
상기에서, R5, R6 및 X는 상기 정의한 바와 같고, R11은 보호기이다. 바람직하게는, R5는 H이고, R6은 CH3이며, R11은 보호기이고, 바람직하게는 R11은 벤조일 또는 치환된 벤조일이며, 보다 바람직하게는 R11은 4-클로로-벤조일이고, X는 F이며, 바람직하게는 R11은 4-클로로-벤조일이다. 화학식 Ⅳ의 화합물은 정제되거나 정제되지 않을 수 있다. 화학식 Ⅳ의 화합물은 화학식 Ⅰ의 화합물 및 화학식 Ⅱ의 화합물을 제조하는데 유용하다.
제5 구현예는 화학식 Ⅴ의 화합물에 관한 것이다.
화학식 Ⅴ
상기에서, R5, R6, R11 X 및 X'는 상기 정의한 바와 같다. 바람직하게는, R5는 H이고, R6은 CH3이며, R11은 보호기이고, 바람직하게는 R11은 벤조일 또는 치환된 벤조일이며, 보다 바람직하게는 R11은 4-클로로-벤조일이고, X는 F이며, X'는 Cl, Br 또는 I(가장 바람직하게는, X'는 Br이다)이다. 화학식 Ⅴ의 화합물은 정제되거나 정제되지 않을 수 있다. 화학식 Ⅴ의 화합물은 화학식 Ⅰ의 화합물 및 화학식 Ⅱ의 화합물을 제조하는데 유용하다.
제6 구현예는 화학식 Ⅴ의 알파-유도체를 염기성 시약을 사용하여 퓨린 또는 유도체화 퓨린 염기와 입체선택적으로 커플링시켜 화학식 Ⅵ의 베타-뉴클레오시드를 수득하는 단계를 포함하는 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법에 관한 것이다.
상기에서, R5, R6, R9, X 및 Z는 상기 정의한 바와 같고, R11은 보호기이며, X' 및 X"는 서로 독립적으로 이탈기이다.
상기 제6 구현예의 제1 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법으로서, 화학식 Ⅴ의 화합물 또는 화학식 Ⅵ의 화합물에서, R5는 H이고, R6은 CH3이며, R9는 NH2이고, R11은 보호기이며, 바람직하게는 R11은 벤조일 또는 치환된 벤조일이고, 보다 바람직하게는 R11은 4-클로로-벤조일이며, X는 F이고, X'는 Br이며, X"는 Cl이고, Z는 N인 방법에 관한 것이다. 상기 염기성 시약은 상기 정의한 바와 같다. 바람직하게는, 상기 염기성 시약은 (저급 알크)옥사이드((저급 알킬)OM) 및 알코올성 용매를 포함한다. 바람직하게는, 상기 염기성 시약은 MeONa/MeOH, EtONa/EtOH, 또는 tBuOK/tBuOH이다. 가장 바람직하게는, 상기 염기성 시약은 tBuOK/tBuOH이다. 상기 입체선택적 커플링은 극성 비양성자성 용매, 비극성 용매 및 극성 용매 중의 하나 이상을 포함하는 용매 중에서 수행될 수 있다. 극성 비양성자성 용매의 예는 아세토니트릴, 디메틸설폭사이드, N,N-디메틸포름아미드, 헥사메틸포스포르아미드 등을 포함하지만 이에 한정되는 것은 아니다. 상기 입체선택적 커플링은 약 0℃ 내지 용매의 대략적인 환류 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다.
제7 구현예는 화학식 Ⅵ의 화합물에 관한 것이다.
화학식 Ⅵ
상기에서, R5, R6, R9 X 및 Z는 본 발명에서 상기 정의한 바와 같고, R11은 보호기이며, X"는 이탈기이다. 바람직하게는, R11은 벤조일 또는 치환된 벤조일이고, 보다 바람직하게는 R11은 4-클로로-벤조일이며, R5는 H이고, R6은 CH3이며, X는 F이고, X"는 Cl이며, R9는 NH2이고, Z는 N이다. 화학식 Ⅵ의 화합물은 정제되거나 정제되지 않을 수 있다. 화학식 Ⅵ의 화합물은 화학식 Ⅰ의 화합물 및 화학식 Ⅱ의 화합물을 제조하는데 유용하다.
상기 제7 구현예의 제1 측면은 화학식 Ⅵ의 화합물의 제조방법으로서, 상기 방법은
(a) 화학식 Ⅲ의 보호된 리보노락톤을 하이드라이드 환원제를 사용하여 입체선택적으로 환원시켜 화학식 Ⅳ의 베타-락톨 유도체를 제공하는 단계:
(b) 시약을 사용하여 상기 락톨 유도체를 입체선택적으로 전환시켜 화학식 Ⅴ의 아노머성 알파- 유도체를 수득하는 단계: 및
(c) 화학식 Ⅴ의 알파-유도체를 염기성 시약을 사용하여 퓨린 또는 유도체화 퓨린 염기와 입체선택적 커플링하여 화학식 Ⅵ의 베타-뉴클레오시드를 생성하는 단계를 포함한다.
상기에서, R5, R6, R9 및 Z는 상기 정의한 바와 같고, X' 및 X"는 각각 서로 독립적으로 이탈기이며, R11은 보호기이다.
상기 제7 구현예의 제2 측면은 R5는 H이고, R6은 CH3이며, R9는 NH2이고, R11은 보호기이며, 바람직하게는 R11은 벤조일 또는 치환된 벤조일이고, 보다 바람직하게는 R11은 4-클로로-벤조일이며, X는 F이고, X'는 Br이며, X"는 Cl이고, Z는 N인 화학식 Ⅵ의 화합물의 제조방법에 관한 것이다. 입체선택성 환원은 테트라하이드로푸란(THF) 또는 디에틸 에테르를 포함하는 용매 중에서 사용될 수 있고, 바람직하게는 상기 용매는 약 (-78℃) 내지 약 25℃ 범위의 온도에서, 바람직하게는 약 (-78℃) 내지 약 0℃ 범위의 온도에서, 가장 바람직하게는 약 (-30℃) 내지 약 0℃ 범위의 온도에서 THF이다. 상기 하이드라이드 환원제는 (tBuO)3AlH, 나트륨(비스(2-메톡시에톡시)(2,2,2-트리플루오로-에톡시)알루미늄 하이드라이드, 또는 Red-Al(나트륨 비스(2-메톡시에톡시)알루미늄 하이드라이드)이다. 상기 입체특이적 커플링은 극성 비양성자성 용매, 비극성 용매 및 극성 용매 중의 하나 이상을 포함하는 용매 중에서 수행될 수 있다. 극성 비양성자성 용매의 예는 아세토니트릴, 디메틸설폭사이드, N,N-디메틸포름아미드, 헥사메틸포스포르아미드 등을 포함하지만 이에 한정되는 것은 아니다. 상기 입체선택적 커플링은 약 0℃ 내지 용매의 대략적인 환류 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 염기성 시약은 상기 정의한 바와 같다. 바람직하게는, 상기 염기성 시약은 (저급 알크)옥사이드((저급 알킬)OM) 및 알코올성 용매를 포함한다. 바람직하게는, 상기 염기성 시약은 MeONa/MeOH, EtONa/EtOH, EtOK/EtOH, iPrONa/iPrOH, iPrOK/iPrOH, 또는 tBuOK/tBuOH이다. 가장 바람직하게는, 상기 염기성 시약은 tBuOK/tBuOH이다.
상기 제7 구현예의 제3 측면은 화학식 Ⅵ의 화합물의 제조방법으로서, 상기 방법은
(a) 화학식 Ⅲ의 보호된 리보노락톤을 하이드라이드 환원제를 사용하여 입체선택적으로 환원시켜 화학식 Ⅳ의 베타-락톨 유도체 및 화학식 Ⅳ-α의 알파-락톨 유도체를 포함하는 혼합물을 제공하는 단계:
(b) 화학식 Ⅳ의 베타-락톨 유도체 및 화학식 Ⅳ-α의 알파-락톨 유도체를 포함하는 혼합물로부터 화학식 Ⅳ의 베타-락톨 유도체를 결정화하는 단계:
(c) 화학식 Ⅳ의 락톨 유도체를 시약을 사용하여 입체선택적으로 전환시켜 화학식 Ⅴ의 아노머성 알파-유도체를 수득하는 단계: 및
(d) 화학식 Ⅴ의 알파-유도체를 염기성 시약을 사용하여 퓨린 또는 유도체화 퓨린 염기와 입체선택적 커플링하여 화학식 Ⅵ의 베타-뉴클레오시드를 생성하는 단계를 포함한다.
상기에서, R5, R6, R9, X 및 Z는 상기 정의한 바와 같고, X' 및 X"는 각각 서로 독립적으로 이탈기이며, R11은 보호기이다. 바람직하게는, R5는 H이고, R6은 CH3이며, R11은 벤조일 또는 치환된 벤조일(바람직하게는, R11은 4-클로로-벤조일이다)이고, X는 F이며, X'는 Br이고, X"는 Cl이며, Z는 N이고, R9는 NH2이다. 상기 하이드라이드 환원제는 (tBuO)3AlH, 나트륨(비스(2-메톡시에톡시)(2,2,2-트리플루오로-에톡시)알루미늄 하이드라이드, 또는 Red-Al(나트륨 비스(2-메톡시에톡시)알루미늄 하이드라이드)이다. 상기 입체선택적 환원은 테트라하이드로푸란(THF) 또는 디에틸 에테르를 포함하는 용매 중에서 수행될 수 있으며, 바람직하게는 상기 용매는 약 (-78℃) 내지 약 25℃ 범위의 온도에서, 바람직하게는 약 (-78℃) 내지 약 0℃ 범위의 온도에서, 가장 바람직하게는 약 (-30℃) 내지 약 0℃ 범위의 온도에서 THF이다. 상기 결정화는 상기 혼합물에 베타-락톨 유도체의 시드 결정(seed crystal)을 첨가한 다음, 베타-락톨 유도체의 시드 결정을 포함하는 혼합물을 약 25℃ 내지 약 80℃, 바람직하게는 약 50℃의 온도에서 (약 0.2 mmHg)으로 또는 진공dml ehdlq없이 가열하는 단계를 포함하는 방법에 의해 일어난다. 상기 입체특이적 커플링은 극성 비양성자성 용매, 비극성 용매 및 극성 용매 중의 하나 이상을 포함하는 용매 중에서 수행될 수 있다. 극성 비양성자성 용매의 예는 아세토니트릴, 디메틸설폭사이드, N,N-디메틸포름아미드, 헥사메틸포스포르아미드 등을 포함하지만 이에 한정되는 것은 아니다. 상기 입체선택적 커플링은 약 0℃ 내지 용매의 대략적인 환류 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 염기성 시약은 상기 정의한 바와 같다. 바람직하게는, 상기 염기성 시약은 (저급 알크)옥사이드((저급 알킬)OM) 및 알코올성 용매를 포함한다. 바람직하게는, 상기 염기성 시약은 MeONa/MeOH, EtONa/EtOH, EtOK/EtOH, iPrONa/iPrOH, iPrOK/iPrOH, 또는 tBuOK/tBuOH이다. 가장 바람직하게는, 상기 염기성 시약은 tBuOK/tBuOH이다.
제8 구현예는 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이나 제1 구현예 및 제2 구현예의 측면들 중의 어느 한 측면에서 언급된 임의의 화합물의 제조방법에 관한 것으로서,
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ의 6-치환된 뉴클레오시드를 생성하는 단계: 및
화학식 Ⅶ의 6-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 생성시키는 단계를 포함한다.
상기에서, R5, R6, R9, X 및 Z는 상기 정의한 바와 같고, R11은 보호기이며, X"는 이탈기이다.
상기 제8 구현예의 제1 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 제조방법으로서, 상기 화학식 Ⅵ의 화합물, 화학식 Ⅶ의 화합물 또는 화학식 Ⅷ의 화합물에 있어서, R5는 H이고, R6은 CH3이며, R8은 임의의 하나의 -OMe, -OEt, -OiPr, -N(-CH2CH2CH2-)(아제티딘-1-일) 및 -OBn이고, R9는 NH2이며, R11은 보호기(바람직하게는 벤조일 또는 치환된 벤조일이고, 보다 바람직하게는 4-클로르-벤조일)이고, X는 F이며, X"는 Cl이고, Z는 N이다. 상기 친핵성 시약은 상기 정의한 바와 같다. 바람직하게는, 상기 친핵성 시약은 임의의 하나의 -OMe, -OEt, -OiPr, -N(-CH2CH2CH2-)(아제티딘-1-일) 및 -OBn인 R8을 제공하는 것이다. 상기 반응은 극성 비양성자성 용매, 비극성 용매 및 극성 용매 중의 하나 이상을 포함하는 하나 이상의 용매 중에서 수행될 수 있다. 극성 용매의 예는 메탄올, 에탄올, t-부탄올 및 벤질 알코올을 포함하지만 이에 한정되는 것은 아니다. 극성 비양성자성 용매의 예는 아세토니트릴, 디메틸설폭사이드, N,N-디메틸포름아미드, 헥사메틸포스포르아미드 등을 포함하지만 이에 한정되는 것은 아니다. 상기 반응은 약 0℃ 내지 하나 이상의 용매의 대략적인 환류 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술된 바와 같이 일어날 수 있다.
상기 제8 구현예의 제2 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 제조방법으로서,
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ의 6-치환된 뉴클레오시드를 생성하는 단계: 및
화학식 Ⅶ의 6-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 생성시키는 단계를 포함한다.
상기 화학식 Ⅵ의 화합물, 화학식 Ⅶ의 화합물 또는 화학식 Ⅷ의 화합물에 있어서, R5는 H이고, R6은 CH3이며, R8은 -OMe이고, R9는 NH2이며, R11은 보호기(바람직하게는, 벤조일 또는 치환된 벤조일이다)이고, X는 F이며, X"는 Cl이고, Z는 N이다(하기 화합물(7) 참조). 상기 친핵성 시약은 MeONa/MeOH이다. 상기 반응은 메탄올을 포함하는 용매 중에서 수행될 수 있다. 상기 반응은 약 0℃ 내지 약 65℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 65℃ 범위이거나, 다른 한편으로는 실온보다 높은 온도 내지 상기 알코올성 용매/시약의 비점의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술한 바와 같이 일어날 수 있다.
상기 제8 구현예의 제3 측면은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 제조방법으로서,
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ의 6-치환된 뉴클레오시드를 생성하는 단계: 및
화학식 Ⅶ의 6-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 생성시키는 단계를 포함한다.
상기 화학식 Ⅵ의 화합물, 화학식 Ⅶ의 화합물 또는 화학식 Ⅷ의 화합물에 있어서, R5는 H이고, R6은 CH3이며, R8은 -OEt이고, R9는 NH2이며, R11은 보호기(바람직하게는, 벤조일 또는 치환된 벤조일이다)이고, X는 F이며, X"는 Cl이고, Z는 N이다(하기 화합물(10) 참조). 상기 친핵성 시약은 상기 정의한 바와 같다. 상기 친핵성 시약이 KOEt/EtOH인 경우, 상기 친핵성 시약은 EtOH를 탄산칼륨과 같은 염기와 반응시킴으로써 인시투(in situ)로 제조할 수 있다. 상기 반응은 에탄올 중에서 약 0℃ 내지 약 78℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 78℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술한 바와 같이 일어날 수 있다.
상기 제8 구현예의 제4 측면은 화학식 Ⅰ 또는 화학식 Ⅱ의 화합물의 제조방법으로서,
화학식 Ⅵ의 베타-뉴클레오시드 유도체 Ⅵ을 친핵성 시약과 반응시켜 화학식 Ⅶ의 6-치환된 뉴클레오시드를 생성시키는 단계; 및
화학식 Ⅶ의 6-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 생성시키는 단계를 포함한다.
상기 화학식 Ⅵ의 화합물, 화학식 Ⅶ의 화합물 또는 화학식 Ⅷ의 화합물에 있어서, R5는 H이고, R6은 CH3이며, R8은 -OBn이고, R11은 보호기(바람직하게는 벤조일 또는 치환된 벤조일)이며, X는 F이고, X"는 Cl이며, Z는 N이다(하기 화합물(9) 참조). 상기 친핵성 시약은 BnONa/BnOH이고, 여기서 BnONa는 벤질 알코올을 N,N-디메틸 포름아미드 용액 중에서 얼음 욕조(약 0℃)를 사용하여 달성된 온도에서 수소화나트륨과 반응시키는 단계를 포함하는 방법에 의해 수득된다. 상기 반응은 벤질 알코올을 포함하는 용매 중에서 수행될 수 있다. 상기 반응은 약 0℃ 내지 약 75℃범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 65℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술한 바와 같이 일어날 수 있다.
상기 제8 구현예의 제5 측면은 화학식 Ⅰ 또는 화학식 Ⅱ의 화합물의 제조방법으로서,
화학식 Ⅵ의 베타-뉴클레오시드 유도체 Ⅵ을 친핵성 시약과 반응시켜 화학식 Ⅶ의 6-치환된 뉴클레오시드를 생성시키는 단계; 및
화학식 Ⅶ의 6-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 생성시키는 단계를 포함한다.
상기 화학식 Ⅵ의 화합물, 화학식 Ⅶ의 화합물 또는 화학식 Ⅷ의 화합물에 있어서, R5는 H이고, R6은 CH3이며, R8은 -N(-CH2CH2CH2-)(아제티딘-1-일)이고, R9는 NH2이며, R11은 보호기(바람직하게는 벤조일 또는 치환된 벤조일)이고, X는 F이며, X"는 Cl이고, Z는 N이다(하기 화합물(8) 참조). 상기 친핵성 시약은 아제티딘/트리에틸 아민이다. 상기 반응은 에탄올을 포함하는 용매 중에서 수행될 수 있다. 상기 반응은 약 0℃ 내지 약 78℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술한 바와 같이 일어날 수 있다.
제9 구현예는 화학식 Ⅷ의 화합물에 관한 것이다.
화학식 Ⅷ
상기 화학식 Ⅷ에 있어서, R5, R6, X, R8, R9 및 Z는 본 발명에서 상기 정의한 바와 같다. 바람직하게는, R5는 H이고, R6은 CH3이며, X는 F이고, R8은 -O(저급 알킬), -O(저급 사이클로알킬), -O(저급 알크아릴) 또는 질소 헤테로사이클이며, R9는 NH2이고, Z는 N이다. 보다 바람직하게는, R5는 H이고, R6은 CH3이며, X는 F이고, R8은 OMe, OEt, OiPr, OBn 및 N(-CH2CH2CH2-)(아제티딘-1-일) 중의 임의의 하나이며, R9는 NH2이고, Z는 N이다. 화학식 Ⅷ의 화합물은 정제되거나 정제되지 않을 수 있다. 바람직하게는, 화학식 Ⅷ의 화합물은 정제된다.
화학식 Ⅷ의 바람직한 화합물은 하기 화합물 7, 8, 9 및 10 중의 하나로 나타낸다(하기 참조).
상기에서, R5는 H이고, R6은 CH3이며, X는 F이고, Z는 N이며, R9는 NH2이다. 화학식 Ⅷ의 화합물은 화학식 Ⅰ의 화합물 및 화학식 Ⅱ의 화합물을 제조하는데 유용하다.
제10 구현예는 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 화학식 Ⅰ의 화합물로 전환시키거나 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 화학식 Ⅱ의 화합물로 전환시키는 단계를 포함하는 방법에 관한 것이다. 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 화학식 Ⅰ의 화합물로 전환시키는 과정은 본 발명뿐만 아니라 2008년 3월 21일자로 출원된 미국 특허 출원 제12/053,015호(또한, WO2008/121634 참조)에도 기재되어 있다. 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 화학식 Ⅱ의 화합물로 전환시키는 과정 또한 본 발명뿐만 아니라 2008년 6월 11일자로 출원된 미국 가특허 출원 제61/060,683호에도 기재되어 있다.
상기 제10 구현예의 제1 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 P(Ⅲ)-시약 또는 P(Ⅴ)-시약과 반응시키는 단계를 포함하는 화학식 Ⅱ의 제조방법에 관한 것이다.
상기 제10 구현예의 제2 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 P(Ⅲ)-시약과 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함한다)를 포함하는 화학식 Ⅱ의 제조방법에 관한 것이다.
상기 제10 구현예의 제3 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 활성제 시약의 존재하에 P(Ⅲ)-시약과 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함한다)를 포함하는 화학식 Ⅱ의 제조방법에 관한 것이다.
상기 제10 구현예의 제4 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 활성제 시약의 존재하에 P(Ⅲ)-시약과 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함한다) 및 화학식 Ⅱ의 화합물의 포스파이트 유도체를 평형을 이루게 하여 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 제공하는 단계를 포함하는 화학식 Ⅱ의 제조방법에 관한 것이다.
상기 제10 구현예의 제5 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 4,5-디시아노이미다졸의 존재하에 R7OP[N(iPr)2]2와 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함하고, R5, R6, R7, R8, R9, X 및 Z는 본 발명에서 정의한 바와 같다): 및
화학식 Ⅱ의 화합물의 포스파이트 유도체를 평형을 이루게 하여 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 제공하는 단계를 포함하는 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체의 제조방법에 관한 것이다.
상기 제10 구현예의 제6 측면은 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 산화시켜 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체 Ⅱ를 수득하는 단계를 추가로 포함하는 상기 제5 측면에 관한 것이다.
상기 제10 구현예의 제7 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 4,5-디시아노이미다졸의 존재하에 R7OP[N(iPr)2]2와 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함하고, R5는 H이고, R6은 CH3이고, X는 F이고, Z는 N이고, R9는 NH2이고, R7 및 R8은 본 발명에서 정의한 바와 같다): 및
화학식 Ⅱ의 화합물의 포스파이트 유도체를 평형을 이루게 하여 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 제공하는 단계를 포함하는 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체의 제조방법에 관한 것이다.
상기 제10 구현예의 제8 측면은 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 산화시켜 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체 Ⅱ를 수득하는 단계를 추가로 포함하는 상기 제7 측면에 관한 것이다.
상기 제10 구현예의 제9 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 4,5-디시아노이미다졸의 존재하에 R7OP[N(iPr)2]2와 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함하고, R5는 H이고, R6은 CH3이고, R7은 Me, iPr, cBu 또는 cPn이고, R8은 OMe, OEt 또는 OiPr이고, R9는 NH2이고, X는 F이고, Z는 N이다): 및
화학식 Ⅱ의 화합물의 포스파이트 유도체를 평형을 이루게 하여 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 제공하는 단계를 포함하는 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체의 제조방법에 관한 것이다.
상기 제10 구현예의 제10 측면은 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 산화시켜 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체 Ⅱ를 수득하는 단계를 추가로 포함하는 상기 제9 측면에 관한 것이다.
상기 제10 구현예의 제11 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 4,5-디시아노이미다졸의 존재하에 iPrOP[N(iPr)2]2와 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함하고, R5는 H이고, R6은 CH3이고, R7은 Me, iPr, cBu 또는 cPn이고, R8은 OMe, OEt 또는 OiPr이고, R9는 NH2이고, X는 F이고, Z는 N이다): 및
화학식 Ⅱ의 화합물의 포스파이트 유도체를 평형을 이루게 하여 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 제공하는 단계를 포함하는 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체의 제조방법에 관한 것이다.
상기 제10 구현예의 제12 측면은 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 산화시켜 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체 Ⅱ를 수득하는 단계를 추가로 포함하는 상기 제11 측면에 관한 것이다.
상기 제10 구현예의 제13 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드를 4,5-디시아노이미다졸의 존재하에 iPrOP[N(iPr)2]2와 반응시켜 화학식 Ⅱ의 화합물의 포스파이트 유도체를 수득하는 단계(여기서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 이성체들의 혼합물을 포함하고, R5는 H이고, R6은 CH3이고, R7은 Me, iPr, cBu 또는 cPn이고, R8은 OMe, OEt 또는 OiPr이고, R9는 NH2이고, X는 F이고, Z는 N이다): 및
소정 온도에서 용액 중에서 화학식 Ⅱ의 화합물의 포스파이트 유도체를 평형을 이루게 하여 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 수득하는 단계를 포함하는 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체의 제조방법에 관한 것이다. 상기 언급된 용액은 극성 용매, 비극성 용매 및 이들의 혼합물을 포함한다. 극성 용매의 예는 물, 디메틸설폭사이드, N,N-디메틸포름아미드, 헥사메틸포스포르아미데이트, 아세토니트릴, 에틸 아세테이트, 테트라하이드로푸란 등 및 이들의 혼합물을 포함하지만 이에 한정되는 것은 아니다. 비극성 용매의 예는 헥산, 헵탄, 벤젠, 톨루엔, 메틸렌 클로라이드, 클로로포름 등 및 이들의 혼합물을 포함하지만 이에 한정되는 것은 아니다. 상기 온도는 상기 용액에 대해 수득할 수 있는 모든 온도 범위에 걸쳐서 가변적일 수 있으며, 상기 용액이 동결로 인해 고화되지 않는 온도 범위, 상기 용액이 비등으로 인해 증발하지 않는 온도 범위 또는 상기 용액 성분이 분해되지 않는 온도 범위를 포함한다. 상기 용액의 온도는 화학식 Ⅱ의 화합물의 포스파이트 유도체의 이성체들의 혼합물의 평형 지점을 기준으로 하여 실험적으로 결정된다. 예를 들면, 시스 이성체가 바람직한 경우, 바람직한 온도 또는 온도 범위는 시스-이성체 대 트랜스-이성체의 몰(또는 몰당) 비가 허용 가능한 최대값인 온도 또는 온도 범위이다.
상기 제10 구현예의 제14 측면은 선택적으로 상기 평형 혼합물을 고체로서 단리시키고 유기 용매를 포함하는 용액 중의 화학식 Ⅱ의 화합물의 포스파이트 이성체 유도체의 평형 혼합물을 산화제와 접촉시켜 하기 나타낸 바와 같은 3',5'-사이클릭 포스페이트 유도체를 수득하는 단계를 추가로 포함하는 상기 제11 측면에 관한 것이다.
바람직한 측면에서, 화학식 Ⅱ의 화합물의 포스파이트 유도체에 대한 산화제의 몰 비는 약 0.9 내지 약 1.5, 바람직하게는 0.9 내지 약 1.2, 보다 바람직하게는 약 0.9 내지 약 1.1이고, 가장 바람직하게는 화학식 Ⅱ의 화합물의 포스파이트 유도체에 대한 산화제의 몰 비는 약 1이다. 바람직한 측면에서, 상기 용액은 테트라하이드로푸란("THF")을 포함하고, 상기 산화제는 요오드(I2)를 포함한다. 바람직한 제1 측면에서, 상기 용액은 THF, 피리딘("pyr"), 및 물을 화학식 Ⅱ의 화합물의 포스파이트 유도체에 대해 약 1몰당량 이상의 양으로 포함한다. 바람직한 제2 측면에서, 상기 용액은 약 60v/v% 내지 약 80v/v%의 THF 및 약 39v/v% 내지 약 17v/v%의 피리딘, 및 약 1v/v% 내지 약 3v/v의 물을 포함하며, 단 상기 물의 양은 화학식 Ⅱ의 화합물의 포스파이트 유도체에 대해 약 1몰당량 이상의 양이다. 바람직한 제2 측면에서, 상기 용액은 약 65v/v% 내지 약 75v/v%의 THF 및 약 34v/v% 내지 약 22v/v%의 피리딘, 및 약 1v/v% 내지 약 3v/v의 물을 포함하며, 단 상기 물의 양은 화학식 Ⅱ의 화합물의 포스파이트 유도체에 대해 약 1몰당량 이상의 양이다. 바람직한 제3 측면에서, 상기 용액은 약 70v/v%의 THF 및 약 28v/v%의 피리딘, 및 약 2v/v%의 물을 포함하며, 단 상기 물의 양은 화학식 Ⅱ의 화합물의 포스파이트 유도체에 대해 약 1몰당량 이상의 양이다.
상기 제10 구현예의 제15 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 P(Ⅴ)-시약과 반응시키는 단계를 포함하는 화학식 Ⅱ의 화합물의 제조방법에 관한 것이다.
상기 제10 구현예의 제16 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 P(Ⅴ)-시약 및 아민 시약과 반응시키는 단계를 포함하는 화학식 Ⅱ의 화합물의 제조방법에 관한 것이다.
상기 제10 구현예의 제17 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 P(O)(Lv)3, R7OP(O)(Lv)2, R7OP(O)(Lv)(N(C1 -6 알킬)2) 및 R7OP(O)[N(C1 -6 알킬)2]2로부터 선택된 P(Ⅴ)-시약 및 아민 시약과 반응시키는 단계를 포함하는 화학식 Ⅱ의 화합물의 제조방법에 관한 것이다.
상기 제10 구현예의 제18 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 R7OP(O)(Lv)2 및 아민 시약과 반응시키는 단계를 포함하는 화학식 Ⅱ의 화합물의 제조방법에 관한 것이다.
상기 제10 구현예의 제19 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 R7OP(O)(Lv)2 및 아민 시약과 반응시키는 단계를 포함하는 화학식 Ⅱ의 화합물의 제조방법으로서, R5은 H이고, R6은 CH3이며, R7은 Me, iPr, cBu, 또는 cPn이고, R8은 OMe, OEt, 또는 OiPr이며, R9는 NH2이고, X는 F이며, Z는 N인 방법에 관한 것이다.
상기 제10 구현예의 제20 측면은 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 R7OP(O)(Lv)2 및 아민 시약과 반응시키는 단계를 포함하는 화학식 Ⅱ의 화합물의 3',5'-사이클릭 포스페이트 유도체의 제조방법으로서, R5는 H이고, R6은 CH3이며, R7은 Me, iPr, cBu, 또는 cPn이고, R8은 OMe, OEt, 또는 OiPr이며, R9는 NH2이고, X는 F이며, Z는 N이고, Lv는 Cl이며, 상기 아민 시약은 트리에틸 아민 및 N-메틸이미다졸을 포함하는 방법에 관한 것이다.
제10 구현예는 하기 화학식으로 나타낸 화학식 Ⅱ의 화합물의 포스파이트 유도체에 관한 것이다.
상기 화학식 Ⅱ의 화합물의 포스파이트 유도체에 있어서, R5, R6, R7, R8, R9, X 및 Z는 상기 정의한 바와 같다. 바람직한 측면에서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 R5는 H이고, R6은 CH3이며, R7은 저급 알킬 또는 저급 사이클로알킬이고, R8은 -O(저급 알킬), -O(저급 사이클로알킬), 또는 -OBn이며, R9는 NH2이고, X는 F이며, Z가 N이다. 추가적인 바람직한 측면에서, 화학식 Ⅱ의 화합물의 포스파이트 유도체는 R5는 H이고, R6은 CH3이며, R7은 Me, iPr, cBu, 또는 cPn이고, R8은 OMe, OEt, 또는 OiPr이며, R9는 NH2이고, X는 F이며, Z가 N이다.
제11 구현예는 R8이 둘 다 OH인 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 제조방법에 관한 것으로서, 상기 방법은
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 전환시켜 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드 또는 화학식 Ⅱ'의 6-X"'-사이클릭 포스페이트 뉴클레오티드를 수득하는 단계: 및
화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드 또는 화학식 Ⅱ'의 6-X"'-사이클릭 포스페이트 뉴클레오티드를 화학식 Ⅰ의 포스포르아미데이트 뉴클레오시드(여기서, R8 = OH) 또는 화학식 Ⅱ의 사이클릭 포스페이트 뉴클레오티드(여기서, R8 = OH)로 전환시키는 단계를 포함하다.
상기 화학식 Ⅵ, Ⅶ', Ⅸ, Ⅰ' 또는 Ⅱ'의 화합물에 있어서, R1, R2, R3a, R3b, R4, R5, R6, R7, R9, X 및 Z는 본 발명에서 정의한 바와 같고, R11은 보호기(바람직하게는 벤조일 또는 4-클로로-벤조일이고, 보다 바람직하게는 4-클로로-벤조일이다)이며, X"는 이탈기이고, X""는 OH로 전환될 수 있는 기이다.
상기 제11 구현예의 제1 측면은 R8이 OH인 화학식 Ⅰ의 화합물의 제조방법에 관한 것으로서, 상기 방법은
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 전환시켜 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 수득하는 단계: 및
화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 화학식 Ⅰ의 포스포르아미데이트 뉴클레오시드(여기서, R8 = OH)로 전환시키는 단계를 포함한다.
상기 화학식 Ⅵ, Ⅶ', Ⅸ, Ⅰ' 또는 Ⅱ'의 화합물에 있어서, R1, R2, R3a, R3b, R4, R5, R6, R7, R9, X 및 Z는 본 발명에서 정의한 바와 같고, R11은 보호기(바람직하게는 벤조일 또는 4-클로로-벤조일이고, 보다 바람직하게는 4-클로로-벤조일이다)이며, X"는 이탈기이고, X""는 OH로 전환될 수 있는 기이며;
상기 반응은 에탄올을 포함하는 용매 중에서 약 0℃ 내지 약 78℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술된 바와 같이 일어날 수 있다.
상기 제11 구현예의 제2 측면은 R8이 OH인 화학식 Ⅰ의 화합물의 제조방법에 관한 것으로서, 상기 방법은
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 전환시켜 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 수득하는 단계: 및
화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 화학식 Ⅰ의 포스포르아미데이트 뉴클레오시드(여기서, R8 = OH)로 전환시키는 단계를 포함한다.
상기 화학식 Ⅵ, Ⅶ', Ⅸ, Ⅰ' 또는 Ⅱ'의 화합물에 있어서, R1, R2, R3a, R3b, R4, R5, R6, R7, R9, X 및 Z는 본 발명에서 정의한 바와 같고, R11은 보호기(바람직하게는 벤조일 또는 4-클로로-벤조일이고, 보다 바람직하게는 4-클로로-벤조일이다)이며, X"는 이탈기이고, X""는 OH로 전환될 수 있는 기이고;
상기 반응은 에탄올을 포함하는 용매 중에서 약 0℃ 내지 약 78℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. OH로 전환될 수 있는 기(X"')는 -OBn, -O-실릴 또는 -O-알릴이다. 탈보호는 본 발명에 기술된 바와 같이 일어날 수 있다.
상기 제11 구현예의 제3 측면은 R8이 OH인 화학식 Ⅰ의 화합물의 제조방법에 관한 것이며, 상기 방법은
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 전환시켜 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 수득하는 단계: 및
화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 화학식 Ⅰ의 포스포르아미데이트 뉴클레오시드(여기서, R8 = OH)로 전환시키는 단계를 포함한다.
상기 화학식 Ⅵ, Ⅶ', Ⅸ, Ⅰ' 또는 Ⅱ'의 화합물에 있어서, R1은 페닐이고, R2는 수소이며, R3a는 수소이고, R3b는 CH3이며, R4는 -저급 알킬 또는 -저급 사이클로알킬이고, R5는 H이며, R6은 CH3이고, R9는 NH2이며, R11은 보호기(바람직하게는, 벤조일 또는 4-클로로 벤조일)이고, X는 F이며, X"는 Cl이고, X"'는 -OBn, -O-실릴, 또는 -O-알릴이고, Z는 N이며;
상기 반응은 에탄올을 포함하는 용매 중에서 약 0℃ 내지 약 78℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. OH로 전환될 수 있는 기(X"')는 -OBn, -O-실릴 또는 -O-알릴이다. 탈보호는 본 발명에 기술된 바와 같이 일어날 수 있다.
상기 제11 구현예의 제4 측면은 R8이 OH인 화학식 Ⅰ의 화합물의 제조방법에 관한 것으로서, 상기 방법은
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드(여기서, X"'는 OH로 전환될 수 있는 기이다)를 생성시키는 단계:
화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 전환시켜 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 수득하는 단계: 및
화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 화학식 Ⅰ의 포스포르아미데이트 뉴클레오시드(여기서, R8 = OH)로 전환시키는 단계를 포함한다.
상기 화학식 Ⅵ, Ⅶ', Ⅸ, Ⅰ' 또는 Ⅱ'의 화합물에 있어서, R1은 페닐이고, R2는 수소이며, R3a는 수소이고, R3b는 CH3이며, R4는 -저급 알킬 또는 -저급 사이클로알킬이고, R5는 H이며, R6은 CH3이고, R9는 NH2이며, R11은 보호기(바람직하게는, 벤조일 또는 4-클로로 벤조일)이고, X는 F이며, X"는 Cl이고, X"'는 -OBn 또는 -O-알릴이며, Z는 N이고;
상기 반응은 에탄올을 포함하는 용매 중에서 약 0℃ 내지 약 78℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술된 바와 같이 일어날 수 있다.
상기 제11 구현예의 제5 측면은 R8이 OH인 화학식 Ⅰ의 화합물의 제조방법에 관한 것으로서, 상기 방법은
화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드(여기서, X"'는 OH로 전환될 수 있는 기이다)를 생성시키는 단계:
화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계:
화학식 Ⅸ의 6-X"'-치환된 뉴클레오시드를 전환시켜 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 수득하는 단계: 및
화학식 Ⅰ'의 6-X"'-포스포르아미데이트 뉴클레오시드를 화학식 Ⅰ의 포스포르아미데이트 뉴클레오시드(여기서, R8 = OH)로 전환시키는 단계를 포함한다.
상기 화학식 Ⅵ, Ⅶ', Ⅸ, Ⅰ' 또는 Ⅱ'의 화합물에 있어서, R1은 페닐이고, R2는 수소이며, R3a는 수소이고, R3b는 CH3이며, R4는 -Me, -Et, -nPr, -iPr, -cPn 또는 cHx이고, R5는 H이며, R6은 CH3이고, R9는 NH2이며, R11은 보호기(바람직하게는, 벤조일 또는 4-클로로 벤조일)이고, X는 F이며, X"는 Cl이고, X"'는 -OBn 또는 -O-알릴이고, Z는 N이며;
상기 반응은 에탄올을 포함하는 용매 중에서 약 0℃ 내지 약 78℃ 범위의 온도에서 수행될 수 있다. 바람직하게는, 상기 온도는 약 25℃ 내지 약 75℃의 범위이다. 보다 바람직하게는, 상기 온도는 약 40℃ 내지 약 60℃의 범위이다. 가장 바람직하게는, 상기 온도는 약 50℃이다. 상기 탈보호는 본 발명에 기술된 바와 같이 일어날 수 있다.
제12 구현예는 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 제조방법에 관한 것으로서, 상기 방법은
(a-1) 화학식 Ⅲ의 보호된 리보노락톤을 하이드라이드 환원제를 사용하여 입체선택적으로 환원시켜 화학식 Ⅳ의 베타-락톨 유도체를 제공하는 단계;
화학식 Ⅲ
화학식 Ⅳ
(b-1) 화학식 Ⅳ의 락톨 유도체를 시약을 사용하여 입체선택적으로 전환시켜 화학식 Ⅴ의 아노머성 알파-유도체를 수득하는 단계;
화학식 Ⅴ
(c-1) 화학식 Ⅴ의 아노머성 알파-유도체를 염기성 시약을 사용하여 퓨린 염기 또는 유도체화 퓨린 염기와 입체선택적으로 커플링시켜 화학식 Ⅵ의 베타-뉴클레오시드 유도체를 생성시키는 단계;
화학식 Ⅵ
(d-1) 화학식 Ⅵ의 베타-뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ의 6-치환된 뉴클레오시드를 생성시키는 단계;
화학식 Ⅶ
(e-1) 화학식 Ⅶ의 6-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 생성시키는 단계;
화학식 Ⅷ
(f-1) 화학식 Ⅷ의 유리 퓨린 뉴클레오티드 유도체를 그의 상응하는 화학식 Ⅰ의 5'-포스포르아미데이트로 전환시키는 단계; 또는
(g-1) 화학식 Ⅷ의 유리 퓨린 뉴클레오티드 유도체를 그의 상응하는 화학식 Ⅱ의 3',5'-사이클릭 포스페이트 유도체로 전환시키는 단계를 포함하거나,
(d-2) 상기 단계(c-1)에서 수득한 화학식 Ⅵ의 베타 뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅷ의 유리 퓨린 뉴클레오시드 유도체를 수득하는 단계; 및
화학식 Ⅷ
(f-2) 화학식 Ⅷ의 유리 퓨린 뉴클레오티드 유도체를 그의 상응하는 화학식 Ⅰ의 5'-포스포르아미데이트로 전환시키는 단계; 또는
(g-2) 화학식 Ⅷ의 유리 퓨린 뉴클레오티드 유도체를 그의 상응하는 화학식 Ⅱ의 3',5'-사이클릭 포스페이트 유도체로 전환시키는 단계를 포함하거나,
R8이 둘 다 OH인 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물을 제조하기 위한 다른 방법에서,
(d-3) 상기 단계(c-1)에서 수득한 화학식 Ⅵ의 베타 뉴클레오시드 유도체를 친핵성 시약과 반응시켜 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 수득하는 단계;
화학식 Ⅶ'
(h-3) 화학식 Ⅶ'의 6-X"'-치환된 뉴클레오시드를 탈보호시켜 화학식 Ⅷ'의 6-X"'-치환된 뉴클레오시드를 생성시키는 단계;
화학식 Ⅷ'
(i-3) 화학식 Ⅷ'의 6-X"'-치환된 뉴클레오시드를 전환시켜 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 또는 화학식 Ⅱ'의 6-X"'-사이클릭 포스페이트 뉴클레오티드를 생성시키는 단계; 및
화학식 Ⅰ'
화학식 Ⅱ'
(j-3) 화학식 Ⅰ'의 6-X"'-포스포르아미데이트 또는 화학식 Ⅱ'의 6-X"'-사이클릭 포스페이트 뉴클레오티드를 화학식 Ⅰ의 포스포르아미데이트(여기서, R8 = OH이다) 또는 화학식 Ⅱ의 사이클릭 포스페이트 뉴클레오티드로 전환시키는 단계를 포함한다.
상기에서, X'는 이탈기이고,
X"는 이탈기이며,
R11은 보호기이고,
X"'는 -OH로 전환될 수 있는 기이다.
이용 가능성
본 발명에 기재된 방법에 의해 제조된 화합물은 하기 바이러스 감염원(viral agent) 중의 어느 하나에 의해 감염된 결과인 임의의 증상을 치료하는데 유용하다: C형 간염 바이러스, 서나일 바이러스, 황열 바이러스, 뎅기 바이러스, 리노바이러스, 소아마비 바이러스, A형 간염 바이러스, 소 바이러스성 설사병 바이러스 및 일본 뇌염 바이러스.
투여량, 투여, 및 용도
제13 구현예에서, 본 발명은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물을 사용하여 상기 바이러스 감염원 중의 임의의 것을 치료 및/또는 예방하기 위한 조성물에 관한 것이다. 가능한 바이러스 감염원은 하기 예를 포함하지만 이에 한정되는 것은 아니다: C형 간염 바이러스, B형 간염 바이러스, A형 간염 바이러스, 서나일 바이러스, 황열 바이러스, 뎅기 바이러스, 리노바이러스, 소아마비 바이러스, 소 바이러스성 설사병 바이러스, 일본 뇌염 바이러스, 또는 페스티바이러스, 헤파시바이러스, 또는 플라바바이러스의 군에 속하는 바이러스.
제14 구현예에서, 화학식 Ⅰ의 바람직한 화합물은 화합물 11로 나타내며, 화학식 Ⅱ의 바람직한 화합물은 화합물 17, 보다 바람직하게는 RP-17로 나타낸다.
본 구현예의 한 측면은 부형제, 담체, 희석제 및 이에 상당하는 매질로부터 선택되는 약학적으로 허용되는 매질, 및 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물을 포함하는, 본 발명에 기재된 바이러스 감염원 중의 임의의 것을 치료하기 위한 조성물에 관한 것이다.
화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물은 독립적으로 다양한 경구 투여되는 제형 및 담체로 제형화될 수 있다. 경구 투여는 정제, 코팅된 정제, 경질 및 연질 젤라틴 캡슐, 용액, 에멀전, 시럽 또는 현탁액의 형태일 수 있다. 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물은 기타 투여 경로 중에서 좌제 투여에 의한 투여되는 경우 효율적이다. 가장 편리한 투여 방식은 상기 질환의 증세 및 항바이러스 약제에 대한 환자의 반응에 따라 조절될 수 있는 편리한 1일 투여 체계(regimen)를 사용하는 경구 투여이다.
화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물뿐만 아니라 이들의 약학적으로 허용되는 염은, 하나 이상의 통상적인 부형제, 담체 또는 희석제와 함께 약학적 조성물 및 단위 제형의 형태로 될 수 있다. 상기 약학적 조성물 및 단위 제형은 추가의 활성 화합물의 존재 또는 부재하에 통상적인 비율의 통상적인 성분들로 구성될 수 있으며, 상기 단위 제형은 사용될 의도하는 1일 투여량 범위에 상응하는 임의의 적합한 유효량의 활성 성분을 함유할 수 있다. 상기 약학적 조성물은 정제 또는 충전된 캡슐, 반고체, 분말, 서방성 제형물, 또는 현탁액, 에멀전과 같은 액체, 또는 경구용 충전된 캡슐로서 사용되거나 직장 또는 질 투여용 좌제 형태로 사용될 수 있다. 전형적인 제제는 약 5% 내지 약 95%의 활성 화합물 또는 화합물들(w/w)을 함유할 것이다.
화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물은 단독으로 투여될 수 있지만, 일반적으로는 의도하는 투여 경로 및 표준 약학적 실시에 관해 선택된 하나 이상의 적합한 약학적 부형제, 희석제 또는 담체와 혼합하여 투여될 것이다.
활성 성분의 약학적으로 허용되는 염 형태는 또한 비-염 형태가 존재하는 활성 성분에 바람직한 약동학적 특성을 초기에 부여할 수 있고, 체내 치료학적 활성에 대해서는 활성 성분의 약역학(pharmacodynamics)에 훨씬 긍정적인 영향을 미칠 수 있다.
고체 제형 제제는, 예를 들면, 분말, 정제, 알약, 캡슐, 좌제 및 분산성 과립을 포함한다. 고체 담체는 희석제, 방향제, 가용화제, 윤활제, 현탁제, 결합제, 방부제, 정제 붕해제, 또는 캡슐화 물질로서 작용할 수 있는 하나 이상의 물질일 수 있다. 분말에서, 상기 담체는 통상, 미분된 활성 성분과의 혼합물인 미분된 고체이다. 정제에서, 상기 활성 성분은 통상, 필요한 결합 용량을 적합한 비율로 갖는 담체와 혼합되어 목적하는 형태 및 크기로 압축된다. 적합한 담체는 탄산마그네슘, 마그네슘 스테아레이트, 활석, 당, 락토스, 펙틴, 덱스트린, 전분, 젤라틴, 트라가칸트, 메틸셀룰로오스, 나트륨 카르복시메틸 셀룰로오스, 저융점 왁스, 코코아 버터 등을 포함하지만 이에 한정되는 것은 아니다. 고체 제형 제제는 활성 성분 이외에 착색제, 방향제, 안정제, 완충제, 인공 및 천연 감미제, 분산제, 증점제, 가용화제 등을 함유할 수 있다. 고체 제형물의 예는 각각 인용에 의해 본 발명에 포함되는 EP0524579; US6,635,278; US2007/0099902; US7,060,294; US2006/0188570; US2007/0077295; US2004/0224917; US7,462,608; US2006/0057196; US6,267,985; US6,294,192; US6,569,463; US6,923,988; US2006/0034937; US6,383,471; US6,395,300; US6,645,528; US6,932,983; US2002/0142050; US2005/0048116; US2005/0058710; US2007/0026073; US2007/0059360; 및 US2008/0014228에 예시되어 있다.
액체 제형물은 또한 경구 투여에 적합하고 에멀전, 시럽, 엑릭시르 및 수성 현탁액을 포함하는 액체 제형물을 포함한다. 이들은 사용 직전 액체 형태의 제제로 전환되는 고체 형태의 제제를 포함한다. 액체 제형물의 예는 미국 특허 제3,994,974호; 제5,695,784호; 및 제6,977,257호에 예시되어 있다. 에멀전은 용액, 예를 들면, 수성 프로필렌 글리콜 용액으로 제조될 수 있거나 레시틴, 솔비탄 모노올레에이트 또는 아카시아와 같은 유화제를 함유할 수 있다. 수성 현탁액은 천연 또는 합성 검, 수지, 메틸 셀룰로오스, 나트륨 카르복시메틸셀룰로오스 및 다른 잘 알려진 현탁제와 같은 점성 물질을 함유하는 물 속에 미분된 활성 성분을 분산시킴으로써 제조될 수 있다.
화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물은 독립적으로 좌제로서 투여되도록 제형화될 수 있다. 지방산 글리세라이드와 코코아 버터의 혼합물과 같은 저융점 왁스는 처음에는 용융되고, 상기 활성 성분은, 예를 들면, 교반에 의해 균질하게 분산된다. 이어서, 용융된 균질한 혼합물을 편리한 크기의 주형에 붓고 냉각시킨 후 고형화시킨다.
화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물은 독립적으로 질 투여용으로 제형화될 수 있다. 상기 활성 성분 이외에 담체도 함유하는 페사리, 탐폰, 크림, 겔, 패이스트, 발포체 또는 스프레이가 적합한 것으로 본 기술분야에 공지되어 있다. 이들 제형물 중의 어떤 것은 살정자제가 존재하거나 부재하는 콘돔과 조합하여 사용될 수 있다.
약학적 담체, 희석제 및 부형제를 함께 함유하는 적합한 제형물은 인용에 의해 본 발명에 포함되는 문헌에 기재되어 있다(Remington: The Science 및 Practice of Pharmacy 1995, edited by E. W. Martin, Mack Publishing Company, 19th edition, Easton, Pennsylvania). 숙련된 제형 과학자는 본 명세서의 교시 내에서 상기 제형물을 개질시켜 상기 조성물의 치료학적 활성을 불안정하게 하거나 절충하지 않으면서 특정한 투여 경로에 맞는 무수한 제형물을 제공할 수 있다.
추가로, 상기 정제된 화학식 Ⅰ 또는 Ⅱ의 화합물은 독립적으로 리포좀 또는 미셀(micell)과 조합하여 제형화될 수 있다. 리포좀에 대하여, 상기 정제된 화합물은 각각 인용에 의해 본 발명에 포함되는 하기 미국 특허에 기재된 바와 같은 방식으로 제형화될 수 있는 것으로 고려된다: 미국 특허 제5,013,556호; 제5,213,804호; 제5,225,212호; 제5,891,468호; 제6,224,903호; 제6,180,134호; 제5,192,549호; 제5,316,771호; 제4,797,285호; 제5,376,380호; 제6,060,080호; 제6,132,763호; 제6,653,455호; 제6,680,068호; 제7,060,689호; 제7,070,801호; 제5,077,057호; 제5,277,914호; 제5,549,910호; 제5,567,434호; 제5,077,056호; 제5,154,930호; 제5,736,155호; 제5,827,533호; 제 5,882,679호; 제6,143,321호; 제6,200,598호; 제6,296,870호; 제6,726,925호; 및 제6,214,375호. 미셀에 대하여, 상기 정제된 화합물은 각각 인용에 의해 본 발명에 포함되는 미국 특허 제5,145,684호 및 제5,091,188호에 기재된 바와 같은 방식으로 제형화될 수 있는 것으로 고려된다.
제14 구현예는 하기 바이러스 감염원 중의 어느 하나에 의한 감염 결과인 임의의 증상을 치료하기 위한 약제의 제조에 있어서의 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물의 용도에 관한 것이다: C형 간염 바이러스, 서나일 바이러스, 황열 바이러스, 뎅기 바이러스, 리노바이러스, 소아마비 바이러스, A형 간염 바이러스, 소 바이러스성 설사병 바이러스 및 일본 뇌염 바이러스. 제14 구현예에서, 화학식 Ⅰ의 바람직한 화합물은 화합물 11로 나타내고, 화학식 Ⅱ의 바람직한 화합물은 화합물 17, 보다 바람직하게는 RP-17로 나타낸다.
용어 "약제"는 이를 필요로 하는 대상을 치료 및/또는 예방하는 방법에서 사용되는 물질을 의미하며, 상기 물질은 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물을 포함하는 조성물, 제형물, 제형 등을 포함하지만 이에 한정되는 것은 아니다. 본 발명에 기술된 항바이러스 증상 중의 임의의 증상을 치료하기 위해 단독으로 또는 다른 화합물과 조합하여 약제를 제조하는데 있어서 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물 중의 어느 한 화합물의 용도가 고려된다. 약제는 제13 구현예에서 고려된 조성물 중의 어느 하나를 포함하지만 이에 한정되는 것은 아니다.
제15 구현예는 치료학적 유효량의 화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물 중의 어느 한 화합물을 치료 및/또는 예방을 필요로 하는 대상에게 투여하는 단계를 포함하는 상기 대상을 치료 및/또는 예방하는 방법에 관한 것이다. 제15 구현예에서, 화학식 Ⅰ의 바람직한 화합물은 화합물 11로 나타내며, 화학식 Ⅱ의 바람직한 화합물은 화합물 17, 보다 바람직하게는 RP-17로 나타낸다.
이를 필요로 하는 대상은 C형 간염 바이러스, 서나일 바이러스, 황열 바이러스, 뎅기 바이러스, 리노바이러스, 소아마비 바이러스, A형 간염 바이러스, 소 바이러스성 설사병 바이러스 및 일본 뇌염 바이러스, 플라비비리대 바이러스, 페스티바이러스 또는 헤파시바이러스, 또는 상기 열거된 바이러스 중의 임의의 바이러스에 상응하거나 필적하는 징후를 유발하는 바이러스를 포함하지만 이에 한정되지는 않는, 본 발명에 기재된 바이러스 감염원 중의 어느 한 바이러스에 의한 감염의 결과인 어느 한 증상을 갖는 대상인 것을 의도한다.
용어 "대상"은 소, 돼지, 양, 닭, 칠면조, 버팔로, 라마, 타조, 개, 고양이 및 사람을 포함하지만 이에 한정되지는 않으며, 바람직하게는 상기 대상은 사람이다. 제15 구현예의 대상을 치료하는 방법에 있어서, 본 발명에서 고려되는 화합물 중의 어느 것이나 단독으로 또는 다른 화합물과 조합하여 사용될 수 있다.
본 발명에서 사용되는 용어 "치료학적 유효량"은 개인에서 질환의 징후를 감소시키는데 필요한 양을 의미한다. 상기 투여량은 각각의 특별한 경우에서 개인적인 요구에 맞춰 조정될 것이다. 상기 투여량은 치료되는 질환의 증세, 환자의 연령 및 일반적인 건강 상태, 환자가 치료받는 다른 약제, 투여 경로 및 제형, 및 관련 의학적 실시자의 선호도 및 경험과 같은 무수한 인자에 따라 좌우되는 광범위한 범위 내에서 변할 수 있다. 경구 투여의 경우, 하루에 약 0.001 내지 약 10g과 이러한 범위 사이의 모든 값, 예를 들면, 0.001g, 0.0025g, 0.005g, 0.0075g, 0.01g, 0.025g, 0.050g, 0.075g, 0.1g, 0.125g, 0.150g, 0.175g, 0.2g, 0.25g, 0.5g, 0.75g, 1g, 1.5g, 2g, 2.5g, 3g, 3.5g, 4g, 4.5g, 5g, 5.5g, 6g, 6.5g, 7g, 7.5g, 8g, 8.5g, 9g, 및 9.5g의 1일 투여량이 단독치료 및/또는 조합 치료에서 적절해야 한다. 특별한 1일 투여량은 하루에 약 0.01 내지 약 1g과 이러한 범위 사이의 0.01g(즉, 10㎎)씩 증가하는 모든 값이며, 바람직하게는 1일 투여량은 하루에 약 0.01 내지 약 0.8g, 보다 바람직하게는 약 0.01 내지 약 0.6g, 가장 바람직하게는 약 0.01 내지 약 0.25g이고, 이들은 각각 이들 범위 사이에 0.01g씩 증가하는 모든 값을 포함한다. 일반적으로, 치료는 상기 바이러스를 신속하게 감소시키거나 제거하기 위한 대량의 초기 "부하 투여량"으로 개시한 다음, 상기 투여량을 상기 감염의 재발을 방지하기에 충분한 농도로 감소시킨다. 본 발명에 기술된 질환을 치료하는데 있어서 통상적인 기술을 갖는 자는 과도한 실험을 하지 않으면서 개인적인 지식, 경험과 본 발명의 기재에 의존해서 소정의 질환 및 환자에 대한 화학식 Ⅰ의 화합물 또는 그의 염이나 화학식 Ⅱ의 화합물 또는 그의 염의 치료학적 유효량을 확정할 것이다.
치료학적 효율은 혈청 단백질(예: 알부민, 응고 인자, 알칼리성 포스파타제, 아미노트랜스퍼라제(예: 알라닌 트랜스아미나제, 아스파테이트 트랜스아미나제), 5'-뉴클레오시다제, γ-글루타미닐트레스펩티다제 등)와 같은 단백질 농도, 빌리루빈의 합성, 콜레스테롤의 합성, 담즙산의 합성을 포함하지만 이에 한정되지 않는 간 기능 시험; 탄수화물 대사작용, 아미노산 및 암모니아 대사작용을 포함하지만 이에 한정되지 않는 간 대사 기능 시험으로부터 확정될 수 있다. 다른 한편으로, 상기 치료학적 효율은 HCV-RNA를 측정함으로써 모니터될 수 있다. 이들 시험 결과는 상기 투여량이 최적화되게 할 것이다.
제15 구현예의 제1 측면은 치료학적 유효량의 화학식 Ⅰ의 화합물(바람직하게는 화합물 11) 또는 화학식 Ⅱ의 화합물(바람직하게는 화합물 17, 보다 바람직하게는 RP-17) 중의 어느 한 화합물과 치료학적 유효량의 다른 항바이러스제를 치료 및/또는 예방을 필요로 하는 대상에게 투여하는 단계를 포함하는 상기 대상을 치료 및/또는 예방하는 방법에 관한 것이며, 이때 상기 투여는 동시에 또는 교대로 투여된다. 교대 투여 사이의 시간은 1 내지 24시간의 범위일 수 있으며, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 및 23시간을 포함하는 이들 범위 사이의 하위 범위가 포함됨이 이해된다.
"또 다른 항바이러스제"의 예는 하기 예를 포함하지만 이에 한정되는 것은 아니다: HCV NS3 프로테아제 억제제(WO2008010921, WO2008010921, EP1881001, WO2007015824, WO2007014925, WO2007014926, WO2007014921, WO2007014920, WO2007014922, US2005267018, WO2005095403, WO2005037214, WO2004094452, US2003187018, WO200364456, WO2005028502 및 WO2003006490 참조); HCV NS5B 억제제(US2007275947, US20072759300, WO2007095269, WO2007092000, WO2007076034, WO200702602, US2005-98125, WO2006093801, US2006166964, WO2006065590, WO2006065335, US2006040927, US2006040890, WO2006020082, WO2006012078, WO2005123087, US2005154056, US2004229840, WO2004065367, WO2004003138, WO2004002977, WO2004002944, WO2004002940, WO2004000858, WO2003105770, WO2003010141, WO2002057425, WO2002057287, WO2005021568, WO2004041201, US20060293306, US20060194749, US20060241064, US6784166, WO2007088148, WO2007039142, WO2005103045, WO2007039145, WO2004096210 및 WO2003037895 참조); HCV NS4 억제제(WO2007070556 및 WO2005067900 참조); HCV NS5a 억제제(US2006276511, WO2006120252, WO2006120251, WO2006100310, WO2006035061 참조); 톨-유사 수용체(Toll-like receptor) 효능제(agonist)(WO2007093901 참조); 및 기타 억제제(WO2004035571, WO2004014852, WO2004014313, WO2004009020, WO2003101993, WO2000006529 참조); 및 2008년 3월 21일자로 출원된 미국 특허 출원 제12/053,015호(이의 내용은 인용에 의해 본 발명에 포함된다)에 기재된 화합물, 인터페론-α, 인터페론-β, 페길레이트화 인터페론-α, 리바비린, 레보비린, 비라미딘, 다른 뉴클레오시드 HCV 폴리머라제 억제제, HCV 비-뉴클레오시드 폴리머라제 억제제, HCV 프로테아제 억제제, HCV 헬리카제 억제제 또는 HCV 융합 억제제.
화학식 Ⅰ의 화합물 또는 화학식 Ⅱ의 화합물이 다른 항바이러스제와 조합하여 투여되는 경우, 상기 활성은 모 화합물에 비해 증가될 수 있다. 상기 치료가 조합 치료인 경우, 이러한 투여는 상기 뉴클레오시드 유도체의 투여와 동시에 또른 순차적으로 이루어질 수 있다. 따라서, 본 발명에서 사용되는 "동시 투여"는 상기 제제를 동시에 또는 상이한 시점에서 투여하는 것을 포함한다. 2개 이상의 제제를 동시에 투여하는 것은 2개 이상의 활성 성분을 함유하는 단일 제형물에 의해 달성되거나 단일 활성제를 갖는 2개 이상의 제형을 실질적으로 동시에 투여함으로써 달성될 수 있다.
본 발명에서 치료에 대한 언급은 기존 증상의 치료뿐만 아니라 예방에도 확장됨을 이해할 것이다. 추가로, 본 발명에서 사용되는 HCV 감염의 "치료"라는 용어는 또한 HCV 감염과 관련되거나 HCV 감염에 의해 매개되는 질환 또는 증상, 또는 그의 임상적 징후의 치료 또는 예방을 포함한다.
도 1은 RP-17에 대한 X-선 결정 구조(30% 확률 열 타원체를 갖는 ORTEP 도면)이다.
도 2는 RP-17의 XRD이다.
도 3은 RP-17의 FT-IR 스펙트럼이다.
도 2는 RP-17의 XRD이다.
도 3은 RP-17의 FT-IR 스펙트럼이다.
상기 기재된 구현예들은 하기 실시예를 고려하여 추가로 이해될 것이며, 하기 실시예는 단지 예시용일 뿐, 본 발명을 한정하지는 않는다.
2'-데옥시-2'-플루오로-2'-C-메틸 퓨린 뉴클레오시드 및 이들의 상응하는 뉴클레오티드 포스포르아미데이트를 제조하기 위한 수렴성 글리코실화 경로는 3,5-디-O-벤조일-2-데옥시-2-플루오로-2-C-메틸리보노락톤(1a)의 합성의 전개에 사용되었다(Chun, K.; Wang, P. 국제 특허 출원 WO2006/031725). 다른 일반적인 중간체는 4-클로로벤조일 동족체 1a이며, 이는 1a의 탈벤조일화에 의해 중간체 락톤 디올 1 a'를 형성한 다음, 4-클로로벤조일화되거나 4-클로로벤조일 클로라이드를 치환시킴으로써 바로 1 a'와 반응시킴으로써 생성될 수 있다. 3,5-디(4-클로로-벤조일화) 중간체의 이례적인 특징은 이들이 3,5-디(벤조일화) 중간체에 비해 보다 우수한 결정 특성을 갖는 경향이 있어서 크로마토그래피 이외의 다른 정제 수단을 제공한다는 점이다.
보르브루에겐형 루이스산 매개된 커플링과 3,5-디-O-벤조일-2-데옥시-2-플루오로-2-C-메틸리보노락톤의 리보노락톨 1-O-아세테이트를 사용하여 몇 차례 시도한 후, 매우 낮은 커플링 수율이 관찰되었으며, 바람직하지 않은 α-아노머가 주요한 생성물이었다. 리보노락톨(2a/2b)과의 미츠노부 커플링은 목적하는 생성물을 제공하지만, 입체선택성이 없으며 크로마토그래피에 의한 분리가 매우 어려워서 이러한 단계 단독으로는 단리 수율이 6 내지 10%이며, 상기 방법은 정량화될 수 없다.
바람직한 접근법은 할로-당 및, 상기 퓨린 염기의 염을 사용하는 SN2형 반응이 되었다. 다시, 이러한 접근법의 도전은 α 할로-당을 어떻게 입체선택적으로 고수율로 수득하여 SN2형 반응으로 기대되는 배위의 역전을 이용하는가에 있다. 전형적인 방법은 당의 1-O-아세테이트의 아노머성 혼합물을 아세트산 중에서 HCl 또는 HBr로 처리하는 것이다. 그러나, 이러한 방법은 바람직하지 않은 아노머성 혼합물을 생성시킨다. 상기 락톤을(예를 들면, LiAlH(t-BuO)3 또는 Red-Al을 사용하여) 초기에 환원시켜 2:1 비의 β/α 아노머를 생성하지만, 실리카 겔 여과 컬럼을 통한 초기 정제 후, 상기 생성된 오일은 서서히 아노머화하여 상기 락톨의 순수한 결정질 β-아노머(2a/2b)를 형성시킨다. 이는 β-결정으로 시딩하면서 주변 온도에서 며칠 내지 50℃에서 5 내지 17시간까지 촉진될 수 있다. 일단 락톨이 용액 상태이면 이는 주변 온도에서 디클로로메탄 또는 클로로포름과 같은 용매 중에서 2:1 평형을 향해 서서히 도로 아노머화한다. 이러한 방법은 상기 용액을 냉각(예를 들면, -20℃)시킴으로써 상당히 느려질 수 있다.
N-클로로숙신이미드(NCS)를 사용한 SN2 메카니즘을 통한 염소화는 α-클로로당(3)을 입체특이적 방식으로 거의 정량적인 수율로 생성시킨다.
α-브로모당(4a)을 수득하기 위해, 아세트산 중의 N-브로모숙신이미드(NBS) 및 HBr을 포함하는 다수의 브롬화 조건이 시도되었다. 이들 조건 중에서, 본 발명자들은 트리페닐포스핀(PPh3) 및 사브롬화탄소(CBr4)의 배합물을 사용하는 일반적인 브롬화 반응을 수행하였다(Hooz et al, Can. J. Chem., 1968, 46, 86-87 참조). 용매로서 메틸렌 클로라이드를 사용하고 저온(-10℃ 내지 -20℃)을 유지시키는 조건하에, 본 발명자들은 목적하는 α/β 이성체 비가 10:1보다 큰 경우 80%를 초과하는 수율의 최고의 결과를 수득하였다. 본 발명자들은 이러한 반응 형태에 대해 이러한 정도의 입체선택성을 기술하는 선행 문헌이 없는 것으로 믿는다. 다른 실제적인 관찰은, 주변 온도보다 낮은 조건(예를 들면, 가장 바람직하게는 약 -20℃)하에 상기 브롬화반응을 수행하고 상기 저온 반응 용액을 반응 종결 후 가능한 빨리 실리카 겔에 노출시킴으로써 상기 브로모당의 아노머화가 최소화된다는 것이다. 상기 브로모당은 실리카 겔 여과 컬럼을 통해 정제될 수 있다. 일단 실리카 겔로 처리되면, 상기 브로모당은 심지어 승온에서도 실제적으로 안정하다.
요오도당(5a)은 유사한 방식으로 제조되며, 이는 상기 퓨린과 커플링되어 주요 중간체(6a)를 생성시킬 수 있다.
바우타(Bauta) 등의 일반적인 퓨린 커플링 방법((국제 특허 출원 WO2003/011877)에 따라, 본 발명자들은 α-브로모당(4a)을 아세토니트릴 중에서 t-부탄올 중의 6-클로로-2-아미노-퓨린의 칼륨염과 커플링하였다. 상기 반응은 주변 온도에서 한 주에 걸쳐서 수행하였다. 상기 반응은 50℃에서 24시간 내에 종결되도록 최적화되었다. 실리카 겔 여과 컬럼을 통한 부분 정제 후, 상기 아노머성 혼합물은 14:1 β/α의 비에서 63% 수율로 단리시켰다. 상기 β 아노머(6a)는 메탄올성 용액으로부터 선택적으로 결정화하여 브로모당(4a)로부터 55% 수율로 순수한 목적하는 β-아노머(6a)를 수득할 수 있다.
수득한 주요 중간체(6a)를 사용하여, 보호되지 않은 2-아미노-6-치환된 퓨린(예를 들면, 7-10)으로의 전환이 수행되었다. 포스포르아미데이트 유도체(예를 들면, 11-14)로의 추가의 전환은 레스텐(Lehsten) 등의 방법(Org. Proc. Res. Dev., 2002, 6, 819-822) 또는 2008년 3월 21일자로 출원된 미국 특허 출원 제12/053,015호(pp. 651-675)에 기술된 바와 같은 방법을 개조함으로써 수행하였다. 사이클릭 포스페이트 유도체(예를 들면, 15-17)는 문헌(Can J. Chem., 1993, 71, 855)에 기재된 바와 같이 또는 2008년 6월 11일자로 출원된 미국 가특허 출원 제61/060,683호(pp. 79-89)에 기재된 바와 같이 제조되었다. 상기 포스포르아미데이트기가 2급 3' 하이드록실 상의 비교적 적은 정도로 반응할 수 있으므로, 3' 모노포스포르아미데이트 및 3',5' 비스-포스포르아미데이트 불순물에 대한 가능성이 존재한다. 상기 3' 이성체는 목적하는 5' 이성체와 유사한 물리적 특성을 가짐으로써 크로마토그래피에 의한 정제가 어려운 것으로 예측될 것이다. 이는 미정제 생성물 혼합물을 피리딘 또는 유사한 염기의 존재하에, t-부틸디메틸실릴 클로라이드, t-부틸디페닐실릴 클로라이드 또는 4,4'-디메톡시트리틸 클로라이드와 같은 2급 하이드록실에 비해 1급 하이드록실에 대해 선택성인, 화학양론적 양보다 적은 양의 보호기와 추가로 반응시켜 5' 보호된 3' 포스포르아미데이트를 생성시킴으로써 완화된다. 상기 생성된 생성물 및 비스 치환된 포스포르아미데이트는 목적하는 5' 포스포르아미데이트에 비해 극성이 낮고, 크로마토크래피에 의해 용이하게 분리될 수 있다.
화합물(1a)은 각각 인용에 의해 본 발명에 포함되는 미국 공개된 출원 제2008/0139802호(이는 WO2008/045419에 상응한다)의 제5면, WO2006/012440에서의 11 내지 13페이지, 및 WO2006/031725에서의 20 내지 22페이지 및 30 내지 31페이지에 기재된 방법에 의해 수득될 수 있다. 다른 한편으로, 상기 4-클로로벤조일 락톤 동족체(1b)는 1a의 탈벤조일화에 의해 중간체 락톤 디아올 1 a'를 형성한 다음, 4-클로로벤조일화에 의해 또는 4-클로로벤조일 클로라이드를 치환함으로써 직접 1a'와 반응시킴으로써 제조될 수 있다.
실시예
1. ((2R,3R,4R)-3-(4-
클로로벤조일옥시
)-4-
플루오로
-4-
메틸
-5-
옥소테
트라하이드로푸란-2-일)
메틸
4-
클로로벤조에이트
(1b)
((2R,3R,4R)-3-(벤조일옥시)-4-플루오로-4-메틸-5-옥소테트라하이드로푸란-2-일)메틸 벤조에이트(1a, 44.50g, 119.5m㏖)를 무수 메탄올(240㎖) 중에서 현탁시켰다. 메탄올(2.3㎖, 10m㏖, 8.3㏖%) 중의 촉매량의 25중량% 나트륨 메톡사이드를 실온에서 첨가하였다. 2시간 후, 상기 반응은 TLC(헥산 중의 20% EtOAc)에 의해 확인한 바와 같이 종결되었다. 감압하에 용매를 농축시킨 후, 상기 잔사를 에틸 에테르 및 헥산의 혼합물(1:2 v/v)(200㎖)로 분쇄하여 미정제 중간체 락톤(a)을 수득하였다. 상기 고체를 여과를 통해 수집하고 헥산(3×40㎖)으로 세정하였다. 건조된 1ℓ 들이 둥근 바닥 플라스크에 상기 미정제 중간체를 부하하고, 이를 무수 THF(500㎖) 중에 용해시켰다. 4-클로로벤조일 클로라이드(46㎖, 358m㏖)를 실온에서 첨가하였다. 상기 혼합물을 얼음 욕조로 냉각시킨 다음, 트리에틸아민(100㎖, 717m㏖)을 첨가하였다. 상기 탁한 혼합물을 실온에서 밤새 교반하였다. 상기 반응은 물(60㎖)를 첨가하여 켄칭시킨 다음, 상기 용액을 감압하에 농축시켰다. 상기 잔사를 에틸 아세테이트(200㎖)로 희석하고 물 및 염수(각각 2×100㎖)로 세척하였다. 상기 유기층을 감압하에 농축시키고, 상기 잔사를 컬럼 크로마토그래피(헥산 중의 20% EtOAc)에 의해 정제하여 상기 생성물을 담황색 솜털형 고체로서 수득하였다. 상기 생성물을(0.2㎜Hg, 50℃, 2시간) 하에 건조시켜 24.3g(46%)을 수득하였다. 융점: 138-141℃. 1H NMR(CDCl3): δ 7.99(m, 2 H, 방향족), 7.91(m, 2 H, 방향족), 7.45(m, 2 H, 방향족), 7.39(m, 2 H, 방향족), 5.45(dd, 1 H, J = 17.6 Hz, J = 7.2 Hz, C3-H), 4.97(m, 1 H, C4-H), 4.73(m, 1 H, C5-Ha), 4.58(m, 1 H, C5-Hb), 1.73(d, 3 H, CH3).
실시예
2. ((2R,3R,4R,5R)-3-(
벤조일옥시
)-4-
플루오로
-5-
하이드록시
-4-
메틸테트라하이드로푸란
-2-일)
메틸
벤조에이트
(2a)
기계적 교반기, 추가 깔때기 및 온도계가 장착된 5ℓ 들이 건조된 3구 둥근 바닥 플라스크에 락톤((2R,3R,4R)-3-(벤조일옥시)-4-플루오로-4-메틸-5-옥소테트라하이드로푸란-2-일)메틸 벤조에이트)(1a, 379g, 1.018㏖)을 장전하였다. 상기 고체를 무수 THF(1.75ℓ)에 용해시키고, 질소 대기하에 -30℃로 냉각시켰다. 리튬 트리-3급-부톡시알루미노하이드라이드의 용액(THF 중의 1.0M, 1.527ℓ)을 1시간에 걸쳐서 교반하고 -30℃ 온도로 유지하면서 상기 락톤 용액에 첨가하였다. 상기 첨가를 종결한 후, 상기 온도를 서서히 증가시키고, 상기 반응을 TLC(락톨 Rf 0.4, 헥산 중의 30% EtOAc)하였다. 상기 반응은 1시간 15분 후 종결하였다(온도는 -10℃에 도달하였다). 상기 반응은 추가 깔때기를 통해 에틸 아세테이트(900㎖)를 첨가함으로써 켄칭시켰다. 포화 NH4Cl(40㎖)을 0℃에서 첨가하였다. 상기 탁한 혼합물을 10ℓ 들이 둥근 바닥 플라스크 내로 디캔팅하였다. 뒤에 남은 고체 잔사를 여과시키고 에틸 아세테이트(2×200㎖)로 세척하였다. 상기 여과물을 상기 디캔팅한 용액과 합하고, 상기 합한 용액을 감압하에 농축시켰다. 상기 오일상 잔사를 에틸 아세테이트(2ℓ)에 용해시키고 3N HCl(600㎖)로 세척하였다. 상기 수성층을 에틸 아세테이트(3×400㎖)로 역추출하였다. 상기 합한 유기층을 물(3×800㎖), 포화 NaHCO3(400㎖) 및 염수(400㎖)로 세척하였다. 상기 유기 용액을 MgSO4 , 상에서 건조시키고 여과하며 감압하에 농축시켜 담갈색 오일성 잔사를 수득하였다. 상기 잔사는 흡인 및 각각 약 5ℓ의 헥산 중의 5%, 10%, 20% 및 30% 에틸 아세테이트의 단계-구배를 사용하는 플러그 컬럼(2.2㎏의 40 내지 63㎛ 실리카 겔, 6ℓ의 소결된 유리 깔때기 중에 팩킹됨, 22㎝ 길이의 실리카 겔, 직경 15㎝)에 의해 정제하였다. 상기 생성물 함유 분획들을 합하고 감압하에 농축시켜 무색 고점성 액체(310.4g)를 수득하였다.
상개 액체는 50℃에서 진공(0.2㎜Hg) 하에 시드(약 100㎎이 펼쳐짐)로서 결정질 베타 생성물을 첨가한 후 서서히 고형화되었다. 상기 고형화방법은 진공의 존재 또는 부재하에 50℃에서 20시간 내에 종결되었다. 이와 같이 수집된 백색 고체(293.8g, 77%)는 융점이 79 내지 80℃이고, β/α의 비가 NMR을 기준으로 하여 20:1이다.
1H-NMR(DMSO-d6) β-이성체, δ = 5.20(dd, 1 H, OH); α-이성체, δ = 5.40(dd, 1 H, OH).(β-락톨) .(DMSO-d6): δ 7.99(m, 2 H, 방향족), 7.93(m, 2 H, 방향족), 7.70(m, 1 H, 방향족), 7.61(m, 1 H, 방향족), 7.55(m, 2 H, 방향족), 7.42(m, 2 H, 방향족), 7.32(dd, 1 H, C1-H), 5.54(dd, 1 H, C3-H), 5.20(dd, 1 H, OH), 4.55-4.50(m, 1 H, C5-Ha), 4.46-4.40(m, 2 H, C5-Hb 및 C4-H), 1.42(d, 3 H, CH3).
실시예
3. ((2R,3R,4R,5R)-3-(4-
클로로벤조일옥시
)-4-
플루오로
-5-
하이드록시
-4-메
틸테트라하이드로푸
란-2-일)
메틸
4-
클로로벤조에이트
(2b)
1리터 들이 건조된 둥근 바닥 플라스크에 ((2R,3R,4R)-3-(4-클로로벤조일옥시)-4-플루오로-4-메틸-5-옥소테트라하이드로푸란-2-일)메틸 4-클로로벤조에이트(1b, 50.0g, 113m㏖)를 부하하고, 상기 고체를 무수 THF(200㎖)에 용해시켰다. 상기 용액을 -20℃로 냉각시켰다. 리튬 트리-3급-부톡시알루미노하이드라이드(THF 중의 1.0M)(170㎖, 170m㏖)를 20분에 걸쳐서 추가 깔때기를 통해 첨가하고, 상기 생성된 혼합물을 추가로 1시간 동안 -20℃에서 교반하였다. 에틸 아세테이트(120㎖)를 첨가하고, 상기 혼합물을 0℃로 서서히 가온하였다. 포화 수성 염화암모늄(4.5㎖)을 첨가하였다. 상기 혼합물을 감압하에 농축시킨 다음, EtOAc(500㎖)로 희석하였다. 수성 HCl(3N, 300㎖)을 첨가하여 모든 고체를 용해시켰다. 분리시킨 후, 상기 유기층을 물(2×200㎖) 및 염수(100㎖)로 세척하고 황산나트륨 상에서 건조시켰다. 상기 유기층을 감압하에 농축시켜 무정형 고체를 제공하였다. 상기 고체를 메탄올(169㎖)에 용해시키고 가열 환류하였다. 실온으로 냉각시킨 후, 약간 혼탁한 혼합물이 형성될 때까지 물을 수분획으로 나누어 첨가하였다(총 37㎖). 정치시킨 후, 상기 침전된 β-락톨 생성물을 여과시키고 메탄올(2×20㎖)로 세척하고 건조시켜(0.2㎜Hg, 50℃, 17시간) β/α > 35:1의 아노머 비를 갖는 30.5g(61%)의 회백색 고체를 수득하였다. 1H NMR(DMSO-d6): δ 7.95(m, 2 H, 방향족), 7.90(m, 2 H, 방향족), 7.61(m, 2 H, 방향족), 7.51(m, 2 H, 방향족), 7.31(dd, 1 H, C1-H, J = 5.2 Hz, J = 0.8 Hz), 5.50(dd, 1 H, C3-H, J = 24 Hz, J = 7.2 Hz), 5.19(dd, 1 H, C4-H, J = 10.8 Hz, J = 5.6 Hz), 4.56(m, 1 H, C5-Ha), 4.42(m, 2 H, C5-Hb 및 OH), 1.42(d, 3 H, CH3, J = 22.8 Hz).
실시예
4. ((2R,3R,4R,5R)-3-(
벤조일옥시
)-5-
클로로
-4-
플루오로
-4-
메틸테트라하이드로푸란
-2-일)
메틸
벤조에이트
(3)
CH2Cl2(15㎖) 중의 화합물 2a(1.0g, 2.67m㏖) 및 PPh3(1.4g, 5.34m㏖)의 혼합물의 용액에 NCS(1.07g, 8.01m㏖)를 몇 분획으로 나누어 0℃에서 첨가하였다. 이어서, 상기 생성된 혼합물을 실온에서 1시간 동안 교반하고 실리카 겔 컬럼 내에 붓고 압력을 사용하여 EtOAc-헥산(1:4)으로 용출하였다. 상기 수집된 정확한 분획들을 합하여 농축시키고 CH2Cl2로 수회 공증발시켜 후속 단계에서 사용하였다(1.0g, 95%).
1H-NMR(CDCl3) δ = 8.13-8.02(m, 4H, 방향족), 7.78-7.50(m, 방향족, 2H), 7.53-7.43(m, 4H, 방향족), 6.01(s, 1H, H-1), 5.28(dd, 1H, J = 3.2, 5.6 Hz, H-3), 4.88(m, 1H, H-H-4), 4.77(dd, 1H, J = 3.2, 12.4 Hz, H-5), 4.61(dd, 1H, J = 4.0, 12.4 Hz, H-5'), 1.73(d, 3H, J = 21.6 Hz, CH3).
실시예
5. ((2R,3R,4R,5R)-3-(
벤조일옥시
)-5-
브로모
-4-
플루오로
-4-
메틸테트라하이드로푸란
-2-일)
메틸
벤조에이트
(4a)
무수 디클로로메탄(5.6ℓ)을 반응기 내로 장전하고 -22℃ 이하로 냉각시켰다. 트리페닐포스핀(205.4g, 0.783㏖)을 상기 냉각 용매에 첨가하고, 상기 현탁액을 교반시켜 용액을 형성시켰다. 고체 제형 중의 락톨(2a, 209.4g, 0.559㏖)을 냉각 용액에 첨가하고 15분 동안 교반하였다. 사브롬화탄소(278.2g, 0.839㏖)를 몇 분획으로 나누어 첨가하면서 질소 기체(약 30분)의 유동하에 상기 용액의 온도를 -22℃ 내지 -20℃로 유지하였다. CBr4의 첨가를 마친 후, 상기 온도를 20분에 걸쳐서 -17℃로 서서히 상승시켰다. 상기 온도는 TLC(Rfs 0.61(α), 0.72(β), 0.36 락톨; 헥산 중의 20% EtOAc)에 의해 > 95% 종결된 것으로 판단되었다. 상기 반응 용액을 230g의 플래쉬 크로마토그래피용 실리카 겔(40-63㎛)을 함유하는 용기에 즉시 옮겼다. 상기 교반된 혼합물을 2.5ℓ 소결된 유리 부흐너 깔때기 중의 실리카 겔(680g) 패드를 통해 즉시 통과시켰다. 상기 여과물을 감압하에 약 800㎖로 농축시키고, 상기 미정제 생성물의 α/β 이성체의 비가 1H-NMR에 의해 측정된 바와 같이 10:1이었다. (CDCl3) δ = 6.35,(s, α C1-H), 6.43,(d, β C1-H). 상기 잔사를 6ℓ 소결된 유리 브흐너 깔때기 중의 2.1㎏의 실리카 겔을 사용하여 플러그 컬럼 크로마토그래피에 의해 정제하고 헥산(각각 약 4ℓ) 중의 1%, 5%, 8%, 12% EtOAc의 단계적 구배 용출을 사용하여(흡인을 통해) 용출하여 비극성 불순물을 제거한 다음, 헥산(총 6ℓ) 중의 12%, 25% EtOAc에 의해 상기 생성물을 용출하였다. 상기 생성물 함유 분획들을 2개의 분획 내로 합하고 감압하에 농축시키며 진공하에 건조시켜(0.1㎜Hg, 주변 온도, 20시간) 무색 오일을 수득하였다. 주요 분획(197g, 89% α/β = 20:1). 상기 알파 이성체를 몇 주 동안 0℃에서 정치시 소분획의 오일로부터 결정화되어 대형의 얇은 플레이트를 제공하였다. 융점 59 내지 61℃. 상기 순수한 베타 이성체는 이전의 비교적 낮은 선택적 수행으로부터의 알파 및 베타 생성물의 혼합물로부터 결정화하여 침상물을 수득하였다. 융점 77-79℃.
1H-NMR(β-브로마이드)(CDCl3): δ = 8.08(m, 2 H, 방향족), 8.04(m, 2 H, 방향족), 7.62(m, 1 H, 방향족), 7.54-7.45(m, 3 H, 방향족), 7.35(m, 2 H, 방향족), 6.43(d, 1 H, C1-H), 6.04(dd, 1 H, C3-H), 4.78-4.73(m, 2 H, C4-H 및 C5-Ha), 4.63-4.58(m, 1 H, C5-Hb), 1.76(d, 3 H, CH3). α-브로마이드, α/β= 20:1)(CDCl3): δ 8.13(m, 2 H, 방향족), 8.02(m, 2 H, 방향족), 7.63-7.56(m, 2 H, 방향족), 7.50-7.42(m, 4 H, 방향족), 6.34(s, 1 H, C1-H), 5.29(dd, 1 H, C3-H), 4.88(m, 1 H, C4-H), 4.78(dd, 1 H, C5-Ha), 4.63(dd, 1 H, C5-Hb), 1.72(d, 3 H, CH3).
실시예
6. (2R,3R,4R,5R)-5-
브로모
-2-((4-
클로로벤조일옥시
)
메틸
)-4-
플루오로
-4-
메틸테트라하이드로푸란
-3-일 4-
클로로벤조에이트
(4b)
무수 디클로로메탄(530㎖)을 1ℓ의 건조된 둥근 바닥 플라스크에 첨가하고 -22℃로 냉각시켰다. 트리페닐포스핀(19.5g, 74m㏖)을 첨가한 다음, 상기 β-락톨(2b, 23.5g, 53m㏖)을 첨가하였다. 상기 용액에 사브롬화탄소(26.3g, 79.5m㏖, 고체)을 5분에 걸쳐서 -22℃에서 몇 분획으로 나누어 첨가하였다. 상기 반응을 실온으로 서서히 가온하고, 일단 반응이 종결되면 상기 용액을 실리카 겔(600㎖의 용융 원형 브흐너 깔때기 중의 148g)의 짧은 패드를 통과시켜 임의의 갈색 극성 불순물을 제거하였다. 상기 무색 여과물을 농축시켜 감압하에 건조시키고, 상기 고체 잔사를 에틸 에테르(170㎖) 중에서 용해시켰다. 침전물이 형성되기 시작할 때까지 헥산(50㎖)을 서서히 첨가하였다. 상기 생성물을 여과를 통해 담황색 고체로서 수집하고 건조시켜(0.2㎜Hg, 25℃, 17분) 아노머 비 α/β가 > 65:1인 21.23g(79%)을 수득하였다. 상기 생성물을 3 내지 4%의 트리페닐포스핀 옥사이드로 오염시켰으며, 이는 후속 반응 단계에 아무런 영향을 미치지 않는다. 1H NMR(CDCl3) : δ 8.05(m, 2 H, 방향족), 7.95(m, 2 H, 방향족), 7.47-7.40(m, 4 H, 방향족), 6.33(s, 1 H, C1-H), 5.22(m, 1 H, C3-H), 4.84(m, 1 H, C4-H), 4.76(m, 1 H, C5-Ha), 4.62(m, 1 H, C5-Hb), 1.69(d, 3 H, CH3, J = 21.6 Hz).
실시예
7. ((2R,3R,4R,5R)-3-(
벤조일옥시
)-4-
플루오로
-5-
요오도
-4-
메틸테트라하이드로푸란
-2-일)
메틸
벤조에이트
(5)
무수 CH2Cl2(10㎖) 중의 화합물 2(1g, 2.67m㏖), 트리페닐포스핀(700㎎, 2.67m㏖) 및 이미다졸(180㎎, 2.67m㏖)의 용액에 요오드(680㎎, 2.68m㏖)를 첨가하였다. 상기 생성된 혼합물을 30분 동안 교반하며 실리카 겔 컬럼 내로 붓고 EtOAc-헥산(1:4)으로 용출시켜 시럽 생성물(1.3g, 정량적)을 수득하고 추가의 특성화 없이 후속 단계에서 사용되었다.
실시예
8. (2R,3R,4R,5R)-5-(2-아미노-6-
클로로
-9H-퓨린-9-일)-2-(
벤조일옥시메틸
)-4-
플루오로
-4-
메틸테트라하이드로푸란
-3-일
벤조에이트
(6a)
12ℓ의 3구 둥근 바닥 플라스크에 6-클로로-2-아미노퓨린(225.4g, 1.329㏖)을 장전하였다. 무수 3급-BuOH(4.5ℓ)를 첨가하고, 상기 용액을 주변 온도에서 기계적 교반기로 교반하였다. 칼륨 3급-부톡사이드(고체, 151.6g, 1.35㏖)를 교반하면서 질소 기체의 유동하에 몇 분획으로 나누어 첨가하였다. 상기 혼합물을 실온에서 추가로 30분 동안 교반하였다. 5ℓ 둥근 바닥 플라스크에 α-브로마이드(4a, 197g, 0.451㏖) 및 3ℓ의 무수 아세토니트릴을 주변 온도에서 첨가하였다. 상기 브로마이드 용액을 주변 온도에서 1분에 걸쳐서 상기 퓨린 염기 현탁액에 첨가하였다. 5ℓ 플라스크를 아세토니트릴(2×1ℓ)로 세정하여 브로마이드를 상기 반응 혼합물로 완전히 옮겼다. 상기 혼합물을 가열 맨틀 및 제어기를 사용하여 2시간에 걸쳐서 50℃로 서서히 가열하였다. 상기 반응은 TLC 베타(Rf 0.28, 헥산 중의 30% EtOAc)에 의해 나타낸 바와 같이 완전히 종결되었다. 상기 반응물을 포화 NH4Cl(200㎖)의 첨가에 의해 켄칭하여 현탁액을 형성하였다. 상기 현탁된 고체는 2.5ℓ 도자기 브흐너 깔때기에서 셀라이트의 3㎝ 패드를 통한 여과에 의해 제거하였다. 상기 고체를 톨루엔(3×100㎖)으로 세척하였다. 상기 합한 여과물을 pH 7(약 220㎖)이 될 때까지 6N HCl 용액을 첨가함으로써 중화시켰다. 상기 혼합물을 감압하에 농축시켰다. 혼합물의 용적을 약 1/3 용적으로 감소시키는 경우, 추가의 침전된 고체는 유사한 방식으로 여과함으로써 제거하였다. 상기 여과물을 약 800㎖의 용적으로 추가로 농축시켰다. 상기 잔사를 플러그 컬럼(6ℓ 소결된 유리 브흐너 깔때기 중의 1.6㎏의 플래쉬용 실리카 겔) 상에 부하하고 헥산(6ℓ) 중의 10% 에틸 아세테이트의 구배를 사용하여(흡인을 통해) 용출시켜 비극성 불순물을 제거하고, 헥산 중의 30% 에틸 아세테이트를 사용하여 소량의 락톨(6ℓ)을 수득한 다음, 헥산(4ℓ) 중의 40%∼45% 에틸 아세테이트를 사용하여 주요량의 생성물을 용출하였다. 상기 생성물 함유 분획들을 합하고 감압하에 농축시키며 진공하에 건조(0.2㎜Hg, 24시간, 주변 온도)시켜 백색 발포체 고체(150.7g, NMR에 의한 β/α = 14:1)를 수득하였다.
1H-NMR.(CDCl3) 베타: δ = 1.33(d, 22.4 Hz, 2'-C-CH3), 알파: 1.55(d, 22 Hz, 2'-C-CH3).
상기 생성물 혼합물 발포체를 주변 온도에서 메탄올(700㎖)에 용해시켰다. 정치시, 고체를 2시간에 걸쳐서 서서히 형성하였다. 상기 현탁액을 동결기에서 17시간 동안 -5℃로 냉각시켰다. 상기 생성된 백색 고체를 여과에 의해 수집하고 냉각 MeOH(-5℃, 3×60㎖) 및 에틸 에테르(3×100㎖)로 세척하였다. 상기 고체를 진공하에 건조(0.2㎜Hg, 24시간, 주변 온도)시켜 우수한 de(HPLC에 의해 β/α 99.8:1)를 갖는 β-생성물 110.5g을 수득하였다. 상기 여과물을 부분적으로 농축(약 400㎖)시킨 다음, 60℃로 가열하면서 보다 다량의 MeOH(400㎖)로 희석하였다. 상기 용액을 주변 온도로 냉각시키고 시딩시키며 -5℃로 냉각시켰다. 제2 수득량을 수집하고 세척하며 유사한 방식으로 건조시켜 보다 다량의 생성물을 유사한 부분입체이성체성 순도를 갖는 백색 고체(12.26g)로서 수득하였다. 상기 모액을 농축시켜 감압하에 건조시켰다(약 25g). 상기 잔사를 β-이성체 및 α-이성체의 혼합물이었다. 이는 자동화 실리카 겔 컬럼 크로마토그래피(Analogix, 240g 카트릿지, 헥산 중의 40% 내지 50% 에틸 아세테이트)하여 14.52g의 생성물을 수득하고, 이를 MeOH로부터 재결정화하고 세척하며 유사한 방식으로 건조시켜 추가의 8.46g의 생성물을 고수율로 수득하였다.
상기 3개의 고체는 유사한 순도를 갖는 것으로 판단되며, 이들을 합하여 131.2g의 백색 결정질 생성물 6a(브로모당으로부터 55%, 락톨로부터 49%)를 수득하였다. 융점 160.5-162.0℃. 0.20% 알파를 함유하는 HPLC 순도 99.5%.
1H-NMR(순수한 β 아노머, CDCl3): δ = 8.03(m, 2 H, 방향족), 7.93(m, 2 H, 방향족), 7.88(s, 1 H, C8-H), 7.60(m, 1 H, 방향족), 7.50(m, 1 H, 방향족), 7.44(m, 2 H, 방향족), 7.33(m, 2 H, 방향족), 6.44(dd, 1 H, C1'-H), 6.12(d, 1 H, C3'-H), 5.35(s, 2 H, NH2), 5.00(dd, 1 H, C5'-Ha), 4.76(m, 1 H, C4'-H), 4.59(dd, 1 H, C5'-Hb), 1.33(d, 3 H, CH3).
1H-NMR(α-이성체, CDCl3): δ = 8.11-8.09(m, 3 H, 방향족 및 C8-H), 8.01(m, 2 H, 방향족), 7.63(m, 1 H, 방향족), 7.55(m, 1 H, 방향족), 7.48(m, 2 H, 방향족), 7.39(m, 2 H, 방향족), 6.35(d, 1 H, C1'-H), 5.76(dd, 1 H, C3'-H), 5.18(s, 2 H, NH2), 4.93-4.89(m, 1 H, C4'-H), 4.75-4.71(m, 1 H, C5'-Ha), 4.58-4.54(m, 1 H, C5'-Hb), 1.55(d, 3 H, CH3).
실시예
9. (2R,3R,4R,5R)-5-(2-아미노-6-
클로로
-9H-퓨린-9-일)-2-((4-
클로로벤조일옥시
)
메틸
)-4-
플루오로
-4-
메틸테트라하이드로푸란
-3-일-4-
클로로벤조에이트
(6b)
250㎖의 건조된 둥근 바닥 플라스크에 2-아미노-6-클로로퓨린(2.57g, 15.1m㏖, 2.95당량)을 장전하였다. 무수 3급-BuOH(51㎖)를 첨가한 다음, 칼륨 3급-부톡사이드(1.73g, 15.4m㏖)를 첨가하였다. 상기 현탁액을 실온에서 30분 동안 교반한 다음, 무수 아세토니트릴(86㎖) 중의 상기 브로마이드(4b, 2.60g, 5.14m㏖)의 용액에 첨가하였다. 상기 혼합물을 50℃에서 43시간 동안 가열하였다. 상기 반응물을 수성 포화 염화암모늄(3㎖)의 첨가에 의해 켄칭하였다. 주로 과량의 출발 퓨린 염기로 이루어진 침전된 고체는 여과에 의해 제거하고, 상기 생성물을 함유하는 여과액을 감압하에 농축시켰다. 상기 생성된 고체 잔사를 에틸 아세테이트(110㎖)로 분쇄하였다. 상기 잔여 고체를 여과에 의해 제거한 후, 상기 여과물을 물(3×40㎖) 및 염수(1×40㎖)로 세척하고 황산나트륨 상에서 건조시켰다. 상기 유기 용액을 감압하에 농축시켜 아노머 비 β/α가 약 10:1인 미정제 생성물 2.96g을 수득하였다. 상기 미정제 생성물을 컬럼 크로마토그래피(헥산 중의 25% 에틸 아세테이트)를 통해 정제하여 1.98g(65%)의 생성물을 오일로서 수득하였다. 한 분획을 메탄올(8㎖/g)에 용해시켜 결정질 백색 고체(β/α = 26:1)를 수득하였다. 융점은 155℃에서 수축되어 167-175℃에서 용융한다. 1H NMR(CDCl3) : δ 7.91(m, 2 H, 방향족), 7.84(m, 2 H, 방향족), 7.84(s, 1 H, C8-H), 7.40(m, 2 H, 방향족), 7.28(m, 2 H, 방향족), 6.48(dd, 1 H, C3'-H, J = 22.8 Hz, J = 9.2 Hz), 6.09(d, 1 H, C1'-H, J = 18 Hz), 5.39(s, 2 H, NH2), 5.06(m, 1 H, C5'-Ha), 4.73(m, 1 H, C4'-H), 4.56(m, 1 H, C5'-Hb), 1.32(d, 3 H, CH3, J = 22.4 Hz).
실시예
10. 화합물 3으로부터의 (2R,3R,4R,5R)-5-(2-아미노-6-
클로로
-9H-퓨린-9-일)-2-(
벤조일옥시메틸
)-4-
플루오로
-4-
메틸테트라하이드로푸란
-3-일
벤조에이트
(6a)
클로로벤젠(1.5㎖) 중의 화합물 3(450㎎, 2.68m㏖)의 용액에 t-부탄올(5㎖) 중의 상기 염기(1.37g, 8.05m㏖)의 칼륨염을 첨가한 다음, 무수 아세토니트릴(5㎖)을 실온에서 첨가하였다. 상기 생성된 혼합물을 7일 동안 밀봉된 튜브 중에서 80 내지 140℃에서 교반하고 HCl로 중화시킨 후 진공에서 농축시켰다. 상기 잔사를 실리카 겔 컬럼 크로마토그래피(헥산:EtOAc = 2:1)에 의해 정제하여 화합물 6a(90 ㎎, 15%)를 백색 발포체로서 수득하였다.
실시예
11. 화합물 5로부터의 (2R,3R,4R,5R)-5-(2-아미노-6-
클로로
-9H-퓨린-9-일)-2-(
벤조일옥시메틸
)-4-
플루오로
-4-
메틸테트라하이드로푸란
-3-일
벤조에이트
(6a)
t-부탄올(10㎖) 중의 화합물 5(1.3g, 2.68m㏖)의 용액에 DMF(10㎖) 중의 상기 염기(1.37g, 8.05m㏖)의 나트륨염을 주변 온도에서 첨가하였다. 상기 생성된 혼합물을 15시간 동안 교반하고 진공하에 농축시켰다. 상기 잔사를 실리카 겔 컬럼 크로마토그래피(헥산:EtOAc = 2:1)에 의해 정제하여 화합물 6(220㎎, 16%)을 백색 발포체로서 수득하였다.
실시예
12. 화합물 6a로부터의 (2R,3R,4R,5R)-5-(2-아미노-6-
메톡시
-9H-퓨린-9-일)-4-
플루오로
-2-(
하이드록시메틸
)-4-
메틸테트라하이드로푸란
-3-올(7)
250㎖ 들이 건조된 둥근 바닥 플라스크에 (2R,3R,4R,5R)-5-(2-아미노-6-클로로-9H-퓨린-9-일)-2-(벤조일옥시메틸)-4-플루오로-4-메틸테트라하이드로푸란-3-일 벤조에이트(6a, 7.50g, 14.26m㏖)를 첨가하였다. 무수 메탄올(30㎖)을 첨가하면 백색 현탁액이 형성되었다. 50℃에서, 메탄올(25%, 19.7㎖, 64.17m㏖) 중의 나트륨 메톡사이드의 용액을 질소 대기하에 건조된 시린지를 통해 첨가하였다. 백색의 탁한 반응 혼합물이 형성되었다. 50℃에서 3.5시간 후, 상기 반응은 TLC 시험에 의해 확인한 바와 잔여 출발 물질이 전혀 없이 종결되었다. 상기 혼합물을 실온으로 냉각시키고 빙초산(3㎖)의 첨가에 의해 중화시켰다. 백색 고체를 여과시키고 메탄올(3×5㎖)로 세척하였다. 상기 여과물을 20g의 실리카 겔과 혼합하고 농축 건조시켰다. 상기 혼합물을 실리카 겔 카트릿지를 따라 부하하고 디클로로메탄 중의 메탄올 0 내지 15% MeOH의 구배를 사용하는 컬럼 크로마토그래피를 통해 분리하였다. 상기 생성물을 디클로로메탄 중의 12% 메탄올에서 용출시켰다. 상기 생성물을 함유하는 분획들을 합하고 감압하에 농축시키고 진공에서 건조(0.2㎜Hg, 50℃, 24시간)시켜 백색 분말 고체(4.45g, 98% 수율)를 수득하였다. 융점 199-202℃.
1H-NMR(DMSO-d6): δ = 8.18(1 H, s, C8-H), 6.61(2 H, s, NH2), 6.05(1 H, d, C1'-H), 5.68(1 H, d, 3'-OH), 5.26(1 H, m, 5'-OH), 4.23-4.13(1 H, m, C3'-H), 3.96(3 H, s, OCH3), 3.92-3.83(2 H, m, C4'-H 및 C5'-Ha), 3.70-3.67(1 H, m, C5'-Hb), 1.06(3 H, d, C2'-CH3).
실시예
13. 화합물 6b로부터의 (2R,3R,4R,5R)-5-(2-아미노-6-
메톡시
-9H-퓨린-9-일)-4-
플루오로
-2-(
하이드록시메틸
)-4-
메틸테트라하이드로푸란
-3-올(7)
기계적 교반기 및 추가 깔때기가 장착된 건조된 5ℓ 들이 3구 둥근 바닥 플라스크에 (2R,3R,4R,5R)-5-(2-아미노-6-클로로-9H-퓨린-9-일)-2-(((4-클로로벤조일)옥시)메틸)-4-플루오로-4-메틸테트라하이드로푸란-3-일 4-클로로벤조에이트(6b, 313.2g , 526.5m㏖)를 부하하였다. 상기 고체를 무수 메탄올(2.1ℓ)에 현탁시키고 질소 대기하에 얼음 욕조에 냉각시켰다. 메탄올(361㎖, 1.58㏖) 중의 나트륨 25중량% 메톡사이드의 용액을 20분에 걸쳐서 추가 깔때기를 통해 첨가하여 맑은 용액을 제공하였다. 상기 반응을 6시간 동안 실온으로 가온시켜 혼탁한 용액을 형성하였다. 상기 반응의 종결은 임의의 잔여 6-클로로 탈보호된 뉴클레오시드의 결핍에 의해 LC/MS로 확인하였다. 상기 반응 용액을 농축 HCl(132㎖, 1.58㏖)로 산성화시켰다. 실온에서 정치(1시간)시킨 후, 상기 용액을 여과하여 백색 침전물을 제거하였다. 상기 침전물을 메탄올(3×50㎖)로 세척하였다. 상기 합한 여과물을 감압하에 농축시켜 점착성 고체 잔사를 수득하였다. 상기 잔사를 420㎖의 2N HCl(420㎖) 및 디클로로메탄(1ℓ)과 혼합하였다. 상기 유기층을 분리시키고, 수성층을 추가의 디클로로메탄(3×500㎖)으로 추출하였다. 상기 수성층에 에틸 아세테이트(1.4ℓ)를 첨가하고, 고체 탄산나트륨(86g)을 몇 분획으로 나누어 첨가하여 상기 수성층을 약 pH 8로 중화시켰다(주의: 발포). 상기 유기층을 분리시킨 후, 수성층 중의 고체를 보다 다량의 물(200㎖)을 첨가함으로써 용해시켰다. 상기 수성층을 에틸 아세테이트(3×700㎖ 및 400㎖)로 추출하였다. 상기 합한 유기층을 황산나트륨 상에서 건조시키고 감압하에 농축시켜 담황색 고체를 수득하고, 이를 50℃에서 아세톤(820㎖)에 재용해시키고 새로운 고체 형성이 개시될 때가지 교반하였다. 상기 포화 용액을 동결기에서 냉각시키고 생성물을 여과에 의해 수집하였다. 상기 백색 고체를 아세톤(2× 150㎖) 및 에틸 에테르(3×80㎖)로 세정하고 건조(0.2㎜Hg, 50℃, 4시간)시켜 백색 결정질 고체, 크로마토그래피에 의해 정제된 NMR 및 HPLC 매칭 물질을 갖는 151.6g(92%)의 물질을 수득하였다.
화합물(7a)은 화합물(7)을 제조하기 위한 실시예 12 내지 13과 유사한 방식으로 제조하였다.
실시예
14. (2S)-이소프로필 2-((((2R,3R,4R,5R)-5-(2-아미노-6-
메톡시
-9H-퓨린-9-일)-4-
플루오로
-3-
하이드록시
-4-
메틸테트라하이드로푸란
-2-일)
메톡시
)(
페녹시
)
포스포릴아미노
)
프로파노에이트
(11)
250㎖ 들이 건조된 둥근 바닥 플라스크에 페닐 디클로로포스페이트(2.66g, 12.61m㏖) 및 무수 디클로로메탄(40㎖)를 부하하였다. 상기 아미노 에스테르 염(2.60g, 15.53m㏖)을 상기 용액에 첨가하고, 상기 혼합물을 -5℃로 냉각시켰다. 이어서, N-메틸 이미다졸(7.7㎖, 97m㏖)을 -5℃에서 건조된 시린지를 통해 신속하게 첨가하고, 상기 용액을 -5℃에서 1시간 동안 교반하였다. 상기 뉴클레오시드(7, 3.04g, 9.7m㏖)를 -5℃에서 바이알로부터 한꺼번에 첨가하고, 상기 고체를 20분에서 서서히 용해시켰다. 상기 반응 온도는 2시간에 걸쳐서 주변 온도로 상승시켰다. 17시간 후, 상기 반응은 종결되지 않았다. 보다 다량의 화학적 시약을 [포스페이트(2.66g), 아미노에스테르(2.60g), 및 NMI(3.8㎖, 48m㏖)로부터 상술한 바와 같이] 제조하고 -5℃에서 상기 반응 혼합물에 첨가하였다. 상기 반응을 2시간 이상 동안 실온에서 교반하였다. 상기 반응을 TLC 결과에 의해 확인되는 바와 같이 거의 종결되었고, 첨가된 70㎖의 디클로로메탄ㆍHCl 용액(1N, 70㎖)으로 희석하였다. 상기 수성층을 분리하고 디클로로메탄으로 추출하였다. 상기 유기층을 포화 NaHCO3, 물 및 염수로 세척하고 MgSO4 상에서 건조시켰다. 감압하에 상기 용매를 제거한 후, 상기 점착성 잔사를 240g의 카트릿지 및 디클로로메탄 중의 0-8% 2-PrOH의 구배를 사용하는 자동화 컬럼 크로마토그래피를 통해 정제하여 생성물을 발포체 고체(4.16g, 7.14m㏖, 73% 수율)로서 수득하였다. HPLC 순도 97.4%. 생성물의 NMR 스펙트럼은 상기 생성물이 1.2:1 비로 혼합한 2개의 부분입체이성체의 혼합물임을 보여준다.
1H-NMR(DMSO-d6): δ = 7.98(1 H, s, 한 이성체의 8-H), 7.95(1 H, s, 다른 이성체의 8-H), 7.37-7.32(2 H, m, 방향족-H), 7.22-7.15(3 H, m, 방향족-H), 6.6(2 H, s, NH2), 6.11(1 H, d, 한 이성체의 C1'-H), 6.09(1 H, d, 다른 이성체의 C1'-H), 6.09-5.98(1 H, m, 아미드 NH), 5.88(1 H, d, 한 이성체의 3'-OH), 5.81(1 H, d, 다른 이성체의 3'-H), 4.85-4.75(1 H, 칠중선, 이소-프로필의 메틴 H), 4.46-4.27(2 H, m, C4'-H, 아미노 에스테르의 α-H), 4.15-4.07(1 H, m, C3'-H), 3.96(3 H, s, OCH3), 3.82-3.72(2 H, m, C5'-Ha 및 C5'-Hb), 1.23-1.06(9 H, m, 아미노 에스테르의 CH3's), 1.03(3 H, d, C2'-CH3).
31P-NMR(DMSO-d6): δ = 4.91(한 이성체), 4.72(또 다른 이성체).
또 다른 정제 방법은 크로마토그래픽 분리를 간략하게 하기 위해 비교적 소량의 3' 포스포르아미데이트 부산물을 화학적으로 변경시키는 것이다. 상기 미정제 포스포르아미데이트 생성물을 무수 피리딘(5㎖/g)에 용해시키고, 주변 온도에서 0.5몰당량의 t-부틸디메틸실릴 클로라이드로 처리하여 3' 이성체 불순물의 유리 5' 1급 하이드록실과 선택적으로 반응시켰다. 반응 진행은 LC/MS에 의해 모니터될 수 있다. 일단 3' 이성체가 5'-tBDMS-3'-포스포르아미데이트 유도체로 전환되면, 상기 반응을 메탄올(3당량)로 켄칭시키고 감압하에 농축시켜 에틸 아세테이트 및 5% 시트르산에 분배한 다음, 유기층을 농축시켰다. 이어서, 상기 잔사를 크로마토그래피하는데, 이는 보다 높은 하중과 보다 신속한 구배로 수행되어 보다 높은 순도를 달성할 수 있다.
화합물(11a) 및(11b)는 출발 시약으로서 화합물(10) 및(7a)를 사용하여 실시예 14와 유사한 방법에 의해 제조되었다.
실시예
15. (2R,3R,4R,5R)-5-(2-아미노-6-(
아제티딘
-1-일)-9H-퓨린-9-일)-4-플루오로-2-(
하이드록시메틸
)-4-
메틸테트라하이드로푸란
-3-올(8)
350㎖의 건조된 밀봉 가압 플라스크(Chemglass)에 (2R,3R,4R,5R)-5-(2-아미노-6-클로로-9H-퓨린-9-일)-2-(벤조일옥시메틸)-4-플루오로-4-메틸테트라하이드로푸란-3-일 벤조에이트(6a, 3.6g, 6.85m㏖) 및 150㎖의 무수 에탄올을 첨가하였다. 아제티딘 하이드로클로라이드(2.56g, 27.4m㏖)를 첨가한 다음, 트리에틸아민(4.16g, 41.1m㏖)을 첨가하였다. 상기 현탁액을 교반하고 70℃로 가열하면서 5시간 동안 밀봉하였다. 모든 출발 물질이 소비되지만, 벤조일기는 TLC에 의해 확인되는 바와 같이 잔존한다. 나트륨 메톡사이드(7.8㎖, 34.3m㏖, 메탄올 중의 25% 용액)를 상기 혼합물에 첨가하고 50℃에서 가열하였다. 상기 반응을 3.5시간 후 종결하였다. 상기 반응 혼합물을 실온으로 냉각시키고 빙초산(0.41g, 6.85m㏖)의 첨가에 의해 중화시켰다. 상기 혼합물을 감압하에 농축시킨 다음, 상기 잔사를 에틸 아세테이트로 분쇄하였다. 상기 생성된 고체를 여과에 의해 제거하고, 상기 고체를 EtOAc(2×15㎖)로 세척하였다. 상기 여과물을 감압하에 농축시키고, 상기 잔사를 컬럼 크로마토그래피(Analogix, 120g 카트릿지, DCM 중의 0 내지 15% MeOH의 구배)를 통해 정제하였다. 상기 순수한 생성물 함유 분획들을 합하고 감압하에 농축시키고 건조(50℃, 0.2mmHg, 17시간)시켜 밝은 분홍색 발포체 고체(2.15g, 6.35m㏖, 93%)를 수득하였다.
1H-NMR(DMSO-d6) δ = 8.00(s, 1 H, C8-H), 6.03(s, 2 H, NH2), 6.00(d, 1 H, C1'-H), 5.64(d, 1 H, 3'-OH), 5.24(t, 1 H, 5'-OH), 4.24-4.10(m, 5 H, 아제티딘의 N-CH2, C3'-H), 3.90-3.81(m, 2 H, C4'-H 및 C5'-Ha), 3.69-3.64(m, 1 H, C5'-Hb), 2.37(오중선, 2 H, 아제티딘의 중심 CH2), 1.05(d, 3 H, C2'-CH3).
실시예
16. (2S)-
메틸
2-((((2R,3R,4R,5R)-5-(2-아미노-6-(
아제티딘
-1-일)-9H-퓨린-9-일)-4-
플루오로
-3-
하이드록시
-4-
메틸테트라하이드로푸란
-2-일)
메톡시
)(페
녹시
)
포스포릴아미노
)
프로파노에이트
(12)
100㎖ 건조된 둥근 바닥 플라스크에 페닐 디클로로포스페이트(1.72g, 8.15m㏖) 및 무수 디클로로메탄(17㎖)을 첨가하였다. 상기 아미노 에스테르(1.42g, 10.2m㏖)를 첨가하고, 상기 현탁액을 -5℃로 냉각시켰다. N-메틸이미다졸(3.34g, 40.7m㏖)을 시린지를 통해 한꺼번에 첨가하고, 상기 용액을 질소 대기하에 1시간 동안 -5℃에서 교반하였다. 이어서, 상기 뉴클레오시드(8, 1.38g, 4.07m㏖)(발포체 고체)를 한꺼번에 첨가하고, 상기 용액을 1시간에 걸쳐서 주변 온도로 가온하였다. 주변 온도에서 4시간 후, TLC(DCM 중의 5% MeOH)은 불안전한 반응(약 30%의 출발 물질이 남아 있다)을 지시하지만, 또한 극성이 낮은 불순물이 증가하였다. 상기 반응을 포화 NH4Cl(20㎖)의 첨가에 의해 켄칭시키고 디클로로메탄(20㎖)으로 희석하였다. 상기 유기층을 분리시키고 물(5×30㎖) 및 염수(20㎖)로 세척하고 Na2SO4 상에서 건조시켰다. 상기 생성물 함유 용액을 여과시키고 감압하에 농축시켜 미정제 오일성 잔사 3.26g를 수득하였다. 이는 컬럼 크로마토그래피(Analogix, 40g 카트릿지, 0%로부터 10%로의 DCM 중의 MeOH의 구배)에 의해 정제하였다. 상기 생성물을 DCM 중의 4% MeOH에서 용출하였다. 상기 순수한 생성물을 함유하는 분획들을 합하고 감압하에 농축시키고 건조(50℃, 0.2㎜Hg, 17시간)시켜 백색 발포체 고체(1.322g, 2.28m㏖, 56%)를 수득하였다. HPLC 순도 99.25%. 생성물의 NMR 스펙트럼은 상기 생성물이 55:45 비로 혼합한 2개의 부분입체이성체의 혼합물임을 나타내었다.
1H-NMR(DMSO-d6) δ = 7.80(s, 1 H, 한 이성체의 8-H), 7.80(s, 1 H, 다른 이성체의 8-H), 7.38-7.33(m, 2 H, 방향족-H), 7.22-7.14(m, 3 H, 방향족-H), 6.09(s, 2 H, NH2), 6.12-6.02(m, 2 H, C1'-H 및 NH), 5.83(d, 1 H, 한 이성체의 3'-OH), 5.77(d, 1 H, 다른 이성체의 3'-OH), 4.46-4.05(m, 8 H, 아제티딘의 NCH2, 아미노에스테르의 α-H, C3'-H, C4'-H, C5'-Ha), 3.89-3.79(m, 1 H, C5'-Hb), 3.56(s, 3 H, 한 이성체 중의 아미노에스테르의 OCH3), 3.54(s, 3 H, 다른 이성체 중의 아미노에스테르의 OCH3), 2.37(오중선, 2 H, 아제티딘의 중심 CH2), 1.21(d, 3 H, 한 이성체 중의 아미노에스테르의 α-CH3), 1.19(d, 3 H, 다른 이성체 중의 아미노에스테르의 α-CH3), 1.08(d, 3 H, C2'-CH3).
31P NMR(DMSO-d6): δ 4.85(한 이성체), 4.77(나머지 이성체).
실시예
17. (2R,3R,4R,5R)-5-(2-아미노-6-(
벤질옥시
)-9H-퓨린-9-일)-4-
플루오로
-2-(
하이드록시메틸
)-4-
메틸테트라하이드로푸란
-3-올(9)
500㎖의 건조된 둥근 바닥 플라스크에 (2R,3R,4R,5R)-5-(2-아미노-6-클로로-9H-퓨린-9-일)-2-(벤조일옥시메틸)-4-플루오로-4-메틸테트라하이드로푸란-3-일 벤조에이트(6a, 8.0g, 15.2m㏖) 및 무수 벤질 알코올(128㎖)을 첨가하였다. 다른 250㎖의 건조된 둥근 바닥 플라스크에 NaH(광유 중의 60%, 2.44g, 60.8m㏖) 및 무수 DMF(40㎖)를 장전하였다. 상기 현탁액을 얼음 욕조 중에서 0℃에서 교반하였다. 벤질 알코올(27㎖)을 시린지를 통해 적가하였다. 용액이 서서히 형성되며, 이를 실온에서 질소 대기하에 뉴클레오시드 현탁액에 신속하게 전달하였다. 상기 혼합물을 50℃로 가열하고 교반하였다. 상기 반응을 3시간 후 종결시키고 주변 온도로 냉각시켰다. 이를 4N HCl의 첨가에 의해 약 pH=7(12㎖)로 중화시켰다. 상기 용액을 감압하에 농축시켰다(4mbar, 90℃ 욕). 상기 탁한 잔사를 디클로로메탄(100㎖)으로 희석하고 물(3×30㎖) 및 염수(30㎖)로 세척하고 Na2SO4 상에서 건조시켰다. 상기 현탁액을 여과하고, 상기 여과물을 감압하에 농축시켜 오일성 잔사를 수득하였다. 이를 컬럼 크로마토그래피(Analogix, DCM 중의 MeOH의 0 내지 8% 구배)에 의해 정제하였다. 상기 생성물을 DCM 중에서 4% MeOH에서 용출하였다. 상기 생성물을 함유하는 분획들을 합하고 감압하에 농축시키고 건조(50℃, 0.2㎜Hg, 17시간)시켜 백색 발포체 고체(4.57g, 11.7m㏖, 77.2%)를 수득하였다.
1H-NMR(DMSO-d6) δ = 8.18(s, 1 H, 8-H), 7.53-7.51(m, 2 H, 방향족-H), 7.43-7.34(m, 3 H, 방향족-H), 6.66(s, 2 H, NH2), 6.05(d, 1 H, C1'-H), 5.67(d, 1 H, 3'-OH), 5.48(dd, 2 H, 벤질의 CH2), 5.25(t, 1 H, 5'-OH), 4.18(dt, 1 H, C3'-H), 3.92-3.82(m, 2 H, C4'-H 및 C5'-Ha), 3.71-3.66(m, 1 H, C5'- Hb), 1.07(d, 3 H, C2'-CH3).
실시예
18. (2S)-
사이클로펜틸
2-((((2R,3R,4R,5R)-5-(2-아미노-6-(
벤질옥시
)-9H-퓨린-9-일)-4-
플루오로
-3-
하이드록시
-4-
메틸테트라하이드로푸란
-2-일)
메톡시
)(
페녹시
)
포스포릴아미노
)
프로파노에이트
(13)
100㎖ 들이 건조된 둥근 바닥 플라스크에 페닐 디클로로포스페이트(3.29g, 15.58m㏖) 및 무수 디클로로메탄(24㎖)을 장전하였다. 상기 아미노에스테르 토실레이트(백색 분말)를 첨가하고, 상기 용액을 질소하에 -5℃로 냉각시켰다. N-메틸이미다졸(4.92g, 59.94m㏖)을 무수 시린지를 통해 한꺼번에 첨가하고, 상기 생성된 무색 투명한 용액을 1시간 동안 -5℃에서 교반하였다. 이어서, 상기 뉴클레오시드(9) 고체를 질소하에 상기 용액에 한꺼번에 첨가(2.334g, 5.99m㏖)하고, 상기 혼합물을 주변 온도로 가온시켜 무색 용액을 수득하였다. 반응 진행을 TLC(디클로로메탄 중의 5% 메탄올)에 의해 모니터하였다. TLC는 20시간 후 반응이 종결되지 않음을 지시한다(약 30%의 출발 물질이 남았다). 상기 반응은 디클로로메탄(30㎖) 및 1N HCl(60㎖)의 첨가에 의해 여전히 켄칭되었다. 상기 유기층을 분리시키고, 상기 수성층을 디클로로메탄(2×20㎖)으로 추출하였다. 상기 합한 유기층을 물(2×40㎖), 포화 NaHCO3(30㎖), 물 및 염수로 세척하였다. 상기 유기층을 Na2SO4 상에서 건조시켰다. 고체를 여과에 의해 제거한 후, 상기 여과물을 감압하에 농축시켜 고무상 잔사(7.28g)를 수득하였다. 상기 잔사를 컬럼 크로마토그래피(Analogix, 80g 카트릿지, DCM 중의 0 내지 10% MeOH의 구배)를 통해 정제하였다. 상기 생성물을 DCM 중의 2% MeOH에서 용출시켰다. 상기 생성물을 함유하는 분획들을 합하고 감압하에 농축시키고 건조(50℃, 0.2㎜Hg, 17시간)시켜 백색 발포체 고체(2.249g, 2개의 이성체의 60:40 혼합물)를 수득하였다. 출발 뉴클레오시드(0.257g)의 일부를 또한 회수하였다. 수율은 소비된 출발 물질을 기준으로 하여 62%이다.
1H-NMR(DMSO-d6): δ = 7.98(s, 1 H, 한 이성체의 8-H), 7.96(s, 1 H, 다른 이성체의 8-H), 7.52-7.50(m, 2 H, 방향족-H), 7.42-7.31(m, 5 H, 방향족-H), 7.21-7.12(m, 3 H, 방향족-H), 6.68(s, 2 H, NH2), 6.12(d, 1 H, 한 이성체의 C1'-), 6.10(d, 1 H, 다른 이성체의 C1'-H), 6.04-5.96(m, 1 H, NH), 5.87(d, 1 H, 한 이성체의 3'-OH), 5.81(d, 1 H, 다른 이성체의 3'-OH), 5.48(dd, 2 H, 벤질의 CH2), 4.99-4.93(m, 1 H, 아미노에스테르의 α-H), 4.46-4.27(m, 3 H, C3'-H, C4'-H, 아미노에스테르의 OCH), 4.15-4.06(m, 1 H, C5'-Ha), 3.81-3.71(m, 1 H, C5'- Hb), 1.74-1.43(m, 8 H, c-펜틸의 메틸렌 CH2), 1.18(d, 3 H, 아미노에스테르), 1.09(d, 3 H, 한 이성체의 C2'-CH3), 1.08(d, 3 H, 다른 이성체의 C2'-CH3).
31P NMR(DMSO-d6): δ = 4.91(한 이성체), 4.73(나머지 이성체).
실시예
19. (2S)-
사이클로펜틸
2-((((2R,3R,4R,5R)-5-(2-아미노-6-
하이드록시
-9H-퓨린-9-일)-4-
플루오로
-3-
하이드록시
-4-
메틸테트라하이드로푸란
-2-일)
메톡시
)(
페녹시
)
포스포릴아미노
)
프로파노에이트
(14)
출발 물질(13, 1.92g, 2.8m㏖)을 갖는 250㎖ 들이 건조된 둥근 바닥 플라스크에 무수 에탄올(50㎖)을 첨가하였다. 목탄상 팔라듐(10%, 120㎎)을 첨가하였다. 상기 플라스크 내의 대기는 수소와 교환하고, 상기 혼합물을 실온에서 3.5시간 동안 1atm의 수소 기체하에 교반하였다. 상기 반응은 TLC에 의해 종결된 것으로 판단되며, 목탄상 Pd을 여과에 의해 제거하고 에탄올(2×10㎖)로 세척하였다. 상기 여과물을 감압하에 농축시켜 고체 잔사를 수득하였다. 상기 고체를 실리카 겔(10g)과 합하고 컬럼 크로마토그래피(Analogix, 40g 카트릿지, DCM 중의 1% 내지 16% MeOH의 구배)에 의해 정제하였다. 상기 생성물을 함유하는 분획들을 합하고 감압하에 농축시키고 건조(50℃, 0.2㎜Hg, 17시간)시켜 백색 분말(1.43g, 86%)을 수득하였다. HPLC 순도 99.55%. 생성물의 NMR 스펙트럼은 상기 생성물이 60:40의 비로 혼합한 2개의 부분입체이성체의 혼합물임을 나타낸다. Mp = 133 내지 150℃.
1H-NMR(DMSO-d6): δ = 10.70(s, 1 H, 이미드의 NH), 7.81(s, 1 H,한 이성), 7.79(s, 1 H, 다른 이성체의 8-H), 7.38-7.33(m, 2 H, 방향족-H), 7.22-7.14(m, 3 H, 방향족-H), 6.62(s, 2 H, NH2), 6.08-5.97(m, 2 H, Cl'-H 및 아미노에스테르의 NH), 5.88(b, 1 H, 한 이성체의 3'-OH), 5.82(b, 1 H, 다른 이성체의 ), 5.01-4.94(m, 1 H, 아미노에스테르의 α-H), 4.44-4.25(m, 3 H, C3'-H, C4'-H, 아미노에스테르의 OCH), 4.12-4.04(m, 1 H, C5'-Ha), 3.82-3.72(m, 1 H, C5'- Hb), 1.77-1.46(m, 8 H, c-펜틸의 메틸렌 CH2), 1.21-1.19(m, 3 H, 아미노에스테르의 αCH3), 1.09(d, 3 H, 한 이성체의 C2'-CH3), 1.08(d, 3 H, 다른 이성체의 C2'-CH).
31P-NMR(DMSO-d6): δ = 4.95(한 이성체), 4.72(또 다른 이성체).
실시예
20. 화합물(6a)로부터의 (2R,3R,4R,5R)-5-(2-아미노-6-
에톡시
-9H-퓨린-9-일)-4-
플루오로
-2-(
하이드록시메틸
)-4-
메틸테트라하이드로푸란
-3-올(10)
500㎖ 들이 건조된 둥근 바닥 플라스크에 (6a, 11g, 20.92m㏖)를 장전하였다. 무수 에탄올(210㎖)을 첨가한 다음, 무수 K2CO3(28.91g, 209.2m㏖)을 첨가하였다. 상기 현탁액을 교반하고 질소하에 5.5시간 동안 75℃에서 가열하였다. 모든 출발 물질을 TLC 시험에 의해 이 시점에서 소비하였다. 상기 혼합물을 실온으로 냉각시키고, 고체를 여과 제거하였다. 상기 여과물을 빙초산(2.52g)의 첨가에 의해 pH 약 7로 중화시키고 감압하에 농축시켰다. 상기 잔사를 메탄올 중에 용해시키고 실리카 겔(15g)과 혼합하였다. 미정제 생성물 및 실리카 겔의 상기 건조된 혼합물을 빈 카트릿지에 옮기고 컬럼 크로마토그래피(Analogix 220g, DCM 중의 0 내지 15% MeOH의 구배)를 통해 분리시켜 생성물(DCM 중의 5% MeOH)을 백색 발포체 고체(3.73g, 54.5%)로서 수득하였다. 제2의 백색 고체를 컬럼(DCM 중의 10% MeOH, 1.44g)으로부터 단리시키며, 이는 뉴클레오시드의 2개의 이량체의 혼합물이다. 보다 극성이 높은 제3의 백색 고체를 컬럼(DCM 중의 15% MeOH, 0.47g)으로부터 수집하며, 이는 뉴클레오시드의 삼량체의 혼합물이다. 생성물의 HPLC 순도는 99.94%이다.
1H-NMR(DMSO-d6): δ 8.16(s, 1 H, 8-H), 6.55(s, 2 H, NH2), 6.04(d, 1 H, C1'-H), 5.66(d, 1 H, 3'-OH), 5.24(m, 1 H, 5'-OH), 4.44(q, 2 H, 6-OCH2), 4.23-4.08(m, 1 H, C3'-H), 3.91-3.82(m, 2 H, C4'-H 및 C5'-Ha), 3.71-3.66(m, 1 H, C5'- Hb), 1.36(t, 3 H, 에틸의 CH3), 1.06(d, 3 H, C2'-CH3).
실시예
21. 화합물 6b로부터의 (2R,3R,4R,5R)-5-(2-아미노-6-
에톡시
-9H-퓨린-9-일)-4-
플루오로
-2-(
하이드록시메틸
)-4-
메틸테트라하이드로푸란
-3-올(10)
(2R,3R,4R,5R)-5-(2-아미노-6-클로로-9H-퓨린-9-일)-2-(((벤조일)옥시)메틸)-4-플루오로-4-메틸테트라하이드로푸란-3-일 벤조에이트(6b, 9.66g, 18.4m㏖)를 감압하에 무수 에탄올(50㎖)로 공증발시켜 임의의 미량의 메탄올을 제거하였다. 나트륨 에톡사이드 용액을 질소 대기(주의, 수소 기체 방출) 하에 얼음 욕조 중에서 냉각시킨 무수 에탄올(50ml)에 수소화나트륨(광유 중의 60중량%, 2.21g, 55.2m㏖)을 소량의 분획으로 나누어 첨가함으로써 제조하였다. 이를 상기 출발 물질에 첨가하고, 상기 생성된 혼합물을 1시간 동안 가열 환류시킨 다음, 5℃에서 농축 HCl의 첨가에 의해 중화시켰다. 상기 용액을 감압하에 농축시키고, 상기 잔사에 1N HCl(18㎖) 및 디클로로메탄(18㎖)을 첨가하였다. 상기 층들을 분리시키고, 상기 수성층을 디클로로메탄(2×10㎖)으로 세척하였다. 상기 수용액에 에틸 아세테이트를 첨가하고, 포화 탄산나트륨 용액을 첨가하여 수성층의 pH를 약 8로 조절하였다. 상기 유기층을 분리시키고, 상기 수성층을 EtOAc(4×10㎖)로 추출하였다. 상기 합한 유기층을 황산나트륨 상에서 건조시키고 감압하에 농축시켜 담황색 발포체 고체를 수득하였다. 상기 미정제 혼합물을 아세톤(10㎖)로부터 결정화에 의해 정제하여 순수한 생성물을 2개의 수득물로 수득하였다. 상기 합한 고체 생성물을 건조(50℃, 0.2㎜Hg, 24시간)시켜, 크로마토그래피에 의해 정제된 NMR 및 HPLC 매칭 물질을 갖는 5.04g(84%)의 물질을 수득하였다.
실시예
22.
N
6
,
N
6
-
디에틸
-9-((4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
메톡시
-7-
메틸
-테트라하이드로-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2,6-디아민(15에 대한
포스파이트
전구체)
(2R,3R,4R,5R)-5-(2-아미노-6-아제티딘-1-일-퓨린-9-일)-4-플루오로-2-하이드록시메틸-4-메틸-테트라하이드로-푸란-3-올(8, 340㎎, 1.0m㏖)을 주변 온도에서 무수 피리딘(6㎖)에 용해시켰다. 아세토니트릴(5.5㎖, 2.5m㏖) 중의 0.45M 1H-테트라졸의 용액을 첨가한 다음, 비스(N,N-디이소프로필아미노)메틸 포스포르아미데이트(317㎕, 1.1m㏖)을 첨가하였다. 상기 혼합물을 주변 온도에서 17시간 동안 교반하였다. 상기 용매를 감압하에 농축시키고, 상기 잔사를 에틸 아세테이트(20㎖)로 분쇄하였다. 상기 생성된 염의 침전물을 여과에 의해 제거하고, 상기 여과물을 감압하에 농축시켰다. 상기 잔사를 헥산(40-80%) 중의 에틸 아세테이트의 구배를 사용하여 실리카 겔 컬럼 크로마토그래피에 의해 정제하였다. 상기 생성물을 함유하는 분획들을 합하고 농축시켜 백색 고체 47㎎(12% 수율)를 수득하였다.
실시예
23. 6-
아제티딘
-1-일-9-((4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
메톡시
-7-
메틸
-2-옥소-테트라하이드로푸로[3,2-d][1,3,2]디옥사포스피닌-6-일)-9H-퓨린-2-
일아민
(15)
디클로로메탄(2㎖) 중의 사이클릭 포스파이트(47㎎, 0.12m㏖)의 교반된 용액에 77% mCPBA(32㎎, 0.14m㏖)를 주변 온도에서 첨가하였다. 5분 후, 상기 용액을 감압하에 농축시키고, 상기 잔사를 헥산(80-100%) 중의 에틸 아세테이트의 구배를 사용하여 실리카 겔 컬럼 크로마토그래피(4g)에 의해 정제하였다. 상기 순수한 생성물 분획들을 합하고 감압하에 농축시켜 백색 고체 21㎎(43%)를 수득하였다.
1H-NMR(400 MHz, CDCl3): δ = 7.45 및 7.44(2개의 s, 1H), 5.45(d, J=20Hz, 1H), 4.89-4.41(m, 10H), 3.93(겉보기 t, J=13.0Hz, 3H), 2.49(bs, 2H), 1.39(중첩 d, J=22.4Hz, 3H); MS(ESI) m/z 415(M+H)+.
31P-NMR(162 MHz, CDCl3): δ = -1.26, -3.58;
실시예
24. 6-
에톡시
-9-((4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
메톡시
-7-
메틸
-2-옥소-
테트라하이드로
-2,5-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-
일아민
(16)
(2R,3R,4R,5R)-5-(2-아미노-6-에톡시-퓨린-9-일)-4-플루오로-2-하이드록시메틸-4-메틸-테트라하이드로-푸란-3-올(10, 150㎎, 0.46m㏖)을 0℃에서 무수 피리딘(2㎖)에 용해시켰다. 아세토니트릴(2.55㎖) 중의 0.45M 1H-테트라졸의 용액을 첨가한 다음, 비스(N,N-디이소프로필아미노)메틸포스포르아미다이트(0.16㎖, 0.55m㏖)를 첨가하였다. 상기 혼합물을 5시간에 걸쳐서 주변 온도로 서서히 가온하였다. TLC는 반응 종결을 지시하였다. 상기 반응은 물(0.1㎖)의 첨가시 켄칭되었다. 상기 반응 용액을 감압하에 농축시킨 다음, 상기 잔사를 에틸 아세테이트(5㎖)로 분쇄하였다. 상기 생성된 백색 침전물을 여과에 의해 제거하고, 상기 여과물을 감압하에 농축시켰다. 상기 생성된 중간체 사이클릭 포스파이트 잔사를 아세토니트릴(2㎖)에 용해시킨 다음, 주변 온도에서 17시간 동안 t-부틸 하이드로퍼옥사이드(수중 70%, 0.25㎖)로 처리하였다. TLC는 반응 종결을 지시하였다. 상기 반응 용액을 감압하에 농축시키고, 상기 잔사를 컬럼 크로마토그래피(Analogix, DCM 중의 0 내지 10% IPA의 구배 사용)에 의해 정제하였다. 상기 생성물을 함유하는 분획들을 합하고 감압하에 농축시켜 백색 고체 80㎎(34% 수율)을 2개의 부분입체이성체의 약 2:1 혼합물로서 수득하였다.
1H-NMR(400 MHz, DMSO-d6): δ = 8.16(s, 1.5H), 6.65(s, 2H), 6.55(bs, 1H), 6.28(d, J = 20.8 Hz, 1.5H), 4.78-4.60(m, 4.5H), 4.45(q, J = 6.8 Hz, 1H), 4.44(q, J = 6.8 Hz, 2H), 4.28-4.22(m, 1.5H), 3.83(d, J = 11.6 Hz, 1.5H), 3.76(d, J = 11.6 Hz, 3H), 1.36(t, J = 7.2 Hz, 1.5H), 1.36(t, J = 7.2 Hz, 3H), 2.46(d, J = 22.4 Hz, 1.5H), 2.44(d, J = 22.8 Hz, 3H).
31P-NMR(162 MHz, DMSO-d6): δ -3.25, -4.16; tR = 0.86(35.0%), 0.89(64.4%).
LRMS(ESI): [M + H]+ C14H20FN5O6P에 대한 계산값 404.3, 실측값 404.3.
실시예
25. 6-
에톡시
-9-((4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
이소프로폭시
-7-
메틸
-2-옥소-
테트라하이드로
-2,5-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-일 아민(17)
(2R,3R,4R,5R)-5-(2-아미노-6-에톡시-퓨린-9-일)-4-플루오로-2-하이드록시메틸-4-메틸-테트라하이드로-푸란-3-올(10, 150㎎, 0.46m㏖)을 0℃에서 무수 피리딘(2㎖)에 용해시켰다. 아세토니트릴(2.55㎖) 중의 0.45M 1H-테트라졸의 용액을 첨가한 다음, 비스(N,N-디이소프로필아미노)이소프로필포스포르아미다이트(0.16㎖, 0.55m㏖, 1.2당량)을 첨가하였다. 상기 혼합물을 3시간에 걸쳐서 주변 온도로 서서히 가온하였다. TLC는 반응 종결을 지시하였다. 상기 반응은 물(0.1㎖)의 첨가에 의해 켄칭되었다. 상기 반응 용액을 감압하에 농축시킨 다음, 상기 잔사를 에틸 아세테이트(5㎖)로 분쇄시켰다. 상기 생성된 백색 침전물을 여과에 의해 제거하고, 상기 여과물을 감압하에 농축시켰다. 상기 생성된 중간체 사이클릭 포스파이트 잔사를 아세토니트릴(2㎖)에 용해시킨 다음, 주변 온도에서 5시간 동안 t-부틸 하이드로퍼옥사이드(수중 70%, 0.19㎖)로 처리하였다. TLC는 반응 종결을 지시하였다. 상기 반응 용액을 감압하에 농축시키고, 상기 잔사를 컬럼 크로마토그래피(Analogix, DCM 중의 0 내지 5% IPA의 구배 사용)에 의해 정제하였다. 상기 2개의 부분입체이성체가 분리 가능하다. 각각의 부분입체이성체를 함유하는 분획들은 별도로 합하고 감압하에 백색 고체로 농축시켜 20㎎의 각각의 부분입체이성체(합한 수율 20%)를 수득하였다.
RP-17: 1H-NMR(400 MHz, CDCl3) d 7.60(s, 1H, C8-H), 6.02(br d, 1H, J= 19.6 Hz, C1'-H), 5.46(br s, 1H, 3'-H), 4.90(칠중선, 1H, J = 6.4 Hz, CH(CH3)2), 4.84(br s, 2H, NH2), 4.69-4.42(m, 4H, 5'-Ha 및 Hb, CH2CH3), 4.40-4.37(m, 1H, 4'-H), 1.48-1.33(m, 9H, CH(CH3)2) 및 CH2CH3), 1.35(d, 3H, J= 22 Hz, 2'-C-CH3). 31P-NMR(162 MHz, -17.80CDCl3): d -7.18(s). LRMS(ESI) [M + H]+ C16H24FN5O6P에 대한 계산값 432.4, 실측값 432.4. 광학 회전 [a]25 D -80.3(c 1.00, 메탄올). 원소 분석: 계산값: C, 44.15; H, 5.37; N, 16.24. 실측값: C, 44.21; H, 5.21; N, 15.90. 융점 193.5-197.0(분해하며 용융.)
SP-17: 1H-NMR(400 MHz, CDCl3) d 7.58(s, 1H, C8-H), 5.98(br d, 1H, J= 20.0 Hz, C1'-H), 5.78(br s, 1H, 3'-H), 5.10(br s, 2H, NH2), 4.83(칠중선, 1H, J = 6.4 Hz, CH(CH3)2), 4.63-4.48(m, 4H, 5'-Ha 및 Hb, CH2CH3), 4.45-4.38(m, 1H, 4'-H), 1.47-1.21(m, 12H, CH(CH3)2), CH2CH3 및 2'-C-CH3). 31P-NMR(162 MHz, -17.80으로 설정된 CDCl3 중의 트리페닐포스페이트의 외부 표준에 대한 CDCl3) δ -3.74(s). LRMS(ESI) [M + H]+ C16H24FN5O6P에 대한 계산값 432.4, 실측값 432.4.
사이클릭 포스페이트 뉴클레오티드, 17에 대한 다른 합성 방법(반응식 2)
본 발명자들은 화합물 17과 같은 사이클릭 포스페이트 뉴클레오티드는 하기 논의 및 이에 수반되는 반응식에 의해 명시되는 바와 같이 P(Ⅲ)- 또는 P(Ⅴ)-시약을 사용하여 제조될 수 있음을 발견하였다.
활성제로서 1H-테트라졸을 사용하여 뉴클레오시드 10 및 P(Ⅲ)-시약(예: 18)을 혼입시킨 P(Ⅲ)-시약 폐환 반응은 초기에 대략 등몰량의 사이클릭 포스파이트 부분입체이성체 혼합물을 제공하지만, 6 내지 24시간 동안 상승된 반응 온도(50 내지 60℃)를 사용하여 상기 혼합물을 문헌에 보고된 바와 같이 시스 이성체가 우세하게 평형을 이룬다. 본 발명자들은 4,5-디시아노이미다졸, DCI가 이러한 전환율을 가속시키고 초기에 약 80%로부터 6시간 후 40 내지 60℃에서 95%를 초과하는 시스로 평형을 이룸을 발견하였다. 상기 시스-포스파이트 부분입체이성체는 산화시 RP-17을 유도하고, 또한 이러한 부분입체이성체의 유효 수율을 2배가 되게 하며, 또한 SP-17로부터의 정제를 간단하게 한다. 본 발명자들은 미정제 사이클릭 포스파이트 에스테르를 직접 산화시키는 것이 보다 효율적이지만 또한 이들을 단리시킬 수도 있음을 발견하였다. 상기 사이클릭 포스페이트 에스테르는 반응 조건하에 평형을 이루지 않는다.
반응식 2: P(Ⅲ)-시약에 의한
사이클릭
포스페이트
포스페이트
뉴클레오티드
상기 포스파이트 에스테르의 상기 포스페이트 에스테르로의 산화[ox]는 여러 가지 방식으로 수행될 수 있다. m-클로로퍼벤조산, t-부틸하이드로퍼옥사이드, 과산화수소와 같은 퍼옥사이드가 잘 작용하지만, 잠재적으로 폭발성이다. 우레아 과산화수소는 상기 전환율에서 잘 작용되는 보다 안전한 퍼옥사이드 형태이다. TEMPO와 같은 촉매를 사용하거나 사용하지 않으면서 과황산칼륨, 표백, 공기-산화를 사용하는 계획을 세울 수 있다. 본 발명자들은 자동화 올리고뉴클레오티드 합성에서 흔히 사용되는 요오드-THF-피리딘-물을 기본으로 하는 산화 시약을 사용하도록 선택하였다. 상기 반응은 거의 순간적이며, 요오드의 갈색을 기준으로 하여 비색계에 의해 모티터될 수 있다.
다른 한편으로, 상기 부분입체이성체 RP-17 및 SP-17은 반응식 3에 도시된 바와 같이 적절한 P(Ⅴ)-시약을 사용하여 화합물(10)으로부터 바로 제조될 수 있다.
반응식 3: P(Ⅴ)-시약에 의한
사이클릭
포스페이트
뉴클레오티드
P(Ⅴ)-시약을 기본으로 하는 화학반응의 경우, 옥시염화인으로 출발하고 하나의 클로라이드를 이소프로판올로 일치환할 수 있다. 상기 생성된 디클로로포스페이트 이소프로파노에이트 시약 22(그룬제(Grunze) 등의 미국 특허 제2,960,527호)는 진공 증류에 의해 정제될 수 있으며, 이후 뉴클레오시드 10과 반응하여 대략 50 내지 70% 단리된 수율로 RP-17을 바로 형성시켰다. 트리에틸아민 및 N-메틸이미다졸을 사용하는 상기 기술된 조건을 사용하여, 단지 미량의 SP-17이 관찰될 수 있다. 수성 후처리 후 상기 생성된 미정제 생성물은 또한 크로마토그래피에 의한 예비정제 없이 직접 결정화되기가 보다 용이할 수 있다.
SP-17 및 기타 부산물(예: 개환 포스페이트)로부터 RP-17의 정제는 상기 미정제 생성물의 유기 용액을 희석 염기로 세척함으로써 유리 포스페이트 및 활성화 시약을 제거한 다음, 실리카 겔 크로마토그래피, 결정화, 또는 이들 둘 다를 통해 수행될 수 있다. 미리 언급한 바와 같이, 목적하는 생성물 RP-17은 에틸 아세테이트, 아세톤 및 이소프로판올을 포함하는 몇 가지 용매로부터 용이하게 결정화된다. 결정의 전체 형태가 변함에도 불구하고, 상기 세 가지 용매로부터의 결정의 XPRD 연구는 단일 다형체를 나타내는데, 이는 에틸 아세테이트로부터의 단결정 x-선으로부터 수학적으로 예측될 수 있는 바와 동일하다.
상기 사이클릭 포스페이트 에스테르의 합성은 P(Ⅲ)- 또는 P(Ⅴ)-시약을 통해 수행될 수 있다. P(Ⅲ)-시약의 사용을 수반하는 화학반응은 반응식 2에 나타낸 바와 같이 중간체 사이클릭 포스파이트 에스테르에 대한 산화 단계를 필요로 한다. P(Ⅲ)-시약 화학반응에 대해, 바람직한 경로는 인 시약, 이소프로필-N,N, N',N'-테트라이소프로필포스포로디아미다이트(18)을 제조하는 것이며, 상기 인 시약은 시판 중이지는 않지만, 후술되는 바와 같이 3급 아민 염기의 존재하에 시판 중인 클로로-N,N,N',N'-테트라이소프로필포스포로디아미다이트(19)를 이소프로판올과 반응시킴으로써 용이하게 제조될 수 있다. 시약 18은 미정제로서 사용될 수 있거나 진공 증류에 의해 정제될 수 있다. 문헌에 공지된 유사한 화합물, 올리고뉴클레오티드 화학에서 통상적으로 사용되는 2-시아노에틸-N,N,N',N'-테트라이소프로필포스포로디아미다이트을 기본으로 하여, 이소프로판올 또는 그의 트리메틸실릴 에테르를 삼염화인과 반응시켜 디클로로 중간체 20을 형성시킨 다음, 18 또는 모노아민 시약 21로 전환시킴으로써 시약 18을 합성하도록 계획을 세울 수 있다. 중간체 20을 피리딘 중에서 상기 뉴클레오시드와 직접 반응시켜 불량한 수율이기는 하지만 상기 중간체 사이클릭 포스파이트 에스테르를 제조할 수 있다. 시약 18에서 디이소프로필아민기는 산성 및/또는 친핵성 시약에 의한 변위에 대해 활성화될 수 있다. 상기 방법은 올리고뉴클레오티드 및 이들의 뉴클레오시드 포스포르아미다이트 전구체 시약의 자동화 합성에 대한 문헌에 의해 충분히 입증되어 있다. 1H-테트라졸은 역사적으로 가장 통상적으로 사용되는 활성제 시약이지만, 이러한 활성제 시약은 잠재적으로 폭발성인 화합물의 유해 선적 규제로 인해 미국에서 더이상 용이하게 입수할 수 없다. 본 발명자들은 비폭발성인 공지된 활성제 시약 DCI가 본 발명의 사이클릭 포스페이트 에스테르 유도체에 대해 보다 우수한 수율을 제공함을 발견하였다. 5-에틸티오테트라졸 및 이미다졸륨 트리플레이트와 같은 기타 공지된 활성제가 또한 1H-테트라졸과 마찬가지로 작용한다.
반응식 4: 선택된 P(Ⅲ) 시약 및 P(Ⅴ) 시약의 합성
실시예
26. 이소프로필-N,N,
N'
,
N'
-
테트라이소프로필포스포로디아미다이트
(18a)
비스(디이소프로필아미노)클로로포스핀(19, 250.1g, 937m㏖)을 무수 에틸 에테르(3.6ℓ)에 용해시키고, 트리에틸아민(190g, 1.87㏖)을 도입하였다. 상기 혼탁한 혼합물을 0℃에서 냉각시키고, 에테르(200㎖) 중의 2-프로판올(225g, 287㎖)의 용액을 깔때기를 통해 여과하였다. 상기 생성된 탁한 혼합물을 실온에서 5.5시간 동안 교반하였다. 상기 반응은 31P NMR(δ = 116.10 ppm, S)로 점검함으로써 종결되었다. 백색 고체(트리에틸아민 HCl 염)는 여과에 의해 제거되었다. 상기 여과물을 농축시켜 담갈색 액체(272g, 정량적)를 수득하고 추가의 정제 없이 후속 단계에서 사용되었다. P(Ⅲ)-시약은 필요하다면 진공 증류(비점 84-86℃, 5㎜Hg)에 의해 정제하여 무색 투명한 오일을 제공할 수 있음을 유의한다. 1H NMR(CDCl3): δ 3.91(m, 1H), 3.51(m, 4 H), 1.19(d, 6 H, J = 6 Hz), 1.16(24 H, m). 31P NMR(CDCl3): δ 116.1.
실시예
27. 6-
에톡시
-9-((2R,4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
이소프로폭시
-7-메틸-2-옥소-
테트라하이드로
-2λ
5
-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-일아민(17-
R
P
) 및 6-
에톡시
-9-((2S,4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
이소프로폭시
-7-메틸-2-옥소-
테트라하이드로
-2λ
5
-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-일아민(
S
P
-17)
0 내지 5℃에서 아세토니트릴(1000㎖) 중의 (2R,3R,4R,5R)-5-(2-아미노-6-에톡시-9H-퓨린-9-일)-4-플루오로-2-(하이드록시메틸)-4-메틸테트라하이드로푸란-3-올(10, 65.0g, 0.199㏖) 및 4,5-디시아노이미다졸(59g, 496㏖)의 교반된 현탁액에 P(Ⅲ)-시약 18(62.35㎖, 0.199㏖)을 20분에 걸쳐서 적가하였다. 상기 P(Ⅲ)-시약의 첨가가 종결된 후 고체를 용해시키면, 투명한 용액이 관찰되었다. 30분 후, 상기 용액을 실온으로 가온하고 3시간 동안 교반하였다. 이어서, 상기 반응 혼합물을 50℃(욕)에서 6시간 동안 가열하였다. 소량의 분취량의 반응물은 등용적의 CDCl3로 희석되고 P-NMR에 의해 δ 127.91ppm에서 5% 미만의 더 적은 트랜스 이성체를 나타내는 것으로 시험되는 용액이다. 상기 용매를 증발 건조시키고, 상기 잔사를 EtOAc(500㎖)과 함께 교반하여 DCI 염의 백색 고체 현탁액을 형성하였다. 상기 고체를 여과에 의해 제거하고 EtOAc(250㎖)로 세척하였다. 상기 합한 여과물을 농축 건조시켰다. 상기 잔사에 5 내지 10℃에서 30분에 걸쳐서 70:28:2(각각 v/v %) THF:피리딘:H2O(2ℓ) 중의 요오드의 0.1M 용액을 첨가하였다. 2시간 후, 보다 다량의 백색 DCI 염 고체를 여과에 의해 수집하고, 상기 여과물을 감압하에 농축시켰다. 상기 잔사를 에틸 아세테이트(1ℓ)에 용해시키고, TLC에 의해 판단되는 바와 같이 DCI가 대부분 제거될 때까지 10% 수성 나트륨 티오설페이트(200㎖)로 세척한 다음, 포화 수성 NaHCO3(3×250㎖)으로 세척하였다. 상기 유기층을 물(250㎖)로 세척하였다. (또한, 포화 탄산나트륨 용액은 DCI를 보다 효율적으로 제거할 수 있음을 유의한다.) 상기 유기층을 무수 황산나트륨 상에서 건조시키고 여과하며 농축시켜 86g의 발포체를 수득하였다. 이는 총 259m㏖의 출발 뉴클레오시드를 사용하는 2개의 추가의 시행으로부터 유사한 물질과 합하였다. 상기 합한 미정제 발포체는 최소한의 디클로로메탄에 용해시키고 30-75% EtOAc/헥산의 단계 구배를 갖는 6ℓ 소결된 유리 브흐너 깔때기 중에서 3ℓ의 실리카 겔을 사용하여 실리카 겔 크로마토그래피하여, 주요 분획인 발포체로서의 83g의 정제된 생성물과 16g의 부차적인 부분 정제된 분획을 수득하였다. 상기 주요 분획을 에틸 에테르(250㎖)에 현탁시키면 미세한 과립상 고체가 바로 제공되었다. 상기 고체를 여과에 의해 수집하고 건조(40℃, 0.2㎜Hg, 17시간)시켜 20몰%의 에틸 에테르를 함유하는 73.5g의 약간의 회백색 분말을 수득하였다. 상기 고체를 아세톤(200㎖)과 공증발시키고 유사한 방식으로 재건조시켜, 2몰%의 아세톤을 함유하며 HPLC 순도가 98.5%인 71.5g의 백색 고체를 수득하였다. 상기 부차적인 오염된 분획들을 크로마토그래피에 의해 정제하여 80.5g(41%)의 순수한 생성물의 총 회수에 대해 추가로 9.0g을 수득하였다. 상기 목적하는 RP-17 고체의 분획들을 에틸 아세테이트, 이소프로판올 및 아세톤 중의 생성물 용액을 느리게 증발시킴으로써 크고 불규칙한 프리즘으로 재결정화될 수 있다. 적은 분획의 상기 저급 이성체(SP-17 250㎎)를 또한 무정형 백색 발포체 고체로서 단리되었다.
RP-17: 1H-NMR(400 MHz, CDCl3) δ 7.60(s, 1H, C8-H), 6.02(br d, 1H, J= 19.6 Hz, C1'-H), 5.46(br s, 1H, 3'-H), 4.90(칠중선, 1H, J = 6.4 Hz, CH(CH3)2), 4.84(br s, 2H, NH2), 4.69-4.42(m, 4H, 5'-Ha 및 Hb, CH2CH3), 4.40-4.37(m, 1H, 4'-H), 1.48-1.33(m, 9H, CH(CH3)2) 및 CH2CH3), 1.35(d, 3H, J= 22 Hz, 2'-C-CH3). 31P-NMR(162 MHz, -17.80으로 설정된 CDCl3 중의 트리페닐포스페이트의 외부 표준에 대한 CDCl3) δ -7.18(s). LRMS(ESI) [M + H]+ C16H24FN5O6P에 대한 계산값 432.4, 실측값 432.4. 광학 회전 [α]25 D -80.3(c 1.00, 메탄올). 원소 분석: 계산값: C, 44.15; H, 5.37; N, 16.24. 실측값: C, 44.21; H, 5.21; N, 15.90. Mp 193.5-197.0(분해되면서 용융된다)
SP-17: 1H-NMR(400 MHz, CDCl3) δ 7.58(s, 1H, C8-H), 5.98(br d, 1H, J= 20.0 Hz, C1'-H), 5.78(br s, 1H, 3'-H), 5.10(br s, 2H, NH2), 4.83(칠중선, 1H, J = 6.4 Hz, CH(CH3)2), 4.63-4.48(m, 4H, 5'-Ha 및 Hb, CH2CH3), 4.45-4.38(m, 1H, 4'-H), 1.47-1.21(m, 12H, CH(CH3)2), CH2CH3 및 2'-C-CH3). 31P-NMR(162 MHz, -17.80으로 설정된 CDCl3 중의 트리페닐포스페이트의 외부 표준에 대한 CDCl3) δ -3.74(s). LRMS(ESI) [M + H]+ C16H24FN5O6P에 대한 계산값 432.4, 실측값 432.4
P(Ⅴ)-시약 화학반응을 통한 17의 다른 합성
실시예
28. 이소프로필
포스포로디클로리데이트(22)의
합성
디클로로메탄(250㎖) 중의 이소프로필 알코올(38.6㎖, 0.50㏖) 및 트리에틸아민(69.83㎖, 0.50㏖)의 용액을 -5℃에서 25분에 걸쳐서 DCM(250㎖) 중의 POCl3(50.45㎖, 0.551㏖)의 교반된 용액에 적가하였다. 상기 혼합물을 1시간 동안 교반한 후, 상기 용매를 증발시키고, 상기 잔사를 디에틸 에테르(400㎖)에 현탁시켰다. 상기 트리에틸아민 하이드로클로라이드 염을 여과시키고 에테르(100㎖)로 세척하였다. 상기 여과물을 농축시키고, 상기 잔사를 카우-헤드(욕 온도가 30분 내에 85℃로 서서히 상승하였다)로 고진공(약 10㎜Hg)하에 증류시켰다. 상기 요구되는 생성물을 42 내지 48℃(증류 헤드 온도)에서 무색 액체(82.0g, 93% 수율)로서 수집하였다.
반응식 5: 선택된
사이클로포스페이트
뉴클레오티드의 제조
실시예
29.
사이클로부틸
-N,N,
N'
,
N'
-
테트라이소프로필포스포로디아미다이트
(18b) 및
사이클로펜틸
-N,N,
N'
,
N'
-
테트라이소프로필포스포로디아미다이트
(18c)
무수 에틸 에테르(20㎖) 중의 알코올(R7OH, 10m㏖)의 용액에 Et3N(10m㏖)을 첨가한 다음, 클로라이드 1(10m㏖)을 첨가하고, 상기 혼합물을 실온에서 16시간 동안 교반하였다. 고체를 여과에 의해 제거하였다. 용매를 증발시켜 시약 18b( cBuOH의 경우) 및 18c(cPnOH의 겨우)를 수득하고, 이를 추가의 정제 없이 후속 단계에서 사용하였다.
실시예
30. 6-
메톡시
-9-((2R,4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
사이클로부톡시
-7-메틸-2-옥소-
테트라하이드로
-2λ
5
-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-
일아민
(23)
사이클로포스페이트 23의 제조. 건조 아세토니트릴(30㎖) 중의 7(0.63g, 2.00m㏖)의 용액에 디시아노이미다졸(DCI, 0.59g, 5m㏖)을 첨가한 다음, 시약 18b(0.58g, 2.00m㏖)를 첨가하고, 상기 혼합물을 실온에서 30분 동안 교반한 다음, 45℃에서 1시간 동안 교반하였다. 상기 혼합물에 추가의 시약 18b(1m㏖) 및 디시아노이미다졸(1.25m㏖)을 첨가하였다. 상기 생성된 용액을 45℃에서 4시간 동안 교반하였다. 용매를 증발시키고, 상기 잔사를 CH2Cl2(30㎖)에 용해시켰다. 상기 용액에 t-BuOOH(70%, 1㎖)를 첨가한 다음, Na2SO4를 첨가하고, 상기 용액을 건조시켰다. 상기 혼합물을 실온에서 1시간 동안 교반하였다. 톨루엔(20㎖)을 첨가하고, 상기 용매를 증발시키고, 상기 잔사를 EtOAc(150㎖)에 용해시켰다. 상기 용액을 수성 K2CO3으로 세척하여 디아시아노이미다졸을 제거하고 Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 상기 잔사를 실리카 겔 컬럼 크로마토그래피(헥산 중의 0-100% EtOAc)에 의해 정제하여 화합물 23을 백색 고체(0.19g, 22%)로서 수득하였다. δH(400MHz, CDCl3): 7.59(s, 1H), 6.01(d, J = 19.2Hz, 1H), 5.50(br. s, 1H), 4.89(m, 3H), 4.36-4.67(m, 3H), 4.08(s, 3H), 2.23-2.50(m, 4H), 1.67, 1.83(㎜, 2H), 1.34(d, J = 22.0Hz, 3H). MS(ESI): 430(M+H+). 31P(CDCl3): -6.98.
실시예
31. 6-
메톡시
-9-((2R,4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
사이클로펜톡시
-7-메틸-2-옥소-
테트라하이드로
-2λ
5
-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-
일아민
(24)
사이클로포스페이트 24의 제조. 결정질 24의 21% 수율을 수득하면서 18b 대신 18c를 사용하는 점을 제외하고는 상기 과정을 화합물 24의 제조에 적용하였다. δH(400MHz, CDCl3): 7.59(s, 1H), 6.02(d, J = 19.4Hz, 1H), 5.30(br. s, 1H), 5.08(m, 1H), 4.85(br.s, 2H), 4.35-4.66(m, 3H), 4.07(s, 3H), 1.65-1.99(m, 8H), 1.34(d, J = 22.0Hz, 3H). MS(ESI): 444(M+H+). 31P(CDCl3): -6.00.
실시예
32. 6-
에톡시
-9-((2R,4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
이소프로폭시
-7-메틸-2-옥소-
테트라하이드로
-2λ
5
-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-일아민(
R
P
-17)
디클로로메탄(75㎖) 중의 (2R,3R,4R,5R)-5-(2-아미노-6-에톡시-9H-퓨린-9-일)-4-플루오로-2-(하이드록시메틸)-4-메틸테트라하이드로푸란-3-올(10, 5.00g, 15.28m㏖)의 교반된 현탁액에 트리에틸아민(8.52㎖, 61.1m㏖)을 실온에서 첨가하였다. 상기 반응 혼합물을 -30℃로 냉각시킨 다음, 5분에 걸쳐서 이소프로필 포스포로디클로리데이트(22)를 적가하였다. 상기 혼합물을 상기 온도에서 15분 동안 교반한 다음, 5분에 걸쳐서 NMI(2.54㎖, 32.1m㏖)를 적가하였다. 상기 혼합물을 -25℃ 내지 -15℃에서 1시간 동안 교반한 다음, 20시간 내에 실온으로 서서히 가온하였다. 상기 용매를 증발시키고, 상기 잔사를 EtOAc(500㎖)로 분쇄하였다. 상기 회백색 고체를 여과하고 에틸 아세테이트(100㎖)로 세척하였다. 단지 미량(< 2%)의 나머지 이성체 SP-17가 상기 미정제 반응에서 가시화되었다. 상기 여과물을 증발시키고, 상기 잔사는 20-85% 에틸 아세테이트/헥산 구배를 사용하여 크로마토그래피하여 순수한 RP-17을 백색 고체(4.65g, 70.6%% 수율)로서 수득하였다.
크로마토그래피가 아닌 대안적인 단리 방법으로서, 동일한 규모의 반응으로부터의 미정제 반응 혼합물을 디클로로메탄(100㎖)으로 희석시키고 1N HCl(2×100㎖) 및 물(2×50㎖)로 세척하였다. 상기 유기층을 황산나트륨 상에서 건조시키고 여과하며 감압하에 농축시킨 다음, 고진공하에 2시간 동안 농축시켜 5.1g의 미정제 RP-17을 수득하였다. 한 분획의 미정제 물질(750㎎)을 에틸 아세테이트(2,0㎖)에 용해시키고 6시간 동안 교반하면서 가열 환류시켰다. 상기 생성된 현탁액을 주변 온도로 냉각시키고 20시간 동안 교반하였다. 상기 고체를 여과에 의해 수집하고 고진공하에 건조시키고 482㎎(10으로부터의 50% 수율)의 RP-17을 HPLC 순도가 99.03%인 백색 고체로서 수득하였다. 제2 분획(1.0g)을 이소프로판올(2㎖)과 유사한 방식으로 처리하여 671㎎(10으로부터의 52%)의 RP-17을 HPLC 순도가 98.64%인 백색 고체로서 수득하였다.
실시예
33.
R
P
-17의 X-선 결정학
20㎖/g에서 출발하여 주변 온도에서의 느린 부분적 증발을 통해 에틸 아세테이트로부터 결정화된 RP-17, (C16H23N5PO6F)는 a=11.3544(13)Å, b=12.4153(14)Å, c=14.1622(15)Å, V=1996.4(4)Å3, Z=4, 및 d계산값=1.435 g/㎝3을 갖는 사방정계 공간 그룹(조직적인 부재 0k0: k=홀수, 및 h0l: l=홀수)에서 결정화되었다. X-선 세기 데이타는 150(1)K의 온도에서 흑연-단색 Mo-Kα 방사선(λ=0.71073Å)을 사용하는 리가쿠 머큐리(Rigaku Mercury) CCD 영역 측정기 상에서 수집하였다. 예비 인덱싱은 30초 노출되는 일련의 12개의 0.5°회전 이미지로부터 수행되었다. 검측기 거리 35㎜, 2θ 스윙각 -10°, 회전 폭 0.5°, 노출 5초에 대해 하나의 결정으로 총 860개의 회전 이미지가 수집되었다: 스캔 번호 1은 ω = 10° 및 χ = 20°에서 -스캔이 0°내지 310°이고; 스캔 번호 2는 χ = -90°및 = 0°에서 ω-스캔이 -20°내지 20°이며; 스캔 번호 3은 χ = -90°및 = 90°에서 ω-스캔이 -20°내지 20°이며; 스캔 번호 4는 χ = -90°및 = 135°에서 ω-스캔이 -20°내지 20°이었다. 회전 이미지는 크리스탈클리어[CrystalClear: 리가쿠 코포레이션(Rigaku Corporation), 1999]를 사용하여 프로세싱하여 평균이 아닌 F2 및 σ(F2) 값의 목록을 제공하는데, 상기 값은 델 펜티엄(Dell Pentium) 4 컴퓨터 상에서의 추가의 프로세싱 및 구조 분해를 위해 결정구조 프로그램 팩키지를 통과시켰다(CrystalStructure: Crystal Structure Analysis Package, Rigaku Corp. Rigaku/MSC(2002)). 총 23016개의 반사를 2.82≤θ≤25.02°, -13≤h≤13, -14≤k≤14, -16≤l≤16의 범위에 대하여 측정하여 3520개의 독특한 반사도를 수득하였다(Rint = 0.0292). 상기 세기 데이타는 로렌츠(Lorentz) 및 편광 효과에 대해 보정되고, REQAB를 사용하여 흡광도(최소 및 최대 투광율 0.8833, 1.0000)에 대해 보정되었다.
상기 구조는 직접적인 방법(SIR97)(SIR97: Altomare, A., M. Burla, M. Camalli, G. Cascarano, C. Giacovazzo, A. Guagliardi, A.moliterni, G. Polidori & R. Spagna(1999). J. Appl. Cryst., 32, 115-119)에 의해 분해되었다. 정밀도는 SHELXL-97(SHELXL-97: Sheldrick, G.M.(2008) Acta Cryst., A64,112-122)을 사용하는 F2를 기준으로 하는 풀-매트릭스 최소제곱법(full-matrix least square)에 의한 것이다. 모든 반사도가 정밀화 동안 사용되었다. 사용되는 계량 체계는 w=1/[σ2(Fo2)+ 0.0500P2 + 1.0836 P =(Fo 2 + 2Fc 2)/3이었다. 수소가 아닌 원자는 동위원소적으로 정밀화되고, 수소 원자는 라이딩 모델(riding model)을 사용하여 정밀화하였다. 정밀도는 F > 4σ(F)인 3376개의 관찰된 반사도에 대해 R1=0.0417 및 wR2=0.0994로 수렴하고 모두 3520개의 독특한 0이 아닌 반사도 및 268개의 변수들에 대해 R1=0.0440 및 wR2=0.1020 및 GOF =1.063로 수렴하였다(R1 = Σ∥Fo| - |Fc∥/Σ|Fo|; wR2 = [Σw(Fo 2 - Fc 2)2/Σw(Fo 2)2]1/2GOF = [Σw(Fo 2 - Fc 2)2/(n - p)]1/2(여기서, n = 반사도의 수이고, p = 정밀화된 파라미터의 수이다). 최소 제곱의 최종 사이클에서 최대 Δ/σ는 0.009이고, 최종 차분 푸리에에서 2개의 가장 두드러진 피크는 +0.487 및 -0.291 e/Å3이다.
표 1은 셀 정보, 데이타 수집 파라미터, 및 정밀도 데이타를 열거한다. 최종 위치 및 상응하는 동위원소의 열적 파라미터가 표 2에 제공된다. 도 1은 30% 확률의 열적 타원체가 표시되어 있는 RP-17의 ORTEP를 도시한다(ORTEP-Ⅱ: A Fortran Thermal Ellipsoid Plot Program for Crystal Structure Illustrations" C.K. Johnson(1976) ORNL-5138).
| 실험식 | C16H23N5PO6F |
| 식 중량 | 431.36 |
| 온도 | 150(1)K |
| 파장 | 0.71073Å |
| 결정 시스템 | 사방정계 |
| 공간 그룹 | P212121 |
| 셀 상수: | |
| a | 11.3544(13)Å |
| b | 12.4153(14)Å |
| c | 14.1622(15)Å |
| 용적 | 1996.4(4)Å3 |
| Z | 4 |
| 밀도(계산값) | 1.435 Mg/m3 |
| 흡광 계수 | 0.191㎜-1 |
| F(000) | 904 |
| 결정 크기 | 0.42×0.30×0.25㎜3 |
| 데이타 수집에 대한 θ범위 | 2.82 내지 25.02° |
| 인덱스 범위 | -13≤h≤13, -14≤k≤14, -16≤l≤16 |
| 수집된 반사도 | 23016 |
| 독립적인 반사도 | 3520[R(int)=0.0292] |
| θ=25.02°에 대한 완비성 | 99.7% |
| 흡광도 보정 | 상응물로부터의 반실험적 |
| 최대 및 최소 투광율 | 1.0000 및 0.8833 |
| 정밀화 방법 | F2에 대한 풀-매트릭스 최소제곱법 |
| 데이타/제한/파라미터 | 3520/0/268 |
| F2에 대한 적합도 | 1.063 |
| 최종 R 지수[I>2σ(I)] | R1 = 0.0417, wR2 = 0.0994 |
| R 지수(모든 데이타) | R1 = 0.0440, wR2 = 0.1020 |
| 절대 구조 파라미터 | 0.00(12) |
| 최대 차분 피크 및 홀 | 0.487 및 -0.291e.Å-3 |
실시예
34.
R
P
-17의 X-선 분말
회절
RP-17의 샘플을 하기 처방하에 X-선 분말 회절(XRD)에 의해 분석하였다.
a.
브루커
(
Bruker
)
AXS
/
시멘스
(
Siemens
)
D5000
X-선 분말 회절 패턴은 Cu Kα 방사선(40kV, 40mA), θ-θ측각기, V20의 발산 및 수신 슬리트, 흑연 2차 단색화 장치 및 신틸레이션 계수기를 사용하는 시멘스 D5000 회절계 상에서 수집되었다. 상기 장치는 인증된 강옥(Corundum) 표준(NIST 1976)을 사용하여 성능을 점검하였다. 데이타 보정에 사용되는 소프트웨어는 Diffrac Plus SXRD Commander v2.3.1이고, 상기 데이타는 Diffrac Plus EVA v 11.0.0.2 또는 v 13.0.0.2를 사용하여 분석 및 제시되었다.
주변 조건
주변 조건하에 수행되는 샘플은 수용되는 분말을 사용하여 편평한 플레이트 시료로서 제조되었다. 약 35㎎의 샘플을 공동 내로 부드럽게 팩킹하고 연마된 제로-배경(510) 실리콘 웨이퍼로 절단하였다. 상기 샘플을 분석 동안 그 자체의 평면에서 회전시켰다. 상기 데이타 보정의 세부사항은 다음과 같다: 각 범위 2 내지 42˚2θ; 단계 크기 0.05˚2θ; 및 보정 시간: 4s.단계-1 .
b.
브루커
AXS
C2
GADDS
X-선 분말 회절 패턴은 Cu Kα 방사선(40kV, 40mA), 자동화 XYZ 스테이지, 자가-샘플 배치용 레이저 비디오 현미경 및 하이스타(HiStar) 2차원 영역 측정기를 사용하는 브루커 AXS C2 GADDS 회절계 상에서 수집하였다. X-선 광학장치는 0.3㎜의 핀홀 광학기와 커플링된 단일 괴벨(Gobel) 다중층 거울로 이루어진다.
도 2는 RP-17에 대한 XRD 회절 데이타를 도시한다.
표 3은 RP-17에 대한 XRD 회절 데이타 피크를 표로 나타낸 것이다.
실시예
35. 푸리에 변환-적외선(
FT
-
IR
) 분광분석법
RP-17에 대한 데이타는 범용 감쇠 총 반사도(ATR) 샘플링 악세서리가 장착된 퍼킨-엘머(Perkin-Elmer) 스팩트럼 분광계 상에서 수집하였다. 상기 데이타를 수집하고 스펙트럼 v5.0.1 소프트웨어를 사용하여 분석하였다.
RP-17에 대해 수득한 FT-IR 스펙트럼은 도 3에 도시하였다. 파수(㎝-1) 단위의 선택된 피크는 다음과 같다:
∼1607, ∼1581, ∼1295, ∼1250, ∼1238, ∼1229, ∼1079, ∼1065, ∼999, ∼968, ∼902, ∼886, ∼876, ∼855, ∼798, 및 ∼791
반응식 6 : 선택된 동위원소가 풍부한 퓨린 동족체(*는
13
C-
표지된
위치를 지시한다)의 제조
실시예
36. (2R,3R,4R,5R)-5-(2-아미노-6-
에톡시
-9H-퓨린-9-일)-4-
플루오로
-2-(하
이드록시메
틸)-4-
퍼듀테리오
-
13
C-
메틸테트라하이드로푸란
-3-올(33, 화합물 10 참조)
26. 피리딘(10㎖) 및 CH2Cl2(90㎖) 중의 화합물 25(5.70g, 10.5m㏖)의 용액에 TMSCl(3.42g, 31.5m㏖, 3당량)을 0℃에서 첨가하고, 상기 용액을 0℃에서 30분 동안 교반하였다. 상기 생성된 용액에 Ac2O(3.21g, 31.5m㏖, 3당량)을 첨가하고, 상기 용액을 0℃에서 1시간 동안 교반한 다음, 실온에서 2시간 동안 교반하였다. EtOAc(200㎖)를 첨가하고, 상기 혼합물을 염수로 세척하며 Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 상기 잔사를 실리카 겔 컬럼 크로마토그래피(헥산 중의 10-60% EtOAc)에 의해 정제하여 화합물 26(5.0g, 72%)을 수득하였다. δH(400MHz, CDCl3): 8.45(s, 1H), 7.95(s, 1H), 5.93(s, 1H), 4.00-4.41(m, 5H), 2.60(s, 3H), 0.91-1.11(m, 28H), 0.21 s, 9H). MS(ESI): 658(M+H+).
27. THF(100㎖) 중의 화합물 26(5.0g, 7.6m㏖)의 용액에 TsOH.H2O(1g)를 첨가하고, 상기 용액을 실온에서 3시간 동안 교반하고 트리에틸아민으로 중화시켰다. 용매를 증발시키고, 상기 잔사를 실리카 겔 컬럼 크로마토그래피(헥산 중의 10-80% EtOAc)에 의해 정제하여 생성물 27(3.5g, 79%)을 수득하였다. δH(400MHz, CDCl3): 8.21(d, J = 1.2Hz, 1H), 8.00, 8.02(ss, 1H), 6.00(s, 1H), 4.68(t, J = 7.2Hz, 1H), 4.45(d, J = 4.8Hz, 1H), 4.05-4.19(m, 3H), 3.17(s, 1H), 2.54(s, 3H), 1.03-1.10(m, 28H). MS(ESI): 586(M+H+).
28. CH2Cl2(30㎖) 중의 CrO3(2.2g, 21.99m㏖, 3㏖ 당량)의 혼합물에 피리딘(1.74g, 22.0m㏖, 3당량)을 첨가한 다음, Ac2O(2.24g, 22m㏖, 3당량)를 첨가하였다. 상기 생성된 혼합물에 CH2Cl2(10㎖) 중의 화합물 27(4.3g, 7.33m㏖)의 용액을 첨가하고, 상기 혼합물을 실온에서 30분 동안 교반하였다. 상기 혼합물에 EtOAc(200㎖)를 서서히 첨가하고, 상기 혼합물을 실온에서 1시간 동안 교반하였다. 상기 고체를 실리카 겔 패드를 통해 여과하였다. 상기 여과물을 농축 건조시키고, 상기 잔사를 톨루엔과 공증발시켰다. EtOAc(100㎖)를 첨가하고, 상기 혼합물을 실리카 겔 패드를 통해 여과하였다. 상기 여과물을 증발시켰다. 상기 잔사를 톨루엔과 공증발시켜 백색 고체를 수득하였다. 상기 잔사를 실리카 겔 컬럼 크로마토그래피(헥산 중의 5-80% EtOAc)에 의해 정제하여 시럽을 제공하였다. 상기 시럽(수화된 상태)을 톨루엔(2×50㎖)과 공증발시켜 화합물 28을 수득하고, 이를 진공하에 밤새 건조시켰다(유리 케톤, 3.65g, 85%). δH(400MHz, CDCl3): 8.00(s, 1H), 7.86(s, 1H), 5.77(s, 1H), 5.25(d, J = 9.2Hz, 1H), 4.07-4.28(m, 3H), 2.41(s, 3H), 1.06-1.16(m, 28H).
31. 건조된 에틸 에테르(40㎖) 중의 Mg(1.68g, 69.14 m㏖)의 혼합물에 13CD3I(8.70g, 60.00m㏖)의 1/3을 첨가하고, 상기 혼합물을 환류될 때까지 실온에서 교반하였다. 상기 혼합물에 나머지 13CD3I를 상기 반응이 부드러운 환류하에 유지되게 하는 속도로 첨가하였다. 실온으로 냉각시킨 후, 상기 용액을 얼음 욕조 중에서 다른 플라스크로 옮겼다. 상기 시약의 용액에 AlCl3(2.67g, 20.00m㏖)을 첨가하고, 상기 혼합물을 0℃에서 1시간 동안 교반하였다. 에테르를 실온에서 증발시켜 시럽을 수득하였다. 상기 시럽에 CH2Cl2(100㎖)를 첨가하였다. 상기 혼합물에 CH2Cl2(30㎖) 중의 화합물 28(5.84g, 10.00m㏖)의 용액을 0℃에서 서서히 첨가하였다. 상기 용액을 0℃에서 3시간 동안 교반하였다. 상기 반응을 포화 NH4Cl(10㎖)의 첨가에 의해 켄칭시켰다. EtOAc(300㎖)를 첨가하고, 상기 혼합물을 실온에서 10분 동안 교반하였다. 고체를 여과에 의해 제거하였다. 상기 여과물을 염수로 세척하고 Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 상기 잔사를 THF(100㎖) 중에 용해시켰다. 상기 혼합물에 TBAF(30m㏖, THF 중의 1M)를 첨가하고, 상기 용액을 실온에서 2시간 동안 교반하였다. 용매를 증발시키고, 상기 잔사를 실리카 겔 컬럼(CH2Cl2 중의 0-15% MeOH)에 의해 정제하여 뉴클레오시드 30을 수득하고, 이를 피리딘(30㎖) 및 CH2Cl2(100㎖) 중에 용해시켰다. 상기 용액에 Ac2O(3㎖, 과량)를 첨가하고, 상기 혼합물을 0℃에서 16시간 동안 교반하였다. 물(10㎖)을 첨가하고, 상기 혼합물을 실온에서 10분 동안 교반하였다. EtOAc(200㎖)를 첨가하고, 상기 용액을 물 및 염수로 세척하며 Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 잔사를 실리카 겔 컬럼 크로마토그래피(CH2Cl2 중의 0-8% MeOH)에 의해 정제하여 화합물 31을 백색 고체(1.33g, 29.9%)로서 수득하였다. δH(400MHz, CDCl3): 8.28(s, 1H), 8.10(s, 1H), 6.03(d, J = 2.4Hz, 1H), 5.22(d, J = 3.2Hz, 1H), 4.50(m, 2H), 4.24(m, 1H), 4.00(s, 1H), 2.45(s, 3H), 2.20, 2.12(ss, 2×3H). MS(ESI): 446(M+H+).
32. -78℃로 예비냉각된 CH2Cl2(68㎖) 중의 화합물 31(0.68g, 1.53m㏖)의 용액에 DAST(0.74g, 4.59m㏖)를 20분 내에 첨가하고, 상기 용액을 동일한 온도에서 30분 동안 교반한 다음, 실온에서 1시간 동안 교반하였다. EtOAc(200㎖)를 첨가하고, 상기 용액을 수성 NaHCO3 및 염수로 세척하고 Na2SO4 상에서 건조시켰다. 용매를 증발시키고, 상기 잔사를 실리카 겔 컬럼 크로마토그래피(헥산 중의 0-90% EtOAc)에 의해 정제하여 화합물 32(0.21g, 30.6%)을 백색 고체로서 수득하였다. δH(400MHz, CDCl3): 8.26(s, 1H), 8.11(s, 1H), 6.23(d, J = 17.2Hz, 1H), 5.75(m, 1H), 4.39, 4.56(m, 3H), 2.21, 2.17(ss, 2×3H). MS(ESI): 448(M+H+).
33. 건조 EtOH(25㎖)에 EtOH(3.1㎖, 21%, 0.53g, 7.83m㏖) 중의 EtONa를 첨가하였다. 상기 용액에 EtOH(11㎖) 중의 화합물 32(0.35g, 0.78m㏖)의 용액을 첨가하고, 상기 용액을 실온에서 20시간 동안 교반하였다. 상기 반응을 pH 7이 되도록 AcOH로 켄칭시켰다. 용매를 증발시키고, 잔사를 실리카 겔 컬럼 크로마토그래피(CH2Cl2 중의 0-10% MeOH)에 의해 정제하여 화합물 33(0.21g, 81%)을 수득하였다. δH(400MHz, CD3OD): 8.22(s, 1H), 6.15(d, J = 18.0Hz, 1H), 4.52(q, J = 6.8Hz, 2H), 4.38(dd, J = 5.8, 23.6Hz, 1H), 4.03(m, 2H), 3.86(m, 1H). MS(ESI): 332(M+H+).
실시예
37.
R
p
-6-
에톡시
-9-((4
aR
,6R,7R,7
aR
)-7-
플루오로
-2-
이소프로폭시
-7-메틸-
13
CD
3
-2-옥소-
테트라하이드로
-2,5-
푸로[3,2-d][1,3,2]디옥사포스피닌
-6-일)-9H-퓨린-2-일
아민(34)의
합성
건조된 50㎖ 들이 둥근 바닥 플라스크에 205㎎의 뉴클레오시드 33을 장전하였다. 무수 아세토니트릴(4㎖)을 첨가하고, 상기 현탁액을 얼음 욕조 중에서 냉각시켰다. 상기 혼합물에 4,5-디시아노이미다졸(183㎎)을 첨가한 다음, 이소프로필 테트라이소프로필포스포로디아미다이트(209㎎)를 첨가하였다. 이어서, 상기 생성된 투명한 용액을 45℃에서 6시간 동안 가열하였다. 상기 반응 혼합물을 농축시키고, 잔사를 20㎖의 에틸 아세테이트로 분쇄하였다. 백색 고체는 상기 상청액을 피펫 중의 짧은 목면 패드에 통과시킴으로써 제거하였다. 상기 플라스크 및 피펫은 에틸 아세테이트(4×5㎖)로 세정하였다. 상기 합한 용액을 농축시키고, 상기 잔사를 갖는 플라스크를 얼음 욕조 중에서 냉각시켰다. 요오드의 용액(THF, 피리딘 및 물의 혼합물 중의 약 0.1M, 약 8㎖)을 첨가하고, 상기 갈색 용액을 실온에서 5분 동안 교반하였다. 담갈색 용액이 형성될 때까지 나트륨 티오설페이트(10%)의 수용액을 적가하였다. 용매를 제거한 후, 상기 잔사를 에틸 아세테이트(20㎖)로 분쇄하고, 상기 용액을 피펫 중의 목면 패드에 통과시킴으로써 고체를 제거하고, 상기 플라스크 및 피펫을 에틸 아세테이트(4×5㎖)로 세정하였다. 상기 합한 유기 용액을 포화 중탄산나트륨(2×15㎖) 및 포화 탄산나트륨(15㎖)으로 세척하였다. 상기 합한 수성층을 에틸 아세테이트(4×20㎖)로 추출하였다. 상기 합한 유기층을 염수(5㎖)로 세척하고 Na2SO4 상에서 건조시켰다. 용매를 제거하고, 잔사를 컬럼 크로마토그래피(실리카 겔, 헥산 중의 40% EtOAc)에 의해 정제하여 98.7㎎의 생성물 34를 34% 수율로 백색 고체로서 수득하였다. 생성물의 HPLC 순도: 98.23%. 1H NMR(CDCl3): δ 7.59(s, 1 H, 8-H), 6.01(d, 1 H, C1'-H), 5.41(br, 1 H, C3'-H), 4.88(s, 2 H, NH2), 4.85(m, 1 H, 에스테르의 CH), 4.64-4.46(m, 4 H, 6-OCH2, C4'-H 및 C5'-Ha), 4.38-4.32(m, 1 H, C5'-Hb), 1.45-1.41(m, 9 H, CH3s). 31P NMR(CDCl3): δ -5.96.
실시예
38. (2S)-이소프로필-2-((((2R,3R,4R,5R)-5-(2-아미노-6-
메톡시
-9H-퓨린-9-일)-4-
플루오로
-3-
하이드록시
-4-
메틸테트라하이드로푸란
-2-일)
메톡시
)(
페녹
시)
포스포릴아미노
)-2-
듀테리오
-
프로파노에이트
-
d
3
(36)
이소프로필 2,3,3,3-d4 L-알라니네이트, 35. 2,3,3,3-d4 L-알라닌(Aldrich, 7.19g, 77.2m㏖)을 무수 이소프로판올(50㎖)에 첨가하고 질소 대기하에 교반하였다. 티오닐 클로라이드(9.19g, 77.2m㏖)를 15분에 걸쳐서 적가하고, 상기 따뜻한 반응 혼합물을 17시간 동안 가열 환류시켰다. 상기 반응을 감압하에 농축시킨 다음, 아세토니트릴(40㎖)과 공증발 시킨 후, 17시간 동안 건조(25℃, 0.1㎜)시켰다. 3일 동안 정치시킨 후, 한 분획을 결정화시켰다. 에틸 에테르(50㎖)를 첨가하고, 상기 혼합물을 2시간 동안 교반하여 미세한 현탁액으로 부서트렸다. 상기 고체를 여과에 의해 수집하고 에테르(50㎖)로 세척하며 건조(50℃, 0.1㎜)시켜 6.3g(48%)의 생성물을 백색의 빛나는 플레이트로서 수득하였다. 상개 생성물은 후속 단계에서 그대로 사용되었다.
36. 100㎖의 건조된 둥근 바닥 플라스크에 페닐 디클로로포스페이트(1.4당량, 0.47g, 2.24m㏖) 및 무수 디클로로메탄(20㎖)을 부하하였다. L-알라닌의 표지된-아미노산 이소프로필 에스테르 염(1.8당량, 0.492g, 2.88m㏖)을 상기 용액에 첨가하고, 상기 혼합물을 -5℃로 냉각시켰다. 이어서, 무수 디클로로메탄(5㎖) 중의 N-메틸 이미다졸(10당량, 1.26㎖, 15.9m㏖)의 용액을 -5℃에서 건조된 시린지를 통해 신속하게 첨가하고, 상기 용액을 -5℃에서 1시간 동안 교반하였다. 상기 뉴클레오시드(7, 0.5g, 1.6m㏖)를 -5℃에서 한꺼번에 바이알로부터 첨가하고, 상기 고체를 20분 내에 서서히 용해시켰다. 상기 반응 온도를 1시간에 걸쳐서 주변 온도로 상승시키고 밤새 교반하였다. 18시간 후, 상기 반응이 TLC 결과에 의해 확인되는 바와 같이 거의 종결되면, 25㎖의 디클로로메탄으로 희석하였다. HCl 용액(1N, 20㎖)을 첨가하였다. 상기 수성층을 분리하고 디클로로메탄으로 추출하였다. 상기 유기층을 포화 NaHCO3, 물 및 염수로 세척하고 MgSO4 상에서 건조시켰다. 상기 용매를 감압하에 제거한 후, 회백색 발포체를 40g 카트릿지, 및 디클로로메탄 중의 0-3% 메탄올의 구배를 사용하는 자동화 컬럼 크로마토그래피를 통해 정제하여 생성물을 백색 발포체 고체(62% 수율)로서 수득하였다. HPLC 순도 99.6%. 생성물의 NMR 스펙트럼은 상기 생성물이 1:3의 비로 혼합한 2개의 부분입체이성체의 혼합물임을 나타내었다. 1H NMR(DMSO D6): δ 7.97(1 H, s) , 7.95(1 H, s) 7.37-7.31(2 H, m), 7.29-7.20(3 H, m), 6.62(2 H, s), 6.11(1 H, d), 6.06(1 H, d), 6.05-5.97(1 H, m), 5.80(1 H, d), 5.81(1 H, d), 4.87-4.76(1 H, 칠중선), 4.45-4.28(2 H, m), 4.10-4.00(1 H, m), 3.95(3 H, s), 3.82-3.72(2 H, m), 1.13-1.09(6 H, m), 1.03(3 H, d). 31P NMR(CDCl3): δ 5.55, 4.71(1:3); MS, m/e 587(M+1)+.
실시예
39. 생물학적
데이타
HCV 레플리콘 검정. HCV 레플리콘 RNA-함유 Huh7 세포(클론 A 세포; Apath, LLC, 미국 세인트 미주리주 루이스 소재)는 10% 태아 소 혈청, 4 mM L-글루타민 및 1mM 나트륨 피루베이트, 1×비필수 아미노산 및 G418(1,000㎍/ml)을 함유하는 둘베코(Dulbecco) 개질된 이글(Eagle) 매질(고 글루코스)에서 지수 성장으로 유지되었다. 항바이러스 검정은 G418 없이 동일한 매질에서 수행되었다. 세포들은 웰당 1,500개의 세포로 96개의 웰 플레이트에서 시딩하고, 시험 화합물들을 시딩 직후 첨가하였다. 4일 동안 항온처리한다. 상기 항온처리 단계의 종료시, 총 세포상 RNA를 단리시켰다(RNeasy 96 키트; Qiagen). 레플리콘 RNA 및 내부 대조용(TaqMan rRNA 대조용 시약; Applied Biosystems)은 제조업자에 의해 추천되는 바와 같이 단일-단계 멀티플렉스 RT-PCR 프로토콜에서 증폭되었다. 상기 HCV 프라이머 및 탐침을 프라이머 익스프레스 소프트웨어(Primer Express software; 제조원: Applied Biosystems)로 설계하고, 고도로 보존된 5'-비번역 부분(UTR) 서열을 커버한다(감작, 5'-AGCCATGGCGTTAGTA(T)GAGTGT-3', 및 항감작, 5'-TTCCGCAGACCACTATGG-3'; 탐침, 5'-FAM-CCTCCAGGACCCCCCCTCCC-TAMRA-3').
화합물의 항바이러스 효율을 표현하기 위해, 시험 화합물의 역치 RT-PCR 사이클을 약물 비함유 대조용의 평균 역치 RT-PCR 사이클로부터 뺀다(ΔCtHCV). ΔCt 3.3은 레플리콘 RNA 농도에서 1-log 10 감소에 상응한다(90% 유효 농도 [EC90]에 상응한다). 상기 시험 화합물의 세포 독성 또한 상기 ΔCtrRNA 값을 계산함으로써 표현할 수 있다. 이어서, 상기 ΔΔCt 특이성 파라미터가 도입될 수 있으며(ΔCtHCV - ΔCtrRNA), 여기서 HCV RNA의 농도는 rRNA 농도에 대해 표준화되고 약물 비함유 대조용에 대해 검정되었다.
하기 구조로 나타낸 화합물 11, 12, 14, 15, 16 및 17은 상기 검정을 기준으로 하여 이들의 생물학적 특성에 대해 시험되었다.
이들 시험의 결과는 표 4에 기재하였다.
2008년 3월 21자로 출원된 미국 특허 출원 제12/053,015호(WO2008/121634 또한 참조), 2009년 6월 5일자로 출원된 미국 특허 출원 제12/479,075호, 2008년 6월 11일자로 출원된 미국 가특허 출원 제61/060,683호, 및 각각 2008년 12월 23일자로 출원된 미국 가특허 출원 제61/140,423호, 제61/140,441호, 제61/140,317호 및 제61/140,369호의 전문은 인용에 의해 본 발명에 포함된다. 추가로, 본 발명에 기술된 특허 및 비-특허 문헌도 인용에 의해 포함된다. 인용된 내용이 본 발명 명세서에 기재된 용어와 상충되는 용어를 포함하는 경우, 본 발명에 포함된 용어의 의미를 기준으로 하되, 인용된 내용의 전반적인 의미는 소실되지 않는다.
Claims (27)
- 화학식 Ⅰ의 화합물 또는 그의 염, 또는 화학식 Ⅱ의 화합물 또는 그의 염:
화학식 Ⅰ
화학식 Ⅱ
상기에서,
(a) R1은 수소, n-알킬; 분지형 알킬; 사이클로알킬; 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며,
상기 페닐 또는 나프틸은 선택적으로 C1 -6 알킬, C2 -6 알케닐, C2 -6 알키닐, C1 -6 알콕시, F, Cl, Br, I, 니트로, 시아노, C1 -6 할로알킬, -N(R1')2, C1 -6 아실아미노, -NHSO2C1-6 알킬, -SO2N(R1')2, COR1 ", 및 -SO2C1 -6 알킬(여기서, R1'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1 -6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R1 "는 -OR' 또는 -N(R1')2이다) 중의 적어도 하나로 치환되고;
(b) R2는 수소 또는 C1 -10 알킬이거나, R3a 또는 R3b와 R2는 함께 (CH2)n(여기서, n은 2 내지 4이다)이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하고;
(c) R3a 및 R3b는
(ⅰ) 독립적으로 수소, C1 -10 알킬, 사이클로알킬, -(CH2)c(NR3')2, C1 -6 하이드록시알킬, -CH2SH, -(CH2)2S(O)dMe, -(CH2)3NHC(=NH)NH2,(1H-인돌-3-일)메틸,(1H-이미다졸-4-일)메틸, -(CH2)eCOR3 ", 아릴 및 아릴 C1 -3 알킬(상기 아릴기는 선택적으로 하이드록실, C1 -10 알킬, C1 -6 알콕시, 할로겐, 니트로 및 시아노로부터 선택된 기로 치환된다)로부터 선택되거나;
(ⅱ) R3a 및 R3b가 둘 다 C1 -6 알킬이거나;
(ⅲ) R3a와 R3b가 함께 (CH2)f이어서 스피로 환을 형성하거나;
(ⅳ) R3a가 수소이고 R3b와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나;
(ⅴ) R3b가 수소이고 R3a와 R2가 함께 (CH2)n이어서 인접한 N 및 C 원자를 포함하는 사이클릭 환을 형성하거나(여기서, c는 1 내지 6이고, d는 0 내지 2이며, e는 0 내지 3이고, f는 2 내지 5이며, n은 2 내지 4이고, R3'는 독립적으로 수소 또는 C1 -6 알킬이며, R3 "는 -OR' 또는 -N(R3')2이다);
(ⅵ) R3a가 H이고, R3b가 H, CH3, CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이거나;
(ⅶ) R3a가 CH3, -CH2CH3, CH(CH3)2, CH2CH(CH3)2, CH(CH3)CH2CH3, CH2Ph, CH2-인돌-3-일, -CH2CH2SCH3, CH2CO2H, CH2C(O)NH2, CH2CH2COOH, CH2CH2C(O)NH2, CH2CH2CH2CH2NH2, -CH2CH2CH2NHC(NH)NH2, CH2-이미다졸-4-일, CH2OH, CH(OH)CH3, CH2((4'-OH)-Ph), CH2SH 또는 저급 사이클로알킬이고, R3b가 H이며(상기 R3'는 독립적으로 수소이거나 C1 -20 알킬, C1 -10 알킬 또는 C1 -6 알킬을 포함하지만 이에 한정되지는 않는 알킬이고, R3 "는 -OR' 또는 -N(R3')2이다);
(d) R4는 수소, C1 -10 알킬; 저급 알킬, 알콕시, 디(저급 알킬)-아미노, 또는 할로겐으로 선택적으로 치환된 C1 -10 알킬; C1 -10 할로알킬, C3 -10 사이클로알킬, 사이클로알킬 알킬, 사이클로헤테로알킬, 아미노아실, 페닐과 같은 아릴, 피리디닐과 같은 헤테로아릴, 치환된 아릴 또는 치환된 헤테로아릴이고;
(e) R5는 H, 저급 알킬, CN, 비닐, O-(저급 알킬), 하이드록실 저급 알킬, 즉, 하이드록실 메틸(CH2OH)을 포함하는 -(CH2)pOH(여기서, p는 1 내지 6이다), CH2F, N3, CH2CN, CH2NH2, CH2NHCH3, CH2N(CH3)2, 알킨(선택적으로 치환됨), 또는 F, Cl, Br 또는 I를 포함하는 할로겐이고;
(f) R6은 H, CH3, CH2F, CHF2, CF3, F, CN, 비닐 또는 에티닐이고;
(g) R7은 수소, n-알킬, 분지형 알킬, 사이클로알킬, 알크아릴 또는 아릴이고, 상기 아릴은 페닐 또는 나프틸을 포함하지만 이에 한정되는 것은 아니며, 상기 페닐 또는 나프틸은 선택적으로 H, F, Cl, Br, I, OH, OR7', SH, SR7', NH2, NHR7', NR7' 2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R7', CONH2, CONHR7', CONR7' 2, CH=CHCO2H, 또는 CH=CHCO2R7'(여기서, R7'는 C1 -10 알킬, C3 -7 사이클로알킬, C2 -10 알케닐, C2 -10 알키닐 및 C1 -10 알콕시알킬을 포함하지만 이에 한정되는 것은 아닌 선택적으로 치환된 알킬, 사이클로알킬, 알케닐, 알키닐 또는 알콕시알킬이다) 중의 적어도 하나로 치환되고;
(h) X는 H, OH, OMe, 할로겐, CN, NH2 또는 N3이고;
(i) Y는 OH이고;
(j) Z는 N 또는 CR10이고;
(k) R8 및 R9는 독립적으로 H, F, Cl, Br, I, OH, OR', SH, SR', NH2, NHR', NR'2, 질소 헤테로사이클, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 저급 알케닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C≡CH와 같은 C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H 또는 CH=CHCO2R'이고; 및
(l) R10은 H, 할로겐(F, Cl, Br, I 포함), OH, OR', SH, SR', NH2, NHR', NR'2, NO2, C1-C6의 저급 알킬, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알킬, C2-C6의 저급 알케닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알케닐, C2-C6의 저급 알키닐, C2-C6의 할로겐화(F, Cl, Br, I) 저급 알키닐, C1-C6의 저급 알콕시, C1-C6의 할로겐화(F, Cl, Br, I) 저급 알콕시, CO2H, CO2R', CONH2, CONHR', CONR'2, CH=CHCO2H, 또는 CH=CHCO2R'이고;
상기 R'는 선택적으로 치환된 C1 -20 알킬, 선택적으로 치환된 C1 -10 알킬, 선택적으로 치환된 저급 알킬을 포함하지만 이에 한정되지는 않는 선택적으로 치환된 알킬; 선택적으로 치환된 사이클로알킬; 알크아릴; C2-C6의 선택적으로 치환된 알키닐; C2-C6의 선택적으로 치환된 저급 알케닐; 또는 C(O)알킬, C(O)(C1 -20 알킬), C(O)(C1-10 알킬), 또는 C(O)(저급 알킬)을 포함하지만 이에 한정되지는 않는 선택적으로 치환된 아실이다. - 청구항 2에 있어서,
R4는 Me, Et, iPr, cPr, cBu 또는 cPn이고, R8은 OMe, OEt, OiPr, OcPr, OcBu, 또는 OcPn인 화학식 Ⅰ의 화합물 또는 그의 염. - 청구항 3의 화합물 또는 그의 염을 포함하는 조성물.
- 청구항 3의 화합물 또는 그의 염을 포함하는 약학적 조성물.
- 바이러스 감염원에 의해 야기된 증상의 치료를 필요로 하는 환자에게 치료학적 유효량의 청구항 3의 화합물 또는 그의 염을 투여하는 단계를 포함하는 바이러스 감염원에 의해 야기된 증상의 치료방법.
- 바이러스 감염원에 의해 야기된 증상을 치료하기 위한 약제의 제조에 있어서의 청구항 3의 화합물 또는 그의 염의 용도.
- 청구항 8에 있어서,
R7은 Me, Et, iPr, cPr, cBu 또는 cPn이고, R8은 OMe, OEt, OiPr, OcPr, OcBu 또는 OcPn인 화합물 또는 그의 염. - 청구항 9의 화합물 또는 그의 염을 포함하는 조성물.
- 청구항 9의 포스포르아미데이트 뉴클레오시드 또는 그의 염을 포함하는 약학적 조성물.
- 바이러스 감염원에 의해 야기된 증상의 치료를 필요로 하는 환자에게 치료학적 유효량의 청구항 9의 화합물 또는 그의 염을 투여하는 단계를 포함하는 상기 증상의 치료방법.
- 바이러스 감염원에 의해 야기된 증상을 치료하기 위한 약제의 제조에 있어서의 청구항 9의 화합물 또는 그의 염의 용도.
- 청구항 18에 있어서,
R5는 H이고, R6은 CH3이며, R9는 NH2이고, R11은 4-클로로-벤조일이며, X는 F이고, X"는 Cl이며, Z는 N인 화학식 Ⅵ의 화합물 또는 그의 염. - 결정질 RP-17.
- 약 12.2에서 XRD 2θ-반사도(°)를 갖는 결정질 RP-17.
- 사방정계 결정질 RP-17.
- 약 999㎝-1에서 FT-IR 피크를 갖는 결정질 RP-17.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US14031708P | 2008-12-23 | 2008-12-23 | |
| US61/140,317 | 2008-12-23 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110104074A true KR20110104074A (ko) | 2011-09-21 |
Family
ID=41683220
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117017244A KR20110104074A (ko) | 2008-12-23 | 2009-12-23 | 퓨린 뉴클레오시드의 합성 |
Country Status (19)
| Country | Link |
|---|---|
| US (2) | US8716263B2 (ko) |
| EP (2) | EP2671888A1 (ko) |
| JP (4) | JP5793084B2 (ko) |
| KR (1) | KR20110104074A (ko) |
| CN (1) | CN102325783A (ko) |
| AR (1) | AR074977A1 (ko) |
| AU (1) | AU2009329872B2 (ko) |
| BR (1) | BRPI0923815A2 (ko) |
| CA (1) | CA2748016A1 (ko) |
| CL (1) | CL2009002206A1 (ko) |
| CO (1) | CO6400228A2 (ko) |
| EA (1) | EA019295B1 (ko) |
| IL (1) | IL213701A0 (ko) |
| MX (1) | MX2011006892A (ko) |
| NZ (1) | NZ593647A (ko) |
| PA (1) | PA8855801A1 (ko) |
| SG (2) | SG172363A1 (ko) |
| TW (1) | TW201031675A (ko) |
| WO (1) | WO2010075554A1 (ko) |
Families Citing this family (70)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MY164523A (en) | 2000-05-23 | 2017-12-29 | Univ Degli Studi Cagliari | Methods and compositions for treating hepatitis c virus |
| KR20050088079A (ko) | 2002-11-15 | 2005-09-01 | 이데닉스 (케이만) 리미티드 | 2'-분지형 뉴클레오시드 및 플라비비리다에 돌연변이 |
| CA2734052A1 (en) | 2003-05-30 | 2005-01-13 | Pharmasset, Inc. | Modified fluorinated nucleoside analogues |
| US7964580B2 (en) | 2007-03-30 | 2011-06-21 | Pharmasset, Inc. | Nucleoside phosphoramidate prodrugs |
| US8173621B2 (en) | 2008-06-11 | 2012-05-08 | Gilead Pharmasset Llc | Nucleoside cyclicphosphates |
| EA201100851A1 (ru) * | 2008-12-23 | 2012-04-30 | Фармассет, Инк. | Аналоги нуклеозидов |
| NZ593648A (en) | 2008-12-23 | 2013-09-27 | Gilead Pharmasset Llc | Nucleoside phosphoramidates |
| CL2009002206A1 (es) | 2008-12-23 | 2011-08-26 | Gilead Pharmasset Llc | Compuestos derivados de pirrolo -(2-3-d]-pirimidin-7(6h)-tetrahidrofuran-2-il fosfonamidato, composicion farmaceutica; y su uso en el tratamiento de enfermedades virales. |
| US8618076B2 (en) | 2009-05-20 | 2013-12-31 | Gilead Pharmasset Llc | Nucleoside phosphoramidates |
| TWI576352B (zh) | 2009-05-20 | 2017-04-01 | 基利法瑪席特有限責任公司 | 核苷磷醯胺 |
| BR112012024884A2 (pt) | 2010-03-31 | 2016-10-18 | Gilead Pharmasset Llc | síntese estereosseletiva de ativos contendo fósforo |
| US8563530B2 (en) | 2010-03-31 | 2013-10-22 | Gilead Pharmassel LLC | Purine nucleoside phosphoramidate |
| WO2012040124A1 (en) | 2010-09-22 | 2012-03-29 | Alios Biopharma, Inc. | Azido nucleosides and nucleotide analogs |
| AR084044A1 (es) | 2010-11-30 | 2013-04-17 | Pharmasset Inc | Compuestos 2’-espiro-nucleosidos |
| AU2011349278C1 (en) * | 2010-12-22 | 2017-01-19 | Alios Biopharma, Inc. | Cyclic nucleotide analogs |
| WO2012142093A2 (en) * | 2011-04-13 | 2012-10-18 | Merck Sharp & Dohme Corp. | 2'-cyano substituted nucleoside derivatives and methods of use thereof for the treatment of viral diseases |
| WO2013039920A1 (en) | 2011-09-12 | 2013-03-21 | Idenix Pharmaceuticals, Inc. | Substituted carbonyloxymethylphosphoramidate compounds and pharmaceutical compositions for the treatment of viral infections |
| CN104244945B (zh) | 2011-09-16 | 2016-08-31 | 吉利德制药有限责任公司 | 用于治疗hcv的方法 |
| EP2768838A1 (en) | 2011-10-14 | 2014-08-27 | IDENIX Pharmaceuticals, Inc. | Substituted 3',5'-cyclic phosphates of purine nucleotide compounds and pharmaceutical compositions for the treatment of viral infections |
| US8889159B2 (en) | 2011-11-29 | 2014-11-18 | Gilead Pharmasset Llc | Compositions and methods for treating hepatitis C virus |
| PL2794627T3 (pl) | 2011-12-22 | 2019-04-30 | Alios Biopharma Inc | Podstawione nukleozydy, nukleotydy i ich analogi |
| US9441007B2 (en) | 2012-03-21 | 2016-09-13 | Alios Biopharma, Inc. | Substituted nucleosides, nucleotides and analogs thereof |
| USRE48171E1 (en) | 2012-03-21 | 2020-08-25 | Janssen Biopharma, Inc. | Substituted nucleosides, nucleotides and analogs thereof |
| AP3913A (en) | 2012-05-22 | 2016-11-26 | Idenix Pharamaceuticals Inc | D-amino acid compounds for liver disease |
| WO2013177188A1 (en) | 2012-05-22 | 2013-11-28 | Idenix Pharmaceuticals, Inc. | 3',5'-cyclic phosphoramidate prodrugs for hcv infection |
| EP2852605B1 (en) | 2012-05-22 | 2018-01-31 | Idenix Pharmaceuticals LLC | 3',5'-cyclic phosphate prodrugs for hcv infection |
| UY34824A (es) | 2012-05-25 | 2013-11-29 | Janssen R & D Ireland | Nucleósidos de espirooxetano de uracilo |
| EP2900682A1 (en) | 2012-09-27 | 2015-08-05 | IDENIX Pharmaceuticals, Inc. | Esters and malonates of sate prodrugs |
| PE20151318A1 (es) * | 2012-10-08 | 2015-10-03 | Idenix Pharmaceuticals Inc | Analogos de 2'-cloro nucleosido para infeccion por vhc |
| US10723754B2 (en) | 2012-10-22 | 2020-07-28 | Idenix Pharmaceuticals Llc | 2′,4′-bridged nucleosides for HCV infection |
| EP2935304A1 (en) | 2012-12-19 | 2015-10-28 | IDENIX Pharmaceuticals, Inc. | 4'-fluoro nucleosides for the treatment of hcv |
| KR102327888B1 (ko) | 2012-12-21 | 2021-11-17 | 얀센 바이오파마, 인코퍼레이트. | 치환된 뉴클레오사이드, 뉴클레오타이드 및 그것의 유사체 |
| DK2950786T3 (da) | 2013-01-31 | 2020-02-17 | Gilead Pharmasset Llc | Kombinationsformulering af to antivirale forbindelser |
| US10034893B2 (en) | 2013-02-01 | 2018-07-31 | Enanta Pharmaceuticals, Inc. | 5, 6-D2 uridine nucleoside/tide derivatives |
| WO2014137926A1 (en) | 2013-03-04 | 2014-09-12 | Idenix Pharmaceuticals, Inc. | 3'-deoxy nucleosides for the treatment of hcv |
| US9339541B2 (en) | 2013-03-04 | 2016-05-17 | Merck Sharp & Dohme Corp. | Thiophosphate nucleosides for the treatment of HCV |
| WO2014160484A1 (en) | 2013-03-13 | 2014-10-02 | Idenix Pharmaceuticals, Inc. | Amino acid phosphoramidate pronucleotides of 2'-cyano, azido and amino nucleosides for the treatment of hcv |
| US9187515B2 (en) | 2013-04-01 | 2015-11-17 | Idenix Pharmaceuticals Llc | 2′,4′-fluoro nucleosides for the treatment of HCV |
| WO2014186637A1 (en) * | 2013-05-16 | 2014-11-20 | Riboscience Llc | 4'-fluor0-2'-methyl substituted nucleoside derivatives |
| US20180200280A1 (en) | 2013-05-16 | 2018-07-19 | Riboscience Llc | 4'-Fluoro-2'-Methyl Substituted Nucleoside Derivatives as Inhibitors of HCV RNA Replication |
| EP3004130B1 (en) | 2013-06-05 | 2019-08-07 | Idenix Pharmaceuticals LLC. | 1',4'-thio nucleosides for the treatment of hcv |
| DK3013843T3 (en) | 2013-06-26 | 2018-09-03 | Alios Biopharma Inc | SUBSTITUTED NUCLEOSIDES, NUCLEOTIDES AND ANALOGS THEREOF |
| WO2015017713A1 (en) | 2013-08-01 | 2015-02-05 | Idenix Pharmaceuticals, Inc. | D-amino acid phosphoramidate pronucleotides of halogeno pyrimidine compounds for liver disease |
| ES2792503T3 (es) | 2013-08-27 | 2020-11-11 | Gilead Pharmasset Llc | Formulación combinada de dos compuestos antivirales |
| UA117375C2 (uk) | 2013-09-04 | 2018-07-25 | Медівір Аб | Інгібітори полімерази hcv |
| SG10201804835VA (en) | 2013-10-11 | 2018-07-30 | Alios Biopharma Inc | Substituted nucleosides, nucleotides and analogs thereof |
| WO2015056213A1 (en) | 2013-10-17 | 2015-04-23 | Medivir Ab | Hcv polymerase inhibitors |
| WO2015061683A1 (en) * | 2013-10-25 | 2015-04-30 | Idenix Pharmaceuticals, Inc. | D-amino acid phosphoramidate and d-alanine thiophosphoramidate pronucleotides of nucleoside compounds useful for the treatment of hcv |
| EP3083654A1 (en) * | 2013-12-18 | 2016-10-26 | Idenix Pharmaceuticals LLC | 4'-or nucleosides for the treatment of hcv |
| EP3131914B1 (en) | 2014-04-16 | 2023-05-10 | Idenix Pharmaceuticals LLC | 3'-substituted methyl or alkynyl nucleosides for the treatment of hcv |
| WO2016033164A1 (en) | 2014-08-26 | 2016-03-03 | Enanta Pharmaceuticals, Inc. | Nucleoside and nucleotide derivatives |
| US10251903B2 (en) | 2014-10-20 | 2019-04-09 | Merck Sharp & Dohme Corp. | Process for making nucleoside phosphoramidate compounds |
| WO2016073756A1 (en) | 2014-11-06 | 2016-05-12 | Enanta Pharmaceuticals, Inc. | Deuterated nucleoside/tide derivatives |
| US9732110B2 (en) | 2014-12-05 | 2017-08-15 | Enanta Pharmaceuticals, Inc. | Nucleoside and nucleotide derivatives |
| MY190867A (en) | 2015-03-06 | 2022-05-13 | Atea Pharmaceuticals Inc | ? -d-2'-deoxy-2'-?-fluoro-2'- ? -c-substituted-2-modified-n6-substituted purine nucleotides for hcv treatment |
| BR112017019409A2 (pt) * | 2015-03-09 | 2018-04-24 | Grace W R & Co | forma cristalina de ribosídeo de nicotinamida |
| JP7005508B2 (ja) * | 2016-03-24 | 2022-01-21 | ノバルティス アーゲー | ヒトライノウイルスの阻害剤としてのアルキニルヌクレオシド類似体 |
| WO2017197055A1 (en) | 2016-05-10 | 2017-11-16 | C4 Therapeutics, Inc. | Heterocyclic degronimers for target protein degradation |
| CN109562113A (zh) | 2016-05-10 | 2019-04-02 | C4医药公司 | 用于靶蛋白降解的螺环降解决定子体 |
| WO2017197046A1 (en) | 2016-05-10 | 2017-11-16 | C4 Therapeutics, Inc. | C3-carbon linked glutarimide degronimers for target protein degradation |
| US10202412B2 (en) | 2016-07-08 | 2019-02-12 | Atea Pharmaceuticals, Inc. | β-D-2′-deoxy-2′-substituted-4′-substituted-2-substituted-N6-substituted-6-aminopurinenucleotides for the treatment of paramyxovirus and orthomyxovirus infections |
| LU100724B1 (en) | 2016-07-14 | 2018-07-31 | Atea Pharmaceuticals Inc | Beta-d-2'-deoxy-2'-alpha-fluoro-2'-beta-c-substituted-4'-fluoro-n6-substituted-6-amino-2-substituted purine nucleotides for the treatment of hepatitis c virus infection |
| EA037868B1 (ru) | 2016-09-07 | 2021-05-28 | Атеа Фармасьютикалс, Инк. | 2'-замещенные-n6-замещенные пуриновые нуклеотиды для лечения вызванных рнк-вирусом заболеваний |
| JP7066728B2 (ja) | 2017-02-01 | 2022-05-13 | アテア ファーマシューティカルズ, インコーポレイテッド | C型肝炎ウイルスの治療のためのヌクレオチドヘミ硫酸塩 |
| JP7299897B2 (ja) | 2017-09-21 | 2023-06-28 | リボサイエンス リミティド ライアビリティ カンパニー | Hcvのrna複製阻害剤としての4’-フルオロ-2’-メチル置換ヌクレオシド誘導体 |
| CA3086535A1 (en) | 2017-12-22 | 2019-06-27 | Elysium Health, Inc. | Crystalline forms of nicotinamide riboside chloride |
| CN112351799A (zh) | 2018-04-10 | 2021-02-09 | 阿堤亚制药公司 | 具有硬化的hcv感染患者的治疗 |
| US10874687B1 (en) | 2020-02-27 | 2020-12-29 | Atea Pharmaceuticals, Inc. | Highly active compounds against COVID-19 |
| CN111253454B (zh) * | 2020-03-19 | 2022-03-08 | 江苏工程职业技术学院 | 一种抗丙肝药物索非布韦的制备方法 |
| CN114686188B (zh) * | 2020-12-31 | 2023-05-02 | 中石化石油工程技术服务有限公司 | 一种核苷磷脂钻井液润滑剂及其制备方法 |
Family Cites Families (449)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2512572A (en) | 1950-06-20 | Substituted pteridines and method | ||
| US2563707A (en) | 1947-12-12 | 1951-08-07 | American Cyanamid Co | Process for preparing pteridines |
| GB768821A (en) | 1954-05-17 | 1957-02-20 | Gruenenthal Chemie | Novel products of the amino-piperidine-2, 6-dione series |
| US2759300A (en) | 1954-08-11 | 1956-08-21 | Pest Control Ltd | Method and means for introducing a predetermined amount of a poisonous material beneath the surface of the soil |
| US3053865A (en) | 1958-03-19 | 1962-09-11 | Merck & Co Inc | Novel 16-alkyl and 16-alkylene steroids and processes |
| US2960527A (en) | 1958-08-20 | 1960-11-15 | Akad Wissenschaften Ddr | Process for the preparation of dichloro phosphoric esters |
| US3097137A (en) | 1960-05-19 | 1963-07-09 | Canadian Patents Dev | Vincaleukoblastine |
| US3104246A (en) | 1961-08-18 | 1963-09-17 | Roussel Uclaf | Process of preparation of beta-methasone |
| FR1533151A (fr) | 1962-05-18 | 1968-07-19 | Rhone Poulenc Sa | Nouvel antibiotique et sa préparation |
| NL6613143A (ko) | 1965-09-21 | 1967-03-22 | ||
| YU33730B (en) | 1967-04-18 | 1978-02-28 | Farmaceutici Italia | Process for preparing a novel antibiotic substance and salts thereof |
| US3480613A (en) | 1967-07-03 | 1969-11-25 | Merck & Co Inc | 2-c or 3-c-alkylribofuranosyl - 1-substituted compounds and the nucleosides thereof |
| CH514578A (de) | 1968-02-27 | 1971-10-31 | Sandoz Ag | Verfahren zur Herstellung von Glucosiden |
| JPS4716483Y1 (ko) | 1969-03-01 | 1972-06-09 | ||
| US3798209A (en) | 1971-06-01 | 1974-03-19 | Icn Pharmaceuticals | 1,2,4-triazole nucleosides |
| USRE29835E (en) | 1971-06-01 | 1978-11-14 | Icn Pharmaceuticals | 1,2,4-Triazole nucleosides |
| US3849397A (en) | 1971-08-04 | 1974-11-19 | Int Chem & Nuclear Corp | 3',5'-cyclic monophosphate nucleosides |
| US3994974A (en) | 1972-02-05 | 1976-11-30 | Yamanouchi Pharmaceutical Co., Ltd. | α-Aminomethylbenzyl alcohol derivatives |
| US3852267A (en) | 1972-08-04 | 1974-12-03 | Icn Pharmaceuticals | Phosphoramidates of 3{40 ,5{40 -cyclic purine nucleotides |
| ZA737247B (en) | 1972-09-29 | 1975-04-30 | Ayerst Mckenna & Harrison | Rapamycin and process of preparation |
| BE799805A (fr) | 1973-05-23 | 1973-11-21 | Toyo Jozo Kk | Nouvel agent immunosuppresseur et sa preparation |
| JPS535678B2 (ko) | 1973-05-30 | 1978-03-01 | ||
| US3991045A (en) | 1973-05-30 | 1976-11-09 | Asahi Kasei Kogyo Kabushiki Kaisha | N4 -acylarabinonucleosides |
| US3888843A (en) | 1973-06-12 | 1975-06-10 | Toyo Jozo Kk | 4-carbamoyl-1-' -d-ribofuranosylimidazolium-5-olate |
| SU508076A1 (ru) | 1973-07-05 | 1976-10-05 | Институт По Изысканию Новых Антибиотиков Амн Ссср | Способ получени карминомицина 1 |
| GB1457632A (en) | 1974-03-22 | 1976-12-08 | Farmaceutici Italia | Adriamycins |
| US3923785A (en) | 1974-04-22 | 1975-12-02 | Parke Davis & Co | (R)-3-(2-deoxy-{62 -D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo{8 4,5-d{9 {8 1,3{9 diazepin-8-ol |
| GB1467383A (en) | 1974-06-12 | 1977-03-16 | Farmaceutici Italia | Daunomycin analogues |
| US4199574A (en) | 1974-09-02 | 1980-04-22 | Burroughs Wellcome Co. | Methods and compositions for treating viral infections and guanine acyclic nucleosides |
| GB1523865A (en) | 1974-09-02 | 1978-09-06 | Wellcome Found | Purine compunds and salts thereof |
| GB1509875A (en) | 1976-06-14 | 1978-05-04 | Farmaceutici Italia | Optically active anthracyclinones and anthracycline glycosides |
| US4197249A (en) | 1977-08-15 | 1980-04-08 | American Cyanamid Company | 1,4-Bis(substituted-amino)-5,8-dihydroxyanthraquinones and leuco bases thereof |
| SE445996B (sv) | 1977-08-15 | 1986-08-04 | American Cyanamid Co | Nya atrakinonderivat |
| US4203898A (en) | 1977-08-29 | 1980-05-20 | Eli Lilly And Company | Amide derivatives of VLB, leurosidine, leurocristine and related dimeric alkaloids |
| US4210745A (en) | 1978-01-04 | 1980-07-01 | The United States Of America As Represented By The Department Of Health, Education And Welfare | Procedure for the preparation of 9-β-D-arabinofuranosyl-2-fluoroadenine |
| US4303785A (en) | 1978-08-05 | 1981-12-01 | Zaidan Hojin Biseibutsu Kagaku Kenkyu Kai | Antitumor anthracycline antibiotics |
| US4307100A (en) | 1978-08-24 | 1981-12-22 | Agence Nationale De Valorisation De La Recherche (Anvar) | Nor bis-indole compounds usable as medicaments |
| DK160616C (da) | 1979-02-03 | 1991-09-02 | Zaidan Hojin Biseibutsu | Fremgangsmaade til fremstilling af anthracyclinderivater eller syreadditionssalte deraf |
| US4418068A (en) | 1981-04-03 | 1983-11-29 | Eli Lilly And Company | Antiestrogenic and antiandrugenic benzothiophenes |
| NZ200204A (en) | 1981-04-03 | 1985-05-31 | Lilly Co Eli | Benzothiophene derivatives and process for preparation |
| US4355032B2 (en) | 1981-05-21 | 1990-10-30 | 9-(1,3-dihydroxy-2-propoxymethyl)guanine as antiviral agent | |
| JPS58219196A (ja) | 1982-06-15 | 1983-12-20 | Nippon Kayaku Co Ltd | 4′−デメチル−エピポドフイロトキシン−β−D−エチリデングルコシドの製造法 |
| JPS5976099A (ja) | 1982-10-22 | 1984-04-28 | Sumitomo Chem Co Ltd | アミノナフタセン誘導体とその製造方法 |
| IT1155446B (it) | 1982-12-23 | 1987-01-28 | Erba Farmitalia | Procedimento per la purificazione di glucosidi antraciclinonici mediante adsobimento selettivo su resine |
| US4526988A (en) | 1983-03-10 | 1985-07-02 | Eli Lilly And Company | Difluoro antivirals and intermediate therefor |
| JPS6019790A (ja) | 1983-07-14 | 1985-01-31 | Yakult Honsha Co Ltd | 新規なカンプトテシン誘導体 |
| DE3485225D1 (de) | 1983-08-18 | 1991-12-05 | Beecham Group Plc | Antivirale guanin-derivate. |
| JPS6051189A (ja) | 1983-08-30 | 1985-03-22 | Sankyo Co Ltd | チアゾリジン誘導体およびその製造法 |
| US4894366A (en) | 1984-12-03 | 1990-01-16 | Fujisawa Pharmaceutical Company, Ltd. | Tricyclo compounds, a process for their production and a pharmaceutical composition containing the same |
| US4760137A (en) | 1984-08-06 | 1988-07-26 | Brigham Young University | Method for the production of 2'-deoxyadenosine compounds |
| CA1269659A (en) | 1984-08-06 | 1990-05-29 | Brigham Young University | Method for the production of 2'-deoxyadenosine compounds |
| US5736155A (en) | 1984-08-08 | 1998-04-07 | The Liposome Company, Inc. | Encapsulation of antineoplastic agents in liposomes |
| US5077056A (en) | 1984-08-08 | 1991-12-31 | The Liposome Company, Inc. | Encapsulation of antineoplastic agents in liposomes |
| NL8403224A (nl) | 1984-10-24 | 1986-05-16 | Oce Andeno Bv | Dioxafosforinanen, de bereiding ervan en de toepassing voor het splitsen van optisch actieve verbindingen. |
| DK173350B1 (da) | 1985-02-26 | 2000-08-07 | Sankyo Co | Thiazolidinderivater, deres fremstilling og farmaceutisk paæparat indeholdende dem |
| US5223263A (en) | 1988-07-07 | 1993-06-29 | Vical, Inc. | Liponucleotide-containing liposomes |
| US4724232A (en) | 1985-03-16 | 1988-02-09 | Burroughs Wellcome Co. | Treatment of human viral infections |
| CS263951B1 (en) | 1985-04-25 | 1989-05-12 | Antonin Holy | 9-(phosponylmethoxyalkyl)adenines and method of their preparation |
| EP0206497B1 (en) | 1985-05-15 | 1994-07-20 | The Wellcome Foundation Limited | Therapeutic nucleosides and their preparation |
| US5246937A (en) | 1985-09-18 | 1993-09-21 | Beecham Group P.L.C. | Purine derivatives |
| US4751221A (en) | 1985-10-18 | 1988-06-14 | Sloan-Kettering Institute For Cancer Research | 2-fluoro-arabinofuranosyl purine nucleosides |
| US4797285A (en) | 1985-12-06 | 1989-01-10 | Yissum Research And Development Company Of The Hebrew University Of Jerusalem | Lipsome/anthraquinone drug composition and method |
| NZ219974A (en) | 1986-04-22 | 1989-08-29 | Goedecke Ag | N-(2'-aminophenyl)-benzamide derivatives, process for their preparation and their use in the control of neoplastic diseases |
| FR2601675B1 (fr) | 1986-07-17 | 1988-09-23 | Rhone Poulenc Sante | Derives du taxol, leur preparation et les compositions pharmaceutiques qui les contiennent |
| US4753935A (en) | 1987-01-30 | 1988-06-28 | Syntex (U.S.A.) Inc. | Morpholinoethylesters of mycophenolic acid and pharmaceutical compositions |
| US5154930A (en) | 1987-03-05 | 1992-10-13 | The Liposome Company, Inc. | Pharmacological agent-lipid solution preparation |
| DE3752123T2 (de) | 1987-03-09 | 1998-05-14 | Kyowa Hakko Kogyo Kk | Derivate des physiologisch aktiven mittels k-252 |
| GB8719367D0 (en) | 1987-08-15 | 1987-09-23 | Wellcome Found | Therapeutic compounds |
| JPH03501253A (ja) | 1987-09-22 | 1991-03-22 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | エイズ(aids)治療を目的とするリポソームによるヌクレオシド類似物質 |
| US5004758A (en) | 1987-12-01 | 1991-04-02 | Smithkline Beecham Corporation | Water soluble camptothecin analogs useful for inhibiting the growth of animal tumor cells |
| US4880784A (en) | 1987-12-21 | 1989-11-14 | Brigham Young University | Antiviral methods utilizing ribofuranosylthiazolo[4,5-d]pyrimdine derivatives |
| US5130421A (en) | 1988-03-24 | 1992-07-14 | Bristol-Myers Company | Production of 2',3'-dideoxy-2',3'-didehydronucleosides |
| GB8815265D0 (en) | 1988-06-27 | 1988-08-03 | Wellcome Found | Therapeutic nucleosides |
| IL91664A (en) | 1988-09-28 | 1993-05-13 | Yissum Res Dev Co | Ammonium transmembrane gradient system for efficient loading of liposomes with amphipathic drugs and their controlled release |
| US6132763A (en) | 1988-10-20 | 2000-10-17 | Polymasc Pharmaceuticals Plc | Liposomes |
| US5705363A (en) | 1989-03-02 | 1998-01-06 | The Women's Research Institute | Recombinant production of human interferon τ polypeptides and nucleic acids |
| US5277914A (en) | 1989-03-31 | 1994-01-11 | The Regents Of The University Of California | Preparation of liposome and lipid complex compositions |
| US5549910A (en) | 1989-03-31 | 1996-08-27 | The Regents Of The University Of California | Preparation of liposome and lipid complex compositions |
| US5077057A (en) | 1989-04-05 | 1991-12-31 | The Regents Of The University Of California | Preparation of liposome and lipid complex compositions |
| US5411947A (en) | 1989-06-28 | 1995-05-02 | Vestar, Inc. | Method of converting a drug to an orally available form by covalently bonding a lipid to the drug |
| US5194654A (en) | 1989-11-22 | 1993-03-16 | Vical, Inc. | Lipid derivatives of phosphonoacids for liposomal incorporation and method of use |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5225212A (en) | 1989-10-20 | 1993-07-06 | Liposome Technology, Inc. | Microreservoir liposome composition and method |
| US5463092A (en) | 1989-11-22 | 1995-10-31 | Vestar, Inc. | Lipid derivatives of phosphonacids for liposomal incorporation and method of use |
| GB8927913D0 (en) | 1989-12-11 | 1990-02-14 | Hoffmann La Roche | Amino acid derivatives |
| US5026687A (en) | 1990-01-03 | 1991-06-25 | The United States Of America As Represented By The Department Of Health And Human Services | Treatment of human retroviral infections with 2',3'-dideoxyinosine alone and in combination with other antiviral compounds |
| US5041246A (en) | 1990-03-26 | 1991-08-20 | The Babcock & Wilcox Company | Two stage variable annulus spray attemperator method and apparatus |
| AU660925B2 (en) | 1990-04-06 | 1995-07-13 | Genelabs Technologies, Inc. | Hepatitis C virus epitopes |
| US5091188A (en) | 1990-04-26 | 1992-02-25 | Haynes Duncan H | Phospholipid-coated microcrystals: injectable formulations of water-insoluble drugs |
| GB9009861D0 (en) | 1990-05-02 | 1990-06-27 | Glaxo Group Ltd | Chemical compounds |
| WO1991016920A1 (en) | 1990-05-07 | 1991-11-14 | Vical, Inc. | Lipid prodrugs of salicylate and nonsteroidal anti-inflammatory drugs |
| HU222234B1 (hu) | 1990-05-18 | 2003-05-28 | Aventis Pharma Deutschland Gmbh. | Eljárás izoxazol-4-karbonsav-amidok és hidroxi-alkilidén-cián-ecetsav-amidok, a vegyületeket tartalmazó gyógyászati készítmények és az ismert vegyületeket tartalmazó rákellenes hatású gyógyszerkészítmények előállítására |
| JPH05507279A (ja) | 1990-05-29 | 1993-10-21 | ネクススター・ファーマシューティカルズ・インコーポレイテッド | グリセロールジ―およびトリホスフェート誘導体の合成 |
| WO1991019721A1 (en) | 1990-06-13 | 1991-12-26 | Arnold Glazier | Phosphorous produgs |
| US6060080A (en) | 1990-07-16 | 2000-05-09 | Daiichi Pharmaceutical Co., Ltd. | Liposomal products |
| JP2599492B2 (ja) | 1990-08-21 | 1997-04-09 | 第一製薬株式会社 | リポソーム製剤の製造法 |
| US5372808A (en) | 1990-10-17 | 1994-12-13 | Amgen Inc. | Methods and compositions for the treatment of diseases with consensus interferon while reducing side effect |
| US5206244A (en) | 1990-10-18 | 1993-04-27 | E. R. Squibb & Sons, Inc. | Hydroxymethyl (methylenecyclopentyl) purines and pyrimidines |
| US5256641A (en) | 1990-11-01 | 1993-10-26 | State Of Oregon | Covalent polar lipid-peptide conjugates for immunological targeting |
| US5543390A (en) | 1990-11-01 | 1996-08-06 | State Of Oregon, Acting By And Through The Oregon State Board Of Higher Education, Acting For And On Behalf Of The Oregon Health Sciences University | Covalent microparticle-drug conjugates for biological targeting |
| US5149794A (en) | 1990-11-01 | 1992-09-22 | State Of Oregon | Covalent lipid-drug conjugates for drug targeting |
| US5543389A (en) | 1990-11-01 | 1996-08-06 | State Of Oregon, Acting By And Through The Oregon State Board Of Higher Education On Behalf Of The Oregon Health Sciences University, A Non Profit Organization | Covalent polar lipid-peptide conjugates for use in salves |
| US5925643A (en) | 1990-12-05 | 1999-07-20 | Emory University | Enantiomerically pure β-D-dioxolane-nucleosides |
| US5179104A (en) | 1990-12-05 | 1993-01-12 | University Of Georgia Research Foundation, Inc. | Process for the preparation of enantiomerically pure β-D-(-)-dioxolane-nucleosides |
| JP3008226B2 (ja) | 1991-01-16 | 2000-02-14 | 第一製薬株式会社 | 六環性化合物 |
| US5145684A (en) | 1991-01-25 | 1992-09-08 | Sterling Drug Inc. | Surface modified drug nanoparticles |
| NZ250842A (en) | 1991-02-22 | 1996-03-26 | Univ Emory | Resolution of a racemic mixture of nucleoside enantiomers such as 2-hydroxymethyl-5-(5-fluorocytosin-1-yl)-1,3-oxathiolane (ftc) |
| NZ241868A (en) | 1991-03-08 | 1995-05-26 | Univ Vermont | 6,9-bis(substituted-amino)benzo[g]isoquinoline-5,10-diones, preparation and pharmaceutical compositions thereof |
| US5595732A (en) | 1991-03-25 | 1997-01-21 | Hoffmann-La Roche Inc. | Polyethylene-protein conjugates |
| US5157027A (en) | 1991-05-13 | 1992-10-20 | E. R. Squibb & Sons, Inc. | Bisphosphonate squalene synthetase inhibitors and method |
| WO1993000910A1 (en) | 1991-07-12 | 1993-01-21 | Vical, Inc. | Antiviral liponucleosides: treatment of hepatitis b |
| HU9202318D0 (en) | 1991-07-22 | 1992-10-28 | Bristol Myers Squibb Co | Method for preparing medical preparatives containing didesoxi-purine nucleoside |
| US5554728A (en) | 1991-07-23 | 1996-09-10 | Nexstar Pharmaceuticals, Inc. | Lipid conjugates of therapeutic peptides and protease inhibitors |
| GB9116601D0 (en) | 1991-08-01 | 1991-09-18 | Iaf Biochem Int | 1,3-oxathiolane nucleoside analogues |
| TW224053B (ko) | 1991-09-13 | 1994-05-21 | Paul B Chretien | |
| DE4200821A1 (de) | 1992-01-15 | 1993-07-22 | Bayer Ag | Geschmacksmaskierte pharmazeutische mittel |
| US5676942A (en) | 1992-02-10 | 1997-10-14 | Interferon Sciences, Inc. | Composition containing human alpha interferon species proteins and method for use thereof |
| US5405598A (en) | 1992-02-24 | 1995-04-11 | Schinazi; Raymond F. | Sensitizing agents for use in boron neutron capture therapy |
| US5610054A (en) | 1992-05-14 | 1997-03-11 | Ribozyme Pharmaceuticals, Inc. | Enzymatic RNA molecule targeted against Hepatitis C virus |
| US5426183A (en) | 1992-06-22 | 1995-06-20 | Eli Lilly And Company | Catalytic stereoselective glycosylation process for preparing 2'-deoxy-2',2'-difluoronucleosides and 2'-deoxy-2'-fluoronucleosides |
| US5256798A (en) | 1992-06-22 | 1993-10-26 | Eli Lilly And Company | Process for preparing alpha-anomer enriched 2-deoxy-2,2-difluoro-D-ribofuranosyl sulfonates |
| MX9303713A (es) | 1992-06-22 | 1994-05-31 | Lilly Co Eli | Proceso estereoselectivo para preparar un derivadoribofuranosilo enriquecido con alfa anomero. |
| US5719147A (en) | 1992-06-29 | 1998-02-17 | Merck & Co., Inc. | Morpholine and thiomorpholine tachykinin receptor antagonists |
| HU214980B (hu) | 1992-09-01 | 1998-08-28 | Eli Lilly And Co. | Eljárás nukleozidok anomerizálására |
| GB9221220D0 (en) | 1992-10-09 | 1992-11-25 | Sandoz Ag | Organic componds |
| GB9226729D0 (en) | 1992-12-22 | 1993-02-17 | Wellcome Found | Therapeutic combination |
| US5484926A (en) | 1993-10-07 | 1996-01-16 | Agouron Pharmaceuticals, Inc. | HIV protease inhibitors |
| CN1078478C (zh) | 1993-02-24 | 2002-01-30 | 王瑞駪 | 活性抗病毒聚合物的组成及应用方法 |
| US6180134B1 (en) | 1993-03-23 | 2001-01-30 | Sequus Pharmaceuticals, Inc. | Enhanced ciruclation effector composition and method |
| AU701574B2 (en) | 1993-05-12 | 1999-02-04 | Karl Y. Hostetler | Acyclovir derivatives for topical use |
| CA2167537A1 (en) | 1993-07-19 | 1995-02-02 | Tsuneo Ozeki | Hepatitis c virus proliferation inhibitor |
| FR2707988B1 (fr) | 1993-07-21 | 1995-10-13 | Pf Medicament | Nouveaux dérivés antimitotiques des alcaloïdes binaires du catharantus rosesus, leur procédé de préparation et les compositions pharmaceutiques les comprenant. |
| US6156501A (en) | 1993-10-26 | 2000-12-05 | Affymetrix, Inc. | Arrays of modified nucleic acid probes and methods of use |
| US7375198B2 (en) | 1993-10-26 | 2008-05-20 | Affymetrix, Inc. | Modified nucleic acid probes |
| US5951974A (en) | 1993-11-10 | 1999-09-14 | Enzon, Inc. | Interferon polymer conjugates |
| DK0730470T3 (da) | 1993-11-10 | 2002-06-03 | Enzon Inc | Forbedrede interferonpolymerkonjugater |
| IL111960A (en) | 1993-12-17 | 1999-12-22 | Merck & Co Inc | Morpholines and thiomorpholines their preparation and pharmaceutical compositions containing them |
| AU6550394A (en) | 1994-03-11 | 1995-09-25 | Isis Pharmaceuticals, Inc. | Novel pyrimidine nucleosides |
| DE4415539C2 (de) | 1994-05-03 | 1996-08-01 | Osama Dr Dr Med Omer | Pflanzen mit virustatischer und antiviraler Wirkung |
| IL129871A (en) | 1994-05-06 | 2003-11-23 | Pharmacia & Upjohn Inc | Process for preparing 4-phenyl-substituted octanoyl-oxazolidin-2-one intermediates that are useful for preparing pyran-2-ones useful for treating retroviral infections |
| US6090932A (en) | 1994-06-22 | 2000-07-18 | Proligo Llc | Method of preparation of known and novel 2'-modified nucleosides by intramolecular nucleophilic displacement |
| DE4432623A1 (de) | 1994-09-14 | 1996-03-21 | Huels Chemische Werke Ag | Verfahren zur Bleichung von wäßrigen Tensidlösungen |
| US5738846A (en) | 1994-11-10 | 1998-04-14 | Enzon, Inc. | Interferon polymer conjugates and process for preparing the same |
| US5696277A (en) | 1994-11-15 | 1997-12-09 | Karl Y. Hostetler | Antiviral prodrugs |
| US5703058A (en) | 1995-01-27 | 1997-12-30 | Emory University | Compositions containing 5-fluoro-2',3'-didehydro-2',3'-dideoxycytidine or a mono-, di-, or triphosphate thereof and a second antiviral agent |
| US6391859B1 (en) | 1995-01-27 | 2002-05-21 | Emory University | [5-Carboxamido or 5-fluoro]-[2′,3′-unsaturated or 3′-modified]-pyrimidine nucleosides |
| GB9505025D0 (en) | 1995-03-13 | 1995-05-03 | Medical Res Council | Chemical compounds |
| GB9618952D0 (en) | 1996-09-11 | 1996-10-23 | Sandoz Ltd | Process |
| US6504029B1 (en) | 1995-04-10 | 2003-01-07 | Daiichi Pharmaceutical Co., Ltd. | Condensed-hexacyclic compounds and a process therefor |
| DE19514523A1 (de) | 1995-04-12 | 1996-10-17 | Schering Ag | Neue Cytosin- und Cytidinderivate |
| ATE318896T1 (de) | 1995-09-27 | 2006-03-15 | Univ Emory | Rekombinante rna-replikase von hepatitis-c-virus |
| US5908621A (en) | 1995-11-02 | 1999-06-01 | Schering Corporation | Polyethylene glycol modified interferon therapy |
| US5767097A (en) | 1996-01-23 | 1998-06-16 | Icn Pharmaceuticals, Inc. | Specific modulation of Th1/Th2 cytokine expression by ribavirin in activated T-lymphocytes |
| GB9602028D0 (en) | 1996-02-01 | 1996-04-03 | Amersham Int Plc | Nucleoside analogues |
| US5980884A (en) | 1996-02-05 | 1999-11-09 | Amgen, Inc. | Methods for retreatment of patients afflicted with Hepatitis C using consensus interferon |
| WO1997032018A2 (en) | 1996-02-29 | 1997-09-04 | Immusol, Inc. | Hepatitis c virus ribozymes |
| US5633388A (en) | 1996-03-29 | 1997-05-27 | Viropharma Incorporated | Compounds, compositions and methods for treatment of hepatitis C |
| US5830905A (en) | 1996-03-29 | 1998-11-03 | Viropharma Incorporated | Compounds, compositions and methods for treatment of hepatitis C |
| US5849733A (en) | 1996-05-10 | 1998-12-15 | Bristol-Myers Squibb Co. | 2-thio or 2-oxo flavopiridol analogs |
| US5990276A (en) | 1996-05-10 | 1999-11-23 | Schering Corporation | Synthetic inhibitors of hepatitis C virus NS3 protease |
| GB9609932D0 (en) | 1996-05-13 | 1996-07-17 | Hoffmann La Roche | Use of IL-12 and IFN alpha for the treatment of infectious diseases |
| US5891874A (en) | 1996-06-05 | 1999-04-06 | Eli Lilly And Company | Anti-viral compound |
| US5837257A (en) | 1996-07-09 | 1998-11-17 | Sage R&D | Use of plant extracts for treatment of HIV, HCV and HBV infections |
| US6214375B1 (en) | 1996-07-16 | 2001-04-10 | Generex Pharmaceuticals, Inc. | Phospholipid formulations |
| US5635517B1 (en) | 1996-07-24 | 1999-06-29 | Celgene Corp | Method of reducing TNFalpha levels with amino substituted 2-(2,6-dioxopiperidin-3-YL)-1-oxo-and 1,3-dioxoisoindolines |
| AU4090697A (en) | 1996-09-03 | 1998-03-26 | Bristol-Myers Squibb Company | Improved process for preparing the antiviral agent {1s-(1alpha, 3alpha, 4beta)}-2-amino-1,9-dihydro-9-{4-hydroxy-3-(hydroxymethyl)-2 -methylenecyclopentyl}-6h-purin-6-one |
| US5908934A (en) | 1996-09-26 | 1999-06-01 | Bristol-Myers Squibb Company | Process for the preparation of chiral ketone intermediates useful for the preparation of flavopiridol and analogs |
| US5922757A (en) | 1996-09-30 | 1999-07-13 | The Regents Of The University Of California | Treatment and prevention of hepatic disorders |
| US6174905B1 (en) | 1996-09-30 | 2001-01-16 | Mitsui Chemicals, Inc. | Cell differentiation inducer |
| TW520297B (en) | 1996-10-11 | 2003-02-11 | Sequus Pharm Inc | Fusogenic liposome composition and method |
| US6224903B1 (en) | 1996-10-11 | 2001-05-01 | Sequus Pharmaceuticals, Inc. | Polymer-lipid conjugate for fusion of target membranes |
| US6509320B1 (en) | 1996-10-16 | 2003-01-21 | Icn Pharmaceuticals, Inc. | Purine L-nucleosides, analogs and uses thereof |
| US6455690B1 (en) | 1996-10-16 | 2002-09-24 | Robert Tam | L-8-oxo-7-propyl-7,8-dihydro-(9H)-guanosine |
| IL129126A0 (en) | 1996-10-16 | 2000-02-17 | Icn Pharmaceuticals | Monocyclic l-nucleosides analogs and uses thereof |
| ATE271063T1 (de) | 1996-10-16 | 2004-07-15 | Icn Pharmaceuticals | Purin-l-nukleoside, deren analoga und verwendungen |
| IL129407A0 (en) | 1996-10-18 | 2000-02-17 | Vertex Pharma | Inhibitors of serine proteases particularly hepatitis C virus NS3 protease pharmaceutical compositions containing the same and the use thereof |
| GB9623908D0 (en) | 1996-11-18 | 1997-01-08 | Hoffmann La Roche | Amino acid derivatives |
| IL119833A (en) | 1996-12-15 | 2001-01-11 | Lavie David | Hypericum perforatum extracts for the preparation of pharmaceutical compositions for the treatment of hepatitis |
| US5827533A (en) | 1997-02-06 | 1998-10-27 | Duke University | Liposomes containing active agents aggregated with lipid surfactants |
| US20020127371A1 (en) | 2001-03-06 | 2002-09-12 | Weder Donald E. | Decorative elements provided with a circular or crimped configuration at point of sale or point of use |
| US6004933A (en) | 1997-04-25 | 1999-12-21 | Cortech Inc. | Cysteine protease inhibitors |
| CN1107068C (zh) | 1997-05-29 | 2003-04-30 | 诺瓦提斯公司 | 2-氨基-7-(1-取代的-2-羟乙基)-3,5-二氢-吡咯并[3,2-d]嘧啶-4-酮 |
| TW593225B (en) | 1997-06-30 | 2004-06-21 | Merz Pharma Gmbh & Co Kgaa | 1-amino-alkylcyclohexane NMDA receptor antagonists |
| NZ503263A (en) | 1997-08-11 | 2002-10-25 | Boehringer Ingelheim Ca Ltd | Hepatitis C NS3 protease inhibitor peptides and peptide analogues |
| DE69801970T2 (de) | 1997-09-21 | 2002-06-13 | Schering Corp | Kombinationstherapie zur Entfernung von nachweisbarer HCV-RNS in Patienten mit chronischer Hepatitis C-Infektion |
| US6703374B1 (en) | 1997-10-30 | 2004-03-09 | The United States Of America As Represented By The Department Of Health And Human Services | Nucleosides for imaging and treatment applications |
| US5981709A (en) | 1997-12-19 | 1999-11-09 | Enzon, Inc. | α-interferon-polymer-conjugates having enhanced biological activity and methods of preparing the same |
| DE69900841T2 (de) | 1998-01-23 | 2002-10-02 | Newbiotics Inc | Durch enzymkatalyse erhaltene therapeutische substanzen. |
| BR9908270A (pt) | 1998-02-25 | 2004-06-29 | Univ Emory | 2-fluoro-nucleosìdeos, composições farmacêuticas e seus usos |
| US6787305B1 (en) | 1998-03-13 | 2004-09-07 | Invitrogen Corporation | Compositions and methods for enhanced synthesis of nucleic acid molecules |
| CA2326535A1 (en) | 1998-03-27 | 1999-10-07 | Regents Of The University Of Minnesota | Nucleosides with antiviral and anticancer activity |
| GB9806815D0 (en) | 1998-03-30 | 1998-05-27 | Hoffmann La Roche | Amino acid derivatives |
| CZ300540B6 (cs) | 1998-05-15 | 2009-06-10 | Schering Corporation | Farmaceutický prostredek obsahující ribavirin v kombinaci s interferonem alfa pro lécbu pacientu s chronickou infekcí hepatitidy C genotypu 1 |
| US20010014352A1 (en) | 1998-05-27 | 2001-08-16 | Udit Batra | Compressed tablet formulation |
| US6274725B1 (en) | 1998-06-02 | 2001-08-14 | Isis Pharmaceuticals, Inc. | Activators for oligonucleotide synthesis |
| PL192364B1 (pl) | 1998-06-08 | 2006-10-31 | Hoffmann La Roche | Zastosowanie koniugatu PEG-IFN-α 2A w połączeniu z rybawiryną |
| US6200598B1 (en) | 1998-06-18 | 2001-03-13 | Duke University | Temperature-sensitive liposomal formulation |
| US6726925B1 (en) | 1998-06-18 | 2004-04-27 | Duke University | Temperature-sensitive liposomal formulation |
| US6320078B1 (en) | 1998-07-24 | 2001-11-20 | Mitsui Chemicals, Inc. | Method of producing benzamide derivatives |
| AU756627B2 (en) | 1998-07-27 | 2003-01-16 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti S.P.A. | Diketoacid-derivatives as inhibitors of polymerases |
| US6323180B1 (en) | 1998-08-10 | 2001-11-27 | Boehringer Ingelheim (Canada) Ltd | Hepatitis C inhibitor tri-peptides |
| ES2579903T3 (es) | 1998-08-10 | 2016-08-17 | Centre National De La Recherche Scientifique (Cnrs) | Beta-L-2'-desoxi-nucleósidos para el tratamiento de la hepatitis B |
| CA2347515C (en) | 1998-10-16 | 2009-10-13 | Mercian Corporation | Crystallization of doxorubicin hydrochloride |
| FR2784892B1 (fr) | 1998-10-23 | 2001-04-06 | Smith & Nephew Kinetec Sa | Attelle de mobilisation passive repliable pour membre inferieur |
| GB9826555D0 (en) | 1998-12-03 | 1999-01-27 | Univ Nottingham | Microemulsion compositions |
| US6635278B1 (en) | 1998-12-15 | 2003-10-21 | Gilead Sciences, Inc. | Pharmaceutical formulations |
| CA2354536A1 (en) | 1998-12-18 | 2000-06-29 | Schering Corporation | Ribavirin-pegylated interferon alfa induction hcv combination therapy |
| US6294192B1 (en) | 1999-02-26 | 2001-09-25 | Lipocine, Inc. | Triglyceride-free compositions and methods for improved delivery of hydrophobic therapeutic agents |
| US6267985B1 (en) | 1999-06-30 | 2001-07-31 | Lipocine Inc. | Clear oil-containing pharmaceutical compositions |
| US6248363B1 (en) | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| US6383471B1 (en) | 1999-04-06 | 2002-05-07 | Lipocine, Inc. | Compositions and methods for improved delivery of ionizable hydrophobic therapeutic agents |
| US7919119B2 (en) | 1999-05-27 | 2011-04-05 | Acusphere, Inc. | Porous drug matrices and methods of manufacture thereof |
| US6395300B1 (en) | 1999-05-27 | 2002-05-28 | Acusphere, Inc. | Porous drug matrices and methods of manufacture thereof |
| CN1079473C (zh) | 1999-05-31 | 2002-02-20 | 李岭群 | 预制梁连接筋 |
| WO2001005433A2 (en) | 1999-07-14 | 2001-01-25 | Board Of Regents, The University Of Texas System | Delivery and retention of activity agents to lymph nodes |
| PL354144A1 (en) | 1999-07-30 | 2003-12-29 | Abbott Gmbh & Co.Kgabbott Gmbh & Co.Kg | 2-pyrazolin-5-ones |
| US6566365B1 (en) | 1999-11-04 | 2003-05-20 | Biochem Pharma Inc. | Method for the treatment of Flaviviridea viral infection using nucleoside analogues |
| TR200601782T2 (tr) | 1999-11-12 | 2006-09-21 | Pharmasset Ltd. | 2'-Deoksi-L-Nükleositlerin sentezi. |
| US20060034937A1 (en) | 1999-11-23 | 2006-02-16 | Mahesh Patel | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| US6495677B1 (en) | 2000-02-15 | 2002-12-17 | Kanda S. Ramasamy | Nucleoside compounds |
| KR20030005197A (ko) | 2000-02-18 | 2003-01-17 | 샤이어 바이오켐 인코포레이티드 | 뉴클레오시드유도체를 이용한 플라비바이러스 감염의 치료또는 예방 방법 |
| DE60136620D1 (de) | 2000-04-13 | 2009-01-02 | Pharmasset Inc | 3 oder 2 hydroxymethyl substituierte nucleoside derivate und ihre verwendung zur behandlung von virusinfektionen |
| WO2001081359A1 (en) | 2000-04-20 | 2001-11-01 | Schering Corporation | Ribavirin-interferon alfa combination therapy for eradicating detectable hcv-rna in patients having chronic hepatitis c infection |
| MY164523A (en) | 2000-05-23 | 2017-12-29 | Univ Degli Studi Cagliari | Methods and compositions for treating hepatitis c virus |
| KR100854398B1 (ko) | 2000-05-26 | 2008-08-26 | 이데닉스 (케이만) 리미티드 | 베타-l-2'-데옥시-뉴클레오사이드를 이용한 델타형 간염바이러스 감염의 치료방법 |
| NZ547204A (en) | 2000-05-26 | 2008-01-31 | Idenix Cayman Ltd | Methods and compositions for treating flaviviruses and pestiviruses |
| US6787526B1 (en) | 2000-05-26 | 2004-09-07 | Idenix Pharmaceuticals, Inc. | Methods of treating hepatitis delta virus infection with β-L-2′-deoxy-nucleosides |
| FR2810322B1 (fr) | 2000-06-14 | 2006-11-10 | Pasteur Institut | PRODUCTION COMBINATOIRE D'ANALOGUES DE NUCLEOTIDES ET NUCLEOTIDES (XiTP) |
| MY141594A (en) | 2000-06-15 | 2010-05-14 | Novirio Pharmaceuticals Ltd | 3'-PRODRUGS OF 2'-DEOXY-ß-L-NUCLEOSIDES |
| US6815542B2 (en) | 2000-06-16 | 2004-11-09 | Ribapharm, Inc. | Nucleoside compounds and uses thereof |
| UA72612C2 (en) | 2000-07-06 | 2005-03-15 | Pyrido[2.3-d]pyrimidine and pyrimido[4.5-d]pyrimidine nucleoside analogues, prodrugs and method for inhibiting growth of neoplastic cells | |
| US6680068B2 (en) | 2000-07-06 | 2004-01-20 | The General Hospital Corporation | Drug delivery formulations and targeting |
| JP4651264B2 (ja) | 2000-07-21 | 2011-03-16 | ギリアード サイエンシーズ, インコーポレイテッド | ホスホネートヌクレオチドアナログのプロドラッグならびにこれを選択および作製するための方法。 |
| EP1301527A2 (en) | 2000-07-21 | 2003-04-16 | Corvas International, Inc. | Peptides as ns3-serine protease inhibitors of hepatitis c virus |
| AR034127A1 (es) | 2000-07-21 | 2004-02-04 | Schering Corp | Imidazolidinonas como inhibidores de ns3-serina proteasa del virus de hepatitis c, composicion farmaceutica, un metodo para su preparacion, y el uso de las mismas para la manufactura de un medicamento |
| BR0112666A (pt) | 2000-07-21 | 2003-06-10 | Schering Corp | Peptìdeos como inibidores de ns3-serina protease de vìrus da hepatite c |
| AR029851A1 (es) | 2000-07-21 | 2003-07-16 | Dendreon Corp | Nuevos peptidos como inhibidores de ns3-serina proteasa del virus de hepatitis c |
| US7018985B1 (en) | 2000-08-21 | 2006-03-28 | Inspire Pharmaceuticals, Inc. | Composition and method for inhibiting platelet aggregation |
| US6897201B2 (en) | 2000-08-21 | 2005-05-24 | Inspire Pharmaceuticals, Inc. | Compositions and methods for the treatment of glaucoma or ocular hypertension |
| AR039558A1 (es) | 2000-08-21 | 2005-02-23 | Inspire Pharmaceuticals Inc | Composiciones y metodo para el tratamiento de glaucoma o hipertension ocular |
| US20030008841A1 (en) | 2000-08-30 | 2003-01-09 | Rene Devos | Anti-HCV nucleoside derivatives |
| EP1326594A2 (en) | 2000-10-18 | 2003-07-16 | Schering Corporation | Ribavirin-pegylated interferon alfa hcv combination therapy |
| CN1646141B (zh) | 2000-10-18 | 2014-06-25 | 吉利德制药有限责任公司 | 用于治疗病毒感染和异常细胞增殖的修饰核苷类化合物 |
| US6555677B2 (en) | 2000-10-31 | 2003-04-29 | Merck & Co., Inc. | Phase transfer catalyzed glycosidation of an indolocarbazole |
| WO2002060926A2 (en) | 2000-11-20 | 2002-08-08 | Bristol-Myers Squibb Company | Hepatitis c tripeptide inhibitors |
| DE20019797U1 (de) | 2000-11-21 | 2001-04-05 | Mala Verschlussysteme Gmbh | Verschlußkappe |
| ES2324594T3 (es) | 2000-12-12 | 2009-08-11 | Schering Corporation | Diaril peptidicos utilizados como inhibidores de la serina proteasa ns3 del virus de la hepatitis c. |
| WO2002048157A2 (en) | 2000-12-13 | 2002-06-20 | Bristol-Myers Squibb Pharma Company | Imidazolidinones and their related derivatives as hepatitis c virus ns3 protease inhibitors |
| WO2002048116A2 (en) | 2000-12-13 | 2002-06-20 | Bristol-Myers Squibb Pharma Company | Inhibitors of hepatitis c virus ns3 protease |
| US6750396B2 (en) | 2000-12-15 | 2004-06-15 | Di/Dt, Inc. | I-channel surface-mount connector |
| AU2002232660A1 (en) | 2000-12-15 | 2002-06-24 | Pharmasset Ltd. | Antiviral agents for treatment of flaviviridae infections |
| US7105499B2 (en) | 2001-01-22 | 2006-09-12 | Merck & Co., Inc. | Nucleoside derivatives as inhibitors of RNA-dependent RNA viral polymerase |
| MXPA03006514A (es) | 2001-01-22 | 2004-12-02 | Merck & Co Inc | Derivados de nucleosidos como inhibidores de polimerasa de acido ribonucleico viral dependiente de acido ribonucleico. |
| MY129350A (en) | 2001-04-25 | 2007-03-30 | Bristol Myers Squibb Co | Aripiprazole oral solution |
| GB0112617D0 (en) | 2001-05-23 | 2001-07-18 | Hoffmann La Roche | Antiviral nucleoside derivatives |
| GB0114286D0 (en) | 2001-06-12 | 2001-08-01 | Hoffmann La Roche | Nucleoside Derivatives |
| EP1404694A1 (en) | 2001-06-21 | 2004-04-07 | Glaxo Group Limited | Nucleoside compounds in hcv |
| US6909000B2 (en) | 2001-07-11 | 2005-06-21 | Vertex Pharmaceuticals Incorporated | Bridged bicyclic serine protease inhibitors |
| EP2335700A1 (en) | 2001-07-25 | 2011-06-22 | Boehringer Ingelheim (Canada) Ltd. | Hepatitis C virus polymerase inhibitors with a heterobicylic structure |
| DE60226447D1 (de) | 2001-08-02 | 2008-06-19 | Ilex Oncology Inc | Verfahren zur herstellung von purinnukleosiden |
| US6962991B2 (en) | 2001-09-12 | 2005-11-08 | Epoch Biosciences, Inc. | Process for the synthesis of pyrazolopyrimidines |
| US7227019B2 (en) | 2001-09-13 | 2007-06-05 | Bristol-Myers Squibb Company | Process for the preparation of rebeccamycin and analogs thereof |
| WO2003024461A1 (en) | 2001-09-20 | 2003-03-27 | Schering Corporation | Hcv combination therapy |
| AU2002330154A1 (en) | 2001-09-28 | 2003-04-07 | Centre National De La Recherche Scientifique | Methods and compositions for treating hepatitis c virus using 4'-modified nucleosides |
| WO2003037895A1 (en) | 2001-11-02 | 2003-05-08 | Glaxo Group Limited | 4-(6-membered)-heteroaryl acyl pyrrolidine derivatives as hcv inhibitors |
| EP1448170A4 (en) | 2001-11-27 | 2010-05-12 | Bristol Myers Squibb Co | EFAVIRENZ STAMP PREPARATIONS HAVING UNIQUE BIOPHARMACEUTICAL CHARACTERISTICS |
| GB0129945D0 (en) | 2001-12-13 | 2002-02-06 | Mrc Technology Ltd | Chemical compounds |
| AU2002365234B2 (en) | 2001-12-14 | 2009-01-29 | Pharmasset Inc | N4-acylcytosine nucleosides for treatment of viral infections |
| AU2002353165A1 (en) | 2001-12-17 | 2003-06-30 | Ribapharm Inc. | Deazapurine nucleoside libraries and compounds |
| EP1458735A2 (en) | 2001-12-21 | 2004-09-22 | Micrologix Biotech, Inc. | Anti-viral 7-deaza l-nucleosides |
| WO2003062256A1 (en) | 2002-01-17 | 2003-07-31 | Ribapharm Inc. | 2'-beta-modified-6-substituted adenosine analogs and their use as antiviral agents |
| US7070801B2 (en) | 2002-01-30 | 2006-07-04 | National Institute Of Advanced Industrial Science And Technology | Sugar-modified liposome and products comprising the liposome |
| CA2370396A1 (en) | 2002-02-01 | 2003-08-01 | Boehringer Ingelheim (Canada) Ltd. | Hepatitis c inhibitor tri-peptides |
| US6642204B2 (en) | 2002-02-01 | 2003-11-04 | Boehringer Ingelheim International Gmbh | Hepatitis C inhibitor tri-peptides |
| EP1476565A2 (en) | 2002-02-08 | 2004-11-17 | Novartis AG | Method for screening for compounds having hdac inhibitory activity |
| CA2474563C (en) | 2002-02-13 | 2010-11-09 | Merck & Co., Inc. | Methods of inhibiting orthopoxvirus replication with nucleoside compounds |
| AU2003217863B9 (en) | 2002-02-28 | 2009-10-29 | Biota Scientific Management Pty Ltd | Nucleotide mimics and their prodrugs |
| CA2477795A1 (en) | 2002-02-28 | 2003-09-12 | Kandasamy Sakthivel | Nucleoside 5'-monophosphate mimics and their prodrugs |
| TWI332956B (en) | 2002-04-26 | 2010-11-11 | Gilead Sciences Inc | Cellular accumulation of phosphonate analogs of hiv protease inhibitor compounds |
| WO2003100017A2 (en) | 2002-05-24 | 2003-12-04 | Isis Pharmaceuticals, Inc. | Oligonucleotides having modified nucleoside units |
| WO2003106477A1 (en) | 2002-06-01 | 2003-12-24 | Isis Pharmaceuticals, Inc. | Oligomeric compounds that include carbocyclic nucleosides and their use in gene modulation |
| JP4602076B2 (ja) | 2002-06-04 | 2010-12-22 | ネオジェネシス ファーマシューティカルズ インコーポレイテッド | 抗ウイルス剤としてのピラゾロ[1,5a]ピリミジン化合物 |
| EP1511757B1 (en) | 2002-06-07 | 2015-11-04 | Universitair Medisch Centrum Utrecht | New compounds for modulating the activity of exchange proteins directly activated by camp (epacs) |
| EP1515971A2 (en) | 2002-06-17 | 2005-03-23 | Merck & Co., Inc. | Carbocyclic nucleoside derivatives as inhibitors of rna-dependent rna viral polymerase |
| AU2003269890A1 (en) | 2002-06-21 | 2004-01-06 | Isis Pharmaceuticals, Inc. | Nucleoside derivatives as inhibitors of rna-dependent rna viral polymerase |
| AU2003269892A1 (en) | 2002-06-27 | 2004-01-19 | Isis Pharmaceuticals, Inc. | Nucleoside derivatives as inhibitors of rna-dependent rna viral polymerase |
| PL374792A1 (en) | 2002-06-28 | 2005-10-31 | Idenix (Cayman) Limited | 2' and 3'-nucleoside prodrugs for treating flaviviridae infections |
| US7608600B2 (en) | 2002-06-28 | 2009-10-27 | Idenix Pharmaceuticals, Inc. | Modified 2′ and 3′-nucleoside prodrugs for treating Flaviviridae infections |
| WO2004002999A2 (en) | 2002-06-28 | 2004-01-08 | Idenix (Cayman) Limited | Modified 2' and 3' -nucleoside produgs for treating flaviridae infections |
| AU2003248748A1 (en) | 2002-06-28 | 2004-01-19 | Idenix (Cayman) Limited | 2'-c-methyl-3'-o-l-valine ester ribofuranosyl cytidine for treatment of flaviviridae infections |
| EP1525186A1 (en) | 2002-07-01 | 2005-04-27 | Pharmacia & Upjohn Company LLC | Inhibitors of hcv ns5b polymerase |
| US6973905B2 (en) | 2002-07-01 | 2005-12-13 | Cinetic Automation Corporation | Valve lash adjustment apparatus and method |
| BR0305426A (pt) | 2002-07-01 | 2004-08-24 | Upjohn Co | Compostos inibidores de ns5b polimerase de hcv, bem como composição farmacêutica compreendendo os mesmos |
| AU2003269902A1 (en) | 2002-07-16 | 2004-02-02 | Isis Pharmaceuticals, Inc. | Nucleoside derivatives as inhibitors of rna-dependent rna viral polymerase |
| CA2493816A1 (en) | 2002-07-24 | 2004-01-29 | Ptc Therapeutics, Inc. | Use of nucleoside compounds for nonsense suppression and the treatment of genetic diseases |
| WO2004009020A2 (en) | 2002-07-24 | 2004-01-29 | Merck & Co., Inc. | Pyrrolopyrimidine thionucleoside analogs as antivirals |
| CN1671727A (zh) | 2002-07-25 | 2005-09-21 | 麦克洛基克斯生物技术有限公司 | 抗病毒7-脱氮-d-核苷及其用途 |
| WO2004014313A2 (en) | 2002-08-12 | 2004-02-19 | Bristol-Myers Squibb Company | Combination pharmaceutical agents as inhibitors of hcv replication |
| PT1572095E (pt) | 2002-09-13 | 2015-10-13 | Novartis Ag | Β-l-2'-desoxinucleósidos para tratamento de estirpes resistentes de vhb |
| AU2003287160A1 (en) | 2002-10-15 | 2004-05-04 | Rigel Pharmaceuticals, Inc. | Substituted indoles and their use as hcv inhibitors |
| US20040229840A1 (en) | 2002-10-29 | 2004-11-18 | Balkrishen Bhat | Nucleoside derivatives as inhibitors of RNA-dependent RNA viral polymerase |
| JP4537315B2 (ja) | 2002-11-01 | 2010-09-01 | バイロファーマ・インコーポレイテッド | ベンゾフラン化合物、組成物およびc型肝炎感染症および関連疾患の治療または予防方法 |
| KR20050088079A (ko) | 2002-11-15 | 2005-09-01 | 이데닉스 (케이만) 리미티드 | 2'-분지형 뉴클레오시드 및 플라비비리다에 돌연변이 |
| TWI332507B (en) | 2002-11-19 | 2010-11-01 | Hoffmann La Roche | Antiviral nucleoside derivatives |
| CA2508656A1 (en) | 2002-12-10 | 2004-06-24 | F.Hoffmann-La Roche Ag | Antiviral nucleoside derivatives |
| CA2509687C (en) | 2002-12-12 | 2012-08-14 | Idenix (Cayman) Limited | Process for the production of 2'-branched nucleosides |
| RU2005123395A (ru) | 2002-12-23 | 2006-01-27 | Айденикс (Кайман) Лимитед (Ky) | Способ получения 3-нуклеозидных пролекарств |
| JP3658392B2 (ja) | 2002-12-27 | 2005-06-08 | キヤノン電子株式会社 | 信号出力装置及び信号出力装置を備えたシート材処理装置 |
| US20040224917A1 (en) | 2003-01-14 | 2004-11-11 | Gilead Sciences, Inc. | Compositions and methods for combination antiviral therapy |
| US7223785B2 (en) | 2003-01-22 | 2007-05-29 | Boehringer Ingelheim International Gmbh | Viral polymerase inhibitors |
| WO2004080466A1 (en) | 2003-03-07 | 2004-09-23 | Ribapharm Inc. | Cytidine analogs and methods of use |
| BRPI0408561A (pt) | 2003-03-20 | 2006-03-21 | Microbiol Quimica Farmaceutica | métodos para manufatura de 2'-desoxi-59-l-nucleosìeos |
| US20040202993A1 (en) | 2003-04-10 | 2004-10-14 | Poo Ramon E. | Apparatus and method for organ preservation and transportation |
| ES2386161T3 (es) | 2003-04-16 | 2012-08-10 | Bristol-Myers Squibb Company | Proceso para separar una mezcla de enantiómeros de éster alquílico usando una enzima |
| WO2005002626A2 (en) | 2003-04-25 | 2005-01-13 | Gilead Sciences, Inc. | Therapeutic phosphonate compounds |
| EP1617848A2 (en) | 2003-04-25 | 2006-01-25 | Gilead Sciences, Inc. | Anti-cancer phosphonate conjugates |
| US7452901B2 (en) | 2003-04-25 | 2008-11-18 | Gilead Sciences, Inc. | Anti-cancer phosphonate analogs |
| ATE490788T1 (de) | 2003-04-25 | 2010-12-15 | Gilead Sciences Inc | Antivirale phosphonate analoge |
| US20050261237A1 (en) | 2003-04-25 | 2005-11-24 | Boojamra Constantine G | Nucleoside phosphonate analogs |
| US7470724B2 (en) | 2003-04-25 | 2008-12-30 | Gilead Sciences, Inc. | Phosphonate compounds having immuno-modulatory activity |
| MXPA05011296A (es) | 2003-04-25 | 2006-01-24 | Gilead Sciences Inc | Conjugados de fosfonato inhibidores de la cinasa. |
| US7407965B2 (en) | 2003-04-25 | 2008-08-05 | Gilead Sciences, Inc. | Phosphonate analogs for treating metabolic diseases |
| US20040259934A1 (en) | 2003-05-01 | 2004-12-23 | Olsen David B. | Inhibiting Coronaviridae viral replication and treating Coronaviridae viral infection with nucleoside compounds |
| WO2004096210A1 (en) | 2003-05-01 | 2004-11-11 | Glaxo Group Limited | Acylated indoline and tetrahydroquinoline derivatives as hcv inhibitors |
| US20040229839A1 (en) | 2003-05-14 | 2004-11-18 | Biocryst Pharmaceuticals, Inc. | Substituted nucleosides, preparation thereof and use as inhibitors of RNA viral polymerases |
| WO2005020884A2 (en) | 2003-05-14 | 2005-03-10 | Idenix (Cayman) Limited | Nucleosides for treatment of infection by corona viruses, toga viruses and picorna viruses |
| WO2004106356A1 (en) | 2003-05-27 | 2004-12-09 | Syddansk Universitet | Functionalized nucleotide derivatives |
| CA2734052A1 (en) | 2003-05-30 | 2005-01-13 | Pharmasset, Inc. | Modified fluorinated nucleoside analogues |
| WO2005007810A2 (en) | 2003-06-16 | 2005-01-27 | Grinstaff Mark W | Functional synthetic molecules and macromolecules for gene delivery |
| EP1644395B1 (en) | 2003-06-19 | 2006-11-22 | F. Hoffmann-La Roche Ag | Processes for preparing 4'azido nucleoside derivatives |
| DE10331239A1 (de) | 2003-07-10 | 2005-02-03 | Robert Bosch Gmbh | Überwachungselektronik für einen Elektromotor und Verfahren zur Überwachung eines Elektromotors |
| GB0317009D0 (en) | 2003-07-21 | 2003-08-27 | Univ Cardiff | Chemical compounds |
| PL1658302T3 (pl) | 2003-07-25 | 2011-03-31 | Idenix Pharmaceuticals Inc | Analogi nukleozydów purynowych do leczenia chorób spowodowanych przez Flaviviridae obejmujących zapalenie wątroby typu C |
| MXPA06002198A (es) | 2003-08-27 | 2007-08-14 | Biota Scient Management | Nucleosidos o nucleotidos triciclicos novedosos como agentes terapeuticos. |
| JP4685775B2 (ja) | 2003-09-18 | 2011-05-18 | バーテックス ファーマシューティカルズ インコーポレイテッド | セリンプロテアーゼ、とりわけhcvns3−ns4aプロテアーゼの阻害剤 |
| US20050148534A1 (en) | 2003-09-22 | 2005-07-07 | Castellino Angelo J. | Small molecule compositions and methods for increasing drug efficiency using compositions thereof |
| US7491794B2 (en) | 2003-10-14 | 2009-02-17 | Intermune, Inc. | Macrocyclic compounds as inhibitors of viral replication |
| EP2407470A3 (en) | 2003-10-14 | 2015-06-10 | F. Hoffmann-La Roche Ltd. | Macrocyclic carboxylic acids and acylsulfonamides as inhibitors of HCV replication |
| MXPA06004680A (es) * | 2003-10-27 | 2007-04-17 | Genelabs Tech Inc | Compuestos de nucleosido para el tratamiento de infecciones virales. |
| US7026339B2 (en) | 2003-11-07 | 2006-04-11 | Fan Yang | Inhibitors of HCV NS5B polymerase |
| TW200528459A (en) | 2004-01-06 | 2005-09-01 | Achillion Pharmaceuticals Inc | Azabenzofuran substituted thioureas; inhibitors of viral replication |
| EP1718152A4 (en) | 2004-01-28 | 2009-09-16 | Merck & Co Inc | AMINOCYCLOPENTYL MODULATORS PYRIDOPYRAZINONE OF CHEMOKINE RECEPTOR ACTIVITY |
| AU2005216971A1 (en) | 2004-02-25 | 2005-09-09 | Government Of The United States Of America, As Represented By The Secretary Department Of Health And Human Services Office Of Technology Transfer | Methylation inhibitor compounds |
| CN100384237C (zh) | 2004-02-28 | 2008-04-23 | 鸿富锦精密工业(深圳)有限公司 | 音量调整装置及方法 |
| WO2005087788A2 (en) | 2004-03-04 | 2005-09-22 | The Regents Of The University Of California | Methods for preparation of nucleoside phosphonate esters |
| US8759317B2 (en) | 2004-03-18 | 2014-06-24 | University Of South Florida | Method of treatment of cancer using guanosine 3′, 5′ cyclic monophosphate (cyclic GMP) |
| EA012389B1 (ru) | 2004-03-30 | 2009-10-30 | Интермун, Инк. | Макроциклические соединения в качестве ингибиторов вирусной репликации |
| GB0408995D0 (en) | 2004-04-22 | 2004-05-26 | Glaxo Group Ltd | Compounds |
| WO2005123087A2 (en) | 2004-06-15 | 2005-12-29 | Merck & Co., Inc. | C-purine nucleoside analogs as inhibitors of rna-dependent rna viral polymerase |
| CA2571675A1 (en) | 2004-06-23 | 2006-01-05 | Idenix (Cayman) Limited | 5-aza-7-deazapurine derivatives for treating infections with flaviviridae |
| US20070265222A1 (en) | 2004-06-24 | 2007-11-15 | Maccoss Malcolm | Nucleoside Aryl Phosphoramidates for the Treatment of Rna-Dependent Rna Viral Infection |
| US7217523B2 (en) | 2004-07-02 | 2007-05-15 | Regents Of The University Of Minnesota | Nucleoside phosphoramidates and nucleoside phosphoramidases |
| CN101023094B (zh) | 2004-07-21 | 2011-05-18 | 法莫赛特股份有限公司 | 烷基取代的2-脱氧-2-氟代-d-呋喃核糖基嘧啶和嘌呤及其衍生物的制备 |
| EP2348029A1 (en) | 2004-07-21 | 2011-07-27 | Pharmasset, Inc. | Preparation of alkyl-substituted 2-deoxy-2-fluoro-d-ribofuranosyl pyrimidines and purines and their derivatives |
| ES2720618T3 (es) | 2004-07-27 | 2019-07-23 | Gilead Sciences Inc | Análogos de fosfonato de compuestos de inhibidores de VIH |
| US7153848B2 (en) | 2004-08-09 | 2006-12-26 | Bristol-Myers Squibb Company | Inhibitors of HCV replication |
| US7348425B2 (en) | 2004-08-09 | 2008-03-25 | Bristol-Myers Squibb Company | Inhibitors of HCV replication |
| CA2577526A1 (en) | 2004-08-23 | 2006-03-02 | Joseph Armstrong Martin | Antiviral 4'-azido-nucleosides |
| WO2006021340A1 (en) | 2004-08-23 | 2006-03-02 | F.Hoffmann-La Roche Ag | Heterocyclic antiviral compounds |
| WO2006029081A2 (en) | 2004-09-02 | 2006-03-16 | Neopharm, Inc. | Nucleoside-lipid conjugates, their method of preparation and uses thereof |
| RU2433124C2 (ru) | 2004-09-14 | 2011-11-10 | Фармассет, Инк. | Способ получения 2'-фтор-2'-алкилзамещенных или других замещенных рибофуранозилпиримидинов и пуринов и их производных |
| EP1804811A4 (en) | 2004-09-24 | 2011-04-27 | Idenix Cayman Ltd | METHOD AND COMPOSITION FOR THE TREATMENT OF FLAVIVERS, PESTIVERS AND HEPACIVIRES |
| AP2007003923A0 (en) | 2004-09-30 | 2007-02-28 | Tibotec Pharm Ltd | Hcv inhibiting bi-cyclic pyrimidines |
| US20080280842A1 (en) | 2004-10-21 | 2008-11-13 | Merck & Co., Inc. | Fluorinated Pyrrolo[2,3-D]Pyrimidine Nucleosides for the Treatment of Rna-Dependent Rna Viral Infection |
| WO2006050161A2 (en) | 2004-10-29 | 2006-05-11 | Biocryst Pharmaceuticals, Inc. | Therapeutic furopyrimidines and thienopyrimidines |
| EP1827460A4 (en) | 2004-12-09 | 2012-03-14 | Univ Minnesota | NUCLEOSIDE WITH ANTIVIRAL AND ANTI-CANCER EFFECT |
| GB0427123D0 (en) | 2004-12-11 | 2005-01-12 | Apv Systems Ltd | Food item coating apparatus and method |
| WO2006063717A2 (en) | 2004-12-16 | 2006-06-22 | Febit Biotech Gmbh | Polymerase-independent analysis of the sequence of polynucleotides |
| WO2006065590A2 (en) | 2004-12-16 | 2006-06-22 | Xtl Biopharmaceuticals Inc. | Pyridine and pyrimidine antiviral compositions |
| WO2006093801A1 (en) | 2005-02-25 | 2006-09-08 | Abbott Laboratories | Thiadiazine derivatives useful as anti-infective agents |
| EA200701849A1 (ru) | 2005-02-28 | 2008-02-28 | Дженелабс Текнолоджис, Инк. | Пролекарственные соединения трициклических нуклеозидов, фармацевтическая композиция на их основе и способ лечения и/или ингибирования вирусной инфекции у млекопитающего |
| US8802840B2 (en) | 2005-03-08 | 2014-08-12 | Biota Scientific Management Pty Ltd. | Bicyclic nucleosides and nucleotides as therapeutic agents |
| GB0505781D0 (en) | 2005-03-21 | 2005-04-27 | Univ Cardiff | Chemical compounds |
| AU2006226322B2 (en) | 2005-03-25 | 2012-03-29 | Tibotec Pharmaceuticals Ltd. | Heterobicylic inhibitors of HCV |
| TW200720285A (en) | 2005-04-25 | 2007-06-01 | Genelabs Tech Inc | Nucleoside compounds for treating viral infections |
| US7485716B2 (en) | 2005-05-02 | 2009-02-03 | Pharmaessentia Corp. | Stereoselective synthesis of β-nucleosides |
| WO2006121820A1 (en) * | 2005-05-05 | 2006-11-16 | Valeant Research & Development | Phosphoramidate prodrugs for treatment of viral infection |
| AR056347A1 (es) | 2005-05-12 | 2007-10-03 | Tibotec Pharm Ltd | Uso de compuestos de pteridina para fabricar medicamentos y composiciones farmaceuticas |
| TW200716631A (en) | 2005-05-12 | 2007-05-01 | Tibotec Pharm Ltd | Pyrido[2,3-d]pyrimidines useful as HCV inhibitors, and methods for the preparation thereof |
| WO2007027248A2 (en) * | 2005-05-16 | 2007-03-08 | Valeant Research & Development | 3', 5' - cyclic nucleoside analogues for treatment of hcv |
| US8143288B2 (en) | 2005-06-06 | 2012-03-27 | Bristol-Myers Squibb Company | Inhibitors of HCV replication |
| TWI471145B (zh) | 2005-06-13 | 2015-02-01 | Bristol Myers Squibb & Gilead Sciences Llc | 單一式藥學劑量型 |
| TWI375560B (en) | 2005-06-13 | 2012-11-01 | Gilead Sciences Inc | Composition comprising dry granulated emtricitabine and tenofovir df and method for making the same |
| WO2007002191A2 (en) | 2005-06-22 | 2007-01-04 | Biocryst Pharmaceuticals, Inc. | Methods for the preparation of 9-deazapurine derivatives |
| US20060293752A1 (en) | 2005-06-27 | 2006-12-28 | Missoum Moumene | Intervertebral disc prosthesis and associated methods |
| BRPI0613962A2 (pt) | 2005-07-25 | 2009-03-24 | Intermune Inc | inibidores macrocìclicos inovadores de replicação de vìrus da hepatite c |
| JP5243247B2 (ja) | 2005-07-28 | 2013-07-24 | アイエスピー インヴェストメンツ インコーポレイテッド | スプレー乾燥された粉体及び粒状化された材料の特性の改良方法、並びにそれによって製造した製品 |
| WO2007013047A2 (en) | 2005-07-29 | 2007-02-01 | Ranbaxy Laboratories Limited | Water-dispersible anti-retroviral pharmaceutical compositions |
| AR054882A1 (es) | 2005-07-29 | 2007-07-25 | Tibotec Pharm Ltd | Inhibidores macrociclicos del virus de la hepatitis c |
| AR055105A1 (es) | 2005-07-29 | 2007-08-08 | Tibotec Pharm Ltd | Inhibidores macrociclicos del virus de la hepatitis c |
| WO2007014925A1 (en) | 2005-07-29 | 2007-02-08 | Tibotec Pharmaceuticals Ltd. | Macrocylic inhibitors of hepatitis c virus |
| PE20070211A1 (es) | 2005-07-29 | 2007-05-12 | Medivir Ab | Compuestos macrociclicos como inhibidores del virus de hepatitis c |
| US7666834B2 (en) | 2005-07-29 | 2010-02-23 | Tibotec Pharmaceuticals Ltd. | Macrocyclic inhibitors of hepatitis C virus |
| CN101287472B (zh) | 2005-08-15 | 2011-10-12 | 弗·哈夫曼-拉罗切有限公司 | 抗病毒的4'-取代前核苷酸的氨基磷酸酯类化合物 |
| GB0519488D0 (en) | 2005-09-23 | 2005-11-02 | Glaxo Group Ltd | Compounds |
| GB0519478D0 (en) | 2005-09-23 | 2005-11-02 | Glaxo Group Ltd | Compounds |
| CA2623522C (en) | 2005-09-26 | 2015-12-08 | Pharmasset, Inc. | Modified 4'-nucleosides as antiviral agents |
| US7668209B2 (en) | 2005-10-05 | 2010-02-23 | Lg Electronics Inc. | Method of processing traffic information and digital broadcast system |
| RU2422454C2 (ru) | 2005-12-09 | 2011-06-27 | Ф. Хоффманн-Ля Рош Аг | Антивирусные нуклеозиды |
| RU2008128452A (ru) | 2005-12-12 | 2010-01-20 | Дженелабс Текнолоджис, Инк. (Us) | Соединения n-(6-членных арил)-амидов, фармацевтическая композиция с противовирусной активностью на их основе, способ лечения или профилактики вирусной инфекции с их помощью и способ их получения |
| NZ544187A (en) | 2005-12-15 | 2008-07-31 | Ind Res Ltd | Deazapurine analogs of 1'-aza-l-nucleosides |
| AU2006330924B2 (en) | 2005-12-21 | 2012-03-15 | Abbvie Inc. | Anti-viral compounds |
| GB0602046D0 (en) | 2006-02-01 | 2006-03-15 | Smithkline Beecham Corp | Compounds |
| WO2007092000A1 (en) | 2006-02-06 | 2007-08-16 | Bristol-Myers Squibb Company | Inhibitors of hcv replication |
| WO2007095269A2 (en) | 2006-02-14 | 2007-08-23 | Merck & Co., Inc. | Nucleoside aryl phosphoramidates for the treatment of rna-dependent rna viral infection |
| CA2640672A1 (en) | 2006-02-17 | 2007-08-23 | Pfizer Limited | 3 -deazapurine derivatives as tlr7 modulators |
| US8895531B2 (en) | 2006-03-23 | 2014-11-25 | Rfs Pharma Llc | 2′-fluoronucleoside phosphonates as antiviral agents |
| ES2343914T3 (es) | 2006-05-25 | 2010-08-12 | Bristol-Myers Squibb Company | Inhibidores de ns5b de hcv de indolobenzazepina condensada con ciclopropilo. |
| EP3696171A1 (en) | 2006-07-07 | 2020-08-19 | Gilead Sciences, Inc. | Modulators of pharmacokinetic properties of therapeutics |
| WO2008008120A1 (en) | 2006-07-14 | 2008-01-17 | Fmc Corporation | Solid form |
| EP1881001A1 (en) | 2006-07-20 | 2008-01-23 | Tibotec Pharmaceuticals Ltd. | HCV NS-3 serine protease inhibitors |
| TW200815384A (en) | 2006-08-25 | 2008-04-01 | Viropharma Inc | Combination therapy method for treating hepatitis C virus infection and pharmaceutical compositions for use therein |
| CA2666098C (en) | 2006-10-10 | 2012-09-25 | Steven D. Axt | Preparation of nucleosides ribofuranosyl pyrimidines |
| PL216525B1 (pl) | 2006-10-17 | 2014-04-30 | Ct Badań Molekularnych I Makromolekularnych Polskiej Akademii Nauk | 5'-O-[(N-acylo)amidoditiofosforano] nukleozydy oraz sposób wytwarzania 5'-O-[(N-acylo)amidofosforano]-,5'-O-[(N-acylo)amidotiofosforano]-, 5'-O-[(N-acylo)amidoditiofosforano]nukleozydów |
| GB0623493D0 (en) | 2006-11-24 | 2007-01-03 | Univ Cardiff | Chemical compounds |
| AU2007338899A1 (en) | 2006-12-20 | 2008-07-03 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti S.P.A. | Nucleoside cyclic phosphoramidates for the treatment of RNA-dependent RNA viral infection |
| US20080261913A1 (en) | 2006-12-28 | 2008-10-23 | Idenix Pharmaceuticals, Inc. | Compounds and pharmaceutical compositions for the treatment of liver disorders |
| EP2124555B1 (en) | 2007-01-05 | 2015-07-08 | Merck Sharp & Dohme Corp. | Nucleoside aryl phosphoramidates for the treatment of rna-dependent rna viral infection |
| EP2136626A4 (en) | 2007-03-19 | 2011-02-23 | Oregon State | MANNICH N-OXIDE BASED MEDICINES |
| US7964580B2 (en) | 2007-03-30 | 2011-06-21 | Pharmasset, Inc. | Nucleoside phosphoramidate prodrugs |
| GB0709791D0 (en) * | 2007-05-22 | 2007-06-27 | Angeletti P Ist Richerche Bio | Antiviral agents |
| CN100532388C (zh) | 2007-07-16 | 2009-08-26 | 郑州大学 | 2’-氟-4’-取代-核苷类似物、其制备方法及应用 |
| CN101108870A (zh) * | 2007-08-03 | 2008-01-23 | 冷一欣 | 核苷磷酸酯类化合物及制备方法和应用 |
| CA2698094A1 (en) | 2007-08-31 | 2009-03-05 | The United States Of America, As Represented By The Secretary, Departmen T Of Health And Human Services | Compounds for inhibiting wip1, prodrugs and compositions thereof, and related methods |
| JO2778B1 (en) | 2007-10-16 | 2014-03-15 | ايساي انك | Certain vehicles, installations and methods |
| JP5238939B2 (ja) | 2007-11-07 | 2013-07-17 | 三菱化学株式会社 | 長繊維強化複合樹脂組成物および成形品 |
| US20090318380A1 (en) | 2007-11-20 | 2009-12-24 | Pharmasset, Inc. | 2',4'-substituted nucleosides as antiviral agents |
| US20090176732A1 (en) | 2007-12-21 | 2009-07-09 | Alios Biopharma Inc. | Protected nucleotide analogs |
| US8227431B2 (en) | 2008-03-17 | 2012-07-24 | Hetero Drugs Limited | Nucleoside derivatives |
| WO2009142822A2 (en) | 2008-03-26 | 2009-11-26 | Alnylam Pharmaceuticals, Inc. | 2-f modified rna interference agents |
| EP3042660A3 (en) | 2008-04-15 | 2016-10-26 | RFS Pharma, LLC. | Nucleoside derivatives for treatment of caliciviridae infections, including norovirus infections |
| PT2280973E (pt) | 2008-04-23 | 2013-02-04 | Gilead Sciences Inc | Análogos de carba-nucleósido para tratamento antiviral |
| US7964560B2 (en) | 2008-05-29 | 2011-06-21 | Bristol-Myers Squibb Company | Hepatitis C virus inhibitors |
| US8173621B2 (en) * | 2008-06-11 | 2012-05-08 | Gilead Pharmasset Llc | Nucleoside cyclicphosphates |
| WO2010042834A1 (en) | 2008-10-09 | 2010-04-15 | Anadys Pharmaceuticals, Inc. | A method of inhibiting hepatitis c virus by combination of a 5,6-dihydro-1h-pyridin-2-one and one or more additional antiviral compounds |
| NZ593648A (en) | 2008-12-23 | 2013-09-27 | Gilead Pharmasset Llc | Nucleoside phosphoramidates |
| CL2009002206A1 (es) | 2008-12-23 | 2011-08-26 | Gilead Pharmasset Llc | Compuestos derivados de pirrolo -(2-3-d]-pirimidin-7(6h)-tetrahidrofuran-2-il fosfonamidato, composicion farmaceutica; y su uso en el tratamiento de enfermedades virales. |
| EA201100851A1 (ru) * | 2008-12-23 | 2012-04-30 | Фармассет, Инк. | Аналоги нуклеозидов |
| RU2011127079A (ru) | 2009-01-07 | 2013-02-20 | Сайнексис, Инк. | Комбинация производного циклоспорина и нуклеозидов для лечения инфекции вирусом гепатита с |
| PE20120013A1 (es) | 2009-01-09 | 2012-02-02 | Univ Cardiff | Fosforamidato derivados de guanosina compuestos nucleosidos para tratamiento de infecciones virales |
| JO3027B1 (ar) | 2009-05-14 | 2016-09-05 | Janssen Products Lp | نيوكليوسيدات يوراسيل سبيرواوكسيتان |
| TWI576352B (zh) | 2009-05-20 | 2017-04-01 | 基利法瑪席特有限責任公司 | 核苷磷醯胺 |
| US8618076B2 (en) | 2009-05-20 | 2013-12-31 | Gilead Pharmasset Llc | Nucleoside phosphoramidates |
| US8719767B2 (en) | 2011-03-31 | 2014-05-06 | Commvault Systems, Inc. | Utilizing snapshots to provide builds to developer computing devices |
| US7973013B2 (en) | 2009-09-21 | 2011-07-05 | Gilead Sciences, Inc. | 2'-fluoro substituted carba-nucleoside analogs for antiviral treatment |
| PE20160217A1 (es) | 2009-09-21 | 2016-05-18 | Gilead Sciences Inc | Analogos de carba-nucleosidos sustituidos con 2'-fluoro antivirales |
| BR112012024884A2 (pt) | 2010-03-31 | 2016-10-18 | Gilead Pharmasset Llc | síntese estereosseletiva de ativos contendo fósforo |
| US8563530B2 (en) | 2010-03-31 | 2013-10-22 | Gilead Pharmassel LLC | Purine nucleoside phosphoramidate |
| AR084044A1 (es) | 2010-11-30 | 2013-04-17 | Pharmasset Inc | Compuestos 2’-espiro-nucleosidos |
-
2009
- 2009-12-23 CL CL2009002206A patent/CL2009002206A1/es unknown
- 2009-12-23 NZ NZ593647A patent/NZ593647A/xx not_active IP Right Cessation
- 2009-12-23 AU AU2009329872A patent/AU2009329872B2/en not_active Ceased
- 2009-12-23 US US12/645,821 patent/US8716263B2/en active Active
- 2009-12-23 JP JP2011543686A patent/JP5793084B2/ja not_active Expired - Fee Related
- 2009-12-23 MX MX2011006892A patent/MX2011006892A/es not_active Application Discontinuation
- 2009-12-23 KR KR1020117017244A patent/KR20110104074A/ko not_active Application Discontinuation
- 2009-12-23 CA CA2748016A patent/CA2748016A1/en not_active Abandoned
- 2009-12-23 EA EA201100932A patent/EA019295B1/ru not_active IP Right Cessation
- 2009-12-23 SG SG2011046364A patent/SG172363A1/en unknown
- 2009-12-23 BR BRPI0923815-8A patent/BRPI0923815A2/pt not_active IP Right Cessation
- 2009-12-23 PA PA20098855801A patent/PA8855801A1/es unknown
- 2009-12-23 TW TW098144469A patent/TW201031675A/zh unknown
- 2009-12-23 EP EP13182837.8A patent/EP2671888A1/en not_active Withdrawn
- 2009-12-23 EP EP09793688A patent/EP2376515A1/en not_active Withdrawn
- 2009-12-23 CN CN2009801573370A patent/CN102325783A/zh active Pending
- 2009-12-23 SG SG2013074166A patent/SG194404A1/en unknown
- 2009-12-23 WO PCT/US2009/069475 patent/WO2010075554A1/en active Application Filing
- 2009-12-23 AR ARP090105094A patent/AR074977A1/es not_active Application Discontinuation
-
2011
- 2011-06-21 CO CO11077750A patent/CO6400228A2/es not_active Application Discontinuation
- 2011-06-21 IL IL213701A patent/IL213701A0/en unknown
-
2012
- 2012-06-07 US US13/491,437 patent/US9045520B2/en active Active
- 2012-12-21 JP JP2012279175A patent/JP2013082728A/ja not_active Withdrawn
-
2015
- 2015-04-20 JP JP2015085771A patent/JP2015180628A/ja not_active Withdrawn
- 2015-06-09 JP JP2015117054A patent/JP2015227337A/ja not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| JP2013082728A (ja) | 2013-05-09 |
| BRPI0923815A2 (pt) | 2015-07-14 |
| EP2376515A1 (en) | 2011-10-19 |
| AU2009329872A1 (en) | 2011-07-14 |
| JP2015227337A (ja) | 2015-12-17 |
| CA2748016A1 (en) | 2010-07-01 |
| EA201100932A1 (ru) | 2012-02-28 |
| AU2009329872B2 (en) | 2016-07-07 |
| US8716263B2 (en) | 2014-05-06 |
| SG172363A1 (en) | 2011-07-28 |
| EA019295B1 (ru) | 2014-02-28 |
| MX2011006892A (es) | 2011-07-20 |
| NZ593647A (en) | 2013-08-30 |
| US9045520B2 (en) | 2015-06-02 |
| CO6400228A2 (es) | 2012-03-15 |
| TW201031675A (en) | 2010-09-01 |
| US20120316327A1 (en) | 2012-12-13 |
| JP5793084B2 (ja) | 2015-10-14 |
| WO2010075554A1 (en) | 2010-07-01 |
| PA8855801A1 (es) | 2010-07-27 |
| JP2012513479A (ja) | 2012-06-14 |
| US20100279973A1 (en) | 2010-11-04 |
| IL213701A0 (en) | 2011-07-31 |
| EP2671888A1 (en) | 2013-12-11 |
| CL2009002206A1 (es) | 2011-08-26 |
| CN102325783A (zh) | 2012-01-18 |
| AR074977A1 (es) | 2011-03-02 |
| SG194404A1 (en) | 2013-11-29 |
| JP2015180628A (ja) | 2015-10-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2009329872B2 (en) | Synthesis of purine nucleosides | |
| AU2009257647B2 (en) | Nucleoside cyclicphosphates | |
| EP2826784B1 (en) | Composition comprising a HCV NS3 protease inhibitor and a phosphoramidate prodrug of 2'-deoxy-2'-fluoro-2'-C-methyluridine nucleoside | |
| EP3159351A2 (en) | Modified 3'-azido-4'-ethynyl-nucleosides as antiviral agents | |
| KR20130064064A (ko) | 인을 함유하는 활성물의 입체선택성 합성 | |
| WO2013187978A1 (en) | Double-liver-targeting phosphoramidate and phosphonoamidate prodrugs | |
| KR20050109918A (ko) | 2'-분지형 뉴클레오시드의 제조 방법 | |
| JP2012514657A (ja) | ウィルス感染を治療するためのグアノシンヌクレオシド化合物のホスホルアミダート誘導体 | |
| US20040181051A1 (en) | Process for the production of 3'-nucleoside prodrugs | |
| Ovadia et al. | Synthesis and anti-HCV activity of β-D-2′-deoxy-2′-α-chloro-2′-β-fluoro and β-d-2′-deoxy-2′-α-bromo-2′-β-fluoro nucleosides and their phosphoramidate prodrugs | |
| US7595390B2 (en) | Industrially scalable nucleoside synthesis | |
| MX2008004079A (en) | Modified 4'-nucleosides as antiviral agents |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |