KR20110050529A - Pd-1 길항제의 조성물 및 사용 방법 - Google Patents
Pd-1 길항제의 조성물 및 사용 방법 Download PDFInfo
- Publication number
- KR20110050529A KR20110050529A KR1020117006754A KR20117006754A KR20110050529A KR 20110050529 A KR20110050529 A KR 20110050529A KR 1020117006754 A KR1020117006754 A KR 1020117006754A KR 20117006754 A KR20117006754 A KR 20117006754A KR 20110050529 A KR20110050529 A KR 20110050529A
- Authority
- KR
- South Korea
- Prior art keywords
- leu
- val
- polypeptide
- thr
- pro
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70532—B7 molecules, e.g. CD80, CD86
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Virology (AREA)
- Immunology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Tropical Medicine & Parasitology (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Toxicology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Pulmonology (AREA)
- Hematology (AREA)
- AIDS & HIV (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
T 세포에서 억제 신호 전달을 감소시키는 화합물을 강력한 T 세포 매개된 반응을 생성시키기 위해 증강제, 예를 들어 시클로포스파미드와 조합하여 투여하는 것을 포함하는 치료 요법을 이용하는 암 및 감염성 질환의 치료 방법을 설명한다. 본 발명의 방법에서 유용한 PD-1 길항제 및 증강제를 포함하는 조성물을 또한 개시한다.
Description
본원은 2009년 4월 2일 출원된 미국 특허 가출원 61/211,697, 2008년 8월 25일 출원된 61/091,694, 2008년 8월 25일 출원된 61/091,709, 및 2008년 8월 25일 출원된 61/091,705를 기초로 한 우선권을 주장하며, 상기 출원은 그 전문이 본원에 참고로 포함된다.
발명의 분야
본 발명은 T 세포에 대한 억제 신호 전달을 방지하는 화합물을 증강제와 조합하여 함유하는 치료 조성물, 및 질환 치료에 유용한 T 세포 반응의 유도를 위한, 상기 성분의 조합물 또는 개별적인 성분의 용도에 관한 것이다.
질환 상태, 예를 들어 감염 및 암과 같은 만성 질환에 대한 T 림프구의 반응은 복잡하고, 세포간 상호작용 및 가용형 매개물질 (시토카인 또는 림포카인으로 불림)의 생산을 수반한다. T 세포의 활성화는 보통 T 세포 수용체 (TCR)와 주요 조직적합 복합체 (MHC)를 통해 제시된 항원성 펩티드와의 접촉 후의 항원-특이적 신호에 따라 결정되는 한편, 상기 반응의 정도는 다양한 보조-자극성 분자로부터 나오는 양성 및 음성 항원-비의존 신호에 의해 제어된다. 후자는 일반적으로 CD28/B7 패밀리의 구성원이다. 이와 반대로, 프로그래밍된 사멸 (Programmed Death)-1 (PD-1)은 T 세포 상에서 유도될 때 음성 면역 반응을 전달하는 CD28 패밀리의 수용체의 구성원이다. PD-1 및 그의 리간드 (B7-H1 또는 B7-DC) 중 하나 사이의 접촉은 T 세포 증식 및/또는 T 세포 반응의 강도 및/또는 지속기간을 감소시키는 억제성 반응을 유도한다.
따라서, T 림프구 반응은 수용체로서 역할을 하는 세포 표면 분자를 포함한 다양한 인자에 의해 조절되고, 여기서 후자는 TCR 복합체 및 다른 표면 분자를 모두 포함한다.
요약하면, 항원 특이적 T 세포 반응은 2개의 신호에 의해 매개된다: 1) TCR과 HC의 상황에서 제시되는 항원성 펩티드와의 결합 (신호 1), 및 2) 상이한 수용체/리간드 쌍 사이의 접촉에 의해 전달되는 제2 항원-비의존 신호 (신호 2). 상기 "제2 신호"는 T 세포 반응의 종류 (활성화 vs 내성) 및 그 반응의 강도 및 지속기간을 결정하는데 중요하고, B7 패밀리의 단백질과 같은 보조자극 분자로부터의 양성 및 음성 신호 모두에 의해 조절된다.
가장 광범위하게 특성이 결정된 T 세포 보조자극 경로는 B7-CD28이고, 여기서 B7-1 (CD80) 및 B7-2 (CD86)은 각각 자극성 CD28 수용체 및 억제성 CTLA-4 (CD152) 수용체에 결합할 수 있다. T 세포 수용체를 통한 신호 전달과 함께, CD28 라이게이션 (ligation)은 T 세포의 항원-특이적 증식을 증가시키고, 시토카인 생산을 향상시키고, 분화 및 효과기 기능을 활성화시키고, T 세포의 생존을 촉진한다 ([Lenshow, et al., Annu. Rev. Immunol., 14:233-258 (1996)]; [Chambers and Allison, Curr. Opin. Immunol., 9:396-404 (1997)]; 및 [Rathmell and Thompson, Annu. Rev. Immunol., 17:781-828 (1999)]). 이와 달리, CTLA-4를 통한 신호 전달은 T 세포 증식, IL-2 생산, 및 세포 주기 진행을 억제하는 음성 신호를 전달하는 것으로 생각된다 ([Krummel and Allison, J. Exp. Med., 183:2533-2540 (1996)]; 및 [Walunas, et al., J. Exp. Med., 183:2541-2550 (1996)]). B7 패밀리의 보조자극 분자의 다른 구성원은 B7-H1 ([Dong, et al., Nature Med., 5:1365-1369 (1999)]; 및 [Freeman, et al., J. Exp. Med., 192:1-9 (2000)]), B7-DC ([Tseng, et al., J. Exp. Med., 193:839-846 (2001)]; 및 [Latchman, et al., Nature Immunol., 2:261-268 (2001)]), B7-H2 ([Wang, et al., Blood, 96:2808-2813 (2000)]; [Swallow, et al., Immunity, 11:423-432 (1999)]; 및 [Yoshinaga, et al., Nature, 402:827-832 (1999)]), B7-H3 ([Chapoval, et al., Nature Immunol., 2:269-274 (2001)]) 및 B7-H4 ([Choi, et al., J. Immunol., 171:4650-4654 (2003)]; [Sica, et al., Immunity, 18:849-861 (2003)]; [Prasad, et al., Immunity, 18:863-873 (2003)]; 및 [Zang, et al., Proc. Natl. Acad. Sci. U.S.A., 100:10388-10392 (2003)])을 포함한다. B7-H5 (WO 2006/012232에 기재됨)는 B7 패밀리의 새로 발견된 구성원이다.
B7 패밀리 분자는 막 근위 IgC (불변) 도메인 및 막 원위 IgV (가변) 도메인을 갖는다. 이들 리간드에 대한 CD28-유사 패밀리의 수용체는 공통의 세포외 IgV-유사 도메인을 공유한다. 수용체-리간드 쌍의 상호작용은 주로 리간드의 IgV 도메인 및 수용체 내의 잔기들을 통해 매개된다 (Schwartz, et al., Nature Immunol., 3:427-434 (2002)). 일반적으로, IgV 도메인은 각각 β-가닥의 층을 포함하는 2개의 시트 (sheet)를 갖는 것으로서 설명된다 (Williams and Barclay, Annu. Rev. Immunol., 6:381-405 (1988)). CTLA-4의 전면 및 후면 시트는 각각 가닥 A'GFC'C 및 ABEDC를 포함하는 반면 (Ostrov, et al., Science, 290:816-819 (2000)), B7 IgV 도메인의 전면 및 후면 시트는 각각 가닥 AGFCC'C" 및 BED로 구성된다 ([Schwartz, et al., Nature, 410:604-608 (2001)]; [Stamper, et al., Nature, 410:608-611 (2001)]; 및 [Ikemizu, et al., Immunity, 12:51-60 (2000)]). 결정학 분석으로 CTLA-4/B7 결합 계면이 MYPPPY 모티프로 구성된, CTLA-4로부터의 CDR3-유사 루프와 주로 G, F, C, C' 및 C" 가닥에 의해 형성된 B7 상의 표면과의 상호작용에 의해 지배됨이 밝혀졌다 ([Schwartz, et al., Nature, 410:604-608 (2001)]; 및 [Stamper, et al., Nature, 410:608-611 (2001)]). 아미노산 상동성, 돌연변이, 및 컴퓨터 모델링으로부터의 데이타는 상기 모티프가 또한 CD28에 대한 주요 B7-결합 부위라는 개념을 지지한다 (Bajorath, et al., J. Mol. Graph. Model., 15:135-139 (1997)). MYPPPY 모티프는 B7-H2에 대한 수용체인 ICOS에서 보존되지 않지만, 연구에서는 서열 FDPPPF를 갖고 유사한 위치에 위치하는 관련 모티프가 B7-H2에 대한 ICOS의 결합에 대한 주요 결정인자임을 나타내었다 (Wand, et al., J. Exp. Med., 195:1033-1041 (2002)).
B7-DC (PD-L2 또는 CD273으로도 불림)는 B7 패밀리의 비교적 새로운 구성원이고, B7-H1 (PD-L1로도 불림)에 약 34% 동일한 아미노산 서열을 갖는다. 인간 및 마우스 B7-DC 오르토로그 (orthologue)는 약 70% 아미노산 동일성을 공유한다. B7-H1 및 B7-DC 전사체는 다양한 조직에서 발견되지만 ([Dong, et al., Nature Med., 5:1365-1369 (1999)]; [Latchman, et al., Nature Immunol., 2:261-268 (2001)]; 및 [Tamura, Blood, 97:1809-1816 (2001)]), 단백질의 발현 프로필은 매우 구별된다. B7-H1은 매우 다양한 조직 및 세포 종류 상에서 널리 발현되는 한편, B7-DC 발현은 주로 활성화된 수지상 세포 (DC) 및 대식세포에 제한된다.
B7-H1 및 B7-DC는 둘 모두 그의 세포질 도메인 내에 면역수용체 티로신-기반 억제성 모티프 (ITIM)를 갖는 CD28 패밀리의 먼 구성원 (Ishida, et al., EMBO J., 11:3887-3895 (1992))인 PD-1에 결합하는 것으로 나타났다 (Freeman, et al., J. Exp. Med., 192:1027-1034 (2000)). CD28 패밀리의 수용체의 구성원인 PD-1은 활성화된 T 세포, B 세포, 천연 킬러 (NK) 세포, 단핵구, DC, 및 대식세포 상에서 유도되어 발현된다 (Keir, et al. Curr. Opin. Immunol. 19:309-314 (2007)).
그의 리간드에 의한 PD-1 라이게이션의 주요 결과는 T 세포 수용체 (TCR)의 하류에서 신호 전달을 억제하는 것이다. 따라서, PD-1을 통한 신호 전달은 대체로 T 세포에 억압 또는 억제 신호를 제공하여, 감소된 T 세포 증식 또는 T 세포 활성의 다른 감소를 일으킨다. B7-H1은 T 세포에서 억제 신호 전달을 일으키는 주요 PD-1 리간드이다. 본 발명에서는 PD-1에 결합하고 따라서 억제 신호 전달을 방지하거나, 또는 달리 PD-1의 리간드, 예를 들어 B7-H1에 결합하여, 리간드가 억제 신호를 전달하기 위해 PD-1에 결합하는 것을 방지하는 물질을 제공함으로써, 바람직하지 않은 T 세포 억제의 문제를 해결한다. 두 경우에, T 세포 반응, 예를 들어 T 세포 증식 또는 활성화가 자극된다.
B7-H1은 아마도 그의 보다 넓은 분포 및 보다 높은 발현 수준으로 인해 주요한 PD-1 리간드이다. PD-1 억제는 면역 시냅스의 환경에서 PD-1 및 TCR이 서로 매우 근접하게 라이게이팅될 때에만 일어난다. PD-1 및 그의 리간드는 몇몇 검토 문헌의 주제이었다.
B7-H1은 또한 많은 암 (예를 들어 유방암, 결장암, 식도암, 위암, 신경아교종, 백혈병, 폐암, 흑색종, 다발 골수종, 난소암, 췌장암, 신세포 암종, 및 요로상피암)에서 과다 발현되고, 불량한 예후에 연관되었다. B7-H1은 특히 인터페론 감마 (IFN-γ)로의 자극 후에 많은 종양 세포주에 의해 발현되고, 또한 종양 침윤성 골수 유래 억제자 세포 (MDSC) 상에서 상향조절된다. 예를 들어, PD-1은 종양 특이적 CD8 T 세포 상에서 상향-조절되고, 기능성 장애, 무응답 (anergy), 결핍, 및 세포자멸 (apoptosis)과 연관된다. PD-1 상향조절은 또한 추가의 세포 종류, 예를 들어 조절성 T 세포 (Treg) 및 천연 킬러 T (NKT) 세포에 대한 기능이상 및/또는 억압 표현형과 연관되었다.
본 발명에서는 증가된 T 세포 활성을 통해 질환, 특히 암 및 감염성 질환을 치료하기 위한 치료 요법을 제공함으로써 상기한 분자 기능을 이용한다.
발명의 개요
한 측면에서, 본 발명은 포유동물에게 면역 세포, 특히 T 세포에서 억제 신호 전달을 감소시키는 화합물 및 증강제를 투여하는 것을 포함하는, 그러한 증가를 필요로 하는 포유동물에서, 예를 들어 항원에 대한 T 세포 반응을 증가시키는 방법에 관한 것이고, 여기서 상기 치료 요법은 상기 포유동물의 T 세포 반응을 증가시키기 위해 효과적이다.
본 발명의 치료 요법에서 유용한 화합물은 억제 신호 전달을 촉발하지 않으면서 T 세포 상의 PD-1 수용체에 결합하고 차단하는 화합물, PD-1 리간드에 결합하여 PD-1에 대한 그들의 결합을 방지하는 화합물, 상기 2가지 역할을 모두 하는 화합물, 및 PD-1 또는 PD-1의 천연 리간드를 코딩하는 유전자의 발현을 방지하는 화합물을 포함한다. 상기 화합물을 본원에서 "PD-1 길항제"로서 칭한다. PD-1의 천연 리간드에 결합하는 화합물은 PD-1 자신 및 PD-1의 활성 단편, 및 B7-H1 리간드의 경우에 B7.1 단백질 및 단편을 포함한다. 상기 길항제는 단백질, 항체, 안티센스 분자 및 작은 유기물질을 포함한다. 바람직한 실시양태에서, 상기 T 세포 반응은 다른 것 없이 하나만 투여될 때 상기 PD-1 길항제 또는 상기 증강제 중 하나에 의해 생산된 반응보다 더 크다.
다른 실시양태에서, 본 발명의 방법에서 유용한 화합물은 T 세포 표면 분자, 예를 들어 CTLA4에 결합하여 그의 천연 리간드의 결합에 의해 촉발된 억제 신호를 방지하는 것 또는 상기 천연 리간드에 결합하는 것이다. 상기 길항제는 단백질, 항체, 안티센스 분자 및 작은 유기물질을 포함한다.
일반적 실시양태에서, 본 발명의 치료 요법 및 조성물에서 유용한 화합물은 PD-1과 TCR의 동시-라이게이션을 촉발 및/또는 유도 및/또는 증가 및/또는 촉진 및/또는 허용하지 않으면서 PD-1에 결합하는 것을 포함한다.
PD-1을 통한 억제 신호 전달을 방지하고 따라서 PD-1 길항제로서 작용하는 바람직한 화합물은 억제 신호 전달을 촉발하지 않으면서 PD-1에 결합하는, B7-DC 폴리펩티드, 특히 이들의 가용형 부분, 예를 들어 이들의 활성 단편, 이들의 변이체 및 상동체, 및 상기한 것 중 임의의 것을 포함한 융합 단백질을 포함하고 이로 제한되지 않는다. 바람직한 실시양태에서, B7-DC는 서열 1, 2, 3 또는 4의 아미노산 서열을 포함한다. 바람직한 상기 화합물은 B7-DC의 가용형 도메인을 포함하는 것이다 (즉, 막횡단 서열이 없는). B7-DC 폴리펩티드의 적합한 단편은 IgV 및/또는 IgC 도메인을 함유하는 단편 또는 IgV 도메인만을 함유하는 단편을 포함하고, 여기서 후자가 바람직한 실시양태이고, 서열 1의 아미노산 20-121이 IgV 도메인의 바람직한 예이다.
또한, 바람직한 PD-1 길항제는 또한 억제 신호 전달을 촉발하지 않으면서 PD-1에 결합하는, B7-H1 폴리펩티드 (그 전문이 본원에 참조로 포함되는 미국 특허 6,803,192에 개시됨)와 같은 PD-1의 천연 리간드의 활성 단편, 특히 이들의 가용형 부분, 예를 들어 이들의 변이체 및 상동체, 및 상기한 것 중 임의의 것을 포함한 융합 단백질을 포함하고 이로 제한되지 않는다.
본 발명의 바람직한 화합물은 또한 PD-1의 천연 리간드에 결합하는 화합물, 예를 들어 활성 단편, 변이체 및 상동체, 예를 들어 B7-H1에 결합하는 B7-1의 단편, 및 리간드가 억제 신호 전달을 촉발하기 위해 PD-1에 결합하는 것을 방지하기 위해 PD-1의 리간드에 결합하는, 상기한 것 중 임의의 것을 포함하는 융합 단백질을 포함하고 이로 제한되지 않는다.
다른 실시양태에서, 조성물 및 그의 사용 방법은 PD-1 수용체에 결합하고 차단하는 PD-1 수용체 길항제, 및 PD-1 수용체 리간드에 결합하고 차단하는 별개의 PD-1 수용체 길항제의 조합물을 포함한다. 본 발명의 다른 실시양태에서는 PD-1 수용체를 통한 억제 신호 전달을 촉발하지 않으면서 PD-1 수용체에 결합하고 또한 PD-1 수용체 리간드, 예를 들어 B7-H1 (이는 그렇지 않으면 PD-1 수용체를 통한 억제 신호 전달을 촉발할 것이다)에 결합하고 그를 길항하는 능력을 갖는 PD-1 수용체 길항제를 제공한다. 다른 고려되는 PD-1 수용체 길항제는 PD-1 수용체 및 PD-1 수용체 리간드에 모두 결합할 수 있는 이중특이적 항체를 포함한다.
본 발명에서 유용한 화합물의 바람직한 실시양태는 또한 PD-1 또는 CTLA4에 결합하여, 이들 공급원에 의해 매개되는 억제 신호 전달을 감소 또는 폐지시키는 항체를 포함한다.
본 발명의 방법에 사용하기 위한 바람직한 화합물은 또한 CTLA4에 결합하여 후속적인 억제 신호를 감소시키지만 CD28에 결합하거나 CD28에 의한 양성 신호 형질도입을 달리 억제하지 않는 CTLA4의 리간드 (예를 들어 B7-1 및 B7-2)의 활성 단편을 포함하고 이로 제한되지 않는다.
PD-1을 통한 억제 신호 전달을 방지하고 따라서 PD-1 길항제로서 작용하는 바람직한 화합물은 B7-DC에 결합하는, B7-DC 길항제, 특히 이들의 가용형 부분, 예를 들어 이들의 활성 단편, 이들의 변이체 및 상동체, 및 상기한 것 중 임의의 것을 포함한 융합 단백질을 포함하고 이로 제한되지 않는다.
한 실시양태에서, B7-DC 폴리펩티드, 그의 단편 또는 변이체는 다른 폴리펩티드에 결합되어, PD-1을 통한 억제 신호 전달을 야기하지 않으면서 PD-1 수용체에 결합하여, PD-1에 대한 리간드 결합, 특히 B7-H1 결합을 감소 또는 저해함으로써 및 PD-1 수용체를 통한 억제 신호 전달을 저해함으로써 PD-1 수용체에 길항하는 융합 단백질을 형성한다. 상기 융합 단백질의 예는 서열 9, 10, 12 또는 13의 아미노산 서열을 포함하는 폴리펩티드 및 그의 상동체이다. 하나의 바람직한 실시양태에서, B7-DC의 세포외 도메인 (ECD)의 전부 또는 일부는 융합 단백질의 일부이고, 여기서 융합 단백질은 면역글로불린의 Fc 부분을 함유하는 제2 폴리펩티드에 연결된다. 그의 바람직한 예는 B7-DC-Ig, 특히 이 구조가 2개의 B7-DC-Ig 분자가 예를 들어 디술피드 연결에 의해 서로 연결되어 있는 동종이량체의 일부인 경우이다.
특정 실시양태에서, 본 발명의 화합물에서 유용한 단편은 목적하는 길항제 활성을 갖는 폴리펩티드의 적어도 10, 15, 25, 50, 75, 100, 150, 200개 또는 그 초과의 인접하는 아미노산으로 이루어진다. 상기 단편은 또한 일반적으로 본 발명에 사용하기 위한 융합 단백질의 일부이다.
다른 측면에서, 본 발명은 포유동물에게 항-PD-1 항체 및 증강제를 포함하는 효과적인 치료 요법을 투여하는 것을 포함하는, 그를 필요로 하는 포유동물에서 T 세포 반응을 증가시키는 방법에 관한 것이고, 여기서 상기 치료 요법은 상기 포유동물의 T 세포 반응을 증가시키기 위해 효과적이다.
다른 측면에서, 본 발명은 포유동물에게 면역조정물질 및 증강제를 포함하는 효과적인 치료 요법을 투여하는 것을 포함하는, 그를 필요로 하는 포유동물에서 T 세포 반응을 증가시키는 방법에 관한 것이고, 여기서 상기 치료 요법은 상기 포유동물의 T 세포 반응을 증가시키기 위해 효과적이다. 상기 면역조정물질은 T 세포 반응을 억제하는 다른 CD28 패밀리 수용체 (예를 들어 CTLA4)를 길항하는 분자를 포함한다. 바람직한 실시양태는 항-CTLA4 항체 및 증강제를 이용한다. 추가의 면역조정물질은 T 세포 반응을 활성화시키는 CD28 패밀리 수용체 (예를 들어 CD28 및 ICOS)를 효능화시키는 분자; T 세포 반응을 억제하는 B7 패밀리 리간드 (예를 들어 B7-H1, B7-DC, B7-H4)를 길항하는 분자; 및 T 세포 반응을 활성화시키는 B7 패밀리 리간드 (예를 들어 B7.1 및 B7.2)를 효능화시키는 분자를 포함한다.
본 발명의 임의의 방법의 추가의 실시양태에서, PD-1 길항제 화합물 및 증강제의 치료 요법은 적어도 하나의 추가의 치료제를 추가로 포함한다. 고려되는 추가의 치료제는 면역조정제를 포함한다. 상기 방법을 위한 예시적인 면역조정제는 항-PD-1 및 항-CTLA4 항체를 포함한다.
한 실시양태에서, 증강제는 시클로포스파미드 및 시클로포스파미드의 유사체, 수니티닙 (수텐트 (Sutent)), 항-TGFβ 및 이마티닙 (글리백 (Gleevac)), 유사분열 억제제, 예를 들어 파클리탁셀, 아로마타제 억제제, 예를 들어 레트로졸, A2a 아데노신 수용체 (A2AR) 길항제, 혈관신생 억제제, 안트라사이클린, 옥살리플라틴, 독소루비신, TLR4 길항제, 및 IL-18 길항제로부터 선택된다. 이들 물질의 일부는 종양 미세환경 내에서 Treg (즉, 조절성 T 림프구 또는 T-reg)의 수를 감소시킨다.
다른 실시양태에서, 본 발명의 방법 및/또는 조성물은 상기 방법 및/또는 조성물의 일부로서 임의의 적합한 아주반트의 사용을 구체적으로 고려한다.
본 발명에 따라서, T 세포는 시험관 내에서, 생체 외에서 또는 생체 내에서 PD-1 수용체 길항제 및/또는 증강제를 함유하는 그의 조성물과 접촉될 수 있다. PD-1 수용체 길항제 및/또는 증강제를 함유하는 그의 조성물을 사용하여 T 세포를 접촉시키는 것은 T 세포의 활성화 전에, 활성화 동안 또는 활성화 후에 일어날 수 있다.
특정 실시양태에서, PD-1을 통한 억제 신호 전달을 방지 또는 감소시키는 분자 및 증강제는 증강제가 PD-1 길항제를 투여하기 전에 투여되는 경우와 같이 상이한 시간에 투여된다. 그러한 투여는 추가의 치료제와 함께 수행될 수 있다.
본 발명의 임의의 방법의 구체적 실시양태에서, 치료 요법은 임의의 또는 모든 PD-1 길항제, 항-PD-1 항체, 항-CTLA4 항체, 및/또는 추가의 치료제를 투여하기 적어도 1시간, 또는 적어도 2시간, 또는 적어도 3시간, 또는 적어도 5시간, 또는 적어도 10시간, 또는 적어도 15시간, 또는 적어도 20시간, 또는 적어도 24시간, 또는 적어도 30시간 전에 또는 심지어 이보다 전에 증강제의 투여를 포함한다. 증강제의 투여는 또한 임의의 또는 모든 PD-1 길항제, 항-PD-1 항체, 항-CTLA4 항체 및/또는 추가의 치료제를 투여한 후에, 예를 들어 PD-1 길항제를 투여한 후 1시간, 2시간, 3시간, 5시간, 10시간, 15시간, 20시간, 24시간 이내에 또는 심지어 30시간까지 일어날 수 있거나, PD-1 길항제를 투여하는 것과 함께 일어날 수 있다.
본 발명의 방법의 결과로서 달성된 증가된 T 세포 반응은 암, 바이러스 감염, 세균 감염 및 기생충 감염 중 하나 이상을 포함한 질환을 치료하기 위해 충분하다. 질환이 암인 경우에, 상기 암은 방광, 뇌, 유방, 자궁경부, 결장직장, 식도, 신장, 간, 폐, 비인두, 췌장, 전립선, 피부, 위, 자궁, 난소, 고환, 또는 혈액암 중 임의의 하나 이상이다.
다른 측면에서, 본 발명은 제약상 허용되는 담체 내의 본 발명의 방법에서 사용되는 길항제의 조성물을 포함하고, 여기서 상기 PD-1 결합 분자 및 상기 증강제는 각각 증가된 T 세포 자극을 생성시키기 위해 효과적인 양으로 존재한다.
하나의 바람직한 실시양태에서, 본 발명은 본 발명에서 사용하기 위한 하나 이상의 물질을 그의 희석을 위한 제약상 담체와 함께 보유하는 용기 및 투여를 위한 지시서를 포함하는 의료 키트를 포함한다. 또한, 상기 PD-1 수용체 길항제 및 증강제는 상기 성분들이 동시에 투여되어야 할 때 둘 모두 단일 용기 내의 성분으로서 제약상 허용되는 담체 내에 존재할 수 있다.
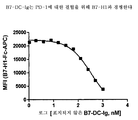
도 1은 B7-DC-Ig가 PD-1에 결합함을 보여준다. 표지된 B7-DC-Ig를 다양한 농도에서 PD-1을 구성적으로 발현하는 CHO 세포주 또는 PD-1을 발현하지 않는 모 CHO 세포와 함께 인큐베이팅하였다. 결합을 유동 세포 측정에 의해 분석하였다. B7-DC-Ig의 중간 형광 강도 (MFI) (y-축)를 프로브의 농도 (x-축)의 함수로서 도시한다. B7-DC-Ig는 CHO.PD-1 세포에 결합하지만 (속이 찬 원), 형질감염되지 않은 CHO 세포에 결합하지 않는다 (회색 삼각형).
도 2는 B7-DC-Ig가 PD-1에 대한 결합을 위해 B7-H1과 경쟁함을 보여준다. 표지되지 않은 B7-DC-Ig를 다양한 농도에서 먼저 PD-1을 구성적으로 발현하는 CHO 세포주와 함께 인큐베이팅한 후, 표지된 B7-H1-Ig를 세포 혼합물에 첨가하였다. B7-H1-Ig의 중간 형광 강도 (MFI) (y-축)을 첨가된 표지되지 않은 B7-DC-Ig 경쟁자의 농도 (x-축)의 함수로서 도시한다. 표지되지 않은 B7-DC-Ig의 농도가 증가함에 따라 CHO 세포에 결합된 표지된 B7-H1-Ig의 양은 감소하고, 이것은 B7-DC-Ig가 PD-1에 대한 결합을 위해 B7-H1과 경쟁함을 입증한다.
도 3은 시클로포스파미드 (CTX 또는 시톡산(Cytoxan)®) 및 이량체성 뮤린 B7-DC-Ig의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)의 근절을 일으켰다는 실험의 결과를 보여준다. 그래프 A는 제10일에 100 mg/kg의 CTX로 처리한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 도시한 한편, 그래프 B는 제10일에 CTX로 처리한 후, 1일 후에 제1 B7-DC-Ig를 투여한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 도시한 것이다. 각각의 그래프 내의 각각의 선은 1마리의 마우스를 나타낸다. 흑색 화살표는 B7-DC-Ig 투여를 나타낸다. 그래프 C는 평균 종양 부피를 보여준다.
도 4는 CTX 및 이량체성 뮤린 B7-DC-Ig의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)을 근절하고, CT26을 사용한 재접종에 대해 보호하였다는 실험 결과를 보여준다. CTX 및 B7-DC-Ig로 처리하고 종양 접종 후 제44일에 종양 성장이 없는 것으로 밝혀진 마우스에게 종양을 재접종하였다. 마우스를 나중에 제70일에 다시 재접종하였다. 마우스는 어느 것도 제100일에 종양 성장을 보이지 않았다.
도 5는 CTX 및 B7-DC-Ig 치료가 종양 특이적 기억 CTL을 생성시켰음을 보여준다. CTX 및 B7-DC-Ig 치료 후 확립된 CT26 피하 종양을 근절시킨 마우스에게 CT26 세포를 재접종하였다. 7일 후에, 비장세포를 단리하고, 난알부민 (비관련 펩티드) 또는 AH1 (CT26 특이적 펩티드)로 펄싱하였다. 세포를 먼저 항-CD8 항체로 염색한 후, 항-IFNγ 항체를 사용하여 세포내 염색한 후 FACS 분석하였다.
도 6은 마우스에서 확립된 CT26 종양의 근절에 대한 CTX와 조합한 상이한 용량의 B7-DC-Ig의 효과를 보여준다. 9 내지 11주령의 Balb/C 마우스에게 1E05개의 CT26 세포를 피하 이식하였다. 제9일에, 마우스에게 100 mg/kg의 CTX를 IP 주사하였다. 24시간 후인 제10일에, 마우스에게 30, 100, 또는 300 ㎍의 B7-DC-Ig로 처리한 후, 매주 2회 주사로 총 8회까지 처리하였다. 종양 성장을 매주 2회 측정하였다.
도 7은 CTX 및 항-PD-1 항체의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)의 근절을 일으켰다는 실험 결과를 보여준다. 그래프 A는 처리하지 않은 마우스 (즉, 비히클 단독으로 처리한 마우스)에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여주고, 그래프 B는 제11일에 주사 당 300 ㎍으로 시작하여 매주 3회 12회 주사하여 항-PD-1 단독으로 처리한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여주고, 그래프 C는 제11일에 CTX로 처리하고 제1 항-PD-1 투여를 제12일에 주사 당 300 ㎍으로 매주 3회 12회 주사한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여준다. 각각의 그래프 내의 각각의 선은 1마리의 마우스를 나타낸다. 흑색 화살표는 항-PD-1 투여를 나타낸다.
도 8은 CTX 및 항-CTLA4 항체의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)의 근절을 일으켰다는 실험 결과를 보여준다. 여기서, 그래프 A는 제11일에 100 mg/kg의 CTX를 처리한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여주는 한편, 그래프 B는 제11일에 CTX로 처리하고, 제12일에 항-CTLA4를 주사 당 100 ㎍로 매주 2회 8회 주사한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여준다. 각각의 그래프 내의 각각의 선은 1마리의 마우스를 나타낸다. 흑색 화살표는 항-CTLA-4 투여를 나타낸다.
도 9는 9 내지 11주령의 Balb/C 마우스에게 1 X 105개의 CT26 세포를 피하 이식한 실험 결과를 보여준다. 제9일에, 마우스에게 100 mg/kg의 CTX를 IP로 주사하였다. 24시간 후인 제10일에, 마우스를 100 ㎍의 B7-DC-Ig로 처리하였다. 5개의 군이 존재하였다: 임의의 종양 세포를 투여하지 않은 나이브 (naive) 마우스, 비히클 주사, CTX 단독, CTX + B7-DC-Ig, 또는 B7-DC-Ig 단독. 2마리의 나이브 마우스 및 다른 군으로부터의 4마리의 마우스를 T 세포 분석을 위해 제11일 (CTX의 2일 후) 및 제16일 (CTX의 7일 후)에 연구로부터 제거하였다. 좌측 패널은 제11일 (CTX 주사의 2일 후)에 CTX 치료한 마우스의 비장 내의 Treg가 종양을 이식하고 비히클을 주사한 마우스에서보다 유의하게 더 낮았음을 보여준다. 우측 패널은 제16일 (CTX의 7일 후 및 B7-DC-Ig 치료의 6일 후)에, B7-DC-Ig가 높은 PD-1을 발현하는 CD4+ T 세포를 유의하게 저하시켰음을 보여준다. 이것은 B7-DC-Ig 처리된 마우스 및 CTX + B7-DC-Ig 처리된 마우스 모두에서 관찰되었다. 종양 세포를 이식한 마우스는 나이브 마우스에 비해 배수 (draining) LN 내에 보다 많은 PD-1+/CD4+ T 세포를 갖도록 의도되었다.
도 10은 마우스 전립선 종양 세포주를 꼬리 정맥에 주사한 마우스에서 CTX 및 B7-DC-Ig의 조합물이 증가된 생존을 일으켰다는 실험 결과를 보여준다. SP-1 세포를 TRAMP 전립선 종양 세포 주사로부터 전이된 마우스 폐로부터 단리하였다. B10.D2 마우스에게 먼저 3 x 105개의 SP-1 세포를 꼬리 정맥 주사를 통해 주사하였다. 제5, 12 및 19일에, 마우스에게 지시되는 곳에 50 mg/kg의 CTX를 주사하였다. 제6, 13 및 20일에, 마우스에게 지시되는 곳에 5 mg/kg의 B7-DC-Ig를 주사하였다. 여기서, "NT"는 "처리하지 않음"을 나타낸다.
도 11. 11-13주령의 Balb/C 마우스에게 단리된 간 전이물을 반비장 (hemispleen) 주사 기술을 이용하여 제공하였다. 마취시킨 마우스의 비장을 2개의 반비장으로 나누고, 반비장들을 클리핑 (clipping)하였다. CT26 세포 (1E05)를 1개의 반비장 내로 주사하고, 30초 후에 그 반비장을 절제하고 비장 배수 정맥을 클리핑하였다. 제10일에, 마우스에게 CTX를 50 mg/kg로 IP로 1회 주사하였다. 24시간 후인 제11일에, 마우스를 AH1 펩티드 (CT26의 면역우성 에피토프)를 보유하는 재조합 리스테리아 (Listeria)로 0.1 x LD50 (1x107 CFU)로, 이어서 제14일 및 제17일에 처리하였다. 마우스를 또한 B7-DC-Ig로 제11일, 이어서 제18일에 처리하였다. 마우스 총 생존을 모니터링하였다.
도 2는 B7-DC-Ig가 PD-1에 대한 결합을 위해 B7-H1과 경쟁함을 보여준다. 표지되지 않은 B7-DC-Ig를 다양한 농도에서 먼저 PD-1을 구성적으로 발현하는 CHO 세포주와 함께 인큐베이팅한 후, 표지된 B7-H1-Ig를 세포 혼합물에 첨가하였다. B7-H1-Ig의 중간 형광 강도 (MFI) (y-축)을 첨가된 표지되지 않은 B7-DC-Ig 경쟁자의 농도 (x-축)의 함수로서 도시한다. 표지되지 않은 B7-DC-Ig의 농도가 증가함에 따라 CHO 세포에 결합된 표지된 B7-H1-Ig의 양은 감소하고, 이것은 B7-DC-Ig가 PD-1에 대한 결합을 위해 B7-H1과 경쟁함을 입증한다.
도 3은 시클로포스파미드 (CTX 또는 시톡산(Cytoxan)®) 및 이량체성 뮤린 B7-DC-Ig의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)의 근절을 일으켰다는 실험의 결과를 보여준다. 그래프 A는 제10일에 100 mg/kg의 CTX로 처리한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 도시한 한편, 그래프 B는 제10일에 CTX로 처리한 후, 1일 후에 제1 B7-DC-Ig를 투여한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 도시한 것이다. 각각의 그래프 내의 각각의 선은 1마리의 마우스를 나타낸다. 흑색 화살표는 B7-DC-Ig 투여를 나타낸다. 그래프 C는 평균 종양 부피를 보여준다.
도 4는 CTX 및 이량체성 뮤린 B7-DC-Ig의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)을 근절하고, CT26을 사용한 재접종에 대해 보호하였다는 실험 결과를 보여준다. CTX 및 B7-DC-Ig로 처리하고 종양 접종 후 제44일에 종양 성장이 없는 것으로 밝혀진 마우스에게 종양을 재접종하였다. 마우스를 나중에 제70일에 다시 재접종하였다. 마우스는 어느 것도 제100일에 종양 성장을 보이지 않았다.
도 5는 CTX 및 B7-DC-Ig 치료가 종양 특이적 기억 CTL을 생성시켰음을 보여준다. CTX 및 B7-DC-Ig 치료 후 확립된 CT26 피하 종양을 근절시킨 마우스에게 CT26 세포를 재접종하였다. 7일 후에, 비장세포를 단리하고, 난알부민 (비관련 펩티드) 또는 AH1 (CT26 특이적 펩티드)로 펄싱하였다. 세포를 먼저 항-CD8 항체로 염색한 후, 항-IFNγ 항체를 사용하여 세포내 염색한 후 FACS 분석하였다.
도 6은 마우스에서 확립된 CT26 종양의 근절에 대한 CTX와 조합한 상이한 용량의 B7-DC-Ig의 효과를 보여준다. 9 내지 11주령의 Balb/C 마우스에게 1E05개의 CT26 세포를 피하 이식하였다. 제9일에, 마우스에게 100 mg/kg의 CTX를 IP 주사하였다. 24시간 후인 제10일에, 마우스에게 30, 100, 또는 300 ㎍의 B7-DC-Ig로 처리한 후, 매주 2회 주사로 총 8회까지 처리하였다. 종양 성장을 매주 2회 측정하였다.
도 7은 CTX 및 항-PD-1 항체의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)의 근절을 일으켰다는 실험 결과를 보여준다. 그래프 A는 처리하지 않은 마우스 (즉, 비히클 단독으로 처리한 마우스)에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여주고, 그래프 B는 제11일에 주사 당 300 ㎍으로 시작하여 매주 3회 12회 주사하여 항-PD-1 단독으로 처리한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여주고, 그래프 C는 제11일에 CTX로 처리하고 제1 항-PD-1 투여를 제12일에 주사 당 300 ㎍으로 매주 3회 12회 주사한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여준다. 각각의 그래프 내의 각각의 선은 1마리의 마우스를 나타낸다. 흑색 화살표는 항-PD-1 투여를 나타낸다.
도 8은 CTX 및 항-CTLA4 항체의 조합물이 마우스에서 확립된 CT26 종양 (결장 암종)의 근절을 일으켰다는 실험 결과를 보여준다. 여기서, 그래프 A는 제11일에 100 mg/kg의 CTX를 처리한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여주는 한편, 그래프 B는 제11일에 CTX로 처리하고, 제12일에 항-CTLA4를 주사 당 100 ㎍로 매주 2회 8회 주사한 마우스에서 종양 부피 (mm3) 대 종양 접종 후 일수를 보여준다. 각각의 그래프 내의 각각의 선은 1마리의 마우스를 나타낸다. 흑색 화살표는 항-CTLA-4 투여를 나타낸다.
도 9는 9 내지 11주령의 Balb/C 마우스에게 1 X 105개의 CT26 세포를 피하 이식한 실험 결과를 보여준다. 제9일에, 마우스에게 100 mg/kg의 CTX를 IP로 주사하였다. 24시간 후인 제10일에, 마우스를 100 ㎍의 B7-DC-Ig로 처리하였다. 5개의 군이 존재하였다: 임의의 종양 세포를 투여하지 않은 나이브 (naive) 마우스, 비히클 주사, CTX 단독, CTX + B7-DC-Ig, 또는 B7-DC-Ig 단독. 2마리의 나이브 마우스 및 다른 군으로부터의 4마리의 마우스를 T 세포 분석을 위해 제11일 (CTX의 2일 후) 및 제16일 (CTX의 7일 후)에 연구로부터 제거하였다. 좌측 패널은 제11일 (CTX 주사의 2일 후)에 CTX 치료한 마우스의 비장 내의 Treg가 종양을 이식하고 비히클을 주사한 마우스에서보다 유의하게 더 낮았음을 보여준다. 우측 패널은 제16일 (CTX의 7일 후 및 B7-DC-Ig 치료의 6일 후)에, B7-DC-Ig가 높은 PD-1을 발현하는 CD4+ T 세포를 유의하게 저하시켰음을 보여준다. 이것은 B7-DC-Ig 처리된 마우스 및 CTX + B7-DC-Ig 처리된 마우스 모두에서 관찰되었다. 종양 세포를 이식한 마우스는 나이브 마우스에 비해 배수 (draining) LN 내에 보다 많은 PD-1+/CD4+ T 세포를 갖도록 의도되었다.
도 10은 마우스 전립선 종양 세포주를 꼬리 정맥에 주사한 마우스에서 CTX 및 B7-DC-Ig의 조합물이 증가된 생존을 일으켰다는 실험 결과를 보여준다. SP-1 세포를 TRAMP 전립선 종양 세포 주사로부터 전이된 마우스 폐로부터 단리하였다. B10.D2 마우스에게 먼저 3 x 105개의 SP-1 세포를 꼬리 정맥 주사를 통해 주사하였다. 제5, 12 및 19일에, 마우스에게 지시되는 곳에 50 mg/kg의 CTX를 주사하였다. 제6, 13 및 20일에, 마우스에게 지시되는 곳에 5 mg/kg의 B7-DC-Ig를 주사하였다. 여기서, "NT"는 "처리하지 않음"을 나타낸다.
도 11. 11-13주령의 Balb/C 마우스에게 단리된 간 전이물을 반비장 (hemispleen) 주사 기술을 이용하여 제공하였다. 마취시킨 마우스의 비장을 2개의 반비장으로 나누고, 반비장들을 클리핑 (clipping)하였다. CT26 세포 (1E05)를 1개의 반비장 내로 주사하고, 30초 후에 그 반비장을 절제하고 비장 배수 정맥을 클리핑하였다. 제10일에, 마우스에게 CTX를 50 mg/kg로 IP로 1회 주사하였다. 24시간 후인 제11일에, 마우스를 AH1 펩티드 (CT26의 면역우성 에피토프)를 보유하는 재조합 리스테리아 (Listeria)로 0.1 x LD50 (1x107 CFU)로, 이어서 제14일 및 제17일에 처리하였다. 마우스를 또한 B7-DC-Ig로 제11일, 이어서 제18일에 처리하였다. 마우스 총 생존을 모니터링하였다.
정의
달리 규정하지 않으면, 모든 기술 및 학술 용어는 본 발명이 속하는 분야의 당업자가 일반적으로 이해하는 바와 동일한 의미를 갖는다. 특히, 다음 용어 및 어구는 다음 의미를 갖는다.
용어 "억제 신호 전달"은 T 세포 증식의 감소 또는 임의의 다른 억제 메카니즘에 의해 항원에 대한 T 세포 반응을 폐지하거나 감소시켜, 면역원성 T 세포 반응의 정도 또는 지속 기간을 감소시키는 효과를 갖는 임의의 신호 전달을 의미하고자 의도된다. 상기 억제 신호 전달은 천연 리간드에 대한 PD-1 결합, 예를 들어 B7-H1 또는 상기 클래스의 리간드의 몇몇 다른 구성원인 B7-DC에 의한 PD-1의 결합에 의한 것일 수 있거나, 또는 CTLA4의 리간드, 예를 들어 B7-1 또는 B7-2에 대한 결합에 의한 것일 수 있다. 일반적으로, 본 발명의 화합물은 상기 억제 신호 전달을 감소시키고, PD-1 길항제 및 CTLA4 길항제를 포함하고 이로 제한되지 않는다.
용어 "PD-1 길항제"는 T 세포, B 세포, 천연 킬러 (NK) 세포, 단핵구, DC, 및 대식세포의 표면에서 발견되는 PD-1에 의해 매개되는 억제 신호 전달을 약화시키는 임의의 분자를 의미한다. 상기 길항제는 T 세포 상의 PD-1 분자에 의해 생성된 임의의 억제 신호를 붕괴시키는 분자를 포함한다. 본 발명의 구체적인 예에서, PD-1 길항제는 PD-1 수용체 신호 전달 경로를 통한 억제 신호 전달을 억제하거나, 감소시키거나 폐지하거나 다른 방식으로 감소시키는 분자이다. 그러한 감소는 (i) 본 발명의 PD-1 길항제가 신호 전달을 촉발하지 않으면서 PD-1 수용체에 결합하여 억제 신호 전달을 감소시키거나 차단하거나; (ii) PD-1 길항제가 PD-1 수용체의 리간드 (예를 들어 효능제)에 결합하여 그에 대한 리간드의 결합을 억제하거나 (예를 들어, 상기 효능제가 B7-H1인 경우에); (iii) PD-1 길항제가, 억제되지 않을 때 PD-1 억제 신호 전달을 자극하거나 달리 용이하게 하는 조절 사슬의 일부인 분자에 결합하거나 분자의 활성을 억제하거나; 또는 (iv) 특히 PD-1 또는 하나 이상의 그의 천연 리간드를 코딩하는 하나 이상의 유전자의 발현을 감소시키거나 폐지함으로써 PD-1 길항제가 PD-1 수용체 또는 그의 발현 리간드의 발현을 억제하는 경우에 발생할 수 있다. 따라서, 본 발명의 PD-1 길항제는 PD-1 억제 신호 전달의 감소를 유도하여 하나 이상의 항원에 대한 T 세포 반응을 증가시키는 분자이다.
본원에서 사용되는 바와 같이, 용어 "CTLA4 길항제"는 T 세포 반응의 CTLA4-매개된 억제를 감소시키는 화합물을 의미한다. 예를 들어, T 세포에서, CTLA4는 B7 리간드, 예를 들어 B7-1 및 B7-2의 결합시에 억제 자극을 전달한다. CTLA4 길항제는 활성화된 T 세포 상의 CTLA4에 대한 상기 리간드의 결합을 붕괴시키는 것이다. 한 실시양태에서, 길항제는 CTLA4에 결합하여 리간드 결합을 억제하는 항-CTLA4 항체이다.
본원에서 사용되는 바와 같이, 용어 "활성 단편"은 예를 들어 PD-1에 결합하거나 또는 PD-1의 리간드에 결합함으로써 PD-1 길항제 활성을 보이는, 천연 폴리펩티드, 또는 천연 폴리펩티드에 대해 높은 서열 상동성 (예를 들어, 적어도 80%, 85%, 90%, 95%, 98%, 또는 99%의 아미노산 서열 동일성)을 갖는 폴리펩티드의 일부를 의미한다. 바람직한 실시양태에서, 상기 단편은 PD-1에 결합하는 B7-DC 단백질의 세포외 도메인 (ECD), 예를 들어 서열 3, 바람직하게는 그의 아미노산 20 내지 221로 구성된다. PD-1 폴리펩티드의 경우에, 활성 단편은 PD-1의 천연 리간드에 결합하여 상기 리간드에 의한 PD-1 매개된 억제 신호 전달의 자극을 억제하는 결합 도메인을 포함하는 상기 폴리펩티드의 일부이다. 활성 단편은 천연 결합 부위에 대한 결합을 위해 그가 유도되는 분자와 경쟁하는 그들의 능력에 의해 확인될 수 있다. 예를 들어, 활성 단편은 PD-1에 대한 결합을 위해 야생형 B7-DC와 경쟁할 것이다.
항체에 관하여, 용어 "활성 단편"은 전체 면역글로불린보다 더 작은 항체의 항원 결합 부분을 의미한다. 상기 단편은 수용체 또는 리간드로서 본원에 개시된 임의의 폴리펩티드와 반응하고 그에 결합할 수 있는 Fab 및 F(ab')2 단편을 포함한다. 이들 Fab 및 F(ab')2 단편은 무손상 항체의 Fc 부분이 결여되고, 혈류로부터 보다 신속하게 제거되고, 무손상 항체보다 더 작은 비-특이적 조직 결합을 가질 수 있다 (Wahl et al., J. Nuc. Med. 24:316-325 (1983)). Fv 단편도 또한 포함된다 ([Hochman, J. et al. (1973) Biochemistry 12:1130-1135]; [Sharon, J. et al. (1976) Biochemistry 15:1591-1594]). 이들 다양한 단편은 통상적인 기술, 예를 들어 프로테아제 절단 또는 화학적 절단을 이용하여 생산된다 (예를 들어, 문헌 [Rousseaux et al., Meth. Enzymol., 121:663-69 (1986)] 참조).
본원에서 사용되는 바와 같이, 용어 PD-1 길항제의 "가용형 부분"은 막횡단 부분 또는 세그먼트의 어떠한 부분도 포함하지 않는 전장 폴리펩티드의 부분을 의미한다. 예를 들어, B7-DC에 대해, 가용형 부분은 세포외 부분 (N-말단 신호 서열이 존재하거나 존재하지 않는)을 포함하지만, 막횡단 부분의 어떠한 부분 (또는, 적어도 용해도를 감소시키기에 충분하지 않은)도 포함하지 않을 것이다. 따라서, 인간 B7-DC의 ECD는 서열 3으로서 제시되고, 전장 분자의 IgV-유사 및 IgC-유사 도메인 (즉, 전장 서열 (서열 1)의 아미노산 20-221)으로 구성된다.
본원에서 사용되는 바와 같이, "보조-자극성 폴리펩티드"는 T 세포 상의 세포-표면 분자와 상호작용시에 T 세포의 활성을 조정하는 폴리펩티드이다. 따라서, T 세포의 반응은 효과기 (예를 들어, CTL 또는 항체-생산 B 세포) 반응, 하나 이상의 효과기 (예를 들어, CTL 또는 항체-생산 B 세포) 반응에 대한 도움을 제공하는 헬퍼 반응, 또는 억압 반응일 수 있다.
본원에서 사용되는 바와 같이, 용어 "치료 요법"은 질환의 치료 또는 요구되는 병리학적 변화, 예를 들어 면역계의 항원 또는 면역원에 대한 증가 또는 감소된 반응, 예를 들어 상기 반응에 관련되는 하나 이상의 세포, 또는 세포 종류의 수 또는 활성의 증가 또는 감소를 달성하는 방법을 의미하고, 여기서 상기 치료 또는 방법은 동물, 예를 들어 포유동물, 특히 인간에게 질환을 효과적으로 치료하거나 상기 병리학적 변화를 생성시키기에 충분한 양의 상기 요법의 2가지 이상의 화학적 작용제 또는 성분을 투여하는 것을 포함하고, 여기서 상기 화학적 작용제 또는 성분은 동일한 조성물의 일부로서 함께 투여되거나 또는 별개로 독립적으로 동시에 또는 상이한 시점에 투여되고 (즉, 각각의 작용제 또는 성분의 투여는 하나 이상의 작용제 또는 성분과 한정된 시간차를 두고 시행된다), 상기 하나 이상의 작용제 또는 성분의 투여는 단독으로 또는 별개로 투여되는 임의의 상기 작용제 또는 성분보다 더 큰 결과를 달성한다.
본원에서 사용되는 바와 같이, 용어 "단리된"은 예를 들어, 펩티드를 자연에서 발견되지 않는 농도로 농축함으로써 그의 자연 환경으로부터 분리된, 화합물이 자연적으로 발생하는 것과 상이한 환경 내에 있는 관심있는 화합물 (예를 들어, 폴리뉴클레오티드 또는 폴리펩티드)을 설명하기 위한 의미를 갖는다. "단리된"은 관심있는 화합물에 대해 실질적으로 농축시킨 및/또는 관심있는 화합물이 부분적으로 또는 실질적으로 정제된 샘플 내에 있는 화합물을 포함하는 의미이다.
본원에서 사용되는 바와 같이, 용어 "폴리펩티드"는 변형 (예를 들어, 인산화 또는 당화)에 상관없이 임의의 길이의 아미노산의 사슬을 나타낸다. 본 발명의 폴리펩티드는 재조합 폴리펩티드, 천연 폴리펩티드 또는 합성 폴리펩티드, 바람직하게는 재조합 폴리펩티드일 수 있다.
본원에서 사용되는 바와 같이, "변이체" 폴리펩티드는 상응하는 야생형 폴리펩티드의 아미노산 서열에 비해 적어도 하나의 아미노산 서열 변경을 함유한다.
본원에서 사용되는 바와 같이, "아미노산 서열 변경"은 예를 들어, 하나 이상의 아미노산의 치환, 결실 또는 삽입일 수 있다.
본원에서 사용되는 바와 같이, 용어 "일부", "세그먼트", 및 "단편"은 폴리펩티드에 대해 사용될 때, 잔기, 예를 들어 아미노산 잔기의 연속적인 서열을 의미하고, 이 서열은 보다 큰 서열의 하위세트를 형성한다. 예를 들어, 폴리펩티드가 임의의 통상적인 엔도펩티다제, 예를 들어 트립신 또는 키모트립신으로 처리될 경우, 상기 처리에 의해 생성되는 올리고펩티드는 출발 폴리펩티드의 일부, 세그먼트 또는 단편을 나타낼 것이다. 따라서, 폴리펩티드의 "단편"은 전장 단백질의 보다 짧은 폴리펩티드인 폴리펩티드의 임의의 하위세트를 나타낸다. 일반적으로, 단편은 5개 이상의 아미노산 길이일 것이다.
본 발명의 폴리펩티드 (또는 그의 단편)의 유도체, 유사체 또는 상동체는 (i) 하나 이상의 아미노산 잔기가 보존된 또는 비-보존된 아미노산 잔기 (바람직하게는 보존된 아미노산 잔기)로 치환되고 상기 치환된 아미노산 잔기가 유전자 코드에 의해 코딩되거나 코딩되지 않을 수 있는 것, 또는 (ii) 하나 이상의 아미노산 잔기가 치환기를 포함하는 것, 또는 (iii) 성숙 폴리펩티드가 다른 화합물, 예를 들어 폴리펩티드의 반감기를 증가시키는 화합물 (예를 들어, 폴리에틸렌 글리콜)과 융합되는 것, 또는 (iv) 추가의 아미노산이 성숙 폴리펩티드, 예를 들어 리더 또는 분비 서열 또는 성숙 폴리펩티드 또는 전단백질 서열의 정제에 사용되는 서열에 융합되는 것일 수 있다. 상기 유도체 및 유사체는 본원의 개시내용으로부터 당업자가 인식할 수 있는 것이다.
본원에서 사용되는 바와 같이, "결합가 (valency)"는 분자당 이용가능한 결합 부위의 수를 나타낸다.
본 발명에 따라서, 용어 "동일성 비율" 또는 "동일한 비율"은 서열에 대해 사용될 때, 비교할 서열 ("비교되는 서열")을 설명되거나 청구되는 서열 ("참조 서열")과 정렬한 후에 서열이 청구되거나 설명되는 서열에 비교됨을 의미한다. 이어서, 동일성 비율은 다음 식에 따라 결정된다:
동일성 비율 = 100 [1-(C/R)]
여기서, C는 참조 서열과 비교되는 서열 사이의 정렬 길이에 걸친 참조 서열과 비교되는 서열 사이의 차이의 수이고, 여기서 (i) 비교되는 서열 내의 대응하는 정렬된 염기 또는 아미노산을 갖지 않는 참조 서열 내의 각각의 염기 또는 아미노산 및 (ii) 참조 서열 내의 각각의 갭 및 (iii) 비교되는 서열 내의 대응하는 정렬된 염기 또는 아미노산과 상이한 참조 서열 내의 각각의 정렬된 염기 또는 아미노산이 상기 차이를 구성하고; R은 비교되는 서열과의 정렬 길이에 걸친 참조 서열 내의 염기 또는 아미노산의 수이고, 참조 서열 내에 생성된 임의의 갭도 염기 또는 아미노산으로 계수된다. 그에 대해 상기와 같이 계산된 동일성 비율이 특정 최소 동일성 비율과 거의 같거나 더 큰 정렬이 비교되는 서열과 참조 서열 사이에 존재할 경우, 비교되는 서열은 참조 서열에 대해 특정 최소 동일성 비율을 갖지만, 상기 계산된 동일성 비율이 특정 동일성 비율보다 작은 정렬이 존재할 수 있다.
본원에서 사용되는 바와 같이, 용어 "보존적" 아미노산 치환은 치환된 아미노산이 유사한 구조적 또는 화학적 특성을 갖는 치환이고, "비-보존적" 아미노산 치환은 치환된 아미노산의 전하, 소수도, 또는 부피가 유의하게 변경된 치환이다. 비-보존적 치환은 (a) 예를 들어, 시트 또는 나선 입체형태로서 치환 영역 내의 펩티드 백본의 구조, (b) 표적 부위에서 분자의 전하 또는 소수성, 또는 (c) 측쇄의 부피를 유지하는 것에 대한 그들의 효과에서 보다 유의하게 상이할 것이다. 보존적 아미노산 치환의 예는 치환이 다음 5개의 군 중의 하나 내에서 이루어지는 것을 포함한다: 1) 작은 지방족, 비극성 또는 경미한 극성 잔기 (Ala, Ser, Thr, Pro, Gly); 2) 극성, 음대전 잔기 및 그들의 아미드 (Asp, Asn, Glu, Gln); 극성, 양대전 잔기 (His, Arg, Lys); 큰 지방족, 비극성 잔기 (Met, Leu, Ile, Val, Cys); 및 큰 방향족 잔기 (Phe, Tyr, Trp). 비-보존적 아미노산 치환의 예는 1) 친수성 잔기, 예를 들어 세릴 또는 트레오닐이 소수성 잔기, 예를 들어, 류실, 이소류실, 페닐알라닐, 발릴, 또는 알라닐을 치환하거나 (또는 이에 의해 치환되거나); 2) 시스테인 또는 프롤린이 임의의 다른 잔기를 치환하거나 (또는 이에 의해 치환되거나); 3) 양전성 측쇄를 갖는 잔기, 예를 들어, 라이실, 아르기닐, 또는 히스티딜이 음전성 잔기, 예를 들어, 글루타밀 또는 아스파르틸을 치환하거나 (또는 이에 의해 치환되거나); 또는 4) 부피가 큰 측쇄를 갖는 잔기, 예를 들어, 페닐알라닌이 측쇄를 갖지 않는 잔기, 예를 들어, 글라이신을 치환하는 (또는 이에 의해 치환되는) 것이다.
용어 "개체", "숙주", "대상체" 및 "환자"는 본원에서 상호교환가능하게 사용되고, 포유동물, 예를 들어 비제한적으로 영장류, 예를 들어, 인간 및 설치류, 예를 들어 마우스 및 래트, 및 다른 실험 동물을 나타낸다.
본원에서 사용되는 바와 같이 용어 "유효량" 또는 "치료 유효량"은 치료되는 질환 상태의 하나 이상의 증상을 치료하거나 억제하거나 완화하기 위해 또는 달리 목적하는 약물학적 및/또는 생리학적 효과를 제공하기 위해, 특히 선택된 항원에 대한 T 세포 반응을 향상시키기 위해 충분한 용량을 의미한다. 정확한 용량은 대상체-의존 변수 (예를 들어, 연령, 면역계 건강 등), 질환, 및 투여되는 치료와 같은 다양한 인자에 따라 변할 것이다.
본원에서 사용되는 바와 같이 "제약상 허용되는 담체"는 임의의 모든 용매, 분산매, 코팅, 항균 및 항진균제, 등장화 및 흡수 지연제 등을 포함한다. 제약 활성 물질에 대한 상기 매질 및 물질의 사용은 당업계에 잘 공지되어 있다. 임의의 통상적인 매질 또는 물질이 활성 화합물과 상용성이 아닌 경우를 제외하고, 치료 조성물에서 그의 용도가 고려된다. 또한, 보충 활성 화합물도 조성물 내에 혼입될 수 있다.
용어 "항체"는 무손상 분자, 및 항원-결합 부위를 포함하는 그의 단편을 모두 포함하는 의미이다. 전체 항체 구조는 종종 H2L2로서 제시되고, 항체가 통상적으로 2개의 경쇄 (L) 아미노산 및 2개의 중쇄 (H) 아미노산을 포함함을 의미한다. 두 사슬은 구조적으로 상보성인 항원성 표적과 상호작용할 수 있는 영역을 갖는다. 표적과 상호작용하는 영역은 "가변" 또는 "V" 영역으로 언급되고, 상이한 항원 특이성의 항체와 아미노산 서열이 상이하다는 특징을 갖는다. H 또는 L 사슬의 가변 영역은 항원성 표적에 특이적으로 결합할 수 있는 아미노산 서열을 함유한다. 이들 서열 내에, 상이한 특이성의 항체 사이의 극도의 가변성 때문에 "초가변"으로 불리는 보다 작은 서열이 존재한다. 상기 초가변 영역은 또한 "상보성 결정 영역" 또는 "CDR" 영역으로 칭해진다. 이들 CDR 영역에 의해 특정 항원 결정 구조에 대한 항체의 기본적인 특이성이 나타난다. CDR은 가변 영역 내의 아미노산의 비-인접 스트레치 (stretch)를 나타내지만, 종과 무관하게, 가변 중쇄 및 경쇄 영역 내의 이들 중요한 아미노산 서열의 위치는 가변 사슬의 아미노산 서열 내의 유사한 위치에 대응하는 것으로 밝혀졌다. 모든 항체의 가변 중쇄 및 경쇄는 각각의 경쇄 (L) 및 중쇄 (H)에 대해 각각 서로 인접하지 않는 3개의 CDR 영역 (L1, L2, L3, H1, H2, H3으로 칭함)을 각각 갖는다. 허용되는 CDR 영역은 문헌 [Kabat et al., J. Biol. Chem. 252:6609-6616 (1977)]에 기재되어 있다. 또한, 본 발명에 따라 개시된 항체는 완전히 합성된 것일 수 있고, 여기서 항체의 폴리펩티드 사슬은 합성되고, 가능하게는 수용체로서 본원에 개시된 폴리펩티드에 대한 결합을 위해 최적화된다. 상기 항체는 키메라 또는 인간화 항체일 수 있고, 완전한 사량체 구조일 수 있거나, 또는 이량체로서 단일 중쇄 및 단일 경쇄만을 포함할 수 있다.
발명의 상세한 설명
본 발명은 면역 반응을 증가시키기 위해 증강제와 함께 투여될 때 T 세포, 바람직하게는 인간 T 세포에서 억제 신호 전달을 감소 또는 폐지시키는 화합물을 포함하는, 포유동물에서 질환을 치료하기 위한 치료 요법 또는 조합 요법을 제공한다.
본 발명의 방법은 또한 광범위 면역조정물질 및 이들의 조성물의 용도에 관련된다. 일반적으로, 이들 방법에서 생성하는 증가된 T 세포 반응은 동일한 용량의 상기 PD-1 길항제 또는 상기 증강제 단독을 투여한 것으로부터 생성하는 임의의 증가된 T 세포 반응보다 더 크다.
개시된 조성물 및 요법은 T 세포를 수반하는 면역 반응을 자극 또는 향상시키기 위해 유용하다. 따라서, 본 발명의 방법은 질환이 감소된 T 세포 반응에 의해 특이적으로 유발되거나 악화되지 않더라도, T 세포 활성의 증가가 유익하고 증가된 T 세포 반응이 질환을 치료하기 위해 필요하거나 충분한 질환 상태를 치료하는데 가장 유용하다. 바람직한 실시양태에서, 치료 또는 예방할 질환의 종류는 즉, 세포독성 T 림프구가 공격하는 악성 종양, 또는 세균, 바이러스, 원생동물, 기생충, 또는 다른 세포내 미생물 병원체에 의해 유발된 만성 감염성 질환이다. 개시된 조성물을 사용한 T 세포의 활성화는 면역억제를 특징으로 하는 병태를 치료 또는 예방하기 위해 또한 유리하다.
본 발명에 따라서, T 세포 반응은 T 세포 표면 상의 수용체에 결합하는 분자 및 상기 수용체의 리간드에 결합하는 분자에 의해 조절될 수 있다. PD-1의 경우에, 그의 억제 효과를 감소시키도록 PD-1에 결합하는 분자 및/또는 PD-1에 결합하는 그들의 능력을 감소시키도록 하나 이상의 PD-1 리간드에 결합하는 분자는 T 세포 반응을 억제하는 PD-1의 능력을 감소시켜, 상기 반응 및 그의 면역학적 효과를 증가시키는 효과를 갖는다.
A.
PD
-1 수용체 길항제
PD-1 수용체의 길항제를 함유하는 조성물을 제공하고, 이는 PD-1의 리간드에 결합하고 차단하거나, PD-1 수용체에 대한 리간드의 결합을 저해 또는 억제하거나, PD-1 수용체를 통한 억제 신호 전달을 유도하지 않으면서 PD-1 수용체에 직접 결합하고 차단하는 화합물 또는 작용제를 포함한다. 다른 실시양태에서, PD-1 수용체 길항제는 억제 신호 전달을 촉발하지 않으면서 PD-1 수용체에 직접 결합하고, 또한 PD-1 수용체의 리간드에 결합하여 리간드가 PD-1 수용체를 통한 신호 전달을 촉발하는 것을 감소 또는 억제한다. PD-1 수용체에 결합하고 억제 신호의 전달을 촉발하는 리간드의 수 및/또는 양을 감소시킴으로써, PD-1 신호 전달에 의해 전달된 음성 신호에 의해 몇몇 세포는 약화되고, 보다 강건한 면역 반응을 성취할 수 있다.
본 발명에 따라서, PD-1 신호 전달은 주요 조직적합 복합체 (MHC)에 의해 제시된 펩티드 항원에 매우 근접하게 PD-1 리간드 (예를 들어 B7-H1 또는 B7-DC)에 대한 결합을 요구한다 (예를 들어, 문헌 [Freeman Proc. Natl. Acad. Sci. U. S. A 105:10275-10276 (2008)] 참조). 따라서, PD-1 및 T 세포막 상의 TCR의 동시-라이게이션을 방지하는 단백질, 항체 또는 소분자가 본 발명에서 고려되는 유용한 PD-1 길항제이다.
예시적인 PD-1 수용체 길항제는 그의 상동체 및 변이체를 포함한 B7-DC 폴리펩티드, 및 이들의 임의의 활성 단편, 및 이들 중 임의의 것을 포함하는 융합 단백질을 포함하고 이로 제한되지 않는다. 바람직한 실시양태에서, 융합 단백질은 항체, 예를 들어 인간 IgG의 Fc 부분에 결합된 B7-DC의 가용형 부분을 포함하고, 인간 B7-DC의 막횡단 부분의 전부 또는 일부를 포함하지 않는다. PD-1 수용체 길항제는 또한 PD-1의 리간드 또는 PD-1 자체에 결합함으로써 PD-1 수용체 신호 전달을 감소 또는 저해하는 소분자 길항제 또는 항체일 수 있고, 특히 여기서 PD-1과 TCR의 동시-라이게이션이 그러한 결합에 이어지지 않아서, PD-1 수용체를 통한 억제 신호 전달을 촉발하지 않는다.
본원에서 제공되는 PD-1 수용체 길항제는 면역 반응-자극 치료제로서 생체 내에서 및 생체 외에서 일반적으로 유용하다. 일반적으로, 개시된 길항제 조성물은 대상체의 면역계가 면역 반응에 착수하는 임의의 질환 또는 장애가 있거나 상기 질환 또는 장애에 소인이 있는 대상체를 치료하기 위해 유용하다.
1. B7-
DC
폴리펩티드
특정 실시양태에서, B7-DC 단백질은 PD-1 수용체 길항제로서 사용될 수 있다. B7-DC는 PD-1의 천연 리간드이고, B7-H1보다 더 큰 친화도로 PD-1에 결합하고, 따라서 B7-H1:PD-1 상호작용을 억제할 수 있다. 그의 변이체, 상동체 및 단편을 포함한 적합한 B7-DC 폴리펩티드는 내인성 신호 펩티드를 갖거나 (서열 1) 갖지 않는 (서열 2) 다음 전장 인간 B7-DC 폴리펩티드로부터 얻을 수 있다.
막 근위 불변 IgC 도메인 및 막 원위 IgV 도메인을 갖는 B7 패밀리의 분자, 예를 들어 B7-DC는 세포 표면에서 발현된다. 이들 리간드에 대한 수용체는 공통의 세포외 IgV-유사 도메인을 공유한다. 수용체-리간드 쌍의 상호작용은 주로 리간드의 IgV 도메인 및 수용체 내의 잔기들을 통해 매개된다. 일반적으로, IgV 도메인은 각각 β-가닥의 층을 포함하는 2개의 시트를 갖는 것으로서 설명된다. 이들 β-가닥은 A', B, C, C', C", D, E, F 및 G로서 칭해진다. 상기 폴리펩티드의 구조는 문헌에 설명되었다 ([Molnar et al., Crystal structure of the complex between programmed death-1 (PD-1) and its ligand PD-L2, PNAS, Vol. 105, pp. 10483-10488 (29 July 2008)] 참조).
막횡단 단백질인 B7-DC은 그의 단량체 형태에서, 분자의 세포외 부분 (세포외 도메인, 또는 ECD)를 구성하는 IgV 및 IgC 도메인을 포함하고, 여기서 IgV-유사 도메인이 전체적으로 또는 부분적으로, 본 발명의 방법에서 언급된 PD-1 결합 및 다른 기능을 담당한다. 인간 단백질에 대해, IgV 도메인은 B 및 F 가닥 (상기 언급된)을 연결하는 디술피드 결합을 갖는 것을 특징으로 하고, 이것은 많은 IgV 도메인의 특징인 것으로 보이고 B7-1 및 B7-2 둘 모두의 IgV 도메인과 유사한 3차원 구조를 갖는다 ([Molnar et al.(2008), 상기 문헌] 참조).
한 실시양태에서, B7-DC 변이체 폴리펩티드는 하나 이상의 이들 β-가닥 내에 아미노산 변경 (즉, 치환, 결실 또는 삽입)을 임의의 가능한 조합으로 함유한다. 다른 실시양태에서, B7-DC 변이체는 A', C, C', C", D, E, F 또는 G β-가닥 내에 하나 이상의 아미노산 변경 (즉, 치환, 결실 또는 삽입)을 함유한다. 바람직한 실시양태에서, B7-DC 변이체는 G β-가닥 내에 하나 이상의 아미노산 변경을 함유한다. 다른 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 IgC 및 IgV 도메인을 함유한다. 다른 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 IgV 도메인을 포함한다.
인간 및 마우스 B7-DC 단백질은 짧은 세포질내 도메인, 단일 막횡단 도메인 및 세포외 도메인을 함유한다. 세포외 도메인은 2개의 Ig 도메인; 막 근위 IgC 도메인 및 막 원위 IgV 도메인을 함유한다. 변이체 B7-DC 폴리펩티드의 유용한 단편은 가용형 단편을 포함한다. 가용형 B7-DC 단편은 생산 세포로부터 흘러나오거나 분비되거나 달리 추출될 수 있는 B7-DC의 단편이다. 한 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 전체 세포외 도메인을 포함한다. B7-DC의 세포외 도메인은 뮤린 또는 인간 B7-DC 또는 그의 활성 단편의 약 20 내지 약 아미노산 221로부터의 아미노산을 포함한다. 다른 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 IgC 및 IgV 도메인을 포함한다. 다른 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 IgV 도메인을 포함한다.
PD-1 신호 전달은 주요 조직적합 복합체 (MHC)에 의해 제시된 펩티드 항원에 매우 근접하게 PD-1 리간드 (대개 B7-H1)에의 결합을 요구하는 것으로 생각된다 (Freeman Proc. Natl. Acad. Sci. U. S. A 105:10275-10276 (2008)). 따라서, PD-1 및 T 세포막 상의 TCR의 동시-라이게이션을 방지하는 단백질, 항체 또는 소분자는 본 발명에서 고려되는 유용한 PD-1 길항제이다.
본 발명의 방법 및 조성물에서 유용한 PD-1 길항제는 ECD를 포함하는 B7-DC 단백질의 단편을 포함한다. 별법으로, B7-DC의 단편은 PD-1 수용체를 통한 억제 신호 전달을 저해하거나 방지하거나 달리 감소시키도록 PD-1 수용체에 결합하기에 충분한, IgV 또는 IgV-유사 도메인의 세포외 도메인의 일부, 바람직하게는 아미노산 20-221, 보다 바람직하게는 20-121을 포함한다. 바람직한 실시양태에서, B7-DC 단편은 PD-1 수용체에 대한 결합을 위해 B7-H1과 경쟁한다.
한 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 PD-1에 대한 결합을 위해 중요한 폴리펩티드의 영역을 함유할 수 있다. 이들 폴리펩티드 단편은 PD-1에 대한 결합을 위해 경쟁하고, 천연 B7-DC가 PD-1에 결합하는 것을 방지하기 위해 유용할 수 있다. B7-H1 및 B7-DC와 PD-1과의 상호작용을 억제하면 그렇지 않으면 일어날 면역 반응의 억압을 억제하므로, PD-1에 대한 결합을 위해 경쟁함으로써 이들 단편은 면역 반응을 향상시키기 위해 유용할 수 있다. PD-1에 경쟁적으로 결합할 수 있는 마우스 또는 인간 B7-DC의 폴리펩티드 단편은 예를 들어, 아미노산 101-108 또는 110-114를 함유할 수 있다. PD-1에 대한 야생형 B7-DC의 결합은, 상기 야생형 B7-DC의 단편의 부재 하의 PD-1에 대한 야생형 B7-DC의 결합 수준에 비해 일반적으로 적어도 50%, 60%, 70%, 75%, 80%, 90%, 95%, 또는 95% 초과로 억제된다. 본 발명의 방법 및/또는 조성물에서 유용한 예시적인 B7-DC 단편은 다음 B7-DC 세포외 도메인들을 포함하고 어떠한 방식으로도 이로 제한되지 않는다:
인간 B7-DC 세포외 도메인 (ECD):
및 뮤린 B7-DC ECD:
시노몰구스 원숭이 B7-DC ECD:
본 발명의 방법 및 조성물에서 유용한 많은 다른 영장류 서열은 문헌 [Onlamoon et al., Immunology, Vol. 124, pp. 277-293 (2008)]에 제공되어 있다.
본 발명의 조성물 및 방법에서 유용한 PD-1 길항제는 또한 제1 및 제2 폴리펩티드 부분을 포함하는 융합 단백질 (아래 설명됨)을 포함하고, 여기서 상기 융합 단백질 또는 그의 적어도 제1 폴리펩티드 부분은 PD-1 길항제 활성을 보유하고, 특히 여기서 상기 융합 단백질은 PD-1에 결합하고 차단하거나 PD-1의 리간드에 결합하고 차단한다. 상기 융합 단백질의 제1 폴리펩티드 부분은 임의의 PD-1 길항제 폴리펩티드, 또는 본 발명의 방법에서 PD-1 길항제로서 사용하기 위해 본원에서 달리 언급되는 그의 PD-1 결합 단편을 포함하거나 그로 이루어질 수 있다. 상기 융합 단백질의 바람직한 실시양태에서, 언급된 제1 폴리펩티드 부분은 언급된 제2 폴리펩티드 부분에 대해 N-말단이다. 별개의 실시양태에서, 언급된 제1 폴리펩티드 부분은 언급된 제1 및 제2 폴리펩티드 부분을 포함하는 아미노산에 추가로 올리고펩티드에 의해 언급된 제2 폴리펩티드 부분에 연결되고, 여기서 상기 연결 아미노산은 상기 융합 단백질의 PD-1 길항제 활성을 실질적으로 감소시키지 않는다.
바람직한 이량체성 융합 단백질에서, 이량체는 이량체화된 정상 Ig 중쇄 내에서 디술피드 연결되는 동일한 Cys 잔기들인, 2개의 Ig 중쇄의 CH 영역 내의 Cys 잔기들의 공유 결합으로부터 생성한다.
융합 단백질 결합 파트너 (partner)로서 통상적으로 사용되는 매우 많은 폴리펩티드 서열이 당업계에 공지되어 있다. 유용한 폴리펩티드 결합 파트너의 예는 초록 형광 단백질 (GFP), 글루타티온 S-트랜스퍼라제 (GST), 폴리히스티딘, myc, 헤마글루티닌, Flag™ 태그 (코닥 (Kodak), 미국 코네티컷주 뉴 헤이븐), 말토스 E 결합 단백질 및 단백질 A를 포함하고 이로 제한되지 않는다.
또 다른 실시양태는 변이체 B7-DC 폴리펩티드의 세포외 도메인에 융합된 BirA 기질을 갖는 사량체 구성체를 제공한다. 사량체 구성체를 제조하는 방법은 당업계에 공지되어 있다 ([Pertovas, et al., J. Exp. Med., 203:2281 (2006)] 참조).
예시적인 뮤린 B7-DC 융합 단백질은 뮤린 IgG2a (CAA49868)의 아미노산 237-469에 융합된 뮤린 B7-DC의 아미노산 20-221을 함유한다. 하나의 비-제한적인 예에서, 인간 B7-DC 융합 단백질은 인간 IgG1 (AAA02914)의 아미노산 245-476에 융합된 인간 B7-DC의 아미노산 20-221을 함유한다. B7-DC 융합 단백질에 대한 신호 펩티드는 숙주로부터 융합 단백질의 분비를 용이하게 하는 내인성 신호 펩티드 또는 임의의 다른 신호 펩티드를 포함한다. 다른 실시양태에서, 제1 폴리펩티드는 IgV 도메인만을 포함할 것이다. 다른 실시양태는 IgG 항체, 예를 들어 IgG1의 힌지 및 Fc 도메인을 포함할 수 있고, 여기서 가변 영역은 존재하지 않는다. 다른 실시양태는 특히 효과기 기능을 감소시키는 N297Q 또는 다른 돌연변이를 갖는, IgG2 또는 IgG4의 힌지 및 Fc 영역의 사용을 포함한다.
본 발명의 방법 및 조성물에 따라, PD-1 길항제로서 유용한 폴리펩티드, 또는 PD-1 길항제로서 유용한 융합 단백질의 제1 폴리펩티드 부분은 서열 1의 아미노산 1-221, 바람직하게는 서열 1의 아미노산 20-221, 또는 서열 1의 아미노산 26-221, 또는 서열 3 또는 4의 아미노산 1-202, 보다 바람직하게는 서열 1의 아미노산 20-121 또는 서열 3 또는 4의 아미노산 1-102에 적어도 60%, 또는 적어도 65%, 또는 적어도 70%, 또는 적어도 75%, 또는 적어도 80%, 또는 적어도 85%, 또는 적어도 90%, 또는 적어도 95%, 또는 적어도 99%의 동일성을 갖는 아미노산 서열을 포함한다.
한 실시양태에서, PD-1 길항제로서 유용한 폴리펩티드, 또는 PD-1 길항제로서 유용한 융합 단백질의 제1 폴리펩티드 부분은 서열 1의 아미노산 1-221로 이루어지거나, 서열 1의 아미노산 20-221로 이루어지거나, 서열 1의 아미노산 26-221로 이루어지거나, 서열 3 또는 4의 아미노산 1-202로 이루어진다. 한 실시양태에서 (서열 2), 이는 서열 1의 아미노산 1-19를 포함하지 않는다.
다른 특정 예에서, PD-1 길항제 폴리펩티드, 또는 PD-1 길항제 융합 단백질의 제1 폴리펩티드 부분은 서열 1의 아미노산 서열 20-121을 포함하고, 바람직하게는 여기서 그의 잔기 110-114에서 아미노산 서열 WDYKY를 포함하거나, 서열 3의 아미노산 1-102를 포함하고, 바람직하게는 그의 잔기 91-95에서 아미노산 서열 WDYKY를 포함한다.
바람직한 실시양태에서, 그러한 동일성%는 본원에서 규정된 바와 같은 보존적 아미노산 치환에 의지하여 달성된다.
상기 한 실시양태에서, PD-1 길항제 폴리펩티드, 또는 PD-1 길항제 융합 단백질의 제1 폴리펩티드 부분은 서열 1의 아미노산 1-19를 포함하지 않거나, PD-1 리간드 또는 다른 PD-1 길항제 단백질의 막횡단 도메인의 어떠한 부분도 포함하지 않고, 특히 전체 상기 도메인을 포함하지 않거나, 세포내 (또는 가용형) 도메인의 어떠한 부분도 포함하지 않고, 특히 전체 상기 도메인을 포함하지 않는다. 바람직한 실시양태에서, 상기 길항제, 또는 제1 폴리펩티드 부분은 서열 1의 세포외 도메인 (ECD)만을 포함하고, 따라서 상기 서열의 폴리펩티드의 가용형 부분, 또는 상기 가용형 부분의 단편만으로 이루어진다.
다른 실시양태에서, PD-1 길항제 폴리펩티드, 또는 PD-1 길항제 융합 단백질의 제1 폴리펩티드 부분은 PD-1 리간드의 IgV 도메인 또는 IgV-유사 도메인, 또는 그의 PD-1 결합 단편을 포함하거나, PD-1 리간드의 IgV 도메인 또는 IgV-유사 도메인, 또는 그의 PD-1 결합 단편으로 이루어진다. 특정 예에서, 상기 PD-1 리간드는 야생형 B7-DC 또는 B7-H1 분자, 바람직하게는 마우스 또는 영장류, 바람직하게는 인간, 야생형 B7-DC 또는 B7-H1 분자이다.
다른 실시양태에서, PD-1 길항제 폴리펩티드, 또는 PD-1 길항제 융합 단백질의 제1 폴리펩티드 부분, PD-1 리간드의 IgV 도메인 또는 IgV-유사 도메인의 PD-1 결합 단편, 특히 IgV 도메인 또는 IgV-유사 도메인은 서열 1의 아미노산 20-121 또는 서열 3의 아미노산 1-102로 이루어진다.
본 발명의 PD-1 길항제는 또한 서열 1 (인간 전장)의 아미노산 20-121 또는 서열 3 (세포외 도메인 또는 ECD)의 아미노산 1-102의 PD-1 결합 단편을 포함한다.
그의 구체적 실시양태에서, 폴리펩티드 또는 PD-1 결합 단편은 또한 서열 1의 잔기 110-114에서 아미노산 WDYKY, 또는 서열 3의 잔기 91-95에서 WDYKY를 포함한다. 비-제한적인 예로서, 상기 PD-1 결합 단편은 서열 1의 아미노산 20-121의 서열의 적어도 10, 또는 적어도 20, 또는 적어도 30, 또는 적어도 40, 또는 적어도 50, 또는 적어도 60, 또는 적어도 70, 또는 적어도 75, 또는 적어도 80, 또는 적어도 85, 또는 적어도 90, 또는 적어도 95, 또는 적어도 100개의 인접하는 아미노산을 포함하고, 여기서 각각의 상기 PD-1 결합 단편의 바람직한 실시양태는 하위 단편으로서, 서열 1의 잔기 110-114에서 발견되는 아미노산 WDYKY 또는 서열 3의 잔기 91-95에서 WDYKY를 포함할 것이다.
본 발명에서 구체적으로 고려되는 다른 바람직한 폴리펩티드 및 PD-1 결합 단편은 서열 1 (인간 전장)의 아미노산 20-121의 폴리펩티드 서열 및 그의 PD-1 결합 단편을 포함하고, 여기서 상기 폴리펩티드 또는 PD-1 결합 단편 내에서 시스테인은 잔기 42 및/또는 102에 존재하고, 여기서, 두 위치 모두에서 시스테인이 존재하는 것이 바람직하고/하거나, 페닐알라닌은 잔기 21에 존재하고/하거나 글루탐산은 잔기 28에 존재하고/하거나, 트레오닌, 및/또는 글루타민은 잔기 60에 존재하고/하거나, 글루탐산은 잔기 101에 존재하고/하거나, 이소류신은 잔기 103에 존재하고/하거나, 이소류신은 잔기 105에 존재하고/하거나, 글라이신은 잔기 107에 존재하고/하거나, 발린은 잔기 108에 존재하고/하거나, 트립토판은 잔기 110에 존재하고/하거나, 아스파르트산은 잔기 111에 존재하고/하거나, 티로신은 잔기 112에 존재하고/하거나, 라이신은 잔기 113에 존재하고/하거나, 티로신은 잔기 114에 존재하고, 단, PD-1 결합 단편의 경우에, 상기 단편은 그러한 아미노산 위치를 포함하도록 충분히 크다.
본 발명에서 구체적으로 고려되는 추가의 바람직한 폴리펩티드 및 PD-1 결합 단편은 서열 3 (인간 ECD) 또는 서열 4 (뮤린 ECD)의 아미노산 1-102의 폴리펩티드 서열 및 그의 PD-1 결합 단편을 포함하고, 여기서 상기 폴리펩티드 또는 PD-1 결합 단편 내에서, 시스테인은 잔기 23 및/또는 83에 존재하고, 여기서 두 위치 모두에 시스테인이 존재하는 것이 바람직하고/하거나 페닐알라닌은 잔기 2에 존재하고/하거나, 글루탐산은 잔기 9에 존재하고/하거나, 트레오닌 또는 아르기닌은 잔기 37에 존재하고, 여기서 트레오닌이 바람직하고/하거나 글루타민은 잔기 41에 존재하고/하거나, 아르기닌은 잔기 82에 존재하고/하거나, 류신은 잔기 84에 존재하고/하거나, 이소류신은 잔기 86에 존재하고/하거나, 글라이신은 잔기 88에 존재하고/하거나, 알라닌은 잔기 89에 존재하고/하거나, 트립토판은 잔기 91에 존재하고/하거나, 아스파르트산은 잔기 92에 존재하고/하거나, 티로신은 잔기 93에 존재하고/하거나, 라이신은 잔기 94에 존재하고/하거나, 티로신은 잔기 95에 존재하고, 단, PD-1 결합 단편의 경우에, 상기 단편은 그러한 아미노산 위치를 포함하도록 충분히 크다.
추가의 실시양태에서, 임의의 상기 폴리펩티드는 마우스 또는 영장류, 바람직하게는 인간의 것과 같은 B7-DC 또는 B7-H1 폴리펩티드의 신호, 막횡단 또는 C-말단 도메인으로부터의 부분 또는 단편, 예를 들어, 1 내지 10개의 인접하는 아미노산을 또한 포함할 수 있다.
상기 폴리펩티드 및/또는 PD-1 결합 단편은 또한 본 발명의 임의의 융합 단백질 내에 존재할 수 있고, 예를 들어, 여기서 상기 폴리펩티드 또는 PD-1 결합 단편은 상기 융합 단백질의 "제1 폴리펩티드"를 나타낸다.
구체적인 예에서, 증강제와 조합하여 본 발명의 치료 요법에 사용하기 위한 분자는 서열 1의 아미노산 20-221의 PD-1 결합 단편을 포함한다. 한 실시양태에서, 단편은 서열 1의 아미노산 20-121을 포함하고, 바람직하게는 여기서 단편은 서열 1의 아미노산 110-114를 함유한다. 일부 실시양태에서, 하나 초과의 상기 단편이 존재하고 (본원에서 설명한 바와 같이), 분자는 B7-DC 단백질의 적어도 2, 3, 4, 5개 또는 그 초과의 단편을 포함하고, 특히 여기서 단편은 서열 1의 아미노산 20-221의 일부이거나 그의 일부를 함유한다. 그의 바람직한 실시양태에서, 적어도 하나의 상기 단편은 서열 1의 아미노산 20-121로부터의 것이고, 보다 바람직하게는 여기서 적어도 하나의 상기 단편은 서열 1의 아미노산 110-114 (즉, 서열 WDYKY (서열 14))을 포함한다. 바람직한 실시양태에서, PD-1 결합 단편은 적어도 10, 또는 적어도 25, 또는 적어도 50, 또는 적어도 75, 또는 적어도 100개의 인접하는 아미노산 길이를 포함한다.
내인성 인간 신호 펩티드는 서열 MIFLLLMLSL ELQLHQIAA (서열 5)을 갖고, 서열 1의 처음 19개의 아미노산을 나타낸다. 특정 실시양태에서, B7-DC의 폴리펩티드 단편은 내인성 또는 이종성 신호 펩티드 (형질전환된 세포에서의 발현 및 분비에 의해 재조합 B7-DC 폴리펩티드를 생산하기 위해 사용될 수 있는)의 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 인접하는 아미노산을 포함할 수 있다. 또한, B7-DC 단편이 PD-1 수용체를 길항하는 능력을 보유하는 한, 유용한 B7-DC 폴리펩티드는 B7-DC의 막횡단 도메인의 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 인접하는 아미노산, 및/또는 세포질 도메인의 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 인접하는 아미노산, 또는 그의 조합을 포함할 수 있음이 또한 이해될 것이다.
PD-1-/- 마우스의 표현형은 PD-1이 생체 내에서 면역 반응의 음성 조절자라는 직접적인 증거를 제공한다. PD-1의 부재 하에, C57BL/6 배경 상의 마우스는 루푸스-유사 사구체신염 및 진행성 관절염을 서서히 발병한다 (Nishimura, et al., Immunity, 11:141-151 (1999)). BALB/c 배경 상의 PD-1-/- 마우스는 치명적인 자가면역 확장성 심근병증을 급속하게 발병한다 (Nishimura, et al., Science. 291:319-322 (2001)). 그러나, 실질적인 증거는 B7-DC가 T 세포 반응을 활성화하는 것을 보조자극하는 기능을 할 수 있음을 나타낸다. 최적 미만의 TCR 신호의 존재 하에, B7-DC는 시험관 내에서 시토카인의 증가된 증식 및 생산을 일으킨다 (Tseng, et al., J. Exp. Med. 193:839-846 (2001)). 다른 한편으로, 시험관내 연구는 T 세포 반응에서 B7-DC에 대한 음성 조절 역할을 나타낸다. 이들 겉보기에 모순되는 데이타는 PD-1 이외의 T 세포 상에서 B7-DC에 대한 추가의 수용체의 발현에 의해 최상으로 해석된다.
따라서, B7-DC 단백질, 그의 변이체, 단편 및 융합체는 PD-1 매개된 억제 신호 전달을 방지함으로써 T 세포 반응을 향상시키는 것에 추가로, T 세포를 활성화시키는 미지의 수용체에 결합함으로써 T 세포 반응을 직접 향상시키는 잇점을 가질 수 있다.
2. B7-
H1
폴리펩티드
다른 실시양태에서, 본 발명의 치료 요법에서 증강제와 조합으로 사용하기 위한 화합물은 바람직하게는 마우스 또는 영장류, 바람직하게는 인간으로부터의 포유동물 B7-H1의 단편이거나 그를 포함하고, 여기서 상기 단편은 PD-1에 결합하고 차단하지만 PD-1을 통한 억제 신호 전달을 일으키지 않고, 상기 단편은 적어도 10, 또는 적어도 20, 또는 적어도 30, 또는 적어도 40, 또는 적어도 50, 또는 적어도 60, 또는 적어도 70, 또는 적어도 80, 또는 적어도 90, 또는 적어도 100개의 인접하는 아미노산 길이이다. 다른 실시양태에서, 단편은 PD-1에 결합하는 기능을 갖지만 감소된 T 세포 증식을 일으키는 억제 신호 전달을 생성하지 않는 한 가변적인 길이의 것일 수 있다. 상기 B7-H1 단편은 또한 본 발명의 융합 단백질의 제1 폴리펩티드 부분의 일부로서 사용된다. B7-H1 서열은 다음과 같다:
인간 B7-H1 폴리펩티드 (서열 16):
뮤린 B7-H1 (서열 17)
붉은털 원숭이 (Macaca mulatta) PD-L1 (서열 18)
B7-H1-Ig 단백질은 WO/2001/014557 (2001년 3월 1일 공개) 및 WO/2002/079499 (2002년 10월 10일 공개)에 기재되어 있다.
3.
PD
-1 및 다른 폴리펩티드
본 발명의 다른 유용한 폴리펩티드는 PD-1 수용체의 리간드에 결합하는 것을 포함한다. 이들은 PD-1 수용체 단백질 또는 그의 가용형 단편을 포함하고, 이는 PD-1 리간드, 예를 들어 B7-H1 또는 B7-DC에 결합하고, 내인성 PD-1 수용체에 대한 결합을 방지하여, 억제 신호 전달을 방지할 수 있다. B7-H1은 또한 단백질 B7.1에 결합하는 것으로 나타났다 (Butte et al., Immunity, Vol. 27, pp. 111-122, (2007)). 또한, 상기 단편은 천연 리간드에 대한 결합을 증가시키는 돌연변이, 예를 들어 A99L 돌연변이를 포함하는 PD-1 단백질의 가용형 ECD 부분을 포함한다 (Molnar et al., Crystal structure of the complex between programmed death-1 (PD-1)) and its ligand PD-L2, PNAS, Vol. 105, pp. 10483-10488 (29 July 2008)). B7-H1 리간드에 결합하고 내인성 PD-1 수용체에 대한 결합을 방지하여, 억제 신호 전달을 방지할 수 있는 B7-1 또는 그의 가용형 단편이 또한 유용하다.
본 발명의 방법에 유용한 PD-1 폴리펩티드는 다음과 같다:
인간 PD-1 (서열 19)
시노몰구스 원숭이 PD-1 (서열 20)
본 발명에 따라서, B7-1 및 그의 단편은 또한 B7-H1에 결합하고 B7-H1을 통해 억제성 신호를 T 세포에 전달할 수 있으므로, 상기 상호작용의 차단은 또한 B7-H1을 통해 일어나는 억제 신호 전달을 감소시킬 수 있다. 본 발명에서 사용하기 위한 화합물은 상기 종류의 상호작용을 차단하는 분자이다. 상기 분자는 문헌 [Butte et al. (2007) 상기 문헌]에 개시되어 있고, B7-H1:B7-1 및 B7-H1:PD-1 상호작용을 차단하는 이중-특이성을 갖는 항-B7-H1 항체, 및 PD-L1:B7-1 상호작용을 차단하는 단일-특이성을 보이는 항체를 포함한다. B7-1을 차단함으로써 상기 상호작용을 차단하는 화합물은 또한 유용하고 항-B7-1 항체를 포함한다.
4.
변이체
폴리펩티드
설명된 바와 같은 본 발명에서 유용한 폴리펩티드는 하나 이상의 아미노산 치환, 결실, 또는 삽입을 함유하도록 돌연변이된 것을 포함한다. 돌연변이유발 방법은 당업계에 공지되어 있다. 돌연변이된 또는 변이체 폴리펩티드는 PD-1의 리간드에 결합함으로써 PD-1 수용체를 통한 억제 신호 전달을 억제 또는 감소시킨다. 별법으로, 변이체 (예를 들어, B7-DC 폴리펩티드)는 PD-1 수용체에 결합하고, PD-1 수용체를 통한 억제 신호 전달을 억제하거나 감소시키거나 차단할 수 있다. 변이체 폴리펩티드는 임의의 종에서 기원된 것일 수 있다. 한 실시양태에서, 변이체 폴리펩티드는 포유동물 종에서 유래한 것이다. 바람직한 실시양태에서, 변이체 폴리펩티드는 뮤린 또는 영장류, 바람직하게는 인간 기원의 것이다.
한 실시양태에서, 변이체 폴리펩티드는 야생형 또는 비-변이체 B7-DC와 동일한 PD-1에 대한 결합 친화도를 갖지만 비-돌연변이된 B7-DC 폴리펩티드에 비해 PD-1 수용체를 통한 억제 신호 전달을 촉발하는 능력을 갖지 않거나 10% 미만으로 갖는 B7-DC 폴리펩티드이다. 다른 실시양태에서, 변이체 B7-DC 폴리펩티드는 PD-1 억제 신호 전달을 촉발하지 않으면서 야생형 B7-DC보다 10%, 20%, 30%, 40%, 50%, 또는 60% 초과의 PD-1에 대한 결합 친화도를 갖는다.
변이체 폴리펩티드 (예를 들어, 변이체 B7-DC 폴리펩티드)는 PD-1 길항 활성이 야생형에 비해 실질적으로 감소되지 않는 한, 아미노산 치환, 결실 또는 삽입의 임의의 조합을 갖는 것을 포함한다. 그러나, 그러한 감소가 있으면, 상기 변이체가 야생형 단백질의 PD-1 길항제 활성의 적어도 50%, 바람직하게는 적어도 60%, 보다 바람직하게는 적어도 80%, 가장 바람직하게는 적어도 90% 또는 95%를 갖도록 (여기서 적어도 100%가 특히 바람직하다) 감소는 야생형의 1/2 이하이어야 한다. 상기 변이체로부터 생성되는 그러한 활성의 증가가 훨씬 더 바람직하다. 한 실시양태에서, 단리된 B7-DC 변이체 폴리펩티드는 그들의 아미노산 서열이 특히 포유동물, 바람직하게는 야생형 뮤린 또는 야생형 영장류, 바람직하게는 인간, B7-DC 폴리펩티드로부터 야생형 B7-DC 폴리펩티드의 아미노산 서열과 적어도 60%, 70%, 80%, 85%, 90%, 95%, 97%, 98%, 99%, 99.5% 또는 100% 동일성을 공유하도록 아미노산 변경을 가진다.
폴리펩티드 서열 동일성은 상기 제공되는 % 동일성의 정의를 이용하여 계산할 수 있다.
폴리펩티드 내의 아미노산 치환은 "보존적" 또는 "비-보존적"일 수 있다.
막 근위 불변 IgC 도메인 및 막 원위 IgV 도메인을 갖는 B7 패밀리의 분자, 예를 들어 B7-DC은 세포 표면에서 발현된다. 이들 리간드에 대한 수용체는 공통의 세포외 IgV-유사 도메인을 공유한다. 수용체-리간드 쌍의 상호작용은 주로 리간드의 IgV 도메인 및 수용체 내의 잔기들을 통해 매개된다. 일반적으로, IgV 도메인은 각각 β-가닥의 층을 포함하는 2개의 시트를 갖는 것으로서 설명된다. 이들 β-가닥은 A', B, C, C', C", D, E, F 및 G로서 칭해진다. 한 실시양태에서, B7-DC 변이체 폴리펩티드는 하나 이상의 이들 β-가닥 내에 아미노산 변경 (즉, 치환, 결실 또는 삽입)을 임의의 가능한 조합으로 함유한다. 다른 실시양태에서, B7-DC 변이체는 A', C, C', C", D, E, F 또는 G β-가닥 내에 하나 이상의 아미노산 변경 (즉, 치환, 결실 또는 삽입)을 함유한다. 한 실시양태에서, B7-DC 변이체는 G β-가닥 내에 하나 이상의 아미노산 변경을 함유한다.
뮤린 또는 영장류, 바람직하게는 인간에 관하여, B7-DC (변이체 B7-DC 폴리펩티드)는 비제한적으로, 비-돌연변이된 B7-DC에 비해 PD-1에 대한 결합을 실질적으로 감소시키지 않는 위치에서 치환, 결실 또는 삽입을 함유할 수 있다.
그러나, 언급된 아미노산 위치에서 치환은 임의의 아미노산 또는 아미노산 유사체를 사용하여 이루어질 수 있음이 이해된다. 예를 들어, 언급된 위치에서 치환은 임의의 천연-발생 아미노산 (예를 들어, 알라닌, 아스파르트산, 아스파라긴, 아르기닌, 시스테인, 글라이신, 글루탐산, 글루타민, 히스티딘, 류신, 발린, 이소류신, 라이신, 메티오닌, 프롤린, 트레오닌, 세린, 페닐알라닌, 트립토판, 또는 티로신)을 사용하여 이루어질 수 있다.
본원에 기재된 치환은 마우스 및 영장류, 특히 인간, B7-DC에 관한 것이지만, 당업자는 다른 종 (예를 들어, 래트, 햄스터, 기니 돼지, 게르빌루스쥐, 토끼, 개, 고양이, 말, 돼지, 양, 소 또는 비-인간 영장류)으로부터 대응하는 폴리펩티드에서 동등한 변경을 쉽게 이룰 수 있음에 주목한다.
바람직한 단편은 PD-1에 결합하기에 효과적인 B7-DC의 세포외 도메인의 전부 또는 일부를 포함한다.
한 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 PD-1 억제 신호 전달을 촉발하지 않으면서 PD-1에 결합하는 능력을 보유하는 것이다. 하나의 실시양태는 전장 B7-DC의 단편이고 일반적으로 전장 변이체 B7-DC 폴리펩티드의 PD-1 길항제 활성을 적어도 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 98%, 99%, 100%, 또는 심지어 100% 초과로 갖는 변이체 B7-DC 폴리펩티드를 제공한다.
변이체 B7-DC 폴리펩티드의 유용한 단편은 가용형 단편을 포함한다. 가용형 B7-DC 단편은 생산 세포로부터 흘러나오거나 분비되거나 달리 추출될 수 있는 B7-DC의 단편이다. 한 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 전체 세포외 도메인을 포함한다. B7-DC의 세포외 도메인은 뮤린 또는 영장류, 바람직하게는 인간 B7-DC의 약 아미노산 20 내지 약 아미노산 221을 포함한다. 다른 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 IgC 및 IgV 도메인을 포함한다. 다른 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 B7-DC의 IgV 도메인을 포함한다.
한 실시양태에서, 변이체 B7-DC 폴리펩티드 단편은 PD-1에 대한 결합 친화도에 중요한 폴리펩티드의 영역을 함유한다. 이들 폴리펩티드 단편은 천연 리간드가 PD-1 수용체에 결합하는 것을 방지하여, 면역 반응을 향상시키기 위해 PD-1 수용체에 결합하고 차단하기 위해 유용하다. 천연 B7-H1 또는 B7-DC와 PD-1의 상호작용을 억제하면 그렇지 않으면 일어날 면역 반응의 억압을 억제한다. PD-1에 결합하는 마우스 또는 영장류, 바람직하게는 인간 B7-DC의 폴리펩티드 단편은 비-제한적인 예로써, 아미노산 101-105, 또는 111-113을 함유한다. B7-H1의 PD-1 수용체에 대한 결합은 일반적으로 단편의 부재 하의 B7-H1의 PD-1에 대한 결합 수준에 비해 적어도 50%, 또는 적어도 60%, 또는 적어도 70%, 또는 적어도 75%, 또는 적어도 80%, 또는 적어도 90%, 또는 적어도 95% 또는 그 초과로 억제된다.
인간 PD-1 돌연변이체 A99L은 돌연변이되지 않은 인간 PD-1보다 더 큰 친화도로 B7-DC 및 B7-H1에 결합한다 (Lazar Molnar et al. PNAS 105 p. 10483-10488 (2008)). 본 발명의 한 실시양태에서, 억제 신호 전달을 감소시키는 작용을 하는 화합물은 상기 돌연변이를 포함하는 PD-1의 ECD와 같은 가용형 단백질이다.
5. 변형된 폴리펩티드
설명되는 바와 같이, 그의 변이체, 상동체 및 단편을 포함한 본 발명에서 유용한 폴리펩티드는 정상 세포 환경에서 폴리펩티드와 연관된 것으로 발견되는 화학적 모이어티 (moiety)에 의해, 예를 들어, 폴리펩티드의 인산화, 메틸화, 아미드화, 황산화, 아실화, 당화, 수모일화 (sumoylation) 및 유비퀴틸화 (ubiquitylation)에 의해 변형될 수 있다.
상기 폴리펩티드는 또한 정상적으로 세포 환경 내에서 폴리펩티드의 일부가 아닌 화학적 모이어티에 의해 변형될 수 있다. 그러한 변형은 폴리펩티드의 표적화된 아미노산 잔기를 선택된 측쇄 또는 말단 잔기와 반응할 수 있는 유기 유도체화제와 반응시킴으로써 분자 내로 도입될 수 있다. 다른 유용한 변형은 단백질의 고리화이다. 그러한 변형은 또한 방사성 동위원소 및 형광 화합물을 포함하고 이로 제한되지 않는, 직접 또는 간접적으로 검출가능한 신호를 제공할 수 있는 표지의 도입을 포함한다.
폴리펩티드의 화학적 유도체의 예는 숙신산 또는 다른 카르복실산 무수물로 유도체화한 라이시닐 및 아미노 말단 잔기를 포함한다. 환식 카르복실산 무수물을 사용한 유도체화는 라이시닐 잔기의 전하를 역전시키는 효과가 있다. 아미노-함유 잔기를 유도체화하기 위한 다른 적합한 시약은 이미도에스테르, 예를 들어 메틸 피콜린이미데이트; 피리독살 포스페이트; 피리독살; 클로로보로히드라이드; 트리니트로벤젠술폰산; O-메틸이소우레아; 2,4 펜탄디온; 및 글리옥실레이트를 사용한 트랜스아미나제-촉매 반응을 포함한다. 카르복실 측쇄기, 아스파르틸 또는 글루타밀은 카르보디이미드 (R-N=C=N-R'), 예를 들어 1-시클로헥실-3-(2-모르폴리닐-(4-에틸)카르보디이미드 또는 1-에틸-3-(4-아조니아-4,4-디메틸펜틸) 카르보디이미드와의 반응에 의해 선택적으로 변형될 수 있다. 또한, 아스파르틸 및 글루타밀 잔기는 암모니아와의 반응에 의해 아스파르기닐 및 글루타미닐 잔기로 전환될 수 있다. 본 발명의 폴리펩티드는 또한 하나 이상의 L-아미노산을 대체하는 하나 이상의 D-아미노산을 포함할 수 있다.
다른 실시양태에서, 증강제, 예를 들어 CTX는 증강제가 본 발명의 PD-1 길항제에 화학적으로 연결되는 경우에서와 같이, 자체가 억제 신호 전달을 감소시키는 화합물의 일부일 수 있다.
6. 융합 단백질
(i) 제2 폴리펩티드에 직접 융합된, 또는 (ii) 임의로 제2 폴리펩티드에 융합된 링커 (linker) 펩티드 서열에 융합된, 제1 융합 파트너 또는 PD-1 길항제 단백질, 예를 들어, B7-DC 폴리펩티드 (변이체, 상동체 및 그의 단편 포함)의 전부 또는 일부를 포함하는 폴리펩티드 부분을 갖는 융합 폴리펩티드를 또한 제공한다. 융합 파트너의 존재는 예를 들어, PD-1 길항제 폴리펩티드의 용해도, 친화도 및/또는 결합가 (valency)를 변경할 수 있다. 개시된 융합 단백질은 상기한 바와 같이 PD-1 길항제 폴리펩티드의 아미노산 변경 (즉, 치환, 결실 또는 삽입), 단편, 및/또는 변형의 임의의 조합을 포함한다. 한 실시양태에서, B7-DC 융합 단백질은 제1 결합 파트너로서 B7-DC 단백질의 세포외 도메인을 포함한다. 다른 실시양태에서, 그러한 B7-DC 융합 단백질은 제1 결합 파트너로서 B7-DC 단백질의 IgV 및 IgC 도메인을 포함한다. 다른 실시양태에서, 변이체 B7-DC 융합 단백질은 제1 결합 파트너로서 B7-DC 단백질의 IgV 도메인을 포함한다.
대표적인 제1 융합 파트너는 영장류, 바람직하게는 인간 또는 뮤린 B7-DC 폴리펩티드, 그의 단편, 및 상기 개시된 그의 변이체를 포함한다. 바람직한 단편은 B7-DC의 세포외 도메인을 포함한다. 언급된 바와 같이, 세포외 도메인은 신호 펩티드의 1-10개의 인접하는 아미노산, B7-DC 막횡단 도메인, 또는 둘 모두를 포함할 수 있다.
한 실시양태에서, 본 발명의 조성물 및/또는 생성물 및/또는 방법에서는 다른 폴리펩티드에 결합되어, PD-1 리간드, 예를 들어 B7-H1에 결합하여 리간드가 PD-1과 상호작용하는 것을 억제함으로써 PD-1 수용체에 길항하는 융합 단백질을 형성하는 PD-1 수용체 길항제, 특히 폴리펩티드 (그의 변이체, 상동체 및 단편 포함)을 이용한다. 다른 실시양태에서, PD-1 수용체 길항제 폴리펩티드, 또는 그의 변이체는 다른 폴리펩티드에 결합되어, PD-1 수용체에 결합하고 차단함으로써 PD-1 수용체에 길항하고 PD-1을 통한 억제 신호 전달을 억제 또는 감소시키는 융합 단백질을 형성한다.
제2 폴리펩티드 결합 파트너, 또는 제2 폴리펩티드 부분은 PD-1 길항제 폴리펩티드에 비해 N-말단 또는 C-말단일 수 있다. 바람직한 실시양태에서, 제2 폴리펩티드는 PD-1 길항제 폴리펩티드에 C-말단이다.
바람직한 실시양태에서, 본 발명의 방법 및 조성물 및/또는 생성물에서 사용하기 위해 고려되는 융합 단백질은 적어도 항체의 일부를 포함한다. 분자 생물학 및 재조합 기술의 방법의 발전으로, 재조합 수단에 의해 항체 분자를 생산하고 그에 의해 항체의 폴리펩티드 구조 내에서 발견되는 특이적 아미노산 서열을 코딩하는 유전자 서열을 생성하는 것이 이제 가능하다. 상기 항체는 상기 항체의 폴리펩티드 사슬을 코딩하는 유전자 서열을 클로닝함으로써 또는 상기 폴리펩티드 사슬의 직접 합성 및 합성된 사슬의 시험관내 조립에 의해 특이적 에피토프 및 항원 결정인자에 대한 친화도를 갖는 활성 사량체 (H2L2) 구조를 형성함으로써 생산할 수 있다. 이것은 상이한 종 및 공급원으로부터 중화 항체의 특징적인 서열을 갖는 항체의 신속한 생산을 허용하였다.
항체의 공급원, 또는 재조합 방식으로 구성된 방식, 또는 시험관 내에서 또는 생체 내에서, 트랜스제닉 (transgenic) 동물, 예를 들어 소, 염소 및 양을 사용하여, 실험실 또는 공업 규모의 큰 세포 배양액을 사용하여, 생물반응기 내에서, 또는 임의의 공정 단계에서 살아있는 유기체를 사용하지 않는 직접 화학 합성에 의하여 합성된 방식에 무관하게, 모든 항체는 유사한 전체 3차원 구조를 갖는다. 상기 구조는 종종 H2L2로서 제공되고, 항체는 일반적으로 2개의 경쇄 (L) 아미노산 및 2개의 중쇄 (H) 아미노산을 포함한다는 사실을 나타낸다. 두 사슬은 구조적으로 상보성인 항원성 표적과 상호작용할 수 있는 영역을 갖는다. 표적과 상호작용하는 영역은 "가변" 또는 "V" 영역으로 칭하고, 상이한 항원 특이성의 항체들로부터 아미노산 서열 차이를 특징으로 한다.
바람직한 실시양태에서, PD-1 수용체 길항제 폴리펩티드 (단편, 돌연변이체 및 다른 변이체 포함)는 (i) 제2 폴리펩티드에 직접 융합된, 또는 (ii) 임의로 제2 폴리펩티드에 융합된 링커 펩티드 서열에 융합된, B7-DC 단백질 또는 그의 변이체의 전부 또는 일부를 갖는 제1 융합 파트너를 갖는다. 융합 파트너의 존재는 B7-DC 폴리펩티드의 용해도, 친화도 및/또는 결합가를 변경할 수 있다. 보다 바람직한 실시양태에서, B7-DC 폴리펩티드는 Ig 중쇄 불변 영역의 하나 이상의 도메인에, 보다 바람직하게는 인간 면역글로불린 Cγ1 사슬의 힌지, CH2 및 CH3 영역에 또는 뮤린 면역글로불린 Cγ2a 사슬의 힌지, CH2 및 CH3 영역에 상응하는 아미노산 서열에 융합된다. 바람직한 실시양태에서, 불변 영역은 바람직하게는 Fc 수용체 결합을 제거 또는 감소시키는 돌연변이 (예를 들어 N297Q)를 포함한다.
인간 면역글로불린 Cγ1 사슬의 힌지, CH2 및 CH3 영역은 다음 아미노산 서열을 갖는다:
뮤린 면역글로불린 Cγ2a 사슬의 힌지, CH2 및 CH3 영역은 다음 아미노산 서열을 갖는다:
예시적인 뮤린 B7-DC 융합 단백질은 뮤린 IgG2a (CAA49868)의 아미노산 237-469에 융합된 뮤린 B7-DC의 아미노산 20-221을 포함한다. 인간 B7-DC 융합 단백질은 인간 IgG1 (AAA02914)의 아미노산 245-476에 융합된 인간 B7-DC의 아미노산 20-221을 포함할 수 있다. B7-DC 융합 단백질에 대한 신호 펩티드는 숙주로부터 융합 단백질의 분비를 용이하게 하는 내인성 신호 펩티드 또는 임의의 다른 신호 펩티드일 수 있다.
대표적인 뮤린 B7-DC-Ig 융합 단백질은 서열 8의 핵산 서열에 의해 코딩된다.
개시된 핵산 서열은 본 발명의 방법 및 조성물에서 유용한 융합 단백질을 합성하기 위해 발현 수준을 증가시키기 위해서 코돈이 최적화될 수 있음이 이해될 것이다. 코돈 최적화 방법은 당업계에 잘 공지되어 있다.
서열 8에 의해 코딩되는 뮤린 B7-DC-Ig 융합 단백질은 다음 아미노산 서열을 갖는다:
서열 10은 신호 서열이 없는 뮤린 B7-DC-Ig 융합 단백질에 대한 아미노산 서열을 제공한다.
한 실시양태에서, 인간 B7-DC-Ig는 인간 B7-DC-Ig의 아미노산 서열을 코딩하는, 서열 11의 핵산 서열에 의해 코딩된다:
본 발명은 구체적으로 본 발명의 방법 및 조성물에서 유용한 성숙한 융합 단백질에서 신호 서열이 제거되는 실시양태를 구체적으로 고려한다. 바람직한 실시양태에서, 신호 서열은 완전히 제거된다.
서열 13은 신호 서열이 없는 인간 B7-DC-Ig에 대한 아미노산 서열을 제공한다.
본 발명은 본원에 개시된 방법 및 조성물에서 사용된 개시된 B7-DC-Ig 융합 단백질이 서열 9, 10, 12, 또는 13에 적어도 약 80%, 85%, 90%, 99% 또는 100%의 서열 동일성을 갖는 실시양태를 구체적으로 고려한다.
본 발명의 다른 실시양태에서, 융합 폴리펩티드는 이중특이적 기능을 가질 수 있어서, 제1 융합 파트너는 PD-1의 리간드, 예를 들어 B7-H1에 결합하고, 제2 융합 파트너은 PD-1 수용체를 통한 억제 신호 전달을 촉발하지 않으면서 PD-1 수용체에 결합한다.
본 발명에서 유용한 폴리펩티드는 단량체성 또는 이량체성일 수 있지만, 융합 단백질 자체는 단량체 또는 올리고머 형태로, 바람직하게는 이량체로서 존재할 수 있다. 특정 실시양태에서, 본 발명의 방법 및 조성물에서 PD-1 길항제로서 유용한 융합 단백질은 올리고성, 특히 이량체성 형태로 자발적으로 조립할 수 있거나, 당업계에 잘 공지된 수단에 의해 그러한 올리고머를 형성하기 위해 화학적으로 연결될 수 있다. 예를 들어, 본 발명을 실시하는데 유용한 융합 단백질은 자체가 항체의 일부에 융합된 B7-DC 폴리펩티드의 일부를 포함할 수 있고, 이들은 이량체로 더욱 조립될 수 있다. 하나의 그러한 예에서, 본 발명에서 유용한 폴리펩티드는 단일 아미노산 사슬로서 항체의 Fc 영역에 융합되고 (상기 구성체가 단일 재조합 폴리뉴클레오티드로부터 발현되는 경우와 같이), 그 후 2개의 그러한 융합 생성물은 각각의 Fc 영역 사이의 디술피드 연결에 의해서와 같이 서로 연결되어 동종이량체를 형성한다.
상기 이량체성 생성물은 동종이량체일 수 있거나 (여기서 두 단량체성 융합 단백질은 동일하다), 이종이량체일 수 있다 (여기서 2개의 상이한 융합 단백질이 서로 연결된다). 상기 이량체의 개별 단량체들은 당업계에 공지된 임의의 수단에 의해, 예를 들어 공유 연결 (예를 들어, 디술피드 결합) 또는 비-공유 연결 (예를 들어 이온성 상호작용)에 의해 연결될 수 있다. 본 발명의 실시예에서 사용된 B7-DC-Ig는 디술피드 연결에 의해 함께 연결된 2개 카피의 서열 10을 갖는 동종이량체의 형태로 존재하였다. 또한, 본 발명의 이종이량체는 이중특이적 단백질 및 융합 단백질을 포함하고, 여기서 하나의 단량체성 부분은 PD-1에 결합하고 다른 것은 PD-1의 천연 리간드에 결합한다. 상기 이종이량체는 본원에 충분히 설명되는 폴리펩티드 및 융합 단백질의 결합에 의해 형성된다.
본 발명의 다른 유용한 실시양태에서, PD-1 길항제는 이종이량체이고, 예를 들어 여기서 2개의 융합 단백질이 함께 연결되지만 동일한 아미노산 서열의 것이 아니다. 특정 예에서, 각각의 단량체는 B7-DC 폴리펩티드의 활성 단편에 연결된 항체의 Fc 부분을 포함할 수 있고, 여기서 이들 활성 단편은 B7-DC 폴리펩티드의 상이한 부분으로부터의 것이거나, 전장 천연 B7-DC 폴리펩티드에 융합된 항체의 Fc 부분을 포함하는 융합 단백질은 항체의 Fc 부분 및 전장 천연 BY-DC 폴리펩티드의 활성 단편을 포함하는 융합 단백질에 연결된다 (예를 들어, 가교결합된다). 각각의 그러한 경우에, 각각의 단량체성 융합 단백질을 형성하는데 사용되는 항체의 부분은 2개의 단량체성 단위 사이에서 상이할 수 있다. 임의의 그러한 이량체 조합은 본 발명의 방법 및 조성물에서 구체적으로 고려된다.
바람직한 이량체성 융합 단백질에서, 이량체는 이량체화된 정상 Ig 중쇄 내에서 디술피드 연결되는 동일한 Cys 잔기들인, 2개의 Ig 중쇄의 CH 영역 내의 Cys 잔기들의 공유 결합으로부터 생성한다.
또 다른 실시양태는 변이체 B7-DC 폴리펩티드의 세포외 도메인에 융합된 BirA 기질을 갖는 사량체 구성체를 제공한다. 사량체 구성체를 제조하는 방법은 당업계에 공지되어 있다 ([Pertovas, et al., J. Exp. Med., 203:2281 (2006)] 참조).
7. 항-
PD
-1 및 다른 항체
본 발명의 방법에서 고려되는 다른 PD-1 길항제는 PD-1 또는 PD-1의 리간드에 결합하는 항체, 및 다른 항체를 포함한다.
한 측면에서, 본 발명은 포유동물에게 항-PD-1 항체 및 증강제를 포함하는 효과적인 치료 요법을 투여하는 것을 포함하는, 그를 필요로 하는 포유동물에서 T 세포 반응을 증가시키는 방법에 관한 것이고, 여기서 상기 치료 요법은 상기 항원에 대한 상기 포유동물의 T 세포 반응을 증가시키기 위해 효과적이다.
본 발명의 치료 요법(들)에 유용한 항-PD-1 항체는 다음 공개문에 기재된 것을 포함하고 이로 제한되지 않는다:
본 발명의 방법에 유용한 항-PD-1 항체의 구체적인 예는 바람직하게는 3 mg/kg의 용량으로 투여되는 인간 항-PD-1 항체인 MDX-1106이다 (US 20070166281 (Kosak, 2007년 7월 19일 공개) at par. 42 참조).
다른 측면에서, 본 발명은 포유동물에게 항-PD-1 리간드 항체, 예를 들어, 항-B7-H1 항체 및 증강제를 포함하는 효과적인 치료 요법을 투여하는 것을 포함하는, 그를 필요로 하는 포유동물에서 T 세포 반응을 증가시키는 방법에 관한 것이고, 여기서 상기 치료 요법은 상기 항원에 대한 상기 포유동물의 T 세포 반응을 증가시키기 위해 효과적이다.
본 발명의 치료 요법(들)에 유용한 항-B7-H1 항체는 다음 공개문에 기재된 것을 포함하고 이로 제한되지 않는다:
PCT/US06/022423 (WO/2006/133396, 2006년 12월 14일 공개),
PCT/US07/088851 (WO/2008/083174, 2008년 7월 10일 공개),
US 2006/0110383 (2006년 5월 25일 공개)
본 발명의 방법에 유용한 항-B7-H1 항체의 구체적인 예는 인간 항-B7-H1 항체인 MDX-1105 (WO/2007/005874, 2007년 1월 11일 공개))이다.
항-B7-DC 항체에 대해서는 7,411,051, 7,052,694, 7,390,888, 20060099203을 참조한다.
본 발명의 다른 실시양태는 PD-1의 리간드, 예를 들어 B7-H1에 결합하는 항체에 연결된, PD-1 수용체에 결합하는 항체를 포함하는 이중특이적 항체를 포함한다. 바람직한 실시양태에서, PD-1 결합 부분은 PD-1 수용체를 통한 신호 전달을 감소 또는 억제한다.
본 발명에 사용하기 위한 항체는 항-PD-1 또는 항-PD-1 리간드 항체일 필요가 없고, 대신에 면역 반응에서 T 세포의 효과를 매개하는데 유용한 다른 항체일 수 있다. 본 측면에서, 본 발명은 포유동물에게 항-CTLA4 항체 및 증강제를 포함하는 효과적인 치료 요법을 투여하는 것을 포함하는, 그를 필요로 하는 포유동물에서 항원에 대한 T 세포 반응을 증가시키는 방법에 관한 것이고, 여기서 상기 치료 요법은 상기 항원에 대한 상기 포유동물의 T 세포 반응을 증가시키기 위해 효과적이다. 본 발명의 방법에 사용하기 위해 고려되는 항-CTLA4 항체의 예는 PCT/US2006/043690 (WO/2007/056539, Fischkoff et al.)에 기재된 바와 같은 항체를 포함한다.
본 발명의 방법에 유용한 항-CTLA4 항체의 특정 예는 바람직하게는 10 mg/kg의 용량으로 투여되는 인간 항-CTLA4 항체인 이필리무맙 (Ipilimumab) (MDX-010 또는 MDX-101로도 알려짐), 및 바람직하게는 15 mg/kg의 용량으로 투여되는 인간 항-CTLA4 항체인 트레멜리무맙 (Tremelimumab)이다.
8.
소분자
PD
-1 길항제
PD-1 수용체 길항제는 또한 소분자 길항제일 수 있다. 용어 "소분자"는 분자량이 100 달톤 초과 내지 약 2,500 달톤 미만, 바람직하게는 100 내지 2000 달톤, 보다 바람직하게는 약 100 내지 약 1250 달톤, 보다 바람직하게는 약 100 내지 약 1000 달톤, 보다 바람직하게는 약 100 내지 약 750 달톤, 보다 바람직하게는 약 200 내지 약 500 달톤인 작은 유기 화합물을 나타낸다. 소분자는 종종 하나 이상의 관능기로 치환된 환식 탄소 또는 헤테로환 구조 및/또는 방향족 또는 폴리방향족 구조를 포함한다. 소분자 길항제는 PD-1의 리간드, 예를 들어 B7-H1 및 B7-DC에 결합하고 리간드가 PD-1과 상호작용하는 것을 방지함으로써 또는 PD-1 수용체를 통한 신호 전달을 촉발하지 않으면서 PD-1 수용체에 직접 결합하고 차단함으로써, PD-1 수용체 신호 전달을 감소 또는 저해한다.
한 실시양태에서, 그러한 소분자는 다른 PD-1 길항제 또는 CTLA4 길항제, 예를 들어 PD-1 또는 그의 리간드 중 하나에 특이적인 항체 또는 CTLA4 또는 그의 리간드 중 하나에 특이적인 항체와 조합하여 투여될 수 있다. 따라서, 그러한 소분자는 하나 이상의 본 발명의 방법에서 화합물로서 투여될 수 있거나, 본 발명의 방법에서 유용한 다른 화합물과 조합하여 투여될 수 있다. 예를 들어, 일련의 작은 유기 화합물은 B7-1 리간드에 결합하여 CTLA4에 대한 결합을 방지하는 것으로 밝혀졌다 (문헌 [Erbe et al., J. Biol. Chem., Vol. 277, pp. 7363-7368 (2002)] 참조). 상기 작은 유기 물질은 T 세포의 억제 신호 전달을 감소시키기 위해서, 단독으로 또는 항-CTLA4 항체와 함께 CTX 투여와 조합하여 투여될 수 있다.
한 실시양태에서, 본 발명의 방법에서 사용하기 위해 고려되는 PD-1 길항제 또는 CTLA4 길항제는 안티센스 핵산, DNA 및 RNA 모두, 및 siRNA 분자를 포함한다. 그러한 안티-센스 분자는 T 세포 상의 PD-1의 발현 및 T 세포 리간드, 예를 들어 B7-H1, PD-L1 및 PD-L2의 생산을 방지한다. 예를 들어, 담체, 예를 들어 폴리에틸렌이민과 복합체화된 siRNA (예를 들어, 약 21개 뉴클레오티드 길이, 이는 PD-1을 코딩하는 유전자 또는 PD-1 리간드를 코딩하는 유전자에 특이적이고, 올리고뉴클레오티드는 상업적으로 쉽게 구입할 수 있다) ([Cubillos-Ruiz et al., J. Clin. Invest. 119(8): 2231-2244 (2009)] 참조)는 PD-1 및 PD-1의 리간드를 발현하는 세포에 의해 쉽게 흡수되고, T 세포에서 억제 신호 전달의 감소를 달성하여, T 세포를 활성화시키기 위해 이들 수용체 및 리간드의 발현을 감소시킨다.
B. 증강제
본 발명에 따라서, PD-1 길항제의 활성은 증강제의 존재에 의해 바람직하게는 상승적으로 증가된다. 증강제는 가능하게는 하나 초과의 메카니즘에 의해 PD-1 수용체 길항제의 효율을 증가시키는 작용을 하지만, 정확한 작용 메카니즘은 본 발명의 광범위한 실시를 위해 필수적이지 않다.
바람직한 실시양태에서, 증강제는 시클로포스파미드이다. 시클로포스파미드 (CTX, 시톡산®, 또는 네소살 (Neosar)®)는 옥사자포스포린 약물이고, 유사체는 이포스파미드 (IFO, 이펙스 (Ifex)), 페르포스파미드, 트로포스파미드 (트로포스파미드 (trofosfamide); 이속텐 (Ixoten)), 및 그의 제약상 허용되는 염, 용매화물, 전구약물 및 대사물을 포함한다 (그 전문이 포함되는 미국 특허 출원 20070202077). 이포스파미드 (미톡사나 (MITOXANA)®)는 시클로포스파미드의 구조적 유사체이고, 그의 작용 메카니즘은 시클로포스파미드와 동일하거나 또는 실질적으로 유사한 것으로 생각된다. 페르포스파미드 (4-히드로퍼옥시시클로포스파미드) 및 트로포스파미드는 또한 알킬화제이고, 이는 시클로포스파미드에 구조상 관련된다. 예를 들어, 페르포스파미드는 DNA를 알킬화시켜, DNA 복제 및 RNA 및 단백질 합성을 억제한다. 숙주 독성을 감소시키면서 선택성 및 반응을 개선시키기 위한 시도로 새로운 옥사자포스포린 유도체가 설계되고 평가되었다 (Liang J, Huang M, Duan W, Yu XQ, Zhou S. Design of new oxazaphosphorine anticancer drugs. Curr Pharm Des. 2007;13(9):963-78. Review). 이들은 마포스파미드 (NSC 345842), 글루포스파미드 (D19575, 베타-D-글루코실이소포스포르아미드 머스타드), S-(-)-브로모포스파미드 (CBM-11), NSC 612567 (알도포스파미드 퍼히드로티아진) 및 NSC 613060 (알도포스파미드 티아졸리딘)를 포함한다. 마포스파미드는 4-히드록시-CPA의 화학적으로 안정한 4-티오에탄 술폰산염인 옥사자포스포린 유사체이다. 글루포스파미드는 IFO 유도체이고, 여기서 이소포스포르아미드 머스타드 (IFO의 알킬화 대사물)는 베타-D-글루코스 분자에 글리코시드 결합으로 연결되어 있다. 추가의 시클로포스파미드 유사체는 그 전체가 본원에 참고로 포함된 미국 특허 5,190,929 (명칭: "Cyclophosphamide analogs useful as anti-tumor agents")에 기재되어 있다.
다른 실시양태에서, 증강제는 조절 T 림프구 (T-reg)의 활성 및/또는 수를 감소시키는 작용제, 바람직하게는 수니티닙 (수텐트®), 항-TGFβ 또는 이마티닙 (글리백®)이다. 언급된 치료 요법은 아주반트 (adjuvant)를 투여하는 것을 또한 포함할 수 있다.
또한, 유용한 증강제는 유사분열 억제제, 예를 들어 파클리탁솔, 아로마타제 억제제 (예를 들어 레트로졸) 및 혈관신생 억제제 (VEGF 억제제, 예를 들어 아바스틴 (Avastin), VEGF-Trap) (예를 들어, 문헌 [Li et al., Vascular endothelial growth factor blockade reduces intratumoral regulatory T cells and enhances the efficacy of a GM-CSF-secreting cancer immunotherapy. Clin Cancer Res. 2006 Nov 15;12(22):6808-16] 참조), 안트라사이클린, 옥살리플라틴, 독소루비신, TLR4 길항제, 및 IL-18 길항제를 포함한다.
C. 제약 조성물
한 측면에서, 본 발명은 PD-1을 통한 억제 신호 전달을 방지하는 분자, 또는 CTLA4 길항제, 및 증강제를 제약상 허용되는 담체 내에 포함하는 치료 조성물에 관한 것이다. 상기 조성물의 성분은 포유동물에서 T 세포 반응을 증가시키는데 유효한 양으로 존재한다. 특정 실시양태에서, 증강제는 시클로포스파미드 또는 시클로포스파미드의 유사체이고, 상기 유사체의 예는 앞에서 언급된 바 있다.
다른 특정 예에서, 증강제는 조절 T 림프구 (T-reg)의 활성을 감소시키는 작용제이고, 바람직하게는 여기서 활성은 상기 T-reg의 수의 감소에 의해 감소된다. 바람직한 비-제한적인 실시양태에서, 증강제는 수니티닙 (수텐트®), 항-TGFβ 또는 이마티닙 (글리백®)이다.
또한, 본 발명의 조성물에 유용한 증강제는 유사분열 억제제, 예를 들어 파클리탁솔, 아로마타제 억제제 (예를 들어 레트로졸), 혈관신생 억제제 (VEGF 억제제, 예를 들어 아바스틴, VEGF-Trap), 안트라사이클린, 옥살리플라틴, 독소루비신, TLR4 길항제, 및 IL-18 길항제를 포함한다.
본 발명의 치료 조성물은 하나 이상의 항-PD-1 항체, 항-CTLA4 항체, 유사분열 억제제, 아로마타제 억제제, A2a 아데노신 수용체 (A2AR) 길항제, 또는 혈관신생 억제제일 수 있는 적어도 하나의 추가의 작용제를 포함한다.
또한, 본 발명의 임의의 치료 조성물은 본원에서 설명되는 하나 이상의 아주반트를 포함할 수 있다.
본 발명의 치료 조성물의 성분으로서 유용한 PD-1 길항제는 임의의 본 발명의 방법에 사용하기 위해 본원에서 언급되는 임의의 PD-1 길항제를 포함한다. 예를 들어, 상기 PD-1 길항제는 본원에서 언급되는 임의의 융합 단백질을 포함한다. 또한, 상기 길항제는 임의의 본 발명의 방법에 사용하기 위해 본원에서 설명되는 임의의 융합 단백질의 제1 폴리펩티드 부분으로서 사용하기 위해 본원에서 언급되는 임의의 폴리펩티드 또는 PD-1 결합 단편일 수 있다. 상기 길항제는 추가로 항체, 예를 들어 본원에서 언급되는 임의의 공지의 항-PD-1, 항-B7-DC 또는 항-B7-H1 항체일 수 있다.
본 발명의 치료 조성물은 또한 상기 언급한 PD-1 길항제에 추가로 또는 그 대신에 항-CTLA4 항체를 포함한다. 상기 조성물은 따라서 상기 항-CTLA4 항체 및 본원에서 이미 설명한 종류의 증강제를 포함한다.
본 발명의 치료 조성물은 임의의 본원에 개시된 본 발명의 방법에서 유용하다. 상기 조성물은 질환 상태의 능동적인 치료제로서 사용하는 것이 의도되지만, 본원에서 언급되는 임의의 질환의 예방을 위한 예방 조성물로서도 사용될 수 있다.
한 측면에서, 본 발명은 PD-1 길항제 및 증강제를 제약상 허용되는 담체 내에 포함하는 치료 조성물을 고려하고, 여기서 PD-1 길항제 및 증강제는 포유동물에서 T 세포 반응을 증가시키는데 유효한 양으로 함께 존재한다.
본 발명의 범위 내의 치료 조성물은 본원에 개시된 PD-1 길항제 및/또는 항체와 임의의 언급된 증강제의 임의의 모든 조합물을 포함하는 조성물을 포함한다. 비-제한적인 예로서, 본 발명의 치료 조성물은 임의의 상기 폴리펩티드의 하나 이상의 단편과 함께 유효량의 하나 이상의 PD-1 길항제, 예를 들어 특정 서열 번호로서 본원에서 제시되는 임의의 또는 모든 전장 폴리펩티드 또는 그의 상동체의 조합물 (여기서, 임의의 또는 모든 물질은 다른 단백질에 융합되거나, 예를 들어 본원에서 언급되는 하나 이상의 면역글로불린에 융합되거나, 또는 융합되지 않음) 및 하나 이상의 증강제를 포함하는 조성물을 포함하고, 증강제는 예를 들어 시클로포스파미드 단독, 또는 시클로포스파미드 + 그의 하나 이상의 유사체, 또는 단지 시클로포스파미드의 하나 이상의 유사체이거나, 또는 시클로포스파미드 및 조성물을 투여받는 포유동물에서 Treg 수를 감소시키는 작용제로 구성될 수 있거나, 또는 시클로포스파미드 유사체 + Treg 수를 감소시키는 작용제로 구성될 수 있거나 또는 Treg 수 또는 다른 Treg 활성을 감소시키는 하나 이상의 물질만으로 구성될 수 있다. 모든 상기 조합물은 조성물이 적어도 하나의 PD-1 길항제 및/또는 T 세포 활성을 매개하는 항체 및 적어도 하나의 증강제를 포함한다면 본 발명에서 고려된다.
또한, 본 발명의 조성물은 추가의 활성 작용제를 포함할 수 있다. 본 발명의 임의의 조성물의 바람직한 실시양태에서, 제약 또는 치료 조성물은 항-PD-1 항체, 항-CTLA4 항체, 유사분열 억제제, 예를 들어 파클리탁셀, 아로마타제 억제제, 예를 들어 레트로졸, A2AR 길항제, 혈관신생 억제제, 안트라사이클린, 옥살리플라틴, 독소루비신, TLR4 길항제, 및 IL-18 길항제로 구성되는 군으로부터 선택되는 적어도 하나의 추가의 작용제를 추가로 포함한다.
PD-1 길항제 및/또는 증강제는 임의의 적합한 수단에 의해 투여될 수 있다. 바람직한 실시양태에서, PD-1 길항제 및/또는 증강제는 비경구 주사에 의해 수용액으로 투여된다. 또한, 제형은 현탁액 또는 에멀젼의 형태일 수 있다. 일반적으로, 유효량의 펩티드 또는 폴리펩티드를 포함하는 제약 조성물이 제공되고, 임의로 제약상 허용되는 희석제, 보존제, 가용화제, 유화제, 아주반트 및/또는 담체를 포함한다. 상기 조성물은 희석제, 멸균수, 다양한 버퍼 함량 (예를 들어, Tris-HCl, 아세테이트, 포스페이트), pH 및 이온 강도의 완충된 염수; 및 임의로, 첨가제, 예를 들어 세제 및 가용화제 (예를 들어, TWEEN 20, TWEEN 80, 폴리소르베이트 80), 항산화제 (예를 들어, 아스코르브산, 메타중아황산나트륨), 및 보존제 (예를 들어, 티메르솔, 벤질 알콜) 및 충전 물질 (예를 들어, 락토스, 만니톨)을 포함한다. 비-수성 용매 또는 비히클의 예는 프로필렌 글리콜, 폴리에틸렌 글리콜, 식물유, 예를 들어 올리브유 및 옥수수유, 젤라틴, 및 주사가능 유기 에스테르, 예를 들어 에틸 올레에이트이다. 제형은 동결건조되고, 사용 직전에 재용해/재현탁될 수 있다. 제형은 예를 들어 세균 보유 필터를 통한 여과에 의해, 멸균제를 조성물에 혼입함으로써, 조성물에 방사선을 조사함으로써, 또는 조성물을 가열함으로써 멸균될 수 있다.
본 발명의 제약 조성물은 비경구 (근내, 복강내, 정맥내 (IV) 또는 피하 주사), 경피 (수동적으로 또는 전기이온영동 (iontophoresis) 또는 전기천공을 사용하여), 또는 경점막 (비내, 질내, 직장, 또는 설하) 투여 경로에 의해 투여될 수 있다. 본 발명의 방법은 별개의 상이한 경로 (예를 들어 국소)에 의한 PD-1 길항제 및 증강제의 투여를 배제하지 않는다.
PD-1 길항제 및 증강제는 동시에, 또는 상이한 시점에 투여될 수 있고, 이때 증강제는 PD-1 길항제 투여 전 또는 후에 투여된다. 한 실시양태에서, 증강제는 PD-1 길항제 투여 전과 후 모두에 투여된다. 한 실시양태에서, 동일한 증강제가 PD-1 길항제의 투여 전과 후에 투여된다. 다른 실시양태에서, 증강제는 PD-1 길항제의 투여 전에 투여된다.
본원에서 사용되는 바와 같이 용어 "유효량" 또는 "치료 유효량"은 치료되는 장애의 하나 이상의 증상을 치료하거나 억제하거나 완화하기 위해 또는 달리 목적하는 약물학적 및/또는 생리학적 효과를 제공하기 위해 충분한 용량을 의미한다. 정확한 용량은 대상체-의존 변수 (예를 들어, 연령, 면역계 건강 등), 질환, 및 수행되는 치료와 같은 다양한 인자에 따라 변할 것이다. 증강제와 함께 PD-1 수용체 길항제 및/또는 항체의 치료 유효량은 면역 반응이 활성화 또는 유지되도록 한다.
선택되는 용량은 목적하는 치료 효과, 투여 경로, 및 요구되는 치료 기간에 따라 결정된다. 일반적으로 0.001 내지 50 mg/kg (체중)의 용량 수준이 포유동물에게 매일 투여된다. 바람직하게는, 상기 용량은 1 내지 50 mg/kg, 보다 바람직하게는 1 내지 40 mg/kg, 또는 심지어 1 내지 30 mg/kg이고, 2 내지 20 mg/kg의 용량도 바람직한 용량이다. 다른 용량의 예는 2 내지 15 mg/kg, 또는 2 내지 10 mg/kg 또는 심지어 3 내지 5 mg/kg을 포함하고, 약 4 mg/kg의 용량이 구체적인 예이다.
증강제 및 항체, 예를 들어 항-PD-1 항체 또는 항-CTLA4 항체를 사용하는 치료 요법을 위해, 용량은 통상적으로 0.1 내지 100 mg/kg이고, 1 내지 50 mg/kg이 바람직하고, 10 내지 20 mg/kg이 보다 바람직하다. 인간 대상체에 대한 적절한 용량은 5 내지 15 mg/kg이고, 10 mg/kg의 항체 (예를 들어, 인간 항-PD-1 항체, 예를 들어 MDX-1106)가 가장 바람직하다 (여기서, 적합한 용량의 시클로포스파미드 또는 다른 증강제가 항체를 투여하기 약 24시간 이전까지 추가로 투여된다).
일반적으로, 단지 예로서, 본 발명의 방법에 유용한 임의의 신호 전달 길항제의 체중을 기준으로 한 투여 형태는 5-300 mg/kg, 또는 5-290 mg/kg, 또는 5-280 mg/kg, 또는 5-270 mg/kg, 또는 5-260 mg/kg, 또는 5-250 mg/kg, 또는 5-240 mg/kg, 또는 5-230 mg/kg, 또는 5-220 mg/kg, 또는 5-210 mg/kg, 또는 20 내지 180 mg/kg, 또는 30 내지 170 mg/kg, 또는 40 내지 160 mg/kg, 또는 50 내지 150 mg/kg, 또는 60 내지 140 mg/kg, 또는 70 내지 130 mg/kg, 또는 80 내지 120 mg/kg, 또는 90 내지 110 mg/kg, 또는 95 내지 105 mg/kg의 용량을 포함하고, 3 mg/kg, 5 mg/kg, 7 mg/kg, 10 mg/kg, 15 mg/kg, 20 mg/kg, 25 mg/kg, 30 mg/kg, 50 mg/kg 및 100 mg/kg의 용량이 바람직한 용량의 구체적인 예이다. 상기 용량은 물론 반복 투여될 수 있다. 용량은 물론 그 용량을 투여받는 포유동물의 종류와 상호관련될 것이다. 상기 언급된 mg/kg 범위의 용량은 포유동물, 예를 들어 설치류, 예를 들어 마우스 및 래트, 및 영장류, 특히 인간에 사용하기 좋고,약 5 mg/kg, 약 10 mg/kg 및 약 15 mg/kg의 용량은 인간 치료에 특히 바람직하다.
본 발명의 치료 요법에 따라서, 증강제, 예를 들어 시클로포스파미드는 동물에 따라 상이한 비독성 용량으로 투여된다. 특정 실시양태에서, 증강제는 비경구 또는 경구를 포함하는 임의의 적합한 투여 수단에 의해 투여되고, 비경구 투여는 전신 투여, 예를 들어 정맥 내 투여를 포함한다. 예를 들어, 시클로포스파미드와 같은 증강제는 통상 경구로 투여된다. 상기 투여는 증강제에 따라 임의의 편리한 용량으로 시행될 수 있다. 각각의 경우에 용량은 체중 기준으로 결정될 수 있거나 또는 단위 용량으로 투여될 수 있다.
CTX 자체는 비독성이지만, 그의 대사산물의 일부는, DNA 가교결합을 유발하고 보다 높은 용량에서는 가닥 파단을 유발하는 세포독성 알킬화제이다. 많은 세포는 CTX에 내성을 보이고, 그 이유는 세포가 높은 수준의 제독 효소 알데히드 데히드로게나제 (ALDH)를 발현하기 때문이다. CTX는, 림프구 (조혈 줄기 세포가 아니라)가 단지 낮은 수준의 ALDH만을 발현하기 때문에 증식하는 림프구를 표적으로 하고, 분열하는 세포는 DNA 알킬화제에 가장 감수성이다.
CTX의 저용량 (< 200 mg/kg)은 인간 및 마우스 암 모델에서 항-종양 면역 반응의 자극을 포함하여 면역 자극 효과를 가질 수 있다 (Brode & Cooke Crit Rev. Immunol. 28:109-126 (2008)). 상기 저용량은 하위-치료이고, 직접적인 항-종양 활성을 갖지 않는다. 이와 달리, CTX의 높은 용량은 항-종양 반응을 억제한다. 몇가지 메카니즘이 항-종양 면역 반응의 증강에서의 CTX의 역할을 설명할 수 있다: (a) CD4+CD25+FoxP3+ Treg (및 구체적으로, 특히 억압성일 수 있는 증식 Treg)의 고갈, (b) B 림프구의 고갈; (c) 질소 산화물 (NO)의 유도, 및 이에 의한 종양 세포 성장의 억압; (d) CD11b+Gr-1+ MDSC의 이동 및 팽창. 상기 주요 효과는 많은 2차 효과를 갖는다; 예를 들어 Treg 고갈 후에 대식세포는 보다 많은 IFN-γ 및 보다 적은 IL-10을 생산한다. 또한, CTX는 타입 I IFN 발현을 유도하고 림프구의 항성성 증식을 촉진하는 것으로 밝혀졌다.
Treg 고갈은 CTX가 그에 의해 항-종양 면역 반응을 증강시키는 메카니즘으로서 흔히 언급된다. 상기 결론은 부분적으로 입양 전달 실험의 결과에 기초로 한 것이다. AB1-HA 종양 모델에서, 제9일에 CTX 처리는 75% 치료율을 제시한다. 제12일에 정제된 Treg의 전달은 CTX 반응을 거의 완전히 억제하였다 (van der Most et al. Cancer Immunol. Immunother. 58:1219-1228 (2009). 유사한 결과가 HHD2 종양 모델에서 관찰되었다: CTX 전처리 후의 CD4+CD25+ Treg의 입양 전달은 백신에 대한 치료 반응을 제거하였다 (Taieb, J. J. Immunol. 176:2722-2729 (2006)).
많은 인간 임상 시험은 저용량 CTX가 안전하고, 허용성이 좋고, 항-종양 면역 반응의 촉진에 효과적인 물질임을 입증하였다 (Bas, & Mastrangelo Cancer Immunol. Immunother. 47:1-12 (1998)).
항-종양 면역 반응을 증강시키기 위한 CTX의 최적 용량은 Treg 수준을 정상 범위 미만으로 저하시킴으로써 전체 T 세포 계수를 감소시키지만 하위치료 용량인 양이다 (Machiels et al. Cancer Res. 61:3689-3697 (2001)).
CTX가 면역증강제로서 사용된 인간 임상 시험에서, 300 mg/m2의 용량이 대체로 사용되었다. 평균적인 수컷 (6 ft, 170 파운드 (78 kg), 체표면적 1.98 m2)의 경우, 300 mg/m2 은 8 mg/kg, 또는 624 mg의 총 단백질에 해당한다. 암의 마우스 모델에서, 효율은 15 - 150 mg/kg의 용량에서 관찰되었고, 이것은 30 g 마우스에서 0.45 - 4.5 mg의 총 단백질에 관련된다 ([Machiels et al. Cancer Res. 61:3689-3697 (2001)], [Hengst et al. Cancer Res. 41:2163-2167 (1981)], [Hengst Cancer Res. 40:2135-2141 (1980)]).
보다 큰 포유동물, 예를 들어 영장류, 바람직하게는 인간 환자에 대해, 상기 mg/m2 용량이 사용될 수 있지만, 한정된 시간에 걸쳐 투여되는 단위 용량이 바람직할 수 있다. 상기 단위 용량은 한정된 기간, 예를 들어 3일 이하, 또는 5일 이하, 또는 7일 이하, 또는 10일 이하, 또는 15일 이하 또는 20일 이하 또는 25일 이하 동안 1일 기준으로 투여될 수 있고, 본 발명에서 모두 구체적으로 고려된다. 동일한 요법이 본원에서 언급되는 다른 증강제에 대해서 적용될 수 있다.
모든 상기 투여는 본 발명의 PD-1 결합 분자의 투여 전 또는 후에 실시될 수 있다. 별법으로, 본 발명의 PD-1 결합 분자의 하나 이상의 용량의 투여는 균일 또는 비-균일 경로를 형성하도록 증강제의 투여와 일시적으로 엇갈리는 방식으로 실시될 수 있고, 이에 의해 상기 물질을 투여하는 연구자 또는 임상의에 의해 선택되거나 요구되는 투여 스케쥴에 따라 하나 이상의 용량의 증강제가 투여된 후, 하나 이상의 용량의 PD-1 결합 화합물이 투여되고, 이어서 하나 이상의 용량의 증강제가 투여된다.
다른 특정 실시양태에서, 치료 요법은 하나 이상의 PD-1 길항제의 다수 투여를 포함한다. 일부 실시양태에서, PD-1 길항제의 그러한 다수의 투여는 동일한 또는 상이한 증강제의 다수 투여와 함께 수행된다.
본 발명의 다른 실시양태에서와 같이, 증강제는 PD-1-길항제를 투여하기 적어도 1, 2, 3, 5, 10, 15, 20, 24 또는 30시간 전에 투여된다.
또한, 본원에서 유용한 제약 조성물은, 그 자체가 조성물이 투여되는 개체에게 유해한 항체의 생산을 유발하지 않고 과도한 독성이 없이 투여될 수 있는 임의의 제약 작용제를 포함하는 제약상 허용되는 담체, 예를 들어 임의의 적합한 희석제 또는 부형제를 함유한다. 제약상 허용되는 담체는 액체, 예를 들어 물, 염수, 글리세롤 및 에탄올 등, 및 비내 및 다른 기도 전달 또는 눈에 대한 전달을 위한 스프레이 형성에 유용한 담체를 포함하고, 이로 제한되지 않는다. 제약상 허용되는 담체, 희석제, 및 다른 부형제에 대한 상세한 논의는 문헌 [REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Pub. Co., N.J. 최신판)]에 제시되어 있다.
백신 조성물 (아래에서 논의됨)은 pH를 안정화하거나, 또는 아주반트, 습윤제, 또는 유화제로서 기능하는, 백신의 효율을 개선하는 작용을 할 수 있는 추가의 작용제를 추가로 포함할 수 있다.
백신은 일반적으로 비경구 투여를 위해 제형화되고, 피하 또는 근내 주사된다. 또한, 상기 백신은 당업계에 공지된 방법을 사용하여 좌제로서 또는 경구 투여를 위해 또는 비내 또는 호흡 경로를 통한 투여를 위해 제형화될 수 있다.
D. 제조 방법
변이체, 상동체 및 그의 단편을 포함하는, 야생형이거나 또는 돌연변이된 단리된 PD-1 길항제 폴리펩티드, 및 임의의 상기 물질을 포함하는 융합 단백질 (모두 본 발명에서 사용하기 위해 고려된다)은 예를 들어 화학 합성에 의해 또는 숙주 세포 내에서 재조합 생산에 의해 얻을 수 있다. 보조자극 폴리펩티드를 재조합 방식으로 생산하기 위해, 폴리펩티드를 코딩하는 뉴클레오티드 서열을 함유하는 핵산은 세균 또는 진핵 숙주 세포 (예를 들어, 곤충, 효모, 또는 포유동물 세포)를 형질전환시키거나 형질도입하거나 형질감염시키기 위해 사용될 수 있다. 뉴클레오티드 서열은 특정 종류의 숙주 세포에서 단백질 발현 수준을 증가시키기 위해서 코돈이 최적화될 수 있음이 이해될 것이다. 코돈 최적화 방법은 당업계에 잘 공지되어 있다. 일반적으로, 핵산 구성체는 보조자극 폴리펩티드를 코딩하는 뉴클레오티드 서열에 작동가능하게 연결된 조절 서열을 포함한다. 조절 서열 (본원에서 발현 제어 서열로도 칭해짐)은 일반적으로 유전자 산물을 코딩하지 않지만, 대신에 그들이 작동가능하게 연결된 핵산 서열의 발현에 영향을 미친다. 세포로부터 단백질을 분비하기 위해 사용되는 신호 펩티드는 내인성 신호 펩티드 또는 숙주로부터 융합 단백질의 분비를 용이하게 하는 임의의 다른 신호 펩티드일 수 있다.
본 발명을 실시하는데 유용한 일반적인 분자 생물학 절차에 대해서는, 분자 생물학 및 유전 공학 분야에 잘 알려져 있는 절차가 기재되어 있는 많은 표준 참고문헌을 이용할 수 있고, 이들 절차는 본원에서 추가로 설명할 필요가 없다. 유용한 참고문헌은 문헌 [Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989)], [Wu et al., Methods in Gene Biotechnology (CRC Press, New York, NY, 1997)], 및 [Recombinant Gene Expression Protocols, in Methods in Molecular Biology, Vol. 62, (Tuan, ed., Humana Press, Totowa, NJ, 1997)]을 포함하고, 이들 문헌의 개시내용은 본원에 참고로 포함된다.
E. 질환 치료
본 발명에서 제공되는 치료 조합물을 투여함으로써 치료 또는 예방할 질환은 악성 종양, 또는 세균, 바이러스, 원생동물, 기생충, 또는 세포 내에 들어오는 다른 미생물 병원체에 의해 유발된 만성 감염성 질환이다. 상기 질환은 종종 세포독성 T 림프구에 의한 공격을 통해 개선된다. 본 발명은 T 세포 활성의 증가, T 세포 증식 증가 및 T 세포 억제 신호의 감소를 통해 T 세포 반응의 향상에 유용한 조합 요법을 제공하기 때문에, 본 발명의 조합 요법은 상기 질환의 치료 (또는 심지어 예방)에 있어 특유한 잇점을 갖는다.
한 실시양태에서, 바이러스 감염은 주로 T-세포에 의해 청소되기 때문에, T-세포 활성의 증가는 동물 또는 영장류, 바람직하게는 인간 대상체로부터 감염성 바이러스 물질의 청소시에 치료상 유용하다. 따라서, 증강제와 함께 PD-1 수용체 길항제 활성을 갖는 본 발명의 개시된 화합물은 국소 또는 전신 바이러스 감염의 치료를 위해 조합하여 작용한다. 본 발명의 화합물에 의해 치료되는 감염은 면역결핍 (예를 들어, HIV), 유두종 (예를 들어, HPV), 포진 (예를 들어, HSV), 뇌염, 인플루엔자 (예를 들어, 인간 인플루엔자 바이러스 A), 간염 (예를 들어 HCV, HBV), 및 감기 (예를 들어, 인간 리노바이러스) 바이러스 감염을 포함하고, 이로 제한되지 않는다. 또한, PD-1 수용체 길항제 조성물의 제약 제형은 AIDS, 인플루엔자, 감기, 또는 뇌염을 포함하고 이로 제한되지 않는 전신 바이러스 질환의 치료를 위해 투여될 수 있다.
본 발명의 화합물에 의해 치료될 수 있는 비-바이러스 감염은 악티노마이세스 (Actinomyces), 아나배나 (Anabaena), 바실러스 (Bacillus), 박테로이데스 (Bacteroides), 델로비브리오 (Bdellovibrio), 보르데텔라 (Bordetella), 볼렐리아 (Borrelia), 캄필로박터 (Campylobacter), 카울로박터 (Caulobacter), 클라미디아 (Chlamydia), 클로로븀 (Chlorobium), 크로마튬 (Chromatium), 클로스트리듐 (Clostridium), 코리네박테리움 (Corynebacterium), 시토파가 (Cytophaga), 데이노코쿠스 (Deinococcus), 에스케리키아 (Escherichia), 프란시셀라 (Francisella), 할로박테리움 (Halobacterium), 헬리오박터 (Heliobacter), 해모필루스 (Haemophilus), 헤모필루스 인플루엔자 타입 B (Hemophilus influenza type B (HIB)), 히포미크로븀 (Hyphomicrobium), 레지오넬라 (Legionella), 렙트스피로시스 (Leptspirosis), 리스테리아, 메닝고코쿠스 A, B 및 C (Meningococcus A, B 및 C), 메타노박테리움 (Methanobacterium), 미크로코쿠스 (Micrococcus), 미오박테리움 (Myobacterium), 미코플라스마, 믹소코쿠스 (Myxococcus), 나이세리아 (Neisseria), 니트로박터 (Nitrobacter), 오실라토리아 (Oscillatoria), 프로클로론 (Prochloron), 프로테우스 (Proteus), 슈도모나스 (Pseudomonas), 포도스피릴룸 (Phodospirillum), 리케차 (Rickettsia), 살모넬라 (Salmonella), 시겔라 (Shigella), 스피릴룸 (Spirillum), 스피로카에타 (Spirochaeta), 스태필로코쿠스 (Staphylococcus), 스트렙토코쿠스 (Streptococcus), 스트렙토마이세스 (Streptomyces), 술폴로부스 (Sulfolobus), 써모플라스마 (Thermoplasma), 티오바실러스 (Thiobacillus), 트레포네마 (Treponema), 비브리오 (Vibrio), 에르시니아 (Yersinia), 크립토코쿠스 네오포르만스 (Cryptococcus neoformans), 히스토플라스마 종 (Histoplasma sp .) (예를 들어 히스토플라스마 캡슐라툼 (Histoplasma capsulatum)), 칸디다 알비칸스 (Candida albicans), 칸디다 트로피칼리스 (Candida tropicalis), 노카르디아 아스테로이데스 (Nocardia asteroides), 리케차 리케치이 (Rickettsia ricketsii), 리케차 티피 (Rickettsia typhi), 리슈마니아 (Leishmania), 미코플라스마 뉴모니아에 (Mycoplasma pneumoniae), 클라미디알 시타시 (Chlamydial psittaci), 클라미디알 트라코마티스 (Chlamydial trachomatis), 플라스모듐 종 (Plasmodium sp .) (예를 들어 플라스모듐 팔시파룸 (Plasmodium falciparum)), 트리파노소마 브루세이 (Trypanosoma brucei), 엔타모에바 히스톨리티카 (Entamoeba histolytica), 톡소플라스마 곤디이 (Toxoplasma gondii), 트리코모나스 바기날리스 (Trichomonas vaginalis) 및 쉬스토소마 만소니 (Schistosoma mansoni)를 포함하고 이로 제한되지 않는 미생물에 의해 야기되는 감염을 포함한다.
한 실시양태에서, 본 발명은 암을 치료하기 위해 숙주에서 면역 반응을 유도 또는 향상시키는 방법 및 조성물을 제공한다. 제공된 조성물 및 방법으로 치료할 수 있는 암의 종류는 다음을 포함하고 이로 제한되지 않는다: 방광, 뇌, 유방, 자궁경부, 결장직장, 식도, 신장, 간, 폐, 비인두, 췌장, 전립선, 피부, 위, 자궁, 난소, 고환, 및 혈액암.
치료될 수 있는 악성 종양은 종양이 그로부터 유래되는 조직의 배아 기원에 따라 본원에서 분류된다. 암종은 내배엽 또는 외배엽 조직, 예를 들어 피부 또는 내부 장기 및 분비 장기의 상피층으로부터 발생하는 종양이다. 덜 빈번하게 발생하는 육종은 내배엽 결합 조직, 예를 들어 뼈, 지방 및 연골로부터 유래한다. 백혈병 및 림프종은 골수의 조혈 세포의 악성 종양이다. 백혈병은 단일 세포로서 증식하는 반면, 림프종은 종양 덩어리로서 성장하는 경향이 있다. 악성 종양은 암을 확립하기 위해 신체의 수많은 장기 또는 조직에서 나타날 수 있다.
본 발명의 치료 요법의 가치에 대한 예시로서, B7-DC-Ig의 뮤린 유사체 (인간 단백질과 72%의 서열 동일성을 공유하는 마우스 B7-DC ECD가 마우스 IgG2a의 Fc 도메인에 융합됨)는, 본원에서 설명되는 시클로포스파미드 (CTX) 전-처리를 포함하는, 결장암, 비만세포종, 및 다른 종양 종류에 대한 동계 (syngeneic) 마우스 종양 모델에서 시험하였다.
그 결과는 면역증강제로 작용하는 단일 하위치료 용량의 CTX, 이어서 뮤린 B7-DC-IG를 사용한 치료가 동물의 80% 이하에서 확립된 CT26 결장 암종 종양을 근절함을 보여주었다. 또한, CT26 결장 암종 종양 재접종 연구에서, CTX + 뮤린 B7-DC-Ig 치료 후에 종양을 사전에 근절한 마우스에서 종양 재-성장이 검출되지 않았다. 또한, 이들 마우스는 나이브 마우스에 비해 증가된 종양-특이적 CTL 집단을 보유함이 밝혀졌다.
한 실시양태에서, 본 발명은 조합 요법에 의해 T 세포 반응을 증가시키기 위한 의약의 제조에 있어서, 본원에서 설명된 바와 같이 T 세포에서 억제 신호 전달을 감소시키는 화합물의 사용을 고려하고, 여기서 상기 화합물은 증강제와 함께 투여된다. 또한, T 세포에서 억제 신호 전달을 감소시키는 화합물 및 상기 증강제는 상이한 시간에 투여하기 위한 별개의 의약으로서 제공되고, 바람직하게는 여기서 증강제는 억제 신호 전달을 감소시키는 화합물을 투여하기 전에, 예를 들어, 억제성 화합물 투여 전에 24시간 이내에 (또는 본원에 언급된 다른 시간 간격으로) 투여된다. 바람직하게는, 화합물 및 증강제는 감염성 질환 또는 암, 예를 들어 임의의 감염원에 의해 유발되는 질환 또는 본원에서 언급된 암의 치료에 사용하기 위한 것이다.
바람직한 실시양태에서, 상기 방법에 유용한 화합물은 인간 IgG1의 Fc 도메인에 융합된 인간 B7-DC의 ECD로 구성된 재조합 단백질로서, 본원에서 B7-DC-Ig로 언급된다.
한 실시양태에서, 본 발명은
(a) T 세포에서 억제 신호 전달을 감소시키는 화합물의 투여 공급물,
(b) 증강제 공급물;
(c) 제약상 허용되는 담체의 공급물; 및
(d) 상기한 바와 같은 용도로 화합물을 투여하기 위한 인쇄된 지시서
를 포함하는, 본원에 개시된 바와 같이 T 세포에서 억제 신호 전달을 감소시키는 화합물을 증강제와 조합하여 투여하기 위한 의료용 키트에 관한 것이다.
F. 조합 요법
백신은 암 세포 및 감염된 세포 또는 감염원을 제거하기 위해 강한 T 세포 반응을 요구한다. 본원에 기재된 PD-1 수용체 길항제는 T 세포에 대한 보조자극 신호를 제공하기 위해 증강제와 함께 백신의 성분으로서 투여될 수 있다. 본원에 개시된 백신은 항원, PD-1 수용체 길항제 및 임의로 아주반트 및 표적화 분자를 포함한다.
그에 대한 T 세포 반응이 본 발명의 방법 및 조성물에 의해 향상되는 항원은 펩티드, 단백질, 다당류, 당류, 지질, 핵산, 또는 그의 조합물을 포함한다. 질환의 경우에 항원은 질환 과정으로 인해 존재한다.
개시된 PD-1 수용체 길항제 조성물은 감염원에 노출된 후에 대상체에서 내성을 부여하는 예방 백신과 함께, 또는 기존의 항원, 예를 들어 암이 있는 대상체에서 종양 항원 또는 바이러스로 감염된 대상체에서 바이러스 항원에 대한 대상체의 면역 반응을 개시 또는 향상시키기 위해 사용될 수 있는 치료 백신과 함께 투여될 수 있다.
예방, 치료 또는 탈감작된 면역 반응의 목적하는 결과는 당업계에 잘 공지된 원칙에 기초하여 질환에 따라 변할 수 있다. 예를 들어, 감염원에 대한 면역 반응은 감염원의 콜로니 형성 및 복제를 완전히 방지하여, "멸균 면역성" 및 임의의 질환 증상의 부재에 영향을 줄 수 있다. 그러나, 감염원에 대한 백신은 증상의 수, 심도 또는 지속시간을 감소시키거나; 증상이 있는 집단 내에서 개체의 수를 감소시키거나; 또는 감염원의 전염을 감소시키면 효과적인 것으로 간주할 수 있다. 이와 유사하게, 암, 알레르겐 또는 감염원에 대한 면역 반응은 질환을 완전히 치료할 수 있거나, 증상을 완화할 수 있거나, 질환에 대한 총 치료적 개입에서 하나의 양상일 수 있다. 예를 들어, 암에 대한 면역 반응의 자극은 치료에 영향을 주기 위해 수술, 화학치료, 방사선, 호르몬 및 다른 면역학적 방안과 결합될 수 있다.
본 발명의 방법 및 생성물은 증강제에 추가로 아주반트의 사용을 배제하지 않는다. 상기 아주반트는 예를 들어 PD-1 길항제와 함께 투여될 수 있다. 본 발명의 조성물 및 방법에서 유용한 아주반트는 다음 중 하나 이상을 포함하고 이로 제한되지 않는다: 오일 에멀젼 (예를 들어, 프로인트 (Freund) 아주반트); 사포닌 제형; 비로좀 및 바이러스-유사 입자; 세균 및 미생물 유도체; 면역자극성 올리고뉴클레오티드; ADP-리보실화 독소 및 제독 유도체; 명반; BCG; 광물-함유 조성물 (예를 들어, 광물염, 예를 들어 알루미늄염 및 칼슘염, 수산화물, 인산염, 황산염 등); 생물접착제 및/또는 점막접착제 (mucoadhesive); 미세입자; 리포좀; 폴리옥시에틸렌 에테르 및 폴리옥시에틸렌 에스테르 제형; 무라밀 펩티드; 폴리포스파젠; 이미다조퀴놀론 화합물; 및 표면 활성 물질 (예를 들어, 리소레시틴, 플루로닉 폴리올, 폴리음이온 (polyanion), 펩티드, 오일 에멀젼, 키홀 림펫 (keyhole limpet) 헤모시아닌, 및 디니트로페놀). 유용한 아주반트는 또한 면역조정물질, 예를 들어 시토카인, 인터류킨 (예를 들어, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 등), 인터페론 (예를 들어, 인터페론-γ), 대식세포 콜로니 자극 인자, 및 종양 괴사 인자를 포함한다.
본원에 개시된 임의의 폴리펩티드, 단편, 변이체, 상동체 및 융합 단백질을 포함하여 본원에 개시된 PD-1 수용체 길항제는 그를 필요로 하는 대상체에게 하나 이상의 추가의 치료제 (증강제에 추가로)와 조합하여 투여될 수 있다. 추가의 치료제는 치료할 병태, 장애 또는 질환에 기초하여 선택된다. 예를 들어, PD-1 수용체 길항제는, 면역 반응을 향상 또는 촉진하는 기능을 하고 본원에서 활성 작용제로서 간주되는 하나 이상의 추가의 작용제와 동시-투여될 수 있다.
상기 작용제는 암사크린, 블레오마이신, 부술판, 카페시타빈, 카르보플라틴, 카르무스틴, 클로람부실, 시스플라틴, 클라드리빈, 클로파라빈, 크리산타스파제, 시타라빈, 다카르바진, 닥티노마이신, 다우노루비신, 독세탁셀, 독소루비신, 에피루비신, 에토포시드, 플루다라빈, 플루오로우라실, 겜시타빈, 히드록시카르바미드, 이다루비신, 이포스파미드, 이리노테칸, 류코보린, 리포좀 독소루비신, 리포좀 다우노루비신, 로무스틴, 멜팔란, 메르캅토퓨린, 메스나, 메토트렉세이트, 미토마이신, 미톡산트론, 옥살리플라틴, 파클리탁셀, 페메트렉세드, 펜토스타틴, 프로카르바진, 랄티트렉세드, 사트라플라틴, 스트렙토조신, 테가푸르-우라실, 테모졸로미드, 테니포시드, 티오테파, 티오구아닌, 토포테칸, 트레오술판, 빈블라스틴, 빈크리스틴, 빈데신, 비노렐빈 또는 이들의 조합물을 포함하고 이로 제한되지 않는다. 대표적인 세포자멸 유도제 (pro-apoptotic agent)는 플루다라빈타우로스포린, 시클로헥시미드, 악티노마이신 D, 락토실세라미드, 15d-PGJ(2) 및 이들의 조합물을 포함하고 이로 제한되지 않는다.
본 발명의 방법 및 조성물에서 제공되는 요법은 또한 다른 종류의 치료, 예를 들어 방사선 요법, 수술 등과 함께 사용될 수 있다.
G. 길항제 활성에 대한 분석
본 발명에서는 본 발명의 방법을 실시하는데 유용한 많은 특이적인 구조를 언급한다. PD-1, CTLA4, 및 임의의 이들의 리간드에 결합하고 T 세포에서 억제 신호 전달을 감소시키는 능력을 또한 갖는 화학적 구조를 확인하기 위한 잘 공지된 분석 절차를 참고로 하여, 길항제 활성을 갖고 본 발명의 방법에 유용한 다른 화합물이 또한 확인될 수 있다. 그러한 일부 분석은 선택된 화학 구조가 수용체에 결합하는지 결정하는데 유용한 결합 분석이고; 이들은 당업계에 잘 공지되어 있고 본원에서 상세히 논의될 필요가 없다 (예를 들어, 각각 T 세포를 사용하여 PD-1 신호 전달 조정물질에 대한 분석을 제시하는, 그 개시내용 전부가 본원에 참고로 포함된 U.S. 2008/0274490 (2008년 11월 6일 공개) 및 U.S. 7,105,328 (2006년 9월 12일 등록) 참조). 다른 분석이 시토카인의 증식 및/또는 생산을 증가시킴으로써 T 세포를 활성화하는 본 발명의 작용제, 예를 들어 활성 단편의 효과를 결정하기 위해 사용된다. 상기 분석은 또한 당업계에 잘 공지되어 있다. 예를 들어, 세포의 증식 증가는 증가된 3H-티미딘 혼입 (세포 증식에 필요한 DNA 합성의 증가에 의해), 또는 배양액에서 T 세포에 의한 시토카인의 생산 증가를 검출하기 위한 ELISA 및/또는 RIA에 의해 입증할 수 있다.
한 실험에서, 인간 B7-DC-Ig의 PD-1 결합 활성을 ELISA에 의해 평가하였다. 96-웰 ELISA 플레이트를 2시간 동안 BupH 탄산염/중탄산염 pH 9.4 버퍼 (피어스 (Pierce)) 내에 희석시킨 100 ㎕의 0.75 ㎍/mL 재조합 인간 PD-1/Fc (알앤디 시스템즈)로 코팅한 후, BSA 용액 (잭슨 이뮤노리서치)으로 90-120분 동안 차단하였다. 연속 희석시킨 인간 B7-DC-Ig (야생형, 및 D111S 뮤테인, 및 PD-1에 대한 감소된 결합을 위해 선택된 K113S 돌연변이체) 및 인간 IgG1 이소형 대조군을 90분 동안 결합시켰다. 100 ㎕의 0.5 ㎍/mL 비오틴 접합된 항-인간 B7-DC 클론 MIH18 (이바이오사이언스 (eBioscience)), 이어서 1:1000으로 희석된 HRP-스트렙타비딘 (비디 바이오사이언스 (BD Bioscience)) 및 TMB 기질 (BioFX)를 사용하여, 결합된 B7-DC-Ig를 검출하였다. 450 nm에서의 흡광도는 플레이트 판독기 (몰레큘라 디바이시스 (Molecular Devices))를 사용하여 판독하고, 데이타는 4-파라미터 로지스틱 피트 (logistic fit)를 이용하여 SoftMax로 분석하였다. 데이타는 인간 B7-DC-Ig (야생형)는 PD-1에 결합하지만, K113S 및 D111S 돌연변이체는 PD-1에 결합하지 않음을 보여주었다.
본 발명의 절차를 수행하는데 있어서 특정 버퍼, 배지, 시약, 세포, 배양 조건 등에 대한 언급은 그로 제한하는 것으로 의도되지 않고, 당업자가 논의가 제시되는 특정 문맥에서 관심있거나 가치있는 것으로 인식하는 모든 관련된 물질을 포함하도록 해석되어야 함을 이해해야 한다. 예를 들어, 하나의 버퍼 시스템 또는 배양 배지를 다른 것으로 대체하고, 동일하지는 않더라도 유사한 결과를 계속 달성하는 것이 종종 가능하다. 당업자는 상기 대체가 본원에 개시된 방법 및 절차를 이용할 때 그 목적을 최적으로 달성하도록 하기 위해 과도한 실험 없이 수행할 수 있는 상기 시스템 및 방법론을 충분히 알 것이다.
본 발명은 다음 비-제한적인 실시예에서 보다 상세히 설명된다. 이들 방법 및 실시예는 결코 본 발명을 본원에 기재된 실시양태에 제한하지 않고, 다른 실시양태 및 용도가 아마 당업자에게 생각날 것임을 이해해야 한다.
실시예
실시예
1
B7-
DC
-
Ig
는
PD01
발현
CHO
세포에 결합한다.
B7-DC-Ig를 먼저 알로피코시아닌 (APC)과 접합시킨 후, 다양한 농도에서 PD-1을 구성적으로 발현하는 CHO 세포주 또는 PD-1을 발현하지 않는 모 CHO 세포와 함께 인큐베이팅하였다. 결합을 유동 세포 측정에 의해 분석하였다. 도 1은 B7-DC-Ig-APC의 중간 형광 강도 (MFI)를 프로브의 농도 (x-축)의 함수로서 보여준다. B7-DC-Ig-APC는 CHO.PD-1 세포에 결합하지만 (속이 찬 원), 형질감염되지 않은 CHO 세포에 결합하지 않는다 (회색 삼각형).
실시예
2
B7- DC - Ig 는 PD -1에 대한 결합을 위해 B7- H1 과 경쟁한다.
B7-H1-Ig를 먼저 알로피코시아닌 (APC)과 접합시켰다. 표지되지 않은 B7-DC-Ig를 다양한 농도에서 먼저 PD-1을 구성적으로 발현하는 CHO 세포주와 함께 인큐베이팅한 후, B7-H1-Ig-APC를 프로브 및 세포 혼합물에 첨가하였다. 도 2는 B7-H1-Fc-APC의 중간 형광 강도 (MFI)를 첨가된 표지되지 않은 B7-DC-Ig 경쟁자의 농도 (x-축)의 함수로서 보여준다. 표지되지 않은 B7-DC-Ig의 농도가 증가함에 따라 CHO 세포에 결합된 B7-H1-Ig-APC의 양은 감소하고, 이것은 B7-DC-Ig가 PD-1에 대한 결합을 위해 B7-H1과 경쟁함을 입증한다.
실시예
3
CT26
종양 모델
마우스 결장직장 종양 세포주 CT26을 ATCC로부터 얻었다. 계대배양 (Passage) 4에서 마스터 (master) 세포 은행을 ATCC 지침에 따라 생성하였다. 세포를 시험하고, 미코플라스마 및 다른 병원체 오염이 없음을 확인하였다. 1개의 바이알의 종양 세포를 냉동보관 원액으로부터 해동시키고, 접종 전에 2 계대배양 동안 성장시켰다.
CT26 세포를 2일 배양을 위해 30 ml 완전 배지 (RPMI + 10% FBS, 2 mM L-Glu, 및 1 x P/S)로 1:5 희석으로 또는 3일 배양을 위해 30 ml 완전 배지로 1:10 희석으로 나누었다. CT26 세포는 배지를 흡인시키고, 플라스크를 5 mL PBS로 세정하고, 5 mL 트립신을 첨가하고, 37℃에서 2 min 동안 인큐베이팅한 후, 10 mL 완전 배지로 중화시킴으로써 수거하였다. 600 x g (약 1000 rpm)에서 5 min 동안 원심분리 후에, 배지를 흡인시키고, 세포 펠렛을 10 ml 플레인 (plain) RPMI로 피펫팅함으로써 재현탁시켰다. 상기 세척 단계를 3회 반복하였다.
접종된 세포의 세포 수 및 생활력을 적합한 희석 (예를 들어 1:5 희석, 10 μL 세포 + 40 μL 트리판 블루)으로 트리판 블루 염료 염색에 의해 분석하고, 마지막 세척 단계 동안 NOVA 세포 계수에 의해 확인하였다. 접종을 위한 세포 생활력은 일반적으로 95%보다 더 컸다.
CT26 세포를 플레인 RPMI로 초기 접종을 위해 6.7 x 105 세포/mL로 희석하고, 얼음 상에 보관하였다. 일반적으로, 각각의 마우스를 150 μL (1 x 105 세포)로 접종하였다.
제9일에, 모든 종양 보유 마우스를 먼저 래트 케이지 내로 모으고, 마우스를 실험군으로 무작위로 나누었다. CTX 용액은 1x PBS에 의해 4 mg/mL로 재구성하였다. 마우스에게 20 g 마우스에 대해 2 mg, 즉 100 mg/kg로 0.5 mL의 CTX 용액을 복강내 (IP) 주사하였다.
제10일에, 마우스에게 20 g 마우스에 대해 0.1 mg, 즉 5 mg/kg로 0.5 mL의 B7-DC-Ig (0.2 mg/mL)를 IP 주사하였다. 동일한 용량을 4주 동안 매주 2회, 총 8회 용량을 제공하였다. 종양을 디지탈 캘리퍼스 (digital calipers)를 통해 B7-DC-Ig를 제공한 날에 시작하여 매주 2회 측정함으로써 종양 성장을 모니터링하였다. 종양 부피는 다음과 같이 계산하였다:
종양 부피 = π(Dshort)2 x (Dlong)/6 = 약 0.52 x (Dshort)2 x (Dlong).
종양 부피가 2000 mm3에 도달하면 또는 종양 접종 부위에 피부 궤양 및 감염이 있으면 마우스를 안락사시키고 연구로부터 제외하였다.
실시예
4
시클로포스파미드
및 B7-
DC
-
Ig
의
조합물은
확립된 종양을 근절할 수 있다.
9 내지 11주령의 Balb/C 마우스에게 상기한 바와 같이 1.0 x 105 CT26 결장직장 종양 세포를 피하 이식하였다. 종양 이식 후 제10일에, 마우스에게 100 mg/kg의 시클로포스파미드를 제공하였다. B7-DC-Ig 처리는 1일 후인 제11일에 시작하였다. 마우스를 100 ㎍의 B7-DC-Ig로 매주 2회 용량으로 4주 동안, 총 8회 용량으로 처리하였다. CTX + B7-DC-Ig 치료 요법을 받은 마우스의 75%가 제44일에 확립된 종양을 근절한 반면, 대조군 CTX 단독군 내의 모든 마우스는 종양 성장의 결과로서 죽거나, 종양이 IACUC에서 승인된 크기를 초과하였으므로 안락사시켰다 (결과를 도 3에 제시함). 이들 결과는 단순한 예방만이 아니라 확립된 종양에 대한 치료 요법의 유효성을 입증한다.
실시예
5
시클로포스파미드
및 B7-
DC
-
Ig
의
조합물은
확립된 종양을 근절하고,
종양 재접종에 대해 보호할 수 있다.
상기한 실험으로부터 확립된 CT26 결장직장 종양을 근절시킨 마우스에게 1 x 105개의 CT26 세포를 제44일 및 제70일에 재접종하였다. 재접종으로부터 종양이 성장하지 않았고, 이것은 시클로포스파미드 및 B7-DC-Ig 조합 요법으로부터 장기 항-종양 면역성을 발달시켰음을 제안한다. 비히클 대조군 내의 모든 마우스는 종양을 발생하였다 (결과를 도 4에 제시함). 이들 결과는 확립된 종양에 대한 치료 요법의 유효성, 및 시클로포스파미드 및 B7-DC-Ig 조합 요법이 종양 항원에 대해 기억 반응을 생성하였음을 보여준다.
실시예
6
시클로포스파미드
및 B7-
DC
-
Ig
의
조합물은
종양 특이적, 기억 세포독성 T 림프구를 생성할 수 있다.
상기한 실험으로부터 확립된 CT26 결장직장 종양을 근절시킨 마우스에게 2.5 x 105개의 CT26 세포를 제44일에 재접종하였다. 7일 후에, 마우스 비장을 단리하였다. 마우스 비장세포를 골지 (Golgi) 차단제 (비디 바이오사이언스)의 존재 하에 5 또는 50 ㎍/mL의 난알부민 (OVA) 또는 AH1 펩티드로 6시간 동안 펄싱하였다. CD8+/IFNγ+ T 세포를 평가함으로써, 기억 T 효과기 세포를 분석하였다. 도 5의 결과는 CT26 종양을 근절시킨 마우스 내에 유의한 양의 CT26 특이적 T 효과기 세포가 존재하였음을 보여준다.
실시예
7
종양 근절에 대한 B7-
DC
-
Ig
용량 의존의 효과
9 내지 11주령의 Balb/C 마우스에게 1.0 x 105개의 CT26 결장직장 종양 세포를 피하 이식하였다. 종양 이식 후 제9일에, 마우스에게 단일 용량의 시클로포스파미드 (100 mg/kg)를 투여하고, 제10일에 30, 100 또는 300 ㎍의 B7-DC-Ig로 매주 2회 용량으로 4주 동안 총 8회 용량으로 치료를 시작하였다. 도 6은 300 ㎍에서 70%의 마우스가 종양을 근절하였고, 100 ㎍에서 40%가 종양을 근절하였고, 30 ㎍ 용량은 10% 종양 근절을 일으켰음을 보여준다.
실시예
8
시클로포스파미드
및 항-
PD
-1의
조합물은
확립된 종양을 근절할 수 있다.
9 내지 11주령의 Balb/C 마우스에게 1.0 x 105개의 CT26 결장직장 종양 세포를 피하 접종하였다. 종양 접종 후 제11일에, 마우스에게 단일 용량의 시클로포스파미드 (100 mg/kg)를 투여하고, 4주 동안 매주 3회 투여한 항-PD-1 항체 (250 ㎍, Clone G4, [Hirano F. et al., 2005 Cancer Research])를 사용한 치료를 시작하였다. CTX + 항-PD-1 요법을 받은 마우스의 70%가 종양 접종 후 제50일에 확립된 CT26 종양을 근절한 반면, 대조군 및 항-PD-1 단독군 내의 모든 마우스는 종양 성장의 결과로서 죽거나 종양이 IACUC에서 승인된 크기를 초과하였으므로 안락사시켰다. 이들 결과는 단순한 예방만이 아니라 확립된 종양에 대한 치료 요법의 유효성을 입증한다. 결과를 도 7에 제시한다.
실시예
9
시클로포스파미드
및 항-
CTLA4
의
조합물은
확립된 종양을 근절할 수 있다.
9 내지 11주령의 Balb/C 마우스에게 1.0 x 105개의 CT26 결장직장 종양 세포를 피하 접종하였다. 종양 접종 후 제11일에, 마우스에게 100 mg/kg의 시클로포스파미드를 투여하였다. 항-CTLA4 (햄스터 하이브리도마로부터의 항-마우스 CTLA4 - ATCC 기탁 UC10-4F10-11) 치료를 1일 후인 제12일에 시작하였다. 마우스를 100 ㎍의 항-CTLA4로 매주 2회 용량으로 4주 동안 처리하였다. CTX + 항-CTLA4 요법을 제공받은 마우스의 56%는 종양 접종 후 제50일에 종양이 없는 반면, 대조군 내의 모든 마우스는 종양 성장의 결과로서 죽거나 종양이 IACUC에서 승인된 크기를 초과하였으므로 안락사시켰다. 결과를 도 8에 제시한다. 이들 결과는 단순한 예방만이 아니라 확립된 종양에 대한 치료 요법의 유효성을 입증한다.
실시예
10
시클로포스파미드
및 B7-
DC
-
Ig
요법의
조합물은
종양 미세환경에서
Treg
의 감소를 일으킨다
도 9는 9 내지 11주령의 Balb/C 마우스에게 1.0 x 105개의 CT26 세포를 피하 이식한 실험의 결과를 보여준다. 제9일에, 마우스에게 100 mg/kg의 CTX를 IP 주사하였다. 24시간 후인 제10일에, 마우스를 100 ㎍의 B7-DC-Ig로 처리하였다. 5개의 군이 존재하였다: 임의의 종양 세포를 투여하지 않은 나이브 마우스, 비히클 주사, CTX 단독, CTX + B7-DC-Ig, 또는 B7-DC-Ig 단독. 2마리의 나이브 마우스 및 다른 군으로부터의 4마리의 마우스를 T 세포 분석을 위해 제11일 (CTX의 2일 후) 및 제16일 (CTX의 7일 후)에 연구로부터 제거하였다. 좌측 패널은 제11일 (CTX 주사의 2일 후)에 CTX 치료한 마우스의 비장 내의 Treg가 종양을 이식하고 비히클을 주사한 마우스에서보다 유의하게 더 낮았음을 보여준다. 우측 패널은 제16일 (CTX의 7일 후 및 B7-DC-Ig 치료의 6일 후)에 B7-DC-Ig가 높은 PD-1을 발현하는 CD4+ T 세포를 유의하게 저하시켰음을 보여준다. 이것은 B7-DC-Ig 처리된 마우스 및 CTX + B7-DC-Ig 처리된 마우스 모두에서 관찰되었다. 종양 세포를 이식한 마우스는 나이브 마우스에 비해 배수 LN 내에 보다 많은 PD-1+/CD4+ T 세포를 갖도록 의도되었다.
실시예
11
시클로포스파미드
및 B7-
DC
-
Ig
의
조합물은
전이성 전립선 종양 모델에서
마우스 생존을 촉진할 수 있다
9 내지 11주령의 B10.D2 마우스에게 모 TRAMP 세포 주사 후 폐 전이로부터 단리된 3.0 x 105개의 SP-1 세포를 정맥내 주사하였다. CTX 마우스에게 3 용량의 CTX (50 mg/kg)를 제5, 12 및 19일에 제공하였다. B7-DC-Ig 처리 마우스에게 3 용량의 B7-DC-Ig (5 mg/kg)를 제6, 13 및 20일에 제공하였다. 제100일에, 대조군, 비처리군, CTX 단독군, B7-DC-Ig 단독군 내의 마우스의 17%가 생존한 반면, CTX 및 B7-DC-Ig의 조합물을 투여한 마우스의 43%가 생존하였다. 결과를 도 10에 제시한다.
실시예
12
리스테리아
암 백신 및 B7-
DC
-
Ig
의
조합물은
CT26
간 이식 후
마우스 생존을 향상시킬 수 있다.
11-13주령의 Balb/C 마우스에게 반비장 주사 기술 (Yoshimura K et al., 2007, Cancer Research)을 이용하여 CT26 세포를 이식하였다. 제10일에, 마우스에게 CTX를 50 mg/kg로 IP로 1회 주사하였다. 24시간 후인 제11일에, 마우스를 AH1 펩티드 (CT26의 면역우성 에피토프)를 보유하는 재조합 리스테리아로 0.1 LD50 (1x107 CFU)로, 이어서 제14일 및 제17일에 처리하였다. 마우스를 또한 B7-DC-Ig로 제11일, 이어서 제18일에 처리하였다. 도 11은 임의로 치료하지 않은 마우스 또는 CTX 및 리스테리아 암 백신으로 처리한 마우스가 모두 제45일 전에 죽었음을 보여준다. 3중 조합물 CTX + 리스테리아 암 백신 및 B7-DC-Ig를 투여한 마우스의 60%는 생존하였다.
1. 참조문헌 목록
SEQUENCE LISTING
<110> Langermann, Solomon
<120> Compositions of PD-1 Antagonists and Methods of Use
<130> 21682-7
<140>
<141>
<150> 61/211,697
<151> 2009-04-02
<150> 61/091,692
<151> 2008-08-25
<150> 61/091,709
<151> 2008-08-25
<150> 61/091,705
<151> 2008-08-25
<160> 20
<170> PatentIn version 3.4
<210> 1
<211> 273
<212> PRT
<213> Homo sapiens
<400> 1
Met Ile Phe Leu Leu Leu Met Leu Ser Leu Glu Leu Gln Leu His Gln
1 5 10 15
Ile Ala Ala Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile
20 25 30
Glu His Gly Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser
35 40 45
His Val Asn Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn
50 55 60
Asp Thr Ser Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu
65 70 75 80
Pro Leu Gly Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp
85 90 95
Glu Gly Gln Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr
100 105 110
Lys Tyr Leu Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr
115 120 125
His Ile Leu Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln
130 135 140
Ala Thr Gly Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val
145 150 155 160
Pro Ala Asn Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val
165 170 175
Thr Ser Val Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys
180 185 190
Val Phe Trp Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp
195 200 205
Leu Gln Ser Gln Met Glu Pro Arg Thr His Pro Thr Trp Leu Leu His
210 215 220
Ile Phe Ile Pro Phe Cys Ile Ile Ala Phe Ile Phe Ile Ala Thr Val
225 230 235 240
Ile Ala Leu Arg Lys Gln Leu Cys Gln Lys Leu Tyr Ser Ser Lys Asp
245 250 255
Thr Thr Lys Arg Pro Val Thr Thr Thr Lys Arg Glu Val Asn Ser Ala
260 265 270
Ile
<210> 2
<211> 254
<212> PRT
<213> Homo sapiens
<400> 2
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Trp Leu Leu His Ile Phe Ile
195 200 205
Pro Phe Cys Ile Ile Ala Phe Ile Phe Ile Ala Thr Val Ile Ala Leu
210 215 220
Arg Lys Gln Leu Cys Gln Lys Leu Tyr Ser Ser Lys Asp Thr Thr Lys
225 230 235 240
Arg Pro Val Thr Thr Thr Lys Arg Glu Val Asn Ser Ala Ile
245 250
<210> 3
<211> 202
<212> PRT
<213> Homo sapiens
<400> 3
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Trp
195 200
<210> 4
<211> 202
<212> PRT
<213> murine
<400> 4
Leu Phe Thr Val Thr Ala Pro Lys Glu Val Tyr Thr Val Asp Val Gly
1 5 10 15
Ser Ser Val Ser Leu Glu Cys Asp Phe Asp Arg Arg Glu Cys Thr Glu
20 25 30
Leu Glu Gly Ile Arg Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Leu Gln Ser Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Leu Phe His Ile Pro Ser Val Gln Val Arg Asp Ser Gly Gln
65 70 75 80
Tyr Arg Cys Leu Val Ile Cys Gly Ala Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Val Lys Val Lys Ala Ser Tyr Met Arg Ile Asp Thr Arg Ile Leu
100 105 110
Glu Val Pro Gly Thr Gly Glu Val Gln Leu Thr Cys Gln Ala Arg Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Gln Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ile Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Gln Pro Ser Arg Asn Phe Ser Cys Met Phe Trp
165 170 175
Asn Ala His Met Lys Glu Leu Thr Ser Ala Ile Ile Asp Pro Leu Ser
180 185 190
Arg Met Glu Pro Lys Val Pro Arg Thr Trp
195 200
<210> 5
<211> 19
<212> PRT
<213> Homo sapiens
<400> 5
Met Ile Phe Leu Leu Leu Met Leu Ser Leu Glu Leu Gln Leu His Gln
1 5 10 15
Ile Ala Ala
<210> 6
<211> 232
<212> PRT
<213> Homo sapiens
<400> 6
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
20 25 30
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
35 40 45
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
50 55 60
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
65 70 75 80
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
85 90 95
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
100 105 110
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
115 120 125
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
130 135 140
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
145 150 155 160
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
165 170 175
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
180 185 190
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
195 200 205
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
210 215 220
Ser Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 7
<211> 233
<212> PRT
<213> murine
<400> 7
Glu Pro Arg Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro
1 5 10 15
Ala Pro Asn Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys
20 25 30
Ile Lys Asp Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val
35 40 45
Val Val Asp Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe
50 55 60
Val Asn Asn Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu
65 70 75 80
Asp Tyr Asn Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His
85 90 95
Gln Asp Trp Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys
100 105 110
Asp Leu Pro Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser
115 120 125
Val Arg Ala Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met
130 135 140
Thr Lys Lys Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro
145 150 155 160
Glu Asp Ile Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn
165 170 175
Tyr Lys Asn Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met
180 185 190
Tyr Ser Lys Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser
195 200 205
Tyr Ser Cys Ser Val Val His Glu Gly Leu His Asn His His Thr Thr
210 215 220
Lys Ser Phe Ser Arg Thr Pro Gly Lys
225 230
<210> 8
<211> 1365
<212> DNA
<213> artificial
<220>
<223> Murine B7-DC-Ig
<400> 8
atgctgctcc tgctgccgat actgaacctg agcttacaac ttcatcctgt agcagcttta 60
ttcaccgtga cagcccctaa agaagtgtac accgtagacg tcggcagcag tgtgagcctg 120
gagtgcgatt ttgaccgcag agaatgcact gaactggaag ggataagagc cagtttgcag 180
aaggtagaaa atgatacgtc tctgcaaagt gaaagagcca ccctgctgga ggagcagctg 240
cccctgggaa aggctttgtt ccacatccct agtgtccaag tgagagattc cgggcagtac 300
cgttgcctgg tcatctgcgg ggccgcctgg gactacaagt acctgacggt gaaagtcaaa 360
gcttcttaca tgaggataga cactaggatc ctggaggttc caggtacagg ggaggtgcag 420
cttacctgcc aggctagagg ttatccccta gcagaagtgt cctggcaaaa tgtcagtgtt 480
cctgccaaca ccagccacat caggaccccc gaaggcctct accaggtcac cagtgttctg 540
cgcctcaagc ctcagcctag cagaaacttc agctgcatgt tctggaatgc tcacatgaag 600
gagctgactt cagccatcat tgaccctctg agtcggatgg aacccaaagt ccccagaacg 660
tgggagccaa gaggtcctac gatcaagccc tgcccgcctt gtaaatgccc agctccaaat 720
ttgctgggtg gaccgtcagt ctttatcttc ccgccaaaga taaaggacgt cttgatgatt 780
agtctgagcc ccatcgtgac atgcgttgtg gtggatgttt cagaggatga ccccgacgtg 840
caaatcagtt ggttcgttaa caacgtggag gtgcataccg ctcaaaccca gacccacaga 900
gaggattata acagcaccct gcgggtagtg tccgccctgc cgatccagca tcaggattgg 960
atgagcggga aagagttcaa gtgtaaggta aacaacaaag atctgccagc gccgattgaa 1020
cgaaccatta gcaagccgaa agggagcgtg cgcgcacctc aggtttacgt ccttcctcca 1080
ccagaagagg agatgacgaa aaagcaggtg accctgacat gcatggtaac tgactttatg 1140
ccagaagata tttacgtgga atggactaat aacggaaaga cagagctcaa ttacaagaac 1200
actgagcctg ttctggattc tgatggcagc tactttatgt actccaaatt gagggtcgag 1260
aagaagaatt gggtcgagag aaacagttat agttgctcag tggtgcatga gggcctccat 1320
aatcatcaca ccacaaagtc cttcagccga acgcccggga aatga 1365
<210> 9
<211> 454
<212> PRT
<213> artificial
<220>
<223> Murine B7-DC-Ig
<400> 9
Met Leu Leu Leu Leu Pro Ile Leu Asn Leu Ser Leu Gln Leu His Pro
1 5 10 15
Val Ala Ala Leu Phe Thr Val Thr Ala Pro Lys Glu Val Tyr Thr Val
20 25 30
Asp Val Gly Ser Ser Val Ser Leu Glu Cys Asp Phe Asp Arg Arg Glu
35 40 45
Cys Thr Glu Leu Glu Gly Ile Arg Ala Ser Leu Gln Lys Val Glu Asn
50 55 60
Asp Thr Ser Leu Gln Ser Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu
65 70 75 80
Pro Leu Gly Lys Ala Leu Phe His Ile Pro Ser Val Gln Val Arg Asp
85 90 95
Ser Gly Gln Tyr Arg Cys Leu Val Ile Cys Gly Ala Ala Trp Asp Tyr
100 105 110
Lys Tyr Leu Thr Val Lys Val Lys Ala Ser Tyr Met Arg Ile Asp Thr
115 120 125
Arg Ile Leu Glu Val Pro Gly Thr Gly Glu Val Gln Leu Thr Cys Gln
130 135 140
Ala Arg Gly Tyr Pro Leu Ala Glu Val Ser Trp Gln Asn Val Ser Val
145 150 155 160
Pro Ala Asn Thr Ser His Ile Arg Thr Pro Glu Gly Leu Tyr Gln Val
165 170 175
Thr Ser Val Leu Arg Leu Lys Pro Gln Pro Ser Arg Asn Phe Ser Cys
180 185 190
Met Phe Trp Asn Ala His Met Lys Glu Leu Thr Ser Ala Ile Ile Asp
195 200 205
Pro Leu Ser Arg Met Glu Pro Lys Val Pro Arg Thr Trp Glu Pro Arg
210 215 220
Gly Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn
225 230 235 240
Leu Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp
245 250 255
Val Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val Val Asp
260 265 270
Val Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn
275 280 285
Val Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn
290 295 300
Ser Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp
305 310 315 320
Met Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro
325 330 335
Ala Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala
340 345 350
Pro Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys
355 360 365
Gln Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile
370 375 380
Tyr Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn
385 390 395 400
Thr Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys
405 410 415
Leu Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys
420 425 430
Ser Val Val His Glu Gly Leu His Asn His His Thr Thr Lys Ser Phe
435 440 445
Ser Arg Thr Pro Gly Lys
450
<210> 10
<211> 435
<212> PRT
<213> artificial
<220>
<223> Murine B7-DC-Ig fusion protein without signal sequence
<400> 10
Leu Phe Thr Val Thr Ala Pro Lys Glu Val Tyr Thr Val Asp Val Gly
1 5 10 15
Ser Ser Val Ser Leu Glu Cys Asp Phe Asp Arg Arg Glu Cys Thr Glu
20 25 30
Leu Glu Gly Ile Arg Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Leu Gln Ser Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Leu Phe His Ile Pro Ser Val Gln Val Arg Asp Ser Gly Gln
65 70 75 80
Tyr Arg Cys Leu Val Ile Cys Gly Ala Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Val Lys Val Lys Ala Ser Tyr Met Arg Ile Asp Thr Arg Ile Leu
100 105 110
Glu Val Pro Gly Thr Gly Glu Val Gln Leu Thr Cys Gln Ala Arg Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Gln Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ile Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Gln Pro Ser Arg Asn Phe Ser Cys Met Phe Trp
165 170 175
Asn Ala His Met Lys Glu Leu Thr Ser Ala Ile Ile Asp Pro Leu Ser
180 185 190
Arg Met Glu Pro Lys Val Pro Arg Thr Trp Glu Pro Arg Gly Pro Thr
195 200 205
Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu Leu Gly
210 215 220
Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val Leu Met
225 230 235 240
Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val Val Asp Val Ser Glu
245 250 255
Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val Glu Val
260 265 270
His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser Thr Leu
275 280 285
Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met Ser Gly
290 295 300
Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ala Pro Ile
305 310 315 320
Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro Gln Val
325 330 335
Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln Val Thr
340 345 350
Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr Val Glu
355 360 365
Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr Glu Pro
370 375 380
Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu Arg Val
385 390 395 400
Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser Val Val
405 410 415
His Glu Gly Leu His Asn His His Thr Thr Lys Ser Phe Ser Arg Thr
420 425 430
Pro Gly Lys
435
<210> 11
<211> 1362
<212> DNA
<213> artificial
<220>
<223> Human B7-DC-Ig
<400> 11
atgatctttc ttctcttgat gctgtctttg gaattgcaac ttcaccaaat cgcggccctc 60
tttactgtga ccgtgccaaa agaactgtat atcattgagc acgggtccaa tgtgaccctc 120
gaatgtaact ttgacaccgg cagccacgtt aacctggggg ccatcactgc cagcttgcaa 180
aaagttgaaa acgacacttc acctcaccgg gagagggcaa ccctcttgga ggagcaactg 240
ccattgggga aggcctcctt tcatatccct caggtgcagg ttcgggatga gggacagtac 300
cagtgcatta ttatctacgg cgtggcttgg gattacaagt atctgaccct gaaggtgaaa 360
gcgtcctatc ggaaaattaa cactcacatt cttaaggtgc cagagacgga cgaggtggaa 420
ctgacatgcc aagccaccgg ctacccgttg gcagaggtca gctggcccaa cgtgagcgta 480
cctgctaaca cttctcattc taggacaccc gagggcctct accaggttac atccgtgctc 540
cgcctcaaac cgcccccagg ccggaatttt agttgcgtgt tttggaatac ccacgtgcga 600
gagctgactc ttgcatctat tgatctgcag tcccagatgg agccacggac tcatccaact 660
tgggaaccta aatcttgcga taaaactcat acctgtcccc cttgcccagc ccccgagctt 720
ctgggaggtc ccagtgtgtt tctgtttccc ccaaaaccta aggacacact tatgatatcc 780
cgaacgccgg aagtgacatg cgtggttgtg gacgtctcac acgaagaccc ggaggtgaaa 840
ttcaactggt acgttgacgg agttgaggtt cataacgcta agaccaagcc cagagaggag 900
caatacaatt ccacctatcg agtggttagt gtactgaccg ttttgcacca agactggctg 960
aatggaaaag aatacaagtg caaagtatca aacaaggctt tgcctgcacc catcgagaag 1020
acaatttcta aagccaaagg gcagcccagg gaaccgcagg tgtacacact cccaccatcc 1080
cgcgacgagc tgacaaagaa tcaagtatcc ctgacctgcc tggtgaaagg cttttaccca 1140
tctgacattg ccgtggaatg ggaatcaaat ggacaacctg agaacaacta caaaaccact 1200
ccacctgtgc ttgacagcga cgggtccttt ttcctgtaca gtaagctcac tgtcgataag 1260
tctcgctggc agcagggcaa cgtcttttca tgtagtgtga tgcacgaagc tctgcacaac 1320
cattacaccc agaagtctct gtcactgagc ccaggtaaat ga 1362
<210> 12
<211> 453
<212> PRT
<213> Artificial
<220>
<223> Human B7-DC-Ig
<400> 12
Met Ile Phe Leu Leu Leu Met Leu Ser Leu Glu Leu Gln Leu His Gln
1 5 10 15
Ile Ala Ala Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile
20 25 30
Glu His Gly Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser
35 40 45
His Val Asn Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn
50 55 60
Asp Thr Ser Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu
65 70 75 80
Pro Leu Gly Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp
85 90 95
Glu Gly Gln Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr
100 105 110
Lys Tyr Leu Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr
115 120 125
His Ile Leu Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln
130 135 140
Ala Thr Gly Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val
145 150 155 160
Pro Ala Asn Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val
165 170 175
Thr Ser Val Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys
180 185 190
Val Phe Trp Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp
195 200 205
Leu Gln Ser Gln Met Glu Pro Arg Thr His Pro Thr Trp Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
325 330 335
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
435 440 445
Leu Ser Pro Gly Lys
450
<210> 13
<211> 434
<212> PRT
<213> Artificial
<220>
<223> Human B7-DC-Ig without signal sequence
<400> 13
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Trp Glu Pro Lys Ser Cys Asp
195 200 205
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
210 215 220
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
225 230 235 240
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
245 250 255
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
260 265 270
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
275 280 285
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
290 295 300
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
305 310 315 320
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
325 330 335
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
340 345 350
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
355 360 365
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
370 375 380
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
385 390 395 400
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
405 410 415
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
420 425 430
Gly Lys
<210> 14
<211> 5
<212> PRT
<213> Homo sapiens
<400> 14
Trp Asp Tyr Lys Tyr
1 5
<210> 15
<211> 202
<212> PRT
<213> Macaca fascicularis
<400> 15
Leu Phe Thr Val Thr Val Pro Lys Glu Leu Tyr Ile Ile Glu His Gly
1 5 10 15
Ser Asn Val Thr Leu Glu Cys Asn Phe Asp Thr Gly Ser His Val Asn
20 25 30
Leu Gly Ala Ile Thr Ala Ser Leu Gln Lys Val Glu Asn Asp Thr Ser
35 40 45
Pro His Arg Glu Arg Ala Thr Leu Leu Glu Glu Gln Leu Pro Leu Gly
50 55 60
Lys Ala Ser Phe His Ile Pro Gln Val Gln Val Arg Asp Glu Gly Gln
65 70 75 80
Tyr Gln Cys Ile Ile Ile Tyr Gly Val Ala Trp Asp Tyr Lys Tyr Leu
85 90 95
Thr Leu Lys Val Lys Ala Ser Tyr Arg Lys Ile Asn Thr His Ile Leu
100 105 110
Lys Val Pro Glu Thr Asp Glu Val Glu Leu Thr Cys Gln Ala Thr Gly
115 120 125
Tyr Pro Leu Ala Glu Val Ser Trp Pro Asn Val Ser Val Pro Ala Asn
130 135 140
Thr Ser His Ser Arg Thr Pro Glu Gly Leu Tyr Gln Val Thr Ser Val
145 150 155 160
Leu Arg Leu Lys Pro Pro Pro Gly Arg Asn Phe Ser Cys Val Phe Trp
165 170 175
Asn Thr His Val Arg Glu Leu Thr Leu Ala Ser Ile Asp Leu Gln Ser
180 185 190
Gln Met Glu Pro Arg Thr His Pro Thr Trp
195 200
<210> 16
<211> 290
<212> PRT
<213> Homo sapiens
<400> 16
Met Arg Ile Phe Ala Val Phe Ile Phe Met Thr Tyr Trp His Leu Leu
1 5 10 15
Asn Ala Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Ser Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu
35 40 45
Asp Leu Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile
50 55 60
Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser
65 70 75 80
Tyr Arg Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn
85 90 95
Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
100 105 110
Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val
115 120 125
Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val
130 135 140
Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr
145 150 155 160
Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser
165 170 175
Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn
180 185 190
Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr
195 200 205
Cys Thr Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu
210 215 220
Val Ile Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His
225 230 235 240
Leu Val Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr
245 250 255
Phe Ile Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys
260 265 270
Gly Ile Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu
275 280 285
Glu Thr
290
<210> 17
<211> 290
<212> PRT
<213> Mus musculus
<400> 17
Met Arg Ile Phe Ala Gly Ile Ile Phe Thr Ala Cys Cys His Leu Leu
1 5 10 15
Arg Ala Phe Thr Ile Thr Ala Pro Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Ser Asn Val Thr Met Glu Cys Arg Phe Pro Val Glu Arg Glu Leu
35 40 45
Asp Leu Leu Ala Leu Val Val Tyr Trp Glu Lys Glu Asp Glu Gln Val
50 55 60
Ile Gln Phe Val Ala Gly Glu Glu Asp Leu Lys Pro Gln His Ser Asn
65 70 75 80
Phe Arg Gly Arg Ala Ser Leu Pro Lys Asp Gln Leu Leu Lys Gly Asn
85 90 95
Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
100 105 110
Cys Cys Ile Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Leu
115 120 125
Lys Val Asn Ala Pro Tyr Arg Lys Ile Asn Gln Arg Ile Ser Val Asp
130 135 140
Pro Ala Thr Ser Glu His Glu Leu Ile Cys Gln Ala Glu Gly Tyr Pro
145 150 155 160
Glu Ala Glu Val Ile Trp Thr Asn Ser Asp His Gln Pro Val Ser Gly
165 170 175
Lys Arg Ser Val Thr Thr Ser Arg Thr Glu Gly Met Leu Leu Asn Val
180 185 190
Thr Ser Ser Leu Arg Val Asn Ala Thr Ala Asn Asp Val Phe Tyr Cys
195 200 205
Thr Phe Trp Arg Ser Gln Pro Gly Gln Asn His Thr Ala Glu Leu Ile
210 215 220
Ile Pro Glu Leu Pro Ala Thr His Pro Pro Gln Asn Arg Thr His Trp
225 230 235 240
Val Leu Leu Gly Ser Ile Leu Leu Phe Leu Ile Val Val Ser Thr Val
245 250 255
Leu Leu Phe Leu Arg Lys Gln Val Arg Met Leu Asp Val Glu Lys Cys
260 265 270
Gly Val Glu Asp Thr Ser Ser Lys Asn Arg Asn Asp Thr Gln Phe Glu
275 280 285
Glu Thr
290
<210> 18
<211> 290
<212> PRT
<213> Macaca mulatta
<400> 18
Met Arg Ile Phe Ala Val Phe Ile Phe Thr Ile Tyr Trp His Leu Leu
1 5 10 15
Asn Ala Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Ser Asn Met Thr Ile Glu Cys Arg Phe Pro Val Glu Lys Gln Leu
35 40 45
Gly Leu Thr Ser Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile
50 55 60
Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Asn
65 70 75 80
Tyr Arg Gln Arg Ala Gln Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn
85 90 95
Ala Ala Leu Arg Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
100 105 110
Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val
115 120 125
Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val
130 135 140
Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr
145 150 155 160
Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser
165 170 175
Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Leu Asn
180 185 190
Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Ala Asn Glu Ile Phe Tyr
195 200 205
Cys Ile Phe Arg Arg Leu Gly Pro Glu Glu Asn His Thr Ala Glu Leu
210 215 220
Val Ile Pro Glu Leu Pro Leu Ala Leu Pro Pro Asn Glu Arg Thr His
225 230 235 240
Leu Val Ile Leu Gly Ala Ile Phe Leu Leu Leu Gly Val Ala Leu Thr
245 250 255
Phe Ile Phe Tyr Leu Arg Lys Gly Arg Met Met Asp Met Lys Lys Ser
260 265 270
Gly Ile Arg Val Thr Asn Ser Lys Lys Gln Arg Asp Thr Gln Leu Glu
275 280 285
Glu Thr
290
<210> 19
<211> 288
<212> PRT
<213> Homo sapiens
<400> 19
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp
20 25 30
Asn Pro Pro Thr Phe Phe Pro Ala Leu Leu Val Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
<210> 20
<211> 288
<212> PRT
<213> Macaca fascicularis
<400> 20
Met Gln Ile Pro Gln Ala Pro Trp Pro Val Val Trp Ala Val Leu Gln
1 5 10 15
Leu Gly Trp Arg Pro Gly Trp Phe Leu Glu Ser Pro Asp Arg Pro Trp
20 25 30
Asn Ala Pro Thr Phe Ser Pro Ala Leu Leu Leu Val Thr Glu Gly Asp
35 40 45
Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Ala Ser Glu Ser Phe Val
50 55 60
Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala
65 70 75 80
Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg
85 90 95
Val Thr Arg Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg
100 105 110
Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu
115 120 125
Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val
130 135 140
Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro
145 150 155 160
Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Val Gly Val Val Gly Gly
165 170 175
Leu Leu Gly Ser Leu Val Leu Leu Val Trp Val Leu Ala Val Ile Cys
180 185 190
Ser Arg Ala Ala Arg Gly Thr Ile Gly Ala Arg Arg Thr Gly Gln Pro
195 200 205
Leu Lys Glu Asp Pro Ser Ala Val Pro Val Phe Ser Val Asp Tyr Gly
210 215 220
Glu Leu Asp Phe Gln Trp Arg Glu Lys Thr Pro Glu Pro Pro Val Pro
225 230 235 240
Cys Val Pro Glu Gln Thr Glu Tyr Ala Thr Ile Val Phe Pro Ser Gly
245 250 255
Met Gly Thr Ser Ser Pro Ala Arg Arg Gly Ser Ala Asp Gly Pro Arg
260 265 270
Ser Ala Gln Pro Leu Arg Pro Glu Asp Gly His Cys Ser Trp Pro Leu
275 280 285
1
Claims (68)
- 포유동물에게 T 세포에서 억제 신호 전달을 감소시키는 화합물 및 증강제를 투여하는 것을 포함하는 효과적인 치료 요법을 포함하며, 여기서 상기 치료 요법이 상기 포유동물에서 T 세포 반응의 증가를 위해 효과적인 것인, 포유동물에서 T 세포 반응을 증가시키는 방법.
- 제1항에 있어서, 상기 화합물이 제1 및 제2 펩티드 부분을 포함하는 융합 단백질이고, 상기 제1 펩티드 부분이 PD-1 길항제 폴리펩티드의 활성 단편을 포함하고, 상기 제2 펩티드 부분이 면역글로불린 (Ig)의 부분을 포함하는 것인 방법.
- 제2항에 있어서, 상기 PD-1 길항제 폴리펩티드가 야생형 B7-DC 폴리펩티드인 방법.
- 제3항에 있어서, 상기 B7-DC가 인간 B7-DC인 방법.
- 제4항에 있어서, 상기 활성 단편이 상기 B7-DC 폴리펩티드의 막횡단 부분의 어떠한 실질적인 부분도 포함하지 않는 것인 방법.
- 제5항에 있어서, 상기 활성 단편이 상기 B7-DC 폴리펩티드의 가용형 부분을 포함하고, 상기 제2 펩티드 부분이 항체의 Fc 영역을 포함하지만 상기 항체의 어떠한 가변 영역도 포함하지 않는 것인 방법.
- 제5항에 있어서, 상기 활성 단편이 서열 3의 아미노산 서열을 포함하고, 상기 제2 폴리펩티드 부분이 항체의 Fc 영역을 포함하지만 상기 항체의 어떠한 가변 영역도 포함하지 않는 것인 방법.
- 제4항에 있어서, 상기 제1 펩티드 부분이 서열 1의 아미노산 20-221 또는 20-121에 적어도 80% 동일성을 갖는 아미노산 서열로 이루어지는 것인 방법.
- 제4항에 있어서, 상기 제1 펩티드 부분이 서열 1의 아미노산 20-221 또는 20-121의 아미노산 서열로 이루어지는 것인 방법.
- 제5항에 있어서, 상기 PD-1 결합 단편이 서열 1의 적어도 10개의 인접하는 아미노산, 또는 적어도 25개의 인접하는 아미노산, 또는 적어도 50개의 인접하는 아미노산, 또는 적어도 75개의 인접하는 아미노산, 또는 적어도 90개의 인접하는 아미노산, 또는 적어도 100개의 인접하는 아미노산을 포함하는 것인 방법.
- 제2항에 있어서, 상기 융합 단백질이 서열 9, 10, 12 또는 13의 서열에 적어도 80% 동일성을 갖는 아미노산 서열을 포함하는 것인 방법.
- 제2항에 있어서, 상기 융합 단백질이 서열 9, 10, 12, 또는 13의 아미노산 서열을 포함하는 것인 방법.
- 제2항에 있어서, 상기 융합 단백질이 단량체인 방법.
- 제2항에 있어서, 상기 융합 단백질이 이량체의 일부인 방법.
- 제14항에 있어서, 상기 이량체가 동종이량체인 방법.
- 제14항에 있어서, 상기 이량체가 이종이량체인 방법.
- 제1항에 있어서, 상기 증강제가 시클로포스파미드 또는 시클로포스파미드의 유사체인 방법.
- 제1항에 있어서, 상기 증강제가 조절 T 림프구 (T-reg)의 활성을 감소시키는 작용제인 방법.
- 제1항에 있어서, 상기 증강제가 상기 화합물을 투여하기 전에 투여되는 방법.
- 제19항에 있어서, 상기 증강제가 상기 화합물을 투여하기 적어도 X 시간 전에 투여되고, 여기서 X가 1, 2, 3, 5, 10, 15, 20, 24 및 30 중에서 선택되는 것인 방법.
- 제1항에 있어서, 상기 치료 요법이 항-PD-1 항체, 항-CTLA4 항체, 유사분열 억제제, 아로마타제 억제제, A2AR 길항제, 및 혈관신생 억제제로 이루어지는 군으로부터 선택되는 적어도 하나의 추가의 작용제를 투여하는 것을 추가로 포함하는 것인 방법.
- 제1항에 있어서, 상기 화합물이 야생형 B7-DC 폴리펩티드의 활성 단편을 포함하는 폴리펩티드인 방법.
- 제22항에 있어서, 상기 활성 단편이 상기 폴리펩티드의 막횡단 부분의 어떠한 부분도 포함하지 않는 것인 방법.
- 제22항에 있어서, 상기 B7-DC 폴리펩티드가 인간 B7-DC 폴리펩티드인 방법.
- 제24항에 있어서, 상기 활성 단편이 서열 1의 아미노산 20-221 또는 20-121에 적어도 80% 동일성을 갖는 아미노산 서열을 포함하는 것인 방법.
- 제24항에 있어서, 상기 활성 단편이 서열 1의 아미노산 20-221 또는 20-121의 아미노산 서열로 이루어지는 것인 방법.
- 제23항에 있어서, 상기 PD-1 결합 단편이 서열 1 또는 19의 적어도 10개의 인접하는 아미노산, 또는 적어도 25개의 인접하는 아미노산, 또는 적어도 50개의 인접하는 아미노산, 또는 적어도 75개의 인접하는 아미노산, 또는 적어도 90개의 인접하는 아미노산, 또는 적어도 100개의 인접하는 아미노산을 포함하는 것인 방법.
- 제1항에 있어서, 상기 화합물이 야생형 B7-H1 폴리펩티드의 활성 단편을 포함하는 폴리펩티드인 방법.
- 제28항에 있어서, 상기 활성 단편이 상기 폴리펩티드의 막횡단 부분의 어떠한 부분도 포함하지 않는 것인 방법.
- 제28항에 있어서, 상기 B7-H1 폴리펩티드가 인간 B7-H1 폴리펩티드인 방법.
- 제28항에 있어서, 상기 활성 단편이 서열 16의 적어도 10개의 인접하는 아미노산, 또는 적어도 25개의 인접하는 아미노산, 또는 적어도 50개의 인접하는 아미노산, 또는 적어도 75개의 인접하는 아미노산, 또는 적어도 90개의 인접하는 아미노산, 또는 적어도 100개의 인접하는 아미노산을 포함하는 것인 방법.
- 제1항에 있어서, 상기 화합물이 야생형 PD-1 폴리펩티드의 활성 단편을 포함하는 폴리펩티드인 방법.
- 제32항에 있어서, 상기 활성 단편이 상기 폴리펩티드의 막횡단 부분의 어떠한 부분도 포함하지 않는 것인 방법.
- 제32항에 있어서, 상기 PD-1 폴리펩티드가 인간 PD-1 폴리펩티드인 방법.
- 제32항에 있어서, 상기 활성 단편이 서열 17 또는 18의 적어도 10개의 인접하는 아미노산, 또는 적어도 25개의 인접하는 아미노산, 또는 적어도 50개의 인접하는 아미노산, 또는 적어도 75개의 인접하는 아미노산, 또는 적어도 90개의 인접하는 아미노산, 또는 적어도 100개의 인접하는 아미노산을 포함하는 것인 방법.
- 제1항에 있어서, 상기 화합물이 항-PD-1 항체 또는 그의 활성 단편인 방법.
- 제36항에 있어서, 상기 증강제가 시클로포스파미드 또는 시클로포스파미드의 유사체인 방법.
- 제36항에 있어서, 상기 증강제가 상기 화합물을 투여하기 전에 투여되는 방법.
- 제38항에 있어서, 상기 증강제가 상기 화합물을 투여하기 적어도 X 시간 전에 투여되고, 여기서 X가 1, 2, 3, 5, 10, 15, 20, 24 및 30 중에서 선택되는 것인 방법.
- 제1항에 있어서, 상기 화합물이 항-CTLA4 항체 또는 그의 활성 단편인 방법.
- 제40항에 있어서, 상기 증강제가 시클로포스파미드 또는 시클로포스파미드의 유사체인 방법.
- 제40항에 있어서, 상기 증강제가 상기 화합물을 투여하기 전에 투여되는 방법.
- 제42항에 있어서, 상기 증강제가 상기 화합물을 투여하기 적어도 X 시간 전에 투여되고, 여기서 X가 1, 2, 3, 5, 10, 15, 20, 24 및 30 중에서 선택되는 것인 방법.
- 제1항에 있어서, 상기 화합물이 B7-DC, B7-H1, PD-1, B7.1의 세포외 도메인, 또는 임의의 이들의 활성 단편으로 이루어지는 것인 방법.
- 제44항에 있어서, 상기 활성 단편이 적어도 10개의 인접하는 아미노산, 또는 적어도 25개의 인접하는 아미노산, 또는 적어도 50개의 인접하는 아미노산, 또는 적어도 75개의 인접하는 아미노산, 또는 적어도 90개의 인접하는 아미노산, 또는 적어도 100개의 인접하는 아미노산을 포함하는 것인 방법.
- 제1항에 있어서, 상기 화합물이 증가된 T 세포-매개된 면역 반응에 의해 치료가능한 질환을 치료하기 위한 충분한 양으로 존재하는 것인 방법.
- 제46항에 있어서, 상기 화합물이
(a) PD-1 길항제 폴리펩티드의 활성 단편을 포함하는 제1 펩티드 부분 및 면역글로불린 (Ig)의 부분을 포함하는 제2 펩티드 부분을 포함하는 융합 단백질;
(b) 그의 활성 단편을 포함하는 항-PD-1 항체;
(c) 그의 활성 단편을 포함하는 항-CTLA4 항체;
(d) PD-1-결합 폴리펩티드 또는 PD-1 리간드-결합 폴리펩티드; 및
(e) (a), (b), (c) 및 (d) 중 임의의 2가지 이상의 조합물
로 이루어지는 군으로부터 선택되는 것인 방법. - 제47항에 있어서, 상기 증강제가 시클로포스파미드 또는 시클로포스파미드의 유사체인 방법.
- 제47항에 있어서, 상기 증강제가 조절 T 림프구 (T-reg)의 활성을 감소시키는 작용제인 방법.
- 제47항에 있어서, 상기 증강제가 수니티닙 (수텐트 (Sutent)®), 항-TGNFβ 또는 이마티닙 (글리백 (Gleevac)®), 안트라사이클린, 옥살리플라틴, 독소루비신, TLR4 길항제, 또는 IL-18 길항제인 방법.
- 제47항에 있어서, 항-PD-1 항체, 항-CTLA4 항체, 유사분열 억제제, 아로마타제 억제제, A2AR 길항제, 및 혈관신생 억제제로 이루어지는 군으로부터 선택되는 적어도 하나의 추가의 작용제를 투여하는 것을 추가로 포함하는 방법.
- 제46항에 있어서, 상기 질환이 감염성 질환인 방법.
- 제46항에 있어서, 상기 질환이 암인 방법.
- 제53항에 있어서, 상기 암이 방광암, 뇌암, 유방암, 자궁경부암, 결장직장암, 식도암, 신장암, 간암, 폐암, 비인두암, 췌장암, 전립선암, 피부암, 위암, 자궁암, 난소암, 고환암, 또는 혈액암인 방법.
- T 세포 상에서 프로그래밍된 (Programmed) 세포 사멸-1 (PD-1)을 통한 억제 신호 전달을 방지하는 화합물 및 증강제를 제약상 허용되는 담체 내에 포함하고, 상기 화합물 및 상기 증강제가 포유동물에서 T 세포 반응을 증가시키는데 유효한 양으로 함께 존재하는 것인 치료 조성물.
- 제55항에 있어서, 상기 화합물이
(a) PD-1 길항제 폴리펩티드의 활성 단편을 포함하는 제1 펩티드 부분 및 면역글로불린 (Ig)의 부분을 포함하는 제2 펩티드 부분을 포함하는 융합 단백질;
(b) 그의 활성 단편을 포함하는 항-PD-1 항체;
(c) 그의 활성 단편을 포함하는 항-CTLA4 항체;
(d) PD-1-결합 폴리펩티드, PD-1 리간드-결합 폴리펩티드, PD-1 폴리펩티드, 또는 그의 활성 단편; 및
(e) (a), (b), (c) 및 (d) 중 임의의 2가지 이상의 조합물
로 이루어지는 군으로부터 선택되는 것인 조성물. - 제55항에 있어서, 상기 증강제가 시클로포스파미드 또는 시클로포스파미드의 유사체인 조성물.
- 제55항에 있어서, 상기 증강제가 수니티닙 (수텐트®), 항-TGNFβ 또는 이마티닙 (글리백®), 안트라사이클린, 옥살리플라틴, 독소루비신, TLR4 길항제, 및 IL-18 길항제인 조성물.
- 제47항에 있어서, 항-PD-1 항체, 항-CTLA4 항체, 유사분열 억제제, 아로마타제 억제제, A2AR 길항제, 및 혈관신생 억제제로 이루어지는 군으로부터 선택되는 적어도 하나의 추가의 작용제를 추가로 포함하는 조성물.
- 조합 요법에 의해 T 세포 반응을 증가시키기 위한 의약의 제조에 있어서, 증강제와 함께 투여되는, T 세포에서 억제 신호 전달을 감소시키는 화합물의 용도.
- 제60항에 있어서, T 세포에서 억제 신호 전달을 감소시키는 상기 화합물 및 상기 증강제가 상이한 시간에 투여하기 위한 별개의 의약으로서 제공되는 것인 용도.
- 제61항에 있어서, 증강제가 억제성 화합물 투여 전에 24시간 이내에 투여되는 것인 용도.
- 감염성 질환의 치료에서 제60항에 따른 화합물 및 증강제의 용도.
- 암의 치료에서 제60항에 따른 화합물 및 증강제의 용도.
- 제64항에 있어서, 상기 암이 방광암, 뇌암, 유방암, 자궁경부암, 결장직장암, 식도암, 신장암, 간암, 폐암, 비인두암, 췌장암, 전립선암, 피부암, 위암, 자궁암, 난소암, 고환암, 또는 혈액암인 용도.
- 감염성 질환의 치료에서 제60항에 따른 화합물 및 증강제의 용도.
- (a) T 세포에서 억제 신호 전달을 감소시키는 화합물의 투여 공급물,
(b) 증강제의 공급물;
(c) 제약상 허용되는 담체의 공급물; 및
(d) 제59 내지 64항에 따른 용도로 화합물을 투여하기 위한 인쇄된 지시서
를 포함하는, T 세포에서 억제 신호 전달을 감소시키는 화합물을 증강제와 조합하여 투여하기 위한 의료용 키트. - 제1항에 있어서, 상기 화합물이 B7-DC, B7-H1, PD-1, 또는 B7-1의 세포외 도메인, 또는 이들과 보존적 아미노산 치환만 상이한 폴리펩티드, 및 이들의 단편으로 이루어지는 것인 방법.
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US9170508P | 2008-08-25 | 2008-08-25 | |
| US9169408P | 2008-08-25 | 2008-08-25 | |
| US9170908P | 2008-08-25 | 2008-08-25 | |
| US61/091,709 | 2008-08-25 | ||
| US61/091,694 | 2008-08-25 | ||
| US61/091,705 | 2008-08-25 | ||
| US21169709P | 2009-04-02 | 2009-04-02 | |
| US61/211,697 | 2009-04-02 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110050529A true KR20110050529A (ko) | 2011-05-13 |
Family
ID=41725778
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117006754A KR20110050529A (ko) | 2008-08-25 | 2009-08-25 | Pd-1 길항제의 조성물 및 사용 방법 |
Country Status (28)
| Country | Link |
|---|---|
| US (4) | US8114845B2 (ko) |
| EP (2) | EP2927240A1 (ko) |
| JP (1) | JP5798919B2 (ko) |
| KR (1) | KR20110050529A (ko) |
| CN (1) | CN102203132A (ko) |
| AU (1) | AU2009288730B2 (ko) |
| CA (1) | CA2734908A1 (ko) |
| CL (1) | CL2011000423A1 (ko) |
| CO (1) | CO6341574A2 (ko) |
| CY (1) | CY1116816T1 (ko) |
| DK (1) | DK2350129T3 (ko) |
| DO (1) | DOP2011000059A (ko) |
| EA (2) | EA023148B1 (ko) |
| ES (1) | ES2545609T3 (ko) |
| HR (1) | HRP20150933T1 (ko) |
| HU (1) | HUE027525T2 (ko) |
| IL (1) | IL211298A0 (ko) |
| MA (1) | MA32646B1 (ko) |
| MX (1) | MX2011002252A (ko) |
| NZ (1) | NZ591130A (ko) |
| PE (1) | PE20110435A1 (ko) |
| PL (1) | PL2350129T3 (ko) |
| PT (1) | PT2350129E (ko) |
| RS (1) | RS54233B1 (ko) |
| SI (1) | SI2350129T1 (ko) |
| SM (1) | SMT201500212B (ko) |
| WO (1) | WO2010027423A2 (ko) |
| ZA (1) | ZA201101120B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150027135A (ko) * | 2012-05-31 | 2015-03-11 | 제넨테크, 인크. | Pd-l1 축 결합 길항제 및 vegf 길항제를 사용하여 암을 치료하는 방법 |
Families Citing this family (562)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001039722A2 (en) | 1999-11-30 | 2001-06-07 | Mayo Foundation For Medical Education And Research | B7-h1, a novel immunoregulatory molecule |
| US7030219B2 (en) | 2000-04-28 | 2006-04-18 | Johns Hopkins University | B7-DC, Dendritic cell co-stimulatory molecules |
| US7432351B1 (en) | 2002-10-04 | 2008-10-07 | Mayo Foundation For Medical Education And Research | B7-H1 variants |
| PL1810026T3 (pl) | 2004-10-06 | 2018-08-31 | Mayo Foundation For Medical Education And Research | B7-H1 i PD-1 w leczeniu raka nerkowokomórkowego |
| EP2439273B1 (en) * | 2005-05-09 | 2019-02-27 | Ono Pharmaceutical Co., Ltd. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| CA2631812C (en) | 2005-12-02 | 2023-08-29 | Peter Palese | Chimeric viruses presenting non-native surface proteins and uses thereof |
| US8067237B2 (en) | 2005-12-13 | 2011-11-29 | President And Fellows Of Harvard College | Scaffolds for cell transplantation |
| CN101784564B (zh) | 2007-07-13 | 2014-07-02 | 约翰霍普金斯大学 | B7-dc变体 |
| JP2012500855A (ja) * | 2008-08-25 | 2012-01-12 | アンプリミューン、インコーポレーテッド | Pd−1アンタゴニストおよび感染性疾患を処置するための方法 |
| PL2350129T3 (pl) | 2008-08-25 | 2015-12-31 | Amplimmune Inc | Kompozycje antagonistów PD-1 i sposoby stosowania |
| KR20190069615A (ko) | 2008-12-09 | 2019-06-19 | 제넨테크, 인크. | 항-pd-l1 항체 및 t 세포 기능을 향상시키기 위한 그의 용도 |
| JP2013512251A (ja) * | 2009-11-24 | 2013-04-11 | アンプリミューン、インコーポレーテッド | Pd−l1/pd−l2の同時阻害 |
| US8993524B2 (en) | 2010-03-05 | 2015-03-31 | The Johns Hopkins University | Compositions and methods for targeted immunomodulatory antibodies and fusion proteins |
| US8906374B2 (en) | 2010-04-20 | 2014-12-09 | Cedars-Sinai Medical Center | Combination therapy with CD4 lymphocyte depletion and mTOR inhibitors |
| US8907053B2 (en) | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| US9783578B2 (en) | 2010-06-25 | 2017-10-10 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| WO2012018538A2 (en) * | 2010-07-26 | 2012-02-09 | Schering Corporation | Bioassays for determining pd-1 modulation |
| DK2624873T3 (da) | 2010-10-06 | 2020-03-02 | Harvard College | Injicerbare, pore-dannende hydrogeler til materiale-baserede celleterapier |
| CN107090029B (zh) * | 2010-11-11 | 2021-07-13 | 港大科桥有限公司 | 可溶性 pd-1变体、融合构建体及其用途 |
| EP2701699B1 (en) | 2011-04-28 | 2019-10-16 | The Broad Institute, Inc. | Inhibitors of histone deacetylase |
| CN102298053B (zh) * | 2011-05-20 | 2014-01-29 | 中山大学肿瘤防治中心 | 原发性肝细胞肝癌术后复发风险评估的组合抗体试剂盒 |
| WO2012168944A1 (en) * | 2011-06-08 | 2012-12-13 | Aurigene Discovery Technologies Limited | Therapeutic compounds for immunomodulation |
| WO2012177788A1 (en) * | 2011-06-20 | 2012-12-27 | La Jolla Institute For Allergy And Immunology | Modulators of 4-1bb and immune responses |
| AU2012275390A1 (en) | 2011-06-28 | 2014-01-16 | Whitehead Institute For Biomedical Research | Using sortases to install click chemistry handles for protein ligation |
| WO2013019906A1 (en) | 2011-08-01 | 2013-02-07 | Genentech, Inc. | Methods of treating cancer using pd-1 axis binding antagonists and mek inhibitors |
| GB201120527D0 (en) * | 2011-11-29 | 2012-01-11 | Ucl Business Plc | Method |
| SG11201404313YA (en) | 2012-01-25 | 2014-10-30 | Dnatrix Inc | Biomarkers and combination therapies using oncolytic virus and immunomodulation |
| WO2013155487A1 (en) | 2012-04-12 | 2013-10-17 | Yale University | Vehicles for controlled delivery of different pharmaceutical agents |
| CA2870309C (en) | 2012-04-16 | 2024-02-20 | President And Fellows Of Harvard College | Mesoporous silica compositions for modulating immune responses |
| EA201492222A1 (ru) | 2012-05-25 | 2015-05-29 | Селлектис | Способы конструирования неаллореактивной и устойчивой к иммуносупрессии т-клетки для иммунотерапии |
| AR091649A1 (es) | 2012-07-02 | 2015-02-18 | Bristol Myers Squibb Co | Optimizacion de anticuerpos que se fijan al gen de activacion de linfocitos 3 (lag-3) y sus usos |
| US9790184B2 (en) | 2012-07-27 | 2017-10-17 | The Broad Institute, Inc. | Inhibitors of histone deacetylase |
| US20150250837A1 (en) * | 2012-09-20 | 2015-09-10 | Morningside Technology Ventures Ltd. | Oncolytic virus encoding pd-1 binding agents and uses of the same |
| ES2824024T3 (es) | 2012-10-10 | 2021-05-11 | Sangamo Therapeutics Inc | Compuestos modificadores de células T y usos de los mismos |
| WO2014121085A1 (en) | 2013-01-31 | 2014-08-07 | Thomas Jefferson University | Pd-l1 and pd-l2-based fusion proteins and uses thereof |
| EP2954327A1 (en) * | 2013-02-07 | 2015-12-16 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting the survival time of patients suffering from diffuse large b-cell lymphomas |
| EP2958942B1 (en) | 2013-02-20 | 2020-06-03 | Novartis AG | Effective targeting of primary human leukemia using anti-cd123 chimeric antigen receptor engineered t cells |
| US9394368B2 (en) | 2013-02-20 | 2016-07-19 | Novartis Ag | Treatment of cancer using humanized anti-EGFRvIII chimeric antigen receptor |
| AU2014220957A1 (en) | 2013-02-22 | 2015-07-30 | Curevac Ag | Combination of vaccination and inhibition of the PD-1 pathway |
| DK3292873T3 (da) | 2013-02-22 | 2019-06-03 | Curevac Ag | Kombination af vaccination og hæmning af PD-1-vejen |
| US20160017011A1 (en) * | 2013-02-26 | 2016-01-21 | Rongfu Wang | Phf20 and jmjd3 compositions and methods of use in cancer immunotherapy |
| US9302005B2 (en) | 2013-03-14 | 2016-04-05 | Mayo Foundation For Medical Education And Research | Methods and materials for treating cancer |
| MX2015011886A (es) | 2013-03-14 | 2016-05-31 | Icahn School Med Mount Sinai | Virus de la enfermedad de newcastle y usos de los mismos. |
| UY35468A (es) | 2013-03-16 | 2014-10-31 | Novartis Ag | Tratamiento de cáncer utilizando un receptor quimérico de antígeno anti-cd19 |
| BR112015025852A2 (pt) | 2013-04-09 | 2017-07-25 | Lixte Biotechnology Inc | as formulações de oxabicicloheptanos e oxabicicloheptenos |
| CA2910278C (en) | 2013-05-02 | 2021-09-28 | Anaptysbio, Inc. | Antibodies directed against programmed death-1 (pd-1) |
| ES2901383T3 (es) | 2013-05-10 | 2022-03-22 | Whitehead Inst Biomedical Res | Producción in vitro de glóbulos rojos con proteínas marcables con sortasa |
| JP6603209B2 (ja) | 2013-05-10 | 2019-11-06 | ホワイトヘッド・インスティテュート・フォー・バイオメディカル・リサーチ | ソルターゼ(Sortase)を用いた生存細胞のタンパク質修飾 |
| US11311575B2 (en) | 2013-05-13 | 2022-04-26 | Cellectis | Methods for engineering highly active T cell for immunotherapy |
| US11077144B2 (en) | 2013-05-13 | 2021-08-03 | Cellectis | CD19 specific chimeric antigen receptor and uses thereof |
| WO2014194293A1 (en) | 2013-05-30 | 2014-12-04 | Amplimmune, Inc. | Improved methods for the selection of patients for pd-1 or b7-h4 targeted therapies, and combination therapies thereof |
| US9452217B2 (en) * | 2013-06-22 | 2016-09-27 | Nitor Therapeutics | Methods for potentiating immune response for the treatment of infectious diseases and cancer |
| JP6794255B2 (ja) | 2013-08-08 | 2020-12-02 | サイチューン ファーマ | 組合せ医薬組成物 |
| KR102364523B1 (ko) | 2013-08-08 | 2022-02-18 | 싸이튠 파마 | Il―15 및 il―15r 알파 스시 도메인 기반 모듈로카인 |
| AR097306A1 (es) * | 2013-08-20 | 2016-03-02 | Merck Sharp & Dohme | Modulación de la inmunidad tumoral |
| BR122023024195A2 (pt) | 2013-09-20 | 2023-12-26 | Bristol-Myers Squibb Company | Usos de anticorpos anti-lag-3 e anticorpos anti-pd-1 |
| EP3757130A1 (en) | 2013-09-26 | 2020-12-30 | Costim Pharmaceuticals Inc. | Methods for treating hematologic cancers |
| ES2714708T3 (es) | 2013-10-01 | 2019-05-29 | Mayo Found Medical Education & Res | Procedimientos para el tratamiento de cáncer en pacientes con niveles elevados de Bim |
| WO2015066413A1 (en) | 2013-11-01 | 2015-05-07 | Novartis Ag | Oxazolidinone hydroxamic acid compounds for the treatment of bacterial infections |
| JP6845691B2 (ja) | 2013-11-01 | 2021-03-24 | イェール ユニバーシティーYale University | 免疫療法のための調節粒子 |
| US10556024B2 (en) | 2013-11-13 | 2020-02-11 | Whitehead Institute For Biomedical Research | 18F labeling of proteins using sortases |
| CN105899232A (zh) | 2013-11-13 | 2016-08-24 | 诺华股份有限公司 | 用于增强免疫应答的mTOR抑制剂 |
| US10344090B2 (en) | 2013-12-12 | 2019-07-09 | Shanghai Hangrui Pharmaceutical Co., Ltd. | PD-1 antibody, antigen-binding fragment thereof, and medical application thereof |
| MX2016007965A (es) * | 2013-12-17 | 2016-10-28 | Genentech Inc | Terapia de combinacion que comprende agonistas de union a ox40 y antagonistas de union al eje pd-1. |
| CA2931684C (en) | 2013-12-19 | 2024-02-20 | Novartis Ag | Human mesothelin chimeric antigen receptors and uses thereof |
| WO2015100219A1 (en) * | 2013-12-23 | 2015-07-02 | Oncomed Pharmaceuticals, Inc. | Immunotherapy with binding agents |
| AU2015203904B2 (en) * | 2014-01-06 | 2018-07-19 | Expression Pathology, Inc. | SRM assay for PD-L1 |
| CA3156357A1 (en) * | 2014-01-06 | 2015-07-09 | The Trustees Of The University Of Pennsylvania | Pd1 and pdl1 antibodies and vaccine combinations and use of same for immunotherapy |
| JO3517B1 (ar) | 2014-01-17 | 2020-07-05 | Novartis Ag | ان-ازاسبيرو الكان حلقي كبديل مركبات اريل-ان مغايرة وتركيبات لتثبيط نشاط shp2 |
| TWI681969B (zh) | 2014-01-23 | 2020-01-11 | 美商再生元醫藥公司 | 針對pd-1的人類抗體 |
| TWI680138B (zh) | 2014-01-23 | 2019-12-21 | 美商再生元醫藥公司 | 抗pd-l1之人類抗體 |
| JOP20200094A1 (ar) | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| JOP20200096A1 (ar) | 2014-01-31 | 2017-06-16 | Children’S Medical Center Corp | جزيئات جسم مضاد لـ tim-3 واستخداماتها |
| EP3102233A4 (en) * | 2014-02-05 | 2017-11-22 | Cedars-Sinai Medical Center | Methods and compositions for treating cancer and infectious diseases |
| KR102407019B1 (ko) | 2014-02-27 | 2022-06-08 | 머크 샤프 앤드 돔 코포레이션 | 암의 치료를 위한 결합 방법 |
| EP3572430A3 (en) * | 2014-03-05 | 2020-02-12 | Bristol-Myers Squibb Company | Treatment of renal cancer using a combination of an anti-pd-1 antibody and another anti-cancer agent |
| CN106687125B (zh) | 2014-03-12 | 2021-12-14 | 耶达研究与开发有限公司 | 降低系统性调节性t细胞水平或活性来治疗cns疾病和损伤 |
| US10519237B2 (en) | 2014-03-12 | 2019-12-31 | Yeda Research And Development Co. Ltd | Reducing systemic regulatory T cell levels or activity for treatment of disease and injury of the CNS |
| US10618963B2 (en) | 2014-03-12 | 2020-04-14 | Yeda Research And Development Co. Ltd | Reducing systemic regulatory T cell levels or activity for treatment of disease and injury of the CNS |
| US9394365B1 (en) | 2014-03-12 | 2016-07-19 | Yeda Research And Development Co., Ltd | Reducing systemic regulatory T cell levels or activity for treatment of alzheimer's disease |
| CA2935878C (en) | 2014-03-12 | 2023-05-02 | Curevac Ag | Combination of vaccination and ox40 agonists |
| BR122024001145A2 (pt) | 2014-03-14 | 2024-02-27 | Novartis Ag | Molécula de anticorpo isolada capaz de se ligar a lag-3, seu método de produção, composição farmacêutica, ácidos nucleicos, vetor de expressão, método para detecção de lag-3 em uma amostra biológica, e uso das referidas molécula de anticorpo e composição |
| US20170335281A1 (en) | 2014-03-15 | 2017-11-23 | Novartis Ag | Treatment of cancer using chimeric antigen receptor |
| CU24441B1 (es) | 2014-03-24 | 2019-09-04 | Novartis Ag | Compuestos orgánicos de monobactam para el tratamiento de infecciones bacterianas |
| RU2016142476A (ru) | 2014-03-31 | 2018-05-07 | Дженентек, Инк. | Комбинированная терапия, включающая антиангиогенезные агенты и агонисты, связывающие ох40 |
| IL307423A (en) | 2014-04-07 | 2023-12-01 | Novartis Ag | Cancer treatment using chimeric antigen receptor (CAR) against CD19 |
| CN107073090A (zh) | 2014-04-30 | 2017-08-18 | 哈佛学院董事会 | 结合的疫苗装置和杀死癌细胞的方法 |
| KR20170003692A (ko) | 2014-05-15 | 2017-01-09 | 브리스톨-마이어스 스큅 컴퍼니 | 항-pd-1 항체 및 또 다른 항암제의 조합물을 사용한 폐암의 치료 |
| US10302653B2 (en) | 2014-05-22 | 2019-05-28 | Mayo Foundation For Medical Education And Research | Distinguishing antagonistic and agonistic anti B7-H1 antibodies |
| RS61678B1 (sr) | 2014-05-28 | 2021-05-31 | Agenus Inc | Anti-gitr antitela i postupci za njihovu primenu |
| TWI693232B (zh) | 2014-06-26 | 2020-05-11 | 美商宏觀基因股份有限公司 | 與pd-1和lag-3具有免疫反應性的共價結合的雙抗體和其使用方法 |
| EP3563870A1 (en) | 2014-07-15 | 2019-11-06 | F. Hoffmann-La Roche AG | Methods of treating cancer using pd-1 axis binding antagonists and mek inhibitors |
| US11542488B2 (en) | 2014-07-21 | 2023-01-03 | Novartis Ag | Sortase synthesized chimeric antigen receptors |
| WO2016014530A1 (en) | 2014-07-21 | 2016-01-28 | Novartis Ag | Combinations of low, immune enhancing. doses of mtor inhibitors and cars |
| EP3722316A1 (en) | 2014-07-21 | 2020-10-14 | Novartis AG | Treatment of cancer using a cd33 chimeric antigen receptor |
| EP3171896A4 (en) | 2014-07-23 | 2018-03-21 | Mayo Foundation for Medical Education and Research | Targeting dna-pkcs and b7-h1 to treat cancer |
| EP4205749A1 (en) | 2014-07-31 | 2023-07-05 | Novartis AG | Subset-optimized chimeric antigen receptor-containing cells |
| EP3177593A1 (en) | 2014-08-06 | 2017-06-14 | Novartis AG | Quinolone derivatives as antibacterials |
| CN106687124B (zh) * | 2014-08-07 | 2022-03-15 | 冈村春树 | 并用il-18与分子靶向抗体的癌治疗药 |
| US10800830B2 (en) * | 2014-08-08 | 2020-10-13 | The Board Of Trustees Of The Leland Stanford Junior University | High affinity PD-1 agents and methods of use |
| WO2016025880A1 (en) | 2014-08-14 | 2016-02-18 | Novartis Ag | Treatment of cancer using gfr alpha-4 chimeric antigen receptor |
| CN112410363A (zh) | 2014-08-19 | 2021-02-26 | 诺华股份有限公司 | 抗cd123嵌合抗原受体(car)用于癌症治疗 |
| CA2960824A1 (en) | 2014-09-13 | 2016-03-17 | Novartis Ag | Combination therapies of alk inhibitors |
| EP3193931B1 (en) * | 2014-09-16 | 2020-08-05 | Innate Pharma | Neutralization of inhibitory pathways in lymphocytes |
| US10577417B2 (en) | 2014-09-17 | 2020-03-03 | Novartis Ag | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| US9616114B1 (en) | 2014-09-18 | 2017-04-11 | David Gordon Bermudes | Modified bacteria having improved pharmacokinetics and tumor colonization enhancing antitumor activity |
| US10053683B2 (en) | 2014-10-03 | 2018-08-21 | Whitehead Institute For Biomedical Research | Intercellular labeling of ligand-receptor interactions |
| WO2016054555A2 (en) | 2014-10-03 | 2016-04-07 | Novartis Ag | Combination therapies |
| RU2743657C2 (ru) | 2014-10-08 | 2021-02-20 | Новартис Аг | Биомаркеры, прогнозирующие способность к терапевтическому ответу на терапию химерным рецептором антигена, и их применение |
| MA41044A (fr) | 2014-10-08 | 2017-08-15 | Novartis Ag | Compositions et procédés d'utilisation pour une réponse immunitaire accrue et traitement contre le cancer |
| ES2952717T3 (es) | 2014-10-14 | 2023-11-03 | Novartis Ag | Moléculas de anticuerpos contra PD-L1 y usos de las mismas |
| NZ732211A (en) * | 2014-10-24 | 2020-04-24 | Calidi Biotherapeutics Inc | Combination immunotherapy approach for treatment of cancer |
| PL3212670T3 (pl) | 2014-10-29 | 2021-06-14 | Five Prime Therapeutics, Inc. | Leczenie skojarzone nowotworów |
| ES2875338T3 (es) * | 2014-11-06 | 2021-11-10 | Hibercell Inc | Métodos de beta-glucano y composiciones que afectan al microentorno tumoral |
| CA2966660A1 (en) | 2014-11-13 | 2016-05-19 | The Johns Hopkins University | Checkpoint blockade and microsatellite instability |
| CN108064244B (zh) | 2014-11-14 | 2021-09-17 | 诺华股份有限公司 | 抗体药物缀合物 |
| WO2016089873A1 (en) * | 2014-12-02 | 2016-06-09 | Celgene Corporation | Combination therapies |
| US20180334490A1 (en) | 2014-12-03 | 2018-11-22 | Qilong H. Wu | Methods for b cell preconditioning in car therapy |
| WO2016094273A1 (en) | 2014-12-08 | 2016-06-16 | Dana-Farber Cancer Institute, Inc. | Methods for upregulating immune responses using combinations of anti-rgmb and anti-pd-1 agents |
| TWI595006B (zh) | 2014-12-09 | 2017-08-11 | 禮納特神經系統科學公司 | 抗pd-1抗體類和使用彼等之方法 |
| RU2726996C1 (ru) * | 2014-12-16 | 2020-07-17 | Бристол-Маерс Сквибб Компани | Применение ингибиторов иммунных контрольных точек при новообразованиях центральной нервной системы |
| CN107001295B (zh) | 2014-12-16 | 2021-02-02 | 诺华股份有限公司 | 作为LpxC抑制剂的异噁唑异羟肟酸化合物 |
| US20170340733A1 (en) | 2014-12-19 | 2017-11-30 | Novartis Ag | Combination therapies |
| CN105983097B (zh) * | 2015-01-28 | 2021-06-08 | 华中科技大学同济医学院附属协和医院 | 一种抗肿瘤制剂及其制备方法 |
| CA3012602A1 (en) * | 2015-01-30 | 2016-08-04 | President And Fellows Of Harvard College | Peritumoral and intratumoral materials for cancer therapy |
| US11161907B2 (en) | 2015-02-02 | 2021-11-02 | Novartis Ag | Car-expressing cells against multiple tumor antigens and uses thereof |
| EP4151231A1 (en) * | 2015-02-13 | 2023-03-22 | Sorrento Therapeutics, Inc. | Antibody therapeutics that bind ctla4 |
| IL278423B2 (en) * | 2015-02-26 | 2024-04-01 | Merck Patent Gmbh | Fidi-1 / Fidi-AL1 inhibitors for cancer treatment |
| MX2017011597A (es) | 2015-03-10 | 2018-05-11 | Aduro Biotech Inc | Composiciones y metodos para activar la señalizacion dependiente del "estimulador del gen de interferon". |
| AU2016236270B2 (en) | 2015-03-23 | 2022-01-27 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Anti-CEACAM6 antibodies and uses thereof |
| ES2876974T3 (es) | 2015-04-07 | 2021-11-15 | Novartis Ag | Combinación de terapia con receptor de antígeno quimérico y derivados de amino pirimidina |
| EP3280464A4 (en) | 2015-04-10 | 2018-09-26 | President and Fellows of Harvard College | Immune cell trapping devices and methods for making and using the same |
| GB201506411D0 (en) | 2015-04-15 | 2015-05-27 | Bergenbio As | Humanized anti-axl antibodies |
| DK3283508T3 (en) | 2015-04-17 | 2021-05-31 | Alpine Immune Sciences Inc | Immunomodulatory Proteins with Tunable Affinities |
| JP6949718B2 (ja) | 2015-04-17 | 2021-10-13 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 抗pd−1抗体と他の抗体の組み合わせを含む組成物 |
| US11896614B2 (en) | 2015-04-17 | 2024-02-13 | Novartis Ag | Methods for improving the efficacy and expansion of chimeric antigen receptor-expressing cells |
| WO2016172583A1 (en) | 2015-04-23 | 2016-10-27 | Novartis Ag | Treatment of cancer using chimeric antigen receptor and protein kinase a blocker |
| US20160362489A1 (en) | 2015-04-28 | 2016-12-15 | Bristol-Myers Squibb Company | Treatment of PD-L1-Positive Melanoma Using an Anti-PD-1 Antibody |
| KR20170138555A (ko) | 2015-04-28 | 2017-12-15 | 브리스톨-마이어스 스큅 컴퍼니 | 항-pd-1 항체 및 항-ctla-4 항체를 사용한 pd-l1-음성 흑색종의 치료 |
| IL274151B (en) | 2015-05-21 | 2022-07-01 | Harpoon Therapeutics Inc | Trispecific binding proteins and methods of use |
| WO2016191751A1 (en) | 2015-05-28 | 2016-12-01 | Bristol-Myers Squibb Company | Treatment of pd-l1 positive lung cancer using an anti-pd-1 antibody |
| WO2016196237A1 (en) | 2015-05-29 | 2016-12-08 | Agenus Inc. | Anti-ctla-4 antibodies and methods of use thereof |
| US11078278B2 (en) | 2015-05-29 | 2021-08-03 | Bristol-Myers Squibb Company | Treatment of renal cell carcinoma |
| TW201709929A (zh) | 2015-06-12 | 2017-03-16 | 宏觀基因股份有限公司 | 治療癌症的聯合療法 |
| EP3310813A1 (en) | 2015-06-17 | 2018-04-25 | Novartis AG | Antibody drug conjugates |
| MA42447A (fr) | 2015-07-13 | 2018-05-23 | Cytomx Therapeutics Inc | Anticorps anti-pd-1, anticorps anti-pd-1 activables, et leurs procédés d'utilisation |
| US10544224B2 (en) | 2015-07-14 | 2020-01-28 | Bristol-Myers Squibb Company | Method of treating cancer using immune checkpoint inhibitor |
| RU2711380C2 (ru) | 2015-07-16 | 2020-01-16 | Байоксэл Терапьютикс, Инк. | Новый подход к лечению рака с применением иммуномодуляции |
| US10682390B2 (en) | 2015-07-16 | 2020-06-16 | Biokine Therapeutics Ltd. | Compositions and methods for treating cancer |
| CA2992551A1 (en) | 2015-07-21 | 2017-01-26 | Novartis Ag | Methods for improving the efficacy and expansion of immune cells |
| WO2017019896A1 (en) | 2015-07-29 | 2017-02-02 | Novartis Ag | Combination therapies comprising antibody molecules to pd-1 |
| KR20180034426A (ko) | 2015-07-29 | 2018-04-04 | 노파르티스 아게 | 암의 치료에서의 항 pd-1 및 항 m-csf 항체의 조합 용도 |
| EP3317301B1 (en) | 2015-07-29 | 2021-04-07 | Novartis AG | Combination therapies comprising antibody molecules to lag-3 |
| BR112018001640A2 (pt) | 2015-07-29 | 2018-09-18 | Novartis Ag | combinação de antagonista da pd-1 com um inibidor de egfr |
| EP3316902A1 (en) | 2015-07-29 | 2018-05-09 | Novartis AG | Combination therapies comprising antibody molecules to tim-3 |
| CN108976300B (zh) | 2015-07-30 | 2023-04-14 | 宏观基因有限公司 | Pd-1结合分子和其使用方法 |
| US10660954B2 (en) | 2015-07-31 | 2020-05-26 | University Of Florida Research Foundation, Incorporated | Hematopoietic stem cells in combinatorial therapy with immune checkpoint inhibitors against cancer |
| EP3331901A1 (en) | 2015-08-07 | 2018-06-13 | Pieris Pharmaceuticals GmbH | Novel fusion polypeptide specific for lag-3 and pd-1 |
| AU2016306090B2 (en) | 2015-08-11 | 2019-05-02 | Novartis Ag | 5-bromo-2,6-di-(1H-pyrazol-l-yl)pyrimidin-4-amine for use in the treatment of cancer |
| CN115212301A (zh) | 2015-08-11 | 2022-10-21 | 卡利迪生物治疗有限公司 | 用以癌症治疗的天花疫苗 |
| EP3344996A2 (en) | 2015-09-03 | 2018-07-11 | The Trustees Of The University Of Pennsylvania | Biomarkers predictive of cytokine release syndrome |
| ES2941968T3 (es) | 2015-10-01 | 2023-05-29 | The Whitehead Institute For Biomedical Res | Marcaje de anticuerpos |
| MX2018003629A (es) | 2015-10-02 | 2018-08-01 | Hoffmann La Roche | Anticuerpos anti-pd1 y metodos de uso. |
| JP6622392B2 (ja) | 2015-10-02 | 2019-12-18 | エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト | Pd1とtim3に特異的な二重特異性抗体 |
| JP7320944B2 (ja) | 2015-10-08 | 2023-08-04 | マクロジェニクス,インコーポレーテッド | B7‐h3に特異的に結合する分子及びpd‐1に特異的に結合する分子 |
| WO2017066561A2 (en) | 2015-10-16 | 2017-04-20 | President And Fellows Of Harvard College | Regulatory t cell pd-1 modulation for regulating t cell effector immune responses |
| EP3365062B1 (en) | 2015-10-19 | 2024-09-18 | CG Oncology, Inc. | Methods of treating solid or lymphatic tumors by combination therapy |
| MA44334A (fr) | 2015-10-29 | 2018-09-05 | Novartis Ag | Conjugués d'anticorps comprenant un agoniste du récepteur de type toll |
| US10875923B2 (en) | 2015-10-30 | 2020-12-29 | Mayo Foundation For Medical Education And Research | Antibodies to B7-H1 |
| CR20180306A (es) | 2015-11-02 | 2018-10-16 | Five Prime Therapeutics Inc | Polipéptidos del dominio extracelular de cd80 y su uso en el tratamiento del cáncer |
| US11702477B2 (en) | 2015-11-06 | 2023-07-18 | Orionis Biosciences BV | Bi-functional chimeric proteins and uses thereof |
| TWI795347B (zh) | 2015-11-18 | 2023-03-11 | 美商必治妥施貴寶公司 | 使用抗pd-1抗體與抗ctla-4抗體之組合以治療肺癌 |
| CN108368174B (zh) | 2015-11-23 | 2023-04-14 | 戊瑞治疗有限公司 | 用于癌症治疗的单独fgfr2抑制剂或与免疫刺激剂的组合 |
| IL299072A (en) | 2015-12-02 | 2023-02-01 | Memorial Sloan Kettering Cancer Center | Antibodies and methods for using them |
| US10590169B2 (en) * | 2015-12-09 | 2020-03-17 | Virogin Biotech Canada Ltd | Compositions and methods for inhibiting CD279 interactions |
| KR102424513B1 (ko) | 2015-12-14 | 2022-07-25 | 마크로제닉스, 인크. | Pd-1 및 ctla-4과의 면역반응성을 가진 이중특이적 분자, 및 이것의 사용 방법 |
| US20180371093A1 (en) | 2015-12-17 | 2018-12-27 | Novartis Ag | Antibody molecules to pd-1 and uses thereof |
| US10392442B2 (en) | 2015-12-17 | 2019-08-27 | Bristol-Myers Squibb Company | Use of anti-PD-1 antibody in combination with anti-CD27 antibody in cancer treatment |
| CA3008102A1 (en) | 2015-12-18 | 2017-06-22 | Novartis Ag | Antibodies targeting cd32b and methods of use thereof |
| CN109069597A (zh) | 2015-12-22 | 2018-12-21 | 诺华股份有限公司 | 间皮素嵌合抗原受体(car)和抗pd-l1抗体抑制剂联用于抗癌治疗 |
| MX2018007613A (es) | 2015-12-22 | 2018-09-21 | Regeneron Pharma | Combinacion de anticuerpos anti proteina 1 de muerte celular (pd1) y anticuerpos anti grupo de diferenciacion 20 (cd20)/anti grupo de diferenciacion (cd3) biespecificos para tratar el cancer. |
| DK3394093T3 (da) | 2015-12-23 | 2022-04-19 | Modernatx Inc | Fremgangsmåder til anvendelse af ox40-ligand-kodende polynukleotider |
| WO2017122203A1 (en) | 2016-01-11 | 2017-07-20 | Technion Research & Development Foundation Limited | Methods of determining prognosis of sepsis and treating same |
| IL260218B2 (en) | 2016-01-11 | 2023-04-01 | Novartis Ag | Humanized monoclonal antibodies that elicit an immune response against interleukin-2, and their fusion proteins |
| CN109071627B (zh) | 2016-02-05 | 2023-04-04 | 奥里尼斯生物科学私人有限公司 | Cd8结合剂 |
| WO2017136837A1 (en) | 2016-02-06 | 2017-08-10 | President And Fellows Of Harvard College | Recapitulating the hematopoietic niche to reconstitute immunity |
| US9845325B2 (en) | 2016-02-19 | 2017-12-19 | Novartis Ag | Tetracyclic pyridone compounds as antivirals |
| CN109476731A (zh) | 2016-02-29 | 2019-03-15 | 基础医药有限公司 | 治疗癌症的方法 |
| WO2017149515A1 (en) | 2016-03-04 | 2017-09-08 | Novartis Ag | Cells expressing multiple chimeric antigen receptor (car) molecules and uses therefore |
| WO2017155981A1 (en) | 2016-03-07 | 2017-09-14 | Massachusetts Institute Of Technology | Protein-chaperoned t-cell vaccines |
| EP3426271A4 (en) | 2016-03-10 | 2019-10-16 | Cold Genesys, Inc. | METHODS OF TREATING SOLID OR LYMPHATIC TUMORS BY POLYTHERAPY |
| AU2017238054B2 (en) | 2016-03-21 | 2023-10-19 | Dana-Farber Cancer Institute, Inc. | T-cell exhaustion state-specific gene expression regulators and uses thereof |
| CN109311885A (zh) | 2016-03-24 | 2019-02-05 | 诺华股份有限公司 | 炔基核苷类似物作为人类鼻病毒的抑制剂 |
| US11209441B2 (en) | 2016-04-05 | 2021-12-28 | Bristol-Myers Squibb Company | Cytokine profiling analysis |
| WO2017178572A1 (en) | 2016-04-13 | 2017-10-19 | Vivia Biotech, S.L | Ex vivo bite-activated t cells |
| NZ746934A (en) | 2016-04-15 | 2023-11-24 | Alpine Immune Sciences Inc | Cd80 variant immunomodulatory proteins and uses thereof |
| EP3243832A1 (en) | 2016-05-13 | 2017-11-15 | F. Hoffmann-La Roche AG | Antigen binding molecules comprising a tnf family ligand trimer and pd1 binding moiety |
| CA3023883A1 (en) | 2016-05-13 | 2017-11-16 | Orionis Biosciences Nv | Targeted mutant interferon-beta and uses thereof |
| CA3023881A1 (en) | 2016-05-13 | 2017-11-16 | Orionis Biosciences Nv | Therapeutic targeting of non-cellular structures |
| TW202408578A (zh) | 2016-05-13 | 2024-03-01 | 美商再生元醫藥公司 | 藉由投予pd-1抑制劑治療皮膚癌之方法 |
| JP7194594B2 (ja) | 2016-05-18 | 2022-12-22 | モデルナティエックス インコーポレイテッド | 免疫調節ポリペプチドをコードするmRNAの組み合わせ及びその使用 |
| JP2019519516A (ja) | 2016-05-18 | 2019-07-11 | モデルナティーエックス, インコーポレイテッド | がんの治療のためのmRNA併用療法 |
| LT3458083T (lt) | 2016-05-18 | 2023-02-10 | Modernatx, Inc. | Polinukleotidai, koduojantys interleukiną-12 (il12), ir jų naudojimas |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| MA45025A (fr) | 2016-05-20 | 2019-03-27 | Lilly Co Eli | Traitement d'association utilisant des inhibiteurs de notch et de pd-1 ou pd-l1 |
| KR20230091191A (ko) | 2016-05-27 | 2023-06-22 | 아게누스 인코포레이티드 | 항-tim-3 항체 및 이의 사용 방법 |
| SI3463457T1 (sl) | 2016-06-02 | 2023-09-29 | Bristol-Myers Squibb Company | Blokada pd-1 z nivolumabom pri refraktornem hodgkinovem limfomu |
| PT3464368T (pt) | 2016-06-02 | 2023-08-17 | Bristol Myers Squibb Co | Utilização de um anticorpo anti-pd-1 em combinação com um anticorpo anti-cd30 no tratamento de linfoma |
| ES2897964T3 (es) | 2016-06-03 | 2022-03-03 | Bristol Myers Squibb Co | Uso del anticuerpo anti-PD-1 en el tratamiento de pacientes con cáncer colorrectal |
| KR20230118713A (ko) | 2016-06-03 | 2023-08-11 | 브리스톨-마이어스 스큅 컴퍼니 | 종양을 치료하는 방법에 사용하기 위한 항-pd-1 항체 |
| JP2019517498A (ja) | 2016-06-03 | 2019-06-24 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 再発性小細胞肺癌の処置方法において使用するための抗pd−1抗体 |
| HUE050796T2 (hu) | 2016-06-14 | 2021-01-28 | Novartis Ag | (R)-4-(5-(ciklopropiletinil)izoxazol-3-il)-N-hidroxi-2-metil-2-(metilszulfonil)butánamid kristályos formája baktériumellenes szerként |
| WO2017216685A1 (en) | 2016-06-16 | 2017-12-21 | Novartis Ag | Pentacyclic pyridone compounds as antivirals |
| WO2017216686A1 (en) | 2016-06-16 | 2017-12-21 | Novartis Ag | 8,9-fused 2-oxo-6,7-dihydropyrido-isoquinoline compounds as antivirals |
| MX2018016227A (es) | 2016-06-24 | 2019-07-08 | Infinity Pharmaceuticals Inc | Terapias de combinacion. |
| EP3507367A4 (en) | 2016-07-05 | 2020-03-25 | Aduro BioTech, Inc. | CYCLIC DINUCLEOTID COMPOUNDS WITH INCLUDED NUCLEIC ACIDS AND USES THEREOF |
| CN115305229A (zh) | 2016-07-13 | 2022-11-08 | 哈佛学院院长等 | 抗原呈递细胞模拟支架及其制备和使用方法 |
| CA3031542A1 (en) | 2016-07-20 | 2018-01-25 | University Of Utah Research Foundation | Cd229 car t cells and methods of use thereof |
| BR112019001570A2 (pt) * | 2016-07-28 | 2019-07-09 | Novartis Ag | terapias de combinação de receptores de antígeno quiméricos e inibidores de pd-1 |
| JP2019525934A (ja) | 2016-07-29 | 2019-09-12 | イーライ リリー アンド カンパニー | 癌の治療に使用するためのメレスチニブおよび抗pd−l1または抗pd−1阻害剤を用いた組み合わせ治療 |
| EP3490548A4 (en) | 2016-08-01 | 2020-04-15 | Molecular Templates, Inc. | ADMINISTRATION OF HYPOXIA-ACTIVATED DRUGS IN COMBINATION WITH IMMUNOMODULATORS FOR THE TREATMENT OF CANCER |
| CN109789197A (zh) | 2016-08-03 | 2019-05-21 | 奈斯科尔公司 | 用于调节lair信号转导的组合物和方法 |
| WO2018027252A1 (en) * | 2016-08-11 | 2018-02-15 | The Council Of The Queensland Institute Of Medical Research | Immune-modulating compounds |
| WO2018037595A1 (ja) * | 2016-08-26 | 2018-03-01 | 哲治 奥野 | 微小血管血流低減剤およびその利用 |
| US20190218294A1 (en) | 2016-09-09 | 2019-07-18 | Bristol-Myers Squibb Company | Use of an anti-pd-1 antibody in combination with an anti-mesothelin antibody in cancer treatment |
| AU2017322501A1 (en) | 2016-09-09 | 2019-03-28 | Laboratoire Francais Du Fractionnement Et Des Biotechnologies | Combination of an anti-CD20 antibody, PI3 kinase-delta inhibitor, and anti-PD-1 or anti-PD-L1 antibody for treating hematological cancers |
| TW201811788A (zh) | 2016-09-09 | 2018-04-01 | 瑞士商諾華公司 | 作為抗病毒劑之多環吡啶酮化合物 |
| IL265179B2 (en) * | 2016-09-14 | 2024-02-01 | Abbvie Biotherapeutics Inc | Antibodies against PD-1 (CD27) |
| EP4360714A3 (en) | 2016-09-21 | 2024-07-24 | Nextcure, Inc. | Antibodies for siglec-15 and methods of use thereof |
| JP7069177B2 (ja) | 2016-09-21 | 2022-05-17 | ネクストキュア インコーポレイテッド | シグレック-15に対する抗体及びその使用方法 |
| AU2017332161B9 (en) | 2016-09-21 | 2024-08-22 | The United States Government As Represented By The Department Of Veterans Affairs | Chimeric antigen receptor (car) that targets chemokine receptor CCR4 and its use |
| WO2018057955A1 (en) | 2016-09-23 | 2018-03-29 | Elstar Therapeutics, Inc. | Multispecific antibody molecules comprising lambda and kappa light chains |
| JOP20190061A1 (ar) | 2016-09-28 | 2019-03-26 | Novartis Ag | مثبطات بيتا-لاكتاماز |
| CN117866991A (zh) | 2016-10-07 | 2024-04-12 | 诺华股份有限公司 | 用于治疗癌症的嵌合抗原受体 |
| MX2019003683A (es) | 2016-10-11 | 2019-08-22 | Agenus Inc | Anticuerpos anti gen 3 de activación linfocítica (lag 3 ) y métodos para usarlos. |
| WO2018071576A1 (en) | 2016-10-14 | 2018-04-19 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Treatment of tumors by inhibition of cd300f |
| WO2018073753A1 (en) | 2016-10-18 | 2018-04-26 | Novartis Ag | Fused tetracyclic pyridone compounds as antivirals |
| CN110114368B (zh) | 2016-10-24 | 2024-08-02 | 奥睿尼斯生物科学私人有限公司 | 靶向突变干扰素-γ及其用途 |
| JP7312106B2 (ja) * | 2016-10-27 | 2023-07-20 | アイオー バイオテック エーピーエス | 新しいpdl2化合物 |
| MA46724A (fr) | 2016-11-01 | 2021-04-21 | Anaptysbio Inc | Anticorps dirigés contre la mort programmée 1 (pd -1) |
| EP3988569A1 (en) | 2016-11-02 | 2022-04-27 | Jounce Therapeutics, Inc. | Antibodies to pd-1 and uses thereof |
| BR112019008426A2 (pt) | 2016-11-02 | 2019-09-03 | Engmab Sarl | anticorpo biespecífico contra bcma e cd3 e um fármaco imunológico para uso combinado no tratamento de mieloma múltiplo |
| TW201825119A (zh) | 2016-11-30 | 2018-07-16 | 日商協和醱酵麒麟有限公司 | 使用抗ccr4抗體及抗pd-1抗體治療癌症之方法 |
| US20190358262A1 (en) | 2016-12-03 | 2019-11-28 | Juno Therapeutics, Inc. | Methods for modulation of car-t cells |
| CN118634323A (zh) | 2016-12-07 | 2024-09-13 | 艾吉纳斯公司 | 抗体和其使用方法 |
| US11180535B1 (en) | 2016-12-07 | 2021-11-23 | David Gordon Bermudes | Saccharide binding, tumor penetration, and cytotoxic antitumor chimeric peptides from therapeutic bacteria |
| EP4289484A3 (en) | 2016-12-07 | 2024-03-06 | Agenus Inc. | Anti-ctla-4 antibodies and methods of use thereof |
| EP4219563A3 (en) | 2017-01-09 | 2023-10-04 | Tesaro, Inc. | Methods of treating cancer with anti-pd-1 antibodies |
| MA47215A (fr) | 2017-01-09 | 2019-11-13 | Bioxcel Therapeutics Inc | Procédés prédictifs et diagnostiques pour le cancer de la prostate |
| EP3568412A2 (en) | 2017-01-13 | 2019-11-20 | Agenus Inc. | T cell receptors that bind to ny-eso-1 and methods of use thereof |
| WO2018134279A1 (en) | 2017-01-18 | 2018-07-26 | Pieris Pharmaceuticals Gmbh | Novel fusion polypeptides specific for lag-3 and pd-1 |
| EP3570870A1 (en) | 2017-01-20 | 2019-11-27 | Novartis AG | Combination therapy for the treatment of cancer |
| TWI788321B (zh) | 2017-01-20 | 2023-01-01 | 美商健臻公司 | 骨靶向抗體 |
| TWI787230B (zh) | 2017-01-20 | 2022-12-21 | 法商賽諾菲公司 | 抗TGF-β抗體及其用途 |
| JOP20190187A1 (ar) | 2017-02-03 | 2019-08-01 | Novartis Ag | مترافقات عقار جسم مضاد لـ ccr7 |
| CN110573172A (zh) | 2017-02-06 | 2019-12-13 | 奥里尼斯生物科学有限公司 | 靶向的工程化干扰素及其用途 |
| IL268346B2 (en) | 2017-02-06 | 2024-08-01 | Orionis Biosciences BV | Targeted chimeric proteins and their uses |
| WO2018151820A1 (en) | 2017-02-16 | 2018-08-23 | Elstar Therapeutics, Inc. | Multifunctional molecules comprising a trimeric ligand and uses thereof |
| US11292842B2 (en) | 2017-02-21 | 2022-04-05 | Regeneron Pharmaceuticals, Inc. | Anti-PD-1 antibodies for treatment of lung cancer |
| US11459394B2 (en) | 2017-02-24 | 2022-10-04 | Macrogenics, Inc. | Bispecific binding molecules that are capable of binding CD137 and tumor antigens, and uses thereof |
| KR102700956B1 (ko) | 2017-02-28 | 2024-09-03 | 사노피 | 치료적 rna |
| EP3592868B1 (en) | 2017-03-06 | 2022-11-23 | Novartis AG | Methods of treatment of cancer with reduced ubb expression |
| WO2018167780A1 (en) | 2017-03-12 | 2018-09-20 | Yeda Research And Development Co. Ltd. | Methods of prognosing and treating cancer |
| US20200150125A1 (en) | 2017-03-12 | 2020-05-14 | Yeda Research And Development Co., Ltd. | Methods of diagnosing and prognosing cancer |
| WO2018170026A2 (en) | 2017-03-16 | 2018-09-20 | Alpine Immune Sciences, Inc. | Cd80 variant immunomodulatory proteins and uses thereof |
| JP2020512357A (ja) | 2017-03-31 | 2020-04-23 | ファイブ プライム セラピューティクス, インコーポレイテッド | 抗gitr抗体を使用した癌の併用療法 |
| JP7426825B2 (ja) | 2017-04-03 | 2024-02-02 | エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト | 抗pd-1抗体と突然変異il-2とまたはil-15とのイムノコンジュゲート |
| WO2018185618A1 (en) | 2017-04-03 | 2018-10-11 | Novartis Ag | Anti-cdh6 antibody drug conjugates and anti-gitr antibody combinations and methods of treatment |
| KR102408873B1 (ko) | 2017-04-05 | 2022-06-15 | 에프. 호프만-라 로슈 아게 | Pd1 및 lag3에 특이적으로 결합하는 이중특이적 항체 |
| US11603407B2 (en) | 2017-04-06 | 2023-03-14 | Regeneron Pharmaceuticals, Inc. | Stable antibody formulation |
| MX2019012223A (es) | 2017-04-13 | 2019-12-09 | Agenus Inc | Anticuerpos anti-cd137 y metodos de uso de los mismos. |
| JP2020517256A (ja) | 2017-04-19 | 2020-06-18 | エルスター セラピューティクス, インコーポレイテッド | 多重特異性分子およびその使用 |
| BR112019021680A2 (pt) | 2017-04-20 | 2020-05-12 | Adc Therapeutics Sa | Terapia de combinação com conjugado anticorpo-fármaco anti-cd25?? |
| PL3612234T3 (pl) | 2017-04-20 | 2024-09-02 | Adc Therapeutics Sa | Terapia skojarzona z koniugatem anty-AXL przeciwciało-lek |
| AR111419A1 (es) | 2017-04-27 | 2019-07-10 | Novartis Ag | Compuestos fusionados de indazol piridona como antivirales |
| ES2899616T3 (es) | 2017-04-28 | 2022-03-14 | Five Prime Therapeutics Inc | Polipéptidos del dominio extracelular del CD80 para su uso en aumentar los linfocitos T de memoria central |
| UY37695A (es) | 2017-04-28 | 2018-11-30 | Novartis Ag | Compuesto dinucleótido cíclico bis 2’-5’-rr-(3’f-a)(3’f-a) y usos del mismo |
| AR111651A1 (es) | 2017-04-28 | 2019-08-07 | Novartis Ag | Conjugados de anticuerpos que comprenden agonistas del receptor de tipo toll y terapias de combinación |
| EP3615566B1 (en) | 2017-04-28 | 2023-12-20 | Marengo Therapeutics, Inc. | Multispecific molecules comprising a non-immunoglobulin heterodimerization domain and uses thereof |
| US20200179511A1 (en) | 2017-04-28 | 2020-06-11 | Novartis Ag | Bcma-targeting agent, and combination therapy with a gamma secretase inhibitor |
| US20200055948A1 (en) | 2017-04-28 | 2020-02-20 | Novartis Ag | Cells expressing a bcma-targeting chimeric antigen receptor, and combination therapy with a gamma secretase inhibitor |
| RS64576B1 (sr) | 2017-05-01 | 2023-10-31 | Agenus Inc | Anti-tigit antitela i postupci njihove primene |
| UY37718A (es) | 2017-05-05 | 2018-11-30 | Novartis Ag | 2-quinolinonas triciclicas como agentes antibacteriales |
| WO2018209298A1 (en) | 2017-05-12 | 2018-11-15 | Harpoon Therapeutics, Inc. | Mesothelin binding proteins |
| JOP20190256A1 (ar) | 2017-05-12 | 2019-10-28 | Icahn School Med Mount Sinai | فيروسات داء نيوكاسل واستخداماتها |
| JP7274426B2 (ja) | 2017-05-16 | 2023-05-16 | ブリストル-マイヤーズ スクイブ カンパニー | 抗gitrアゴニスト抗体での癌の処置 |
| CA3063723A1 (en) | 2017-05-18 | 2018-11-22 | Modernatx, Inc. | Polynucleotides encoding tethered interleukin-12 (il12) polypeptides and uses thereof |
| JP2020520671A (ja) | 2017-05-24 | 2020-07-16 | ノバルティス アーゲー | 抗体−サイトカイングラフト化タンパク質及び使用方法 |
| WO2018215937A1 (en) | 2017-05-24 | 2018-11-29 | Novartis Ag | Interleukin-7 antibody cytokine engrafted proteins and methods of use in the treatment of cancer |
| MX2019014023A (es) | 2017-05-24 | 2020-02-17 | Novartis Ag | Proteinas de anticuerpo injertadas con citocina y metodos de uso en el tratamiento del cancer. |
| HUE065242T2 (hu) | 2017-05-30 | 2024-05-28 | Bristol Myers Squibb Co | LAG-3-pozitív tumorok kezelése |
| AU2018275209A1 (en) | 2017-05-30 | 2019-10-17 | Bristol-Myers Squibb Company | Compositions comprising an anti-LAG-3 antibody or an anti-LAG-3 antibody and an anti-PD-1 or anti-PD-L1 antibody |
| JP2020522495A (ja) | 2017-05-30 | 2020-07-30 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 抗lag−3抗体、pd−1経路阻害剤および免疫療法剤の組み合わせを含む組成物 |
| WO2018222901A1 (en) | 2017-05-31 | 2018-12-06 | Elstar Therapeutics, Inc. | Multispecific molecules that bind to myeloproliferative leukemia (mpl) protein and uses thereof |
| KR20200024158A (ko) | 2017-05-31 | 2020-03-06 | 주식회사 에스티큐브앤컴퍼니 | Btn1a1에 면역특이적으로 결합하는 항체 및 분자를 사용하여 암을 치료하는 방법 |
| WO2018223004A1 (en) | 2017-06-01 | 2018-12-06 | Xencor, Inc. | Bispecific antibodies that bind cd20 and cd3 |
| KR20200041834A (ko) | 2017-06-01 | 2020-04-22 | 젠코어 인코포레이티드 | Cd123 및 cd3에 결합하는 이중특이성 항체 |
| US11559504B2 (en) * | 2017-06-02 | 2023-01-24 | The Penn State Research Foundation | Ceramide nanoliposomes, compositions and methods of using for immunotherapy |
| CN111225675B (zh) | 2017-06-02 | 2024-05-03 | 朱诺治疗学股份有限公司 | 使用过继细胞疗法治疗的制品和方法 |
| US11542331B2 (en) | 2017-06-06 | 2023-01-03 | Stcube & Co., Inc. | Methods of treating cancer using antibodies and molecules that bind to BTN1A1 or BTN1A1-ligands |
| BR112019026564A2 (pt) | 2017-06-14 | 2020-06-30 | Adc Therapeutics Sa | regimes de dosagem para a administração de um adc anti-cd19 |
| US11312783B2 (en) | 2017-06-22 | 2022-04-26 | Novartis Ag | Antibody molecules to CD73 and uses thereof |
| EP3642240A1 (en) | 2017-06-22 | 2020-04-29 | Novartis AG | Antibody molecules to cd73 and uses thereof |
| WO2019006427A1 (en) | 2017-06-29 | 2019-01-03 | Juno Therapeutics, Inc. | WALL MODEL FOR ASSESSING TOXICITIES ASSOCIATED WITH IMMUNOTHERAPIES |
| US11285149B2 (en) | 2017-07-28 | 2022-03-29 | Dana-Farber Cancer Institute, Inc. | Enhanced immunotherapy of cancer using targeted transcriptional modulators |
| EP3658914A1 (en) | 2017-07-28 | 2020-06-03 | Bristol-Myers Squibb Company | Predictive peripheral blood biomarker for checkpoint inhibitors |
| EP3668517A4 (en) * | 2017-08-14 | 2021-02-17 | Phosphorex, Inc. | ADENOSIN RECEPTOR ANTAGONIST MICROPARTICLE FORMULATIONS FOR THE TREATMENT OF CANCER |
| WO2019035938A1 (en) | 2017-08-16 | 2019-02-21 | Elstar Therapeutics, Inc. | MULTISPECIFIC MOLECULES BINDING TO BCMA AND USES THEREOF |
| JP7250764B2 (ja) | 2017-08-18 | 2023-04-03 | コセラ バイオサイエンス, インコーポレイテッド | Tg02の多形形態 |
| SG11202001211TA (en) | 2017-08-28 | 2020-03-30 | Bristol Myers Squibb Co | Tim-3 antagonists for the treatment and diagnosis of cancers |
| CA3073055A1 (en) | 2017-09-04 | 2019-03-07 | Agenus Inc. | T cell receptors that bind to mixed lineage leukemia (mll)-specific phosphopeptides and methods of use thereof |
| KR20200045520A (ko) | 2017-09-07 | 2020-05-04 | 오거스타 유니버시티 리서치 인스티튜트, 인크. | 프로그래밍된 세포사 단백질 1에 대한 항체 |
| CR20200195A (es) | 2017-10-13 | 2020-08-14 | Harpoon Therapeutics Inc | Proteínas de unión a antigenos de maduraciòn de celulas b |
| CN109662966A (zh) * | 2017-10-16 | 2019-04-23 | 北京莱科金基因科技有限责任公司 | 伊曲茶碱在制备用于肿瘤治疗的药物中的用途 |
| WO2019077062A1 (en) | 2017-10-18 | 2019-04-25 | Vivia Biotech, S.L. | C-CELLS ACTIVATED BY BIT |
| US11066475B2 (en) | 2017-11-01 | 2021-07-20 | Juno Therapeutics, Inc. | Chimeric antigen receptors specific for B-cell maturation antigen and encoding polynucleotides |
| AU2018358067A1 (en) | 2017-11-01 | 2020-05-07 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for B-cell maturation antigen |
| WO2019089858A2 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Methods of assessing or monitoring a response to a cell therapy |
| WO2019099838A1 (en) | 2017-11-16 | 2019-05-23 | Novartis Ag | Combination therapies |
| US11111297B2 (en) | 2017-11-17 | 2021-09-07 | Merck Sharp & Dohme Corp. | Antibodies specific for immunoglobulin-like transcript 3 (ILT3) and uses thereof |
| CN111315749A (zh) | 2017-11-17 | 2020-06-19 | 诺华股份有限公司 | 新颖的二氢异噁唑化合物及其在治疗乙型肝炎中的用途 |
| EP3717907A1 (en) | 2017-11-30 | 2020-10-07 | Novartis AG | Bcma-targeting chimeric antigen receptor, and uses thereof |
| EP3720881A1 (en) | 2017-12-08 | 2020-10-14 | Elstar Therapeutics, Inc. | Multispecific molecules and uses thereof |
| US11946094B2 (en) | 2017-12-10 | 2024-04-02 | Augusta University Research Institute, Inc. | Combination therapies and methods of use thereof |
| JP2021506260A (ja) | 2017-12-15 | 2021-02-22 | ジュノー セラピューティクス インコーポレイテッド | 抗cct5結合分子およびその使用方法 |
| US11234977B2 (en) | 2017-12-20 | 2022-02-01 | Novartis Ag | Fused tricyclic pyrazolo-dihydropyrazinyl-pyridone compounds as antivirals |
| US11324774B2 (en) | 2018-01-05 | 2022-05-10 | Augusta University Research Institute, Inc. | Compositions of oral alkaline salts and metabolic acid inducers and uses thereof |
| MX2020006171A (es) | 2018-01-12 | 2020-09-03 | Bristol Myers Squibb Co | Terapia de combinacion con anticuerpos anti interleucina-8 (il-8) y anticuerpos anti receptor de muerte programada (pd-1) para tratar cancer. |
| US12128018B2 (en) | 2018-01-12 | 2024-10-29 | KDAc Therapeutics, Inc. | Combination of a selective histone deacetylase 3 (HDAC3) inhibitor and an immunotherapy agent for the treatment of cancer |
| WO2019144126A1 (en) | 2018-01-22 | 2019-07-25 | Pascal Biosciences Inc. | Cannabinoids and derivatives for promoting immunogenicity of tumor and infected cells |
| US20210032346A1 (en) | 2018-01-23 | 2021-02-04 | Nextcure, Inc. | B7-h4 antibodies and methods of use thereof |
| EP3746117A1 (en) | 2018-01-31 | 2020-12-09 | Celgene Corporation | Combination therapy using adoptive cell therapy and checkpoint inhibitor |
| EP3746480A1 (en) | 2018-01-31 | 2020-12-09 | F. Hoffmann-La Roche AG | Bispecific antibodies comprising an antigen-binding site binding to lag3 |
| US20200405806A1 (en) | 2018-02-08 | 2020-12-31 | Bristol-Myers Squibb Company | Combination of a tetanus toxoid, anti-ox40 antibody and/or anti-pd-1 antibody to treat tumors |
| US20200407365A1 (en) | 2018-02-28 | 2020-12-31 | Novartis Ag | Indole-2-carbonyl compounds and their use for the treatment of hepatitis b |
| US20210002373A1 (en) | 2018-03-01 | 2021-01-07 | Nextcure, Inc. | KLRG1 Binding Compositions and Methods of Use Thereof |
| MX2020009275A (es) | 2018-03-07 | 2021-01-08 | Pfizer | Composiciones de anticuerpo anti-pd-1. |
| US20210030703A1 (en) | 2018-03-12 | 2021-02-04 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of caloric restriction mimetics for potentiating chemo-immunotherapy for the treatment of cancers |
| WO2019178362A1 (en) | 2018-03-14 | 2019-09-19 | Elstar Therapeutics, Inc. | Multifunctional molecules that bind to calreticulin and uses thereof |
| US10738128B2 (en) | 2018-03-14 | 2020-08-11 | Surface Oncology, Inc. | Antibodies that bind CD39 and uses thereof |
| EP3765516A2 (en) | 2018-03-14 | 2021-01-20 | Elstar Therapeutics, Inc. | Multifunctional molecules and uses thereof |
| US20210361734A1 (en) | 2018-03-19 | 2021-11-25 | 9 Meters Biopharma, Inc. | Compositions and methods for potentiating immune checkpoint inhibitor therapy |
| US11874276B2 (en) | 2018-04-05 | 2024-01-16 | Dana-Farber Cancer Institute, Inc. | STING levels as a biomarker for cancer immunotherapy |
| BR112020020826A2 (pt) | 2018-04-12 | 2021-01-19 | Bristol-Myers Squibb Company | Terapia de combinação anticâncer com anticorpo antagonista de cd73 e anticorpo antagonista do eixo pd-1/pd-l1 |
| CN114028568A (zh) | 2018-04-16 | 2022-02-11 | 上海岸阔医药科技有限公司 | 预防或治疗肿瘤疗法副作用的方法 |
| EP3781265A2 (en) | 2018-04-17 | 2021-02-24 | Celldex Therapeutics, Inc. | Anti-cd27 and anti-pd-l1 antibodies and bispecific constructs |
| IL310398A (en) | 2018-04-18 | 2024-03-01 | Xencor Inc | Proteins from heterodimeric il-15/il-15rα fc and their uses |
| SG11202010163QA (en) | 2018-04-18 | 2020-11-27 | Xencor Inc | Pd-1 targeted heterodimeric fusion proteins containing il-15/il-15ra fc-fusion proteins and pd-1 antigen binding domains and uses thereof |
| EP3784688A2 (en) | 2018-04-26 | 2021-03-03 | Agenus Inc. | Heat shock protein-binding peptide compositions and methods of use thereof |
| WO2019210153A1 (en) | 2018-04-27 | 2019-10-31 | Novartis Ag | Car t cell therapies with enhanced efficacy |
| US20210396739A1 (en) | 2018-05-01 | 2021-12-23 | Novartis Ag | Biomarkers for evaluating car-t cells to predict clinical outcome |
| KR20210016562A (ko) | 2018-05-23 | 2021-02-16 | 에이디씨 테라퓨틱스 에스에이 | 분자 애쥬번트 |
| UY38247A (es) | 2018-05-30 | 2019-12-31 | Novartis Ag | Anticuerpos frente a entpd2, terapias de combinación y métodos de uso de los anticuerpos y las terapias de combinación |
| JP7490574B2 (ja) | 2018-05-31 | 2024-05-27 | ノバルティス アーゲー | B型肝炎抗体 |
| US20210214459A1 (en) | 2018-05-31 | 2021-07-15 | Novartis Ag | Antibody molecules to cd73 and uses thereof |
| CN112512578A (zh) | 2018-06-01 | 2021-03-16 | 诺华股份有限公司 | 结合cd123和cd3的双特异性抗体的给药 |
| KR20210016390A (ko) | 2018-06-01 | 2021-02-15 | 노파르티스 아게 | Bcma에 대한 결합 분자 및 이의 용도 |
| AU2019281358A1 (en) | 2018-06-03 | 2021-01-07 | Lamkap Bio Beta Ltd. | Bispecific antibodies against CEACAM5 and CD47 |
| US11505782B2 (en) | 2018-06-04 | 2022-11-22 | Calidi Biotherapeutics, Inc. | Cell-based vehicles for potentiation of viral therapy |
| JP7438988B2 (ja) | 2018-06-13 | 2024-02-27 | ノバルティス アーゲー | Bcmaキメラ抗原受容体及びその使用 |
| TW202005985A (zh) | 2018-06-21 | 2020-02-01 | 美商再生元醫藥公司 | 用雙特異性抗CD3xMUC16抗體及抗PD-1抗體治療癌症的方法 |
| WO2020010250A2 (en) | 2018-07-03 | 2020-01-09 | Elstar Therapeutics, Inc. | Anti-tcr antibody molecules and uses thereof |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| KR20210031680A (ko) | 2018-07-10 | 2021-03-22 | 노파르티스 아게 | 3-(5-하이드록시-1-옥소이소인돌린-2-일)피페리딘-2,6-디온 유도체 및 ikaros 패밀리 아연 핑거 2(ikzf2)-의존성 질환의 치료에 있어서의 이의 용도 |
| WO2020014583A1 (en) | 2018-07-13 | 2020-01-16 | Bristol-Myers Squibb Company | Ox-40 agonist, pd-1 pathway inhibitor and ctla-4 inhibitor combination for use in a mehtod of treating a cancer or a solid tumor |
| WO2020021061A1 (en) | 2018-07-26 | 2020-01-30 | Pieris Pharmaceuticals Gmbh | Humanized anti-pd-1 antibodies and uses thereof |
| US20210238287A1 (en) | 2018-07-26 | 2021-08-05 | Bristol-Myers Squibb Company | LAG-3 Combination Therapy for the Treatment of Cancer |
| EP3843849A1 (en) | 2018-08-27 | 2021-07-07 | Pieris Pharmaceuticals GmbH | Combination therapies comprising cd137/her2 bispecific agents and pd-1 axis inhibitors and uses thereof |
| CN109053895B (zh) * | 2018-08-30 | 2020-06-09 | 中山康方生物医药有限公司 | 抗pd-1-抗vegfa的双功能抗体、其药物组合物及其用途 |
| US20210340279A1 (en) | 2018-08-31 | 2021-11-04 | Yale University | Compositions and methods of using cell-penetrating antibodies in combination with immune checkpoint modulators |
| WO2020048942A1 (en) | 2018-09-04 | 2020-03-12 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for enhancing cytotoxic t lymphocyte-dependent immune responses |
| AU2019336197A1 (en) | 2018-09-07 | 2021-02-18 | Pfizer Inc. | Anti-avb8 antibodies and compositions and uses thereof |
| WO2020053742A2 (en) | 2018-09-10 | 2020-03-19 | Novartis Ag | Anti-hla-hbv peptide antibodies |
| BR112021004371A2 (pt) | 2018-09-11 | 2021-05-25 | Curis Inc. | terapia em combinação com um inibidor de fosfoinositídeo 3-quinase com uma porção de ligação a zinco |
| KR102672512B1 (ko) | 2018-09-12 | 2024-06-10 | 노파르티스 아게 | 항바이러스 피리도피라진디온 화합물 |
| AU2019345151A1 (en) | 2018-09-19 | 2021-04-29 | Alpine Immune Sciences, Inc. | Methods and uses of variant CD80 fusion proteins and related constructs |
| EP3853251A1 (en) | 2018-09-19 | 2021-07-28 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical composition for the treatment of cancers resistant to immune checkpoint therapy |
| AU2019346466A1 (en) | 2018-09-25 | 2021-05-20 | Harpoon Therapeutics, Inc. | DLL3 binding proteins and methods of use |
| CA3113826A1 (en) | 2018-09-27 | 2020-04-02 | Marengo Therapeutics, Inc. | Csf1r/ccr2 multispecific antibodies |
| EP3856779A1 (en) | 2018-09-28 | 2021-08-04 | Novartis AG | Cd22 chimeric antigen receptor (car) therapies |
| WO2020069409A1 (en) | 2018-09-28 | 2020-04-02 | Novartis Ag | Cd19 chimeric antigen receptor (car) and cd22 car combination therapies |
| EP3856345A1 (en) | 2018-09-29 | 2021-08-04 | Novartis AG | Process of manufacture of a compound for inhibiting the activity of shp2 |
| EP3860578A1 (en) | 2018-10-01 | 2021-08-11 | Institut National de la Santé et de la Recherche Médicale (INSERM) | Use of inhibitors of stress granule formation for targeting the regulation of immune responses |
| KR20210069641A (ko) | 2018-10-03 | 2021-06-11 | 젠코어 인코포레이티드 | IL-12 이종이량체 Fc-융합 단백질 |
| WO2020077276A2 (en) | 2018-10-12 | 2020-04-16 | Xencor, Inc. | Pd-1 targeted il-15/il-15ralpha fc fusion proteins and uses in combination therapies thereof |
| BR112021007318A2 (pt) | 2018-10-17 | 2021-08-31 | Biolinerx Ltd. | Tratamento de adenocarcinoma pancreático metastático |
| EP3873532A1 (en) | 2018-10-31 | 2021-09-08 | Novartis AG | Dc-sign antibody drug conjugates |
| JP2022506598A (ja) | 2018-11-01 | 2022-01-17 | ジュノー セラピューティクス インコーポレイテッド | Gタンパク質共役受容体クラスcグループ5メンバーd(gprc5d)に特異的なキメラ抗原受容体 |
| JP7510413B2 (ja) | 2018-11-01 | 2024-07-03 | ジュノー セラピューティクス インコーポレイテッド | B細胞成熟抗原に特異的なキメラ抗原受容体を使用する処置方法 |
| US20220001026A1 (en) | 2018-11-08 | 2022-01-06 | Modernatx, Inc. | Use of mrna encoding ox40l to treat cancer in human patients |
| WO2020099230A1 (en) | 2018-11-14 | 2020-05-22 | Bayer Aktiengesellschaft | Pharmaceutical combination of anti-ceacam6 and either anti-pd-1 or anti-pd-l1 antibodies for the treatment of cancer |
| EP3880186B1 (en) | 2018-11-14 | 2024-04-03 | Regeneron Pharmaceuticals, Inc. | Intralesional administration of pd-1 inhibitors for treating skin cancer |
| EP3880231A1 (en) | 2018-11-16 | 2021-09-22 | NeoImmuneTech, Inc. | Method of treating a tumor with a combination of il-7 protein and an immune checkpoint inhibitor |
| US20220008465A1 (en) | 2018-11-16 | 2022-01-13 | Juno Therapeutics, Inc. | Methods of dosing engineered t cells for the treatment of b cell malignancies |
| US20220016079A1 (en) | 2018-11-26 | 2022-01-20 | Debiopharm International S.A. | Combination treatment of hiv infections |
| US20220018828A1 (en) | 2018-11-28 | 2022-01-20 | Inserm (Institut National De La Santé Et La Recherche Médicale | Methods and kit for assaying lytic potential of immune effector cells |
| AU2019387497A1 (en) | 2018-11-30 | 2021-06-24 | Juno Therapeutics, Inc. | Methods for treatment using adoptive cell therapy |
| EP3891270A1 (en) | 2018-12-07 | 2021-10-13 | Institut National de la Santé et de la Recherche Médicale (INSERM) | Use of cd26 and cd39 as new phenotypic markers for assessing maturation of foxp3+ t cells and uses thereof for diagnostic purposes |
| EP3897624A1 (en) | 2018-12-17 | 2021-10-27 | Institut National de la Santé et de la Recherche Médicale (INSERM) | Use of sulconazole as a furin inhibitor |
| CN113438961A (zh) | 2018-12-20 | 2021-09-24 | Xencor股份有限公司 | 含有IL-15/IL-15Rα和NKG2D抗原结合结构域的靶向异二聚体Fc融合蛋白 |
| CN113271945A (zh) | 2018-12-20 | 2021-08-17 | 诺华股份有限公司 | 包含3-(1-氧代异吲哚啉-2-基)哌啶-2,6-二酮衍生物的给药方案和药物组合 |
| EP4406555A3 (en) | 2018-12-21 | 2024-11-06 | Novartis AG | Antibodies to pmel17 and conjugates thereof |
| JP7450622B2 (ja) | 2018-12-21 | 2024-03-15 | ヴァレリオ・セラピューティクス | 新規のコンジュゲートされた核酸分子及びその使用 |
| CN113508129A (zh) | 2019-01-15 | 2021-10-15 | 法国国家健康和医学研究院 | 突变的白介素-34(il-34)多肽及其在治疗中的用途 |
| US11116729B2 (en) | 2019-01-17 | 2021-09-14 | Georgia Tech Research Corporation | Drug delivery systems containing oxidized cholesterols |
| KR20210118870A (ko) | 2019-01-21 | 2021-10-01 | 사노피 | 진행성 단계의 고형 종양 암에 대한 치료용 rna 및 항-pd1 항체 |
| EA202192103A1 (ru) | 2019-01-29 | 2021-12-15 | Джуно Терапьютикс, Инк. | Антитела и химерные антигенные рецепторы, специфичные к орфанному рецептору типа рецеторной тирозинкиназы 1 (ror1) |
| EP3924054A1 (en) | 2019-02-15 | 2021-12-22 | Novartis AG | 3-(1-oxo-5-(piperidin-4-yl)isoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| EP3924521A4 (en) | 2019-02-15 | 2023-03-29 | IncellDx, Inc. | BLADDER-ASSOCIATED SPECIMEN ASSAY, IDENTIFICATION AND TREATMENT OF BLADDER-ASSOCIATED NEOPLASIA, AND KITS FOR USE THEREOF |
| US20220144798A1 (en) | 2019-02-15 | 2022-05-12 | Novartis Ag | Substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| WO2020169472A2 (en) | 2019-02-18 | 2020-08-27 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods of inducing phenotypic changes in macrophages |
| US20220088075A1 (en) | 2019-02-22 | 2022-03-24 | The Trustees Of The University Of Pennsylvania | Combination therapies of egfrviii chimeric antigen receptors and pd-1 inhibitors |
| CA3137361A1 (en) | 2019-02-28 | 2020-09-03 | Regeneron Pharmaceuticals, Inc. | Administration of pd-1 inhibitors for treating skin cancer |
| AU2020231343A1 (en) | 2019-03-06 | 2021-10-21 | Regeneron Pharmaceuticals, Inc. | IL-4/IL-13 pathway inhibitors for enhanced efficacy in treating cancer |
| JP2022527298A (ja) | 2019-03-26 | 2022-06-01 | ザ リージェンツ オブ ザ ユニヴァシティ オブ ミシガン | Stat3の低分子分解誘導剤 |
| WO2020205467A1 (en) | 2019-03-29 | 2020-10-08 | The Regents Of The University Of Michigan | Stat3 protein degraders |
| EP3947737A2 (en) | 2019-04-02 | 2022-02-09 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods of predicting and preventing cancer in patients having premalignant lesions |
| AU2020252372A1 (en) * | 2019-04-02 | 2021-10-28 | Board Of Regents, The University Of Texas System | Combinations of transcription inhibitors and immune checkpoint inhibitors for treatment of disease |
| US20220160692A1 (en) | 2019-04-09 | 2022-05-26 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of sk2 inhibitors in combination with immune checkpoint blockade therapy for the treatment of cancer |
| US20220220480A1 (en) | 2019-04-17 | 2022-07-14 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and compositions for treatment of nlrp3 inflammasome mediated il-1beta dependent disorders |
| EP3725370A1 (en) | 2019-04-19 | 2020-10-21 | ImmunoBrain Checkpoint, Inc. | Modified anti-pd-l1 antibodies and methods and uses for treating a neurodegenerative disease |
| SG11202111262XA (en) | 2019-05-13 | 2021-11-29 | Regeneron Pharma | Combination of pd-1 inhibitors and lag-3 inhibitors for enhanced efficacy in treating cancer |
| CA3138086A1 (en) | 2019-05-20 | 2020-11-26 | Massachusetts Institute Of Technology | Boronic ester prodrugs and uses thereof |
| WO2020239558A1 (en) | 2019-05-24 | 2020-12-03 | Pfizer Inc. | Combination therapies using cdk inhibitors |
| WO2020252336A1 (en) | 2019-06-12 | 2020-12-17 | Vanderbilt University | Dibenzylamines as amino acid transport inhibitors |
| WO2020252353A1 (en) | 2019-06-12 | 2020-12-17 | Vanderbilt University | Amino acid transport inhibitors and the uses thereof |
| JP2022537324A (ja) | 2019-06-18 | 2022-08-25 | ヤンセン・サイエンシズ・アイルランド・アンリミテッド・カンパニー | B型肝炎ウイルス(hbv)ワクチンおよび抗pd-1抗体の組合せ |
| MA56523A (fr) | 2019-06-18 | 2022-04-27 | Janssen Sciences Ireland Unlimited Co | Combinaison de vaccins contre le virus de l'hépatite b (vhb) et d'anticorps anti-pd-1 ou anti-pd-l1 |
| EP3999510A1 (en) | 2019-07-16 | 2022-05-25 | The Regents Of The University Of Michigan | Imidazopyrimidines as eed inhibitors and the use thereof |
| EP4008730A4 (en) * | 2019-08-02 | 2023-09-06 | Akeso Pharmaceuticals, Inc. | BISPECIFIC ANTI-CTLA4-ANTI-PD-1 ANTIBODY AND ITS USES |
| US20220257698A1 (en) | 2019-08-02 | 2022-08-18 | Lanthiopep B.V. | Angiotensin type 2 (at2) receptor agonists for use in the treatment of cancer |
| EP4013788A1 (en) | 2019-08-12 | 2022-06-22 | Purinomia Biotech, Inc. | Methods and compositions for promoting and potentiating t-cell mediated immune responses through adcc targeting of cd39 expressing cells |
| GB201912107D0 (en) | 2019-08-22 | 2019-10-09 | Amazentis Sa | Combination |
| WO2021041532A1 (en) | 2019-08-26 | 2021-03-04 | Dana-Farber Cancer Institute, Inc. | Use of heparin to promote type 1 interferon signaling |
| WO2021041664A1 (en) | 2019-08-27 | 2021-03-04 | The Regents Of The University Of Michigan | Cereblon e3 ligase inhibitors |
| KR20220053007A (ko) | 2019-08-30 | 2022-04-28 | 아게누스 인코포레이티드 | 항-cd96 항체 및 이의 사용 방법 |
| EP4031178A1 (en) | 2019-09-16 | 2022-07-27 | Surface Oncology, Inc. | Anti-cd39 antibody compositions and methods |
| EP4031566A1 (en) | 2019-09-18 | 2022-07-27 | Novartis AG | Nkg2d fusion proteins and uses thereof |
| AU2020350205A1 (en) | 2019-09-18 | 2022-05-12 | Lamkap Bio Alpha AG | Bispecific antibodies against CEACAM5 and CD3 |
| EP4031578A1 (en) | 2019-09-18 | 2022-07-27 | Novartis AG | Entpd2 antibodies, combination therapies, and methods of using the antibodies and combination therapies |
| TW202124446A (zh) | 2019-09-18 | 2021-07-01 | 瑞士商諾華公司 | 與entpd2抗體之組合療法 |
| EP4031241A1 (en) | 2019-09-19 | 2022-07-27 | The Regents Of The University Of Michigan | Spirocyclic androgen receptor protein degraders |
| CN114728046A (zh) | 2019-09-25 | 2022-07-08 | 思进公司 | 联合抗cd30 adc、抗pd-1和化疗以治疗血液癌症 |
| CN115087671A (zh) | 2019-09-25 | 2022-09-20 | 表面肿瘤学公司 | 抗il-27抗体及其用途 |
| AU2020353055B2 (en) | 2019-09-26 | 2024-03-07 | Gilead Sciences, Inc. | Antiviral pyrazolopyridinone compounds |
| CA3151322A1 (en) | 2019-10-01 | 2021-04-08 | Silverback Therapeutics, Inc. | Combination therapy with immune stimulatory conjugates |
| EP3800201A1 (en) | 2019-10-01 | 2021-04-07 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Cd28h stimulation enhances nk cell killing activities |
| EP4037700A2 (en) | 2019-10-03 | 2022-08-10 | Xencor, Inc. | Targeted il-12 heterodimeric fc-fusion proteins |
| WO2021064184A1 (en) | 2019-10-04 | 2021-04-08 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical composition for the treatment of ovarian cancer, breast cancer or pancreatic cancer |
| TW202128757A (zh) | 2019-10-11 | 2021-08-01 | 美商建南德克公司 | 具有改善之特性的 PD-1 標靶 IL-15/IL-15Rα FC 融合蛋白 |
| EP4058465A1 (en) | 2019-11-14 | 2022-09-21 | Cohbar Inc. | Cxcr4 antagonist peptides |
| IL292934A (en) * | 2019-11-20 | 2022-07-01 | Gi Cell Inc | Composition of medium for t-cell culture and method for culture of t-cells using the same composition of medium |
| WO2021108025A1 (en) | 2019-11-26 | 2021-06-03 | Massachusetts Institute Of Technology | Cell-based cancer vaccines and cancer therapies |
| CN114945382A (zh) | 2019-11-26 | 2022-08-26 | 诺华股份有限公司 | Cd19和cd22嵌合抗原受体及其用途 |
| GB201917254D0 (en) | 2019-11-27 | 2020-01-08 | Adc Therapeutics Sa | Combination therapy |
| EP3831849A1 (en) | 2019-12-02 | 2021-06-09 | LamKap Bio beta AG | Bispecific antibodies against ceacam5 and cd47 |
| EP3920976B1 (en) | 2019-12-04 | 2023-07-19 | Orna Therapeutics, Inc. | Circular rna compositions and methods |
| US11897950B2 (en) | 2019-12-06 | 2024-02-13 | Augusta University Research Institute, Inc. | Osteopontin monoclonal antibodies |
| BR112022011268A2 (pt) | 2019-12-09 | 2022-09-06 | Seagen Inc | Terapia de combinação com antagonista de liv1-adc e pd1 |
| IL293834A (en) | 2019-12-20 | 2022-08-01 | Novartis Ag | A combination of anti-tim-3 antibody mbg453 and anti, nis793 tgf-beta antibody with or without decitabine or anti-pd-1 antibody spratlizumab, for the treatment of myelofibrosis and myelodysplastic syndrome |
| WO2021138407A2 (en) | 2020-01-03 | 2021-07-08 | Marengo Therapeutics, Inc. | Multifunctional molecules that bind to cd33 and uses thereof |
| CN111110655B (zh) * | 2020-01-20 | 2020-12-25 | 山东大学 | 一种纳米复合物及其制备方法和应用 |
| MX2022009100A (es) | 2020-01-28 | 2022-08-18 | Genentech Inc | Proteinas de fusion fc heterodimericas il15/il15r alfa para el tratamiento de cancer. |
| WO2021152548A1 (en) | 2020-01-30 | 2021-08-05 | Benitah Salvador Aznar | Combination therapy for treatment of cancer and cancer metastasis |
| WO2021171264A1 (en) | 2020-02-28 | 2021-09-02 | Novartis Ag | Dosing of a bispecific antibody that binds cd123 and cd3 |
| WO2021176424A1 (en) | 2020-03-06 | 2021-09-10 | Ona Therapeutics, S.L. | Anti-cd36 antibodies and their use to treat cancer |
| US20240245805A1 (en) | 2020-03-20 | 2024-07-25 | Orna Therapeutics, Inc. | Circular rna compositions and methods |
| US20230159573A1 (en) | 2020-03-26 | 2023-05-25 | The Regents Of The University Of Michigan | Small molecule stat protein degraders |
| US20230149462A1 (en) | 2020-04-10 | 2023-05-18 | Juno Therapeutics, Inc. | Methods and uses related to cell therapy engineered with a chimeric antigen receptor targeting b-cell maturation antigen |
| US20230181756A1 (en) | 2020-04-30 | 2023-06-15 | Novartis Ag | Ccr7 antibody drug conjugates for treating cancer |
| CN115768524A (zh) | 2020-05-01 | 2023-03-07 | 恩格姆生物制药公司 | Ilt结合剂和其使用方法 |
| AU2021270750B2 (en) | 2020-05-13 | 2024-06-13 | Massachusetts Institute Of Technology | Compositions of polymeric microdevices and their use in cancer immunotherapy |
| US20230212231A1 (en) | 2020-05-26 | 2023-07-06 | Institut National De La Santé Et De La Recherche Médicale (Inserm) | Severe acute respiratory syndrome coronavirus 2 (sars-cov-2) polypeptides and uses thereof for vaccine purposes |
| AU2021280245A1 (en) | 2020-05-26 | 2022-12-08 | Regeneron Pharmaceuticals, Inc. | Methods of treating cervical cancer by administering a PD-1 inhibitor |
| WO2021243207A1 (en) | 2020-05-28 | 2021-12-02 | Modernatx, Inc. | Use of mrnas encoding ox40l, il-23 and il-36gamma for treating cancer |
| US11767353B2 (en) | 2020-06-05 | 2023-09-26 | Theraly Fibrosis, Inc. | Trail compositions with reduced immunogenicity |
| KR20230024967A (ko) | 2020-06-11 | 2023-02-21 | 노파르티스 아게 | Zbtb32 억제제 및 이의 용도 |
| AR122644A1 (es) | 2020-06-19 | 2022-09-28 | Onxeo | Nuevas moléculas de ácido nucleico conjugado y sus usos |
| US20230321067A1 (en) | 2020-06-23 | 2023-10-12 | Novartis Ag | Dosing regimen comprising 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives |
| WO2021260675A1 (en) | 2020-06-24 | 2021-12-30 | Yeda Research And Development Co. Ltd. | Agents for sensitizing solid tumors to treatment |
| US20230233690A1 (en) | 2020-07-10 | 2023-07-27 | The Regents Of The University Of Michigan | Androgen receptor protein degraders |
| WO2022011204A1 (en) | 2020-07-10 | 2022-01-13 | The Regents Of The University Of Michigan | Small molecule androgen receptor protein degraders |
| US20230271940A1 (en) | 2020-08-03 | 2023-08-31 | Novartis Ag | Heteroaryl substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| EP4204592A1 (en) | 2020-08-26 | 2023-07-05 | Regeneron Pharmaceuticals, Inc. | Methods of treating cancer by administering a pd-1 inhibitor |
| KR20230074487A (ko) | 2020-08-26 | 2023-05-30 | 마렝고 테라퓨틱스, 인크. | Trbc1 또는 trbc2를 검출하는 방법 |
| JP2023540490A (ja) | 2020-09-02 | 2023-09-25 | ファーマブシン インコーポレイテッド | がん患者を治療するためのpd-1拮抗薬及びvegfr-2拮抗薬の併用療法 |
| JP2023542490A (ja) | 2020-09-03 | 2023-10-10 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | Pd-1阻害剤を投与することによりがん疼痛を処置する方法 |
| KR20230060527A (ko) * | 2020-09-08 | 2023-05-04 | 주식회사 유틸렉스 | Pd-1 폴리펩티드 변이체 |
| BR112023005377A2 (pt) | 2020-09-24 | 2023-04-25 | Merck Sharp & Dohme Llc | Formulações estáveis de anticorpos de receptor de morte programada 1 (pd-1) e variantes de hialuronidase e fragmentos das mesmas e métodos de uso das mesmas |
| KR20230082038A (ko) | 2020-10-02 | 2023-06-08 | 리제너론 파마슈티칼스 인코포레이티드 | 사이토카인 방출 증후군을 저하하는 암 치료용 항체 조합 |
| AU2021373366A1 (en) | 2020-11-06 | 2023-06-01 | Novartis Ag | Cd19 binding molecules and uses thereof |
| JP2023554587A (ja) | 2020-11-12 | 2023-12-28 | アンセルム(アンスティチュート・ナシオナル・ドゥ・ラ・サンテ・エ・ドゥ・ラ・ルシェルシュ・メディカル) | Sars-cov-2 スパイクタンパク質の受容体結合ドメインにコンジュゲートまたは融合している抗体およびワクチン目的でのそれらの使用 |
| WO2022101463A1 (en) | 2020-11-16 | 2022-05-19 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of the last c-terminal residues m31/41 of zikv m ectodomain for triggering apoptotic cell death |
| US20220168293A1 (en) | 2020-12-02 | 2022-06-02 | Pfizer Inc. | Time to resolution of axitinib-related adverse events |
| WO2022125497A1 (en) | 2020-12-08 | 2022-06-16 | Infinity Pharmaceuticals, Inc. | Eganelisib for use in the treatment of pd-l1 negative cancer |
| KR20220082558A (ko) | 2020-12-10 | 2022-06-17 | 재단법인 의약바이오컨버젼스연구단 | 면역 증진 활성이 있는 신규 crs 단편 펩타이드 및 이의 용도 |
| WO2022130348A1 (en) | 2020-12-18 | 2022-06-23 | Lamkap Bio Beta Ag | Bispecific antibodies against ceacam5 and cd47 |
| JP2024505049A (ja) | 2021-01-29 | 2024-02-02 | ノバルティス アーゲー | 抗cd73及び抗entpd2抗体のための投与方式並びにその使用 |
| WO2022165403A1 (en) | 2021-02-01 | 2022-08-04 | Yale University | Chemotherapeutic bioadhesive particles with immunostimulatory molecules for cancer treatment |
| CN114452403A (zh) | 2021-02-10 | 2022-05-10 | 同润生物医药(上海)有限公司 | 一种含有双功能免疫检查点/TGFβ抑制剂的药物组合 |
| GB202102396D0 (en) | 2021-02-19 | 2021-04-07 | Adc Therapeutics Sa | Molecular adjuvant |
| WO2022187423A1 (en) | 2021-03-03 | 2022-09-09 | The Regents Of The University Of Michigan | Cereblon ligands |
| US20240190874A1 (en) | 2021-03-03 | 2024-06-13 | The Regents Of The University Of Michigan | Small molecule degraders of androgen receptor |
| US20240092942A1 (en) | 2021-03-05 | 2024-03-21 | Leadartis, S.L. | Trimeric polypeptides and uses thereof in the treatment of cancer |
| AU2022242000A1 (en) | 2021-03-23 | 2023-09-14 | Regeneron Pharmaceuticals, Inc. | Methods of treating cancer in immunosuppressed or immunocompromised patients by administering a pd-1 inhibitor |
| US20240181052A1 (en) | 2021-03-29 | 2024-06-06 | Juno Therapeutics, Inc. | Methods for dosing and treatment with a combination of a checkpoint inhibitor therapy and a car t cell therapy |
| TW202304979A (zh) | 2021-04-07 | 2023-02-01 | 瑞士商諾華公司 | 抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途 |
| CA3214757A1 (en) | 2021-04-08 | 2022-10-13 | Andreas Loew | Multifuntional molecules binding to tcr and uses thereof |
| EP4322938A1 (en) | 2021-04-14 | 2024-02-21 | Institut National de la Santé et de la Recherche Médicale (INSERM) | New method to improve nk cells cytotoxicity |
| EP4427590A2 (en) | 2021-04-16 | 2024-09-11 | Novartis AG | Antibody drug conjugates and methods for making thereof |
| AR125874A1 (es) | 2021-05-18 | 2023-08-23 | Novartis Ag | Terapias de combinación |
| AU2022277263A1 (en) | 2021-05-21 | 2023-12-14 | Tianjin Lipogen Technology Co., Ltd | Pharmaceutical combination and use thereof |
| CA3218786A1 (en) | 2021-05-25 | 2022-12-01 | Lifei HOU | C-x-c motif chemokine receptor 6 (cxcr6) binding molecules, and methods of using the same |
| JP2024520067A (ja) | 2021-05-26 | 2024-05-21 | セントロ デ インミュノロヒア モレキュラル | 上皮起源の腫瘍を有する患者の処置のための治療用組成物の使用 |
| WO2022254337A1 (en) | 2021-06-01 | 2022-12-08 | Novartis Ag | Cd19 and cd22 chimeric antigen receptors and uses thereof |
| EP4346903A1 (en) | 2021-06-03 | 2024-04-10 | Synthorx, Inc. | Head and neck cancer combination therapy comprising an il-2 conjugate and pembrolizumab |
| WO2023280790A1 (en) | 2021-07-05 | 2023-01-12 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Gene signatures for predicting survival time in patients suffering from renal cell carcinoma |
| EP4373505A1 (en) | 2021-07-19 | 2024-05-29 | Regeneron Pharmaceuticals, Inc. | Combination of checkpoint inhibitors and an oncolytic virus for treating cancer |
| JP2024529502A (ja) | 2021-07-30 | 2024-08-06 | オーエヌエー セラピューティクス エセ.エレ. | 抗cd36抗体及び癌を治療するためのそれらの使用 |
| EP4380980A1 (en) | 2021-08-03 | 2024-06-12 | F. Hoffmann-La Roche AG | Bispecific antibodies and methods of use |
| WO2023015198A1 (en) | 2021-08-04 | 2023-02-09 | Genentech, Inc. | Il15/il15r alpha heterodimeric fc-fusion proteins for the expansion of nk cells in the treatment of solid tumours |
| WO2023031366A1 (en) | 2021-09-02 | 2023-03-09 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Anti-cecam6 antibodies with reduced side-effects |
| AU2022341239A1 (en) | 2021-09-08 | 2024-03-21 | Redona Therapeutics, Inc. | Papd5 and/or papd7 inhibiting 4-oxo-1,4-dihydroquinoline-3-carboxylic acid derivatives |
| TW202327595A (zh) | 2021-10-05 | 2023-07-16 | 美商輝瑞大藥廠 | 用於治療癌症之氮雜內醯胺化合物的組合 |
| KR20240099331A (ko) | 2021-10-28 | 2024-06-28 | 라이엘 이뮤노파마, 인크. | 면역 세포를 배양하기 위한 방법 |
| WO2023079428A1 (en) | 2021-11-03 | 2023-05-11 | Pfizer Inc. | Combination therapies using tlr7/8 agonist |
| MX2024006003A (es) | 2021-11-17 | 2024-08-06 | Inst Nat Sante Rech Med | Vacunas universales contra el sarbecovirus. |
| EP4448761A1 (en) | 2021-12-16 | 2024-10-23 | Valerio Therapeutics | New conjugated nucleic acid molecules and their uses |
| EP4452327A1 (en) | 2021-12-20 | 2024-10-30 | Synthorx, Inc. | Head and neck cancer combination therapy comprising an il-2 conjugate and pembrolizumab |
| EP4456907A1 (en) | 2021-12-30 | 2024-11-06 | NeoImmuneTech, Inc. | Method of treating a tumor with a combination of il-7 protein and vegf antagonist |
| US20230312718A1 (en) | 2022-01-07 | 2023-10-05 | Regeneron Pharmaceuticals, Inc | Methods of Treating Recurrent Ovarian Cancer with Bispecific Anti-MUC16 x Anti-CD3 Antibodies Alone or in Combination with Anti-PD-1 Antibodies |
| CN114432441B (zh) * | 2022-01-11 | 2023-04-25 | 中国人民解放军陆军军医大学第一附属医院 | 一种pd-1修饰的金复合硒化铜纳米粒子及其在介导光热靶向治疗癌症方面的应用 |
| CN118742325A (zh) | 2022-01-28 | 2024-10-01 | 上海岸阔医药科技有限公司 | 预防或治疗与抗肿瘤剂相关的疾病或病症的方法 |
| WO2023154799A1 (en) | 2022-02-14 | 2023-08-17 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Combination immunotherapy for treating cancer |
| WO2023154905A1 (en) | 2022-02-14 | 2023-08-17 | Gilead Sciences, Inc. | Antiviral pyrazolopyridinone compounds |
| WO2023159102A1 (en) | 2022-02-17 | 2023-08-24 | Regeneron Pharmaceuticals, Inc. | Combinations of checkpoint inhibitors and oncolytic virus for treating cancer |
| KR20240150493A (ko) | 2022-02-21 | 2024-10-15 | 온퀄리티 파마슈티컬스 차이나 리미티드 | 화합물 및 그 용도 |
| WO2023161453A1 (en) | 2022-02-24 | 2023-08-31 | Amazentis Sa | Uses of urolithins |
| WO2023177772A1 (en) | 2022-03-17 | 2023-09-21 | Regeneron Pharmaceuticals, Inc. | Methods of treating recurrent epithelioid sarcoma with bispecific anti-muc16 x anti-cd3 antibodies alone or in combination with anti-pd-1 antibodies |
| WO2023192478A1 (en) | 2022-04-01 | 2023-10-05 | Bristol-Myers Squibb Company | Combination therapy with anti-il-8 antibodies and anti-pd-1 antibodies for treating cancer |
| WO2023196988A1 (en) | 2022-04-07 | 2023-10-12 | Modernatx, Inc. | Methods of use of mrnas encoding il-12 |
| WO2023214325A1 (en) | 2022-05-05 | 2023-11-09 | Novartis Ag | Pyrazolopyrimidine derivatives and uses thereof as tet2 inhibitors |
| WO2023224912A1 (en) | 2022-05-16 | 2023-11-23 | Regeneron Pharmaceuticals, Inc. | Methods of treating metastatic castration-resistant prostate cancer with bispecific anti-psma x anti-cd3 antibodies alone or in combination with anti-pd-1 antibodies |
| WO2023230554A1 (en) | 2022-05-25 | 2023-11-30 | Pfizer Inc. | Combination of a braf inhibitor, an egfr inhibitor, and a pd-1 antagonist for the treatment of braf v600e-mutant, msi-h/dmmr colorectal cancer |
| WO2023242351A1 (en) | 2022-06-16 | 2023-12-21 | Lamkap Bio Beta Ag | Combination therapy of bispecific antibodies against ceacam5 and cd47 and bispecific antibodies against ceacam5 and cd3 |
| WO2023250400A1 (en) | 2022-06-22 | 2023-12-28 | Juno Therapeutics, Inc. | Treatment methods for second line therapy of cd19-targeted car t cells |
| WO2024015803A2 (en) | 2022-07-11 | 2024-01-18 | Autonomous Therapeutics, Inc. | Encrypted rna and methods of its use |
| WO2024030453A1 (en) | 2022-08-02 | 2024-02-08 | Regeneron Pharmaceuticals, Inc. | Methods of treating metastatic castration-resistant prostate cancer with bispecific anti-psma x anti-cd28 antibodies in combination with anti-pd-1 antibodies |
| US20240041929A1 (en) | 2022-08-05 | 2024-02-08 | Juno Therapeutics, Inc. | Chimeric antigen receptors specific for gprc5d and bcma |
| WO2024040175A1 (en) | 2022-08-18 | 2024-02-22 | Pulmatrix Operating Company, Inc. | Methods for treating cancer using inhaled angiogenesis inhibitor |
| WO2024040264A1 (en) | 2022-08-19 | 2024-02-22 | Massachusetts Institute Of Technology | Compositions and methods for targeting dendritic cell lectins |
| WO2024052356A1 (en) | 2022-09-06 | 2024-03-14 | Institut National de la Santé et de la Recherche Médicale | Inhibitors of the ceramide metabolic pathway for overcoming immunotherapy resistance in cancer |
| WO2024076926A1 (en) | 2022-10-03 | 2024-04-11 | Regeneron Pharmaceuticals, Inc. | Methods of treating cancer with bispecific egfr x cd28 antibodies alone or in combination with anti-pd-1 antibodies |
| WO2024081736A2 (en) | 2022-10-11 | 2024-04-18 | Yale University | Compositions and methods of using cell-penetrating antibodies |
| WO2024102722A1 (en) | 2022-11-07 | 2024-05-16 | Neoimmunetech, Inc. | Methods of treating a tumor with an unmethylated mgmt promoter |
| WO2024112867A1 (en) | 2022-11-23 | 2024-05-30 | University Of Georgia Research Foundation, Inc. | Compositions and methods of use thereof for increasing immune responses |
| WO2024129778A2 (en) | 2022-12-13 | 2024-06-20 | Juno Therapeutics, Inc. | Chimeric antigen receptors specific for baff-r and cd19 and methods and uses thereof |
| WO2024163477A1 (en) | 2023-01-31 | 2024-08-08 | University Of Rochester | Immune checkpoint blockade therapy for treating staphylococcus aureus infections |
| WO2024192033A1 (en) | 2023-03-13 | 2024-09-19 | Regeneron Pharmaceuticals, Inc. | Combination of pd-1 inhibitors and lag-3 inhibitors for enhanced efficacy in treating melanoma |
| WO2024215787A1 (en) | 2023-04-11 | 2024-10-17 | Ngm Biopharmaceuticals, Inc. | Methods of treating osteosarcoma using lair1 binding agents and pd-1 antagonists |
| WO2024216028A1 (en) | 2023-04-12 | 2024-10-17 | Agenus Inc. | Methods of treating cancer using an anti-ctla4 antibody and an enpp1 inhibitor |
| WO2024213767A1 (en) | 2023-04-14 | 2024-10-17 | Institut National de la Santé et de la Recherche Médicale | Engraftment of mesenchymal stromal cells engineered to stimulate immune infiltration in tumors |
Family Cites Families (115)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2011464A (en) | 1933-03-23 | 1935-08-13 | Winkler Alfred | Device for removing from a pile of sheets the sheet lowermost at the time |
| US4272398A (en) | 1978-08-17 | 1981-06-09 | The United States Of America As Represented By The Secretary Of Agriculture | Microencapsulation process |
| US4376110A (en) | 1980-08-04 | 1983-03-08 | Hybritech, Incorporated | Immunometric assays using monoclonal antibodies |
| US5155020A (en) | 1989-03-08 | 1992-10-13 | Health Research Inc. | Recombinant poxvirus host range selection system |
| US4769330A (en) | 1981-12-24 | 1988-09-06 | Health Research, Incorporated | Modified vaccinia virus and methods for making and using the same |
| US4650764A (en) | 1983-04-12 | 1987-03-17 | Wisconsin Alumni Research Foundation | Helper cell |
| US4861719A (en) | 1986-04-25 | 1989-08-29 | Fred Hutchinson Cancer Research Center | DNA constructs for retrovirus packaging cell lines |
| CH671155A5 (ko) | 1986-08-18 | 1989-08-15 | Clinical Technologies Ass | |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US4980289A (en) | 1987-04-27 | 1990-12-25 | Wisconsin Alumni Research Foundation | Promoter deficient retroviral vector |
| US4861627A (en) | 1987-05-01 | 1989-08-29 | Massachusetts Institute Of Technology | Preparation of multiwall polymeric microcapsules |
| US6699475B1 (en) | 1987-09-02 | 2004-03-02 | Therion Biologics Corporation | Recombinant pox virus for immunization against tumor-associated antigens |
| US5567584A (en) | 1988-01-22 | 1996-10-22 | Zymogenetics, Inc. | Methods of using biologically active dimerized polypeptide fusions to detect PDGF |
| DE721983T1 (de) | 1988-01-22 | 2002-07-04 | Zymogenetics, Inc. | Verfahren zur herstellung von biologisch-aktive Dimerpeptiden |
| US5750375A (en) | 1988-01-22 | 1998-05-12 | Zymogenetics, Inc. | Methods of producing secreted receptor analogs and biologically active dimerized polypeptide fusions |
| US6018026A (en) | 1988-01-22 | 2000-01-25 | Zymogenetics, Inc. | Biologically active dimerized and multimerized polypeptide fusions |
| US5278056A (en) | 1988-02-05 | 1994-01-11 | The Trustees Of Columbia University In The City Of New York | Retroviral packaging cell lines and process of using same |
| US5190929A (en) | 1988-05-25 | 1993-03-02 | Research Corporation Technologies, Inc. | Cyclophosphamide analogs useful as anti-tumor agents |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5124263A (en) | 1989-01-12 | 1992-06-23 | Wisconsin Alumni Research Foundation | Recombination resistant retroviral helper cell and products produced thereby |
| US5225538A (en) | 1989-02-23 | 1993-07-06 | Genentech, Inc. | Lymphocyte homing receptor/immunoglobulin fusion proteins |
| US5225336A (en) | 1989-03-08 | 1993-07-06 | Health Research Incorporated | Recombinant poxvirus host range selection system |
| US5175099A (en) | 1989-05-17 | 1992-12-29 | Research Corporation Technologies, Inc. | Retrovirus-mediated secretion of recombinant products |
| US5240846A (en) | 1989-08-22 | 1993-08-31 | The Regents Of The University Of Michigan | Gene therapy vector for cystic fibrosis |
| US5013556A (en) | 1989-10-20 | 1991-05-07 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5283173A (en) | 1990-01-24 | 1994-02-01 | The Research Foundation Of State University Of New York | System to detect protein-protein interactions |
| US5204243A (en) | 1990-02-14 | 1993-04-20 | Health Research Incorporated | Recombinant poxvirus internal cores |
| US6641809B1 (en) | 1990-03-26 | 2003-11-04 | Bristol-Myers Squibb Company | Method of regulating cellular processes mediated by B7 and CD28 |
| JP3507486B2 (ja) | 1991-03-15 | 2004-03-15 | アムジエン・インコーポレーテツド | 顆粒球コロニー刺激因子の肺内投与 |
| US5637481A (en) | 1993-02-01 | 1997-06-10 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| CA2120234A1 (en) * | 1991-10-21 | 1993-04-29 | Jack B. Jiang | 2-aminopropan-1,3-diol chemotherapeutic agents |
| US5932448A (en) | 1991-11-29 | 1999-08-03 | Protein Design Labs., Inc. | Bispecific antibody heterodimers |
| US5521184A (en) | 1992-04-03 | 1996-05-28 | Ciba-Geigy Corporation | Pyrimidine derivatives and processes for the preparation thereof |
| TW225528B (ko) | 1992-04-03 | 1994-06-21 | Ciba Geigy Ag | |
| US5942607A (en) | 1993-07-26 | 1999-08-24 | Dana-Farber Cancer Institute | B7-2: a CTLA4/CD28 ligand |
| US5861310A (en) | 1993-11-03 | 1999-01-19 | Dana-Farber Cancer Institute | Tumor cells modified to express B7-2 with increased immunogenicity and uses therefor |
| US5451569A (en) | 1994-04-19 | 1995-09-19 | Hong Kong University Of Science And Technology R & D Corporation Limited | Pulmonary drug delivery system |
| US5632983A (en) | 1994-11-17 | 1997-05-27 | University Of South Florida | Method for treating secondary immunodeficiency |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5675848A (en) | 1995-10-18 | 1997-10-14 | Mallinckrodt Medical, Inc. | Inflatable blanket having perforations of different sizes |
| US6750334B1 (en) | 1996-02-02 | 2004-06-15 | Repligen Corporation | CTLA4-immunoglobulin fusion proteins having modified effector functions and uses therefor |
| AU737910B2 (en) | 1997-01-31 | 2001-09-06 | Regents Of The University Of California, The | Chimeric antibody fusion proteins for the recruitment and stimulation of an antitumor immune response |
| US7368531B2 (en) | 1997-03-07 | 2008-05-06 | Human Genome Sciences, Inc. | Human secreted proteins |
| US7411051B2 (en) | 1997-03-07 | 2008-08-12 | Human Genome Sciences, Inc. | Antibodies to HDPPA04 polypeptide |
| US20060223088A1 (en) | 1997-03-07 | 2006-10-05 | Rosen Craig A | Human secreted proteins |
| US20070224663A1 (en) | 1997-03-07 | 2007-09-27 | Human Genome Sciences, Inc. | Human Secreted Proteins |
| US6468546B1 (en) | 1998-12-17 | 2002-10-22 | Corixa Corporation | Compositions and methods for therapy and diagnosis of ovarian cancer |
| WO2001001137A1 (en) | 1999-06-30 | 2001-01-04 | Children's Medical Center Corporation | Fusion protein and uses thereof |
| EP1074617A3 (en) | 1999-07-29 | 2004-04-21 | Research Association for Biotechnology | Primers for synthesising full-length cDNA and their use |
| AU7072700A (en) | 1999-08-23 | 2001-03-19 | Dana-Farber Cancer Institute, Inc. | Pd-1, a receptor for b7-4, and uses therefor |
| US6803192B1 (en) | 1999-11-30 | 2004-10-12 | Mayo Foundation For Medical Education And Research | B7-H1, a novel immunoregulatory molecule |
| UA73976C2 (uk) | 2000-02-15 | 2005-10-17 | Суджен, Інк. | Заміщені піролом 2-індолінони, фармацевтична композиція, спосіб модуляції каталітичної активності протеїнкінази та спосіб лікування або профілактики захворювання, пов'язаного з протеїнкіназою |
| CA2405557C (en) | 2000-04-12 | 2013-09-24 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| US7030219B2 (en) | 2000-04-28 | 2006-04-18 | Johns Hopkins University | B7-DC, Dendritic cell co-stimulatory molecules |
| EP1292619B1 (en) * | 2000-06-06 | 2008-02-06 | Bristol-Myers Squibb Company | B7-related nucleic acids and polypeptides and their uses for immunomodulation |
| US20030031675A1 (en) * | 2000-06-06 | 2003-02-13 | Mikesell Glen E. | B7-related nucleic acids and polypeptides useful for immunomodulation |
| DK1296714T3 (da) * | 2000-06-22 | 2009-12-07 | Coley Pharm Gmbh | Kombination af CpG og antistoffer, der er rettet mod CD19, CD20, CD22 eller CD40 til behandling eller forebyggelse af kræft |
| CA2413857C (en) | 2000-06-28 | 2010-04-27 | Genetics Institute, Llc. | Pd-l2 molecules: pd-1 ligands and uses therefor |
| CA2406649A1 (en) | 2000-06-30 | 2002-01-10 | Human Genome Sciences, Inc. | B7-like polynucleotides, polypeptides, and antibodies |
| US6635750B1 (en) | 2000-07-20 | 2003-10-21 | Millennium Pharmaceuticals, Inc. | B7-H2 nucleic acids, members of the B7 family |
| US20020107363A1 (en) | 2000-09-20 | 2002-08-08 | Amgen, Inc. | B7-Like molecules and uses thereof |
| US7182942B2 (en) | 2000-10-27 | 2007-02-27 | Irx Therapeutics, Inc. | Vaccine immunotherapy for immune suppressed patients |
| US7408041B2 (en) | 2000-12-08 | 2008-08-05 | Alexion Pharmaceuticals, Inc. | Polypeptides and antibodies derived from chronic lymphocytic leukemia cells and uses thereof |
| US6551786B2 (en) | 2001-01-04 | 2003-04-22 | Myriad Genetics, Inc. | Screen assay for selecting protein-protein interaction modulators |
| US6743619B1 (en) | 2001-01-30 | 2004-06-01 | Nuvelo | Nucleic acids and polypeptides |
| CA2442066C (en) | 2001-04-02 | 2005-11-01 | Wyeth | Pd-1, a receptor for b7-4, and uses therefor |
| AR036993A1 (es) | 2001-04-02 | 2004-10-20 | Wyeth Corp | Uso de agentes que modulan la interaccion entre pd-1 y sus ligandos en la submodulacion de respuestas inmunologicas |
| US20060084794A1 (en) | 2001-04-12 | 2006-04-20 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| WO2002086083A2 (en) | 2001-04-20 | 2002-10-31 | Mayo Foundation For Medical Education And Research | Methods of enhancing cell responsiveness |
| GB0121285D0 (en) * | 2001-09-03 | 2001-10-24 | Cancer Res Ventures Ltd | Anti-cancer combinations |
| DE60224822T2 (de) | 2001-10-19 | 2009-01-22 | Zymogenetics, Inc., Seattle | Dimerisierter wachstumsfaktor sowie materialien und verfahren zu seiner herstellung |
| EP1456652A4 (en) | 2001-11-13 | 2005-11-02 | Dana Farber Cancer Inst Inc | IMMUNOCELL ACTIVATION MODULATING SUBSTANCES AND USE METHOD THEREFOR |
| US7164500B2 (en) | 2002-01-29 | 2007-01-16 | Hewlett-Packard Development Company, L.P. | Method and apparatus for the automatic generation of image capture device control marks |
| IL149820A0 (en) | 2002-05-23 | 2002-11-10 | Curetech Ltd | Humanized immunomodulatory monoclonal antibodies for the treatment of neoplastic disease or immunodeficiency |
| FI2206517T3 (fi) | 2002-07-03 | 2023-10-19 | Ono Pharmaceutical Co | Immuunopotentioivia koostumuksia käsittäen anti-PD-L1 -vasta-aineita |
| US7052694B2 (en) | 2002-07-16 | 2006-05-30 | Mayo Foundation For Medical Education And Research | Dendritic cell potentiation |
| CA2494911A1 (en) | 2002-08-12 | 2004-02-19 | Dynavax Technologies Corporation | Immunomodulatory compositions, methods of making, and methods of use thereof |
| US7432351B1 (en) | 2002-10-04 | 2008-10-07 | Mayo Foundation For Medical Education And Research | B7-H1 variants |
| ATE514713T1 (de) | 2002-12-23 | 2011-07-15 | Wyeth Llc | Antikörper gegen pd-1 und ihre verwendung |
| EP1591527B1 (en) | 2003-01-23 | 2015-08-26 | Ono Pharmaceutical Co., Ltd. | Substance specific to human pd-1 |
| WO2004076479A2 (en) | 2003-02-27 | 2004-09-10 | Theravision Gmbh | Soluble ctla4 polypeptides and methods for making the same |
| EP2251353B1 (en) | 2003-08-07 | 2013-03-06 | ZymoGenetics, Inc. | Homogeneous preparations of IL-29 |
| EP1732946B1 (en) | 2004-03-08 | 2011-07-27 | ZymoGenetics, Inc. | Dimeric fusion proteins and materials and methods for producing them |
| ES2405273T3 (es) | 2004-06-24 | 2013-05-30 | Mayo Foundation For Medical Education And Research | Polipéptido coestimulador B7-H5 |
| US20060099203A1 (en) | 2004-11-05 | 2006-05-11 | Pease Larry R | B7-DC binding antibody |
| EP1773318A1 (en) * | 2004-07-23 | 2007-04-18 | OM Pharma | Combination anticancer therapy and pharmaceutical compositions therefor |
| US20070166281A1 (en) | 2004-08-21 | 2007-07-19 | Kosak Kenneth M | Chloroquine coupled antibodies and other proteins with methods for their synthesis |
| PL1810026T3 (pl) * | 2004-10-06 | 2018-08-31 | Mayo Foundation For Medical Education And Research | B7-H1 i PD-1 w leczeniu raka nerkowokomórkowego |
| WO2006050172A2 (en) | 2004-10-29 | 2006-05-11 | University Of Southern California | Combination cancer immunotherapy with co-stimulatory molecules |
| EP2439273B1 (en) | 2005-05-09 | 2019-02-27 | Ono Pharmaceutical Co., Ltd. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| LT2397156T (lt) | 2005-06-08 | 2017-02-27 | Dana-Farber Cancer Institute, Inc. | Būdai ir kompozicijos, skirti nuolatinių infekcijų ir vėžio gydymui inhibuojant užprogramuotos ląstelės mirties-1 (pd-1) kelią |
| ES2546333T3 (es) * | 2005-07-01 | 2015-09-22 | E. R. Squibb & Sons, L.L.C. | Anticuerpos monoclonales humanos para ligandos 1 (PD-L1) de muerte programada |
| GB0519303D0 (en) | 2005-09-21 | 2005-11-02 | Oxford Biomedica Ltd | Chemo-immunotherapy method |
| US20070231344A1 (en) * | 2005-10-28 | 2007-10-04 | The Brigham And Women's Hospital, Inc. | Conjugate vaccines for non-proteinaceous antigens |
| US20070243184A1 (en) | 2005-11-08 | 2007-10-18 | Steven Fischkoff | Prophylaxis and treatment of enterocolitis associated with anti-ctla-4 antibody therapy |
| EP2345412A1 (en) | 2005-12-02 | 2011-07-20 | The Johns Hopkins University | Use of high-dose oxazaphosphorine drugs for treating immune disorders |
| NZ568016A (en) | 2005-12-07 | 2011-12-22 | Medarex Inc | CTLA-4 antibody dosage escalation regimens |
| CA2632663C (en) | 2005-12-08 | 2015-08-18 | University Of Louisville Research Foundation, Inc. | Immunostimulatory compositions and methods |
| CA2663521A1 (en) | 2006-09-20 | 2008-07-17 | The Johns Hopkins University | Combinatorial therapy of cancer and infectious diseases with anti-b7-h1 antibodies |
| WO2008037080A1 (en) | 2006-09-29 | 2008-04-03 | Universite De Montreal | Methods and compositions for immune response modulation and uses thereof |
| CN101663323A (zh) | 2006-12-27 | 2010-03-03 | 埃默里大学 | 用于治疗传染病和肿瘤的组合物和方法 |
| WO2008100562A2 (en) * | 2007-02-14 | 2008-08-21 | Medical College Of Georgia Research Institute, Inc. | Indoleamine 2,3-dioxygenase, pd-1/pd-l pathways, and ctla4 pathways in the activation of regulatory t cells |
| CN101784564B (zh) | 2007-07-13 | 2014-07-02 | 约翰霍普金斯大学 | B7-dc变体 |
| WO2009014708A2 (en) | 2007-07-23 | 2009-01-29 | Cell Genesys, Inc. | Pd-1 antibodies in combination with a cytokine-secreting cell and methods of use thereof |
| WO2009023566A2 (en) | 2007-08-09 | 2009-02-19 | Genzyme Corporation | Method of treating autoimmune disease with mesenchymal stem cells |
| CA2704038A1 (en) | 2007-10-31 | 2009-05-07 | The Scripps Research Institute | Combination therapy to treat persistent viral infections |
| WO2009073533A2 (en) | 2007-11-30 | 2009-06-11 | Medarex, Inc. | Anti-b7h4 monoclonal antibody-drug conjugate and methods of use |
| MX2010008786A (es) | 2008-02-11 | 2010-12-01 | Curetech Ltd | Anticuerpos monoclonales para tratamiento de tumores. |
| US20090226435A1 (en) | 2008-03-08 | 2009-09-10 | Sanjay Khare | Engineered fusion molecules immunotherapy in cancer and inflammatory diseases |
| EP2262837A4 (en) | 2008-03-12 | 2011-04-06 | Merck Sharp & Dohme | PD-1 BINDING PROTEINS |
| DK2113253T3 (da) | 2008-04-30 | 2010-07-19 | Immatics Biotechnologies Gmbh | Ny sammensætning af tumorassocierede peptider, der bindes til humant leukocyt-antigen (HLA) klasse I eller II molekyler, til vaccinebrug |
| PL2350129T3 (pl) | 2008-08-25 | 2015-12-31 | Amplimmune Inc | Kompozycje antagonistów PD-1 i sposoby stosowania |
| JP2012500855A (ja) | 2008-08-25 | 2012-01-12 | アンプリミューン、インコーポレーテッド | Pd−1アンタゴニストおよび感染性疾患を処置するための方法 |
| KR20190069615A (ko) | 2008-12-09 | 2019-06-19 | 제넨테크, 인크. | 항-pd-l1 항체 및 t 세포 기능을 향상시키기 위한 그의 용도 |
| JP2013512251A (ja) | 2009-11-24 | 2013-04-11 | アンプリミューン、インコーポレーテッド | Pd−l1/pd−l2の同時阻害 |
-
2009
- 2009-08-25 PL PL09811805T patent/PL2350129T3/pl unknown
- 2009-08-25 US US12/547,129 patent/US8114845B2/en not_active Expired - Fee Related
- 2009-08-25 RS RS20150547A patent/RS54233B1/en unknown
- 2009-08-25 HU HUE09811805A patent/HUE027525T2/en unknown
- 2009-08-25 EP EP15163742.8A patent/EP2927240A1/en not_active Withdrawn
- 2009-08-25 AU AU2009288730A patent/AU2009288730B2/en not_active Ceased
- 2009-08-25 CA CA2734908A patent/CA2734908A1/en not_active Abandoned
- 2009-08-25 PT PT98118052T patent/PT2350129E/pt unknown
- 2009-08-25 PE PE2011000200A patent/PE20110435A1/es not_active Application Discontinuation
- 2009-08-25 CN CN2009801422563A patent/CN102203132A/zh active Pending
- 2009-08-25 SI SI200931266T patent/SI2350129T1/sl unknown
- 2009-08-25 DK DK09811805.2T patent/DK2350129T3/en active
- 2009-08-25 EA EA201170373A patent/EA023148B1/ru not_active IP Right Cessation
- 2009-08-25 EP EP09811805.2A patent/EP2350129B1/en active Active
- 2009-08-25 MX MX2011002252A patent/MX2011002252A/es active IP Right Grant
- 2009-08-25 KR KR1020117006754A patent/KR20110050529A/ko not_active Application Discontinuation
- 2009-08-25 EA EA201500417A patent/EA201500417A1/ru unknown
- 2009-08-25 JP JP2011524986A patent/JP5798919B2/ja not_active Expired - Fee Related
- 2009-08-25 NZ NZ591130A patent/NZ591130A/xx not_active IP Right Cessation
- 2009-08-25 ES ES09811805.2T patent/ES2545609T3/es active Active
- 2009-08-25 WO PCT/US2009/004825 patent/WO2010027423A2/en active Application Filing
-
2011
- 2011-02-11 ZA ZA2011/01120A patent/ZA201101120B/en unknown
- 2011-02-17 IL IL211298A patent/IL211298A0/en unknown
- 2011-02-22 DO DO2011000059A patent/DOP2011000059A/es unknown
- 2011-02-25 CO CO11023516A patent/CO6341574A2/es not_active Application Discontinuation
- 2011-02-25 CL CL2011000423A patent/CL2011000423A1/es unknown
- 2011-03-18 MA MA33714A patent/MA32646B1/fr unknown
- 2011-12-06 US US13/312,201 patent/US20130230514A1/en not_active Abandoned
- 2011-12-20 US US13/332,164 patent/US8709416B2/en not_active Expired - Fee Related
- 2011-12-20 US US13/332,154 patent/US8609089B2/en not_active Expired - Fee Related
-
2015
- 2015-09-07 HR HRP20150933TT patent/HRP20150933T1/hr unknown
- 2015-09-07 CY CY20151100775T patent/CY1116816T1/el unknown
- 2015-09-09 SM SM201500212T patent/SMT201500212B/xx unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150027135A (ko) * | 2012-05-31 | 2015-03-11 | 제넨테크, 인크. | Pd-l1 축 결합 길항제 및 vegf 길항제를 사용하여 암을 치료하는 방법 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20110050529A (ko) | Pd-1 길항제의 조성물 및 사용 방법 | |
| US11760787B2 (en) | B7-H5, a costimulatory polypeptide | |
| AU2009288289B2 (en) | PD-1 antagonists and methods of use thereof | |
| KR20240035633A (ko) | Lair 신호 변환을 조정하기 위한 조성물 및 방법 | |
| JP2021512151A (ja) | B7−h4抗体およびその使用方法 | |
| KR20220065839A (ko) | 면역요법의 증강제로서 유용한 il-10/fc 융합 단백질 | |
| CN110115758B (zh) | Pik3ip1蛋白在调节t细胞反应和制备抗肿瘤药物中的应用 | |
| RU2812915C2 (ru) | Антитела к белку программируемой клеточной смерти 1 | |
| AU2013227994A1 (en) | Compositions of PD-1 antagonists and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |