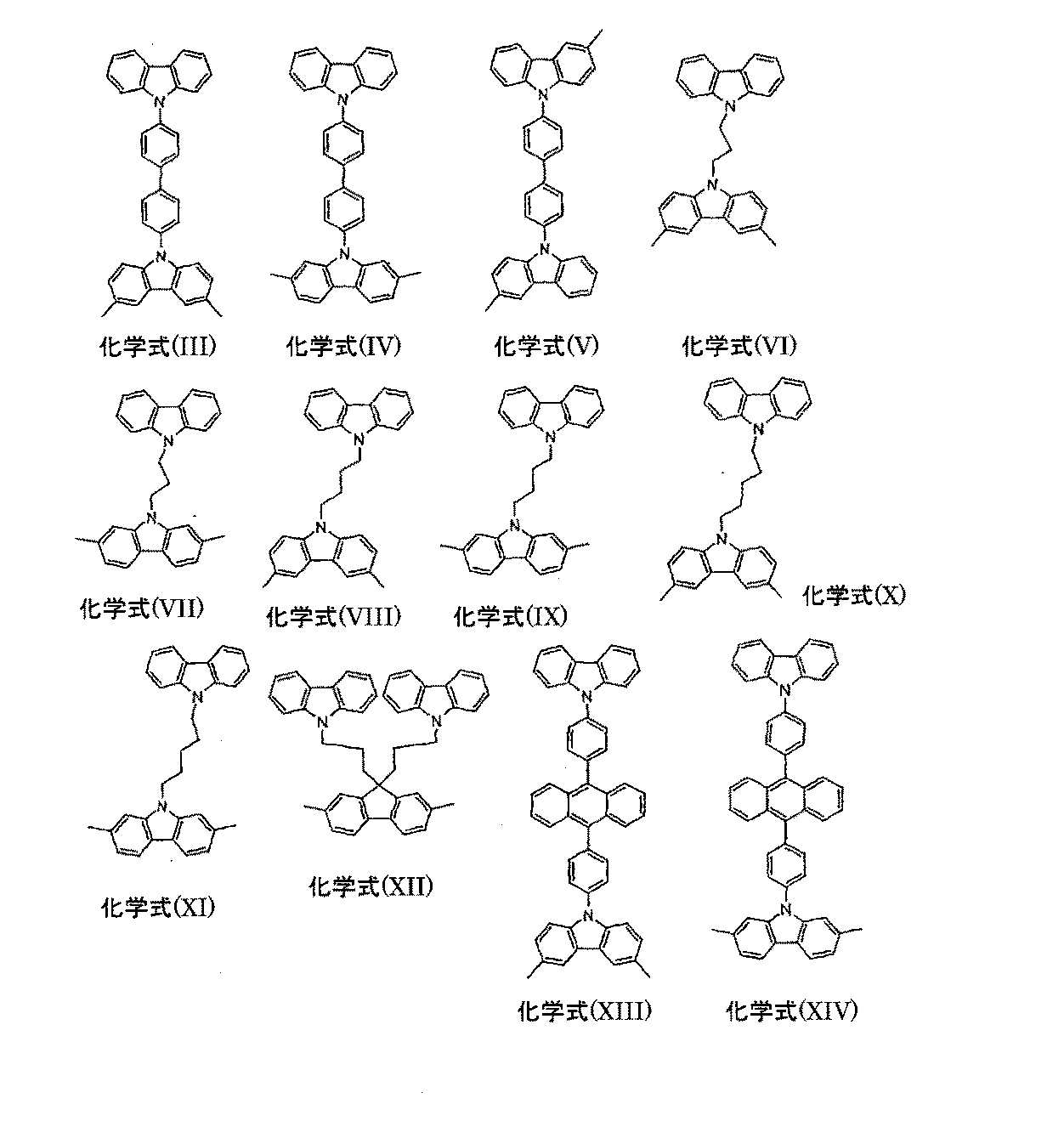JP4874792B2 - 電界発光用新規材料 - Google Patents
電界発光用新規材料 Download PDFInfo
- Publication number
- JP4874792B2 JP4874792B2 JP2006516042A JP2006516042A JP4874792B2 JP 4874792 B2 JP4874792 B2 JP 4874792B2 JP 2006516042 A JP2006516042 A JP 2006516042A JP 2006516042 A JP2006516042 A JP 2006516042A JP 4874792 B2 JP4874792 B2 JP 4874792B2
- Authority
- JP
- Japan
- Prior art keywords
- carbon atoms
- substituted
- polymer
- unit
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000000463 material Substances 0.000 title description 10
- 238000005401 electroluminescence Methods 0.000 title description 3
- 229920000642 polymer Polymers 0.000 claims description 93
- 239000000203 mixture Substances 0.000 claims description 87
- 125000004432 carbon atom Chemical group C* 0.000 claims description 49
- 125000003118 aryl group Chemical group 0.000 claims description 35
- UJOBWOGCFQCDNV-UHFFFAOYSA-N Carbazole Natural products C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 claims description 34
- 125000001424 substituent group Chemical group 0.000 claims description 34
- 150000001875 compounds Chemical class 0.000 claims description 24
- 229920000547 conjugated polymer Polymers 0.000 claims description 24
- 239000000126 substance Substances 0.000 claims description 22
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims description 21
- -1 stilbenyl unit Chemical group 0.000 claims description 21
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 claims description 18
- 125000001072 heteroaryl group Chemical group 0.000 claims description 15
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 claims description 14
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 14
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 claims description 14
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 claims description 14
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 claims description 14
- 229910052760 oxygen Inorganic materials 0.000 claims description 13
- 229910052794 bromium Inorganic materials 0.000 claims description 12
- 229910052717 sulfur Inorganic materials 0.000 claims description 11
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 claims description 9
- 229910052731 fluorine Inorganic materials 0.000 claims description 9
- 229910052741 iridium Inorganic materials 0.000 claims description 9
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 claims description 8
- ICPSWZFVWAPUKF-UHFFFAOYSA-N 1,1'-spirobi[fluorene] Chemical compound C1=CC=C2C=C3C4(C=5C(C6=CC=CC=C6C=5)=CC=C4)C=CC=C3C2=C1 ICPSWZFVWAPUKF-UHFFFAOYSA-N 0.000 claims description 7
- 125000004429 atom Chemical group 0.000 claims description 7
- 239000004305 biphenyl Substances 0.000 claims description 7
- 235000010290 biphenyl Nutrition 0.000 claims description 7
- XXPBFNVKTVJZKF-UHFFFAOYSA-N dihydrophenanthrene Natural products C1=CC=C2CCC3=CC=CC=C3C2=C1 XXPBFNVKTVJZKF-UHFFFAOYSA-N 0.000 claims description 7
- 238000002347 injection Methods 0.000 claims description 7
- 239000007924 injection Substances 0.000 claims description 7
- 229910052757 nitrogen Inorganic materials 0.000 claims description 7
- 125000001997 phenyl group Chemical class [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 7
- 229930192474 thiophene Natural products 0.000 claims description 7
- 229910052801 chlorine Inorganic materials 0.000 claims description 6
- 239000011737 fluorine Substances 0.000 claims description 6
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 6
- 229910052740 iodine Inorganic materials 0.000 claims description 6
- 229910052751 metal Inorganic materials 0.000 claims description 6
- 239000002184 metal Substances 0.000 claims description 6
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 5
- 150000002220 fluorenes Chemical class 0.000 claims description 5
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 claims description 4
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 claims description 4
- 229910004013 NO 2 Inorganic materials 0.000 claims description 3
- 125000001931 aliphatic group Chemical group 0.000 claims description 3
- 125000003545 alkoxy group Chemical group 0.000 claims description 3
- 125000004104 aryloxy group Chemical group 0.000 claims description 3
- 125000006165 cyclic alkyl group Chemical group 0.000 claims description 3
- 230000003287 optical effect Effects 0.000 claims description 3
- 229910052763 palladium Inorganic materials 0.000 claims description 3
- 125000003367 polycyclic group Chemical group 0.000 claims description 3
- 229910052723 transition metal Inorganic materials 0.000 claims description 3
- 150000003624 transition metals Chemical class 0.000 claims description 3
- 229920002554 vinyl polymer Polymers 0.000 claims description 3
- 125000004958 1,4-naphthylene group Chemical group 0.000 claims description 2
- 125000005731 2,5-thiophenylene group Chemical group [H]C1=C([*:1])SC([*:2])=C1[H] 0.000 claims description 2
- SNFCXVRWFNAHQX-UHFFFAOYSA-N 9,9'-spirobi[fluorene] Chemical compound C12=CC=CC=C2C2=CC=CC=C2C21C1=CC=CC=C1C1=CC=CC=C21 SNFCXVRWFNAHQX-UHFFFAOYSA-N 0.000 claims description 2
- PJULCNAVAGQLAT-UHFFFAOYSA-N indeno[2,1-a]fluorene Chemical compound C1=CC=C2C=C3C4=CC5=CC=CC=C5C4=CC=C3C2=C1 PJULCNAVAGQLAT-UHFFFAOYSA-N 0.000 claims description 2
- 229910052762 osmium Inorganic materials 0.000 claims description 2
- 230000000737 periodic effect Effects 0.000 claims description 2
- 229910052703 rhodium Inorganic materials 0.000 claims description 2
- 229910052707 ruthenium Inorganic materials 0.000 claims description 2
- 125000005259 triarylamine group Chemical group 0.000 claims description 2
- 125000000217 alkyl group Chemical group 0.000 claims 3
- 125000004122 cyclic group Chemical group 0.000 claims 2
- 125000005565 oxadiazolylene group Chemical group 0.000 claims 1
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 39
- 239000000178 monomer Substances 0.000 description 27
- 239000000243 solution Substances 0.000 description 20
- 230000015572 biosynthetic process Effects 0.000 description 15
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 14
- 239000002904 solvent Substances 0.000 description 14
- 238000003786 synthesis reaction Methods 0.000 description 14
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 238000004128 high performance liquid chromatography Methods 0.000 description 10
- 238000005481 NMR spectroscopy Methods 0.000 description 9
- 239000000412 dendrimer Substances 0.000 description 9
- 229920000736 dendritic polymer Polymers 0.000 description 9
- 238000000034 method Methods 0.000 description 9
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 8
- FIHILUSWISKVSR-UHFFFAOYSA-N 3,6-dibromo-9h-carbazole Chemical compound C1=C(Br)C=C2C3=CC(Br)=CC=C3NC2=C1 FIHILUSWISKVSR-UHFFFAOYSA-N 0.000 description 8
- 230000008901 benefit Effects 0.000 description 8
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 8
- 238000010992 reflux Methods 0.000 description 8
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 7
- 229910000104 sodium hydride Inorganic materials 0.000 description 7
- QPUYECUOLPXSFR-UHFFFAOYSA-N 1-methylnaphthalene Chemical compound C1=CC=C2C(C)=CC=CC2=C1 QPUYECUOLPXSFR-UHFFFAOYSA-N 0.000 description 6
- QPTWWBLGJZWRAV-UHFFFAOYSA-N 2,7-dibromo-9-H-carbazole Natural products BrC1=CC=C2C3=CC=C(Br)C=C3NC2=C1 QPTWWBLGJZWRAV-UHFFFAOYSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 6
- 150000003384 small molecules Chemical class 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- PHKYYUQQYARDIU-UHFFFAOYSA-N 3-methyl-9h-carbazole Chemical compound C1=CC=C2C3=CC(C)=CC=C3NC2=C1 PHKYYUQQYARDIU-UHFFFAOYSA-N 0.000 description 5
- 229920000265 Polyparaphenylene Polymers 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 125000002947 alkylene group Chemical group 0.000 description 5
- 239000007789 gas Substances 0.000 description 5
- 238000002156 mixing Methods 0.000 description 5
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 5
- 125000002524 organometallic group Chemical group 0.000 description 5
- 238000006116 polymerization reaction Methods 0.000 description 5
- 230000001681 protective effect Effects 0.000 description 5
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 4
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 4
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 4
- 239000012300 argon atmosphere Substances 0.000 description 4
- 150000001716 carbazoles Chemical class 0.000 description 4
- 229910052799 carbon Inorganic materials 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 4
- 150000002367 halogens Chemical group 0.000 description 4
- 125000000623 heterocyclic group Chemical group 0.000 description 4
- 239000010410 layer Substances 0.000 description 4
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 4
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 4
- JHJLBTNAGRQEKS-UHFFFAOYSA-M sodium bromide Chemical compound [Na+].[Br-] JHJLBTNAGRQEKS-UHFFFAOYSA-M 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- 239000008096 xylene Substances 0.000 description 4
- DTFKRVXLBCAIOZ-UHFFFAOYSA-N 2-methylanisole Chemical compound COC1=CC=CC=C1C DTFKRVXLBCAIOZ-UHFFFAOYSA-N 0.000 description 3
- ZVQPLPSCABMKLZ-UHFFFAOYSA-N 3-methyl-9-[4-[4-(3-methylcarbazol-9-yl)phenyl]phenyl]carbazole Chemical group C12=CC=CC=C2C2=CC(C)=CC=C2N1C1=CC=C(C=2C=CC(=CC=2)N2C3=CC=C(C)C=C3C3=CC=CC=C32)C=C1 ZVQPLPSCABMKLZ-UHFFFAOYSA-N 0.000 description 3
- KJSZNBRGRCCYHF-UHFFFAOYSA-N 9-(3-bromopropyl)carbazole Chemical compound C1=CC=C2N(CCCBr)C3=CC=CC=C3C2=C1 KJSZNBRGRCCYHF-UHFFFAOYSA-N 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical group CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 3
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- 238000006664 bond formation reaction Methods 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 238000004440 column chromatography Methods 0.000 description 3
- 230000000052 comparative effect Effects 0.000 description 3
- 230000021615 conjugation Effects 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 238000005265 energy consumption Methods 0.000 description 3
- 229910052736 halogen Inorganic materials 0.000 description 3
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 3
- 239000012074 organic phase Substances 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 229920002098 polyfluorene Polymers 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 239000012312 sodium hydride Substances 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 230000007704 transition Effects 0.000 description 3
- 238000011282 treatment Methods 0.000 description 3
- 238000007740 vapor deposition Methods 0.000 description 3
- VEFLKXRACNJHOV-UHFFFAOYSA-N 1,3-dibromopropane Chemical compound BrCCCBr VEFLKXRACNJHOV-UHFFFAOYSA-N 0.000 description 2
- AVXFJPFSWLMKSG-UHFFFAOYSA-N 2,7-dibromo-9h-fluorene Chemical compound BrC1=CC=C2C3=CC=C(Br)C=C3CC2=C1 AVXFJPFSWLMKSG-UHFFFAOYSA-N 0.000 description 2
- RICKKZXCGCSLIU-UHFFFAOYSA-N 2-[2-[carboxymethyl-[[3-hydroxy-5-(hydroxymethyl)-2-methylpyridin-4-yl]methyl]amino]ethyl-[[3-hydroxy-5-(hydroxymethyl)-2-methylpyridin-4-yl]methyl]amino]acetic acid Chemical compound CC1=NC=C(CO)C(CN(CCN(CC(O)=O)CC=2C(=C(C)N=CC=2CO)O)CC(O)=O)=C1O RICKKZXCGCSLIU-UHFFFAOYSA-N 0.000 description 2
- PWJYOTPKLOICJK-UHFFFAOYSA-N 3-methylcarbazole Natural products C1=CC=C2C3=CC=C(C)C=C3NC2=C1 PWJYOTPKLOICJK-UHFFFAOYSA-N 0.000 description 2
- IXCQFUSWIBGIQG-UHFFFAOYSA-N 9-(4-bromobutyl)carbazole Chemical compound C1=CC=C2N(CCCCBr)C3=CC=CC=C3C2=C1 IXCQFUSWIBGIQG-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 2
- GODFYRLYJQMVAD-UHFFFAOYSA-N C1=CC=CC=C1C1=CC=CN=C1[Ir](C=1C(=CC=CN=1)C=1C=CC=CC=1)C1=NC=CC=C1C1=CC=CC=C1 Chemical class C1=CC=CC=C1C1=CC=CN=C1[Ir](C=1C(=CC=CN=1)C=1C=CC=CC=1)C1=NC=CC=C1C1=CC=CC=C1 GODFYRLYJQMVAD-UHFFFAOYSA-N 0.000 description 2
- 0 CC(*)(C=C1)C=Cc2c1c(C=CC(C)(CC(*)=N)C=C1)c1[n]2*[n]1c(C=CC(C)(*=C)C=C2)c2c2c1C=C*(*)C=C2 Chemical compound CC(*)(C=C1)C=Cc2c1c(C=CC(C)(CC(*)=N)C=C1)c1[n]2*[n]1c(C=CC(C)(*=C)C=C2)c2c2c1C=C*(*)C=C2 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- 238000006619 Stille reaction Methods 0.000 description 2
- 238000006069 Suzuki reaction reaction Methods 0.000 description 2
- 239000011149 active material Substances 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 2
- 230000031709 bromination Effects 0.000 description 2
- 238000005893 bromination reaction Methods 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 238000007306 functionalization reaction Methods 0.000 description 2
- 150000002366 halogen compounds Chemical class 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 229910000160 potassium phosphate Inorganic materials 0.000 description 2
- 235000011009 potassium phosphates Nutrition 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000006862 quantum yield reaction Methods 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- MNWBNISUBARLIT-UHFFFAOYSA-N sodium cyanide Chemical compound [Na+].N#[C-] MNWBNISUBARLIT-UHFFFAOYSA-N 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- ATWLRNODAYAMQS-UHFFFAOYSA-N 1,1-dibromopropane Chemical compound CCC(Br)Br ATWLRNODAYAMQS-UHFFFAOYSA-N 0.000 description 1
- ULTHEAFYOOPTTB-UHFFFAOYSA-N 1,4-dibromobutane Chemical compound BrCCCCBr ULTHEAFYOOPTTB-UHFFFAOYSA-N 0.000 description 1
- HQJQYILBCQPYBI-UHFFFAOYSA-N 1-bromo-4-(4-bromophenyl)benzene Chemical group C1=CC(Br)=CC=C1C1=CC=C(Br)C=C1 HQJQYILBCQPYBI-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- HDCPQTBWYINLEL-UHFFFAOYSA-N 2,3,5,6-tetraphenylbenzene-1,4-diamine Chemical group C=1C=CC=CC=1C1=C(N)C(C=2C=CC=CC=2)=C(C=2C=CC=CC=2)C(N)=C1C1=CC=CC=C1 HDCPQTBWYINLEL-UHFFFAOYSA-N 0.000 description 1
- IUVCFHHAEHNCFT-INIZCTEOSA-N 2-[(1s)-1-[4-amino-3-(3-fluoro-4-propan-2-yloxyphenyl)pyrazolo[3,4-d]pyrimidin-1-yl]ethyl]-6-fluoro-3-(3-fluorophenyl)chromen-4-one Chemical compound C1=C(F)C(OC(C)C)=CC=C1C(C1=C(N)N=CN=C11)=NN1[C@@H](C)C1=C(C=2C=C(F)C=CC=2)C(=O)C2=CC(F)=CC=C2O1 IUVCFHHAEHNCFT-INIZCTEOSA-N 0.000 description 1
- IRTCJFCIQKNFPP-UHFFFAOYSA-N 2-methyl-1,4-dioxane Chemical compound CC1COCCO1 IRTCJFCIQKNFPP-UHFFFAOYSA-N 0.000 description 1
- XFKAGZBULPTUAK-UHFFFAOYSA-N 3-bromo-9-[4-[4-(3-bromo-6-methylcarbazol-9-yl)phenyl]phenyl]-6-methylcarbazole Chemical group C12=CC=C(Br)C=C2C2=CC(C)=CC=C2N1C1=CC=C(C=2C=CC(=CC=2)N2C3=CC=C(Br)C=C3C3=CC(C)=CC=C32)C=C1 XFKAGZBULPTUAK-UHFFFAOYSA-N 0.000 description 1
- DSNQPNGWFBNTQE-UHFFFAOYSA-N 4-(4-aminophenyl)-2,3,5,6-tetraphenylaniline Chemical group C1=CC(N)=CC=C1C(C(=C(C=1C=CC=CC=1)C(N)=C1C=2C=CC=CC=2)C=2C=CC=CC=2)=C1C1=CC=CC=C1 DSNQPNGWFBNTQE-UHFFFAOYSA-N 0.000 description 1
- AEUXLPUUNJMBLQ-UHFFFAOYSA-N 4-(bromomethyl)-1,2-dipentoxybenzene Chemical compound CCCCCOC1=CC=C(CBr)C=C1OCCCCC AEUXLPUUNJMBLQ-UHFFFAOYSA-N 0.000 description 1
- PMJDIEGGCRBUET-UHFFFAOYSA-N 6-bromo-1-(3-bromobutyl)-9-carbazol-9-ylcarbazole Chemical compound BrC(CCC1=CC=CC=2C3=CC(=CC=C3N(C12)N1C2=CC=CC=C2C=2C=CC=CC12)Br)C PMJDIEGGCRBUET-UHFFFAOYSA-N 0.000 description 1
- UKLPSWVXWRCFHJ-UHFFFAOYSA-N 6-bromo-1-(3-bromopropyl)-9-carbazol-9-ylcarbazole Chemical compound BrCCCC1=CC=CC=2C3=CC(=CC=C3N(C12)N1C2=CC=CC=C2C=2C=CC=CC12)Br UKLPSWVXWRCFHJ-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- PUMJBASCKOPOOW-UHFFFAOYSA-N 9-[2',7,7'-tri(carbazol-9-yl)-9,9'-spirobi[fluorene]-2-yl]carbazole Chemical group C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C(=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C23C4=CC(=CC=C4C4=CC=C(C=C42)N2C4=CC=CC=C4C4=CC=CC=C42)N2C4=CC=CC=C4C4=CC=CC=C42)C3=C1 PUMJBASCKOPOOW-UHFFFAOYSA-N 0.000 description 1
- PEJPEMIEPXUGRR-UHFFFAOYSA-N 9-[3-[2,7-dibromo-9-(3-carbazol-9-ylpropyl)fluoren-9-yl]propyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1CCCC1(CCCN2C3=CC=CC=C3C3=CC=CC=C32)C2=CC(Br)=CC=C2C2=CC=C(Br)C=C21 PEJPEMIEPXUGRR-UHFFFAOYSA-N 0.000 description 1
- LFHHICCSUVCXTL-UHFFFAOYSA-N 9-[4-[2,7-dibromo-9-(4-carbazol-9-ylbutyl)fluoren-9-yl]butyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1CCCCC1(CCCCN2C3=CC=CC=C3C3=CC=CC=C32)C2=CC(Br)=CC=C2C2=CC=C(Br)C=C21 LFHHICCSUVCXTL-UHFFFAOYSA-N 0.000 description 1
- NBGYDKYGLKCYFS-UHFFFAOYSA-N 9-carbazol-9-yl-1-propylcarbazole Chemical compound C1=CC=CC=2C3=CC=CC=C3N(C12)N1C2=CC=CC=C2C=2C=CC=C(C12)CCC NBGYDKYGLKCYFS-UHFFFAOYSA-N 0.000 description 1
- SRNIXQHICVKSQE-UHFFFAOYSA-N 9h-carbazole;9h-fluorene Chemical class C1=CC=C2CC3=CC=CC=C3C2=C1.C1=CC=C2C3=CC=CC=C3NC2=C1 SRNIXQHICVKSQE-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- LRGOCXVQEJOXKY-UHFFFAOYSA-N BrC(CCN1C2=CC=CC=C2C=2C=CC=CC12)C Chemical compound BrC(CCN1C2=CC=CC=C2C=2C=CC=CC12)C LRGOCXVQEJOXKY-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 238000007126 N-alkylation reaction Methods 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- NPRDEIDCAUHOJU-UHFFFAOYSA-N [Pt].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 Chemical class [Pt].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 NPRDEIDCAUHOJU-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002152 alkylating effect Effects 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 125000005264 aryl amine group Chemical group 0.000 description 1
- 125000001769 aryl amino group Chemical group 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 238000005574 benzylation reaction Methods 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical class OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 150000004292 cyclic ethers Chemical class 0.000 description 1
- 125000002993 cycloalkylene group Chemical group 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000000151 deposition Methods 0.000 description 1
- 125000004986 diarylamino group Chemical group 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 125000005549 heteroarylene group Chemical group 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- RTRAMYYYHJZWQK-UHFFFAOYSA-N iridium;2-phenylpyridine Chemical compound [Ir].C1=CC=CC=C1C1=CC=CC=N1 RTRAMYYYHJZWQK-UHFFFAOYSA-N 0.000 description 1
- 229920000267 ladder-type polyparaphenylene Polymers 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 125000000962 organic group Chemical group 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 150000002902 organometallic compounds Chemical class 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical group C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 238000010651 palladium-catalyzed cross coupling reaction Methods 0.000 description 1
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 1
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920001690 polydopamine Polymers 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000001226 reprecipitation Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- ZGNPLWZYVAFUNZ-UHFFFAOYSA-N tert-butylphosphane Chemical compound CC(C)(C)P ZGNPLWZYVAFUNZ-UHFFFAOYSA-N 0.000 description 1
- 125000006617 triphenylamine group Chemical group 0.000 description 1
- 238000001771 vacuum deposition Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L23/00—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers
- C08L23/02—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers not modified by chemical after-treatment
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/12—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule
- C08G61/122—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides
- C08G61/123—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides derived from five-membered heterocyclic compounds
- C08G61/124—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides derived from five-membered heterocyclic compounds with a five-membered ring containing one nitrogen atom in the ring
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L65/00—Compositions of macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain; Compositions of derivatives of such polymers
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B23/00—Methine or polymethine dyes, e.g. cyanine dyes
- C09B23/14—Styryl dyes
- C09B23/145—Styryl dyes the ethylene chain carrying an heterocyclic residue, e.g. heterocycle-CH=CH-C6H5
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/101—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing an anthracene dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/105—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing a methine or polymethine dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/109—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing other specific dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
- H10K85/113—Heteroaromatic compounds comprising sulfur or selene, e.g. polythiophene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/151—Copolymers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/10—Definition of the polymer structure
- C08G2261/14—Side-groups
- C08G2261/152—Side-groups comprising metal complexes
- C08G2261/1526—Side-groups comprising metal complexes of Os, Ir, Pt, Ru, Rh or Pd
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/30—Monomer units or repeat units incorporating structural elements in the main chain
- C08G2261/31—Monomer units or repeat units incorporating structural elements in the main chain incorporating aromatic structural elements in the main chain
- C08G2261/312—Non-condensed aromatic systems, e.g. benzene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/30—Monomer units or repeat units incorporating structural elements in the main chain
- C08G2261/31—Monomer units or repeat units incorporating structural elements in the main chain incorporating aromatic structural elements in the main chain
- C08G2261/314—Condensed aromatic systems, e.g. perylene, anthracene or pyrene
- C08G2261/3142—Condensed aromatic systems, e.g. perylene, anthracene or pyrene fluorene-based, e.g. fluorene, indenofluorene, or spirobifluorene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/30—Monomer units or repeat units incorporating structural elements in the main chain
- C08G2261/37—Metal complexes
- C08G2261/374—Metal complexes of Os, Ir, Pt, Ru, Rh, Pd
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/14—Macromolecular compounds
- C09K2211/1441—Heterocyclic
- C09K2211/1466—Heterocyclic containing nitrogen as the only heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P70/00—Climate change mitigation technologies in the production process for final industrial or consumer products
- Y02P70/50—Manufacturing or production processes characterised by the final manufactured product
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Electroluminescent Light Sources (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Indole Compounds (AREA)
- Compositions Of Macromolecular Compounds (AREA)
Description
(1)発光の効率はより一層増加しなくてはならない。この目的のために、三重項発光体へのより効率的なエネルギー移動が必要であり、そのためにより適切なマトリックス材料が必要である。より高い効率が原理的に可能であることが蒸着によって塗布された低分子量の三重項発光体を用いた結果により示されている。
(A)少なくとも1種の共役ポリマー、
(B)少なくとも1種の架橋カルバゾール単位、および
(C)少なくとも1種の三重項発光体
を含む混合物を提供する。
Rは、各例で同一または異なり、1個から40個の炭素原子を有しR1-置換でも非置換でもよい、直鎖、分枝鎖もしくは環式のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-、-S-、-CO-、-CO-O-、-CO-NR2-、-O-CO-O-で置き換わっていてもよい)、または2個から40個の炭素原子を有しR1-置換でも非置換でもよい、2価の芳香環構造もしくは複素芳香環構造、R1-置換もしくは非置換のビニレン単位、アセチレン単位、またはこれらの系の2種から5種の組み合わせであり;考えられる前記置換基R1は状況に応じて任意の自由な位置にあってもよい;
R1は、各例で同一または異なり、1個から22個の炭素原子を有する直鎖、分枝鎖もしくは環式の、アルキル鎖もしくはアルコキシ鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-、-S-、-CO-O-、-O-CO-O-で置き換わっていてもよく、1個またはそれ以上の水素原子がフッ素で置き換わっていてもよい)、または5個から40個の炭素原子を有するアリール基もしくはアリールオキシ基(1個またはそれ以上の炭素原子がO、S、またはNで置き換わっていてもよく、1つまたはそれ以上の非芳香族のR1基によって置換されていてもよい)、ビニル基もしくはアセチレン基、またはF、Cl、Br、I、NO2、CN、N(R2)2、B(R2)2、Si(R2)3であり、2つまたはそれ以上のR1基が合わさって、脂肪族もしくは芳香族の、単環式もしくは多環式の環構造を形成していてもよい;
R2は、各例で同一または異なり、H、または1個から22個の炭素原子を有する直鎖、分枝鎖もしくは環式のアルキル鎖(1個またはそれ以上の非隣接炭素原子がO、S、-CO-O-、O-CO-Oと置き換わっていてもよく、1個またはそれ以上の水素原子がフッ素と置き換わっていてもよい)、または5個から40個の炭素原子を有するアリール基(1個またはそれ以上の炭素原子がO、SまたはNで置き換わっていてもよく、1つまたはそれ以上の非芳香族のR2基で置換されていてもよい)であり;2つまたはそれ以上のR2基が合わさって環構造を形成していてもよい;
nは、各例で同一または異なり、0,1、2、3、または4であるが、ただし、このフェニル単位にポリマー鎖への1つの結合(すなわちX)がある場合にはnは4であってはならず、このフェニル単位にポリマー鎖への両方の結合(すなわちX)がある場合にはnは3または4であってはならない;
Xは前記共役ポリマーへの前記単位の結合を示す。
(A)5−99.5重量%の少なくとも1種の共役ポリマーPOLY1(1−100mol%、好ましくは10−100mol%、より好ましくは20−100mol%の、1つまたはそれ以上の化学式(I)の単位を含む);
および
(B)0.1−95重量%、好ましくは0.5−80重量%、より好ましくは1−50重量%、特に2−25重量%の、1種またはそれ以上の三重項発光体(COMP1)
を含む。
実施形態BLEND1では、三重項発光体(COMP1)が非共有結合的にポリマーPOLY1と混合している。
(A)0.5−99重量%の少なくとも1種の共役ポリマーPOLY2(共有結合した形で、0.1−100mol%、好ましくは0.5から80mol%の1種またはそれ以上の三重項発光体(COMP2)を含む)、
および
(B)1−99.5重量%の化学式(II)の構造単位の化合物
を含む。
(A)0.5−98.5重量%の任意の共役ポリマーPOLY3;
および
(B)1−99重量%、好ましくは10−90重量%の、化学式(II)の少なくとも1つの構造単位
および
(C)0.1−95重量%、好ましくは0.5−80重量%、より好ましくは1−50重量%、特に2−25重量%の、1種またはそれ以上の三重項発光体(COMP1)
を含む。
本発明の他の態様は混合物BLEND4であり、
(A)0.5−98.5重量%の任意の共役ポリマーPOLY3またはその複数
および
(B)1.5−99.5重量%の化合物COMP3(化学式(II)の少なくとも1つの構造単位と共有結合した1種またはそれ以上の三重項発光体を含む)
を含む。
1. ポリマー骨格を形成できる構造単位:
まずここで、フェニレンおよびそれから得られる構造について述べる。これらは、例えば、(各々のケースで置換または非置換の)オルト-、メタ-もしくはパラ-フェニレン、1,4-ナフチレン、9,10-アントラセニレン、2,7-フェナントレニレン(phenanthrenylene)、1,6-もしくは2,7-もしくは4,9-ピレン、または2,7-テトラヒドロピレンである。対応する複素環式のポリアリーレン形成構造、例えば2,5-チオフェニレン、2,5-ピロリレン、2,5-フラニレン、2,5-ピリジレン、2,5-ピリミジニレンまたは5,8-キノリニレンも有用である。
これは電子の注入または輸送の特性(例えば、オキサジアゾール単位)、およびホールの注入または輸送の特性(例えば、トリアリールアミン単位)の両方に関わり得る。上記した出願書類WO 02/077060におけるこのような構造単位の包括的リストを再度ここで参照する。この出願の優先日の時点ではまだ公開されていない出願書類DE 10249723.0に記載されているナフチルアリールアミン、またはこの出願の優先日の時点ではまだ公開されていない出願書類DE 10304819.7に記載されているカルバゾールはこの目的に対して同様に有用である。
Rは、各例で同一または異なり、2から20個の炭素原子を有しR1置換でも非置換でもよい、直鎖、分枝鎖もしくは環式のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-、-S-、-CO-、-CO-O-、-CO-NR2-、-O-CO-O-で置き換わっていてもよい)、チオフェン、ベンゾチオフェン、ベンゼン、ビフェニル、ピリジン、キノキサリン、フルオレン、スピロビフルオレン、ナフタレン、アントラセン、ピレン、フェナントレン、ジヒドロフェナントレンから選択され、0から4種の置換基R1を自由な位置に有する、2価の芳香環構造もしくは複素芳香環構造、0から4種の置換基R1を自由な位置に有するスチルベニレンまたはトラニレン(tolanylene)系、または2種から5種のこれらの系の組み合わせである;
R1、R2、nは上の記載に類似したものである;
POLY1における結合は、Rがアリール単位もしくはヘテロアリール単位、またはスチルベニル単位もしくはトラニル(tolanyl)単位である場合には3,6-位もしくは2,7-位、2,2’-位もしくは3,3’-位を介してなされることが好ましく、またはRもしくはR1が芳香族単位もしくは複素芳香族単位、またはスチルベニル単位もしくはトラニル単位である場合にはRもしくはR1基を介してなされることが好ましく、その結果、結合点の間に偶数の芳香族原子が存在する。
Rは、各例で同一または異なり、2から15個の炭素原子を有しR1置換でも非置換でもよい、直鎖、分枝鎖、または環式のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-または-S-で置き換わっていてもよい)、チオフェン、ベンゾチオフェン、ベンゼン、ビフェニル、ナフタレン、アントラセン、ピレンまたはフェナントレンから選択され、非置換でも1つまたは2つの置換基R1で置換されていてもよい2価の芳香環構造もしくは複素芳香環構造、非置換でも、4つまでの置換基R1によって置換されていてもよい9,9’-置換フルオレン、スピロビフルオレン、9,10-置換もしくは9,9,10,10-置換ジヒドロフェナントレン、0から2つの置換基R1を自由な位置に有するスチルベニル系もしくはトラニル系、または2種から4種のこれらの系の組み合わせである;
R1、R2は上の記載に類似したものである;
nは各例で同一または異なり、0、1または2である;
POLY1との結合は、Rがアリール系、ヘテロアリール系、スチルベニル系またはトラニル系である場合には、3,6-位または2,7-位、3,3’-位を介して、またはRもしくはR1が芳香族単位もしくは複素芳香族単位、またはスチルベニル単位もしくはトラニル単位である場合には、RもしくはR1基を介してなされることが好ましく、その結果、結合点の間の芳香族炭素原子の数が4の倍数となる。
Rは、各例で同一または異なり、3個から10個の炭素原子を有し非置換でもR1置換でもよい、直鎖もしくは分枝鎖のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-または-S-で置き換わっていてもよい)、チオフェン、ベンゼン、ビフェニル、ナフタレン、アントラセンまたはフェナントレンから選択される2価の芳香環構造もしくは複素芳香環構造(その各々は非置換であるか、1つまたは2つの置換基R1で置換されている)、9,9’-置換フルオレン、0から4つまでの置換基R1によって置換されているスピロビフルオレン、9,10-置換もしくは9,9,10,10-置換ジヒドロフェナントレン、0から2つの置換基R1を自由な位置に有するスチルベニル系もしくはトラニル系、または2種または3種のこれらの系の組み合わせである;
R1、R2、nは上の記載に類似したものである;
POLY1における結合は上の記述に類似したものである。
Rは、各例で同一または異なり、2から20個の炭素原子を有しR1置換でも非置換でもよい、直鎖、分枝鎖、もしくは環式のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-、-S-、-CO-、-CO-O-、-CO-NR2-、または-O-CO-O-で置き換わっていてもよい)、チオフェン、ベンゾチオフェン、ベンゼン、ビフェニル、ピリジン、キノキサリン、フルオレン、スピロビフルオレン、ナフタレン、アントラセン、ピレン、フェナントレン、ジヒドロフェナントレンから選択され、自由な位置に0から4つの置換基R1を有する2価の芳香環構造もしくは複素芳香環構造、0から4つの置換基R1を自由な位置に有するスチルベニル系もしくはトラニル系、または2種から5種のこれらの系の組み合わせである;
R1、R2、nは上の記載に類似したものである。
Rは、各例で同一または異なり、2から15個の炭素原子を有しR1置換でも非置換でもよい、直鎖もしくは分枝鎖のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-または-S-で置き換わっていてもよい)、チオフェン、ベンゾチオフェン、ベンゼン、ビフェニル、ピリジン、ナフタレン、アントラセン、ピレンまたはフェナントレンから選択され、非置換でも、1つまたは2つの置換基R1で置換されていてもよい2価の芳香環構造もしくは複素芳香環構造、9,9’-置換フルオレン、4つまでの置換基R1で置換されているスピロビフルオレン、9,10-置換もしくは9,9,10,10-置換ジヒドロフェナントレン、0から2つの置換基R1を自由な位置に有するスチルベニル系もしくはトラニル系、または2種から4種のこれらの系の組み合わせである;
R1、R2は上の記載に類似したものである;
nは各例で同一または異なり、0、1または2である。
Rは、各例で同一または異なり、3個から10個の炭素原子を有し非置換でもR1置換でもよい、直鎖もしくは分枝鎖のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR2-、-O-または-S-で置き換わっていてもよい)、チオフェン、ベンゼン、ビフェニル、ナフタレン、アントラセンまたはフェナントレンから選択される2価の芳香環構造もしくは複素芳香環構造(その各々は非置換であるか、1つまたは2つの置換基R1で置換されている、9,9’-置換フルオレン、0から4つの置換基R1によって置換されているスピロビフルオレン、9,10-置換もしくは9,9,10,10-置換ジヒドロフェナントレン、0から2つの置換基R1を自由な位置に有するスチルベニル系もしくはトラニル系、または2種または3種のこれらの系の組み合わせである;
R1、R2、nは上の記載に類似したものである。
カルバゾールのN-アルキル化またはN-ベンジル化は文献で知られている。この方法で、2つのカルバゾール単位を置換されたもしくは非置換のアルキレン鎖、ベンジル鎖、アルキルアリーレン鎖もしくはシクロアルキレン鎖によって架橋できる。合成は、例えばM.E. Wrightら., J. Org. Chem. 1989, 54, 965に記載されているように、塩基性条件下でカルバゾールをアルキル化試薬と反応させることでなされる。
3,6-ジブロモカルバゾールは、文献:Smithら., Tetrahedron 1992, 48, 7479に記載されているように、カルバゾールを臭素化することで合成する。
(A)1−99.9mol%、好ましくは10−99mol%、より好ましくは20−99mol%の1つまたはそれ以上の化学式(I)の単位
および
(B)0.1−95mol%、好ましくは0.5−80mol%、より好ましくは1−50mol%、特に2−25mol%の、好ましくは1種またはそれ以上の有機金属構造単位COMP2の形態にある、1種またはそれ以上の三重項発光体
を含む。
化学式(I)または化学式(II)の単位を全く含まない比較例のポリマーおよびブレンドでのものと比べ、本発明のポリマーPOLY1またはブレンドBLEND1からBLEND4での三重項発光体の発光は驚くほど著しくより効率的である(表1のデータを参照のこと)。
パートA:モノマーおよびブレンド成分の合成
例A1:POLY1用のモノマーの合成
モノマーM1からモノマーM23の合成はWO 02/077060およびそこで引用されている文献に既に詳細に説明されている。よりよい理解のために、モノマーを再度以下に示す。
化学式(I)のモノマーを以下、“IM”(=本発明のモノマー)と呼ぶ。
保護ガス下で、9.0g(28mmol)の2,7-ジブロモフルオレン、16.4g(57mmol)のN-(3-ブロモプロピル)カルバゾールおよび0.5g(3mmol)のKIを、56mlのDMSO中で、室温で透明な溶液が形成されるまで攪拌した。続けて、6.6g(119mmol)のKOHを少しずつ添加した。一時間後、その混合物を200mlの水と混合し、CHCl3で抽出した。混合した有機層を水で洗浄し、MgSO4で乾燥した。続けて、溶媒を減圧下で除去し、生成した油分をカラムクロマトグラフィーで精製した(シリカゲル、ヘキサン/EA 40:1)。
合成をEM3の合成と同様に行った。9.0g(28mmol)の2,7-ジブロモフルオレン、17.2g(57mmol)のN-(4-ブロモブチル)カルバゾールおよび0.5g(3mmol)のKI、6.6g(119mmol)のKOH、56mlのDMSO。
化学式(II)のブレンド成分を以下、CARBと呼ぶ。
例としてここで使用する化合物COMP1はトリス(フェニルピリジル)イリジウム(III)の誘導体である。これらの化合物の合成は既に出願書類WO 02/081488およびWO 04/026886で説明されている。明確にするために、ここで使用するイリジウム錯体を再度以下に示す:
ここで使用するコモノマーCOMP2はトリス(フェニルピリジル)イリジウム(III)の誘導体である。これらの化合物の合成は、例えば、本願の優先日にはまだ公開されていない出願DE 10350606.3で説明されている。ここで使用するイリジウムコモノマーIr4およびIr5を、明確にするために、再度以下に示す:
化学式(I)の単位も化合物COMP2も全く含まない、共役ポリマーPOLY3は既に出願書類WO 02/077060およびWO 03/020790で説明されている。これらは、参照により、本出願の一部である。
3.1706g(4mmol)のモノマーM2、1.9650g(2.4mmol)のモノマーM1、0.6069g(0.8mmol)のモノマーM9、0.4258g(0.8mmol)のIM1、および4.05gの水和したリン酸カリウムを、25mlのジオキサン、25mlのトルエン、7mlのH2O(全て酸素を含まない溶媒である)に溶解させた。反応溶液をアルゴンを用いて40℃で30分脱気した。それから、0.45mgのPd(OAc)2、3.65mgのP(o-トリル)3を触媒として添加し、その溶液をアルゴン雰囲気下で還流しながら4時間加熱した。エンドキャッピングを、24mgの3,4-ビスペントキシベンゼンホウ酸を用い20mlのトルエン中で行い、その混合物を還流しながら一時間加熱した。それから、10mlのトルエンに溶解した40mgの臭化3,4-ビスペントキシベンジルを添加し、その混合物を還流しながら3時間加熱した。さらに50mlのトルエンを添加した後、ポリマー溶液を100mlの0.01%NaCN水溶液と共に60℃で3時間攪拌した。相を分離し、有機相を100mlのH2Oで4回洗浄した。ポリマーを300mlのメタノールに滴下添加することで析出させて、濾過した。300mlのTHFに60℃でアルゴン雰囲気下で溶解させ、セライトを通して濾過し、600mlのメタノールを添加することで再析出させることによって、さらに精製を行った。ポリマーを濾過し、減圧下で乾燥させた。4.73g(理論値の93%)のポリマーを分離した;Mw=352000g/mol、Mn=93000g/mol、多分散性=3.8(THF中のGPC、PS基準で)。
3.1760g(4mmol)のモノマーM2、1.0825g(1.6mmol)のモノマーM7、1.7726g(2.4mmol)のIM3、および4.05gの水和したリン酸カリウムを、37.5mlのジオキサン、12.5mlのトルエン、7mlのH2O(全て酸素を含まない溶媒である)に溶解させた。その反応溶液をアルゴンを用いて40℃で30分間脱気した。それから、0.45mgのPd(OAc)2、3.65mgのP(o-トリル)3を触媒として添加し、その溶液をアルゴン雰囲気下で還流しながら3時間加熱した。高粘性ポリマー溶液を50mlのトルエンで希釈した。それからエンドキャッピングを20mlのトルエンに溶解した24mgの3,4-ビスペントキシベンゼンホウ酸を用いて行い、その混合物を還流しながら一時間加熱し、それから、30mlのトルエンに溶解した40mgの臭化3,4-ビスペントキシベンジルを添加し、その混合物を還流しながら1時間加熱した。ポリマー溶液を再度50mlのトルエンで希釈し、100mlの0.01%NaCN水溶液と共に60℃で3時間攪拌した。相を分離し、有機相を100mlのH2Oで4回洗浄した。ポリマーを400mlのメタノールに滴下添加することで析出させて、濾過した。350mlのTHFに60℃でアルゴン雰囲気下で溶解させ、セライトを通して濾過し、700mlのメタノールを添加することで再析出させることによって、さらに精製を行った。ポリマーを濾過し、減圧下で乾燥させた。4.69g(理論値の90%)のポリマーを分離した;Mw=681000g/mol、Mn=202000g/mol、多分散性=3.4(THF中のGPC、PS基準で)。
ブレンドを、所望の比率および所望の濃度でブレンド成分を適切な溶媒に溶解させることで、調製した。ここで使用した溶媒はトルエンであった。溶解操作は60℃で不活性雰囲気下で行った。溶液を、ブレンドの分離(固体部分の繰り返し析出)なしに、直接処理した。
こうして得られた全てのブレンドBLEND1からBLEND4までおよびポリマー4をさらにOLEDの使用について検討した。これらのブレンドを用いて得られた結果(色、効率、動作電圧)を表1にまとめる(例D1からD6)。比較用のポリマーおよびブレンドであって、化学式(I)および化学式(II)の単位を全く含まないものを用いて得られた結果も同様にまとめる(例V1からV4)。ポリマーPOLY4を用いて得られた結果を表2にまとめる(例D7からD8)。PLEDの製造はDE 10249723.0およびそこで引用されている文献に詳細に説明されている。
b 混合物の全体の組成物中のブレンド成分CARBおよびCOMP1および他のブレンド成分のタイプおよび含有量、単位 重量%
c CPB=2,2’,7,7’-テトラ(N-カルバゾリル)-9,9’-スピロビフルオレン、PVK=ポリ(ビニルカルバゾール)。
b CIE座標:Commission Internationale de l’Eclairageの色度座標
Claims (19)
- (A)5−99.5重量%の少なくとも1種の共役ポリマーPOLY1(1−100mol%の1つまたはそれ以上の化学式(I)の単位を含む);および
(B)0.1−95重量%の1種またはそれ以上の三重項発光体(COMP1)
を含む混合物BLEND1。
Rは、各例で同一または異なり、1個から40個の炭素原子を有しR 1 -置換でも非置換でもよい、直鎖、分枝鎖もしくは環式のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR 2 -、-O-、-S-、-CO-、-CO-O-、-CO-NR 2 -、-O-CO-O-で置き換わっていてもよい)、または2個から40個の炭素原子を有しR 1 -置換でも非置換でもよい、2価の芳香環構造もしくは複素芳香環構造、R 1 -置換もしくは非置換のビニレン単位、アセチレン単位、またはこれらの系の2種から5種の組み合わせであり;考えられる前記置換基R 1 は状況に応じて任意の自由な位置にあってもよい;
R 1 は、各例で同一または異なり、1個から22個の炭素原子を有する直鎖、分枝鎖もしくは環式の、アルキル鎖もしくはアルコキシ鎖(1個またはそれ以上の非隣接炭素原子が-NR 2 -、-O-、-S-、-CO-O-、-O-CO-O-で置き換わっていてもよく、1個またはそれ以上の水素原子がフッ素で置き換わっていてもよい)、または5個から40個の炭素原子を有するアリール基もしくはアリールオキシ基(1個またはそれ以上の炭素原子がO、S、またはNで置き換わっていてもよく、1つまたはそれ以上の非芳香族のR 1 基によって置換されていてもよい)、ビニル基もしくはアセチレン基、またはF、Cl、Br、I、NO 2 、CN、N(R 2 ) 2 、B(R 2 ) 2 、Si(R 2 ) 3 であり、2つまたはそれ以上のR 1 基が合わさって、脂肪族もしくは芳香族の、単環式もしくは多環式の環構造を形成していてもよい;
R 2 は、各例で同一または異なり、H、または1個から22個の炭素原子を有する直鎖、分枝鎖もしくは環式のアルキル鎖(1個またはそれ以上の非隣接炭素原子がO、S、-CO-O-、O-CO-Oと置き換わっていてもよく、1個またはそれ以上の水素原子がフッ素と置き換わっていてもよい)、または5個から40個の炭素原子を有するアリール基(1個またはそれ以上の炭素原子がO、SまたはNで置き換わっていてもよく、1つまたはそれ以上の非芳香族のR 2 基で置換されていてもよい)であり;2つまたはそれ以上のR 2 基が合わさって環構造を形成していてもよい;
nは、各例で同一または異なり、0,1、2、3、または4であるが、ただし、このフェニル単位にポリマー鎖への1つの結合(すなわちX)がある場合にはnは4であってはならず、このフェニル単位にポリマー鎖への両方の結合(すなわちX)がある場合にはnは3または4であってはならない;
Xは前記共役ポリマーへの前記単位の結合を示す。 - 前記化学式(I)の構造単位がカルバゾールの3,6-位または2,7-位を介してPOLY1に組み込まれていることを特徴とする請求項1に記載の混合物。
- Rがアリール単位、ヘテロアリール単位、ビニル単位またはアセチレン単位またはこれら系の組み合わせを表す場合に、前記化学式(I)の構造単位が2つのカルバゾール単位の3,3’-位または2,2’-位を介してポリマーPOLY1に組み込まれていることを特徴とする請求項1又は2に記載の混合物。
- RおよびR 1 がアリール単位、ヘテロアリール単位、スチルベニル単位またはトラニル単位、あるいはこれらの系の組み合わせである場合、前記化学式(I)の構造単位が前記架橋Rを介して、または1つまたは2つの置換基R 1 を介してPOLY1に組み込まれていることを特徴とする請求項1乃至3の何れか1項に記載の混合物。
- 前記ポリマーPOLY1の他の構造要素は、オルト-、メタ-もしくはパラ-フェニレン、1,4-ナフチレン、9,10-アントラセニレン、2,7-フェナントレニレン(phenanthrenylene)、1,6-もしくは2,7-もしくは4,9-ピレン、または2,7-テトラヒドロピレン、オキサジアゾリレン、2,5-チオフェニレン、2,5-ピロリレン、2,5-フラニレン、2,5-ピリジレン、2,5-ピリミジニレン、5,8-キノリニレン、フルオレン、スピロ-9,9’-ビフルオレン、インデノフルオレン、またはヘテロインデノフルオレンからなる群より選択されることを特徴とする請求項1乃至4の何れか1項に記載の混合物。
- 電荷輸送および/または電荷注入および/または電荷平衡を改善する他の構造要素が前記ポリマーPOLY1に存在し、前記他の構造要素はトリアリールアミンまたはオキサジゾリレンからなる群より選択されることを特徴とする請求項1乃至5の何れか1項に記載の混合物。
- 化学式(I)の記号および添字は:
Rは、各例で同一または異なり、3から10個の炭素原子を有し非置換でもR 1 置換でもよい、直鎖もしくは分枝鎖のアルキル鎖(1個またはそれ以上の非隣接炭素原子がN-R 2 、OまたはSで置き換わっていてもよい)、チオフェン、ベンゼン、ビフェニル、ナフタレン、アントラセンまたはフェナントレンから選択される2価の芳香環構造もしくは複素芳香環構造(その各々は非置換であるか、1つまたは2つの置換基R 1 で置換されている)、9,9’-置換フルオレン、0から4つまでの置換基R 1 によって置換されているスピロビフルオレン、9,10-置換もしくは9,9,10,10-置換ジヒドロフェナントレン、0から2つの置換基R 1 を自由な位置に有するスチルベニル系もしくはトラニル系、または2種または3種のこれらの系の組み合わせである;
R 1 、R 2 は、各々、請求項1で説明したとおりである;
nは各例で同一または異なり、0、1または2である;
前記ポリマー鎖への結合は、Rがアリール系、ヘテロアリール系、スチルベニル系またはトラニル系である場合には3,6-位もしくは2,7-位を介してまたは3,3’-位を介して、またはRもしくはR 1 がアリール系またはヘテロアリール系またはスチルベニル系またはトラニル系である場合にはR自身またはR 1 上の2つの位置を介し、その結果、結合点の間の芳香族炭素原子の数が4の倍数となる
ことを特徴とする請求項1乃至6の何れか1項に記載の混合物。 - 前記三重項発光体は重原子、すなわち周期表で36以上の原子番号を有する元素の原子を含むことを特徴とする請求項1乃至8の何れか1項に記載の混合物。
- 前記三重項発光体はdおよび/またはfの遷移金属を含むことを特徴とする請求項9に記載の混合物。
- 前記三重項発光体は8族から10族の金属を含むことを特徴とする請求項10に記載の混合物。
- 前記三重項発光体はRu、Os、Rh、Ir、Pdおよび/またはPtを含むことを特徴とする請求項11に記載の混合物。
- 化学式(I)の構造単位および化学式(II)の化合物の合計含有量は20−99mol%であることを特徴とする請求項14に記載の混合物。
- (A)1−99.9mol%の化学式(I)の単位;および
(B)0.1−95mol%の1種またはそれ以上の構造単位としての三重項発光体
を含む共役ポリマー(POLY4)。
Rは、各例で同一または異なり、1個から40個の炭素原子を有しR 1 -置換でも非置換でもよい、直鎖、分枝鎖もしくは環式のアルキレン鎖(1個またはそれ以上の非隣接炭素原子が-NR 2 -、-O-、-S-、-CO-、-CO-O-、-CO-NR 2 -、-O-CO-O-で置き換わっていてもよい)、または2個から40個の炭素原子を有しR 1 -置換でも非置換でもよい、2価の芳香環構造もしくは複素芳香環構造、R 1 -置換もしくは非置換のビニレン単位、アセチレン単位、またはこれらの系の2種から5種の組み合わせであり;考えられる前記置換基R 1 は状況に応じて任意の自由な位置にあってもよい;
R 1 は、各例で同一または異なり、1個から22個の炭素原子を有する直鎖、分枝鎖もしくは環式の、アルキル鎖もしくはアルコキシ鎖(1個またはそれ以上の非隣接炭素原子が-NR 2 -、-O-、-S-、-CO-O-、-O-CO-O-で置き換わっていてもよく、1個またはそれ以上の水素原子がフッ素で置き換わっていてもよい)、または5個から40個の炭素原子を有するアリール基もしくはアリールオキシ基(1個またはそれ以上の炭素原子がO、S、またはNで置き換わっていてもよく、1つまたはそれ以上の非芳香族のR 1 基によって置換されていてもよい)、ビニル基もしくはアセチレン基、またはF、Cl、Br、I、NO 2 、CN、N(R 2 ) 2 、B(R 2 ) 2 、Si(R 2 ) 3 であり、2つまたはそれ以上のR 1 基が合わさって、脂肪族もしくは芳香族の、単環式もしくは多環式の環構造を形成していてもよい;
R 2 は、各例で同一または異なり、H、または1個から22個の炭素原子を有する直鎖、分枝鎖もしくは環式のアルキル鎖(1個またはそれ以上の非隣接炭素原子がO、S、-CO-O-、O-CO-Oと置き換わっていてもよく、1個またはそれ以上の水素原子がフッ素と置き換わっていてもよい)、または5個から40個の炭素原子を有するアリール基(1個またはそれ以上の炭素原子がO、SまたはNで置き換わっていてもよく、1つまたはそれ以上の非芳香族のR 2 基で置換されていてもよい)であり;2つまたはそれ以上のR 2 基が合わさって環構造を形成していてもよい;
nは、各例で同一または異なり、0,1、2、3、または4であるが、ただし、このフェニル単位にポリマー鎖への1つの結合(すなわちX)がある場合にはnは4であってはならず、このフェニル単位にポリマー鎖への両方の結合(すなわちX)がある場合にはnは3または4であってはならない;
Xは前記共役ポリマーへの前記単位の結合を示す。 - 有機発光ダイオード(OLED)、有機太陽電池(O−SC)、有機レーザーダイオード(O−レーザー)、または有機光学検出器における請求項1乃至16の何れか1項に記載の混合物またはポリマーの使用方法。
- 1層またはそれ以上の活性層を含み、これらの層の少なくとも1層は請求項1乃至16の何れか1項に記載の混合物またはポリマーを含む電子部品。
- 有機発光ダイオード、有機太陽電池、有機レーザーダイオード、または有機光学検出器であることを特徴とする請求項18に記載の電子部品。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10328627.6 | 2003-06-26 | ||
| DE10328627A DE10328627A1 (de) | 2003-06-26 | 2003-06-26 | Neue Materialien für die Elektrolumineszenz |
| PCT/EP2004/006832 WO2004113468A1 (de) | 2003-06-26 | 2004-06-24 | Neue materialien für die elektrolumineszenz |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009513723A JP2009513723A (ja) | 2009-04-02 |
| JP4874792B2 true JP4874792B2 (ja) | 2012-02-15 |
Family
ID=33520977
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006516042A Expired - Fee Related JP4874792B2 (ja) | 2003-06-26 | 2004-06-24 | 電界発光用新規材料 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20060284140A1 (ja) |
| EP (1) | EP1641894B1 (ja) |
| JP (1) | JP4874792B2 (ja) |
| KR (1) | KR20060073541A (ja) |
| CN (1) | CN1780897B (ja) |
| DE (2) | DE10328627A1 (ja) |
| WO (1) | WO2004113468A1 (ja) |
Families Citing this family (323)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10310887A1 (de) | 2003-03-11 | 2004-09-30 | Covion Organic Semiconductors Gmbh | Matallkomplexe |
| DE10337346A1 (de) | 2003-08-12 | 2005-03-31 | Covion Organic Semiconductors Gmbh | Konjugierte Polymere enthaltend Dihydrophenanthren-Einheiten und deren Verwendung |
| DE10337077A1 (de) | 2003-08-12 | 2005-03-10 | Covion Organic Semiconductors | Konjugierte Copolymere, deren Darstellung und Verwendung |
| WO2005033118A1 (ja) * | 2003-08-26 | 2005-04-14 | Idemitsu Kosan Co., Ltd. | 配位金属化合物、有機エレクトロルミネッセンス素子用材料、発光性塗膜形成用材料及び有機エレクトロルミネッセンス素子 |
| JP2007517079A (ja) | 2003-10-22 | 2007-06-28 | メルク パテント ゲーエムベーハー | エレクトロルミネセンスのための新規材料、およびそれらの使用 |
| DE10350722A1 (de) | 2003-10-30 | 2005-05-25 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| DE102004020298A1 (de) | 2004-04-26 | 2005-11-10 | Covion Organic Semiconductors Gmbh | Elektrolumineszierende Polymere und deren Verwendung |
| US7825249B2 (en) | 2004-05-19 | 2010-11-02 | Merck Patent Gmbh | Metal complexes |
| DE102004032527A1 (de) * | 2004-07-06 | 2006-02-02 | Covion Organic Semiconductors Gmbh | Elektrolumineszierende Polymere |
| DE102004034517A1 (de) | 2004-07-16 | 2006-02-16 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| JP4982984B2 (ja) * | 2004-08-31 | 2012-07-25 | 住友化学株式会社 | 高分子発光体組成物および高分子発光素子 |
| TW200619300A (en) * | 2004-08-31 | 2006-06-16 | Sumitomo Chemical Co | Luminescent-polymer composition and luminescent -polymer device |
| KR101420608B1 (ko) | 2004-12-24 | 2014-07-18 | 미쓰비시 가가꾸 가부시키가이샤 | 유기 화합물, 전하 수송 물질 및 유기 전계발광 소자 |
| JP2008525608A (ja) * | 2004-12-29 | 2008-07-17 | ケンブリッジ ディスプレイ テクノロジー リミテッド | 硬質アミン |
| GB2437899B (en) * | 2005-03-04 | 2010-12-29 | Sumitomo Chemical Co | Dicarbazole aromatic amine polymers and electronic devices |
| DE112006000604T5 (de) | 2005-03-15 | 2008-01-24 | Isis Innovation Ltd. | Hochverzweigte Dendrimere |
| DE102005022903A1 (de) * | 2005-05-18 | 2006-11-23 | Merck Patent Gmbh | Lösungen organischer Halbleiter |
| DE102005037734B4 (de) * | 2005-08-10 | 2018-02-08 | Merck Patent Gmbh | Elektrolumineszierende Polymere, ihre Verwendung und bifunktionelle monomere Verbindungen |
| DE102005040411A1 (de) | 2005-08-26 | 2007-03-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102006003710A1 (de) * | 2006-01-26 | 2007-08-02 | Merck Patent Gmbh | Elektrolumineszierende Materialien und deren Verwendung |
| JP4952037B2 (ja) * | 2006-04-24 | 2012-06-13 | 住友化学株式会社 | 高分子発光素子及び有機トランジスタ並びにそれらに有用な組成物 |
| DE102006031991A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Elektrolumineszierende Polymere und ihre Verwendung |
| DE102006061909A1 (de) * | 2006-12-21 | 2008-06-26 | Samsung SDI Co., Ltd., Suwon | Emitterschicht für eine organische Leuchtdiode |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP5401448B2 (ja) * | 2007-06-01 | 2014-01-29 | イー・アイ・デュポン・ドウ・ヌムール・アンド・カンパニー | 深青色発光用途のためのクリセン類 |
| EP2197981B1 (en) | 2007-06-01 | 2013-04-03 | E. I. Du Pont de Nemours and Company | Green luminescent materials |
| ATE536340T1 (de) * | 2007-06-01 | 2011-12-15 | Du Pont | Blaue lumineszente materialien |
| EP2150599B1 (en) * | 2007-06-01 | 2012-11-28 | E. I. Du Pont de Nemours and Company | Chrysenes for green luminescent applications |
| JP5233185B2 (ja) * | 2007-07-04 | 2013-07-10 | 富士ゼロックス株式会社 | カルバゾール含有化合物 |
| CN102037579B (zh) | 2007-10-24 | 2015-07-08 | 默克专利有限公司 | 光电子器件 |
| DE102008045662A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Optoelektronische Vorrichtung |
| DE102008045664A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Optoelektronische Vorrichtung |
| DE102008015526B4 (de) | 2008-03-25 | 2021-11-11 | Merck Patent Gmbh | Metallkomplexe |
| DE102008017591A1 (de) | 2008-04-07 | 2009-10-08 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008027005A1 (de) | 2008-06-05 | 2009-12-10 | Merck Patent Gmbh | Organische elektronische Vorrichtung enthaltend Metallkomplexe |
| US20110173758A1 (en) * | 2008-06-20 | 2011-07-21 | Ricky Jay Fontaine | Inflatable mattress and method of operating same |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008044868A1 (de) | 2008-08-29 | 2010-03-04 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| DE102008045663A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Fluorverbrückte Assoziate für optoelektronische Anwendungen |
| DE102008049037A1 (de) * | 2008-09-25 | 2010-04-22 | Merck Patent Gmbh | Neue Polymere mit niedriger Polydispersität |
| DE102008050841B4 (de) | 2008-10-08 | 2019-08-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010054730A1 (de) | 2008-11-11 | 2010-05-20 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| DE102009022858A1 (de) | 2009-05-27 | 2011-12-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057051B4 (de) | 2008-11-13 | 2021-06-17 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057050B4 (de) | 2008-11-13 | 2021-06-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8263973B2 (en) | 2008-12-19 | 2012-09-11 | E I Du Pont De Nemours And Company | Anthracene compounds for luminescent applications |
| US8531100B2 (en) | 2008-12-22 | 2013-09-10 | E I Du Pont De Nemours And Company | Deuterated compounds for luminescent applications |
| DE102009005289B4 (de) | 2009-01-20 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung und elektronische Vorrichtungen, enthaltend diese |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005746A1 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009007038A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| DE102009009277B4 (de) | 2009-02-17 | 2023-12-07 | Merck Patent Gmbh | Organische elektronische Vorrichtung, Verfahren zu deren Herstellung und Verwendung von Verbindungen |
| US8759818B2 (en) | 2009-02-27 | 2014-06-24 | E I Du Pont De Nemours And Company | Deuterated compounds for electronic applications |
| DE102009010714A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Vernetzbare und vernetzte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung |
| DE102009010713A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Polymer mit Aldehydgruppen, Umsetzung sowie Vernetzung dieses Polymers, vernetztes Polymer sowie Elektrolumineszenzvorrichtung enthaltend dieses Polymer |
| DE102009059985A1 (de) | 2009-12-22 | 2011-07-07 | Merck Patent GmbH, 64293 | Polymer mit Aldehydgruppen, Umsetzung sowie Vernetzung dieses Polymers, vernetztes Polymer sowie Elektrolumineszenzvorrichtung enthaltend dieses Polymer |
| US9156939B2 (en) | 2009-02-27 | 2015-10-13 | Merck Patent Gmbh | Polymer containing aldehyde groups, reaction and crosslinking of this polymer, crosslinked polymer, and electroluminescent device comprising this polymer |
| DE102009011223A1 (de) | 2009-03-02 | 2010-09-23 | Merck Patent Gmbh | Metallkomplexe |
| DE102009013041A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010114583A1 (en) | 2009-04-03 | 2010-10-07 | E. I. Du Pont De Nemours And Company | Electroactive materials |
| DE102009023156A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Polymere, die substituierte Indenofluorenderivate als Struktureinheit enthalten, Verfahren zu deren Herstellung sowie deren Verwendung |
| DE102009023154A1 (de) | 2009-05-29 | 2011-06-16 | Merck Patent Gmbh | Zusammensetzung, enthaltend mindestens eine Emitterverbindung und mindestens ein Polymer mit konjugationsunterbrechenden Einheiten |
| DE102009030847A1 (de) | 2009-06-26 | 2010-12-30 | Merck Patent Gmbh | Polymere enthaltend substituierte Anthracenyleinheiten, Blends enthaltend diese Polymere sowie Vorrichtungen enthaltend diese Polymere oder Blends |
| DE102009030848A1 (de) | 2009-06-26 | 2011-02-03 | Merck Patent Gmbh | Polymere enthaltend Struktureinheiten, die Alkylalkoxygruppen aufweisen, Blends enthaltend diese Polymere sowie optoelektronische Vorrichtungen enthaltend diese Polymere und Blends |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009034194A1 (de) | 2009-07-22 | 2011-01-27 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009034625A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP5778148B2 (ja) | 2009-08-04 | 2015-09-16 | メルク パテント ゲーエムベーハー | 多環式炭水化物を含む電子デバイス |
| US8968883B2 (en) * | 2009-08-13 | 2015-03-03 | E I Du Pont De Nemours And Company | Chrysene derivative materials |
| KR101820974B1 (ko) | 2009-09-16 | 2018-01-22 | 메르크 파텐트 게엠베하 | 전자 소자 제조를 위한 제형 |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| CN102510889B (zh) | 2009-09-29 | 2015-11-25 | E.I.内穆尔杜邦公司 | 用于发光应用的氘代化合物 |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| EP2493887A4 (en) | 2009-10-29 | 2013-06-19 | Du Pont | DEUTERIZED CONNECTIONS FOR ELECTRONIC APPLICATIONS |
| DE102009053191A1 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| DE102009053382A1 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8617720B2 (en) | 2009-12-21 | 2013-12-31 | E I Du Pont De Nemours And Company | Electroactive composition and electronic device made with the composition |
| JP5836970B2 (ja) | 2009-12-22 | 2015-12-24 | メルク パテント ゲーエムベーハー | 機能性材料を含む調合物 |
| EP2517537B1 (en) | 2009-12-22 | 2019-04-03 | Merck Patent GmbH | Electroluminescent functional surfactants |
| WO2011076314A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent formulations |
| KR101736973B1 (ko) * | 2010-01-15 | 2017-05-17 | 삼성전자주식회사 | 고분자 및 상기 고분자를 포함한 유기 발광 소자 |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010005697A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent GmbH, 64293 | Verbindungen für elektronische Vorrichtungen |
| DE102010006377A1 (de) | 2010-01-29 | 2011-08-04 | Merck Patent GmbH, 64293 | Styrolbasierte Copolymere, insbesondere für die Anwendung in optoelektronischen Bauteilen |
| DE102010007938A1 (de) | 2010-02-12 | 2011-10-06 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| EP2544765A1 (en) | 2010-03-11 | 2013-01-16 | Merck Patent GmbH | Fibers in therapy and cosmetics |
| US9373807B2 (en) | 2010-03-11 | 2016-06-21 | Merck Patent Gmbh | Radiative fibers |
| US9627632B2 (en) | 2010-03-23 | 2017-04-18 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010014933A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| KR101007516B1 (ko) * | 2010-04-23 | 2011-01-14 | 주식회사 이엘엠 | 유기 전기 발광 조성물 및 이를 포함하는 유기 전기 발광 소자 |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| DE102010019306B4 (de) | 2010-05-04 | 2021-05-20 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2011138889A1 (ja) * | 2010-05-07 | 2011-11-10 | 住友化学株式会社 | 有機光電変換素子 |
| US9689556B2 (en) | 2010-05-27 | 2017-06-27 | Merck Patent Gmbh | Down conversion array comprising quantum dots |
| JP5944380B2 (ja) | 2010-05-27 | 2016-07-05 | メルク パテント ゲーエムベーハー | 量子ドットを含む組成物 |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010027316A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027320A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Polymere Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010032737A1 (de) | 2010-07-29 | 2012-02-02 | Merck Patent Gmbh | Polymere enthaltend substituierte Benzodithiopheneinheiten, Blends enthaltend diese Polymere sowie Vorrichtungen enthaltend diese Polymere oder Blends |
| DE102010033080A1 (de) | 2010-08-02 | 2012-02-02 | Merck Patent Gmbh | Polymere mit Struktureinheiten, die Elektronen-Transport-Eigenschaften aufweisen |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| JP2011038103A (ja) * | 2010-08-26 | 2011-02-24 | Sumitomo Chemical Co Ltd | 高分子化合物及びそれを用いた高分子発光素子 |
| DE102010045369A1 (de) | 2010-09-14 | 2012-03-15 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010048498A1 (de) | 2010-10-14 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010048607A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| EP2655547A1 (en) | 2010-12-20 | 2013-10-30 | E.I. Du Pont De Nemours And Company | Compositions for electronic applications |
| DE102010055901A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010056151A1 (de) | 2010-12-28 | 2012-06-28 | Merck Patent Gmbh | Materiallen für organische Elektrolumineszenzvorrichtungen |
| WO2012095143A1 (de) | 2011-01-13 | 2012-07-19 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8751777B2 (en) | 2011-01-28 | 2014-06-10 | Honeywell International Inc. | Methods and reconfigurable systems to optimize the performance of a condition based health maintenance system |
| DE112012000624T5 (de) * | 2011-01-31 | 2013-11-14 | Cambridge Display Technology Ltd. | Polymer |
| DE102011010841A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | (1,3)-Dioxan-5-on-Verbindungen |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| CN103476774B (zh) | 2011-04-13 | 2017-02-15 | 默克专利有限公司 | 用于电子器件的材料 |
| US9768385B2 (en) | 2011-04-13 | 2017-09-19 | Merck Patent Gmbh | Compounds for electronic devices |
| KR101929602B1 (ko) | 2011-04-18 | 2018-12-14 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| US8940411B2 (en) * | 2011-04-25 | 2015-01-27 | General Electric Company | Materials for optoelectronic devices |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| KR101884496B1 (ko) | 2011-05-05 | 2018-08-01 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| EP2705550B1 (de) | 2011-05-05 | 2017-07-05 | Merck Patent GmbH | Verbindungen für elektronische vorrichtungen |
| DE102011104745A1 (de) | 2011-06-17 | 2012-12-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2014527550A (ja) | 2011-07-25 | 2014-10-16 | メルク パテント ゲーエムベーハー | 機能性側鎖基を有するポリマーおよびオリゴマー |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| US9773979B2 (en) | 2011-08-03 | 2017-09-26 | Merck Patent Gmbh | Materials for electronic devices |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| US9923141B2 (en) * | 2011-10-19 | 2018-03-20 | Idemitsu Kosan Co., Ltd. | Carbazole-based polymer and organic electroluminescence element using same |
| US9812643B2 (en) | 2011-10-27 | 2017-11-07 | Merck Patent Gmbh | Materials for electronic devices |
| DE102011117422A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung in elektronischen Vorrichtungen |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| KR20180126629A (ko) | 2011-12-12 | 2018-11-27 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| DE102012022880B4 (de) | 2011-12-22 | 2024-12-24 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| KR101497133B1 (ko) * | 2011-12-23 | 2015-02-27 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| KR101376874B1 (ko) * | 2011-12-28 | 2014-03-26 | 주식회사 두산 | 신규 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| KR20220005650A (ko) | 2012-02-14 | 2022-01-13 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 스피로비플루오렌 화합물 |
| EP2817350A2 (de) | 2012-02-22 | 2014-12-31 | Merck Patent GmbH | Polymere enthaltend dibenzocycloheptan-struktureinheiten |
| CN103304779B (zh) * | 2012-03-15 | 2016-01-20 | 国家纳米科学中心 | 一种聚咔唑聚合物及其制备方法和应用 |
| US9425401B2 (en) | 2012-03-23 | 2016-08-23 | Merck Patent Gmbh | 9,9′-spirobixanthene derivatives for electroluminescent devices |
| KR102040350B1 (ko) | 2012-04-17 | 2019-11-04 | 메르크 파텐트 게엠베하 | 가교성 및 가교된 중합체, 그의 제조 방법 및 그의 용도 |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| WO2014000860A1 (de) | 2012-06-29 | 2014-01-03 | Merck Patent Gmbh | Polymere enthaltend 2,7-pyren-struktureinheiten |
| CN104428392B (zh) | 2012-07-13 | 2017-05-31 | 默克专利有限公司 | 金属络合物 |
| EP2875699B1 (de) | 2012-07-23 | 2017-02-15 | Merck Patent GmbH | Derivate von 2-diarylaminofluoren und diese enthaltnde organische elektronische verbindungen |
| JP6219388B2 (ja) | 2012-07-23 | 2017-10-25 | メルク パテント ゲーエムベーハー | フルオレンおよびそれらを含む有機電子素子 |
| WO2014015937A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektrolumineszierende vorrichtungen |
| US11917901B2 (en) | 2012-08-07 | 2024-02-27 | Udc Ireland Limited | Metal complexes |
| DE112013004610A5 (de) | 2012-09-20 | 2015-06-03 | Merck Patent Gmbh | Metallkomplexe |
| KR101716069B1 (ko) | 2012-11-12 | 2017-03-13 | 메르크 파텐트 게엠베하 | 전자 소자용 재료 |
| JP6363090B2 (ja) | 2012-11-30 | 2018-07-25 | メルク パテント ゲーエムベーハー | 電子素子 |
| CN104871330B (zh) | 2012-12-28 | 2018-09-21 | 默克专利有限公司 | 包含聚合物有机半导体化合物的组合物 |
| EP2941469A2 (de) | 2013-01-03 | 2015-11-11 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| JP6367229B2 (ja) | 2013-01-03 | 2018-08-01 | メルク パテント ゲーエムベーハー | 電子素子のための化合物 |
| FR3001730B1 (fr) | 2013-02-07 | 2016-01-08 | Commissariat Energie Atomique | Nouveaux metallopolymeres et leur utilisation |
| KR102310370B1 (ko) | 2013-10-02 | 2021-10-07 | 메르크 파텐트 게엠베하 | Oled 에서의 사용을 위한 붕소 함유 화합물 |
| EP3693437B1 (de) | 2013-12-06 | 2021-08-25 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| EP3080229B1 (de) | 2013-12-12 | 2018-01-17 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| KR102618668B1 (ko) | 2013-12-19 | 2023-12-27 | 메르크 파텐트 게엠베하 | 헤테로시클릭 스피로 화합물 |
| US10615343B2 (en) | 2014-09-05 | 2020-04-07 | Merck Patent Gmbh | Formulations and electronic devices |
| KR102496045B1 (ko) | 2014-11-11 | 2023-02-03 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| US10862038B2 (en) | 2014-12-30 | 2020-12-08 | Merck Patent Gmbh | Compositions comprising at least one polymer and at least one salt, and electroluminescent devices containing said compositions |
| DE102015108016A1 (de) * | 2015-01-20 | 2016-07-21 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in optoelektronischen Bauelementen |
| EP3250658B1 (en) | 2015-01-30 | 2019-06-19 | Merck Patent GmbH | Materials for electronic devices |
| EP3251128B1 (en) | 2015-01-30 | 2023-06-14 | Merck Patent GmbH | Formulations with a low particle content |
| US11024815B2 (en) | 2015-02-03 | 2021-06-01 | Merck Patent Gmbh | Metal complexes |
| KR102570137B1 (ko) | 2015-03-30 | 2023-08-23 | 메르크 파텐트 게엠베하 | 실록산 용매를 포함하는 유기 기능성 재료의 제형 |
| CN107683281A (zh) | 2015-06-10 | 2018-02-09 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| EP3581633B1 (en) | 2015-06-12 | 2021-01-27 | Merck Patent GmbH | Esters containing non-aromatic cycles as solvents for oled formulations |
| EP3323159B1 (en) | 2015-07-15 | 2023-01-04 | Merck Patent GmbH | Composition comprising organic semiconducting compounds |
| EP3326218B1 (en) | 2015-07-22 | 2021-02-17 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| GB201513037D0 (en) | 2015-07-23 | 2015-09-09 | Merck Patent Gmbh | Phenyl-derived compound for use in organic electronic devices |
| CN113248392B (zh) | 2015-07-29 | 2024-04-16 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP3334731B1 (en) | 2015-08-14 | 2021-03-03 | Merck Patent GmbH | Phenoxazine derivatives for organic electroluminescent devices |
| CN107849444A (zh) | 2015-08-28 | 2018-03-27 | 默克专利有限公司 | 用于电子器件的化合物 |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| EP3387077B1 (en) | 2015-12-10 | 2023-10-18 | Merck Patent GmbH | Formulations containing ketones comprising non-aromatic cycles |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| EP3390549B1 (en) | 2015-12-16 | 2022-06-29 | Merck Patent GmbH | Formulations containing a solid solvent |
| GB2545497A (en) | 2015-12-18 | 2017-06-21 | Cambridge Display Tech Ltd | Polymer |
| US12479815B2 (en) | 2016-02-05 | 2025-11-25 | Merck Patent Gmbh | Materials for electronic devices |
| KR102776731B1 (ko) | 2016-02-17 | 2025-03-05 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| TWI745361B (zh) | 2016-03-17 | 2021-11-11 | 德商麥克專利有限公司 | 具有螺聯茀結構之化合物 |
| KR20250004078A (ko) | 2016-04-11 | 2025-01-07 | 메르크 파텐트 게엠베하 | 디벤조푸란 및/또는 디벤조티오펜 구조를 포함하는 헤테로시클릭 화합물 |
| KR102487147B1 (ko) | 2016-06-03 | 2023-01-11 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| KR20190019138A (ko) | 2016-06-16 | 2019-02-26 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| KR102374183B1 (ko) | 2016-06-17 | 2022-03-14 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| TW201815998A (zh) | 2016-06-28 | 2018-05-01 | 德商麥克專利有限公司 | 有機功能材料之調配物 |
| US11192909B2 (en) | 2016-06-30 | 2021-12-07 | Merck Patent Gmbh | Method for the separation of enantiomeric mixtures from metal complexes |
| EP3481796B1 (en) | 2016-07-08 | 2021-02-17 | Merck Patent GmbH | Materials for organic electroluminescent devices |
| CN109415344B (zh) | 2016-07-14 | 2022-06-03 | 默克专利有限公司 | 金属络合物 |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| KR102468446B1 (ko) | 2016-09-14 | 2022-11-18 | 메르크 파텐트 게엠베하 | 스피로바이플루오렌-구조를 갖는 화합물 |
| EP3512848B1 (de) | 2016-09-14 | 2020-11-18 | Merck Patent GmbH | Verbindungen mit carbazol-strukturen |
| TWI766884B (zh) | 2016-09-30 | 2022-06-11 | 德商麥克專利有限公司 | 具有二氮雜二苯并呋喃或二氮雜二苯并噻吩結構的化合物、其製法及其用途 |
| KR102773142B1 (ko) | 2016-09-30 | 2025-02-25 | 메르크 파텐트 게엠베하 | 디아자디벤조푸란 또는 디아자디벤조티오펜 구조를 갖는 카르바졸 |
| TWI764942B (zh) | 2016-10-10 | 2022-05-21 | 德商麥克專利有限公司 | 電子裝置 |
| KR102451842B1 (ko) | 2016-10-31 | 2022-10-07 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| EP3532566B1 (en) | 2016-10-31 | 2021-04-21 | Merck Patent GmbH | Formulation of an organic functional material |
| TWI745467B (zh) | 2016-11-02 | 2021-11-11 | 德商麥克專利有限公司 | 電子裝置用的材料 |
| JP7073388B2 (ja) | 2016-11-08 | 2022-05-23 | メルク パテント ゲーエムベーハー | 電子デバイスのための化合物 |
| TWI756292B (zh) | 2016-11-14 | 2022-03-01 | 德商麥克專利有限公司 | 具有受體基團與供體基團之化合物 |
| TW201833118A (zh) | 2016-11-22 | 2018-09-16 | 德商麥克專利有限公司 | 用於電子裝置之材料 |
| TWI781123B (zh) | 2016-11-25 | 2022-10-21 | 德商麥克專利有限公司 | 用於有機電激發光裝置之材料 |
| US11584753B2 (en) | 2016-11-25 | 2023-02-21 | Merck Patent Gmbh | Bisbenzofuran-fused 2,8-diaminoindeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (OLED) |
| EP3548467B1 (de) | 2016-11-30 | 2023-06-21 | Merck Patent GmbH | Verbindungen mit valerolaktam-strukturen |
| JP7023957B2 (ja) | 2016-11-30 | 2022-02-22 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 非対称性の繰り返し単位を有するポリマー |
| TW201831468A (zh) | 2016-12-05 | 2018-09-01 | 德商麥克專利有限公司 | 含氮的雜環化合物 |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| CN110168047B (zh) | 2016-12-13 | 2023-08-08 | 默克专利有限公司 | 有机功能材料的制剂 |
| TW201835300A (zh) | 2016-12-22 | 2018-10-01 | 德商麥克專利有限公司 | 包含至少二種有機官能性化合物之混合物 |
| KR102594781B1 (ko) | 2017-01-23 | 2023-10-26 | 메르크 파텐트 게엠베하 | 유기 전계발광 디바이스용 재료 |
| EP3573973B1 (de) | 2017-01-25 | 2023-12-06 | Merck Patent GmbH | Carbazolderivate |
| TWI763772B (zh) | 2017-01-30 | 2022-05-11 | 德商麥克專利有限公司 | 電子裝置之有機元件的形成方法 |
| TWI791481B (zh) | 2017-01-30 | 2023-02-11 | 德商麥克專利有限公司 | 形成有機電致發光(el)元件之方法 |
| KR102683465B1 (ko) | 2017-02-02 | 2024-07-09 | 메르크 파텐트 게엠베하 | 전자 디바이스용 재료 |
| KR102557516B1 (ko) | 2017-03-02 | 2023-07-20 | 메르크 파텐트 게엠베하 | 유기 전자 디바이스용 재료 |
| TW201843143A (zh) | 2017-03-13 | 2018-12-16 | 德商麥克專利有限公司 | 含有芳基胺結構之化合物 |
| US10862046B2 (en) | 2017-03-30 | 2020-12-08 | Universal Display Corporation | Organic electroluminescent materials and devices |
| JP7123967B2 (ja) | 2017-03-31 | 2022-08-23 | メルク パテント ゲーエムベーハー | 有機発光ダイオード(oled)のための印刷方法 |
| KR20180113659A (ko) * | 2017-04-06 | 2018-10-17 | 삼성디스플레이 주식회사 | 발광 재료 및 이를 포함하는 유기 전계 발광 소자 |
| CN110494514A (zh) | 2017-04-10 | 2019-11-22 | 默克专利有限公司 | 有机功能材料的制剂 |
| WO2018197447A1 (de) | 2017-04-25 | 2018-11-01 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| JP7330898B2 (ja) | 2017-05-03 | 2023-08-22 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| KR102596593B1 (ko) | 2017-05-22 | 2023-11-01 | 메르크 파텐트 게엠베하 | 전자 디바이스를 위한 헥사시클릭 헤테로방향족 화합물 |
| TW201920343A (zh) | 2017-06-21 | 2019-06-01 | 德商麥克專利有限公司 | 電子裝置用材料 |
| CN110753685A (zh) | 2017-06-23 | 2020-02-04 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| JP7317725B2 (ja) | 2017-06-28 | 2023-07-31 | メルク パテント ゲーエムベーハー | 電子デバイスのための材料 |
| TWI813576B (zh) | 2017-07-03 | 2023-09-01 | 德商麥克專利有限公司 | 具有低含量苯酚類雜質的調配物 |
| CN110892543B (zh) | 2017-07-18 | 2023-07-28 | 默克专利有限公司 | 有机功能材料的制剂 |
| EP4603562A3 (en) | 2017-07-28 | 2025-11-26 | Merck Patent GmbH | Spirobifluorene derivatives for use in electronic devices |
| EP3679024B1 (de) | 2017-09-08 | 2022-11-02 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| KR20250035612A (ko) | 2017-11-23 | 2025-03-12 | 메르크 파텐트 게엠베하 | 전자 디바이스용 재료 |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| KR20250086795A (ko) | 2017-12-15 | 2025-06-13 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 치환된 방향족 아민 |
| TW201938562A (zh) | 2017-12-19 | 2019-10-01 | 德商麥克專利有限公司 | 雜環化合物 |
| EP3728275B1 (en) | 2017-12-20 | 2024-09-04 | Merck Patent GmbH | Heteroaromatic compounds |
| CN108559484B (zh) * | 2018-01-15 | 2019-08-02 | 太原理工大学 | 一种烷基溴代咔唑衍生物室温磷光材料及其制备和应用 |
| KR102710151B1 (ko) | 2018-02-26 | 2024-09-25 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 포뮬레이션 |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| EP3856717A2 (de) | 2018-09-27 | 2021-08-04 | Merck Patent GmbH | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| KR20210068054A (ko) | 2018-09-27 | 2021-06-08 | 메르크 파텐트 게엠베하 | 유기 전자 디바이스에서 활성 화합물로 사용될 수 있는 화합물 |
| WO2020094539A1 (de) | 2018-11-05 | 2020-05-14 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| CN112930606A (zh) | 2018-11-06 | 2021-06-08 | 默克专利有限公司 | 用于形成电子器件的有机元件的方法 |
| CN112955489A (zh) | 2018-11-07 | 2021-06-11 | 默克专利有限公司 | 具有含胺基团的重复单元的聚合物 |
| CN113015720A (zh) | 2018-11-14 | 2021-06-22 | 默克专利有限公司 | 可用于制造有机电子器件的化合物 |
| KR102471152B1 (ko) | 2019-01-10 | 2022-11-24 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 화합물, 유기 광전자 소자 및 표시 장치 |
| TW202110935A (zh) | 2019-04-16 | 2021-03-16 | 德商麥克專利有限公司 | 含有可交聯聚合物之調配物 |
| US20220416172A1 (en) | 2019-10-22 | 2022-12-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| CN110981889A (zh) * | 2019-12-11 | 2020-04-10 | 北京大学深圳研究生院 | 一种空穴传输材料及其制备方法与应用 |
| WO2021122538A1 (de) | 2019-12-18 | 2021-06-24 | Merck Patent Gmbh | Aromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| US20230104248A1 (en) | 2019-12-19 | 2023-04-06 | Merck Patent Gmbh | Polycyclic compounds for organic electroluminescent devices |
| KR20220133937A (ko) | 2020-01-29 | 2022-10-05 | 메르크 파텐트 게엠베하 | 벤즈이미다졸 유도체 |
| EP4110884B1 (de) | 2020-02-25 | 2024-11-20 | Merck Patent GmbH | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| EP4115457A1 (de) | 2020-03-02 | 2023-01-11 | Merck Patent GmbH | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| KR20220154751A (ko) | 2020-03-17 | 2022-11-22 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 복소환 화합물 |
| US20230157170A1 (en) | 2020-03-17 | 2023-05-18 | Merck Patent Gmbh | Heteroaromatic compounds for organic electroluminescent devices |
| EP4126880A1 (de) | 2020-03-26 | 2023-02-08 | Merck Patent GmbH | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| JP7723680B2 (ja) | 2020-04-06 | 2025-08-14 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子のための多環式化合物 |
| DE112020006772T5 (de) | 2020-04-17 | 2023-01-12 | Irpc Public Company Limited | Fluorenderivate, aus diesen fluorenderivaten erhaltene polymere und verfahren zu deren herstellung |
| EP4139408A1 (en) | 2020-04-21 | 2023-03-01 | Merck Patent GmbH | Formulation of an organic functional material |
| EP4139971A1 (en) | 2020-04-21 | 2023-03-01 | Merck Patent GmbH | Emulsions comprising organic functional materials |
| KR20230027175A (ko) | 2020-06-18 | 2023-02-27 | 메르크 파텐트 게엠베하 | 인데노아자나프탈렌 |
| CN115867426A (zh) | 2020-06-23 | 2023-03-28 | 默克专利有限公司 | 生产混合物的方法 |
| JP2023531470A (ja) | 2020-06-29 | 2023-07-24 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子のためのヘテロ芳香族化合物 |
| CN115916794A (zh) | 2020-06-29 | 2023-04-04 | 默克专利有限公司 | 用于有机电致发光器件的杂环化合物 |
| TW202229215A (zh) | 2020-09-30 | 2022-08-01 | 德商麥克專利有限公司 | 用於有機電致發光裝置功能層之結構化的化合物 |
| TW202222748A (zh) | 2020-09-30 | 2022-06-16 | 德商麥克專利有限公司 | 用於結構化有機電致發光裝置的功能層之化合物 |
| US20230389423A1 (en) | 2020-10-16 | 2023-11-30 | Merck Patent Gmbh | Heterocyclic compounds for organic electroluminescent devices |
| CN116406414A (zh) | 2020-10-16 | 2023-07-07 | 默克专利有限公司 | 用于有机电致发光器件的包含杂原子的化合物 |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| EP4263543A1 (de) | 2020-12-18 | 2023-10-25 | Merck Patent GmbH | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| US20240114782A1 (en) | 2020-12-18 | 2024-04-04 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitrile derivatives as blue fluorescent emitters for use in oleds |
| CN116649013A (zh) | 2020-12-18 | 2023-08-25 | 默克专利有限公司 | 用于有机电致发光器件的含氮杂芳族化合物 |
| US20240244957A1 (en) | 2021-04-23 | 2024-07-18 | Merck Patent KGaA | Formulation of an organic functional material |
| EP4330257B1 (de) | 2021-04-30 | 2025-03-19 | Merck Patent GmbH | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| EP4340969A1 (de) | 2021-05-21 | 2024-03-27 | Merck Patent GmbH | Verfahren zur kontinuierlichen aufreinigung von mindestens einem funktionalen material und vorrichtung zur kontinuierlichen aufreinigung von mindestens einem funktionalen material |
| CN117730638A (zh) | 2021-08-02 | 2024-03-19 | 默克专利有限公司 | 通过组合油墨进行的印刷方法 |
| KR20240064697A (ko) | 2021-09-14 | 2024-05-13 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 붕소 복소환 화합물 |
| TW202349760A (zh) | 2021-10-05 | 2023-12-16 | 德商麥克專利有限公司 | 電子裝置之有機元件的形成方法 |
| CN118159623A (zh) | 2021-10-27 | 2024-06-07 | 默克专利有限公司 | 用于有机电致发光器件的含硼和氮的杂环化合物 |
| CN118303151A (zh) | 2021-11-30 | 2024-07-05 | 默克专利有限公司 | 具有芴结构的化合物 |
| CN118647622A (zh) | 2022-02-23 | 2024-09-13 | 默克专利有限公司 | 用于有机电致发光器件的芳族杂环 |
| CN118696106A (zh) | 2022-02-23 | 2024-09-24 | 默克专利有限公司 | 用于有机电致发光器件的含氮杂环化合物 |
| WO2023213759A1 (de) | 2022-05-04 | 2023-11-09 | Merck Patent Gmbh | Polymere enthaltend speziell substituierte triarylamin-einheiten sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| EP4519383B1 (de) | 2022-05-06 | 2026-01-14 | Merck Patent GmbH | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| TW202411366A (zh) | 2022-06-07 | 2024-03-16 | 德商麥克專利有限公司 | 藉由組合油墨來印刷電子裝置功能層之方法 |
| KR20250025718A (ko) | 2022-06-20 | 2025-02-24 | 메르크 파텐트 게엠베하 | 광전 디바이스용 복소환 |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| CN119894856A (zh) | 2022-09-22 | 2025-04-25 | 默克专利有限公司 | 用于有机电致发光器件的含氮化合物 |
| CN120152954A (zh) | 2022-11-01 | 2025-06-13 | 默克专利有限公司 | 用于有机电致发光器件的含氮杂环化合物 |
| WO2024115426A1 (de) | 2022-12-01 | 2024-06-06 | Merck Patent Gmbh | Polymere enthaltend spirotruxenderivate als wiederholungseinheit sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| TW202440819A (zh) | 2022-12-16 | 2024-10-16 | 德商麥克專利有限公司 | 有機功能性材料之調配物 |
| KR20250137143A (ko) | 2023-01-10 | 2025-09-17 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스용 함질소 복소환 |
| CN120569385A (zh) | 2023-01-17 | 2025-08-29 | 默克专利有限公司 | 用于有机电致发光器件的杂环化合物 |
| CN120787228A (zh) | 2023-03-07 | 2025-10-14 | 默克专利有限公司 | 用于有机电致发光器件的环状氮化合物 |
| WO2025003084A1 (de) | 2023-06-28 | 2025-01-02 | Merck Patent Gmbh | Dicyanoarylverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025032039A1 (en) | 2023-08-07 | 2025-02-13 | Merck Patent Gmbh | Process for the preparation of an electronic device |
| WO2025045935A1 (de) | 2023-08-31 | 2025-03-06 | Merck Patent Gmbh | Cyanogruppen-enthaltende aromaten für organische elektrolumineszenzvorrichtungen |
| WO2025109056A1 (de) | 2023-11-24 | 2025-05-30 | Merck Patent Gmbh | Sauerstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025181044A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025181097A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025181124A1 (de) | 2024-03-01 | 2025-09-04 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2026008710A1 (de) | 2024-07-05 | 2026-01-08 | Merck Patent Gmbh | Cyclische siliciumverbindungen für organische elektrolumineszenzvorrichtungen |
Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4111850A (en) * | 1977-02-16 | 1978-09-05 | Amp Incorporated | Organic photoconductors and methods |
| US4125534A (en) * | 1977-02-25 | 1978-11-14 | Allied Chemical Corporation | Carbazolyl diacetylenic compounds |
| JPS5686927A (en) * | 1979-12-18 | 1981-07-15 | Asahi Glass Co Ltd | Polymer containing carbazole skeleton and its preparation |
| JPH0753682A (ja) * | 1993-06-08 | 1995-02-28 | Toray Ind Inc | カルバゾール系重合体及びその製造方法 |
| JPH10316658A (ja) * | 1997-05-21 | 1998-12-02 | Mitsubishi Chem Corp | 4,4’−ビス(n−カルバゾリル)ジフェニルアミン誘導体及びそれを用いた有機電界発光素子 |
| JP2002117978A (ja) * | 2000-07-17 | 2002-04-19 | Fuji Photo Film Co Ltd | 発光素子及びイリジウム錯体 |
| JP2002203680A (ja) * | 2000-12-27 | 2002-07-19 | Fuji Photo Film Co Ltd | 発光素子 |
| WO2002081488A1 (de) * | 2001-04-05 | 2002-10-17 | Covion Organic Semiconductors Gmbh | Rhodium-und iridium-komplexe |
| JP2003045666A (ja) * | 2001-05-23 | 2003-02-14 | Honda Motor Co Ltd | 有機エレクトロルミネッセンス素子 |
| JP2005071909A (ja) * | 2003-08-27 | 2005-03-17 | Dainippon Printing Co Ltd | 電荷輸送性材料、有機エレクトロルミネッセンス素子、および表示用パネル |
| JP2008525608A (ja) * | 2004-12-29 | 2008-07-17 | ケンブリッジ ディスプレイ テクノロジー リミテッド | 硬質アミン |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SU474533A1 (ru) * | 1973-01-03 | 1975-06-25 | Томский политехнический институт им.С.М.Кирова | Способ получени 1,3-ди-(9-карбазолил)-пропанолов-2 |
| US6830828B2 (en) * | 1998-09-14 | 2004-12-14 | The Trustees Of Princeton University | Organometallic complexes as phosphorescent emitters in organic LEDs |
| KR100379810B1 (ko) * | 2000-11-07 | 2003-04-11 | 삼성에스디아이 주식회사 | 전하공급 균형을 높인 전기발광 고분자 및 그를 이용한전기발광 소자 |
| EP1381639B1 (de) * | 2001-03-24 | 2004-09-08 | Covion Organic Semiconductors GmbH | Konjugierte polymere enthaltend spirobifluoren-einheiten und fluoren-einheiten und deren verwendung |
| US6670054B1 (en) * | 2002-07-25 | 2003-12-30 | Xerox Corporation | Electroluminescent devices |
| US7094902B2 (en) * | 2002-09-25 | 2006-08-22 | 3M Innovative Properties Company | Electroactive polymers |
| US7374828B2 (en) * | 2003-12-05 | 2008-05-20 | Eastman Kodak Company | Organic electroluminescent devices with additive |
-
2003
- 2003-06-26 DE DE10328627A patent/DE10328627A1/de not_active Withdrawn
-
2004
- 2004-06-24 JP JP2006516042A patent/JP4874792B2/ja not_active Expired - Fee Related
- 2004-06-24 CN CN2004800115160A patent/CN1780897B/zh not_active Expired - Lifetime
- 2004-06-24 US US10/561,739 patent/US20060284140A1/en not_active Abandoned
- 2004-06-24 DE DE502004008921T patent/DE502004008921D1/de not_active Expired - Lifetime
- 2004-06-24 KR KR1020057025029A patent/KR20060073541A/ko not_active Ceased
- 2004-06-24 EP EP04740246A patent/EP1641894B1/de not_active Expired - Lifetime
- 2004-06-24 WO PCT/EP2004/006832 patent/WO2004113468A1/de not_active Ceased
Patent Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4111850A (en) * | 1977-02-16 | 1978-09-05 | Amp Incorporated | Organic photoconductors and methods |
| US4125534A (en) * | 1977-02-25 | 1978-11-14 | Allied Chemical Corporation | Carbazolyl diacetylenic compounds |
| JPS5686927A (en) * | 1979-12-18 | 1981-07-15 | Asahi Glass Co Ltd | Polymer containing carbazole skeleton and its preparation |
| JPH0753682A (ja) * | 1993-06-08 | 1995-02-28 | Toray Ind Inc | カルバゾール系重合体及びその製造方法 |
| JPH10316658A (ja) * | 1997-05-21 | 1998-12-02 | Mitsubishi Chem Corp | 4,4’−ビス(n−カルバゾリル)ジフェニルアミン誘導体及びそれを用いた有機電界発光素子 |
| JP2002117978A (ja) * | 2000-07-17 | 2002-04-19 | Fuji Photo Film Co Ltd | 発光素子及びイリジウム錯体 |
| JP2002203680A (ja) * | 2000-12-27 | 2002-07-19 | Fuji Photo Film Co Ltd | 発光素子 |
| WO2002081488A1 (de) * | 2001-04-05 | 2002-10-17 | Covion Organic Semiconductors Gmbh | Rhodium-und iridium-komplexe |
| JP2004533430A (ja) * | 2001-04-05 | 2004-11-04 | コビオン・オーガニック・セミコンダクターズ・ゲーエムベーハー | ロジウムおよびイリジウム錯体 |
| JP2003045666A (ja) * | 2001-05-23 | 2003-02-14 | Honda Motor Co Ltd | 有機エレクトロルミネッセンス素子 |
| JP2005071909A (ja) * | 2003-08-27 | 2005-03-17 | Dainippon Printing Co Ltd | 電荷輸送性材料、有機エレクトロルミネッセンス素子、および表示用パネル |
| JP2008525608A (ja) * | 2004-12-29 | 2008-07-17 | ケンブリッジ ディスプレイ テクノロジー リミテッド | 硬質アミン |
Also Published As
| Publication number | Publication date |
|---|---|
| DE502004008921D1 (de) | 2009-03-12 |
| CN1780897B (zh) | 2013-07-24 |
| DE10328627A1 (de) | 2005-02-17 |
| JP2009513723A (ja) | 2009-04-02 |
| US20060284140A1 (en) | 2006-12-21 |
| WO2004113468A1 (de) | 2004-12-29 |
| CN1780897A (zh) | 2006-05-31 |
| KR20060073541A (ko) | 2006-06-28 |
| EP1641894B1 (de) | 2009-01-21 |
| EP1641894A1 (de) | 2006-04-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4874792B2 (ja) | 電界発光用新規材料 | |
| KR101041766B1 (ko) | 카르바졸을 함유하는 공액 중합체 및 배합물, 그의제조방법 및 용도 | |
| KR101318070B1 (ko) | 전계발광 중합체 및 이의 용도 | |
| JP5398989B2 (ja) | エレクトロルミネセンスポリマーおよびその使用 | |
| CN1947275B (zh) | 电致发光聚合物和其用途 | |
| CN1835986B (zh) | 含有二氢菲单元的共轭聚合物及其用途 | |
| KR100997069B1 (ko) | 아릴아민 단위를 포함하는 공액 중합체, 그의 제조방법 및용도 | |
| JP5657250B2 (ja) | エレクトロルミネセンスポリマー及びその使用 | |
| KR100895236B1 (ko) | 스피로비플루오렌 단위를 함유하는 공액 중합체 및 이의용도 | |
| KR101964475B1 (ko) | 유기 전계발광 디바이스용 재료 | |
| KR100903247B1 (ko) | 디아릴안트라센 중합체를 갖는 전기발광 장치 | |
| US20060229427A1 (en) | Conjugated copolymers, representation and use thereof | |
| Wang et al. | Tunable charge transfer effect in poly (spirobifluorene) s with different electron-rich side chains | |
| JP2005509068A (ja) | 芳香族ポリマーを調製する方法 | |
| WO2024177081A1 (ja) | 重合体、有機電界発光素子用組成物、有機電界発光素子、有機el表示装置及び有機el照明 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100121 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100817 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20101115 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20101122 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101202 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20111025 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20111124 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20141202 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4874792 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |