JP2005502322A - 非天然アミノ酸のインビボ組込み - Google Patents
非天然アミノ酸のインビボ組込み Download PDFInfo
- Publication number
- JP2005502322A JP2005502322A JP2002583449A JP2002583449A JP2005502322A JP 2005502322 A JP2005502322 A JP 2005502322A JP 2002583449 A JP2002583449 A JP 2002583449A JP 2002583449 A JP2002583449 A JP 2002583449A JP 2005502322 A JP2005502322 A JP 2005502322A
- Authority
- JP
- Japan
- Prior art keywords
- protein
- amino acids
- receptor
- amino acid
- unnatural amino
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 COc1cc(CC(*)N)ccc1 Chemical compound COc1cc(CC(*)N)ccc1 0.000 description 2
- AGEZXYOZHKGVCM-UHFFFAOYSA-N BrCc1ccccc1 Chemical compound BrCc1ccccc1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 1
- POCWCQCPUVUNTC-SNVBAGLBSA-N CC(c1cc(C[C@H](N)O)ccc1)=O Chemical compound CC(c1cc(C[C@H](N)O)ccc1)=O POCWCQCPUVUNTC-SNVBAGLBSA-N 0.000 description 1
- AHYKHXBTEDMMOK-UHFFFAOYSA-N OCC(C(O)=O)N=[IH] Chemical compound OCC(C(O)=O)N=[IH] AHYKHXBTEDMMOK-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/505—Erythropoietin [EPO]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/67—General methods for enhancing the expression
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/93—Ligases (6)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P13/00—Preparation of nitrogen-containing organic compounds
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P13/00—Preparation of nitrogen-containing organic compounds
- C12P13/005—Amino acids other than alpha- or beta amino acids, e.g. gamma amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P13/00—Preparation of nitrogen-containing organic compounds
- C12P13/04—Alpha- or beta- amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P13/00—Preparation of nitrogen-containing organic compounds
- C12P13/04—Alpha- or beta- amino acids
- C12P13/22—Tryptophan; Tyrosine; Phenylalanine; 3,4-Dihydroxyphenylalanine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P19/00—Preparation of compounds containing saccharide radicals
- C12P19/26—Preparation of nitrogen-containing carbohydrates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/02—Preparation of peptides or proteins having a known sequence of two or more amino acids, e.g. glutathione
Abstract
Description
【0001】
関連出願の相互参照
本出願は、2001年4月19日に出願された米国仮特許出願第60/285,030号、及び2002年2月6日に出願された米国仮特許出願第60/355,514号の優先権および利益を主張し、それらの明細書の全体をここで援用する。
【0002】
連邦政府の後援を受けた研究開発に関する声明
本発明は、海軍研究事務所からの補助金交付第6502573号及び国立衛生研究所からの補助金交付第GM62159号の下で米国政府の支援により為された。米国政府はこの発明に一定の権利を有する。
【0003】
技術分野
本発明はタンパク質生合成の分野に関する。特に、本発明は非天然アミノ酸を含むタンパク質を生産するための組成物と方法の分野に関する。
【背景技術】
【0004】
タンパク質は光合成からシグナル伝達や免疫応答に至るまでの複雑な生命現象のほぼ全てを行っている。これらの複雑な機能を理解し、制御するためには、タンパク質の構造と機能の関係の理解を深めることが必要である。
【0005】
化合物の機能特性を変えるためにほぼ任意構造を変化させることができる小有機分子合成と異なり、タンパク質合成は20種の天然アミノ酸によりコードされる変化に限られる。細菌からヒトに至る全公知生物の遺伝コードは同一の20種の共通アミノ酸をコードする。これらのアミノ酸はタンパク質の翻訳後修飾(例えばグリコシル化、リン酸化又は酸化)、又は頻度は低いが、例えばセレノシステインの場合のようにアミノアシル化サプレッサーtRNAの酵素修飾により改変することができる。それにもかかわらず、これらの僅か20種の単純な構成単位から合成されるポリペプチドが複雑な生命現象の全てを行っている。
【0006】
部位特異的及びランダム突然変異誘発はタンパク質の特定アミノ酸を他の19種の共通アミノ酸の任意のもので置換でき、タンパク質の構造と機能の関係を解明するための重要なツールになっている。これらの方法により、安定性、触媒活性及び結合特異性等の特性を強化したタンパク質を作製することが可能になっている。しかし、タンパク質置換は大半が単純な官能基をもつ20種の共通アミノ酸に限られているKnowles,J.R.Tinkering with enzymes: what are we learning?Science,236(4806)1252−1258(1987);及びZoller,M.J.,Smith,M.Oligonucleotide−directed mutagenesis of DNA fragments cloned into M13 vectors,Methods Enzymol,154:468−500(1983)参照。新規な生物学的、化学的又は物理的特性をもつ付加アミノ酸を含むように遺伝コードを拡張することにより、例えば天然タンパク質のように20種の共通アミノ酸に含まれるアミノ酸のみから構成されるタンパク質に比較してタンパク質の性質(例えば寸法、酸性度、求核性、水素結合、疎水性)を改変することができる。
【0007】
非天然アミノ酸をタンパク質に導入するために数種のストラテジーが利用されている。最初の実験はLys、Cys及びTyr等の反応性側鎖をアミノ酸に付加した(例えばリジンをN2 −アセチル−リジンに変換)。化学合成も非天然アミノ酸を導入する簡単な方法であるが、日常的固相ペプチド合成は一般に100残基未満の小ペプチド又はタンパク質に限られている。ペプチドフラグメントの酵素ライゲーションと天然化学ライゲーションの最近の開発に伴い、より大きいタンパク質を生産することが可能であるが、方法の大規模化は容易ではない。例えばP.E.DawsonとS.B.H.Kent,Annu.Rev.Biochem.,69:923(2000)参照。タンパク質生合成に有用なin vitro抽出物に所望非天然アミノ酸で化学的にアシル化したサプレッサーtRNAを加える一般的なin vitro生合成法を使用して100種を上回る非天然アミノ酸がほぼ任意寸法の各種タンパク質に部位特異的に組込まれている。例えばV.W.Cornish,D.Mendel and P.G.Schultz,Angew.Chem.Int.Ed.Engl.,1995,34:621(1995);C.J.Noren,S.J.Anthony−Cahill,M.C.Griffith,P.G.Schultz,A general method for site−specific incorporation of unnatural amino acids into proteins,Science 244 182−188(1989);及びJ.D.Bain,C.G.Glabe,T.A.Dix,A.R.Chamberlin,E.S.Diala,Biosynthetic site−specific incorporation of a non−natural amino acid into a polypeptide,J.Am.Chem.Soc.111 8013−8014(1989)参照。タンパク質安定性、タンパク質フォールディング、酵素メカニズム及びシグナル伝達の研究のために多様な官能基がタンパク質に導入されている。これらの研究はタンパク質生合成機構が多様なアミノ酸側鎖を許容することを立証しているが、方法は技術的に困難であり、突然変異タンパク質収率は低い。
【0008】
50年以上前に天然アミノ酸の多数の類似体は細菌の増殖を阻害することが発見された。これらのアミノ酸類似体の存在下で生産したタンパク質を分析すると、各種程度までその天然対応物を置換していることが分かった。例えばM.H.Richmond,Bacteriol.Rev.,26:398(1962)参照。これは正しいアミノ酸とそのコグネイトtRNAの結合に関与する酵素であるアミノアシル−tRNAシンテターゼが類似体を対応する天然アミノ酸から厳密に区別できないためである。例えば、ノルロイシンはメチオニル−tRNAシンテターゼにより負荷され、p−フルオロフェニルアラニンはフェニルアラニン−tRNAシンテターゼにより負荷される。D.B.Cowie,G.N.Cohen,E.T.Bolton and H.DeRrobinchon−Szulmajst,Biochim.Biophys.Acta,1959,34:39(1959);及びR.MunierとG.N.Cohen,Biochim.Biophys.Acta,1959,31:378(1959)参照。
【0009】
その後、種々の野生型シンテターゼを利用するために選択圧組込みと呼ばれるin vivo方法が開発された。例えばN.Budisa,C.Minks,S.Alefelder,W.Wenger,F.M.Dong,L.Moroder and R.Huber,FASEB J.,13:41(1999)参照。この方法では特定天然アミノ酸を細胞に供給する該当代謝経路を遮断する栄養要求株を使用し、ターゲット遺伝子の転写を抑制しながら制限濃度の天然アミノ酸を含む最少培地で培養する。定常増殖期が開始したら天然アミノ酸の供給を停止して非天然アミノ酸類似体に交換する。組換えタンパク質の発現を誘導すると、非天然類似体を含むタンパク質が蓄積する。例えば、このストラテジーを使用してo、m及びp−フルオロフェニルアラニンがタンパク質に組込まれ、紫外線スペクトルで容易に識別可能な2つの特徴的な肩を示しており(例えばC.Minks,R.Huber,L.Moroder and N.Budisa,Anal.Biochem.,284:29(2000)参照)、また、トリフルオロメチオニンを使用してバクテリオフアージT4リゾチームのメチオニンを置換し、キトオリゴ糖リガンドとのその相互作用が19F NMRにより試験されており(例えばH.Duewel,E.Darb,V.Robinson and J.F.Honek,Biochemistry,36:3404(1997))、更にロイシンの代わりにトリフルオロロイシンを挿入してロイシン−ジッパータンパク質の熱及び化学安定性を高めている。例えばY.Tang,G.Ghirlanda,W.A.Petka,T.Nakajima,W.F.DeGrado and D.A.Tirrell,Angew.Chem.Int.Ed.Engl.,40:1494(2001)参照。更に、セレノメチオニンとテルロメチオニンを各種組換えタンパク質に組込んでX線結晶解析で位相決定を容易にしている。例えばW.A.Hendrickson,J.R.Horton and D.M.Lemaster,EMBO J.,9:1665(1990);J.O.Boles,K.Lewinski,M.Kunkle,J.D.Odom,B.Dunlap,L.Lebioda and M.Hatada,Nat.Struct.Biol.,1:283(1994);N.Budisa,B.Steipe,P.Demange,C.Eckerskorn,J.Kellermann and R.Huber,Eur.J.Biochem.,230:788(1995);及びN.Budisa,W.Karnbrock,S.Steinbacher,A.Humm,L.Prade,T.Neuefeind,L.Moroder and R.Huber,J.Mol.Biol.,270:616(1997)参照。アルケン又はアルキン官能基をもつメチオニン類似体も効率的に挿入され、化学的手段によりタンパク質の付加修飾が可能である。例えばJ.C.M.van HestとD.A.Tirrell,FEBS Lett.,424:68(1998);J.C.M.van Hest,K.L.Kiick and D.A.Tirrell,J.Am.Chem.Soc.,122:1282(2000);及びK.L.KiickとD.A.Tirrell,Tetrahedron,56:9487(2000)参照。
【0010】
この方法の成功は一般にタンパク質翻訳の忠実度を確保するためには高い選択性を必要とするアミノアシル−tRNAシンテターゼによる非天然アミノ酸類似体の認識に依存している。従って、この方法により接近可能な化学官能基の範囲は限られている。例えば、チアプロリンは定量的にタンパク質に組込むことができるが、オキサプロリンやセレノプロリンはできない。N.Budisa,C.Minks,F.J.Medrano,J.Lutz,R.Huber and L.Moroder,Proc.Natl.Acad.Sci.U S A,95:455(1998)参照。この方法の範囲を拡大する1つの方法はアミノアシル−tRNAシンテターゼの基質特異性を緩和することであり、少数の例で成功している。例えば、大腸菌フェニルアラニル−tRNAシンテターゼ(PheRS)でAla294 をGlyに置換すると、基質結合ポケットの寸法が増し、その結果、tRNAPheはp−Cl−フェニルアラニン(p−Cl−Phe)によりアシル化される。M.Ibba,P.Kast and H.Hennecke,Biochemistry,33:7107(1994)参照。この突然変異体PheRSを大腸菌株に導入すると、フェニルアラニンの代わりにp−Cl−フェニルアラニン又はp−Br−フェニルアラニンを組込むことができる。例えばM.IbbaとH.Hennecke,FEBS Lett.,364:272(1995);及びN.Sharma,R.Furter,P.Kast and D.A.Tirrell,FEBS Lett.,467:37(2000)参照。同様に、大腸菌チロシル−tRNAシンテターゼのアミノ酸結合部位の近傍の点突然変異Phe130Serの結果、アザチロシンをチロシンよりも効率的に組込めることが示されている。F.Hamano−Takaku,T.Iwama,S.Saito−Yano,K.Takaku,Y.Monden,M.Kitabatake,D.Soll and S.Nishimura,J.Biol.Chem.,275:40324(2000)参照。
【0011】
アミノアシル化の忠実性は非コグネイト中間体及び生成物の基質識別とプルーフリーディングの両レベルで維持される。従って、非天然アミノ酸をタンパク質にin vivo組込む代替ストラテジーはプルーフリーディングメカニズムをもつシンテターゼの改変である。これらのシンテターゼはコグネイト天然アミノ酸に構造的に類似するアミノ酸を識別することができず、従って活性化することができない。このエラーは別部位で修正され、tRNAから誤って負荷されたアミノ酸を脱アシル化し、タンパク質翻訳の忠実度を維持する。シンテターゼのプルーフリーディング活性が機能しなくなると、誤って活性化された構造類似体が編集機能から抜け落ちて組込まれる恐れがある。このアプローチはバリル−tRNAシンテターゼ(ValRS)で最近立証されている。V.Doring,H.D.Mootz,L.A.Nangle,T.L.Hendrickson,V.de Crecy−Lagard,P.Schimmel and P.Marliere,Science,292:501(2001)参照。ValRSがtRNA ValをCys、Thr又はアミノ酪酸(Abu)で誤ってアミノアシル化すると、これらの非コグネイトアミノ酸は編集ドメインにより加水分解される。大腸菌染色体のランダム突然変異誘発後に、ValRSの編集部位に突然変異をもつ突然変異体大腸菌株が選択された。この編集欠損ValRSはtRNA Valに誤ってCysを負荷する。AbuはCysに立体的に似ている(AbuではCysの−SH基を−CH3で置換)ので、この突然変異体大腸菌株をAbuの存在下に増殖させると、突然変異体ValRSはAbuもタンパク質に組込む。質量分析によると、天然タンパク質ではバリンの約24%が各バリン位でAbuにより置換されている。
【0012】
上記方法の少なくとも1つの重大な欠点は、タンパク質中の特定天然アミノ酸に対応する全部位を置換することである。また、天然及び非天然アミノ酸の組込み度も一定せず、細胞の内側でコグネイト天然アミノ酸を完全に枯渇させることは困難であるので、定量的置換が達成されることは稀である。類似体の多重部位組込みは毒性を生じるので、これらのストラテジーは生きた細胞では突然変異体タンパク質を試験し難いという欠点もある。最後に、ゲノム内の全部位で置換できなければならないという理由から、この方法は一般に共通アミノ酸の近似構造類似体にしか適用できない。
【0013】
固相合成及び半合成法により新規アミノ酸を含む多数の小タンパク質の合成も行われている。例えば以下の刊行物とその引用文献を参照されたい。Crick,F.J.C.,Barrett,L.Brenner,S.Watts−Tobin,R.General natue of the genetic code for proteins.Nature,1227−1232(1961);Hofmann,K.,Bohn,H.Studies on polypeptides.XXXVI.The effect ofpyrazole−imidazole replacements on the S−protein activating potency of an S−peptide fragments,J.Am.Chem.,5914−5919(1966);Kaiser,E.T.Synthetic approaches to biologically active peptides and proteins including enzymes,Acc Chem Res,47−54(1989);Nakatsuka,T.,Sasaki,T.,Kaiser,E.T.Peptide segment coupling catalyzed by the semisynthetic enzyme thiosubstilisin,J Am Chem Soc.,3808−3810(1987);Schnolzer,M.,Kent,S B H.Constructing proteins by dovetailing unprotected synthetic peptides:backbone−engineered HIV protease,Science,221−225(1992);Chaiken,I.M.Semisynthetic peptides and proteins,CRC Crit Rev Biochem,255−301(1981);Offord,R.E.Protein engineering by chemical means?Protein Eng .,151−157(1987);及びJackson,D.Y.,Burnier,J.,Quan,C.,Stanley,M.,Tom,J.,Wells,J.A.A Designed Peptide Ligase for Total Synthesis of Ribonuclease A with Unnatural Catalytic Residues,Science,243(1994)。
【0014】
補因子、スピンラベル及びオリゴヌクレオチド等の各種非天然側鎖をタンパク質にin vitro導入するために化学修飾が使用されている。例えばCorey,D.R.,Schultz,P.G.Generation of a hybrid sequence−specific single−stranded deoxyribonuclease,Science,1401−1403(1987);Kaiser,E.T.,Lawrence D.S.,Rokita,S.E.The chemical modification of enzymatic specificity,Rev Biochem,565−595(1985);Kaiser,E.T.,Lawrence,D.S.Chemical mutation of enzyme active sites,Science,505−511(1984);Neet,K.E.,Nanci A,Koshland,D.E.Properties of thiol−substilisin,J Biol.Chem.,6392−6401(1968);Polgar,L.B.,M.L.A new enzyme containing a synthetically formed active site.Thiol−substilisin.J.Am.Chem Soc.,3153−3154(1966);及びPollack,S.J.,Nakayama,G.Schultz,P.G.Introduction of nucleophiles and spectroscopic probes into antibody combining sites,Science,1038−1040(1988)参照。
【0015】
あるいは、数種の生物理学的プローブをin vitro合成タンパク質に組込むために化学修飾アミノアシル−tRNAを利用する生合成法が使用されている。以下の刊行物とその引用文献参照。Brunner,J.New Photolabeling and crosslinking methods,Annu.Rev Biochem,483−514(1993);及びKrieg,U.C.,Walter,P.,Hohnson,A.E.Photocrosslinking of the signal sequence of nascent preprolactin of the 54−kilodalton polypeptide of the signal recognition particle,Proc.Natl.Acad.Sci,8604−8608(1986)。
【0016】
所望アンバーナンセンス突然変異を含む遺伝子でプログラムされたタンパク質合成反応に化学的にアミノアシル化したサプレッサーtRNAを加えることにより非天然アミノ酸をタンパク質に部位特異的にin vitro組込むことができることは従来示されている。これらのアプローチを使用すると、特定アミノ酸の栄養要求性株を使用して20種の共通アミノ酸の多数のものを近似構造相同体(例えばフェニルアラニンをフルオロフェニルアラニン)で置換することができる。例えばNoren,C.J.,Anthony−Cahill,Griffith,M.C.,Schultz,P.G.A general method for site−specific incorporation of unnatural amino acids into proteins,Science,244:182−188(1989);M.W.Nowakら,Science 268:439−42(1995);Bain,J.D.,Glabe,C.G.,Dix,T.A.,Chamberlin,A.R.,Diala,E.S.Biosynthetic site−specific Incorporation of a non−natural amino acid into a polypeptide,J.Am Chem Soc,111:8013−8014(1989);N.Budisaら,FASEB J.13:41−51(1999);Ellman,J.A.,Mendel,D.,Anthony−Cahill,S.,Noren,C.J.,Schultz,P.G.Biosynthetic method for introducing unnatural amino acids site−specifically into proteins.Methods in Enz.,301−336(1992);及びMendel,D.,Cornish,V.W.& Schultz,P.G.Site−Directed Mutagenesis with an Expanded Genetic Code,Annu Rev Biophys.Biomol Struct.24,435−62(1995)参照。
【0017】
例えば、終止コドンUAGを認識するサプレッサーtRNAが作製され、非天然アミノ酸で化学的にアミノアシル化された。タンパク質遺伝子の所期部位に終止コドンTAGを導入するために慣用部位特異的突然変異誘発が使用された。例えばSayers,J.R.,Schmidt,W.Eckstein,F.5' ,3' Exonuclease in phosphorothioate−based oligonucleotide−directed mutagenesis,Nucleic Acids Res,791−802(1988)参照。アシル化サプレッサーtRNAと突然変異体遺伝子をin vitro転写/翻訳系で組合せると、UAGコドンに応答して非天然アミノ酸が組込まれ、このアミノ酸を特定位置に含むタンパク質が得られた。[ 3H]−Pheを使用する実験とα−ヒドロキシ酸を使用する実験によると、所望アミノ酸のみがUAGコドンにより指定される位置に組込まれ、このアミノ酸はタンパク質の他のどの位置にも組込まれないことが判明した。例えばNorenら,前出;及びEllman,J.A.,Mendel,D.,Schultz,P.G.Site−specific incorporation of novel backbone structures into proteins,Science,197−200(1992)参照。
【0018】
一般に、これらのin vitroアプローチはアミノ酸の部位特異的組込みが困難であることや、アミノ酸が20種の共通アミノ酸の単純な誘導体でなければならないことや、大きいタンパク質又はペプチドフラグメントの合成に伴う固有の問題などの限界がある。
【0019】
非天然アミノ酸をタンパク質に組込むためにマイクロインジェクション法も使用されている。例えばM.W.Nowak,P.C.Kearney,J.R.Sampson,M.E.Saks,C.G.Labarca,S.K.Silverman,W.G.Zhong,J.Thorson,J.N.Abelson,N.Davidson,P.G.Schultz,D.A.Dougherty and H.A.Lester,Science,268:439(1995);及びD.A.Dougherty,Cuur.Opin.Chem.Biol.,4:645(2000)参照。in vitro作製した2種のRNA種即ち所期アミノ酸位置にUAG終止コドンをもつターゲットタンパク質をコードするmRNAと、所望非天然アミノ酸でアミノアシル化したアンバーサプレッサーtRNAをアフリカツメガエル卵母細胞に同時に注射している。こうすると、卵母細胞の翻訳機構はUAGにより指定される位置に非天然アミノ酸を挿入する。この方法により一体的膜タンパク質のin vivo構造−機能研究が可能になったが、一般にin vitro発現系には応用できない。例えば、蛍光アミノ酸をタキキニンニューロキニン−2受容体に組込んで蛍光共鳴エネルギー移動により距離を測定したり(例えばG.Turcatti,K.Nemeth,M.D.Edgerton,U.Meseth,F.Talabot,M.Peitsch,J.Knowles,H.Vogel and A.Chollet,J.Biol.Chem.,271:19991(1996)参照)、ビオチン化アミノ酸を組込んでイオンチャンネルで表面残基を同定したり(例えばJ.P.Gallivan,H.A.Lester and D.A.Dougherty,Chem.Biol.,4:739(1997)参照)、ケージドチロシン類似体を使用してイオンチャンネルの共焦点変化をリアルタイムでモニターしたり(例えばJ.C.Miller,S.K.Silverman,P.M.England,D.A.Dougherty and H.A.Lester,Neuron,20:619(1998)参照)、αヒドロキシアミノ酸を使用してイオンチャンネルのバックボーンを改変し、その開閉メカニズムを探索する(例えばP.M.England,Y.Zhang,D.A.Dougherty and H.A.Lester,Cell,96:89(1999);及びT.Lu,A.Y.Ting,J.Mainland,L.Y.Jan,P.G.Schultz and J.Yang,Nat.Neurosci.,4:239(2001)参照)等の方法が挙げられる。
【0020】
しかし、マイクロインジェクション法には、例えばサプレッサーtRNAを非天然アミノ酸で化学的にin vitroアミノアシル化しなければならないことや、アシル化tRNAが翻訳中に化学量論的試薬として消費され、再生できないなどの欠点がある。この欠点により、抑圧効率が悪く、タンパク質収率が低いので、電気生理学的測定等の高感度技術で突然変異体タンパク質を定量することが必要である。更に、この方法はマイクロインジェクションが可能な細胞にしか適用できない。
【0021】
非天然アミノ酸をタンパク質に直接in vivo組込むことができるならば、突然変異体タンパク質の収率が上がり、技術的に容易であり、細胞や場合によっては生きた生物で突然変異体タンパク質を試験することが可能になり、これらの突然変異体タンパク質を治療処置に使用できる等の利点がある。各種寸法、酸性度、求核性、疎水性等をもつ非天然アミノ酸をタンパク質に組込むことができるならば、タンパク質の構造を合理的且つ体系的に操作し、タンパク質機能を探索すると共に新規特性をもつ新規タンパク質又は生物を創製する可能性が著しく広がる。しかし、タンパク質翻訳の忠実度を高くするために必要なtRNA−シンテターゼ相互作用の複雑な性質によりその方法は困難である。
【0022】
パラ−F−Pheを部位特異的に組込む試みの1つとして、酵母アンバーサプレッサーtRNAPheCUA/フェニルアラニル−tRNAシンテターゼ対がp−F−Phe耐性Phe栄養要求性大腸菌株で使用されている。例えばR.Furter,Protein Sci.,7:419(1998)参照。酵母PheRSはp−F−Pheに対して高い基質特異性をもたないので、突然変異誘発部位は64〜75%のp−F−Pheでしか翻訳されず、増殖培地に過剰のp−F−Pheを加えてもPheとLysとして残る。更に、Pheコドン位置に7%のp−F−Pheが検出され、内在大腸菌PheRSはPhe以外にp−F−Pheも組込むと考えられる。このアプローチは翻訳忠実度が劣り、例えばサプレッサーtRNAとPheRSが真に直交ではないので、一般に他の非天然アミノ酸には適用できない。
【発明の開示】
【発明が解決しようとする課題】
【0023】
従って、細胞の生合成機構をより効率的且つ有効に改変できるように方法を改善することが必要である。以下の開示から自明の通り、本発明はこれらの必要及び他の必要に取組むものである。
【課題を解決するための手段】
【0024】
本発明は非天然アミノ酸をタンパク質に組込むことができる翻訳系を作製及び使用するための各種方法と関連組成物を提供する。翻訳系により生産された非天然アミノ酸を含むタンパク質も本発明の特徴の1つである。本発明の翻訳系を使用すると、公知及び新規両者の非天然アミノ酸をタンパク質に組込むことができる。本発明は更に新規非天然アミノ酸、非天然アミノ酸を含む各種組成物(例えば非天然アミノ酸を含むタンパク質と細胞)、非天然アミノ酸を生産するための化学及び生化学的方法、並びに自律性21アミノ酸細胞の作製方法とこれを含む組成物も提供する。
【0025】
即ち、1側面において本発明は翻訳系を含む組成物を提供する。翻訳系は直交tRNA(O−tRNA)と直交アミノアシルtRNAシンテターゼ(O−RS)を含む。一般に、O−RSは翻訳系の少なくとも1種の非天然アミノ酸でO−tRNAを優先的にアミノアシル化し、O−tRNAは少なくとも1種のセレクターコドンを認識する。従って、翻訳系はコード化セレクターコドンに応答して系で生産されるタンパク質に非天然アミノ酸を挿入する。
【0026】
典型的翻訳系としては細胞が挙げられ、例えば細菌細胞(例えば大腸菌)、始原菌細胞、真核細胞(例えば酵母細胞、哺乳動物細胞、植物細胞、昆虫細胞)等が挙げられる。あるいは、翻訳系はin vitro翻訳系を含み、例えば細胞抽出物を含む翻訳抽出物が挙げられる。
【0027】
O−tRNAの例としては、配列番号1〜3及び/又はその相補的ポリヌクレオチド配列から構成される群から選択されるポリヌクレオチド配列を含む核酸が挙げられる。同様に、O−RSの例としては、配列番号35〜66から構成される群から選択されるアミノ酸配列を含むポリペプチドと、配列番号4〜34及びその相補的ポリヌクレオチド配列から構成される群から選択されるポリヌクレオチド配列を含む核酸によりコードされるポリペプチドから構成される群から選択されるポリペプチドが挙げられる。
【0028】
翻訳系により使用可能な非天然アミノ酸の例としては、チロシンアミノ酸の非天然類似体;グルタミンアミノ酸の非天然類似体;フェニルアラニンアミノ酸の非天然類似体;セリンアミノ酸の非天然類似体;スレオニンアミノ酸の非天然類似体;アルキル、アリール、アシル、アジド、シアノ、ハロ、ヒドラジン、ヒドラジド、ヒドロキシル、アルケニル、アルキニル、エーテル、チオール、スルホニル、セレノ、エステル、チオ酸、硼酸、ボロン酸、ホスホ、ホスホノ、ホスフィン、複素環、エノン、イミン、アルデヒド、ヒドロキシルアミン、ケトもしくはアミノ置換アミノ酸又はその任意組合せ;光架橋基をもつアミノ酸;スピンラベル付きアミノ酸;蛍光アミノ酸:新規官能基をもつアミノ酸;別の分子と共有又は非共有的に相互作用するアミノ酸;金属結合性アミノ酸;金属含有アミノ酸;放射性アミノ酸;フォトケージド及び/又は光異性化可能なアミノ酸;ビオチン又はビオチン類似体含有アミノ酸;グリコシル化又は糖鎖修飾アミノ酸;ケト含有アミノ酸;ポリエチレングリコール又はポリエーテルを含むアミノ酸;重原子置換アミノ酸;化学分解性又は光分解性アミノ酸;延長側鎖をもつアミノ酸;毒性基を含むアミノ酸;糖鎖置換アミノ酸(例えば糖鎖置換セリン等);炭素結合糖含有アミノ酸;レドックス活性アミノ酸;α−ヒドロキシ含有酸;アミノチオ酸含有アミノ酸;α,αジ置換アミノ酸;βアミノ酸;及びプロリン以外の環状アミノ酸が挙げられる。
【0029】
例えば、非天然アミノ酸としてはO−メチル−L−チロシン、L−3−(2−ナフチル)アラニン、3−メチルフェニルアラニン、O−4−アリル−L−チロシン、4−プロピル−L−チロシン、トリ−O−アセチル−GlcNAcβ−セリン、L−Dopa、フッ素化フェニルアラニン、イソプロピル−L−フェニルアラニン、p−アジド−L−フェニルアラニン、p−アシル−L−フェニルアラニン、p−ベンゾイル−L−フェニルアラニン、L−ホスホセリン、ホスホノセリン、ホスホノチロシン、p−ヨードフェニルアラニン、p−ブロモフェニルアラニン、p−アミノ−L−フェニルアラニン、及びイソプロピル−L−フェニルアラニンが挙げられる。1態様では、少なくとも1種の非天然アミノ酸はO−メチル−L−チロシンである。1特定態様では、少なくとも1種の非天然アミノ酸はL−3−(2−ナフチル)アラニンである。別の特定態様では、少なくとも1種の非天然アミノ酸はアミノ−、イソプロピル−、又はO−アリル含有フェニルアラニン類似体である。
【0030】
本発明では各種セレクターコドンの任意のものを使用することができ、例えばナンセンスコドン、レアコドン又は4塩基(以上)コドン等が挙げられる。例えば、1態様では少なくとも1種のセレクターコドンはアンバーコドンである。
【0031】
本明細書には各種翻訳系の例を示し、例えばmtRNACUA Tyr と突然変異体TyrRS(LWJ16)を含む大腸菌細胞が挙げられ、この場合、突然変異体TyrRS(LWJ16)は細胞内でmtRNACUA Tyr をO−メチル−L−チロシンで優先的にアミノアシル化し、細胞はmtRNACUA Tyr を使用してアンバーコドンを認識する。別の例ではmtRNACUA Tyr とSS12−TyrRSを含む大腸菌細胞が挙げられ、この場合、SS12−TyrRSは細胞内でmtRNACUA Tyr をL−3−(2−ナフチル)アラニンで優先的にアミノアシル化し、細胞はmtRNACUA Tyr を使用してアンバーコドンを認識する。
【0032】
本発明の翻訳系は有用量の大量の非天然アミノ酸を含むタンパク質を合成することができる。例えば、細胞抽出物と緩衝液と医薬的に許容可能な賦形剤及び/又はその他を含む組成物中に少なくとも約10、50、100μg/L以上の濃度で少なくとも1種の非天然アミノ酸を含むタンパク質を生産することができる。
【0033】
本発明の別の側面は入手可能な任意タンパク質と相同であるが、1種以上の非天然アミノ酸相同体を含むタンパク質を生産できるようにする。例えば、1種以上の非天然アミノ酸を含み、1種以上の治療用タンパク質に相同の治療用タンパク質を生産することができる。例えば、1側面では、タンパク質はサイトカイン、増殖因子、増殖因子受容体、インターフェロン、インターロイキン、炎症性分子、腫瘍遺伝子産物、ペプチドホルモン、シグナル伝達分子、ステロイドホルモン受容体、転写アクチベーター、転写サプレッサー、エリスロポエチン(EPO)、インスリン、ヒト成長ホルモン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、肝細胞増殖因子、インスリン様増殖因子、白血病阻害因子、オンコスタチンM、PD−ECSF、PDGF、プレイオトロピン、SCF、cキットリガンド、VEGEF、G−CSF、IL−1、IL−2、IL−8、IGF−I、IGF−II、FGF(繊維芽細胞増殖因子)、PDGF、TNF、TGF−α、TGF−β、EGF(表皮増殖因子)、KGF(ケラチノサイト増殖因子)、SCF/cキット、CD40L/CD40、VLA−4/VCAM−1、ICAM−1/LFA−1、ヒアルリン/CD44、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体、及び/又はコルチコステロン受容体等の治療用又は他のタンパク質に相同である。別の態様では、タンパク質はα1アンチトリプシン、アンジオスタチン、抗血友病因子、抗体、アポリポタンパク質、アポタンパク質、心房性ナトリウム利尿因子、心房性ナトリウム利尿ポリペプチド、心房性ペプチド、C−X−Cケモカイン、T39765、NAP−2、ENA−78、Gro−a、Gro−b、Gro−c、IP−10、GCP−2、NAP−4、SDF−1、PF−4、MIG、カルシトニン、cキットリガンド、サイトカイン、CCケモカイン、単球化学誘引タンパク質−1、単球化学誘引タンパク質−2、単球化学誘引タンパク質−3、単球炎症性タンパク質−1α、単球炎症性タンパク質−1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262、CD40、CD40リガンド、Cキットリガンド、コラーゲン、コロニー刺激因子(CSF)、補体因子5a、補体阻害剤、補体受容体1、サイトカイン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、表皮増殖因子(EGF)、上皮好中球活性化ペプチド、エリスロポエチン(EPO)、表皮剥離毒素、IX因子、VII因子、VIII因子、X因子、繊維芽細胞増殖因子(FGF)、フィブリノーゲン、フィブロネクチン、G−CSF、GM−CSF、グルコセレブロシダーゼ、ゴナドトロピン、増殖因子、増殖因子受容体、ヘッジホッグタンパク質、ヘモグロビン、肝細胞増殖因子(HGF)、ヒルジン、ヒト血清アルブミン、ICAM−1、ICAM−1受容体、LFA−1、LFA−1受容体、インスリン、インスリン様増殖因子(IGF)、IGF−I、IGF−II、インターフェロン、IFN−α、IFN−β、IFN−γ、インターロイキン、IL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、ケラチノサイト増殖因子(KGF)、ラクトフェリン、白血病阻害因子、ルシフェラーゼ、ニュールチュリン、好中球阻害因子(NIF)、オンコスタチンM、骨形成タンパク質、腫瘍遺伝子産物、副甲状腺ホルモン、PD−ECSF、PDGF、ペプチドホルモン、ヒト増殖ホルモン、プレイオトロピン、プロテインA、プロテインG、発熱外毒素A、B又はC、リラキシン、レニン、SCF、可溶性補体受容体I、可溶性I−CAM1、可溶性インターロイキン受容体、可溶性TNF受容体、ソマトメジン、ソマトスタチン、ソマトトロピン、ストレプトキナーゼ、スーパー抗原、ブドウ球菌エンテロトキシン、SEA、SEB、SEC1、SEC2、SEC3、SED、SEE、ステロイドホルモン受容体、スーパーオキシドジスムターゼ、毒素性ショック症候群毒素、チモシンα1、組織プラスミノーゲンアクチベーター、腫瘍増殖因子(TGF)、TGF−α、TGF−β、腫瘍壊死因子、腫瘍壊死因子α、腫瘍壊死因子β、腫瘍壊死因子受容体(TNFR)、VLA−4タンパク質、VCAM−1タンパク質、血管内皮増殖因子(VEGEF)、ウロキナーゼ、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体、及び/又はコルチコステロン受容体等の治療用又は他のタンパク質に相同である。1側面では、本発明の組成物は非天然アミノ酸を含むタンパク質と医薬的に許容可能な賦形剤を含み、例えば上記タンパク質の任意のものと医薬的に許容可能な賦形剤を含む。
【0034】
ポリペプチドとの相同度は例えばデフォルトパラメーターに設定した例えばBLASTIN又はBLASTPを使用して配列アラインメントを実施することにより推定することができる。例えば、1態様では、タンパク質は公知治療用タンパク質(例えばGenebank又は他の入手可能なデータベースに登録されたタンパク質)に少なくとも約50%、少なくとも約75%、少なくとも約80%、少なくとも約90%又は少なくとも約95%一致する。例えば、1好適態様では、治療用タンパク質はエリスロポエチン(EPO)である。
【0035】
所期タンパク質は1、2、3、4、5、6、7、8、9、10、11、12、13、14、15又は16種以上の非天然アミノ酸を含むことができる。非天然アミノ酸は同一でも異なっていてもよく、例えば1、2、3、4、5、6、7、8、9、10、11、12、13、14、15又は16種以上の異なる非天然アミノ酸を含むタンパク質に1、2、3、4、5、6、7、8、9、10、11、12、13、14、15又は16個以上の異なる部位が存在することができる。例えば、1態様では、タンパク質はDHFRであり、少なくとも1種の非天然アミノ酸はO−メチル−L−チロシンとL−3−(2−ナフチル)アラニンから構成される群から選択される。
【0036】
本発明は少なくとも1種のタンパク質が少なくとも1種の非天然アミノ酸を含むように少なくとも1種のタンパク質を翻訳系で生産する方法も提供する。本方法では、少なくとも1種のセレクターコドンを含む少なくとも1種の核酸を翻訳系に加え、前記核酸は前記少なくとも1種のタンパク質をコードする。翻訳系で機能し、少なくとも1種のセレクターコドンを認識する直交tRNA(O−tRNA)と、翻訳系内でO−tRNAを少なくとも1種の非天然アミノ酸で優先的にアミノアシル化する直交アミノアシルtRNAシンテターゼ(O−RS)も翻訳系に加える。少なくとも1種の非天然アミノ酸も翻訳系に加え、少なくとも1種の非天然アミノ酸を含む少なくとも1種のタンパク質を翻訳系で生産する。
【0037】
本方法では組成物の上記全構造特徴、例えば翻訳系の種類(例えば細胞、細胞抽出物等)、翻訳系で生産されるタンパク質の種類(例えばEPO相同体及び本明細書に記載する他のタンパク質)、特定突然変異体タンパク質、特定非天然アミノ酸等を具体化することができる。
【0038】
1側面では、生産される非天然アミノ酸を含むタンパク質を細胞依存的にプロセシング及び改変する。こうして、安定的にフォールディング、グリコシル化又は他の方法で改変されたタンパク質を細胞により生産することができる。
【0039】
非天然アミノ酸は場合により外部から翻訳系に加える。あるいは、例えば翻訳系が細胞である場合には、非天然アミノ酸を翻訳系により生合成することができる。
【0040】
1特定態様では、本発明は少なくとも1種のO−メチル−L−チロシンを含む少なくとも1種のタンパク質を大腸菌細胞で生産する方法を提供する。本方法はアンバーコドンを含み、前記少なくとも1種のタンパク質をコードする少なくとも1種の核酸を翻訳系に加える段階と、mtRNACUA Tyr (但し、mtRNACUA Tyr は細胞で機能し、mtRNACUA Tyr はアンバーコドンを認識する)を翻訳系に加える段階と、突然変異体TyrRS(LWJ16)(但し、突然変異体TyrRS(LWJ16)は細胞内でmtRNACUA Tyr をO−メチル−L−チロシンでアミノアシル化する)を翻訳系に加える段階と、O−メチル−L−チロシンを細胞に加え、O−メチル−L−チロシンを含む少なくとも1種のタンパク質を細胞内で生産する段階を含む。
【0041】
別の態様では、本発明は少なくとも1種のL−3−(2−ナフチル)アラニンを含む少なくとも1種のタンパク質を大腸菌細胞で生産する方法を提供する。本態様では、本方法はアンバーコドンを含み、前記少なくとも1種のタンパク質をコードする少なくとも1種の核酸を翻訳系に加える段階と、mtRNACUA Tyr (但し、mtRNACUA Tyr は細胞で機能し、mtRNACUA Tyr はアンバーコドンを認識する)を細胞に加える段階と、SS12−TyrRS(但し、SS12−TyrRSは細胞内でmtRNACUA Tyr をL−3−(2−ナフチル)アラニンでアミノアシル化する)を細胞に加える段階と、L−3−(2−ナフチル)アラニンを細胞に加え、L−3−(2−ナフチル)アラニンを含む少なくとも1種のタンパク質を細胞内で生産する段階を含む。
【0042】
別の側面では、本発明は例えばメタ置換フェニルアラニン類似体(例えば3−アセチルフェニルアラニン及び3−メトキシフェニルアラニン)、チロシン類似体(例えば4−アリルチロシン)、グリコシル化アミノ酸等の非天然アミノ酸を提供する。
【0043】
非天然アミノ酸を含む各種組成物(例えば本発明の非天然アミノ酸を含むタンパク質や細胞)も提供する。例えば、(例えば共有結合した)非天然アミノ酸と直交tRNAを含む組成物を提供する。(例えば水素結合した)非天然アミノ酸と直交アミノアシルtRNAシンテターゼを含む組成物も提供する。
【0044】
1側面では、本発明はアミノ酸の合成方法を提供する。例えば、4−アリル−L−チロシンを合成するには一般に例えば水素化ナトリウムとDMFの存在下に保護チロシンを臭化アリルと反応させ、脱保護して4−アリル−L−チロシンを得る。一般に、NBoc又はFmoc保護チロシンを使用し、例えば塩酸とジオキサンの存在下に例えば酸脱保護する。最終生成物を場合により例えばエタノール又はジクロロメタンで抽出する。
【0045】
メタ置換フェニルアラニン類似体を合成するには一般にアセトアミドマロン酸ジエチルとメタ置換臭化ベンジルを縮合させる。その後、縮合物を一般に加水分解してメタ置換フェニルアラニン類似体(例えばケト、アセチル又はメトキシ置換フェニルアラニン、例えば3−メトキシフェニルアラニン又は3−アセチルフェニルアラニン)を得る。所望メタ置換臭化ベンジルは、場合によりN−ブロモスクシンイミド(NBS)を3−メチルアセトフェノンと反応させて臭素化物を生成し、臭素化物をヘキサン溶液中で結晶化させることにより合成される。結晶化させると、一臭化物と二臭化物の混合物ではなく一臭化物の生成物が得られる。
【0046】
別の側面では、本発明は非天然アミノ酸の生合成方法を提供する。例えば、場合により例えばN−アセチルガラクトサミニダーゼ、トランスグリコシラーゼ又はセリングリコシルヒドロラーゼの遺伝子を含むプラスミドで細胞を形質転換させることによりグリコシル化アミノ酸をin vivo合成する。その後、細胞は例えば細胞資源から所望グリコシル化アミノ酸を生産する。別の例では、例えばコリスミン酸を4−アミノ−4−デオキシコリスミン酸に酵素変換し、4−アミノ−4−デオキシコリスミン酸を4−アミノ−4−デオキシプレフェン酸に酵素変換し、4−アミノ−4−デオキシプレフェン酸をp−アミノフェニルピルビン酸に酵素変換し、p−アミノフェニルピルビン酸をp−アミノフェニルアラニンに酵素変換することによりp−アミノフェニルアラニンをin vivo合成する。酵素変換は一般に夫々4−アミノ−4−デオキシコリスミン酸シンターゼ(例えばPapA)、コリスミン酸ムターゼ(例えばPapB)及びプレフェン酸デヒドロゲナーゼ(例えばPapC)を使用して実施する。最終段階は一般にp−アミノフェニルピルビン酸をアミノトランスフェラーゼ(例えば大腸菌由来非特異的チロシンアミノトランスフェラーゼ)と接触させることにより実施する。本発明で使用するアミノトランスフェラーゼとしてはtyrB、aspS又はilvEが挙げられるが、これらに限定されない。一般に上記段階は例えば合成に使用する酵素をコードする遺伝子を含むプラスミドで細胞を形質転換させることによりin vivoで実施する。
【0047】
別の側面では、本発明は大腸菌でp−アミノフェニルアラニンを生産する方法を提供する。本方法は一般にコリスミン酸とアミノトランスフェラーゼを含む細胞をpapA、papB及びpapCを含むプラスミドで形質転換する。papA、papB及びpapCの発現の結果としてシンターゼ、ムターゼ及びデヒドロゲナーゼが生産され、これらの酵素がアミノトランスフェラーゼと共にコリスミン酸からp−フェニルアラニンを生産する。
【0048】
別の側面では、本発明は自律21(以上)アミノ酸細胞を提供する。細胞(例えば細菌細胞)は一般に細胞内の1種以上の炭素源(例えばコリスミン酸)から非天然アミノ酸(例えばp−アミノフェニルアラニン)を生産するための生合成経路系と、直交tRNA(O−tRNA)と直交アミノアシルtRNAシンテターゼ(O−RS)を含む翻訳系を含む。O−RSはO−tRNAを非天然アミノ酸で優先的にアミノアシル化し、O−tRNAはセレクターコドン(例えばTAG等のナンセンスコドン、4塩基コドン又はアンバーコドン)に応答して非天然アミノ酸をタンパク質に組込む。細胞は1種以上(例えば1、2、3、4、5、6、7、8、9、10、11、12、13、14、15又は16種以上)の非天然アミノ酸を含むことができ、場合により1種以上の直交tRNA(例えば非天然アミノ酸をタンパク質に1個ずつ部位特異的に組込むには非天然アミノ酸1個につき1個、又は非天然アミノ酸組込みの特異性を調節するにはそれ以上もしくはそれ以下)及び/又は1種以上の直交アミノアシルtRNAシンテターゼ(O−RS)(例えば直交tRNA1個につき1個、又は非天然アミノ酸組込みの特異性を調節するにはそれ以上もしくはそれ以下)も含むことができる。
【0049】
所定態様では、生合成経路系は天然細胞量の非天然アミノ酸を生産し、例えば細胞はタンパク質生合成に十分な量でありながら、非天然アミノ酸の生産において天然アミノ酸の濃度を実質的に変えたり、細胞資源を実質的に枯渇させない量の非天然アミノ酸を生産する。
【0050】
1類の態様では、上記のようにコリスミン酸からp−アミノフェニルアラニンを生産するように自律細胞を遺伝子組換えする。本態様では、上記のような所望酵素(例えばStreptomyces venezuelae又はStreptomyces pristinaespiralisに由来するシンターゼ、デヒドロゲナーゼ及びムターゼと大腸菌に由来するアミノトランスフェラーゼ)を生産するように細胞を遺伝子組換えする。例えば、本発明の細胞は、場合によりpapA、papB及びpapCと更にlppプロモーターとlacプロモーターを含むプラスミド(例えば低コピーpSC101由来プラスミド)で形質転換する。所定態様では、プラスミドは更に1個以上のリボソーム結合部位を含む。
【0051】
本発明の細胞により場合により生産される他の非天然アミノ酸としては、dopa、O−メチル−L−チロシン、グリコシル化アミノ酸、ペグ化アミノ酸、本明細書に記載する他の非天然アミノ酸等が挙げられるが、これらに限定されない。
【0052】
別の関連側面では、本発明は少なくとも21種以上のアミノ酸を生産し、アミノ酸の1種以上を細胞内の1種以上のタンパク質に特異的に組込むための1種以上の系を含む細胞も提供し、組込まれるアミノ酸の少なくとも1種は非天然アミノ酸を含む。
【0053】
別の側面では、本発明は細胞の1種以上のタンパク質に組込まれた非天然アミノ酸により提供される効果を識別する方法を提供する。本方法は一般に例えば大腸菌ゲノムに由来するランダム変異プラスミドを各々含む細胞のライブラリーを提供する段階を含む。ランダム変異プラスミドの1個以上は一般に非天然アミノ酸をタンパク質に組込み能力を細胞に付与する。次に細胞ライブラリーをスクリーニングし、天然大腸菌細胞に比較して増殖が亢進した細胞を識別し、非天然アミノ酸により付与される効果を識別する。所定態様では、第2のスクリーニングを使用し、識別された任意効果が非天然アミノ酸に起因することを更に確認する。
【0054】
本発明の付加特徴はキットである。例えば、キットは1種以上の上記翻訳系(例えば細胞、21以上のアミノ酸の細胞等)と、1種以上の非天然アミノ酸と、例えば適当なパッケージング材料と、キットの成分を保持するための容器と、本発明の方法を実施するための説明書及び/又は他の成分を含むことができる。同様に、例えばキットの成分を保持するための容器と、本発明の方法を実施するための説明書及び/又は他の成分を含むキットの形態で翻訳系の生産物(例えば非天然アミノ酸を含むEPO類似体等のタンパク質)を提供することもできる。
【0055】
図面の簡単な説明
図1は、TyrRSの活性部位におけるアミノ酸残基の立体図(P.Brick,T.N.Bhat,D.M.Blow,J.Mol.Biol.208,83−98(1988)を改変)。B.stearothermophilus TyrRSに由来する残基も記入した。
【0056】
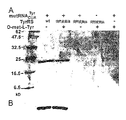
図2は、各種条件下における野生型(wt)及び突然変異体両者の大腸菌DHFRタンパク質の蓄積を示す。発現条件は各レーンの上部に示す。左側のレーンは分子量マーカーである。図2Aは精製DHFRの銀染色SDS−PAGEゲルである。図2Bは図2Aのゲルのウェスタンブロットである。
【0057】
図3は、DHFRのNH2末端ペプチドMIY* MIAALAVDRのタンデム質量スペクトル。O−メチル−L−チロシン残基(Y* )を含むペプチドの部分配列Y* MIAALAVDRは注釈付きb又はyイオン系列から読み取ることができる。
【0058】
図4は、各種条件下における野生型(wt)及び突然変異体両者のマウスDHFRタンパク質の蓄積を示す。発現条件は各レーンの上部に示す。左側のレーンは分子量マーカーである。図4Aは精製DHFRの銀染色SDS−PAGEゲルである。図4Bは図4Aのゲルのウェスタンブロットである。
【0059】
図5は、トリプシン消化ペプチドLLPEX* TGVLSEVQEEK(式中、X* はL−3−(2−ナフチル)アラニンを表す)のタンデム質量スペクトル。配列は注釈付きb又はyイオン系列から読み取ることができるが、b7とy13は観測されない。二重負荷y14に帰属する基準ピーク821.7(100%)は分かり易くするために短縮している。
【0060】
図6A〜Dは、増幅性蛍光レポーター系の特徴を示す。図6AはプラスミドpREPである。T7RNAポリメラーゼ転写はaraプロモーターにより制御され、タンパク質発現は遺伝子内の各種位置のアンバーコドンの抑圧に依存する。GFPuv発現はT7RNAポリメラーゼにより制御される。プラスミドpREPは直交シンテターゼ/tRNA対を発現するColE1プラスミドと使用するのに適合可能である。図6BはpREP(1〜12)内のT7RNAポリメラーゼ遺伝子構築物の組成と蛍光増加を示す。構築物番号を各構築物の左側に示す。蛍光増加は各構築物の右側に示し、pREP(1〜12)とpQ又はpQDを含む細胞の蛍光をフルオロメトリーにより測定し、細胞濃度補正比として計算した。遺伝子内のアンバー突然変異の位置を各構築物の上部に示す。図6CはpREP(10)とpQD(上段)又はpQ(下段)を含む細胞のサイトメトリー分析を示す。図6DはpREP(10)を含み、各種大腸菌サプレッサーtRNAを発現する細胞の蛍光分析を示す。「なし」は細胞がサプレッサーtRNAを含まないことを示す。
【0061】
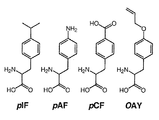
図7A〜Cは、M.jannaschii TyrRSの進化を誘導するための多目的レポータープラスミド系の成分を示す。図7AはプラスミドpREP/YC−JYCUAを示す。プラスミドpREP/YC−JYCUAはプラスミドpBK及び変異体と使用するのに適合可能である。図7BはM.jannaschii TyrRSの進化のターゲットとして使用した非天然アミノ酸の構造を示す。図7CはプラスミドpREP/YC−JYCUAを使用してアミノアシル−tRNAシンテターゼを進化させるためのストラテジーを示す。蛍光及び非蛍光細胞を夫々黒とグレーで示す。
【0062】
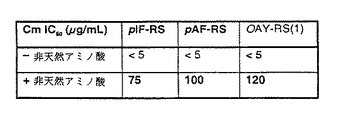
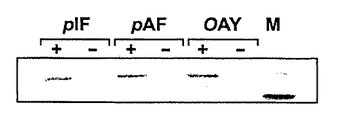
図8A〜Dは、成功した各進化実験からの優性シンテターゼ変異体の活性を示す。図8AはpREP/YC−JYCUAと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下(+)又は不在下(−)で増殖させ、長波長紫外線を照射した場合の写真である。図8BはpREP/YC−JYCUAと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下(左)又は不在下(右)で増殖させた場合の蛍光分析を示す。図8CはpREP/YC−JYCUAと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下又は不在下で増殖させた場合のCm IC50分析を示す表である。図8DはpBAD/JYAMB−4TAGと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下(+)又は不在下(−)で増殖させた場合のタンパク質発現分析を示す。
【0063】
図9は、ネガティブFACSスクリーニング[OAY−RS(1,3,5)]又はネガティブバルナーゼ選択[OAY−RS(B)]を使用して得られたOAS−RS変異体の活性比較を示す。pREP/YC−JYCUAと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下(立体棒、左)又は不在下(立体棒、右)で増殖させ、蛍光分析した。非天然アミノ酸の不在下に対して存在下で増殖させた細胞の蛍光の細胞濃度補正比として蛍光増加(背後棒)計算した。
【0064】
図10は、m−MeO−Pheとm−アセチル−Pheを組込んだDHFRの発現を示すウェスタンブロットのオートラジオグラフ。
【0065】
図11は、フルオレセインヒドラジドで標識したタンパク質の蛍光スペクトルを示す。
【0066】
図12は、非天然アミノ酸パラアジドフェニルアラニン及びパラベンゾイルフェニルアラニンを示す。
【0067】
図13は、アリル置換フェニルアラニンの合成の為の化学スキームを示す。
【0068】
図14は、メタ置換フェニルアラニンの合成のための化学スキームを示す。
【0069】
図15は、p−アミノフェニルアラニンの生合成を示す。Aはp−アミノフェニルアラニンの生合成に使用するプラスミドを示し、Bは例えばAのプラスミドを使用してコリスミン酸からp−アミノフェニルアラニンを生産するための生合成スキームを示す。
【0070】
図16は、各種非天然アミノ酸を示す。
【0071】
図17は、各種非天然アミノ酸を示す。
【0072】
図18は、各種非天然アミノ酸を示す。
【0073】
図19は、in vivo抑圧によりタンパク質に組込む付加的天然及び非天然アミノ酸を示す。
【0074】
図20は、dopaの生産のための生合成スキームを示す。
【0075】
図21は、21種のアミノ酸を特異的に組込むことができる結果として細胞に得られる進化的効果を測定するための方法を示す。
【0076】
図22は、非天然アミノ酸の部位特異的組込み方法を示す。
【0077】
図23は、各種グルタミン類似体の合成を示す。
【0078】
図24は、γ置換グルタミン類似体の合成を示す。
【0079】
図25は、環状グルタミン誘導体の合成を示す。
【0080】
図26は、各種チロシン類似体を示す。
【0081】
図27は、チロシン類似体の生産のための合成スキームを示す。
【0082】
図28は、グリコシル化アミノ酸を生産するための生合成スキームを示す。
【0083】
図29は、例えば細胞取込み試験で使用される各種非天然アミノ酸を示す。以上の任意又は全図面は実際に模式図である。
【発明を実施するための最良の形態】
【0084】
概要
本発明は直交tRNA/アミノアシルtRNAシンテターゼ(O−tRNA/O−RS)対を使用して遺伝的にコードされる付加アミノ酸を受容するように細胞のタンパク質生合成機構を補強するための組成物と方法を提供する。本明細書に記載する組成物と方法は非天然アミノ酸と共に使用し、例えば多様な側鎖の任意のものを使用して新規立体、化学又は構造特性をタンパク質に提供することができる。本発明は原核(例えば真正細菌、始原菌)細胞と真核(例えば酵母、哺乳動物、植物又は昆虫)細胞の両者に適用可能である。これらの組成物と方法はセレクターコドン(例えば終止コドン、4塩基コドン等)を介して非天然アミノ酸を部位特異的に組込むために有用である。本発明は本発明の組成物を使用して生産されるか又は本発明の方法により生産された非天然アミノ酸を含むタンパク質も提供する。非天然アミノ酸を直接生きた細胞でタンパク質に導入できるので、タンパク質及び細胞機能の研究の新規ツールを提供すると共に、例えば治療に有用な特性を増進したタンパク質を作製することが可能になる。
【0085】
定義
相同:タンパク質及び/又はタンパク質配列は共通の祖先タンパク質又はタンパク質配列から天然又は人工的に誘導される場合に「相同」である。同様に、核酸及び/又は核酸配列は共通の祖先核酸又は核酸配列から天然又は人工的に誘導される場合に相同である。例えば、入手可能な任意突然変異誘発法により任意天然核酸を改変し、1個以上のセレクターコドンを加えることができる。この突然変異誘発した核酸は発現されると、1種以上の非天然アミノ酸を含むポリペプチドをコードする。突然変異法は当然のことながら更に1個以上の標準コドンを変異させ、得られる突然変異体タンパク質の1個以上の標準アミノ酸も変異させることができる。相同性は一般に2種以上の核酸又はタンパク質(又はその配列)間の配列類似度から推定される。相同性の判定に有用な配列間類似度の厳密な百分率は該当核酸及びタンパク質により異なるが、通常は25%程度の低い配列類似度を使用して相同性を判定する。もっと高いレベルの配列類似度、例えば30%、40%、50%、60%、70%、80%、90%、95%又は99%以上を使用して相同性を判定することもできる。配列類似度百分率の決定方法(例えばデフォルトパラメーターを使用するBLASTP及びBLASTIN)は本明細書に記載し、一般に入手可能である。
【0086】
直交:本明細書において「直交」なる用語は所期系(例えば翻訳系、例えば細胞)により低効率で使用される分子(例えば直交tRNA(O−tRNA)及び/又は直交アミノアシルtRNAシンテターゼ(O−RS))を意味する。直交とは直交tRNA及び/又は直交RSが所期翻訳系で機能できないか又は機能効率が低く、例えば20%未満、10%未満、5%未満、又は例えば1%未満であることを意味する。例えば、直交tRNAが所期翻訳系で所期翻訳系の任意内在RSをアミノアシル化する効率は内在RSによる内在tRNAのアミノアシル化に比較して低下するか又はゼロである。別の例では、直交RSが所期翻訳系で任意内在tRNAをアミノアシル化する効率は内在RSによる内在tRNAのアミノアシル化に比較して低下するか又はゼロである。
【0087】
優先的にアミノアシル化する:「優先的にアミノアシル化する」なる用語はO−RSが非天然アミノ酸でO−tRNAをアミノアシル化する効率が天然tRNA又はO−tRNAを作製するために使用する出発材料に比較した場合に例えば約70%、約75%、約85%、約90%、約95%、又は約99%以上であることを意味する。その後、非天然アミノ酸は所与セレクターコドンで約75%以上、所与セレクターコドンで約80%以上、所与セレクターコドンで約90%以上、所与セレクターコドンで約95%以上、又は所与セレクターコドンで99%以上の高い忠実度で成長中のポリペプチド鎖に組込まれる。
【0088】
セレクターコドン:「セレクターコドン」なる用語は翻訳プロセスでO−tRNAにより認識されるが、内在tRNAには認識されないコドンを意味する。O−tRNAアンチコドンループはmRNA上のセレクターコドンを認識し、そのアミノ酸(例えば非天然アミノ酸)をポリペプチド内のこの部位に組込む。セレクターコドンとしては例えばナンセンスコドン、例えば終止コドン(例えばアンバー、オーカー及びオパールコドン)、4塩基以上のコドン、天然又は非天然塩基対から誘導されるコドン等を挙げることができる。所与系ではセレクターコドンは更に天然3塩基コドンの1種を含むことができ、内在系は前記天然3塩基コドンを使用せず、このような系としては例えば天然3塩基コドンを認識するtRNAを欠失する系や、天然3塩基コドンがレアコドンである系が挙げられる。
【0089】
サプレッサーtRNA:サプレッサーtRNAは所与翻訳系でメッセンジャーRNA(mRNA)の読取りを改変するtRNAである。サプレッサーtRNAは例えば終止コドン、4塩基コドン又はレアコドンを介して読み取ることができる。
【0090】
翻訳系:「翻訳系」なる用語は成長中のポリペプチド鎖(タンパク質)に天然アミノ酸を組込むために必要な成分を意味する。翻訳系の成分としては例えばリボソーム、tRNA、シンテターゼ、mRNA等を挙げることができる。本発明の成分はin vivoでもin vitroでも翻訳系に加えることができる。翻訳系は原核細胞(例えば大腸菌)でも真核細胞(例えば酵母、哺乳動物、植物又は昆虫)でもよい。
【0091】
非天然アミノ酸:本明細書において「非天然アミノ酸」なる用語は20種の天然アミノ酸の1種又はセレノシステイン以外の任意アミノ酸、改変アミノ酸及び/又はアミノ酸類似体を意味する。
【0092】
本項又は本明細書の以下の記載において特に定義しない限り、本明細書で使用する全技術及び科学用語は本発明が属する分野の当業者に一般に理解されている通りの意味をもつ。
【0093】
詳細な説明
タンパク質は光合成や視覚からシグナル伝達や免疫応答までのほぼ全生物プロセスの岐路に位置する。これらの複雑な機能は規定一次配列に配置された比較的単純な20個の構成単位から構成されるポリアミド系ポリマーから得られる。
【0094】
本発明は非天然アミノ酸をタンパク質に部位特異的に直接in vivo組込むのに使用する方法と組成物を含む。重要な点は、非天然アミノ酸を20種の共通アミノ酸の1種に置換するのでなく遺伝子レパートリーに加えるという点である。本発明は例えば(i)任意タンパク質の任意所望位置に1種以上の非天然アミノ酸を部位特異的又はランダムに挿入することができ、(ii)原核細胞と真核細胞のいずれにも適用可能であり、(iii)大量の精製突然変異体タンパク質の作製に加えて突然変異体タンパク質のin vivo試験が可能であり、(iv)多様な非天然アミノ酸の任意のものをタンパク質にin vivo組込むように応用できる。本発明は非天然アミノ酸のin vivo部位特異的組込みに有用な組成物と方法を提供する。具体的には、本発明は直交tRNA(O−tRNA)と直交アミノアシルtRNAシンテターゼ(O−RS)と非天然アミノ酸を含む翻訳系(例えば細胞)を提供し、O−RSはO−tRNAを非天然アミノ酸でアミノアシル化し、細胞は成長中のポリペプチド鎖に非天然アミノ酸を組込むために成分を使用する。
【0095】
本発明は更に本発明の翻訳系を使用して非天然アミノ酸を部位特異的にin vivo組込むための方法を提供する。本発明は本発明の方法により生産されたタンパク質も提供する。請求するタンパク質は非天然アミノ酸を含む。
【0096】
本発明の組成物と方法は、直交tRNA(O−tRNA)アミノアシルtRNAシンテターゼ(O−RS)対を使用する。O−tRNAがO−RSにより非天然アミノ酸で優先的にアミノアシル化される性質をもつ限り、多様な対を使用することができる。更に、直交対は所期翻訳系で機能し、例えば翻訳系は非天然アミノ酸でアミノアシル化されたO−tRNAを使用して非天然アミノ酸をポリペプチド鎖に組込む。組込みは部位特異的に行われ、例えばO−tRNAはタンパク質をコードするmRNAでセレクターコドン(例えば終止コドン)を認識する。
【0097】
1態様において、O−tRNAはMethanococcus jannaschii細胞に由来するTyr−tRNAから誘導される。1好適態様では、O−tRNAは本明細書でmtRNACUA Tyr と呼ぶものである。別の態様では、O−tRNAは配列番号1〜3を含む群から選択されるポリヌクレオチド配列又はその相補的ポリヌクレオチド配列を含む核酸を含む。
【0098】
本発明の所定態様において、O−RSはMethanococcus jannaschii細胞に由来するTyrRSから誘導される。1好適態様では、O−RSは本明細書で突然変異体TyrRS(LWJ16)又はSS12−TyrRSと呼ぶものである。別の態様では、O−RSは、配列番号35〜66から構成される群から選択されるアミノ酸配列を含むポリペプチドと、配列番号4〜34から構成される群から選択されるポリヌクレオチド配列又はその相補的ポリヌクレオチド配列を含む核酸によりコードされるポリペプチドから構成される群から選択されるポリペプチドを含む。
【0099】
1好適態様では、本発明はmtRNACUA Tyr と突然変異体TyrRS(LWJ16)を含む大腸菌細胞に関し、突然変異体TyrRS(LWJ16)は細胞内でmtRNACUA Tyr をO−メチル−L−チロシンで優先的にアミノアシル化し、細胞はmtRNACUA Tyr を使用してアンバーコドンを認識する。
【0100】
別の好適態様では、本発明はmtRNACUA Tyr とSS12−TyrRSを含む大腸菌細胞に関し、SS12−TyrRSは細胞内でmtRNACUA Tyr をL−3−(2−ナフチル)アラニンで優先的にアミノアシル化し、細胞はmtRNACUA Tyr を使用してアンバーコドンを認識する。
【0101】
具体的なO−tRNA及びO−RS分子の配列は実施例に記載する。
【0102】
直交tRNAと直交アミノアシルtRNAシンテターゼの対
直交対はO−tRNA(例えばサプレッサーtRNA、フレームシフトtRNA等)とO−RSから構成される。O−tRNAは上述のように内在シンテターゼによりアシル化されず、セレクターコドンをデコードすることができる。O−RSは例えば拡張アンチコドンループでO−tRNAを認識し、O−tRNAを非天然アミノ酸で優先的にアミノアシル化する。多重直交tRNA/シンテターゼ対の開発により、各種コドンを使用して多重非天然アミノ酸を同時に組込むことが可能になる。
【0103】
O−tRNAとO−RSは天然に存在するものでもよいし、起源と宿主名で記載されている各種生物に由来する天然tRNA及び/又はRSを突然変異させることにより誘導してもよい。各種態様において、O−tRNAとO−RSは少なくとも1種の生物に由来する。別の態様では、O−tRNAは第1の生物に由来する天然に存在するか又は天然に存在するものを突然変異させたtRNAから誘導し、O−RSは第2の生物に由来する天然に存在するか又は天然に存在するものを突然変異させたRSから誘導する。
【0104】
本発明の組成物と方法で使用するO−tRNA、O−RS及び対を得るための方法(誘導、突然変異、スクリーニング)は本願と同時に出願した米国特許出願番号第 号(発明の名称" Methods and Compositions for the production of orthogonal tRNA−tRNA synthetase pairs" )(代理人整理番号54−000130US,Schultzら)にも記載されており、その開示内容全体を本明細書に組込む。
【0105】
これらの方法は直交tRNA/RS対を作製するために試みられた他のストラテジーについて背景技術の項に記載した問題を解決する。具体的には、これらの方法は(a)第1の生物に由来する少なくとも1種のtRNAから誘導されるtRNAのライブラリーを作製する段階と、(b)第1の生物に由来するRSの不在下に第2の生物に由来するアミノアシル−tRNAシンテターゼ(RS)によりアミノアシル化されるtRNAのライブラリーをネガティブ選択することによりtRNAのプールを提供する段階と、(c)導入した直交RS(O−RS)によりアミノアシル化される個体をtRNAのプールから選択することにより少なくとも1種の組換えO−tRNAを提供する段階を含む。少なくとも1種の組換えO−tRNAはセレクターコドンを認識し、第2の生物に由来するRSにより効率的に認識されず、O−RSにより優先的にアミノアシル化される。本方法は更に、(d)第3の生物に由来する少なくとも1種のアミノアシル−tRNAシンテターゼ(RS)から誘導される突然変異体RSのライブラリーを作製する段階と、(e)非天然アミノ酸と天然アミノ酸の存在下に少なくとも1種の組換えO−tRNAを優先的にアミノアシル化するメンバーをRSのライブラリーから選択することにより活性RSのプールを提供する段階と、(f)非天然アミノ酸の不在下に少なくとも1種の組換えO−tRNAを優先的にアミノアシル化する活性RSのプールをネガティブ選択することにより少なくとも1種の特異的O−tRNA/O−RS対を提供する段階を含み、但し、少なくとも1種の特異的O−tRNA/O−RS対は非天然アミノ酸に特異的な少なくとも1種の組換えO−RSと少なくとも1種の組換えO−tRNAを含む。
【0106】
直交対を作製する第1のストラテジーは突然変異体ライブラリーを作製してこのライブラリーからO−tRNA又はO−RSをスクリーニング及び/又は選択する。
【0107】
直交tRNA/シンテターゼ対を作製する第2のストラテジーは異種tRNA/シンテターゼ対(例えば別の起源の生物からの対)を宿主細胞に導入する。異種シンテターゼ候補の性質としては、例えば宿主細胞tRNAに負荷しない等が挙げられ、異種tRNA候補の性質としては、例えば宿主細胞シンテターゼによりアシル化されない等が挙げられる。更に、異種tRNAから誘導される異種tRNAは全宿主細胞シンテターゼに直交性である。
【0108】
本明細書及び米国特許出願番号第 号(発明の名称" Methods and Compositions for the production of orthogonal tRNA−tRNA synthetase pairs" )(代理人整理番号54−000130US,Schultzら)に記載されている方法を使用し、上記所望対及び対の成分を進化させ、所望特性、例えばO−tRNAを非天然アミノ酸で優先的にアミノアシル化できるという特性をもつ直交tRNA/シンテターゼ対を作製する。
【0109】
本明細書では非天然アミノ酸をタンパク質に組込むためのストラテジーについて記載するが、同様にセレクターコドンに応答して天然アミノ酸を組込むストラテジーを開発し、突然変異誘発の付加基盤を提供できることも自明である。即ち、本明細書全般に記載する非天然アミノ酸の負荷と同様にセレクターコドンを認識する直交tRNAに天然アミノ酸を負荷するようにシンテターゼを改変することができる。
【0110】
直交アミノアシルtRNAシンテターゼ(O−RS)の生産
O−RSの生産方法は野生型シンテターゼの骨格から突然変異体シンテターゼのプールを作製した後、20種の共通アミノ酸に比較して非天然アミノ酸に対する特異性に基づいて突然変異RSを選択することを基本とする。このようなシンテターゼを単離するために、本発明の選択方法は(i)1回目の選択からの所望シンテターゼの活性を低くすることができ、集団を小さくできるので高感度であり、(ii)各回の選択で選択ストリンジェンシーを変えることが望ましいので「調節可能」であり、(iii)汎用性であるため、種々の非天然アミノ酸に使用できる。
【0111】
直交アミノアシルtRNAシンテターゼを作製する方法は例えばシンテターゼの活性部位、シンテターゼの編集メカニズム部位、シンテターゼの種々のドメインを組み合わせることにより種々の部位等でシンテターゼを突然変異させ、選択プロセスを適用する。ポジティブ選択後にネガティブ選択を行う併用に基づくストラテジーを使用する。ポジティブ選択では、ポジティブマーカーの非必須位置に導入したセレクターコドンを抑圧し、ポジティブ選択圧下に細胞を生存させる。従って、天然及び非天然アミノ酸両者の存在下で生存細胞は直交サプレッサーtRNAに天然又は非天然アミノ酸を負荷する活性シンテターゼをコードする。ネガティブ選択では、ネガティブマーカーの非必須位置に導入したセレクターコドンを抑圧し、天然アミノ酸特異性をもつシンテターゼを除去する。ネガティブ選択とポジティブ選択の生存細胞は直交サプレッサーtRNAを非天然アミノ酸のみでアミノアシル化(負荷)するシンテターゼをコードする。その後、これらのシンテターゼを例えばDNAシャフリング又は他の再帰的突然変異誘発法により更に突然変異誘発することができる。
【0112】
突然変異体RSのライブラリーは、当分野で公知の種々の突然変異誘発技術を使用して作製することができる。例えば、突然変異体RSは部位特異的突然変異、ランダム点突然変異、相同組換え、キメラ構築等により作製することができる。
【0113】
ポジティブ選択段階は例えば少なくとも1種のセレクターコドン(例えばアンバーコドン)を含むポジティブ選択マーカー(例えば抗生物質耐性遺伝子等)と突然変異体RSのライブラリーを複数の細胞に導入し、選択物質の存在下に複数の細胞を増殖させ、ポジティブ選択マーカー中で少なくとも1種のセレクターコドンを抑圧することにより選択物質の存在下に生存する細胞を選択し、活性突然変異体RSのプールを含むポジティブ選択細胞のサブセットを提供することができる。場合により、選択物質濃度を変動してもよい。
【0114】
ネガティブ選択段階は例えば少なくとも1種のセレクターコドンを含む抗生物質耐性遺伝子(例えばクロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子)であるネガティブ選択マーカーをポジティブ選択からの活性突然変異体RSのプールと共に第2の生物の複数の細胞に導入し、非天然アミノ酸と選択物質を加えた第1の培地で生存するが、非天然アミノ酸と選択物質を加えない第2の培地では生存することができない細胞を選択し、少なくとも1種の組換えO−RSをもつ生存細胞を提供することができる。場合により、選択物質濃度を変動してもよい。
【0115】
ポジティブ選択はセレクターコドン(例えばアンバー終止コドン)を含むポジティブ選択マーカー(例えばクロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子)の抑圧に基づいて行うことができるので、クロラムフェニコールをポジティブ選択圧として適用することができる。更に、非天然アミノ酸の存在下と不在下で本明細書に記載するようなポジティブマーカーとネガティブマーカーのいずれにもCAT遺伝子を使用することができる。場合により、セレクターコドンを含むCAT遺伝子をポジティブ選択に使用し、少なくとも1種以上のセレクターコドンを含むネガティブ選択マーカー(例えばバルナーゼ遺伝子等の毒性マーカー)をネガティブ選択に使用する。
【0116】
ポジティブ選択は細胞をアンピシリン耐性にするβ−ラクタマーゼ遺伝子の非必須位置におけるセレクターコドンを抑圧に基づいて行うこともでき、ネガティブマーカーとしてリボヌクレアーゼバルナーゼを使用するネガティブ選択を使用する。ペリプラズムに分泌されるβ−ラクタマーゼに対して、CATは細胞質に局在し、更にアンピシリンは殺菌性であるが、クロラムフェニコールは静菌性である。
【0117】
組換えO−RSを更に突然変異させ、選択することができる。1態様では、少なくとも1種の組換え直交アミノアシル−tRNAシンテターゼ(O−RS)の生産方法は更に(d)少なくとも1種の組換えO−RSを単離する段階と、(e)少なくとも1種の組換えO−RSから誘導される第2組の突然変異O−RSを作製する段階と、(f)O−tRNAを優先的にアミノアシル化することができる突然変異O−RSが得られるまで段階(b)及び(c)を反復する段階を含むことができる。場合により、段階(d)〜(f)を例えば少なくとも約2回反復する。1側面では、第2組の突然変異O−RSは突然変異誘発(例えばランダム突然変異誘発、部位特異的突然変異誘発、組換え又はその組合せ)により作製することができる。
【0118】
直交tRNA(O−tRNA)の生産
組換え直交tRNA(O−tRNA)の生産方法は米国特許出願番号第 号(発明の名称" Methods and Compositions for the production of orthogonal tRNA−tRNA synthetase pairs" )(代理人整理番号54−000130US,Schultzら)に記載されている。
【0119】
組換えO−tRNAの生産方法は(a)第1の生物に由来する少なくとも1種のtRNA(例えばサプレッサーtRNA)から誘導される突然変異体tRNAのライブラリーを作製する段階と、(b)第1の生物に由来するRSの不在下に第2の生物に由来するアミノアシル−tRNAシンテターゼ(RS)によりアミノアシル化される突然変異体tRNAのライブラリーをネガティブ選択することにより突然変異体tRNAのプールを提供する段階と、(c)導入した直交RS(O−RS)によりアミノアシル化されるメンバーを突然変異体tRNAのプールから選択することにより少なくとも1種の組換えO−tRNAを提供する段階を含み、但し、少なくとも1種の組換えO−tRNAはセレクターコドンを認識し、第2の生物に由来するRSにより効率的に認識されず、O−RSにより優先的にアミノアシル化される。1態様では、組換えO−tRNAは直交性が改善されている。
【0120】
例えば、所望RSに対するその親和性を維持しながらtRNAの直交性を改善するために、本方法は夫々コグネイトシンテターゼの不在下と存在下の突然変異体サプレッサーtRNAによるネガティブ選択とポジティブ選択を組合せる。ネガティブ選択ではセレクターコドンをマーカー遺伝子(例えばバルナーゼ遺伝子等の毒性遺伝子)の非必須位置に導入する。例えばMethanococcus jannaschiiに由来する突然変異tRNAライブラリーのメンバーが内在宿主(例えば大腸菌)シンテターゼによりアミノアシル化される(即ち宿主、例えば大腸菌シンテターゼに非直交性である)場合には、セレクターコドン(例えばアンバーコドン)が抑圧され、生産された毒性遺伝子産物は細胞死に至る。直交tRNA又は非機能的tRNAをもつ細胞は生存する。その後、生存細胞をポジティブ選択し、セレクターコドン(例えばアンバーコドン)をポジティブマーカー遺伝子(例えばβ−ラクタマーゼ遺伝子等の薬剤耐性遺伝子)に挿入する。これらの細胞はコグネイトRSをもつ発現ベクターも含む。これらの細胞を選択物質(例えばアンピシリン)の存在下に増殖させる。その後、同時発現したコグネイトシンテターゼによりアミノアシル化され、このセレクターコドンに応答してアミノ酸を挿入することができるtRNAを選択する。非機能的tRNA又は所期シンテターゼにより認識することができないtRNAを含む細胞は抗生物質に感受性である。従って、(i)内在宿主(例えば大腸菌)シンテターゼの基質でなく、(ii)所期シンテターゼによりアミノアシル化することができ、(iii)翻訳に機能的なtRNAはどちらの選択でも生存する。
【0121】
突然変異tRNAのライブラリーを構築する。tRNAの所望ループ(例えばアンチコドンループ(Dアーム、Vループ、TΨCアーム)又はループ組合せ又は全ループ)の特定位置(例えば非保存位置、保存位置)、ランダム位置又は両者の組合せに突然変異を導入することができる。tRNAのキメラライブラリーも本発明に含まれる。場合により各種生物(例えば真正細菌又は始原菌等の微生物)に由来するtRNAシンテターゼのライブラリー(例えば天然ダイバーシティを含むライブラリー)(例えばShortらの米国特許第6,238,884号、Schallenbergerらの米国特許第5,756,316号、Petersenらの米国特許第5,783,431号、Thompsonらの米国特許第5,824,485号、Shortらの米国特許第5,958,672号参照)を構築して直交対をスクリーニングしてもよい。
【0122】
例えば、アミノアシル−tRNAシンテターゼによりアミノアシル化される突然変異体tRNAのライブラリーをネガティブ選択するには、少なくとも1種以上のセレクターコドンを含む毒性マーカー遺伝子と突然変異体tRNAのライブラリーを第2の生物に由来する複数の細胞に導入し、少なくとも1種の直交tRNA又は非機能的tRNAを含む突然変異体tRNAのプールを含む生存細胞を選択することができる。例えば、毒性マーカー遺伝子はリボヌクレアーゼバルナーゼ遺伝子であり、リボヌクレアーゼバルナーゼ遺伝子は少なくとも1個のアンバーコドンを含む。場合により、リボヌクレアーゼバルナーゼ遺伝子に2個以上のアンバーコドンを加えてもよい。生存細胞は例えば比較比細胞密度アッセイを使用することにより選択することができる。
【0123】
別の例では、導入した直交RS(O−RS)によりアミノアシル化されるメンバーを突然変異体tRNAのプールから選択するには、例えばセレクターコドンの少なくとも1種を含む薬剤耐性遺伝子(例えばβ−ラクタマーゼ遺伝子)を含むポジティブ選択マーカー遺伝子(例えば少なくとも1種のアンバー終止コドンを含むβ−ラクタマーゼ遺伝子)とO−RSと突然変異体tRNAのプールを第2の生物に由来する複数の細胞に導入し、選択物質(例えば抗生物質)の存在下に増殖した生存細胞を選択することにより、O−RSによりアミノアシル化され、少なくとも1種のセレクターコドンに応答してポジティブマーカー遺伝子によりコードされる翻訳産物にアミノ酸を挿入する少なくとも1種の組換えtRNAをもつ細胞プールを提供することができる。別の態様では、選択物質濃度を変動させる。本方法により生産された組換えO−tRNAも本発明に含まれる。
【0124】
上記方法における選択段階(例えばポジティブ選択段階、ネガティブ選択段階又はポジティブ選択段階とネガティブ選択段階の両者)のストリンジェンシーは場合により選択ストリンジェンシーの変動を含む。例えば、バルナーゼは極毒性タンパク質であるので、バルナーゼ遺伝子に導入するセレクターコドンの数を変えることによりネガティブセレクターのストリンジェンシーを制御することができる。本発明の1側面では、初期回に所望活性を低くできるのでストリンジェンシーを変動できる。即ち、初期回には低ストリンジェンシー選択基準を適用し、後期回の選択ではよりストリンジェントな基準を適用する。
【0125】
本発明では例えばO−RS、O−tRNA及びO−tRNA/O−RS対を作製するために他の型の選択も使用できる。例えば、ポジティブ選択段階、ネガティブ選択段階又はポジティブ選択段階とネガティブ選択段階の両者はレポーターを使用することができ、レポーターは蛍光活性化細胞ソーティング(FACS)により検出される。例えば、ポジティブ選択マーカー(例えばセレクターコドン(例えばアンバー終止コドン)を含むクロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子)を使用してまずポジティブ選択を行った後にネガティブ選択スクリーニングを行い、ネガティブマーカー(例えばT7 RNAポリメラーゼ遺伝子)内の位置でセレクターコドン(例えば2個以上)を抑圧できないものを選択することができる。1態様では、ポジティブ選択マーカーとネガティブ選択マーカーを同一ベクター(例えばプラスミド)に配置することができる。ネガティブマーカーの発現はレポーター(例えばグリーン蛍光タンパク質(GFP))の発現を誘導する。選択とスクリーニングのストリンジェンシーは変動させることができ、例えばレポーターを蛍光させるために必要な光強度を変動させることができる。別の態様では、FACによりスクリーニングされるポジティブ選択マーカーとしてレポーターを使用してポジティブ選択を行った後にネガティブ選択スクリーニングを行い、ネガティブマーカー(例えばバルナーゼ遺伝子)内の位置でセレクターコドン(例えば2個以上)を抑圧できないものを選択することができる。
【0126】
場合により、レポーターを細胞表面、ファージディスプレイ等に提示する。細胞表面提示(例えばOmpA細胞表面提示系)は大腸菌細胞表面における特定エピトープ(例えば例えば外膜ポリンOmpAに融合したポリオウイルスCペプチド)の発現に依存する。エピトープは翻訳中にタンパク質メッセージ中のセレクターコドンが抑圧されるときにしか細胞表面に提示されない。従って、提示されるペプチドはライブラリー内の突然変異体アミノアシル−tRNAシンテターゼの1種により認識されるアミノ酸を含み、特定非天然アミノ酸を含むペプチドに対する抗体で対応するシンテターゼ遺伝子を含む細胞を分離することができる。OmpA細胞表面提示系はファージディスプレイの代用としてGeorgiouらにより開発され、改良された。Francisco,J.A.,Campbell,R.,Iverson,B.L.& Georgoiu,G.Production and fluorescence−activated cell sorting of Escherichia coli expressing a functional antibody fragment on the external surface.Proc Natl Acad Sci U S A.90:10444−8(1993)参照。
【0127】
選択段階はin vitroで実施することもできる。その後、選択した成分(例えばシンテターゼ及び/又はtRNA)を非天然アミノ酸のin vivo組込みに使用する細胞に導入することができる。
【0128】
資源及び宿主生物
直交tRNA−RS対は例えば少なくとも第1の資源生物又は同一でも異なっていてもよい少なくとも2種の資源生物に由来し、各種宿主生物(例えば第2の生物)で使用することができる。本発明の方法の第1の生物と第2の生物は同一でも異なっていてもよい。1態様では第1の生物は例えばMethanococcus jannaschii、Methanobacterium thermoautotrophicum、Halobacterium、Escherichia coli、A.fulgidus、Halobacterium、P.furiosus、P.horikoshii、A.pernix、T.thermophilus等の原核生物である。あるいは、第1の生物は例えば植物(例えば単子葉植物又は双子葉植物等の複雑な植物)、藻類、原生動物、真菌類(例えば酵母等)、動物(例えば哺乳動物、昆虫、節足動物等)等の真核生物でもよい。別の態様では、第2の生物はMethanococcus jannaschii、Methanobacterium thermoautotrophicum、Halobacterium、Escherichia coli、A.fulgidus、Halobacterium、P.furiosus、P.horikoshii、A.pernix、T.thermophilus等の原核生物である。あるいは、第2の生物は例えば植物、真菌類、動物等の真核生物でもよい。
【0129】
上述のように、対の各成分は同一生物に由来するものでも異なる生物に由来するものでもよい。例えば、tRNAは例えば始原菌(例えばMethanococcus jannaschii及びHalobacterium NURC−1)又は真正細菌(例えば大腸菌)等の原核生物に由来し、シンテターゼは同一又は異なる原核生物(例えばMethanococcus jannaschii、Archaeroglobus fulgidus、Methanobacterium thermoautotrophicum、P.furiosus、P.horikoshii、A.pernix、T.thermophilus、Halobacterium、Escherichia coli等)に由来するものとすることができる。例えば植物(例えば単子葉植物又は双子葉植物等の複雑な植物)、藻類、原生動物、真菌類(例えば酵母等)、動物(例えば哺乳動物、昆虫、節足動物等)等の真核源も使用できる。
【0130】
セレクターコドン
本発明のセレクターコドンは、タンパク質生合成機構の遺伝コドン枠を拡張する。例えば、セレクターコドンとしては例えばユニーク3塩基コドン、ナンセンスコドン、(例えばアンバーコドン又はオパールコドン等の終止コドン)、非天然コドン、少なくとも4塩基のコドン等が挙げられる。例えば1個以上、2個以上、3個以上等の多数のセレクターコドンを所望遺伝子に導入することができる。
【0131】
64種の遺伝コドンは20種のアミノ酸と3種の終止コドンをコードする。翻訳終結には1個の終止コドンしか必要ないので、他の2個は主に非タンパク生産アミノ酸をコードするために使用することができる。アンバー終止コドンであるUAGはin vitro生合成系とアフリカツメガエル卵母細胞で使用して非天然アミノ酸の組込みに成功している。3種の終止コドンのうちでUAGは大腸菌での使用頻度が最も低い終止コドンである。大腸菌株にはUAGを認識して天然アミノ酸を挿入する天然サプレッサーtRNAを含むものもある。更に、これらのアンバーサプレッサーtRNAは慣用タンパク質突然変異誘発でも使用されている。
【0132】
1態様では、本方法は非天然アミノ酸のin vivo組込みに終止コドンであるセレクターコドンを使用する。例えば、終止コドン(例えばUAG)を認識するO−tRNAを作製し、O−RSにより所望非天然アミノ酸でアミノアシル化する。このO−tRNAは天然アミノアシル−tRNAシンテターゼにより認識されない。慣用部位特異的突然変異誘発を使用して終止コドン(例えばTAG)をタンパク質遺伝子内の所期部位に導入することができる。例えばSayers,J.R.,Schmidt,W.Eckstein,F.5' ,3' Exonuclease in phosphorothioate−based oligonucleotide−directed mutagenesis.Nucleic Acids Res,791−802(1988)参照。O−RS、O−tRNA及び突然変異体遺伝子をin vivo融合すると、UAGコドンに応答して非天然アミノ酸が組込まれ、特定位置に非天然アミノ酸を含むタンパク質が得られる。
【0133】
非天然アミノ酸のin vivo組込みは宿主(例えば大腸菌)にさほど影響を与えずに行うことができる。例えば、UAGコドンの抑圧効率はO−tRNA(例えばアンバーサプレッサーtRNA)と(UAGコドンに結合してリボソームから増殖ペプチドの放出を開始する)放出因子1(RF1)の競合に依存するので、抑圧効率は、例えばO−tRNA(例えばサプレッサーtRNA)の発現レベルを高めるか又はRF1欠損株を使用することにより調節することができる。
【0134】
非天然アミノ酸はレアコドンでコードすることもできる。例えば、in vitroタンパク質合成反応でアルギニン濃度を下げると、レアアルギニンコドンAGGはアラニンでアシル化された合成tRNAによるAlaの挿入に有効であることが分かっている。例えばC.H.Ma,W.Kudlicki,O.W.Odom,G.Kramer and B.Hardesty,Biochemistry,32:7939(1993)参照。この場合には、合成tRNAは大腸菌に少量種として存在する天然tRNAArgと競合する。生物によっては全三重項コドンを使用しないものもある。Micrococcus luteusで割り当てられないコドンAGAがin vitro転写/翻訳抽出物へのアミノ酸の挿入に使用されている。例えばA.K.KowalとJ.S.Oliver,Nucl.Acid.Res.,25:4685(1997)参照。本発明の成分はこれらのレアコドンをin vivo使用するために作製することができる。
【0135】
セレクターコドンは更に4塩基以上のコドン(例えば4、5、6、又は7塩基以上のコドン)も含む。4塩基コドンの例としては例えばAGGA、CUAG、UAGA、CCCU等が挙げられる。5塩基コドンの例としては例えばAGGAC、CCCCU、CCCUC、CUAGA、CUACU、UAGGC等が挙げられる。例えば、突然変異O−tRNA(例えば特殊フレームシフトサプレッサーtRNA)とアンチコドンループ(例えば少なくとも8〜10ntアンチコドンループ)の存在下では、4塩基以上のコドンは単一アミノ酸として読取られる。他の態様では、アンチコドンループは例えば少なくとも4塩基コドン、少なくとも5塩基コドン、又は少なくとも6塩基コドン又はそれ以上をデコードすることができる。4塩基コドンは256種が考えられるので、4塩基以上のコドンを使用すると同一細胞で多重非天然アミノ酸をコードすることができる。J.Christopher Andersonら,Exploring the Limits of Codon and Anticodon Size,Chemistry and Biology,Vol.9,237−244(2002);Thomas J.Magliery,Expanding the Genetic Code:Selection of Efficient Suppressors of Four−base Codons and Identification of " Shifty" Four−base Codons with a Library Approach in Escherichia coli,J.Mol.Biol.307:755−769(2001)参照。
【0136】
本発明の方法はフレームシフト抑圧に基づく拡張コドンを使用する。4塩基以上のコドンは例えば1個又は多数の非天然アミノ酸を同一タンパク質に挿入することができる。例えば、in vitro生合成法を使用して非天然アミノ酸をタンパク質に組込むために4塩基コドンが使用されている。例えばC.H.Ma,W.Kudlicki,O.W.Odom,G.Kramer and B.Hardesty,Biochemistry,1993,32,7939(1993);及びT.Hohsaka,D.Kajihara,Y.Ashizuka,H.Murakami and M.Sisido,J.Am.Chem.Soc.,121:34(1999)参照。2個の化学的にアシル化したフレームシフトサプレッサーtRNAを使用して2−ナフチルアラニンとリジンのNBD誘導体を同時にストレプトアビジンにin vitro組込むためにCGGGとAGGUが使用されている。例えばT.Hohsaka,Y.Ashizuka,H.Sasaki,H.Murakami and M.Sisido,J.Am.Chem.Soc.,121:12194(1999)参照。in vivo研究では、MooreらがNCUAアンチコドンをもつtRNALeu誘導体がUAGNコドンを抑圧できるかどうかを試験し(NはU、A、G又はCであり得る)、四重項UAGAはUCUAアンチコドンをもつtRNALeuにより13から26%の効率でデコードすることができるが、0又は−1フレームでは殆どデコードできないことを見出した。B.Moore,B.C.Persson,C.C.Nelson,R.F.Gesteland and J.F.Atkins,J.Mol.Biol.,298:195(2000)参照。1態様では、本発明ではレアコドン又はナンセンスコドンに基づく拡張コドンを使用し、他の望ましくない部位でのミスセンス読み飛ばしとフレームシフト抑圧を減らすことができる。
【0137】
翻訳バイパス系を使用して非天然アミノ酸を所望ポリペプチドに組込むこともできる。1翻訳バイパス系では、大きい配列を遺伝子に挿入するが、タンパク質に翻訳しない。この配列はリボソームに配列を飛び越させて挿入の下流の翻訳を再開するための合図として機能する構造を含む。
【0138】
非天然アミノ酸をポリペプチドに組込むための他の上記方法の代用又は併用してトランス翻訳系を使用することができる。この系は大腸菌に存在するtmRNAと呼ぶ分子を利用する。このRNA分子はアラニルtRNAに構造的に近縁であり、アラニルシンテターゼによりアミノアシル化される。tmRNAとtRNAの相違はアンチコドンループが特殊な大きい配列で置換されていることである。この配列は鋳型としてtmRNA内でコードされるオープンリーディングフレームを使用して停止した配列でリボソームに翻訳を再開させることができる。本発明では、直交シンテターゼで優先的にアミノアシル化して非天然アミノ酸を負荷することができる直交tmRNAを作製することができる。この系を使用する遺伝子を転写することにより、リボソームは特定部位で停止し、非天然アミノ酸はこの部位に導入され、その後、直交tmRNA内にコードされた配列を使用して翻訳が再開する。
【0139】
セレクターコドンは場合により非天然塩基対を含む。これらの非天然塩基対は更に既存遺伝アルファベットを拡張する。塩基対が1個増えると、三重項コドンの数は64から125に増す。3番目の塩基対の性質としては安定的且つ選択的な塩基対合、高い忠実度で効率的なポリメラーゼによるDNAへの酵素組込み、及び新生非天然塩基対の合成後の効率的な連続プライマー伸長が挙げられる。方法と組成物に応用可能な非天然塩基対については、例えばHiraoら,An unnatural base pair for incorporating amino acid analogues into protein,Nature Biotechnology,20:177−182(2002)に記載されている。他の関連文献は以下に挙げる。
【0140】
in vivo使用では、非天然ヌクレオシドは膜浸透性であり、リン酸化して対応する三リン酸塩を形成する。更に、増加した遺伝情報は安定しており、細胞酵素により破壊されない。Bennerらによる従来の研究ではカノニカルワトソンクリック対とは異なる水素結合パターンを利用しており、そのうちで最も注目に価する例はイソC:イソG対である。例えばC.Switzer,S.E.Moroney and S.A.Benner,J.Am.chem.Soc.,111:8322(1989);J.A.Piccirilli,T,Krauch,S.E.Moroney and S.A.Benner,Nature,1990,343:33(1990);及びE.T.Kool,Curr.Opin.Chem.Biol.,4:602(2000)参照。これらの塩基は一般に天然塩基とある程度ミスペアであり、酵素により複製することができない。Koolらは水素結合の代わりに塩基間の疎水性充填相互作用により塩基対の形成を誘導できることを示した。E.T.Kool,Curr.Opin.Chem.Biol.,4:602(2000);及びK.M.GuckianとE.T.Kool,Angew.Chem.Int.Ed.Engl.,36,2825(1998)参照。上記全要件を満足する非天然塩基対を開発する試みとして、Schultz,Romerbergらは一連の非天然疎水性塩基を体系的に合成し、試験している。PICS:PICS自己対が天然塩基対よりも安定であることが判明し、大腸菌DNAポリメラーゼIのKlenowフラグメント(KF)によりDNAに効率的に組込むことができる。例えばD.L.McMinn,A.K.Ogawa,Y.Q.Wu,J.Q.Liu,P.G.Schultz and F.E.Romersberg,J.Am.Chem.Soc.,121:11586(1999);及びA.K.Ogawa,Y.Q.Wu,K.L.McMinn,J.Q.Liu,P.G.Schultz and F.E.Romersberg,J.Am.Chem.Soc.,122:3274(2000)参照。生物機能に十分な効率と選択性でKFにより3MN:3MN自己対を合成することができる。例えばA.K.Ogawa,Y.Q.Wu,M.Berger,P.G.Schultz and F.E.Romersberg,J.Am.Chem.Soc.,122:8803(2000)参照。しかし、どちらの塩基も後期複製用チェーンターミネーターとして作用するに止まっている。PICS自己対を複製するために使用できる突然変異体DNAポリメラーゼが最近開発された。更に、7AI自己対も複製できる。例えばE.J.L.Tae,Y.Q.Wu,G.Xia,P.G.Schultz and F.E.Romersberg,J.Am.Chem.Soc.,123:7439(2001)参照。Cu(II)と結合すると安定な対を形成する新規メタロ塩基対Dipic:Pyも開発されている。E.Meggers,P.L.Holland,W.B.Tolman,F.E.Romersberg and P.G.Schultz,J.Am.Chem.Soc.,122:10714(2000)。拡張コドンと非天然コドンは天然コドンに本質的に直交性であるので、本発明の方法はその直交tRNAを作製するためにこの性質を利用することができる。
【0141】
非天然アミノ酸
本明細書において非天然アミノ酸とはセレノシステインと20種の遺伝的にコードされるαアミノ酸(即ちアラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン、グルタミン酸、グリシン、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、スレオニン、トリプトフアン、チロシン、バリン)以外の任意アミノ酸、改変アミノ酸又はアミノ酸類似体を意味する。αアミノ酸の一般構造は式I:
【0142】
【化1】
により表される。
【0143】
非天然アミノ酸は一般に式Iをもつ任意構造であり、式中、R基は20種の天然アミノ酸で使用されている以外の任意置換基である。20種の天然アミノ酸の構造については、例えばL.Stryer著Biochemistry,第3版,1988,Freeman and Company,New Yorkを参照されたい。本発明の非天然アミノ酸は上記20種のαアミノ酸以外の天然化合物でもよいことに留意されたい。
【0144】
本発明の非天然アミノ酸は一般に側鎖のみが天然アミノ酸と異なるので、本発明の非天然アミノ酸は天然タンパク質で形成されると同様に他のアミノ酸(例えば天然又は非天然アミノ酸)とアミド結合を形成する。他方、非天然アミノ酸は天然アミノ酸と異なる側鎖基をもつ。例えば、式I中のRは場合によりアルキル、アリール、アシル、ケト、アジド、ヒドロキシル、ヒドラジン、シアノ、ハロ、ヒドラジド、アルケニル、アルキニル、エーテル、チオール、セレノ、スルホニル、硼酸、ボロン酸、ホスホ、ホスホノ、ホスフィン、複素環、エノン、イミン、アルデヒド、エステル、チオ酸、ヒドロキシルアミン、アミノ基等又はその任意組合せを含む。他の該当非天然アミノ酸としては、光架橋基を含むアミノ酸、スピンラベル付きアミノ酸、蛍光アミノ酸、金属結合性アミノ酸、金属含有アミノ酸、放射性アミノ酸、新規官能基をもつアミノ酸、他の分子と共有又は非共有的に相互作用するアミノ酸、フォトケージド及び/又は光異性化可能なアミノ酸、ビオチン又はビオチン類似体含有アミノ酸、グリコシル化アミノ酸(例えば糖鎖置換セリン)、他の糖鎖修飾アミノ酸、ケト含有アミノ酸、ポリエチレングリコール又はポリエーテルを含むアミノ酸、重原子置換アミノ酸、化学分解性又は光分解性アミノ酸、天然アミノ酸に比較して延長側鎖(例えばポリエーテル又は例えば炭素長が約5もしくは約10を越える長鎖炭化水素)をもつアミノ酸、炭素結合糖含有アミノ酸、レドックス活性アミノ酸、アミノチオ酸含有アミノ酸、及び1個以上の毒性部分を含むアミノ酸が挙げられるが、これらに限定されない。
【0145】
新規側鎖を含む非天然アミノ酸に加え、非天然アミノ酸は場合により例えば式II及びIII:
【0146】
【化2】
【0147】
【化3】
【0148】
の構造により表されるような修飾主鎖構造を含み、式中、Zは一般にOH、NH2 、SH、NH−R' 又はS−R' を含み、XとYは同一でも異なっていてもよく、一般にS又はOであり、RとR' は場合により同一又は異なり、一般に式Iをもつ非天然アミノ酸について上記に記載したR基と同一の基及び水素から選択される。例えば、本発明の非天然アミノ酸は場合により式II及びIIにより表されるようにアミノ又はカルボキシル基に置換を含む。この種の非天然アミノ酸としては、例えば20種の共通天然アミノ酸に対応する側鎖又は非天然側鎖をもつα−ヒドロキシ酸、α−チオ酸、α−アミノチオカルボキシレートが挙げられるが、これらに限定されない。更に、α−炭素の置換は場合によりL、D又はα,α−ジ置換アミノ酸(例えばD−グルタミン酸、D−アラニン、D−メチル−O−チロシン、アミノ酪酸等)を含む。他の構造としては環状アミノ酸(例えばプロリン類似体や、3、4、6、7、8及び9員環プロリン類似体)、β及びγアミノ酸(例えば置換β−アラニン及びγ−アミノ酪酸)が挙げられる。
【0149】
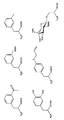
例えば、多数の非天然アミノ酸は天然アミノ酸(例えばチロシン、グルタミン、フェニルアラニン等)に由来する。チロシン類似体としてはパラ置換チロシン、オルト置換チロシン、及びメタ置換チロシンが挙げられ、置換チロシンはアセチル基、ベンゾイル基、アミノ基、ヒドラジン、ヒドロキシルアミン、チオール基、カルボキシ基、イソプロピル基、メチル基、C6 −C20直鎖又は分枝鎖炭化水素、飽和又は不飽和炭化水素、O−メチル基、ポリエーテル基、ニトロ基等を含む。更に、多重置換アリール環も考えられる。本発明のグルタミン類似体としてはα−ヒドロキシ誘導体、γ置換誘導体、環状誘導体及びアミド置換グルタミン誘導体が挙げられるが、これらに限定されない。フェニルアラニン類似体の例としてはヒドロキシ基、メトキシ基、メチル基、アリル基、アセチル基等を置換基に含むメタ置換フェニルアラニンか挙げられるが、これらに限定されない。非天然アミノ酸の特定例としてはO−メチル−L−チロシン、L−3−(2−ナフチル)アラニン、3−メチルフェニルアラニン、O−4−アリル−L−チロシン、4−プロピル−L−チロシン、トリ−O−アセチル−GlcNAcβ−セリン、L−Dopa、フッ素化フェニルアラニン、イソプロピル−L−フェニルアラニン、p−アジド−L−フェニルアラニン、p−アシル−L−フェニルアラニン、p−ベンゾイル−L−フェニルアラニン、L−ホスホセリン、ホスホノセリン、ホスホノチロシン、p−ヨードフェニルアラニン、p−ブロモフェニルアラニン、p−アミノ−L−フェニルアラニン、及びイソプロピル−L−フェニルアラニン等が挙げられるが、これらに限定されない。各種非天然アミノ酸の構造を図(例えば図17、18、19、26及び29)に示す。
【0150】
一般に、本発明の非天然アミノ酸は20種の天然アミノ酸では得られない付加特性を提供するように選択又は設計される。例えば、非天然アミノ酸は場合により(例えばこれらのアミノ酸を組込む)タンパク質の生物学的性質を改変するように設計又は選択される。例えば、非天然アミノ酸をタンパク質に組込むことにより、場合により毒性、生体分布、溶解度、安定性(例えば熱、加水分解、酸化、酵素耐性、分解等)、精製と処理し易さ、構造的性質、分光学的性質、化学及び/又は光化学的性質、触媒活性、酸化還元電位、半減期、他の分子との(例えば共有又は非共有)反応性等の性質を改変する。
【0151】
非天然アミノ酸の化学的合成
上記非天然アミノ酸の多くは例えばSigma(米国)やAldrich(Milwaukee,WI,米国)から市販されている。市販されていないものは場合により下記実施例の記載や当業者に公知の標準方法を使用して合成する。有機合成技術については例えばFessendonとFessendon著Organic Chemistry(1982,第2版,Willard Grant Press,Boston Mass.);March著Advanced Organic Chemistry(第3版,1985,Wiley and Sons,New York);及びCareyとSundberg著Advanced Organic Chemistry(第3版,Parts A and B,1990,Plenum Press,New York)を参照されたい。
【0152】
例えば、メタ置換フェニルアラニンは図14に要約するような手順で合成される。一般に、NBS(N−ブロモスクシンイミド)をメタ置換メチルベンゼン化合物に加えてメタ置換臭化ベンジルを得た後にマロン酸化合物と反応させてメタ置換フェニルアラニンを得る。メタ位に使用される典型的置換基としては、ケトン、メトキシ基、アルキル、アセチル等が挙げられるが、これらに限定されない。例えば、3−アセチルフェニルアラニンはNBSを3−メチルアセトフェノンの溶液と反応させることにより製造される。詳細については下記実施例を参照されたい。同様の合成を使用して3−メトキシフェニルアラニンを製造する。その場合の臭化ベンジルのメタ位のR基は−OCH3 である。例えば、Matsoukasら,J.Med.Chem.,1995,38,4600−4669参照。
【0153】
所定態様では、シンテターゼの活性部位に関する公知情報により非天然アミノ酸の設計を変更し、例えば直交tRNAシンテターゼを使用して直交tRNAをアミノアシル化する。例えば、アミド窒素を置換した誘導体(1)、γ位のメチル基(2)、及び
【数1】
環状誘導体(3)の3種のグルタミン類似体が提供される。主要結合部位残基が酵母GlnRSに相同である大腸菌GlnRSのX線結晶構造に基づき、グルタミン側鎖から10Å以内の残基の一連の側鎖突然変異を相補するように類似体を設計し、例えば活性部位Phe233から小疎水性アミノ酸への突然変異はGlnの
【数2】
位の立体嵩増加により相補することができる。
【0154】
例えば、N−ナフタロイル−L−グルタミン酸1,5−無水物(図23の化合物番号4)を場合により使用してアミド窒素に置換基をもつグルタミン類似体を合成する。例えばKing,F.E.& Kidd,D.A.A.A New Synthesis of Glutamine and of γ−Dipeptides of Glutamic Acid from Phthylated Intermediates.J.Chem.Soc.,3315−3319(1949);Friedman,O.M.& Chatterrji,R.Synthesis of Derivatives of Glutamine as Model Substrates for Anti−Tumor Agents.J.Am.Chem.Soc.81,3750−3752(1959);Craig,J.C.ら,Absolute Configuration of the Enatiomers of 7−Chloro−4−[[4−(diethylamino)−1−methylbutyl]amino]quinoline(Chloroquine).J.Org.Chem.53,1167−1170(1988);及びAzoulay,M.,Vilmont,M.& Frappier,F.Glutamine analogues as Potential Antimalarials,.Eur.J.Med.Chem.26,201−5(1991)参照。前記無水物は一般にグルタミン酸から製造し、まずアミンをフタルイミドとして保護した後に酢酸中で還流させる。次に無水物を多数のアミンで開環し、アミドに各種置換基を加える。フタロイル基をヒドラジンで脱保護すると、図23に示すような遊離アミノ酸が得られる。
【0155】
γ位の置換は一般にグルタミン酸のアルキル化により実施される。例えばKoskinen,A.M.P.& Rapoport,H.Synthesis of 4−Substituted Prolines as Conformationally Constrained Amino Acid Analogues.J.Org.Chem.54,1859−1866(1989)参照。例えば図24の化合物番号5に示すような保護アミノ酸は場合によりまずアミノ部分を9−ブロモ−9−フェニルフルオレン(PhflBr)でアルキル化(例えばChristie,B.D.& Rapoport,H.Synthesis of Optically Pure Pipecolates from L−Asparagine.Application to the total Synthesis of (+)−Apovincamine through Amino Acid Decarbonylation and Iminium Ion Cyclization.J.Org.Chem.1989,1859−1866(1986)参照)した後、O−tert−ブチル−N,N' −ジイソプロピルイソ尿素を使用して酸部分をエステル化することにより製造される。KN(Si(CH3)3)2 を加えてメチルエステルのα位を部位選択的に脱プロトン化してエノラートを形成した後、場合により各種ヨウ化アルキルでアルキル化する。t−ブチルエステルとPhfl基を加水分解すると、所望γ−メチルグルタミン類似体(図24の化合物番号2)が得られた。
【0156】
図25に化合物番号3で示すような
【数3】
環状類似体は場合により従来記載されているようにBoc−Asp−Ot−Buから4段階で製造される。例えばBarton,D.H.R.,Herve,Y.,Potier,P.& Thierry,J.Synthesis of Novel a−Amino−Acids and Derivatives Using Radical Chemistry:Synthesis of L− and D−a−Amino−Adipic Acids,L−a−aminopimelic Acid and Appropriate Unsaturated Derivatives.Tetradedron Lett.43,4297−4308(1987)及びSubasinghe,N.,Schulte,M.,Roon,R.J.,Koerner,J.F.& Johnson,R.L.Quisqualic acid analogues:synthesis of beta−heterocyclic 2−aminopropanoic acid derivatives and their activity at a novel quisqualate−sensitized site.J.Med.Chem.35 4602−7(1992)参照。N−t−Boc−ピロリジノン、ピロリジノン、又はオキサゾリドンのアニオンの生成後に図25に示すような化合物7を加えるとマイケル付加物が得られる。次にTFAで脱保護すると遊離アミノ酸が得られる。
【0157】
上記非天然アミノ酸以外に、チロシン類似体ライブラリーも設計した。活性部位がM.jannashiiシンテターゼの活性部位と相同度が高いB.stearothermophilus TyrRSの結晶構造に基づき、チロシンの芳香族側鎖から10Å以内の残基を突然変異させた(Y32,G34,L65,Q155,D158,A167,Y32及びD158)。これらの活性部位アミノ酸の一連の置換を相補するように図26に示すようなチロシン類似体ライブラリーを設計した。これらは種々の疎水性及び水素結合性を付与する各種フェニル置換パターンを含む。チロシン類似体は場合により図27により示す一般ストラテジーを使用して製造される。例えば、場合によりナトリウムエトキシドを使用してアセトアミドマロン酸ジエチルのエノラートを生成する。その後、適当な臭化ベンジルを加えた後に加水分解することにより所望チロシン類似体を製造することができる。
【0158】
非天然アミノ酸の細胞取込み
非天然アミノ酸取込みは例えばタンパク質に組込むために非天然アミノ酸を設計及び選択する場合に一般に検討される問題の1つである。例えば、αアミノ酸は電荷密度が高いのでこれらの化合物が細胞浸透性である可能性は低いと思われる。天然アミノ酸は各種程度のアミノ酸特異性を示す一連のタンパク質輸送系を介して細菌に取込まれる。従って、本発明は非天然アミノ酸が細胞に取込まれるのであるならば、どの非天然アミノ酸が取込まれるかを調べる迅速なスクリーニングを提供する。
【0159】
例えば、場合により各種アミノ酸を最少培地で細胞毒性についてスクリーニングする。毒性は一般に(1)倍加時間の有意変化がない無毒性、(2)倍加時間の増加が約10%未満である低毒性、(3)倍加時間の増加が約10%〜約50%である中毒性、(4)倍加時間の増加が約50%〜約100%である高毒性、及び(5)倍加時間の増加が約100%を上回る極毒性の5分類に分類される。例えばLiu,D.R.& Schultz,P.G.Progress toward the evolution of an organism with an expanded genetic code.Proceedings of the National Academy of Sciences of the United States of America 96,4780−4785(1999)参照。高毒性又は極毒性に分類されるアミノ酸の毒性は一般にIC50値を得るためにその濃度の関数として測定される。一般に、天然アミノ酸の近縁類似体であるか又は反応性官能性を示すアミノ酸が最高毒性を示す。この傾向はこれらの非天然アミノ酸の毒性メカニズムが天然アミノ酸をもつ必須酵素のタンパク質組込み又は阻害である可能性を示唆している。
【0160】
毒性アミノ酸の可能な取込み経路を同定するためには、場合により例えば過剰の構造的に類似する天然アミノ酸を加えた培地でIC50レベルで毒性アッセイを繰返す。毒性アミノ酸では過剰の天然アミノ酸の存在は毒素存在下の細胞の増殖能を救済するが、これは天然アミノ酸が細胞取込み又は必須酵素との結合のために毒素と有効に競合解消するためであると予想される。これらの場合には、場合により毒性アミノ酸を可能な取込み経路に割り当て、細胞生存にその相補が必要な「致死対立遺伝子」と呼ぶ。これらの致死対立遺伝子は細胞が非毒性非天然アミノ酸を取込む能力をアッセイするのに極めて有用である。毒性対立遺伝子の相補は細胞増殖の回復により判断され、恐らく致死対立遺伝子に割り当てられると同一の取込み経路により非毒性アミノ酸が細胞に取込まれることを示唆している。相補の欠如については結論が出ていない。例えば、試験と結論については下記実施例を参照されたい。
【0161】
(例えば下記実施例に記載するような)得られた結果は、致死非天然アミノ酸対立遺伝子の相補がアミノ酸取込みを定量的に試験するために効率的な方法であることを立証している。この方法は一般に多数の化合物を放射性標識するよりも手間がかからないので所期非天然アミノ酸の分析方法としてより有利な方法である。この一般ストラテジーは場合により核酸塩基類似体、糖鎖類似体又はペプチド類似体等の広範な分子の細胞取込みを迅速に評価するために使用される。例えば、このストラテジーは場合により本明細書に記載する非天然アミノ酸の細胞取込みを評価するために使用される。
【0162】
本発明は、非天然アミノ酸を送達するための一般方法として全アミノ酸取込み経路に独立した方法も提供する。この一般方法は細胞膜を通してジペプチドとトリペプチドを輸送するペプチドパーミアーゼによる取込みに依存する。ペプチドパーミアーゼはあまり側鎖特異的ではなく、その基質に対するKD値はアミノ酸パーミアーゼのKDアミノ酸と同等であり、例えば約0.1mM〜約10mMである。例えばNickitenko,A.,Trakhanov,S.& Quiocho,S.A structure of DppA,a periplasmic dipeptide transport/chemosensory receptor.Biochemistry 34,16585−16595(1995)及びDunten,P.,Mowbray,S.L.Crystal structure of the dipeptide binding protein from Escherichia coli involved in active transport and chemotaxis.Protein Science 4,2327−34(1995)参照。その後、非天然アミノ酸はリジン等の天然アミノ酸のコンジュゲートとして取込まれ、内在大腸菌ペプチダーゼの1種によるジペプチドの加水分解後に細胞質に放出される。このアプローチを試験するために、本発明者らは数種のUnn−Lys及びLys−Unnジペプチドを固相合成により合成し、これらのジペプチドの存在下と不在下にリジン最少培地でリジン生合成欠損大腸菌株の増殖を試験した。これらの細胞に利用可能な唯一のリジン源は非天然アミノ酸を含むジペプチドである。ホスホノセリン、ホスホノチロシン、ペンタフルオロフェニルアラニン及びケージドセリンの取込みをこのように分析した。4例のいずれでも10mM以上のジペプチド濃度で増殖が観察された。取込みは本明細書に記載する方法で容易に分析されるが、細胞取込み経路に利用可能な非天然アミノ酸を設計する別法は、アミノ酸をin vivo生産する生合成経路の提供である。
【0163】
非天然アミノ酸の生合成
細胞にはアミノ酸と他の化合物を生産するために多数の生合成経路が元々存在している。特定非天然アミノ酸の生合成法は自然界(例えば大腸菌中)では存在しないかもしれないが、本発明はこのような方法を提供する。例えば、非天然アミノ酸の生合成経路は場合により新規酵素を付加するか又は既存大腸菌経路を改変することにより大腸菌で作製される。付加新規酵素は場合により天然酵素でも人工的に作製した酵素でもよい。例えば、(下記実施例に記載するような)p−アミノフェニルアラニンの生合成は他の生物からの公知酵素の組合せの付加に依存している。これらの酵素の遺伝子はこの遺伝子を含むプラスミドで細胞(例えば大腸菌細胞)を形質転換することにより細胞に導入することができる。遺伝子は細胞で発現されると、所望化合物を合成するための酵素経路を提供する。場合により付加される酵素種の例は下記実施例に記載する。付加酵素配列は例えばGenbankに登録されている。場合により人工的に作製した酵素も同様に細胞に付加する。このように、非天然アミノ酸を生産するように細胞機構と細胞資源を操作する。
【0164】
生合成経路で使用する新規酵素の生産方法又は既存経路を進化させる方法は種々のものが入手可能である。例えば、場合により例えばMaxygen,Inc.(maxygen.comの世界ウェブサイト)により開発されたような再帰的組換えを使用して新規酵素及び経路を開発する。例えば、Stemmer 1994," Rapid evolution of a protein in vitro by DNA shuffling," Nature Vol.370 No.4:Pg.389−391;及びStemmer,1994," DNA Shuffling by random fragmentation and reassembly:In vitro recombination for molecular evolution," Proc.Natl.Acad.Sci.USA.Vol.91:Pg.10747−10751参照。同様に、場合によりGenencor(genencor.comの世界ウェブサイト)により開発されたDesignPath(登録商標)を代謝経路組換えに使用し、例えば大腸菌でO−メチル−L−チロシンを生産するように経路を組換える。この技術は例えば機能ゲノミクスと分子進化及び設計により同定した新規遺伝子の組合せを使用して宿主生物で既存経路を再構成する。Diversa Corporation(diversa.comの世界ウェブサイト)も例えば新規経路を作製するために遺伝子ライブラリーと遺伝子経路を迅速にスクリーニングするための技術を提供している。
【0165】
一般に、本発明の生合成方法(例えばコリスミン酸からp−アミノフェニルアラニン(pAF)を生産するための経路)は細胞で生産される他のアミノ酸濃度に影響を与えない。例えば、コリスミン酸からpAFを生産するために使用される経路は細胞内でpAFを生産するが、コリスミン細胞から一般に生産される他の芳香族アミノ酸の濃度は実質的に変わらない。一般に本発明の組換え生合成経路で生産される非天然アミノ酸は効率的タンパク質生合成に十分な濃度(例えば天然細胞量)で生産されるが、他のアミノ酸の濃度を変化させたり細胞資源を枯渇させる程にはならない。こうしてin vivo生産される典型濃度は約10mM〜約0.05mMである。特定経路に所望される酵素を生産するために使用される遺伝子を含むプラスミドで細菌を形質転換し、21番目のアミノ酸(例えばpAF、dopa、O−メチル−L−チロシン等)を作製したら、場合によりin vivo選択を使用してリボソームタンパク質合成と細胞増殖の両者に合うように非天然アミノ酸の生産を更に最適化させる。
【0166】
非天然アミノ酸を組込んだタンパク質を含む組成物
本発明は少なくとも1種の非天然アミノ酸を組込んだタンパク質を含む組成物を提供する。本発明は本発明の組成物と方法を使用して生産した少なくとも1種の非天然アミノ酸を組込んだタンパク質を含む組成物も提供する。1態様では、タンパク質を細胞依存的にプロセシング及び改変(例えばリン酸化、グルコシル化、折り畳み、膜結合等)する。
【0167】
1側面では、組成物は場合により少なくとも約10μg、例えば少なくとも約50μg、少なくとも約100μg、少なくとも約500μg、少なくとも約1mg、又は少なくとも約10mg以上、例えばin vivoタンパク質生産法で達成可能な量のタンパク質を含む(組換えタンパク質の生産と精製の詳細については本明細書に記載する)。例えば、タンパク質は場合により(例えば約1nl〜約100Lの任意容量の)例えば細胞溶解液、医薬緩衝液又は他の液体懸濁液中に少なくとも10μg/L、少なくとも約50μg/L、少なくとも約100μg/L、少なくとも約500μg/L、少なくとも約1mg/L、又は少なくとも約10mg/L以上の濃度で組成物に存在する。少なくとも1種の非天然アミノ酸を含むタンパク質を大量(例えば他の方法、例えばin vitro翻訳で一般に可能な量よりも多い量)に生産することが本発明の1つの特徴であり、従来技術にまさる効果である。
【0168】
少なくとも1種の非天然アミノ酸を含むタンパク質を大量(例えば他の方法、例えばin vitro翻訳で一般に可能な量よりも多い量)に生産することは本発明の1つの特徴であり、従来技術にまさる効果である。例えば、重金属を含むタンパク質を大量に合成できるので、例えばX線結晶解析によるタンパク質構造の決定が容易になる。
【0169】
非天然アミノ酸の組込みは例えば寸法、酸性度、求核性、水素結合、疎水性、プロテアーゼ標的部位接近性等を改変するように例えばタンパク質構造及び/又は機能をカスタマイズするために実施することができる。非天然アミノ酸を含むタンパク質は触媒性又は物性を強化するか又は全く新規にすることができる。例えば、非天然アミノ酸をタンパク質に組込むことにより、場合により毒性、生体分布、構造的性質、分光学的性質、化学及び/又は光化学的性質、触媒能、半減期(例えば血清半減期)、他の分子との(例えば共有又は非共有)反応性等の性質を改変する。少なくとも1種の非天然アミノ酸を組込んだタンパク質を含む組成物は例えば新規治療、診断、触媒酵素、結合タンパク質(例えば抗体)、及び例えばタンパク質構造と機能の研究に有用である。
【0170】
本発明の1側面では、組成物は少なくとも1種、例えば少なくとも2種、少なくとも3種、少なくとも4種、少なくとも5種、少なくとも6種、少なくとも7種、少なくとも8種、少なくとも9種、少なくとも10種、又は11種以上の非天然アミノ酸を組込んだ少なくとも1種のタンパク質を含む。2種以上の非天然アミノ酸を組込んだ所与タンパク質では、非天然アミノ酸は同一でも異なっていてもよい(例えばタンパク質は2種以上の異なる型の非天然アミノ酸を組込んでもよいし、非天然アミノ酸をもつ2個以上の異なる部位を組込んでもよいし、その両方でもよい)。
【0171】
非天然アミノ酸を組込んだほぼ任意タンパク質(及び例えば1種以上のセレクターコドンを組込んだ対応する任意コーディング核酸)は本明細書に記載する組成物と方法を使用して生産することができる。数十万種の公知タンパク質を同定しようとするのではなく、例えば該当翻訳系に1種以上の適当なセレクターコドンを組込むように入手可能な任意突然変異法をカスタマイズすることにより、1種以上の非天然アミノ酸を組込むように公知タンパク質の任意のものを改変することができる。公知タンパク質の一般的な配列寄託機関としてはGenBank、EMBL、DDBJ及びNCBIが挙げられる。他の寄託機関もインターネットを検索することにより容易に確認できる。
【0172】
本明細書に記載する非天然アミノ酸をin vivo組込むための組成物と方法を使用して生産することができるタンパク質の1好適類としては治療用タンパク質が挙げられる。1種以上の非天然アミノ酸を組込むように改変可能な治療用及び他のタンパク質の例としては例えばα1アンチトリプシン、アンジオスタチン、抗血友病因子、抗体(抗体の詳細については後述する)、アポリポタンパク質、アポタンパク質、心房性ナトリウム利尿因子、心房性ナトリウム利尿ポリペプチド、心房性ペプチド、C−X−Cケモカイン(例えばT39765、NAP−2、ENA−78、Gro−a、Gro−b、Gro−c、IP−10、GCP−2、NAP−4、SDF−1、PF−4、MIG)、カルシトニン、CCケモカイン(例えば単球化学誘引タンパク質−1、単球化学誘引タンパク質−2、単球化学誘引タンパク質−3、単球炎症性タンパク質−1α、単球炎症性タンパク質−1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262)、CD40リガンド、Cキットリガンド、コラーゲン、コロニー刺激因子(CSF)、補体因子5a、補体阻害剤、補体受容体1、サイトカイン(例えば上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1)、表皮増殖因子(EGF)、エリスロポエチン(「EPO」、1種以上の非天然アミノ酸の組込みによる改変の好適ターゲット)、表皮剥離毒素A及びB、IX因子、VII因子、VIII因子、X因子、繊維芽細胞増殖因子(FGF)、フィブリノーゲン、フィブロネクチン、G−CSF、GM−CSF、グルコセレブロシダーゼ、ゴナドトロピン、増殖因子、ヘッジホッグタンパク質(例えばソニック、インディアン、デザート)、ヘモグロビン、肝細胞増殖因子(HGF)、ヒルジン、ヒト血清アルブミン、インスリン、インスリン様増殖因子(IGF)、インターフェロン(例えばIFN−α、IFN−β、IFN−γ)、インターロイキン(例えばIL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12等)、ケラチノサイト増殖因子(KGF)、ラクトフェリン、白血病阻害因子、ルシフェラーゼ、ニュールチュリン、好中球阻害因子(NIF)、オンコスタチンM、骨形成タンパク質、副甲状腺ホルモン、PD−ECSF、PDGF、ペプチドホルモン(例えばヒト増殖ホルモン)、プレイオトロピン、プロテインA、プロテインG、発熱外毒素A、B及びC、リラキシン、レニン、SCF、可溶性補体受容体I、可溶性I−CAM1、可溶性インターロイキン受容体(IL−1、2、3、4、5、6、7、8、9、10、11、12、13、14、15)、可溶性TNF受容体、ソマトメジン、ソマトスタチン、ソマトトロピン、ストレプトキナーゼ、スーパー抗原即ちブドウ球菌エンテロトキシン(SEA、SEB、SEC1、SEC2、SEC3、SED、SEE)、スーパーオキシドジスムターゼ、毒素性ショック症候群毒素(TSST−1)、チモシンα1、組織プラスミノーゲンアクチベーター、腫瘍壊死因子β(TNFβ)、腫瘍壊死因子受容体(TNFR)、腫瘍壊死因子α(TNFα)、血管内皮増殖因子(VEGEF)、ウロキナーゼ等が挙げられる。
【0173】
これらのタンパク質の多くは市販されており(例えばSigma BioSciences 2002カタログ及び価格表参照)、対応するタンパク質配列と遺伝子及び、一般に多くのその変異体は周知である(例えばGenebank参照)。例えば1種以上の所期治療特性に関してタンパク質を改変するように本発明に従って1種以上の非天然アミノ酸を挿入することにより前記タンパク質の任意のものを改変することができる。治療関連特性の例としては血清半減期、貯蔵半減期、安定性、免疫原性、治療活性、(例えば非天然アミノ酸へのレポーター基(例えばラベル又はラベル結合部位)の組込みによる)検出性、LD−50又は他の副作用の低減、胃を通して体内に導入できること(例えば経口利用性)等が挙げられる。
【0174】
本明細書に記載する非天然アミノ酸をin vivo組込むための組成物と方法を使用して生産することができるタンパク質の1類としては転写及び発現アクチベーターが挙げられる。転写及び発現アクチベーターの例としては細胞増殖、分化、制御等を調節する遺伝子とタンパク質が挙げられる。発現及び転写アクチベーターは原核生物、ウイルス及び真核生物(例えば真菌類、植物及び哺乳動物を含む動物)に存在し、広範な治療ターゲットとなる。自明の通り、発現及び転写アクチベーターは例えば受容体との結合、シグナル導入カスケードの刺激、転写因子の発現調節、プロモーターやエンハンサーとの結合、プロモーターやエンハンサーと結合するタンパク質との結合、DNA巻き戻し、プレmRNAスプライシング、RNAポリアデニル化及びRNA分解等の多数のメカニズムにより転写を調節する。
【0175】
本発明のタンパク質(例えば1種以上の非天然アミノ酸を組込んだタンパク質)の1好適類としては発現アクチベーター(例えばサイトカイン、炎症性分子、増殖因子、その受容体、及び腫瘍遺伝子産物、例えばインターロイキン(例えばIL−1、IL−2、IL−8等)、インターフェロン、FGF、IGF−I、IGF−II、FGF、PDGF、TNF、TGF−α、TGF−β、EGF、KGF、SCF/c−キット、CD40L/CD40、VLA−4/VCAM−1、ICAM−1/LFA−1及びヒアルリン/CD44)と、シグナル伝達分子及び対応する腫瘍遺伝子産物(例えばMos、Ras、Raf及びMet)と、転写アクチベーター及びサプレッサー(例えばp53、Tat、Fos、Myc、Jun、Myb、Rel、及びステロイドホルモン受容体(例えばエストロゲン、プロゲステロン、テストステロン、アルドステロン、LDL受容体リガンド及びコルチコステロン))が挙げられる。
【0176】
他の各種タンパク質も本発明の1種以上の非天然アミノ酸を組込むように改変することができる。例えば、本発明は1種以上のワクチンタンパク質における1種以上の天然アミノ酸を非天然アミノ酸で置換することができ、このようなタンパク質は例えば感染性真菌類(例えばAspergillus、Candida種)、細菌類、特に病原細菌モデルとして利用できる大腸菌や医学的に重要な細菌(例えばStaphylococci(例えばaureus)又はStreptococci(例えばpneumoniae))、原生動物(例えば胞子虫類(例えばPlasmodia)、根足虫類(例えばEntamoeba)及び鞭毛虫類(Trypanosoma、Leishmania、Trichomonas、Giardia等))、ウイルス(例えば(+)RNAウイルス(例えばポックスウイルス(例えばワクシニア)、ピコルナウイルス(例えばポリオ)、トガウイルス(例えば風疹)、フラビウイルス(例えばHCV)、及びコロナウイルス)、(−)RNAウイルス(例えばラブドウイルス(例えばVSV)、パラミクソウイルス(例えばRSV)、オルトミクソウイルス(例えばインフルエンザ)、ブンヤウイルス及びアレナウイルス)、dsDNAウイルス(例えばレオウイルス)、RNA→DNAウイルス(即ちレトロウイルス、例えばHIV及びHTLV)、及び所定のDNA→RNAウイルス(例えばB型肝炎))に由来する。
【0177】
本明細書に記載する方法に従って1種以上の非天然アミノ酸を組込むように各種酵素(例えば産業用酵素)を改変することもでき、このような酵素としてはアミダーゼ、アミノ酸ラセマーゼ、アシラーゼ、デハロゲナーゼ、ジオキシゲナーゼ、ジアリールプロパンペルオキシダーゼ、エピメラーゼ、エポキシドヒドロラーゼ、エステラーゼ、イソメラーゼ、キナーゼ、グルコースイソメラーゼ、グリコシダーゼ、グリコシルトランスフェラーゼ、ハロペルオキシダーゼ、モノオキシゲナーゼ(例えばp450類)、リパーゼ、リグニンペルオキシダーゼ、ニトリルヒドラターゼ、ニトリラーゼ、プロテアーゼ、ホスファターゼ、スブチリシン、トランスアミナーゼ及びヌクレアーゼが挙げられる。
【0178】
昆虫耐性タンパク質(例えばCryタンパク質)、澱粉及び脂質生産酵素、植物及び昆虫毒素、毒素耐性タンパク質、マイコトキシン解毒タンパク質、植物成長酵素(例えばリブロース1,5−ビスホスフェートカルボキシラーゼ/オキシゲナーゼ、「RUBISCO」)、リポキシゲナーゼ(LOX)及びホスホエノールピルベート(PEP)カルボキシラーゼ等の農業関連タンパク質も非天然アミノ酸改変に利用可能なターゲットである。
【0179】
少なくとも1種の非天然アミノ酸を組込んだタンパク質をコードする遺伝子は本明細書の「一般分子生物学技術」の項に記載する当業者に周知の方法を使用して突然変異誘発することができる。例えば、1種以上のセレクターコドンを組込むように所期タンパク質の核酸を突然変異誘発し、1種以上の非天然アミノ酸を挿入できるようにする。本発明は例えば少なくとも1種の非天然アミノ酸を組込んだ任意タンパク質のこのような任意変異体(例えば突然変異体、変形)を含む。
【0180】
同様に、本発明は対応する核酸、即ち1種以上の非天然アミノ酸をコードする1種以上のセレクターコドンを組込んだ任意核酸も含む。
【0181】
1態様において、本発明は本発明の組成物と方法により生産されたクロラムフェニコールアセチルトランスフェラーゼ(CAT)のAsp112TAG突然変異体を含む組成物を提供し、CATタンパク質は少なくとも1種の非天然アミノ酸(例えばO−メチル−L−チロシン、L−3−(2−ナフチル)アラニン、アミノ、イソプロピル又はアリル含有チロシン類似体等)を含み、タンパク質は組成物中に少なくとも約100μg/Lの濃度で存在する。別の態様では、本発明はマウスジヒドロ葉酸レダクターゼ(DHFR)のTyr163TAG突然変異体を含み、DHFRタンパク質は少なくとも1種の非天然アミノ酸(例えばO−メチル−L−チロシン、L−3−(2−ナフチル)アラニン、アミノ、イソプロピル又はアリル含有チロシン類似体等)を含み、タンパク質は組成物中に少なくとも約100μg/Lの濃度で存在する。
【0182】
非天然アミノ酸を含むタンパク質に対する抗体の製造
1側面では、本発明は非天然アミノ酸及び非天然アミノ酸を含むタンパク質に対する抗体を提供する。非天然アミノ酸及びこのような非天然アミノ酸を含むタンパク質に対する抗体は例えば本発明のタンパク質と非天然アミノ酸を精製するために、精製試薬として有用である。更に、抗体は例えば非天然アミノ酸又は非天然アミノ酸を含むタンパク質の(例えばin vivo又はin situ)存在又は位置を追跡するために、非天然アミノ酸又は非天然アミノ酸を含むタンパク質の存在を指示するための指示試薬として使用することができる。当然のことながら、非天然アミノ酸自体に1種以上の非天然アミノ酸を組込み、1種以上の非天然アミノ酸により付与される1種以上の特性をもつ抗体を提供することもできる。
【0183】
本発明の抗体は免疫グロブリン遺伝子又は免疫グロブリン遺伝子のフラグメントにより実質的又は部分的にコードされる1種以上のポリペプチドを含むタンパク質とすることができる。認識される免疫グロブリン遺伝子としてはκ、λ、α、γ、δ、ε及びμ定常領域遺伝子と、無数の免疫グロブリン可変領域遺伝子が挙げられる。L鎖はκ又はλに分類される。H鎖はγ、μ、α、δ又はεに分類され、夫々免疫グロブリンIgG、IgM、IgA、IgD及びIgE類と言う。典型的な免疫グロブリン(例えば抗体)構造単位は四量体からなる。各四量体は各々1個の「L」鎖(約25kD)と1個の「H」鎖(約50〜70kD)からなる同一の2対のポリペプチド鎖から構成される。各鎖のN末端は主に抗原認識に関与する約100〜110又はそれ以上のアミノ酸からなる可変領域を規定する。可変L鎖(VL)及び可変H鎖(VH )なる用語は夫々これらのL鎖とH鎖を意味する。
【0184】
抗体は無傷の免疫グロブリンとして存在するか又は各種ペプチドによる消化により生産された多数の明確に特性決定されたフラグメントとして存在する。従って、例えば、ペプシンはヒンジ部のジスルフィド結合下の抗体を消化し、それ自体ジスルフィド結合によりVH −CH 1に結合したL鎖であるFabの二量体F(ab')2 を生産する。F(ab')2 を温和な条件下に還元してヒンジ部のジスルフィド結合を切断すると、F(ab')2 二量体をFab' 単量体に変換することができる。Fab' 単量体は主にヒンジ部を構成するFabである(他の抗体フラグメントの更に詳細な説明についてはFundamental Immunology,W.E.Paul編,Raven Press,N.Y.(1999)参照)。各種抗体フラグメントが無傷の抗体の消化について定義されているが、当業者に自明の通り、化学的又は組換えDNA技術を使用することによりこのようなFab' フラグメント等をde novo合成してもよい。従って、本明細書において抗体なる用語は場合により全抗体の改変により生産されるか又は組換えDNA技術を使用してde novo合成される抗体フラグメントを含む。抗体は単鎖抗体を含み、可変H鎖と可変L鎖が(直接又はペプチドリンカーを介して)結合して連続ポリペプチドを形成している側鎖Fv(sFv又はscFv)抗体を含む。本発明の抗体は例えばポリクローナル、モノクローナル、キメラ、ヒト化、単鎖、Fabフラグメント、Fab発現ライブラリーにより生産されるフラグメント等とすることができる。
【0185】
一般に、本発明の抗体は各種分子生物学又は医薬プロセスで一般試薬及び治療試薬として有用である。ポリクローナル抗体とモノクローナル抗体の製造方法は入手可能であり、本発明の抗体の製造に適用することができる。多数の基礎教科書が標準抗体製造法を記載しており、例えばBorrebaeck(編)(1995)Antibody Engineering,第2版,Freeman and Company,NY(Borrebaeck);McCaffertyら(1996)Antibody Engineering.A practical Approach IRL,Oxford Press,Oxford,England(McCafferty);Paul(1995)Antibody Engineering Protocols Humana Press,Towata,NJ(Paul);Paul(編),(1999)Fundamental Immunology,第5版,Raven Press,N.Y.;Coligan(1991)Current Protocols in Immunology Wiley/Greene,NY;HarlowとLane(1989)Antibodies:A Laboratory Manual Cold Spring Harbor Press,NY;Stitesら(編)Basic and Clinical Immunology(第4版)Lange Medical Publications,Los Altos,CAとその引用文献;Goding(1986)Monoclonal Antibodies:Principles and Practice(第2版)Academic Press,New York;及びKohlerとMilstein(1975)Nature 256:495−497が挙げられる。
【0186】
例えば動物への抗原注射に依存しない組換えによる各種抗体製造技術が開発されており、本発明の関連で使用することができる。例えば、ファージ又は同様のベクターで組換え抗体のライブラリーを作製及び選択することが可能である。例えばWinterら(1994)" Making Antibodies by Phage Display Technology" Annu.Rev.Immunol.12:433−55とその引用文献参照。更にGriffithsとDuncan(1998)" Strategies for selection of antibodies by phage display" Curr Opin Biotechnol 9:102−8;Hoogenboomら(1998)" Antibody phage display technology and its applications" Immunotechnology 4:1−20;Gramら(1992)" in vivo selection and affinity maturation of antibodies from a native combinatorial immunoglobulin library" PNAS 89:3576−3580;Huseら(1989)Science 246:1275−1281;及びWardら(1989)Nature 341:544−546も参照されたい。
【0187】
1態様では、抗体ライブラリーは糸状バクテリオファージの表面にH鎖及びL鎖可変領域を組合せて提示するためにクローニングされる(例えばリンパ球集団から回収するか又はin vitro組立てた)V遺伝子のレパートリーを含むことができる。ファージは抗原との結合により選択する。ファージ感染細菌から可溶性抗体を発現させ、例えば突然変異誘発により抗体を改良することができる。例えばBalintとLarrick(1993)" Antibody Engineering by Parsimonious Mutagenesis" Gene 137:109−118;Stemmerら(1993)" Selection of an Active Single Chain Fv Antibody From a Protein Linker Library Prepared by Enzymatic Inverse PCR" Biotechniques 14(2):256−65;Crameriら(1996)" Construction and evolution of antibody−phage libraries by DNA shuffling" Nature Medicine 2:100−103;及びCrameriとStemmer(1995)" Combinatorial multiple cassette mutagenesis creates all the permutations of mutant and wildtype cassettes" BioTechniques 18:194−195参照。
【0188】
組換え抗体ファージ系のクローニング及び発現用キットも公知で市販されており、例えばAmersham−Pharmacia Biotechnology(Uppsala,スウェーデン)から「組換えファージ抗体系、マウスScFvモジュール」が販売されている。鎖シャフリングにより高親和性ヒト抗体を製造するためのバクテリオファージ抗体ライブラリーも作製されている(例えばMarksら(1992)" By−Passing Immunization:Building High Affinity Human Antibodies by Chain Shuffling" Biotechniques 10:779−782参照)。実際に、抗体は一般にPeptidoGenic(pkim@ccnet.com)、HTI Bio−products,inc.(www.htibio.com)、BMA Biomedicals Ltd(英国)、Bio−Synthesis,Inc.,Research Genetics(Huntsville,Alabama)等の各種製造業者からオーダーメードすることができる。
【0189】
所定態様では、例えば抗体を治療投与しようとする場合には、本発明の抗体を「ヒト化」することが有用である。ヒト化抗体を使用すると、(例えば患者がヒトである場合に)治療用抗体に対する望ましくない免疫応答が発生しにくくなる。上記抗体関連文献はヒト化ストラテジーを記載している。ヒト化抗体に加え、ヒト抗体も本発明の特徴である。ヒト抗体はヒト免疫グロブリン配列から構成されることを特徴とする。ヒト抗体は多様な方法を使用して製造することができる(例えばLarrickら,米国特許第5,001,065号参照)。トリオーマ法によりヒト抗体を製造するための一般アプローチはOstbergら(1983),Hybridoma 2:361−367、Ostberg,米国特許第4,634,664号、及びEngelmanら,米国特許第4,634,666号に記載されている。
【0190】
タンパク質の精製と検出に抗体を使用する方法は各種のものが公知であり、本明細書に記載するような非天然アミノ酸を含むタンパク質の検出と精製に適用することができる。一般に、抗体はELISA、ウェスタンブロッティング、免疫化学、アフィニティークロマトグラフィー法、SPR及び他の多数の方法の有用な試薬である。上記文献にはELISAアッセイ、ウェスタンブロッティング、表面プラズモン共鳴(SPR)等の実施方法が詳細に記載されている。
【0191】
本発明の1側面では、本発明の抗体はそれ自体非天然アミノ酸を含み、所期特性(例えば半減期、安定性、毒性等の改善)をもつ抗体を提供する。抗体は臨床試験で現在使用されている全化合物のほぼ50%を占めており(Wittrup,(1999)" Phage on display" Tibtech 17:423−424)、抗体は診断試薬として広く使用されている。従って、抗体を非天然アミノ酸で改変できるならば、これらの有用試薬を改変するための重要なツールとなる。
【0192】
例えば、MAbは診断分野に多数の用途がある。アッセイは単純なスポット試験から腫瘍イメージングに使用されているDuPont Merck Co.製品放射標識NR−LU−10MAb(Ruschら(1993)" NR−LU−10 monoclonal antibody scanning.A helpful new adjunct to computed tomographgy in evaluating non−small−cell lung cancer." J Thorac Cardiovasc Surg 106:200−4)等のより複雑な方法まで多岐にわたる。周知の通り、MAbはELISA、ウェスタンブロッティング、免疫化学、アフィニティークロマトグラフィー法等の中心試薬である。1種以上の非天然アミノ酸を組込むようにこのような任意診断用抗体を改変し、例えばターゲットに対するAbの特異性又はアビディティを改変したり、例えば検出可能なラベル(例えば分光、蛍光、発光等)を非天然アミノ酸に組込むことにより1種以上の検出可能な特性を改変することができる。
【0193】
有用な抗体試薬の1類は治療用Abである。例えば、抗体は抗体依存性細胞傷害性(ADCC)又は補体介在性溶解(CML)により破壊するために腫瘍細胞にターゲティングすることにより腫瘍増殖を阻止する腫瘍特異的MAbとすることができる(これらの一般型のAbを「魔法の弾丸」とも言う)。1例は非ホジキンリンパ腫の治療に使用される抗CD20MAbであるリツキサンである(Scott(1998)" Rituximab:a new therapeutic monoclonal antibody for non−Hodgkin' s lymphoma" Cancer Pract 6:195−7)。第2の例は腫瘍増殖の重要成分を妨害する抗体に関連する。ハーセプチンは転移性乳癌の治療に使用される抗HER−2モノクローナル抗体であり、この作用メカニズムをもつ抗体の1例である(Baselgaら(1998)" Recombinant humanized anti−HER2 antibody (Herceptin) enhances the antitumor activity of paclitaxel and doxorubicin against HER2/neu overexpressing human breast cancer xenografts Cancer Res(1999)59(8):2020に誤載],Cancer Res 58:2825−31)。
【0194】
第3の例は腫瘍又は他の所期部位に直接細胞毒性化合物(毒素、放射性核種等)を送達するための抗体に関連する。例えば、1例のMabは前立腺腫瘍細胞に放射線を直接送達する90Y結合抗体であるCYT−356である(Debら(1996)" Treatment of hormon−refractory prostate cancer with 90Y−CTY−356 monoclonal antibody" Clin Cancer Res 2:1289−97)。第4の例は抗体特異的酵素プロドラッグ療法であり、腫瘍に同時局在させた酵素が全身投与したプロドラッグを腫瘍近傍で活性化する。例えば、カルボキシペプチダーゼAに結合した抗ep−CAM1抗体が大腸癌治療用に開発中である(Wolfeら(1999)" Antibody−directed enzyme prodrug therapy with the T268G mutant of human carboxypeptidase A1:in vitro and in vivo studies with prodrugs of methotrexate and the thymidylate synthase inhibitors GW1031 and GW1843" Bioconjug Chem 10:38−48)。この他に、治療効果のために正常細胞機能を特に阻害するように設計したAb(例えば拮抗薬)もある。1例は急性臓器移植拒絶を緩和するためにJohnson and Johnsonから販売されている抗CD3MAbであるオルソクローンOKT3である(Strateら(1990)" Orthoclone OKT3 as first−line therapy in acute renal allograft rejection" Transplant Proc 22:219−20)。別の類の抗体製品は作動薬である。これらのMabは治療効果のために正常細胞機能を特に強化するように設計されている。例えば、アセチルコリン受容体のMab作動薬が神経治療用に開発中である(Xieら(1997)" Direct demonstration of MuSK involvement in acetylcholine receptor clustering through identification of agonist ScFv" Nat.Biotechnol.15:768−71)。1種以上の治療特性(特異性、アビディティ、血清半減期等)を強化するために1種以上の非天然アミノ酸を組込むようにこれらの抗体に任意のものを改変することができる。
【0195】
別の類の抗体製品は新規機能を提供する。この類の主な抗体は酵素の触媒能に似せて組換えたIg配列等の触媒抗体である(WentworthとJanda(1998)" Catalytic antibodies" Curr Opin Chem Biol 2:138−44)。例えば、興味深い1適用例では触媒抗体mAb−15A10を使用し、中毒治療のためにコカインをin vivo加水分解している(Metsら(1998)" A catalytic antibody against cocaine prevents cocaine' s reinforcing and toxic effects in rats" Proc Natl Acad Sci U S A 95:10176−81)。触媒抗体も1種以上の所期性質を改善するために1種以上の非天然アミノ酸を組込むように改変することができる。
【0196】
非天然アミノ酸を含む組換えタンパク質の精製
本発明のタンパク質(例えば非天然アミノ酸を含むタンパク質、非天然アミノ酸を含むタンパク質に対する抗体等)は当業者に使用されている公知標準手順に従って部分的又は実質的に均質まで精製することができる。従って、本発明のポリペプチドは当分野で周知の多数の方法の任意のものにより回収及び精製することができ、このような方法としては例えば硫安又はエタノール沈殿、酸又は塩基抽出、カラムクラマトグラフィー、アフィニティーカラムクラマトグラフィー、アニオン又はカチオン交換クロマトグラフィー、ホスホセルロースクロマトグラフィー、疎水性相互作用クロマトグラフィー、ヒドロキシアパタイトクロマトグラフィー、レクチンクロマトグラフィー、ゲル電気泳動等が挙げられる。所望によりタンパク質リフォールディング段階を使用して正しく折畳まれた成熟タンパク質を製造することができる。高純度が所望される場合には高性能液体クロマトグラフィー(HPLC)、アフィニティークロマトグラフィー又は他の適当な方法を最終精製段階で使用することができる。1態様では、非天然アミノ酸(又は非天然アミノ酸を含むタンパク質)に対して製造した抗体を精製試薬として使用し、例えば1種以上の非天然アミノ酸を含むタンパク質をアフィニティー精製する。所望に応じて部分的又は均質まで精製したら、ポリペプチドを場合により例えばアッセイ成分、治療試薬又は抗体生産用免疫原として使用する。
【0197】
本明細書に引用する他の文献以外に各種精製/タンパク質フォールディング方法が当分野で周知であり、例えばR.Scopes,Protein Purification,Springer−Verlag,N.Y.(1982);Deutscher,Methods in Enzymology Vol.182:Guide to Protein Purification,Academic Press,Inc.N.Y.(1990);Sandana(1997)Bioseparation of Proteins,Academic Press,Inc.;Bollagら(1996)Protein Methods,第2版,Wiley−Liss,NY;Walker(1996)The Protein Protocols Handbook Humana Press,NJ;HarrisとAngal(1990)Protein Purification Applications:A Practical Approach IRL Press at Oxford,Oxford,英国;HarrisとAngal Protein Purification Methods:A Practical Approach IRL Press at Oxford,Oxford,英国;Scopes(1993)Protein Purification:Principles and Practice 第3版,Springer Verlag,NY;JansonとRyden(1998)Protein Purification:Principles,High Resolution Methods and Applications,第2版,Wiley−VCH,NY;及びWalker(1998)Protein Protocols on CD−ROM Humana Press,NJ;及びその引用文献に記載されている方法が挙げられる。
【0198】
当然のことながら、当業者に自明の通り、合成、発現及び/又は精製後にタンパク質は該当ポリペプチドの所望コンフォーメーションとは異なるコンフォーメーションをもつことができる。例えば、原核系により生産されるポリペプチドは適正なフォールディングを達成するためにカオトロピック剤に暴露して最適化することが多い。例えば大腸菌に由来する溶解液から精製中に発現されたタンパク質を場合により変性させた後、再生させる。これは例えばグアニジンHCl等のカオトロピック剤でタンパク質を可溶化することにより行われる。
【0199】
一般に、発現されたポリペプチドを変性及び還元した後にポリペプチドを好適コンフォーメーションにリフォールディングすることが望ましいことがある。例えば、グアニジン、尿素、DTT、DTE及び/又はシャペロニンを所期翻訳産物に加えることができる。タンパク質の還元、変性及び再生方法も当業者に周知である(上記文献や、Debinskiら(1993)J.Biol.Chem.,268:14065−14070;KreitmanとPastan(1993)Bioconjug.Chem..,4:581−585;及びBuchnerら,(1992)Anal.Biochem.,205:263−270参照)。例えば、Debinskiらはグアニジン−DTEでの封入体タンパク質の変性と還元について記載している。タンパク質は例えば酸化グルタチオンとL−アルギニンを加えたレドックス緩衝液中でリフォールディングすることができる。リフォールディング試薬を流すか又は他の方法で移動させて1種以上のポリペプチド又は他の発現産物と接触させるか、又はポリペプチドを移動させて試薬と接触させることができる。
【0200】
核酸及びポリペプチド配列変異体
上記及び下記に記載するように、本発明は核酸ポリヌクレオチド配列及びポリペプチドアミノ酸配列(例えばO−tRNA及びO−RS)と、例えば前記配列を含む組成物と方法を提供する。前記配列(例えばO−tRNA及びO−RS)の例を本明細書に開示する。しかし、当業者に自明の通り、本発明は本明細書(例えば実施例)に開示する配列に限定されない。当業者に自明の通り、本発明は本明細書に記載する機能をもつ(例えば(例えばO−tRNA又はO−RSをコードする))多数の非関連配列も提供する。
【0201】
同様に当業者に自明の通り、開示配列の多数の変異体も本発明に含まれる。例えば、機能的に同一配列である開示配列の保存変異も本発明に含まれる。少なくとも1種の開示配列にハイブリダイスする核酸ポリヌクレオチド配列の変異体も本発明に含むものとする。例えば標準配列比較法により本明細書に開示する配列のユニークサブ配列であるとみなされる配列も本発明に含まれる。
【0202】
保存変異
遺伝コードの縮重により、「サイレント置換」(即ちコードされるポリペプチドに変化を生じない核酸配列の置換)はアミノ酸をコードする全核酸配列の暗黙の特徴である。同様に、「保存アミノ酸置換」はアミノ酸配列中の1又は数個のアミノ酸を高度に類似する特性をもつ別のアミノ酸で置換するものであり、このような置換も開示構築物と高度に類似するとは自明である。各開示配列のこのような保存変異は本発明の1つの特徴である。
【0203】
特定核酸配列の「保存変異」とは同一又は本質的に同一のアミノ酸配列をコードする核酸を意味し、核酸がアミノ酸配列をコードしない場合には本質的に同一の配列を意味する。当業者に自明の通り、コードされる配列中の単一アミノ酸又は低百分率(一般に5%未満、より一般には4%、2%又は1%未満)のアミノ酸を置換、付加又は欠失させる個々の置換、欠失又は付加の結果としてアミノ酸1個を欠失するか、アミノ酸1個が付加するか、又はアミノ酸1個が化学的に類似するアミノ酸1個で置換される場合には、これらの改変は「保存改変変異」である。従って、本発明に示すポリペプチド配列の「保存変異」はポリペプチド配列のアミノ酸の低百分率、一般に5%未満、より一般には2%又は1%未満を同一保存置換基の保存可能に選択したアミノ酸で置換する置換を含む。最後に、非機能的配列の付加のように核酸分子のコードされる活性を変えない配列の付加も基本核酸の保存変異である。
【0204】
機能的に類似するアミノ酸を生じる保存置換表は当分野で周知である。相互に「保存置換」を含む天然アミノ酸を含む基の例を以下に示す。
【0205】
保存置換基
【0206】
核酸ハイブリダイゼーション
比較ハイブリダイゼーションを使用して(本発明の核酸の保存変異を含む)本発明の核酸を同定することができ、この比較ハイブリダイゼーション法は本発明の核酸を識別する好適な方法である。更に、高、超高及び超々高ストリンジェンシー条件下で配列番号1〜34に示す核酸とハイブリダイズするターゲット核酸も本発明の1つの特徴である。このような核酸の例としては所定核酸配列と比較して1又は数個のサイレント又は保存核酸置換をもつものが挙げられる。
【0207】
完全にマッチする相補的ターゲットに比較して少なくとも1/2の割合でプローブにハイブリダイズする場合、即ちマッチしないターゲット核酸の任意のものとのハイブリダイゼーションに観測されるシグナル対ノイズ比の少なくとも約5倍〜10倍で完全にマッチするプローブが完全にマッチする相補的ターゲットと結合する条件下におけるプローブとターゲットのハイブリダイゼーションに比較してシグナル対ノイズ比が少なくとも1/2である場合に試験核酸はプローブ核酸に特異的にハイブリダイズすると言う。
【0208】
核酸は一般に溶液中で会合するときに「ハイブリダイズ」する。核酸は水素結合、溶媒排除、塩基スタッキング等の種々の十分に特性決定された物理化学的力によりハイブリダイズする。核酸ハイブリダイゼーションの詳しい手引きはTijssen(1993)Laboratory Techniques in Biochemistry and Molecular Biology − Hybridization with Nucleic Acid Probes part I,chapter 2," Overview of principles of hybridization and the strategy of nucleic acid probe assays," (Elsevier,New York)及びAusubel,前出に記載されている。HamesとHiggins(1995)Gene Probes 1 IRL Press at Oxford University Press,Oxford,英国(HamesとHiggins 1)及びHamesとHiggins(1995)Gene Probes 2 IRL Press at Oxford University Press,Oxford,英国(HamesとHiggins 2)はDNAとRNA(オリゴヌクレオチドを含む)の合成、標識、検出及び定量について詳細に記載している。
【0209】
サザン又はノーザンブロットでフィルター上で100を越える相補的残基をもつ相補的核酸のハイブリダイゼーションを行うためのストリンジェントハイブリダイゼーション条件の1例は、50%ホルマリンにヘパリン1mgを加え、42℃で一晩のハイブリダイゼーションである。ストリンジェント洗浄条件の1例は65℃、0.2×SSCで15分間である(SSC緩衝液の説明についてはSambrook,前出参照)。多くの場合には高ストリンジェンシー洗浄の前に低ストリンジェンシー洗浄でバックグラウンドプローブシグナルを除去する。低ストリンジェンシー洗浄の1例は40℃、2×SSCで15分間である。一般に、シグナル対ノイズ比が特定ハイブリダイゼーションアッセイで非関連プローブに観測されるよりも5倍(以上)である場合に特異的ハイブリダイゼーションが検出されたとみなす。
【0210】
サザン及びノーザンハイブリダイゼーション等の核酸ハイブリダイゼーション実験に関して「ストリンジェントハイブリダイゼーション洗浄条件」は配列依存的であり、種々の環境パラメーターにより異なる。核酸ハイブリダイゼーションの詳しい手引きはTijssen(1993),前出やHamesとHiggins 1及び2に記載されている。ストリンジェントハイブリダイゼーション及び洗浄条件は任意試験核酸について経験により容易に決定することができる。例えば、高ストリンジェントハイブリダイゼーション及び洗浄条件を決定するには、総合選択基準に合致するまで(例えばハイブリダイゼーション又は洗浄における温度上昇、塩濃度低下、界面活性剤濃度増加及び/又はホルマリン等の有機溶媒濃度増加により)ハイブリダイゼーション及び洗浄条件を漸増させる。例えば、マッチしないターゲットとプローブのハイブリダイゼーションに観測されるシグナル対ノイズ比の少なくとも約5倍でプローブが完全にマッチする相補的ターゲットと結合するまでハイブリダイゼーション及び洗浄条件を漸増させる。
【0211】
「超ストリンジェント」条件は特定プローブの熱融点(Tm )に等しくなるように選択する。Tm は(規定イオン強度及びpH下で)試験配列の50%が完全にマッチするプローブとハイブリダイズする温度である。本発明の趣旨では、一般に規定イオン強度及びpHで特定配列のTm よりも約5℃低くなるように「高ストリンジェント」ハイブリダイゼーション及び洗浄条件を選択する。
【0212】
「超高ストリンジェンシー」ハイブリダイゼーション及び洗浄条件は完全にマッチする相補的ターゲット核酸とプローブを結合させる場合のシグナル対ノイズ比がマッチしないターゲット核酸の任意のものとのハイブリダイゼーションに観測されるシグナル対ノイズ比の少なくとも10倍になるまでハイブリダイゼーション及び洗浄条件のストリンジェンシーを増す条件である。完全にマッチする相補的ターゲットのシグナル対ノイズ比の少なくとも1/2で前記条件下でプローブとハイブリダイズする場合にターゲット核酸は超高ストリンジェンシー条件下でプローブと結合すると言う。
【0213】
同様に、該当ハイブリダイゼーションアッセイのハイブリダイゼーション及び/又は洗浄条件を漸増させることにより更に高いレベルのストリンジェンシーを決定することもできる。例えば、完全にマッチする相補的ターゲット核酸とプローブを結合させる場合のシグナル対ノイズ比がマッチしないターゲット核酸の任意のものとのハイブリダイゼーションに観測されるシグナル対ノイズ比の少なくとも10倍、20倍、50倍、100倍又は500倍以上になるまでハイブリダイゼーション及び洗浄条件のストリンジェンシーを増す。完全にマッチする相補的ターゲットのシグナル対ノイズ比の少なくとも1/2で前記条件下でプローブとハイブリダイズする場合にターゲット核酸は超々高ストリンジェンシー条件下でプローブと結合すると言う。
【0214】
ストリンジェント条件下で相互にハイブリダイズしない核酸でも、これらの核酸によりコードされるポリペプチドが実質的に同一である場合には実質的に同一である。これは、例えば遺伝コードに許容される最大コドン縮重を使用して核酸のコピーを作製する場合に該当する。
【0215】
ユニークサブ配列
1側面では、本発明は本明細書に開示するO−tRNA及びO−RSの配列から選択される核酸にユニークサブ配列を含む核酸を提供する。ユニークサブ配列は任意公知O−tRNA及びO−RS核酸配列に対応する核酸に比較してユニークである。例えばデフォルトパラメーターに設定したBLASTを使用してアラインメントを実施することができる。任意ユニークサブ配列は例えば本発明の核酸を同定するためのプローブとして有用である。
【0216】
同様に、本発明は本明細書に開示するO−RSの配列から選択されるポリペプチド中にユニークサブ配列を含むポリペプチドを含む。この場合には、ユニークサブ配列は公知ポリペプチド配列の任意のものに対応するポリペプチドに比較してユニークである。
【0217】
本発明はO−RSの配列から選択されるポリペプチド中のユニークサブ配列をコードするユニークコーディングオリゴヌクレオチドとストリンジェント条件下でハイブリダイズするターゲット核酸も提供し、この場合、ユニークサブ配列は対照ポリペプチド(例えば本発明のシンテターゼを得るために例えば突然変異させた親配列)の任意のものに対応するポリペプチドに比較してユニークである。ユニーク配列は上記のように決定する。
【0218】
配列比較、一致度及び相同度
2種以上の核酸又はポリペプチド配列に関して「一致」又は「一致度」百分率なる用語は2種以上の配列又はサブ配列を最大限に対応するように対比及び整列させ、以下に記載する配列比較アルゴリズム(又は当業者に入手可能な他のアルゴリズム)の1種を使用するか又は目視により測定した場合に相互に同一であるか又は同一のアミノ酸残基もしくはヌクレオチドの百分率が特定値であることを意味する。
【0219】
2種以上の核酸又はポリペプチド(例えばO−tRNAもしくはO−RS又はO−RSのアミノ酸配列をコードするDNA)に関して「実質的に一致」なる用語は2種以上の配列又はサブ配列を最大限に対応するように対比及び整列させ、配列比較アルゴリズムを使用するか又は目視により測定した場合にヌクレオチド又はアミノ酸残基一致度が少なくとも約60%、好ましくは80%、最も好ましくは90〜95%であることを意味する。このような「実質的に一致」する配列は一般に実際の起源が記載されていなくても「相同」であるとみなす。少なくとも約50残基長の配列の領域にわたって「実質的一致」が存在することが好ましく、少なくとも約100残基長の配列の領域がより好ましく、少なくとも約150残基又は比較する2配列の全長にわたって配列が実質的に一致していることが最も好ましい。
【0220】
配列比較及び相同性決定には、一般に一方の配列を参照配列としてこれに試験配列を比較する。配列比較アルゴリズムを使用する場合には、試験配列と参照配列をコンピューターに入力し、必要に応じてサブ配列座標を指定し、配列アルゴリズムプログラムパラメーターを指定する。こうすると、配列比較アルゴリズムは指定プログラムパラメーターに基づいて参照配列に対して試験配列の配列一致度百分率を計算する。
【0221】
比較のための最適な配列アラインメントは例えばSmith & waterman,Adv.Appl.Math.2:482(1981)の局所相同性アルゴリズム、Needleman & Wunsch,J.Mol.Biol.48:443(1970)の相同性アラインメントアルゴリズム、Pearson & Lipman,Proc.Nat' l Acad.Sci.USA 85:2444(1988)の類似性探索法、これらのアルゴリズムのコンピューターソフトウェア(Wisconsin Genetics Software Package,Genetics Computer Group,575 Science Dr.,Madison,WIのGAP、BESTFIT、FASTA及びTFASTA)、又は目視(一般にAusubelら,後出参照)により実施することができる。
【0222】
配列一致度及び配列類似度百分率を決定するのに適したアルゴリズムの1例はAltschulら,J.Mol.Biol.215:403−410(1990)に記載されているBLASTアルゴリズムである。BLAST分析を実施するためのソフトウェアはNational Center for Biotechnology Information(www.ncbi.nlm.nih.gov/)から公に入手可能である。このアルゴリズムはデータベース配列中の同一長さの単語と整列した場合に所定の正の閾値スコアTと一致するか又はこれを満足するクエリー配列中の長さWの短い単語を識別することによりまず高スコア配列対(HSP)を識別する。Tを隣接単語スコア閾値と言う(Altschulら,前出)。これらの初期隣接単語ヒットをシードとして検索を開始し、これらの単語を含むもっと長いHSPを探索する。次に、累積アラインメントスコアを増加できる限り、単語ヒットを各配列に沿って両方向に延長する。ヌクレオチド配列の場合にはパラメーターM(1対のマッチ残基のリウォードスコア、常に>0)及びN(ミスマッチ残基のペナルティースコア、常に<0)を使用して累積スコアを計算する。アミノ酸配列の場合には、スコアリングマトリクスを使用して累積スコアを計算する。累積アラインメントスコアがその最大到達値から量Xだけ低下するか、累積スコアが1カ所以上の負スコア残基アラインメントの累積によりゼロ以下になるか、又はどちらかの配列の末端に達したら各方向の単語ヒットの延長を停止する。BLASTアルゴリズムパラメーターW、T及びXはアラインメントの感度と速度を決定する。BLASTINプログラム(ヌクレオチド配列用)は語長(W)11、期待値(E)10、カットオフ100、M=5、N=4、及び両鎖の比較をデフォルトとして使用する。アミノ酸配列用として、BLASTPプログラムは語長(W)3、期待値(E)10、及びBLOSUM62スコアリングマトリクスをデフォルトとして使用する(Henikoff & Henikoff(1989)Proc.Natl.Acad.Sci.USA 89:10915参照)。
【0223】
配列一致度百分率の計算に加え、BLASTアルゴリズムは2配列間の類似性の統計分析も実施する(例えばKarlin & Altschul,Proc.Nat' l.Acad.Sci.USA 90:5873−5787(1993)参照)。BLASTアルゴリズムにより提供される類似性の1尺度は2種のヌクレオチド又はアミノ酸配列間に偶然にマッチが起こる確率を示す最小合計確率(P(N))である。例えば、試験核酸を参照核酸に比較した場合の最小合計確率が約0.1未満、より好ましくは約0.01未満、最も好ましくは約0.001未満である場合に核酸は参照核酸に類似しているとみなす。
【0224】
免疫反応性によるポリペプチドの特性決定
本発明のポリペプチドは(例えば本発明の翻訳系で合成されるタンパク質の場合には非天然アミノ酸を含み、例えば本発明の新規シンテターゼの場合には標準アミノ酸の新規配列を含む)種々の新規ポリペプチドを提供するので、ポリペプチドは例えばイムノアッセイで認識することができる新規構造特徴も提供する。本発明のポリペプチドに特異的に結合する抗血清の作製とこのような抗血清と結合するポリペプチドも本発明の特徴の1つである。
【0225】
例えば、本発明は配列番号35〜66の1種以上から選択されるアミノ酸配列を含む免疫原に対して作製した抗体又は抗血清に特異的に結合するか又は特異的に免疫反応性であるシンテターゼタンパク質を含む。他の相同体との交差反応性をなくすために、野生型Methanococcus jannaschii(M.janaschii)チロシルシンテターゼ(TyrRS)等の入手可能なシンテターゼを用いて抗体又は抗血清をサブトラクションする。野生型Methanococcus jannaschii(M.janaschii)チロシルシンテターゼ(TyrRS)が核酸に対応する場合には、核酸によりコードされるポリペプチドを作製し、抗体/抗血清サブトラクション目的に使用する。
【0226】
典型的なフォーマットの1例では、イムノアッセイは配列番号35〜66の1種以上に対応する配列の1種以上又はその実質的サブ配列(即ち記載する全長配列の少なくとも約30%)を含む1種以上のポリペプチドに対して作製したポリクローナル抗血清を使用する。配列番号35〜66に由来する潜在的ポリペプチド免疫原群を以下の文中では「免疫原性ポリペプチド」と総称する。得られた抗血清を場合により対照シンテターゼ相同体に対する交差反応性が低くなるように選択し、ポリクローナル抗血清をイムノアッセイで使用する前に例えば対照シンテターゼ相同体の1種以上に免疫吸着させることによりこのような交差反応性を除去する。
【0227】
イムノアッセイで使用する抗血清を作製するためには、免疫原性ポリペプチドの1種以上を本明細書に記載するように作製し、精製する。例えば、組換えタンパク質を組換え細胞で生産することができる。標準マウス免疫プロトコールに従って近交系マウス(マウスの仮想遺伝子一致により結果の再現性が高いのでこのアッセイで使用)に標準アジュバント(例えばフロイントアジュバント)と共に免疫原性タンパク質を免疫する(抗体作製、イムノアッセイフォーマット及び特異的免疫反応性を測定するために使用可能な条件の標準解説については、例えばHarlowとLane(1988)Antibodies,A Laboratory Manual,Cold Spring Harbor Publications,New York参照。本明細書に示した他の抗体関連文献もこの場合の免疫反応性によるポリペプチドの特性決定に適用することができる)。あるいは、本明細書に開示する配列から誘導される1種以上の合成又は組換えポリペプチドをキャリヤータンパク質に結合させて免疫原として使用してもよい。
【0228】
ポリクローナル血清を収集し、イムノアッセイ(例えば固体支持体に固定化した免疫原性タンパク質の1種以上を使用する固相イムノアッセイ)で免疫原性ポリペプチドに対する力価を測定する。106 以上の力価をもつポリクローナル抗血清を選択し、プールし、対照シンテターゼポリペプチドでサブトラクションし、高力価ポリクローナル抗血清サブトラクションプールを作製する。
【0229】
高力価ポリクローナル抗血清サブトラクションプールを比較イムノアッセイで対照相同体に対する交差反応性について試験する。この比較アッセイでは、高力価ポリクローナル坑血清が免疫原性シンテターゼと結合する場合のシグナル対ノイズ比が対照シンテターゼ相同体と結合する場合の少なくとも約5〜10倍となるように、サブトラクション高力価ポリクローナル坑血清に差別的な結合条件を決定する。即ち、アルブミン又は脱脂粉乳等の非特異的競合剤を加えるか及び/又は塩条件、温度及び/又はその他を調節することにより結合反応のストリンジェンシーを調整する。これらの結合条件は、試験ポリペプチド(免疫原性ポリペプチド及び/又は対照ポリペプチドに比較するポリペプチド)がサブトラクションポリクローナル坑血清プールに特異的に結合するか否かを調べる後期アッセイで使用される。特に、差別的結合条件下で対照シンテターゼ相同体の少なくとも2〜5倍のシグナル対ノイズ比と、免疫原性ポリペプチドの少なくとも約1.5倍のシグナル対ノイズ比を示す試験ポリペプチドは公知シンテターゼに比較して免疫原ポリペプチドと実質的な構造類似性をもつので、本発明のポリペプチドである。
【0230】
別の例では、試験ポリペプチドの検出に競合結合フォーマットのイムノアッセイを使用する。例えば、自明の通り、対照ポリペプチドに免疫吸着させることにより坑血清混合物プールから交差反応性抗体を除去する。次に、免疫原性ポリペプチドを固体支持体に固定化し、支持体をサブトラクション坑血清プールに暴露する。試験タンパク質をアッセイに加え、サブトラクション坑血清プールとの結合を競合させる。試験タンパク質が固定化タンパク質に対してサブトラクション坑血清プールとの結合を競合する能力と、アッセイに加えた免疫原性ポリペプチドが結合を競合する能力とを比較する(免疫原性ポリペプチドは坑血清プールとの結合を固定化免疫原性ポリペプチドと有効に競合する)。標準計算を使用して試験タンパク質の交差反応性百分率を計算する。
【0231】
平行アッセイで場合により対照タンパク質がサブトラクション坑血清プールとの結合を競合する能力を免疫原性ポリペプチドが坑血清との結合を競合する能力と比較測定する。この場合も、標準計算を使用して対照ポリペプチドの交差反応性百分率を計算する。試験ポリペプチドの交差反応性百分率が対照ポリペプチドの少なくとも5〜10倍である場合又は試験ポリペプチドの結合が免疫原性ポリペプチドの結合とほぼ同一範囲である場合に、試験ポリペプチドはサブトラクション坑血清プールに特異的に結合すると言う。
【0232】
一般に、本明細書に記載する競合的結合イムノアッセイでは任意試験ポリペプチドを免疫原性及び/又は対照ポリペプチドに比較するために免疫吸着坑血清プールを使用することができる。この比較を行うためには、免疫原性、試験及び対照ポリペプチドを各々広い濃度範囲でアッセイし、サブトラクション坑血清と例えば固定化した対照、試験又は免疫原性タンパク質との結合の50%を阻害するために必要な各ポリペプチドの量を標準技術により決定する。競合アッセイで結合に必要な試験ポリペプチドの量が免疫原性ポリペプチドの必要量の2倍未満であり、対照ポリペプチドの少なくとも約5〜10倍である場合には試験ポリペプチドは免疫原性タンパク質に対して作製した抗体に特異的に結合すると言う。
【0233】
特異性の付加試験として、得られる免疫原性ポリペプチドサブトラクション坑血清プールと免疫吸着に使用する免疫原性ポリペプチドの結合が殆ど又は全く検出できなくなるまで場合により坑血清プールを(対照ポリペプチドではなく)免疫原性ポリペプチドに完全に免疫吸着させる。この完全に免疫吸着した坑血清を次に試験ポリペプチドとの反応性について試験する。反応性が殆ど又は全く観察されない場合(即ち完全に免疫吸着した坑血清と免疫原性ポリペプチドの結合に観察されるシグナル対ノイズ比の2倍以下)には、試験ポリペプチドは免疫原性タンパク質により誘導される坑血清に特異的に結合する。
【0234】
一般分子生物学技術
分子生物学技術について記載している一般教科書としてはBergerとKimmel,Guide to Molecular Cloning Techniques,Methods in Enzymology volume 152 Academic Press,Inc.,San Diego,CA(Berger);Sambrookら,Molecular Cloning−A Laboragory Manual(第2版),Vol.1−3,Cold Spring Harbor Laboratory, Cold Spring Harbor,New York,1989(「Sambrook」);及びCurrent Protocols in Molecular Biology,F.M.Ausubelら,編,Current Protocols,a joint venture between Greene Publishing Associates,Inc.and John Wiley & Sons,Inc.(1999年補遺)(「Ausubel」)が挙げられる。これらの教科書は突然変異誘発、ベクターの使用、プロモーター及び他の多くの関連事項について記載しており、例えば非天然アミノ酸、直交tRNA、直交シンテターゼ及びその対を含むタンパク質を生産するためのセレクターコドンを含む遺伝子の作製についても記載している。
【0235】
例えば非天然アミノ酸をコードするセレクターコドンをタンパク質に挿入するために、本発明では各種突然変異誘発を使用する。これらの方法としては部位特異的、ランダム点突然変異誘発、相同組換え(DNAシャフリング)、ウラシル含有鋳型を使用する突然変異誘発、オリゴヌクレオチド特異的突然変異誘発、ホスホロチオエート修飾DNA突然変異誘発、ギャップデュプレクスDNAを使用する突然変異誘発等が挙げられるが、これらに限定されない。他の利用可能な方法としては点ミスマッチ修復、修復欠損宿主株を使用する突然変異誘発、制限−選択及び制限−精製、欠失突然変異誘発、完全遺伝子合成による突然変異誘発、2本鎖切断修復等が挙げられる。例えばキメラ構築物を使用する突然変異誘発も本発明に含まれる。1態様では、天然分子又は改変もしくは突然変異させた天然分子の公知情報(例えば配列、配列比較、物性、結晶構造等)により突然変異誘発を実施することができる。
【0236】
本明細書に記載する上記教科書と実施例はこれらの手順について記載している。以下の刊行物とその引用文献にも情報が記載されていれる。Lingら,Approaches to DNA mutagenesis:an overview,Anal Biochem.254(2):157−178(1997);Daleら,Oligonucleotide−directed random mutagenesis using phosphorothioate method,Methods Mol.Bio.57:369−374(1996);Smith,In vivo mutagenesis,Ann.Rev.Genet.19:423−462(1985);Botstein & Shortle,Strategies and applications of in vitro mutagenesis,Science 229:1193−1201(1985);Carter,Site−directed mutagenesis,Biochem.J.237:1−7(1986);Kunkel,The efficiency of oligonucleotide directed mutagenesis,in Nucleic Acids & Molecular Biology(Eckstein,F.and Lilley,D.M.J.編,Springer Verlag,Berlin))(1987);Kunklel,Rapid and efficient site−specific mutagenesis without phenotypic selection,Proc.Natl.Acad.Sci.USA 82:488−492(1985);Kunkelら,Rapid and efficient site−specific mutagenesis without phenotypic selection,Methods in Enzymol.154,367−382(1987);Bassら,Mutant Trp repressors with new DNA−binding specificities,Science 242:240−245(1988);Methods in Enzymol.100:468−500(1983);Methods in Enzymol.154:329−350(1987);Zoller & Smith,Oligonucleotide−directed mutagenesis using M13−derived vectors:an efficient and general procedure for the production of point mutations in any DNA fragment,Nucleic Acids Res.109:6487−6500(1982);Zoller & Smith,Oligonucleotide−directed mutagenesis of DNA fragments cloned into M13 vectors,Methods in Enzymol.100:468−500(1983);Zoller & Smith,Oligonucleotide−directed mutagenesis:a simple method using two oligonucleotide primers and a single−stranded DNA template,Methods in Enzymol.154:329−350(1987);Taylorら,The use of phosphorothioate−modified DNA in restriction enzyme reactions to prepare nicked DNA,Nucl.Acids Res.13:8749−8764(1985);Taylorら,The rapid generation of oligonucleotide−directed mutations at high frequency using phosphorothioate−modified DNA,Nucl.Acids Res.13:8765−8787(1985);NakamayeとEckstein,Inhibition of restriction enconuclease NciI cleavage by phosphorothioate groups and its application to oligonucleotide−directed mutagenesis,Nucl.Acids Res.14:9679−9698(1986);Sayersら,Y−T Exonucleases in phosphorothioate−based oligonucleotide−directed mutagenesis,Nucl.Acids Res.16:791−802(1988);Sayersら,Strand specific cleavage of phosphorothioate−containing DNA by reaction with restriction endonucleases in the presence of ethidium bromide,(1988)Nucl.Acids Res.16:803−814;Kramerら,The gapped duplex DNA approach to oligonucleotide−directed mutation construction,Nucl.Acids Res.12:9441−9456(1984);Kramer & Fritz Oligonucletide−directed construction of mutations via gapped duplex DNA,Methods in Enzymol.154:350−367(1987);Kramerら,Improved enzymatic in vitro reactions in the gapped duplex DNA approach to oligonucleotide−directed construction of mutations,Nucl.Acids Res.16:7207(1988);Fritzら,Oligonucleotide−directed construction of mutations:a gapped duplex DNA procedure without enzymatic reactions in vitro,Nucl.Acids Res.16:6987−6999(1988);Kramerら,Point Mismatch Repair,Cell 38:879−887(1984);Carterら,Improved oligonucleotide site−directed mutagenesis using M13 vectors,Nucl.Acids Res.13:4431−4443(1985);Carter,Improved oligonucleotide−directed mutagenesis using M13 vectors,Methods in Enzymol.154:382−403(1987);Eghtedarzadeh & Henikoff,Use of oligonucleotides to generate large deletions,Nucl.Acids Res.14:5115(1986);Wellsら,Importance of hydrogen−bond formation in stabilizing the transition state of subtilisin,Phil.Trans.R.Soc.Lond.A 317:415−423(1986);Nambiarら,Total synthesis and cloning of a gene coding for the ribonuclease S protein,Science 223:1299−1301(1984);Sakamar & Khorana,Total synthesis and expression of a gene for the a−subunit of bovine rod outer segment guanine nucleotide−binding protein(transducin),Nucl.Acids Res.14:6361−6372(1988);Wellsら,Cassette mutagenesis:an efficient method for generation of multiple mutations at defined sites,Gene 34:315−323(1985);Grundstromら,Oligonucleotide−directed mutagenesis by microscale ' shot−gun' gene synthesis,Nucl.Acids Res.13:3305−3316(1985);Mandecki,Oligonucleotide−directed double−strand break repair in plasmids of Escherichia coli:a method for site−specific mutagenesis,Proc.Natl.Acad.Sci.USA,83:7177−7181(1986);Arnold,Protein engineering for unusual environments,Current Opinion in Biotechnology 4:450−451(1993);Sieberら,Nature Biotechnology,19:456−460(2001);W.P.C.Stemmer,Nature 370,389−91(1994);及びI.A.Lorimer,I.Pastan,Nucleic Acids Res.23,3067−8(1995)。上記方法の多くに関する更に詳細な説明はMethods in Enzomology Volume 154に記載されており、この文献には各種突然変異誘発法に伴うトラブルシューティング問題の有用な解決方法も記載されている。
【0237】
本発明は直交tRNA/RS対を介する非天然アミノ酸のin vivo組込みに用いる宿主細胞及び生物にも関する。例えばクローニングベクター又は発現ベクターとすることができる本発明のベクターで宿主細胞を遺伝子組換え(例えば形質転換、形質導入又はトランスフェクション)する。ベクターは例えばプラスミド、細菌、ウイルス、裸のポリヌクレオチド又はポリヌクレオチドコンジュゲートの形態とすることができる。ベクターはエレクトロポレーション(Fromら,Proc.Natl.Acad.Sci.USA 82,5824(1985))、ウイルスベクターによる感染、核酸を小ビーズもしくは粒子のマトリックスに埋込むか又は表面に付着させて小粒子形態で高速射入する(Kleinら,Nature 327,70−73(1987)等の標準方法により細胞及び/又は微生物に導入する。
【0238】
組換え宿主細胞は例えばスクリーニング段階、プロモーター活性化又は形質転換細胞選択等の操作に合うように適宜改変した慣用栄養培地で培養することができる。これらの細胞を場合によりトランスジェニック生物で培養することができる。
【0239】
ターゲット核酸を宿主細胞に導入する方法としては数種の周知方法が入手可能であり、本発明ではその任意のものを使用することができる。これらの方法としては、DNAを含む細菌プロトプラストとレシピエント細胞の融合、エレクトロポレーション、遺伝子銃及びウイルスベクターによる感染(下記に詳述)等が挙げられる。本発明のDNA構築物を含むプラスミドの数を増幅するためには細菌細胞を使用することができる。対数期まで細菌細胞を増殖させると、細菌内のプラスミドを当分野で公知の各種方法により分離することができる(例えばSambrook参照)。更に、細菌からプラスミドを精製するために多数のキットが市販されている(例えばEasyPrep(登録商標)、FlexiPrep(登録商標)(いずれもPharmacia Biotech);StrataClean(登録商標)(Stratagene);及びQIAprep(登録商標)(Qiagen))。分離精製したプラスミドを更に操作して他のプラスミドを作製し、細胞をトランスフェクトするために使用するか又は生物に感染させるために関連ベクターに組込む。典型的ベクターは転写及び翻訳ターミネーターと、転写及び翻訳開始配列と、特定ターゲット核酸の発現の調節に有用なプロモーターを含む。ベクターは場合により少なくとも1個の独立ターミネーター配列と、真核生物又は原核生物又は両者(例えばシャトルベクター)でカセットの複製を可能にする配列と、原核系と真核系の両者の選択マーカーを含む包括的発現カセットを含む。ベクターは原核生物、真核生物、又は好ましくは両者での複製と組込みに適している。Giliman & Smith,Gene 8:81(1979);Robertsら,Nature,328:731(1987);Schneider,B.ら,Protein Expr.Purif.6435:10(1995);Ausubel,Sambrook,Berger(いずれも前出)参照。クローニングに有用な細菌とバクテリオファージのカタログは例えばATCCから入手でき、例えばATCCから刊行されたThe ATCC Catalogue of Bacteria and Bacteriophage(1992)Ghernaら(編)が挙げられる。その他のシーケンシング、クローニング及び分子生物学の他の側面の基本手順と基礎理論事項もWatsonら(1992)Recombinant DNA 第2版,Scientific American Books,NYに記載されている。
【0240】
(例えば後期核酸分離のための)例えば細胞分離及び培養に関する他の有用な文献としてはFreshney(1994)Culture of Animal Cells,a Manual of Basic Technique,第3版,Wiley−Liss,New Yorkとその引用文献;Payneら(1992)Plant Cell and Tissue Culture in Liquid Systems John Wiley & Sons,Inc,New York,NY;GamborgとPhillips(編)(1995)Plant Cell,Tissue and Organ Culture;Fundamental Method Springer Lab Manual,Springer−Verlag(Berlin Heidelberg New York;及びAtlasとParks(編)The Handbook of Microbiological Media(1993)CRC Press,Boca Raton,FLが挙げられる。
【0241】
更に、The Midland Certified Reagent Company(mcrc@oligos.com)、The Great American Gene Company(www.genco.com)、ExpressGen Inc.(www.expressgen.com)、Operon Technologies Inc.(Alameda,CA)、その他多数の各種販売会社からほぼ任意核酸(及び標準又は標準外を問わずほぼ任意標識核酸)をオーダーメード又は標準注文することができる。
【0242】
医薬組成物
(例えば1種以上の非天然アミノ酸を含む)本発明のタンパク質(例えばポリペプチド、ペプチド等)は場合により例えば適当な医薬キャリヤーと共に治療用途に使用される。このような組成物は例えば治療上有効な量の化合物と医薬的に許容可能なキャリヤー又は賦形剤を含む。このようなキャリヤー又は賦形剤としては食塩水、緩衝食塩水、デキストロース、水、グリセロール、エタノール及び/又はその組合せが挙げられるが、これらに限定されない。製剤は投与方法に合わせて製造される。一般に、タンパク質の投与方法は当分野で周知であり、本発明のポリペプチドの投与に適用することができる。
【0243】
1種以上の本発明のポリペプチドを含む治療用組成物は場合により1種以上の適当なin vitro及び/又はin vivo動物疾患モデルで試験し、当分野で周知の方法により効力、組織代謝を確認し、用量を推定する。特に、本明細書に記載する非天然アミノ酸の活性、安定性又は他の適当な尺度を天然アミノ酸相同体と比較(例えば1種以上の非天然アミノ酸を組込むように改変したEPOと天然アミノ酸EPOを比較)する試験即ち関連アッセイによりまず用量を決定することができる。
【0244】
投与は分子を最終的に血液又は組織細胞と接触させるために通常使用されている任意経路で行う。本発明の非天然アミノ酸ポリペプチドは場合により1種以上の医薬的に許容可能なキャリヤーと共に適当な任意方法で投与される。本発明の関連でこのようなポリペプチドを患者に投与するのに適した方法は入手可能であり、特定組成物を投与するために2種以上の経路を使用することもできるが、特定経路のほうが別の経路よりも迅速で有効な作用又は反応を得られることが多い。
【0245】
医薬的に許容可能なキャリヤーは投与する特定組成物や、組成物を投与するために使用する特定方法によっても異なる。従って、本発明の医薬組成物の利用可能な製剤は多様である。
【0246】
ポリペプチド組成物は多数の経路で投与することができ、例えば経口、静脈内、腹膜組織内、筋肉内、経皮、皮下、局所、舌下又は直腸手段が挙げられるが、これらに限定されない。非天然アミノ酸ポリペプチド組成物はリポソームにより投与することもできる。このような投与経路及び適切な製剤は一般に当業者に公知である。
【0247】
非天然アミノ酸ポリペプチドは単独又は他の適当な成分と共にエアゾール製剤に処方(即ち「噴霧」)して吸入投与することもできる。エアゾール製剤はジクロロジフルオロメタン、プロパン、窒素等の許容可能な加圧噴射剤に加えることができる。
【0248】
例えば関節内、静脈内、筋肉内、皮内、腹膜組織内及び皮下経路等の非経口投与に適した製剤としては、酸化防止剤、緩衝液、静菌剤、及び製剤を所期レシピエントの血液に等張にする溶質を加えることができる水性及び非水性等張滅菌注射溶液剤や、懸濁剤、溶解補助剤、増粘剤、安定剤及び防腐剤を加えることができる水性及び非水性滅菌懸濁液が挙げられる。アンプルやバイアル等の単位用量又は多重用量密閉容器に収容してパッケージ核酸製剤とすることもできる。
【0249】
非経口投与と静脈内投与が好ましい投与方法である。特に、天然アミノ酸相同体治療で既に使用されている投与経路(例えばEPO、GCSF、GMCSF、IFN、インターロイキン、抗体及び/又は他の医薬的送達タンパク質に一般に使用される投与経路)と現行製剤が本発明の非天然アミノ酸の好ましい投与経路と製剤である。
【0250】
本発明の関連で患者に投与する用量は患者に有益な治療応答を経時的に生じるために十分な量又は例えば用途に応じて病原体による感染を阻害するか又は他の適当な活性を生じるために十分な量とする。用量は特定ベクター又は製剤の効力、使用する非天然アミノ酸ポリペプチドの活性、安定性又は血清半減期、患者の症状、更には治療する患者の体重又は体表面積により異なる。用量は特定患者における特定ベクター、製剤等の投与に伴う副作用の存在、性質及び程度によっても異なる。
【0251】
疾病(例えば癌、遺伝病、糖尿病、エイズ等)の治療又は予防に投与するベクター又は製剤の有効量を決定する際には、医師は循環血漿値、製剤毒性、疾病の進行及び/又は該当する場合には抗非天然アミノ酸ポリペプチド抗体の生産を考慮する。
【0252】
例えば体重70kgの患者の用量は一般に現在使用されている治療用タンパク質の用量と同等の範囲であり、該当組成物の活性又は血清半減期の変化に合わせて調節する。本発明のベクターは抗体投与、ワクチン投与、細胞毒性剤、天然アミノ酸ポリペプチド、核酸、ヌクレオチド類似体、生体応答調節剤の投与等の任意公知慣用治療による治療条件を補うことができる。
【0253】
投与に当たり、本発明の製剤は該当製剤のLD50及び/又は例えば患者の体重と総合健康状態に応じた各種濃度の非天然アミノ酸の副作用の観察により決定される頻度で投与する。一度に投与してもよいし、分けて投与してもよい。
【0254】
製剤を注入した患者が発熱、悪寒又は筋肉痛を生じる場合には、適当な用量のアスピリン、イブプロフェン、アセトアミノフェン又は他の鎮痛/解熱剤を投与する。発熱、筋肉痛及び悪寒等の注入反応を生じる患者には、次回注入の30分前にアスピリン、アセトアミノフェン又は例えばジフェニルヒドラミンを前投薬する。解熱剤や抗ヒスタミン剤がすぐに効かない重度悪寒及び筋肉痛にはメペリジンを使用する。反応の重度に応じて細胞注入を遅らせるか又は中断する。
【実施例1】
【0255】
実施例1:O−メチル−L−チロシンのin vivo組込み
異種間アミノアシル化が非効率的な場合には、別の生物からの対を導入することにより大腸菌で直交tRNA/シンテターゼ対を作製することができ(Y.Kwok,J.T.Wong,Can.J.Biochem.58,213−8(1980))、アンチコドンループはシンテターゼ認識の主要決定因子ではない。このような対の1候補はtRNAアイデンティティーエレメントが大腸菌tRNATyrと異なり、チロシルシンテターゼ(TyrRS)がアンチコドンループ結合ドメインを欠失する始原菌であるMethanococcus jannaschii(M.jannaschii)のチロシルtRNA/シンテターゼ対である(B.A.Steer,P.Schimmel,J.Biol.Chem.274,35601−6(1999))。更に、M.jannaschii TyrRSは編集メカニズムをもたない(H.Jakubowski,E.Goldman,Microbiol.Rev.56,412−29(1992))ので、tRNAにライゲートした非天然アミノ酸を校正しないと思われる。
【0256】
M.jannaschii tRNATyr に由来するアンバーサプレッサーtRNAは大腸菌シンテターゼにより効率的にアミノアシル化されないが、大腸菌でタンパク質翻訳に効率的に機能することが示されている(L.Wang,T.J.Magliery,D.R.Liu,P.G.Schultz,J.Am.Chem.Soc.122,5010−1(2000))。更に、M.jannaschii TyrRSは大腸菌tRNAに直交性である(B.A.Steer,P.Schimmel,J.Biol.Chem.274,35601−6(1999))が、それ自体のサプレッサーtRNACUA Tyr を効率的にアミノアシル化する(L.Wang,T.J.Magliery,D.R.Liu,P.G.Schultz,J.Am.Chem.Soc.122,5010−1(2000))。従って、M.jannaschii tRNACUA Tyr /TyrRSは直交対として機能し、大腸菌でアンバーコドンUAGに応答してチロシンを効率的に組込むことができる。
【0257】
大腸菌シンテターゼによるこの直交tRNAの認識を更に弱めるために、突然変異誘発及び選択スキームを実施した。更に詳細については、本願と同時に出願し、その開示内容全体を本明細書に組込む米国特許出願番号第 号(発明の名称" Methods and Compositions for the Production of Orthogonal tRNA−tRNA Synthetase Pairs" )(代理人整理番号54−000130US,Schultzら)を参照されたい。
【0258】
要約すると、M.jannaschii TyrRSと直接相互作用しないM.jannaschii tRNACUA Tyr CUATyrの11個のヌクレオチドをランダムに突然変異させてサプレッサーtRNAライブラリーを得た。このtRNAライブラリーをネガティブ選択にかけて大腸菌シンテターゼによりアミノアシル化されるtRNAを除去した後、ポジティブ選択にかけ、M.jannaschii TyrRSにより効率的にアミノアシル化されるtRNAを選択した。得られたサプレッサーtRNAの直交性をプラスミドpBLAMに担持したTEM−1βラクタマーゼ遺伝子の非必須位置(Ala184)のアンバー終止コドンの抑圧に基づいてin vivo相補アッセイにより試験した。形質転換したサプレッサーtRNAが内在大腸菌シンテターゼによりアミノアシル化されると、アンピシリンの存在下で細胞増殖する。M.jannaschii tRNACUA Tyr とpBLAMで形質転換した大腸菌は55.5μg/mLアンピシリンの存在下に生存する。ライブラリーから選択した最良突然変異体サプレッサーtRNA(mtRNACUA Tyr )が発現された場合には、細胞は僅か12.4μg/mLのアンピシリン濃度でも生存した。突然変異体サプレッサーmtRNACUA Tyr はヌクレオチド置換C17A、U17aG、U20C、G37A及びU47Gを含んでいた。比較のために、pBLAMのみを導入した細胞は(サプレッサーtRNAの不在下で)アンピシリン濃度9.7μg/mLで生存する。M.jannaschii TyrRSをこのmtRNACUA Tyr と同時発現させると、細胞はアンピシリン濃度436μg/mLで生存する。従って、mtRNACUA Tyr はM.jannaschii tRNACUA Tyr よりも弱い内在シンテターゼの基質であるので、M.jannaschii TyrRSにより効率的にアミノアシル化される。
【0259】
mtRNACUA Tyr に所望非天然アミノ酸を負荷するように直交M.jannaschii TyrRSのアミノ酸特異性を改変するために、TyrRS突然変異体のライブラリーを作製し、スクリーニングした。Bacillus stearothermophilusに由来する相同TyrRSの結晶構造(P.Brick,T.N.Bhat,D.M.Blow,J.Mol.Biol.208,83−98(1988))に基づき、結合チロシンのアリール環のパラ位から6.5Å以内にあるM.jannaschii TyrRSの活性部位の5個の残基(Tyr32、Glu107、Asp158、Ile159及びLeu162)を突然変異させた。突然変異体M.jannaschii TyrRS(mutTyrRS、O−メチル−L−チロシンによるアミノアシル化の場合)からの対応する残基はTyr32(Tyr34)、Glu107 (Asn123 )、Asp158 (Asp176 )、Ile159 (Phe177 )及びLeu162 (Leu180)である(括弧内はB.stearothermophilus TyrRS残基を表す)。
【0260】
以下に更に詳述するように、これらの残基をまず全てアラニンに突然変異させ、mtRNACUA Tyr にチロシンを負荷することができないAla5TyrRSを作製した。この突然変異体Ala5TyrRSを鋳型として使用し、オリゴヌクレオチドをプライマーとしてPCR突然変異誘発により5個の残基をランダム突然変異させたTyrRS突然変異体のライブラリーを作製した。
【0261】
カナマイシン耐性を付与したpBR322由来プラスミドであるプラスミドpBK−JYRSで大腸菌GlnRSプロモーター及びターミネーターの制御下にM.jannaschii TyrRS遺伝子を発現させた。残基Tyr32、Glu107、Asp158、Ile159及びLeu162を部位特異的突然変異誘発によりAlaで置換し、プラスミドpBK−JYA5を得た。オリゴヌクレオチドLW157 5' −GGAATTCCATATGGACGAATTTGAAATG−3' 、LW164 5' −GTATTTTACCACTTGGTTCAAAACCTATMNNAGCAGATTTTTCATCTTTTTTTCATCTTTTTTTAAAAC−3' 、LW159 5' −TAGGTTTTGAACCAAGTGGTAAAATAC−3' 、LW165 5' −CATTCAGTGTATAATCCTTATCAAGCTGGAAMNNACTTCCATAAACATATTTTGCCTTTAAC−3' 、LW161 5' −TCCAGCTTGATAAGGATTATACACTGAATG−3' 、LW167 5' −CATCCCTCCAACTGCAACATCAACGCCMNNATAATGMNNMNNATTAACCTGCATTATTGGATAGATAAC−3' 、LW163 5' −GCGTTGATGTTGCAGTTGGAGGGATG−3' 、及びLW105 5' −AAACTGCAGTTATAATCTCTTTCTAATTGGCTC−3' とNNK(N=A+T+G+C、K=G+T、及びM=C+A(Operon,Alameda,CA)を突然変異部位に使用してAla5TyrRS突然変異体(pBK−JYA5)のPCR増幅を行い、NdeI−PstIで消化したpBK−JYA5に再ライゲートしてTyrRSライブラリーを得た。ライゲートしたベクターを大腸菌DH10Bコンピテント細胞に形質転換し、1.6×109 コロニー形成単位(cfu)のライブラリーを得た。40個のランダムに抽出したコロニーからのTyrRS遺伝子を配列決定した処、ランダムに突然変異させたNNK位置に塩基変異はなく、他の予想外の突然変異もないことが確認された。ライブラリーをマキシプレップにより増幅し、スーパーコイルDNAを使用して選択株pYC−J17を形質転換した。
【0262】
次に、クロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子の非必須位置(Asp112)のアンバーコドンの抑圧に基づくポジティブ選択を行った(M.Pastrnak,T.J.Magliery,P.G.Schultz,Helvetica Chimica Acta.83,2277−86(2000))。非天然アミノ酸を加えた培地で細胞を増殖させ、各種濃度のクロラムフェニコールの存在下でのその生存について選択した。突然変異体TyrRSが直交mtRNACUA Tyr に天然又は非天然アミノ酸を負荷する場合には、細胞はCATを生産し、生存する。
【0263】
次に生存細胞をクロラムフェニコールの存在下で非天然アミノ酸の不在下に増殖させた。非天然アミノ酸を加えたレプリカプレートから生存しない細胞即ち直交mtRNACUA Tyr に非天然アミノ酸を負荷する突然変異体TyrRSをコードする細胞を分離した。突然変異体TyrRS遺伝子をこれらの細胞から分離し、DNAシャフリングによりin vitro組換えし、後期選択のために大腸菌に再形質転換した。
【0264】
アリール環のパラ位に各種官能基(アセチル、アミノ、カルボキシル、イソプロピル、メチル、O−メチル及びニトロ)をもつ7種のチロシン類似体を個々に使用して以下の選択を行った。
【0265】
lppプロモーターとrrnCターミネーターの制御下にmtRNACUA Tyr をコードする遺伝子をプラスミドpACMD112TAG(そのCAT遺伝子のAsp112を置換するTAG終止コドンをつけたpACYC184プラスミド(M.Pastrnak,T.J.Magliery,P.G.Schultz,Helvetica Chimica Acta.83,2277−86(2000)))に挿入し、プラスミドpYC−J17を得た。pYC−J17を導入した大腸菌DH10Bコンピテント細胞にTyrRSライブラリーをコードするスーパーコイルDNAを形質転換し、元のライブラリーを完全にカバーする3×109 cfuよりも大きい寸法のライブラリーを得た。次に、1%グリセロールと0.3mMロイシンを含む最少培地(GMML)プレートに17μg/mLテトラサイクリン(Tet)、25μg/mLカナマイシン(Kan)、50μg/mLクロラムフェニコール(Cm)及び1mM非天然アミノ酸を加えて細胞を培養した。37℃で44時間培養後にO−メチル−L−チロシンを加えたプレート上のコロニーをプールし、プラスミドを分離し、pYC−J17を導入した大腸菌DH10Bコンピテント細胞に再形質転換し、形質転換細胞を50μg/mL Cm上でポジティブ選択した。コロニー(96)をプレートから個々に抽出し、液体GMML培地100mLで希釈し、各種濃度のCmを加えたKan/Tet GMMLプレート2組に画線した。第1組のプレートはO−メチル−L−チロシンを加えず、Cm濃度を10〜25μg/mLとし、第2組のプレートは1mM O−メチル−L−チロシンと50μg/mL Cmを加えた。第1組のプレートで15μg/mLのCmの存在下に増殖しなかったコロニーのレプリカを第2組のプレートから抽出した。TyrRS遺伝子を含むプラスミドを精製し、断片化反応のMg2+を10mM Mn2+に代えた以外はStemmerのプロトコール(W.P.C.Stemmer,Nature 370,389−91(1994))を使用してDNAシャフリングによりin vitro組換えした(I.A.Lorimer,I.Pastan,Nucleic Acids Res.23,3067−8)1995))。次に、予め消化しておいたpBK−JYA5ベクターにライブラリーを再ライゲートし、典型寸法8×108 〜3×109 cfuの第2世代TyrRSライブラリーを得た。ライブラリーからランダムに選択した30個を配列決定した。DNAシャフリングにより導入された突然変異誘発率は0.35%であった。このライブラリーを次回の選択のために選択株に形質転換した後、シャフリングした。ポジティブ選択と第2組プレートのCm濃度は2回目に80μg/mL、3回目に120μg/mLに上げ、第1組のプレートのCm濃度は変えなかった。3回のDNAシャフリング後、コロニーは第1組のプレートではCm濃度20〜25μg/mLで増殖し始め、TyrRS突然変異体が天然アミノ酸を基質として受容していることを示した。従って、2回のDNAシャフリング後に選択した最良クローンを詳細に特性決定した。
【0266】
2回の選択とDNAシャフリング後にクロラムフェニコール中の生存が増殖培地への1mM O−メチル−L−チロシン添加に依存するクローン(突然変異体TyrRS(LWJ16))を得た。O−メチル−L−チロシンの不在下では、突然変異体TyrRS(LWJ16)を導入した細胞は1%グリセロール、0.3mMロイシンを含む最少培地(GMML)プレートに15μg/mLクロラムフェニコールを加えると生存できなかった。細胞は1mM O−メチル−L−チロシンの存在下では125μg/mLクロラムフェニコールを加えたGMMLプレートで増殖することができた。液体GMMLでも同様の結果が得られた。対照として、mtRNACUA Tyr と不活性Ala5TyrRSを導入した細胞は1mM O−メチル−L−チロシンの有無に拘わらず、使用した最低クロラムフェニコール濃度でも生存しなかった。これは、クロラムフェニコール中の細胞増殖が突然変異体TyrRS(LWJ16)の発現に依存しており、単なるO−メチル−L−チロシンの栄養効果ではないことを示している。1mM O−メチル−L−チロシン自体を加えても大腸菌の増殖率はさほど変わらない。
【0267】
観察される表現型がアンバー終止コドンに応答する直交mtRNACUA Tyr /突然変異体TyrRS(LWJ16)対によるO−メチル−L−チロシンの部位特異的組込みに起因することを更に立証するために、ジヒドロ葉酸レダクターゼ(DHFR)のO−メチル−L−チロシン突然変異体を作製し、特性決定した。大腸菌DHFR遺伝子の第3コドン(許容部位)をTAGに突然変異させ、突然変異体タンパク質を内在大腸菌DHFRから分離するためにC末端His6 タグを付けた。対照として、mtRNACUA Tyr を野生型M.jannaschii TyrRSと同時発現させ、DHFR中のナンセンスコドンをチロシンで効率的に抑圧した。図2参照。液体GMML増殖培地でmtRNACUA Tyr と1mM O−メチル−L−チロシンの存在下に突然変異体TyrRS(LWJ16)を発現させると、全長DHFRも生産され、分離収率2mg/LでNiアフィニティークロマトマグラフィーにより精製することができた。
【0268】
精製タンパク質の収率は液体GMML培地では2YTリッチ培地の約26分の1である。例えば、mtRNACUA Tyr と野生型M.jannaschii TyrRSを同時発現させる場合には、DHFRの収率は2YTでは67mg/L、液体GMMLでは2.6mg/Lである。
【0269】
O−メチル−L−チロシン、mtRNACUA Tyr 又は突然変異体TyrRS(LWJ16)の不在下ではSDS−ポリアクリルアミドゲル電気泳動と銀染色による分析でDHFRは観察されなかった(デンシトメトリーによると<0.1%)。図2参照。更にウェスタン分析の結果、mtRNACUA Tyr 、突然変異体TyrRS(LWJ16)又はO−メチル−L−チロシンの不在下ではDHFRが全く生産されないことが判明した。図2参照。
【0270】
TAGコドンに応答して挿入されたアミノ酸の正体を無傷のタンパク質とトリプシン消化フラグメントの両者の質量分析により確認した。無傷のタンパク質の平均分子量をエレクトロスプレーイオン化フーリエ変換イオンサイクロトロン共鳴質量スペクトロメトリー(FT−ICR MS)により測定した。内部標準に近接するクラスターからのモノアイソトピック質量の観測値は18096.002Daであり、理論質量18095.908Daから5ppmの範囲内であり、O−メチル−L−チロシンの組込みを明らかに示している。
【0271】
この実験にはC末端Hisタグを付けないDHFR突然変異体を使用し、メトトレキセートアフィニティークロマトマグラフィーにより精製した。突然変異体タンパク質ではアンバー抑圧効率を高めるために第3コドンをTAGに置換し、第4コドンをCTGからATGに置換し、Leu4Met突然変異とした。
【0272】
この結果も他の内在大腸菌シンテターゼがO−メチル−L−チロシンを基質として利用しないことを示している。トリプシン消化物の液体クロマトマグラフィータンデム質量分析を行い、N末端ペプチドの配列を確認した。タンデムMSスペクトルの1例を図3に示す。N末端トリプシン消化ペプチドMIY* MIAALAVDRに対応する691.5Daの二重負荷前駆体イオンを選択し、イオントラップ質量分析計(ITMS)で断片化した。フラグメントイオン質量は図3に示すようにはっきりと割当られ、O−メチル−L−チロシンの部位特異的組込みを裏付けた。タンパク質質量スペクトルもトリプシン消化ペプチドマップもO−メチル−L−チロシンの代わりにチロシン又は他のアミノ酸が組込まれたことを示さず、タンパク質質量スペクトルのシグナル対ノイズ比からO−メチル−L−チロシンの最低組込み純度95%が得られた。
【0273】
まとめると、細胞増殖、タンパク質発現及び質量分析実験の結果、mtRNACUA Tyr /突然変異体TyrRS(LWJ16)直交対は天然アミノ酸に匹敵する忠実度でアンバーコドンに応答してO−メチル−L−チロシンをタンパク質に選択的に挿入できることが判明した。
【0274】
mtRNACUA Tyr にO−メチル−L−チロシンを負荷する突然変異体TyrRS(LWJ16)の配列を分析した処、12箇所のヌクレオチド置換が判明し、そのうち2箇所はサイレントであった。10箇所の非サイレント突然変異の結果、野生型TyrRSに対して以下のアミノ酸残基置換が生じた。水素が天然基質チロシンのアリール酸素原子に結合するTyr32はGlnに突然変異し、水素がチロシンのヒドロキシル基に結合するAsp158はAlaに突然変異し、水素がAsp158に結合するGlu107はThrに突然変異し、結合ポケットの底部に位置するLeu162はProに突然変異した。相同B.stearothermophilus TyrRSのX線結晶構造によると、Tyr32、Asp158と基質チロシン間の水素結合網が失われるとチロシンと突然変異体TyrRS(LWJ16)の結合に不利であると思われる。実際に、B.stearothermophilus TyrRSのAsp176(M.jannaschiiのAsp158に対応)の突然変異は不活性な酵素を生じる(G.D.P.Gray,H.W.Duckworth,A.R.Fersht,FEBS 318,167−71(1993))。同時に、Asp158Ala及びLeu162Pro突然変異はO−メチル−L−チロシンのメチル基を更に基質結合キャビティに延ばす疎水性ポケットを形成する。リボース又はアデニル酸のリン酸基に結合する活性部位の他の重要な触媒残基は2回のDNAシャフリング後も変化しなかった。これらの突然変異の詳細な分析は突然変異体TyrRS(LWJ16)の三次元構造を待つばかりである。
【0275】
突然変異体TyrRS(LWJ16)を触媒としてATPによるO−メチル−L−チロシンとチロシンのアデニル酸形成の動態をピロリン酸交換アッセイによりin vitro分析した。そのC末端に6個のヒスチジンを付けた突然変異体TyrRS(LWJ16)をプラスミドpQE−60(Qiagen,CA)にクローニングし、プラスミドpQE−mJYRSを得た。製造業者のプロトコール(Qiagen,CA)に従って固定化金属アフィニティークロマトグラフィーによりタンパク質を精製した。100mM TrisHCl(pH7.5)、10mM KF、5mM MgCl2、2mM ATP、2mM NaPPi、0.1mg.mLウシ血清アルブミン、約0.01μCi/mL[32P]NaPPi及び各種濃度のチロシン又はO−メチル−L−チロシンを含む反応混合物中で37℃でピロリン酸(PPi)交換を行った。精製突然変異体TyrRS(LWJ16)を加えて反応を開始し、定期的にアリコートを分取し、0.2M NaPPi、7%過塩素酸及び2%活性炭で反応停止した。活性炭を濾過し、10mM NaPPi(pH2)で洗浄した後、活性炭吸着ATP中の32P濃度をシンチレーション計数により測定した。非線形回帰分析を使用してミカエリス・メンテンの式の直接フィットによりkcat及びKm値を計算した。
【0276】
表1. リン酸交換アッセイにより測定したチロシンとO−メチル−L−チロシンに対する突然変異体TyrRS(LWJ16)の動態パラメーター
【0277】
この分析の結果を表1に示す。チロシンのKm(5833μM)はO−メチル−L−チロシンの約13倍であり、チロシンのkcat(1.8×10-3s-1)はO−メチル−L−チロシンの8分の1である。従って、O−メチル−L−チロシンに対する突然変異体TyrRS(LWJ16)のkcat/Km値はチロシンの約100倍である。大腸菌におけるチロシンの生理的濃度は約80μMであり、突然変異体TyrRS(LWJ16)のチロシンに対するKm値(5833μM)よりもはるかに低い。細胞中のO−メチル−L−チロシンの濃度はKm(443μM)と同等以上であると予想される。
【実施例2】
【0278】
実施例2:L−3−(2−ナフチル)アラニンのin vivo組込み
第2の非天然アミノ酸L−3−(2−ナフチル)アラニンを大腸菌でタンパク質への部位特異的組込みを行った。この結果、このスキーム全体を多数のアミノ酸に適用できることが判明した。L−3−(2−ナフチル)アラニンに特異的なシンテターゼは上記実施例1で作製した突然変異体TyrRSライブラリーから選択しなかった。
【0279】
非天然アミノ酸をコードするためにアンバー終止コドンとその対応する直交アンバーサプレッサーtRNAであるmtRNACUA Tyr を選択した(Wang,L.;Schultz,P.G.Chem.Biol.8,883−890(2001))。非天然アミノ酸特異性をもつ直交シンテターゼを生産するための出発点としてM.jannaschiiチロシル−TRNAシンテターゼ(TyrRS)を使用した。このTyrRSは内在大腸菌tRNAをアミノアシル化しない(Steer,B.A.;Schimmel,P.J.Biol.Chem.,274,35601−35606(1999))が、mtRNACUA Tyr をチロシンでアミノアシル化する(Wang,L.;Magliery,T.J.;Liu,D.R.;Schultz,P.G.J.Am.Chem.Soc.,122,5010−5011(2000))。L−3−(2−ナフチル)アラニンはチロシンによる構造変動が大きく、新規充填特性をもつ可能性があることからこの試験に選択した。
【0280】
mtRNACUA Tyr に20種の共通アミノ酸は負荷せずにL−3−(2−ナフチル)アラニンを負荷するようにTyrRSのアミノ酸特異性を改変するために、M.jannaschii TyrRS突然変異体のライブラリーを作製し、スクリーニングした。Bacillus stearothermophilusからの相同TyrRSの結晶構造の分析(Brick,P.;Bhat,T.N.;Blow,D.M.J.Mol.Biol.,208,83−98(1989))に基づき、チロシンのアリール環のバラ位から7Å以内にあるM.jannaschii TyrRSの活性部位の5個の残基(Tyr32、Asp158 、Ile159 、Leu162 及びAla167 )を突然変異させた。後期選択で野生型シンテターゼ汚染を少なくするために、(Ala167 を除く)これらの残基をまず全てアラニンに突然変異させた。得られた不活性Ala5 TyrRS遺伝子を鋳型として使用し、対応する部位にランダム突然変異をもつオリゴヌクレオチドを用いてポリメラーゼ連鎖反応(PCR)によりランダム突然変異誘発させた。
【0281】
突然変異体TyrRSライブラリーをまずクロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子の非必須位置(Asp112)のアンバー終止コドンの抑圧に基づくポジティブ選択にかけた。1mM L−3−(2−ナフチル)アラニンと80μg/mLクロラムフェニコールを加えた最少培地で突然変異体TyrRSライブラリーとmtRNACUA Tyr で形質転換した細胞を増殖させた。細胞は突然変異体TyrRSが天然アミノ酸又はL−3−(2−ナフチル)アラニンでmtRNACUA Tyr をアミノアシル化する場合にしか生存することができない。次に、クロラムフェニコールの存在下で非天然アミノ酸の不在下に生存細胞を増殖させた。生存しなかった細胞はmtRNACUA Tyr にL−3−(2−ナフチル)アラニンを負荷する突然変異体をコードすると思われるので、非天然アミノ酸を加えたレプリカプレートから抽出した。3回のポジティブ選択後にネガティブスクリーニングを行った後、CAT遺伝子でのAsp112TAGコドンの抑圧に基づくin vivoアッセイを使用して4個の突然変異体TyrRSを特性決定した。L−3−(2−ナフチル)アラニンの不在下では、選択したTyrRSとmtRNACUA Tyr を発現する細胞は1%グリセロールと0.3mMロイシンを含む最少培地プレート(GMMLプレート)でクロラムフェニコール濃度25〜35μg/mLで生存し、L−3−(2−ナフチル)アラニンの存在下では、細胞はGMMLプレートでクロラムフェニコール濃度100〜120μg/mLで生存した。TyrRSの不在下(4μg/mLクロラムフェニコール)のIC50値に比較してこれらの結果は選択したTyrRSがL−3−(2−ナフチル)アラニンを受容するが、天然アミノ酸もある程度まで負荷することを示している。
【0282】
天然アミノ酸に対する突然変異体TyrRSの活性を更に弱めるために、上記4種の突然変異体遺伝子を鋳型として使用してDNAシャフリングを1回行った。得られた突然変異体TyrRSライブラリーを更にポジティブ選択2回とネガティブスクリーニングにかけた。天然アミノ酸に対する活性が大幅に低下し(IC50=9μg/mLクロラムフェニコール)且つL−3−(2−ナフチル)アラニンに対する活性が増加(IC50=150μg/mLクロラムフェニコール)した1個の突然変異体TyrRS(SS12−TyrRS)が得られた。
【0283】
各種突然変異体TyrRSを使用した上記in vivo CATアッセイの結果を表2に示す。pYC−J17プラスミドを使用してmtRNACUA Tyr 遺伝子とAsp112にアンバー終止コドンをもつクロラムフェニコールアセチルトランスフェラーゼ遺伝子を発現させた。pBKプラスミドを使用してTyrRSを発現させ、pYC−J17と共に大腸菌DH10Bにコトランスフェクトした。各種濃度のクロラムフェニコールの存在下にGMMLプレートで細胞生存をアッセイした。
【0284】
表2. 突然変異体TyrRSのin vivoクロラムフェニコールアセチルトランスフェラーゼアッセイ
【0285】
マウスデヒドロ葉酸レダクターゼ(DHFR)のL−3−(2−ナフチル)アラニン突然変異体を作製して特性決定し、mtRNACUA Tyr /SS12−TyrRSがアンバー終止コドンに応答してL−3−(2−ナフチル)アラニンを部位特異的に組込むことができることを確認した。マウスDHFR遺伝子のTyr163コドンをTAGに突然変異させ、DHFRのCOOH末端にHis6タグを付けてNi2+アフィニティークロマトグラフィーを使用するタンパク質精製を容易にした。陽性対照として野生型M.jannaschii TyrRSをmtRNACUA Tyr と同時発現させ、TAGコドンをチロシンで効率的に抑圧した(図4)。1mM L−3−(2−ナフチル)アラニンの存在下にSS12−TyrRSをmtRNACUA Tyr と同時発現させると、全長マウスDHFRも生産された(液体GMML最少培地中収率2.2mg/L)。L−3−(2−ナフチル)アラニン、mtRNACUA Tyr 又はSS12−TyrRSの不在下では、全長DHFRは生産されなかった。ペンタ−His抗体を使用してウェスタンブロットでDHFRのCOOH末端のHis6タグを検出した。上記3成分の各々の不在下ではDHFRを検出することができなかった。
【0286】
マウスDHFRのL−3−(2−ナフチル)アラニン突然変異体のトリプシン消化物をMALDI FT−ICRと液体クロマトグラフィータンデム質量分析により分析した処、L−3−(2−ナフチル)アラニンの組込みが明白に確認された。内部校正消化物のペブチドマップはトリプシン消化ペプチドLLPEX* TGVLSEVQEEK(式中、X* はL−3−(2−ナフチル)アラニン残基を表す(Pro164をThrに突然変異させてアンバー抑圧効率を改善した))の理論質量から3.5ppm以内である1867.962に主ピークを示す。更に、所期ペプチドの二重負荷イオンに対応するm/z934.5における前駆体イオンのタンデム質量スペクトルの解釈を図5に示す。スペクトルからの配列情報をまとめると、タンパク質へのL−3−(2−ナフチル)アラニンの部位特異的組込みは明白である。ペプチドマップもLC MS/MS試験もL−3−(2−ナフチル)アラニン残基が他のアミノ酸により置換された突然変異体を示さなかった。ペプチドマップで観察された1500を上回るシグナル対ノイズ比はL−3−(2−ナフチル)アラニンの組込みの忠実度が99.8%を上回ることを示している。
【0287】
得られたSS12−TyrRSは突然変異Tyr32→Leu32、Asp158→Pro158、Ile159→Ala159、Leu162→Gln162、及びAla167→Val167をもつ。B.stearothermophilusからの対応残基はTyr32(Tyr34)、Asp158 (Asp176 )、Ile159 (Phe177 )、Leu162 (Leu180 )、及びAla167 (Gln189 )である(括弧内はB.stearothermophilus TyrRS残基)。
【0288】
相同B.stearothermophilus TyrRSの結晶構造によると、Tyr32→Leu32とAsp158→Pro158の突然変異はTyr32、Asp158と天然基質チロシン間の水素結合を失わせるのでチロシンとSS12−TyrRSの結合に不利であると考えられる。殆どの残基はL−3−(2−ナフチル)アラニンの結合を助長すると予想される疎水性側鎖をもつアミノ酸に突然変異される。
【0289】
要約すると、細胞増殖、タンパク質発現及び質量分析実験の結果、mtRNACUA Tyr /SS12−TyrRS対は天然アミノ酸に匹敵する忠実度でアンバーコドンに応答してL−3−(2−ナフチル)アラニンをタンパク質に選択的に挿入できることが判明した。
【実施例3】
【0290】
実施例3:アミノ、イソプロピル又はアリル含有チロシン類似体のin vivo組込み
FACに基づくスクリーニングシステムを使用してアミノ、イソプロピル又はアリル含有チロシン類似体を受容する3種の高度選択性シンテターゼ変異体を迅速に得た。このシステムでは多目的レポータープラスミドを使用してポジティブ及びネガティブ両者の選択圧をかけ、シンテターゼ活性を容易且つ定量的に評価した。クロラムフェニコールアセチルトランスフェラーゼ(CAT)マーカーによりM.jannaschiiチロシル−tRNAシンテターゼ(TyrRS)の活性のポジティブ選択を行った。T7ポリメラーゼ/GFPレポーター系により、非天然アミノ酸の存在下と不在下で増殖させた細胞内のシンテターゼ活性を評価した。蛍光活性化細胞ソーティング(FACS)を使用して天然アミノ酸を受容するシンテターゼ変異体をスクリーニングし、目視と蛍光分析によりシンテターゼ活性を夫々定性及び定量的に評価した。
【0291】
増幅性蛍光レポーター系の設計。生きた細胞でシンテターゼ活性を評価する汎用スクリーニングシステムを開発する試みは、シンテターゼ変異体集団に適用する選択圧、特にネガティブ選択圧をより精密に制御したいという要望に端を発した。多数のシンテターゼ変異体の活性を評価するためにシステムを使用しなければならないので、高スループットスクリーニングが可能なレポーターが追求された。更に、シンテターゼ活性を容易に定性及び定量評価できるようなレポーターが必要であった。これらの要件を満たすために、蛍光スクリーニングが考案された。このシステムは大腸菌での発現に最適化されたグリーン蛍光タンパク質の変異体であるGFPuvのシンテターゼ依存性生産に基づいて考案された(Crameri,A.,Whitehorn,E.A.,Tate,E.& Stemmer,W.P.,Nature Biotechnol.1996,14,315−319)。この蛍光体はFACSとフルオロメトリーで使用することができ、更に固体培地と液体培地で目視にも利用できる。このシステムはセレクター(例えばアンバーナンセンスコドン)のシンテターゼ依存性抑圧により蛍光シグナルを発生するように設計された。レポーターの感度を最大にするために、他の増幅可能な細胞内レポーター系と同様にGFPuvレポーター遺伝子の発現を誘導するように構成されたT7 RNAポリメラーゼ遺伝子内にアンバーコドンを配置することにより増幅可能にした(Lorincz,M.,Roederer,M.,Diwu,Z.,Herzenberg,L.A.,Nolan,G.P.Cytometry,1996,24,321−329;Zlokarnik,G.,Negulescu,P.A.,Knapp,T.E.,Mere,L.,Burres,N.,Feng,L.,Whitney,M.,Roemer,K.& Tsien,R.Y.,Science,1998,279,84−88)。アンバーコドンを含むT7 RNAポリメラーゼに合うようにRNA転写産物の生産を容易に最適化できるようにするために、T7 RNAポリメラーゼ遺伝子をアラビノースプロモーターの制御下においた。
【0292】
T7 RNAポリメラーゼ/GFPuvレポーター系の最適化。アラビノースプロモーターの制御下にアンバーコドンを含むT7 RNAポリメラーゼ変異体を発現させると共にT7プロモーターの制御下にGFPuv遺伝子を発現させるように中コピーレポータープラスミドpREPを設計した(図6a)。シンテターゼ依存性蛍光増加を最適化するように設計した12種の一連のT7 RNAポリメラーゼ変異体(図6b)をpREPに挿入してプラスミドpREP(1〜12)を作製した。全変異体は7アミノ酸(MTMITVH)のN末端リーダー配列と1〜3個のアンバー終止コドン(TAG)を含んでいた。変異体1〜3はリーダー配列のすぐ下流の1位の元のメチオニン(M1)を夫々1、2及び3個のアンバー終止コドンで置換していた。変異体4〜9は構造のループ領域に位置すると予想されるD10、R96、Q107、A159、Q169又はQ232に夫々置換するアミノ酸を含んでいた(Jeruzalmi,D.& Steiz,T.A.,EMBO J.,1998,17,4101−4113)。変異体10〜12はM1位でQ107、A159又はQ232に夫々置換するアンバー終止コドンを含んでいた。直交グルタミニル−tRNAシンテターゼとS.cerevisiae由来グルタミンtRNACUA を含む適合可能なプラスミドを使用して生きた細胞のフルオロメトリーとフローサイトメトリーによりプラスミド構築物の蛍光増加を検討した。プラスミドpREP(1〜12)は各種レベルのシンテターゼ依存性蛍光増加を生じることが判明し、最良構築物pREP(10)は不活性突然変異体に比較して野生型シンテターゼを含む細胞でフルオロメトリーにより220倍の蛍光(図6c)を示し、サイトメトリーにより〜400倍の蛍光中央値(図6d)を示した。pREP(10)内のアンバーコドンに対応する位置で各種官能基を置換した処、T7 RNAポリメラーゼ内の107位の許容性が高いことが判明した。
【0293】
多目的レポータープラスミドの構築。M.jannaschii TyrRSの変異体を選択及びスクリーニングするために使用する多目的プラスミドを構築するために、プラスミドpREP(10)をプラスミドpYC−J17(Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,2001,292,498−500)と融合し、pREP/YC−JUCUAを得た(図7b)。O−メチル−L−チロシン(OMY)の組込みに選択的なM.jannaschii TyrRSの変異体を発現する適合可能なプラスミド(pBK−mJYRS;Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,2001,292,498−500)を使用してプラスミドpREP/YC−JYCUAの機能をアッセイした。pREP/YC−JYCUAとpBK−mJYRSを導入した細胞をOMYの存在下に増殖させた処、プラスミドpYC−J17を使用して得られると同一の120μg/mlのクロラムフェニコール(Cm)IC50値を示し、フルオロメトリーで測定した場合にOMYの存在下に増殖させた細胞の蛍光強度は不在下の330倍であった。
【0294】
M.jannaschiiチロシル−tRNAシンテターゼの基質特異性の進化。チロシンのフェノール側鎖以外の化学基を選択的に受容するようにM.jannaschii TyrRSのアミノ酸側鎖結合ポケットを進化させることができることが報告されている(Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,2001,292,498−500;Wang,L.,Brock,A.,& Schultz,P.G.,J.Am.Chem.Soc.2002,124,1836−1837)。本発明者らはp−イソプロピルフェニルアラニン(pIF)、p−アミノフェニルアラニン(pAF)、p−カルボキシルフェニルアラニン(pCF)又はO−アリルチロシン(OAT)の4種の新規官能基(図7b)を酵素に受容させることによりM.jannaschii TyrRSによる非天然アミノ酸組込みの一般性を更に検討しようと試みた。チロシル環のパラ位に結合ポケットを形成すると考えられる残基であるY32、E107、D158、I159及びL162の位置にランダム変異をもつM.jannaschii TyrRS変異体のライブラリー(Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,2001,292,498−500)を、プラスミドpREP/YC−JYCUAを導入した細胞に導入した。ライブラリーダイバーシティ〜109 のこれらの細胞を使用してpIF、pAF、pCF又はOATに選択的なシンテターゼ変異体を同定する4種の進化実験を開始した(図7c)。Cmと4種の非天然アミノ酸の1種の存在下に細胞培養液を飽和まで増殖させることによりポジティブ選択を2サイクル行った。2サイクル目のポジティブ選択後に細胞アリコートを取出し、アミノ酸又はCmを加えない新しい培養物に接種するために使用し、培養物を再び飽和まで増殖させた。この時点で蛍光発光する細胞は20種の天然アミノ酸の1種を受容できるシンテターゼ変異体を含むと思われる。各株から約108 個の細胞をFACSによるネガティブスクリーニングにかけ、天然アミノ酸を受容するシンテターゼ変異体を排除した。蛍光発光しない細胞を集め、飽和まで増殖させることにより増幅した。これらの増幅細胞を使用して新規培養物に接種し、非天然アミノ酸とCmを加えた液体培地で最終サイクルのポジティブ選択にかけた。飽和まで増殖後に0、30、60又は100μg/mLCmと適当な非天然アミノ酸0又は1mMを加えた培地に各細胞集団を播種した。
【0295】
進化シンテターゼ変異体の同定と特性決定。pIF、pAF及びOATを加えたCmプレートはアミノ酸を加えないプレートの10〜100倍の数の蛍光コロニーを生じた。これに対して、pCF集団のプレートはpCF添加の有無に拘わらず同一数の蛍光コロニーを生じた。非天然アミノ酸を加えたプレートからのpIF、pAF及びOAT集団の各々から大きいほうから10個の蛍光コロニーを抽出し、非天然アミノ酸を添加するか又は添加せずに液体培地で飽和まで増殖させた。携帯長波長紫外線ランプを使用して蛍光発生の定性評価を目視により行った(図8a)。
【0296】
蛍光に有意差を生じるクローンに対応するシンテターゼ変異体を配列決定した。pIF及びpAF集団からの全10個のクローンは同一配列であったが、OAT集団からは3種の異なるクローンが同定された。全クローンで5カ所のランダム変異部位にアミノ酸置換があり、pIF−tRNAシンテターゼ(pIF−RS)変異体には更に2箇所の置換があった。各クローンの活性を定量評価した。非天然アミノ酸の存在下又は不在下に液体培地で増殖させた細胞で蛍光をフルオロメトリーにより測定した(図8b)。非天然アミノ酸の存在下又は不在下に各種Cm濃度で細胞をプレーティングすることによりCm IC50を測定した(図8c)。
【0297】
4位にアンバーコドンを含むミオグロブリン遺伝子を使用して非天然アミノ酸を含むタンパク質の生産を評価した。pIF、pAF又はOATの存在下又は不在下にpIF−RS、pAF−RS又はOMT−RS変異体を夫々使用して遺伝子を細胞で発現させた(図8d)。タンパク質収率は全3種の変異体で同等であり、非天然アミノ酸含有細胞培養液1リットル当たりタンパク質1〜2mgであった。他方、非天然アミノ酸の不在下に増殖させた培養液ではタンパク質生産はほとんど検出できなかった。タンパク質をエレクトロスプレー質量分析により分析した処、夫々の質量はpIF含有タンパク質18457.40±0.81(予想値18457.28)、pAF含有タンパク質18430.30±0.27(予想値18430.21)であった。Cm IC50、フルオロメトリー及びタンパク質発現分析を使用して得られた活性測定値はよく相関していたが、pIF−RSの活性はフルオロメトリーで多少低いようである。他のアッセイに比較して不釣り合いに低いpIF−RA変異体のフルオロメトリー測定値は、レポーター内のアンバー位置の見掛けの許容性にも拘わらずT7 RNAポリメラーゼがpIF類似体の組込み後に部分的に不安定になる可能性を示している。
【0298】
多目的レポーター系の有用性。本実施例に記載するレポーター系はポジティブ選択とネガティブスクリーニングの両者に単一の多目的プラスミドを使用できるので、ポジティブ選択とネガティブ選択で交互にプラスミドを交換する必要がなくなる。全体でたった3回のポジティブ選択と1回のネガティブスクリーニングで所望非天然アミノ酸を選択的に受容するシンテターゼ変異体を同定することができた。これらの特徴によりほんの数日間で進化実験を実施することができる。このスクリーニングシステムを使用すると、非天然アミノ酸を加えた寒天プレートを使用して活性シンテターゼ変異体を容易に同定することができ、変異体のアミノ酸特異性を個々にアッセイすることができる。
【0299】
上述のように、T7 RNAポリメラーゼ/GFP系はシンテターゼ変異体の活性を定量的に比較するために使用することができる。CATとバルナーゼに基づくポジティブ/ネガティブ選択(表2)を使用して本実施例に記載する3種のOAT−RSクローンと同一ライブラリーから独立して得られる別のOAT−RSクローンを入手できるので、各々に由来するシンテターゼ変異体について2種の異なる進化系を比較することが可能になる(図9)。この分析によると、ポジティブ選択とネガティブスクリーニング後に得られる3種のクローンはOATの存在下ではやや低い蛍光レベルを示すが、非天然アミノ酸の不在下では〜10分の1のバックグラウンドレベルを示す。従って、非天然アミノ酸の不在下に対して存在下で増殖させた細胞の蛍光増加は選択とスクリーニング後のOAT−RS(1)を発現する細胞がバルナーゼを使用するポジティブ/ネガティブ選択後のOAT−RSクローンを発現する細胞に比較して約6倍となる。この例が代表例であるか否かははっきりしないが、これらのデータはT7 RNAポリメラーゼ/GFP系が天然アミノ酸基質に対して無差別なシンテターゼ変異体を選択する際にストリンジェンシーを高くできることを示唆している。しかし、非天然アミノ酸は進化したシンテターゼ変異体との結合を競合して天然アミノ酸の結合が減るので、非天然アミノ酸の不在下よりも存在下で増殖させたほうが細胞の蛍光が増加するのは非天然アミノ酸組込みの忠実度の限界が低くなることに相当すると予想される。更に、忠実度が高いことは明らかに望ましいが、所望用途に応じて忠実度と総シンテターゼ活性のどちらかをとらなければならないと思われる。
【0300】
アミノアシルtRNAシンテターゼ進化の一般性。従来の報告と本明細書に記載する結果から明らかなように、M.jannaschii TyrRSのアミノ酸側鎖結合ポケットは非常に適応性がある。チロシンのフェノール側鎖の代わりに各種官能基を受容するように酵素を進化させることができ、これは高い選択性で実施できる。本願では、チロシン環のパラ位にヒドロキシルの代わりにアミン、イソプロピル又はアリルエーテル官能基を受容するように酵素を進化できることが立証された。
【0301】
プラスミド構築。プラスミドpREP(図6a)はT7 RNAポリメラーゼ遺伝子を含むBamHI/ApaLIオーバーラップPCRフラグメントをrrnB転写終結領域の上流に挿入した後にpBAD/Myc−HisAプラスミドからのaraC遺伝子及びaraプロモーター領域(Invitrogen;T7 RNAポリメラーゼ遺伝子の転写制御用)とGFPuv遺伝子(Clontech;T7ターミネーター領域の上流でT7プロモーターの下流)を含むApaLI/AhdIオーバーラップPCRフラグメントをプラスミドpACYC177(New England Biolabs)のAhaI/BamHI部位間に挿入することにより構築した。プラスミドpREP(1〜12)は位置にアンバー突然変異を含むオーバーラップPCRフラグメントでT7 RNAポリメラーゼのHpaI/ApaLIフラグメントを置換することにより構築した。プラスミドpREP/YC−JYCUAはpREP(10)からのAfeI/SacIIフラグメントとpYC−J17(Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,2001,292,498−500)からのEarI(平滑化)/SacIIフラグメントのライゲーションにより構築した。プラスミドpQを含む細胞に形質転換後に蛍光スクリーニングにより所望構築物を同定した。
【0302】
プラスミドpQはlacプロモーター領域の下流で大腸菌QRS終結領域の上流にScQRSを含むAatII/SalIオーバーラップPCRフラグメントと、lppプロモーター領域の下流でrrnC終結領域の上流にS.cerevisiae tRNA(CUA)Gln を含むSalI/AvaIオーバーラップPCRフラグメントと、pBR322(New England Biolabs)のAvaI/AatIIフラグメントの三重ライゲーションにより構築した。プラスミドpQDはBamHIとBglIIの間のpQフラグメントをScQRS(D291A)突然変異体のBamHI/BglIIフラグメントで置換することにより構築した。
【0303】
プラスミドpBAD/JYAMB−4TAGはプラスミドpYC−J17(Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,2001,292,498−500)と、MjYtRNACUA の遺伝子とpBADプロモーターと挿入遺伝子のヘテロ発現用クローニング領域を含むpBAD/Myc−HisA(Invitrogen)のハイブリッドであるpBAD/YC−JYCUAプラスミドにC末端6Hisタグを含むミオグロブリンのS4アンバー突然変異体のPCRフラグメントを挿入することにより構築した。
【0304】
フルオロメトリー及びサイトメトリー分析。所望プラスミドを含む単一コロニーを使用し、適当な抗体と0.002%アラビノースと必要に応じて適当な非天然アミノ酸を加えたGMML培養液2mLに接種した。培養液を飽和まで増殖させ、細胞(200μL)をペレット化してリン酸緩衝食塩水(PBS)1mLに再懸濁した。600nm吸光度により細胞濃度を分析し、FluoroMax−2フルオロメーターを使用して励起波長396nm、測定波長505nmで蛍光強度を測定した。PBSに懸濁した細胞をサイトメトリーにより分析した。pREP(10)のT7ポリメラーゼ遺伝子内のアンバー位置の許容性を評価するためには、レポータープラスミドを一連のサプレッサー株に形質転換した後、フルオロメトリーにより分析した。
【0305】
アミノアシル−tRNAシンテターゼ変異体の進化。Y32、E107、D158、I159及びL162の位置をランダム変異させたM.jannaschii TyrRS変異体(Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,2001,292,498−500)を、pREP/YC−JYCUAを含むDH10B大腸菌細胞(Life Technologies)に形質転換させ、ダイバーシティ〜109 のライブラリーを作製した。形質転換細胞をSOC培地で60分間37℃で再生させ、LB培地で飽和まで増殖させた。1回目のポジティブ選択を開始するために、ペレット化してGMML培地に再懸濁したライブラリー培養液2mLを使用し、25μg/mLテトラサイクリン(Tet)、35μg/mLカナマイシン(Kn)及び1mM pIF、pAF、pCF又はOAYを加えたGMML500mLに接種した。37℃で3時間培養後に終濃度75μg/mLとなるようにCmを加え、細胞を飽和まで(〜48時間)増殖させた。2回目のポジティブ選択では、Tet、Kn、75μg/mL Cm及び1mM pIF、pAF、pCF又はOAYを加えたGMML100mLに1回目のポジティブ選択からの細胞(500μL)を接種し、37℃で飽和まで(〜24〜36時間)増殖させた。ネガティブスクリーニングに備え、Tet、Kn及び0.02%アラビノース(Ara)を加えたGMML培地25mLに2回目のポジティブ選択からの細胞(100μL、ペレット化してGMMLに再懸濁)を接種し、37℃で飽和まで(〜24時間)増殖させた。Araで誘導して非天然アミノ酸の不在下に増殖させた細胞(1mL)をペレット化し、リン酸緩衝食塩水(PBS)3mLに再懸濁した。Coherent Enterprise IIイオンレーザーを351nmで励起し、575/25nm帯域フィルターで発光を検出することによりBDIS FACVantage TSO細胞ソーターを使用してGFPuvを発現しない細胞を選別した。細胞を集め、TetとKnを加えたLB少なくとも10容量で希釈し、飽和まで増殖させた。3回目のポジティブ選択を開始するために、ネガティブスクリーニングからの細胞100μLをペレット化し、GMMLに再懸濁したものを使用し、Tet、Kn及び1mM pIF、pAF、pCF又はOAYを加えたGMML25mLに接種した。3時間37℃で培養後に終濃度75μg/mLとなるようにCmを加え、細胞を飽和まで(〜24時間)増殖させた。3回目のポジティブ選択後に、Tet、Kn、0.002%Ara、0、75又は100μg/mL Cm、及び0又は1mMpIF、pAF、pCF又はOAYを加えたGMML/寒天に細胞をプレーティングし、37℃で48時間増殖させた。
【0306】
非天然アミノ酸を含有するタンパク質の発現と特性決定。pBAD/JYAMB−4TAGと適当なpBKプラスミドをコトランスフェクトしたDH10B細胞を使用し、KnとTetを加えて飽和まで増殖させたGMMLスターター培養液100mLに接種した。Kn、Tet、0.002%Ara、5μM FeCl3 及び所望非天然アミノ酸(又はなし)を加えた培養液500mLにスターター培養液50mLを接種し、飽和まで(〜18時間)増殖させた。培養液をペレット化し、音波処理し、QiaExpressionist(Qiagen)His−タグ精製キットのプロトールに従ってミオグロブリンタンパク質を分離した。タンパク質を12→20%グラジエントSDSポリアクリルアミドゲル電気泳動とエレクトロスプレー質量分析により分析した。
【実施例4】
【0307】
実施例4:自律21アミノ酸細菌の創製
上述のように、20種の共通アミノ酸は全公知生物で保存されている。しかし、本発明では例えば付加機能、構造決定等の拡張遺伝コードを提供する。拡張遺伝コードが例えば特定非天然アミノ酸を組込んだ細胞に有利であるか否かを調べるためには、所期非天然アミノ酸を生産してこれを組込む自律細菌が望ましい。本発明はこのような自律21アミノ酸生物を提供し、その成果を付加アミノ酸生物、例えば22アミノ酸生物等の創製に拡張することができる。自律細菌を創製するためには、一般に(i)単純な炭素源から新規アミノ酸を合成できること、(ii)この新規アミノ酸以外は利用しないアミノアシルシンテターゼ、及び(iii)前記シンテターゼ以外ではアシル化されず、他のアミノ酸をコードしないコドンに応答してアミノ酸をタンパク質に送達するtRNAの3点を一般に考慮する。
【0308】
遺伝コードへの新規アミノ酸のin vivo組込みを目的として膨大な研究が進められているが、これらの大半は正常な21アミノ酸細菌を作製するために組込み特異性をもたない。例えばHest,J.C.M.v.,K.L.Kiick and D.A.Tirrell,J.Am.Chem.Soc.,2000.122:p.1282;Hamano−Takaku,F.ら,J.Biol.Chem.,2000.275:p.40324;及びBudisa,N.ら,FASEB J.,1999.13:p.41−51参照。しかし、新規成分を大腸菌の翻訳機構に加え、各種新規アミノ酸を例えば高い忠実度でタンパク質に部位特異的にin vivo組込むことができることが最近示された。例えばWang,L.ら,Science,2001,292:p.498−500;及びWang,L.とP.G.Schultz,Chem.Comm,2002:p.1−10参照。また、2002年4月19日付け同時特許出願(発明の名称" Methods and Compositions for the Production of Orthogonal tRNA−tRNA Synthetase Pairs" ,発明者Schultzら)(代理人整理番号54−000130)も参照されたい。
【0309】
本発明は上記技術と生合成経路系を組合せて自律21アミノ酸細菌を創製する。更に、本発明はこのような生物が20種の天然アミノ酸を使用する生物よりも進化的効果があるか又は進化的効果をもつように進化させることができるかという問題に取り組む。
【0310】
完全自律細菌は一般に例えば非天然アミノ酸を生産するための生合成経路系と、非天然アミノ酸を細菌で1種以上のタンパク質に組込むための翻訳系を含む。翻訳系は一般にこの非天然アミノ酸のみを利用するアミノアシルシンテターゼと、このシンテターゼ以外ではアシル化されず、他のアミノ酸をコードしないコドンに応答して非天然アミノ酸をタンパク質に送達するtRNAを含む。1態様では、改変細菌を最大限に制御できるように生合成経路系遺伝子とアミノアシルシンテターゼ遺伝子とtRNA遺伝子を一般に別々のプラスミドに配置する。
【0311】
1例では、非天然アミノ酸としてp−アミノフェニルアラニン(pAF)を生合成し、タンパク質にin vivo組込む。pAFは場合により例えばその有利な物性(例えばπ供与効果、水素結合特性、弱塩基性、大腸菌に対する毒性の欠如、及び公知二次代謝物であるという事実)に基づいて自律細胞の非天然アミノ酸として選択する。更に、クロラムフェニコールとプリスチナマイシン生産の代謝中間体としてpAFを生産する遺伝子はStreptomyces VenezuelaeとStreptomyces pristinaespiralisで夫々同定されている。例えばYanai,K.ら,Streptomyces venezuelae genes papA,papB,papC,PCT国際出願,2001,明治製菓株式会社:日本国.p.1−83;及びBlanc,V.ら,Identification and analysis of genes from Streptomyces pristinaespiralis encoding enzymes involved in the biosynthesis of the 4−dimethylamino−L−phenylalanine precursor of pristinamycin 1.Molecular Microbiology,1997,23(2):p.191−202参照。上述のように、pAFは場合によりS.Venezuelae酵素PapA、PapB及びPapCと大腸菌アミノトランスフエェラーゼを使用して大腸菌でコリスミン酸2(芳香族アミノ酸合成の生合成中間体)から合成する。例えば図15Aに示すようなプラスミドを場合により使用して細胞を形質転換し、それ自体のin vivopAF供給源を合成する細胞を提供する。pAFのin vivo生合成に使用するプラスミドの1例を配列番号67に示す。配列番号68はコリスミン酸からpAFへの変換を行うために使用される酵素をコードする個々の遺伝子papABCの配列を示す。
【0312】
細胞が非天然アミノ酸(例えばpAF、O−メチル−L−チロシン、グリコシル化アミノ酸、L−dopa等)を生産するように改変されると、この細胞は一般に非天然アミノ酸を細胞内で1種以上のタンパク質に組込むための翻訳系も付加される。生合成経路系を含むように細胞を改変するのに使用するプラスミドとは別のプラスミドにより翻訳系を細胞に導入すると、例えばコピー数、プロモーター等に関する細胞内のプラスミドの機能をより精密に制御できるので、一般には別のプラスミドを使用する。
【0313】
翻訳機構は一般に例えば2002年4月19日付け同時特許出願(発明の名称" Methods and Compositions for the Production of Orthogonal tRNA−tRNA Synthetase Pairs" ,発明者Schultzら)(代理人整理番号54−000130)に記載されているように直交tRNA/RS対を含む。例えば、場合によりMethanococcus jannaschiiチロシル−tRNAシンテターゼ(TyrRS)と突然変異体チロシンアンバーサプレッサーtRNA(mtRNACUATyr)の対を出発点として使用してpAFの直交tRNA/RS対を予備作製する。例えばWang,L.ら,A new functional suppressor tRNA/aminoacyl−tRNA synthetase pair for the in vivo incorporation of unnatural amino acids into proteins.J.Am.Chem.Soc.,2000 122:p.5010−5011;及びWang,L.とP.G.Schultz,Chem.and Biol.,2001,8:883参照。
【0314】
例えば、場合によりpAFを受容し且つ20種の共通アミノ酸のいずれをも受容しないようにM.jannaschii TyrRSのアミノ酸特異性を改変することによりpAF特異的シンテターゼ(pAFRS)を作製する。例えばWang,L.ら,Expanding the genetic code of Escherichia coli.Science,2001,292:p.498−500;WangL.とP.G.Schultz,Expanding the Genetic Code.Chem.Comm.,2002:1:1−10;及びWang,L.,A.Brock,and P.G.Schultz,Adding L−3−(2−naphthyl)alanine to the genetic code of E.coli.J.Am.Chem.Soc.,2002.124:p.1836参照。場合によりポジティブ選択とネガティブスクリーニングの組合せを使用し、5カ所(例えばTyr32、Glu107、Asp158、Ile159及びLeu162)にランダムアミノ酸を含むTyr32変異体のライブラリーからpAFrs酵素を同定する。場合により例えば2002年4月19日付け同時特許出願(発明の名称" Methods and Compositions for the Production of Orthogonal tRNA−tRNA Synthetase Pairs" ,発明者Schultzら)(代理人整理番号54−000130)に記載されているように、選択とスクリーニングの両者に単一レポータープラスミドを使用する。ポジティブ選択は一般に例えばpAF又は内在アミノ酸によるクロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子内の許容位置のTAGコドンの抑圧に基づいて行う(例えばWang,L.ら,Expanding the genetic code of Escherichia coli.Science,2001,292:p.498−500;Pasternak,M.,T.J.Magliery,and P.G.Schultz,A new orthogonal suppressor tRNA/aminoacyl−tRNA synthetase pair for evolving an organism with an expanded genetic code.Helvetica Chemica Acta,2000 83:p.2277参照)。pAFを含む液体培地で増殖させたTyrRSライブラリーとレポータープラスミドを含む細胞を一般に例えばクロラムフェニコール(Cm)の存在下での生存に関して選択する。T7 RNAポリメラーゼ遺伝子内の許容位置の2個のUAG終止コドンの抑圧に基づくネガティブスクリーニングはグリーン蛍光タンパク質(GFP)の発現を誘導する。pAFとCmの不在下で増殖させた細胞をポジティブ選択した後、一般に例えば蛍光活性化細胞ソーティング(FACS)を使用して蛍光の欠如についてスクリーニングする。
【0315】
pAFrsの進化:レポータープラスミドpREP(2)/YC−JYCUAはCAT、T7 RNAポリメラーゼ、GFP及びmtRNACUA Tyr 、Tet耐性選択マーカーを含む(Santoro未公開文献)。CAT遺伝子はD112位置にTAGコドン置換を含む。T7 RNAポリメラーゼ遺伝子は7アミノ酸N末端リーダーペプチドとM1及びQ107にTAG置換を含む。ポジティブ選択では、35μg/ml Kn、25μg/ml Tet、75μg/ml Cm及び1mM pAF(Sigma)を加えたGMML最少培地で細胞を増殖させた。ネガティブスクリーニングでは、35μg/ml Kn、25μg/ml Tet及び0.002%アラビノースを加えたGMML培地で細胞を増殖させた。Coherent Enterprise IIイオンレーザーでBDIS FACVantage TSO細胞ソーターを使用してFACSを実施した。励起波長は351nmとし、575/25nm帯域フィルターで発光を検出した。細胞を集め、TetとKnを加えたLB少なくとも10容量で希釈し、飽和まで増殖させた。
【0316】
pAF生合成経路の付加:papA、papB及びpapC遺伝子はS.Venezuelae(ATCC10712)ゲノムDNAからPCR増幅した。遺伝子papABCをオーバーラップPCRにより組み立て、pSC101由来プラスミドpLASCに挿入し、アンピシリン選択により維持した。LacZ、malE及びcroの5' UTRからリボソーム結合部位(rbs)を得、夫々papA、papB及びpapCの前に配置した。papABC遺伝子をlac及びlppプロモーターの制御下におき、2種の経路プラスミドpLASC−lacPW及びpLASC−lppPWを得た。
【0317】
pAFRSによるpAF生合成の試験:レポータープラスミド(pREP(2)/YC−JYCUA)とシンテターゼ(pAFRS)と経路プラスミド(pLASC−lacPW及びpLASC−lppPW)の3種のプラスミドを含む大腸菌DH10B細胞をGMML最少培地で飽和まで増殖させた(バックグラウンド、pAFなし、1mM外来pAF試験にはpLASCを使用した)。プラスミドを導入せずにDH10Bを増殖させ、レポータープラスミドのバックグラウンド抑圧レベルを測定した。各細胞増殖試料をOD1.0(600nm)まで水で希釈し、200μLをペレット化した。細胞を1%PBS1mLに懸濁し、Fluoromax−2蛍光検出器を使用して分析した(励起波長は351nmとし、505nmのピーク発光をモニターした)。DH10Bは1.0×104蛍光単位を発生したが、レポーター系からのバックグラウンド蛍光(pAF添加せず)は2.5×104蛍光単位であった。lacPW、lppPW及び外部から加えた1mM pAFは夫々7.9×104、3.0×106、及び3.0×104蛍光単位を発生した。IPTGはレポータープラスミド(pREP(2)/YC−JYCUA)でアラビノースプロモーターに阻害作用があるため、lacPWをIPTGで誘導することはできなかった。
【0318】
芳香族アミノ酸濃度:110μg/mlアンピシリンを加えたGMML最少培地(1%グリセロール、0.3mMロイシン)でpLASCプラスミドとpLASC−lacPW又はpLASC−lppPWを含む大腸菌DH10B細胞を飽和まで増殖させた。外部からpAFを加えて増殖させた細胞は増殖開始時に1mMアミノ酸を含んでいた。細胞を遠心分離により回収し(100ml)、洗浄し、水1mlとトルエン0.2mlを加えた。細胞を37℃で30分間震盪した後、遠心分離により分離した。水層を濾過(microcon YM−10)し、HPLC−MS(Agilent 1100)により分析し、1%TFA/アセトニトリル1%TFA(95:5)→(5:95)のグラジエントを用いてZorbax SB−C18カラム(5μm,4.6×150mm)で10分間かけて水層5〜15μLを分離した。全イオン質量スペクトルからそのMW(+1)を差し引くことによりアミノ酸を同定した。差し引いたイオンの面積を使用して各試料に存在するアミノ酸の量を計算した。細胞濃度は細胞ペレット中に存在する水分(70重量%)に基づいて計算した。
【0319】
pAFを含有するタンパク質の発現:テトラサイクリン耐性を付与したプラスミドpBAD/JYAMB−4TAGを使用してlppプロモーターとrrnCターミネーターの制御下にTyrCUAmutRNA遺伝子を発現させ、(Ser4にアンバー終止コドンをもつ)ミオグロブリン遺伝子をアラビノースプロモーターとrrnBターミネーターの制御下に発現させた。ミオグロブリンのカルボキシ末端にはhis6タグを付けた。TyrRS及びpAFRS遺伝子はカナマイシン耐性を付与したpBR322由来プラスミドで大腸菌GlnRSプロモーター及びターミネーターの制御下に発現させた。papABC遺伝子は天然ターミネーターの制御下にpLASC−lacPW又はpLASC−lppPW(13)から発現させた。0.002%アラビノースを加えた最少培地0.5LでプラスミドpBAD/JYAMB−4TAG、pBK−TyrRS又はpBK−pAFRSとpLASC由来プラスミド(指示に応じてpLASC、pLASC−lacPW又はpLASC−lppPW)を含む大腸菌DH10B細胞を増殖させた。外部からpAFを加える発現試験は終濃度1mM pAF(Sigma)とした。全試験で細胞を飽和まで(20〜30時間)37℃で平行して増殖させ、ペレット化し、天然条件下で製造業者のプロトコール(Qiagen,Valencia,Ca)に従ってNi+アフィニティークロマトグラフィーによりタンパク質を精製した。12%SDSポリアクリルアミドゲルで各調製物からの最終タンパク質溶液(3.5ml)から15μlを分離し、銀染色した。
【実施例5】
【0320】
実施例5:非天然アミノ酸を生合成するように遺伝子組換えした大腸菌細胞へのO−メチル−L−チロシンのin vivo組込み
本明細書に記載するように、本発明の1側面は大腸菌における非天然アミノ酸の生合成経路である。これは例えば新規酵素の遺伝子を細胞に付加するか又は既存大腸菌経路を改変することにより得られる。本実施例では、非天然アミノ酸O−メチル−L−チロシンを生産するように大腸菌を遺伝子組換えした。
【0321】
植物O−メチルトランスフェラーゼはヒドロキシル基をメトキシル基に変換する二次代謝に関与する酵素である。(イソ)オイゲノールO−メチルトランスフェラーゼ(IEMT)とカフェイン酸O−メチルトランスフェラーゼ(COMT)(Clarkia breweri)の2種の酵素を大腸菌組込みに選択した。IEMTはオイゲノール/イソオイゲノールをメチル化し、COMTはカフェイン酸をメチル化する。これらの2種の酵素の基質はチロシンに類似する。しかし、これらの酵素はいずれも高い基質特異性とメチル化部位特異性をもつ。
【0322】
併用アプローチを使用して両酵素のチロシンに対する基質特異性を進化させ、チロシンをO−メチル−L−チロシンに変換させた。タンパク質の活性部位を突然変異させて大きな突然変異体ライブラリーを作製し、数回選択を行った。3個のクローンが同定された。クローンを特性決定し、少なくとも1個を選択してO−メチル−L−チロシンを生合成する大腸菌株を作製した。上記実施例1に記載したような直交tRNA/RS対も発現するようにこの大腸菌株を遺伝子組換えし、非天然アミノ酸の自律in vivo組込みを行う細胞を得た。
【実施例6】
【0323】
実施例6:重原子アミノ酸のin vivo組込み
構造に基づく薬剤発見は歴史的に時間と労力のかかるプロセスであり、産業界では薬剤発見プログラムの一端でしか使用されていない。障害の1つはタンパク質構造を決定するためにX線結晶解析を使用する際に遭遇する位相問題である。一般に、セレノメチオニンの存在下でタンパク質を再発現させなければならないので仕事量が倍増する上、必ずしも結晶化に成功するとは限らない。別法は重原子を加えた溶液に結晶を浸漬する方法であるが、結晶が粉砕する恐れがある。重原子含有非天然アミノ酸のin vivoタンパク質組込みはタンパク質結晶構造の決定を促進する有用なツールである。
【0324】
p−ヨードフェニルアラニンとp−ブロモフェニルアラニンのタンパク質への部位特異的in vivo組込みを行った。ヨウ素と臭素は重原子であり、これらを組込みとMADを使用する場合に位相を決定し易くなる。非天然アミノ酸を使用して重原子を部位特異的に導入すると、重原子の位置を選択する際に選択性と柔軟性も得られる。
【0325】
実施例1に記載した方法と組成に従ってp−ヨードフェニルアラニンとp−ブロモフェニルアラニンに夫々特異性をもつ突然変異体シンテターゼを作製した。非天然アミノ酸のin vivo組込みを使用してp−ヨードフェニルアラニンとp−ブロモフェニルアラニンとして臭素又はヨウ素を選択的に導入したタンパク質Zドメイン(B.Nilssonら,Protein Eng.1:107−113(1987))を発現させた。標準プロトコールに従ってタンパク質結晶トレーをセットした。
【0326】
タンパク質の三次元構造をX線結晶解析により決定し、タンパク質に含まれる重原子を使用して位相を決定した。
【実施例7】
【0327】
実施例7:メタチロシン類似体のin vivo組込み
(実施例1に記載した)mtRNACUA Tyr をメタチロシン類似体でアミノアシル化するために直交TyrRSを作製した。
【0328】
突然変異体TyrRSライブラリープラスミドの作製。実施例1に記載した方法にほぼ従って、メタ置換チロシン誘導体に特異的な突然変異体M.jannaschii TyrRSをコードするプラスミドのライブラリーを構築した。要約すると、上記実施例1に記載したようにNNKコドンスキームを使用してBacillus stearothermophilus TyrRSの結晶構造中の結合チロシンのアリール環のメタ位から6.9Å以内にあるM.jannaschii TyrRSの活性部位の6個の残基(Tyr32、Ala67、His70、Gln155 、Asp158 、Ala167 )をDNAレベルで全20種のアミノ酸に突然変異させた。構築したプラスミドライブラリーpBK−libは約1×109 個の独立クローンを含んでいた。
【0329】
m−アセチルフェニルアラニン組込みのための直交tRNA−シンテターゼ対の進化。ポジティブ選択3回とネガティブ選択2回を行った後にクロラムフェニコール中での生存が非天然アミノ酸付加に依存する5個の候補クローン(配列番号17〜21)を得た。m−アセチルフェニルアラニンの不在下では、3種の突然変異体TyrRSプラスミドのうちの1種を含む細胞のクロラムフェニコール耐性のIC50は20μg/mlである。m−アセチルフェニルアラニンの存在下では、同一細胞のクロラムフェニコール耐性のIC50は100μg/mlである。これらの2つの数値の大差は選択したシンテターゼが細胞内で天然アミノ酸よりもm−アセチルフェニルアラニンを特異的に組込むことができることを示している。m−メトキシフェニルアラニンのデータも同様であり、5個のクローンを分離した(配列番号22〜26)。
【0330】
非天然アミノ酸を組込んだDHFRのタンパク質発現。上記で選択したm−メトキシフェニルアラニン及びm−アセチルフェニルアラニンシンテターゼを使用して上記実施例1に記載したようにDHFRでアンバーコドンに応答して該当非天然アミノ酸を組込ませた。陰性対照として、tRNA/シンテターゼの直交対とDHFRをコードするアンバー突然変異体ベクターの両者を含む細胞を非天然アミノ酸の不在下に増殖させた。タンパク質発現の結果を図10に示す。これらの結果は、tRNA/シンテターゼの直交対が非天然m−メトキシフェニルアラニン及びm−アセチルフェニルアラニンを特異的に組込むことを明白に示した。DHFRタンパク質の発現収率はどちらの場合も約0.5mg/L培養液であった。
【0331】
結合手としてのメタアセチルフェニルアラニンの利用。m−アセチルフェニルアラニンを組込んだDHFRタンパク質を細胞外と細胞内の両者でmg規模のヒドラジド誘導体で標識した。カルボキシル基は水溶液中でヒドラジドと迅速に反応し、生理的条件下で安定なヒドラゾンを形成する(Shao,J.;Tam,J.J.Am.Chem.Soc.117,3893−3899(1995))。この化学を使用してSchultzらはケトンを含む精製T4リゾチームをフルオレセインヒドラジドで特異的に標識している(Cornish,V.W.;Hahn,K.M.;Schultz,P.G.J.Am.Chem.Soc.118,8150−8151(1996))。
【0332】
精製m−アセチルフェニルアラニンを組込んだDHFRタンパク質を水性緩衝液中でフルオレセインヒドラジドで処理した。平行対照として、精製m−メトキシフェニルアラニンを組込んだDHFRタンパク質も同一反応条件にかけた。反応後、両者タンパク質を精製した後、491nmで励起すると、図11に示す蛍光発光スペクトルが得られた。同一条件下で精製m−アセチルフェニルアラニンを組込んだDHFRはフルオレセインヒドラジドで標識されたが、m−メトキシフェニルアラニンは標識されなかった。
【0333】
フルオレセインヒドラジドは細胞浸透性であり、4℃で細胞を溶解しない。従って、m−アセチルフェニルアラニンを組込んだDHFRタンパク質を細胞内でフルオレセインヒドラジドで標識することができる。「ケトン結合手」を組み込んだDHFRを発現する細胞をフルオレセインヒドラジド溶液と共にインキュベートした。4℃で36時間インキュベートし、十分に洗浄して過剰なフルオレセインヒドラジドを除去した後に、標識DHFRタンパク質を精製し、蛍光発光試験にかけた。平行陰性対照として、m−メトキシフェニルアラニンを組込んだDHFRも同一手順で精製した。無傷細胞をフルオレセインヒドラジドで標識した後にDHFRを精製した場合にも細胞外実験(図15)と同様の結果が得られた。
【0334】
これらの実験は少なくとも1種の非天然アミノ酸を組込んだタンパク質の有用性の1例を実証するものである。他の化合物を使用して少なくとも1種の非天然アミノ酸を組込んだタンパク質をin vivo標識することもできる。例えばビオチンヒドラジドや他のヒドラジド誘導体が挙げられる。
【実施例8】
【0335】
実施例8:光反応性アミノ酸のin vivo組込み
序論:光架橋性アミノ酸を遺伝的にコードし、特定タンパク質に特異的にin vivo組込む実験を行った。その後、光反応基付加用時間制御の励起により必要に応じてこのタンパク質を架橋させた。
【0336】
本発明は例えばタンパク質相互作用の検討に有用である。例えば、本発明はタンパク質中の架橋基の位置を変えることにより各種細胞成分との相互作用を媒介するタンパク質一次配列における残基を決定するのに有用である。タンパク質とこのタンパク質と相互作用する分子の間には共有結合が形成されるので、弱い相互作用や一過的な相互作用を検出することが可能である。
【0337】
アリールアジドとベンゾフェノンの2種の化学官能基は300nm(これ以下では光酸化によるタンパク質損傷が問題になることがある)を上回る波長で活性化できるので架橋基として傑出している。これらの2種の架橋基を非天然アミノ酸p−アジドフェニルアラニンとp−ベンゾイルフェニルアラニンに夫々組込んだ(図12)。
【0338】
光架橋性アミノ酸に特異的なO−RSの作製。実施例1に記載した直交対であるMethanococcus jannaschii mtRNACUA Tyr /TyrRS対を出発点として使用して架橋性非天然アミノ酸p−アジドフェニルアラニン(pBpa)に特異的なO−RSを作製した。突然変異誘発、スクリーニング及び選択方法は実施例1に記載した実験概要に従って実施した。要約すると、5個の残基(Tyr34,Glu107,Asp158,Ile159,Leu162)をランダム突然変異させた突然変異体のMjTyrRSライブラリーを作製した。これらの残基は相同残基(Tyr34,Asn123,Asp176,Phe177,Leu180)が結合チロシンのアリール環のパラ位から6Å以内にあるアデニル酸チロシルと複合化したBacillus stearothermophilus TyrRSの結晶構造(P.Brick,T.N.Bhat & D.M.Blow Journal of Molecular Biology 208,83(1989))に基づいて選択した。突然変異体TyrRSライブラリーをクロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子の許容部位(Asp112)のアンバー終止コドンの抑圧の基づくポジティブ選択にかけた。シンテターゼライブラリーとCAT突然変異体で形質転換した細胞を1mM pBpaとクロラムフェニコールの存在下に増殖させようと試みた。生存細胞は直交mtRNACUA Tyr に天然又は非天然アミノ酸を負荷することが可能なシンテターゼを含んでいた。mtRNACUA Tyr と許容部位に3個のアンバー突然変異(Gln2,Asp44,Gly65)を含む毒性バルナーゼタンパク質をコードする遺伝子の変異体(Wang,L.,Brock,A.,Herberich,B.& Schultz,P.G.,Science,292,498−500(2001))を含む細胞にこれらのシンテターゼ遺伝子を導入した。pBpaの不在下でこれらの細胞を増殖させ、天然アミノ酸を利用することが可能なシンテターゼを選択した。
【0339】
5回のポジティブ及びネガティブ選択後に、全長CAT及びT7 RNAポリメラーゼ(T7 RNAP)の生産が夫々CAT及びT7 RNAP遺伝子中のアンバー終止コドンの抑圧に依存するレポーター株(Santoro SW,Schultz PG.Proc Natl Acad Sci U S A Apr 2;99(7):4185−90(2002))に生存シンテターゼプラスミドを形質転換した。T7 RNAPはグリーン蛍光タンパク質(GFP)の発現を誘導するので、これらの細胞をフルオロメトリーによりスクリーニングすることができる。96個のクローンをpBpa依存性クロラムフェニコール耐性とGFP蛍光についてスクリーニングした。6個の別個のシンテターゼが1mM pBpaの存在下と不在下に夫々120mg/Lと5mg/LのIC50で大腸菌にIleクロラムフェニコール耐性を付与し、同時にpBpa依存性GFP蛍光も示した。pBpaの存在下と不在下のクロラムフェニコール耐性の大差は選択したシンテターゼ/tRNA対がアンバーコドンに応答して細胞に含まれる全20種の天然アミノ酸よりも実質的にin vivo特異的にpBpaを挿入することを示している。
【0340】
ミオグロブリンへのpBpaのin vivo組込み。pBpa組込みの忠実度と効率を測定するために、(C末端His6タグを付けた)マッコウクジラミオグロブリンのSerのコドンをアンバーコドンに変換した。Mjp−BpaRS−1、mtRNACUA Tyr とpBpaの両者の存在下に2mg/Lの精製収率で全長ミオグロブリンが生産された。pBpaによる特異的アンバー抑圧に関与する3成分(アミノ酸、シンテターゼ又はtRNA)のいずれかを除くと、ミオグロブリンのC末端His6タグに対する銀染色又はウェスタンブロットによりミオグロブリンタンパク質を検出することができなかった。このデータは選択したシンテターゼがpBpaに非常に選択的であることを更に裏付けている。
【0341】
突然変異体ミオグロブリンのエレクトロスプレーイオン化イオントラップ質量分析によるとpBpaを含むタンパク質の質量計算値である18519.0に一致する質量18159±0.5が得られた。これはpBpaがタンパク質の単一部位に組込まれたことを裏付けている。天然アミノ酸に対応する質量スペクトルに質量は観察されず、pBpaが高い忠実度で組込まれたことを更に裏付けている。
【0342】
突然変異体O−RSの配列分析。選択したシンテターゼは興味深い配列収束を示す。M.jannaschii TyrRSのTyr32は6個の突然変異体シンテターゼクローンのうちの5個でアラニン又はグリシンに変換される。M.jannaschii TyrRSのAsp158は選択した6個の突然変異体のうちの5個でスレオニンに変換され、Ile159は6個の突然変異体のうちの4個でセリンに変換される。セリン又はプロリン置換はM.jannaschii TyrRSの107位に位置し、Leu162は6個の突然変異体のうちの4個で保存されている。この分析から突然変異のコンセンサス組合せ(32:Gly,Ala/107:Ser,Pro/158:Thr/159:Ser/162:Leu)が判明した。
【0343】
GSTへのpBpaのin vivo組込み。タンパク質−タンパク質相互作用のマッピングにおけるこの方法の有用性を立証するために、グルタチオン−S−トランスフェラーゼを用いて架橋実験を実施した。このタンパク質はグルタルアルデヒドを使用して予め非特異的に架橋されている2個の同一サブユニットのダイマーである。ダイマーSchistosoma Japonicaグルタチオン−S−トランスフェラーゼ(SjGST)の結晶構造(McTigue,M.A.,Williams,D.R.& Tainer,J.A.Journal of Molecular Biology 246,21−27(1995))を使用してpBpaで置換する2部位、即ち結晶構造のダイマー界面に隠れている残基Phe52と溶媒に暴露されている残基Tyr198を同定した。27kDaタンパク質SjGSTの遺伝子におけるPhe52又はTyr198に対応するコドンをアンバーコドンで置換した。次に、直交シンテターゼtRNA対を使用し、大腸菌でSjGSTのこれらの部位にpBpaを部位特異的に組込んだ。長波長紫外線を照射すると、精製SjGSTは共有結合ホモダイマーに変換されることが変性SDS PAGEにより分かった。存在するSjGSTの約70%が5分間で架橋した。これに対して、野生型SjGST又はダイマー界面の外側に位置する残基198にpBpaを組込んだSjGSTを使用した対照実験ではUV照射に応答する架橋を検出できない。
【0344】
これらの結果は、タンパク質−タンパク質相互作用に関与するアミノ酸を決定するために部位特異的pBpa置換を使用できることを示している。
【0345】
突然変異体シンテターゼの特性決定。DH10B/pREP(2)/YC−JYCUAにおける各シンテターゼクローンを使用し、カナマイシンとテトラサイクリンを30、20mg/Lまで加えたLB0.5mLに接種した。20時間増殖(37℃、300rpm)後に細胞をdH2 Oで104 倍に希釈し、レプリカを2組のGMMLプレートにスポットした。第1組のプレートにはカナマイシン及びテトラサイクリン夫々30及び20μg/Lと濃度0μg/L〜110μg/Lのクロラムフェニコールを加えた。第2組のプレートは1mM pBpaを加えた以外は第1組と同一とした。48時間後に、クロラムフェニコールを加えないプレート上のコロニーの半数が見えるクロラムフェニコール濃度からpBpaの存在下と不在下のクロラムフェニコール耐性のIC50を計算した。Stormホスホイメージャー(Molecular dynamics)を使用してpBpaの存在下と不在下のGFP発現を画像化した。GFPシグナルとクロラムフェニコール耐性の両者に最大のアミノ酸依存性を示す突然変異体シンテターゼ遺伝子を標準方法により分離し、配列決定した。
【0346】
タンパク質発現。アラビノースプロモーターとrrnBターミネーターにつなげた突然変異体SjGST遺伝子と、lppプロモーターとrrnCターミネーターにつなげたmtRNACUA Tyr と、テトラサイクリン耐性マーカーを含むプラスミドPYC/SjGSTmutを、p−BpaRSを発現するpBKベクターと共にDH10B大腸菌にコトランスフェクトした。カナマイシン30μg/Lとテトラサイクリン25μg/Lを加えた2x−YT10mL中で細胞を増幅した後、PBSで洗浄したものを使用し、適当な抗生物質とpBpa1mMまでを加えた液体GMML1Lに接種した。アラビノース0.2%までを加えてから5時間増殖させることによりOD600 =0.6でタンパク質発現を誘導した。細胞を遠心分離により回収し、Ni−NTAアフィニティークロマトグラフィーを使用してC末端ヘキサヒスチジンタグによりタンパク質を精製した。
【0347】
0.002%アラビノースで誘導した以外はSjGSTと同様の方法でpBAD/JYAMB−4TAGを含む細胞からマッコウクジラミオグロブリンを発現させ、精製した。質量分析用試料をNAP−10カラム(Pharmacia)で脱塩し、HPLCにより精製した。pBpaの組込みを確認するために、エレクトロスプレーイオン化イオントラップ質量分析によりタンパク質質量を確認した。
【0348】
突然変異体SjGSTクローニング。pGEX−3(Pharmacia)を鋳型としてオーバーラップPCRにより突然変異体SjGST遺伝子を組み立てた。全PCR反応は製造業者の指示に従ってExpand PCRキット(Roche)を使用して実施した。得られた遺伝子をNcoI及びKpnI制限酵素で消化し、予め消化して脱リン酸しておいたpBADJYCベクターの同一制限部位間にC末端ヘキサヒスチジンタグとインフレームでクローニングした。全最終構築物はDNAシーケンシングにより確認した。
【0349】
光架橋。架橋反応は(50mM NaH2 PO4 ,300mM NaCl,250mMイミダゾール中)10ng/μL SjGST100μLを使用して96穴マイクロタイタープレート(Nuncsorb)で4℃で実施した。携帯UVランプ(115V,60Hz,0.2A;Spectronics,NY,USA)を使用して365nmで試料に1分間又は5分間照射した。試料をウェルから取出し、SDSローディング緩衝液で希釈し、10→20%グラジエントゲルでSDS−PAGEにより生成物を分解した。SjGSTをPVDF(Biorad)に移し、ヤギ抗GST(Pharmacia)と二次マウス抗ヤギHRPコンジュゲート(Sigma)を使用してウェスタンブロットにより探索した。Super Signal West(Pierce)を使用してシグナルを発生させ、ハイパーフィルム(Amersham)で露光して可視化した。
【実施例9】
【0350】
実施例9:メタ置換フェニルアラニンの合成
1側面では、本発明は式IV:
【0351】
【化4】
【0352】
及び式V:
【0353】
【化5】
に示すメタ置換フェニルアラニンを提供する。
【0354】
式IVは3−アセチルフェニルアラニンの構造を示し、式Vは3−メトキシフェニルアラニンを示す。
【0355】
メタ置換フェニルアラニンは図14に要約するような手順で合成される。一般に、NBS(N−ブロモスクシンイミド)をメタ置換メチルベンゼン化合物に加えてメタ置換臭化ベンジルを得た後、マロン酸化合物と反応させてメタ置換フェニルアラニンを得る。メタ位に使用する典型的置換基としてはケトン、メトキシ基、アルキル、アセチル等が挙げられるが、これらに限定されない。特定例を以下に示す。
【0356】
NBS(N−ブロモスクシンイミド)を使用前に沸騰水から再結晶させた。NBS(1.85g,10.5mmol)を3−メチルアセトフェノン(1.34g,10mmol)の溶液に加えた。AIBN(2' ,2' −アゾビスイソブチロニトリル)(0.043g,0.25mmol)を混合物に加えた。反応混合物を4時間還流させた。反応の完了をTLC(8:1/ヘキサン:EtOAc)により確認した。水を加えて反応を停止した後に有機溶媒を除去し、ヘキサンを加えて固形分を得た。固形分を濾過し、ヘキサンとEtOAcで洗浄した。次に、混合物をヘキサンで再結晶させた。上清を集め、溶媒を除去し、化合物(1−(3−ブロモメチルフェニル)エタノン)を得た。
【0357】
ペンタンで洗浄したナトリウム片(2.3g,0.1mol)にアルゴン雰囲気下で無水エタノール(50ml)を滴下した。滴下の完了後に、ナトリウム片を完全に溶解させるには撹拌が必要であった。ジエチルアセチルアミドマロン酸エステル(21.7g,0.1mol)の溶液を30分間かけて加えた。無水エタノール中の1−(3−ブロモエチルフェニル)エタノン(21.1g,0.1mol)を90分間かけて滴下した。混合物を一晩還流後にエーテルと水を加え、有機層を分離した。水を加えて反応を停止した後に有機層を合わせてブラインで洗浄し、MgSO4で乾燥し、濾過した。溶媒を減圧除去した。ヘキサン−ジクロロメタン4:1を残渣に加え、不溶分を濾去し、10:1ジクロロメタン−ベンゼンで完全に洗浄し、2−アセトアミド−2−[3−アセチルフェニル]メチルマロン酸ジエチルを得た。この化合物をジオキサン中で8M HClと共に一晩撹拌した。次に、混合物を乾燥し、水を加え、再び乾燥し、最終化合物塩酸m−アセチルフェニルアラニンを得た。HPLCを使用して所望化合物を精製し、白色固体とした。総収率は64%であった。1HNMR(D2O):d7.85−7.28(m,4H), 4.23(dd,1H), 3.2(m,2H), 2.7(s,3H)。分子量計算値243.69、実測値243.07。同様の合成を使用して3−メトキシフェニルアラニンを製造した。この場合の臭化ベンジルのメタ位のR基は−OCH3 である。例えばMatsoukasら,J.Med.Chem.,1995,38,4660−4669参照。
【実施例10】
【0358】
実施例10:4−アリル−L−チロシンの合成
別の側面では、本発明は式II:
【0359】
【化6】
に示す構造の4−アリル−L−チロシンを提供する。
【0360】
式IIの化合物4−アリル−L−チロシンは図13に示すスキームに従って合成される。保護チロシン(例えばNboc又はFmoc保護チロシン)を臭化アリルと反応させて保護アリルチロシンを得た後、一般に脱保護して4−アリル−L−チロシンを得る。1例では、N−(tert−ブトキシカルボニル)−L−チロシン(2.95g,10mmol)をDMF80mlに溶かした。溶液を5℃まで冷却し、NaH(0.63g,26mmol)を加えた。反応混合物を10℃まで昇温させ、更に2時間撹拌した。その後、臭化アリル(1.33g,11mmol)を混合物に加え、反応混合物を10℃まで昇温させ、更に2時間撹拌した。その後、混合物に臭化アリル(1.33g,11mmol)を加え、反応混合物を室温まで昇温させた。反応混合物を4時間撹拌した。水を加えて反応を停止した。水層を酢酸エチルとCH2Cl2で抽出した。有機層を無水MgSO4で乾燥した。有機溶媒を除去し、白色固体を得た。次にこの化合物を1,4−ジオキサン中4M HCl中で4時間還流した。全溶媒を蒸発させ、所望生成物を白色固体として得た(1.9g,86%)。1HNMR(CD3OD):d ppm 3.1(m,2H), 4.1(t,1H), 4.5(d,2H), 5.3(q,1H), 5.9(m,1H), 6.9(d,2H), 7.1(d,2H)。分子量計算値221、実測値222。
【実施例11】
【0361】
実施例11:非天然アミノ酸の細胞取込みスクリーニング
市販品又は市販品を出発材料として簡単に合成した各種非天然アミノ酸と所期α−ヒドロキシ酸(I.Shin,B.Herberich,A.Varak,T.Magliery,P.Schultz,未公開文献)を細胞毒性についてスクリーニングした。例えば、図29は以下のスクリーニングに有用な非天然アミノ酸のライブラリーを示す。各アミノ酸をグリセロール最少培地中1mMで(例えばpBLAM−YQRSとpACYsupA38を含むDH10Bに対する)細胞毒性についてスクリーニングした。毒性は(1)倍加時間の有意変化がない無毒性、(2)倍加時間の増加が約10%未満である低毒性(図29の化合物S63、S69、S74、S75、S81、S95)、(3)倍加時間の増加が約10%〜約50%である中毒性(図29の化合物B、M、P、S12、S14、S22、S41、S45、S49、S52、S62、S64、S65、S71、S91、S93、B10)、(4)倍加時間の増加が約50%〜約100%である高毒性(図29の化合物C、Q、V、BB、S2、S5、S50、S60、S78、S83、S89、S90)、及び(5)倍加時間の増加が約100%を上回る極毒性(図29の化合物W、S15、S26、S27、S30、S31、S39、S47、S88、S94)の5分類に分類される。例えばLiu,D.R.& Schultz,P.G.Progress toward the evolution of an organism with an expanded genetic code.Proceedings of the National Academy of Sciences of the United States of America 96,4780−4785(1999)参照。
【0362】
高毒性又は極毒性に分類されるアミノ酸の毒性は、一般にIC50値を得るためにその濃度の関数として測定される。一般に、天然アミノ酸の近縁類似体(例えばQ、W、S5、S26、S27、S50、S90、S94)であるか又は反応性官能性を示す(例えばS15、S39、S47)アミノ酸が最高毒性を示す。
【0363】
毒性アミノ酸の可能な取込み経路を同定するために、例えば過剰(2mM)の構造的に類似する天然アミノ酸を加えた培地でIC50レベル(一般に3μM〜500μM)で毒性アッセイを繰返した。毒性アミノ酸では過剰の天然アミノ酸の存在は毒素存在下の細胞の増殖能を救済したが、これは天然アミノ酸が細胞取込み又は必須酵素との結合のために毒素と有効に競合解消したためであると予想される。これらの場合には、毒性アミノ酸を可能な取込み経路に割り当て、細胞生存にその相補が必要な「致死対立遺伝子」と呼ぶことができる。こうして同定された致死対立遺伝子(毒性非天然アミノ酸の16種)はアラニン、グルタミン酸、リジン、ロイシン、メチオニン、プロリン、グルタミン、アルギニン、スレオニン及びチロシンの10種の可能なアミノ酸取込み基に及ぶ。
【0364】
これらの致死対立遺伝子は細胞が非毒性非天然アミノ酸を取込む能力をアッセイするのに極めて有用である。IC50レベルの各対立遺伝子を加えた培地に各非毒性非天然アミノ酸2mMを加えた。毒性対立遺伝子の相補は細胞増殖の回復により判断され、恐らく致死対立遺伝子に割り当てられると同一の取込み経路により非毒性アミノ酸が細胞に取込まれることを示す。相補の欠如については結論が出ていない。
【0365】
この方法を使用し、22種のグルタミン及びグルタミン酸類似体がDH10Bに取込まれるか否かを調べた。アミノ酸S27及びS47を毒性グルタミン対立遺伝子として夫々100μMと30μMで使用し、S50を毒性グルタミン酸対立遺伝子として150μMで使用した。S27とS47の相補の結果は完全に一致し、(S27とS47に加えて)アミノ酸B、Z、S6、S60、S61及びS62も恐らくグルタミン取込み経路を介して細胞に取込まれることが判明した。同様に、S50の相補からB、C、K、X、S60、S65及びS84が恐らくグルタミン酸輸送系を介してDH10Bに取込まれることが判明した。
【0366】
これらの知見は大腸菌グルタミン及びグルタミン酸輸送経路が側鎖延長(X及びZ)、γ位にケトン又はメチレンを配置(B,C,S65)、カルボキサミドをスルホキシド(S61)、細菌グルタミン輸送体又はヒドラジドの公知基質(S47)、更にグルタミン輸送体基質で置換及び側鎖末端の各種ハイブリダイゼーション置換(S60,S62,K,S84)等のアミノ酸構造の有意変動に耐えられることを示している。Jucovic,M.& Hartley,R.W.Protein−protein interaction:a genetic selection for compensating mutations at the barnase−barstar interface.Proceedings of the National Academy of Sciences of the United States of America 93,2343−2347(1996)及びWeiner,J.H.,Furlong,C.E.& Heppel,L.A.A binding protein for L−glutamine and its relation to active transport in E.coli.Archives of Biochemistry and Biophysics 142,715−7(1971)参照。
【実施例12】
【0367】
実施例12:p−アミノフェニルアラニンの生合成
非天然アミノ酸p−アミノフェニルアラニン(pAF)をin vivo生産させるためには、場合によりクロラムフェニコールとプリスチナマイシン生産経路に依存する遺伝子を使用する。例えば、Streptomyces VenezuelaeとStreptomyces pristinaespiralisでこれらの遺伝子は代謝中間体としてpAFを生産する。例えばYanai,K.ら,Streptomyces venezuelae genes papA,papB,papC,PCT国際出願,2001,明治製菓株式会社:日本国.p.1−83;及びBlanc,V.ら,Identification and analysis of genes from Streptomyces pristinaespiralis encoding enzymes involved in the biosynthesis of the 4−dimethylamino−L−phenylalanine precursor of pristinamycin 1.Molecular Microbiology,1997,23(2):p.191−202参照。
【0368】
pAFの生合成経路を図15Bに示す。pAFは場合により芳香族アミノ酸合成の生合成中間体であるコリスミン酸(図15Bの化合物2)から大腸菌で合成する。コリスミン酸からpAFを合成するためには、細胞は一般にコリスミンシンターゼ、コリスミン酸ムターゼ、デヒドロゲナーゼ(例えばプレフェン酸デヒドロゲナーゼ)及びアミノトランスフェラーゼを使用する。例えば、(例えば図15Bに示すように)S.Venezuelae酵素PapA、PapB及びPapCと大腸菌アミノトランスフエェラーゼを使用し、コリスミン酸からpAFを生産する。
【0369】
例えば、4−アミノ−4−デオキシコリスミン酸シンターゼは例えば単純な付加/脱離反応で(グルタミンからの)アンモニアを使用してコリスミン酸を4−アミノ−4−デオキシコリスミン酸(図15Bの化合物3)に変換する。コリスミン酸ムターゼとプレフェン酸デヒドロゲナーゼに夫々類似するPapBとPapCを使用し、4−アミノ−4−デオキシコリスミン酸を4−アミノ−4−デオキシプレフェン酸(図15Bの化合物4)に変換した後、p−アミノフェニルピルビン酸(図15Bの化合物5)に変換する。例えば大腸菌に由来する非特異的チロシンアミノトランスフェラーゼを使用してp−アミノフェニルピルビン酸をpAFに変換する。例えばEscherichia coli and Salmonella,第2版,F.C.Neidhardt編,Vol.1.1996,Washington,D.D.:ASM Press参照。例えば、場合によりtyrB、aspS又はilvEを使用してp−アミノフェニルピルビン酸からpAFを生産する。
【0370】
図13はpAFの生合成で使用されるプラスミドを示す。図のプラスミドは例えばlac又はlppプロモーターの制御下にpSC101由来pLASCプラスミドにクローニングされたS.venezuelae遺伝子papA、papB及びpapCを含む。このプラスミドを使用し、遺伝子によりコードされる酵素を生産するように細胞(例えば細菌細胞)を形質転換する。発現されると、酵素は所望非天然アミノ酸(例えばpAF)の生産を目的とする1種以上の反応を触媒する。例えば、タンパク質PapA、PapB及びPapCはコリスミン酸をp−アミノフェニルピルビン酸に変換し、大腸菌芳香族アミノトランスフェラーゼは生合成を完了し、pAFを生じる。
【0371】
一般に、本発明におけるコリスミン酸からのpAFの合成は細胞で生産される他のアミノ酸(例えばコリスミン酸から一般に生産される他の芳香族アミノ酸)の濃度に影響を与えない。一般に、p−アミノフェニルアラニンは効率的タンパク質生合成に十分な濃度(例えば天然細胞量)で生産されるが、他の芳香族アミノ酸の濃度を変化させたり細胞資源を枯渇させる程にはならない。こうしてin vivo生産されるpAFの典型濃度は約10mM〜約0.05mMである。S.venezuelaeでの知見は、シキミン酸経路の調節が第4の芳香族アミノ酸の生産におけるコリスミン酸消費を補償するように改変されることを示唆している。例えばHe,J.ら,Mecrobiology,2001 147:p.2817−2829参照。上記経路で使用される酵素を生産するために使用される遺伝子を含むプラスミドで細菌を形質転換し、21番目のアミノ酸としてpAFを作製したら、場合によりin vivo選択を使用してリボソームタンパク質合成と細胞増殖の両者に合うようにpAFの生産を更に最適化する。
【0372】
pAF tRNA−シンテターゼ対はタンパク質の非必須位置におけるTAGコドンの抑圧を許容するので、場合によりこのタンパク質の生産により生合成経路の有効性をモニターし、最適化する。タンパク質生合成に十分な濃度のpAFを生産する細胞のみがTAGコドンを抑圧することが可能である。同時に、TAG−タンパク質が細胞増殖に必須のタンパク質である場合には大腸菌増殖率に基づいて最適pAF生産を選択することができる。生合成遺伝子をプラスミドに配置すると、例えばプラスミドコピー数とプロモーター強度を変えることにより、pAF生産レベルを改変することができる。pAF生合成経路の付加が大腸菌における他の芳香族アミノ酸の生産に影響を与えるか否かを調べ、pAF生産を定量するためには、場合により例えば抽出とLCMS分析により芳香族アミノ酸の細胞濃度をモニターする。例えばMoss,R.E.,Methods in Enzymology,1995.262:p.497−499及びMimura,H.,S.Nagata,and T.Matsumoto,Biosci.Biotech.Biochem.,1994,58(10):p.1873−1874参照。
【実施例13】
【0373】
実施例13:Dopaの生合成
dopaをin vivo生合成するためには、例えば大腸菌に由来する非特異的芳香族ヒドロキシラーゼの1種以上の遺伝子(例えばhpaBC)を一般にlppプロモーターの制御下においた低コピー数ベクター(例えばpSC101誘導体)にクローニングする。この構築物は図20に示すように、チロシン(1)からdopa(2)をin vivo生産するが、増殖細胞に非毒性である。この遺伝子を用いて同様に操作し、精製目的でdopaを過剰生産させた。例えばJang−Young Lee,Luying Xun,Biotechnology Letters,1998,20,479−482参照。しかし、上述のように、過剰生産は一般に望ましくない。本願では、低コピープラスミドを使用して天然細胞量のdopaを生産させる。
【実施例14】
【0374】
実施例14:O−メチル−L−チロシンの生合成
O−メチル−L−チロシンは場合によりヒドロキシル基をメトキシル基に変換する二次代謝に関与する酵素である植物O−メチルトランスフェラーゼにより生合成する。このような酵素として(イソ)オイゲノールO−メチルトランスフェラーゼ(IEMT)とカフェイン酸O−メチルトランスフェラーゼ(COMT)の2種を選択した。いずれもClarkia breweriに由来する。IEMTはオイゲノール/イソオイゲノールをメチル化し、COMTはカフェイン酸をメチル化する。これらの2種の酵素の基質はチロシンに類似する。しかし、これらの酵素はいずれも高い基質特異性とメチル化部位特異性をもつ。従って、これらの2種の酵素がチロシンをその基質として使用してチロシンをO−メチル−L−チロシンに変換するようにこれらの酵素を進化させる併用アプローチを採用した。活性部位残基を突然変異に選択し、大きな突然変異体ライブラリーを作製した。数回選択後に少なくとも約3個のクローンが同定された。
【0375】
他の態様では、O−メチル−L−チロシンを生産するために使用する酵素を人工的に進化させることもでき、例えば式IIIに示すようなメタ置換メトキシフェニルアラニンを生産するように進化させることもできる。
【実施例15】
【0376】
実施例15:グリコシル化アミノ酸の生合成
本発明はグリコシル化アミノ酸の生合成法も提供する。グリコシル化アミノ酸のin vivo形成は場合により多数の方法で実施される。例えばN−アセチルガラクトサミニダーゼ、トランスグリコシラーゼ、又はヒドロラーゼ(例えば逆方向に作用する例えばセリン−グリコシルヒドロラーゼ)を含むプラスミドで細胞を形質転換すると、グリコシル化アミノ酸を生産する細胞が得られる。下記に記載するような翻訳系と組合せると、この生合成経路の結果、グリコシル化アミノ酸を生産して細胞内で1種以上のタンパク質に組込む細胞が得られる。例えば、図28はグリコシル化アミノ酸の形成を示しており、Rは場合によりアルコール、アミン、又はN−アセチルアミンである。構造の1例を式IV:
【0377】
【化7】
に示す。
【実施例16】
【0378】
実施例16:非天然アミノ酸の組込みによる効果の識別
例えばDNA内のナンセンスコドンに応答して高い翻訳効率と忠実度で基本炭素源から非天然アミノ酸を生合成し、このアミノ酸をタンパク質に組込むことが可能な完全自律細菌を本発明により開発できるとしても、この細菌がこのような付加により実際に20種の天然アミノ酸のみを組込む生物にまさる効果を得るのかどうかは問題である。本発明は拡張遺伝コードがこのような効果を提供するか否かを調べると共に、効果の種類と効果の元となる非天然アミノ酸を識別する方法を提供する。
【0379】
19世紀以来、細菌学者は増殖条件を変えると細菌培養物が大きく変化することに関心を示してきた。例えばSummers,W.C.,J.Hist.Biol.,1991,24:P.171−190参照。しかし、20アミノ酸生物では全進化形態が検討されている。本発明は非天然アミノ酸を組込んだ大腸菌の遺伝コードの拡張可能性について検討し、付加アミノ酸を組込む能力が大腸菌に進化的効果を与えるか否を試験する方法を提供する。
【0380】
遺伝コードに新規アミノ酸を付加することにより大腸菌に進化的効果が得られるか否かを調べるためには、場合により21アミノ酸細菌の進化を20アミノ酸細菌の進化と比較する。このアプローチは非天然アミノ酸をタンパク質に組込む新規翻訳機構群と選択圧下においた突然変異誘発大腸菌ゲノムライブラリーを組合せるものである。上記及びSchultzらが他の文献に記載している遺伝的選択アプローチによると、TAGコドンに応答して高い忠実度で効率的に新規アミノ酸をタンパク質に組込むことができる少なくとも約11種の新規アミノアシルシンテターゼがこれまでに作製されている。
【0381】
大腸菌ゲノムのプラスミドライブラリーを突然変異誘発すると、コドンが入り乱れ、ゲノムにTAGナンセンスコドンがランダムに付加される。新規TAGコドンは発現されるタンパク質に新規アミノ酸を組込むことにより抑圧することができる。これらの細菌系に選択圧をかけ、大腸菌増殖亢進について選択する。例えば図21参照。効果を付与するライブラリーから選択したゲノムフラグメントを場合により分離し、TAGコドンに応答して他の非天然アミノ酸とチロシンを組込む場合には増殖能の亢進についてスクリーニングする。
【0382】
場合によりpSC101低コピーベクター(約5コピー/細胞)を使用して当業者に公知の標準方法により大きなインサート(7〜14kb)大腸菌ゲノムライブラリーを構築する。例えば、個体数600のpSC101由来大腸菌ゲノムライブラリーは大腸菌ゲノムを完全に網羅すると共にアミノアシルシンテターゼと上記tRNAプラスミドに適合可能である。多数の突然変異原がTAGコドンを遺伝子に組込む能力について検討されている。例えばMiller,J.H.,A short course in bacterial genetics.1992,Plainview:Cold Spring Harbor Laboratory Press参照。各突然変異原はそのTAGコドン形成に関して完全にランダムではないので、場合により多重突然変異誘発法を使用する。同一の個体数600の大腸菌ゲノムライブラリーを4種の異なる突然変異原で突然変異誘発することにより、TAGコドンを一般できるだけ多数の部位に配置する。ゲノムライブラリーを突然変異させ、ライブラリーを合わせて個体数>1010の1つの大きな突然変異ゲノムライブラリーを作製するためには、紫外線照射、ミューテーター株(XL1 red)、4−ニトロキノリン−1−オキシド(NQO)及びエチル・メタン・スルホン酸(EMS)の4種の方法を選択できるが、これらに限定されない。これらの突然変異法はいずれも主に点突然変異の形成に依存するが、突然変異誘発メカニズムで補完し合う結果、全体ではより均一なTAGコドン分布が得られる。紫外線照射とミューテーター株は全塩基置換を誘発するが、NQOとEMSは基本的にG:CからA:Tへの遷移を誘発する。誘発される点突然変異の大半は20種の天然アミノ酸の1種をコードするコドンを形成する。単一点突然変異の約12.5%しかTAGコドンを形成できないので、大きな高度突然変異誘発ゲノムライブラリーが必要である。この方法は一般に多数の新規コドンをランダムに配置した各遺伝子の突然変異コピーを少なくとも約106個作製する。その後、突然変異誘発前後のライブラリー個体のサブセットを配列決定することにより一般にTAGコドンが組込まれているかどうかゲノムライブラリーを確かめる。
【0383】
新規アミノ酸の1種の組込みによりどの遺伝子を改善できるかを調べるためには、場合により各種選択圧の任意のものを使用して触媒機能、タンパク質相互作用、炭素源、多重応答遺伝子及び広義代謝機能等の多様な細胞生物学をターゲットにスクリーニングを行う。例えば、トポイソメラーゼとDNAジャイレースをターゲットとするにはキノロンに基づく選択圧を使用する。DNA合成をターゲットとするには5−フルオロウラシルを使用し、プロトンポンプ阻害薬をターゲットとするにはオメプラゾールを使用し、炭素利用と応答に関する各種遺伝子をターゲットとするには単一炭素源としての脂肪酸と酸性培地を使用し、チオール−レドックス経路とジスルフィドを含むタンパク質をターゲットとするには還元培地を使用する。例えばBronson,J.J.とJ.F.Barrett,Curr.Med.Chemistry,2001 8:p.1775−1793;Bearden,D.T.とL.H.Danziger,Pharmacotherapy,2001 21(10):p.224S−232S;Matthews,D.A.ら,J.Mol.Biol.1990.2144(4):p.937−948;Knox,M.R.とJ.E.Harris,Arch.Microbiol.,1988.149(6):p.557−60;McGowan,C.C.,T.L.Cover,and M.J.Blaser,Gasteroenterology,1994.107(5):p.1573−8;Clark,D.PとJ.E.Cronan,Two carbon compounds and fatty acids as carbon sources.Escheria coli and Salmonella cellular and molecular biology,F.C.Neidhardt編.Vol.1.1996,Washington D.C:ASM press;Slonczewski,J.L.とJ.W.Foster,pH−regulated genes and survival at extreme pH.Eschericia coli and Salmonella cellular and molecular biology,F.C.Neidhardt編.Vol.1.1996.Washington D.C.:ASM press;及びRitz,D.とJ.Beckwith,Annu.Rev.Microbiol.,2001.55:p.21−48参照。
【0384】
突然変異ゲノムライブラリーをスクリーニングすると、所定選択圧下で増殖効果を付与する1組の突然変異ゲノムフラグメントが得られる。これらのフラグメントを比較し、制限マッピングとシーケンシングにより非天然アミノ酸を加えないスクリーニングと同一であるか否かを調べる。非天然アミノ酸に起因する増殖亢進を生じるフラグメントを選択し、場合によりこのフラグメントを再スクリーニングし、増殖率を各非天然アミノ酸とTAGコドンを抑圧するチロシンに比較する。例えば図21参照。選択したゲノムフラグメントのこの再スクリーニングは非天然アミノ酸が増殖効果を付与する要因であることを確証する。非天然アミノ酸をTAGコドンに挿入して選択増殖効果を示すフラグメントについては、効果を付与する遺伝子を場合により分離し、例えば消化とサブクローニングにより同定する。タンパク質を試験し、非天然アミノ酸が細胞機能をどのように亢進しているかを確認することができる。亢進したタンパク質を場合により精製し、in vitro及びin vivo試験の両者で天然アミノ酸と比較する。場合により標準酵素技術を使用してタンパク質安定性、動態及び他の生合成経路成分とその相互作用を検討する。
【実施例17】
【0385】
実施例17: 配列
【0386】
以上、分かり易くする目的で本発明を詳細に説明したが、以上の開示から当業者に自明の通り、本発明の真の範囲を逸脱することなく形態や細部に種々の変更を加えることができる。例えば、上記全技術及び装置は種々に組合せて使用することができる。本明細書に引用した全刊行物、特許、特許出願及び/又は他の文献は全目的でその開示内容全体を参考資料として組込み、個々の刊行物、特許、特許出願及び/又は他の文献を全目的で参考資料として組込むと示しているものとして扱う。
【図面の簡単な説明】
【0387】
【図1】TyrRSの活性部位におけるアミノ酸残基の立体図である。
【図2】各種条件下における野生型(wt)及び突然変異体両者の大腸菌DHFRタンパク質の蓄積を示し、図2Aは精製DHFRの銀染色SDS−PAGEゲルであり、図2Bは図2Aのゲルのウェスタンブロットである。
【図3】DHFRのNH2末端ペプチドMIY* MIAALAVDRのタンデム質量スペクトルを示す。
【図4】各種条件下における野生型(wt)及び突然変異体両者のマウスDHFRタンパク質の蓄積を示し、図4Aは精製DHFRの銀染色SDS−PAGEゲルであり、図4Bは図4Aのゲルのウェスタンブロットである。
【図5】トリプシン消化ペプチドLLPEX* TGVLSEVQEEK(式中、X* はL−3−(2−ナフチル)アラニンを表す)のタンデム質量スペクトルを示す。
【図6A】増幅性蛍光レポーター系の特徴を示す。図6AはプラスミドpREPである。
【図6B】増幅性蛍光レポーター系の特徴を示す。図6BはpREP(1〜12)内のT7RNAポリメラーゼ遺伝子構築物の組成と蛍光増加を示す。
【図6C】増幅性蛍光レポーター系の特徴を示す。図6CはpREP(10)とpQD(上段)又はpQ(下段)を含む細胞のサイトメトリー分析を示す。
【図6D】増幅性蛍光レポーター系の特徴を示す。図6DはpREP(10)を含み、各種大腸菌サプレッサーtRNAを発現する細胞の蛍光分析を示す。
【図7A】M.jannaschii TyrRSの進化を誘導するための多目的レポータープラスミド系の成分を示す。図7AはプラスミドpREP/YC−JYCUAを示す。
【図7B】M.jannaschii TyrRSの進化を誘導する為の多目的レポータープラスミド系の成分を示す。図7BはM.jannaschii TyrRSの進化のターゲットとして使用した非天然アミノ酸の構造を示す。
【図7C】M.jannaschii TyrRSの進化を誘導するための多目的レポータープラスミド系の成分を示す。図7CはプラスミドpREP/YC−JYCUAを使用してアミノアシル−tRNAシンテターゼを進化させるためのストラテジーを示す。
【図8A】成功した各進化実験からの優性シンテターゼ変異体の活性を示す。図8AはpREP/YC−JYCUAと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下(+)又は不在下(−)で増殖させ、長波長紫外線を照射した場合の写真である。
【図8B】成功した各進化実験からの優性シンテターゼ変異体の活性を示す。図8BはpREP/YC−JYCUAと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下(左)又は不在下(右)で増殖させた場合の蛍光分析を示す。
【図8C】成功した各進化実験からの優性シンテターゼ変異体の活性を示す。図8CはpREP/YC−JYCUAと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下又は不在下で増殖させた場合のCm IC50分析を示す表である。
【図8D】成功した各進化実験からの優性シンテターゼ変異体の活性を示す。図8DはpBAD/JYAMB−4TAGと指定シンテターゼ変異体を含む細胞を対応する非天然アミノ酸の存在下(+)又は不在下(−)で増殖させた場合のタンパク質発現分析を示す。
【図9】ネガティブFACSスクリーニング[OAY−RS(1,3,5)]又はネガティブバルナーゼ選択[OAY−RS(B)]を使用して得られたOAS−RS変異体の活性比較を示す。
【図10】m−MeO−Pheとm−アセチル−Pheを組込んだDHFRの発現を示すウェスタンブロットのオートラジオグラフ。
【図11】フルオレセインヒドラジドで標識したタンパク質の蛍光スペクトルを示す。
【図12】非天然アミノ酸パラアジドフェニルアラニン及びパラベンゾイルフェニルアラニンを示す。
【図13】アリル置換フェニルアラニンの合成の為の化学スキームを示す。
【図14】メタ置換フェニルアラニンの合成のための化学スキームを示す。
【図15】p−アミノフェニルアラニンの生合成を示す。
【図16】各種非天然アミノ酸を示す。
【図17】各種非天然アミノ酸を示す。
【図18】各種非天然アミノ酸を示す。
【図19】in vivo抑圧によりタンパク質に組込む付加的天然及び非天然アミノ酸を示す。
【図20】dopaの生産のための生合成スキームを示す。
【図21】21種のアミノ酸を特異的に組込むことができる結果として細胞に得られる進化的効果を測定するための方法を示す。
【図22】非天然アミノ酸の部位特異的組込み方法を示す。
【図23】各種グルタミン類似体の合成を示す。
【図24】γ置換グルタミン類似体の合成を示す。
【図25】環状グルタミン誘導体の合成を示す。
【図26】各種チロシン類似体を示す。
【図27】チロシン類似体の生産のための合成スキームを示す。
【図28】グリコシル化アミノ酸を生産するための生合成スキームを示す。
【図29】例えば細胞取込み試験で使用される各種非天然アミノ酸を示す。
Claims (140)
- 直交tRNA(O−tRNA)と直交アミノアシルtRNAシンテターゼ(O−RS)を含む翻訳系を含む組成物であって、O−RSが翻訳系内でO−tRNAを少なくとも1種の非天然アミノ酸で優先的にアミノアシル化し、O−tRNAが少なくとも1種のセレクターコドンを認識する前記組成物。
- 翻訳系が細胞を含む請求項1に記載の組成物。
- 翻訳系が細菌細胞を含む請求項2に記載の組成物。
- 翻訳系が大腸菌細胞を含む請求項3に記載の組成物。
- 翻訳系が始原菌細胞を含む請求項2に記載の組成物。
- 翻訳系が真核細胞を含む請求項2に記載の組成物。
- 翻訳系が酵母細胞、哺乳動物細胞、植物細胞又は昆虫細胞を含む請求項6に記載の組成物。
- 翻訳系がin vitro翻訳系を含む請求項1に記載の組成物。
- 翻訳系が細胞抽出物を含む請求項8に記載の組成物。
- O−tRNAが配列番号1〜3及びその相補的ポリヌクレオチド配列から構成される群から選択されるポリヌクレオチド配列を含む核酸を含む請求項1に記載の組成物。
- O−RSが、配列番号4〜34から構成される群から選択されるアミノ酸配列を含むポリペプチドと、配列番号35〜66及びその相補的ポリヌクレオチド配列から構成される群から選択されるポリヌクレオチド配列を含む核酸によりコードされるポリペプチドから構成される群から選択されるポリペプチドを含む請求項1に記載の組成物。
- 少なくとも1種の非天然アミノ酸がO−メチル−L−チロシン、L−3−(2−ナフチル)アラニン、3−メチルフェニルアラニン、O−4−アリル−L−チロシン、4−プロピル−L−チロシン、トリ−O−アセチル−GlcNAcβ−セリン、L−Dopa、フッ素化フェニルアラニン、イソプロピル−L−フェニルアラニン、p−アジド−L−フェニルアラニン、p−アシル−L−フェニルアラニン、p−ベンゾイル−L−フェニルアラニン、L−ホスホセリン、ホスホノセリン、ホスホノチロシン、p−ヨードフェニルアラニン、p−ブロモフェニルアラニン、p−アミノ−L−フェニルアラニン、イソプロピル−L−フェニルアラニン、チロシンアミノ酸の非天然類似体;グルタミンアミノ酸の非天然類似体;フェニルアラニンアミノ酸の非天然類似体;セリンアミノ酸の非天然類似体;スレオニンアミノ酸の非天然類似体;アルキル、アリール、アシル、アジド、シアノ、ハロ、ヒドラジン、ヒドラジド、ヒドロキシル、アルケニル、アルキニル、エーテル、チオール、スルホニル、セレノ、エステル、チオ酸、硼酸、ボロン酸、ホスホ、ホスホノ、ホスフィン、複素環、エノン、イミン、アルデヒド、ヒドロキシルアミン、ケトもしくはアミノ置換アミノ酸又はその任意組合せ;光架橋基をもつアミノ酸;スピンラベル付きアミノ酸;蛍光アミノ酸:新規官能基をもつアミノ酸;別の分子と共有又は非共有的に相互作用するアミノ酸;金属結合性アミノ酸;金属含有アミノ酸;放射性アミノ酸;フォトケージド及び/又は光異性化可能なアミノ酸;ビオチン又はビオチン類似体含有アミノ酸;グリコシル化又は糖鎖修飾アミノ酸;ケト含有アミノ酸;ポリエチレングリコール又はポリエーテルを含むアミノ酸;重原子置換アミノ酸;化学分解性又は光分解性アミノ酸;延長側鎖をもつアミノ酸;毒性基を含むアミノ酸;糖鎖置換アミノ酸(例えば糖鎖置換セリン等);炭素結合糖含有アミノ酸;レドックス活性アミノ酸;α−ヒドロキシ含有酸;アミノチオ酸含有アミノ酸;α,αジ置換アミノ酸;βアミノ酸;及びプロリン以外の環状アミノ酸から構成される群から選択される請求項1に記載の組成物。
- 少なくとも1種の非天然アミノ酸がO−メチル−L−チロシンである請求項12に記載の組成物。
- 少なくとも1種の非天然アミノ酸がL−3−(2−ナフチル)アラニンである請求項12に記載の組成物。
- 少なくとも1種の非天然アミノ酸がアミノ−、イソプロピル−、又はO−アリル含有フェニルアラニン類似体である請求項12に記載の組成物。
- 少なくとも1種のセレクターコドンがナンセンスコドン、レアコドン又は4塩基コドンである請求項1に記載の組成物。
- 少なくとも1種のセレクターコドンがアンバーコドンである請求項16に記載の組成物。
- mtRNACUA Tyr と突然変異体TyrRS(LWJ16)を含む大腸菌細胞であって、突然変異体TyrRS(LWJ16)が細胞内でmtRNACUA Tyr をO−メチル−L−チロシンで優先的にアミノアシル化し、細胞がmtRNACUA Tyr を使用してアンバーコドンを認識する前記大腸菌細胞。
- mtRNACUA Tyr とSS12−TyrRSを含む大腸菌細胞であって、SS12−TyrRSが細胞内でmtRNACUA Tyr をL−3−(2−ナフチル)アラニンで優先的にアミノアシル化し、細胞がmtRNACUA Tyr を使用してアンバーコドンを認識する前記大腸菌細胞。
- 少なくとも1種の非天然アミノ酸を含むタンパク質を含む組成物であって、タンパク質が少なくとも約100μg/Lの濃度で存在する前記組成物。
- タンパク質がサイトカイン、増殖因子、増殖因子受容体、インターフェロン、インターロイキン、炎症性分子、腫瘍遺伝子産物、ペプチドホルモン、シグナル伝達分子、ステロイドホルモン受容体、転写アクチベーター、転写サプレッサー、エリスロポエチン(EPO)、インスリン、ヒト成長ホルモン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、肝細胞増殖因子、インスリン様増殖因子、白血病阻害因子、オンコスタチンM、PD−ECSF、PDGF、プレイオトロピン、SCF、cキットリガンド、VEGEF、G−CSF、IL−1、IL−2、IL−8、IGF−I、IGF−II、FGF(繊維芽細胞増殖因子)、PDGF、TNF、TGF−α、TGF−β、EGF(表皮増殖因子)、KGF(ケラチノサイト増殖因子)、SCF/cキット、CD40L/CD40、VLA−4/VCAM−1、ICAM−1/LFA−1、ヒアルリン/CD44、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である請求項20に記載の組成物。
- タンパク質がα1アンチトリプシン、アンジオスタチン、抗血友病因子、抗体、アポリポタンパク質、アポタンパク質、心房性ナトリウム利尿因子、心房性ナトリウム利尿ポリペプチド、心房性ペプチド、C−X−Cケモカイン、T39765、NAP−2、ENA−78、Gro−a、Gro−b、Gro−c、IP−10、GCP−2、NAP−4、SDF−1、PF−4、MIG、カルシトニン、cキットリガンド、サイトカイン、CCケモカイン、単球化学誘引タンパク質−1、単球化学誘引タンパク質−2、単球化学誘引タンパク質−3、単球炎症性タンパク質−1α、単球炎症性タンパク質−1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262、CD40、CD40リガンド、Cキットリガンド、コラーゲン、コロニー刺激因子(CSF)、補体因子5a、補体阻害剤、補体受容体1、サイトカイン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、表皮増殖因子(EGF)、上皮好中球活性化ペプチド、エリスロポエチン(EPO)、表皮剥離毒素、IX因子、VII因子、VIII因子、X因子、繊維芽細胞増殖因子(FGF)、フィブリノーゲン、フィブロネクチン、G−CSF、GM−CSF、グルコセレブロシダーゼ、ゴナドトロピン、増殖因子、増殖因子受容体、ヘッジホッグタンパク質、ヘモグロビン、肝細胞増殖因子(HGF)、ヒルジン、ヒト血清アルブミン、ICAM−1、ICAM−1受容体、LFA−1、LFA−1受容体、インスリン、インスリン様増殖因子(IGF)、IGF−I、IGF−II、インターフェロン、IFN−α、IFN−β、IFN−γ、インターロイキン、IL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、ケラチノサイト増殖因子(KGF)、ラクトフェリン、白血病阻害因子、ルシフェラーゼ、ニュールチュリン、好中球阻害因子(NIF)、オンコスタチンM、骨形成タンパク質、腫瘍遺伝子産物、副甲状腺ホルモン、PD−ECSF、PDGF、ペプチドホルモン、ヒト増殖ホルモン、プレイオトロピン、プロテインA、プロテインG、発熱外毒素A、B又はC、リラキシン、レニン、SCF、可溶性補体受容体I、可溶性I−CAM1、可溶性インターロイキン受容体、可溶性TNF受容体、ソマトメジン、ソマトスタチン、ソマトトロピン、ストレプトキナーゼ、スーパー抗原、ブドウ球菌エンテロトキシン、SEA、SEB、SEC1、SEC2、SEC3、SED、SEE、ステロイドホルモン受容体、スーパーオキシドジスムターゼ、毒素性ショック症候群毒素、チモシンα1、組織プラスミノーゲンアクチベーター、腫瘍増殖因子(TGF)、TGF−α、TGF−β、腫瘍壊死因子、腫瘍壊死因子α、腫瘍壊死因子β、腫瘍壊死因子受容体(TNFR)、VLA−4タンパク質、VCAM−1タンパク質、血管内皮増殖因子(VEGEF)、ウロキナーゼ、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である請求項20に記載の組成物。
- タンパク質が治療用タンパク質に少なくとも約50%又は少なくとも約75%相同である請求項22に記載の組成物。
- 治療用タンパク質がエリスロポエチン(EPO)である請求項22に記載の組成物。
- タンパク質が少なくとも2種の非天然アミノ酸を含む請求項20に記載の組成物。
- タンパク質が少なくとも3種の非天然アミノ酸を含む請求項20に記載の組成物。
- タンパク質が少なくとも4種の非天然アミノ酸を含む請求項20に記載の組成物。
- タンパク質が少なくとも5種又は6種以上の非天然アミノ酸を含む請求項20に記載の組成物。
- 組成物が少なくとも約100μgのタンパク質を含む請求項20に記載の組成物。
- タンパク質がDHFRであり、少なくとも1種の非天然アミノ酸がO−メチル−L−チロシンとL−3−(2−ナフチル)アラニンから構成される群から選択される請求項20に記載の組成物。
- 少なくとも1種の非天然アミノ酸を含むタンパク質を含む組成物であって、タンパク質がサイトカイン、増殖因子、増殖因子受容体、インターフェロン、インターロイキン、炎症性分子、腫瘍遺伝子産物、ペプチドホルモン、シグナル伝達分子、ステロイドホルモン受容体、転写アクチベーター、転写サプレッサー、エリスロポエチン(EPO)、インスリン、ヒト成長ホルモン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、肝細胞増殖因子、インスリン様増殖因子、白血病阻害因子、オンコスタチンM、PD−ECSF、PDGF、プレイオトロピン、SCF、cキットリガンド、VEGEF、G−CSF、IL−1、IL−2、IL−8、IGF−I、IGF−II、FGF(繊維芽細胞増殖因子)、PDGF、TNF、TGF−α、TGF−β、EGF(表皮増殖因子)、KGF(ケラチノサイト増殖因子)、SCF/cキット、CD40L/CD40、VLA−4/VCAM−1、ICAM−1/LFA−1、ヒアルリン/CD44、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である前記組成物。
- 少なくとも1種の非天然アミノ酸を含むタンパク質を含む組成物であって、タンパク質がα1アンチトリプシン、アンジオスタチン、抗血友病因子、抗体、アポリポタンパク質、アポタンパク質、心房性ナトリウム利尿因子、心房性ナトリウム利尿ポリペプチド、心房性ペプチド、C−X−Cケモカイン、T39765、NAP−2、ENA−78、Gro−a、Gro−b、Gro−c、IP−10、GCP−2、NAP−4、SDF−1、PF−4、MIG、カルシトニン、cキットリガンド、サイトカイン、CCケモカイン、単球化学誘引タンパク質−1、単球化学誘引タンパク質−2、単球化学誘引タンパク質−3、単球炎症性タンパク質−1α、単球炎症性タンパク質−1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262、CD40、CD40リガンド、Cキットリガンド、コラーゲン、コロニー刺激因子(CSF)、補体因子5a、補体阻害剤、補体受容体1、サイトカイン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、表皮増殖因子(EGF)、上皮好中球活性化ペプチド、エリスロポエチン(EPO)、表皮剥離毒素、IX因子、VII因子、VIII因子、X因子、繊維芽細胞増殖因子(FGF)、フィブリノーゲン、フィブロネクチン、G−CSF、GM−CSF、グルコセレブロシダーゼ、ゴナドトロピン、増殖因子、増殖因子受容体、ヘッジホッグタンパク質、ヘモグロビン、肝細胞増殖因子(HGF)、ヒルジン、ヒト血清アルブミン、ICAM−1、ICAM−1受容体、LFA−1、LFA−1受容体、インスリン、インスリン様増殖因子(IGF)、IGF−I、IGF−II、インターフェロン、IFN−α、IFN−β、IFN−γ、インターロイキン、IL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、ケラチノサイト増殖因子(KGF)、ラクトフェリン、白血病阻害因子、ルシフェラーゼ、ニュールチュリン、好中球阻害因子(NIF)、オンコスタチンM、骨形成タンパク質、腫瘍遺伝子産物、副甲状腺ホルモン、PD−ECSF、PDGF、ペプチドホルモン、ヒト増殖ホルモン、プレイオトロピン、プロテインA、プロテインG、発熱外毒素A、B又はC、リラキシン、レニン、SCF、可溶性補体受容体I、可溶性I−CAM1、可溶性インターロイキン受容体、可溶性TNF受容体、ソマトメジン、ソマトスタチン、ソマトトロピン、ストレプトキナーゼ、スーパー抗原、ブドウ球菌エンテロトキシン、SEA、SEB、SEC1、SEC2、SEC3、SED、SEE、ステロイドホルモン受容体、スーパーオキシドジスムターゼ、毒素性ショック症候群毒素、チモシンα1、組織プラスミノーゲンアクチベーター、腫瘍増殖因子(TGF)、TGF−α、TGF−β、腫瘍壊死因子、腫瘍壊死因子α、腫瘍壊死因子β、腫瘍壊死因子受容体(TNFR)、VLA−4タンパク質、VCAM−1タンパク質、血管内皮増殖因子(VEGEF)、ウロキナーゼ、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である前記組成物。
- タンパク質が少なくとも2種の非天然アミノ酸を含む請求項32に記載の組成物。
- タンパク質が少なくとも3種の非天然アミノ酸を含む請求項32に記載の組成物。
- タンパク質が少なくとも4種の非天然アミノ酸を含む請求項32に記載の組成物。
- タンパク質が少なくとも5種又は6種以上の非天然アミノ酸を含む請求項32に記載の組成物。
- タンパク質が治療用タンパク質に少なくとも約50%又は少なくとも約75%相同である請求項32に記載の組成物。
- 治療用タンパク質がエリスロポエチン(EPO)である請求項32に記載の組成物。
- タンパク質と医薬的に許容可能な賦形剤を含む組成物であって、タンパク質が少なくとも1種の非天然アミノ酸を含む前記組成物。
- タンパク質が少なくとも2種の非天然アミノ酸を含む請求項39に記載の組成物。
- タンパク質が少なくとも3種の非天然アミノ酸を含む請求項39に記載の組成物。
- タンパク質が少なくとも4種の非天然アミノ酸を含む請求項39に記載の組成物。
- タンパク質が少なくとも5種又は6種以上の非天然アミノ酸を含む請求項39に記載の組成物。
- タンパク質がサイトカイン、増殖因子、増殖因子受容体、インターフェロン、インターロイキン、炎症性分子、腫瘍遺伝子産物、ペプチドホルモン、シグナル伝達分子、ステロイドホルモン受容体、転写アクチベーター、転写サプレッサー、エリスロポエチン(EPO)、インスリン、ヒト成長ホルモン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、肝細胞増殖因子、インスリン様増殖因子、白血病阻害因子、オンコスタチンM、PD−ECSF、PDGF、プレイオトロピン、SCF、cキットリガンド、VEGEF、G−CSF、IL−1、IL−2、IL−8、IGF−I、IGF−II、FGF(繊維芽細胞増殖因子)、PDGF、TNF、TGF−α、TGF−β、EGF(表皮増殖因子)、KGF(ケラチノサイト増殖因子)、SCF/cキット、CD40L/CD40、VLA−4/VCAM−1、ICAM−1/LFA−1、ヒアルリン/CD44、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である請求項39に記載の組成物。
- タンパク質がα1アンチトリプシン、アンジオスタチン、抗血友病因子、抗体、アポリポタンパク質、アポタンパク質、心房性ナトリウム利尿因子、心房性ナトリウム利尿ポリペプチド、心房性ペプチド、C−X−Cケモカイン、T39765、NAP−2、ENA−78、Gro−a、Gro−b、Gro−c、IP−10、GCP−2、NAP−4、SDF−1、PF−4、MIG、カルシトニン、cキットリガンド、サイトカイン、CCケモカイン、単球化学誘引タンパク質−1、単球化学誘引タンパク質−2、単球化学誘引タンパク質−3、単球炎症性タンパク質−1α、単球炎症性タンパク質−1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262、CD40、CD40リガンド、Cキットリガンド、コラーゲン、コロニー刺激因子(CSF)、補体因子5a、補体阻害剤、補体受容体1、サイトカイン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、表皮増殖因子(EGF)、上皮好中球活性化ペプチド、エリスロポエチン(EPO)、表皮剥離毒素、IX因子、VII因子、VIII因子、X因子、繊維芽細胞増殖因子(FGF)、フィブリノーゲン、フィブロネクチン、G−CSF、GM−CSF、グルコセレブロシダーゼ、ゴナドトロピン、増殖因子、増殖因子受容体、ヘッジホッグタンパク質、ヘモグロビン、肝細胞増殖因子(HGF)、ヒルジン、ヒト血清アルブミン、ICAM−1、ICAM−1受容体、LFA−1、LFA−1受容体、インスリン、インスリン様増殖因子(IGF)、IGF−I、IGF−II、インターフェロン、IFN−α、IFN−β、IFN−γ、インターロイキン、IL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、ケラチノサイト増殖因子(KGF)、ラクトフェリン、白血病阻害因子、ルシフェラーゼ、ニュールチュリン、好中球阻害因子(NIF)、オンコスタチンM、骨形成タンパク質、腫瘍遺伝子産物、副甲状腺ホルモン、PD−ECSF、PDGF、ペプチドホルモン、ヒト増殖ホルモン、プレイオトロピン、プロテインA、プロテインG、発熱外毒素A、B又はC、リラキシン、レニン、SCF、可溶性補体受容体I、可溶性I−CAM1、可溶性インターロイキン受容体、可溶性TNF受容体、ソマトメジン、ソマトスタチン、ソマトトロピン、ストレプトキナーゼ、スーパー抗原、ブドウ球菌エンテロトキシン、SEA、SEB、SEC1、SEC2、SEC3、SED、SEE、ステロイドホルモン受容体、スーパーオキシドジスムターゼ、毒素性ショック症候群毒素、チモシンα1、組織プラスミノーゲンアクチベーター、腫瘍増殖因子(TGF)、TGF−α、TGF−β、腫瘍壊死因子、腫瘍壊死因子α、腫瘍壊死因子β、腫瘍壊死因子受容体(TNFR)、VLA−4タンパク質、VCAM−1タンパク質、血管内皮増殖因子(VEGEF)、ウロキナーゼ、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である請求項39に記載の組成物。
- タンパク質が治療用タンパク質に少なくとも約50%又は少なくとも約75%相同である請求項45に記載の組成物。
- 治療用タンパク質がエリスロポエチン(EPO)である請求項45に記載の組成物。
- 少なくとも1種の非天然アミノ酸を含む少なくとも1種のタンパク質を翻訳系で生産する方法であって、
少なくとも1種のセレクターコドンを含み、前記少なくとも1種のタンパク質をコードする少なくとも1種の核酸を翻訳系に加える段階と、
直交tRNA(O−tRNA)(但し、O−tRNAは翻訳系で機能し、O−tRNAは少なくとも1種のセレクターコドンを認識する)を翻訳系に加える段階と、
直交アミノアシルtRNAシンテターゼ(O−RS)(但し、O−RSは翻訳系内でO−tRNAを少なくとも1種の非天然アミノ酸で優先的にアミノアシル化する)を翻訳系に加える段階と、
少なくとも1種の非天然アミノ酸を翻訳系に加え、少なくとも1種の非天然アミノ酸を含む少なくとも1種のタンパク質を翻訳系で生産する段階を含む前記方法。 - 翻訳系が細胞を含む請求項48に記載の方法。
- 翻訳系が細菌細胞を含む請求項49に記載の方法。
- 翻訳系が大腸菌細胞を含む請求項50に記載の方法。
- 翻訳系が始原菌細胞を含む請求項49に記載の方法。
- 翻訳系が真核細胞を含む請求項49に記載の方法。
- 翻訳系が酵母細胞、哺乳動物細胞、植物細胞又は昆虫細胞を含む請求項53に記載の方法。
- 請求項49に記載の方法により生産した少なくとも1種の非天然アミノ酸を含むタンパク質であって、タンパク質が細胞依存的にプロセシング及び改変されている前記タンパク質。
- タンパク質がサイトカイン、増殖因子、増殖因子受容体、インターフェロン、インターロイキン、炎症性分子、腫瘍遺伝子産物、ペプチドホルモン、シグナル伝達分子、ステロイドホルモン受容体、転写アクチベーター、転写サプレッサー、エリスロポエチン(EPO)、インスリン、ヒト成長ホルモン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、肝細胞増殖因子、インスリン様増殖因子、白血病阻害因子、オンコスタチンM、PD−ECSF、PDGF、プレイオトロピン、SCF、cキットリガンド、VEGEF、G−CSF、IL−1、IL−2、IL−8、IGF−I、IGF−II、FGF(繊維芽細胞増殖因子)、PDGF、TNF、TGF−α、TGF−β、EGF(表皮増殖因子)、KGF(ケラチノサイト増殖因子)、SCF/cキット、CD40L/CD40、VLA−4/VCAM−1、ICAM−1/LFA−1、ヒアルリン/CD44、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である請求項55に記載のタンパク質。
- タンパク質がα1アンチトリプシン、アンジオスタチン、抗血友病因子、抗体、アポリポタンパク質、アポタンパク質、心房性ナトリウム利尿因子、心房性ナトリウム利尿ポリペプチド、心房性ペプチド、C−X−Cケモカイン、T39765、NAP−2、ENA−78、Gro−a、Gro−b、Gro−c、IP−10、GCP−2、NAP−4、SDF−1、PF−4、MIG、カルシトニン、cキットリガンド、サイトカイン、CCケモカイン、単球化学誘引タンパク質−1、単球化学誘引タンパク質−2、単球化学誘引タンパク質−3、単球炎症性タンパク質−1α、単球炎症性タンパク質−1β、RANTES、I309、R83915、R91733、HCC1、T58847、D31065、T64262、CD40、CD40リガンド、Cキットリガンド、コラーゲン、コロニー刺激因子(CSF)、補体因子5a、補体阻害剤、補体受容体1、サイトカイン、上皮好中球活性化ペプチド−78、GROα/MGSA、GROβ、GROγ、MIP−1α、MIP−1δ、MCP−1、表皮増殖因子(EGF)、上皮好中球活性化ペプチド、エリスロポエチン(EPO)、表皮剥離毒素、IX因子、VII因子、VIII因子、X因子、繊維芽細胞増殖因子(FGF)、フィブリノーゲン、フィブロネクチン、G−CSF、GM−CSF、グルコセレブロシダーゼ、ゴナドトロピン、増殖因子、増殖因子受容体、ヘッジホッグタンパク質、ヘモグロビン、肝細胞増殖因子(HGF)、ヒルジン、ヒト血清アルブミン、ICAM−1、ICAM−1受容体、LFA−1、LFA−1受容体、インスリン、インスリン様増殖因子(IGF)、IGF−I、IGF−II、インターフェロン、IFN−α、IFN−β、IFN−γ、インターロイキン、IL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、ケラチノサイト増殖因子(KGF)、ラクトフェリン、白血病阻害因子、ルシフェラーゼ、ニュールチュリン、好中球阻害因子(NIF)、オンコスタチンM、骨形成タンパク質、腫瘍遺伝子産物、副甲状腺ホルモン、PD−ECSF、PDGF、ペプチドホルモン、ヒト増殖ホルモン、プレイオトロピン、プロテインA、プロテインG、発熱外毒素A、B又はC、リラキシン、レニン、SCF、可溶性補体受容体I、可溶性I−CAM1、可溶性インターロイキン受容体、可溶性TNF受容体、ソマトメジン、ソマトスタチン、ソマトトロピン、ストレプトキナーゼ、スーパー抗原、ブドウ球菌エンテロトキシン、SEA、SEB、SEC1、SEC2、SEC3、SED、SEE、ステロイドホルモン受容体、スーパーオキシドジスムターゼ、毒素性ショック症候群毒素、チモシンα1、組織プラスミノーゲンアクチベーター、腫瘍増殖因子(TGF)、TGF−α、TGF−β、腫瘍壊死因子、腫瘍壊死因子α、腫瘍壊死因子β、腫瘍壊死因子受容体(TNFR)、VLA−4タンパク質、VCAM−1タンパク質、血管内皮増殖因子(VEGEF)、ウロキナーゼ、Mos、Ras、Raf、Met、p53、Tat、Fos、Myc、Jun、Myb、Rel、エストロゲン受容体、プロゲステロン受容体、テストステロン受容体、アルドステロン受容体、LDL受容体及びコルチコステロン受容体から構成される群から選択される治療用タンパク質に相同である請求項55に記載のタンパク質。
- タンパク質が治療用タンパク質に少なくとも約50%又は少なくとも約75%相同である請求項57に記載のタンパク質。
- 治療用タンパク質がエリスロポエチン(EPO)である請求項57に記載のタンパク質。
- タンパク質が少なくとも2種の非天然アミノ酸を含む請求項55に記載のタンパク質。
- タンパク質が少なくとも3種の非天然アミノ酸を含む請求項55に記載のタンパク質。
- タンパク質が少なくとも4種の非天然アミノ酸を含む請求項55に記載のタンパク質。
- タンパク質が少なくとも5種又は6種以上の非天然アミノ酸を含む請求項55に記載のタンパク質。
- 翻訳系がin vivo翻訳系を含む請求項48に記載の方法。
- 翻訳系が細胞抽出物を含む請求項64に記載の方法。
- 少なくとも1種のタンパク質がクロラムフェニコールアセチルトランスフェラーゼ(CAT)のAsp112TAG突然変異体、マウスジヒドロ葉酸レダクターゼ(DHFR)のTyr163TAG突然変異体、又はCOOH His6タグを付けたマウスジヒドロ葉酸レダクターゼ(DHFR)のTyr163TAG突然変異体である請求項48に記載の方法。
- 非天然アミノ酸がO−メチル−L−チロシン、L−3−(2−ナフチル)アラニン、3−メチルフェニルアラニン、O−4−アリル−L−チロシン、4−プロピル−L−チロシン、トリ−O−アセチル−GlcNAcβ−セリン、L−Dopa、フッ素化フェニルアラニン、イソプロピル−L−フェニルアラニン、p−アジド−L−フェニルアラニン、p−アシル−L−フェニルアラニン、p−ベンゾイル−L−フェニルアラニン、L−ホスホセリン、ホスホノセリン、ホスホノチロシン、p−ヨードフェニルアラニン、p−ブロモフェニルアラニン、p−アミノ−L−フェニルアラニン、イソプロピル−L−フェニルアラニン、チロシンアミノ酸の非天然類似体;グルタミンアミノ酸の非天然類似体;フェニルアラニンアミノ酸の非天然類似体;セリンアミノ酸の非天然類似体;スレオニンアミノ酸の非天然類似体;アルキル、アリール、アシル、アジド、シアノ、ハロ、ヒドラジン、ヒドラジド、ヒドロキシル、アルケニル、アルキニル、エーテル、チオール、スルホニル、セレノ、エステル、チオ酸、硼酸、ボロン酸、ホスホ、ホスホノ、ホスフィン、複素環、エノン、イミン、アルデヒド、ヒドロキシルアミン、ケトもしくはアミノ置換アミノ酸又はその任意組合せ;光架橋基をもつアミノ酸;スピンラベル付きアミノ酸;蛍光アミノ酸:新規官能基をもつアミノ酸;別の分子と共有又は非共有的に相互作用するアミノ酸;金属結合性アミノ酸;金属含有アミノ酸;放射性アミノ酸;フォトケージド及び/又は光異性化可能なアミノ酸;ビオチン又はビオチン類似体含有アミノ酸;グリコシル化又は糖鎖修飾アミノ酸;ケト含有アミノ酸;ポリエチレングリコール又はポリエーテルを含むアミノ酸;重原子置換アミノ酸;化学分解性又は光分解性アミノ酸;延長側鎖をもつアミノ酸;毒性基を含むアミノ酸;糖鎖置換アミノ酸(例えば糖鎖置換セリン等);炭素結合糖含有アミノ酸;レドックス活性アミノ酸;α−ヒドロキシ含有酸;アミノチオ酸含有アミノ酸;α,αジ置換アミノ酸;βアミノ酸;及びプロリン以外の環状アミノ酸から構成される群から選択される請求項48に記載の方法。
- 少なくとも1種の非天然アミノ酸がO−メチル−L−チロシンである請求項48に記載の方法。
- 少なくとも1種の非天然アミノ酸がL−3−(2−ナフチル)アラニンである請求項48に記載の方法。
- 少なくとも1種の非天然アミノ酸がアミノ−、イソプロピル−、又はO−アリル含有フェニルアラニン類似体である請求項48に記載の方法。
- O−tRNAが配列番号1〜3及びその相補的ポリヌクレオチド配列から構成される群から選択されるポリヌクレオチド配列を含む核酸を含む請求項48に記載の方法。
- 少なくとも1種のセレクターコドンがナンセンスコドン、レアコドン又は4塩基コドンである請求項48に記載の方法。
- 少なくとも1種のセレクターコドンがアンバーコドンである請求項72に記載の方法。
- O−RSがO−tRNAをO−メチル−L−チロシンで優先的にアミノアシル化する請求項48に記載の方法。
- O−RSがO−tRNAをアミノ−、イソプロピル−、又はO−アリル含有フェニルアラニン類似体で優先的にアミノアシル化する、請求項48に記載の方法。
- O−RSが、配列番号4〜34から構成される群から選択されるアミノ酸配列を含むポリペプチドと、配列番号35〜66及びその相補的ポリヌクレオチド配列から構成される群から選択されるポリヌクレオチド配列を含む核酸によりコードされるポリペプチドから構成される群から選択されるポリペプチドを含む請求項48に記載の方法。
- 非天然アミノ酸を外部から加える請求項48に記載の方法。
- 翻訳系が細胞であり、非天然アミノ酸が細胞により生合成される請求項48に記載の方法。
- 少なくとも1種のO−メチル−L−チロシンを含む少なくとも1種のタンパク質を大腸菌細胞で生産する方法であって、
アンバーコドンを含み、前記少なくとも1種のタンパク質をコードする少なくとも1種の核酸を翻訳系に加える段階と、
mtRNACUA Tyr (但し、mtRNACUA Tyr は細胞で機能し、mtRNACUA Tyr はアンバーコドンを認識する)を翻訳系に加える段階と、
突然変異体TyrRS(LWJ16)(但し、突然変異体TyrRS(LWJ16)は細胞内でmtRNACUA Tyr をO−メチル−L−チロシンでアミノアシル化する)を翻訳系に加える段階と、
O−メチル−L−チロシンを細胞に加え、O−メチル−L−チロシンを含む少なくとも1種のタンパク質を細胞内で生産する段階を含む前記方法。 - 少なくとも1種のL−3−(2−ナフチル)アラニンを含む少なくとも1種のタンパク質を大腸菌細胞で生産する方法であって、
アンバーコドンを含み、前記少なくとも1種のタンパク質をコードする少なくとも1種の核酸を翻訳系に加える段階と、
mtRNACUA Tyr (但し、mtRNACUA Tyr は細胞で機能し、mtRNACUA Tyr はアンバーコドンを認識する)を細胞に加える段階と、
SS12−TyrRS(但し、SS12−TyrRSは細胞内でmtRNACUA Tyr をL−3−(2−ナフチル)アラニンでアミノアシル化する)を細胞に加える段階と、
L−3−(2−ナフチル)アラニンを細胞に加え、L−3−(2−ナフチル)アラニンを含む少なくとも1種のタンパク質を細胞内で生産する段階を含む前記方法。 - 更に直交tRNAを含む請求項81、請求項82、請求項83又は請求項84に記載の組成物。
- 非天然アミノ酸が直交tRNAに共有結合している請求項85に記載の組成物。
- 非天然アミノ酸がアミノアシル結合を介して直交tRNAに共有結合している請求項85に記載の組成物。
- 非天然アミノ酸が直交tRNAの末端リボース糖の3' OH又は2' OHに共有結合している請求項85に記載の組成物。
- 更に直交アミノアシルtRNAシンテターゼを含む請求項81、請求項82、請求項83又は請求項84に記載の組成物。
- 非天然アミノ酸が直交アミノアシルtRNAシンテターゼに水素結合している請求項89に記載の組成物。
- 請求項81、請求項82、請求項83又は請求項84に記載の非天然アミノ酸を含むタンパク質。
- 請求項81、請求項82、請求項83又は請求項84に記載の非天然アミノ酸を含む細胞。
- 4−アリル−L−チロシンの合成方法であって、
(a)保護チロシンを臭化アリルと反応させて保護アリルチロシンを得る段階と、
(b)保護アリルチロシンを脱保護して4−アリル−L−チロシンを生産する段階を含む前記方法。 - 水素化ナトリウムとDMFの存在下に臭化アリルと保護チロシンを反応させる請求項93に記載の方法。
- 保護チロシンがNBoc保護チロシンを含む請求項93に記載の方法。
- 段階(b)において保護アリルチロシンを酸性溶液中で脱保護する請求項95に記載の方法。
- 段階(b)において保護アリルチロシンを塩酸とジオキサンの存在下に脱保護する請求項95に記載の方法。
- 4−アリル−L−チロシンをエタノール又はジクロロメタンで抽出する段階を更に含む請求項93に記載の方法。
- Rがケト、アセチル又はメトキシ基を含む請求項99に記載の方法。
- メタ置換フェニルアラニン類似体が3−メトキシフェニルアラニン又は3−アセチルフェニルアラニンを含む請求項99に記載の方法。
- 式Vの化合物が1−(3−ブロモメチルフェニル)エタノンを含む請求項99に記載の方法。
- N−ブロモスクシンイミドを3−メチルアセトフェノンと反応させて臭素化物を生成し、臭素化物をヘキサン溶液中で結晶化させることにより、メタ置換臭化ベンジルを得る段階を更に含む請求項99に記載の方法。
- グリコシル化アミノ酸のin vivo製造方法であって、N−アセチルガラクトサミニダーゼ、トランスグリコシラーゼ又はセリングリコシルヒドロラーゼの遺伝子を含むプラスミドで細胞を形質転換することを含む前記方法。
- p−アミノフェニルアラニンの製造方法であって、
(a)コリスミン酸を4−アミノ−4−デオキシコリスミン酸に酵素変換する段階と、
(b)4−アミノ−4−デオキシコリスミン酸を4−アミノ−4−デオキシプレフェン酸に酵素変換する段階と、
(c)4−アミノ−4−デオキシプレフェン酸をp−アミノフェニルピルビン酸に酵素変換する段階と、
(d)p−アミノフェニルピルビン酸をp−アミノフェニルアラニンに酵素変換する段階を含む前記方法。 - 段階(a)においてコリスミン酸を4−アミノ−4−デオキシコリスミン酸シンターゼと接触させる請求項105に記載の方法。
- 4−アミノ−4−デオキシコリスミン酸シンターゼがpapAを含む請求項106に記載の方法。
- 段階(b)において4−アミノ−4−デオキシコリスミン酸をコリスミン酸ムターゼと接触させる請求項105に記載の方法。
- コリスミン酸ムターゼがpapBを含む請求項108に記載の方法。
- 段階(c)において4−アミノ−4−デオキシプレフェン酸をプレフェン酸デヒドロゲナーゼと接触させる請求項105に記載の方法。
- プレフェン酸デヒドロゲナーゼがpapCを含む、請求項110に記載の方法。
- 段階(d)においてp−アミノフェニルピルビン酸をアミノトランスフェラーゼと接触させる請求項105に記載の方法。
- アミノトランスフェラーゼが大腸菌由来非特異的チロシンアミノトランスフェラーゼを含む請求項112に記載の方法。
- アミノトランスフェラーゼがtyrB、aspS又はilvEを含む請求項116に記載の方法。
- 段階(a)〜(d)をin vivoで実施する、請求項105に記載の方法。
- papA、papB及びpapCを含むプラスミドで細胞を形質転換して大腸菌内でp−アミノフェニルアラニンを生産する方法であって、細胞がコリスミン酸とアミノトランスフェラーゼを含み、papA、papB及びpapCの発現の結果としてシンターゼ、ムターゼ及びデヒドロゲナーゼが生産され、シンターゼ、ムターゼ、デヒドロゲナーゼ及びアミノトランスフェラーゼがコリスミン酸からp−フェニルアラニンを生産する前記方法。
- (a)細胞内の1種以上の炭素源から非天然アミノ酸を生産するための生合成経路系と、
(b)直交tRNA(O−tRNA)と直交アミノアシルtRNAシンテターゼ(O−RS)を含む翻訳系を含む細胞であって、O−RSがO−tRNAを非天然アミノ酸で優先的にアミノアシル化し、O−tRNAがセレクターコドンに応答して非天然アミノ酸をタンパク質に組込む前記細胞。 - 細胞が細菌細胞を含む請求項117に記載の細胞。
- セレクターコドンがナンセンスコドン、4塩基コドン又はアンバーコドンを含む請求項117に記載の細胞。
- ナンセンスコドンがTAGコドンを含む請求項119に記載の細胞。
- 生合成経路系が天然細胞量の非天然アミノ酸を生産する請求項117に記載の細胞。
- 生合成経路系がシンターゼ、ムターゼ、デヒドロゲナーゼ及びアミノトランスフェラーゼを含む請求項117に記載の細胞。
- シンターゼが4−アミノ−4−デオキシコリスミン酸シンターゼを含む請求項122に記載の細胞。
- ムターゼがコリスミン酸ムターゼを含む請求項122に記載の細胞。
- デヒドロゲナーゼがプレフェン酸デヒドロゲナーゼを含む請求項122に記載の細胞。
- シンターゼ、デヒドロゲナーゼ及びムターゼがStreptomyces venezuelae又はStreptomyces pristinaespiralisに由来し、アミノトランスフェラーゼが大腸菌に由来する請求項122に記載の細胞。
- 非天然アミノ酸がp−アミノフェニルアラニン、dopa又はO−メチル−L−チロシンを含む請求項117に記載の細胞。
- 非天然アミノ酸がグリコシル化アミノ酸又はペグ化アミノ酸を含む請求項117に記載の細胞。
- 炭素源がコリスミン酸を含む請求項117に記載の細胞。
- 生合成経路系がコリスミン酸からp−アミノフェニルアラニンを生産する請求項117に記載の細胞。
- 生合成経路系が、
(a)コリスミン酸を4−アミノ−4−デオキシコリスミン酸に酵素変換し、
(b)4−アミノ−4−デオキシコリスミン酸を4−アミノ−4−デオキシプレフェン酸に酵素変換し、
(c)4−アミノ−4−デオキシプレフェン酸をp−アミノフェニルピルビン酸に酵素変換し、
(d)p−アミノフェニルピルビン酸をp−アミノフェニルアラニンに酵素変換する請求項117に記載の細胞。 - 細胞がタンパク質生合成に十分な量でありながら、天然アミノ酸の濃度を実質的に変えたり、細胞資源を枯渇させない量の非天然アミノ酸を生産する請求項117に記載の細胞。
- 非天然アミノ酸がp−アミノフェニルアラニン、L−dopa又はO−メチル−L−チロシンである請求項132に記載の細胞。
- 生合成経路系がプラスミドを含み、プラスミドがコリスミン酸シンターゼをコードするポリヌクレオチドと、コリスミン酸ムターゼをコードするポリヌクレオチドと、プレフェン酸デヒドロゲナーゼをコードするポリヌクレオチドを含む請求項117に記載の細胞。
- 細胞がプラスミドを含み、プラスミドがpapA遺伝子、papB遺伝子及びpapC遺伝子を含む請求項117に記載の細胞。
- プラスミドが更にlppプロモーターとlacプロモーターを含む請求項135に記載の細胞。
- プラスミドが更に1個以上のリボソーム結合部位を含む請求項135に記載の細胞。
- プラスミドが低コピーpSC101由来プラスミドである請求項135に記載の細胞。
- 少なくとも21種のアミノ酸を生産し、アミノ酸の1種以上を細胞内の1種以上のタンパク質に特異的に組込むための細胞であって、組込まれるアミノ酸の少なくとも1種が非天然アミノ酸を含む前記細胞。
- 細胞に組込まれた非天然アミノ酸により提供される効果を識別する方法であって、
(a)大腸菌ゲノムに由来するランダム変異プラスミド(ランダム変異プラスミドの1個以上は非天然アミノ酸をタンパク質に組込む能力を細胞に付与する)を各々含む細胞のライブラリーを提供する段階と、
(b)細胞ライブラリーをスクリーニングし、天然大腸菌細胞に比較して増殖が亢進した1個以上の細胞を識別し、非天然アミノ酸により付与される効果を識別する段階を含む前記方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US28503001P | 2001-04-19 | 2001-04-19 | |
| US35551402P | 2002-02-06 | 2002-02-06 | |
| PCT/US2002/012465 WO2002085923A2 (en) | 2001-04-19 | 2002-04-19 | In vivo incorporation of unnatural amino acids |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008285996A Division JP2009132704A (ja) | 2001-04-19 | 2008-11-06 | 非天然アミノ酸のインビボ組込み |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005502322A true JP2005502322A (ja) | 2005-01-27 |
| JP2005502322A5 JP2005502322A5 (ja) | 2009-01-08 |
Family
ID=26962950
Family Applications (7)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002583449A Pending JP2005502322A (ja) | 2001-04-19 | 2002-04-19 | 非天然アミノ酸のインビボ組込み |
| JP2002583590A Pending JP2004537984A (ja) | 2001-04-19 | 2002-04-19 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2008285996A Pending JP2009132704A (ja) | 2001-04-19 | 2008-11-06 | 非天然アミノ酸のインビボ組込み |
| JP2008285997A Pending JP2009077731A (ja) | 2001-04-19 | 2008-11-06 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2010211248A Expired - Lifetime JP5766925B2 (ja) | 2001-04-19 | 2010-09-21 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2013156012A Expired - Lifetime JP6239888B2 (ja) | 2001-04-19 | 2013-07-26 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2016021701A Expired - Lifetime JP6294368B2 (ja) | 2001-04-19 | 2016-02-08 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
Family Applications After (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002583590A Pending JP2004537984A (ja) | 2001-04-19 | 2002-04-19 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2008285996A Pending JP2009132704A (ja) | 2001-04-19 | 2008-11-06 | 非天然アミノ酸のインビボ組込み |
| JP2008285997A Pending JP2009077731A (ja) | 2001-04-19 | 2008-11-06 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2010211248A Expired - Lifetime JP5766925B2 (ja) | 2001-04-19 | 2010-09-21 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2013156012A Expired - Lifetime JP6239888B2 (ja) | 2001-04-19 | 2013-07-26 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2016021701A Expired - Lifetime JP6294368B2 (ja) | 2001-04-19 | 2016-02-08 | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
Country Status (11)
| Country | Link |
|---|---|
| US (19) | US7045337B2 (ja) |
| EP (5) | EP2322631B1 (ja) |
| JP (7) | JP2005502322A (ja) |
| AU (2) | AU2002256292C1 (ja) |
| CA (2) | CA2444098C (ja) |
| DK (4) | DK1456360T3 (ja) |
| ES (1) | ES2464532T3 (ja) |
| HK (4) | HK1065065A1 (ja) |
| IL (7) | IL158418A0 (ja) |
| MX (2) | MXPA03009563A (ja) |
| WO (2) | WO2002086075A2 (ja) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009132704A (ja) * | 2001-04-19 | 2009-06-18 | Scripps Res Inst:The | 非天然アミノ酸のインビボ組込み |
| JP2010502218A (ja) * | 2006-09-08 | 2010-01-28 | アンブルックス,インコーポレイテッド | 修飾ヒト血漿ポリペプチドまたは修飾ヒトFc足場タンパク質ならびにこれらの利用 |
| JP2010502222A (ja) * | 2006-09-08 | 2010-01-28 | アンブルックス,インコーポレイテッド | 脊椎動物細胞用のハイブリッドサプレッサーtrna |
| JP2010504096A (ja) * | 2006-09-21 | 2010-02-12 | ザ スクリップス リサーチ インスティテュート | 真正細菌における選択的に硫酸化された蛋白質の遺伝的にプログラムされた発現 |
| JP2011502507A (ja) * | 2007-11-02 | 2011-01-27 | ザ スクリプス リサーチ インスティチュート | 非天然アミノ酸を含有する蛋白質を使用する指向的進化 |
| JP2011527886A (ja) * | 2007-12-11 | 2011-11-10 | ザ スクリプス リサーチ インスティチュート | メタノール資化性酵母ピキア・パストリスにおけるインビボ非天然アミノ酸発現 |
| WO2011158895A1 (ja) * | 2010-06-16 | 2011-12-22 | 独立行政法人理化学研究所 | 非天然タンパク質製造用の組換え細菌の作製方法、及びその利用 |
| KR101568336B1 (ko) | 2013-07-02 | 2015-11-12 | 서강대학교산학협력단 | 목적 단백질의 돌연변이체를 생성하는 세포, 상기 세포의 제조 방법, 및 상기 세포를 이용한 목적 단백질의 돌연변이체의 제조 방법 |
Families Citing this family (383)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6964859B2 (en) | 2001-10-16 | 2005-11-15 | Massachusetts Institute Of Technology | Suppressor tRNA system |
| US20030148391A1 (en) * | 2002-01-24 | 2003-08-07 | Salafsky Joshua S. | Method using a nonlinear optical technique for detection of interactions involving a conformational change |
| US7112435B1 (en) | 2002-08-07 | 2006-09-26 | Ambit Biosciences Corporation | Uncoupling of DNA insert propagation and expression of protein for phage display |
| US20040038273A1 (en) * | 2002-06-17 | 2004-02-26 | Whitehead Institute For Biomedical Research | Bifunctional tRNA for in vitro selection |
| EP1551439A2 (en) * | 2002-07-25 | 2005-07-13 | MDS Proteomics Inc. | Improved systems and methods for analysis of protein post-translational modification |
| US7897381B2 (en) * | 2002-08-07 | 2011-03-01 | Ambit Biosciences Corporation | Uncoupling of DNA insert propagation and expression of protein for phage display |
| US7833741B2 (en) * | 2002-08-07 | 2010-11-16 | Ambit Biosciences Corporation | Uncoupling of DNA insert propagation and expression of protein for phage display |
| US7563600B2 (en) | 2002-09-12 | 2009-07-21 | Combimatrix Corporation | Microarray synthesis and assembly of gene-length polynucleotides |
| KR20050073559A (ko) | 2002-10-16 | 2005-07-14 | 더 스크립스 리서치 인스티튜트 | 당단백질 합성 |
| US7432092B2 (en) | 2002-10-16 | 2008-10-07 | The Scripps Research Institute | Site specific incorporation of keto amino acids into proteins |
| AU2003300389B2 (en) | 2002-12-22 | 2009-10-08 | The Scripps Research Institute | Protein arrays |
| JP4903036B2 (ja) | 2003-01-06 | 2012-03-21 | アンジオケム・インコーポレーテッド | 血液脳関門を通過する担体としてのアプロチニンおよび類似体 |
| US7772188B2 (en) | 2003-01-28 | 2010-08-10 | Ironwood Pharmaceuticals, Inc. | Methods and compositions for the treatment of gastrointestinal disorders |
| JP2006180701A (ja) * | 2003-02-10 | 2006-07-13 | Institute Of Physical & Chemical Research | チロシルtRNA合成酵素の変異体及びその作製方法 |
| ATE542894T1 (de) * | 2003-04-17 | 2012-02-15 | Scripps Research Inst | Ausweitung des eukaryotischen genetischen codes |
| AU2013201487B2 (en) * | 2003-04-17 | 2014-09-18 | The Scripps Research Institute | Expanding the eukaryotic genetic code |
| WO2004110964A2 (en) * | 2003-06-16 | 2004-12-23 | Nuevolution A/S | Encoded molecules by translation (emt) |
| EP2410331B1 (en) * | 2003-06-18 | 2015-09-23 | The Scripps Research Institute | Aminoacyl-tRNA synthetase for aminoacylation tRNA with unnatural amino acids |
| US7527943B2 (en) | 2003-07-07 | 2009-05-05 | The Scripps Research Institute | Compositions of orthogonal glutamyl-tRNA and aminoacyl-tRNA synthetase pairs and uses thereof |
| US20060160175A1 (en) * | 2003-07-07 | 2006-07-20 | The Scripps Research Institute | Compositions of orthogonal leucyl-trna and aminoacyl-trna synthetase pairs and uses thereof |
| ATE386133T1 (de) * | 2003-07-07 | 2008-03-15 | Scripps Research Inst | Zusammensetzungen der orthogonalen lysyl-trna und aminoacyl-trna synthetase paaren und ihre verwendungen |
| ATE447611T1 (de) | 2003-08-18 | 2009-11-15 | Univ California | Polypeptid-display-bibliotheken und verfahren zur herstellung und verwendung davon |
| EP1687401B1 (en) | 2003-10-14 | 2012-11-21 | The Scripps Research Institute | Site-specific incorporation of redox active amino acids into proteins |
| CA2549263A1 (en) * | 2003-12-12 | 2005-08-11 | Conjugon, Inc. | Systems for tightly regulated gene expression |
| EP1725251A4 (en) * | 2003-12-18 | 2009-07-01 | Scripps Research Inst | SELECTIVE INCORPORATION OF 5-HYDROXYTRYPTOPHANE IN PROTEINS IN MAMMALIAN CELLS |
| BRPI0507169A (pt) | 2004-02-02 | 2007-06-26 | Ambrx Inc | polipeptìdeos do hormÈnio de crescimento humano modificados e seu usos |
| US20060127920A1 (en) * | 2004-02-27 | 2006-06-15 | President And Fellows Of Harvard College | Polynucleotide synthesis |
| FR2868081A1 (fr) * | 2004-03-23 | 2005-09-30 | Libragen Sa | Methode d'identification de famille de voie metabolique par selection positive |
| US20050260711A1 (en) * | 2004-03-30 | 2005-11-24 | Deepshikha Datta | Modulating pH-sensitive binding using non-natural amino acids |
| JP4799405B2 (ja) * | 2004-04-09 | 2011-10-26 | 中外製薬株式会社 | 細胞死誘導剤 |
| US20050287639A1 (en) | 2004-05-17 | 2005-12-29 | California Institute Of Technology | Methods of incorporating amino acid analogs into proteins |
| JP2008500050A (ja) * | 2004-05-25 | 2008-01-10 | ザ スクリップス リサーチ インスティテュート | 結晶構造決定のための重原子含有非天然アミノ酸の部位特異的蛋白質組込み |
| US20060008844A1 (en) * | 2004-06-17 | 2006-01-12 | Avidia Research Institute | c-Met kinase binding proteins |
| ZA200609926B (en) * | 2004-06-18 | 2009-02-25 | Ambrx Inc | Novel antigen-binding polypeptides and their uses |
| JP2008503217A (ja) * | 2004-06-18 | 2008-02-07 | アンブレツクス・インコーポレイテツド | 新規抗原結合ポリペプチド及びそれらの使用 |
| ES2339789T3 (es) | 2004-07-20 | 2010-05-25 | Genentech, Inc. | Inhibidores de proteina 4 de tipo angiopoyetina, combinaciones y su utilizacion. |
| AU2005327906B2 (en) * | 2004-07-21 | 2010-05-13 | Ambrx, Inc. | Biosynthetic polypeptides utilizing non-naturally encoded amino acids |
| EP2770053B1 (en) * | 2004-09-21 | 2018-02-21 | The Scripps Research Institute | In vivo incorporation of alkynyl amino acids into proteins in eubacteria |
| WO2006036779A2 (en) * | 2004-09-22 | 2006-04-06 | The Scripps Research Institute | Site-specific labeling of proteins for nmr studies |
| EP1812598A1 (en) * | 2004-10-18 | 2007-08-01 | Codon Devices, Inc. | Methods for assembly of high fidelity synthetic polynucleotides |
| US20070122817A1 (en) * | 2005-02-28 | 2007-05-31 | George Church | Methods for assembly of high fidelity synthetic polynucleotides |
| JP2008516637A (ja) | 2004-10-20 | 2008-05-22 | ザ スクリップス リサーチ インスティテュート | 真正細菌へのn−アセチルガラクトサミンアミノ酸のインビボ部位特異的組込み |
| AU2005330514B2 (en) | 2004-10-27 | 2011-05-12 | The Scripps Research Institute | Orthogonal translation components for the in vivo incorporation of unnatural amino acids |
| AU2011204773B2 (en) * | 2004-10-27 | 2012-02-02 | The Scripps Research Institute | Orthogonal translation components for the in vivo incorporation of unnatural amino acids |
| DK2586456T3 (en) | 2004-10-29 | 2016-03-21 | Ratiopharm Gmbh | Conversion and glycopegylation of fibroblast growth factor (FGF) |
| WO2006055898A2 (en) * | 2004-11-20 | 2006-05-26 | Massachusetts Institute Of Technology | Orthogonal suppressor trnas and aminoacyl-trna synthetases and uses thereof |
| JPWO2006054807A1 (ja) * | 2004-11-22 | 2008-06-05 | 国立大学法人岐阜大学 | ミトコンドリア蛋白質を用いる、非天然アミノ酸を蛋白質に部位特異的に導入する方法及びtRNAの効率的調製方法 |
| NZ555206A (en) | 2004-12-22 | 2010-09-30 | Ambrx Inc | Methods for expression and purification of recombinant human growth hormone |
| EP1836314B1 (en) | 2004-12-22 | 2012-01-25 | Ambrx, Inc. | Modified human growth hormone |
| CA2594561C (en) | 2004-12-22 | 2014-12-23 | Ambrx, Inc. | Formulations of human growth hormone comprising a non-naturally encoded amino acid |
| JP5425398B2 (ja) | 2004-12-22 | 2014-02-26 | アンブレツクス・インコーポレイテツド | 非天然アミノ酸及びポリペプチドを含む組成物、非天然アミノ酸及びポリペプチドに関連する方法並び非天然アミノ酸及びポリペプチドその使用 |
| CA2590429C (en) | 2004-12-22 | 2014-10-07 | Ambrx, Inc. | Compositions of aminoacyl-trna synthetase and uses thereof |
| AU2013205042B2 (en) * | 2004-12-22 | 2016-05-12 | Ambrx, Inc. | Compositions containing, methods involving, and uses of non-natural amino acids and polypeptides |
| PA8660701A1 (es) | 2005-02-04 | 2006-09-22 | Pfizer Prod Inc | Agonistas de pyy y sus usos |
| US7723069B2 (en) * | 2005-04-05 | 2010-05-25 | Yale University | Site specific incorporation of phosphoserine into polypeptides using phosphoseryl-tRNA synthetase |
| US20070154992A1 (en) | 2005-04-08 | 2007-07-05 | Neose Technologies, Inc. | Compositions and methods for the preparation of protease resistant human growth hormone glycosylation mutants |
| WO2006122224A1 (en) | 2005-05-11 | 2006-11-16 | Wayne State University | Methods and compositions for the identification of antibiotics that are not susceptible to antibiotic resistance in pseudomonas aeruginosa |
| CN103030690A (zh) * | 2005-06-03 | 2013-04-10 | Ambrx公司 | 经改良人类干扰素分子和其用途 |
| EP1891092A4 (en) * | 2005-06-03 | 2011-12-21 | Ambrx Inc | INSTALLATION OF NATURALLY CODED AMINO ACIDS IN PROTEINS |
| JP5068167B2 (ja) * | 2005-06-10 | 2012-11-07 | 中外製薬株式会社 | メグルミンを含有するタンパク質製剤の安定化剤、およびその利用 |
| US20070004041A1 (en) * | 2005-06-30 | 2007-01-04 | Codon Devices, Inc. | Heirarchical assembly methods for genome engineering |
| CA2614326C (en) * | 2005-07-15 | 2012-09-18 | Medical Research Council | Compositions and methods relating to orthogonal ribosome mrna pairs |
| AU2006272405B2 (en) | 2005-07-15 | 2013-02-07 | Angiochem Inc. | Use of aprotinin polypeptides as carriers in pharmaceutical conjugates |
| US8008453B2 (en) | 2005-08-12 | 2011-08-30 | Amgen Inc. | Modified Fc molecules |
| ES2408581T3 (es) * | 2005-08-18 | 2013-06-21 | Ambrx, Inc. | Composiciones de ARNt y usos de las mismas |
| US7666817B2 (en) | 2005-08-31 | 2010-02-23 | The Regents Of The University Of California | Cellular libraries of peptide sequences (CLiPS) and methods of using the same |
| EP1934343A4 (en) * | 2005-10-12 | 2009-09-16 | Scripps Research Inst | SELECTIVE MODIFICATION POST-TRANSLATION OF POLYPEPTIDES EXPRESSED ON THE SURFACE OF PHAGES |
| US20090018029A1 (en) | 2005-11-16 | 2009-01-15 | Ambrx, Inc. | Methods and Compositions Comprising Non-Natural Amino Acids |
| CA2882445A1 (en) * | 2005-12-14 | 2007-06-21 | Ambrx, Inc. | Compositions containing, methods involving, and uses of non-natural amino acids and polypeptides |
| EP3056575B1 (en) | 2005-12-22 | 2017-10-11 | Pacific Biosciences Of California, Inc. | Polymerases for nucleotide analogue incorporation |
| CN105085313A (zh) * | 2005-12-30 | 2015-11-25 | Ambrx公司 | 含有非天然氨基酸和多肽的组合物、涉及非天然氨基酸和多肽的方法以及非天然氨基酸和多肽的用途 |
| JP2009523815A (ja) * | 2006-01-19 | 2009-06-25 | アンブルックス,インコーポレイテッド | 免疫原性が調節された非天然アミノ酸ポリペプチド |
| US20070178554A1 (en) * | 2006-02-01 | 2007-08-02 | Nima Shiva | Orthogonal Aminoacyl Synthetase-tRNA Pairs for Incorporating Unnatural Amino Acids Into Proteins |
| WO2007090198A2 (en) * | 2006-02-01 | 2007-08-09 | Encode Bio, Inc. | Fluorescent assays using orthogonal trna - aminoacyl synthetase pairs |
| WO2007092475A2 (en) * | 2006-02-06 | 2007-08-16 | Franklin And Marshall College | Site-specific incorporation of fluorinated amino acids into proteins |
| SI1999259T1 (sl) | 2006-03-03 | 2014-11-28 | California Institute Of Technology | Usmerjeno vključevanje amino kislin v molekule |
| EP1991680B1 (en) * | 2006-03-09 | 2013-08-21 | The Scripps Research Institute | System for the expression of orthogonal translation components in eubacterial host cells |
| JP5249194B2 (ja) * | 2006-03-16 | 2013-07-31 | ザ スクリプス リサーチ インスティチュート | 非天然アミノ酸フェニルセレノシステインを含有するタンパク質の遺伝的にプログラムされた発現 |
| US20080096819A1 (en) | 2006-05-02 | 2008-04-24 | Allozyne, Inc. | Amino acid substituted molecules |
| CA2653748A1 (en) | 2006-05-02 | 2007-11-15 | Allozyne, Inc. | Non-natural amino acid substituted polypeptides |
| RU2473690C2 (ru) * | 2006-05-23 | 2013-01-27 | Зе Скрипс Ресеч Инститьют | Генетически кодируемые флюоресцентные кумариновые аминокислоты |
| JO2968B1 (en) * | 2006-06-09 | 2016-03-15 | نوفارتيس ايه جي | Polypeptides are a stable insulin-like growth factor |
| EP2048233B8 (en) * | 2006-06-28 | 2012-05-02 | Riken | MUTANT SepRS, AND METHOD FOR SITE-SPECIFIC INTRODUCTION OF PHOSPHOSERINE INTO PROTEIN BY USING THE SAME |
| US8715958B2 (en) * | 2006-06-29 | 2014-05-06 | The Board Of Trustees Of The Leland Stanford Junior University | Cell-free synthesis of proteins containing unnatural amino acids |
| AU2007273507A1 (en) * | 2006-07-13 | 2008-01-17 | Chugai Seiyaku Kabushiki Kaisha | Cell death inducer |
| AU2012203737B2 (en) * | 2006-09-08 | 2014-06-19 | Ambrx, Inc. | Modified human plasma polypeptide or Fc scaffolds and their uses |
| WO2008030614A2 (en) | 2006-09-08 | 2008-03-13 | Ambrx, Inc. | Suppressor trna transcription in vertebrate cells |
| CA2662752C (en) * | 2006-09-08 | 2016-04-12 | Ambrx, Inc. | Site specific incorporation of non-natural amino acids by vertebrate cells |
| AU2013202770B2 (en) * | 2006-09-08 | 2015-08-20 | Ambrx, Inc. | Modified human plasma polypeptide or Fc scaffolds and their uses |
| EP2069481A4 (en) | 2006-10-18 | 2010-01-06 | Scripps Research Inst | GENETIC ASSEMBLY OF UNNATURAL AMINO ACIDS IN PROTEINS IN MAMMALIAN CELLS |
| EP2120998B1 (en) | 2006-11-28 | 2013-08-07 | HanAll Biopharma Co., Ltd. | Modified erythropoietin polypeptides and uses thereof for treatment |
| EP1936340A1 (en) * | 2006-12-21 | 2008-06-25 | Koninklijke Philips Electronics N.V. | Sub wavelength aperture |
| WO2008103618A1 (en) * | 2007-02-22 | 2008-08-28 | University Of Utah Research Foundation | Synthesis of novel xylosides and potential uses thereof |
| CL2008000719A1 (es) * | 2007-03-12 | 2008-09-05 | Univ Tokushima Chugai Seiyaku | Agente terapeutico para cancer resistente a agentes quimioterapeuticos que comprende un anticuerpo que reconoce hla de clase i como ingrediente activo; composicion farmaceutica que comprende dicho anticuerpo; y metodo para tratar cancer resistente a |
| KR101476472B1 (ko) | 2007-03-30 | 2015-01-05 | 암브룩스, 인코포레이티드 | 변형된 fgf-21 폴리펩티드 및 그 용도 |
| WO2008127900A1 (en) * | 2007-04-13 | 2008-10-23 | The Salk Institute For Biological Studies | Methods of genetically encoding unnatural amino acids in eukaryotic cells using orthogonal trna/synthetase pairs |
| JP2010525821A (ja) | 2007-05-02 | 2010-07-29 | アンブルックス,インコーポレイテッド | 修飾IFNβポリペプチドおよびこれらの使用 |
| US9365634B2 (en) | 2007-05-29 | 2016-06-14 | Angiochem Inc. | Aprotinin-like polypeptides for delivering agents conjugated thereto to tissues |
| US8969514B2 (en) | 2007-06-04 | 2015-03-03 | Synergy Pharmaceuticals, Inc. | Agonists of guanylate cyclase useful for the treatment of hypercholesterolemia, atherosclerosis, coronary heart disease, gallstone, obesity and other cardiovascular diseases |
| EP2998314B1 (en) | 2007-06-04 | 2020-01-22 | Bausch Health Ireland Limited | Agonists of guanylate cyclase useful for the treatment of gastrointestinal disorders, inflammation, cancer and other disorders |
| US8293685B2 (en) | 2007-07-26 | 2012-10-23 | The Regents Of The University Of California | Methods for enhancing bacterial cell display of proteins and peptides |
| CA2707840A1 (en) | 2007-08-20 | 2009-02-26 | Allozyne, Inc. | Amino acid substituted molecules |
| WO2009036460A2 (en) * | 2007-09-14 | 2009-03-19 | Ambrx, Inc. | Modified human apolipoprotein a-i polypeptides and their uses |
| CA2702061A1 (en) * | 2007-10-08 | 2009-04-16 | Synthetic Genomics, Inc. | System and method for producing synthetic microorganisms capable of translating proteins containing non-standard amino acids |
| MX2010004464A (es) * | 2007-10-25 | 2010-06-07 | Scripps Research Inst | Incorporacion genetica de 3-aminotirosina a reductasas. |
| CN101951954A (zh) | 2007-11-02 | 2011-01-19 | 诺瓦提斯公司 | 调节低密度脂蛋白受体相关蛋白6(lrp6)的分子和方法 |
| EP2220218A4 (en) * | 2007-11-02 | 2010-12-08 | Scripps Research Inst | BORONIC AMINO ACID GENETICALLY CODED |
| WO2009064416A2 (en) * | 2007-11-15 | 2009-05-22 | The Scripps Research Institute | Genetic incorporation of an alpha-hydroxy acid into proteins to generate ester backbone linkages at defined sites |
| DK2217265T3 (en) | 2007-11-20 | 2017-07-03 | Ambrx Inc | Modified insulin polypeptides and their use |
| JP5563990B2 (ja) | 2008-01-03 | 2014-07-30 | ヴェレニウム コーポレイション | トランスフェラーゼおよびオキシドレダクターゼ、それらをコードする核酸並びにそれらを製造および使用する方法 |
| US20110065633A1 (en) | 2008-01-30 | 2011-03-17 | Indiana University Research And Technology Corporation | Ester-based peptide prodrugs |
| AU2009210677A1 (en) * | 2008-02-08 | 2009-08-13 | The Scripps Research Institute | Breaking immunological tolerance with a genetically encoded unnatural amino acid |
| CN103694337B (zh) | 2008-02-08 | 2016-03-02 | Ambrx公司 | 经修饰瘦素多肽和其用途 |
| US20110015345A1 (en) * | 2008-03-19 | 2011-01-20 | Ambrx, Inc. | Modified FGF-23 Polypeptides and Their Uses |
| WO2009117726A2 (en) * | 2008-03-21 | 2009-09-24 | The Regents Of The University Of California | High-sensitive fluorescent energy transfer assay using fluorescent amino acids and fluoresent proteins |
| WO2009120922A2 (en) | 2008-03-27 | 2009-10-01 | Zymogenetics, Inc. | Compositions and methods for inhibiting pdgfrbeta and vegf-a |
| EP2942404B1 (en) | 2008-03-31 | 2016-11-23 | Pacific Biosciences of California, Inc. | Generation of modified polymerases for improved accuracy in single molecule sequencing |
| EP2383292A1 (en) | 2008-05-02 | 2011-11-02 | Novartis AG | Improved fibronectin-based binding molecules and uses thereof |
| WO2009149279A2 (en) | 2008-06-04 | 2009-12-10 | Synergy Pharmaceuticals Inc. | Agonists of guanylate cyclase useful for the treatment of gastrointestinal disorders, inflammation, cancer and other disorders |
| CN102625813A (zh) | 2008-06-20 | 2012-08-01 | 诺华公司 | 具有降低的聚集的免疫球蛋白 |
| JP5756751B2 (ja) | 2008-06-26 | 2015-07-29 | エータイアー ファーマ, インコーポレイテッド | 非正準的な生物学的活性を有するグリシル−tRNA合成酵素を含む組成物および方法 |
| WO2010006454A2 (en) | 2008-06-30 | 2010-01-21 | Esbatech, An Alcon Biomedical Research Unit Llc | Functionalized polypeptides |
| KR20110031373A (ko) | 2008-07-10 | 2011-03-25 | 에스바테크, 언 알콘 바이오메디칼 리서치 유닛 엘엘씨 | 마크로분자 전달을 증강하는 방법 및 조성물 |
| WO2010009319A2 (en) | 2008-07-16 | 2010-01-21 | Synergy Pharmaceuticals Inc. | Agonists of guanylate cyclase useful for the treatment of gastrointestinal, inflammation, cancer and other disorders |
| EP3225248B1 (en) | 2008-07-23 | 2023-06-07 | Ambrx, Inc. | Modified bovine g-csf polypeptides and their uses |
| US9182406B2 (en) | 2008-08-04 | 2015-11-10 | Biodesy, Inc. | Nonlinear optical detection of molecules comprising an unnatural amino acid possessing a hyperpolarizability |
| JP2012500284A (ja) * | 2008-08-19 | 2012-01-05 | フェリング ベスローテン フェンノートシャップ | ペプチド性pth受容体アゴニスト |
| KR101732054B1 (ko) | 2008-09-26 | 2017-05-02 | 암브룩스, 인코포레이티드 | 비천연 아미노산 복제 의존성 미생물 및 백신 |
| AU2009296397B2 (en) | 2008-09-26 | 2012-11-08 | Ambrx Inc. | Modified animal erythropoietin polypeptides and their uses |
| AU2009304560A1 (en) | 2008-10-15 | 2010-04-22 | Angiochem Inc. | Conjugates of GLP-1 agonists and uses thereof |
| CA2871855C (en) | 2008-10-24 | 2017-08-15 | Irm Llc | Biosynthetically generated pyrroline-carboxy-lysine and site specific protein modifications via chemical derivatization of pyrroline-carboxy-lysine and pyrrolysine residues |
| AU2009322043A1 (en) | 2008-12-05 | 2011-07-07 | Angiochem Inc. | Conjugates of neurotensin or neurotensin analogs and uses thereof |
| WO2010068278A2 (en) | 2008-12-10 | 2010-06-17 | The Scripps Research Institute | Production of carrier-peptide conjugates using chemically reactive unnatural amino acids |
| US20090197339A1 (en) * | 2008-12-10 | 2009-08-06 | The Scripps Research Institute | In vivo unnatural amino acid expression in the methylotrophic yeast pichia pastoris |
| CA2747220A1 (en) | 2008-12-17 | 2010-06-24 | Richard Beliveau | Membrane type-1 matrix metalloprotein inhibitors and uses thereof |
| WO2010071807A1 (en) | 2008-12-19 | 2010-06-24 | Indiana University Research And Technology Corporation | Amide based glucagon superfamily peptide prodrugs |
| CA2747490C (en) | 2008-12-19 | 2017-02-14 | Indiana University Research And Technology Corporation | Insulin analogs |
| CN102245624B (zh) | 2008-12-19 | 2016-08-10 | 印第安纳大学研究及科技有限公司 | 基于酰胺的胰岛素前药 |
| PE20120331A1 (es) * | 2008-12-19 | 2012-04-14 | Univ Indiana Res & Tech Corp | Agentes medicinales unidos a dipeptido |
| WO2010096394A2 (en) | 2009-02-17 | 2010-08-26 | Redwood Biosciences, Inc. | Aldehyde-tagged protein-based drug carriers and methods of use |
| EP2403864B1 (en) | 2009-02-27 | 2015-08-12 | Atyr Pharma, Inc. | Polypeptide structural motifs associated with cell signaling activity |
| WO2010120509A2 (en) | 2009-03-31 | 2010-10-21 | Atyr Pharma, Inc. | Compositions and methods comprising aspartyl-trna synthetases having non-canonical biological activities |
| ES2729261T3 (es) | 2009-04-20 | 2019-10-31 | Angiochem Inc | Tratamiento del cáncer de ovario utilizando un agente anticancerígeno conjugado con un análogo de Angiopep-2 |
| CA2761578C (en) | 2009-05-11 | 2019-06-18 | Pfenex, Inc. | Production of recombinant proteins utilizing non-antibiotic selection methods and the incorporation of non-natural amino acids therein |
| WO2010141902A2 (en) | 2009-06-04 | 2010-12-09 | Novartis Ag | METHODS FOR IDENTIFICATION OF SITES FOR IgG CONJUGATION |
| CA2766537A1 (en) | 2009-07-02 | 2011-01-06 | Angiochem Inc. | Multimeric peptide conjugates and uses thereof |
| US10292956B2 (en) | 2009-09-01 | 2019-05-21 | Serbig Pharmaceutics Corp. | Cancer starvation therapy |
| US20110054019A1 (en) * | 2009-09-01 | 2011-03-03 | Pedro Anastacio Serrano-Ojeda | Cancer Starvation Therapy |
| EP2311947A1 (en) * | 2009-10-14 | 2011-04-20 | Ludwig-Maximilians-Universität München | Protein synthesis via click chemistry |
| WO2011056494A1 (en) | 2009-10-26 | 2011-05-12 | Genentech, Inc. | Activin receptor-like kinase-1 antagonist and vegfr3 antagonist combinations |
| WO2011056502A1 (en) | 2009-10-26 | 2011-05-12 | Genentech, Inc. | Bone morphogenetic protein receptor type ii compositions and methods of use |
| WO2011056497A1 (en) | 2009-10-26 | 2011-05-12 | Genentech, Inc. | Activin receptor type iib compositions and methods of use |
| WO2011051327A2 (en) | 2009-10-30 | 2011-05-05 | Novartis Ag | Small antibody-like single chain proteins |
| WO2011051466A1 (en) | 2009-11-02 | 2011-05-05 | Novartis Ag | Anti-idiotypic fibronectin-based binding molecules and uses thereof |
| US20120282276A1 (en) | 2009-11-05 | 2012-11-08 | The Regents Of The University Of Michigan | Biomarkers predictive of progression of fibrosis |
| EP2805964A1 (en) | 2009-12-21 | 2014-11-26 | Ambrx, Inc. | Modified bovine somatotropin polypeptides and their uses |
| WO2011078987A1 (en) | 2009-12-21 | 2011-06-30 | Trustees Of Dartmouth College | Recombinant prokaryotes and use thereof for production of o-glycosylated proteins |
| NZ600363A (en) | 2009-12-21 | 2014-07-25 | Ambrx Inc | Modified porcine somatotropin polypeptides and their uses |
| WO2011094445A1 (en) | 2010-01-27 | 2011-08-04 | Massachusetts Institute Of Technology | Engineered polypeptide agents for targeted broad spectrum influenza neutralization |
| WO2011092233A1 (en) | 2010-01-29 | 2011-08-04 | Novartis Ag | Yeast mating to produce high-affinity combinations of fibronectin-based binders |
| KR20120125357A (ko) | 2010-02-10 | 2012-11-14 | 노파르티스 아게 | 근육 성장을 위한 방법 및 화합물 |
| US8674064B2 (en) * | 2010-03-03 | 2014-03-18 | Onkologix Ltd | Immunogenic compositions against human progastrin peptides |
| US8464858B2 (en) * | 2010-03-12 | 2013-06-18 | Cabin Creek Inc. | Conveyor belt scraper and system for the same |
| US20130078660A1 (en) * | 2010-03-23 | 2013-03-28 | Salk Institute For Biological Studies | Methods and compositions for detecting protein modifications |
| JP6066900B2 (ja) | 2010-04-26 | 2017-01-25 | エータイアー ファーマ, インコーポレイテッド | システイニルtRNA合成酵素のタンパク質フラグメントに関連した治療用、診断用および抗体組成物の革新的発見 |
| CA2797259C (en) | 2010-04-27 | 2020-09-29 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of threonyl trna synthetases |
| AU2011248614B2 (en) | 2010-04-27 | 2017-02-16 | Pangu Biopharma Limited | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of isoleucyl tRNA synthetases |
| CA2797271C (en) | 2010-04-28 | 2021-05-25 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of alanyl trna synthetases |
| EP2563383B1 (en) | 2010-04-29 | 2017-03-01 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of valyl trna synthetases |
| WO2011139854A2 (en) | 2010-04-29 | 2011-11-10 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of asparaginyl trna synthetases |
| CN103108655B (zh) | 2010-05-03 | 2017-04-05 | Atyr 医药公司 | 与丝氨酰‑tRNA合成酶的蛋白片段相关的治疗、诊断和抗体组合物的创新发现 |
| CN103140233B (zh) | 2010-05-03 | 2017-04-05 | Atyr 医药公司 | 与甲硫氨酰‑tRNA合成酶的蛋白片段相关的治疗、诊断和抗体组合物的发现 |
| CA2797277C (en) | 2010-05-03 | 2021-02-23 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of arginyl-trna synthetases |
| US9034321B2 (en) | 2010-05-03 | 2015-05-19 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of phenylalanyl-alpha-tRNA synthetases |
| CN102985103A (zh) | 2010-05-04 | 2013-03-20 | Atyr医药公司 | 与p38多-tRNA合成酶复合物相关的治疗、诊断和抗体组合物的创新发现 |
| JP6008843B2 (ja) | 2010-05-04 | 2016-10-19 | エータイアー ファーマ, インコーポレイテッド | グルタミル−プロリルtRNA合成酵素のタンパク質フラグメントに関連した治療用、診断用および抗体組成物の革新的発見 |
| JP6396656B2 (ja) | 2010-05-14 | 2018-09-26 | エータイアー ファーマ, インコーポレイテッド | フェニルアラニルβtRNA合成酵素のタンパク質フラグメントに関連した治療用、診断用および抗体組成物の革新的発見 |
| US9034598B2 (en) | 2010-05-17 | 2015-05-19 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of leucyl-tRNA synthetases |
| CN103096913B (zh) | 2010-05-27 | 2017-07-18 | Atyr 医药公司 | 与谷氨酰胺酰‑tRNA合成酶的蛋白片段相关的治疗、诊断和抗体组合物的创新发现 |
| AU2011261486B2 (en) | 2010-06-01 | 2017-02-23 | Pangu Biopharma Limited | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of lysyl-tRNA synthetases |
| US8940860B2 (en) | 2010-06-16 | 2015-01-27 | Indiana University Research And Technology Corporation | Single-chain insulin agonists exhibiting high activity at the insulin receptor |
| EP2588126A4 (en) | 2010-06-24 | 2015-07-08 | Univ Indiana Res & Tech Corp | GLUCAGON SUPERFAMILY AMIDE PEPTIDE PRODRUGS |
| EP2585102B1 (en) | 2010-06-24 | 2015-05-06 | Indiana University Research and Technology Corporation | Amide-based insulin prodrugs |
| US8969301B2 (en) | 2010-07-12 | 2015-03-03 | Atyr Pharma Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of aspartyl-tRNA synthetases |
| JP6116479B2 (ja) | 2010-07-12 | 2017-04-19 | エータイアー ファーマ, インコーポレイテッド | グリシルtRNA合成酵素のタンパク質フラグメントに関連した治療用、診断用および抗体組成物の革新的発見 |
| CN103108649B (zh) | 2010-07-12 | 2016-10-12 | Atyr医药公司 | 与组氨酰-tRNA合成酶的蛋白片段相关的治疗、诊断和抗体组合物 |
| US8999321B2 (en) | 2010-07-12 | 2015-04-07 | Atyr Pharma, Inc. | Innovative discovery of therapeutic, diagnostic, and antibody compositions related to protein fragments of glycyl-tRNA synthetases |
| US9567386B2 (en) | 2010-08-17 | 2017-02-14 | Ambrx, Inc. | Therapeutic uses of modified relaxin polypeptides |
| DK2605789T3 (da) | 2010-08-17 | 2019-09-16 | Ambrx Inc | Modificerede relaxinpolypeptider og anvendelser deraf |
| WO2012027611A2 (en) * | 2010-08-25 | 2012-03-01 | Atyr Pharma, Inc. | INNOVATIVE DISCOVERY OF THERAPEUTIC, DIAGNOSTIC, AND ANTIBODY COMPOSITIONS RELATED TO PROTEIN FRAGMENTS OF TYROSYL-tRNA SYNTHETASES |
| WO2012032181A2 (en) | 2010-09-10 | 2012-03-15 | Allozyne, Inc | Novel antibody derivatives |
| US9616097B2 (en) | 2010-09-15 | 2017-04-11 | Synergy Pharmaceuticals, Inc. | Formulations of guanylate cyclase C agonists and methods of use |
| TWI480288B (zh) | 2010-09-23 | 2015-04-11 | Lilly Co Eli | 牛顆粒細胞群落刺激因子及其變體之調配物 |
| ES2645019T3 (es) | 2010-10-06 | 2017-12-01 | Atyr Pharma, Inc. | Descubrimiento innovador de composiciones terapéuticas, de diagnóstico y de anticuerpos relacionadas con fragmentos de proteínas de triptofanil-ARNt sintetasas |
| WO2012048249A1 (en) | 2010-10-07 | 2012-04-12 | Yale University | Site-specific incorporation of phosphoserine into proteins in escherichia coli |
| US9023791B2 (en) | 2010-11-19 | 2015-05-05 | Novartis Ag | Fibroblast growth factor 21 mutations |
| AU2012205301B2 (en) | 2011-01-14 | 2017-01-05 | Redwood Bioscience, Inc. | Aldehyde-tagged immunoglobulin polypeptides and method of use thereof |
| US9085514B2 (en) | 2011-02-03 | 2015-07-21 | Embl | Unnatural amino acids comprising a cyclooctynyl or trans-cyclooctenyl analog group and uses thereof |
| US9428789B2 (en) | 2011-03-21 | 2016-08-30 | Biodesy, Inc. | Classification of kinase inhibitors using nonlinear optical techniques |
| WO2012131109A2 (en) | 2011-04-01 | 2012-10-04 | Max-Planck-Gesellschaft zur Förderung der Wissenschaft e.V. | Peptides and pharmaceutical compositions for use in the treatment by nasal administration of patients suffering from anxiety and sleep disorders |
| WO2012138941A1 (en) | 2011-04-05 | 2012-10-11 | Longevity Biotech, Inc. | Compositions comprising glucagon analogs and methods of making and using the same |
| CN103717595A (zh) | 2011-05-27 | 2014-04-09 | Ambrx公司 | 含有非天然氨基酸连接的海兔毒素衍生物的组合物、涉及该海兔毒素衍生物的方法及其用途 |
| ES2898854T3 (es) | 2011-05-27 | 2022-03-09 | Ambrx Inc | Composiciones que contienen, métodos que implican, y usos de derivados de dolastatina enlazados con aminoácidos no naturales |
| US11788111B2 (en) | 2011-07-11 | 2023-10-17 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
| US10876142B2 (en) | 2011-07-11 | 2020-12-29 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
| US9464288B2 (en) | 2011-07-11 | 2016-10-11 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
| US10240158B2 (en) | 2011-07-11 | 2019-03-26 | Yale University | Compositions and methods for making selenocysteine containing polypeptides |
| CN102888387B (zh) * | 2011-07-21 | 2015-03-18 | 中国科学院生物物理研究所 | 3-氯代酪氨酸翻译系统及其应用 |
| US10323236B2 (en) | 2011-07-22 | 2019-06-18 | President And Fellows Of Harvard College | Evaluation and improvement of nuclease cleavage specificity |
| CN102925427B (zh) * | 2011-08-08 | 2014-01-22 | 中国科学院生物物理研究所 | 丙烯酰赖氨酸翻译系统及其应用 |
| US9714419B2 (en) | 2011-08-09 | 2017-07-25 | Atyr Pharma, Inc. | PEGylated tyrosyl-tRNA synthetase polypeptides |
| US9458214B2 (en) | 2011-09-26 | 2016-10-04 | Novartis Ag | Dual function fibroblast growth factor 21 proteins |
| WO2013068874A1 (en) | 2011-11-11 | 2013-05-16 | Pfizer Inc. | Antibody-drug conjugates |
| US9822353B2 (en) | 2011-12-06 | 2017-11-21 | Atyr Pharma, Inc. | PEGylated aspartyl-tRNA synthetase polypeptides |
| WO2013086216A1 (en) | 2011-12-06 | 2013-06-13 | Atyr Pharma, Inc. | Improved aspartyl-trna synthetases |
| CN104114183A (zh) | 2011-12-20 | 2014-10-22 | 印第安纳大学研究及科技有限公司 | 用于治疗糖尿病的基于ctp的胰岛素类似物 |
| TWI640541B (zh) | 2011-12-28 | 2018-11-11 | 中外製藥股份有限公司 | Peptide compound having an annular portion and pharmaceutical composition thereof |
| AU2012368189B2 (en) | 2011-12-29 | 2017-08-31 | Atyr Pharma, Inc. | Aspartyl-tRNA synthetase-Fc conjugates |
| US9395358B2 (en) | 2012-02-05 | 2016-07-19 | Biodesy, Inc. | Methods for detecting allosteric modulators of protein |
| WO2013123432A2 (en) | 2012-02-16 | 2013-08-22 | Atyr Pharma, Inc. | Histidyl-trna synthetases for treating autoimmune and inflammatory diseases |
| BR112014027991A2 (pt) | 2012-05-10 | 2017-07-18 | Massachusetts Inst Technology | agentes para neutralização de influenza |
| AU2013270686B2 (en) | 2012-06-07 | 2016-11-10 | Ambrx, Inc. | Prostate-specific membrane antigen antibody drug conjugates |
| KR102172897B1 (ko) | 2012-06-08 | 2020-11-02 | 서트로 바이오파마, 인크. | 부위-특이적 비-천연 아미노산 잔기를 포함하는 항체, 그의 제조 방법 및 그의 사용 방법 |
| EP3488870B1 (en) | 2012-06-19 | 2024-03-20 | Ambrx, Inc. | Anti-cd70 antibody drug conjugates |
| WO2014004639A1 (en) | 2012-06-26 | 2014-01-03 | Sutro Biopharma, Inc. | Modified fc proteins comprising site-specific non-natural amino acid residues, conjugates of the same, methods of their preparation and methods of their use |
| CN103571804B (zh) * | 2012-08-10 | 2015-08-12 | 中国科学院生物物理研究所 | 3-吡唑基酪氨酸翻译系统及其应用 |
| EP2887966B1 (en) | 2012-08-22 | 2018-07-18 | The Government of the United States of America as represented by The Secretary of the Department of Health and Human Services | Engineered anthrax lethal toxin for targeted delivery |
| US8859735B2 (en) | 2012-08-27 | 2014-10-14 | Empire Technology Development Llc | Gelatin alkyd peptides and uses thereof |
| PL3584255T3 (pl) | 2012-08-31 | 2022-05-16 | Sutro Biopharma, Inc. | Modyfikowane aminokwasy zawierające grupę azydkową |
| CN104812734B (zh) | 2012-09-24 | 2017-08-22 | 米迪缪尼有限公司 | 氨基酸衍生物 |
| EP3395358B1 (en) | 2012-09-26 | 2019-11-06 | Indiana University Research and Technology Corporation | Insulin analog dimers |
| CN102875733B (zh) * | 2012-10-25 | 2014-06-11 | 西安科技大学 | 具有仿细胞外层膜结构的纳米颗粒及其制备方法 |
| US20140120116A1 (en) | 2012-10-26 | 2014-05-01 | The Chinese University Of Hong Kong | Treatment of cancer using smad3 inhibitor |
| UY35144A (es) | 2012-11-20 | 2014-06-30 | Novartis Ag | Miméticos lineales sintéticos de apelina para el tratamiento de insuficiencia cardiaca |
| EP3626735A1 (en) | 2012-12-18 | 2020-03-25 | Novartis AG | Stabilized insulin-like growth factor polypeptides |
| CA2936092A1 (en) | 2013-01-23 | 2014-07-31 | The Board Of Trustees Of The Leland Stanford Junior University | Stabilized hepatitis b core polypeptide |
| EP3718557A3 (en) | 2013-02-25 | 2020-10-21 | Bausch Health Ireland Limited | Guanylate cyclase receptor agonist sp-333 for use in colonic cleansing |
| US9255255B2 (en) | 2013-03-04 | 2016-02-09 | The Board Of Trustees Of The Leland Stanford Junior University | Synthesis of linear and branched polymers of polypeptides through direct conjugation |
| JO3564B1 (ar) | 2013-03-08 | 2020-07-05 | Novartis Ag | ببتيدات وتركيبات لعلاج ضرر المفاصل |
| JP6538645B2 (ja) | 2013-03-14 | 2019-07-03 | インディアナ ユニバーシティー リサーチ アンド テクノロジー コーポレーションIndiana University Research And Technology Corporation | インスリン‐インクレチン複合物 |
| WO2014145718A2 (en) | 2013-03-15 | 2014-09-18 | Longevity Biotech, Inc. | Peptides comprising non-natural amino acids and methods of making and using the same |
| AU2014235209B2 (en) | 2013-03-15 | 2018-06-14 | Bausch Health Ireland Limited | Guanylate cyclase receptor agonists combined with other drugs |
| US9587235B2 (en) | 2013-03-15 | 2017-03-07 | Atyr Pharma, Inc. | Histidyl-tRNA synthetase-Fc conjugates |
| US9708367B2 (en) | 2013-03-15 | 2017-07-18 | Synergy Pharmaceuticals, Inc. | Agonists of guanylate cyclase and their uses |
| US11156608B2 (en) | 2013-03-15 | 2021-10-26 | The Trustees Of The University Of Pennsylvania | Method for the site-specific covalent cross-linking of antibodies to surfaces |
| JP6574754B2 (ja) | 2013-03-19 | 2019-09-11 | ベイジン シェノゲン ファーマ グループ リミテッド | エストロゲン受容体関連疾患を処置するための抗体及び方法 |
| KR102272746B1 (ko) | 2013-06-05 | 2021-07-08 | 보슈 헬스 아일랜드 리미티드 | 구아닐레이트 사이클라제 c의 초순수 작용제, 및 이의 제조 및 사용 방법 |
| WO2015006555A2 (en) | 2013-07-10 | 2015-01-15 | Sutro Biopharma, Inc. | Antibodies comprising multiple site-specific non-natural amino acid residues, methods of their preparation and methods of their use |
| EP3021942A4 (en) | 2013-07-19 | 2017-04-19 | The Regents of The University of California | Milk fat globule epidermal growth factor 8 regulates fatty acid uptake |
| EA201690282A1 (ru) | 2013-07-25 | 2016-09-30 | Новартис Аг | Биоконъюгаты синтетических апелиновых полипептидов |
| JP6501775B2 (ja) | 2013-07-25 | 2019-04-17 | ノバルティス アーゲー | 心不全治療用の環状ポリペプチド |
| WO2015021358A2 (en) | 2013-08-09 | 2015-02-12 | Dominique Charmot | Compounds and methods for inhibiting phosphate transport |
| US9163284B2 (en) | 2013-08-09 | 2015-10-20 | President And Fellows Of Harvard College | Methods for identifying a target site of a Cas9 nuclease |
| US9359599B2 (en) | 2013-08-22 | 2016-06-07 | President And Fellows Of Harvard College | Engineered transcription activator-like effector (TALE) domains and uses thereof |
| WO2015031268A1 (en) | 2013-08-26 | 2015-03-05 | Arizona Board Of Regents On Behalf Of Arizona State University | High affinity synbodies for influenza |
| US9737604B2 (en) | 2013-09-06 | 2017-08-22 | President And Fellows Of Harvard College | Use of cationic lipids to deliver CAS9 |
| US9340799B2 (en) | 2013-09-06 | 2016-05-17 | President And Fellows Of Harvard College | MRNA-sensing switchable gRNAs |
| US9322037B2 (en) | 2013-09-06 | 2016-04-26 | President And Fellows Of Harvard College | Cas9-FokI fusion proteins and uses thereof |
| EA201690732A1 (ru) | 2013-10-10 | 2016-12-30 | Синерджи Фармасьютикалз, Инк. | Агонисты гуанилатциклазы, используемые для лечения индуцированных опиоидами дисфункций |
| EP3055298B1 (en) | 2013-10-11 | 2020-04-29 | Sutro Biopharma, Inc. | Modified amino acids comprising tetrazine functional groups, methods of preparation, and methods of their use |
| WO2015057908A1 (en) | 2013-10-18 | 2015-04-23 | Novartis Ag | Methods of treating diabetes and related disorders |
| US9068179B1 (en) | 2013-12-12 | 2015-06-30 | President And Fellows Of Harvard College | Methods for correcting presenilin point mutations |
| CA2936615C (en) | 2014-01-14 | 2023-06-13 | European Molecular Biology Laboratory | Multiple cycloaddition reactions for labeling of molecules |
| WO2015120287A2 (en) | 2014-02-06 | 2015-08-13 | Yale University | Compositions and methods of use thereof for making polypeptides with many instances of nonstandard amino acids |
| WO2015175375A1 (en) | 2014-05-13 | 2015-11-19 | Short Jay M | Conditionally active biological proteins |
| WO2015200080A1 (en) | 2014-06-23 | 2015-12-30 | Novartis Ag | Site specific protein modifications |
| US10588980B2 (en) | 2014-06-23 | 2020-03-17 | Novartis Ag | Fatty acids and their use in conjugation to biomolecules |
| EP3164501A4 (en) | 2014-07-02 | 2018-01-17 | Sutro Biopharma, Inc. | High growth capacity auxotrophic escherichia coli and methods of use |
| WO2016011080A2 (en) | 2014-07-14 | 2016-01-21 | The Regents Of The University Of California | Crispr/cas transcriptional modulation |
| AU2015298571B2 (en) | 2014-07-30 | 2020-09-03 | President And Fellows Of Harvard College | Cas9 proteins including ligand-dependent inteins |
| MX2017002805A (es) | 2014-09-03 | 2017-12-20 | Bioatla Llc | Descubrimiento y producción de proteínas biológicas condicionalmente activas en las mismas células hospederas eucariotas de producción. |
| ES2822994T3 (es) | 2014-09-24 | 2021-05-05 | Univ Indiana Res & Tech Corp | Conjugados de incretina-insulina |
| WO2016049174A1 (en) | 2014-09-24 | 2016-03-31 | Indiana University Research And Technology Corporation | Lipidated amide-based insulin prodrugs |
| US11408007B2 (en) | 2014-09-26 | 2022-08-09 | Yale University | Compositions and methods for biocontainment of microorganisms |
| UY36370A (es) | 2014-10-24 | 2016-04-29 | Bristol Myers Squibb Company Una Corporación Del Estado De Delaware | Polipéptidos fgf-21 modificados y sus usos |
| CN114656483A (zh) | 2014-12-04 | 2022-06-24 | 细胞基因公司 | 生物分子共轭物 |
| WO2016106286A1 (en) | 2014-12-23 | 2016-06-30 | Biodesy, Inc. | Attachment of proteins to interfaces for use in nonlinear optical detection |
| SE538541C2 (en) * | 2015-01-19 | 2016-09-13 | Fogelstrand Per | Method for preparing a biological sample for use in an immunolabeling process |
| MA41580A (fr) | 2015-01-23 | 2017-11-29 | Novartis Ag | Conjugués d'acides gras de l'apeline synthétique présentant une demi-vie améliorée |
| US20190388469A1 (en) | 2015-01-30 | 2019-12-26 | The Regents Of The University Of California | Protein delivery in primary hematopoietic cells |
| HUE059925T2 (hu) | 2015-03-13 | 2023-01-28 | Chugai Pharmaceutical Co Ltd | Módosított aminoacil-tRNS-szintetáz és alkalmazása |
| US10483262B2 (en) * | 2015-05-15 | 2019-11-19 | Taiwan Semiconductor Manufacturing Co., Ltd. | Dual nitride stressor for semiconductor device and method of manufacturing |
| EP3309250A4 (en) * | 2015-06-09 | 2019-06-19 | National Institute of Advanced Industrial Science and Technology | NUCLEIC ACID MODIFIED WITH AMINO ACID AND USE THEREOF |
| CA2989400A1 (en) | 2015-06-15 | 2016-12-22 | Angiochem Inc. | Ang1005 for the treatment of leptomeningeal carcinomatosis |
| CN108289930A (zh) | 2015-07-10 | 2018-07-17 | 香港科技大学 | 用于治疗神经退行性和神经炎性病症的方法和组合物 |
| WO2017062334A1 (en) | 2015-10-05 | 2017-04-13 | Merck Sharp & Dohme Corp. | Antibody peptide conjugates that have agonist activity at both the glucagon and glucagon-like peptide 1 receptors |
| IL258821B (en) | 2015-10-23 | 2022-07-01 | Harvard College | Nucleobase editors and their uses |
| CN108367053A (zh) | 2015-12-22 | 2018-08-03 | 诺华股份有限公司 | 使用生长分化因子15(gdf-15)治疗或改善代谢性疾病的方法 |
| US10294303B2 (en) | 2015-12-23 | 2019-05-21 | Amgen Inc. | Method of treating or ameliorating metabolic disorders using binding proteins for gastric inhibitory peptide receptor (GIPR) in combination with GLP-1 agonists |
| CN106929482A (zh) * | 2015-12-31 | 2017-07-07 | 北京大学 | 定点突变的流感病毒、其活疫苗及其制备方法和应用 |
| CN108884130B (zh) | 2016-01-11 | 2022-09-13 | 博士医疗爱尔兰有限公司 | 用于治疗溃疡性结肠炎的制剂和方法 |
| CN114796520A (zh) | 2016-01-27 | 2022-07-29 | 苏特罗生物制药公司 | 抗cd74抗体偶联物,包含抗cd74抗体偶联物的组合物以及抗cd74抗体偶联物的使用方法 |
| WO2017189432A1 (en) | 2016-04-26 | 2017-11-02 | R.P. Scherer Technologies, Llc | Antibody conjugates and methods of making and using the same |
| EP3455628A4 (en) | 2016-05-09 | 2019-12-04 | Biodesy, Inc. | METHOD AND DEVICES FOR DETECTING INTERACTIONS OF PERIPHERAL MEMBRANE PROTEINS USING NONLINEAR OPTICAL TECHNIQUES |
| WO2017204729A1 (en) * | 2016-05-25 | 2017-11-30 | Fogelstrand Per | Method for preparing a biological sample for use in an immunolabeling process |
| WO2017216724A1 (en) | 2016-06-15 | 2017-12-21 | Novartis Ag | Methods for treating disease using inhibitors of bone morphogenetic protein 6 (bmp6) |
| IL264565B1 (en) | 2016-08-03 | 2024-03-01 | Harvard College | Adenosine nuclear base editors and their uses |
| CA3033327A1 (en) | 2016-08-09 | 2018-02-15 | President And Fellows Of Harvard College | Programmable cas9-recombinase fusion proteins and uses thereof |
| WO2018039438A1 (en) * | 2016-08-24 | 2018-03-01 | President And Fellows Of Harvard College | Incorporation of unnatural amino acids into proteins using base editing |
| EP3309260A1 (en) | 2016-10-14 | 2018-04-18 | European Molecular Biology Laboratory | Archaeal pyrrolysyl trna synthetases for orthogonal use |
| JP2019530464A (ja) | 2016-10-14 | 2019-10-24 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 核酸塩基エディターのaav送達 |
| CN109963579A (zh) | 2016-11-14 | 2019-07-02 | 诺华股份有限公司 | 用于治疗软骨损伤和关节炎的方法和组合物 |
| EP3538546A1 (en) | 2016-11-14 | 2019-09-18 | Novartis AG | Compositions, methods, and therapeutic uses related to fusogenic protein minion |
| CA3047321A1 (en) | 2016-12-19 | 2018-06-28 | Quantum-Si Incorporated | Polymerizing enzymes for sequencing reactions |
| US10745677B2 (en) | 2016-12-23 | 2020-08-18 | President And Fellows Of Harvard College | Editing of CCR5 receptor gene to protect against HIV infection |
| US11951165B2 (en) | 2016-12-30 | 2024-04-09 | Vaxcyte, Inc. | Conjugated vaccine carrier proteins |
| JOP20190177A1 (ar) | 2017-01-17 | 2019-07-16 | Amgen Inc | طريقة لعلاج أو تحسين اضطرابات أيضية باستخدام مساعدات مستقبل glp-1 مقترنة بمناهضات لمستقبل ببتيد مثبط معوي (gipr) |
| ES2963839T3 (es) | 2017-02-08 | 2024-04-02 | Bristol Myers Squibb Co | Polipéptidos de relaxina modificados que comprenden un potenciador farmacocinético y usos de los mismos |
| US11898179B2 (en) | 2017-03-09 | 2024-02-13 | President And Fellows Of Harvard College | Suppression of pain by gene editing |
| CN110914310A (zh) | 2017-03-10 | 2020-03-24 | 哈佛大学的校长及成员们 | 胞嘧啶至鸟嘌呤碱基编辑器 |
| WO2018176009A1 (en) | 2017-03-23 | 2018-09-27 | President And Fellows Of Harvard College | Nucleobase editors comprising nucleic acid programmable dna binding proteins |
| EP3381932A1 (en) | 2017-03-28 | 2018-10-03 | Technische Universität Berlin | Modified mussel proteins, uses thereof and related compounds |
| EP3612215A4 (en) | 2017-04-20 | 2021-05-26 | aTyr Pharma, Inc. | COMPOSITIONS AND METHODS OF TREATMENT OF Pneumonia |
| US11560566B2 (en) | 2017-05-12 | 2023-01-24 | President And Fellows Of Harvard College | Aptazyme-embedded guide RNAs for use with CRISPR-Cas9 in genome editing and transcriptional activation |
| JP7245786B2 (ja) | 2017-06-02 | 2023-03-24 | アンブルックス,インコーポレイテッド | 非天然アミノ酸含有タンパク質の産生を促進する方法および組成物 |
| KR102610527B1 (ko) | 2017-06-09 | 2023-12-05 | 추가이 세이야쿠 가부시키가이샤 | N-치환 아미노산을 포함하는 펩타이드의 합성 방법 |
| US20200131555A1 (en) * | 2017-07-11 | 2020-04-30 | Synthorx, Inc. | Incorporation of unnatural nucleotides and methods thereof |
| KR101956042B1 (ko) * | 2017-07-13 | 2019-03-08 | 서강대학교산학협력단 | 표적 단백질 내 l-디하이드록시페닐알라닌의 도입 방법 |
| EP3658588A1 (en) | 2017-07-26 | 2020-06-03 | Sutro Biopharma, Inc. | Methods of using anti-cd74 antibodies and antibody conjugates in treatment of t-cell lymphoma |
| WO2019023680A1 (en) | 2017-07-28 | 2019-01-31 | President And Fellows Of Harvard College | METHODS AND COMPOSITIONS FOR EVOLUTION OF BASIC EDITORS USING PHAGE-ASSISTED CONTINUOUS EVOLUTION (PACE) |
| SG11202000939PA (en) | 2017-08-03 | 2020-02-27 | Synthorx Inc | Cytokine conjugates for the treatment of proliferative and infectious diseases |
| WO2019139645A2 (en) | 2017-08-30 | 2019-07-18 | President And Fellows Of Harvard College | High efficiency base editors comprising gam |
| AU2018327224A1 (en) | 2017-09-07 | 2020-04-23 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptide with conjugation sites and methods of use thereof |
| EP3684814A1 (en) | 2017-09-18 | 2020-07-29 | Sutro Biopharma, Inc. | Anti-folate receptor alpha antibody conjugates and their uses |
| WO2019079347A1 (en) | 2017-10-16 | 2019-04-25 | The Broad Institute, Inc. | USES OF BASIC EDITORS ADENOSINE |
| JP7411414B2 (ja) | 2017-12-15 | 2024-01-11 | 中外製薬株式会社 | ペプチドの製造方法、及び塩基の処理方法 |
| US20210108213A1 (en) | 2018-05-01 | 2021-04-15 | Ambrx, Inc. | A method for optimizing antibody expression |
| WO2019237119A1 (en) | 2018-06-08 | 2019-12-12 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | New compositions and detection methods for onchocerca volvulus infection |
| EP3847271A4 (en) * | 2018-09-07 | 2022-10-12 | MedImmune, LLC | CELL SELECTION METHODS |
| JP7441826B2 (ja) | 2018-09-11 | 2024-03-01 | アンブルックス,インコーポレイテッド | インターロイキン-2ポリペプチド抱合物およびその使用 |
| JP2022500454A (ja) | 2018-09-17 | 2022-01-04 | ストロ バイオファーマ インコーポレーテッド | 抗葉酸受容体抗体コンジュゲートによる併用療法 |
| AU2019361206A1 (en) | 2018-10-19 | 2021-06-03 | Ambrx, Inc. | Interleukin-10 polypeptide conjugates, dimers thereof, and their uses |
| US11325978B2 (en) | 2018-11-06 | 2022-05-10 | The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services | Compositions and methods for treating beta-globinopathies |
| KR20210098476A (ko) | 2018-11-30 | 2021-08-10 | 추가이 세이야쿠 가부시키가이샤 | 펩티드 화합물 또는 아마이드 화합물의 탈보호법 및 고상 반응에 있어서의 탈수지 방법, 및 펩티드 화합물의 제조 방법 |
| KR20210123299A (ko) | 2019-02-06 | 2021-10-13 | 신톡스, 인크. | Il-2 콘쥬게이트 및 이의 사용 방법 |
| JP2022520792A (ja) | 2019-02-12 | 2022-04-01 | アンブルックス,インコーポレイテッド | 抗体-tlrアゴニストコンジュゲートを含有する組成物、その方法、及び使用 |
| EP3696189A1 (en) | 2019-02-14 | 2020-08-19 | European Molecular Biology Laboratory | Means and methods for preparing engineered target proteins by genetic code expansion in a target protein selective manner |
| WO2020180971A1 (en) * | 2019-03-04 | 2020-09-10 | The Texas A&M University System | Methods of making and utilizing amber-obligated phage display libraries |
| WO2020191239A1 (en) | 2019-03-19 | 2020-09-24 | The Broad Institute, Inc. | Methods and compositions for editing nucleotide sequences |
| EP3962951A1 (en) | 2019-05-03 | 2022-03-09 | Sutro Biopharma, Inc. | Anti-bcma antibody conjugates |
| WO2020236907A1 (en) * | 2019-05-20 | 2020-11-26 | Albert Einstein College Of Medicine | Compounds and methods for treatment of bacterial infections |
| US20220233673A1 (en) | 2019-06-04 | 2022-07-28 | Institut Curie | METHODS OF PRODUCING SHIGA TOXIN B-SUBUNIT (STxB) MONOMERS AND OLIGOMERS, AND USES THEREOF |
| US20220242871A1 (en) | 2019-06-10 | 2022-08-04 | Sutro Biopharma, Inc. | 5H-PYRROLO[3,2-d]PYRIMIDINE-2,4-DIAMINO COMPOUNDS AND ANTIBODY CONJUGATES THEREOF |
| WO2020257235A1 (en) | 2019-06-17 | 2020-12-24 | Sutro Biopharma, Inc. | 1-(4-(aminomethyl)benzyl)-2-butyl-2h-pyrazolo[3,4-c]quinolin-4-amine derivatives and related compounds as toll-like receptor (tlr) 7/8 agonists, as well as antibody drug conjugates thereof for use in cancer therapy and diagnosis |
| MX2022000055A (es) | 2019-06-28 | 2022-05-30 | Quantum Si Inc | Enzimas de polimerización para reacciones de secuenciación. |
| TW202128996A (zh) * | 2019-10-10 | 2021-08-01 | 美商史基普研究協會 | 用於活體內合成非天然多肽的組合物及方法 |
| US11149280B2 (en) | 2019-10-29 | 2021-10-19 | Yale University | Engineering organisms resistant to viruses and horizontally transferred genetic elements |
| JP2022554396A (ja) * | 2019-11-05 | 2022-12-28 | ニトロ バイオサイエンシーズ, インコーポレイテッド | パラ-ニトロ-l-フェニルアラニンの生合成 |
| CN116925237A (zh) | 2019-12-31 | 2023-10-24 | 北京质肽生物医药科技有限公司 | Glp-1和gdf15的融合蛋白以及其缀合物 |
| US20230201315A1 (en) | 2020-01-03 | 2023-06-29 | The United States Of America, As Represented By The Secretary, Department Of Health And Human | Tnap locally administered for promoting periodontal health |
| CN113728013B (zh) | 2020-01-11 | 2022-06-14 | 北京质肽生物医药科技有限公司 | Glp-1和fgf21的融合蛋白的缀合物 |
| EP4107258A4 (en) * | 2020-02-20 | 2024-04-17 | B G Negev Technologies And Applications Ltd At Ben Gurion Univ | MUTANT AMINOACYL-ARNT SYNTHETASES |
| EP3868882A1 (en) | 2020-02-21 | 2021-08-25 | European Molecular Biology Laboratory | Archaeal pyrrolysyl trna synthetases for orthogonal use |
| WO2021178597A1 (en) | 2020-03-03 | 2021-09-10 | Sutro Biopharma, Inc. | Antibodies comprising site-specific glutamine tags, methods of their preparation and methods of their use |
| CA3174114A1 (en) | 2020-03-11 | 2021-09-16 | Ambrx, Inc. | Interleukin-2 polypeptide conjugates and methods of use thereof |
| CN111302975A (zh) * | 2020-03-30 | 2020-06-19 | 滨海吉尔多肽有限公司 | 一种n-叔丁氧羰基-o-烯丙基-l-酪氨酸的制备方法 |
| US11827684B2 (en) | 2020-04-22 | 2023-11-28 | Merck Sharp & Dohme Llc | Human interleukin-2 conjugates biased for the interleukin-2 receptor beta GAMMAc dimer and conjugated to a nonpeptidic, water-soluble polymer |
| US20210340586A1 (en) | 2020-04-30 | 2021-11-04 | Sutro Biopharma, Inc. | Methods of Producing Full-Length Antibodies Using E. coli |
| EP4146665A1 (en) | 2020-05-05 | 2023-03-15 | Genentech, Inc. | Systems and methods for tyrosinase-mediated site-specific protein conjugation |
| DE112021002672T5 (de) | 2020-05-08 | 2023-04-13 | President And Fellows Of Harvard College | Vefahren und zusammensetzungen zum gleichzeitigen editieren beider stränge einer doppelsträngigen nukleotid-zielsequenz |
| CN115835904A (zh) | 2020-05-22 | 2023-03-21 | 武田药品工业有限公司 | 用于治疗和诊断冠状病毒疾病并发症的adamts13组合物和方法 |
| JP2023538071A (ja) | 2020-08-20 | 2023-09-06 | アンブルックス,インコーポレイテッド | 抗体-tlrアゴニストコンジュゲート、その方法及び使用 |
| AU2021342284A1 (en) * | 2020-09-14 | 2023-04-20 | Sutro Biopharma, Inc. | Method for large scale production of antibodies using a cell-free protein synthesis system |
| CN115925995A (zh) | 2020-09-30 | 2023-04-07 | 北京质肽生物医药科技有限公司 | 多肽缀合物和使用方法 |
| CA3213805A1 (en) | 2021-04-03 | 2022-10-06 | Feng Tian | Anti-her2 antibody-drug conjugates and uses thereof |
| WO2023281484A1 (en) | 2021-07-09 | 2023-01-12 | Bright Peak Therapeutics Ag | Synthetic il-7 and il-7 immunocytokines |
| WO2023281482A1 (en) | 2021-07-09 | 2023-01-12 | Bright Peak Therapeutics Ag | Cd20-targeted il-2 and its uses |
| AU2022306145A1 (en) | 2021-07-09 | 2024-02-01 | Bright Peak Therapeutics Ag | Antibody conjugates and manufacture thereof |
| WO2023281480A1 (en) | 2021-07-09 | 2023-01-12 | Bright Peak Therapeutics Ag | Conjugates of checkpoint inhibitors with il-2, and uses thereof |
| US20230183331A1 (en) | 2021-07-09 | 2023-06-15 | Bright Peak Therapeutics Ag | Modified tnf-alpha antibodies and uses thereof |
| WO2023031445A2 (en) | 2021-09-06 | 2023-03-09 | Veraxa Biotech Gmbh | Novel aminoacyl-trna synthetase variants for genetic code expansion in eukaryotes |
| CA3231955A1 (en) * | 2021-09-17 | 2023-03-23 | Yi Zhang | Composition of transfer rnas and use in production of proteins containing non-standard amino acids |
| WO2023069816A2 (en) | 2021-09-20 | 2023-04-27 | The Broad Institute, Inc. | Compositions and methods for multiplex decoding of quadruplet codons |
| WO2023081167A2 (en) | 2021-11-02 | 2023-05-11 | The Regents Of The University Of California | P-selectin mutants and modulation of integrin-mediated signaling |
| EP4186529A1 (en) | 2021-11-25 | 2023-05-31 | Veraxa Biotech GmbH | Improved antibody-payload conjugates (apcs) prepared by site-specific conjugation utilizing genetic code expansion |
| WO2023094525A1 (en) | 2021-11-25 | 2023-06-01 | Veraxa Biotech Gmbh | Improved antibody-payload conjugates (apcs) prepared by site-specific conjugation utilizing genetic code expansion |
| WO2023104941A1 (en) | 2021-12-08 | 2023-06-15 | European Molecular Biology Laboratory | Hydrophilic tetrazine-functionalized payloads for preparation of targeting conjugates |
| WO2023146807A1 (en) | 2022-01-25 | 2023-08-03 | The Regents Of The University Of California | Vegf mutants and modulation of integrin-mediated signaling |
| WO2023161857A1 (en) | 2022-02-23 | 2023-08-31 | Bright Peak Therapeutics Ag | Bifunctional cytokine compositions |
| US20230355795A1 (en) | 2022-02-23 | 2023-11-09 | Bright Peak Therapeutics Ag | Immune antigen specific il-18 immunocytokines and uses thereof |
| US20240058465A1 (en) | 2022-06-30 | 2024-02-22 | Sutro Biopharma, Inc. | Anti-ror1 antibody conjugates, compositions comprising anti ror1 antibody conjugates, and methods of making and using anti-ror1 antibody conjugates |
| WO2024072224A2 (en) | 2022-09-29 | 2024-04-04 | Stichting Vu | Compounds for rna stabilisation and delivery |
| WO2024077277A1 (en) | 2022-10-07 | 2024-04-11 | Ambrx, Inc. | Drug linkers and antibody conjugates thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004537984A (ja) * | 2001-04-19 | 2004-12-24 | ザ スクリップス リサーチ インスティテュート | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH652145A5 (de) | 1982-01-22 | 1985-10-31 | Sandoz Ag | Verfahren zur in vitro-herstellung von hybridomen welche humane monoklonale antikoerper erzeugen. |
| US4634666A (en) | 1984-01-06 | 1987-01-06 | The Board Of Trustees Of The Leland Stanford Junior University | Human-murine hybridoma fusion partner |
| US5001065A (en) | 1987-05-27 | 1991-03-19 | Cetus Corporation | Human cell line and triomas, antibodies, and transformants derived therefrom |
| DE9115660U1 (ja) * | 1991-12-18 | 1992-07-30 | Hoechst Ag, 6230 Frankfurt, De | |
| KR100501838B1 (ko) | 1995-04-24 | 2005-07-21 | 큐비스트 파마슈티컬즈 인코포레이티드 | 새로운 대사 경로를 만들고 이를 스크리닝하는 방법 |
| US5958672A (en) | 1995-07-18 | 1999-09-28 | Diversa Corporation | Protein activity screening of clones having DNA from uncultivated microorganisms |
| US5756316A (en) | 1995-11-02 | 1998-05-26 | Genencor International, Inc. | Molecular cloning by multimerization of plasmids |
| US6238884B1 (en) | 1995-12-07 | 2001-05-29 | Diversa Corporation | End selection in directed evolution |
| US5783431A (en) | 1996-04-24 | 1998-07-21 | Chromaxome Corporation | Methods for generating and screening novel metabolic pathways |
| US6706504B1 (en) * | 1996-11-12 | 2004-03-16 | The Scripps Research Institute | Tissue type plasminogen activator (t-PA) variants: compositions and methods of use |
| DE10151556A1 (de) * | 2001-10-23 | 2003-04-30 | Bosch Gmbh Robert | Vorrichtung zum Öffnen und Schließen eines beweglichen Teils |
| ITTO20020441A1 (it) * | 2002-05-24 | 2003-11-24 | Telecom Italia Lab Spa | Metodo per determinare l'installazione di costo minimo per le apparecchiature di una rete fissa di telecomunicazione. |
| KR20050073559A (ko) * | 2002-10-16 | 2005-07-14 | 더 스크립스 리서치 인스티튜트 | 당단백질 합성 |
| US7432092B2 (en) * | 2002-10-16 | 2008-10-07 | The Scripps Research Institute | Site specific incorporation of keto amino acids into proteins |
| AU2003300389B2 (en) * | 2002-12-22 | 2009-10-08 | The Scripps Research Institute | Protein arrays |
| ATE542894T1 (de) * | 2003-04-17 | 2012-02-15 | Scripps Research Inst | Ausweitung des eukaryotischen genetischen codes |
| EP2410331B1 (en) * | 2003-06-18 | 2015-09-23 | The Scripps Research Institute | Aminoacyl-tRNA synthetase for aminoacylation tRNA with unnatural amino acids |
| US20060160175A1 (en) * | 2003-07-07 | 2006-07-20 | The Scripps Research Institute | Compositions of orthogonal leucyl-trna and aminoacyl-trna synthetase pairs and uses thereof |
| US7527943B2 (en) * | 2003-07-07 | 2009-05-05 | The Scripps Research Institute | Compositions of orthogonal glutamyl-tRNA and aminoacyl-tRNA synthetase pairs and uses thereof |
| ATE386133T1 (de) * | 2003-07-07 | 2008-03-15 | Scripps Research Inst | Zusammensetzungen der orthogonalen lysyl-trna und aminoacyl-trna synthetase paaren und ihre verwendungen |
| EP1687401B1 (en) * | 2003-10-14 | 2012-11-21 | The Scripps Research Institute | Site-specific incorporation of redox active amino acids into proteins |
| EP1725251A4 (en) * | 2003-12-18 | 2009-07-01 | Scripps Research Inst | SELECTIVE INCORPORATION OF 5-HYDROXYTRYPTOPHANE IN PROTEINS IN MAMMALIAN CELLS |
| JP2008500050A (ja) * | 2004-05-25 | 2008-01-10 | ザ スクリップス リサーチ インスティテュート | 結晶構造決定のための重原子含有非天然アミノ酸の部位特異的蛋白質組込み |
| EP2770053B1 (en) * | 2004-09-21 | 2018-02-21 | The Scripps Research Institute | In vivo incorporation of alkynyl amino acids into proteins in eubacteria |
| US20060134746A1 (en) * | 2004-09-21 | 2006-06-22 | The Scripps Research Institute | Adding photoregulated amino acids to the genetic code |
| WO2006036779A2 (en) * | 2004-09-22 | 2006-04-06 | The Scripps Research Institute | Site-specific labeling of proteins for nmr studies |
| JP2008516637A (ja) * | 2004-10-20 | 2008-05-22 | ザ スクリップス リサーチ インスティテュート | 真正細菌へのn−アセチルガラクトサミンアミノ酸のインビボ部位特異的組込み |
| AU2005330514B2 (en) * | 2004-10-27 | 2011-05-12 | The Scripps Research Institute | Orthogonal translation components for the in vivo incorporation of unnatural amino acids |
| FR2888097B1 (fr) * | 2005-07-06 | 2007-10-05 | Oreal | Dispositif de conditionnement et d'application comportant un organe d'essorage |
| EP1934343A4 (en) * | 2005-10-12 | 2009-09-16 | Scripps Research Inst | SELECTIVE MODIFICATION POST-TRANSLATION OF POLYPEPTIDES EXPRESSED ON THE SURFACE OF PHAGES |
| EP1991680B1 (en) * | 2006-03-09 | 2013-08-21 | The Scripps Research Institute | System for the expression of orthogonal translation components in eubacterial host cells |
| JP5249194B2 (ja) * | 2006-03-16 | 2013-07-31 | ザ スクリプス リサーチ インスティチュート | 非天然アミノ酸フェニルセレノシステインを含有するタンパク質の遺伝的にプログラムされた発現 |
| RU2473690C2 (ru) | 2006-05-23 | 2013-01-27 | Зе Скрипс Ресеч Инститьют | Генетически кодируемые флюоресцентные кумариновые аминокислоты |
| US7421795B2 (en) * | 2006-08-04 | 2008-09-09 | Seagate Technology Llc | Sapphire alignment fixture |
| PT2052083E (pt) * | 2006-09-21 | 2014-04-10 | Scripps Research Inst | Expressão geneticamente programada de proteínas seletivamente sulfatadas em eubactérias |
| EP2069481A4 (en) * | 2006-10-18 | 2010-01-06 | Scripps Research Inst | GENETIC ASSEMBLY OF UNNATURAL AMINO ACIDS IN PROTEINS IN MAMMALIAN CELLS |
| TWI334126B (en) * | 2007-07-17 | 2010-12-01 | Au Optronics Corp | Voltage adjusting circuit, method, and display apparatus having the same |
| JP4978419B2 (ja) * | 2007-10-23 | 2012-07-18 | 富士ゼロックス株式会社 | 光送受信モジュール |
| MX2010004464A (es) * | 2007-10-25 | 2010-06-07 | Scripps Research Inst | Incorporacion genetica de 3-aminotirosina a reductasas. |
| EP2220218A4 (en) | 2007-11-02 | 2010-12-08 | Scripps Research Inst | BORONIC AMINO ACID GENETICALLY CODED |
| BRPI0819092A2 (pt) * | 2007-11-02 | 2014-10-14 | Scripps Research Inst | Evolução direcionada usando proteínas que compreendem aminoácidos não naturais. |
| WO2009064416A2 (en) | 2007-11-15 | 2009-05-22 | The Scripps Research Institute | Genetic incorporation of an alpha-hydroxy acid into proteins to generate ester backbone linkages at defined sites |
| US8218509B2 (en) * | 2008-01-15 | 2012-07-10 | Apple Inc. | Dynamic allocation of communication resources in a wireless system |
| AU2009210677A1 (en) * | 2008-02-08 | 2009-08-13 | The Scripps Research Institute | Breaking immunological tolerance with a genetically encoded unnatural amino acid |
| WO2009151491A2 (en) | 2008-02-27 | 2009-12-17 | The Scripps Research Institute | In vivo incorporation of an unnatural amino acid comprising a 1,2-aminothiol group |
| US20090197339A1 (en) * | 2008-12-10 | 2009-08-06 | The Scripps Research Institute | In vivo unnatural amino acid expression in the methylotrophic yeast pichia pastoris |
| WO2010068278A2 (en) * | 2008-12-10 | 2010-06-17 | The Scripps Research Institute | Production of carrier-peptide conjugates using chemically reactive unnatural amino acids |
| WO2010114615A2 (en) | 2009-04-03 | 2010-10-07 | The Scripps Research Institute | A facile system for encoding unnatural amino acids in mammalian cells |
-
2002
- 2002-04-19 MX MXPA03009563A patent/MXPA03009563A/es active IP Right Grant
- 2002-04-19 IL IL15841802A patent/IL158418A0/xx active IP Right Grant
- 2002-04-19 EP EP10182672.5A patent/EP2322631B1/en not_active Expired - Lifetime
- 2002-04-19 AU AU2002256292A patent/AU2002256292C1/en not_active Expired
- 2002-04-19 ES ES09006800.8T patent/ES2464532T3/es not_active Expired - Lifetime
- 2002-04-19 US US10/126,927 patent/US7045337B2/en not_active Expired - Lifetime
- 2002-04-19 AU AU2002303431A patent/AU2002303431C1/en not_active Expired
- 2002-04-19 JP JP2002583449A patent/JP2005502322A/ja active Pending
- 2002-04-19 WO PCT/US2002/012635 patent/WO2002086075A2/en active Search and Examination
- 2002-04-19 MX MXPA03009566A patent/MXPA03009566A/es active IP Right Grant
- 2002-04-19 EP EP14167479.6A patent/EP2796546B1/en not_active Expired - Lifetime
- 2002-04-19 US US10/126,931 patent/US7083970B2/en not_active Expired - Lifetime
- 2002-04-19 EP EP09006800.8A patent/EP2128246B1/en not_active Expired - Lifetime
- 2002-04-19 EP EP02731454.1A patent/EP1456360B1/en not_active Expired - Lifetime
- 2002-04-19 DK DK02731454.1T patent/DK1456360T3/en active
- 2002-04-19 IL IL15841902A patent/IL158419A0/xx unknown
- 2002-04-19 DK DK10182672.5T patent/DK2322631T3/en active
- 2002-04-19 CA CA2444098A patent/CA2444098C/en not_active Expired - Lifetime
- 2002-04-19 EP EP02725743.5A patent/EP1490483B1/en not_active Expired - Lifetime
- 2002-04-19 DK DK02725743.5T patent/DK1490483T3/en active
- 2002-04-19 DK DK09006800.8T patent/DK2128246T3/da active
- 2002-04-19 CA CA2443757A patent/CA2443757C/en not_active Expired - Lifetime
- 2002-04-19 JP JP2002583590A patent/JP2004537984A/ja active Pending
- 2002-04-19 WO PCT/US2002/012465 patent/WO2002085923A2/en active Application Filing
-
2003
- 2003-10-15 IL IL158419A patent/IL158419A/en active IP Right Grant
-
2004
- 2004-09-30 HK HK04107497.9A patent/HK1065065A1/xx not_active IP Right Cessation
- 2004-12-01 US US11/002,387 patent/US7713721B2/en not_active Expired - Lifetime
- 2004-12-10 US US11/009,635 patent/US8183012B2/en not_active Expired - Lifetime
- 2004-12-17 US US11/017,550 patent/US20050250183A1/en not_active Abandoned
-
2005
- 2005-03-17 HK HK11112479.2A patent/HK1158259A1/xx not_active IP Right Cessation
- 2005-03-17 HK HK05102325.7A patent/HK1069848A1/xx not_active IP Right Cessation
- 2005-10-18 US US11/254,170 patent/US7354761B2/en not_active Expired - Lifetime
- 2005-10-18 US US11/254,161 patent/US7368275B2/en not_active Expired - Lifetime
-
2006
- 2006-10-18 US US11/583,551 patent/US7638300B2/en not_active Expired - Lifetime
-
2007
- 2007-05-04 US US11/800,455 patent/US7915025B2/en not_active Expired - Fee Related
- 2007-10-26 US US11/978,108 patent/US8030074B2/en not_active Expired - Fee Related
- 2007-10-26 US US11/978,154 patent/US8012739B2/en not_active Expired - Fee Related
- 2007-10-26 US US11/978,156 patent/US8173392B2/en not_active Expired - Lifetime
- 2007-10-26 US US11/978,221 patent/US8173364B2/en not_active Expired - Lifetime
- 2007-10-26 US US11/978,157 patent/US20090068717A1/en not_active Abandoned
- 2007-10-26 US US11/978,217 patent/US20110027867A1/en not_active Abandoned
- 2007-10-26 US US11/978,188 patent/US8114648B2/en not_active Expired - Fee Related
- 2007-11-22 IL IL187588A patent/IL187588A/en active IP Right Grant
- 2007-11-29 IL IL187775A patent/IL187775A0/en active IP Right Grant
-
2008
- 2008-11-06 JP JP2008285996A patent/JP2009132704A/ja active Pending
- 2008-11-06 JP JP2008285997A patent/JP2009077731A/ja active Pending
-
2009
- 2009-01-26 IL IL196714A patent/IL196714A/en active IP Right Grant
- 2009-01-28 IL IL196762A patent/IL196762A/en active IP Right Grant
-
2010
- 2010-09-21 JP JP2010211248A patent/JP5766925B2/ja not_active Expired - Lifetime
-
2011
- 2011-06-15 US US13/161,335 patent/US20120101006A1/en not_active Abandoned
- 2011-08-02 US US13/196,829 patent/US20120202243A1/en not_active Abandoned
-
2012
- 2012-05-18 US US13/475,792 patent/US9163271B2/en not_active Expired - Fee Related
-
2013
- 2013-07-26 JP JP2013156012A patent/JP6239888B2/ja not_active Expired - Lifetime
-
2015
- 2015-04-29 HK HK15104166.3A patent/HK1203558A1/xx unknown
-
2016
- 2016-02-08 JP JP2016021701A patent/JP6294368B2/ja not_active Expired - Lifetime
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004537984A (ja) * | 2001-04-19 | 2004-12-24 | ザ スクリップス リサーチ インスティテュート | 直交tRNA−アミノアシルtRNAシンテターゼ対を生産するための方法及び組成物 |
| JP2009132704A (ja) * | 2001-04-19 | 2009-06-18 | Scripps Res Inst:The | 非天然アミノ酸のインビボ組込み |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009132704A (ja) * | 2001-04-19 | 2009-06-18 | Scripps Res Inst:The | 非天然アミノ酸のインビボ組込み |
| JP2010502218A (ja) * | 2006-09-08 | 2010-01-28 | アンブルックス,インコーポレイテッド | 修飾ヒト血漿ポリペプチドまたは修飾ヒトFc足場タンパク質ならびにこれらの利用 |
| JP2010502222A (ja) * | 2006-09-08 | 2010-01-28 | アンブルックス,インコーポレイテッド | 脊椎動物細胞用のハイブリッドサプレッサーtrna |
| US8618257B2 (en) | 2006-09-08 | 2013-12-31 | Ambrx, Inc. | Modified human plasma polypeptide or Fc scaffolds and their uses |
| JP2010504096A (ja) * | 2006-09-21 | 2010-02-12 | ザ スクリップス リサーチ インスティテュート | 真正細菌における選択的に硫酸化された蛋白質の遺伝的にプログラムされた発現 |
| JP2011502507A (ja) * | 2007-11-02 | 2011-01-27 | ザ スクリプス リサーチ インスティチュート | 非天然アミノ酸を含有する蛋白質を使用する指向的進化 |
| JP2011527886A (ja) * | 2007-12-11 | 2011-11-10 | ザ スクリプス リサーチ インスティチュート | メタノール資化性酵母ピキア・パストリスにおけるインビボ非天然アミノ酸発現 |
| WO2011158895A1 (ja) * | 2010-06-16 | 2011-12-22 | 独立行政法人理化学研究所 | 非天然タンパク質製造用の組換え細菌の作製方法、及びその利用 |
| JP5858543B2 (ja) * | 2010-06-16 | 2016-02-10 | 国立研究開発法人理化学研究所 | 非天然タンパク質製造用の組換え細菌の作製方法、及びその利用 |
| US9340790B2 (en) | 2010-06-16 | 2016-05-17 | Riken | Method for constructing recombinant bacterium for producing non-native protein, and utilization of same |
| KR101568336B1 (ko) | 2013-07-02 | 2015-11-12 | 서강대학교산학협력단 | 목적 단백질의 돌연변이체를 생성하는 세포, 상기 세포의 제조 방법, 및 상기 세포를 이용한 목적 단백질의 돌연변이체의 제조 방법 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DK1490483T3 (en) | In vivo incorporation of unnatural amino acids | |
| AU2002256292A1 (en) | In vivo incorporation of unnatural amino acids | |
| AU2008200780B2 (en) | In vivo incorporation of unnatural amino acids |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050318 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20061110 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080507 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080806 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080818 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080908 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080917 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081106 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20081106 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20081113 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20090803 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20090918 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20090918 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100412 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100419 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100528 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100604 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100702 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100714 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100803 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20100810 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20100830 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20100830 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100908 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110125 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110524 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20110802 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20111028 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20120801 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20120801 |