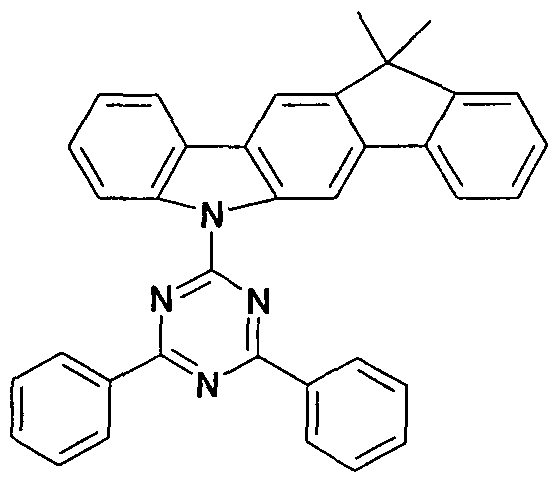
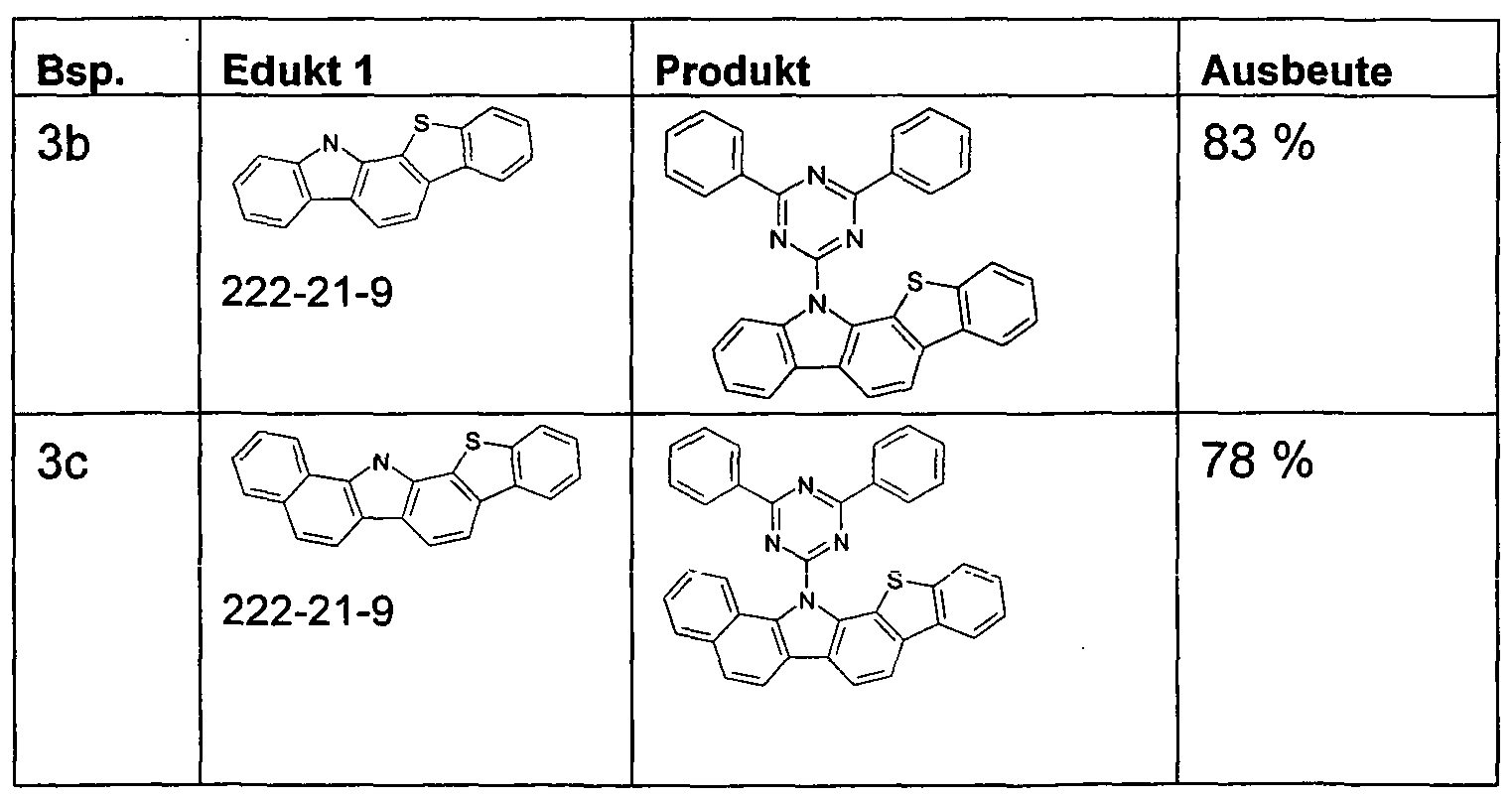
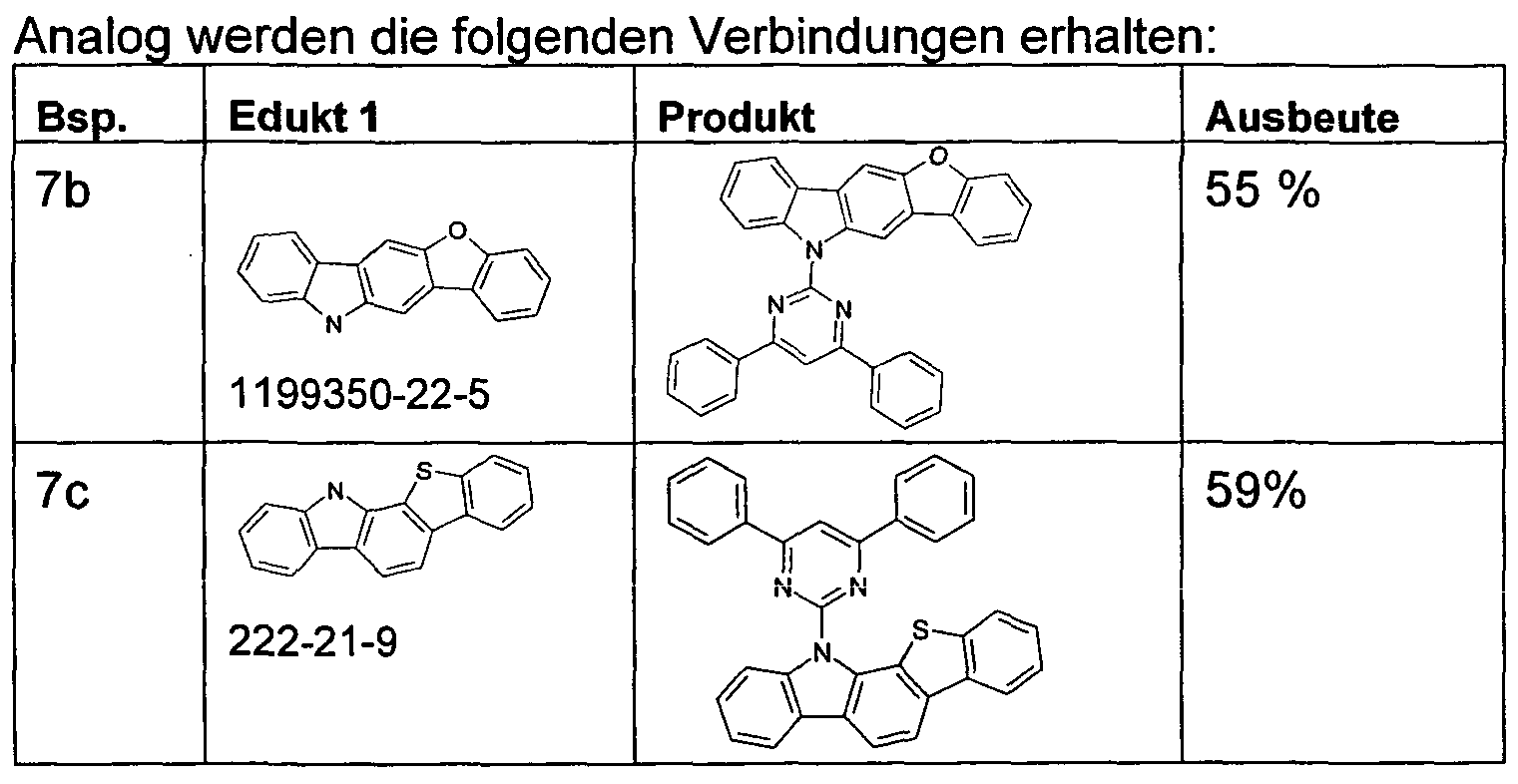
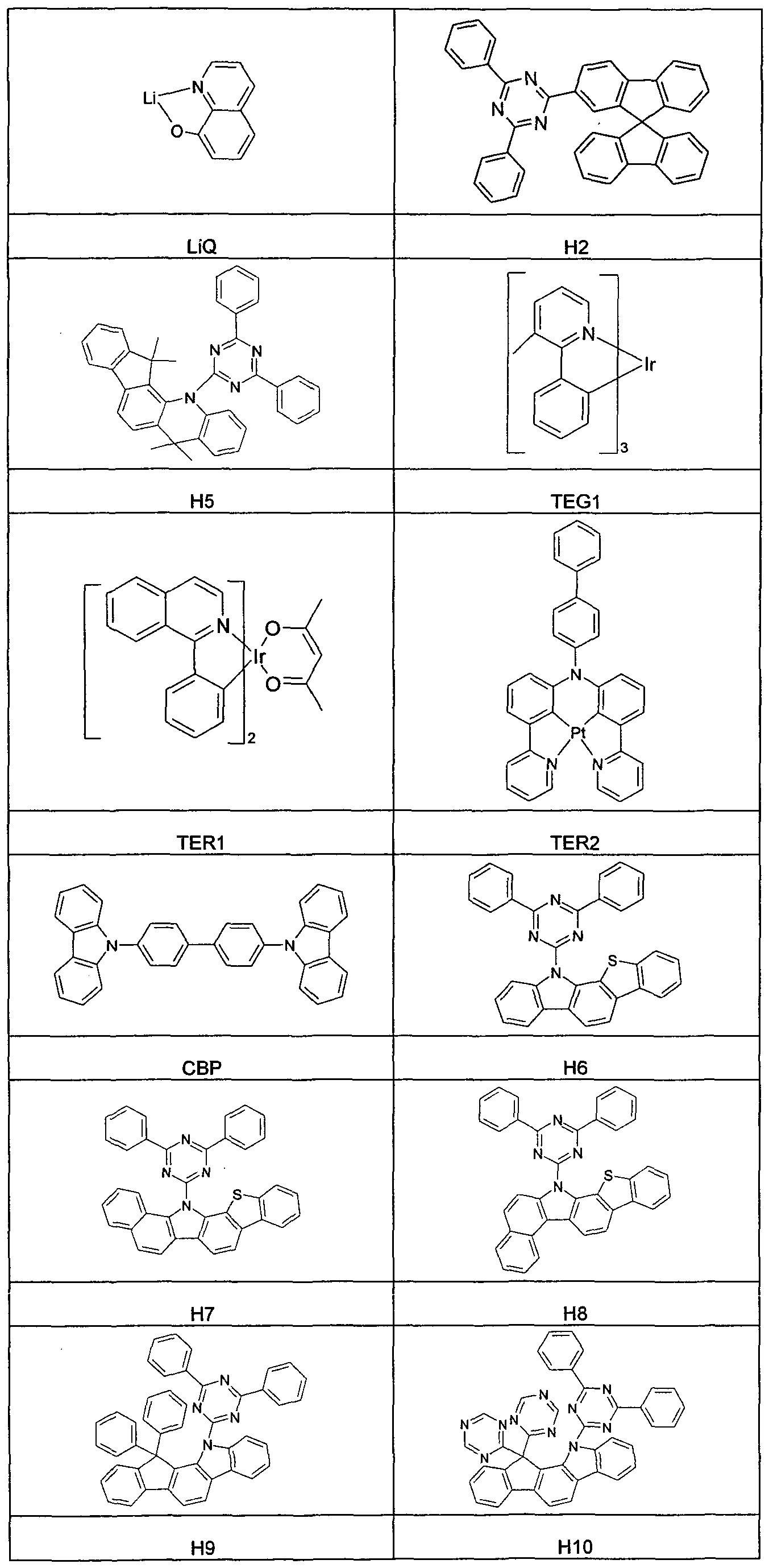
WO2011000455A1 - Materialien für organische elektrolumineszenzvorrichtungen - Google Patents
Materialien für organische elektrolumineszenzvorrichtungen Download PDFInfo
- Publication number
- WO2011000455A1 WO2011000455A1 PCT/EP2010/003324 EP2010003324W WO2011000455A1 WO 2011000455 A1 WO2011000455 A1 WO 2011000455A1 EP 2010003324 W EP2010003324 W EP 2010003324W WO 2011000455 A1 WO2011000455 A1 WO 2011000455A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- atoms
- substituted
- radicals
- aromatic ring
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
- YKZJNMBOMIZOHJ-UHFFFAOYSA-N CC(C)(c1ccccc1-c1c2)c1cc1c2c(cccc2)c2[n]1-c1cc(-c2ncccn2)cc(-c2ncccn2)c1 Chemical compound CC(C)(c1ccccc1-c1c2)c1cc1c2c(cccc2)c2[n]1-c1cc(-c2ncccn2)cc(-c2ncccn2)c1 YKZJNMBOMIZOHJ-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B57/00—Other synthetic dyes of known constitution
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains three hetero rings
- C07D487/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S428/00—Stock material or miscellaneous articles
- Y10S428/917—Electroluminescent
Definitions
- the present invention describes indenocarbazole derivatives which can preferably be used as matrix materials for phosphorescent dopants or as electron transport materials, in particular for use in the emission and / or charge transport layer of electroluminescent devices.
- the invention further relates to polymers which contain these compounds as structural units and to a process for the preparation of the compounds according to the invention and to electronic devices which contain these compounds.
- Organic semiconductors are becoming more diverse for a number of reasons.
- OLEDs organic electroluminescent devices
- carbazole derivatives e.g. Bis (carbazolyl) biphenyl
- carbazole derivatives e.g. Bis (carbazolyl) biphenyl
- ketones WO 2004/093207, WO 2010/006680
- Phosphine oxides and sulfones (WO 2005/003253) used as matrix materials for phosphorescent emitters. Especially with ketones low operating voltages and long lifetimes are achieved. There is still room for improvement, especially with regard to the
- metal complexes for example BAIq or bis [2- (2-benzothiazole) phenolate] zinc (II), are used as matrix materials for phosphorescent emitters. There is still room for improvement here, especially with regard to the operating voltage and the chemical stability. Pure organic compounds are often more stable than these metal complexes. Thus, some of these metal complexes are sensitive to hydrolysis, which makes the handling of the complexes more difficult.
- AIQ 3 has since been widely used as an electron transport material, but has several disadvantages: It can not be evaporated without leaving any residue, as it partially decomposes at the sublimation temperature, which is a major problem especially for production plants. This has the consequence that the Aufdampfarion must always be cleaned or changed. Furthermore, decomposition products of AIQ 3 enter the OLED, where they contribute to a reduced lifetime and reduced quantum and power efficiency. AIQ 3 also has low electron mobility, resulting in higher voltages and lower power efficiency.
- AIQ 3 Because of the low charge carrier mobility and the resulting increase in voltage.
- the charge carrier mobility of other electron conductors (US Pat. No. 4,539,507) is also too low to build up thicker layers, with the lifetime of the OLED being even worse than when using AlQ 3 .
- the inherent color (yellow in the solid) of AIQ 3 also proves unfavorable, which can lead to color shifts, especially with blue OLEDs, due to reabsorption and weak reemission.
- blue OLEDs can only be represented with high efficiency or color loss.
- Indenofluorene derivatives for use in electronic devices. It cites good lifetimes when used as a hole transport material or as a deep blue emitter. However, some of these compounds have the problem that they crystallize from the crystallinity of the materials during vapor deposition in mass production at the evaporation source, thereby clogging the evaporation source. The use of these materials in production is therefore at an elevated level
- electroluminescent devices which use indenocarbazole derivatives according to the invention have clear improvements over the prior art, in particular especially when used as matrix materials for phosphorescent dopants or as electron transport materials.
- longer service life results, on the other hand lower operating voltages due to changes in the interface morphology and a lower dependence of the tension on the transport layer thickness, possibly due to improved electron mobility.
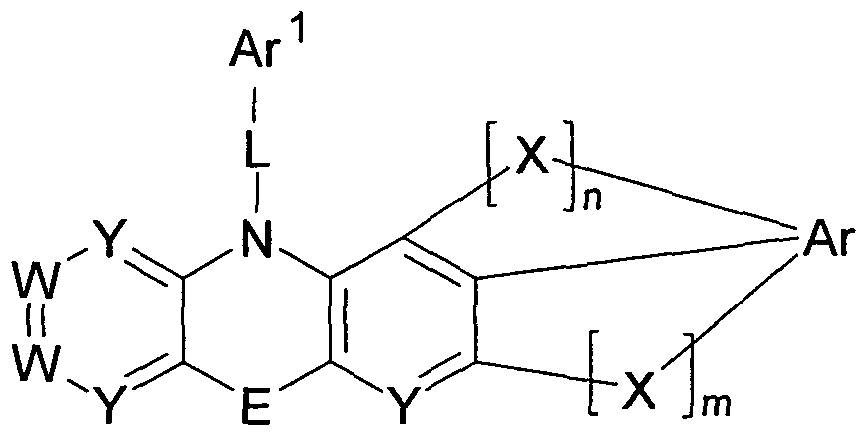
- the invention provides a compound of the following formula I:
- w is the same or different at each occurrence N or CR 1 ;
- Y is the same or different at each occurrence N or CR 2 ;
- E is either a single covalent bond or is a divalent unit selected from the group consisting of N (R 3 ), C (R 3 ) 2 ,
- X is the same or different at each occurrence as a bivalent
- Ar is a divalent or trivalent, mono- or polycyclic
- R 4b may be substituted
- An aryloxy or heteroaryloxy group having 5 to 40 aromatic ring atoms is understood as meaning a group which, via an O atom, carries a mono- or polycyclic aromatic or heteroaromatic group having 5 to 40 ring atoms as defined above.
- the aryloxy or heteroaryloxy group may also carry one or more substituents defined above.
- Ar 1 is an R 4b substituted or unsubstituted 1, 3,5-
- L is preferably a single covalent bond or a bivalent unit -Ar 2 -.
- Ar 2 is preferably a bivalent mono- or polycyclic aromatic or heteroaromatic unit having 5 to 10 aromatic ring atoms which may be substituted by one or more R 4a or R 4b radicals. Particularly preferred examples thereof are phenylene and naphthylene, more preferably phenylene.
- two R 1 or R 1 and R 2 together may be a mono- or polycyclic aromatic or heteroaromatic
- R 3 is preferably the same or different at each occurrence selected from the group consisting of H, D, a straight-chain alkyl group having 1 to 10 C atoms, a branched or cyclic alkyl group having 3 to 10 C Atoms and a mono- or polycyclic aromatic or heteroaromatic ring system having 5 to 10 aromatic ring atoms. Preference is given here to methyl, phenyl, diphenyl-amino-p-phenyl, and 3- (N-phenyl) -carbazolyl. Alternatively, two R 3 may together form a bivalent mono- or polycyclic aromatic or heteroaromatic ring system having 5 to 20 aromatic ring atoms. A preferred example of this is:
- R 4b is preferably the same or different at each occurrence selected from the group consisting of: CN, F, a straight-chain alkyl
- Ar 3 is preferably a mono- or polycyclic aromatic or heteroaromatic ring system having from 5 to 20 aromatic ring atoms.
- 10 E is either a single covalent bond or a bivalent moiety selected from N (R 3 ), C (R 3 J 2 , O and S, especially a single covalent bond;
- X is the same or different at each occurrence as a divalent moiety selected from the group consisting of C (R 3 ) 2 , S and O, especially C (R 3 J 2 ;
- Ar is a bivalent or trivalent monocyclic or polycyclic aromatic or heteroaromatic moiety having 5 to 10 aromatic 20 ring atoms, which may be substituted with one or more radicals R 4a, in particular phenylene or naphthylene, the Bradzugtesten phenylene;
- Ar 1 is a mono- or polycyclic heteroaromatic group having from 5 to 2 ⁇ 10 aromatic ring atoms containing one or more radicals
- Benzooxazole each of which may be substituted with R 4b , most preferably an R 4b substituted or unsubstituted 1,3,5-triazine;
- aromatic or heteroaromatic ring system having 5 to 20 aromatic ring atoms, each by one or more
- R 6 may be substituted
- R 3 is the same or different at each occurrence in the group
- H selected from H, D, a straight-chain alkyl group having 1 to 10 carbon atoms, a branched or cyclic alkyl group having 3 to 10
- R 4b is the same or different at each occurrence in the group
- the compounds of the invention can according to the expert known synthesis steps, such as. As bromination, Suzuki coupling, Hartwig-Buchwald coupling, etc., are shown.
- the synthesis of compounds of the invention is generally illustrated in the following Schemes 1 to 3.
- the synthesis is based, for example, on 9,9-dimethylfluorenyl-2-boronic acid (Synlett, 2006, 5, 737-740), which is coupled in a Suzuki coupling with 1-bromo-2-nitrobenzene.
- the nitro group is under Exposure of a phosphite, such as triethyl phosphite, closed to the ring, so that the corresponding Indenocarbazolderivat receives.
- the nitrogen can then be alkylated by alkylating agents or arylated in a Hartwig-Buchwald reaction. So the group Ar 1 can be introduced.
- the structures may of course also be substituted by further substituents.
- the synthesis starts from a 2-bromocarbazole derivative. This is reacted with a 1-boronic acid 2-methylcarbonyl derivative of benzene in a Suzuki coupling. Subsequently, the nitrogen is protected with a thionyl group. The carbonyl group is reduced with methyllithium to a hydroxy group. The subsequent ring closure can take place under the action of polyphosphoric acid. After cleavage of the thionyl protecting group, the nitrogen can then be alkylated by alkylating agents or arylated in a Hartwig-Buchwald reaction. So the group Ar 1 can be introduced.
- Scheme 3 Another alternative manufacturing option is shown in Scheme 3.
- Scheme 3 Another alternative manufacturing option is shown in Scheme 3.
- Another object of the invention is a process for preparing a compound of general formula I 1 comprising the steps: a) coupling a carbazole derivative or fluorene derivative with a benzene derivative, and b) arylating the carbazole nitrogen to introduce Ar 1 .
- the compounds shown above can also be used for the preparation of polymers, oligomers or dendrimers. This is usually done via polymerizable functional groups. Particularly preferred compounds for this purpose are those which are substituted by reactive leaving groups, such as bromine, iodine, boronic acid, boronic acid ester, tosylate or triflate. These can be used as comonomers for generating corresponding conjugated, partially conjugated or non-conjugated polymers, oligomers or as the core of dendrimers find use.
- the polymerization is preferably carried out via the halogen functionality or the boronic acid functionality.
- the polymers may also have crosslinkable groups or be crosslinked. In particular, crosslinkable groups are suitable, which are then crosslinked in the layer of the electronic device.
- defined compounds represent a bond to the polymer, oligomer or dendrimer.
- the polymers, oligomers or dendrimers may be conjugated, partially conjugated or non-conjugated. Also included are mixtures (blends) of the polymers, oligomers or dendrimers according to the invention with further polymers, oligomers or dendrimers.
- an oligomer is a compound which has about three to nine repeat units.
- a polymer is understood as meaning a compound which has ten or more repeat units.
- These oligomers or polymers may contain further repeat units. These further repeat units are preferably selected from the group consisting of fluorenes (for example according to EP 842208 or WO 2000/22026), spirobifluorenes (for example according to EP 707020, EP 894107 or EP 04028865.6), triarylamines, para-phenylenes (for example according to WO 92/18552), carbazoles (for example according to WO 2004/070772 and WO 2004/113468), thiophenes (for example according to EP 1028136), dihydrophenanthrenes (for example according to US Pat WO 2005/014689), indenofluorenes (for example according to WO 2004/041901 and WO 2004/113412), aromatic ketones (for example according to WO 2005/040302), phenanthrenes (for example according to WO
- the polymers also have several different repeat units which are selected from one or more of the above groups.
- the compounds according to formula I can be used in electronic devices, in particular in organic electroluminescent devices. The exact use of the compounds depends on the substituents.
- Another object of the invention is therefore the use of the compounds according to formula I or the above-defined polymers, oligomers or dendrimers in electronic devices.
- Another object of the invention is an electronic device containing at least one compound as defined above, or a polymer, oligomer or dendrimer, as defined above. Also included in the invention are mixtures (blends) of the invention
- the electronic device is preferably selected from the group consisting of organic electroluminescent devices (OLEDs), organic field-effect transistors (O-FETs), organic thin-film transistors (O-TFTs), organic light-emitting transistors
- OLEDs organic electroluminescent devices
- O-FETs organic field-effect transistors
- O-TFTs organic thin-film transistors
- O-LETs organic integrated circuits
- O-ICs organic solar cells
- O-SCs organic field quench devices
- LOCs light-emitting electrochemical cells
- O-SCs organic laser diodes
- the present invention also provides organic electroluminescent devices, which are characterized in that a plurality of emitting compounds are used in the same layer or in different layers.
- the compound of the formula I according to the invention can either be used in an emitting layer as matrix material or in an electron transport layer as electron transport material or in a hole transport layer as hole transport be used material.
- compounds according to the invention can also be used in several of the layers mentioned.
- these emission layers have a total of several emission maxima between 380 nm and 750 nm, so that overall white emission results, ie in the emitting layers, different emitting compounds are used, which can fluoresce or phosphoresce and emit the blue and yellow, orange or red light ,
- At least one of these layers contains at least one compound according to formula I and at least one phosphorescent emitter and wherein the three layers exhibit blue, green and orange or red emission (for the basic structure see, for example, WO 2005/011013).
- the use of more than three emitting layers may also be preferred. Also suitable for white emission emitters, which have broadband emission bands and thereby show white emission.
- the organic electroluminescent device may also contain further layers. These may be, for example: hole injection layer, electron blocking layer, hole blocking layer,
- Electron injection layer and / or a charge generation layer (charge generation layer).
- charge generation layer Electron injection layer and / or a charge generation layer (charge generation layer).
- the organic electroluminescent device does not contain a separate electron transport layer and the emitting layer directly adjoins the electron injection layer or the cathode.
- the host material may also simultaneously serve as an electron transport material in an electron transport layer. It may likewise be preferred if the organic electroluminescent device does not contain a separate hole transport layer and the emitting layer directly adjoins the hole injection layer or the anode.
- inventive compounds of the formula I or the polymers, oligomers or dendrimers according to the invention are used as the matrix material for phosphorescent dopants in the electronic device. It is further preferred within the scope of the invention that in the electronic device the compounds according to formula I or the polymers, oligomers or dendrimers according to the invention are used as electron transport material in an electron transport layer and / or as hole transport material in the hole transport layer and / or as hole blocking material in a hole blocking layer become.
- An organic electroluminescent device is a device that includes anode, cathode and at least one emissive layer disposed between the anode and the cathode. In addition, in each case one or more electron transport layers and / or hole transport layers may be contained.
- An organic electroluminescent device according to the invention contains at least one layer between the anode and the cathode which contains a compound of the formula I.
- the compounds of formula I are used as matrix material for emitting materials, preferably phosphorescent dopants.
- the compounds of the formula I are used as matrix material for emitting materials in an organic electroluminescent device.
- Another object of the invention are therefore mixtures of one or more compounds of formula I with one or several emitting compounds, in particular phosphorescent compounds.
- the mixture of the compound according to formula I and the phosphorescent emitter used in the emitting layer preferably contains between 99 and 50% by volume, preferably between 98 and
- the mixture contains between 1 and 50% by volume, preferably between 2 and 50% by volume, more preferably between 3 and 40% by volume, in particular between 5 and 15% by volume of the phosphorescent emitter relative to the total mixture made of emitter and matrix material.
- a further preferred embodiment of the present invention is the use of the compound according to the invention as a matrix material for a phosphorescent emitter in combination with a further matrix material.
- Particularly suitable matrix materials which can be used in combination with the compounds according to the invention are aromatic ketones, aromatic phosphine oxides or aromatic sulfoxides or sulfones, eg. B. according to WO 2004/013080, WO 2004/093207, WO 2006/005627 or WO 2010/006680, triarylamines, carbazole derivatives, z. B.
- CBP N, N-Biscarbazolylbiphenyl
- CBP indolocarbazole derivatives
- indolocarbazole derivatives for. B. according to WO 2007/063754 or WO 2008/056746
- Azacarbazolderivate z. B. according to EP 1617710, EP 1617711, EP 1731584, JP 2005/347160
- bipolar matrix materials for. B. according to WO 2007/137725, silanes, z. B. according to WO 2005/111172, azaborole or boronic esters, z. B. according to
- AIs phosphorescent compounds are particularly compounds which emit light, preferably in the visible range, with suitable excitation and also at least one atom of atomic number greater than 20, preferably greater than 38 and less than 84, more preferably greater than 56 and less than 80.
- Preferred phosphorescence emitters used are compounds containing copper, molybdenum, tungsten, rhenium, ruthenium, osmium, rhodium, iridium, palladium, platinum, silver, gold or europium, in particular compounds containing iridium or platinum.
- Examples of the emitters described above can be found in applications WO 00/70655, WO 2001/41512, WO 2002/02714, WO 2002/15645, EP 1191613, EP 1191612, EP 1191614, WO 2005/033244, WO 2005/019373 and US 2005 / 0258742 are taken.
- all phosphorescent complexes used in the prior art for phosphorescent OLEDs and as known to those skilled in the art of organic electroluminescence are suitable, and those skilled in the art may use other phosphorescent complexes without inventive step.
- two or more different phosphorescent emitters in an emitting layer, in particular emitters having different emission maxima.
- red luminescence with a green and a red phosphorescent emitter
- the organic electroluminescent device according to the invention does not contain a separate hole injection layer and / or hole transport layer and / or hole blocking layer and / or electron transport layer, ie the emitting layer directly adjoins the hole injection layer or the anode and / or borders the emitting layer directly to the electron transport layer or the electron injection layer or the cathode, as described for example in WO 2005/053051.
- a metal complex which is the same or similar to the metal complex in the emitting layer, to be used directly adjacent to the emitting layer as Lochtransport- or Lochinjemiesmaterial, such.
- the compounds of the formula I are used as electron transport material in an organic electroluminescent device, they can also be used according to the invention in combination with an organic or inorganic alkali metal compound.
- “in combination with an organic alkali metal compound” means that the compounds of the formula I and the alkali metal compound are present either as a mixture in one layer or separately in two successive layers
- the compounds of the formula I and the organic compounds Alkali metal compound as a mixture in a layer before.
- an organic alkali metal compound is to be understood as meaning a compound which contains at least one alkali metal, ie lithium, sodium, potassium, rubidium or cesium, and which also contains at least one organic ligand.
- Suitable organic alkali metal compounds are, for example, the compounds disclosed in WO 2007/050301, WO 2007/050334 and EP 1144543. These are via quote part of the present application.
- Preferred organic alkali metal compounds are the compounds of the following formula A,
- R 1 has the same meaning as described above, the curved line represents two or three atoms and bonds required to complement with M a 5- or 6-membered ring, these atoms also by one or more radicals R 1 and M is an alkali metal selected from the group consisting of lithium, sodium, potassium, rubidium or cesium.
- the complex according to formula A is present in monomeric form, as shown above, or that it is in the form of aggregates, for example of two alkali metal ions and two ligands, four alkali metal ions and four ligands, six alkali metal ions and six ligands or others aggregates.
- Preferred compounds of the formula A are the compounds of the following formulas B and C,
- Formula B is where C is 0, 1, 2 or 3 and o is 0, 1, 2, 3 or 4 and the other symbols used have the meanings given above.
- the alkali metal is selected from lithium, sodium and potassium, more preferably lithium and sodium, most preferably lithium.
- Lithium quinolinate Lithium quinolinate
- Examples of suitable organic alkali metal compounds are the structures (1) to (45) listed in the following table.
- the layer thickness of this electron transport layer is preferably between 3 and 150 nm, particularly preferably between 5 and 100 nm, very particularly preferably between 10 and 60 nm, in particular between 15 and 40 nm.
- the layer thickness of the layer containing the compound of the formula I is preferably between 3 and 150 nm, particularly preferably between 5 and 100 nm, most preferably between 10 and 60 nm, in particular between 15 and 40 nm.
- the layer thickness of the layer containing the organic or inorganic alkali metal compound and which is arranged between the layer with the compound of formula I and the cathode is preferably between 0.5 and 20 nm, more preferably between 1 and 10 nm, very particularly preferably between 1 and 5 nm, in particular between 1.5 and 3 nm.
- the compounds of formula I are used as Lochblockiermaterial.
- the compounds are then preferably used in a hole blocking layer, in particular in a phosphorescent OLED.
- a hole blocking layer in the sense of this invention is a layer which is arranged between an emitting layer and an electron transport layer.
- the compounds according to formula I are used as hole transport material and / or as hole injection material.
- the compounds are then preferably used in a hole transport layer and / or in a hole injection layer.
- a hole injection layer in the sense of this invention is a layer which is directly adjacent to the anode.
- a hole transport Layer in the sense of this invention is a layer which lies between the hole injection layer and the emission layer.
- low work function metals such as alkaline earth metals, alkali metals, main group metals or
- Lanthanides e.g., Ca, Ba, Mg, Al, In, Mg, Yb, Sm, etc.
- further metals which have a relatively high work function, such as, for example, B. Ag, which then usually combinations of metals, such as Mg / Ag, Ca / Ag or Ba / Ag are used.
- metal alloys in particular alloys of an alkali metal or alkaline earth metal and silver, particularly preferably an alloy of Mg and Ag. It may also be preferable to have a thin layer between a metallic cathode and the organic semiconductor
- Intermediate layer of a material with a high dielectric constant to bring is alkali metal or alkaline earth metal fluorides, but also the corresponding oxides or carbonates (eg LiF, Li 2 O, CsF, Cs 2 CO 3 , BaF 2 , MgO, NaF, etc.).
- the layer thickness of this layer is preferably between 0.5 and 5 nm.
- the anode high workfunction materials are preferred.
- the anode has a work function greater than 4.5 eV against vacuum.
- metals with a high redox potential such as Ag, Pt or Au, are suitable for this purpose.
- metal / metal oxide electrodes eg Al / Ni / NiO x , Al / PtO x) WoO 3
- at least one of the electrodes must be transparent or partially transparent to allow either the irradiation of the organic material (O-SC) or the outcoupling of light (OLED / PLED, O-laser).
- Preferred anode materials here are conductive mixed metal oxides. Particularly preferred are indium tin oxide (ITO) or indium zinc oxide (IZO). Preference is furthermore given to conductive, doped organic materials, in particular conductive doped polymers.
- the device is structured accordingly (depending on the application), contacted and finally hermetically sealed, as the life such devices drastically shortened in the presence of water and / or air.
- compounds of the formula I can be used either as a hole-transporting unit and / or as an electron-transporting unit and / or as a matrix for phosphorescent units.
- an organic electroluminescent device characterized in that one or more layers are coated with a sublimation process.
- the materials in vacuum sublimation systems become smaller at an initial pressure
- the initial pressure may be even lower, for example less than 10" 7 mbar.
- an organic electroluminescent device characterized in that one or more layers are coated with the OVPD (Organic Vapor Phase Deposition) method or with the aid of a carrier gas sublimation.
- the materials are applied at a pressure between 10 '5 mbar and 1 bar.
- OVJP Organic Vapor Jet Printing
- the materials are applied directly through a nozzle and thus structured (for example, BMS Arnold et al., Appl. Phys. Lett., 2008, 92, 053301).
- an organic electroluminescent device characterized in that one or more layers of solution, such. B. by spin coating, or with any printing process such.
- screen printing flexographic printing, offset printing, LITI (Light Induced Thermal Imaging, thermal transfer printing) ink jet printing (ink jet printing) or Nozzle Printing, are produced.
- LITI Light Induced Thermal Imaging, thermal transfer printing
- ink jet printing ink jet printing
- Nozzle Printing are produced.
- soluble compounds according to formula I are necessary. High solubility can be achieved by suitable
- the organic electroluminescent device may also be fabricated as a hybrid system by applying one or more layers of solution and depositing one or more other layers.
- an emitting layer comprising a compound of the formula I and a phosphorescent dopant from solution and then evaporate a hole blocking layer and / or an electron transport layer in vacuo.
- the emissive layer comprising a compound of the formula I and a phosphorescent dopant can be vapor-deposited in vacuo and one or more other layers can be applied from solution.
- Another object of the present invention is therefore a formulation containing at least one compound of formula I and at least one organic solvent.
- all organic solvents can be used, as they are commonly used for the production of organic Elektrolumineszenzvor- devices.
- Another object of the present invention are mixtures containing at least one phosphorescent emitter and
- the compounds according to the invention When used in organic electroluminescent devices, the compounds according to the invention have the following surprising advantages over the prior art:
- the compounds of the invention are very suitable for use as a matrix material for phosphorescent emitter and lead in this use to good efficiencies, high lifetimes and low operating voltages.
- the organic electroluminescent devices according to the invention have a very high efficiency.
- the improved efficiency 5 may be due to enhanced electron injection from the electron transport layer in the emissive layer.
- Example 3a 6- (4,6-Diphenyl- [1,3,5] triazin-2-yl) -12,12-dimethyl-1-6,12-dihydro-6-aza-indeno [1,2-b ] fluorene
- Example 5a 6- (2,6-Diphenyl-pyridin-4-yl) -12,12-dimethyl-1-6,12-dihydro-6-aza-indeno [1,2-b] fluorene a) 2,6 dibromo-4-nitropyridine
- a solution of 20 g (78 mmol) is heated in 70 ml H 2 SO 4 at 40 0 C 2,6-Dibromopyridin-1-oxide. At this temperature, the solution is treated with nitrating acid (70 ml H 2 SO 4 and 34 ml fuming HNO 3 ). The reaction mixture is heated at 90 ° C. for 3 hours. After cooling, the reaction mixture is poured onto 800 ml of ice water. The precipitated solid is filtered and washed with water.
- the 2,6-dibromo-4-nitropyridin-1-oxide (17.9 g) is suspended in 200 ml of chloroform and treated at room temperature with 6 ml of phosphorus tribromide (64 mmol), stirred for 1 h and then heated under reflux for 2 days. After cooling, the solution is poured onto 500 ml of ice-water and neutralized with solid NaHCO 3 . The aqueous phase is separated and extracted several times with CHCl 3 , the combined organic phases are washed with a sodium thiosulfate solution and then with water, dried and concentrated. The residue is recrystallized from EtOH.
- Example 6a 6- (3,5-Di-pyrimidin-2-yl-phenyl) -12,12-dimethyl-6,12-dihydro-6-aza-indeno [1,2-b] fluorene a) 5- iodo-1, 3- (2'-pyrimidyl) benzene
- Example 7a 6- (4,6-Diphenyl-pyrimidin-2-yl) -12,12-dimethyl-6,12-dihydro-6-aza-indeno [1,2-b] fluorene a) 2-Chloro 4,6-diphenyl-pyrimidine
- inventive OLEDs and OLEDs according to the prior art is carried out according to a general method according to WO 2004/058911, based on the circumstances described here
- the OLEDs have in principle the following layer structure: substrate / optional hole injection layer (HIL1) 5 nm / hole transport layer (HTM1) / electron blocking layer (EBL) 20 nm / emission layer (EML) / optional hole blocking layer (HBL) 10 nm / electron transport layer (ETM) and finally a cathode ,
- HIL1 optional hole injection layer
- HTM1 hole transport layer
- EBL electron blocking layer
- EML emission layer
- HBL optional hole blocking layer
- ETM optional hole blocking layer
- cathode is formed by a 100 nm thick aluminum layer, wherein depending on the electron transport material used, a 1 nm thick electron injection layer of LiF is introduced between the cathode and the electron transport layer.
- Table 3 The materials used to make the OLEDs are shown in Table 3.
- the emission layer always consists of at least one matrix material (host) and a dopant (dopant), which is mixed with the host material or the host materials by cover evaporation.
- An indication such as H2: TER1 (85%: 15%) here means that the material H2 is present in a volume fraction of 85% and TER1 in a proportion of 15% in the coating.
- the electron transport layer may consist of a mixture of two materials. The OLEDs are characterized by default.
- the lifetime is defined as the time after which the brightness has dropped from a certain starting brightness to half. This value can be converted by means of conversion formulas known to those skilled in the art to an indication of other starting brightnesses.
- the lifetime for a starting brightness of 1000 cd / m 2 is a common statement.
- Table 1 shows data of some OLEDs which show the advantages of using compounds according to the invention in the electron transport layer.
- the OLEDs consist of the layer sequence substrate / hole injection layer (HIL1) 5 nm / hole transport layer (HTM1) 140 nm / NPB 20 nm / emission layer 30 nm / electron transport layer (ETM) 20 nm / optionally 1 nm LiF / aluminum 100 nm
- Emission layer of the host material H1 which is doped to the volume of 5% by volume with the blue emitting dopant D1.
- a mixed layer prepared by co-evaporation is used as the electron transport layer an electron transport material and LiQ used.
- the volume fraction of LiQ is 60%.
- the OLEDs according to Comparative Examples 1 and 2 and Examples 1 to 4 show comparable CIE color coordinates and a comparable life of about 150 h at a starting brightness of
- ETM2 and ETM3 leads to a significant improvement of both the external quantum efficiency (EQE), the current efficiency (in cd / A), but above all the operating voltage and thus the power efficiency (in Im / W).
- Electron transport layer which already with the electron transport material ETM1 according to the prior art gives a good power efficiency (Comparative Example 2), can be achieved by using ETM2 or
- the compounds according to the invention can also be used as host materials (host materials) for phosphorescent dopants.
- host materials host materials
- the materials ETM2 and ETM3 described in the previous section are used, which for the sake of clarity are referred to below as H3 and H4.
- the compound H2 is used.
- OLEDs are compared with the green emitting dopant TEG1 and the red emitting dopants TER1 and TER2.
- the OLEDs have the structure substrate / hole transport layer (HTM1) / electron blocker layer (EBL) 20 nm / emission layer (EML) / optional hole blocking layer (HBL) 10 nm / electron transport layer (ETM) / optional LiF 1 nm / aluminum 100 nm.
- HTM1 hole transport layer
- EBL electron blocker layer
- HBL hole blocking layer
- ETM electron transport layer
- the thickness of the hole transport layer is 20 nm
- the electron blocking layer is formed by NPB
- the electron transport layer is 20 nm thick Alq3 layer with a 1 nm thick electron injection layer of LiF.
- the OLEDs of Comparative Example 5 and Example 7 additionally contain a 10 nm thick hole blocking layer of the material H2 between the emission layer and the electron transport layer.
- the OLEDs of Comparative Examples 6 and 7 and Examples 8-12, 15-24 and 26-31 contain a 160 nm-thick hole transport layer and an electron-blocking layer formed by the material EBM1.
- these OLEDs contain a mixture of ETM1 and LiQ in the volume ratio 50%: 50%, an electron injection layer is absent.
- a 10 nm thick hole blocking layer of material H2 is present; the thickness of the electron transport layer is 30 nm.
- the hole blocking layer is absent in the OLEDs of Comparative Example 7 and Examples 9, 11, 12, 15-20, 22-24, 26-28, 30 and 31; the thickness of the electron transport layer is 40 nm here.
- the use of host material H5 gives a 25-50% increase in power efficiency, depending on whether the dopant TER1 or TER2 is used and whether another host material is present (Comparison of Comparative Examples 3 to 5 with Examples 5 to 7). Furthermore, the lifetime increases when using H5 by 20-35% compared to components in which the material H2 is used according to the prior art.
- the compounds according to the invention thus result in significant improvements in all relevant parameters.
- the efficiency, operating voltage and service life can be improved even more clearly than in the same described red emitting OLEDs.
- the use of H4 as host material gives an improvement of 35-40% in power efficiency and an increase of about 30-40% in lifetime over the use of H2 (Comparison of Comparative Example 6 with Example 10, and Comparative Example 7 with Example 11) ).
- the very high increase in the power efficiency results above all from the significant reduction of the operating voltage by about 1 V.
- the use of the compound H3 according to the invention also results in a significant improvement of the power efficiency by about 20%, increasing the service life by 20-30% (Comparison of Comparative Example 6 with Example 8, and Comparative Example 7 with Example 9).
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Photovoltaic Devices (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Indole Compounds (AREA)
Abstract
Description
Claims
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201080029223.0A CN102471602B (zh) | 2009-06-30 | 2010-06-01 | 用于有机电致发光器件的材料 |
| JP2012516542A JP5734965B2 (ja) | 2009-06-30 | 2010-06-01 | 有機エレクトロルミネセンス素子のための材料 |
| DE112010002775.7T DE112010002775B4 (de) | 2009-06-30 | 2010-06-01 | Materialien für organische elektrolumineszenzvorrichtungen |
| US13/379,879 US9040172B2 (en) | 2009-06-30 | 2010-06-01 | Materials for organic electroluminescent devices |
| KR1020127002648A KR101777883B1 (ko) | 2009-06-30 | 2010-06-01 | 유기 전계발광 소자용 재료 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102009031021A DE102009031021A1 (de) | 2009-06-30 | 2009-06-30 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009031021.5 | 2009-06-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2011000455A1 true WO2011000455A1 (de) | 2011-01-06 |
Family
ID=42542439
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2010/003324 Ceased WO2011000455A1 (de) | 2009-06-30 | 2010-06-01 | Materialien für organische elektrolumineszenzvorrichtungen |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9040172B2 (de) |
| JP (1) | JP5734965B2 (de) |
| KR (1) | KR101777883B1 (de) |
| CN (1) | CN102471602B (de) |
| DE (3) | DE102009031021A1 (de) |
| TW (1) | TW201127811A (de) |
| WO (1) | WO2011000455A1 (de) |
Cited By (332)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011057701A1 (de) * | 2009-11-10 | 2011-05-19 | Merck Patent Gmbh | Organische verbindungen für elektroluminiszenz vorrichtungen |
| CN102153503A (zh) * | 2011-02-22 | 2011-08-17 | 黑龙江省科学院石油化学研究院 | 咔唑-芴类化合物及其合成方法 |
| WO2011137951A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2011141109A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2011157339A1 (de) | 2010-06-15 | 2011-12-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2011157346A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2011160758A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012007086A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2012007087A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2012016630A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012034627A1 (de) | 2010-09-15 | 2012-03-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012048781A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien auf basis von triphenylen für organische elektrolumineszenzvorrichtungen |
| WO2012069121A1 (de) | 2010-11-24 | 2012-05-31 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012079741A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012074210A3 (ko) * | 2010-12-02 | 2012-07-26 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012136296A1 (de) | 2011-04-04 | 2012-10-11 | Merck Patent Gmbh | Metallkomplexe |
| WO2012136295A1 (de) | 2011-04-05 | 2012-10-11 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012143080A2 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012150001A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102012007810A1 (de) | 2011-05-16 | 2012-11-22 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2012163465A1 (de) | 2011-06-03 | 2012-12-06 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012163471A1 (de) | 2011-06-03 | 2012-12-06 | Merck Patent Gmbh | Metallkomplexe |
| WO2013000531A1 (de) | 2011-06-28 | 2013-01-03 | Merck Patent Gmbh | Metallkomplexe |
| CN102911112A (zh) * | 2011-08-03 | 2013-02-06 | 三星显示有限公司 | 杂环化合物和包括该化合物的有机发光装置 |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2013020631A1 (de) | 2011-08-10 | 2013-02-14 | Merck Patent Gmbh | Metallkomplexe |
| WO2013026515A1 (de) | 2011-08-22 | 2013-02-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2013041176A1 (de) | 2011-09-21 | 2013-03-28 | Merck Patent Gmbh | Carbazolderivate für organische elektrolumineszenzvorrichtungen |
| WO2013056776A1 (de) | 2011-10-20 | 2013-04-25 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2013064206A1 (de) | 2011-11-01 | 2013-05-10 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| WO2013087142A1 (de) | 2011-12-12 | 2013-06-20 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| WO2013100467A1 (ko) * | 2011-12-30 | 2013-07-04 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| WO2013100464A1 (ko) * | 2011-12-29 | 2013-07-04 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| WO2013105747A1 (ko) * | 2012-01-13 | 2013-07-18 | 덕산하이메탈(주) | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2013108997A1 (ko) * | 2012-01-18 | 2013-07-25 | 덕산하이메탈(주) | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| WO2013135352A1 (de) | 2012-03-15 | 2013-09-19 | Merck Patent Gmbh | Elektronische vorrichtungen |
| WO2013139431A1 (de) | 2012-03-23 | 2013-09-26 | Merck Patent Gmbh | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen |
| WO2013172255A1 (ja) * | 2012-05-17 | 2013-11-21 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| WO2014008967A2 (de) | 2012-07-10 | 2014-01-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014008982A1 (de) | 2012-07-13 | 2014-01-16 | Merck Patent Gmbh | Metallkomplexe |
| WO2014010910A1 (ko) * | 2012-07-13 | 2014-01-16 | 덕산하이메탈(주) | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2014015935A2 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektronische vorrichtungen |
| WO2014015937A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektrolumineszierende vorrichtungen |
| WO2014015931A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014015938A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Derivate von 2-diarylaminofluoren und diese enthaltnde organische elektronische verbindungen |
| WO2014023377A2 (de) | 2012-08-07 | 2014-02-13 | Merck Patent Gmbh | Metallkomplexe |
| WO2014023388A1 (de) | 2012-08-10 | 2014-02-13 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| KR101375359B1 (ko) * | 2011-01-19 | 2014-03-21 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 이용한 유기 광소자 |
| WO2014044344A1 (de) | 2012-09-18 | 2014-03-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| WO2014056567A1 (de) | 2012-10-11 | 2014-04-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102012020167A1 (de) | 2012-10-13 | 2014-04-17 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| KR101390523B1 (ko) * | 2011-12-08 | 2014-05-07 | 주식회사 두산 | 신규 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| WO2014067614A1 (de) | 2012-10-31 | 2014-05-08 | Merck Patent Gmbh | Elektronische vorrichtung |
| DE102012021650A1 (de) | 2012-11-03 | 2014-05-08 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| KR101395607B1 (ko) * | 2011-11-11 | 2014-05-16 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 이용한 유기 광소자 |
| WO2014079532A1 (de) | 2012-11-20 | 2014-05-30 | Merck Patent Gmbh | Formulierung in hochreinem l?sungsmittel zur herstellung elektronischer vorrichtungen |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014094963A1 (de) * | 2012-12-21 | 2014-06-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014104600A1 (ko) * | 2012-12-31 | 2014-07-03 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| TWI461427B (zh) * | 2012-01-18 | 2014-11-21 | Duksan High Metal Co Ltd | 用於有機電子元件之化合物、使用此化合物之有機電子元件及其電子裝置 |
| DE102013008189A1 (de) | 2013-05-14 | 2014-12-04 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| KR101507423B1 (ko) | 2012-06-22 | 2015-04-08 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2015082046A2 (de) | 2013-12-06 | 2015-06-11 | Merck Patent Gmbh | Substituierte oxepine |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015090504A2 (de) | 2013-12-19 | 2015-06-25 | Merck Patent Gmbh | Heterocyclische spiroverbindungen |
| WO2015165563A1 (de) | 2014-04-30 | 2015-11-05 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015169412A1 (de) | 2014-05-05 | 2015-11-12 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102015006708A1 (de) | 2014-06-12 | 2015-12-17 | Merck Patent Gmbh | Metallkomplexe |
| WO2015192941A1 (de) | 2014-06-18 | 2015-12-23 | Merck Patent Gmbh | Zusammensetzungen für elektronische vorrichtungen |
| WO2015197156A1 (de) | 2014-06-25 | 2015-12-30 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP2725080A4 (de) * | 2011-06-27 | 2016-03-02 | Lg Chemical Ltd | Neue verbindung und organische lichtemittierende vorrichtung damit |
| DE102014012818A1 (de) | 2014-08-28 | 2016-03-03 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2016074755A1 (de) | 2014-11-11 | 2016-05-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2016091353A1 (de) | 2014-12-12 | 2016-06-16 | Merck Patent Gmbh | Organische verbindungen mit löslichen gruppen |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016198144A1 (en) | 2015-06-10 | 2016-12-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017012687A1 (en) | 2015-07-22 | 2017-01-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017025166A1 (en) | 2015-08-13 | 2017-02-16 | Merck Patent Gmbh | Hexamethylindanes |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| DE102015013381A1 (de) | 2015-10-14 | 2017-04-20 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2017071791A1 (en) | 2015-10-27 | 2017-05-04 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| CN106632392A (zh) * | 2016-12-30 | 2017-05-10 | 上海升翕光电科技有限公司 | 苯并噻吩并咔唑类有机发光材料及其制备方法和有机发光器件 |
| CN106632413A (zh) * | 2016-12-30 | 2017-05-10 | 上海升翕光电科技有限公司 | 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件 |
| DE102015016016A1 (de) | 2015-12-10 | 2017-06-14 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| US20170207398A1 (en) * | 2014-07-17 | 2017-07-20 | Rohm And Haas Electronic Materials Korea Ltd. | Electron transport material and organic electroluminescent device comprising the same |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| KR101771051B1 (ko) * | 2014-11-18 | 2017-08-24 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2017148564A1 (de) | 2016-03-03 | 2017-09-08 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2017157983A1 (de) | 2016-03-17 | 2017-09-21 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2017178311A1 (de) | 2016-04-11 | 2017-10-19 | Merck Patent Gmbh | Heterocyclische verbindungen mit dibenzofuran- und/oder dibenzothiophen-strukturen |
| WO2017186760A1 (en) | 2016-04-29 | 2017-11-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017207596A1 (en) | 2016-06-03 | 2017-12-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018001990A1 (de) | 2016-06-30 | 2018-01-04 | Merck Patent Gmbh | Verfahren zur auftrennung von enantiomerenmischungen von metallkomplexen |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018011186A1 (de) | 2016-07-14 | 2018-01-18 | Merck Patent Gmbh | Metallkomplexe |
| WO2018019687A1 (de) | 2016-07-25 | 2018-02-01 | Merck Patent Gmbh | Di- und oligonukleare metallkomplexe mit tripodalen bidentaten teilliganden sowie deren verwendung in elektronischen vorrichtungen |
| WO2018019688A1 (de) | 2016-07-25 | 2018-02-01 | Merck Patent Gmbh | Metallkomplexe für den einsatz als emitter in organischen elektrolumineszenzvorrichtungen |
| WO2018041769A1 (de) | 2016-08-30 | 2018-03-08 | Merck Patent Gmbh | Bl- und trinukleare metallkomplexe aufgebaut aus zwei miteinander verknüpften tripodalen hexadentaten liganden zur verwendung in elektrolumineszenzvorrichtungen |
| WO2018050584A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2018050583A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit carbazol-strukturen |
| KR101826013B1 (ko) * | 2017-05-19 | 2018-03-22 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2018054798A1 (de) | 2016-09-21 | 2018-03-29 | Merck Patent Gmbh | Binukleare metallkomplexe für den einsatz als emitter in organischen elektrolumineszenzvorrichtungen |
| WO2018060307A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Verbindungen mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018060218A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Carbazole mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2018069196A1 (de) | 2016-10-12 | 2018-04-19 | Merck Patent Gmbh | Binukleare metallkomplexe sowie elektronische vorrichtungen, insbesondere organische elektrolumineszenzvorrichtungen, enthaltend diese metallkomplexe |
| WO2018069273A1 (de) | 2016-10-13 | 2018-04-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| WO2018069197A1 (de) | 2016-10-12 | 2018-04-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2018077769A1 (de) | 2016-10-25 | 2018-05-03 | Merck Patent Gmbh | Metallkomplexe |
| KR101853875B1 (ko) | 2011-06-22 | 2018-05-03 | 삼성디스플레이 주식회사 | 헤테로고리 화합물 및 이를 포함한 유기발광 소자 |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087022A1 (de) | 2016-11-09 | 2018-05-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2018087346A1 (de) | 2016-11-14 | 2018-05-17 | Merck Patent Gmbh | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018091435A1 (en) | 2016-11-17 | 2018-05-24 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| WO2018099846A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Verbindungen mit valerolaktam-strukturen |
| WO2018104195A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018104193A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018104194A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018114882A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| EP3345984A1 (de) | 2013-12-06 | 2018-07-11 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| WO2018127465A1 (de) | 2017-01-04 | 2018-07-12 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018138039A1 (de) | 2017-01-25 | 2018-08-02 | Merck Patent Gmbh | Carbazolderivate |
| WO2018138306A1 (de) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018149769A1 (de) | 2017-02-14 | 2018-08-23 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018154501A1 (en) | 2017-02-24 | 2018-08-30 | Idemitsu Kosan Co., Ltd. | Specific ladder type compounds for organic light emitting devices |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018158232A1 (en) | 2017-03-01 | 2018-09-07 | Merck Patent Gmbh | Organic electroluminescent device |
| WO2018166934A1 (de) | 2017-03-15 | 2018-09-20 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018166932A1 (de) | 2017-03-13 | 2018-09-20 | Merck Patent Gmbh | Verbindungen mit arylamin-strukturen |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2018177981A1 (de) | 2017-03-29 | 2018-10-04 | Merck Patent Gmbh | Aromatische verbindungen |
| US20180282276A1 (en) * | 2015-08-20 | 2018-10-04 | Duk San Neolux Co., Ltd. | Compound for organic electric element, organic electric element comprising the same and electronic device thereof |
| WO2018189134A1 (de) | 2017-04-13 | 2018-10-18 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| KR101917715B1 (ko) | 2012-01-18 | 2018-11-13 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| WO2018206537A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Carbazole-based bodipys for organic electroluminescent devices |
| WO2018206526A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Organoboron complexes for organic electroluminescent devices |
| WO2018215318A1 (de) | 2017-05-22 | 2018-11-29 | Merck Patent Gmbh | Hexazyklische heteroaromatische verbindungen für elektronische vorrichtungen |
| US10153436B2 (en) * | 2011-12-23 | 2018-12-11 | Cheil Industries, Inc. | Compound for an organic optoelectronic element, organic light-emitting element comprising same, and display device comprising the organic light-emitting element |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018234220A1 (de) | 2017-06-21 | 2018-12-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019002198A1 (en) | 2017-06-26 | 2019-01-03 | Merck Patent Gmbh | HOMOGENEOUS MIXTURES |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| WO2019007866A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019007867A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019020538A1 (de) | 2017-07-25 | 2019-01-31 | Merck Patent Gmbh | Metallkomplexe |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019052933A1 (de) | 2017-09-12 | 2019-03-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019068679A1 (en) | 2017-10-06 | 2019-04-11 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019076789A1 (en) | 2017-10-17 | 2019-04-25 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019081391A1 (de) | 2017-10-24 | 2019-05-02 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019096717A2 (de) | 2017-11-14 | 2019-05-23 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019115423A1 (de) | 2017-12-13 | 2019-06-20 | Merck Patent Gmbh | Metallkomplexe |
| WO2019121458A1 (de) | 2017-12-19 | 2019-06-27 | Merck Patent Gmbh | Heterocyclische verbindung zur verwendung in electronischen vorrichtungen |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| WO2019145316A1 (de) | 2018-01-25 | 2019-08-01 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019158453A1 (de) | 2018-02-13 | 2019-08-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2019170572A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019170578A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019179909A1 (de) | 2018-03-19 | 2019-09-26 | Merck Patent Gmbh | Metallkomplexe |
| WO2019229011A1 (de) | 2018-05-30 | 2019-12-05 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019233904A1 (de) | 2018-06-07 | 2019-12-12 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2020011686A1 (de) | 2018-07-09 | 2020-01-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020016264A1 (en) | 2018-07-20 | 2020-01-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020039708A1 (ja) | 2018-08-23 | 2020-02-27 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| WO2020043640A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043646A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043657A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020053314A1 (de) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Elektrolumineszierende vorrichtungen |
| WO2020053315A1 (de) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Elektrolumineszierende vorrichtungen |
| WO2020053150A1 (en) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020064662A2 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| EP3647393A1 (de) | 2013-07-30 | 2020-05-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2020089138A1 (en) | 2018-10-31 | 2020-05-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020094539A1 (de) | 2018-11-05 | 2020-05-14 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020094542A1 (de) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | 5,6-diphenyl-5,6-dihydro-dibenz[c,e][1,2]azaphosphorin- und 6-phenyl-6h-dibenzo[c,e][1,2]thiazin-5,5-dioxid-derivate und ähnliche verbindungen als organische elektrolumineszenzmaterialien für oleds |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020099307A1 (de) | 2018-11-15 | 2020-05-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020127165A1 (de) | 2018-12-19 | 2020-06-25 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020148243A1 (en) | 2019-01-16 | 2020-07-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020165064A1 (de) | 2019-02-11 | 2020-08-20 | Merck Patent Gmbh | Mononukleare iridiumkomplexe mit drei ortho-metallierten bidentaten liganden und optischer orientierungsanisotropie |
| WO2020169241A1 (de) | 2019-02-18 | 2020-08-27 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2020178230A1 (en) | 2019-03-04 | 2020-09-10 | Merck Patent Gmbh | Ligands for nano-sized materials |
| WO2020182779A1 (de) | 2019-03-12 | 2020-09-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3712229A1 (de) | 2013-07-30 | 2020-09-23 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2020187865A1 (de) | 2019-03-20 | 2020-09-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020193447A1 (de) | 2019-03-25 | 2020-10-01 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020208051A1 (en) | 2019-04-11 | 2020-10-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020212296A1 (de) | 2019-04-15 | 2020-10-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2021037401A1 (de) | 2019-08-26 | 2021-03-04 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021043703A1 (de) | 2019-09-02 | 2021-03-11 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021043755A1 (de) | 2019-09-03 | 2021-03-11 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021053046A1 (de) | 2019-09-20 | 2021-03-25 | Merck Patent Gmbh | Peri-kondensierte heterozyklische verbindungen als materialien für elektronische vorrichtungen |
| WO2021052924A1 (en) | 2019-09-16 | 2021-03-25 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021052921A1 (de) | 2019-09-19 | 2021-03-25 | Merck Patent Gmbh | Mischung von zwei hostmaterialien und organische elektrolumineszierende vorrichtung damit |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021078710A1 (en) | 2019-10-22 | 2021-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021089450A1 (en) | 2019-11-04 | 2021-05-14 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021094269A1 (en) | 2019-11-12 | 2021-05-20 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021110720A1 (de) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Metallkomplexe |
| WO2021110741A1 (en) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021122535A1 (de) | 2019-12-17 | 2021-06-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021122740A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021122538A1 (de) | 2019-12-18 | 2021-06-24 | Merck Patent Gmbh | Aromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| WO2021160898A2 (de) | 2020-05-27 | 2021-08-19 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2021170522A1 (de) | 2020-02-25 | 2021-09-02 | Merck Patent Gmbh | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| WO2021185712A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021185829A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021191117A1 (de) | 2020-03-24 | 2021-09-30 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2021191183A1 (de) | 2020-03-26 | 2021-09-30 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021191058A1 (en) | 2020-03-23 | 2021-09-30 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021198213A1 (de) | 2020-04-02 | 2021-10-07 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021204646A1 (de) | 2020-04-06 | 2021-10-14 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| EP3904361A2 (de) | 2013-10-02 | 2021-11-03 | Merck Patent GmbH | Borenthaltende verbindungen |
| WO2021239772A1 (de) | 2020-05-29 | 2021-12-02 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| WO2022002771A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022002772A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022017997A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022029096A1 (de) | 2020-08-06 | 2022-02-10 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022034046A1 (de) | 2020-08-13 | 2022-02-17 | Merck Patent Gmbh | Metallkomplexe |
| WO2022038066A1 (de) | 2020-08-19 | 2022-02-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022038065A1 (de) | 2020-08-18 | 2022-02-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022069380A1 (de) | 2020-09-29 | 2022-04-07 | Merck Patent Gmbh | Mononukleare tripodale hexadentate iridium komplexe zur verwendung in oleds |
| WO2022069422A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Verbindungen zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen |
| WO2022069421A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen einsetzbare verbindungen |
| WO2022079068A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022079067A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Verbindungen mit heteroatomen für organische elektrolumineszenzvorrichtungen |
| WO2022101171A1 (de) | 2020-11-10 | 2022-05-19 | Merck Patent Gmbh | Schwefelhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022117473A1 (de) | 2020-12-02 | 2022-06-09 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022122682A2 (de) | 2020-12-10 | 2022-06-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022124367A1 (ja) | 2020-12-11 | 2022-06-16 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子用材料及び有機電界発光素子 |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022148717A1 (de) | 2021-01-05 | 2022-07-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022157343A1 (de) | 2021-01-25 | 2022-07-28 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| EP4037000A1 (de) | 2014-07-21 | 2022-08-03 | Merck Patent GmbH | Materialen für elektronische vorrichtungen |
| WO2022184601A1 (de) | 2021-03-02 | 2022-09-09 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022194799A1 (de) | 2021-03-18 | 2022-09-22 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022200638A1 (de) | 2021-07-06 | 2022-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP4079742A1 (de) | 2021-04-14 | 2022-10-26 | Merck Patent GmbH | Metallkomplexe |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022229298A1 (de) | 2021-04-29 | 2022-11-03 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022229126A1 (de) | 2021-04-29 | 2022-11-03 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023052314A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052272A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052313A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052275A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023094412A1 (de) | 2021-11-25 | 2023-06-01 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| WO2023110742A1 (de) | 2021-12-13 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023117835A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| WO2023117836A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| WO2023117837A1 (de) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023139034A1 (en) | 2022-01-20 | 2023-07-27 | Merck Patent Gmbh | Organic electric element with mixed host system |
| WO2023152063A1 (de) | 2022-02-09 | 2023-08-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023152346A1 (de) | 2022-02-14 | 2023-08-17 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP4236652A2 (de) | 2015-07-29 | 2023-08-30 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023222559A1 (de) | 2022-05-18 | 2023-11-23 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2024013004A1 (de) | 2022-07-11 | 2024-01-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024019072A1 (ja) | 2022-07-22 | 2024-01-25 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子 |
| EP4311849A1 (de) | 2022-07-27 | 2024-01-31 | UDC Ireland Limited | Metallkomplexe |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024094592A2 (de) | 2022-11-01 | 2024-05-10 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024105066A1 (en) | 2022-11-17 | 2024-05-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024133048A1 (en) | 2022-12-20 | 2024-06-27 | Merck Patent Gmbh | Method for preparing deuterated aromatic compounds |
| WO2024132993A1 (de) | 2022-12-19 | 2024-06-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024149694A1 (de) | 2023-01-10 | 2024-07-18 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024153568A1 (de) | 2023-01-17 | 2024-07-25 | Merck Patent Gmbh | Heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024170605A1 (en) | 2023-02-17 | 2024-08-22 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024184050A1 (de) | 2023-03-07 | 2024-09-12 | Merck Patent Gmbh | Cyclische stickstoffverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024194264A1 (de) | 2023-03-20 | 2024-09-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2024218109A1 (de) | 2023-04-20 | 2024-10-24 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US12144249B2 (en) | 2020-07-17 | 2024-11-12 | Samsung Sdi Co., Ltd. | Compound for organic optoelectronic device, composition for organic optoelectronic device, organic optoelectronic device and display device |
| WO2024240725A1 (de) | 2023-05-25 | 2024-11-28 | Merck Patent Gmbh | Tris[1,2,4]triazolo[1,5-a:1',5'-c:1'',5''-e][1,3,5]triazin-derivate zur verwendung in organischen elektrolumineszenzvorrichtungen |
| WO2024256357A1 (de) | 2023-06-12 | 2024-12-19 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| EP4486099A1 (de) | 2023-06-30 | 2025-01-01 | Merck Patent GmbH | Verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025003084A1 (de) | 2023-06-28 | 2025-01-02 | Merck Patent Gmbh | Dicyanoarylverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025012253A1 (en) | 2023-07-12 | 2025-01-16 | Merck Patent Gmbh | Materials for electronic devices |
| WO2025021855A1 (de) | 2023-07-27 | 2025-01-30 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen und organische sensoren |
| WO2025045842A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025045935A1 (de) | 2023-08-31 | 2025-03-06 | Merck Patent Gmbh | Cyanogruppen-enthaltende aromaten für organische elektrolumineszenzvorrichtungen |
| WO2025045851A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025045843A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025109056A1 (de) | 2023-11-24 | 2025-05-30 | Merck Patent Gmbh | Sauerstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025119821A1 (en) | 2023-12-05 | 2025-06-12 | Merck Patent Gmbh | Material composition for organic electroluminescent devices |
| WO2025132547A1 (en) | 2023-12-21 | 2025-06-26 | Merck Patent Gmbh | Mechanochemical method for deuterating organic compounds |
| WO2025132551A1 (de) | 2023-12-22 | 2025-06-26 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2025181124A1 (de) | 2024-03-01 | 2025-09-04 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2025181097A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025181044A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025196145A1 (en) | 2024-03-22 | 2025-09-25 | Merck Patent Gmbh | Materials for organic light emitting devices |
| WO2025210013A1 (de) | 2024-04-04 | 2025-10-09 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen, insbesondere verbindungen für oleds |
| WO2025228800A1 (de) | 2024-04-30 | 2025-11-06 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
Families Citing this family (125)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102009032922B4 (de) | 2009-07-14 | 2024-04-25 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung, deren Verwendung sowie elektronische Vorrichtung |
| DE102009041289A1 (de) * | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053645A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtung |
| JP5784608B2 (ja) | 2009-09-16 | 2015-09-24 | メルク パテント ゲーエムベーハー | 電子素子製造のための調合物 |
| DE102009041414A1 (de) | 2009-09-16 | 2011-03-17 | Merck Patent Gmbh | Metallkomplexe |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009057167A1 (de) | 2009-12-05 | 2011-06-09 | Merck Patent Gmbh | Elektronische Vorrichtung enthaltend Metallkomplexe |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010009193B4 (de) | 2010-02-24 | 2022-05-19 | MERCK Patent Gesellschaft mit beschränkter Haftung | Zusammensetzung enthaltend Fluor-Fluor Assoziate, Verfahren zu deren Herstellung, deren Verwendung sowie organische elektronische Vorrichtung diese enthaltend |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010010481A1 (de) | 2010-03-06 | 2011-09-08 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010018321A1 (de) | 2010-04-27 | 2011-10-27 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| DE102010020567A1 (de) | 2010-05-14 | 2011-11-17 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027218A1 (de) | 2010-07-15 | 2012-01-19 | Merck Patent Gmbh | Organische Komplexe enthaltend Metalle |
| DE102010027319A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010046412B4 (de) | 2010-09-23 | 2022-01-13 | Merck Patent Gmbh | Metall-Ligand Koordinationsverbindungen |
| DE102010046512A1 (de) | 2010-09-24 | 2012-03-29 | Merck Patent Gmbh | Phosphorhaltige Metallkomplexe |
| DE102010054316A1 (de) | 2010-12-13 | 2012-06-14 | Merck Patent Gmbh | Substituierte Tetraarylbenzole |
| DE102010054525A1 (de) | 2010-12-15 | 2012-04-26 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010055901A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| DE102010055902A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| US8751777B2 (en) | 2011-01-28 | 2014-06-10 | Honeywell International Inc. | Methods and reconfigurable systems to optimize the performance of a condition based health maintenance system |
| DE102011010841A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | (1,3)-Dioxan-5-on-Verbindungen |
| DE102011011104A1 (de) | 2011-02-12 | 2012-08-16 | Merck Patent Gmbh | Substituierte Dibenzonaphtacene |
| DE102012016192A1 (de) | 2011-08-19 | 2013-02-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| DE102011117422A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung in elektronischen Vorrichtungen |
| KR20140117440A (ko) | 2011-12-27 | 2014-10-07 | 메르크 파텐트 게엠베하 | 1,2,3-트리아졸을 포함하는 금속 착물 |
| CN104053746B (zh) | 2012-01-16 | 2016-11-09 | 默克专利有限公司 | 有机金属络合物 |
| WO2013174471A1 (en) | 2012-05-24 | 2013-11-28 | Merck Patent Gmbh | Metal complexes comprising condensed heteroaromatic rings |
| WO2014112360A1 (ja) * | 2013-01-17 | 2014-07-24 | 保土谷化学工業株式会社 | インデノアクリダン環構造を有する化合物および有機エレクトロルミネッセンス素子 |
| CN104995185B (zh) | 2013-02-07 | 2018-05-01 | 株式会社Lg化学 | 杂环化合物及使用其的有机发光元件 |
| KR101576570B1 (ko) | 2013-02-18 | 2015-12-10 | 주식회사 두산 | 유기 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| KR102191023B1 (ko) * | 2013-02-28 | 2020-12-15 | 에스에프씨 주식회사 | 유기발광 화합물 및 이를 포함하는 유기전계발광소자 |
| JP6553022B2 (ja) * | 2013-04-08 | 2019-07-31 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子 |
| CN105102582B (zh) * | 2013-04-08 | 2018-10-12 | 默克专利有限公司 | 有机电致发光器件 |
| JP6567498B2 (ja) | 2013-04-08 | 2019-08-28 | メルク パテント ゲーエムベーハー | 熱活性化遅延蛍光材料をもつ有機エレクトロルミネッセント素子 |
| US10193094B2 (en) | 2013-04-08 | 2019-01-29 | Merck Patent Gmbh | Organic light-emitting device having delayed fluorescence |
| KR101653338B1 (ko) * | 2013-08-05 | 2016-09-01 | 제일모직 주식회사 | 유기 화합물, 유기 광전자 소자 및 표시 장치 |
| KR102116495B1 (ko) * | 2013-08-28 | 2020-06-03 | 삼성디스플레이 주식회사 | 축합환 화합물을 포함하는 유기 전계 발광 소자 |
| CN103936659B (zh) * | 2013-12-12 | 2016-06-22 | 石家庄诚志永华显示材料有限公司 | 含有碳桥联咔唑结构单元的化合物及其制备方法与应用 |
| EP3094703B1 (de) * | 2014-01-17 | 2018-02-07 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| KR20150093440A (ko) * | 2014-02-07 | 2015-08-18 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 소자 |
| EP2907815B1 (de) | 2014-02-12 | 2023-12-06 | Samsung Electronics Co., Ltd. | Kondensierte zyklische Verbindung und organische lichtemittierende Vorrichtung damit |
| JP6498685B2 (ja) * | 2014-02-21 | 2019-04-10 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子のための材料 |
| KR20150108330A (ko) * | 2014-03-17 | 2015-09-25 | 롬엔드하스전자재료코리아유한회사 | 전자 버퍼 재료 및 이를 포함하는 유기 전계 발광 소자 |
| WO2015142040A1 (en) | 2014-03-17 | 2015-09-24 | Rohm And Haas Electronic Materials Korea Ltd. | Electron buffering material and organic electroluminescent device |
| KR102411748B1 (ko) * | 2014-03-17 | 2022-06-23 | 롬엔드하스전자재료코리아유한회사 | 전자 버퍼 재료 및 유기 전계 발광 소자 |
| KR101537500B1 (ko) * | 2014-04-04 | 2015-07-20 | 주식회사 엘지화학 | 유기 발광 소자 |
| WO2015170930A1 (en) * | 2014-05-08 | 2015-11-12 | Rohm And Haas Electronic Materials Korea Ltd. | An electron transport material and an organic electroluminescence device comprising the same |
| KR20150128590A (ko) * | 2014-05-08 | 2015-11-18 | 롬엔드하스전자재료코리아유한회사 | 전자전달재료 및 이를 포함하는 유기 전계 발광 소자 |
| KR20150141147A (ko) * | 2014-06-09 | 2015-12-17 | 롬엔드하스전자재료코리아유한회사 | 유기 전계 발광 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| US11107994B2 (en) | 2014-06-18 | 2021-08-31 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR102319999B1 (ko) | 2014-07-10 | 2021-11-01 | 삼성디스플레이 주식회사 | 유기 화합물 및 이를 포함하는 유기 발광 장치 |
| WO2016010380A1 (en) | 2014-07-17 | 2016-01-21 | Rohm And Haas Electronic Materials Korea Ltd. | Electron transport material and organic electroluminescent device comprising the same |
| JP2017529689A (ja) * | 2014-07-29 | 2017-10-05 | ローム・アンド・ハース・エレクトロニック・マテリアルズ・コリア・リミテッド | 電子緩衝材及び有機エレクトロルミネセントデバイス |
| KR102388865B1 (ko) | 2014-09-05 | 2022-04-20 | 메르크 파텐트 게엠베하 | 제형 및 전자 소자 |
| WO2016060516A1 (en) * | 2014-10-17 | 2016-04-21 | Rohm And Haas Electronic Materials Korea Ltd. | A plurality of host materials and an organic electroluminescence device comprising the same |
| KR102432080B1 (ko) * | 2014-12-08 | 2022-08-16 | 엘지디스플레이 주식회사 | 유기전계발광소자 |
| EP3032605B1 (de) | 2014-12-08 | 2019-08-21 | LG Display Co., Ltd. | Organische lichtemittierende anzeigevorrichtung |
| EP3241248A1 (de) | 2014-12-30 | 2017-11-08 | Merck Patent GmbH | Formulierungen und elektronische vorrichtungen |
| KR102338908B1 (ko) | 2015-03-03 | 2021-12-14 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| KR102424977B1 (ko) | 2015-04-14 | 2022-07-26 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| EP3581633B1 (de) | 2015-06-12 | 2021-01-27 | Merck Patent GmbH | Ester mit nichtaromatischen zyklen als lösungsmittel für oled-formulierungen |
| TWI564294B (zh) | 2015-08-24 | 2017-01-01 | 國立清華大學 | 載子產生材料與有機發光二極體 |
| CN106687461A (zh) | 2015-08-28 | 2017-05-17 | 出光兴产株式会社 | 化合物、有机电致发光元件用材料、有机电致发光元件和电子设备 |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| KR102591635B1 (ko) * | 2015-10-27 | 2023-10-20 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| KR102399570B1 (ko) | 2015-11-26 | 2022-05-19 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| EP3387077B1 (de) | 2015-12-10 | 2023-10-18 | Merck Patent GmbH | Formulierungen mit ketonen mit nichtaromatischen zyklen |
| CN108369997B (zh) | 2015-12-15 | 2020-03-24 | 默克专利有限公司 | 作为用于有机电子制剂的溶剂的含芳族基团的酯 |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| KR102630644B1 (ko) | 2015-12-17 | 2024-01-30 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| US11910707B2 (en) | 2015-12-23 | 2024-02-20 | Samsung Display Co., Ltd. | Organic light-emitting device |
| EP3417033B1 (de) | 2016-02-17 | 2021-02-24 | Merck Patent GmbH | Formulierung aus einem organischen funktionellen material |
| EP3432378A4 (de) * | 2016-03-15 | 2019-11-20 | NIPPON STEEL Chemical & Material Co., Ltd. | Organisches elektrolumineszentes element |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| CN107068879B (zh) * | 2016-04-25 | 2020-09-22 | 中节能万润股份有限公司 | 一种含有三嗪类化合物的有机电致发光器件及其应用 |
| CN107043382A (zh) * | 2016-04-25 | 2017-08-15 | 中节能万润股份有限公司 | 一种以三嗪为核心的化合物及其在有机电致发光器件上的应用 |
| CN105936821A (zh) * | 2016-05-04 | 2016-09-14 | 中节能万润股份有限公司 | 一类双茚并吩恶嗪有机电致发光材料及其应用 |
| KR20170127101A (ko) | 2016-05-10 | 2017-11-21 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| CN106008537B (zh) * | 2016-05-19 | 2018-03-30 | 中节能万润股份有限公司 | 一种双极性主体有机电致发光材料及其应用 |
| JP2019523997A (ja) | 2016-06-16 | 2019-08-29 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| JP2019523998A (ja) | 2016-06-17 | 2019-08-29 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| TW201815998A (zh) | 2016-06-28 | 2018-05-01 | 德商麥克專利有限公司 | 有機功能材料之調配物 |
| JP6980757B2 (ja) | 2016-08-04 | 2021-12-15 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| CN109863223B (zh) | 2016-10-31 | 2023-06-20 | 默克专利有限公司 | 有机功能材料的制剂 |
| JP7013459B2 (ja) | 2016-10-31 | 2022-01-31 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| KR102472751B1 (ko) | 2016-12-06 | 2022-11-30 | 메르크 파텐트 게엠베하 | 전자 디바이스의 제조 방법 |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| KR102633478B1 (ko) * | 2016-12-23 | 2024-02-06 | 솔루스첨단소재 주식회사 | 유기 화합물 및 이를 이용한 유기 전계 발광 소자 |
| TWI791481B (zh) | 2017-01-30 | 2023-02-11 | 德商麥克專利有限公司 | 形成有機電致發光(el)元件之方法 |
| TWI763772B (zh) | 2017-01-30 | 2022-05-11 | 德商麥克專利有限公司 | 電子裝置之有機元件的形成方法 |
| KR20190131554A (ko) | 2017-03-31 | 2019-11-26 | 메르크 파텐트 게엠베하 | 유기 발광 다이오드 (oled) 를 위한 인쇄 방법 |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| JP7330898B2 (ja) | 2017-05-03 | 2023-08-22 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| KR102423253B1 (ko) * | 2017-06-29 | 2022-07-21 | 솔루스첨단소재 주식회사 | 유기 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| KR102698061B1 (ko) | 2017-07-18 | 2024-08-22 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 제형 |
| CN110291077B (zh) * | 2017-09-12 | 2022-05-17 | 株式会社Lg化学 | 新型杂环化合物及包含其的有机发光器件 |
| JP7293229B2 (ja) | 2017-12-15 | 2023-06-19 | メルク パテント ゲーエムベーハー | 有機機能材料の調合物 |
| GB2569636A (en) * | 2017-12-21 | 2019-06-26 | Sumitomo Chemical Co | Composition |
| CN111712551A (zh) | 2018-02-26 | 2020-09-25 | 默克专利有限公司 | 有机功能材料的制剂 |
| KR20210022046A (ko) | 2018-06-15 | 2021-03-02 | 메르크 파텐트 게엠베하 | 유기 기능성 재료의 포뮬레이션 |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| EP3878022A1 (de) | 2018-11-06 | 2021-09-15 | Merck Patent GmbH | Verfahren zur bildung eines organischen elements einer elektronischen vorrichtung |
| CN109824576B (zh) * | 2019-02-21 | 2021-01-19 | 青岛海洋生物医药研究院股份有限公司 | 一种有机光电材料中间体二甲基茚并咔唑的合成方法 |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021259824A1 (de) | 2020-06-23 | 2021-12-30 | Merck Patent Gmbh | Verfahren zur herstellung einer mischung |
| CN116235643A (zh) | 2020-09-18 | 2023-06-06 | 三星显示有限公司 | 发射绿光的有机电致发光器件 |
| CN116635491A (zh) | 2020-12-08 | 2023-08-22 | 默克专利有限公司 | 油墨体系和用于喷墨印刷的方法 |
| KR20220099156A (ko) | 2021-01-04 | 2022-07-13 | 삼성디스플레이 주식회사 | 발광 소자 및 이를 포함한 전자 장치 |
| EP4326826A1 (de) | 2021-04-23 | 2024-02-28 | Merck Patent GmbH | Formulierung eines organischen funktionellen materials |
| KR20240012506A (ko) | 2021-05-21 | 2024-01-29 | 메르크 파텐트 게엠베하 | 적어도 하나의 기능성 물질의 연속 정제 방법 및 적어도 하나의 기능성 물질의 연속 정제를 위한 디바이스 |
| TW202349760A (zh) | 2021-10-05 | 2023-12-16 | 德商麥克專利有限公司 | 電子裝置之有機元件的形成方法 |
| CN113968811B (zh) * | 2021-11-16 | 2023-06-23 | 阜阳欣奕华材料科技有限公司 | 茚并咔唑类有机化合物及其应用 |
| TW202440819A (zh) | 2022-12-16 | 2024-10-16 | 德商麥克專利有限公司 | 有機功能性材料之調配物 |
| WO2025032039A1 (en) | 2023-08-07 | 2025-02-13 | Merck Patent Gmbh | Process for the preparation of an electronic device |
Citations (67)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4539507A (en) | 1983-03-25 | 1985-09-03 | Eastman Kodak Company | Organic electroluminescent devices having improved power conversion efficiencies |
| US5151629A (en) | 1991-08-01 | 1992-09-29 | Eastman Kodak Company | Blue emitting internal junction organic electroluminescent device (I) |
| WO1992018552A1 (de) | 1991-04-11 | 1992-10-29 | Wacker-Chemie Gmbh | Leiterpolymere mit konjugierten doppelbindungen |
| EP0652273A1 (de) | 1993-11-09 | 1995-05-10 | Shinko Electric Industries Co. Ltd. | Organisches Material für elektrolumineszente Vorrichtung und elektrolumineszente Vorrichtung |
| EP0676461A2 (de) | 1994-04-07 | 1995-10-11 | Hoechst Aktiengesellschaft | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0707020A2 (de) | 1994-10-14 | 1996-04-17 | Hoechst Aktiengesellschaft | Konjugierte Polymere mit Spirozentren und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0842208A1 (de) | 1995-07-28 | 1998-05-20 | The Dow Chemical Company | 2,7-aryl-9-substituierte fluorene und 9-substituierte fluorenoligomere und polymere |
| WO1998027136A1 (de) | 1996-12-16 | 1998-06-25 | Aventis Research & Technologies Gmbh & Co Kg | ARYLSUBSTITUIERTE POLY(p-ARYLENVINYLENE), VERFAHREN ZUR HERSTELLUNG UND DEREN VERWENDUNG IN ELEKTROLUMINESZENZBAUELEMENTEN |
| US5843607A (en) * | 1997-10-02 | 1998-12-01 | Xerox Corporation | Indolocarbazole photoconductors |
| EP0894107A1 (de) | 1996-04-17 | 1999-02-03 | Hoechst Research & Technology Deutschland GmbH & Co. KG | Polymere mit spiroatomen und ihre verwendung als elektrolumineszenzmaterialien |
| WO2000022026A1 (de) | 1998-10-10 | 2000-04-20 | Celanese Ventures Gmbh | Konjugierte polymere, enthaltend spezielle fluoren-bausteine mit verbesserten eigenschaften |
| EP1028136A2 (de) | 1999-02-10 | 2000-08-16 | Carnegie-Mellon University | Ein Verfahren zur Herstellung von Poly(3-substituierten)thiophenen |
| WO2000070655A2 (en) | 1999-05-13 | 2000-11-23 | The Trustees Of Princeton University | Very high efficiency organic light emitting devices based on electrophosphorescence |
| WO2001041512A1 (en) | 1999-12-01 | 2001-06-07 | The Trustees Of Princeton University | Complexes of form l2mx as phosphorescent dopants for organic leds |
| EP1144543A1 (de) | 1998-12-02 | 2001-10-17 | South Bank University Enterprises Ltd. | Elektrolumineszente chinolate |
| WO2002002714A2 (en) | 2000-06-30 | 2002-01-10 | E.I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| WO2002015645A1 (en) | 2000-08-11 | 2002-02-21 | The Trustees Of Princeton University | Organometallic compounds and emission-shifting organic electrophosphorescence |
| EP1191614A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung und dafür verwendete Metallkoordinationsverbindung |
| EP1191612A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| EP1191613A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| EP1205527A1 (de) | 2000-03-27 | 2002-05-15 | Idemitsu Kosan Co., Ltd. | Organische elektrolumineszierende vorrichtung |
| US20020132134A1 (en) * | 2001-01-26 | 2002-09-19 | Xerox Corporation | Electroluminescent (EL) devices |
| WO2004013080A1 (en) | 2002-08-01 | 2004-02-12 | Covion Organic Semiconductors Gmbh | Spirobifluorene derivatives, their preparation and uses thereof |
| WO2004041901A1 (en) | 2002-11-08 | 2004-05-21 | Covion Organic Semiconductors Gmbh | Aryl-substituted polyindenofluorenes for use in organic electroluminiscent devices |
| WO2004058911A2 (de) | 2002-12-23 | 2004-07-15 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2004070772A2 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte polymere und blends, deren darstellung und verwendung |
| JP2004288381A (ja) | 2003-03-19 | 2004-10-14 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子 |
| WO2004093207A2 (de) | 2003-04-15 | 2004-10-28 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialien, deren verwendung und elektronikbauteile enthaltend diese mischungen |
| WO2004113412A2 (en) | 2003-06-23 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Polymer |
| WO2004113468A1 (de) | 2003-06-26 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Neue materialien für die elektrolumineszenz |
| WO2005003253A2 (de) | 2003-07-07 | 2005-01-13 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialen, deren verwendung und elektronikbauteile enthaltend diese |
| WO2005011013A1 (de) | 2003-07-21 | 2005-02-03 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2005014689A2 (de) | 2003-08-12 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung |
| WO2005019373A2 (de) | 2003-08-19 | 2005-03-03 | Basf Aktiengesellschaft | Übergangsmetallkomplexe mit carbenliganden als emitter für organische licht-emittierende dioden (oleds) |
| US20050069729A1 (en) | 2003-09-30 | 2005-03-31 | Konica Minolta Holdings, Inc. | Organic electroluminescent element, illuminator, display and compound |
| WO2005033244A1 (de) | 2003-09-29 | 2005-04-14 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| WO2005040302A1 (de) | 2003-10-22 | 2005-05-06 | Merck Patent Gmbh | Neue materialien für die elektrolumineszenz und deren verwendung |
| WO2005053051A1 (de) | 2003-11-25 | 2005-06-09 | Merck Patent Gmbh | Organisches elektrolumineszenzelement |
| WO2005104264A1 (de) | 2004-04-26 | 2005-11-03 | Merck Patent Gmbh | Elektrolumineszierende polymere und deren verwendung |
| WO2005111172A2 (de) | 2004-05-11 | 2005-11-24 | Merck Patent Gmbh | Neue materialmischungen für die elektrolumineszenz |
| US20050258742A1 (en) | 2004-05-18 | 2005-11-24 | Yui-Yi Tsai | Carbene containing metal complexes as OLEDs |
| JP2005347160A (ja) | 2004-06-04 | 2005-12-15 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| EP1617711A1 (de) | 2003-04-23 | 2006-01-18 | Konica Minolta Holdings, Inc. | Organisches elektrolumineszenzbauelement und anzeige |
| WO2006005627A1 (en) | 2004-07-15 | 2006-01-19 | Merck Patent Gmbh | Oligomeric derivatives of spirobifluorene, their preparation and use |
| WO2006100896A1 (ja) | 2005-03-18 | 2006-09-28 | Idemitsu Kosan Co., Ltd. | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2006108497A1 (de) * | 2005-04-14 | 2006-10-19 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| WO2006117052A1 (de) | 2005-05-03 | 2006-11-09 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung und in deren herstellung verwendete boronsäure- und borinsäure-derivate |
| WO2006122630A1 (de) | 2005-05-20 | 2006-11-23 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| EP1731584A1 (de) | 2004-03-31 | 2006-12-13 | Konica Minolta Holdings, Inc. | Organischer elektrolumineszenzvorrichtungsstoff, organische elektrolumineszenzvorrichtung, display und beleuchtungsvorrichtung |
| JP2006339577A (ja) * | 2005-06-06 | 2006-12-14 | Konica Minolta Holdings Inc | 有機半導体薄膜及び有機薄膜トランジスタ |
| WO2007050334A1 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007050301A2 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007063754A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2007137725A1 (de) | 2006-05-31 | 2007-12-06 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| DE102006025846A1 (de) | 2006-06-02 | 2007-12-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2008006449A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2008056746A1 (en) | 2006-11-09 | 2008-05-15 | Nippon Steel Chemical Co., Ltd. | Compound for organic electroluminescent device and organic electroluminescent device |
| WO2008086851A1 (de) | 2007-01-18 | 2008-07-24 | Merck Patent Gmbh | Carbazol-derivate für organische elektrolumineszenzvorrichtungen |
| WO2008132103A1 (de) | 2007-04-26 | 2008-11-06 | Basf Se | Pentaphenylenderivate als photosensibilisatoren in solarzellen |
| WO2008146839A1 (ja) | 2007-05-29 | 2008-12-04 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2008149691A1 (ja) | 2007-05-30 | 2008-12-11 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2009030981A2 (en) | 2006-12-28 | 2009-03-12 | Universal Display Corporation | Long lifetime phosphorescent organic light emitting device (oled) structures |
| WO2009062578A1 (de) | 2007-11-12 | 2009-05-22 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen enthaltend azomethin-metall-komplexe |
| WO2009148015A1 (ja) * | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2010006680A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010015306A1 (de) | 2008-08-08 | 2010-02-11 | Merck Patent Gmbh, | Organische elektrolumineszenzvorrichtung |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5666907B2 (ja) * | 2008-06-05 | 2015-02-12 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| DE102009023155A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| KR101333694B1 (ko) * | 2009-06-25 | 2013-11-27 | 제일모직주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| KR101174088B1 (ko) * | 2009-06-25 | 2012-08-14 | 제일모직주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
-
2009
- 2009-06-30 DE DE102009031021A patent/DE102009031021A1/de not_active Withdrawn
-
2010
- 2010-06-01 CN CN201080029223.0A patent/CN102471602B/zh active Active
- 2010-06-01 KR KR1020127002648A patent/KR101777883B1/ko active Active
- 2010-06-01 WO PCT/EP2010/003324 patent/WO2011000455A1/de not_active Ceased
- 2010-06-01 JP JP2012516542A patent/JP5734965B2/ja active Active
- 2010-06-01 DE DE112010006144.0T patent/DE112010006144B4/de active Active
- 2010-06-01 DE DE112010002775.7T patent/DE112010002775B4/de active Active
- 2010-06-01 US US13/379,879 patent/US9040172B2/en active Active
- 2010-06-25 TW TW099120837A patent/TW201127811A/zh unknown
Patent Citations (70)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4539507A (en) | 1983-03-25 | 1985-09-03 | Eastman Kodak Company | Organic electroluminescent devices having improved power conversion efficiencies |
| WO1992018552A1 (de) | 1991-04-11 | 1992-10-29 | Wacker-Chemie Gmbh | Leiterpolymere mit konjugierten doppelbindungen |
| US5151629A (en) | 1991-08-01 | 1992-09-29 | Eastman Kodak Company | Blue emitting internal junction organic electroluminescent device (I) |
| EP0652273A1 (de) | 1993-11-09 | 1995-05-10 | Shinko Electric Industries Co. Ltd. | Organisches Material für elektrolumineszente Vorrichtung und elektrolumineszente Vorrichtung |
| EP0676461A2 (de) | 1994-04-07 | 1995-10-11 | Hoechst Aktiengesellschaft | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0707020A2 (de) | 1994-10-14 | 1996-04-17 | Hoechst Aktiengesellschaft | Konjugierte Polymere mit Spirozentren und ihre Verwendung als Elektrolumineszenzmaterialien |
| EP0842208A1 (de) | 1995-07-28 | 1998-05-20 | The Dow Chemical Company | 2,7-aryl-9-substituierte fluorene und 9-substituierte fluorenoligomere und polymere |
| EP0894107A1 (de) | 1996-04-17 | 1999-02-03 | Hoechst Research & Technology Deutschland GmbH & Co. KG | Polymere mit spiroatomen und ihre verwendung als elektrolumineszenzmaterialien |
| WO1998027136A1 (de) | 1996-12-16 | 1998-06-25 | Aventis Research & Technologies Gmbh & Co Kg | ARYLSUBSTITUIERTE POLY(p-ARYLENVINYLENE), VERFAHREN ZUR HERSTELLUNG UND DEREN VERWENDUNG IN ELEKTROLUMINESZENZBAUELEMENTEN |
| US5843607A (en) * | 1997-10-02 | 1998-12-01 | Xerox Corporation | Indolocarbazole photoconductors |
| WO2000022026A1 (de) | 1998-10-10 | 2000-04-20 | Celanese Ventures Gmbh | Konjugierte polymere, enthaltend spezielle fluoren-bausteine mit verbesserten eigenschaften |
| EP1144543A1 (de) | 1998-12-02 | 2001-10-17 | South Bank University Enterprises Ltd. | Elektrolumineszente chinolate |
| EP1028136A2 (de) | 1999-02-10 | 2000-08-16 | Carnegie-Mellon University | Ein Verfahren zur Herstellung von Poly(3-substituierten)thiophenen |
| WO2000070655A2 (en) | 1999-05-13 | 2000-11-23 | The Trustees Of Princeton University | Very high efficiency organic light emitting devices based on electrophosphorescence |
| WO2001041512A1 (en) | 1999-12-01 | 2001-06-07 | The Trustees Of Princeton University | Complexes of form l2mx as phosphorescent dopants for organic leds |
| EP1205527A1 (de) | 2000-03-27 | 2002-05-15 | Idemitsu Kosan Co., Ltd. | Organische elektrolumineszierende vorrichtung |
| WO2002002714A2 (en) | 2000-06-30 | 2002-01-10 | E.I. Du Pont De Nemours And Company | Electroluminescent iridium compounds with fluorinated phenylpyridines, phenylpyrimidines, and phenylquinolines and devices made with such compounds |
| WO2002015645A1 (en) | 2000-08-11 | 2002-02-21 | The Trustees Of Princeton University | Organometallic compounds and emission-shifting organic electrophosphorescence |
| EP1191612A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| EP1191613A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung, Bildanzeigevorrichtung und Metallkoordinationsverbindung |
| EP1191614A2 (de) | 2000-09-26 | 2002-03-27 | Canon Kabushiki Kaisha | Lumineszente Vorrichtung und dafür verwendete Metallkoordinationsverbindung |
| US20020132134A1 (en) * | 2001-01-26 | 2002-09-19 | Xerox Corporation | Electroluminescent (EL) devices |
| WO2004013080A1 (en) | 2002-08-01 | 2004-02-12 | Covion Organic Semiconductors Gmbh | Spirobifluorene derivatives, their preparation and uses thereof |
| WO2004041901A1 (en) | 2002-11-08 | 2004-05-21 | Covion Organic Semiconductors Gmbh | Aryl-substituted polyindenofluorenes for use in organic electroluminiscent devices |
| WO2004058911A2 (de) | 2002-12-23 | 2004-07-15 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2004070772A2 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte polymere und blends, deren darstellung und verwendung |
| JP2004288381A (ja) | 2003-03-19 | 2004-10-14 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子 |
| WO2004093207A2 (de) | 2003-04-15 | 2004-10-28 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialien, deren verwendung und elektronikbauteile enthaltend diese mischungen |
| EP1617710A1 (de) | 2003-04-23 | 2006-01-18 | Konica Minolta Holdings, Inc. | Material für ein organisches elektrolumineszenzgerät, organisches elektrolumineszenzgerät, beleuchtungsvorrichtung und anzeige |
| EP1617711A1 (de) | 2003-04-23 | 2006-01-18 | Konica Minolta Holdings, Inc. | Organisches elektrolumineszenzbauelement und anzeige |
| WO2004113412A2 (en) | 2003-06-23 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Polymer |
| WO2004113468A1 (de) | 2003-06-26 | 2004-12-29 | Covion Organic Semiconductors Gmbh | Neue materialien für die elektrolumineszenz |
| WO2005003253A2 (de) | 2003-07-07 | 2005-01-13 | Covion Organic Semiconductors Gmbh | Mischungen von organischen zur emission befähigten halbleitern und matrixmaterialen, deren verwendung und elektronikbauteile enthaltend diese |
| WO2005011013A1 (de) | 2003-07-21 | 2005-02-03 | Covion Organic Semiconductors Gmbh | Organisches elektrolumineszenzelement |
| WO2005014689A2 (de) | 2003-08-12 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung |
| WO2005019373A2 (de) | 2003-08-19 | 2005-03-03 | Basf Aktiengesellschaft | Übergangsmetallkomplexe mit carbenliganden als emitter für organische licht-emittierende dioden (oleds) |
| WO2005033244A1 (de) | 2003-09-29 | 2005-04-14 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| WO2005039246A1 (ja) | 2003-09-30 | 2005-04-28 | Konica Minolta Holdings, Inc. | 有機エレクトロルミネッセンス素子、照明装置、表示装置 |
| US20050069729A1 (en) | 2003-09-30 | 2005-03-31 | Konica Minolta Holdings, Inc. | Organic electroluminescent element, illuminator, display and compound |
| WO2005040302A1 (de) | 2003-10-22 | 2005-05-06 | Merck Patent Gmbh | Neue materialien für die elektrolumineszenz und deren verwendung |
| WO2005053051A1 (de) | 2003-11-25 | 2005-06-09 | Merck Patent Gmbh | Organisches elektrolumineszenzelement |
| EP1731584A1 (de) | 2004-03-31 | 2006-12-13 | Konica Minolta Holdings, Inc. | Organischer elektrolumineszenzvorrichtungsstoff, organische elektrolumineszenzvorrichtung, display und beleuchtungsvorrichtung |
| WO2005104264A1 (de) | 2004-04-26 | 2005-11-03 | Merck Patent Gmbh | Elektrolumineszierende polymere und deren verwendung |
| WO2005111172A2 (de) | 2004-05-11 | 2005-11-24 | Merck Patent Gmbh | Neue materialmischungen für die elektrolumineszenz |
| US20050258742A1 (en) | 2004-05-18 | 2005-11-24 | Yui-Yi Tsai | Carbene containing metal complexes as OLEDs |
| JP2005347160A (ja) | 2004-06-04 | 2005-12-15 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| WO2006005627A1 (en) | 2004-07-15 | 2006-01-19 | Merck Patent Gmbh | Oligomeric derivatives of spirobifluorene, their preparation and use |
| WO2006100896A1 (ja) | 2005-03-18 | 2006-09-28 | Idemitsu Kosan Co., Ltd. | 芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| EP1860097A1 (de) | 2005-03-18 | 2007-11-28 | Idemitsu Kosan Co., Ltd. | Aromatisches aminderivat und organisches elektrolumineszenzgerät, bei dem dieses verwendet wird |
| WO2006108497A1 (de) * | 2005-04-14 | 2006-10-19 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| WO2006117052A1 (de) | 2005-05-03 | 2006-11-09 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung und in deren herstellung verwendete boronsäure- und borinsäure-derivate |
| WO2006122630A1 (de) | 2005-05-20 | 2006-11-23 | Merck Patent Gmbh | Verbindungen für organische elektronische vorrichtungen |
| JP2006339577A (ja) * | 2005-06-06 | 2006-12-14 | Konica Minolta Holdings Inc | 有機半導体薄膜及び有機薄膜トランジスタ |
| WO2007050301A2 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007050334A1 (en) | 2005-10-26 | 2007-05-03 | Eastman Kodak Company | Organic element for low voltage electroluminescent devices |
| WO2007063754A1 (ja) | 2005-12-01 | 2007-06-07 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2007137725A1 (de) | 2006-05-31 | 2007-12-06 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| DE102006025846A1 (de) | 2006-06-02 | 2007-12-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2008006449A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2008056746A1 (en) | 2006-11-09 | 2008-05-15 | Nippon Steel Chemical Co., Ltd. | Compound for organic electroluminescent device and organic electroluminescent device |
| WO2009030981A2 (en) | 2006-12-28 | 2009-03-12 | Universal Display Corporation | Long lifetime phosphorescent organic light emitting device (oled) structures |
| WO2008086851A1 (de) | 2007-01-18 | 2008-07-24 | Merck Patent Gmbh | Carbazol-derivate für organische elektrolumineszenzvorrichtungen |
| WO2008132103A1 (de) | 2007-04-26 | 2008-11-06 | Basf Se | Pentaphenylenderivate als photosensibilisatoren in solarzellen |
| WO2008146839A1 (ja) | 2007-05-29 | 2008-12-04 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2008149691A1 (ja) | 2007-05-30 | 2008-12-11 | Nippon Steel Chemical Co., Ltd. | 有機電界発光素子用化合物及び有機電界発光素子 |
| WO2009062578A1 (de) | 2007-11-12 | 2009-05-22 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen enthaltend azomethin-metall-komplexe |
| WO2009148015A1 (ja) * | 2008-06-05 | 2009-12-10 | 出光興産株式会社 | ハロゲン化合物、多環系化合物及びそれを用いた有機エレクトロルミネッセンス素子 |
| WO2010006680A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010015306A1 (de) | 2008-08-08 | 2010-02-11 | Merck Patent Gmbh, | Organische elektrolumineszenzvorrichtung |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
Non-Patent Citations (1)
| Title |
|---|
| M.SONNTAG ET AL.: "Synthesis and Characterization of novel conjugated Bisindenocarbazoles", TETRAHEDRON, vol. 62, 2006, pages 8103 - 8108, XP002596837 * |
Cited By (401)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9090590B2 (en) | 2009-11-10 | 2015-07-28 | Merck Patent Gmbh | Organic compounds for electroluminescent devices |
| WO2011057701A1 (de) * | 2009-11-10 | 2011-05-19 | Merck Patent Gmbh | Organische verbindungen für elektroluminiszenz vorrichtungen |
| WO2011137951A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2011141109A1 (de) | 2010-05-11 | 2011-11-17 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2011157339A1 (de) | 2010-06-15 | 2011-12-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2011157346A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2011160758A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012007086A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2012007087A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2012016630A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012034627A1 (de) | 2010-09-15 | 2012-03-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012048781A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien auf basis von triphenylen für organische elektrolumineszenzvorrichtungen |
| WO2012069121A1 (de) | 2010-11-24 | 2012-05-31 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| CN103228647A (zh) * | 2010-11-24 | 2013-07-31 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| WO2012074210A3 (ko) * | 2010-12-02 | 2012-07-26 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| US9559309B2 (en) | 2010-12-02 | 2017-01-31 | Cheil Industries, Inc. | Compound for organic optoelectronic device, organic light emitting diode including the same, and display device including the organic light emitting diode |
| WO2012079741A1 (de) | 2010-12-15 | 2012-06-21 | Merck Patent Gmbh | Metallkomplexe |
| KR101375359B1 (ko) * | 2011-01-19 | 2014-03-21 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 이용한 유기 광소자 |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| CN103380191A (zh) * | 2011-02-17 | 2013-10-30 | 默克专利有限公司 | 用于电子器件的化合物 |
| WO2012110182A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| CN103380191B (zh) * | 2011-02-17 | 2016-08-10 | 默克专利有限公司 | 用于电子器件的化合物 |
| CN102153503A (zh) * | 2011-02-22 | 2011-08-17 | 黑龙江省科学院石油化学研究院 | 咔唑-芴类化合物及其合成方法 |
| WO2012136296A1 (de) | 2011-04-04 | 2012-10-11 | Merck Patent Gmbh | Metallkomplexe |
| WO2012136295A1 (de) | 2011-04-05 | 2012-10-11 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| JP2014516471A (ja) * | 2011-04-13 | 2014-07-10 | メルク パテント ゲーエムベーハー | 電子素子のための材料 |
| CN103459391A (zh) * | 2011-04-13 | 2013-12-18 | 默克专利有限公司 | 用于电子器件的化合物 |
| KR20140025456A (ko) * | 2011-04-13 | 2014-03-04 | 메르크 파텐트 게엠베하 | 전자 소자용 재료 |
| KR20140023353A (ko) * | 2011-04-13 | 2014-02-26 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| JP2018056569A (ja) * | 2011-04-13 | 2018-04-05 | メルク パテント ゲーエムベーハー | 電子素子のための材料 |
| KR101947206B1 (ko) * | 2011-04-13 | 2019-02-12 | 메르크 파텐트 게엠베하 | 전자 소자용 재료 |
| US9876171B2 (en) | 2011-04-13 | 2018-01-23 | Merck Patent Gmbh | Materials for electronic devices |
| KR102013465B1 (ko) | 2011-04-13 | 2019-08-22 | 메르크 파텐트 게엠베하 | 전자 소자용 화합물 |
| US9768385B2 (en) | 2011-04-13 | 2017-09-19 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| JP2014524884A (ja) * | 2011-04-13 | 2014-09-25 | メルク パテント ゲーエムベーハー | 電子デバイス用化合物 |
| WO2012143080A2 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| WO2012150001A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102012007810A1 (de) | 2011-05-16 | 2012-11-22 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| WO2012163465A1 (de) | 2011-06-03 | 2012-12-06 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012163471A1 (de) | 2011-06-03 | 2012-12-06 | Merck Patent Gmbh | Metallkomplexe |
| KR101853875B1 (ko) | 2011-06-22 | 2018-05-03 | 삼성디스플레이 주식회사 | 헤테로고리 화합물 및 이를 포함한 유기발광 소자 |
| EP2725080A4 (de) * | 2011-06-27 | 2016-03-02 | Lg Chemical Ltd | Neue verbindung und organische lichtemittierende vorrichtung damit |
| US9728728B2 (en) | 2011-06-27 | 2017-08-08 | Lg Chem, Ltd. | Compound and organic light-emitting device using same |
| US9373793B2 (en) | 2011-06-27 | 2016-06-21 | Lg Chem, Ltd. | Compound and organic light-emitting device using same |
| WO2013000531A1 (de) | 2011-06-28 | 2013-01-03 | Merck Patent Gmbh | Metallkomplexe |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| CN102911112B (zh) * | 2011-08-03 | 2016-12-14 | 三星显示有限公司 | 杂环化合物和包括该化合物的有机发光装置 |
| EP3439065A1 (de) | 2011-08-03 | 2019-02-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| CN102911112A (zh) * | 2011-08-03 | 2013-02-06 | 三星显示有限公司 | 杂环化合物和包括该化合物的有机发光装置 |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2013020631A1 (de) | 2011-08-10 | 2013-02-14 | Merck Patent Gmbh | Metallkomplexe |
| WO2013026515A1 (de) | 2011-08-22 | 2013-02-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2013041176A1 (de) | 2011-09-21 | 2013-03-28 | Merck Patent Gmbh | Carbazolderivate für organische elektrolumineszenzvorrichtungen |
| WO2013056776A1 (de) | 2011-10-20 | 2013-04-25 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| CN103889952A (zh) * | 2011-10-20 | 2014-06-25 | 默克专利有限公司 | 用于有机电致发光器件的材料 |
| US9978957B2 (en) | 2011-10-20 | 2018-05-22 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US9515266B2 (en) | 2011-10-20 | 2016-12-06 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2013064206A1 (de) | 2011-11-01 | 2013-05-10 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| KR101395607B1 (ko) * | 2011-11-11 | 2014-05-16 | (주)씨에스엘쏠라 | 유기발광화합물 및 이를 이용한 유기 광소자 |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| KR101390523B1 (ko) * | 2011-12-08 | 2014-05-07 | 주식회사 두산 | 신규 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| WO2013087142A1 (de) | 2011-12-12 | 2013-06-20 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| US10153436B2 (en) * | 2011-12-23 | 2018-12-11 | Cheil Industries, Inc. | Compound for an organic optoelectronic element, organic light-emitting element comprising same, and display device comprising the organic light-emitting element |
| WO2013100464A1 (ko) * | 2011-12-29 | 2013-07-04 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| KR101497134B1 (ko) * | 2011-12-29 | 2015-03-02 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| CN104024373B (zh) * | 2011-12-30 | 2016-02-03 | 第一毛织株式会社 | 用于有机光电子装置的化合物、包括该化合物的有机发光二极管和包括该有机发光二极管的显示器 |
| CN104024373A (zh) * | 2011-12-30 | 2014-09-03 | 第一毛织株式会社 | 用于有机光电子装置的化合物、包括该化合物的有机发光二极管和包括该有机发光二极管的显示器 |
| US10121973B2 (en) | 2011-12-30 | 2018-11-06 | Cheil Industries, Inc. | Compound for organic optoelectronic device, organic light-emitting diode including same, and display device including organic light-emitting diode |
| WO2013100467A1 (ko) * | 2011-12-30 | 2013-07-04 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| US9768389B2 (en) | 2011-12-30 | 2017-09-19 | Cheil Industries, Inc. | Compound for optoelectronic device, organic light-emitting diode including same, and display device including organic light-emitting diode |
| KR101507001B1 (ko) | 2011-12-30 | 2015-03-31 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| WO2013105747A1 (ko) * | 2012-01-13 | 2013-07-18 | 덕산하이메탈(주) | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR101498278B1 (ko) * | 2012-01-18 | 2015-03-06 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| US9373806B2 (en) | 2012-01-18 | 2016-06-21 | Duk San Neolux Co., Ltd. | Compound for organic electric element, organic electric element comprising the same and electronic device thereof |
| KR101917715B1 (ko) | 2012-01-18 | 2018-11-13 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| WO2013108997A1 (ko) * | 2012-01-18 | 2013-07-25 | 덕산하이메탈(주) | 유기전기소자용 화합물, 이를 포함하는 유기전기소자 및 그 전자 장치 |
| TWI461427B (zh) * | 2012-01-18 | 2014-11-21 | Duksan High Metal Co Ltd | 用於有機電子元件之化合物、使用此化合物之有機電子元件及其電子裝置 |
| EP3235892A1 (de) | 2012-02-14 | 2017-10-25 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| EP3101088A1 (de) | 2012-02-14 | 2016-12-07 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2013135352A1 (de) | 2012-03-15 | 2013-09-19 | Merck Patent Gmbh | Elektronische vorrichtungen |
| EP3460864A1 (de) | 2012-03-15 | 2019-03-27 | Merck Patent GmbH | Elektronische vorrichtungen |
| EP4369378A2 (de) | 2012-03-15 | 2024-05-15 | Merck Patent GmbH | Elektronische vorrichtungen |
| WO2013139431A1 (de) | 2012-03-23 | 2013-09-26 | Merck Patent Gmbh | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen |
| US9660199B2 (en) | 2012-05-17 | 2017-05-23 | Kyulux, Inc. | Compound, light-emitting material, and organic light-emitting device |
| WO2013172255A1 (ja) * | 2012-05-17 | 2013-11-21 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| WO2013182263A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Phenanthrenverbindungen für organische elektronische vorrichtungen |
| KR101507423B1 (ko) | 2012-06-22 | 2015-04-08 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2014008967A2 (de) | 2012-07-10 | 2014-01-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014010910A1 (ko) * | 2012-07-13 | 2014-01-16 | 덕산하이메탈(주) | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR101552135B1 (ko) * | 2012-07-13 | 2015-09-10 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2014008982A1 (de) | 2012-07-13 | 2014-01-16 | Merck Patent Gmbh | Metallkomplexe |
| WO2014015937A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektrolumineszierende vorrichtungen |
| WO2014015935A2 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektronische vorrichtungen |
| WO2014015938A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Derivate von 2-diarylaminofluoren und diese enthaltnde organische elektronische verbindungen |
| EP3424907A2 (de) | 2012-07-23 | 2019-01-09 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| DE202013012401U1 (de) | 2012-07-23 | 2016-10-12 | Merck Patent Gmbh | Verbindungen und Organische Elektronische Vorrichtungen |
| WO2014015931A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014023377A2 (de) | 2012-08-07 | 2014-02-13 | Merck Patent Gmbh | Metallkomplexe |
| EP3424936A1 (de) | 2012-08-07 | 2019-01-09 | Merck Patent GmbH | Metallkomplexe |
| WO2014023388A1 (de) | 2012-08-10 | 2014-02-13 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014044344A1 (de) | 2012-09-18 | 2014-03-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| WO2014056567A1 (de) | 2012-10-11 | 2014-04-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102012020167A1 (de) | 2012-10-13 | 2014-04-17 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2014067614A1 (de) | 2012-10-31 | 2014-05-08 | Merck Patent Gmbh | Elektronische vorrichtung |
| EP3806176A1 (de) | 2012-10-31 | 2021-04-14 | Merck Patent GmbH | Elektronische vorrichtung |
| DE102012021650A1 (de) | 2012-11-03 | 2014-05-08 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2014079532A1 (de) | 2012-11-20 | 2014-05-30 | Merck Patent Gmbh | Formulierung in hochreinem l?sungsmittel zur herstellung elektronischer vorrichtungen |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| US10227528B2 (en) | 2012-12-21 | 2019-03-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2014094963A1 (de) * | 2012-12-21 | 2014-06-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2014104600A1 (ko) * | 2012-12-31 | 2014-07-03 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106524A3 (de) * | 2013-01-03 | 2014-08-28 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102013008189A1 (de) | 2013-05-14 | 2014-12-04 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| EP3712229A1 (de) | 2013-07-30 | 2020-09-23 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| EP3647393A1 (de) | 2013-07-30 | 2020-05-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| EP3904361A2 (de) | 2013-10-02 | 2021-11-03 | Merck Patent GmbH | Borenthaltende verbindungen |
| EP3345984A1 (de) | 2013-12-06 | 2018-07-11 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| EP3693437A1 (de) | 2013-12-06 | 2020-08-12 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| WO2015082046A2 (de) | 2013-12-06 | 2015-06-11 | Merck Patent Gmbh | Substituierte oxepine |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP3708634A1 (de) | 2013-12-19 | 2020-09-16 | Merck Patent GmbH | Heterocyclische spiroverbindungen |
| EP4438693A2 (de) | 2013-12-19 | 2024-10-02 | Merck Patent GmbH | Heterocyclische spiroverbindungen |
| WO2015090504A2 (de) | 2013-12-19 | 2015-06-25 | Merck Patent Gmbh | Heterocyclische spiroverbindungen |
| EP3533794A2 (de) | 2014-04-30 | 2019-09-04 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2015165563A1 (de) | 2014-04-30 | 2015-11-05 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015169412A1 (de) | 2014-05-05 | 2015-11-12 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102015006708A1 (de) | 2014-06-12 | 2015-12-17 | Merck Patent Gmbh | Metallkomplexe |
| WO2015192941A1 (de) | 2014-06-18 | 2015-12-23 | Merck Patent Gmbh | Zusammensetzungen für elektronische vorrichtungen |
| DE102014008722A1 (de) | 2014-06-18 | 2015-12-24 | Merck Patent Gmbh | Zusammensetzungen für elektronische Vorrichtungen |
| DE102014008722B4 (de) | 2014-06-18 | 2024-08-22 | Merck Patent Gmbh | Zusammensetzungen für elektronische Vorrichtungen, Formulierung diese enthaltend, Verwendung der Zusammensetzung, Verwendung der Formulierung sowie organische elektronische Vorrichtung enthaltend die Zusammensetzung |
| WO2015197156A1 (de) | 2014-06-25 | 2015-12-30 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US20170207398A1 (en) * | 2014-07-17 | 2017-07-20 | Rohm And Haas Electronic Materials Korea Ltd. | Electron transport material and organic electroluminescent device comprising the same |
| EP4037000A1 (de) | 2014-07-21 | 2022-08-03 | Merck Patent GmbH | Materialen für elektronische vorrichtungen |
| DE102014012818A1 (de) | 2014-08-28 | 2016-03-03 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2016074755A1 (de) | 2014-11-11 | 2016-05-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| KR101771051B1 (ko) * | 2014-11-18 | 2017-08-24 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2016091353A1 (de) | 2014-12-12 | 2016-06-16 | Merck Patent Gmbh | Organische verbindungen mit löslichen gruppen |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016198144A1 (en) | 2015-06-10 | 2016-12-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017012687A1 (en) | 2015-07-22 | 2017-01-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| EP4236652A2 (de) | 2015-07-29 | 2023-08-30 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP4301110A2 (de) | 2015-07-30 | 2024-01-03 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017025166A1 (en) | 2015-08-13 | 2017-02-16 | Merck Patent Gmbh | Hexamethylindanes |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| US11299459B2 (en) * | 2015-08-20 | 2022-04-12 | Duk San Neolux Co., Ltd. | Compound for organic electric element, organic electric element comprising the same and electronic device thereof |
| US20180282276A1 (en) * | 2015-08-20 | 2018-10-04 | Duk San Neolux Co., Ltd. | Compound for organic electric element, organic electric element comprising the same and electronic device thereof |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| DE102015013381A1 (de) | 2015-10-14 | 2017-04-20 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2017071791A1 (en) | 2015-10-27 | 2017-05-04 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102015016016A1 (de) | 2015-12-10 | 2017-06-14 | Eberhard Karls Universität Tübingen | Metallkomplexe |
| WO2017097397A1 (de) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Metallkomplexe |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017148564A1 (de) | 2016-03-03 | 2017-09-08 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2017148565A1 (de) | 2016-03-03 | 2017-09-08 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2017157983A1 (de) | 2016-03-17 | 2017-09-21 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2017178311A1 (de) | 2016-04-11 | 2017-10-19 | Merck Patent Gmbh | Heterocyclische verbindungen mit dibenzofuran- und/oder dibenzothiophen-strukturen |
| WO2017186760A1 (en) | 2016-04-29 | 2017-11-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017207596A1 (en) | 2016-06-03 | 2017-12-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP3978477A2 (de) | 2016-06-03 | 2022-04-06 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2018001990A1 (de) | 2016-06-30 | 2018-01-04 | Merck Patent Gmbh | Verfahren zur auftrennung von enantiomerenmischungen von metallkomplexen |
| EP3792235A1 (de) | 2016-07-08 | 2021-03-17 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018011186A1 (de) | 2016-07-14 | 2018-01-18 | Merck Patent Gmbh | Metallkomplexe |
| WO2018019688A1 (de) | 2016-07-25 | 2018-02-01 | Merck Patent Gmbh | Metallkomplexe für den einsatz als emitter in organischen elektrolumineszenzvorrichtungen |
| WO2018019687A1 (de) | 2016-07-25 | 2018-02-01 | Merck Patent Gmbh | Di- und oligonukleare metallkomplexe mit tripodalen bidentaten teilliganden sowie deren verwendung in elektronischen vorrichtungen |
| WO2018041769A1 (de) | 2016-08-30 | 2018-03-08 | Merck Patent Gmbh | Bl- und trinukleare metallkomplexe aufgebaut aus zwei miteinander verknüpften tripodalen hexadentaten liganden zur verwendung in elektrolumineszenzvorrichtungen |
| WO2018050583A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit carbazol-strukturen |
| WO2018050584A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2018054798A1 (de) | 2016-09-21 | 2018-03-29 | Merck Patent Gmbh | Binukleare metallkomplexe für den einsatz als emitter in organischen elektrolumineszenzvorrichtungen |
| WO2018060218A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Carbazole mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018060307A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Verbindungen mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| EP4113643A1 (de) | 2016-10-10 | 2023-01-04 | Merck Patent GmbH | Elektronische vorrichtung |
| EP4255151A2 (de) | 2016-10-10 | 2023-10-04 | Merck Patent GmbH | Spiro[fluoren-9,9'-(thio)xanthen] verbindungen |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2018069197A1 (de) | 2016-10-12 | 2018-04-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2018069196A1 (de) | 2016-10-12 | 2018-04-19 | Merck Patent Gmbh | Binukleare metallkomplexe sowie elektronische vorrichtungen, insbesondere organische elektrolumineszenzvorrichtungen, enthaltend diese metallkomplexe |
| WO2018069273A1 (de) | 2016-10-13 | 2018-04-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102017008794A1 (de) | 2016-10-17 | 2018-04-19 | Merck Patent Gmbh | Materialien zur Verwendung in elektronischen Vorrichtungen |
| WO2018077769A1 (de) | 2016-10-25 | 2018-05-03 | Merck Patent Gmbh | Metallkomplexe |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2018087022A1 (de) | 2016-11-09 | 2018-05-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018087346A1 (de) | 2016-11-14 | 2018-05-17 | Merck Patent Gmbh | Verbindungen mit einer akzeptor- und einer donorgruppe |
| EP4271163A2 (de) | 2016-11-14 | 2023-11-01 | Merck Patent GmbH | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018091435A1 (en) | 2016-11-17 | 2018-05-24 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| WO2018099846A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Verbindungen mit valerolaktam-strukturen |
| WO2018104195A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018104193A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018104194A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3978491A1 (de) | 2016-12-05 | 2022-04-06 | Merck Patent GmbH | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018114882A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| CN106632413A (zh) * | 2016-12-30 | 2017-05-10 | 上海升翕光电科技有限公司 | 苯并噻吩并咔唑类衍生物及其制备方法和有机发光器件 |
| CN106632392A (zh) * | 2016-12-30 | 2017-05-10 | 上海升翕光电科技有限公司 | 苯并噻吩并咔唑类有机发光材料及其制备方法和有机发光器件 |
| WO2018127465A1 (de) | 2017-01-04 | 2018-07-12 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018138039A1 (de) | 2017-01-25 | 2018-08-02 | Merck Patent Gmbh | Carbazolderivate |
| WO2018138306A1 (de) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018149769A1 (de) | 2017-02-14 | 2018-08-23 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US11616201B2 (en) | 2017-02-24 | 2023-03-28 | Idemitsu Kosan Co., Ltd. | Specific ladder type compounds for organic light emitting devices |
| WO2018154501A1 (en) | 2017-02-24 | 2018-08-30 | Idemitsu Kosan Co., Ltd. | Specific ladder type compounds for organic light emitting devices |
| WO2018158232A1 (en) | 2017-03-01 | 2018-09-07 | Merck Patent Gmbh | Organic electroluminescent device |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018166932A1 (de) | 2017-03-13 | 2018-09-20 | Merck Patent Gmbh | Verbindungen mit arylamin-strukturen |
| WO2018166934A1 (de) | 2017-03-15 | 2018-09-20 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2018177981A1 (de) | 2017-03-29 | 2018-10-04 | Merck Patent Gmbh | Aromatische verbindungen |
| US11778907B2 (en) | 2017-04-13 | 2023-10-03 | Merck Patent Gmbh | Composition for organic electronic devices |
| WO2018189134A1 (de) | 2017-04-13 | 2018-10-18 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2018206537A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Carbazole-based bodipys for organic electroluminescent devices |
| WO2018206526A1 (en) | 2017-05-11 | 2018-11-15 | Merck Patent Gmbh | Organoboron complexes for organic electroluminescent devices |
| KR101826013B1 (ko) * | 2017-05-19 | 2018-03-22 | 덕산네오룩스 주식회사 | 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| WO2018215318A1 (de) | 2017-05-22 | 2018-11-29 | Merck Patent Gmbh | Hexazyklische heteroaromatische verbindungen für elektronische vorrichtungen |
| WO2018234220A1 (de) | 2017-06-21 | 2018-12-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019002198A1 (en) | 2017-06-26 | 2019-01-03 | Merck Patent Gmbh | HOMOGENEOUS MIXTURES |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| EP4186898A1 (de) | 2017-07-05 | 2023-05-31 | Merck Patent GmbH | Zusammensetzung für organische elektronische verbindungen |
| WO2019007867A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019007866A1 (de) | 2017-07-05 | 2019-01-10 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019020538A1 (de) | 2017-07-25 | 2019-01-31 | Merck Patent Gmbh | Metallkomplexe |
| EP4603562A2 (de) | 2017-07-28 | 2025-08-20 | Merck Patent GmbH | Spirobifluorenderivate zur verwendung in elektronischen vorrichtungen |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019052933A1 (de) | 2017-09-12 | 2019-03-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019068679A1 (en) | 2017-10-06 | 2019-04-11 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019076789A1 (en) | 2017-10-17 | 2019-04-25 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019081391A1 (de) | 2017-10-24 | 2019-05-02 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019096717A2 (de) | 2017-11-14 | 2019-05-23 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP4242286A2 (de) | 2017-11-23 | 2023-09-13 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2019115423A1 (de) | 2017-12-13 | 2019-06-20 | Merck Patent Gmbh | Metallkomplexe |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019121458A1 (de) | 2017-12-19 | 2019-06-27 | Merck Patent Gmbh | Heterocyclische verbindung zur verwendung in electronischen vorrichtungen |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| EP4451832A2 (de) | 2017-12-20 | 2024-10-23 | Merck Patent GmbH | Heteroaromatische verbindungen |
| WO2019145316A1 (de) | 2018-01-25 | 2019-08-01 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2019158453A1 (de) | 2018-02-13 | 2019-08-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2019170578A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019170572A1 (en) | 2018-03-06 | 2019-09-12 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019179909A1 (de) | 2018-03-19 | 2019-09-26 | Merck Patent Gmbh | Metallkomplexe |
| WO2019229011A1 (de) | 2018-05-30 | 2019-12-05 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2019233904A1 (de) | 2018-06-07 | 2019-12-12 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| WO2020011686A1 (de) | 2018-07-09 | 2020-01-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020016264A1 (en) | 2018-07-20 | 2020-01-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020039708A1 (ja) | 2018-08-23 | 2020-02-27 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| WO2020043640A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043646A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020043657A1 (en) | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020053315A1 (de) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Elektrolumineszierende vorrichtungen |
| DE202019005923U1 (de) | 2018-09-12 | 2023-06-27 | MERCK Patent Gesellschaft mit beschränkter Haftung | Elektrolumineszierende Vorrichtungen |
| WO2020053314A1 (de) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Elektrolumineszierende vorrichtungen |
| WO2020053150A1 (en) | 2018-09-12 | 2020-03-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP4190880A1 (de) | 2018-09-27 | 2023-06-07 | Merck Patent GmbH | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020064662A2 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| EP4601449A2 (de) | 2018-09-27 | 2025-08-13 | Merck Patent GmbH | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020089138A1 (en) | 2018-10-31 | 2020-05-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020094539A1 (de) | 2018-11-05 | 2020-05-14 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020094542A1 (de) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | 5,6-diphenyl-5,6-dihydro-dibenz[c,e][1,2]azaphosphorin- und 6-phenyl-6h-dibenzo[c,e][1,2]thiazin-5,5-dioxid-derivate und ähnliche verbindungen als organische elektrolumineszenzmaterialien für oleds |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020099307A1 (de) | 2018-11-15 | 2020-05-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020127165A1 (de) | 2018-12-19 | 2020-06-25 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020148243A1 (en) | 2019-01-16 | 2020-07-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020165064A1 (de) | 2019-02-11 | 2020-08-20 | Merck Patent Gmbh | Mononukleare iridiumkomplexe mit drei ortho-metallierten bidentaten liganden und optischer orientierungsanisotropie |
| WO2020169241A1 (de) | 2019-02-18 | 2020-08-27 | Merck Patent Gmbh | Zusammensetzung für organische elektronische vorrichtungen |
| WO2020178230A1 (en) | 2019-03-04 | 2020-09-10 | Merck Patent Gmbh | Ligands for nano-sized materials |
| WO2020182779A1 (de) | 2019-03-12 | 2020-09-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020187865A1 (de) | 2019-03-20 | 2020-09-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020193447A1 (de) | 2019-03-25 | 2020-10-01 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2020208051A1 (en) | 2019-04-11 | 2020-10-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2020212296A1 (de) | 2019-04-15 | 2020-10-22 | Merck Patent Gmbh | Metallkomplexe |
| WO2021037401A1 (de) | 2019-08-26 | 2021-03-04 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021043703A1 (de) | 2019-09-02 | 2021-03-11 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021043755A1 (de) | 2019-09-03 | 2021-03-11 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021052924A1 (en) | 2019-09-16 | 2021-03-25 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021052921A1 (de) | 2019-09-19 | 2021-03-25 | Merck Patent Gmbh | Mischung von zwei hostmaterialien und organische elektrolumineszierende vorrichtung damit |
| WO2021053046A1 (de) | 2019-09-20 | 2021-03-25 | Merck Patent Gmbh | Peri-kondensierte heterozyklische verbindungen als materialien für elektronische vorrichtungen |
| WO2021078710A1 (en) | 2019-10-22 | 2021-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021089450A1 (en) | 2019-11-04 | 2021-05-14 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021094269A1 (en) | 2019-11-12 | 2021-05-20 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021110720A1 (de) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Metallkomplexe |
| WO2021110741A1 (en) | 2019-12-04 | 2021-06-10 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021122535A1 (de) | 2019-12-17 | 2021-06-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021122538A1 (de) | 2019-12-18 | 2021-06-24 | Merck Patent Gmbh | Aromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021122740A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| WO2021170522A1 (de) | 2020-02-25 | 2021-09-02 | Merck Patent Gmbh | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| WO2021185829A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021185712A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021191058A1 (en) | 2020-03-23 | 2021-09-30 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021191117A1 (de) | 2020-03-24 | 2021-09-30 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2021191183A1 (de) | 2020-03-26 | 2021-09-30 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021198213A1 (de) | 2020-04-02 | 2021-10-07 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2021204646A1 (de) | 2020-04-06 | 2021-10-14 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021160898A2 (de) | 2020-05-27 | 2021-08-19 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2021239772A1 (de) | 2020-05-29 | 2021-12-02 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| WO2022002772A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022002771A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| US12144249B2 (en) | 2020-07-17 | 2024-11-12 | Samsung Sdi Co., Ltd. | Compound for organic optoelectronic device, composition for organic optoelectronic device, organic optoelectronic device and display device |
| WO2022017997A1 (en) | 2020-07-22 | 2022-01-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2022029096A1 (de) | 2020-08-06 | 2022-02-10 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022034046A1 (de) | 2020-08-13 | 2022-02-17 | Merck Patent Gmbh | Metallkomplexe |
| WO2022038065A1 (de) | 2020-08-18 | 2022-02-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022038066A1 (de) | 2020-08-19 | 2022-02-24 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022069380A1 (de) | 2020-09-29 | 2022-04-07 | Merck Patent Gmbh | Mononukleare tripodale hexadentate iridium komplexe zur verwendung in oleds |
| WO2022069422A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Verbindungen zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen |
| WO2022069421A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen einsetzbare verbindungen |
| WO2022079068A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022079067A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Verbindungen mit heteroatomen für organische elektrolumineszenzvorrichtungen |
| WO2022101171A1 (de) | 2020-11-10 | 2022-05-19 | Merck Patent Gmbh | Schwefelhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022117473A1 (de) | 2020-12-02 | 2022-06-09 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022122682A2 (de) | 2020-12-10 | 2022-06-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022124367A1 (ja) | 2020-12-11 | 2022-06-16 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子用材料及び有機電界発光素子 |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022148717A1 (de) | 2021-01-05 | 2022-07-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022157343A1 (de) | 2021-01-25 | 2022-07-28 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022184601A1 (de) | 2021-03-02 | 2022-09-09 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022194799A1 (de) | 2021-03-18 | 2022-09-22 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| EP4079742A1 (de) | 2021-04-14 | 2022-10-26 | Merck Patent GmbH | Metallkomplexe |
| WO2022229298A1 (de) | 2021-04-29 | 2022-11-03 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022229126A1 (de) | 2021-04-29 | 2022-11-03 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022200638A1 (de) | 2021-07-06 | 2022-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023052272A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052314A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052313A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023052275A1 (de) | 2021-09-28 | 2023-04-06 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023094412A1 (de) | 2021-11-25 | 2023-06-01 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| WO2023110742A1 (de) | 2021-12-13 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023117837A1 (de) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023117835A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| WO2023117836A1 (en) | 2021-12-21 | 2023-06-29 | Merck Patent Gmbh | Electronic devices |
| WO2023139034A1 (en) | 2022-01-20 | 2023-07-27 | Merck Patent Gmbh | Organic electric element with mixed host system |
| WO2023152063A1 (de) | 2022-02-09 | 2023-08-17 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023152346A1 (de) | 2022-02-14 | 2023-08-17 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023222559A1 (de) | 2022-05-18 | 2023-11-23 | Merck Patent Gmbh | Verfahren zur herstellung von deuterierten organischen verbindungen |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2024013004A1 (de) | 2022-07-11 | 2024-01-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024019072A1 (ja) | 2022-07-22 | 2024-01-25 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子 |
| EP4311849A1 (de) | 2022-07-27 | 2024-01-31 | UDC Ireland Limited | Metallkomplexe |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024094592A2 (de) | 2022-11-01 | 2024-05-10 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024105066A1 (en) | 2022-11-17 | 2024-05-23 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024132993A1 (de) | 2022-12-19 | 2024-06-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024133048A1 (en) | 2022-12-20 | 2024-06-27 | Merck Patent Gmbh | Method for preparing deuterated aromatic compounds |
| WO2024149694A1 (de) | 2023-01-10 | 2024-07-18 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024153568A1 (de) | 2023-01-17 | 2024-07-25 | Merck Patent Gmbh | Heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024170605A1 (en) | 2023-02-17 | 2024-08-22 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2024184050A1 (de) | 2023-03-07 | 2024-09-12 | Merck Patent Gmbh | Cyclische stickstoffverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024194264A1 (de) | 2023-03-20 | 2024-09-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2024218109A1 (de) | 2023-04-20 | 2024-10-24 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2024240725A1 (de) | 2023-05-25 | 2024-11-28 | Merck Patent Gmbh | Tris[1,2,4]triazolo[1,5-a:1',5'-c:1'',5''-e][1,3,5]triazin-derivate zur verwendung in organischen elektrolumineszenzvorrichtungen |
| WO2024256357A1 (de) | 2023-06-12 | 2024-12-19 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2025003084A1 (de) | 2023-06-28 | 2025-01-02 | Merck Patent Gmbh | Dicyanoarylverbindungen für organische elektrolumineszenzvorrichtungen |
| EP4486099A1 (de) | 2023-06-30 | 2025-01-01 | Merck Patent GmbH | Verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025012253A1 (en) | 2023-07-12 | 2025-01-16 | Merck Patent Gmbh | Materials for electronic devices |
| WO2025021855A1 (de) | 2023-07-27 | 2025-01-30 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen und organische sensoren |
| WO2025045842A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025045851A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025045843A1 (de) | 2023-08-30 | 2025-03-06 | Merck Patent Gmbh | Materialien für organische lichtemittierende vorrichtungen |
| WO2025045935A1 (de) | 2023-08-31 | 2025-03-06 | Merck Patent Gmbh | Cyanogruppen-enthaltende aromaten für organische elektrolumineszenzvorrichtungen |
| WO2025109056A1 (de) | 2023-11-24 | 2025-05-30 | Merck Patent Gmbh | Sauerstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025119821A1 (en) | 2023-12-05 | 2025-06-12 | Merck Patent Gmbh | Material composition for organic electroluminescent devices |
| WO2025132547A1 (en) | 2023-12-21 | 2025-06-26 | Merck Patent Gmbh | Mechanochemical method for deuterating organic compounds |
| WO2025132551A1 (de) | 2023-12-22 | 2025-06-26 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2025181097A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025181044A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025181124A1 (de) | 2024-03-01 | 2025-09-04 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2025196145A1 (en) | 2024-03-22 | 2025-09-25 | Merck Patent Gmbh | Materials for organic light emitting devices |
| WO2025210013A1 (de) | 2024-04-04 | 2025-10-09 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen, insbesondere verbindungen für oleds |
| WO2025228800A1 (de) | 2024-04-30 | 2025-11-06 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
Also Published As
| Publication number | Publication date |
|---|---|
| CN102471602A (zh) | 2012-05-23 |
| KR20120103551A (ko) | 2012-09-19 |
| JP2012531383A (ja) | 2012-12-10 |
| KR101777883B1 (ko) | 2017-09-12 |
| US9040172B2 (en) | 2015-05-26 |
| DE112010006144B4 (de) | 2025-12-24 |
| DE102009031021A1 (de) | 2011-01-05 |
| DE112010002775A5 (de) | 2012-09-20 |
| CN102471602B (zh) | 2014-05-07 |
| TW201127811A (en) | 2011-08-16 |
| JP5734965B2 (ja) | 2015-06-17 |
| DE112010002775B4 (de) | 2021-08-12 |
| US20120097899A1 (en) | 2012-04-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE112010006144B4 (de) | Organische Elektrolumineszenzvorrichtungen | |
| DE112010004381B4 (de) | Materialien für elektronische Vorrichtungen | |
| DE112009004294B4 (de) | Materialien für organische Elektrolumineszenzvorrichtungen, deren Verwendung, Verfahren zu deren Herstellung und elektronische Vorrichtung | |
| DE102009005289B4 (de) | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung und elektronische Vorrichtungen, enthaltend diese | |
| EP2303814B1 (de) | Verbindungen für elektronische vorrichtungen | |
| DE112010004304B4 (de) | Materialien für elektronische Vorrichtungen | |
| DE102010019306B4 (de) | Organische Elektrolumineszenzvorrichtungen | |
| EP2344609B1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| EP2102309B1 (de) | Carbazol-derivate für organische elektrolumineszenzvorrichtungen | |
| DE102010013806B4 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| DE112011103412B4 (de) | Materialien für elektronische Vorrichtungen | |
| EP2737554A1 (de) | Verbindungen für elektronische vorrichtungen | |
| DE102009023155A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| EP2344608A1 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| WO2011060877A2 (de) | Materialien für organische elektrolumineszenzvorrichtungen | |
| WO2011160757A1 (de) | Materialien für elektronische vorrichtungen | |
| WO2010094378A1 (de) | Organische elektronische vorrichtung | |
| DE102010048608A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| EP2705550A1 (de) | Verbindungen für elektronische vorrichtungen | |
| WO2010083871A1 (de) | Verbindungen für elektronische vorrichtungen | |
| WO2012016630A1 (de) | Materialien für elektronische vorrichtungen | |
| EP2697225B1 (de) | Materialien für elektronische vorrichtungen | |
| EP2828266A1 (de) | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen | |
| DE112011102056B4 (de) | Verbindungen für elektronische Vorrichtungen | |
| EP2697226B1 (de) | Verbindungen für elektronische vorrichtungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 201080029223.0 Country of ref document: CN |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 10725026 Country of ref document: EP Kind code of ref document: A1 |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 13379879 Country of ref document: US |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2012516542 Country of ref document: JP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 1120100027757 Country of ref document: DE Ref document number: 112010002775 Country of ref document: DE |
|
| ENP | Entry into the national phase |
Ref document number: 20127002648 Country of ref document: KR Kind code of ref document: A |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 10725026 Country of ref document: EP Kind code of ref document: A1 |
|
| REG | Reference to national code |
Ref country code: DE Ref legal event code: R225 Ref document number: 112010002775 Country of ref document: DE Effective date: 20120920 |