新除草剂抗性基因
相关申请的交叉参考
本申请要求2004年4月30日提交的U.S.临时申请序列No.60/567,052的优先权。
背景技术
杂草可以迅速耗尽土壤中作物和其他目的植物所需的有价值的养分。目前有多种类型的除草剂用于控制杂草。一种特别流行的除草剂是草甘膦。
已经开发了对草甘膦具有抗性的作物,如玉米、大豆、芸苔、棉花、甜菜、小麦、草坪和稻。因此可以例如对积极种植草甘膦抗性作物的田地喷洒草甘膦以控制杂草而不显著损害作物植物。
随着二十世纪九十年代中期遗传改造的草甘膦耐性作物(GTC)的引入,在农业中前所未有地使种植者能够以简单、便利、灵活并廉价的工具控制广谱阔叶和禾本科杂草。因此,生产者们迅速采用了GTC,并在很多情况下放弃了公认最佳的农业实践,如作物轮作、除草剂作用方式轮作、罐混、在化学和栽培杂草控制中掺入机械控制。目前在美国和西半球其他地方可以购买到草甘膦耐性大豆、棉花、玉米和芸苔。取决于全球市场的接受度,更多的GTC(如小麦、稻、甜菜、草坪等等)正准备引入。许多其他草甘膦抗性物种正在实验至开发阶段(如苜蓿、甘蔗、向日葵、甜菜、豌豆、胡萝卜、黄瓜、莴苣、洋葱、草莓、西红柿和烟草、林业物种如白杨、香枫和园艺物种如金盏花、牵牛花和秋海棠,参阅“isb.vt.edu/cfdocs/fieldtests1.cfm,2005”站点)。此外,近年来草甘膦的费用已经大幅降低至几乎没有常规杂草控制程序能在价格和性能上与草甘膦GTC系统有效竞争。
草甘膦已经在灭生(burndown)和其他非作物地区成功用于完全植被控制超过15年。在许多情况下(如对于GTC),可以在连续的3、5、10直至15年中每年使用草甘膦1-3次。这些情况已经导致对草甘膦和GTC技术的过度依赖,并在天然杂草物种中对草甘膦天然更具耐性或已经发展出对抗草甘膦除草剂活性的机制的植物施加了高选择压。
仅用草甘膦的杂草控制程序的广泛使用正导致对草甘膦抗性植物的选择,并且正在选择固有地比多数靶物种更能耐受草甘膦的杂草物种后代(即杂草演替)。(Ng等,2003;Simarmata等,2003;Lorraine-Colwill等,2003;Sfiligoj,2004;Millar等,2003;Heap,2005;Murphy等,2002;Martin等,2002)。尽管草甘膦已经在全球广泛使用超过15年,但仅有少数杂草被报道已发展出对草甘膦的抗性(Heap,2005),然而它们中的大多数都鉴定于过去的3-5年。抗性杂草包括阔叶和禾本科杂草——瑞士黑麦草(Lolium rigidum)、多花黑麦草(Lolium multiflorum)、牛筋草(Eleusineindica)、豚草(Ambrosia artemisiifolia)、小飞蓬(Conyza canadensis)、野塘蒿(Conyza bonariensis)和长叶车前(Plantago lanceolata)。此外,在广泛使用GTC之前并不是农业问题的杂草现在开始盛行,并且难于用GTC(包括>80%的美国棉花和大豆地区和>20%的美国玉米地区)控制(Gianessi,2005)。这些杂草演替主要与(但不仅与)难于控制的阔叶杂草一起出现。一些实例包括药薯(ipomea)、苋属(Amaranthus)、藜属(Chenopodium)、蒲公英属(Taraxacum)和鸭跖草科(Commelina)物种。
在种植者要面对草甘膦抗性杂草或演替到更难于控制的杂草物种的地区,种植者可以通过罐混或换用能控制遗漏杂草的其他除草剂来弥补草甘膦的弱点。在许多情况下控制阔叶逃选的一种流行且有效的罐混伴侣为2,4-二氯苯氧乙酸(2,4-滴)。2,4-滴已经在农业和非作物条件下用于广谱阔叶杂草控制超过60年。已有关于更具耐性物种的个案报道,但2,4-滴仍是全球最广泛使用的除草剂之一。对进一步使用2,4-滴的限制在于它在双子叶植物(如大豆或棉花)中的选择性非常低,因此2,4-滴一般不用于(且一般不靠近)敏感性双子叶作物。此外,2,4-滴在禾本科作物中的用途在某种程度上受限于可能出现的作物损伤的性质。2,4-滴和草甘膦的组合已经用于在种植免耕大豆和棉花之前提供更强的灭生处理,然而,由于这些双子叶物种对2,4-滴的敏感性,这些灭生处理必须在种植前14-30天以前进行(Agriliance,2003)。
和MCPA、2-甲-4-氯丙酸和2,4-滴丙酸一样,2,4-滴是苯氧酸类除草剂。2,4-滴用于在许多单子叶作物(如玉米、小麦和稻)中选择性控制阔叶杂草而不严重损伤目的作物植物。2,4-滴是合成的植物生长素衍生物,其作用为使正常的细胞激素内稳态失调,并阻碍平衡的受控生长,然而,其确切的作用模式仍不了解。
2,4-滴对某些植物具有不同水平的选择性(如双子叶植物比禾本科植物更敏感)。不同植物对2,4-滴的不同代谢是不同水平选择性的一种解释。通常植物缓慢代谢2,4-滴,因此靶位点的不同活性更可能解释植物对2,4-滴不同的应答(WSSA,2002)。2,4-滴的植物代谢一般通过两步代谢实现,一般是羟基化后接着与氨基酸或葡萄糖缀合(WSSA,2002)。
随着时间的发展,微生物种群已经发展出降解此特定外来物的有效的替代途径,所述途径引起2,4-滴的完全矿化。对微生物连续应用除草剂选择了能利用除草剂作为碳源用于生长(从而使其在土壤中具有竞争优势)的微生物。因为这个原因,目前将2,4-滴配制为具有相对短的土壤半衰期,并且对其后的作物没有遇到明显的遗留效应(carryover effect)。这促进了2,4-滴的除草剂应用。
已经广泛研究了其降解2,4-滴能力的一种生物是真养雷氏菌(Ralstonia eutropha)(Streber等,1987)。编码矿化途径中第一个酶促步骤的基因为tfdA。参阅U.S.专利No.6,153,401和GENBANK登录号M16730。TfdA通过α酮戊二酸依赖性双加氧酶反应催化2,4-滴酸转化成二氯苯酚(DCP)(Smejkal等,2001)。DCP与2,4-滴相比几乎不具有除草剂活性。TfdA在转基因植物中用于向通常对2,4-滴敏感的双子叶植物(如棉花和烟草)中输入2,4-滴抗性(Streber等(1989),Lyon等(1989),Lyon(1993)和U.S.专利No.5,608,147)。
已在环境中鉴定了大量编码能降解2,4-滴的蛋白质的tfdA型基因并已保存于Genebank数据库。许多同系物与tfdA类似(氨基酸同一性>85%)并具有与tfdA相似的酶活性。然而,有大量同系物与tfdA具有显著更低的同一性(25-50%),但却具有与α酮戊二酸依赖性双加氧酶Fe+2双加氧酶相关的特征残基。因此这些不同的双加氧酶的底物特异性是什么并不明确。
与tfdA具有低同源性(氨基酸同一性28%)的独特实例是来自Sphingobium herbicidovorans的rdpA(Kohler等,1999,Westendorf等,2002)。已经显示此酶催化(R)-2,4-滴丙酸(和其他(R)-苯氧丙酸)以及2,4-滴(苯氧乙酸)矿化的第一步(Westendorf等,2003)。尽管以前已经描述了降解苯氧丙酸的生物,但直至最近对此途径的表征才取得进展(Horvath等,1990)。使2,4-滴丙酸降解复杂化的另一因素是与2,4-滴丙酸摄取(Kohler,1999)和初期氧化(Westendorf等,2003)相关的立体特异性(R与S)。迄今仍没有在其他微生物中异源表达rdpA或将此基因转化进植物的报道。文献主要着眼于主要降解非手性苯氧乙酸(如2,4-滴)的tfdA近亲同系物。
新除草剂耐受作物(HTC)技术的开发很大程度上受到GTC的效力、低费用和便利性的限制。因此,GTC在生产者中的采用率非常高。这很难刺激开发新的HTC技术。
芳氧基链烷酸酯化学亚结构是许多商品除草剂(包括苯氧基生长素(如2,4-滴和2,4-滴丙酸)、吡啶氧基生长素(如氟草烟和绿草定)、芳氧基苯氧丙酸酯(AOPP)乙酰辅酶A羧化酶(ACC酶)抑制剂(如吡氟氯禾灵(haloxyfop)、喹禾灵(quizalofop)和禾草灵(flumiclorac))和5取代苯氧乙酸初卟啉原氧化酶IX抑制剂(如霸草灵和氟胺草酯))的通用实体。然而,这些除草剂类别的差别都很大,目前的文献中没有这些化学品类别中共有的降解途径的证据。发现涵盖除草剂降解多种模式的多功能酶将是独一无二的,并且具有作为HTC性状的价值。
发明概述
本发明提供不仅对2,4-滴具有抗性,而且还对AOPP除草剂具有抗性的新植物。迄今还没有预期或提出可通过引入单个基因产生具有这两种有利特性的植物。本发明还包括这样的植物:其产生与一种或多种其他除草剂抗性基因(包括但不仅限于草甘膦、咪唑啉酮和草铵膦抗性基因)“叠加”的一种或多种本发明的酶,以提供与更广更多的强杂草控制和除草剂抗性管理选择相容的除草剂耐性植物。本发明还包括利用本文示例的基因和蛋白质的同系物的方法和组合物。
在一些实施方案中,本发明提供对2,4-滴、AOPP和一种或多种市售除草剂(如草甘膦、咪唑啉酮、草铵膦、磺脲类、二氯甲氧苯酸、溴草腈等等)具有耐性的单子叶和双子叶植物。还公开了含有负责这些除草剂耐性的核酸序列的载体以及将这些耐性植物和除草剂组合用于杂草控制和防止杂草种群演替的方法。本发明提供以新的方法使用除草剂的新组合。此外,本发明提供预防产生并控制对一种或多种除草剂(如草甘膦)具有抗性的杂草株系的新方法。本发明赋予除草剂和作物的新组合的新用途,包括在种植对该除草剂(如2,4-滴)敏感的植物的种子之前对将种植的地区进行的种植前应用。
本发明部分涉及酶的鉴定,所述酶不仅能降解2,4-滴,而且还令人吃惊地具有例如使本发明的酶区别于先前已知的tfdA蛋白的新特性。更具体的,本发明涉及能以对映体特异性方式降解2,4-滴和AOPP除草剂的酶的用途。先前已报道的α酮戊二酸依赖性双加氧酶均不具有降解不同化学类别或作用模式的除草剂的能力。本发明使用的优选酶和基因在本文中称为AAD-1(芳氧基链烷酸酯双加氧酶)。这一高度新颖的发现是重要的HTC性状和选择标记可能性的基础。
之前没有动机产生含有AAD-1基因(优选如本文所示例的具有为了在一种或多种植物中表达而优化的序列的AAD-1多核苷酸)的植物,也没有期望这些植物能有效的产生AAD-1酶以使植物不仅对苯氧酸除草剂(如2,4-滴)具有抗性,而且还对AOPP除草剂(如喹禾灵、吡氟氯禾灵等)具有抗性。因此,本发明提供了许多本领域迄今未曾设想过的优点。
本发明还部分涉及编码能降解苯氧基植物生长素和芳氧基苯氧丙酸酯除草剂的芳氧基链烷酸酯双加氧酶的基因的鉴定和用途。筛选蛋白质的这些活性的方法也在本发明的范围内。因此,本发明包括通过重组表达的AAD-1酶降解2,4-二氯苯氧乙酸、其他苯氧基链烷酸酯生长素除草剂和芳氧基苯氧丙酸酯除草剂。本发明还包括控制杂草的方法,其中所述方法包括对含有AAD-1基因的植物应用一种或多种AOPP、苯氧基生长素或其他芳氧基链烷酸酯除草剂。本发明还提供使用AAD-1基因作为鉴定转化了AAD-1的植物细胞和完整植物的选择标记物的方法,所述植物细胞或完整植物任选地包含同时插入靶植物细胞的一个、两个或更多外源基因。本发明的方法包括选择对适当水平的除草剂具有抗性的转化细胞。本发明还包括通过培养本发明的植物和/或细胞制备具有芳氧基链烷酸酯双加氧酶生物活性的多肽的方法。
附图简述
图1显示苯氧基生长素或AOPP除草剂的双加氧酶裂解的一般方案。
图2显示用AAD-1处理的2,4-滴溶液的除草剂活性的丧失。
图3显示用AAD-1处理的吡氟氯禾灵溶液的除草剂活性的丧失。
图4显示用AAD-1催化代表性的除草剂预计产生的酚。
图5显示重组AAD-1产生的2,4-二氯苯酚。
图6A和6B显示由重组AAD-1从多种除草剂底物产生的酚。
图7显示对四种除草剂底物的底物浓度的AAD-1反应速率。
图8A和8B显示AAD-1(v3)在不同时期的拟南芥叶中等量表达,但在25天的实验中持续积累。未喷洒除草剂2,4-滴(图A)的植物比经喷洒(图B)的植物表达稍多的AAD-1(v3)。条柱代表来自5株不同植物的5片叶的平均值±SEM和用可溶性蛋白总量标准化的AAD-1(v3)表达百分数。浅色条代表采自顶端的第三幼的叶(N-3),深色条代表采自底部的第五老的叶。
图9A、9B和9C显示2,4-滴处理后拟南芥植物的损伤。用四种不同剂量的2,4-滴处理四个不同株系,在处理后4天(图A)和14天(图B)对其损伤分级。还使用ELISA测定其叶中AAD-1(v3)的表达(图C)。结果为来自接受同一处理的5株不同植物的5片叶的平均值±SEM。
图10展示在第7天,与野生型和经转化的对照拟南芥株系相比,转化了pDAB3230的拟南芥(AAD-1+EPSPS)显示出>14倍水平的草甘膦耐性。
图11显示愈伤组织玉米悬液对R-吡氟氯禾灵的剂量应答。
图12显示在1μM cyhalofop phenol下,生长仍然高达无cyhalofopphenol的对照的76%。
图13展示一个转基因事件3404-006对吡氟氯禾灵的剂量应答数据。
图14显示若干转化AAD-1(v3)和非转化事件克隆对一周前以出苗后喷洒应用的两种致死剂量的AOPP除草剂(吡氟氯禾灵和喹禾灵)的应答。
图15显示用Liberty_除去无效从3404个转化中预筛选的三个不同T2谱系,选择它们用来相对于其AAD-1的表达而比较其对喹禾灵的耐性。在第14天(数据未显示)和第30天测量表达。
图16显示在大田条件下,转化了AAD-1(v3)的玉米对8X大田用量的喹禾灵(Assure II)具有耐性。
图17展示在含有cyhalofop的培养基上培养的未成熟玉米胚。
图18显示转化了AAD-1(V3)基因的大豆愈伤组织的Western印迹分析表明愈伤组织细胞表达AAD-1(V3)蛋白。
图19显示AAD-2(v1)与AAD-1(v1)的2,4-滴降解率拟合曲线。
图20显示转化了AAD-1 v3(植物优化)或AAD-1(v2)(天然)、AAD-2(v1)(天然)或AAD-2(v2)(植物优化)的T1拟南芥对一系列出苗后应用的2,4-滴用量的反应。每盆代表T1家族每个基因内的单个转化事件。
图21显示转化了天然AAD-2(v2)的单个T1拟南芥植物的western印迹分析。其显示200g ae(酸当量)/ha 2,4-滴处理对表达AAD-2(v1)的植物造成严重的损伤,而一般对转化天然AAD-1(v2)或植物优化的AAD-1(v3)的拟南芥很少造成损伤。在凝胶上鉴定AAD-2蛋白。在转化AAD-2和转化Pat/Cry1F的样品中检测到了若干背景条带。
图22显示AAD-2(v1)对底物的相对活性为2,4-滴=2,4-滴丙酸>(R,S)-吡氟氯禾灵>>(R)-吡氟氯禾灵。
序列简述
SEQ ID NO:1为用于扩增rdpA/AAD-1(v1)基因的正向引物。
SEQ ID NO:2为用于扩增rdpA/AAD-1(v1)基因的反向引物。
SEQ ID NO:3为来自Sphingobium herbicidovorans的AAD-1(v1)的核苷酸序列。
SEQ ID NO:4为去除了内部Not I限制性位点的天然AAD-1基因的核酸序列。此基因命名为AAD-1(v2)。DNA测序证实产生了正确的PCR产物,但是在氨基酸#212处无意地造成了由精氨酸到半胱氨酸的改变。
SEQ ID NO:5为“植物优化”的DNA序列AAD-1(v3)。此“基因”编码SEQ ID NO:11,它除了在第二个位置加入了丙氨酸残基以外均与SEQ ID NO:9相同。包含额外的丙氨酸密码子(GCT)以编码跨越ATG起始密码子的Nco I位点(CCATGG)以便进行其后的克隆操作。
SEQ ID NO:6(“rdpA(ncoI)”)和SEQ ID NO:7(“3′sacI”)用于使用Fail Safe PCR System(Epicenter)扩增DNA片段。
SEQ ID NO:8为与“3′SacI”引物一起使用的另一PCR引物(“BstEII/De1 NotI”)。
SEQ ID NO:9为来自Sphingobium herbicidovorans的AAD-1(v1)基因所编码的天然氨基酸序列。
SEQ ID NO:10为SEQ ID NO:4的AAD-1(v2)DNA序列所编码的氨基酸序列。
SEQ ID NO:11为SEQ ID NO:5的AAD-1(v3)植物优化DNA序列所编码的氨基酸序列。
SEQ ID NO:12为天然AAD-2(v1)基因的DNA序列。
SEQ ID NO:13为AAD-2(v1)蛋白的氨基酸序列。
SEQ ID NO:14为扩增用于克隆的AAD-2(v1)DNA所使用的正向引物。
SEQ ID NO:15为扩增用于克隆的AAD-2(v1)DNA所使用的反向引物。
SEQ ID NO:16为M13正向引物。
SEQ ID NO:17为M13反向引物。
SEQ ID NO:18为扩增用于克隆的AAD-2(v1)DNA所使用的正向引物。
SEQ ID NO:19为扩增用于克隆的AAD-2(v1)DNA所使用的反向引物。
SEQ ID NO:20为天然大豆EPSPS蛋白。
SEQ ID NO:21为含有残基183(用异亮氨酸替换天然蛋白质的苏氨酸)和残基187(用丝氨酸替换天然蛋白质的脯氨酸)处突变的双突变大豆EPSPS蛋白序列。
SEQ ID NO:22为编码SEQ ID NO:21的EPSPS蛋白的大豆偏好DNA序列。
SEQ ID NO:23为引物Pat5-3。
SEQ ID NO:24为引物Pat3-3。
SEQ ID NO:25为正向引物AAD-1PTU。
SEQ ID NO:26为反向引物AAD-1PTU。
SEQ ID NO:27为用于AAD-1编码区PCR的正向引物。
SEQ ID NO:28为用于AAD-1编码区PCR的反向引物。
SEQ ID NO:29为AAD-2(v2)核苷酸(植物优化)。
SEQ ID NO:30为翻译的AAD-2(v2)蛋白序列。
SEQ ID NO:31为AAD-1 Southern片段PCR的正向引物。
SEQ ID NO:32为AAD-1 Southern片段PCR的反向引物。
发明详述
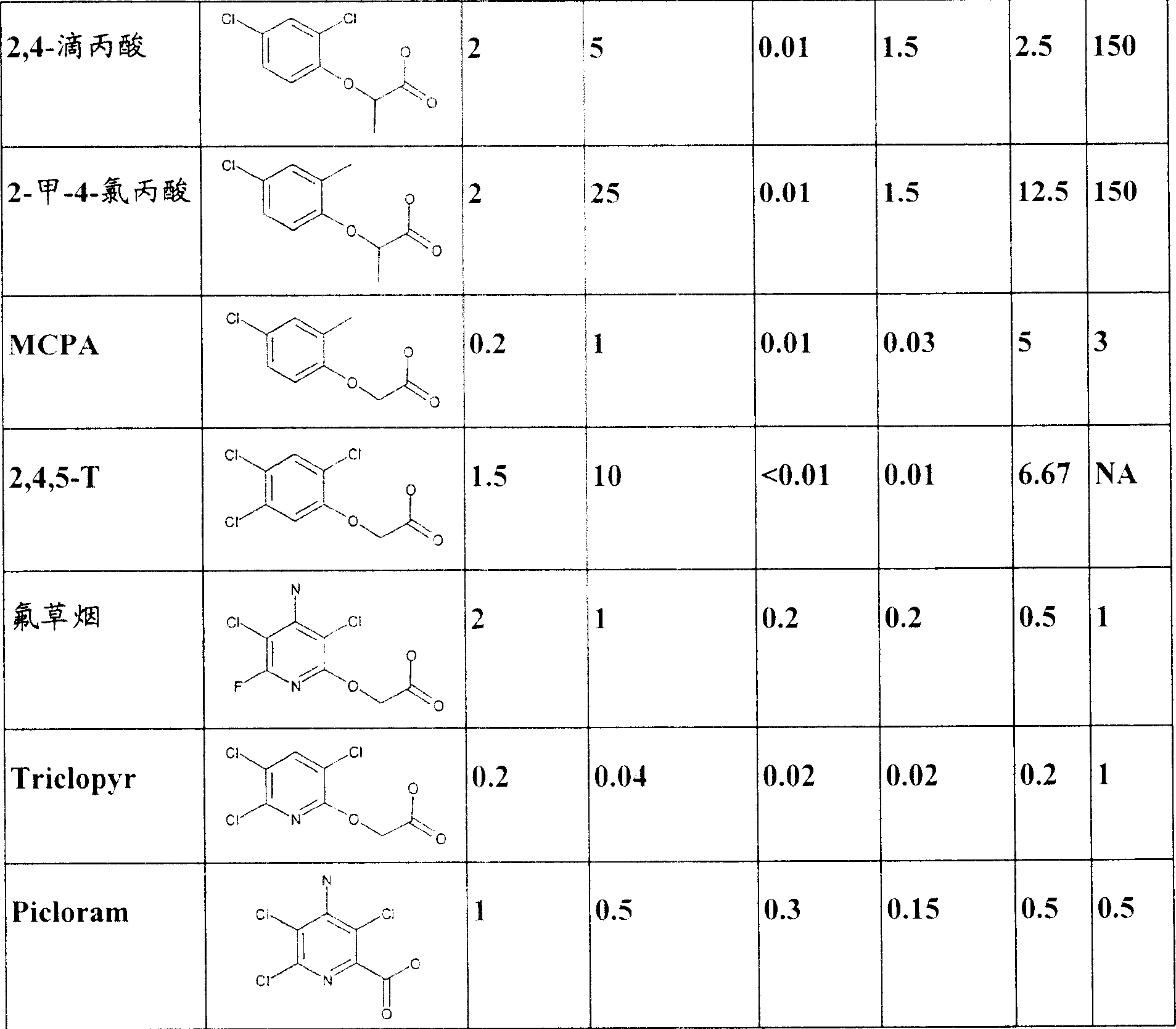
本发明开发的2,4-滴抗性基因及其后的抗性作物提供用于在作物中控制草甘膦抗性(或高耐性和演替的)阔叶杂草物种的优良选择。2,4-滴是广谱、相对便宜且强力的阔叶除草剂,如果在双子叶和单子叶中同样能提供更强的作物耐性,则可为种植者提供优良的效用。2,4-滴耐性转基因双子叶植物还可在应用时间和用量上具有更高的灵活性。2,4-滴除草剂耐性性状的另一用途是它可用于预防2,4-滴漂移、挥发、转化(inversion)(或其他远距离的移动现象)、误用、破坏等等对正常敏感性作物的损害。AAD-1基因的另一益处是,与目前已表征的所有tfdA同系物不同,AAD-1除了能降解非手性苯氧基生长素(如2,4-滴、MCPA和2-甲-4-氯丙酸)以外,还能降解手性苯氧基生长素(如2,4-滴丙酸和2-甲-4-氯丙酸)的R-对映体(除草剂活性异构体)。见表1。已经广泛使用不同苯氧基生长素组合的多种混合来处理不同地区特定的杂草谱和环境条件。在植物中使用AAD-1可以提供对更广谱的苯氧基生长素除草剂的防护,从而提高灵活性和可控制的杂草谱,提供对全范围市售苯氧基生长素的漂移或其他远距离苯氧基除草剂损伤的防护。
表1.市售的苯氧基生长素。对于苯氧基生长素除草剂通常制成活性酸,但也有一些商品化配制为多种相应酯制剂之一,由于一般的植物酯酶在植物中将这些酯转换成活性酸,因此这些也同样认为是在植物中AAD-1酶的底物。类似的还可以是相应酸的相应有机或无机盐。当表示手性丙酸、丙酸盐或丙酸酯除草剂时,即使不同的CAS号可能对应于光学纯的化合物,在命名这些除草剂时仍认为消旋(R,S)或光学纯化的(R或S)对映体是同一除草剂。可能的用量范围可以是作物或非作物用途中单独处理或与其他除草剂组合。
AAD-1基因的另一好处是其前所未有的附带降解大量芳氧基苯氧丙酸酯(AOPP)类商品和非商品禾本科除草剂化合物的能力。见表2。此属性使得可以对含有AAD-1的转基因作物应用大量AOPP化合物中的任一种,而在转基因之前这些作物的耐性并不保重AOPP可用于其中。这些作物中最常见的包括禾本科作物,如玉米、稻、小麦、大麦、黑麦、燕麦、高粱、暖季和凉季草坪物种、禾本科牧草物种以及许多其他物种,但也可包括双子叶作物,其中AOPP耐性(天然存在于多数双子叶植物中)未达到可以在所述双子叶作物中使用AOPP的商品化水平。
表2.以公认的通用名列出的AOPP禾本科除草剂化合物。AOPP通常制成活性酸,但也有一些商品化配制为多种相应酯制剂之一,由于一般的植物酯酶在植物中将这些酯转换成活性酸,因此这些在植物中也同样认为是AAD-1酶的底物。类似的还可以是相应酸的相应有机或无机盐。当表示手性丙酸、丙酸盐或丙酸酯除草剂时,即使不同的CAS号可能对应于光学纯的化合物,在命名这些除草剂时仍认为消旋(R,S)或光学纯化的(R或S)对映体是同一除草剂。可能的用量范围可以是作物或非作物用途中单独处理或与其他除草剂组合。
现已鉴定了单一基因(AAD-1),其在遗传改造用于植物表达后具有允许在植物中使用苯氧基生长素除草剂的特性,所述植物中固有耐性不存在或不足以允许使用这些除草剂。此外,AAD-1可以在天然耐性不足以允许选择性时在植物中提供对AOPP除草剂的防护。现在可以连续或罐混地与一种、两种或若干苯氧基生长素除草剂的组合处理仅含AAD-1的植物。用于控制广谱双子叶杂草的每种苯氧基生长素除草剂的用量范围从25到4000g ae/ha,更通常从100到2000g ae/ha。类似的,可以对具有降低的受到AOPP禾本科除草剂损伤风险的表达AAD-1的植物应用一种、两种或若干种所述除草剂化合物的混合物。用于控制广谱单子叶杂草的每种AOPP的用量范围可以从10到2000g ae/ha,更通常是从20到500g ae/ha。在同一大田里(连续或罐混组合地)组合这些不同化学类别和具有不同作用模式和范围的除草剂可以提供对大多数需要除草剂控制的潜在杂草的控制。
草甘膦被广泛地使用,因为它控制非常广谱的阔叶和禾本科杂草物种。然而,在GTC和非作物应用中重复使用草甘膦已经(而且仍将继续)选择使杂草演替为天然更具耐性的物种或草甘膦抗性生物型。多数除草剂抗性管理策略建议使用有效用量的罐混除草剂伴侣作为延缓出现抗性杂草的方法,所述除草剂伴侣提供对同一物种的控制,但具有不同的作用模式。将AAD-1与草甘膦耐性性状(和/或其他除草剂耐性性状)叠加可通过允许对同一作物选择性使用草甘膦、苯氧基生长素(如2,4-滴)和AOPP除草剂(如喹禾灵)而实现对GTC中草甘膦抗性杂草物种(被一种或多种AOPP除草剂控制的禾本科杂草物种或被苯氧基生长素控制的阔叶杂草物种)的控制。这些除草剂的应用可以是在含有不同作用模式的两种或更多除草剂的罐混合物中同时使用、在连续应用(如种植前、出苗前或出苗后)中单个除草剂组合物的单独使用(使用的间隔时间范围从2小时到3个月),或者备选地,可以在任何时间(从种植作物7个月内到收获作物时(或对于单个除草剂为收获前间隔,取最短者))使用代表可应用每种化学类别的任意数目除草剂的组合。
在控制广谱禾本科和阔叶杂草中具有灵活性是很重要的,即使用时间、单个除草剂用量和控制顽固或抗性杂草的能力。作物中与草甘膦抗性基因/AAD-1叠加的草甘膦应用的范围可以从250-2500g ae/ha;苯氧基生长素除草剂(一种或多种)可按照从25-4000g ae/ha应用;AOPP除草剂(一种或多种)可按从10-2000g ae/ha应用。这些应用的时间的最佳组合取决于具体的条件、物种和环境,并可由杂草控制领域且具有本公开内容的优先权的技术人员最佳决定。
除草剂制剂(如酯、酸或盐配方或可溶浓缩剂、乳化浓缩剂或可溶液体)和罐混添加剂(如佐剂或相容剂)可显著影响给定的除草剂或一种或多种除草剂的组合的杂草控制。任意前述除草剂化学的任意这些组合都在本发明的范围内。
本领域技术人员还会了解,两种或更多作用模式的组合在提高受控杂草谱和/或天然更具耐性物种或抗性杂草物种上的益处还可扩展到通过人工(转基因或非转基因)在作物中产生除GTC外的除草剂耐性的化学品。事实上,可以单独或以多重组合叠加编码以下抗性的性状以提供有效控制或防止杂草演替/对任意前述类别的除草剂的抗性的能力:草甘膦抗性(如抗性植物或细菌EPSPS、GOX、GAT)、草铵膦抗性(如Pat、bar)、乙酰乳酸合酶(ALS)抑制性除草剂抗性(如咪唑啉酮、磺酰脲、三唑嘧啶、磺苯胺、嘧啶硫代苯甲酸和其他化学品如AHAS,Csr1,SurA等)、溴草腈抗性(如Bxn)、对HPPD(4-羟苯基丙酮酸双加氧酶)酶抑制剂的抗性、对八氢番茄红素去饱和酶(PDS)抑制剂的抗性、对光系统II抑制性除草剂的抗性(如psbA)、对光系统I抑制性除草剂的抗性、对原卟啉原氧化酶IX(PPO)抑制性除草剂的抗性(如PPO-1)、对苯脲除草剂的抗性(如CYP76B1)、二氯甲氧苯酸降解酶(参阅如US 20030135879)等等。
关于其他除草剂,一些其他优选的ALS抑制剂包括三唑嘧啶磺苯胺(如氯酯磺草胺、双氯磺草安、双氟磺草胺、唑嘧磺草胺、磺草唑胺(metosulam)和嘧啶并三唑类磺胺(penoxsulam)、嘧啶硫代苯甲酸(如bispyribac和pyrithiobac)和氟唑磺隆。一些优选的HPPD抑制剂包括甲基磺草酮、异恶唑草酮和磺草酮。一些优选的PPO抑制剂包括flumiclorac、丙炔氟草胺、flufenpyr、pyraflufen、fluthiacet、氟丙嘧草酯、唑草酮、甲磺草胺和二苯醚(如三氟羧草醚、氟磺胺草醚、乳氟禾草灵和乙氧氟草醚)。
此外,可以将AAD-1单独或与其他HTC特征叠加后再与一种或多种其他输入(如昆虫抗性、真菌抗性或胁迫耐性等)或输出(如提高的产量、改进的油谱、提高的纤维品质等)性状叠加。因此,本发明可用于提供以灵活且经济地控制任何数目的农学害虫的能力提高作物品质的完整农学解决方案。
本发明部分涉及鉴定不仅能降解2,4-滴,而且令人惊奇地具有使本发明的酶区别于先前已知的(例如)tfdA蛋白的新特性的酶。尽管此酶与tfdA的同源性很低,但本发明的基因一般仍可归类到α酮戊二酸依赖性双加氧酶的同一总体家族。此家族蛋白质的特征在于包含活性位点的“HX(D/E)X23-26(T/S)X114-183HX10-13R”基序中的三个保守性组氨酸残基。组氨酸与活性位点中催化活性所必需的Fe+2离子配位(Hogan等,2000)。设计了本文所讨论的初步体外表达实验以帮助选择新属性。
更具体的,本发明部分涉及不仅能降解2,4-滴而且还能降解AOPP除草剂的酶的用途。先前已经报道的α酮戊二酸依赖性双加氧酶均不具有降解不同化学类别和作用方式的除草剂的能力。本发明用途中优选的酶和基因在本文中称为AAD-1(芳氧基链烷酸酯双加氧酶)基因和蛋白。
本发明还部分涉及编码能降解苯氧基生长素和芳氧基苯氧丙酸酯除草剂的芳氧基链烷酸酯双加氧酶的基因的鉴定和用途。因此,本发明部分涉及通过重组表达的AAD-1酶降解2,4-二氯苯氧乙酸、其他苯氧链烷基生长素的除草剂和芳氧基苯氧基链烷酸酯除草剂。
在分析和生物测定中,本发明的蛋白质对2,4-滴到2,4-二氯苯酚(“DCP”,无除草剂活性)的转化测试为阳性。部分纯化的本发明蛋白质能在体外将2,4-滴迅速转化为DCP(转化率从50%-100%)。转化AAD-1的植物提供的另一优点是母体除草剂代谢为失活形式,从而降低谷物或秸秆中收获除草剂残留物的可能。
本发明还包括控制杂草的方法,其中所述方法包括对含有AAD-1基因的植物应用AOPP除草剂和/或苯氧基生长素除草剂。
根据这些发现,现在提供了含有编码这种类型酶的多核苷酸的新植物。迄今为止还没有产生这种植物的动机,也没有预期这样的植物能有效产生此酶,以不仅赋予植物对苯氧基酸除草剂(如2,4-滴)的抗性,而且赋予植物对AOPP除草剂的抗性。因此,本发明提供本领域从未设想过的许多有点。
可以获得(保藏于培养物保藏中心如ATCC或DSMZ的)公共可得的菌株并使用本文公开的技术筛选新基因。本文公开的序列可用于扩增同源基因并克隆进重组表达系统,以根据本发明进一步进行筛选和测试。
如上文背景章节所讨论的,已被广泛研究其降解2,4-滴能力的一种生物为真养雷氏菌(Streber等,1987)。编码降解途径中第一种酶的基因为tfdA。参阅U.S.专利No.6,153,401和GENBANK登录号M16730。tfdA催化通过α酮戊二酸依赖性双加氧酶反应使2,4-滴酸转化成无除草剂活性的DCP(Smejkal等,2001)。tfdA已在转基因植物中用于将2,4-滴抗性输入到通常对2,4-滴敏感的双子叶植物(如棉花和烟草)中(Streber等,1989;Lyon等,1989;Lyon等,1993)。已经从环境中鉴定了编码能降解2,4-滴的蛋白质的大量tfdA型基因并保存于Genebank数据库。许多同系物与tfdA非常相似(氨基酸同一性>85%)并具有与tfdA相似的酶特性。然而,现在鉴定了与tfdA具有低水平同源性的一小批α酮戊二酸依赖性双加氧酶同系物。
来自Sphingobium herbicidovorans的rdpA(Westendorf等,2002)是具有低同源性(氨基酸同一性28%)的一个独特实例。此酶已显示催化(R)-2,4-滴丙酸(及其他(R)-苯氧丙酸)和2,4-滴矿化的第一个步骤(Westendorf等,2003)。尽管了解负责苯氧丙酸降解的生物已有一段时间,但直到最近,此途径的表征几乎没有取得任何进展(Horvath等,1990)。2,4-滴丙酸降解的另一个复杂因素是与摄取(Kohler,1999)和2,4-滴丙酸起始氧化(Westendorf等,2003)相关的空间特异性(R和S)。迄今为止还没有在其他微生物中异源表达rdpA或将此基因转化进植物中的报道。文献主要着眼于主要降解非手性苯氧乙酸的tfdA近亲同系物上。本领域还没有预期能在植物中成功表达rfpA或AAD-1基因以赋予植物对2,4-滴的抗性(更不必说让人大为惊奇的AOPP抗性)。
如下文实施例中所更详细描述的,从Sphingobium herbicidovorans中克隆了rdpA并测试了在多种除草剂化学类别中的底物混杂性。已经显示以其天然形式纯化的这种α酮戊二酸依赖性双加氧酶可降解2,4-滴和2,4-滴丙酸(Westendorf等,2002和2003)。然而,先前已报道的α酮戊二酸依赖性双加氧酶均不具有降解不同化学类别和作用方式的除草剂的能力。从未在植物中表达过rdpA,也没有动机这样做,因为新HTC技术的开发已经在很大程度上受到GTC的效能、低费用和便利性的限制(Devine,2005)。
根据新的活性,本发明的新蛋白质和基因在本文中称为AAD-1蛋白和基因。目前已证实AAD-1在体外降解多种苯氧乙酸和苯氧丙酸生长素除草剂。然而,如本文所第一次报道的,惊奇地发现此酶还能降解芳氧基链烷酸酯类分子的其他底物。具有重要农学意义的底物为芳氧基苯氧丙酸酯(AOPP)禾本科除草剂。这一高度新颖的发现是重要的除草剂耐受作物(HTC)和选择标记物特征可能性的基础。
本文报道AAD-1的最适底物为广谱禾本科AOPP除草剂以及2,4-滴、2,4-滴丙酸和其他苯氧基生长素。此酶的独特性在于其输入对一系列广谱阔叶除草剂(苯氧基生长素)和一系列广谱高活性禾本科除草剂(AOPP)的降解活性的能力。
因此,本发明部分涉及通过重组表达的芳氧基链烷酸酯双加氧酶(AAD-1)降解2,4-二氯苯氧乙酸、其他苯氧链烷基生长素除草剂和芳氧基苯氧链烷酸酯除草剂。本发明还部分涉及编码能降解苯氧基生长素和芳氧基苯氧丙酸酯除草剂的芳氧基链烷酸酯双加氧酶降解酶(ADD-1)的基因的鉴定和用途。
本发明使得可进行转基因表达,所述转基因表达引起控制几乎所有阔叶和禾本科杂草的除草剂组合的耐性。AAD-1可作为优秀的除草剂耐受作物(HTC)性状与例如其他HTC性状(如草甘膦抗性、草铵膦抗性、咪唑啉酮抗性、溴草腈抗性等)和昆虫抗性性状(如Cry1F、Cry1Ab、Cry34/45等)叠加。此外,AAD-1可作为选择标记物辅助选择用另一个基因或基因组遗传改造的植物的原代转化体。
此外,已经重新设计了本发明的微生物基因,以使该蛋白质由倾向于单子叶和双子叶植物用途的密码子编码(hemicot)。已经用含有AAD-1的构建体转化了拟南芥、玉米、烟草、棉花、大豆、芸苔和稻,并已证明了对苯氧基生长素和AOPP除草剂的高水平抗性。因此,本发明还涉及编码本发明蛋白质的“植物优化的”基因。如下文实施例6所示,与细菌基因相比,示例的重构基因能更有效的将除草剂抗性输入到植物。
Oxyalkanoate基团可用于将稳定的酸官能度引入除草剂。酸性基团可通过“酸捕获”输入韧皮部活动性(除草剂作用所需的属性),从而可以为了活动性目的而整合进新除草剂。本发明的方面还提供产生HTC的机制。存在很多可能为AAD-1底物的市售和实验性除草剂。因此,使用本发明基因还可以得到对其他除草剂的除草剂耐性。
本发明的HTC性状可用在与其他HTC性状(包括但不仅限于草甘膦耐性)的新组合中。由于对除草剂(如草甘膦)的新获得的抗性或固有的耐性,这些性状组合产生控制杂草(等)物种的新方法。因此,除了HTC性状,本发明的范围还包括使用除草剂控制杂草的新方法,其中通过转基因作物中的所述酶产生对所述除草剂的耐性。
此外,种植草甘膦耐性作物在全球盛行。与其他草甘膦耐性作物多次轮作后,在轮作作物中控制草甘膦耐性自生作物可能很困难。因此,(叠加或单独转化进作物的)本发明转基因性状的使用提供了控制其他HTC自生作物的工具。
本发明可以用于使(例如)大豆中与目前的草甘膦抗性性状叠加的2,4-滴抗性性状商品化。因此,本发明提供对抗阔叶杂草物种演替和/或选择除草剂抗性阔叶杂草的工具,所述杂草来自于种植者在多种作物的杂草控制中对草甘膦极高的依赖性。
本发明的AAD-1基因的转基因表达示例于如拟南芥、玉米(玉蜀黍)、烟草、棉花、稻、大豆和芸苔。然而本发明可应用于任何其他所需类型的植物。大豆是本发明的转化优选的作物。然而,本发明可应用于多种其他禾本科和其他阔叶作物。类似的,2,4-滴可更积极地用于2,4-滴耐性适中的禾本科作物中,由此性状得到的提高的耐性将为种植者提供能以更有效的用量和更广的使用时间来使用2,4-滴而无作物损伤风险的可能性。
另外,本发明提供了可提供对控制阔叶杂草(生长素)和禾本科杂草(AOPP)的除草剂的抗性的单基因。此基因可用于多种作物中,让使用广谱除草剂组合变成可能。本发明还可控制对目前的化学品具有抗性的杂草,并辅助控制目前的农业实践产生的演替的杂草谱。本发明的AAD-1还可以用于将其他除草剂底物解毒成非除草剂形式的尝试。因此,本发明发展了其他HTC性状和/或选择标记物技术。
除了使用本发明基因产生HTC以外,本发明基因还可用作细胞培养物、温室和大田中成功选择转化体的选择标记物。本发明基因仅作为生物技术目的的选择标记物就具有很高的内在价值。AAD-1与其他苯氧基链烷生长素除草剂的混杂性提供了将此基因用于HTC和/或选择标记物目的的许多可能。
通过PCR从Sphingobium herbicidovorans(ATCC 700291)将本发明的一个基因(本文称为AAD-1(芳氧基链烷酸酯双加氧酶))克隆进pET280-S/S(命名为pDAB 3203)并在BL-21 Star大肠杆菌中表达。(以1mMIPTG和与以下反应混合物组合的培养物裂解液诱导:112.5μg/ml 2,4-滴、1mM抗坏血酸、1mMα酮戊二酸、50μM Fe(NH4)2(SO4)2)过表达此基因时,重组产生的酶将2,4-滴降解成无除草剂活性的DCP(通过HPLC、质谱、比色测定和拟南芥平板测定确定)。此外,已证明AAD-1将以下除草剂转化成其相应的失活酚:二氯苯氧丙酸、2-甲-4氯丙酸、吡氟氯禾灵、禾草灵等等(参阅表3和4)。
表3:纯化的AAD-1(v1)对多种除草剂生长素和类似物的效应。每个0.16ml的测定使用1μl或10μl(10×)纯化的AAD1(v1)测定25mM MOPS pH6.8、200μM Fe2+、200μM抗坏血酸钠、1mMα-酮戊二酸中1mM的底物。
表4:纯化的AAD-1(v1)对多种AOPP禾本科除草剂和类似物的效应和对cloquintocet的效应。每个0.16ml的测定使用1μl或10μl(10×)纯化的AAD1(v1)测定25mM MOPS pH6.8、200μM Fe2+、200μM抗坏血酸钠、1mMα-酮戊二酸中1mM的底物。
本发明的蛋白质(和来源分离物)。本发明提供功能蛋白质。“功能活性”(或“活性”)在本文中指本发明用途的蛋白质/酶(单独或与其他蛋白质组合)具有降解或减弱除草剂活性的能力。产生本发明蛋白质的植物优选产生“有效量”的蛋白质,从而在用除草剂处理植物时,蛋白质表达的水平足以给予植物对除草剂(若无特别说明则为一般用量,一般应用量可见于例如熟知的《Herbicide Handbook》(Weed Science Society ofAmerica,第八版,2002))完全或部分的抗性或耐性。可以以通常杀死靶植物的用量、正常的大田用量和浓度使用除草剂。(由于本发明,水平和/或浓度可以任选地比先前所使用的更高。)优选地,本发明的植物细胞和植物被保护免受除草剂处理引起的生长抑制和损伤。本发明的转化植物和植物细胞优选具有对本文讨论的除草剂的抗性或耐性,即转化植物和植物细胞能在有效用量的一种或多种本文讨论的除草剂存在下生长。本发明优选的蛋白质具有代谢一种或多种芳氧基链烷酸酯化合物的催化活性。
转移功能活性到植物或细菌系统可涉及编码本发明蛋白质氨基酸序列的核酸序列,所述核酸序列整合进蛋白质表达载体,所述载体适于其将居留的宿主。获得编码具有功能活性的蛋白质的核酸序列的一种方法是使用从本文讨论的蛋白质的氨基酸序列推出的信息从产生目的蛋白质的细菌物种中分离天然遗传物质。如下文更详细讨论的,可以优化天然序列用于例如植物表达。也可以基于蛋白质序列设计优化的多核苷酸。
本发明提供具有本文所述新活性的蛋白质类别。表征这些蛋白质类别和编码它们的多核苷酸的一种方法是通过多核苷酸在一系列特定条件下与示例核苷酸序列(其互补物和/或来自任一链的探针)杂交的能力和/或其使用来自示例序列的引物通过PCR被扩增的能力来定义多核苷酸。
有许多获得本发明用途的蛋白质的方法。例如,可以用本文所公开蛋白质的抗体从蛋白质混合物中鉴定和分离其他蛋白质。具体的,可以针对蛋白质中与其他相关蛋白质相比最保守或最特殊的部分产生抗体。接着可使用这些抗体通过免疫沉淀、酶联免疫吸附测定(ELISA)或免疫印迹来具体鉴定具有特征活性的等价蛋白质。可以使用标准方案便利的制备针对本文公开蛋白质、针对等价蛋白质或针对这些蛋白质的片段的抗体。这些抗体是本发明的一个方面。本发明的抗体包括单克隆抗体和多克隆抗体,优选针对示例或建议蛋白质产生。
本领域技术人员容易认识到,可以从多种来源获得本发明的蛋白质(和基因)。由于已知完整的除草剂降解操纵子除了整合在基因组中以外,还编码在可转座元件如质粒上,因此可以从多种微生物(如包括重组和/或野生型细菌)获得本发明的蛋白质。Firmicutes和Proteobacteria目的其他成员和具有已知的rdpA的特定属如Sphingobium、Delftia、Rodoferax和Comamonas可用作来源分离物。
可以通过本领域所熟知的方案产生细菌分离物的突变体。例如,可以通过分离物的甲基磺酸乙酯(EMS)诱变来获得不产孢子突变体。可以通过本领域熟知的方案使用紫外光和亚硝基胍产生突变体。
“来自”或“得自”对象分离物指该蛋白质(或相似的蛋白质)可得自该分离物或其他一些来源,如其他细菌菌株或植物。“产生自”也具有这一含义,并包括可从经修饰用于(例如)在植物中表达的给定类型的细菌获得的蛋白质。例如,本领域技术人员容易理解,在细菌基因和蛋白质公开后就可以设计植物以产生该蛋白质。可以使用本文公开的多核苷酸和/或氨基酸序列制备抗体制剂、核酸探针(DNA、RNA或PNA)等,并用于从其他(天然)来源筛选和回收其他蛋白质基因。
可以使用标准分子生物学技术克隆和测序本文所述蛋白质和基因。其他信息可见于本文引入为参考的Sambrook等,1989。
多核苷酸和探针。本发明还提供编码本发明蛋白质的核苷酸序列。本发明还提供鉴定和表征具有所需除草剂活性的蛋白质的基因的方法。在一个实施方案中,本发明提供可作为杂交探针和/或PCR技术的引物使用的独有核苷酸序列。引物产生可用于鉴定、表征和/或分离特定目的基因的特征性基因片段。本发明的核苷酸序列编码与先前已描述蛋白质不同的蛋白质。
本发明的多核苷酸序列可用于形成完整“基因”,以在所需宿主细胞中编码蛋白质或肽。例如,本领域技术人员容易了解,可以如本领域所熟知的,在目的宿主中将本发明的多核苷酸适当地放置于启动子的控制之下。基因表达和暂时/组织特异性表达的水平可极大的影响本发明的应用。一般而言,降解基因蛋白质较高水平的表达会引起底物(本文中为靶除草剂)更快更完全的降解。除非高表达对植物健康具有继发的负影响,否则需要启动子以高水平表达靶基因。为了在全部生长阶段中完全保护植物,一般希望AAD-1基因在所有组织中组成型表达。然而,也可以使用营养生长表达抗性基因,这允许在植物中使用靶除草剂进行杂草控制,接着通过在开花期使用来控制靶作物的有性生殖。
如本领域技术人员所知,DNA一般以双链形式存在。在这种排列下,一条链与另一条链互补,反之亦然。当DNA在(例如)植物中复制时产生了额外的互补DNA链。本领域中经常使用“编码链”指代与反义链结合的链。mRNA转录自DNA的“反义”链。“有义”或“编码”链具有一连串密码子(密码子是可以作为三残基单位阅读以指定特定氨基酸的三个核苷酸),所述密码子可以作为开放读码框(ORF)阅读以形成目的蛋白质或多肽。为在体内产生蛋白质,一般将DNA链转录成用作蛋白质模板的mRNA互补链。因此,本发明包括附带的序列列表中所示的示例多核苷酸和/或等价物(包括互补链)的用途。与示例DNA功能性等价的RNA和PNA(肽核酸)也包含于本发明中。
在本发明的一个实施方案中,可以在使微生物高度增殖的条件下培养细菌分离物。在处理微生物以提供单链基因组核酸后,可以用本发明的引物与DNA接触并进行PCR扩增。目的基因的特征性片段将被该操作扩增,从而鉴定目的基因的存在。
本发明的其他方面包括使用本文公开的方法和核苷酸序列鉴定的基因和分离物。所鉴定的基因编码本发明的除草剂抗性蛋白。
可以通过如使用寡核苷酸探针鉴定和获得本发明的蛋白质和基因。这些探针为可检测的核苷酸序列,所述核苷酸序列由于适当的标记或如国际申请No.WO 93/16094所述使其具有固有的荧光性而可被检测。探针(和本发明的多核苷酸)可以是DNA、RNA或PNA。除了腺嘌呤(A)、胞嘧啶(C)、鸟嘌呤(G)、胸腺嘧啶(T)和尿嘧啶(U,RNA分子中)之外,本发明的合成探针(和多核苷酸)还可以含有次黄嘌呤核苷(能与全部四种碱基配对的中性碱基,有时用于在合成探针中代替全部四种碱基的混合物)。因此,当本文中提到合成的简并寡核苷酸时一般使用“n”,“n”可以是G、A、T、C或次黄嘌呤核苷。本文使用的多义密码子与提交本申请的标准IUPAC命名约定一致(如R为A或G、Y为C或T等)。
如本领域所熟知,如果探针分子与核酸样品杂交,可以合理的假设探针和样品具有显著同源性/相似性/同一性。优选地,首先进行多核苷酸杂交,之后使用本领域所熟知的技术在低、中或高严格条件下进行洗涤,如Keller,G.H.,M.M.Manak(1987)《DNA Probes》,Press,New York,NY,169-170页中所述。例如,如文中所述可以通过首先在室温下用2×SSC(标准柠檬酸盐水)/0.1%SDS(十二烷基硫酸钠)洗涤15分钟来得到低严格条件。一般进行两次洗涤。可以通过降低盐浓度和/或通过提高温度得到较高的严格度。例如,在上述洗涤之后可以接着在室温下两次用0.1×SSC/0.1%SDS洗涤15分钟,然后在55℃用0.1×SSC/0.1%SDS接着洗涤30分钟。如本领域技术人员所知,这些温度可以与本文公开的其他杂交和洗涤程序一起使用(例如可以用SSPE代替SSC作为盐使用)。可以通过向445ml水中加入50ml 20×SSC和5ml 10%SDS制备2×SSC/0.1%SDS。可以通过组合NaCl(175.3g/0.150M)、柠檬酸钠(88.2g/0.015M)和1升水并接着用10N NaOH调整pH至7.0来制备20×SSC。可以通过将10g SDS溶解到50ml高压灭菌水中、稀释到100ml来制备10%SDS并分成等分试样。
检测探针提供了以已知方式测定是否保持了杂交的方法。这种探针分析提供了鉴定本发明的本发明基因的快速方法。可以使用DNA合成仪和标准程序合成本发明用作探针的核苷酸片段。这些核苷酸片段还可以用作PCR引物以扩增本发明的基因。
可以用分子的杂交特征定义本发明的多核苷酸。因此本发明包括与本文示例的多核苷酸杂交的多核苷酸(和/或其互补物、优选其完整互补物)。即,定义基因(和其编码的蛋白质)的一种方法是通过其与已知或特别示例的基因(在本文指定的任意条件下)杂交的能力。
本文使用的“严格”杂交条件指得到与本应用中所使用条件相同或大致相同程度杂交特异性的条件。具体地,通过标准方法进行固定在Southern印迹上的DNA与32p标记的基因特异性探针的杂交(参阅如Maniatis等,J)。一般在允许检测靶序列的条件下进行杂交和其后的洗涤。对于双链DNA基因探针,在6×SSPE、5×Denhardt溶液、0.1%SDS、0.1mg/ml变性DNA中在DNA杂交体解链温度(Tm)以下20-25℃进行过夜杂交。按下式描述解链温度(Beltz等,1983):
Tm=81.5℃+16.6Log[Na+]+0.41(G+C%)-0.61(甲酰胺%)-600/双链体长度(碱基对)
一般如下述进行洗涤:
(1)在1×SSPE、0.1%SDS中室温15分钟洗涤两次(低严格洗涤)。
(2)在0.2×SSPE、0.1%SDS中在Tm-20℃15分钟洗涤一次(中度严格洗涤)。
对于寡核苷酸探针,在6×SSPE、5×Denhardt溶液、0.1%SDS、0.1mg/ml变性DNA中在杂交体解链温度(Tm)以下10-20℃进行过夜杂交。按下式确定寡核苷酸探针的Tm:
Tm(℃)=2(T/A碱基对数)+4(G/C碱基对数)
(Suggs等,1981)。
一般如下述进行洗涤:
(1)在1×SSPE、0.1%SDS中室温15分钟洗涤两次(低严格洗涤)。
(2)在0.2×SSPE、0.1%SDS中在Tm-20℃15分钟洗涤一次(中度严格洗涤)。
一般可以改变盐和/或温度以改变严格度。对于长度>70碱基左右的标记DNA片段,可以使用以下条件:
低: 1或2×SSPE,室温
低: 1或2×SSPE,42℃
中: 0.2×或1×SSPE,65℃
高: 0.1×SSPE,65℃。
双链体的形成和稳定依赖于杂交体两条链间的显著互补性,且如上文所提到的,某种程度的错配是允许的。因此,本发明的探针序列包括所述序列的突变(单链和双链)、缺失、插入及其组合,其中所突变、插入和缺失允许与目的靶多核苷酸形成稳定的杂交体。可以以多种方法在给定的多核苷酸序列中产生突变、插入和缺失,这些方法为本领域普通技术人员所共知。其他方法可能在将来逐渐被了解。
PCR技术
聚合酶链式反应(PCR)是核苷酸序列的引发式的重复性酶合成。此方法为本领域技术人员所熟知并普遍使用(参阅Mullis,U.S.专利No.4,683,195、4,683,202和4,800,159、Saiki等,1985)。PCR是基于目的DNA片段的酶扩增,所述DNA片段两侧为与靶序列相反链杂交的两个寡核苷酸引物。引物优选在3’末端彼此指向。模板热变性、引物与其互补序列退火和用DNA聚合酶延伸退火引物的重复循环引起PCR引物5’末端所定义片段的延伸。每一引物的延伸产物可作为其他引物的模板,因此每个循环基本上倍增前一循环中产生的DNA片段数量。这引起特定靶片段的指数积累,可在几小时内多达数百万倍。通过使用热稳定的DNA聚合酶(如分离自嗜热水生菌(Thermus aquaticus)的Taq聚合酶)可以完全自动地完成扩增过程。可以使用的其他酶为本领域技术人员所共知。
示例DNA序列或其片段可以用作PCR扩增的引物。在PCR扩增中,引物和模板间某种程度的错配是可以接受的。因此,示例引物的突变、缺失和插入(特别是在5’末端加入核苷酸)在本发明的范围内。可以通过本领域普通技术人员已知的方法在给定的引物中产生突变、插入和缺失。
基因和蛋白质的修饰
本发明的基因可以与其他基因和蛋白质融合以产生嵌合或融合蛋白。本发明的有用基因和蛋白质不仅包括具体示例的全长序列,还包括这些序列的部分、区段和/或片段(包括临近片段和与全长分子相比内部和/或末端缺失)、其变体、突变体、嵌合体和融合物。只要保留所需的功能活性,本发明的蛋白质可以具有替换的氨基酸。“变体”基因含有编码具有与示例蛋白质等价或相似的活性的相同蛋白质或等价蛋白质的核苷酸序列。术语“变体蛋白”和“等价蛋白质”指对靶害虫具有相同或基本相同的生物/功能活性和与示例蛋白质等价的序列的蛋白质。本文所使用的“等价”序列指含有提高或不对活性产生显著不利影响的氨基酸替换、缺失、添加或插入的序列。保留活性的片段也包含于本发明中。保留了如示例蛋白质相应片段的相同或相似功能或活性的片段和其他等价物在本发明的范围内。可以为了各种目的(如(不严重/显著降低蛋白质功能活性地)提高(或降低)蛋白质的蛋白酶稳定性、去除或加入限制性位点等等)产生变化,如氨基酸替代或添加。例如,可以使用产生点突变的标准技术便利地构建基因的变异。
另外,如U.S.专利No.5,605,793描述了在随机或聚焦破碎后使用DNA重组装产生额外的分子多样性的方法。这可称为基因“改组”,一般包括混合两种或更多不同DNA分子的(所需大小的)片段,接着重复若干轮的复性。这可以改进起始基因所编码蛋白质的活性。结果为具有改进的活性、改变的底物特异性、提高的酶稳定性、改变的立体特异性或其他特征的嵌合蛋白。
得到并检查目的蛋白质的原子3D(三维)坐标和晶体结构之后可设计并靶向“改组”。因此,可以将“聚焦的改组”针对于修饰理想的蛋白质的某些片段,如表面暴露的片段,并优选不是与蛋白质折叠和基本的3D结构完整性相关的内部片段。
可以使用变体基因产生变体蛋白质,可以使用重组宿主产生变体蛋白质。使用这些“基因改组”技术可以构建含有本文示例的任何序列中任何5、10或20个连续残基(氨基酸或核苷酸)的等价基因或蛋白质。如本领域技术人员所了解的,可以调整基因改组技术以获得具有如与任何示例或建议序列(或其互补物(完整互补物))中(相同大小)的片段相对应的3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、183、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、219、220、221、222、223、224、226、227、228、229、230、231、232、235、236、237、238、239、240、242、243、244、245、246、247、248、249、250、251、253、254、255、256、258、259、260、261、262、263、264、265、266、268、269、270、271、272、273、274、275、276、277、278、279、282、284、285、286、287、288、289、290、291、292、293、294、295、296、297、298、299、300、301、302、303、304、305、306、307、308、309、310、311、312、313、314、315、316、317、318、319、320、323、324、325、326、327、328、329、330、331、332、333、334、335、336、337、338、339、340、341、342、343、344、345、346、347、348、349、350、351、352、353、354、355、356、357、358、359、360、361、362、363、366、367、368、369、370、371、372、373、374、375、376、377、380、381、382、383、384、385、386、387、388、389、390、391、392、393、394、395、396、397、398、399、400、401、402、403、404、405、406、407、408、409、410、411、412、413、414、415、416、417、418、419、420、421、422、423、424、425、426、427、428、429、430、431、432、433、434、435、436、437、438、439、440、441、442、443、444、445、446、447、448、449、450、452、453、454、455、456、457、458、459、460、461、462、463、464、465、466、467、468、469、470、471、472、473、474、475、476、477、478、479、480、481、482、483、484、485、486、487、488、489、490、491、492、493、494、495、496、497、498、499或500个连续残基(氨基酸或核苷酸)的等价物。类似大小的片段特别是保守区的片段也可以作为探针和/或引物。
可以根据标准程序使用市售的外切核酸酶或内切核酸酶产生全长基因的片段。例如,可以使用酶如(Bal31)或定向诱变从这些基因的末端系统地切除核苷酸。还可以使用多种限制性酶获得编码活性片段的基因。可以使用蛋白酶直接获得这些蛋白质的活性片段。
如本文所公开的,可以截短毒素而仍保留功能活性,这也在本发明的范围内。“截短的蛋白质”指蛋白质的部分可被切除,并在切除后仍保留并表现活性。可以通过多种蛋白酶进行切割。另外,可以使用分子生物学技术产生有效切割的蛋白质,其中通过用限制性内切核酸酶消化或本领域技术人员可使用的其他技术去除编码所述蛋白质的DNA碱基。截短后,可以在异源系统(如大肠杆菌、杆状病毒、基于植物的病毒系统、酵母等)中表达所述蛋白质,然后置于本文公开的昆虫实验中测定活性。如本领域所熟知,可以成功地产生小于完整的全长序列而保留功能活性的截短蛋白质。例如,可以以截短(核心蛋白质)形式使用B.t.蛋白质(参阅如Hofte等(1989)和Adang等,(1985))。本文所使用的术语“蛋白质”还可包括功能活性的截短物。
在一些情况下(特别是植物中的表达),使用编码截短蛋白质的截短基因可能是有利的。优选的截短基因一般编码全长蛋白质的40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、82、83、84、86、87、88、90、91、92、93、94、95、96、97、98或99%。
本发明的某些毒素已在本文中具体示例。这些毒素仅是本发明毒素的范例,显然本发明包括具有与示例毒素相同或相似活性的变体或等价蛋白质(和编码其等价物的核苷酸序列)。等价蛋白质与示例蛋白质具有氨基酸相似性(和/或同源性)。氨基酸同一性一般至少为60%,优选至少为75%,更优选至少为80%,甚至更优选至少为90%并可以至少为95%。还可以通过更具体的同一性和/或相似性范围定义本发明优选的蛋白质。例如,与本文示例或建议的序列相比,同一性和/或相似性可以为49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、82、83、84、86、87、88、90、91、92、93、94、95、96、97、98或99%。上文列出的任意数字可用于定义上限和下限。
除非另有说明,使用如Karlin和Altschul(1993),Proc.Natl.Acad.Sci.USA 90:5873-5877中所改良的Karlin和Altschul(1990),Proc.Natl.Acad.Sci.USA 87:2264-2268的算法测定本文所使用的两个核酸的序列同一性和/或相似性百分比。这样的算法整合在Altschul等(1990),J.Mol.Biol.215:402-410的NBLAST和XBLAST程序中。使用NBLAST程序进行BLAST核苷酸搜索,评分=100、字宽=12。可以如Altschul等(1997),Nucl.AcidsRes.25:3389-3402中所述使用Gapped BLAST。使用BLAST和GappedBLAST程序时,使用程序(NBLAST和XBLAST)各自的默认参数。参阅NCBI/NIH网址。使用默认参数用Vector NTI Suite 8(InforMax,Inc.,North Bethesda,MD,U.S.A)中的AlignX函数得到用于比较目的的缺口比对。它们是:缺口打开罚分15、缺口延伸罚分6.66和缺口分离罚分范围8。
还可以改变蛋白质的多种特性和三维特征而不对蛋白质的毒素活性/功能性产生不利影响。保守性氨基酸替换是可以接受的/可以产生而不对分子的三维构型产生不利影响。氨基酸可按以下分类:非极性、极性不带电荷、碱性和酸性。只要替换不损害化合物的生物活性,则保守性替换在本发明的范围内,在所述保守性氨基酸替代中,一类氨基酸被同一类型的另一氨基酸替换。表5提供属于每一类的氨基酸实例列表。
|
表5 |
|
|
氨基酸类别极性极性不带电荷酸性碱性 |
氨基酸实例丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、甲硫氨酸、苯丙氨酸、色氨酸甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺天冬氨酸、谷氨酸赖氨酸、精氨酸、组氨酸 |
在一些情况下,还可以进行非保守性替环。然而,优选的替换不显著降低蛋白质的功能/生物活性。
本文提到的“分离的”多核苷酸和/或“纯化的”蛋白质是指这些分子不伴随有与其天然共存的其他分子。因此,提到“分离的”和/或“纯化的”表示与本文所述的“人为”相关。例如,放入植物进行表达的本发明细菌“基因”是“分离的多核苷酸”。同样,植物所产生的来自细菌蛋白质的蛋白质是“分离的蛋白质”。
由于遗传密码的简并性/冗余性,多种不同的DNA序列都可以编码本文公开的氨基酸序列。产生编码相同或基本相同蛋白质的替代DNA序列在受本领域训练的技术人员的能力范围内。这些变体DNA序列在本发明的范围内。在下文标题为“用于植物表达的序列优化”的章节中对此也有更详细的描述。
用于植物表达的序列优化。为了在植物中得到异源基因的高表达,可能优选重新设计所述基因以使其在植物细胞(的胞质)中更有效的表达。玉米就是这样的一种植物,其中在转化前重新设计异源基因以提高其在所述植物中的表达水平可能是优选的。因此,在设计编码细菌毒素的基因中额外的步骤是使用与靶植物序列(双子叶植物或单子叶植物)更接近的密码子偏好重新改造异源基因以得到最优表达。还可以优化序列以在本文其他处讨论的更多具体类型植物中的任意一种中进行表达。
转基因宿主
可以将本发明的蛋白质编码基因引入多种微生物或植物宿主中。本发明包括转基因植物细胞和转基因植物。优选的植物(和植物细胞)为玉米、拟南芥、烟草、大豆、棉花、芸苔、稻、小麦、草坪草和牧草等等。还可以根据本发明产生其他类型的转基因植物,如水果、蔬菜和树木。更一般的,双子叶植物和/单子叶植物可用在本发明的多个方面中。
在优选的实施方案中,基因的表达直接或间接引起目的蛋白质在细胞内的产生(和保持)。植物可以以这种方式得到除草剂抗性。这些宿主可以指转基因、重组、转化和/或转染的宿主和/或细胞。在本发明的一些方面中(例如克隆和制备目的基因),可以借助本发明的公开内容根据标准技术产生和使用微生物(优选细菌)细胞。
转染了本发明多核苷酸的植物细胞可以再生为整个植株。本发明包括细胞培养物,包括组织细胞培养物、液体培养物和植物培养物。由本发明植物所产生和/或用于再生本发明植物的种子也包括在本发明范围内。其他植物组织和部分也包括在本发明中。本发明同样包括产生含有本发明多核苷酸的植物或细胞的方法。产生这些植物的一种优选方法为通过种植本发明的种子。
插入基因以形成转基因宿主。本发明的一个方面是用表达本发明蛋白质的本发明多核苷酸转化/转染植物、植物细胞和其他宿主细胞。以这种方式转化的植物可以获得对多种作用模式的多种除草剂的抗性。
可以使用多种方法在允许稳定保持和表达基因的条件下将所需蛋白质的基因引入靶宿主。这些方法为本领域技术人员所熟知,并描述于如美国专利No.5,135,867。
含有AAD-1多核苷酸的载体包括在本发明范围内。例如,大量克隆载体可用于将外来基因插入到高等植物中,所述载体含有大肠杆菌复制系统和允许选择转化的细胞的标记物。载体包括如pBR322、pUC系列、M13mp系列、pACYC184等。因此,可以在合适的限制性位点将编码蛋白质的序列插入载体。得到的质粒用于转化进大肠杆菌中。在合适的营养培养基上培养大肠杆菌细胞,然后收获并裂解。通过纯化从基因组DNA中回收质粒。作为分析方法,一般进行序列分析、限制性分析、电泳和其他生物化学-分子生物学方法。每次操作之后,可以切开所使用的DNA序列并与下一个DNA序列连接。每个质粒序列都可以克隆到同一个或其他质粒中。
取决于将所需基因插入到植物中的方法,其他DNA序列可能是必要的。例如,如果使用Ti或Ri质粒转化植物细胞,则必须连接Ti或Ri质粒T-DNA序列的至少右侧边界(但常为右侧和左侧边界)作为待插入基因的侧翼区域。T-DNA用于转化植物细胞的用途已在EP 120516、Hoekema(1985)、Fraley等,(1986)和An等(1985)中有深入的研究和详细的描述。
大量技术可用于将DNA插入植物宿主细胞。这些技术包括使用根瘤农杆菌或发根农杆菌(Agrobacterium rhizogenes)作为转化剂用T-DNA转化、融合、注射、生物射弹(微粒轰击)、碳化硅颈须、气溶胶柱、PEG或电穿孔以及其他可能的方法。如果用农杆菌进行转化,必须将待插入的DNA克隆进特殊的质粒中,即中间载体或二元载体中。由于与T-DNA中序列同源的序列,中间载体可以通过同源重组整合进Ti或Ri质粒。Ti或Ri质粒还含有转移T-DNA所必需的vir区。中间载体不能在农杆菌中自我复制。可以通过辅助质粒(缀合)将中间载体转移到根瘤农杆菌中。二元载体在大肠杆菌和农杆菌中都可以自我复制。它们含有选择标记物基因和接头或多聚接头,两侧为右和左T-DNA边界区。它们可以直接转化进农杆菌中(Holsters等,1978)。作为宿主的农杆菌含有携带vir区的质粒。vir区是将T-DNA转移进植物细胞所必需的。还可以含有额外的T-DNA。将这样转化的细菌用于转化植物细胞。可以有利地用根瘤农杆菌或发根农杆菌培养植物外植体,以将DNA转移进植物细胞。然后可以在合适的培养基中从感染的植物材料(如叶碎片、茎节段、根以及原生质体或悬浮培养的细胞)再生完整植物,所述培养基可以含有用于选择的抗生素或杀虫剂。然后可以测试这样得到的植物中插入DNA的存在。在注射和电穿孔的情况下质粒没有特殊的要求。可以使用普通质粒,如pUC衍生物。
转化细胞以通常的方式在植物中生长。它们可以形成生殖细胞并将转化的性状传递到子代植物。可以以正常方式培养这些植物并与具有同一转化遗传因子或其他遗传因子的植物杂交。得到的杂合个体具有相应的表型特性。
在本发明优选的一些实施方案中,从插入植物基因组的转录单位表达编码细菌蛋白质的基因。优选地,所述转录单位是重组载体,所述重组载体能够稳定整合进植物基因组,并使得可以选择表达编码蛋白质的mRNA的转化植物株系。
一但整合进基因组,则插入DNA在其中是相对稳定的(并不再释放出来)。它一般包含赋予转化植物细胞对杀虫剂或抗生素(如卡那霉素、G418、博来霉素、潮霉素或氯霉素等)的抗性的选择标记物。植物选择标记物一般还提供对多种除草剂(如glufosinate(PAT)、草甘膦(EPSPS)、imazethyapyr(AHAS)及许多其他除草剂)的抗性。单独使用的标记物应允许从不含有插入DNA的细胞中选择转化细胞。目的基因在植物中优选由组成型或诱导型启动子表达。一但表达之后,mRNA翻译成蛋白质,从而将目的氨基酸掺入蛋白质中。在植物中表达的编码蛋白质的基因可以在组成型启动子、组织特异性启动子或诱导型启动子的控制下。
存在若干将外来重组载体引入植物细胞和获得稳定保持和表达引入基因的方法。这些技术包括将包裹在微粒上的遗传物质直接引入细胞(Cornell的U.S.专利No.4,945,050和DowElanco,现在的DowAgroSciences,LLC的U.S.专利No.5,141,131)。此外,可以使用农杆菌技术转化植物,参阅University of Toledo的U.S.专利No.5,177,010;TexasA&M的5,104,310;欧洲专利申请0131624B1;Schilperoot的欧洲专利申请120516、159418B1和176112;Schilperoot的U.S.专利No.5,149,645、5,469,976、5,464,763和4,940,838和4,693,976;Max Planck的欧洲专利申请116718、290799、320500;Japan Tobacco的欧洲专利申请604662和627752和U.S.专利No.5,591,616;Ciba Geigy,现在的Novartis的欧洲专利申请0267159和0292435和U.S.专利No.5,231,019;Calgene的U.S.专利No.5,463,174和4,762,785和Agracetus的U.S.专利No.5,004,863和5,159,135。其他转化技术包括颈须技术。参阅Zeneca的U.S.专利No.5,302,523和5,464,765。也可以使用电穿孔技术转化植物。参阅Boyce ThompsonInstitute的WO 87/06614;Dekalb的U.S.专利No.5,472,869和5,384,253和Plant Genetic Systems的WO 92/09696和WO 93/21335。另外,也可以用病毒载体产生表达目的蛋白质的转基因植物。例如,可以用MycogenPlant Science和Ciba-Giegy(现在的Syngenta)的U.S.专利No.5,569,597以及Biosource(现在的Large Scale Biology)的U.S.专利No.5,589,367和5,316,931中所述的方法用病毒载体转化单子叶植物。
如前述,将DNA构建体引入植物宿主的方法对于本发明不是关键的。任何提供有效转化的方法都可以使用。例如,本文描述了多种植物细胞转化的方法,包括使用Ti或Ri质粒等进行农杆菌介导的转化。在许多情况下,需要用T-DNA边界与用于转化的载体的一侧或两侧(更具体地为右侧)相连。尽管T-DNA边界也可见用于其他转化模式,但在使用根瘤农杆菌或发根农杆菌作为转化模式时特别有用。在将农杆菌用于植物细胞转化时,可以使用能引入宿主以与宿主中存在的T-DNA或Ti或Ri质粒同源重组的质粒。可以通过电穿孔、三亲杂交和本领域技术人员已知的用于转化革兰氏阴性菌的其他技术进行载体导入。载体转化进农杆菌宿主的方式对于本发明不是关键的。含有用于重组的T-DNA的Ti或Ri质粒可以能够或不能引起根肿大成瘤(gall formation),只要所述宿主中存在vir基因,这对本发明就不是关键的。
将农杆菌用于转化时,在一些情况下将T-DNA边界内的表达载体插入广谱载体如pRK2或其衍生物中,如本文引入作为参考文献的Ditta等,PNASUSA(1980)77:7347-7351和EPO 0120515中所述。表达构建体和T-DNA内包括一个或多个如本文所述允许选择转化农杆菌和转化植物细胞的标记物。使用的具体标记物对于本发明并不重要,优选的标记物取决于所使用的宿主和构建体。
为了用农杆菌转化植物细胞,可以将外植体与转化农杆菌组合并孵育足够的时间以允许其转化。转化后,通过用适当抗生素的选择杀死农杆菌,并用适当的选择培养基培养植物细胞。一但形成愈伤组织,可以根据植物组织培养和植物再生领域已知的方法通过使用适当的植物激素促进芽形成。然而,愈伤组织中间期并不总是必要的。芽形成以后,可以将所述植物细胞转移到促进根形成的培养基,从而完成植物再生。可以培养植物产生种子,所述种子可以用于建立将来的世代。不考虑转化技术,优选将编码细菌毒素的基因整合进基因转移载体中,通过在载体中包含植物启动子调节元件以及3’非翻译转录终止区(如Nos等)使所述转移载体适于在植物细胞中表达该基因。
除了用于转化植物的大量技术之外,与外来基因接触的组织类型也可以是多样的。这些组织包括但不仅限于胚胎发生组织、I、II、和III型愈伤组织、下胚轴、分生组织、根组织、用于韧皮部表达的组织等。使用本文所述的适当技术几乎可以在去分化中转化几乎所有的植物组织。
如上文所述,需要时可以使用多种选择标记物。具体标记物的选择由技术人员决定,但是任何以下的选择标记物以及本文未列出的能发挥选择标记物功能的其他基因都可以使用。这些选择标记物包括但不仅限于编码对抗生素卡那霉素、新霉素和G418的抗性的转座子Tn5氨基糖苷磷酸转移酶基因(Aph II)以及编码对草甘磷、潮霉素、氨甲喋呤、草铵磷(双丙氨磷或glufosinate)、咪唑啉酮、磺酰脲和三唑嘧啶除草剂(如氯磺隆、溴草腈、茅草枯等)抗性或耐性的基因。
除了选择标记物以外,可能需要使用报道基因。在一些情况下,报道基因可以与或不与选择标记物一起使用。报道基因一般是在受体生物或组织中不存在的基因,一般编码引起一些表型变化或酶特性的蛋白质。Weising等.1998中提供了这些基因的实例。优选的报道基因包括大肠杆菌uidA基因座的β-葡糖醛酸糖苷酶(GUS)、来自大肠杆菌Tn9的氯霉素乙酰转移酶基因、来自生物发光水母维多利亚多管水母(Aequorea victoria)的绿色荧光蛋白和来自萤火虫Photinus pyralis的荧光素酶基因。接着可以在所述基因引入受体细胞后的适当时间实施检测报道基因表达的试验。优选的这些方法使用如Jefferson等1987所述的大肠杆菌uidA基因座编码β-葡糖醛酸糖苷酶(GUS)的基因鉴定转化细胞。
除了植物启动子调节元件以外,可以在植物细胞中有效地使用来自多种来源的启动子调节元件表达外源基因。例如,可以使用细菌来源的启动子调节元件,如章鱼碱合酶启动子、胭脂碱合酶启动子、甘露碱合酶启动子;病毒来源的启动子,如花椰菜花叶病毒(35S和19S)、35T(再改造的35S启动子,参阅U.S.专利No.6,166,302,特别是实施例7E)等。植物启动子调节元件包括但不仅限于核酮醣-1,6-二磷酸(RUBP)羧化酶小亚基(ssu)、β-伴大豆球蛋白(conglycinin)启动子、β-菜豆素启动子、ADH启动子、热休克启动子和组织特异性启动子。还可以存在其他元件,如基质附着区、支架附着区、内含子、增强子、多腺苷酸化序列等,从而提高转录效率或DNA整合。尽管这些元件可能通过影响转录、mRNA稳定性等提供较好的DNA表达或功能,但是它们对DNA功能可能是或不是必需的。这些元件可以如所需包含在DNA中,以得到转化DNA在植物中的优化表达。典型元件包括但不仅限于Adh-内含子1、Adh-内含子6、苜蓿花叶病毒外壳蛋白前导序列、玉米线条病毒外壳蛋白前导序列以及其他本领域技术人员可用的元件。还可以使用组成型启动子调节元件从而指导在所有细胞类型和所有时间的持续基因表达(如肌动蛋白、泛素、CaMV 35S等)。组织特异性启动子负责在特定细胞或组织类型(如叶或种子)中的基因表达(如玉米蛋白、油质蛋白、油菜籽蛋白、ACP、球蛋白等),这些也可以使用。
启动子调节元件也可以在植物发育的某些阶段有活性(或无活性)以及在植物组织和器官中有活性。这些的实例包括但不仅限于花粉特异性、胚胎特异性、玉米穗丝特异性、棉花纤维特异性、根特异性、种子胚乳特异性或营养期特异性启动子调节元件等。在某些情况下可能需要使用诱导型启动子调节元件,其负责应答于特定信号(如物理刺激(热休克基因)、光(RUBP羧化酶)、激素(Em)、代谢物、化学品(四环素应答)和胁迫)的基因表达。还可以使用在植物中发挥功能的其他所需的转录和翻译元件。本领域已知大量植物特异性基因转移载体。
基于植物RNA病毒的系统也可用于表达细菌蛋白质。为此,可以将编码蛋白质的基因插入感染目的宿主植物的适当植物病毒的外壳启动子区。然后可以表达蛋白质从而为植物提供对除草剂损害的保护。基于植物RNA病毒的系统描述于Mycogen Plant Sciences,Inc.的U.S.专利No.5,500,360和Biosource,现在的Large Scale Biology的U.S.专利No.5,316,931和5,589,367。
本文提到或引用的所有专利、专利申请、临时申请和出版物整体引入为参考,引用程度不与本说明书的明确教导相冲突。
以下为说明本发明操作实践的实施例。这些实施例不应理解为限制性的。除非另有说明,所有的百分比均以重量计,所有的溶剂混合物比例以体积计。
实施例1-鉴定在植物中输入对2,4-滴抗性的基因的方法
作为鉴定在植物中具有除草剂降解活性的基因的方法,可以发掘现有的公共数据库如NCBI(国家生物技术信息中心)。为开始此过程,需要有已鉴定为编码具有所需特征(即α酮戊二酸双加氧酶活性)的蛋白质的基因。接着将此蛋白质序列用作BLAST(基本局部比对检索工具)(Altschul,1997)算法的输入,以对存储的可用NCBI蛋白质序列进行比较。使用默认设置,此工具返回不同水平的100个以上同源蛋白质序列。它们在氨基酸水平的范围从高同一性(85%-98%)到极低同一性(23%-32%)。通常仅高同源性的序列可预期保留与输入序列相似的活性。在这种情况下我们仅选择具有≤50%的同源性的序列。我们继续举例说明,克隆和重组表达低至27%氨基酸保守性的同系物不仅可用于输入对计划内的除草剂的商品水平的抗性,还可用于输入对从未用这些酶测试过的底物的抗性。
PCR基因并克隆进pET
从NCBI数据库鉴定了与来自真养雷氏菌的tfdA仅有28%氨基酸同一性的单基因(rdpA)(参阅ncbi.nlm.nih.gov站点,登录号AF516752)。通过首先将数据库中保存的rdpA和tfdA翻译成蛋白质,然后用VectorNTI软件包中的ClustalW进行多重序列比对来测定同一性百分比。
含有rdpA的Sphingobium herbicidovorans菌株得自ATCC(美国典型培养物保藏中心,菌株号700291)。根据ATCC方案复苏冻干的菌株,并以Dow细菌菌株DB 536在20%甘油中保存于-80℃用于内部用途。从此冷冻贮液取一菌环细胞涂在胰蛋白酶大豆琼脂平板上,并在28℃孵育3天。
用一单菌落接种到500ml三角瓶中的100ml胰蛋白酶大豆培养液中,将三角瓶在摇床上以150rpm在28℃孵育过夜。用Qiagen的DNeasy试剂盒(Qiagen目录号69504)的革兰氏阴性方案从其中提取总DNA。设计以下引物以从基因组DNA扩增靶基因,正向:5′
TCT AGA AGG AGA TAT ACC ATG CAT GCT GCA CTG TCC CCC CTC TCC CAG CG 3′[(SEQ ID NO:1)(加入了Xba I限制性位点和核糖体结合位点(RBS))]和反向:5′
CTC GAG TTA CTA GCG CGC CGG GCG CAC GCC ACCGAC CG3′[(SEQ ID NO:2)(加入了额外的终止密码子和XhoI位点)]。
按以下装配20μl反应物:MasterMix 8μl、ea.引物1μl(50pmole/μl)、gDNA 2.5μl、H2O 7.5μl。然后按以下条件进行PCR:94℃45秒、52℃1.5分钟、72℃1.5分钟的30个循环,接着为72℃5分钟的终循环,使用Eppendorf Master Taq试剂盒(Eppendorf目录号0032002.250)。使用化学感受态TOP10F′大肠杆菌作为宿主菌株,按照所包含的方案将得到的约1kb的PCR产物克隆进pCR 2.1(Invitrogen目录号K4550-40)中用于验证核苷酸序列。
挑取10个得到的白色菌落到4ml Luria Broth+50μ/ml卡那霉素(LBK)中并在37℃搅动生长过夜。使用Promega Wizard Plus SV试剂盒(Promega目录号A1460)按照所包含的方案从每个培养物提取质粒。按照生产商的说明使用M13正向(5′GTA AAA CGA CGG CCA GT3′)(SEQ ID NO:16)和反向(5′CAG GAA ACA GCT ATG AC3′)(SEQID NO:17)引物,用Beckman CEQ Quick Start试剂盒(Beckman Coulter目录号608120)进行测序。为了内部一致,将此基因序列(SEQ ID NO:3)及其相应蛋白质(SEQ ID NO:9)给予新的一般命名AAD-1(v1)(芳氧基链烷酸酯双加氧酶,
芳氧基链烷酸酯
Dioxygenase)。
使用与引物接头一起加入的位点相应的限制性酶(Xba1、Xho1)将AAD-1(v1)从pCR2.1载体中切出并连接进pET 280链霉素/大观霉素抗性载体中。接着将连接产物转化进TOPI OF′大肠杆菌,并涂在Luria Broth+50μg/ml链霉素&大观霉素(LB S/S)琼脂平板上。为区分AAD-1(v1):pET280和pCR2.1:pET 280连接,挑取约20个分离菌落至6ml LB S/S中,并在37℃摇动培养4小时。
然后将每个培养物点到LBK平板上,在37℃孵育过夜。假定在LBK上生长的菌落具有连接进的pCR2.1载体,将其弃去。如前述从剩余的培养物提取质粒。给此表达构建体命名为pDAB 3203。
实施例2-表达和测试
2.1-HPLC分析
以Dow重组菌株DR 1878在TOP10F′细胞中将质粒pDAB 3203保存于-80℃。为进行表达,按照生产商的说明将使用Promega的Wizard试剂盒(Fisher目录号PR-A1460)纯化的质粒DNA转化进BL-21Star(DE3)细胞(Invitrogen目录号C6010-03)。转化后,将50μl细胞涂在LB S/S琼脂平板上并在37℃孵育过夜。
第二天早上,刮下整个平板上的所有菌落至500ml三角瓶中的100mlLB中并在37℃/200rpm孵育1小时。接着用1mM IPTG诱导基因表达并在30℃/200rpm孵育4小时。将全部100ml培养物以4000rpm离心20分钟。然后弃去上清液,将沉淀重悬于10ml 50mM MOPS中。接着对其进行三轮45秒的超声处理以裂解细胞。其后将裂解液以15000rpm离心去除细胞碎片。吸出上清液并保存于4℃。为检查重组表达,将20μl的等分式样在4%-20%Tris甘氨酸琼脂(Invitrogen目录号EC60255)上进行电泳。
确认表达后,按以下测试酶活性。首先,用PD-10管(Amersham目录号17-0435-01)除去细胞提取物的等分式样的盐分。然后将其用于其后的除草剂酶反应。
对于每个反应,组合2,4-滴(125μg/ml)、[100mM MOPS中的维生素C(1mM)、亚铁离子(50μM)、α酮戊二酸(1mM)]和细胞提取物(100μl)。接着将此反应物在室温下孵育30分钟,其后加入0.1N HCl至pH在2和3之间,以终止反应。留出一半反应体积(约500μl)用于生物测定,剩余的体积用Solid Phase Extraction管(Fisher目录号11-131-6)有机提取,用400μl乙腈+0.05%TFA洗脱。
接着在HPLC上对提取物测试2,4-滴峰的降低或由2,4-滴降解或修饰引起的任意其他峰的存在。HPLC条件为:Luna 10μ C18(2)250×4.6mm(Phenomenex目录号00G-4253-E0),以50%ACN+0.05%TFA:50%H2O+0.05%TFA到100%ACN+0.05%TFA运行5分钟。
2.2-除草剂降解的平板测试生物测定
植物生物测定用于测定体外的酶促除草剂转化是否引起除草剂活性的伴随降低。由于测试的除草剂的选择性性质(即,AOPP除草剂控制单子叶植物而生长素除草剂控制双子叶植物),分别使用野生型Agrostispalustris var.Pencross和拟南芥哥伦比亚变种作为单子叶和双子叶测试物种。使每个物种在小培养皿中萌发和生长。
在加入1μL Tween-20作为湿润剂的50%商品漂白剂/去离子水(体积/体积)中剧烈摇动(振动台,250rpm)使拟南芥种子表面灭菌。在无菌管中将漂白剂溶液倒出并用无菌水漂洗三次。以类似的方式将翦股颖种子表面灭菌20分钟。
将每个测试物种的20到30个灭菌种子加入60×15mm培养皿(Falcon1007)中的无菌固体琼脂平板测试培养基(PTM)[2.5mM KNO3、2.5mMKH2PO4、50mM FeSO4、10mM NaEDTA(pH8.0)、2mM MgSO4、2mMCa(NO3)2、70μM H3BO3、14μM MnCl2、0.5μM CuSO4、1μM ZnSO4、0.2μM NaMoO4-2H2O、10μM NaCL、10nM CoCl2-H2O、0.8%(重量/体积)蔗糖、0.4%葡萄糖(重量/体积)]中用于生物测定。再通过加入多至6个剂量的测试除草剂标准品或除草剂-酶测试溶液稀释液来修饰PTM,以使四倍的浓度增量覆盖三个数量级的等级范围,同时GR50率(50%生长降低)约在范围的中间。
对于除草剂酶测试溶液,在出现任何继发的酶降解之前先基于标称浓度测定最大浓度。通过加入3ml熔化的同一组成的PTM、振荡并凝固使种子均匀分布。密封平板并在无菌条件下在低光生长室(24小时天-1、100μE/m2s1、23℃)中维持7天。分别测量五株随机选择的拟南芥和翦股颖植物的根长度或根+嫩枝长度,测定平均长度(未处理对照百分比)和标称除草剂浓度和GR50。
此生物测定用于证实由多种农学相关除草剂oxyalkanoate侧链的AAD-1(v1)降解引起的除草剂活性的损失。在一些情况下,HPLC上与母体酸共洗脱的预期酚产物和该生物测定用作除草剂降解的原始筛选。表6和7表示测试的除草剂底物。
*空白载体代表无基因插入片段的大肠杆菌pET载体的细胞裂解液处理。
**GR50比衡量酶表达裂解液处理比空白载体处理的除草剂活性损失。数字≥2认为是此测定中检测除草剂活性损失的阈值。
*空白载体代表无基因插入片段的大肠杆菌pET载体的细胞裂解液处理。
**GR50比衡量酶的裂解液处理比空白载体处理的除草剂活性损失。数字≥2认为是此测定中检测除草剂活性损失的阈值。
2.3-HPLC结果
从文献中已知此类双加氧酶需要作为协同底物的α酮戊二酸(一般性描述见图1)和亚铁离子以结合活性位点。文献中的其他实验已经显示加入维生素C通过维持铁的还原态从而防止酶被降解而提高酶活性。基于此先期工作,在本发明酶以与此大类酶的其他成员相同的方式工作这一假设下安排初始测定。
令人惊奇地,起始HPLC结果显示除了5.5分钟处降低的2,4-滴峰以外,还在6.1分钟存在新的峰。这一新峰在对照测定中不存在。为对6.1分钟处的峰进行初步鉴定,在我们的测定条件下用DCP对照进行实验,预期其也在6.1分钟处洗脱。使用比色测定检测酚(见实施例3.1)以及质谱确认此产物的形成。与预期一致,AAD-1(v1)与此酶类别的其他成员实现相似的反应。在生物测定中,这些相同的样品还在拟南芥平板测定中显示2,4-滴除草剂活性几乎完全的丧失(图2)。不考虑测定的具体条件(即较长的孵育、较多的酶),HPLC中仅50%-75%的2,4-滴可降解为DCP。事实上,尽管表达了更多的总重组蛋白,用IPTG更长时间的诱导BL-21大肠杆菌仅得到更弱活性的酶。
证明了2,4-滴的降解之后,以类似的环取代(即氧丙酮和氧丙酸)测试其他底物。首先测试的化合物是吡啶类似物fluroxypyr和triclopyr,均为pyridinyloxyacetates。对于这些底物中的任一种均未检测到酶活性。对去除氟或氨基团的这两种pyridinyloxyacetates的多种类似物的其他测试中也无降解。然而,有趣的是在2,4-滴的5位置加入氟导致酶降解的几乎完全丧失(其他结果见以下章节)。
其后使用与2,4-滴相同的条件测试了ACC酶抑制剂吡氟氯禾灵和禾草灵。(在所使用的HPLC条件下相应的酚代谢物与母体化合物共洗脱)。这些样品的生物测定结果显示针对吡氟氯禾灵(图3)和禾草灵的除草剂活性丧失。还通过也用于测试这些化合物的更多样品的比色测定证实了这些结果。
2.4-除草剂降解的平板测试生物测定
生物测定测试结果确证了表明将2,4-滴溶液与未纯化重组AAD-1(v1)提取物孵育后2,4-滴母体丧失的HPLC结果(图2)。另外,苯氧丙酸2,4-滴丙酸也被有效降解。除草剂+酶溶液的标称GR50与单独的除草剂溶液的比值作为酶活性引起的母体除草剂活性丧失的量度。2-3的比值一般对应于母体除草剂活性50%-75%的丧失(表6)。酶处理后常不能测定GR50,事实上,没有可检测的除草剂活性剩余。
如翦股颖平板生物测定中禾本科除草剂活性的几乎完全降解(图3和图7)所示,AOPP类除草剂也可作为AAD-1(v1)的优良底物。这些数据的意义在于这是第一次报道观察到这类酶的任何成员对苯氧基生长素之外的除草剂具有活性。其内在含义在于此酶广泛到可以利用具有类似苯氧基链烷酸酯亚结构的化学品,尽管它们作为除草剂具有完全不同的作用模式。
实施例3-通过比色酚检测体外测定AAD-1
(v1)活性
3.1-AAD-1
(v1)测定
通过产物酚的比色检测测量AAD-1(v1)酶活性,其中使用由Fukumori和Hausinger(1993)(J.Biol.Chem.268:24311-24317)的方案改良以允许使用96孔微孔板形式的方案。已有描述将比色测定用于测量双加氧酶裂解2,4-滴和2,4-滴丙酸以释放产物2,4-二氯苯酚。然而,也可能从不同的芳氧基链烷酸酯除草剂如吡氟氯禾灵和cyhalofop释放其他酚(见图4)。使用前述检测方法将来自若干酚的颜色与2,4-二氯苯酚的进行比较,以确定哪种酚产物便于检测。在含有200μM NH4(FeSO4)2、200uM维生素C酸钠的0.15ml 20mM MOPS pH6.75中以100μM终浓度检测酚和酚类似物。容易检测到,来自吡氟氯禾灵和cyhalofop的酚具有与2,4-二氯苯酚等价的颜色。来自fluroxypyr和triclopyr的Pyridinol未产生明显的颜色。在高至500μM的测定中,2,4-二氯苯酚和吡氟氯禾灵酚的颜色产生是线性的,并与酚浓度成比例。在标准测定条件(160μl终测定体积)下得到的校正曲线表明从172μM酚可得到510nm处1.0的吸收。
在含有200μM NH4FeSO4、200μM维生素C酸钠、1mMα酮戊二酸、适当底物(以DMSO中制备的100mM原液加入)和酶的总体积0.15ml的20mM MOPS pH6.75中进行酶测定。在时间零点加入芳氧基链烷酸酯底物、酶或α酮戊二酸起始反应。在25℃孵育15分钟后,通过加入10μl 100mM EDTA酸钠终止反应。通过加入15μl pH10缓冲液(3.09g硼酸+3.73g KCl+44ml 1NKOH)、1.5μl 2%4-氨基安替比林和1.5μl8%铁氰化钾显色。10到20分钟后,在分光光度微孔板读数器中记录510nm处的吸收。空白含有除酶以外的所有试剂,以补偿底物被少量酚造成的偶然的轻微污染。通过固定加入以下来更便利的进行以后的测定:通过加入30μl 1∶1∶1混合的50mM Na EDTA、pH10缓冲液和0.2%4-氨基安替比林并接着加入10μl 0.8%铁氰化钾来淬灭反应。
3.2-提取
大肠杆菌中表达的重组AAD-1
(v1)的活性
室温下将大肠杆菌细胞沉淀重悬于0.1M Tris,pH7.4+1mg/ml溶菌酶(5ml/来自250ml培养物的细胞,20ml/来自1升的细胞)中。间或振荡15分钟后,将悬液在液氮中冰冻再融化。以0.02mg/ml的终浓度加入DNA酶,以1mM加入MgCl2。当提取物不再黏稠后将提取物离心15分钟。使上清液经过用20mM MOPS pH6.75预平衡的BioRad l0DG柱,并将洗脱液以等分式样保存于-70℃。用这些未纯化的脱盐提取物或纯化的酶进行测定。
使用前述方案提取来自250ml经诱导大肠杆菌细胞培养物的细胞沉淀并测定,所述大肠杆菌细胞表达含有编码AAD-1(v1)的基因的pDAB3203。用1mM 2,4-滴将AAD-1(v1)提取物的2,4-滴裂解活性与来自表达无AAD-1(v1)的载体的大肠杆菌细胞的活性进行比较,示于图5。形成的2,4-二氯苯酚的量与测定中加入的提取物的量明显成比例,而对照提取物不含2,4-滴裂解活性。
对另外四种除草剂(R,S)-2,4-滴丙酸、(R,S)-2-甲-4-氯丙酸、(R,S)-吡氟氯禾灵和(R,S)-禾草灵测试此提取物的活性与2,4-滴进行比较(终浓度均为0.5mM),其中每个测定使用4μl大肠杆菌提取物和15分钟的测定期。图6A显示AAD-1(v1)裂解全部五种除草剂而得到酚,对底物的相对活性为2,4-滴丙酸=2-甲-4-氯丙酸>禾草灵>吡氟氯禾灵>2,4-滴。因此AAD-1(v1)对禾本科芳氧基苯氧丙酸酯除草剂和苯氧基生长素具有活性。
接着使用消旋(R,S)-吡氟氯禾灵、吡氟氯禾灵的R对映体和cyhalofop的S对映体(均为0.5mM)作为可能的底物测试AAD-1(v1)提取物以确证AAD-1(v1)可能的对应结构体特异性。结果示于图6B。酶对(R)-吡氟氯禾灵的活性与对(R,S)-吡氟氯禾灵的活性等价,而对S对映体则未见到活性,说明AAD-1(v1)对AOPP具有R特异性。
实施例4-AAD-1
(v1)的底物特异性
4.1-AAD-1
(v1)的其他底物
测试了AAD-1(v1)对多种商品和实验性除草剂的底物特异性。每个160μl测定使用1或10μg纯化的AAD-1(v1),以1mM和15分钟的测定时间测试每种底物。表3显示了多种芳氧基链烷酸酯生长素除草剂和生长素类似物经AAD-1(v1)作用后检测到的A510。测试的最佳底物为2,4-滴丙酸,2-甲-4-氯丙酸也被有效裂解。AAD-1(v1)还有效作用于两种其他的苯氧丙酸:2,4-滴丙酸的4-氟和3-氨基类似物。在使用较高量(10μg)AAD-1(v1)的测定中更好的度量了对这些底物的相对剂量。从这些数据看,2,4-滴被AAD-1(v1)裂解,两种苯氧基烷基磺酸X188476和X398166(sesone)也是如此。
表4显示多种AOPP禾本科除草剂及安全剂解毒喹作为AAD1底物的数据。测试的所有商品AOPP除草剂均被AAD-1(v1)高效裂解。这是未曾预期的发现,并大大提高了此酶在转基因用途中用于赋予对多种禾本科除草剂(不仅包括生长素)的抗性的潜在功用。AAD-1(v1)对喹禾灵具有最高的活性(2,4-滴丙酸剂量的76%),对cyhalofop具有最低的活性(喹禾灵剂量的27%,2,4-滴丙酸剂量的21%)。吡氟氯禾灵的芳氧基乙酸类似物(X043865)被裂解得十分缓慢,使用较高(10μg)的酶量后A510仅略有增加。这与AAD-1(v1)在苯氧丙酸上观察到的相对于苯氧乙酸生长素更高的活性一致。在(S)-cyhalofop上观察到最低的活性,说明AAD-1(v1)对芳氧基丙酸底物的R对映体具有明显的偏好。类似的,对quinolinoxyacetate安全剂解毒喹也未记录到活性,这与AAD-1(v1)优选芳氧基丙酸底物胜过苯氧基生长素这一观察一致。
每个测试使用27μg粗重组AAD-1(v1)测试1mM的底物X11115427、X124987和MCPA。全部三种化合物均为AAD-1(v1)的底物,但具有不同的相对效率(表8)。与作为底物优于2,4-滴约7倍的近亲类似物3-氨基2,4-滴丙酸(表3)相反,X11115427作为底物稍优于2,4-滴(2,4-滴剂量的125%)。5-F取代似乎降低了X11115427作为AAD-1(v1)底物的效率。来自5-F-苯氧乙酸和MCPA的产物形成率分别为2,4-滴的32%和55%。
表8:AAD-1(v1)对三种底物相对于2,4-滴的效率。使用提取自大肠杆菌的粗重组AAD-1(v1)测定1mM的表6中的底物。
4.2-动力学特征
在标准测定条件(25mM MOPS,pH 6.8、200μtM维生素C酸钠、200μM Fe2+、1mMα酮戊二酸、25℃)下测定纯化的AAD-1(v1)对四种除草剂底物(R)-2,4-滴丙酸、(R)-吡氟氯禾灵、(R)-喹禾灵和2,4-滴的Km和kcat值(参阅实施例10)。使用Grafit(Erithacus Software,UK)拟合剂量应答曲线,图表和产生的常量分别示于图7和表9。对四种底物的Km值相当类似(75-125μM),但kcat。值存在显著差别。(R)-2,4-滴丙酸具有最高的kcat值,2,4-滴最低((R)-2,4-滴丙酸的10%)。由于在高(饱和)底物浓度(1mM)下进行这些测定,这些kcat值与表3和表4中所示底物特异性测试中的值的范围一致。
表9:AAD-1(v1)底物的动力学常数。使用米-曼方程的Grafit拟合从图7的数据产生动力学常数。
|
表9.底物的动力学常数 |
|
底物 |
Km(μM)±SE |
Vmax(μmol min-1mg-1AAD1)±SE |
kcat(分钟-1) |
kcat/Km(分钟-1mM-1) |
|
R-2,4-滴丙酸 |
75±10 |
0.79±0.03 |
26.1 |
348 |
|
R-喹禾灵 |
125±20 |
0.57±0.03 |
18.9 |
151 |
|
R-吡氟氯禾灵 |
120±54 |
0.34±0.04 |
11.2 |
94 |
|
2,4-滴 |
96±8 |
0.57±0.00 |
2.7 |
28 |
2,4-滴丙酸和2,4-滴的相对Km和Kcat值与Westendorf等(2003)(ActaBiotechnol.23:3-17)等出版的来自Delftia acidovorans的R特异性双加氧酶的值存在显著差异。已出版的2,4-滴的Kcat/Km值为2,4-滴丙酸的0.6%,而在我们的研究中,2,4-滴的Kcat/Km值为2,4-滴丙酸的8%。因此,在此研究中AAD-1
(v1)催化裂解2,4-滴出乎意料的有效。这提高了其在转基因应用中用于赋予多种除草剂耐性性状的潜在功用。
4.3-AAD-1
(v1)的其他底物
在每个测试中使用27μg粗重组AAD-1(v1)测试1mM的其他三种底物X11115427、X124987和MCPA。全部三种化合物均为AAD-1(v1)的底物,但具有不同的相对效率。X11115427作为底物仅稍优于(125%)2,4-滴。这与作为底物优于2,4-滴约7倍的3-氨基2,4-滴丙酸(表3)相反。因此,5-F取代显著降低了X11115427作为AAD-1(v1)底物的效率。用5-F-2,4-滴也观察到类似的模式,其作为底物的效率仅相当于2,4-滴的32%。在此测定中,MCPA作为AAD-1(v1)底物的效率的产物也较低(2,4-滴的55%)。
实施例5-用于植物表达的序列优化
5.1-背景
为了在植物中得到异源基因的高表达,可能优选重新设计所述基因以使其在植物细胞(的胞质)中更有效的表达。玉米就是这样的一种植物,其中在转化前重新设计异源基因以提高其在所述植物中的表达水平可能是优选的。因此,在设计编码细菌蛋白质的基因中额外的步骤是重新改造异源基因以得到最优表达。
在玉米中进行表达时重新改造细菌蛋白质的一个原因是由于天然基因的非最优G+C含量。例如,许多天然细菌基因极低的G+C含量(和因此高A+T含量的倾向)引起产生模拟或复制已知为高度富含A+T的植物控制序列的序列。在引入植物的基因中存在一些富含A+T的序列(如一般见于基因启动子中的TATA盒区)可能引起基因的异常转录。另一方面,转录的mRNA中其他调节序列(如多腺苷酸化信号序列(AAUAAA)或与前mRNA剪接相关的核内小RNA的互补序列)的存在可能导致RNA的不稳定性。因此,设计用于玉米表达的编码细菌蛋白质的基因(更优选称为植物优化基因)的一个目的是产生具有较高G+C含量(优选与编码代谢酶的玉米基因接近的G+C含量)的DNA序列。设计编码细菌蛋白质的植物优化基因的另一个目的是产生其序列修饰不阻碍翻译的DNA序列。
表10展示了玉米中的G+C含量有多高。对于表10中的数据,基因的编码区出自GenBank(第71次发布)条目,并用Mac Vector.TM.程序(Accelerys,San Diego,California)计算碱基组成。计算中忽略了内含子序列。
|
表10:玉米基因蛋白质编码区G+C含量汇编 |
|
蛋白质分类(注a)代谢酶(76)结构蛋白(18)调节蛋白(5)未表征蛋白质(9)所有蛋白质(108) |
G+C百分比范围44.4-75.348.6-70.557.2-68.841.5-70.344.4-75.3 |
平均G+C百分比(注b)59.0(.+-.8.0)63.6(.+-.6.7)62.0(.+-.4.9)64.3(.+-.7.2)60.8(.+-.5.2) |
注a:每一类基因的数目在括号内给出。
注b:标准差在括号内给出。
注c:平均值计算中忽略了组合组平均值。
由于遗传密码的冗余性/简并性(即一些氨基酸由多于一个密码子指定)提供的可塑性,基因组在不同生物或不同纲的生物中的进化引起了对冗余密码子不同的使用。在蛋白质编码区的平均碱基组成中反映了这种“密码子偏好”。例如,具有相对低G+C含量的生物使用冗余密码子的第三个位置上为A或T的密码子,而具有较高G+C含量的使用第三个位置上为G或C的密码子。mRNA中少见密码子的存在被认为可降低该mRNA的绝对翻译率,特别是对应于少见密码子的载荷tRNA的相对丰度低时。这一事实可扩展为:对于多个少见密码子,单个少见密码子对翻译的降低将至少是累加的。因此,具有相对高含量少见密码子的mRNA将相应的具有低翻译率。该翻译率将进而反映为低水平的编码蛋白质。
在设计用于玉米(或其他植物,如棉花或大豆)表达的编码细菌蛋白质的基因时已经测定了所述植物的密码子偏好。玉米的密码子偏好是该植物用于编码其蛋白质的密码子统计分布,表11显示了优选的密码子使用。测定偏好之后,测定目的基因中密码子的频率百分比。应该测定植物优选的主要密码子,在存在多种选择时,还要测定优选密码子的第二、第三和第四选择。设计编码细菌蛋白质的氨基酸序列的新DNA序列,但新DNA序列通过用植物(第一优选,第二优选、第三优选或第四优选)密码子进行替换以指定蛋白质氨基酸序列内每个位置的氨基酸而区别于(编码蛋白质的)天然细菌DNA序列。然后分析新序列中可能由修饰产生的限制性酶切位点。通过用第一、第二、第三或第四选择的优选密码子取代该密码子来进一步修饰鉴定出的位点。序列中可能影响目的基因转录或翻译的其他位点为外显子-内含子接合处(5’或3’)、多腺苷酸加成信号或RNA聚合酶终止信号。进一步分析和修饰序列,以降低TA或GC双联体的频率。除了双联体之外,具有多于约四个相同碱基的G或C序列嵌段也能影响序列的转录。因此,也通过用下一优选的密码子选择取代首选或次选的密码子来修饰这些嵌段。
|
表11.在玉米中表达的蛋白质优选的氨基酸密码子 |
|
氨基酸 |
密码子* |
|
丙氨酸半胱氨酸天冬氨酸谷氨酸苯丙氨酸甘氨酸组氨酸异亮氨酸赖氨酸 |
GCC/GCGTGC/TGTGAC/GATGAG/GAATTC/TTTGGC/GGGCAC/CATATC/ATTAAG/AAA |
|
亮氨酸甲硫氨酸天冬酰胺脯氨酸谷氨酰胺精氨酸丝氨酸苏氨酸缬氨酸色氨酸酪氨酸终止 |
CTG/CTCATGAAC/AATCCG/CCACAG/CAAAGG/CGCAGC/TCCACC/ACGGTG/GTCTGGTAC/TATTGA/TAG |
编码细菌蛋白质的植物优化基因优选含有约63%的首选密码子、约22%到约37%之间的次选密码子和约15%到约0%之间的三选或四选密码子,其中总百分比为100%。最优选植物优化基因含有约63%的首选密码子、至少约22%的次选密码子、约7.5%的三选密码子和约7.5%的四选密码子,其中总百分比为100%。上述方法使本领域技术人员能够修饰就具体植物而言是外来的基因,从而使基因在植物中优化表达。PCT申请WO97/13402中进一步说明了该方法。
为了设计编码细菌蛋白质的植物优化基因,使用建立自密码子偏好表的冗余遗传密码设计编码所述蛋白质的氨基酸序列的DNA序列,所述偏好表整理自具体植物的基因序列。得到DNA序列具有较高水平的密码子多样性、所需的碱基组成、可含有根据策略放置的限制性酶识别位点并缺少可能干扰基因转录或产物mRNA翻译的序列的DNA序列。
5.2-重建分析
对天然AAD-1(v1)编码区(SEQ ED NO:3)888个碱基对(bp)DNA序列的广泛分析显示存在若干认为不利于最佳植物表达的序列基序以及非最佳密码子组成。为改善重组蛋白在单子叶和双子叶植物中的产生,产生了编码SEQ ID NO:11的“植物优化”DNA序列(SEQ ID NO:5),除了在第二个位置加入丙氨酸残基外,它与天然SEQ ID NO:9相同。包含额外的丙氨酸密码子(GCT,在SEQ ID NO:5以下划线标出)以编码跨越ATG起始密码子的NcoI位点(CCATGG),以允许其后的克隆操作。天然(v1)和植物优化(v3)的编码区所编码的蛋白质99.3%相同,仅2号氨基酸不同。相反,天然(v1)和植物优化的(v3)编码区的DNA序列仅77.7%相同。进行了天然和植物优化的DNA的序列比对,表12显示天然和植物优化的序列密码子组成的差异。
|
表12.天然AAD-1编码区和植物优化形式的密码子组成比较 |
|
氨基酸 |
密码子 |
天然基因中个数 |
天然基因百分比 |
植物优化基因中个数 |
植物优化基因百分比 |
氨基酸 |
密码子 |
天然基因中个数 |
天然基因百分比 |
植物优化基因中个数 |
植物优化基因百分比 |
|
丙氨酸(A)22 |
GCA |
2 |
9.1 |
5 |
22 |
亮氨酸(L)22 |
CTA |
0 |
0.0 |
0 |
0 |
|
GCC |
10 |
45.5 |
8 |
35 |
CTC |
5 |
22.7 |
7 |
32 |
|
GCG |
9 |
40.9 |
0 |
0 |
CTG |
16 |
72.7 |
0 |
0 |
|
GCT |
1 |
4.5 |
10 |
43 |
CTT |
0 |
0.0 |
8 |
36 |
|
精氨酸(R)23 |
AGA |
0 |
0.0 |
|
30 |
TTA |
0 |
0.0 |
0 |
0 |
|
AGG |
0 |
0.0 |
7 |
30 |
TTG |
1 |
4.5 |
7 |
32 |
|
CGA |
0 |
0.0 |
0 |
0 |
赖氨酸(K)7 |
AAA |
1 |
14.3 |
2 |
29 |
|
CGC |
16 |
69.6 |
5 |
22 |
AAG |
6 |
85.7 |
5 |
71 |
|
CGG |
4 |
17.4 |
0 |
0 |
甲硫氨酸(M) |
ATG |
8 |
100 |
8 |
100 |
|
CGT |
3 |
13.0 |
4 |
17 |
苯丙氨酸(F)13 |
TTC |
10 |
76.9 |
9 |
69 |
|
天冬酰胺(N)8 |
AAC |
8 |
100.0 |
4 |
50 |
TTT |
i |
23.1 |
4 |
31 |
|
AAT |
0 |
0.0 |
4 |
50 |
脯氨酸(P)17 |
CCA |
1 |
5.9 |
8 |
47 |
|
天冬氨酸(D)19 |
GAC |
15 |
78.9 |
10 |
53 |
CCC |
9 |
52.9 |
1 |
6 |
|
GAT |
4 |
21.1 |
9 |
47 |
CCG |
7 |
41.2 |
0 |
0 |
|
半胱氨酸(C)3 |
TGC |
3 |
100.0 |
2 |
67 |
|
CCT |
0 |
0.0 |
8 |
47 |
|
TGT |
0 |
0.0 |
1 |
33 |
丝氨酸(S)15 |
AGC |
11 |
73.3 |
4 |
27 |
|
终止1 |
TAA |
0 |
0.0 |
0 |
0 |
AGT |
0 |
0.0 |
0 |
0 |
|
TAG |
1 |
l00.0 |
0 |
0 |
TCA |
0 |
0.0 |
4 |
27 |
|
TGA |
0 |
0.0 |
1 |
100 |
TCC |
2 |
13.3 |
3 |
20 |
|
谷氨酰胺(Q)13 |
CAA |
0 |
0.0 |
7 |
54 |
TCG |
2 |
13.3 |
0 |
0 |
|
CAG |
13 |
100.0 |
6 |
46 |
TCT |
0 |
0.0 |
4 |
27 |
|
谷氨酸(E)16 |
GAA |
8 |
50.0 |
5 |
31 |
苏氨酸(T)23 |
ACA |
1 |
4.3 |
6 |
26 |
|
GAG |
8 |
50.0 |
11 |
69 |
ACC |
16 |
69.6 |
9 |
39 |
|
甘氨酸(G)21 |
GGA |
0 |
0.0 |
6 |
29 |
ACG |
5 |
21.7 |
0 |
0 |
|
GGC |
15 |
71.4 |
7 |
33 |
ACT |
1 |
4.3 |
8 |
35 |
|
GGG |
3 |
14.3 |
2 |
10 |
色氨酸(W) |
TGG |
5 |
100 |
5 |
100 |
|
GGT |
3 |
14.3 |
6 |
29 |
酪氨酸(Y)10 |
TAG |
7 |
70.0 |
6 |
60 |
|
组氨酸(H)10 |
CAC |
6 |
60.0 |
5 |
50 |
TAT |
3 |
30.0 |
4 |
40 |
|
CAT |
4 |
40.0 |
5 |
50 |
缬氨酸(V)28 |
GTA |
2 |
7.1 |
0 |
0 |
|
异亮氨酸(I)12 |
ATA |
0 |
0.0 |
3 |
25 |
GTC |
11 |
39.3 |
8 |
29 |
|
ATC |
12 |
100.0 |
5 |
42 |
GTG |
15 |
53.6 |
10 |
36 |
|
ATT |
0 |
0.0 |
4 |
33 |
GTT |
0 |
0.0 |
10 |
36 |
总计148 149 总计148 149
5.3-二元载体的完成
5.3.1-重建AAD-1
(v3)
植物优化基因AAD-1(v3)得自Picoscript(完成了基因重建设计(见上文)并交给Picoscript进行构建)并内部验证了序列(SEQ ID NO:5)以证实预期序列中不存在改变。如上文使用Beckman Coulter″DyeTerminator Cycle Sequencing with Quick Start Kit″试剂用M13正向(SEQID NO:16)和M13反向(SEQ ID NO:17)引物进行测序反应。分析序列数据,结果表明植物优化的AAD-1(v3)DNA序列中不存在异常。以NcoI-SacI片段将AAD-1(v3)基因克隆进pDAB726。得到的构建体命名为pDAB720,其含有:[AtUbi10启动子:Nt OSM 5′UTR:AAD-1(v3):Nt OSM3′UTR:ORF1 polyA 3′UTR](用NotI选择性消化验证)。接着将含有所述盒的NotI-NotI片段克隆进二元载体pDAB3038的NotI位点。然后(用Bam HI、EcoR I、EcoR V、HinD III、PacI和XmnI)限制性消化得到的二元载体pDAB721以验证正确的方向,pDAB721含有如下的盒:[AtUbi10启动子:Nt OSM 5′UTR:AAD-1(v3):Nt OSM 3′UTR:ORF1polyA 3′UTR:CsVMV启动子:PAT:ORF25/26 3′UTR]。用经验证的完整构建体(pDAB721)转化进农杆菌(参阅6.2章节)。
5.3.2-天然AAD1(v1)和修饰的AAD-1
(v2)
从pDAB3203 PCR扩增AAD-1(v1)基因(SEQ ID NO:3)。在PCR反应中,在引物内产生改变以分别在5’引物和3’引物中引入NcoI和SacI限制性位点。使用Fail Safe PCR系统(Epicenter)用引物“rdpA(ncoI)”[CCC ATG GCT GCT GCA CTG TCC CCC CTC TCC](SEQ ID NO:6)和“3′sacI”[GAG CTC ACT AGC GCG CCG GGC GCA CGC CAC CGA](SEQ ID NO:7)扩增DNA片段。
将PCR扩增子连接进pCR 2.1 TOPO TA克隆载体(Invitrogen)并使用Beckman Coulter“Dye Terminator Cycle Sequencing with QuickStart Kit”测序试剂,用M13正向(SEQ ID NO:16)和M13反向(SEQ ID NO:17)引物验证序列。
序列数据鉴定了具有正确序列的克隆。在分析中鉴定了AAD-1(v1)3’末端多余的NotI限制性位点。去除了此位点以便于克隆进pDAB3038。为去除额外的位点,用内部5’引物进行PCR反应。通过掺入编码氨基酸的新密码子以去除多余的NotI位点来改变NotI位点。这一变化使位置212的精氨酸变成半胱氨酸。使用的PCR引物为“BstEII/Del NotI”[TGGTGG TGA CCC ATC CGG GCA GCG GCT GCA AGG GCC](SEQ IDNO:8)和“3′sacI”(SEQ ID NO:7)。
使用Fail Safe PCR系统(Epicenter)完成PCR反应,将得到的片段克隆进克隆pCR 2.1 TOPO TA试剂盒(Invitrogen)。通过DNA测序确认正确的PCR产物,“修改的”基因命名为AAD-1(v2)(SEQ ID NO:4)。
使用M13反向引物(SEQ ID NO:17)和Beckman Coulter“DyeTerminator Cycle Sequencing with Quick Start Kit”测序试剂的测序反应表明分离了正确的PCR片段。用BstEII和SacI酶消化此构建体。将得到的片段克隆进pCR2.1 AAD-1(v2)构建体(pCR2.1 Delta NotI)并通过限制性酶消化确认。
接着以NcoI/SacI DNA片段将修饰的AAD-1(v2)基因克隆进pDAB726。用限制性消化确认得到的构建体(pDAB708)。然后以Not I-NotI片段将此构建体克隆进二元pDAB3038。最终得到的含有[AtUbi10启动子:Nt OSM 5′UTR:AAD-1(v2):Nt OSM 3′UTR:ORF1 polyA 3′UTR:CsVMV启动子:PAT:ORF25/26 3′UTR]的构建体命名为pDAB766,进行限制性消化以确认正确的方向。用完成的构建体转化进农杆菌。
5.3.3-编码具有赋予草甘膦耐性的突变大豆EPSPS的大豆密码子偏
好DNA序列
此实施例教导设计新的DNA序列,其编码突变的大豆5-enolpyruvoylshikimate 3-磷酸合酶(EPSPS),但经优化用于在大豆中表达。三重突变的大豆EPSPS的氨基酸序列以SEQ ID NO:5公开于WO2004/009761。在其公开的序列中突变的氨基酸为残基183(用异亮氨酸替换天然蛋白质的苏氨酸)、残基186(用赖氨酸替换天然蛋白质的精氨酸)和残基187(用丝氨酸替换天然蛋白质的脯氨酸)。因此,可以通过在适当位置用天然氨基酸取代WO 2004/009761的SEQ ID NO:5中的已替换氨基酸来推出天然大豆EPSPS蛋白的氨基酸序列。这样的天然蛋白质序列在本文中显示为SEQ ID NO:20。双突变的大豆EPSPS蛋白在本文中显示为SEQ ID NO:21,其含有残基183(用异亮氨酸取代天然蛋白质中的苏氨酸)和残基187(用丝氨酸取代天然蛋白质中的脯氨酸)处的突变。
用于大豆(Glycine max)蛋白质编码序列的密码子使用表得自“
kazusa.or.jp/codon”万维网址,它从362096个密码子(约870个编码序列)中计算得到。将这些数据重新整理示于表13。表13的D和H栏代表大豆基因蛋白质编码区中每个氨基酸的同义密码子分布(以该氨基酸的作用密码子的使用百分比计)。显然在大豆蛋白质编码区中一些氨基酸的一些同义密码子(一个氨基酸可以由1、2、3、4或6个密码子指代)的存在相对稀少(例如,比较指代丙氨酸的GCG和GCT密码子的使用)。从表13的数据表计算偏好的大豆密码子使用表。忽略在大豆基因中小于具体氨基酸总存在数约10%的密码子。为平衡剩余氨基酸密码子选择的分布,使用下式计算每个密码子加权的平均比例:
C1的加权百分比=1/(%C1+%C2+%C3+其他)×%C1×100其中C1为所讨论的密码子,C2、C3、其他代表剩余的同义密码子,相关密码子的百分比值取自表13的D和H列(忽略粗体的稀有密码子的值)。每个密码子的加权百分比值在表13的C和G列给出。任意选择TGA作为翻译终止子。接着将偏好密码子使用频率并入专门的遗传密码表,以用于OptGeneTM基因设计程序(Ocimum Biosolutions LLC,Indianapolis,Indiana)。
|
表13.大豆蛋白质编码序列中的同义密码子表现度,以及用于大豆优化的合成基因设计的偏好密码子表现度计算 |
|
A |
B |
C |
D |
E |
F |
G |
H |
|
氨基酸 |
密码子 |
加权百分比 |
大豆百分比 |
氨基酸 |
密码子 |
加权百分比 |
大豆百分比 |
|
丙氨酸(A) |
GCA |
33.1 |
30.3 |
亮氨酸(L) |
CTA |
DNU |
9.1 |
|
GCC |
24.5 |
22.5 |
CTC |
22.4 |
18.1 |
|
GCG |
DNU* |
8.5 |
CTG |
16.3 |
13.2 |
|
GCT |
42.3 |
38.7 |
CTT |
31.5 |
25.5 |
|
精氨酸(R) |
AGA |
36.0 |
30.9 |
TTA |
DNU |
9.8 |
|
AGG |
32.2 |
27.6 |
TTG |
29.9 |
24.2 |
|
CGA |
DNU |
8.2 |
赖氨酸(K) |
AAA |
42.5 |
42.5 |
|
|
CGC |
14.8 |
12.7 |
|
AAG |
57.5 |
57.5 |
|
CGG |
DNU |
6.0 |
甲硫氨酸(M) |
ATG |
100.0 |
100 |
|
CGT |
16.9 |
14.5 |
苯丙氨酸(F) |
TTC |
49.2 |
49.2 |
|
天冬酰胺(N) |
AAC |
50.0 |
50.0 |
TTT |
50.8 |
50.8 |
|
AAT |
50.0 |
50.0 |
脯氨酸(P) |
CCA |
39.8 |
36.5 |
|
天冬氨酸(D) |
GAC |
38.1 |
38.1 |
CCC |
20.9 |
19.2 |
|
GAT |
61.9 |
61.9 |
CCG |
DNU |
8.3 |
|
半胱氨酸(C) |
TGC |
50.0 |
50.0 |
CCT |
39.3 |
36.0 |
|
TGT |
50.0 |
50.0 |
丝氨酸(S) |
AGC |
16.0 |
15.1 |
|
终止 |
TAA |
DNU |
40.7 |
AGT |
18.2 |
17.1 |
|
TAG |
DNU |
22.7 |
TCA |
21.9 |
20.6 |
|
TGA |
100.0 |
36.6 |
TCC |
18.0 |
16.9 |
|
谷氨酰胺(Q) |
CAA |
55.5 |
55.5 |
TCG |
DNU |
6.1 |
|
CAG |
44.5 |
44.5 |
TCT |
25.8 |
24.2 |
|
谷氨酸(E) |
GAA |
50.5 |
50.5 |
苏氨酸(T) |
ACA |
32.4 |
29.7 |
|
GAG |
49.5 |
49.5 |
ACC |
30.2 |
27.7 |
|
甘氨酸(G) |
GGA |
31.9 |
31.9 |
ACG |
DNU |
8.3 |
|
GGC |
19.3 |
19.3 |
ACT |
37.4 |
34.3 |
|
GGG |
18.4 |
18.4 |
色氨酸(W) |
TGG |
100.0 |
100 |
|
GGT |
30.4 |
30.4 |
酪氨酸(Y) |
TAC |
48.2 |
48.2 |
|
组氨酸(H) |
CAC |
44.8 |
44.8 |
TAT |
51.8 |
51.8 |
|
CAT |
55.2 |
55.2 |
缬氨酸(V) |
GTA |
11.5 |
11.5 |
|
异亮氨酸(I) |
ATA |
23.4 |
23.4 |
GTC |
17.8 |
17.8 |
|
ATC |
29.9 |
29.9 |
GTG |
32.0 |
32.0 |
|
ATT |
46.7 |
46.7 |
GTT |
38.7 |
38.7 |
*DNU=不使用
为产生编码双突变EPSPS的大豆优化DNA序列,使用来自上文的大豆偏好遗传密码通过OptGeneTM程序反向翻译SEQ ID NO:21的蛋白质序列。接着通过补偿密码子变化来修饰这样产生的原始DNA序列(而保持密码子的总体加权平均比例),以减少相邻密码子间CG和TA双联体数,增加相邻密码子间CT和TG双联体数、去除高度稳定的链间二级结构、去除或加入限制性酶识别位点并去除可能不利于所改造基因的表达或克隆操作的其他序列。进一步精加工序列,以消除潜在的植物内含子剪接位点、A/T或C/G残基的长段和可能干扰植物细胞中RNA稳定性、转录或编码区翻译的其他基序。制造其他改变以消除长内部开放读码框(除+1之外的框)。在保持上述大豆偏好的密码子组成并保留SEQ ID NO:21公开的氨基酸序列这一约束下产生这些改变。
以SEQ ID NO:22的碱基1-1575给出编码SEQ ID NO:21 EPSPS蛋白的大豆偏好DNA序列。由商业供应商(PicoScript,Houston TX)进行含有SEQ ID NO:22的DNA片段的合成。
5.3.4-其他二元构建体的克隆
完成pDAB3295和pDAB3757整合了对GateWay克隆技术(Invitrogen,目录号11791-043和目录号12535-019)的使用。GateWay技术使用基于λ噬菌体的位点特异性重组将基因盒插入载体。更多信息参考《GatewayTechnology:A universal technology to clone DNA sequence for functionalanalysis and expression in multiple systems》,_1999-2003,InvitrogenCorp.,1600 Faraday Ave.,Carlsbad,CA 92008(2003年出版)。使用与上文类似的方法和其他标准分子克隆方法建立所有其他用于转化进适当植物物种的构建体(Maniatis等,1982)。表14列出了所使用的所有具有适当启动子和所定义特征的转化构建体及其转化的作物。
将sacB基因加入二元载体pDAB3289作为细菌阴性选择标记物,以减少与转化植物组织相关的残留农杆菌。sacB是由芽孢杆菌属产生的果聚糖蔗糖酶,在蔗糖存在下进行培养时它对多数革兰氏阴性菌具有毒性(Gay等,1983)。从质粒pREl 12(Edwards等,1998)的Hind III片段回收sacB基因并克隆进pDAB3289中的单Hind III位点。
|
表14.多个植物物种的转化中使用的二元构建体 |
|
pDAB# |
pDAS# |
转化进的物种* |
目的基因(GOI) |
启动子 |
特征1 |
特征2 |
GOI2 |
启动子 |
细菌选择基因 |
细菌选择基因2 |
植物选择基因 |
启动子 |
Trxn方法 |
|
721 |
|
A、T、Ct、S、Ca |
AAD1v3 |
AtUbi10 |
NtOsm |
- |
- |
- |
红霉素 |
- |
pat |
CsVMV |
农杆菌二元 |
|
3230 |
|
A |
EPSPS |
AtUbi10 |
NtOsm |
RB7Marv2 |
- |
- |
大观霉素 |
- |
AAD1v3 |
CsVMV |
农杆菌二元 |
|
3289 |
|
S |
AAD1v3 |
CsVMV |
NtOsm |
RB7Marv2 |
EPSPS |
AtUbi10 |
大观霉素 |
sacB |
Hptll |
AtUbi3 |
农杆菌二元 |
|
3291 |
|
S |
AAD1v3 |
CsVMV |
NtOsm |
RB7Marv2 |
EPSPS |
AtUbi10 |
大观霉素 |
- |
Hptll |
AtUbi3 |
农杆菌二元 |
|
3295 |
|
S |
AAD1v3 |
CsVMV |
NtOsm |
RB7Marv2 |
- |
- |
大观霉素 |
- |
pat |
AtUbi10 |
气溶胶束 |
|
3297 |
1270 |
A,T |
AAD1v3 |
CsVMV |
NtOsm |
RB7Marv2 |
- |
- |
大观霉素 |
- |
pat |
AtUbi10 |
农杆菌二元 |
|
3403 |
|
Cn,R |
AAD1v3 |
ZmUbi1 |
- |
RB7Marv2 |
- |
- |
氨苄青霉素 |
- |
与GOI相同 |
颈须/枪 |
|
3404 |
|
Cn |
AAD1v3 |
ZmUbi1 |
- |
RB7Marv2 |
- |
- |
氨苄青霉素 |
- |
pat |
OsActl |
颈须 |
|
3415 |
1283 |
Cn |
AAD1v3 |
ZmUbi1 |
- |
RB7Marv2 |
- |
- |
氨苄青霉素 |
- |
AHASv3 |
OsAct1 |
颈须 |
|
3602 |
1421 |
Cn |
AAD1v3 |
ZmUbi1 |
- |
RB7Marv2 |
- |
- |
大观霉素 |
- |
AHASv3 |
OsAct1 |
农杆菌超级二元 |
|
3757 |
|
Ca |
AAD1v3 |
CsVMV |
NtOsm |
RB7Marv2 |
EPSPS |
AtUbi10 |
大观霉素 |
- |
pat |
AtUbi11 |
农杆菌二元 |
|
3705 |
|
A |
AAD2v2 |
AtUbi10 |
NtOsm |
RB7Marv2 |
- |
- |
红霉素 |
- |
pat |
CsVMV |
农杆菌二元 |
*A=拟南芥 CsVMV=木薯叶脉花叶病毒启动子 ZmUbi1=玉米泛素1启动子
T=烟草 AtUbi10=拟南芥泛素10启动子 HptH=潮霉素磷酸转移酶
S=大豆 RB7Marv2=烟草基质相关区(MAR)
Ct=棉花 Nt Osm=烟草Osmotin 5′非翻译区和烟草Osmotin 3′非翻译区
R=稻 (721和793)Atu ORF13′UTR=根瘤农杆菌开放读码框13′非翻译区
Cn=玉米 (3295和3757)Atu ORF243′UTR=根瘤农杆菌开放读码框243′非翻译区
实施例6-转化进拟南芥并选择
6.1-拟南芥培养条件
将野生型拟南芥种子悬于0.1%琼脂糖(Sigma Chemical Co.,St.Louis,MO)溶液中。将悬浮的种子在4℃保存2天以完成对休眠的需要并保证种子同步萌发(分层)。
用细蛭石覆盖Sunshine Mix LP5(Sun Gro Horticulture,Bellevue,WA)并用Hoagland溶液下层灌溉至湿润。使土壤混合物排水24小时。将成层的种子种在蛭石上并用保湿罩(KORD Products,Bramalea,Ontario,Canada)覆盖7天。
使种子萌发并在恒温(22℃)恒湿(40%-50%)光强度为120-150μmol/m2秒的长日照条件下在Conviron(models CMP4030 and CMP3244,Controlled Environments Limited,Winnipeg,Manitoba,Canada)中培养植物。开始用Hoagland溶液灌溉植物,接着用去离子水灌溉,保持土壤潮湿但不湿透。
6.2-农杆菌转化
带有划线的DH5α菌落的含红霉素(Sigma Chemical Co.,St.Louis,MO)(200mg/L)或大观霉素(100mg/L)的LB+琼脂平板用于提供菌落接种到4ml小量制备培养物(液体LB+红霉素)中。将培养物在37℃持续摇动孵育过夜。按照生产商的说明使用Qiagen(Valencia,CA)SpinMini Preps纯化质粒DNA。
使用来自Weigel和Glazebrook(2002)的方案制备电感受态的根瘤农杆菌(菌株Z707、EHA101和LBA4404)细胞。使用修改自Weigel和Glazebrook(2002)的电穿孔方法转化感受态农杆菌细胞。在冰上融化50μl感受态农杆菌细胞并在细胞中加入10-25ng所需的质粒。将DNA和细胞混合物加入预冷的电穿孔杯(2mm)中。用以下条件使用Eppendorf电穿孔仪2510进行转化:电压:2.4kV,脉冲长度:5毫秒。
电穿孔后,向杯中加入1ml YEP培养液(每升:10g酵母提取物、10g细菌用蛋白胨、5g NaCl)并将细胞-YEP悬液转移到15ml培养管中。将细胞在水浴中持续摇动以28℃孵育4小时。孵育后,将培养物涂到含红霉素(200mg/L)或大观霉素(100mg/L)和链霉素(Sigma Chemical Co.,St.Louis,MO)(250mg/L)的YEP+琼脂上。28℃孵育平板2-4天。
选取菌落并划线到含红霉素(200mg/L)或大观霉素(100mg/L)和链霉素(Sigma Chemical Co.,St.Louis,MO)(250mg/L)的新鲜YEP+琼脂上,在28℃孵育1-3天。选取菌落使用载体特异性引物进行PCR分析,以确认基因插入片段的存在。按照生产商的说明使用Qiagen SpinMini Prep从选取的农杆菌菌落纯化质粒DNA,另将15ml小量制备培养物(液体YEP+红霉素(200mg/L)或大观霉素(100mg/L)和链霉素(250mg/L))的4ml等分式样用于DNA纯化。Qiagen Spin Mini Prep DNA的替代是裂解转化的农杆菌细胞,在100℃悬浮于10μl水中5分钟。包括了来自农杆菌转化中使用的二元载体的DNA作为对照。以0.5×的浓度按照生产商的说明使用Takara Minis Bio Lac.(Madison,Wisconsin)的TaqDNA聚合酶完成PCR反应。按以下条件设置程序在MJ Research Peltier热循环仪中进行PCR反应:1)94℃3分钟,2)94℃45秒,3)55℃30秒,4)72℃1分钟,共29个循环,其后是72℃10分钟的一个循环。循环后将反应物保持在4℃。通过1%琼脂糖凝胶电泳分析扩增并通过溴化乙啶染色显像。选择了其PCR产物与质粒对照相同的菌落。
6.3-拟南芥转化
使用花浸泡法转化拟南芥。用选取的菌落接种一个或多个15-30ml含红霉素(200mg/L)或大观霉素(100mg/L)和链霉素(250mg/L)的YEP培养液的预培养物。以220rpm将培养物在28℃恒速摇动孵育过夜。每个预培养物用于接种两个500ml含红霉素(200mg/L)或大观霉素(100mg/L)和链霉素(250mg/L)的YEP培养液的培养物并将培养物在28℃持续摇动孵育过夜。室温下以约8700×g离心10分钟沉淀细胞,弃去得到的上清液。将细胞沉淀轻柔重悬于500ml渗透培养基中,所述渗透培养基含有1/2×Murashige和Skoog盐/Gamborg B5维生素、10%(重量/体积)蔗糖、0.044μM苯甲酸嘌呤(10μl升(1mg/ml DMSO中的原液)和300μl/l Silwet L-77。将约1月龄的植物在培养基中浸泡15秒,确保浸没最新的花序。接着将植物侧面放倒并覆盖(透明或不透明)24小时,接着用水洗涤并竖直放置。在22℃以16小时光/8小时暗的光周期培养植物。浸泡约4周后收获种子。
6.4-转化植物的选择
将新收获的(转化了天然[AAD-1(v2)]或植物优化的[AAD-1(v3)]基因的)T1种子在室温下干燥7天。将种子种在26.5×51cm萌发盘(T.O.Plastics Inc.,Clearwater,MN)中,每盘接受200mg等分式样的成层T1种子(10000个种子),所述种子事先已悬于40ml 0.1%琼脂糖溶液并在4℃保存2天以完成休眠需要并保证同步的种子萌发。
用蛭石覆盖Sunshine Mix LP5(Sun Gro Horticulture Inc.,Bellevue,WA)并用Hagland溶液地下灌溉至湿透,利用重力排水。用移液管将成层种子的每个40ml等分式样均匀的种到蛭石上,并用保湿罩(KORDProducts,Bramalea,Ontario,Canada)覆盖4-5天。在使用出苗后喷洒草铵膦(选择共转化的PAT基因)进行转化体选择前1天移去罩。
在5到6个种植后天数(DAP)和10DAP,使用DeVilbiss压缩空气喷雾器以10ml/盘(703L/ha)的喷洒体积用Liberty除草剂(200g ai/L的草铵膦,Bayer Crop Sciences,Kansas City,MO)的0.2%溶液喷洒T1植物(分别为子叶期和2-4叶期),以输入每次应用280g ai/ha有效量的草铵膦。在最后喷洒5-7天后鉴定存活株(活跃生长的植物),并分别移植到用盆栽基质(Metro Mix 360)制备的3英寸盆中。用保湿罩覆盖移植的植物3-5天,并如前置于22℃培养室中。接着移去盖并在测试AAD-1(v3)(植物优化基因)或AAD-1(v2)(天然微生物基因)提供苯氧基生长素除草剂抗性的能力之前至少1天将植物移到温室(22±5℃,50±30%RH,14小时光照:10小时黑暗,至少500uE/mV天然+补充光)。
对上述选择了草铵膦抗性的随机个体T1植物使用PAT ELISA试剂盒(部件号7000045,Strategic Diagnostics,Inc.,Newark,DE)证实其PAT蛋白的表达(生产商的方案),以非破坏性地证实选择过程的精确度。接着将植物随机分配到多个用量的苯氧基除草剂(2,4-滴丙酸或2,4-滴)。开始应用的苯氧基用量为12.5g ae/ha 2,4-滴和50或200g ae/ha 2,4-滴丙酸。在其后的试验中使用提高的用量(50、200、800或3200g ae/ha)。
如上述使用DeVilbiss喷雾器实现所有的生长素除草剂应用,以应用703L/ha的喷洒体积(0.4ml溶液/3英寸盆),或者通过履带式喷雾机以187L/ha的喷洒体积应用。使用的2,4-滴为溶于DMSO并稀释于水中(<1%DMSO终浓度)的工业级(Sigma,St.Louis,MO)或为商品二甲胺盐成分(456g ae/L,NuFarm,St Joseph,MO)。使用的2,4-滴丙酸为溶于DMSO并稀释于水中(<1%DMSO终浓度)的工业级(Sigma,St.Louis,MO)。由于除草剂的量提高到超过800g ae/ha,喷洒溶液的pH变的极度酸性,烧伤幼小拟南芥植物的叶子,并使评估除草剂的首效变得复杂。使用200mM Tris缓冲液(pH9.0)中终pH7-8的苯氧基除草剂已成为标准实践。
使一些T1个体接受代替苯氧基生长素的备选商品除草剂。目的的一个方面是测定吡氟氯禾灵在植物中是否可被有效降解。
尽管双子叶植物拟南芥不是测试ACC酶抑制AOPP禾本科除草剂的最佳系统,但仍然用DeVilbiss喷雾器使上述转化了AAD-1(v3)的T1植物遭受提高剂量(400-1600g ae/ha)的RS-吡氟氯禾灵酸(内部合成),该剂量确实引起野生型拟南芥的生长异常和死亡。处理7天和14天后取得损伤量。类似的,用pyridyloxyacetate生长素除草剂氟草烟处理T1个体。
6.5-转化植物的选择结果
用AAD-1(v3)(植物优化基因)进行第一个拟南芥转化。首先使用草铵膦选择方案从未转化种子背景中选择T1转化体。筛选了超过400000个T1种子,鉴定了493个草铵膦抗性植物(PAT基因),等于0.12%的转化/选择频率。取决于测试种子的批次,其范围从0.05%-0.23%(见表15)。还使用草铵膦选择剂选择了一小批转化天然AAD-1(v2)的种子。从筛选的84000颗种子中鉴定了278个草铵膦抗性T1个体(0.33%的转化/选择频率)。
|
表15:使用草铵膦和2,4-滴选择转化AAD-1(v3)(植物优化)或AAD-1(v2)(天然)、AAD-2(v1)(天然)或植物优化的AAD-2(v2)的T1个体植物的选择。 |
|
选择剂 |
基因 |
密码子偏好 |
播种并筛选的种子总数 |
抗性T1数 |
选择率 |
选择率范围 |
选择的表达PAT3植物的百分比 |
|
草铵膦1草铵膦12,4-滴2 |
AAD-1(v2)AAD-1(v3)AAD-1(v3) |
npp |
8400040050070000 |
27849353 |
0.33%0.12%0.08% |
0.44%0.05至0.23%0.07至0.08% |
nd497%96% |
|
草铵膦1 |
AAD-2(v1) |
n |
1301500 |
228 |
0.018% |
0.007至0.021% |
100% |
|
草铵膦1 |
AAD-2(v2) |
p |
200000 |
224 |
0.11% |
0.11% |
nd4 |
1草铵膦选择方案:5-6+10DAP应用280g ai/ha草铵膦
22,4-滴选择方案:5-7+10-14DAP应用50g ai/ha 2,4-滴
3通过PAT ELISA条带确定PAT蛋白表达
4nd,未测定
5密码子偏好,n-天然微生物基因,p-植物优化
其后将上述选择的T1植物移植到单个盆中并用多个用量的商品aryloxyalkanoate除草剂喷洒。表16比较了天然AAD-1(v2)和AAD-1(v3)植物优化基因输入2,4-滴抗性到拟南芥T1转化体的应答。两个基因都将抗性输入到个体T1拟南芥植物。在给定的处理内,植物应答的水平差异显著,这可能是由于每个植物代表独立的转化事件的事实。特别需要注意在测试的每个2,4-滴用量中都存在未受影响的个体,而另一些则受到严重的影响。总体种群平均损伤率示于表16,以证明转化AAD-1(v2)或AAD-1(v3)的植物与野生型或转化PAT/Cry1F的对照之间的显著差异。另外,显然植物优化序列AAD-1(v3)的耐性看来显著强于天然序列AAD-1(v2)(见表16)。对表达AAD-1(v3)的其他T1个体使用了高剂量的2,4-滴(高至3200gae/ha)。损伤水平倾向于提高,且在这些提高的剂量(6×大田剂量)下高抗性植物的频率较低。另外在这些高剂量下,如果不进行缓冲则喷洒溶液变成高酸性。主要在生长室中培养的拟南芥角质层很薄,严重的烧伤效应会使这些提高剂量下的测试复杂化。尽管如此,仍有一些个体在3200gae/ha 2,4-滴下无损伤或几乎无损伤的存活下来。
表16.转化AAD-1v3(植物优化)或AAD-1v2(天然)或AAD-2(天然)的T1植物对出苗后应用的一系列2,4-滴用量的应答。以可见损伤百分比2WAT显示应答。以表现无损伤或几乎无损伤(<20%)、中度损伤(20-40%)或严重损伤(>40%)的个体的直方图显示数据。由于每株个体都是独立的转化事件,可以预计在给定剂量内个体T1应答的显著变异。显示了每个处理的算术平均值和标准差。还在最后一列标出了每一剂量和转化的个体应答的范围。转化PAT/Cry1F的拟南芥作为生长素敏感型转化对照。野生型拟南芥未转化。
表16.转化AAD-1v3(植物优化)或AAD-1v2(天然)或AAD-2(天然)的T1拟南芥对出苗后使用的一系列2,4-滴用量的应答。
|
天然AAD-1(v2)基因平均值 |
%损伤 |
|
%损伤 |
|
<20% |
20-40% |
>40% |
|
平均值 |
标准差 |
|
未处理对照缓冲液 |
20 |
6 |
7 |
|
25.3 |
34.7 |
|
50g ae/ha 2,4-滴200g ae/ha 2,4-滴800g ae/ha 2,4-滴 |
554511 |
161132 |
92437 |
|
14.834.152.5 |
22.739.334.2 |
|
天然AAD-2基因 |
%损伤 |
|
%损伤 |
|
平均值 |
<20% |
20-40% |
>40% |
|
平均值 |
标准差 |
| 未处理对照缓冲液50g ae/ha 2,4-滴200g ae/ha 2,4-滴800g ae/ha 2,4-滴 |
4100 |
1230 |
1111114 |
|
25.068.282.799.8 |
21.730.228.80.8 |
|
重建AAD-1(v3)基因 |
%损伤 |
|
%损伤 |
|
平均值 |
<20% |
20-40% |
>40% |
|
平均值 |
标准差 |
|
未处理对照缓冲液50g ae/ha 2,4-滴200g ae/ha 2,4-滴800g ae/ha 2,4-滴 |
9101111 |
0144 |
0511 |
|
0.024.314.014.7 |
0.035.925.926.1 |
|
野生型 |
%损伤 |
|
%损伤 |
|
平均值 |
<20% |
20-40% |
>40% |
|
平均值 |
标准差 |
| 未处理对照缓冲液50g ae/ha 2,4-滴200g ae/ha 2,4-滴800g ae/ha 2,4-滴 |
11000 |
0000 |
0151515 |
|
0.090.095.1100.0 |
0.00.00.50.0 |
|
PAT/Cry1F(转化对照) |
%损伤 |
|
%损伤 |
|
平均值 |
<20% |
20-40% |
>40% |
|
平均值 |
标准差 |
| 未处理对照缓冲液50g ae/ha 2,4-滴200g ae/ha 2,4-滴800g ae/ha 2,4-滴 |
11000 |
0000 |
0151515 |
|
0.090.797.2100.0 |
0.04.21.70.0 |
表17显示T1拟南芥对苯氧丙酸2,4-滴丙酸类似的剂量应答。可见与2,4-滴类似的倾向,说明手性丙酸侧链确实作为可用的底物。接着,确定了可以向拟南芥输入400-1,600g ae/ha的提高剂量下提高的吡氟氯禾灵耐性(表18)。吡氟氯禾灵(禾本科特异性除草剂)正常的大田用量为50-70g ae/ha左右。一般认为双子叶植物对AOPP除草剂具有天然耐性,然而,在这些提高剂量下在拟南芥中确实出现了严重的生理效应。一些转化AAD1(v3)的个体的确对吡氟氯禾灵表现出提高的耐性。这提供了AAD-1(v3)会提供AOPP抗性的第一组植物中的数据。与使用异源表达酶的体外工作一致,在转化拟南芥中没有观察到对氟草烟(pryridyloxyacetate生长素)的抗性。
表17.T1拟南芥对出苗后应用的一系列2,4-滴丙酸用量的应答。以可见损伤百分比2WAT显示应答。以表现无损伤或几乎无损伤(<20%)、中度损伤(20-40%)或严重损伤(>40%)的个体的直方图显示数据。由于每株个体都是独立的转化事件,可以预计在给定剂量内个体T1应答的显著变异。显示了每个处理的算术平均值和标准差。还在最后一列标出了每一剂量和转化的个体应答的范围。转化PAT/Cry1F的拟南芥作为生长素敏感型转化对照。野生型拟南芥未转化。
表17.T1拟南芥对出苗后使用的一系列2,4-滴丙酸剂量的应答。
|
AAD-1(v3) |
%损伤 |
%损伤 |
|
平均值 |
<20% |
20-40% |
>40% |
平均值 |
标准差 |
范围 |
|
未处理对照缓冲液12.5g ae/ha 2,4-滴丙酸50g ae/ha 2,4-滴丙酸200g ae/ha 2,4-滴丙酸800g ae/ha 2,4-滴丙酸 |
37740 |
01115 |
00033 |
0.05.03.140.051.9 |
0.07.68.850.140.0 |
00-200-250-10020-100 |
|
PAT/Cry1F |
%损伤 |
%损伤 |
|
平均值未处理对照缓冲液12.5g ae/ha 2,4-滴丙酸 |
<20%30 |
20-40%06 |
>40%02 |
平均值0.038.1 |
标准差0.025.3 |
范围020-90 |
|
50g ae/ha 2,4-滴丙酸200g ae/ha 2,4-滴丙酸800g ae/ha 2,4-滴丙酸 |
000 |
000 |
888 |
80.098.3100.0 |
25. 32.20.0 |
50-10095-100100 |
|
野生型 |
%损伤 |
%损伤 |
|
平均值未处理对照缓冲液12.5g ae/ha 2,4-滴丙酸50g ae/ha 2,4-滴丙酸200g ae/ha 2,4-滴丙酸800g ae/ha 2,4-滴丙酸 |
<20%33000 |
20-40%00000 |
>40%00333 |
平均值0.013.353.395.0100.0 |
标准差0.02.95.85.00.0 |
范围010-1550-6090-100100 |
表18.T1拟南芥对出苗后以人工高剂量使用的一系列吡氟氯禾灵剂量的应答,试图显示双子叶拟南芥对禾本科除草剂的耐性。以可见损伤百分比2WAT显示应答。以表现无损伤或几乎无损伤(<20%)、中度损伤(20-40%)或严重损伤(>40%)的个体的直方图显示数据。由于每株T1都是独立的转化事件,可以预计在给定剂量内个体T1应答的显著变异。显示了每个处理的算术平均值和标准差。还在最后一列标出了每一剂量和转化的个体应答的范围。转化PAT/Cry1F的拟南芥作为生长素敏感型转化对照。野生型拟南芥未转化。
表18.T1拟南芥对出苗后以人工高剂量应用的一系列吡氟氯禾灵剂量的应答,试图显示双子叶拟南芥对禾本科除草剂的耐性。
|
AAD-1(v3) |
%损伤 |
%损伤 |
|
平均值 |
<20% |
20-40% |
>40% |
平均值 |
标准差 |
范围 |
|
未处理对照缓冲液100g ae/ha吡氟氯禾灵200g ae/ha吡氟氯禾灵400g ae/ha吡氟氯禾灵800g ae/ha吡氟氯禾灵 |
34431 |
00011 |
00002 |
0.00.00.06.346.3 |
0.00.00.09.542.7 |
0000-200-85 |
|
1600g ae/ha吡氟氯禾灵 |
1 |
0 |
3 |
65.0 |
47.3 |
0-100 |
|
PAT/Cry1F |
%损伤 |
%损伤 |
|
平均值 |
<20% |
20-40% |
>40% |
平均值 |
标准差 |
范围 |
|
未处理对照缓冲液100g ae/ha吡氟氯禾灵200g ae/ha吡氟氯禾灵400g ae/ha吡氟氯禾灵800g ae/ha吡氟氯禾灵 |
34400 |
00040 |
00004 |
0.00.027.578.847.5 |
0.00.05.06.343.5 |
0020-3070-8580-100 |
|
1600g ae/ha吡氟氯禾灵 |
0 |
0 |
4 |
|
|
|
|
野生型 |
%损伤 |
%损伤 |
|
平均值未处理对照缓冲液100g ae/ha吡氟氯禾灵200g ae/ha吡氟氯禾灵400g ae/ha吡氟氯禾灵800g ae/ha吡氟氯禾灵 |
<20%33300 |
20-40%00030 |
>40%00003 |
平均值0.00.00.020.073.3 |
标准差0.00.00.00.010.4 |
范围0002070-85 |
|
1600g ae/ha吡氟氯禾灵 |
0 |
0 |
3 |
93.3 |
11.5 |
80-100 |
6.6-AAD-1
(v3)作为选择标记物
最初用如上述转化的拟南芥分析使用AAD-1(v3)作为选择标记物的能力,其中使用2,4-滴作为选择剂。将转化了PAT和AAD-1(v3)(pDAB 721)的T1种子种到平板上并如上述萌发,与用正常草铵膦选择方案(5和10DAP)处理的类似种子进行比较。像先前用草铵膦那样对幼苗拟南芥应用2,4-滴(50g ae/ha)。对应用次数和应用时间的变化进行了测试。每盘植物按以下处理方案接受一次或两次应用时间:5+10DAP、5+14DAP、10DAP、10+14DAP、14DAP。在19DAP鉴定植物为抗性或敏感,并进行ELISA测试带以测定活性PAT基因成功共转化的频率。
种植的70000颗种子中的53颗鉴定为对2,4-滴有抗性。使用ELISA筛选此种群中44个个体的亚组的PAT蛋白表达。96%的个体为阳性,说明存在共转化的基因PAT。阴性ELISA结果的低数目(4%)与草铵膦抗性植物群体中3%的错误率一致(表15)。2,4-滴的选择效率(0.08%)看来似乎低于草铵膦(0.12%),然而在所有实验中的选择率范围说明两种选择剂在分别选择转化了AAD-1(v3)或PAT基因的拟南芥上同等优秀。两种依次应用最准确的鉴定了对测试的两种除草剂有抗性的个体。
6.7-遗传力
使多个T1事件自花传粉产生T2种子。通过对100株随机T2同胞应用2,4-滴(200g ae/ha)对这些种子进行子代测试。在喷洒应用(187L/ha的应用量的履带式喷雾机)之前,先将每个T2个体植物移植到7.5cm见方的盆中。卡方分析(P>0.05)确定超过60%的T1家族(T2植物)以预期的孟德尔遗传单基因座显性遗传的3抗性:1敏感模式分离。
收集12到20个T2个体的种子(T3种子)。如前述对任意8个随机选择T2家族中每个家族的25个T3幼苗进行子代测试。在每个测试株系中鉴定了约三分之一的预期为纯合的T2家族(未分离种群):范围为测试家族的八分之一到八分之四。这些数据显示AAD1(v3)稳定整合,且以孟德尔方式遗传至少3代。
6.8-拟南芥中归因于AAD-1的其他除草剂抗性
使用改良的体外平板测定测试AAD-1(v3)在转基因拟南芥中提供对其他芳氧基苯氧链烷酸酯除草剂抗性的能力。通过在50%漂白剂溶液中摇动10分钟使来自野生型拟南芥和含有植物优化AAD-1(v3)基因的拟南芥(T4纯合植物名=PAAD1.315.064)的种子灭菌。然后用无菌水洗涤这些种子四次除去漂白剂。
剂量应答测定使用补充了多种剂量的测试化合物的营养培养基(见下文)。以DMSO中的浓缩液将测试化合物加入热培养基(55℃)中。对照孔含有适当量的无其他化合物的DMSO。DMSO的终浓度不超过1%(体积/体积)。彻底混合后,将含有适当浓度化合物的温培养基加入6孔平底聚苯乙烯组织培养皿(Falcon 353046,Becton Dickson and Company,Franklin Lakes,NJ)的孔中。培养基凝固后,在固体培养基上应用20到30个拟南芥种子并将剩余的2mL培养基倒在种子上。轻柔摇动平板使种子分散,盖上盖子并冷却至培养基完全凝固。在持续荧光照明(75μE m-2s-1)下在25℃孵育平板7天。营养培养基的组成描述于实施例2.2和Somerville和Orgen(1982)。
生长下降的评估
目测评估在经处理培养基中培养的拟南芥的顶端部分和在仅含DMSO的培养基中培养的植物的顶端部分。以生长下降的百分比记录值。通过小心的将植物从培养基中拉出并测量根长来评估在经处理培养基中培养的拟南芥根生长的抑制。然后将这些根长度与对照植物的根长度进行比较以测定生长下降百分比。每个处理至少评估5株植物。记录的值为所有评估植物的平均值。测定对野生型和转化AAD-1的拟南芥的根和芽达到50%抑制效应的计算浓度(I50)。表19中包含了抗性与敏感性生物型的比值。根和芽测量都大于2的比值一般表示显著的抗性。比例越高,抗性水平越高。所有商品苯氧基生长素均显示显著水平的抗性,包括羟乙基酸(2,4-滴和MCPA)和羟丙基酸(2,4-滴丙酸和2-甲-4-氯丙酸)。事实上,长期根评估显示AAD-1(v3)对羟丙基酸的抗性高于羟乙基酸,与AAD-1(v1)的酶特征一致。其他含有吡啶环的生长素的评估显示未对拟南芥提供对除草剂triclopyr、氟草烟和或邻吡啶甲酸除草剂落叶素的保护。首先在植物中报道了广泛的苯氧基生长素抗性。AAD-1未能保护的其他备选生长素将是用于控制和遏制转化AAD-1的商品作物或实验植物物种的可靠工具。
6.9-AAD-1
拟南芥中的叶敷除草剂抗性
通过叶敷应用实施例6.8中所述的多种底物测定AAD-1(v3)在转基因拟南芥中提供对其他芳氧基苯氧链烷酸酯生长素除草剂的抗性的能力。使T4代拟南芥种子(AAD-1(v3)纯合)(株系AADI.01.315.076)成层并种到与拟南芥相似的选择盘(实施例6.4)中。以类似的方式种植含有PAT和昆虫抗性基因Cry1F的转化对照株系。将苗转移到温室中单独的3英寸盆中。以187L/ha用履带式喷雾机对所有植物喷洒。对植物喷洒一系列苯氧基生长素除草剂:12.5-1600g ae/ha 2,4-滴二甲胺盐(DMA)(RiversideChemicals)、12.5-1600g ae/ha 2-甲-4-氯丙酸(AH Marks)、50-3200g ae/haR-2,4-滴丙酸(AH Marks)、8.75-1120g ae/ha 2,4,5-三氯苯氧乙酸(工业级)、pyridyloxyacetates除草剂、50-3200g ae/ha triclopyr(Dow AgroSciences)和50-3200g ae/ha氟草烟(Dow AgroSciences)以及由AAD-1活性引起的2,4-滴代谢物2,4-二氯苯酚(DCP,Sigma)(50-3200g ae/ha,工业级)。所有的应用都配制到200mM Hepes缓冲液(pH7.5)中。每个处理重复3-4次。在处理后第3和第14天评估植物并对两次实验进行平均。
这些结果(见表20)证实在拟南芥中提供对苯氧乙酸生长素、苯氧丙酸生长素提供强抗性,但未对测试的pyridyloxyacetic生长素显示明显的交叉抗性,并证实了体外酶和全平板底物特异性数据。另外,代谢物2,4-二氯苯酚(DCP)对野生型或转基因拟南芥无影响。
|
表20.纯合T4 AAD-1(v3)和野生型拟南芥植物对叶敷应用的多种生长素除草剂的应答的比较 |
|
苯氧丙酸生长素 |
| 除草剂处理 |
14DAT的平均%损伤 |
|
AAD1.01.315.076.T4纯合AAD1植物 |
PatCry1f-对照 |
|
50g ae/ha R-2,4-滴丙酸200g ae/ha R-2,4-滴丙酸800g ae/ha R-2,4-滴丙酸3200g ae/ha R-2,4-滴丙酸 |
3333 |
31738995 |
|
12.5g ae/ha2-甲-4-氯丙酸25g ae/ha2-甲-4-氯丙酸50g ae/ha2-甲-4-氯丙酸100g ae/ha2-甲-4-氯丙酸200g ae/ha2-甲-4-氯丙酸400g ae/ha2-甲-4-氯丙酸800g ae/ha2-甲-4-氯丙酸1600g ae/ha2-甲-4-氯丙酸 |
30003000 |
021733627893100 |
|
苯氧乙酸生长素 |
|
|
|
|
14DAT的平均%损伤 |
| 除草剂处理 |
AAD1.01.315.076.T4纯合AAD1植物 |
Pat/Cry1f-对照 |
|
12.5g ae/ha 2,4-滴DMA25g ae/ha 2,4-滴DMA50g ae/ha 2,4-滴DMA100g ae/ha 2,4-滴DMA200g ae/ha 2,4-滴DMA400g ae/ha 2,4-滴DMA800g ae/ha 2,4-滴DMA1600g ae/ha 2,4-滴DMA |
00000000 |
677893100100100100100 |
|
8.75g ae/ha 2,4,5-T17.5g ae/ha 2,4,5-T35g ae/ha 2,4,5-T70g ae/ha 2,4,5-T140g ae/ha 2,4,5-T280g ae/ha 2,4,5-T560g ae/ha 2,4,5-T1120g ae/ha 2,4,5-T |
030300173 |
02043859598100100 |
|
Pyridyloxyacetic生长素 |
|
|
| 除草剂处理 |
14DAT的平均%损伤 |
|
AAD1.01.315.076.T4纯合AAD1植物 |
Pat/Cry1f-对照 |
|
50g ae/ha Triclopyr200g ae/ha Triclopyr800g ae/ha Triclopyr3200g ae/ha Triclopyr50g ae/ha氟草烟 |
3158749748 |
3665849576 |
|
200g ae/ha氟草烟800g ae/ha氟草烟3200g ae/ha氟草烟 |
758895 |
858595 |
|
无活性DCP代谢物 |
|
50g ae/ha 2,4-滴CP200g ae/ha 2,4-滴CP800g ae/ha 2,4-滴CP3200g ae/ha 2,4-滴CP |
0000 |
0000 |
6.10-拟南芥中植物生长与AAD-1
(v3)表达的关系
设计了检测AAD-1(v3)在拟南芥中的不同生长阶段中表达水平是否发生变化的实验。在温室中培养高耐性纯合AAD-1(v3)T4株系(编号PAAD1.01.345.163)。(如前述)用800g ae/ha的2,4-滴处理一半植物,而另一半不处理。在4、10、14、20和25DAT从(处理和未处理的)5株植物获得两片叶(顶端第3片叶和底端第5片叶)通过ELISA和Western印迹(如实施例11所述)进行分析。图8A和8B显示在幼叶和老叶中AAD-1(v3)表达无统计学差异。此外,除草剂2,4-滴对AAD-1(v3)蛋白的表达水平几乎无影响。在较老的植物中蛋白质水平发生累积,而在较后的时间点则有显著的蛋白质降解。
在分开的实验中,对显示不同除草剂2,4-滴耐性水平的四个不同的拟南芥纯合T4株系喷洒多种水平(0、200、800和3200g/ha)的2,4-滴,并检查其除草剂损伤和AAD-1(v3)表达。除草剂处理四天后,甚至在测试的最高剂量下在四个株系中的三个中几乎未观察到损伤(图9A)。这些植物也表达高水平的AAD-1(v3),从0.1到0.25%(图9B)。相反,低耐性株系在TSP中表达少于0.1%的AAD-1(v3),并受到可见的损伤。更重要的,它们在14DAT从损伤中恢复(图9A),说明低水平的AAD-1(v3)表达能使植物免遭严重的除草剂损伤。所有的对照植物均遭受严重损伤并在800gae/ha2,4-滴剂量及以上时在14DAT死亡。
6.11-AAD-1
(v3)拟南芥的分子分析
用总DNA进行用于PAT基因拷贝数的侵入物测定(Third WaveAgbio试剂盒方案的方法)和/或Southern印迹分析以测定含有PAT和AAD-1(v3)的植物转化单位的稳定整合,所述总DNA使用Qiagen DNeasy试剂盒从多个AAD-1(v3)纯合株系获得。由于它们包含于同一质粒,分析假定这些基因直接物理连接。
对于Southern分析,将总计1μg DNA用Nsi I过夜消化,以得到pDAB721的整合数据。以40伏将这些样品在大0.85%琼脂糖凝胶上电泳过夜。然后在0.2M NaOH、0.6M NaCl中使凝胶变性30分钟。接着使凝胶在pH7.5的0.5M Tris HCl、1.5M NaCl中中和30分钟。接着装配含有20SSC的凝胶装置以过夜得到凝胶到尼龙膜(Millipore INYC00010)的重力转移。过夜转移之后,以1200×100微焦耳通过交联仪(stratageneUV交联仪1800)将膜置于UV光下。接着在0.1%SDS、0.1SSC中洗膜45分钟。洗涤45分钟后,将膜在80℃烘干3小时并保存于4℃至杂交。杂交模板片段由设计用于获得PAT编码区的制备的引物(Pat5-3AGATACCCTTGGTTGGTTGC)(SEQ ID NO:23)和(Pat3-3CAGATGGATCGTTTGGAAGG)(SEQ ID NO:24)组成。将产物在1%琼脂糖凝胶上电泳并切下,接着使用Qiagen(28706)凝胶提取方案提取凝胶。接着将膜在Perfect Hyb缓冲液(Sigma H7033)中置于60℃的预杂交步骤1小时。使用Prime it RmT dCTP-labeling rxn(Stratagene 300392)方案使基于p32的探针(Perkin Elmer)显色。使用Probe Quant提纯探针。用每毫升二百万计数CPM的Perfect Hyb缓冲液与southern印迹杂交过夜。过夜杂交后将印迹在65℃下接受两次0.1%SDS,0.1SSC的20分钟洗涤。接着使印迹接触胶片过夜,在-80℃孵育。
结果显示测试的所有2,4-滴抗性植物都含有PAT(从而推断也含有AAD-1(v3))。拷贝数分析显示总插入片段的范围从1到>10个拷贝。这也与AAD-1(V3)蛋白表达数据一致,指示酶的存在产生对所有市售苯氧乙酸和苯氧丙酸除草剂显著高水平的抗性(>>200倍)。
6.12-用AAD-1
(v3)和草甘膦抗性基因的分子叠加转化的拟南芥
如前述产生含有编码推定的草甘膦抗性性状的pDAB3230质粒(AAD-1(v3)+EPSPS)的T1拟南芥种子。如实施例6.6所述(只是使用的2,4-滴用量为75g ae/ha)使用AAD-1(v3)作为选择标记物选择T1转化体。从第一次选择尝试中回收了24个T1个体转化事件并如前述转移到温室中的3英寸盆中。还测试了三个不同的对照拟南芥株系:野生型Columbia-0、AAD-1(v3)+PATT5纯合株系(转化了pDAB721)和PAT+Cry1F纯合株系(转化了对照)。在苗阶段仅筛选pDAB3230植物的2,4-滴耐性。移植4天后,将植物平均分开,如前述通过履带式喷雾机以200mMHepes缓冲液(pH 5.5)中的0、26.25、105、420或1680g ae/ha草甘膦(Glyphomax Plus,Dow AgroSciences)进行叶处理。所有的处理都重复4或5次。在处理7和14天后评估植物。计算I50值,显示通过与AAD-1(v3)叠加的EPSPS输入了>14倍水平的耐性(见图10)。AAD-1(v3)未提供对草甘膦本身的抗性(参考pDAB721应答)。将这些T1植物培养至产生种子,自交以获得T2种子。已证明PDAB3230 T1植物对致死剂量的2,4-滴和草甘膦具有耐性。将进一步测试T2植物以证明这些共转化植物可经受如实施例21所述和实施例8中AAD-1(v3)转化玉米中所示的以罐混应用的草甘膦+2,4-滴。
实施例7-颈须介导转化进玉米和用AAD-1
(v3)作为选择标记物的用途
7.1-AAD-1
(v3)的克隆
从NcoI/SacI片段得到AAD-1(v3)片段。用NcoI和SacI消化构建体pDAB4005并分离5175bp的骨架片段。使用T4 DNA连接酶将两个片段连接在一起并转化进DH5α细胞。使用Qiagen的QIA Spin小量制备试剂盒对得到的菌落进行小量制备,消化菌落以检查方向。正确的中间质粒命名为pDAB3403。用NotI消化pDAB3403和pDAB8505(OsAct1/PAT/ZmLip)。分离并纯化来自pDAB3403的3442bp条带和来自pDAB8505的11017bp条带。将片段连接到一起,转化进DH5α并筛选得到质粒的方向。最终的构建体命名为pDAB3404,含有ZmUbil/po-aad1/ZmPer5::OsActl/PAT/ZmLip。
7.2-愈伤组织/悬液起始
为得到用于愈伤组织培养物起始的未成熟胚,进行温室培养的Hi-II亲本A和B(Armstrong等1991)之间的F1杂交。当胚大小为1.0-1.2mm(授粉后约9-10天)时,收获穗并通过用Liqui-Nox_皂擦洗、浸入70%乙醇2-3分钟接着浸入20%商品漂白剂(0.1%次氯酸钠)30分钟来表面灭菌。
在无菌蒸馏水中洗涤穗,无菌切下未成熟胚并在15Ag10培养基(N6培养基(Chu等,1975)、1.0mg/L2,4-滴、20g/L蔗糖、100mg/L酪蛋白水解物(酶消化)、25mM L-脯氨酸、10mg/L AgNO3、2.5g/L Gelrite,pH5.8)上培养。在约6周中以两周间隔选择性的将显示正确形态(Welter等,1995)的组织转移到新的15Ag10培养基上,接着在约2个月中以两周间隔转移到4培养基(N6培养基(Chu等,1975),1.0mg/L2,4-滴、20g/L蔗糖、100mg/L酪蛋白水解物(酶消化)、6mM L-脯氨酸、2.5g/L Gelrite,pH5.8)上。
为起始胚胎发生的悬液培养物,将约3ml细胞压积(PCV)来源于单个胚的愈伤组织加入约30ml H9CP+液体培养基(MS基础盐混合物(Murashige和Skoog,1962)、改良的MS维生素(含有更少烟酸(10倍)和更多(5倍)硫胺-HCl)、2.0mg/L 2,4-滴、2.0mg/Lα-萘乙酸(NAA)、30g/L蔗糖、200mg/L酪蛋白水解物(酸消化)、100mg/L肌醇、6mML-脯氨酸、5%(体积/体积)椰汁(在马上进行传代培养前加入),pH6.0)中。在暗条件下,以28℃、125rpm在控温振荡器上的125ml锥形瓶中维持悬浮培养。一般在起始后2到3个月建立细胞系。在建立中,每3.5天通过使用广口移液管将3ml PCV的细胞和7ml条件培养基加入20ml新鲜H9CP+液体培养基中进行传代培养。当组织开始倍增生长时,将悬液扩大规模并在500ml瓶中维持,其中把12ml PCV的细胞和28ml的条件培养基转移到80ml H9CP+培养基中。悬液完全建立后将其深低温保藏以备将来使用。
7.3-悬液的深低温保藏和融化
传代培养后两天,将4ml PCV的悬浮细胞和4ml条件培养基加入8ml冷动保护剂(1M甘油、1M DMSO、2M蔗糖,溶于无椰汁的H9CP+培养基中,过滤灭菌)中,并在125ml瓶中以125rpm在4℃振荡1小时。1小时之后,将4.5ml加入冷的5.0ml Corning冻存管中。装满后,将单个管在控速制冷器中在4℃保持15分钟,接着以-0.5℃/分钟的速度将其冷冻,直至达到-40℃的终温度。达到终温度后,将管转移到充满液氮蒸汽的Cryoplus 4存储单元(Forma Scientifific)内架子上的盒内。
融化时,将管从存储装置中取出并置于封闭的干冰容器中,接着投入保持于40-45℃的水浴中直至“沸腾”平息。融化后,将内含物倒在有盖的100×25mm培养皿中约8层的无菌70mm Whatman滤纸(No.4)层上。使液体吸收到滤纸中几分钟,接着将含有细胞的顶层滤纸转移到GN6培养基(N6培养基,2.0mg/L2,4-滴、30g/L蔗糖、2.5g/L Gelrite,pH5.8)上1周。1周后,仅将形态有希望的组织直接从滤纸上转移到新鲜的GN6培养基上。每7-14天传代培养此组织至1到3克,可用于125ml锥形瓶中约30ml H9CP+培养基中的悬液起始。每3.5天将3ml PCV在新的H9CP+培养基中传代培养,直至得到总计12ml PCV,此时如前述传代培养。
7.4-非转化组织对吡氟氯禾灵酸的剂量应答
将非转化供体Hi-II细胞系混合在一起、无DNA地进行颈须处理、以每个滤器6ml的用量过滤到GN6培养基上并在28℃愈伤2-3周。每次处理将约200mg愈伤悬浮组织转移到60×20mm平板中含有30、100或300nM R-吡氟氯禾灵酸的选择培养基上。每个浓度使用三个重复。还包括了含有1mg/L双丙氨磷(来自除草剂商业配方,Meiji Seika,Japan)、GN6(1H)的对照培养基用于比较。2周后移出愈伤组织,称重并转移到同样浓度的新培养基中再培养两周。经过总计4周时间后,移出组织,在终时间称重并丢弃。结果示于图11。
还分别进行了愈伤组织对吡氟氯禾灵和氰氟草酯酚降解产物的两个剂量应答研究,以证实此终产物对愈伤组织生长是无害的。来自氰氟草酯酚剂量应答(见图12)的数据显示在1μM氰氟草酯酚下,生长仍高达无氰氟草酯酚对照的76%。来自吡氟氯禾灵酚剂量应答的数据显示在300nM吡氟氯禾灵酚下,生长与无吡氟氯禾灵酚对照相同或更高(数据未显示)。
7.5-使用双丙氨磷选择的颈须介导的转化
转化前约24小时,将12ml前述冷冻保存的胚胎发生玉米悬浮细胞加28ml条件培养基传代培养到500ml锥形瓶中的80ml GN6液体培养基(缺少Glerite的GN6培养基)中,并置于28℃下125rpm的振荡器上。使用同一细胞系重复2次,以将36ml PCV分配到3个锥形瓶中。24小时后去除GN6液体培养基,用每瓶72ml GN6 S/M渗透培养基(N6培养基、2.0mg/L2,4-滴、30g/L蔗糖、45.5g/L山梨醇、45.5g/L甘露醇、100mg/L肌醇,pH6.0)代替,以使细胞原浆分离。将瓶在黑暗中置于振荡器上30-35分钟,其间通过将适当体积的GN6 S/M液体培养基加入约405mg预先高压灭菌的碳化硅颈须(Advanced Composite Materials,Inc.)来制备50mg/ml的碳化硅颈须悬液。
在GN6 S/M中孵育后,将每个瓶的内含物在250ml离心瓶中混合。当细胞沉降到底部时,去除液体至只余约14ml并收集在无菌1L瓶中以备将来使用。将预湿润的颈须悬液以最大速度涡旋60秒并在将8.1mL加入瓶底,最后一步在其中加入170μgDNA。立即将瓶置于改良的Red Devil5400商品油漆混合器中振荡10秒。振荡后,细胞、培养基、颈须和DNA的混合物与125ml新的GN6液体培养基一起加入1L瓶的内含物中以减少osmoticant。在使用与房间真空线连接的玻璃试池收集单元过滤到Whatman#4滤纸(5.5cm)上之前,使细胞在振荡器上恢复2小时。
将3或6mL分散的悬液吸到用真空抽吸的滤纸表面。将滤纸置于GN6培养基的60×20mm平板上。在28℃下将平板在暗盒中培养1周,暗盒用单层塑料(厚度<2毫米)宽松密封以使个体平板的蒸发最小化。
1周后,将滤纸转移到GN6(1H)培养基(N6培养基、2.0mg/L2,4-滴、30g/L蔗糖、100mg/L肌醇、1.0mg/L双丙氨磷、2.5g/L Gelrite、pH5.8)或GN6D(1H)培养基(除了8.0mg/L二氯甲氧丙酸和0.8mg/L2,4-滴之外与GN6(1H)相同)的60×20mm平板。
将平板置于盒中并如上文再培养一周。转化两周后,通过刮下平板上的1/2细胞或平板上的全部细胞至3.0mL融化的含有1mg/L双丙氨磷的GN6琼脂糖培养基(N6培养基,2.0mg/L2,4-滴、30g/L蔗糖、100mg/L肌醇、7g/L Sea Plaque琼脂糖,pH5.8,在121℃仅高压灭菌10分钟)来包埋组织。破碎组织并将3mL琼脂糖和组织均匀倒在GN6(1H)或GN6D(1H)的100×15mm平板上。对所有剩余的平板重复此处理。包埋后,用Nescofilm_或Parafilm M_单个密封并在28℃下在暗盒中培养1周。
推定的转化分离物一般在转化首先在5-8周后可见。从包埋的平板中移出任何可能的分离物并转移到60×20mm平板中同样浓度的新鲜选择培养基中。如果在约2周后持续生长很明显,则认为事件是有抗性的并进行分子分析。
通过将愈伤组织转移到基于细胞分裂素的诱导培养基中起始再生,所述诱导培养基含有1mg/L双丙氨磷、MS盐和维生素、30.0g/L蔗糖、5mg/L BAP、0.25mg/L2,4-滴、2.5g/L Gelrite,pH5.7。在转移到再生培养基36(1H)之前,先使细胞在低光照(13μEm-2s-1)下生长一周,接着在较高的光照(40μEm-2s-1)下再生长一周,所述再生培养基除了缺乏植物生长调节剂之外与28(1H)相同。移出3-5cm的小植株并置于含有非选择SHGA培养基(Schenk和Hildebrandt基础盐和维生素,1972、1g/L肌醇、10g/L蔗糖、2.0g/L Gelrite,pH5.8)的150×25mm培养管中。一旦小植株发育出足够的根和芽系统,将其移植到温室的土壤中。
7.6-使用吡氟氯禾灵选择的颈须介导的转化
除了一起共转化85μg pDAB-3403和85μg含有GFP(绿色荧光蛋白)报道基因的构建体,并且在2小时恢复后仅将3mL悬液过滤到GN6培养基上之外,正选择“fop”的DNA递送参数与双丙氨磷选择的方案相同。
在GN6非选择培养基上0-7天之后,将滤纸转移到含有2mg/L2,4-滴加50、100或200nM R-吡氟氯禾灵酸的GN6培养基的60×20mm平板上。将平板置于盒中再培养一周。一周后,向前述转移一样通过从平板刮下全部细胞至3.0mL融化的含有相同浓度选择剂的GN6琼脂糖培养基中来包埋组织。其后所有步骤都与PAT选择/再生方案相同,只是在再生培养基中用100nM R-吡氟氯禾灵代替1mg/L双丙氨磷。
7.7-结果
起始了测试多种吡氟氯禾灵和氰氟草酯水平的的多个实验,从定向选择中回收了47个分离物。将愈伤组织事件的亚群提交使用PCR和Western分析进行的筛选。根据这些表达数据,将21个领先事件提交Southern分析。使用单切割酶NcoI在用AAD-1(v3)探查之后获得整合数据的结果明确证明与“fop”选择偶联的颈须介导的转化之后AAD-1(v3)的稳定整合。
7.8-定量证明来自双丙氨磷选的表达AAD-1
(3)的愈伤组织事件的体外 耐性
对从双丙氨磷选择中再生的97个愈伤组织分离物通过侵入物分析进行PAT拷贝计数并通过PCR进行AAD-1(v3)PTU分析(见实施例7.10)。对事件的亚群完成使用Western印迹/夹层ELISA(实施例11)的AAD-1(v3)蛋白表达。概述于下文的表21。从每一个这些事件中再生了至少15个T0植物,并用于喷洒测试和苗产生。
|
表21 |
|
事件 |
PAT拷贝数 |
用于AAD-1(v3)PTU的PCR |
愈伤组织Western |
|
3404-001 |
2 |
+ |
+ |
|
3404-006 |
2 |
+ |
+ |
|
3404-013 |
3 |
+ |
+ |
|
3404-017 |
1 |
+ |
+ |
|
3404-020 |
3 |
+ |
nd |
|
3404-022 |
2 |
4- |
+ |
|
3404-025 |
2 |
+ |
+ |
|
3404-027 |
3 |
+ |
+ |
|
3404-031 |
1 |
+ |
+ |
|
3404-033 |
2 |
+ |
nd |
|
3404-036 |
3 |
+ |
+ |
|
3404-044 |
3 |
+ |
+ |
|
3404-050 |
3 |
+ |
+ |
|
3404-053 |
3 |
+ |
+ |
|
3404-074 |
2 |
+ |
+ |
|
3404-082 |
2 |
+ |
+ |
在剂量-应答研究中对这些转化事件的亚群与未转化对照相比进行评估。测试了高至400nM的一系列吡氟氯禾灵(来自Gallant Super配方)浓度。使用实施例7.4的一般方法产生了一个事件3404-006的剂量应答数据,并示于图13。这证明事件3404-006在高至400nM浓度的吡氟氯禾灵下未显示愈伤组织生长的显著降低,而未转化玉米愈伤组织的生长在此用量下被抑制。这些数据未进行标准化以消除与转基因表达无关的内在生长差异。
7.9-使用咪草烟选择的颈须介导的转化
用AscI/SwaI从pDAB3404中移出ZmUbi1/AAD-1(V3)/ZmPer5盒并插入pDAB2212,以产生AAD-1(v3)和AHAS颈须转化载体pDAB3415(也称为pDAS1283)。完成后,通过如实施例7.4所述的碳化硅颈须介导的转化(过滤2mL)将此构建体转化进玉米,接着在GN6培养基上恢复7天,接着在含有3μM咪草烟(来自Pursuit_DG herbicide)的培养基上进行选择。侵入物分析之后鉴定了含有AAD-1(v3)和AHAS基因的36个事件。
在ELISA和Western印迹实验中测试了来自这些转化的53个玉米愈伤组织事件的AAD-1(v3)表达——数据的子集示于下文。对于表22列出的事件,检测为阳性的事件的表达水平为90到超过1000ppm的总可溶蛋白。
|
表22 |
|
AAD-1事件识 别号 |
表达水平(ppm) |
Western印迹 |
|
1283[1]-001 |
2 |
- |
|
1283[1]-002 |
206 |
+++ |
|
1283[1]-003 |
1 |
- |
|
1283[1]-004 |
90 |
+++ |
|
1283[1]-005 |
1 |
- |
|
1283[1]-006 |
105 |
+++ |
|
1283[1]-007 |
212 |
++ |
|
1283[1]-008 |
114 |
± |
|
1283[1]-009 |
305 |
+ |
|
1283[1]-010 |
2 |
- |
|
1283[1]-011 |
4 |
- |
|
1283[1]-012 |
200 |
+++ |
|
1283[1]-013 |
134 |
+++ |
|
1283[1]-014 |
4 |
- |
|
1283[1]-015 |
194 |
+++ |
|
1283[1]-016 |
4 |
- |
|
1283[1]-017 |
196 |
+++ |
|
1283[1]-018 |
3 |
- |
|
1283[1]-019 |
178 |
+ |
|
1283[1]-020 |
260 |
++ |
|
1283[1]-021 |
144 |
+++ |
|
1283[1]-022 |
140 |
+++ |
|
1283[1]-023 |
191 |
+++ |
|
1283[1]-024 |
392 |
++ |
|
1283[1]-025 |
368 |
++ |
|
1283[1]-026 |
14 |
- |
|
1283[1]-027 |
1006 |
++ |
|
阴性对照 |
3 |
- |
|
阴性对照 |
3 |
- |
|
标准品(0.5μg/mL ) |
|
++ |
|
标准品(5μg/mL) |
|
++++ |
7.10-分子分析:玉米材料和方法
7.10.1-收获组织的DNA的分离和定量
将新鲜组织置于管中并在4℃低压冻干两天。组织完全干燥后,将钨珠(Valenite)放进管中并使用Kelco玻珠研磨机将样品干磨1分钟。其后遵循标准DNeasy DNA分离方案(Qiagen,DNeasy 69109)。将提取的DNA的等分试样用Pico Green(Molecular Probes P7589)染色并与已知标准品一起在荧光计(BioTek)中读数,以得到以ng/μl计的浓度。
7.10.2-侵入物测定分析
将DNA样品稀释到20ng/μl,接着通过在热循环仪中在95℃孵育10分钟变性。接着使用提供的寡核苷酸混合物和MgCl2(Third WaveTechnologies)制备信号探针混合物。在侵入物测定平板的每个孔中放入7.5μl的等分试样,接着放入7.5μl对照、标准品和20ng/μl稀释的未知样品。用15μl液体石蜡(Sigma)覆盖每个孔。接着将平板在63℃孵育1小时并在荧光计(Biotek)上读数。用靶探针信号对背景的百分比除以内参探针信号对背景的百分比计算出比值。由Southern印迹分析得到并确认的已知拷贝数标准品的比值用于鉴定未知事件的估计拷贝数。
7.10.3-聚合酶链式反应
用总计100ng总DNA作为模板。使用20mM每种引物和Takara ExTaq PCR聚合酶试剂盒(Minis TAKRR001A)。用于AAD-1(v3)PTU的引物为(正向-ATAATGCCAGCCTGTTAAACGCC)(SEQ ID NO:25)和(反向-CTCAAGCATATGAATGACCTCGA)(SEQ m NO:26)。在9700 Geneamp热循环仪(Applied Biosystems)中进行PCR反应:将样品置于94℃3分钟,94℃30秒、63℃30秒、72℃1分45秒的35个循环和其后72℃的10分钟。用于AAD-1(v3)编码区PCR的引物为(正向-ATGGCTCATGCTGCCCTCAGCC)(SEQ ID NO:27)和(反向-CGGGCAGGCCTAACTCCACCAA)(SEQ ID NO:28)。在9700Geneamp热循环仪(Applied Biosystems)中进行PCR反应:将样品置于94℃3分钟,94℃30秒、65℃30秒、72℃1分45秒的35个循环和其后72℃的10分钟。通过用溴化乙啶染色的1%琼脂糖凝胶上的电泳分析PCR产物。
7.10.4-Southern印迹分析
用得自Qiagen DNeasy试剂盒的总DNA进行Southern印迹分析。用Afl II过夜消化总计2μgDNA,还用EcoRV消化pDAB3404、用NcoI消化pDAB3403、用Spel消化pDAB1421以得到整合数据。过夜消化后在1%凝胶上电泳约100ng的等分试样以确认完全消化。确认后将样品在大块0.85%琼脂糖凝胶上以40伏电泳过夜。接着在0.2M NaOH、0.6M NaCl中使凝胶变性30分钟。接着将胶在pH7.5的0.5M Tris HCl、1.5M NaCl中中和30分钟。接着装配含有20×SSC的凝胶装置以过夜得到凝胶到尼龙膜(Millipore INYC00010)的重力转移。过夜转移之后,以1200×100微焦耳通过交联仪(stratagene UV交联仪1800)将膜置于UV光下。接着在0.1%SDS、0.1SSC中洗膜45分钟。洗涤45分钟后,将膜在80℃烘干3小时并保存于4℃至杂交。使用上述用质粒pDAB3404的编码区PCR制备杂交模板片段。在1%琼脂糖凝胶上电泳产物并切开,接着使用Qiagen(28706)凝胶提取方案提取凝胶。接着将膜在Perfect Hyb缓冲液(SigmaH7033)中置于60℃的预杂交步骤1小时。使用Prime it RmT dCTP标记反应(Stratagene 300392)方案开发基于p32的探针(Perkin Elmer)。使用Probe Quant.G50柱(Amersham 27-5335-01)提纯探针。用每毫升二百万计数CPM的Perfect Hyb缓冲液与southern印迹杂交过夜。过夜杂交后将印迹置于65℃下在0.1%SDS,0.1SSC中20分钟的两次洗涤中。接着使印迹接触胶片过夜,在-80℃孵育。
实施例8-由PAT选择(pDAB3404)的AAD-1
(v3)事件产生的体内耐性 和大田耐性数据
8.1-T0玉米植物对AOPP除草剂的耐性
如果成功产生了每个事件超过15个的克隆植物,则将额外的植物转移到温室用于在出苗后对T0玉米植物使用AOPP除草剂进行的初步耐性筛选。使适应温室的植物生长至从轮生体长出2-4片新的外观正常的叶(即植物已由组织培养转变到温室生长条件)。在温室中在16小时光照:8小时黑暗的条件下已27℃培养植物。然后用三种AOPP除草剂之一的商品制剂处理植物:Assure_II(DuPont)、Clincher*(Dow AgroSciences)或Gallant Super*(Dow AgroSciences),分别为喹禾灵、氰氟草酯或吡氟氯禾灵。以187L/ha的喷洒体积、50cm的喷洒高度用履带式喷雾机使用除草剂,所有的喷洒都含有1%(体积/体积)的Agridex作物油浓缩佐剂。由于每个事件的再生和顺应的速率不同,每周每个事件的克隆数都发生变化。总之,试图用一系列除草剂剂量(范围从1×致死剂量(约1/8大田剂量)上至8×大田剂量(64×致死剂量))处理每个事件的代表性克隆。致死剂量定义为导致Hi-II近交株>95%损伤的剂量。Hi-II是本发明转化体的遗传背景。
通常AOPP是非常高效的杀死玉米的除草剂。用分别为8.8、62.5和4.4g ae/ha的吡氟氯禾灵、氰氟草酯和喹禾灵可有效杀死(>95%损伤)由种子培养的三到四叶的Hi-II玉米。测试的每个AAD-1(v3)转化株系都在测试的每个AOPP除草剂的最小致死剂量下存活。事实上,甚至在用8×大田剂量(64×致死剂量)的喹禾灵处理时,测试的多数株系无可见损伤(14DAT)的存活下来。然而,来自事件“017”和“038”的若干个体克隆在提高的剂量下受到严重的损伤。这可能是由于基因插入的方式或位置引起降低基因表达的功能。
甚至是在植物刚从组织培养中移出(T0期)就使用时也在多数事件中证明了高水平的AOPP耐性。对全部三种AOPP除草剂都显示了这一耐性,而且很可能扩展到AAD-1如前述在体外显示的所有AOPP除草剂。
图14显示若干转化了AAD-1(v3)和未转化事件的克隆对1周前应用的致死剂量的两种AOPP除草剂(吡氟氯禾灵和喹禾灵)的应答。
表23显示选择的转化AAD-1(v3)的T0玉米事件对出苗后应用的三种AOPP除草剂的应答数据。
|
表23.选择的转化AAD-1(v3)的T0玉米事件对出苗后应用的三种AOPP除草剂的应答 |
|
构建体 |
事件 |
克隆 |
吡氟氯禾灵*g ae/ha |
氰氟草酯**g ae/ha |
喹禾灵***g ae/ha |
14DAT的损伤百分比 |
|
3404 |
001 |
016 |
8.8 |
|
|
0 |
|
3404 |
001 |
018 |
|
62.5 |
|
0 |
|
3404 |
001 |
017 |
|
|
8.8 |
0 |
|
3404 |
001 |
019 |
|
|
8.8 |
30 |
|
3404 |
001 |
020 |
|
|
35 |
0 |
|
|
|
3404 |
017 |
018 |
|
|
35 |
0 |
|
3404 |
017 |
019 |
|
|
35 |
0 |
|
3404 |
017 |
020 |
|
|
70 |
0 |
|
3404 |
017 |
021 |
|
|
70 |
0 |
|
3404 |
017 |
022 |
|
|
140 |
0 |
|
3404 |
017 |
023 |
|
|
140 |
30 |
|
3404 |
017 |
024 |
|
|
1280 |
30 |
|
3404 |
017 |
025 |
|
|
280 |
20 |
|
|
|
|
|
|
|
|
|
3404 |
022 |
019 |
8.8 |
|
|
0 |
|
3404 |
022 |
020 |
17.5 |
|
|
0 |
|
3404 |
022 |
016 |
17.5 |
|
|
0 |
|
3404 |
022 |
024 |
|
62.5 |
|
0 |
|
3404 |
022 |
018 |
|
125 |
|
0 |
|
3404 |
022 |
021 |
|
|
8.8 |
0 |
|
3404 |
022 |
017 |
|
|
17.5 |
0 |
|
3404 |
022 |
022 |
|
|
35 |
0 |
|
3404 |
022 |
023 |
|
|
70 |
0 |
|
|
|
|
|
|
|
|
|
3404 |
033 |
012 |
|
|
35 |
0 |
|
3404 |
033 |
013 |
|
|
70 |
0 |
|
3404 |
033 |
014 |
|
|
70 |
0 |
|
3404 |
033 |
015 |
|
|
140 |
0 |
|
3404 |
033 |
016 |
|
|
280 |
0 |
|
|
|
|
|
|
|
|
|
3404 |
038 |
016 |
8.8 |
|
|
0 |
|
3404 |
038 |
018 |
|
62.5 |
|
0 |
|
3404 |
038 |
017 |
|
|
8.8 |
0 |
|
3404 |
038 |
019 |
|
|
35 |
70 |
|
3404 |
038 |
020 |
|
|
35 |
80 |
|
3404 |
038 |
021 |
|
|
70 |
80 |
|
3404 |
038 |
022 |
|
|
70 |
80 |
(致死剂量=(致死剂量=(致死剂量=
8.8g ae/ha)62.5g ae/ha)4.4g ae/ha)
*Gallant super#+1%COC(体积/体积)
**Clincher#+1%COC(体积/体积)
***AssureII+1%COC(体积/体积)
#Dow AgroSciences,LLC的商标
8.2-pDAB3404 T1玉米植物对喹禾灵、2,4-滴和草铵膦除草剂的大田耐性
在Hawaii和Indiana的大田站建立了两个大田试验。使用近交T1植物的玉米种子评估16个AAD1事件株系针对喹禾灵和2,4-滴的耐性。包含了用于比较目的的三个未转化杂合体。杂合体Hi-II×5XH571与AAD-1(v3)事件株系的家系相同。杂合体Croplan 585SR是sethoxydim抗性株系。
实验设计为四次重复的分割区(split-plot)。主区为除草剂处理,小区为AAD-1(v3)事件或比较杂合体。区为3.7米的一行,每行种植约25个种子。对于AAD-1事件,在每个重复中种植来自事件内不同谱系的种子。
在V2期对AAD-1(v3)区使用560g ai/ha的草铵膦以清除未转化植物。实验处理包括以70和140g ae/ha使用的喹禾灵商品配方、以560和1120gae/ha使用的2,4-滴(二甲胺盐)和未处理的对照。使用以130-220kpa压力递送187L/ha载体体积的背包式撒播增强装置进行处理。在V3-V4玉米期应用喹禾灵处理,在V5-V6期应用2,4-滴处理。
在应用后1和3周(WAA)使用0-100%的尺度目测评估用喹禾灵处理的田的作物损伤,其中0等于无损伤,100等于完全死亡。在应用后2天(DAA)使用0-100%的尺度目测评估用2,4-滴处理的田的作物倾斜,其中0等于任何植物均无倾斜,100等于所有植物倾斜。此外,在3-4WAA使用0-10的尺度目测评估用2,4-滴处理的田的支柱根形成。
8.2.1-结果
表24显示了AAD-1(v3)事件对测试中最高剂量的喹禾灵和2,4-滴的应答。这些剂量约为正常商品用量的二倍。未转化杂合体受到70g ae/ha的喹禾灵严重损伤(80%-100%),包括sethoxydim抗性株系(尽管它显示出比其他两种杂合体稍强的耐性)。除了3404.001事件的一个谱系之外,所有的AAD-1(v3)事件均显示对70g ae/ha的喹禾灵良好的耐性。除了上文提到的事件外,在AAD-1(v3)事件中未观察到可见症状。
1120g ae/ha剂量的2,4-滴在未转化杂合体中引起显著水平(11%-33%)的偏上倾斜——超过V4生长期应用时的正常应答。除了3404.001(仅在Indiana处出现中等水平(5%-13%)的倾斜外,在所有的AAD-1(v3)事件中未观察到或几乎未观察到倾斜。
1120g ae/ha剂量的2,4-滴使未转化杂合体的支柱根严重变形(在0-10尺度中评分为9)。这同样是在V4生长期后使用2,4-滴的正常应答。与倾斜应答一样,除了3404.001一个谱系外,所有的AAD-1(v3)事件中未观察到或几乎未观察到支柱根损伤。
用较低测试剂量的喹禾灵和2,4-滴也出现类似的趋势,尽管有所降低,但未转化杂合体中仍有显著水平的应答(数据未显示)。
这些结果说明多数AAD-1(v3)转化事件对使未转化玉米杂合体致死或引起严重偏上畸形的喹禾灵和2,4-滴显示高水平的抗性。也见图16。
8.2.2-三个T2事件的预期孟德尔分离比例
在大田中使来自每个事件的单个谱系的植物随机自花受粉。在生理成熟后手工收获T2种子。基于单基因拷贝数(见上文表24)和T1代的总体性能(分离、除草剂耐性和活力)选择了三个事件(022、031和074)在大田中进一步评估。使用各含有2500-3000个种子的精密锥形播种器种植每个事件的育种行。在V2生长期如前述使用背包式喷雾器对所有的AAD-1(v3)株系喷洒140g ae/ha喹禾灵(Assure_II)。此剂量迅速杀死所有的“空”(未转化)分离子。每个事件都具有与单基因座显性基因的孟德尔遗传一致的分离比(3抗性:1敏感性,或75%存活)(见表24)。通过接合性测试(参考玉米AAD-1(v3)侵入物测定的描述)鉴定来自事件74的纯合子和杂合子。去除半合子植物并使纯合植物与BE1146玉米(近交渗透并纯合对草甘膦的抗性性状,NK603)杂交,产生对草甘膦抗性、AAD-1(v3)和草铵膦抗性均为半合子的同质F1杂合体。
8.3-在玉米中将AAD-1
(v3)和PAT与草甘膦抗性基因叠加。
如先前的实施例所述将纯合T2 AAD-1(v3)/PAT玉米植物与草甘膦抗性玉米植物杂交产生含有AAD-1(v3)、PAT和草甘膦抗性基因的F1种子。
将F1种子单独种在用Metro-Mix_360生长培养基(Sun GroHorticulture)制备的3英寸盆中。开始用Hoagland溶液地下灌溉至湿透,接着重力排水,并在温室中16小时光:8小时黑暗的条件下以27℃培养。在研究的剩余部分中用去离子水地下灌溉植物。
使植物生长至从出现2-4片叶。在这个点以187L/ha的喷洒体积、50cm喷洒高度用履带式喷雾机应用除草剂。对植物喷洒2,4-滴DMA、草甘膦、草铵膦和这三种的多种组合。所有应用都配制在200mM Hepes缓冲液(pH7.5)中。在存在草铵膦的喷洒应用中,与额外的2%(重量/体积)磷酸铵一起配制处理。
在处理后3和14天(DAT)评估植物。就发育障碍、缺绿症和坏死对植物给定损伤率。给出90%或以上损伤率的植物认为是死亡。14DAT的研究结果见于表25。
|
表25. |
|
|
大田用量 |
14DAT的损伤百分比 |
|
Hill×5XH751 |
RR/PAT/AAD1 |
|
平均值 |
平均值 |
|
未处理对照 |
- |
0 |
0 |
|
840g ae/ha草甘膦 |
1X |
98 |
0 |
|
1680g ae/ha草甘膦 |
2X |
100 |
0 |
|
3360g ae/ha草甘膦 |
4X |
100 |
0 |
|
560g ae/ha2,4-滴DMA |
1X |
10 |
0 |
|
1120g ae/ha2,4-滴DMA |
2X |
14 |
0 |
|
2240g ae/ha2,4-滴DMA |
4X |
29 |
0 |
|
470g ae/ha草铵膦 |
1X |
80 |
0 |
|
940g ae/ha草铵膦 |
2X |
90 |
3 |
|
1880g ae/ha草铵膦 |
4X |
96 |
15 |
|
840g ae/ha草甘膦+560g ae/ha2,4-滴DMA |
1X+1X |
96 |
1 |
|
1680g ae/ha草甘膦+1120g ae/ha2,4-滴DMA |
2X+2X |
100 |
2 |
|
3360g ae/ha草甘膦+2240g ae/ha2,4-滴DMA |
4X+4X |
100 |
1 |
|
470g ae/ha草铵膦+560g ae/ha2,4-滴DMA |
1X+1X |
89 |
5 |
|
940g ae/ha草铵膦+1120g ae/ha2,4-滴DMA |
2X+2X |
91 |
10 |
|
1880g ae/ha草铵膦+2240g ae/ha2,4-滴DMA |
4X+4X |
97 |
13 |
|
840g ae/ha草甘膦+470g ae/ha草铵膦 |
1X+1X |
90 |
5 |
|
1680g ae/ha草甘膦+940g ae/ha草铵膦 |
2X+2X |
98 |
15 |
|
3360g ae/ha草甘膦+1880g ae/ha草铵膦 |
4X+4X |
100 |
15 |
此研究证明玉米中的基因可与草甘膦抗性基因和草铵膦基因叠加以提供对单独或罐混组合物中的2,4-滴、草甘膦和草铵膦的大田水平的强抗性。
8.3.1-使用罐混的2,4-滴DMA和喹禾灵的AAD-1(v3)玉米抗性
将半合子事件号为3404-025.001R/R001 Bulked.001.S058的T2BC1种子单个种在用Metro-Mix_生长培养基制备的3英寸盆中。开始用Hoagland溶液地下灌溉至湿透,接着重力排水,并在温室中16小时光:8小时黑暗的条件下以27℃培养。在研究的剩余部分中用去离子水地下灌溉植物。
使植物在温室中生长至V1期。在这个点以187L/ha用研究用track喷洒装置用200mM Hepes缓冲液中加入了1%Agridex作物油浓缩剂的560g ae/ha Assure_II选择植物。使植物生长4天以显示选择症状。所有的植物都受到损伤。以187L/ha的喷洒体积、18英寸的喷洒高度用track喷雾器进行除草剂应用。所有的应用都配制在加入了1%(体积/体积)Agridex的200mM Hepes缓冲液(pH7.5)中。
在处理后3和14天(DAT)评估植物。就发育障碍、缺绿症和坏死对植物确定损伤率。给出90%或以上损伤率的植物认为是死亡。来自此特定谱系的植物在14DAT对所有的罐混组合物具有0%损伤,而野生型为100%损伤。这些结果表明AAD-1(v3)不仅分别提供对2,4-滴的喹禾灵大田水平的强抗性,而且提供对过量的两种化学品多种组合的抗性。逻辑上可以预期用苯氧基生长素和AOPP禾本科除草剂在玉米(或转化AAD-1的其他作物)中实现新的杂草控制措施,这是先前用单基因HTC所不能的。
8.3.2-(pDAB3403)T0玉米植物对喹禾灵除草剂的耐性
再生了来自17个事件中每一事件的约8株T0植物克隆的靶标并转移到温室中用于初步耐性筛选,其中使用前述的track喷雾器条件以35gae/ha(1×大田剂量,4×致死剂量)对3叶的温室适应T0玉米出苗后应用不同剂量的喹禾灵除草剂。处理后7天给植物评定为抗性或敏感性。每个喷洒应用中都包括了对照非转基因玉米。事件014和047这两个事件有两个或更多对35g ae/ha的喹禾灵敏感的T0克隆,表明了此事件意外的敏感性水平。其他15个事件显示稳定的整合、蛋白质表达和在完整植物水平耐受4×致死剂量喹禾灵的能力。
8.3.3关于喹禾灵耐性的AAD-1
(v3)表达
选择用Liberty_(如前述)预筛选以去除空转化的来自3404转化的三个不同T2谱系关于其AAD-1(v3)表达比较其对喹禾灵的耐性。在14DAT(数据未显示)和30DAT(见图15)测量表达。在1×和更高的大田剂量下,最高耐性的株系(事件3404-074)总是表达比其他两个事件更高量的AAD-1(v3)。从此数据可以得出结论,表达AAD-1(v3)的玉米在16倍于35g/ha 1×大田剂量的测试最高水平(2,240g/ha)受到保护免受喹禾灵的损伤。此外,表达水平在整个实验期中保持一致。
实施例9-AAD-1(v3)由农杆菌介导的玉米转化。
9.1-植物材料
将“High II”(即亲本A和B)的F1杂交(Armstrong等,1991)种子直接种在含有95:5的Metro-Mix_360:矿物土的5加仑盆中。在温室中以通过高压钠灯和金素卤素灯的组合补充的16小时光周期培养植物。
9.2-组织来源
未得到未成熟Hi-II(F2)胚,进行人工近亲授粉。授粉当天,将活跃的下垂雄花穗装入袋中,收集新鲜的花粉并小心的使用在花丝上。如实施例7.2所述分离未成熟胚。
9.3-超级二元载体的制备
通过从含有ZmUbi1 v2/AAD-1(V3)/ZmPer5 v2的pDAB3404上分离3443碱基对的NotI片段并插入pDAB8549的NotI位点完成农杆菌构建体pDAB2272的构建,所述农杆菌构建体含有与AHAS选择标记物组合的AAD-1(v3)基因。得到的质粒含有ZmUbi1 v2/AAD-1(V3)/ZmPer5 v2和OsAct1 v2/AHAS v3/ZmLip v1盒,两侧为同一方向的非全同MAR区。接着将其转化进LBA/4404/pSBI以产生命名为pDAB3602的超级二元载体,也称为pDAS1421。
9.4-细菌供给
所有的转化使用U.S.专利No.5,591,616中(转化单子叶植物的方法)所述来自Japan Tobacco的“超级二元”载体。为制备用于处理的农杆菌悬液,将来自YP划线平板的1-2菌环pDAS 1421重组细菌放入5mlLS-inf.Mod培养基(LS基础培养基(Linsmaier和Skoog,1965)、N6维生素、1.5mg/L2,4-滴、68.5g/L蔗糖、36.0g/L葡萄糖、6mM L-脯氨酸,pH5.2)中。涡旋混合物直至得到均匀的悬液。使用Klett-Summerson光电比色计通过读出溶液的密度测定细菌浓度。将溶液调整至Klett200(约1×109cfu/ml)浓度并在溶液中加入100μM actetosyringone。
9.5-感染和共培养
将未成熟胚直接分离到含有2ml LS-inf.Mod液体培养基的离心管中。将含有约100个胚的每个管涡旋3-5秒。去除培养基并用新鲜液体培养基代替,再次涡旋。再次去除培养基,这次用Klett 200浓度的农杆菌溶液代替。将农杆菌和胚的混合物涡旋30秒。在室温孵育5分钟后,将胚转移到LS-As Mod培养基(LS基础培养基、N6维生素、1.5mg/L2,4-滴、30.0g/L蔗糖、6mM L-脯氨酸、0.85mg/L AgNO3、1,100μM actetosyringone、3.0g/L Gelrite,pH5.2),在25℃共培养5天。
9.6-使用未成熟胚的剂量应答
用缺乏前述质粒的农杆菌菌株LBA4404处理未成熟胚开始剂量应答研究。处理后,将胚在25℃共培养5天,接着转移到含有多种水平的R-吡氟氯禾灵或R-氰氟草酯的选择培养基。还将胚转移到含有1mg/L双丙氨膦和100nM咪草烟的培养基作物阴性对照。两周后就胚胎发生愈伤组织形成的百分比对胚胎评分,4周后再次评分。在高至30nM的R-吡氟氯禾灵水平测试胚,然而在最高水平下未观察到愈伤组织形成的足够下降,因此在转化实验中使用了更高(50-100nM)的浓度。来自在含有氰氟草酯的培养基上培养的胚的数据示于图17。
9.7-选择
共培养后,通过两个步骤的选择方案移动胚,其后得到转化的分离物。为进行选择,与一个或两个选择水平的吡氟氯禾灵、氰氟草酯或咪草烟一起使用LSD Mod培养基(LS基础培养基、N6维生素、1.5mg/L2,4-滴、0.5g/L MES、30.0g/L蔗糖、6mM L-脯氨酸、1.0mg/L AgNO3、250mg/Lcephotaxime、2.5g/L Gelrite,pH5.7)。在整个选择期中,以28℃在黑暗中培养胚。首先将胚转移至初始水平的选择(50-100nM R-吡氟氯禾灵或300nM R-氰氟草酯)14天,接着以5个胚/盘的比例升级到较高的选择水平(250-500nM R-吡氟氯禾灵酸或1.5μM氰氟草酯)。将胚的亚群类似的逐步升高到100到500nM来自Pursuit_DG的咪草烟作物阳性对照。基于U.S.专利No.5,731,180,Pursuit_用于在使用AHAS基因时作为选择剂。以两周间隔将组织转移到相同的培养基上直至获得胚胎发生集落。在剩余的培养期中在高选择压下维持这些集落。通过以两周间隔转移到新鲜的选择培养基来扩大回收的转基因集落用于再生和进一步分析。
9.8-再生和种子的产生
为进行再生,将培养物转移到如前述含有100nM R-吡氟氯禾灵或1.5μM氰氟草酯的28个“诱导”培养基和36个“再生”培养基中以分化小植株。建立小植株后,如前述将其转移到SHGA管中以进一步生长并发育根和芽。如前述进行人工授粉以产生种子。
9.9-事件回收和分析细节;含有AAD-1(v3)和AHAS(pDAS 1421)的T0 玉米谱系的完整植物筛选
在多种水平的R-吡氟氯禾灵和R-氰氟草酯下体外选择了两72个农杆菌转化事件。如前述通过Southern印迹分析对22个愈伤组织样品分析AAD-1(v3)进入基因组的稳定整合。选择表26指出的10个单拷贝事件进行再生。
|
表26 |
| 玉米事件 |
体外选择剂 |
Southern拷贝数(愈伤组织) |
Western印迹(AAD-1)T0愈伤组织 |
T0谱系对35g ae/ha喹禾灵抗性的评估 |
|
|
(nM) |
AAD-1 |
|
抗性 |
敏感 |
|
1421[21]-016 |
50吡氟氯禾灵 |
1 |
+ |
8 |
0 |
|
1421[22]-020 |
100吡氟氯禾灵 |
1 |
++ |
8 |
0 |
|
1421[22]-022 |
100吡氟氯禾灵 |
1 |
+ |
8 |
0 |
|
1421[22]-023 |
100吡氟氯禾灵 |
1 |
++ |
8 |
0 |
|
1421[3]-036 |
100吡氟氯禾灵 |
1 |
++ |
8 |
0 |
|
1421[4]-031 |
300氰氟草酯 |
1 |
++ |
9 |
0 |
|
1421[4]-032 |
300氰氟草酯 |
1 |
++ |
8 |
0 |
|
1421[4]-033 |
300氰氟草酯 |
1 |
++ |
12 |
0 |
|
1421[4]-034 |
300氰氟草酯 |
1 |
++ |
8 |
0 |
|
1421[4]-035 |
300氰氟草酯 |
1 |
++ |
6 |
0 |
|
多于1个拷贝的事件未转移到温室中 |
将每个事件的至少6个再生克隆谱系移到温室的土壤中,并在出现2-4片新的正常叶时使用履带式喷雾机应用35g ae/ha喹禾灵(参阅8.3.3章节)进行筛选。不管用什么AOPP除草剂进行选择,Western印迹中AAD-1蛋白的存在都与T0代的除草剂抗性高度相关。第二种HTC基因(AHAS)对AAD-1(v3)的功能没有负影响。
实施例10-用于抗体产生和生化表征的AAD-1
(v1)纯化
纯化中的所有操作都在4℃进行。将来自如实施例3进行培养和诱导的1L培养物的冰冻或新鲜大肠杆菌细胞重悬于含有20mM Tris-HCl、1mM EDTA和2ml蛋白酶抑制剂混合物(Sigma)的200ml提取缓冲液中,使用Branson超声波仪在冰上通过超声波处理破碎细胞。通过在GSA转子(Sorvall)中以12,000rpm(24,000g)离心20分钟获得可溶性提取物。接着将上清液装入用20mM Tris-HCl、1mM EDTA、pH8.0平衡的MonoQ离子交换柱(Pharmacia HR 10/10),并用10CV(80ml)的同一缓冲液洗柱。用80ml柱缓冲液中0到0.25M的NaCl线性梯度洗脱蛋白质,收集了2ml级分。混合含有AAD-1(v1)的级分并使用MWCO 30 kDa膜浓缩自旋柱(Millipore)进行浓缩。接着在Superdex 200大小排阻柱(Pharmacia,XK 16/60)上以1ml/分钟的流速用含有20mM Tris-HCl、0.15M NaCl和1mM DTT,pH8.0的缓冲液进一步分开样品。通过SDS-PAGE分析纯化方案,通过使用牛血清白蛋白作为标准品的Bradford测定来测定蛋白质的浓度。
实施例11-重组AAD1的纯化和抗体产生
在-80℃以Dow重组菌株DR1878在TOP10F′细胞(Invitrogen)中冰冻维持含有AAD-1(v1)基因的质粒pDAB3202。为进行表达,按照生产商的说明将用Promega的Wizard试剂盒(Fisher目录号PR-A1460)从TOP10F′细胞培养物纯化的质粒DNA转化进BL-21 Star(DE3)细胞(Invitrogen目录号C6010-03)中。转化后,将50μl细胞涂在LB S/S琼脂平板上并在37℃孵育过夜。将整个琼脂平板上的所有菌落刮到500mL三角瓶中的100mL LB中,并在37℃以200rpm振荡孵育1小时。接着用1mM IPTG诱导基因表达,在30℃以200rpm振荡孵育4小时。以4000rpm将全部100mL培养物离心20分钟。弃去上清液,将沉淀重悬于含有20mM Tris-HCl(pH8.0)、1mM EDTA和2ml蛋白酶抑制剂混合物(Sigma)的200mL提取液中,使用Branson超声仪在冰上通过超声波处理进行破碎。以24000×g离心裂解液20分钟以去除细胞碎片。接着将含有AAD-1蛋白的上清液提交纯化方案。
除非另有说明,否则所有的AAD-1(v1)纯化都如实施例10所讨论的一样在4℃进行。将细胞裂解液装入用20mM Tris-HCl(pH8.0)、1mMEDTA平衡的Mono Q离子交换柱(Pharmacia HR 10/10),接着用80ml的相同缓冲液洗涤。用80ml柱缓冲液中0到0.25M的NaCl线性梯度洗脱蛋白质,收集了2ml级分。混合含有AAD-1(v1)的级分并使用MWCO30kDa膜浓缩自旋柱(Millipore)进行浓缩。接着在Superdex 200大小排阻柱(Pharmacia,XK 16/60)上以1ml/分钟的流速用含有20mM Tris-HCl(pH8.0)、0.15M NaCl和1mM DTT的缓冲液进一步分开样品。通过使用牛血清白蛋白作为标准品的Bradford测定来测定蛋白质的浓度。
将5毫克纯化的AAD-1(v1)送到Zymed Laboratories,Inc.(South SanFrancisco,CA)用于产生兔多克隆抗体。兔在5周时间内接受5次注射,每次注射含有悬于1mL弗氏不完全佐剂中的0.5mg纯化蛋白质。在亲和纯化和缀合辣根过氧化物酶(HRP)(Zymed Lab Inc)之前,在ELISA和Western印迹实验中测试血清以证实特异性和亲和力。
11.1-从植物的叶提取AAD-1
(v3)
将50到100mg的叶组织切成小块并放入含有两个不锈钢珠(4.5mm;Daisy Co.,目录号145462-000)和300μL植物提取缓冲液(含有0.1%Triton X-100和10mM DTT的PBS)的微量离心管中。用研磨器以最大速度振荡管4分钟,接着以5000×g离心10分钟。分析含有植物可溶性蛋白的上清液的可溶性蛋白总量(TSP)和AAD-1(v3)浓度。
11.2-Bradford测定
使用牛血清白蛋白(BSA)作为标准品通过Bradford测定来测定来自植物叶组织的可溶性蛋白总量浓度。一式三份将5μl在PBS中连续稀释的BSA或植物提取物转移到96孔微孔板中。对于标准品,浓度范围从2000到15.6μg/mL。首先将蛋白质测定浓缩物5倍稀释于PBS中,在每个孔中加入250μL并在室温孵育5分钟。使用微孔板读数器在595nm处测量每个吸光度(OD)。使用Softmax_Pro(4.0版)(Molecular Devices)从标准曲线推断每个样品的蛋白质浓度。
11.3-酶联免疫吸附测定(ELISA)
除非另外说明,否则在室温下进行测定。将100毫升纯化的抗AAD-1抗体(0.5μg/mL)包被96孔微孔板并在4℃孵育16小时。使用平板洗涤器用洗涤缓冲液(含有0.05%Tween 20的100mM磷酸缓冲盐水(PBS,pH7.4))洗涤平板四次,接着用溶解在PBS中的4%脱脂乳封闭1小时。洗涤后,在孔中孵育100μL已知浓度的标准AAD-1或植物提取物(参阅前一章节)。对于标准曲线,一式三份的AAD-1浓度范围从100到1.6ng/mL。将植物提取物在PBS中稀释5、10、20或40倍,一式二份进行分析。孵育1小时后,如上文洗涤平板。洗涤前在每个孔中孵育100μl抗AAD-1抗体-HRP缀合物(0.25μg/mL)1小时。在加入100μl 0.4N H2SO4终止反应之前,在每个孔中孵育100μl HRP底物1-StepTM Ultra TMB-ELISA(Pierce)10分钟。使用微孔板读数器在450nm处测量每个孔的OD。为测定植物提取物中AAD-1的浓度,平均两次重复的OD值,并使用Softmax_Pro 4.0版(Molecular Devices)从标准曲线进行推断。
11.4-Western印迹分析
将植物提取物或AAD-1标准品(5和0.5μg/mL)与Laemmli样品缓冲液在95℃孵育10分钟并在8-16%Tris-甘氨酸预制凝胶上电泳分离。接着使用标准方案将蛋白质电转移到硝酸纤维素膜上。用PBS中的4%脱脂乳封闭后,通过抗AAD1抗血清和其后的山羊抗兔/HRP缀合物检测AAD-1蛋白。通过化学发光底物ECL Western分析试剂(Amersham目录号RPN 21058)使检测的蛋白质显像。
实施例12-烟草转化
通过与已公开的方法(Horsch等,1988)类似但不完全相同的方法用根瘤农杆菌转化烟草。为提供用于转化的来源组织,将烟草种子(Nicotianatabacum cv.Kentucky 160)表面灭菌并种到TOB培养基的表面上,TOB培养基是用琼脂固化的无激素Murashige和Skoog培养基(Murashige和Skoog,1962)。在有光照的培养室中在28-30℃培养植物6-8周,无菌收集叶用于转化方案。从这些叶上无菌切下约1平方厘米不含中脉的块。将以250rpm在28℃在瓶中培养过夜的农杆菌菌株(含有pDAB721,AAD-1(v3)+PAT的EHA101S)培养物离心沉淀并重悬于无菌Murashige&Skoog盐中,调整至600nm处的终吸光度为0.5。将叶块在此细菌悬液中浸泡约30秒,接着在无菌纸巾上蘸干,右侧朝上放在TOB+培养基(含有1mg/L吲哚乙酸和2.5mg/L苄腺嘌呤的Murashige和Skoog培养基)上并在28℃在黑暗中孵育。两天后将叶块移至含有250mg/L头孢噻肟(Agri-Bio,North Miami,Florida)和5mg/L草铵膦(Basta的活性成分,Bayer Crop Sciences)的TOB+培养基并在28-30℃孵育。前两周每周两次将叶块转移到含有头孢噻肟和Basta的新鲜TOB+培养基,其后每周一次。用细菌处理叶块四到六周后,从此组织制剂中除去从转化病灶发出的小植物并种到PhytatrayTM II管(Sigma)中含有250mg/L头孢噻肟和10mg/L Basta的培养基TOB中。在光照孵育室中培养这些小植株。3周后,进行枝插并在相同的培养基中重新生根。再过2-3周后,植物即可移出至温室。
通过以下步骤将植物移至温室中:从根上洗掉琼脂,移植到13.75cm见方盆的土壤中,将盆放在Ziploc_袋子(SC Johnson&Son,Inc.)中,在袋子的底部放入自来水并在30℃温室中直接光照下放置一周。3-7天后,打开袋子,给植物施肥并使其在打开的袋子中生长直至适应温室,此时去掉袋子。在普通温室条件(30℃,16小时白天、8小时黑夜、最小自然光+补充光=500μE/m2s1)下培养植物。
繁殖前,对T0植物取样用于DNA分析以测定其插入片段拷贝数。为方便起见,测定与AAD-1(v3)分子连接的PAT基因。将新鲜组织置于管中并在4℃低压冻干两天。组织完全干燥后,将钨珠(Valenite)放入管中并使用Kelco玻珠研磨机干磨样品1分钟。接着遵循标准DNsesy DNA分离方法(Qiagen,DNeasy 69109)。接着用Pico Green(Molecular Probes P7589)染色提取的DNA的等分试样并与已知标准品一起在florometer(BioTek)中读数,以得到以ng/μl计的浓度。
将DNA样品稀释到9ng/μl,接着通过在热循环仪中以95℃孵育10分钟变性。接着使用制备的寡核苷酸混合物和MgCl2(Third WaveTechnologies)制备信号探针。在侵入物测定平板的每个孔中加入7.5μl的等分试样,接着加入7.5μl对照、标准品和20ng/μl稀释的未知样品。用15μl矿物油(Sigma)覆盖每个孔。接着将平板在63℃孵育1.5小时并在florometer(Biotek)上读数。计算靶探针信号对背景的百分比除以内参探针背景信号百分比的结果得出比率。使用已知拷贝数并用southern印迹分析确认的标准品的比率鉴定未知事件的估计拷贝数(表27)。
|
表27.用pDAB721(AAD-1(v3)+PAT)进行转化的烟草T0事件 |
|
事件 |
PAT拷贝数(Southern) |
AAD-1的编码区PCR |
ELISA(μg AAD-1/ml植物提取物) |
用2,4-滴*喷洒的T0相对耐性 |
|
721(1)1 |
1 |
+ |
0.9 |
中 |
|
721(2)1 |
nd |
nd |
0.6 |
中 |
|
721(2)2 |
5 |
+ |
0.3 |
低 |
|
721(2)3 |
3 |
+ |
2.6 |
中 |
|
721(2)5 |
5 |
+ |
4.1 |
变化的 |
|
721(2)6 |
3 |
+ |
0.5 |
变化的 |
|
721(2)8 |
5 |
+ |
0.3 |
高 |
|
721(2)11 |
3 |
+ |
n/a |
高 |
|
721(2)12 |
3 |
+ |
4.1 |
中 |
|
721(2)13 |
2 |
+ |
0.5 |
中 |
|
721(2)14 |
5 |
+ |
0.2 |
高 |
|
721(2)16 |
4 |
+ |
3.2 |
中 |
|
721(2)17 |
3 |
+ |
nd |
高 |
|
721(2)18 |
5 |
+ |
nd |
高 |
|
721(2)19 |
>10 |
+ |
nd |
低 |
|
721(2)20 |
5 |
+ |
nd |
中 |
|
721(2)21 |
4 |
+ |
nd |
高 |
|
721(2)22 |
7 |
+ |
nd |
中 |
|
721(2)23 |
>10 |
+ |
nd |
变化的 |
|
721(3)003 |
3 |
+ |
nd |
变化的 |
|
721(3)008 |
2 |
+ |
nd |
高 |
|
721(3)012 |
1 |
+ |
nd |
高 |
|
721(3)4 |
2 |
+ |
0.5 |
高 |
|
721(3)5 |
9 |
+ |
3.3 |
高 |
|
721(3)6 |
4 |
+ |
7.1 |
变化的 |
|
721(3)9 |
2 |
+ |
1 |
低 |
|
721(3)10 |
3 |
+ |
0.6 |
高 |
|
721(3)11 |
7 |
+ |
6 |
低 |
|
721(3)13 |
4 |
+ |
0.1 |
高 |
|
721(3)014 |
2 |
+ |
0.1 |
中 |
|
nd=未实验图例: 相对耐性* 3200g ae/ha 2,4-滴下的损伤(14DAT) |
|
低中高变化的 |
>50%损伤20-50%损伤<20%损伤不一致 |
若干事件的Southern分析证实了对拷贝数的估计。用得自QiagenDNeasy试剂盒的总DNA进行Southern印迹分析。对总计2μg DNA进行NsiI和HindIII过夜消化以获得pDAB721的整合数据。过夜消化后,在1%凝胶上电泳约100ng的等分试样以确认完全消化。确认后使用实施例6第11章节中的方案处理样品。
还使用相同的提取DNA样品通过PCR测定所有事件中AAD-1(v3)基因的存在。使用总计100ng总DNA作为模板。使用20mM的每种引物和Takara Ex Taq聚合酶试剂盒(Minis TAKRR001 A)。用于编码区PCR AAD-1的引物为(RdpAcodF ATGGCTCA TGCTGCCCTCAGCC)(SEQ ID NO:27)和(RdpAcodR CGGGCAGGCCTAACTCCACCAA)(SEQ ID NO:28)。在9700 Geneamp热循环仪(Applied Biosystems)中进行PCR反应,将样品置于94℃3分钟,接着是94℃30秒、64℃30秒和72℃1分45秒的35个循环,接着是72℃10分钟。在溴化乙啶染色的1%琼脂糖凝胶上通过电泳分析PCR产物。再生了来自30个PCR阳性事件中每一个事件4到12个克隆谱系并移至温室。
通过前述的ELISA方法测定19个事件中每一事件的代表性植物中AAD-1(v3)的表达。测试的所有事件都显示可检测水平的(AAD-1(v3)表27)。蛋白质表达在各事件间存在差异。
通过对3-4英寸高的植物喷洒广泛范围的2,4-滴来攻击来自30个事件中每一事件的T0植物。如前述以187L/ha的喷洒体积使用履带式喷雾机进行喷洒应用。以0、50、200、800或3200g ae/ha(在去离子水中混合)的对每一事件的代表性克隆应用2,4-滴二甲胺盐(Riverside Corp)。每个处理重复1-3次。在3和14DAT记录损伤率。测试的每个事件都比未转染对照株系KYI 60对2,4-滴更有耐性。在几个事件中,在800g ae/ha或更低的剂量下开始出现了与生长素除草剂相关的偏上性。一些事件在此用量(等价于1.5×大田用量)下未受损伤。用3200g ae/ha处理时,所有的事件在3 DAT出现暂时性生长素损伤。由于喷洒溶液的酸性,此高剂量下还出现了一些叶烧伤。推迟了高2,4-滴剂量下的其他试验。用3200g ae/ha2,4-滴(约6×大田用量)处理的T0植物的应答将每个事件的相对耐性分为“低”(14 DAT损伤>50%)、“中”(20%-50%损伤)“高”(<20%损伤)。一些事件的重复之间应答不一致,视为“变化的”(表27)。
高2,4-滴耐性的验证
在每个事件中保留在高用量2,4-滴下存活的2到4个T0植物并使其在温室中自体受精产生T1种子。从T0代中选择两个AAD-1(v3)烟草株系(事件721(2)-013.010和721(3)-008.005)。使T1种子成层并以与拟南芥(实施例6.4)十分相似的方式种到选择盘中,接着用280g ai/ha草甘膦(PAT选择)在此分离群体中选择性去除未转化空白。将存活株转移到温室中的单个3英寸盆中。这些株系在T0代中提供中等水平和高水平的2,4-滴强度。预期在这些不直接来自组织培养的T1植物中具有提高的应答一致性。将这些植物与野生型KY 160烟草进行比较。使用设置为187L/ha的履带式喷雾机对所有植物喷洒。用70-4480g ae/ha范围的2,4-滴二甲胺盐(DMA)、R-2,4-滴丙酸和两种除草剂50/50的混合喷洒植物。所有的应用都配制在200mM Hepes缓冲液(pH7.5)中。每个处理重复四次。在处理后3和14天评估植物。就发育障碍、缺绿症和坏死对植物评定损伤率。T1代是分离的,因此由于接合性的差异可以预计到一些不同的应答(表28)。每个事件在低于1×大田剂量(560g ae/ha)的2,4-滴或R-2,4-滴丙酸用量下均未观察到损伤。甚至在高达8倍大田用量(4480g ae/ha)仍几乎未观察到损伤,其表现为发育障碍而不是生长素除草剂损伤。这些结果表明AAD-1(v3)甚至在高度生长素敏感性的单子叶作物如烟草中也可以提供商品水平的耐性。这些结果还显示,可以输入对单独或罐混组合中的手性(2,4-二氯苯氧丙酸)和非手性(2,4-二氯苯氧乙酸)苯氧基生长素除草剂的抗性。
|
表28.分离的AAD-1 T1烟草对苯氧基生长素除草剂的应答 |
|
除草剂 |
KY160-野生型 |
721(2)013.101(T0代中等耐性) |
721(3)008.005(T0代高耐性) |
|
14DAT时重复的平均损伤百分比 |
|
560g ae/ha 2,4-滴DMA1120g ae/ha 2,4-滴DMA2240g ae/ha 2,4-滴DMA4480g ae/ha 2,4-滴DMA560g ae/ha R-2,4-滴丙酸1120g ae/ha R-2,4-滴丙酸2240g ae/ha R-2,4-滴丙酸4480g ae/ha R-2,4-滴丙酸560g ae/ha 2,4-滴DMA/R-2,4-滴丙酸1120g ae/ha 2,4-滴DMA/R-2,4-滴丙酸2240g ae/ha 2,4-滴DMA/R-2,4-滴丙酸4480g ae/ha 2,4-滴DMA/R-2,4-滴丙酸 |
758090957075889580809595 |
5555555105101515 |
020500055101515 |
还对两个AAD-1(v3)株系(事件721(2)-013.010和721(3)-008.005)中的每一个株系进行了100个植物的子代测定。按以上方法使种子成层、播种并移植,只是不通过Liberty选择去除空白植物。14 DAT后,技术抗性和敏感植物。经卡方分析测定,事件“013”和“008”均以单基因座显性孟德尔性状分离(3R:1S)。AAD-1可在多个物种中作为强苯氧基生长素抗性基因遗传。
通过以下证明大田水平的耐性:在温室中种植T1或T2种子,如前述通过Liberty选择来选择性去除空白植物,按照上文指出的培养条件在72孔移植平台(Hummert International)中在Metro 360培养基中培养单个苗。使用工业蔬菜种植机将单个植物移植到大田。用滴液或头顶灌溉保持植物旺盛生长。当植物高度达到6-12英寸时,如上文所示用广泛剂量的苯氧基生长素喷洒烟草植物。在大田条件下环境胁迫更加显著,然而,基于先前AAD-1转化玉米的经验可以预计从温室到大田转移的强抗性。
实施例13-大豆转化
已通过基因转移技术完成了对大豆以下性状的改良:如除草剂耐性(Falco等,1995)、氨基酸修饰(Padgette等,1995)和昆虫抗性(Parrott等,1994)。将外源性状引入作物物种需要允许使用含有简单插入片段的选择标记物序列常规产生转基因株系的方法。转基因应以单功能性基因座遗传以简化育种。已经报道了通过合子胚轴(McCabe等,1988)或体细胞胚发生培养物(Finer和McMullen,1991)的微粒轰击和农杆菌介导的有子叶外植体(Hinchee等,1988)或合子胚(Chee等,1989)的转化将外源基因递送到种植大豆。
来自农杆菌介导的转化的转化体往往具有低拷贝数的简单插入片段(Birch,1991)。研究用于将基因转移进大豆的三种靶组织(合子胚轴(Chee等,1989;McCabe等,1988)、子叶(Hinchee等,1988)和体细胞胚发生培养物(Finer和McMullen,1991))都有各自的优缺点。后者已经被广泛研究作为直接基因转移的靶组织。胚发生培养物往往相当高效,并可维持超过延长期。然而,原代转化体的不育和染色体畸变与胚发生悬液的时期相关(Singh等,1998),因此持续起始新的培养物对使用这种组织的大豆转化系统似乎是必要的。这种系统需要高水平的2,4-滴(40mg/L浓度)来起始胚胎发生愈伤组织,由于培养基中含有2,4-滴时转化的基因座不能进一步发育,因此这使AAD-1(v3)基因的使用产生了基本的问题。因此,基于分生组织的转化可理想地用于开发使用AAD-1(v3)的2,4-滴抗性植物。
13.1-转化方法1:根瘤农杆菌介导的大豆子叶节转化
最先报道的大豆转化靶向子叶节区中的分生细胞(Hinchee等,1988)和来自顶端分生组织的嫩枝增殖物(McCabe等,1988)。在基于根瘤农杆菌的子叶节方法中,外植体制品和培养基组合物刺激节中辅助分生组织的增殖(Hinchee等,1988)。仍不清楚这些处理是否起始了真正去分化而全能的愈伤组织培养物。从单个外植体再生多个转化事件克隆和少见的嵌合体植物再生(Clemente等,2000;Olhoft等,2003)表明单细胞来源和其后的转基因细胞增殖产生多育的转基因分生组织培养物或单一转化的嫩枝(再经历嫩枝增殖)。由于系统是基于种系嵌合体的成功鉴定,大豆嫩枝增殖方法(最初基于微粒轰击(McCabe等,1988),最近改造用于农杆菌介导的转化(Martinell等,2002))显然不经历与子叶节方法相同的去分化水平或类型。通过基于农杆菌的子叶节方法转化的基因型范围正逐渐扩大(Olhoft和Somers,2001)。这种从新分生组织和嫩枝增殖方法较少受到具体基因型的限制。这还是不基于2,4-滴的方案,可理想地用于2,4-滴选择系统。因此,子叶节方法可能是开发2,4-滴抗性大豆品种应选择的方法。尽管此方法早在1988年(Hinchee等,1988)即有所描述,但直到最近才将其优化用于若干大豆基因型的常规高频转化(Zhang等,1999;Zeng等,2004)。
13.1.1-农杆菌制备
质粒pDAB721含有拟南芥Ubi10启动子控制下的AAD-1(v3)基因。这种质粒还带有稻肌动蛋白启动子控制下的PAT基因,其编码降解可用作转化体选择剂的草甘膦的酶。此载体可用于下文所述的转化实验。通过电穿孔将构建体pDAB721转移进农杆菌菌株EHA101S。
可以在YEP培养基(10g/L蛋白胨、5g/L酵母提取物和5g/L NaCl,pH7.0)中培养转化中使用的含有pDAB721的农杆菌培养物。低速沉淀农杆菌培养物并重悬于SCM液体培养基(见下文)中至OD660为0.6以用于接种。
13.1.2-植物转化
可通过在补充2滴Liqui-Nox_的20%(体积/体积)商品漂白剂(NaCIO)中洗涤20分钟来消毒“Thome”、“Williams82”或“NE3001”公共基因型大豆的种子。种子应在无激素SHGA培养基上用无菌水洗涤5次,接着以18/6小时的光/暗安排在24℃萌发5天。B5培养基由常量营养素和微量营养素和维生素组成,描述于Gamborg等(1968)(Sigma,目录号G5893,St.Louis)。用0.8%(重量/体积)洗过的琼脂(Sigma目录号A8678)固化所有的培养基。或者,某些基因型的大豆可承受使用氯气(Cl2)的干燥表面灭菌方法,其中将成熟种子以单层放入100×25mm培养皿中,每皿使用约130个种子。以使所有平板半开且在干燥器中间有足够空间放下250ml烧杯的方式将约3-4个平板放入通风橱内的干燥器中。用95ml商品漂白剂充满烧杯,沿烧杯壁逐滴在其中加入5ml浓缩(12N)HCl。立即关上干燥器,在通风橱中静置至少16小时。灭菌之后,盖上平板,接着移到层流橱中并开盖约30分钟以去除过剩的Cl2气体。接着如前述萌发种子。在室温下使干燥表面灭菌的种子保持无菌约2周。如前述制备外植体用于接种(Hinchee等,1988)。
外植体应孵育30分钟。共培养培养基和农杆菌重悬培养基由补充了1mg/L BAP、1mg/L GA3、3%(重量/体积)蔗糖、20mM MES(2-[N-吗啉代]乙基磺酸)、400mg/L L-半胱氨酸(Olhoft and Somers,2001)pH5.7、0.99mM二硫苏糖醇(DTT)和200μM乙酰丁香酮(AS)的B5培养基组成。将外植体在25℃共培养5天。共培养之后在含有100mg/L特美汀和200mg/L头孢噻肟、无MES和AS的共培养培养基中洗涤外植体。
在除草剂选择之前先将外植体置于嫩枝诱导培养基上并每14天转移一次,共28天。嫩枝诱导培养基由补充了1.7mg/L BAP、100mg/L特美汀、200mg/L头孢噻肟pH5.7和3%(重量/体积)蔗糖的全浓度B5培养基组成。将子叶以近轴侧向上放置,子叶节区浸入培养基中,在8周中每2周在所述培养基中补充水平升高的Basta(2、5、6和7mg/L的草铵膦)或非致死水平的2,4-滴(范围从10mg到400mg/L)。
其后将分化的外植体转移到嫩枝伸长培养基,在同样的草铵膦选择或降低的2,4-滴选择压(范围从10mg到100mg/L)下再培养4到10周。伸长培养基由用1mg/L玉米蛋白肌苷、0.1mg/L IAA(吲哚-3-乙酸)、0.5mg/L GA3、50mg/L谷氨酰胺、50mg/L天冬酰胺和3%(重量/体积)蔗糖修正,pH5.8的B5培养基(Sigma目录号M0404)组成。应该在含有全浓度维生素加0.5mg/L NAA(α-萘乙酸)或0.1mg/L IAA和2%(重量/体积)蔗糖的半浓度MS/B5培养基上不进行其他选择而使伸长的嫩枝生根。
在整个选择过程中在培养基中维持抗生素、特美汀和头孢噻肟。每两周将培养物转移到新鲜的培养基。在转移到温室之前使外植体适应1到2周。
13.1.3-子代评估
使T0植物在温室中自体受精以产生T1种子。用一系列的除草剂剂量喷洒T1植物(至产生足够的T0克隆的程度)以测定转基因大豆中AAD-1(v3)和PAT基因提供的除草剂抗性水平。对T0植物的2,4-滴用量一般使用100-400g ae/ha范围内的一个或两个选择用量。用更广泛的除草剂用量(范围从50-3200g ae/ha 2,4-滴)处理T1植物。类似的,可以通过分别用的草铵膦进行出苗后处理来筛选T0和T1植物的草铵膦抗性。如实施例9中对拟南芥和玉米的描述进行蛋白质表达分析。使用就除草剂耐性的T1和T2子代分离确定AAD-1(v3)的遗传。
13.2-转化方法2:不可再生的大豆悬浮细胞的“非摇动”农杆菌介导的转
化
以3天的循环培养DAS大豆细胞悬液,将10ml沉降的悬浮体积转移到115ml新鲜液体培养基中。如下确定沉降细胞体积:剧烈摇动后使细胞悬液在125mL瓶沉降2分钟,接着用大口10ml移液管将细胞从瓶底吸出。接着将瓶转移到140rpm的定轨摇床上。
将0.72OD600的细胞悬液的4ml等分试样与200μM乙酰丁香酮(AS)一起转移到100×25无菌培养皿上。将加入100μL密度为1.2 OD650的EHA105农杆菌悬液并充分混合。充分摇动农杆菌和悬浮细胞混合物并将平板转移到黑暗的生长室中,其中温度保持为25℃。
13.2.1-选择大豆悬浮细胞和分离转化集落
共培养4天后,再次摇动平板以使悬液充分混合,将1.5ml等分试样转移到选择培养基并涂在100×15ml培养皿上的凝胶培养基上。选择培养基由补充了1.7mg/L BAP、100mg/L特美汀、200mg/L头孢噻肟pH5.7和3%(重量/体积)的全浓度B5培养基组成,并用5mg/L水平的草铵膦修正了培养基。在通风橱中干燥10分钟后,于28℃在暗中孵育平板4周。选择中出现了集落并将来自三个不同实验的总计11个集落转移到新鲜培养基并维持3-4个月。全部11个抗性集落产生了在含有5mg/L草铵膦的选择培养基上生长的愈伤组织。涂到5mg/L草铵膦培养基上之后,非转化悬浮细胞为敏感性。然而,转化集落对5×浓度的草铵膦有抗性,并保持长达4个月。
当直径达到2到3cm时,选取愈伤组织事件的样品用于分析。至少分析两个集落分离物(各来自两个不同实验)的AAD1蛋白表达。对这两个分离物进行的ELISA和Western分析显示AAD1蛋白的阳性表达。对两个单独的转化AAD-1(v3)基因的大豆愈伤组织进行的ELISA(表29)和Western印迹(图18)分析表明愈伤组织表达AAD-1(v3)蛋白。夹层ELISA在两个不同的愈伤组织样品中检测到可溶性蛋白总量的0.0318%和0.0102%的AAD-1(v3)。由于抗血清的敏感性和交叉反应性,在Western印迹中观察到了多个条带。然而,在两个愈伤组织样品中都观察到了AAD-1(v3)特异性条带,而野生型(阴性)组织中则没有。编码区PCR分析显示了这些集落中AAD1和PAT编码区预期大小的产物,说明它们是转化而来。
|
表29.转基因大豆的PCR和ELISA数据 |
|
事件 |
AAD-1编码区PCR |
PAT编码区PCR |
TSP(μg/mL) |
AAD-1(ng/mL) |
表达百分比 |
|
1-1 |
+ |
+ |
1995.13 |
633.89 |
0.0318% |
|
2-1 |
+ |
+ |
2018.91 |
205.92 |
0.0102% |
|
阴性对照 |
- |
- |
2074.63 |
-1.22 |
-0.0001% |
13.3-转化方法3:气溶胶束介导的胚胎发生大豆愈伤组织的转化
如U.S.专利No.6,809,232(Held等)所述进行胚胎发生大豆愈伤组织的培养和其后的beaming。
转移到新鲜培养基三天后,分别将若干Stine良种(包括96E750、96E94、,97E986、96E144和96E692)的胚胎发生愈伤组织收集在B1-303Co5My或B1-30 3Co5My0.25PA0.5K平板中央。以约0.2μg/ml的浓度使用线性化DNA用pDAB3295 beaming组织。Beaming之后,将胚胎发生愈伤组织转移到新鲜的B1-30 3Co5My或B1-30 3Co5My0.25PA0.5K,1个月传代一次。然后将组织转移到含有1mg/l双丙氨膦的选择培养基。就双丙氨膦而言,一般在前两次一个月的传代中将选择维持在1mg/l,接着在其后的3到7个月升高到2mg/l。当转化实验产生的愈伤组织在含有2,4-滴加双丙氨膦的选择培养基上开始组织并发育成胚胎发生结构时鉴定转基因事件。鉴定后,按以下方案将成熟中的结构再生成植物:将胚胎发生结构从B1-30 3Co5My或B1-30 3/co5My0.25PA0.5K转移到B3培养基。在B3培养基上生长3到4周后,将单个结构转移至新鲜培养基。再过3到4周后,将成熟的胚转移到B5G培养基并置于光下。将具有伸长和拉长的根的胚转移到含有1/2 B5G培养基的管中(在此继续发育成小植株)并从管中移出置于盆中。
测试了表30中提到的培养基变更,如通过在B1-30中加入3%椰汁和5gm/l肌醇产生的B1-30 3Co5My。其他变更包括:含有以下成分的B1-303Co5My0.25 PA0.5K:B1-30基础培养基加3%椰汁、5gm/l肌醇、0.25gm/l植酸和0.5gm/l额外KH2PO4的和含有一半浓度的B5G培养基所有成分的1/2 B5G。
|
表30.大豆生长培养基 |
|
|
1升中成分 |
|
B1-30 |
B3 |
B5G |
|
Ms盐 |
4.43g |
4.43g |
|
|
B5盐 |
|
|
3.19g |
|
NaEDTA |
37.3mg |
37.3mg |
37.3mg |
|
2,4-滴 |
30mg |
|
|
|
活性炭 |
|
5g |
|
|
Phytagar |
8g |
8g |
|
|
Gelrite |
|
|
2g |
|
pH |
5.8 |
5.8 |
5.8 |
实施例14-在棉花中启动AAD-1
(v3)
14.1-棉花转化方案
使棉花种子(Co310基因型)在95%乙醇中表面灭菌1分钟、洗涤、用50%商品漂白剂灭菌20分钟并用无菌蒸馏水漂洗三次,其后使其在Magenta GA-7管中的G培养基(表31)上萌发并在40-60μE/m2的高光强下维持,光周期设置为28℃下16小时光照和8小时黑暗。
从7-10天龄的苗分离子叶节段(约5mm)到培养皿中的液体M液体培养基(表31)。用农杆菌溶液处理剪下的片段(约30分钟),其后转移到半固体M培养基(表31)共培养2-3天。共培养之后将片段转移至MG培养基(表31)。用羧苄青霉素作为杀死农杆菌的抗生素,用草铵膦作为仅允许含有转移基因的细胞生长的选择剂。
农杆菌的制备
接种35ml Y培养基(表31)(含有链霉素(100mg/ml贮存液)和红霉素(100mg/ml贮存液))和1菌环细菌在28℃在黑暗中生长过夜。第二天将农杆菌溶液倒入无菌oakridge管(Nalge-Nunc,3139-0050)中并在Beckman J2-21中以8000rpm离心5分钟。倒掉上清液并将沉淀重悬于25ml M液体(表31)中并涡旋。将等分试样放入玻璃培养管(Fisher,14-961-27)用于Klett读数(Klett-Summerson,model 800-3)。以总体积40ml用M液体培养基将新悬液稀释到Klett计读数为每mL 108个菌落形成单位。
三周后,分离来自子叶的愈伤组织并转移至新鲜MG培养基。愈伤组织转移到MG培养基上再过3周。接着将愈伤组织转移至CG培养基(表31),并在三周后再转移至新鲜的选择培养基。再经过三周后,将愈伤组织转移至缺少植物生长调节剂的D培养基(表31)用于胚胎发生愈伤组织诱导。在此培养基上经过4-8周后形成了胚胎发生愈伤组织,可通过其淡黄白色的颜色和颗粒细胞区别于非胚胎发生愈伤组织。胚在其后很快开始再生,颜色为不同的绿色。
分离较大的发育良好的胚转移到DK培养基(表31)用于胚发育。3周后(或当胚已发育时)将萌发的胚转移至新鲜培养基用于嫩枝和根发育。4-8周后,将任何发育良好的植物转移到土壤中培养至成熟。在接下来的两三个月中,植物已经生长至可以喷洒以确定其是否具有2,4-滴抗性的点。
|
表31.用于棉花转化的培养基 |
|
1升中成分 |
G |
M液体 |
M |
MG |
CG |
D |
DK |
Y |
|
LS盐(5×) |
200ml |
200ml |
200ml |
200ml |
200ml |
|
|
|
|
葡萄糖 |
|
30克 |
30克 |
30克 |
30克 |
20克 |
|
|
|
改良的B5维生素(1000×) |
1ml |
1ml |
1ml |
1ml |
1ml |
10ml |
1ml |
|
|
激动素(1mM) |
|
1ml |
1ml |
1ml |
4.6ml |
|
0.5ml |
|
|
2,4-滴(1mM) |
|
1ml |
1ml |
1ml |
|
|
|
|
|
琼脂 |
8克 |
|
8克 |
8克 |
8克 |
8克 |
8克 |
|
|
DKW盐(D190) |
|
|
|
|
|
1包 |
1包 |
|
|
肌醇(100×) |
|
|
|
|
|
1ml |
10ml |
|
|
蔗糖3% |
30克 |
|
|
|
|
|
30克 |
10克 |
|
NAA |
|
|
|
|
|
|
|
|
|
羧苄青霉素(250mg/ml) |
|
|
|
2ml |
0.4ml |
|
|
|
|
GLA(IOmg/ml) |
|
|
|
0.5ml |
0.3ml |
|
|
|
|
蛋白胨 |
|
|
|
|
|
|
|
10克 |
|
酵母提取物 |
|
|
|
|
|
|
|
10克 |
|
NaCl |
|
|
|
|
|
|
|
5克 |
14.2-实验细节
此实验用pDAB721处理500个子叶节段。处理的500个节段中的475个在选择中分离了愈伤组织(95%转化频率)。构建体中包含PAT基因,由于已经开发了选择方案,因此在草铵膦上选择愈伤组织。起始了PCR和侵入物形式的愈伤组织株系分析以测定插入模式和确定在愈伤组织期中存在该基因,接着将胚胎发生的愈伤组织株系用于Western分析。
14.3-愈伤组织分析结果
该分析的目的是消除任何不含有完整PTU、无表达或具有高拷贝数的任何株系,从而不再生这些株系。在475个pDAB721转化愈伤组织株系中,将306个用于PCR分析和侵入物测定(表32)。很少的株系为PCR阴性。此时侵入物结果尚未完成,因为提取后一些样品的DNA量很低而进行了重新提交。然而,目前的侵入物数据显示提交的株系中少量具有高拷贝数(>2的拷贝数)(表32)。由于通过分析的株系数量庞大,由于容量的缘故有必要降低维持的胚胎发生愈伤组织株系。将90个株系送交Western分析,其中8个为阴性。Western分析在多数株系中显示了高表达(表32)。基于分析结果(和未决的结果)维持了82个胚胎发生愈伤组织株系用于植物再生。
表32.棉花愈伤组织分析
|
株系 |
拷贝数 |
PTU |
Wester |
|
1 |
2 |
阳性 |
*** |
|
2 | |
阳性 |
*** |
|
3 | |
阳性 |
*** |
|
4 |
2 |
阳性 |
*** |
|
5 | |
阳性 |
*** |
|
6 | |
阳性 |
阴性 |
|
7 | |
阳性 |
**** |
|
8 | |
阳性 |
***** |
|
株系 |
拷贝数 |
PTU |
Western |
|
43 |
1 |
阳性 |
***** |
|
44 |
低DNA |
阳性 |
***** |
|
45 |
1 |
阳性 |
***** |
|
46 |
2 |
阳性 |
***** |
|
47 |
1 |
阳性 |
*** |
|
48 |
1 |
阳性 |
*** |
|
49 |
3 |
假阳 |
阴性 |
|
50 |
1 |
阳性 |
**** |
|
9 |
2 |
阳性 |
* |
|
10 |
|
阳性 |
* |
|
11 |
|
阳性 |
***** |
|
12 |
|
阳性 |
* |
|
13 |
|
阳性 |
* |
|
14 |
|
阳性 |
** |
|
15 |
|
阳性 |
**** |
|
16 |
|
阳性 |
***** |
|
17 |
|
阳性 |
* |
|
18 |
|
阳性 |
*** |
|
19 |
|
阳性 |
** |
|
20 |
|
阳性 |
***** |
|
21 |
2 |
阳性 |
***** |
|
22 |
|
阳性 |
***** |
|
23 |
|
阳性 |
***** |
|
24 |
4 |
阳性 |
*或阴性 |
|
25 |
|
阳性 |
**** |
|
26 |
|
阳性 |
**** |
|
27 |
低 |
阳性 |
***** |
|
28 |
低 |
阳性 |
** |
|
29 |
低 |
阳性 |
***** |
|
30 |
17 |
阳性 |
* |
|
31 |
低 |
阳性 |
***** |
|
32 |
低 |
阳性 |
***** |
|
51 |
4 |
阳性 |
阴性 |
|
52 |
2 |
阳性 |
**** |
|
53 |
1 |
阳性 |
*** |
|
54 |
1 |
阳性 |
**** |
|
55 |
1 |
阳性 |
阴性 |
|
56 |
5 |
阳性 |
* |
|
57 |
2 |
假阳 |
阴性 |
|
58 |
8 |
阳性 |
**** |
|
59 |
2 |
阳性 |
**** |
|
60 |
5 |
阳性 |
***** |
|
61 |
1 |
阳性 |
** |
|
62 |
1 |
阳性 |
** |
|
63 |
1 |
阳性 |
*** |
|
64 |
1 |
阳性 |
*** |
|
65 |
3 |
阳性 |
* |
|
66 |
5 |
阳性 |
* |
|
61 |
6 |
阳性 |
* |
|
68 |
低DNA |
阳性 |
阴性 |
|
69 |
低DNA |
阳性 |
** |
|
70 |
低DNA |
阳性 |
** |
|
71 |
低DNA |
假阳 |
** |
|
72 |
低DNA |
阳性 |
**** |
|
73 |
低DNA |
阴性 |
*** |
|
74 |
低DNA |
假阳 |
*** |
|
33 |
低 |
阳性 |
**** |
|
34 |
低 |
假阳性 |
***** |
|
35 |
低 |
阳性 |
**** |
|
36 |
低 |
阳性 |
阴性 |
|
37 |
低 |
阳性 |
**** |
|
38 |
低 |
阴性 |
***** |
|
39 |
1 |
阳性 |
**** |
|
40 |
低 |
阳性 |
* |
|
41 |
低 |
阳性 |
* |
|
42 |
低 |
阳性 |
** |
|
75 |
低DNA |
阳性 |
*** |
|
76 |
低DNA |
阳性 |
阴性 |
|
77 |
低DNA |
假阳 |
**** |
|
78 |
低DNA |
阳性 |
**** |
|
79 |
1 |
阳性 |
** |
|
80 |
低DNA |
阳性 |
*** |
|
81 |
低DNA |
阳性 |
*** |
|
82 |
低DNA |
阳性 |
*** |
|
83 |
低DNA |
阴性 |
*** |
|
84 |
低DNA |
阳性 |
*** |
|
85 |
低DNA |
阳性 |
** |
|
86 |
低DNA |
阳性 |
* |
|
|
|
|
|
标准AAD1 5μg/ml*****
标准AAD1 0.5μg/ml**
14.4-植物再生
将按上述方案产生植物的两个AAD-1(v3)棉花株系送至温室。为证明AAD-1(v3)基因在棉花中提供对2,4-滴的抗性,用设置为187L/ha的履带式喷雾机喷洒两种AAD-1(v3)棉花植物和野生型棉花植物。以配制在200mM Hepes缓冲液(pH7.5)中的560g ae/ha 2,4-DMA喷洒植物。在处理后3、7和14天评估植物。就发育障碍、缺绿症和坏死对植物评定损伤率。评定为90%或以上损伤率的植物认为是死亡。处理后3天(DAT),野生型开始显示epinasy,损伤率为15%;相反,AAD-1(v3)植物显示0%损伤。到7 DAT epinasy在野生型上继续存在,并且新长出的嫩枝开始变成褐色。此时其损伤率为50%。在14 DAT,AAD-1(v3)植物仍无损伤,而野生型形成严重的发育障碍,新长出的部分为褐色并枯萎。因此,野生型在14 DAT损伤率为90%。
此研究证明棉花中的AAD-1(v3)基因提供对高达至少560g ae/ha的2,4-滴显著的耐性。
实施例15-其他作物的农杆菌转化
按照本文公开的内容,可以根据本发明使用本领域已知的技术转化其他作物。对于农杆菌介导的黑麦转化,参阅如Popelka和Altpeter(2003)。对于农杆菌介导的大豆转化,参阅如Hinchee等,1988。对于农杆菌介导的高粱转化,参阅如Zhao等,2000。对于农杆菌介导的大麦转化,参阅如Tingay等,1997。对于农杆菌介导的小麦转化,参阅如Cheng等,1997。对于农杆菌介导的稻转化,参阅如Hiei等,1997。
下文给出了这些和其他植物的拉丁名。应该明确,这些和其他(非农杆菌)转化技术可用于将例如AAD-1(v3)转化进这些植物和其他植物,包括但不仅限于玉米(Gramineae Zea mays)、小麦(Pooideae Triticum属)、Rice(Gramineae Oryza属和Zizania属)、大麦(Pooideae Hordeum属)、棉花(Abroma Dicotyledoneae Abroma augusta和Malvaceae Gossypium属)、大豆(Soya Leguminosae Glycine max)、甜菜(Chenopodiaceae Betavulgaris altissima)、甘蔗(Arenga pinnata)、西红柿(SolanaceaeLycopersicon esculentum和其他属、Physalis ixocarpa、Solarium incanum和其他属,以及Cyphomandra betacea)、马铃薯、甘薯、黑麦(PooideaeSecale属)、胡椒(Solanaceae Capsicum annuum、sinense和frutescens)、莴苣(Compositae Lactuca sativa,perennis,andpulchella)、卷心菜、芹菜(Umbelliferae Apium graveolens)、茄子(Solanaceae Solariummelongena)、高粱(所有Sorghum物种)、苜蓿(Leguminosae Medicagosativum)、胡萝卜(Umbelliferae Daucus carota sativa)、豆类(Leguminosae Phaseolus属和其他属)、燕麦(Avena Sativa和Strigosa)、豌豆(Leguminosae Pisum、Vigna和Tetragonolobus属)向日葵(Compositae Helianthus annuus)、南瓜(Dicotyledoneae Cucurbita属)黄瓜(Dicotyledoneae genera)、烟草(Solanaceae Nicotiana属)、拟南芥(Cruciferae Arabidopsis thaliana)、Turfgrass(Loliwn、Agrostis和其他科)和三叶草(Leguminosae)。带有如AAD-1(v3)的这些植物包括于本发明中。
实施例16-将AAD-1
(v3)与AHAS除草剂抗性基因叠加
实施例7.9中描述了将AAD-1(v3)与AHAS除草剂抗性基因叠加。
实施例17-令人惊奇的结果的其他证据:AAD-1
对AAD-2
17.1-AAD-2(v1)起始克隆
从NCBI数据库(参阅
ncbi.nlm.nih.gov网址,登录号AP005940)鉴定了与tfdA只有44%氨基酸同一性的另一个基因。为保持一致性,此基因在本文中称为AAD-2(v1)。通过以下测定同一性百分比:首先将AAD-2和tfdA DNA序列(分别为SEQ ID NO:12和GENBANK登录号M16730)翻译成蛋白质(分别为SEQ ID NO:13和GENBANK登录号M16730),接着使用VectorNTI软件包中的ClustalW进行多重序列比对。
含有AAD-2(v1)基因的大豆慢生根瘤菌(Bradyrhizobium japonicum)菌株得自Northern Regional Research Laboratory(NRRL,菌株号B4450)。按照NRRL方案复苏低压冻干的菌株并以Dow细菌菌株DB 663在20%甘油中保存于-80℃用于内部用途。将来自此冰冻原种的一菌环细菌涂在Triptic大豆琼脂上用于分离,并在28℃孵育3天。用单菌落接种到500ml三角瓶中的100ml Tryptic大豆培养液中,在150rpm的平板摇床上以28℃孵育过夜。使用Qiagen的DNeasy试剂盒(Qiagen目录号69504)的革兰氏阴性方案从其中分离总DNA。设计以下引物以从基因组DNA中扩增靶基因,正向:5′ACT AGT AAC AAA GAA GGA GAT ATA CCA TGACGA T 3′[brjap 5′(speI)SEQ ID NO:14(加入了SpeI限制性位点和核糖体结合位点(RBS))]和反向:5′TTC TCG AGC TAT CAC TCC GCC GCCTGC TGC TGC 3′[br jap 3′(xhol)SEQ ID NO:15(加入了XhoI位点)]。
按如下建立50μl的反应:Fail Safe Buffer 25μl、ea.引物1μl(50ng/μl)、gDNA 1μl(200 ng/μl)、H2O 21μl、Taq聚合酶1μl(2.5单位/μl)。在三个分开的反应中使用三种Three Fail Safe Buffer-A、B和C。使用FailSafe PCR系统(Epicenter目录号FS99100)在以下条件下进行PCR反应:95℃3.0分钟的热变性循环;95℃1.0分钟、50℃1.0分钟、72℃1.5分钟的30个循环;接着是72℃5分钟的终循环。使用化学感受态的TOP10F’大肠杆菌作为宿主菌株,按照所包含的方案将得到的约1kb的PCR产物克隆进pCR 2.1(Invitrogen目录号K4550-40)以验证核苷酸序列。
挑出10个得到的白色克隆至3μl Luria培养液+1000μg/ml氨苄青霉素(LB Amp)并在37℃摇动培养过夜。按照所包含的方案使用NucleospinPlus质粒小量制备试剂盒(BD Biosciences目录号K3063-2)从每个培养物中纯化质粒。用限制性内切酶EcoRI(New England Biolabs目录号R0101S)消化质粒DNA。按照生产商的说明使用M13正向[5′GTA AAACGA CGG CCA GT 3′](SEQ ID NO:16)和反向[5′CAG GAA ACA GCTATG AC 3′](SEQ ID NO:17)引物用Beckman CEQ Quick Start试剂盒(Beckman Coulter目录号608120)进行测序。为了内部一致性,给予此基因序列及其相应蛋白质新的通用名AAD-2(v1)。
17.2-AAD-2(vl)二元载体的完成
从pDAB3202中PCR扩增AAD-2(v1)基因。在PCR反应中,在引物内进行了改变,以在5’引物和3’引物中分别引入AfIIII和SacI限制性位点。使用Fail Safe PCR系统(Epicentre)用引物“Ncol of Brady”[5′TATACC ACA TGT CGA TCG CCA TCC GGC AGC TT 3′](SEQ ID NO:18)和“Sac I of Brady”[5′GAG CTC CTA TCA CTC CGC CGC CTG CTGCTG CAC 3′](SEQ ID NO:19)扩增DNA片段。将PCR产物克隆进pCR2.1 TOPO TA克隆载体(Invitrogen),使用Beckman Coulter″DyeTerminator Cycle Sequencing with Quick Start Kif″测序试剂用M13正向和M13反向引物验证序列。测序数据鉴定了一个具有正确序列的克隆(pDAB716)。接着将Afllll/SacI AAD-2(v1)基因片段克隆进NcoI/SacIpDAB726载体。通过(用NcoI/SacI)限制性消化验证得到的构建体(pDAB717);AtUbi10启动子:Nt OSM 5′UTR:AAD-2(v1):NtOSM3′UTR:ORF1 polyA 3′UTR。将此构建体以NotI-NotI DNA片段克隆进二元载体pDAB3038。(用NotI、EcoRI、HinDIII、Ncol、PvuII和Sal)限制性消化得到的构建体(pDAB767);AtUbi10启动子:NtOSM5′UTR:AAD-2(v1):Nt OSM 3′UTR:ORF1 polyA 3′UTR:CsVMV启动子:PAT:ORF25/26 3′UTR以验证正确的方向。接着用完成的构建体(pDAB767)转化进农杆菌中。
17.3-AAD-2(v1)和AAD-1
(v1)底物特异性的比较
测试了如实施例11制备的来自表达AAD-2(v1)(pDAB3202)的大肠杆菌提取物对四种除草剂2,4-滴、(R,S)-2,4-滴丙酸、(R,S)-吡氟氯禾灵和(R)-吡氟氯禾灵(均为0.5mM终浓度)的活性,每个测定使用15μl(42μg)大肠杆菌提取物和15分钟的测定期。图22显示AAD-2(v1)对底物的相对活性为2,4-滴=2,4-滴丙酸>(R,S)-吡氟氯禾灵>>(R)-吡氟氯禾灵。因此AAD-2(v1)与AAD-1(v1)的差异在于它对2,4-滴和2,4-滴丙酸具有相似水平的活性(而AAD-1(v1)对2,4-滴的活性仅为2,4-滴丙酸的约10%)。AAD-2(v1)与AAD-1(v1)的差异还在于它不能作用于(R)-吡氟氯禾灵。表33显示了来自用AAD-1(v1)和AAD-2(v1)测试其他底物的数据,证实了与(R)对映体特异性的AAD-1(v1)相反,AAD-2(v1)对(S)对映体底物具有特异性。在另一个测试中发现,AAD-2(v1)与AAD-1(v1)的差异在于它不或几乎不从磺酸2,4-滴(其中磺酸基取代了的羧基)中释放可检测的酚,而AAD-1(v1)由此底物产生显著水平的酚(约2,4-滴的25%)。
使用2,4-滴作为底物比较了部分纯化的AAD-1(v1)和AAD-2(v1)的酶动力学。见图19。AAD-1(v1)和AAD-2(v1)对2,4-滴的Km值分别为97和423μM,表观Vmax值分别为0.11和0.86 A510单位(表34)。由于在测定中使用了等价量的酶(通过SDS-PAGE分析测定),因此可以得出结论,AAD-2(v1)对2,4-滴的kcat几乎比AAD-1(v1)高8倍,而kcat/Km高2倍。因此在体外AAD-2(v1)能比AAD-1(v1)显著更高效的裂解2,4-滴。令人惊奇地,这与下文报道的植物中的发现相反,在报道中相对于AAD-2(v1)而言,表达AAD-1(v1)的植物能显著更好的赋予2,4-滴抗性。
|
表34.用不同底物比较来自pDAB3202(AAD-2)和pDAB3203(AAD-1(v1))的芳氧基链烷酸酯双加氧酶(AAD)的Km和“Vmax”值 |
|
酶 |
化合物 |
Km(μM)±SE |
Vmax(A510单位) |
Km/Vmax(主观) |
|
AAD-2AAD-1(v1) |
2,4-滴2,4-滴 |
423(±1)97(±21) |
0.860.11 |
2.031.16 |
注:在MOPS pH6.75+1mMα酮戊二酸+0.1mM维生素C酸钠+0.1mM Fe2+中进行测定,使用4-氨基安替比林/铁氰化物用色度法测定释放的酚。
17.4-转化拟南芥的评估
在室温下使新收获的转化天然[AAD-1(v2)]、植物优化的[AAD-1(v3)]或天然AAD-2(v1)基因的T1种子干燥7天。将T1种子种到26.5×51cm的萌发盘(T.O.Plastics Inc.,Clearwater,MN)中,每盘容纳200mg(约10000个种子)的成层T1种子等分试样,种子事先悬于40ml 0.1%琼脂糖溶液并在4℃保存2天以完成休眠的需要并保证同步的种子萌发
用细蛭石覆盖Sunshine Mix LP5(Sun Gro Horticulture Inc.,Bellevue,WA)并用Hoagland溶液地下灌溉至湿透,接着重力排水。用移液管将成层种子的每个40ml的等分试样均匀种在蛭石上并用保湿罩(KORDProducts,Bramalea,Ontario,Canada)覆盖4-5天。在使用草甘膦出苗后喷洒(选择共转化的PAT基因)起始转化体选择之前1天去除盖。
种植后5到6天(DAP)以及10 DAP用Liberty除草剂(200g ai/L草铵膦,Bayer Crop Sciences,Kansas City,MO)的0.2%溶液喷洒T1植物(分别为子叶期和2-4叶期),在每次应用中以10ml/盘(703L/ha)的喷洒体积使用DeVilbiss压缩空气喷雾头使用280g ai/ha有效剂量的草铵膦。在最后应用5-7天后鉴定存活株(活跃生长的植物)并单独移植到用盆栽基质(Metro Mix 360)制备的3英寸盆中用保湿罩覆盖移植的植物3-4天并如前置于22℃生长室中。其后去除盖,并测试AAD-1(v3)、AAD-1(v2)或AAD-2(v1)提供苯氧基生长素除草剂抗性的能力之前至少1天将植物移至温室(22+5℃、50±30%RH、14小时光照:10小时黑暗、最小500μE/mV的自然+补充光)。
选择用于上述草铵膦抗性的随机单个T1植物使用PAT ELISA试剂盒(部件号7000045,Strategic Diagnostics,Inc.,Newark,DE)确认PAT蛋白质的表达,以非破坏性的确认选择方法的保真度(生产商的方案)。接着将植物随机提交多种用量的2,4-滴(50-800g ae/ha)。
以187L/ha的喷洒体积通过履带式喷雾机应用除草剂。使用的2,4-滴为混合在200mM Tris缓冲液(pH9.0)中的商品二甲胺盐配方(456g ae/L,NuFarm,St Joseph,MO)。
17.5-转化植物的选择结果
首先使用AAD-1(v3)进行拟南芥转化。首先使用草铵膦选择方案从未转化种子的背景中选择T1转化体。筛选了超过400000个T1种子,鉴定了493个草铵膦抗性植物(PAT基因),等同于0.12%的转化/选择率。取决于测试种子的批次,其范围从0.05-0.23%(见上文实施例6.5的表15)。还使用草铵膦选择剂选择了一小批天然AAD-1(v2)转化种子。从筛选的84000个种子中鉴定了278个草铵膦抗性T1个体(0.33%的转化/选择率)。令人惊奇地,当对草铵膦耐性(PAT选择标记物功能)进行选择时,使用天然AAD-2(v1)基因的拟南芥转化提供了极低的转化率。筛选了约一百三十万个种子,仅回收了228个草铵膦转化体,等同于0.018%的转化/选择率(见表15)。天然AAD-2(v1)的转化率仅为天然AAD-1(v2)的6%。接着合成优化了天然AAD-2(v1)基因、克隆并使用前述方法(见表5)以pDAB3705转化进拟南芥。植物优化的AAD-2(v2)(编码SEQ ID NO:30的SEQ ID NO:29)获得了使用Liberty除草剂的正常T1拟南芥选择率,约为0.11%(见表15)。
其后将以上选择的T1植物移植到单个盆中并用多种用量的芳氧基链烷酸酯商品除草剂喷洒。(上文实施例6.5中的)表16比较了AAD-1(v2)、AAD-1(v3)、AAD-2(v1)和AAD-2(v2)输入2,4-滴抗性到拟南芥T1转化体的应答。相对于转化和未转化对照株系,所有基因都确实提供了一些显著的2,4-滴抗性,然而,各个构建体在其输入2,4-滴抗性到个体T1拟南芥植物的能力上存在广泛的差异。在给定的处理中,植物的应答水平差异很大,这可归因于每个植物代表独立的转化事件。要着重指出的是,在测试的每个2,4-滴用量下都存在未受影响的个体,而另外一些则受到严重的影响。总体种群平均损伤率示于表16,仅用于证明在转化了AAD-1(v2)、AAD-1(v3)、AAD-2(v1)或AAD-2(v2)的植物和野生型或转化PAT/CryIF的对照之间的显著差异。
令人惊奇地,从高耐性植物的频率以及总体平均损伤来看,AAD-2(v1)转化体对2,4-滴的耐性远低于AAD-1(v2)或AAD-1(v3)(表16)。没有转化AAD-2(v1)的植物能相对无损伤(的可见损伤)的在200g ae/ha 2,4-滴下存活,总体种群损伤约为83%。相反,56%(80个中的45个)的AAD-1(v2)转化T1植物无损伤的在下存活(种群平均损伤=34%),>73%(15个中的11个)的AAD-1(v3)转化植物无损伤(种群平均损伤=14%)。见表20。植物优化的AAD-2(v2)的耐性比天然基因略有提高,然而,AAD-1和AAD-2植物优化基因的比较表明AAD-1(v3)在植物中具有显著的优势(见表16)。
由于AAD-1(v2)和AAD-2(v1)的体外比较表明AAD-2(v1)更好的降解2,4-滴,因此这些结果是未曾预料到的。AAD-2(v1)在T1植物个体中以预期的大小以变化的水平表达,然而这种表达的蛋白质几乎不提供对2,4-滴损伤的保护。Western印迹指出的表达水平和同一植物的2,4-滴损伤水平之间几乎没有关系。见图21。天然和植物优化的AAD-2基因(在植物中)的蛋白质表达水平没有明显的大差异。这些数据证实了之前的发现,即在植物中产生AAD-1(v3)的功能性表达以输入对2,4-滴和AOPP除草剂的抗性是意外。
实施例18-种植前灭生性应用
此实施例和其后的实施例是本发明AAD-1带来的新除草剂用途的具体实例,所述除草剂可能是由本发明的AAD-1制成。
种植前灭生性除草剂应用旨在在种植给定作物前杀死在冬天或早春出现的杂草。一般在种植前未完成物理除草的非耕地或减少的耕地管理系统中使用这些应用。因此除草剂程序必须控制种植时存在的广谱阔叶和禾本科杂草。草甘膦、对草快和草铵膦是种植前灭生除草剂应用中广泛使用的非选择性无残留除草剂的实例。然而,由于以下一种或多种原因使这个季节的一些杂草很难控制:杂草物种或生物型对除草剂的内在不敏感性、冬性一年生杂草的相对较大的大小和限制除草剂摄取和活性的凉爽的天气条件。一些除草剂选择可以与这些除草剂罐混以提高谱和对非选择性除草剂不太有效的杂草的活性。实例为2,4-滴与草甘膦罐混应用以辅助控制Conyza canadensis(加拿大蓬)。用于存在的多数杂草的种植前灭生的草甘膦用量可从420到1680g ae/ha,更一般的从560到840g ae/ha,然而,可以应用280-1120g ae/ha的2,4-滴以辅助控制许多阔叶杂草物种(如加拿大蓬)。2,4-滴是优选的除草剂,因为它对多种阔叶杂草有效、甚至在低温下也有效并且非常廉价。然而,如果其后的作物为敏感性双子叶作物,则土壤中的2,4-滴残留(尽管残留很短)可能对作物产生负影响。大豆是敏感性作物,需要在灭生应用和种植之间存在至少7天(对于280g ae/ha的2,4-滴用量)到至少30天(对于1120g ae/ha的2,4-滴应用)的时间。在棉花种植前禁止用2,4-滴进行灭生性处理(参阅联邦label,多数通过CPR,2003提供或在
cdms.net/manuf/manuf.asp在线提供)。使用AAD-1(v3)转化的大豆,这些作物在土壤中来自之前甚至在种植后作物出苗前的灭生性应用的2,4-滴残留下存活。罐混(或商品预混)伴侣中提高的灵活性和降低的费用可改善杂草控制的选择并提高重要的非耕地或减少耕地条件下灭生性应用的强度。此实施例是可能的多种选择之一。通过使用联邦除草剂标签(CPR,2003)中所述产品和例如Agriliance Crop Protection Guide(2003)所描述的用途,杂草控制领域的技术人员会注意到多种其他应用,包括但不仅限于对草快+2,4-滴或草铵膦+2,4-滴。本领域技术人员还会认识到,以上实施例可应用于任何由AAD-1(v3)基因(如果稳定转化后)保护的2,4-滴敏感性(或其他苯氧基生长素)作物。
实施例19-苯氧基生长素除草剂在仅转化AAD-1
(v3)的大豆、棉花和其他 双子叶作物中的植物内应用
AAD-1(v3)使得可以在通常对2,4-滴敏感的作物中使用苯氧基生长素除草剂(如2,4-滴、2,4-滴丙酸、MCPA等)直接控制广谱阔叶杂草。280到2240g ae/ha的2,4-滴应用可控制农业环境中存在的多数阔叶杂草物种。更一般的使用560-1120g ae/ha。就完全的杂草控制系统而言,禾本科杂草必须受到控制。目前已批准将多种阔叶谱禾本科除草剂(包括但不仅限于吡氟氯禾灵、喹禾灵、fenoxaprop、二氢吡啶、sethoxydim和clethodim)用于多数天然耐受这些除草剂的双子叶作物。喹禾灵(20-100g ae/ha)加2,4-滴(420-840g ae/ha)的组合可在转化了AAD-1(v3)双子叶作物(即大豆或棉花)提供两种除草剂作用模式,可以与草甘膦在草甘膦耐性作物中相似的方式控制多数农业杂草(见杂草控制谱,参阅Agriliance CropProtection Guide性能评定)。
这种额外的工具的优势是阔叶除草剂组分极低的费用和以较高用量使用时较高用量的2,4-滴和/或AOPP除草剂提供的可能的短期残留杂草控制,而非残留除草剂如草甘膦不提供对后来的禾本科杂草的控制。这种工具还提供了借助HTC作为整合的除草剂抗性轮换除草剂作用模式的机制和草甘膦耐性作物/AAD-1(v3)HTC轮作策略中杂草转换管理的策略(无论是否轮作作物物种)。另外,此系统的禾本科和阔叶杂草控制组分彼此独立,因此允许杂草控制领域的技术人员确定生长素和AOPP除草剂最经济和高效的比例。例如,如果当需要除草剂应用时阔叶杂草是仅存的显著杂草,则可以无另一种除草剂的进行560到1120g ae/ha 2,4-滴的除草剂应用。这可以降低不必要的除草剂应用,提供降低输入费用和降低杀虫剂环境载荷的灵活性,并降低不必要的发展除草剂抗性杂草的选择压。
其他益处包括对以2,4-滴漂移或挥发为机制的远距离2,4-滴对双子叶作物的损伤的耐性;在2,4-滴应用后种植之前不需要间隔(见前述实施例)和较少的由未完全清洁的含有2,4-滴的大罐引起的对双子叶作物的污染损伤问题。二氯甲氧苯酸(和其他除草剂)仍可用于继续控制转化了AAD-1(v3)的双子叶作物自生作物。
本领域技术人员还会认识到,以上实施例可用于可被稳定转化的AAD-1(v3)基因保护的任何2,4-滴(或其他苯氧基生长素除草剂)敏感性作物。杂草控制领域的技术人员会认识到,AAD-1(v3)转化使得可以使用单独或与多种商品AOPP除草剂组合的多种商品苯氧基生长素除草剂。可以通过CPR(《作物保护参考》)书中汇编的除草剂标签或类似的汇编或任何商品或学术作物保护参考(如来自Agriliance的《作物保护指南》(2003))确定这些化学中其他代表性除草剂的具体用量。每种由于AAD-1(v3)而可以使用于HTC的(单独、罐混或顺序使用的)备选除草剂都考虑在本发明的范围内。
实施例20-苯氧基生长素和AOPP除草剂在仅转化AAD-1(v3)的玉米、稻
和其他单子叶物种中的植物内用途
以类似的方式用AAD-1(v3)转化禾本科物种(例如但不仅限于玉米、稻、小麦、大麦或草坪和牧草)将使得可以在通常对高效AOPP禾本科除草剂敏感的作物中使用这些除草剂。多数禾本科物种对生长素除草剂如苯氧基生长素(即2,4-滴、2,4-滴丙酸等)具有天然耐性。然而,由于应用时间窗口变短和替代的阔叶杂草,相对低水平的作物选择性导致了这些植物中应用的减少。因此转化了AAD-1(v3)的单子叶作物可使得使用描述用于处理双子叶作物的类似组合,如应用280到2240g ae/ha的2,4-滴控制多数阔叶杂草物种。更一般的使用560-1120g ae/ha。多种广谱AOPP禾本科除草剂(包括但不仅限于吡氟氯禾灵、喹禾灵、fenoxaprop和吡氟禾草灵)可用于有效控制广泛使用的禾本科杂草。环己二酮禾本科除草剂如sethoxydim、clethodim等不能用于这种双子叶作物系统,因为AAD-1不能提供对此化学品的保护,并且禾本科作物对环己二酮化学品天然敏感。然而,这种属性可允许将环己二酮用于转化了AAD-1(v3)的禾本科作物自生作物的继后控制。现在AAD-1使类似的杂草控制策略可用于双子叶物种。喹禾灵(20-100g ae/ha)加2,4-滴(420-840g ae/ha)的组合可在转化了AAD-1(v3)的单子叶作物(如玉米和稻)中提供两种除草剂作用模式,可以与草甘膦在草甘膦耐性作物中相似的方式控制多数农学杂草(参考Agriliance Crop Protection Guide性能评定的杂草控制谱)
这种额外的工具的优势是阔叶除草剂组分费用极低和以较高用量使用时较高用量的2,4-滴和/或AOPP除草剂提供的可能的短期残留杂草控制。相比之下,非残留除草剂(如草甘膦)不提供对后来的禾本科杂草的控制。这种工具还提供了借助HTC作为整合的除草剂抗性轮换除草剂作用模式的机制和草甘膦耐性作物/AAD-1(v3)HTC轮作策略中杂草转换管理的策略(无论是否轮作作物物种)。另外,此系统的禾本科和阔叶杂草控制组分彼此独立,因此允许杂草控制领域的技术人员确定生长素和AOPP除草剂最经济和有效的比例。例如,如果当需要除草剂应用时阔叶杂草是仅存的显著杂草,则可以无另一种除草剂的进行560到1120g ae/ha 2,4-滴的除草剂应用。这可以降低不必要的除草剂应用,提供降低输入费用和降低杀虫剂环境载荷的灵活性,并降低不必要的发展除草剂抗性杂草的选择压。玉米和其他单子叶植物对苯氧基生长素提高的耐性将能够在作物中使用这些除草剂而无生长阶段限制或作物倾斜、展开现象如“鼠尾”、作物倾斜、玉米中生长调节剂诱导的茎脆性或支柱根变形的可能。
本领域技术人员还会认识到,以上实施例可用于可被稳定转化的AAD-1(v3)保护免受AOPP除草剂损伤的任何单子叶作物。杂草控制领域的技术人员会认识到,AAD-1(v3)转化使得可以使用单独或与多种商品AOPP除草剂组合的多种商品苯氧基生长素。可以通过CPR(《作物保护参考》)书中汇编的除草剂标签或类似的汇编、在线(如cdms.net/manuf/manuf.asp)汇编的标签或任何商品或学术作物保护参考(如来自Agriliance的《作物保护指南》(2003))确定这些化学中其他代表性除草剂的具体用量。每种由于AAD-1(v3)而可以使用于HTC的(单独、罐混或顺序使用的)备选除草剂都考虑在本发明的范围内。
实施例21-任一作物中与草甘膦耐性性状叠加的AAD-1
(v3)
北美大田种植的绝大多数棉花、芸苔和大豆含有草甘膦耐性(GT)性状,并且对GT作物的选用正在增加。其他GT作物(如小麦、稻、甜菜和草坪)已在开发中,但目前尚未获得商品许可。许多其他草甘膦耐性物种正在实验至开发阶段(如苜蓿、甘蔗、向日葵、甜菜、豌豆、胡萝卜、黄瓜、莴苣、洋葱、草莓、西红柿和烟草、林业物种如白杨和香枫以及园艺物种如金盏花、牵牛花和秋海棠,万维网上的isb.vt.edu/cfdocs/fieldtestsl.cfm,2005)。GTC是受控杂草sheer breadth的有用工具,此系统提供便利性和费用效益。然而,草甘膦作为目前标准的基础处理的用途正在选择草甘膦抗性杂草。此外,在实行仅用草甘膦化学品的程序的大田中草甘膦固有效力较低的杂草正在演替为主要物种。通过常规育种或共同作为新转化事件将AAD-1(v3)与GT性状叠加可以改进杂草控制的效力、灵活性和管理杂草演替及除草剂抗性发展的能力。如前述实施例中所提到的,通过用AAD-1(v3)转化作物,可以在单子叶作物中选择性应用AOPP除草剂,单子叶作物将具有较高的苯氧基生长素安全限度,并可以在双子叶作物中选择性应用苯氧基生长素。可以想像改善的杂草控制选择的一些方案,其中在任意单子叶或双子叶作物物种中叠加了AAD-1(v3)和GT性状:
a)可以以标准出苗后用量(420至2160g ae/ha,优选560至840gae/ha)应用草甘膦,用于控制多数禾本科和阔叶杂草物种。为控制草甘膦抗性阔叶杂草如加拿大蓬或内在难以控制的杂草(如鸭跖草科),可以连续、罐混或作为预混料与草甘膦一起应用280-2240g ae/ha(优选560-1120g ae/ha)2,4-滴以提供有效控制。
b)可以以标准出苗后用量(420至2160g ae/ha,优选560至840gae/ha)应用草甘膦,用于控制多数禾本科和阔叶杂草物种。为控制草甘膦抗性禾本科物种如Lolium rigidum或Eleusine indica,可以连续、罐混或作为预混料与草甘膦一起应用10-200g ae/ha(优选20-100g ae/ha)喹禾灵以提供有效控制。
c)目前,应用于GTC的草甘膦用量范围一般为每个应用时间560至2240g ae/ha。草甘膦对于禾本科物种的效力远高于阔叶杂草物种。AAD-1(v3)+GT叠加性状可允许禾本科有效的草甘膦用量(105-840g ae/ha,更优选210-420g ae/ha)。接着可以连续、罐混或预混与禾本科有效用量的草甘膦一起应用2,4-滴(280-2240gae/ha,更优选560-1120g ae/ha)以提供必要的阔叶杂草控制。AOPP除草剂如10-200g ae/ha(优选20-100g ae/ha且更优选20-35g ae/ha)的喹禾灵可以用于更强的禾本科杂草控制和/或用于延缓草甘膦抗性草的发展。草甘膦的低用量还可为阔叶杂草控制提供一些益处,然而初期控制可来自2,4-滴。
杂草控制领域的技术人员会认识到,AAD-1(v3)转化进作物使得可以单独或与一种或多种AOPP除草剂组合(连续或独立的)使用一种或多种商品苯氧基生长素除草剂。可以通过CPR(《作物保护参考》)书中汇编的除草剂标签或类似的汇编、在线(如
cdms.net/manuf/manuf.asp)汇编的标签或任意商品或学术作物保护指南(如Agriliance的《作物保护指南》(2003))确定这些化学中其他代表性除草剂的具体用量。每种由于AAD-1(v3)而可以在HTC中使用(单独、罐混或连续使用)的备选除草剂都考虑在本发明的范围内。
实施例22-在任意作物中与草铵膦耐性叠加的AAD-1
(v3)
草铵膦耐性(PAT或bar)目前作为输入性状(如昆虫抗性蛋白)的选择标记物或具体作为HTC性状存在于北美种植的大量作物中。作物包括但不仅限于草铵膦耐性芸苔、玉米和棉花。其他的草铵膦耐性作物(如稻、甜菜、大豆和草坪)已在开发中,但目前尚未准予上市。与草甘膦相似,草铵膦是相对非选择性广谱禾本科和阔叶除草剂。草铵膦的作用方式与草甘膦不同。其作用较快,在除草剂应用24-48小时后引起受到处理的叶的脱水和“烧伤”。这对于表现快速杂草控制是有利的。然而,这也限制了草铵膦向靶植物分生组织区的转移,引起较弱的杂草控制,这被两种化合物在许多物种中的相对杂草控制性能评定所证明(Agriliance,2003)。
通过常规育种或共同作为新转化事件将AAD-1(v3)与草铵膦耐性性状叠加可以改进杂草控制的效力、灵活性和管理杂草演替及除草剂抗性发展的能力。如前述实施例中所提到的,通过用AAD-1(v3)转化作物,可以在单子叶作物中选择性应用AOPP除草剂,单子叶作物将具有较高的苯氧基生长素安全限度,并可以在双子叶作物中选择性应用苯氧基生长素。可以想像改善的杂草控制选择的一些方案,其中在任意单子叶或双子叶作物物种中叠加了AAD-1(v3)和草铵膦性状:
a)可以以标准出苗后用量(200至1700g ae/ha,优选350至500gae/ha)应用草甘膦,用于控制多种禾本科和阔叶杂草物种。目前尚未确认草铵膦抗性杂草,然而固有对草铵膦更有耐性的杂草数目多余草甘膦。
i)通过罐混10-200g ae/ha(优选20-100g ae/ha)喹禾灵来控制固有耐性的禾本科杂草物种(如Echinochloa spp或Sorghumspp)。
ii)内在耐性阔叶杂草物种(如Cirsium arvensis和Apocynumcannabinum)的控制可通过罐混280-2240g ae/ha(更优选560-2240g ae/ha)的2,4-滴以有效控制这些更难以控制的多年生物种并改进对一年生阔叶杂草物种的控制强度。
b)三重组合(如草铵膦(200-500g ae/ha)+2,4-滴(280-1120g ae/ha)+喹禾灵(10-100g ae/ha))可提供更强的重叠杂草控制谱。另外,重叠谱提供管理或延缓除草剂抗性杂草的另一种机制。
杂草控制领域的技术人员会认识到,AAD-1(v3)转化进作物使得可以单独或与一种或多种AOPP除草剂组合(连续或独立的)使用一种或多种商品苯氧基生长素除草剂。可以通过CPR(《作物保护参考》)书或类似的汇编中汇编的除草剂标签、在线(如
cdms.net/manuf/manuf.asp)汇编的标签或任意商品或学术作物保护指南(如Agriliance的《作物保护指南》(2003))确定这些化学中其他代表性除草剂的具体用量。每种由于AAD-1(v3)而可以在HTC中使用(单独、罐混或连续使用)的备选除草剂都考虑在本发明的范围内。
实施例23-在任一作物中与AHAS性状叠加的AAD-1
(v3)
咪唑啉酮除草剂耐性(AHAS等)目前存在于北美种植的大量作物中,包括但不仅限于玉米、稻和小麦。其他的咪唑啉酮耐性作物(如棉花和甜菜)已在开发中,但目前尚未上市。目前将许多咪唑啉酮除草剂(如甲氧咪草烟、咪草烟、灭草喹和甲咪唑烟酸)选择性用于多种常规作物中。通过耐性性状如AHAS等使得可以使用咪草烟、甲氧咪草烟和非选择性的咪唑烟酸。咪唑啉酮耐性HTC目前具有转基因的优势。这类化学品也具有显著的土壤残留活性,因此与基于草甘膦和草铵膦的系统不同,它能提供延长超过应用时间的杂草控制。然而,咪唑啉酮除草剂控制的杂草谱不如草甘膦广泛(Agriliance,2003)。另外,咪唑啉酮除草剂具有许多杂草已经对其发展出抗性的作用模式(抑制乙酰乳酸合酶,ALS)(Heap,2004)。通过常规育种或共同作为新转化事件将AAD-1(v3)与咪唑啉酮耐性性状叠加可以改进杂草控制的效力、灵活性和管理杂草演替及除草剂抗性发展的能力。如前述实施例中所提到的,通过用AAD-1(v3)转化作物,可以在单子叶作物中选择性应用AOPP除草剂,单子叶作物将具有较高的苯氧基生长素安全限度,并可以在双子叶作物中选择性应用苯氧基生长素。可以想像改善的杂草控制选择的一些方案,其中在任意单子叶或双子叶作物物种中叠加了AAD-1(v3)和咪唑啉酮耐性性状:
a)可以以标准出苗后用量(35至280g ae/ha,优选70至140g ae/ha)应用草甘膦,用于控制多种禾本科和阔叶杂草物种。目前尚未确认草铵膦抗性杂草,然而固有对草铵膦更有耐性的杂草数目多余草甘膦。
i)可以通过罐混280-2240g ae/ha(更优选560-2240g ae/ha)的2,4-滴来控制ALS抑制剂抗性阔叶杂草物种(如Amaranihusrudis、Ambrosia trifida、Chenopodium album(等等,Heap,2004))。
ii)也可以通过罐混280-2240g ae/ha(更优选560-2240g ae/ha)的2,4-滴来控制固有对咪唑啉酮更具耐性的阔叶物种。
iii)可以罐混10-200g ae/ha(优选20-100g ae/ha)喹禾灵来控制ALS抑制剂抗性禾本科杂草(如Sorghum halepense和Loliumspp)。
iv)也可以罐混10-200g ae/ha(优选20-100g ae/ha)喹禾灵来控制固有更具耐性的禾本科杂草物种。
b)三重组合(如咪草烟(35-280g ae/ha,优选70-140g ae/ha)+2,4-滴(280-1120g ae/ha)+喹禾灵(10-100g ae/ha))可提供更强的重叠杂草控制谱。另外,重叠谱提供管理或延缓除草剂抗性杂草的另一种机制。
杂草控制领域的技术人员会认识到,通过AAD-1(v3)转化并通过常规育种或遗传工程与任意咪唑啉酮耐性显著叠加使得可以单独或以多种组合使用多种商品咪唑啉酮除草剂、苯氧基生长素除草剂或AOPP除草剂。可以通过CPR(《作物保护参考》)书或类似的汇编中汇编的除草剂标签、在线(如
cdms.net/manuf/manuf.asp)汇编的标签或任意商品或学术作物保护指南(如Agriliance的《作物保护指南》(2003))确定这些化学品中其他代表性除草剂的具体用量。每种由于AAD-1(v3)而可以在HTC中使用(单独、罐混或连续使用)的备选除草剂都考虑在本发明的范围内。
实施例24-稻中的AAD-1
(v3)
24.1-培养基说明
用1M KOH将使用的培养基调整至pH5.8,并用2.5g/l Phytagel(Sigma)固化。在含有40ml半固体培养基的100×20mm培养皿中培养胚胎发生愈伤组织。在Magenta盒中的50ml培养基中培养稻小植株。在含有35ml液体培养基的125ml锥形瓶中维持细胞悬液并以125rpm旋转。在25-26℃在黑暗中诱导和维持胚胎发生培养物,在16小时光周期下进行植物再生和全植物培养(Zhang等1996)。
如前述在NB基础培养基上诱导和维持胚胎发生愈伤组织(Li等,1993),但调整为含有500mg/l谷氨酰胺。在SZ液体培养基(Zhang等1998)中起始和维持悬浮培养物,其中含有代替麦芽糖的30g/l蔗糖。渗透培养基(NBO)由加入各0.256M的甘露醇和山梨醇的NB培养基组成。在补充了50mg/l潮霉素B的NB培养基上选择潮霉素B抗性愈伤组织3到4周。在由NB培养基组成的培养基(PRH50)上预再生一周,其中NB培养基无2,4-二氯苯氧乙酸(2,4-滴),但加入了2mg/l 6-苄氨基嘌呤(BAP)、1mg/lα-萘乙酸(NAA)、5mg/l脱落酸(ABA)和50mg/l潮霉素B。接着通过在再生培养基(RNH50)上培养至嫩枝再生来再生小植株,所述再生培养基含有无2,4-滴并补充了3mg/l BAP、0.5mg/l NAA和50mg/l潮霉素B的NB培养基。将嫩枝转移到含有半浓度Murashige和Skoog基础盐和Gamborg B5维生素、补充了1%蔗糖和50mg/l潮霉素B的生根培养基(1/2MSH50)。
24.2-组织培养发育
如Zhang等1996所述将日本稻台北309(Oryza sativa L.japonica cv.Taipei 309)的成熟干燥种子灭菌。通过在黑暗中在NB培养基上无菌培养成熟稻种诱导胚胎发生组织。将直径约1mm的原始愈伤组织从盾片中移出,并用于在SZ液体培养基中起始细胞悬液。接着如Zhang 1995所述维持悬液。前述继代培养后3-5天后将来自悬液的胚胎发生组织从液体培养基中移出,并置于培养皿中的NBO渗透培养基上以形成跨过约2.5cm的圆圈,在轰击前培养4小时。轰击16到20小时后,将组织从NBO培养基转移到NBH50潮霉素B选择培养基上(保证轰击表面向上),并在黑暗中孵育14-17天。接着从原始轰击外植体分离新形成的愈伤组织放在旁边的相同培养基上。再过8-12天后,可目测鉴定相对致密、不透明的愈伤组织,并转移到PRH50预再生培养基在黑暗中经过7天。接着将变得更加致密和不透光的生长的愈伤组织继代培养到RNH50再生培养基上,在16小时光周期下经过14-21天的时间。将再生的嫩枝转移到含有1/2MSH50培养基的Magenta盒中。再生自单个外植体的多个植物认为是同胞,以一个独立植物株系处理。如果植物产生粗的白色根并在1/2MSH50培养基上旺盛生长,则将其评定为hph基因阳性。当植物达到Magenta盒的顶部时,将其转移到100%湿度下6cm盆里的土壤中一周,接着在移植到温室中的13cm盆之前移至14小时30℃的光照期和21℃黑暗的培养箱中2-3周。收集种子并在37℃干燥一周,接着保存于4℃。
24.3-微粒轰击
用Biolistic PDS-1000/HeTM系统(Bio-Rad,Laboratories,Inc.)实施所有轰击。将300mg 1.0μm直径的金颗粒用100%乙醇洗涤一次,用无菌蒸馏水洗涤两次并重悬于经硅化处理的Eppendorf管中的50μl水中。在金悬液中加入500μg质粒DNA(1∶6摩尔比的pDOW3303(含有Hpt的载体)和pDAB3404)、20μl亚精胺(0.1M)和50μl氯化钙(2.5M)。在室温下孵育混合物10分钟,以10000rpm沉淀10秒,重悬于60μl冷的100%乙醇并给每个巨载体分配8-9μl。以Zhang等(1996)所述的1100psi和27英寸Hg真空轰击组织样品。
24.4-耐性测试
使用DeVilbiss球状喷雾器(型号15-RD,玻璃喷嘴)用含有1%(体积/体积)Agridex作物油浓缩剂的DuPontTM Assure_II 0.3%(体积/体积)溶液喷洒3-5叶期的稻小植株。此浓缩剂对应于约140g ae/ha。在通风橱中以8-12英寸距离用喷雾器的6次完全喷射喷洒每株植物,以使整个植物被等量的除草剂覆盖。每次喷射项小植株输送约100μl溶液。喷洒后,使小植株干燥1小时之后再移出通风橱。在处理后10-14天(DAT)进行敏感性或抗性评定,示于下文表35。
|
表35. |
|
样品名 |
140g ae/ha喹禾灵 |
|
对照 |
死亡 |
|
63-1A |
无损伤 |
|
63-1F |
无损伤 |
|
63-4B |
无损伤 |
|
63-4D |
无损伤 |
|
63-6C |
死亡 |
24.5-组织收获、DNA分离和定量
将新鲜组织置于管中并在4℃低压冻干两天。组织完全干燥后,将钨珠(Valenite)放进管中并使用Kelco玻珠研磨机将样品干磨1分钟。其后遵循标准DNeasy DNA分离方案(Qiagen,DNeasy 69109)。将提取的DNA的等分试样用Pico Green(Molecular Probes P7589)染色并与已知标准品一起在荧光计(BioTek)中读数,以得到以ng/μl计的浓度。
24.6-Southern印迹分析
用得自Qiagen DNeasy试剂盒的总DNA进行Southern印迹分析。用HindIII过夜消化总计2μgDNA以得到整合数据。同样用MfeI过夜消化总计2μgDNA以得到PTU数据。过夜消化后在1%凝胶上电泳约100ng的等分试样以确认完全消化。确认后将样品在大块0.85%琼脂糖凝胶上以40伏电泳过夜。接着在0.2M NaOH、0.6M NaCl中使凝胶变性30分钟。接着将胶在pH7.5的0.5M Tris HCl、1.5M NaCl中中和30分钟。接着装配含有20×SSC的凝胶装置,以得到凝胶到尼龙膜(MilliporeINYC00010)的过夜重力转移。过夜转移之后,以1200×100微焦耳通过交联仪(stratagene UV交联仪1800)将膜置于UV光下。接着在0.1%SDS、0.1 SSC中洗膜45分钟。洗涤45分钟后,将膜在80℃烘干3小时并保存于4℃至杂交。通过使用质粒pDAB3404的编码区PCR制备杂交模板片段。将总计100ng总DNA作为模板。使用20mM每种引物和Takara Ex TaqPCR聚合酶试剂盒(Mirus TAKRR001A)。用于Southern片段PCRAAD-1的引物为(正向-ATGGCTCATGCTGCCCTCAGCC)(SEQ ID NO:31)和(反向-GGGCAGGCCTAACTCCACCAA)(SEQ ID NO:32)。在9700 Geneamp热循环仪(Applied Biosystems)中进行PCR反应:将样品置于94℃3分钟,94℃30秒、63℃30秒、72℃1分45秒的35个循环和其后72℃的10分钟。
在1%琼脂糖凝胶上电泳产物并切开,接着使用Qiagen(28706)凝胶提取方案提取凝胶。接着将膜置于Perfect Hyb缓冲液(Sigma H7033)中60℃的预杂交步骤1小时。使用Prime it RmT dCTP标记反应(Stratagene300392)方案开发基于p32的探针(Perkin Elmer)。使用Probe Quant.G50柱(Amersham 27-5335-01)提纯探针。用每毫升二百万计数CPM与southern印迹杂交过夜。过夜杂交后将印迹置于65℃下在0.1%SDS,0.1SSC中20分钟的两次洗涤中。接着使印迹过夜暴露于无机发光材料显像屏并用storm扫描仪(MOLECULAR DEVICES)扫描。结果的概述示于表36。
|
表36.Southern结果 |
|
事件 |
整合Southern数据 |
PTU Southern数据 |
|
条带数 |
预期大小3049bp |
|
63-1A |
8 |
有,7条可区分带 |
|
63-1F |
5, |
有,9条可区分带 |
|
63-4A |
20 |
有,20条可区分带 |
|
63-4D |
20 |
有,19条可区分带 |
|
63-6C |
2 |
两个切割产物的DNA得率均不足 |
植物63-1A和63-1F不是相同的事件。植物63-4A和63-4D是相同的事件。这些事件具有预期大小的PTU,但是非常复杂。此Southern印迹PTU数据与表达数据和喷洒数据相关。样品63-6C没有足以进行整合和PTU southern印迹的DNA。
24.7-Western数据
样品制备和分析条件如前述。使用ELISA和Western印迹分析了5个转基因稻株系和1个非转基因对照的AAD-1表达。在4个株系(63-1A、63-1F、63-4B和63-4D)中检测到了AAD-1,但在株系63-1C和对照植物中没有。表达水平从可溶性蛋白总量的15.6到183ppm。结果概述示于表37。
|
表37. |
| 泳道 |
样品名 |
TSP(μg/mL) |
ELISA[AAD1]表达(ppm)(ng/mL) |
Western |
|
1 |
对照 |
6719.58 |
0.00 0.00 |
- |
|
2345678 |
63-1A63-1F63-4B36-4D63-6CAAD1AAD1 |
8311.8711453.3113835.0913656.495343.63标准品(0.5μg/mL)标准品(5.0μg/mL) |
351.17 42.252092.35 182.69216.00 15.61717.05 52.510.00 0.00 |
±+++++-++++++++ |
实施例25-草坪草转化方法
可以如下文一般描述的通过从种子(cv.Penn-A-4)起始的胚胎发生愈伤组织实现匍匐翦股颖中由根瘤农杆菌介导的用AAD-1(v3)替换“bar”基因的遗传转化。参阅“Effciency of Agrobacterium tumefaciens-medistedturfgrass(Agrostis stolonifera L)transformation”(Luo等,2004)。
用带有超级二元载体的根瘤农杆菌菌株(LBA4404)感染愈伤组织,所述超级二元载体含有由稻泛素启动子驱动的除草剂抗性bar基因。总体稳定转化效率范围从18%到45%。Southern印迹和遗传分析证实了转基因在匍匐翦股颖基因组中的整合和转基因在T1代中的正常输入和稳定表达。所有的独立转化事件带有1到3个转基因拷贝,多数(60%-65%)仅含有外源基因的单拷贝,没有明显的重排。
25.1-用于胚胎发生愈伤组织诱导的种子的制备
用砂纸使成熟种子脱皮,并在10%(体积/体积)Clorox漂白剂(6%次氯酸钠)加0.2%(体积/体积)Tween 20(聚山梨酯20)中剧烈振荡90分钟表面灭菌。在无菌蒸馏水中洗涤5次后,将种子置于愈伤组织诱导培养基(MS基础盐和维生素、30g/l蔗糖、500mg/l酪蛋白水解物、6.6mg/l3,6-二氯-o-anisic acid(二氯甲氧苯酸)、0.5mg/l 6-苄氨基嘌呤(BAP)和2g/l植烷。以120℃高压灭菌20分钟前将pH调整至5.7)上。
25.2-胚胎发生愈伤组织诱导
室温下将含有制备的种子外植体的培养皿保存在黑暗中6周。可见选择胚胎发生愈伤组织并继代培养到新鲜的愈伤组织诱导培养基上,在共培养之前在室温下在黑暗中培养1周。
25.3-农杆菌感染和共培养
农杆菌感染前1天,将胚胎发生愈伤组织分成1-2mm的片,放在含有100μM乙酰丁香酮的愈伤组织诱导培养基上。对每片愈伤组织应用10μl等分试样(LBA4404)的农杆菌悬液(660nm处OD=1.0),接着在25℃在黑暗中共培养3天。
25.4-静止期和农杆菌对照
对于抗生素处理步骤,转移愈伤组织并在愈伤组织培养基加125mg/l头孢噻肟和250mg/l氨苄西林(用于抑制细菌生长)上培养2周。
25.5-选择和潜在转基因集落的鉴定
其后,为进行选择,将愈伤组织移至含有250mg/l头孢噻肟和10mg/l膦丝菌素(PPT)的愈伤组织诱导培养基上8周。室温下在黑暗中进行抗生素处理和整个选择过程。选择期间的继代培养间隔(subculture interval)一般为3周。
25.6-转基因植物的再生
对于植物再生,首先将PPT抗性增育愈伤组织事件移至补充了头孢噻肟、PPT或潮霉素的再生培养基(MS基础培养基、30g/l蔗糖、100mg/l肌醇、1mg/l BAP和2g/l Phytagel)。室温下使这些愈伤组织保持在黑暗中1周,接着移至光照下2-3周以发育嫩枝。用PPT避免选择白化体(如果使用潮霉素作为选择剂则产生高水平的白化植物)。
25.7-根诱导并转移到温室
接着分开小嫩枝并转移到含有PPT和头孢噻肟的无激素再生培养基,以保持选择压的促进根生长并抑制残留的农杆菌细胞。接着将根发育良好的小植株(3-5周)转移到土壤并在温室或大田中生长。
25.8-转基因植物的春化和异型杂交
在封闭苗圃中室外保持转基因植物(3-6个月)至12月冬至。接着将已春化植物转移到温室中并在16/8小时光周期下保持在25℃,并用非转基因野生型植物围绕使其与其他花粉来源物理分离。移回温室后3-4周植物开始开花。它们与周围野生型植物的花粉异型杂交。使收集自每个个体转基因植物的种子在25℃下在土壤中萌发,在温室中培养T1植物用于进一步分析。
25.9-其他靶禾本科植物
本发明的AAD-1转化可以靶定的其他禾本科植物包括一年生草坪草(Poa annua)、美洲雀稗、翦股颖、铁线草、莓系属的牧草、Bluestems、雀麦草、Browntop bent(Agrostis capillaries)、Buffalograss、Canary Grass、Carpetgrass、Centipedegrass、Chewings牛毛草(Festuca rubracommutate)、Crabgrass、Creeping bent(Agrostis stolonifera)、纹饰银须草(Koeleria macrantha)、Dallisgrass、牛毛草、Festolium、Hard/sheeps牛毛草(Festuca ovina)、格兰马草、假高粱草、石茅高粱、Lovegrass、mixes(Equine、Pasture等)、Native Grasses、Orchardgrass、多年生ryegrass(Lolium perenne)、小糠草、雀麦属草、一年生和多年生Ryegrass、瘦弱匍匐红色牛毛草(Festuca rubra trichophylla)、滑柄草坪草(Poa pratensis)、St.Augustine、强壮匍匐红色牛毛草(Festuca rubra rubra)、双色高粱、柳枝稷、Tall牛毛草(Festuca arundinacea)、梯牧草、丛生银须草(Deschampsiacaespitosa)、Turfgrasses、芽草和Zoysiagrass。
实施例26-芸苔中的AAD-1
(v3)
26.1-芸苔转化
以农杆菌介导的转化用赋予对2,4-滴抗性的AAD-1(v3)基因转化欧洲油菜Nexera*710变种。构建体含有CsVMV启动子驱动的AAD-1(v3)基因和AtUbi10启动子驱动的PAT基因。
用10%商品漂白剂使种子表面灭菌10分钟并用无菌蒸馏水洗涤3次。将种子置于半浓度MS基础培养基(Murashige and Skoog,1962)上并按设置为25℃和16小时光照/8小时黑暗的光周期的生长制度下维持。
从5-7天龄的苗上剪下下胚轴段(3-5mm)并置于愈伤组织诱导培养基(含1mg/l玻璃酸酶和1mg/l 2,4-滴的MS培养基)上3天作为预处理。接着将片段转移进培养皿,用含有pDAB721的农杆菌Z707S或LBA4404菌株处理。在28℃下黑暗中在150rpm的振荡器上将农杆菌培养过夜并接着重悬于培养基中。
用农杆菌处理下胚轴片段30分钟后,将其放回愈伤组织诱导培养基3天。共培养之后将片段置于K1D1TC(含有250mg/l羧苄青霉素和300mg/l特美汀的愈伤组织诱导培养基)恢复1周。或者,直接将片段置于选择培养基K1D1H1(带有1mg/l Herbiace的以上培养基)。用于杀死农杆菌的抗生素为羧苄青霉素和特美汀。选择剂Herbiace允许转化细胞生长。
通过PCR测试来自35个独立事件的愈伤组织样品。全部35个样品对AAD-1(v3)的存在测试为阳性,而未转化对照为阴性(PCR测定)。通过ELISA(蛋白质分析)证实10个样品表达AAD-1蛋白。
接着将形成愈伤组织的下胚轴片段置于B3Z1H1(MS培养基、3mg/l苯甲酸嘌呤、1mg/l玉米蛋白、0.5gm/l MES[2-(N-吗啉代)乙磺酸],5mg/l硝酸盐、1mg/l Herbiace、羧苄青霉素和特美汀)嫩枝再生培养基。3周后嫩枝开始再生。将下胚轴片段与嫩枝一起转移到B3Z1H3培养基(MS培养基、3mg/l苯甲酸嘌呤、1mg/l玉米蛋白、0.5gm/l MES[2-(N-吗啉代)乙磺酸]、5mg/l硝酸盐、3mg/l Herbiace、羧苄青霉素和特美汀)再过三周。
从下胚轴片段上剪下嫩枝并转移到嫩枝伸长培养基MESH10(MS培养基、0.5gm/l MES、10mg/l Herbiace、羧苄青霉素和特美汀)上2-4周。将伸长的嫩枝在MSI.1(含0.1mg/l吲哚基丁酸的MS)上进行根诱导。待植物具有良好建立的根系时将其移植到土壤中。转移到温室之前1-2周在Conviron中受控环境条件下使植物适应。
在温室中使转化的T0植物自花受粉以得到T1种子。用一系列的除草剂浓度喷洒T0植物和T1子代以建立通过AAD-1(v3)基因的保护水平。
26.2-“分子分析”:芸苔材料和方法
26.2.1-组织收获的DNA的分离和定量
将新鲜组织置于管中并在4℃低压冻干两天。组织完全干燥后,将钨珠(Valenite)放进管中并使用Kelco玻珠研磨机将样品干磨1分钟。其后遵循标准DNeasy DNA分离方案(Qiagen,DNeasy 69109)。将提取的DNA的等分试样用Pico Green(Molecular Probes P7589)染色并与已知标准品一起在荧光计(BioTek)中读数,以得到以ng/μl计的浓度。
26.2.2-聚合酶链式反应
用总计100ng总DNA作为模板。使用20mM每种引物和Takara ExTaq PCR聚合酶试剂盒(Minis TAKRR001A)。用于AAD-1(v3)编码区PCR的引物为(正向-ATGGCTCATGCTGCCCTCAGCC)(SEQ IDNO:27)和(反向-CGGGCAGGCCTAACTCCACCAA)(SEQ ID NO:28)。在9700 Geneamp热循环仪(Applied Biosystems)中进行PCR反应:将样品置于94℃3分钟,94℃30秒、65℃30秒、72℃2分钟的35个循环和其后72℃的10分钟。通过用溴化乙啶染色的1%琼脂糖凝胶上的电泳分析PCR产物。来自35株含AAD-1(v3)事件的35个样品测试为阳性。三个对照样品测试为阴性。
26.3-ELIS
使用以上章节描述的ELISA检测10个不同芸苔转化事件中的AAD-1蛋白。表达水平从可溶性蛋白总量(TSP)的150到1000ppm。平行测试的三个不同的未转化愈伤组织样品几乎未检测到信号,表明该测定中使用的抗体与芸苔细胞基质具有最小的交叉反应性。结果的概括于表38。
|
表38.AAD1在芸苔愈伤组织中的表达。 |
|
样品号 |
重量(mg) |
[TSP](μg/mL) |
[AAD1](ng/mL) |
表达(ppmTSP) |
AAD1的PCR |
|
1 |
114 |
757.02 |
119.36 |
157.67 |
+ |
|
2 |
55 |
839.79 |
131.84 |
156.99 |
+ |
|
3 |
53 |
724.41 |
202.12 |
279.01 |
+ |
|
4 |
52 |
629.01 |
284.89 |
452.92 |
+ |
|
5 |
55 |
521.75 |
175.88 |
337.08 |
+ |
|
6 |
61 |
707.69 |
74.24 |
153.71 |
+ |
|
7 |
51 |
642.02 |
559.11 |
1026.73 |
+ |
|
8 |
65 |
707.69 |
270.73 |
382.56 |
+ |
|
9 |
51 |
642.02 |
197.90 |
308.25 |
+ |
|
10 |
51 |
1417.42 |
220.63 |
156.66 |
+ |
|
对照1 |
53 |
2424.67 |
18.67 |
7.70 |
- |
|
对照2 |
61 |
2549.60 |
35.00 |
13.73 |
- |
|
对照3 |
59 |
2374.41 |
22.79 |
9.60 |
- |
参考文献
Adang,M.J.,M.J.Staver,T.A.Rocheleau,J.Leighton,R.F.Barker和D.V.Thompson.1985.Characterized full-length and truncated plasmidclones of the crystal protein of Bacillus thuringiensis subsp kurstaki HD-73and their toxicity to Manduca sexta.Gene 36:289-300.
Agriliance Crop Protection Guide.2003.Agriliance,LLC.St Paul,MN.588 p.
Altschul,S.F.,W.Gish,W.Miller,E.W.Myers和D.J.Lipman.1990.Basic Iocal alignment search tool.J.Mol.Biol.215:403-410.
Altschul,S.F.,T.L.Madden,A.A.Schaffer,J.Zhang,Z,Zhang,W.Miller和D.J.Lipman.1997.Gapped BLAST and PSIBLAST:a newgeneration of protein databasesearch programs.Nucl.Acids Res.25:3389-3402.
An,G.,B.D.Watson,S.Stachel,M.P.Gordon,E.W.Nester.1985.New cloning vehicles for transformation of higher plants.EMBO J.4:277-284.
Armstrong C.L.,C.E.Green,R.L.Phillips.1991.Development andavailability of germplasm with high Type II culture formation response.Maize Genet Coop News Lett 65:92-93.
Beltz,G.A.,K.A.Jacobs,T.H.Eickbush,P.T.Cherbas和F.C.Kafatos.1983 Methods of Enzymology,R.Wu,L.Grossman and K.Moldave [eds.]Academic Press,New York 100:266-285
Birch R.G.和T.Franks.1991.Development and optimization ofmicroprojectile systems for plant genetic transformation.Aust.J.PlantPhysiol.18:453-469.
CDMS.Crop Data Management Systems Labels and MSDS.在线。互联网。2004年3月13日。在net/manuf/manuf.asp提供。
Chee P.P.,K.A.Fober,J.L.Slightom.1989.Transformation ofsoybean(Glycine max)by infecting germinating seeds with Agrobacteriumtumefaciens.Plant Physiol.91:1212-1218.
Cheng M.,J.E.Fry,S.Pang,H.Zhou,CM.Hironaka,D.R.Duncan,T.W.Conner和Y.Wan.1997.Genetic transformation of wheat mediatedby Agrobacterium tumefaciens.Plant Physiol 115:971-980.
Chu C.C.,C.C.Wang,C.S.Sun,C.Hsu,K.C.Yin,C.Y.Chu,F.Y.Bi.1975.Establishment of an efficient medium for anther culture of ricethrough comparative experiments on the nitrogen sources.Sci.Sinica18:659-668.
Clemente T.E.,B.J.LaVallee,A.R.Howe,D.Conner-Ward,R.J.Rozman,P.E.Hunter,D.L.Broyles,D.S.Kasten,M.A.Hinchee.2000.Progeny analysis of glyphosate selected transgenic soybeans derived fromAgrobacterium-mediated transformation.Crop Sci 40:797-803.
CPR:Crop Protection Reference.2003 Chemical and PharmaceuticalPress,New York,NY.2429 p.
Devine,M.D.2005.Why are there not more herbicide-tolerant crops?Pest Manag.Sci.61:312-317.
Dietrich,Gabriele Elfriede(1998)hnidazolinone resistant AHASmutants.U.S.Patent 5,731,180.
Didierjean L,L.Gondet,R.Perkins,S.M.Lau,H.Schaller,D.P.O′Keefe,D.Werck-Reichhart.2002.Engineering Herbicide Metabolism inTobacco and Arabidopsis with CYP76B1,a Cytochrome P450 Enzymefrom Jerusalem Artichoke.Plant Physiol 2002,130:179-189.
Ditta,G.S.Stranfield,D.Corbin和D.R.Helinski.1980.Broad hostrange DNA cloning system for Gram-negative bacteria:Construction ofagene bank of Rhizobium leliloti.PNAS 77:7347-7351.
Edwards,R.A.,L.H.Keller和D.M.Schifferli.1998.Improved allelicexchange vectors and their use to analyze 987P fimbria gene expression.Gene 207:149-157.
Falco S.C.,T.Guida,M.Locke,J.Mauvais,C.Sanders,R.T.Ward,P.Webber.1995.Transgenic canola and soybean seeds with increased lysine.Bio/Technology 13:577-582.
Finer J.and M.McMullen.1991.Transformation of soybean viaparticle bombardment of embryogenic suspension culture tissue,hi VitroCell.Dev.Biol.27P:175-182.
Fraley,R.T.,D.G.Rogers和R.B.Horsch.1986.Genetictransformation in higher plants.Crit.Rev.Plant Sci.4:1-46.
Frame B.R.,P.R.Drayton,S.V.Bagnall,C.J.Lewnau,W.P.Bullock,H.M.Wilson,J.M.Dunwell,J.A.Thompson和K.Wang.1994.Productionof fertile maize plants by silicon carbide whisker-mediated transformation.Plant J.6:941-948.
Fukumori,F.和R.P.Hausinger.1993.Purification andcharacterization of 2,4-滴ichlorophenoxyacetate/ a -ketoglutaratedioxygenase.J.Biol.Chem.268:24311-24317.
Gamborg,O.L.,R.A.Miller和K.Ojima.1968.Nutirent requirementsof suspensions of cultures of soybean root cells.Exp.Cell Res.50:151-158.
Gay,P.,D.Le Coq,M.Steinmetz,E.Ferrari和J.A.Hoch.1983.Cloning structural gene sacB,which codes for exoenzyme levansucrase ofBacillus subtilis:expression of the gene in Eschericia coli.J.Bacteriol.153:1424-1431.
Gianessi,L.R.2005 Economic and herbicide use impacts ofglyphosate-resistant crops.Pest.Manag.Sci.61:241-245.
Heap,I.The International Survey of Herbicide Resistant Weeds.在线。互联网。2005年3月18日。在
weedscience.com提供
Hiei Y.,T.Komari和T.Kubo.1997.Tranformation of rice mediatedby Agrobacterium tumefaciens,Plant Mol.Biol.35:205-218.
Hiei,Y.,T.Komari(1997)Method for Transforming Monocotyledons.U.S.专利5,591,616.
Hinchee M.A.W.,D.V.Conner-Ward,C.A.Newell,R.E.McDonnell,S.J.Sato,C.S.Gasser,D.A.Fischkoff,D.B.Re,R.T.Fraley,R.B.Horsch.1988. Production of transgenic soybean plants usingAgrobacterium-mediated DNA transfer.Bio/Technology 6:915-922.
Hofte,H.and H.R.Whiteley.1989.Insecticidalcristal proteins of Bacillus thuringiensis.1989.Microbiol.Rev.53:242-255.
Hoekema,A.1985:The Binary Plant Vector System,Offset-durkkerijKanters B.V.,Alblasserdam,第5章。
Hogan,D.A.;S.R.Smith,E.A.Saari,J.McCracken,RP.Hausinger.2000.Site-directed mutagenesis of 2,4-滴ichlorophenoxyaceticacid/a-ketoglutarate dioxygenase.Identification of residues involved inmetallocenter formation and substrate binding.J.Biol.Chem.275:12400-12409.
Holsters,M.,D.De Waele,A.Depicker,E.Messens,M.VanMontagu和J.Sckell.1978.Transfection and transformation ofAgrobacterium tumefaciens.Mol Gen.Genet.163:181-187.
Horsch,R.,J.Fry,N.Hoffman,J.Neidermeyer,S.Rogers和R.Fraley.1988.Plant Molecular Biology Manual,S.Gelvin 等编辑,KluwerAcademic Publishers.Boston
Horvath,M.,G.Ditzehniiller,M.Lodl和F.Streichsbier.1990.Isolation and characterization of a 2-(2,4-滴ichlorophenoxy)propionicacid-degrading soil bacterium.Appl.Microbiol Biotechnol.33:213-216.
Jefferson,R.A.M.Bevan和T.Kavanagh.1987.The use ofEscherichia coli B-glucuronidase gene as a gene fustion marker for studiesof gene expression in higher plants.Biochem.Soc.Trans.15:17-19.
Karlin,S.和S.F.Altschul.1990.Methods for assessing the statisticalsignificance of molecular sequence features by using general scoringschemes.PNAS 87:2264-2268.
Karlin,S.和S.F.Altschul.1993.Applications and statistics formultiple high-scoring segments in molecular sequences.PNAS90:5873-5877
Keller,G.H.和M.M.Manak.1987.DNA Probes.Stockton Press,NewYork,NY,169-170页.
Kohler,H.P.E.1999.Sphingobium herbicidovorans MH:a versatilephenoxyalkanoic acid herbicide degrader.J.Ind Microbiol and Biotech.23:336-340.
Li L,Qu R,Kochko A de,Fauquet CM,Beachy RN(1993)Animproved rice transformation system using the biolistic method.Plant CellRep 12:250-255
Linsmaier,E.M.和F.Skoog(1965)Organic growth factorrequirements of tobacco tissue cultures.Physiol.Plant.18:100-127.
Lorraine-Colwill,D.F.,S.B.Powles,T.R.Hoawkes,P.H.Hollingshead,S.AJ.Arner和C.Preston.2003.Investigations into themechanism of glyphosate resistance in Lolium rigidum.Pestic.Biochem.Physiol.74:62-73.
Luo,H.,Q.Hu,K.Nelson,C.Longo,A.P.Kausch,J.M.Chandlee,J.K.Wipff and C.R.Fricker.2004.Agrobacterium tumefaciens-mediatodcreeping bentgrass(Agrostis stolonifera L.)transformation usingphosphinothricin selection results in a high frequency of single-copytransgene integration.Plant Cell Reports 22:645-652.
Lyon,B.R.,D.J.Llewellyn,J.L.Huppatz,E.S.Dennis和W.J.Peacock.1989.Expression of a bacterial gene in transgenic tobacco confersresistance to the herbicide 2,4-滴ichlorophenoxyacetic acid.Plant Mol.Bio.13:533-540.
Lyon,B.R.,Y.L.Cousins,D.J.Llewellyn和E.S.Dennis.1993.Cotton plants transformed with a bacterial degradation gene are protectedfrom accidental spray drift damage by the herbicide 2,4-滴ichlorophenoxyacetic acid.Transgenic Res.2:166-169.
Maniatis,T.,E.F.Fritsch,J.Sambrook.1982.Molecular Cloning:ALaboratory Manual,Cold Spring Harbor Laboratory,Cold Spring Harbor,NY
Martin,J.R.和W.W.Witt.2002.Response of glyphosate tolerant andsusceptible biotypes of horseweed(Conyza canadensis)to foliar appliedherbicides.Proc.North Cent.Weed Sci.Soc.57:185.
Martinell B.J.,L.S.Julson,C.A.Emler,H.Yong,D.E.McCabe,E.J.Williams.2002.Soybean Agrobacterium transformation method.U.S.Patent Application No.6384301
McCabe D.E.,W.F.Swain,B.J.Martinell,P.Christou.1988.Stabletransformation of soybean(Glycine max)by particle acceleration.Bio/Technology 6:923-926.
Miller S.D.,P.W.Stahlman,P.Westra,G.W.Wicks,R.G.Wilson,J.M.Tichota.2003.Risks of weed spectrum shifts and herbicide resistance inglyphosate-resistant cropping systems.Proc.West.Soc.Weed Sci.56:61-62.
Muller R,S.Jorks,S.Kleinsteuber,W.Babel.1999.Comamonasacidovorans strain MCI:a new isolate capable of degrading the chiralherbicides dichlorprop and mecoprop and the herbicides 2,4-滴andMCPA.Microbiol.Res.154:241-246.
Murashige T.和F.Skoog.1962.A revised medium for rapid growthand bioassays with tobacco tissue cultures.Physiol.Plant.15:473-497.
Murphy G.P.,T.E.Dutt,R.F.Montgomery,T.S.Willard,G.A.Elmore.2002.Control of horseweed with glyphosate.Proc.North Cent.WeedSci.Soc.57:194.
Ng,C.H.,R.Wickneswari,S.Salmigah,Y.T.Teng和B.S.Ismail.2003.Gene polymorphisms in glyphosate-resistant and-susceptible biotypes ofEleusine indica from Malaysia.Weed Res.43:108-115.
Olkon P.M.和D.A.Somers.2001.L-Cysteine increasesAgrobacterium-mediated T-DNA delivery into soybean cotyledonary-nodecells.Plant Cell Rep 20:706-711
Olhoft,P.M.,L.E.Flagel,CM.Donovan和D.A.Somers.2003.Efficient soybean transformation using hygromycin B selection in thecotyledonary-node method.Planta 216:723-735
Padgette S.R.,K.H.Kolacz,X.Delannay,D.B.Re,B.J.LaVallee,C.N.Tinius,W.K.Rhodes,Y.I.Otero,G.F.Barry,D.A.Eichholtz,V.M.Peschke,D.L.Nida,N.B.Taylor和G.M.Kishore.1995.Development,identification和characterization of a glyphosate-tolerant soybean line.Crop Sci.1995;35:1451-1461.
Parrott W.A.,J.N.All,M.J.Adang,M.A.Bailey,H.R.Boerma和C.N.Stewart,Jr.
1994.Recovery and evaluation of soybean plants transgenicfor a Bacillus thuringiensis var.kurstaki insecticidal gene.In Vitro Cell.Dev.Biol.30P:144-149.
Popelka,J.C.和F.Altpeter 2003.Agrobacteriumtumefaciens-mediated genetic transformation of rye(Secale cereale L)Mol.Breed 11:203-211
Saari,R.E.,D.A.Hogan和R.P.Hausinger.1999.Stereospecificdegradation of the pheonxypropionate herbicide dichlorprop.J.Mol.Catal.B:Enz.6:421-428.
Saiki,R.K.,S.Scharf,F.Faloona,KB.Mullis,G.T.Horn,H.A.Erlich和N.Arnheim.1985.Enzymatic Amplification of p-Globin GenomicSequences and Restriction Site Analysis for Diagnosis of Sickle CellAnemia.Science 230:1350-1354.
Sambrook,J.,E.F.Fritsch和T.Maniatis.1989.Molecular Cloning,ALaboratory Manual,Cold Spring Harbor Press.
Sambrook,J.和D.W.Russell.2000.Molecular Cloning.Cold SpringHarbor Laboratory Press,Cold Spring Harbor,NY.
Schenk,R.U.和A.C.Hildebrandt(1972)Methods and techniques forinduction and growth of monocotyledenous and dicotyledenous plant cellcultures.Can.J.Bot.50:199-204.
Sfiligoj,E.2004.Spreading resistance.Crop Life.March issue.
Simarmata,M.,J.E.Kaufmann和D.Penner.2003.Potential basis ofglyphosate resistance in California rigid ryegrass(Lolium rigidum).WeedSci.51:678-682.
Singh R.J.,T.M.Klein,C.J.Mauvais,S.Knowlton,T.Hymowitz,CM.Kostow.Cytological characterization of transgenic soybean.Theor.Appl.Genet.1998;96:319-324.
Smejkal,C.W.,T.Vallaeys,S.K.Burton和H.M.Lappin-Scott.2001.Substrate specificity of chlorophenoxyalkanoic acid-degrading bacteria isnot dependent upon phylogenetically related tfdA gene types.Biol.Fertil.Sols 33:507-513.
Streber,W.和L.Willmitzer.1989.Transgenic tobacco plantsexpressing a bacterial detoxifying enzyme are resistant to 2,4-滴.Bio/Technology 7:811-816.
Streber,W.R.,K.N.Timmis和M.H.Zen k.2000.Microorganisms andplasmids for 2,4-滴ichlorophenoxyacetic acid(2,4-滴)monooxygenaseformation and process for the production of these plasmids and strains.US专利6,153,401.
Streber,W.R.,K.N.Timmis和M.H.Zen k.1987.Analysis,cloning和high-level expression of 2,4-滴ichlorophenixyacetic monooxygenase genetfdA of Alcaligenes eutrophus JMP134.J.Bacterid.169:2950-2955.
Suggs,S.V.,T.Miyake,E.H.Kawashime,M.J.Johnson,K.Itakura和R.B.Wallace.1981. ICN-UCLA Symp.Dev.Biol.Using PurifiedGenes,D.D.Brown编辑,Academic Press,New York,23:683-693.
Tingay,S.,D.McElroy,R.Kalla,S.Fieg,W.Mingbo,S.Thornton和R.Bretell.1997.Agrobacterium tumefaciens-medi&ted barleytransformation.Plant.1.11:1369-1376.
Weigel,D.和J.Glazebrook.2002.Arabidopsis:A Laboratory Manual.Cold Spring Harbor Lab Press,Cold Spring Harbor,N.Y.,358页.
Weising,K.,J.Schell和G.Kahl.1988.Foreign genes in plants:transfer,structure,expression and applications.Ann.Rev.Genet.22:421-477.
Welter,M.E.,D.S.Clayton,M.A.miler和J.F.Petolino.1995.Morphotypes of friable embryogenic maize callus.Plant Cell Rep.14:725-729.
Westendorf A.,D.Benndorf,R.Muller,W.Babel.2002.The twoenantiospecific dichlorprop/a-ketoglutarate-dioxygenases from Delftiaacidovorans MCI-protein and sequence data of RdpA and SdpA.Microbiol.Res.157:317-22.
Westendorf.A.,R.H.Muller和W.Babel.2003.Purification andcharacterization of the enantiospecific dioxygenases from Delftiaacidovorans MCI initiating the degradation of phenoxypropionatesandphenoxyacetate herbicides.Acta Biotechnol.23:3-17.
WSSA.2002.Herbicide Handbook(8thed).Weed Science Society ofAmerica.Lawrence,KS 492页.
Zeng P,D.Vadnais,Z.Zhang和J.Polacco.2004.Refined glufosinateselection in Agrobacterium-mediated transformation of soybean[Glycinemax(L.)Merr.].Plant Cell Rep.22:478-482.
Zhang S(1995)Efficient plant regeneration from indica(group 1)riceprotoplasts of one advanced breeding line and three varieties.Plant CellRep 15:68-71
Zhang S,Chen L,Qu R,Marmey P,Beachy RN,Fauquet CM(1996)Efficient plant regeneration from indica(group 1)rice protoplasts of oneadvanced breeding line and three varieties.Plant Cell Rep 15:465-469.
Zhang S,Song W,Chen L,Ruan D,Taylor N,Ronald P,Beachy RN,Fauquet CM(1998)Transgenic elite Indica rice varieties,resistant toXanthomonas oryzae pv.oryzae.Mol Breed 4:551-558.
Zhang,Z.,A.Xing,P.E.Staswick和T.E.Clemente.1999.The use ofglufosinate as a selective agent in Agrobacterium-mediated transformationof soybean.Plant Cell,Tissue和Organ Culture 56:37-46.
Zhao,Z.Y.,T.Cai,L.Tagliani,M.Miller,N.Wang,H.Pang,M.Rudert,S.Schroeder,D.Hondred,J.Seltzer和D.Pierce. 2000.Agrobacterium-mediated sorghum transformation,Plant Mol.Biol.44:789-798.
Zipper,C,M.Bunk,A.Zehnder,H.Kohler.1998.Enantioselectiveuptake and degradation of the chiral herbicide dichlorprop[(RS)-2-(2,4-滴ichlorophenoxy)propanoic acid]by Sphingobium herbicidovorans MH.J.Ract.13:3368-3374
序列表
<110>美国陶氏益农公司
<120>新除草剂抗性基因
<130>DAS-115XC1
<150>US 60/567,052
<151>2004-04-30
<160>32
<170>PatentIn版本3.2
<210>1
<211>50
<212>DNA
<213>人工序列
<220>
<223>用于扩增rdpA/AAD-1(v1)基因的正向引物
<400>1
tctagaagga gatataccat gcatgctgca ctgtcccccc tctcccagcg 50
<210>2
<211>38
<212>DNA
<213>人工序列
<220>
<223>用于扩增rdpA/AAD-1(v1)基因的反向引物
<400>2
ctcgagttac tagcgcgccg ggcgcacgcc accgaccg 38
<210>3
<211>915
<212>DNA
<213>Sphingobium herbicidovorans
<220>
<221>misc_feature
<222>(1)..(18)
<223>引物接头
<220>
<221>misc_feature
<222>(907)..(915)
<223>引物接头
<400>3
tctagaagga gatataccat gcatgctgca ctgtcccccc tctcccagcg ctttgagcgc 60
atcgcggtcc agccgctgac cggcgtcctg ggcgccgaga tcaccggcgt cgacctgcgc 120
gagccgctcg acgacagcac ctggaacgaa atcctcgacg cgttccacac ttaccaggtc 180
atctattttc ccggccaggc gatcaccaac gaacagcaca tcgccttcag ccggcgcttc 240
ggccccgtcg atcccgtgcc cctgctcaag agcatcgaag ggtatccaga ggtgcagatg 300
atccgccgcg aagccaacga aagcgggcgt gtgatcggtg aygactggca caccgacagc 360
accttcctgg acgcaccgcc ggccgccgtg gtgatgcgcg cgatcgacgt gcccgagcat 420
ggcggcgaca ccggttttct gagcatgtac accgcgtggg agacgctgtc gcccaccatg 480
caggccacca tcgaagggtt gaacgtagtg cacagcgcca cgcgtgtgtt cggctcgctc 540
taccaggccc agaaccggcg cttcagcaac accagcgtca aggtgatgga cgtcgacgcg 600
ggcgaccgtg aaaccgtgca ccccctggtg gtgacccatc cgggcagcgg ccgcaagggc 660
ctgtacgtga accaggtcta ttgccagcgc atcgagggca tgaccgatgc cgaaagcaaa 720
ccgctgctgc agttcctgta cgagcatgcg acacggttcg atttcacctg ccgcgtgcgc 780
tggaagaagg accaggtcct ggtctgggac aacctgtgca cgatgcaccg ggccgtaccc 840
gactacgcgg gcaagttccg ctacctgacg cgcaccacgg tcggtggcgt gcgcccggcg 900
cgctagtaac tcgag 915
<210>4
<211>897
<212>DNA
<213>人工序列
<220>
<223>AAD-1(v2)引物序列
<220>
<221>misc_feature
<222>(1)..(2)
<223>引物接头
<220>
<221>misc_feature
<222>(891)..(897)
<223>引物接头
<400>4
ccatggctgc tgcactgtcc cccctctccc agcgctttga gcgcatcgcg gtccagccgc 60
tgaccggcgt cctgggcgcc gagatcaccg gcgtcgacct gcgcgagccg ctcgacgaca 120
gcacctggaa cgaaatcctc gacgcgttcc acacttacca ggtcatctat tttcccggcc 180
aggcgatcac caacgaacag cacatcgcct tcagccggcg cttcggcccc gtcgatcccg 240
tgcccctgct caagagcatc gaagggtatc cagaggtgca gatgatccgc cgcgaagcca 300
acgaaagcgg gcgtgtgatc ggtgatgact ggcacaccga cagcaccttc ctggacgcac 360
cgccggccgc cgtggtgatg cgcgcgatcg acgtgcccga gcatggcggc gacaccggtt 420
ttctgagcat gtacaccgcg tgggagacgc tgtcgcccac catgcaggcc accatcgaag 480
ggttgaacgt agtgcacagc gccacgcgtg tgttcggctc gctctaccag gcccagaacc 540
ggcgcttcag caacaccagc gtcaaggtga tggacgtcga cgcgggcgac cgtgaaaccg 600
tgcaccccct ggtggtgacc catccgggca gcggctgcaa gggcctgtac gtgaaccagg 660
tctattgcca gcgcatcgag ggcatgaccg atgccgaaag caaaccgctg ctgcagttcc 720
tgtacgagca tgcgacacgg ttcgatttca cctgccgcgt gcgctggaag aaggaccagg 780
tcctggtctg ggacaacctg tgcacgatgc accgggccgt acccgactac gcgggcaagt 840
tccgctacct gacgcgcacc acggtcggtg gcgtgcgccc ggcgcgctag tgagctc 897
<210>5
<211>919
<212>DNA
<213>人工序列
<220>
<223>AAD-1(v3)引物序列
<220>
<221>misc_feature
<222>(1)..(2)
<223>引物接头
<220>
<221>misc_feature
<222>(6)..(8)
<223>附加的丙氨酸密码子(GCT)
<220>
<221>misc_feature
<222>(894)..(919)
<223>引物接头
<400>5
ccatggctca tgctgccctc agccctctct cccaacgctt tgagagaata gctgtccagc 60
cactcactgg tgtccttggt gctgagatca ctggagtgga cttgagggaa ccacttgatg 120
acagcacctg gaatgagata ttggatgcct tccacactta ccaagtcatc tactttcctg 180
gccaagcaat caccaatgag cagcacattg cattctcaag aaggtttgga ccagttgatc 240
cagtgcctct tctcaagagc attgaaggct atccagaggt tcagatgatc cgcagagaag 300
ccaatgagtc tggaagggtg attggtgatg actggcacac agactccact ttccttgatg 360
cacctccagc tgctgttgtg atgagggcca tagatgttcc tgagcatggc ggagacactg 420
ggttcctttc aatgtacaca gcttgggaga ccttgtctcc aaccatgcaa gccaccatcg 480
aagggctcaa cgttgtgcac tctgccacac gtgtgttcgg ttccctctac caagcacaga 540
accgtcgctt cagcaacacc tcagtcaagg tgatggatgt tgatgctggt gacagagaga 600
cagtccatcc cttggttgtg actcatcctg gctctggaag gaaaggcctt tatgtgaatc 660
aagtctactg tcagagaatt gagggcatga cagatgcaga atcaaagcca ttgcttcagt 720
tcctctatga gcatgccacc agatttgact tcacttgccg tgtgaggtgg aagaaagacc 780
aagtccttgt ctgggacaac ttgtgcacca tgcaccgtgc tgttcctgac tatgctggca 840
agttcagata cttgactcgc accacagttg gtggagttag gcctgcccgc tgagtagtta 900
gcttaatcac ctagagctc 919
<210>6
<211>30
<212>DNA
<213>人工序列
<220>
<223>rdpA(ncoI)5’引物
<400>6
cccatggctg ctgcactgtc ccccctctcc 30
<210>7
<211>33
<212>DNA
<213>人工序列
<220>
<223>3’saci引物
<400>7
gagctcacta gcgcgccggg cgcacgccac cga 33
<210>8
<211>36
<212>DNA
<213>人工序列
<220>
<223>BstEII/Del NotI 5’引物
<400>8
tggtggtgac ccatccgggc agcggctgca agggcc 36
<210>9
<211>295
<212>PRT
<213>Sphingobium herbicidovorans
<400>9
Met His Ala Ala Leu Ser Pro Leu Ser Gln Arg Phe Glu Arg Ile Ala
1 5 10 15
Val Gln Pro Leu Thr Gly Val Leu Gly Ala Glu Ile Thr Gly Val Asp
20 25 30
Leu Arg Glu Pro Leu Asp Asp Ser Thr Trp Asn Glu Ile Leu Asp Ala
35 40 45
Phe His Thr Tyr Gln Val Ile Tyr Phe Pro Gly Gln Ala Ile Thr Asn
50 55 60
Glu Gln His Ile Ala Phe Ser Arg Arg Phe Gly Pro Val Asp Pro Val
65 70 75 80
Pro Leu Leu Lys Ser Ile Glu Gly Tyr Pro Glu Val Gln Met Ile Arg
85 90 95
Arg Glu Ala Asn Glu Ser Gly Arg Val Ile Gly Asp Asp Trp His Thr
100 105 110
Asp Ser Thr Phe Leu Asp Ala Pro Pro Ala Ala Val Val Met Arg Ala
115 120 125
Ile Asp Val Pro Glu His Gly Gly Asp Thr Gly Phe Leu Ser Met Tyr
130 135 140
Thr Ala Trp Glu Thr Leu Ser Pro Thr Met Gln Ala Thr Ile Glu Gly
145 150 155 160
Leu Asn Val Val His Ser Ala Thr Arg Val Phe Gly Ser Leu Tyr Gln
165 170 175
Ala Gln Asn Arg Arg Phe Ser Asn Thr Ser Val Lys Val Met Asp Val
180 185 190
Asp Ala Gly Asp Arg Glu Thr Val His Pro Leu Val Val Thr His Pro
195 200 205
Gly Ser Gly Arg Lys Gly Leu Tyr Val Asn Gln Val Tyr Cys Gln Arg
210 215 220
Ile Glu Gly Met Thr Asp Ala Glu Ser Lys Pro Leu Leu Gln Phe Leu
225 230 235 240
Tyr Glu His Ala Thr Arg Phe Asp Phe Thr Cys Arg Val Arg Trp Lys
245 250 255
Lys Asp Gln Val Leu Val Trp Asp Asn Leu Cys Thr Met His Arg Ala
260 265 270
Val Pro Asp Tyr Ala Gly Lys Phe Arg Tyr Leu Thr Arg Thr Thr Val
275 280 285
Gly Gly Val Arg Pro Ala Arg
290 295
<210>10
<211>295
<212>PRT
<213>人工序列
<220>
<223>AAD-1 v2翻译
<220>
<221>MISC_FEATURE
<222>(2)..(2)
<223>与v1不同
<220>
<221>MISC_FEATURE
<222>(212)..(212)
<223>与v1不同
<400>10
Met Ala Ala Ala Leu Ser Pro Leu Ser Gln Arg Phe Glu Arg Ile Ala
1 5 10 15
Val Gln Pro Leu Thr Gly Val Leu Gly Ala Glu Ile Thr Gly Val Asp
20 25 30
Leu Arg Glu Pro Leu Asp Asp Ser Thr Trp Asn Glu Ile Leu Asp Ala
35 40 45
Phe His Thr Tyr Gln Val Ile Tyr Phe Pro Gly Gln Ala Ile Thr Asn
50 55 60
Glu Gln His Ile Ala Phe Ser Arg Arg Phe Gly Pro Val Asp Pro Val
65 70 75 80
Pro Leu Leu Lys Ser Ile Glu Gly Tyr Pro Glu Val Gln Met Ile Arg
85 90 95
Arg Glu Ala Asn Glu Ser Gly Arg Val Ile Gly Asp Asp Trp His Thr
100 105 110
Asp Ser Thr Phe Leu Asp Ala Pro Pro Ala Ala Val Val Met Arg Ala
115 120 125
Ile Asp Val Pro Glu His Gly Gly Asp Thr Gly Phe Leu Ser Met Tyr
130 135 140
Thr Ala Trp Glu Thr Leu Ser Pro Thr Met Gln Ala Thr Ile Glu Gly
145 150 155 160
Leu Asn Val Val His Ser Ala Thr Arg Val Phe Gly Ser Leu Tyr Gln
165 170 175
Ala Gln Asn Arg Arg Phe Ser Asn Thr Ser Val Lys Val Met Asp Val
180 185 190
Asp Ala Gly Asp Arg Glu Thr Val His Pro Leu Val Val Thr His Pro
195 200 205
Gly Ser Gly Cys Lys Gly Leu Tyr Val Asn Gln Val Tyr Cys Gln Arg
210 215 220
Ile Glu Gly Met Thr Asp Ala Glu Ser Lys Pro Leu Leu Gln Phe Leu
225 230 235 240
Tyr Glu His Ala Thr Arg Phe Asp Phe Thr Cys Arg Val Arg Trp Lys
245 250 255
Lys Asp Gln Val Leu Val Trp Asp Asn Leu Cys Thr Met His Arg Ala
260 265 270
Val Pro Asp Tyr Ala Gly Lys Phe Arg Tyr Leu Thr Arg Thr Thr Val
275 280 285
Gly Gly Val Arg Pro Ala Arg
290 295
<210>11
<211>296
<212>PRT
<213>人工序列
<220>
<223>AAD-1 v3翻译
<220>
<221>MISC_FEATURE
<222>(2)..(3)
<223>与v1不同
<400>11
Met Ala His Ala Ala Leu Ser Pro Leu Ser Gln Arg Phe Glu Arg Ile
1 5 10 15
Ala Val Gln Pro Leu Thr Gly Val Leu Gly Ala Glu Ile Thr Gly Val
20 25 30
Asp Leu Arg Glu Pro Leu Asp Asp Ser Thr Trp Asn Glu Ile Leu Asp
35 40 45
Ala Phe His Thr Tyr Gln Val Ile Tyr Phe Pro Gly Gln Ala Ile Thr
50 55 60
Asn Glu Gln His Ile Ala Phe Ser Arg Arg Phe Gly Pro Val Asp Pro
65 70 75 80
Val Pro Leu Leu Lys Ser Ile Glu Gly Tyr Pro Glu Val Gln Met Ile
85 90 95
Arg Arg Glu Ala Asn Glu Ser Gly Arg Val Ile Gly Asp Asp Trp His
100 105 110
Thr Asp Ser Thr Phe Leu Asp Ala Pro Pro Ala Ala Val Val Met Arg
115 120 125
Ala Ile Asp Val Pro Glu His Gly Gly Asp Thr Gly Phe Leu Ser Met
130 135 140
Tyr Thr Ala Trp Glu Thr Leu Ser Pro Thr Met Gln Ala Thr Ile Glu
145 150 155 160
Gly Leu Asn Val Val His Ser Ala Thr Arg Val Phe Gly Ser Leu Tyr
165 170 175
Gln Ala Gln Asn Arg Arg Phe Ser Asn Thr Ser Val Lys Val Met Asp
180 185 190
Val Asp Ala Gly Asp Arg Glu Thr Val His Pro Leu Val Val Thr His
195 200 205
Pro Gly Ser Gly Arg Lys Gly Leu Tyr Val Asn Gln Val Tyr Cys Gln
210 215 220
Arg Ile Glu Gly Met Thr Asp Ala Glu Ser Lys Pro Leu Leu Gln Phe
225 230 235 240
Leu Tyr Glu His Ala Thr Arg Phe Asp Phe Thr Cys Arg Val Arg Trp
245 250 255
Lys Lys Asp Gln Val Leu Val Trp Asp Asn Leu Cys Thr Met His Arg
260 265 270
Ala Val Pro Asp Tyr Ala Gly Lys Phe Arg Tyr Leu Thr Arg Thr Thr
275 280 285
Val Gly Gly Val Arg Pro Ala Arg
290 295
<210>12
<211>888
<212>DNA
<213>大豆慢生根瘤菌USDA110
<400>12
atgacgatcg ccatccggca gcttcagacg cattttgtcg gccaggtttc cggcctcgat 60
ttgcgaaagc cgctcacgcc gggcgaggcc cgcgaggtcg agtccgccat ggacaaatac 120
gcggtgctcg ttttccacga ccaggacatc accgacgagc agcagatggc tttcgcgctg 180
aacttcggcc agcgcgagga cgcgcgcggc ggcacggtca ccaaggagaa ggactaccgg 240
ctgcaatccg gcctgaacga cgtctccaat ctcggcaagg acggcaagcc gctggccaag 300
gacagccgca cgcacctgtt caatctcggc aactgcctct ggcactccga cagctcgttc 360
cgtcccattc ccgcaaaatt ctcgctgctg tcggcgcgcg tggtgaaccc gacgggcggc 420
aacaccgaat tcgcggacat gcgcgccgcc tatgacgcgc tcgacgacga gaccaaggcc 480
gaaatcgagg acctcgtctg cgagcactcg ctgatgtatt cgcgcggctc gctcggcttc 540
accgagtaca ccgacgaaga gaagcagatg ttcaagccgg tcctgcaacg cctcgtgcgc 600
acccatccgg tccaccgccg caagtcgctg tatctctcgt cgcatgccgg caagatcgcc 660
agcatgagcg tgccggaggg gcggctgctg ttgcgcgatc tcaacgagca cgcgacgcag 720
ccggaattcg tctacgtcca caaatggaag ctgcatgacc tcgtgatgtg ggacaaccgc 780
cagaccatgc accgcgtccg ccgctacgac cagtcccagc cccgcgacat gcgccgcgcg 840
acggtggcgg ggacggagcc gacggtgcag cagcaggcgg cggagtag 888
<210>13
<211>289
<212>PRT
<213>大豆慢生根瘤菌USDA110
<400>13
Met Thr Ile Ala Ile Arg Gln Leu Gln Thr His Phe Val Gly Gln Val
1 5 10 15
Ser Gly Leu Asp Leu Arg Lys Pro Leu Thr Pro Gly Glu Ala Arg Glu
20 25 30
Val Glu Ser Ala Met Asp Lys Tyr Ala Val Leu Val Phe His Asp Gln
35 40 45
Asp Ile Thr Asp Glu Gln Gln Met Ala Phe Ala Leu Asn Phe Gly Gln
50 55 60
Arg Glu Asp Ala Arg Gly Gly Thr Val Thr Lys Glu Lys Asp Tyr Arg
65 70 75 80
Leu Gln Ser Gly Leu Asn Asp Val Ser Asn Leu Gly Lys Asp Gly Lys
85 90 95
Pro Leu Ala Lys Asp Ser Arg Thr His Leu Phe Asn Leu Gly Asn Cys
100 105 110
Leu Trp His Ser Asp Ser Ser Phe Arg Pro Ile Pro Ala Lys Phe Ser
115 120 125
Leu Leu Ser Ala Arg Val Val Asn Pro Thr Gly Gly Asn Thr Glu Phe
130 135 140
Ala Asp Met Arg Ala Ala Tyr Asp Ala Leu Asp Asp Glu Thr Lys Ala
145 150 155 160
Glu Ile Glu Asp Leu Val Cys Glu His Ser Leu Met Tyr Ser Arg Gly
165 170 175
Ser Leu Gly Phe Thr Glu Tyr Thr Asp Glu Glu Lys Gln Met Phe Lys
180 185 190
Pro Val Leu Gln Arg Leu Val Arg Thr His Pro Val His Arg Arg Lys
195 200 205
Ser Leu Tyr Leu Ser Ser His Ala Gly Lys Ile Ala Ser Met Ser Val
210 215 220
Pro Glu Gly Arg Leu Leu Leu Arg Asp Leu Asn Glu His Ala Thr Gln
225 230 235 240
Pro Glu Phe Val Tyr Val His Lys Trp Lys Leu His Asp Leu Val Met
245 250 255
Trp Asp Asn Arg Gln Thr Met His Arg Val Arg Arg Tyr Asp Gln Ser
260 265 270
Gln Pro Arg Asp Met Arg Arg Ala Thr Val Ala Gly Thr Glu Pro Thr
275 280 285
Val
<210>14
<211>34
<212>DNA
<213>人工序列
<220>
<223>brjap 5’(speI)
<400>14
actagtaaca aagaaggaga tataccatga cgat 34
<2l0>15
<211>33
<212>DNA
<213>人工序列
<220>
<223>br jap 3’ (xhoI)
<400>15
ttctcgagct atcactccgc cgcctgctgc tgc 33
<210>16
<2ll>17
<212>DNA
<213>人工序列
<220>
<223>M13 forward引物
<400>16
gtaaaacgac ggccagt 17
<210>17
<211>17
<212>DNA
<213>人工序列
<220>
<223>M13 reverse引物
<400>17
caggaaacag ctatgac 17
<210>18
<21l>32
<212>DNA
<213>人工序列
<220>
<223>NcoI of Brady
<400>18
tataccacat gtcgatcgcc atccggcagc tt 32
<210>19
<211>33
<212>DNA
<213>人工序列
<220>
<223>SacI of Brady
<400>19
gagctcctat cactccgccg cctgctgctg cac 33
<210>20
<211>525
<212>PRT
<213>大豆
<400>20
Met Ala Gln Val Ser Arg Val His Asn Leu Ala Gln Ser Thr Gln Ile
1 5 10 15
Phe Gly His Ser Ser Asn Ser Asn Lys Leu Lys Ser Val Asn Ser Val
20 25 30
Ser Leu Arg Pro Arg Leu Trp Gly Ala Ser Lys Ser Arg Ile Pro Met
35 40 45
His Lys Asn Gly Ser Phe Met Gly Asn Phe Asn Val Gly Lys Gly Asn
50 55 60
Ser Gly Val Phe Lys Val Ser Ala Ser Val Ala Ala Ala Glu Lys Pro
65 70 75 80
Ser Thr Ser Pro Glu Ile Val Leu Glu Pro Ile Lys Asp Phe Ser Gly
85 90 95
Thr Ile Thr Leu Pro Gly Ser Lys Ser Leu Ser Asn Arg Ile Leu Leu
100 105 110
Leu Ala Ala Leu Ser Glu Gly Thr Thr Val Val Asp Asn Leu Leu Tyr
115 120 125
Ser Glu Asp Ile His Tyr Met Leu Gly Ala Leu Arg Thr Leu Gly Leu
130 135 140
Arg Val Glu Asp Asp Lys Thr Thr Lys Gln Ala Ile Val Glu Gly Cys
145 150 155 160
Gly Gly Leu Phe Pro Thr Ser Lys Glu Ser Lys Asp Glu Ile Asn Leu
165 170 175
Phe Leu Gly Asn Ala Gly Thr Ala Met Arg Pro Leu Thr Ala Ala Val
180 185 190
Val Ala Ala Gly Gly Asn Ala Ser Tyr Val Leu Asp Gly Val Pro Arg
195 200 205
Met Arg Glu Arg Pro Ile Gly Asp Leu Val Ala Gly Leu Lys Gln Leu
210 215 220
Gly Ala Asp Val Asp Cys Phe Leu Gly Thr Asn Cys Pro Pro Val Arg
225 230 235 240
Val Asn Gly Lys Gly Gly Leu Pro Gly Gly Lys Val Lys Leu Ser Gly
245 250 255
Ser Val Ser Ser Gln Tyr Leu Thr Ala Leu Leu Met Ala Ala Pro Leu
260 265 270
Ala Leu Gly Asp Val Glu Ile Glu Ile Val Asp Lys Leu Ile Ser Val
275 280 285
Pro Tyr Val Glu Met Thr Leu Lys Leu Met Glu Arg Phe Gly Val Ser
290 295 300
Val Glu His Ser Gly Asn Trp Asp Arg Phe Leu Val His Gly Gly Gln
305 310 315 320
Lys Tyr Lys Ser Pro Gly Asn Ala Phe Val Glu Gly Asp Ala Ser Ser
325 330 335
Ala Ser Tyr Leu Leu Ala Gly Ala Ala Ile Thr Gly Gly Thr Ile Thr
340 345 350
Val Asn Gly Cys Gly Thr Ser Ser Leu Gln Gly Asp Val Lys Phe Ala
355 360 365
Glu Val Leu Glu Lys Met Gly Ala Lys Val Thr Trp Ser Glu Asn Ser
370 375 380
Val Thr Val Ser Gly Pro Pro Arg Asp Phe Ser Gly Arg Lys Val Leu
385 390 395 400
Arg Gly Ile Asp Val Asn Met Asn Lys Met Pro Asp Val Ala Met Thr
405 410 415
Leu Ala Val Val Ala Leu Phe Ala Asn Gly Pro Thr Ala Ile Arg Asp
420 425 430
Val Ala Ser Trp Arg Val Lys Glu Thr Glu Arg Met Ile Ala Ile Cys
435 440 445
Thr Glu Leu Arg Lys Leu Gly Ala Thr Val Glu Glu Gly Pro Asp Tyr
450 455 460
Cys Val Ile Thr Pro Pro Glu Lys Leu Asn Val Thr Ala Ile Asp Thr
465 470 475 480
Tyr Asp Asp His Arg Met Ala Met Ala Phe Ser Leu Ala Ala Cys Gly
485 490 495
Asp Val Pro Val Thr Ile Lys Asp Pro Gly Cys Thr Arg Lys Thr Phe
500 505 510
Pro Asp Tyr Phe Glu Val Leu Glu Arg Leu Thr Lys His
515 520 525
<210>21
<211>525
<212>PRT
<213>人工序列
<220>
<223>双突变大豆EPSPS蛋白:苏氨酸183转变成异亮氨酸;脯氨酸187转变成丝氨酸
<400>21
Met Ala Gln Val Ser Arg Val His Asn Leu Ala Gln Ser Thr Gln Ile
1 5 10 15
Phe Gly His Ser Ser Asn Ser Asn Lys Leu Lys Ser Val Asn Ser Val
20 25 30
Ser Leu Arg Pro Arg Leu Trp Gly Ala Ser Lys Ser Arg Ile Pro Met
35 40 45
His Lys Asn Gly Ser Phe Met Gly Asn Phe Asn Val Gly Lys Gly Asn
50 55 60
Ser Gly Val Phe Lys Val Ser Ala Ser Val Ala Ala Ala Glu Lys Pro
65 70 75 80
Ser Thr Ser Pro Glu Ile Val Leu Glu Pro Ile Lys Asp Phe Ser Gly
85 90 95
Thr Ile Thr Leu Pro Gly Ser Lys Ser Leu Ser Asn Arg Ile Leu Leu
100 105 110
Leu Ala Ala Leu Ser Glu Gly Thr Thr Val Val Asp Asn Leu Leu Tyr
115 120 125
Ser Glu Asp Ile His Tyr Met Leu Gly Ala Leu Arg Thr Leu Gly Leu
130 135 140
Arg Val Glu Asp Asp Lys Thr Thr Lys Gln Ala Ile Val Glu Gly Cys
145 150 155 160
Gly Gly Leu Phe Pro Thr Ser Lys Glu Ser Lys Asp Glu Ile Asn Leu
165 170 175
Phe Leu Gly Asn Ala Gly Ile Ala Met Arg Ser Leu Thr Ala Ala Val
180 185 190
Val Ala Ala Gly Gly Asn Ala Ser Tyr Val Leu Asp Gly Val Pro Arg
195 200 205
Met Arg Glu Arg Pro Ile Gly Asp Leu Val Ala Gly Leu Lys Gln Leu
210 215 220
Gly Ala Asp Val Asp Cys Phe Leu Gly Thr Asn Cys Pro Pro Val Arg
225 230 235 240
Val Asn Gly Lys Gly Gly Leu Pro Gly Gly Lys Val Lys Leu Ser Gly
245 250 255
Ser Val Ser Ser Gln Tyr Leu Thr Ala Leu Leu Met Ala Ala Pro Leu
260 265 270
Ala Leu Gly Asp Val Glu Ile Glu Ile Val Asp Lys Leu Ile Ser Val
275 280 285
Pro Tyr Val Glu Met Thr Leu Lys Leu Met Glu Arg Phe Gly Val Ser
290 295 300
Val Glu His Ser Gly Asn Trp Asp Arg Phe Leu Val His Gly Gly Gln
305 310 315 320
Lys Tyr Lys Ser Pro Gly Asn Ala Phe Val Glu Gly Asp Ala Ser Ser
325 330 335
Ala Ser Tyr Leu Leu Ala Gly Ala Ala Ile Thr Gly Gly Thr Ile Thr
340 345 350
Val Asn Gly Cys Gly Thr Ser Ser Leu Gln Gly Asp Val Lys Phe Ala
355 360 365
Glu Val Leu Glu Lys Met Gly Ala Lys Val Thr Trp Ser Glu Asn Ser
370 375 380
Val Thr Val Ser Gly Pro Pro Arg Asp Phe Ser Gly Arg Lys Val Leu
385 390 395 400
Arg Gly Ile Asp Val Asn Met Asn Lys Met Pro Asp Val Ala Met Thr
405 410 415
Leu Ala Val Val Ala Leu Phe Ala Asn Gly Pro Thr Ala Ile Arg Asp
420 425 430
Val Ala Ser Trp Arg Val Lys Glu Thr Glu Arg Met Ile Ala Ile Cys
435 440 445
Thr Glu Leu Arg Lys Leu Gly Ala Thr Val Glu Glu Gly Pro Asp Tyr
450 455 460
Cys Val Ile Thr Pro Pro Glu Lys Leu Asn Val Thr Ala Ile Asp Thr
465 470 475 480
Tyr Asp Asp His Arg Met Ala Met Ala Phe Ser Leu Ala Ala Cys Gly
485 490 495
Asp Val Pro Val Thr Ile Lys Asp Pro Gly Cys Thr Arg Lys Thr Phe
500 505 510
Pro Asp Tyr Phe Glu Val Leu Glu Arg Leu Thr Lys His
515 520 525
<210>22
<211>1604
<212>DNA
<213>人工序列
<220>
<223>编码公开于SEQ ID N0:21的具有附加序列的双突变EPSPS的大豆偏爱DNA序列
<220>
<221>misc_feature
<222>(1)..(1575)
<223>编码SEQ ID N0:21的双突变EPSPS的大豆偏爱DNA序列的编码序列
<220>
<22l>misc_feature
<222>(1576)..(1578)
<223>翻译终止子tga
<220>
<22l>misc_feature
<222>(1579)..(1604)
<223>包括来用于在所有6个开放阅读框引入翻译终止密码子并引入用于克隆的SacI限制 酶识别位点的序列
<400>22
atggctcaag tctcccgtgt tcacaatctt gctcagtcaa cccaaatctt tggacattca 60
agcaactcaa acaaactgaa gtctgtgaat tctgtctcac ttcgcccacg cctttgggga 120
gcatccaaga gtcgcatacc aatgcacaag aatgggagtt tcatgggcaa cttcaatgtt 180
gggaaaggca attctggtgt cttcaaagtt tcagcttctg ttgcagccgc agagaaaccc 240
agcacttccc ctgagattgt tcttgaaccc attaaggact tcagtggaac aatcactctg 300
cctggatcaa agagtctttc aaacagaata cttctcttgg cagctctgag tgaaggaacc 360
actgtagttg acaacctttt gtactctgaa gatattcatt acatgttggg tgctctcaga 420
actcttgggt tgagagttga agatgacaag accacaaaac aagccatagt tgaaggatgt 480
ggtgggttgt ttccaacaag caaagaatcc aaagatgaga tcaacttgtt tcttggcaat 540
gctggaattg caatgagaag cctcactgct gcagtagttg cagctggtgg gaatgcaagt 600
tatgtccttg atggtgtccc cagaatgagg gaaaggccca tcggtgacct tgtggctggc 660
ctgaaacagc ttggagcaga tgttgattgc ttcttgggca caaactgccc tccagtgaga 720
gtgaatggga agggaggttt gcctggtgga aaggtcaaac tgagtggatc agtctcttcc 780
cagtatctga ctgccttgct catggctgcc cctctggctt tgggtgatgt ggagattgaa 840
atagtggaca agttgatttc tgttccatat gtggaaatga ccctcaaact catggagagg 900
tttggagttt ctgttgaaca ttctggcaac tgggatcgtt tccttgtaca tggaggtcag 960
aagtacaaaa gccctggcaa tgcctttgtt gaaggggatg caagctctgc ttcctatctc 1020
ttggctgggg ctgccatcac tggtgggacc atcactgtga atggctgtgg cacctcatcc 1080
cttcaaggtg atgtaaagtt tgcagaggtc ttggagaaaa tgggtgccaa ggtcacctgg 1140
tctgagaaca gtgtaactgt gtctggacct cccagagact tcagtggcag aaaggttctc 1200
cgtggaattg atgtgaacat gaacaagatg ccagatgtgg ccatgaccct cgctgttgta 1260
gccctgtttg caaatggacc aactgcaatc cgtgatgttg cttcatggag ggtgaaggag 1320
acagagagga tgattgccat ttgcacagaa ctccgcaaac ttggtgcaac agttgaagag 1380
ggaccagatt actgtgtgat aaccccacct gagaagctca atgtgacagc cattgacacc 1440
tatgatgacc acagaatggc aatggctttc tcccttgctg cctgtggtga tgtgcctgtg 1500
actatcaaag accctgggtg cacaaggaag acatttccag actactttga agttttggag 1560
aggttgacaa agcactgagt agttagctta atcacctaga gctc 1604
<210>23
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物Pat 5-3
<400>23
agataccctt ggttggttgc 20
<210>24
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物Pat 3-3
<400>24
cagatggatc gtttggaagg 20
<210>25
<211>23
<212>DNA
<213>人工序列
<220>
<223>AAD-1 PTU正向引物
<400>25
ataatgccag cctgttaaac gcc 23
<210>26
<211>23
<212>DNA
<213>人工序列
<220>
<223>AAD-1 PTU反向引物
<400>26
ctcaagcata tgaatgacct cga 23
<210>27
<211>22
<212>DNA
<213>人工序列
<220>
<223>用于编码区PCR AAD-1(RdpAcodF)的正向引物
<400>27
atggctcatg ctgccctcag cc 22
<210>28
<211>22
<212>DNA
<213>人工序列
<220>
<223>用于编码区PCR AAD-1(RdpAcodR)的反向引物
<400>28
cgggcaggcc taactccacc aa 22
<210>29
<211>932
<212>DNA
<213>人工序列
<220>
<223>AAD-2v2植物优选的核苷酸
<400>29
ccatggctac catagcaatc agacagctcc agacccactt tgtgggtcaa gtttctggat 60
tggacctcag aaagccactc actcctggag aagccagaga agttgaatca gctatggaca 120
agtacgcagt tcttgtcttc catgaccaag acatcacaga tgagcaacag atggcctttg 180
ccctcaactt tggtcagagg gaggatgcac gtggtggcac tgtcaccaaa gagaaggatt 240
accgtcttca gtctggcctc aatgatgttt ccaacttggg caaagatgga aagccacttg 300
ccaaggacag ccgcacccat ttgttcaacc ttggaaactg cttgtggcat tctgactcca 360
gcttcagacc aatcccagcc aagttcagcc tcctttctgc tcgtgttgtg aacccaactg 420
gtgggaacac tgagtttgct gacatgagag ctgcctatga tgctcttgac gatgaaacca 480
aagctgagat tgaggacctt gtgtgtgagc actctctcat gtactcaagg ggctcacttg 540
gcttcactga gtacacagat gaagagaagc aaatgttcaa gcccgtcttg cagcgcttgg 600
tccgcacaca ccctgtgcac cgtcgcaaat cactctacct ctccagccat gccggaaaga 660
ttgccagcat gtccgtccct gaagggaggc tccttttgag ggatttgaat gaacatgcta 720
ctcagcctga gttcgtctat gttcacaaat ggaagttgca tgatcttgtg atgtgggaca 780
ataggcaaac catgcacaga gtgaggagat atgaccagtc ccaacccaga gacatgcgcc 840
gtgcaacagt tgctgggacc gagcccacag tgcaacagca agcagcagag tgagtagtta 900
gcttaatcac ctagagctcg gtcaccagat ct 932
<210>30
<211>296
<212>PRT
<213>人工序列
<220>
<223>翻译的AAD-2 v2蛋白质
<400>30
Met Ala Thr Ile Ala Ile Arg Gln Leu Gln Thr His Phe Val Gly Gln
1 5 10 15
Val Ser Gly Leu Asp Leu Arg Lys Pro Leu Thr Pro Gly Glu Ala Arg
20 25 30
Glu Val Glu Ser Ala Met Asp Lys Tyr Ala Val Leu Val Phe His Asp
35 40 45
Gln Asp Ile Thr Asp Glu Gln Gln Met Ala Phe Ala Leu Asn Phe Gly
50 55 60
Gln Arg Glu Asp Ala Arg Gly Gly Thr Val Thr Lys Glu Lys Asp Tyr
65 70 75 80
Arg Leu Gln Ser Gly Leu Asn Asp Val Ser Asn Leu Gly Lys Asp Gly
85 90 95
Lys Pro Leu Ala Lys Asp Ser Arg Thr His Leu Phe Asn Leu Gly Asn
100 105 110
Cys Leu Trp His Ser Asp Ser Ser Phe Arg Pro Ile Pro Ala Lys Phe
115 120 125
Ser Leu Leu Ser Ala Arg Val Val Asn Pro Thr Gly Gly Asn Thr Glu
130 135 140
Phe Ala Asp Met Arg Ala Ala Tyr Asp Ala Leu Asp Asp Glu Thr Lys
145 150 155 160
Ala Glu Ile Glu Asp Leu Val Cys Glu His Ser Leu Met Tyr Ser Arg
165 170 175
Gly Ser Leu Gly Phe Thr Glu Tyr Thr Asp Glu Glu Lys Gln Met Phe
180 185 190
Lys Pro Val Leu G1n Arg Leu Val Arg Thr His Pro Val His Arg Arg
195 200 205
Lys Ser Leu Tyr Leu Ser Ser His Ala Gly Lys Ile Ala Ser Met Ser
210 215 220
Val Pro Glu Gly Arg Leu Leu Leu Arg Asp Leu Asn Glu His Ala Thr
225 230 235 240
Gln Pro Glu Phe Val Tyr Val His Lys Trp Lys Leu His Asp Leu Val
245 250 255
Met Trp Asp Asn Arg Gln Thr Met His Arg Val Arg Arg Tyr Asp Gln
260 265 270
Ser Gln Pro Arg Asp Met Arg Arg Ala Thr Val Ala Gly Thr Glu Pro
275 280 285
Thr Val Gln Gln Gln Ala Ala Glu
290 295
<210>31
<211>22
<212>DNA
<213>人工序列
<220>
<223>Southern片段PCR AAD-1正向引物
<400>31
atggctcatg ctgccctcag cc 22
<210>32
<211>21
<212>DNA
<213>人工序列
<220>
<223>Southern片段PCR AAD-1反向引物
<400>32
gggcaggcct aactccacca a 21