JP6204350B2 - 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 - Google Patents
抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 Download PDFInfo
- Publication number
- JP6204350B2 JP6204350B2 JP2014514947A JP2014514947A JP6204350B2 JP 6204350 B2 JP6204350 B2 JP 6204350B2 JP 2014514947 A JP2014514947 A JP 2014514947A JP 2014514947 A JP2014514947 A JP 2014514947A JP 6204350 B2 JP6204350 B2 JP 6204350B2
- Authority
- JP
- Japan
- Prior art keywords
- antigen
- binding
- region
- amino acid
- antibody
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2812—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Description
さらに、本発明者らは、中性pHまたは酸性pHにおけるFcRnに対するアフィニティーが増強されたが、既存の抗医薬品抗体に対する結合活性が有意に増強されていない改変FcRn結合ドメインについて、およびこのようなFcRn結合ドメインを含む抗原結合分子について鋭意研究を行った。その結果、本発明者らは、FcRn結合ドメインの特定の位置における置換によって、FcRn結合活性が実質的に低下することなく、中性pHにおける既存の抗医薬品抗体に対するアフィニティーが低下することを見出した。
[1]改変FcRn結合ドメインを含む抗原結合分子であって、該改変FcRn結合ドメインが、EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置にアミノ酸置換を含み、数字がEUナンバリングで表される置換の位置を示す、抗原結合分子。
[2]前記FcRn結合ドメインが、
a) EU252位およびEU434位におけるアミノ酸置換;ならびに
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU387、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置におけるアミノ酸置換
を有する、[1]記載の抗原結合分子。
[3]前記改変FcRn結合ドメインが、
EU238位にアスパラギン酸、
EU250位にバリン、
EU252位にチロシン、
EU254位にスレオニン、
EU255位にロイシン、
EU256位にグルタミン酸、
EU258位にアスパラギン酸もしくはイソロイシン、
EU286位にグルタミン酸、
EU307位にグルタミン、
EU308位にプロリン、
EU309位にグルタミン酸、
EU311位にアラニンもしくはヒスチジン、
EU315位にアスパラギン酸、
EU428位にイソロイシン、
EU433位にアラニン、リジン、プロリン、アルギニン、もしくはセリン、
EU434位にチロシンもしくはトリプトファン、および/または
EU436位にイソロイシン、ロイシン、バリン、スレオニン、もしくはフェニルアラニン
を含む、[1]または[2]記載の抗原結合分子。
[4]前記FcRn結合ドメインが、
a) EU252、EU434、およびEU436;
b) EU252、EU307、EU311、およびEU434;
c) EU252、EU315、およびEU434;
d) EU252、EU308、およびEU434:
e) EU238、EU252、およびEU434;
f) EU252、EU434、EU307、EU311、およびEU436;ならびに
g) EU252、EU387、およびEU434
からなる群より選択される位置の組み合わせのうちの1つまたは複数にアミノ酸置換を含む、[2]記載の抗原結合分子。
[5]前記FcRn結合ドメインが、
a) EU252位にチロシン、EU315位にアスパラギン酸、およびEU434位にチロシン;または
b) EU252位にチロシン、EU434位にチロシン、およびEU436位にイソロイシン;または
c) EU252位にチロシン、EU434位にチロシン、およびEU436位にロイシン;または
d) EU252位にチロシン、EU434位にチロシン、およびEU436位にバリン;または
e) EU252位にチロシン、EU254位にスレオニン、EU434位にチロシン、およびEU436位にイソロイシン
を含む、[4]記載の抗原結合分子。
[6]前記FcRn結合ドメインが3つ以上の位置にアミノ酸置換を含み、該3つ以上の位置が、
a) EU252/EU434/EU307/EU311/EU286;
b) EU252/EU434/EU307/EU311/EU286/EU254;
c) EU252/EU434/EU307/EU311/EU436;
d) EU252/EU434/EU307/EU311/EU436/EU254;
e) EU252/EU434/EU307/EU311/EU436/EU250;
f) EU252/EU434/EU308/EU250;
g) EU252/EU434/EU308/EU250/EU436;および
h) EU252/EU434/EU308/EU250/EU307/EU311
からなる組み合わせ群のうちの1つである、[2]記載の抗原結合分子。
[7]前記FcRn結合ドメインが、
a) EU252位にチロシン、EU286位にグルタミン酸、EU307位にグルタミン、EU311位にアラニン、およびEU434位にチロシン;または
b) EU252位にチロシン、EU254位にスレオニン、EU286位にグルタミン酸、EU307位にグルタミン、EU311位にアラニン、およびEU434位にチロシン;または
c) EU252位にチロシン、EU307位にグルタミン、EU311位にアラニン、EU434位にチロシン、および436位にイソロイシン;または
d) EU252位にチロシン、EU254位にスレオニン、EU286位にグルタミン酸、EU307位にグルタミン、EU311位にアラニン、EU434位にチロシン、およびEU436位にイソロイシン;または
e) EU250位にバリン、EU252位にチロシン、EU254位にスレオニン、EU308位にプロリン、EU434位にチロシン、およびEU436位にバリン;または
f) EU250位にバリン、EU252位にチロシン、EU307位にグルタミン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
g) EU252位にチロシン、EU307位にグルタミン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
h) EU250位にバリン、EU252位にチロシン、EU308位にプロリン、およびEU434位にチロシン;または
i) EU250位にバリン、EU252位にチロシン、EU307位にグルタミン、EU308位にプロリン、EU311位にアラニン、およびEU434位にチロシン
を含む、[6]記載の抗原結合分子。
[8]前記FcRn結合ドメインが3つ以上の位置にアミノ酸置換を含み、該3つ以上の位置が、
a) EU252およびEU434およびEU307およびEU311およびEU436およびEU286;
b) EU252およびEU434およびEU307およびEU311およびEU436およびEU250およびEU308;
c) EU252およびEU434およびEU307およびEU311およびEU436およびEU250およびEU286およびEU308;
d) EU252およびEU434およびEU307およびEU311およびEU436およびEU250およびEU286およびEU308およびEU428
からなる組み合わせ群のうちの1つである、[2]記載の抗原結合分子。
[9]前記FcRn結合ドメインが、
a) EU252位にチロシン、EU286位にグルタミン酸、EU307位にグルタミン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
b) EU250位にバリン、EU252位にチロシン、EU307位にグルタミン、EU308位にプロリン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
c) EU250位にバリン、EU252位にチロシン、EU286位にグルタミン酸、EU307位にグルタミン、EU308位にプロリン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
d) EU250位にバリン、EU252位にチロシン、EU286位にグルタミン酸、EU307位にグルタミン、EU308位にプロリン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン
を含む、[8]記載の抗原結合分子。
[10]前記FcRn結合ドメインが、
a) EU434およびEU307およびEU311;
b) EU434およびEU307およびEU309およびEU311;または
c) EU434およびEU250およびEU252およびEU436
からなる組み合わせ群のうちの1つである3つ以上の位置においてアミノ酸置換を含む、[2]記載の抗原結合分子。
[11]前記FcRn結合ドメインが、
a) EU307位にグルタミン、EU311位にヒスチジン、およびEU434位にチロシン;または
b) EU307位にグルタミン、EU309位にグルタミン酸、EU311位にアラニン、およびEU434位にチロシン;または
c) EU307位にグルタミン、EU309位にグルタミン酸、EU311位にヒスチジン、およびEU434位にチロシン;または
d) EU250位にバリン、EU252位にチロシン、EU434位にチロシン、およびEU436位にバリン
を含む、[10]記載の抗原結合分子。
[12]高分子量種の割合が2%未満である、[1]〜[11]のいずれか一つに記載の抗原結合分子。
[13]a) 抗原に対する結合活性が、pH 7〜8よりもpH 5.5〜6.5において低いか、または
b) 抗原に対する「カルシウム濃度依存的結合」活性を有する
抗原結合ドメインを含む、[1]〜[12]のいずれか一つに記載の抗原結合分子。
[14]pH 7におけるFcRnに対する前記結合分子の結合活性が50〜150 nMであり、Tmが63.0℃よりも高く、かつEpibaseスコアが250未満である、[1]〜[5]のいずれか一つに記載の抗原結合分子。
[15]pH 7におけるFcRnに対する前記結合分子の結合活性が15〜50 nMであり、Tmが60℃よりも高く、かつEpibaseスコアが500未満である、[1]〜[3]および[6]〜[7]のいずれか一つに記載の抗原結合分子。
[16]pH 7におけるFcRnに対する前記結合分子の結合活性が15nMよりも強く、Tmが57.5℃よりも高く、かつEpibaseスコアが500未満である、[1]〜[3]および[8]〜[9]のいずれか一つに記載の抗原結合分子。
[17]前記FcRn結合ドメインが、
a) EU238位、EU255位、および/またはEU258位、ならびに
b) 表4〜7に記載された組み合わせのうちの1つである3つ以上の位置
においてアミノ酸置換を含む、[1]〜[3]のいずれか一つに記載の抗原結合分子。
[18]a) 前記FcRn結合ドメインのEU257位のアミノ酸が、アラニン、バリン、イソロイシン、ロイシン、およびスレオニンからなる群より選択されるアミノ酸ではなく、かつ/または
b) 前記FcRn結合ドメインのEU252位のアミノ酸がトリプトファンではない、
[1]〜[17]のいずれか一つに記載の抗原結合分子。
[19]既存の抗医薬品抗体に対する結合活性が、インタクトなFcRn結合ドメインを含む対照抗体の結合アフィニティーと比較して有意に増強されていない、[1]〜[18]のいずれか一つに記載の抗原結合分子。
[20]前記FcRn結合ドメインが、EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置にアミノ酸置換をさらに含む、[19]記載の抗原結合分子。
[21]前記FcRn結合ドメインが、
EU387位におけるアルギニン、
EU422位におけるグルタミン酸、アルギニン、またはセリン、アスパラギン酸、リジン、スレオニン、またはグルタミン;
EU424位におけるグルタミン酸、またはアルギニン、リジン、またはアスパラギン;
EU426位におけるアスパラギン酸、グルタミン、アラニン、またはチロシン;
EU433位におけるアスパラギン酸;
EU436位におけるスレオニン;
EU438位におけるグルタミン酸、アルギニン、セリン、またはリジン;および
EU440位におけるグルタミン酸、アスパラギン酸、またはグルタミン
からなる群より選択される1つまたは複数のアミノ酸置換を含む、[20]記載の抗原結合分子。
[22]前記改変FcRn結合ドメインが、表12〜13に記載された組み合わせのうちの1つである3つ以上の置換を含む、[1]〜[21]のいずれか一つに記載の抗原結合分子。
[23]前記改変FcRn結合ドメインが、表14〜15に記載された組み合わせのうちの1つである3つ以上の置換を含む、[1]〜[22]のいずれか一つに記載の抗原結合分子。
[24]前記FcRn結合ドメインが、
a) EU252位にチロシン、EU387位にアルギニン、EU434位にチロシン、およびEU436位にバリン;または
b) EU252位にチロシン、EU422位にグルタミン酸、EU434位にチロシン、およびEU436位にバリン;または
c) EU252位にチロシン、EU422位にアルギニン、EU434位にチロシン、およびEU436位にバリン;または
d) EU252位にチロシン、EU422位にセリン、EU434位にチロシン、およびEU436位にバリン;または
e) EU252位にチロシン、EU422位にグルタミン酸、EU434位にチロシン、およびEU436位にバリン;または
f) EU252位にチロシン、EU424位にアルギニン、EU434位にチロシン、およびEU436位にバリン;または
g) EU252位にチロシン、EU434位にチロシン、EU436位にバリン、およびEU438位にグルタミン酸;または
h) EU252位にチロシン、EU434位にチロシン、EU436位にバリン、およびEU438位にアルギニン;または
i) EU252位にチロシン、EU434位にチロシン、EU436位にバリン、およびEU438位にセリン;または
j) EU252位にチロシン、EU434位にチロシン、EU436位にバリン、およびEU440位にグルタミン酸
を含む、[20]〜[23]のいずれか一つに記載の抗原結合分子。
[25]抗体である、[1]〜[24]のいずれか一つに記載の抗原結合分子。
[26]抗原結合分子による抗原の細胞内への取り込みを改善するための、[1]〜[25]のいずれか一つに記載の抗原結合分子の使用。
[27]特定の抗原の血漿中濃度を低下させるための[1]〜[25]のいずれか一つに記載の抗原結合分子の使用であって、該抗原結合分子が該抗原に結合し得る抗原結合ドメインを含む、使用。
[28]EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、抗原結合分子のFcRn結合ドメインにアミノ酸置換を導入する工程を含む、抗原結合分子の薬物動態を改善する方法。
[29]EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、抗原結合分子のFcRn結合ドメインにアミノ酸置換を導入する工程を含む、対象における抗原結合分子の消失を遅らせる方法。
[30]EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、抗原結合分子のFcRn結合ドメインにアミノ酸置換を導入する工程を含む、抗原結合分子の血漿中滞留時間を長くする方法。
[31]EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、抗原結合分子のFcRn結合ドメインにアミノ酸置換を導入する工程を含む、抗原結合分子の血漿中抗原消失速度を増大させる方法。
[32]EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、抗原結合分子のFcRn結合ドメインにアミノ酸置換を導入する工程を含む、抗原結合分子の血漿中抗原消失能を増強する方法。
[33]前記FcRn結合ドメイン中のEU256位においてさらなるアミノ酸置換が導入される、[28]〜[32]のいずれか一つに記載の方法。
[34]EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において前記FcRn結合ドメインにアミノ酸置換を導入する工程をさらに含む、[28]〜[33]のいずれか一つに記載の方法。
[35]以下の工程を含む、[1]〜[25]のいずれか一つに記載の抗原結合分子を製造する方法:
(a) 親FcRn結合ドメインを選択し、EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置にアミノ酸置換を導入することにより、親FcRnを改変する工程;
(b) pH依存的抗原結合ドメインまたはカルシウムイオン依存的抗原結合ドメインを得るために、抗原結合分子の抗原結合ドメインを選択し、該抗原結合ドメイン中の少なくとも1つのアミノ酸を改変する工程;
(c) (a)および(b)において調製されたヒトFcRn結合ドメインおよび抗原結合ドメインが連結された抗原結合分子をコードする遺伝子を得る工程、ならびに
(d) (c)において調製された遺伝子を用いて、抗原結合分子を製造する工程。
[36]工程a)において、前記FcRn結合ドメイン中のEU256位においてさらなるアミノ酸置換が導入される、[35]記載の方法。
[37]EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において前記FcRn結合ドメインにアミノ酸置換を導入する工程をさらに含む、[35]または[36]記載の方法。
[38]改変FcRn結合ドメインを含む抗原結合分子であって、該改変FcRn結合ドメインが、EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置にアミノ酸置換を含み、中性pHにおける既存の抗医薬品抗体(ADA)に対する該抗原結合分子の結合アフィニティーが、インタクトなFcRn結合ドメインを含む抗原結合分子の結合アフィニティーと比較して有意に増強されていない、抗原結合分子。
[39]さらにpH中性域またはpH酸性域におけるFcRnに対する結合アフィニティーが増強されている、[38]記載の抗原結合分子。
[40]EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置を置換するアミノ酸が、
a) EU387位におけるアルギニン;
b) EU422位におけるグルタミン酸、アルギニン、セリン、アスパラギン酸、リジン、スレオニン、またはグルタミン;
c) EU424位におけるグルタミン酸、アルギニン、リジン、またはアスパラギン;
d) EU426位におけるアスパラギン酸、グルタミン、アラニン、またはチロシン;
e) EU433位におけるアスパラギン酸
f) EU436位におけるスレオニン
g) EU438位におけるグルタミン酸、アルギニン、セリン、またはリジン;および
h) EU440位におけるグルタミン酸、アスパラギン酸、またはグルタミン
からなる群より選択される、[38]または[39]記載の抗原結合分子。
[41]前記改変FcRn結合ドメインが、表10に記載された1つもしくは複数の位置または組み合わせのうちの1つにおいてアミノ酸置換を含む、[38]〜[40]のいずれか一つに記載の抗原結合分子。
[42]前記改変FcRn結合ドメインが、表11に記載されたアミノ酸の置換または置換の組み合わせのいずれか1つを含む、[38]〜[40]のいずれか一つに記載の抗原結合分子。
[43]前記改変FcRn結合ドメインが、FcRn結合ドメインにおけるEU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU434、およびEU436からなる群より選択される1つまたは複数の位置にアミノ酸置換をさらに含み、該置換がpH中性域またはpH酸性域におけるFcRn結合活性を増強する、[39]〜[42]のいずれか一つに記載の抗原結合分子。
[44]前記改変FcRn結合ドメインが、FcRn結合ドメインにおける位置
i) a) EU438/EU440 または b) EU424;および
ii) a) EU434、b) EU252/EU254/EU256、c) EU428/EU434、または d) EU250/EU428
にアミノ酸置換を含む、[39]〜[43]のいずれか一つに記載の抗原結合分子。
[45]前記改変FcRn結合ドメインが、アミノ酸置換
i) a) EU438R/EU440E または b) EU424N;および
ii) a) M434H、b) M252Y/S254T/T256E、c) M428L/N434S、または d) T250QおよびM428L(EUナンバリング)
を含む、[44]記載の抗原結合分子。
[46]前記改変FcRn結合ドメインが、表13および15に記載された組み合わせのうちの1つである3つ以上のアミノ酸置換を含む、[45]記載の抗原結合分子。
[47]前記改変FcRn結合ドメインが、
a) EU387、EU422、EU424、EU438、EU440、EU433からなる群より選択される1つもしくは複数の位置、またはEU422/EU424およびEU438/EU440からなる組み合わせ群のうちの1つである2つ以上の位置;ならびに
b) 表9に記載された組み合わせのうちの1つである2つ以上の位置
に置換を含む、[39]〜[42]のいずれか一つに記載の抗原結合分子。
[48]前記改変FcRn結合ドメインが、表12または14に記載された組み合わせのうちの1つである3つ以上のアミノ酸置換を含む、[47]記載の抗原結合分子。
[49]pH依存的抗原結合ドメインまたはカルシウムイオン依存的抗原結合ドメインを含む、[39]〜[48]のいずれか一つに記載の抗原結合分子。
[50]以下の工程を含む、中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されており、かつ中性pHにおける既存のADAに対する結合活性が増強されているFcRn結合ドメインを含む抗原結合分子の、既存のADAに対する結合活性を低下させる方法:
a) 中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されており、かつ中性pHにおける既存のADAに対する結合活性が増強されているFcRn結合ドメインを有する抗原結合分子を提供する工程;および
b) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、FcRn結合ドメイン中のアミノ酸を置換して、改変FcRn結合ドメインを有する抗原結合分子をもたらす工程。
[51]工程b)が、表10に記載された組み合わせのうちの1つである3つ以上の位置においてアミノ酸を置換することを含む、[50]記載の方法。
[52]工程b)が、表11に記載された組み合わせのうちの1つである3つ以上のアミノ酸置換をFcRn結合ドメインに導入することを含む、[50]記載の方法。
[53]以下の工程を含む、親抗体と比較して中性pHにおける既存のADAに対する結合活性を有意に増強することなく、単一の抗原結合分子が結合できる抗原の総数を増加させる方法:
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程a)の親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
[54]以下の工程を含む、親抗体と比較して中性pHにおける既存のADAに対する抗原結合分子の結合活性を有意に増強することなく、抗原と結合した状態で細胞内に取り込まれた抗原結合分子の、抗原と結合していない状態での細胞外への放出を促進する方法:
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436、およびEU428からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
[55]以下の工程を含む、親抗体と比較して中性pHにおける既存のADAに対する結合活性を有意に増強することなく、抗原結合分子の血漿中抗原消失能を増強する方法:
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436、およびEU428からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
[56]以下の工程を含む、親抗体と比較して中性pHにおける既存のADAに対する結合活性を有意に増強することなく、抗原結合分子の薬物動態を改善する方法:
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
[57]以下の工程を含む、親抗体と比較して中性pHにおける既存のADAに対する結合活性を有意に増強することなく、血漿中の総抗原濃度または遊離抗原濃度を低下させる方法:
a) 親FcRn結合ドメインを含む抗原結合分子であって、該抗原と結合し得る抗原結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
[58]以下の工程を含む、中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されており、かつ中性pHにおける既存のADAに対する結合活性が低下しているFcRn結合ドメインを含む抗原結合分子を製造する方法:
(a) pH中性域またはpH酸性域におけるFcRnに対する結合活性、およびpH中性域における既存のADAに対する結合活性が増強されているFcRn結合ドメインを提供する工程、
(b) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、アミノ酸を置換する工程、
(c) pH依存的抗原結合ドメインを得るために、抗原結合分子の抗原結合ドメインを選択して該抗原結合ドメイン中の少なくとも1つのアミノ酸を改変する工程、またはカルシウムイオン依存的抗原結合ドメインを選択する工程;
(d) (a)および(b)において調製されたヒトFcRn結合ドメインおよび抗原結合ドメインが連結された抗原結合分子をコードする遺伝子を得る工程、ならびに
(e) (c)において調製された遺伝子を用いて抗原結合分子を製造する工程であって、製造された該抗原結合分子が、インタクトなFcRn結合ドメインを有する親抗原結合ドメインと比較して、中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されており、かつ中性pHにおける内因性ADAに対する結合活性が低下している、工程。
[59]pH中性域またはpH酸性域におけるFcRnおよび既存のADAに対する結合活性ならびにpH中性域における既存のADAに対する結合活性が増強されている前記FcRn結合ドメインが、EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置にアミノ酸の置換を含む、[58]記載の方法。
[60]工程a)で導入されるアミノ酸置換が3つ以上の位置におけるものであり、該3つ以上の位置が、表4〜7に記載された組み合わせのうちの1つである、[53]〜[57]のいずれか一つに記載の方法。
[61]工程b)で導入されるアミノ酸置換が3つ以上の位置におけるものであり、該3つ以上の位置が、表10に記載された組み合わせのうちの1つである、[53]〜[60]のいずれか一つに記載の方法。
本発明の材料および方法を説明する前に、これらの説明が単に例示にすぎず、限定を意図するものではないことが理解されるべきである。本明細書に記載される特定のサイズ、形状、寸法、材料、方法論、プロトコール等は慣行的な実験法および/または最適化に従って変更可能であるため、本発明がこれらに限定されないこともまた理解されるべきである。説明で用いられる用語は、特定の型または態様を説明するためのものにすぎず、添付の特許請求の範囲によってのみ限定される本発明の範囲を限定することは意図されない。特記されない限り、本明細書で用いられる技術的および科学的用語はすべて、本発明が属する技術分野の当業者によって一般的に理解されている意味と同じ意味を有する。矛盾する場合には、定義を含めて本明細書が優先する。
具体的には、本発明は、EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置においてFcRn結合ドメイン中にアミノ酸置換を有する改変FcRn結合ドメインを有する抗原結合分子を提供する。本発明の抗原結合分子はまた、さらなる位置に置換を含み得る。例えば、抗原結合分子は、上記の1つまたは複数の位置における置換に加えて、EU256位に置換を含み得る。好ましくは、EU256位のアミノ酸はグルタミン酸と置換される。
より具体的には、FcRn結合ドメインにおけるアミノ酸の置換は、親FcRn結合ドメインのアミノ酸配列に関するアミノ酸の置き換えを意味する。望ましい置換を既に有する改変FcRn結合ドメインもまた、本発明のFcRn結合ドメインに含まれる。親FcRn結合ドメインは、EU238位にプロリン、EU250位にスレオニン、EU252位にメチオニン、EU254位にセリン、EU255位にアルギニン、EU256位にスレオニン、U258位にグルタミン酸、EU286位にアスパラギン、EU307位にスレオニン、EU308位にバリン、EU309位にロイシン、EU311位にグルタミン、EU315位にアスパラギン、EU387位にプロリン、EU422位にバリン、EU424位にセリン、EU426位にセリン、EU428位にメチオニン、EU433位にヒスチジン、EU434位にアスパラギン、EU436位にチロシン、EU438位にグルタミン、およびEU440位にセリンを有し、かつ中性pHにおけるFcRnに対するアフィニティーがないかまたは低い(3200 nMよりも弱い)FcRn結合ドメインである。親FcRn結合ドメインは、他の位置に置換を含んでもよいが、好ましくは親FcRn結合ドメインは改変されていない。好ましくは、親FcRn結合ドメインはFc領域(親Fc領域)である。好ましくは、親Fc領域は哺乳動物抗体に由来する;より好ましくは、親Fc領域はヒト抗体のFc領域である。ヒト抗体のFc領域は、本発明においてヒトFc領域と称される。
親Fc領域は好ましくはインタクトなFc領域であり、より好ましくはヒトのインタクトなFc領域である。好ましくは、親Fc領域はIgGのFc領域であり、より好ましくはヒトIgGのFc領域である。さらにより好ましくは、親Fc領域は、野生型ヒンジ、野生型CH2、および野生型CH3ドメインを含むヒトFc領域である。本発明において、親抗体という用語は、親Fc領域を含む抗体を意味する。
a) EU252位およびEU434位において、ならびに
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、
置換されたアミノ酸とは異なるアミノ酸によるアミノ酸置換を含む改変FcRn結合ドメインを有する。
置換の導入によりFcRn結合ドメインを操作することで、抗原結合分子の安定性が低下する場合がある(WO/2007/092772)。安定性に乏しいタンパク質は貯蔵中に容易に凝集する傾向があるため、薬物タンパク質の安定性は医薬品の製造にとって極めて重要である。そのため、Fc領域における置換によって起こる安定性の低下のために、安定な製剤の開発が困難になる(WO2007/092772)。
安定性を有意に失うことなく;
高分子量種の割合を上昇させることなく、かつ
免疫原性のリスク(抗医薬品抗体形成のリスク)を高めることなく、
pH 7.4におけるFcRn結合アフィニティーを改善することである。
したがって、本発明はまた、EU252位、EU434位、EU307位、およびEU311位においてFcRn結合ドメイン中にアミノ酸置換を含み、pH 7におけるFcRnに対する結合活性が15 nM超であり、融解温度Tmが57.5℃以上であり、HMWが2%未満であり、かつ免疫原性が低い(Epibase(Lonza)により決定したスコア500未満に相当する)抗原結合分子を提供する。
好ましくは、抗原結合分子は4つ以上の位置においてFcRn結合ドメイン中にアミノ酸置換を含み、該4つ以上の位置は、
a) EU252/EU434/EU307/EU311/EU436、ならびに
b) EU286、EU308、およびEU428からなる群より選択される1つまたは複数の位置と組み合わせたEU252/ EU434/EU307/EU311/EU436
からなる組み合わせ群のうちの1つである。
a) EU252位にチロシン、EU286位にグルタミン酸、EU307位にグルタミン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
b) EU250位にバリン、EU252位にチロシン、EU307位にグルタミン、EU308位にプロリン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
c) EU250位にバリン、EU252位にチロシン、EU286位にグルタミン酸、EU307位にグルタミン、EU308位にプロリン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン;または
d) EU250位にバリン、EU252位にチロシン、EU286位にグルタミン酸、EU307位にグルタミン、EU308位にプロリン、EU311位にアラニン、EU434位にチロシン、およびEU436位にバリン
を含む。
本発明はまた、3つ以上の位置においてFcRn結合ドメイン中にアミノ酸置換を含む抗原結合分子を提供し、該3つ以上の位置は、a) EU252/EU434/EU307/EU311;およびb) EU252/EU434/EU308からなる組み合わせ群のうちの1つであり;中性pHにおける該抗原結合分子のFcRn結合活性は15〜50 nMであり、Tmは60℃よりも高く、HMWは2%未満であり、かつ抗原結合分子の免疫原性は低く、Epibase(Lonza)により決定したスコアが500未満に相当する。
a) EU252位のチロシン、EU286位のグルタミン酸、EU307位のグルタミン、EU311位のアラニン、およびEU434位のチロシン;
b) EU252位のチロシン、EU254位のスレオニン、EU286位のグルタミン酸、EU307位のグルタミン、EU311位のアラニン、およびEU434位のチロシン;
c) EU252位のチロシン、EU307位のグルタミン、EU311位のアラニン、EU434位のチロシン、および436位のイソロイシン;
d) EU252位のチロシン、EU254位のスレオニン、EU286位のグルタミン酸、EU307位のグルタミン、EU311位のアラニン、EU434位のチロシン、およびEU436位のイソロイシン;
e) EU250位のバリン、EU252位のチロシン、EU254位のスレオニン、EU308位のプロリン、EU434位のチロシン、およびEU436位のバリン;
f) EU250位のバリン、EU252位のチロシン、EU307位のグルタミン、EU311位のアラニン、EU434位のチロシン、およびEU436位のバリン;
g) EU252位のチロシン、EU307位のグルタミン、EU311位のアラニン、EU434位のチロシン、およびEU436位のバリン;
h) EU250位のバリン、EU252位のチロシン、EU308位のプロリン、およびEU434位のチロシン;ならびに
i) EU250位のバリン、EU252位のチロシン、EU307位のグルタミン、EU308位のプロリン、EU311位のアラニン、およびEU434位のチロシン
からなる組み合わせ群のうちの1つである。
本発明はまた、
a) EU252位/EU434位において;ならびに
b) EU436位および/またはEU254位および/またはEU315位において
FcRn結合ドメイン中にアミノ酸置換を含み、
かつpH 7におけるFcRn結合活性が50〜150 nMであり、Tmが63℃よりも高く、HMWが2%未満であり、かつEpibase(Lonza)により決定したスコアが250未満と定義される非常に低い免疫原性を有する抗原結合分子を提供する。
a) EU252位のチロシン、EU315位のアスパラギン酸、およびEU434位のチロシン;
b) EU252位のチロシン、EU434位のチロシン、およびEU436位のイソロイシン;
c) EU252位のチロシン、EU434位のチロシン、およびEU436位のロイシン;
d) EU252位のチロシン、EU434位のチロシン、およびEU436位のバリン;ならびに
e) EU252位のチロシン、EU254位のスレオニン、EU434位のチロシン、およびEU436位のイソロイシン
からなる組み合わせ群のうちの1つである。
本発明はさらに、3つ以上の位置においてFcRn結合ドメイン中にアミノ酸置換を含む抗原結合分子を提供し、該3つ以上の位置は、表7に記載された組み合わせのうちの1つである。該改変抗原結合分子は、pH 7におけるFcRnに対する結合活性が150〜700 nMであり、Tmが66.5℃よりも高く、HMWが2%未満であり、かつEpibase(Lonza)により決定したスコアが250未満と定義される非常に低い免疫原性を有する。
a) EU307位のグルタミン、EU311位のヒスチジン、およびEU434位のチロシン;
b) EU307位のグルタミン、EU309位のグルタミン酸、EU311位のアラニン、EU434位のチロシン;
c) EU307位のグルタミン、EU309位のグルタミン酸、EU311位のヒスチジン、EU434位のチロシン;または
d) EU250位のバリン、EU252位のチロシン、EU434位のチロシン、EU436位のバリン
からなる組み合わせ群のうちの1つである。
抗体におけるアミノ酸の置換は、例えば治療用抗体の免疫原性の上昇といった負の結果をもたらし得、次いでサイトカインストームおよび/または抗医薬品抗体(ADA)の産生を引き起こし得る。ADAは治療用抗体の効果および薬物動態に影響を及ぼし、時に重篤な副作用をもたらすことがあるため、臨床における治療用抗体の有用性と薬効は制限され得る。多くの要因が治療用抗体の免疫原性に影響を及ぼし、エフェクターT細胞エピトープの存在がその要因の1つである。同様に、治療用抗体に対する既存の抗体の存在もまた問題があると考えられる。そのような既存の抗体の例は、リウマトイド因子(RF)、抗体(すなわち、IgG)のFc部分に対する自己抗体(自己のタンパク質に対する抗体)である。リウマトイド因子は特に、全身性エリテマトーデス(SLE)患者または関節リウマチ患者において見られる。関節炎患者では、RFとIgGが連結して免疫複合体を形成し、これが疾患過程に寄与する。最近、Asn434His変異を有するヒト化抗CD4 IgG1抗体が顕著なリウマトイド因子結合を誘発することが報告された(Clin Pharmacol Ther. 2011 Feb;89(2):283-90(非特許文献9))。詳細な研究により、ヒトIgG1におけるAsn434His変異が、親ヒトIgG1と比較して、抗体のFc領域に対するリウマトイド因子の結合を増強することが確認された。
a) EU252位およびEU434位;ならびに
b) EU238、EU250、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、およびEU436からなる群より選択される1つまたは複数の位置
においてFc領域中にアミノ酸置換を含む、pH中性域におけるFcRnに対するアフィニティーが増強され、かつ中性pHにおける既存のADAに対するアフィニティーが増強されたFc領域を含む抗原結合分子である。
より好ましくは、pH中性域におけるFcRnに対するアフィニティーが増強され、かつpH中性域における既存のADAに対するアフィニティーが増強されたFc領域を含む抗原結合分子は、表9に記載された組み合わせのうちの1つを含む。
i) EU434位に、または
ii) a) EU252/EU254/EU256;b) EU428/EU434;およびc) EU250/EU428からなる組み合わせ群のうちの1つである、2つ以上の位置に
置換を含む、pH酸性域におけるFcRnに対するアフィニティーが増強され、かつpH中性域における既存のADAに対するアフィニティーが増強されたFc領域を含む抗原結合分子である。
i) 置換M434H;または
ii) a) M252Y/S254T/T256E;b) M428L/N434S;およびc) T250Q/M428L(EUナンバリング)からなる組み合わせ群のうちの1つ
を含む。
好ましくは、以下の置換または組み合わせ a) M252Y/S254T/T256E、b) M428L/N434S、またはc) T250QおよびM428L、またはd) M434H(EUナンバリング)のうちの1つを含むFc領域を含む抗原結合分子は、酸性pHにおけるFcRnに対する結合活性が増強されているが、pH中性域における結合活性は増強されていない。
より好ましくは、当該置換は、a) EU424NおよびEU438R/EU440Eの中から選択される。
EU248、EU249、EU250、EU251、EU252、EU253、EU254、EU255、EU256、EU257、EU305、EU306、EU307、EU308、EU309、EU310、EU311、EU312、EU313、EU314、EU342、EU343、EU344、EU345、EU346、EU347、EU348、EU349、EU350、EU351、EU352、EU380、EU381、EU382、EU383、EU384、EU385、EU386、EU388、EU414、EU415、EU416、EU417、EU418、EU419、EU420、EU421、EU423、EU425、EU427、EU428、EU429、EU430、EU431、EU432、EU433、EU434、EU435、EU436、EU437、EU441、EU442、EU443、およびEU444
のうちの1つまたは複数においてアミノ酸の置換をさらに含み得る。
EU248、EU249、EU250、EU251、EU252、EU253、EU254、EU255、EU256、EU257、EU305、EU306、EU307、EU308、EU309、EU310、EU311、EU312、EU313、EU314、EU342、EU343、EU344、EU345、EU346、EU347、EU348、EU349、EU350、EU351、EU352、EU380、EU381、EU382、EU383、EU384、EU385、EU386、EU388、EU414、EU415、EU416、EU417、EU418、EU419、EU420、EU421、EU423、EU425、EU427、EU428、EU429、EU430、EU431、EU432、EU433、EU434、EU435、EU436、EU437、EU441、EU442、EU443、およびEU444
のうちの1つまたは複数において、上記の抗原結合分子のFc領域を置換する工程をさらに含み得る。
Fcγ受容体または補体タンパク質への結合もまた、望ましくない影響(例えば、不適切な血小板活性化)を引き起こし得る。FcγRIIa受容体などのエフェクター受容体に結合しない改変抗原結合分子は、より安全であり、かつ/またはより有効である。したがって、好ましい態様において、本発明の改変抗原結合分子はさらに、エフェクター受容体に対する結合活性が弱いかまたはエフェクター受容体に結合しない。エフェクター受容体の例には、活性化Fcγ受容体、特にFcγ受容体I、Fcγ受容体II、およびFcγ受容体IIIが含まれるが、これらに限定されない。Fcγ受容体Iには、Fcγ受容体Ia、Fcγ受容体Ib、およびFcγ受容体Ic、ならびにこれらのサブタイプが含まれる。Fcγ受容体IIには、Fcγ受容体IIa(2つのアロタイプR131およびH131を有する)およびFcγ受容体IIbが含まれる。Fcγ受容体IIIには、Fcγ受容体IIIa(2つのアロタイプ:V158およびF158を有する)およびFcγ受容体IIIb(2つのアロタイプ:FcγIIIb-NA1およびFcγIIIb-NA2を有する)が含まれる。エフェクター受容体に対する結合活性が弱いかまたはそれらに結合しない抗体は、例えば、サイレントFc領域を含む抗体、またはFc領域を含まない抗体(例えば、Fab、F(ab)'2、scFv、sc(Fv)2、ダイアボディ)である。
EU234位のアミノ酸は、好ましくは、Ala、Arg、Asn、Asp、Gln、Glu、Gly、His、Lys、Met、Phe、Pro、Ser、およびThrからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU235位のアミノ酸は、好ましくは、Ala、Asn、Asp、Gln、Glu、Gly、His、Ile、Lys、Met、Pro、Ser、Thr、Val、およびArgからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU236位のアミノ酸は、好ましくは、Arg、Asn、Gln、His、Leu、Lys、Met、Phe、Pro、およびTyrからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU237位のアミノ酸は、好ましくは、Ala、Asn、Asp、Gln、Glu、His、Ile、Leu、Lys、Met、Pro、Ser、Thr、Val、Tyr、およびArgからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU238位のアミノ酸は、好ましくは、Ala、Asn、Gln、Glu、Gly、His、Ile、Lys、Thr、Trp、およびArgからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU239位のアミノ酸は、好ましくは、Gln、His、Lys、Phe、Pro、Trp、Tyr、およびArgからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU265位のアミノ酸は、好ましくは、Ala、Arg、Asn、Gln、Gly、His、Ile、Leu、Lys、Met、Phe、Ser、Thr、Trp、Tyr、およびValからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU266位のアミノ酸は、好ましくは、Ala、Arg、Asn、Asp、Gln、Glu、Gly、His、Lys、Phe、Pro、Ser、Thr、Trp、およびTyrからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU267位のアミノ酸は、好ましくは、Arg、His、Lys、Phe、Pro、Trp、およびTyrからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU269位のアミノ酸は、好ましくは、Ala、Arg、Asn、Gln、Gly、His、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr、およびValからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU270位のアミノ酸は、好ましくは、Ala、Arg、Asn、Gln、Gly、His、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr、およびValからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU271位のアミノ酸は、好ましくは、Arg、His、Phe、Ser、Thr、Trp、およびTyrからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU295位のアミノ酸は、好ましくは、Arg、Asn、Asp、Gly、His、Phe、Ser、Trp、およびTyrからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU296位のアミノ酸は、好ましくは、Arg、Gly、Lys、およびProからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU297位のアミノ酸は、好ましくはAlaと置き換えられる。
EU298位のアミノ酸は、好ましくは、Arg、Gly、Lys、Pro、Trp、およびTyrからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU300位のアミノ酸は、好ましくは、Arg、Lys、およびProからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU324位のアミノ酸は、好ましくはLysまたはProと置き換えられる。
EU325位のアミノ酸は、好ましくは、Ala、Arg、Gly、His、Ile、Lys、Phe、Pro、Thr、Trp、Tyr、およびValからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU327位のアミノ酸は、好ましくは、Arg、Gln、His、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr、およびValからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU328位のアミノ酸は、好ましくは、Arg、Asn、Gly、His、Lys、およびProからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU329位のアミノ酸は、好ましくは、Asn、Asp、Gln、Glu、Gly、His、Ile、Leu、Lys、Met、Phe、Ser、Thr、Trp、Tyr、Val、およびArgからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU330位のアミノ酸は、好ましくはProまたはSerと置き換えられる。
EU331位のアミノ酸は、好ましくは、Arg、Gly、およびLysからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
EU332位のアミノ酸は、好ましくは、Arg、Lys、およびProからなる群より選択されるアミノ酸のうちの1つと置き換えられる。
好ましくは、サイレントFc領域は、EU235位におけるLysもしくはArgとの置換、EU237位におけるLysもしくはArgとの置換、EU238位におけるLysもしくはArgとの置換、EU239位におけるLysもしくはArgとの置換、EU270位におけるPheとの置換、EU298位におけるGlyとの置換、EU325位におけるGlyとの置換、またはEU329位におけるLysもしくはArgとの置換を含む。より好ましくは、サイレントFc領域は、EU235位におけるアルギニンとの置換およびEU239位におけるリジンとの置換を含む。より好ましくは、サイレントFc領域は置換L235R/S239Kを含む。
a) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置、ならびに
b) EU234、EU235、EU236、EU237、EU238、EU239、EU265、EU266、EU267、EU269、EU270、EU271、EU295、EU296、EU297、EU298、EU300、EU324、EU325、EU327、EU328、EU329、EU331、およびEU332(EUナンバリングシステムによる)からなる群より選択される1つまたは複数の位置
において、FcRn結合ドメイン中に置換を含む。より好ましくは、エフェクター受容体および/または補体タンパク質に対する結合活性が低下した、または結合活性をもたない本発明の改変抗原結合分子は、EU235位におけるLysまたはArgとの置換、EU237位におけるLysまたはArgとの置換、EU238位におけるLysまたはArgとの置換、EU239位におけるLysまたはArgとの置換、EU270位におけるPheとの置換、EU298位におけるGlyとの置換、EU325位におけるGlyとの置換、およびEU329位におけるLysまたはArgとの置換からなる群より選択される、Fc領域における1つまたは複数の置換を含む。さらにより好ましくは、当該抗原結合分子は、Fc領域において、EU235位におけるArgとの置換、およびEU239位におけるLysとの置換を含む。さらにより好ましくは、当該抗原結合分子はFc領域において置換の組み合わせL235R/S239Kを含む。
さらに、本発明の抗原結合分子は、上記の改変に加えて、FcRn結合ドメインのEU257位に、アラニン、バリン、イソロイシン、ロイシン、およびスレオニンからなる群より選択されるアミノ酸を含まず、
かつ/またはFcRn結合ドメインのEU252位にトリプトファンを含まない。言い換えると、本発明の好ましい抗原結合分子は、上記の改変のいずれかに加えて、EU257位にアラニン、バリン、イソロイシン、ロイシン、スレオニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グルタミン、グリシン、ヒスチジン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、トリプトファン、またはチロシンを含み、かつEU252位にアルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グルタミン、グリシン、ヒスチジン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、またはチロシンを含む。
本発明の抗原結合分子は、対象とする抗原への特異的な結合活性を有する抗原結合ドメインおよび本発明のFcRn結合ドメインを含んでいれば、特に限定されない。抗原結合ドメインの好ましい例として、抗体の抗原結合領域を有しているドメインを挙げることができる。抗体の抗原結合領域の例として、CDRを挙げることができる。抗体の抗原結合領域は、全長抗体に含まれる6つのCDR全てを含んでいてもよいし、1つ若しくは2つ以上のCDRを含んでいてもよい。抗体の抗原結合領域は、アミノ酸の欠失、置換、付加及び/又は挿入を含み、又、CDRの一部分を含んでもよい。
pH酸性域におけるFcRn結合活性が増強されており、かつ、抗原結合活性がpH中性域よりもpH酸性域において低いか、または抗原結合活性が高カルシウム濃度よりも低カルシウム濃度において低い、本発明の抗原結合分子もまた好ましい。好ましくは、pH中性域における既存のADAに対するこのような抗原結合分子の結合活性は有意に増強されていない。このような抗原結合分子の具体例には、生体内の早期エンドソーム内のpHであると推定されるpH 5.8〜6.0においてヒトFcRnに対する結合活性がIgGよりも高く、抗原結合活性がpH 7.4よりもpH 5.8において低いものが含まれる。抗原結合活性がpH 7.4よりもpH 5.8において低い抗原結合分子はまた、抗原結合活性がpH 7.4よりもpH 5.8において弱い抗原結合分子と称され得る。好ましくは、pH酸性域におけるFcRnに対する結合活性が増強された抗原結合分子は、pH中性域におけるFcRn結合活性がインタクトなヒトIgGよりも強い。
好ましくは、抗原結合分子の抗原結合ドメインは、酸性pHまたは低カルシウムイオン濃度において抗原に対するアフィニティーが低下する。より好ましくは、抗原結合ドメインは、本明細書に記載されたpH依存的抗原結合ドメインまたはイオン化カルシウム濃度依存的抗原結合ドメインである。
さらに、本発明の抗原結合分子は、好ましくは、pH酸性域における抗原結合活性がpH中性域における抗原結合活性よりも低いpH依存的抗原結合ドメインを含む。該抗原結合分子は、好ましくは、抗原結合活性がpH中性域よりもpH酸性域において低い。抗原結合活性がpH中性域よりもpH酸性域において低い限り、結合活性の比は限定されない。好ましい態様において、本発明の抗原結合分子には、pH 7.4における抗原結合活性がpH 5.8における抗原結合活性よりも2倍以上、好ましくは10倍以上高い抗原結合分子が含まれる。さらにより好ましい態様において、本発明の抗原結合分子には、pH 7.4における抗原結合活性がpH 5.8における抗原結合活性よりも40倍以上高い抗原結合分子が含まれる。
重鎖:H27、H31、H32、H33、H35、H50、H58、H59、H61、H62、H63、H64、H65、H99、H100b、およびH102
軽鎖:L24、L27、L28、L32、L53、L54、L56、L90、L92、およびL94
これらの改変箇所のうち、H32、H61、L53、L90、およびL94は普遍性の高い改変箇所と考えられる。アミノ酸位置はKabatナンバリング(Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991))で示している。Kabatナンバリングシステムは一般的に、可変ドメインの残基(およそ、軽鎖の1番目〜107番目の残基および重鎖の1番目〜113番目の残基)について言及する場合に用いられる(例えば、Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991))。複数の箇所を組み合わせてヒスチジン又は非天然アミノ酸に置換する場合の好ましい組み合わせの具体例としては、例えば、H27、H31、およびH35の組み合わせ、H27、H31、H32、H35、H58、H62、およびH102の組み合わせ、L32およびL53の組み合わせ、L28、L32、およびL53の組み合わせ等を挙げることができる。さらに、重鎖と軽鎖の置換箇所の好ましい組み合わせの例としては、H27、H31、L32、およびL53の組み合わせを挙げることができる。
重鎖:H27、H31、H32、H35、H50、H58、H61、H62、H63、H64、H65、H100b、およびH102
軽鎖:L24、L27、L28、L32、L53、L56、L90、L92、およびL94
複数の箇所を組み合わせてヒスチジン又は非天然アミノ酸に置換する場合の好ましい組み合わせの具体例としては、例えば、H27、H31、およびH35の組み合わせ、H27、H31、H32、H35、H58、H62、およびH102の組み合わせ、L32およびL53の組み合わせ、L28、L32、およびL53の組み合わせ等を挙げることができる。さらに、重鎖と軽鎖の置換箇所の好ましい組み合わせの例としては、H27、H31、L32、およびL53の組み合わせを挙げることができる。
別の好ましい態様において、本発明の抗原結合分子はカルシウムイオン依存的抗原結合ドメインを含む。このような抗原結合分子の抗原結合活性はカルシウム濃度に依存し、低カルシウム濃度における抗原結合活性は、高カルシウム濃度における抗原結合活性よりも低い。
(i) 細胞内への抗原の取り込みを促進する機能;
(ii) 抗原に2回以上結合する機能;
(iii) 血漿中抗原濃度の低下を促進する機能;および
(iv) 優れた血漿中滞留性の機能。
(a) 低カルシウム濃度条件下における抗原結合分子の抗原結合活性を決定する工程;
(b) 高カルシウム濃度条件下における抗原結合分子の抗原結合活性を決定する工程;および
(c) 低カルシウム濃度条件下における抗原結合活性が高カルシウム濃度条件下における抗原結合活性よりも低い抗原結合分子を選択する工程。
(a) 低カルシウム濃度条件下における抗原結合分子の抗原結合活性を決定する工程;
(b) 高カルシウム濃度条件下における抗原結合分子の抗原結合活性を決定する工程;および
(c) 低カルシウム濃度条件下における抗原結合活性が高カルシウム濃度条件下における抗原結合活性よりも低い抗原結合分子を選択する工程。
(a) 高カルシウム濃度条件下で抗原を抗原結合分子または抗原結合分子のライブラリーと接触させる工程;
(b) 工程(a)で抗原に結合した抗原結合分子を得る工程;
(c) 工程(b)で得られた抗原結合分子を低カルシウム濃度条件下に置く工程;
(d) 工程(c)における抗原結合活性が工程(b)の選択に関する活性よりも低い抗原結合分子を得る工程;
(e) 工程(d)で得られた抗原結合分子をコードする遺伝子を得る工程;および
(f) 工程(e)で得られた遺伝子を用いて抗原結合分子を製造する工程。
工程(a)〜(e)は2回以上繰り返してもよい。したがって、本発明は、上記の方法において、工程(a)〜(e)を2回以上繰り返す工程をさらに含む方法を提供する。工程(a)〜(e)の反復回数は特に限定されないが、典型的には10回以下である。
このようなカルシウムイオン依存的抗原結合分子またはカルシウムイオン依存的抗原結合ドメインをスクリーニングするさらなる方法は、PCT出願第PCT/JP2011/077619号に記載されている。
本発明の抗体等の本発明の抗原結合分子が認識する抗原は特に限定されず、そのような本発明の抗原結合分子は、いかなる抗原を認識するものであってもよい。本発明の抗原結合分子が認識する抗原の具体的な例としては、17-IA、4-1 BB、4Dc、6-ケト-PGF1a、8-イソ-PGF2a、8-オキソ-dG、A1アデノシン受容体、A33、ACE、ACE-2、アクチビン、アクチビンA、アクチビンAB、アクチビンB、アクチビンC、アクチビンRIA、アクチビンRIA ALK-2、アクチビンRIB ALK-4、アクチビンRIIA、アクチビンRIIB、ADAM、ADAM10、ADAM12、ADAM15、ADAM17/TACE、ADAM8、ADAM9、ADAMTS、ADAMTS4、ADAMTS5、アドレシン(Addressins)、アディポネクチン、ADPリボシルシクラーゼ-1、aFGF、AGE、ALCAM、ALK、ALK-1、ALK-7、アレルゲン、α1-アンチキモトリプシン、α1-アンチトリプシン、α-シヌクレイン、α-V/β-1アンタゴニスト、アミニン(aminin)、アミリン、アミロイドβ、アミロイド免疫グロブリン重鎖可変領域、アミロイド免疫グロブリン軽鎖可変領域、アンドロゲン、ANG、アンジオテンシノーゲン、アンジオポエチンリガンド-2、抗Id、アンチトロンビンIII、炭疽、APAF-1、APE、APJ、アポA1、アポ血清アミロイドA、アポ-SAA、APP、APRIL、AR、ARC、ART、アルテミン(Artemin)、ASPARTIC、心房性ナトリウム利尿因子、心房性ナトリウム利尿ペプチド、心房性ナトリウム利尿ペプチドA、心房性ナトリウム利尿ペプチドB、心房性ナトリウム利尿ペプチドC、av/b3インテグリン、Axl、B7-1、B7-2、B7-H、BACE、BACE-1、バチルス・アントラシス(Bacillus anthracis)防御抗原、Bad、BAFF、BAFF-R、Bag-1、BAK、Bax、BCA-1、BCAM、Bcl、BCMA、BDNF、b-ECGF、β-2-ミクログロブリン、βラクタマーゼ、bFGF、BID、Bik、BIM、BLC、BL-CAM、BLK、Bリンパ球刺激因子(BIyS)、BMP、BMP-2 (BMP-2a)、BMP-3 (オステオゲニン(Osteogenin))、BMP-4 (BMP-2b)、BMP-5、BMP-6 (Vgr-1)、BMP-7 (OP-1)、BMP-8 (BMP-8a)、BMPR、BMPR-IA (ALK-3)、BMPR-IB (ALK-6)、BMPR-II (BRK-3)、BMP、BOK、ボンベシン、骨由来神経栄養因子(Bone-derived neurotrophic factor)、ウシ成長ホルモン、BPDE、BPDE-DNA、BRK-2、BTC、Bリンパ球細胞接着分子、C10、C1阻害因子、C1q、C3、C3a、C4、C5、C5a(補体5a)、CA125、CAD-8、カドヘリン-3、カルシトニン、cAMP、炭酸脱水酵素-IX、癌胎児抗原(CEA)、癌関連抗原(carcinoma-associated antigen)、カルジオトロフィン-1、カテプシンA、カテプシンB、カテプシンC/DPPI、カテプシンD、カテプシンE、カテプシンH、カテプシンL、カテプシンO、カテプシンS、カテプシンV、カテプシンX/Z/P、CBL、CCI、CCK2、CCL、CCL1/I-309、CCL11/エオタキシン、CCL12/MCP-5、CCL13/MCP-4、CCL14/HCC-1、CCL15/HCC-2、CCL16/HCC-4、CCL17/TARC、CCL18/PARC、CCL19/ELC、CCL2/MCP-1、CCL20/MIP-3-α、CCL21/SLC、CCL22/MDC、CCL23/MPIF-1、CCL24/エオタキシン-2、CCL25/TECK、CCL26/エオタキシン-3、CCL27/CTACK、CCL28/MEC、CCL3/M1P-1-α、CCL3Ll/LD-78-β、CCL4/MIP-l-β、CCL5/RANTES、CCL6/C10、CCL7/MCP-3、CCL8/MCP-2、CCL9/10/MTP-1-γ、CCR、CCR1、CCR10、CCR2、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CD1、CD10、CD105、CD11a、CD11b、CD11c、CD123、CD13、CD137、CD138、CD14、CD140a、CD146、CD147、CD148、CD15、CD152、CD16、CD164、CD18、CD19、CD2、CD20、CD21、CD22、CD23、CD25、CD26、CD27L、CD28、CD29、CD3、CD30、CD30L、CD32、CD33 (p67タンパク質)、CD34、CD37、CD38、CD3E、CD4、CD40、CD40L、CD44、CD45、CD46、CD49a、CD49b、CD5、CD51、CD52、CD54、CD55、CD56、CD6、CD61、CD64、CD66e、CD7、CD70、CD74、CD8、CD80 (B7-1)、CD89、CD95、CD105、CD158a、CEA、CEACAM5、CFTR、cGMP、CGRP受容体、CINC、CKb8-1、クローディン18、CLC、クロストリジウム・ボツリヌム(Clostridium botulinum)毒素、クロストリジウム・ディフィシレ(Clostridium difficile)毒素、クロストリジウム・パーフリンジェンス(Clostridium perfringens)毒素、c-Met、CMV、CMV UL、CNTF、CNTN-1、補体因子3 (C3)、補体因子D、コルチコステロイド結合グロブリン、コロニー刺激因子-1受容体、COX、C-Ret、CRG-2、CRTH2、CT-1、CTACK、CTGF、CTLA-4、CX3CL1/フラクタルカイン、CX3CR1、CXCL、CXCL1/Gro-α、CXCL10、CXCL11/I-TAC、CXCL12/SDF-l-α/β、CXCL13/BCA-1、CXCL14/BRAK、CXCL15/ラングカイン(Lungkine)、CXCL16、CXCL16、CXCL2/Gro-β CXCL3/Gro-γ、CXCL3、CXCL4/PF4、CXCL5/ENA-78、CXCL6/GCP-2、CXCL7/NAP-2、CXCL8/IL-8、CXCL9/Mig、CXCLlO/IP-10、CXCR、CXCR1、CXCR2、CXCR3、CXCR4、CXCR5、CXCR6、シスタチンC、サイトケラチン腫瘍関連抗原、DAN、DCC、DcR3、DC-SIGN、崩壊促進因子、デルタ様タンパク質(Delta-like protein)リガンド4、des(1-3)-IGF-1 (脳IGF-1)、Dhh、DHICAオキシダーゼ、Dickkopf-1、ジゴキシン、ジペプチジルペプチダーゼIV、DK1、DNAM-1、Dnase、Dpp、DPPIV/CD26、Dtk、ECAD、EDA、EDA-A1、EDA-A2、EDAR、EGF、EGFR (ErbB-1)、EGF様ドメイン含有タンパク質7(EGF like domain containing protein 7)、エラスターゼ、エラスチン、EMA、EMMPRIN、ENA、ENA-78、エンドシアリン(Endosialin)、エンドセリン受容体、エンドトキシン、エンケファリナーゼ、eNOS、Eot、エオタキシン、エオタキシン-2、エオタキシニ(eotaxini)、EpCAM、エフリンB2/EphB4、Epha2チロシンキナーゼ受容体、上皮増殖因子受容体 (EGFR)、ErbB2受容体、ErbB3チロシンキナーゼ受容体、ERCC、エリスロポエチン(EPO)、エリスロポエチン受容体、E-セレクチン、ET-1、エクソダス(Exodus)-2、RSVのFタンパク質、F10、F11、F12、F13、F5、F9、第Ia因子、第IX因子、第Xa因子、第VII因子、第VIII因子、第VIIIc因子、Fas、FcαR、FcイプシロンRI、FcγIIb、FcγRI、FcγRIIa、FcγRIIIa、FcγRIIIb、FcRn、FEN-1、フェリチン、FGF、FGF-19、FGF-2、FGF-2受容体、FGF-3、FGF-8、酸性FGF(FGF-acidic)、塩基性FGF(FGF-basic)、FGFR、FGFR-3、フィブリン、線維芽細胞活性化タンパク質(FAP)、線維芽細胞増殖因子、線維芽細胞増殖因子-10、フィブロネクチン、FL、FLIP、Flt-3、FLT3リガンド、葉酸受容体、卵胞刺激ホルモン(FSH)、フラクタルカイン(CX3C)、遊離型重鎖、遊離型軽鎖、FZD1、FZD10、FZD2、FZD3、FZD4、FZD5、FZD6、FZD7、FZD8、FZD9、G250、Gas 6、GCP-2、GCSF、G-CSF、G-CSF受容体、GD2、GD3、GDF、GDF-1、GDF-15 (MIC-1)、GDF-3 (Vgr-2)、GDF-5 (BMP-14/CDMP-1)、GDF-6 (BMP-13/CDMP-2)、GDF-7 (BMP-12/CDMP-3)、GDF-8 (ミオスタチン)、GDF-9、GDNF、ゲルゾリン、GFAP、GF-CSF、GFR-α1、GFR-α2、GFR-α3、GF-β1、gH外被糖タンパク質、GITR、グルカゴン、グルカゴン受容体、グルカゴン様ペプチド1受容体、Glut 4、グルタミン酸カルボキシペプチダーゼII、糖タンパク質ホルモン受容体、糖タンパク質IIb/IIIa (GP IIb/IIIa)、グリピカン-3、GM-CSF、GM-CSF受容体、gp130、gp140、gp72、顆粒球-CSF (G-CSF)、GRO/MGSA、成長ホルモン放出因子、GRO-β、GRO-γ、ピロリ菌(H. pylori)、ハプテン(NP-capまたはNIP-cap)、HB-EGF、HCC、HCC 1、HCMV gB外被糖タンパク質、HCMV UL、造血増殖因子(Hemopoietic growth factor) (HGF)、Hep B gp120、ヘパラナーゼ、ヘパリン補因子II、肝細胞増殖因子(hepatic growth factor)、バチルス・アントラシス防御抗原、C型肝炎ウイルスE2糖タンパク質、E型肝炎、ヘプシジン、Her1、Her2/neu (ErbB-2)、Her3 (ErbB-3)、Her4 (ErbB-4)、単純ヘルペスウイルス(HSV) gB糖タンパク質、HGF、HGFA、高分子量メラノーマ関連抗原(High molecular weight melanoma-associated antigen) (HMW-MAA)、GP120等のHIV外被タンパク質、HIV MIB gp 120 V3ループ、HLA、HLA-DR、HM1.24、HMFG PEM、HMGB-1、HRG、Hrk、HSP47、Hsp90、HSV gD糖タンパク質、ヒト心筋ミオシン、ヒトサイトメガロウイルス(HCMV)、ヒト成長ホルモン(hGH)、ヒト血清アルブミン、ヒト組織型プラスミノーゲン活性化因子(t-PA)、ハンチンチン、HVEM、IAP、ICAM、ICAM-1、ICAM-3、ICE、ICOS、IFN-α、IFN-β、IFN-γ、IgA、IgA受容体、IgE、IGF、IGF結合タンパク質、IGF-1、IGF-1 R、IGF-2、IGFBP、IGFR、IL、IL-1、IL-10、IL-10受容体、IL-11、IL-11受容体、IL-12、IL-12受容体、IL-13、IL-13受容体、IL-15、IL-15受容体、IL-16、IL-16受容体、IL-17、IL-17受容体、IL-18 (IGIF)、IL-18受容体、IL-1α、IL-1β、IL-1受容体、IL-2、IL-2受容体、IL-20、IL-20受容体、IL-21、IL-21受容体、IL-23、IL-23受容体、IL-2受容体、IL-3、IL-3受容体、IL-31、IL-31受容体、IL-3受容体、IL-4、IL-4受容体、IL-5、IL-5受容体、IL-6、IL-6受容体、IL-7、IL-7受容体、IL-8、IL-8受容体、IL-9、IL-9受容体、免疫グロブリン免疫複合体、免疫グロブリン、INF-α、INF-α受容体、INF-β、INF-β受容体、INF-γ、INF-γ受容体、I型IFN、I型IFN受容体、インフルエンザ、インヒビン、インヒビンα、インヒビンβ、iNOS、インスリン、インスリンA鎖、インスリンB鎖、インスリン様増殖因子1、インスリン様増殖因子2、インスリン様増殖因子結合タンパク質、インテグリン、インテグリンα2、インテグリンα3、インテグリンα4、インテグリンα4/β1、インテグリンα-V/β-3、インテグリンα-V/β-6、インテグリンα4/β7、インテグリンα5/β1、インテグリンα5/β3、インテグリンα5/β6、インテグリンα-δ (αV)、インテグリンα-θ、インテグリンβ1、インテグリンβ2、インテグリンβ3(GPIIb-IIIa)、IP-10、I-TAC、JE、カリクレイン、カリクレイン11、カリクレイン12、カリクレイン14、カリクレイン15、カリクレイン2、カリクレイン5、カリクレイン6、カリクレインL1、カリクレインL2、カリクレインL3、カリクレインL4、カリスタチン、KC、KDR、ケラチノサイト増殖因子(KGF)、ケラチノサイト増殖因子-2 (KGF-2)、KGF、キラー免疫グロブリン様受容体、kitリガンド (KL)、Kitチロシンキナーゼ、ラミニン5、LAMP、LAPP (アミリン、膵島アミロイドポリペプチド)、LAP (TGF-1)、潜伏期関連ペプチド、潜在型TGF-1、潜在型TGF-1 bp1、LBP、LDGF、LDL、LDL受容体、LECT2、レフティー、レプチン、黄体形成ホルモン(leutinizing hormone)(LH)、Lewis-Y抗原、Lewis-Y関連抗原、LFA-1、LFA-3、LFA-3受容体、Lfo、LIF、LIGHT、リポタンパク質、LIX、LKN、Lptn、L-セレクチン、LT-a、LT-b、LTB4、LTBP-1、肺サーファクタント、黄体形成ホルモン、リンホタクチン、リンホトキシンβ受容体、リゾスフィンゴ脂質受容体、Mac-1、マクロファージ-CSF (M-CSF)、MAdCAM、MAG、MAP2、MARC、マスピン、MCAM、MCK-2、MCP、MCP-1、MCP-2、MCP-3、MCP-4、MCP-I (MCAF)、M-CSF、MDC、MDC (67 a.a.)、MDC (69 a.a.)、メグシン(megsin)、Mer、METチロシンキナーゼ受容体ファミリー、メタロプロテアーゼ、膜糖タンパク質OX2、メソテリン、MGDF受容体、MGMT、MHC (HLA-DR)、微生物タンパク質(microbial protein)、MIF、MIG、MIP、MIP-1 α、MIP-1 β、MIP-3 α、MIP-3 β、MIP-4、MK、MMAC1、MMP、MMP-1、MMP-10、MMP-11、MMP-12、MMP-13、MMP-14、MMP-15、MMP-2、MMP-24、MMP-3、MMP-7、MMP-8、MMP-9、単球誘引タンパク質(monocyte attractant protein)、単球コロニー阻害因子(monocyte colony inhibitory factor)、マウスゴナドトロピン関連(gonadotropin-associated)ペプチド、MPIF、Mpo、MSK、MSP、MUC-16、MUC18、ムチン(Mud)、ミュラー管抑制因子、Mug、MuSK、ミエリン関連糖タンパク質、骨髄前駆細胞阻害因子-1 (MPIF-I)、NAIP、ナノボディ(Nanobody)、NAP、NAP-2、NCA 90、NCAD、N-カドヘリン、NCAM、ネプリライシン、神経細胞接着分子、ニューロセルピン(neroserpin)、神経成長因子(NGF)、ニューロトロフィン-3、ニューロトロフィン-4、ニューロトロフィン-6、ニューロピリン1、ニュールツリン、NGF-β、NGFR、NKG20、N-メチオニルヒト成長ホルモン、nNOS、NO、Nogo-A、Nogo受容体、C型肝炎ウイルス由来の非構造タンパク質3型 (NS3)、NOS、Npn、NRG-3、NT、NT-3、NT-4、NTN、OB、OGG1、オンコスタチンM、OP-2、OPG、OPN、OSM、OSM受容体、骨誘導因子(osteoinductive factor)、オステオポンチン、OX40L、OX40R、酸化型LDL、p150、p95、PADPr、副甲状腺ホルモン
、PARC、PARP、PBR、PBSF、PCAD、P-カドヘリン、PCNA、PCSK9、PDGF、PDGF受容体、PDGF-AA、PDGF-AB、PDGF-BB、PDGF-D、PDK-1、PECAM、PEDF、PEM、PF-4、PGE、PGF、PGI2、PGJ2、PIGF、PIN、PLA2、胎盤増殖因子、胎盤アルカリホスファターゼ(PLAP)、胎盤ラクトゲン、プラスミノーゲン活性化因子阻害因子-1、血小板増殖因子(platelet-growth factor)、plgR、PLP、異なるサイズのポリグリコール鎖(poly glycol chain)(例えば、PEG-20、PEG-30、PEG40)、PP14、プレカリクレイン、プリオンタンパク質、プロカルシトニン、プログラム細胞死タンパク質1、プロインスリン、プロラクチン、プロタンパク質転換酵素PC9、プロリラキシン(prorelaxin)、前立腺特異的膜抗原(PSMA)、プロテインA、プロテインC、プロテインD、プロテインS、プロテインZ、PS、PSA、PSCA、PsmAr、PTEN、PTHrp、Ptk、PTN、P-セレクチン糖タンパク質リガンド-1、R51、RAGE、RANK、RANKL、RANTES、リラキシン、リラキシンA鎖、リラキシンB鎖、レニン、呼吸器多核体ウイルス(RSV) F、Ret、レチキュロン(reticulon)4、リウマチ因子、RLI P76、RPA2、RPK-1、RSK、RSV Fgp、S100、RON-8、SCF/KL、SCGF、スクレロスチン(Sclerostin)、SDF-1、SDF1 α、SDF1 β、セリン(SERINE)、血清アミロイドP、血清アルブミン、sFRP-3、Shh、志賀様毒素II、SIGIRR、SK-1、SLAM、SLPI、SMAC、SMDF、SMOH、SOD、SPARC、スフィンゴシン一リン酸受容体1、ブドウ球菌のリポテイコ酸、Stat、STEAP、STEAP-II、幹細胞因子(SCF)、ストレプトキナーゼ、スーパーオキシドジスムターゼ、シンデカン-1、TACE、TACI、TAG-72 (腫瘍関連糖タンパク質-72)、TARC、TB、TCA-3、T細胞受容体α/β、TdT、TECK、TEM1、TEM5、TEM7、TEM8、テネイシン、TERT、精巣PLAP様アルカリホスファターゼ、TfR、TGF、TGF-α、TGF-β、TGF-β汎特異的(TGF-β Pan Specific)、TGF-β RII、TGF-β RIIb、TGF-β RIII、TGF-β Rl (ALK-5)、TGF-β1、TGF-β2、TGF-β3、TGF-β4、TGF-β5、TGF-I、トロンビン、トロンボポエチン(TPO)、胸腺間質性リンホプロテイン(Thymic stromal lymphoprotein)受容体、胸腺Ck-1、甲状腺刺激ホルモン(TSH)、チロキシン、チロキシン結合グロブリン、Tie、TIMP、TIQ、組織因子、組織因子プロテアーゼインヒビター、組織因子タンパク質、TMEFF2、Tmpo、TMPRSS2、TNF受容体I、TNF受容体II、TNF-α、TNF-β、TNF-β2、TNFc、TNF-RI、TNF-RII、TNFRSF10A (TRAIL R1 Apo-2/DR4)、TNFRSF10B (TRAIL R2 DR5/KILLER/TRICK-2A/TRICK-B)、TNFRSF10C (TRAIL R3 DcR1/LIT/TRID)、TNFRSF10D (TRAIL R4 DcR2/TRUNDD)、TNFRSF11A (RANK ODF R/TRANCE R)、TNFRSF11B (OPG OCIF/TR1)、TNFRSF12 (TWEAK R FN14)、TNFRSF12A、TNFRSF13B (TACI)、TNFRSF13C (BAFF R)、TNFRSF14 (HVEM ATAR/HveA/LIGHT R/TR2)、TNFRSF16 (NGFR p75NTR)、TNFRSF17 (BCMA)、TNFRSF18 (GITR AITR)、TNFRSF19 (TROY TAJ/TRADE)、TNFRSF19L (RELT)、TNFRSF1A (TNF Rl CD120a/p55-60)、TNFRSF1B (TNF RII CD120b/p75-80)、TNFRSF21 (DR6)、TNFRSF22 (DcTRAIL R2 TNFRH2)、TNFRSF25 (DR3 Apo-3/LARD/TR-3/TRAMP/WSL-1)、TNFRSF26 (TNFRH3)、TNFRSF3 (LTbR TNF RIII/TNFC R)、TNFRSF4 (OX40 ACT35/TXGP1 R)、TNFRSF5 (CD40 p50)、TNFRSF6 (Fas Apo-1/APT1/CD95)、TNFRSF6B (DcR3 M68/TR6)、TNFRSF7 (CD27)、TNFRSF8 (CD30)、TNFRSF9 (4-1 BB CD137/ILA)、TNFRST23 (DcTRAIL R1 TNFRH1)、TNFSF10 (TRAIL Apo-2リガンド/TL2)、TNFSF11 (TRANCE/RANKリガンドODF/OPGリガンド)、TNFSF12 (TWEAK Apo-3リガンド/DR3リガンド)、TNFSF13 (APRIL TALL2)、TNFSF13B (BAFF BLYS/TALL1/THANK/TNFSF20)、TNFSF14 (LIGHT HVEMリガンド/LTg)、TNFSF15 (TL1A/VEGI)、TNFSF18 (GITRリガンド AITRリガンド/TL6)、TNFSF1A (TNF-a コネクチン(Conectin)/DIF/TNFSF2)、TNFSF1B (TNF-b LTa/TNFSF1)、TNFSF3 (LTb TNFC/p33)、TNFSF4 (OX40リガンドgp34/TXGP1)、TNFSF5 (CD40リガンドCD154/gp39/HIGM1/IMD3/TRAP)、TNFSF6 (Fasリガンド Apo-1リガンド/APT1リガンド)、TNFSF7 (CD27リガンドCD70)、TNFSF8 (CD30リガンドCD153)、TNFSF9 (4-1 BBリガンド CD137リガンド)、TNF-α、TNF-β、TNIL-I、毒性代謝産物(toxic metabolite)、TP-1、t-PA、Tpo、TRAIL、TRAIL R、TRAIL-R1、TRAIL-R2、TRANCE、トランスフェリン受容体、TGF-αおよびTGF-β等のトランスフォーミング増殖因子(TGF)、膜貫通型糖タンパク質NMB、トランスサイレチン、TRF、Trk、TROP-2、トロホブラスト糖タンパク質、TSG、TSLP、腫瘍壊死因子(TNF)、腫瘍関連抗原CA 125、Lewis Y関連糖を示す腫瘍関連抗原、TWEAK、TXB2、Ung、uPAR、uPAR-1、ウロキナーゼ、VAP-1、血管内皮増殖因子(VEGF)、バスピン(vaspin)、VCAM、VCAM-1、VECAD、VE-カドヘリン、VE-カドヘリン-2、VEFGR-1 (flt-1)、VEFGR-2、VEGF受容体 (VEGFR)、VEGFR-3 (flt-4)、VEGI、VIM、ウイルス抗原、ビタミンB12受容体、ビトロネクチン受容体、VLA、VLA-1、VLA-4、VNRインテグリン、フォン・ヴィルブランド因子(vWF)、WIF-1、WNT1、WNT10A、WNT10B、WNT11、WNT16、WNT2、WNT2B/13、WNT3、WNT3A、WNT4、WNT5A、WNT5B、WNT6、WNT7A、WNT7B、WNT8A、WNT8B、WNT9A、WNT9B、XCL1、XCL2/SCM-l-β、XCLl/リンホタクチン、XCR1、XEDAR、XIAP、XPD、HMGB1、IgA、Aa、CD81、CD97、CD98、DDR1、DKK1、EREG、Hsp90、IL-17/IL-17R、IL-20/IL-20R、酸化LDL、PCSK9、プレカリクレイン、RON、TMEM16F、SOD1、クロモグラニンA、クロモグラニンB、タウ、VAP1、高分子キニノーゲン、IL-31、IL-31R、Nav1.1、Nav1.2、Nav1.3、Nav1.4、Nav1.5、Nav1.6、Nav1.7、Nav1.8、Nav1.9、EPCR、C1、C1q、C1r、C1s、C2、C2a、C2b、C3、C3a、C3b、C4、C4a、C4b、C5、C5a、C5b、C6、C7、C8、C9、factor B、第D因子、第H因子、プロパージン、スクレロスチン、フェブリノゲン、フィブリン、プロトロンビン、トロンビン、組織因子、第V因子、第Va因子、第VII因子、第VIIa因子、第VIII因子、第VIIIa因子、第IX因子、第IXa因子、第X因子、第Xa因子、第XI因子、第XIa因子、第XII因子、第XIIa因子、第XIII因子、第XIIIa因子、TFPI、アンチトロンビンIII、EPCR、トロンボモデュリン、TAPI、tPA、プラスミノーゲン、プラスミン、PAI-1、PAI-2、GPC3、シンデカン-1、シンデカン-2、シンデカン-3、シンデカン-4、LPA、S1Pなどを挙げることができるが、これらに限定されない。
本発明はまた、上記の本発明の抗原結合分子の多くの使用を提供する。
薬物動態を改善するとは、具体的には以下を包含する:
(1) 消失の遅延:抗原結合分子が投与されてから血漿中から消失するまでの時間を、対照抗原結合分子(例えば、インタクトなFcRn結合ドメインを有する抗原結合分子)と比較して長くすること;および/または
(2) 好ましくは抗体もしくは抗体誘導体がその抗原に結合できる形態をした抗原結合分子の、抗原結合分子投与後の血漿中滞留時間を、対照抗原結合分子(例えば、インタクトなFcRn結合ドメインを有する抗原結合分子)の血漿中滞留時間と比較して長くすること;および/または
(3) 抗原結合分子の投与から消失までの、抗原と結合していない(抗原が体内で抗原結合分子に結合していない)期間を、対照抗原結合分子と比較して短くすること(投与から消失までの、抗原結合分子が対象の体内でその抗原に結合している期間を、対照抗原結合分子(例えば、インタクトなFcRn結合ドメインを有する抗原結合分子)と比較して長くすること);および/または
(4)抗体が分解される前の、体内の全抗原に対する、抗原結合分子に結合している抗原の割合を、対照抗原結合分子(例えば、インタクトなFcRn結合ドメインを有する抗原結合分子)に結合している抗原の割合と比較して増加させること(抗体もしくは抗体誘導体の投与から分解までの抗原結合分子とその抗原との結合事象の数を、投与から分解までの対照抗原結合分子の結合事象の数と比較して増加させること)。
(5) 抗原結合分子の投与後の血漿中総抗原濃度もしくは遊離抗原濃度を、対照抗原結合分子(例えば、インタクトなFcRn結合ドメインを有する抗原結合分子)の投与後の血漿中総抗原濃度もしくは遊離抗原濃度と比較して低下させること。
したがって、本発明はまた、EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、抗原結合分子のFcRn結合ドメインに改変を導入する工程を含む、抗原結合分子の血漿中滞留時間を長くする方法を提供する。インタクトなヒトIgGは、非ヒト動物由来のFcRnに結合することができる。例えば、インタクトなヒトIgGはヒトFcRnよりもマウスFcRnに強く結合することができることから(Int Immunol. 2001 Dec; 13(12): 1551-9)、本発明の抗原結合分子の特性を確認する目的で、好ましくはマウスを用いて投与を行うことができる。別の例として、本来のFcRn遺伝子が破壊されており、ヒトFcRn遺伝子に関するトランスジーンを有して発現するマウス(Methods Mol Biol. 2010; 602: 93-104)もまた、以下に記載する本発明の抗原結合分子の特性を確認する目的で、投与を行うために好ましく用いることができる。
具体的には、「薬物動態の改善」とはまた、具体的には、「薬物動態が改善する」とはまた、抗原に結合していない抗原結合分子(抗原非結合型抗原結合分子)が投与されてから分解されるまでの、時間が長くなることを含む。抗原結合分子が血漿中に存在していても、その抗原結合分子にすでに抗原が結合している場合は、その抗原結合分子は新たな抗原に結合できない。そのため抗原結合分子が抗原に結合していない時間が長くなれば、新たな抗原に結合できる時間が長くなる(別の抗原に結合する機会が多くなる)。言い換えると、より短い時間により多くの抗原が結合する。したがって、改変抗原結合分子の投与により血漿中からの抗原の消失を加速することができれば、抗原非結合型抗原結合分子の血漿中濃度は上昇し、また、抗原が抗原結合分子に結合している時間が長くなる。
a) 親FcRn結合ドメインを含む抗原結合分子であって、前記抗原と結合し得る抗原結合ドメインを含む抗原結合分子を提供する工程、
b) 親FcRn結合ドメイン中の、EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置のアミノ酸を置換し、それによってインタクトなFcRn結合ドメインを有する抗原結合分子と比較して中性pHにおけるFcRn結合活性を増強する工程。
A値:各時点での抗原のモル濃度
B値:各時点での抗原結合分子のモル濃度
C値:各時点での抗原結合分子のモル濃度あたりの抗原のモル濃度(抗原/抗原結合分子モル比)
C=A/B。
本発明において、「抗原結合分子のpH中性域における抗原結合活性をpH酸性域における抗原結合活性より低下させる」という用語は、抗原結合分子のpH6.7〜pH10.0での抗原結合活性をpH4.0〜pH6.5での抗原結合活性より弱くすることを意味する。好ましくは、抗原結合分子のpH7.0〜pH8.0での抗原結合活性をpH5.5〜pH6.5での抗原結合活性より弱くすることを意味し、特に好ましくは、生体内において生体内の血漿中のpHにおける抗原結合活性を早期エンドソーム内のpHにおける抗原結合活性より弱くする、具体的には、抗原結合分子のpH7.4での抗原結合活性をpH5.8〜pH6.0での抗原結合活性より弱くすることを意味する。
「抗原結合分子のpH中性域における抗原結合活性をpH酸性域における抗原結合活性より低下させる」という表現は、「抗原結合分子のpH酸性域における抗原結合活性をpH中性域における抗原結合活性よりも高くする」と表現することもできる。つまり、本発明においては、抗原結合分子のpH酸性域における抗原結合活性とpH中性域における抗原結合活性の比を大きくすればよい。例えば、後述のように、KD(pH7.4)/KD(pH5.8)の値を大きくするという態様が挙げられる。抗原結合分子のpH中性域における抗原結合活性とpH酸性域における抗原結合活性の比を大きくするためには、例えば、pH酸性域における抗原結合活性を低くしてもよいし、pH中性域における抗原結合活性を高くしてもよいし、又は、その両方でもよい。
既存の抗医薬品抗体に対するアフィニティーが、中性pHにおいて野生型Fc領域と比較して有意に増強されていない本発明の抗原結合分子、特に、EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置においてFcRn結合ドメイン中にアミノ酸置換を含む本発明の抗原結合分子は、自己免疫疾患、移植拒絶反応(移植片対宿主病)、他の炎症性疾患およびアレルギー疾患に罹患しているヒト患者を治療するための治療用抗体として特に有用である。
本発明はまた、中性pHまたは酸性pHにおけるFcRnに対するアフィニティーが増強されておりかつ既存のADAに対する結合活性が増強された抗原結合分子の、中性pHにおける既存のADAに対する結合活性を低下させるための、改変FcRn結合ドメインを含む本発明の抗原結合分子の使用を提供する。
a) 中性pHまたは酸性pHにおけるFcRnに対する結合活性および中性pHにおける既存のADAに対する結合活性が増強されたFc領域を提供する工程、ならびに
b) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置においてアミノ酸を置換する工程。
工程a)における好ましいFc領域はヒトFc領域である。好ましくは、pH中性域またはpH酸性域におけるFcRnに対する結合活性およびpH中性域における既存のADAに対する結合活性が増強されたFc領域は、EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置にアミノ酸の置換を含み、より好ましくは表2および4〜7より選択される位置の組み合わせのいずれか1つに置換を含み、さらにより好ましくは表3および17〜20のいずれか1つに記載された置換または置換の組み合わせのいずれか1つを含む。
a) 酸性pHにおけるFcRnに対する結合活性および中性pHにおける既存のADAに対する結合活性が増強されたFc領域を含む抗原結合分子を提供する工程、ならびに
b) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、Fc領域中のアミノ酸を置換する工程。
a) 酸性pHにおけるFcRnに対する結合活性および中性pHにおける既存のADAに対する結合活性が増強されたFc領域を含む抗原結合分子を提供する工程、ならびに
b) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、Fc領域中のアミノ酸を置換する工程。
工程a)における好ましいFc領域はヒトFc領域である。好ましくは、酸性pHにおけるFcRnに対する結合活性およびpH中性域における既存のADAに対する結合活性が増強されたFc領域は、
i) EU434位、または
ii) a) EU252/EU254/EU256;b) EU428/EU434;およびc) EU250/EU428からなる組み合わせ群のうちの1つである、2つ以上の位置
にアミノ酸置換を含む。好ましくは、Fc領域は以下を含む:i) 置換M434H;またはii) a) M252Y/S254T/T256E;b) M428L/N434S;およびc) T250Q/M428L(EUナンバリング)からなる組み合わせ群のうちの1つ。
好ましい態様において、工程b)では、アミノ酸は、a) EU424位またはb) EU438位/EU440位において置換される。より好ましくは、当該置換はa) EU424Nまたはb) 組み合わせEU438R/EU440Eである。
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程a)の親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436、およびEU428からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436、およびEU428からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
a) 親FcRn結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
a) 親FcRn結合ドメインを含む抗原結合分子であって、該抗原と結合し得る抗原結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、親FcRn結合ドメインを改変する工程;ならびに
c) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、親FcRn結合ドメインのアミノ酸配列中のアミノ酸を置換することにより、工程b)の改変FcRn結合ドメインを改変する工程。
i) EU434位における、または
ii) a) EU252/EU254/EU256;b) EU428/EU434;およびc) EU250/EU428からなる組み合わせ群のうちの1つである、2つ以上の位置における
置換であり、工程b)のFc領域は、酸性域におけるFcRn結合活性が増強されており、かつpH中性域における既存のADAに対する結合活性が増強されている。好ましくは、当該Fc領域は以下を含む:i) 置換M434H;またはii) a) M252Y/S254T/T256E;b) M428L/N434S;およびc) T250Q/M428L(EUナンバリング)からなる組み合わせ群のうちの1つ。好ましい態様において、工程c)では、アミノ酸は、a) EU424位またはb) EU438位/EU440位において置換される。より好ましくは、当該置換は、a) EU424Nまたはb) 組み合わせEU438R/EU440Eである。
また本発明は、本発明の抗原結合分子、または本発明の製造方法により製造された抗原結合分子を含む医薬組成物に関する。本発明の抗原結合分子または本発明の製造方法により製造された抗原結合分子はその投与により通常の抗原結合分子と比較して血漿中の抗原濃度を低下させる作用が高いことから医薬組成物として有用である。本発明の医薬組成物は薬学的に許容される担体を含むことができる。本発明において医薬組成物とは、通常、疾患の治療もしくは予防、あるいは検査・診断のための薬剤を言う。
本発明は、本発明の抗原結合分子を製造する方法を提供する。具体的には、本発明は、FcRn結合ドメインの中性pHにおけるFcRnに対する結合活性が、野生型Fc領域を含む抗原結合分子と比較して増強された、抗原結合分子を製造する方法を提供する。
本発明は、以下の工程を含む、抗原結合分子を製造する方法を提供する:
(a) 親FcRn結合ドメインを選択し、該親FcRnドメインを、EU252、EU434、EU436、EU315、EU311、EU308、EU307、EU286、EU254、EU250、EU238、EU387、EU422、EU424、EU428、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、アミノ酸配列中のアミノ酸を別のアミノ酸と置換することにより改変する工程;
(b) pH依存的抗原結合ドメインまたはカルシウムイオン依存的抗原結合ドメインを得るために、抗原結合分子の抗原結合ドメインを選択し、該抗原結合ドメイン中の少なくとも1つのアミノ酸を改変する工程;
(c) (a)および(b)において調製されたヒトFcRn結合ドメインおよび抗原結合ドメインが連結された抗原結合分子をコードする遺伝子を得る工程;ならびに
(d) (c)において調製された遺伝子を用いて、抗原結合分子を製造する工程。
工程(a)は、EU238、EU250、EU252、EU254、EU255、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置においてアミノ酸を置換し、pH中性域におけるヒトFcRn結合活性がKD 3.2μMよりも強いFcRn結合ドメインを選択する工程を含み得る。
工程(b)は、pH依存的抗原結合ドメインを得るために、抗原結合ドメインを選択し、該抗原結合ドメイン中の少なくとも1つのアミノ酸を改変する工程、またはカルシウムイオン依存的抗原結合ドメインを選択する工程を含み得る。アミノ酸を改変する工程は、好ましくは、少なくとも1つのアミノ酸をヒスチジンに置換するか、または少なくとも1つのヒスチジンを挿入する工程である。一方、少なくとも1つのヒスチジン変異を導入する部位は特に限定されず、よって、ヒスチジン変異により、pH酸性域における抗原結合活性がpH中性域における抗原結合活性より低くなる限り、任意の位置にヒスチジン変異を導入することができる。このようなヒスチジン変異は、単一の部位または2以上の部位に導入することができる。工程a)およびb)は、2回以上繰り返してもよい。工程(a)および(b)を繰り返す回数は特に限定されないが、典型的には10回以下である。
好ましくは、中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されかつ中性pHにおける既存のADAに対する結合活性が低下したFc領域を含む抗原結合分子を製造する方法は、以下の工程を含む:
(a) pH中性域またはpH酸性域におけるFcRnに対する結合活性が増強されかつpH中性域における既存のADAに対する結合活性が増強されたFc領域を提供する工程、
b) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置において、Fc領域のアミノ酸配列中のアミノ酸を置換する工程、
(c) 抗原結合分子の抗原結合ドメイン中の少なくとも1つのアミノ酸を改変し、抗原結合活性がpH酸性域よりもpH中性域において強い抗原結合分子を選択する工程;
(d) (b)において調製されたヒトFcRn結合ドメインと(c)において調製された抗原結合ドメインが連結された抗原結合分子をコードする遺伝子を得る工程、ならびに
(e) (d)において調製された遺伝子を用いて、抗原結合分子を製造する工程。
好ましくは、工程b)における置換は、表10に記載された1つもしくは複数の位置または位置の組み合わせにおけるアミノ酸置換である。より好ましくは、工程b)の置換は、表11に記載された置換の組み合わせのうちの1つである。工程b)において、EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440からなる群より選択される1つまたは複数の位置におけるアミノ酸は、好ましくは、ヌクレオチド配列中の1つまたは複数のヌクレオチドを置き換えることによって置換される。
工程(b)と(c)はいずれの順序で行ってもよい。さらに、工程c)は、pH依存的抗原結合ドメインを得るために、上記の抗原結合ドメイン中の少なくとも1つのアミノ酸を改変する工程、またはカルシウムイオン依存的抗原結合ドメインを選択する工程を含み得る。工程(c)において、アミノ酸を改変する工程は、好ましくは、少なくとも1つのアミノ酸をヒスチジンに置換するか、または少なくとも1つのヒスチジンを挿入する工程である。一方、少なくとも1つのヒスチジン変異を導入する部位は特に限定されず、よって、ヒスチジン変異により、pH酸性域における抗原結合活性がpH中性域における抗原結合活性より低くなる限り、任意の位置にヒスチジン変異を導入することができる。このようなヒスチジン変異は、単一の部位または2以上の部位に導入することができる。工程b)およびc)は、2回以上繰り返してもよい。工程(b)および(c)を繰り返す回数は特に限定されないが、典型的には10回以下である。
さらに、本発明の製造方法は、EU234、EU235、EU236、EU237、EU238、EU239、EU265、EU266、EU267、EU269、EU270、EU271、EU295、EU296、EU297、EU298、EU300、EU324、EU325、EU327、EU328、EU329、EU331、およびEU332(EUナンバリングシステムによる)からなる群より選択される1つまたは複数の位置において、Fc領域のアミノ酸配列中のアミノ酸を置換する工程をさらに含み得る。好ましくは、置換L235R/S239Kが導入される。
a) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置、ならびに
b) EU387、EU422、EU424、EU426、EU433、EU436、EU438、およびEU440(EUナンバリング)からなる群より選択される1つまたは複数の位置
においてアミノ酸の置換を有するヒトFc領域をさらに含む抗原結合分子が含まれる。
好ましくは、EU256位のアミノ酸はグルタミン酸と置換される。
より好ましくは、抗原結合分子は、表11〜13に記載された置換の組み合わせを含む。
(1)疎水性:アラニン、イソロイシン、バリン、メチオニン及びロイシン;
(2)中性親水性:アスパラギン、グルタミン、システイン、スレオニン及びセリン;
(3)酸性:アスパラギン酸及びグルタミン酸;
(4)塩基性:アルギニン、ヒスチジン及びリジン;
(5)鎖の配向に影響する残基:グリシンおよびプロリン;ならびに
(6)芳香族性:チロシン、トリプトファン及びフェニルアラニン
のグループに分類される。
血漿中からの抗原消失を増強する目的で、FcRnと相互作用する抗原結合分子(抗体)のFc領域(Nat Rev Immunol. 2007 Sep; 7(9):715-25)を、中性pHにおけるFcRnに対する結合アフィニティーが改善されるように操作した。従来の抗体と比較して中性pHにおけるFcRnに対する結合アフィニティーが改善されたpH依存的抗原結合抗体による血漿中からの抗原消失の機構を図1Aに示す。
高い安定性、高い純度、および低い免疫原性リスクを維持しつつ、中性pHにおけるhFcRnに対する結合アフィニティーが改善された様々なFc改変体を設計した。野生型IgG1のFc領域に導入した変異(アミノ酸置換)を、各Fc改変体について表16に示す(IgG1-F1〜F1434)。WO2011/122011の参考実施例1に記載の当業者公知の方法によって、アミノ酸置換をVH3-IgG1(配列番号:1)に導入してFc改変体を作製した。
実施例1で調製された新規Fc改変体(F600〜F1434)、およびWO2011/122011の実施例1で調製された既存のFc改変体(F1〜F599)のhFcRn結合アフィニティーを、Biacore T100(GE Healthcare)を用いて評価した。このために、参考実施例A2に記載された通りにヒトFcRnを調製した。適量のプロテインL(ACTIGEN)をアミノカップリング法によりセンサーチップCM4(GE Healthcare)上に固定化し、このチップに目的の抗体を捕捉させた。次に、FcRn希釈液およびランニングバッファー(対照溶液として)を注入し、ヒトFcRnが、センサーチップ上に捕捉された抗体と相互作用できるようにした。50 mmol/lリン酸ナトリウム、150 mmol/l NaCl、および0.05%(w/v) Tween20(pH7.0)を含むランニングバッファー使用した。各バッファーを用いてFcRnを希釈した。チップは、10 mmol/lグリシン-HCl(pH 1.5)を用いて再生した。アッセイはもっぱら25℃で行った。アッセイで得られたセンサーグラムに基づき、いずれもカイネティクスパラメーターである結合速度定数ka(1/Ms)および解離速度定数kd(1/s)を算出し、これらの値からヒトFcRnに対する各抗体のKD(M)を決定した。各パラメーターは、Biacore T100 Evaluation Software(GE Healthcare)を用いて算出した。全Fc改変体の結合アフィニティーを表16に示す。
実施例1で調製された新規Fc改変体(F600〜F1434)、およびWO2011/122011の実施例1で調製された既存のFc改変体(F1〜F599)の安定性を、示差走査蛍光定量法(DSF)を用いて評価した。この方法は、温度を徐々に上昇させながら極性感受性プローブの蛍光強度を測定し、タンパク質の疎水性領域が露出する遷移温度を得ることからなる。DSFを用いて得られた遷移温度は、示差走査熱量測定法を用いて得られた融解温度と良好な相関を示すことが既に報告されている(Journal of Pharmaceutical Science 2010; 4: 1707-1720)。SYPRO orange色素(Molecular Probes)をPBS(Sigma)により希釈し、タンパク質溶液に添加した。各試料は染色した溶液20μLとして用いた。470 nmの固定励起波長を用いて、蛍光放射を555 nmで収集した。DSF実験中は、温度を30℃から99℃まで0.4℃ずつ上昇させ、各温度で6秒間の平衡時間を設けてから測定した。データは、Rotor-Gene Q Series Software(QIAGEN)を用いて解析した。蛍光遷移の温度を融解温度(Tm)と定義する。Fc改変体F1〜F1434のTm値を表16に示す。
実施例1で調製された新規Fc改変体(F600〜F1434)、およびWO2011/122011の実施例1で調製された既存のFc改変体(F1〜F599)の高分子量種の割合(HMW(%))を、サイズ排除クロマトグラフィー(SEC)を用いて評価した。SECはACQUITY UPLC H-Classシステム(waters)で実施した。抗体をBEH200 SECカラム(1.7μm、4.6×150 mm、waters)上に注入した。0.05 Mリン酸ナトリウム、0.3 M塩化ナトリウム(pH 7.0、Isekyu)を移動相とし、流速0.3 mL/分にて均一濃度で流した。溶出されたタンパク質を、215 nmのUV吸光度で検出した。データはEmpower2(waters)を用いて解析した。抗体単量体のピークよりも早く溶出するピークを、HMW成分パーセンタイルとして記録した。全Fc改変体(F1〜F1434)のHMW(%)を表16に示す。
抗医薬品抗体(ADA)は治療用抗体の効果および薬物動態に影響を及ぼし、時に重篤な副作用をもたらすことがあるため、臨床における治療用抗体の有用性と薬効はADAの産生によって制限され得る。多くの要因が治療用抗体の免疫原性に影響を及ぼすが、治療用タンパク質中に存在するエフェクターT細胞エピトープの重要性が多数報告されている。
DRB1*0701(25.3%)、DRB1*1501(23.1%)、DRB1*0301(21.7%)、DRB1*0101(15.3%)、DRB1*0401(13.8%)、DRB1*1101(11.8%)、DRB1*1302(8.0%)、DRB1*1401(4.9%)、DRB1*0403(2.3%)、DRB1*0901(1.8%)
2-1. hFcRn結合アフィニティーに対してTm、HMW(%)、および免疫原性スコアをプロットすることによる、既存のFc改変体および新規Fc改変体の解析
WO2011/122011の実施例1に記載された既存のFc改変体(F1〜F599)、および実施例1で作製され評価された新規Fc改変体(F600〜F1052)のhFcRn結合アフィニティーおよびTmをプロットし、図2に示す。既存のFc改変体および新規Fc改変体のhFcRn結合アフィニティーおよびHMW(%)をプロットし、図3に示す。Fc改変体F1〜F599および新規Fc改変体(F600〜F1052)のhFcRn結合アフィニティーおよび免疫原性スコアをプロットし、図4に示す。
hFcRnに対する結合アフィニティーが15 nMよりも強い(以後、グループ1と記載する)、実施例1で作製され評価された新規Fc改変体(F600〜F1052)、およびWO2011/122011の実施例1に記載された既存のFc改変体(F1〜F599)を、X軸にhFcRn結合アフィニティーをプロットし、Y軸にTm、HMW(%)、および免疫原性スコアをプロットすることにより詳細に解析した。
X軸にhFcRn結合アフィニティー(15 nMよりも強いKD)をプロットし、Y軸にTm、HMW(%)、および免疫原性スコアをプロットすることによるグループ1の詳細な解析を、それぞれ図5、6、および7に示す。
hFcRnに対する結合アフィニティーが15 nM〜50 nMである(以後「グループ2」と称する)、実施例1で作製され評価された新規Fc改変体(F600〜F1052)、およびWO2011/122011の実施例1に記載された既存のFc改変体(F1〜F599)を、X軸にhFcRn結合アフィニティーをプロットし、Y軸にTm、HMW(%)、および免疫原性スコアをプロットすることにより詳細に解析した。
hFcRnに対する結合アフィニティーが50 nM〜150 nMである(以後「グループ3」と称する)、実施例1で作製され評価された新規Fc改変体(F600〜F1052)、およびWO2011/122011の実施例1に記載された既存のFc改変体(F1〜F599)を、X軸にhFcRn結合アフィニティーをプロットし、Y軸にTm、HMW(%)、および免疫原性スコアをプロットすることにより詳細に解析した。
hFcRnに対する結合アフィニティーが150 nM〜700 nMである(以後「グループ4」と称する)、実施例1で作製され評価された新規Fc改変体(F600〜F1052)、およびWO2011/122011の実施例1に記載された既存のFc改変体(F1〜F599)を、X軸にhFcRn結合アフィニティーをプロットし、Y軸にTm、HMW(%)、および免疫原性スコアをプロットすることにより詳細に解析した。
3-1. インビボ試験用の抗体の調製
pH依存的抗ヒトIL6受容体IgG1抗体である、VH3-IgG1(配列番号:1)およびVL3-CK(配列番号:3)を含むFv4-IgG1、既存のFc改変体である、VH3-F11(配列番号:4)およびVL3-CK(配列番号:3)を含むFv4-F11、ならびに、新規Fc改変体である、VH3-F652(配列番号:5)およびVL3-CK(配列番号:3)を含むFv4-F652、VH3-F890(配列番号:6)およびVL3-CK(配列番号:3)を含むFv4-F890、VH3-F946(配列番号:7)およびVL3-CK(配列番号:3)を含むFv4-F946を、WO2011/122011の参考実施例2に記載の当業者公知の方法によって発現させて精製した。
ヒトFcRnトランスジェニックマウス系統32を用いた定常状態注入モデルによりインビボ試験を行った。ヒトFcRnトランスジェニックマウス系統32(B6.mFcRn-/-.hFcRn Tg 系統32 +/+マウス(B6.mFcRn-/- hFCRN Tg32 B6.Cg-Fcgrt<tm1Dcr> Tg(FCGRT)32Dcr)、Jackson Laboratories; Methods Mol Biol. (2010) 602: 93-104)の背部皮下に、可溶型ヒトIL-6受容体を充填した注入ポンプ(MINI-OSMOTIC PUMP MODEL 2004;alzet)を埋め込むことで、血漿中可溶型ヒトIL-6受容体濃度が一定に維持されるモデル動物を作製した。モデル動物に抗ヒトIL-6受容体抗体を投与し、投与後の可溶型ヒトIL-6受容体の体内動態を評価した。可溶型ヒトIL-6受容体に対する中和抗体の産生を抑制するために、注入ポンプを埋め込む前と、抗体を尾静脈に投与した7日後および17日後に、モノクローナル抗マウスCD4抗体(自社製)を20 mg/kgで投与した。次に、92.8μg/mlの可溶型ヒトIL-6受容体を充填した注入ポンプをマウスの背部皮下に埋め込んだ。注入ポンプ埋め込み3日後に、抗ヒトIL-6受容体抗体を尾静脈に単回投与した。試験1では、約1g/kgのサングロポール(CSLベーリング)と共に、Fv4-IgG1、Fv4-F652、Fv4-F890およびFv4-F946を1mg/kgの用量で投与し、試験2では、Fv4-IgG1、Fv4-F11およびFv4-F652を1mg/kgの用量で投与した。両試験において、対照群(抗体注入なし)には抗体を投与しなかった。抗ヒトIL-6受容体抗体の投与後、適切な時点で血液を採取した。採取した血液は直ちに4℃、15,000 rpmで15分間遠心分離し、血漿を得た。分離した血漿は、測定を実施するまで-20℃以下に設定された冷凍庫に保存した。
マウス血漿中の抗ヒトIL-6受容体抗体濃度はELISA法にて測定した。まず抗ヒトIgG(γ鎖特異的)F(ab')2抗体断片(Sigma) をNunc-ImmunoPlate, MaxiSorp (Nalge Nunc International)に分注し、4℃で一晩静置し抗ヒトIgG固相化プレートを調製した。血漿中濃度として0.8、0.4、0.2、0.1、0.05、0.025、0.0125μg/mLの検量線試料と100倍以上希釈したマウス血漿測定試料を調製し、これら検量線試料および血漿測定試料100μLに20 ng/mLのhsIL-6Rを200μL加え、室温で1時間静置した。その後抗ヒトIgG固相化プレートに分注しさらに室温で1時間静置した。その後ビオチン化抗ヒトIL-6 R抗体(R&D)を室温で1時間反応させ、さらにStreptavidin-PolyHRP80 (Stereospecific Detection Technologies)を室温で1時間反応させ、TMB One Component HRP Microwell Substrate (BioFX Laboratories)を基質として用い発色反応を行い、1N硫酸(昭和化学)で反応停止後、マイクロプレートリーダーにて450 nmの吸光度を測定した。マウス血漿中濃度は検量線の吸光度から解析ソフトウェアSOFTmax PRO(Molecular Devices)を用いて算出した。
マウスの血漿中hsIL-6R濃度は電気化学発光法にて測定した。2000、1000、500、250、125、62.5、および31.25 pg/mLの濃度に調整したhsIL-6R検量線試料ならびに50倍以上希釈したマウス血漿測定試料を調製した。試料を、SULFO-TAG NHS Ester(Meso Scale Discovery)でルテニウム化したモノクローナル抗ヒトIL-6R抗体(R&D)、ビオチン化抗ヒトIL-6 R抗体(R&D, Systems Inc., USA)、およびトシリズマブ(中外製薬株式会社)の溶液と混合し、37℃で一晩反応させた。その際の抗ヒトIL-6受容体抗体として、トシリズマブの終濃度は試料に含まれる抗ヒトIL-6受容体抗体濃度より過剰の333μg/mLであり、試料中のほぼ全てのhsIL-6Rをトシリズマブと結合した状態にすることを目的とした。その後、MA400 PR Streptavidin Plate(Meso Scale Discovery)に分注した。さらに室温で1時間反応させ洗浄後、Read Buffer T(×4)(Meso Scale Discovery)を分注し、ただちにSECTOR PR 400 reader(Meso Scale Discovery)で測定を行った。hsIL-6R濃度は検量線のレスポンスから解析ソフトウェアSOFTmax PRO(Molecular Devices)を用いて算出した。
図17は、Fv4-IgG1、Fv4-F652、Fv4-F890、およびFv4-F946の注射後の血漿中hsIL-6R濃度の時間プロファイルを示し、図18は、Fv4-IgG1、Fv4-F652、Fv4-F890、およびFv4-F946の注射後の血漿中抗体濃度の時間プロファイルを示す。Fv4-IgG1および対照(抗体の注射なし)と比較して、中性pHにおけるFcRnに対する結合が改善された新規Fc改変体を有するFv4-F652、Fv4-F890、およびFv4-F946は、血漿中hsIL-6R濃度の有意な低下を示し、中性pHにおけるFcRnに対する結合が改善されたpH依存的抗原結合抗体のインビボ抗原消失効果が示された。Fv4-F652およびFv4-F890は、それぞれFv4-IgG1と比較して30倍および10倍の抗原消失効果を7日目に示したが、それらの血漿中抗体濃度時間プロファイルはFv4-IgG1と同程度であった。
図19は、Fv4-IgG1、Fv4-F11、およびFv4-F652の注射後の血漿中hsIL-6R濃度の時間プロファイルを示し、図20は、Fv4-IgG1、Fv4-F11、およびFv4-F652の注射後の血漿中抗体濃度の時間プロファイルを示す。Fv4-F11は血漿中hsIL-6R濃度の低下を示したが、Fv4-F652は血漿中hsIL-6R濃度のより大きな低下を示した。Fv4-F11とFv4-F652は同程度の血漿中抗体濃度時間プロファイルを示した。
抗医薬品抗体(ADA)は治療用抗体の効果および薬物動態に影響を及ぼし、時に重篤な副作用をもたらすことがあるため、臨床における治療用抗体の有用性と薬効はADAの産生によって制限され得る。多くの要因が治療用抗体の免疫原性に影響を及ぼし、エフェクターT細胞エピトープの存在がその要因の1つである。加えて、治療用抗体に対する既存の抗体の存在もまた、ADAの観点から問題があると考えられる。特に、関節リウマチなどの自己免疫疾患の患者に対する治療用抗体の場合、ヒトIgGに対する自己抗体であるリウマトイド因子が既存の抗体の問題となり得る。最近、Asn434His変異を有するヒト化抗CD4 IgG1抗体が顕著なリウマトイド因子結合を誘発することが報告された(Clin Pharmacol Ther. 2011 Feb;89(2):283-90)。詳細な研究により、ヒトIgG1におけるAsn434His変異が、親ヒトIgG1と比較して抗体のFc領域に対するリウマトイド因子の結合を増強することが確認された。
リウマトイド因子に対する結合アッセイは、15名または30名の個々のRA患者の血清(Proteogenex)を用いて、pH 7.4における電気化学発光(ECL)により行った。50倍希釈した血清試料、ビオチン標識した試験抗体(1μg/mL)、およびSULFO-TAG NHS Ester(Meso Scale Discovery)標識した試験抗体(1μg/mL)を混合し、室温で3時間インキュベートした。その後、混合物をStreptavidinでコーティングされたMULTI-ARRAY 96ウェルプレート(Meso Scale Discovery)に加え、プレートを室温で2時間インキュベートし、洗浄した。Read Buffer T(×4)(Meso Scale Discovery)を各ウェルに加えた後、直ちにプレートをSECTOR imager 2400 Reader(Meso Scale Discovery)にセットし、化学発光を測定した。
FcRn結合能を維持しつつ、ポリクローナルリウマトイド因子結合が低下した改変体を作製するために、ヒトFcRn/ヒトIgG相互作用を妨げないと推定されるCH2/CH3界面近傍の表面残基に変異を合理的に導入した。
驚いたことに、強いリウマトイド因子結合を示したF890と比較して、F1062、F1064〜F1072、およびF1107〜F1114などの、F890に対して単一の変異を有する新規Fc改変体は、リウマトイド因子結合の有意な低下を示した。特に、F1062、F1064、F1068、F1070、F1072、F1107〜F1109、およびF1111〜F1113は、天然IgG1と同程度のリウマトイド因子結合を示した。このことによって、ヒトFcRn結合に影響することなくリウマトイド因子結合を低下させるさらなる単一の変異を導入することにより、F890改変体の高まった免疫原性リスクが完全に消失することが示された。患者におけるリウマトイド因子は、Fc領域中の複数のエピトープに結合するポリクローナル抗体であるため、Fc領域に対するリウマトイド因子の結合が単一の変異によって有意に消失したことは驚くべきことであった。
リウマトイド因子結合エピトープの近傍に付加的なN-グリコシル化を導入することによっても、かさ高いN-グリコシル化による立体障害によってリウマトイド因子結合が抑制され得る。FcRn結合を維持しつつNグリコシル化配列(Asn-Xxx-Ser/Thr)を導入する変異という点から変異を選択することができる。Fc領域に付加的なN-グリコシル化配列を導入するために、単一変異または二重変異をFv4-F11に導入した。表23に記載された新規Fc改変体(F1077〜F1083、F1094〜F1097)を作製した。これらの改変体について、pH 7.0におけるヒトFcRnに対する結合アフィニティーを評価し、また付加的なグリコシル化の存在をSDS-Pageにより評価した。結果を表23に記載する。F1077(K248N)、F1080(S424N)、F1081(Y436N/Q438T)、および F1082(Q438N)は付加的なグリコシル化を有することが見出され、特にF1080(S424N)はヒトFcRnに対する結合アフィニティーを維持していた。
酸性pHにおけるFcRn結合を改善し、抗体薬物動態を長くするFv4-YTE改変体、Fv4-N434H改変体、およびFv4-LS改変体のリウマトイド因子結合を低下させるため、これらの改変体にQ438R/S440E変異またはS424N変異を導入した。表25に記載された新規Fc改変体(F1166、F1167、F1172、F1173、F1170、およびF1171)を作製した。これらの改変体について、まず、pH 6.0におけるヒトFcRnに対する結合アフィニティーを評価した。結果もまた表25に示す。
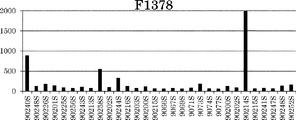
新たな単一変異をFv4-LSに導入し、表26に記載されたFc改変体(Fv4-F1380〜Fv4-F1392)を作製した。
表27に記載された新規Fc改変体(F939、F1378、F1379、F1262、F1138、F1344、F1349、F1350、F1351、F1261、F1263、F1305、F1306、F1268、F1269、F1413、F1416、F1419、F1420、F1370、F1371、F1599、F1600、F1566、F1448、F1601〜F1603、F1531、F1604、F1605、F1586、F1592、F1610〜F1615、F1567、F1572、F1576、F1578、F1579、F1641〜F1655、F1329、F1331)を作製した。これらの改変体について、まず、pH 7.0におけるヒトFcRnに対する結合アフィニティーを評価した。結果もまた表27に示す。
リウマトイド因子結合を低下させる二重変異(Q438R/S440E、Q438R/S440D、Q438K/S440E、およびQ438K/S440D)は、中性pHにおけるFcRn結合を増強するための他の変異に対するリウマトイド因子結合の有意な低下を示した。
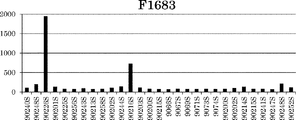
表28に記載された新規Fc改変体(F1718〜F1721、F1671、F1670、F1711〜F1713、F1722〜F1725、F1675、F1714〜F1717、F1683、F1756〜F1759、F1681、F1749〜F1751、F1760〜F1763、F1752〜F1755、F1685)を作製した。これらの改変体について、まず、pH 6.0におけるヒトFcRnに対する結合アフィニティーを評価した。結果もまた表28に示す。
リウマトイド因子結合を低下させる二重変異(Q438R/S440E、Q438R/S440D、Q438K/S440E、およびQ438K/S440D)は、酸性pHにおけるFcRn結合を増強するための他の変異に対して、リウマトイド因子結合の有意な低下を示した。
6-1. インビボ試験用の抗体の調製
pH依存的抗ヒトIL6受容体IgG1抗体である、VH3-IgG1(配列番号:1)およびVL3-CK(配列番号:3)を含むFv4-IgG1、ならびに、新規Fc改変体である、VH3-F1243(配列番号:8)およびVL3-CK(配列番号:3)を含むFv4-F1243、VH3-F1245(配列番号:9)およびVL3-CK(配列番号:3)を含むFv4-F1245を、WO2011/122011の実施例2に記載の当業者公知の方法によって発現させて精製した。
WO2011/122011の実施例13に記載されたものと同じ方法によって、ヒトFcRnトランスジェニックマウス系統32を用いた定常状態注入モデルによりインビボ試験を行った。
図131は、Fv4-IgG1、Fv4-F1243、およびFv4-F1245の注射後の血漿中hsIL-6R濃度の時間プロファイルを示し、図132は、Fv4-IgG1、Fv4-F1243、およびFv4-F1245の注射後の血漿中抗体濃度の時間プロファイルを示す。Fv4-IgG1および対照(抗体の注射なし)と比較して、中性pHにおけるFcRnに対する結合が改善された新規Fc改変体を有するFv4-F1243およびFv4-F1245は、血漿中hsIL-6R濃度の有意な低下を示し、中性pHにおけるFcRnに対する結合が改善されたpH依存的抗原結合抗体のインビボ抗原消失が示された。Fv4-F1243およびFv4-F1245はそれぞれ21日目または7日目にFv4-IgG1と比較して10倍の抗原消失効果を示したが、Fv4-F1243およびFv4-F1245の血漿中抗体濃度時間プロファイルはFv4-IgG1と同程度であった。
7-1. インビボ試験用の抗体の調製
pH依存的抗ヒトIL6受容体IgG1抗体である、VH3-IgG1(配列番号:1)およびVL3-CK(配列番号:3)を含むFv4-IgG1、新規Fc改変体である、VH3-F1389(配列番号:10)およびVL3-CK(配列番号:3)を含むFv4-F1389を、WO2011/122011の参考実施例2に記載の当業者公知の方法によって発現させて精製した。
WO2011/122011の実施例13に記載されたものと同じ方法により、ヒトFcRnトランスジェニックマウス系統32を用いてインビボ試験を行った。
図133は、Fv4-IgG1およびFv4-F1389の注射後の血漿中抗体濃度の時間プロファイルを示す。Fv4-IgG1と比較して、酸性pHにおけるFcRnに対する結合が改善され、かつリウマトイド因子に対する結合が低下した新規Fc改変体を有するFv4-F1389は、薬物動態の改善を示した。表28に記載された新規Fc改変体は、pH 6.0におけるFcRnに対する結合アフィニティーが、F1389と同レベルまで増強されている。よって、これらの改変体もまた、リウマトイド因子に対する結合を低下させながら、ヒトFcRnトランスジェニックマウス系統32を用いた薬物動態の改善を示すと予測される。
8-1. ヒトIgA(hIgA)の調製
抗原であるヒトIgA(以下hIgAとも呼ばれる)は以下のような組換え技術を用いて調製された。H (WT)-IgA1(配列番号:12)とL (WT)(配列番号:13)を含む組み組換えベクターを含む宿主細胞を培養することによって発現されたhIgA(可変領域は抗ヒトIL-6受容体抗体に由来する)が、当業者公知の方法によってイオン交換クロマトグラフィーおよびゲルろ過クロマトグラフィーを用いて精製された。
GA2-IgG1(重鎖配列番号:14、軽鎖配列番号:15)はhIgAに結合する抗体である。GA2-IgG1の重鎖(配列番号:14)およびGA2-IgG1の軽鎖(配列番号:15)をコードするDNA配列を、動物細胞発現用プラスミドに当業者公知の方法で組み込んだ。抗体の発現は以下の方法を用いて行った。ヒト胎児腎細胞由来FreeStyle 293-F株(Invitrogen)をFreeStyle 293 Expression Medium培地(Invitrogen)に懸濁させた細胞懸濁液を、1.33 x 106個/mLの細胞密度で6 well plateの各ウェルへ3 mLずつ播種した。次に、リポフェクション法により調製したプラスミドを細胞に導入した。当該細胞をCO2インキュベーター(37℃、8% CO2, 90 rpm)で4日間培養し、単離したその培養上清から、rProtein A SepharoseTM Fast Flow(Amersham Biosciences)を用いて当業者公知の方法で抗体を精製した。精製した抗体溶液の吸光度(波長:280nm)は、分光光度計を用いて測定した。得られた測定値からPACE法によって算出した吸光係数を用いて抗体濃度を算出した(Protein Science (1995) 4, 2411-2423)。
Biacore T200(GE Healthcare)を用いて、8-2で単離された抗体のhIgA結合活性(解離定数KD (M))を評価した。ランニングバッファーとして3μMまたは1.2 mM CaCl2を含有する0.05% tween20、20 mmol/L ACES、150 mmol/L NaCl(pH7.4またはpH5.8)を用いて測定を行った。
アミノカップリング法で適切な量の組換え型プロテインA/G(Thermo Scientific)が適当量固定化されたSensor chip CM5(GE Healthcare)に、抗体を結合させた。次に、アナライトとして適切な濃度のhIgA(8−1に記載)をインジェクトすることによって、hIgAとセンサーチップ上の抗体を相互作用させた。測定は37℃で行われた。測定後、10 mmol/L Glycine-HCl、 pH1.5をインジェクトすることによって、センサーチップを再生した。Biacore T200 Evaluation Software(GE Healthcare)を用いて、カーブフィッティングによる解析および平衡値解析により、測定結果から解離定数KD(M)を算出した。その結果を表29に示した。また、得られたセンサーグラムを図134に示した。GA2-IgG1はCa2+濃度が1.2 mMにおいてはhIgAに強く結合するが、Ca2+濃度が3μMにおいてはhIgAに弱く結合することが示された。また、GA2-IgG1はCa2+濃度が1.2 mMの条件下で、pH7.4においてはヒトIgAに強く結合するが、pH5.8においてはヒトIgAに弱く結合することが示された。すなわち、GA2-IgG1は、ヒトIgAに対して、pH依存的、および、カルシウム依存的に結合することが明らかとなった。
次に、FcRn結合が血漿中からの抗原(hIgA)消失に及ぼす効果を評価する目的で、FcγRへの結合を消失させるためにアミノ酸置換L235RおよびS239KをGA2-IgG1に導入することにより、GA2-F760(重鎖配列番号:16;軽鎖配列番号:15)を構築した。さらに、アミノ酸置換G236R、M252Y、S254T、T256E、N434Y、Y436V、Q438R、およびS440EをGA2-F760に導入することにより、pH 7.4においてGA2-F760よりも強くFcRnに結合するGA2-F1331(重鎖配列番号:17;軽鎖配列番号:15)を構築した。GA2-F1331(重鎖配列番号:17;軽鎖配列番号:15)およびGA2-F760(重鎖配列番号:16;軽鎖配列番号:15)をコードするDNA配列を当業者に公知の方法によって挿入した動物発現プラスミドを用いて、上記の方法により改変抗体を発現させた。精製後に抗体濃度を決定した。GA2-F760について、様々なマウスFcγR(mFcγRI、mFcγRII、mFcγRIII、およびmFcγRIV)に対する結合を評価した。その結果、GA2-F760は上記受容体のいずれにも結合しないことが示された。
10-1. ヒトFcRnトランスジェニックマウスを用いたインビボ試験
ヒトFcRnトランスジェニックマウス(B6.mFcRn-/-.hFcRn Tg line 32 +/+ mouse, Jackson Laboratories; Methods Mol Biol. (2010) 602: 93-104)に対して、hIgA(ヒトIgA:実施例8にて作製)を、単独で、または抗hIgA抗体と組み合わせて投与した後の、hIgAおよび抗hIgA抗体の薬物動態を評価した。hIgAと抗hIgA抗体の混合溶液を尾静脈に10 mL/kgの用量で単回投与した。抗hIgA抗体として、上述のGA2-F760およびGA2-F1331を使用した。
マウス血漿中の抗hIgA抗体濃度をELISA法にて測定した。まずAnti-Human IgG(γ-chain specific) F(ab')2 Fragment Antibody (SIGMA) を各ウェルに分注したNunc-Immuno Plate, MaxiSorp(Nalge nunc International)を4℃で1晩静置することによってAnti-Human IgG固相化プレートを作成した。血漿中濃度の標準液として0.5、0.25、0.125、0.0625、0.03125、0.01563、0.07813μg/mLに調製した抗hIgA抗体の検量線試料と、100倍以上希釈したマウス血漿測定試料とを、前記のAnti-Human IgG固相化プレートに分注した後、当該プレートを25℃で1時間インキュベーションした。その後、Goat Anti-Human IgG (γ chain specific) Biotin (BIOT) Conjugate(Southern Biotechnology Associates Inc.)を前記プレートの各ウェルに分注した後、当該プレートを25℃で1時間反応させた。さらに、Streptavidin-PolyHRP80(Stereospecific Detection Technologies)を前記プレートの各ウェルに分注した後、当該プレートを25℃で1時間反応させた。TMB One Component HRP Microwell Substrate(BioFX Laboratories)を基質として用いた発色反応を、1N硫酸(昭和化学)を用いて停止した後、マイクロプレートリーダーを用いて各ウェルの反応液の450 nmの吸光度を測定した。マウス血漿中の抗hIgA抗体濃度は、検量線の吸光度から解析ソフトウェアSOFTmax PRO(Molecular Devices)を用いて算出した。この方法で測定した静脈内投与後のヒトFcRnトランスジェニックマウスにおけるGA2-F1331およびGA2-F760の血漿中抗体濃度推移を図135に示した。
マウスの血漿中hIgA濃度をELISA法にて測定した。まずGoat anti-Human IgA Antibody(BETHYL)を各ウェルに分注したNunc-Immuno Plate, MaxiSorp(Nalge nunc International)を4℃で1晩静置することによってAnti-Human IgA固相化プレートを作成した。血漿中濃度0.4、0.2、0.1、0.05、0.025、0.0125、0.00625μg/mLの標準液としてhIgAの検量線試料を調製し、マウス血漿測定試料を100倍以上希釈することによりアッセイ用試料を調製した。各試料(100μL)を200μLのhsIL-6R(500 ng/mL)と室温で1時間混合し、続いて、Anti-Human IgA固相化プレートに分注した。次に、Biotinylated Anti-human IL-6 R Antibody(R&D)を前記プレートの各ウェルに分注した後、当該プレートを室温で1時間反応させた。更にStreptavidin-PolyHRP80(Stereospecific Detection Technologies)を前記プレートの各ウェルに分注した後、当該プレートを室温で1時間反応させた。TMB One Component HRP Microwell Substrate(BioFX Laboratories)を基質として用いた発色反応を、1N硫酸(昭和化学)を用いて停止させた後、マイクロプレートリーダーを用いて各ウェルの反応液の450 nmの吸光度を測定した。マウス血漿中濃度を検量線の吸光度から解析ソフトウェアSOFTmax PRO(Molecular Devices)を用いて算出した。この方法で測定した静脈内投与後のヒトFcRnトランスジェニックマウスにおける血漿中hIgA濃度推移を図136に示した。
11-1. 抗ヒトIgE抗体の取得
pH依存的抗ヒトIgE抗体を取得するために、抗原であるヒトIgE(重鎖配列番号:18、軽鎖配列番号:19)(可変領域は抗ヒトGlypican3抗体からなる)をFreeStyle293(Life Technologies)を用いて発現させた。発現したヒトIgEは、当業者公知の一般的なカラムクロマトグラフィー法により精製、調製した。
エンドソーム内で抗原を解離することができる抗体は、抗原に対してpH依存的に結合するだけでなく、Ca依存的に結合する抗原に結合することによっても創製することが可能である。そこで、クローン278およびコントロールとなるpH/Ca依存的IgE結合能を有さないXolair (omalizumab, Novartis)の、ヒトIgE(hIgE)に対するpH依存的結合能およびpH/Ca依存的結合能を評価した。
1.2 mmol/l CaCl2 /0.05% tween20, 20 mmol/l ACES, 150 mmol/l NaCl, pH7.4
1.2 mmol/l CaCl2 /0.05% tween20, 20 mmol/l ACES, 150 mmol/l NaCl, pH5.8
3 μmol/l CaCl2 /0.05% tween20, 20 mmol/l ACES, 150 mmol/l NaCl, pH5.8
次に、FcRn結合が血漿中からの抗原(ヒトIgE)消失に及ぼす効果を評価する目的で、FcγRへの結合を消失させるために278-F760(重鎖配列番号:23;軽鎖配列番号:21)を構築した。さらに、アミノ酸置換G236R、M252Y、S254T、T256E、N434Y、Y436V、Q438R、およびS440Eを278-F760に導入することにより、pH 7.4において278-F760よりも強くFcRnに結合する278-F1331(重鎖配列番号:24;軽鎖配列番号:21)を構築した。278-F1331(重鎖配列番号:24;軽鎖配列番号:21)および278-F760(重鎖配列番号:23;軽鎖配列番号:21)をコードするDNA配列を当業者に公知の方法によって挿入した動物発現プラスミドを用いて、上記の方法により改変抗体を発現させた。精製後に抗体濃度を決定した。
13-1. インビボ評価用のヒトIgE(hIgE(Asp6))の調製
重鎖(配列番号:25)および軽鎖(配列番号:19)からなるインビボ評価用のヒトIgEであるhIgE (Asp6)(可変領域は抗ヒトGlypican3抗体)を、実施例11と同様の方法で調製した。hIgE(Asp6)は、ヒトIgEのN型糖鎖のヘテロジェニティーが抗原であるヒトIgEの血漿中濃度推移の影響を受けないようにするために、ヒトIgEの6か所のN型糖鎖結合サイトのアスパラギンをアスパラギン酸に改変された分子である。
hIgE(Asp6)を抗hIgE抗体(278-F760および278-F1331)ならびに サングロポール(ヒト正常免疫グロブリン、CSLベーリング)と組み合わせてヒトFcRnトランスジェニックマウス(B6.mFcRn-/-.hFcRn Tg系統32 +/+マウス、Jackson Laboratories;Methods Mol Biol. (2010) 602: 93-104)に投与した後に、hIgE(Asp6)および抗ヒトIgE抗体の薬物動態を評価した。hIgE(Asp6)、抗ヒトIgE抗体、およびサングロポールの混合物(濃度を表31に示す)を、尾静脈より10 mL/kgの用量で単回投与した。上記の条件下では、各抗体はhIgE(Asp6)に対して十分に過剰に存在するため、hIgE(Asp6)はほぼ完全に抗体に結合していると予測される。投与から5分後、2時間後、7時間後、1日後、2日後、4日後または5日後、7日後、14日後、21日後、および28日後に、当該マウスから採血した。採取した血液を直ちに15,000 rpm、4℃で5分間遠心分離して、血漿を得た。分離した血漿は、測定を実施するまで-20℃以下に設定された冷凍庫にて保存した。
マウス血漿中の抗hIgE抗体濃度は、電気化学発光(ECL)アッセイによって決定した。32、16、8、4、2、1、0.5、および0.25μg/mLの血漿中濃度で、検量線試料を調製した。hIgE(Asp6)を固定化したECLプレートに、検量線試料およびマウス血漿アッセイ試料を分注した。プレートを4℃で一晩置いた。その後、SULFO-TAG標識抗ウサギ抗体(ヤギ)(Meso Scale Discovery)を室温で1時間反応させた。Read Buffer T(×4)(Meso Scale Discovery)を分注してから直ちに、Sector Imager 2400 Reader(Meso Scale Discovery)により測定を行った。解析ソフトウェアSOFTmax PRO(Molecular Devices)を用いて、検量線の応答からマウス血漿中の濃度を算出した。上記の方法によって決定された静脈内投与後の血漿中抗体濃度の経時変化を図137に示す。
マウス血漿中hIgE(Asp6)濃度をELISA法にて測定した。血漿中濃度として192、96、48、24、12、6、3 ng/mLの検量線試料を調製した。hIgE(Asp6)と抗hIgE抗体の免疫複合体を均一にするため、検量線およびマウス血漿測定試料には、10μg/mLとなるようにXolair(Novartis)を添加し、室温で30分静置させた。静置後の検量線およびマウス血漿測定試料を抗ヒトIgEが固相化されたイムノプレート(MABTECH)もしくは、抗ヒトIgE(clone 107、MABTECH)が固相化されたイムノプレート(Nunc F96 MicroWell Plate(Nalge nunc International))に分注し、室温で2時間静置もしくは4℃で一晩静置させた。その後、ヒトGPC3コアタンパク質(配列番号:26)、NHS-PEG4-ビオチン(Thermo Fisher Scientific)でビオチン化された抗GPC3抗体(中外製薬株式会社にて調製)、ストレプトアビジン-ポリHRP80(Stereospecific Detection Technologies)をそれぞれ1時間順次反応させた。TMB One Component HRP Microwell Substrate(BioFX Laboratories)を基質として用いた発色反応を1N硫酸(昭和化学)で反応停止後、当該発色をマイクロプレートリーダーにて450nmの吸光度を測定する方法、もしくはSuperSignal(r) ELISA Pico Chemiluminescent Substrate(Thermo Fisher Scientific)を基質として発光反応を行い、マイクロプレートリーダーにて発光強度を測定する方法によってマウス血漿中濃度を測定した。マウス血漿中濃度は検量線の吸光度もしくは発光強度から解析ソフトウェアSOFTmax PRO(Molecular Devices)を用いて算出した。この方法で測定された静脈内投与後の血漿中hIgE(Asp6)濃度推移を図138に示した。
抗原として組み換えヒトIL-6受容体を以下のように調製した。J. Immunol. 152, 4958-4968 (1994)で報告されているN末端側1番目から357番目のアミノ酸配列からなる可溶型ヒトIL-6受容体(以下、hsIL-6R)を恒常的に発現する細胞株を当業者公知の方法で樹立し、培養し、hsIL-6Rを発現させた。得られた培養上清から、Blue Sepharose 6 FFカラムクロマトグラフィーおよびゲルろ過クロマトグラフィーの2工程によりhsIL-6Rを精製した。最終工程においてメインピークとして溶出した画分を最終精製品として用いた。
FcRnは、FcRnのα鎖とβ2-ミクログロブリンとのヘテロ二量体である。公表されているヒトFcRn遺伝子配列に基づいてオリゴDNAプライマーを調製した(J Exp Med. 1994 Dec 1; 180(6): 2377-81)。遺伝子全体をコードするDNA断片は、調製したプライマーおよび鋳型としてヒトcDNA(Human Placenta Marathon-Ready cDNA, Clontech)を用いてPCRによって調製した。得られたDNA断片を鋳型として用い、シグナル領域(Met1〜Leu290)を含有する細胞外ドメインをコードするDNA断片をPCRによって増幅し、哺乳動物細胞発現ベクターに挿入した。同様に、公表されているヒトβ2-ミクログロブリン遺伝子配列(Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16899-16903 (2002))に基づいてオリゴDNAプライマーを調製した。遺伝子全体をコードするDNA断片は、調製したプライマーおよび鋳型としてヒトcDNA(Human Placenta Marathon-Ready cDNA, Clontech)を用いてPCRによって調製した。得られたDNA断片を鋳型として用い、シグナル領域(Met1〜Met119)を含有するタンパク質全体をコードするDNA断片をPCRによって増幅し、哺乳動物細胞発現ベクターに挿入した。
H(WT)-IgA1(配列番号:12)とL(WT)(配列番号:13)とを含むhIgAを発現させて、当業者公知の方法によってrProtein L-agarose(ACITgen)の後にゲルろ過クロマトグラフィーを用いて精製した。
抗原として組換え型可溶型ヒトプレキシンA1(以下、hsプレキシンA1)を以下のように調製した。NCBI参照配列(NP_115618)を参照してhsプレキシンA1を構築した。特に、hsプレキシンA1は、上記のNCBI参照由来の27番目から1243番目のアミノ酸配列からなり、そのC末端にFLAGタグ(DYKDDDDK、配列番号:29)が接続された。hsプレキシンA1を、FreeStyle293(Invitrogen)を用いて一過性に発現させ、培養上清から、抗FLAGカラムクロマトグラフィーおよびゲルろ過クロマトグラフィーの2工程により精製した。最終工程においてメインピークとして溶出した分画を最終精製品として用いた。
Claims (32)
- 改変抗体Fc領域を含む抗原結合分子であって、該改変抗体Fc領域が、EU438の位置にアルギニンへのアミノ酸置換を含み、さらに、
a) EU387位におけるアルギニンへのアミノ酸置換;
b) EU422位におけるグルタミン酸、アルギニン、セリン、アスパラギン酸、リジン、スレオニン、またはグルタミンへのアミノ酸置換;
c) EU424位におけるグルタミン酸、アルギニン、リジン、またはアスパラギンへのアミノ酸置換;
d) EU426位におけるアスパラギン酸、グルタミン、アラニン、またはチロシンへのアミノ酸置換;
e) EU433位におけるアスパラギン酸へのアミノ酸置換;
f) EU436位におけるスレオニンへのアミノ酸置換;および
g) EU440位におけるグルタミン酸、アスパラギン酸、またはグルタミンへのアミノ酸置換
からなる群より選択される1つまたは複数のアミノ酸置換を含み、中性pHにおけるリウマトイド因子に対する該改変抗体Fc領域の結合アフィニティーが、インタクトな抗体Fc領域の結合アフィニティーと比較して有意に増強されていない、抗原結合分子。 - 前記改変抗体Fc領域が、次のアミノ酸置換の組み合わせのいずれか1つを含む、請求項1記載の抗原結合分子。
1) EU438R/EU440E
2) EU438R/EU440D - 前記改変抗体Fc領域が、抗体Fc領域におけるEU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置にアミノ酸置換をさらに含み、該置換がpH中性域またはpH酸性域におけるFcRn結合活性を増強する、請求項1または2記載の抗原結合分子。
- 前記改変抗体Fc領域が、アミノ酸置換
i) a) EU438R/EU440E;および
ii) a) M434H、b) M252Y/S254T/T256E、c) M428L/N434S、または d) T250QおよびM428L(EUナンバリング)
を含む、請求項1または2記載の抗原結合分子。 - 前記改変抗体Fc領域が、次のアミノ酸置換の組み合わせのいずれか1つを含む、請求項1または2記載の抗原結合分子。
1) EU252Y/EU254T/EU256E/EU438R/EU440E
2) EU428L/EU434S/EU438R/EU440E
3) EU434H/EU438R/EU440E
4) N434Y/Y436V/Q438R/S440E
5) N434Y/Y436V/Q438R/S440D
6) H433D/N434Y/Y436V/Q438R/S440E
7) H433D/N434Y/Y436V/Q438R/S440D
8) N434Y/Y436T/Q438R/S440E
9) N434Y/Y436T/Q438R/S440D
10) H433D/N434Y/Y436T/Q438R/S440E
11) H433D/N434Y/Y436T/Q438R/S440D - 前記改変抗体Fc領域が、次のアミノ酸置換の組み合わせのいずれか1つを含む、請求項1または2記載の抗原結合分子。
1) L235R/S239K/N434Y/Y436V/Q438R/S440E
2) L235R/S239K/N434Y/Y436V/Q438R/S440D
3) L235R/S239K/H433D/N434Y/Y436V/Q438R/S440E
4) L235R/S239K/H433D/N434Y/Y436V/Q438R/S440D
5) L235R/S239K/N434Y/Y436T/Q438R/S440E
6) L235R/S239K/N434Y/Y436T/Q438R/S440D
7) L235R/S239K/H433D/N434Y/Y436T/Q438R/S440E
8) L235R/S239K/H433D/N434Y/Y436T/Q438R/S440D - 前記改変抗体Fc領域が、次のアミノ酸置換の組み合わせのいずれか1つを含む、請求項1または2記載の抗原結合分子。
1) M252Y/N434Y/Y436V/Q438R/S440E
2) M252Y/N434Y/Y436T/Q438R/S440E
3) M252Y/N434Y/Y436F/Q438R/S440E
4) M252Y/N434Y/Y436V/Q438R/S440D
5) M252Y/H433D/N434Y/Y436V/Q438R/S440D
6) M252Y/H433D/N434Y/Y436V/Q438R/S440E
7) M252Y/H433D/N434W/Y436V/Q438R/S440E
8) M252Y/S254T/T256B/H433D/N434Y/Y436V/Q438R/S440E
9) M252Y/S254T/T256E/H433D/N434Y/Y436V/Q438R/S440D
10) M252Y/S254T/T256E/N286E/H433D/N434Y/Y436V/Q438R/S440E
11) M252Y/S254T/T256E/N286E/H433D/N434Y/Y436V/Q438R/S440D
12) M252Y/S254T/R255L/T256E/H433D/N434Y/Y436V/Q438R/S440E
13) M252Y/S254T/R255L/T256E/H433D/N434Y/Y436V/Q438R/S440D
14) M252Y/S254T/R255L/T256E/E258D/H433D/N434Y/Y436V/Q438R/S440E
15) M252Y/S254T/R255L/T256E/E258I/H433D/N434Y/Y436V/Q438R/S440E
16) M252Y/S254T/R255L/T256E/E258D/H433D/N434Y/Y436V/Q438R/S440D
17) M252Y/S254T/R255L/T256E/E258I/H433D/N434Y/Y436V/Q438R/S440D
18) M252Y/S254T/T256E/H433A/N434Y/Y436V/Q438R/S440E
19) M252Y/S254T/T256E/H433K/N434Y/Y436V/Q438R/S440E
20) M252Y/S254T/T256E/H433P/N434Y/Y436V/Q438R/S440E
21) M252Y/S254T/T256E/H433R/N434Y/Y436V/Q438R/S440E
22) M252Y/S254T/T256E/H433S/N434Y/Y436V/Q438R/S440E
23) M252Y/S254T/T256E/H433A/N434Y/Y436V/Q438R/S440D
24) M252Y/S254T/T256E/H433K/N434Y/Y436V/Q438R/S440D
25) M252Y/S254T/T256E/H433P/N434Y/Y436V/Q438R/S440D
26) M252Y/S254T/T256E/H433R/N434Y/Y436V/Q438R/S440D
27) M252Y/S254T/T256E/H433S/N434Y/Y436V/Q438R/S440D
28) L235R/G236R/S239K/M252Y/S254T/N434Y/Y436V/Q438R/S440E
29) L235R/G236R/S239K/M252Y/S254T/T256E/N434Y/Y436V/Q438R/S440E
30) EU252Y/EU434Y/EU436V/EU438R/EU440E
31) EU252Y/EU434Y/EU436V/EU438R/EU440D - pH7.4における抗原結合活性がpH5.8における抗原結合活性よりも2倍以上高い抗体可変領域、または、イオン化カルシウム濃度0.1μM〜30μMにおける抗原結合活性がイオン化カルシウム濃度100μM〜10 mMにおける抗原結合活性よりも低い抗体可変領域を含む、請求項1〜8のいずれか一項記載の抗原結合分子。
- 以下の工程を含む、中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されており、かつ中性pHにおけるリウマトイド因子に対する結合活性が増強されている抗体Fc領域を含む抗原結合分子の、リウマトイド因子に対する結合活性を低下させる方法:
a) 中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されており、かつ中性pHにおけるリウマトイド因子に対する結合活性が増強されている抗体Fc領域を有する抗原結合分子を提供する工程;および
b) EU438の位置のアミノ酸をアルギニンへ置換して、改変抗体Fc領域を有する抗原結合分子をもたらす工程。 - 工程b)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置においてアミノ酸を置換することを含む、請求項10記載の方法。
- 工程b)が、次のアミノ酸置換の組み合わせのいずれか1つを抗体Fc領域に導入することを含む、請求項11記載の方法。
1) EU438R/EU440E
2) EU438R/EU440D - 以下の工程を含む、親抗体と比較して中性pHにおけるリウマトイド因子に対する改変抗体Fc領域の結合活性を有意に増強することなく、単一の抗原結合分子が結合できる抗原の総数を増加させる方法:
a) 親抗体Fc領域を含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することにより、工程a)の親抗体Fc領域を改変する工程;ならびに
c) EU438の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸をアルギニンへ置換することにより、工程b)の改変抗体Fc領域を改変する工程。 - 工程c)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することを含む、請求項13記載の方法。
- 以下の工程を含む、親抗体と比較して中性pHにおけるリウマトイド因子に対する改変抗体Fc領域の結合活性を有意に増強することなく、抗原と結合した状態で細胞内に取り込まれた抗原結合分子の、抗原と結合していない状態での細胞外への放出を促進する方法:
a) 親抗体Fc領域を含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436、およびEU428からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することにより、親抗体Fc領域を改変する工程;ならびに
c) EU438の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸をアルギニンへ置換することにより、工程b)の改変抗体Fc領域を改変する工程。 - 工程c)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することを含む、請求項15記載の方法。
- 以下の工程を含む、親抗体と比較して中性pHにおけるリウマトイド因子に対する改変抗体Fc領域の結合活性を有意に増強することなく、抗原結合分子の血漿中抗原消失能を増強する方法:
a) 親抗体Fc領域を含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436、およびEU428からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することにより、親抗体Fc領域を改変する工程;ならびに
c) EU438の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸をアルギニンへ置換することにより、工程b)の改変抗体Fc領域を改変する工程。 - 工程c)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することを含む、請求項17記載の方法。
- 以下の工程を含む、親抗体と比較して中性pHにおけるリウマトイド因子に対する改変抗体Fc領域の結合活性を有意に増強することなく、抗原結合分子の薬物動態を改善する方法:
a) 親抗体Fc領域を含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することにより、親抗体Fc領域を改変する工程;ならびに
c) EU438の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸をアルギニンへ置換することにより、工程b)の改変抗体Fc領域を改変する工程。 - 工程c)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することを含む、請求項19記載の方法。
- 以下の工程を含む、親抗体と比較して中性pHにおけるリウマトイド因子に対する改変抗体Fc領域の結合活性を有意に増強することなく、血漿中の総抗原濃度または遊離抗原濃度を低下させる方法:
a) 親抗体Fc領域を含む抗原結合分子であって、該抗原と結合し得る抗原結合ドメインを含む抗原結合分子を提供する工程、
b) EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することにより、親抗体Fc領域を改変する工程;ならびに
c) EU438の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸をアルギニンへ置換することにより、工程b)の改変抗体Fc領域を改変する工程。 - 工程c)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置において、親抗体Fc領域のアミノ酸配列中のアミノ酸を置換することを含む、請求項21記載の方法。
- 工程b)で導入されるアミノ酸置換が、次の組み合わせのうちの1つである、請求項13〜22のいずれか一項記載の方法。
a) EU252/EU434/EU307/EU311/EU436/EU286
b) EU252/EU434/EU307/EU311/EU436/EU308
c) EU252/EU434/EU307/EU311/EU436/EU286/EU308
d) EU252/EU434/EU307/EU311/EU436/EU428
e) EU252/EU434/EU307/EU311/EU436/EU308/EU428
f) EU252/EU434/EU307/EU311/EU436/EU250/EU428
g) EU252/EU434/EU307/EU311/EU436/EU250/EU308
h) EU252/EU434/EU307/EU311/EU436/EU250/EU286/EU308
i) EU252/EU434/EU307/EU311/EU436/EU250/EU286/EU308/EU428 - 工程b)で導入されるアミノ酸置換が、次の組み合わせのうちの1つである、請求項13〜22のいずれか一項記載の方法。
a) EU252/EU434/EU307/EU311/EU286
b) EU252/EU434/EU307/EU311/EU286/EU254
c) EU252/EU434/EU307/EU311/EU436
d) EU252/EU434/EU307/EU311/EU436/EU254
e) EU252/EU434/EU307/EU311/EU436/EU250
f) EU252/EU434/EU308/EU250
g) EU252/EU434/EU308/EU250/EU436
h) EU252/EU434/EU308/EU250/EU307/EU311 - 工程b)で導入されるアミノ酸置換が、次の組み合わせのうちの1つである、請求項13〜22のいずれか一項記載の方法。
a) EU252/EU315/EU434
b) EU252/EU434/EU436
c) EU252/EU254/EU434/EU436 - 工程b)で導入されるアミノ酸置換が、次の組み合わせのうちの1つである、請求項13〜22のいずれか一項記載の方法。
a) EU307/EU311/EU434
b) EU307/EU309/EU311/EU434
c) EU307/EU309/EU311/EU434
d) EU250/EU252/EU434/EU436 - 工程c)が、次の組み合わせのうちの1つを導入する工程を含む、請求項13〜22のいずれか一項記載の方法。
1) EU438R/EU440E
2) EU438R/EU440D - 以下の工程を含む、中性pHまたは酸性pHにおけるFcRnに対する結合活性が増強されており、かつ中性pHにおけるリウマトイド因子に対する結合活性が低下しているFcドメインを含む抗原結合分子を製造する方法:
(a) pH中性域またはpH酸性域におけるFcRnに対する結合活性、およびpH中性域におけるリウマトイド因子に対する結合活性が増強されているFcドメインを提供する工程、
(b) EU438の位置において、Fc領域のアミノ酸配列中のアミノ酸をアルギニンへ置換する工程、
(c) 次のいずれかの工程:
(i) pH7.4における抗体可変領域の抗原結合活性を決定する工程、pH5.8における抗体可変領域の抗原結合活性を決定する工程、および、pH7.4における抗原結合活性がpH5.8における抗原結合活性よりも2倍以上高い抗体可変領域を選択する工程を含む、pH依存的抗体可変領域を選択する工程、または
(ii) イオン化カルシウム濃度0.1μM〜30μMにおける抗体可変領域の抗原結合活性を決定する工程、イオン化カルシウム濃度100μM〜10 mMにおける抗体可変領域の抗原結合活性を決定する工程、および、イオン化カルシウム濃度0.1μM〜30μMにおける抗原結合活性がイオン化カルシウム濃度100μM〜10 mMにおける抗原結合活性よりも低い抗体可変領域を選択する工程を含む、カルシウムイオン依存的抗体可変領域を選択する工程、
(d) (b)において調製されたヒトFcドメインおよび(c)において調製された抗体可変領域が連結された抗原結合分子をコードする遺伝子を得る工程、ならびに
(e) (d)において調製された遺伝子を用いて抗原結合分子を製造する工程。 - 工程b)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置において、Fc領域のアミノ酸配列中のアミノ酸を置換することを含む、請求項28記載の方法。
- pH中性域またはpH酸性域におけるFcRnに対する結合活性ならびにpH中性域におけるリウマトイド因子に対する結合活性が増強されている前記Fcドメインが、EU238、EU250、EU252、EU254、EU255、EU256、EU258、EU286、EU307、EU308、EU309、EU311、EU315、EU428、EU433、EU434、およびEU436からなる群より選択される1つまたは複数の位置にアミノ酸の置換を含む、請求項28または29記載の方法。
- 以下の工程を含む、抗原結合分子を製造する方法:
(a) 親抗体Fc領域を選択し、該親抗体Fc領域を、EU438の位置において、アミノ酸配列中のアミノ酸をアルギニンへ置換することにより改変する工程;
(b) 次のいずれかの工程:
(i) pH7.4における抗体可変領域の抗原結合活性を決定する工程、pH5.8における抗体可変領域の抗原結合活性を決定する工程、および、pH7.4における抗原結合活性がpH5.8における抗原結合活性よりも2倍以上高い抗体可変領域を選択する工程を含む、pH依存的抗体可変領域を選択する工程、または
(ii) イオン化カルシウム濃度0.1μM〜30μMにおける抗体可変領域の抗原結合活性を決定する工程、イオン化カルシウム濃度100μM〜10 mMにおける抗体可変領域の抗原結合活性を決定する工程、および、イオン化カルシウム濃度0.1μM〜30μMにおける抗原結合活性がイオン化カルシウム濃度100μM〜10 mMにおける抗原結合活性よりも低い抗体可変領域を選択する工程を含む、カルシウムイオン依存的抗体可変領域を選択する工程;
(c) (a)および(b)において調製されたヒト抗体Fc領域および抗体可変領域が連結された抗原結合分子をコードする遺伝子を得る工程;ならびに
(d) (c)において調製された遺伝子を用いて、抗原結合分子を製造する工程。 - 工程a)が、さらに、EU440、EU436、EU433、EU426、EU424、EU422、およびEU387からなる群より選択される1つまたは複数の位置において、Fc領域のアミノ酸配列中のアミノ酸を置換することを含む、請求項31記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014514947A JP6204350B2 (ja) | 2011-09-30 | 2012-09-28 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
Applications Claiming Priority (16)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011218736 | 2011-09-30 | ||
| JP2011218736 | 2011-09-30 | ||
| JPPCT/JP2012/058603 | 2012-03-30 | ||
| PCT/JP2012/058603 WO2012133782A1 (ja) | 2011-03-30 | 2012-03-30 | 抗原結合分子の血漿中滞留性と免疫原性を改変する方法 |
| JP2012123773 | 2012-05-30 | ||
| JP2012123782 | 2012-05-30 | ||
| JP2012123781 | 2012-05-30 | ||
| JP2012123782 | 2012-05-30 | ||
| JP2012123773 | 2012-05-30 | ||
| JP2012123781 | 2012-05-30 | ||
| JP2012139211 | 2012-06-20 | ||
| JP2012139211 | 2012-06-20 | ||
| JP2012177311 | 2012-08-09 | ||
| JP2012177311 | 2012-08-09 | ||
| PCT/JP2012/006218 WO2013046704A2 (en) | 2011-09-30 | 2012-09-28 | THERAPEUTIC ANTIGEN-BINDING MOLECULE WITH A FcRn-BINDING DOMAIN THAT PROMOTES ANTIGEN CLEARANCE |
| JP2014514947A JP6204350B2 (ja) | 2011-09-30 | 2012-09-28 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017166638A Division JP6541730B2 (ja) | 2011-09-30 | 2017-08-31 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2014528906A JP2014528906A (ja) | 2014-10-30 |
| JP2014528906A5 JP2014528906A5 (ja) | 2015-11-12 |
| JP6204350B2 true JP6204350B2 (ja) | 2017-09-27 |
Family
ID=47996560
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014514947A Active JP6204350B2 (ja) | 2011-09-30 | 2012-09-28 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
| JP2017166638A Active JP6541730B2 (ja) | 2011-09-30 | 2017-08-31 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
| JP2019108321A Active JP7001637B2 (ja) | 2011-09-30 | 2019-06-11 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
| JP2021211155A Pending JP2022034037A (ja) | 2011-09-30 | 2021-12-24 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017166638A Active JP6541730B2 (ja) | 2011-09-30 | 2017-08-31 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
| JP2019108321A Active JP7001637B2 (ja) | 2011-09-30 | 2019-06-11 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
| JP2021211155A Pending JP2022034037A (ja) | 2011-09-30 | 2021-12-24 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
Country Status (14)
| Country | Link |
|---|---|
| US (3) | US10253100B2 (ja) |
| EP (3) | EP2760890B1 (ja) |
| JP (4) | JP6204350B2 (ja) |
| KR (1) | KR20140069332A (ja) |
| CN (2) | CN108948197A (ja) |
| AU (2) | AU2012313670B2 (ja) |
| BR (1) | BR112014007290A2 (ja) |
| CA (1) | CA2850035A1 (ja) |
| HK (1) | HK1257946A1 (ja) |
| MX (1) | MX2014003891A (ja) |
| RU (2) | RU2014117500A (ja) |
| SG (2) | SG11201401098TA (ja) |
| TW (3) | TW201817744A (ja) |
| WO (1) | WO2013046704A2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018048120A (ja) * | 2011-09-30 | 2018-03-29 | 中外製薬株式会社 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
| US11780912B2 (en) | 2016-08-05 | 2023-10-10 | Chugai Seiyaku Kabushiki Kaisha | Composition for prophylaxis or treatment of IL-8 related diseases |
Families Citing this family (80)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4342995A2 (en) | 2006-03-31 | 2024-03-27 | Chugai Seiyaku Kabushiki Kaisha | Methods for controlling blood pharmacokinetics of antibodies |
| MX2010003450A (es) | 2007-09-26 | 2010-04-27 | Chugai Pharmaceutical Co Ltd | Region constante de anticuerpo modificada. |
| EP3127921A1 (en) | 2007-09-26 | 2017-02-08 | Chugai Seiyaku Kabushiki Kaisha | Method of modifying isoelectric point of antibody via amino acid substition in cdr |
| KR102269708B1 (ko) | 2008-04-11 | 2021-06-25 | 추가이 세이야쿠 가부시키가이샤 | 복수 분자의 항원에 반복 결합하는 항원 결합 분자 |
| TWI440469B (zh) | 2008-09-26 | 2014-06-11 | Chugai Pharmaceutical Co Ltd | Improved antibody molecules |
| AU2011337704B2 (en) | 2010-11-30 | 2017-06-15 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule capable of binding to plurality of antigen molecules repeatedly |
| KR102147548B1 (ko) | 2011-02-25 | 2020-08-24 | 추가이 세이야쿠 가부시키가이샤 | FcγRIIb 특이적 Fc 항체 |
| EP3939996A1 (en) | 2011-09-30 | 2022-01-19 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule promoting disappearance of antigens having plurality of biological activities |
| TWI681970B (zh) | 2011-09-30 | 2020-01-11 | 日商中外製藥股份有限公司 | 包含依離子濃度之條件對抗原之結合活性會改變之抗原結合分域、及於pH中性之條件下對FcRn有結合活性之FcRn結合分域、且誘導對標的抗原的免疫反應之抗原結合分子 |
| CN113416256A (zh) * | 2011-11-30 | 2021-09-21 | 中外制药株式会社 | 包含进入细胞内以形成免疫复合体的搬运体(载体)的药物 |
| US20150353630A1 (en) * | 2012-05-30 | 2015-12-10 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule for eliminating aggregated antigens |
| MX2014014678A (es) | 2012-05-30 | 2015-02-10 | Chugai Pharmaceutical Co Ltd | Molecula de union al antigeno especifico para el tejido objetivo. |
| US11236168B2 (en) | 2012-08-24 | 2022-02-01 | Chugai Seiyaku Kabushiki Kaisha | Mouse FcγammaRII-specific Fc antibody |
| TWI717591B (zh) | 2012-08-24 | 2021-02-01 | 日商中外製藥股份有限公司 | FcγRIIb特異性Fc區域變異體 |
| AU2014248515B2 (en) | 2013-03-13 | 2019-03-07 | Prothena Biosciences Limited | Tau immunotherapy |
| KR20210130260A (ko) | 2013-04-02 | 2021-10-29 | 추가이 세이야쿠 가부시키가이샤 | Fc영역 개변체 |
| MX2016002870A (es) | 2013-09-05 | 2017-02-23 | Amgen Inc | Moleculas que contienen fc que presentan perfiles de glicoforma predecibles, consistentes y reproducibles. |
| JP6534615B2 (ja) | 2013-09-27 | 2019-06-26 | 中外製薬株式会社 | ポリペプチド異種多量体の製造方法 |
| KR20220142539A (ko) | 2013-12-04 | 2022-10-21 | 추가이 세이야쿠 가부시키가이샤 | 화합물의 농도에 따라 항원 결합능이 변화되는 항원 결합 분자 및 그의 라이브러리 |
| NZ711451A (en) | 2014-03-07 | 2016-05-27 | Alexion Pharma Inc | Anti-c5 antibodies having improved pharmacokinetics |
| US10780182B2 (en) | 2014-04-25 | 2020-09-22 | The Trustees Of The University Of Pennsylvania | Methods and compositions for treating metastatic breast cancer and other cancers in the brain |
| JP6974943B2 (ja) | 2014-05-13 | 2021-12-01 | ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア | 2種の抗体構築物を発現するaavを含む組成物およびこの使用 |
| MA40764A (fr) | 2014-09-26 | 2017-08-01 | Chugai Pharmaceutical Co Ltd | Agent thérapeutique induisant une cytotoxicité |
| MA41294A (fr) | 2014-12-19 | 2017-11-08 | Chugai Pharmaceutical Co Ltd | Anticorps anti-myostatine, polypeptides contenant des variants de régions fc, et procédés d'utilisation |
| EP3233921B1 (en) | 2014-12-19 | 2021-09-29 | Chugai Seiyaku Kabushiki Kaisha | Anti-c5 antibodies and methods of use |
| US10633433B2 (en) | 2015-01-28 | 2020-04-28 | Prothena Biosciences Limited | Anti-transthyretin antibodies |
| US9879080B2 (en) | 2015-01-28 | 2018-01-30 | Prothena Biosciences Limited | Anti-transthyretin antibodies |
| US10464999B2 (en) | 2015-01-28 | 2019-11-05 | Prothena Biosciences Limited | Anti-transthyretin antibodies |
| MA41459A (fr) * | 2015-02-03 | 2017-12-12 | Als Therapy Development Inst | Anticorps anti-cd40l et méthodes pour traiter des maladies ou des troubles liés aux cd40l |
| CN114773470A (zh) | 2015-02-05 | 2022-07-22 | 中外制药株式会社 | 包含离子浓度依赖性的抗原结合结构域的抗体,fc区变体,il-8-结合抗体及其应用 |
| CA2972393A1 (en) | 2015-02-27 | 2016-09-01 | Chugai Seiyaku Kabushiki Kaisha | Composition for treating il-6-related diseases |
| FR3038517B1 (fr) * | 2015-07-06 | 2020-02-28 | Laboratoire Francais Du Fractionnement Et Des Biotechnologies | Utilisation de fragments fc modifies en immunotherapie |
| FR3039832A1 (fr) * | 2015-08-04 | 2017-02-10 | Univ Francois Rabelais De Tours | Igg1 et leur utilisation therapeutique |
| JP6953020B2 (ja) | 2015-09-08 | 2021-10-27 | セリピオン, インコーポレイテッド | ApoA−1融合ポリペプチドならびに関連する組成物および方法 |
| MX2018003005A (es) | 2015-09-18 | 2018-04-11 | Chugai Pharmaceutical Co Ltd | Anticuerpos que se unen a interleucina 8 (il-8) y sus usos. |
| BR112018008407A2 (pt) | 2015-10-28 | 2018-11-27 | Univ Pennsylvania | administração intratecal de vetores virais adenoassociados para terapia genética |
| JP7141336B2 (ja) * | 2015-12-25 | 2022-09-22 | 中外製薬株式会社 | 抗ミオスタチン抗体および使用方法 |
| TN2018000301A1 (en) * | 2016-03-14 | 2020-01-16 | Univ Oslo | Engineered immunoglobulins with altered fcrn binding |
| EA201892417A1 (ru) | 2016-05-02 | 2019-05-31 | Протена Биосайенсис Лимитед | Антитела, распознающие тау |
| EP3452507B1 (en) | 2016-05-02 | 2022-10-19 | Prothena Biosciences Limited | Tau immunotherapy |
| MX2018015721A (es) | 2016-07-29 | 2019-05-27 | Chugai Pharmaceutical Co Ltd | Anticuerpos biespecificos que exhiben actividad de funcion de cofactor fviii alternativa mejorada. |
| CN110072887A (zh) | 2016-08-02 | 2019-07-30 | 威特拉公司 | 工程化多肽及其应用 |
| SG10201607778XA (en) | 2016-09-16 | 2018-04-27 | Chugai Pharmaceutical Co Ltd | Anti-Dengue Virus Antibodies, Polypeptides Containing Variant Fc Regions, And Methods Of Use |
| CN110177875B (zh) * | 2016-11-28 | 2023-11-28 | 中外制药株式会社 | 包含抗原结合结构域和运送部分的多肽 |
| WO2018139623A1 (en) | 2017-01-30 | 2018-08-02 | Chugai Seiyaku Kabushiki Kaisha | Anti-sclerostin antibodies and methods of use |
| US11851486B2 (en) | 2017-05-02 | 2023-12-26 | National Center Of Neurology And Psychiatry | Method for predicting and evaluating therapeutic effect in diseases related to IL-6 and neutrophils |
| AU2018263935A1 (en) | 2017-05-02 | 2019-12-19 | Prothena Biosciences Limited | Antibodies recognizing tau |
| CN110914294A (zh) * | 2017-05-12 | 2020-03-24 | 夏尔人类遗传性治疗公司 | 重组卵泡抑素-fc融合蛋白及其在治疗杜氏肌营养不良中的用途 |
| US11384152B2 (en) * | 2017-05-24 | 2022-07-12 | Als Therapy Development Institute | Therapeutic anti-CD40 ligand antibodies |
| ES2923143T3 (es) | 2017-05-25 | 2022-09-23 | Bristol Myers Squibb Co | Anticuerpos monoclonales antagonistas contra CD40 y sus usos |
| CN116271012A (zh) | 2017-07-27 | 2023-06-23 | 瑞颂医药公司 | 高浓度抗c5抗体制剂 |
| WO2019033087A1 (en) * | 2017-08-11 | 2019-02-14 | Research Development Foundation | MODIFIED FC ANTIBODY VARIANTS FOR ENHANCED SERIAL HALF LIFE |
| JP7357609B2 (ja) | 2017-10-06 | 2023-10-06 | ノボ ノルディスク エー/エス | 抗トランスサイレチン抗体 |
| SG11202004187UA (en) | 2017-11-29 | 2020-06-29 | Prothena Biosciences Ltd | Lyophilized formulation of a monoclonal antibody against transthyretin |
| US11629198B2 (en) | 2017-12-05 | 2023-04-18 | The Trustees Of The University Of Pennsylvania | Fusion proteins and antibodies targeting human red blood cell antigens |
| MX2020009296A (es) | 2018-03-15 | 2020-11-13 | Chugai Pharmaceutical Co Ltd | Anticuerpos anti-virus del dengue que tienen reactividad cruzada con el virus zika y metodos de uso. |
| US20210238308A1 (en) | 2018-06-04 | 2021-08-05 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule showing changed half-life in cytoplasm |
| AR114550A1 (es) | 2018-08-10 | 2020-09-16 | Chugai Pharmaceutical Co Ltd | Moléculas de unión al antígeno anti-cd137 y sus usos |
| CR20210166A (es) | 2018-09-06 | 2021-07-27 | Cidara Therapeutics Inc | Composiciones y métodos para el tratamiento de infecciones virales |
| US20230416385A1 (en) * | 2018-11-01 | 2023-12-28 | Shandong New Time Pharmaceutical Co., Ltd. | Bispecific antibody and use thereof |
| AR117091A1 (es) | 2018-11-19 | 2021-07-07 | Bristol Myers Squibb Co | Anticuerpos monoclonales antagonistas contra cd40 y sus usos |
| AR117453A1 (es) * | 2018-12-20 | 2021-08-04 | Genentech Inc | Fc de anticuerpos modificados y métodos para utilizarlas |
| JP2022524588A (ja) | 2019-03-03 | 2022-05-09 | プロセナ バイオサイエンシーズ リミテッド | タウ認識抗体 |
| EP3943108A4 (en) | 2019-03-19 | 2023-01-04 | Chugai Seiyaku Kabushiki Kaisha | ANTIGEN-BINDING MOLECULE CONTAINING AN ANTIGEN-BINDING DOMAIN WHOSE ANTIGEN-BINDING ACTIVITY IS ALTERED DEPENDING ON THE MTA, AND BANK FOR OBTAINING SUCH ANTIGEN-BINDING DOMAIN |
| KR20210149779A (ko) | 2019-04-10 | 2021-12-09 | 추가이 세이야쿠 가부시키가이샤 | Fc 영역 개변 항체의 정제 방법 |
| CA3137649A1 (en) * | 2019-05-15 | 2020-11-19 | Chugai Seiyaku Kabushiki Kaisha | An antigen-binding molecule, a pharmaceutical composition, and a method |
| CA3148764A1 (en) * | 2019-07-25 | 2021-01-28 | Genzyme Corporation | Methods of treating antibody-mediated disorders with fcrn antagonists |
| CN114599389A (zh) * | 2019-08-22 | 2022-06-07 | 奇达拉治疗公司 | 变体fc结构域及其用途 |
| TW202122117A (zh) | 2019-09-06 | 2021-06-16 | 美商席達拉醫療有限公司 | 用於治療病毒感染之組合物及方法 |
| AU2020403913A1 (en) | 2019-12-18 | 2022-06-09 | F. Hoffmann-La Roche Ag | Bispecific anti-CCL2 antibodies |
| AU2019479791A1 (en) | 2019-12-27 | 2022-07-14 | Chugai Seiyaku Kabushiki Kaisha | Anti-CTLA-4 antibody and use thereof |
| TW202144395A (zh) | 2020-02-12 | 2021-12-01 | 日商中外製藥股份有限公司 | 用於癌症之治療的抗cd137抗原結合分子 |
| AR122766A1 (es) * | 2020-06-29 | 2022-10-05 | Hanall Biopharma Co Ltd | Formulación para anticuerpos anti-fcrn |
| WO2022044248A1 (ja) | 2020-08-28 | 2022-03-03 | 中外製薬株式会社 | ヘテロ二量体Fcポリペプチド |
| CN113063949A (zh) * | 2021-03-23 | 2021-07-02 | 中国医学科学院输血研究所 | 一种血浆中特异性IgM抗体的定量测定方法 |
| AR125344A1 (es) | 2021-04-15 | 2023-07-05 | Chugai Pharmaceutical Co Ltd | Anticuerpo anti-c1s |
| EP4342984A1 (en) | 2021-05-19 | 2024-03-27 | Chugai Seiyaku Kabushiki Kaisha | Method for predicting in vivo pharmacokinetics of molecule |
| WO2022263501A1 (en) | 2021-06-18 | 2022-12-22 | F. Hoffmann-La Roche Ag | Bispecific anti-ccl2 antibodies |
| CN117616123A (zh) | 2021-06-25 | 2024-02-27 | 中外制药株式会社 | 抗ctla-4抗体 |
| AR126236A1 (es) | 2021-06-25 | 2023-10-04 | Chugai Pharmaceutical Co Ltd | Uso del anticuerpo anti-ctla-4 |
Family Cites Families (236)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4769320A (en) | 1982-07-27 | 1988-09-06 | New England Medical Center Hospitals, Inc. | Immunoassay means and methods useful in human native prothrombin and human abnormal prothorombin determinations |
| JPS58201994A (ja) | 1982-05-21 | 1983-11-25 | Hideaki Hagiwara | 抗原特異的ヒト免疫グロブリンの生産方法 |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| JPH06104071B2 (ja) | 1986-08-24 | 1994-12-21 | 財団法人化学及血清療法研究所 | 第▲ix▼因子コンホメ−シヨン特異性モノクロ−ナル抗体 |
| US4801687A (en) | 1986-10-27 | 1989-01-31 | Bioprobe International, Inc. | Monoclonal antibody purification process using protein A |
| US4851341A (en) | 1986-12-19 | 1989-07-25 | Immunex Corporation | Immunoaffinity purification system |
| US5004697A (en) | 1987-08-17 | 1991-04-02 | Univ. Of Ca | Cationized antibodies for delivery through the blood-brain barrier |
| US4803247A (en) | 1987-10-27 | 1989-02-07 | Allied-Signal Inc. | Polyamide compositions having nitrile rubber and copolymer of ethylene and alpha-olefin therein |
| JPH01144991A (ja) | 1987-12-02 | 1989-06-07 | Kagaku Oyobi Ketsusei Riyouhou Kenkyusho | 血液凝固第8因子の精製方法 |
| US5322678A (en) | 1988-02-17 | 1994-06-21 | Neorx Corporation | Alteration of pharmacokinetics of proteins by charge modification |
| JPH0636741B2 (ja) | 1989-11-08 | 1994-05-18 | 帝人株式会社 | ヒト・プロテインcの分離方法 |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| ATE185601T1 (de) | 1990-07-10 | 1999-10-15 | Cambridge Antibody Tech | Verfahren zur herstellung von spezifischen bindungspaargliedern |
| DK0814159T3 (da) | 1990-08-29 | 2005-10-24 | Genpharm Int | Transgene, ikke-humane dyr, der er i stand til at danne heterologe antistoffer |
| DE122009000019I1 (de) | 1991-04-25 | 2009-07-16 | Chugai Seiyaku K K 5 1 | Rekombinierte humane antikörper gegen den humanen interleukin-6 rezeptor |
| DK0605522T3 (da) | 1991-09-23 | 2000-01-17 | Medical Res Council | Fremgangsmåde til fremstilling af humaniserede antistoffer |
| ATE463573T1 (de) | 1991-12-02 | 2010-04-15 | Medimmune Ltd | Herstellung von autoantikörpern auf phagenoberflächen ausgehend von antikörpersegmentbibliotheken |
| JPH07503132A (ja) | 1991-12-17 | 1995-04-06 | ジェンファーム インターナショナル,インコーポレイティド | 異種抗体を産生することができるトランスジェニック非ヒト動物 |
| CA2131151A1 (en) | 1992-03-24 | 1994-09-30 | Kevin S. Johnson | Methods for producing members of specific binding pairs |
| ES2301158T3 (es) | 1992-07-24 | 2008-06-16 | Amgen Fremont Inc. | Produccion de anticuerpos xenogenicos. |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| WO1994029471A1 (en) | 1993-06-10 | 1994-12-22 | Genetic Therapy, Inc. | Adenoviral vectors for treatment of hemophilia |
| GB9313509D0 (en) | 1993-06-30 | 1993-08-11 | Medical Res Council | Chemisynthetic libraries |
| FR2707189B1 (fr) | 1993-07-09 | 1995-10-13 | Gradient Ass | Procédé de traitement de résidus de combustion et installation de mise en Óoeuvre dudit procédé. |
| GB9314271D0 (en) | 1993-07-09 | 1993-08-18 | Inst Of Cancer The Research | Cell growth factor receptors |
| IL107742A0 (en) | 1993-11-24 | 1994-02-27 | Yeda Res & Dev | Chemically-modified binding proteins |
| US6214613B1 (en) | 1993-12-03 | 2001-04-10 | Ashai Kasei Kogyo Kabushiki Kaisha | Expression screening vector |
| WO1995015388A1 (en) | 1993-12-03 | 1995-06-08 | Medical Research Council | Recombinant binding proteins and peptides |
| US6074642A (en) | 1994-05-02 | 2000-06-13 | Alexion Pharmaceuticals, Inc. | Use of antibodies specific to human complement component C5 for the treatment of glomerulonephritis |
| CA2194907A1 (en) | 1994-07-13 | 1996-02-01 | Kouji Matsushima | Reshaped human antibody against human interleukin-8 |
| US6309636B1 (en) | 1995-09-14 | 2001-10-30 | Cancer Research Institute Of Contra Costa | Recombinant peptides derived from the Mc3 anti-BA46 antibody, methods of use thereof, and methods of humanizing antibody peptides |
| RU2147443C1 (ru) | 1994-10-07 | 2000-04-20 | Чугаи Сейяку Кабусики Кайся | Лечебные средства против хронического ревматоидного артрита, содержащие антагонист il-6 в качестве эффективного компонента |
| EP1884524A3 (en) | 1994-10-21 | 2008-06-25 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for treatment of diseases caused by IL-6 production |
| US6485943B2 (en) | 1995-01-17 | 2002-11-26 | The University Of Chicago | Method for altering antibody light chain interactions |
| EP0822830B1 (en) | 1995-04-27 | 2008-04-02 | Amgen Fremont Inc. | Human anti-IL-8 antibodies, derived from immunized xenomice |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| CA2249195A1 (en) | 1996-03-18 | 1997-09-25 | Board Of Regents, The University Of Texas System | Immunoglobin-like domains with increased half lives |
| CZ399A3 (cs) | 1996-07-19 | 1999-06-16 | Amgen Inc. | Polypeptidová analoga kationaktivních polypeptidů |
| KR100847441B1 (ko) | 1996-09-26 | 2008-07-21 | 츄가이 세이야꾸 가부시키가이샤 | 인간의 부갑상선 호르몬 관련 펩티드에 대한 항체 |
| US5990286A (en) | 1996-12-18 | 1999-11-23 | Techniclone, Inc. | Antibodies with reduced net positive charge |
| US6277375B1 (en) | 1997-03-03 | 2001-08-21 | Board Of Regents, The University Of Texas System | Immunoglobulin-like domains with increased half-lives |
| US20070059302A1 (en) | 1997-04-07 | 2007-03-15 | Genentech, Inc. | Anti-vegf antibodies |
| US6884879B1 (en) | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| FR2761994B1 (fr) | 1997-04-11 | 1999-06-18 | Centre Nat Rech Scient | Preparation de recepteurs membranaires a partir de baculovirus extracellulaires |
| US5897781A (en) | 1997-06-06 | 1999-04-27 | Waters Investments Limited | Active pump phasing to enhance chromatographic reproducibility |
| RU2221809C2 (ru) | 1997-10-03 | 2004-01-20 | Тугаи Сейяку Кабусики Кайся | Способ получения природного гуманизированного антитела |
| AU752730B2 (en) | 1998-04-03 | 2002-09-26 | Chugai Seiyaku Kabushiki Kaisha | Humanized antibody against human tissue factor (TF) and process for constructing humanized antibody |
| EP2261229A3 (en) | 1998-04-20 | 2011-03-23 | GlycArt Biotechnology AG | Glycosylation engineering of antibodies for improving antibody-dependent cellular cytotoxicity |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| US20020142374A1 (en) | 1998-08-17 | 2002-10-03 | Michael Gallo | Generation of modified molecules with increased serum half-lives |
| US6475718B2 (en) | 1998-09-08 | 2002-11-05 | Schering Aktiengesellschaft | Methods and compositions for modulating the interaction between the APJ receptor and the HIV virus |
| WO2000032634A1 (en) | 1998-12-01 | 2000-06-08 | Protein Design Labs, Inc. | Humanized antibodies to gamma-interferon |
| NZ539776A (en) | 1999-01-15 | 2006-12-22 | Genentech Inc | Polypeptide variants with altered effector function |
| US7183387B1 (en) * | 1999-01-15 | 2007-02-27 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6972125B2 (en) | 1999-02-12 | 2005-12-06 | Genetics Institute, Llc | Humanized immunoglobulin reactive with B7-2 and methods of treatment therewith |
| EP2270148A3 (en) | 1999-04-09 | 2011-06-08 | Kyowa Hakko Kirin Co., Ltd. | Method for controlling the activity of immunologically functional molecule |
| SK782002A3 (en) | 1999-07-21 | 2003-08-05 | Lexigen Pharm Corp | FC fusion proteins for enhancing the immunogenicity of protein and peptide antigens |
| SE9903895D0 (sv) | 1999-10-28 | 1999-10-28 | Active Biotech Ab | Novel compounds |
| FR2807767B1 (fr) | 2000-04-12 | 2005-01-14 | Lab Francais Du Fractionnement | Anticorps monoclonaux anti-d |
| CA2406650C (en) | 2000-05-03 | 2009-07-21 | Mbt Munich Biotechnology Ag | Cationic diagnostic, imaging and therapeutic agents associated with activated vascular sites |
| WO2002002641A1 (en) | 2000-06-16 | 2002-01-10 | Human Genome Sciences, Inc. | Antibodies that immunospecifically bind to blys |
| US7417130B2 (en) | 2000-09-08 | 2008-08-26 | University Of Zurich | Collection of repeat proteins comprising repeat modules |
| ES2639222T5 (es) | 2000-10-06 | 2023-11-24 | Kyowa Kirin Co Ltd | Células que producen unas composiciones de anticuerpo |
| AU2002213251B2 (en) | 2000-10-16 | 2007-06-14 | Bristol-Myers Squibb Company | Protein scaffolds for antibody mimics and other binding proteins |
| EP2354149B1 (en) | 2000-12-12 | 2017-08-30 | MedImmune, LLC | Molecules with extended half-lives, compositions and uses thereof |
| US7754208B2 (en) | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| JP2005500018A (ja) | 2001-04-02 | 2005-01-06 | アイデック ファーマスーティカルズ コーポレイション | GnTIIIと同時発現する組換え抗体 |
| UA83791C2 (ru) | 2001-04-13 | 2008-08-26 | Байоджен Айдек Ма Инк. | Антитело против vla-1, фармацевтическая композиция, которая его содержит, и из применение для лечения индивидуума с иммунологическим расстройством, опосредованным vla-1 |
| US7667004B2 (en) | 2001-04-17 | 2010-02-23 | Abmaxis, Inc. | Humanized antibodies against vascular endothelial growth factor |
| US20030157561A1 (en) | 2001-11-19 | 2003-08-21 | Kolkman Joost A. | Combinatorial libraries of monomer domains |
| US20040236080A1 (en) | 2001-06-22 | 2004-11-25 | Hiroyuki Aburatani | Cell proliferation inhibitors containing anti-glypican 3 antibody |
| AU2002319402B2 (en) | 2001-06-28 | 2008-09-11 | Domantis Limited | Dual-specific ligand and its use |
| US20040161741A1 (en) | 2001-06-30 | 2004-08-19 | Elazar Rabani | Novel compositions and processes for analyte detection, quantification and amplification |
| US20030049203A1 (en) | 2001-08-31 | 2003-03-13 | Elmaleh David R. | Targeted nucleic acid constructs and uses related thereto |
| EP2308888B1 (en) | 2001-11-14 | 2017-03-01 | Janssen Biotech, Inc. | Anti-IL-6 antibodies, compositions, methods and uses |
| AU2002362197A1 (en) | 2001-12-28 | 2003-07-24 | Chugai Seiyaku Kabushiki Kaisha | Method of stabilizing protein |
| AU2003216250A1 (en) | 2002-02-11 | 2003-09-04 | Genentech, Inc. | Antibody variants with faster antigen association rates |
| AR038568A1 (es) | 2002-02-20 | 2005-01-19 | Hoffmann La Roche | Anticuerpos anti-a beta y su uso |
| US7317091B2 (en) | 2002-03-01 | 2008-01-08 | Xencor, Inc. | Optimized Fc variants |
| US7662925B2 (en) | 2002-03-01 | 2010-02-16 | Xencor, Inc. | Optimized Fc variants and methods for their generation |
| AU2003217912A1 (en) | 2002-03-01 | 2003-09-16 | Xencor | Antibody optimization |
| US20080199471A1 (en) | 2002-03-01 | 2008-08-21 | Bernett Matthew J | Optimized cd40 antibodies and methods of using the same |
| US8188231B2 (en) | 2002-09-27 | 2012-05-29 | Xencor, Inc. | Optimized FC variants |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| AU2003248652A1 (en) | 2002-06-12 | 2003-12-31 | Genencor International, Inc. | Methods for improving a binding characteristic of a molecule |
| EP1511861A4 (en) | 2002-06-12 | 2007-12-05 | Genencor Int | METHODS AND BINDING COMPOSITIONS DEPENDENT FROM THE MEDIUM OF A TARGET AGENT TO A TARGET |
| US8193318B2 (en) | 2002-08-14 | 2012-06-05 | Macrogenics, Inc. | FcγRIIB specific antibodies and methods of use thereof |
| AU2003264009A1 (en) | 2002-08-15 | 2004-03-03 | Epitomics, Inc. | Humanized rabbit antibodies |
| RU2325186C2 (ru) | 2002-09-27 | 2008-05-27 | Ксенкор, Инк. | АНТИТЕЛО, СОДЕРЖАЩЕЕ Fc-ВАРИАНТНУЮ ЧАСТЬ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, И СПОСОБ ЛЕЧЕНИЯ МЛЕКОПИТАЮЩЕГО |
| ES2562177T3 (es) | 2002-09-27 | 2016-03-02 | Xencor Inc. | Variantes de Fc optimizadas y métodos para su generación |
| US7217797B2 (en) | 2002-10-15 | 2007-05-15 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| CA2502904C (en) | 2002-10-15 | 2013-05-28 | Protein Design Labs, Inc. | Alteration of fcrn binding affinities or serum half-lives of antibodies by mutagenesis |
| AU2003290330A1 (en) | 2002-12-27 | 2004-07-22 | Domantis Limited | Dual specific single domain antibodies specific for a ligand and for the receptor of the ligand |
| US7960512B2 (en) | 2003-01-09 | 2011-06-14 | Macrogenics, Inc. | Identification and engineering of antibodies with variant Fc regions and methods of using same |
| US7223393B2 (en) | 2003-02-07 | 2007-05-29 | Pdl Biopharma, Inc | Amphiregulin antibodies and their use to treat cancer and psoriasis |
| PT1601697E (pt) | 2003-02-28 | 2007-09-04 | Lonza Biologics Plc | Purificação de anticorpos através de proteína a e cromatografia de troca iónica. |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| US8388955B2 (en) | 2003-03-03 | 2013-03-05 | Xencor, Inc. | Fc variants |
| GB2401040A (en) | 2003-04-28 | 2004-11-03 | Chugai Pharmaceutical Co Ltd | Method for treating interleukin-6 related diseases |
| KR100973564B1 (ko) | 2003-05-02 | 2010-08-03 | 젠코어 인코포레이티드 | 최적화된 Fc 변이체 및 그의 제조 방법 |
| BRPI0411276A (pt) | 2003-06-05 | 2006-08-01 | Genentech Inc | métodos de esgotamento de células b, método de tratamento de neoplasma de células b ou malignidade, método de alìvio de disfunção autoimunológica regulada por células b, composição e artigo industrializado |
| AU2004253868B2 (en) | 2003-06-13 | 2011-06-16 | Biogen Ma Inc. | Aglycosyl anti-CD154 (CD40 ligand) antibodies and uses thereof |
| CA2534959A1 (en) | 2003-09-05 | 2005-03-31 | Genentech, Inc. | Antibodies with altered effector functions |
| JP2005101105A (ja) | 2003-09-22 | 2005-04-14 | Canon Inc | 位置決め装置、露光装置、デバイス製造方法 |
| US8101720B2 (en) | 2004-10-21 | 2012-01-24 | Xencor, Inc. | Immunoglobulin insertions, deletions and substitutions |
| WO2005035753A1 (ja) | 2003-10-10 | 2005-04-21 | Chugai Seiyaku Kabushiki Kaisha | 機能蛋白質を代替する二重特異性抗体 |
| WO2005037867A1 (en) | 2003-10-15 | 2005-04-28 | Pdl Biopharma, Inc. | ALTERATION OF Fc-FUSION PROTEIN SERUM HALF-LIVES BY MUTAGENESIS OF POSITIONS 250, 314 AND/OR 428 OF THE HEAVY CHAIN CONSTANT REGION OF IG |
| WO2005040229A2 (en) | 2003-10-24 | 2005-05-06 | Avidia, Inc. | Ldl receptor class a and egf domain monomers and multimers |
| PT1689777E (pt) | 2003-11-05 | 2007-05-31 | Ares Trading Sa | Processo para a purificação da proteína de ligação a il-18 |
| JP2008504002A (ja) | 2003-11-12 | 2008-02-14 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 新生児Fcレセプター(FcRn)結合ポリペプチド改変体、ダイマーFc結合タンパク質、およびそれらに関連する方法 |
| DK1711207T3 (da) | 2003-12-10 | 2013-03-11 | Medarex Inc | Interferon-alpha-antistoffer og anvendelse heraf |
| US20050249723A1 (en) | 2003-12-22 | 2005-11-10 | Xencor, Inc. | Fc polypeptides with novel Fc ligand binding sites |
| JP4315982B2 (ja) | 2004-01-09 | 2009-08-19 | ファイザー インコーポレイティッド | MAdCAMに対する抗体 |
| JP4762156B2 (ja) | 2004-01-12 | 2011-08-31 | アプライド モレキュラー エボリューション,インコーポレイテッド | Fc領域変異体 |
| WO2005092925A2 (en) | 2004-03-24 | 2005-10-06 | Xencor, Inc. | Immunoglobulin variants outside the fc region |
| US20050260711A1 (en) | 2004-03-30 | 2005-11-24 | Deepshikha Datta | Modulating pH-sensitive binding using non-natural amino acids |
| WO2005123780A2 (en) | 2004-04-09 | 2005-12-29 | Protein Design Labs, Inc. | Alteration of fcrn binding affinities or serum half-lives of antibodies by mutagenesis |
| WO2005112564A2 (en) | 2004-04-15 | 2005-12-01 | The Government Of The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Germline and sequence variants of humanized antibodies and methods of making and using them |
| KR20070038453A (ko) | 2004-04-16 | 2007-04-10 | 마크로제닉스, 인크. | FcγRIIB-특이적 항체 및 그의 사용 방법 |
| AR049390A1 (es) | 2004-06-09 | 2006-07-26 | Wyeth Corp | Anticuerpos contra la interleuquina-13 humana y usos de los mismos |
| US7632924B2 (en) | 2004-06-18 | 2009-12-15 | Ambrx, Inc. | Antigen-binding polypeptides and their uses |
| AU2005259992A1 (en) | 2004-06-25 | 2006-01-12 | Medimmune, Llc | Increasing the production of recombinant antibodies in mammalian cells by site-directed mutagenesis |
| DE102004032634A1 (de) | 2004-07-06 | 2006-02-16 | Sms Demag Ag | Verfahren und Einrichtung zum Messen und Regeln der Planheit und/oder der Bandspannungen eines Edelstahlbandes oder einer Edelstahlfolie beim Kaltwalzen in einem Vielwalzengerüst, insbesondere in einem 20-Walzen-Sendizimir-Walzwerk |
| EP2471813B1 (en) | 2004-07-15 | 2014-12-31 | Xencor, Inc. | Optimized Fc variants |
| ES2426817T3 (es) | 2004-08-04 | 2013-10-25 | Mentrik Biotech, Llc | Regiones Fc variantes |
| CN101080421A (zh) | 2004-08-11 | 2007-11-28 | 三菱化学株式会社 | 抗体以及其利用 |
| AU2005277567A1 (en) | 2004-08-16 | 2006-03-02 | Medimmune, Llc | Integrin antagonists with enhanced antibody dependent cell-mediated cytotoxicity activity |
| US20060067930A1 (en) | 2004-08-19 | 2006-03-30 | Genentech, Inc. | Polypeptide variants with altered effector function |
| WO2006030200A1 (en) | 2004-09-14 | 2006-03-23 | National Institute For Biological Standards And Control | Vaccine |
| US7563443B2 (en) | 2004-09-17 | 2009-07-21 | Domantis Limited | Monovalent anti-CD40L antibody polypeptides and compositions thereof |
| JP2008518936A (ja) | 2004-10-29 | 2008-06-05 | メディミューン,インコーポレーテッド | Rsv感染症および関連状態を予防および治療する方法 |
| US7462697B2 (en) | 2004-11-08 | 2008-12-09 | Epitomics, Inc. | Methods for antibody engineering |
| AU2005335714B2 (en) | 2004-11-10 | 2012-07-26 | Macrogenics, Inc. | Engineering Fc antibody regions to confer effector function |
| CN101098890B (zh) * | 2004-11-12 | 2012-07-18 | 赞科股份有限公司 | 对FcRn的结合被改变的Fc变体 |
| US8367805B2 (en) | 2004-11-12 | 2013-02-05 | Xencor, Inc. | Fc variants with altered binding to FcRn |
| EP2325207B1 (en) * | 2004-11-12 | 2017-03-15 | Xencor, Inc. | FC variants with altered binding to FCRN |
| US8802820B2 (en) | 2004-11-12 | 2014-08-12 | Xencor, Inc. | Fc variants with altered binding to FcRn |
| EP1829961A4 (en) | 2004-12-22 | 2008-06-04 | Chugai Pharmaceutical Co Ltd | PROCESS FOR PREPARING ANTIBODY USING A CELL WHOSE FUCOSE CARRIER FUNCTION IS INHIBITED |
| ES2343426T3 (es) | 2004-12-23 | 2010-07-30 | Novo Nordisk A/S | Ligandos de afinidad de union a anticuerpos. |
| CA2602663A1 (en) | 2005-03-31 | 2006-10-05 | Xencor, Inc. | Fc variants with optimized properties |
| AU2006232287B2 (en) | 2005-03-31 | 2011-10-06 | Chugai Seiyaku Kabushiki Kaisha | Methods for producing polypeptides by regulating polypeptide association |
| WO2006109592A1 (ja) | 2005-04-08 | 2006-10-19 | Chugai Seiyaku Kabushiki Kaisha | 血液凝固第viii因子の機能代替抗体 |
| AU2006239851B2 (en) | 2005-04-26 | 2011-06-16 | Medimmune, Llc | Modulation of antibody effector function by hinge domain engineering |
| AU2006244445B2 (en) | 2005-05-05 | 2013-04-18 | Duke University | Anti-CD19 antibody therapy for autoimmune disease |
| WO2006130834A2 (en) | 2005-05-31 | 2006-12-07 | Board Of Regents, The University Of Texas System | IGGl ANTIBODIES WITH MUTATED FC PORTION FOR INCREASED BINDING TO FCRN RECEPTOR AND USES THEREOF |
| DK2573114T3 (en) | 2005-08-10 | 2016-07-04 | Macrogenics Inc | The identification and production of antibodies with variant Fc regions, and methods of using same |
| CN103450359B (zh) | 2005-08-19 | 2018-07-24 | 惠氏有限责任公司 | 抗gdf-8的拮抗剂抗体以及在als和其他gdf-8-相关病症治疗中的用途 |
| DK1931709T3 (en) | 2005-10-03 | 2017-03-13 | Xencor Inc | FC VARIETIES WITH OPTIMIZED FC RECEPTOR BINDING PROPERTIES |
| WO2007056441A2 (en) | 2005-11-07 | 2007-05-18 | Genentech, Inc. | Binding polypeptides with diversified and consensus vh/vl hypervariable sequences |
| WO2007060411A1 (en) | 2005-11-24 | 2007-05-31 | Ucb Pharma S.A. | Anti-tnf alpha antibodies which selectively inhibit tnf alpha signalling through the p55r |
| EP1959995A1 (en) | 2005-11-30 | 2008-08-27 | Can-Fite Biopharma Ltd. | Therapeutic uses of a3 adenosine receptor antibodies |
| DK3219328T3 (da) | 2005-12-29 | 2020-07-13 | Janssen Biotech Inc | Humane anti-il-23-antistoffer, sammensætninger, fremgangsmåder og anvendelser |
| WO2007092772A2 (en) | 2006-02-03 | 2007-08-16 | Medimmune, Inc. | Protein formulations |
| JP5144499B2 (ja) | 2006-03-31 | 2013-02-13 | 中外製薬株式会社 | 二重特異性抗体を精製するための抗体改変方法 |
| EP4342995A2 (en) | 2006-03-31 | 2024-03-27 | Chugai Seiyaku Kabushiki Kaisha | Methods for controlling blood pharmacokinetics of antibodies |
| TWI395754B (zh) | 2006-04-24 | 2013-05-11 | Amgen Inc | 人類化之c-kit抗體 |
| EP2021029B1 (en) | 2006-05-26 | 2014-06-11 | MacroGenics, Inc. | Humanized fc gamma riib-specific antibodies and methods of use thereof |
| DK2047863T3 (da) | 2006-06-08 | 2013-09-16 | Chugai Pharmaceutical Co Ltd | Middel til forebyggelse eller behandling af inflammatoriske sygdomme |
| EP2032159B1 (en) | 2006-06-26 | 2015-01-07 | MacroGenics, Inc. | Combination of fcgammariib antibodies and cd20-specific antibodies and methods of use thereof |
| ME01786B (me) | 2006-08-14 | 2014-09-20 | Xencor Inc | Optimizovana antitela usmerena na cd19 |
| CA3163418A1 (en) | 2006-10-06 | 2008-05-22 | Jeffrey S. Isenberg | Prevention of tissue ischemia, related methods and compositions |
| US20100034194A1 (en) | 2006-10-11 | 2010-02-11 | Siemens Communications Inc. | Eliminating unreachable subscribers in voice-over-ip networks |
| WO2008140603A2 (en) | 2006-12-08 | 2008-11-20 | Macrogenics, Inc. | METHODS FOR THE TREATMENT OF DISEASE USING IMMUNOGLOBULINS HAVING FC REGIONS WITH ALTERED AFFINITIES FOR FCγR ACTIVATING AND FCγR INHIBITING |
| SI2436696T1 (sl) | 2007-01-05 | 2017-10-30 | University Of Zurich | Anti-beta-amiloidno protitelo in načini njegove uporabe |
| AU2008207898B2 (en) | 2007-01-23 | 2012-05-03 | Xencor, Inc | Optimized CD40 antibodies and methods of using the same |
| WO2008092117A2 (en) | 2007-01-25 | 2008-07-31 | Xencor, Inc. | Immunoglobulins with modifications in the fcr binding region |
| EP2087111A2 (en) | 2007-03-19 | 2009-08-12 | Medimmune Limited | Polypeptide variants |
| WO2009011941A2 (en) | 2007-04-04 | 2009-01-22 | The Government Of U.S.A., As Represented By The Secretary, Departmetnt Of Health & Human Services | Monoclonal antibodies against dengue and other viruses with deletion in fc region |
| CA2687117A1 (en) | 2007-05-14 | 2008-11-27 | Biogen Idec Ma Inc. | Single-chain fc (scfc) regions, binding polypeptides comprising same, and methods related thereto |
| EP2176298B1 (en) | 2007-05-30 | 2017-11-15 | Xencor, Inc. | Methods and compositions for inhibiting cd32b expressing cells |
| EP3543691A1 (en) | 2007-06-29 | 2019-09-25 | Quest Diagnostics Investments Incorporated | Analysis of amino acids in body fluid by liquid chromatography-mass spectrometry |
| JP5439176B2 (ja) | 2007-07-06 | 2014-03-12 | 公益財団法人東京都医学総合研究所 | Tdp−43凝集物に特異的に結合する抗体 |
| EP3127921A1 (en) | 2007-09-26 | 2017-02-08 | Chugai Seiyaku Kabushiki Kaisha | Method of modifying isoelectric point of antibody via amino acid substition in cdr |
| AR068564A1 (es) | 2007-09-26 | 2009-11-18 | Chugai Pharmaceutical Co Ltd | Anticuerpo anti- receptor de il-6 (interleuquina 6) |
| MX2010003450A (es) | 2007-09-26 | 2010-04-27 | Chugai Pharmaceutical Co Ltd | Region constante de anticuerpo modificada. |
| AU2008305851B2 (en) | 2007-09-28 | 2014-12-18 | Chugai Seiyaku Kabushiki Kaisha | Anti-glypican-3 antibody having improved kinetics in plasma |
| CA2702448A1 (en) | 2007-10-22 | 2009-04-30 | Merck Serono S.A. | Method for purifying fc-fusion proteins |
| US20120030144A1 (en) | 2007-11-08 | 2012-02-02 | Pikamab, Inc. | Methods for doing business using biomarkers |
| US8414893B2 (en) | 2007-12-21 | 2013-04-09 | Amgen Inc. | Anti-amyloid antibodies and uses thereof |
| HUE024903T2 (en) | 2007-12-26 | 2016-02-29 | Xencor Inc | FC variants with modified binding to FCRN |
| WO2009095235A1 (en) | 2008-01-29 | 2009-08-06 | Ablynx N.V. | Methods to stabilize proteins and polypeptides |
| KR102269708B1 (ko) | 2008-04-11 | 2021-06-25 | 추가이 세이야쿠 가부시키가이샤 | 복수 분자의 항원에 반복 결합하는 항원 결합 분자 |
| ES2487846T3 (es) | 2008-05-01 | 2014-08-25 | Amgen, Inc. | Anticuerpos anti-hepcindina y métodos de uso |
| ES2669591T3 (es) | 2008-06-20 | 2018-05-28 | Novartis Ag | Inmunoglobulinas con agregación reducida |
| JP5028372B2 (ja) | 2008-09-26 | 2012-09-19 | 京セラドキュメントソリューションズ株式会社 | 画像処理装置、画像処理方法及び画像処理プログラム |
| TWI440469B (zh) | 2008-09-26 | 2014-06-11 | Chugai Pharmaceutical Co Ltd | Improved antibody molecules |
| JP5913980B2 (ja) | 2008-10-14 | 2016-05-11 | ジェネンテック, インコーポレイテッド | 免疫グロブリン変異体及びその用途 |
| WO2010058860A1 (ja) | 2008-11-18 | 2010-05-27 | 株式会社シノテスト | 試料中のc反応性蛋白質の測定方法及び測定試薬 |
| JP5851842B2 (ja) | 2009-01-12 | 2016-02-03 | サイトムエックス セラピューティクス, インク.CytomX Therapeutics, Inc. | 改変した抗体組成物、それを作製および使用する方法 |
| CN102369291A (zh) * | 2009-01-23 | 2012-03-07 | 比奥根艾迪克Ma公司 | 效应子功能降低的稳定Fc多肽及使用方法 |
| EP2400981A4 (en) | 2009-02-26 | 2013-02-27 | Lpath Inc | DESGIN FOR HUMANIZED THROMBOZYTE ACTIVATION FACTOR ANTIBODIES BY ANTI-LIPID ANTIBODY TEMPLATES |
| TWI646193B (zh) | 2009-03-19 | 2019-01-01 | 中外製藥股份有限公司 | 抗體恆定區域改變體 |
| EP2233500A1 (en) * | 2009-03-20 | 2010-09-29 | LFB Biotechnologies | Optimized Fc variants |
| CA2700030C (en) | 2009-04-16 | 2019-11-05 | Accenture Global Services Gmbh | Touchpoint customization system |
| RU2540020C2 (ru) | 2009-10-06 | 2015-01-27 | Медиммьюн Лтд | Молекула, специфически связывающаяся с rsv |
| US8568726B2 (en) * | 2009-10-06 | 2013-10-29 | Medimmune Limited | RSV specific binding molecule |
| JP5898082B2 (ja) | 2009-10-07 | 2016-04-06 | マクロジェニクス,インコーポレーテッド | フコシル化程度の変更により改良されたエフェクター機能を示すFc領域含有ポリペプチドおよびその使用法 |
| US9624290B2 (en) | 2010-01-28 | 2017-04-18 | Ab Biosciences, Inc. | Lowered affinity antibodies and methods of making the same |
| AU2011217770B2 (en) | 2010-02-19 | 2016-02-04 | Xencor, Inc. | Novel CTLA4-IG immunoadhesins |
| JP2011184418A (ja) | 2010-03-11 | 2011-09-22 | Tokyo Institute Of Technology | 親和性可変抗体 |
| KR20120138241A (ko) | 2010-03-11 | 2012-12-24 | 화이자 인코포레이티드 | pH 의존성 항원 결합을 갖는 항체 |
| TWI667346B (zh) | 2010-03-30 | 2019-08-01 | 中外製藥股份有限公司 | 促進抗原消失之具有經修飾的FcRn親和力之抗體 |
| RU2745989C9 (ru) | 2010-03-30 | 2022-03-18 | Чугаи Сейяку Кабусики Кайся | АНТИТЕЛА С МОДИФИЦИРОВАННОЙ АФФИННОСТЬЮ К FcRn, КОТОРЫЕ УВЕЛИЧИВАЮТ КЛИРЕНС АНТИГЕНОВ |
| CN103201293B (zh) | 2010-09-08 | 2016-04-27 | 哈洛齐梅公司 | 评估和鉴定或发展条件活性治疗蛋白的方法 |
| AU2011337704B2 (en) | 2010-11-30 | 2017-06-15 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule capable of binding to plurality of antigen molecules repeatedly |
| WO2012132067A1 (ja) | 2011-03-30 | 2012-10-04 | 中外製薬株式会社 | 抗原結合分子の血漿中滞留性と免疫原性を改変する方法 |
| KR102147548B1 (ko) | 2011-02-25 | 2020-08-24 | 추가이 세이야쿠 가부시키가이샤 | FcγRIIb 특이적 Fc 항체 |
| JP5972915B2 (ja) | 2011-03-16 | 2016-08-17 | アムジエン・インコーポレーテツド | Fc変異体 |
| EP3825325A3 (en) * | 2011-03-30 | 2021-10-13 | Chugai Seiyaku Kabushiki Kaisha | Retention of antigen-binding molecules in blood plasma and method for modifying immunogenicity |
| JP2014517846A (ja) | 2011-05-25 | 2014-07-24 | メルク・シャープ・アンド・ドーム・コーポレーション | 改善された特性を有するFc含有ポリペプチドの製造方法 |
| UA117901C2 (uk) * | 2011-07-06 | 2018-10-25 | Ґенмаб Б.В. | Спосіб посилення ефекторної функції вихідного поліпептиду, його варіанти та їх застосування |
| EP3939996A1 (en) | 2011-09-30 | 2022-01-19 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule promoting disappearance of antigens having plurality of biological activities |
| TWI681970B (zh) | 2011-09-30 | 2020-01-11 | 日商中外製藥股份有限公司 | 包含依離子濃度之條件對抗原之結合活性會改變之抗原結合分域、及於pH中性之條件下對FcRn有結合活性之FcRn結合分域、且誘導對標的抗原的免疫反應之抗原結合分子 |
| BR112014007353B1 (pt) * | 2011-09-30 | 2022-09-13 | Chugai Seiyaku Kabushiki Kaisha | Biblioteca de anticorpos dependentes de concentração de íon |
| CN108144058A (zh) | 2011-09-30 | 2018-06-12 | 中外制药株式会社 | 促进抗原消除的抗原结合分子 |
| TW201817744A (zh) * | 2011-09-30 | 2018-05-16 | 日商中外製藥股份有限公司 | 具有促進抗原清除之FcRn結合域的治療性抗原結合分子 |
| US20150299313A1 (en) | 2011-10-05 | 2015-10-22 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule for promoting clearance from plasma of antigen comprising suger chain receptor-binding domain |
| CN113416256A (zh) | 2011-11-30 | 2021-09-21 | 中外制药株式会社 | 包含进入细胞内以形成免疫复合体的搬运体(载体)的药物 |
| US20150210763A1 (en) | 2012-02-09 | 2015-07-30 | Chugai Seiyaku Kabushiki Kaisha | MODIFIED Fc REGION OF ANTIBODY |
| TW202015731A (zh) | 2012-02-24 | 2020-05-01 | 日商中外製藥股份有限公司 | 經FcγRIIB促進抗原消失之抗原結合分子 |
| US20150353630A1 (en) | 2012-05-30 | 2015-12-10 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule for eliminating aggregated antigens |
| MX2014014678A (es) | 2012-05-30 | 2015-02-10 | Chugai Pharmaceutical Co Ltd | Molecula de union al antigeno especifico para el tejido objetivo. |
| CA2881679C (en) | 2012-08-13 | 2021-01-26 | Regeneron Pharmaceuticals, Inc. | Anti-pcsk9 antibodies with ph-dependent binding characteristics |
| US11236168B2 (en) | 2012-08-24 | 2022-02-01 | Chugai Seiyaku Kabushiki Kaisha | Mouse FcγammaRII-specific Fc antibody |
| TWI717591B (zh) | 2012-08-24 | 2021-02-01 | 日商中外製藥股份有限公司 | FcγRIIb特異性Fc區域變異體 |
| TW201418707A (zh) | 2012-09-21 | 2014-05-16 | Alexion Pharma Inc | 補體組分c5拮抗劑之篩選分析 |
| JP6608702B2 (ja) | 2013-01-31 | 2019-11-20 | ソウル大学校産学協力団 | 補体関連疾患の予防及び治療のためのc5抗体及び方法 |
| WO2014144080A2 (en) | 2013-03-15 | 2014-09-18 | Amgen Inc. | Human antigen binding proteins that bind to proprotein convertase subtilisin kexin type 9 |
| US9321686B2 (en) | 2013-03-15 | 2016-04-26 | Forta Corporation | Reinforcement fiber coating compositions, methods of making and treating, and uses for improved adhesion to asphalt and portland cement concrete |
| KR20210130260A (ko) | 2013-04-02 | 2021-10-29 | 추가이 세이야쿠 가부시키가이샤 | Fc영역 개변체 |
| NZ711451A (en) | 2014-03-07 | 2016-05-27 | Alexion Pharma Inc | Anti-c5 antibodies having improved pharmacokinetics |
| CN106459192B (zh) | 2014-06-30 | 2021-08-03 | 默克专利股份公司 | 具有pH依赖性抗原结合的抗TNFa抗体 |
| EP3233921B1 (en) * | 2014-12-19 | 2021-09-29 | Chugai Seiyaku Kabushiki Kaisha | Anti-c5 antibodies and methods of use |
| CN114773470A (zh) * | 2015-02-05 | 2022-07-22 | 中外制药株式会社 | 包含离子浓度依赖性的抗原结合结构域的抗体,fc区变体,il-8-结合抗体及其应用 |
-
2012
- 2012-09-27 TW TW107101834A patent/TW201817744A/zh unknown
- 2012-09-27 TW TW107101835A patent/TW201817745A/zh unknown
- 2012-09-27 TW TW101135493A patent/TW201326209A/zh unknown
- 2012-09-28 EP EP12775324.2A patent/EP2760890B1/en active Active
- 2012-09-28 RU RU2014117500/10A patent/RU2014117500A/ru unknown
- 2012-09-28 BR BR112014007290A patent/BR112014007290A2/pt active Search and Examination
- 2012-09-28 WO PCT/JP2012/006218 patent/WO2013046704A2/en active Application Filing
- 2012-09-28 EP EP23210057.8A patent/EP4324850A2/en active Pending
- 2012-09-28 RU RU2018118993A patent/RU2018118993A/ru not_active Application Discontinuation
- 2012-09-28 AU AU2012313670A patent/AU2012313670B2/en not_active Ceased
- 2012-09-28 MX MX2014003891A patent/MX2014003891A/es unknown
- 2012-09-28 SG SG11201401098TA patent/SG11201401098TA/en unknown
- 2012-09-28 EP EP19150272.3A patent/EP3549956A3/en not_active Withdrawn
- 2012-09-28 SG SG10201808187TA patent/SG10201808187TA/en unknown
- 2012-09-28 JP JP2014514947A patent/JP6204350B2/ja active Active
- 2012-09-28 CN CN201810780566.9A patent/CN108948197A/zh not_active Withdrawn
- 2012-09-28 US US14/347,187 patent/US10253100B2/en active Active
- 2012-09-28 CN CN201280058760.7A patent/CN103958547B/zh not_active Expired - Fee Related
- 2012-09-28 KR KR1020147011698A patent/KR20140069332A/ko not_active Application Discontinuation
- 2012-09-28 CA CA2850035A patent/CA2850035A1/en not_active Abandoned
-
2017
- 2017-08-18 AU AU2017216587A patent/AU2017216587B2/en not_active Ceased
- 2017-08-31 JP JP2017166638A patent/JP6541730B2/ja active Active
-
2019
- 2019-01-09 HK HK19100308.6A patent/HK1257946A1/zh unknown
- 2019-02-01 US US16/264,735 patent/US20190233525A1/en not_active Abandoned
- 2019-06-11 JP JP2019108321A patent/JP7001637B2/ja active Active
-
2021
- 2021-12-24 JP JP2021211155A patent/JP2022034037A/ja active Pending
-
2023
- 2023-12-08 US US18/533,360 patent/US20240117059A1/en active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2018048120A (ja) * | 2011-09-30 | 2018-03-29 | 中外製薬株式会社 | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 |
| US11780912B2 (en) | 2016-08-05 | 2023-10-10 | Chugai Seiyaku Kabushiki Kaisha | Composition for prophylaxis or treatment of IL-8 related diseases |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7001637B2 (ja) | 抗原クリアランスを促進するFcRn結合ドメインを有する治療用抗原結合分子 | |
| JP7186813B2 (ja) | 抗原の消失を促進する、FcRnに対するアフィニティーが変更された抗体 | |
| US20230220083A1 (en) | Antibodies with modified affinity to fcrn that promote antigen clearance | |
| RU2810471C1 (ru) | АНТИТЕЛА С МОДИФИЦИРОВАННОЙ АФФИННОСТЬЮ К FcRn, КОТОРЫЕ УВЕЛИЧИВАЮТ КЛИРЕНС АНТИГЕНОВ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150318 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150916 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150916 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160818 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20161013 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161125 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170306 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170406 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170802 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170831 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6204350 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |