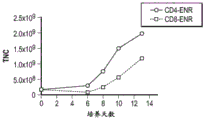
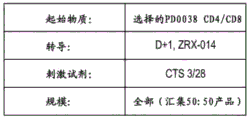
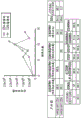
CN112877291A - 基因修饰的t细胞产品、其制备方法和用途 - Google Patents
基因修饰的t细胞产品、其制备方法和用途 Download PDFInfo
- Publication number
- CN112877291A CN112877291A CN202110101875.0A CN202110101875A CN112877291A CN 112877291 A CN112877291 A CN 112877291A CN 202110101875 A CN202110101875 A CN 202110101875A CN 112877291 A CN112877291 A CN 112877291A
- Authority
- CN
- China
- Prior art keywords
- cells
- population
- alternatives
- cell
- expressing
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000001744 T-lymphocyte Anatomy 0.000 title claims abstract description 967
- 238000000034 method Methods 0.000 title claims abstract description 289
- 102000004127 Cytokines Human genes 0.000 claims abstract description 262
- 108090000695 Cytokines Proteins 0.000 claims abstract description 262
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 claims abstract description 154
- 239000003550 marker Substances 0.000 claims abstract description 120
- 239000013598 vector Substances 0.000 claims abstract description 115
- 230000004936 stimulating effect Effects 0.000 claims abstract description 20
- 230000002062 proliferating effect Effects 0.000 claims abstract description 9
- 210000004027 cell Anatomy 0.000 claims description 515
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 135
- 239000000203 mixture Substances 0.000 claims description 110
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 73
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 73
- 108090000623 proteins and genes Proteins 0.000 claims description 67
- 102000005962 receptors Human genes 0.000 claims description 54
- 108020003175 receptors Proteins 0.000 claims description 54
- 238000011282 treatment Methods 0.000 claims description 53
- 102100027207 CD27 antigen Human genes 0.000 claims description 50
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 50
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 47
- 101001018097 Homo sapiens L-selectin Proteins 0.000 claims description 42
- 102100033467 L-selectin Human genes 0.000 claims description 42
- 239000002243 precursor Substances 0.000 claims description 38
- 201000010099 disease Diseases 0.000 claims description 34
- 238000004519 manufacturing process Methods 0.000 claims description 26
- 101001043809 Homo sapiens Interleukin-7 receptor subunit alpha Proteins 0.000 claims description 23
- 102100021593 Interleukin-7 receptor subunit alpha Human genes 0.000 claims description 23
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 claims description 22
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 claims description 21
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 20
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 20
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 claims description 16
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 claims description 16
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 claims description 16
- 102100021260 Galactosylgalactosylxylosylprotein 3-beta-glucuronosyltransferase 1 Human genes 0.000 claims description 14
- 101000894906 Homo sapiens Galactosylgalactosylxylosylprotein 3-beta-glucuronosyltransferase 1 Proteins 0.000 claims description 14
- 239000001963 growth medium Substances 0.000 claims description 14
- 238000002560 therapeutic procedure Methods 0.000 claims description 14
- 238000000926 separation method Methods 0.000 claims description 12
- 238000000684 flow cytometry Methods 0.000 claims description 11
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 10
- 238000003314 affinity selection Methods 0.000 claims description 9
- 238000002955 isolation Methods 0.000 claims description 9
- 102000006306 Antigen Receptors Human genes 0.000 claims description 4
- 108010083359 Antigen Receptors Proteins 0.000 claims description 4
- 239000003814 drug Substances 0.000 claims description 4
- 230000005764 inhibitory process Effects 0.000 claims description 4
- 230000001737 promoting effect Effects 0.000 claims description 4
- 230000002708 enhancing effect Effects 0.000 claims 1
- 229940124531 pharmaceutical excipient Drugs 0.000 claims 1
- 230000004083 survival effect Effects 0.000 abstract description 42
- 230000035755 proliferation Effects 0.000 abstract description 22
- 230000002463 transducing effect Effects 0.000 abstract description 15
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 440
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 439
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 298
- 239000000047 product Substances 0.000 description 92
- 102000003812 Interleukin-15 Human genes 0.000 description 91
- 108090000172 Interleukin-15 Proteins 0.000 description 91
- 102000000588 Interleukin-2 Human genes 0.000 description 85
- 108010002350 Interleukin-2 Proteins 0.000 description 85
- 241000699670 Mus sp. Species 0.000 description 83
- 230000012010 growth Effects 0.000 description 79
- 108020001756 ligand binding domains Proteins 0.000 description 78
- 102000000704 Interleukin-7 Human genes 0.000 description 67
- 108010002586 Interleukin-7 Proteins 0.000 description 67
- 102000001301 EGF receptor Human genes 0.000 description 61
- 108060006698 EGF receptor Proteins 0.000 description 61
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 57
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 57
- 239000013603 viral vector Substances 0.000 description 54
- 102100030704 Interleukin-21 Human genes 0.000 description 52
- 206010028980 Neoplasm Diseases 0.000 description 52
- 108010074108 interleukin-21 Proteins 0.000 description 52
- 125000006850 spacer group Chemical group 0.000 description 46
- 206010061309 Neoplasm progression Diseases 0.000 description 45
- 230000005751 tumor progression Effects 0.000 description 45
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 42
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 42
- 210000004698 lymphocyte Anatomy 0.000 description 42
- 108700010039 chimeric receptor Proteins 0.000 description 40
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 35
- 238000002474 experimental method Methods 0.000 description 35
- 239000000427 antigen Substances 0.000 description 34
- 108091007433 antigens Proteins 0.000 description 34
- 102000036639 antigens Human genes 0.000 description 34
- 239000012636 effector Substances 0.000 description 33
- 230000014509 gene expression Effects 0.000 description 30
- 238000002360 preparation method Methods 0.000 description 30
- 238000012360 testing method Methods 0.000 description 30
- 239000003446 ligand Substances 0.000 description 28
- 102000004169 proteins and genes Human genes 0.000 description 28
- 230000011664 signaling Effects 0.000 description 28
- 210000002443 helper t lymphocyte Anatomy 0.000 description 25
- 239000011324 bead Substances 0.000 description 24
- 230000003321 amplification Effects 0.000 description 23
- 230000004068 intracellular signaling Effects 0.000 description 23
- 238000003199 nucleic acid amplification method Methods 0.000 description 23
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 22
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 22
- 238000012546 transfer Methods 0.000 description 22
- 239000012634 fragment Substances 0.000 description 21
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 20
- 230000001177 retroviral effect Effects 0.000 description 20
- 230000010261 cell growth Effects 0.000 description 19
- 235000018102 proteins Nutrition 0.000 description 19
- 210000003719 b-lymphocyte Anatomy 0.000 description 18
- 230000002829 reductive effect Effects 0.000 description 18
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 17
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 description 17
- 230000001965 increasing effect Effects 0.000 description 17
- 241001430294 unidentified retrovirus Species 0.000 description 17
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 16
- 241000713666 Lentivirus Species 0.000 description 16
- 230000003612 virological effect Effects 0.000 description 16
- 241000702421 Dependoparvovirus Species 0.000 description 15
- 201000011510 cancer Diseases 0.000 description 15
- 238000005138 cryopreservation Methods 0.000 description 15
- 238000009169 immunotherapy Methods 0.000 description 15
- 239000002245 particle Substances 0.000 description 15
- 230000000644 propagated effect Effects 0.000 description 15
- 239000000523 sample Substances 0.000 description 15
- 241000701161 unidentified adenovirus Species 0.000 description 15
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 14
- -1 DNA Chemical class 0.000 description 14
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 14
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 14
- 210000001185 bone marrow Anatomy 0.000 description 14
- 230000001413 cellular effect Effects 0.000 description 14
- 238000001802 infusion Methods 0.000 description 14
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 13
- 208000035475 disorder Diseases 0.000 description 13
- 230000002401 inhibitory effect Effects 0.000 description 13
- 108020004705 Codon Proteins 0.000 description 12
- 238000000338 in vitro Methods 0.000 description 12
- 238000001727 in vivo Methods 0.000 description 12
- 238000005457 optimization Methods 0.000 description 12
- 230000004044 response Effects 0.000 description 12
- 230000035899 viability Effects 0.000 description 12
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 11
- 230000000694 effects Effects 0.000 description 11
- 230000001976 improved effect Effects 0.000 description 11
- 210000003071 memory t lymphocyte Anatomy 0.000 description 11
- 102000039446 nucleic acids Human genes 0.000 description 11
- 108020004707 nucleic acids Proteins 0.000 description 11
- 150000007523 nucleic acids Chemical class 0.000 description 11
- 210000005259 peripheral blood Anatomy 0.000 description 11
- 239000011886 peripheral blood Substances 0.000 description 11
- 230000002688 persistence Effects 0.000 description 11
- 238000010361 transduction Methods 0.000 description 11
- 230000026683 transduction Effects 0.000 description 11
- 108010065805 Interleukin-12 Proteins 0.000 description 10
- 102000013462 Interleukin-12 Human genes 0.000 description 10
- 102000003810 Interleukin-18 Human genes 0.000 description 10
- 108090000171 Interleukin-18 Proteins 0.000 description 10
- 230000004913 activation Effects 0.000 description 10
- 108090000765 processed proteins & peptides Proteins 0.000 description 10
- 230000001902 propagating effect Effects 0.000 description 10
- 210000004881 tumor cell Anatomy 0.000 description 10
- 208000007660 Residual Neoplasm Diseases 0.000 description 9
- 150000001413 amino acids Chemical class 0.000 description 9
- 238000011161 development Methods 0.000 description 9
- 230000018109 developmental process Effects 0.000 description 9
- 102000004196 processed proteins & peptides Human genes 0.000 description 9
- 230000000638 stimulation Effects 0.000 description 9
- 108020004414 DNA Proteins 0.000 description 8
- 102000053602 DNA Human genes 0.000 description 8
- 241000282412 Homo Species 0.000 description 8
- 241001465754 Metazoa Species 0.000 description 8
- 108091008874 T cell receptors Proteins 0.000 description 8
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 8
- 235000001014 amino acid Nutrition 0.000 description 8
- 229940024606 amino acid Drugs 0.000 description 8
- 229960002685 biotin Drugs 0.000 description 8
- 235000020958 biotin Nutrition 0.000 description 8
- 239000011616 biotin Substances 0.000 description 8
- 230000004069 differentiation Effects 0.000 description 8
- 238000011534 incubation Methods 0.000 description 8
- 208000015181 infectious disease Diseases 0.000 description 8
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 8
- 229920001184 polypeptide Polymers 0.000 description 8
- 238000010257 thawing Methods 0.000 description 8
- 102000015696 Interleukins Human genes 0.000 description 7
- 108010063738 Interleukins Proteins 0.000 description 7
- 238000002659 cell therapy Methods 0.000 description 7
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 7
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 7
- 230000006870 function Effects 0.000 description 7
- 230000028993 immune response Effects 0.000 description 7
- 238000011081 inoculation Methods 0.000 description 7
- 230000003834 intracellular effect Effects 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 7
- 208000024891 symptom Diseases 0.000 description 7
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- 230000024932 T cell mediated immunity Effects 0.000 description 6
- 241000700605 Viruses Species 0.000 description 6
- 238000011319 anticancer therapy Methods 0.000 description 6
- 231100000433 cytotoxic Toxicity 0.000 description 6
- 230000001472 cytotoxic effect Effects 0.000 description 6
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 6
- 229940082789 erbitux Drugs 0.000 description 6
- 230000003993 interaction Effects 0.000 description 6
- 239000002953 phosphate buffered saline Substances 0.000 description 6
- 239000000902 placebo Substances 0.000 description 6
- 229940068196 placebo Drugs 0.000 description 6
- 102000040430 polynucleotide Human genes 0.000 description 6
- 108091033319 polynucleotide Proteins 0.000 description 6
- 239000002157 polynucleotide Substances 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- 208000014644 Brain disease Diseases 0.000 description 5
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 5
- 208000032274 Encephalopathy Diseases 0.000 description 5
- 208000009329 Graft vs Host Disease Diseases 0.000 description 5
- 102000001398 Granzyme Human genes 0.000 description 5
- 108060005986 Granzyme Proteins 0.000 description 5
- 238000011394 anticancer treatment Methods 0.000 description 5
- 230000024245 cell differentiation Effects 0.000 description 5
- 238000004520 electroporation Methods 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 208000024908 graft versus host disease Diseases 0.000 description 5
- 210000000987 immune system Anatomy 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 230000002147 killing effect Effects 0.000 description 5
- 208000032839 leukemia Diseases 0.000 description 5
- 210000002540 macrophage Anatomy 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 210000001541 thymus gland Anatomy 0.000 description 5
- 229920001917 Ficoll Polymers 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 101001055157 Homo sapiens Interleukin-15 Proteins 0.000 description 4
- 102000014150 Interferons Human genes 0.000 description 4
- 108010050904 Interferons Proteins 0.000 description 4
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 4
- 230000005867 T cell response Effects 0.000 description 4
- 230000000735 allogeneic effect Effects 0.000 description 4
- 238000002617 apheresis Methods 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 210000004970 cd4 cell Anatomy 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 206010052015 cytokine release syndrome Diseases 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 102000056003 human IL15 Human genes 0.000 description 4
- 210000002865 immune cell Anatomy 0.000 description 4
- 230000010354 integration Effects 0.000 description 4
- 210000000265 leukocyte Anatomy 0.000 description 4
- 210000003738 lymphoid progenitor cell Anatomy 0.000 description 4
- 210000000822 natural killer cell Anatomy 0.000 description 4
- 125000003729 nucleotide group Chemical group 0.000 description 4
- 229930192851 perforin Natural products 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 229920002477 rna polymer Polymers 0.000 description 4
- 238000011172 small scale experimental method Methods 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 208000023275 Autoimmune disease Diseases 0.000 description 3
- 101150013553 CD40 gene Proteins 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 3
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000000589 Interleukin-1 Human genes 0.000 description 3
- 108010002352 Interleukin-1 Proteins 0.000 description 3
- 108010092694 L-Selectin Proteins 0.000 description 3
- 102000016551 L-selectin Human genes 0.000 description 3
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 230000001154 acute effect Effects 0.000 description 3
- 230000001270 agonistic effect Effects 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 208000018805 childhood acute lymphoblastic leukemia Diseases 0.000 description 3
- 201000011633 childhood acute lymphocytic leukemia Diseases 0.000 description 3
- 230000001461 cytolytic effect Effects 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 210000003527 eukaryotic cell Anatomy 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 238000001415 gene therapy Methods 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 229940079322 interferon Drugs 0.000 description 3
- 229940047122 interleukins Drugs 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 230000035800 maturation Effects 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000002773 nucleotide Substances 0.000 description 3
- 244000052769 pathogen Species 0.000 description 3
- 230000001717 pathogenic effect Effects 0.000 description 3
- 238000009520 phase I clinical trial Methods 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 238000013341 scale-up Methods 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000000638 solvent extraction Methods 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- 102100023990 60S ribosomal protein L17 Human genes 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 102000019034 Chemokines Human genes 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 2
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 2
- 101001043807 Homo sapiens Interleukin-7 Proteins 0.000 description 2
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 description 2
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 2
- 102000008070 Interferon-gamma Human genes 0.000 description 2
- 102000003814 Interleukin-10 Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 102000003816 Interleukin-13 Human genes 0.000 description 2
- 108090000176 Interleukin-13 Proteins 0.000 description 2
- 101800003050 Interleukin-16 Proteins 0.000 description 2
- 102000049772 Interleukin-16 Human genes 0.000 description 2
- 102100036705 Interleukin-23 subunit alpha Human genes 0.000 description 2
- 108010002386 Interleukin-3 Proteins 0.000 description 2
- 102000000646 Interleukin-3 Human genes 0.000 description 2
- 101710181549 Interleukin-34 Proteins 0.000 description 2
- 102100033499 Interleukin-34 Human genes 0.000 description 2
- 108091007973 Interleukin-36 Proteins 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 102000004890 Interleukin-8 Human genes 0.000 description 2
- 108090001007 Interleukin-8 Proteins 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- 102100031789 Myeloid-derived growth factor Human genes 0.000 description 2
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 210000000173 T-lymphoid precursor cell Anatomy 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 108010022394 Threonine synthase Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 2
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 2
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000000601 blood cell Anatomy 0.000 description 2
- 210000001772 blood platelet Anatomy 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000032823 cell division Effects 0.000 description 2
- 239000002458 cell surface marker Substances 0.000 description 2
- 230000007969 cellular immunity Effects 0.000 description 2
- 230000005754 cellular signaling Effects 0.000 description 2
- 230000000973 chemotherapeutic effect Effects 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 102000004419 dihydrofolate reductase Human genes 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 210000002889 endothelial cell Anatomy 0.000 description 2
- 230000003511 endothelial effect Effects 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 2
- 230000003394 haemopoietic effect Effects 0.000 description 2
- 102000052622 human IL7 Human genes 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000036039 immunity Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 150000004706 metal oxides Chemical class 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 230000036457 multidrug resistance Effects 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 238000004091 panning Methods 0.000 description 2
- 230000002085 persistent effect Effects 0.000 description 2
- 238000009521 phase II clinical trial Methods 0.000 description 2
- 210000004180 plasmocyte Anatomy 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 229960004618 prednisone Drugs 0.000 description 2
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 2
- 210000001938 protoplast Anatomy 0.000 description 2
- 150000003212 purines Chemical class 0.000 description 2
- 150000003230 pyrimidines Chemical class 0.000 description 2
- 230000008707 rearrangement Effects 0.000 description 2
- 230000004043 responsiveness Effects 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229960003989 tocilizumab Drugs 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000014616 translation Effects 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 230000005748 tumor development Effects 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- BRZYSWJRSDMWLG-DJWUNRQOSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-[(1r)-1-hydroxyethyl]oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H]([C@@H](C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-DJWUNRQOSA-N 0.000 description 1
- 108091071338 17 family Proteins 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 108020003589 5' Untranslated Regions Proteins 0.000 description 1
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 1
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical group N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 1
- 102100036664 Adenosine deaminase Human genes 0.000 description 1
- 102000014777 Adipokines Human genes 0.000 description 1
- 108010078606 Adipokines Proteins 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 206010002961 Aplasia Diseases 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 229930192334 Auxin Natural products 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 230000003844 B-cell-activation Effects 0.000 description 1
- 241001649247 Boehmeria Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 101710149858 C-C chemokine receptor type 7 Proteins 0.000 description 1
- 108010041397 CD4 Antigens Proteins 0.000 description 1
- 108010029697 CD40 Ligand Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- 102100025221 CD70 antigen Human genes 0.000 description 1
- 108010032795 CD8 receptor Proteins 0.000 description 1
- 210000001239 CD8-positive, alpha-beta cytotoxic T lymphocyte Anatomy 0.000 description 1
- 102100027221 CD81 antigen Human genes 0.000 description 1
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 102000016289 Cell Adhesion Molecules Human genes 0.000 description 1
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 1
- 101710098119 Chaperonin GroEL 2 Proteins 0.000 description 1
- 108700010070 Codon Usage Proteins 0.000 description 1
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 1
- 102100030135 Complement C1q tumor necrosis factor-related protein 5 Human genes 0.000 description 1
- 102100032768 Complement receptor type 2 Human genes 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 102100035298 Cytokine SCM-1 beta Human genes 0.000 description 1
- 206010050685 Cytokine storm Diseases 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102100031780 Endonuclease Human genes 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 101710111526 Erythroferrone Proteins 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 101001091269 Escherichia coli Hygromycin-B 4-O-kinase Proteins 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 206010066476 Haematological malignancy Diseases 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 1
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 1
- 101000914479 Homo sapiens CD81 antigen Proteins 0.000 description 1
- 101000941929 Homo sapiens Complement receptor type 2 Proteins 0.000 description 1
- 101000804771 Homo sapiens Cytokine SCM-1 beta Proteins 0.000 description 1
- 101001002470 Homo sapiens Interferon lambda-1 Proteins 0.000 description 1
- 101001002634 Homo sapiens Interleukin-1 alpha Proteins 0.000 description 1
- 101000853002 Homo sapiens Interleukin-25 Proteins 0.000 description 1
- 101000853000 Homo sapiens Interleukin-26 Proteins 0.000 description 1
- 101000998139 Homo sapiens Interleukin-32 Proteins 0.000 description 1
- 101001055222 Homo sapiens Interleukin-8 Proteins 0.000 description 1
- 101000804764 Homo sapiens Lymphotactin Proteins 0.000 description 1
- 101001128431 Homo sapiens Myeloid-derived growth factor Proteins 0.000 description 1
- 101000622137 Homo sapiens P-selectin Proteins 0.000 description 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 1
- 101000956004 Homo sapiens Vitamin D-binding protein Proteins 0.000 description 1
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 108010034143 Inflammasomes Proteins 0.000 description 1
- 108010005716 Interferon beta-1a Proteins 0.000 description 1
- 108010005714 Interferon beta-1b Proteins 0.000 description 1
- 229940119178 Interleukin 1 receptor antagonist Drugs 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102000003815 Interleukin-11 Human genes 0.000 description 1
- 101710187487 Interleukin-12 subunit beta Proteins 0.000 description 1
- 102100036701 Interleukin-12 subunit beta Human genes 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 102100039879 Interleukin-19 Human genes 0.000 description 1
- 108050009288 Interleukin-19 Proteins 0.000 description 1
- 102100030703 Interleukin-22 Human genes 0.000 description 1
- 108010065637 Interleukin-23 Proteins 0.000 description 1
- 101710184597 Interleukin-23 subunit alpha Proteins 0.000 description 1
- 102100036679 Interleukin-26 Human genes 0.000 description 1
- 108010066979 Interleukin-27 Proteins 0.000 description 1
- 101710181613 Interleukin-31 Proteins 0.000 description 1
- 108010067003 Interleukin-33 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 102000000743 Interleukin-5 Human genes 0.000 description 1
- 102100026236 Interleukin-8 Human genes 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 102000000585 Interleukin-9 Human genes 0.000 description 1
- 108010025815 Kanamycin Kinase Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 108090000581 Leukemia inhibitory factor Proteins 0.000 description 1
- 102000004058 Leukemia inhibitory factor Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 102100035304 Lymphotactin Human genes 0.000 description 1
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 1
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 1
- 102100026894 Lymphotoxin-beta Human genes 0.000 description 1
- 108090000362 Lymphotoxin-beta Proteins 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 1
- 102000009571 Macrophage Inflammatory Proteins Human genes 0.000 description 1
- 108010009474 Macrophage Inflammatory Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 108010064862 Nicotinamide phosphoribosyltransferase Proteins 0.000 description 1
- 102000015532 Nicotinamide phosphoribosyltransferase Human genes 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 102000004140 Oncostatin M Human genes 0.000 description 1
- 108090000630 Oncostatin M Proteins 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 102100023472 P-selectin Human genes 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 1
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 1
- 235000008331 Pinus X rigitaeda Nutrition 0.000 description 1
- 235000011613 Pinus brutia Nutrition 0.000 description 1
- 241000018646 Pinus brutia Species 0.000 description 1
- 102000004211 Platelet factor 4 Human genes 0.000 description 1
- 108090000778 Platelet factor 4 Proteins 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 208000009989 Posterior Leukoencephalopathy Syndrome Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102000014128 RANK Ligand Human genes 0.000 description 1
- 108010025832 RANK Ligand Proteins 0.000 description 1
- 239000008156 Ringer's lactate solution Substances 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 101001091268 Streptomyces hygroscopicus Hygromycin-B 7''-O-kinase Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 108700005078 Synthetic Genes Proteins 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 208000001871 Tachycardia Diseases 0.000 description 1
- 210000000068 Th17 cell Anatomy 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 1
- 206010045170 Tumour lysis syndrome Diseases 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 102100038611 Vitamin D-binding protein Human genes 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000003044 adaptive effect Effects 0.000 description 1
- 210000005006 adaptive immune system Anatomy 0.000 description 1
- 239000000478 adipokine Substances 0.000 description 1
- 208000014619 adult acute lymphoblastic leukemia Diseases 0.000 description 1
- 201000011184 adult acute lymphocytic leukemia Diseases 0.000 description 1
- 238000011256 aggressive treatment Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 102000006707 alpha-beta T-Cell Antigen Receptors Human genes 0.000 description 1
- 108010087408 alpha-beta T-Cell Antigen Receptors Proteins 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 239000002363 auxin Substances 0.000 description 1
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- 238000010923 batch production Methods 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 229960003008 blinatumomab Drugs 0.000 description 1
- 238000004820 blood count Methods 0.000 description 1
- ZEWYCNBZMPELPF-UHFFFAOYSA-J calcium;potassium;sodium;2-hydroxypropanoic acid;sodium;tetrachloride Chemical compound [Na].[Na+].[Cl-].[Cl-].[Cl-].[Cl-].[K+].[Ca+2].CC(O)C(O)=O ZEWYCNBZMPELPF-UHFFFAOYSA-J 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000013043 chemical agent Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 230000004186 co-expression Effects 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 108091036078 conserved sequence Proteins 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 230000002338 cryopreservative effect Effects 0.000 description 1
- 239000002577 cryoprotective agent Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000008260 defense mechanism Effects 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- PGUYAANYCROBRT-UHFFFAOYSA-N dihydroxy-selanyl-selanylidene-lambda5-phosphane Chemical compound OP(O)([SeH])=[Se] PGUYAANYCROBRT-UHFFFAOYSA-N 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 230000001037 epileptic effect Effects 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 239000003777 experimental drug Substances 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 210000000285 follicular dendritic cell Anatomy 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 238000010363 gene targeting Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 1
- 229940097277 hygromycin b Drugs 0.000 description 1
- 230000036543 hypotension Effects 0.000 description 1
- 210000003297 immature b lymphocyte Anatomy 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 208000033065 inborn errors of immunity Diseases 0.000 description 1
- SEOVTRFCIGRIMH-UHFFFAOYSA-N indole-3-acetic acid Chemical compound C1=CC=C2C(CC(=O)O)=CNC2=C1 SEOVTRFCIGRIMH-UHFFFAOYSA-N 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 230000008611 intercellular interaction Effects 0.000 description 1
- 229960004461 interferon beta-1a Drugs 0.000 description 1
- 229960003161 interferon beta-1b Drugs 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 108010018844 interferon type III Proteins 0.000 description 1
- 229940028894 interferon type ii Drugs 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 108090000681 interleukin 20 Proteins 0.000 description 1
- 102000004114 interleukin 20 Human genes 0.000 description 1
- 229940076144 interleukin-10 Drugs 0.000 description 1
- 108010074109 interleukin-22 Proteins 0.000 description 1
- 102000003898 interleukin-24 Human genes 0.000 description 1
- 108090000237 interleukin-24 Proteins 0.000 description 1
- 229940100601 interleukin-6 Drugs 0.000 description 1
- 229940100994 interleukin-7 Drugs 0.000 description 1
- 229940096397 interleukin-8 Drugs 0.000 description 1
- XKTZWUACRZHVAN-VADRZIEHSA-N interleukin-8 Chemical compound C([C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](NC(C)=O)CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCSC)C(=O)N1[C@H](CCC1)C(=O)N1[C@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC=1C=CC(O)=CC=1)C(=O)N[C@H](CO)C(=O)N1[C@H](CCC1)C(N)=O)C1=CC=CC=C1 XKTZWUACRZHVAN-VADRZIEHSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 230000000366 juvenile effect Effects 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000005923 long-lasting effect Effects 0.000 description 1
- 238000011469 lymphodepleting chemotherapy Methods 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- GRPSNTXTTSBKGW-BVGHQBMWSA-J magnesium;potassium;sodium;(3r,4s,5s,6r)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol;triacetate;chloride Chemical compound [Na+].[Mg+2].[Cl-].[K+].CC([O-])=O.CC([O-])=O.CC([O-])=O.OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O GRPSNTXTTSBKGW-BVGHQBMWSA-J 0.000 description 1
- FVVLHONNBARESJ-NTOWJWGLSA-H magnesium;potassium;trisodium;(2r,3s,4r,5r)-2,3,4,5,6-pentahydroxyhexanoate;acetate;tetrachloride;nonahydrate Chemical compound O.O.O.O.O.O.O.O.O.[Na+].[Na+].[Na+].[Mg+2].[Cl-].[Cl-].[Cl-].[Cl-].[K+].CC([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O FVVLHONNBARESJ-NTOWJWGLSA-H 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 201000010893 malignant breast melanoma Diseases 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000011177 media preparation Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 210000003593 megakaryocyte Anatomy 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- 210000003643 myeloid progenitor cell Anatomy 0.000 description 1
- 210000004296 naive t lymphocyte Anatomy 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000012261 overproduction Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 210000001539 phagocyte Anatomy 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 150000004713 phosphodiesters Chemical class 0.000 description 1
- PTMHPRAIXMAOOB-UHFFFAOYSA-N phosphoramidic acid Chemical compound NP(O)(O)=O PTMHPRAIXMAOOB-UHFFFAOYSA-N 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 238000012809 post-inoculation Methods 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 1
- 208000028529 primary immunodeficiency disease Diseases 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 210000003289 regulatory T cell Anatomy 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 210000005212 secondary lymphoid organ Anatomy 0.000 description 1
- 238000009394 selective breeding Methods 0.000 description 1
- JRPHGDYSKGJTKZ-UHFFFAOYSA-K selenophosphate Chemical compound [O-]P([O-])([O-])=[Se] JRPHGDYSKGJTKZ-UHFFFAOYSA-K 0.000 description 1
- 238000007390 skin biopsy Methods 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 102000009076 src-Family Kinases Human genes 0.000 description 1
- 108010087686 src-Family Kinases Proteins 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000011255 standard chemotherapy Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000011476 stem cell transplantation Methods 0.000 description 1
- 210000002536 stromal cell Anatomy 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000006794 tachycardia Effects 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 208000010380 tumor lysis syndrome Diseases 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000002689 xenotransplantation Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1774—Immunoglobulin superfamily (e.g. CD2, CD4, CD8, ICAM molecules, B7 molecules, Fc-receptors, MHC-molecules)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/179—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/10—Cellular immunotherapy characterised by the cell type used
- A61K40/11—T-cells, e.g. tumour infiltrating lymphocytes [TIL] or regulatory T [Treg] cells; Lymphokine-activated killer [LAK] cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/30—Cellular immunotherapy characterised by the recombinant expression of specific molecules in the cells of the immune system
- A61K40/31—Chimeric antigen receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/30—Cellular immunotherapy characterised by the recombinant expression of specific molecules in the cells of the immune system
- A61K40/32—T-cell receptors [TCR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/40—Cellular immunotherapy characterised by antigens that are targeted or presented by cells of the immune system
- A61K40/41—Vertebrate antigens
- A61K40/42—Cancer antigens
- A61K40/4202—Receptors, cell surface antigens or cell surface determinants
- A61K40/421—Immunoglobulin superfamily
- A61K40/4211—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0091—Purification or manufacturing processes for gene therapy compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70517—CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- C07K14/7151—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons for tumor necrosis factor [TNF], for lymphotoxin [LT]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
- C12N5/0638—Cytotoxic T lymphocytes [CTL] or lymphokine activated killer cells [LAK]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y105/00—Oxidoreductases acting on the CH-NH group of donors (1.5)
- C12Y105/01—Oxidoreductases acting on the CH-NH group of donors (1.5) with NAD+ or NADP+ as acceptor (1.5.1)
- C12Y105/01003—Dihydrofolate reductase (1.5.1.3)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/10—Protein-tyrosine kinases (2.7.10)
- C12Y207/10001—Receptor protein-tyrosine kinase (2.7.10.1)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K2035/124—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells the cells being hematopoietic, bone marrow derived or blood cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5158—Antigen-pulsed cells, e.g. T-cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/90—Vectors containing a transposable element
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2820/00—Vectors comprising a special origin of replication system
- C12N2820/002—Vectors comprising a special origin of replication system inducible or controllable
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- Cell Biology (AREA)
- Wood Science & Technology (AREA)
- Molecular Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Biotechnology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- General Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Microbiology (AREA)
- Toxicology (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Virology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Developmental Biology & Embryology (AREA)
- Endocrinology (AREA)
- Mycology (AREA)
- Neurology (AREA)
Abstract
本发明涉及制备基因修饰的T细胞的方法、基因修饰的T细胞群及其用途。该方法包括:从混合的T细胞群分隔或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群以产生分隔的或富集的T细胞群;刺激分隔的或富集的T细胞群以产生刺激的CD8+T细胞群和/或CD4+T细胞群;用载体转导刺激的CD8+T细胞群和/或CD4+T细胞群;使转导的CD8+T细胞群和/或CD4+T细胞群与至少一种细胞因子接触;通过选择标记序列富集转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群;增殖富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群。本发明的基因修饰的T细胞具有高存活率和增殖率。
Description
本申请是申请日为2015年4月8日,申请号为201580029752.3,发明名称为“确定的组合基因修饰的T细胞产品”的中国专利申请的分案申请。
相关申请的交叉引用
本申请要求2014年4月10日提交的美国临时专利申请号61/977,751、2014年4月30日提交的美国临时专利申请号61/986,479、2014年10月2日提交的美国临时专利申请号62/058,973、2014年12月5日提交的美国临时专利申请号62/088,363、2014年12月9日提交的美国临时专利申请号62/089,730和2014年12月11日提交的美国临时专利申请号62/090845的优先权的权益。上述申请的全部公开内容特别地通过引用全文并入。
序列表的引用
本申请连同电子格式的序列表一起提交。序列表提供为2015年3月23日创建的大小为2.92kb的命名为SCRI-090WO_SEQUENCE_LISTING.TXT的文件。电子格式的序列表的信息通过引用全文并入本文。
技术领域
本发明的方面涉及制备含有嵌合抗原受体的基因修饰的T细胞的方法。公开的方法涉及从混合的T细胞群选择和/或分离CD4+和/或CD8+T细胞,然后使所述CD4+和/或CD8+T细胞在一种或多种细胞因子的存在下,在分离的培养物中激活、基因修饰和增殖,所述细胞因子维持细胞的存活、移入和/或增殖以及促进细胞表面受体如CD62L、CD28和/或CD27的保留。
背景技术
同种异体的造血干细胞移植(HSCT)后,急性成淋巴细胞性白血病(ALL)复发可以发生。因此,许多人相信这样的方法是无效的。人T淋巴细胞的过继转移具有有效治疗许多晚期癌症还有恶性肿瘤的潜力,所述人T淋巴细胞通过基因转移被工程化以表达对存在于肿瘤细胞或恶性B细胞表面上的分子特异性的嵌合抗原受体(CAR)。然而,为了有效并长期持久地治疗,在转移至患者后,施用的包括嵌合抗原受体的T细胞希望地具有高存活率和增殖率。用于治疗的T细胞也希望地适于移入。尽管在本领域具有极大的成就,仍然存在对另外的有效的细胞治疗的需求。
发明内容
本文描述的本发明的方面包括制备含有用于人治疗的嵌合抗原受体的基因修饰的T细胞的方法。供选择的方案包括使用从混合的T细胞群中选择、富集和/或分离表达CD4+和/或CD8+的T细胞的方法,所述T细胞如源自胸腺细胞的T细胞或源自工程化的前体的T细胞,所述工程化的前体希望地是iPS细胞。一旦选择、富集和/或分离,则使表达CD4+和/或CD8+的T细胞激活、基因修饰并增殖,优选地在分隔的、富集的或分离的培养物中,在一种或多种细胞因子存在下进行激活、基因修饰并增殖,所述细胞因子能被外源地提供给T细胞,例如为除了可以由细胞产生或存在于培养基中的任何细胞因子之外的细胞因子,并且支持、促进、诱导或有助于细胞的存活、移入和/或增殖,以及优选地支持、促进、诱导或有助于保留细胞表面受体,如CD62L、CD28和/或CD27。本文也包括通过将一种或多种类型的基因工程化T细胞或包括如本文描述的基因工程化T细胞的组合物施用于有需要的受试者治疗、抑制、改善或清除癌症的方法。
本文描述的本发明的某些方面涉及制备具有嵌合抗原受体的基因修饰的T细胞的方法。所述的某些方法,这些方法通过以下步骤来实践:从混合的T细胞群分隔、分离或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群以产生分隔的、分离的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激这些分隔的、富集的或分离的T细胞群以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触,以产生转导的细胞因子刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,所述细胞因子能被外源地提供给T细胞,例如为除了可以由细胞产生或存在于培养基中的任何细胞因子以外的细胞因子;通过选择标记序列富集转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分隔的、富集的或分离的转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;以及增殖分隔的、富集的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞和/或表达CD4+的T细胞群至少两天,以获得具有嵌合抗体的所述基因修饰的T细胞。在一些供选择的方案中,可以增殖表达CD8+的T细胞和/或表达CD4+的T细胞至少或等于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。在一些供选择的方案中,通过亲和性选择具有存在于CD8和/或CD4上的表位的T细胞,进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。在一些供选择的方案中,通过流式细胞术进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。在一些供选择的方案中,通过免疫磁性选择进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。在一些供选择的方案中,基因修饰的CD8+T细胞和/或CD4+T细胞包括促进、诱导、有助于或提高移入适合性(engraftment fitness)的至少一种受体。在一些供选择的方案中,至少一种受体是CD45RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,通过使CD8+和/或CD4+T细胞与抗体结合支持物如珠或颗粒接触,进行刺激分离的T细胞群。在一些供选择的方案中,抗体结合支持物包括抗TCR、抗CD2、抗CD3、抗CD4和/或抗CD28抗体。在一些供选择的方案中,抗体结合支持物包括抗CD3和/或抗CD28抗体。在一些供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记的第四序列。在一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体。在一些供选择的方案中,标记序列编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL7、IL-15和/或IL-21,细胞因子的量可以提供为0.1ng/mL、0.2ng/mL、0.3ng/mL、0.4ng/mL、0.5ng/mL、0.6ng/mL、0.7ng/mL、0.8ng/mL、0.9ng/mL或1.0ng/mL或由任意两个前述的量限定的范围内的量和/或10U/mL、20U/mL、30U/mL、40U/mL、50U/mL、60U/mL、70U/mL、80U/mL、90U/mL或100U/mL或由任意两个前述的量限定的范围内的量。在一些供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21,其中细胞因子的量提供为0.5ng/mL和/或50U/mL。在一些供选择的方案中,接触进行1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个这些值限定的范围内的一段时间。在一些供选择的方案中,用分离的、纯化的、富集的或分隔的CD4+细胞执行方法,所述CD4+细胞不存在、实质上贫化或富集超过CD8+细胞。在一些供选择的方案中,用分离的、纯化的、富集的或分隔的CD8+细胞执行方法,所述CD8+细胞不存在、实质上贫化或富集超过CD4+细胞。在一些供选择的方案中,增殖表达CD4+的T细胞至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。在一些供选择的方案中,增殖CD8+T细胞至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。在一些供选择的方案中,方法进一步包括移除抗体结合支持物如珠或颗粒。在一些供选择的方案中,嵌合抗原受体的配体结合域包括抗体或其结合部分。在一些供选择的方案中,嵌合抗原受体的配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,嵌合抗原受体的配体结合域包括FMC63或其结合部分。在一些供选择的方案中,嵌合抗原受体的配体结合域对CD19是特异性的。在一些供选择的方案中,方法进一步包括深低温保藏基因修饰的CD8+和/或CD4+T细胞。
在一些供选择的方案中,通过亲和性选择具有存在于CD8和/或CD4上的表位的T细胞,进行从混合的T细胞群分隔、富集或分离表达CD8+的T细胞群和/或表达CD4+的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞。在一些供选择的方案中,通过流式细胞术进行从混合的T细胞群分隔、富集或分离表达CD8+的T细胞群和/或表达CD4+的T细胞群。在一些供选择的方案中,通过免疫磁性选择进行从混合的T细胞群分隔、富集或分离表达CD8+的T细胞群和/或表达CD4+的T细胞群。在一些供选择的方案中,基因修饰的表达CD8+的T细胞和/或表达CD4+的T细胞包括至少一种促进、诱导或有助于移入适合性的受体。在一些供选择的方案中,至少一种促进、诱导或有助于移入适合性的受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在优选的供选择的方案中,至少一种促进、诱导或有助于移入适合性的受体是CD27、CD28和/或CD62L。在一些供选择的方案中,通过使表达CD8+和/或CD4+的T细胞与抗体结合支持物如珠或颗粒接触进行刺激分离的、富集的或分隔的T细胞群。在这些供选择的方案的一些中,抗体结合支持物包括抗TCR、抗CD2、抗CD3、抗CD4和/或抗CD28抗体。在优选的供选择的方案中,抗体结合支持物包括抗CD3和/或抗CD28抗体。
在许多前述的供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列。在这些供选择的方案的一些中,载体进一步包括编码间隔区的序列,所述间隔区在某些供选择的方案中可包括IgG4铰链。在许多前述的供选择的方案中,载体是病毒载体或微环。
在许多前述的供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。优选地,病毒载体是慢病毒载体。在许多前述的供选择的方案中,标记序列编码截短的表皮生长因子受体(EGFRt)。在许多前述的供选择的方案中,使用的至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21并且所述细胞因子能被外源地提供给T细胞,例如为除了可以由细胞产生或存在于培养基中的任何细胞因子以外的细胞因子。
在希望的可选择的实施方式中,至少一种细胞因子包括IL-7、IL-15和/或IL-21。在许多前述的供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在优选的供选择的方案中,接触时间进行至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个这些时间点限定的范围内的一段时间。在许多前述的供选择的方案中,在表达CD8+的细胞不存在或与未分隔的、未富集的或未分离的T细胞群的天然群相比具有减少量的表达CD8+的T细胞下,用分离的、分隔的或富集的表达CD4+的T细胞执行方法,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞。在许多前述的供选择的方案中,在表达CD4+的细胞不存在或与未分隔的、未富集的或未分离的T细胞群的天然群相比具有减少量的表达CD4+的细胞下,用分离的、分隔的或富集的表达CD8+的T细胞群执行方法,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞。在许多前述的供选择的方案中,增殖表达CD4+的T细胞至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。在许多前述的供选择的方案中,增殖表达CD8+的T细胞至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。
在许多前述的供选择的方案中,方法进一步包括移除抗体结合支持物如珠或颗粒。在许多前述的供选择的方案中,嵌合抗原受体的配体结合域包括抗体或其结合部分。在许多前述的供选择的方案中,嵌合抗原受体的配体结合域包括单链可变区片段(scFv)或其结合部分。在许多前述的供选择的方案中,嵌合抗原受体的配体结合域包括FMC63或其结合部分,如在美国专利号7,446,179中可获得的,特别地通过引用全文并入本文。在许多前述的供选择的方案中,嵌合抗原受体的配体结合域对CD19是特异性的。在许多前述的供选择的方案中,方法进一步包括深低温保藏基因修饰的CD8+和/或CD4+T细胞。
本发明的另外的方面涉及基因修饰的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述基因修饰的T细胞群包括大量亲和性选择的富集形式的表达CD8+和/或CD4+的T细胞,所述富集形式的表达CD8+和/或CD4+的T细胞如从表达CD8-和/或CD4-的T细胞富集、表达CD8-和/或CD4-的T细胞不存在或从表达CD8-和/或CD4-的T细胞分离,其中所述大量亲和性选择的表达CD8+和/或CD4+的T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的或富集的表达CD8+和/或CD4+的T细胞进一步包括编码嵌合抗原受体的基因和编码细胞表面选择性标记的基因,并且其中所述大量亲和性选择的或富集的表达CD8+和/或CD4+的T细胞已经被至少一种细胞因子重刺激,所述细胞因子可以被外源地提供给T细胞,例如为除了可以由细胞产生或存在于培养基中的任何细胞因子以外,如使所述细胞与外源添加的细胞因子接触至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。在一些供选择的方案中,所述大量亲和性选择的表达CD8+和/或CD4+的T细胞进一步包括至少一种促进、诱导或有助于移入适合性的受体。在一些供选择的方案中,至少一种促进、诱导、改善或有助于移入适合性的受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,至少一种促进、诱导、改善或有助于移入适合性的受体是CD27、CD28和/或CD62L。在一些供选择的方案中,大量亲和性选择的表达CD8+和/或CD4+的T细胞进一步包括具有编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列的载体。
一些供选择的方案涉及基因修饰的T细胞群。在一些供选择的方案中,基因修饰的T细胞群包括大量亲和性选择的CD8+和/或CD4+T细胞,所述CD8+和/或CD4+T细胞不存在、实质上贫化或富集超过CD8-和/或CD4-T细胞,其中所述大量亲和性选择的CD8+和/或CD4+T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括编码嵌合抗原受体的基因和细胞表面选择性标记的基因,并且其中所述大量亲和性选择的CD8+和/或CD4+T细胞已经被至少一种细胞因子重刺激。在一些供选择的方案中,所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括促进、提高、改善或有助于移入适合性的至少一种受体。在一些供选择的方案中,促进、提高、改善或有助于移入适合性的至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,促进、提高、改善或有助于移入适合性的至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,大量亲和性选择的CD8+和/或CD4+T细胞进一步包括具有编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记的第四序列的载体。在一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体。在一些供选择的方案中,细胞表面选择性标记编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,配体结合域包括抗体或其结合部分。在一些供选择的方案中,配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,配体结合域包括FMC63或其结合部分。在一些供选择的方案中,配体结合域对CD19是特异性的。在一些供选择的方案中,群包括分离的、纯化的、分隔的或富集的CD8+T细胞,所述CD8+T细胞不存在、实质上贫化或富集超过CD4+T细胞。在一些供选择的方案中,群包括分离的、纯化的、分隔的或富集的CD4+T细胞,所述CD4+T细胞不存在、实质上贫化或富集超过CD8+T细胞。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。在一些供选择的方案中,载体进一步包括编码间隔区的序列,如包括IgG4铰链的间隔区。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体或微环。在一些供选择的方案中,细胞表面选择性标记编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,配体结合域包括抗体或其结合部分。在一些供选择的方案中,配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,配体结合域包括FMC63或其结合部分,如在美国专利号7,446,179中可获得的,特别地通过引用全文并入本文。在一些供选择的方案中,配体结合域对CD19是特异性的。在一些供选择的方案中,基因修饰的T细胞(如源自胸腺细胞的T细胞或源自工程化前体的T细胞)群包括分离的表达CD8+的T细胞,所述表达CD8+的T细胞不存在表达CD4+的T细胞或与未分隔的、未富集的或未分离的T细胞群的天然群相比具有减少量的表达CD4+的T细胞。在一些供选择的方案中,基因修饰的T细胞(如源自胸腺细胞的T细胞或源自工程化前体的T细胞)群包括分离的表达CD4+的T细胞,所述表达CD4+的T细胞不存在表达CD8+的T细胞或与未分隔的、未富集的或未分离的T细胞群的天然群相比具有减少量的表达CD8+的T细胞。
本发明的另外的方面涉及用于人治疗的包含药用赋形剂的组合物或产品组合;和至少一个如前段所述的基因修饰的T细胞群。在一些供选择的方案中,组合物或产品组合包含基因修饰的表达CD8+的T细胞群。在一些供选择的方案中,组合物或产品组合包含基因修饰的表达CD4+的T细胞群。在一些供选择的方案中,组合物或产品组合包含在混合的群中或以1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1的比或由任意两个前述的比限定的范围内的比联合施用的、如上所述的基因修饰的表达CD8+的T细胞群和如上所述的基因修饰的表达CD4+的T细胞群。
本发明的另外的方面涉及治疗、抑制或减轻有需要的受试者的疾病的方法,所述方法包括将至少一种如上所述的组合物或产品组合施用于受试者。在一些供选择的方案中,方法包括预先或在施用表达CD8+的T细胞之前,施用包含表达CD4+的T细胞(如源自胸腺细胞的T细胞或源自工程化前体的T细胞)的组合物或产品组合,以及在其他供选择的方案中,在施用表达CD4+的T细胞之前施用表达CD8+的细胞,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞。在许多供选择的方案中,鉴别或选择受试者以接受抗癌治疗。在许多前述方法中,方法也涉及测量或评价疾病的抑制。在许多前述方法中,方法也涉及在施用如上所述的组合物或产品组合之前、期间或之后,向所述受试者提供另外的抗癌治疗。
在许多前述方法中,通过过继细胞转移将组合物或产品组合施用于所述受试者。在一些供选择的方案中,在受试者接受了另一形式的抗癌治疗后将组合物或产品组合施用于所述受试者。在许多前述方法中,受试者患有白血病。在许多前述方法中,受试者具有复发性和/或化学治疗难治性CD19+儿童急性成淋巴细胞性白血病(ALL)。在许多前述方法中,受试者具有复发性和/或化学治疗难治性CD19+急性成淋巴细胞性白血病(ALL)。在许多前述方法中,受试者患有自身免疫疾病。在许多前述方法中,受试者患有HSCT后复发。
因此,本发明的一些方面涉及如下供选择的方案:
1.制备具有嵌合抗原受体的基因修饰的T细胞的方法,包括:
从混合的T细胞群分隔或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群以产生分隔的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;
刺激分隔的或富集的T细胞群,以产生刺激的CD8+T细胞群和/或CD4+T细胞群;
用载体转导刺激的CD8+T细胞群和/或CD4+T细胞群,以产生转导的CD8+T细胞群和/或CD4+T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;
使转导的CD8+T细胞群和/或CD4+T细胞群与至少一种细胞因子接触,如接触1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间,以产生转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,所述细胞因子可以被外源地提供给T细胞,例如为除了可以由细胞产生或存在于培养基中的任何细胞因子以外的细胞因子;
通过选择标记序列富集转导的细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,以产生富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群;以及
增殖富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。
2.供选择的方案1的方法,其中通过亲和性选择具有存在于CD8和/或CD4上的表位的T细胞,进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。
3.供选择的方案1或2的方法,其中通过流式细胞术进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。
4.供选择的方案1或2的方法,其中通过免疫磁性选择进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。
5.供选择的方案1-4中任一项的方法,其中基因修饰的CD8+T细胞和/或CD4+T细胞包括促进、诱导、有助于或提高移入适合性的至少一种受体。
6.供选择的方案5的方法,其中至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。
7.供选择的方案5或6的方法,其中至少一种受体是CD27、CD28和/或CD62L。
8.供选择的方案1-7中任一项的方法,其中通过使CD8+T细胞和/或CD4+T细胞与抗体结合支持物如珠或颗粒接触进行刺激分离的T细胞群。
9.供选择的方案8的方法,其中抗体结合支持物包括抗TCR、抗CD2、抗CD3、抗CD4和/或抗CD28抗体。
10.供选择的方案8或9的方法,其中抗体结合支持物包括抗CD3和/或抗CD28抗体。
11.供选择的方案1-10中任一项的方法,其中载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记的第四序列。
12.供选择的方案1-11中任一项的方法,其中载体进一步包括编码间隔区的序列。
13.供选择的方案12的方法,其中间隔区包括IgG4铰链。
14.供选择的方案1-13中任一项的方法,其中载体是病毒载体。
15.供选择的方案14的方法,其中病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。
16.供选择的方案14或15的方法,其中病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。
17.供选择的方案14-16中任一项的方法,其中病毒载体是慢病毒载体。
18.供选择的方案1-17中任一项的方法,其中标记序列编码截短的表皮生长因子受体(EGFRt)。
19.供选择的方案1-18中任一项的方法,其中至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21。
20.供选择的方案1-19中任一项的方法,其中至少一种细胞因子包括IL7、IL-15和/或IL-21,所述细胞因子可以以0.1ng/mL、0.2ng/mL、0.3ng/mL、0.4ng/mL、0.5ng/mL、0.6ng/mL、0.7ng/mL、0.8ng/mL、0.9ng/mL或1.0ng/mL或由任意两个前述的量限定的范围内的量和/或以10U/mL、20U/mL、30U/mL、40U/mL、50U/mL、60U/mL、70U/mL、80U/mL、90U/mL或100U/mL或由任意两个前述的量限定的范围内的量提供。
21.供选择的方案1-19中任一项的方法,其中至少一种细胞因子包括IL-2、IL-15和/或IL-21,其中细胞因子的量以0.5ng/mL和/或50U/mL提供。
22.供选择的方案1-21中任一项的方法,其中接触进行1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个这些值限定的范围内的一段时间。
23.供选择的方案1-20或22中任一项的方法,其中用分离的、纯化的、富集的或分隔的CD4+细胞,在CD8+细胞不存在、实质上贫化或所述CD4+细胞富集超过CD8+细胞的情况下进行所述方法。
24.供选择的方案1-19、21或22中任一项的方法,其中方法用分离的、纯化的、富集的或分隔的CD8+细胞,在CD4+细胞不存在、实质上贫化或所述CD8+细胞富集超过CD4+细胞的情况下进行所述方法。
25.供选择的方案1-20、22或23中任一项的方法,其中表达CD4+的T细胞增殖至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。
26.供选择的方案1-19、21、22或24中任一项的方法,其中,所述CD8+T细胞增殖至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。
27.供选择的方案8-26中任一项的方法,其中方法进一步包括移除抗体结合支持物如珠或颗粒。
28.供选择的方案1-27中任一项的方法,其中嵌合抗原受体的配体结合域包括抗体或其结合部分。
29.供选择的方案1-28中任一项的方法,其中嵌合抗原受体的配体结合域包括单链可变区片段(scFv)或其结合部分。
30.供选择的方案1-29中任一项的方法,其中嵌合抗原受体的配体结合域包括FMC63或其结合部分。
31.供选择的方案1-30中任一项的方法,其中嵌合抗原受体的配体结合域对CD19是特异性的。
32.供选择的方案1-31中任一项的方法,其中方法进一步包括深低温保藏基因修饰的CD8+和/或CD4+T细胞。
33.基因修饰的T细胞群,包括:
大量亲和性选择的CD8+和/或CD4+T细胞,所述CD8+和/或CD4+T细胞不存在CD8-和/或CD4-T细胞、实质上贫化CD8-和/或CD4-T细胞或富集超过CD8-和/或CD4-T细胞,其中所述大量亲和性选择的CD8+和/或CD4+T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括编码嵌合抗原受体和细胞表面选择性标记的基因,并且其中所述大量亲和性选择的CD8+和/或CD4+T细胞已经被至少一种细胞因子重刺激。
34.供选择的方案33的基因修饰的T细胞群,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括促进、提高、改善或有助于移入适合性的至少一种受体。
35.供选择的方案33或34的基因修饰的T细胞群,其中促进、提高、改善或有助于移入适合性的至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。
36.供选择的方案34或35的基因修饰的T细胞群,其中促进、提高、改善或有助于移入适合性的至少一种受体是CD27、CD28和/或CD62L。
37.供选择的方案33-36中任一项的基因修饰的T细胞群,其中大量亲和性选择的CD8+和/或CD4+T细胞进一步包括具有编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记的第四序列的载体。
38.供选择的方案37的基因修饰的T细胞群,其中载体进一步包括编码间隔区的序列。
39.供选择的方案38的基因修饰的T细胞群,其中间隔区包括IgG4铰链。
40.供选择的方案33-39中任一项的基因修饰的T细胞群,其中载体是病毒载体。
41.供选择的方案40的基因修饰的T细胞群,其中病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。
42.供选择的方案40或41的基因修饰的T细胞群,其中病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。
43.供选择的方案40-42中任一项的基因修饰的T细胞群,其中病毒载体是慢病毒载体。
44.供选择的方案33-43中任一项的基因修饰的T细胞群,其中细胞表面选择性标记编码截短的表皮生长因子受体(EGFRt)。
45.供选择的方案37-44中任一项的基因修饰的T细胞群,其中配体结合域包括抗体或其结合部分。
46.供选择的方案37-45中任一项的基因修饰的T细胞群,其中配体结合域包括单链可变区片段(scFv)或其结合部分。
47.供选择的方案37-46中任一项的基因修饰的T细胞群,其中配体结合域包括FMC63或其结合部分。
48.供选择的方案37-47中任一项的基因修饰的T细胞群,其中配体结合域对CD19是特异性的。
49.供选择的方案33-48中任一项的基因修饰的T细胞群,其中群包括分离的、纯化的、分隔的或富集的CD8+T细胞,所述CD8+T细胞不存在CD4+T细胞、实质上贫化CD4+T细胞或富集超过CD4+T细胞。
50.供选择的方案33-48中任一项的基因修饰的T细胞群,其中群包括分离的、纯化的、分隔的或富集的CD4+T细胞,所述CD4+T细胞不存在CD8+T细胞、实质上贫化CD8+T细胞或富集超过CD8+T细胞。
51.用于人治疗的组合物或产品组合,包含:
药用赋形剂;和
至少一种根据供选择的方案33-50中任一项或多项的基因修饰的T细胞群。
52.供选择的方案51的组合物或产品组合,其中组合物或产品组合包含供选择的方案49的基因修饰的T细胞群。
53.供选择的方案47的组合物或产品组合,其中组合物或产品组合包含供选择的方案50的基因修饰的T细胞群。
54.供选择的方案47的组合物或产品组合,其中组合物或产品组合包含以1:1的比混合或联合施用的供选择的方案49的基因修饰的T细胞群和供选择的方案50的基因修饰的T细胞群。
55.一种治疗、抑制或减轻有需要的受试者的疾病的方法,包括:
将至少一种供选择的方案51-54中任一项或多项的组合物或产品组合施用于受试者。
56.供选择的方案55的方法,其中方法包括施用供选择的方案52的组合物或产品组合。
57.供选择的方案55的方法,其中方法包括施用供选择的方案53的组合物或产品组合。
58.供选择的方案56的方法,其中方法进一步包括施用供选择的方案53的组合物或产品组合。
59.供选择的方案57的方法,其中方法进一步包括施用供选择的方案52的组合物或产品组合.
60.供选择的方案55的方法,其中方法包括施用供选择的方案54的组合物或产品组合,如通过这样的方法,其中在施用表达CD4+的T细胞之前,施用表达CD8+的T细胞,如在施用CD4+T细胞前1、2、3、4、5、6、7、8、9、10、20、30、40、50或60分钟或由任意两个前述的时间定义的范围内的时间段。
61.供选择的方案55-60中任意一项或多项的方法,其中鉴别或选择受试者以接受抗癌治疗。
62.供选择的方案55-61中任意一项或多项的方法,进一步包括测量或评价疾病的抑制。
63.供选择的方案55-62中任意一项或多项的方法,进一步包括在施用供选择的方案51-54中任意一项或多项的组合物或产品组合之前、期间或之后,向所述受试者提供另外的抗癌治疗。
64.供选择的方案55-63中任意一项或多项的方法,其中通过过继细胞转移向所述受试者施用供选择的方案51-54中任意一项或多项的组合物或产品组合。
65.供选择的方案55-64中任意一项或多项的方法,其中在所述受试者接受了另一种形式的抗癌治疗后,将供选择的方案51-54中任意一项或多项的组合物或产品组合施用于所述受试者。
66.供选择的方案55-65中任意一项或多项的方法,其中在所述受试者接受了另一种形式的抗癌治疗后,将供选择的方案51-54中任意一项或多项的组合物或产品组合施用于所述受试者。
67.供选择的方案55-66中任意一项或多项的方法,其中受试者患有白血病。
68.供选择的方案55-67中任意一项或多项的方法,其中受试者具有复发性和/或化学治疗难治性CD19+儿童急性成淋巴细胞性白血病(ALL)。
69.供选择的方案55-68中任意一项或多项的方法,其中受试者具有复发性和/或化学治疗难治性CD19+急性成淋巴细胞性白血病(ALL)。
70.供选择的方案55-69中任意一项或多项的方法,其中受试者患有自身免疫疾病。
71.供选择的方案55-70中任意一项或多项的方法,其中受试者患有HSCT后复发。
72.供选择的方案1的方法,其中所述T细胞是前体T细胞。
73.供选择的方案72的方法,其中所述前体T细胞是造血干细胞(HSC)。
附图说明
图1A显示了从第0天到第65天过继转移承载CAR的T细胞之后的11名患者中,承载抗CD19 CAR的T细胞的绝对数量;示出了在外周血中存留的CAR T细胞的绝对数据/μl。图1B显示了经3个剂量处理之后的承载抗CD19 CAR的T细胞的绝对数量。
图2A显示了从第0天到第65天过继转移承载CAR的T细胞的患者的外周血中,承载抗CD19 CAR的T细胞的存留率;示出了在外周血中存留的T细胞的百分比。图2B显示了在3个剂量处理之后的承载抗CD19 CAR的T细胞的存留率。
图3A显示了从第0天到第65天过继转移承载CAR的T细胞之后的患者的骨髓中,承载抗CD19 CAR的T细胞的存留率;示出了骨髓中的存留。图3B显示了在3个剂量处理之后的患者的骨髓中承载抗CD19 CAR的T细胞的存留率。
图4显示了在3个剂量之后的患者X中急性成淋巴细胞性白血病(ALL)的百分比。
图5显示了研究中所用的患者特征的表格,HSCT:造血干细胞移植物;BiTE:博纳吐单抗(blinatumomab);MPF:多参数流;Ph样:费城样;iAMP21:21号染色体的体内扩增;MRD:最小残留病;CR:完全缓解;PR:部分响应;PD:进行性疾病。
图6A-图6B显示了与疾病和剂量相关的CNS淋巴瘤的发展。如显示的,两幅柱状图表示经历包括承载抗CD19 CAR的T细胞的处理的患者数量和其在3次处理之后的疾病的严重程度。
图7A-图7B显示了在患有ALL的患者的异常MRI中的4级脑病;4级脑病/DLT异常MRI。第一幅图表示在用承载抗CD19 CAR的T细胞处理之后的结果。
图8A-图8C显示了经用承载抗CD19 CAR的T细胞处理后的急性皮肤移植物抗宿主病(GVHD)。如图8A所示,S03在CAR T细胞移入后第17天重新发展出2级急性皮肤GVHD。在图8B中,皮肤活组织检查揭示了仅9%的皮肤局部T细胞标记了EGFRt+,而79%的循环T细胞标记了EGFRt+。在图8C中,在同一时间的外周血显示大多数T细胞是CAR+的T细胞。将该受试者以2周疗程的1mg/kg强的松处理,随后在6周的时间内快速减少,并判断GVHD。尽管用强的松处理,受试者仍具有持续存留的CAR+T细胞。
图9显示了在用承载抗CD19 CAR的T细胞处理之后经历作为微小残留病(MRD)的标记的Ig或TCR的患者的表格;示出了Ig或TCR重排为MRD的标记物,通过适应性技术进行的测定。*第42天;<表示最高95%置信区间的上限。
图10显示了抗CD19CAR T细胞的同种异体的造血干细胞移植后的患者概况的表格。
图11A-图11G显示了在抗CD19 CAR T细胞的造血干细胞移植(HSCT)之后,从外周血和CSF分离的细胞的FACS散点分析,其中,图11A-图11B:外周血第14天;图11E-图11G:第14天CSF。
图12显示了3个剂量的抗CD19 CAR T细胞的造血干细胞移植后肿瘤负荷与响应;PLAT-02:第7天肿瘤负荷与响应。
图13显示了3个剂量的造血干细胞移植之后的患者的缓解持续时间;PLAT-02:缓解持续时间(意图是治疗/HSCT复发后)。
图14显示了在第7天时2个剂量的抗CD19 CAR T细胞的造血干细胞移植后,肿瘤负荷与响应;PLAT-02:第7天肿瘤负荷与植入。
图15显示了在3个剂量的抗CD19 CAR T细胞的造血干细胞移植后的患者中的CAR/EGFRt+T细胞存留的量级和持续时间;PLAT-02:CAR/EGFRt+T细胞存留的量级和持续时间剂量水平CAR T细胞的绝对数量/μl。
图16显示了在3个剂量的抗CD19 CAR T细胞的造血干细胞移植后B细胞发育不全的持续时间;PLAT-02:B细胞发育不全的持续时间。
图17显示了3个剂量的抗CD19 CAR T细胞的造血干细胞移植后的患者的CRS概况,PLAT-02CRS概况。
图18A-图18B显示了说明制备基因修饰的T细胞的两个流程图;图18A:初始制备流程图;图18B:当前制备流程图。如描述的,初始的扩增方法批量处理不总是立即起始。单采血液成分术产品(Apheresis product)的部分总是进行Ficoll处理。如果没有要起始批量培养,那么冷冻保存通过Ficoll分隔分离的产品。
图19显示了制备具有嵌合抗原受体的基因修饰的T细胞的不同方法的比较流程图。
图20A-图20D显示了使用不同浓度的细胞在起子培养物中的细胞生长中的最初比较;图20A:PD0064生长曲线;图20B:PD0064 CD3+生长倍数;图20C:PD0080生长曲线;图20D:PD0080生长曲线。如所示的,PD0064是PD0063供体,所述PD0063供体是富集的表达CD8+的T细胞,PD0064用于在起始时在T25瓶中测试起始细胞密度。实验测试了两个细胞密度,在实验期间当体积早期增加时,两个细胞密度均显示了更大的生存力和扩增。
图21A-图21D显示了细胞生长的初始比较;图21A:PD0104生长-TNC;图21B:PD0104CD3+生长倍数;图21C:PD0116生长;图21D:PD0116生长。这是用于向当前使用的更新的制备方法过渡的全面数据。
图22显示了说明用于测试表达CD4+和CD8+的T细胞生长的细胞因子的混合物变化的流程图。
图23A-图23F说明了在表达CD4+和CD8+的T细胞生长期间测试的细胞因子的比较;图23A:PD0047 D15细胞因子比较;图23B:PD0047 D21细胞因子比较,起始物质:PD0038 CD8富集的,载体:ZRX-014,Tx:D1,注意:#4和#5终止于D18;图23C:PD0040可变的细胞因子条件;图23D:PD0040可变的细胞因子条件;图23E:PD0047细胞因子比较;图23F:PD0047细胞因子比较。
图24A-图24F说明了在表达CD4+和CD8+的T细胞生长期间测试的细胞因子的比较;图24A:PD0051 D20供体与供体细胞因子比较;图24B:PD0055D17细胞因子比较;图24C:PD0040可变的细胞因子条件;图24D:PD0040可变的细胞因子条件;图24E:PD0047细胞因子比较;图24F:PD0047细胞因子比较。
图25A、图25B1-B4显示了对细胞生长的细胞因子比较;图25A:Pd0078解冻后;图25B1:PD0059 PLAT-02细胞因子比较;图25B2:PD0059 PLAT-02细胞因子比较;图25B3:PD0078生长曲线;图25B4:PD0078生长曲线。对PD0059供体样品,进行与PD0051相同的细胞因子测试实验,除了测试新的CD4和CD8供体(PD0057)以外。
图26显示了说明源自测试不同细胞因子混合物的实验的初始扩增方法和当前的扩增方法的流程图.
图27A-图27C显示了样品PD0080、PD084和PD0085的扩增比较;图27A:PD0080生长曲线;图27B:PD084 CD8生长曲线;图27C:PD0085 CD4 TNC生长曲线。这些实验是“早期扩增”方法的重复。
图28A-图28D显示了对PD0044产生基因修饰的细胞的测试,其中,图28B:PD0044D21终产物,解冻后,PLAT-02预审(Pre-Qual);图28C:PD0044生长曲线;图28D:Tx/4/8。对于第一比例放大的PLAT-02(I期和II期试验)使用来自深低温保藏的选择的细胞的“预先通过鉴定的细胞(pre-qual)”。
图29A-图29C显示了对PD0046从按比例放大的PLAT-02“质量鉴定(Qual run)#1”产生基因修饰的细胞的测试,其中,图29B:PD0046 D21解冻后;图29C:PD0046生长曲线(QR#1)。
图30A-图30C显示了PD0063从按比例放大或PLAT-02“质量鉴定(Qual run)#2”产生基因修饰的细胞的测试,其中,图30B:PD0063生长曲线;图30C:Pd0063解冻后。生长曲线显示来自细胞的两个V-197袋的TNC。珠移除和EGFRt富集对于表达CD4+的T细胞发生在D+14天之后,对于表达CD8+的T细胞发生在D+15天之后。表达CD8+的T细胞生长于IL-2(50U/mL)/IL-15(0.5ng/mL)中,表达CD4+的T细胞生长于IL-7(5ng/mL)/IL-15(0.5ng/mL)中。对表达CD4+的T细胞,珠移除和EGFRt富集发生在第12天,以及对表达CD8+的T细胞,珠移除和EGFRt富集发生在第13天。
图31A1-图31A2、图31B1-图31B2显示了在细胞因子存在下生长时从批量PBMC培养物中扩增细胞;图31A1:PD0024扩增;图31A2:PD0024表型比较;图31B1:Pd0040可变的细胞因子条件;图31B2:PD0040表型比较。如所示的,表达CD4+的T细胞(·)在IL2和IL15存在下生长。表达CD8+的T细胞(■)在IL7和IL15存在下生长。
图32A1-图32A2、图32B1-图32B2显示了在细胞因子混合物中的富集的表达CD8+和CD4+的T细胞的扩增;图32A1:PD0044扩增;图32A2:PD0044表型,在IL-2/IL-15中生长CD8富集培养物和在IL-7/IL-15中生长CD4富集培养物产生两种培养物的稳健扩增和记忆表型的强烈表达(代表性数据如上所示);图32B1:14602-S14;图32B2:14602-S14表型比较,在IL-2/IL-15中生长CD8富集培养物和在IL-7/IL-15中生长CD4富集培养物产生两种培养物的稳健扩增和记忆表型的强烈表达(代表性数据如上所示)。如样品PD0044所示,富集的表达CD8+的T细胞在IL2和IL15的存在下扩增。在样品PD0044中,富集的表达CD4+的T细胞在IL7和IL15的存在下扩增超过20天。
图33A-图33C显示了使用如图18A-图18B的流程图所示的早期方法扩增富集的表达CD4+的T细胞和表达CD8+的T细胞。所示的是在样品14602-S01、14602-S02和14602-S03/14602-S03-02中的细胞实验;图33A:14602-S01;图33B:14602-S02;图33C:14602-S03/14602-S03-02。
图34A-图34C显示了使用如图18A-图18B的流程图所示的早期方法扩增富集的表达CD4+的T细胞和表达CD8+的T细胞。所示的是在样品14602-S04/14602-S04-02、14602-S05、14602-SO6和14602-S06-2/14602-S06-04中的细胞实验;图34A:14602-S04/14602-S04-02;图34B:14602-S05;图34C:14602-SO6和14602-S06-2/14602-S06-04。
图35A-图35C显示了使用如图18A-图18B的流程图所示的早期方法扩增富集的表达CD4+的T细胞和表达CD8+的T细胞。所示是在样品14602-S07、14602-S08和14602-S09中的细胞实验;图35A:14602-S07;图35B:14602-S08;图35C:14602-S09。
图36A-图36D显示了在样品14602-S10、14602-S11、14602-S12和14602-S13中扩增细胞;图36A:14602-S10;图36B:14602-S11;图36C:14602-S12;图36D:14602-S13。
图37A-图37C显示了在样品14602-S14、14602-S15和14602-S16中扩增细胞;图37A:14602-S14;图37B:14602-S15;图37C:14602-S16。
图38A-图38B显示了在细胞扩增后富集的表达CD4+和CD8+的T细胞的延伸的表型;图38A:14602CD4富集的延伸的表型;图38B:14602CD8富集的延伸的表型。
图39A、图39B1-图39B2显示了用来自样品PD00044和PD00046的细胞注射的小鼠的存存活,其中,图39B1:无肿瘤症状存活,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0044;图39B2:平均肿瘤进展±SEM,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0046。记载了PD00046细胞具有移入适合性标记的表达(CD27、CD28、CD127和CD62L)。
图40A-图40D显示了用来自PD0044和PD0046细胞批次的细胞处理的小鼠的平均肿瘤进展;图40A:平均肿瘤进展±SEM,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0044;图40B:平均肿瘤进展±SEM,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0046;图40C:曲线下面积±SD,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0044;图40D:曲线下面积±SD,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0046。
图41显示了测试用针对移入适合性制备的T细胞处理的小鼠的肿瘤进展的实验建立,示出了JME13-25:细胞因子生长条件。
图42A-图42E显示了在施用于动物的当天和在细胞因子生长条件下来自样品PD0051和PD00055的表达CD4+和表达CD8+的T细胞之间的比较,显示了JME13-25:细胞因子生长条件,对用于在JME13-25下注射至小鼠体内的解冻后的细胞的FACS分析。图42A:PD T细胞-CJ06641 CD8标准_008.fcs单线态8115;图42B:PD T细胞-CJ06641 CD8脉冲_009.fcs单线态6722;图42C:PD T细胞-CJ06643 CD4标准_006.fcs单线态8722;图42D:PD T细胞-CJ06645 CD4脉冲_007.fcs单线态8828;图42E:用相似的%EGFRt+解冻出的细胞,样品收集于来自制备用于注射到小鼠体内剩下的混合样品,获得数据但没有分析。
图43A-图43C显示了用PBS、PD0051(正常扩增细胞)和PD00055(在细胞因子组合存在下扩增的细胞)处理的三组小鼠的比较,其中,图43B:平均肿瘤进展±SEM,靶标:RajieGFP-ffLuc_epHIV7(cJ06089),效应物:PD0051 VS PD0055;图43C:无肿瘤症状存活率,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0051 VS PD0055。
图44A-图44C显示了通过检测EGFRt CAR标记检测在小鼠的外周血中的T细胞存留,图44A:CTL后3天在外周血中存留的T细胞;图44B:T细胞转移后3天外周血中存留的CD4T细胞;图44C:T细胞转移后3天外周血中存留的CD8 T细胞。注意事项:该染色在包括活/死细胞染色和在优化的小鼠模型中从CD3转换为CD45之前;淋巴细胞门没有被确定;EGFRt染色在CD3群中;CD4-CD8-群存在于CD3+EGFRt+群。
图45显示了用于测试三组小鼠的实验建立,以确定在抗原重复暴露(encounter)下,在体外不同细胞因子条件下生长的细胞之间的杀伤能力在体内的差异。
图46A-图46B显示了处理后从第0天至第120天,PD0051和PD0055处理的小鼠的肿瘤进展。
图47A-图47C显示了用重复抗原暴露攻击的PD0051和PD0055细胞;图47A:无肿瘤症状存活率,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0051 VS PD0055;图47B:平均肿瘤进展±SEM,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0051 VSPD0055;图47C:曲线下面积±SD,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0051 VS PD0055。
图48A-图48D显示了JME13-29重复Raji肿瘤攻击“正常扩增细胞”与用细胞因子组合脉冲的T细胞,其中,图48A:平均肿瘤进展±SEM,靶标:Raji eGFP-ffLuc_epHIV7(cJ06089),效应物:PD0051 VS PD0055;图48B:PD0051;图48C:PD0055。
图49显示了确定在与PLAT-01(I期临床试验)和PLAT-02(I期和II期临床试验)以及“中间”方案相同条件下生长的细胞之间在杀伤能力方面在体内是否具有差异的实验建立。
图50显示了表明来自表达CD8+的T细胞和表达CD4+的T细胞的EGFRt的细胞产品和水平。其中,1)来自PLAT-1.33的数据是有问题的,虽然针对CD4和CD8选择了细胞,但是最终EGFRt+CD8细胞%表现出反常地低,为48%;2)来自PLAT-1.33的数据是有问题的,因为最终EGFRt%仅为66.7%,即使大量细胞经历对EGFRt富集的中间-过程;3)在10×106和5×106两个剂量组中接受PLAT-2.0细胞的动物发展出xGvHD,第一组由于xGvHD将进入中间-研究,并且第二组通过物理观察确认了xGvHD和通过骨髓的FACS分析确认了T细胞的存留。
图51A-图51D显示了用特定剂量调整的T细胞处理后的平均肿瘤进展;图51A:平均肿瘤进展±SD:PLAT-1.00剂量调整;图51B:平均肿瘤进展±SD:PLAT-2.00剂量调整;图51C:平均肿瘤进展±SD:PLAT-1.33剂量调整;图51D:平均肿瘤进展±SD:PLAT-1.67剂量调整。
图52A-图52D显示了T细胞处理的给药组中的PLAT比较;图52A:平均肿瘤进展±SD:10×106剂量对比;图52B:平均肿瘤进展±SD:5×106剂量对比;图52C:平均肿瘤进展±SD:2.5×106剂量对比;图52D:平均肿瘤进展±SD:1.25×106剂量对比。
图53A1-图53A4、图53B1-图53B4、图53C1-图53C4和图53E1-图53E4显示了来自在相似给药浓度下的产品PLAT-1.00、PLAT-1.33、PLAT-1.67和PLAT-2.00的T细胞的比较。图中说明了个体动物的肿瘤进展。每排的开始显示每个PLAT组以不同剂量调整分组,然后是梳理出个体组。图53A1:平均肿瘤进展±SD:PLAT-1.00个体的小鼠;图53A2:平均肿瘤进展±SD:PLAT-2.00个体的小鼠;图53A3:平均肿瘤进展±SD:PLAT-1.33个体的小鼠;图53A4:平均肿瘤进展±SD:PLAT-1.67个体的小鼠;图53B1:PLAT-1.00(10×10e6)个体的小鼠;图53B2:PLAT-1.00(5×10e6)个体的小鼠;图53B3:PLAT-1.00(2.5×10e6)个体的小鼠;图53B4:PLAT-1.00(1.25×10e6)个体的小鼠;图53C1:PLAT-1.33(10×10e6)个体的小鼠;图53C2:PLAT-1.33(5×10e6)个体的小鼠;图53C3:PLAT-1.33(2.5×10e6)个体的小鼠;图53C4:PLAT-1.33(1.25×10e6)个体的小鼠;图53D1:PLAT-1.67(10×10e6)个体的小鼠;图53D2:PLAT-1.67(5×10e6)个体的小鼠;图53D3:PLAT-1.67(2.5×10e6)个体的小鼠;图53D4:PLAT-1.67(1.25×10e6)个体的小鼠;图53E1:PLAT-2.00(10×10e6)个体的小鼠;图53E2:PLAT-2.00(5×10e6)个体的小鼠;图53E3:PLAT-2.00(2.5×10e6)个体的小鼠;图53E4:PLAT-2.00(1.25×10e6)个体的小鼠。
图54A-图54D显示了用来自产品PLAT-1.00、PLAT-1.33、PLAT-1.67和PLAT-2.00的T细胞处理的小鼠的剂量调整存活率;图54A:存活比例:10×106剂量,*PLAT-2.00(10×10e6)-由xGvHD死亡的;图54B:存活比例:5×106剂量;图54C:存活比例:2.5×106剂量;图54D:存活比例:1.25×106剂量。图说明了细胞处理的给药组内的PLAT比较。
图55A-图55D显示了存活曲线的PLAT比较;图55A:存活比例:PLAT-1.00剂量调整;图55B:存活比例:PLAT-2.00剂量调整,*PLAT-2.00(10×10e6)-由xGvHD死亡的;图55C:存活比例:PLAT-1.33剂量调整;图55D:存活比例:PLAT-1.67剂量调整。图说明了在用特定剂量的T细胞处理后的平均肿瘤进展。
图56A-图56D显示了对T细胞治疗响应的小鼠的存活率,其中T细胞在正常扩增方法下生长或在细胞因子存在下生长。图也显示了小鼠在T细胞处理后是否发展出异种移植宿主疾病。图56A:存活比例:2.5×106剂量;图56C:存活比例:1.25×106剂量;图56D:平均肿瘤进展±SD:1.25×106剂量调整。
图57A-图57C显示了对T细胞治疗响应的小鼠的存活率,其中T细胞在正常扩增方法下生长或在细胞因子存在下生长。图也显示了小鼠在T细胞处理后是否发展出异种移植宿主疾病。图57A:JME14-03:异种移植与宿主疾病;图57B:PLAT-2.00(10×106)个体的小鼠;图57C:PLAT-2.00(5×106)个体的小鼠。注意:用10×106和5×106剂量的PLAT-02细胞处理的动物发展出xGvHD。结果,接受了10×106剂量的动物在肿瘤接种后第58天或施用T细胞后第51天死亡。那些接受了5×106剂量的动物在肿瘤接种后第90天施用T细胞后第83天研究结束时被处死。
图58A1-图58A5、图58B1-图58B12和图58C1-图58C12显示了对T细胞治疗响应的小鼠的存活率,其中T细胞在正常扩增方法下生长或在细胞因子存在下生长。图也显示了小鼠在T细胞处理后是否发展出异种移植宿主疾病。图58A1-图58A5显示了JME14-03:通过FACS确认xGvHD(图58A1:JME14-03第90天BM 051214_染色的O2300_012.fcs未设门的1.04E6;图58A2:JME14-03第90天BM 051214_染色的O2300_012.fcs单线态7.77E5;图58A3:JME14-03第90天BM 051214_染色的O2300_012.fcs淋巴细胞6.55E5;图58A4:JME14-03第90天BM051214_染色的O2300_012.fcs UV活死,PerCP Cy5-5CD45 2904;图58A5:JME14-03第90天BM 051214_染色的O2300_012.fcs爱必妥生物素SA APC Pos 2761)。图58B1-图58B12显示了JME14-03 N组(10×10e6剂量)T细胞处理后第51天(肿瘤接种后第58天),iLabber ELN#EXP-14-CW6229(图58B1:JME14-03N BM 041014_染色的2187_010.fcs淋巴细胞4.91E5;图58B2:JME14-03N BM 041014_染色的2218_011.fcs淋巴细胞5.83E5;图58B3:JME14-03N BM041014_染色的2316_012.fcs淋巴细胞7.07E5;图58B4:JME14-03N BM 041014_染色的2333_013.fcs淋巴细胞5.96E5;图58B5:JME14-03N BM 041014_染色的2187_010.fcs活,CD45 9937;图58B6:JME14-03N BM 041014_染色的2218_011.fcs活,CD45 4361;图58B7:JME14-03N BM 041014_染色的2316_012.fcs活,CD45 12476;图58B8:JME14-03N BM041014_染色的2333_013.fcs活,CD45 15132;图58B9:JME14-03N BM 041014_染色的2187_010.fcs CD45,EGFRt Pos 9498;图58B10:JME14-03N BM 041014_染色的2218_011.fcsCD45,EGFRt Pos 4121;图58B11:JME14-03N BM 041014_染色的2316_012.fcs CD45,EGFRtPos 12116;图58B12:JME14-03N BM 041014_染色的2333_013.fcs CD45,EGFRt Pos14217)。图58C1-图58C12显示了JME14-03 O组(5×10e6剂量)T细胞处理后第83天(肿瘤接种后第90天),iLabber ELN#EXP-14-CW6241(图58C1:JME14-03第90天BM 051214_染色的O2189_010.fcs淋巴细胞7.91E5;图58C2:JME14-03第90天BM 051214_染色的O2189_011.fcs淋巴细胞7.81E5;图58C3:JME14-03第90天BM 051214_染色的O2189_012.fcs淋巴细胞6.65E5;图58C4:JME14-03第90天BM 051214_染色的O2334_013.fcs淋巴细胞4.31E5;图58C5:JME14-03第90天BM 051214_染色的O2189_010.fcs UV活死,PerCP Cy5-5CD452206;图58C6:JME14-03第90天BM 051214_染色的O2199_011.fcs UV活死,PerCP Cy5-5CD45 9221;图58C7:JME14-03第90天BM 051214_染色的O2300_012.fcs UV活死,PerCPCy5-5 CD45 2904;图58C8:JME14-03第90天BM 051214_染色的O2334_013.fcs UV活死,PerCP Cy5-5 CD45 2115;图58C9:JME14-03第90天BM 051214_染色的O2189_010.fcs爱必妥生物素SA APC Pos 2099;图58C10:JME14-03第90天BM 051214_染色的O2189_011.fcs爱必妥生物素SA APC Pos 8594;图58C11:JME14-03第90天BM 051214_染色的O2300_012.fcs爱必妥生物素SA APC Pos 2761;图58C12:JME14-03第90天BM 051214_染色的O2334_013.fcs爱必妥生物素SA APC Pos1783)。
图59A、图59B1-图59B4、图59C、图59D1-图59D11、图59E、图59F1-图59F4、图59G、图59H1-图59H4显示了对T细胞治疗响应的小鼠的存活率,其中T细胞在正常扩增方法下生长或在细胞因子存在下生长。图也显示了小鼠在T细胞处理后是否发展出异种移植宿主疾病。图59A:JME14-03 PLAT-02:活的和CD45+%,T细胞处理后第51天,骨髓活的和CD45+%。图59B1-图59B4:JME14-03 PLAT-02:活的和CD45+%。图59C:T细胞处理后第83天:骨髓活的/CD45+%。图59D1-图59D11:JME14-03 PLAT-02:活的和CD45+%。图59E:JME14-03 PLAT-02,5×106个T细胞剂量组;活的、CD45细胞的EGFRt%,T细胞处理后第51天:骨髓CD45+的EGFRt%。图59F1-图59F4显示了JME14-03 PLAT-02,5×106个T细胞剂量组;活的、CD45细胞的EGFRt%(图59F1:JME14-03N BM 041014_染色的2187_010.fcs活的、CD45 9937;图59F2:JME14-03N BM 041014_染色的2218_011.fcs活的、CD45 4631;图59F3:JME14-03N BM041014_染色的2316_012.fcs活的、CD45 12476;图59F4:JME14-03N BM 041014_染色的2316_012.fcs活的、CD45 15132)。图59G:JME14-03 PLAT-02,5×106个T细胞剂量组;活的、CD45细胞的EGFRt%,T细胞处理后第83天:骨髓CD45+的EGFRt%。图59H1-图59H4显示了JME14-03 PLAT-02,5×106个T细胞剂量组;活的、CD45细胞的EGFRt%(图59H1:JME14-03第90天BM 051214_染色的O2300_012.fcs UV活死,PerCP Cy5-5 CD45;图59H2:JME14-03第90天BM 051214_染色的O2334_013.fcs UV活死,PerCP Cy5-5 CD45;图59H3:JME14-03第90天BM 051214_染色的O2189_010.fcs UV活死,PerCP Cy5-5 CD45;图59H4:JME14-03第90天BM051214_染色的O2199_013.fcs UV活死,PerCP Cy5-5 CD45)。
图60A、图60B1-图60B4、图60C和图60D1-图60D4显示了对T细胞治疗响应的小鼠的存活率,其中T细胞在正常扩增方法下生长或在细胞因子存在下生长。图也显示了小鼠在T细胞处理后是否发展出异种移植宿主疾病。图60A:JME14-03 PLAT-02,5×106剂量组:%CD4+vs CD8,CD45+,EGFRt+,T细胞处理后第51天;骨髓中CD4与CD8。图60B1-图60B4显示了JME14-03 PLAT-02,5×106剂量组:活的、CD45+的、EGFR+的CD4+与CD8+%,其中,图60B1:JME14-03N BM 041014_染色的2187_010.fcs CD45,EGFRt Pos 9498;图60B2:JME14-03NBM 041014_染色的2218_011.fcs CD45,EGFRt Pos 4121;图60B3:JME14-03N BM 041014_染色的2316_012.fcs CD45,EGFRt Pos 12116;图60B4:JME14-03N BM 041014_染色的2333_013.fcs CD45,EGFRt Pos 14217。图60C:JME14-03 PLAT-02,5×106剂量组:活的、CD45+的、EGFR+的CD4+与CD8+%,T细胞处理后第83天:骨髓中CD4与CD8%。图60D1-图60D4显示了JME14-03 PLAT-02,5×106剂量组:活的、CD45+的、EGFR+的CD4+与CD8+%,其中,图60D1:JME14-03第90天BM 051214_染色的O2300_012.fcs爱必妥生物素SA APC Pos 2761;图60D2:JME14-03第90天BM 051214_染色的O2334_013.fcs爱必妥生物素SA APC Pos1783;图60D3:JME14-03第90天BM 051214_染色的O2189_010.fcs爱必妥生物素SA APC Pos2099;图60D4:JME14-03第90天BM 051214_染色的O2199_013.fcs爱必妥生物素SA APC Pos8594。
图61显示了JME14-03 N组在T细胞处理后51天、在51天和在90天的表格。
具体实施方式
提供下面的定义以促进对本文描述的数个供选择的方案的理解。
如本文使用的,“一个/一种(a)”或“一个/一种(an)”可表示一个/一种或多于一个/一种。
如本文使用的,“核酸”或“核酸分子”是指多核苷酸或寡核苷酸如脱氧核糖核酸(DNA)或核糖核酸(RNA),寡核苷酸,通过聚合酶链式反应(PCR)产生的片段以及通过任意的连接、断裂、核酸内切酶作用、核酸外切酶作用产生的片段和通过合成产生产生的片段。核酸分子可由天然存在的核苷酸(如DNA和RNA)的单体组成,或由天然存在的核苷酸的类似物(如对映异构体形式的天然存在的核苷酸)的单体组成,或两者的组合组成。修饰的核苷酸可具有在糖部分和/或在嘧啶或嘌呤碱基部分的改变。糖修饰包括,例如用卤素、烷基、胺和叠氮基取代一个或多个羟基,或糖可以被官能化为醚类或酯类。此外,可以用空间或电子相似结构,如氮杂糖和碳环糖类似物取代全部糖部分。在碱基部分修饰的例子包括包括烷基化的嘌呤和嘧啶、酰基化的嘌呤或嘧啶或其他熟知的杂环取代。核酸单体可以通过磷酸二酯键或这样的连键的类似物连接。磷酸二酯键的类似物包括硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺硫代磷酸酯(phosphoroanilothioate)、苯胺磷酸酯(phosphoranilidate)、氨基磷酸酯等。术语“核酸分子”也包括所谓的“肽核酸”,其包括连接于聚酰胺骨架的天然存在或修饰的核酸碱基。核酸可以是单链的或双链的。
如本文使用的“基因修饰”,是指使用通过基因工程技术改变的遗传物质如核酸修饰有机体或细胞如细菌、T细胞、细菌细胞、真核细胞、昆虫、植物或哺乳动物的方法。例如,可以通过以下方法将核酸如DNA插入宿主基因组:首先使用分子克隆方法分离和复制感兴趣的遗传物质以产生DNA序列或通过合成DNA;然后将该构建体插入宿主有机体。也可以使用核酸酶移除或“敲除”基因。基因打靶是不同的技术,其使用同源重组以改变内源基因,并且可以用于删除基因,移除外显子,添加基因或引入点突变。
本文描述了通过转导进行的基因修饰。“转导”是指通过载体的方式将遗传物质例如DNA或RNA转移至细胞的方法。常用技术使用病毒载体、电穿孔和化学试剂以增加细胞通透性。通过病毒或经由病毒载体可以转移DNA。如本文描述,提供了修饰免疫CD4+和/或CD8+T细胞的方法。为了获得治疗性基因的高表达和/或增加细胞表面上的嵌合抗原受体的量,例如,可以用编码嵌合抗原受体的遗传物质转导T细胞。可以使用病毒基因修饰T细胞。通常用于基因治疗的病毒是腺病毒、腺伴随病毒(AAV)、反转录病毒和慢病毒。
已经开发了多种转导技术,其使用重组感染性病毒颗粒以递送编码嵌合抗原受体的核酸。这表现了当前优选的转导T淋巴细胞的方法。如本文描述,用于转导的病毒载体可以包括源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒和反转录病毒的病毒载体。因此,基因转移和表达方法是很多的但基本上用于在哺乳动物细胞中引入和表达遗传物质。数种上述技术可以用于转导造血细胞或淋巴样细胞,包括磷酸钙转染;原生质体融合;电穿孔和用重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体感染。通过电穿孔和通过反转录病毒或慢病毒感染已经成功转导了原代T淋巴细胞。如此,反转录病毒和慢病毒载体可以提供用于在真核细胞中基因转移的高效的方法。反转录病毒和慢病毒载体提供用于基因转移到T细胞中的高效的方法。此外,反转录病毒或慢病毒的整合以控制方式发生并导致每个细胞一个或几个拷贝的新遗传信息的稳定整合。
如本文描述的“表达载体”或载体是编码在宿主细胞中表达的基因的核酸分子。典型地,表达载体包括转录启动子、基因和转录终止子。基因表达通常置于启动子的控制之下,并且这样的基因被称为“可操作地连接于”启动子。相似地,如果调控元件调节核心启动子的活性,调控元件和核心启动子是可操作地连接的。
在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,其中方法包括从混合的T细胞群分隔、分离或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分离的、分隔的或富集的T细胞群;刺激分离的、分隔的或富集的T细胞群,以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以产生转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;通过选择由标记序列编码的标记,富集、分隔或分离转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生富集的、分隔的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;以及增殖富集的、分隔的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。在该方法的一些供选择的方案中,载体是病毒载体。在该方法的一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在该方法的一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在该方法的一些供选择的方案中,病毒载体是慢病毒载体。
“前导序列”也称为“5’非翻译区(5’UTR)”,是位于起始密码子上游并对调控mRNA转录物的翻译重要的mRNA区。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,编码嵌合抗原受体的载体包括编码前导序列的序列。
如本文描述的“配体”是指可以与另一分子或生物分子形成复合体用于生物目的例如信号触发的小分子。结合可以通过分子间的力例如离子键、氢键和范德华相互作用发生。结合于受体蛋白的配体可以改变三维结构并确定其功能状态。
通过示例而非限制,配体可以包括底物、蛋白、小分子、抑制剂、激活剂和神经递质。配体结合的强度被称为配体亲和力,并可以通过直接相互作用和溶剂效应确定。配体可以通过“配体结合域”结合。配体结合域可以指能结合特异性配体的结构中的保守序列。不作为限制,配体结合域可以是对一种或多种配体特异性的特异性蛋白域。
“特异性的”或“特异性”可以指配体对于结合配偶体,或可供选择地,结合配偶体对于配体的特征,并可以包括互补形状、电荷和结合的疏水特异性。结合特异性可以包括立体专一性、区域选择性和化学选择性。
“信号传导域”也称为“共刺激域”,是与细胞内部相互作用的蛋白或受体蛋白的胞内域或胞浆域,并通过传递信号起作用。存在于细胞的胞内部分的蛋白部分也被称作“内域(endodomain)”。该相互作用可以通过经由特异性蛋白-蛋白或蛋白-配体相互作用与效应分子或效应蛋白连通的胞内域发生,所述效应分子或效应蛋白反过来可以沿信号链发送信号到达其目的地。
信号传导域或共刺激域也指信号传导部分,所述信号传导部分向T细胞提供除了由例如TCR/CD3复合体的CD3ζ链提供的初级信号以外的信号,介导T细胞应答例如免疫应答、激活、增殖、分化、细胞因子分泌、溶细胞活性、穿孔素和/或颗粒酶活性等。信号传导域或共刺激域可以包括以下的所有或部分,但不限制于:CD27、CD28、4-1BB、OX40、CD30、CD40、ICOS、淋巴细胞功能相关抗原-1(LFA-1)、CD2、CD7、LIGHT、NKG2C、B7-H3和/或与CD83特异性结合的配体。
“选择性标记序列”是引入载体或细胞的基因,所述基因提供用于人工选择的特征。选择性标记序列或标记序列可以是可筛选标记以允许研究者区分需要的和不想要的细胞,或富集特定的细胞类型。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,提供了载体,其中载体编码包括标记序列的嵌合抗原受体,其中所述标记序列编码细胞表面选择性标记。
在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分隔、分离或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分离的、分隔的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激分离的、分隔的或富集的T细胞群以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以产生转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,所述细胞因子优选为外源添加的细胞因子,例如为除了由T细胞产生的或存在于培养基中的任何细胞因子以外的细胞因子;通过选择由标记序列编码的标记,分隔、富集或分离转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生富集的、分隔的或分离的转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;以及增殖富集的、分隔的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。
在该方法的一些供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列。在该方法的一些供选择的方案中,载体进一步包括编码间隔区的序列。在该方法的一些供选择的方案中,间隔区包括IgG4铰链。在该方法的一些供选择的方案中,载体是病毒载体。在该方法的一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在该方法的一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在该方法的一些供选择的方案中,病毒载体是慢病毒载体。在该方法的一些供选择的方案中,标记序列编码截短的表皮生长因子受体(EGFRt)。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域包括抗体或其结合部分。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域包括单链可变区片段(scFv)或其结合部分。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域包括FMC63或其结合部分。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域对CD19是特异性的。在该方法的一些供选择的方案中,载体包括编码标记序列的序列。在这些供选择的方案的一些中,标记序列是截短的表皮生长因子受体(EGFRt)。
如本文描述的“密码子优化”是指改变密码子为已知增加最大蛋白表达效率的密码子的设计过程。在一些供选择的方案中,描述了用于在人体中表达的密码子优化,其中可以通过使用本领域技术人员已知的算法进行密码子优化以产生针对在人体中具有高mRNA和蛋白产量优化的合成基因转录物。含有用于在人体中密码子优化的算法的程序是容易获得的。这样的程序可以包括例如OptimumGeneTM或算法。此外,可以商业地获得人密码子优化序列,例如从Integrated DNA Technologies。
在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分隔、分离或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分离的、分隔的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激分离的、分隔的或富集的T细胞群,以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以产生转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,所述细胞因子优选为外源添加的细胞因子,例如为除了由T细胞产生的或存在于培养基中的任何细胞因子以外的细胞因子;通过选择由标记序列编码的标记,富集、分离或分隔转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生富集的、分离的或分隔的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;以及增殖富集的、分隔的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。在该方法的一些供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列。在该方法的一些供选择的方案中,载体的序列是针对在人体中表达进行密码子优化的。在一些供选择的方案中,载体的序列被优化为具有特别地针对在人细胞中最大蛋白表达的选择的密码子,这可以增加T细胞的蛋白或CAR的浓度。
也可以进行优化以减少多核苷酸中二级结构的发生。在该方法的一些供选择的方案中,也可以进行载体中序列的优化以减少总GC/AT比。严格的密码子优化会导致不想要的二级结构或导致二级结构的不希望的高GC含量。如此,二级结构影响转录效率。在密码子使用优化后,可以使用如GeneOptimizer的程序以避免二级结构和优化GC含量。在初始密码子优化后,这些另外的程序可以用于进一步的优化和错误检查以限制可在第一轮优化后发生的二级结构。用于优化的可供选择的程序是容易获得的。在该方法的一些供选择的方案中,载体包括为避免二级结构优化的序列和/或序列被优化为减少总GC/AT比的序列和/或序列被优化以在人体中表达的序列。
标记域也可以为本文描述的供选择的实施方案提供重要的方面。利用细胞表面上的标记域可以在与施用T细胞或转导的T细胞存在相关的毒性事件的事件中使转导的淋巴细胞消融。例如,在EGFRt标记序列的情况下,EGFR的全长抗体可以用于结合于表达EGFR的细胞,并经由抗体依赖性细胞介导的细胞毒性(ADCC)杀伤细胞。在一些供选择的方案中,对标记域特异性的抗体可以连接于细胞毒性剂如放射性核素或毒素,导致产生能够在在体内消融或杀伤转导的细胞的治疗剂。在一些供选择的方案中,提供标记序列用于富集和细胞选择。在本文描述的示例性的供选择的方案中,EGFRt标记序列用于纯化和富集使得针对EGFRt标记进行免疫磁性选择的方法。
如本文描述的“间隔区”可以指长度为如下的多肽链:10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239或240个氨基酸或由任意两个前述的长度限定的范围内的长度。间隔区可以包括任意的20个氨基酸,例如以任意顺序以在嵌合抗原受体中建立希望长度的多肽链,所述多肽链包括氨基酸精氨酸、组氨酸、赖氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、甘氨酸、脯氨酸、丙氨酸、缬氨酸、异亮氨酸、蛋氨酸、苯丙氨酸、酪氨酸和/或色氨酸。间隔区序列可以是嵌合抗原受体的scFv与跨膜域之间的接头。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,载体进一步包括编码间隔区的序列。在该方法的一些供选择的方案中,间隔区包括长度为如下的序列:10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239或240个氨基酸或由任意两个前述的长度限定的范围内的长度。在该方法的一些供选择的方案中,间隔区存在于嵌合抗原受体的scFv和跨膜区之间。
如本文描述的“IgG4铰链”是指在IgG4抗体的重链和轻链之间的多肽域。在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分隔、富集或分离表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分离的、分隔的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激分离的、分隔的或富集的T细胞群,以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以产生转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,所述细胞因子优选为外源添加的细胞因子,例如为除了由T细胞产生的或存在于培养基中的任何细胞因子以外的细胞因子;通过选择由标记序列编码的标记,富集转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生富集的、分隔的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;以及增殖富集的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。
在该方法的一些供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记的第四序列。在该方法的一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括人抗体的铰链区。在该方法的一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,IgG4铰链区是修饰的IgG4铰链。如本文描述的“修饰的IgG4铰链”可以指与如SEQ ID NO:1(SEQ ID NO:1;ESKYGPPCPPCP)、SEQ ID NO:2(SEQ ID NO:2;YGPPCPPCP)、SEQ ID NO:3(SEQ ID NO:3;KYGPPCPPCP)或SEQ ID NO:4(SEQ ID NO:4;EVVKYGPPCPPCP)中所记载的铰链区氨基酸序列具有至少90%、92%、95%或100%的序列一致性或由任意两个前述的百分比限定的范围内的序列一致性的铰链区。如上文提及的,可以针对在人体中表达使任意一个或多个这些序列密码子优化,并且可以使任意一个或多个这些序列密码子优化以减少二级结构或GC/AT比,并且任意一个或多个这些序列可以是由至少两个同种型基因产生的共有序列。
“跨膜域”是可位于细胞的双层中以锚定嵌入生物膜的蛋白的疏水性蛋白的区域。不作为限制,跨膜域的拓扑学可以是跨膜α螺旋。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,载体包括编码跨膜域的序列。在该方法的一些供选择的方案中,跨膜域包括CD28跨膜序列或其片段,所述CD28跨膜序列或其片段为10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27或28个氨基酸的长度或由任意两个前述的长度限定的范围内的长度。在该方法的一些供选择的方案中,CD28跨膜序列或其片段包括长度为28个氨基酸。在该方法的一些供选择的方案中,跨膜域包括SEQ ID NO:5(SEQID NO:5;MFWVLVVVGGVLACYSLLVTVAFIIFWV)中所记载的序列。
“信号传导域”也称为“共刺激域”,是与细胞内部相互作用的蛋白或受体蛋白的胞内域或胞浆域,并通过传递信号起作用。存在于细胞的胞内部分的蛋白部分也被称作“内域”。该相互作用可以通过经由特异性蛋白-蛋白或蛋白-配体相互作用与效应分子或效应蛋白连通的胞内域发生,所述效应分子或效应蛋白反过来可以沿信号链发送信号到达其目的地。信号传导域或共刺激域也是指信号传导部分,所述信号传导部分向T细胞提供除了由例如TCR/CD3复合体的CD3ζ链提供的初级信号以外的信号,介导T细胞应答例如免疫应答、激活、增殖、分化、细胞因子分泌、溶细胞活性、穿孔素和/或颗粒酶活性等。信号传导域或共刺激域可以包括以下的所有或部分,但不限制于CD27、CD28、4-1BB、OX40、CD30、CD40、ICOS、淋巴细胞功能相关抗原-1(LFA-l)、CD2、CD7、LIGHT、NKG2C和/或B7-H3和/或与CD83特异性结合的配体。
在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,编码嵌合抗原受体的载体进一步包括用于共刺激域的序列,其中共刺激域是与其他胞内介质相互作用以介导包括免疫应答、激活、增殖、分化、细胞因子分泌、溶细胞活性、穿孔素和/或颗粒酶活性等的细胞应答的胞内信号传导域。在该方法的一些供选择的方案中,载体包括编码信号传导域的序列。在该方法的一些供选择的方案中,信号传导域包括4-1BB域和/或CD3-ζ域。在一些供选择的方案中,4-1BB域包括在SEQ ID NO:6(SEQ ID NO:6;KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL)中所记载的序列。在一些供选择的方案中,CD3-ζ域包括在SEQ ID NO:7(SEQ ID NO:7;RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR)所记载的序列。
如本文描述的“嵌合抗原受体”(CAR)也被称为嵌合T细胞受体,是指人工T细胞受体或基因工程受体,其将希望的特异性移植至免疫效应细胞上。这些受体例如可以用于将单克隆抗体或其结合部分的特异性移植至T细胞上;将编码CAR的序列转移至由反转录病毒载体促进的受体细胞。CAR的结构可以包括源自单克隆抗体的单链可变区片段(scFv),所述单克隆抗体融合于CD3-ζ跨膜域和内域。这样的分子导致响应于通过其靶标的scFv识别的ζ信号的传递。
在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分隔、分离或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分离的、分隔的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激分离的、分隔的或富集的T细胞群,以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触,如接触至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以产生转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;通过选择标记序列编码的标记富集、分隔或分离转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生富集的、分隔的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;以及增殖富集的、分隔的或分离的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。在该方法的一些供选择的方案中,嵌合抗原受体对CD19是特异性的。
使用称为“过继细胞转移”的技术,这些人工T细胞受体或CAR可以用于癌症或病毒感染的治疗。从患者中移除T细胞并修饰该T细胞,以便所述T细胞表达对癌细胞或病毒,或病毒感染的细胞上显示的分子特异性的受体。基因工程T细胞被重新引入患者体内,所述基因工程T细胞可以识别和杀伤癌细胞或病毒感染的细胞,或促进清除病毒。在一些供选择的方案中,提供了治疗、抑制或减轻有需要的受试者的疾病的方法。
在某些方面,方法可以包括施用至少一种组合物或产品组合,其中至少一种组合物或产品组合包含基因修饰的T细胞群,其中基因修饰的T细胞群包括大量亲和性选择的表达CD8+和/或CD4+的T细胞,所述大量亲和性选择的表达CD8+和/或CD4+的T细胞不存在、富集自、实质上分隔自或实质上分离自表达CD8-和/或CD4-的T细胞,其中所述大量亲和性选择的表达CD8+和/或CD4+的T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的表达CD8+和/或CD4+的T细胞进一步包括编码嵌合抗原受体和细胞表面选择性标记的基因并且,其中所述大量亲和性选择的表达CD8+和/或CD4+的T细胞已经被至少一种细胞因子重刺激如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。在一些供选择的方案中,通过过继细胞转移将至少一种组合物或产品组合施用于所述受试者。
如本文描述的“抗体”是指由免疫系统使用的浆细胞产生的用于鉴别和中和外来物如细菌和病毒的大的Y形蛋白。抗体蛋白可包括四条多肽链;由二硫键连接的两条相同的重链和两条相同的轻链。每条链由称作免疫球蛋白域的结构域组成。这些域可以含有70-110个氨基酸并根据它们的大小和功能分为不同的类别。在一些供选择的方案中,配体结合域是抗体片段,希望地是其结合部分。在一些供选择的方案中,存在于CAR上的抗体片段或其结合部分对CD19是特异性的。
“单链可变区片段”或scFv是包括以短接头肽连接的免疫球蛋白的重链(VH)和轻链(VL)可变区的融合蛋白。不作为限制,接头可以包括用于柔性的甘氨酸和亲水性氨基酸,如用于溶解性的丝氨酸或苏氨酸。接头可连接VH的N末端和VL的C末端,或者其可以连接VH的C末端和VL的N末端。在一些供选择的方案中,存在于CAR上的配体结合域是单链可变区片段(scFv)。在一些供选择的方案中,存在于CAR上的scFv域对存在于肿瘤细胞上的CD19是特异性的。
“FMC63”是CD19特异性的单克隆抗体。CD19是在白细胞的表面上发现的蛋白,并且CD19可以与B淋巴细胞的抗原受体组装以降低抗原受体依赖性刺激的阈值。CD19表达于滤泡树突状细胞和B细胞上。CD19存在于来自在发育为未成熟B细胞(B-cell blasts)的过程中的最早期可识别的B谱系细胞(earliest recognizable B-lineage cells),但是在成熟为浆细胞时丢失的B细胞上。CD19与CD21和CD81结合主要起B细胞共受体的作用。激活时,CD19的胞浆尾部变为磷酸化,导致通过Src家族激酶结合和PI-3激酶募集。如T细胞上,数种表面分子形成抗原受体,并形成B淋巴细胞上的复合物。
CD19中的突变与表征为抗体产生减少的重度免疫缺陷综合征相关。例如,在急性骨髓性白血病中,CD19的异常表达是单核细胞谱系的标记。因为CD19是B细胞的标志,因此该蛋白可以用于诊断由该类型的细胞引起的癌症,尤其是B细胞淋巴瘤。自2011年以来,靶向CD19的治疗已经开始进入试验。最新的在开发工作中的实验性抗CD19药物通过利用CD19的存在将治疗特异性地指向B细胞癌症。然而,目前显现出该蛋白通过稳定MYC癌蛋白的浓度在驱动这些癌症的生长中起积极作用。因此,CD19和其下游信号传导是引人注目的治疗靶点。
在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分隔、富集、分离或纯化表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分离的、分隔的、富集的或纯化的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激分离的、分隔的、富集的或纯化的T细胞群,以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触,如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以产生转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;通过选择标记富集转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生富集的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;以及增殖富集的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。
在该方法的一些供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列。在该方法的一些供选择的方案中,载体进一步包括编码间隔区的序列。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域包括抗体或其结合部分。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域包括单链可变区片段(scFv)或其结合部分。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域包括FMC63或其结合部分。在该方法的一些供选择的方案中,嵌合抗原受体的配体结合域对CD19是特异性的。
如本文描述的T细胞的“纯化”,指的是高度纯化的、功能性T细胞的分离,所述T细胞用于研究或用于产生用于治疗的T细胞的方法。如本文描述T细胞的“分离”或T细胞的“分隔”指的是从污染的细胞群或其他组分中分离或分隔希望的T细胞、T细胞群或亚群,例如通过使用如间接淘选(indirect panning)等的技术。在该方法中,可以通过细胞结合于附着在支持物如塑料或聚碳酸酯表面、珠、颗粒、板或孔上的抗体的能力分离、分隔或选择细胞。细胞可以基于具体的细胞表面标记结合。在一些情况下,希望的T细胞群是“富集的”意思是希望的T细胞群在富集之后大于该T细胞所来源的天然群的T细胞群。
在制备基因修饰的T细胞的方法的一些供选择的方案中,使用CD8特异性抗体和/或CD4特异性抗体从不希望的组分中分离、富集、纯化或分隔表达CD8+的T细胞群和/或表达CD4+的T细胞群。在该方法的一些供选择的方案中,使用流式细胞术分离、富集或纯化表达CD8+的T细胞群和/或表达CD4+的T细胞群。在一些供选择的方案中,使用免疫磁性选择分离、富集、纯化或分隔表达CD8+的T细胞群和/或表达CD4+的T细胞群。在该方法的一些供选择的方案中,使用抗CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28、CD8、CD4和/或CD62L的抗体分离、富集、纯化或分隔表达CD8+的T细胞群和/或表达CD4+的T细胞群。在该方法的一些供选择的方案中,通过使用抗CD27、CD28和/或CD62L的抗体分离、富集、纯化或分隔表达CD8+的T细胞群和/或表达CD4+的T细胞群。在一些供选择的方案中,用分离的、富集的或分隔的表达CD4+的T细胞,在用于分离、富集或纯化的混合T细胞群中不存在表达CD8+的细胞或表达CD4+的T细胞比表达CD8+的细胞的量更丰富的情况下执行所述方法。在一些供选择的方案中,用分离的、富集的或分隔的表达CD8+的T细胞,在用于分离、富集或纯化的混合T细胞群中不存在表达CD4+的细胞或表达CD8+的T细胞比表达CD4+的细胞的量更丰富的情况下执行所述方法。
T细胞的“刺激”或激活是指诱导T细胞起始应答如信号转导应答,例如增殖,同时保存T细胞的生存力和免疫功能的方法。例如,刺激性信号转导至TCR/CD3和CD8可触发生理学激活和人T细胞的增殖。在适当的刺激之后,T细胞可以在体外大量增殖。在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分离、分隔、富集或纯化表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分离的、分隔的、纯化的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激分离的、分隔的、纯化的或富集的T细胞群,以产生刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群;用载体转导刺激的表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触,如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以产生转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群;通过选择标记序列编码的标记,富集、分隔或分离转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生富集的、转导的、细胞因子刺激的、CD8+T细胞群和/或CD4+T细胞群;以及增殖富集的、分离的或分隔的、转导的、细胞因子刺激的、表达CD8+的T细胞群和/或表达CD4+的T细胞群至少1天,如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。在一些供选择的方案中,用抗体结合支持物如珠或颗粒进行刺激。在一些供选择的方案中,用包括抗TCR、抗CD2、抗CD3、抗CD4和/或抗CD28抗体的抗体结合支持物进行刺激。在一些供选择的方案中,用包括抗CD3和/或抗CD28抗体的抗体结合支持物进行刺激。在一些供选择的方案中,方法进一步包括移除抗体结合支持物如珠或颗粒。
如本文使用的“T细胞”或“T淋巴细胞”可以来自任何哺乳动物,优选灵长类动物,包括人或猴子,伴侣动物如狗、猫或马,或家畜如绵羊、山羊或牛。在一些供选择的方案中,T细胞是与受体受试者同种异体的(来自相同物种但不同的供体);在一些供选择的方案中,T细胞是自体的(供体与受体是相同的);在一些供选择的方案中,T细胞是同基因的(供体与受体不同但是是同卵双胞胎)。
从始至终同义使用的“表达CD8+的T细胞”或“CD8+T细胞”也被称为TC、细胞毒性T淋巴细胞、CTL、T杀伤细胞、溶细胞的T细胞或杀伤T细胞。如本文描述,CD8+T细胞是可以杀伤癌细胞、病毒感染的细胞或损伤的细胞的T淋巴细胞。CD8+T细胞表达可以识别特异性抗原的T细胞受体(TCR)。CD8+T细胞在表面上表达CD8。表达CD8+的T细胞具有产生一些细胞因子的能力,然而CD8+T细胞产生的细胞因子的量不具有促进、改善、有助于或诱导移入适合性的浓度。
从始至终同义使用的“表达CD4+的T细胞”或“CD4+T细胞”也被称为T辅助细胞,其在免疫系统和适应性免疫系统中发挥重要作用。CD4+T细胞也通过释放T细胞细胞因子帮助其他免疫细胞的活性。这些细胞帮助、抑制或调控免疫应答。它们在B细胞抗体类别转换中,在细胞毒性T细胞的激活和生长中以及在使吞噬细胞如巨噬细胞的杀菌活性最大化中是必需的。表达CD4+的T细胞具有产生一些细胞因子的能力,然而CD4+T细胞产生的细胞因子的量不具有促进、改善、有助于或诱导移入适合性的浓度。
成熟T细胞表达表面蛋白CD4,并被称为CD4+T细胞。CD4+T细胞通常被视作具有作为免疫系统中的辅助T细胞的预定义的作用。例如,当抗原提呈细胞在II类MHC上表达抗原时,CD4+细胞会通过细胞与细胞相互作用的结合(例如CD40和CD40L)和通过细胞因子帮助那些细胞。然而,存在少有的例外;例如,调控T细胞、自然杀伤细胞和细胞毒性T细胞的亚群表达CD4。所有后者的表达CD4+的T细胞群不能认为是T辅助细胞。
如本文使用的“中枢记忆”T细胞(“TCM”)是指在其表面上表达CD62L或CCR-7和CD45RO,而与初始细胞相比不表达CD45RA或CD45RA表达减少的抗原刺激过的(antigenexperienced)CTL。在一些供选择的方案中,中枢记忆细胞对CD62L、CCR7、CD28、CD127、CD45RO和/或CD95的表达呈阳性,并且与初始细胞相比具有减少的CD45RA表达。
如本文使用的“效应记忆”T细胞(或“TEM”)是指与中枢记忆细胞相比在其表面不表达CD62L或CD62L的表达减少,并且与初始细胞相比不表达CD45RA或CD45RA的表达减少的抗原刺激过的T细胞。在一些供选择的方案中,与初始细胞或中枢记忆细胞相比,效应记忆细胞对于CD62L和/或CCR7的表达呈阴性,并具有可变的CD28和/或CD45RA的表达。
如本文使用的“初始”T细胞是指与中枢记忆细胞或效应记忆细胞相比表达CD62L和/或CD45RA,和/或不表达CD45RO的未经抗原刺激过的T淋巴细胞。在一些供选择的方案中,初始CD8+T淋巴细胞被表征为表达初始T细胞的表型标记(包括CD62L、CCR7、CD28、CD127和/或CD45RA)。
如本文使用的“效应”“TE”T细胞是指与中枢记忆T细胞或初始T细胞相比,不表达CD62L、CCR7、CD28或CD62L、CCR7、CD28的表达减少,并且对于颗粒酶B和/或穿孔素呈阳性的抗原刺激过的细胞毒性T淋巴细胞。
如本文描述的“移入适合性”是指在细胞通过过继转移进入体内(例如血流)后,细胞生长和增殖的能力。移入通常可以发生在转移之后2至4周内。可以通过频繁对特异性细胞检查血球计数监控移入。在提供的治疗、抑制或减轻受试者疾病的方法的一些供选择的方案中,方法可以包括施用如本文描述的包括基因修饰的T细胞的组合物或产品组合。在一些供选择的方案中,方法可以进一步包括通过检查对表达嵌合抗原受体的基因修饰的T细胞的血球计数,例如通过鉴别与转移的T细胞相关的标记的存在或不存在,监测受试者。
具有改善的移入适合性的T细胞在细胞表面上可以具有提供T细胞免疫的产生和长期维持的特异性标记。存在对于T细胞激活和存活已知的数种蛋白。CD28是表达于T细胞上的蛋白,所述CD28提供T细胞激活和存活需要的共刺激信号。CD27是T细胞免疫的产生和长期维持所需要的。它结合于配体CD70,并在调控B细胞激活和免疫球蛋白合成中起关键作用。L-选择素也称为CD62L,是淋巴细胞上发现的细胞粘附分子。L-选择素起“归巢受体”的作用以使淋巴细胞或T细胞经高内皮静脉(high endothelial venues)进入次级淋巴组织。存在于内皮细胞上的配体会结合于表达L-选择素的淋巴细胞,使通过血液的淋巴细胞运输(trafficking)减慢,并所述配体可以在该部位促进进入次级淋巴器官。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,T细胞包括促进、诱导、改善或有助于移入适合性的至少一种受体。在一些供选择的方案中,至少一种受体是CD45 RA、CD45RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,至少一种受体是CD27、CD28和/或CD62L。在本文提供的一些供选择的方案中,描述了这样的方法,其中表达CD4+的T细胞和表达CD8+的T细胞通过转导载体形式的遗传物质基因修饰,使得基因修饰的表达CD4+的T细胞和表达CD8+的T细胞表达特异性嵌合抗原受体。在基因修饰的表达CD4+的T细胞和表达CD8+的T细胞的一些供选择的方案中,基因修饰的表达CD4+的T细胞和CD8+T细胞进一步被修饰以改善或提高移入适合性。
如本文描述的“细胞因子”指的是在细胞信号传导中重要的小蛋白(5-25kDa)。细胞因子被细胞释放,并影响其他细胞的行为,有时影响释放细胞本身如T细胞。细胞因子可包括,例如趋化因子、干扰素、白介素、淋巴因子和肿瘤坏死因子。细胞因子可以通过一系列的细胞产生,所述细胞可包括例如免疫细胞如巨噬细胞、B淋巴细胞、T淋巴细胞和肥大细胞,以及内皮细胞,成纤维细胞和多种基质细胞。
细胞因子可以通过受体起作用,由于细胞因子可以调节体液免疫应答和基于细胞的免疫应答之间的平衡并且细胞因子可以调控具体细胞群的成熟、生长和响应性,因此细胞因子在免疫系统中是重要的。一些细胞因子通过复合方式提高或抑制其他细胞因子的作用。不作为限制,细胞因子可以包括例如酰化刺激蛋白、脂肪因子、白蛋白干扰素(Albinterferon)、CCL1、CCL11、CCL12、CCL13、CCL14、CCL15、CCL16、CCL17、CCL18、CCL19、CCL2、CCL20、CCL21、CCL22、CCL23、CCL24、CCL25、CCL26、CCL27、CCL28、CCL3、CCL5、CCL6、CCL7、CCL8、CCL9、趋化因子、集落刺激因子、CX3CL1、CX3CR1、CXCL1、CXCL10、CXCL11、CXCL13、CXCL14、CXCL15、CXCL16、CXCL17、CXCL2、CXCL3、CXCL5、CXCL6、CXCL7、CXCL9、红细胞生成素、Gc-MAF、粒细胞集落刺激因子、粒细胞巨噬细胞集落刺激因子、肝细胞生长因子、细胞因子的IL 10家族、细胞因子的IL 17家族、IL1A、IL1B、炎性体、干扰体(Interferome)、干扰素、干扰素β1a、干扰素β1b、干扰素γ、I型干扰素、II型干扰素、III型干扰素、白介素、白介素1家族、白介素1受体拮抗剂、白介素10、白介素12、白介素12亚单位β、白介素13、白介素15、白介素16、白介素2、白介素23、白介素23亚单位α、白介素34、白介素35、白介素6、白介素7、白介素8、白介素36、白血病抑制因子、白细胞促进因子、淋巴因子、淋巴毒素、淋巴毒素α、淋巴毒素β、巨噬细胞集落刺激因子、巨噬细胞炎性蛋白、巨噬细胞激活因子、单核因子、肌因子(Myokine)、肌联素(Myonectin)、烟酰胺磷酸核糖基转移酶、抑癌蛋白M、奥普瑞白介素、血小板因子4、促炎性细胞因子、Promega促红细胞生长素(Promegapoietin)、RANKL、基质细胞衍生因子1、黑色素瘤药物(Talimogene laherparepvec)、肿瘤坏死因子α、肿瘤坏死因子、XCL1、XCL2、GM-CSF和/或XCR1。在制备基因修饰的T细胞的方法的一些供选择的方案中,使转导的表达CD8+的T细胞群和/或表达CD4+的T细胞群与至少一种细胞因子接触,以产生转导的、细胞因子刺激的、CD8+T细胞群和/或CD4+T细胞群。在该方法的一些供选择的方案中,使用的至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21。在一些供选择的方案中,与细胞因子接触的时间为至少1天,如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。
如本文描述的“白介素”或IL是免疫系统主要依赖的细胞因子。本文可使用的白介素的例子,例如包括IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、Il-7、IL-8/CXCL8、IL-9、IL-10、IL-11、IL-12、IL-13、IL-14、IL-15、IL-16、IL-17、IL-18、IL-19、IL-20、IL-21、IL-22、IL-23、IL-24、IL-25、IL-26、IL-27、IL-28、IL-29、IL-30、IL-31、IL-32、IL-33、IL-34、IL-35和/或IL-36。使T细胞与白介素接触可具有促进、支持、诱导或改善细胞的移入适合性的作用。IL-1,例如可以在T细胞的成熟和增殖中起作用。IL-2,例如,可以刺激T细胞应答的生长和分化。IL-3,例如,可以促进骨髓系祖细胞的分化和增殖。IL-4,例如,可以促进增殖和分化。IL-7,例如,可以促进淋巴系祖细胞的分化和增殖,涉及B细胞、T细胞和NK细胞的存活、发育和内稳态。IL-15,例如,可诱导天然杀伤细胞的产生。IL-21,例如,共刺激CD8+T细胞的激活和增殖,增加NK细胞毒性,增加CD40驱动的B细胞增殖、分化和同种型转换,并促进Th17细胞的分化。
在一些供选择的方案中,提供了制备基因修饰的T细胞的方法,其中方法包括从混合的T细胞群纯化、分隔、富集或分离CD8+T细胞群和/或CD4+T细胞群,以产生分离的、分隔的、富集的或纯化的T细胞群,所述CD8+T细胞和/或CD4+T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激分离、分隔、富集或纯化的T细胞群,以产生刺激的CD8+T细胞群和/或CD4+T细胞群;用载体转导刺激的CD8+T细胞群和/或CD4+T细胞群,以产生转导的CD8+T细胞群和/或CD4+T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的CD8+T细胞群和/或CD4+T细胞群与至少一种细胞因子接触,以产生转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群;通过选择标记序列编码的标记,富集、分离或分隔转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,以产生富集的、分离的或分隔的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群;以及增殖富集的、分离的或分隔的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群至少1天,如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。在一些供选择的方案中,至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-18、IL-15、IL-2和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL/7、IL-15和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在该方法的一些供选择的方案中,细胞因子接触进行1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。在一些供选择的方案中,添加至少一种细胞因子改善、提高、促进或诱导移入适合性。在一些供选择的方案中,以5ng/mL重组人IL-7(rhIL-7)和/或0.5ng/mL重组人IL-15(rhIL-15)接触,例如增殖富集的表达CD4+的T细胞。在一些供选择的方案中,以50U/mL重组人IL-2(rhIL-2)和/或0.5ng/mL重组人IL-15(rhIL-15)接触,例如增殖富集的表达CD8+的T细胞。在更多供选择的方案中,以0.1ng/mL、0.2ng/mL、0.3ng/mL、0.4ng/mL、0.5ng/mL、0.6ng/mL、0.7ng/mL、0.8ng/mL、0.9ng/mL或1.0ng/mL rhIL-7或由任意两个前述的量限定的范围内的量的rhIL-7和/或0.1ng/mL、0.2ng/mL、0.3ng/mL、0.4ng/mL、0.5ng/mL、0.6ng/mL、0.7ng/mL、0.8ng/mL、0.9ng/mL或1.0ng/mL rhIL-15或由任意两个前述的量限定的范围内的量的rhIL-15接触,例如增殖富集的表达CD4+的T细胞。在更多供选择的方案中,以10U/mL、20U/mL、30U/mL、40U/mL、50U/mL、60U/mL、70U/mL、80U/mL、90U/mL或100U/mL rhIL-2或由任意两个前述的量限定的范围内的量的rhIL-2和/或0.1ng/mL、0.2ng/mL、0.3ng/mL、0.4ng/mL、0.5ng/mL、0.6ng/mL、0.7ng/mL、0.8ng/mL、0.9ng/mL或1.0ng/mL rhIL-7和/或0.1ng/mL、0.2ng/mL、0.3ng/mL、0.4ng/mL、0.5ng/mL、0.6ng/mL、0.7ng/mL、0.8ng/mL、0.9ng/mL或1.0ng/mL rhIL-15或由任意两个前述的量限定的范围内的量的rhIL-15接触,例如增殖富集的表达CD8+的T细胞。在一些供选择的方案,将前述的细胞因子和量联合施用于T细胞,例如以混合的方式,或在添加一种之后不久添加另一种,以及在其他供选择的方案中,使前述的细胞因子与T细胞分开接触,例如以1-10分钟或1-10小时的时间段分开。
本文中“富集的”和“贫化的”也用于描述在混合物中细胞类型的量,指的是使细胞的混合物经受过程或步骤,导致“富集的”类型数量增加以及“贫化的(depleted)”类型数量减少。因此,根据经受富集过程的原始细胞群的来源,混合物或组合物可以包含60%、70%、80%、90%、95%或99%或更多或由任意两个这些值(数量或计数)限定的范围内的任意值的“富集的”细胞,和40%、30%、20%、10%、5%或1%或更少或由任意两个这些值(数量或计数)限定的范围内的任意值的“贫化的”细胞。在制备基因修饰的T细胞的方法的一些供选择的方案中,预期通过亲和性选择细胞表面标记,富集转导的细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,使得产生富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群。
“增殖细胞”或增殖是指使细胞增殖、扩增、生长和复制。例如,典型地可以在适于T淋巴细胞生长和增殖的条件下孵育CD8+T细胞和CD4+T细胞的培养物。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,增殖表达CD4+的T细胞至少1天,并可以增殖20天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,增殖表达CD8+的T细胞至少1天,并可以增殖20天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。
如本文描述的“亲和性选择”是指,通过存在于细胞上的分子或标记或表位与结合亲和剂结合,选择特异性分子或具有选择性细胞表面标记的细胞,这使得选择出感兴趣的特异性分子或细胞。可以通过例如抗体、缀合的抗体、凝集素、适体和/或肽进行亲和性选择。在制备基因修饰的T细胞的方法的一些供选择的方案中,通过亲和性选择具有存在于CD8和/或CD4上的表位的T细胞,进行从混合的T细胞群分隔CD8+T细胞群和/或CD4+T细胞群。在该方法的一些供选择的方案中,使用抗CD8或抗CD4抗体或其结合部分选择出感兴趣的细胞。在该方法的一些供选择的方案中,通过流式细胞术进行从混合的T细胞群分隔CD8+T细胞群和/或CD4+T细胞群。在该方法的一些供选择的方案中,通过免疫磁性选择进行从混合的T细胞群分隔CD8+T细胞群和/或CD4+T细胞群。在该方法的一些供选择的方案中,抗CD8或抗CD4抗体缀合于固体支持物,例如惰性珠或惰性颗粒。
如本文描述的“T细胞前体”指可以迁移至胸腺并成为不表达T细胞受体的T细胞前体的淋巴样前体细胞。所有T细胞来源于骨髓中的造血干细胞。来自造血干细胞的造血祖细胞(淋巴系祖细胞)位于胸腺并通过细胞分裂扩增以产生一大群不成熟的胸腺细胞。最早的胸腺细胞既不表达CD4也不表达CD8,并且因此被分类为双阴性(CD4-CD8-)细胞。随着胸腺细胞通过发育进展,它们成为双阳性胸腺细胞(CD4+CD8+),并且最终成熟为单阳性(CD4+CD8-或CD4-CD8+)胸腺细胞,然后从胸腺释放至外周组织。大约98%的胸腺细胞在胸腺中的发育过程中通过阳性选择或阴性选择失败而死亡,而其他2%的胸腺细胞存活并离开胸腺成为成熟的免疫活性T细胞。
前体T细胞的双阴性(DN)阶段集中于产生功能性β-链,而双阳性(DP)阶段集中于产生功能性α-链,最终产生功能性αβT细胞受体。由于发育中的胸腺细胞进展经过4个DN阶段(DN1、DN2、DN3和DN4),T细胞表达不变的α-链但是重排β-链基因座。如果重排的β-链成功地与不变的α-链配对,产生停止β-链的重排(并沉默交互等位基因),并且导致产生细胞增殖的信号。虽然这些信号需要在细胞表面处的这种前-TCR,但是他们依赖于结合于前-TCR的配体。这些胸腺细胞然后将表达CD4和CD8两者并进展至发生α-链选择的双阳性(DP)阶段。如果重排的β-链没有导致任意信号传导(例如由于不能与不变的α-链配对),细胞可能由于被忽略而死亡(缺少信号传导)。
如本文描述的“造血干细胞”或“HSC”,是可以引起骨髓系细胞的前体细胞,所述骨髓系细胞例如巨噬细胞、单核细胞、巨噬细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、红细胞、巨核细胞/血小板、树突状细胞和淋巴系(例如T细胞、B细胞、NK细胞)。HSC具有异源群体,其中存在三类干细胞,通过他们的在血液中淋巴系与骨髓系后代的比例(L/M)区分他们。
“深低温保藏”是通过冷却至零下温度保存细胞、完整组织或易于损伤的物质的方法。在低温下,任何可对细胞、组织或问题中的物质引起伤害的酶活性或化学活性均有效停止。深低温保藏方法寻求达到低温而不引起在冷冻过程中因冰的形成而引起另外的损伤。传统的深低温保藏依赖于用称为深低温保护剂的一类分子包覆要冷冻的物质。由于许多低温保护剂的固有毒性,新的方法被持续地研究。深低温保藏方法是本领域技术人员已知的。在制备具有嵌合抗原受体的基因修饰的T细胞的方法的一些供选择的方案中,方法可以进一步包括深低温保藏基因修饰的T细胞。
在一些供选择的方案中,提供了基因修饰的T细胞群,其中基因修饰的T细胞群,如源自胸腺细胞的T细胞或源自工程化前体的T细胞(所述工程化前体希望地是iPS细胞),包括大量亲和性选择的表达CD8+和/或CD4+的T细胞,所述表达CD8+和/或CD4+的T细胞不存在、富集超过或分离自CD8-和/或CD4-T细胞,其中所述大量亲和性选择的CD8+和/或CD4+T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括编码嵌合抗原受体和细胞表面选择性标记的基因,并且其中所述大量亲和性选择的表达CD8+和/或CD4+的T细胞已经被至少一种细胞因子重刺激如至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。在一些供选择的方案中,通过本文提供的方法产生选择的CD8+和/或CD4+T细胞。在一些供选择的方案中,至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL/7、IL-15和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在基因修饰的T细胞群的一些供选择的方案,大量亲和性选择的CD8+和/或CD4+T细胞进一步包括促进、诱导、提高或有助于移入适合性的至少一种受体。在一些供选择的方案中,促进、诱导、提高或有助于移入适合性的至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,促进、提高、有助于或诱导移入适合性的至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,大量亲和性选择的表达CD8+和/或CD4+的T细胞进一步包括具有编码前导序列的第一序列,编码配体结合域的第二序列,编码信号传导域的第三序列和编码选择性标记的第四序列的载体。在一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体。在一些供选择的方案中,细胞表面选择性标记编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,配体结合域包括抗体或其结合部分。在一些供选择的方案中,配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,配体结合域包括FMC63或其结合部分。在一些供选择的方案中,配体结合域对CD19是特异性的。在一些供选择的方案中,群包括分离的或富集的表达CD8+的T细胞,所述表达CD8+的T细胞不存在、富集超过或实质上贫化CD4+T细胞。在一些供选择的方案中,群包括分离的或富集的CD4+的T细胞,所述CD4+的T细胞不存在、富集超过或实质上贫化CD8+T细胞。
在一些供选择的方案中,过继细胞免疫治疗组合物是对治疗疾病或癌症有用的。在一些供选择的方案中,提供了用于人治疗的组合物或产品组合,其中组合物或产品组合包含药用赋形剂和根据任意一种或多种可供选择的T细胞的至少一种基因修饰的T细胞群或如本文描述制备或获得的基因修饰的T细胞群。在用于人治疗的组合物或产品组合的一些供选择的方案中,组合物或产品组合包含基因修饰的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞,其中群包括分离的CD8+T细胞,不存在,富集超过,实质上贫化CD4+T细胞。在用于人治疗的组合物或产品组合的一些供选择的方案中,组合物或产品组合包含基因修饰的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞,其中群包括分离的CD4+T细胞,不存在,富集超过或实质上贫化CD8+T细胞。在用于人治疗的组合物或产品组合一些供选择的方案中,组合物或产品组合包含1:1的不存在、富集超过或实质上贫化CD4+T细胞的分离的CD8+T细胞,与不存在、富集超过或实质上贫化CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,将基因修饰的T细胞群以CD4+T细胞与CD8+T细胞的比为1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10或由任意两个这些比限定的范围内的比混合并施用或作为单独的制剂联合施用于有需要的受试者。在一些供选择的方案中,将基因修饰的T细胞群以CD8+T细胞与CD4+T细胞的比为1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10或由任意两个这些比限定的范围内的比混合并施用或作为单独的制剂联合施用于有需要的受试者。
如本文描述的“药用赋形剂”或药物溶媒可以指用作溶剂的载体或惰性介质,于所述溶剂中配制和或施用用于治疗的药学活性剂或T细胞。溶媒可包括聚合物胶束、脂质体、基于脂蛋白的载体、纳米颗粒载体、树枝状分子和/或其他本领域技术人员已知的用于T细胞的溶媒。理想的溶媒或赋形剂可以是无毒性的、生物可相容的、无免疫原性的、生物可降解的并可以避免被宿主的防御机制识别。
在一些供选择的方案中,提供了用于人治疗的组合物或产品组合,其中组合物或产品组合包含药用赋形剂和至少一种本文描述的任意的供选择的方案中的基因修饰的T细胞群。在一些供选择的方案中,赋形剂是药物溶媒。在一些供选择的方案中,药物溶媒包括药物组合物。
急性成淋巴细胞性白血病(ALL)或急性淋巴样白血病是白细胞的癌症,被表征为癌性的、未成熟白细胞(也称为成淋巴细胞)的过度产生。在具有ALL的患者中,成淋巴细胞在骨髓中过度产生,并持续增殖,通过抑制正常细胞例如红血球和白细胞及血小板在骨髓中的产生和通过扩散至其他器官,导致损伤和死亡。ALL在儿童期最常见,发病高峰在2-5岁以及在相对更高的年龄有另一高峰。
ALL的症状表明功能性血细胞产生减少,因为白血病浪费正常用于产生新的功能性血细胞的骨髓的资源。症状可包括发烧、感染风险增加、流血倾向增加、贫血、心跳过速、疲劳和头痛。50-70%的儿童和40-50%的成人在初始治疗后获得完全地缓解,但是然后遭受复发,这些人能够进入第二次完全缓解。在第一次缓解后对复发的治疗可以是标准化学治疗或实验性药物或更积极的治疗如干细胞移植。然而,对其他如急性骨髓性白血病和ALL,自发的涉及同种异体的造血干细胞移植(HSCT)的死亡率减少,可小于癌症复发的可能性和相关的死亡率,因此同种异体治疗对这些病症可以是优选的。因此需要这样的方法改善用于治疗白血病、髓性白血病和ALL的细胞。
在一些供选择的方案中,提供了治疗、抑制或减轻有需要的受试者的疾病,如癌症,如ALL的方法,其中方法包括将至少一种本文描述的任意一个或多个供选择的方案的组合物或产品组合施用于受试者,其中组合物或产品组合包含具有嵌合抗原受体的基因修饰的T细胞,其中T细胞是转导的细胞因子刺激的CD8+T细胞和/或CD4+T细胞。在该方法的一些供选择的方案中,方法包括施用组合物或产品组合,其中组合物或产品组合包含基因修饰的T细胞群,所述基因修饰的T细胞群包括分离的CD8+T细胞,所述CD8+T细胞不存在、富集超过或实质上贫化CD4+T细胞。在该方法的一些供选择的方案中,方法包括施用组合物或产品组合,其中组合物或产品组合包含基因修饰的T细胞群,所述基因修饰的T细胞群包括分离的CD4+T细胞,所述分离的CD4+T细胞不存在、富集超过或实质上贫化CD8+T细胞。在一些供选择的方案中,方法进一步包括施用组合物或产品组合,其中组合物或产品组合包含基因修饰的T细胞群,所述T细胞群包括分离的CD4+T细胞,所述CD4+T细胞不存在、富集超过或实质上贫化CD8+T细胞。在该方法的一些供选择的方案中,方法进一步包括施用组合物或产品组合,其中组合物或产品组合包含基因修饰的T细胞群所述T细胞群包括分离的CD8+T细胞,所述CD8+T细胞不存在、富集超过或实质上贫化CD4+T细胞。在该方法的一些供选择的方案中,方法进一步包括施用组合物或产品组合,其中组合物或产品组合包含比为1:1的不存在、富集超过或实质上贫化CD4+T细胞的分离的CD8+T细胞和不存在、富集超过或实质上贫化CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,将基因修饰的T细胞群以CD4+T细胞与CD8+T细胞的比为1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10或由任意两个这些比限定的范围内的比混合并施用或作为单独的制剂联合施用于有需要的受试者。在一些供选择的方案中,将基因修饰的T细胞群以CD8+T细胞与CD4+T细胞的比为1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10或由任意两个这些比限定的范围内的比混合并施用或作为单独的制剂联合施用于有需要的受试者。在一些供选择的方案中,鉴别或选择受试者以接受抗癌治疗。在一些供选择的方案中,方法进一步包括测量或评价疾病的抑制。在一些供选择的方案中,方法进一步包括在施用本文描述的任意一个或多个供选择的方案的组合物或产品组合之前、期间或之后,向所述受试者提供另外的抗癌治疗。在该方法的一些供选择的方案中,通过过继细胞转移将本文描述的任意一个或多个供选择的方案的组合物或产品组合施用于所述受试者。在一些供选择的方案中,在所述受试者接受另一形式的抗癌治疗后,将本文描述的任意一个或多个供选择的方案的组合物或产品组合施用于所述受试者。在一些供选择的方案中,在所述受试者接受另一形式的抗癌治疗后,将本文描述的任意一个或多个供选择的方案的组合物或产品组合施用于所述受试者。在一些供选择的方案中,受试者患有白血病。在一些供选择的方案中,受试者具有复发性和/或难治性CD19+儿童急性成淋巴细胞性白血病(ALL)。在该方法的一些供选择的方案中,受试者具有复发性和/或化学治疗难治性CD19+急性成淋巴细胞性白血病(ALL)。在该方法的一些供选择的方案中,受试者患有自身免疫疾病。在该方法的一些供选择的方案中,受试者患有HSCT后复发。
另外的供选择的方案
载体、细胞和转导细胞的方法
本文描述的组合物提供表达CD4+和/或CD8+的T淋巴细胞,所述T淋巴细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞。可以根据已知的技术收集T淋巴细胞,并且可以通过已知的技术富集或贫化细胞,如亲和性结合于抗体如流式细胞术和/或免疫磁性选择。在富集和/或贫化步骤之后,可以根据已知的技术进行希望的T淋巴细胞的体外扩增(包括但不限于Riddell等人的美国专利号6,040,177,据此特别地通过引用全文并入)。在一些供选择的方案中,T细胞是自体T细胞,即获得自细胞被递送的患者。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞(HSC)。
例如,可以通过以下方法扩增希望的T细胞群或亚群,即在体外将初始T淋巴细胞群添加至培养基中,然后添加至培养基饲养细胞如不分裂的外周血单核细胞(PBMC),(例如,这样使得产生的细胞群对要扩增的初始群中的每个T淋巴细胞含有至少5、10、20或40或更多个PBMC饲养细胞);以及温育培养物(例如,温育足以扩增T细胞的数量的时间)。不分裂的饲养细胞可以包括γ-辐射的PBMC饲养细胞。在一些供选择的方案中,用γ射线以3000、3200、3300、3400、3500或3600拉德或由任意两个前述的拉德值限定的范围内的拉德辐射PBMC以防止细胞分裂。如需要,T细胞和饲养细胞添加至培养基的顺序可以颠倒。可以在适于T淋巴细胞生长的条件下温育培养物。对人T淋巴细胞的生长,例如温度一般会在至少25℃,优选30℃,更优选37℃或由任意两个这些温度限定的范围内的其他温度。
扩增的T淋巴细胞包括可对人肿瘤或病原体上存在的抗原具有特异性并表达嵌合抗原受体的CD8+细胞毒性T淋巴细胞(CTL)和CD4+辅助T淋巴细胞。
在另一供选择的方案中,扩增方法或增殖可以进一步包括添加不分裂的EBV转化的淋巴样干细胞(LCL)作为饲养细胞。可以用6000、7000、8000、9000或10,000拉德,或由任意两个前述的拉德值限定的范围内的拉德的γ射线辐射LCL。可以以任何适当的量提供LCL饲养细胞,如LCL饲养细胞与初始T淋巴细胞比为至少10:1。
在另一供选择的方案中,扩增方法或增殖可以进一步包括将抗CD3和/或抗CD28抗体添加至培养基(例如,浓度为至少0.5ng/ml)。在另一种供选择的方案中,制备具有嵌合抗原受体的基因修饰的T细胞的方法可进一步包括将IL-2、IL-15和/或IL-21添加至培养基(例如,其中IL-2的浓度为至少10个单位/m1)。在另一种供选择的方案中,制备具有嵌合抗原受体的基因修饰的T细胞的方法可进一步包括将IL-7、IL-15和/或IL21添加至培养基(例如,其中IL-7的浓度为至少10个单位/m1)。在分离T淋巴细胞后,无论在扩增前或扩增后可以将细胞毒性T淋巴细胞和辅助T淋巴细胞两者都分类为初始T细胞、记忆T细胞和效应T细胞亚群。
也可以通过使用标准方法获得CD8+细胞。在一些供选择的方案中,通过鉴别与CD8+细胞的那些类型中的每一种相关的细胞表面抗原将CD8+细胞进一步分选为初始细胞、中枢记忆细胞和效应记忆细胞。在一些供选择的方案中,记忆T细胞存在于CD8+外周血淋巴细胞的CD62L+和CD62L-两个亚集中。在用抗CD8和抗CD62L抗体染色后,将PBMC分选为CD62L-CD8+和CD62L+CD8+部分。在一些供选择的方案中,中枢记忆TCM的表型标记的表达包括CD45RO、CD62L、CCR7、CD28、CD3和/或CD127,和/或对颗粒酶B和/或CD45RA呈阳性或是低的。在一些供选择的方案中,中枢记忆T细胞是CD28+、CD27+、CD45RO+、CD62L+和/或CD8+T细胞。在一些供选择的方案中,初始CD8+T淋巴细胞被表征为初始T细胞的包括CD62L、CCR7、CD27、CD28、CD3、CD127和/或CD45RA的表型标记的表达。
可以通过使用对表面标记特异的特异性抗体和同种型匹配对照抗体的流式细胞术确定细胞或细胞群对具体的细胞表面标记是否呈阳性或是否表达具体的细胞表面标记。对标记阴性的细胞群指与特异性抗体不存在高于同种型对照的显著结合的细胞群,表明缺乏所述标记的表达;阳性指细胞群的统一结合高于同种型对照,表明标记表达。在一些供选择的方案中,一个或多个标记的表达的减少指平均荧光强度损失1log10和/或显示出标记的细胞的百分比与参比细胞群相比减少至少20%的细胞、25%的细胞、30%的细胞、35%的细胞、40%的细胞、45%的细胞、50%的细胞、55%的细胞、60%的细胞、65%的细胞、70%的细胞、75%的细胞、80%的细胞、85%的细胞、90%的细胞、95%的细胞和100%的细胞或由任意两个这些值限定的%范围内的任意%。在一些供选择的方案中,对一个或多个标记呈阳性的细胞群指显示出标记的细胞的百分比当与参比细胞群相比时,为至少50%的细胞、55%的细胞、60%的细胞、65%的细胞、70%的细胞、75%的细胞、80%的细胞、85%的细胞、90%的细胞、95%的细胞或100%的细胞或由任意两个这些值限定的%范围内的任意%。
通过鉴别具有细胞表面抗原的细胞群将CD4+T辅助细胞分为初始细胞、中枢记忆细胞和效应细胞。通过标准方法可以获得CD4+淋巴细胞。在一些供选择的方案中,初始CD4+T淋巴细胞是CD45RO-、CD45RA+、CD62L+、CD27+、CD28+和/或CD4+T细胞。在一些供选择的方案中,中枢记忆CD4+细胞是CD62L+和/或CD45RO+。在一些供选择的方案中,效应CD4+细胞是CD62L-和/或CD45RO-。在一些供选择的方案中,效应CD4+细胞是CD28+、CD27+和/或CD62L+。
在一些供选择的方案中,可通过用抗原刺激初始T淋巴细胞或抗原特异性T淋巴细胞获得抗原特异性CD4+群和CD8+群。例如,可以通过从感染的受试者中分离T细胞并在体外用相同抗原刺激产生针对巨细胞病毒抗原的抗原特异性T细胞系或克隆。也可以使用初始T细胞。可以使用来自肿瘤细胞的任意数量的抗原作为靶标以引起T细胞应答。在一些供选择的方案中,过继细胞免疫治疗组合物在对包括实体瘤、恶性血液肿瘤、乳腺癌或黑色素瘤的疾病或紊乱治疗中是有用的。
T淋巴细胞群的修饰
在一些供选择的方案中,根据本发明将功能性基因引入待用于免疫治疗的T细胞可以是希望的。例如,引入的基因或多个基因可以通过促进转移的T细胞的生存力和/或功能改善治疗的疗效;或所述功能性基因可以提供遗传标记以及允许在体内存活或迁移的选择和/或评价;或所述功能性基因可以合并改善免疫治疗的安全性的功能,例如通过使细胞易受体内阴性选择的影响,如Lupton S.D.等人,分子和细胞生物学(Mol.and CellBiol.),11:6(1991);和Riddell等人,人基因治疗(Human Gene Therapy)3:319-338(1992)描述;也可参见Lupton等人的公开PCT/US91/08442和PCT/US94/05601,描述了源自将显性阳性选择标记与阴性选择标记融合的双功能选择融合基因的用途,在此特别地通过引用将其二者全文并入。这可以根据已知的技术(见例如Riddell等人的美国专利号6,040,177,第14-17栏,在此特别地通过引用将其全文并入)或根据本公开对本领域技术人员显而易见的其变体。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞(HSC)。
在一些供选择的方案中,用如本文描述的嵌合受体修饰T细胞。在一些供选择的方案中,T细胞获得自要治疗的受试者,在其他供选择的方案中,淋巴细胞获得自同种异体的人供体,优选健康的人供体。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞(HSC)。
在一些供选择的方案中,如本文描述,嵌合受体包括特异性结合于细胞上的表面分子的配体结合域、多肽间隔区区域、跨膜域和胞内信号传导域。在一些供选择的方案中,配体结合域是源自单克隆抗体(mAb)的重链可变区(VH)和轻链可变区(VL)的单链抗体片段(scFv)。经通过将CD28和/或4-1BB的共刺激域融合于CD3ζ链的嵌合受体也可提供共刺激信号。嵌合受体对从HLA独立的细胞表面分子是特异性的,因此克服了TCR识别的局限,包括HLA限制性和在肿瘤细胞上低水平的HLA表达。
在一些供选择的方案中,可以将相同或不同的嵌合受体引入CD4+和CD8+T淋巴细胞的每个群中。在一些供选择的方案中,在这些群中的每一个中的嵌合受体具有特异性结合于在细胞上的相同配体的配体结合域。细胞信号传导组件可以不同。在一些供选择的方案中,CD8+细胞毒性T细胞的胞内信号传导域与CD4+辅助T细胞的胞内信号传导域相同。在其他供选择的方案中,CD8+细胞毒性T细胞的胞内信号传导域与CD4+辅助T细胞的胞内信号传导域不同。在一些供选择的方案中,抗CD19 CAR被引入一个淋巴细胞群,以及EGFR特异性CAR被引入另一淋巴细胞群。
在一些供选择的方案中,在如本文描述的在转导之前将CD4或CD8 T淋巴细胞中的每一个分选为初始细胞、中枢记忆细胞、效应记忆细胞或效应细胞。在一些供选择的方案中,在转导之后将CD4或CD8 T淋巴细胞中的每一个分选为初始细胞、中枢记忆细胞、效应记忆细胞或效应细胞。
已经发展了各种转导技术,所述转导技术利用用于基因递送的重组感染病毒颗粒。这代表当前优选的转导本文描述的T淋巴细胞的方法。已经用于该方法的病毒载体包括源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒载体和反转录病毒的病毒载体。因此,基因转移和表达方法是很多的但是在哺乳动物细胞中引入和表达遗传物质的基本功能。数种上述的技术已经用于转导造血细胞或淋巴样细胞,所述技术包括磷酸钙转染;原生质体融合;电穿孔;和用重组腺病毒、腺伴随病毒和反转录病毒载体感染。通过电穿孔和通过反转录病毒或慢病毒感染已经成功转导了原代T淋巴细胞。
反转录病毒和慢病毒载体提供了用于将基因转移入真核细胞的高效的方法。此外,反转录病毒或慢病毒的整合以控制的方式发生,并导致每个细胞中新的遗传信息的一个或几个拷贝的稳定整合。
在一些供选择的方案中,在T细胞中包括使在体外选择阴性选择性表型的细胞成为可能的阳性标记可能是有用的。阳性选择性标记可以是基因,该基因在引入宿主细胞时,表达允许对携带该基因的细胞阳性选择的显性表型。该类型的基因是本领域已知的,并且包括尤其是给予潮霉素B抗性的潮霉素B磷酸转移酶基因(hph)、来自Tn5的编码抗生素G418抗性的氨基糖苷磷酸转移酶基因(neo或aph)、二氢叶酸还原酶(DHFR)基因、腺苷脱氨酶基因(ADA)和多药抗性(MDR)基因。在一些供选择的方案中,阳性标记是用于细胞选择的EGFR截短的蛋白。
如本领域熟知的可以采用各种方法转导T淋巴细胞。在一些供选择的方案中,使用慢病毒载体进行转导。在一些供选择的方案中,CD4+和CD8+细胞各自可以分别用编码嵌合受体的表达载体修饰以形成定义的群。在一些供选择的方案中,然后通过分选对那些细胞群中的每一个独特的细胞表面抗原,将这些细胞进一步分选为如上文描述的初始细胞、中枢记忆细胞和效应细胞的亚群。
在一些供选择的方案中,选择了响应于抗原或肿瘤靶标增殖的CD4+和CD8+细胞。例如,当用抗原和肿瘤靶标刺激时,与假转导细胞相比,选择了快速增殖的CD4+细胞或选择了CD8+转导的细胞。在一些供选择的方案中,选择对承载抗原的细胞有细胞毒性的CD4+和CD8+细胞。在一些供选择的方案中,预期与CD8+细胞相比CD4+是弱细胞毒性的。
在另一种供选择的方案中,选择转导的淋巴细胞,如CD8中枢记忆细胞,使用为特别类型的癌症建立的动物模型以提供体内细胞杀伤。这样的动物模型对本领域技术人员是已知的并且排除人类。如本文描述,不是所有转导入淋巴细胞的嵌合受体构建体提供体内杀伤肿瘤细胞的能力,虽然这种能力能被激活并在体外杀伤细胞。
本公开预期将在组合物中使用CD4+和CD8+T细胞的组合。在一种供选择的方案中,可以将嵌合受体转导的CD4+细胞的组合物与相同配体特异性的嵌合受体转导的CD8+细胞组合,或与对有区别的肿瘤配体特异性的嵌合受体转导的CD8+T细胞组合。在其他供选择的方案中,将嵌合受体转导的CD8+细胞与对表达于肿瘤上的不同配体特异性的嵌合受体转导的CD4+细胞组合。在又一种供选择的方案中,将嵌合受体修饰的CD4+和CD8+细胞组合。在一些供选择的方案中,可以以不同的比组合CD8+和CD4+细胞,例如CD8+与CD4+的比为1:1,CD8+与CD4+的比为10:1或CD8+与CD4+的比为100:1或由任意两个前述比值限定的范围内的比。在一些供选择的方案中,在体外和/或在体内测试组合的群的细胞增殖并且选择提供细胞增殖的细胞的比。
如本文描述,本公开预期CD4+和CD8+细胞可以进一步被分隔为亚群,如初始细胞、中枢记忆细胞和效应记忆细胞群。如本文描述,在一些供选择的方案中,初始CD4+细胞是CD45RO-、CD45RA+、CD62L+、CD28+、CD27+和/或CD4+阳性T细胞。在一些供选择的方案中,中枢记忆CD4+细胞是CD62L阳性的和/或CD45RO阳性的。在一些供选择的方案中,效应CD4+细胞是CD62L阴性的和/或CD45RO阳性的。这些群中的每个可以被嵌合受体独立修饰。在一些供选择的方案中,中枢记忆CD4+细胞是CD62L+、CD28+和/或CD27+细胞。
在对承载嵌合受体的细胞转导和/或选择后,细胞群优选在体外扩增直到获得足够数量的细胞以提供对人受试者的至少一次输注典型地为约104个细胞/kg至109个细胞/kg。在一些供选择的方案中,在抗原承载细胞、抗CD3、抗CD28、和IL 2、IL-7、IL 15或IL-21或其组合存在下培养转导细胞。在一些供选择的方案中,在抗体结合支持物,如珠或颗粒的存在下刺激T细胞。在一些供选择的方案中,用抗体结合支持物刺激T细胞,其中抗体结合支持物包括抗TCR、抗CD2、抗CD3、抗CD4和/或抗CD28抗体。在一些供选择的方案中,用抗体结合支持物刺激T细胞,其中抗体结合支持物包括抗CD3和/或抗CD28抗体。
可以将CD4+和CD8+细胞的亚群中彼此组合。在具体的供选择的方案中,将修饰的初始或中枢记忆CD4+细胞与修饰的中枢记忆CD8+T细胞组合以对抗原承载细胞如在细胞表面上包括CD19的B细胞提供协同的细胞毒性作用。
组合物
本公开提供了过继细胞免疫治疗组合物,该组合物包含如本文描述的基因修饰的T淋巴细胞细胞制剂。
在一些供选择的方案中,T淋巴细胞制剂包括具有嵌合受体的CD4+T细胞,所述嵌合受体包括如本文所述的对与疾病或紊乱相关的配体特异的胞外抗体可变域、可定制的间隔区、跨膜域和T细胞受体或其他受体的胞内信号传导域。在其他供选择的方案中,过继细胞免疫治疗组合物进一步包含提供细胞免疫应答的嵌合受体修饰的肿瘤特异性CD8+细胞毒性T淋巴细胞细胞制剂,其中细胞毒性T淋巴细胞细胞制剂包括具有嵌合受体的CD4+T细胞,所述嵌合受体包括如本文所述的对与疾病或紊乱相关的配体特异的胞外单链抗体、可定制的间隔区、跨膜域和T细胞受体的胞内信号传导域。
在一些供选择的方案中,过继细胞免疫治疗组合物包含嵌合受体修饰的肿瘤特异性CD8+细胞毒性T淋巴细胞细胞制剂,所述细胞毒性T淋巴细胞细胞制剂提供细胞免疫应答,其中细胞毒性T淋巴细胞细胞制剂包括具有嵌合受体的CD8+T细胞与源自CD45RO-CD62L+和/或CD4+T细胞的抗原反应嵌合受体修饰的初始CD4+T辅助细胞的组合,以及药学上可接受的载体,所述嵌合受体包括对与疾病或紊乱相关的配体特异性的胞外单链抗体、可定制的间隔区、跨膜域和T细胞受体的胞内信号传导域。
在其他供选择的方案中,过继细胞免疫治疗组合物包含与提高CD8+免疫应答的抗原反应嵌合受体修饰的初始CD4+T辅助细胞组合的抗原特异性CD8+细胞毒性T淋巴细胞细胞制剂,所述细胞毒性T淋巴细胞细胞制剂提供源自患者的细胞免疫应答,其中辅助T淋巴细胞细胞制剂包括具有嵌合受体的CD4+T细胞,所述嵌合受体包括对与疾病或紊乱相关的配体特异性的胞外抗体可变域、可定制的间隔区、跨膜域和T细胞受体的胞内信号传导域。
在进一步的供选择的方案中,过继细胞免疫治疗组合物包含提高CD8+免疫应答的抗原反应嵌合受体修饰的初始CD4+T辅助细胞,其中辅助T淋巴细胞细胞制剂包括具有嵌合受体的CD4+T细胞,所述嵌合受体包括对与疾病或紊乱相关的配体特异性的胞外抗体可变域、可定制的间隔区、跨膜域和T细胞受体的胞内信号传导域
在一些供选择的方案中,CD4+T辅助淋巴细胞选自由初始CD4+T细胞、中枢记忆CD4+T细胞、效应记忆CD4+T细胞和混合CD4+T细胞组成的组。在一些供选择的方案中,CD4+辅助淋巴细胞是初始CD4+T细胞,其中初始CD4+T细胞包括CD45RO-、CD45RA+、CD62L+CD28+、CD27+和/或CD4+。在一些供选择的方案中,CD8+T细胞毒性淋巴细胞选自由初始CD8+T细胞、中枢记忆CD8+T细胞、效应记忆CD8+T细胞和混合CD8+T细胞组成的组。在一些供选择的方案中,CD8+细胞毒性T淋巴细胞是中枢记忆T细胞,其中中枢记忆T细胞包括CD45RO+、CD62L+、CD27+、CD28+和/或CD8+T细胞。在其他的供选择的方案中,CD8+细胞毒性T淋巴细胞是中枢记忆T细胞,以及CD4+辅助T淋巴细胞是初始或中枢记忆CD4+T细胞。
本公开提供了制备过继免疫治疗组合物的方法和使用这些组合物对患有疾病或紊乱的受试者进行细胞免疫治疗的用途或方法。可通过使用疾病或紊乱的动物模型和施用细胞并确定转移细胞的存留和/或增殖能力来确定嵌合受体修饰的T细胞的增殖和存留。在其他供选择的方案中,可以通过用抗原承载细胞进行的多周期激活来测试增殖和激活。
在一些供选择的方案中,制备组合物的方法包括:获得修饰的初始CD4+T辅助细胞,其中修饰的辅助T淋巴细胞细胞制剂包括具有嵌合受体的CD4+T细胞,所述嵌合受体包括如本文所述的对肿瘤细胞表面分子特异的配体结合域、定制的间隔区、跨膜域和胞内信号传导域。
在另一供选择的方案中,方法进一步包括获得修饰的CD8+细胞毒性T细胞,其中修饰的细胞毒性T淋巴细胞细胞制剂包括具有嵌合受体的CD8+细胞,所述嵌合受体包括如本文描述的对肿瘤细胞表面分子特异的配体结合域、定制的间隔区、跨膜域和胞内信号传导域。
在另一种供选择的方案中,方法包括获得修饰的CD8+细胞毒性T细胞,其中修饰的细胞毒性T淋巴细胞细胞制剂包括具有嵌合受体的CD8+细胞,所述嵌合受体包括如本文描述的对肿瘤细胞表面分子特异的配体结合域、定制的间隔区、跨膜域和胞内信号传导域,并进一步包括将修饰的CD8+细胞毒性T细胞与CD4+辅助细胞淋巴细胞细胞制剂组合。
在上文以及在实例中已经描述了用嵌合受体修饰的CD4+和CD8+细胞的制剂。抗原特异性T淋巴细胞可以获得自患有疾病或紊乱的患者,或可以通过在体外在抗原存在下刺激T淋巴细胞制备。未选择用于抗原特异性的CD4+和/或CD8+T淋巴细胞亚群也可以如本文描述被分离并且在制备方法中组合。在一些供选择的方案中,可以通过至少两代评价细胞群的组合的细胞表面标记的一致性、增殖能力以具有一致的细胞分化状态。通过将表达靶配体的细胞系与嵌合受体修饰的T细胞共培养进行质量控制,以确定嵌合受体修饰的T细胞是否使用本领域已知的细胞毒性、增殖或细胞因子产生测定识别细胞系。可以通过流式细胞术确定嵌合受体修饰的T细胞上的细胞分化状态和细胞表面标记。在一些供选择的方案中,CD8+细胞上的标记和细胞分化状态包括CD3、CD8、CD62L、CD28、CD27、CD69、CD25、PD-1、CTLA-4、CD45RO和/或CD45RA。在一些供选择的方案中,CD4+细胞上的标记和细胞分化状态包括CD3、CD4、CD62L、CD28、CD27、CD69、CD25、PD-1、CTLA-4CD45RO和/或CD45RA。在一些供选择的方案中,标记包括CD45 RA、CD45RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,标记包括CD27、CD28和/或CD62L。
一些供选择的方案涉及用于治疗、抑制或减轻有需要的受试者的疾病如癌症,如ALL的方法,所述方法包括对有需要的患者抑制或延迟癌症的进展和/或转移的方法,抑制或减少肿瘤或癌细胞存在的方法和/或抑制或减少靶标表达CD19的细胞群的方法。这样的方法涉及将提供细胞免疫应答的基因修饰的细胞毒性T淋巴细胞细胞制剂施用于有需要的受试者或患者,其中细胞毒性T淋巴细胞细胞制剂包括具有嵌合受体的CD8+T细胞,所述嵌合受体包括:编码配体结合域的多核苷酸,其中配体是肿瘤特异性抗原或表达于靶T细胞群(例如CD19)上的任意其他分子,所述靶T细胞群适于通过淋巴细胞介导识别和清除;编码多肽间隔区的多核苷酸,其中多肽间隔区具有定制的长度,其中间隔区提供与参比嵌合受体相比提高的T细胞增殖和/或细胞因子产生;编码跨膜域的多核苷酸;和编码一个或多个胞内信号传导域的多核苷酸。
本公开也提供在患有疾病或紊乱,如癌症,如ALL的受试者中进行细胞免疫治疗的方法,所述方法包括:施用如本文描述的表达嵌合受体的淋巴细胞的组合物。在其他供选择的方案中,方法包括将提供细胞免疫应答的基因修饰的细胞毒性T淋巴细胞细胞制剂施用于受试者,其中细胞毒性T淋巴细胞细胞制剂包括具有嵌合受体的CD8+T细胞,所述嵌合受体包括:如本文描述的对细胞表面分子特异性的配体结合域、定制的间隔区域、跨膜域和胞内信号传导域;以及将基因修饰的辅助T淋巴细胞细胞制剂施用于受试者,所述基因修饰的辅助T淋巴细胞细胞制剂引起直接识别和提高基因修饰的细胞毒性T淋巴细胞基因细胞制剂介导细胞免疫应答的能力,其中辅助T淋巴细胞细胞制剂包括具有嵌合受体的CD4+T细胞,所述嵌合受体包括:如本文描述的对细胞表面分子特异性的配体结合域、定制的间隔区域、跨膜域和胞内信号传导域。
虽然不限制本公开的范围,认为在施用前选择可以在体内存留和增殖的嵌合受修饰的T细胞群可导致能够使用低剂量的T细胞并提供更均一的治疗活性。在一些供选择的方案中,T细胞的剂量可以减少至少10%、20%或30%或更多。T细胞的剂量的减少可有利地减少风险或肿瘤溶解综合征和细胞因子风暴。
在另一种供选择的方案中,在患有疾病或紊乱的受试者中进行细胞免疫治疗的方法包括:将基因修饰的辅助T淋巴细胞细胞制剂施用于受试者,其中修饰的辅助T淋巴细胞细胞制剂包括具有嵌合受体的CD4+T细胞,所述嵌合受体包括如本文描述的对肿瘤细胞表面分子特异性的配体结合域、定制的间隔区域、跨膜域和胞内信号传导域。在一些供选择的方案中,方法进一步包括将基因修饰的细胞毒性T淋巴细胞细胞制剂施用于受试者,其中修饰的细胞毒性T淋巴细胞细胞制剂包括具有嵌合受体的CD4+细胞,所述嵌合受体包括如本文描述的对肿瘤细胞表面分子特异性的配体结合域、定制的间隔区域、跨膜域和胞内信号传导域。
另一种供选择的方案描述了对患有疾病或紊乱的受试者进行细胞免疫治疗的方法,所述方法包括:分析受试者的生物样品的与疾病或紊乱相关的靶分子(例如CD19)的存在,并施用本文描述的过继免疫治疗组合物,其中嵌合受体特异性结合于靶分子(CD19)。
在一些供选择的方案中,在引入嵌合受体之前CD4+T辅助淋巴细胞选自由初始CD4+T细胞、中枢记忆CD4+T细胞、效应记忆CD4+T细胞和混合CD4+T细胞组成的组。在特别的供选择的方案中,CD4+辅助淋巴细胞是初始CD4+T细胞,其中初始CD4+T细胞包括CD45RO-、CD45RA+、CD28+、CD27+、CD62L+和/或CD4+。在另一种供选择的方案中,在引入嵌合受体之前CD8+T细胞毒性淋巴细胞选自由初始CD8+T细胞、中枢记忆CD8+T细胞、效应记忆CD8+T细胞和混合CD8+T细胞组成的组。在特别的供选择的方案中,CD8+细胞毒性T淋巴细胞是中枢记忆T细胞,其中中枢记忆T细胞包括CD45RO+、CD62L+、CD28+、CD28+和/或CD8+。在特别的供选择的方案中,CD8+细胞毒性T淋巴细胞是中枢记忆T细胞,以及CD4+辅助T淋巴细胞是初始CD4+T细胞。
在一些供选择的方案中,CD8+T细胞和CD4+T细胞均是用嵌合受体基因修饰的,所述嵌合受体包括特异性结合于细胞表面分子的抗体重链域。在其他供选择的方案中,CD8细胞毒性T细胞的胞内信号传导域与CD4辅助T细胞的胞内信号传导域相同。在另一种供选择的方案中,CD8细胞毒性T细胞的胞内信号传导域与CD4辅助T细胞的胞内信号传导域不同。
可以施用本文描述的供选择的方案的受试者包括人、其他灵长类如猴子和猿类,伴侣动物如狗、猫和马,以及家畜动物如猪、山羊、绵羊和牛。受试者可以是雄性或雌性,并且可以是任何适当的年龄,包括婴幼儿、少年、青少年、成年和老年受试者。方法对治疗例如CD19承载癌症或细胞是有用的。
可以根据基于本公开对本领域技术人员来说显而易见的已知的技术或其变体在用于过继免疫治疗的方法和组合物中利用如上文制备的细胞。
在一些供选择的方案中,通过以下方式配制细胞,即首先从细胞培养基中收获细胞,然后洗涤并在适于以治疗有效量施用的介质和容器系统(“药学上可接受的”载体)中浓缩细胞。适当的输注介质可以是等渗介质制剂,典型为生理盐水、Normosol R(Abbott)或勃脉力A(Plasma-Lyte A)(Baxter),而且也可以利用5%葡萄糖的水溶液或乳酸林格氏液。可以用胎牛血清补充输注介质。然后用细胞因子处理细胞以产生转导的细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,与非细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群相比移入适合性提高或改善。为了产生移入适合性希望的改善的细胞,在T细胞的增殖期间希望地在体外添加细胞因子。如此,在修饰的T细胞的增殖期间,通过添加细胞因子进行细胞因子-刺激分隔的CD4+和CD8+T细胞。在一些供选择的方案中,用至少一种细胞因子刺激CD4+T细胞,其中至少一种细胞因子包括IL/7、IL-15和/或IL-21。在一些供选择的方案中,用至少一种细胞因子刺激CD8+T细胞,其中至少一种细胞因子包括IL-2、IL-15和/或IL-21.
组合物中的细胞的治疗或抑制有效的量是至少2个细胞亚集(例如1个CD8+中枢记忆T细胞亚集和1个CD4+辅助T细胞亚集)或是更典型地大于102个细胞以及高达106,高达以及包括108或109个细胞,以及可以大于1010个细胞或由任意两个这些值限定的范围内的任意其他值。细胞的数量如同组合物中包括的细胞的类型一样,将取决于组合物预期的最终用途。例如,如果对具体抗原特异的细胞是希望的,那么群体将含有大于70%,一般大于80%、85%和90-95%的这样的细胞。对本文提供的用途,细胞一般是以升或更少的体积计,可以是500ml或更少,甚至250ml或100ml或更少,或由任意两个这些值限定的范围内的任意其他值。因此希望的细胞的密度典型地大于104个细胞/ml,以及一般为大于107个细胞/ml,一般地108个细胞/ml或更大。可以将临床相关数量的免疫细胞分配至多次输注物中,所述输注物累积地等于或超过106、107、108、108、109、1010或1011个细胞或由任意两个这些值限定的范围内的任意其他值。
在一些供选择的方案中,本发明的淋巴细胞可用于赋予个体免疫性。“免疫性”的意思是与对病原体导致的感染或对淋巴细胞应答针对的肿瘤的应答相关的一个或多个身体症状的减少。施用的细胞的量通常在存在于对病原体具有免疫性的正常个体的范围内。因此,通常通过输注施用细胞,每次输注在2个细胞、高达至少106至3×1010个细胞的范围内,优选在至少107至109个细胞的范围内。通过单次输注或通过在一段时间内的多次输注施用T细胞。然而,因为预计不同个体在应答能力上的变化,输注的细胞的类型和量,以及多次输注给予的输注的数量和时间范围由主治医师确定并可以由常规检查确定。使用如本文例示的本发明的快速扩增方法可容易获得充足水平的T淋巴细胞(包括细胞毒性T淋巴细胞和/或辅助T淋巴细胞)的代次。见例如Riddell等人的美国专利号6,040,177第17栏,特别地通过引用全文并入本文。
在一些供选择的方案中,如本文描述的组合物经静脉内、腹腔内、瘤内、骨髓内、淋巴结内和/或脑脊髓液内施用。
在一些供选择的方案中,如本文描述的组合物与化学治疗剂和/或免疫抑制剂施用。在供选择的方案中,首先向患者施用抑制或破坏其他免疫细胞的化学治疗剂,随后施用本文描述的组合物。在一些情况下,可以完全避免化学治疗。
施用于ALL的患者
从获得自研究参与者的单采血液成分术(apheresis)产品分离CD4和CD8T细胞亚集。在用抗CD3×CD28珠刺激后,用指导共表达FMC63scFv:IgG4铰链:CD28tm:4-1BB:ζCAR和选择并追踪自杀构建体EGFRt的SIN慢病毒载体转导T细胞系。在转导的细胞经受EGFRt免疫磁性阳性选择的时间期间,使用重组人细胞因子增殖转导的细胞至适合于临床使用超过10-20天的数量。在进行淋巴细胞清除性化学治疗(lymphodepleting chemotherapy)之后不久,将深低温保藏的CD4/EGFRt+和CD8/EGFRt+T细胞产品解冻并临床输注,以使患者接受表明的方案规定的剂量水平(1=0.5×106/kg;2=1×106/kg;3=5×106/kg)的1:1比的EGFRt+CD4和CD8 T细胞。在一些供选择的方案中,以5ng/mL重组人IL-7(rhIL-7)和/或0.5ng/mL重组人IL-15(rhIL-15)接触,例如增殖富集的表达CD4+的T细胞。在一些供选择的方案中,以50U/mL重组人IL-2(rhIL-2)和/或0.5ng/mL重组人IL-15(rhIL-15)接触,例如增殖富集的表达CD8+的T细胞。
所有入选的受试者(n=16)具有满足给药规范的细胞产品,并且准备好输注。以不同的剂量水平(0.5×106/kg-5×106/kg的范围)治疗13名受试者(6个月-3岁/p HSCT)。输注耐受良好,仅1例AE>2级(与DMSO相关的3级过敏)。13名受试者中有12名对ORR具有响应,即92%。13名受试者中有11名获得MRD阴性CR(85%)。带有高疾病负荷的受试者与MRD阴性骨髓相比具有更高的峰值PB CAR T细胞水平(62.7%相对于19.6%)。观察到骨髓(n=12)、外周血(n=12)和CSF中的CAR T细胞扩增的积累。丢失其T细胞移植物的5名受试者的平均存留持续时间为63天(范围为42-150天)。
12名响应受试者中的每一名发展了一些程度的CRS,以发热和低血压为标志性症状。两名受试者S02和S09需要针对sCRS的免疫调节治疗(两名用托珠单抗(tocilizumab)治疗,并且一名添加地塞米松治疗)。13名这些患者中的4名发展了脑病(2名1级、1名3级和1名4级)。4级脑病是DLT,且伴随癫痫和与PRES相似的异常MRI结果。MRI结果在治疗后9周正常化,但是受试者在从治疗开始6个月的最后一次评估时保持具有癫痫。
如显示的,定义的组合物CD4:CD8 CD19CAR/EGFRt+T细胞的规定剂量水平/kg的输注在遭受HSCT后复发的小儿和年轻成人ALL患者中产生了令人鼓舞的MRD阴性CR的比率。因此,由16名入选患者中的每一个产生供体衍生的产物是可行的。对13名可评价的患者预期的毒性包括约30%ICU入住率的CRS,严重程度为轻度至重度的脑病。在所有剂量水平都观察到了MRD阴性响应,虽然早期数据显示剂量逐渐上升时持久性提高。
虽然一名患者在T细胞治疗后发展出急性GVHD,初步评估显示CAR T细胞不是这种响应的媒介。有趣地,强的松不影响T细胞移植物的持久性。如此,保持标记CD28、CD27和CD62L的细胞与没有用定义的细胞因子混合物处理并缺少移入适合性的标记的细胞相比显示高持久性,后者是当前的处理方法所使用的T细胞。
图18A-图18B所示的是描述用于制备包括嵌合抗原受体的基因修饰的T细胞的方法的发展历程的流程图。如表明的,当前的制备工序不具有Ficoll处理,而最初的实验方法包括Ficoll处理步骤。如图19的流程图所示还测试了细胞浓度的初始变化。在细胞因子的存在下还扩增了细胞(图20A-图20D)。
如图20A-图20D所示,用供体样品PD0064:PD0063 CD8+富集的T细胞在起始时在T25瓶中测试起始细胞密度。在正常的PLAT-02培养条件,IL-2(50U/ml)+IL-15(0.5ng/mL)下测试两种细胞(来自PD0064、PD0063)。通过添加培养基和细胞因子使终细胞浓度达0.7×106个细胞/mL,将来自供体样品PD0080的细胞用于研究中以在Tx天测试细胞的扩增(“早期扩增”)。基于珠刺激的日子被定义为第+0天,“Tx”自始至终是指第+1天。PD0063 CD8+细胞被用作富集的起始物质。使用与PD0064:PD0063 CD8+富集的细胞相同的细胞因子条件。实验测试了两种细胞的密度,均显示当在细胞因子存在下细胞早期体积增加时,细胞更大的生存力和扩增性。在上下文中“体积增加”是指用于在Tx之后初始喂养的培养基/细胞因子添加的体积在“早期扩增”条件下更大,导致“早期扩增”条件下的培养物中在该点的细胞密度降低。
如图21A-图21D所示的是细胞样品PD104和PD0116的生长和在实验条件下的细胞生长的比较。在添加如下的细胞因子,并且各自的浓度为:对于CD8+T细胞添加IL-2(50U/ml)+IL-15(0.5ng/mL)以及对于CD4+T细胞添加IL-7(5ng/mL)+IL-15(0.5ng/mL)下,将PD0104:PD0063 CD8+和CD4+富集的细胞用于重复前面的实验以测试在Tx天扩增至0.7×106个细胞/mL的细胞(“早期扩增”)。生长和生存力显著提高。这些曲线就生长/珠移除/选择/深低温保藏的时机而言模拟在临床产品所观察到的现象。
将PD0116:PD0046 CD8+和CD4+富集的细胞用于重复前面的实验以测试在Tx天扩增至0.7×106个细胞/mL的细胞(“早期扩增”)。正常的PLAT-02培养条件,对于CD8细胞添加IL-2(50U/ml)+IL-15(0.5ng/mL)以及对于CD4细胞添加IL-7(5ng/mL)+IL-15(0.5ng/mL)。在V-197袋中PD116以180×106个细胞开始,然后在转移袋中进行磁性富集和离心感染细胞(spinoculation)。如所示的,从这些条件,生长和生存力显著提高。这些曲线就T细胞的生长、珠移除、选择和深低温保藏的时机而言模拟在临床产品所观察到的现象。
通过添加培养基和细胞因子至终体积为0.7×106个细胞/mL,将PD0116:PD0046CD8+和CD4+富集的细胞用于重复实验以测试在Tx天扩增细胞(“早期扩增”)。执行正常的PLAT-02培养条件,其中对于CD8细胞添加IL-2(50U/ml)+IL-15(0.5ng/mL)以及对于CD4细胞添加IL-7(5ng/mL)+IL-15(0.5ng/mL)。在V-197袋中PD116以180×106个细胞/mL开始,然后在转移袋中进行磁性富集和离心感染细胞。这是用于向更新的制备方法过渡的全面数据。如图21A-图21D所示,与CD4+细胞相比,CD8+细胞的生长扩增增加。用于CD4+和CD8+细胞的细胞因子和使用的细胞因子的组合的变化描述于如图22所示的流程图中。
还对来自供体的CD8+和CD4+细胞测试了不同细胞因子条件。如图23A-图23F所示,用IL2/IL15、IL7/IL15、IL2/IL7/IL15、IL2脉冲及IL7/IL15、仅IL2、IL2脉冲及IL7/IL21和IL2/IL15测试来自PD0047和PD0040的样品。这包括单独用IL-2(脉冲)温育5天,然后添加IL-7/IL-21,然后所述IL-7/IL-21在培养物的剩余物中一直存在;单独用IL-2(脉冲)温育5天,然后添加IL-7/IL-21和IL2/IL15,然后所述IL-7/IL-21和IL2/IL15在培养物的剩余物中一直存在。PD0040:PD0038 CD8+富集的T细胞用于测试不同细胞因子混合物。每个条件的浓度是IL-2(50U/mL)、IL-7(5ng/mL)、IL-15(0.5ng/mL)。条件#4是IL-2脉冲5天,然后是IL-7/IL-21在培养物的剩余物中一直存在。从小规模试验推测出倍数生长和TNC。当前使用的IL-2/IL-15显示最佳扩增。在该研究中,证实了IL-2/IL-15组合导致最佳扩增。
如显示的,PD0047:PD0038 CD8+富集的细胞用于测试不同细胞因子混合物。使用10U/mL终浓度的“低剂量”IL-2测试相同的细胞因子混合物。在不同组合中使用的个体细胞因子的浓度是:如图例中所述的IL-2(50U/mL)和(10U/mL),IL-7(5ng/mL)、IL-15(0.5ng/mL)、IL-21(5ng/mL)。脉冲条件是IL-2脉冲5天,然后是IL-7/IL-21在培养物的剩余物中一直存在。从小规模试验推测出倍数生长和TNC。IL-2/IL-15组合显示最佳扩增,并用于下面的实验。“正常”剂量的IL-2显示最佳生长。图23A显示在与不同的细胞因子条件温育之后,PD0047在温育第15天(D15)的结果和用不同细胞因子生长的比较和以及阳性细胞百分比(CD3+、CD62L+、CD3+/CD62L+/CD45RO-、CD28+、CDD45RA+/CD4RO-、CD45RA+/CD45RO_和CD45RA-/CD45RO+)。
图23B显示如上所表明的PD0047在第21天(D21)温育之后的结果和用不同细胞因子生长的比较以及阳性细胞百分比。图23C显示PD0040第21天和用不同细胞因子生长的比较,其中在培养物中生长22天后检测总细胞数。图23D显示PD0040第21天和用不同细胞因子生长的比较,如表明的在培养物中生长22天后检测CD3+细胞生长。图23E显示PD0047和用不同细胞因子生长的比较,其中在培养物中生长22天后检测总细胞数。图23F显示PD0047和用不同细胞因子生长的比较,其中培养物生长22天后检测CD3+细胞生长。如显示的,PD0040:PD0038 CD8+富集的细胞用于测试不同细胞因子混合物。每个条件的浓度是:IL-2(50U/mL)、IL-7(5ng/mL)、IL-15(0.5ng/mL)。条件#4是IL-2脉冲5天,然后是IL-7/IL-21在培养物的剩余物中一直存在。从小规模试验推测出倍数生长和TNC。IL-2/IL-15组合显示最佳扩增并用于后续实验。另外,PD0047:PD0038 CD8+富集的细胞用于测试不同细胞因子混合物。使用10U/mL终浓度的“低剂量”IL-2测试相同的细胞因子混合物。每个条件的浓度是:如图例所述的IL-2(50U/mL)和(10U/mL),IL-7(5ng/mL)、IL-15(0.5ng/mL)、IL-21(5ng/mL)。脉冲条件是IL-2脉冲5天,然后是IL-7/IL-21在培养物的剩余物中一直存在。然后从小规模试验推测出倍数生长和TNC。上文描述的研究中使用的IL-2/IL-15细胞因子组合显示最佳扩增。“正常”剂量的IL-2也显示最佳生长。用于表型生长的流式细胞术是可使用的,并且在本文的进一步实验中说明。
图24A-图24F所示的是测试细胞因子的不同组合的一系列实验的结果。用PD0051:来自两个不同供体的CD8+细胞测试使用IL-2(50U/mL)和IL-15(0.5ng/mL)的“正常”细胞因子条件。脉冲条件是IL-2脉冲5天,然后是IL-7(5ng/mL)、IL-21(5ng/mL)在培养物的剩余物中一直存在。所示的倍数生长和TNC来自从30×106个细胞开始的规模试验。当前使用的IL-2/IL-15组合显示了最佳扩增,但是也可以从用IL-2脉冲然后转换为IL-7/IL-21的培养物中发现扩增。倍数扩增在脉冲条件下与PD0047相似。
对于PD0055,测试与评估PD0051相同的细胞因子条件,但是使用CD4+供体细胞(与以上相同的供体PD0038)。细胞因子条件是IL-7(5ng/mL)和IL-15(0.5ng/mL)用于实验。脉冲条件是IL-2脉冲5天,然后是IL-7(5ng/mL)、IL-21(5ng/mL)在培养物的剩余物中一直存在。倍数生长和TNC来自从30×106个细胞开始的规模试验。当前使用的IL-7/IL-15组合显示通常的扩增,然而从用IL-2脉冲然后转换为IL-7/IL-21的培养物中发现更好的扩增。图24A显示在第15天的PD0051和用不同细胞因子生长的比较以及供体与供体细胞因子比较的阳性细胞百分比(EGFRt+、EGFRt+/CD4+、EGFRt+/CD8+、CD3+、CD3+/CD4+、CD3+/CD4+/CD8+、CD3+/CD8+、CD62L+、CD3+/CD8+、CD62L+、CD3+/CD28+、CD27+、CD127+、CD45RA+/CD45RO-、CD45RA+/CD45RO_/CD45RO_/CD45RA-、CD62+/CD28+)。图24B显示在第17天(D17)的PD0055和用不同细胞因子生长的比较以及阳性细胞百分比。图24C显示PD0051生长曲线和用不同细胞因子生长的比较,其中在培养物中生长20天后检测总细胞数。图24D显示PD0051和用不同细胞因子生长的比较,如表明的培养物生长20天后检测CD3+细胞生长。图24C和图24D显示PD0051的生长曲线(总细胞和CD3+),比较了通过培养物中20天用表明的不同细胞因子温育细胞后的生长。图24E和图24F显示在表明的时间点即在培养物中生长的第17天,用表明的不同细胞因子温育后的供体PD0055的生长曲线(总细胞和CD3+)。
图25A、图25B1-B4所示的是细胞因子测试实验,其中评价不同的细胞因子的组合对细胞扩增的影响。例如PD0059,进行与所示的PD0051相同的细胞因子测试实验,除了该实验涉及测试新的CD4+和CD8+供体(PD0057)。对于CD4细胞使用IL-7(5ng/mL)和IL-15(0.5ng/mL)测试“正常”细胞因子条件,以及对于CD8+细胞使用IL-2(50U/mL)和IL-15(0.5ng/mL)测试“正常”细胞因子条件。脉冲条件是IL-2脉冲5天,然后是IL-7(5ng/mL)、IL-21(5ng/mL)在培养物的剩余物中一直存在。倍数生长和TNC来自从30×106个细胞开始的规模试验。本研究中的“正常”细胞因子组合导致了扩增;用IL-2脉冲然后转换为IL-7/IL-21之后观察到良好的扩增。
对PD0078,进行与PD0051中相似的细胞因子研究,除了用不同的CD4+和CD8+供体(PD0063)进行实验以外。使用“正常”细胞因子条件进行测试,即对于CD4细胞使用IL-7(5ng/mL)和IL-15(0.5ng/mL),对于CD8细胞使用IL-2(50U/mL)和IL-15(0.5ng/mL),与仅有IL-2的条件对比。所有生长经过第14天(D+14)处在正常平台期,然后将培养物选择为EGFRt。选择CD8+细胞后没有观察到生存力和生长的恢复。如图25A所示的是解冻细胞后的阳性细胞百分比。图25B1显示了PD0059 PLAT-02细胞因子对比。-图25B2显示了PD0059PLAT-02细胞因子对比和CD3+细胞生长。图25B3显示了PD0078生长曲线。图25B4显示了PD0078生长曲线和CD3+细胞生长。
图26所示的是说明基于实验的细胞扩增的初始扩增方法以及更新的(或“当前的”)扩增方法的两个流程图,然后这些流程图用于后续的实验。
图27A-图27C所示的是来自PD0080、PD0084和PD0085的样品的生长曲线,以及所有三个之间的比较。这三个实验是“早期扩增”方法的重复实验。对这些实验,使用标准细胞因子条件:对于CD8+T细胞,IL-2(50U/mL)+IL-15(0.5ng/mL);对于CD4+T细胞,IL-7(5ng/mL)+IL-15(0.5ng/mL)。对于PD0080,使用PD0063 CD8+T细胞一式两份地测试两个起始密度。经过在转导日的3小时温育后,每个细胞重复中的一个接受高达约0.7×106个细胞/mL的量。对于PD0084,评估两种另外的CD8+供体T细胞的早期扩增作用。使用30×106个细胞的起始条件作为每个供体的对照,使用60×106个细胞的起始密度与早期扩增一起用作测试条件。对于PD0085,进行与PD0084相似的测试,除了用CD4+T细胞测试早期扩增以外。再次将30×106起始细胞密度用作“正常”对照条件,并且将60×106个细胞的起始密度用作测试条件。
如图28A-图28D所示,PD0038起始物质包括选择的CD4+和CD8+细胞。生长曲线显示来自汇集在一起的细胞的两个V-197袋的TNC。从早期发展来看,意图是在深低温保藏之前汇集至50:50CD4:CD8产品。流数据显示汇集产品解冻后。珠移除和EGFRt富集,对于CD4+T细胞发生在D+14,对于CD8+细胞发生在D+15。CD8+T细胞生长于IL-2(50U/mL)/IL-15(0.5ng/mL)中,并且CD4+T细胞生长于IL-7(5ng/mL)/IL-15(0.5ng/mL)中。该方法改变为将分隔的产品深低温保藏并在解冻时以50:50产品输注。
图29A-图29C所示的是PD0046的生长曲线。生长曲线显示来自在一起的细胞的两个V-197袋的TNC。在早期发展中,具有在深低温保藏前汇集50:50CD4:CD8产品的意图。流数据显示汇集产品解冻后。然后发生珠移除和EGFRt富集。CD4+T细胞发生在D+14,CD8+T细胞发生在D+15。CD8+T细胞生长于IL-2(50U/mL)/IL-15(0.5ng/mL)中,以及CD4+T细胞生长于IL-7(5ng/mL)/IL-15(0.5ng/mL)中。然而,该产品没有起太大作用,因为供体细胞解冻不充分。随后使用细胞测试10%HA解冻并被证明要好得多。
图30A-图30C所示的是PD0063的生长曲线。生长曲线显示来自在一起的细胞的两个V-197袋的TNC。珠移除和EGFRt富集,然后显示CD4+T细胞发生在D+14,CD8+T细胞发生在D+15。CD8+细胞生长于IL-2(50U/mL)/IL-15(0.5ng/mL)中,并且CD4+细胞生长于IL-7(5ng/mL)/IL-15(0.5ng/mL)中。然后发生珠移除和EGFRt富集。
图31A1-图31A2、图31B1-图31B2所示的是在细胞因子存在下生长时从批量PBMC培养物中扩增细胞。如所示的,CD4+细胞(·)在IL2和IL15存在下生长。CD8+细胞(■)在IL7和IL15存在下生长。图31A1和图31B1(表型比较)显示了在不同条件下温育后在其表面上表达指示的标记的总细胞百分比,所述不同条件中的每一种均导致细胞表达移入适合性的标记,例如CD62L、CD28、CD27、CD45RA。在IL-2/IL-15中生长CD8富集培养物和在IL-7/IL-15中生长CD4富集培养物产生两种培养物的稳健扩增和记忆表型的强烈表达。
图32A1-图32A2、图32B1-图32B2所示的是富集的CD8+和CD4+细胞在细胞因子混合物中的扩增。如样品PD0044所示,富集的CD8+T细胞在IL2和IL15的存在下扩增(图32A1)。在样品PD0044中,富集的CD4+T细胞在IL7和IL15的存在下扩增超过20天。如所示的,汇集的CD4+和CD8+T细胞表达CD3、CD4、CD8、CD62L、CD28、CD27、CD45RA和CD45RO。还测试了样品14602-S14(见图32BB1-图32B2)。如所示的,在IL-2/IL-15中生长CD8富集的培养物和在IL-7/IL-15中生长CD4富集的培养物产生两种培养物的稳健扩增和记忆表型的强烈表达。重要地,从产生并示于图31A1-图31A2、图31B1-图31B2,和图32A1-图32A2、图32B1-图32B2的数据,CD4+T细胞和CD8+T细胞最佳地与不同细胞因子组合生长,使得在这些研究中CD4+T细胞最佳用IL7和IL15进行,而在这些研究中CD8+T细胞生长最佳用IL2和IL15进行。用它们各自的最佳细胞因子组合生长导致细胞在细胞扩增后具有表型,其中细胞表达表面标记CD45RA、CD62L、CD28和CD27,所述表面标记表明在过继转移时高的或改善的或提高的移入适合性。
图33A-图33C所示的是来自使用细胞扩增的原始PLAT-02(I期和II期临床试验)方法的14602-S01至14602-SO6的样品。在深低温保藏之前,细胞对EGFRt呈阳性。测试细胞的生存力。如底部的表所示,细胞14602-SO3 CD8+和14602-SO3-CD8+细胞不表达CD3、CD62L、CD27、CD127、CD45RA/CD45RO-或CD45RA。
图34A-图34C所示的是对具有CD4+和CD8+T细胞两者的细胞产品14602-SO4和14602-SO4-02的测试。细胞使用“早期扩增”方法生长于培养物中。在深低温保藏之前测试细胞对EGFRt表达呈阳性。
图35A-图35C所示的是来自样品14602-SO7、14602-SO8和14602-SO9的细胞。使用早期扩增方法扩增CD4+和CD8+细胞。在上部图片中,如表格中所示的14602-SO7 CD4+细胞和14602-SO7 CD8+细胞显示在不同时间表达不同标记(包括CD3、CD62L、CD27、CD27、CD127和CD45RA+)的细胞的百分比。在底部的图片中在培养10天后样品14602-SO8 CD4+和CD8+富集的T细胞保持存活。
图36A-图36D所示的是从批量样品14602-S10、14602-S11、14602-S12和14602-S13中测试细胞的生存力。如所附表格显示,在深低温保藏前细胞均表达EGFRt。在至少12天的细胞培养物中测试细胞的生存力。
图37A-图37C所示的是从批量样品14602-S14、14602-S15、14602-S16和14602-S13中测试细胞的生存力。如所附表格显示,在深低温保藏前细胞均表达EGFRt。在至少12天的细胞培养物中测试细胞的生存力。
如图38A-图38B所示的来自样品14602的细胞对CD3、CD62L、CD28、CD127、CD45RA+/CD45RO-、CD45RA和CD45RO呈阳性,CD4+和CD8+T细胞富集自所述的样品14602的细胞。这些是特定的标记,用于表明在用CD4+和CD8+细胞的特定的细胞因子组合处理后,CD4+和CD8+细胞二者均具有高水平的移入适合性。
图39A、图39B1-图39B2所示的是接种肿瘤(存活、肿瘤进展)后的T细胞施用后小鼠的结果。如所示,用来自样品PD0046的细胞注射小鼠表明细胞具有高的、改善的或提高的移入适合性,由于小鼠在用多种浓度的细胞施用80天后能够存活。由于存活率百分比在第40天下降,样品PD00044不具有高的、改善的或提高的移入适合性(图39B1-图39B2)。
如图40A-图40D所示的是用来自PD0044和PD0046细胞批次的细胞处理的小鼠的平均肿瘤进展。如图所示,如果用来自PD0046批次的CD8+和CD4+T细胞施用于小鼠,则小鼠的肿瘤进展减少,其中细胞最初在对CD4+和CD8+T细胞合适的细胞因子混合物中生长(对于CD4+T细胞:IL7/IL15,以及对于CD8+T细胞:IL2/IL15)。作为对照,溶媒细胞用PD0044和PD0046进行的任一项研究中均不使肿瘤发展停止。如图40C所示,在用来自PD0044样品的细胞处理的小鼠中,肿瘤进展增加,并且具体为当用最小浓度的T细胞处理时大幅增加。与溶媒对照对比肿瘤进展减少。
作为进一步的测试,测试了三组小鼠,其中每个组具有总数为5只小鼠/组。对A组,用磷酸盐缓冲盐水(PBS)安慰剂处理小鼠。B组利用来自“正常”扩增的细胞,所述细胞具有用Zrx-014转导的1:1EGFRt+CD4:CD8。使用的细胞来自组PD0055#1(供体PD0038 CD4用5ng/ml IL7和0.5ng/ml IL15,S1D14在75.9%EGFRt+下)和组PD0051#1(供体PD0038 CD8用50U/ml IL2和0.5ng/ml IL15,S1D21在76.8%EGFRt+下)。C组利用以细胞因子处理液“脉冲”的细胞,所述细胞包括用Zrx-014转导的1:1EGFRt+CD4:CD8,PD0055#2(供体PD0038 CD4用50U/ml IL2脉冲5天,然后5ng/ml IL7和5ng/ml IL21,S1D21在89.5%EGFRt+下)。
如图42A-图42E所示的是对解冻后的细胞的FACS分析,所述细胞在JME13-25(PD0051和PD00055细胞)中用于注射到小鼠体内。如所示的,两种细胞样品均具有表达EGFRt的CD8+和CD4+T细胞。
如图43A-图43C所示的是来自用安慰剂PBS(A组)、B组(PD00051“正常扩增细胞”)和C组(PD00055,用细胞因子组合脉冲的细胞)处理的A、B和C组的三组小鼠。如所示的,A组中用安慰剂处理的小鼠具有在第20天明显可见的肿瘤进展。对于用PD0051(正常扩增细胞)处理的B组小鼠,显示在两只小鼠中肿瘤进展大幅增加。在C组中,用PD00055处理的小鼠仅显示少量的肿瘤进展,因此表明在用于处理前用细胞因子混合物处理的细胞具有更高的移入适合性。
如图44A-图44C所示的是施用3天后在小鼠中表达CAR的T细胞的存留。如表明的,与正常扩增的细胞以及CD8+T细胞相比,表达CAR的CD4+T细胞具有更高的存留。
在用表达CAR的T细胞的T细胞治疗之后检测肿瘤进展的实验之后,进行实验以确定在在抗原重复暴露下在体外不同细胞因子条件下生长的细胞之间的杀伤能力在体内是否具有差异(图45)。对于实验,使用3组小鼠,其中每组使用3只小鼠。对于A组,用安慰剂(PBS)处理小鼠。B组通过“正常扩增方法”(“正常的”用Zrx-014转导的1:1EGFRt+CD4:CD8PD0055#1(供体PD0038 CD4,用5ng/ml IL7和0.5ng/ml IL15,S1D14在75.9%EGFRt+下)PD0051#1(供体PD0038 CD8,用50U/ml IL2和0.5ng/ml IL15,S1D21在76.8%EGFRt+下))扩增的细胞处理(图18A-图18B)。C组用在扩增过程中用细胞因子脉冲的细胞(“脉冲的”用Zrx-014转导的1:1EGFRt+CD4:CD8,PD0055#2(供体PD0038 CD4,用50U/ml IL2脉冲5天,然后5ng/ml IL7和5ng/ml IL21,S1D11在81.2%EGFRt+下)PD0051#2(供体PD0038 CD8,用50U/ml IL2脉冲5天,然后5ng/ml IL7和5ng/ml IL21,S1D21在89.5%EGFRt+下))处理。
如图46A-图46B所示,A组小鼠在注射PBS后第20天死亡。用通过“正常扩增方法”扩增的细胞处理的B组小鼠在第120天,在一只小鼠中具有肿瘤进展。然而,对于用以细胞因子扩增的细胞处理的小鼠,在第120天小鼠没有肿瘤。如此的数据表明用对CD4+和CD8+特异性的细胞因子混合物处理的细胞导致更高的移入率和小鼠增加的存活率。另外,在预防肿瘤进展中细胞是更有效的。
如图47A-图47C所示,当用PD0051和PD0055细胞在肿瘤接种后处理小鼠时,小鼠具有100%的存活率。然而,当使用PD0055细胞处理时,肿瘤进展显示降低。
如图48A-图48D所示,检测用安慰剂、在“正常扩增”方法下生长的T细胞和以细胞因子组合脉冲的T细胞处理的小鼠的平均肿瘤进展。对在第0天的实验,将小鼠接种肿瘤,在第6天对肿瘤成像。在第7天,施用T细胞或安慰剂。然后在第14天和第21天重复接种肿瘤。
在第28、35、49、63、78、92、105和120天检测小鼠的肿瘤进展,其中拍下肿瘤的图像。如各组小鼠所示的,在用以细胞因子脉冲的细胞处理的小鼠中肿瘤进展降低,因此表明以细胞因子脉冲的细胞比在正常条件下没有细胞因子扩增的细胞具有更高的、改善的或提高的移入适合性。
如图49所示,建立实验以确定在与PLAT-01和PLAT-02以及“中间”方案相同条件下生长的细胞之间在杀伤能力方面在体内是否具有差异。对于实验,在肿瘤接种后的小鼠处理中使用17组,每组5只小鼠测试细胞。各组给予细胞剂量(1.25×106、2.5×106、5×106、10×106)每种产品条件,如图49的表中所示的。在同一天将细胞解冻、计数并注射入小鼠体内。如图50所示,是来自两种扩增方法的不同细胞产品中的CD4+和CD8+细胞的量和细胞中它们的EGFRt的量。
如图51A-图51D所示,将17组小鼠接种肿瘤,然后用在正常扩增方法下扩增的T细胞或以细胞因子组合脉冲的T细胞以剂量调整处理。如图中所见,以更高浓度的PLAT-1.00细胞给药的小鼠的肿瘤进展降低。以PLAT-2.00给药的小鼠也可见在以更高浓度的细胞施用25天后肿瘤发展降低。然而,对于用PLAT-1.33给药的小鼠,无论细胞浓度,可见小鼠肿瘤进展增加,表明这些细胞的低的或降低的移入适合性。对于给予来自PLAT-1.67的细胞的小鼠,当在施用中以最高浓度细胞处理时,小鼠具有降低的肿瘤进展。然而如图50所记载的,PLAT-1.33的细胞也具有低的EGFRt计数,这也说明细胞表面上CAR量的减少。
图51A-图51D所示的是PD104和PD116细胞产品之间的初始比较,对于PD0104产品,PD0063 CD8+和CD4+富集的细胞用于重复试验以测试在第Tx天细胞扩增至0.7×106个细胞/mL(“早期扩增”)。对于正常PLAT-02培养条件,对于CD8+细胞使用IL-2(50U/ml)+IL-15(0.5ng/mL),以及对于CD4+T细胞使用IL-7(5ng/mL)+IL-15(0.5ng/mL)。生长和生存力显著增加。这些曲线就生长/珠移除/选择/深低温保藏的时机而言模拟在临床产品所观察到的现象。
如图52A-图52D所示,用PLAT-1.00、PLAT-1.33、PLAT-1.67和PLAT-2.00的剂量调整的细胞产品处理。如所有图中所示,细胞的最低浓度在肿瘤进展处理中是有效性最小。然而,显示最大移入适合性的细胞是更高浓度的PLAT-1.00和the PLAT-2.00。
如图53A1-图53A4、图53B1-图53B4、图53C1-图53C4和图53E1-图53E4所示,所有细胞在浓度1.25x106下有效性最小。来自PLAT-1.00的细胞显示在抑制肿瘤进展时是最有效的,表明细胞的移入适合性与其他组相比是优越的或改善的或提高的,并且表明用细胞因子处理也促进、改善或提高细胞的移入适合性。如在5×106的浓度下所示,与用于处理小鼠的其他组的细胞相比,在第25天肿瘤进展停止,
如图54A-图54D所示,如果用2.5×106至10×106个细胞每剂的细胞剂量处理小鼠,小鼠具有更高的存活率。然而,用来自PLAT-1.00产品的细胞处理的小鼠具有更长的存活率,表明来自该组的T细胞更稳健并展示了更高的、改善的或提高的移入适合性。
如图55A-图55D所示,小鼠的存活决定于细胞的剂量浓度。对于所有细胞,在使用最低剂量的T细胞处理下,小鼠的存活率减少。然而,如前面所示的用来自PLAT-1.00产品的细胞处理的小鼠具有更长的存活率,表明来自该组的T细胞更稳健并具有改善的移入适合性。
另外的供选择的方案
在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分隔、分离或富集CD8+T细胞群和/或CD4+T细胞群,以产生分离的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;刺激获得的T细胞群,以产生刺激的CD8+T细胞群和/或CD4+T细胞群;用载体转导刺激的CD8+T细胞群和/或CD4+T细胞群,以产生转导的CD8+T细胞群和/或CD4+T细胞群,其中载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;使转导的CD8+T细胞群和/或CD4+T细胞群与至少一种细胞因子接触,以产生转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群;通过选择标记序列富集转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,以产生富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群;以及增殖富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群至少1天,以获得具有嵌合抗原受体的所述基因修饰的T细胞。
在一些供选择的方案中,通过亲和性选择具有存在于CD8和/或CD4上的表位的T细胞从混合的T细胞群分隔CD8+T细胞群和/或CD4+T细胞群。在一些供选择的方案中,通过流式细胞术进行从混合的T细胞群分隔CD8+T细胞群和/或CD4+T细胞群。在一些供选择的方案中,通过免疫磁性选择进行从混合的T细胞群分隔CD8+T细胞群和/或CD4+T细胞群。在一些供选择的方案中,基因修饰的CD8+T细胞和/或CD4+T细胞包括至少一种促进移入适合性的受体。在一些供选择的方案中,至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,通过使CD8+和/或CD4+T细胞与抗体结合支持物如珠或颗粒接触进行刺激分离的T细胞群。在一些供选择的方案中,抗体结合支持物包括抗TCR、抗CD2、抗CD3、抗CD4和/或抗CD28抗体。在一些供选择的方案中,抗体结合支持物包括抗CD3和/或抗CD28抗体。在一些供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列。在一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体。在一些供选择的方案中,标记序列编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL/7、IL-15和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在一些供选择的方案中,接触进行2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个这些值限定的范围内的一段时间。在一些供选择的方案中,用不存在CD8+细胞的分离的CD4+细胞执行方法。在一些供选择的方案中,用不存在或富集超过CD4+细胞的分离的CD8+细胞执行方法。在一些供选择的方案中,增殖表达CD4+的T细胞至少1天,以及可增殖20天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。在一些供选择的方案中,增殖表达CD8+的T细胞至少1天,以及可增殖20天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。在一些供选择的方案中,方法进一步包括移除抗体结合支持物如珠或颗粒。在一些供选择的方案中,嵌合抗原受体的配体结合域包括抗体或其结合部分。在一些供选择的方案中,嵌合抗原受体的配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,嵌合抗原受体的配体结合域包括FMC63或其结合部分。在一些供选择的方案中,嵌合抗原受体的配体结合域对CD19是特异性的。在一些供选择的方案中,方法进一步包括深低温保藏基因修饰的CD8+和/或CD4+T细胞。
在一些供选择的方案中,提供了基因修饰的T细胞群,其中基因修饰的T细胞群包括大量亲和性选择的CD8+和/或CD4+T细胞,所述大量亲和性选择的CD8+和/或CD4+T细胞不存在、富集超过或分离自CD8-和/或CD4-T细胞,其中所述大量亲和性选择的CD8+和/或CD4+T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括编码嵌合抗原受体和细胞表面选择性标记的基因,并且其中所述大量亲和性选择的CD8+和/或CD4+T细胞已经被至少一种细胞因子重刺激。在一些供选择的方案中,至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-18、IL-15、IL-2和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL/7、IL-15和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在一些供选择的方案中,所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括促进、诱导、有助于或提高移入适合性的至少一种受体。在一些供选择的方案中,促进、诱导、有助于或提高移入适合性的至少一种受体是CD45RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,促进、诱导、有助于或提高移入适合性的至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,大量亲和性选择的CD8+和/或CD4+T细胞进一步包括具有编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列的载体。在一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体。在一些供选择的方案中,细胞表面选择性标记编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,配体结合域包括抗体或其结合部分。在一些供选择的方案中,配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,配体结合域包括FMC63或其结合部分。在一些供选择的方案中,配体结合域对CD19是特异性的。在一些供选择的方案中,群包括不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,群包括不存在或富集超过CD4+T细胞的分离的CD8+T细胞。
在一些供选择的方案中,提供了用于人治疗的组合物或产品组合,其中组合物或产品组合包含药用赋形剂和至少一种基因修饰的T细胞群。在一些供选择的方案中,至少一种基因修饰的T细胞群包括大量亲和性选择的CD8+和/或CD4+T细胞,所述亲和性选择的CD8+和/或CD4+T细胞不存在、富集超过或分离自CD8-和/或CD4-T细胞,其中所述大量亲和性选择的CD8+和/或CD4+T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括编码嵌合抗原受体和细胞表面选择性标记的基因,并且其中所述大量亲和性选择的CD8+和/或CD4+T细胞已经被至少一种细胞因子重刺激。在一些供选择的方案中,至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL/7、IL-15和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在一些供选择的方案中,所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括促进、诱导、有助于或提高移入适合性的至少一种受体。在一些供选择的方案中,促进、诱导、有助于或提高移入适合性的至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,促进、诱导、有助于或提高移入适合性的至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,大量亲和性选择的CD8+和/或CD4+T细胞进一步包括具有编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列的载体。在一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体。在一些供选择的方案中,细胞表面选择性标记编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,配体结合域包括抗体或其结合部分。在一些供选择的方案中,配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,配体结合域包括FMC63或其结合部分。在一些供选择的方案中,配体结合域对CD19是特异性的。在一些供选择的方案中,至少一个群包括不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,至少一个群包括不存在或富集超过CD4+T细胞的分离的CD8+T细胞。在一些供选择的方案中,组合物或产品组合包含基因修饰的T细胞群,其中基因修饰的T细胞群包括不存在或富集超过CD4+T细胞的分离的CD8+T细胞。在一些供选择的方案中,组合物或产品组合包含基因修饰的T细胞群,其中基因修饰的T细胞群包括不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,群包括以1:1的比混合或联合施用的不存在或富集超过CD4+T细胞的分离的CD8+T细胞与不存在或富集超过CD8+T细胞的分离的CD4+T细胞。
在一些供选择的方案中,提供了治疗、抑制或减轻有需要的受试者的疾病的方法,其中方法包括将至少一种组合物或产品组合施用于受试者。在一些供选择的方案中,至少一种组合物或产品组合包括药用赋形剂和至少一种基因修饰的T细胞群。在一些供选择的方案中,至少一种基因修饰的T细胞群包括大量亲和性选择的CD8+和/或CD4+T细胞,所述大量亲和性选择的CD8+和/或CD4+T细胞不存在、富集超过或分离自CD8-和/或CD4-T细胞,其中所述大量亲和性选择的CD8+和/或CD4+T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括编码嵌合抗原受体和细胞表面选择性标记的基因,并且其中所述大量亲和性选择的CD8+和/或CD4+T细胞已经被至少一种细胞因子重刺激。在一些供选择的方案中,至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-2和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL/7、IL-15和/或IL-21。在一些供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在一些供选择的方案中,所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括促进移入适合性的至少一种受体。在一些供选择的方案中,促进、诱导、有助于或提高移入适合性的至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在一些供选择的方案中,促进、诱导、有助于或提高移入适合性的至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,大量亲和性选择的CD8+和/或CD4+T细胞进一步包括具有编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列的载体。在一些供选择的方案中,载体进一步包括编码间隔区的序列。在一些供选择的方案中,间隔区包括IgG4铰链。在一些供选择的方案中,载体是病毒载体。在一些供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。在一些供选择的方案中,病毒载体是慢病毒载体。在一些供选择的方案中,细胞表面选择性标记编码截短的表皮生长因子受体(EGFRt)。在一些供选择的方案中,配体结合域包括抗体或其结合部分。在一些供选择的方案中,配体结合域包括单链可变区片段(scFv)或其结合部分。在一些供选择的方案中,配体结合域包括FMC63或其结合部分。在一些供选择的方案中,配体结合域对CD19是特异性的。在一些供选择的方案中,至少一个群包括不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,至少一个群包括不存在或富集超过CD4+T细胞的分离的CD8+T细胞。在一些供选择的方案中,组合物或产品组合包含基因修饰的T细胞群,其中基因修饰的T细胞群包括不存在或富集超过CD4+T细胞的分离的CD8+T细胞。在一些供选择的方案中,组合物或产品组合包含基因修饰的T细胞群,其中基因修饰的T细胞群包括不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,群包括以1:1的比混合或联合施用的不存在或富集超过CD4+T细胞的分离的CD8+T细胞与不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,方法包括施用组合物或产品组合,其中组合物或产品组合包含至少一个群,其中至少一个群包括不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,方法包括施用组合物或产品组合,其中组合物或产品组合包含至少一个群,其中至少一个群包括不存在或富集超过CD4+T细胞的分离的CD8+T细胞。在一些供选择的方案中,方法包括施用组合物或产品组合,其中组合物或产品组合包含至少一个群,其中至少一个群包括以1:1的比混合或联合施用的不存在或富集超过CD8+T细胞的分离的CD4+T细胞与不存在或富集超过CD4+T细胞的分离的CD8+T细胞。在一些供选择的方案中,方法进一步包括施用组合物或产品组合,其中组合物或产品组合包括至少一个群,其中至少一个群包括不存在或富集超过CD4+T细胞的分离的CD8+T细胞。在一些供选择的方案中,方法进一步包括施用组合物或产品组合,其中组合物或产品组合包括至少一个群,其中至少一个群包括不存在或富集超过CD8+T细胞的分离的CD4+T细胞。在一些供选择的方案中,鉴别或选择受试者以接受抗癌治疗。在一些供选择的方案中,方法进一步包括测量或评价疾病的抑制。在一些供选择的方案中,方法进一步包括在施用如上所述的组合物或产品组合之前、期间或之后,向所述受试者提供另外的抗癌治疗。在一些供选择的方案中,通过过继细胞转移将组合物或产品组合施用于所述受试者。在一些供选择的方案中,在所述受试者接受另一形式的抗癌治疗后,将组合物或产品组合施用于所述受试者。在一些供选择的方案中,在所述受试者接受另一形式的抗癌治疗后,将组合物或产品组合施用于所述受试者。在一些供选择的方案中,受试者患有白血病。在一些供选择的方案中,受试者具有复发性和/或化疗难治性CD19+儿童急性成淋巴细胞性白血病(ALL)。在一些供选择的方案中,受试者具有复发性和/或化学治疗难治性CD19+急性成淋巴细胞性白血病(ALL)。在一些供选择的方案中,受试者患有自身免疫疾病。在一些供选择的方案中,受试者患有HSCT后复发。
关于本文任何实质上复数和/或单数术语的使用,在适合于上下文和/或本申请时,本领域技术人员可从复数翻译为单数和/或从单数翻译为复数。为了清晰,本文中不同的单数/复数交换可被特别地提出。
本领域技术人员将会理解,通常本文使用的术语,尤其在所附的权利要求中(例如所附权利要求的主体)的术语通常意指“开放性”术语(例如术语“包括(including)”应该被解释为“包括但不限于”,术语“具有”应该被解释为“至少具有”,术语“包括(includes)”应该被解释为“包括但不限于”等)。本领域技术人员将进一步理解如果意图引入的权利要求记载的具体数字,这样的意图将明确记载在权利要求中,并且如不存在这样的记载,则不存在这样的意图。例如,为了帮助理解,下面所附的权利要求可以包含介绍性短语“至少一个”和“一个或多个”的使用以介绍权利要求记载。然而,这样的短语的使用不应被解释为暗示通过不定冠词“a”或“an”介绍权利要求记载限制任何包含这样的介绍的权利要求记载的特定权利要求至仅含有一个这样的记载的供选择的方案,即使当相同权利要求包括介绍性短语“一个或多个”或“至少一个”以及不定冠词如“a”或“an”(例如“a”和/或“an”应该被解释为“至少一个”或“一个或多个”);同样适于用于介绍权利要求记载的定冠词的使用。另外,即使明确记载介绍的权利要求记载的具体数字,本领域技术人员会认识到这样的记载应该被解释为意思至少是引用的数字(例如“两个记载”的直接记载,没有其他修饰,意思是至少两个记载,或两个或多个记载)。此外,在使用类似于“A、B和C中的至少一个等”惯例的那些情况下,通常这样的结构意指就本领域技术人员将理解惯例(例如“具有A、B和C中的至少一个的系统”这个意义而言,将包括但不限于具有单独A、单独B、单独C、A和B一起、A和C一起、B和C一起和/或A、B和C一起等)。在类似于“A、B或C中的至少一个等”惯例的那些情况下,通常这样的结构意指就本领域技术人员会理解惯例(例如“具有A、B或C中的至少一个的系统”这个意义而言,将包括但不限于具有单独A、单独B、单独C、A和B一起、A和C一起、B和C一起和/或A、B和C一起等的系统)。本领域技术人员会进一步理解事实上呈现两个或更多个可供选择的术语的任何转折性词语和/或转折性短语,不论在说明书、权利要求书或附图中,应该被理解为预期包括术语中的一个、术语中的任一个或两个术语的可能性,例如短语“A或B”会被理解为包括“A”或“B”或“A和B”的可能性。
更多供选择的方案
在一些供选择的方案中,通过亲和性选择具有存在于CD8和/或CD4上的表位的T细胞,从混合的T细胞群分隔、富集或分离表达CD8+的T细胞群和/或表达CD4+的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞。在一些供选择的方案中,通过流式细胞术进行从混合的T细胞群分隔、富集或分离表达CD8+的T细胞群和/或表达CD4+的T细胞群。在一些供选择的方案中,通过免疫磁性选择进行从混合的T细胞群分隔、富集或分离表达CD8+的T细胞群和/或表达CD4+的T细胞群。在一些供选择的方案中,基因修饰的表达CD8+的T细胞和/或表达CD4+的T细胞包括促进、诱导或有助于移入适合性的至少一种受体。在一些供选择的方案中,促进、诱导或有助于移入适合性的至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。在优选的供选择的方案中,促进、诱导或有助于移入适合性的至少一种受体是CD27、CD28和/或CD62L。在一些供选择的方案中,通过使表达CD8+和/或CD4+的T细胞与抗体结合支持物如珠或颗粒接触进行刺激分离的、富集的或分隔的T细胞群。在这些供选择的方案的一些中,抗体结合支持物包括抗TCR、抗CD2、抗CD3、抗CD4和/或抗CD28抗体。在优选的供选择的方案中,抗体结合支持物包括抗CD3和/或抗CD28抗体。
在许多前述的供选择的方案中,载体进一步包括编码前导序列的第一序列、编码配体结合域的第二序列、编码信号传导域的第三序列和编码选择性标记序列的第四序列。在这些供选择的方案的一些中,载体进一步包括编码间隔区的序列,所述间隔区在一些供选择的方案中可包括IgG4铰链。在许多前述的供选择的方案中,载体是病毒载体或微环。
在许多前述的供选择的方案中,病毒载体源自猿猴病毒40、腺病毒、腺伴随病毒(AAV)、慢病毒或反转录病毒。在一些供选择的方案中,病毒载体是重组腺病毒、腺伴随病毒、慢病毒或反转录病毒载体。优选地,病毒载体是慢病毒载体。在许多前述的供选择的方案中,标记序列编码截短的表皮生长因子受体(EGFRt)。在许多前述的供选择的方案中,使用的至少一种细胞因子包括GM-CSF、IL-7、IL-12、IL-15、IL-18、IL-15、IL-2和/或IL-21,并且所述细胞因子被外源地提供给T细胞,例如为除了可通过细胞产生或存在于培养基中的任意细胞因子以外的细胞因子。
在希望的可选择的实施方式中,至少一种细胞因子包括IL-7、IL-15和/或IL-21。在许多前述的供选择的方案中,至少一种细胞因子包括IL-2、IL-15和/或IL-21。在希望的可选择的实施方式中,至少一种细胞因子包括IL-21和另一细胞因子;和/或包括IL-7和至少一种其他细胞因子;和/或包括IL-15和至少一种其他细胞因子,如包括IL-21和IL-15、包括IL-21和IL-7,或包括IL-15和IL-7,或包括IL-2和IL-15,或包括IL-7和IL-15。在优选的供选择的方案中,接触时间进行至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个这些时间点限定的范围内的一段时间。在许多前述的供选择的方案中,在表达CD8+的T细胞不存在或与未分隔的、未富集的或未分离的T细胞群的天然群相比具有减少量的表达CD8+的T细胞下,用分离的、分隔的或富集的CD4+细胞执行方法,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞。在许多前述的供选择的方案中,在表达CD4+的T细胞不存在或与未分隔的、未富集的或未分离的T细胞群的天然群相比具有减少量的表达CD4+的T细胞下,用分离的、分隔的或富集的表达CD8+的T细胞群执行这些方法,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞。在许多前述的供选择的方案中,增殖表达CD4+的T细胞至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。在许多前述的供选择的方案中,增殖表达CD8+的T细胞至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间点限定的时间范围内的任意时间。
在一些供选择的方案中,提供了制备具有嵌合抗原受体的基因修饰的T细胞的方法,其中方法包括从混合的T细胞群分隔或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分隔的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,其中所述前体任选地是iPS细胞;刺激分隔的或富集的T细胞群,以产生刺激的CD8+T细胞群和/或CD4+T细胞群;用载体转导刺激的CD8+T细胞群和/或CD4+T细胞群,以产生转导的CD8+T细胞群和/或CD4+T细胞群,其中载体编码嵌合抗原受体;使转导的CD8+T细胞群和/或CD4+T细胞群与外源地提供的至少一种细胞因子接触1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间,以产生转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,其中借此方法获得具有嵌合抗原受体的所述基因修饰的T细胞,其中所述方法从而获得所述具有嵌合抗原受体的基因修饰的T细胞。在一些供选择的方案中,方法进一步包括通过选择标记,富集转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,以产生富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群。在一些供选择的方案中,标记由载体编码并任选地是细胞表面标记。在一些供选择的方案中,方法进一步包括增殖富集的、转导的、细胞因子刺激的CD8+T细胞和/或CD4+T细胞的群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间。
在一些供选择的方案中,提供了产生基因修饰的T细胞的方法,其中方法包括:将编码重组蛋白的载体引入CD4+富集的T细胞组合物的细胞内,以及与包括IL-7和IL-15的细胞因子的组合温育CD4+富集的T细胞组合物的细胞;和/或将编码重组蛋白的载体引入CD8+富集的T细胞组合物的细胞内以及与包括IL-2和IL-15的细胞因子的组合温育CD8+富集的T细胞组合物的细胞,其中方法借此产生了转导的CD4+富集的群和/或转导的CD8+富集的群。在一些供选择的方案中,转导的CD4+富集的群与参考富集的转导的CD4+细胞群相比,具有更高水平的CD62L、CD27和/或CD28的表面表达,和/或在施用于受试者时与参考富集的转导的CD4+细胞群相比,具有增加的移入适合性和/或扩增和/或存留的指标,其中参考群是通过另一种方法制备的CD4+-富集的群,所述另一种方法与该方法相同,除了用单独的IL-2替代细胞因子的组合以外。在一些供选择的方案中,转导的CD8+富集的群与参考富集的转导的CD8+细胞群相比,具有更高水平的CD62L、CD27和/或CD28的表面表达,和/或在施用于受试者时与参考富集的转导的CD8+细胞群相比,具有升高的移入适合性和/或扩增和/或存留的指标,其中参考群是通过另一种方法制备的CD8+-富集的群,所述另一种方法与该方法相同,除了用单独的IL-2替代细胞因子的组合以外。
在一些供选择的方案中,提供了产生基因修饰的T细胞的方法,其中方法包括:将编码重组蛋白的载体引入CD4+富集的T细胞组合物的细胞内,以及与第一细胞因子的组合温育CD4+富集的T细胞组合物的细胞;和将编码重组蛋白的载体引入CD8+富集的T细胞组合物的细胞内,以及与第二细胞因子的组合温育CD8+富集的T细胞组合物的细胞,所述第二细胞因子的组合区别于第一细胞因子的组合,其中借此方法产生转导的CD4+富集的群和转导的CD8+富集的群。在一些供选择的方案中,转导的CD4+富集的群与通过另一种方法制备的参考富集的转导的CD4+细胞群相比,具有更高水平的CD62L、CD27和/或CD28的表面表达,所述另一种方法与该方法相同,除了第一和第二细胞因子的组合是相同的以外,和/或在施用于受试者时与参考富集的转导的CD4+细胞群相比,具有增加的移入适合性和/或扩增和/或存留的指标。在一些供选择的方案中,转导的CD8+富集的群与通过另一种方法制备的参考富集的转导的CD8+细胞群相比,具有更高水平的CD62L、CD27和/或CD28的表面表达,所述另一种方法与该方法相同,除了第一和第二细胞因子的组合是相同的以外,和/或在施用于受试者时与参考富集的转导的CD8+细胞群相比,具有增加的移入适合性和/或扩增和/或存留的指标。在一些供选择的方案中,第一组合包括IL-7和IL-15,以及第二组合包括IL-2和IL-15。在一些供选择的方案中,添加细胞因子组合以起始转导,任选地在起始转导的同一天添加细胞因子组合。在一些供选择的方案中,IL-2的浓度在适当的情况下为或约为50U/mL,IL-15的浓度在适当的情况下为或约为0.5ng/mL和/或IL-7的浓度在适当的情况下为或约为5ng/mL。在一些供选择的方案中,细胞因子的组合添加至CD4+富集的和/或添加至CD8+富集的组合物包含增加组合物的体积以减少细胞密度,其中细胞在所述组合物中温育。在一些供选择的方案中,移入适合性的指标包括在组合物中的细胞的百分比和细胞表面标记的群的总表面表达水平,所述细胞表面标记选自由CD62L、CD27和/或CD28组成的组。在一些供选择的方案中,移入适合性的指标包括施用时在受试者中的存留。在一些供选择的方案中,细胞源自受试者。在一些供选择的方案中,转导的CD8+和/或CD4+细胞在施用于所述细胞所源自的受试者时存留至少为或约为将细胞注射入受试者后的30或60天。在一些供选择的方案中,重组蛋白是嵌合抗原受体。在一些供选择的方案中,方法进一步包括在转导前,富集T细胞组合物的表达CD4的细胞,以此产生这样转导的富集的CD4+富集的T细胞组合物,和/或在转导前,富集T细胞组合物的表达CD8的细胞,以此产生这样转导的富集的CD8+富集的T细胞组合物。在一些供选择的方案中,方法进一步包括深低温保藏工程化细胞。在一些供选择的方案中,方法进一步包括将工程化细胞施用于受试者,和任选地进一步包括在所述施用之前汇集转导的CD4+富集的和转导的CD8+富集的组合物。
在一些供选择的方案中,通过更多供选择的方案的该部分的前面段落中列出的方法的任意供选择的方案产生细胞或组合物。在一些供选择的方案中,预期通过前面段落中列出的任意的方法的供选择的方案或组合物的供选择的方案产生的施用细胞的方法。在一些供选择的方案中,将细胞或组合物施用于受试者。在一些供选择的方案中,施用于细胞所源自的受试者。
在一些供选择的方案中,提供了过继细胞治疗的方法,其中方法包括:(a)在刺激条件下和在IL-15和IL-7存在下温育CD4+富集的T细胞组合物,以此产生扩增的CD4+组合物;(b)在刺激条件下和在IL-15和IL-2存在下单独地温育CD8+富集的T细胞组合物以此产生扩增的CD8+组合物;以及(c)施用扩增的CD4+和扩增的CD8+群至受试者,任选地同时进行。在一些供选择的方案中,CD4+和CD8+群获得自受试者。在一些供选择的方案中,所记载的细胞因子中的一个或多个或细胞因子的组合进一步包括CD21。在一些供选择的方案中,CD4+-富集的群或其中T细胞的总数包括至少70、80、90、95、96、97、98或99%CD4+细胞,和/或CD8+-富集的群或其中T细胞的总细胞数包括至少70、80、90、95、96、97、98或99%CD8+细胞。
另外,在依据Markush组描述本公开的特征或方面时,本领域技术人员会认识到,进而也依据Markush群组的任意单个成员或成员子组来描述本公开。
Claims (10)
1.一种制备具有嵌合抗原受体的基因修饰的T细胞的方法,包括:
从混合的T细胞群分隔或富集表达CD8+的T细胞群和/或表达CD4+的T细胞群,以产生分隔的或富集的T细胞群,所述T细胞是如源自胸腺细胞的T细胞或源自工程化前体的T细胞,所述工程化前体希望地是iPS细胞;
刺激所述分隔的或富集的T细胞群,以产生刺激的CD8+T细胞群和/或CD4+T细胞群;
用载体转导所述刺激的CD8+T细胞群和/或CD4+T细胞群,以产生转导的CD8+T细胞群和/或CD4+T细胞群,其中所述载体编码嵌合抗原受体和标记序列,其中所述标记序列编码细胞表面选择性标记;
使所述转导的CD8+T细胞群和/或CD4+T细胞群与至少一种细胞因子接触,如接触1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间,以产生转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,所述细胞因子可以被外源地提供给T细胞,例如为除了可以由细胞产生或存在于培养基中的任何细胞因子以外的细胞因子;
通过选择所述标记序列富集所述转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群,以产生富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群;以及
增殖所述富集的、转导的、细胞因子刺激的CD8+T细胞群和/或CD4+T细胞群至少1天,如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天或由任意两个前述的时间段限定的范围内的一段时间,以获得具有嵌合抗原受体的所述基因修饰的T细胞。
2.权利要求1所述的方法,其中,通过亲和性选择具有存在于CD8和/或CD4上的表位的T细胞,进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。
3.权利要求1或2所述的方法,其中,通过流式细胞术进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。
4.权利要求1或2所述的方法,其中通过免疫磁性选择进行从混合的T细胞群分隔或富集CD8+T细胞群和/或CD4+T细胞群。
5.权利要求1-4中任一项所述的方法,其中,所述基因修饰的CD8+T细胞和/或CD4+T细胞包括促进、诱导、有助于或提高移入适合性的至少一种受体。
6.基因修饰的T细胞群,包括:
大量亲和性选择的CD8+和/或CD4+T细胞,所述CD8+和/或CD4+T细胞不存在、实质上贫化或富集超过CD8-和/或CD4-T细胞,其中所述大量亲和性选择的CD8+和/或CD4+T细胞具有刺激的CD2、CD3、CD4和/或CD28受体,其中所述大量亲和性选择的CD8+和/或CD4+T细胞进一步包括编码嵌合抗原受体和细胞表面选择性标记的基因,并且其中所述大量亲和性选择的CD8+T细胞和/或CD4+T细胞已经被至少一种细胞因子重刺激。
7.权利要求6所述的基因修饰的T细胞群,其中,所述大量亲和性选择的CD8+T细胞和/或CD4+T细胞进一步包括促进、提高、改善或有助于移入适合性的至少一种受体。
8.权利要求6或7所述的基因修饰的T细胞群,其中,促进、提高、改善或有助于移入适合性的所述至少一种受体是CD45 RA、CD45 RO、CCR7、CD25、CD127、CD57、CD137、CD27、CD28和/或CD62L。
9.用于人治疗的组合物或产品组合,包含:
药用赋形剂;和
至少一种根据权利要求6-8中任一项所述的基因修饰的T细胞群。
10.至少一种权利要求9所述的组合物或产品组合在制备治疗、抑制或减轻有需要的受试者的疾病的药物中的用途。
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461977751P | 2014-04-10 | 2014-04-10 | |
| US61/977,751 | 2014-04-10 | ||
| US201461986479P | 2014-04-30 | 2014-04-30 | |
| US61/986,479 | 2014-04-30 | ||
| US201462058973P | 2014-10-02 | 2014-10-02 | |
| US62/058,973 | 2014-10-02 | ||
| US201462088363P | 2014-12-05 | 2014-12-05 | |
| US62/088,363 | 2014-12-05 | ||
| US201462089730P | 2014-12-09 | 2014-12-09 | |
| US62/089,730 | 2014-12-09 | ||
| US201462090845P | 2014-12-11 | 2014-12-11 | |
| US62/090,845 | 2014-12-11 | ||
| CN201580029752.3A CN106535934A (zh) | 2014-04-10 | 2015-04-08 | 确定的组合基因修饰的t细胞产品 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580029752.3A Division CN106535934A (zh) | 2014-04-10 | 2015-04-08 | 确定的组合基因修饰的t细胞产品 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN112877291A true CN112877291A (zh) | 2021-06-01 |
Family
ID=54288361
Family Applications (7)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580027077.0A Active CN106573969B (zh) | 2014-04-10 | 2015-04-08 | 药物相关的转基因表达 |
| CN202110842538.7A Pending CN113528581A (zh) | 2014-04-10 | 2015-04-08 | 多核苷酸的诱导型表达的系统、宿主细胞、方法和组合物 |
| CN202110101875.0A Pending CN112877291A (zh) | 2014-04-10 | 2015-04-08 | 基因修饰的t细胞产品、其制备方法和用途 |
| CN201580030815.7A Active CN106661570B (zh) | 2014-04-10 | 2015-04-08 | 通过与氨甲蝶呤选择偶联的睡美人转座子制备工程化t细胞 |
| CN201580030814.2A Pending CN106536558A (zh) | 2014-04-10 | 2015-04-08 | 转基因遗传标签和使用的方法 |
| CN201580030056.4A Pending CN106574246A (zh) | 2014-04-10 | 2015-04-08 | 用于细胞免疫治疗的方法和组合物 |
| CN201580029752.3A Pending CN106535934A (zh) | 2014-04-10 | 2015-04-08 | 确定的组合基因修饰的t细胞产品 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580027077.0A Active CN106573969B (zh) | 2014-04-10 | 2015-04-08 | 药物相关的转基因表达 |
| CN202110842538.7A Pending CN113528581A (zh) | 2014-04-10 | 2015-04-08 | 多核苷酸的诱导型表达的系统、宿主细胞、方法和组合物 |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580030815.7A Active CN106661570B (zh) | 2014-04-10 | 2015-04-08 | 通过与氨甲蝶呤选择偶联的睡美人转座子制备工程化t细胞 |
| CN201580030814.2A Pending CN106536558A (zh) | 2014-04-10 | 2015-04-08 | 转基因遗传标签和使用的方法 |
| CN201580030056.4A Pending CN106574246A (zh) | 2014-04-10 | 2015-04-08 | 用于细胞免疫治疗的方法和组合物 |
| CN201580029752.3A Pending CN106535934A (zh) | 2014-04-10 | 2015-04-08 | 确定的组合基因修饰的t细胞产品 |
Country Status (19)
| Country | Link |
|---|---|
| US (12) | US10865242B2 (zh) |
| EP (8) | EP3129471A4 (zh) |
| JP (12) | JP2017515464A (zh) |
| KR (8) | KR102463529B1 (zh) |
| CN (7) | CN106573969B (zh) |
| AU (8) | AU2015243920B2 (zh) |
| BR (3) | BR112016023517A2 (zh) |
| CA (5) | CA2945320A1 (zh) |
| ES (2) | ES2867224T3 (zh) |
| IL (5) | IL248243B2 (zh) |
| MX (6) | MX2016013144A (zh) |
| MY (4) | MY184163A (zh) |
| NZ (3) | NZ725081A (zh) |
| PH (4) | PH12016502010B1 (zh) |
| RU (5) | RU2729112C2 (zh) |
| SA (1) | SA516380056B1 (zh) |
| SG (8) | SG10201808819XA (zh) |
| WO (5) | WO2015157384A1 (zh) |
| ZA (2) | ZA201607061B (zh) |
Families Citing this family (174)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100548667C (zh) * | 2003-01-20 | 2009-10-14 | 日本瑞翁株式会社 | 层合件及其制造方法 |
| WO2014100615A1 (en) | 2012-12-20 | 2014-06-26 | Purdue Research Foundation | Chimeric antigen receptor-expressing t cells as anti-cancer therapeutics |
| RU2717984C2 (ru) * | 2013-11-21 | 2020-03-27 | ЮСиЭл БИЗНЕС ЛТД | Клетка |
| SG10201808819XA (en) * | 2014-04-10 | 2018-11-29 | Seattle Childrens Hospital Dba Seattle Childrens Res Inst | Transgene genetic tags and methods of use |
| MA51794A (fr) | 2014-04-23 | 2020-05-06 | Juno Therapeutics Inc | Procédés d'isolation, de culture et de modification génétique de populations de cellules immunitaires pour thérapie adoptive |
| US10494422B2 (en) | 2014-04-29 | 2019-12-03 | Seattle Children's Hospital | CCR5 disruption of cells expressing anti-HIV chimeric antigen receptor (CAR) derived from broadly neutralizing antibodies |
| EP3209690B1 (en) | 2014-10-20 | 2021-05-05 | Juno Therapeutics, Inc. | Methods and compositions for dosing in adoptive cell therapy |
| KR101697473B1 (ko) | 2014-11-26 | 2017-01-18 | 주식회사 녹십자랩셀 | T 세포를 이용한 자연살해세포의 배양방법 |
| EP3227323B1 (en) | 2014-12-03 | 2020-08-05 | Juno Therapeutics, Inc. | Methods and compositions for adoptive cell therapy |
| SI3226897T1 (sl) | 2014-12-05 | 2021-08-31 | Memorial Sloan Kettering Cancer Center | Protitelesa, ki ciljajo na B-celični maturacijski antigen, in postopki uporabe |
| CA3008162A1 (en) | 2014-12-15 | 2016-06-23 | The Regents Of The University Of California | Bispecific or-gate chimeric antigen receptor responsive to cd19 and cd20 |
| MA41346A (fr) | 2015-01-12 | 2017-11-21 | Juno Therapeutics Inc | Eléments régulateurs post-transcriptionnels d'hépatite modifiée |
| US20160208018A1 (en) | 2015-01-16 | 2016-07-21 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for ror1 |
| EP3804741A3 (en) * | 2015-02-24 | 2021-07-14 | Board of Regents, The University of Texas System | Selection methods for genetically-modified t cells |
| EP3261651B1 (en) | 2015-02-27 | 2022-05-04 | iCell Gene Therapeutics LLC | Chimeric antigen receptors (cars) targeting hematologic malignancies, compositions and methods of use thereof |
| TWI833684B (zh) | 2015-06-25 | 2024-03-01 | 美商生物細胞基因治療有限公司 | 嵌合抗原受體(car)、組合物及其使用方法 |
| US11173179B2 (en) | 2015-06-25 | 2021-11-16 | Icell Gene Therapeutics Llc | Chimeric antigen receptor (CAR) targeting multiple antigens, compositions and methods of use thereof |
| WO2017222593A1 (en) * | 2016-06-24 | 2017-12-28 | Icell Gene Therapeutics Llc | Chimeric antigen receptors (cars), compositions and methods thereof |
| CA2994829A1 (en) | 2015-08-07 | 2017-02-16 | Seattle Children's Hospital (dba Seattle Children's Research Institute) | Bispecific car t-cells for solid tumor targeting |
| EP3352798A1 (en) * | 2015-09-22 | 2018-08-01 | Julius-Maximilians-Universität Würzburg | A method for high level and stable gene transfer in lymphocytes |
| US11466097B2 (en) * | 2015-10-06 | 2022-10-11 | City Of Hope | Chimeric antigen receptors targeted to PSCA |
| CA3001710A1 (en) * | 2015-10-23 | 2017-04-27 | The Regents Of The University Of Colorado, A Body Corporate | Prognosis and treatment of squamous cell carcinomas |
| EP3368574A1 (en) | 2015-10-30 | 2018-09-05 | NBE-Therapeutics AG | Anti-ror1 antibodies |
| WO2017079703A1 (en) * | 2015-11-05 | 2017-05-11 | Juno Therapeutics, Inc. | Vectors and genetically engineered immune cells expressing metabolic pathway modulators and uses in adoptive cell therapy |
| NZ742068A (en) * | 2015-12-14 | 2023-07-28 | Genomefrontier Therapeutics Inc | Transposon system, kit comprising the same, and uses thereof |
| WO2017112877A1 (en) * | 2015-12-22 | 2017-06-29 | Icell Gene Therapeutics, Llc | Chimeric antigen receptors and enhancement of anti-tumor activity |
| SG11201806120WA (en) | 2016-01-20 | 2018-08-30 | Scripps Research Inst | Ror1 antibody compositions and related methods |
| EP3202783A1 (en) * | 2016-02-02 | 2017-08-09 | Ecole Polytechnique Fédérale de Lausanne (EPFL) | Engineered antigen presenting cells and uses thereof |
| EP3430549A1 (en) | 2016-03-16 | 2019-01-23 | Juno Therapeutics, Inc. | Methods for adaptive design of a treatment regimen and related treatments |
| EP3439675A4 (en) | 2016-04-08 | 2019-12-18 | Purdue Research Foundation | METHOD AND COMPOSITIONS FOR CAR-T CELL THERAPY |
| WO2017190100A1 (en) * | 2016-04-28 | 2017-11-02 | The Trustees Of Dartmouth College | Nucleic acid constructs for co-expression of chimeric antigen receptor and transcription factor, cells containing and therapeutic use thereof |
| WO2017211900A1 (en) * | 2016-06-07 | 2017-12-14 | Max-Delbrück-Centrum für Molekulare Medizin | Chimeric antigen receptor and car-t cells that bind bcma |
| KR102652827B1 (ko) * | 2016-06-08 | 2024-04-01 | 프레시전 인코포레이티드 | Cd33 특이적 키메라 항원 수용체 |
| US20190119636A1 (en) * | 2017-10-23 | 2019-04-25 | Poseida Therapeutics, Inc. | Modified stem cell memory t cells, methods of making and methods of using same |
| AU2017343780B2 (en) | 2016-10-13 | 2023-08-31 | Juno Therapeutics, Inc. | Immunotherapy methods and compositions involving tryptophan metabolic pathway modulators |
| WO2018075941A1 (en) * | 2016-10-21 | 2018-04-26 | Washington University | Ap4 and methods of promoting t cell activation |
| WO2018102606A1 (en) * | 2016-11-30 | 2018-06-07 | Intrexon Corporation | Steroid administration and immunotherapy |
| MX2019006288A (es) | 2016-12-03 | 2020-10-01 | Juno Therapeutics Inc | Metodos y composiciones para el uso de celulas t terapeuticas en combinacion con inhibidores de quinasa. |
| CN110291200B (zh) * | 2016-12-12 | 2024-05-14 | 西雅图儿童医院(Dba西雅图儿童研究所) | 对哺乳动物细胞中转基因表达的药剂配体诱导具有增大的灵敏度的嵌合转录因子变异体 |
| CN106800601B (zh) * | 2017-01-19 | 2021-04-06 | 广东昭泰体内生物医药科技有限公司 | 一种嵌合抗原受体及其应用 |
| JP2020505034A (ja) | 2017-01-20 | 2020-02-20 | ジュノ セラピューティクス ゲーエムベーハー | 細胞表面コンジュゲートならびに関連する細胞組成物および方法 |
| ES2988795T3 (es) | 2017-02-27 | 2024-11-21 | Juno Therapeutics Inc | Composiciones, artículos de fabricación y métodos relacionados con la dosificación en terapia celular |
| EP4501352A2 (en) | 2017-02-28 | 2025-02-05 | Endocyte, Inc. | Compositions and methods for car t cell therapy |
| CA3056393A1 (en) | 2017-03-14 | 2018-09-20 | Juno Therapeutics, Inc. | Methods for cryogenic storage |
| CN106963945A (zh) * | 2017-03-27 | 2017-07-21 | 山东兴瑞生物科技有限公司 | 一种加强型人乳头瘤病毒hpv‑16/18的二价dc疫苗 |
| WO2018191490A1 (en) * | 2017-04-13 | 2018-10-18 | The Trustees Of The University Of Pennsylvania | Use of gene editing to generate universal tcr re-directed t cells for adoptive immunotherapy |
| JOP20180040A1 (ar) | 2017-04-20 | 2019-01-30 | Gilead Sciences Inc | مثبطات pd-1/pd-l1 |
| CN108728477B (zh) * | 2017-04-24 | 2022-02-22 | 华东理工大学 | 一种高效的转座突变系统及构建方法 |
| CN110913871B (zh) * | 2017-05-17 | 2024-02-23 | 西雅图儿童医院(Dba西雅图儿童研究所) | 生成哺乳动物t细胞活化诱导型合成启动子(syn+pro)以改善t细胞疗法 |
| US10780119B2 (en) | 2017-05-24 | 2020-09-22 | Effector Therapeutics Inc. | Methods and compositions for cellular immunotherapy |
| WO2018217064A2 (ko) * | 2017-05-26 | 2018-11-29 | 주식회사 녹십자랩셀 | 형질전환된 t세포를 이용한 자연살해세포의 배양방법 |
| BR112019025403A2 (pt) | 2017-06-02 | 2020-08-18 | Juno Therapeutics Inc | artigos de fabricação e métodos para tratamento usando terapia celular adotiva |
| CN107335054B (zh) * | 2017-06-30 | 2021-01-15 | 山东兴瑞生物科技有限公司 | 一种慢性乙肝治疗性dc疫苗 |
| RU2764031C2 (ru) | 2017-08-07 | 2022-01-12 | ЭнБиИ - ТЕРАПЬЮТИКС АГ | Конъюгаты антител с лекарственными средствами, характеризующиеся высокой in vivo переносимостью |
| CN111133104A (zh) * | 2017-08-11 | 2020-05-08 | 特里比奥迪卡有限责任公司 | 通过模板化组装生成结合到识别分子的表位的方法 |
| CN111094349B (zh) * | 2017-08-23 | 2025-02-07 | 马克思-德布鲁克-分子医学中心亥姆霍兹联合会 | 嵌合抗原受体和结合cxcr5的car-t细胞 |
| CA3077187A1 (en) * | 2017-09-26 | 2019-04-04 | Longwood University | Pd1-specific chimeric antigen receptor as an immunotherapy |
| CN107759700A (zh) * | 2017-10-18 | 2018-03-06 | 银丰生物工程集团有限公司 | 靶向cd19抗原的转基因t细胞及其制备方法与应用 |
| SG11202003543WA (en) | 2017-10-18 | 2020-05-28 | Intrexon Corp | Polypeptide compositions comprising spacers |
| US10329543B2 (en) | 2017-10-23 | 2019-06-25 | Poseida Therapeutics, Inc. | Modified stem cell memory T cells, methods of making and methods of using same |
| WO2019089982A1 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Method of assessing activity of recombinant antigen receptors |
| WO2019089858A2 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Methods of assessing or monitoring a response to a cell therapy |
| WO2019089969A2 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for b-cell maturation antigen |
| WO2019089855A1 (en) * | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Process for generating therapeutic compositions of engineered cells |
| KR20200099137A (ko) | 2017-11-06 | 2020-08-21 | 주노 쎄러퓨티크스 인코퍼레이티드 | 세포 요법 및 감마 세크레타제 억제제의 조합 |
| KR20200080270A (ko) | 2017-11-10 | 2020-07-06 | 더 유나이티드 스테이츠 오브 어메리카, 애즈 리프리젠티드 바이 더 세크러테리, 디파트먼트 오브 헬쓰 앤드 휴먼 서비씨즈 | 종양 항원을 타겟으로 하는 키메릭 항원 수용체 |
| EP3710020A4 (en) * | 2017-11-14 | 2021-06-23 | Memorial Sloan-Kettering Cancer Center | IL-36 SECRECTING IMMUNOREACTIVE CELLS AND RELATED USES |
| AU2018379094A1 (en) | 2017-12-08 | 2020-06-25 | Juno Therapeutics, Inc. | Phenotypic markers for cell therapy and related methods |
| WO2019123339A1 (en) | 2017-12-20 | 2019-06-27 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3' cyclic dinucleotides with phosphonate bond activating the sting adaptor protein |
| KR102492187B1 (ko) | 2017-12-20 | 2023-01-27 | 인스티튜트 오브 오가닉 케미스트리 앤드 바이오케미스트리 에이에스 씨알 브이.브이.아이. | Sting 어댑터 단백질을 활성화하는 포스포네이트 결합을 가진 3'3' 사이클릭 다이뉴클레오티드 |
| CN110028588A (zh) * | 2018-01-11 | 2019-07-19 | 上海细胞治疗研究院 | 抗原-Fc融合蛋白及其检测阳性CAR-T细胞的应用 |
| US10561686B2 (en) | 2018-01-12 | 2020-02-18 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| CA3089051A1 (en) | 2018-01-22 | 2019-07-25 | Endocyte, Inc. | Methods of use for car t cells |
| CN108103027B (zh) * | 2018-02-02 | 2021-12-24 | 中国医学科学院血液病医院(血液学研究所) | 高效率血细胞重编程同时实现基因编辑的方法 |
| CR20200347A (es) | 2018-02-13 | 2020-09-23 | Gilead Sciences Inc | Inhibidores pd-1/pd-l1 |
| CN108383914A (zh) * | 2018-02-23 | 2018-08-10 | 北京美康基免生物科技有限公司 | 一种基于cd19的嵌合抗原受体及其应用 |
| EP3765601A1 (en) * | 2018-03-16 | 2021-01-20 | Immusoft Corporation | B cells genetically engineered to secrete follistatin and methods of using the same to treat follistatin-related diseases, conditions, disorders and to enhance muscle growth and strength |
| TWI818007B (zh) | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| TWI833744B (zh) | 2018-04-06 | 2024-03-01 | 捷克科學院有機化學與生物化學研究所 | 3'3'-環二核苷酸 |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| US10869888B2 (en) | 2018-04-17 | 2020-12-22 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| JP7242702B2 (ja) | 2018-04-19 | 2023-03-20 | ギリアード サイエンシーズ, インコーポレイテッド | Pd-1/pd-l1阻害剤 |
| US20190359645A1 (en) | 2018-05-03 | 2019-11-28 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides comprising carbocyclic nucleotide |
| MX2020012137A (es) | 2018-05-14 | 2021-01-29 | Gilead Sciences Inc | Inhibidores de mcl-1. |
| AU2019271819A1 (en) * | 2018-05-15 | 2021-01-14 | Crage Medical Co., Limited | Genetically engineered cell and application thereof |
| MX2020013923A (es) | 2018-06-29 | 2021-03-29 | Apitbio Inc | Anticuerpos anti molécula de adhesión celular l1 (l1cam) y usos de estos. |
| PL3820572T3 (pl) | 2018-07-13 | 2024-02-26 | Gilead Sciences, Inc. | Inhibitory pd-1/pd-l1 |
| CN110845621A (zh) * | 2018-08-21 | 2020-02-28 | 上海恒润达生生物科技有限公司 | 一种靶向egfr和cd19双靶点的嵌合抗原受体方法 |
| US20220348682A1 (en) | 2018-08-30 | 2022-11-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Chimeric antigen receptor cells for treating solid tumor |
| JP7627080B2 (ja) * | 2018-08-31 | 2025-02-05 | シアトル チルドレンズ ホスピタル ディー/ビー/エイ シアトル チルドレンズ リサーチ インスティテュート | B7h3キメラ抗原受容体を含む方法および組成物 |
| EP3860717A1 (en) | 2018-10-03 | 2021-08-11 | Gilead Sciences, Inc. | Imidozopyrimidine derivatives |
| US11236085B2 (en) | 2018-10-24 | 2022-02-01 | Gilead Sciences, Inc. | PD-1/PD-L1 inhibitors |
| KR102658602B1 (ko) | 2018-10-31 | 2024-04-19 | 길리애드 사이언시즈, 인코포레이티드 | Hpk1 억제 활성을 갖는 치환된 6-아자벤즈이미다졸 화합물 |
| PL3873903T3 (pl) | 2018-10-31 | 2024-05-20 | Gilead Sciences, Inc. | Podstawione związki 6-azabenzimidazolu jako inhibitory hpk1 |
| WO2020088631A1 (en) | 2018-11-01 | 2020-05-07 | Gracell Biotechnologies (Shanghai) Co., Ltd. | Compositions and methods for t cell engineering |
| AU2019381827A1 (en) * | 2018-11-16 | 2021-06-10 | Juno Therapeutics, Inc. | Methods of dosing engineered T cells for the treatment of B cell malignancies |
| US10918667B2 (en) | 2018-11-20 | 2021-02-16 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expressing therapeutic agent and uses thereof |
| PT3886875T (pt) * | 2018-11-30 | 2024-06-27 | Juno Therapeutics Inc | Métodos para tratamento utilizando terapia celular adotiva |
| MX2021006402A (es) * | 2018-11-30 | 2021-08-11 | Celularity Inc | Celulas t-car alogenicas derivadas de placenta y usos de las mismas. |
| FI3886894T3 (fi) * | 2018-11-30 | 2024-05-24 | Juno Therapeutics Inc | Menetelmiä annosteluun ja b-solumaligniteettien hoitoon adoptiivisessa soluterapiassa |
| WO2020178768A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| CN113543851A (zh) | 2019-03-07 | 2021-10-22 | 捷克共和国有机化学与生物化学研究所 | 2’3’-环二核苷酸及其前药 |
| EP3935066A1 (en) | 2019-03-07 | 2022-01-12 | Institute of Organic Chemistry and Biochemistry ASCR, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| WO2020191172A1 (en) * | 2019-03-19 | 2020-09-24 | Immatics US, Inc. | Cd28 t cell cultures, compositions, and methods of using thereof |
| US20200308248A1 (en) * | 2019-03-26 | 2020-10-01 | ST Phi Therapeutics | Chimeric Natural Killer Cell Receptors and Method of Using Thereof |
| EP3953383A4 (en) * | 2019-04-08 | 2023-01-18 | Russell Biotech, Inc. | Improved manufacturing procedures for cell based therapies |
| CN109994156A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含报告模板信息管理模块的精准用药智能报告系统 |
| CN109994180A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含基因位点信息管理模块的精准用药智能报告系统 |
| CN110010222A (zh) * | 2019-04-16 | 2019-07-12 | 长沙三济生物科技有限公司 | 一种基于精准用药知识库的基因身份识别系统 |
| CN109994176A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含样本类型信息管理模块的精准用药智能报告系统 |
| CN110010200A (zh) * | 2019-04-16 | 2019-07-12 | 长沙三济生物科技有限公司 | 一种基因身份识别系统 |
| CN109872792A (zh) * | 2019-04-16 | 2019-06-11 | 北京中佰耀因医药科技有限公司 | 一种用于指导精准用药的基因检测智能报告系统 |
| CN109979545A (zh) * | 2019-04-16 | 2019-07-05 | 北京中佰耀因医药科技有限公司 | 一种含样本状态信息管理模块的精准用药智能报告系统 |
| TW202212339A (zh) | 2019-04-17 | 2022-04-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TW202210480A (zh) | 2019-04-17 | 2022-03-16 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TWI826690B (zh) | 2019-05-23 | 2023-12-21 | 美商基利科學股份有限公司 | 經取代之烯吲哚酮化物及其用途 |
| CN114269356A (zh) * | 2019-06-17 | 2022-04-01 | 伊诺奇安生物制药公司 | 诱导细胞免疫和体液免疫的基于同种异体t细胞的hiv疫苗 |
| CA3143108A1 (en) * | 2019-06-19 | 2020-12-24 | Julius-Maximilians-Universitat Wurzburg | Ultramodular igg3-based spacer domain and multi-function site for implementation in chimeric antigen receptor design |
| US20210009718A1 (en) | 2019-06-25 | 2021-01-14 | Gilead Sciences, Inc. | FLT3L-Fc FUSION PROTEINS AND METHODS OF USE |
| CN110608991B (zh) * | 2019-09-09 | 2022-04-29 | 浙江普罗亭健康科技有限公司 | 基于质谱流式检测技术的细胞周期检测试剂盒及检测方法 |
| PL4045083T3 (pl) | 2019-10-18 | 2024-05-13 | Forty Seven, Inc. | Terapie skojarzone do leczenia zespołów mielodysplastycznych i ostrej białaczki szpikowej |
| JP2022552748A (ja) | 2019-10-31 | 2022-12-19 | フォーティ セブン, インコーポレイテッド | 抗cd47及び抗cd20による血液癌の治療 |
| TWI778443B (zh) | 2019-11-12 | 2022-09-21 | 美商基利科學股份有限公司 | Mcl1抑制劑 |
| DK4081305T3 (da) | 2019-12-24 | 2024-10-14 | Carna Biosciences Inc | Diacylglycerinkinase modulerende forbindelser |
| CN117964757A (zh) | 2020-02-14 | 2024-05-03 | 吉利德科学公司 | 与ccr8结合的抗体和融合蛋白及其用途 |
| US12076343B2 (en) | 2020-02-19 | 2024-09-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Engineered safety in cell therapy |
| CN111533808B (zh) * | 2020-03-10 | 2021-02-09 | 南京医科大学 | 一种可自分泌TLR4 scFv且靶向cMet的嵌合抗原受体修饰的T细胞及其应用 |
| CA3159639A1 (en) | 2020-03-20 | 2021-09-23 | Lyell Immunopharma, Inc. | Novel recombinant cell surface markers |
| US20240043427A1 (en) | 2020-05-01 | 2024-02-08 | Gilead Sciences, Inc. | Cd73 compounds |
| US12043654B2 (en) | 2020-06-02 | 2024-07-23 | Innovative Cellular Therapeutics Holdings, Ltd. | Anti-GCC antibody and CAR thereof for treating digestive system cancer |
| CN115701999A (zh) * | 2020-07-09 | 2023-02-14 | 南京传奇生物科技有限公司 | 用白介素-36工程化γδT细胞用于免疫疗法 |
| US20230310606A1 (en) | 2020-07-17 | 2023-10-05 | Simurx, Inc. | Chimeric myd88 receptors for redirecting immunosuppressive signaling and related compositions and methods |
| CA3202218A1 (en) | 2020-12-18 | 2022-06-23 | Century Therapeutics, Inc. | Chimeric antigen receptor systems with adaptable receptor specificity |
| EP4277639A2 (en) * | 2021-01-15 | 2023-11-22 | Seattle Children's Hospital d/b/a Seattle Children's Research Institute | Hybrid and truncated immune cell proteins |
| AU2022227686A1 (en) | 2021-02-25 | 2023-07-27 | Lyell Immunopharma, Inc. | Ror1 targeting chimeric antigen receptor |
| TW202302145A (zh) | 2021-04-14 | 2023-01-16 | 美商基利科學股份有限公司 | CD47/SIRPα結合及NEDD8活化酶E1調節次單元之共抑制以用於治療癌症 |
| WO2022245671A1 (en) | 2021-05-18 | 2022-11-24 | Gilead Sciences, Inc. | Methods of using flt3l-fc fusion proteins |
| US11932634B2 (en) | 2021-06-23 | 2024-03-19 | Gilead Sciences, Inc. | Diacylglycerol kinase modulating compounds |
| KR20240005901A (ko) | 2021-06-23 | 2024-01-12 | 길리애드 사이언시즈, 인코포레이티드 | 디아실글리세롤 키나제 조절 화합물 |
| CN117355531A (zh) | 2021-06-23 | 2024-01-05 | 吉利德科学公司 | 二酰基甘油激酶调节化合物 |
| JP2024524210A (ja) | 2021-06-23 | 2024-07-05 | ギリアード サイエンシーズ, インコーポレイテッド | ジアシルグリセロールキナーゼ調節化合物 |
| JP2024532305A (ja) * | 2021-08-24 | 2024-09-05 | 賽斯尓▲チン▼生物技術(上海)有限公司 | 細胞を修飾する方法 |
| KR20240099259A (ko) | 2021-10-14 | 2024-06-28 | 아스널 바이오사이언시스, 인크. | 공동 발현된 shrna 및 논리 게이트 시스템을 갖는 면역 세포 |
| CA3234909A1 (en) | 2021-10-28 | 2023-05-04 | Gilead Sciences, Inc. | Pyridizin-3(2h)-one derivatives |
| EP4422756A1 (en) | 2021-10-29 | 2024-09-04 | Gilead Sciences, Inc. | Cd73 compounds |
| CN118488948A (zh) | 2021-12-22 | 2024-08-13 | 吉利德科学公司 | Ikaros锌指家族降解剂及其用途 |
| EP4452414A2 (en) | 2021-12-22 | 2024-10-30 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| TW202340168A (zh) | 2022-01-28 | 2023-10-16 | 美商基利科學股份有限公司 | Parp7抑制劑 |
| WO2023173137A1 (en) * | 2022-03-11 | 2023-09-14 | Yale University | Compositions and methods for efficient and stable genetic modification of eukaryotic cells |
| IL315083A (en) | 2022-03-17 | 2024-10-01 | Gilead Sciences Inc | The IKAROS family of zinc fingers degrades and uses them |
| CN119031937A (zh) | 2022-03-24 | 2024-11-26 | 吉利德科学公司 | 用于治疗表达Trop-2的癌症的联合疗法 |
| EP4504243A1 (en) * | 2022-04-01 | 2025-02-12 | Miltenyi Biotec B.V. & Co. KG | A system for drug-inducible expression of a polynucleotide |
| TW202345901A (zh) | 2022-04-05 | 2023-12-01 | 美商基利科學股份有限公司 | 用於治療結腸直腸癌之組合療法 |
| KR20250004824A (ko) | 2022-04-21 | 2025-01-08 | 길리애드 사이언시즈, 인코포레이티드 | Kras g12d 조절 화합물 |
| WO2023212655A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Il-12 polypeptides, il-15 polypeptides, il-18 polypeptides, cd8 polypeptides, compositions, and methods of using thereof |
| WO2023212697A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Membrane-bound il-15, cd8 polypeptides, cells, compositions, and methods of using thereof |
| WO2023212691A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | DOMINANT NEGATIVE TGFβ RECEPTOR POLYPEPTIDES, CD8 POLYPEPTIDES, CELLS, COMPOSITIONS, AND METHODS OF USING THEREOF |
| CN114990069B (zh) * | 2022-05-17 | 2023-09-22 | 郑州大学第一附属医院 | 一种过表达slc43a2的嵌合抗原受体t细胞的制备方法和应用 |
| WO2023227900A1 (en) * | 2022-05-27 | 2023-11-30 | Autolus Limited | Method |
| TW202413647A (zh) * | 2022-06-10 | 2024-04-01 | 俄羅斯聯邦商拜奧卡德聯合股份公司 | 具有啟動子活性之核酸及其用途 |
| WO2024006702A1 (en) * | 2022-06-27 | 2024-01-04 | Foundation Medicine, Inc. | Methods and systems for predicting genotypic calls from whole-slide images |
| WO2024006929A1 (en) | 2022-07-01 | 2024-01-04 | Gilead Sciences, Inc. | Cd73 compounds |
| WO2024064668A1 (en) | 2022-09-21 | 2024-03-28 | Gilead Sciences, Inc. | FOCAL IONIZING RADIATION AND CD47/SIRPα DISRUPTION ANTICANCER COMBINATION THERAPY |
| CN116179495A (zh) * | 2022-11-28 | 2023-05-30 | 上海恩凯细胞技术有限公司 | 转基因免疫细胞及其应用 |
| WO2024129984A1 (en) * | 2022-12-15 | 2024-06-20 | The Board Of Trustees Of The Leland Stanford Junior University | Homology-independent targeted dna insertion in human t cells |
| WO2024137652A2 (en) * | 2022-12-20 | 2024-06-27 | Abata Therapeutics, Inc. | Cell therapies for type 1 diabetes |
| US20240254118A1 (en) | 2022-12-22 | 2024-08-01 | Gilead Sciences, Inc. | Prmt5 inhibitors and uses thereof |
| WO2024153036A1 (zh) * | 2023-01-19 | 2024-07-25 | 武汉昭智生物技术有限公司 | 一种car分子、包含其的细胞或外泌体及它们的应用 |
| WO2024215754A1 (en) | 2023-04-11 | 2024-10-17 | Gilead Sciences, Inc. | Kras modulating compounds |
| WO2024220917A1 (en) | 2023-04-21 | 2024-10-24 | Gilead Sciences, Inc. | Prmt5 inhibitors and uses thereof |
| WO2025006720A1 (en) | 2023-06-30 | 2025-01-02 | Gilead Sciences, Inc. | Kras modulating compounds |
| CN116844685B (zh) * | 2023-07-03 | 2024-04-12 | 广州默锐医药科技有限公司 | 一种免疫治疗效果评估方法、装置、电子设备及存储介质 |
| WO2025024663A1 (en) | 2023-07-26 | 2025-01-30 | Gilead Sciences, Inc. | Parp7 inhibitors |
| WO2025024811A1 (en) | 2023-07-26 | 2025-01-30 | Gilead Sciences, Inc. | Parp7 inhibitors |
Family Cites Families (113)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK0557459T3 (da) | 1990-11-13 | 1997-12-15 | Immunex Corp | Bifunktionelle, selekterbare fusionsgener |
| US20020111474A1 (en) * | 1990-12-14 | 2002-08-15 | Capon Daniel J. | Chimeric chains for receptor-associated signal transduction pathways |
| EP0650367A4 (en) | 1992-06-01 | 1998-04-15 | New England Medical Center Inc | BLOCKING OF INTERCELLULAR INTERACTIONS WITH CD43 CHEMICAL MOLECULES. |
| US5827642A (en) | 1994-08-31 | 1998-10-27 | Fred Hutchinson Cancer Research Center | Rapid expansion method ("REM") for in vitro propagation of T lymphocytes |
| US5783186A (en) | 1995-12-05 | 1998-07-21 | Amgen Inc. | Antibody-induced apoptosis |
| US6133027A (en) * | 1996-08-07 | 2000-10-17 | City Of Hope | Inducible expression system |
| US6660257B1 (en) * | 1996-10-25 | 2003-12-09 | Pharmacia Corporation | Circular permuteins of flt3 ligand |
| AU2472400A (en) | 1998-10-20 | 2000-05-08 | City Of Hope | CD20-specific redirected T cells and their use in cellular immunotherapy of CD20+ malignancies |
| US6912492B1 (en) * | 1999-05-25 | 2005-06-28 | University Of Medicine & Dentistry Of New Jersey | Methods for diagnosing, preventing, and treating developmental disorders due to a combination of genetic and environmental factors |
| JP4045713B2 (ja) | 2000-01-31 | 2008-02-13 | 松下電器産業株式会社 | 自動機用溶接機 |
| GB0015119D0 (en) * | 2000-06-20 | 2000-08-09 | Angeletti P Ist Richerche Bio | Methods and means for regulation of gene expression |
| JP4762478B2 (ja) | 2000-07-03 | 2011-08-31 | キャタレント ファーマ ソリューションズ リミテッド ライアビリティ カンパニー | 発現ベクター |
| GB0025307D0 (en) * | 2000-10-16 | 2000-11-29 | Celltech Chiroscience Ltd | Biological products |
| AU2001297703B2 (en) | 2000-11-07 | 2006-10-19 | City Of Hope | CD19-specific redirected immune cells |
| AU2002248571B2 (en) * | 2001-03-07 | 2007-01-18 | Merck Patent Gmbh | Expression technology for proteins containing a hybrid isotype antibody moiety |
| US7070995B2 (en) * | 2001-04-11 | 2006-07-04 | City Of Hope | CE7-specific redirected immune cells |
| US20090257994A1 (en) | 2001-04-30 | 2009-10-15 | City Of Hope | Chimeric immunoreceptor useful in treating human cancers |
| WO2002097099A1 (en) * | 2001-05-29 | 2002-12-05 | Valentis, Inc. | Regulated expression of ghrh |
| JP2004537293A (ja) | 2001-05-31 | 2004-12-16 | ノバルティス アクチエンゲゼルシャフト | 新規なエストロゲン受容体リガンド結合ドメイン変異体及び新規なリガンド及び医薬組成物 |
| WO2003025228A1 (en) | 2001-09-18 | 2003-03-27 | Proteologics, Inc. | Methods and compositions for treating hcap associated diseases |
| US20030148982A1 (en) * | 2001-11-13 | 2003-08-07 | Brenner Malcolm K. | Bi-spcific chimeric T cells |
| WO2003087338A2 (en) | 2002-04-11 | 2003-10-23 | Amgen, Inc. | Her-2 receptor tyrosine kinase molecules and uses thereof |
| WO2004029284A2 (en) | 2002-09-30 | 2004-04-08 | Protein Design Labs, Inc. | Efficient generation of stable expression cell lines through the use of scorable homeostatic reporter genes |
| CA2516455C (en) * | 2003-02-20 | 2012-05-01 | Seattle Genetics, Inc. | Anti-cd70 antibody-drug conjugates and their use for the treatment of cancer and immune disorders |
| US20050129671A1 (en) | 2003-03-11 | 2005-06-16 | City Of Hope | Mammalian antigen-presenting T cells and bi-specific T cells |
| WO2004092338A2 (en) | 2003-04-11 | 2004-10-28 | Diadexus, Inc. | Compositions, splice variants and methods relating to cancer specific genes and proteins |
| ZA200509363B (en) * | 2003-04-18 | 2007-04-25 | Norwood Immunology Ltd | Tolerance to graft prior to thymic regeneration |
| WO2005017102A2 (en) | 2003-05-30 | 2005-02-24 | Diadexus, Inc. | Compositions, splice variants and methods relating to ovarian specific nucleic acids and proteins |
| CN101173282B (zh) | 2003-07-21 | 2011-04-06 | P.安杰莱蒂分子生物学研究所 | 编码人表皮生长因子2/neu抗原的合成基因及其用途 |
| EP1680447A2 (en) * | 2003-10-24 | 2006-07-19 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti S.P.A. | Orthogonal gene switches |
| US20130266551A1 (en) | 2003-11-05 | 2013-10-10 | St. Jude Children's Research Hospital, Inc. | Chimeric receptors with 4-1bb stimulatory signaling domain |
| WO2005062881A2 (en) | 2003-12-24 | 2005-07-14 | Transgenrx, Inc. | Gene therapy using transposon-based vectors |
| US7935510B2 (en) | 2004-04-30 | 2011-05-03 | Intrexon Corporation | Mutant receptors and their use in a nuclear receptor-based inducible gene expression system |
| US20090098142A1 (en) | 2004-06-09 | 2009-04-16 | Kasaian Marion T | Methods and compositions for treating and monitoring treatment of IL-13-associated disorders |
| US7910101B2 (en) * | 2004-10-25 | 2011-03-22 | Centocor, Inc. | Melanocortin receptor binding mimetibodies, compositions, methods and uses |
| DE202005002921U1 (de) | 2005-02-23 | 2005-04-21 | Magcode Ag | Verbindungssystem, insbesondere elektrisches Verbindungssystem |
| EP1890708A4 (en) * | 2005-06-01 | 2009-07-15 | Biotec Inst For Internat | GLUCOSE INDUCIBLE INSULIN EXPRESSION AND METHODS OF TREATING DIABETES |
| JP2009521474A (ja) | 2005-12-21 | 2009-06-04 | メディミューン,エルエルシー | EphA2BiTE分子およびその使用 |
| AU2007254508B2 (en) | 2006-05-22 | 2012-03-22 | Hiprocell, Llc | Protein production using eukaryotic cell lines |
| US8148129B2 (en) | 2006-06-30 | 2012-04-03 | The Regents Of The University Of California | Generation of potent dominant negative transcriptional inhibitors |
| WO2008012237A1 (en) * | 2006-07-24 | 2008-01-31 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti Spa | Multi-antigen construct and uses thereof |
| US7709253B2 (en) * | 2006-08-04 | 2010-05-04 | The Board Of Trustees Of The Leland Stanford Junior University | Ligand-regulable transactivation systems, methods of use thereof, methods of detecting estrogen receptor ligands, and methods of differentiating estrogen receptor ligand agonists and antagonists |
| US20100183516A1 (en) | 2007-07-25 | 2010-07-22 | Markus Ribbert | Self coupling recombinant antibody fusion proteins |
| WO2009091826A2 (en) | 2008-01-14 | 2009-07-23 | The Board Of Regents Of The University Of Texas System | Compositions and methods related to a human cd19-specific chimeric antigen receptor (h-car) |
| DK2279253T3 (en) | 2008-04-09 | 2017-02-13 | Maxcyte Inc | Construction and application of therapeutic compositions of freshly isolated cells |
| DK3006459T3 (da) | 2008-08-26 | 2021-12-06 | Hope City | Fremgangsmåde og sammensætninger til forbedring af t-cellers antitumoreffektorfunktion |
| MY156333A (en) | 2008-09-26 | 2016-02-15 | Tocagen Inc | Gene therapy vectors and cytosine deaminases |
| US8829173B2 (en) * | 2008-09-26 | 2014-09-09 | Tocagen Inc. | Recombinant vectors |
| US8329882B2 (en) | 2009-02-18 | 2012-12-11 | California Institute Of Technology | Genetic control of mammalian cells with synthetic RNA regulatory systems |
| EP2438443A4 (en) | 2009-06-02 | 2012-07-25 | Targeted Molecular Diagnostics Llc | METHOD FOR DETECTING AND QUANTIFYING THE P95 COMPONENT OF HER2 / NEU (ERBB2) |
| US9873035B2 (en) * | 2009-07-09 | 2018-01-23 | Cfph, Llc | Amusement device for a game of chance involving one or more rolling indicators on a rotating element with position indicators |
| US8075895B2 (en) | 2009-09-22 | 2011-12-13 | Janssen Pharmaceutica N.V. | Identification of antigenic peptides from multiple myeloma cells |
| CA2776143A1 (en) | 2009-10-01 | 2011-04-07 | The United States Of America, As Represented By The Secretary, Departmen T Of Health And Human Services | Anti-vascular endothelial growth factor receptor-2 chimeric antigen receptors and use of same for the treatment of cancer |
| EP4049674A1 (en) * | 2009-11-03 | 2022-08-31 | City of Hope | Truncated epidermal growth factor receptor (egfrt) for transduced t cell selection |
| JP5285678B2 (ja) | 2010-06-18 | 2013-09-11 | 株式会社エヌ・ティ・ティ・ドコモ | 移動通信方法及びコアネットワーク装置 |
| DK3012268T3 (en) | 2010-09-08 | 2018-02-19 | Chemotherapeutisches Forschungsinstitut Georg Speyer Haus | Chimeric antigen receptors with an optimized hinge region |
| PH12013501201A1 (en) | 2010-12-09 | 2013-07-29 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| SG192010A1 (en) | 2011-01-18 | 2013-08-30 | Univ Pennsylvania | Compositions and methods for treating cancer |
| EP2689010B1 (en) * | 2011-03-23 | 2020-11-18 | Fred Hutchinson Cancer Research Center | Method and compositions for cellular immunotherapy |
| KR102028340B1 (ko) * | 2011-04-13 | 2019-10-04 | 이뮤니쿰 에이비 | 항원-특이적 t 세포의 증식 방법 |
| US20130071414A1 (en) * | 2011-04-27 | 2013-03-21 | Gianpietro Dotti | Engineered cd19-specific t lymphocytes that coexpress il-15 and an inducible caspase-9 based suicide gene for the treatment of b-cell malignancies |
| ES2773891T3 (es) | 2011-06-01 | 2020-07-15 | Prec Biosciences Inc | Procedimientos para la producción de líneas celulares de mamífero modificadas con transgenes amplificados |
| SG195077A1 (en) * | 2011-06-22 | 2013-12-30 | Hoffmann La Roche | Removal of target cells by circulating virus-specific cytotoxic t-cells using mhc class i comprising complexes |
| JP6267644B2 (ja) | 2011-10-20 | 2018-01-24 | アメリカ合衆国 | 抗cd22キメラ抗原受容体 |
| DE102011118018B4 (de) | 2011-10-25 | 2017-10-26 | Plasmidfactory Gmbh & Co. Kg | Minicircles mit Transpositionskassetten und ihre Verwendung zur Transformation von Zellen |
| US10391126B2 (en) | 2011-11-18 | 2019-08-27 | Board Of Regents, The University Of Texas System | CAR+ T cells genetically modified to eliminate expression of T-cell receptor and/or HLA |
| AU2013221672B2 (en) * | 2012-02-13 | 2017-11-09 | Seattle Children's Hospital D/B/A Seattle Children's Research Institute | Bispecific chimeric antigen receptors and therapeutic uses thereof |
| ITRM20120058A1 (it) | 2012-02-20 | 2013-08-21 | Pisanelli Giovanni Codacci | Famiglia di molecole a base di zuccheri ad uso terapeutico e relativo procedimento di produzione |
| CN104159917A (zh) * | 2012-02-22 | 2014-11-19 | 宾夕法尼亚大学董事会 | 使用icos基cars增强抗肿瘤活性和car持久性 |
| KR102086874B1 (ko) * | 2012-04-11 | 2020-03-10 | 더 유나이티드 스테이츠 오브 어메리카, 애즈 리프리젠티드 바이 더 세크러테리, 디파트먼트 오브 헬쓰 앤드 휴먼 서비씨즈 | B-세포 성숙 항원을 표적화하는 키메라 항원 수용체 |
| US20130280220A1 (en) | 2012-04-20 | 2013-10-24 | Nabil Ahmed | Chimeric antigen receptor for bispecific activation and targeting of t lymphocytes |
| WO2013177533A1 (en) | 2012-05-25 | 2013-11-28 | California Institute Of Technology | Expression of secreted and cell-surface polypeptides |
| KR20150027756A (ko) | 2012-05-30 | 2015-03-12 | 베일러 칼리지 오브 메디신 | Dna 수복, 변경 및 대체를 위한 도구로서의 초나선 미니벡터 |
| EP2669378A1 (en) | 2012-05-31 | 2013-12-04 | Helmut Hanenberg | Cytochrome P450 suicide gene system |
| CN104350709B (zh) | 2012-06-01 | 2018-03-13 | 日本电气株式会社 | 交换机系统、线路卡、交换卡、fdb学习方法及fdb学习调停方法 |
| RU2700765C2 (ru) | 2012-08-20 | 2019-09-19 | Фред Хатчинсон Кансэр Рисёч Сентер | Способ и композиции для клеточной иммунотерапии |
| WO2014039044A1 (en) * | 2012-09-06 | 2014-03-13 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Methods of producing t memory stem cell populations |
| MX370148B (es) | 2012-10-02 | 2019-12-03 | Memorial Sloan Kettering Cancer Center | Composiciones y su uso para inmunoterapia. |
| US10117896B2 (en) | 2012-10-05 | 2018-11-06 | The Trustees Of The University Of Pennsylvania | Use of a trans-signaling approach in chimeric antigen receptors |
| AU2013329186B2 (en) | 2012-10-10 | 2019-02-14 | Sangamo Therapeutics, Inc. | T cell modifying compounds and uses thereof |
| US20150329640A1 (en) * | 2012-12-20 | 2015-11-19 | Bluebird Bio, Inc. | Chimeric antigen receptors and immune cells targeting b cell malignancies |
| DE112012007250B4 (de) | 2012-12-20 | 2024-10-24 | Mitsubishi Electric Corp. | Fahrzeuginterne Vorrichtung und Programm |
| EP2964753B1 (en) | 2013-03-07 | 2018-04-25 | Baylor College of Medicine | Targeting cd138 in cancer |
| EP2777711A1 (en) | 2013-03-11 | 2014-09-17 | Icon Genetics GmbH | Her2/Neu cancer vaccine |
| TWI654206B (zh) | 2013-03-16 | 2019-03-21 | 諾華公司 | 使用人類化抗-cd19嵌合抗原受體治療癌症 |
| EP3783098A1 (en) * | 2013-05-14 | 2021-02-24 | Board Of Regents, The University Of Texas System | Human application of engineered chimeric antigen receptor (car) t-cells |
| CA2913052A1 (en) | 2013-05-24 | 2014-11-27 | Board Of Regents, The University Of Texas System | Chimeric antigen receptor-targeting monoclonal antibodies |
| US9108442B2 (en) | 2013-08-20 | 2015-08-18 | Ricoh Company, Ltd. | Image forming apparatus |
| US20160250258A1 (en) | 2013-10-31 | 2016-09-01 | Fred Hutchinson Cancer Research Center | Modified hematopoietic stem/progenitor and non-t effector cells, and uses thereof |
| RU2717984C2 (ru) | 2013-11-21 | 2020-03-27 | ЮСиЭл БИЗНЕС ЛТД | Клетка |
| AU2014368383B2 (en) | 2013-12-20 | 2020-01-16 | Cellectis | Method of engineering multi-input signal sensitive T cell for immunotherapy |
| CN107074957B (zh) | 2014-01-13 | 2021-05-07 | 希望之城公司 | 在Fc间隔物区中具有突变的嵌合抗原受体(CAR)及其使用方法 |
| EP3656864A1 (en) | 2014-02-14 | 2020-05-27 | Board of Regents, The University of Texas System | Chimeric antigen receptors and methods of making |
| CN106163547A (zh) | 2014-03-15 | 2016-11-23 | 诺华股份有限公司 | 使用嵌合抗原受体治疗癌症 |
| SG10201808819XA (en) | 2014-04-10 | 2018-11-29 | Seattle Childrens Hospital Dba Seattle Childrens Res Inst | Transgene genetic tags and methods of use |
| KR102110187B1 (ko) | 2014-05-14 | 2020-05-14 | 카르스젠 테라퓨틱스 리미티드 | 키메라 항원 수용체 단백질을 코딩하는 핵산 및 키메라 항원 수용체 단백질을 발현하는 t 림프구 |
| KR102668549B1 (ko) | 2014-06-02 | 2024-05-22 | 더 유나이티드 스테이츠 오브 어메리카, 애즈 리프리젠티드 바이 더 세크러테리, 디파트먼트 오브 헬쓰 앤드 휴먼 서비씨즈 | Cd19를 표적화하는 키메라 항원 수용체 |
| TWI751102B (zh) | 2014-08-28 | 2022-01-01 | 美商奇諾治療有限公司 | 對cd19具專一性之抗體及嵌合抗原受體 |
| AU2015339402B2 (en) | 2014-10-27 | 2021-08-26 | Fred Hutchinson Cancer Center | Compositions and methods for boosting the efficacy of adoptive cellular immunotherapy |
| GB201503742D0 (en) | 2015-03-05 | 2015-04-22 | Ucl Business Plc | Chimeric antigen receptor |
| WO2016187349A1 (en) | 2015-05-18 | 2016-11-24 | Tcr2, Inc. | Compositions and methods for tcr reprogramming using fusion proteins |
| CA2987290C (en) | 2015-06-10 | 2023-10-03 | Nantkwest, Inc. | Modified nk-92 cells for treating cancer |
| ES2854731T3 (es) | 2015-06-12 | 2021-09-22 | Lentigen Tech Inc | Procedimiento para tratar cáncer con células T modificadas genéticamente |
| CA2994829A1 (en) | 2015-08-07 | 2017-02-16 | Seattle Children's Hospital (dba Seattle Children's Research Institute) | Bispecific car t-cells for solid tumor targeting |
| DK3411393T3 (da) | 2016-02-05 | 2021-06-28 | Hope City | Administration af manipulerede t-celler til behandling af cancere i centralnervesystemet |
| WO2017172952A1 (en) | 2016-04-01 | 2017-10-05 | Promab Biotechnologies, Inc. | Flag tagged cd19-car-t cells |
| TWI828334B (zh) | 2016-09-28 | 2024-01-01 | 美商凱特製藥公司 | 抗原結合分子類和使用彼等之方法 |
| US11286291B2 (en) | 2016-10-04 | 2022-03-29 | Precision Biosciences, Inc. | Co-stimulatory domains for use in genetically-modified cells |
| CN110291200B (zh) | 2016-12-12 | 2024-05-14 | 西雅图儿童医院(Dba西雅图儿童研究所) | 对哺乳动物细胞中转基因表达的药剂配体诱导具有增大的灵敏度的嵌合转录因子变异体 |
| JOP20180042A1 (ar) | 2017-04-24 | 2019-01-30 | Kite Pharma Inc | نطاقات ربط مولد ضد متوافقة مع البشر وطرق الاستخدام |
| US10869888B2 (en) | 2018-04-17 | 2020-12-22 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| US10714296B2 (en) | 2018-12-12 | 2020-07-14 | Axcelis Technologies, Inc. | Ion source with tailored extraction shape |
| US11104732B2 (en) | 2019-04-24 | 2021-08-31 | Innovative Cellular Therapeutics Holdings, Ltd. | Reducing immune inhibition induced by SIGLEC-15 |
-
2015
- 2015-04-08 SG SG10201808819XA patent/SG10201808819XA/en unknown
- 2015-04-08 ES ES15776745T patent/ES2867224T3/es active Active
- 2015-04-08 IL IL248243A patent/IL248243B2/en unknown
- 2015-04-08 JP JP2016561839A patent/JP2017515464A/ja active Pending
- 2015-04-08 MX MX2016013144A patent/MX2016013144A/es unknown
- 2015-04-08 KR KR1020167031064A patent/KR102463529B1/ko active IP Right Review Request
- 2015-04-08 AU AU2015243920A patent/AU2015243920B2/en active Active
- 2015-04-08 IL IL248238A patent/IL248238B2/en unknown
- 2015-04-08 SG SG11201608395PA patent/SG11201608395PA/en unknown
- 2015-04-08 AU AU2015243849A patent/AU2015243849B2/en active Active
- 2015-04-08 JP JP2016561722A patent/JP6772068B2/ja active Active
- 2015-04-08 WO PCT/US2015/024866 patent/WO2015157384A1/en active Application Filing
- 2015-04-08 RU RU2016143384A patent/RU2729112C2/ru active
- 2015-04-08 MY MYPI2016703721A patent/MY184163A/en unknown
- 2015-04-08 RU RU2016143388A patent/RU2751920C2/ru active
- 2015-04-08 MX MX2016013159A patent/MX2016013159A/es unknown
- 2015-04-08 EP EP15777020.7A patent/EP3129471A4/en active Pending
- 2015-04-08 BR BR112016023517A patent/BR112016023517A2/pt not_active Application Discontinuation
- 2015-04-08 SG SG10201808811QA patent/SG10201808811QA/en unknown
- 2015-04-08 CN CN201580027077.0A patent/CN106573969B/zh active Active
- 2015-04-08 KR KR1020227038237A patent/KR102618955B1/ko active IP Right Review Request
- 2015-04-08 MY MYPI2016703719A patent/MY185678A/en unknown
- 2015-04-08 AU AU2015243927A patent/AU2015243927B2/en active Active
- 2015-04-08 PH PH1/2016/502010A patent/PH12016502010B1/en unknown
- 2015-04-08 WO PCT/US2015/024947 patent/WO2015157432A1/en active Application Filing
- 2015-04-08 EP EP15776745.0A patent/EP3129405B1/en active Active
- 2015-04-08 EP EP21175647.3A patent/EP3943507A1/en active Pending
- 2015-04-08 JP JP2016561635A patent/JP6765967B2/ja active Active
- 2015-04-08 SG SG11201608392WA patent/SG11201608392WA/en unknown
- 2015-04-08 PH PH1/2016/502009A patent/PH12016502009B1/en unknown
- 2015-04-08 SG SG10201808833XA patent/SG10201808833XA/en unknown
- 2015-04-08 WO PCT/US2015/024882 patent/WO2015157391A1/en active Application Filing
- 2015-04-08 CN CN202110842538.7A patent/CN113528581A/zh active Pending
- 2015-04-08 CA CA2945320A patent/CA2945320A1/en active Pending
- 2015-04-08 NZ NZ725081A patent/NZ725081A/en not_active IP Right Cessation
- 2015-04-08 CA CA2945303A patent/CA2945303C/en active Active
- 2015-04-08 EP EP15776211.3A patent/EP3129053A4/en not_active Withdrawn
- 2015-04-08 KR KR1020167031070A patent/KR102509481B1/ko active IP Right Grant
- 2015-04-08 US US15/302,403 patent/US10865242B2/en active Active
- 2015-04-08 US US15/302,415 patent/US10266592B2/en active Active
- 2015-04-08 KR KR1020167031069A patent/KR20160144431A/ko active IP Right Grant
- 2015-04-08 RU RU2016143389A patent/RU2016143389A/ru not_active Application Discontinuation
- 2015-04-08 NZ NZ725079A patent/NZ725079A/en unknown
- 2015-04-08 EP EP15776501.7A patent/EP3129480A4/en active Pending
- 2015-04-08 SG SG11201608393TA patent/SG11201608393TA/en unknown
- 2015-04-08 NZ NZ73944815A patent/NZ739448A/en unknown
- 2015-04-08 US US15/302,420 patent/US10611837B2/en active Active
- 2015-04-08 KR KR1020167031068A patent/KR102387243B1/ko active IP Right Review Request
- 2015-04-08 KR KR1020237007831A patent/KR102730216B1/ko active IP Right Grant
- 2015-04-08 IL IL297591A patent/IL297591B1/en unknown
- 2015-04-08 CN CN202110101875.0A patent/CN112877291A/zh active Pending
- 2015-04-08 EP EP22151326.0A patent/EP4056201A1/en active Pending
- 2015-04-08 KR KR1020167031067A patent/KR102508166B1/ko active IP Right Grant
- 2015-04-08 CN CN201580030815.7A patent/CN106661570B/zh active Active
- 2015-04-08 AU AU2015243922A patent/AU2015243922B2/en active Active
- 2015-04-08 EP EP21180797.9A patent/EP3954708A1/en active Pending
- 2015-04-08 KR KR1020227011931A patent/KR102600544B1/ko active IP Right Grant
- 2015-04-08 CA CA2945305A patent/CA2945305C/en active Active
- 2015-04-08 RU RU2016143385A patent/RU2751921C2/ru active
- 2015-04-08 CA CA2945302A patent/CA2945302A1/en active Pending
- 2015-04-08 CA CA2945308A patent/CA2945308C/en active Active
- 2015-04-08 WO PCT/US2015/024895 patent/WO2015157399A1/en active Application Filing
- 2015-04-08 RU RU2016143381A patent/RU2752275C2/ru active
- 2015-04-08 WO PCT/US2015/024868 patent/WO2015157386A1/en active Application Filing
- 2015-04-08 SG SG11201608396YA patent/SG11201608396YA/en unknown
- 2015-04-08 ES ES15777065T patent/ES2880932T3/es active Active
- 2015-04-08 EP EP15777065.2A patent/EP3129399B1/en active Active
- 2015-04-08 BR BR112016023500-2A patent/BR112016023500B1/pt active IP Right Grant
- 2015-04-08 MX MX2016013149A patent/MX2016013149A/es unknown
- 2015-04-08 BR BR112016023523A patent/BR112016023523A2/pt active Search and Examination
- 2015-04-08 SG SG10201808825XA patent/SG10201808825XA/en unknown
- 2015-04-08 MY MYPI2016703722A patent/MY192522A/en unknown
- 2015-04-08 MX MX2016013160A patent/MX2016013160A/es unknown
- 2015-04-08 CN CN201580030814.2A patent/CN106536558A/zh active Pending
- 2015-04-08 CN CN201580030056.4A patent/CN106574246A/zh active Pending
- 2015-04-08 JP JP2017504604A patent/JP6788573B6/ja active Active
- 2015-04-08 CN CN201580029752.3A patent/CN106535934A/zh active Pending
- 2015-04-08 MX MX2016013158A patent/MX2016013158A/es unknown
- 2015-04-08 JP JP2016561659A patent/JP6765968B2/ja active Active
- 2015-04-08 AU AU2015243882A patent/AU2015243882C1/en active Active
- 2015-04-08 MY MYPI2016703720A patent/MY186846A/en unknown
- 2015-04-08 US US15/302,449 patent/US20170029774A1/en not_active Abandoned
- 2015-04-08 PH PH1/2016/502011A patent/PH12016502011B1/en unknown
- 2015-04-08 US US15/302,426 patent/US20170015746A1/en not_active Abandoned
-
2016
- 2016-10-06 MX MX2022010807A patent/MX2022010807A/es unknown
- 2016-10-06 IL IL248229A patent/IL248229B2/en unknown
- 2016-10-06 IL IL248235A patent/IL248235B/en active IP Right Grant
- 2016-10-10 SA SA516380056A patent/SA516380056B1/ar unknown
- 2016-10-10 PH PH12016502012A patent/PH12016502012A1/en unknown
- 2016-10-13 ZA ZA2016/07061A patent/ZA201607061B/en unknown
- 2016-10-13 ZA ZA2016/07060A patent/ZA201607060B/en unknown
-
2019
- 2019-02-27 US US16/287,074 patent/US11155616B2/en active Active
-
2020
- 2020-02-19 US US16/794,673 patent/US11414486B2/en active Active
- 2020-06-18 JP JP2020105133A patent/JP7062720B2/ja active Active
- 2020-09-16 JP JP2020155809A patent/JP7093385B2/ja active Active
- 2020-09-16 JP JP2020155429A patent/JP7148580B2/ja active Active
- 2020-09-30 JP JP2020164326A patent/JP7106610B2/ja active Active
- 2020-11-12 US US17/096,138 patent/US20210139583A1/en active Pending
- 2020-11-13 US US17/097,630 patent/US20210371517A1/en active Pending
-
2021
- 2021-01-04 AU AU2021200007A patent/AU2021200007B2/en active Active
- 2021-03-17 AU AU2021201679A patent/AU2021201679B2/en active Active
- 2021-09-10 US US17/472,284 patent/US12202897B2/en active Active
- 2021-11-26 AU AU2021273652A patent/AU2021273652A1/en not_active Abandoned
-
2022
- 2022-04-20 JP JP2022069142A patent/JP7542270B2/ja active Active
- 2022-04-21 US US17/660,114 patent/US20220372140A1/en active Pending
- 2022-07-13 JP JP2022112278A patent/JP7402933B2/ja active Active
- 2022-07-15 US US17/812,848 patent/US20220380461A1/en active Pending
- 2022-09-22 JP JP2022150928A patent/JP7508516B2/ja active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2021200007B2 (en) | Defined composition gene modified T-cell products | |
| TW202030323A (zh) | 製備表現嵌合抗原受體的細胞之方法 | |
| TW202134264A (zh) | 嵌合抗原受體及其用途 | |
| CN111566124A (zh) | 制备表达嵌合抗原受体的细胞的方法 | |
| JP2023516008A (ja) | キメラ抗原受容体発現細胞を作製する方法 | |
| KR20220147109A (ko) | 키메라 항원 수용체 발현 세포의 제조 방법 | |
| JP7018387B2 (ja) | 腫瘍標的療法のためのcxcr6形質導入t細胞 | |
| KR20170075792A (ko) | T 세포를 자극 및 증대시키는 조성물 및 방법 | |
| TW202140790A (zh) | 病毒載體轉導細胞的方法 | |
| AU2019234580B2 (en) | IL-13 receptor alpha 2 targeted, zetakine directed T cell immunotherapy | |
| TW202300643A (zh) | 用於增強幹細胞樣記憶t細胞工程改造之材料及方法 | |
| US20230374104A1 (en) | Methods and compositions comprising pd1 chimeric polypeptides | |
| WO2021211663A1 (en) | Chimeric myd88 receptors | |
| CN117858901A (zh) | 制备表达嵌合抗原受体的细胞的方法 | |
| JP2022526843A (ja) | 制御性b細胞の産生方法およびその使用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |