JP6772068B2 - 導入遺伝子の遺伝子タグおよびその使用方法 - Google Patents
導入遺伝子の遺伝子タグおよびその使用方法 Download PDFInfo
- Publication number
- JP6772068B2 JP6772068B2 JP2016561722A JP2016561722A JP6772068B2 JP 6772068 B2 JP6772068 B2 JP 6772068B2 JP 2016561722 A JP2016561722 A JP 2016561722A JP 2016561722 A JP2016561722 A JP 2016561722A JP 6772068 B2 JP6772068 B2 JP 6772068B2
- Authority
- JP
- Japan
- Prior art keywords
- cells
- seq
- domain
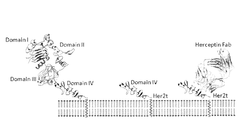
- her2
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000623 proteins and genes Proteins 0.000 title claims description 203
- 108700019146 Transgenes Proteins 0.000 title description 68
- 210000004027 cell Anatomy 0.000 claims description 656
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 242
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 211
- 235000001014 amino acid Nutrition 0.000 claims description 206
- 150000001413 amino acids Chemical group 0.000 claims description 206
- 150000007523 nucleic acids Chemical class 0.000 claims description 173
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 171
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 165
- 229920001184 polypeptide Polymers 0.000 claims description 156
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 131
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 131
- 102000039446 nucleic acids Human genes 0.000 claims description 130
- 108020004707 nucleic acids Proteins 0.000 claims description 130
- 230000014509 gene expression Effects 0.000 claims description 126
- 102000040430 polynucleotide Human genes 0.000 claims description 124
- 108091033319 polynucleotide Proteins 0.000 claims description 124
- 239000002157 polynucleotide Substances 0.000 claims description 124
- 101150029707 ERBB2 gene Proteins 0.000 claims description 123
- 239000000427 antigen Substances 0.000 claims description 120
- 108091007433 antigens Proteins 0.000 claims description 120
- 102000036639 antigens Human genes 0.000 claims description 120
- 206010028980 Neoplasm Diseases 0.000 claims description 92
- 230000027455 binding Effects 0.000 claims description 79
- 229940022353 herceptin Drugs 0.000 claims description 70
- 125000006850 spacer group Chemical group 0.000 claims description 60
- 108010076504 Protein Sorting Signals Proteins 0.000 claims description 59
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 44
- 235000003704 aspartic acid Nutrition 0.000 claims description 44
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 claims description 44
- 201000011510 cancer Diseases 0.000 claims description 30
- 210000000130 stem cell Anatomy 0.000 claims description 23
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 claims description 22
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 claims description 22
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 claims description 22
- 210000003958 hematopoietic stem cell Anatomy 0.000 claims description 20
- 230000003834 intracellular effect Effects 0.000 claims description 19
- 238000011282 treatment Methods 0.000 claims description 16
- 230000004936 stimulating effect Effects 0.000 claims description 15
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 13
- 102000005962 receptors Human genes 0.000 claims description 11
- 108020003175 receptors Proteins 0.000 claims description 11
- 229940127089 cytotoxic agent Drugs 0.000 claims description 9
- 229940082789 erbitux Drugs 0.000 claims description 9
- 239000002254 cytotoxic agent Substances 0.000 claims description 7
- 231100000599 cytotoxic agent Toxicity 0.000 claims description 6
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 claims description 3
- 235000013922 glutamic acid Nutrition 0.000 claims 1
- 239000004220 glutamic acid Substances 0.000 claims 1
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 138
- 125000003275 alpha amino acid group Chemical group 0.000 description 126
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 109
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 109
- 238000000034 method Methods 0.000 description 88
- 239000000203 mixture Substances 0.000 description 68
- 108060006698 EGF receptor Proteins 0.000 description 65
- 108700010039 chimeric receptor Proteins 0.000 description 65
- 102000001301 EGF receptor Human genes 0.000 description 64
- 239000013598 vector Substances 0.000 description 48
- 230000004068 intracellular signaling Effects 0.000 description 47
- 108091028043 Nucleic acid sequence Proteins 0.000 description 43
- 229960000575 trastuzumab Drugs 0.000 description 41
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 40
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 40
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 40
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 40
- 239000012634 fragment Substances 0.000 description 40
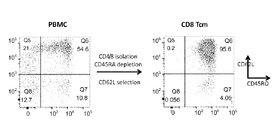
- 101001018097 Homo sapiens L-selectin Proteins 0.000 description 39
- 102100033467 L-selectin Human genes 0.000 description 39
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 38
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 38
- 108020001756 ligand binding domains Proteins 0.000 description 31
- 238000001727 in vivo Methods 0.000 description 30
- 239000012636 effector Substances 0.000 description 28
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 26
- 239000003446 ligand Substances 0.000 description 26
- 239000002609 medium Substances 0.000 description 26
- 239000003550 marker Substances 0.000 description 25
- 210000004698 lymphocyte Anatomy 0.000 description 24
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 23
- 210000004881 tumor cell Anatomy 0.000 description 22
- 102000004127 Cytokines Human genes 0.000 description 21
- 108090000695 Cytokines Proteins 0.000 description 21
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 21
- 229930195712 glutamate Natural products 0.000 description 21
- 210000003071 memory t lymphocyte Anatomy 0.000 description 21
- 230000011664 signaling Effects 0.000 description 20
- 239000013603 viral vector Substances 0.000 description 20
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 19
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 17
- 238000010361 transduction Methods 0.000 description 17
- 230000026683 transduction Effects 0.000 description 17
- 241000700605 Viruses Species 0.000 description 16
- 238000002360 preparation method Methods 0.000 description 16
- 230000035755 proliferation Effects 0.000 description 16
- 230000006870 function Effects 0.000 description 15
- 230000002068 genetic effect Effects 0.000 description 15
- 239000012528 membrane Substances 0.000 description 15
- 239000011325 microbead Substances 0.000 description 15
- 238000009169 immunotherapy Methods 0.000 description 14
- 238000004519 manufacturing process Methods 0.000 description 14
- 238000010186 staining Methods 0.000 description 14
- 238000006467 substitution reaction Methods 0.000 description 14
- 230000001225 therapeutic effect Effects 0.000 description 14
- 201000010099 disease Diseases 0.000 description 13
- 208000035475 disorder Diseases 0.000 description 13
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 12
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 12
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 12
- 108010002350 Interleukin-2 Proteins 0.000 description 12
- 102000000588 Interleukin-2 Human genes 0.000 description 12
- 241000713666 Lentivirus Species 0.000 description 12
- 241000699670 Mus sp. Species 0.000 description 12
- 210000002443 helper t lymphocyte Anatomy 0.000 description 12
- 235000018102 proteins Nutrition 0.000 description 12
- 102000004169 proteins and genes Human genes 0.000 description 12
- 230000002829 reductive effect Effects 0.000 description 12
- 230000009870 specific binding Effects 0.000 description 12
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 description 11
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 11
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 11
- 230000001745 anti-biotin effect Effects 0.000 description 11
- 238000000684 flow cytometry Methods 0.000 description 11
- 239000011324 bead Substances 0.000 description 10
- 230000007423 decrease Effects 0.000 description 10
- 239000003102 growth factor Substances 0.000 description 10
- 238000000338 in vitro Methods 0.000 description 10
- 230000004044 response Effects 0.000 description 10
- 230000004913 activation Effects 0.000 description 9
- 238000012258 culturing Methods 0.000 description 9
- 230000031146 intracellular signal transduction Effects 0.000 description 9
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 8
- 206010006187 Breast cancer Diseases 0.000 description 8
- 208000026310 Breast neoplasm Diseases 0.000 description 8
- 101001043809 Homo sapiens Interleukin-7 receptor subunit alpha Proteins 0.000 description 8
- 102100021593 Interleukin-7 receptor subunit alpha Human genes 0.000 description 8
- 108091008874 T cell receptors Proteins 0.000 description 8
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 8
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 8
- 230000001965 increasing effect Effects 0.000 description 8
- 239000013600 plasmid vector Substances 0.000 description 8
- 108091026890 Coding region Proteins 0.000 description 7
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 7
- 102000003812 Interleukin-15 Human genes 0.000 description 7
- 108090000172 Interleukin-15 Proteins 0.000 description 7
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 238000002347 injection Methods 0.000 description 7
- 239000007924 injection Substances 0.000 description 7
- 210000004962 mammalian cell Anatomy 0.000 description 7
- 239000002773 nucleotide Substances 0.000 description 7
- 125000003729 nucleotide group Chemical group 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 238000001262 western blot Methods 0.000 description 7
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 6
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 6
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 6
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 6
- 108010090804 Streptavidin Proteins 0.000 description 6
- 230000000259 anti-tumor effect Effects 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 210000001185 bone marrow Anatomy 0.000 description 6
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 6
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 210000005260 human cell Anatomy 0.000 description 6
- 230000001939 inductive effect Effects 0.000 description 6
- 208000015181 infectious disease Diseases 0.000 description 6
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 6
- 230000002062 proliferating effect Effects 0.000 description 6
- 230000001360 synchronised effect Effects 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- -1 CD86 Proteins 0.000 description 5
- 102000001398 Granzyme Human genes 0.000 description 5
- 108060005986 Granzyme Proteins 0.000 description 5
- 125000000539 amino acid group Chemical group 0.000 description 5
- 238000010171 animal model Methods 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 230000016396 cytokine production Effects 0.000 description 5
- 230000003013 cytotoxicity Effects 0.000 description 5
- 231100000135 cytotoxicity Toxicity 0.000 description 5
- 238000006471 dimerization reaction Methods 0.000 description 5
- 230000009977 dual effect Effects 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 238000003384 imaging method Methods 0.000 description 5
- 230000028993 immune response Effects 0.000 description 5
- 238000001802 infusion Methods 0.000 description 5
- 230000002147 killing effect Effects 0.000 description 5
- 208000032839 leukemia Diseases 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000002688 persistence Effects 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 108091008146 restriction endonucleases Proteins 0.000 description 5
- 210000001541 thymus gland Anatomy 0.000 description 5
- 238000001890 transfection Methods 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- 102100027207 CD27 antigen Human genes 0.000 description 4
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 4
- 101000746373 Homo sapiens Granulocyte-macrophage colony-stimulating factor Proteins 0.000 description 4
- 206010060862 Prostate cancer Diseases 0.000 description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 4
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 4
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 4
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 235000020958 biotin Nutrition 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 230000024245 cell differentiation Effects 0.000 description 4
- 230000032823 cell division Effects 0.000 description 4
- 230000005754 cellular signaling Effects 0.000 description 4
- 238000003501 co-culture Methods 0.000 description 4
- 230000001472 cytotoxic effect Effects 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 210000002865 immune cell Anatomy 0.000 description 4
- 238000002955 isolation Methods 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 238000002823 phage display Methods 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 230000000638 stimulation Effects 0.000 description 4
- 238000010189 synthetic method Methods 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 231100000331 toxic Toxicity 0.000 description 4
- 230000002588 toxic effect Effects 0.000 description 4
- 241001430294 unidentified retrovirus Species 0.000 description 4
- 230000003612 virological effect Effects 0.000 description 4
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 description 3
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 3
- 102000009410 Chemokine receptor Human genes 0.000 description 3
- 108050000299 Chemokine receptor Proteins 0.000 description 3
- 241000701022 Cytomegalovirus Species 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 description 3
- 101001040800 Homo sapiens Integral membrane protein GPR180 Proteins 0.000 description 3
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 3
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 3
- 102100021244 Integral membrane protein GPR180 Human genes 0.000 description 3
- 108010002586 Interleukin-7 Proteins 0.000 description 3
- 102000000704 Interleukin-7 Human genes 0.000 description 3
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 3
- 102000003735 Mesothelin Human genes 0.000 description 3
- 108090000015 Mesothelin Proteins 0.000 description 3
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 3
- 241000288906 Primates Species 0.000 description 3
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 3
- 108010022394 Threonine synthase Proteins 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 239000012472 biological sample Substances 0.000 description 3
- 239000013592 cell lysate Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 239000002458 cell surface marker Substances 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000011651 chromium Substances 0.000 description 3
- 230000004186 co-expression Effects 0.000 description 3
- 102000003675 cytokine receptors Human genes 0.000 description 3
- 108010057085 cytokine receptors Proteins 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 102000004419 dihydrofolate reductase Human genes 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 210000003162 effector t lymphocyte Anatomy 0.000 description 3
- 239000007850 fluorescent dye Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 230000002055 immunohistochemical effect Effects 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 108010074108 interleukin-21 Proteins 0.000 description 3
- 239000006166 lysate Substances 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 201000001441 melanoma Diseases 0.000 description 3
- 238000004806 packaging method and process Methods 0.000 description 3
- 244000052769 pathogen Species 0.000 description 3
- 229930192851 perforin Natural products 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000010188 recombinant method Methods 0.000 description 3
- 230000001177 retroviral effect Effects 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 238000007619 statistical method Methods 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 230000002463 transducing effect Effects 0.000 description 3
- 241000701161 unidentified adenovirus Species 0.000 description 3
- 238000011144 upstream manufacturing Methods 0.000 description 3
- 108010024223 Adenine phosphoribosyltransferase Proteins 0.000 description 2
- 102100029457 Adenine phosphoribosyltransferase Human genes 0.000 description 2
- 101710145634 Antigen 1 Proteins 0.000 description 2
- 208000003950 B-cell lymphoma Diseases 0.000 description 2
- 206010005949 Bone cancer Diseases 0.000 description 2
- 208000018084 Bone neoplasm Diseases 0.000 description 2
- 101150013553 CD40 gene Proteins 0.000 description 2
- 102100035793 CD83 antigen Human genes 0.000 description 2
- 102100037904 CD9 antigen Human genes 0.000 description 2
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 2
- 229940045513 CTLA4 antagonist Drugs 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 101710178046 Chorismate synthase 1 Proteins 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- 101710152695 Cysteine synthase 1 Proteins 0.000 description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102100038595 Estrogen receptor Human genes 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 2
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 2
- 101000946856 Homo sapiens CD83 antigen Proteins 0.000 description 2
- 101000738354 Homo sapiens CD9 antigen Proteins 0.000 description 2
- 101000746783 Homo sapiens Cytochrome b-c1 complex subunit 6, mitochondrial Proteins 0.000 description 2
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 2
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 2
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 2
- 101001055157 Homo sapiens Interleukin-15 Proteins 0.000 description 2
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 2
- 101000998120 Homo sapiens Interleukin-3 receptor subunit alpha Proteins 0.000 description 2
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 2
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 2
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 2
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 2
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 description 2
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 description 2
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 2
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 2
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 2
- 102000018251 Hypoxanthine Phosphoribosyltransferase Human genes 0.000 description 2
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 description 2
- 102000003814 Interleukin-10 Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 2
- 102100030703 Interleukin-22 Human genes 0.000 description 2
- 102100033493 Interleukin-3 receptor subunit alpha Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 2
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 2
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 2
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 2
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 2
- 102100032831 Protein ITPRID2 Human genes 0.000 description 2
- 102000001253 Protein Kinase Human genes 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- 230000024932 T cell mediated immunity Effects 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 2
- 210000000662 T-lymphocyte subset Anatomy 0.000 description 2
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 2
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 2
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 108010044540 auristatin Proteins 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 210000003995 blood forming stem cell Anatomy 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000004590 computer program Methods 0.000 description 2
- 230000000139 costimulatory effect Effects 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 210000003979 eosinophil Anatomy 0.000 description 2
- 108010038795 estrogen receptors Proteins 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 238000005206 flow analysis Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 102000056003 human IL15 Human genes 0.000 description 2
- 102000048638 human UQCRH Human genes 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 125000001165 hydrophobic group Chemical group 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 239000012212 insulator Substances 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 238000012737 microarray-based gene expression Methods 0.000 description 2
- 230000036457 multidrug resistance Effects 0.000 description 2
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 2
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 2
- 102000003998 progesterone receptors Human genes 0.000 description 2
- 108090000468 progesterone receptors Proteins 0.000 description 2
- 108020001580 protein domains Proteins 0.000 description 2
- 108060006633 protein kinase Proteins 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 102000035160 transmembrane proteins Human genes 0.000 description 2
- 108091005703 transmembrane proteins Proteins 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- BRZYSWJRSDMWLG-DJWUNRQOSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-[(1r)-1-hydroxyethyl]oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H]([C@@H](C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-DJWUNRQOSA-N 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- WLKSPGHQGFFKGE-UHFFFAOYSA-N 1-chloropropan-2-yl n-(3-chlorophenyl)carbamate Chemical group ClCC(C)OC(=O)NC1=CC=CC(Cl)=C1 WLKSPGHQGFFKGE-UHFFFAOYSA-N 0.000 description 1
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 1
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 1
- VDABVNMGKGUPEY-UHFFFAOYSA-N 6-carboxyfluorescein succinimidyl ester Chemical compound C=1C(O)=CC=C2C=1OC1=CC(O)=CC=C1C2(C1=C2)OC(=O)C1=CC=C2C(=O)ON1C(=O)CCC1=O VDABVNMGKGUPEY-UHFFFAOYSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 102100036664 Adenosine deaminase Human genes 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 108010031480 Artificial Receptors Proteins 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 208000011691 Burkitt lymphomas Diseases 0.000 description 1
- 101710149858 C-C chemokine receptor type 7 Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 102100025466 Carcinoembryonic antigen-related cell adhesion molecule 3 Human genes 0.000 description 1
- 108010077544 Chromatin Proteins 0.000 description 1
- 101001091269 Escherichia coli Hygromycin-B 4-O-kinase Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000016355 Granulocyte-Macrophage Colony-Stimulating Factor Receptors Human genes 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 208000031220 Hemophilia Diseases 0.000 description 1
- 208000009292 Hemophilia A Diseases 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101000914337 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 3 Proteins 0.000 description 1
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 description 1
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 1
- 101000818543 Homo sapiens Tyrosine-protein kinase ZAP-70 Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 102000014413 Neuregulin Human genes 0.000 description 1
- 108050003475 Neuregulin Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 229920000037 Polyproline Polymers 0.000 description 1
- 108010072866 Prostate-Specific Antigen Proteins 0.000 description 1
- 102100038358 Prostate-specific antigen Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 239000012083 RIPA buffer Substances 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 101001091268 Streptomyces hygroscopicus Hygromycin-B 7''-O-kinase Proteins 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 description 1
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 1
- 208000002903 Thalassemia Diseases 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 102000008579 Transposases Human genes 0.000 description 1
- 108010020764 Transposases Proteins 0.000 description 1
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 1
- 102100021125 Tyrosine-protein kinase ZAP-70 Human genes 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 101150063416 add gene Proteins 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 210000001772 blood platelet Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 210000004970 cd4 cell Anatomy 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 230000010307 cell transformation Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 210000003483 chromatin Anatomy 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 230000001149 cognitive effect Effects 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000003568 cytokine secretion assay Methods 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000012137 double-staining Methods 0.000 description 1
- 230000002222 downregulating effect Effects 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 239000012997 ficoll-paque Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000002073 fluorescence micrograph Methods 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 102000046157 human CSF2 Human genes 0.000 description 1
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 1
- 229940097277 hygromycin b Drugs 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 238000003331 infrared imaging Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000004073 interleukin-2 production Effects 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 238000001325 log-rank test Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 108010026228 mRNA guanylyltransferase Proteins 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- GRPSNTXTTSBKGW-BVGHQBMWSA-J magnesium;potassium;sodium;(3r,4s,5s,6r)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol;triacetate;chloride Chemical compound [Na+].[Mg+2].[Cl-].[K+].CC([O-])=O.CC([O-])=O.CC([O-])=O.OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O GRPSNTXTTSBKGW-BVGHQBMWSA-J 0.000 description 1
- FVVLHONNBARESJ-NTOWJWGLSA-H magnesium;potassium;trisodium;(2r,3s,4r,5r)-2,3,4,5,6-pentahydroxyhexanoate;acetate;tetrachloride;nonahydrate Chemical compound O.O.O.O.O.O.O.O.O.[Na+].[Na+].[Na+].[Mg+2].[Cl-].[Cl-].[Cl-].[Cl-].[K+].CC([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O FVVLHONNBARESJ-NTOWJWGLSA-H 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 201000010893 malignant breast melanoma Diseases 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 210000003593 megakaryocyte Anatomy 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- 210000004296 naive t lymphocyte Anatomy 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 101150111388 pac gene Proteins 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 108010026466 polyproline Proteins 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 210000004986 primary T-cell Anatomy 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 210000001938 protoplast Anatomy 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 208000002491 severe combined immunodeficiency Diseases 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000006433 tumor necrosis factor production Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1774—Immunoglobulin superfamily (e.g. CD2, CD4, CD8, ICAM molecules, B7 molecules, Fc-receptors, MHC-molecules)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/179—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
- A61K39/464412—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0091—Purification or manufacturing processes for gene therapy compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70517—CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- C07K14/7151—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons for tumor necrosis factor [TNF], for lymphotoxin [LT]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
- C12N5/0638—Cytotoxic T lymphocytes [CTL] or lymphokine activated killer cells [LAK]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y105/00—Oxidoreductases acting on the CH-NH group of donors (1.5)
- C12Y105/01—Oxidoreductases acting on the CH-NH group of donors (1.5) with NAD+ or NADP+ as acceptor (1.5.1)
- C12Y105/01003—Dihydrofolate reductase (1.5.1.3)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/10—Protein-tyrosine kinases (2.7.10)
- C12Y207/10001—Receptor protein-tyrosine kinase (2.7.10.1)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K2035/124—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells the cells being hematopoietic, bone marrow derived or blood cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5158—Antigen-pulsed cells, e.g. T-cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2121/00—Preparations for use in therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/90—Vectors containing a transposable element
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2820/00—Vectors comprising a special origin of replication system
- C12N2820/002—Vectors comprising a special origin of replication system inducible or controllable
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Cell Biology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Hematology (AREA)
- Mycology (AREA)
- Oncology (AREA)
- Virology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Developmental Biology & Embryology (AREA)
- Endocrinology (AREA)
- Communicable Diseases (AREA)
Description
本願は、2014年10月2日に出願された米国仮特許出願62/058,973号、2014年4月10日に出願された米国仮特許出願61/977,751号、2014年4月30日に出願された米国仮特許出願61/986,479号、2014年12月9日に出願された米国仮特許出願62/089,730号、2014年12月11日に出願された米国仮特許出願62/090845号、および2014年12月5日に出願された米国仮特許出願62/088,363号に係る優先権を主張するものである。前記出願の開示は、参照によりその全体が明示的に本明細書に組み込まれる。
本願は電子形式の配列表とともに出願されたものである。この配列表は、SCRI-066WO-SEQUENCE_LISTING.TXTのファイル名で2015年4月7日に作成された47kbのファイルとして提供されたものである。この電子形式の配列表に記載された情報は、参照によりその全体が本明細書に組み込まれる。
配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないこと
を特徴とする単離されたポリペプチドを提供する。
この単離されたポリペプチドをコードする核酸も本発明に包含される。
いくつかの実施形態において、本発明の方法は、
単離された核酸を宿主細胞に導入すること、および
少なくとも1つの増殖因子を含む培地中で前記宿主細胞を培養すること
を含み、
前記核酸は、たとえば、配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメイン(ECD)からなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有する単離されたポリペプチドをコードする核酸であり、
該単離されたポリペプチドは、Her2のドメインIVのエピトープに結合する抗体に特異的に結合する。
いくつかの実施形態において、本発明の方法は、前記培養工程の前もしくは後またはその前後に、ECDを発現している宿主細胞を選択することをさらに含む。別の実施形態においては、前記製造方法は、第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸を前記宿主細胞に導入することをさらに含む。いくつかの実施形態において、前記方法は、前記培養工程の前もしくは後またはその前後に、前記第2の遺伝子タグを発現している宿主細胞を選択することをさらに含む。
単離された第1の核酸を第1の宿主細胞に導入すること、
ECDを発現している第1の宿主細胞を選択すること、
第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸を第2の宿主細胞に導入すること、
前記第2の遺伝子タグを発現している第2の宿主細胞を選択すること、ならびに
任意に、少なくとも1つの増殖因子を含む培地中で前記第1の宿主細胞および第2の宿主細胞を培養すること
を含み、
前記核酸が、たとえば、配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有する単離されたポリペプチドをコードする核酸であること、
該単離されたポリペプチドが、Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること
を特徴とする方法が提供される。
別の実施形態では、組成物は第1の宿主細胞集団および第2の宿主細胞集団を含む。
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないこと
を特徴とする単離されたポリペプチドが提供される。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていること
を特徴とする単離されたポリペプチドが提供される。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないこと
を特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていること
を特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列LEGGGEGRGSLLTCG(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないこと
を特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていること
を特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列L E G G G E G R G S L L T C G(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。いくつかの実施形態においては、前記宿主細胞は、CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞、CD4セントラルメモリー細胞およびこれらの組み合わせからなる群から選択される。いくつかの実施形態においては、前記宿主細胞は自己由来である。いくつかの実施形態においては、前記宿主細胞は抗原特異的である。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないこと
を特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていること
を特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列L E G G G E G R G S L L T C G(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。いくつかの実施形態においては、前記宿主細胞は、CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞、CD4セントラルメモリー細胞およびこれらの組み合わせからなる群から選択される。いくつかの実施形態においては、前記宿主細胞は自己由来である。いくつかの実施形態においては、前記宿主細胞は抗原特異的である。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
単離された核酸を宿主細胞に導入すること、および
少なくとも1つの増殖因子を含む培地中で前記宿主細胞を培養すること
を含む方法が提供される。
いくつかの実施形態においては、前記単離された核酸はポリペプチドをコードする。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていること
を特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないこと
を特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列L E G G G E G R G S L L T C G(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。いくつかの実施形態においては、前記宿主細胞は、CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞、CD4セントラルメモリー細胞およびこれらの組み合わせからなる群から選択される。いくつかの実施形態においては、前記宿主細胞は自己由来である。いくつかの実施形態においては、前記宿主細胞は抗原特異的である。いくつかの実施形態においては、前記増殖因子は、IL−15、IL−7、IL−21、IL−2およびこれらの組み合わせからなる群から選択される。いくつかの実施形態においては、前記方法は、前記Her2tポリペプチドを発現している細胞を選択することをさらに含む。いくつかの実施形態においては、前記細胞は、前記培地中での培養前に選択される。いくつかの実施形態においては、前記細胞は、Her2のドメインIVに結合する抗体を使用して選択する。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態においては、前記方法は、第2の遺伝子タグに連結されたキメラ抗原受容体をコードする第2の単離された核酸を導入することをさらに含む。いくつかの実施形態においては、前記方法は、前記第2の遺伝子タグを発現している細胞を選択することをさらに含む。いくつかの実施形態においては、前記第2の遺伝子タグはEGFRtを含む。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
特に記載がない限り、本明細書で使用されている技術用語および科学用語はいずれも、本発明が属する技術分野における当業者によって一般的に理解される意味を有すると見なされる。
本開示の一態様は、細胞における導入遺伝子の安定な発現を可能とする、導入遺伝子の発現のための遺伝子タグを提供する。いくつかの実施形態においては、前記遺伝子タグを使用することによって、内在性遺伝子と同等のレベルで導入遺伝子を発現している形質導入細胞の選択が可能となる。いくつかの実施形態においては、前記遺伝子タグは、細胞表面に発現され、免疫原性が低減されており、ベクター内の遺伝子ペイロードを増やすことが実質的になく、かつ/または様々な細胞における導入遺伝子の発現を可能にする。
本開示の別の態様は、本明細書に記載の遺伝子タグをコードする核酸構築物およびそのバリアントを含む。
いくつかの実施形態において、ベクターは、遺伝子タグをコードする核酸を含む。遺伝子タグをコードする核酸は、独立した構築物としてベクター内にパッケージングされていてもよく、導入遺伝子をコードする核酸に連結されていてもよい。いくつかの実施形態において、遺伝子タグをコードする核酸は、独立した構築物としてベクター内にパッケージングされるか、あるいは導入遺伝子をコードする核酸に連結される。
使用することができる。いくつかの実施形態において、PBは、キメラ抗原受容体および第1の遺伝子タグをコードするポリヌクレオチドに連結されたプロモーターを含み、別のPBは、キメラ抗原受容体および第2の別の遺伝子タグをコードするポリヌクレオチドに連結されたプロモーターを含む。前記構築物それぞれの各構成要素は、自己切断T2A配列をコードする核酸などの核酸を介して隔てられている。いくつかの実施形態において、それぞれのPBに含まれるキメラ抗原受容体が互いに異なっており、たとえば、スペーサーの長さおよびスペーサーの配列、細胞内シグナル伝達ドメイン、ならびに/または遺伝子タグ配列が異なっている(ただし、これらに限定されない)。
本発明の態様はいくつかの導入遺伝子も包含する。
本明細書に記載の実施形態においては、いくつか種類のキメラ抗原受容体を使用することができる。
本明細書に記載の実施形態においては、様々なリガンド結合ドメインを使用することができる。
いくつかの実施形態において、前記キメラ受容体の核酸配列は、スペーサー領域をコードするポリヌクレオチドを含む。スペーサー領域は、典型的には、キメラ受容体のリガンド結合ドメインと膜貫通ドメインとの間に位置する。いくつかの実施形態において、スペーサー領域は、前記リガンド結合ドメインに柔軟性を持たせ、かつリンパ球において高レベル発現を可能とする。約229アミノ酸長のスペーサードメインを有するCD19特異的キメラ受容体の抗腫瘍活性は、改変IgG4ヒンジのみからなる短いスペーサー領域を有するCD19特異的キメラ受容体の抗腫瘍活性よりも低い。
いくつかの実施形態において、前記キメラ受容体の核酸配列は、膜貫通ドメインをコードするポリヌクレオチドを含む。該膜貫通ドメインは、前記キメラ受容体を膜につなぎ止める役割を果たす。いくつかの実施形態においては、前記キメラ抗原受容体の前記膜貫通ドメインは、前記遺伝子タグの膜貫通ドメインとは異なる。
いくつかの実施形態において、前記キメラ受容体の核酸配列は、細胞内シグナル伝達ドメインをコードするポリヌクレオチドを含む。該細胞内シグナル伝達ドメインが存在することによって、前記キメラ受容体を発現する形質導入細胞が腫瘍細胞上に発現されたリガンドに結合すると、該形質導入細胞の1つの機能が活性化される。いくつかの実施形態において、前記細胞内シグナル伝達ドメインは、1つ以上の細胞内シグナル伝達ドメインを含む。いくつかの実施形態において、前記細胞内シグナル伝達ドメインは、前記形質導入細胞の少なくとも1つの機能を活性化する細胞内シグナル伝達ドメインの一部および/またはそのバリアントである。
いくつかの実施形態においては、CAR構築物中のドメイン間に柔軟性を持たせることを目的として、リンカードメインが使用される。以下に示すように、Her2tG構築物は、Her2tのドメインIVと膜貫通ドメインとの間にリンカー(配列番号45)を有する。このリンカーは、タンパク質ドメイン間に柔軟性を持たせることを目的として使用される。別の例では、CARのscFvの多くは、CARのscFvのVhドメインとVlドメインとの間に4つの連続的G3Sサブユニットを含む。これにより、2つのscFvドメインに柔軟性を付与することができ、scFvを折りたたむことが可能となる。典型的な一実施形態において、2つのG3Sリンカーサブユニットを使用するという原理を利用することによって、Her2tGの柔軟性を増加することができると考えられる。
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていること
を特徴とする単離されたポリペプチドが提供される。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。
本明細書に記載の組成物は、本明細書に記載のベクターおよび/または構築物を含む遺伝子改変宿主細胞を提供する。いくつかの実施形態では、前記宿主細胞はCD4+Tリンパ球および/またはCD8+Tリンパ球である。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
いくつかの実施形態においては、本発明の開示による免疫療法に使用する前記T細胞に機能性遺伝子を導入することが望ましい場合がある。たとえば、単一の遺伝子または複数の遺伝子をT細胞に導入することによって、体内に移入された該T細胞の生存能および/または機能を向上することができ、それによって治療法の有効性を改善することができる。あるいは、上記単一または複数の遺伝子を導入することによって、遺伝子マーカーを提供することができ、この遺伝子マーカーを利用することによって、インビボにおける生存T細胞および/または移行T細胞の選択および/または評価が可能となる。あるいは、上記単一または複数の遺伝子をT細胞に導入することによって、たとえば、該導入遺伝子の発現制御により該T細胞を調節することができ、それによって免疫療法の安全性を改善することができる。これらは、本発明の開示を踏まえ、当業者であれば容易に理解できる公知の技術に従って行うことができる。
いくつかの実施形態では、本発明の方法は、
単離された核酸を宿主細胞に導入すること、および
少なくとも1つの増殖因子を含む培地中で前記宿主細胞を培養することを含み、
前記単離された核酸は、たとえば、単離されたポリペプチドをコードする核酸であり、
該単離されたポリペプチドは、配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%の配列同一性を有し、Her2のドメインIVのエピトープに結合する抗体に特異的に結合することを特徴とする。
いくつかの実施形態において、本発明の方法は、前記培養工程の前もしくは後またはその前後に、Her2tを発現している宿主細胞を選択することをさらに含む。別の実施形態においては、本発明の製造方法は、第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸を前記宿主細胞に導入することをさらに含む。いくつかの実施形態において、前記方法は、前記培養工程の前もしくは後またはその前後に、前記第2の遺伝子タグを発現している宿主細胞を選択することをさらに含む。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
単離された第1の核酸を第1の宿主細胞に導入すること、
Her2tを発現している第1の宿主細胞を選択すること、
第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸を第2の宿主細胞に導入すること、
前記第2の遺伝子タグを発現している第2の宿主細胞を選択すること、ならびに
任意に、少なくとも1つの増殖因子を含む培地中で前記第1の宿主細胞および第2の宿主細胞を培養することを含み、
前記核酸が、たとえば、配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%の配列同一性を有する単離されたポリペプチドをコードする核酸であること、ならびに
該単離されたポリペプチドが、Her2のドメインIVのエピトープに結合する抗体に特異的に結合することを特徴とする方法が提供される。
別の実施形態では、組成物は第1の宿主細胞集団および第2の宿主細胞集団を含む。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
+細胞は、CD45RO−、CD45RA+、CD62L+、および/またはCD4+T細胞である。いくつかの実施形態において、セントラルメモリーCD4+細胞は、CD62L+および/またはCD45RO+である。いくつかの実施形態において、エフェクターCD4+細胞は、CD62L−および/またはCD45RO+である。これらの集団はそれぞれ別個にキメラ受容体で改変することができる。
は、キメラ受容体をコードする発現ベクターを使用して、CD4+細胞およびCD8+細胞をそれぞれ別々に改変し、所定の集団を形成することができる。いくつかの実施形態においては、細胞は、CARおよび第1の遺伝子タグをコードするポリヌクレオチドを含むベクター、ならびに/またはCARおよび第2の別の遺伝子タグをコードするポリヌクレオチドを含むベクターを使用して、別々に改変することができる。いくつかの実施形態において、前記CAR構築物は、同じものであっても異なるものであってもよい。たとえば、CD8 T細胞は、第1の遺伝子タグを有するCAR構築物で形質導入され、CD4 T細胞は、第2の遺伝子タグを有する同じCARで形質導入される。
別の実施形態において、形質導入細胞は、遺伝子タグの発現によって選択される。いくつかの実施形態において、形質導入を行った後、たとえば、前記遺伝子タグに結合する抗体を使用して、Her2tまたはEGFRtを発現する細胞を選択する。いくつかの実施形態においては、前記抗体を使用することによって、遺伝子タグ陽性の細胞を少なくとも80〜100%含む細胞集団が選択される。
の発現の評価をすることができる。いくつかの実施形態において、遺伝子タグの発現により選択された細胞は、たとえば、刺激ドメイン(たとえば、CD3ζ)の量、プロテインLの量、およびT2Aの量を分析することなどによって、CARの発現がさらに評価される。いくつかの実施形態においては、CARの発現と遺伝子タグの発現の比率が約1:0.1〜10:0.1である細胞が選択される。いくつかの実施形態においては、CARの発現と遺伝子タグの発現の比率が、1:0.1、2:0.1、3:0.1、4:0.1、5:0.1、6:0.1、7:0.1、8:0.1、9:0.1、もしくは10:0.1である細胞、またはCARの発現と遺伝子タグの発現の比率が、これらの比率のいずれかの間にある細胞が選択される。いくつかの実施形態においては、CARの発現が低い場合、EGFRtよりも導入遺伝子の発現レベルが良好なHer2t遺伝子タグを使用することができる。いくつかの実施形態において、Her2t遺伝子タグは、EGFRt遺伝子タグの少なくとも1.5倍、2倍、5倍、もしくは10倍の導入遺伝子発現の増加をもたらし、またはこれらの値のいずれか2つの間の倍率の導入遺伝子発現の増加をもたらす。
本発明の開示は、本明細書に記載の遺伝子改変Tリンパ球製剤を含む養子細胞免疫療法組成物を提供する。
いくつかの実施形態では、宿主細胞は、
単離された核酸と、
第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸とを含み、
前記単離された核酸は、たとえば、単離されたポリペプチドをコードする核酸であり、
該単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合することを特徴とする。
いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
単離された第1の核酸を含む第1の宿主細胞と、
第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸を含む第2の宿主細胞とを含み、
前記単離された核酸は、たとえば、単離されたポリペプチドをコードする核酸であり、
該単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合することを特徴とする。
いくつかの実施形態においては、前記第1宿主細胞および前記第2の宿主細胞は、同じ種類の宿主細胞であっても異なる種類の宿主細胞であってもよく、たとえば、前記第1の宿主細胞がCD8セントラルメモリー細胞であり、かつ前記第2の宿主細胞がナイーブCD4細胞であってもよい。いくつかの実施形態においては、第1の宿主細胞および第2の宿主細胞はそれぞれ、CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞、CD4セントラルメモリー細胞およびこれらの組み合わせからなる群から選択される。
本発明の開示は、養子免疫療法組成物の製造方法、および、疾患または障害を有する対象において細胞免疫療法を行うための、該組成物の使用、または疾患または障害を有する対象において組成物を使用して細胞免疫療法を行う方法を提供する。
いくつかの実施形態では、本発明の方法は、
単離された核酸を宿主細胞に導入すること、および
少なくとも1つの増殖因子を含む培地中で前記宿主細胞を培養することを含み、
前記単離された核酸は、たとえば、単離されたポリペプチドをコードする核酸であり、
該単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合することを特徴とする。
いくつかの実施形態において、本発明の方法は、前記培養工程の前もしくは後またはその前後に、Her2tを発現している宿主細胞を選択することをさらに含む。別の実施形態においては、本発明の製造方法は、第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸を前記宿主細胞に導入することをさらに含む。いくつかの実施形態において、前記方法は、前記培養工程の前もしくは後またはその前後に、前記第2の遺伝子タグを発現している宿主細胞を選択することをさらに含む。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。
単離された第1の核酸を第1の宿主細胞に導入すること、
Her2tを発現している第1の宿主細胞を選択すること、
第2のキメラ抗原受容体および第2の遺伝子タグをコードする第2の核酸を第2の宿主細胞に導入すること、
前記第2の遺伝子タグを発現している第2の宿主細胞を選択すること、ならびに
任意に、少なくとも1つの増殖因子を含む培地中で前記第1の宿主細胞および第2の宿主細胞を培養することを含み、
前記核酸が、たとえば、配列番号23において膜貫通ドメインに連結した511〜652番目または563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%の配列同一性を有する単離されたポリペプチドをコードする核酸であること、ならびに
該単離されたポリペプチドが、Her2のドメインIVのエピトープに結合する抗体に特異的に結合することを特徴とする方法が提供される。
別の実施形態では、組成物は第1の宿主細胞集団および第2の宿主細胞集団を含む。
において細胞の追跡を可能にするため、抗体は検出可能な標識で標識される。いくつかの実施形態において、インビボでの検出に抗体を使用する場合、ADCC反応を回避するため、前記抗体または抗原結合フラグメントは、Fc領域全体またはその一部を含んでいないことが好ましい。検出可能な標識としては、ビオチン、Hisタグ、mycタグ、放射標識、および/または蛍光標識が挙げられる。いくつかの実施形態において、検出可能な標識は、ビオチン、Hisタグ、mycタグ、放射標識、および/または蛍光標識を含む。
遺伝子改変細胞傷害性Tリンパ球製剤および/または遺伝子改変ヘルパーTリンパ球製剤を対象に投与することを含み、
前記細胞傷害性Tリンパ球製剤が、細胞性免疫応答を提供し、かつキメラ受容体を有するCD8+T細胞を含み、該キメラ受容体が、本明細書に記載されているように、腫瘍細胞の表面分子に特異的なリガンド結合ドメイン、スペーサードメイン、膜貫通ドメイン、細胞内シグナル伝達ドメインおよび第1の遺伝子タグを含むこと、ならびに
前記ヘルパーTリンパ球製剤が、腫瘍の直接認識を誘導するとともに、前記遺伝子改変細胞傷害性Tリンパ球製剤が細胞性免疫応答を媒介する能力を増強し、かつキメラ受容体を有するCD4+T細胞を含み、該キメラ受容体が、腫瘍細胞の表面分子に特異的なリガンド結合ドメイン、スペーサードメイン、膜貫通ドメイン、細胞内シグナル伝達ドメインおよび第2の遺伝子タグを含むことを特徴とする。
前記対象の生体試料を分析して、前記疾患または障害に関連する標的分子の存在を検出すること、および
本明細書に記載の養子免疫療法組成物を投与することを含み、前記キメラ受容体が、前記標的分子に特異的に結合することを特徴とする方法に関する。
いくつかの実施形態においては、単離されたポリペプチドであって、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする単離されたポリペプチドが提供される。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていることを特徴とする単離されたポリペプチドが提供される。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていることを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列L E G G G E G R G S L L T C G(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。いくつかの実施形態において、前記単離された核酸の大きさとしては、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kbもしくは14.9kb、またはこれらの大きさのいずれか2つの間にある任意の大きさが挙げられる。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていることを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列L E G G G E G R G S L L T C G(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。いくつかの実施形態においては、前記宿主細胞は、CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞、CD4セントラルメモリー細胞およびこれらの組み合わせからなる群から選択される。いくつかの実施形態においては、前記宿主細胞は自己由来である。いくつかの実施形態においては、前記宿主細胞は抗原特異的である。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。いくつかの実施形態において、前記単離された核酸の大きさとしては、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kbもしくは14.9kb、またはこれらの大きさのいずれか2つの間にある任意の大きさが挙げられる。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていることを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列L E G G G E G R G S L L T C G(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。いくつかの実施形態においては、前記宿主細胞は、CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞、CD4セントラルメモリー細胞およびこれらの組み合わせからなる群から選択される。いくつかの実施形態においては、前記宿主細胞は自己由来である。いくつかの実施形態においては、前記宿主細胞は抗原特異的である。いくつかの実施形態においては、前記宿主細胞はT細胞前駆細胞である。いくつかの実施形態においては、前記宿主細胞は造血幹細胞である。いくつかの実施形態において、前記単離された核酸の大きさとしては、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kbもしくは14.9kb、またはこれらの大きさのいずれか2つの間にある任意の大きさが挙げられる。
単離された核酸を宿主細胞に導入すること、および
少なくとも1つの増殖因子を含む培地中で前記宿主細胞を培養することを含む方法が提供される。
いくつかの実施形態においては、前記単離された核酸はポリペプチドをコードする。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態においては、前記リーダーペプチドは配列番号17で表される配列を有する。いくつかの実施形態では、前記抗体はトラスツズマブである。
いくつかの実施形態においては、前記単離されたポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、
完全長成熟HERではないこと、および
前記配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインが、GGGSGGGS(配列番号45)で示されるアミノ酸を含む配列を介して前記膜貫通ドメインに連結されていることを特徴とする。
いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミンを含む。いくつかの実施形態においては、前記HER2ポリペプチドは、配列番号23の563〜652番目のアミノ酸を含む。いくつかの実施形態では、前記膜貫通ドメインは、配列番号23の653〜675番目のアミノ酸を含む。いくつかの実施形態では、前記単離されたポリペプチドは、細胞表面発現を可能とするリーダーペプチドをさらに含む。いくつかの実施形態では、前記リーダーペプチドは、配列番号17で表されるアミノ酸配列を含む。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態では、前記単離された核酸はプロモーターをさらに含む。いくつかの実施形態では、前記単離された核酸は導入遺伝子をさらに含む。いくつかの実施形態では、前記導入遺伝子は、キメラ抗原受容体をコードするポリヌクレオチドを含む。いくつかの実施形態では、前記キメラ抗原受容体は、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含む。いくつかの実施形態では、前記導入遺伝子をコードするポリヌクレオチドは、自己切断リンカーを有する前記HER2ポリペプチドをコードする前記核酸に連結されている。
いくつかの実施形態においては、前記HER2ポリペプチドは、
配列番号23において膜貫通ドメインに連結した563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインからなるポリペプチドと少なくとも95%、96%、97%、98%または99%の配列同一性を有し、
Her2のドメインIVのエピトープに結合する抗体に特異的に結合すること、および
完全長成熟HER2ではないことを特徴とする。
いくつかの実施形態においては、前記自己切断リンカーは、配列L E G G G E G R G S L L T C G(配列番号26)を有するT2Aリンカーである。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号2のアミノ酸配列を含む。いくつかの実施形態においては、前記キメラ抗原受容体は、配列番号25(CD20CAR)のアミノ酸配列を含む。いくつかの実施形態においては、前記宿主細胞は、CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞、CD4セントラルメモリー細胞およびこれらの組み合わせからなる群から選択される。いくつかの実施形態においては、前記宿主細胞は自己由来である。いくつかの実施形態においては、前記宿主細胞は抗原特異的である。いくつかの実施形態においては、前記増殖因子は、IL−15、IL−7、IL−21、IL−2およびこれらの組み合わせから選択される。いくつかの実施形態においては、前記方法は、前記Her2tポリペプチドを発現している細胞を選択することをさらに含む。いくつかの実施形態においては、前記細胞は、前記培地中での培養前に選択される。いくつかの実施形態においては、前記細胞は、Her2のドメインIVに結合する抗体を使用して選択する。いくつかの実施形態では、前記抗体はトラスツズマブである。いくつかの実施形態においては、前記方法は、第2の遺伝子タグに連結されたキメラ抗原受容体をコードする第2の単離された核酸を導入することをさらに含む。いくつかの実施形態においては、前記方法は、前記第2の遺伝子タグを発現している細胞を選択することをさらに含む。いくつかの実施形態においては、前記第2の遺伝子タグはEGFRtを含む。
蛍光色素標識アイソタイプコントロール、抗CD3、抗CD4、抗CD8、抗CD45、Her2、およびストレプトアビジンはBD Biosciencesから入手した。セツキシマブ(アービタックス)およびトラスツズマブ(ハーセプチン)はシアトル小児病院から購入した。製造元の説明書に従って、アービタックスおよびハーセプチンをビオチン化(Pierce)するか、あるいはAPC(Solulink)に直接結合させた。データは、LSRFortessa(BD Biosciences)測定し、分析した領域中の細胞のパーセンテージは、FlowJoデータ解析ソフトウェアを使用して算出した。
別途の記載がない限り、細胞株はいずれも、2mM L−グルタミン、25mM HEPES(Irvine Scientific)および10%加熱不活性化ウシ胎仔血清(HycloneまたはAtlas)を添加したRPMI 1640培地中で維持した。K562赤白血病標的細胞株は、Stanley Riddell博士(Fred Hutchinson Cancer Research Center)から提供を受けた。その他の細胞株、すなわちH9 Tリンパ芽球、Raji(ヒトバーキットリンパ腫)、および293T(高効率に遺伝子を導入することが可能なヒト胎児腎293細胞)は、American Type Culture Collectionから入手した。過去の報告(Pelloquin et al. 1986)に従って、エプスタインバーウイルスで形質転換したリンパ芽球様細胞株(TM-LCL)を末梢血単核球(PBMC)から作製した。GFP:ffluc発現細胞株をGFP:ffluc_epHIV7で形質導入し、BD FACSJazzソーターを使用してソートした。
第2世代41BB-ζ CD19CAR-T2A-EGFRt_epHIV7レンチウイルス構築物は、過去に報告(Hudecek et al. 2013)されている(表1)。
と同じシグナル伝達成分と、IgG4のヒトIgG4ヒンジ−CH3(119アミノ酸長)スペーサードメイン部分に融合させたLeu16(マウス抗ヒトCD20)scFvとを含む(表9)。
用い、epHIV7レンチウイルスベクターをレシピエントとして使用して、Her2tをPCRにより合成した(表6および表8)。最終生成物であるHer2t_epHIV7は、ドメインIV(563〜652番目のアミノ酸)およびHer2の膜貫通成分(653〜675番目のアミノ酸)にインフレームで融合させたヒト顆粒球・マクロファージコロニー刺激因子受容体のリーダーペプチド(GMCSFRss)を含む。CD19CAR-T2A-EGFRt_epHIV7構築物は、PCRおよびGibsonクローニングによってHer2tをEGFRtで置換することにより作製した。EGFRtは、過去の報告(Wang et al. 2011)に従って合成した(表7)。
において産生させた。
CD4セントラルメモリーT細胞またはCD8セントラルメモリーT細胞を作製するため、Ficoll-Paque(Pharmacia Biotech)を使用して、健常ドナーの血液処分キット(Puget Sound Blood Center)からヒトPBMCを単離した。製造元のプロトコルに従って、各ドナー由来のPBMCを2つのグループ(CD4セントラルメモリーT細胞またはCD8セントラルメモリーT細胞の単離用)に分け、次いで、CD4単離キットまたはCD8単離キットおよび抗CD45RAマイクロビーズ(Miltenyi Biotec)を使用して、AutoMACSで不要な細胞を除去した。その後、抗CD62Lマイクロビーズを使用して除去画分をAutoMACSでポジティブ選択し、CD4+CD45RO+CD62L+セントラルメモリーT細胞またはCD8+CD45RO+CD62L+セントラルメモリーT細胞を得た。次に、単離された細胞を50U/mlインターロイキン−2(IL−2)、2ng/mlインターロイキン−15(IL−15)、および抗CD3/CD28ビーズ(Life Technologies)で刺激した。初代T細胞株を硫酸プロタミン(1:100希釈)およびMOI=1のウイルスで活性化した3日目に形質導入を行い、32℃、800×gで45分間遠心分離した。他の細胞株はいずれも少ない継代数で同様に形質導入した。
で標識したハーセプチンまたはアービタックスと抗ビオチンマイクロビーズ(Miltenyi)とを使用して免疫磁気選択を行うことにより、各細胞株のHer2t+サブセットまたはEGFRt+サブセットを濃縮した。50U/ml IL−2および2ng/ml IL−15の存在下、放射線照射(8000 rad)したTM−LCLをT細胞:TM−LCL=1:7の比率で使用して、選択されたCD19CAR+T細胞またはCD20CAR+T細胞を刺激することによって、形質導入後12〜18日間増殖させた。ビオチン化ハーセプチンおよび抗ビオチンマルチソートマイクロビーズ(Miltenyi)を使用してCD19CAR-T2A-Her2t+T細胞またはCD20CAR-T2A-EGFRt+T細胞をソートし、次いでビーズを除去し、アービタックス−APCで細胞を標識し、抗APCマイクロビーズ(Miltenyi)を使用してソートした。
プロテアーゼ阻害剤反応混液を含むRIPA緩衝液中で細胞溶解を行った。細胞溶解物をBCAアッセイ(Pierce)により分析し、ゲルに同量で載せ、Her2一次抗体、phospho−Her2一次抗体(いずれもCell Signaling Technology)、抗CD247(CD3ζ)、ビオチン化ハーセプチン、または抗βアクチン(ローディングコントロール)を使用してウェスタンブロットを行った。製造元の説明書に従って、IRDye800CW標識ストレプトアビジン二次抗体またはヤギ抗マウス抗体もしくはヤギ抗ウサギ抗体(LI-COR)を加えた。Odyssey赤外イメージングシステム(LI-COR)でブロットを画像化した。
細胞傷害性:
過去の報告(Wang et al. 2011)に従って、4時間クロム放出アッセイを実施した。CD19またはCD20を発現している5×103個のCr51標識K562細胞との共培養において、Her2tマーカーを有するCD19CARを発現しているTcm細胞、EGFRtマーカーを有するCD20CARを発現しているTcm細胞、CD19CAR−Her2tおよびCD20CAR−EGFRtを発現しているTcm細胞、ならびにEGFRtマーカー配列を有するCD19CARを発現しているTcm細胞をエフェクター細胞として最大で2.5×105個使用して、抗体依存性細胞傷害(ADCC)を測定した。
T細胞(5×105個)と標的細胞をE:T=2:1の比率で96ウェルプレートに三連で播種し、製造元の説明書に従ってBio-Plex Human Cytokine Panel(Bio-Rad)を使用して、上清をcytometric bead arrayにより解析した。
0.2μMのカルボキシフルオレセインスクシンイミジルエステル(CFSE;Invitrogen)でT細胞を標識し、洗浄後、外因性サイトカインを含まない培地中に刺激細胞とともに三連で播種した。72時間のインキュベーションの後、細胞を抗CD3で標識して生死染色法し、次いでフローサイトメトリーで分析して生存していたCD3+細胞の細胞分裂を評価した。
マウスを用いた実験は、Seattle Children’s Research Instituteの実験動物委員会によって承認された。NOD/Scid IL2RγCnullマウスをJackson Laboratoryから入手するか、研究所内で繁殖させた。
6〜10週齢のNOD/Scid IL2RγCnullマウスに、0日目において107個のHer2t/EGFRt陰性(Mock)、選択されたHer2tT細胞または選択されたEGFRtT細胞を静脈内に注射し、5×106個の生存可能なNS0-IL15細胞を皮下に注射して、ヒトIL−15をインビボ全身に供給した。14日後にマウスを屠殺して骨髄を採取し、BD Biosciencesから入手した抗CD45、生死染色、抗CD4、抗CD8、ビオチン化ハーセプチン、ビオチン化アービタックス、およびストレプトアビジン−APCを使用して、細胞懸濁液をフローサイトメトリーにより分析した。これとは別に、大腿骨を10%のホルマリンで24時間固定し、2時間脱灰し(Richard-Allan Scientific)、パラフィンに包埋した後、製造元の説明書に従って、抗CD45(DAKO)、抗EGFR(クローン31G7;Invitrogen)、またはビオチン化ハーセプチンおよびSA−AF647を使用して免疫組織化学的染色を行い、Hoechstで対比染色した。同様に、Her2+細胞株またはHer2t+細胞株をポリ−L−リシンを使用してスライドに接着させ、ビオチン化ハーセプチンおよびSA−AF647を使用して染色した。Nuance FX Biomarker Imaging Systemを使用して蛍光像を取得した。
Prism Software(GraphPad)を使用して統計解析を行った。対応のある両側検定として、95%の信頼区間でスチューデントのt検定を行い、0.05未満のP値を有する結果を有意と見なした。生存の統計解析をログランク検定により行い、0.05未満のP値を有する結果を有意と見なした。
養子療法戦略において臨床的成功を収め、再現性を高めるには、均質な免疫細胞製品を選択し、それを使用することが不可欠である。これを目的として、ヒトHer2に基づいた非免疫原性エピトープ(Her2tと呼ぶ)を、細胞を改変するための遺伝子タグ候補および遺伝子ツール候補として設計した(図1パネルA)。Her2tはHer2の細胞内成分を全く含んでいないが、Her2の膜貫通領域、モノクローナル抗体であるトラスツズマブ(ハーセプチン)により認識される高次構造的に完全な結合エピトープ(conformationally intact binding epitope)、および表面発現を容易とするGMCSFRssを含んでいる(図1パネルB)。まず、Her2t構築物の3種のバリアント、すなわち、Her2ドメインIVの完全長を含む1つの構築物と、ハーセプチンと複合体化したHer2の三次元構造(Garrett et al 2007; Cho et al 2003)から設計した2つの最小コンフォメーショナルエピトープとをレンチウイルスパッケージングプラスミドepHIV7に組み込み、CHO細胞においてその特性を評価した。図1のパネルBに概略を示した563〜652番目のアミノ酸を含むHer2t構築物は、ビオチン化ハーセプチンおよびストレプトアビジン標識蛍光色素を使用したフロー分析によって、最も高い一時的な表面発現を示したことから、さらに下流の特性評価を行うために選択した(データ示さず)。
一時的発現の分析を最初に実施した後、Her2tを含むepHIV7を使用して、VSV-g偽型自己不活性化レンチウイルスを作製した。その後、得られたウイルスを複数種の細胞に形質導入し、8.2〜65%の細胞がHer2t+である集団を複数得た(データは示さず)。その代表例として、形質導入されたK562赤白血病細胞(13.8%の細胞がHer2t+)を示す(図2パネルA)。導入遺伝子を有する細胞集団を選択的に濃縮するための標的としてHer2tが有用であるかどうかを評価するために、ビオチン化ハーセプチンおよび抗ビオチンマイクロビーズを使用して、形質導入K562集団を2段階で免疫磁気精製した。この処理により、95%以上の細胞がHer2t+である細胞集団が一貫して得られた(図2パネルB)。その後の滴定実験により、106個のHer2t+細胞を最大限に標識するには、1.2ng以下のビオチン化ハーセプチンで十分であったことが明らかになった(図2パネルA)。
で選択されたHer2t+発現細胞または完全長Her2+発現細胞について、Her2tおよび完全長Her2のウエスタン免疫ブロット分析をそれぞれ同様に実施した。予測されたように、市販のHer2抗体を使用した場合、185kDaの完全長Her2タンパク質は、完全長Her2発現細胞の溶解物のみで検出された。同様に、Her2のリン酸化は、ニューレグリンで処理した完全長Her2発現細胞の溶解物のみで検出された。ビオチン化ハーセプチンで検出した場合、Her2tのバンドはHer2t+細胞の溶解物のみで検出された(図2パネルD)。
キメラ抗原受容体(CAR)を発現している治療用T細胞を選択するための非常に効率的な選択エピトープ(EGFRtと呼ばれる)は、過去に同定されている(Wang et al 2011)。本願では、CAR含有ウイルスベクターにおいてHer2tを同調発現させることによって、広範囲に適用可能なエクスビボ遺伝子改変CAR治療薬の臨床適用が容易になるかどうかを評価した。さらに、Her2tを使用することによって、CARリダイレクト治療用T細胞の選択マーカーとして使用可能な非免疫原性選択マーカーのレパートリーを増やすことができ、また、Her2tは、EGFRtによる選択の代替または補助的手段として使用することができる(すなわち、複数の腫瘍抗原候補に対する二重特異性をT細胞に付与するものである)。
の評価を目的として、Her2tとの共発現を誘導するため、過去に報告されているCD19CAR(Hudecek et al 2013)とリボソームスキップT2A配列とを含むマルチドメインDNA構築物を構築した(図1パネルC)。その後、得られたCD19CAR-T2A-Her2t構築物をepHIV7に組み込み、前述のようにウイルスを作製した。
の発現と比較したときの選択マーカーとしてのHer2tの機能、またはEGFRtの発現と同調させたときの選択マーカーとしてのHer2tの機能を評価するために、CD4+またはCD8+セントラルメモリー(Tcm)細胞(図3パネルA)を、各種のCAR-T2A-Her2t含有ウイルスベクターおよび/またはCAR-T2A-EGFRt含有ウイルスベクターで形質導入した(図3パネルB)。単一のCAR含有ベクターで形質導入したCD4+またはCD8+Tcmでは、ビオチン化ハーセプチン(Her2t)またはビオチン化アービタックス(EGFRt)と抗ビオチンマイクロビーズとを使用した免疫磁気選択を行う前は22〜72%の細胞がHer2t+またはEGFRt+であったが、免疫磁気選択を行った後では、一貫して均一な純度(>90%)に濃縮された(図3B)。これとは別に、マルチソートと抗APCビーズとの組み合わせ(「材料および方法」参照)を使用して、Her2t+およびEGFRt+の二重形質導入細胞を免疫磁気的にソートしたところ、90%を超える導入遺伝子二重陽性細胞が得られた(図6)。
多くのがんでは、標的抗原をダウンレギュレートさせたり変異させたりすることによって、治療を回避している。したがって、複数の腫瘍関連抗原を同時に標的とすることは、腫瘍による回避を克服するための有望な治療アプローチであり、治療用T細胞の治療用途の拡大しうるものである。表面マーカー(Her2tおよびEGFRt)の選択による2種のCAR(CD19-CARおよびCD20-CAR)の共発現によって、CARリダイレクトT細胞の機能特性を向上させることできるかどうかを評価するため、二重CAR発現Tcmのインビトロにおける機能を、単一のCARを発現するTcmと比較した。細胞傷害性分析の結果、CARリダイレクトTcmサブセット(CD19-CAR発現Tcmサブセット、CD20-CAR発現Tcmサブセット、またはCD19-CARとCD20-CARとを共発現するTcmサブセット)はいずれも、CD19発現K562細胞、CD20発現K562細胞、またはCD19およびCD20を発現するK562細胞に対して類似したレベルの特異的な溶解性を示したが(図4パネルA)、CD19−/CD20−のK562標的親細胞の認識を媒介しなかったことが示された(図4パネルB)。
、K562標的パネルに対する、二重CAR発現TcmのCD19およびCD20による協同機能を試験したところ(図4パネルB)、いずれの標的発現K562細胞に対しても特異的な溶解性を示したのは二重CAR発現Tcmのみであったことが分かった。これに対して、CD19特異的CAR発現Tcm細胞またはCD20特異的CAR発現Tcm細胞は、これらのコグネイト標的抗原を発現しているK562細胞の細胞溶解活性を誘導するのに留まった(図4パネルB)。
による刺激に応答したサイトカイン産生の定量分析では、前記と類似した特異性が示されている。CARを発現していないTcmでは、K562親細胞との共培養に応答してサイトカインが産生された。これに対して、二重CAR発現Tcmでは、いずれの標的発現細胞とも共培養に応答してIL−2、IFNγおよびTNFαが産生されたが、単一のCARを発現するTcmでは、サイトカインの産生はK562/CD19-CD20標的細胞およびK562/CD19標的細胞またはK562/CD20標的細胞でしか見られなかった(図4パネルC)。これらの結果から、二重CAR発現TcmのみがCD19およびCD20に対する二重特異性を示し、CD19およびCD20のいずれかの抗原と遭遇したときにT細胞の活性化および標的化を媒介できることが示された。興味深いことに、Her2tにより選択されたCD19CAR発現Tcmは、EGFRtにより選択されたCD19CAR発現Tcmと比較して、多様性が増しており、(たとえば約2〜3倍に)亢進されたサイトカインプロファイルを示した(図3パネルD)。これは、Her2tを使用することによってストリンジェントな選択が可能となり、Her2tにより選択されたTcmでは総CARの発現量が増加していることに起因していると考えられる。
の抗腫瘍活性は、移入したT細胞の増殖および生存と相関するため、CAR改変Tcmをそれぞれの標的と接触させた場合の増殖をCFSE希釈アッセイにより分析した。刺激を加えた後の二重CAR発現によるTcmの増殖は、CD19CAR発現Tcmと同等のレベルまで亢進されたことが見出された。
現在まで、CAR療法臨床試験の大部分では、PCRに基づく技術によって、治療投与後の遺伝子改変細胞の持続性を定量してきた。Her2tなどの治療特異的遺伝子タグを使用することによって、多くのパラメータによる表現型の分析が可能となり、また、注入されたCAR T細胞サブセットのうち、治療応答と相関しうるもの特定することが可能となる。
nullマウスにCD19CAR+Her2t+CD4 TcmおよびCD19CAR+Her2t+CD8 Tcmを移植し、このマウスから骨髄検体を採取し、検体を処理した後、試料をフローサイトメトリーで分析した(図5パネルA)。マーカー陰性かつHer2t+EGFRt+の細胞を投与したマウスと同等レベルのCD45+T細胞の生着が認められた(図5パネルB)。CD45+T細胞サブセットのうち、CD8の二重染色が11.7〜45.7%の細胞で見られ、CD4+T細胞が優位に増殖されたことが示された。さらに、ビオチン化ハーセプチンおよびAPC標識ストレプトアビジンを使用したHer2tの共染色により、Her2t+T細胞とHer2t陰性T細胞とを区別することができた(図5パネルC)。これらの結果から、Her2tは養子移入されたT細胞の有効な追跡マーカーであることが示された。
おいて有効な標的となるかどうかを判定した。予備試験として、Her2t+細胞をスライドに接着させ、ビオチン化ハーセプチンおよび蛍光色素標識ストレプトアビジンで染色した(図5パネルD)。
治療中に有害な臨床的事象が発生した場合に備えて、投与するT細胞に安全機構を組み込むことは有利である。GMCSF刺激PBMCとハーセプチンまたはアービタックスとを加えて共培養することによって、Her2t+T細胞またはEGFRt+T細胞のインビトロ細胞傷害性分析を行う。
×106個の親細胞、Her2t+細胞、EGFRt+細胞、またはHer2t+/EGFRt+細胞)を混合し、精製を行った(図6)。まず、ビオチン化ハーセプチンおよび抗ビオチンマルチソートビーズを使用して細胞を精製した。その後、マルチソートビーズを除去した後、アービタックス−APCおよび抗APCマイクロビーズを使用して陽性画分を精製した。最終的に得られた陽性画分は、Her2tおよびEGFRtに対して二重陽性であった(図6)。
において、抗体依存性細胞傷害を誘導することが可能なエフェクター細胞として機能する。ハーセプチンまたはアービタックスを共培養に加え、Her2t+細胞またはEGFRt+細胞を選択的に除去することを目的とする。これらの試験は、Her2tまたはEGFRtを共発現するffluc+Tcmを使用することによって、インビボで行うことができる。この実験条件では、TcmはNOD/Scid IL-2RγCnullマウスに移植され、続いて、ハーセプチンまたはアービタックスと新たに活性化させたPBMCとが投与される。移入されたTcmのインビボでの生着および抗体媒介性除去は、インビボでのバイオフォトニックイメージングにより測定される。ハーセプチンまたはアービタックスにより媒介された除去は、Her2t発現Tcm、EGFRt発現Tcm、またはその両方のマーカーを発現しているTcmに特異的である必要がある。
この実験は、インビボにおいて選択的な抗腫瘍活性を付与することを目的とする。CD19+、CD20+、またはCD19/CD20+であるK562 ffluc+腫瘍細胞は、NOD/Scid IL-2RγCnullマウスの左脇腹または右脇腹に皮下注射することによって樹立する。腫瘍が樹立された後、CD19CAR-Her2t発現Tcm、CD19CAR-EGFRt発現Tcm、CD20CAR-EGFRt発現TcmまたはCD19CAR-Her2t発現TcmおよびCD20 CAR発現Tcmを静脈内に注射し、バイオフォトニックイメージングによりT細胞特異性を測定する。腫瘍のルシフェラーゼ活性(総光子量)の低下によって、腫瘍の縮小が示される。
を処置した場合、すべての標的腫瘍において腫瘍の縮小が起こると考えられるが、コグネイトなCARを発現しているTcmでマウスを処置した場合は、CD19またはCD20のみを発現するK562腫瘍が退縮すると考えられる。あるいは、前述のようにCD19+K562細胞、CD20+K562細胞、またはCD19/CD20+K562細胞を樹立し、腫瘍が樹立された後にffluc+CAR+Tcmを投与する。CAR特異性に基づくTcmの局在は、バイオフォトニックイメージングにより決定される。二重選択Her2t+EGFRt+T細胞は、K562腫瘍上の標的抗原に関係なくCD19および/CD20が陽性の細胞に局在化すると考えられるが、CD19またはCD20のCAR発現細胞は、それらの標的抗原に特異的なK562腫瘍に局在化すると考えられる。
Her2tおよびHer2tGの一次配列の模式図を図7に示す。Her2tGは、Her2のドメインIVと膜貫通領域との間にリンカー配列が付加された点でHer2tとは異なり、配列GGGSGGGS(配列番号45)を含み、このような構築物をHer2tGと呼ぶ。Her2tまたはHer2tGを有するレンチウイルスをMOI=1で使用して、H9細胞に形質導入した。その後、製造元のプロトコルに従って、ビオチン化ハーセプチンおよび抗ビオチンマイクロビーズにより形質導入細胞を精製した。その後、ビオチン化ハーセプチンおよびストレプトアビジン−PEを使用して、精製した細胞集団のHer2t染色またはHer2tG染色を行った。ヒストグラムは、Her2tGへの結合の方が強いことを示す(図8)。図9に示すように(左のグラフから右のグラフの方向に参照されたい)、0.05μl、0.1μl、0.25μl、0.5μl、1μlまたは3μlのレンチウイルスでH9細胞に形質導入した5日後にハーセプチンへの結合について分析した。Her2tのバリアントであるHer2t(CD28ヒンジ)は、元のHer2tと同レベルでハーセプチンに結合することができた(Her2t染色は示していないが、過去の実験に基づく)。Her2t(IgG4ヒンジ)は、Her2tまたはHer2t(CD28ヒンジ)よりもハーセプチンへの結合が増強されたが、Her2tGバリアントは、ハーセプチンに結合する能力が最も高く、形質導入H9細胞を染色する能力も最も高かった。
は、cDNAフットプリントが最低限の大きさのため、単独で発現させることができ、あるいは、生物学的に活性な導入遺伝子、すなわちキメラ抗原受容体(CAR)とともに自己不活性化型レンチウイルスベクターに同調的に組み込むこともできることが示された。T2Aリボソームスキップリンカーを介してHer2tをCARに付加することによって同調的な導入遺伝子の発現が達成され、この同調的な導入遺伝子の発現は、Her2tにより精製されたCD8セントラルメモリーT細胞をフロー分析およびウェスタンブロット分析することによって検証された。さらに、Her2tは、EGFRtによる選択よりもストリンジェントな選択を行うことができる選択エピトープであり、CARの発現が強くかつエフェクターサイトカインの産生が増加したT細胞をエクスビボで選択することを可能にするものであることも示された。このような特徴は、CAR療法を複数の種類の腫瘍の治療に適用する場合のように、さらに高い導入遺伝子の発現が望まれる場合に有利であると考えられる。
において導入遺伝子の発現レベルを高めることに加えて、複数の腫瘍抗原に対する二重特異性を個々のT細胞に付与することも臨床的に有益であると考えられる。実際に、標的抗原のダウンレギュレーションや変異は、様々な種類のがんにおいて見られ、そのため、単一のCARによる治療戦略を超えた戦略が必要とされている。これに伴って、Her2tは、EGFRtに対する相補的な選択エピトープであることが示され、このような選択エピトープをそれぞれのCARに付加した場合に、マルチソーティングによる二重CAR発現T細胞の精製が容易になることが示された。細胞傷害性活性およびエフェクターサイトカインの産生は、単一のCARを発現するT細胞と二重CAR発現T細胞との間でほとんど差がなかったことから、Her2tおよびEGFRtを個別に発現させたり、これらを同調的に発現させても、何ら明白な機能障害は生じないことが示された。
、ビオチン化または化学標識に適している。ハーセプチンは市販用に製剤化されているため、臨床グレードのH2Oで再構築され、ビオチン化された後でもHer2に特異的な結合親和性が高いまま保持されている。このような理由と、cGMPグレードの抗ビオチンマイクロビーズ(Miltenyi Biotec)の入手が容易であることから、CliniMACS装置上での治療的に有意義なHer2t+細胞の選択が可能となる。13.8%程度のHer2t陽性しか含まない細胞集団を、90%を超える純度にまで免疫磁気的に濃縮することができることが示された。さらに、これらの結果から、T細胞マーカーを標的とする抗体とビオチン化ハーセプチンとを組み合わせて、多くの表現型パラメータを分析すること、および治療的CAR発現T細胞のインビボでの分布を追跡することが可能になることが示された。
適用範囲は、血液由来腫瘍の治療における最初の成功を踏まえて、急速に拡大し続けている。本質的に非免疫原性で、T細胞集団に特異的であり、かつ高効率に選択できる遺伝子タグの代替が必要とされているのは明らかである。Her2tは、上述の特徴を包含し、CAR療法に使用可能な選択エピトープのレパートリーを増やすことができる。さらに、Her2tは、マルチプレックス遺伝的システムによるCAR治療薬を同調的に選択するための有力な候補である。
を使用することの利点は、その小さいサイズにある。したがって、Her2tは、自体よりも大きな構築物においてパッケージング効率がよいという利点を有する。このシステムを利用するためには、5kb未満の構築物にすることが好ましい。いくつかの実施形態において、構築物のサイズは、5kb、6kb、7kb、8kb、9kb、10kb、11kb、12kb、13kb、14kb、14.9kb、またはこれらの構築物サイズのいずれか2つの間の任意のサイズである。15kbを超える構築物は力価が低くなる可能性があるため、構築物のサイズは小さくする必要がある。
Claims (17)
- 配列番号23の563〜652番目のアミノ酸配列を有するHER2ポリペプチド細胞外ドメインと少なくとも95%の配列同一性を有するポリペプチドであって、
Her2のドメインIVのエピトープに結合する抗体と特異的に結合すること、ならびに
配列番号23の23〜217番目のアミノ酸配列に対応するHer2のドメインI、配列番号23の218〜341番目のアミノ酸配列に対応するHer2のドメインII、配列番号23の342〜510番目のアミノ酸配列に対応するHer2のドメインIII、およびHer2の細胞内ドメインを含んでいないことを特徴とし、
前記細胞外ドメインがリンカーを介して膜貫通ドメインと連結し、
前記リンカーが、配列番号45のアミノ酸配列を含むポリペプチド。 - 前記HER2ポリペプチドが、配列番号23の580番目のグルタミン酸、582番目のアスパラギン酸、592番目のアスパラギン酸、595番目のフェニルアラニンおよび624番目のグルタミン、ならびに配列番号23の563〜652番目のアミノ酸配列または配列番号23の653〜675番目のアミノ酸配列を含む、請求項1に記載のポリペプチド。
- 細胞表面発現を可能とするリーダーペプチドをさらに含み、該リーダーペプチドが配列番号17に示される配列を含むリーダーペプチドである、請求項1または2に記載のポリペプチド。
- 前記抗体がHer2受容体に結合する、請求項1〜3のいずれか一項に記載のポリペプチド。
- 請求項1〜4のいずれか一項に記載の単離されたポリペプチドをコードするポリヌクレオチドを含む、単離された核酸分子。
- 第一のキメラ抗原受容体をコードするポリヌクレオチドをさらに含む、請求項5に記載の単離された核酸分子。
- 前記第一のキメラ抗原受容体が、抗原結合ドメイン、スペーサードメイン、膜貫通ドメインおよび少なくとも1つの刺激ドメインを含むこと、ならびに
前記第一のキメラ抗原受容体をコードするポリヌクレオチドが、配列番号26の配列を有するT2Aリンカーを有するポリペプチドをコードするポリヌクレオチドに連結されていることを特徴とする、請求項6に記載の単離された核酸分子。 - 前記第一のキメラ抗原受容体が、配列番号2に示されるアミノ酸配列または配列番号25に示されるアミノ酸配列を含む、請求項7に記載の単離された核酸分子。
- 請求項1〜4のいずれか一項に記載のポリペプチドまたは請求項5〜8のいずれか一項に記載の単離された核酸分子を発現する単離された宿主細胞であって、
CD8 T細胞、CD4 T細胞、CD4ナイーブT細胞、CD8ナイーブT細胞、CD8セントラルメモリー細胞およびCD4セントラルメモリー細胞からなる群から選択される、宿主細胞。 - 第2のキメラ抗原受容体と遺伝子タグとを含む第2のポリペプチドを含む、請求項9に記載の単離された宿主細胞。
- 前記単離されたポリペプチドが、配列番号2に示される配列を含む第1のキメラ抗原受容体と、配列番号25に示されるアミノ酸配列を含む第2のキメラ抗原受容体とを含む、請求項9または10に記載の単離された宿主細胞。
- 遺伝子タグがEGFRtを含む、請求項10または11に記載の単離された宿主細胞。
- 自己由来かつ抗原特異的であり、T細胞前駆細胞または造血幹細胞由来である、請求項9〜12のいずれか一項に記載の単離された宿主細胞。
- 前記宿主細胞上の第1のキメラ抗原受容体または第1および第2のキメラ抗原受容体によって認識される腫瘍抗原を有するがんの治療において使用するための、請求項9〜13のいずれか一項に記載の単離された宿主細胞。
- 前記宿主細胞上の第1のキメラ抗原受容体または第1および第2のキメラ抗原受容体と、遺伝子タグに特異的に結合する抗体とによって認識される腫瘍抗原を有するがんの治療において使用するための、請求項9〜13のいずれか一項に記載の単離された宿主細胞。
- 前記抗体が細胞傷害薬と結合しており、かつ/または検出可能な標識で標識されている、請求項15に記載の単離された宿主細胞。
- 前記抗体がハーセプチン(登録商標)またはアービタックス(登録商標)である、請求項15に記載の単離された宿主細胞。
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461977751P | 2014-04-10 | 2014-04-10 | |
| US61/977,751 | 2014-04-10 | ||
| US201461986479P | 2014-04-30 | 2014-04-30 | |
| US61/986,479 | 2014-04-30 | ||
| US201462058973P | 2014-10-02 | 2014-10-02 | |
| US62/058,973 | 2014-10-02 | ||
| US201462088363P | 2014-12-05 | 2014-12-05 | |
| US62/088,363 | 2014-12-05 | ||
| US201462089730P | 2014-12-09 | 2014-12-09 | |
| US62/089,730 | 2014-12-09 | ||
| US201462090845P | 2014-12-11 | 2014-12-11 | |
| US62/090,845 | 2014-12-11 | ||
| PCT/US2015/024895 WO2015157399A1 (en) | 2014-04-10 | 2015-04-08 | Transgene genetic tags and methods of use |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020164326A Division JP7106610B2 (ja) | 2014-04-10 | 2020-09-30 | 導入遺伝子の遺伝子タグおよびその使用方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2017518037A JP2017518037A (ja) | 2017-07-06 |
| JP2017518037A5 JP2017518037A5 (ja) | 2018-05-24 |
| JP6772068B2 true JP6772068B2 (ja) | 2020-10-21 |
Family
ID=54288361
Family Applications (12)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017504604A Active JP6788573B6 (ja) | 2014-04-10 | 2015-04-08 | メトトレキサートによる選択と組み合わせたSleeping Beautyトランスポゾンによる遺伝子改変T細胞の製造 |
| JP2016561839A Pending JP2017515464A (ja) | 2014-04-10 | 2015-04-08 | 細胞免疫療法のための方法および組成物 |
| JP2016561722A Active JP6772068B2 (ja) | 2014-04-10 | 2015-04-08 | 導入遺伝子の遺伝子タグおよびその使用方法 |
| JP2016561635A Active JP6765967B2 (ja) | 2014-04-10 | 2015-04-08 | 特定の組成を有する遺伝子により改変されたt細胞製剤 |
| JP2016561659A Active JP6765968B2 (ja) | 2014-04-10 | 2015-04-08 | 薬物制御による導入遺伝子の発現 |
| JP2020105133A Active JP7062720B2 (ja) | 2014-04-10 | 2020-06-18 | 細胞免疫療法のための方法および組成物 |
| JP2020155809A Active JP7093385B2 (ja) | 2014-04-10 | 2020-09-16 | 薬物制御による導入遺伝子の発現 |
| JP2020155429A Active JP7148580B2 (ja) | 2014-04-10 | 2020-09-16 | 特定の組成を有する遺伝子により改変されたt細胞製剤 |
| JP2020164326A Active JP7106610B2 (ja) | 2014-04-10 | 2020-09-30 | 導入遺伝子の遺伝子タグおよびその使用方法 |
| JP2022069142A Active JP7542270B2 (ja) | 2014-04-10 | 2022-04-20 | 細胞免疫療法のための方法および組成物 |
| JP2022112278A Active JP7402933B2 (ja) | 2014-04-10 | 2022-07-13 | 導入遺伝子の遺伝子タグおよびその使用方法 |
| JP2022150928A Active JP7508516B2 (ja) | 2014-04-10 | 2022-09-22 | 特定の組成を有する遺伝子により改変されたt細胞製剤 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017504604A Active JP6788573B6 (ja) | 2014-04-10 | 2015-04-08 | メトトレキサートによる選択と組み合わせたSleeping Beautyトランスポゾンによる遺伝子改変T細胞の製造 |
| JP2016561839A Pending JP2017515464A (ja) | 2014-04-10 | 2015-04-08 | 細胞免疫療法のための方法および組成物 |
Family Applications After (9)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016561635A Active JP6765967B2 (ja) | 2014-04-10 | 2015-04-08 | 特定の組成を有する遺伝子により改変されたt細胞製剤 |
| JP2016561659A Active JP6765968B2 (ja) | 2014-04-10 | 2015-04-08 | 薬物制御による導入遺伝子の発現 |
| JP2020105133A Active JP7062720B2 (ja) | 2014-04-10 | 2020-06-18 | 細胞免疫療法のための方法および組成物 |
| JP2020155809A Active JP7093385B2 (ja) | 2014-04-10 | 2020-09-16 | 薬物制御による導入遺伝子の発現 |
| JP2020155429A Active JP7148580B2 (ja) | 2014-04-10 | 2020-09-16 | 特定の組成を有する遺伝子により改変されたt細胞製剤 |
| JP2020164326A Active JP7106610B2 (ja) | 2014-04-10 | 2020-09-30 | 導入遺伝子の遺伝子タグおよびその使用方法 |
| JP2022069142A Active JP7542270B2 (ja) | 2014-04-10 | 2022-04-20 | 細胞免疫療法のための方法および組成物 |
| JP2022112278A Active JP7402933B2 (ja) | 2014-04-10 | 2022-07-13 | 導入遺伝子の遺伝子タグおよびその使用方法 |
| JP2022150928A Active JP7508516B2 (ja) | 2014-04-10 | 2022-09-22 | 特定の組成を有する遺伝子により改変されたt細胞製剤 |
Country Status (19)
| Country | Link |
|---|---|
| US (12) | US10865242B2 (ja) |
| EP (8) | EP3129053A4 (ja) |
| JP (12) | JP6788573B6 (ja) |
| KR (8) | KR102509481B1 (ja) |
| CN (7) | CN112877291A (ja) |
| AU (8) | AU2015243922B2 (ja) |
| BR (3) | BR112016023517A2 (ja) |
| CA (5) | CA2945305C (ja) |
| ES (2) | ES2867224T3 (ja) |
| IL (5) | IL297591A (ja) |
| MX (6) | MX2016013144A (ja) |
| MY (4) | MY185678A (ja) |
| NZ (3) | NZ739448A (ja) |
| PH (4) | PH12016502010A1 (ja) |
| RU (5) | RU2752275C2 (ja) |
| SA (1) | SA516380056B1 (ja) |
| SG (8) | SG11201608393TA (ja) |
| WO (5) | WO2015157386A1 (ja) |
| ZA (2) | ZA201607060B (ja) |
Families Citing this family (163)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100548667C (zh) * | 2003-01-20 | 2009-10-14 | 日本瑞翁株式会社 | 层合件及其制造方法 |
| ES2832586T3 (es) * | 2013-11-21 | 2021-06-10 | Autolus Ltd | Célula |
| IL297591A (en) | 2014-04-10 | 2022-12-01 | Seattle Childrens Hospital Dba Seattle Childrens Res Inst | Drug-related transgene expression |
| KR20220136455A (ko) | 2014-04-23 | 2022-10-07 | 주노 쎄러퓨티크스 인코퍼레이티드 | 입양 치료용 면역 세포 집단의 단리, 배양 및 유전자 조작 방법 |
| WO2015167766A1 (en) | 2014-04-29 | 2015-11-05 | Seattle Children's Hospital (dba Seattle Children's Research Institute) | Ccr5 disruption of cells expressing anti-hiv chimeric antigen receptor (car) derived from broadly neutralizing antibodies |
| SG11201703203RA (en) | 2014-10-20 | 2017-05-30 | Juno Therapeutics Inc | Methods and compositions for dosing in adoptive cell therapy |
| KR101697473B1 (ko) | 2014-11-26 | 2017-01-18 | 주식회사 녹십자랩셀 | T 세포를 이용한 자연살해세포의 배양방법 |
| EP3227323B1 (en) | 2014-12-03 | 2020-08-05 | Juno Therapeutics, Inc. | Methods and compositions for adoptive cell therapy |
| RU2766094C2 (ru) | 2014-12-05 | 2022-02-07 | Мемориал Слоан-Кеттеринг Кэнсер Сентер | Антитела, нацеленные на антиген созревания в-клеток, и способы их применения |
| WO2016100232A1 (en) | 2014-12-15 | 2016-06-23 | The Regents Of The University Of California | Bispecific or-gate chimeric antigen receptor responsive to cd19 and cd20 |
| MA41346A (fr) | 2015-01-12 | 2017-11-21 | Juno Therapeutics Inc | Eléments régulateurs post-transcriptionnels d'hépatite modifiée |
| AU2016206457B2 (en) | 2015-01-16 | 2021-11-11 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for ROR1 |
| WO2016138091A2 (en) * | 2015-02-24 | 2016-09-01 | Board Of Regents, The University Of Texas System | Selection methods for genetically-modified t cells |
| EP4091616A1 (en) | 2015-02-27 | 2022-11-23 | iCell Gene Therapeutics LLC | Chimeric antigen receptors (car) targeting hematologic malignancies, compositions and methods of use thereof |
| SG10201913682QA (en) | 2015-06-25 | 2020-03-30 | Icell Gene Therapeutics Llc | CHIMERIC ANTIGEN RECEPTORS (CARs), COMPOSITIONS AND METHODS OF USE THEREOF |
| US11173179B2 (en) | 2015-06-25 | 2021-11-16 | Icell Gene Therapeutics Llc | Chimeric antigen receptor (CAR) targeting multiple antigens, compositions and methods of use thereof |
| MX2018001568A (es) | 2015-08-07 | 2019-04-25 | Seattle Children´S Hospital Dba Seattle Children´S Res Institute | Celulas t biespecificas de receptor quimerico de antigeno (car) para focalizacion a tumores solidos. |
| BR112018005620A2 (pt) * | 2015-09-22 | 2018-10-09 | Univ Wuerzburg J Maximilians | método para transferência de gene estável e de nível elevado em linfócitos |
| BR112018006991A2 (pt) * | 2015-10-06 | 2018-10-16 | Hope City | receptores de antígeno quiméricos direcionados ao psca |
| CN108463228A (zh) * | 2015-10-23 | 2018-08-28 | 科罗拉多大学董事会法人团体 | 鳞状细胞癌的预后和治疗 |
| KR20180069067A (ko) | 2015-10-30 | 2018-06-22 | 엔비이-테라퓨틱스 아게 | 안티-ror1 항체 |
| US11020429B2 (en) | 2015-11-05 | 2021-06-01 | Juno Therapeutics, Inc. | Vectors and genetically engineered immune cells expressing metabolic pathway modulators and uses in adoptive cell therapy |
| MX2018007203A (es) * | 2015-12-14 | 2018-11-12 | Genomefrontier Therapeutics Inc | Sistema de transposon, kit que comprende el mismo, y sus usos. |
| US20180371052A1 (en) * | 2015-12-22 | 2018-12-27 | Icell Gene Therapeutics Llc | Chimeric antigen receptors and enhancement of anti-tumor activity |
| JP7000660B2 (ja) | 2016-01-20 | 2022-02-04 | ザ スクリプス リサーチ インスティテュート | Ror1抗体組成物及び関連の方法 |
| EP3202783A1 (en) * | 2016-02-02 | 2017-08-09 | Ecole Polytechnique Federale de Lausanne (EPFL) | Engineered antigen presenting cells and uses thereof |
| EP3430549A1 (en) | 2016-03-16 | 2019-01-23 | Juno Therapeutics, Inc. | Methods for adaptive design of a treatment regimen and related treatments |
| WO2017190100A1 (en) * | 2016-04-28 | 2017-11-02 | The Trustees Of Dartmouth College | Nucleic acid constructs for co-expression of chimeric antigen receptor and transcription factor, cells containing and therapeutic use thereof |
| CA3026778A1 (en) * | 2016-06-07 | 2017-12-14 | Max-Delbruck-Centrum Fur Molekulare Medizin In Der Helmholtz-Gemeinschaft | Chimeric antigen receptor and car-t cells that bind bcma |
| KR102652827B1 (ko) | 2016-06-08 | 2024-04-01 | 프레시전 인코포레이티드 | Cd33 특이적 키메라 항원 수용체 |
| EP4353750A3 (en) * | 2016-06-24 | 2024-07-24 | iCell Gene Therapeutics LLC | Chimeric antigen receptors (cars), compositions and methods thereof |
| US20190119636A1 (en) * | 2017-10-23 | 2019-04-25 | Poseida Therapeutics, Inc. | Modified stem cell memory t cells, methods of making and methods of using same |
| ES2939646T3 (es) | 2016-10-13 | 2023-04-25 | Juno Therapeutics Inc | Métodos y composiciones de inmunoterapia que comprenden moduladores de la vía metabólica del triptófano |
| US11739129B2 (en) | 2016-10-21 | 2023-08-29 | Washington University | AP4 and methods of promoting T cell activation |
| CN110234327A (zh) * | 2016-11-30 | 2019-09-13 | 英特拉克森公司 | 类固醇施用和免疫疗法 |
| MA46995A (fr) | 2016-12-03 | 2019-10-09 | Acerta Pharma Bv | Méthodes et compositions pour l'utilisation de lymphocytes t thérapeutiques en association avec des inhibiteurs de kinase |
| US11408005B2 (en) | 2016-12-12 | 2022-08-09 | Seattle Children's Hospital | Chimeric transcription factor variants with augmented sensitivity to drug ligand induction of transgene expression in mammalian cells |
| CN106800601B (zh) * | 2017-01-19 | 2021-04-06 | 广东昭泰体内生物医药科技有限公司 | 一种嵌合抗原受体及其应用 |
| MA47325A (fr) | 2017-01-20 | 2019-11-27 | Juno Therapeutics Gmbh | Conjugués de surface cellulaire et compositions cellulaires et méthodes associées |
| JP7228522B2 (ja) | 2017-02-27 | 2023-02-24 | ジュノー セラピューティクス インコーポレイテッド | 細胞療法における投薬に関する組成物、製造物品、および方法 |
| JP7178355B2 (ja) | 2017-02-28 | 2022-11-25 | エンドサイト・インコーポレイテッド | Car t細胞療法のための組成物および方法 |
| EA201992155A1 (ru) | 2017-03-14 | 2020-03-16 | Джуно Терапьютикс, Инк. | Способы криогенного хранения |
| CN106963945A (zh) * | 2017-03-27 | 2017-07-21 | 山东兴瑞生物科技有限公司 | 一种加强型人乳头瘤病毒hpv‑16/18的二价dc疫苗 |
| WO2018191490A1 (en) * | 2017-04-13 | 2018-10-18 | The Trustees Of The University Of Pennsylvania | Use of gene editing to generate universal tcr re-directed t cells for adoptive immunotherapy |
| JOP20180040A1 (ar) | 2017-04-20 | 2019-01-30 | Gilead Sciences Inc | مثبطات pd-1/pd-l1 |
| CN108728477B (zh) * | 2017-04-24 | 2022-02-22 | 华东理工大学 | 一种高效的转座突变系统及构建方法 |
| CA3063695A1 (en) * | 2017-05-17 | 2018-11-22 | Seattle Children's Hospital (Dba Seattle Children's Research Institute | Generating mammalian t cell activation inducible synthetic promoters (syn+pro) to improve t cell therapy |
| CA3064000A1 (en) * | 2017-05-24 | 2018-11-29 | Effector Therapeutics, Inc. | Methods and compositions for cellular immunotherapy |
| WO2018217064A2 (ko) * | 2017-05-26 | 2018-11-29 | 주식회사 녹십자랩셀 | 형질전환된 t세포를 이용한 자연살해세포의 배양방법 |
| BR112019025403A2 (pt) | 2017-06-02 | 2020-08-18 | Juno Therapeutics Inc | artigos de fabricação e métodos para tratamento usando terapia celular adotiva |
| CN107335054B (zh) * | 2017-06-30 | 2021-01-15 | 山东兴瑞生物科技有限公司 | 一种慢性乙肝治疗性dc疫苗 |
| CN111133002B (zh) | 2017-08-07 | 2024-05-24 | 恩比伊治疗股份公司 | 具有高体内耐受性的基于蒽环类药的抗体药物缀合物 |
| CA3072569A1 (en) * | 2017-08-11 | 2019-02-14 | Tribiotica Llc | Methods for generating epitopes for binding to recognition molecules by templated assembly |
| CN111094349A (zh) * | 2017-08-23 | 2020-05-01 | 马克思-德布鲁克-分子医学中心亥姆霍兹联合会 | 嵌合抗原受体和结合cxcr5的car-t细胞 |
| JP2020536531A (ja) * | 2017-09-26 | 2020-12-17 | ロングウッド ユニバーシティーLongwood University | 免疫療法としてのpd1特異的キメラ抗原受容体 |
| CN107759700A (zh) * | 2017-10-18 | 2018-03-06 | 银丰生物工程集团有限公司 | 靶向cd19抗原的转基因t细胞及其制备方法与应用 |
| CA3079264A1 (en) | 2017-10-18 | 2019-04-25 | Intrexon Corporation | Polypeptide compositions comprising spacers |
| US10329543B2 (en) | 2017-10-23 | 2019-06-25 | Poseida Therapeutics, Inc. | Modified stem cell memory T cells, methods of making and methods of using same |
| WO2019089969A2 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for b-cell maturation antigen |
| CN111542596A (zh) * | 2017-11-01 | 2020-08-14 | 朱诺治疗学股份有限公司 | 产生工程化细胞的治疗性组合物的方法 |
| US11851679B2 (en) | 2017-11-01 | 2023-12-26 | Juno Therapeutics, Inc. | Method of assessing activity of recombinant antigen receptors |
| US12031975B2 (en) | 2017-11-01 | 2024-07-09 | Juno Therapeutics, Inc. | Methods of assessing or monitoring a response to a cell therapy |
| EP3707160A1 (en) | 2017-11-10 | 2020-09-16 | The U.S.A. as represented by the Secretary, Department of Health and Human Services | Chimeric antigen receptors targeting tumor antigens |
| EP3710020A4 (en) * | 2017-11-14 | 2021-06-23 | Memorial Sloan-Kettering Cancer Center | IL-36 SECRECTING IMMUNOREACTIVE CELLS AND RELATED USES |
| AU2018392213B2 (en) | 2017-12-20 | 2021-03-04 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3' cyclic dinucleotides with phosphonate bond activating the STING adaptor protein |
| CN111511754B (zh) | 2017-12-20 | 2023-09-12 | 捷克共和国有机化学与生物化学研究所 | 活化sting转接蛋白的具有膦酸酯键的2’3’环状二核苷酸 |
| CN110028588A (zh) * | 2018-01-11 | 2019-07-19 | 上海细胞治疗研究院 | 抗原-Fc融合蛋白及其检测阳性CAR-T细胞的应用 |
| US10561686B2 (en) | 2018-01-12 | 2020-02-18 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| US11311576B2 (en) | 2018-01-22 | 2022-04-26 | Seattle Children's Hospital | Methods of use for CAR T cells |
| CN108103027B (zh) * | 2018-02-02 | 2021-12-24 | 中国医学科学院血液病医院(血液学研究所) | 高效率血细胞重编程同时实现基因编辑的方法 |
| AU2019222644B2 (en) | 2018-02-13 | 2021-04-01 | Gilead Sciences, Inc. | PD-1/PD-L1 inhibitors |
| CN108383914A (zh) * | 2018-02-23 | 2018-08-10 | 北京美康基免生物科技有限公司 | 一种基于cd19的嵌合抗原受体及其应用 |
| CA3093716A1 (en) * | 2018-03-16 | 2019-09-19 | Immusoft Corporation | B cells genetically engineered to secrete follistatin and methods of using the same to treat follistatin-related diseases, conditions, disorders and to enhance muscle growth and strength |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| TWI818007B (zh) | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| TWI833744B (zh) | 2018-04-06 | 2024-03-01 | 捷克科學院有機化學與生物化學研究所 | 3'3'-環二核苷酸 |
| US10869888B2 (en) | 2018-04-17 | 2020-12-22 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| CN112041311B (zh) | 2018-04-19 | 2023-10-03 | 吉利德科学公司 | Pd-1/pd-l1抑制剂 |
| WO2019211799A1 (en) | 2018-05-03 | 2019-11-07 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide |
| PL3793565T3 (pl) | 2018-05-14 | 2022-05-02 | Gilead Sciences, Inc. | Inhibitory MCL-1 |
| SG11202011392VA (en) * | 2018-05-15 | 2020-12-30 | Carsgen Therapeutics Co Ltd | Genetically engineered cell and application thereof |
| MX2020013923A (es) | 2018-06-29 | 2021-03-29 | Apitbio Inc | Anticuerpos anti molécula de adhesión celular l1 (l1cam) y usos de estos. |
| EP4234030A3 (en) | 2018-07-13 | 2023-10-18 | Gilead Sciences, Inc. | Pd-1/pd-l1 inhibitors |
| CN110845621A (zh) * | 2018-08-21 | 2020-02-28 | 上海恒润达生生物科技有限公司 | 一种靶向egfr和cd19双靶点的嵌合抗原受体方法 |
| US20220348682A1 (en) | 2018-08-30 | 2022-11-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Chimeric antigen receptor cells for treating solid tumor |
| CN113039206A (zh) * | 2018-08-31 | 2021-06-25 | 西雅图儿童医院(Dba西雅图儿童研究所) | 包含b7h3嵌合抗原受体的方法和组合物 |
| EP3860717A1 (en) | 2018-10-03 | 2021-08-11 | Gilead Sciences, Inc. | Imidozopyrimidine derivatives |
| WO2020086556A1 (en) | 2018-10-24 | 2020-04-30 | Gilead Sciences, Inc. | Pd-1/pd-l1 inhibitors |
| US11071730B2 (en) | 2018-10-31 | 2021-07-27 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds |
| EP3873903B1 (en) | 2018-10-31 | 2024-01-24 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds as hpk1 inhibitors |
| AU2019372673A1 (en) | 2018-11-01 | 2021-05-27 | Gracell Biotechnologies (Shanghai) Co., Ltd. | Compositions and methods for T cell engineering |
| US20220008465A1 (en) * | 2018-11-16 | 2022-01-13 | Juno Therapeutics, Inc. | Methods of dosing engineered t cells for the treatment of b cell malignancies |
| US10918667B2 (en) | 2018-11-20 | 2021-02-16 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expressing therapeutic agent and uses thereof |
| SG11202105502RA (en) * | 2018-11-30 | 2021-06-29 | Juno Therapeutics Inc | Methods for treatment using adoptive cell therapy |
| CN113395972A (zh) * | 2018-11-30 | 2021-09-14 | 细胞结构公司 | 胎盘源性同种异体car-t细胞及其用途 |
| BR112021010120A2 (pt) * | 2018-11-30 | 2021-08-31 | Juno Therapeutics, Inc. | Métodos para dosagem e tratamento de malignidades celulares em terapia celular adotiva |
| CN113543851A (zh) | 2019-03-07 | 2021-10-22 | 捷克共和国有机化学与生物化学研究所 | 2’3’-环二核苷酸及其前药 |
| KR20210137518A (ko) | 2019-03-07 | 2021-11-17 | 인스티튜트 오브 오가닉 케미스트리 앤드 바이오케미스트리 에이에스 씨알 브이.브이.아이. | 3'3'-사이클릭 다이뉴클레오티드 및 이의 프로드럭 |
| US11766447B2 (en) | 2019-03-07 | 2023-09-26 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| US20200297768A1 (en) * | 2019-03-19 | 2020-09-24 | Immatics US, Inc. | Cd28 t cell cultures, compositions, and methods of using thereof |
| US20200308248A1 (en) * | 2019-03-26 | 2020-10-01 | ST Phi Therapeutics | Chimeric Natural Killer Cell Receptors and Method of Using Thereof |
| WO2020210023A1 (en) * | 2019-04-08 | 2020-10-15 | Russell Biotech, Inc. | Improved manufacturing procedures for cell based therapies |
| CN109994176A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含样本类型信息管理模块的精准用药智能报告系统 |
| CN109994156A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含报告模板信息管理模块的精准用药智能报告系统 |
| CN109994180A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含基因位点信息管理模块的精准用药智能报告系统 |
| CN110010200A (zh) * | 2019-04-16 | 2019-07-12 | 长沙三济生物科技有限公司 | 一种基因身份识别系统 |
| CN109872792A (zh) * | 2019-04-16 | 2019-06-11 | 北京中佰耀因医药科技有限公司 | 一种用于指导精准用药的基因检测智能报告系统 |
| CN110010222A (zh) * | 2019-04-16 | 2019-07-12 | 长沙三济生物科技有限公司 | 一种基于精准用药知识库的基因身份识别系统 |
| CN109979545A (zh) * | 2019-04-16 | 2019-07-05 | 北京中佰耀因医药科技有限公司 | 一种含样本状态信息管理模块的精准用药智能报告系统 |
| TW202212339A (zh) | 2019-04-17 | 2022-04-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TW202210480A (zh) | 2019-04-17 | 2022-03-16 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| WO2020237025A1 (en) | 2019-05-23 | 2020-11-26 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| CA3143108A1 (en) * | 2019-06-19 | 2020-12-24 | Julius-Maximilians-Universitat Wurzburg | Ultramodular igg3-based spacer domain and multi-function site for implementation in chimeric antigen receptor design |
| CA3142513A1 (en) | 2019-06-25 | 2020-12-30 | Gilead Sciences, Inc. | Flt3l-fc fusion proteins and methods of use |
| CN110608991B (zh) * | 2019-09-09 | 2022-04-29 | 浙江普罗亭健康科技有限公司 | 基于质谱流式检测技术的细胞周期检测试剂盒及检测方法 |
| EP4045083B1 (en) | 2019-10-18 | 2024-01-10 | Forty Seven, Inc. | Combination therapies for treating myelodysplastic syndromes and acute myeloid leukemia |
| CN114599392A (zh) | 2019-10-31 | 2022-06-07 | 四十七公司 | 基于抗cd47和抗cd20的血癌治疗 |
| TWI778443B (zh) | 2019-11-12 | 2022-09-21 | 美商基利科學股份有限公司 | Mcl1抑制劑 |
| CN117736207A (zh) | 2019-12-24 | 2024-03-22 | 卡尔那生物科学株式会社 | 二酰基甘油激酶调节化合物 |
| CN117964757A (zh) | 2020-02-14 | 2024-05-03 | 吉利德科学公司 | 与ccr8结合的抗体和融合蛋白及其用途 |
| US12076343B2 (en) | 2020-02-19 | 2024-09-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Engineered safety in cell therapy |
| CN111533808B (zh) * | 2020-03-10 | 2021-02-09 | 南京医科大学 | 一种可自分泌TLR4 scFv且靶向cMet的嵌合抗原受体修饰的T细胞及其应用 |
| JP2023518293A (ja) | 2020-03-20 | 2023-04-28 | ライル・イミュノファーマ,インコーポレイテッド | 新規の組換え細胞表面マーカー |
| US12110294B2 (en) | 2020-05-01 | 2024-10-08 | Gilead Sciences, Inc. | CD73 compounds |
| US12043654B2 (en) | 2020-06-02 | 2024-07-23 | Innovative Cellular Therapeutics Holdings, Ltd. | Anti-GCC antibody and CAR thereof for treating digestive system cancer |
| WO2022007938A1 (en) * | 2020-07-09 | 2022-01-13 | Nanjing Legend Biotech Co., Ltd. | Engineering gamma delta t cells with interleukin-36 for immunotherapy |
| CN116490518A (zh) | 2020-07-17 | 2023-07-25 | 西穆尔克斯股份有限公司 | 用于重定向免疫抑制信号传导的嵌合MyD88受体及相关组合物和方法 |
| EP4263600A1 (en) | 2020-12-18 | 2023-10-25 | Century Therapeutics, Inc. | Chimeric antigen receptor systems with adaptable receptor specificity |
| EP4277639A2 (en) * | 2021-01-15 | 2023-11-22 | Seattle Children's Hospital d/b/a Seattle Children's Research Institute | Hybrid and truncated immune cell proteins |
| TW202302145A (zh) | 2021-04-14 | 2023-01-16 | 美商基利科學股份有限公司 | CD47/SIRPα結合及NEDD8活化酶E1調節次單元之共抑制以用於治療癌症 |
| TW202313094A (zh) | 2021-05-18 | 2023-04-01 | 美商基利科學股份有限公司 | 使用FLT3L—Fc融合蛋白之方法 |
| EP4359415A1 (en) | 2021-06-23 | 2024-05-01 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| EP4359411A1 (en) | 2021-06-23 | 2024-05-01 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| US11932634B2 (en) | 2021-06-23 | 2024-03-19 | Gilead Sciences, Inc. | Diacylglycerol kinase modulating compounds |
| CN117396478A (zh) | 2021-06-23 | 2024-01-12 | 吉利德科学公司 | 二酰基甘油激酶调节化合物 |
| EP4394043A1 (en) * | 2021-08-24 | 2024-07-03 | Cells & Genes Biotech (Shanghai) Co., Ltd | Method for modifying cell |
| AU2022366987A1 (en) | 2021-10-14 | 2024-05-16 | Arsenal Biosciences, Inc. | Immune cells having co-expressed shrnas and logic gate systems |
| WO2023076983A1 (en) | 2021-10-28 | 2023-05-04 | Gilead Sciences, Inc. | Pyridizin-3(2h)-one derivatives |
| MX2024005066A (es) | 2021-10-29 | 2024-05-24 | Gilead Sciences Inc | Compuestos de cd73. |
| WO2023122615A1 (en) | 2021-12-22 | 2023-06-29 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| WO2023122581A2 (en) | 2021-12-22 | 2023-06-29 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| TW202340168A (zh) | 2022-01-28 | 2023-10-16 | 美商基利科學股份有限公司 | Parp7抑制劑 |
| WO2023173137A1 (en) * | 2022-03-11 | 2023-09-14 | Yale University | Compositions and methods for efficient and stable genetic modification of eukaryotic cells |
| IL315083A (en) | 2022-03-17 | 2024-10-01 | Gilead Sciences Inc | The IKAROS family of zinc fingers degrades and uses them |
| US20230355796A1 (en) | 2022-03-24 | 2023-11-09 | Gilead Sciences, Inc. | Combination therapy for treating trop-2 expressing cancers |
| WO2023187031A1 (en) * | 2022-04-01 | 2023-10-05 | Miltenyi Biotec B.V. & Co. KG | A system for drug-inducible expression of a polynucleotide |
| TW202345901A (zh) | 2022-04-05 | 2023-12-01 | 美商基利科學股份有限公司 | 用於治療結腸直腸癌之組合療法 |
| AU2023256670A1 (en) | 2022-04-21 | 2024-10-17 | Gilead Sciences, Inc. | Kras g12d modulating compounds |
| US20230348548A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Membrane-bound il-15, cd8 polypeptides, cells, compositions, and methods of using thereof |
| US20230348561A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Dominant negative tgfbeta receptor polypeptides, cd8 polypeptides, cells, compositions, and methods of using thereof |
| US20240066127A1 (en) | 2022-04-28 | 2024-02-29 | Immatics US, Inc. | Il-12 polypeptides, il-15 polypeptides, il-18 polypeptides, cd8 polypeptides, compositions, and methods of using thereof |
| CN114990069B (zh) * | 2022-05-17 | 2023-09-22 | 郑州大学第一附属医院 | 一种过表达slc43a2的嵌合抗原受体t细胞的制备方法和应用 |
| WO2023227900A1 (en) * | 2022-05-27 | 2023-11-30 | Autolus Limited | Method |
| AR129552A1 (es) * | 2022-06-10 | 2024-09-04 | Joint Stock Company Biocad | Ácido nucleico con actividad promotora y uso del mismo |
| WO2024006702A1 (en) * | 2022-06-27 | 2024-01-04 | Foundation Medicine, Inc. | Methods and systems for predicting genotypic calls from whole-slide images |
| US20240116928A1 (en) | 2022-07-01 | 2024-04-11 | Gilead Sciences, Inc. | Cd73 compounds |
| US20240091351A1 (en) | 2022-09-21 | 2024-03-21 | Gilead Sciences, Inc. | FOCAL IONIZING RADIATION AND CD47/SIRPa DISRUPTION ANTICANCER COMBINATION THERAPY |
| CN116179495A (zh) * | 2022-11-28 | 2023-05-30 | 上海恩凯细胞技术有限公司 | 转基因免疫细胞及其应用 |
| WO2024129984A1 (en) * | 2022-12-15 | 2024-06-20 | The Board Of Trustees Of The Leland Stanford Junior University | Homology-independent targeted dna insertion in human t cells |
| WO2024137652A2 (en) * | 2022-12-20 | 2024-06-27 | Abata Therapeutics, Inc. | Cell therapies for type 1 diabetes |
| US20240254118A1 (en) | 2022-12-22 | 2024-08-01 | Gilead Sciences, Inc. | Prmt5 inhibitors and uses thereof |
| CN118359729A (zh) * | 2023-01-19 | 2024-07-19 | 武汉昭智生物技术有限公司 | 一种car分子、包含其的细胞或外泌体及它们的应用 |
| CN116844685B (zh) * | 2023-07-03 | 2024-04-12 | 广州默锐医药科技有限公司 | 一种免疫治疗效果评估方法、装置、电子设备及存储介质 |
Family Cites Families (87)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0557459B1 (en) | 1990-11-13 | 1997-10-22 | Immunex Corporation | Bifunctional selectable fusion genes |
| US20020111474A1 (en) * | 1990-12-14 | 2002-08-15 | Capon Daniel J. | Chimeric chains for receptor-associated signal transduction pathways |
| EP0650367A4 (en) | 1992-06-01 | 1998-04-15 | New England Medical Center Inc | BLOCKING OF INTERCELLULAR INTERACTIONS WITH CD43 CHEMICAL MOLECULES. |
| US5827642A (en) | 1994-08-31 | 1998-10-27 | Fred Hutchinson Cancer Research Center | Rapid expansion method ("REM") for in vitro propagation of T lymphocytes |
| US5783186A (en) | 1995-12-05 | 1998-07-21 | Amgen Inc. | Antibody-induced apoptosis |
| US6133027A (en) * | 1996-08-07 | 2000-10-17 | City Of Hope | Inducible expression system |
| US6660257B1 (en) | 1996-10-25 | 2003-12-09 | Pharmacia Corporation | Circular permuteins of flt3 ligand |
| AU2472400A (en) | 1998-10-20 | 2000-05-08 | City Of Hope | CD20-specific redirected T cells and their use in cellular immunotherapy of CD20+ malignancies |
| US6912492B1 (en) * | 1999-05-25 | 2005-06-28 | University Of Medicine & Dentistry Of New Jersey | Methods for diagnosing, preventing, and treating developmental disorders due to a combination of genetic and environmental factors |
| JP4045713B2 (ja) | 2000-01-31 | 2008-02-13 | 松下電器産業株式会社 | 自動機用溶接機 |
| GB0015119D0 (en) * | 2000-06-20 | 2000-08-09 | Angeletti P Ist Richerche Bio | Methods and means for regulation of gene expression |
| KR100545945B1 (ko) | 2000-07-03 | 2006-01-25 | 갈라 디자인, 인크. | 발현 벡터 |
| GB0025307D0 (en) | 2000-10-16 | 2000-11-29 | Celltech Chiroscience Ltd | Biological products |
| AU2001297703B2 (en) | 2000-11-07 | 2006-10-19 | City Of Hope | CD19-specific redirected immune cells |
| EP1366067B1 (en) | 2001-03-07 | 2012-09-26 | Merck Patent GmbH | Expression technology for proteins containing a hybrid isotype antibody moiety |
| US7070995B2 (en) * | 2001-04-11 | 2006-07-04 | City Of Hope | CE7-specific redirected immune cells |
| US20090257994A1 (en) | 2001-04-30 | 2009-10-15 | City Of Hope | Chimeric immunoreceptor useful in treating human cancers |
| WO2002097099A1 (en) * | 2001-05-29 | 2002-12-05 | Valentis, Inc. | Regulated expression of ghrh |
| IL160933A0 (en) | 2001-09-18 | 2004-08-31 | Proteologics Inc | Methods and compositions for treating ?cap associated diseases |
| US20030148982A1 (en) | 2001-11-13 | 2003-08-07 | Brenner Malcolm K. | Bi-spcific chimeric T cells |
| WO2003087338A2 (en) | 2002-04-11 | 2003-10-23 | Amgen, Inc. | Her-2 receptor tyrosine kinase molecules and uses thereof |
| WO2004029284A2 (en) | 2002-09-30 | 2004-04-08 | Protein Design Labs, Inc. | Efficient generation of stable expression cell lines through the use of scorable homeostatic reporter genes |
| CA2516455C (en) * | 2003-02-20 | 2012-05-01 | Seattle Genetics, Inc. | Anti-cd70 antibody-drug conjugates and their use for the treatment of cancer and immune disorders |
| US20050129671A1 (en) | 2003-03-11 | 2005-06-16 | City Of Hope | Mammalian antigen-presenting T cells and bi-specific T cells |
| US20060160090A1 (en) | 2003-04-11 | 2006-07-20 | Macina Robert A | Composition splice variants and methods relating to cancer specific genes and proteins |
| CN1809277A (zh) * | 2003-04-18 | 2006-07-26 | 诺伍德免疫学有限公司 | 先于胸腺再活化的移植物耐受 |
| WO2005017102A2 (en) | 2003-05-30 | 2005-02-24 | Diadexus, Inc. | Compositions, splice variants and methods relating to ovarian specific nucleic acids and proteins |
| EP1649020B1 (en) * | 2003-07-21 | 2017-01-11 | MSD Italia S.r.l. | Synthetic gene encoding human epidermal growth factor 2/neu antigen and uses thereof |
| US20070087346A1 (en) | 2003-10-24 | 2007-04-19 | Gennaro Ciliberto | Orthogonal gene switches |
| US8071364B2 (en) | 2003-12-24 | 2011-12-06 | Transgenrx, Inc. | Gene therapy using transposon-based vectors |
| US20090098142A1 (en) | 2004-06-09 | 2009-04-16 | Kasaian Marion T | Methods and compositions for treating and monitoring treatment of IL-13-associated disorders |
| US7910101B2 (en) * | 2004-10-25 | 2011-03-22 | Centocor, Inc. | Melanocortin receptor binding mimetibodies, compositions, methods and uses |
| DE202005002921U1 (de) | 2005-02-23 | 2005-04-21 | Magcode Ag | Verbindungssystem, insbesondere elektrisches Verbindungssystem |
| CN101212977A (zh) * | 2005-06-01 | 2008-07-02 | 国际创新生物技术研究所有限公司 | 葡萄糖可诱导的胰岛素表达和治疗糖尿病的方法 |
| JP2009538144A (ja) | 2006-05-22 | 2009-11-05 | ハイプロセル・リミテッド・ライアビリティ・カンパニー | 真核細胞株を用いたタンパク質産生 |
| WO2008012237A1 (en) * | 2006-07-24 | 2008-01-31 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti Spa | Multi-antigen construct and uses thereof |
| US7709253B2 (en) | 2006-08-04 | 2010-05-04 | The Board Of Trustees Of The Leland Stanford Junior University | Ligand-regulable transactivation systems, methods of use thereof, methods of detecting estrogen receptor ligands, and methods of differentiating estrogen receptor ligand agonists and antagonists |
| EP2171456A2 (en) * | 2007-07-25 | 2010-04-07 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Self coupling recombinant antibody fusion proteins |
| US8450112B2 (en) | 2008-04-09 | 2013-05-28 | Maxcyte, Inc. | Engineering and delivery of therapeutic compositions of freshly isolated cells |
| PT3006459T (pt) | 2008-08-26 | 2021-11-26 | Hope City | Método e composições para funcionamento melhorado de efetores antitumorais de células t |
| EP3502256A3 (en) | 2008-09-26 | 2019-09-25 | Tocagen Inc. | Recombinant vectors |
| US8829173B2 (en) | 2008-09-26 | 2014-09-09 | Tocagen Inc. | Recombinant vectors |
| US8329882B2 (en) * | 2009-02-18 | 2012-12-11 | California Institute Of Technology | Genetic control of mammalian cells with synthetic RNA regulatory systems |
| WO2010141543A1 (en) * | 2009-06-02 | 2010-12-09 | Targeted Molecular Diagnostics, Llc | Methods for the detection and quantitation of the p95 component of her2/neu (erbb2) |
| US9873035B2 (en) * | 2009-07-09 | 2018-01-23 | Cfph, Llc | Amusement device for a game of chance involving one or more rolling indicators on a rotating element with position indicators |
| AU2010301042B2 (en) | 2009-10-01 | 2014-03-20 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Anti-vascular endothelial growth factor receptor-2 chimeric antigen receptors and use of same for the treatment of cancer |
| SI2496698T1 (sl) | 2009-11-03 | 2019-07-31 | City Of Hope | Skrajšan epiderimalni receptor faktorja rasti (EGFRt) za selekcijo transduciranih T celic |
| JP5285678B2 (ja) | 2010-06-18 | 2013-09-11 | 株式会社エヌ・ティ・ティ・ドコモ | 移動通信方法及びコアネットワーク装置 |
| ES2754394T3 (es) * | 2010-09-08 | 2020-04-17 | Chemotherapeutisches Forschungsinstitut Georg Speyer Haus | Receptores de antígenos quiméricos con una región bisagra optimizada |
| SG190997A1 (en) | 2010-12-09 | 2013-07-31 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| SG192010A1 (en) * | 2011-01-18 | 2013-08-30 | Univ Pennsylvania | Compositions and methods for treating cancer |
| CN106074601A (zh) * | 2011-03-23 | 2016-11-09 | 弗雷德哈钦森癌症研究中心 | 用于细胞免疫治疗的方法和组合物 |
| JP2014514927A (ja) | 2011-04-13 | 2014-06-26 | イミュニカム・エイビイ | 抗原特異的t細胞の増殖のための方法 |
| US20130071414A1 (en) * | 2011-04-27 | 2013-03-21 | Gianpietro Dotti | Engineered cd19-specific t lymphocytes that coexpress il-15 and an inducible caspase-9 based suicide gene for the treatment of b-cell malignancies |
| EP3489366B1 (en) | 2011-06-01 | 2019-12-25 | Precision Biosciences, Inc. | Methods for producing engineered mammalian cell lines with amplified transgenes |
| PE20141212A1 (es) * | 2011-06-22 | 2014-09-19 | Hoffmann La Roche | Eliminacion de celulas diana por parte de celulas t citotoxicas especificas de virus utilizando complejos que comprenden mhc de clase 1 |
| JP6267644B2 (ja) | 2011-10-20 | 2018-01-24 | アメリカ合衆国 | 抗cd22キメラ抗原受容体 |
| DE102011118018B4 (de) | 2011-10-25 | 2017-10-26 | Plasmidfactory Gmbh & Co. Kg | Minicircles mit Transpositionskassetten und ihre Verwendung zur Transformation von Zellen |
| US10391126B2 (en) | 2011-11-18 | 2019-08-27 | Board Of Regents, The University Of Texas System | CAR+ T cells genetically modified to eliminate expression of T-cell receptor and/or HLA |
| JP6850528B2 (ja) | 2012-02-13 | 2021-03-31 | シアトル チルドレンズ ホスピタル ドゥーイング ビジネス アズ シアトル チルドレンズ リサーチ インスティテュート | 二重特異性キメラ抗原受容体およびその治療的使用 |
| ITRM20120058A1 (it) | 2012-02-20 | 2013-08-21 | Pisanelli Giovanni Codacci | Famiglia di molecole a base di zuccheri ad uso terapeutico e relativo procedimento di produzione |
| JP2015509717A (ja) * | 2012-02-22 | 2015-04-02 | ザ トラスティーズ オブ ザ ユニバーシティ オブ ペンシルバニア | 抗腫瘍活性およびcar存続性を強化するためのicosベースのcarの使用 |
| EA033110B1 (ru) * | 2012-04-11 | 2019-08-30 | Дзе Юнайтед Стейтс Оф Америка, Эз Репрезентед Бай Дзе Секретари, Департмент Оф Хелс Энд Хьюман Сёрвисез | Химерный рецептор антигена, направленный на антиген созревания b-клеток, кодирующая его нуклеиновая кислота, соответствующие экспрессионный вектор, клетка-хозяин, применения и способы |
| US20130280220A1 (en) | 2012-04-20 | 2013-10-24 | Nabil Ahmed | Chimeric antigen receptor for bispecific activation and targeting of t lymphocytes |
| WO2013177533A1 (en) | 2012-05-25 | 2013-11-28 | California Institute Of Technology | Expression of secreted and cell-surface polypeptides |
| IN2014DN10996A (ja) | 2012-05-30 | 2015-09-25 | Baylor College Medicine | |
| EP2669378A1 (en) | 2012-05-31 | 2013-12-04 | Helmut Hanenberg | Cytochrome P450 suicide gene system |
| WO2013180287A1 (ja) | 2012-06-01 | 2013-12-05 | 日本電気株式会社 | スイッチングシステム、ラインカード、スイッチカード、fdb学習方法、fdb学習調停方法及びプログラム |
| RU2700765C2 (ru) * | 2012-08-20 | 2019-09-19 | Фред Хатчинсон Кансэр Рисёч Сентер | Способ и композиции для клеточной иммунотерапии |
| US10316289B2 (en) * | 2012-09-06 | 2019-06-11 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Methods of producing T memory stem cell populations |
| WO2014055657A1 (en) | 2012-10-05 | 2014-04-10 | The Trustees Of The University Of Pennsylvania | Use of a trans-signaling approach in chimeric antigen receptors |
| WO2014097442A1 (ja) | 2012-12-20 | 2014-06-26 | 三菱電機株式会社 | 車載装置及びプログラム |
| WO2014099671A1 (en) | 2012-12-20 | 2014-06-26 | Bluebird Bio, Inc. | Chimeric antigen receptors and immune cells targeting b cell malignancies |
| EP3241897B1 (en) | 2013-03-07 | 2018-10-03 | Baylor College of Medicine | Targeting cd138 in cancer |
| EP2777711A1 (en) * | 2013-03-11 | 2014-09-17 | Icon Genetics GmbH | Her2/Neu cancer vaccine |
| TWI654206B (zh) | 2013-03-16 | 2019-03-21 | 諾華公司 | 使用人類化抗-cd19嵌合抗原受體治療癌症 |
| CN105408473B9 (zh) * | 2013-05-14 | 2021-09-17 | 得克萨斯州大学系统董事会 | 工程化嵌合抗原受体(car)t细胞的人应用 |
| US9108442B2 (en) | 2013-08-20 | 2015-08-18 | Ricoh Company, Ltd. | Image forming apparatus |
| BR112016009898A2 (pt) | 2013-10-31 | 2017-12-05 | Hutchinson Fred Cancer Res | células-tronco/progenitoras hematopoiéticas e efetoras não-t modificadas e usos das mesmas |
| ES2832586T3 (es) | 2013-11-21 | 2021-06-10 | Autolus Ltd | Célula |
| CA2936501A1 (en) | 2014-01-13 | 2015-07-16 | Stephen J. Forman | Chimeric antigen receptors (cars) having mutations in the fc spacer region and methods for their use |
| EP3593812A3 (en) | 2014-03-15 | 2020-05-27 | Novartis AG | Treatment of cancer using chimeric antigen receptor |
| IL297591A (en) | 2014-04-10 | 2022-12-01 | Seattle Childrens Hospital Dba Seattle Childrens Res Inst | Drug-related transgene expression |
| MX2018001568A (es) | 2015-08-07 | 2019-04-25 | Seattle Children´S Hospital Dba Seattle Children´S Res Institute | Celulas t biespecificas de receptor quimerico de antigeno (car) para focalizacion a tumores solidos. |
| KR20180105709A (ko) | 2016-02-05 | 2018-09-28 | 시티 오브 호프 | 중추 신경계의 암의 치료를 위한 조작된 t 세포의 투여 |
| US11408005B2 (en) | 2016-12-12 | 2022-08-09 | Seattle Children's Hospital | Chimeric transcription factor variants with augmented sensitivity to drug ligand induction of transgene expression in mammalian cells |
| US10714296B2 (en) | 2018-12-12 | 2020-07-14 | Axcelis Technologies, Inc. | Ion source with tailored extraction shape |
-
2015
- 2015-04-08 IL IL297591A patent/IL297591A/en unknown
- 2015-04-08 EP EP15776211.3A patent/EP3129053A4/en not_active Withdrawn
- 2015-04-08 ES ES15776745T patent/ES2867224T3/es active Active
- 2015-04-08 WO PCT/US2015/024868 patent/WO2015157386A1/en active Application Filing
- 2015-04-08 MX MX2016013144A patent/MX2016013144A/es unknown
- 2015-04-08 WO PCT/US2015/024947 patent/WO2015157432A1/en active Application Filing
- 2015-04-08 US US15/302,403 patent/US10865242B2/en active Active
- 2015-04-08 MX MX2016013160A patent/MX2016013160A/es unknown
- 2015-04-08 IL IL248243A patent/IL248243B2/en unknown
- 2015-04-08 RU RU2016143381A patent/RU2752275C2/ru active
- 2015-04-08 JP JP2017504604A patent/JP6788573B6/ja active Active
- 2015-04-08 MY MYPI2016703719A patent/MY185678A/en unknown
- 2015-04-08 CA CA2945305A patent/CA2945305C/en active Active
- 2015-04-08 ES ES15777065T patent/ES2880932T3/es active Active
- 2015-04-08 MX MX2016013159A patent/MX2016013159A/es unknown
- 2015-04-08 CA CA2945302A patent/CA2945302A1/en active Pending
- 2015-04-08 KR KR1020167031070A patent/KR102509481B1/ko active IP Right Grant
- 2015-04-08 WO PCT/US2015/024882 patent/WO2015157391A1/en active Application Filing
- 2015-04-08 RU RU2016143384A patent/RU2729112C2/ru active
- 2015-04-08 RU RU2016143385A patent/RU2751921C2/ru active
- 2015-04-08 US US15/302,420 patent/US10611837B2/en active Active
- 2015-04-08 JP JP2016561839A patent/JP2017515464A/ja active Pending
- 2015-04-08 SG SG11201608393TA patent/SG11201608393TA/en unknown
- 2015-04-08 US US15/302,449 patent/US20170029774A1/en not_active Abandoned
- 2015-04-08 BR BR112016023517A patent/BR112016023517A2/pt not_active Application Discontinuation
- 2015-04-08 CN CN202110101875.0A patent/CN112877291A/zh active Pending
- 2015-04-08 KR KR1020237007831A patent/KR20230038310A/ko active IP Right Grant
- 2015-04-08 AU AU2015243922A patent/AU2015243922B2/en active Active
- 2015-04-08 KR KR1020167031068A patent/KR102387243B1/ko active IP Right Review Request
- 2015-04-08 WO PCT/US2015/024866 patent/WO2015157384A1/en active Application Filing
- 2015-04-08 AU AU2015243849A patent/AU2015243849B2/en active Active
- 2015-04-08 NZ NZ73944815A patent/NZ739448A/en unknown
- 2015-04-08 CA CA2945308A patent/CA2945308C/en active Active
- 2015-04-08 MY MYPI2016703721A patent/MY184163A/en unknown
- 2015-04-08 JP JP2016561722A patent/JP6772068B2/ja active Active
- 2015-04-08 SG SG10201808811QA patent/SG10201808811QA/en unknown
- 2015-04-08 IL IL248238A patent/IL248238B1/en unknown
- 2015-04-08 SG SG11201608395PA patent/SG11201608395PA/en unknown
- 2015-04-08 NZ NZ725081A patent/NZ725081A/en not_active IP Right Cessation
- 2015-04-08 CA CA2945303A patent/CA2945303C/en active Active
- 2015-04-08 CN CN201580030814.2A patent/CN106536558A/zh active Pending
- 2015-04-08 KR KR1020167031067A patent/KR102508166B1/ko active IP Right Grant
- 2015-04-08 MX MX2016013149A patent/MX2016013149A/es unknown
- 2015-04-08 JP JP2016561635A patent/JP6765967B2/ja active Active
- 2015-04-08 BR BR112016023500-2A patent/BR112016023500B1/pt active IP Right Grant
- 2015-04-08 SG SG11201608396YA patent/SG11201608396YA/en unknown
- 2015-04-08 CN CN202110842538.7A patent/CN113528581A/zh active Pending
- 2015-04-08 EP EP15777065.2A patent/EP3129399B1/en active Active
- 2015-04-08 CN CN201580029752.3A patent/CN106535934A/zh active Pending
- 2015-04-08 MY MYPI2016703722A patent/MY192522A/en unknown
- 2015-04-08 AU AU2015243882A patent/AU2015243882C1/en active Active
- 2015-04-08 JP JP2016561659A patent/JP6765968B2/ja active Active
- 2015-04-08 SG SG11201608392WA patent/SG11201608392WA/en unknown
- 2015-04-08 EP EP21175647.3A patent/EP3943507A1/en active Pending
- 2015-04-08 KR KR1020227011931A patent/KR102600544B1/ko active IP Right Grant
- 2015-04-08 SG SG10201808825XA patent/SG10201808825XA/en unknown
- 2015-04-08 NZ NZ725079A patent/NZ725079A/en unknown
- 2015-04-08 EP EP15776745.0A patent/EP3129405B1/en active Active
- 2015-04-08 EP EP22151326.0A patent/EP4056201A1/en active Pending
- 2015-04-08 CN CN201580030815.7A patent/CN106661570B/zh active Active
- 2015-04-08 RU RU2016143388A patent/RU2751920C2/ru active
- 2015-04-08 BR BR112016023523A patent/BR112016023523A2/pt active Search and Examination
- 2015-04-08 MY MYPI2016703720A patent/MY186846A/en unknown
- 2015-04-08 KR KR1020167031064A patent/KR102463529B1/ko active IP Right Review Request
- 2015-04-08 US US15/302,415 patent/US10266592B2/en active Active
- 2015-04-08 AU AU2015243927A patent/AU2015243927B2/en active Active
- 2015-04-08 EP EP21180797.9A patent/EP3954708A1/en active Pending
- 2015-04-08 EP EP15777020.7A patent/EP3129471A4/en active Pending
- 2015-04-08 WO PCT/US2015/024895 patent/WO2015157399A1/en active Application Filing
- 2015-04-08 CN CN201580030056.4A patent/CN106574246A/zh active Pending
- 2015-04-08 US US15/302,426 patent/US20170015746A1/en not_active Abandoned
- 2015-04-08 KR KR1020227038237A patent/KR102618955B1/ko active IP Right Review Request
- 2015-04-08 AU AU2015243920A patent/AU2015243920B2/en active Active
- 2015-04-08 SG SG10201808833XA patent/SG10201808833XA/en unknown
- 2015-04-08 KR KR1020167031069A patent/KR20160144431A/ko active IP Right Grant
- 2015-04-08 RU RU2016143389A patent/RU2016143389A/ru not_active Application Discontinuation
- 2015-04-08 CN CN201580027077.0A patent/CN106573969B/zh active Active
- 2015-04-08 MX MX2016013158A patent/MX2016013158A/es unknown
- 2015-04-08 SG SG10201808819XA patent/SG10201808819XA/en unknown
- 2015-04-08 EP EP15776501.7A patent/EP3129480A4/en active Pending
- 2015-04-08 CA CA2945320A patent/CA2945320A1/en active Pending
-
2016
- 2016-10-06 IL IL248235A patent/IL248235B/en active IP Right Grant
- 2016-10-06 IL IL248229A patent/IL248229B2/en unknown
- 2016-10-06 MX MX2022010807A patent/MX2022010807A/es unknown
- 2016-10-10 PH PH12016502010A patent/PH12016502010A1/en unknown
- 2016-10-10 SA SA516380056A patent/SA516380056B1/ar unknown
- 2016-10-10 PH PH12016502009A patent/PH12016502009A1/en unknown
- 2016-10-10 PH PH12016502012A patent/PH12016502012A1/en unknown
- 2016-10-10 PH PH12016502011A patent/PH12016502011A1/en unknown
- 2016-10-13 ZA ZA2016/07060A patent/ZA201607060B/en unknown
- 2016-10-13 ZA ZA2016/07061A patent/ZA201607061B/en unknown
-
2019
- 2019-02-27 US US16/287,074 patent/US11155616B2/en active Active
-
2020
- 2020-02-19 US US16/794,673 patent/US11414486B2/en active Active
- 2020-06-18 JP JP2020105133A patent/JP7062720B2/ja active Active
- 2020-09-16 JP JP2020155809A patent/JP7093385B2/ja active Active
- 2020-09-16 JP JP2020155429A patent/JP7148580B2/ja active Active
- 2020-09-30 JP JP2020164326A patent/JP7106610B2/ja active Active
- 2020-11-12 US US17/096,138 patent/US20210139583A1/en active Pending
- 2020-11-13 US US17/097,630 patent/US20210371517A1/en active Pending
-
2021
- 2021-01-04 AU AU2021200007A patent/AU2021200007B2/en active Active
- 2021-03-17 AU AU2021201679A patent/AU2021201679B2/en active Active
- 2021-09-10 US US17/472,284 patent/US20220064292A1/en active Pending
- 2021-11-26 AU AU2021273652A patent/AU2021273652A1/en not_active Abandoned
-
2022
- 2022-04-20 JP JP2022069142A patent/JP7542270B2/ja active Active
- 2022-04-21 US US17/660,114 patent/US20220372140A1/en active Pending
- 2022-07-13 JP JP2022112278A patent/JP7402933B2/ja active Active
- 2022-07-15 US US17/812,848 patent/US20220380461A1/en active Pending
- 2022-09-22 JP JP2022150928A patent/JP7508516B2/ja active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7402933B2 (ja) | 導入遺伝子の遺伝子タグおよびその使用方法 | |
| US10869889B2 (en) | Method and compositions for cellular immunotherapy | |
| RU2822461C1 (ru) | Трансгенные генетические метки и способы применения | |
| BR112016023507B1 (pt) | Polipeptídeo isolado que compreende um domínio extracelular de um polipeptídeo her2 | |
| NZ745375B2 (en) | Method and compositions for cellular immunotherapy | |
| NZ738636B2 (en) | Method and compositions for cellular immunotherapy | |
| NZ738636A (en) | Method and compositions for cellular immunotherapy | |
| NZ745372B2 (en) | Method and compositions for cellular immunotherapy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170201 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180406 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180406 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20190207 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190226 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190515 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190716 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190826 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200121 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200416 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20200615 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200720 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200818 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200818 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20200901 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20200930 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6772068 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |