RU2751921C2 - Продукты определенного состава, содержащие генетически модифицированные т-клетки - Google Patents
Продукты определенного состава, содержащие генетически модифицированные т-клетки Download PDFInfo
- Publication number
- RU2751921C2 RU2751921C2 RU2016143385A RU2016143385A RU2751921C2 RU 2751921 C2 RU2751921 C2 RU 2751921C2 RU 2016143385 A RU2016143385 A RU 2016143385A RU 2016143385 A RU2016143385 A RU 2016143385A RU 2751921 C2 RU2751921 C2 RU 2751921C2
- Authority
- RU
- Russia
- Prior art keywords
- cells
- population
- alternative aspects
- cell
- vector
- Prior art date
Links
- 210000001744 T-lymphocyte Anatomy 0.000 title claims abstract description 1016
- 239000000203 mixture Substances 0.000 title claims description 101
- 238000000034 method Methods 0.000 claims abstract description 306
- 102000004127 Cytokines Human genes 0.000 claims abstract description 230
- 108090000695 Cytokines Proteins 0.000 claims abstract description 230
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims abstract description 144
- 102000003812 Interleukin-15 Human genes 0.000 claims abstract description 101
- 108090000172 Interleukin-15 Proteins 0.000 claims abstract description 101
- 102000000588 Interleukin-2 Human genes 0.000 claims abstract description 91
- 108010002350 Interleukin-2 Proteins 0.000 claims abstract description 91
- 102000000704 Interleukin-7 Human genes 0.000 claims abstract description 70
- 108010002586 Interleukin-7 Proteins 0.000 claims abstract description 70
- 102100030703 Interleukin-22 Human genes 0.000 claims abstract description 47
- 108010074108 interleukin-21 Proteins 0.000 claims abstract description 47
- 108010065805 Interleukin-12 Proteins 0.000 claims abstract description 13
- 102000013462 Interleukin-12 Human genes 0.000 claims abstract description 13
- 102000003810 Interleukin-18 Human genes 0.000 claims abstract description 11
- 108090000171 Interleukin-18 Proteins 0.000 claims abstract description 11
- 210000004027 cell Anatomy 0.000 claims description 551
- 239000003550 marker Substances 0.000 claims description 118
- 239000013598 vector Substances 0.000 claims description 117
- 108020001756 ligand binding domains Proteins 0.000 claims description 78
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 69
- 102100033467 L-selectin Human genes 0.000 claims description 69
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 69
- 102000001301 EGF receptor Human genes 0.000 claims description 68
- 108060006698 EGF receptor Proteins 0.000 claims description 68
- 101001018097 Homo sapiens L-selectin Proteins 0.000 claims description 66
- 239000013603 viral vector Substances 0.000 claims description 55
- 206010028980 Neoplasm Diseases 0.000 claims description 54
- 102000005962 receptors Human genes 0.000 claims description 54
- 108020003175 receptors Proteins 0.000 claims description 54
- 102100027207 CD27 antigen Human genes 0.000 claims description 51
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 51
- 125000006850 spacer group Chemical group 0.000 claims description 47
- 241000713666 Lentivirus Species 0.000 claims description 43
- 239000000427 antigen Substances 0.000 claims description 38
- 108091007433 antigens Proteins 0.000 claims description 38
- 102000036639 antigens Human genes 0.000 claims description 38
- 241001430294 unidentified retrovirus Species 0.000 claims description 31
- 241000702421 Dependoparvovirus Species 0.000 claims description 28
- 241000701161 unidentified adenovirus Species 0.000 claims description 28
- 201000011510 cancer Diseases 0.000 claims description 25
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 claims description 24
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 claims description 24
- 238000000926 separation method Methods 0.000 claims description 23
- 101001043809 Homo sapiens Interleukin-7 receptor subunit alpha Proteins 0.000 claims description 22
- 102100021593 Interleukin-7 receptor subunit alpha Human genes 0.000 claims description 22
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 21
- 238000005138 cryopreservation Methods 0.000 claims description 21
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 claims description 20
- 241000700605 Viruses Species 0.000 claims description 20
- 238000012546 transfer Methods 0.000 claims description 20
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 claims description 19
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 19
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 19
- 239000012634 fragment Substances 0.000 claims description 19
- 238000009169 immunotherapy Methods 0.000 claims description 19
- 210000003958 hematopoietic stem cell Anatomy 0.000 claims description 18
- 241000282693 Cercopithecidae Species 0.000 claims description 16
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 15
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 claims description 15
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 claims description 15
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 15
- 230000001413 cellular effect Effects 0.000 claims description 14
- 238000000338 in vitro Methods 0.000 claims description 14
- 102100021260 Galactosylgalactosylxylosylprotein 3-beta-glucuronosyltransferase 1 Human genes 0.000 claims description 13
- 101000894906 Homo sapiens Galactosylgalactosylxylosylprotein 3-beta-glucuronosyltransferase 1 Proteins 0.000 claims description 13
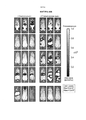
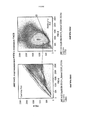
- 238000000684 flow cytometry Methods 0.000 claims description 13
- 230000002401 inhibitory effect Effects 0.000 claims description 13
- 108091026890 Coding region Proteins 0.000 claims description 12
- 238000003314 affinity selection Methods 0.000 claims description 10
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 claims description 10
- 239000008194 pharmaceutical composition Substances 0.000 claims description 9
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 9
- 230000004936 stimulating effect Effects 0.000 claims description 9
- 238000011319 anticancer therapy Methods 0.000 claims description 8
- 208000032839 leukemia Diseases 0.000 claims description 8
- 230000000306 recurrent effect Effects 0.000 claims description 7
- 208000018805 childhood acute lymphoblastic leukemia Diseases 0.000 claims description 4
- 201000011633 childhood acute lymphocytic leukemia Diseases 0.000 claims description 4
- 238000002054 transplantation Methods 0.000 claims description 3
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 claims 3
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 claims 3
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 12
- 239000003814 drug Substances 0.000 abstract description 9
- 239000000126 substance Substances 0.000 abstract description 5
- 238000002619 cancer immunotherapy Methods 0.000 abstract 1
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 454
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 454
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 453
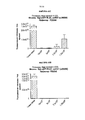
- 230000012010 growth Effects 0.000 description 104
- 108090000623 proteins and genes Proteins 0.000 description 63
- 241000699670 Mus sp. Species 0.000 description 61
- 230000000638 stimulation Effects 0.000 description 44
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 40
- 201000004272 thyroid hyalinizing trabecular adenoma Diseases 0.000 description 40
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 38
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 38
- 238000002474 experimental method Methods 0.000 description 35
- 238000011282 treatment Methods 0.000 description 35
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 31
- 102000004169 proteins and genes Human genes 0.000 description 29
- 206010061309 Neoplasm progression Diseases 0.000 description 28
- 108700010039 chimeric receptor Proteins 0.000 description 28
- 239000003446 ligand Substances 0.000 description 28
- 230000005751 tumor progression Effects 0.000 description 28
- 201000010099 disease Diseases 0.000 description 27
- 238000004519 manufacturing process Methods 0.000 description 27
- 230000014509 gene expression Effects 0.000 description 26
- 238000002360 preparation method Methods 0.000 description 25
- 230000004083 survival effect Effects 0.000 description 25
- 210000002443 helper t lymphocyte Anatomy 0.000 description 24
- 210000004698 lymphocyte Anatomy 0.000 description 24
- 238000010361 transduction Methods 0.000 description 24
- 230000001965 increasing effect Effects 0.000 description 23
- 230000004068 intracellular signaling Effects 0.000 description 23
- 230000026683 transduction Effects 0.000 description 23
- 239000012636 effector Substances 0.000 description 22
- 210000003071 memory t lymphocyte Anatomy 0.000 description 22
- 108091008874 T cell receptors Proteins 0.000 description 21
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 21
- 230000035755 proliferation Effects 0.000 description 21
- 239000011324 bead Substances 0.000 description 20
- 235000018102 proteins Nutrition 0.000 description 20
- 230000010261 cell growth Effects 0.000 description 18
- 238000002955 isolation Methods 0.000 description 18
- 239000002609 medium Substances 0.000 description 16
- 230000004044 response Effects 0.000 description 16
- 239000002245 particle Substances 0.000 description 15
- 239000000523 sample Substances 0.000 description 15
- 238000012360 testing method Methods 0.000 description 15
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 14
- 210000003719 b-lymphocyte Anatomy 0.000 description 14
- 238000001802 infusion Methods 0.000 description 14
- 230000002829 reductive effect Effects 0.000 description 14
- 238000002560 therapeutic procedure Methods 0.000 description 14
- 208000035475 disorder Diseases 0.000 description 13
- 230000001976 improved effect Effects 0.000 description 13
- 230000004069 differentiation Effects 0.000 description 12
- 230000011664 signaling Effects 0.000 description 12
- 101000798762 Anguilla anguilla Troponin C, skeletal muscle Proteins 0.000 description 11
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 11
- 102100038126 Tenascin Human genes 0.000 description 11
- 230000015572 biosynthetic process Effects 0.000 description 11
- 231100000433 cytotoxic Toxicity 0.000 description 11
- 230000001472 cytotoxic effect Effects 0.000 description 11
- 238000001727 in vivo Methods 0.000 description 11
- 230000007774 longterm Effects 0.000 description 11
- 102000039446 nucleic acids Human genes 0.000 description 11
- 108020004707 nucleic acids Proteins 0.000 description 11
- 150000007523 nucleic acids Chemical class 0.000 description 11
- 230000035899 viability Effects 0.000 description 11
- 108020004705 Codon Proteins 0.000 description 10
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 10
- 230000004913 activation Effects 0.000 description 10
- 238000003556 assay Methods 0.000 description 10
- 238000011161 development Methods 0.000 description 10
- 230000018109 developmental process Effects 0.000 description 10
- -1 for example Proteins 0.000 description 10
- 238000005457 optimization Methods 0.000 description 10
- 210000004881 tumor cell Anatomy 0.000 description 10
- 150000001413 amino acids Chemical class 0.000 description 9
- 210000001185 bone marrow Anatomy 0.000 description 9
- 230000000139 costimulatory effect Effects 0.000 description 9
- 238000011534 incubation Methods 0.000 description 9
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 9
- 108090000765 processed proteins & peptides Proteins 0.000 description 9
- 108020004414 DNA Proteins 0.000 description 8
- 102000053602 DNA Human genes 0.000 description 8
- 235000001014 amino acid Nutrition 0.000 description 8
- 229940024606 amino acid Drugs 0.000 description 8
- 238000013459 approach Methods 0.000 description 8
- 230000003394 haemopoietic effect Effects 0.000 description 8
- 208000015181 infectious disease Diseases 0.000 description 8
- 239000002243 precursor Substances 0.000 description 8
- 230000008569 process Effects 0.000 description 8
- 102000004196 processed proteins & peptides Human genes 0.000 description 8
- 241000282412 Homo Species 0.000 description 7
- 230000024932 T cell mediated immunity Effects 0.000 description 7
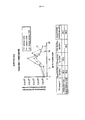
- 238000010586 diagram Methods 0.000 description 7
- 239000001963 growth medium Substances 0.000 description 7
- 230000003993 interaction Effects 0.000 description 7
- 102000040430 polynucleotide Human genes 0.000 description 7
- 108091033319 polynucleotide Proteins 0.000 description 7
- 239000002157 polynucleotide Substances 0.000 description 7
- 229920001184 polypeptide Polymers 0.000 description 7
- 102000015696 Interleukins Human genes 0.000 description 6
- 108010063738 Interleukins Proteins 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 230000007423 decrease Effects 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 230000028993 immune response Effects 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 238000011275 oncology therapy Methods 0.000 description 6
- 210000005259 peripheral blood Anatomy 0.000 description 6
- 239000011886 peripheral blood Substances 0.000 description 6
- 230000001177 retroviral effect Effects 0.000 description 6
- 238000010257 thawing Methods 0.000 description 6
- 208000014644 Brain disease Diseases 0.000 description 5
- 208000032274 Encephalopathy Diseases 0.000 description 5
- 102000001398 Granzyme Human genes 0.000 description 5
- 108060005986 Granzyme Proteins 0.000 description 5
- 241000699666 Mus <mouse, genus> Species 0.000 description 5
- 230000000735 allogeneic effect Effects 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 238000004590 computer program Methods 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- 238000004520 electroporation Methods 0.000 description 5
- 210000000987 immune system Anatomy 0.000 description 5
- 230000036039 immunity Effects 0.000 description 5
- 230000003834 intracellular effect Effects 0.000 description 5
- 210000000265 leukocyte Anatomy 0.000 description 5
- 210000002540 macrophage Anatomy 0.000 description 5
- 125000003729 nucleotide group Chemical group 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 239000000902 placebo Substances 0.000 description 5
- 229940068196 placebo Drugs 0.000 description 5
- 235000000346 sugar Nutrition 0.000 description 5
- 210000001541 thymus gland Anatomy 0.000 description 5
- 101150013553 CD40 gene Proteins 0.000 description 4
- 229920001917 Ficoll Polymers 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 101001055157 Homo sapiens Interleukin-15 Proteins 0.000 description 4
- 101000801481 Homo sapiens Tissue-type plasminogen activator Proteins 0.000 description 4
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 4
- 208000007660 Residual Neoplasm Diseases 0.000 description 4
- 102100033571 Tissue-type plasminogen activator Human genes 0.000 description 4
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 4
- 206010052015 cytokine release syndrome Diseases 0.000 description 4
- 230000003247 decreasing effect Effects 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 4
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 230000002068 genetic effect Effects 0.000 description 4
- 208000024908 graft versus host disease Diseases 0.000 description 4
- 102000056003 human IL15 Human genes 0.000 description 4
- 210000002865 immune cell Anatomy 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 229940047122 interleukins Drugs 0.000 description 4
- 210000000822 natural killer cell Anatomy 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 229930192851 perforin Natural products 0.000 description 4
- 229940124531 pharmaceutical excipient Drugs 0.000 description 4
- 230000000644 propagated effect Effects 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 229920002477 rna polymer Polymers 0.000 description 4
- 238000011172 small scale experimental method Methods 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 208000023275 Autoimmune disease Diseases 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 102000014150 Interferons Human genes 0.000 description 3
- 108010050904 Interferons Proteins 0.000 description 3
- 102000000589 Interleukin-1 Human genes 0.000 description 3
- 108010002352 Interleukin-1 Proteins 0.000 description 3
- 102000003814 Interleukin-10 Human genes 0.000 description 3
- 108090000174 Interleukin-10 Proteins 0.000 description 3
- 108010092694 L-Selectin Proteins 0.000 description 3
- 230000005867 T cell response Effects 0.000 description 3
- 210000000173 T-lymphoid precursor cell Anatomy 0.000 description 3
- 230000001154 acute effect Effects 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 230000001461 cytolytic effect Effects 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 210000003527 eukaryotic cell Anatomy 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 238000007710 freezing Methods 0.000 description 3
- 230000008014 freezing Effects 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 238000011081 inoculation Methods 0.000 description 3
- 230000002147 killing effect Effects 0.000 description 3
- 210000003738 lymphoid progenitor cell Anatomy 0.000 description 3
- 238000002595 magnetic resonance imaging Methods 0.000 description 3
- 238000012423 maintenance Methods 0.000 description 3
- 230000035800 maturation Effects 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 3
- 244000052769 pathogen Species 0.000 description 3
- 230000001717 pathogenic effect Effects 0.000 description 3
- 239000008188 pellet Substances 0.000 description 3
- 238000009520 phase I clinical trial Methods 0.000 description 3
- 229960004618 prednisone Drugs 0.000 description 3
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 2
- 101710169336 5'-deoxyadenosine deaminase Proteins 0.000 description 2
- 102100023990 60S ribosomal protein L17 Human genes 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- 102000055025 Adenosine deaminases Human genes 0.000 description 2
- 102000006306 Antigen Receptors Human genes 0.000 description 2
- 108010083359 Antigen Receptors Proteins 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 210000001239 CD8-positive, alpha-beta cytotoxic T lymphocyte Anatomy 0.000 description 2
- 102100035793 CD83 antigen Human genes 0.000 description 2
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 2
- 229940045513 CTLA4 antagonist Drugs 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 102000019034 Chemokines Human genes 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- 206010010904 Convulsion Diseases 0.000 description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 2
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 101000946856 Homo sapiens CD83 antigen Proteins 0.000 description 2
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 2
- 101001002657 Homo sapiens Interleukin-2 Proteins 0.000 description 2
- 101001043807 Homo sapiens Interleukin-7 Proteins 0.000 description 2
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 description 2
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 2
- 102100025390 Integrin beta-2 Human genes 0.000 description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 2
- 102000008070 Interferon-gamma Human genes 0.000 description 2
- 102100030694 Interleukin-11 Human genes 0.000 description 2
- 102000003816 Interleukin-13 Human genes 0.000 description 2
- 108090000176 Interleukin-13 Proteins 0.000 description 2
- 101800003050 Interleukin-16 Proteins 0.000 description 2
- 102000049772 Interleukin-16 Human genes 0.000 description 2
- 108050003558 Interleukin-17 Proteins 0.000 description 2
- 102000013691 Interleukin-17 Human genes 0.000 description 2
- 102000013264 Interleukin-23 Human genes 0.000 description 2
- 108010065637 Interleukin-23 Proteins 0.000 description 2
- 108010002386 Interleukin-3 Proteins 0.000 description 2
- 102000000646 Interleukin-3 Human genes 0.000 description 2
- 101710181549 Interleukin-34 Proteins 0.000 description 2
- 102100033499 Interleukin-34 Human genes 0.000 description 2
- 108091007973 Interleukin-36 Proteins 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 102000004890 Interleukin-8 Human genes 0.000 description 2
- 108090001007 Interleukin-8 Proteins 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 2
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 2
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 206010048723 Multiple-drug resistance Diseases 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- 102100031789 Myeloid-derived growth factor Human genes 0.000 description 2
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 2
- 206010037660 Pyrexia Diseases 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 2
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 2
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 2
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 2
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 238000002617 apheresis Methods 0.000 description 2
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 2
- 210000000601 blood cell Anatomy 0.000 description 2
- 210000001772 blood platelet Anatomy 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 230000032823 cell division Effects 0.000 description 2
- 238000002659 cell therapy Methods 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 239000002577 cryoprotective agent Substances 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 2
- 229940000406 drug candidate Drugs 0.000 description 2
- 210000003162 effector t lymphocyte Anatomy 0.000 description 2
- 210000002889 endothelial cell Anatomy 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000003777 experimental drug Substances 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 102000052622 human IL7 Human genes 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 229940117681 interleukin-12 Drugs 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 210000000066 myeloid cell Anatomy 0.000 description 2
- 238000009521 phase II clinical trial Methods 0.000 description 2
- 210000004180 plasmocyte Anatomy 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 238000009258 post-therapy Methods 0.000 description 2
- 230000004850 protein–protein interaction Effects 0.000 description 2
- 210000001938 protoplast Anatomy 0.000 description 2
- 150000003212 purines Chemical class 0.000 description 2
- 150000003230 pyrimidines Chemical class 0.000 description 2
- 238000012797 qualification Methods 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 210000000130 stem cell Anatomy 0.000 description 2
- 210000002536 stromal cell Anatomy 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 102000003390 tumor necrosis factor Human genes 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 108020003589 5' Untranslated Regions Proteins 0.000 description 1
- 102000014777 Adipokines Human genes 0.000 description 1
- 108010078606 Adipokines Proteins 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 206010002961 Aplasia Diseases 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 230000003844 B-cell-activation Effects 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 101710149858 C-C chemokine receptor type 7 Proteins 0.000 description 1
- 102100023702 C-C motif chemokine 13 Human genes 0.000 description 1
- 102100023705 C-C motif chemokine 14 Human genes 0.000 description 1
- 102100023703 C-C motif chemokine 15 Human genes 0.000 description 1
- 102100023700 C-C motif chemokine 16 Human genes 0.000 description 1
- 102100023701 C-C motif chemokine 18 Human genes 0.000 description 1
- 102100036842 C-C motif chemokine 19 Human genes 0.000 description 1
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 1
- 102100036848 C-C motif chemokine 20 Human genes 0.000 description 1
- 102100036846 C-C motif chemokine 21 Human genes 0.000 description 1
- 102100036850 C-C motif chemokine 23 Human genes 0.000 description 1
- 102100036849 C-C motif chemokine 24 Human genes 0.000 description 1
- 102100021933 C-C motif chemokine 25 Human genes 0.000 description 1
- 102100021935 C-C motif chemokine 26 Human genes 0.000 description 1
- 102100021936 C-C motif chemokine 27 Human genes 0.000 description 1
- 102100021942 C-C motif chemokine 28 Human genes 0.000 description 1
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 1
- 102100032366 C-C motif chemokine 7 Human genes 0.000 description 1
- 102100034871 C-C motif chemokine 8 Human genes 0.000 description 1
- 102100025248 C-X-C motif chemokine 10 Human genes 0.000 description 1
- 102100025279 C-X-C motif chemokine 11 Human genes 0.000 description 1
- 102100025277 C-X-C motif chemokine 13 Human genes 0.000 description 1
- 102100036153 C-X-C motif chemokine 6 Human genes 0.000 description 1
- 102100036170 C-X-C motif chemokine 9 Human genes 0.000 description 1
- 101150049756 CCL6 gene Proteins 0.000 description 1
- 101150011672 CCL9 gene Proteins 0.000 description 1
- 108010041397 CD4 Antigens Proteins 0.000 description 1
- 108010029697 CD40 Ligand Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- 102100025221 CD70 antigen Human genes 0.000 description 1
- 108010032795 CD8 receptor Proteins 0.000 description 1
- 102100027221 CD81 antigen Human genes 0.000 description 1
- 108090000835 CX3C Chemokine Receptor 1 Proteins 0.000 description 1
- 102100039196 CX3C chemokine receptor 1 Human genes 0.000 description 1
- 101150075117 Ccl12 gene Proteins 0.000 description 1
- 102000016289 Cell Adhesion Molecules Human genes 0.000 description 1
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 1
- 102100035294 Chemokine XC receptor 1 Human genes 0.000 description 1
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 1
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 1
- 102100030135 Complement C1q tumor necrosis factor-related protein 5 Human genes 0.000 description 1
- 102100032768 Complement receptor type 2 Human genes 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 102100035298 Cytokine SCM-1 beta Human genes 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102100031780 Endonuclease Human genes 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102100023688 Eotaxin Human genes 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 101710111526 Erythroferrone Proteins 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 101001091269 Escherichia coli Hygromycin-B 4-O-kinase Proteins 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 102100020997 Fractalkine Human genes 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 102100034221 Growth-regulated alpha protein Human genes 0.000 description 1
- 206010066476 Haematological malignancy Diseases 0.000 description 1
- 206010062713 Haemorrhagic diathesis Diseases 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 description 1
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101000978379 Homo sapiens C-C motif chemokine 13 Proteins 0.000 description 1
- 101000978381 Homo sapiens C-C motif chemokine 14 Proteins 0.000 description 1
- 101000978376 Homo sapiens C-C motif chemokine 15 Proteins 0.000 description 1
- 101000978375 Homo sapiens C-C motif chemokine 16 Proteins 0.000 description 1
- 101000978371 Homo sapiens C-C motif chemokine 18 Proteins 0.000 description 1
- 101000713106 Homo sapiens C-C motif chemokine 19 Proteins 0.000 description 1
- 101000897480 Homo sapiens C-C motif chemokine 2 Proteins 0.000 description 1
- 101000713099 Homo sapiens C-C motif chemokine 20 Proteins 0.000 description 1
- 101000713085 Homo sapiens C-C motif chemokine 21 Proteins 0.000 description 1
- 101000713081 Homo sapiens C-C motif chemokine 23 Proteins 0.000 description 1
- 101000713078 Homo sapiens C-C motif chemokine 24 Proteins 0.000 description 1
- 101000897486 Homo sapiens C-C motif chemokine 25 Proteins 0.000 description 1
- 101000897493 Homo sapiens C-C motif chemokine 26 Proteins 0.000 description 1
- 101000897494 Homo sapiens C-C motif chemokine 27 Proteins 0.000 description 1
- 101000897477 Homo sapiens C-C motif chemokine 28 Proteins 0.000 description 1
- 101000797762 Homo sapiens C-C motif chemokine 5 Proteins 0.000 description 1
- 101000797758 Homo sapiens C-C motif chemokine 7 Proteins 0.000 description 1
- 101000946794 Homo sapiens C-C motif chemokine 8 Proteins 0.000 description 1
- 101000858088 Homo sapiens C-X-C motif chemokine 10 Proteins 0.000 description 1
- 101000858060 Homo sapiens C-X-C motif chemokine 11 Proteins 0.000 description 1
- 101000858064 Homo sapiens C-X-C motif chemokine 13 Proteins 0.000 description 1
- 101000947177 Homo sapiens C-X-C motif chemokine 6 Proteins 0.000 description 1
- 101000947172 Homo sapiens C-X-C motif chemokine 9 Proteins 0.000 description 1
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 1
- 101000914479 Homo sapiens CD81 antigen Proteins 0.000 description 1
- 101000804783 Homo sapiens Chemokine XC receptor 1 Proteins 0.000 description 1
- 101000941929 Homo sapiens Complement receptor type 2 Proteins 0.000 description 1
- 101000804771 Homo sapiens Cytokine SCM-1 beta Proteins 0.000 description 1
- 101000978392 Homo sapiens Eotaxin Proteins 0.000 description 1
- 101000854520 Homo sapiens Fractalkine Proteins 0.000 description 1
- 101001069921 Homo sapiens Growth-regulated alpha protein Proteins 0.000 description 1
- 101001002470 Homo sapiens Interferon lambda-1 Proteins 0.000 description 1
- 101001076407 Homo sapiens Interleukin-1 receptor antagonist protein Proteins 0.000 description 1
- 101000853002 Homo sapiens Interleukin-25 Proteins 0.000 description 1
- 101000853000 Homo sapiens Interleukin-26 Proteins 0.000 description 1
- 101000998139 Homo sapiens Interleukin-32 Proteins 0.000 description 1
- 101001055222 Homo sapiens Interleukin-8 Proteins 0.000 description 1
- 101000804764 Homo sapiens Lymphotactin Proteins 0.000 description 1
- 101001128431 Homo sapiens Myeloid-derived growth factor Proteins 0.000 description 1
- 101000622137 Homo sapiens P-selectin Proteins 0.000 description 1
- 101000947178 Homo sapiens Platelet basic protein Proteins 0.000 description 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 1
- 101000956004 Homo sapiens Vitamin D-binding protein Proteins 0.000 description 1
- GRRNUXAQVGOGFE-UHFFFAOYSA-N Hygromycin-B Natural products OC1C(NC)CC(N)C(O)C1OC1C2OC3(C(C(O)C(O)C(C(N)CO)O3)O)OC2C(O)C(CO)O1 GRRNUXAQVGOGFE-UHFFFAOYSA-N 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 206010021460 Immunodeficiency syndromes Diseases 0.000 description 1
- 108010034143 Inflammasomes Proteins 0.000 description 1
- 108010014726 Interferon Type I Proteins 0.000 description 1
- 102000002227 Interferon Type I Human genes 0.000 description 1
- 108010005716 Interferon beta-1a Proteins 0.000 description 1
- 108010005714 Interferon beta-1b Proteins 0.000 description 1
- 229940119178 Interleukin 1 receptor antagonist Drugs 0.000 description 1
- 102000051628 Interleukin-1 receptor antagonist Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 102100039879 Interleukin-19 Human genes 0.000 description 1
- 108050009288 Interleukin-19 Proteins 0.000 description 1
- 102000011718 Interleukin-23 Subunit p19 Human genes 0.000 description 1
- 108010076561 Interleukin-23 Subunit p19 Proteins 0.000 description 1
- 102100036679 Interleukin-26 Human genes 0.000 description 1
- 108010066979 Interleukin-27 Proteins 0.000 description 1
- 101710181613 Interleukin-31 Proteins 0.000 description 1
- 108010067003 Interleukin-33 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 102000000743 Interleukin-5 Human genes 0.000 description 1
- 102100026236 Interleukin-8 Human genes 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 102000000585 Interleukin-9 Human genes 0.000 description 1
- 108010025815 Kanamycin Kinase Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 102100035304 Lymphotactin Human genes 0.000 description 1
- 102100026894 Lymphotoxin-beta Human genes 0.000 description 1
- 108090000362 Lymphotoxin-beta Proteins 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102000007651 Macrophage Colony-Stimulating Factor Human genes 0.000 description 1
- 108010009474 Macrophage Inflammatory Proteins Proteins 0.000 description 1
- 102000009571 Macrophage Inflammatory Proteins Human genes 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 101000934342 Mus musculus T-cell surface glycoprotein CD5 Proteins 0.000 description 1
- 108010064862 Nicotinamide phosphoribosyltransferase Proteins 0.000 description 1
- 102000015532 Nicotinamide phosphoribosyltransferase Human genes 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 102000004140 Oncostatin M Human genes 0.000 description 1
- 108090000630 Oncostatin M Proteins 0.000 description 1
- 102100023472 P-selectin Human genes 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 1
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 102100036154 Platelet basic protein Human genes 0.000 description 1
- 102100030304 Platelet factor 4 Human genes 0.000 description 1
- 108090000778 Platelet factor 4 Proteins 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102000014128 RANK Ligand Human genes 0.000 description 1
- 108010025832 RANK Ligand Proteins 0.000 description 1
- 239000008156 Ringer's lactate solution Substances 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 101001091268 Streptomyces hygroscopicus Hygromycin-B 7''-O-kinase Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 208000001871 Tachycardia Diseases 0.000 description 1
- 210000000068 Th17 cell Anatomy 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 102100038611 Vitamin D-binding protein Human genes 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 210000005006 adaptive immune system Anatomy 0.000 description 1
- 239000000478 adipokine Substances 0.000 description 1
- 208000014619 adult acute lymphoblastic leukemia Diseases 0.000 description 1
- 201000011184 adult acute lymphocytic leukemia Diseases 0.000 description 1
- 238000011256 aggressive treatment Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 230000036783 anaphylactic response Effects 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000690 anti-lymphoma Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000003190 augmentative effect Effects 0.000 description 1
- IVRMZWNICZWHMI-UHFFFAOYSA-N azide group Chemical group [N-]=[N+]=[N-] IVRMZWNICZWHMI-UHFFFAOYSA-N 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- ZEWYCNBZMPELPF-UHFFFAOYSA-J calcium;potassium;sodium;2-hydroxypropanoic acid;sodium;tetrachloride Chemical compound [Na].[Na+].[Cl-].[Cl-].[Cl-].[Cl-].[K+].[Ca+2].CC(O)C(O)=O ZEWYCNBZMPELPF-UHFFFAOYSA-J 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000004186 co-expression Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 108091036078 conserved sequence Proteins 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000008260 defense mechanism Effects 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 238000009093 first-line therapy Methods 0.000 description 1
- 210000000285 follicular dendritic cell Anatomy 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 238000010363 gene targeting Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 208000031169 hemorrhagic disease Diseases 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- GRRNUXAQVGOGFE-NZSRVPFOSA-N hygromycin B Chemical compound O[C@@H]1[C@@H](NC)C[C@@H](N)[C@H](O)[C@H]1O[C@H]1[C@H]2O[C@@]3([C@@H]([C@@H](O)[C@@H](O)[C@@H](C(N)CO)O3)O)O[C@H]2[C@@H](O)[C@@H](CO)O1 GRRNUXAQVGOGFE-NZSRVPFOSA-N 0.000 description 1
- 229940097277 hygromycin b Drugs 0.000 description 1
- 230000036543 hypotension Effects 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229960004461 interferon beta-1a Drugs 0.000 description 1
- 229960003161 interferon beta-1b Drugs 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 108010018844 interferon type III Proteins 0.000 description 1
- 229940028894 interferon type ii Drugs 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 239000003407 interleukin 1 receptor blocking agent Substances 0.000 description 1
- 108090000681 interleukin 20 Proteins 0.000 description 1
- 102000004114 interleukin 20 Human genes 0.000 description 1
- 229940076144 interleukin-10 Drugs 0.000 description 1
- 229940124829 interleukin-23 Drugs 0.000 description 1
- 102000003898 interleukin-24 Human genes 0.000 description 1
- 108090000237 interleukin-24 Proteins 0.000 description 1
- 229940100601 interleukin-6 Drugs 0.000 description 1
- 229940100994 interleukin-7 Drugs 0.000 description 1
- 229940096397 interleukin-8 Drugs 0.000 description 1
- XKTZWUACRZHVAN-VADRZIEHSA-N interleukin-8 Chemical compound C([C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](NC(C)=O)CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCSC)C(=O)N1[C@H](CCC1)C(=O)N1[C@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC=1C=CC(O)=CC=1)C(=O)N[C@H](CO)C(=O)N1[C@H](CCC1)C(N)=O)C1=CC=CC=C1 XKTZWUACRZHVAN-VADRZIEHSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- GRPSNTXTTSBKGW-BVGHQBMWSA-J magnesium;potassium;sodium;(3r,4s,5s,6r)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol;triacetate;chloride Chemical compound [Na+].[Mg+2].[Cl-].[K+].CC([O-])=O.CC([O-])=O.CC([O-])=O.OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O GRPSNTXTTSBKGW-BVGHQBMWSA-J 0.000 description 1
- 201000010893 malignant breast melanoma Diseases 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 210000003593 megakaryocyte Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- 210000003643 myeloid progenitor cell Anatomy 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 108010046821 oprelvekin Proteins 0.000 description 1
- 229960001840 oprelvekin Drugs 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000012261 overproduction Methods 0.000 description 1
- 238000004091 panning Methods 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 210000001539 phagocyte Anatomy 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 125000005642 phosphothioate group Chemical group 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000002601 radiography Methods 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000009712 regulation of translation Effects 0.000 description 1
- 210000003289 regulatory T cell Anatomy 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 210000005212 secondary lymphoid organ Anatomy 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 230000008054 signal transmission Effects 0.000 description 1
- 238000007390 skin biopsy Methods 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000011255 standard chemotherapy Methods 0.000 description 1
- 238000011476 stem cell transplantation Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000006794 tachycardia Effects 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 229960003989 tocilizumab Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 210000000264 venule Anatomy 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1774—Immunoglobulin superfamily (e.g. CD2, CD4, CD8, ICAM molecules, B7 molecules, Fc-receptors, MHC-molecules)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/179—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
- A61K38/1793—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
- A61K39/464412—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0091—Purification or manufacturing processes for gene therapy compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70517—CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/715—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons
- C07K14/7151—Receptors; Cell surface antigens; Cell surface determinants for cytokines; for lymphokines; for interferons for tumor necrosis factor [TNF], for lymphotoxin [LT]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
- C12N5/0638—Cytotoxic T lymphocytes [CTL] or lymphokine activated killer cells [LAK]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/12—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y105/00—Oxidoreductases acting on the CH-NH group of donors (1.5)
- C12Y105/01—Oxidoreductases acting on the CH-NH group of donors (1.5) with NAD+ or NADP+ as acceptor (1.5.1)
- C12Y105/01003—Dihydrofolate reductase (1.5.1.3)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/10—Protein-tyrosine kinases (2.7.10)
- C12Y207/10001—Receptor protein-tyrosine kinase (2.7.10.1)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K2035/124—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells the cells being hematopoietic, bone marrow derived or blood cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5158—Antigen-pulsed cells, e.g. T-cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2121/00—Preparations for use in therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/10—Immunoglobulins specific features characterized by their source of isolation or production
- C07K2317/14—Specific host cells or culture conditions, e.g. components, pH or temperature
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/15011—Lentivirus, not HIV, e.g. FIV, SIV
- C12N2740/15041—Use of virus, viral particle or viral elements as a vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2800/00—Nucleic acids vectors
- C12N2800/90—Vectors containing a transposable element
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2820/00—Vectors comprising a special origin of replication system
- C12N2820/002—Vectors comprising a special origin of replication system inducible or controllable
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Medicinal Chemistry (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Cell Biology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Hematology (AREA)
- Mycology (AREA)
- Oncology (AREA)
- Virology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Developmental Biology & Embryology (AREA)
- Endocrinology (AREA)
- Communicable Diseases (AREA)
Abstract
Изобретение относится к области биотехнологии, конкретно к способу культивирования популяции T-клеток, содержащих химерный антигенный рецептор (CAR), и может быть использовано в медицине. Заявленный способ, включающий приведение популяции Т-клеток в контакт с комбинацией цитокинов, включающей IL-15 и по меньшей мере один цитокин, выбранный из IL-2, IL-7, IL-12, IL-18 и IL-21, позволяет получать популяцию T-клеток, содержащих CAR, эффективно применяемую в иммунотерапии рака. 4 н. и 46 з.п. ф-лы, 61 ил., 1 пр.
Description
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №61/977751, поданной 10 апреля 2014 г., предварительной заявке на патент США №61/986479, поданной 30 апреля 2014 г., предварительной заявке на патент США №62/058973, поданной 2 октября 2014 г., предварительной заявке на патент США №62/088363, поданной 5 декабря 2014 г., предварительной заявке на патент США №62/089730 поданной 9 декабря 2014 г., и предварительной заявке на патент США №62/090845, поданной 11 декабря 2014 г. Описания упомянутых выше заявок в явном виде полностью включены в данную заявку посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящая заявка подается вместе с Перечнем последовательностей в электронном формате. Перечень последовательностей предоставлен в виде файла с наименованием SCRI-090WO_SEQUENCE_LISTING.TXT, созданного 23 марта 2015 г., размер которого составляет 2,92 кб. Информация, представленная в электронном формате перечня последовательностей, полностью включена в данную заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0003] В аспектах настоящего изобретения предложены подходы к получению генетически модифицированных Т-клеток, содержащих химерный антигенный рецептор. Описанные способы включают селекцию и/или выделение CD4+ и/или CD8+ Т-клеток из смешанной популяции Т-клеток, которые затем активируют, генетически модифицируют и размножают в отдельных культурах в присутствии одного или более цитокинов, которые поддерживают выживаемость, приживление и/или пролиферацию данных клеток, а также способствуют сохранению рецепторов клеточной поверхности, таких как CD62L, CD28 и/или CD27.
УРОВЕНЬ ТЕХНИКИ
[0004] После аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК) может произойти рецидив острого лимфобластного лейкоза (ОЛЛ). Соответственно, многие полагают, что такие подходы неэффективны. У адоптивного переноса Т-лимфоцитов человека, которые сконструированы путем переноса генов для экспрессии химерных антигенных рецепторов (CAR), специфичных к молекулам, представленным на поверхности опухолевых клеток или злокачественных В-клеток, также есть потенциал эффективного лечения многих распространенных типов рака и злокачественных новообразований. Для того чтобы обеспечивать эффективное и длительное лечение тем не менее у введенных Т-клеток, которые содержат химерные антигенные рецепторы, желательно должны быть высокие уровни выживаемости и скорости пролиферации после переноса пациенту. Указанные Т-клетки, применяемые для терапии, также желательно должны быть пригодны для трансплантации. Несмотря на колоссальные усилия, предпринятые в данной области техники, сохраняется потребность в дополнительных эффективных клеточных методах лечения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] В аспектах настоящего изобретения, описанных в настоящей заявке, предложены способы получения генетически модифицированных Т-клеток, содержащих химерный антигенный рецептор, для терапии человека. В качестве альтернативы предложены способы, в которых используют селекцию, обогащение и/или выделение Т-клеток, экспрессирующих CD4+ и/или CD8+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно индуцированных плюрипотентных стволовых клеток (иПС-клеток), из смешанной популяции Т-клеток. После селекции, обогащения или выделения Т-клетки, экспрессирующие CD4+ и/или CD8+, активируют, генетически модифицируют и размножают, предпочтительно, в отдельных, обогащенных или выделенных культурах, в присутствии одного или более цитокинов, которые можно экзогенно добавить к Т-клеткам, например, дополнительно к любому цитокину, который может продуцироваться указанными клетками или присутствовать в среде, и которые поддерживают, вызывают, индуцируют или способствуют выживаемости, приживлению и/или пролиферации данных клеток, а также предпочтительно поддерживают, вызывают, индуцируют или способствуют сохранению рецепторов клеточной поверхности, таких как CD62L, CD28 и/или CD27. В данной заявке также предложены способы лечения, ингибирования, снижения выраженности или элиминации рака путем введения нуждающемуся в этом субъекту одного или более типов полученных с помощью генетической инженерии Т-клеток или композиций, которые содержат полученную с помощью генетической инженерии Т-клетку, полученную, как описано в данной заявке.
[0006] В некоторых аспектах настоящего изобретения, описанных в настоящей заявке, предложены способы получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. С помощью нескольких подходов данные способы осуществляют путем отделения, выделения или обогащения популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток для того, чтобы получить отделенную, выделенную или обогащенную популяцию Т-клеток; стимуляции данных отделенных, выделенных или обогащенных популяций Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+; трансдукции популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+; приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, с по меньшей мере одним цитокином, который можно экзогенно добавить к Т-клеткам, например, дополнительно к любому цитокину, который может продуцироваться указанными клетками или присутствовать в среде, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+; обогащения популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по указанной маркерной последовательности для того, чтобы получить отделенную, обогащенную или выделенную популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+; и размножения указанной отделенной, обогащенной или выделенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере двух дней с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. В некоторых альтернативных аспектах указанные Т-клетки, экспрессирующие CD8+, и/или Т-клетки, экспрессирующие CD4+, можно размножать в течение по меньшей мере или ровно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. В некоторых альтернативных аспектах отделение или обогащение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют путем аффинной селекции Т-клеток, содержащих эпитоп, представленный на CD8 и/или CD4. В некоторых альтернативных аспектах отделение или обогащение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной осуществляют с помощью проточной цитометрии. В некоторых альтернативных аспектах отделение или обогащение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют с помощью иммуномагнитной селекции. В некоторых альтернативных аспектах указанные генетически модифицированные CD8+ Т-клетки и/или CD4+ Т-клетки содержат по меньшей мере один рецептор, который вызывает, индуцирует, способствует или повышает способность к приживлению. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах стимуляцию выделенной популяции Т-клеток осуществляют путем приведения в контакт CD8+ и/или CD4+ Т-клеток с подложкой, с которой связаны антитела, такой как гранула или частица. В некоторых альтернативных аспектах подложка, с которой связаны антитела, содержит антитела к TCR, к CD2, к CD3, к CD4 и/или к CD28. В некоторых альтернативных аспектах подложка, с которой связаны антитела, содержит антитела к CD3 и/или к CD28. В некоторых альтернативных аспектах указанный вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных аспектах маркерная последовательность кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах по меньшей мере один цитокин включает GM-CSF, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21, который можно добавлять в количестве 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл или 1,0 нг/мл, или в количестве, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств, и/или в количестве 10 Ед/мл, 20 Ед/мл, 30 Ед/мл, 40 Ед/мл, 50 Ед/мл, 60 Ед/мл, 70 Ед/мл, 80 Ед/мл, 90 Ед/мл или 100 Ед/мл, или в количестве, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21, при этом добавляемое количество цитокина составляет 0,5 нг/мл и/или 50 Ед/мл. В некоторых альтернативных аспектах контакт осуществляют в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение периода времени, который находится внутри диапазона, ограниченного любыми двумя из данных значений. В некоторых альтернативных аспектах указанный способ осуществляют с выделенными, очищенными, обогащенными или отделенными CD4+ клетками в отсутствие CD8+ клеток, при существенном обеднении CD8+ клетками или при обогащении относительно CD8+ клеток. В некоторых альтернативных аспектах указанный способ осуществляют с выделенными, очищенными, обогащенными или отделенными CD8+ клетками в отсутствие CD4+ клеток, при существенном обеднении CD4+ клетками или при обогащении относительно CD4+ клеток. В некоторых альтернативных аспектах указанные Т-клетки, экспрессирующие CD4+, размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени. В некоторых альтернативных аспектах CD8+ Т-клетки размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени. В некоторых альтернативных аспектах указанный способ дополнительно включает удаление подложки, с которой связаны антитела, такой как гранулы или частицы. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора содержит FMC63 или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора специфичен к CD19. В некоторых альтернативных аспектах указанный способ дополнительно включает криоконсервацию указанных генетически модифицированных CD8+ и/или CD4+ Т-клеток.
[0007] В некоторых альтернативных аспектах отделение, обогащение или выделение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток осуществляют путем аффинной селекции Т-клеток, содержащих эпитоп, представленный на CD8 и/или CD4. В некоторых альтернативных аспектах отделение, обогащение или выделение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, из смешанной популяции Т-клеток осуществляют с помощью проточной цитометрии. В некоторых альтернативных аспектах отделение, обогащение или выделение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, из смешанной популяции Т-клеток осуществляют с помощью иммуномагнитной селекции. В некоторых альтернативных аспектах указанные генетически модифицированные Т-клетки, экспрессирующие CD8+, и/или Т-клетки, экспрессирующие CD4+, содержат по меньшей мере один рецептор, который вызывает, индуцирует или способствует приживлению. В некоторых альтернативных аспектах по меньшей мере один рецептор, который вызывает, индуцирует или способствует приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В предпочтительных альтернативных аспектах по меньшей мере один рецептор, который вызывает, индуцирует или способствует приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах стимуляцию выделенной, обогащенной или отделенной популяции Т-клеток осуществляют путем приведения в контакт Т-клеток, экспрессирующих CD8+ и/или CD4+, с подложкой, с которой связаны антитела, такой как гранула или частица. В некоторых из данных альтернативных аспектов подложка, с которой связаны антитела, содержит антитела к TCR, к CD2, к CD3, к CD4 и/или к CD28. В предпочтительных альтернативных аспектах подложка, с которой связаны антитела, содержит антитела к CD3 и/или к CD28.
[0008] Во многих из упомянутых выше альтернативных аспектов вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемую маркерную последовательность. В некоторых из данных альтернативных аспектов вектор дополнительно содержит последовательность, кодирующую спейсер, который, в некоторых альтернативных аспектах, возможно содержит шарнир IgG4. Во многих из упомянутых выше альтернативных аспектов вектор представляет собой вирусный вектор или миникольцо.
[0009] Во многих из упомянутых выше альтернативных аспектов вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. Предпочтительно вирусный вектор представляет собой вектор на основе лентивируса. Во многих из упомянутых выше альтернативных аспектов маркерная последовательность кодирует укороченный рецептор эпидермального фактора роста (EGFRt). Во многих из упомянутых выше альтернативных аспектов по меньшей мере один применяемый цитокин включает GM-CSF, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21, и указанный цитокин добавляют к Т-клеткам экзогенно, например, дополнительно к любому цитокину, который может продуцироваться указанными клетками или присутствовать в среде.
[0010] В желательных альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. Во многих из упомянутых выше альтернативных аспектов по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В предпочтительных альтернативных аспектах период осуществления контакта составляет по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или период времени, который находится внутри диапазона, ограниченного любыми двумя из данных моментов времени. Во многих из упомянутых выше альтернативных аспектов указанные способы осуществляют с выделенными, отделенными или обогащенными популяциями Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, в отсутствие или с пониженным количеством Т-клеток, экспрессирующих CD8+, по сравнению с нативной популяцией неотделенных, необогащенных или невыделенных Т-клеток. Во многих из упомянутых выше альтернативных аспектов данные способы осуществляют с выделенными, отделенными или обогащенными популяциями Т-клеток, экспрессирующих CD8+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, в отсутствие или с пониженным количеством Т-клеток, экспрессирующих CD4+, по сравнению с нативной популяцией неотделенных, необогащенных или невыделенных Т-клеток. Во многих из упомянутых выше альтернативных аспектов указанные Т-клетки, экспрессирующие CD4+, размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени. Во многих из упомянутых выше альтернативных аспектов указанные Т-клетки, экспрессирующие CD8+, размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени.
[0011] Во многих из упомянутых выше альтернативных аспектов указанные способы дополнительно включают удаление подложки, с которой связаны антитела, такой как гранулы или частицы. Во многих из упомянутых выше альтернативных аспектов лиганд-связывающий домен химерного антигенного рецептора содержит антитело или его связывающую часть. Во многих из упомянутых выше альтернативных аспектов лиганд-связывающий домен химерного антигенного рецептора содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. Во многих из упомянутых выше альтернативных аспектов лиганд-связывающий домен химерного антигенного рецептора содержит FMC63 или его связывающую часть, такой как описанный в патенте США номер 7446179, описание которого явно полностью включено в данную заявку посредством ссылки. Во многих из упомянутых выше альтернативных аспектов лиганд-связывающий домен химерного антигенного рецептора специфичен к CD19. Во многих из упомянутых выше альтернативных аспектов способ дополнительно включает криоконсервацию указанных генетически модифицированных CD8+ и/или CD4+ Т-клеток.
[0012] В дополнительных аспектах настоящего изобретения предложена популяция генетически модифицированных Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, содержащая множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, в обогащенной форме, например, обогащенных или выделенных из CD8- и/или CD4- Т-клеток или в отсутствие CD8- и/или CD4- Т-клеток, при этом указанное множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции или обогащенных Т-клеток, экспрессирующих CD8+ и/или CD4+, дополнительно содержит ген, кодирующий химерный антигенный рецептор, и ген, кодирующий селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции или обогащенных Т-клеток, экспрессирующих CD8+ и/или CD4+, повторно стимулируют по меньшей мере одним цитокином, который можно экзогенно добавить к Т-клеткам, например, дополнительно к любому цитокину, который может продуцироваться указанными клетками или присутствовать в среде, например, путем осуществления контакта клеток с экзогенно добавленным цитокином в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени. В некоторых альтернативных аспектах указанное множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, дополнительно содержат по меньшей мере один рецептор, который вызывает, индуцирует или способствует приживлению. В некоторых альтернативных аспектах по меньшей мере один рецептор, который вызывает, индуцирует, улучшает или повышает способность к приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах по меньшей мере один рецептор, который вызывает, индуцирует, улучшает или повышает способность к приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, дополнительно содержит вектор, содержащий первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер.
[0013] В некоторых альтернативных аспектах предложена популяция генетически модифицированных Т-клеток. В некоторых альтернативных аспектах популяция генетически модифицированных Т-клеток включает множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток при отсутствии CD8- и/или CD4- Т-клеток, при существенном обеднении CD8- и/или CD4- Т-клетками или при обогащении относительно CD8- и/или CD4- Т-клеток, при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит ген, кодирующий химерный антигенный рецептор, и селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток повторно стимулируют по меньшей мере одним цитокином. В некоторых альтернативных аспектах указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит по меньшей мере один рецептор, который вызывает, усиливает, улучшает или способствует приживлению. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который вызывает, усиливает, улучшает или способствует приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который вызывает, усиливает, улучшает или способствует приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит вектор, содержащий первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных аспектах селектируемый маркер на поверхности клетки кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах лиганд-связывающий домен содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит FMC63 или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен специфичен к CD19. В некоторых альтернативных аспектах указанная популяция включает выделенные, очищенные, отделенные или обогащенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток, при существенном обеднении CD4+ Т-клетками или при обогащении относительно CD4+ Т-клеток. В некоторых альтернативных аспектах указанная популяция включает выделенные, очищенные, отделенные или обогащенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток, при существенном обеднении CD8+ Т-клетками или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах Т-клетка представляет собой предшественник Т-клетки. В некоторых альтернативных аспектах предшественник Т-клетки представляет собой гематопоэтическую стволовую клетку. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер, такой как спейсер, который содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса или миникольцо. В некоторых альтернативных аспектах селектируемый маркер на поверхности клетки кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах лиганд-связывающий домен содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит FMC63 или его связывающую часть, такой как описанный в патенте США номер 7446179, описание которого в явном виде полностью включено в данную заявку посредством ссылки. В некоторых альтернативных аспектах лиганд-связывающий домен специфичен к CD19. В некоторых альтернативных аспектах популяция генетически модифицированных Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, включает выделенные Т-клетки, экспрессирующие CD8+, в отсутствие или с пониженным количеством Т-клеток, экспрессирующих CD4+, по сравнению с нативной популяцией неотделенных, необогащенных или невыделенных Т-клеток. В некоторых альтернативных аспектах популяция генетически модифицированных Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, включает выделенные Т-клетки, экспрессирующие CD4+, в отсутствие или с пониженным количеством Т-клеток, экспрессирующих CD8+, по сравнению с нативной популяцией неотделенных, необогащенных или невыделенных Т-клеток.
[0014] В дополнительных аспектах настоящего изобретения предложена композиция или комбинация продуктов для терапии человека, содержащая фармацевтически приемлемое вспомогательное вещество; и по меньшей мере одну популяцию указанных генетически модифицированных Т-клеток, как описано в предыдущем абзаце. В некоторых альтернативных аспектах композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, экспрессирующих CD8+. В некоторых альтернативных аспектах композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, экспрессирующих CD4+. В некоторых альтернативных аспектах композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, экспрессирующих CD8+, как описано выше, и популяцию генетически модифицированных Т-клеток, экспрессирующих CD4+, как описано выше, в составе смешанной популяции или при одновременном введении при соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или 10:1, или при соотношении, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых соотношений.
[0015] В дополнительных аспектах настоящего изобретения предложены способы лечения, ингибирования или облегчения заболевания у нуждающегося в этом субъекта, включающие введение указанному субъекту по меньшей мере одной композиции или комбинации продуктов, описанных выше. В некоторых альтернативных аспектах указанные способы включают введение композиции или комбинации продуктов, содержащей Т-клетки, экспрессирующие CD4+, такие как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, заранее или перед введением указанных Т-клеток, экспрессирующих CD8+, и в других альтернативных аспектах, клетки, экспрессирующие CD8+, такие как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, вводят перед введением указанных Т-клеток, экспрессирующих CD4+. Во многих альтернативных аспектах субъекта идентифицируют или выбирают для проведения ему противораковой терапии. Во многих из упомянутых выше способов указанный подход также включает измерение или оценку ингибирования заболевания. Во многих из упомянутых выше способов указанный подход также включает проведение указанному субъекту дополнительной противораковой терапии до, во время или после введения композиции или комбинации продуктов, описанных выше.
[0016] Во многих из упомянутых выше способов композицию или комбинацию продуктов вводят указанному субъекту путем адоптивного переноса клеток. В некоторых альтернативных аспектах композицию или комбинацию продуктов вводят указанному субъекту после того, как указанный субъект получил другой вид противораковой терапии. Во многих из упомянутых выше способов указанный субъект страдает от лейкоза. Во многих из упомянутых выше способов субъект страдает от рецидивирующего и/или нечувствительного к химиотерапии CD19+ детского острого лимфобластного лейкоза (ОЛЛ). Во многих из упомянутых выше способов субъект страдает от рецидивирующего и/или нечувствительного к химиотерапии CD19+ острого лимфобластного лейкоза (ОЛЛ). Во многих из упомянутых выше способов указанный субъект страдает от аутоиммунного заболевания. Во многих из упомянутых выше способов указанный субъект страдает от рецидива после ТГСК.
[0017] Соответственно, согласно некоторым аспектам настоящего изобретения предложены следующие альтернативные варианты реализации:
1. Способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, включающий:
отделение или обогащение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток для того, чтобы получить отделенную или обогащенную популяцию Т-клеток;
стимуляцию отделенной или обогащенной популяции Т-клеток для того, чтобы получить стимулированную популяцию CD8+Т-клеток и/или CD4+ Т-клеток;
трансдукцию стимулированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить трансдуцированную популяцию CD8+ Т-клеток и/или CD4+ Т-клеток;
приведение в контакт указанной трансдуцированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток с по меньшей мере одним цитокином, который можно экзогенно добавить к Т-клеткам, например, дополнительно к любому цитокину, который может продуцироваться указанными клетками или присутствовать в среде, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток;
обогащение популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток путем селекции по указанной маркерной последовательности для того, чтобы получить обогащенную популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток; и
размножение обогащенной популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор.
2. Способ согласно альтернативному варианту реализации 1, отличающийся тем, что отделение или обогащение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют путем аффинной селекции Т-клеток, содержащих эпитоп, представленный на CD8 и/или CD4.
3. Способ согласно альтернативному варианту реализации 1 или 2, отличающийся тем, что отделение или обогащение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют с помощью проточной цитометрии.
4. Способ согласно альтернативному варианту реализации 1 или 2, отличающийся тем, что отделение или обогащение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют с помощью иммуномагнитной селекции.
5. Способ согласно любому из альтернативных вариантов реализации 1-4, отличающийся тем, что указанные генетически модифицированные CD8+ Т-клетки и/или CD4+ Т-клетки содержат по меньшей мере один рецептор, который вызывает, индуцирует, способствует или повышает способность к приживлению.
6. Способ согласно альтернативному варианту реализации 5, отличающийся тем, что указанный по меньшей мере один рецептор представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L.
7. Способ согласно альтернативному варианту реализации 5 или 6, отличающийся тем, что указанный по меньшей мере один рецептор представляет собой CD27, CD28 и/или CD62L.
8. Способ согласно любому из альтернативных вариантов реализации 1-7, отличающийся тем, что стимуляцию выделенной популяции Т-клеток осуществляют путем приведения в контакт CD8+ и/или CD4+ Т-клеток с подложкой, с которой связаны антитела, такой как гранула или частица.
9. Способ согласно альтернативному варианту реализации 8, отличающийся тем, что подложка, с которой связаны антитела, содержит антитела к TCR, к CD2, к CD3, к CD4 и/или к CD28.
10. Способ согласно альтернативному варианту реализации 8 или 9, отличающийся тем, что подложка, с которой связаны антитела, содержит антитела к CD3 и/или к CD28.
11. Способ согласно любому из альтернативных вариантов реализации 1-10, отличающийся тем, что вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер.
12. Способ согласно любому из альтернативных вариантов реализации 1-11, отличающийся тем, что вектор дополнительно содержит последовательность, кодирующую спейсер.
13. Способ согласно альтернативному варианту реализации 12, отличающийся тем, что спейсер содержит шарнир IgG4.
14. Способ согласно любому из альтернативных вариантов реализации 1-13, отличающийся тем, что вектор представляет собой вирусный вектор.
15. Способ согласно альтернативному варианту реализации 14, отличающийся тем, что вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов.
16. Способ согласно альтернативному варианту реализации 14 или 15, отличающийся тем, что вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса.
17. Способ согласно любому из альтернативных вариантов реализации 14-16, отличающийся тем, что вирусный вектор представляет собой вектор на основе лентивируса.
18. Способ согласно любому из альтернативных вариантов реализации 1-17, отличающийся тем, что маркерная последовательность кодирует укороченный рецептор эпидермального фактора роста (EGFRt).
19. Способ согласно любому из альтернативных вариантов реализации 1-18, отличающийся тем, что по меньшей мере один цитокин включает GM-CSF, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21.
20. Способ согласно любому из альтернативных вариантов реализации 1-19, отличающийся тем, что по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21, который можно добавлять в количестве 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл или 1,0 нг/мл, или в количестве, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств, и/или в количестве 10 Ед/мл, 20 Ед/мл, 30 Ед/мл, 40 Ед/мл, 50 Ед/мл, 60 Ед/мл, 70 Ед/мл, 80 Ед/мл, 90 Ед/мл или 100 Ед/мл, или в количестве, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств.
21. Способ согласно любому из альтернативных вариантов реализации 1-19, отличающийся тем, что по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21, при этом добавляемое количество цитокина составляет 0,5 нг/мл и/или 50 Ед/мл.
22. Способ согласно любому из альтернативных вариантов реализации 1-21, отличающийся тем, что контакт осуществляют в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение периода времени, который находится внутри диапазона, ограниченного любыми двумя из данных значений.
23. Способ согласно любому из альтернативных вариантов реализации 1-20 или 22, отличающийся тем, что указанный способ осуществляют с выделенными, очищенными, обогащенными или отделенными CD4+ клетками в отсутствие CD8+ клеток, при существенном обеднении CD8+ клетками или при обогащении относительно CD8+ клеток.
24. Способ согласно любому из альтернативных вариантов реализации 1-19, 21 или 22, отличающийся тем, что указанный способ осуществляют с выделенными, очищенными, обогащенными или отделенными CD8+ клетками в отсутствие CD4+ клеток, при существенном обеднении CD4+ клетками или при обогащении относительно CD4+ клеток.
25. Способ согласно любому из альтернативных вариантов реализации 1-20, 22 или 23, отличающийся тем, что указанные Т-клетки, экспрессирующие CD4+, размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени.
26. Способ согласно любому из альтернативных вариантов реализации 1-19, 21, 22 или 24, отличающийся тем, что CD8+ Т-клетки размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени.
27. Способ согласно любому из альтернативных вариантов реализации 8-26, отличающийся тем, что указанный способ дополнительно включает удаление подложки, с которой связаны антитела, такой как гранулы или частицы.
28. Способ согласно любому из альтернативных вариантов реализации 1-27, отличающийся тем, что лиганд-связывающий домен химерного антигенного рецептора содержит антитело или его связывающую часть.
29. Способ согласно любому из альтернативных вариантов реализации 1-28, отличающийся тем, что лиганд-связывающий домен химерного антигенного рецептора содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть.
30. Способ согласно любому из альтернативных вариантов реализации 1-29, отличающийся тем, что лиганд-связывающий домен химерного антигенного рецептора содержит FMC63 или его связывающую часть.
31. Способ согласно любому из альтернативных вариантов реализации 1-30, отличающийся тем, что лиганд-связывающий домен химерного антигенного рецептора специфичен к CD19.
32. Способ согласно любому из альтернативных вариантов реализации 1-31, отличающийся тем, что указанный способ дополнительно включает криоконсервацию указанных генетически модифицированных CD8+ и/или CD4+ Т-клеток.
33. Популяция генетически модифицированных Т-клеток, содержащая:
множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток при отсутствии CD8- и/или CD4- Т-клеток, при существенном обеднении CD8- и/или CD4- Т-клетками или при обогащении относительно CD8- и/или CD4- Т-клеток, при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит ген, кодирующий химерный антигенный рецептор, и селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток повторно стимулируют по меньшей мере одним цитокином.
34. Популяция генетически модифицированных Т-клеток согласно альтернативному варианту реализации 33, отличающаяся тем, что указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит по меньшей мере один рецептор, который вызывает, усиливает, улучшает или способствует приживлению.
35. Популяция генетически модифицированных Т-клеток согласно альтернативному варианту реализации 33 или 34, отличающаяся тем, что указанный по меньшей мере один рецептор, который вызывает, усиливает, улучшает или способствует приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L.
36. Популяция генетически модифицированных Т-клеток согласно альтернативному варианту реализации 34 или 35, отличающаяся тем, что указанный по меньшей мере один рецептор, который вызывает, усиливает, улучшает или способствует приживлению, представляет собой CD27, CD28 и/или CD62L.
37. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 33-36, отличающаяся тем, что указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит вектор, содержащий первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер.
38. Популяция генетически модифицированных Т-клеток согласно альтернативному варианту реализации 37, отличающаяся тем, что указанный вектор дополнительно содержит последовательность, кодирующую спейсер.
39. Популяция генетически модифицированных Т-клеток согласно альтернативному варианту реализации 38, отличающаяся тем, что спейсер содержит шарнир IgG4.
40. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 33-39, отличающаяся тем, что вектор представляет собой вирусный вектор.
41. Популяция генетически модифицированных Т-клеток согласно альтернативному варианту реализации 40, отличающаяся тем, что вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов.
42. Популяция генетически модифицированных Т-клеток согласно альтернативному варианту реализации 40 или 41, отличающаяся тем, что вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса.
43. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 40-42, отличающаяся тем, что вирусный вектор представляет собой вектор на основе лентивируса.
44. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 33-43, отличающаяся тем, что селектируемый маркер на поверхности клетки кодирует укороченный рецептор эпидермального фактора роста (EGFRt).
45. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 37-44, отличающаяся тем, что лиганд-связывающий домен содержит антитело или его связывающую часть.
46. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 37-45, отличающаяся тем, что лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть.
47. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 37-46, отличающаяся тем, что лиганд-связывающий домен содержит FMC63 или его связывающую часть.
48. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 37-47, отличающаяся тем, что лиганд-связывающий домен специфичен к CD19.
49. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 33-48, отличающаяся тем, что указанная популяция содержит выделенные, очищенные, отделенные или обогащенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток, при существенном обеднении CD4+ Т-клетками или при обогащении относительно CD4+ Т-клеток.
50. Популяция генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации 33-48, отличающаяся тем, что указанная популяция содержит выделенные, очищенные, отделенные или обогащенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток, при существенном обеднении CD8+ Т-клетками или при обогащении относительно CD8+ Т-клеток.
51. Композиция или комбинация продуктов для терапии человека, содержащая:
фармацевтически приемлемое вспомогательное вещество; и
по меньшей мере одну популяцию генетически модифицированных Т-клеток согласно любому одному или более из альтернативных вариантов реализации 33-50.
52. Композиция или комбинация продуктов согласно альтернативному варианту реализации 51, отличающаяся тем, что указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток согласно альтернативному варианту реализации 49.
53. Композиция или комбинация продуктов согласно альтернативному варианту реализации 47, отличающаяся тем, что указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток согласно альтернативному варианту реализации 50.
54. Композиция или комбинация продуктов согласно альтернативному варианту реализации 47, отличающаяся тем, что указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток согласно альтернативному варианту реализации 49 и популяцию генетически модифицированных Т-клеток согласно альтернативному варианту реализации 50, которые смешивают или вводят совместно при соотношении 1:1.
55. Способ лечения, ингибирования или облегчения заболевания у нуждающегося в этом субъекта включающий:
введение указанному субъекту по меньшей мере одной композиции или комбинации продуктов согласно любому одному или более из альтернативных вариантов реализации 51-54.
56. Способ согласно альтернативному варианту реализации 55, отличающийся тем, что указанный способ включает введение композиции или комбинации продуктов согласно альтернативному варианту реализации 52.
57. Способ согласно альтернативному варианту реализации 55, отличающийся тем, что указанный способ включает введение композиции или комбинации продуктов согласно альтернативному варианту реализации 53.
58. Способ согласно альтернативному варианту реализации 56, отличающийся тем, что указанный способ дополнительно включает введение композиции или комбинации продуктов согласно альтернативному варианту реализации 53.
59. Способ согласно альтернативному варианту реализации 57, отличающийся тем, что указанный способ дополнительно включает введение композиции или комбинации продуктов согласно альтернативному варианту реализации 52.
60. Способ согласно альтернативному варианту реализации 55, отличающийся тем, что указанный способ включает введение композиции или комбинации продуктов согласно альтернативному варианту реализации 54, например, с помощью подхода, в котором указанные Т-клетки, экспрессирующие CD8+, вводят перед введением указанных Т-клеток, экспрессирующих CD4+, например, за 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50 или 60 минут до введения CD4+ Т-клеток или за период времени, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше моментов времени.
61. Способ согласно любому одному или более из альтернативных вариантов реализации 55-60, отличающийся тем, что субъекта идентифицируют или выбирают для проведения ему противораковой терапии.
62. Способ согласно любому одному или более из альтернативных вариантов реализации 55-61, дополнительно включающий измерение или оценку ингибирования заболевания.
63. Способ согласно любому одному или более из альтернативных вариантов реализации 55-62, дополнительно включающий проведение указанному субъекту дополнительной противораковой терапии до, во время или после введения композиции или комбинации продуктов согласно любому одному или более из альтернативных вариантов реализации 51-54.
64. Способ согласно любому одному или более из альтернативных вариантов реализации 55-63, отличающийся тем, что указанную композицию или комбинацию продуктов согласно любому одному или более из альтернативных вариантов реализации 51-54 вводят указанному субъекту путем адоптивного переноса клеток.
65. Способ согласно любому одному или более из альтернативных вариантов реализации 55-64, отличающийся тем, что указанную композицию или комбинацию продуктов согласно любому одному или более из альтернативных вариантов реализации 51-54 вводят указанному субъекту после того, как указанный субъект получил другой вид противораковой терапии.
66. Способ согласно любому одному или более из альтернативных вариантов реализации 55-65, отличающийся тем, что указанную композицию или комбинацию продуктов согласно любому одному или более из альтернативных вариантов реализации 51-54 вводят указанному субъекту после того, как указанный субъект получил другой вид противораковой терапии.
67. Способ согласно любому одному или более из альтернативных вариантов реализации 55-66, отличающийся тем, что указанный субъект страдает от лейкоза.
68. Способ согласно любому одному или более из альтернативных вариантов реализации 55-67, отличающийся тем, что субъект страдает от рецидивирующего и/или нечувствительного к химиотерапии CD19+ детского острого лимфобластного лейкоза (ОЛЛ).
69. Способ согласно любому одному или более из альтернативных вариантов реализации 55-68, отличающийся тем, что субъект страдает от рецидивирующего и/или нечувствительного к химиотерапии CD19+ острого лимфобластного лейкоза (ОЛЛ).
70. Способ согласно любому одному или более из альтернативных вариантов реализации 55-69, отличающийся тем, что указанный субъект страдает от аутоиммунного заболевания.
71. Способ согласно любому одному или более из альтернативных вариантов реализации 55-70, отличающийся тем, что указанный субъект страдает от рецидива после ТГСК.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0018] На фигуре 1А показано абсолютное количество Т-клеток, несущих CAR против CD19, у 11 пациентов после адоптивного переноса несущих CAR Т-клеток с дня 0 по день 65. На фигуре 1В показано абсолютное количество Т-клеток, несущих CAR против CD19, после трех доз лекарственного средства.
[0019] На фигуре 2А показано длительное присутствие Т-клеток, несущих CAR против CD19, в периферической крови пациентов после адоптивного переноса несущих CAR Т-клеток с дня 0 по день 65. На фигуре 2В показано длительное присутствие Т-клеток, несущих CAR против CD19, после трех доз лекарственного средства.
[0020] На фигуре 3А показано длительное присутствие Т-клеток, несущих CAR против CD19, в костном мозге пациентов после адоптивного переноса несущих CAR Т-клеток с дня 0 по день 65. На фигуре 3В показано длительное присутствие Т-клеток, несущих CAR против CD19, в костном мозге пациентов после трех доз лекарственного средства.
[0021] На фигуре 4 показан процент острого лимфобластного лейкоза (ОЛЛ) у пациента X после введения трех доз.
[0022] На фигуре 5 показана таблица особенностей пациентов, которых использовали в данных исследованиях.
[0023] На фигуре 6 показано развитие лимфомы ЦНС в зависимости от заболевания и дозировки. На двух столбчатых диаграммах показано количество пациентов, подвергнутых лечению, включающему введение Т-клеток, несущих CAR против CD19, и тяжесть их заболевания после введения 3 доз лекарственного средства.
[0024] На фигуре 7 показана энцефалопатия 4 степени на аномальном снимке, полученном путем магнитно-резонансной томографии (МРТ) пациента, страдающего ОЛЛ. На первой панели указаны результаты, полученные после лечения с применением Т-клеток, несущих CAR против CD19.
[0025] На фигуре 8 показана острая реакция «трансплантат против хозяина» (РТПХ) на коже после лечения Т-клетками, несущими CAR против CD19. На панели А показано, что у S03 развилась de novo острая РТПХ на коже 2 степени в день 17 после приживления несущих CAR Т-клеток. На панели В представлен биоптат кожи, по которому выявили, что лишь 9% локализованных в коже Т-клеток были положительны по маркеру EGFRt (EGFRt+), тогда как 79% Т-клеток в кровотоке были EGFRt+. На панели С в периферической крови в то же время выявили, что большая часть Т-клеток была CAR+. Данного субъекта лечили с помощью 2-недельного курса преднизона в дозе 1 мг/кг, после чего следовало быстрое уменьшение дозы в течение шестинедельного периода и прекращение РТПХ. Несмотря на преднизон у субъекта постоянно присутствовали CAR+ Т-клетки.
[0026] На фигуре 9 показана таблица пациентов, у которых наблюдали Ig или TCR как маркер минимального остаточного заболевания (MRD) после лечения с применением Т-клеток, несущих CAR против CD19.
[0027] На фигуре 10 показана таблица профилей пациентов после аллогенной трансплантации гемопоэтических стволовых Т-клеток, несущих CAR против CD19.
[0028] На фигуре 11 показан анализ путем сортировки клеток с возбуждением флуоресценции (FACS) рассеяния клеток, выделенных из периферической крови и спинномозговой жидкости (СМЖ) после трансплантации гемопоэтических стволовых Т-клеток, несущих CAR против CD19 (ТГСК).
[0029] На фигуре 12 показана опухолевая нагрузка в зависимости от ответа после трех доз трансплантированных гемопоэтических стволовых клеток Т-клеток, несущих CAR против CD19.
[0030] На фигуре 13 показана продолжительность ремиссии у пациентов после трех доз трансплантированных гемопоэтических стволовых клеток.
[0031] На фигуре 14 показана опухолевая нагрузка в зависимости от ответа после двух доз трансплантированных гемопоэтических стволовых Т-клеток, несущих CAR против CD19, в день 7.
[0032] На фигуре 15 показано количество и продолжительность присутствия CAR/EGFRt+ Т-клеток у пациента после трех доз трансплантированных гемопоэтических стволовых Т-клеток, несущих CAR против CD19.
[0033] На фигуре 16 показана продолжительность аплазии В-клеток после трех доз трансплантированных гемопоэтических стволовых Т-клеток, несущих CAR против CD19.
[0034] На фигуре 17 показан профиль синдрома высвобождения цитокинов (СВЦ) у пациента после трех доз трансплантированных гемопоэтических стволовых Т-клеток, несущих CAR против CD19.
[0035] На фигуре 18 представлено две блок-схемы, на которых показано производство генетически модифицированных Т-клеток. На изображении видно, что в исходной методике выращивания обработку общей массы не всегда начинали незамедлительно. Часть продукта афереза всегда отбирали для обработки фиколлом. Если не предстояло инициирование общих культур, то продукт, разделенный с помощью фиколла, подвергали криоконсервации.
[0036] На фигуре 19 показана блок-схема сравнения различных способов получения генетически модифицированных Т-клеток, которые содержат химерные антигенные рецепторы.
[0037] На фигуре 20 показаны пероначальные сравнения роста клеток при использовании различных концентраций клеток в заквасочной культуре. Показано, что PD0064 представляет собой донора PD0063, который обогащен Т-клетками, экспрессирующими CD8+, и которого использовали для проверки исходной плотности клеток в флаконе Т25 при инициировании культуры. В данных экспериментах исследовали две плотности клеток, и в обоих показали большую жизнеспособность и рост клеток, когда их объем увеличивали на более раннем этапе эксперимента.
[0038] На фигуре 21 показано исходное сравнение роста клеток. Это были полномасштабные результаты, которые использовали для перехода к усовершенствованному производственному процессу, который теперь применяют.
[0039] На фигуре 22 представлена блок-схема, на которой показаны варианты коктейлей цитокинов, которые применяли для анализа роста Т-клеток, экспрессирующих CD4+ и CD8+.
[0040] На фигурах 23А-F проиллюстрировано сравнение цитокинов, которые исследовали во время роста Т-клеток, экспрессирующих CD4+ и CD8+.
[0041] На фигурах 24А-F проиллюстрировано сравнение цитокинов, которые исследовали во время роста Т-клеток, экспрессирующих CD4+ и CD8+.
[0042] На фигурах 25А-В показано сравнение влияния цитокинов на рост клеток. Для образца из донора PD0059 проводили такой же эксперимент с тестированием цитокинов, как и для PD0051, за исключением того, что проверяли нового донора CD4 и CD8 (PD0057).
[0043] На фигуре 26 представлена блок-схема, на которой показана исходная методика выращивания и используемая в настоящее время методика выращивания, выработанная в ходе экспериментов по проверке различных смесей цитокинов.
[0044] На фигуре 27 показано сравнение скорости роста для образцов PD0080, PD084 и PD0085. Данные эксперименты представляли собой повторные эксперименты по методике "раннего роста".
[0045] На фигуре 28 показаны анализы, проведенные для PD0044 для получения генетически модифицированных клеток. Для первичного увеличения масштаба использовали "предварительно отобранные" PLAT-02 (фаза I и фаза II исследования) из криосохраненных подвергнутых селекции клеток.
[0046] На фигуре 29 показаны анализы, проведенные для PD0046 для получения генетически модифицированных клеток из увеличенного масштаба "квалиф. запуска №1" PLAT-02.
[0047] На фигуре 30 показаны анализы, проведенные для PD0063 для получения генетически модифицированных клеток из увеличенного масштаба "квалиф. запуска №2" PLAT-02. На кривых роста показаны TNC из обеих емкостей V-197 с клетками V-197 вместе. Впоследствии проводили удаление гранул и обогащение EGFRt. День +14 для Т-клеток, экспрессирующих CD4+, и день +15 для Т-клеток, экспрессирующих CD8+. Т-клетки, экспрессирующие CD8+, растили в IL-2 (50 Ед/мл)/IL-15 (0,5 нг/мл), Т-клетки, экспрессирующие CD4+, растили в IL-7 (5 нг/мл)/IL-15 (0,5 нг/мл). Удаление гранул и обогащение EGFRt осуществляли в день 12 для Т-клеток, экспрессирующих CD4+, и день 13 для Т-клеток, экспрессирующих CD8+.
[0048] На фигурах 31А-В показан рост клеток из смешанных культур мононуклеарных клеток периферической крови (МКПК), когда их растили в присутствии цитокинов. Показано, что Т-клетки, экспрессирующие CD4+ (•), растили в присутствии IL-2 и IL-15. Т-клетки, экспрессирующие CD8+ , растили в присутствии IL-7 и IL-15.
[0049] На фигурах 32А-В показан рост популяций, обогащенных Т-клетками, экспрессирующими CD8+ и CD4+, в смесях цитокинов. Для образца PD0044 показано, что обогащенные Т-клетки, экспрессирующие CD8+, растили в присутствии IL-2 и IL-15. В образце PD0044 обогащенные Т-клетки, экспрессирующие CD4+, растили в присутствии IL-7 и IL-15 в течение более 20 дней.
[0050] На фигуре 33 показано выращивание обогащенных Т-клеток, экспрессирующих CD4+ и CD8+, с применением описанной ранее методики, показанной на блок-схеме на Фигуре 18. Показаны эксперименты для клеток в образцах 14602-S01, 14602-S02 и 14602-S03/14602-S03-02.
[0051] На фигуре 34 показано выращивание обогащенных Т-клеток, экспрессирующих CD4+ и CD8+, с применением описанной ранее методики, показанной на блок-схеме на фигуре 18. Показаны эксперименты для клеток в образцах 14602-S04/14602-S04-02, 14602-S05, 14602-S06 и 14602-S06-2/14602-S06-04.
[0052] На фигуре 35 показано выращивание обогащенных Т-клеток, экспрессирующих CD4+ и CD8+, с применением методики "раннего роста", показанной на блок-схеме на фигуре 18. Показаны эксперименты для клеток в образцах 14602-S07, 14602-S08 и 14602-S09.
[0053] На фигуре 36 показан рост клеток в образцах 14602-S10, 14602-S11, 14602-S12H 14602-S13.
[0054] На фигуре 37 показан рост клеток в образцах 14602-S14, 14602-S15 и 14602-S16.
[0055] На фигуре 38 показаны расширенные фенотипы обогащенных Т-клеток, экспрессирующих CD4+ и CD8+, после их выращивания.
[0056] На фигурах 39А-В показана выживаемость мыши, которой вводили клетки из образцов PD00044 и PD00046. Отметили, что клетки PD00046 экспрессируют маркеры способности к приживлению (CD27, CD28, CD127 и CD62L).
[0057] На фигуре 40 показан средний уровень прогрессирования опухоли у мышей, которых лечили клетками из партий клеток PD0044 и PD0046.
[0058] На фигуре 41 показана постановка эксперимента по анализу прогрессирования опухоли у мышей, которых лечили Т-клетками, которые получили благодаря их способности к приживлению.
[0059] На фигуре 42 показано сравнение между Т-клетками, экспрессирующими CD4+ и CD8+, из образцов PD0051 и PD00055 в день введения животным, и условия выращивания с цитокинами.
[0060] На фигуре 43 показано сравнение трех групп мышей, которым вводили ФБР, PD0051 (обычное выращивание клеток) и PD00055 (клетки, выращенные в присутствии комбинаций цитокинов).
[0061] На фигуре 44 показано длительное присутствие Т-клеток в периферической крови мышей, выявленное путем обнаружения маркера CAR EGFRt.
[0062] На фигуре 45 показана постановка эксперимента для анализа трех групп мышей, чтобы определить различие in vivo в способности к уничтожению между клетками, которые выращивали в условиях присутствия различных цитокинов in vitro при повторяющихся встречах с антигенами.
[0063] На фигуре 46 показано прогрессирование опухоли мышей, которым вводили PD0051 и PD0055, после лечения с дня 0 по день 120.
[0064] На фигуре 47 показаны клетки PD0051 и PD0055, сенсибилизированные повторяющимся воздействием антигенов.
[0065] На фигуре 48 показана повторяющаяся сенсибилизация опухолью Raji JME13-29 Т-клеток при "обычном выращивании" по сравнению с Т-клетками, в которые порциями добавляли комбинации цитокинов.
[0066] На фигуре 49 показана постановка эксперимента для определения того, есть ли различия в способности к уничтожению in vivo между клетками, которые выращивали при тех же условиях, как и для PLAT-01 (фаза I клинического испытания) и PLAT-02 (фаза I и фаза II клинического испытания), а также по "промежуточным" протоколам.
[0067] На фигуре 50 показана таблица, в которой указаны производимые продукты и уровни EGFRt, продуцируемые Т-клетками, экспрессирующими CD8+ и CD4+.
[0068] На фигуре 51 показан средний уровень прогрессирования опухоли после лечения Т-клетками при определенном титровании доз.
[0069] На фигуре 52 показано сравнение PLAT между различными группами дозировки при лечении Т-клетками.
[0070] На фигурах 53А-Е показано сравнение Т-клеток из продуктов PLAT-1.00, PLAT-1.33, PLAT-1.67 и PLAT-2.00 при сходных концентрациях доз. На данной фигуре проиллюстрировано прогрессирование опухолей у отдельных животных. В начале каждого ряда показаны сгруппированные значения для каждой группы PLAT с различными титрами доз, а затем выеление отдельных групп.
[0071] На фигуре 54 показана выживаемость мышей, которых лечили различными титрами доз Т-клеток из продуктов PLAT-1.00, PLAT-1.33, PLAT-1.67 и PLAT-2.00. На данной фигуре проиллюстрировано сравнение PLAT между группами дозировок вводимых клеток.
[0072] На фигуре 55 показано сравнение кривых выживаемости для различных PLAT. На данной фигуре проиллюстрирован средний уровень прогрессирования опухоли после лечения Т-клетками при определенных дозах.
[0073] На фигуре 56 показана выживаемость мышей в ответ на лечение Т-клетками, когда Т-клетки растили в условиях нормального роста или растили в присутствии цитокинов. На данной фигуре также показано, развивалась ли у мышей реакция «ксенотрансплантат против хозяина» после лечения Т-клетками.
[0074] На фигуре 57 показана выживаемость мышей в ответ на лечение Т-клетками, когда Т-клетки растили в условиях нормального роста или растили в присутствии цитокинов. На данной фигуре также показано, развивалась ли у мышей реакция «ксенотрансплантат против хозяина» после лечения Т-клетками.
[0075] На фигурах 58А-С показана выживаемость мышей в ответ на лечение Т-клетками, когда Т-клетки растили в условиях нормального роста или растили в присутствии цитокинов. На данных фигурах также показано, развивалась ли у мышей реакция «ксенотрансплантат против хозяина» после лечения Т-клетками.
[0076] На фигурах 59А-Н показана выживаемость мышей в ответ на лечение Т-клетками, когда Т-клетки растили в условиях нормального роста или растили в присутствии цитокинов. На данных фигурах также показано, развивалась ли у мышей реакция «ксенотрансплантат против хозяина» после лечения Т-клетками.
[0077] На фигурах 60А-D показана выживаемость мышей в ответ на лечение Т-клетками, когда Т-клетки растили в условиях нормального роста или растили в присутствии цитокинов. На данных фигурах также показано, развивалась ли у мышей реакция «ксенотрансплантат против хозяина» после лечения Т-клетками.
[0078] На фигуре 61 показана таблица для группы N JME14-03 в день 51 и в день 90 после лечения Т-клетками.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0079] Следующие определения предусмотрены для облегчения понимания некоторых из альтернативных вариантов реализации, описанных в данной заявке.
[0080] В настоящей заявке использование единственного числа может означать один или более чем один.
[0081] В настоящей заявке "нуклеиновая кислота" или "молекула нуклеиновой кислоты" относится к полинуклеотидам или олигонуклеотидам, таким как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК), олигонуклеотидам, фрагментам, полученным с помощью полимеразной цепной реакции (ПЦР), и фрагментам, полученным с помощью любого из следующих способов: лигирование, расщепление, воздействие эндонуклеазой, воздействие экзонуклеазой, - и полученным синтетическим путем. Молекулы нуклеиновых кислот могут состоять из мономеров, которые представляют собой встречающиеся в природе нуклеотиды (такие как ДНК и РНК) или аналоги встречающихся в природе нуклеотидов (например, энантиомерные формы встречающихся в природе нуклеотидов), или комбинацию указанных нуклеотидов. Модифицированные нуклеотиды могут содержать изменения в молекулах сахаров и/или в молекулах пиримидиновых или пуриновых оснований. Модификации сахаров включают, например, замену одной или более гидроксильных групп на галоген, алкильные группы, амины и азидные группы, или сахара можно функционализировать с получением простых эфиров или сложных эфиров. Более того, всю молекулу сахара можно заменить на аналогичные стерически и по заряду структуры, такие как азасахара и карбоциклические аналоги сахаров. Примеры модификаций в молекуле основания включают алкилированные пурины и пиримидины, ацилированные пурины или пиримидины, или другие хорошо известные гетероциклические заместители. Мономеры нуклеиновых кислот могут быть соединены фосфодиэфирными связями или аналогами таких связей. Аналоги фосфодиэфирных связей включают фосфотиоатные, фосфодитиоатные, фосфоселеноатные, фосфодиселеноатные, фосфоанилотиоатные, фосфоанилидатные, фосфоамидатные и тому подобные связи. В объем термина "молекула нуклеиновой кислоты" также входят так называемые "пептидо-нуклеиновые кислоты", которые содержат встречающиеся в природе или модифицированные основания нуклеиновых кислот, присоединенные к полиамидному каркасу. Нуклеиновые кислоты могут быть либо одноцепочечными, либо двухцепочечными.
[0082] "Генетически модифицировать" в настоящей заявке относится к процессу модификации организма или клетки, таких как бактерия, Т-клетка, бактериальная клетка, эукариотическая клетка, насекомое, растение или млекопитающее, генетическим материалом, таким как нуклеиновая кислота, которая была изменена с применением методик генной инженерии. Например, нуклеиновую кислоту, такую как ДНК, можно вставить в геном хозяина путем сначала выделения и копирования интересующего генетического материала, применяя способы молекулярного клонирования, с получением последовательности ДНК, или путем синтеза ДНК, а затем вставки данной конструкции в организм хозяина. Гены также можно удалить или "нокаутировать", применяя нуклеазу. Направленное воздействие на ген представляет собой отличную методику, в которой применяют гомологичную рекомбинацию для изменения эндогенного гена, и которую можно применять для удаления гена, удаления экзонов, вставки гена или введения точечных мутаций.
[0083] Генетическая модификация, осуществленная с помощью трансдукции, описана в настоящей заявке. "Трансдукция" относится к способам переноса генетического материала, такого как, например, ДНК или РНК, в клетку посредством вектора. В обычных методиках применяют вирусные векторы, электропорацию и химические реагенты для повышения проницаемости клеток. ДНК можно переносить с помощью вируса или посредством вирусного вектора. Как описано в данной заявке, предложены способы модификации иммунных CD4+ и/или CD8+ Т-клеток. Для того, чтобы добиться высокого уровня экспрессии терапевтических генов и/или увеличить количество химерных антигенных рецепторов на поверхности клеток, например, Т-клетки можно трансдуцировать генетическим материалом, кодирующим химерный антигенный рецептор. Т-клетки можно генетически модифицировать, применяя вирус. Вирусы, широко применяемые для генотерапии, представляют собой аденовирус, аденоассоциированный вирус (AAV), ретровирусы и лентивирусы.
[0084] Были разработаны различные методики трансдукции, в которых применяют рекомбинантные инфекционные вирусные частицы для доставки нуклеиновой кислоты, кодирующей химерный антигенный рецептор. На сегодняшний день этот способ представляет собой предпочтительный подход к трансдукции Т-лимфоцитов. В данной заявке описано, что вирусные векторы, применяемые для трансдукции, могут включать вирусные векторы, полученные из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивирусные векторы и ретровирусы. Таким образом, способы переноса генов и экспрессии многочисленны, но по существу они позволяют внедрить и экспрессировать генетический материал в клетках млекопитающих. Несколько из описанных выше методик можно применять для трансдукции гематопоэтических или лимфоидных клеток, включая трансфекцию с использованием фосфата кальция, слияние протопластов, электропорацию и инфекцию рекомбинантным аденовирусом, аденоассоциированным вирусом, лентивирусом, или применение ретровирусных векторов. Первичные Т-лимфоциты были успешно трансдуцированы путем электропорации и путем ретровирусной или лентивирусной инфекции. Таким образом, векторы на основе ретровирусов и лентивирусов могут обеспечить высокоэффективный способ переноса генов в эукариотические клетки. Векторы на основе ретровирусов и лентивирусов обеспечивают высокоэффективные способы переноса генов в Т-клетки. Более того, встраивание ретровируса или лентивируса происходит контролируемым образом и приводит к стабильному встраиванию одной или нескольких копий новой генетической информации на клетку.
[0085] "Вектор экспрессии" или вектор, описанный в настоящей заявке, представляет собой молекулу нуклеиновой кислоты, кодирующую ген, который экспрессируется в клетке-хозяине. Обычно вектор экспрессии содержит промотор транскрипции, ген и терминатор транскрипции. Экспрессию гена обычно помещают под контроль промотора, и такой ген называют "функционально связанным с" промотором. Аналогично, регуляторный элемент и коровый промотор функционально связаны, если указанный регуляторный элемент модулирует активность корового промотора.
[0086] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, которые содержат химерный антигенный рецептор, при этом указанный способ включает: отделение, выделение или обогащение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, из смешанной популяции Т-клеток для того, чтобы получить выделенную, отделенную или обогащенную популяцию Т-клеток, стимуляцию выделенной, отделенной или обогащенной популяции Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, трансдукцию популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с по меньшей мере одним цитокином для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, обогащение, отделение или выделение трансдуцированной и стимулированной цитокинами популяции Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по маркеру, кодируемому маркерной последовательностью, для того, чтобы получить обогащенную, отделенную или выделенную популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, и размножение указанной обогащенной, отделенной или выделенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. В некоторых альтернативных вариантах указанного способа вектор представляет собой вирусный вектор. В некоторых альтернативных вариантах указанного способа вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных вариантах указанного способа вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных вариантах указанного способа вирусный вектор представляет собой вектор на основе лентивируса.
[0087] "Лидерная последовательность", также известная как "5'-нетранслируемая область (5'-НТО)", представляет собой участок мРНК, который расположен против хода транскрипции от инициирующего кодона и важен для регуляции трансляции мРНК-транскрипта. В некоторых альтернативных вариантах указанного способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, вектор, кодирующий химерный антигенный рецептор, содержит последовательность, кодирующую лидерную последовательность.
[0088] "Лиганд", описанный в данной заявке, относится к малой молекуле, которая может образовать комплекс с другой молекулой или биомолекулой для биологических целей, таких как, например, запуск сигнала. Связывание может происходить посредством сил межмолекулярного взаимодействия, например, ионных связей, водородных связей и ван-дер-ваальсовских взаимодействий. Связывание лиганда с рецепторным белком может изменять его трехмерную структуру и определять его функциональное состояние.
[0089] В качестве примера, но не для ограничения, лиганды могут включать субстраты, белки, малые молекулы, ингибиторы, активаторы и нейромедиаторы. Силу связывания лиганда называют аффинностью связывания, и ее можно определить по непосредственным взаимодействиям и эффектам растворителя. Лиганд может быть связан "лиганд-связывающим доменом". Лиганд-связывающий домен может относиться к консервативной последовательности в структуре, которая может связывать специфичный лиганд. Без ограничения, лиганд-связывающий домен может представлять собой определенный белковый домен, который специфичен к лиганду или лигандам.
[0090] "Специфичный" или "специфичность" может относиться к свойству лиганда по отношению к партнеру по связыванию или, в качестве альтернативы, партнера по связыванию по отношению к лиганду, и может включать комплементарную форму, заряд и гидрофобную специфичность связывания. Специфичность связывания может включать стереоспецифичность, региоселективность и хемоселективность.
[0091] "Сигнальный домен", также известный как "костимулирующий домен", представляет собой внутриклеточный или цитоплазматический домен белка или рецепторного белка, который взаимодействует с внутренним пространством клеток и осуществляет передачу сигнала. Часть белка, которая находится во внутреннем пространстве клетки, также называют "эндодоменом". Такое взаимодействие может произойти вследствие обмена информацией между внутриклеточным доменом, через специфические белок-белковые взаимодействия или взаимодействия белок-лиганд, и эффекторной молекулой или эффекторным белком, который, в свою очередь, может передать сигнал по сигнальной цепочке до места назначения.
[0092] Сигнальный или костимулирующий домен также относится к сигнальной молекуле, которая передает Т-клеткам сигнал, который дополнительно к первоначальному сигналу, передаваемому, например, дзета-цепью CD3 комплекса TCR/CD3, опосредует Т-клеточный ответ, такой как, например, иммунный ответ, активация, пролиферация, дифференцировка, секреция цитокинов, цитолитическая активность, активность перфорина и/или гранзима и тому подобные ответы. Сигнальный или костимулирующий домен может включать весь CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, ICOS, функционально-ассоциированный антиген лимфоцитов-1 (LFA-1), CD2, CD7, LIGHT, NKG2C, В7-Н3, и/или лиганд, который специфично связывается с CD83, или часть любой из перечисленных молекул, но не ограничен ими.
[0093] "Селектируемая маркерная последовательность" представляет собой ген, внедренный в вектор или клетку, который наделяет их возможностью искусственной селекции. Селектируемая маркерная последовательность или маркерная последовательность может представлять собой поддающийся сортировке маркер, который позволяет исследователю различить желательные и нежелательные клетки или обогатить препарат определенным типом клеток. В некоторых альтернативных вариантах реализации способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, предложен вектор, при этом указанный вектор кодирует химерный антигенный рецептор, содержащий маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки.
[0094] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает отделение, выделение или обогащение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток для того, чтобы получить выделенную, отделенную или обогащенную популяцию Т-клеток, стимуляцию выделенной, отделенной или обогащенной популяции Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, трансдукцию популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с по меньшей мере одним цитокином, который предпочтительно представляет собой добавленный экзогенно цитокин, например, дополнительно к любому цитокину, либо продуцируемому Т-клетками, либо присутствующему в среде, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, отделение, обогащение или выделение трансдуцированной и стимулированной цитокином популяции Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по маркеру, кодируемому маркерной последовательностью, для того, чтобы получить обогащенную, отделенную или выделенную популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, и размножение указанной обогащенной, отделенной или выделенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор.
[0095] В некоторых альтернативных вариантах указанного способа вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемую маркерную последовательность. В некоторых альтернативных вариантах указанного способа вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных вариантах указанного способа спейсер содержит шарнир IgG4. В некоторых альтернативных вариантах указанного способа вектор представляет собой вирусный вектор. В некоторых альтернативных вариантах указанного способа вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных вариантах указанного способа вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных вариантах указанного способа вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных вариантах указанного способа маркерная последовательность кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора содержит антитело или его связывающую часть. В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора содержит FMC63 или его связывающую часть. В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора специфичен к CD19. В некоторых альтернативных вариантах указанного способа вектор содержит последовательность, кодирующую маркерную последовательность. В некоторых из данных альтернативных аспектов маркерная последовательность представляет собой укороченный рецептор эпидермального фактора роста (EGFRt).
[0096] "Оптимизация кодонов", описанная в настоящей заявке, относится к процессу разработки, в котором осуществляют изменение кодонов на кодоны, которые, как известно, повышают максимальную эффективность экспрессии белка. В некоторых альтернативных аспектах описана оптимизация кодонов для экспрессии у человека, при этом оптимизацию кодонов можно осуществить, применяя алгоритмы, которые известны специалистам в данной области техники, чтобы получить синтетические генетические транскрипты, оптимизированные для высокого выхода мРНК и белка у людей. Компьютерные программы с алгоритмами для оптимизации кодонов у людей легко доступны. Такие компьютерные программы могут включать, например, алгоритмы OptimalGene™ или GeneGPS®. Дополнительно последовательности, кодон-оптимизированные для человека, можно получить из коммерческих источников, например, из Integrated DNA Technologies.
[0097] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает отделение, выделение или обогащение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток для того, чтобы получить выделенную, отделенную или обогащенную популяцию Т-клеток, стимуляцию выделенной, отделенной или обогащенной популяции Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, трансдукцию популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с по меньшей мере одним цитокином, который предпочтительно представляет собой добавленный экзогенно цитокин, например, дополнительно к любому цитокину, либо продуцируемому Т-клетками, либо присутствующему в среде, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, обогащение, выделение или отделение трансдуцированной и стимулированной цитокином популяции Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по маркеру, кодируемому маркерной последовательностью, для того, чтобы получить обогащенную, выделенную или отделенную популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, и размножение указанной обогащенной, отделенной или выделенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. В некоторых альтернативных вариантах указанного способа вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемую маркерную последовательность. В некоторых альтернативных вариантах указанного способа указанные последовательности вектора кодон-оптимизированы для экспрессии у людей. В некоторых альтернативных аспектах указанные последовательности вектора оптимизированы таким образом, чтобы они содержали выбранные кодоны, в частности, для максимальной экспрессии белка в клетках человека, что может повысить концентрацию белков или CAR в Т-клетке.
[0098] Оптимизацию также можно осуществить, чтобы уменьшить вероятность образования вторичной структуры в полинуклеотиде. В некоторых альтернативных вариантах указанного способа оптимизацию указанных последовательностей в векторе также можно осуществить, чтобы уменьшить результирующее отношение GC/AT. Строгая оптимизация кодонов может приводить к образованию нежелательной вторичной структуры или нежелательно высокому содержанию GC, которое приводит к образованию вторичной структуры. Сами вторичные структуры влияют на эффективность транскрипции. Компьютерные программы, такие как GeneOptimizer, можно применять после оптимизации использования кодонов, чтобы избежать образования вторичной структуры и оптимизировать содержание GC. Данные дополнительные компьютерные программы можно применять для дополнительной оптимизации и выявления проблем после исходной оптимизации кодонов, чтобы ограничить образование вторичных структур, которое может произойти после первого раунда оптимизации. Альтернативные компьютерные программы для оптимизации легко доступны. В некоторых альтернативных вариантах указанного способа вектор содержит последовательности, которые оптимизированы таким образом, чтобы избежать образования вторичной структуры, и/или указанные последовательности оптимизированы таким образом, чтобы уменьшилось результирующее отношение GC/AT, и/или указанные последовательности оптимизированы для экспрессии у людей.
[0099] Маркерные домены также могут представлять собой важные аспекты альтернативных вариантов реализации, описанных в данной заявке. Использование маркерного домена на поверхности клетки может обеспечить возможность разрушения трансдуцированных лимфоцитов в результате токсической реакции, связанной с введением или присутствием трансдуцированных Т-клеток. Например, в случае маркерной последовательности EGFRt, полноразмерные антитела к EGFR можно применять для того, чтобы они связывались с клетками, экспрессирующими EGFR, и уничтожали их посредством антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦ). В некоторых альтернативных аспектах антитело, специфичное к маркерному домену, можно соединить с цитотоксическим агентом, таким как радионуклид или токсин, который приводит к способности терапевтического средства разрушать или уничтожать трансдуцированные клетки in vivo. В некоторых альтернативных аспектах маркерная последовательность предусмотрена для обогащения и селекции клеток. В типичном альтернативном варианте реализации, описанном в данной заявке, маркерную последовательность EGFRt применяют в способе очистки и обогащения, позволяющем осуществить иммуномагнитную селекцию по маркеру EGFRt.
[0100] "Спейсер", описанный в данной заявке, возможно относится к полипептидной цепи, длина которой может находиться в диапазоне длин от 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78. 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239 или 240 аминокислот, или длина которой находится внутри диапазона, ограниченного любыми двумя из упомянутых выше длин. Спейсер может содержать любые из 20 аминокислот, например, в любом порядке, для получения любой желательной длины полипептидной цепи в химерном антигенном рецепторе, которые включают следующие аминокислоты: аргинин, гистидин, лизин, аспарагиновую кислоту, глутаминовую кислоту, серии, треонин, аспарагин, глутамин, цистеин, глицин, пролин, аланин, валин, изолейцин, метионин, фенилаланин, тирозин и/или триптофан. Спейсерная последовательность возможно представляет собой линкер между scFv и трансмембранным доменом химерного антигенного рецептора. В некоторых альтернативных вариантах указанного способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных вариантах указанного способа спейсер включает последовательность, длина которой составляет 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78. 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239 или 240 аминокислот, или длина которой находится внутри диапазона, ограниченного любыми двумя из упомянутых выше длин. В некоторых альтернативных вариантах указанного способа спейсер расположен между scFv и трансмембранным участком химерного антигенного рецептора.
[0101] "Шарнир IgG4", описанный в настоящей заявке, относится к доменам полипептида, которые расположены между тяжелой цепью и легкими цепями антитела IgG4. В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает отделение, обогащение или выделение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток для того, чтобы получить выделенную, отделенную или обогащенную популяцию Т-клеток, стимуляцию выделенной, отделенной или обогащенной популяции Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, трансдукцию популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с по меньшей мере одним цитокином, который предпочтительно представляет собой добавленный экзогенно цитокин, например, дополнительно к любому цитокину, либо продуцируемому Т-клетками, либо присутствующему в среде, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, обогащение популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по маркеру, кодируемому маркерной последовательностью, для того, чтобы получить обогащенную, отделенную или выделенную популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, и размножение обогащенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор.
[0102] В некоторых альтернативных вариантах указанного способа вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер. В некоторых альтернативных вариантах указанного способа вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнирную область антитела человека. В некоторых альтернативных вариантах указанного способа спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах шарнирная область IgG4 представляет собой модифицированный шарнир IgG4. "Модифицированный шарнир IgG4", описанный в данной заявке, возможно относится к шарнирной области, последовательность которой идентична по меньшей мере на 90%, 92%, 95% или 100% или идентична на процент, находящийся в пределах диапазона, ограниченного любыми двумя из упомянутых выше процентов, последовательности аминокислот шарнирной области, представленной в SEQ ID NO: 1 (SEQ ID NO: 1; ESKYGPPCPPCP), SEQ ID NO: 2 (SEQ ID NO: 2; YGPPCPPCP), SEQ ID NO: 3 (SEQ ID NO: 3; KYGPPCPPCP) или SEQ ID NO: 4 (SEQ ID NO: 4; EVVKYGPPCPPCP). Выше упоминалось, что любую одну или более из данных последовательностей можно кодон-оптимизировать для экспрессии у людей и любую одну или более из данных последовательностей можно оптимизировать, чтобы уменьшить образование вторичных структур или уменьшить отношение GC/AT, и любая одна или более из данных последовательностей могут представлять собой консенсусные последовательности, полученные из генов по меньшей мере двух изотипов.
[0103] "Трансмембранный домен" представляет собой участок белка, который гидрофобен и может находиться в бислое клетки, чтобы заякорить белок, который его содержит, в биологическую мембрану. Без ограничения, топология трансмембранного домена может представлять собой трансмембранную альфа спираль. В некоторых альтернативных вариантах указанного способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, указанный вектор содержит последовательность, кодирующую трансмембранный домен. В некоторых альтернативных вариантах указанного способа трансмембранный домен включает трансмембранную последовательность CD28, или ее фрагмент, длина которой составляет 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 или 28 аминокислот, или длина которой находится внутри диапазона, ограниченного любыми двумя из упомянутых выше длин. В некоторых альтернативных вариантах указанного способа длина трансмембранной последовательности CD28, или ее фрагмента, составляет 28 аминокислот. В некоторых альтернативных вариантах указанного способа трансмембранный домен включает последовательность, представленную в SEQ ID NO: 5 (SEQ ID NO: 5; MFWVLVVVGGVLACYSLLVTVAFIIFWV).
[0104] "Сигнальный домен", также известный как "костимулирующий домен", представляет собой внутриклеточный или цитоплазматический домен белка или рецепторного белка, который взаимодействует с внутренним пространством клетки и осуществляет передачу сигнала. Часть белка, которая находится во внутренней части клетки, также называют "эндодоменом". Такое взаимодействие может произойти вследствие обмена информацией между внутриклеточным доменом, через специфические белок-белковые взаимодействия или взаимодействия белок-лиганд, и эффекторной молекулой или эффекторным белком, который, в свою очередь, может передать сигнал по сигнальной цепочке до места назначения. Сигнальный или костимулирующий домен также относится к сигнальной молекуле, которая передает Т-клеткам сигнал, который дополнительно к первоначальному сигналу, передаваемому, например, дзета-цепью CD3 комплекса TCR/CD3, опосредует Т-клеточный ответ, такой как, например, иммунный ответ, активация, пролиферация, дифференцировка, секреция цитокинов, цитолитическая активность, активность перфорина и/или гранзима и тому подобные ответы. Сигнальный или костимулирующий домен может включать весь CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, ICOS, функционально-ассоциированный антиген лимфоцитов-1 (LFA-1), CD2, CD7, LIGHT, NKG2C, и/или В7-Н3, и/или лиганд, который специфично связывается с CD83, или часть любой из перечисленных молекул, но не ограничен ими.
[0105] В некоторых альтернативных вариантах указанного способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, вектор, кодирующий химерный антигенный рецептор, дополнительно содержит последовательность костимулирующего домена, при этом костимулирующий домен представляет собой внутриклеточный сигнальный домен, который взаимодействует с другими внутриклеточными медиаторами для опосредования клеточного ответа, включая иммунный ответ, активацию, пролиферацию, дифференцировку, секрецию цитокинов, цитолитическую активность, активность перфорина и/или гранзима, и тому подобные ответы. В некоторых альтернативных вариантах указанного способа вектор содержит последовательность, кодирующую сигнальный домен. В некоторых альтернативных вариантах указанного способа указанный сигнальный домен включает домен 4-1ВВ и/или домен дзета CD3. В некоторых альтернативных аспектах домен 4-1ВВ включает последовательность, представленную в SEQ ID NO: 6 (SEQ ID NO: 6; KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL). В некоторых альтернативных аспектах домен дзета CD3 включает последовательность, представленную в SEQ ID NO: 7 (SEQ ID NO: 7; RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR).
[0106] "Химерный антигенный рецептор" (CAR), описанный в данной заявке, также известный как химерный Т-клеточный рецептор, относится к синтетическому Т-клеточному рецептору или полученному с помощью генетической инженерии рецептору, который прививает желательную специфичность на иммунную эффекторную клетку. Данные рецепторы можно применять, чтобы привить специфичность моноклонального антитела или его связывающей части на Т-клетку, например; путем переноса кодирующей CAR последовательности на реципиентную клетку, который упрощает применение ретровирусного вектора. Структура CAR может включать одноцепочечные вариабельные фрагменты (scFv), полученные из моноклональных антител, слитых с трансмембранным доменом и эндодоменом CD3-дзета. Такие молекулы приводят к передаче сигнала дзета в ответ на распознавание scFv его мишени.
[0107] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает отделение, выделение или обогащение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток для того, чтобы получить выделенную, отделенную или обогащенную популяцию Т-клеток, стимуляцию выделенной, отделенной или обогащенной популяции Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, трансдукцию популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, с по меньшей мере одним цитокином, например, в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, обогащение, отделение или выделение трансдуцированной и стимулированной цитокином популяции Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по маркеру, кодируемому маркерной последовательностью, для того, чтобы получить обогащенную, отделенную или выделенную популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, и размножение указанной обогащенной, отделенной или выделенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. В некоторых альтернативных вариантах указанного способа химерный антигенный рецептор специфичен к CD19.
[0108] Такие искусственные Т-клеточные рецепторы, или CAR, можно применять в качестве терапевтического средства от рака или вирусной инфекции, применяя методику, названную "адоптивным переносом клеток". Т-клетки удаляют из пациента и модифицируют таким образом, чтобы они экспрессировали рецепторы, специфичные к молекуле, представленной на поверхности раковой клетки, или вируса, или инфицированной вирусом клетки. Полученные с помощью генетической инженерии Т-клетки, которые после этого могут распознать и уничтожить раковые клетки или инфицированные вирусом клетки, или вызвать выведение вируса, вводят обратно пациенту. В некоторых альтернативных аспектах предложен способ лечения, ингибирования или облегчения заболевания у субъекта, нуждающегося в этом.
[0109] В некоторых аспектах указанный способ может включать введение по меньшей мере одной композиции или комбинации продуктов, при этом по меньшей мере одна композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, где указанная популяция генетически модифицированных Т-клеток содержит множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, в отсутствие, при относительном обогащении последних, по существу отделенных или по существу изолированных от не экспрессирующих CD8 и/или CD4 Т-клеток, при этом указанное множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, дополнительно содержит ген, кодирующий химерный антигенный рецептор, и селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, повторно стимулировали по меньшей мере одним цитокином, например, в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени. В некоторых альтернативных аспектах по меньшей мере одну композицию или комбинацию продуктов вводят указанному субъекту путем адоптивного переноса клеток.
[0110] "Антитело", описанное в данной заявке, относится к большому белку в форме Y, продуцируемому плазматическими клетками, который используется иммунной системой для того, чтобы идентифицировать и нейтрализовать чужеродные объекты, такие как бактерии и вирусы. Белок антитела может содержать четыре полипептидные цепи: две идентичные тяжелые цепи и две идентичные легкие цепи, соединенные дисульфидными связями. Каждая цепь состоит из структурных доменов, называемых доменами иммуноглобулина. Данные домены могут содержать 70-110 аминокислот, и их классифицируют по различным категориям в соответствии с размером и функцией. В некоторых альтернативных аспектах лиганд-связывающий домен представляет собой фрагмент антитела, желательно, его связывающую часть. В некоторых альтернативных аспектах фрагмент антитела или его связывающая часть, присутствующие на CAR, специфичны к CD19.
[0111] "Одноцепочечный вариабельный фрагмент" или scFv представляет собой слитый белок, который содержит вариабельные области тяжелой (VH) и легкой (VL) цепей иммуноглобулина, которые соединены коротким линкерным пептидом. Без ограничения, линкер может содержать глицин для гибкости и гидрофильные аминокислоты, например, серии или треонин для растворимости. Линкер может соединять N-конец VH с С-концом VL или может соединять С-конец VH с N-концом VL. В некоторых альтернативных аспектах лиганд-связывающий домен, присутствующий на CAR, представляет собой одноцепочечный вариабельный фрагмент (scFv). В некоторых альтернативных аспектах домен scFv, присутствующий на CAR, специфичен к CD19, присутствующему на опухолевой клетке.
[0112] "FMC63" представляет собой специфичное к CD19 моноклональное антитело. CD19 представляет собой белок, который находится на поверхности белых кровяных клеток и может соединяться с антигенным рецептором В лимфоцитов для того, чтобы снизить порог рецептор-зависимой стимуляции антигеном. CD19 экспрессируется на фолликулярных дендритных клетках и В-клетках. CD19 присутствует на самых ранних распознаваемых стадиях дифференцировки клеток В-клеточной линии в процессе развития в В-лимфобласты, но утрачивается при созревании в плазматические клетки. CD19, главным образом, действует как В-клеточный корецептор вместе с CD21 и CD81. После активации цитоплазматический хвост CD19 фосфорилируется, что приводит к его связыванию с киназами семейства Src и привлечению киназы PI-3. Как и на Т-клетках, несколько молекул клеточной поверхности образуют антигенный рецептор и образуют комплекс на В-лимфоцитах.
[0113] Мутации в CD19 связаны с синдромами тяжелого иммунодефицита, который характеризуется пониженной продукцией антител. Например, аберрантная экспрессия CD19 представляет собой маркер моноцитарной линии при остром миелогенном лейкозе. Поскольку CD19 является отличительным признаком В-клеток, указанный белок можно применять для диагностики раков, которые возникают из этого типа клеток, в особенности В-клеточных лимфом. Начиная с 2011 г., лекарственные средства, направленные против CD19, начали проходить клинические испытания. Самые последние находящиеся в разработке экспериментальные лекарственные средства, направленные против CD19, действуют, используя присутствие CD19 для нацеливания лечения, в частности, на В-клеточные раки. Тем не менее теперь выясняется, что данный белок играет активную роль в стимуляции роста данных раков путем стабилизации концентраций онкобелка MYC. Следовательно, CD19 и нижележащий сигнальный путь могут представлять собой привлекательные терапевтические мишени.
[0114] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает отделение, обогащение, выделение или очистку популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток, чтобы получить выделенную, отделенную, обогащенную или очищенную популяцию Т-клеток, стимуляцию выделенной, отделенной, обогащенной или очищенной популяции Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, трансдукцию популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, с по меньшей мере одним цитокином, например, в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, обогащение популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по указанному маркеру для того, чтобы получить обогащенную популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, и размножение обогащенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор.
[0115] В некоторых альтернативных вариантах указанного способа вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемую маркерную последовательность. В некоторых альтернативных вариантах указанного способа вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора содержит антитело или его связывающую часть. В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора содержит FMC63 или его связывающую часть. В некоторых альтернативных вариантах указанного способа лиганд-связывающий домен химерного антигенного рецептора специфичен к CD19.
[0116] "Очистка" Т-клеток, описанная в настоящей заявке, относится к выделению высокоочищенных функциональных Т-клеток для исследования или для способов получения Т-клеток для терапии. "Выделение" Т-клеток или "отделение" Т-клеток, описанное в настоящей заявке, относится к процедуре выделения или отделения желательных Т-клеток, популяций или субпопуляций Т-клеток от контаминирующих популяций клеток или других компонентов, например, путем применения таких методик, как непрямой пэннинг. В данном способе клетки можно выделить, отделить или подвергнуть селекции по их способности связываться с антителом, которое присоединено к подложке, такой как пластиковая или поликарбонатная поверхность, гранула, частица, чашка или лунка. Клетки могут связываться на основе определенных маркеров клеточной поверхности. В некоторых случаях желательные популяции Т-клеток "обогащены", если концентрация популяции желательных Т-клеток больше после обогащения, чем концентрация их популяции в нативной форме, из которой получены Т-клетки.
[0117] В некоторых альтернативных вариантах указанного способа получения генетически модифицированной Т-клетки, популяция Т-клеток, экспрессирующих CD8+, и/или популяция Т-клеток, экспрессирующих CD4+, выделена, обогащена, очищена или отделена от нежелательных компонентов путем применения антител, специфичных к CD8, и/или антител, специфичных к CD4. В некоторых альтернативных вариантах указанного способа популяция Т-клеток, экспрессирующих CD8+, и/или популяция Т-клеток, экспрессирующих CD4+, выделена, обогащена или очищена путем применения проточной цитометрии. В некоторых альтернативных аспектах популяция Т-клеток, экспрессирующих CD8+, и/или популяция Т-клеток, экспрессирующих CD4+, выделена, обогащена, очищена или отделена путем применения иммуномагнитной селекции. В некоторых альтернативных вариантах указанного способа популяция Т-клеток, экспрессирующих CD8+, и/или популяция Т-клеток, экспрессирующих CD4+, выделена, обогащена, очищена или отделена путем применения антител против CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28, CD8, CD4 и/или CD62L. В некоторых альтернативных вариантах указанного способа популяция Т-клеток, экспрессирующих CD8+, и/или популяция Т-клеток, экспрессирующих CD4+, выделена, обогащена, очищена или отделена путем применения антитела против CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный способ осуществляют с выделенными, обогащенными или отделенными Т-клетками, экспрессирующими CD4+, в отсутствие или при большом избытке относительно количества экспрессирующих CD8+ клеток в смешанной популяции Т-клеток, использованной для выделения, обогащения или очистки. В некоторых альтернативных аспектах указанный способ осуществляют с выделенными, обогащенными или отделенными CD8+ в отсутствие или при большом избытке относительно количества экспрессирующих CD4+ клеток в смешанной популяции Т-клеток, использованной для выделения, обогащения или очистки.
[0118] "Стимуляция" или активация Т-клеток относится к способу индукции Т-клетки к стимуляции ответа, такого как ответ передачей сигнала, например, пролиферация, при котором сохраняется жизнеспособность и иммунная функция Т-клетки. Например, одновременная передача сигнала TCR/CD3 и CD8 может запускать физиологическую активацию и рост Т-клеток человека. После подходящей стимуляции Т-клетки могут активно пролиферировать in vitro. В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает выделение, отделение, обогащение или очистку популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток, для того, чтобы получить выделенную, отделенную, очищенную или обогащенную популяцию Т-клеток, стимуляцию выделенной, отделенной, очищенной или обогащенной популяции Т-клеток для того, чтобы получить популяцию стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, трансдукцию популяции стимулированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить популяцию трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приведение в контакт указанной популяции трансдуцированных Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, с по меньшей мере одним цитокином, например, в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, обогащение, отделение или выделение трансдуцированной и стимулированной цитокинами популяции Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, путем селекции по маркеру, кодируемому маркерной последовательностью, для того, чтобы получить обогащенную популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток, и размножение обогащенной, выделенной или отделенной популяции трансдуцированных и стимулированных цитокином Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, в течение по меньшей мере одного дня, например, в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. В некоторых альтернативных аспектах стимуляцию осуществляют с помощью подложки, с которой связаны антитела, такой как гранула или частица. В некоторых альтернативных аспектах стимуляцию осуществляют с помощью подложки, с которой связаны антитела, включая антитела к TCR, к CD2, к CD3, к CD4 и/или к CD28. В некоторых альтернативных аспектах стимуляцию осуществляют с помощью подложки, с которой связаны антитела, включая антитела к CD3 и/или к CD28. В некоторых альтернативных аспектах указанный способ дополнительно включает удаление подложки, с которой связаны антитела, такой как гранулы или частицы.
[0119] "Т-клетки" или "Т-лимфоциты" в настоящей заявке могут быть получены из любого млекопитающего, предпочтительно из примата, включая обезьян или людей, домашнего животного, такого как собака, кошка или лошадь, или сельскохозяйственного животного, такого как овцы, козы или крупный рогатый скот. В некоторых альтернативных вариантах реализации Т-клетки аллогенны (из того же вида, но из отличного донора) по отношению к субъекту-реципиенту; в некоторых альтернативных вариантах реализации Т-клетки аутологичны (донор и реципиент представляют собой одного и того же субъекта); в некоторых альтернативных вариантах реализации Т-клетки сингенны (донор и реципиент разные, но являются идентичными близнецами).
[0120] "Т-клетка, экспрессирующая CD8+" или "CD8+ Т-клетка", которые используют синонимично на протяжении всего текста настоящей заявки, также известны как ТС, цитотоксический Т-лимфоцит, CTL, клетка Т-киллер, цитолитическая Т-клетка или Т-клетка-киллер. В данной заявке описано, что CD8+ Т-клетки представляют собой Т-лимфоциты, которые могут уничтожать раковые клетки, инфицированные вирусами клетки или поврежденные клетки. CD8+ Т-клетки экспрессируют Т-клеточные рецепторы (TCR), которые могут распознавать специфический антиген. CD8+ Т-клетки экспрессируют CD8 на своей поверхности. Т-клетки, экспрессирующие CD8+, способны продуцировать некоторые цитокины, тем не менее, концентрации цитокинов, продуцируемых CD8+ Т-клетками, не достаточно высоки, чтобы вызывать, повышать, способствовать или индуцировать способность к приживлению.
[0121] "Т-клетка, экспрессирующая CD4+" или "CD4+ Т-клетка", которые используют синонимично на протяжении всего текста настоящей заявки, также известны как Т-хелперные клетки, которые играют важную роль в иммунной системе и в адаптивной иммунной системе. CD4+ Т-клетки также помогают активности других иммунных клеток путем высвобождения Т-клеточных цитокинов. Данные клетки содействуют, подавляют или регулируют иммунные ответы. Они необходимы для переключения классов антител, продуцируемых В-клетками, активации и роста цитотоксических Т-клеток и максимизирования бактерицидной активности фагоцитов, таких как макрофаги. Т-клетки, экспрессирующие CD4+, способны продуцировать некоторые цитокины, тем не менее, концентрации цитокинов, продуцируемых CD4+ Т-клетками, не достаточно высоки, чтобы вызывать, повышать, способствовать или индуцировать способность к приживлению.
[0122] Зрелые Т-клетки экспрессируют поверхностный белок CD4, и их называют CD4+ Т-клетками. Как правило, считают, что CD4+ Т-клетки в иммунной системе играют заранее определенную роль хелперных Т-клеток. Например, если антигенпредставляющая клетка экспрессирует антиген на МНС II класса, то CD4+ клетка будет помогать таким клетками посредством комбинации межклеточных взаимодействий (например, CD40 и CD40L) и посредством цитокинов. Тем не менее, существуют редкие исключения: например, подгруппы регуляторных Т-клеток, естественных клеток-киллеров и цитотоксических Т-клеток экспрессируют CD4. Все эти группы Т-клеток, экспрессирующих CD4+, не считают Т-хелперными клетками.
[0123] "Центральная Т-клетка памяти" (или "Тем") в данной заявке относится к обученному антигеном CTL, который экспрессирует CD62L или CCR-7 и CD45RO на своей поверхности, и не экспрессирует или экспрессирует пониженное количество CD45RA по сравнению с непримированными клетками. В некоторых альтернативных аспектах центральные клетки памяти положительны по экспрессии CD62L, CCR7, CD28, CD127, CD45RO и/или CD95, и экспрессируют пониженное количество CD54RA по сравнению с непримированными клетками.
[0124] "Эффекторная Т-клетка памяти" (или "Тем") в данной заявке относится к обученной антигеном Т-клетке, которая не экспрессирует или экспрессирует пониженное количество CD62L на своей поверхности по сравнению с центральными клетками памяти, и не экспрессирует или экспрессирует пониженное количество CD45RA в отличие от непримированной клетки. В некоторых альтернативных аспектах эффекторные клетки памяти отрицательны по экспрессии CD62L и/или CCR7, в отличие от непримированных клеток или центральных клеток памяти, и у них различна экспрессия CD28 и/или CD45RA.
[0125] "Непримированные" Т-клетки в данной заявке относится к необученному антигеном Т-лимфоциту, который экспрессирует CD62L и/или CD45RA, и/или не экспрессирует CD45RO, в отличие от центральных или эффекторных клеток памяти. В некоторых альтернативных аспектах отличительным признаком непримированных CD8+ Т-лимфоцитов служит экспрессия фенотипических маркеров непримированных Т-клеток, включая CD62L, CCR7, CD28, CD127 и/или CD45RA.
[0126] "Эффекторные", "TE" Т-клетки в данной заявке относится к обученным антигеном цитотоксическим Т-лимфоцитам, которые не экспрессируют или экспрессируют пониженное количество CD62L, CCR7, CD28 и положительны по гранзиму В и/или перфорину, отличие от центральных клеток памяти или непримированных Т-клеток.
[0127] "Способность к приживлению", описанная в настоящей заявке, относится к способности клетки расти и пролиферировать после того, как клетки проникли в организм, например, в кровоток, посредством адоптивного переноса. Приживление обычно может произойти в течение двух-четырех недель после переноса. Приживление можно отслеживать, проверяя количество определенных клеток в крови на постоянной основе. В некоторых альтернативных вариантах реализации предложен способ лечения, ингибирования или облегчения заболевания у субъекта, указанный способ возможно включает введение композиции или комбинации продуктов, содержащих генетически модифицированные Т-клетки, описанные в данной заявке. В некоторых альтернативных аспектах указанный способ возможно дополнительно включает мониторинг субъекта путем проверки количества генетически модифицированных Т-клеток, которые экспрессируют химерный антигенный рецептор, например, путем идентификации присутствия или отсутствия маркера, ассоциированного с перенесенными Т-клетками.
[0128] Т-клетки с улучшенной способностью к приживлению могут содержать на своей поверхности специфические маркеры, которые вызывают формирование и длительное поддержание Т-клеточного иммунитета. Известно несколько белков, которые способствуют активации и выживаемости Т-клеток. CD28 представляет собой белок, который экспрессируется на Т-клетках, который передает костимулирующие сигналы, необходимые для активации и выживаемости Т-клеток. CD27 необходим для формирования и длительного поддержания Т-клеточного иммунитета. Он связывается с лигандом CD70 и играет ключевую роль в регуляции активации В-клеток и синтеза иммуноглобулинов. L-селектин, также известный как CD62L, представляет собой молекулу клеточной адгезии, обнаруженную на лимфоцитах. L-селектин действует как "хоминг-рецептор" для лимфоцитов или Т-клеток для проникновения во вторичные лимфоидные ткани через наружные эндотелиальные венулы. Лиганды, присутствующие на эндотелиальных клетках, связываются с лимфоцитами, экспрессирующими L-селектин, замедляют миграцию лимфоцитов в крови и могут способствовать их проникновению во вторичный лимфоидный орган на этом этапе. В некоторых альтернативных аспектах способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, указанные Т-клетки содержат по меньшей мере один рецептор, который вызывает, индуцирует, улучшает или повышает способность к приживлению. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных вариантах реализации, предложенных в данной заявке, описаны способы, в которых Т-клетки, экспрессирующие CD4+ и CD8+, генетически модифицируют путем трансдукции генетического материала в составе вектора таким образом, чтобы генетически модифицированные Т-клетки, экспрессирующие CD4+ и CD8+, экспрессировали определенный химерный антигенный рецептор. В некоторых альтернативных вариантах генетически модифицированных CD4+ и CD8+ Т-клеток указанные генетически модифицированные CD4+ и CD8+ Т-клетки дополнительно модифицируют, чтобы улучшить или повысить способность к приживлению.
[0129] "Цитокины", описанные в настоящей заявке, относятся к малым белкам (5-25 кДа), которые важны для передачи сигналов в клетке. Цитокины высвобождаются клетками и влияют на поведение других клеток, а иногда и самой высвобождающей их клетки, такой как Т-клетка. Цитокины могут включать, например, хемокины, интерфероны, интерлейкины, лимфокины и фактор некроза опухоли. Цитокины могут продуцироваться широким разнообразием клеток, которые возможно включают, например, иммунные клетки, такие как макрофаги, В-лимфоциты, Т-лимфоциты и тучные клетки, а также эндотелиальные клетки, фибробласты и различные стромальные клетки.
[0130] Цитокины могут действовать через рецепторы и важны для иммунной системы, так как цитокины могут изменять равновесие между гуморальным и клеточным иммунными ответами, и могут регулировать созревание, рост и восприимчивость определенных популяций клеток. Некоторые цитокины усиливают или ингибируют действие других цитокинов сложными путями. Без ограничения, цитокины возможно включают, например, белок, стимулирующий ацилирование, адипокин, альбинтерферон, CCL1, CCL11, CCL12, CCL13, CCL14, CCL15, CCL16, CCL17, CCL18, CCL19, CCL2, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCL26, CCL27, CCL28, CCL3, CCL5, CCL6, CCL7, CCL8, CCL9, хемокин, колониестимулирующий фактор, CX3CL1, CX3CR1, CXCL1, CXCL10, CXCL11, CXCL13, CXCL14, CXCL15, CXCL16, CXCL17, CXCL2, CXCL3, CXCL5, CXCL6, CXCL7, CXCL9, эритропоэтин, Gc-MAF, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, фактор роста гепатоцитов, семейство цитокинов IL-10, семейство цитокинов IL-17, IL-1-A, IL-1-В, инфламмасому, интерфером, интерферон, интерферон-бета 1а, интерферон-бета 1b, интерферон-гамма, интерферон типа I, интерферон типа II, интерферон типа III, интерлейкин, семейство интерлейкина 1, антагонист рецептора интерлейкина 1, интерлейкин 10, интерлейкин 12, субъединицу бета интерлейкина 12, интерлейкин 13, интерлейкин 15, интерлейкин 16, интерлейкин 2, интерлейкин 23, субъединицу альфа интерлейкина 23, интерлейкин 34, интерлейкин 35, интерлейкин 6, интерлейкин 7, интерлейкин 8, интерлейкин 36, ингибирующий лейкоз фактор, содействующий лейкоцитам фактор, лимфокин, лимфотоксин, лимфотоксин-альфа, лимфотоксин-бета, колониестимулирующий фактор макрофагов, воспалительный белок макрофагов, фактор активации макрофагов, монокин, миокин, мионектин, никотинамид-фосфорибозилтрансферазу, онкостатин М, опрелвекин, фактор 4 тромбоцитов, провоспалительный цитокин, промегапоэтин, RANKL, фактор стромальных клеток 1, Talimogene Laherparepvec, фактор некроза опухоли альфа, факторы некроза опухоли, XCL1, XCL2, ГМ-КСФ и/или XCR1. В некоторых альтернативных вариантах реализации способа получения генетически модифицированных Т-клеток трансдуцированную популяцию Т-клеток, экспрессирующих CD8+, и/или Т-клеток, экспрессирующих CD4+, приводят в контакт с по меньшей мере одним цитокином для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток. В некоторых альтернативных вариантах указанного способа используемый по меньшей мере один цитокин включает ГМ-КСФ, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21. В некоторых альтернативных аспектах период времени контакта с цитокином составляет по меньшей мере один день, например, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или любой период времени, который находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени.
[0131] Описанные в настоящей заявке "интерлейкины" или IL представляют собой цитокины, от которых сильно зависит иммунная система. Примеры интерлейкинов, которые можно применять в данной заявке, например, включают IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8/CXCL8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, IL-34, IL-35 и/или IL-36. Приведение в контакт Т-клеток с интерлейкинами может приводить к эффектам, которые вызывают, поддерживают, индуцируют или улучшают способность указанных клеток к приживлению. IL-1, например, может влиять на созревание и пролиферацию Т-клеток. IL-2, например, может стимулировать рост и дифференцировку Т-клеток. IL-3, например, может вызывать дифференцировку и пролиферацию миелоидных клеток-предшественников. IL-4, например, может вызывать пролиферацию и дифференцировку. IL-7, например, может вызывать дифференцировку и пролиферацию лимфоидных клеток-предшественников, которые участвуют в выживаемости, развитии и гомеостазе В-, Т- и NK-клеток. IL-15, например, может вызывать продукцию естественных клеток-киллеров. IL-21, например, костимулирует активацию и пролиферацию CD8+ Т-клеток, повышает цитотоксичность NK, усиливает запускаемую CD40 пролиферацию, дифференцировку и переключение изотипа В-клеток, и вызывает дифференцировку клеток Th17.
[0132] В некоторых альтернативных аспектах предложен способ получения генетически модифицированной Т-клетки, при этом указанный способ включает очистку, отделение, обогащение или выделение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток для того, чтобы получить выделенную, отделенную, обогащенную или очищенную популяцию Т-клеток, стимуляцию выделенной, отделенной, обогащенной или очищенной популяции Т-клеток для того, чтобы получить стимулированную популяцию CD8+ Т-клеток и/или CD4+ Т-клеток, трансдукцию стимулированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить трансдуцированную популяцию CD8+ Т-клеток и/или CD4+ Т-клеток, приведение в контакт указанной трансдуцированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток с по меньшей мере одним цитокином для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток, обогащение, выделение или отделение трансдуцированной и стимулированной цитокином популяции CD8+ Т-клеток и/или CD4+ Т-клеток путем селекции по маркеру, кодируемому маркерной последовательностью, для того, чтобы получить обогащенную, выделенную или отделенную популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток, и размножение полученной обогащенной, выделенной или отделенной популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток в течение по меньшей мере одного дня, например, в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени, с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор. В некоторых альтернативных аспектах по меньшей мере один цитокин включает ГМ-КСФ, IL-7, IL-12, IL-18, IL-15, IL-2 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В некоторых альтернативных вариантах указанного способа приведение в контакт с цитокином осуществляют в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или периода времени, который находится внутри диапазона, ограниченного любыми двумя из указанных периодов времени. В некоторых альтернативных аспектах добавление по меньшей мере одного цитокина улучшает, повышает, вызывает или индуцирует способность к приживлению. В некоторых альтернативных аспектах указанные обогащенные Т-клетки, экспрессирующие CD4+, приводят в контакт, например, выращивают с добавлением 5 нг/мл рекомбинантного IL-7 человека (rhIL-7) и/или 0,5 нг/мл рекомбинантного IL-15 человека (rhIL-15). В некоторых альтернативных аспектах указанные обогащенные Т-клетки, экспрессирующие CD8+, приводят в контакт, например, выращивают с добавлением 50 Ед/мл рекомбинантного IL-2 человека (rhIL-2) и/или 0,5 нг/мл рекомбинантного IL-15 человека (rhIL-15). В дополнительных альтернативных аспектах указанные обогащенные Т-клетки, экспрессирующие CD4+, приводят в контакт, например, выращивают с добавлением 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл или 1,0 нг/мл rhIL-7 или количества, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств rhIL-7, и/или с 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл или 1,0 нг/мл rhIL-15 или количества, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств rhIL-15. В дополнительных альтернативных аспектах указанные обогащенные Т-клетки, экспрессирующие CD8+, приводят в контакт, например, выращивают с добавлением 10 Ед/мл, 20 Ед/мл, 30 Ед/мл, 40 Ед/мл, 50 Ед/мл, 60 Ед/мл, 70 Ед/мл, 80 Ед/мл, 90 Ед/мл или 100 Ед/мл rhIL-2 или количества, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств rhIL-2, и/или с 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл или 1,0 нг/мл rhIL-7 и/или 0,1 нг/мл, 0,2 нг/мл, 0,3 нг/мл, 0,4 нг/мл, 0,5 нг/мл, 0,6 нг/мл, 0,7 нг/мл, 0,8 нг/мл, 0,9 нг/мл или 1,0 нг/мл rhIL-15 или количества, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше количеств rhIL-15. В некоторых альтернативных вариантах реализации упомянутые выше цитокины и количества добавляют к Т-клеткам одновременно, например, в виде смеси, или добавляют с коротким перерывом между ними, и в других альтернативных аспектах упомянутые выше цитокины приводят в контакт с Т-клетками отдельно, например, с интервалом времени между ними, составляющим 1-10 минут или 1-10 часов.
[0133] Термины "обогащенный" и "обедненный", которые также используются в данной заявке для описания количеств типов клеток в смеси, относятся к проведению со смесью указанных клеток процесса или этапа, который приводит к увеличению количества "обогащенного" типа и уменьшению количества "обедненного" типа клеток. Таким образом, в зависимости от источника исходной популяции клеток, подвергнутой процессу обогащения, смесь или композиция может содержать 60, 70, 80, 90, 95 или 99 процентов или более, или любой процент внутри диапазона, ограниченного любыми двумя из данных значений (по величине или количеству), "обогащенных" клеток и 40, 30, 20, 10, 5 или 1 процент или менее, или любое значение внутри диапазона, ограниченного любыми двумя из данных значений (по величине или количеству), "обедненных" клеток. В некоторых альтернативных вариантах указанного способа получения генетически модифицированных Т-клеток предложено обогащение популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток путем аффинной селекции по маркеру клеточной поверхности, таким образом, что получают обогащенную популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток.
[0134] "Выращивание клеток" или "размножение" относится к этапам, позволяющим пролиферацию, наращивание, рост и воспроизводство клеток. Например, культуры CD8+ Т-клеток и CD4+ Т-клеток обычно можно инкубировать при условиях, которые подходят для роста и пролиферации Т-лимфоцитов. В некоторых альтернативных вариантах указанного способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, указанные Т-клетки, экспрессирующие CD4+, выращивают в течение по меньшей мере 1 дня и возможно выращивают в течение 20 дней, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени. В некоторых альтернативных вариантах указанного способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, указанные Т-клетки, экспрессирующие CD8+, выращивают в течение по меньшей мере 1 дня и возможно выращивают в течение 20 дней, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени.
[0135] "Аффинная селекция", описанная в настоящей заявке, относится к селекции специфической молекулы или клетки, содержащей селектируемый маркер на поверхности, путем связывания указанной молекулы или маркера, или эпитопа, присутствующего на них, с агентом для аффинного связывания, который позволяет отделить интересующую специфическую молекулу или клетку. Аффинную селекцию можно осуществить посредством, например, антител, конъюгированных антител, лектинов, аптамеров и/или пептидов. В некоторых альтернативных аспектах способа получения генетически модифицированных Т-клеток, отделение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют путем аффинной селекции Т-клеток, содержащих эпитоп, представленный на CD8 и/или CD4. В некоторых альтернативных вариантах указанного способа антитела к CD8 или к CD4 или связывающие части антител используют для селекции интересующих клеток. В некоторых альтернативных вариантах указанного способа отделение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют с помощью проточной цитометрии. В некоторых альтернативных вариантах указанного способа отделение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют с помощью иммуномагнитной селекции. В некоторых альтернативных вариантах указанного способа антитела к CD8 или к CD4 конъюгированы с твердой подложкой, такой как, например, инертная гранула или инертная частица.
[0136] "Предшественники Т-клеток", описанные в данной заявке, относятся к лимфоидным клеткам-предшественникам, которые могут мигрировать в тимус и становиться предшественниками Т-клеток, которые не экспрессируют Т-клеточный рецептор. Все Т-клетки происходят из гематопоэтических стволовых клеток в костном мозге. Гематопоэтические предшественники (лимфоидные клетки-предшественники) из гематопоэтических стволовых клеток оседают в тимусе и размножаются путем деления клеток с образованием большой популяции незрелых тимоцитов. Тимоциты на самой ранней стадии развития не экспрессируют ни CD4, ни CD8, и следовательно, их классифицируют как дважды отрицательные (CD4-CD8-) клетки. По мере их развития они становятся дважды положительными тимоцитами (CD4+CD8+) и, наконец, созревают в одинарно положительные (CD4+CD8- или CD4-CD8+) тимоциты, которые затем высвобождаются из тимуса в периферические ткани. Приблизительно 98% тимоцитов погибают в процессе развития в тимусе из-за неспособности пройти положительную селекцию или отрицательную селекцию, тогда как оставшиеся 2% выживают и покидают тимус, чтобы стать зрелыми иммунокомпетентными Т-клетками.
[0137] Дважды отрицательная (ДН) стадия предшественника Т-клетки сосредоточена на продукции функциональной β-цепи, тогда как дважды положительная (ДП) стадия сосредоточена на продукции функциональной α-цепи, что в конечном итоге приводит к продукции функционального αβ-Т-клеточного рецептора. По мере прохождения развивающимся тимоцитом через четыре стадии ДН (ДН1, ДН2, ДН3 и ДН4) Т-клетка экспрессирует неизменную α-цепь, но перестраивает локус β-цепи. Если перестроенная β-цепь успешно образует пару с неизменной α-цепью, то вырабатываются сигналы, которые прекращают перестройку β-цепи (и замалчивают альтернативную аллель) и приводят к пролиферация клетки. Хотя для таких сигналов требуется присутствие данного пре-TCR на поверхности клетки, они зависят от связывания лиганда с пре-TCR. Полученные тимоциты затем будут экспрессировать как CD4, так и CD8 и перейдут на дважды положительную (ДП) стадию, на которой происходит селекция α-цепи. Если перестроенная β-цепь не передает какой-либо сигнал (например, в результате неспособности образовать пару с неизменной α-цепью), то клетка может погибнуть от забвения (отсутствия передачи сигналов).
[0138] "Гематопоэтические стволовые клетки" или "ГСК", описанные в данной заявке, представляют собой клетки-предшественники, из которых могут образовываться миелоидные клетки, такие как, например, макрофаги, моноциты, макрофаги, нейтрофилы, базофилы, эозинофилы, эритроциты, мегакариоциты/тромбоциты, дендритные клетки и лимфоидные линии дифференцировки (такие как, например, Т-клетки, В-клетки, NK-клетки). Популяция ГСК гетерогена и содержит три класса стволовых клеток, которые можно различить по соотношению в крови произошедших из них лимфоидных и миелоидных клеток (L/M).
[0139] "Криосохранение" представляет собой процесс консервации клеток, целых тканей или веществ, чувствительных к повреждению, путем охлаждения до температуры ниже нуля. При низких температурах любая ферментативная или химическая активность, которая может вызвать повреждения обсуждаемых клеток, ткани или веществ, эффективно останавливается. В способах криосохранения пытаются достичь низких температур, не вызывая дополнительного повреждения, вызванного образованием льда в процессе заморозки. При обычном криосохранении материал, который нужно заморозить, покрывают классом молекул, названных криопротекторами. Постоянно разрабатываются новые способы криосохранения вследствие свойственной многим криопротекторам токсичности. Способы криосохранения известны специалистам в данной области техники. В некоторых альтернативных вариантах способа получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, указанный способ может дополнительно включать криоконсервацию генетически модифицированных Т-клеток.
[0140] В некоторых альтернативных аспектах предложена популяция генетически модифицированных Т-клеток, при этом указанная популяция генетически модифицированных Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, содержит множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, в отсутствие CD8- и/или CD4- Т-клеток, при обогащении относительно CD8- и/или CD4- Т-клеток или изолировании от CD8- и/или CD4- Т-клеток, при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит ген, кодирующий химерный антигенный рецептор, и селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, повторно стимулируют по меньшей мере одним цитокином, например, в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени. В некоторых альтернативных аспектах подвергнутые селекции CD8+ и/или CD4+ Т-клетки получают с помощью способов, предложенных в данной заявке. В некоторых альтернативных аспектах по меньшей мере один цитокин включает ГМ-КСФ, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В некоторых альтернативных вариантах популяции генетически модифицированных Т-клеток, указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит по меньшей мере один рецептор, который вызывает, индуцирует, улучшает или способствует приживлению. В некоторых альтернативных аспектах по меньшей мере один рецептор, который вызывает, улучшает, индуцирует или способствует приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах по меньшей мере один рецептор, который вызывает, улучшает, способствует или индуцирует способность к приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах множество подвергнутых аффинной селекции Т-клеток, экспрессирующих CD8+ и/или CD4+, дополнительно содержит вектор, содержащий первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных аспектах селектируемый маркер на поверхности клетки кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах лиганд-связывающий домен содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит FMC63 или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен специфичен к CD19. В некоторых альтернативных аспектах популяция содержит выделенные или обогащенные Т-клетки, экспрессирующие CD8+, в отсутствие CD4+ Т-клеток, при обогащении относительно CD4+ Т-клеток, при существенном обеднении CD4+ Т-клетками. В некоторых альтернативных аспектах популяция содержит выделенные или обогащенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток, при обогащении относительно CD8+ Т-клеток, при существенном обеднении CD8+ Т-клетками.
[0141] В некоторых альтернативных аспектах композиции для адоптивной клеточной иммунотерапии полезны для лечения некоторого заболевания или рака. В некоторых альтернативных аспектах предложена композиция или комбинация продуктов для терапии человека, при этом указанная композиция или комбинация продуктов содержит фармацевтическое вспомогательное вещество и по меньшей мере одну популяцию генетически модифицированных Т-клеток согласно любому одному или более из альтернативных вариантов Т-клеток, или популяцию генетически модифицированных Т-клеток, собранных или полученных, как описано в данной заявке. В некоторых альтернативных вариантах реализации композиции или комбинации продуктов для терапии человека указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, при этом указанная популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток, при обогащении относительно CD4+ Т-клеток, при существенном обеднении CD4+ Т-клетками. В некоторых альтернативных вариантах реализации композиции или комбинации продуктов для терапии человека указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, при этом указанная популяция содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток, при обогащении относительно CD8+ Т-клеток или при существенном обеднении CD8+ Т-клетками. В некоторых альтернативных вариантах реализации композиции или комбинации продуктов для терапии человека указанная композиция или комбинация продуктов содержит комбинацию выделенных CD8+ Т-клеток в отсутствие CD4+ Т-клеток, при обогащении относительно CD4+ Т-клеток или при существенном обеднении CD4+ Т-клетками, и выделенных CD4+ Т-клеток в отсутствие CD8+ Т-клеток, при обогащении относительно CD8+ Т-клеток или при существенном обеднении CD8+ Т-клетками, в соотношении 1:1. В некоторых альтернативных аспектах популяции генетически модифицированных Т-клеток смешивают и вводят или вводят одновременно в отдельных лекарственных формах нуждающемуся в этом субъекту при отношении CD4+ Т-клеток к CD8+ Т-клеткам, которое составляет 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, или при отношении, которое находится в пределах диапазона, ограниченного любыми двумя из данных отношений. В некоторых альтернативных аспектах популяции генетически модифицированных Т-клеток смешивают и вводят или вводят одновременно в отдельных лекарственных формах нуждающемуся в этом субъекту при отношении CD8+ Т-клеток к CD4+ Т-клеткам, которое составляет 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, или при отношении, которое находится в пределах диапазона, ограниченного любыми двумя из данных отношений.
[0142] "Фармацевтическое вспомогательное вещество" или фармацевтический носитель, описанные в данной заявке, возможно относятся к носителю или инертной среде, используемой в качестве растворителя, в которой растворяют и/или вводят медицинский активный агент или Т-клетки для лечения. Среды могут включать полимерные мицеллы, липосомы, носители на основе липопротеинов, носители на основе наночастиц, дендримеры и/или другие среды для Т-клеток, которые известны специалисту в данной области техники. Идеальная среда или вспомогательное вещество возможно нетоксичное, биосовместимое, неиммуногенное, биоразлагаемое и может избежать распознавания защитными механизмами хозяина.
[0143] В некоторых альтернативных аспектах предложена композиция или комбинация продуктов для терапии человека, при этом указанная композиция или комбинация продуктов содержит фармацевтическое вспомогательное вещество и по меньшей мере одну популяцию генетически модифицированных Т-клеток согласно любому из альтернативных вариантов реализации, описанных в данной заявке. В некоторых альтернативных аспектах вспомогательные вещества представляют собой фармацевтические носители. В некоторых альтернативных аспектах фармацевтические носители включают фармацевтические композиции.
[0144] Острый лимфобластный лейкоз (ОЛЛ) или острый лимфоидный лейкоз представляет собой рак белых кровяных клеток, для которого характерна избыточная продукция раковых незрелых белых кровяных клеток, также известных как лимфобласты. У пациентов с ОЛЛ лимфобласты продуцируются в избытке в костном мозге и непрерывно размножаются, вызывая повреждение и смерть в результате ингибирования продукции нормальных клеток, таких как, например, красные и белые кровяные клетки и тромбоциты, в костном мозге и распространения в другие органы. ОЛЛ наиболее часто встречается в детском возрасте с пиком встречаемости в возрасте 2-5 лет и другим пиком в более старшем возрасте.
[0145] Симптомы ОЛЛ свидетельствуют о пониженной продукции функциональных кровяных клеток, так как лейкоз расходует ресурсы костного мозга, которые обычно используются для продукции новых функциональных кровяных клеток. Симптомы могут включать жар, повышенный риск инфицирования, повышенную склонность к кровотечениям, анемию, тахикардию, утомляемость и головную боль. У 50-70% детей и 40-50% взрослых, у которых добиваются полной ремиссии после первичной терапии, но у которых затем возникает рецидив, можно добиться второй полной ремиссии. Лечение рецидива после первой ремиссии может представлять собой стандартную химиотерапию, или экспериментальные лекарственные средства, или более агрессивные способы лечения, такие как трансплантация стволовых клеток. Тем не менее для других заболеваний, таких как острый миелоидный лейкоз и ОЛЛ, пониженную смертность при аутогенной по сравнению с аллогенной трансплантацией гемопоэтических стволовых клеток (ТГСК) может перевесить повышенная вероятность рецидива рака и связанная с ним смертность, и следовательно, аллогенное лечение может быть предпочтительным для данных состояний. Поэтому существует потребность в способах улучшения клеток для лечения лейкоза, миелоидного лейкоза и ОЛЛ.
[0146] В некоторых альтернативных аспектах предложен способ лечения, ингибирования или облегчения заболевания, такого как рак, такой как ОЛЛ, у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту по меньшей мере одной композиции или комбинации продуктов согласно любому одному или более альтернативным вариантам реализации, описанным в данной заявке, где указанная композиция или комбинация продуктов содержит генетически модифицированные Т-клетки, которые содержат химерный антигенный рецептор, при этом указанные Т-клетки представляют собой трансдуцированные и стимулированные цитокином CD8+ Т-клетки и/или CD4+ Т-клетки. В некоторых альтернативных вариантах реализации указанный способ включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, содержащую выделенные CD8+ Т-клетки при отсутствии, при относительном обогащении последними или при существенном обеднении CD4+ Т-клетками. В некоторых альтернативных вариантах реализации указанный способ включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, содержащую выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток, при обогащении относительно CD8+ Т-клеток или при существенном обеднении CD8+ Т-клетками. В некоторых альтернативных аспектах указанный способ дополнительно включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, содержащую выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток, при обогащении относительно CD8+ Т-клеток или при существенном обеднении CD8+ Т-клетками. В некоторых альтернативных вариантах реализации указанный способ дополнительно включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, содержащую выделенные CD8+ Т-клетки при отсутствии, при относительном обогащении последними или при существенном обеднении CD4+ Т-клетками. В некоторых альтернативных вариантах реализации указанный способ дополнительно включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит выделенные CD8+ Т-клетки при отсутствии, при относительном обогащении последними или при существенном обеднении CD4+ Т-клетками, и выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток, при обогащении относительно CD8+ Т-клеток или при существенном обеднении CD8+ Т-клетками, в соотношении 1:1. В некоторых альтернативных аспектах популяции генетически модифицированных Т-клеток смешивают и вводят или вводят одновременно в отдельных лекарственных формах нуждающемуся в этом субъекту при отношении CD4+ Т-клеток к CD8+ Т-клеткам, которое составляет 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, или при отношении, которое находится в пределах диапазона, ограниченного любыми двумя из данных отношений. В некоторых альтернативных аспектах популяции генетически модифицированных Т-клеток смешивают и вводят или вводят одновременно в отдельных лекарственных формах нуждающемуся в этом субъекту при отношении CD8+ Т-клеток к CD4+ Т-клеткам, которое составляет 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, или при отношении, которое находится в пределах диапазона, ограниченного любыми двумя из данных отношений. В некоторых альтернативных аспектах субъекта идентифицируют или выбирают для проведения ему противораковой терапии. В некоторых альтернативных аспектах указанный способ дополнительно включает измерение или оценку ингибирования заболевания. В некоторых альтернативных аспектах указанный способ дополнительно включает проведение указанному субъекту дополнительной противораковой терапии до, во время или после введения композиции или комбинации продуктов согласно любому одному или более альтернативным вариантам реализации, описанным в данной заявке. В некоторых альтернативных вариантах указанного способа композицию или комбинацию продуктов согласно любому одному или более альтернативным вариантам реализации, описанным в данной заявке, вводят указанному субъекту путем адоптивного переноса клеток. В некоторых альтернативных аспектах композицию или комбинацию продуктов согласно любому одному или более альтернативным вариантам реализации, описанным в данной заявке, вводят указанному субъекту после того, как указанный субъект получил другой вид противораковой терапии. В некоторых альтернативных аспектах композицию или комбинацию продуктов согласно любому одному или более альтернативным вариантам реализации, описанным в данной заявке, вводят указанному субъекту после того, как указанный субъект получил другой вид противораковой терапии. В некоторых альтернативных аспектах указанный субъект страдает от лейкоза. В некоторых альтернативных аспектах указанный субъект страдает от рецидивирующего и/или нечувствительного CD19+ детского острого лимфобластного лейкоза (ОЛЛ). В некоторых альтернативных вариантах указанного способа субъект страдает от рецидивирующего и/или нечувствительного к химиотерапии CD19+ острого лимфобластного лейкоза (ОЛЛ). В некоторых альтернативных вариантах указанного способа субъект страдает от аутоиммунного заболевания. В некоторых альтернативных вариантах указанного способа субъект страдает от рецидива после ТГСК.
Дополнительные альтернативные аспекты
Векторы, клетки и способы трансдукции клеток
[0147] Композиции, описанные в данной заявке, содержат экспрессирующие CD4+ и/или CD8+ Т-лимфоциты, такие как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток. Т-лимфоциты можно собрать в соответствии с известными методиками и обогатить или обеднить с помощью известных методик, таких как аффинное связывание с антителами, например, проточная цитометрия и/или иммуномагнитная селекция. После этапов обогащения и/или обеднения можно осуществить выращивание in vitro желательных Т-лимфоцитов в соответствии с известными методиками (включая, но не ограничиваясь описанными в патенте США номер 6040177, Riddell и др., который настоящим явно полностью включен посредством ссылки). В некоторых альтернативных аспектах Т-клетки представляют собой аутологические Т-клетки, т.е. полученные из пациента, которому доставляют указанные клетки. В некоторых альтернативных аспектах Т-клетки представляют собой предшественников Т-клеток. В некоторых альтернативных аспектах предшественники Т-клеток представляют собой гематопоэтические стволовые клетки (ГСК).
[0148] Например, желательную популяцию или субпопуляцию Т-клеток можно нарастить путем добавления исходной популяции Т-лимфоцитов в культуральную среду in vitro, а затем добавления в указанную культуральную среду питающих клеток, таких как не способные делиться мононуклеарные клетки периферической крови (МКПК) (например, таким образом, что полученная в результате этого популяция клеток содержит по меньшей мере 5, 10, 20 или 40 или более питающих клеток МКПК на каждый Т-лимфоцит в исходной популяции, которую нужно нарастить); и инкубации полученной культуры (например, в течение некоторого времени, достаточного для увеличения количества Т-клеток). Не способные делиться питающие клетки могут включать гамма-облученные питающие клетки МКПК. В некоторых альтернативных аспектах МКПК облучают гамма-излучением в дозе 3000, 3200, 3300, 3400, 3500 или 3600 рад, чтобы предотвратить деление клеток, или в пределах диапазона доз, ограниченного любыми двумя из упомянутых выше значений рад. При желании порядок добавления Т-клеток и питающих клеток в культуральную среду можно изменить. Культуру можно инкубировать при условиях, которые подходят для выращивания Т-лимфоцитов. Для выращивания Т-лимфоцитов человека, например, температура, как правило, будет составлять по меньшей мере 25 градусов по Цельсию, предпочтительно по меньшей мере 30 градусов, более предпочтительно 37 градусов, или любое другое значение температуры в пределах диапазона, ограниченного любыми двумя из указанных значений.
[0149] Выращиваемые Т-лимфоциты включают CD8+цитотоксические Т-лимфоциты (CTL) и CD4+ хелперные Т-лимфоциты, которые возможно специфичны к антигену, присутствующему на опухоли человека или патогене, и экспрессируют химерный антигенный рецептор.
[0150] В другом альтернативном аспекте способ выращивания или размножения возможно дополнительно включает добавление в качестве питающих клеток не способных делиться трансформированных EBV лимфобластоидных клеток (LCL). LCL можно облучить гамма-излучением в диапазоне доз 6000, 7000, 8000, 9000, или 1000 рад, или в пределах диапазона доз, ограниченного любыми двумя из упомянутых выше значений рад. Питающие клетки LCL можно предоставить в любом подходящем количестве, например, при отношении питающих клеток LCL к исходным Т-лимфоцитам, составляющем по меньшей мере 10:1.
[0151] В другом альтернативном варианте реализации способ выращивания или размножения возможно дополнительно включает добавление в культуральную среду антитела к CD3 и/или к CD28 (например, при концентрации по меньшей мере 0,5 нг/мл). В другом альтернативном варианте реализации указанный способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, возможно дополнительно включает добавление в культуральную среду IL-2, IL-15 и/или IL-21 (например, где концентрация IL-2 составляет по меньшей мере 10 единиц/мл). В другом альтернативном варианте реализации способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, возможно дополнительно включает добавление в культуральную среду IL-7, IL-15 и/или IL-21 (например, где концентрация IL-2 составляет по меньшей мере 10 единиц/мл). После выделения Т-лимфоцитов как цитотоксические, так и хелперные Т-лимфоциты возможно подвергают сортировке с получением субпопуляций непримированных Т-клеток, Т-клеток памяти и эффекторных Т-клеток, либо до, либо после выращивания.
[0152] CD8+ клетки также возможно получают, применяя стандартные способы. В некоторых альтернативных аспектах CD8+ клетки подвергают дополнительной сортировке с получением непримированных, центральных клеток памяти и эффекторных клеток памяти путем идентификации антигенов на поверхности клетки, которые связаны с каждым из данных типов CD8+ клеток. В некоторых альтернативных аспектах Т-клетки памяти присутствуют в обеих субпопуляциях CD62L+ и CD62L-CD8+ лимфоцитов периферической крови. МКПК сортируют с получением фракций CD62L-CD8+ и CD62L+CD8+ после окрашивания антителами к CD8 и к CD62L. В некоторых альтернативных аспектах экспрессируемые на центральных Т-клетках памяти (TCM) фенотипические маркеры включают CD45RO, CD62L, CCR7, CD28, CD3 и/или CD127, и/или они отрицательны по гранзиму В и/или CD45RA или проявляют низкую экспрессию последних. В некоторых альтернативных аспектах центральные Т-клетки памяти представляют собой CD28+, CD27+, CD45RO+, CD62L+ и/или CD8+ Т-клетки. В некоторых альтернативных аспектах непримированные CD8+ Т-лимфоциты отличаются экспрессией фенотипических маркеров непримированных Т-клеток, включая CD62L, CCR7, CD27, CD28, CD3, CD127 и/или CD45RA.
[0153] Является ли клетка или популяция клеток положительной по конкретному маркеру или экспрессирует ли его на клеточной поверхности, можно определить с помощью проточной цитометрии, применяя определенное антитело, которое специфично к поверхностному маркеру, и изотипически сходное контрольное антитело. Популяция клеток, отрицательная по маркеру, относится к популяции клеток, которая не связывается со специфическим антителом на существенном уровне, превышающем уровень для изотипического контроля, что указывает на отсутствие экспрессии указанного маркера; положительная по маркеру популяция относится к популяции клеток, которая равномерно связывается с антителом на уровне, превышающем уровень для изотипического контроля, что указывает на экспрессию указанного маркера. В некоторых альтернативных аспектах снижение уровня экспрессии одного из маркеров относится к утрате 1 log 10 от средней интенсивности флуоресценции и/или к уменьшению процента клеток, на которых представлен маркер, на по меньшей мере 20% клеток, 25% клеток, 30% клеток, 35% клеток, 40% клеток, 45% клеток, 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клетки, 95% клеток или 100% клеток, или на любой % в пределах диапазона %, ограниченного любыми двумя из данных значений, по сравнению с исходной популяцией клеток. В некоторых альтернативных аспектах популяция клеток, положительная по одному из маркеров, относится к проценту клеток, на которых представлен маркер, составляющему по меньшей мере 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клетки, 95% клеток или 100% клеток, или любой % в пределах диапазона %, ограниченного любыми двумя из данных значений, по сравнению с исходной популяцией клеток.
[0154] CD4+ Т-хелперные клетки сортируют с получением непримированных клеток, центральных клеток памяти и эффекторных клеток путем идентификации популяций клеток, которые содержат антигены на своей поверхности. CD4+ лимфоциты можно получить с помощью стандартных способов. В некоторых альтернативных аспектах непримированные CD4+ Т-лимфоциты представляют собой CD45RO-, CD45RA+, CD62L+, CD27+, CD28+ и/или CD4+ Т-клетки. В некоторых альтернативных аспектах CD4+ центральные клетки памяти представляют собой CD62L+ и/или CD45RO+. В некоторых альтернативных аспектах CD4+ эффекторные клетки представляют собой CD62L- и/или CD45RO-. В некоторых альтернативных аспектах CD4+ эффекторные клетки представляют собой CD28+, CD27+ и/или CD62L+.
[0155] В некоторых альтернативных аспектах популяции CD4+ и CD8+, которые специфичны к антигену, можно получить путем стимуляции антигеном непримированных или антиген-специфичных Т-лимфоцитов. Например, можно получить линии антиген-специфичных Т-клеток или клонов к антигенам цитомегаловируса путем выделения Т-клеток из инфицированных субъектов и стимуляции указанных клеток in vitro тем же самым антигеном. Также можно использовать непримированные Т-клетки. В качестве мишеней для Т-клеточных ответов можно использовать любое количество антигенов из опухолевых клеток. В некоторых альтернативных аспектах композиции для адоптивной клеточной иммунотерапии полезны для лечения заболевания или расстройства, включая солидную опухоль, гематологическое злокачественное новообразование, рак молочной железы или меланому.
Модификация популяций Т-лимфоцитов
[0156] В некоторых альтернативных вариантах реализации может потребоваться внедрить функциональные гены в Т-клетки, чтобы использовать последние для иммунотерапии в соответствии с настоящим описанием. Например, внедренный ген или гены возможно улучшают эффективность терапии путем поддержания жизнеспособности и/или функционирования перенесенных Т-клеток; или они возможно привносят генетический маркер, чтобы позволить селекцию и/или оценку выживаемости или миграции in vivo; или они возможно привносят функции, которые улучшают безопасность иммунотерапии, например, делая клетку чувствительной к отрицательной селекции in vivo, как описано в Lupton S.D. и др., Mol. and Cell Biol., 11:6 (1991); и Riddell и др., Human Gene Therapy 3:319-338 (1992); см. также следующие публикации PCT/US91/08442 и PCT/US94/05601, Lupton и др., в которых описано применение бифункциональных селектируемых слитых генов, полученных путем слияния доминирующего маркера положительной селекции с маркером отрицательной селекции, описания обоих документов настоящим явно полностью включены посредством ссылки. Это можно осуществить в соответствии с известными методиками (см., например, патент США номер 6040177, Riddell и др., колонки 14-17, описание которого настоящим явно полностью включено посредством ссылки) или их вариантами, которые будут очевидны специалистам в данной области техники, исходя из настоящего описания. В некоторых альтернативных аспектах Т-клетки представляют собой предшественников Т-клеток. В некоторых альтернативных аспектах предшественники Т-клеток представляют собой гематопоэтические стволовые клетки (ГСК).
[0157] В некоторых альтернативных аспектах Т-клетки модифицируют химерными рецепторами, описанными в данной заявке. В некоторых альтернативных аспектах указанные Т-клетки получают из субъекта, которого лечат, в других альтернативных аспектах лимфоциты получают из аллогенных доноров-людей, предпочтительно из здоровых доноров-людей. В некоторых альтернативных аспектах Т-клетки представляют собой предшественников Т-клеток. В некоторых альтернативных аспектах предшественники Т-клеток представляют собой гематопоэтические стволовые клетки (ГСК).
[0158] В некоторых альтернативных аспектах химерные рецепторы содержат лиганд-связывающий домен, который специфично связывается с молекулой на поверхности клетки, полипептидный спейсерный участок, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке. В некоторых альтернативных аспектах лиганд-связывающий домен представляет собой одноцепочечный фрагмент антитела (scFv), который получают из вариабельной области тяжелой (VH) цепи и вариабельной области легкой (VL) цепи моноклонального антитела (МАТ). Костимулирующие сигналы также можно передавать через химерный рецептор путем слияния костимулирующего домена CD28 и/иди 4-1ВВ с цепью CD3ζ. Химерные рецепторы специфичны к молекулам на поверхности клетки независимо от HLA, таким образом, они преодолевают ограничения распознавания TCR, включая HLA-рестрикцию и низкие уровни экспрессии HLA на опухолевых клетках.
[0159] В некоторых альтернативных аспектах одинаковые или отличные химерные рецепторы можно внедрить в каждую из популяций CD4+ и CD8+ Т-лимфоцитов. В некоторых альтернативных аспектах химерный рецептор в каждой из данных популяций содержит лиганд-связывающий домен, который специфично связывается с одним и тем же лигандом на клетке. Элементы передачи сигналов в клетке могут отличаться. В некоторых альтернативных аспектах внутриклеточный сигнальный домен CD8+ цитотоксических Т-клеток такой же, как и внутриклеточный сигнальный домен CD4+ хелперных Т-клеток. В других альтернативных аспектах внутриклеточный сигнальный домен CD8+ цитотоксических Т-клеток отличается от внутриклеточного сигнального домена CD4+ хелперных Т-клеток. В некоторых альтернативных аспектах CAR против CD19 внедряют в одну популяцию лимфоцитов и специфичный к EGFR CAR внедряют в другую популяцию лимфоцитов.
[0160] В некоторых альтернативных вариантах реализации каждую из популяций CD4 или CD8 Т-лимфоцитов сортируют с получением непримированных клеток, центральных клеток памяти, эффекторных клеток памяти или эффекторных клеток перед трансдукцией, как описано в данной заявке. В некоторых альтернативных аспектах каждую из популяций CD4 или CD8 Т-лимфоцитов сортируют с получением непримированных клеток, центральных клеток памяти, эффекторных клеток памяти или эффекторных клеток после трансдукции.
[0161] Были разработаны различные методики трансдукции, в которых для доставки генов используют рекомбинантные инфекционные вирусные частицы. На сегодняшний день это предпочтительный способ трансдукции Т-лимфоцитов, описанный в данной заявке. Вирусные векторы, которые использовались таким образом, включают вирусные векторы, полученные из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивирусных векторов и ретровирусов. Таким образом, способы переноса и экспрессии генов многочисленны, но по существу их функция состоит во внедрении и экспрессии генетического материала в клетках млекопитающих. Несколько из описанных выше методик использовали для трансдукции гематопоэтических или лимфоидных клеток, включая трансфекцию с использованием фосфата кальция, слияние протопластов, электропорацию и инфекцию рекомбинантным аденовирусным вектором, аденоассоциированным вирусным вектором и ретровирусным вектором. Первичные Т-лимфоциты успешно трансдуцировали путем электропорации и путем ретровирусной или лентивирусной инфекции.
[0162] Векторы на основе ретровирусов и лентивирусов позволяют с высокой эффективностью переносить гены в эукариотические клетки. Более того, встраивание ретровируса или лентивируса происходит контролируемым образом и приводит к стабильному встраиванию одной или нескольких копий новой генетической информации на клетку.
[0163] В некоторых альтернативных вариантах реализации возможно будет полезно внедрить в Т-клетки положительный маркер, который позволит отделить клетки от клеток с отрицательным фенотипом in vitro. Указанный маркер положительной селекции возможно представляет собой ген, который при введении в клетку-хозяина экспрессирует доминирующий фенотип, позволяя положительную селекцию клеток, несущих указанный ген. Гены такого типа известны в данной области техники и включают, среди прочего, ген фосфотрансферазы гигромицина-В (hph), который придает устойчивость к гигромицину В, ген фосфотрансферазы аминогликозида (neo или aph) из Tn5, который кодирует устойчивость к антибиотику G418, ген дигидрофолатредуктазы (DHFR), ген аденозиндезаминазы (ADA) и ген множественной лекарственной устойчивости (MDR). В некоторых альтернативных аспектах положительный маркер представляет собой укороченный белок EGFR для селекции клеток.
[0164] Для трансдукции Т-лимфоцитов можно применять различные способы, хорошо известные в данной области техники. В некоторых альтернативных аспектах трансдукцию осуществляют, применяя векторы на основе лентивируса. В некоторых альтернативных аспектах каждую из CD4+ и CD8+ клеток можно отдельно модифицировать вектором экспрессии, кодирующим химерный рецептор, с получением определенных популяций. В некоторых альтернативных аспектах данные клетки затем дополнительно подвергают сортировке с получением субпопуляций непримированных клеток, центральных клеток памяти и эффекторных клеток, как описано выше, путем сортировки по антигенам на поверхности клетки, уникальным для каждой из данных популяций клеток.
[0165] В некоторых альтернативных аспектах выбирают CD4+ и CD8+ клетки, которые пролиферируют в ответ на антиген или опухолевые мишени. Например, выбирают CD4+ клетки, которые интенсивно пролиферируют при стимуляции антигеном или опухолевыми мишенями по сравнению с трансдуцированными ложной конструкцией клетками, или трансдуцированные CD8+ клетки. В некоторых альтернативных аспектах выбирают CD4+ и CD8+ клетки, которые цитотоксичны для несущих антиген клеток. В некоторых альтернативных аспектах ожидают, что CD4+ слабо цитотоксичны по сравнению с CD8+ клетками.
[0166] В другом альтернативном варианте реализации выбирают трансдуцированные лимфоциты, такие как CD8+ центральные клетки памяти, которые обеспечивают уничтожение клеток in vivo при использовании модели на животных, созданной для конкретного типа рака. Такие модели на животных известны специалистам в данной области техники и не включают использование людей. В данной заявке описано, что не все конструкции, содержащие химерный рецептор, при их трансдукции в лимфоциты придают последним способность уничтожать опухолевые клетки in vivo, несмотря на способность становиться активированными и уничтожать клетки in vitro.
[0167] В настоящем описании предполагается, что в композициях будут использоваться комбинации CD4+ и CD8+ Т-клеток. В одном альтернативном варианте реализации трансдуцированные химерным рецептором CD4+ клетки возможно комбинируют с трансдуцированными химерным рецептором CD8+ клетками со специфичностью к такому же лиганду или комбинируют с CD8+ Т-клетками, которые специфичны к отличному опухолевому лиганду. В других альтернативных вариантах реализации трансдуцированные химерным рецептором CD8+ клетки комбинируют с трансдуцированными химерным рецептором CD4+ клетками, специфичными к отличному лиганду, экспрессируемому на опухоли. В еще одном альтернативном варианте реализации комбинируют модифицированные химерным рецептором CD4+ и CD8+ клетки. В некоторых альтернативных вариантах реализации CD8+ и CD4+ клетки возможно комбинируют в различных соотношениях, например, при соотношении CD8+ и CD4+ 1:1, соотношении CD8+ и CD4+ 10:1 или соотношении CD8+ и CD4+ 100:1, или при любом другом соотношении в пределах диапазона, ограниченного любыми двумя из упомянутых выше значений соотношений. В некоторых альтернативных аспектах исследуют пролиферацию клеток in vitro и/или in vivo в комбинированной популяции, и выбирают соотношение клеток, которое позволяет пролиферацию клеток.
[0168] Как описано данной заявке, согласно настоящему описанию предложено, что CD4+ и CD8+ клетки можно дополнительно разделить на субпопуляции, такие как популяции непримированных клеток, центральных клеток памяти и эффекторных клеток памяти. В данной заявке описано, что в некоторых альтернативных аспектах непримированные CD4+ клетки представляют собой CD45RO-, CD45RA+, CD62L+, CD28+, CD27+ и/или CD4+ положительные Т-клетки. В некоторых альтернативных аспектах центральные клетки памяти CD4+ представляют собой CD62L-положительные и/или CD45RO-положительные клетки. В некоторых альтернативных аспектах эффекторные CD4+ клетки представляют собой CD62L-отрицательные и/или CD45RO-положительные клетки. Каждую из данных популяций можно независимо модифицировать химерным рецептором. В некоторых альтернативных аспектах центральные клетки памяти CD4+ представляют собой CD62L+, CD28+ и/или CD27+ клетки.
[0169] После трансдукции и/или селекции клеток, несущих химерный рецептор, популяции клеток предпочтительно выращивают in vitro до получения количества клеток, достаточного для проведения по меньшей мере одной инфузии человеку, обычно приблизительно от 104 клеток/кг до 109 клеток/кг. В некоторых альтернативных аспектах трансдуцированные клетки культивируют в присутствии клеток, несущих антиген, антитела к CD3, антитела к CD28, IL-2, IL-7, IL-15 и/или IL-21, и/или комбинаций перечисленных. В некоторых альтернативных аспектах Т-клетки стимулируют в присутствии подложки, с которой связаны антитела, такой как гранула или частица. В некоторых альтернативных аспектах Т-клетки стимулируют антителами, связанными с подложкой, при этом подложка, с которой связаны антитела, содержит антитела к TCR, к CD2, к CD3, к CD4 и/или к CD28. В некоторых альтернативных аспектах Т-клетки стимулируют антителами, связанными с подложкой, при этом подложка, с которой связаны антитела, содержит антитела к CD3 и/или к CD28.
[0170] Каждую из субпопуляций CD4+ и CD8+ клеток возможно комбинируют друг с другом. В конкретном альтернативном варианте реализации модифицированные непримированные клетки или центральные CD4+ клетки памяти комбинируют с модифицированными центральными CD8+ Т-клетками памяти, чтобы вызвать синергичное цитотоксическое действие на клетки, несущие антиген, такие как В-клетка, содержащая на поверхности CD19.
Композиции
[0171] В настоящем описании предложена композиция для адоптивной клеточной иммунотерапии, содержащая препарат генетически модифицированных Т-лимфоцитов, описанных в данной заявке.
[0172] В некоторых альтернативных аспектах препарат Т-лимфоцитов содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный вариабельный домен антитела, специфичный к лиганду, связанному с указанным заболеванием или расстройством, спейсерный участок с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен Т-клеточного рецептора или других рецепторов, описанных в данной заявке. В других альтернативных аспектах композиция для адоптивной клеточной иммунотерапии дополнительно содержит препарат модифицированных химерным рецептором специфичных к опухоли CD8+ цитотоксических Т-лимфоцитов, которые вызывают клеточный иммунный ответ, где указанный препарат цитотоксических Т-лимфоцитов содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный домен одноцепочечного антитела, специфичного к лиганду, связанному с указанным заболеванием или расстройством, спейсерный участок с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен Т-клеточного рецептора, описанный в данной заявке.
[0173] В некоторых альтернативных аспектах композиция для адоптивной клеточной иммунотерапии содержит препарат модифицированных химерным рецептором специфичных к опухоли CD8+ цитотоксических Т-лимфоцитов, которые вызывают клеточный иммунный ответ, где указанный препарат цитотоксических Т-лимфоцитов содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный домен одноцепочечного антитела, специфичного к лиганду, связанному с указанным заболеванием или расстройством, спейсерный участок с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен Т-клеточного рецептора, в комбинации с антиген-реактивной модифицированной химерным рецептором непримированной CD4+ Т-хелперной клеткой, полученной из CD45RO- CD62L+ и/или CD4+ Т-клеток, и фармацевтически приемлемый носитель.
[0174] В других альтернативных аспектах композиция для адоптивной клеточной иммунотерапии содержит специфичный к антигену препарат CD8+ цитотоксических Т-лимфоцитов, который вызывает клеточный иммунный ответ, возникающий у пациента, в комбинации с антиген-реактивной модифицированной химерным рецептором непримированной CD4+ Т-хелперной клеткой, которая повышает иммунный ответ CD8+ Т-клеток, где препарат хелперных Т-лимфоцитов содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный вариабельный домен антитела, специфичного к антигену, связанному с заболеванием или расстройством, спейсерный участок с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен Т-клеточного рецептора.
[0175] В дополнительном альтернативном аспекте композиция для адоптивной клеточной иммунотерапии содержит антиген-реактивную модифицированную химерным рецептором непримированную CD4+ Т-хелперную клетку, которая повышает иммунный ответ CD8+ Т-клеток, где препарат хелперных Т-лимфоцитов содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий внеклеточный вариабельный домен антитела, специфичный к лиганду, связанному с заболеванием или расстройством, спейсерный участок с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен Т-клеточного рецептора.
[0176] В некоторых альтернативных аспектах CD4+ Т-хелперный лимфоцит выбран из группы, состоящей из непримированных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных популяций CD4+ Т-клеток. В некоторых альтернативных аспектах CD4+ хелперный лимфоцит представляет собой непримированную CD4+ Т-клетку, при этом указанная непримированная CD4+ Т-клетка включает CD45RO-, CD45RA+, CD62L+ CD28+, CD27+ и/или CD4+ Т-клетку. В некоторых альтернативных аспектах CD8+ цитотоксический Т-лимфоцит выбран из группы, состоящей из непримированных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных популяций CD8+ Т-клеток. В некоторых альтернативных аспектах цитотоксический CD8+ Т-лимфоцит представляет собой центральную Т-клетку памяти, при этом указанная центральная Т-клетка памяти включает CD45RO+, CD62L+, CD27+, CD28+ и/или CD8+ Т-клетку. В других альтернативных аспектах цитотоксический CD8+ Т-лимфоцит представляет собой центральную Т-клетку памяти и хелперный CD4+ Т-лимфоцит представляет собой непримированную CD4+ Т-клетку или центральную CD4+ Т-клетку памяти.
[0177] В настоящем описании предложены способы получения композиций для адоптивной иммунотерапии и применения или способы применения данных композиций для проведения клеточной иммунотерапии у субъекта, страдающего заболеванием или расстройством. Пролиферацию и длительное присутствие модифицированных химерным рецептором Т-клеток можно определить, используя модель указанного заболевания или расстройства у животных, путем введения клеток и определения длительного присутствия и/или пролиферативного потенциала перенесенных клеток. В других альтернативных аспектах, пролиферацию и активацию можно исследовать in vitro, осуществив несколько циклов активации клетками, несущими антиген.
[0178] В некоторых альтернативных аспектах способ производства указанных композиций включает получение модифицированной непримированной CD4+ Т-хелперной клетки, при этом препарат модифицированных хелперных Т-лимфоцитов содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий лиганд-связывающий домен, специфичный к молекуле на поверхности опухолевой клетки, спейсерный домен с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке.
[0179] В другом альтернативном варианте реализации способ дополнительно включает получение модифицированной цитотоксической CD8+ Т-клетки, при этом препарат модифицированных цитотоксических Т-лимфоцитов содержит CD8+ клетки, которые содержат химерный рецептор, содержащий лиганд-связывающий домен, специфичный к молекуле на поверхности опухолевой клетки, спейсерный домен с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке.
[0180] В другом альтернативном варианте реализации способ включает получение модифицированной цитотоксической CD8+ Т-клетки, при этом препарат модифицированных цитотоксических Т-лимфоцитов содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий лиганд-связывающий домен, специфичный к молекуле на поверхности опухолевой клетки, спейсерный домен с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке, и дополнительно включает комбинирование модифицированных цитотоксических CD8+ Т-клеток с препаратом хелперных CD4+ лимфоцитов.
[0181] Получение CD4+ и CD8+ клеток, которые модифицированы химерным рецептором, было описано выше, а также в примерах. Специфичные к антигену Т-лимфоциты можно получить из пациента, страдающего указанным заболеванием или расстройством, или можно получить путем стимуляции Т-лимфоцитов in vitro в присутствии антигена. Субпопуляции CD4+ и CD8+ Т-лимфоцитов, которые не прошли селекцию по специфичности к антигену, также можно выделить, как описано в данной заявке, и комбинировать в способах получения. В некоторых альтернативных аспектах в комбинации популяций клеток можно оценить однородность маркеров на поверхности клеток, способность пролиферировать на протяжении по меньшей мере двух поколений, однородность статуса дифференцировки клеток. Можно провести контроль качества путем совместного культивирования линии клеток, экспрессирующей целевой лиганд, с модифицированными химерным рецептором Т-клетками, чтобы определить, распознают ли модифицированные химерным рецептором Т-клетки данную линию клеток, применяя анализы цитотоксичности, пролиферации или продукции цитокинов, которые известны в данной области техники. Статус дифференцировки клеток и маркеры клеточной поверхности на модифицированных химерным рецептором Т-клетках можно определить с помощью проточной цитометрии. В некоторых альтернативных аспектах статус дифференцировки клеток и указанные маркеры на CD8+клетках включают CD3, CD8, CD62L, CD28, CD27, CD69, CD25, PD-1, CTLA-4, CD45RO и/или CD45RA. В некоторых альтернативных аспектах статус дифференцировки клеток и указанные маркеры на CD4+ клетках включают CD3, CD4, CD62L, CD28, CD27, CD69, CD25, PD-1, CTLA-4 CD45RO и/или CD45RA. В некоторых альтернативных аспектах указанные маркеры включают CD45RA, CD45RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанные маркеры включают CD27, CD28 и/или CD62L.
[0182] В некоторых альтернативных аспектах предложены подходы к лечению, ингибированию или облегчению заболевания, такого как рак, такой как ОЛЛ, у нуждающегося в этом субъекта, включая способы ингибирования или задержки прогрессирования и/или метастазирования рака, способы ингибирования или уменьшения количества присутствующих опухолевых или раковых клеток и/или способы ингибирования или уменьшения целевой популяции экспрессирующих CD19 клеток у нуждающегося в этом пациента. Такие способы включают введение субъекту или нуждающемуся в этом пациенту препарата генетически модифицированных цитотоксических Т-лимфоцитов, которые вызывают клеточный иммунный ответ, где указанный препарат цитотоксических Т-лимфоцитов содержит CD8+ Т-клетки, которые содержат химерный рецептор, полинуклеотид которого содержит полинуклеотид, кодирующий лиганд-связывающий домен, где лиганд представляет собой специфический для опухоли антиген или любую другую молекулу, экспрессированную на целевой популяции клеток (например, CD19), которая подходит для опосредования распознавания и элиминирования лимфоцитом; полинуклеотид, кодирующий полипептидный спейсер, при этом длину указанного полипептидного спейсера можно адаптировать под конкретные требования, и при этом указанный спейсер обеспечивает повышенный уровень пролиферации Т-клеток и/или продукции цитокинов по сравнению с исходным химерным рецептором; полинуклеотид, кодирующий трансмембранный домен; и полинуклеотид, кодирующий один или более внутриклеточных сигнальных доменов.
[0183] В настоящем описании также предложены способы проведения клеточной иммунотерапии у субъекта, страдающего заболеванием или расстройством, таким как рак, такой как ОЛЛ, включающие введение композиции лимфоцитов, экспрессирующих химерный рецептор, описанный в данной заявке. В других альтернативных аспектах способ включает введение указанному субъекту препарата генетически модифицированных цитотоксических Т-лимфоцитов, которые вызывают клеточный иммунный ответ, где указанный препарат цитотоксических Т-лимфоцитов содержит CD8+ Т-клетки, которые содержат химерный рецептор, содержащий лиганд-связывающий домен, специфичный к молекуле на поверхности клетки, спейсерный домен с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке, и препарата генетически модифицированных хелперных Т-лимфоцитов, которые вызывают непосредственное распознавание и повышают способность препаратов генетически модифицированных цитотоксических Т-лимфоцитов опосредовать клеточный иммунный ответ, при этом указанный препарат хелперных Т-лимфоцитов содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий лиганд-связывающий домен, специфичный к молекуле на поверхности клетки, спейсерный домен с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке.
[0184] Без ограничения объема настоящего описания полагают, что селекция перед введением популяции модифицированных химерным рецептором Т-клеток, которые могут длительно сохраняться и пролиферировать in vivo, может позволить применение более низкой дозы Т-клеток и обеспечить более однородную терапевтическую активность. В некоторых альтернативных аспектах дозу Т-клеток можно уменьшить по меньшей мере на 10%, 20% или 30%, или больше. Уменьшение дозы Т-клеток может быть полезно для снижения риска синдрома распада опухоли и цитокиновой бури.
[0185] В другом альтернативном варианте реализации способ проведения клеточной иммунотерапии субъекта, страдающего заболеванием или расстройством, включает: введение указанному субъекту препарата генетически модифицированных хелперных Т-лимфоцитов, при этом указанный препарат модифицированных хелперных Т-лимфоцитов содержит CD4+ Т-клетки, которые содержат химерный рецептор, содержащий лиганд-связывающий домен, специфичный к молекуле на поверхности опухолевой клетки, спейсерный домен с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке. В некоторых альтернативных аспектах указанный способ дополнительно включает введение указанному субъекту препарата генетически модифицированных цитотоксических Т-лимфоцитов, при этом указанный препарат модифицированных цитотоксических Т-лимфоцитов содержит CD4+ клетки, которые содержат химерный рецептор, содержащий лиганд-связывающий домен, специфичный к молекуле на поверхности опухолевой клетки, спейсерный домен с возможностью адаптации под конкретные требования, трансмембранный домен и внутриклеточный сигнальный домен, описанные в данной заявке.
[0186] В другом альтернативном варианте реализации описан способ проведения клеточной иммунотерапии субъекта, страдающего заболеванием или расстройством, включающий: анализ присутствия в биологическом образце из субъекта целевой молекулы (например, CD19), связанной с заболеванием или расстройством, и введение указанных композиций для адоптивной иммунотерапии, описанных в данной заявке, при этом указанный химерный рецептор специфично связывается с целевой молекулой (CD19).
[0187] В некоторых альтернативных аспектах CD4+ Т-хелперный лимфоцит перед внедрением химерного рецептора выбирают из группы, состоящей из непримированных CD4+ Т-клеток, центральных CD4+ Т-клеток памяти, эффекторных CD4+ Т-клеток памяти и смешанных CD4+ Т-клеток. В конкретном альтернативном варианте реализации CD4+ хелперный лимфоцит представляет собой непримированную CD4+ Т-клетку, где указанная непримированная CD4+ Т-клетка включает CD45RO-, CD45RA+, CD28+, CD27+, CD62L+ и/или CD4+ Т-клетку. В других альтернативных аспектах CD8+ цитотоксический Т-лимфоцит перед внедрением химерного рецептора выбирают из группы, состоящей из непримированных CD8+ Т-клеток, центральных CD8+ Т-клеток памяти, эффекторных CD8+ Т-клеток памяти и смешанных популяций CD8+ Т-клеток. В конкретном альтернативном варианте реализации цитотоксический CD8+ Т-лимфоцит представляет собой центральную Т-клетку памяти, при этом указанная центральная Т-клетка памяти включает CD45RO+, CD62L+, CD28+, CD28+ и/или CD8+ Т-клетку. В конкретном альтернативном варианте реализации цитотоксический CD8+ Т-лимфоцит представляет собой центральную Т-клетку памяти и CD4+ хелперный Т-лимфоцит представляет собой непримированную CD4+ Т-клетку.
[0188] В некоторых альтернативных аспектах как CD8+ Т-клетка, так и CD4+ Т-клетка генетически модифицированы химерным рецептором, содержащим домен тяжелой цепи антитела, который специфично связывается с молекулой на поверхности клетки. В других альтернативных аспектах внутриклеточный сигнальный домен CD8+ цитотоксических Т-клеток такой же, как и внутриклеточный сигнальный домен CD4+ хелперных Т-клеток. В других альтернативных аспектах внутриклеточный сигнальный домен CD8+ цитотоксических Т-клеток отличается от внутриклеточного сигнального домена CD4+ хелперных Т-клеток.
[0189] Субъекты, которым можно вводить композиции согласно альтернативным вариантам реализации, описанным в данной заявке, включают людей, других приматов, таких как обезьяны и человекообразные обезьяны, домашние животные, такие как собаки, коты и лошади, и сельскохозяйственные животные, такие как свиньи, козы, овцы и крупный рогатый скот. Субъекты могут представлять собой мужчину или женщину и могут быть любого подходящего возраста, включая младенцев, детей, подростков, взрослых и пожилых субъектов. Указанные способы полезны для лечения, например, несущего CD19 рака или несущих CD19 клеток.
[0190] Клетки, полученные как описано выше, можно применять в способах и композициях для адоптивной иммунотерапии в соответствии с известными методиками, или в вариантах указанных способов, которые должны быть очевидны специалистам в данной области техники исходя из настоящего описания.
[0191] В некоторых альтернативных аспектах клетки включают в состав лекарственной формы путем сначала их сбора из культуральной среды, а затем промывки и концентрирования клеток в среде и контейнерной системе, подходящей для введения ("фармацевтически приемлемый" носитель), в эффективном для лечения количестве. Подходящая среда для инфузии может представлять собой любую изотоническую среду, обычно нормальный солевой раствор, Нормосол R (Abbott) или Плазма-лит A (Baxter), но также можно применять 5% декстрозу в воде или лактат Рингера. Среду для инфузии можно дополнить эмбриональной телячьей сывороткой. Клетки затем обрабатывают цитокинами для получения трансдуцированной и стимулированной цитокином популяции CD8+ Т-клеток и/или CD4+ Т-клеток с повышенной или улучшенной способностью к приживлению по сравнению с не стимулированными цитокином популяциями CD8+ Т-клеток и/или CD4+ Т-клеток. Для того чтобы получить клетки с желательным улучшением способности к приживлению, цитокины желательно добавляют in vitro в процессе выращивания Т-клеток. По этой причине, отделенные CD4+ и CD8+ Т-клетки стимулируют цитокинами путем добавления цитокинов в процессе выращивания генетически модифицированных Т-клеток. В некоторых альтернативных аспектах CD4+ Т-клетки стимулируют по меньшей мере одним цитокином, при этом указанный по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. В некоторых альтернативных аспектах CD8+ Т-клетки стимулируют по меньшей мере одним цитокином, при этом указанный по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21.
[0192] Эффективное для лечения или ингибирования количество клеток в композиции составляет по меньшей мере 2 субпопуляции клеток (например, 1 субпопуляция CD8+ центральных Т-клеток памяти и 1 субпопуляция CD4+ хелперных Т-клеток) или составляет, чаще всего, более чем 102 клеток, и до 106, до и включая 108 или 109 клеток, и может быть больше, чем 1010 клеток, или представляет собой любое другое значение в диапазоне, ограниченном любыми из двух данных значений. Количество клеток будет зависеть от конечного применения, для которого предназначена композиция, от которого также будет зависеть тип клеток, содержащихся в ней. Например, если желательны клетки, которые специфичны к конкретному антигену, то популяция будет содержать более чем 70%, как правило более чем 80%, 85% и/или 90-95% таких клеток. Для применений, предложенных в данной заявке, клетки как правило находятся в объеме, составляющем литр или менее, возможно 500 миллилитров или менее, даже 250 миллилитров или 100 миллилитров или менее, или любое другое значение в пределах диапазона, ограниченного любыми двумя из данных значений. Следовательно, плотность желательных клеток обычно больше, чем 104 клеток/мл, и как правило больше, чем 107 клеток/мл, как правило составляет 108 клеток/мл или больше. Клинически значимое количество иммунных клеток можно пропорционально разделить на несколько доз для инфузии, которые суммарно равны или превышают 106, 107, 108, 109, 1010 или 1011 клеток, или любое другое количество в пределах диапазона, ограниченного любыми из данных двух значений.
[0193] В некоторых альтернативных аспектах лимфоциты согласно настоящему изобретению можно применять для того, чтобы наделить индивида иммунитетом. "Иммунитет" означает ослабление одного или более физических симптомов, связанных с ответом на инфекцию патогеном или на опухоль, на которые направлен ответ лимфоцитов. Количество клеток, которые вводят, обычно находится в диапазоне, присутствующем у нормальных индивидов с иммунитетом к патогену. Таким образом, клетки обычно вводят путем инфузии, при этом в каждой инфузии содержится количество клеток в диапазоне от 2 клеток до по меньшей мере 106-3×1010 клеток, предпочтительно количество клеток находится внутри диапазона от по меньшей мере 107 до 109 клеток. Указанные Т-клетки можно вводить путем однократной инфузии или путем нескольких инфузий в течение диапазона времени. Тем не менее, поскольку ожидается, что у различных индивидов будет различная чувствительность, то тип и количество клеток, которое вводят путем инфузии, а также количество инфузий и диапазон времени, в течение которого осуществляют несколько инфузий, определяет лечащий врач, что можно определить с помощью стандартного обследования. Получение достаточных уровней Т-лимфоцитов (включая цитотоксические Т-лимфоциты и/или хелперные Т-лимфоциты) легко достижимо при применении способа быстрого выращивания согласно настоящему изобретению, как поясняется примером в данной заявке. См., например, патент США номер 6040177, Riddell и др., колонка 17, описание которого настоящим явно полностью включено посредством ссылки.
[0194] В некоторых альтернативных аспектах композиции, описанные в данной заявке, вводят внутривенно, интраперитонеально, внутрь опухоли, в костный мозг, в лимфатический узел и/или в спинномозговую жидкость.
[0195] В некоторых альтернативных аспектах композиции, описанные в данной заявке, вводят вместе с химиотерапевтическими агентами и/или иммуносупрессорами. В альтернативном варианте реализации пациенту сначала вводят химиотерапевтический агент, который ингибирует или уничтожает другие иммунные клетки, а затем вводят композиции, описанные в данной заявке. В некоторых случаях, химиотерапии можно полностью избежать.
Введение пациентам с ОЛЛ.
[0196] Субпопуляции CD4+ и CD8+ Т-клеток выделяли иммуномагнитным способом из продуктов афереза, полученных от участника исследования. После стимуляции гранулами, содержащими антитела к CD3xCD28, линии Т-клеток трансдуцировали вектором на основе лентивируса SIN, который направляет совместную экспрессию FMC63scFv.IgG4hinge: CD28tm:4-1BB:ζ CAR, а затем подвергали селекции и отслеживали суицидную конструкцию EGFRt. Трансдуцированные клетки размножали, применяя рекомбинантные цитокины человека, до количеств, подходящих для клинического применения, в течение 10-20 дней, и в течение этого времени их подвергали иммуномагнитной селекции с отбором положительных по EGFRt клеток. Вскоре после противолимфомной химиотерапии криосохраненные CD4/EGFRt+ и CD8/EGFRt+ Т-клеточные продукты размораживали и вводили путем инфузии лежащему в постели больному таким образом, что пациенты получали EGFRt+ CD4+ и CD8+ Т-клетки в соотношении 1:1 при указанном, предусмотренном протоколом уровне дозы (1=0,5×106/кг; 2=1×106/кг; 3=5×106/кг). В некоторых альтернативных аспектах указанные обогащенные Т-клетки, экспрессирующие CD4+, приводили в контакт, например, выращивали с добавлением 5 нг/мл рекомбинантного IL-7 человека (rhIL-7) и/или 0,5 нг/мл рекомбинантного IL-15 человека (rhIL-15). В некоторых альтернативных аспектах указанные обогащенные Т-клетки, экспрессирующие CD8+, приводили в контакт, например, выращивали с добавлением 50 Ед/мл рекомбинантного IL-2 человека (rhIL-2) и/или 0,5 нг/мл рекомбинантного IL-15 человека (rhIL-15).
[0197] Все участвующие в исследовании субъекты (n=16) получали клеточные продукты, которые удовлетворяли требованиям дозирования и были осветлены для инфузии. 13 субъектов (6 мес - 3 года после ТГСК) лечили различными уровнями доз (в диапазоне 0,5×106/кг - 5×106/кг). Данные инфузии хорошо переносились, наблюдалось лишь 1 нежелательное явление (НЯ) > 2 степени (3 степень анафилаксии, связанной с ДМСО). У 12 из 13 субъектов наблюдали ответы с частотой общего ответа (ЧОО), равной 92%. У 11 из 13 субъектов наблюдали результатов компьютерной рентгенографии (КР) с отсутствием минимального остаточного заболевания (МОЗ) (85%). У субъектов с большей нагрузкой заболевания наблюдали более высокие пиковые уровни в периферической крови несущих CAR Т-клеток по сравнению с субъектами с отсутствием МОЗ в костном мозге (62,7% по сравнению с 19,6%). Наблюдали накопление с экспансией несущих CAR Т-клеток в костном мозге (n=12), периферической крови (n=12) и СМЖ. Средняя продолжительность длительного присутствия у 5 субъектов, которые утратили привитые Т-клетки, составляла 63 дня (диапазон от 42 до 150 дней).
[0198] У каждого из двенадцати отвечающих на терапию субъектов развилась некоторая степень СВЦ с характерными симптомами - жаром и гипотонией. Двум субъектам - S02 и S09 - потребовалась иммуномодулирующая терапия тяжелого СВЦ (тоцилизумабом у двоих и с добавлением дексаметазона у одного). У четырех из данных 13 пациентов развилась энцефалопатия (1 степени у 2, 3 степени у 1 и 4 степени у 1). Энцефалопатия 4 степени представляла собой ограничивающую дозу токсичность (DLT), и сопровождалась припадками и атипичными результатами магнитно-резонансной томографии МРТ, сходными с синдромом обратимой задней энцефалопатии (PRES). Результаты МРТ нормализовались к 9 неделе после терапии, но у данного субъекта, на момент последней оценки, продолжались припадки через 6 месяцев после терапии.
[0199] Показано, что инфузия прописанных уровней дозы определенной композиции CD4:CD8 CD19CAR/EGFRt+ Т-клеток/кг привела к обнадеживающим уровням МОЗ-отрицательных КР у детей и молодых взрослых пациентов с ОЛЛ, которые перенесли рецидив после ТГСК. Следовательно, можно получить донорские продукты из каждого из шестнадцати участвующих в исследовании пациентов. Ожидаемые токсичности для 13 подвергнутых оценке пациентов включали СВЦ с ~30% вероятностью поступления в отделение интенсивной терапии (ОИТ) и энцефалопатию с тяжестью внутри диапазона от легкой до тяжелой. Отсутствие МОЗ наблюдалось при всех уровнях доз, хотя ранние результаты позволили предположить более длительное присутствие указанных Т-клеток при повышении доз.
[0200] Хотя у одного пациента развилась острая РТПХ после терапии Т-клетками, предварительная оценка позволила предположить, что несущие CAR Т-клетки не являлись медиаторами данной реакции. Интересно отметить, что преднизон не влиял на длительность присутствия трансплантированных Т-клеток. По этой причине выявили более длительное присутствие клеток, у которых сохранились маркеры CD28, CD27 и CD62L, по сравнению с клетками, которые не обрабатывали определенными смесями цитокинов и у которых отсутствовали маркеры способности к приживлению, которые представляют собой Т-клетки, используемые для современного способа лечения.
[0201] На фигуре 18 показана блок-схема, на которой изображена история разработки процесса, применяемого для производства генетически модифицированных Т-клеток, содержащих химерный антигенный рецептор. Указано, что в современной процедуре производства не используют обработку фиколлом, тогда как первоначальные экспериментальные процессы включали этап обработки фиколлом. Также исследовали первоначальные вариации концентраций клеток, как показано на блок-схеме на фигуре 19. Клетки также выращивали в присутствии цитокинов (фигура 20).
[0202] На фигуре 20 показано, что обогащенные CD8+ Т-клетки из донорского образца PD0064: PD0063 использовали для тестирования исходной плотности клеток в емкости Т25 для инициации. Обе субпопуляции клеток (из PD0064, PD0063) исследовали при нормальных условиях культивирования PLAT-02: IL-2 (50 Ед/мл) + IL-15 (0,5 нг/мл). Клетки из донорского образца PD0080 использовали в исследовании по проверке роста клеток в день Тх путем добавления среды и цитокинов при конечной концентрации клеток до 0,7×106 клеток/мл ("ранний рост"). Под "Тх" на протяжении всего текста настоящей заявки подразумевают день +1, исходя из дня стимуляции гранулами, который обозначили как день +0. CD8+ клетки из PD0063 использовали в качестве обогащенного исходного материала. Такие же условия добавления цитокина использовали и для обогащенных PD0064:PD0063 CD8+ клеток. В данном эксперименте исследовали две плотности клеток, и для обеих показали большую жизнеспособность и рост, когда указанные клетки доводили до большего объема раньше в присутствии цитокинов. В данном контексте "довести до большего объема" относится к объему добавленной среды/цитокинов для первоначальной подпитки после Тх, который был больше при условиях "раннего роста", что приводило к пониженной плотности клеток в этот момент в культуре для условий "раннего роста".
[0203] На фигуре 21 показан рост образцов клеток PD104 и PD0116 и сравнение роста клеток при экспериментальных условиях. Обогащенные PD0104 : PD0063 CD8+ и CD4+ клетки использовали для повторения предыдущих экспериментов по проверке роста клеток в день Тх до плотности 0,7×106 клеток/мл ("ранний рост") при добавлении следующих цитокинов при соответствующих концентрациях: IL-2 (50 Ед/мл) + IL-15 (0,5 нг/мл) для CD8+ Т-клеток и IL-7 (5 нг/мл) + IL-15 (0,5 нг/мл) для CD4+ Т-клеток. Рост и жизнеспособность резко повышались. Данные кривые показывают, что именно наблюдали в клинических продуктах, а также хронометраж роста/удаления гранул/селекции/криосохранения.
[0204] Обогащенные PD0116 : PD0046 CD8+ и CD4+ клетки использовали для повторения экспериментов по проверке роста клеток в день Тх до плотности 0,7×106 клеток/мл ("ранний рост"). Нормальные условия культивирования PLAT-02: IL-2 (50 Ед/мл) + IL-15 (0,5 нг/мл) для CD8+ клеток и IL-7 (5 нг/мл) + IL-15 (0,5 нг/мл) для CD4+клеток. PD116 инициировали добавлением 180×106 клеток в контейнер V-197, и осуществляли обогащение путем магнитной сортировки и центрифужную инокуляцию в контейнере для переноса. Показано, что при данных условиях рост и жизнеспособность резко повышались. Данные кривые показывают, что именно наблюдали в клинических продуктах, а также хронометраж роста, удаления гранул, селекции и криосохранения Т-клеток.
[0205] Обогащенные PD0116 : PD0046 CD8+ и CD4+ клетки также использовали для повторения эксперимента по проверке роста клеток в день Тх путем добавления среды и цитокинов до конечного объема с получением плотности 0,7×106 клеток/мл ("ранний рост"). Нормальные условия культивирования PLAT-02, при которых осуществляли добавление IL-2 (50 Ед/мл) + IL-15 (0,5 нг/мл) для CD8+ клеток и IL-7 (5 нг/мл) + IL-15 (0,5 нг/мл) для CD4+ клеток. PD116 инициировали добавлением 180×106 клеток в контейнер V-197, и осуществляли обогащение путем магнитной сортировки и центрифужную инокуляцию в контейнере для переноса. Это были полномасштабные результаты, использованные для перехода к усовершенствованному процессу производства. На фигуре 21 показано, что рост был интенсивнее для CD8+ клеток по сравнению с CD4+клетками. Цитокины, использованные для CD4+ и CD8+ клеток, и варианты использованных комбинаций цитокинов изображены на блок-схеме, показанной на фигуре 22.
[0206] Также исследовали различные условия добавления цитокинов к CD8+ и CD4+ клеткам из доноров. На фигуре 23, панели А-F, показано, что образцы из PD0047 и PD0040 исследовали с добавлением IL-2/IL-15, IL-7/IL-15, IL-2/IL-7/IL-15, стимуляция IL-2 с добавлением IL-7/IL-15, только стимуляция IL-2, стимуляция IL-2 с добавлением IL-7/IL-21 и IL-2/IL-15. Это включало инкубацию с IL-2 отдельно (стимуляцию) в течение 5 дней с последующим добавлением IL-7/IL-21, которые затем присутствовали на всем остальном протяжении культивирования, инкубацию с IL-2 отдельно (стимуляцию) в течение 5 дней с последующим добавлением IL-7/IL-21 и IL-2/IL-15, которые затем присутствовали на всем остальном протяжении культивирования. PD0040 : PD0038 CD8+ обогащенные Т-клетки использовали для тестирования различных коктейлей цитокинов. Концентрации для каждого условия были следующими: IL-2 (50 Ед/мл), IL-7 (5 нг/мл), IL-15 (0,5 нг/мл). Условие №4 состояло в стимуляции IL-2 в течение 5 дней с последующим добавлением IL-7/IL-15 на всем остальном протяжении культивирования. Кратность роста и TNC экстраполировали из мелкомасштабного эксперимента. Для используемой на данный момент комбинации IL-2/IL-15 выявили наилучшее размножение. В данном исследовании было показано, что комбинация IL-2/IL-15 приводит к наилучшему размножению.
[0207] Показано, что PD0047 : PD0038 CD8+ обогащенные клетки использовали для тестирования различных коктейлей цитокинов. Те же самые коктейли цитокинов исследовали, применяя "низкую дозу" IL-2 при конечной концентрации 10 Ед/мл. Концентрации отдельных цитокинов, используемых в различных комбинациях, составляли: IL-2 (50 Ед/мл) и (10 Ед/мл), как указано на подписи к фигуре, IL-7 (5 нг/мл), IL-15 (0,5 нг/мл), IL-21 (5 нг/мл). Условия стимуляции были следующими: стимуляция IL-2 в течение 5 дней с последующим добавлением IL-7/IL-21 на всем остальном протяжении культивирования. Кратность роста и TNC экстраполировали из мелкомасштабного эксперимента. Для комбинации IL-2/IL-15 выявили наилучшее размножение, и использовали ее для следующих экспериментов. Для "нормальной" дозы IL-2 выявили наилучший рост. На панели А показаны результаты инкубации клеток PD0047 в день 15 (Д15), а также сравнение роста в присутствии различных цитокинов и процент положительных клеток (CD3+, CD62L+, CD3+/CD62L+/CD45RO-, CD28+, CDD45RA+/CD4RO-, CD45RA+/CD45RO- и CD45RA-/CD45RO+) после инкубации в условиях различного содержания цитокинов.
[0208] На панели В показаны результаты после инкубации клеток PD0047 в день 21 (Д21), а также сравнение роста в присутствии различных цитокинов и процент положительных клеток, как указано выше. На панели С показаны PD0040 в Д21 и сравнение роста в присутствии различных цитокинов, где суммарное количество клеток проверяли после 22 дней роста в культуре. На панели D показаны PD0040 в Д21 и сравнение роста в присутствии различных цитокинов, как указано, исследовали рост CD3+ клеток после 22 дней роста в культуре. На панели Е показаны PD0047 и сравнение роста в присутствии различных цитокинов, где суммарное количество клеток проверяли после 22 дней роста в культуре. На панели F показаны PD0047 и сравнение роста в присутствии различных цитокинов, как указано, исследовали рост CD3+ клеток после 22 дней роста в культуре. Как показано для PD0040 : PD0038, CD8+ обогащенные клетки использовали для тестирования различных коктейлей цитокинов. Концентрации для каждого условия составляли: IL-2 (50 Ед/мл), IL-7 (5 нг/мл), IL-15 (0,5 нг/мл). Условие №4 представляло собой стимуляцию IL-2 в течение 5 дней с последующим добавлением IL-7/IL-15 на всем остальном протяжении культивирования. Кратность роста и TNC экстраполировали из мелкомасштабных экспериментов. Для комбинации IL-2/IL-15 выявили наилучшее размножение, и использовали ее для следующих экспериментов. Кроме того, PD0047 : PD0038 CD8+ обогащенные клетки использовали для тестирования различных коктейлей цитокинов. Те же самые коктейли цитокинов исследовали, применяя "низкую дозу" IL-2 при конечной концентрации 10 Ед/мл. Концентрации для каждого условия составляли: IL-2 (50 Ед/мл) и (10 Ед/мл), как указано на подписи к фигуре, IL-7 (5 нг/мл), IL-15 (0,5 нг/мл), IL-21 (5 нг/мл). Условия стимуляции были следующими: стимуляция IL-2 в течение 5 дней с последующим добавлением IL-7/IL-21 на всем остальном протяжении культивирования. Кратность роста и TNC затем экстраполировали из мелкомасштабных экспериментов. Для комбинации цитокинов IL-2/IL-15, используемых в описанном выше исследовании, выявили наилучшее размножение. Для "нормальной" дозы IL-2 также выявили наилучший рост. Результаты проточной цитометрии по фенотипическому росту доступны и указаны в дополнительных экспериментах в данной заявке.
[0209] На фигуре 24 показаны результаты серии экспериментов по тестированию различных комбинаций цитокинов. PD0051: CD8+ клетки из двух различных доноров использовали для тестирования "нормальных" условий содержания цитокинов, применяя IL-2 (50 Ед/мл) и IL-15 (0,5 нг/мл). Условия стимуляции были следующими: стимуляция IL-2 в течение 5 дней с последующим добавлением IL-7 (5 нг/мл), IL-21 (5 нг/мл) на всем остальном протяжении культивирования. Показанные кратность роста и TNC получены из масштабированного эксперимента, который начинался с 30×106 клеток. Для используемой на данный момент комбинации IL-2/IL-15 выявили наилучшее размножение, но размножение также наблюдали в культурах, в которые порциями добавляли IL-2, а потом заменяли его на IL-7/IL-21. Кратность размножения в условиях стимуляции была сходна с PD0047.
[0210] Для PD0055 исследовали такие же условия содержания цитокинов, как и исследованные для PD0051, но с CD4+ донорскими клетками (то же донор PD0038, как и выше). Условия содержания цитокинов для указанных экспериментов быи следующими: IL-7 (5 нг/мл) и IL-15 (0,5 нг/мл). Условия стимуляции были следующими: стимуляция IL-2 в течение 5 дней с последующим добавлением IL-7 (5 нг/мл), IL-21 (5 нг/мл), на всем остальном протяжении культивирования. Кратность роста и TNC получены из масштабированного эксперимента, который начинался с 30×106 клеток. Для используемой на данный момент комбинации IL-7/IL-15 выявили обычное размножение, тем не менее, лучшее размножение наблюдали в культурах, в которые порциями добавляли IL-2, а потом заменяли его на IL-7/IL-21. На панели А показаны PD0051 в день 15 (Д15), а также сравнение роста в присутствии различных цитокинов и процент положительных клеток у донора (EGFRt+, EGFRt+/CD4+, EGFRt+/CD8+, CD3+, CD3+/CD4+, CD3+/CD4+/CD8+, CD3+/CD8+, CD62L+, CD3+/CD8+, CD62L+, CD3+/CD28+, CD27+, CD127+, CD45RA+/CD45RO-, CD45RA+/CD45RO-/CD45RO-/CD45RA-, CD62+/CD28+), роста в присутствии цитокинов донора. На панели В показаны PD0055 в день 17 (Д17), а также сравнение роста в присутствии различных цитокинов и процент положительных клеток. На панели С показана кривая роста PD0051 и сравнение роста в присутствии различных цитокинов, при котором исследовали суммарное количество клеток после 20 дней роста в культуре. На панели D показан PD0051 и сравнение роста в присутствии различных цитокинов, как указано, рост CD3+ клеток исследовали после 20 дней роста в культуре. На панелях С и D показаны кривые роста (суммарное количество клеток и количество CD3+ клеток) для PD0051, сравнение роста после инкубации указанных клеток с указанными различными цитокинами через 20 дней культивирования. На панелях Е и F показаны кривые роста (суммарное количество клеток и CD3+ соответственно) для донора PD0055 после инкубации с различными указанными цитокинами, в указанный момент времени в день 17 роста в культуре.
[0211] На фигуре 25 показан эксперимент с тестированием цитокинов, в котором оценивали влияние различных комбинаций цитокинов на рост клеток. Для образца PD0059 проводили такой же эксперимент с тестированием цитокинов, как показано для PD0051, за исключением того, что в данном эксперименте также исследовали нового донора CD4+ и CD8+ клеток (PD0057). Проводили анализ "нормальных" условий содержания цитокинов, применяя IL-7 (5 нг/мл) и IL-15 (0,5 нг/мл) для CD4+ клеток и IL-2 (50 Ед/мл) и IL-15 (0,5 нг/мл) для CD8+клеток. Условия стимуляции были следующими: стимуляция IL-2 в течение 5 дней с последующим добавлением IL-7 (5 нг/мл), IL-21 (5 нг/мл), на всем остальном протяжении культивирования. Кратность роста и TNC получены из масштабированного эксперимента, который начинался с 30×106 клеток. "Нормальные" комбинации цитокинов в данном исследовании приводили к размножению; хорошее размножение наблюдали после стимуляции IL-2 и его замены на IL-7/IL-21.
[0212] Для PD0078 проводили исследование цитокинов, аналогичное таковому для PD0051, за исключением того, что данный эксперимент проводили с отличным донором CD4+ и CD8+ клеток (PD0063). Анализ осуществляли, используя "нормальные" условия содержания цитокинов, применяя IL-7 (5 нг/мл) и IL-15 (0,5 нг/мл) для CD4+ клеток и IL-2 (50 Ед/мл) и IL-15 (0,5 нг/мл) для CD8+ клеток, по сравнению с условием стимуляции только IL-2. Весь рост до дня 14 (Д+14) находился на нормальной плоскости, культуры затем подвергали селекции по EGFRt. Восстановление жизнеспособности и роста не наблюдали после селекции CD8+ клеток. На панели А показан процент положительных клеток после размораживания клеток. На панели В показано сравнение цитокинов PD0059 PLAT-02. На панели С показано сравнение цитокинов PD0059 PLAT-02 и рост CD3+ клеток. На панели D показаны кривые роста PD0078. На панели D показаны кривые роста PD0078 и рост CD3+ клеток.
[0213] На фигуре 26 показано две блок-схемы, на которых представлена исходная методика выращивания и усовершенствованная (или "современная") на основании экспериментирования методика выращивания клеток, которую затем использовали для будущих экспериментов.
[0214] На фигуре 27 показаны кривые роста для образцов из PD0080, PD0084 и PD0085 и сравнение между всеми тремя. Данные три эксперимента представляли собой повторные эксперименты методики "раннего роста". Для данных экспериментов использовали стандартные условия содержания цитокинов: IL-2 (50 Ед/мл) + IL-15 (0,5 нг/мл) для CD8+ Т-клеток и IL-7 (5 нг/мл) + IL-15 (0,5 нг/мл) для CD4+ Т-клеток. Для PD0080 исследовали две исходных плотности в двух повторах, применяя PD0063 CD8+ Т-клетки. Для одного из каждых повторов клеток получали объемы до ~0,7×106 клеток/мл после 3-часовой инкубации в день трансдукции. Для PD0084 две дополнительные CD8+ донорские Т-клетки оценивали по влиянию на них раннего роста. Исходные условия с 30×106 клетками использовали в качестве контроля для каждого донора, и исходную плотность клеток 60×106 использовали в качестве анализируемого условия раннего роста. Для PD0085 проводили анализ, аналогичный PD0084, за исключением того, что CD4+ Т-клетки использовали для анализа раннего роста. Опять же, исходную плотность клеток 30×106 использовали в качестве контрольного "нормального" условия и исходную плотность клеток 60×106 использовали в качестве анализируемого условия.
[0215] На фигуре 28 показано, что исходный материал PD0038 включал подвергнутые селекции CD4+ и CD8+ Т-клетки. На кривых роста показаны TNC из обеих емкостей V-197 с клетками, которые были объединены. На раннем этапе разработки решили объединить 50:50 CD4:CD8 продукт перед криосохранением. Показаны результаты проточной цитометрии после размораживания объединенного продукта. Удаление гранул и обогащение EGFRt происходило в день +14 для CD4+ и в день +15 для CD8+ Т-клеток. CD8+ Т-клетки растили в IL-2 (50 Ед/мл)/IL-15 (0,5 нг/мл) и CD4+ Т-клетки растили в IL-7 (5 нг/мл)/IL-15 (0,5 нг/мл). Данный процесс заменяли на криосохранение продуктов по-отдельности и инфузию объединенного 50:50 продукта после размораживания.
[0216] На фигуре 29 показана кривая роста для PD0046. На кривых роста показаны TNC из обеих емкостей V-197 с клетками V-197 вместе. На раннем этапе разработки собирались объединить 50:50 CD4:CD8 продукт перед криосохранением. Результаты проточной цитометрии показаны после размораживания объединенного продукта. Затем осуществляли удаление гранул и обогащение EGFRt в день +14 для CD4+ Т-клеток и в день +15 для CD8+ Т-клеток. CD8+ Т-клетки растили в IL-2 (50 Ед/мл)/IL-15 (0,5 нг/мл) и CD4+ Т-клетки растили в IL-7 (5 нг/мл)/IL-15 (0,5 нг/мл). Тем не менее немного было сделано с данным продуктом вследствие плохого размораживания донорских клеток. Клетки использовали позже для проверки замораживание с 10% НА, и оказались гораздо лучше после размораживания.
[0217] На фигуре 30 показана кривая роста для PD0063. На кривых роста показаны TNC из обеих емкостей V-197 с клетками V-197 вместе. Затем осуществляли удаление гранул и обогащение EGFRt в день +14 для CD4+ клеток и в день +15 для CD8+ клеток, как показано. CD8+ клетки растили в IL-2 (50 Ед/мл)/IL-15 (0,5 нг/мл) и CD4+ клетки растили в IL-7 (5 нг/мл)/IL-15 (0,5 нг/мл). Затем осуществляли удаление гранул и обогащение EGFRt.
[0218] На фигуре 31 показан рост клеток из смешанных культур МКПК, когда их растили в присутствии цитокинов. Показано, что CD4+ клетки (•) растили в присутствии IL-2 и IL-15. CD8+ клетки растили в присутствии IL-7 и IL-15. На нижней панели (фенотипическое сравнение) на фигурах 31А и 31В показан процент от всех клеток, экспрессирующих указанные маркеры на поверхности, после инкубации в различных условиях, каждое из которых приводило к экспрессии клетками маркеров способности к приживлению, например, CD62L, CD28, CD27, CD45RA. Выращивание обогащенных CD8+ культур в IL-2/IL-15 и обогащенных CD4+ культур в IL-7/IL-15 позволяло добиться активного роста обеих культур и сильной экспрессии фенотипа клеток памяти.
[0219] На фигуре 32 показан рост обогащенных CD8+ и CD4+ клеток в смесях цитокинов. Для образца PD0044 показано, что обогащенные CD8+ Т-клетки растили в присутствии IL-2 и IL-15 (верхняя панель). Для образца PD0044 обогащенные CD4+ Т-клетки растили в присутствии IL-7 и IL-15 в течение более 20 дней. Показано, что объединенные CD4+ и CD8+ Т-клетки экспрессируется CD3, CD4, CD8, CD62L, CD28, CD27, CD45RA и CD45RO. Также исследовали образец 14602-S14 (см. фигуру 32В). Показано, что выращивание обогащенных CD8+культур в IL-2/IL-15 и обогащенных CD4+ культур в IL-7/IL-15 позволяло добиться активного роста обеих культур и сильной экспрессии фенотипа клеток памяти. Важно отметить, что согласно полученным результатам, показанным на фигурах 31 и 32, CD4+ Т-клетки и CD8+ Т-клетки росли оптимально с различными комбинациями цитокинов, например, CD4+ Т-клетки лучше всего функционировали в данных исследованиях с IL-7 и IL-15, тогда как CD8+ Т-клетки лучше всего росли в данных исследованиях с цитокинами IL-2 и IL-15. Рост с соответствующими оптимальными комбинациями цитокинов приводил к такому фенотипу клеток после выращивания клеток, при котором клетки экспрессировали поверхностные маркеры CD45RA, CD62L, CD28, и CD27, и который свидетельствовал о том, что после адоптивного переноса у клеток будет высокая, или улучшенная, или повышенная способность к приживлению.
[0220] На фигуре 33 показаны образцы из 14602-S01 - 14602-SO6, полученные с применением исходной методики выращивания клеток PLAT-02 (фаза I и фаза II клинических испытаний). Клетки были положительны по EGFRt перед криосохранением. Исследовали жизнеспособность клеток. В таблице внизу показано, что 14602-SO3 CD8+ клетки и 14602-SO3-CD8+ клетки не экспрессировали CD3, CD62L, CD27, CD127, CD45RA/CD45RO- или CD45RA.
[0221] На фигуре 34 показаны анализы, проведенные с клеточным продуктом 14602-SO4 и 14602-SO4-02, который содержит как CD4+, так и CD8+ Т-клетки. Указанные клетки растили в культурах, применяя методику "раннего роста". Результаты проверки показали, что клетки были положительны по экспрессии EGFRt перед криосохранением.
[0222] На фигуре 35 показаны клетки из образцов 14602-SO7, 14602-SO8 и 14602-SO9. CD4+ и CD8+ клетки выращивали, применяя методику раннего роста. На верхней панели, как показано в таблице для 14602-SO7 CD4+ клеток и 14602-SO7 CD8+ клеток, показаны проценты клеток, экспрессирующих различные маркеры, включая CD3, CD62L, CD27, CD27, CD127 и CD45RA+, в различные моменты времени. На нижней панели для образца 14602-SO8 обогащенные CD4+ и CD8+ Т-клетки оставались жизнеспособными после 10 дней в культуре.
[0223] На фигуре 36 показаны клетки, жизнеспособность которых исследовали, из образцов партий 14602-S10, 14602-S11, 14602-S12 и 14602-S13. В сопроводительных таблицах показано, что все клетки экспрессировали EGFRt перед их криосохранением. Исследовали жизнеспособность клеток в культуре в течение по меньшей мере 12 дней.
[0224] На фигуре 37 показаны клетки, жизнеспособность которых исследовали, из образцов партий 14602-S14, 14602-S15 и 14602-S16. В сопроводительных таблицах показано, что все клетки экспрессировали EGFRt перед их криосохранением. Исследовали жизнеспособность клеток в культуре в течение по меньшей мере 12 дней.
[0225] На фигуре 38 показано, что клетки из образца 14602, который обогатили популяциями CD4+ и CD8+ Т-клеток, были положительны по CD3, CD62L, CD28, CD127, CD45RA+/CD45RO-, CD45RA и CD45RO. Это специфические маркеры, которые свидетельствуют о том, что как у CD4+, так и у CD8+ клеток был высокий уровень способности к приживлению после обработки специфическими для них комбинациями цитокинов.
[0226] На фигуре 39 показаны результаты для мыши после введения Т-клеток после прививки опухоли (выживаемость, прогрессирование опухоли). Показано, что по мыши, которой вводили клетки из образца PD0046, определили, что у данных клеток была повышенная, улучшенная или усиленная способность к приживлению, вследствие выживаемости мыши через 80 дней после введения, при применении множества концентраций клеток. Для образца PD00044 не выявили повышенную, улучшенную или усиленную способность к приживлению, так как процент выживаемости падал в день 40 (фигура 39В).
[0227] На фигуре 40 показан средний уровень прогрессирования опухоли у мышей, которых лечили клетками из партий клеток PD0044 и PD0046. На диаграммах показано, что прогрессирование опухоли у мышей уменьшалось, если им вводили CD8+ и CD4+ Т-клетки из партии PD0046, в которой клетки изначально растили в подходящих для CD4+ и CD8+ Т-клеток смесях цитокинов (IL-7/IL-15 для CD4+ Т-клеток и IL-2/IL-15 для CD8+ Т-клеток). Контрольные клетки, которые растили только в среде, не задерживали прогрессирование опухоли ни в одном из исследований с PD0044 и PD0046. На нижних панелях показано, что прогрессирование опухоли повышалось у мышей, которых лечили клетками из образца PD0044, и, в частности, существенно повышалось при лечении наименьшей концентрацией Т-клеток. Прогрессирование опухоли уменьшалось по сравнению с контролем средой.
[0228] В качестве дополнительного анализа исследовали три группы мышей, при этом в каждой группе содержалось всего по 5 мышей. Мышам в группе А вводили плацебо - фосфатно-солевой буферный раствор (ФБР). Для введения группе В использовали клетки из условий "нормального роста", которые представляли собой 1:1 EGFRt+ CD4:CD8, трансдуцированные Zrx-014. Использованные клетки были из группы PD0055 №1 (донор PD0038, CD4 с добавлением 5 нг/мл IL-7 и 0,5 нг/мл IL-15, S1D14 при 75,9% EGFRt+) и группы PD0051 №1 (донор PD0038, CD8 с добавлением 50 Ед/мл IL-2 и 0,5 нг/мл IL-15, S1D21 при 76,8% EGFRt+). Для введения группе С использовали клетки, которые были "стимулированы" обработкой цитокинами, которые включали 1:1 EGFRt+ CD4:CD8, трансдуцированные Zrx-014, PD0055 №2 (донор PD0038, CD4 с добавлением 50 Ед/мл IL-2, стимуляция 5 дней, затем 5 нг/мл IL-7 и 5 нг/мл IL-21, S1D11, при 81,2% EGFRt+) и PD0051 №2 (донор PD0038, CD8 с добавлением 50 Ед/мл IL-2, стимуляция 5 дней, затем 5 нг/мл IL-7 и 5 нг/мл IL-21, S1D21 при 89,5% EGFRt+).
[0229] На фигуре 42 показан FACS-анализ клеток после размораживания, которые использовали для инъекции мышам в JME13-25 (клетки PD0051 и PD00055). Показано, что оба образца клеток содержали CD8+ и CD4+ Т-клетки, которые экспрессировали EGFRt.
[0230] На фигуре 43 показаны три группы мышей А, В и С: группе А вводили плацебо ФБР, группе В вводили клетки из PD00051 ("обычное выращивание клеток") и группе С вводили клетки из PD00055 (клетки, в которые порциями добавляли комбинации цитокинов). Показано, что у мышей, которым вводили плацебо, из группы А наблюдалось прогрессирование опухоли, которое было видно невооруженным глазом в день 20. Для мышей из группы В, которым вводили клетки из PD0051 (обычное выращивание клеток), было показано, что прогрессирование опухоли у двух мышей существенно возросло. Для мышей из группы С, которым вводили клетки из PD00055, была показана лишь небольшая степень прогрессирования опухоли, что, следовательно, свидетельствует о том, что у клеток, обработанных смесью цитокинов перед применением для лечения, была повышенная способность к приживлению.
[0231] На фигуре 44 показано длительное присутствие экспрессирующих CAR Т-клеток у указанных мышей через три дня после введения. Показано, что наблюдали более длительное присутствие CD4+ Т-клеток, экспрессирующих CAR, по сравнению с клетками из условий нормального выращивания, а также с CD8+ Т-клетками.
[0232] После проведения экспериментов по изучению прогрессирования опухоли после лечения Т-клетками, экспрессирующими CAR, проводили эксперименты для выявления различий in vivo в способности к уничтожению между клетками, которые выращивали в условиях присутствия различных цитокинов in vitro при повторяющихся встречах с антигенами (фигура 45). Для данного эксперимента использовали 3 группы мышей, в каждой из которых было по 3 мыши. Мышам из группы А вводили плацебо (ФБР). Мышам из группы В вводили клетки, которые растили согласно "способу нормального выращивания" ("нормальные", 1:1 EGFRt+ CD4:CD8, трансдуцированные Zrx-014, PD0055 №1 (донор PD0038 CD4 с добавлением 5 нг/мл IL-7 и 0,5 нг/мл IL-15, S1D14, при 75,9% EGFRt+), PD0051 №1 (донор PD0038 CD8 с добавлением 50 Ед/мл IL-2 и 0,5 нг/мл IL-15, S1D21, при 76,8% EGFRt+) (фигура 18). Мышам из группы С вводили клетки, в которые в процессе выращивания порциями добавляли цитокины ("стимулированные", 1:1 EGFRt+ CD4:CD8, трансдуцированные Zrx-014, PD0055 №2 (донор PD0038 CD4 с добавлением 50 Ед/мл IL-2, стимуляция 5 дней, затем 5 нг/мл IL-7 и 5 нг/мл IL-21, S1D11, при 81,2% EGFRt+), PD0051 №2 (донор PD0038 CD8 с добавлением 50 Ед/мл IL-2, стимуляция 5 дней, затем 5 нг/мл IL-7 и 5 нг/мл IL-21, S1D21, при 89,5% EGFRt+).
[0233] На фигуре 46 показано, что мыши из группы А погибали к 20 дню после введения ФБР. У мышей из группы В, которых лечили клетками, выращенными с помощью "способа нормального выращивания", наблюдали прогрессирование опухоли у одной мыши ко дню 120. Тем не менее, среди мышей, которых лечили клетками, выращенными в присутствии цитокинов, у всех мышей отсутствовали опухоли ко дню 120. Следовательно, полученные результаты свидетельствуют о том, что для клеток, обработанных смесями цитокинов, специфичных для CD4+ и CD8+, выявили более высокий уровень приживления и повышенную выживаемость у указанных мышей. Кроме того, данные клетки более эффективно предотвращали прогрессирование опухоли.
[0234] На фигуре 47 показано, что у мышей наблюдали 100% уровень выживаемости при введении им клеток PD0051 и PD0055 после прививки опухоли. Тем не менее было показано снижение прогрессирования опухоли при лечении с применением клеток PD0055.
[0235] На фигуре 48 показан средний уровень прогрессирования опухоли, исследованный у мышей, которым вводили плацебо, Т-клетки, выращенные с помощью способов "нормального выращивания", и Т-клетки, в которые порциями добавляли комбинации цитокинов. Для данного эксперимента в день 0 мышам прививали опухоль и в день 6 проводили визуализацию опухолей. В день 7 затем вводили Т-клетки или плацебо. Прививку опухоли затем повторяли в день 14 и день 21.
[0236] У мышей исследовали прогрессирование опухоли в дни 28, 35, 49, 63, 78, 92, 105 и 120, в которые получали изображения опухолей. Для данных групп мышей показали, что прогрессирование опухоли снижалось у мышей, которым вводили клетки, в которые порциями добавляли цитокины, следовательно, указывая на то, что у клеток, в которые порциями добавляли цитокины, была повышенная, улучшенная или усиленная способность к приживлению, по сравнению с клетками, которые выращивали при нормальных условиях без добавления цитокинов.
[0237] На фигуре 49 показаны эксперименты, проведенные для того, чтобы определить, есть ли различие in vivo в способности к уничтожению между клетками, которые выращивали при тех же условиях, как и в PLAT-01 и PLAT-02, а также следуя "промежуточным" протоколам. Для данного эксперимента использовали 17 групп по 5 мышей, чтобы проверить способность указанных клеток лечить мышей после прививки опухоли. Указанным группам давали дозу клеток (1,25×106, 2,5×106, 5×106, 10×106) для каждого условия используемого продукта, как указано в таблице на фигуре 49. Клетки размораживали, подсчитывали и вводили мышам в тот же день. На фигуре 50 показаны количества CD4+ и CD8+ клеток в различных клеточных продуктах для двух способов выращивания и количества EGFRt в указанных клетках.
[0238] На фигуре 51 показано 17 групп мышей, которым прививали опухоли, а затем вводили титрованные дозы Т-клеток, которые растили с помощью способов нормального выращивания или в которые порциями добавляли комбинации цитокинов. На представленных диаграммах видно, что у мышей, которым вводили дозу клеток PLAT-1.00, при более высоких концентрациях наблюдали уменьшение прогрессирования опухоли. У мышей, которым вводили дозу клеток PLAT-2.00, также наблюдали уменьшение прогрессирования опухоли через 25 дней после введения при более высоких концентрациях клеток. Тем не менее у мышей, которым вводили клетки PLAT-1.33, наблюдали повышенное прогрессирование опухоли независимо от концентрации клеток, что свидетельствует о низкой или пониженной способности данных клеток к приживлению. У мышей, которым вводили клетки PLAT-1.67, наблюдали уменьшение прогрессирования опухоли при лечении наиболее высокой концентрацией клеток в вводимой композиции. Тем не менее на фигуре 50 отмечено, что среди клеток PLAT-1.33 также было мало EGFRt-положительных, что также может свидетельствовать о пониженном количестве CAR на поверхности клеток.
[0239] На фигуре 51 показано сравнение между клеточными продуктами PD104 и PD116. Для продукта PD0104 использовали обогащенные PD0063 CD8+ и CD4+ клетки, чтобы повторить эксперимент по проверке нарастания клеток в день Тх до плотности 0,7×106 клеток/мл ("ранний рост"). Для нормальных условий культивирования PLAT-02 использовали IL-2 (50 Ед/мл) + IL-15 (0,5 нг/мл) для CD8+ клеток и IL-7 (5 нг/мл) + IL-15 (0,5 нг/мл) для CD4+ Т-клеток. Рост и жизнеспособность резко повышались. Данные кривые показывают, что именно наблюдали в клинических продуктах, а также хронометраж роста/удаления гранул/селекции/криоконсервации.
[0240] На фигуре 52 показано, что мышей лечили титрованными дозами клеточных продуктов из PLAT-1.00, PLAT-1.33, PLAT-1.67 и PLAT-2.00. Как показано на всех диаграммах, наиболее низкая концентрация клеток была наименее эффективной для лечения прогрессирования опухоли. Тем не менее, клетки, у которых выявили наибольшую способность к приживлению, представляли собой PLAT-1.00 и PLAT-2.00 при наиболее высокой концентрации.
[0241] На фигуре 53 показано, что все клетки были наименее эффективны при концентрации 1,25×106. Показали, что клетки из PLAT-1.00 наиболее эффективно ингибировали прогрессирование опухоли, что указывает на то, что способность к приживлению у данных клеток была наилучшей, или улучшенной, или повышенной по сравнению с другими группами, и на то, что обработка цитокинами также стимулировала, улучшала или повышала способность данных клеток к приживлению. Видно, что при концентрации 5×106 прогрессирование опухоли через 25 дней остановилось, по сравнению с другими группами клеток, используемых для лечения мышей.
[0242] На фигуре 54 показано, что у мышей наблюдали более высокий уровень выживаемости, если доза вводимых клеток находилась между 2,5×106 и 10×106 клеток на дозу. Тем не менее у мышей, которым вводили клетки из продукта PLAT-1.00, наблюдали более длительную выживаемость, что указывает на то, что Т-клетки из данной группы были более устойчивыми и проявляли повышенную, улучшенную или усиленную способность к приживлению.
[0243] На фигуре 55 показано, что выживаемость мышей зависела от концентрации указанных клеток в дозе. Для всех клеток выживаемость мышей уменьшалась при лечении наименьшей дозой Т-клеток. Тем не менее ранее показали, что у мышей, которым вводили клетки из продукта PLAT-1.00, наблюдали более длительную выживаемость, что указывает на то, что Т-клетки из данной группы были более устойчивыми и проявляли улучшенную способность к приживлению.
Дополнительные альтернативные аспекты.
[0244] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает отделение, выделение или обогащение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, для того, чтобы получить выделенную популяцию Т-клеток, стимуляцию полученной популяции Т-клеток для того, чтобы получить стимулированную популяцию CD8+ Т-клеток и/или CD4+ Т-клеток, трансдукцию стимулированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток вектором, при этом указанный вектор кодирует химерный антигенный рецептор и маркерную последовательность, где указанная маркерная последовательность кодирует селектируемый маркер на поверхности клетки, для того, чтобы получить трансдуцированную популяцию CD8+ Т-клеток и/или CD4+ Т-клеток, приведение в контакт указанной трансдуцированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток с по меньшей мере одним цитокином для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток, обогащение популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток путем селекции по указанной маркерной последовательности для того, чтобы получить обогащенную популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток, и размножение обогащенной популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток в течение по меньшей мере одного дня с получением указанных генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор.
[0245] В некоторых альтернативных аспектах отделение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют путем аффинной селекции Т-клеток, содержащих эпитоп, представленный на CD8 и/или CD4. В некоторых альтернативных аспектах отделение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют с помощью проточной цитометрии. В некоторых альтернативных аспектах отделение популяции CD8+ Т-клеток и/или популяции CD4+ Т-клеток из смешанной популяции Т-клеток осуществляют с помощью иммуномагнитной селекции. В некоторых альтернативных аспектах указанные генетически модифицированные CD8+ Т-клетки и/или CD4+ Т-клетки содержат по меньшей мере один рецептор, который стимулирует способность к приживлению. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах стимуляцию выделенной популяции Т-клеток осуществляют путем приведения в контакт CD8+ и/или CD4+ Т-клеток с подложкой, с которой связаны антитела, такой как гранула или частица. В некоторых альтернативных аспектах подложка, с которой связаны антитела, содержит антитела к TCR, к CD2, к CD3, к CD4 и/или к CD28. В некоторых альтернативных аспектах подложка, с которой связаны антитела, содержит антитела к CD3 и/или к CD28. В некоторых альтернативных аспектах указанный вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемую маркерную последовательность. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных аспектах маркерная последовательность кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах по меньшей мере один цитокин включает ГМ-КСФ, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В некоторых альтернативных аспектах контакт осуществляют в течение 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или периода времени, который находится внутри диапазона, ограниченного любыми двумя из данных значений. В некоторых альтернативных аспектах указанный способ осуществляют с выделенными CD4+ клетками в отсутствие CD8+ клеток. В некоторых альтернативных аспектах указанный способ осуществляют с выделенными CD8+ клетками в отсутствие CD4+ клеток или при обогащении относительно CD4+ клеток. В некоторых альтернативных аспектах указанные Т-клетки, экспрессирующие CD4+, выращивают в течение по меньшей мере 1 дня и возможно выращивают в течение 20 дней, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени. В некоторых альтернативных аспектах указанные Т-клетки, экспрессирующие CD8+, выращивают в течение по меньшей мере 1 дня и возможно выращивают в течение 20 дней, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени. В некоторых альтернативных аспектах указанный способ дополнительно включает удаление подложки, с которой связаны антитела, такой как гранулы или частицы. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора содержит FMC63 или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен химерного антигенного рецептора специфичен к CD19. В некоторых альтернативных аспектах указанный способ дополнительно включает криоконсервацию указанных генетически модифицированных CD8+ и/или CD4+ Т-клеток.
[0246] В некоторых альтернативных аспектах предложена популяция генетически модифицированных Т-клеток, при этом указанная популяция генетически модифицированных Т-клеток содержит множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток, в отсутствие CD8- и/или CD4- Т-клеток, при обогащении относительно CD8- и/или CD4- Т-клеток или изолировании от CD8- и/или CD4- Т-клеток, при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит ген, кодирующий химерный антигенный рецептор, и селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток повторно стимулируют по меньшей мере одним цитокином. В некоторых альтернативных аспектах по меньшей мере один цитокин включает ГМ-КСФ, IL-7, IL-12, IL-18, IL-15, IL-2 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В некоторых альтернативных аспектах указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит вектор, содержащий первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных аспектах селектируемый маркер на поверхности клетки кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах лиганд-связывающий домен содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит FMC63 или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен специфичен к CD19. В некоторых альтернативных аспектах популяция содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток.
[0247] В некоторых альтернативных аспектах предложена композиция или комбинация продуктов для терапии человека, при этом указанная композиция или комбинация продуктов содержит фармацевтическое вспомогательное вещество и по меньшей мере одну популяцию генетически модифицированных Т-клеток. В некоторых альтернативных аспектах указанная по меньшей мере одна популяция генетически модифицированных Т-клеток содержит множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток, в отсутствие CD8- и/или CD4- Т-клеток, при обогащении относительно CD8- и/или CD4- Т-клеток или изолировании от CD8- и/или CD4- Т-клеток, при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит ген, кодирующий химерный антигенный рецептор, и селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток повторно стимулируют по меньшей мере одним цитокином. В некоторых альтернативных аспектах по меньшей мере один цитокин включает ГМ-КСФ, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В некоторых альтернативных аспектах указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит вектор, содержащий первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных аспектах селектируемый маркер на поверхности клетки кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах лиганд-связывающий домен содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит FMC63 или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен специфичен к CD19. В некоторых альтернативных аспектах по меньшей мере одна популяция содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах по меньшей мере одна популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток. В некоторых альтернативных аспектах композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, при этом указанная популяция генетически модифицированных Т-клеток содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток. В некоторых альтернативных аспектах композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, при этом указанная популяция генетически модифицированных Т-клеток содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток и выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток, смешанные или вводимые совместно при соотношении 1:1.
[0248] В некоторых альтернативных аспектах предложен способ лечения, ингибирования или облегчения заболевания у нуждающегося в этом субъекта, при этом указанный способ включает введение указанному субъекту по меньшей мере одной композиции или комбинации продуктов. В некоторых альтернативных аспектах указанная по меньшей мере одна композиция или комбинация продуктов содержит фармацевтическое вспомогательное вещество и по меньшей мере одну популяцию генетически модифицированных Т-клеток. В некоторых альтернативных аспектах указанная по меньшей мере одна популяция генетически модифицированных Т-клеток содержит множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток, в отсутствие CD8- и/или CD4- Т-клеток, при обогащении относительно CD8- и/или CD4- Т-клеток или изолированных от CD8- и/или CD4- Т-клеток, при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток содержит стимулированные рецепторы CD2, CD3, CD4 и/или CD28, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит ген, кодирующий химерный антигенный рецептор, и селектируемый маркер на поверхности клетки, и при этом указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток повторно стимулируют по меньшей мере одним цитокином. В некоторых альтернативных аспектах по меньшей мере один цитокин включает ГМ-КСФ, IL-7, IL-12, IL-15, IL-18, IL-2 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. В некоторых альтернативных аспектах по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В некоторых альтернативных аспектах указанное множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит по меньшей мере один рецептор, который стимулирует способность к приживлению. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах указанный по меньшей мере один рецептор, который стимулирует, индуцирует, способствует или улучшает способность к приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах множество подвергнутых аффинной селекции CD8+ и/или CD4+ Т-клеток дополнительно содержит вектор, содержащий первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер. В некоторых альтернативных аспектах указанный вектор дополнительно содержит последовательность, кодирующую спейсер. В некоторых альтернативных аспектах спейсер содержит шарнир IgG4. В некоторых альтернативных аспектах вектор представляет собой вирусный вектор. В некоторых альтернативных аспектах вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. В некоторых альтернативных аспектах вирусный вектор представляет собой вектор на основе лентивируса. В некоторых альтернативных аспектах селектируемый маркер на поверхности клетки кодирует укороченный рецептор эпидермального фактора роста (EGFRt). В некоторых альтернативных аспектах лиганд-связывающий домен содержит антитело или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен содержит FMC63 или его связывающую часть. В некоторых альтернативных аспектах лиганд-связывающий домен специфичен к CD19. В некоторых альтернативных аспектах по меньшей мере одна популяция содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах по меньшей мере одна популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток. В некоторых альтернативных аспектах композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, при этом указанная популяция генетически модифицированных Т-клеток содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток. В некоторых альтернативных аспектах композиция или комбинация продуктов содержит популяцию генетически модифицированных Т-клеток, при этом указанная популяция генетически модифицированных Т-клеток содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток и выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток, смешанные или вводимые совместно при соотношении 1:1. В некоторых альтернативных аспектах указанный способ включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит по меньшей мере одну популяцию, при этом указанная по меньшей мере одна популяция содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах указанный способ включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит по меньшей мере одну популяцию, при этом указанная по меньшей мере одна популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток. В некоторых альтернативных аспектах указанный способ включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит по меньшей мере одну популяцию, при этом указанная по меньшей мере одна популяция содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток и выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток, смешанные или вводимые совместно при соотношении 1:1. В некоторых альтернативных аспектах указанный способ дополнительно включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит по меньшей мере одну популяцию, при этом указанная по меньшей мере одна популяция содержит выделенные CD8+ Т-клетки в отсутствие CD4+ Т-клеток или при обогащении относительно CD4+ Т-клеток. В некоторых альтернативных аспектах указанный способ дополнительно включает введение композиции или комбинации продуктов, где указанная композиция или комбинация продуктов содержит по меньшей мере одну популяцию, при этом указанная по меньшей мере одна популяция содержит выделенные CD4+ Т-клетки в отсутствие CD8+ Т-клеток или при обогащении относительно CD8+ Т-клеток. В некоторых альтернативных аспектах субъекта идентифицируют или выбирают для проведения ему противораковой терапии. В некоторых альтернативных аспектах указанный способ дополнительно включает измерение или оценку ингибирования заболевания. В некоторых альтернативных аспектах указанный способ дополнительно включает проведение указанному субъекту дополнительной противораковой терапии до, во время или после введения композиции или комбинации продуктов. В некоторых альтернативных аспектах композицию или комбинации продуктов вводят указанному субъекту путем адоптивного переноса клеток. В некоторых альтернативных аспектах композицию или комбинации продуктов вводят указанному субъекту после того, как указанный субъект получил другой вид противораковой терапии. В некоторых альтернативных аспектах композицию или комбинации продуктов вводят указанному субъекту после того, как указанный субъект получил другой вид противораковой терапии. В некоторых альтернативных аспектах указанный субъект страдает от лейкоза. В некоторых альтернативных аспектах субъект страдает от рецидивирующего и/или нечувствительного к химиотерапии CD19+ детского острого лимфобластного лейкоза (ОЛЛ). В некоторых альтернативных аспектах субъект страдает от рецидивирующего и/или нечувствительного к химиотерапии CD19+ острого лимфобластного лейкоза (ОЛЛ). В некоторых альтернативных аспектах указанный субъект страдает от аутоиммунного заболевания. В некоторых альтернативных аспектах указанный субъект страдает от рецидива после ТГСК.
[0249] Касательно использования в настоящей заявке по существу любых терминов во множественном и/или единственном числе, специалисты в данной области техники могут перейти от множественного числа к единственному числу и/или от единственного числа к множественному числу, если это уместно для данного контекста и/или данной заявки. Различные преобразования единственного числа во множественное число и наоборот могут быть явно указаны в данной заявке для полной ясности.
[0250] Для специалистов в данной области техники будет очевидно, что в общем термины, используемые в данной заявке и особенно в прилагаемой формуле изобретения (например, в ограничительной части прилагаемой формулы изобретения), как правило, считают "открытыми" терминами (например, термин "включающий" следует истолковывать как "включающий, но не ограниченный этим", термин "обладающий" следует понимать как "обладающий по меньшей мере", термин "включает" следует понимать как "включает, но не ограничен этим", и т.д.). Для специалистов в данной области техники дополнительно будет очевидно, что если предполагается перечисление определенного числа пунктов формулы изобретения, то такое число пунктов будет практически перечислено в формуле изобретения, а отсутствие такого перечисления указывает на то, что данное намерение отсутствовало. Например, для облегчения понимания, в следующей прилагаемой формуле изобретения могут использоваться вводные фразы "по меньшей мере один" и "один или более", чтобы представить перечисленные пункты формулы изобретения. Тем не менее, использование таких фраз не должно истолковываться как подразумевающее, что представление в форме единственного числа перечисленного пункта формулы изобретения ограничивает какой-либо конкретный пункт формулы изобретения, включающий такое перечисление пункта формулы изобретения, альтернативными вариантами реализации, включающими только одно такое перечисление, даже если один и тот же пункт формулы изобретения включает вводные фразы "один или более" или "по меньшей мере один" и формы единственного числа (например, форму единственного числа следует истолковывать как "по меньшей мере один" или "один или более"). Кроме того, даже при указании в явном виде конкретного номера перечисленного пункта формулы изобретения для специалистов в данной области техники будет очевидно, что данный пункт формулы изобретения следует понимать, как по меньшей мере перечисленный пункт (например, открытый пункт "двух пунктов"; не считая других модификаций, обычно означает по меньшей мере два пункта или два или более двух пунктов). Более того, в случаях, когда используют условие, аналогичное "по меньшей мере один из А, В и С, и т.д.", обычно подразумевается, что смысл такого выражения понятен специалистам в данной области техники (например, формулировка "система, содержащая по меньшей мере один из А, В и С" будет включать, но не будет ограничена системами, которые содержат А отдельно, В отдельно, С отдельно, А и В вместе, А и С вместе, В и С вместе и/или А, В, и С вместе, и т.д.). В случаях, когда используют условие, аналогичное "по меньшей мере один из А, В или С, и т.д.", обычно подразумевается, что смысл такого выражения понятен специалистам в данной области техники (например, формулировка "система, содержащая по меньшей мере один из А, В или С" будет включать, но не будет ограничена системами, которые содержат А отдельно, В отдельно, С отдельно, А и В вместе, А и С вместе, В и С вместе и/или А, В и С вместе, и т.д.). Для специалистов в данной области техники дополнительно будет очевидно, что практически любое альтернативное слово и/или формулировка, представляющие два или более альтернативных терминов, либо в описании, либо в формуле изобретения, либо на фигурах, следует понимать как возможность включения одного из терминов, любого из данных терминов или обоих терминов. Например, следует понимать, что формулировка "А или В" включает возможные варианты "А" или "В" или "А и В".
Дополнительные альтернативные аспекты
[0251] В некоторых альтернативных аспектах отделение, обогащение или выделение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, из смешанной популяции Т-клеток осуществляют путем аффинной селекции Т-клеток, содержащих эпитоп, представленный на CD8 и/или CD4. В некоторых альтернативных аспектах отделение, обогащение или выделение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, из смешанной популяции Т-клеток осуществляют с помощью проточной цитометрии. В некоторых альтернативных аспектах отделение, обогащение или выделение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, из смешанной популяции Т-клеток осуществляют с помощью иммуномагнитной селекции. В некоторых альтернативных аспектах указанные генетически модифицированные Т-клетки, экспрессирующие CD8+, и/или Т-клетки, экспрессирующие CD4+, содержат по меньшей мере один рецептор, который вызывает, индуцирует или способствует приживлению. В некоторых альтернативных аспектах по меньшей мере один рецептор, который вызывает, индуцирует или способствует приживлению, представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L. В предпочтительных альтернативных аспектах по меньшей мере один рецептор, который вызывает, индуцирует или способствует приживлению, представляет собой CD27, CD28 и/или CD62L. В некоторых альтернативных аспектах стимуляцию выделенной, обогащенной или отделенной популяции Т-клеток осуществляют путем приведения в контакт Т-клеток, экспрессирующих CD8+ и/или CD4+, с подложкой, с которой связаны антитела, такой как гранула или частица. В некоторых из данных альтернативных аспектов подложка, с которой связаны антитела, содержит антитела к TCR, к CD2, к CD3, к CD4 и/или к CD28. В предпочтительных альтернативных аспектах подложка, с которой связаны антитела, содержит антитела к CD3 и/или к CD28.
[0252] Во многих из упомянутых выше альтернативных аспектов вектор дополнительно содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемую маркерную последовательность. В некоторых из данных альтернативных аспектов вектор дополнительно содержит последовательность, кодирующую спейсер, который, в некоторых альтернативных аспектах, возможно содержит шарнир IgG4. Во многих из упомянутых выше альтернативных аспектов вектор представляет собой вирусный вектор или миникольцо.
[0253] Во многих из упомянутых выше альтернативных аспектов вирусный вектор получают из вируса обезьян 40, аденовирусов, аденоассоциированного вируса (AAV), лентивируса или ретровирусов. В некоторых альтернативных аспектах вирусный вектор представляет собой рекомбинантный вектор на основе аденовируса, аденоассоциированного вируса, лентивируса или ретровируса. Предпочтительно вирусный вектор представляет собой вектор на основе лентивируса. Во многих из упомянутых выше альтернативных аспектов маркерная последовательность кодирует укороченный рецептор эпидермального фактора роста (EGFRt). Во многих из упомянутых выше альтернативных аспектов по меньшей мере один применяемый цитокин включает ГМ-КСФ, IL-7, IL-12, IL-15, IL-18, IL-15, IL-2 и/или IL-21, и указанный цитокин добавляют к Т-клеткам экзогенно, например, дополнительно к любому цитокину, который может продуцироваться указанными клетками или присутствовать в среде.
[0254] В желательных альтернативных аспектах по меньшей мере один цитокин включает IL-7, IL-15 и/или IL-21. Во многих из упомянутых выше альтернативных аспектов по меньшей мере один цитокин включает IL-2, IL-15 и/или IL-21. В желательных альтернативных аспектах по меньшей мере один цитокин включает IL-21 и другой цитокин, и/или включает IL-7 и по меньшей мере один другой цитокин, и/или включает IL-15 и по меньшей мере один другой цитокин, например, включает IL-21 и IL-15, включает IL-21 и IL-7, или включает IL-15 и IL-7, или включает IL-2 и IL-15, или включает IL-7 и IL-15. В предпочтительных альтернативных аспектах период осуществления контакта составляет по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или период времени, который находится внутри диапазона, ограниченного любыми двумя из данных моментов времени. Во многих из упомянутых выше альтернативных аспектов способы осуществляют с выделенными, отделенными или обогащенными популяциями Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, в отсутствие или с пониженным количеством Т-клеток, экспрессирующих CD8+, по сравнению с нативной популяцией неотделенных, необогащенных или невыделенных Т-клеток. Во многих из упомянутых выше альтернативных аспектов данные способы осуществляют с выделенными, отделенными или обогащенными популяциями Т-клеток, экспрессирующих CD8+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, желательно иПС-клеток, в отсутствие или с пониженным количеством Т-клеток, экспрессирующих CD4+, по сравнению с нативной популяцией неотделенных, необогащенных или невыделенных Т-клеток. Во многих из упомянутых выше альтернативных аспектов указанные Т-клетки, экспрессирующие CD4+, размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени. Во многих из упомянутых выше альтернативных аспектов указанные Т-клетки, экспрессирующие CD8+, размножают в течение по меньшей мере 1 дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение любого времени, которое находится внутри диапазона времени, ограниченного любыми двумя из упомянутых выше моментов времени.
[0255] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, которые содержат химерный антигенный рецептор, при этом указанный способ включает отделение или обогащение популяции Т-клеток, экспрессирующих CD8+, и/или популяции Т-клеток, экспрессирующих CD4+, таких как Т-клетки, которые получают из тимоцитов, или Т-клетки, которые получают из сконструированных предшественников, где указанные предшественники возможно представляют собой иПС-клетки, из смешанной популяции Т-клеток, для того, чтобы получить отделенную или обогащенную популяцию Т-клеток, стимуляцию отделенной или обогащенной популяции Т-клеток для того, чтобы получить стимулированную популяцию CD8+ Т-клеток и/или CD4+ Т-клеток, трансдукцию стимулированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток вектором, при этом указанный вектор кодирует химерный антигенный рецептор для того, чтобы получить трансдуцированную популяцию CD8+ Т-клеток и/или CD4+ Т-клеток, приведение в контакт указанной трансдуцированной популяции CD8+ Т-клеток и/или CD4+ Т-клеток с по меньшей мере одним добавленным экзогенно цитокином в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней или в течение периода времени, которое находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени, для того, чтобы получить популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток, при этом данный способ таким образом позволяет получить указанные генетически модифицированные Т-клетки, которые содержат химерный антигенный рецептор. В некоторых альтернативных аспектах указанный способ дополнительно включает обогащение популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток путем селекции по маркеру для того, чтобы получить обогащенную популяцию трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток. В некоторых альтернативных аспектах указанный маркер кодируется вектором и возможно представляет собой маркер клеточной поверхности. В некоторых альтернативных аспектах указанный способ дополнительно включает размножение обогащенной популяции трансдуцированных и стимулированных цитокином CD8+ Т-клеток и/или CD4+ Т-клеток в течение по меньшей мере одного дня, например, в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 дней, или в течение периода, который находится внутри диапазона, ограниченного любыми двумя из упомянутых выше периодов времени.
[0256] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, при этом указанный способ включает внедрение вектора, кодирующего рекомбинантный белок, в клетки из композиции, обогащенной CD4+ Т-клетками, и инкубацию клеток из композиции, обогащенной CD4+ Т-клетками, с комбинацией цитокинов, включающей IL-7 и IL-15, и/или введение вектора, кодирующего рекомбинантный белок, в клетки из композиции, обогащенной CD8+ Т-клетками, и инкубацию клеток из композиции, обогащенной CD8+ Т-клетками, с комбинацией цитокинов, включающей IL-2 и IL-15, при этом указанный способ позволяет получить трансдуцированную обогащенную CD4+ популяцию и/или трансдуцированную обогащенную CD8+ популяцию. В некоторых альтернативных аспектах у указанной трансдуцированной обогащенной CD4+ популяции повышен уровень экспрессии CD62L, CD27 и/или CD28 на поверхности клеток по сравнению с исходной обогащенной популяцией трансдуцированных CD4+ клеток, и/или повышен показатель способности к приживлению, и/или роста, и/или устойчивости, после введения субъекту, по сравнению с исходной обогащенной популяцией трансдуцированных CD4+ клеток, при этом указанная исходная популяция представляет собой обогащенную CD4+ популяцию, полученную с помощью другого способа, который идентичен указанному способу за исключением того, что вместо комбинации цитокинов используют IL-2 отдельно. В некоторых альтернативных аспектах у указанной трансдуцированной обогащенной CD8+ популяции повышен уровень экспрессии на поверхности клеток CD62L, CD27 и/или CD28, по сравнению с исходной обогащенной популяцией трансдуцированных CD8+ клеток, и/или повышен показатель способности к приживлению, и/или роста, и/или устойчивости, после введения субъекту, по сравнению с исходной обогащенной популяцией трансдуцированных CD8+ клеток, при этом указанная исходная популяция представляет собой обогащенную CD8+ клетками популяцию, полученную с помощью другого способа, который идентичен указанному способу за исключением того, что вместо комбинации цитокинов используют IL-2 отдельно.
[0257] В некоторых альтернативных аспектах предложен способ получения генетически модифицированных Т-клеток, при этом указанный способ включает введение вектора, кодирующего рекомбинантный белок, в клетки композиции, обогащенной CD4+ Т-клетками, и инкубацию клеток из композиции, обогащенной CD4+ Т-клетками, с первой комбинацией цитокинов; и введение вектора, кодирующего рекомбинантный белок, в клетки из композиции, обогащенной CD8+ Т-клетками, и инкубацию клеток из композиции, обогащенной CD8+ Т-клетками, со второй комбинацией цитокинов, которая отличается от первой комбинации цитокинов, при этом указанный способ позволяет получить трансдуцированную обогащенную CD4+ популяцию и трансдуцированную обогащенную CD8+ популяцию. В некоторых альтернативных аспектах у указанной трансдуцированной обогащенной CD4+ популяции повышен уровень экспрессии на поверхности клеток CD62L, CD27 и/или CD28 по сравнению с исходной обогащенной популяцией трансдуцированных CD4+ клеток, полученной с помощью другого способа, который идентичен указанному способу за исключением того, что первая и вторая комбинации цитокинов идентичны, и/или повышен показатель способности к приживлению, и/или роста, и/или устойчивости, после введения субъекту, по сравнению с исходной обогащенной популяцией трансдуцированных CD4+ клеток. В некоторых альтернативных аспектах у указанной трансдуцированной обогащенной CD8+ популяции повышен уровень экспрессии на поверхности клеток CD62L, CD27 и/или CD28 по сравнению с исходной обогащенной популяцией трансдуцированных CD8+ клеток, полученной с помощью другого способа, который идентичен указанному способу за исключением того, что первая и вторая комбинации цитокинов идентичны, и/или повышен показатель способности к приживлению, и/или роста, и/или устойчивости, после введения субъекту, по сравнению с исходной обогащенной популяцией трансдуцированных CD8+ клеток. В некоторых альтернативных аспектах первая комбинация включает IL-7 и IL-15 и вторая комбинация включает IL-2 и IL-15. В некоторых альтернативных аспектах комбинацию(и) цитокинов добавляли после проведения трансдукции, и возможно в тот же день, в который проводили трансдукцию. В некоторых альтернативных аспектах концентрация IL-2 составляет или приблизительно равна 50 Ед/мл, в соответствующих случаях, концентрация IL-15 составляет или приблизительно равна 0,5 нг/мл, в соответствующих случаях, и/или концентрация IL-7 составляет или приблизительно равна 5 нг/мл, в соответствующих случаях. В некоторых альтернативных аспектах добавление комбинации цитокинов к CD4+-обогащенной и/или CD8+-обогащенной композиции приводит к увеличению объема композиции, в которой инкубировали указанные клетки, тем самым уменьшая плотность клеток. В некоторых альтернативных аспектах показатель способности к приживлению включает процент клеток в композиции или суммарные уровни экспрессии на клетках популяции маркера клеточной поверхности, выбранного из группы, состоящей из CD62L, CD27 и/или CD28. В некоторых альтернативных аспектах показатель способности к приживлению включает длительное присутствие у субъекта после введения. В некоторых альтернативных аспектах клетки получены из указанного субъекта. В некоторых альтернативных аспектах трансдуцированные CD8+ и/или CD4+ клетки после введения сохраняются у субъекта, из которого указанные клетки были получены, в течение по меньшей мере или приблизительно 30 или 60 дней после инъекции указанных клеток субъекту. В некоторых альтернативных аспектах рекомбинантный белок представляет собой химерный антигенный рецептор. В некоторых альтернативных аспектах указанный способ дополнительно включает обогащение композиции Т-клеток перед проведением трансдукции клетками, экспрессирующими CD4, что позволяет получить композицию, обогащенную CD4+ Т-клетками, трансдуцированными таким образом, и/или обогащение композиции Т-клеток перед проведением трансдукции клетками, экспрессирующими CD8, что позволяет получить композицию, обогащенную CD8+ Т-клетками, трансдуцированными таким образом. В некоторых альтернативных аспектах указанный способ дополнительно включает криоконсервацию сконструированных клеток. В некоторых альтернативных аспектах указанный способ дополнительно включает введение сконструированных клеток субъекту, и возможно дополнительно включает объединение трансдуцированных обогащенных CD4+ и трансдуцированных обогащенных CD8+ композиций перед введением.
[0258] В некоторых альтернативных аспектах клетку или композицию получают с помощью любого из альтернативных способов, перечисленых в предыдущих абзацах в данном разделе дополнительных альтернативных аспектов. В некоторых альтернативных аспектах предложен способ введения клетки, полученной с помощью любого из альтернативных способов, или альтернативных композиций, перечисленых в предыдущих абзацах. В некоторых альтернативных аспектах клетку или композицию вводят субъекту. В некоторых альтернативных аспектах введение осуществляют субъекту, из которого были получены указанные клетки.
[0259] В некоторых альтернативных аспектах предложен способ адоптивной клеточной терапии, при этом указанный способ включает (a) инкубацию композиции, обогащенной CD4+ Т-клетками, в условиях стимуляции и в присутствии IL-15 и IL-7, что позволяет нарастить CD4+ Т-клетки в композиции, (b) отдельную инкубацию композиции, обогащенной CD8+ Т-клетками, в условиях стимуляции и в присутствии IL-15 и IL-2, что позволяет нарастить CD8+ Т-клетки в композиции, и (c) введение популяций выращенных CD4+ и выращенных CD8+ Т-клеток субъекту, возможно одновременно. В некоторых альтернативных аспектах CD4+ и CD8+ популяции получают из субъекта. В некоторых альтернативных аспектах один или более перечисленных цитокинов или комбинаций цитокинов дополнительно включает CD21. В некоторых альтернативных аспектах CD4+-обогащенная популяция или суммарное количество Т-клеток в ней включает по меньшей мере 70, 80, 90, 95, 96, 97, 98 или 99% CD4+ клеток, и/или С8+-обогащенная популяция или суммарное количество Т-клеток в ней включает по меньшей мере 70, 80, 90, 95, 96, 97, 98 или 99% CD8+ клеток.
[0260] Кроме того, если свойства или аспекты настоящего описания представлены в виде групп Маркуша, то для специалистов в данной области техники будет очевидно, что настоящее описание, тем самым, также описано в виде любого отдельного представителя или подгруппы представителей группы Маркуша.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> СИЭТЛ ЧИЛДРЕН'С ХОСПИТАЛ
ДБА СИЭТЛ ЧИЛДРЕН'С РЕСЁРЧ ИНСТИТЬЮТ
ДЖЕНСЕН, Майкл К.
<120> ПРОДУКТЫ ОПРЕДЕЛЕННОГО СОСТАВА, СОДЕРЖАЩИЕ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ T-КЛЕТКИ
<130> SCRI.090WO
<150> 62/088363
<151> 2014-12-05
<160> 7
<170> FastSEQ для Windows, версия 4.0
<210> 1
<211> 12
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Модифицированная шарнирная область IgG4
<400> 1
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 2
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Модифицированная шарнирная область IgG4
<400> 2
Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5
<210> 3
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Модифицированная шарнирная область IgG4
<400> 3
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 4
<211> 13
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Модифицированная шарнирная область IgG4
<400> 4
Glu Val Val Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
1 5 10
<210> 5
<211> 28
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Трансмембранный домен CD28
<400> 5
Met Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser
1 5 10 15
Leu Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 6
<211> 42
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Домен 4-1BB
<400> 6
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 7
<211> 112
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Домен CD3-дзета
<400> 7
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<---
Claims (53)
1. Способ in vitro культивирования популяции T-клеток, содержащих химерный антигенный рецептор (CAR), для клеточной иммунотерапии, включающий:
(a) получение популяции Т-клеток, содержащих CAR, причем указанная популяция Т-клеток обогащена CD4+ T-клетками или CD8+ T-клетками; и
(b) приведение указанной популяции T-клеток в контакт с комбинацией цитокинов, включающей IL-15 и по меньшей мере один цитокин, выбранный из IL-2, IL-7, IL-12, IL-18 и IL-21, причем указанная комбинация цитокинов является экзогенной по отношению к популяции Т-клеток, и при этом концентрация указанного IL-15 является равной или меньшей чем 1 нг/мл.
2. Способ по п. 1, отличающийся тем, что указанная популяция Т-клеток обогащена CD8+ T-клетками.
3. Способ по п. 1 или 2, отличающийся тем, что указанная комбинация цитокинов включает IL-2 и IL-15.
4. Способ по п. 1 или 2, отличающийся тем, что указанная комбинация цитокинов состоит из IL-2 и IL-15.
5. Способ по п. 3 или 4, отличающийся тем, что концентрация IL-2 составляет более чем 20 Ед/мл.
6. Способ по п. 3 или 4, отличающийся тем, что концентрация IL-2 находится в диапазоне от 20 Ед/мл до 70 Ед/мл, а концентрация IL-15 находится в диапазоне от 0,1 нг/мл до 1 нг/мл.
7. Способ по п. 3 или 4, отличающийся тем, что концентрация IL-2 находится в диапазоне от 30 Ед/мл до 70 Ед/мл, а концентрация IL-15 находится в диапазоне от 0,3 нг/мл до 0,7 нг/мл.
8. Способ по п. 3 или 4, отличающийся тем, что концентрация IL-2 в композиции составляет приблизительно 50 Ед/мл.
9. Способ по п. 3 или 4, отличающийся тем, что концентрация IL-15 в композиции составляет приблизительно 0,5 нг/мл.
10. Способ по п. 1, отличающийся тем, что стадия (a) дополнительно включает отделение или обогащение популяции CD8+ T-клеток и/или популяции CD4+ T-клеток из смешанной популяции T-клеток путем аффинной селекции.
11. Способ по п. 10, отличающийся тем, что отделение или обогащение осуществляют с помощью проточной цитометрии.
12. Способ по п. 10, отличающийся тем, что отделение или обогащение осуществляют с помощью иммуномагнитной селекции.
13. Способ по п. 1, отличающийся тем, что указанные генетически модифицированные T-клетки содержат по меньшей мере один рецептор, который вызывает, индуцирует, способствует или повышает способность к приживлению.
14. Способ по п. 13, отличающийся тем, что указанный по меньшей мере один рецептор представляет собой CD45 RA, CD45 RO, CCR7, CD25, CD127, CD57, CD137, CD27, CD28 и/или CD62L.
15. Способ по п. 13, отличающийся тем, что указанный по меньшей мере один рецептор представляет собой CD27, CD28 и/или CD62L.
16. Способ по п. 1, отличающийся тем, что стадия (a) дополнительно включает стимуляцию популяции T-клеток путем приведения в контакт популяции T-клеток с подложкой, с которой связаны антитела.
17. Способ по п. 16, отличающийся тем, что подложка, с которой связаны антитела, содержит антитело к TCR, антитело к CD2, антитело к CD3, антитело к CD4 и/или антитело к CD28.
18. Способ по п. 17, отличающийся тем, что подложка, с которой связаны антитела, содержит антитело к CD3 и/или антитело к CD28.
19. Способ по любому из пп. 1-18, отличающийся тем, что перед стадией (a) включает трансдукцию популяции T-клеток с вектором, кодирующим CAR с получением популяции Т-клеток, содержащих CAR, причем указанный вектор содержит первую последовательность, кодирующую лидерную последовательность, вторую последовательность, кодирующую лиганд-связывающий домен, третью последовательность, кодирующую сигнальный домен, и четвертую последовательность, кодирующую селектируемый маркер.
20. Способ по п. 19, отличающийся тем, что вектор дополнительно содержит последовательность, кодирующую спейсер.
21. Способ по п. 20, отличающийся тем, что спейсер содержит шарнир IgG4.
22. Способ по п. 19, отличающийся тем, что вектор представляет собой вирусный вектор.
23. Способ по п. 22, отличающийся тем, что вирусный вектор получают из вируса обезьян 40, аденовируса, аденоассоциированного вируса (AAV), лентивируса или ретровируса.
24. Способ по п. 22, отличающийся тем, что вирусный вектор представляет собой вектор на основе аденовируса, вектор на основе аденоассоциированного вируса, вектор на основе лентивируса или вектор на основе ретровируса.
25. Способ по п. 22, отличающийся тем, что вирусный вектор представляет собой вектор на основе лентивируса.
26. Способ по п. 19, отличающийся тем, что четвертая последовательность кодирует укороченный рецептор эпидермального фактора роста (EGFRt).
27. Способ по п. 1, отличающийся тем, что комбинация цитокинов включает рекомбинантный цитокин.
28. Способ по п. 1, отличающийся тем, что приведение в контакт осуществляют в течение периода времени в диапазоне от 1 дня до 20 дней.
29. Способ по любому из пп. 3-28, отличающийся тем, что популяция Т-клеток обогащена CD4+ T-клетками.
30. Способ по п. 1, отличающийся тем, что популяцию T-клеток размножают в течение по меньшей мере 1 дня или в течение периода времени в диапазоне от 1 дня до 20 дней.
31. Способ по п. 16, отличающийся тем, что указанный способ дополнительно включает удаление подложки, с которой связаны антитела.
32. Способ по п. 19, отличающийся тем, что лиганд-связывающий домен содержит антитело или его антиген связывающую часть.
33. Способ по п. 19, отличающийся тем, что лиганд-связывающий домен содержит одноцепочечный вариабельный фрагмент (scFv) или его антиген-связывающую часть.
34. Способ по п. 19, отличающийся тем, что лиганд-связывающий домен содержит FMC63 или его антиген-связывающую часть.
35. Способ по п. 19, отличающийся тем, что лиганд-связывающий домен специфичен к CD19.
36. Способ по п. 1, дополнительно включающий криоконсервацию популяции T-клеток.
37. Способ по любому из пп. 1-36, отличающийся тем, что популяция Т-клеток содержит предшественника T-клетки и/или гемопоэтическую стволовую клетку (ГСК).
38. Композиция для клеточной иммунотерапии, содержащая популяцию T-клеток, полученную согласно способу по любому из пп. 1-37, причем CAR содержит лиганд-связывающий домен, способный специфично связываться с раковым антигеном, экспрессируемым на раковой клетке.
39. Фармацевтическая композиция для клеточной иммунотерапии рака, экспрессирующего раковый антиген, содержащая композицию по п. 38 и фармацевтически приемлемое вспомогательное вещество.
40. Фармацевтическая композиция по п. 39, отличающаяся тем, что популяция Т-клеток содержит первую популяцию, обогащенную CD8+ T-клетками, и вторую популяцию, обогащенную CD4+ T-клетками, причем указанные первая популяция и вторая популяция объединены в соотношении 1:1.
41. Способ лечения или ингибирования рака, экспрессирующего раковый антиген, у субъекта, включающий:
введение эффективного количества фармацевтической композиции по п. 39 или 40 субъекту, нуждающемуся в этом.
42. Способ по п. 41, отличающийся тем, что указанный раковый антиген представляет собой CD19.
43. Способ по п. 41, отличающийся тем, что указанная фармацевтическая композиция обогащена CD8+ T-клетками и указанную композицию вводят субъекту перед введением указанному субъекту второй фармацевтической композиции, обогащенной CD4+ T-клетками.
44. Способ по п. 41, дополнительно включающий введение указанному субъекту дополнительной противораковой терапии.
45. Способ по п. 41, отличающийся тем, что указанную фармацевтическую композицию вводят указанному субъекту путем адоптивного переноса клеток.
46. Способ по п. 41, отличающийся тем, что указанную фармацевтическую композицию вводят указанному субъекту до введения дополнительной противораковой терапии.
47. Способ по п. 41, отличающийся тем, что указанную фармацевтическую композицию вводят указанному субъекту после введения указанному субъекту дополнительной противораковой терапии.
48. Способ по п. 41, отличающийся тем, что рак включает лейкоз.
49. Способ по п. 48, отличающийся тем, что лейкоз включает рецидивирующий и/или нечувствительный к химиотерапии CD19+ детский острый лимфобластный лейкоз (ОЛЛ).
50. Способ по п. 41, отличающийся тем, что указанный субъект страдает от рецидива после трансплантации гематопоэтических стволовых клеток (ТГСК).
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461977751P | 2014-04-10 | 2014-04-10 | |
| US61/977,751 | 2014-04-10 | ||
| US201461986479P | 2014-04-30 | 2014-04-30 | |
| US61/986,479 | 2014-04-30 | ||
| US201462058973P | 2014-10-02 | 2014-10-02 | |
| US62/058,973 | 2014-10-02 | ||
| US201462088363P | 2014-12-05 | 2014-12-05 | |
| US62/088,363 | 2014-12-05 | ||
| US201462089730P | 2014-12-09 | 2014-12-09 | |
| US62/089,730 | 2014-12-09 | ||
| US201462090845P | 2014-12-11 | 2014-12-11 | |
| US62/090,845 | 2014-12-11 | ||
| PCT/US2015/024866 WO2015157384A1 (en) | 2014-04-10 | 2015-04-08 | Defined composition gene modified t-cell products |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2016143385A RU2016143385A (ru) | 2018-05-15 |
| RU2016143385A3 RU2016143385A3 (ru) | 2018-11-30 |
| RU2751921C2 true RU2751921C2 (ru) | 2021-07-20 |
Family
ID=54288361
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016143381A RU2752275C2 (ru) | 2014-04-10 | 2015-04-08 | Способ и композиции для клеточной иммунотерапии |
| RU2016143384A RU2729112C2 (ru) | 2014-04-10 | 2015-04-08 | Трансгенные генетические метки и способы применения |
| RU2016143385A RU2751921C2 (ru) | 2014-04-10 | 2015-04-08 | Продукты определенного состава, содержащие генетически модифицированные т-клетки |
| RU2016143388A RU2751920C2 (ru) | 2014-04-10 | 2015-04-08 | Экспрессия трансгенов, регулируемая лекарственным средством |
| RU2016143389A RU2016143389A (ru) | 2014-04-10 | 2015-04-08 | Получение генно-инженерных т-клеток посредством транспозона "спящая красавица" в сочетании с отбором метотрексатом |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016143381A RU2752275C2 (ru) | 2014-04-10 | 2015-04-08 | Способ и композиции для клеточной иммунотерапии |
| RU2016143384A RU2729112C2 (ru) | 2014-04-10 | 2015-04-08 | Трансгенные генетические метки и способы применения |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2016143388A RU2751920C2 (ru) | 2014-04-10 | 2015-04-08 | Экспрессия трансгенов, регулируемая лекарственным средством |
| RU2016143389A RU2016143389A (ru) | 2014-04-10 | 2015-04-08 | Получение генно-инженерных т-клеток посредством транспозона "спящая красавица" в сочетании с отбором метотрексатом |
Country Status (19)
| Country | Link |
|---|---|
| US (12) | US10865242B2 (ru) |
| EP (8) | EP3129053A4 (ru) |
| JP (12) | JP6788573B6 (ru) |
| KR (8) | KR102509481B1 (ru) |
| CN (7) | CN112877291A (ru) |
| AU (8) | AU2015243922B2 (ru) |
| BR (3) | BR112016023517A2 (ru) |
| CA (5) | CA2945305C (ru) |
| ES (2) | ES2867224T3 (ru) |
| IL (5) | IL297591A (ru) |
| MX (6) | MX2016013144A (ru) |
| MY (4) | MY185678A (ru) |
| NZ (3) | NZ739448A (ru) |
| PH (4) | PH12016502010A1 (ru) |
| RU (5) | RU2752275C2 (ru) |
| SA (1) | SA516380056B1 (ru) |
| SG (8) | SG11201608393TA (ru) |
| WO (5) | WO2015157386A1 (ru) |
| ZA (2) | ZA201607060B (ru) |
Families Citing this family (163)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN100548667C (zh) * | 2003-01-20 | 2009-10-14 | 日本瑞翁株式会社 | 层合件及其制造方法 |
| ES2832586T3 (es) * | 2013-11-21 | 2021-06-10 | Autolus Ltd | Célula |
| IL297591A (en) | 2014-04-10 | 2022-12-01 | Seattle Childrens Hospital Dba Seattle Childrens Res Inst | Drug-related transgene expression |
| KR20220136455A (ko) | 2014-04-23 | 2022-10-07 | 주노 쎄러퓨티크스 인코퍼레이티드 | 입양 치료용 면역 세포 집단의 단리, 배양 및 유전자 조작 방법 |
| WO2015167766A1 (en) | 2014-04-29 | 2015-11-05 | Seattle Children's Hospital (dba Seattle Children's Research Institute) | Ccr5 disruption of cells expressing anti-hiv chimeric antigen receptor (car) derived from broadly neutralizing antibodies |
| SG11201703203RA (en) | 2014-10-20 | 2017-05-30 | Juno Therapeutics Inc | Methods and compositions for dosing in adoptive cell therapy |
| KR101697473B1 (ko) | 2014-11-26 | 2017-01-18 | 주식회사 녹십자랩셀 | T 세포를 이용한 자연살해세포의 배양방법 |
| EP3227323B1 (en) | 2014-12-03 | 2020-08-05 | Juno Therapeutics, Inc. | Methods and compositions for adoptive cell therapy |
| RU2766094C2 (ru) | 2014-12-05 | 2022-02-07 | Мемориал Слоан-Кеттеринг Кэнсер Сентер | Антитела, нацеленные на антиген созревания в-клеток, и способы их применения |
| WO2016100232A1 (en) | 2014-12-15 | 2016-06-23 | The Regents Of The University Of California | Bispecific or-gate chimeric antigen receptor responsive to cd19 and cd20 |
| MA41346A (fr) | 2015-01-12 | 2017-11-21 | Juno Therapeutics Inc | Eléments régulateurs post-transcriptionnels d'hépatite modifiée |
| AU2016206457B2 (en) | 2015-01-16 | 2021-11-11 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for ROR1 |
| WO2016138091A2 (en) * | 2015-02-24 | 2016-09-01 | Board Of Regents, The University Of Texas System | Selection methods for genetically-modified t cells |
| EP4091616A1 (en) | 2015-02-27 | 2022-11-23 | iCell Gene Therapeutics LLC | Chimeric antigen receptors (car) targeting hematologic malignancies, compositions and methods of use thereof |
| SG10201913682QA (en) | 2015-06-25 | 2020-03-30 | Icell Gene Therapeutics Llc | CHIMERIC ANTIGEN RECEPTORS (CARs), COMPOSITIONS AND METHODS OF USE THEREOF |
| US11173179B2 (en) | 2015-06-25 | 2021-11-16 | Icell Gene Therapeutics Llc | Chimeric antigen receptor (CAR) targeting multiple antigens, compositions and methods of use thereof |
| MX2018001568A (es) | 2015-08-07 | 2019-04-25 | Seattle Children´S Hospital Dba Seattle Children´S Res Institute | Celulas t biespecificas de receptor quimerico de antigeno (car) para focalizacion a tumores solidos. |
| BR112018005620A2 (pt) * | 2015-09-22 | 2018-10-09 | Univ Wuerzburg J Maximilians | método para transferência de gene estável e de nível elevado em linfócitos |
| BR112018006991A2 (pt) * | 2015-10-06 | 2018-10-16 | Hope City | receptores de antígeno quiméricos direcionados ao psca |
| CN108463228A (zh) * | 2015-10-23 | 2018-08-28 | 科罗拉多大学董事会法人团体 | 鳞状细胞癌的预后和治疗 |
| KR20180069067A (ko) | 2015-10-30 | 2018-06-22 | 엔비이-테라퓨틱스 아게 | 안티-ror1 항체 |
| US11020429B2 (en) | 2015-11-05 | 2021-06-01 | Juno Therapeutics, Inc. | Vectors and genetically engineered immune cells expressing metabolic pathway modulators and uses in adoptive cell therapy |
| MX2018007203A (es) * | 2015-12-14 | 2018-11-12 | Genomefrontier Therapeutics Inc | Sistema de transposon, kit que comprende el mismo, y sus usos. |
| US20180371052A1 (en) * | 2015-12-22 | 2018-12-27 | Icell Gene Therapeutics Llc | Chimeric antigen receptors and enhancement of anti-tumor activity |
| JP7000660B2 (ja) | 2016-01-20 | 2022-02-04 | ザ スクリプス リサーチ インスティテュート | Ror1抗体組成物及び関連の方法 |
| EP3202783A1 (en) * | 2016-02-02 | 2017-08-09 | Ecole Polytechnique Federale de Lausanne (EPFL) | Engineered antigen presenting cells and uses thereof |
| EP3430549A1 (en) | 2016-03-16 | 2019-01-23 | Juno Therapeutics, Inc. | Methods for adaptive design of a treatment regimen and related treatments |
| WO2017190100A1 (en) * | 2016-04-28 | 2017-11-02 | The Trustees Of Dartmouth College | Nucleic acid constructs for co-expression of chimeric antigen receptor and transcription factor, cells containing and therapeutic use thereof |
| CA3026778A1 (en) * | 2016-06-07 | 2017-12-14 | Max-Delbruck-Centrum Fur Molekulare Medizin In Der Helmholtz-Gemeinschaft | Chimeric antigen receptor and car-t cells that bind bcma |
| KR102652827B1 (ko) | 2016-06-08 | 2024-04-01 | 프레시전 인코포레이티드 | Cd33 특이적 키메라 항원 수용체 |
| EP4353750A3 (en) * | 2016-06-24 | 2024-07-24 | iCell Gene Therapeutics LLC | Chimeric antigen receptors (cars), compositions and methods thereof |
| US20190119636A1 (en) * | 2017-10-23 | 2019-04-25 | Poseida Therapeutics, Inc. | Modified stem cell memory t cells, methods of making and methods of using same |
| ES2939646T3 (es) | 2016-10-13 | 2023-04-25 | Juno Therapeutics Inc | Métodos y composiciones de inmunoterapia que comprenden moduladores de la vía metabólica del triptófano |
| US11739129B2 (en) | 2016-10-21 | 2023-08-29 | Washington University | AP4 and methods of promoting T cell activation |
| CN110234327A (zh) * | 2016-11-30 | 2019-09-13 | 英特拉克森公司 | 类固醇施用和免疫疗法 |
| MA46995A (fr) | 2016-12-03 | 2019-10-09 | Acerta Pharma Bv | Méthodes et compositions pour l'utilisation de lymphocytes t thérapeutiques en association avec des inhibiteurs de kinase |
| US11408005B2 (en) | 2016-12-12 | 2022-08-09 | Seattle Children's Hospital | Chimeric transcription factor variants with augmented sensitivity to drug ligand induction of transgene expression in mammalian cells |
| CN106800601B (zh) * | 2017-01-19 | 2021-04-06 | 广东昭泰体内生物医药科技有限公司 | 一种嵌合抗原受体及其应用 |
| MA47325A (fr) | 2017-01-20 | 2019-11-27 | Juno Therapeutics Gmbh | Conjugués de surface cellulaire et compositions cellulaires et méthodes associées |
| JP7228522B2 (ja) | 2017-02-27 | 2023-02-24 | ジュノー セラピューティクス インコーポレイテッド | 細胞療法における投薬に関する組成物、製造物品、および方法 |
| JP7178355B2 (ja) | 2017-02-28 | 2022-11-25 | エンドサイト・インコーポレイテッド | Car t細胞療法のための組成物および方法 |
| EA201992155A1 (ru) | 2017-03-14 | 2020-03-16 | Джуно Терапьютикс, Инк. | Способы криогенного хранения |
| CN106963945A (zh) * | 2017-03-27 | 2017-07-21 | 山东兴瑞生物科技有限公司 | 一种加强型人乳头瘤病毒hpv‑16/18的二价dc疫苗 |
| WO2018191490A1 (en) * | 2017-04-13 | 2018-10-18 | The Trustees Of The University Of Pennsylvania | Use of gene editing to generate universal tcr re-directed t cells for adoptive immunotherapy |
| JOP20180040A1 (ar) | 2017-04-20 | 2019-01-30 | Gilead Sciences Inc | مثبطات pd-1/pd-l1 |
| CN108728477B (zh) * | 2017-04-24 | 2022-02-22 | 华东理工大学 | 一种高效的转座突变系统及构建方法 |
| CA3063695A1 (en) * | 2017-05-17 | 2018-11-22 | Seattle Children's Hospital (Dba Seattle Children's Research Institute | Generating mammalian t cell activation inducible synthetic promoters (syn+pro) to improve t cell therapy |
| CA3064000A1 (en) * | 2017-05-24 | 2018-11-29 | Effector Therapeutics, Inc. | Methods and compositions for cellular immunotherapy |
| WO2018217064A2 (ko) * | 2017-05-26 | 2018-11-29 | 주식회사 녹십자랩셀 | 형질전환된 t세포를 이용한 자연살해세포의 배양방법 |
| BR112019025403A2 (pt) | 2017-06-02 | 2020-08-18 | Juno Therapeutics Inc | artigos de fabricação e métodos para tratamento usando terapia celular adotiva |
| CN107335054B (zh) * | 2017-06-30 | 2021-01-15 | 山东兴瑞生物科技有限公司 | 一种慢性乙肝治疗性dc疫苗 |
| CN111133002B (zh) | 2017-08-07 | 2024-05-24 | 恩比伊治疗股份公司 | 具有高体内耐受性的基于蒽环类药的抗体药物缀合物 |
| CA3072569A1 (en) * | 2017-08-11 | 2019-02-14 | Tribiotica Llc | Methods for generating epitopes for binding to recognition molecules by templated assembly |
| CN111094349A (zh) * | 2017-08-23 | 2020-05-01 | 马克思-德布鲁克-分子医学中心亥姆霍兹联合会 | 嵌合抗原受体和结合cxcr5的car-t细胞 |
| JP2020536531A (ja) * | 2017-09-26 | 2020-12-17 | ロングウッド ユニバーシティーLongwood University | 免疫療法としてのpd1特異的キメラ抗原受容体 |
| CN107759700A (zh) * | 2017-10-18 | 2018-03-06 | 银丰生物工程集团有限公司 | 靶向cd19抗原的转基因t细胞及其制备方法与应用 |
| CA3079264A1 (en) | 2017-10-18 | 2019-04-25 | Intrexon Corporation | Polypeptide compositions comprising spacers |
| US10329543B2 (en) | 2017-10-23 | 2019-06-25 | Poseida Therapeutics, Inc. | Modified stem cell memory T cells, methods of making and methods of using same |
| WO2019089969A2 (en) | 2017-11-01 | 2019-05-09 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for b-cell maturation antigen |
| CN111542596A (zh) * | 2017-11-01 | 2020-08-14 | 朱诺治疗学股份有限公司 | 产生工程化细胞的治疗性组合物的方法 |
| US11851679B2 (en) | 2017-11-01 | 2023-12-26 | Juno Therapeutics, Inc. | Method of assessing activity of recombinant antigen receptors |
| US12031975B2 (en) | 2017-11-01 | 2024-07-09 | Juno Therapeutics, Inc. | Methods of assessing or monitoring a response to a cell therapy |
| EP3707160A1 (en) | 2017-11-10 | 2020-09-16 | The U.S.A. as represented by the Secretary, Department of Health and Human Services | Chimeric antigen receptors targeting tumor antigens |
| EP3710020A4 (en) * | 2017-11-14 | 2021-06-23 | Memorial Sloan-Kettering Cancer Center | IL-36 SECRECTING IMMUNOREACTIVE CELLS AND RELATED USES |
| AU2018392213B2 (en) | 2017-12-20 | 2021-03-04 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3' cyclic dinucleotides with phosphonate bond activating the STING adaptor protein |
| CN111511754B (zh) | 2017-12-20 | 2023-09-12 | 捷克共和国有机化学与生物化学研究所 | 活化sting转接蛋白的具有膦酸酯键的2’3’环状二核苷酸 |
| CN110028588A (zh) * | 2018-01-11 | 2019-07-19 | 上海细胞治疗研究院 | 抗原-Fc融合蛋白及其检测阳性CAR-T细胞的应用 |
| US10561686B2 (en) | 2018-01-12 | 2020-02-18 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| US11311576B2 (en) | 2018-01-22 | 2022-04-26 | Seattle Children's Hospital | Methods of use for CAR T cells |
| CN108103027B (zh) * | 2018-02-02 | 2021-12-24 | 中国医学科学院血液病医院(血液学研究所) | 高效率血细胞重编程同时实现基因编辑的方法 |
| AU2019222644B2 (en) | 2018-02-13 | 2021-04-01 | Gilead Sciences, Inc. | PD-1/PD-L1 inhibitors |
| CN108383914A (zh) * | 2018-02-23 | 2018-08-10 | 北京美康基免生物科技有限公司 | 一种基于cd19的嵌合抗原受体及其应用 |
| CA3093716A1 (en) * | 2018-03-16 | 2019-09-19 | Immusoft Corporation | B cells genetically engineered to secrete follistatin and methods of using the same to treat follistatin-related diseases, conditions, disorders and to enhance muscle growth and strength |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| TWI818007B (zh) | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| TWI833744B (zh) | 2018-04-06 | 2024-03-01 | 捷克科學院有機化學與生物化學研究所 | 3'3'-環二核苷酸 |
| US10869888B2 (en) | 2018-04-17 | 2020-12-22 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expansion and uses thereof |
| CN112041311B (zh) | 2018-04-19 | 2023-10-03 | 吉利德科学公司 | Pd-1/pd-l1抑制剂 |
| WO2019211799A1 (en) | 2018-05-03 | 2019-11-07 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide |
| PL3793565T3 (pl) | 2018-05-14 | 2022-05-02 | Gilead Sciences, Inc. | Inhibitory MCL-1 |
| SG11202011392VA (en) * | 2018-05-15 | 2020-12-30 | Carsgen Therapeutics Co Ltd | Genetically engineered cell and application thereof |
| MX2020013923A (es) | 2018-06-29 | 2021-03-29 | Apitbio Inc | Anticuerpos anti molécula de adhesión celular l1 (l1cam) y usos de estos. |
| EP4234030A3 (en) | 2018-07-13 | 2023-10-18 | Gilead Sciences, Inc. | Pd-1/pd-l1 inhibitors |
| CN110845621A (zh) * | 2018-08-21 | 2020-02-28 | 上海恒润达生生物科技有限公司 | 一种靶向egfr和cd19双靶点的嵌合抗原受体方法 |
| US20220348682A1 (en) | 2018-08-30 | 2022-11-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Chimeric antigen receptor cells for treating solid tumor |
| CN113039206A (zh) * | 2018-08-31 | 2021-06-25 | 西雅图儿童医院(Dba西雅图儿童研究所) | 包含b7h3嵌合抗原受体的方法和组合物 |
| EP3860717A1 (en) | 2018-10-03 | 2021-08-11 | Gilead Sciences, Inc. | Imidozopyrimidine derivatives |
| WO2020086556A1 (en) | 2018-10-24 | 2020-04-30 | Gilead Sciences, Inc. | Pd-1/pd-l1 inhibitors |
| US11071730B2 (en) | 2018-10-31 | 2021-07-27 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds |
| EP3873903B1 (en) | 2018-10-31 | 2024-01-24 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds as hpk1 inhibitors |
| AU2019372673A1 (en) | 2018-11-01 | 2021-05-27 | Gracell Biotechnologies (Shanghai) Co., Ltd. | Compositions and methods for T cell engineering |
| US20220008465A1 (en) * | 2018-11-16 | 2022-01-13 | Juno Therapeutics, Inc. | Methods of dosing engineered t cells for the treatment of b cell malignancies |
| US10918667B2 (en) | 2018-11-20 | 2021-02-16 | Innovative Cellular Therapeutics CO., LTD. | Modified cell expressing therapeutic agent and uses thereof |
| SG11202105502RA (en) * | 2018-11-30 | 2021-06-29 | Juno Therapeutics Inc | Methods for treatment using adoptive cell therapy |
| CN113395972A (zh) * | 2018-11-30 | 2021-09-14 | 细胞结构公司 | 胎盘源性同种异体car-t细胞及其用途 |
| BR112021010120A2 (pt) * | 2018-11-30 | 2021-08-31 | Juno Therapeutics, Inc. | Métodos para dosagem e tratamento de malignidades celulares em terapia celular adotiva |
| CN113543851A (zh) | 2019-03-07 | 2021-10-22 | 捷克共和国有机化学与生物化学研究所 | 2’3’-环二核苷酸及其前药 |
| KR20210137518A (ko) | 2019-03-07 | 2021-11-17 | 인스티튜트 오브 오가닉 케미스트리 앤드 바이오케미스트리 에이에스 씨알 브이.브이.아이. | 3'3'-사이클릭 다이뉴클레오티드 및 이의 프로드럭 |
| US11766447B2 (en) | 2019-03-07 | 2023-09-26 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| US20200297768A1 (en) * | 2019-03-19 | 2020-09-24 | Immatics US, Inc. | Cd28 t cell cultures, compositions, and methods of using thereof |
| US20200308248A1 (en) * | 2019-03-26 | 2020-10-01 | ST Phi Therapeutics | Chimeric Natural Killer Cell Receptors and Method of Using Thereof |
| WO2020210023A1 (en) * | 2019-04-08 | 2020-10-15 | Russell Biotech, Inc. | Improved manufacturing procedures for cell based therapies |
| CN109994176A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含样本类型信息管理模块的精准用药智能报告系统 |
| CN109994156A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含报告模板信息管理模块的精准用药智能报告系统 |
| CN109994180A (zh) * | 2019-04-16 | 2019-07-09 | 北京中佰耀因医药科技有限公司 | 一种含基因位点信息管理模块的精准用药智能报告系统 |
| CN110010200A (zh) * | 2019-04-16 | 2019-07-12 | 长沙三济生物科技有限公司 | 一种基因身份识别系统 |
| CN109872792A (zh) * | 2019-04-16 | 2019-06-11 | 北京中佰耀因医药科技有限公司 | 一种用于指导精准用药的基因检测智能报告系统 |
| CN110010222A (zh) * | 2019-04-16 | 2019-07-12 | 长沙三济生物科技有限公司 | 一种基于精准用药知识库的基因身份识别系统 |
| CN109979545A (zh) * | 2019-04-16 | 2019-07-05 | 北京中佰耀因医药科技有限公司 | 一种含样本状态信息管理模块的精准用药智能报告系统 |
| TW202212339A (zh) | 2019-04-17 | 2022-04-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TW202210480A (zh) | 2019-04-17 | 2022-03-16 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| WO2020237025A1 (en) | 2019-05-23 | 2020-11-26 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| CA3143108A1 (en) * | 2019-06-19 | 2020-12-24 | Julius-Maximilians-Universitat Wurzburg | Ultramodular igg3-based spacer domain and multi-function site for implementation in chimeric antigen receptor design |
| CA3142513A1 (en) | 2019-06-25 | 2020-12-30 | Gilead Sciences, Inc. | Flt3l-fc fusion proteins and methods of use |
| CN110608991B (zh) * | 2019-09-09 | 2022-04-29 | 浙江普罗亭健康科技有限公司 | 基于质谱流式检测技术的细胞周期检测试剂盒及检测方法 |
| EP4045083B1 (en) | 2019-10-18 | 2024-01-10 | Forty Seven, Inc. | Combination therapies for treating myelodysplastic syndromes and acute myeloid leukemia |
| CN114599392A (zh) | 2019-10-31 | 2022-06-07 | 四十七公司 | 基于抗cd47和抗cd20的血癌治疗 |
| TWI778443B (zh) | 2019-11-12 | 2022-09-21 | 美商基利科學股份有限公司 | Mcl1抑制劑 |
| CN117736207A (zh) | 2019-12-24 | 2024-03-22 | 卡尔那生物科学株式会社 | 二酰基甘油激酶调节化合物 |
| CN117964757A (zh) | 2020-02-14 | 2024-05-03 | 吉利德科学公司 | 与ccr8结合的抗体和融合蛋白及其用途 |
| US12076343B2 (en) | 2020-02-19 | 2024-09-03 | Innovative Cellular Therapeutics Holdings, Ltd. | Engineered safety in cell therapy |
| CN111533808B (zh) * | 2020-03-10 | 2021-02-09 | 南京医科大学 | 一种可自分泌TLR4 scFv且靶向cMet的嵌合抗原受体修饰的T细胞及其应用 |
| JP2023518293A (ja) | 2020-03-20 | 2023-04-28 | ライル・イミュノファーマ,インコーポレイテッド | 新規の組換え細胞表面マーカー |
| US12110294B2 (en) | 2020-05-01 | 2024-10-08 | Gilead Sciences, Inc. | CD73 compounds |
| US12043654B2 (en) | 2020-06-02 | 2024-07-23 | Innovative Cellular Therapeutics Holdings, Ltd. | Anti-GCC antibody and CAR thereof for treating digestive system cancer |
| WO2022007938A1 (en) * | 2020-07-09 | 2022-01-13 | Nanjing Legend Biotech Co., Ltd. | Engineering gamma delta t cells with interleukin-36 for immunotherapy |
| CN116490518A (zh) | 2020-07-17 | 2023-07-25 | 西穆尔克斯股份有限公司 | 用于重定向免疫抑制信号传导的嵌合MyD88受体及相关组合物和方法 |
| EP4263600A1 (en) | 2020-12-18 | 2023-10-25 | Century Therapeutics, Inc. | Chimeric antigen receptor systems with adaptable receptor specificity |
| EP4277639A2 (en) * | 2021-01-15 | 2023-11-22 | Seattle Children's Hospital d/b/a Seattle Children's Research Institute | Hybrid and truncated immune cell proteins |
| TW202302145A (zh) | 2021-04-14 | 2023-01-16 | 美商基利科學股份有限公司 | CD47/SIRPα結合及NEDD8活化酶E1調節次單元之共抑制以用於治療癌症 |
| TW202313094A (zh) | 2021-05-18 | 2023-04-01 | 美商基利科學股份有限公司 | 使用FLT3L—Fc融合蛋白之方法 |
| EP4359415A1 (en) | 2021-06-23 | 2024-05-01 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| EP4359411A1 (en) | 2021-06-23 | 2024-05-01 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| US11932634B2 (en) | 2021-06-23 | 2024-03-19 | Gilead Sciences, Inc. | Diacylglycerol kinase modulating compounds |
| CN117396478A (zh) | 2021-06-23 | 2024-01-12 | 吉利德科学公司 | 二酰基甘油激酶调节化合物 |
| EP4394043A1 (en) * | 2021-08-24 | 2024-07-03 | Cells & Genes Biotech (Shanghai) Co., Ltd | Method for modifying cell |
| AU2022366987A1 (en) | 2021-10-14 | 2024-05-16 | Arsenal Biosciences, Inc. | Immune cells having co-expressed shrnas and logic gate systems |
| WO2023076983A1 (en) | 2021-10-28 | 2023-05-04 | Gilead Sciences, Inc. | Pyridizin-3(2h)-one derivatives |
| MX2024005066A (es) | 2021-10-29 | 2024-05-24 | Gilead Sciences Inc | Compuestos de cd73. |
| WO2023122615A1 (en) | 2021-12-22 | 2023-06-29 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| WO2023122581A2 (en) | 2021-12-22 | 2023-06-29 | Gilead Sciences, Inc. | Ikaros zinc finger family degraders and uses thereof |
| TW202340168A (zh) | 2022-01-28 | 2023-10-16 | 美商基利科學股份有限公司 | Parp7抑制劑 |
| WO2023173137A1 (en) * | 2022-03-11 | 2023-09-14 | Yale University | Compositions and methods for efficient and stable genetic modification of eukaryotic cells |
| IL315083A (en) | 2022-03-17 | 2024-10-01 | Gilead Sciences Inc | The IKAROS family of zinc fingers degrades and uses them |
| US20230355796A1 (en) | 2022-03-24 | 2023-11-09 | Gilead Sciences, Inc. | Combination therapy for treating trop-2 expressing cancers |
| WO2023187031A1 (en) * | 2022-04-01 | 2023-10-05 | Miltenyi Biotec B.V. & Co. KG | A system for drug-inducible expression of a polynucleotide |
| TW202345901A (zh) | 2022-04-05 | 2023-12-01 | 美商基利科學股份有限公司 | 用於治療結腸直腸癌之組合療法 |
| AU2023256670A1 (en) | 2022-04-21 | 2024-10-17 | Gilead Sciences, Inc. | Kras g12d modulating compounds |
| US20230348548A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Membrane-bound il-15, cd8 polypeptides, cells, compositions, and methods of using thereof |
| US20230348561A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Dominant negative tgfbeta receptor polypeptides, cd8 polypeptides, cells, compositions, and methods of using thereof |
| US20240066127A1 (en) | 2022-04-28 | 2024-02-29 | Immatics US, Inc. | Il-12 polypeptides, il-15 polypeptides, il-18 polypeptides, cd8 polypeptides, compositions, and methods of using thereof |
| CN114990069B (zh) * | 2022-05-17 | 2023-09-22 | 郑州大学第一附属医院 | 一种过表达slc43a2的嵌合抗原受体t细胞的制备方法和应用 |
| WO2023227900A1 (en) * | 2022-05-27 | 2023-11-30 | Autolus Limited | Method |
| AR129552A1 (es) * | 2022-06-10 | 2024-09-04 | Joint Stock Company Biocad | Ácido nucleico con actividad promotora y uso del mismo |
| WO2024006702A1 (en) * | 2022-06-27 | 2024-01-04 | Foundation Medicine, Inc. | Methods and systems for predicting genotypic calls from whole-slide images |
| US20240116928A1 (en) | 2022-07-01 | 2024-04-11 | Gilead Sciences, Inc. | Cd73 compounds |
| US20240091351A1 (en) | 2022-09-21 | 2024-03-21 | Gilead Sciences, Inc. | FOCAL IONIZING RADIATION AND CD47/SIRPa DISRUPTION ANTICANCER COMBINATION THERAPY |
| CN116179495A (zh) * | 2022-11-28 | 2023-05-30 | 上海恩凯细胞技术有限公司 | 转基因免疫细胞及其应用 |
| WO2024129984A1 (en) * | 2022-12-15 | 2024-06-20 | The Board Of Trustees Of The Leland Stanford Junior University | Homology-independent targeted dna insertion in human t cells |
| WO2024137652A2 (en) * | 2022-12-20 | 2024-06-27 | Abata Therapeutics, Inc. | Cell therapies for type 1 diabetes |
| US20240254118A1 (en) | 2022-12-22 | 2024-08-01 | Gilead Sciences, Inc. | Prmt5 inhibitors and uses thereof |
| CN118359729A (zh) * | 2023-01-19 | 2024-07-19 | 武汉昭智生物技术有限公司 | 一种car分子、包含其的细胞或外泌体及它们的应用 |
| CN116844685B (zh) * | 2023-07-03 | 2024-04-12 | 广州默锐医药科技有限公司 | 一种免疫治疗效果评估方法、装置、电子设备及存储介质 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030148982A1 (en) * | 2001-11-13 | 2003-08-07 | Brenner Malcolm K. | Bi-spcific chimeric T cells |
| WO2012079000A1 (en) * | 2010-12-09 | 2012-06-14 | The Trustees Of The University Of Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| WO2012140130A1 (en) * | 2011-04-13 | 2012-10-18 | Immunicum Ab | Method for proliferation of antigen-specific t cells |
| WO2013123061A1 (en) * | 2012-02-13 | 2013-08-22 | Seattle Children's Hospital D/B/A Seattle Children's Research Institute | Bispecific chimeric antigen receptors and therapeutic uses thereof |
| WO2014031687A1 (en) * | 2012-08-20 | 2014-02-27 | Jensen, Michael | Method and compositions for cellular immunotherapy |
Family Cites Families (82)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0557459B1 (en) | 1990-11-13 | 1997-10-22 | Immunex Corporation | Bifunctional selectable fusion genes |
| US20020111474A1 (en) * | 1990-12-14 | 2002-08-15 | Capon Daniel J. | Chimeric chains for receptor-associated signal transduction pathways |
| EP0650367A4 (en) | 1992-06-01 | 1998-04-15 | New England Medical Center Inc | BLOCKING OF INTERCELLULAR INTERACTIONS WITH CD43 CHEMICAL MOLECULES. |
| US5827642A (en) | 1994-08-31 | 1998-10-27 | Fred Hutchinson Cancer Research Center | Rapid expansion method ("REM") for in vitro propagation of T lymphocytes |
| US5783186A (en) | 1995-12-05 | 1998-07-21 | Amgen Inc. | Antibody-induced apoptosis |
| US6133027A (en) * | 1996-08-07 | 2000-10-17 | City Of Hope | Inducible expression system |
| US6660257B1 (en) | 1996-10-25 | 2003-12-09 | Pharmacia Corporation | Circular permuteins of flt3 ligand |
| AU2472400A (en) | 1998-10-20 | 2000-05-08 | City Of Hope | CD20-specific redirected T cells and their use in cellular immunotherapy of CD20+ malignancies |
| US6912492B1 (en) * | 1999-05-25 | 2005-06-28 | University Of Medicine & Dentistry Of New Jersey | Methods for diagnosing, preventing, and treating developmental disorders due to a combination of genetic and environmental factors |
| JP4045713B2 (ja) | 2000-01-31 | 2008-02-13 | 松下電器産業株式会社 | 自動機用溶接機 |
| GB0015119D0 (en) * | 2000-06-20 | 2000-08-09 | Angeletti P Ist Richerche Bio | Methods and means for regulation of gene expression |
| KR100545945B1 (ko) | 2000-07-03 | 2006-01-25 | 갈라 디자인, 인크. | 발현 벡터 |
| GB0025307D0 (en) | 2000-10-16 | 2000-11-29 | Celltech Chiroscience Ltd | Biological products |
| AU2001297703B2 (en) | 2000-11-07 | 2006-10-19 | City Of Hope | CD19-specific redirected immune cells |
| EP1366067B1 (en) | 2001-03-07 | 2012-09-26 | Merck Patent GmbH | Expression technology for proteins containing a hybrid isotype antibody moiety |
| US7070995B2 (en) * | 2001-04-11 | 2006-07-04 | City Of Hope | CE7-specific redirected immune cells |
| US20090257994A1 (en) | 2001-04-30 | 2009-10-15 | City Of Hope | Chimeric immunoreceptor useful in treating human cancers |
| WO2002097099A1 (en) * | 2001-05-29 | 2002-12-05 | Valentis, Inc. | Regulated expression of ghrh |
| IL160933A0 (en) | 2001-09-18 | 2004-08-31 | Proteologics Inc | Methods and compositions for treating ?cap associated diseases |
| WO2003087338A2 (en) | 2002-04-11 | 2003-10-23 | Amgen, Inc. | Her-2 receptor tyrosine kinase molecules and uses thereof |
| WO2004029284A2 (en) | 2002-09-30 | 2004-04-08 | Protein Design Labs, Inc. | Efficient generation of stable expression cell lines through the use of scorable homeostatic reporter genes |
| CA2516455C (en) * | 2003-02-20 | 2012-05-01 | Seattle Genetics, Inc. | Anti-cd70 antibody-drug conjugates and their use for the treatment of cancer and immune disorders |
| US20050129671A1 (en) | 2003-03-11 | 2005-06-16 | City Of Hope | Mammalian antigen-presenting T cells and bi-specific T cells |
| US20060160090A1 (en) | 2003-04-11 | 2006-07-20 | Macina Robert A | Composition splice variants and methods relating to cancer specific genes and proteins |
| CN1809277A (zh) * | 2003-04-18 | 2006-07-26 | 诺伍德免疫学有限公司 | 先于胸腺再活化的移植物耐受 |
| WO2005017102A2 (en) | 2003-05-30 | 2005-02-24 | Diadexus, Inc. | Compositions, splice variants and methods relating to ovarian specific nucleic acids and proteins |
| EP1649020B1 (en) * | 2003-07-21 | 2017-01-11 | MSD Italia S.r.l. | Synthetic gene encoding human epidermal growth factor 2/neu antigen and uses thereof |
| US20070087346A1 (en) | 2003-10-24 | 2007-04-19 | Gennaro Ciliberto | Orthogonal gene switches |
| US8071364B2 (en) | 2003-12-24 | 2011-12-06 | Transgenrx, Inc. | Gene therapy using transposon-based vectors |
| US20090098142A1 (en) | 2004-06-09 | 2009-04-16 | Kasaian Marion T | Methods and compositions for treating and monitoring treatment of IL-13-associated disorders |
| US7910101B2 (en) * | 2004-10-25 | 2011-03-22 | Centocor, Inc. | Melanocortin receptor binding mimetibodies, compositions, methods and uses |
| DE202005002921U1 (de) | 2005-02-23 | 2005-04-21 | Magcode Ag | Verbindungssystem, insbesondere elektrisches Verbindungssystem |
| CN101212977A (zh) * | 2005-06-01 | 2008-07-02 | 国际创新生物技术研究所有限公司 | 葡萄糖可诱导的胰岛素表达和治疗糖尿病的方法 |
| JP2009538144A (ja) | 2006-05-22 | 2009-11-05 | ハイプロセル・リミテッド・ライアビリティ・カンパニー | 真核細胞株を用いたタンパク質産生 |
| WO2008012237A1 (en) * | 2006-07-24 | 2008-01-31 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti Spa | Multi-antigen construct and uses thereof |
| US7709253B2 (en) | 2006-08-04 | 2010-05-04 | The Board Of Trustees Of The Leland Stanford Junior University | Ligand-regulable transactivation systems, methods of use thereof, methods of detecting estrogen receptor ligands, and methods of differentiating estrogen receptor ligand agonists and antagonists |
| EP2171456A2 (en) * | 2007-07-25 | 2010-04-07 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Self coupling recombinant antibody fusion proteins |
| US8450112B2 (en) | 2008-04-09 | 2013-05-28 | Maxcyte, Inc. | Engineering and delivery of therapeutic compositions of freshly isolated cells |
| PT3006459T (pt) | 2008-08-26 | 2021-11-26 | Hope City | Método e composições para funcionamento melhorado de efetores antitumorais de células t |
| EP3502256A3 (en) | 2008-09-26 | 2019-09-25 | Tocagen Inc. | Recombinant vectors |
| US8829173B2 (en) | 2008-09-26 | 2014-09-09 | Tocagen Inc. | Recombinant vectors |
| US8329882B2 (en) * | 2009-02-18 | 2012-12-11 | California Institute Of Technology | Genetic control of mammalian cells with synthetic RNA regulatory systems |
| WO2010141543A1 (en) * | 2009-06-02 | 2010-12-09 | Targeted Molecular Diagnostics, Llc | Methods for the detection and quantitation of the p95 component of her2/neu (erbb2) |
| US9873035B2 (en) * | 2009-07-09 | 2018-01-23 | Cfph, Llc | Amusement device for a game of chance involving one or more rolling indicators on a rotating element with position indicators |
| AU2010301042B2 (en) | 2009-10-01 | 2014-03-20 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Anti-vascular endothelial growth factor receptor-2 chimeric antigen receptors and use of same for the treatment of cancer |
| SI2496698T1 (sl) | 2009-11-03 | 2019-07-31 | City Of Hope | Skrajšan epiderimalni receptor faktorja rasti (EGFRt) za selekcijo transduciranih T celic |
| JP5285678B2 (ja) | 2010-06-18 | 2013-09-11 | 株式会社エヌ・ティ・ティ・ドコモ | 移動通信方法及びコアネットワーク装置 |
| ES2754394T3 (es) * | 2010-09-08 | 2020-04-17 | Chemotherapeutisches Forschungsinstitut Georg Speyer Haus | Receptores de antígenos quiméricos con una región bisagra optimizada |
| SG192010A1 (en) * | 2011-01-18 | 2013-08-30 | Univ Pennsylvania | Compositions and methods for treating cancer |
| CN106074601A (zh) * | 2011-03-23 | 2016-11-09 | 弗雷德哈钦森癌症研究中心 | 用于细胞免疫治疗的方法和组合物 |
| US20130071414A1 (en) * | 2011-04-27 | 2013-03-21 | Gianpietro Dotti | Engineered cd19-specific t lymphocytes that coexpress il-15 and an inducible caspase-9 based suicide gene for the treatment of b-cell malignancies |
| EP3489366B1 (en) | 2011-06-01 | 2019-12-25 | Precision Biosciences, Inc. | Methods for producing engineered mammalian cell lines with amplified transgenes |
| PE20141212A1 (es) * | 2011-06-22 | 2014-09-19 | Hoffmann La Roche | Eliminacion de celulas diana por parte de celulas t citotoxicas especificas de virus utilizando complejos que comprenden mhc de clase 1 |
| JP6267644B2 (ja) | 2011-10-20 | 2018-01-24 | アメリカ合衆国 | 抗cd22キメラ抗原受容体 |
| DE102011118018B4 (de) | 2011-10-25 | 2017-10-26 | Plasmidfactory Gmbh & Co. Kg | Minicircles mit Transpositionskassetten und ihre Verwendung zur Transformation von Zellen |
| US10391126B2 (en) | 2011-11-18 | 2019-08-27 | Board Of Regents, The University Of Texas System | CAR+ T cells genetically modified to eliminate expression of T-cell receptor and/or HLA |
| ITRM20120058A1 (it) | 2012-02-20 | 2013-08-21 | Pisanelli Giovanni Codacci | Famiglia di molecole a base di zuccheri ad uso terapeutico e relativo procedimento di produzione |
| JP2015509717A (ja) * | 2012-02-22 | 2015-04-02 | ザ トラスティーズ オブ ザ ユニバーシティ オブ ペンシルバニア | 抗腫瘍活性およびcar存続性を強化するためのicosベースのcarの使用 |
| EA033110B1 (ru) * | 2012-04-11 | 2019-08-30 | Дзе Юнайтед Стейтс Оф Америка, Эз Репрезентед Бай Дзе Секретари, Департмент Оф Хелс Энд Хьюман Сёрвисез | Химерный рецептор антигена, направленный на антиген созревания b-клеток, кодирующая его нуклеиновая кислота, соответствующие экспрессионный вектор, клетка-хозяин, применения и способы |
| US20130280220A1 (en) | 2012-04-20 | 2013-10-24 | Nabil Ahmed | Chimeric antigen receptor for bispecific activation and targeting of t lymphocytes |
| WO2013177533A1 (en) | 2012-05-25 | 2013-11-28 | California Institute Of Technology | Expression of secreted and cell-surface polypeptides |
| IN2014DN10996A (ru) | 2012-05-30 | 2015-09-25 | Baylor College Medicine | |
| EP2669378A1 (en) | 2012-05-31 | 2013-12-04 | Helmut Hanenberg | Cytochrome P450 suicide gene system |
| WO2013180287A1 (ja) | 2012-06-01 | 2013-12-05 | 日本電気株式会社 | スイッチングシステム、ラインカード、スイッチカード、fdb学習方法、fdb学習調停方法及びプログラム |
| US10316289B2 (en) * | 2012-09-06 | 2019-06-11 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Methods of producing T memory stem cell populations |
| WO2014055657A1 (en) | 2012-10-05 | 2014-04-10 | The Trustees Of The University Of Pennsylvania | Use of a trans-signaling approach in chimeric antigen receptors |
| WO2014097442A1 (ja) | 2012-12-20 | 2014-06-26 | 三菱電機株式会社 | 車載装置及びプログラム |
| WO2014099671A1 (en) | 2012-12-20 | 2014-06-26 | Bluebird Bio, Inc. | Chimeric antigen receptors and immune cells targeting b cell malignancies |
| EP3241897B1 (en) | 2013-03-07 | 2018-10-03 | Baylor College of Medicine | Targeting cd138 in cancer |
| EP2777711A1 (en) * | 2013-03-11 | 2014-09-17 | Icon Genetics GmbH | Her2/Neu cancer vaccine |
| TWI654206B (zh) | 2013-03-16 | 2019-03-21 | 諾華公司 | 使用人類化抗-cd19嵌合抗原受體治療癌症 |
| CN105408473B9 (zh) * | 2013-05-14 | 2021-09-17 | 得克萨斯州大学系统董事会 | 工程化嵌合抗原受体(car)t细胞的人应用 |
| US9108442B2 (en) | 2013-08-20 | 2015-08-18 | Ricoh Company, Ltd. | Image forming apparatus |
| BR112016009898A2 (pt) | 2013-10-31 | 2017-12-05 | Hutchinson Fred Cancer Res | células-tronco/progenitoras hematopoiéticas e efetoras não-t modificadas e usos das mesmas |
| ES2832586T3 (es) | 2013-11-21 | 2021-06-10 | Autolus Ltd | Célula |
| CA2936501A1 (en) | 2014-01-13 | 2015-07-16 | Stephen J. Forman | Chimeric antigen receptors (cars) having mutations in the fc spacer region and methods for their use |
| EP3593812A3 (en) | 2014-03-15 | 2020-05-27 | Novartis AG | Treatment of cancer using chimeric antigen receptor |
| IL297591A (en) | 2014-04-10 | 2022-12-01 | Seattle Childrens Hospital Dba Seattle Childrens Res Inst | Drug-related transgene expression |
| MX2018001568A (es) | 2015-08-07 | 2019-04-25 | Seattle Children´S Hospital Dba Seattle Children´S Res Institute | Celulas t biespecificas de receptor quimerico de antigeno (car) para focalizacion a tumores solidos. |
| KR20180105709A (ko) | 2016-02-05 | 2018-09-28 | 시티 오브 호프 | 중추 신경계의 암의 치료를 위한 조작된 t 세포의 투여 |
| US11408005B2 (en) | 2016-12-12 | 2022-08-09 | Seattle Children's Hospital | Chimeric transcription factor variants with augmented sensitivity to drug ligand induction of transgene expression in mammalian cells |
| US10714296B2 (en) | 2018-12-12 | 2020-07-14 | Axcelis Technologies, Inc. | Ion source with tailored extraction shape |
-
2015
- 2015-04-08 IL IL297591A patent/IL297591A/en unknown
- 2015-04-08 EP EP15776211.3A patent/EP3129053A4/en not_active Withdrawn
- 2015-04-08 ES ES15776745T patent/ES2867224T3/es active Active
- 2015-04-08 WO PCT/US2015/024868 patent/WO2015157386A1/en active Application Filing
- 2015-04-08 MX MX2016013144A patent/MX2016013144A/es unknown
- 2015-04-08 WO PCT/US2015/024947 patent/WO2015157432A1/en active Application Filing
- 2015-04-08 US US15/302,403 patent/US10865242B2/en active Active
- 2015-04-08 MX MX2016013160A patent/MX2016013160A/es unknown
- 2015-04-08 IL IL248243A patent/IL248243B2/en unknown
- 2015-04-08 RU RU2016143381A patent/RU2752275C2/ru active
- 2015-04-08 JP JP2017504604A patent/JP6788573B6/ja active Active
- 2015-04-08 MY MYPI2016703719A patent/MY185678A/en unknown
- 2015-04-08 CA CA2945305A patent/CA2945305C/en active Active
- 2015-04-08 ES ES15777065T patent/ES2880932T3/es active Active
- 2015-04-08 MX MX2016013159A patent/MX2016013159A/es unknown
- 2015-04-08 CA CA2945302A patent/CA2945302A1/en active Pending
- 2015-04-08 KR KR1020167031070A patent/KR102509481B1/ko active IP Right Grant
- 2015-04-08 WO PCT/US2015/024882 patent/WO2015157391A1/en active Application Filing
- 2015-04-08 RU RU2016143384A patent/RU2729112C2/ru active
- 2015-04-08 RU RU2016143385A patent/RU2751921C2/ru active
- 2015-04-08 US US15/302,420 patent/US10611837B2/en active Active
- 2015-04-08 JP JP2016561839A patent/JP2017515464A/ja active Pending
- 2015-04-08 SG SG11201608393TA patent/SG11201608393TA/en unknown
- 2015-04-08 US US15/302,449 patent/US20170029774A1/en not_active Abandoned
- 2015-04-08 BR BR112016023517A patent/BR112016023517A2/pt not_active Application Discontinuation
- 2015-04-08 CN CN202110101875.0A patent/CN112877291A/zh active Pending
- 2015-04-08 KR KR1020237007831A patent/KR20230038310A/ko active IP Right Grant
- 2015-04-08 AU AU2015243922A patent/AU2015243922B2/en active Active
- 2015-04-08 KR KR1020167031068A patent/KR102387243B1/ko active IP Right Review Request
- 2015-04-08 WO PCT/US2015/024866 patent/WO2015157384A1/en active Application Filing
- 2015-04-08 AU AU2015243849A patent/AU2015243849B2/en active Active
- 2015-04-08 NZ NZ73944815A patent/NZ739448A/en unknown
- 2015-04-08 CA CA2945308A patent/CA2945308C/en active Active
- 2015-04-08 MY MYPI2016703721A patent/MY184163A/en unknown
- 2015-04-08 JP JP2016561722A patent/JP6772068B2/ja active Active
- 2015-04-08 SG SG10201808811QA patent/SG10201808811QA/en unknown
- 2015-04-08 IL IL248238A patent/IL248238B1/en unknown
- 2015-04-08 SG SG11201608395PA patent/SG11201608395PA/en unknown
- 2015-04-08 NZ NZ725081A patent/NZ725081A/en not_active IP Right Cessation
- 2015-04-08 CA CA2945303A patent/CA2945303C/en active Active
- 2015-04-08 CN CN201580030814.2A patent/CN106536558A/zh active Pending
- 2015-04-08 KR KR1020167031067A patent/KR102508166B1/ko active IP Right Grant
- 2015-04-08 MX MX2016013149A patent/MX2016013149A/es unknown
- 2015-04-08 JP JP2016561635A patent/JP6765967B2/ja active Active
- 2015-04-08 BR BR112016023500-2A patent/BR112016023500B1/pt active IP Right Grant
- 2015-04-08 SG SG11201608396YA patent/SG11201608396YA/en unknown
- 2015-04-08 CN CN202110842538.7A patent/CN113528581A/zh active Pending
- 2015-04-08 EP EP15777065.2A patent/EP3129399B1/en active Active
- 2015-04-08 CN CN201580029752.3A patent/CN106535934A/zh active Pending
- 2015-04-08 MY MYPI2016703722A patent/MY192522A/en unknown
- 2015-04-08 AU AU2015243882A patent/AU2015243882C1/en active Active
- 2015-04-08 JP JP2016561659A patent/JP6765968B2/ja active Active
- 2015-04-08 SG SG11201608392WA patent/SG11201608392WA/en unknown
- 2015-04-08 EP EP21175647.3A patent/EP3943507A1/en active Pending
- 2015-04-08 KR KR1020227011931A patent/KR102600544B1/ko active IP Right Grant
- 2015-04-08 SG SG10201808825XA patent/SG10201808825XA/en unknown
- 2015-04-08 NZ NZ725079A patent/NZ725079A/en unknown
- 2015-04-08 EP EP15776745.0A patent/EP3129405B1/en active Active
- 2015-04-08 EP EP22151326.0A patent/EP4056201A1/en active Pending
- 2015-04-08 CN CN201580030815.7A patent/CN106661570B/zh active Active
- 2015-04-08 RU RU2016143388A patent/RU2751920C2/ru active
- 2015-04-08 BR BR112016023523A patent/BR112016023523A2/pt active Search and Examination
- 2015-04-08 MY MYPI2016703720A patent/MY186846A/en unknown
- 2015-04-08 KR KR1020167031064A patent/KR102463529B1/ko active IP Right Review Request
- 2015-04-08 US US15/302,415 patent/US10266592B2/en active Active
- 2015-04-08 AU AU2015243927A patent/AU2015243927B2/en active Active
- 2015-04-08 EP EP21180797.9A patent/EP3954708A1/en active Pending
- 2015-04-08 EP EP15777020.7A patent/EP3129471A4/en active Pending
- 2015-04-08 WO PCT/US2015/024895 patent/WO2015157399A1/en active Application Filing
- 2015-04-08 CN CN201580030056.4A patent/CN106574246A/zh active Pending
- 2015-04-08 US US15/302,426 patent/US20170015746A1/en not_active Abandoned
- 2015-04-08 KR KR1020227038237A patent/KR102618955B1/ko active IP Right Review Request
- 2015-04-08 AU AU2015243920A patent/AU2015243920B2/en active Active
- 2015-04-08 SG SG10201808833XA patent/SG10201808833XA/en unknown
- 2015-04-08 KR KR1020167031069A patent/KR20160144431A/ko active IP Right Grant
- 2015-04-08 RU RU2016143389A patent/RU2016143389A/ru not_active Application Discontinuation
- 2015-04-08 CN CN201580027077.0A patent/CN106573969B/zh active Active
- 2015-04-08 MX MX2016013158A patent/MX2016013158A/es unknown
- 2015-04-08 SG SG10201808819XA patent/SG10201808819XA/en unknown
- 2015-04-08 EP EP15776501.7A patent/EP3129480A4/en active Pending
- 2015-04-08 CA CA2945320A patent/CA2945320A1/en active Pending
-
2016
- 2016-10-06 IL IL248235A patent/IL248235B/en active IP Right Grant
- 2016-10-06 IL IL248229A patent/IL248229B2/en unknown
- 2016-10-06 MX MX2022010807A patent/MX2022010807A/es unknown
- 2016-10-10 PH PH12016502010A patent/PH12016502010A1/en unknown
- 2016-10-10 SA SA516380056A patent/SA516380056B1/ar unknown
- 2016-10-10 PH PH12016502009A patent/PH12016502009A1/en unknown
- 2016-10-10 PH PH12016502012A patent/PH12016502012A1/en unknown
- 2016-10-10 PH PH12016502011A patent/PH12016502011A1/en unknown
- 2016-10-13 ZA ZA2016/07060A patent/ZA201607060B/en unknown
- 2016-10-13 ZA ZA2016/07061A patent/ZA201607061B/en unknown
-
2019
- 2019-02-27 US US16/287,074 patent/US11155616B2/en active Active
-
2020
- 2020-02-19 US US16/794,673 patent/US11414486B2/en active Active
- 2020-06-18 JP JP2020105133A patent/JP7062720B2/ja active Active
- 2020-09-16 JP JP2020155809A patent/JP7093385B2/ja active Active
- 2020-09-16 JP JP2020155429A patent/JP7148580B2/ja active Active
- 2020-09-30 JP JP2020164326A patent/JP7106610B2/ja active Active
- 2020-11-12 US US17/096,138 patent/US20210139583A1/en active Pending
- 2020-11-13 US US17/097,630 patent/US20210371517A1/en active Pending
-
2021
- 2021-01-04 AU AU2021200007A patent/AU2021200007B2/en active Active
- 2021-03-17 AU AU2021201679A patent/AU2021201679B2/en active Active
- 2021-09-10 US US17/472,284 patent/US20220064292A1/en active Pending
- 2021-11-26 AU AU2021273652A patent/AU2021273652A1/en not_active Abandoned
-
2022
- 2022-04-20 JP JP2022069142A patent/JP7542270B2/ja active Active
- 2022-04-21 US US17/660,114 patent/US20220372140A1/en active Pending
- 2022-07-13 JP JP2022112278A patent/JP7402933B2/ja active Active
- 2022-07-15 US US17/812,848 patent/US20220380461A1/en active Pending
- 2022-09-22 JP JP2022150928A patent/JP7508516B2/ja active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030148982A1 (en) * | 2001-11-13 | 2003-08-07 | Brenner Malcolm K. | Bi-spcific chimeric T cells |
| WO2012079000A1 (en) * | 2010-12-09 | 2012-06-14 | The Trustees Of The University Of Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| WO2012140130A1 (en) * | 2011-04-13 | 2012-10-18 | Immunicum Ab | Method for proliferation of antigen-specific t cells |
| WO2013123061A1 (en) * | 2012-02-13 | 2013-08-22 | Seattle Children's Hospital D/B/A Seattle Children's Research Institute | Bispecific chimeric antigen receptors and therapeutic uses thereof |
| WO2014031687A1 (en) * | 2012-08-20 | 2014-02-27 | Jensen, Michael | Method and compositions for cellular immunotherapy |
Non-Patent Citations (8)
| Title |
|---|
| BURNS W. R. et al., A high molecular weight melanoma-associated antigen-specific chimeric antigen receptor redirects lymphocytes to target human melanomas, Cancer research, 2010, V. 70, N. 8, p.3027-3033. * |
| CHEN X. et al., Fusion protein linkers: property, design and functionality, Advanced drug delivery reviews, 2013, V. 65, N. 10, p.1357-1369. * |
| DOLEZAL O. et al., ScFv multimers of the anti-neuraminidase antibody NC10: shortening of the linker in single-chain Fv fragment assembled in VL to VH orientation drives the formation of dimers, trimers, tetramers and higher molecular mass multimers, Protein engineering, 2000, V. 13, N. 8, p.565-574. * |
| MAEDA Y. et al., Engineering of functional chimeric protein G-VargulaLuciferase, Analytical biochemistry, 1997, V. 249, N. 2, p.147-152. * |
| MAUS M. V. et al., T cells expressing chimeric antigen receptors can cause anaphylaxis in humans, Cancer immunology research, 2013, V. 1, N. 1, p.26-31. * |
| TEPLYAKOV A. et al., Antibody modeling assessment II. Structures and models, Proteins: Structure, Function, and Bioinformatics, 2014, V. 82, N. 8, p.1563-1582. * |
| ЛИКАРЬ Ю. Н. и др., Использование мутированного варианта человеческой деоксицитидинкиназы в качестве репортерного гена для оценки адоптивной Т-клеточной терапии, Вопросы гематологии, онкологии и иммунопатологии в педиатрии, 2012, V. 11, N. 2, p.23-31. * |
| ЛИКАРЬ Ю. Н. и др., Использование мутированного варианта человеческой деоксицитидинкиназы в качестве репортерного гена для оценки адоптивной Т-клеточной терапии, Вопросы гематологии, онкологии и иммунопатологии в педиатрии, 2012, V. 11, N. 2, p.23-31. MAUS M. V. et al., T cells expressing chimeric antigen receptors can cause anaphylaxis in humans, Cancer immunology research, 2013, V. 1, N. 1, p.26-31. BURNS W. R. et al., A high molecular weight melanoma-associated antigen-specific chimeric antigen receptor redirects lymphocytes to target human melanomas, Cancer research, 2010, V. 70, N. 8, p.3027-3033. TEPLYAKOV A. et al., Antibody modeling assessment II. Structures and models, Proteins: Structure, Function, and Bioinformatics, 2014, V. 82, N. 8, p.1563-1582. CHEN X. et al., Fusion protein linkers: property, design and functionality, Advanced drug delivery reviews, 2013, V. 65, N. 10, p.1357-1369. MAEDA Y. et al., Engineering of functional chimeric protein G-VargulaLuciferase, Analytic * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2021200007B2 (en) | Defined composition gene modified T-cell products | |
| TW202134264A (zh) | 嵌合抗原受體及其用途 | |
| JP2021534783A (ja) | キメラ抗原受容体発現細胞を作製する方法 | |
| US20210324388A1 (en) | A Method to Specifically Stimulate Survival and Expansion of Genetically-Modified Immune Cells | |
| AU2017368320A1 (en) | Cancer immuno therapy with highly enriched CD8+ chimeric antigen receptor T cells | |
| JP2023516008A (ja) | キメラ抗原受容体発現細胞を作製する方法 | |
| WO2019152660A1 (en) | Combination therapy using a chimeric antigen receptor | |
| WO2021148019A1 (zh) | 病毒载体转导细胞的方法 | |
| US20220195441A1 (en) | Combinatorial car t cell and hematopoeitic stem cell genetic engineering for specific immunotherapy of myeloid leukemias | |
| TW202423983A (zh) | 使用嵌合抗原受體療法的自體免疫性障礙的治療 | |
| IL292542A (en) | A drug for the treatment of cancer, a mixture of drugs, a medicinal preparation, a cell that responds to an immune campaign, a carrier for the transfer of nucleic acids and a product | |
| JP2024532876A (ja) | プライマリー免疫細胞を作製するための方法 | |
| US20210017246A1 (en) | Il-13 receptor alpha 2 targeted, zetakine directed t cell immunotherapy | |
| US20240085403A1 (en) | Method for inhibiting adventitious viral infection | |
| US20230374104A1 (en) | Methods and compositions comprising pd1 chimeric polypeptides | |
| WO2023091420A2 (en) | Compositions and methods for t cell engineering | |
| KR20230021022A (ko) | 항-cd171 키메라 항원 수용체 |