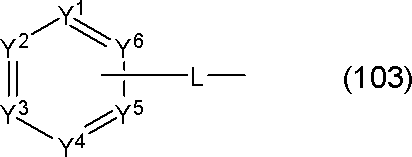WO2012133188A1 - 有機エレクトロルミネッセンス素子 - Google Patents
有機エレクトロルミネッセンス素子 Download PDFInfo
- Publication number
- WO2012133188A1 WO2012133188A1 PCT/JP2012/057520 JP2012057520W WO2012133188A1 WO 2012133188 A1 WO2012133188 A1 WO 2012133188A1 JP 2012057520 W JP2012057520 W JP 2012057520W WO 2012133188 A1 WO2012133188 A1 WO 2012133188A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- organic
- compound
- energy
- layer
- egs
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/02—Use of particular materials as binders, particle coatings or suspension media therefor
- C09K11/025—Use of particular materials as binders, particle coatings or suspension media therefor non-luminescent particle coatings or suspension media
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/20—Delayed fluorescence emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/27—Combination of fluorescent and phosphorescent emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/30—Highest occupied molecular orbital [HOMO], lowest unoccupied molecular orbital [LUMO] or Fermi energy values
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/40—Interrelation of parameters between multiple constituent active layers or sublayers, e.g. HOMO values in adjacent layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Organic Chemistry (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
Abstract
Description
蛍光型の有機EL素子は、近年、長寿命化技術が進展し、携帯電話やテレビ等のフルカラーディスプレイへ応用されつつあるものの、高効率化が課題であった。
このTTF機構による遅延蛍光を利用すると、蛍光型発光においても理論的に内部量子効率を40%まで高めることができると考えられている。しかしながら、依然として燐光型発光に比べて高効率化の課題を有するものである。そこで、さらなる内部量子効率向上を図るべく、他の遅延蛍光のメカニズムを利用するものが検討されている。
このため、TADF機構による遅延蛍光を利用については、まだ実用上の課題が多く残されていると考えられ、特に実用的な高電流密度領域における発光効率の向上が要望されている。
一対の電極間に有機化合物層を備える有機エレクトロルミネッセンス素子であって、
前記有機化合物層は、第一の材料と第二の材料とを含む発光層を有し、
前記第二の材料は、蛍光発光を示す材料であり、
前記第一の材料の一重項エネルギーEgS(H)と前記第二の材料の一重項エネルギーEgS(D)とが、下記数式(1)の関係を満たし、
前記第一の材料は、前記一重項エネルギーEgS(H)と、77[K]におけるエネルギーギャップEg77K(H)との差ΔST(H)が、下記数式(2)の関係を満たす
ことを特徴とする。
遅延蛍光比率とは、全発光強度に対する遅延蛍光に由来する発光強度の割合に相当する。より具体的には、後述の算出方法により導かれるものである。
前記第一の材料の77[K]におけるエネルギーギャップEg77K(H)と、前記第二の材料の77[K]におけるエネルギーギャップEg77K(D)との差ΔTが、下記数式(3)の関係を満たす
ことが好ましい。
以下、本発明に係る有機EL素子の素子構成について説明する。
本発明の有機EL素子は、一対の電極間に有機化合物層を備える。この有機化合物層は、有機化合物で構成される層を少なくとも一層、有する。有機化合物層は、無機化合物を含んでいてもよい。
本発明の有機EL素子において、有機化合物層のうち少なくとも1層は、発光層を有する。そのため、有機化合物層は、例えば、一層の発光層で構成されていてもよいし、正孔注入層、正孔輸送層、電子注入層、電子輸送層、正孔障壁層、電子障壁層等の公知の有機EL素子で採用される層を有していてもよい。
(a)陽極/発光層/陰極
(b)陽極/正孔注入・輸送層/発光層/陰極
(c)陽極/発光層/電子注入・輸送層/陰極
(d)陽極/正孔注入・輸送層/発光層/電子注入・輸送層/陰極
(e)陽極/正孔注入・輸送層/発光層/障壁層/電子注入・輸送層/陰極
などの構造を挙げることができる。
上記の中で(d)の構成が好ましく用いられるが、もちろんこれらに限定されるものではない。
なお、上記「発光層」とは、一般的にドーピングシステムが採用されており、第一の材料と第二の材料とを含む有機化合物層である。第一の材料は、一般的に電子と正孔の再結合を促し、再結合により生じた励起エネルギーを第二の材料に伝達させる。このような第一の材料は、ホスト材料と呼ばれることが多く、以下の説明でも、第一の材料のことをホスト材料という。また、第二の材料は、一般的にホスト材料(第一の材料)から励起エネルギーを受け取り、高い発光性能を示す。このような第二の材料は、ドーパント材料と呼ばれることが多く、以下の説明でも、第二の材料のことをドーパント材料という。ドーパント材料としては、量子収率の高い化合物が好まれる。本発明では、ドーパント材料は、蛍光発光を示す材料が用いられる。
上記「正孔注入・輸送層」は「正孔注入層および正孔輸送層のうちの少なくともいずれか1つ」を意味し、「電子注入・輸送層」は「電子注入層および電子輸送層のうちの少なくともいずれか1つ」を意味する。ここで、正孔注入層および正孔輸送層を有する場合には、陽極側に正孔注入層が設けられていることが好ましい。また、電子注入層および電子輸送層を有する場合には、陰極側に電子注入層が設けられていることが好ましい。
本発明において電子輸送層といった場合には、発光層と陰極との間に存在する電子輸送領域の有機層のうち、最も電子移動度の高い有機層をいう。電子輸送領域が一層で構成されている場合には、当該層が電子輸送層である。また、発光層と電子輸送層との間には、構成(e)に示すように発光層で生成された励起エネルギーの拡散を防ぐ目的で、必ずしも電子移動度の高くない障壁層が設けられることがある。そのため、発光層に隣接する有機層が電子輸送層に必ずしも該当しない。
有機EL素子1は、透光性の基板2と、陽極3と、陰極4と、陽極3と陰極4との間に配置された有機化合物層10と、を有する。
有機化合物層10は、ホスト材料およびドーパント材料を含む発光層5を有する。また、有機化合物層10は、発光層5と陽極3との間に、陽極3から順に、正孔注入層6、正孔輸送層7を有する。さらに、有機化合物層10は、発光層5と陰極4との間に、発光層5側から順に、電子輸送層8、電子注入層9を有する。
本発明では、上記のとおり、発光層のホスト材料、及びドーパント材料に特定の条件を満たす化合物を用いる。この特定の条件について、次に説明する。
本発明者らは、ホスト材料として、一重項エネルギーEgSと三重項エネルギーEgTとのエネルギー差(ΔST)が小さい化合物を用いると、高電流密度領域で有機EL素子が高効率で発光することを見出した。上記ΔST(H)は、ホスト材料のΔSTについて示すものである。
一重項エネルギーEgSと三重項エネルギーEgTの差に値するΔSTを小さくするには、量子化学的には、一重項エネルギーEgSと三重項エネルギーEgTにおける交換相互作用が小さいことで実現する。ΔSTと交換相互作用の関係性における物理的な詳細に関しては、例えば、
文献1:安達千波矢ら、有機EL討論会 第10回例会予稿集、S2-5,p11~12
文献2:徳丸克己、有機光化学反応論、東京化学同人出版、(1973)
に記載されている。このような材料は、量子計算により分子設計を行い合成することが可能であり、具体的には、LUMO、及びHOMOの電子軌道を重ねないように局在化させた化合物である。
本発明のホスト材料に用いるΔSTの小さな化合物の例としては、分子内でドナー要素とアクセプター要素とを結合した化合物であり、さらに電気化学的な安定性(酸化還元安定性)を考慮し、ΔSTが0eV以上0.3eV未満の化合物が挙げられる。
好ましいドナー要素は、カルバゾール構造、アリールアミン構造等である。
好ましいアクセプター要素は、アジン環構造、アザ芳香族環構造、アザ含酸素環構造、CN置換芳香族環、ケトン含有環等である。
本発明における、カルバゾール構造、アジン環構造、アザ芳香族環構造、アザ含酸素環構造とは、それぞれ、カルバゾール、アジン環、アザ芳香族環、アザ含酸素環を部分構造とするものも含む環構造をいう。また、これらの環構造は適宜、置換基を保有してもよい。置換基としては、炭素数6~40のアリール基、炭素数2~40の複素環基、トリアルキルシリル基、ジアルキルアリールシリル基、アルキルジアリールシリル基、トリアリールシリル基、フッ素原子、シアノ基等があげられる。この置換基におけるトリアルキルシリル基、ジアルキルアリールシリル基、アルキルジアリールシリル基、及びトリアリールシリル基は、炭素数1~30のアルキル基、及び炭素数6~30のアリール基の少なくともいずれかを含む。なお、水素原子には重水素原子を含む。
ドナー要素とアクセプター要素とを結合するとは各種、連結基で結合することを意味する。好ましい連結基は、単結合、フェニレン構造、メタビフェニレン構造である。本発明の開示に基づき、量子化学的な考察を加え、さらに最適化を行うことにより、ΔSTが0.3eV未満の化合物を本発明のホスト材料として使用することができる。
また、より好ましい化合物は、分子の励起状態で形成される双極子(ダイポール)が互いに相互作用し、交換相互作用エネルギーが小さくなるような会合体を形成する化合物である。本発明者らの検討によれば、このような化合物は、双極子(ダイポール)の方向がおおよそ揃い、分子の相互作用により、さらにΔSTが小さくなり得る。このような場合、ΔSTは、0eV以上0.2eV以下と極めて小さくなり得る。
また、一重項エネルギーEgSと三重項エネルギーEgTとのエネルギー差(ΔST)を小さくするには、会合体を形成することによっても可能である。ここでの会合体とは、単純な1分子だけの電子状態を反映したものではなく、数分子が物理的に接近したものである。複数の分子が接近した結果、複数の分子間における電子状態が混ざり、電子状態が変化することによりエネルギー準位が変化し、主に一重項エネルギーの値が減少することで、ΔSTの値が小さくなると考えられる。このような会合体形成によるΔSTの値の減少は、2分子が接近した事により電子状態が変化するDavydov splitting modelによっても説明することができる(図2参照)。このDavydov splitting modelで示されるように、2分子が物理的に接近する事で、1分子と異なる電子状態の変化が考えられる。励起一重項状態がS1‐m+、及びS1‐m-の2つの状態で存在し、励起三重項状態がT1‐m+、及びT1‐m-の2つの状態で存在する。この結果、エネルギー準位が低いS1‐m-、及びT1‐m-が存在する事により、S1‐m-とT1‐m-との差であるΔSTの大きさは、1分子での電子状態と比べて、小さくなる。
上記Davydov splitting modelについては、例えば、
文献3:J. Kang, et al, International Journal of Polymer Science, Volume 2010,Article ID 264781,
文献4:M. Kasha, et al, Pure and Applied Chemistry, Vol.11, pp371, 1965
文献5:S. Das, et al, J. Phys. Chem. B., vol.103, pp209, 1999
に記載されている。
また、本発明者は薄膜中に会合体を形成しやすい化合物を用いることによって、励起一重項状態と励起三重項状態の副準位を利用し、結果的に薄膜中の分子や会合体による逆項間交差が促進される可能性を見出した。
例えば、フォトルミネッセンススペクトルの半値幅が大きい化合物は、当該化合物の薄膜内において会合体を形成し易いと考えられる。また、フォトルミネッセンススペクトルの半値幅の大きさと会合体の形成し易さとの関連性は、次のように推測できる。
会合体を形成せずに主として1分子状態で存在する性質の化合物については、励起一重項状態における振動準位の存在が少なく、その結果、フォトルミネッセンススペクトルの半値幅が狭く観測される。例えば、CBPは、主として1分子状態で存在する性質を有し、フォトルミネッセンススペクトルの半値幅の大きさは、50nm程度と比較的狭い。
一方、会合体を形成し易い化合物については、複数の分子が電子的に影響しあう事により、励起一重項状態に多くの振動準位が存在する。この結果、各振動準位から基底状態に緩和する状態が多くなるので、フォトルミネッセンススペクトルの半値幅が大きくなる。
このような会合体を形成しやすい化合物は、励起三重項状態においても多くの振動準位が存在すると予想される。その結果、励起一重項状態と励起三重項状態との間に副準位が多く存在することになるため、この副準位を介在して熱的なΔSTが小さくなり、逆項間交差が促進されると考えられる。
前述したとおり、有機材料のΔST(H)が小さいと、外部から与えられる熱エネルギーによって、ホスト材料の三重項準位からホスト材料の一重項準位への逆項間交差が起こり易くなる。ここで、有機EL素子内部の電気励起された励起子の励起三重項状態が、逆項間交差によって、励起一重項状態へスピン交換がされるエネルギー状態変換機構をTADF機構と呼ぶ。
本発明では、ホスト材料にΔST(H)が小さい材料を用いるため、外部から与えられる熱エネルギーによって、ホスト材料の三重項準位からホスト材料の一重項準位への逆項間交差が起こり易くする。
図3は、発光層におけるホスト材料、及びドーパント材料のエネルギー準位の関係を示す図である。図3において、S0は、基底状態を表し、S1Hは、ホスト材料の最低励起一重項状態を表し、T1Hは、ホスト材料の最低励起三重項状態を表し、S1Dは、ドーパント材料の最低励起一重項状態を表し、T1Dは、ドーパント材料の最低励起三重項状態を表す。図3に示すように、S1HとT1Hとの差がΔST(H)に相当し、S1HとS0との差がEgS(H)に相当し、S1DとS0との差がEgS(D)に相当し、T1HとT1Dとの差がΔTに相当する。図3中の破線矢印は、各励起状態間のエネルギー移動を表す。
上記のとおり、本発明のホスト材料に用いる化合物として選択されるのは、ΔST(H)の小さい材料である。何故なら、ΔST(H)の小さな材料では、最低励起三重項状態T1Hに生じた三重項励起子が熱エネルギーにより、ホスト材料の最低励起一重項状態S1Hに逆項間交差する現象が起こり易くなると考えられるからである。ΔST(H)が小さいため、例えば、室温程度でも逆項間交差が起こり易くなる。このような逆項間交差が起こり易くなれば、ホスト材料から蛍光発光性のドーパント材料の最低励起一重項状態T1Dへとフェルスター移動によりエネルギー移動する割合も増え、結果として蛍光型の有機EL素子の発光効率が向上する。
つまり、ホスト材料にΔST(H)が小さい化合物を用いることで、TADF機構に由来する発光が増え、結果として遅延蛍光比率が大きくなる。遅延蛍光比率が大きくなれば、高い内部量子効率を得ることができる。なお、このTADF機構による遅延蛍光を利用することにより、理論的に内部量子効率を100%まで高めることができると考えられる。
そこで、本発明者らは、以下に詳述する理由からΔST(H)が小さい蛍光発光性化合物をホスト材料に用いることにした。
本発明者らは、ホスト材料からドーパント材料へ三重項エネルギーが遷移しにくいホスト-ドーパントシステムにおいては、高電流密度領域における発光効率の低下をある程度抑制することができると考える。本発明では、ΔSTが小さい化合物を発光層のホスト材料に用いており、ホスト材料の三重項励起準位はTADF機構によって一重項励起準位へ逆項間交差後、ドーパント材料の一重項励起準位にエネルギー移動する。従って、生成された三重項励起子は、発光層中において存在比が大きいホスト材料上で三重項励状態が保たれることになる。一方、ΔSTが小さい化合物を発光層のドーパント材料に用いる場合、生成された三重項励起子は、発光層中において存在比が極めて小さいドーパント材料上で三重項励状態が保たれることになる。即ち、高電流領域の有機ELの駆動においては、三重項励起状態がドーパント材料上に集中しないようなシステムを設計することが好ましいと考え、本発明ではΔST(H)が小さい材料をホスト材料として採用する。
ここで、本発明ではΔSTが所定値以下である化合物を用いており、上記した三重項エネルギーEgTは、通常定義される三重項エネルギーとは異なる点がある。この点について、以下に説明する。
一般に、三重項エネルギーは、測定対象となる化合物を溶媒に溶解させた試料を低温(77[K])で燐光スペクトル(縦軸:燐光発光強度、横軸:波長とする。)を測定し、この燐光スペクトルの短波長側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値に基づいて、所定の換算式から算出される。
ここで、本発明のホスト材料に用いる化合物は、上記のとおりΔSTが小さい。ΔSTが小さいと、低温(77[K])状態でも、項間交差、及び逆項間交差が起こりやすく、励起一重項状態と励起三重項状態とが混在する。その結果、上記と同様にして測定されるスペクトルは、励起一重項状態、及び励起三重項状態の両者からの発光を含んだものとなり、いずれの状態から発光したものかについて峻別することは困難であるが、基本的には3重項エネルギーの値が支配的と考えられる。
そのため、本発明では、通常の三重項エネルギーEgTと測定手法は同じであるが、その厳密な意味において異なることを区別するため、測定対象となる化合物を溶媒に溶解させた試料について低温(77[K])で燐光スペクトル(縦軸:燐光発光強度、横軸:波長とする。)を測定し、この燐光スペクトルの短波長側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値に基づいて、所定の換算式から算出されるエネルギー量をエネルギーギャップEg77Kとし、ΔSTを一重項エネルギーEgSとエネルギーギャップEg77Kとの差として定義する。それゆえ、ΔST(H)については、上記式(1)のように表される。
一重項エネルギーEgSについては、本発明においても通常の手法と同様にして算出されるもので定義される。すなわち、測定対象となる化合物を石英基板上に蒸着して試料を作製し、常温(300K)でこの試料の吸収スペクトル(縦軸:吸光度、横軸:波長とする。)を測定する。この吸収スペクトルの長波長側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値に基づいて、所定の換算式から算出される。また、会合体を形成する場合の、EgSは、上記Davydov splitting modelにおけるS1‐m-と基底状態S0とのエネルギーギャップに対応する。
なお、一重項エネルギーEgS、及びエネルギーギャップEg77Kの具体的な算出については、後述する。
本発明の有機EL素子によれば、遅延蛍光の比率が、TTF機構のみで遅延蛍光が起こっていると仮定した場合の遅延蛍光の比率(TTF比率)の理論値上限を上回ることを見出した。つまり、本発明によれば、より高い内部量子効率の有機EL素子を実現することができる。
ただし、本発明で定義される遅延蛍光成分とは、TTF由来の発光成分に加え、本発明が開示する熱活性化による遅延蛍光(TADF機構)が含まれると考えられる。従って、本発明では、以下の数式(4)から求められる遅延蛍光成分の比率をTTF比率とは呼ばず、遅延蛍光比率と呼ぶことにする。
遅延蛍光比率は、数式(4)を用いて求める。
図6Aのグラフにて、時刻約3×10-8秒のところでパルス電圧を除去した。なお、図6Aのグラフは電圧を除去した時の輝度を1として表したものである。
電圧除去後、約2×10-7秒までの急速な減衰の後、緩やかな減衰成分が現れる。
直線部分を時間原点へ延長したときの縦軸との交点Aの値は1.55である。すると、この過渡EL波形から得られる遅延蛍光由来の発光強度比は、1/(1.55)2=0.41となる。つまり、41%が遅延蛍光由来であることになる。すなわち、TTF比率の理論限界と考えられる37.5%を超えるものである。
過渡EL波形から得られる遅延蛍光由来の発光強度は、測定する温度により変化している。このような現象は、主にTADF機構による蛍光発光特有のものと考えられる。
直線へのフィッティングは、最小二乗法により行うことが好ましい。この場合、10-5秒までの値を用いてフィッティングすることが好ましい。
上記したように、TTF機構は、2つの三重項励起子の衝突によって、一重項励起子が生成する現象を利用するものである。図7に示すように、ホスト材料の最低励起三重項状態T1Hは、ドーパント材料の最低励起三重項状態T1Dよりも小さいことが好ましいとされ、この結果、三重項励起子はホスト材料分子上に集中する。これらの三重項励起子の密度が高まることで三重項励起子同士が効率的に対衝突を起していき、一部は一重項励起子に変化することになる。TTF機構によって生成されたホスト材料の最低励起一重項状態S1Hは速やかにドーパント材料の最低励起一重項状態S1Dへのフェルスター移動を起こし、ドーパント材料が蛍光発光をする。
S.M.Bachiloらによれば(J.Phys.Cem.A,104,7711(2000))、五重項等の高次の励起子が、すぐに三重項に戻ると仮定すると、三重項励起子(以下、3A*と記載する)の密度が上がってきたとき、三重項励起子同士が衝突し下記数式(5)のような反応が起きる。ここで、1Aは基底状態、1A*は最低励起一重項励起子を表す。
すなわち、
53A*→41A+1A*
となり、当初生成した75%の三重項励起子のうち、1/5、つまり20%が一重項励起子に変化することが予測されている。
従って、光として寄与する一重項励起子は、当初生成する25%分に75%×(1/5)=15%を加えた40%ということになる。
このとき、全発光強度中に占めるTTF由来の発光比率(TTF比率)は、15/40、すなわち37.5%となる。よって、本発明の有機EL素子の遅延蛍光比率は、TTF比率のみの理論値上限を上回ることが分かる。
遅延蛍光の大きさを相対的に知る方法としては、1μsにおける残存強度を測定することが挙げられる。1μsにおける残存強度比は、過渡EL法により測定したパルス電圧を除去した時点における電圧に対する、パルス電圧を除去したのち1μs経過後の発光強度の比と定義する。過渡EL法により測定したパルス電圧を除去した後のEL発光の減衰挙動から、相対的な遅延蛍光の量を見積もることができる。1μsにおける残存強度比は、図6Aのグラフにおける1.0μs時の発光強度を読み取ることにより取得できる。
なお、1μsにおける残存強度比は、36.0%より大きいことが好ましい。さらに好ましくは、38.0%以上である。
本発明における好ましいドーパント材料の特性としては、蛍光発光性で、かつ輻射遷移の速度定数が大きいものである。このような場合、ホスト材料で電気励起された一重項励起子及び、TADF機構によって生成された一重項励起子等は、ドーパント材料の一重項励起子にフェルスターエネルギー移動し、ドーパント材料は速やかに発光する。即ち、ホスト材料上の三重項励起子がTTAを起こす前に、上記エネルギー遷移を経て蛍光発光することが可能となり、高電流領域の効率低下が大きく改善される可能性がある。
本発明における輻射遷移の速度定数が大きいドーパント材料は、ドーパント材料の蛍光寿命が、5ns以下となるものを選択することが好ましい。さらに好ましくは、2ns以下であることである。また、ドーパント材料の蛍光量子収率は、溶液状態で80%以上であることが好ましい。蛍光量子収率は、例えば、浜松ホトニクス(株)製、絶対PL量子収率測定装置 C9920-02を用い、トルエン溶液中の濃度が10-5~10-6mol/lの範囲で測定することによって求めることができる。
また、輻射遷移の速度定数の大きいドーパント材料であることは、素子のELスペクトルを測定し、ドーパント材料の発光成分に対し、それ以外の発光成分が1/10以下であることを確認することからも推定される。
また、ホスト材料のΔST(H)が小さいと、ホスト材料と、発光層に隣接する電子輸送層とのエネルギー差が小さくなり、発光層に電子が注入しやすくなる。その結果、キャリアバランスが取りやすくなり、ロールオフが小さくなる
また、正孔輸送層のイオン化ポテンシャルをIPHTとしたとき、IPHT≦5.7eVであることが好ましい。これにより、電子と正孔とのバランスをより整えることが可能となる。イオン化ポテンシャルは、例えば、光電子分光装置(理研計器(株)製:AC-3)を用いて当該材料の薄膜状態で測定することによって求めることができる。
本発明において、ドーパント材料は、蛍光発光性のドーパント材料であり、ホスト材料に用いる化合物とドーパント材料に用いる化合物は、前記数式(2)のような一重項エネルギーの大小関係を満たす。
このような関係を満たすことで、ホスト材料の当初生成する一重項励起子と遅延蛍光由来の一重項励起子が、ドーパント材料へエネルギー移動し易くなる。その結果、ドーパント材料が効率良く蛍光発光する。
本発明者らは、ΔSTを小さくする手段の一つとして会合体を形成する化合物を用いることを見出し、Δnが大きい化合物は、当該化合物の膜内において会合体を形成し易いことを見出した。ここでのΔnとは、分光エリプソメトリー測定(測定範囲:200nm~1000nm)において屈折率と同時に観測される反射率が観測されない領域において、シリコン基板面に対して垂直方向の屈折率nZと、シリコン基板に対して平行方向の屈折率nXとの差が最も大きい時の値を取ったものである。
Δnの大きさと会合体の形成し易さとの関連性は、次のように推測される。
シリコン基板面に対して垂直方向zと平行方向xの屈折率nに大きな違いが生じる場合は、薄膜状態において分子が、ある程度の規則性を有する状態で存在していることを意味していると考えられる。すなわち、本発明のホスト材料に用いる化合物は、所定の大きさのΔnを有する化合物であり、薄膜状態において会合体を形成し、ある程度の規則性を有して存在していると推測される。
一方で、このΔnが非常に小さい化合物、例えば、CBPやAlq3などは、薄膜状態において分子が全く規則性を有していないアモルファス状態で存在している。
Δnの大きさと会合体の形成し易さとの関連性については、例えば、
文献6:D. Yokoyama et al., Org. Electron. 10, 127-137 (2009)、
文献7:D. Yokoyama et al., Appl. Phys. Lett. 93, 173302 (2008)、
文献8:D. Yokoyama et al., Appl. Phys. Lett. 95, 243303 (2009)、
の文献に記載されている。
各化合物をシリコン基板(Si(100))上に蒸着し、厚さ100nmの有機薄膜を形成する。そして多入角高速分光エリプソメータ(J.A.Woollam社製、M-2000D)を用い、入射角45度から80度(5度おき)、波長200nmから1000nm(1.6nmおき)の範囲でエリプソパラメーターψおよびΔを測定する。得られたパラメーターに対し、解析ソフトWVASE32(J.A.Woollam社製)を用いて一括解析を行う事で、膜の光学異方性を調べる。膜の光学定数(屈折率nや消衰係数k)の異方性が、膜内における分子配向の異方性を反映する。詳細な測定方法・解析方法は、上記文献6~8に記載されている。
Δnは、シリコン基板面に対して垂直方向zと平行方向xの屈折率nの差として求めることができる。シリコン基板面に対する垂直方向z、及び平行方向xについては、図8Aに示す。
半値幅は、発光スペクトルの最大発光強度に対して発光強度が半分になった時の発光スペクトルの幅を示す。本発明者は、ホスト材料のフォトルミネッセンススペクトルの半値幅が50nm以上であることによって、ホスト材料が会合状態を形成しやすい材料であって、薄膜中での逆項間交差の起こしやすい材料であることを見出した。したがって、フォトルミネッセンススペクトルの半値幅が50nm以上であるホスト材料では、TADF機構が起こりやすい。特に好ましくは、ホスト材料のフォトルミネッセンススペクトルの半値幅が75nm以上である。
本発明において、ホスト材料の三重項エネルギーEg77K(H)と、ドーパント材料の三重項エネルギーEg77K(D)との差ΔTが、上記数式(3)の関係を満たすことが好ましい。また、ΔTが、0.8eV以上であることがより好ましく、1.0eV以上であることがよりさらに好ましい。
ΔTが数式(3)の関係を満たすことで、再結合により生成したホスト材料上の三重項励起子が、ドーパント材料の三重項準位にエネルギー移動し難くなり、三重項励起子が熱失活し難くなると考えられるからである。その結果、ドーパント材料が効率良く蛍光発光する。
上記数式(1)、及び(2)の関係を満たす、ホスト材料、及びドーパント材料に用いる化合物は、次の通りである。
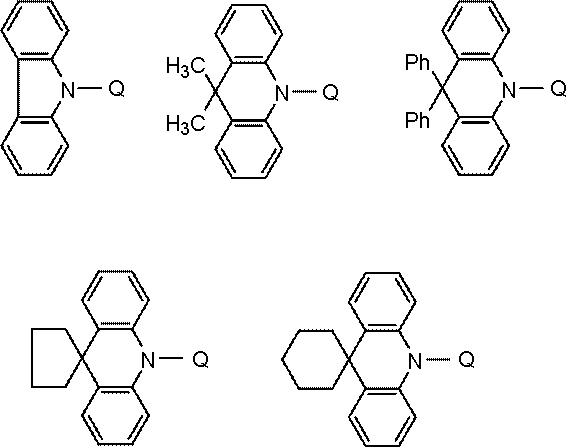
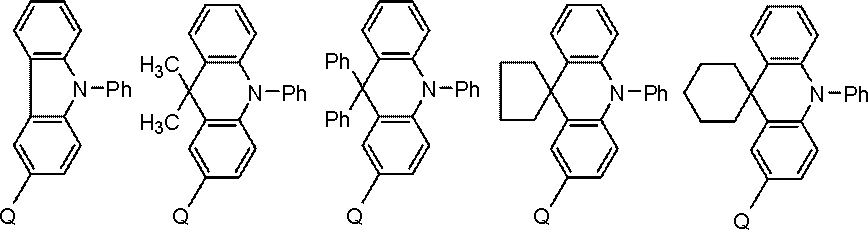
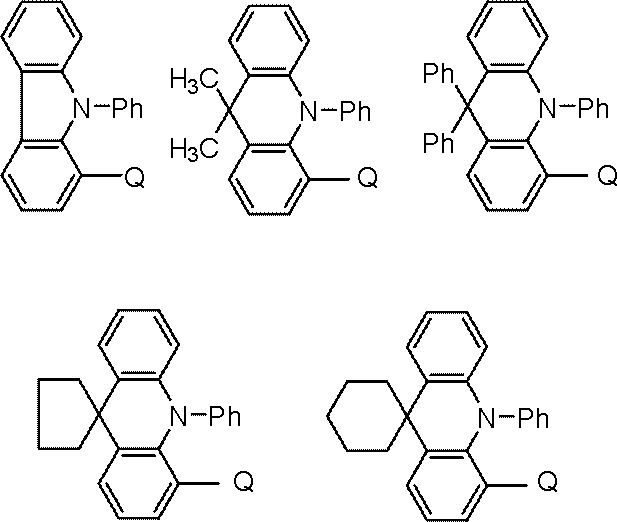
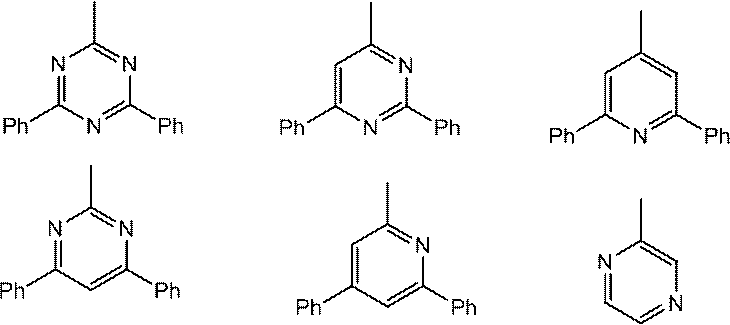
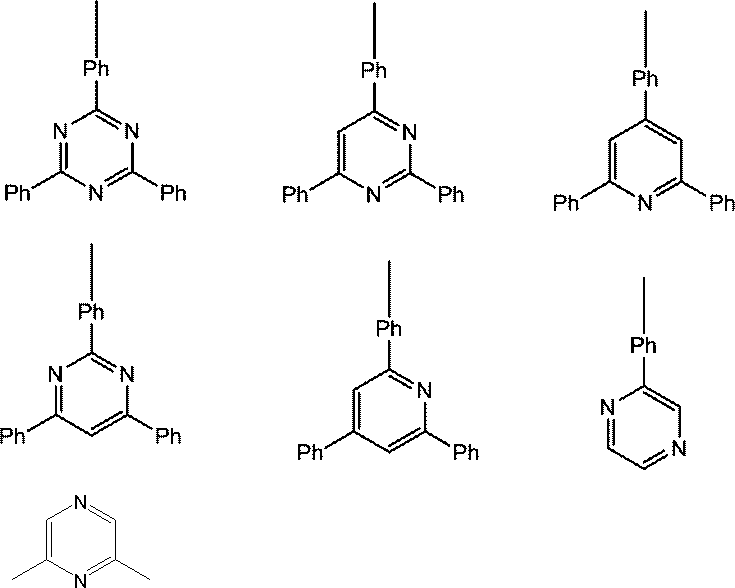
ホスト材料としては、カルバゾール誘導体、ビスカルバゾール誘導体、インドロカルバゾール誘導体、アクリジン誘導体、オキサジン誘導体、ピラジン誘導体、ピリミジン誘導体、トリアジン誘導体、ジベンゾフラン誘導体、ジベンゾチオフェン誘導体などが挙げられる。これらの誘導体は、適宜、置換基を保有してもよい。
置換基としては、炭素数6~40のアリール基、炭素数2~40の複素環基、トリアルキルシリル基、ジアルキルアリールシリル基、アルキルジアリールシリル基、トリアリールシリル基、フッ素原子、シアノ基等があげられる。この置換基におけるトリアルキルシリル基、ジアルキルアリールシリル基、アルキルジアリールシリル基、及びトリアリールシリル基は、炭素数1~30のアルキル基、及び炭素数6~30のアリール基の少なくともいずれかを含む。なお、水素原子には重水素原子を含む。
また、ホスト材料として好ましくは、カルバゾール構造、ビスカルバゾール構造、インドロカルバゾール構造、アクリジン構造から選ばれる少なくとも1種と、オキサジン構造、ピラジン構造、ピリミジン構造、トリアジン構造、ジベンゾフラン構造から選ばれる少なくとも1種とが結合した構造の化合物が挙げられる。
これらの構造が結合するとは各種、連結基で結合することを意味する。好ましい連結基は、単結合、フェニレン構造、メタビフェニレン構造である。
カルバゾール構造、インドロカルバゾール構造、アクリジン構造、オキサジン構造、ピラジン構造、ピリミジン構造、トリアジン構造、ジベンゾフラン構造とは、それぞれ、インドロカルバゾール、アクリジン、オキサジン、ピラジン、ピリミジン、トリアジン、ジベンゾフランを部分構造とするものも含む環構造をいう。
また、カルバゾール構造、ビスカルバゾール構造、インドロカルバゾール構造、アクリジン構造、オキサジン構造、ピラジン構造、ピリミジン構造、トリアジン構造、ジベンゾフラン構造は適宜、置換基を保有してもよい。
置換基としては、炭素数6~40のアリール基、炭素数2~40の複素環基、トリアルキルシリル基、ジアルキルアリールシリル基、アルキルジアリールシリル基、トリアリールシリル基、フッ素原子、シアノ基等があげられる。この置換基におけるトリアルキルシリル基、ジアルキルアリールシリル基、アルキルジアリールシリル基、及びトリアリールシリル基は、炭素数1~30のアルキル基、及び炭素数6~30のアリール基の少なくともいずれかを含む。なお、水素原子には重水素原子を含む。
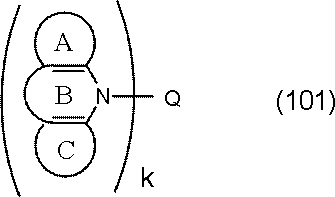
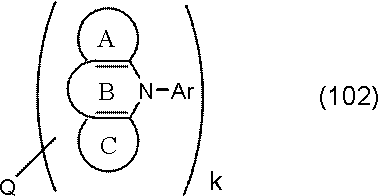
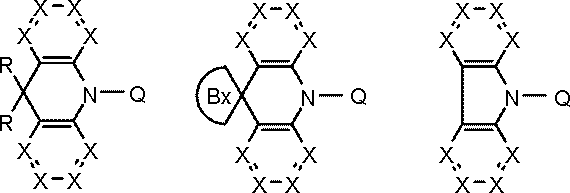
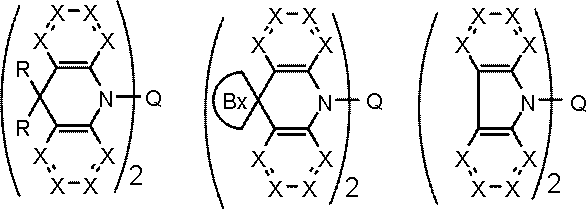
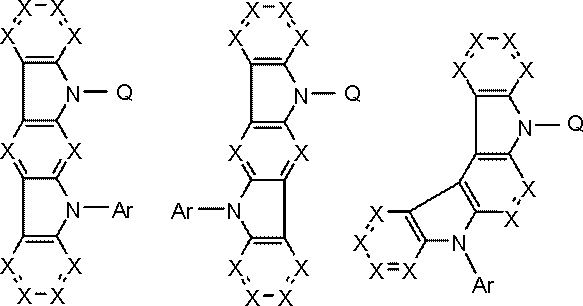
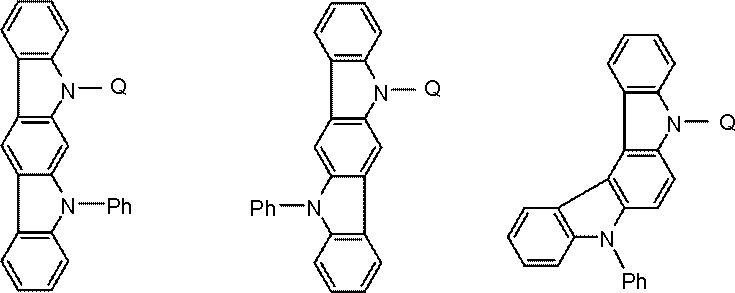
環A,環B,環Cは、
炭素原子、窒素原子、酸素原子、硫黄原子、ケイ素原子から選ばれる原子を環構成原子として有する置換または無置換の5~7員環であり、
環Aと環B,および環Cと環Bは縮合している。
環Cには、さらに別の環が縮合されていてもよい。
Qは、下記一般式(103)で表される基である。
kは1または2である。)
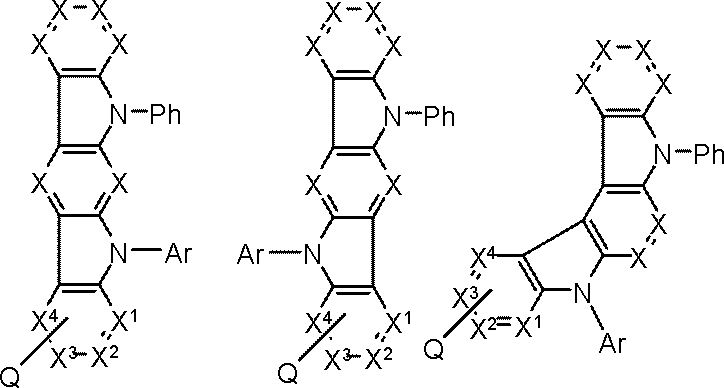
Y1~Y6の少なくとも1個はLに結合する炭素原子であり、
Y1~Y6のうち1~3個は窒素原子であり、
Y1~Y6のうちLに結合する炭素原子または窒素原子以外のものは、CAr1である。
Ar1は置換または無置換の芳香族炭化水素基である。
一般式(103)が複数のCAr1を有する場合、Ar1は互いに同一または異なる。
Lは単結合または連結基を表す。)
Arは置換または無置換の芳香族炭化水素基である。)
Rxは置換基を表す。
Bxは炭素原子で形成される5~7員環である。)
X,X1~X4はCH、CRxまたは窒素原子である。
Rxは、置換基を表す。
ただし、X1~X4のうち1つは、Qに結合する炭素原子である。
Bxは炭素原子で形成される5~7員環である。
Arは芳香族炭化水素基、Phはフェニル基を表す。)
上記一般式(102)で表される化合物は、さらに好ましくは、下記一般式で表される化合物である。
本発明では、上記のとおり、発光層のドーパント材料に蛍光発光性のドーパント材料を用いる。
蛍光発光性ドーパント材料としては、公知の蛍光発光性材料を用いることができる。具体的には、例えば、ビスアリールアミノナフタレン誘導体、アリール置換ナフタレン誘導体、ビスアリールアミノアントラセン誘導体、アリール基置換アントラセン誘導体、ビスアリールアミノピレン誘導体、アリール基置換ピレン誘導体、ビスアリールアミノクリセン誘導体、アリール置換クリセン誘導体、ビスアリールアミノフルオランテン誘導体、アリール置換フルオランテン誘導体、インデノペリレン誘導体、ピロメテンホウ素錯体化合物、ピロメテン骨格を有する化合物もしくはその金属錯体、ジケトピロロピロール誘導体、ペリレン誘導体が挙げられる。
本発明の有機EL素子は、透光性の基板上に作製する。この透光性基板は、有機EL素子を構成する陽極、有機化合物層、陰極等を支持する基板であり、400nm以上700nm以下の可視領域の光の透過率が50%以上で平滑な基板が好ましい。
透光性基板としては、ガラス板やポリマー板などが挙げられる。
ガラス板としては、特にソーダ石灰ガラス、バリウム・ストロンチウム含有ガラス、鉛ガラス、アルミノケイ酸ガラス、ホウケイ酸ガラス、バリウムホウケイ酸ガラス、石英などを原料として用いてなるものを挙げられる。
またポリマー板としては、ポリカーボネート、アクリル、ポリエチレンテレフタレート、ポリエーテルサルファイド、ポリサルフォンなどを原料として用いてなるものを挙げることができる。
有機EL素子の陽極は、正孔を発光層に注入する役割を担うものであり、4.5eV以上の仕事関数を有することが効果的である。
陽極材料の具体例としては、酸化インジウム錫合金(ITO)、酸化錫(NESA)、酸化インジウム亜鉛酸化物、金、銀、白金、銅などが挙げられる。
発光層からの発光を陽極側から取り出す場合、陽極の可視領域の光の透過率を10%より大きくすることが好ましい。また、陽極のシート抵抗は、数百Ω/□(Ω/sq。オーム・パー・スクウェア。)以下が好ましい。陽極の膜厚は、材料にもよるが、通常10nm以上1μm以下、好ましくは10nm以上200nm以下の範囲で選択される。
陰極材料は特に限定されないが、具体的にはインジウム、アルミニウム、マグネシウム、マグネシウム-インジウム合金、マグネシウム-アルミニウム合金、アルミニウム-リチウム合金、アルミニウム-スカンジウム-リチウム合金、マグネシウム-銀合金などが使用できる。
陰極も、陽極と同様に、蒸着法などの方法で、例えば、電子輸送層や電子注入層上に薄膜を形成できる。また、陰極側から、発光層からの発光を取り出す態様を採用することもできる。発光層からの発光を陰極側から取り出す場合、陰極の可視領域の光の透過率を10%より大きくすることが好ましい。
陰極のシート抵抗は、数百Ω/□以下が好ましい。
陰極の膜厚は、材料にもよるが、通常10nm以上1μm以下、好ましくは50nm以上200nm以下の範囲で選択される。
正孔注入・輸送層は、発光層への正孔注入を助け、発光領域まで輸送する層であって、正孔移動度が大きく、イオン化エネルギーが小さい化合物が用いられる。
正孔注入・輸送層を形成する材料としては、より低い電界強度で正孔を発光層に輸送する材料が好ましく、例えば、芳香族アミン化合物が好適に用いられる。
電子注入・輸送層は、発光層への電子の注入を助け、発光領域まで輸送する層であって、電子移動度が大きい化合物が用いられる。
電子注入・輸送層に用いられる化合物としては、例えば、分子内にヘテロ原子を1個以上含有する芳香族ヘテロ環化合物が好ましく用いられ、特に含窒素環誘導体が好ましい。含窒素環誘導体としては、含窒素6員環もしくは5員環骨格を有する複素環化合物が好ましい。
本発明の有機EL素子の各層の形成方法としては、上記で特に言及した以外には制限されないが、真空蒸着、スパッタリング、プラズマ、イオンプレーティングなどの乾式成膜法や、スピンコーティング、ディッピング、フローコーティング、インクジェットなどの湿式成膜法などの公知の方法を採用することができる。
本発明の有機EL素子の各有機層の膜厚は、上記で特に言及した以外には制限されないが、一般に膜厚が薄すぎるとピンホール等の欠陥が生じやすく、逆に厚すぎると高い印加電圧が必要となり効率が悪くなるため、通常は数nmから1μmの範囲が好ましい。
なお、本発明は、上述の実施形態に限定されるものではなく、本発明の目的を達成できる範囲での変更、改良などは、本発明に含まれるものである。
また、有機EL素子が複数の発光層を有する場合、これらの発光層が互いに隣接して設けられていてもよい。
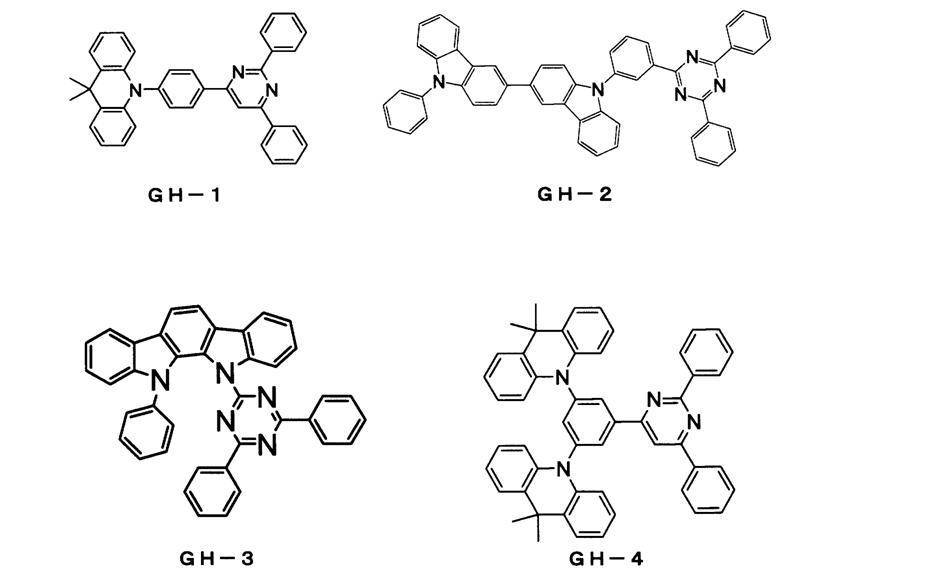
〔合成例1〕 GH-4の合成
アルゴン雰囲気下、特開2010-180204号公報に記載の方法に従って合成した中間体A(4.4g、21mmol)、国際公開第2003/080760号に記載の方法に従って合成した中間体B(4.7g、10mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(0.37g、0.4mmol)、トリ-t-ブチルホスホニウムテトラフルオロほう酸塩(0.46g、1.6mmol)、t-ブトキシナトリウム(2.7g、28mmol)、無水トルエン(100mL)を順次加えて8時間加熱還流した。
室温まで反応液を冷却した後、有機層を分離し、有機溶媒を減圧下で留去した。得られた残渣をシリカゲルカラムクロマトグラフィーにて精製し、目的化合物GH-4(3.6g、収率50%)を得た。
FD-MS分析の結果、分子量722に対してm/e=722であった。
以下に目的化合物GH-4の合成スキームを示す。
室温まで反応液を冷却した後、有機層を分離し、有機溶媒を減圧下留去した。得られた残渣をシリカゲルカラムクロマトグラフィーにて精製し、1.8gの固体を得た。
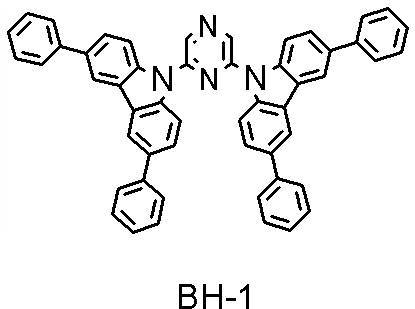
得られた化合物について、FD-MSを行った結果、化合物BH-1と同定した。
FD-MS:
calcd for C52H34N4=714,found m/z=714(M+,100)
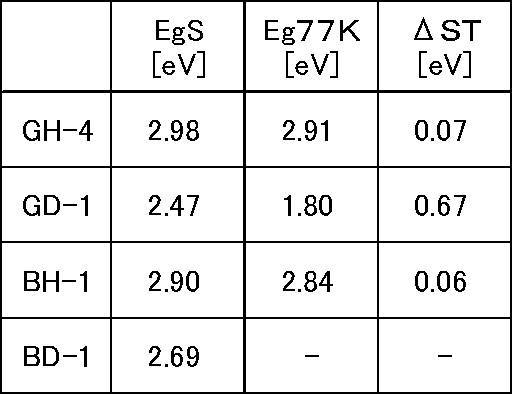
次に、本実施例で使用した化合物の物性を測定した。対象化合物は、GH-4、GD-1、BH-1、BD-1である。測定方法、又は算出方法を以下に示すとともに、測定結果、又は算出結果を表1に示す。
(1)一重項エネルギーEgS
一重項エネルギーEgSは、以下の方法により求めた。
測定対象化合物を石英基板上に蒸着して試料を作製し、常温(300K)でこの試料の吸収スペクトルを測定した。試料の膜厚は100nmとした。吸収スペクトルは、縦軸を吸光度、横軸を波長とした。この吸収スペクトルの長波長側の立ち下がりに対して接線を引き、その接線と横軸との交点の波長値λedge[nm]を求めた。この波長値を次に示す換算式でエネルギー値に換算した値をEgSとした。
換算式:EgS[eV]=1239.85/λedge
吸収スペクトルの測定には、分光光度計(日立製、U3310)を用いた。
なお、吸光度の値が0.2以下の極大点は、上記最も長波長側の極大値には含めなかった。
Eg77K、及びEgTDは、以下の方法により求めた。
各化合物を、公知の燐光測定法(例えば、「光化学の世界」(日本化学会編・1993)50頁付近の記載の方法)により測定した。具体的には、各化合物を溶媒に溶解(試料10[μmol/リットル]、EPA(ジエチルエーテル:イソペンタン:エタノール=5:5:5(容積比)、各溶媒は分光用グレード)し、燐光測定用試料とした。石英セルへ入れた燐光測定用試料を77[K]に冷却し、励起光を燐光測定用試料に照射し、波長を変えながら燐光強度を測定した。燐光スペクトルは、縦軸を燐光強度、横軸を波長とした。
この燐光スペクトルの短波長側の立ち上がりに対して接線を引き、その接線と横軸との交点の波長値λedge[nm]を求めた。この波長値を次に示す換算式でエネルギー値に換算した値をEg77K(H)又はEgTD(Eg77K(D))とした。
換算式:Eg77K(H)[eV]=1239.85/λedge
:EgTD[eV]=1239.85/λedge
なお、スペクトルの最大ピーク強度の10%以下のピーク強度をもつ極大点は、上述の最も短波長側の極大値には含めず、最も短波長側の極大値に最も近い、傾きの値が極大値をとる点において引いた接線を当該燐光スペクトルの短波長側の立ち上がりに対する接線とする。
燐光の測定には、(株)日立ハイテクノロジー製のF-4500形分光蛍光光度計本体と低温測定用オプション備品を用いた。なお、測定装置はこの限りではなく、冷却装置及び低温用容器と、励起光源と、受光装置とを組み合わせることにより、測定してもよい。
ΔSTは、上記(1)、及び(2)で測定したEgSとEg77Kとの差として求めた(上記数式(2)参照)。結果を表1に示す。
ΔTは、上記(1)、及び(2)で測定したEg77K(H)とEgT(D)との差として求めた。
ΔT=Eg77K(H)-EgT(D)
ホスト材料GH-4とドーパント材料GD-1の組み合わせの場合、
ΔT=1.11[eV]
となった。
なおホスト材料BH-1とドーパント材料BD-1の組み合わせの場合、ドーパント材料BD-1のEgT(D)が測定できなかったためΔTは、分からなかった。
また、GD-1について、浜松ホトニクス(株)製、絶対PL量子収率測定装置C9920-02を用いて、トルエン溶液で濃度を10-5~10-6mol/lの範囲で測定した結果、100%という値を得た。
また、BD-1について、浜松ホトニクス(株)製、絶対PL量子収率測定装置C9920-02を用いて、トルエン溶液で濃度を10-5~10-6mol/lの範囲で測定した結果、90%という値を得た。
HT-1のIPの値は、薄膜状態を光電子分光装置(理研計器(株)製:AC-3)を用いて測定し、5.6eVという値を得た。
各化合物を溶媒(ジクロロメタン)に溶解(試料10[μmol/リットル])し、蛍光測定用試料とした。石英セルへ入れた蛍光測定用試料に室温(300[K])で励起光を照射し、波長を変えながら蛍光強度を測定した。フォトルミネッセンススペクトルは、縦軸を蛍光強度、横軸を波長とした。蛍光の測定に用いた装置は、(株)日立ハイテクノロジー製のF-4500形分光蛍光光度計である。
このフォトルミネッセンススペクトルから半値幅(単位は、nm。)を測定した。
半値幅を測定した化合物は、GH-4、BH-1である。その結果、GH-4は79nm、BH-1は98nmであった。
有機EL素子を以下のように作製し、評価した。
25mm×75mm×1.1mm厚のITO透明電極(陽極)付きガラス基板(ジオマティック社製)をイソプロピルアルコール中で超音波洗浄を5分間行なった後、UVオゾン洗浄を30分間行なった。ITOの膜厚は、130nmとした。
洗浄後の透明電極ライン付きガラス基板を真空蒸着装置の基板ホルダーに装着し、まず透明電極ラインが形成されている側の面上に透明電極を覆うようにして化合物HI-1を蒸着し、膜厚50nmの化合物HI-1膜を形成した。このHI-1膜は、正孔注入層として機能する。
このHI-1膜の成膜に続けて、化合物HT-1を蒸着し、HI-1膜上に膜厚60nmのHT-1膜を成膜した。このHT-1膜は、正孔輸送層として機能する。
このHT-1膜上に化合物GH-4(ホスト材料)および化合物GD-1(蛍光発光性ドーパント材料)を共蒸着し、膜厚30nmの発光層を成膜した。ドーパント材料濃度は、5質量%とした。
この発光層上に電子輸送性化合物であるET-1を蒸着し、膜厚25nmの電子輸送層を形成した。
この電子輸送層上にLiFを蒸着して、膜厚1nmのLiF膜を形成した。
このLiF膜上に金属Alを蒸着して、膜厚80nmの金属陰極を形成した。
このようにして、実施例1の有機EL素子を作製した。
実施例1の有機EL素子の素子構成を略式的に示すと、次のとおりである。
ITO(130)/HI-1(50)/HT-1(60)/GH-4:GD-1(30,5%)/ET-1(25)/LiF(1)/Al(80)
なお、括弧内の数字は、膜厚(単位:nm)を示す。また、同じく括弧内において、パーセント表示された数字は、発光層における蛍光光発光性ドーパント材料等のように、添加される成分の割合(質量%)を示す。
作製した有機EL素子について、駆動電圧、CIE1931色度、電流効率L/J、電力効率、外部量子効率EQE、及び遅延蛍光比率の評価を行った。遅延蛍光比率以外の各評価項目について、電流密度を1.00mA/cm2、又は10.00mA/cm2とした場合について行い、前者の場合を評価例1、後者の場合を評価例2とした。結果を表2に示す。
電流密度が1.00mA/cm2、又は10.00mA/cm2となるようにITOとAlとの間に通電したときの電圧(単位:V)を計測した。
電流密度が1.00mA/cm2、又は10.00mA/cm2となるように素子に電圧を印加した時のCIE1931色度座標(x、y)を分光放射輝度計CS-1000(コニカミノルタ社製)で計測した。
電流密度が1.00mA/cm2、又は10.00mA/cm2となるように素子に電圧を印加した時の分光放射輝度スペクトルを上記分光放射輝度計で計測し、得られた分光放射輝度スペクトルから、電流効率(単位:cd/A)、及び電力効率η(単位:lm/W)を算出した。
得られた上記分光放射輝度スペクトルから主ピーク波長λpを求めた。
得られた上記分光放射輝度スペクトルから、ランバシアン放射を行なったと仮定し外部量子効率EQE(単位:%)を算出した。
パルスジェネレータ(アジレント社製8114A)から出力した電圧パルス波形(パルス幅:500マイクロ秒、周波数:20Hz、電圧:0.1~100mA/cm2相当の電圧を印加し、EL発光を光電子増倍管(浜松ホトニクス社製R928)に入力し、パルス電圧波形とEL発光とを同期させてオシロスコープ(テクトロニクス社製2440)に取り込んで過渡EL波形を得た。これを最小二乗法により10-5秒までの値を用いて直線へフィッティングし、遅延蛍光比率を決定した。
実施例1の有機EL素子に対して、室温下、0.14mA/cm2で通電した時の過渡EL波形を、前述の図6Aに示した。時刻約3×10-8秒のところでパルス電圧を除去した。
電圧除去時点を原点にとり、電圧除去後、1.5×10-5秒までの光強度の平方根の逆数をプロットしたグラフが、前述の図6Bのグラフである。このグラフから求めた実施例1の有機EL素子における遅延蛍光比率は、41%であった。この遅延蛍光比率の値は、TTF比率の理論値限界37.5%を超えるものであった。
また、図6Aの図から、1μsにおける残存強度比を読み取ったところ、39.8%であった。
実施例1の有機EL素子について、電流密度を変化させた場合の電流効率を測定した。図9に、電流効率及びの関係を示すグラフとして測定結果を示す。
図9に示されているように、電流密度が0.01mA/cm2のときよりも、1mA/cm2~10mA/cm2の電流密度領域におけるときの方が、電流効率が高くなった。
25mm×75mm×1.1mm厚のITO透明電極(陽極)付きガラス基板(ジオマティック社製)をイソプロピルアルコール中で超音波洗浄を5分間行なった後、UVオゾン洗浄を30分間行なった。ITOの膜厚は、70nmとした。
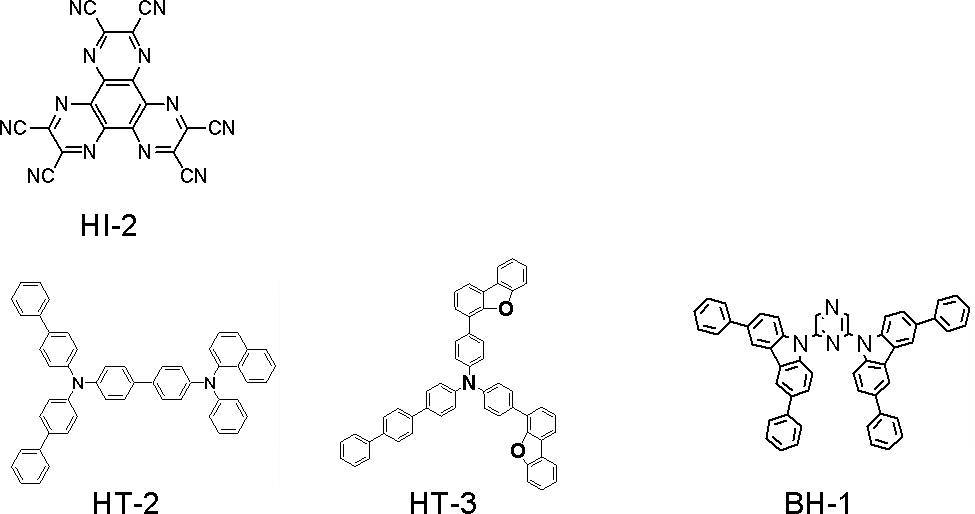
洗浄後の透明電極ライン付きガラス基板を真空蒸着装置の基板ホルダーに装着し、まず透明電極ラインが形成されている側の面上に透明電極を覆うようにして化合物HI-2を蒸着し、膜厚5nmの化合物HI-2膜を形成した。このHI-2膜は、正孔注入層として機能する。
このHI-2膜の成膜に続けて、化合物HT-2を蒸着し、HI-2膜上に膜厚125nmのHT-2膜を成膜した。このHT-2膜の成膜に続けて、化合物HT-3を蒸着し、HT-2膜上に膜厚25nmのHT-3膜を成膜した。このHT-2、HT-3膜は、正孔輸送層として機能する。
このHT-3膜上に化合物BH-1(ホスト材料)および化合物BD-1(蛍光発光性ドーパント材料)を共蒸着し、膜厚25nmの発光層を成膜した。ドーパント材料濃度は、4質量%とした。
この発光層上に電子輸送性化合物であるET-2を蒸着し、膜厚5nmの正孔阻止層を形成した。
この正孔阻止層上にET-3およびLiqを共蒸着して、膜厚20nmの電子輸送膜を形成した。ET-3およびLiqの濃度比は50質量%:50質量%とした。
この電子輸送層上にLiqを蒸着し、膜厚1nmのLiq層を形成した。
このLiq膜上に金属Alを蒸着して、膜厚80nmの金属陰極を形成した。
このようにして、実施例2の有機EL素子を作製した。
実施例2の有機EL素子の素子構成を略式的に示すと、次のとおりである。
ITO(70)/HI-2(5)/HT-2(125)/ HT-3(25)/BH-1:BD-1(25,4%)/ET-2(5)/ ET-3:Liq(20,50%)/Liq(1)/Al(80)
なお、括弧内の数字は、膜厚(単位:nm)を示す。また、同じく括弧内において、パーセント表示された数字は、BD-1、Liqの割合(質量%)を示す。
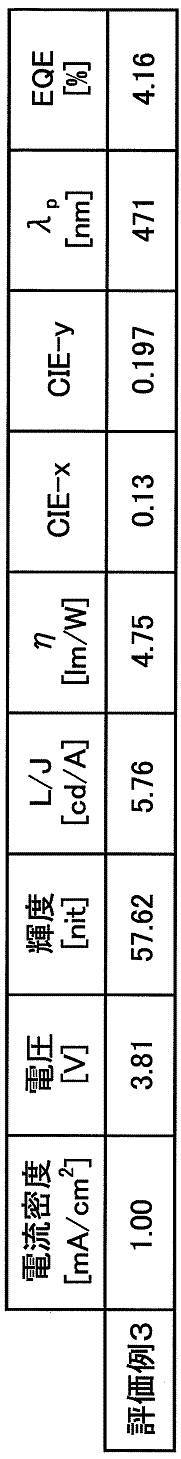
作製した有機EL素子について、駆動電圧、CIE1931色度、電流効率L/J、電力効率、外部量子効率EQE、及び遅延蛍光比率の評価を行った。遅延蛍光比率以外の各評価項目について、電流密度を1.00mA/cm2とした場合について実施例1と同様の方法で行い、評価例3とした。結果を表3に示す。
実施例1と同様の方法で、過渡EL波形を得た。これを最小二乗法により10-5秒までの値を用いて直線へフィッティングし、解析して遅延蛍光比率を決定した。
実施例2の有機EL素子に対して、室温下、1.00mA/cm2で通電した時の過渡EL波形を、図10に示した。時刻約3×10-8秒のところでパルス電圧を除去した。
電圧除去時点を原点にとり、実施例1と同様にして、電圧除去後、1.0×10-5秒までの光強度の平方根の逆数をプロットしたグラフを作成し、このグラフから遅延蛍光比率を求めた。実施例2の有機EL素子における遅延蛍光比率は、38.7%であった。この遅延蛍光比率の値は、TTF比率の理論値限界37.5%を超えるものであった。
・1μsにおける残存強度比
また、図10から、1μsにおける残存強度比を読み取ったところ、36.3%であった。
ここで、非特許文献1に記載された有機EL素子を参考例として挙げ、実施例1の有機EL素子の素子構成との比較を行う。
この参考例の有機EL素子の構成は、実施例1の略式的表示に倣って示すと、次のとおりである。ITO(110)/NPD(40)/m-CP(10)/m-CP:PIC-TRZ(20,6%)/BP4mPy(40)/LiF(0.8)/Al(70)
参考例の素子に使用された化合物を以下に示す。
2…基板
3…陽極
4…陰極
5…発光層
6…正孔注入層
7…正孔輸送層
8…電子輸送層
9…電子注入層
10…有機化合物層
Claims (6)
- 一対の電極間に有機化合物層を備える有機エレクトロルミネッセンス素子であって、
前記有機化合物層は、第一の材料と第二の材料とを含む発光層を有し、
前記第二の材料は、蛍光発光を示す材料であり、
前記第一の材料の一重項エネルギーEgS(H)と前記第二の材料の一重項エネルギーEgS(D)とが、下記数式(1)の関係を満たし、
前記第一の材料は、前記一重項エネルギーEgS(H)と、77[K]におけるエネルギーギャップEg77K(H)との差ΔST(H)が、下記数式(2)の関係を満たす
ことを特徴とする有機エレクトロルミネッセンス素子。
[数1]
EgS(H)>EgS(D) …(1)
[数2]
ΔST(H)=EgS(H)-Eg77K(H)<0.3[eV]…(2) - 請求項1に記載の有機エレクトロルミネッセンス素子において、
遅延蛍光比率が37.5%より大きい
ことを特徴とする有機エレクトロルミネッセンス素子。 - 請求項1または請求項2に記載の有機エレクトロルミネッセンス素子において、
過渡EL測定における電圧除去後1μs経過後の残存強度比が36.0%より大きい
ことを特徴とする有機エレクトロルミネッセンス素子。 - 請求項1から請求項3のいずれか一項に記載の有機エレクトロルミネッセンス素子において、
前記第一の材料のフォトルミネッセンススペクトルの半値幅が50nm以上である
ことを特徴とする有機エレクトロルミネッセンス素子。 - 請求項1から請求項3のいずれか一項に記載の有機エレクトロルミネッセンス素子において、
前記第一の材料のフォトルミネッセンススペクトルの半値幅が75nm以上である
ことを特徴とする有機エレクトロルミネッセンス素子。 - 請求項1から請求項5のいずれか一項に記載の有機エレクトロルミネッセンス素子において、
前記第一の材料の77[K]におけるエネルギーギャップEg77K(H)と、前記第二の材料の77[K]におけるエネルギーギャップEg77K(D)との差ΔTが、下記数式(3)の関係を満たす
ことを特徴とする有機エレクトロルミネッセンス素子。
[数3]
ΔT=Eg77K(H)―Eg77K(D)≧0.6[eV] …(3)
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020167022479A KR102018418B1 (ko) | 2011-03-25 | 2012-03-23 | 유기 일렉트로 루미네선스 소자 |
| EP19191788.9A EP3598520A1 (en) | 2011-03-25 | 2012-03-23 | Organic electroluminescent element |
| CN201280013486.1A CN103443949B9 (en) | 2011-03-25 | 2012-03-23 | Organic electroluminescent device |
| KR1020137024878A KR101650996B1 (ko) | 2011-03-25 | 2012-03-23 | 유기 일렉트로 루미네선스 소자 |
| JP2013507516A JP5889280B2 (ja) | 2011-03-25 | 2012-03-23 | 有機エレクトロルミネッセンス素子 |
| EP12762893.1A EP2690681B1 (en) | 2011-03-25 | 2012-03-23 | Organic electroluminescent element |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011-068758 | 2011-03-25 | ||
| JP2011068758 | 2011-03-25 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2012133188A1 true WO2012133188A1 (ja) | 2012-10-04 |
Family
ID=46926281
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2012/057520 WO2012133188A1 (ja) | 2011-03-25 | 2012-03-23 | 有機エレクトロルミネッセンス素子 |
Country Status (7)
| Country | Link |
|---|---|
| US (4) | US8643268B2 (ja) |
| EP (2) | EP3598520A1 (ja) |
| JP (1) | JP5889280B2 (ja) |
| KR (2) | KR102018418B1 (ja) |
| CN (1) | CN105762279B (ja) |
| TW (2) | TW201638086A (ja) |
| WO (1) | WO2012133188A1 (ja) |
Cited By (57)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013172255A1 (ja) * | 2012-05-17 | 2013-11-21 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
| WO2013180241A1 (ja) * | 2012-06-01 | 2013-12-05 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および有機エレクトロルミネッセンス素子用材料 |
| JP2013258402A (ja) * | 2012-05-18 | 2013-12-26 | Semiconductor Energy Lab Co Ltd | 発光素子、発光装置、表示装置、電子機器及び照明装置 |
| WO2014013947A1 (ja) * | 2012-07-20 | 2014-01-23 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| KR20140018133A (ko) * | 2012-08-03 | 2014-02-12 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자 |
| WO2014092083A1 (ja) * | 2012-12-10 | 2014-06-19 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2014104346A1 (ja) * | 2012-12-28 | 2014-07-03 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2014104315A1 (ja) * | 2012-12-28 | 2014-07-03 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2014109274A1 (en) * | 2013-01-10 | 2014-07-17 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, electronic device, and lighting device |
| JP2014182898A (ja) * | 2013-03-18 | 2014-09-29 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子の製造方法、有機エレクトロルミネッセンス素子、および電子機器 |
| WO2014157619A1 (ja) * | 2013-03-29 | 2014-10-02 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| WO2014157610A1 (ja) | 2013-03-29 | 2014-10-02 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、照明装置、表示装置、有機ルミネッセンス素子用発光性薄膜と組成物及び発光方法 |
| KR20150002534A (ko) * | 2013-06-28 | 2015-01-07 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자의 제작 방법 및 발광 소자 |
| JP5669163B1 (ja) * | 2013-08-14 | 2015-02-12 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| JP2015037138A (ja) * | 2013-08-14 | 2015-02-23 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子用金属錯体、並びに表示装置及び照明装置 |
| JP2015038941A (ja) * | 2013-08-19 | 2015-02-26 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、それに用いる蛍光発光性化合物、当該有機エレクトロルミネッセンス素子を具備する照明装置及び表示装置 |
| JP2015053476A (ja) * | 2013-07-30 | 2015-03-19 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| JP2015065225A (ja) * | 2013-09-24 | 2015-04-09 | 日本放送協会 | 有機エレクトロルミネッセンス素子及びこれを用いた表示装置、照明装置 |
| JP2015106659A (ja) * | 2013-11-29 | 2015-06-08 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| WO2015098975A1 (ja) | 2013-12-26 | 2015-07-02 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| WO2015198987A1 (ja) * | 2014-06-26 | 2015-12-30 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子用材料、および電子機器 |
| WO2016010136A1 (ja) * | 2014-07-18 | 2016-01-21 | 国立大学法人九州大学 | 有機発光素子 |
| JP2016036022A (ja) * | 2014-07-31 | 2016-03-17 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、電荷移動性薄膜、表示装置及び照明装置 |
| KR20160045569A (ko) * | 2014-10-17 | 2016-04-27 | 엘지디스플레이 주식회사 | 지연 형광 화합물, 이를 포함하는 유기발광다이오드소자 및 표시장치 |
| JP2016129262A (ja) * | 2013-12-26 | 2016-07-14 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| JP2016522579A (ja) * | 2013-06-06 | 2016-07-28 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子 |
| WO2016125807A1 (ja) * | 2015-02-06 | 2016-08-11 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| KR20160099644A (ko) * | 2013-12-17 | 2016-08-22 | 베이징 비젼녹스 테크놀로지 컴퍼니 리미티드 | 유기 전계 발광 소자 및 그의 제조방법 |
| KR20160113219A (ko) | 2014-03-07 | 2016-09-28 | 코니카 미놀타 가부시키가이샤 | 유기 일렉트로루미네센스 소자, 표시 장치, 조명 장치 및 발광성 조성물 |
| JP2017054972A (ja) * | 2015-09-10 | 2017-03-16 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、照明装置、π共役系化合物、及び発光性薄膜 |
| JP2017509164A (ja) * | 2014-03-13 | 2017-03-30 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子 |
| KR20170085434A (ko) | 2014-10-07 | 2017-07-24 | 이데미쓰 고산 가부시키가이샤 | 유기 일렉트로루미네선스 소자 및 전자 기기 |
| JP2017197482A (ja) * | 2016-04-28 | 2017-11-02 | コニカミノルタ株式会社 | π共役系化合物、有機エレクトロルミネッセンス素子材料、発光材料、電荷輸送材料、発光性薄膜、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| KR101835934B1 (ko) * | 2015-05-04 | 2018-03-08 | 단국대학교 산학협력단 | 지연형광을 나타내는 호스트를 함유하는 유기발광다이오드 |
| JP2018519663A (ja) * | 2015-06-16 | 2018-07-19 | 昆山国顕光電有限公司Kunshan Go−Visionox Opto−Electronics Co., Ltd. | 有機エレクトロルミネッセンス装置及びその製造方法 |
| US10043982B2 (en) | 2013-04-26 | 2018-08-07 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, display device, electronic device, and lighting device |
| JP2018524803A (ja) * | 2015-06-03 | 2018-08-30 | ユー・ディー・シー アイルランド リミテッド | 減衰時間がきわめて短く高度に効率的なoledデバイス |
| JP2018524819A (ja) * | 2015-07-23 | 2018-08-30 | メルク パテント ゲーエムベーハー | 有機電子素子での使用のための少なくとも2種の電子受容体と少なくとも2種の電子供与体で置換されたフェニル誘導体 |
| JPWO2017115608A1 (ja) * | 2015-12-28 | 2018-10-18 | コニカミノルタ株式会社 | π共役系化合物、有機エレクトロルミネッセンス素子材料、発光材料、電荷輸送材料、発光性薄膜、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| US10141520B2 (en) | 2013-04-05 | 2018-11-27 | Konica Minolta, Inc. | Coating liquid for forming light emitting layer, organic electroluminescent element, method for manufacturing organic electroluminescent element, and lighting/display device |
| JP2019054261A (ja) * | 2013-08-26 | 2019-04-04 | 株式会社半導体エネルギー研究所 | 発光装置 |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| US10388888B2 (en) | 2014-12-29 | 2019-08-20 | University Court Of The University Of St Andrews | Light emitting electrochemical cells and compounds |
| WO2019225483A1 (ja) * | 2018-05-21 | 2019-11-28 | 住友化学株式会社 | 発光素子用組成物、発光素子用組成物の製造方法、発光素子用組成物の評価方法、発光素子及び発光素子の製造方法 |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| US10693095B2 (en) | 2014-08-29 | 2020-06-23 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, display device, electronic device, and lighting device |
| WO2020178230A1 (en) | 2019-03-04 | 2020-09-10 | Merck Patent Gmbh | Ligands for nano-sized materials |
| WO2021122868A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2021192159A1 (ja) * | 2020-03-26 | 2021-09-30 | シャープ株式会社 | 発光素子、表示デバイス |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
Families Citing this family (56)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103329621A (zh) * | 2011-01-20 | 2013-09-25 | 出光兴产株式会社 | 有机电致发光元件 |
| EP3598520A1 (en) * | 2011-03-25 | 2020-01-22 | Idemitsu Kosan Co., Ltd | Organic electroluminescent element |
| DE102011089687A1 (de) * | 2011-12-22 | 2013-06-27 | Hartmut Yersin | Singulett-Harvesting mit speziellen organischen Molekülen ohne Metallzentren für opto-elektronische Vorrichtungen |
| US10957870B2 (en) * | 2012-09-07 | 2021-03-23 | Universal Display Corporation | Organic light emitting device |
| JP6113993B2 (ja) * | 2012-10-03 | 2017-04-12 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2014157433A1 (en) | 2013-03-26 | 2014-10-02 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, electronic device, and lighting device |
| WO2014166572A1 (de) | 2013-04-08 | 2014-10-16 | Merck Patent Gmbh | Organische lichtemittierende vorrichtung mit verzögerter fluoreszenz |
| KR102361072B1 (ko) | 2013-04-08 | 2022-02-09 | 메르크 파텐트 게엠베하 | 열 활성화 지연 형광 재료를 갖는 유기 전계발광 디바이스 |
| EP2984151B1 (de) | 2013-04-08 | 2018-04-25 | Merck Patent GmbH | Organische elektrolumineszenzvorrichtung |
| KR20230156154A (ko) * | 2013-05-16 | 2023-11-13 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자, 발광 장치, 전자 기기, 및 조명 장치 |
| US9130182B2 (en) * | 2013-06-28 | 2015-09-08 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, lighting device, light-emitting device, and electronic device |
| EP3029033B1 (en) * | 2013-08-01 | 2021-06-16 | Kyushu University, National University Corporation | Compound, light-emitting material, and organic light-emitting device |
| US10734587B2 (en) | 2014-03-13 | 2020-08-04 | Merck Patent Gmbh | Formulations of luminescent compounds |
| US10461260B2 (en) * | 2014-06-03 | 2019-10-29 | Universal Display Corporation | Organic electroluminescent materials and devices |
| WO2016042781A1 (ja) | 2014-09-19 | 2016-03-24 | 出光興産株式会社 | 新規な化合物 |
| KR20230051628A (ko) * | 2014-09-30 | 2023-04-18 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자, 표시 장치, 전자 기기, 및 조명 장치 |
| KR102409803B1 (ko) | 2014-10-10 | 2022-06-17 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자, 표시 장치, 전자 기기, 및 조명 장치 |
| EP3010052B1 (en) * | 2014-10-17 | 2017-08-09 | LG Display Co., Ltd. | Delayed fluorescence compound, and organic light emitting diode and display device using the same |
| US10334685B2 (en) * | 2014-11-14 | 2019-06-25 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Carbon dot light emitting diodes |
| US9957280B2 (en) | 2014-12-15 | 2018-05-01 | Samsung Electronics Co., Ltd. | Luminescent compound and electroluminescent device exhibiting thermally activated delayed fluorescence |
| US11653511B2 (en) * | 2015-02-13 | 2023-05-16 | Idemitsu Kosan Co., Ltd. | Organic EL light-emitting apparatus and electronic instrument |
| KR101706752B1 (ko) * | 2015-02-17 | 2017-02-27 | 서울대학교산학협력단 | 호스트, 인광 도펀트 및 형광 도펀트를 포함하는 유기발광소자 |
| TW202404148A (zh) | 2015-03-09 | 2024-01-16 | 日商半導體能源研究所股份有限公司 | 發光元件、顯示裝置、電子裝置及照明設備 |
| DE102015106941A1 (de) * | 2015-05-05 | 2016-11-10 | Osram Oled Gmbh | Organische Emitterschicht, organische Leuchtdiode und Verwendung von Schweratomen in einer organischen Emitterschicht einer organischen Leuchtdiode |
| WO2016181705A1 (ja) * | 2015-05-11 | 2016-11-17 | 日本放送協会 | 有機薄膜および有機薄膜の製造方法、有機エレクトロルミネッセンス素子、表示装置、照明装置、有機薄膜太陽電池、薄膜トランジスタ、塗料組成物 |
| US10651392B2 (en) | 2015-09-30 | 2020-05-12 | Samsung Electronics Co., Ltd. | Organic light-emitting device |
| JP6622569B2 (ja) * | 2015-11-13 | 2019-12-18 | 株式会社ジャパンディスプレイ | 有機el素子 |
| CN109196679B (zh) * | 2015-12-01 | 2021-06-08 | 株式会社半导体能源研究所 | 发光元件、发光装置、电子设备及照明装置 |
| US10854838B2 (en) | 2015-12-08 | 2020-12-01 | Idemitsu Kosan Co., Ltd. | Organic EL light emitting apparatus and electronic instrument |
| TWI594476B (zh) * | 2015-12-11 | 2017-08-01 | 友達光電股份有限公司 | 螢光有機發光材料及有機電激發光裝置 |
| CN106898709B (zh) * | 2015-12-18 | 2019-03-29 | 昆山国显光电有限公司 | 一种红色磷光有机电致发光器件 |
| CN108603957B (zh) * | 2016-02-19 | 2019-11-15 | 东丽株式会社 | 颜色转换片、包含其的光源单元、显示器及照明装置 |
| WO2018083801A1 (ja) | 2016-11-07 | 2018-05-11 | 日立化成株式会社 | 有機エレクトロニクス材料、有機層、有機エレクトロニクス素子、有機エレクトロルミネセンス素子、表示素子、照明装置、及び表示装置 |
| CN105895819B (zh) * | 2016-04-28 | 2018-07-06 | 京东方科技集团股份有限公司 | 一种oled器件及其制备方法、oled显示面板 |
| US10988447B2 (en) | 2016-06-30 | 2021-04-27 | Samsung Electronics Co., Ltd. | Bipyridine derivatives and their uses for organic light emitting diodes |
| JP6789195B2 (ja) | 2016-08-24 | 2020-11-25 | サイノラ ゲゼルシャフト ミット ベシュレンクテル ハフツング | 特に有機光電子デバイスに使用するための有機分子 |
| US11271164B2 (en) | 2016-10-03 | 2022-03-08 | Idemitsu Kosan Co., Ltd | Compound, composition, organic electroluminescent element and electronic device |
| KR102037816B1 (ko) * | 2016-11-16 | 2019-10-29 | 삼성에스디아이 주식회사 | 유기 광전자 소자 및 표시 장치 |
| US10153445B2 (en) * | 2016-11-21 | 2018-12-11 | Universal Display Corporation | Organic electroluminescent materials and devices |
| WO2018117241A1 (ja) * | 2016-12-21 | 2018-06-28 | 国立大学法人九州大学 | 発光材料、化合物および有機発光素子 |
| US11508909B2 (en) | 2017-03-02 | 2022-11-22 | Showa Denko Materials Co., Ltd. | Organic electronic material and use of same |
| US10636977B2 (en) | 2017-04-14 | 2020-04-28 | Feng-wen Yen | Light emitting material for organic electroluminescence device |
| KR102515592B1 (ko) | 2017-08-24 | 2023-03-30 | 삼성디스플레이 주식회사 | 함질소 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| CN109599493B (zh) * | 2017-09-30 | 2021-06-29 | 昆山国显光电有限公司 | 一种有机电致发光器件 |
| DE112019001181T5 (de) | 2018-03-07 | 2020-12-10 | Semiconductor Energy Laboratory Co., Ltd. | Licht emittierendes Element, Anzeigevorrichtung, elektronisches Gerät, organische Verbindung und Beleuchtungsvorrichtung |
| KR102477354B1 (ko) * | 2018-03-29 | 2022-12-15 | 삼성전자주식회사 | 가스 분배 판을 갖는 플라즈마 처리 장치 |
| US20210057667A1 (en) * | 2018-05-11 | 2021-02-25 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, display device, electronic appliance, organic compound, and lighting device |
| US11063224B2 (en) * | 2018-05-30 | 2021-07-13 | Kunshan Go-Visionox Opto-Electronics Co., Ltd. | Organic electroluminescent device |
| KR102648402B1 (ko) | 2018-06-12 | 2024-03-18 | 삼성디스플레이 주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| WO2020043657A1 (en) * | 2018-08-28 | 2020-03-05 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| KR102647025B1 (ko) | 2018-12-28 | 2024-03-12 | 엘지디스플레이 주식회사 | 발광 특성이 우수한 유기 화합물, 이를 포함하는 유기발광다이오드 및 유기발광장치 |
| US11930653B2 (en) | 2019-02-06 | 2024-03-12 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting device, light-emitting appliance, display device, electronic appliance, and lighting device |
| CN110854279B (zh) * | 2019-10-22 | 2021-06-01 | Tcl华星光电技术有限公司 | 一种oled显示面板及显示装置 |
| JP2021172603A (ja) * | 2020-04-22 | 2021-11-01 | 出光興産株式会社 | 化合物、有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子及び電子機器 |
| KR20230068392A (ko) | 2020-09-18 | 2023-05-17 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 |
| EP4223853A1 (en) * | 2022-02-04 | 2023-08-09 | Samsung Display Co., Ltd. | Organic electroluminescent devices |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003080760A1 (fr) | 2002-03-22 | 2003-10-02 | Idemitsu Kosan Co., Ltd. | Materiau pour dispositifs electroluminescents organiques et dispositifs electroluminescents organiques produits avec ce materiau |
| WO2003080761A1 (fr) * | 2002-03-25 | 2003-10-02 | Idemitsu Kosan Co., Ltd. | Materiau pour element organique electroluminescent et element organique electroluminescent l'utilisant |
| JP2010180204A (ja) | 2009-01-06 | 2010-08-19 | Fujifilm Corp | 電荷輸送材料及び有機電界発光素子 |
| WO2010134352A1 (ja) | 2009-05-22 | 2010-11-25 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2010134350A1 (ja) | 2009-05-22 | 2010-11-25 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2011070963A1 (ja) * | 2009-12-07 | 2011-06-16 | 新日鐵化学株式会社 | 有機発光材料及び有機発光素子 |
| WO2011132683A1 (ja) * | 2010-04-20 | 2011-10-27 | 出光興産株式会社 | ビスカルバゾール誘導体、有機エレクトロルミネッセンス素子用材料及びそれを用いた有機エレクトロルミネッセンス素子 |
Family Cites Families (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5821635B2 (ja) | 1971-12-06 | 1983-05-02 | エリ− リリ− エンド カンパニ− | 3− メチル −3− セフエムコウセイブツシツノ セイホウ |
| JPH11307255A (ja) | 1998-04-22 | 1999-11-05 | Matsushita Electric Ind Co Ltd | 有機電界発光素子 |
| US20030205696A1 (en) | 2002-04-25 | 2003-11-06 | Canon Kabushiki Kaisha | Carbazole-based materials for guest-host electroluminescent systems |
| EP1551206A4 (en) * | 2002-10-09 | 2007-12-05 | Idemitsu Kosan Co | ORGANIC ELECTROLUMINESCENCE ELEMENT |
| CN100518424C (zh) * | 2002-11-18 | 2009-07-22 | 出光兴产株式会社 | 有机电致发光元件 |
| JP4287198B2 (ja) * | 2002-11-18 | 2009-07-01 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2004055921A2 (en) * | 2002-12-13 | 2004-07-01 | Philips Intellectual Property & Standards Gmbh | Organic electroluminescent component with triplet emitter complex |
| JP2004214180A (ja) * | 2002-12-16 | 2004-07-29 | Canon Inc | 有機発光素子 |
| JP2004241374A (ja) | 2003-01-17 | 2004-08-26 | Sogo Pharmaceutical Co Ltd | 有機エレクトロルミネッセンス素子 |
| KR101035795B1 (ko) | 2003-04-10 | 2011-05-20 | 이데미쓰 고산 가부시키가이샤 | 방향족 아민 유도체 및 그것을 이용한 유기 전기발광 소자 |
| JP4552436B2 (ja) | 2003-12-24 | 2010-09-29 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP4970934B2 (ja) | 2004-03-19 | 2012-07-11 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| KR100573137B1 (ko) | 2004-04-02 | 2006-04-24 | 삼성에스디아이 주식회사 | 플루오렌계 화합물 및 이를 이용한 유기 전계 발광 소자 |
| KR100787425B1 (ko) | 2004-11-29 | 2007-12-26 | 삼성에스디아이 주식회사 | 페닐카바졸계 화합물 및 이를 이용한 유기 전계 발광 소자 |
| JP2006024830A (ja) | 2004-07-09 | 2006-01-26 | Sogo Pharmaceutical Co Ltd | 有機エレクトロルミネッセンス素子 |
| JP4541809B2 (ja) | 2004-09-08 | 2010-09-08 | キヤノン株式会社 | 有機化合物及び有機発光素子 |
| US7597967B2 (en) * | 2004-12-17 | 2009-10-06 | Eastman Kodak Company | Phosphorescent OLEDs with exciton blocking layer |
| US7474048B2 (en) | 2005-06-01 | 2009-01-06 | The Trustees Of Princeton University | Fluorescent filtered electrophosphorescence |
| WO2006130883A2 (en) * | 2005-06-01 | 2006-12-07 | The Trustees Of Princeton University | Fluorescent filtered electrophosphorescence |
| WO2007065550A1 (de) | 2005-12-08 | 2007-06-14 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| DE102005058557A1 (de) | 2005-12-08 | 2007-06-14 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung |
| KR100752321B1 (ko) * | 2005-12-23 | 2007-08-29 | 주식회사 두산 | 백색 유기 전계 발광소자 |
| KR100955993B1 (ko) | 2006-11-09 | 2010-05-04 | 신닛테츠가가쿠 가부시키가이샤 | 유기 전계 발광 소자용 화합물 및 유기 전계 발광 소자 |
| JP2007208289A (ja) * | 2007-03-30 | 2007-08-16 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子 |
| US20090179552A1 (en) * | 2007-11-15 | 2009-07-16 | Jesse Froehlich | Light emitting devices and compositions |
| JP2009123976A (ja) | 2007-11-16 | 2009-06-04 | Toyo Ink Mfg Co Ltd | 有機エレクトロルミネッセンス素子用材料および有機エレクトロルミネッセンス素子。 |
| KR100966885B1 (ko) * | 2008-02-29 | 2010-06-30 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 전계 발광 소자 |
| KR100946411B1 (ko) | 2008-03-28 | 2010-03-09 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 발광 소자 |
| KR100964232B1 (ko) | 2008-09-03 | 2010-06-17 | 삼성모바일디스플레이주식회사 | 실리콘 함유 화합물 및 이를 이용한 유기 전계 발광 장치 |
| JP2010114070A (ja) | 2008-10-10 | 2010-05-20 | Canon Inc | 白色有機el素子 |
| JP2010114428A (ja) | 2008-10-10 | 2010-05-20 | Canon Inc | 有機el表示装置 |
| JP5448680B2 (ja) | 2008-10-10 | 2014-03-19 | キヤノン株式会社 | 表示装置 |
| JP2010114425A (ja) | 2008-10-10 | 2010-05-20 | Canon Inc | 有機el表示装置 |
| EP2337785A1 (en) * | 2008-10-16 | 2011-06-29 | Solvay SA | N-phenyl carbazole-based host material for light-emitting diodes |
| DE102009023155A1 (de) * | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| KR101506999B1 (ko) * | 2009-11-03 | 2015-03-31 | 제일모직 주식회사 | 유기광전소자용 화합물 및 이를 포함하는 유기광전소자 |
| CN101740723B (zh) | 2009-11-03 | 2011-09-21 | 电子科技大学 | 一种有机电致发光器件及其制备方法 |
| US8617720B2 (en) * | 2009-12-21 | 2013-12-31 | E I Du Pont De Nemours And Company | Electroactive composition and electronic device made with the composition |
| JP2011222831A (ja) | 2010-04-12 | 2011-11-04 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子 |
| CN102884156B (zh) | 2010-06-24 | 2016-01-20 | 东丽株式会社 | 发光元件材料和发光元件 |
| JP5594031B2 (ja) | 2010-10-01 | 2014-09-24 | 東レ株式会社 | 発光素子材料および発光素子 |
| EP3598520A1 (en) * | 2011-03-25 | 2020-01-22 | Idemitsu Kosan Co., Ltd | Organic electroluminescent element |
| US9530969B2 (en) | 2011-12-05 | 2016-12-27 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescence device and organic electroluminescence device |
| WO2013084885A1 (ja) | 2011-12-05 | 2013-06-13 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| KR101704150B1 (ko) | 2011-12-05 | 2017-02-07 | 이데미쓰 고산 가부시키가이샤 | 유기 전기발광 소자용 재료 및 유기 전기발광 소자 |
| JP5959970B2 (ja) * | 2012-07-20 | 2016-08-02 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| US11611046B2 (en) * | 2014-03-13 | 2023-03-21 | Merck Patent Gmbh | Organic electroluminescent device |
-
2012
- 2012-03-23 EP EP19191788.9A patent/EP3598520A1/en active Pending
- 2012-03-23 JP JP2013507516A patent/JP5889280B2/ja active Active
- 2012-03-23 WO PCT/JP2012/057520 patent/WO2012133188A1/ja active Application Filing
- 2012-03-23 KR KR1020167022479A patent/KR102018418B1/ko active IP Right Grant
- 2012-03-23 TW TW105121552A patent/TW201638086A/zh unknown
- 2012-03-23 CN CN201610200978.1A patent/CN105762279B/zh active Active
- 2012-03-23 KR KR1020137024878A patent/KR101650996B1/ko active IP Right Grant
- 2012-03-23 TW TW101110136A patent/TWI552406B/zh active
- 2012-03-23 US US13/428,314 patent/US8643268B2/en active Active
- 2012-03-23 EP EP12762893.1A patent/EP2690681B1/en active Active
-
2013
- 2013-12-26 US US14/141,364 patent/US20140103329A1/en not_active Abandoned
-
2017
- 2017-02-01 US US15/422,054 patent/US10879482B2/en active Active
-
2020
- 2020-11-20 US US17/100,128 patent/US20210074941A1/en active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003080760A1 (fr) | 2002-03-22 | 2003-10-02 | Idemitsu Kosan Co., Ltd. | Materiau pour dispositifs electroluminescents organiques et dispositifs electroluminescents organiques produits avec ce materiau |
| WO2003080761A1 (fr) * | 2002-03-25 | 2003-10-02 | Idemitsu Kosan Co., Ltd. | Materiau pour element organique electroluminescent et element organique electroluminescent l'utilisant |
| JP2010180204A (ja) | 2009-01-06 | 2010-08-19 | Fujifilm Corp | 電荷輸送材料及び有機電界発光素子 |
| WO2010134352A1 (ja) | 2009-05-22 | 2010-11-25 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2010134350A1 (ja) | 2009-05-22 | 2010-11-25 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2011070963A1 (ja) * | 2009-12-07 | 2011-06-16 | 新日鐵化学株式会社 | 有機発光材料及び有機発光素子 |
| WO2011132683A1 (ja) * | 2010-04-20 | 2011-10-27 | 出光興産株式会社 | ビスカルバゾール誘導体、有機エレクトロルミネッセンス素子用材料及びそれを用いた有機エレクトロルミネッセンス素子 |
Non-Patent Citations (13)
| Title |
|---|
| "Hikarikagaku no Sekai", 1993, pages: 50 |
| "Organic EL Symposium", 17 June 2010, article "Expression of Highly-Efficient Thermally-Activated Delayed-Fluorescence and Application thereof to OLED", pages: 11 - 12 |
| "Organic EL Symposium", vol. S2-5, pages: II-12 |
| "Organic Photochemical Reaction Theory", 1973, TOKYO KAGAKU DOJIN CO., LTD. |
| D. YOKOYAMA ET AL., APPL. PHYS. LETT., vol. 93, 2008, pages 173302 |
| D. YOKOYAMA ET AL., APPL. PHYS. LETT., vol. 95, 2009, pages 243303 |
| D. YOKOYAMA ET AL., ORG. ELECTRON., vol. 10, 2009, pages 127 - 137 |
| ENDO ET AL.: "Efficient up-conversion of triplet excitons into a singlet state and its application for organic light emitting diodes", APPLIED PHYSICS LETTERS, vol. 98, no. 8, 24 February 2011 (2011-02-24), pages 083302 - 1-3, XP012140060 * |
| J. KANG ET AL., INTERNATIONAL JOURNAL OF POLYMER SCIENCE, vol. 2010 |
| M. KASHA ET AL., PURE AND APPLIED CHEMISTRY, vol. 11, 1965, pages 371 |
| S. DAS ET AL., J. PHYS. CHEM. B., vol. 103, 1999, pages 209 |
| S. M. BACHILO ET AL., J. PHYS. CHEM. A, vol. 104, 2000, pages 7711 |
| See also references of EP2690681A4 |
Cited By (135)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9660199B2 (en) | 2012-05-17 | 2017-05-23 | Kyulux, Inc. | Compound, light-emitting material, and organic light-emitting device |
| WO2013172255A1 (ja) * | 2012-05-17 | 2013-11-21 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
| JP2013258402A (ja) * | 2012-05-18 | 2013-12-26 | Semiconductor Energy Lab Co Ltd | 発光素子、発光装置、表示装置、電子機器及び照明装置 |
| US9099658B2 (en) | 2012-06-01 | 2015-08-04 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device |
| WO2013180241A1 (ja) * | 2012-06-01 | 2013-12-05 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および有機エレクトロルミネッセンス素子用材料 |
| USRE49343E1 (en) | 2012-06-01 | 2022-12-20 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device |
| WO2014013947A1 (ja) * | 2012-07-20 | 2014-01-23 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| US10461264B2 (en) | 2012-07-20 | 2019-10-29 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| US10930860B2 (en) | 2012-07-20 | 2021-02-23 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| US10032998B2 (en) | 2012-07-20 | 2018-07-24 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| US9608209B2 (en) | 2012-07-20 | 2017-03-28 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| US9219242B2 (en) | 2012-07-20 | 2015-12-22 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| JP7030927B2 (ja) | 2012-08-03 | 2022-03-07 | 株式会社半導体エネルギー研究所 | 発光素子、照明装置、発光装置および電子機器 |
| JP2021022744A (ja) * | 2012-08-03 | 2021-02-18 | 株式会社半導体エネルギー研究所 | 発光素子、照明装置、発光装置および電子機器 |
| JP2020141138A (ja) * | 2012-08-03 | 2020-09-03 | 株式会社半導体エネルギー研究所 | 発光装置 |
| US10644254B2 (en) | 2012-08-03 | 2020-05-05 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| US9947885B2 (en) | 2012-08-03 | 2018-04-17 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| JP2022065158A (ja) * | 2012-08-03 | 2022-04-26 | 株式会社半導体エネルギー研究所 | 発光素子、照明装置、発光装置および電子機器 |
| US10734594B2 (en) | 2012-08-03 | 2020-08-04 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| US10505132B2 (en) | 2012-08-03 | 2019-12-10 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| KR102208540B1 (ko) * | 2012-08-03 | 2021-01-28 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자 |
| KR20140018133A (ko) * | 2012-08-03 | 2014-02-12 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자 |
| JP2018152589A (ja) * | 2012-08-03 | 2018-09-27 | 株式会社半導体エネルギー研究所 | 発光方法、発光素子、照明装置、発光装置、および電子機器 |
| JP7202491B2 (ja) | 2012-08-03 | 2023-01-11 | 株式会社半導体エネルギー研究所 | 発光素子、照明装置、発光装置および電子機器 |
| JP2014045179A (ja) * | 2012-08-03 | 2014-03-13 | Semiconductor Energy Lab Co Ltd | 発光素子 |
| JP2017195389A (ja) * | 2012-08-03 | 2017-10-26 | 株式会社半導体エネルギー研究所 | 発光素子、照明装置、発光装置、電子機器 |
| US9559313B2 (en) | 2012-08-03 | 2017-01-31 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| KR20180133352A (ko) * | 2012-08-03 | 2018-12-14 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자 |
| JP2016006906A (ja) * | 2012-08-03 | 2016-01-14 | 株式会社半導体エネルギー研究所 | 発光素子 |
| JP2019054257A (ja) * | 2012-08-03 | 2019-04-04 | 株式会社半導体エネルギー研究所 | 発光装置および発光方法 |
| JP2019041114A (ja) * | 2012-08-03 | 2019-03-14 | 株式会社半導体エネルギー研究所 | 発光装置 |
| US9276228B2 (en) | 2012-08-03 | 2016-03-01 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| US11355722B2 (en) | 2012-08-03 | 2022-06-07 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| US11730007B2 (en) | 2012-08-03 | 2023-08-15 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| US10297761B2 (en) | 2012-12-10 | 2019-05-21 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| WO2014092083A1 (ja) * | 2012-12-10 | 2014-06-19 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| US10186665B2 (en) | 2012-12-28 | 2019-01-22 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| JPWO2014104315A1 (ja) * | 2012-12-28 | 2017-01-19 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2014104315A1 (ja) * | 2012-12-28 | 2014-07-03 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| WO2014104346A1 (ja) * | 2012-12-28 | 2014-07-03 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| US9882144B2 (en) | 2012-12-28 | 2018-01-30 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element |
| US9391290B2 (en) | 2013-01-10 | 2016-07-12 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting device comprising an organic compound |
| US9634267B2 (en) | 2013-01-10 | 2017-04-25 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, electronic device, and lighting device |
| WO2014109274A1 (en) * | 2013-01-10 | 2014-07-17 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, electronic device, and lighting device |
| US9935286B2 (en) | 2013-01-10 | 2018-04-03 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, electronic device, and lighting device |
| JP2014182898A (ja) * | 2013-03-18 | 2014-09-29 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子の製造方法、有機エレクトロルミネッセンス素子、および電子機器 |
| JPWO2014157619A1 (ja) * | 2013-03-29 | 2017-02-16 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| US10600983B2 (en) | 2013-03-29 | 2020-03-24 | Kyulux, Inc. | Organic electroluminescent device comprising delayed fluorescent materials |
| WO2014157619A1 (ja) * | 2013-03-29 | 2014-10-02 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| CN105074951A (zh) * | 2013-03-29 | 2015-11-18 | 国立大学法人九州大学 | 有机电致发光元件 |
| WO2014157610A1 (ja) | 2013-03-29 | 2014-10-02 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、照明装置、表示装置、有機ルミネッセンス素子用発光性薄膜と組成物及び発光方法 |
| US10141520B2 (en) | 2013-04-05 | 2018-11-27 | Konica Minolta, Inc. | Coating liquid for forming light emitting layer, organic electroluminescent element, method for manufacturing organic electroluminescent element, and lighting/display device |
| US10043982B2 (en) | 2013-04-26 | 2018-08-07 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, display device, electronic device, and lighting device |
| US10833279B2 (en) | 2013-04-26 | 2020-11-10 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, display device, electronic device, and lighting device |
| JP2016522579A (ja) * | 2013-06-06 | 2016-07-28 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子 |
| KR102550264B1 (ko) * | 2013-06-28 | 2023-07-04 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자의 제작 방법 및 발광 소자 |
| KR20150002534A (ko) * | 2013-06-28 | 2015-01-07 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자의 제작 방법 및 발광 소자 |
| JP2015053476A (ja) * | 2013-07-30 | 2015-03-19 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| CN105453294A (zh) * | 2013-08-14 | 2016-03-30 | 国立大学法人九州大学 | 有机电致发光元件 |
| US11944010B2 (en) | 2013-08-14 | 2024-03-26 | Kyulux, Inc. | Organic electroluminescent device |
| JP5669163B1 (ja) * | 2013-08-14 | 2015-02-12 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| CN105453294B (zh) * | 2013-08-14 | 2018-02-02 | 国立大学法人九州大学 | 有机电致发光元件 |
| WO2015022974A1 (ja) * | 2013-08-14 | 2015-02-19 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| JP2015037138A (ja) * | 2013-08-14 | 2015-02-23 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子用金属錯体、並びに表示装置及び照明装置 |
| EP4152910A1 (en) * | 2013-08-14 | 2023-03-22 | Kyulux, Inc. | Organic electroluminescent device |
| US11450817B2 (en) | 2013-08-14 | 2022-09-20 | Kyulux, Inc. | Organic electroluminescent device |
| US10862047B2 (en) | 2013-08-14 | 2020-12-08 | Kyushu University, National University Corporation | Organic electroluminescent device |
| JP2015179809A (ja) * | 2013-08-14 | 2015-10-08 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| JP2015179817A (ja) * | 2013-08-14 | 2015-10-08 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| JP2015038941A (ja) * | 2013-08-19 | 2015-02-26 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、それに用いる蛍光発光性化合物、当該有機エレクトロルミネッセンス素子を具備する照明装置及び表示装置 |
| JP2019054261A (ja) * | 2013-08-26 | 2019-04-04 | 株式会社半導体エネルギー研究所 | 発光装置 |
| US11825718B2 (en) | 2013-08-26 | 2023-11-21 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, display module, lighting module, light-emitting device, display device, electronic appliance, and lighting device |
| US11049908B2 (en) | 2013-08-26 | 2021-06-29 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, display module, lighting module, light-emitting device, display device, electronic appliance, and lighting device |
| JP2015065225A (ja) * | 2013-09-24 | 2015-04-09 | 日本放送協会 | 有機エレクトロルミネッセンス素子及びこれを用いた表示装置、照明装置 |
| JP2015106659A (ja) * | 2013-11-29 | 2015-06-08 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| US10312453B2 (en) | 2013-12-17 | 2019-06-04 | Beijing Visionox Technology Co., Ltd. | Organic electroluminescent device and method for manufacture thereof |
| KR101930146B1 (ko) * | 2013-12-17 | 2018-12-17 | 베이징 비젼녹스 테크놀로지 컴퍼니 리미티드 | 유기 전계 발광 소자 및 그의 제조방법 |
| JP2017503343A (ja) * | 2013-12-17 | 2017-01-26 | 北京維信諾科技有限公司 | 有機エレクトロルミネッセン素子及びその製造方法 |
| KR20160099644A (ko) * | 2013-12-17 | 2016-08-22 | 베이징 비젼녹스 테크놀로지 컴퍼니 리미티드 | 유기 전계 발광 소자 및 그의 제조방법 |
| JP2019054262A (ja) * | 2013-12-26 | 2019-04-04 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| EP3879592A1 (en) | 2013-12-26 | 2021-09-15 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element and electronic device |
| KR20190083000A (ko) | 2013-12-26 | 2019-07-10 | 이데미쓰 고산 가부시키가이샤 | 유기 일렉트로 루미네센스 소자 및 전자 기기 |
| US9905779B2 (en) | 2013-12-26 | 2018-02-27 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element and electronic device |
| US10811616B2 (en) | 2013-12-26 | 2020-10-20 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element and electronic device |
| WO2015098975A1 (ja) | 2013-12-26 | 2015-07-02 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| JP2016129262A (ja) * | 2013-12-26 | 2016-07-14 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| KR20180020320A (ko) | 2013-12-26 | 2018-02-27 | 이데미쓰 고산 가부시키가이샤 | 유기 일렉트로 루미네센스 소자 및 전자 기기 |
| US11569456B2 (en) | 2013-12-26 | 2023-01-31 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent element and electronic device |
| KR20160113219A (ko) | 2014-03-07 | 2016-09-28 | 코니카 미놀타 가부시키가이샤 | 유기 일렉트로루미네센스 소자, 표시 장치, 조명 장치 및 발광성 조성물 |
| JP2017509164A (ja) * | 2014-03-13 | 2017-03-30 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセント素子 |
| US11611046B2 (en) | 2014-03-13 | 2023-03-21 | Merck Patent Gmbh | Organic electroluminescent device |
| JP2016027605A (ja) * | 2014-06-26 | 2016-02-18 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子用材料、および電子機器 |
| WO2015198987A1 (ja) * | 2014-06-26 | 2015-12-30 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子用材料、および電子機器 |
| WO2016010136A1 (ja) * | 2014-07-18 | 2016-01-21 | 国立大学法人九州大学 | 有機発光素子 |
| JP2016036022A (ja) * | 2014-07-31 | 2016-03-17 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子材料、有機エレクトロルミネッセンス素子、電荷移動性薄膜、表示装置及び照明装置 |
| US10693095B2 (en) | 2014-08-29 | 2020-06-23 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, display device, electronic device, and lighting device |
| US11563191B2 (en) | 2014-08-29 | 2023-01-24 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element with light-emitting layer including first and second organic compounds, display device, electronic device, and lighting device |
| US10714700B2 (en) | 2014-08-29 | 2020-07-14 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, display device, electronic device, and lighting device |
| US11043638B2 (en) | 2014-10-07 | 2021-06-22 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device and electronic device |
| KR20170085434A (ko) | 2014-10-07 | 2017-07-24 | 이데미쓰 고산 가부시키가이샤 | 유기 일렉트로루미네선스 소자 및 전자 기기 |
| KR20160045569A (ko) * | 2014-10-17 | 2016-04-27 | 엘지디스플레이 주식회사 | 지연 형광 화합물, 이를 포함하는 유기발광다이오드소자 및 표시장치 |
| KR102503744B1 (ko) | 2014-10-17 | 2023-02-24 | 엘지디스플레이 주식회사 | 지연 형광 화합물, 이를 포함하는 유기발광다이오드소자 및 표시장치 |
| US10388888B2 (en) | 2014-12-29 | 2019-08-20 | University Court Of The University Of St Andrews | Light emitting electrochemical cells and compounds |
| US10351765B2 (en) | 2015-02-06 | 2019-07-16 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence element and electronic device |
| CN107112431A (zh) * | 2015-02-06 | 2017-08-29 | 出光兴产株式会社 | 有机电致发光元件和电子设备 |
| CN107112431B (zh) * | 2015-02-06 | 2019-08-23 | 出光兴产株式会社 | 有机电致发光元件和电子设备 |
| JPWO2016125807A1 (ja) * | 2015-02-06 | 2017-11-24 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| WO2016125807A1 (ja) * | 2015-02-06 | 2016-08-11 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| US10125310B2 (en) | 2015-02-06 | 2018-11-13 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence element and electronic device |
| KR101835934B1 (ko) * | 2015-05-04 | 2018-03-08 | 단국대학교 산학협력단 | 지연형광을 나타내는 호스트를 함유하는 유기발광다이오드 |
| JP2018524803A (ja) * | 2015-06-03 | 2018-08-30 | ユー・ディー・シー アイルランド リミテッド | 減衰時間がきわめて短く高度に効率的なoledデバイス |
| US11437582B2 (en) | 2015-06-16 | 2022-09-06 | Kunshan Go-Visionox Opto-Electronics Co., Ltd. | Organic electroluminescent device and manufacturing method thereof |
| JP2018519663A (ja) * | 2015-06-16 | 2018-07-19 | 昆山国顕光電有限公司Kunshan Go−Visionox Opto−Electronics Co., Ltd. | 有機エレクトロルミネッセンス装置及びその製造方法 |
| JP2018524819A (ja) * | 2015-07-23 | 2018-08-30 | メルク パテント ゲーエムベーハー | 有機電子素子での使用のための少なくとも2種の電子受容体と少なくとも2種の電子供与体で置換されたフェニル誘導体 |
| JP2017054972A (ja) * | 2015-09-10 | 2017-03-16 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、照明装置、π共役系化合物、及び発光性薄膜 |
| JPWO2017115608A1 (ja) * | 2015-12-28 | 2018-10-18 | コニカミノルタ株式会社 | π共役系化合物、有機エレクトロルミネッセンス素子材料、発光材料、電荷輸送材料、発光性薄膜、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP2017197482A (ja) * | 2016-04-28 | 2017-11-02 | コニカミノルタ株式会社 | π共役系化合物、有機エレクトロルミネッセンス素子材料、発光材料、電荷輸送材料、発光性薄膜、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019225483A1 (ja) * | 2018-05-21 | 2019-11-28 | 住友化学株式会社 | 発光素子用組成物、発光素子用組成物の製造方法、発光素子用組成物の評価方法、発光素子及び発光素子の製造方法 |
| CN111095590B (zh) * | 2018-05-21 | 2021-12-17 | 住友化学株式会社 | 发光元件用组合物的制造方法和发光元件的制造方法 |
| CN111095590A (zh) * | 2018-05-21 | 2020-05-01 | 住友化学株式会社 | 发光元件用组合物、发光元件用组合物的制造方法、发光元件用组合物的评价方法、发光元件和发光元件的制造方法 |
| US11158829B2 (en) | 2018-05-21 | 2021-10-26 | Sumitomo Chemical Company, Limited | Method for producing a composition for a light-emitting element and method for evaluating same |
| WO2020064582A1 (de) | 2018-09-24 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von granulat |
| WO2020178230A1 (en) | 2019-03-04 | 2020-09-10 | Merck Patent Gmbh | Ligands for nano-sized materials |
| WO2021122868A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| CN115298723A (zh) * | 2020-03-26 | 2022-11-04 | 夏普株式会社 | 发光元件、显示装置 |
| WO2021192159A1 (ja) * | 2020-03-26 | 2021-09-30 | シャープ株式会社 | 発光素子、表示デバイス |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
Also Published As
| Publication number | Publication date |
|---|---|
| US20120248968A1 (en) | 2012-10-04 |
| CN103443949B (zh) | 2016-03-09 |
| EP2690681B1 (en) | 2019-09-11 |
| US20170149007A1 (en) | 2017-05-25 |
| KR102018418B1 (ko) | 2019-09-04 |
| TW201638086A (zh) | 2016-11-01 |
| EP2690681A4 (en) | 2014-09-03 |
| KR20140015385A (ko) | 2014-02-06 |
| US10879482B2 (en) | 2020-12-29 |
| TWI552406B (zh) | 2016-10-01 |
| JP5889280B2 (ja) | 2016-03-22 |
| EP2690681A1 (en) | 2014-01-29 |
| CN105762279B (zh) | 2018-04-17 |
| EP3598520A1 (en) | 2020-01-22 |
| CN103443949A (zh) | 2013-12-11 |
| JPWO2012133188A1 (ja) | 2014-07-28 |
| US8643268B2 (en) | 2014-02-04 |
| TW201248965A (en) | 2012-12-01 |
| KR20160101214A (ko) | 2016-08-24 |
| US20210074941A1 (en) | 2021-03-11 |
| CN105762279A (zh) | 2016-07-13 |
| KR101650996B1 (ko) | 2016-08-24 |
| US20140103329A1 (en) | 2014-04-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5889280B2 (ja) | 有機エレクトロルミネッセンス素子 | |
| JP5959970B2 (ja) | 有機エレクトロルミネッセンス素子 | |
| US9899620B2 (en) | Organic electroluminescent element | |
| US8847218B2 (en) | Organic electroluminescent element | |
| JP5925308B2 (ja) | 有機エレクトロルミネッセンス素子 | |
| KR101831015B1 (ko) | 유기 일렉트로 루미네선스 소자 | |
| WO2014087913A1 (ja) | 有機エレクトロルミネッセンス素子 | |
| JP6317499B2 (ja) | 有機エレクトロルミネッセンス素子 | |
| JP6117413B2 (ja) | 有機エレクトロルミネッセンス素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 201280013486.1 Country of ref document: CN |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12762893 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2013507516 Country of ref document: JP Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 20137024878 Country of ref document: KR Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |