JP4220249B2 - サイクリックアミジン誘導体 - Google Patents
サイクリックアミジン誘導体 Download PDFInfo
- Publication number
- JP4220249B2 JP4220249B2 JP2002583377A JP2002583377A JP4220249B2 JP 4220249 B2 JP4220249 B2 JP 4220249B2 JP 2002583377 A JP2002583377 A JP 2002583377A JP 2002583377 A JP2002583377 A JP 2002583377A JP 4220249 B2 JP4220249 B2 JP 4220249B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- cyclic
- phenyl
- butyl
- tert
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 CC*c(cc(cc1*2CC(CC(C)CC(CC)C(C)C=C)CC2)C(C)=O)c1OCOC Chemical compound CC*c(cc(cc1*2CC(CC(C)CC(CC)C(C)C=C)CC2)C(C)=O)c1OCOC 0.000 description 16
- AWWZFOCSQDUJDE-UHFFFAOYSA-N CCC(C)Cc1cc(C)cc(C)c1C Chemical compound CCC(C)Cc1cc(C)cc(C)c1C AWWZFOCSQDUJDE-UHFFFAOYSA-N 0.000 description 1
- RJCLVZXDTKQCOR-CYZMBNFOSA-N CC[C@H](C)[C@@H](CNC1=N)[C@H]1c1ccccc1 Chemical compound CC[C@H](C)[C@@H](CNC1=N)[C@H]1c1ccccc1 RJCLVZXDTKQCOR-CYZMBNFOSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/44—Iso-indoles; Hydrogenated iso-indoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Rheumatology (AREA)
- Physical Education & Sports Medicine (AREA)
- Pulmonology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Pain & Pain Management (AREA)
- Immunology (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pyrrole Compounds (AREA)
- Indole Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Thiazole And Isothizaole Compounds (AREA)
Description
本発明は、新規なサイクリックアミジン誘導体およびその塩、ならびにそれらを含有する医薬組成物等に関する。
背景技術
最近の抗血栓症へのアプローチは、トロンビンへの酵素活性を阻害するものであり、これにはヘパリン、低分子ヘパリン、ヒルジン、アルガトロバン、ヒルログ等の化合物が含まれる。これらの化合物はすべてトロンビンの酵素活性を阻害する。従ってこれらの化合物はいずれもトロンビンの細胞に対する作用を特異的には阻害せず、フィブリン血餅形成も阻害する。そのため臨床においては出血傾向と言う副作用が常に付きまとっている。血栓症におけるトロンビンの役割は、その血液凝固活性に制限されず、血小板トロンビンレセプターの活性化の結果生じる血管損傷部位での血小板凝集塊形成にもあると思われる。
今一つの抗血栓症へのアプローチとしてはGPIIb/IIIaレセプターアンタゴニストとしてAbciximab、Eptifibatide、Tirofiban等が静注剤として利用されている。これらの化合物はトロンビン、ADP、コラーゲン、PAF等のあらゆる刺激に対して血小板凝集を抑制するため強力な抗血栓作用を示す反面、トロンビンの酵素活性阻害剤と同様、副作用としての出血傾向が付きまとう。そのため経口剤としての開発も進められてはいるが未だに上市された化合物はない。
冠動脈血管形成術といった侵襲的治療によって誘発された血管壁損傷に対する血管過増殖性応答である再狭窄は、トロンビンが直接的または間接的に細胞に作用することによって誘発された事象である可能性がある。損傷を受けた血管に血小板が粘着し成長因子の放出が起こり、平滑筋細胞増殖が誘発される。内皮細胞に対するトロンビンの作用によっても、間接的に平滑筋細胞が作用を受ける可能性がある。さらに、血管損傷部位では血小板粘着が起こりプロコアグラント活性が上昇する。その部位において生成されたトロンビンの高い局所的濃度のため平滑筋細胞は直接刺激される可能性もある。実際効力あるトロンビン阻害剤ヒルジンを用いた最近の研究では、トロンビンが再狭窄プロセスにおいて細胞増殖を引き起こすことが示唆されているが、トロンビンの効果が直接的な作用であるか間接的な作用であるかは解明されていない(Sarembock et al.,Circulation.1992,84:232−243)。トロンビンの細胞作用は、様々な病的症状を引き起こす可能性を持つものの、トロンビンの細胞作用を特異的に遮断する治療用作用物質は全く知られていない。
最近、トロンビンレセプター(PAR−1)がクローニングされ(Vu et al.,Cell,1991,64:1057−1068)、細胞トロンビンレセプターを標的とする作用物質を開発する重要な機会が生み出された。トロンビンレセプターのアミノ酸配列の詳細な検査によりレセプターの100残基アミノ末端ドメイン内に存在するトロンビンの結合部位と加水分解部位が明らかにされた。その後行ったレセプターのアミノ酸変異体の研究によって、トロンビンレセプターのこの部位をトロンビンが限定加水分解することがレセプターの活性化に必要であることが立証された(Vu et al.,Nature,1991,353:674−677)。トロンビンレセプターが加水分解の結果、新たに生じるアミノ酸配列に対応した合成ペプチド(「トロンビンレセプター活性化ペプチド、thrombin receptor activating peptide;TRAP」と呼ばれる)が、トロンビンによる加水分解がない状態のレセプターを活性化し得る。この事はレセプターの分解によってアミノ末端に生じる新しいアミノ酸配列(「連結型リガンドペプチド、tethered ligand peptide」と呼ばれる)がリガンドとして機能し遠位の結合部位において相互作用することを示唆している。TRAPの更なる研究により血小板、内皮細胞、繊維芽細胞及び平滑筋細胞の中に存在するトロンビンレセプターの類似性が確認された(Hung et al.,J.Cell.Biol.1992,116:827−832,Ngaiza,Jaffe,Biochem.Biophys.Res.Commun.1991,179:1656−1661)。
TRAPの構造活性研究からペンタペプチドPhe−Leu−Leu−Arg−Asnは、トロンビン又はTRAPのいずれかで活性化された血小板トロンビンレセプターの弱い拮抗体であることが示唆された(Vssallo.et al.,J.Biol.Chem.,1992,267:6081−6085(1992))。レセプターの拮抗に対する異なるアプローチがその他のグループにより研究されてきた。一つ目はトロンビンレセプターのトロンビン結合ドメインに対する抗体を作成する試みである。これらの抗体は有効かつ特異的に血小板のトロンビンによる活性化を抑制し、トロンビンレセプターの拮抗体として作用する(Hung et al.,J.Clin.Invest.1992,89:1350−1353)。二つ目はTRAPからのペプチド誘導体の開発である(steven M.S.,J.Med.Chem.1996,39:4879−4887,William J.H.,Bioorg.Med.Chem.Lett.1998,8:1649−1654,David F.M.,Bioorg.Med.Chem.Lett.1999,9:255−260)。最後にレセプターバインディングを中心とした各種アッセイ系を利用したハイスループットスクリーニングの実施により見出された低分子化合物の開発である(Andrew W.S.et al.,Bioorg.Med Chem.Lett.1999,9:2073−2078,Scherig Plough WO99/26943.Halord S.et al.,ACS meeting in Oct.2001)。
発明の開示
このように、トロンビン受容体に拮抗作用を有する化合物は、トロンビンが関与する疾患の治療や予防において優れた作用効果を発揮するものと期待されており、従って、例えば血栓症、血管再狭窄、深部静脈血栓症、肺塞栓症、脳梗塞、心疾患、播種性血管内血液凝固症候群、高血圧、炎症性疾患、リウマチ、喘息、糸球体腎炎、骨粗鬆症、神経疾患、悪性腫瘍、等の治療や予防に有効であると期待することができる。薬理活性、トロンビン受容体に対する受容体特異性、安全性、投与量、経口有用性、等の点を満足させるトロンビン受容体拮抗剤の提供が待望されている。
しかしながら、従来のトロンビン受容体拮抗剤は、受容体に対する特異性や経口有効性等の点で充分ではなかった。
本発明の目的は、優れたトロンビン受容体阻害活性を有し、トロンビン受容体拮抗剤として有用な化合物を探索し、見出すことにある。
本発明者らは、上記事情に鑑み精力的に研究を重ねた結果、下式一般式(I)で表される新規なサイクリックアミジン誘導体を合成することに成功し、更に予想外にも、これらの化合物またはその塩が、優れたトロンビン受容体阻害活性を有し、トロンビン受容体拮抗剤として有用であることを見出し、本発明を完成するに至った。
本発明は、
<1> 式
[式中、R1、R2、R3、R4、R5およびR7は同一または相異なって(1)水素原子、(2)シアノ基、(3)ハロゲン原子または(4)下記置換基群aから選ばれるいずれか1の基を示し、zは0または1を示し、さらに、R2とR4は結合してC,NおよびOから選ばれる1乃至5個の原子を有する5〜6員環を形成してもよく、R4およびR5は結合により一緒になって単結合を形成してもよい;R6は(1)水素原子、(2)C1−6アルキル基、(3)アシル基、(4)カルバモイル基、(5)水酸基、(6)C1−6アルコキシ基、(7)C1−6アルキルオキシカルボニルオキシ基、(8)C3−8環状アルキル基、(9)アシルオキシ基で置換されていてもよいC1−6アルキルオキシカルボニル基または(10)それぞれ下記置換基群eから選ばれる少なくとも1の基で置換されていてもよいC6−14芳香族炭化水素環式基もしくは5乃至14員芳香族複素環式基を示し;nは1または2の整数を示し;Y1は単結合、−(CH2)m−、−CR8−、−CR8R9−、−CH2CO−、−NR8−、−SO−、−SO2−、−CO−、−CONR8−または−SO2NR8−〔式中、mは1乃至3の整数を、R8およびR9は同一または相異なって水素原子、ハロゲン原子、C1−6アルキル基、カルボキシル基またはC1−6アルコキシカルボニル基を示す〕を示し;Y2は単結合、O、N、−(CH2)m−、−CR8−、CR8R9−、−CO−、−SO−、−SO2−または−C(=N−OR8)−〔式中、m、R8およびR9は前記定義と同意義を示す〕を示し;Arは(1)水素原子、(2)式
〔式中、R10、R11、R12、R13およびR14は同一または相異なって(1)水素原子、(2)シアノ基、(3)ハロゲン原子、(4)ニトロ基または(5)下記置換基群bから選ばれるいずれか1の基を示し、さらに、R11とR12、または、R12とR13は結合してN、SおよびOから選ばれる1乃至4個の複素原子を含有していてもよくかつ下記置換基群fから選ばれる少なくとも1の基で置換されていてもよい5乃至8員複素環を形成していてもよい。〕で表わされる基または(3)下記置換基群gから選ばれる少なくとも1の基で置換されていてもよい5乃至14員芳香族複素環式基を示す。
<前記置換基群a>下記置換基群a’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、アルキリデン基、C2−6アルケニル基、C2−6アルキニル基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、スルホニルアミノ基、スルホニル基、スルファモイル基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群a’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子、C3−8環状アルキル基、含ヘテロ環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群を示し、更に、前記C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基は、それぞれC1−6アルキル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子およびC3−8環状アルキル基からなる群より選ばれる少なくとも1の基で置換されていてもよい;
<前記置換基群b>下記置換基群b’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、スルホニルアミノ基、スルホニル基、スルファモイル基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群b’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、オキソ基、シアノ基、C1−6シアノアシル基、C2−7アシル基、C1−6アルカノイル基、ベンゾイル基、アラルカノイル基、C1−6アルコキシアルキルカルボニル基、C1−6ヒドロキシアルキルカルボニル基、カルボキシル基、C1−6カルボキシルアルキル基、C1−6カルボキシルアルキルオキシ基、カルバモイル基、カルバモイルアルキルオキシ基、C1−6アルコキシカルボニル基、C1−10アルコキシカルボニルC1−6アルキル基、C1−10アルコキシカルボニルC1−6アルキルオキシ基、C1−6モノアルキルアミノカルボニル基、C2−6ジアルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C1−10アルコキシアルキル基、C1−10アラルキルオキシアルキル基、C1−6ヒドロキシアルキル基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、C1−6アルキルスルホニルアミノ基、フェニルスルホニルアミノ基、C1−6アルキルスルホニル基、フェニルスルホニル基、C1−6モノアルキルアミノスルホニル基、C2−6ジアルキルアミノスルホニル基、スルファモイル基、ハロゲノ基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基、含ヘテロ環状アミノカルボニル基、含ヘテロ環状アミノスルホニル基およびイソキサゾリニル基からなる群を示し、更に、前記5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基およびイソキサゾリニル基は、独立に、C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C1−6ジアルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、アルキルスルホニルアミノ基、アルキルスルホニル基、スルファモイル基、ハロゲノ基およびC3−8環状アルキル基からなる群より選ばれる少なくとも1の基で置換されていてもよい;
<前記置換基群e>C1−6アルキル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子およびC3−8環状アルキル基からなる群;
<前記置換基群f>(1)水素原子、(2)シアノ基、(3)ハロゲン原子、(4)オキソ基ならびに(5)それぞれ下記置換基群f’から選ばれる少なくとも1の基で置換されていてもよいC1−6アルキル基、アルケニル基、アルキニル基、アシル基、C1−6アルカノイル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、イミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、スルホニルアミノ基、スルホニル基、スルファモイル基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群f’>C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、ベンジルオキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、C1−6アルキルスルホニルアミノ基、C1−6アルキルスルホニル基、スルファモイル基、ハロゲノ基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群g>C1−6アルキル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、スルホニル基、スルファモイル基、ハロゲノ基およびC3−8環状アルキル基からなる群。]
で表わされる化合物またはその塩;
<2> R1、R2およびR3は同一または相異なって水素原子、C1−6アルキル基、C1−6アルコキシ基、アリールC1−6アルキル基およびアリールC1−6アルキリデン基からなる群から選ばれるいずれか1の基を示し、R4、R5およびR7は同一または相異なって水素原子、C1−6アルキル基および水酸基からなる群から選ばれるいずれか1の基を示し、zは0または1を示し、さらに、R2とR4は結合してC,NおよびOから選ばれる1乃至5個の原子を有する5〜6員環を形成してもよく、R4およびR5は結合により一緒になって単結合を形成してもよい;R6は水素原子、C1−6アルキル基およびアシルオキシ基で置換されていてもよいC1−6アルキルオキシカルボニル基からなる群から選ばれるいずれか1の基を示し;nは1を示し;Y1は単結合または−(CH2)m−〔式中、mは1乃至3の整数を示す〕を示し;Y2は単結合または−CO−を示し;Arは水素原子または式
〔式中、R10、R11、R12、R13およびR14は同一または相異なって水素原子、C1−6アルキル基、水酸基、C1−6アルコキシ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、5乃至14員非芳香族複素環式基およびC1−6アルキルオキシカルボニルオキシ基からなる群から選ばれるいずれか1の基を示し、さらに、R11とR12、または、R12とR13は結合して、(i)N、SおよびOから選ばれる1乃至4個の複素原子を含有していてもよく、かつ(ii)シアノ基、オキソ基ならびにそれぞれ下記置換基群f”:
<前記置換基群f”>C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基およびC1−6アルコキシ基からなる群;
から選ばれる少なくとも1の基で置換されていてもよいC1−6アルキル基、アシル基、C1−6アルカノイル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、スルホニル基および5乃至14員非芳香族複素環式基からなる群から選ばれる少なくとも1の基で置換されていてもよい、5乃至8員複素環を形成していてもよい。〕で表わされる基を示す、<1>記載の化合物またはその塩;
<3> Y1が−CH2−である<1>記載の化合物またはその塩;
<4> Y2が−CO−である<1>記載の化合物またはその塩;
<5> Y1が−CH2−で、Y2が−CO−である<1>記載の化合物またはその塩;
<6> Y1が単結合で、Y2が単結合で、Arが水素原子である<1>記載の化合物またはその塩;
<7> Arが式
〔式中、R10、R11、R12、R13およびR14は前記定義と同意義を示す。〕で表わされる基である<1>記載の化合物またはその塩。
<8> R10およびR14が水素原子である<7>記載の化合物またはその塩。
<9> Arが(1)式
[式中、R10、R11、R12、R13およびR14はそれぞれ前記定義と同意義を示す。]で表わされる基または(2)前記置換基群gから選ばれる少なくとも1の基で置換されていてもよい5乃至14員芳香族複素環式基である<1>記載の化合物またはその塩;
<10> R10およびR14が水素原子である<9>記載の化合物またはその塩;
<11> Arが式
[式中、R11およびR13は前記定義と同意義を、R15は(1)水素原子または(2)下記置換基群hから選ばれるいずれか1の基を示し、さらに、R11およびR15は結合して前記置換基群fから選ばれる少なくとも1の基で置換されていてもよくN、SおよびOから選ばれる1または2個の複素原子を含有していてもよい5乃至8員複素環を形成してもよい。
<前記置換基群h>下記置換基群h’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、アシル基、C1−6アルコキシカルボニル基、アミノカルボニル基、C1−6アルキルアミノカルボニル基、C3−8環状アルキル基、C1−6アミノアルキル基、スルホニル基、C3−8環状アルキルアミノ基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群h’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、オキソ基、シアノ基、C1−6シアノアルキル基、C2−7アシル基、C1−6アルカノイル基、ベンゾイル基、アラルカノイル基、C1−6アルコキシアルキルカルボニル基、C1−6ヒドロキシアルキルカルボニル基、カルボキシル基、C1−6カルボキシルアルキル基、C1−6カルボキシルアルキルオキシ基、カルバモイル基、カルバモイルアルキルオキシ基、C1−6アルコキシカルボニル基、C1−10アルコキシカルボニルC1−6アルキル基、C1−10アルコキシカルボニルC1−6アルキルオキシ基、C1−6モノアルキルアミノカルボニル基、C2−6ジアルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C1−10アルコキシアルキル基、C1−10アラルキルオキシアルキル基、C1−6ヒドロキシアルキル基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、C1−6アルキルスルホニルアミノ基、フェニルスルホニルアミノ基、C1−6アルキルスルホニル基、フェニルスルホニル基、C1−6モノアルキルアミノスルホニル基、C2−6ジアルキルアミノスルホニル基、スルファモイル基、ハロゲノ基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基、含ヘテロ環状アミノカルボニル基、含ヘテロ環状アミノスルホニル基およびイソキサゾリニル基からなる群を示し、更に、前記5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基およびイソキサゾリニル基は、独立に、C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C1−6ジアルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、アルキルスルホニルアミノ基、アルキルスルホニル基、スルファモイル基、ハロゲノ基およびC3−8環状アルキル基からなる群から選ばれる少なくとも1の基で置換されていてもよい。]
で表される基である<1>記載の化合物またはその塩;
<12> Arが式
[式中、R11およびR15はそれぞれ前記定義と同意義を、R16は(1)水素原子または(2)前記置換基群hから選ばれるいずれか1の基を示し、さらに、R11とR15、または、R15とR16が結合して前記置換基群fから選ばれる少なくとも1の基で置換されていてもよくN、SおよびOから選ばれる1または2個の複素原子を有していてもよい5乃至6員複素環を形成していてもよい。]
で表される基である<1>記載の化合物またはその塩;
<13> Arが式
[式中、R11およびR15はそれぞれ前記定義と同意義を、R17およびR18は同一または相異なって(1)水素原子または(2)下記置換基群iから選ばれるいずれか1の基を示し、さらに、R11とR15、R15とR17、R15とR18、または、R17とR18は結合して前記置換基群fから選ばれる少なくとも1の基で置換されていてもよくN、SおよびOから選ばれる1または2個の複素原子を含有していてもよい5乃至8員複素環を形成してもよい。
<前記置換基群i>下記置換基群i’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、アシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、C1−6アミノアルキル基、スルホニル基、スルファモイル基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群i’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、オキソ基、シアノ基、C1−6シアノアルキル基、C2−7アシル基、C1−6アルカノイル基、ベンゾイル基、アラルカノイル基、C1−6アルコキシアルキルカルボニル基、C1−6ヒドロキシアルキルカルボニル基、カルボキシル基、C1−6カルボキシルアルキル基、C1−6カルボキシルアルキルオキシ基、カルバモイル基、カルバモイルアルキルオキシ基、C1−6アルコキシカルボニル基、C1−10アルコキシカルボニルC1−6アルキル基、C1−10アルコキシカルボニルC1−6アルキルオキシ基、C1−6モノアルキルアミノカルボニル基、C2−6ジアルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C1−10アルコキシアルキル基、C1−10アラルキルオキシアルキル基、C1−6ヒドロキシアルキル基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、C1−6アルキルスルホニルアミノ基、フェニルスルホニルアミノ基、C1−6アルキルスルホニル基、フェニルスルホニル基、C1−6モノアルキルアミノスルホニル基、C2−6ジアルキルアミノスルホニル基、スルファモイル基、ハロゲノ基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基、含ヘテロ環状アミノカルボニル基、含ヘテロ環状アミノスルホニル基およびイソキサゾリニル基からなる群を示し、更に、前記5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基およびイソキサゾリニル基は、独立に、C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C1−6ジアルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、アルキルスルホニルアミノ基、アルキルスルホニル基、スルファモイル基、ハロゲノ基およびC3−8環状アルキル基からなる群から選ばれる少なくとも1の基で置換されていてもよい。]
で表わされる基である<1>記載の化合物またはその塩;
<14> <1>記載の化合物またはその塩を含有してなる医薬組成物;
<15> トロンビン受容体の拮抗剤である<14>記載の組成物;
<16> トロンビンのPAR1受容体の拮抗剤である<14>記載の組成物;
<17> 血小板凝集阻害剤である<14>記載の組成物;
<18> 平滑筋細胞の増殖阻害剤である<14>記載の組成物;
<19> 内皮細胞、繊維芽細胞、腎細胞、骨肉腫細胞、筋細胞、ガン細胞および/またはグリア細胞の増殖阻害剤である<14>記載の組成物;
<20> 血栓症、血管再狭窄、深部静脈血栓症、肺塞栓症、脳梗塞、心疾患、播種性血管内血液凝固症候群、高血圧、炎症性疾患、リウマチ、喘息、糸球体腎炎、骨粗鬆症、神経疾患および/または悪性腫瘍の治療剤または予防剤である<14>記載の組成物;
<21> トロンビン受容体拮抗剤の製造のための<1>記載の化合物またはその塩の使用;
<22> トロンビン受容体拮抗剤がPAR1受容体拮抗剤である<21>記載の使用;
<23> 血小板凝集阻害剤の製造のための<1>記載の化合物またはその塩の使用;
<24> トロンビン受容体が関与する疾患の患者に、治療上有効量の<1>記載の化合物またはその塩を投与する、前記疾患の治療方法;
<25> 内皮細胞、繊維芽細胞、腎細胞、骨肉腫細胞、筋細胞、ガン細胞および/またはグリア細胞の増殖性疾患を有する患者に、治療上有効量の<1>記載の化合物またはその塩を投与する、前記疾患の治療方法;
にある。
発明を実施するための最良の形態
以下、本発明の内容について詳細に説明する。
本明細書中においては、化合物の構造式が便宜上一定の異性体を表すことがあるが、本発明には化合物の構造上生ずる総ての幾何異性体、不斉炭素に基づく光学異性体、立体異性体、互変異性体等の異性体および異性体混合物を含み、便宜上の式の記載に限定されるものではなく、いずれか一方の異性体でも混合物でもよい。従って、本発明化合物には、分子内に不斉炭素原子を有し光学活性体およびラセミ体が存在することがあり得るが、本発明においては限定されず、いずれもが含まれる。また、結晶多形が存在することもあるが同様に限定されず、いずれかの結晶形が単一であってもまたは結晶形混合物であってもよい。本発明にかかる化合物またはその塩は、無水物であっても水和物をはじめとする溶媒和物であってもよく、いずれも本明細書の特許請求の範囲に含まれる。また、本発明にかかる化合物が生体内で分解されて生じる代謝物、ならびに、本発明にかかる化合物またはその塩のプロドラッグも本明細書の特許請求の範囲に包含される。
以下に、本明細書において記載する記号、用語等の意義を説明し、本発明を詳細に説明する。
本明細書において用いる「および/または」なる語句は、「および」の場合と「または」の場合の両者を含む意味で用いられる。
本明細書において用いる「ハロゲン原子」としては、例えばフッ素原子、塩素原子、臭素原子、ヨウ素原子、等の原子があげられ、好ましくはフッ素原子、塩素原子、臭素原子である。
本明細書において用いる「C1−6アルキル基」とは、炭素数が1ないし6個のアルキル基を示し、好適な基としては例えばメチル基、エチル基、n−プロピル基、iso−プロピル基、n−ブチル基、iso−ブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、1,1−ジメチルプロピル基、1,2−ジメチルプロピル基、2,2−ジメチルプロピル基、1−エチルプロピル基、2−エチルプロピル基、n−ヘキシル基、1−メチル−2−エチルプロピル基、1−エチル−2−メチルプロピル基、1,1,2−トリメチルプロピル基、1−プロピルプロピル基、1−メチルブチル基、2−メチルブチル基、1,1−ジメチルブチル基、1,2−ジメチルブチル基、2,2−ジメチルブチル基、1,3−ジメチルブチル基、2,3−ジメチルブチル基、2−エチルブチル基、2−メチルペンチル基、3−メチルペンチル基、等の直鎖または分枝状アルキル基があげられ、より好ましくはメチル基、エチル基、n−プロピル基、iso−プロピル基、n−ブチル基、iso−ブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、等である。
本明細書において用いる「C2−6アルケニル基」とは、炭素数2ないし6個のアルケニル基を示し、好適な基として例えばビニル基、アリル基、1−プロペニル基、2−プロペニル基、イソプロペニル基、2−メチル−1−プロペニル基、3−メチル−1−プロペニル基、2−メチル−2−プロペニル基、3−メチル−2−プロペニル基、1−ブテニル基、2−ブテニル基、3−ブテニル基、1−ペンテニル基、1−ヘキセニル基、1,3−ヘキサンジエニル基、1,6−ヘキサンジエニル基、等があげられる。
本明細書において用いる「C2−6アルキニル基」とは、炭素数が2ないし6個のアルキニル基を示し、好適な基として例えばエチニル基、1−プロピニル基、2−プロピニル基、1−ブチニル基、2−ブチニル基、3−ブチニル基、3−メチル−1−プロピニル基、1−エチニル−2プロピニル基、2−メチル−3−プロピニル基、1−ペンチニル基、1−ヘキシニル基、1,3−ヘキサンジインイル基、1,6−ヘキサンジインイル基、等があげられる。
本明細書において用いる「C3−8シクロ(環状)アルキル基」とは、3ないし8個の炭素原子で構成されたシクロアルキル基を示し、例えばシクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基、シクロヘプチル基、シクロオクチル基、等があげられる。
本明細書において用いる「C3−8シクロ(環状)アルケニル基」とは、3ないし8個の炭素原子で構成されたC3−8シクロアルケニル基を示し、例えばシクロプロペン−1−イル、シクロプロペン−3−イル、シクロブテン−1−イル、シクロブテン−3−イル、1,3−シクロブタジエン−1−イル、シクロペンテン−1−イル、シクロペンテン−3−イル、シクロペンテン−4−イル、1,3−シクロペンタジエン−1−イル、1,3−シクロペンタジエン−2−イル、1,3−シクロペンタジエン−5−イル、シクロヘキセン−1−イル、シクロヘキセン−3−イル、シクロヘキセン−4−イル、1,3−シクロヘキサジエン−1−イル、1,3−シクロヘキサジエン−2−イル、1,3−シクロヘキサジエン−5−イル、1,4−シクロヘキサジエン−3−イル、1,4−シクロヘキサジエン−1−イル、シクロヘプテン−1−イル、シクロヘプテン−3−イル、シクロヘプテン−4−イル、シクロヘプテン−5−イル、1,3−シクロヘプテン−2−イル、1,3−シクロヘプテン−1−イル、1,3−シクロヘプタジエン−5−イル、1,3−シクロヘプタジエン−6−イル、1,4−シクロヘプタジエン−3−イル、1,4−シクロヘプタジエン−2−イル、1,4−シクロヘプタジエン−1−イル、1,4−シクロヘプタジエン−6−イル、1,3,5−シクロヘプタトリエン−3−イル、1,3,5−シクロヘプタトリエン−2−イル、1,3,5−シクロヘプタトリエン−1−イル、1,3,5−シクロヘプタトリエン−7−イル、シクロオクテン−1−イル、シクロオクテン−3−イル、シクロオクテン−4−イル、シクロオクテン−5−イル、1,3−シクロオクタジエン−2−イル、1,3−シクロオクタジエン−1−イル、1,3−シクロオクタジエン−5−イル、1,3−シクロオクタジエン−6−イル、1,4−シクロオクタジエン−3−イル、1,4−シクロオクタジエン−2−イル、1,4−シクロオクタジエン−1−イル、1,4−シクロオクタジエン−6−イル、1,4−シクロオクタジエン−7−イル、1,5−シクロオクタジエン−3−イル、1,5−シクロオクタジエン−2−イル、1,3,5−シクロオクタトリエン−3−イル、1,3,5−シクロオクタトリエン−2−イル、1,3,5−シクロオクタトリエン−1−イル、1,3,5−シクロオクタトリエン−7−イル、1,3,6−シクロオクタトリエン−2−イル、1,3,6−シクロオクタトリエン−1−イル、1,3,6−シクロオクタトリエン−5−イル、1,3,6−シクロオクタトリエン−6−イル基、等があげられる。
本明細書において用いる「C1−6アルコキシ基」とは、炭素数1ないし6のアルコキシ基を示し、好適な基としては例えばメトキシ基、エトキシ基、n−プロポキシ基、iso−プロポキシ基、sec−プロポキシ基、n−ブトキシ基、iso−ブトキシ基、sec−ブトキシ基、tert−ブトキシ基、n−ペンチルオキシ基、iso−ペンチルオキシ基、sec−ペンチルオキシ基、n−ヘキソキシ基、iso−ヘキソキシ基、1,1−ジメチルプロピルオキシ基、1,2−ジメチルプロポキシ基、2,2−ジメチルプロピルオキシ基、2−エチルプロポキシ基、1−メチル−2−エチルプロポキシ基、1−エチル−2−メチルプロポキシ基、1,1,2−トリメチルプロポキシ基、1,1,2−トリメチルプロポキシ基、1,1−ジメチルブトキシ基、1,2−ジメチルブトキシ基、2,2−ジメチルブトキシ基、2,3−ジメチルブチルオキシ基、1,3−ジメチルブチルオキシ基、2−エチルブトキシ基、1,3−ジメチルブトキシ基、2−メチルペントキシ基、3−メチルペントキシ基、ヘキシルオキシ基、等があげられる。
本明細書において用いる「C2−6アルケニルオキシ基」とは、炭素数2ないし6のアルケニルオキシ基を示し、好適な基としては例えばビニロキシ基、アリロキシ基、1−プロペニルオキシ基、2−プロペニルオキシ基、イソプロペニルオキシ基、2−メチル−1−プロペニルオキシ基、3−メチル−1−プロペニルオキシ基、2−メチル−2−プロペニルオキシ基、3−メチル−2−プロペニルオキシ基、1−ブテニルオキシ基、2−ブテニルオキシ基、3−ブテニルオキシ基、1−ペンテニルオキシ基、1−ヘキセニルオキシ基、1,3−ヘキサンジエニルオキシ基、1,6−ヘキサンジエニルオキシ基、等があげられる。
本明細書において用いる「アシル基」とは、カルボン酸のカルボキシル基からOH基を除いた原子団を示し、好ましくはC2−7アシル基(炭素数2乃至7のカルボン酸(より好ましくは脂肪酸)のカルボキシル基からOH基を除いた原子団)であり、好適な基としては例えばアセチル基、プロピオニル基、ブチロイル基、ベンゾイル基、等があげられる。
本明細書における「C6−14芳香族炭化水素環式基」とは、6ないし14個の炭素原子で構成された芳香族炭化水素環式基をいい、単環式基、ならびに、二環式基や三環式基等の縮合環が含まれる。当該基における具体的な例をあげると、フェニル基、インデニル基、1−ナフチル基、2−ナフチル基、アズレニル基、ヘプタレニル基、ビフェニル基、インダセニル基、アセナフチル基、フルオレニル基、フェナレニル基、フェナントレニル基、アントラセニル基、シクロペンタシクロオクテニル基、ベンゾシクロオクテニル基、等があげられる。
本明細書における「5乃至14員芳香族複素環式基」とは、窒素原子、硫黄原子および酸素原子からなる群から選ばれる複素原子を1個以上含んでなる単環式、二環式または三環式の5乃至14員芳香族複素環式基をいう。当該基における具体的な例をあげると、(i)例えば含窒素芳香族複素環式基としてはピロリル基、ピリジル基、ピリダジニル基、ピリミジニル基、ピラジニル基、トリアゾリル基、テトラゾリル基、ベンゾトリアゾリル基、ピラゾリル基、イミダゾリル基、ベンツイミダゾリル基、インドリル基、イソインドリル基、インドリジニル基、プリニル基、インダゾリル基、キノリル基、イソキノリル基、キノリジル基、フタラジル基、ナフチリジニル基、キノキサリル基、キナゾリニル基、シンノリニル基、プテリジニル基、イミダゾトリアジニル基、ピラジノピリダジニル基、アクリジニル基、フェナントリジニル基、カルバゾリル基、カルバゾリニル基、ペリミジニル基、フェナントロリニル基、フェナシニル基、イミダゾピリジニル基、イミダゾピリミジニル基、ピラゾロピリジニル基、ピラゾロピリジニル基、等;(ii)含硫黄芳香族複素環式基としてはチエニル基、ベンゾチエニル基、等;(iii)含酸素芳香族複素環式基としてはフリル基、ピラニル基、シクロペンタピラニル基、ベンゾフリル基、イソベンゾフリル基、等;(iv)2個以上の異種複素原子を含んでなる芳香族複素環式基としてはチアゾリル基、イソチアゾリル基、ベンゾチアゾリル基、ベンズチアジアゾリル基、フェノチアジニル基、イソキサゾリル基、フラザニル基、フェノキサジニル基、オキサゾリル基、イソキサゾイル基、ベンゾオキサゾリル基、オキサジアゾリル基、ピラゾロオキサゾリル基、イミダゾチアゾリル基、チエノフラニル基、フロピロリル基、ピリドオキサジニル基、等があげられる。
本明細書において用いる「5乃至14員非芳香族複素環式基」とは、窒素原子、硫黄原子および酸素原子からなる群から選ばれる複素原子を1個以上含んでなる単環式、二環式または三環式の5乃至14員非芳香族複素環式基をいう。当該基における具体的な例をあげると、例えばピロリジル基、ピロリル基、ピペリジル基、ピペラジル基、イミダゾリル基、ピラゾリジル基、イミダゾリジル基、モルホリル基、テトラヒドロフリル基、テトラヒドロピラニル基、アジリジニル基、オキシラニル基、オキサチオラニル基、等があげられる。また、当該非芳香族複素環式基には、ピリドン環から誘導される基や、非芳香族性の縮合環(例えばフタルイミド環、スクシンイミド環、等から誘導される基)も含まれる。
本明細書中における「5乃至8員複素環」とは、5乃至8員の芳香族または非芳香族の複素環を示す。
本明細書における「アリール」とは、芳香族炭化水素の環に結合する水素原子が1個離脱した残りの原子団をいい、フェニル基、トリル基、キシリル基、ビフェニル基、ナフチル基、アントリル基、フェナントリル基、等があげられる。
本明細書中における「アルキリデン基」とは、脂肪族炭化水素(好ましくは炭素数1〜6のアルカン)の同一炭素原子から水素2原子が失われて生じる2価の基を示し、エチリデン基等があげられる。
また、本明細書中において表される「置換基を有していてもよい」とは、「置換可能な部位に、任意に組み合わせて1または複数個の置換基を有してもよい」と同意義である。
本明細書中において「ヘテロ原子」とは、具体的には酸素原子、硫黄原子、窒素原子、リン、砒素、アンチモン、ケイ素、ゲルマニウム、スズ、鉛、ホウ素、水銀などが挙げられ、好ましくは酸素原子、硫黄原子、窒素原子である。
本明細書中において「n−」とはノルマルタイプまたは1級置換基であることを意味し、「sec−」とは2級置換基であることを意味し、「t−」とは3級置換基であることを意味し、「i−」とはイソタイプの置換基であることを意味する。
前記一般式(I)で表わされる本発明の化合物におけるR1、R2、R3、R4、R5、R7、z、n、R6、Y1、Y2、Arの意義は前記定義の如くであるが、nとしては1が好ましく、A環はピロリジン環がより好ましい。
また、R1、R2およびR3としては、水素原子、C1−6アルキル基、C1−6アルコキシ基、アリールC1−6アルキル基およびアリールC1−6アルキリデン基からなる群から選ばれるいずれか1の基が好ましい。さらに、R4、R5およびR7としては、水素原子、C1−6アルキル基および水酸基からなる群から選ばれるいずれか1の基が好ましい。なお、R1が単結合でA環に結合している場合はR7の数(z)は1が好ましく、他方、R1が二重結合でA環に結合している場合はR7の数(z)は0が好ましい。また、R2とR4は結合してC,NおよびOから選ばれる1乃至5個の原子を有する5〜6員環を形成していてもよく、R4およびR5は結合により一緒になって単結合を形成していてもよい。
R6としては水素原子、C1−6アルキル基およびアシルオキシ基で置換されていてもよいC1−6アルキルオキシカルボニル基からなる群から選ばれるいずれか1の基が好ましい。
さらに、Y1としては単結合または−(CH2)m−〔式中、mは1乃至3の整数を示す〕が好ましく、Y2としては単結合または−CO−が好ましく、中でも(i)Y1が−CH2−、Y2が−CO−である組み合わせ、(ii)Y1およびY2が単結合である組み合わせがより好ましい。
また、Arとしては水素原子または式
〔式中、R10、R11、R12、R13およびR14は前記定義と同意義を示す。〕で表わされる基が好ましい。
なお、(i)(Y1が−CH2−、Y2が−CO−)の場合はArが前記一般式(II)で表わされる基であることが好ましく、(ii)(Y1およびY2が単結合)の場合はArが水素原子であることが好ましい。
また、R10、R11、R12、R13およびR14は同一または相異なって水素原子、C1−6アルキル基、水酸基、C1−6アルコキシ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、5乃至14員非芳香族複素環式基およびC1−6アルキルオキシカルボニルオキシ基からなる群から選ばれるいずれか1の基であることが好ましく、中でもR10およびR14は水素原子であることがより好ましい。さらに、R11とR12、または、R12とR13は結合して、(i)N、SおよびOから選ばれる1乃至4個の複素原子を含有していてもよく、かつ(ii)シアノ基、オキソ基ならびにそれぞれ下記置換基群f”:
<前記置換基群f”>C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基およびC1−6アルコキシ基からなる群;
から選ばれる少なくとも1の基で置換されていてもよいC1−6アルキル基、アシル基、C1−6アルカノイル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、スルホニル基および5乃至14員非芳香族複素環式基からなる群から選ばれる少なくとも1の基で置換されていてもよい、5乃至8員複素環を形成していてもよい。なお、前記(ii)の群としては、シアノ基、オキソ基、C1−6アルキル基、シアノC1−6アルキル基、C1−6アシル基、カルボキシル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基からなる群が好ましい。
このようにR10およびR14は水素原子であるArの中でより好適な例としては、式
[式中、R11およびR13は前記定義と同意義を、R15は(1)水素原子または(2)前記置換基群hから選ばれるいずれか1の基を示し、さらに、R11およびR15は結合して前記置換基群fから選ばれる少なくとも1の基で置換されていてもよくN、SおよびOから選ばれる1または2個の複素原子を含有していてもよい5乃至8員複素環を形成してもよい。]で表される基;式
[式中、R11およびR15はそれぞれ前記定義と同意義を、R16は(1)水素原子または(2)前記置換基群hから選ばれるいずれか1の基を示し、さらに、R11とR15、または、R15とR16が結合して前記置換基群fから選ばれる少なくとも1の基で置換されていてもよくN、SおよびOから選ばれる1または2個の複素原子を有していてもよい5乃至6員複素環を形成していてもよい。]で表される基;式
[式中、R11およびR15はそれぞれ前記定義と同意義を、R17およびR18は同一または相異なって(1)水素原子または(2)前記置換基群iから選ばれるいずれか1の基を示し、さらに、R11とR15、R15とR17、R15とR18、または、R17とR18は結合して前記置換基群fから選ばれる少なくとも1の基で置換されていてもよくN、SおよびOから選ばれる1または2個の複素原子を含有していてもよい5乃至8員複素環を形成してもよい。]で表わされる基;
が挙げられる。
本明細書における「塩」とは、本発明にかかる化合物と塩を形成し、且つ薬理学的に許容されるものであれば特に限定されないが、好ましくはハロゲン化水素酸塩(例えばフッ化水素酸塩、塩酸塩、臭化水素酸塩、ヨウ化水素酸塩等)、無機酸塩(例えば硫酸塩、硝酸塩、過塩素酸塩、リン酸塩、炭酸塩、重炭酸塩等)有機カルボン酸塩(例えば酢酸塩、トリフルオロ酢酸塩、シュウ酸塩、マレイン酸塩、酒石酸塩、フマル酸塩、クエン酸塩等)、有機スルホン酸塩(例えばメタンスルホン酸塩、トリフルオロメタンスルホン酸塩、エタンスルホン酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩、カンファースルホン酸塩等)、アミノ酸塩(例えばアスパラギン酸塩、グルタミン酸塩等)、四級アミン塩、アルカリ金属塩(例えばナトリウム塩、カリウム塩等)、アルカリ土類金属塩(マグネシウム塩、カルシウム塩等)等があげられ、当該「薬理学的に許容できる塩」として、より好ましくは塩酸塩、シュウ酸塩、トリフルオロ酢酸塩、等である。
次に、本発明の化合物またはその塩の製造法について述べる。前記一般式(I)で表わされる本発明の化合物またはその塩の製造方法としては様々な方法が考えられ、通常の有機合成手段を用いて合成することができるが、以下にその代表的な製造法を挙げる。
[代表的な製造方法]
飽和環状アミジン誘導体の一般的合成方法を以下の製造法IからKに示す。
<製造法I>
(スキームI)
本スキームは、イミデート(I−b)を中間体とする環状アミジン(I−d)の合成法である。式中R1〜R6およびArは請求項1で示した(I)で表される化合物における定義と同じである。
工程1は、ラクタムからイミデートへの変換方法である。ジクロロメタン中室温でトリメチルオキソニウムテトラフルオロボーレートを作用させることにより(I−b)を得ることができる。
工程2は、アミノ基での置換反応である。アルコール溶媒中塩化アンモニウムあるいはアルキルアミン塩酸塩とともに加熱還流することにより(I−c)を得ることができる。
工程3は、フェナシルブロマイドとのカップリング反応であり、以下の2種類の方法により行うことができる。1)(I−c)のアセトニトリル溶液に、等量のDBUを作用させ塩フリーにした後、フェナシルブロマイドを作用させる方法またはアルコール溶媒中、塩基性イオン交換樹脂で塩フリーにした後、アルコールとアセトニトリルの混合溶媒中、フェナシルブロミドを作用させる方法いずれかにより(I−d)を得ることができる。
また、(I−c)であらわされる環状アミジンは、製造法Jに示した方法によっても合成可能である。
<製造法J>
(スキームJ)
本スキームは、チオイミデート(J−b)を中間体とする環状アミジン(I−c)の合成法である。式中R1,R2,R3,R4,R5およびR6は請求項1で示した(I)で表される化合物における定義と同じである。R7はメチルあるいはエチル基を表す。
工程1は、チオラクタムの合成方法である。テトラヒドロフラン等の溶媒中ローソン試薬を作用させることにより(J−a)を得ることができる。
工程2は、硫黄原子のアルキル化の方法である。ジメチルホルムアミド等の溶媒中炭酸カリウムの存在下、メチルヨーダイドあるいはエチルヨーダイドを作用させることにより(J−b)を得ることができる。
工程3は、アミノ基への置換反応の方法であり、スキームI工程2と同様の方法により(I−c)を得ることができる。
ここで、製造法IおよびJの原料となるラクタム(I−a)は、主にHansen,Donald W.D.,Jr.,et al.WO96/35677に記載の方法のスキームI−1あるいはI−2に示した方法により行うことができるが、他にピログルタミン酸誘導体、ピログルタミノール誘導体[C.Najera et.al.,Tetrahedron:Asymmetry,10,p2245(1999)]、アルコキシカルボニル置換誘導体[T.S.Mansour et.al.,Bioorg.Med.Chem.Lett.,1,p757(1991)、K.J.Lindstrom et.al.,Syn.Commun.,20,p2335(1990)]、アミノ基置換誘導体[S.Ranganathan et.al.,Tetrahedron Lett.,29,p3111(1988)]、あるいは双環性化合物の合成法として、ポーソン−カンド反応を利用するM.E.Kraftt et.al.,J.Org.Chem.,57,p5277(1992)等に記載の方法を用いて合成することができる。あるいはこれらから常法による各種変換反応を行った化合物を利用することもできる。
(スキームI−1)
(スキームI−2)
式中R1,R2,R3およびR4は請求項1で示した(I)で表される化合物における定義と同じである。ここで、(II−a)であらわされる不飽和エステル誘導体は、対応するカルボニル化合物のWittig反応あるいはHoner−Emmons反応、またY.Ueno et.al.,Teterahedron Lett.,39,p3753(1978)に記載の方法等を利用し合成することができる。
さらに(I−a)であらわされるラクタムよりスキームI−3およびI−4に示す方法でアルキル基やアルキリデン基の導入が可能である。
(スキームI−3)
式中R1,R2,R3,R4,R5およびR7は請求項1で示した(I)で表される化合物における定義と同じである。
工程1は、ラクタムの窒素原子をBoc基で保護する方法である。ジクロロメタン中トリエチルアミンおよびジメチルアミノピリジンの存在下ジ第3ブチルジカーボネートを作用させることにより(I3−a)を得ることができる。
工程2は、アルキル化の方法である。テトラヒドロフラン中リチウムヘキサメチルジシラザンを用いてアニオンを発生させた後アルキルハライドを作用させることにより(I3−b)を得ることができる。
工程3は、保護基を除去する方法である。ジクロロメタンで希釈したトリフルオロ酢酸に溶解することにより脱保護を行い(I3−c)を得ることができる。
得られた化合物(I3−c)は、製造法IおよびJで示した方法により最終目的化合物へと導かれる。
(スキームI−4)
式中R1,R2,R3,R4およびR5は請求項1で示した(I)で表される化合物における定義と同じである。R8は、置換されていてもよいアルキル基、置換されていてもよいフェニル基、芳香族複素環式基を表す。
工程1は、アルデヒドを用いる縮合である。テトラヒドロフラン中リチウムヘキサメチルジシラザンを用いてアニオンを発生させた後、アルデヒドを作用させる。芳香族アルデヒドを用いた場合は、後処理中に脱水反応も進行し(I4−a)であらわされる化合物を得ることができる。一方、飽和アルデヒドを用いた場合には、アルコールを単離後、さらに以下の二工程の変換を行う。1)ジクロロメタン中トリエチルアミンの存在下メシルクロライドを作用させメシレートを得る。2)アセトニトリル等の溶媒中DBUで処理することにより(I4−a)を得ることができる。
工程2および4は、保護基を除去する方法であり、スキームI−3工程2と同様の方法に従い行うことができる。
工程3は、二重結合の還元の方法であり、アルコール溶媒中パラジウム炭素の存在化水素添加反応を行い(I4−c)を得ることができる。
得られた化合物(I4−b)および(I4−d)は製造法IおよびJで示した方法に従い最終目的化合物へと導かれる。また、ニトリル基を利用し直接アミジンを得ることも可能である。
<製造法K>
(スキームK)
本スキームは、環状アミジン(K−c)の合成法である。式中R2,R3およびR4は請求項1で示した(I)で表される化合物における定義と同じである。R9は水素原子、シアノ基、ハロゲノ基、水酸基、アリルオキシ基、アルコキシカルボニル基、置換されていてもよいアルコキシ基、置換されていてもよいアルキル基、置換されていてもよいアミノ基、置換されていてもよいアミノスルフォニル基を表す。R10は水素原子、ハロゲノ基、置換されていてもよいアルキル基,置換されていてもよいアルコキシ基を表す。
ここで用いる反応は、いずれもスキームI−2に示した方法と同様の手法を用いることにより行うことができる。
以下からは、前記の製造法で使用する出発原料の一般的合成法を述べていく。
<製造法AP>
アミノフェノール誘導体合成の共通原料となる中間体(AP1−c),(AP1−d),(AP1−e),(AP2−b),(AP2−c)および(AP2−d)を合成する方法である。
(スキームAP−1)
本スキームは、(AP1−a)から(AP1−e)を合成する方法である。式中R1は水素および置換されていてもよいアルキル基、置換されていてもよい環状アルキル基、置換されていてもよいアルコキシ基等を表す。R2は、製造法MOで定義したR6およびR7と同義である。
工程1は、フリーデルクラフトアシル化の工程である。(AP1−a)をジクロロメタンおよびトルエン等の溶媒中、塩化アルミニウム、塩化亜鉛および塩化第二スズ等のルイス酸存在下、アセチルクロリドと−70℃から室温で反応させることにより(AP1−b)を得ることができる。
工程2は、ニトロ化の工程である。トルエン、ヘキサン、エーテルおよび無水酢酸等の溶媒中、発煙硝酸あるいは濃硝酸と反応させることにより(AP1−c)を得ることができる。または、硝酸ナトリウムと塩酸から硝酸を発生させて反応させることもできる。
工程3は、(AP1−c)の水酸基に種々の構造の置換基R2を導入する工程である。ジメチルホルムアミド、アセトニトリル、テトラヒドロフラン、ジクロロメタンまたはアセトン等の溶媒中、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、トリアルキルアミン、ピリジン誘導体および水素化ナトリウム等の塩基存在下、種々のハライド、メシレートおよびトシレートを反応させて(AP1−d)を得ることができる。式中R2は製造法MOの工程1で定義したR6と同義である。
工程4は、ニトロ基の還元工程である。テトラヒドロフラン、酢酸エチル、メタノールおよびエタノール等の溶媒中、パラジウム炭素等の触媒存在下、水素雰囲気下で反応させ(AP1−e)を得ることができる。あるいは、含水メタノールや含水エタノール等の溶媒中、塩化アンモニウム存在下、溶媒の還流温度で鉄を加えて反応させる方法によっても(AP1−e)を得ることができる。
(スキームAP−2)
本スキームは、(AP1−a)から(AP2−d)を合成する方法である。式中R1は水素原子および置換されていてもよいアルキル基、置換されていてもよい環状アルキル基、置換されていてもよいアルコキシ基等を表す。
工程1は、フェノール性水酸基のパラ位をブロム化する工程である。メタノール、エタノールおよびクロロホルム等の溶媒中、臭素と反応させる。あるいはアセトニトリル、ジメチルホルムアミド等の溶媒中、N−ブロモスクシンイミドと作用させることにより(AP2−a)を得ることができる。
工程2は、ニトロ化の工程である。トルエン、ヘキサン、エーテルおよび無水酢酸等の溶媒中、発煙硝酸あるいは濃硝酸と反応させることにより(AP2−b)を得ることができる。または、硝酸ナトリウムと塩酸から硝酸を発生させて反応させることもできる。
工程3は、(AP2−b)の水酸基に種々の構造の置換基R2を導入する工程である。ジメチルホルムアミド、アセトニトリル、テトラヒドロフラン、ジクロロメタンまたはアセトン等の溶媒中、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム、トリアルキルアミン、ピリジン誘導体および水素化ナトリウム等の塩基存在下、種々のハライド、メシレートおよびトシレートを反応させて(AP2−c)を得ることができる。式中R2は製造法MOの工程1で定義したR6と同義である。
工程4は、ニトロ基の還元工程である。含水メタノールや含水エタノール等の溶媒中、塩化アンモニウム存在下、溶媒の還流温度で鉄を加えて反応させる方法によっても(AP2−d)を得ることができる。
以下の製造法PPから製造法BOLに、製造法APで合成した化合物を原料とした各種アミノフェノール誘導体の一般的製造法を示す。
<製造法PP>
製造法PPは、ピペラジン誘導体の一般的合成法である。
工程1は化合物(PP−a)のアミノ基をビスクロロエチルアミン塩酸塩で処理してピペラジン環を形成する工程である。好ましくは、化合物(PP−a)にビスクロロエチルアミン塩酸塩を1,2−ジクロロベンゼン中加熱還流下で作用させ、発生する塩酸ガスを除去しながら反応を行い(PP−b)を得る。
式中R1は水素原子および置換されていてもよいアルキル基、置換されていてもよい環状アルキル基、置換されていてもよいアルコキシ基、置換されていてもよいアルキルアミノ基等を表す。R2は水素原子、置換されていてもよいアルキル基等を表す。
なお、製造法PPの式中を通してピペラジンに限定され記されているが、特にこれに限定されるものではなく窒素原子を複数含む5〜8員環の環形成も含まれるものとする。
工程2は化合物(PP−b)のピペラジンの2級アミンの部位に置換基R3を導入する工程である。化合物(PP−b)にジクロロメタン、テトラヒドロフラン等の適切な溶媒中、炭酸カリウムおよび炭酸水素ナトリウム等の無機塩基、またはトリアルキルアミン、ピリジン誘導体等の有機塩基存在下で試薬R3−X1(X1はハロゲン)を反応させR3の導入された化合物(PP−c)を得ることができる。試薬R3−X1のR3は置換されていてもよいアルキル、末端または分枝上にシアノ基を有する置換されていてもよいアルキル、末端または分枝上に保護もしくは置換されたカルボン酸を有するアルキル、末端または分枝上に保護もしくは置換された水酸基を有するアルキル、末端または分枝上に保護もしくは置換されたアミノ基を有するアルキル、各種置換されていてもよいスルフォニル、各種置換されていてもよいアシル、各種置換されていてもよいカルバモイル等を意味する。また、化合物(PP−b)に置換基R3を導入する試薬として、上記R3−X1以外にも、ジ−t−ブチルジカーボネート、各種置換されていてもよいイソシアナートがある。また、各種置換されていてもよいアルデヒドまたはケトンと、トリアセトキシ水素化ホウ素ナトリウムまたはシアノ水素化ホウ素ナトリウム等を用い、化合物(PP−b)を還元アミノ化反応に付し置換基R3を導入することもできる。
本製造法で得られた化合物(PP−c)は、製造法Aに従い最終目的化合物へと導かれる。
<製造法MO>
製造法MOは、含ヘテロ環状アミノ基誘導体の一般的製造法をである。
工程1は化合物(MO−a)のアミノ基をZ1−Y1−Y2−Y3−Z2で表される試薬で処理して窒素原子を含む環を形成する工程である。
化合物(MO−a)をジメチルホルムアミド、テトラヒドロフランおよびジクロロメタン等の適切な溶媒中、炭酸カリウム、炭酸水素ナトリウムおよび炭酸セシウム等の無機塩基、またはトリアルキルアミン、ピリジン誘導体等の有機塩基存在下で試薬Z1−Y1−Y2−Y3−Z2を反応させることにより、化合物(MO−b)を得ることができる。
ここでZ1−Y1−Y2−Y3−Z2中のZ1およびZ2は、ハロゲンおよびスルフォネート等の脱離基を意味する。Y1およびY3は、アルキルやアルコキシ等で任意に置換されていてもよいメチレン、カルボニル、カルボキシル、スルホニル、アミドを意味する。−Y2−で表される部分で主鎖を形成する元素は、炭素、酸素、窒素および硫黄があげられ、この主鎖の長さは特に限定されない。さらに−Y2−の主鎖を形成する上記元素上からは可能ならば、置換されていてもよいアルキル、置換されていてもよいアルコキシ、置換されていてもよいアルコキシアルキル、置換されていてもよいヒドロキシアルキル、ヒドロキシ、カルボニル、保護または置換されていてもよいカルボキシル、保護または置換されていてもよいカルボキシルアルキル、保護または置換されていてもよいアミン、保護または置換されていてもよいアミノアルキル等が置換基として存在してもよい。またさらに−Y2−の主鎖上にオキソ基が存在し主鎖上の炭素原子や硫黄原子と一緒になって、カルボニル、スルフォニル、スルフィニルを形成していてもよい。
式中R1は、製造法PPの工程1中で記載したR1と同義である。式中R6は、置換されていてもよいアルキル、水酸基の保護基たとえばメトキシメチル基、テトラヒドロピラニル基およびトリアルキルシリル基等、さらに、末端または分枝上にシアノ基を有するアルキル、末端または分枝上に保護もしくは置換されたカルボン酸を有するアルキル、末端または分枝上に保護もしくは置換されたカルボン酸を有するアリールアルキル、末端または分枝上に保護もしくは置換された水酸基を有するアルキル、末端または分枝上に保護もしくは置換された水酸基を有するアリールアルキル、末端または分枝上に保護もしくは置換されたアミノ基を有するアルキル、末端または分枝上に保護もしくは置換されたアミノ基を有するアリールアルキル、各種置換されていてもよいスルフォニル、各種置換されていてもよいアシル、各種置換されていてもよいカルバモイル等を意味する。
工程2は化合物(MO−b)のR6がフェノール性水酸基の保護基となっている場合の脱保護の工程である。たとえばR6がメトキシメチル基であった場合、化合物(MO−b)を5規定塩酸―アセトンまたは10%過塩素酸水―テトラヒドロフラン等の酸性混合溶媒で処理し、化合物(MO−c)を得ることができる。
工程3は化合物(MO−c)のフェノール性水酸基に新たに置換基R7を導入する工程である。
R7は本製造法MOの工程1で定義したR6と同義である。
以下に述べる試薬R7−X2のX2がハロゲンおよびスルホネート等の脱離基の場合、以下のようにして化合物(MO−d)を合成することができる。化合物(MO−c)をジメチルホルムアミド、アセトニトリル、ジエチルエーテル、テトラヒドロフランおよびジクロロメタン等の適切な溶媒中、炭酸カリウム、炭酸水素ナトリウムおよび炭酸セシウム等の無機塩基存在下、またはトリアルキルアミン、ピリジン誘導体等の有機塩基存在下あるいは水素化ナトリウム存在下で試薬R7−X2を反応させることにより、化合物(MO−d)を得ることができる。
また化合物(MO−d)のR7がメチル基となる場合は、化合物(MO−c)にジエチルエーテル中にジアゾメタンを作用させるか、アセトニトリル−ジイソプロピルエチルアミン−メタノール中にトリメチルシリルジアゾメタンを作用させることにより高収率に(MO−d)を得ることができる。
さらに試薬R7−X2のX2が水酸基である場合には、テトラヒドロフランおよびトルエン等の適切な溶媒中、化合物(MO−c)と試薬R7−X2を公知の光延反応させることにより化合物(MO−d)を得ることもできる。
本製造法MOにおいて、R6およびR7はその導入後の適切な段階で当該研究者が容易に予想のつく方法により、定義されていない構造へと変換を受ける場合があるものとする。また、工程1で環化して得られた−N−Y1−Y2−Y3(−N)の部分も同様に、定義されていない構造へと変換を受ける場合があるものとする(−N−Y1−Y2−Y3(−N)の部分の変換は後述するいくつかの製造法例に記載されている)。
本製造法で得られた化合物(MO−b)、(MO−c)および(MO−d)は、製造法Aに従い最終目的化合物へと導かれる。
<製造法PR>
製造法PRは、ピロリジン誘導体の一般的合成法である。
(スキームPR−1)
スキームPR−1は、製造法MOの工程1で環化して得られた−N−Y1−Y2−Y3(−N)の部分がさらに構造変換を受ける場合の製造法の一つである。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R10およびR11は、製造法MOで定義したR6およびR7と同義である。また、式中では化合物(PR1−a)および(PR1−b)のフェノール性水酸基の保護基をメトキシメチル基に限定して記載しているが必ずしもこれに限定されるものではない。
工程1は化合物(PR1−a)の水酸基に置換基R10を導入する工程である。反応は、適切なアルカリ性含水有機溶媒中、相関移動触媒の存在下、試薬R10−X3を用いて行う。望ましくは、50%水酸化ナトリウム水溶液とトルエンの混合溶媒中、テトラブチルアンモニウムブロミドの存在下に、試薬R10−X3を化合物(PR1−a)に反応させて行い化合物(PR1−b)を得る。ここで、X3はハロゲンおよびスルホネート等の脱離基である。
工程2は化合物(PR1−b)を製造法MOの工程2と同様に処理して、化合物(PR1−c)を得る工程である。
工程3は化合物(PR1−c)のフェノール性水酸基に新たな置換基R11を導入する工程である。化合物(PR1−c)を製造法MOの工程3のR7導入法と同様の処理をして、R11の導入された化合物(PR1−d)を得ることができる。
工程4は化合物(PR1−a)を製造法MOの工程2と同様に処理して、化合物(PR1−e)を得る工程である。
工程5は化合物(PR1−e)のフェノール性水酸基の方のみに、選択的に置換基R11を導入する工程である。化合物(PR1−e)の2つの水酸基の反応性の差を利用して、製造法MOの工程3のR7導入法と同様の処理をして、R11の導入された化合物(PR1−f)を得ることができる。
工程6は化合物(PR1−f)を本スキームPR−1の工程1と同様の処理をして、化合物(PR1−d)を得る工程である。
本スキームPR−1で得られた化合物(PR1−b)および(PR1−d)は製造法Aに従い最終目的化合物へと導かれる。
(スキームPR−2)
スキームPR−2は、製造法MOの工程1で環化して得られた−N−Y1−Y2−Y3(−N)の部分がさらに構造変換を受ける場合の製造法の一つである。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R15およびR20は、製造法MOで定義したR6およびR7と同義である。
工程1は化合物(PR1−a)の水酸基を置換基R14(FまたはCN)で置き換える工程である。
R14がフルオロの場合:化合物(PR1−a)をジクロロメタン中、ジエチルアミノサルファトリフルオリド(DAST)で処理することにより化合物(PR2−a:R14=F)を得る。R14がシアノの場合:化合物(PR1−a)をジクロロメタン等の適切な溶媒中、トリエチルアミン等の塩基存在下に、メタンスルフォニルクロリド等のアシルクロリド試薬で水酸基を脱離基に変換する。続いて、この中間体にシアン化水素の塩を反応させてシアノ基を導入する。好ましくは、ジメチルホルムアミドにその中間体を加え、テトラブチルアンモニウムヨード存在下に、シアン化ナトリウムを反応させて化合物(PR2−a:R14=CN)を得る。
工程2は化合物(PR2−a)(R14=FまたはCN)を製造法MOの工程2と同様に処理して、化合物(PR2−b)(R14=FまたはCN)を得る工程である。
工程3は化合物(PR2−b)(R14=FまたはCN)のフェノール性水酸基に置換基R15を導入する工程である。化合物(PR2−b)を製造法MOの工程3のR7導入法と同様の処理をして、R15の導入された化合物(PR2−c)(R14=FまたはCN)を得ることができる。
工程4はR14=CNの化合物(PR2−c)をアルカリ加水分解によりシアノ基をカルボキシ基に変換し化合物(PR2−d)へと変換する工程である。好ましくは、R14=CNの化合物(PR2−c)を水酸化ナトリウム水溶液とエタノールの混合溶媒中で加熱還流して反応させ、化合物(PR2−d)を得ることができる。
工程5は化合物(PR2−d)のカルボン酸を常法によりエステル化したリアミド化し置換基R18を導入する工程である。化合物(PR2−d)のカルボン酸を、クロロギ酸エステルを用いた酸混合物法やオギザリルクロリドを用いた酸クロリド法等の常法を用い活性種に変換したのち、アルコールやアミンと反応させることにより(PR2−e)へと変換できる。または、(PR2−d)を適切な塩基存在下、相当するアルキルハライド試薬と反応させても、ジメチルアミノピリジン存在下t−ブチルアルコール中、ジ第3ブチルジカーボネートと反応させてもエステル化できる。また、(PR2−d)をアルコールやアミンとペプチド化縮合剤を用いて脱水反応を行っても(PR2−e)へと変換できる。その他、既知の可能な反応を用いても合成できる。R18は各種アミノ基、各種アルコキシ基を意味する。
工程6は化合物(PR2−a:R14=CN)を、工程4と同様のアルカリ加水分解に続いて工程5のエステル化と同様の処理をした後に、アセトフェノンのカルボニル基をケタール保護する工程である。化合物(PR2−a:R14=CN)が、カルボン酸のエステルへと導かれた後、酸性条件下でオルトぎ酸メチル等のケタール化試薬と反応させて化合物(PR2−f)を得る。好ましくは、カンファースルホン酸やパラトルエンスルホン酸等の酸触媒とモレキュラーシブス3A存在下、メタノール中オルトぎ酸メチルとカルボニル基を反応させて化合物(PR2−f)を得る。
工程7は化合物(PR2−f)のエステル基を還元してヒドロキシメチル基に変換後、アセトフェノンのカルボニル基のケタール保護のみ選択的に脱保護する工程である。まず、化合物(PR2−f)をテトラヒドロフラン、ジエチルエーテル等の適切な溶媒中、水素化リチウムアルミニウム等のエステルを還元する試薬で反応させ、ヒドロキシメチル基に変換する。つづいて、穏和な酸性条件、望ましくは、酢酸―テトラヒドロフラン―水(4:1:1)の混合酸溶媒条件下で、フェノール性水酸基のメトキシメチル基を残したまま、カルボニル基のケタール保護基のみ選択的脱保護し化合物(PR2−g)を得る。
工程8は化合物(PR2−g)の水酸基を置換基R19(シアノ基、または各種アルコキシ基)に変換する工程である。
R19がシアノ基の場合:工程1のR14がシアノ基の場合の変換と同様に処理して、化合物(PR2−g)のヒドロキシメチル基をシアノメチル基へと変換した化合物(PR2−h)を得る。R19はシアノ基を意味する。
R19が各種アルコキシ基の場合:化合物(PR2−g)をスキームPR−1の工程1と同様の処理をして、各種アルコキシ基へと変換された化合物(PR2−h)を得る。R19はスキームPR−1のOR10と同義である。
工程9は化合物(PR2−h)のフェノール性水酸基の保護基であるメトキシメチル基の脱保護後、置換基R20を導入する工程である。まず化合物(PR2−h)を製造法MOの工程2と同様の処理をして、メトキシメチル基をはずす。つづいて、製造法MOの工程3のR7導入法と同様の処理をして、R20の導入された化合物(PR2−i)を得る。
本スキームPR−2で得られた化合物(PR2−c)、(PR2−e)および(PR2−i)は製造法Aに従い最終目的化合物へと導かれる。
(スキームPR−3)
スキームPR−3は、製造法MOの工程1で環化して得られた−N−Y1−Y2−Y3(−N)の部分がさらに構造変換を受ける場合の製造法の一つである。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R23,R24およびR25は、製造法MOで定義したR6およびR7と同義である。
工程1は化合物(PR3−a)をスキームPR−1の工程1と同様に処理して、置換基R24が一つ導入された化合物(PR3−b)と置換基R24が二つ導入された化合物(PR3−c)を得る工程である。あるいはR24がメトキシメチル基等の場合、化合物(PR3−a)に、過剰のメトキシメチルクロリドをジイソプロピルエチルアミン存在下に反応させて化合物(PR3−b)、(PR3−c)を得ることもできる。化合物(PR3−b)と(PR3−c)はシリカゲルカラムクロマトグラフィーにより分離できる。
工程2は化合物(PR3−b)を工程1と同様の処理をして、新たに置換基R25の導入された化合物(PR3−d)を得る工程である。
工程3は化合物(PR3−b)の水酸基の立体の反転反応を行い化合物(PR3−e)を得る工程である。化合物(PR3−b)をジクロロメタン中、トリエチルアミン、ジメチルアミノピリジン存在下、m−ニトロベンゼンスルホニルクロリドを反応させる。つぎに、ジメチルスルホキシド中加熱条件下、酢酸セシウムで処理し水酸基の反転したアセテート体を得る。これを、メタノール中に炭酸カリウムで処理し水酸基の反転した化合物(PR3−e)を得る。
スキームPR−3で得られた化合物(PR3−b)、(PR3−c)および(PR3−d)は製造法Aに従い最終目的化合物へと導かれる。また、(PR3−e)に関しては本スキームの工程2と同様の処理をされた後、製造法Aに従い最終目的化合物へと導かれる。
(スキームPR−4)
スキームPR−4は、製造法MOの工程1で環化して得られた−N−Y1−Y2−Y3(−N)の部分がさらに構造変換を受ける場合の製造法の一つである。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R26は、製造法MOで定義したR6およびR7と同義である。
工程1は化合物(PR4−a)を1,4−ジオキサン溶媒中加熱条件下、Lawesson’s試薬処理し、チオアミド(PR4−b)を得る工程である。
工程2は化合物(PR4−b)をエチル O−トリフルオロメタンスルフォニルヒドロキシアセテート、トリフェニルホスフィン、トリエチルアミンで処理し、化合物(PR4−c)を得る工程。
工程3は化合物(PR4−c)を1,2−ジクロロエタン中、酢酸存在下で、トリアセトキシ水素化ホウ素ナトリウムと反応させエナミンの還元を行うことにより化合物(PR4−d)を得る工程である。
工程4は化合物(PR4−d)を、置換基R26が影響を受けないような適切な条件下でカルボン酸誘導体(PR4−e)へと導く工程。一般的には、アルコール中もしくはアルコールーテトラヒドロフラン混合溶媒中で、水酸化ナトリウム水溶液や水酸化リチウム水溶液等で処理してアルカリ加水分解を行い(PR4−e)を得る。
工程5は化合物(PR4−e)を第3ブタノール中、ジメチルアミノピリジン存在下で、ジ第3ブチルジカーボネートで処理して第3ブチルエステル化された(PR4−f)へと導く工程である。
本スキーム(PR−4)で得られた化合物(PR4−c),(PR4−d)および(PR4−f)は製造法Aに従い最終目的化合物へと導かれる。
(スキームPR−5)
スキームPR−5は、製造法MOの工程1で環化して得られた−N−Y1−Y2−Y3(−N)の部分がさらに構造変換を受ける場合の製造法の一つである。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R27は、製造法MOで定義したR6およびR7と同義である。
工程1は化合物(PR5−a)をトルエン溶媒中加熱条件下、触媒量のロジウム(II)アセテートダイマーと既知試薬のジエチルジアゾマロネートで処理し、化合物(PR5−b)を得る工程である。
工程2は化合物(PR5−b)をエタノール中加熱条件下、当量のナトリウムエトキシド、アクリル酸エチルで処理し、環化した化合物(PR5−c)を得る工程である。
工程3は化合物(PR5−c)をエタノール中加熱条件下、5規定塩酸で処理し、保護基メトキシメチル基のはずれた化合物(PR5−d)を得る工程である。
工程4は化合物(PR5−d)を、新たな置換基R27の導入された化合物(PR5−e)へと導く工程。製造法MOの工程3のR7導入法と同様の処理をして、化合物(PR5−e)を得ることができる。
工程5は化合物(PR5−e)をジクロロメタン中、1,2−ビス(トリメチルシロキシ)エタン、トリエチルシリルトリフラートで処理し、(PR5−e)のアセチルのカルボニルをケタール保護した(PR5−f)を得る工程である。
工程6は化合物(PR5−f)のラクタム部分カルボニル基を還元しメチレンに変換する工程である。(PR5−f)をテトラヒドロフラン等の適切な溶媒中、カルボニルハイドライドトリス(トリフェニルフォスフィン)ロジウム(I)、ジフェニルシランで反応させることにより化合物(PR5−g)を得ることができる。
工程7は化合物(PR5−g)を5%塩酸―テトラヒドロフラン中反応させることにより、ケタールの脱保護した化合物(PR5−h)を得ることができる。
本スキームPR−5で得られた化合物(PR5−d),(PR5−e)および(PR5−h)は、製造法Aに従い最終目的化合物へと導かれる。
<製造法PS>
本製造法PSはピペリジン誘導体の一般的合成法である。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R28およびR30は、製造法MOで定義したR6およびR7と同義である。
工程1は化合物(PS−a)をホルムアルデヒドと反応させイミンとした後に、エノールエーテル構造を有するジエンとヘテロDiels−Alder反応を行いオキソピペリジン環を形成する工程である。好ましくは、化合物(PS−a)をジクロロメタン中硫酸マグネシウム存在下、37%ホルマリンと反応させイミンとし反応液をセライト濾過する。この濾液に2−トリメチルシリルオキシ−1,3−ブタジエンとトルエンを加え、−70℃に冷却した後に、ジエチルアルミニウムクロリド1Mヘキサン溶液を滴下し以後昇温する。反応終了後、テトラヒドロフラン溶液に置換し1N−塩酸で処理しシリルエノールエーテルをケトンへと変換し化合物(PS−b)を得ることができる。
工程2は化合物(PS−b)をジメトキシエタンー第3ブタノール中、第3ブトキシカリウム存在下、パラトルエンスルホニルメチルイソシアニド(TosMIC)で処理し、オキソ基がシアノ基に変換された化合物(PS−c)を得る工程である。
工程3は化合物(PS−b)のカルボニルに種々の有機金属試薬を反応させ、置換基R29の付加した3級アルコール体(PS−d)を得る工程である。たとえば、化合物(PS−b)にメチルマグネシウムブロミドをジエチルエーテル中で反応させて、メチル基の付加した(PS−d)を得ることができる。R29はアルキル、アルケニルおよびアルキニルである。
工程4は化合物(PS−b)を、還元試薬で処理してアルコール化合物(PS−e)へと導く工程である。種々の還元試薬が使用可能であるが、好ましくは、メタノールージクロロメタン混合溶媒中に水素化ホウ素ナトリウムで処理し化合物(PS−e)を得ることができる。
工程5は化合物(PS−e)を製造法PRのスキームPR−1の工程1と同様に処理して、水酸基に新たな置換基R30の導入された化合物(PS−f)を得る工程である。置換基R30は、製造法MOで定義したR6およびR7と同義である。
工程6は化合物(PS−b)のカルボニル基に対しHorner−Emmons反応を行い、増炭した不飽和エステル(PS−g)を得る工程である。ジエチルホスホノ酢酸第3ブチルエステルを1,2−ジメトキシエタン中、水素化ナトリウムで処理した後に、1,2−ジメトキシエタンに溶解させた化合物(PS−b)を加え化合物(PS−g)を得ることができる。
工程7は不飽和エステルの1,4還元を行う工程である。化合物(PS−g)をジクロロメタンーメタノールの混合溶媒中、触媒量の塩化ニッケル(II)6水和物存在下、水素化ホウ素ナトリウムで処理したり、メタノール中でマグネシウムと反応させる事等により不飽和エステルの選択的な1,4還元を行うことができ、化合物(PS−h)を得ることができる。
また、ピペリジン誘導体は以下の工程8から10を行っても合成できる。
工程8は化合物(PS−i)に工程1と同様の処理行い、オキソピペリジン環の形成と、フェノール性水酸基の保護基であるメトキシメチル基の脱保護を同時に達成した化合物(PS−j)を得る工程である。
工程9は化合物(PS−j)を製造法MOの工程3のR7導入法と同様に処理して、置換基R28で置換された化合物(PS−k)を得る工程である。
工程10は化合物(PS−k)のアセトフェノンのカルボニルを選択的に保護する工程である。化合物(PS−k)をテトラヒドロフラン中、トリエチルアミンを加え−70度に冷却した後、トリフルオロメタンスルホン酸第3ブチルジメチルシリルで処理する。反応の様子を薄層カラムクロマトグラフィーで調べつつ必要ならば徐々に昇温する。低温下に水を加え反応停止し化合物(PS−m)を得ることができる。
この後、化合物(PS−m)は工程2,3,4と同様の処理を行うことが可能である。または直接、製造法Aにならってアシルブロミドに変換し最終目的化合物へと導くこともできる。
本製造法で得られた化合物(PS−b),(PS−c),(PS−d),(PS−e),(PS−f),(PS−g),(PS−h),(PS−j)および(PS−k)は、製造法Aに従い最終目的化合物へと導かれる。
<製造法AN>
(スキームAN−1)
本スキームはアニリン誘導体の一般的合成を示す。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R31、R32およびR33は、製造法MOで定義したR6およびR7と同義である。
工程1は化合物(AN1−a)のアミノ基に置換基R31を一つないしは二つ導入する工程である。化合物(AN1−a)を、製造法MOの工程3の水酸基に対するR7導入法とほぼ同様の処理をして、化合物(AN1−b)と(AN1−c)を得ることができる。R31がアシル基やスルフォニル基を介して結合せず、単純なアルキル基でアニリンのアミノ基に結合している場合(試薬としてR31−IやR31−Brを用いる場合等)、置換基R31導入にあたっては加温条件下で長時間反応が必要なこともある。なお、化合物(AN1−b)と(AN1−c)はシリカゲルカラムクロマトグラフィーにより容易に分離精製できる。
工程2は化合物(AN1−b)を工程1と同様の処理をして、新たな置換基R32を導入した化合物(AN1−d)を得る工程である。
工程3は化合物(AN1−c)と(AN1−d)を、製造法MOの工程2と同様の処理をして、それぞれ化合物(AN1−e)と(AN1−f)を得る工程である。
工程4は化合物(AN1−e)と(AN1−f)を、製造法MOの工程3のR7導入法と同様の処理をしてそれぞれ化合物(AN1−g)と(AN1−h)を得る工程である。
工程5は出発原料として化合物(AN1−i)を用い、工程1と同様の処理をすることにより、置換基R31とR33の入った化合物(AN1−j)を得る工程である。また、この方法によっても化合物(AN1−g)を得ることができる。
工程6は化合物(AN1−j)を工程2と同様の処理をすることにより、化合物(AN1−h)を得る工程である。
工程7は化合物(AN1−i)をスキームPR−2の工程6のケタール化反応ステップと同様の処理をして、化合物(AN1−k)を得る工程である。
工程8は化合物(AN1−k)に、アルデヒドあるいはケトン(R34−(C=O)−R35であらわされる)と還元剤を用いて還元アミノ化反応を行うことにより、化合物(AN1−m)を得る工程である。
化合物(AN1−k)に、メタノールー酢酸の混合溶媒中でシアノ水素化ホウ素ナトリウムを作用させるか、1,2−ジクロロエタンー酢酸の混合溶媒中でトリアセトキシ水素化ホウ素ナトリウムを作用させることにより、ケタール保護基も脱保護された化合物(AN1−m)を一気に得ることができる。R34とR35はどちらか一方が水素であってもよく、さらにR34とR35が一緒になって環を形成していてもよい。
工程9は化合物(AN1−i)にケタール保護することなく、アルデヒドあるいはケトン(R34−(C=O)−R35であらわされる)と還元剤を用いて還元アミノ化反応を行うことにより、化合物(AN1−m)を得ることができる場合の工程である。通常この場合、1,2−ジクロロエタンー酢酸の混合溶媒中でトリアセトキシ水素化ホウ素ナトリウムを作用させる。
本スキームAN−1で得られた化合物(AN1−b),(AN1−c),(AN1−d),(AN1−e),(AN1−f),(AN1−g),(AN1−h),(AN1−j)および(AN1−m)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームAN−2)
スキームAN−2は、スキームAN−1で合成した中間体のアニリン窒素上の置換基を、さらに構造変換する一般的合成法である。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R36は、製造法MOで定義したR6およびR7と同義である。式中R37およびR38は、どちらか一方か両方がアミドとなってアニリン窒素と結合している場合、あるいは、それら置換基上にエステル構造を有している場合とがある。出発原料(AN2−a)のアニリン窒素上の置換基は、一つは水素原子であっても良い。
工程1は化合物(AN2−a)を、製造法PRのスキームPR−2の工程6のケタール化反応ステップと同様の処理をして、カルボニルの保護された化合物(AN2−b)を得る工程である。
工程2は化合物(AN2−b)を還元剤で処理し、アミド基をメチレンアミノ基に変換したり(−N−CO−→−N−CH2−)、エステルをアルコールへと変換する(−CO−O−→−CH2−OH,−O−CO−→−OH)工程である。好ましくは化合物(AN2−b)を、ジエチルエーテル中、水素化リチウムアルミニウムで処理することにより、化合物(AN2−c)を得ることができる。置換基R39とR10は、それぞれR37とR38が上記の変換を受けたあとの構造と定義される。
工程3は化合物(AN2−c)を、製造法PRのスキームPR−2の工程7のケタール脱保護反応のステップと同様の処理をして、化合物(AN2−d)を得る工程である。
工程4は化合物(AN2−d)が置換基R39あるいはR40上に水酸基を有している場合にのみ行う工程であり、その水酸基に新たな置換基が導入され、結果として置換基R41およびR42へと変換された化合物(AN2−e)を得ることができる。
本工程で行う反応は、製造法PRのスキームPR−1の工程1と同様にして行う。本スキームAN−2で得られた化合物(AN2−d)および(AN2−e)は、製造法Aに従い最終目的化合物へと導かれる。
<製造法BO>
製造法BOにおいて以下に示すスキームBO−1,2,3,4は、ベンズオキサジン誘導体の一般的合成法を表す。
(スキームBO−1)
式中R1は製造法PPの工程1で定義したR1と同義である。R2は水素原子、置換されていてもよいアルキル基等を表す。R3は水素原子、ハロゲノ基、オキソ基、置換されていてもよいアルキル基、置換されていてもよいアルコキシ基、置換されていてもよいアシル基、置換されていてもよいカルボキシル基、置換されていてもよいカルバモイル基を表す。
工程1はアミノ基のアシル化の方法である。テトラヒドロフラン、塩化メチレン、アセトニトリル等の溶液中、ピリジン、トリエチルアミン等の塩基存在下、各種アシルクロリドを室温で作用させることあるいは、ピリジン溶液中、各種酸無水物を作用させるいずれかを選択することにより(BO1−b)を得ることができる。
工程2はアルコールの保護基のメトキシメチル基の脱保護の方法である。テトラヒドロフラン、アセトン溶媒中、希塩酸水溶液、10%過塩素酸水溶液を室温で作用させることにより(BO1−c)を得ることができる。
工程3は水酸基、アミノ基のアルキル化の方法である。ジメチルホルムアミド溶液中、炭酸カリウム、炭酸セシウム、水素化ナトリウム等の塩基存在下、各種ジハライド、ジメシレート、ジトシレートを室温から150℃までの加熱条件下で作用させることにより(BO1−d)を得ることができる。
工程4は脱アシル化の方法である。メタノール、エタノール、テトラヒドロフラン等の溶媒中、水酸化ナトリウム水溶液で室温から溶媒の還流温度で作用させることあるいは、塩酸水溶液で室温から溶媒の還流温度で作用させることにより(BO1−e)を得ることができる。
本スキームBO−1で得られた化合物(BO1−d)および(BO1−e)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームBO−2)
式中R1は製造法PPの工程1で定義したR1と同義である。R2はスキームBO−1に記載のR3と同義である。
工程1は、水酸基のアルキル化の方法である。ジメチルホルムアミド溶液中、各種ジハライド、ジメシレート、ジトシレートを室温から150℃までの加熱条件下で作用させることにより(BO2−b)を得ることができる。
工程2はオキサジン環を形成させる方法。ジメチルホルムアミド溶液中、炭酸カリウム、炭酸セシウム、水素化ナトリウム等の塩基存在下、各種ジハライド、ジメシレート、ジトシレートを室温から150℃までの加熱条件下で作用させる。続いて、エタノール、メタノール溶液中、触媒量のパラジウム炭素存在下、水素雰囲気中、室温で作用させることにより(BO2−c)を得ることができる。
本スキームBO−2で得られた化合物(BO2−c)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームBO−3)
式中R1は水素原子、置換されていてもよいアルキル基、置換されていてもよい環状アルキル基、置換されていてもよいアルコキシ基を表す。R2は水素原子、置換されていてもよいアルキル基、末端または分岐状にシアノ基を有するアルキル基、置換されていてもよいアルコキシ基、置換されていてもよいアリールアルキル基、置換されていてもよいアシル基、置換されていてもよいスルフォニル基、置換されていてもよいカルバモイル基、置換されていてもよいカルボキシル基等を表す。
工程1はアミノ基のアルキル化、アシル化、置換カルバモイル化およびウレタン化等の方法であり、以下の1から4の方法がある。
1.ジメチルホルムアミド溶液中、炭酸カリウム、炭酸セシウム、水素化ナトリウム等の塩基存在下、各種ハライド、メシレート、トシレートを室温から150℃までの加熱条件下で作用させることにより(BO3−b)を得ることができる。
2.テトラヒドロフラン、塩化メチレン、アセトニトリル等の溶液中、ピリジン、トリエチルアミン等の塩基存在下、各種アシルクロリド、各種スルフォニルクロリド、各種イソシアネートを室温で作用させることあるいは、ピリジン溶液中、各種酸無水物を作用させるいずれかを選択することにより(BO3−b)を得ることができる。
3.メタノール、エタノール溶媒中、触媒量の4−ジメチルアミノピリジン存在下、エチル N−(1−シアノ)イミノフォルメートと室温から溶媒の還流温度で作用させることにより(BO3−b)を得ることができる。
4.メタノール、エタノール溶媒中、触媒量のp−トルエンスルフォン酸、カンファースルフォン酸存在下、オルトギ酸トリメチル、オルトギ酸トリエチルを作用させ、アセチル基をケタール保護し上記1から3の方法を用い各種置換基導入した後、酸性条件下で脱保護することにより(BO3−b)を得ることができる。
本スキームBO−3で得られた化合物(BO3−b)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームBO−4)
式中R1は製造法PPの工程1で定義したR1と同義である。R2はスキームBO−1に記載のR3と同義である。R3はスキームBO−3に記載のR2と同義である。
工程1はアルキル化の方法である。TAWADA,H.;SUGIYAMA,Y.;IKEDA,H.;YAMAMOTO,Y.;MEGURO,K.;Chem Pharm Bull,38(5),1238−1245(1990)の方法、あるいはメタノール、エタノール、トルエン溶媒中、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウム等の塩基存在下、室温から溶媒の還流温度でアリルブロミド、マレイン酸無水物等を作用させた後、メタノール、エタノール溶媒中、炭酸カリウムトリエチルアミン等の塩基存在下、室温から溶媒の還流温度で作用させることにより(BO4−b)を得ることができる。
工程2はアミノ基のアルキル化、アシル化、置換カルバモイル化およびウレタン化等の工程である。スキームBO−3の工程1と同様の処理をして(BO4−c)を得る。本スキームBO−4で得られた化合物(BO4−b)および(BO4−c)は、製造法Aに従い最終目的化合物へと導かれる。
<製造法BOL>
製造法BOLは、ベンズオキサゾール誘導体の一般的合成法である。式中R1は製造法PPの工程1で定義したR1と同義である。R2は水素原子、置換されていてもよいアルキル基、置換されていてもよいアルコキシ基等を表す。
工程1はオキサゾール環を形成する方法である。テトラヒドロフラン、塩化メチレン、アセトニトリル溶媒中、トリエチルアミン等の塩基存在下、各種酸クロリドと作用させ、次にエタノール、メタノール、テトラヒドロフラン、メチルエチルケトン等の溶媒中、希塩酸水溶液、p−トルエンスルホン酸と作用させることにより(BOL−b)を得ることができる。
製造法BOLで得られたベンズオキサゾールエタノン誘導体(BOL−b)は製造法Aの方法に従って最終化合物へと導かれる。
<製造法CA>
製造法CAにおいて以下に示すスキームCA−1,2,3は、カテコール誘導体の一般的合成法を表す。
(スキームCA−1)
式中R1は、製造法PPの工程1で記載したR1と同義である。式中R2,R3およびR4は製造法MOで定義したR6およびR7と同義である
工程1は化合物(CA1−a)の水酸基をメトキシメチル化する方法である。ジメチルホルムアミド中で(CA1−a)と水素化ナトリウムを室温にて処理した後に,メトキシメチルクロリド(MOM−C1)を作用させることで(CA1−b)が得られる。
工程2は(CA1−b)のメトキシメチル基の置換基効果を利用したオルトリチオ化をへてホルミル基を導入する方法である。ジエチルエーテル溶媒中氷冷下(CA1−b)にテトラメチルエチレンジアミン存在下n−ブチルリチウムで処理した後、ジメチルホルムアミドまたはN−ホルミルモルホリン等のホルミル化剤によりオルトホルミル化体(CA1−c)を得る。
工程3は(CA1−c)のメトキシメチル基のパラ位をブロム化する方法である。メタノール中室温で(CA1−c)と臭素を反応させる、この際系中に発生した臭化水素によりメトキシメチル基は脱離して(CA1−d)を得る。
工程4は(CA1−d)の水酸基に種々の置換基導入する方法である。製造法MOの工程3のR7導入と同様の手法により化合物(CA1−e)を得る。
工程5はホルミル基から水酸基へ酸化的に変換する方法。ジクロルメタン中(CA1−e)を室温または加温してメタクロル過安息香酸を作用させた後、精製したエステルをメタノール中で炭酸カリウムを用いて加水分解して(CA1−f)を得る。
工程6は本スキームCA−1の工程4と同様の方法で置換基R3が導入された化合物(CA1−g)を得る。
工程7はR2が水酸基の保護基となっている場合の置換基R4への変換方法である。製造法MOの工程2と工程3の連続処理と同様にして化合物(CA1−h)を得る。
本スキームCA−1で得られた化合物(CA1−g)および(CA1−h)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCA−2)
スキームCA−2は、環状カテコール誘導体の一般的合成法を表す。式中R1は、製造法PPの工程1で記載したR1と同義である。式中R2およびR4は製造法MOで定義したR6およびR7と同義である。
工程8はR2が脱離可能な水酸基の保護基である場合の、カテコール体への変換法である。R2がメトキシメチル基の場合は(CA1−f)を6規定塩酸で処理することでジオール(カテコール)(CA2−a)が得られる。
工程9はカテコールのアルキル化により環化させる方法。(CA2−a)をジメチルホルムアミド、アセトニトリル又はアセトン等の溶媒中炭酸カリウム、炭酸セシウム又は水素化ナトリウム等の塩基存在下、1,2−ジブロモエチル誘導体と作用させて縮合ジオキサン環(CA2−b)を得られる。また、(CA2−a)とアセトンを五酸化リン存在下で処理してアセトナイド体として五員環生成物(CA2−b)が得られる。
本スキームCA−2で得られた化合物(CA2−b)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCA−3)
スキームCA−3は、カテコール2置換誘導体の一般的合成法を表す。式中R5およびR6は製造法MOで定義したR6およびR7と同義である。
工程10はカテコール(CA3−a)を原料としてスキームCA−1の工程4と同様の方法で(CA3−b)を得る工程である。
工程11は(CA3−b)にスキームCA−1の工程3と同様の方法で、置換基を持たない水酸基のパラ位に選択的にブロム化した(CA3−c)を得る工程である。
工程12はスキームCA−1の工程4と同様の方法でR6の導入された(CA3−d)を得る工程である。
スキームCA−3で得られた(CA3−d)は製造法Aの方法に従って最終目的化合物へと導かれる。
<製造法CO>
製造法COのスキームCO−1,CO−2,CO−3,CO−4,CO−5,CO−6,CO−7,CO−8およびCO−9はフェノールおよびフェノキシ誘導体の一般的合成法を表す。
(スキームCO−1)
スキームCO−1の式中R1、R2は製造法PPの工程1で記載したR1と同義である。R3は製造法MOで定義されたR6およびR7と同義である。
工程1はフリーデルクラフトアシル化の方法である。塩化メチレン、トルエン溶媒中、塩化アルミニウム、塩化亜鉛、塩化第二スズ等のルイス酸存在下、アセチルクロリドと−70℃から室温で作用させることにより(CO1−b)を得る。
工程2はアルキル化、カーボネート化、スルホネート化等の方法である。
1.ジメチルホルムアミド溶液中、炭酸カリウム、炭酸セシウム、水素化ナトリウム等の塩基存在下、各種ハライド、メシレート、トシレートを室温から150℃までの加熱条件下で作用させることにより(CO1−c)を得る。
2.テトラヒドロフラン、塩化メチレン、アセトニトリル等の溶液中、ピリジン、トリエチルアミン等塩基存在下、各種アシルクロリド、スルフォニルクロリド、イソシアネートを−15℃から室温で作用させることあるいは、ピリジン溶液中、各種酸無水物を作用させるいずれかを選択することにより(CO1−c)を得る。
3.テトラヒドロフラン、塩化メチレン、アセトニトリル等の溶液中、ピリジン、トリエチルアミン等塩基存在下、クロルギ酸フェニルを作用させた後、各種アミンと作用させることにより(CO1−c)を得る。
本スキームCO−1で得られた化合物(CO1−b)および(CO1−c)は、製造法Aに従い最終目的化合物へと導かれる。または(CO1−a)を製造法AのスキームA−4の(A4−c)の変換に適用してもよい。
(スキームCO−2)
スキームCO−2は各種芳香環置換ベンゼン誘導体の一般的合成法を表す。式中R1は製造法PPの工程1で記載したR1と同義である。R2は製造法MOで定義されたR6およびR7と同義である。R3は各種芳香環を表す。
工程1はStilleカップリング法を用いた各種芳香環置換基の導入方法である。トルエン、キシレン等の溶媒中、触媒量のテトラキストリフェニルホスフィンパラジウム存在下、各種芳香環置換トリブチルスズを窒素雰囲気下、溶媒の還流温度で作用させ(CO2−b)を得る。
本スキームCO−2で得られた化合物(CO2−b)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCO−3)
本スキームCO−3は、ベンジルアミン誘導体の一般的合成法を表す。式中R1、R3は製造法PPの工程1で記載したR1と同義である。R2,R2’は製造法MOで定義されたR6およびR7と同義である。R4,R5はスキームBO−3に記載のR2と同義である。またR4,R5は一緒になって環を形成していてもよい。Xは水酸基および各種スルフォネートを表す。
工程1はアルキルハライドを導入する方法である。メタノール、エタノール溶媒中、水素化ホウ素ナトリウムを作用させた後、ジメチルフォルムアミド中、ピリジン、トリエチルアミン等の塩基存在下メタンスルフォニルクロリド等を作用させ(CO3−b)を得る。
工程2はアミノ化の方法である。
1.メタノール、エタノール、アセトニトリル、テトラヒドロフラン溶媒中、各種アミンを作用させ(CO3−c)を得る。
2.ジメチルフォルムアミド溶媒中、炭酸カリウム、水素化ナトリウム等の塩基存在下、各種アミンと作用させることにより(CO3−c)を得る。
3.Xが水酸基の場合、トルエン溶媒中、1,8−ジアザビシクロ[5,4,0]ウンデ−7−セン等の塩基存在下、ジフェニルホスホリルアジドを作用させアジド体を得た後、テトラヒドロフラン−水溶媒中、トリアルキルホスフィン、トリフェニルホスフィン等と作用させることにより(CO3−c)を得る。
工程3はR2がR2が水酸基の保護基の場合の置換基R2’への変換方法である。製造法MOの工程2と工程3の連続処理と同様にして化合物(CO3−d)を得る。
本スキームCO−3で得られた化合物(CO3−c)および(CO3−d)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCO−4)
本スキームCO−4はWittig反応を利用したフェノールおよびフェノキシ誘導体の一般的合成法を表す。式中R1は製造法PPで記載したR1と同義である。R2およびR2’は製造法MOで定義されたR6およびR7と同義である。R3は水素原子、低級アルキル基を表す。R4は置換されていてもよいアルキル基、置換されていてもよいカルボキシル基、シアノ基等を表す
工程1はWittig反応を利用したアルキル化の方法である。塩化メチレン、テトラヒドロフラン溶媒中、各種ホスホラン誘導体を作用させる。あるいは、テトラヒドロフラン、ジメチルフォルムアミド溶媒中、カリウム第3ブトキシド、水素化ナトリウム等の塩基存在下、各種ホスフォニウム塩、ホスフォネートと作用させるいずれかの方法により(CO4−b)を得る。
工程2はオレフィンの還元を行う工程である。酢酸エチル、テトラヒドロフラン、メタノール中でパラジウム炭素存在下、水素雰囲気下で作用させたり、メタノール中マグネシウムと反応させる事等に還元を行うことができ、化合物(CO4−c)を得ることができる。
工程3はR2が水酸基の保護基の場合の置換基R2’への変換方法である。製造法MOの工程2と工程3の連続処理と同様にして化合物(CO4−d)を得る。
本スキームCO−4で得られた化合物(CO4−b),(CO4−c)および(CO4−d)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCO−5)
本スキームCO−5は、フリーデルクラフト反応を利用したフェノールおよびフェノキシ誘導体の一般的合成法を表す。式中R1は製造法PPの工程1で記載したR1と同義である。R2は水素原子、置換されていてもよいアルキル基、置換されていてもよい環状アルキル基を表す。R3は製造法MOで定義されたR6およびR7と同義である。
工程1はフェニルのパラ位をブロム化する方法である。メタノール、エタノール溶媒中、臭素と作用させる。あるいは、アセトニトリル溶媒中、N−ブロモスクシンイミドと作用させる。この2種のいずれかの方法により(CO5−a)を得る事ができる。
工程2はフリーデルクラフトを利用したアルキル化の方法である。H.katsuki et al.,Synthesis 603(1999)の方法により、ベンゼン、ジクロロエタン溶媒中、スカンジウムトリフレート存在下、各種アルキルメシレートを作用させることにより(CO5−b)得る。
工程3は水酸基に種々の置換基R3を導入する方法である。製造法MOの工程3のR7導入法と同様の処理をして化合物(CO5−c)を得る。
本スキームCO−5で得られた化合物(CO5−b)および(CO5−c)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCO−6)
本スキームCO−6は、カルボン酸誘導体およびベンジルアルコール誘導体の一般的合成法を表す。式中R1は製造法PPの工程1で記載したR1と同義である。R2は置換されていてもよいアルキル基、R3およびR4は製造法MOで定義されたR6およびR7と同義である。
工程1は(CA1−b)のメトキシメチル基の置換基効果を利用したオルトリチオ化をへてカルボキシル基を導入する方法である。ジエチルエーテル溶媒中氷冷下(CA1−b)にテトラメチルエチレンジアミン存在下n−ブチルリチウムで処理した後、アルキルジカーボネートを作用させ(CO6−a)を得る。
工程2はアルコールの保護基のメトキシメチル基の脱保護の方法である。テトラヒドロフラン、アセトン溶媒中、希塩酸水溶液、10%過塩素酸水溶液を室温で作用させることにより(CO6−b)を得る。
工程3は水酸基に種々の置換基R3を導入する方法である。製造法MOの工程3のR7導入法と同様の処理をして化合物(CO6−c)を得る。
工程4はカルボキシル基の還元、アルキル化の方法である。ジエチルエーテル、テトラヒドロフラン溶媒中、氷冷下で水素化リチウムアルミニウムを作用させた後、工程3と同様の方法により(CO6−d)を得る。
本スキームCO−6で得られた化合物(CO6−b),(CO6−c)および(CO6−d)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCO−7)
本スキームCO−7は、フェネチルアルコール誘導体、フェニル酢酸誘導体およびベンゾフラン誘導体の一般的合成法を表す。式中R1は製造法PPの工程1で記載したR1と同義である。R2およびR3は製造法MOで定義されたR6およびR7と同義である。R4およびR5は置換されていてもよいアルキル基を表す。
工程1はWittig反応に続くハイドロボレーション反応による水酸基の導入方法である。テトラヒドロフラン溶媒中、カリウム第3ブトキシド存在下、メチルトリフェニルホスホニウムブロミドと作用させる。その後、テトラヒドロフラン溶媒中、ボラン−テトラヒドロフランと作用させ30%過酸化水素水溶液と作用させ(CO7−a)を得る。
工程2は水酸基に置換基R3を導入する工程である。製造法MOの工程3のR7導入法と同様の処理をして化合物(CO7−b)を得る。
工程3は増炭反応の方法である。テトラヒドロフラン溶媒中、トリトンB存在下、メチルメチルチオメチルスルフォキシドと溶媒の還流温度で作用させた後、メタノール、エタノール溶媒中で希塩酸水溶液と作用させ(CO7−c)を得る。
工程4は酸化の方法である。Mangzho Zhao et al.,Tetrahedron Lett.39,5323(1998)に記載の方法あるいはRyoji Noyori et al.,J.Am.Chem.Soc.,119,12386(1997)に記載の方法を利用して化合物(CO7−c)を得る。
工程5はR2が水素原子の場合のフラン環の形成方法である。ジメチルフォルムアミド溶媒中、炭酸カリウム存在下、ブロモ酢酸エステルを溶媒の還流温度で作用させ(CO7−d)を得る。
本スキームCO−7で得られた化合物(CO7−a),(CO7−b),(CO7−c)および(CO7−d)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCO−8)
本スキームCO−8は、2,3ジヒドロベンゾフラン誘導体、2,3ジヒドロベンゾチオフェン誘導体の一般的合成法である。式中R1は製造法PPの工程1で記載したR1と同義である。R2およびR3は水素原子、置換されていてもよいアルキル基、置換されていてもよいアルコキシ基等を表す。
工程1は水酸基のアルキル化の方法である。J.M.Janusz et al.,J,Med.Chem.41,1112(1998)の方法に従い、ジメチルホルムアミド、アセトニトリル又はアセトン等の溶媒中、ヨウ化ナトリウム存在下、炭酸カリウム、炭酸セシウム又は水素化ナトリウム等の塩基存在下、種々のアリルハライド、アリルメシレート、アリルトシレートを作用させて(CO8−b)を得る。
工程2はフラン環およびチオフェン環を形成する方法である。J.M.Janusz st al.,J.Med.Chem.41,1112(1998)の方法あるいは、マグネシウムクロリド中210℃で作用させ(CO8−c)を得る。
工程3はフリーデルクラフトアシル化の方法である。塩化メチレン、トルエン溶媒中、塩化アルミニウム、塩化亜鉛、塩化第二スズ等のルイス酸存在下、アセチルクロリドと−70℃から室温で作用させることにより(CO8−d)を得る。
工程4はブロム化の方法である。メタノール、エタノール溶媒中、ブロミンと作用させる。あるいはアセトニトリル、ジメチルホルムアミド溶媒中、N−ブロモスクシンイミドと作用させることにより(CO8−e)および(CO8−g)を得る。
工程5はフラン環およびチオフェン環を形成する方法である。J.Schwaltz et al.,J.Org.Chem.59,940(1994)の方法に従い、ジメチルアセトアミド溶媒中、シクロペンタジエニルジクロロチタン存在下、水素化ホウ素ナトリウムで75℃で作用させることにより(CO8−g)を得る。
本スキームCO−8で得られた化合物(CO8−d)および(CO8−g)は、製造法Aに従い最終目的化合物へと導かれる。
(スキームCO−9)
本スキームCO−9は、カルボン酸誘導体の一般的合成法を表す。式中R1,R2,R3およびR4は水素原子、置換されていてもよいアルキル基等を表す。
工程1はアルキル化の方法である。テトラヒドロフラン、ジメチルホルムアミド溶媒中、カリウム第3ブトキシド、水素化ナトリウム存在下、各種アルキルハライド、メシレート、トシレートを作用させ(CO9−b)を得る。
工程2は還元の方法である。テトラヒドロフラン溶媒中、ジイソブチルアルミニウムハイドライドと作用させ(CO9−c)を得る。
工程3はWittig反応を利用した増炭の方法である。塩化メチレン、テトラヒドロフラン溶媒中、各種ホスホラン誘導体を作用させる。あるいは、テトラヒドロフラン、ジメチルフォルムアミド溶媒中、カリウム第3ブトキシド、水素化ナトリウム等の塩基存在下、各種ホスフォニウム塩、ホスフォネートと作用させる2種のいずれかの方法により(CO9−d)を得る。
本スキームCO−9で得られた化合物(CO9−b)および(CO9−d)は、製造法Aに従い最終目的化合物へと導かれる。
以上が本発明の化合物またはその塩の製造方法の代表例であるが、本発明化合物の製造における原料化合物・各種試薬は、塩や水和物を形成していてもよく、反応を阻害しない限りにおいて特に限定されるものではない。また、本発明に係る化合物(I)がフリー体として得られる場合、前記の化合物(I)が形成していてもよい塩の状態に常法に従って変換することができる。また、本発明に係る化合物(I)について得られる種々の異性体(例えば幾何異性体、不斉炭素に基づく光学異性体、立体異性体、互変異性体、等)は、通常の分離手段、例えば再結晶、ジアステレオマー塩法、酵素分割法、種々のクロマトグラフィー(例えば薄層クロマトグラフィー、カラムクロマトグラフィー、ガスクロマトグラフィー、等)を用いることにより精製し、単離することができる。
前記式(I)で表わされる本発明の化合物またはその塩は、優れたトロンビン受容体拮抗作用を有し、特にトロンビンのPAR1受容体に対して選択的に拮抗作用を示すものである。そして、本発明の化合物またはその塩は、優れた血小板凝集抑制作用および平滑筋細胞の増殖抑制作用を示し、且つ、経口有効性が高い。このように、本発明の化合物またはその塩によれば、トロンビンのフィブリノーゲンをフィブリンに変換する触媒活性を阻害することなくトロンビンによる血小板凝集などの細胞応答を抑制することができ、また、冠動脈血管形成術等により血管壁に損傷が生じたときに起こる血管平滑筋増殖に対してもPAR1選択的阻害に基づいて抑制することが可能となる。
従って、本発明の化合物またはその塩を用いることにより、(i)トロンビン受容体の拮抗剤(特にトロンビンのPAR1受容体の拮抗剤)、(ii)血小板凝集阻害剤、(iii)平滑筋細胞の増殖阻害剤、(iv)内皮細胞、繊維芽細胞、腎細胞、骨肉腫細胞、筋細胞、ガン細胞および/またはグリア細胞の増殖阻害剤、(v)血栓症、血管再狭窄、深部静脈血栓症、肺塞栓症、脳梗塞、心疾患、播種性血管内血液凝固症候群、高血圧、炎症性疾患、リウマチ、喘息、糸球体腎炎、骨粗鬆症、神経疾患および/または悪性腫瘍の治療剤または予防剤、といった医薬組成物(製剤)が得られる。
また、本発明の化合物またはその塩を投与することにより、トロンビン受容体が関与する疾患の患者の治療、例えば内皮細胞、繊維芽細胞、腎細胞、骨肉腫細胞、筋細胞、ガン細胞および/またはグリア細胞の増殖性疾患を有する患者の治療が可能である。
前記式(I)で表わされる本発明の化合物もしくはその塩またはそれらの水和物は、慣用される方法により製剤化することが可能である。好ましい剤形としては錠剤、散剤、細粒剤、顆粒剤、被覆錠剤、カプセル剤、シロップ剤、トローチ剤、吸入剤、坐剤、注射剤、軟膏剤、眼軟膏剤、点眼剤、点鼻剤、点耳剤、パップ剤、ローション剤等があげられる。製剤化には、通常用いられる賦形剤、結合剤、崩壊剤、滑沢剤、着色剤、矯味矯臭剤や、および必要により安定化剤、乳化剤、吸収促進剤、界面活性剤、pH調整剤、防腐剤、抗酸化剤などを使用することができ、一般に医薬品製剤の原料として用いられる成分を配合して常法により製剤化可能である。
これらの成分としては例えば(1)大豆油、牛脂、合成グリセライド等の動植物油;(2)流動パラフィン、スクワラン、固形パラフィン等の炭化水素;(3)ミリスチン酸オクチルドデシル、ミリスチン酸イソプロピル等のエステル油;(4)セトステアリルアルコール、ベヘニルアルコール等の高級アルコール;(5)シリコン樹脂;(6)シリコン油;(7)ポリオキシエチレン脂肪酸エステル、ソルビタン脂肪酸エステル、グリセリン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、ポリオキシエチレン硬化ひまし油、ポリオキシエチレンポリオキシプロピレンブロックコポリマー等の界面活性剤;(8)ヒドロキシエチルセルロース、ポリアクリル酸、カルボキシビニルポリマー、ポリエチレングリコール、ポリビニルピロリドン、メチルセルロースなどの水溶性高分子;(9)エタノール、イソプロパノールなどの低級アルコール;(10)グリセリン、プロピレングリコール、ジプロピレングリコール、ソルビトールなどの多価アルコール;(11)グルコース、ショ糖などの糖;(12)無水ケイ酸、ケイ酸アルミニウムマグネシウム、ケイ酸アルミニウムなどの無機粉体;(13)精製水などがあげられる。
▲1▼賦形剤としては、例えば乳糖、コーンスターチ、白糖、ブドウ糖、マンニトール、ソルビット、結晶セルロース、二酸化ケイ素等;▲2▼結合剤としては、例えばポリビニルアルコール、ポリビニルエーテル、メチルセルロース、エチルセルロース、アラビアゴム、トラガント、ゼラチン、シェラック、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、ポリプロピレングリコール・ポリオキシエチレン・ブロックポリマー、メグルミン、クエン酸カルシウム、デキストリン、ペクチン等;▲3▼崩壊剤としては、例えば澱粉、寒天、ゼラチン末、結晶セルロース、炭酸カルシウム、炭酸水素ナトリウム、クエン酸カルシウム、デキストリン、ペクチン、カルボキシメチルセルロース・カルシウム等;▲4▼滑沢剤としては、例えばステアリン酸マグネシウム、タルク、ポリエチレングリコール、シリカ、硬化植物油、等;▲5▼着色剤としては医薬品に添加することが許可されているものであれば、いかなるものでもよく;▲6▼矯味矯臭剤としては、ココア末、ハッカ脳、芳香散、ハッカ油、竜脳、桂皮末等;▲7▼抗酸化剤としては、アスコルビン酸、α−トコフェロール、等、医薬品に添加することが許可されているものがそれぞれ用いられる。
(i)経口製剤は、本発明にかかる化合物またはその塩に賦形剤、さらに必要に応じて結合剤、崩壊剤、滑沢剤、着色剤、矯味矯臭剤などを加えた後、常法により散剤、細粒剤、顆粒剤、錠剤、被覆錠剤、カプセル剤等とする。(ii)錠剤・顆粒剤の場合には、糖衣、ゼラチン衣、その他必要により適宜コーティングすることはもちろん差支えない。(iii)シロップ剤、注射用製剤、点眼剤、等の液剤の場合は、pH調整剤、溶解剤、等張化剤、等と、必要に応じて溶解補助剤、安定化剤、緩衝剤、懸濁化剤、抗酸化剤、等を加えて、常法により製剤化する。該液剤の場合、凍結乾燥物とすることも可能で、また、注射剤は静脈、皮下、筋肉内に投与することができる。懸濁化剤における好適な例としては、メチルセルロース、ポリソルベート80、ヒドロキシエチルセルロース、アラビアゴム、トラガント末、カルボキシメチルセルロースナトリウム、ポリオキシエチレンソルビタンモノラウレート、等;溶解補助剤における好適な例としては、ポリオキシエチレン硬化ヒマシ油、ポリソルベート80、ニコチン酸アミド、ポリオキシエチレンソルビタンモノラウレート等;安定化剤における好適な例としては、亜硫酸ナトリウム、メタ亜硫酸ナトリウム、エーテル等;保存剤における好適な例としては、パラオキシ安息香酸メチル、パラオキシ安息香酸エチル、ソルビン酸、フェノール、クレゾール、クロロクレゾール等があげられる。また、(iv)外用剤の場合は、特に製法が限定されず、常法により製造することができる。使用する基剤原料としては、医薬品、医薬部外品、化粧品等に通常使用される各種原料を用いることが可能で、例えば動植物油、鉱物油、エステル油、ワックス類、高級アルコール類、脂肪酸類、シリコン油、界面活性剤、リン脂質類、アルコール類、多価アルコール類、水溶性高分子類、粘土鉱物類、精製水などの原料が挙げられ、必要に応じ、pH調整剤、抗酸化剤、キレート剤、防腐防黴剤、着色料、香料などを添加することができる。さらに、必要に応じて分化誘導作用を有する成分、血流促進剤、殺菌剤、消炎剤、細胞賦活剤、ビタミン類、アミノ酸、保湿剤、角質溶解剤、等の成分を配合することもできる。
本発明にかかる医薬の投与量は、症状の程度、年齢、性別、体重、投与形態・塩の種類、薬剤に対する感受性差、疾患の具体的な種類、等に応じて異なるが、通常、成人の場合は1日あたり経口投与で約30μgないし1000mg、好ましくは100μgないし500mg、さらに好ましくは100μgないし100mgを、注射投与で約1ないし3000μg/kg、好ましくは3ないし1000μg/kgを、それぞれ1回または数回に分けて投与する。
実施例
以下に前記式(I)で表わされる本発明の化合物またはその塩における好適な実施態様をあげるが、以下の実施例および試験例は例示的なものであって、本発明にかかる化合物またはその塩は以下の具体例に制限されない。当業者はこれらの実施態様に様々な変更を加えて本発明を実施することができ、かかる変更態様も本明細書の特許請求の範囲に包含される。
<実施例1>
1−(3,5−ジ−第3ブチル 4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
(工程1)メチル(E)−2−ヘキセノエイト
n−ブチルアルデヒド(4.5g,62mmol)のアセトニトリル(90ml)溶液にメチル 2−[(Z)−1−トリフェニルフォスフィニリデン]アセテート(21g,63mmol)を加え室温で12時間攪拌した。溶媒を減圧留去した後、残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し標記化合物4.62gを淡黄色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
0.93(3H,t,J=7.2Hz)1.44〜1.54(2H,m)2.17(2H,q,J=7.2Hz)3.72(3H,s)5.82(1H,d,J=15.6Hz)6.97(1H,dt,J=15.6Hz,7.2Hz)
(工程2)メチル 3−(ニトロメチル)ヘキサノエイト
メチル(E)−2−ヘキセノエイト(4.62g,36mmol)のアセトニトリル(20ml)溶液にニトロメタン(2.54ml,46ml)、1,8−ジアザビシクロ[5,4,0]ウンデ−7−セン(5.4ml,36mmol)を加え室温え14時間攪拌した。反応液に1N.HCl水溶液を加え酸性にした後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し標記化合物3.64gを淡黄色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
0.92(3H,t,J=.8Hz)1.29−1.48(4H,m)2.45(2H,d,J=6.4Hz)2.57−2.68(1H,m)3.69(3H,s)4.43(1H,dd,J=14.0Hz,6.0Hz)4.50(1H,dd,J=14.0,6.8Hz)
(工程3)4−プロピル−2−ピロリジノン
メチル 3−(ニトロメチル)ヘキサノエイト(3.64g,19.2mmol)のエタノール(20ml)溶液に酸化白金(0.4g)を加え水素気流下室温で18時間攪拌した。反応液をセライト濾過後、濾液の溶媒を減圧留去し、残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル、酢酸エチル:メタノール)にて精製し標記化合物1.63gを淡黄色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
0.92(3H,t,J=7.2Hz)1.27−1.53(4H,m)1.93−2.05(1H,m)2.37−2.53(2H,m)3.01(1H,dd,J=9.2Hz,6.4Hz)3.48(1H,dd,J=9.2Hz,9.2Hz)5.67−5.97(1H,m)
(工程4)5−メトキシ−3−プロピル−3,4−ジヒドロ−2H−ピロール
4−プロピル−2−ピロリジノン(410mg,3.22mmol)の塩化メチレン(8ml)溶液にトリメチルオキソニウムテトラフルオロボーレイト(715mg,4.83mmol)を加え室温で14時間攪拌した。反応液に飽和重曹水溶液を加え弱塩基性とし後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、有機層を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し標記化合物306mgを淡黄色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
0.90(3H,t,J=7.2Hz)1.21−1.50(4H,m)2.13(1H,dd,J=16.4Hz,16.8Hz)2.34−2.48(1H,m)2.57(1H,dd,J=16.4Hz,9.2Hz)3.24(1H,dd,J=13.6Hz,6.0Hz)3.71−3.90(4H,m)
(工程5)(4−プロピルテトラヒドロ−1H−2−ピロリデン)アンモニウム クロリド
5−メトキシ−3−プロピル−3,4−ジヒドロ−2H−ピロール(306mg,2.17mmol)のエタノール(12ml)溶液に塩化アンモニウム(110mg,2.06mmol)を加え4時間加熱還流した。反応液を濾過し濾液を減圧留去し標記化合物257mgを粗生成物として白色固体として得た。
1H−NMR(DMSO−d6)δ(ppm)
0.86(3H,t,J=7.2Hz)1.12−1.52(4H,m)2.34−2.60(1H and DMSO,m)2.78−2.93(1H,m)3.05−3.22(2H,m)3.54−3.70(1H,m)
(実施例1:最終工程)
(4−プロピルテトラヒドロ−1H−2−ピロリデン)アンモニウム クロリド(257mg,1.58mmol)、1,8−ジアザビシクロ[5,4,0]ウンデ−7−セン(236ul,1.58mmol)のアセトニトリル(15ml)溶液に、氷冷下2−ブロモ−1−[3,5−ジ(第3ブチル)−4−ヒドロキシフェニル]−1−エタノン(569mg,1.74mmol)を加え室温で15時間攪拌した。反応中に析出した結晶を濾取し標記化合物100mgを淡黄色結晶として得た。また、母液の溶媒を減圧留去し残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル:メタノール)にて精製し、更に目的化合物64mgを淡黄色結晶として得た。
1H−NMR(DMSO−d6)δ(ppm)
0.88(3H,t,J=7.2Hz),1.10−1.63(23H,m),2.50−2.68(1H,m),3.08(1H,dd,J=17.6Hz,8.4Hz),3.63−3.80(1H,m),5.13(2H,s),7.71(2H,s),8.03(1H,brs),8.71(1H,s),9.20(1H,s).
MS:m/e(ESI)373.2(MH+)
<実施例2>
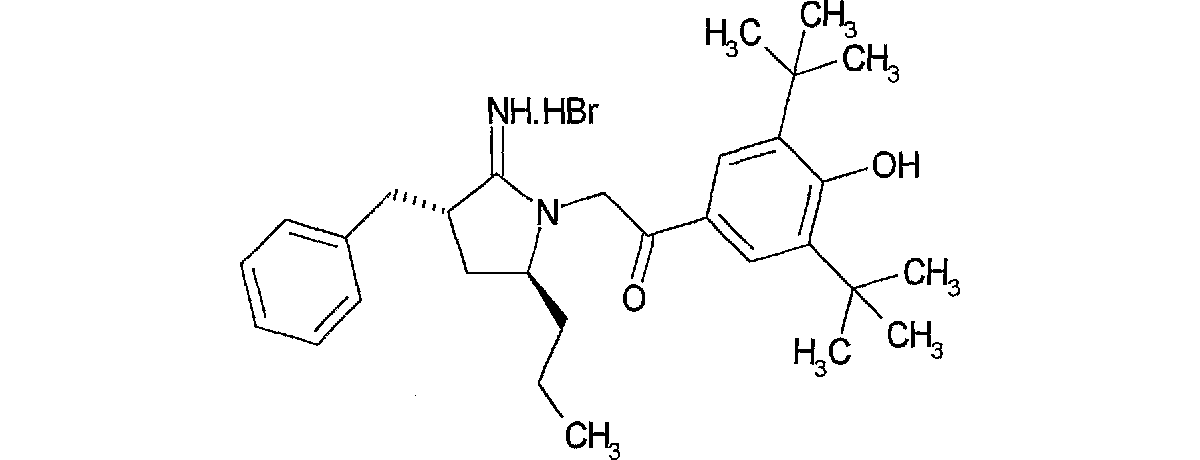
2−((3R,4R)−3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル 4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
(工程1)第3ブチル 2−オキソ−4−プロピル−1−ピロリジンカルボキシレート
4−プロピル−2−ピロリジノン(1.22g,9.59mmol)の塩化メチレン(20ml)溶液に、トリエチルアミン(81.4ml,10mmol)、第3ブチルジカーボネート(4.2g,19.2mmol)、ジメチルアミノピリジ(1.18g,9.58mmol)を加え室温で12時間攪拌した。溶媒を減圧留去後、残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し標記化合物1.35gを無色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
0.93(3H,t,J=7.2Hz)1.28−1.50(4H,m)1.52(9H,s)2.14−2.32(2H,m)2.61(1H,dd,J=15.0Hz,7.0Hz)3.30(1H,dd,J=10.8Hz,7.2Hz)3.87(1H,dd,J=10.8Hz,8.0Hz)
(工程2)第3ブチル 3−ベンジル−2−オキソ−4−プロピル−1−ピロリジンカルボキシレート
第3ブチル 2−オキソ−4−プロピル−1−ピロリジンカルボキシレート(1.35g,5.94mmol)のテトラヒドロフラン(20ml)溶液に−70℃でリチウムヘキサメチルジシラザンの1.0M.テトラヒドロフラン溶液(6.2ml,6.2mmol)を徐々に加え15分間攪拌した。反応液にベンジルブロミドを加え徐々に0℃まで昇温し3時間攪拌した。反応液に飽和塩化アンモニウム水溶液を加え酢酸エチルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、溶媒を減圧留去し残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し標記化合物1.22gを淡黄色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
0.80(3H,t,J=7.2Hz)1.10−1.40(4H,m)1.52(9H,s)1.87−1.95(1H,m)2.44−2.52(1H,m)2.90(1H,dd,J=14.4Hz,7.2Hz)3.10(1H,dd,J=14.4Hz,5.2Hz)3.15(1H,dd,J=10.8Hz,8.0Hz)3.71(1H,dd,J=10.8Hz,8.0Hz)7.15−7.33(5H,m)
(工程3)3−ベンジル−4−プロピル−2−ピロリジノン
第3ブチル 3−ベンジル−2−オキソ−4−プロピル−1−ピロリジンカルボキシレート(1.22g,3.84mmol)の塩化メチレン(10ml)溶液にトリフルオロ酢酸(10ml)を加え氷冷下14時間攪拌した。反応液に飽和重曹水溶液を加え酢酸エチルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、溶媒を減圧留去し標記化合物0.83gを白色結晶の粗生成物として得た。
1H−NMR(CDCl3)δ(ppm)
0.79(3H,t,J=7.2Hz)1.08−1.36(4H,m)2.04−2.21(1H,m)2.28−2.40(1H,m)2.81−2.96(2H,m)3.09(1H,dd,J=14.0Hz,4.8Hz)3.29(1H,dd,J=8.4Hz,8.4Hz)5.73(1H,brs)7.15−7.36(5H,m)
(工程4)4−ベンジル−3−プロピル−3,4−ジヒドロ−2H−5−ピロリル メチル エーテル
3−ベンジル−4−プロピル−2−ピロリジノン(0.83g,3.8mmol)の塩化メチレン(15ml)溶液にトリメチルオキソニウムテトラフルオロボーレイト(0.85g,5.7mmol)を加え室温で14時間攪拌した。反応液に飽和重曹水溶液を加え弱塩基性とし後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、溶媒をを減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し標記化合物0.67gを淡黄色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
0.75(3H,t,J=7.2Hz)1.02−1.28(4H,m)2.02−2.16(1H,m)2.55−2.66(1H,m)2.69(1H,dd,J=13.2Hz,8.4Hz)2.99(1H,dd,J=13.2Hz,4.8Hz)3.10(1H,dd,J=13.2Hz,5.2Hz)3.58(1H,dd,J=13.2Hz,8.8Hz)3.83(3H,s)7.05−7.40(5H,m)
(工程5)(3−ベンジル−4−プロピルテトラヒドロ−1H−2−ピロリデン )アンモニウム クロリド
4−ベンジル−3−プロピル−3,4−ジヒドロ−2H−5−ピロリル メチル エーテル(0.67g,2.9mmol)のエタノール(15ml)溶液に塩化アンモニウム(155mg,2.9mmol)を加え4時間加熱還流した。反応液を濾過し濾液を減圧留去した。残渣を酢酸エチルから結晶化し標記化合物440mgを白色粗生成物として得た。
1H−NMR(DMSO−d6)δ(ppm)
0.62(3H,t,J=7.2Hz)0.87−1.20(4H,m)2.01−2.15(1H,m)2.72−2.85(1H,m)2.88−2.98(1H,m)3.05−3.25(1H,m)3.50−3.62(1H,m)7.19−7.40(5H,m)
(実施例2:最終工程)
A法
水酸化ナトリウム水溶液で処理した塩基性樹脂DIAION SA10A(14.5g)を水およびメタノールで十分に洗浄後、dl−[(3S,4R)−4−ベンジル−3−プロピル−3,4−ジヒドロ−2H−5−ピロールアミン塩酸塩(1.63g,7.5mmol)のメタノール(30ml)溶液に加え30分撹拌した。樹脂を濾去後、溶媒を減圧留去しdl−[(3S,4R)−4−ベンジル−3−プロピル−3,4−ジヒドロ−2H−5−ピロールアミン(1.45g)を得た。
引き続き、上記dl−[(3S,4R)−4−ベンジル−3−プロピル−3,4−ジヒドロ−2H−5−ピロールアミンおよびフェナシルブロマイド(2.7g,8.3mmol)のエタノール溶液を6時間加熱還流した。溶媒を減圧留去後、エーテルより結晶化し標記化合物(2.54g)を白色アモルファスとして得た。
B法
(3−ベンジル−4−プロピルテトラヒドロ−1H−2−ピロリデン)アンモニウム クロリド(223mg,1.03mmpol)の、1,8−ジアザビシクロ[5,4,0]ウンデ−7−セン(154ul,1.03mmol)のアセトニトリル(10ml)溶液に、氷冷下2−ブロモ−1−[3,5−ジ(第3ブチル)−4−ヒドロキシフェニル]−1−エタノン(405mg,1.03mmol)を加え室温で7時間、更に60℃で3時間攪拌した。溶媒を減圧留去し残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル:メタノール)にて精製し、更に標記化合物107mgを白色アモルファスとして得た。
1H−NMR(DMSO−d6)δ(ppm)
0.61(3H,t,J=7.2Hz),0.85−1.30(5H,m),1.41(18H,s),2.05−2.16(1H,m),2.75−2.88(1H,m),3.02−3.28(2H,m),3.75−3.86(1H,m),5.17(2H,s),7.20−7.42(5H,m),7.73(2H,s),8.05(1H,s),8.94(1H,s),9.41(1H,s).
MS:m/e(ESI)463.2(MH+)
<実施例3>
N−{3−第3ブチル 2−ヒドロキシ−5−[2−((3S,4S)−2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−フェニル}−N−メチル−メタンスルフォンアミド;臭化水素酸塩
(工程1)[(3S,4R)−3−フェニル−4−プロピルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド
n−ブチルトリフェニルフォスフォニウム ブロミド(30.17g,76mmol)のテトラヒドロフラン(140ml)懸濁液にカリウム t−ブトキシド(8.48g,76mmol)加え室温で1時間攪拌した。反応液を水冷しエチル ベンゾイルフォルメート(10.0ml,63mmol)のテトラヒドロフラン(50ml)溶液を内温が20度を越えないように滴下した。室温で1時間30分撹拌後、水に注ぎ酢酸エチルで抽出した。有機層を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣にn−ヘキサンを加え不溶物を濾別後、シリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し無色油状物13.27gを得た。
この油状物(13.27g,61mmol)のジメチルスルフォキシド(80ml)溶液に無水炭酸カリウム(4.21g,30mmol)を加え、90℃に加熱した。撹拌下ニトロメタン(4.95ml,91mmol)のジメチルスルフォキシド(40ml)溶液を40分かけて滴下した。3時間攪拌後、反応液を酢酸水溶液に注ぎ、酢酸エチルで抽出した。有機層を1N−塩酸、飽和炭酸ナトリウム水溶液、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し黄色油状物6.40gを得た。
この油状物(12.3g,44mmol)のエタノール(200ml)溶液に酸化白金(1.2g)を加え水素気流下室温で15時間攪拌した。反応液を濾過後、溶媒を減圧留去し、残渣を110℃で1時間加熱した。残渣に水を加え酢酸エチルで抽出した。有機層を1N−塩酸、飽和炭酸ナトリウム水溶液、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し白色固体5.95gを得た。
この固体(5.95g,29mmol)の塩化メチレン(100ml)溶液にトリメチルオキソニウムテトラフルオロボーレート(5.2g,35mmol)を加え室温で15時間攪拌した。反応液に飽和重曹水溶液を加え、クロロホルムで抽出した。有機層を無水硫酸マグネシウムで乾燥後、減圧留去した。残渣を酢酸エチルに溶解しアルミナ−シリカゲルで濾過後、減圧留去し、淡黄色油状物6.91gを得た。
この油状物(6.31g,29mmol)のメタノール(60ml)溶液に塩化アンモニウム(1.56g,29mmol)を加え21時間加熱還流した。反応液を減圧留去し、残渣に酢酸エチルを加え析出物を濾取し標記化合物5.40gを粗生成物として白色固体として得た。
1H−NMR(DMSO−d6)δ(ppm)
0.77(3H,t,J=7.2Hz)1.09−1.25(2H,m)1.35−1.47(2H,m)2.39(1H,m)3.26(1H,m)3.77(1H,dd,J=10.8Hz,8.8Hz)3.96(1H,d,J=8.8Hz)7.22−7.44(5H,m)8.52(1H,brs)9.05(1H,brs)
(実施例3:最終工程)
[(3S,4R)−3−フェニル−4−プロピルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド(800mg,3.5mmol)、1,8−ジアザビシクロ[5.4.0]ウンデ−7−セン(0.52ml,3.5mmol)のアセトニトリル(10ml)溶液に、フェナシルブロマイド(1.32g,3.5mmol)を加え60℃で9時間攪拌した。反応を減圧留去し残渣をシリカゲルカラムクロマトグラフィー(溶媒:酢酸エチル:メタノール)にて精製し、酢酸エチル−ジイソプロピルエーテルで結晶化し目的化合物710mgを微クリーム色粉末として得た。
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.6Hz),1.20−1.33(2H,m),1.40(9H,s),1.47−1.58(2H,m),2.42(1H,m),3.16(3H,s),3.46(1H,m),3.93(1H,m),4.16(1H,d,J=7.2Hz),5.27(2H,s),7.35−7.50(5H,m),7.82(1H,s),7.94(1H,s),8.89(1H,s),9.01(1H,s),10.03(1H,brs).
<実施例4>
1−(3,5−ジ−第3ブチル 4−ヒドロキシ−フェニル)−2−[(3S,4S)−2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
(工程1)[(3S,4R)−4−(2−メトキシエチル)−3−フェニルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド
3−ベンジルオキシプロピルトリフェニルフォスフォニウム ブロミド(21.8g,44mmol)のテトラヒドロフラン(100ml)懸濁液を−30℃に冷却し、n−ブチルリチウム(2.6M,17.8ml,44mmol)を滴下し1時間撹拌した。−50℃に冷却しエチルベンゾイルフォルメート(7.2g,40mmol)のテトラヒドロフラン(10ml)溶液を内温が−40℃を越えないように滴下した。7時間撹拌後、反応液に水を加え酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣にトルエンを加え不溶物を濾別後、シリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し無色油状物3.66gを得た。
この油状物(4.17g,14mmol)のジメチルスルフォキシド(15ml)溶液に無水炭酸カリウム(0.93g,6.7mmol)を加え、90℃に加熱した。撹拌下ニトロメタン(1.1ml,20mmol)のジメチルスルフォキシド(10ml)溶液を40分かけて滴下した。3時間攪拌後、反応液を1N−塩酸に注ぎ、酢酸エチルで抽出した。有機層を水、飽和炭酸ナトリウム水溶液、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し黄色油状物3.07gを得た。
この油状物(3.07g,8.3mmol)のエタノール(50ml)溶液に濃塩酸(6.9ml,83mmol)、亜鉛(2.7g,42mmol)を加え室温で1時間攪拌した。反応液を氷冷し5N−水酸化ナトリウム水溶液(17ml,85mmol)を加え室温で11時間撹拌した。反応液をセライトで濾過後、溶媒を減圧留去し、残渣を120℃で1時間加熱した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し微黄色油状物1.03gを得た。
この微黄色油状物(1.03g,3.5mmol)のメタノール(20ml)溶液に10%パラジウム炭素(1.0g)、ギ酸アンモニウム(1.1g,18mmol)を加え6時間加熱還流した。反応液を濾過し、減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:酢酸エチル−メタノール)にて精製し白色固体669mgを得た。
この固体(600mg,2.9mmol)の塩化メチレン(10ml)溶液にトリメチルオキソニウムテトラフルオロボーレート(1.1g,7.0mmol)を加え室温で15時間攪拌した。反応液を飽和重曹水溶液に注ぎ、クロロホルムで抽出した。有機層を無水硫酸マグネシウムで乾燥後、減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し無色油状物515mgを得た。
この油状物(515mg,2.2mmol)のメタノール(5ml)溶液に塩化アンモニウム(118mg,2.2mmol)を加え21時間加熱還流した。反応液を減圧留去し、残渣に酢酸エチルを加え析出物を濾取し標記化合物471mgを粗生成物として白色粉末として得た。
1H−NMR(DMSO−d6)δ(ppm)
1.62−1.78(2H,m)2.42−2.56(1H and DMSO,m)3.11(3H,s)3.18−3.42(3H and H20,m)3.78(1H,dd,J=10.8Hz,8.8Hz)4.04(1H,d,J=8.8Hz)7.26−7.32(2H,m)7.34−7.45(3H,m)
(実施例4:最終工程)
[(3S,4R)−4−(2−メトキシエチル)−3−フェニルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド(300mg,1.3mmol)、1,8−ジアザビシクロ[5.4.0]ウンデ−7−セン(0.19ml,1.3mmol)のアセトニトリル(5ml)溶液に、フェナシルブロマイド(408mg,1.3mmol)を加え60℃で5時間攪拌した。反応を減圧留去し残渣をシリカゲルカラムクロマトグラフィー(溶媒:酢酸エチル:メタノール)にて精製し、酢酸エチル−ジイソプロピルエーテルで結晶化し目的化合物273mgを微クリーム色粉末として得た。
1H−NMR(DMSO−d6)δ:
1.43(18H,s),1.44−1.60(2H,m),2.55(1H,m),3.15(3H,s),3.24−3.42(3H,m),3.51(1H,dd,J=6.8,10.4Hz),3.90(1H,dd,J=7.6,10.4Hz),4.24(2H,d,J=7.2Hz),5.30(2H,s),7.36−7.50(5H,m),7.78(2H,s),8.07(1H,brs),8.86(1H,brs),8.96(1H,brs).
<実施例5>
1−(3,5−ジ−第3ブチル 4−ヒドロキシ−フェニル)−2−[(3S,4S)−2−イミノ−4−(3−メトキシ−プロピル)−3−フェニル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
(工程1)[(3S,4R)−4−(3−メトキシプルピル)−3−フェニルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド
水素化ナトリウム(70%,1.06g,31mmol)のテトラヒドロフラン(80ml)懸濁液を氷冷し、メチル 2−フェニル−2−ジエチルフォスフォノアセテート(8.00g,28mmol)のテトラヒドロフラン(10ml)溶液を滴下し1時間撹拌した。4−ベンジルオキシブタナール(5.48g,3lmmol)のテトラヒドロフラン(10ml)溶液を滴下し、室温で17時間撹拌後、反応液に水を加え酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し無色油状物4.05gを得た。
この油状物(4.05g,12.5mmol)のジメチルスルフォキシド(15ml)溶液に無水炭酸カリウム(0.86g,6.3mmol)を加え、80℃に加熱した。撹拌下ニトロメタン(1.0ml,19mmol)のジメチルスルフォキシド(15ml)溶液を55分かけて滴下した。2時間30分攪拌後、反応液を1N−塩酸に注ぎ、酢酸エチルで抽出した。有機層を水、飽和炭酸ナトリウム水溶液、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し淡黄色油状物2.04gを得た。
この油状物(2.04g,5.5mmol)のエタノール(35ml)溶液に濃塩酸(4.6ml,55mmol)、亜鉛(1.8g,28mmol)を加え室温で20分撹拌後、60℃で1時間攪拌した。反応液を氷冷し5N−水酸化ナトリウム水溶液(12ml,60mmol)を加え室温で15分撹拌した。反応液をセライトで濾過後、溶媒を減圧留去し、残渣を110℃で1時間加熱した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し微黄色油状物1.03gを得た。
この微黄色油状物(1.03g,3.3mmol)のメタノール(20ml)溶液に10%パラジウム炭素(1.0g)、ギ酸アンモニウム(1.05g,17mmol)を加え6時間加熱還流した。反応液を濾過し、減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:酢酸エチル−メタノール)にて精製し白色固体649mgを得た。
この固体(600mg,2.7mmol)の塩化メチレン(10ml)溶液にトリメチルオキソニウムテトラフルオロボーレート(973mg,6.6mmol)を加え室温で15時間攪拌した。反応液を飽和重曹水溶液に注ぎ、クロロホルムで抽出した。有機層を無水硫酸マグネシウムで乾燥後、減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し無色油状物503mgを得た。
この油状物(503mg,2.0mmol)のメタノール(5ml)溶液に塩化アンモニウム(109mg,2.0mmol)を加え19時間加熱還流した。反応液を減圧留去し、残渣に酢酸エチルを加え析出物を濾取し標記化合物410mgを粗生成物として白色粉末として得た。
1H−NMR(DMSO−d6)δ(ppm)
1.32−1.54(4H,m)2.41(1H,m)3.15(3H,s)3.22(2H,t,J=6.0Hz)3.27(1H,dd,J=10.8Hz,8.0Hz)3.80(1H,dd,J=10.8Hz,8.8Hz)3.99(1H,d,J=8.8Hz)7.27−7.31(2H,m)7.34−7.45(3H,m)
(実施例5:最終工程)
[(3S,4R)−4−(3−メトキシプルピル)−3−フェニルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド(300mg,1.2mmol)、1,8−ジアザビシクロ[5.4.0]ウンデ−7−セン(0.18ml,1.2mmol)のアセトニトリル(5ml)溶液に、フェナシルブロマイド(386mg,1.2mmol)を加え60℃で5時間攪拌した。反応を減圧留去し残渣をシリカゲルカラムクロマトグラフィー(溶媒:酢酸エチル:メタノール)にて精製し、酢酸エチル−ジイソプロピルエーテルで結晶化し目的化合物273mgを白色綿状結晶として得た。
1H−NMR(DMSO−d6)δ:
1.43(18H,s),1.44−1.62(4H,m),2.42(1H,m),3.18(3H,s),3.26(2H,t,J=6.0Hz),3.36(1H,m),3.46(1H,dd,J=6.0,10.8Hz),3.92(1H,dd,J=7.6,10.8Hz),4.16(2H,d,J=7.2Hz),5.29(2H,s),7.36−7.50(5H,m),7.78(2H,s),8.07(1H,brs),8.86(1H,brs),8.96(1H,brs).
<実施例6>
1−(3,5−ジ−第3ブチル 4−ヒドロキシ−フェニル)−2−((3S,4S)−2−イミノ−4−メトキシメチル−3−フェニル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
(工程1)(3S,4R)−4−[(ベンジルオキシ)メチル]−3−フェニルテトラヒドロ−1H−2−ピロロン
水素化ナトリウム(70%,0.87g,25mmol)のテトラヒドロフラン(40ml)懸濁液を氷冷し、メチル 2−フェニル−2−ジエチルフォスフォノアセテート(6.03g,21mmol)のテトラヒドロフラン(10ml)溶液を滴下し、室温で1時間撹拌した。反応液を氷冷し2−ベンジルオキシエタナール(4.74g,32mmol)のテトラヒドロフラン(10ml)溶液を滴下し、室温で1.5時間撹拌後、2−ベンジルオキシエタナール(2.14g,14mmol)を追加し、室温で17時間撹拌した。反応液を飽和食塩水に注ぎ、酢酸エチルで抽出した。有機層を水、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し微黄色油状物3.89gを得た。
この油状物(3.89g,13.8mmol)のジメチルスルフォキシド(15ml)溶液に無水炭酸カリウム(0.95g,6.9mmol)を加え、90℃に加熱した。撹拌下ニトロメタン(1.1ml,21mmol)のジメチルスルフォキシド(20ml)溶液を40分かけて滴下した。3時間30分攪拌後、反応液に酢酸(2ml)および水を加え酢酸エチルで抽出した。有機層を1N−塩酸、飽和炭酸ナトリウム水溶液、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し微黄色油状物3.28gを得た。
この油状物(3.28g,9.6mmol)のエタノール(65ml)溶液に濃塩酸(8.0ml,96mmol)、亜鉛(5.0g,77mmol)を加え室温で1時間撹拌した。反応液を氷冷し5N−水酸化ナトリウム水溶液(19ml,95mmol)を加え反応液をセライトで濾過後、溶媒を減圧留去した。残渣に水を加え酢酸エチルで抽出した。有機層を1N−塩酸、飽和炭酸ナトリウム水溶液、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し標記化合物1.73gを無色油状物として得た。
1H−NMR(CDCl3)δ(ppm)
2.78(1H,m)3.36(1H,dd,J=9.6Hz,8.0Hz)3.47−3.60(4H,m)4.47(1H,d,J=12.0Hz)4.54(1H,d,J=12.0Hz)6.06(1H,brs)7.17−7.21(2H,m)7.24−7.38(8H,m)
(工程2)(3S,4R)−4−(ヒドロキシメチル)−3−フェニルテトラヒドロ−1H−2−ピロロン
(3S,4R)−4−[(ベンジルオキシ)メチル]−3−フェニルテトラヒドロ−1H−2−ピロロン(1.73g,6.2mmol)のメタノール(40ml)溶液に10%パラジウム炭素(1.7g)を加え水素気流下室温で15時間攪拌し、更に60℃で3時間撹拌した。反応液を濾過し、減圧留去した。残渣にエーテルを加え析出物濾取し標記化合物1.05gを白色粉末として得た。
1H−NMR(CDCl3)δ(ppm)
1.90(1H,brs)2.69(1H,m)3.32(1H,dd,J=10.0Hz,8.0Hz)3.46(1H,d,J=9.2Hz)3.56(1H,t,J=8.8Hz)3.67(1H,m)3.75(1H,m)6.50(1H,brs)7.19−7.30(3H,m)7.32−7.38(2H,m)
(工程3)[(3S,4R)−4−(メトキシメチル)−3−フェニルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド
(3S,4R)−4−(ヒドロキシメチル)−3−フェニルテトラヒドロ−1H−2−ピロロン(600mg,3.1mmol)の塩化メチレン(10ml)溶液にトリメチルオキソニウムテトラフルオロボーレート(1.12g,7.5mmol)を加え室温で14時間攪拌した。反応液を飽和重曹水溶液に注ぎ、塩化メチレンで抽出した。有機層を無水硫酸マグネシウムで乾燥後、減圧留去した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:n−ヘキサン−酢酸エチル)にて精製し無色油状物431mgを得た。
この油状物(431mg,2.0mmol)のメタノール(5ml)溶液に塩化アンモニウム(105mg,2.0mmol)を加え5時間加熱還流した。残渣をシリカゲルカラムクロマトグラフィー(溶媒:酢酸エチル:メタノール)にて精製し標記化合物335mgを無色ガラス状固体として得た。
1H−NMR(DMSO−d6)δ(ppm)
2.64(1H,m)3.26(3H,s)3.37−3.46(3H,m)3.83(1H,dd,J=10.2Hz,8.8Hz)4.07(1H,d,J=8.8Hz)7.26−7.30(2H,m)7.33−7.44(3H,m)
(実施例6:最終工程)
[(3S,4R)−4−(メトキシメチル)−3−フェニルテトラヒドロ−1H−2−ピロリリデン]アンモニウム クロリド(333mg,1.5mmol)、1,8−ジアザビシクロ[5.4.0]ウンデ−7−セン(0.22ml,1.5mmol)のアセトニトリル(5ml)溶液に、フェナシルブロマイド(481mg,1.5mmol)を加え60℃で5時間攪拌した。反応を減圧留去し残渣をシリカゲルカラムクロマトグラフィー(溶媒:酢酸エチル:メタノール)にて精製し、酢酸エチル−ジイソプロピルエーテルで結晶化し目的化合物217mgを暗クリーム色粉末として得た。
1H−NMR(DMSO−d6)δ:
1.44(18H,s),2.63(1H,m),3.31(3H,s),3.44−3.64(3H,m),3.96(1H,dd,J=8.0,10.8Hz),4.24(1H,d,J=7.2Hz),5.27(1H,d,J=18.0Hz),5.34(1H,d,J=18.0Hz),7.39(1H,m),7.42−7.52(4H,m),7.78(2H,s),8.07(1H,brs),8.97(1H,m),9.06(1H,brs).
以下の実施例化合物は各種2−イミノピロリジン誘導体と各種2−ブロモ−1−エタノン誘導体から前記実施例1の最終工程と同様の方法で合成した。
実施例7
2−(3−ベンジル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.40(18H,s),1.70−2.12(2H,m),2.68−2.81(1H,m),3.17−3.64(4H,m),5.18(2H,s),7.15−7.40(5H,m),7.73(2H,s),7.96−8.08(1H,m),8.90−9.00(1H,m),9.35−9.47(1H,m).
MS:m/e(ESI)421.2(MH+)
実施例8
2−(3−ベンジル−2−イミノ−4−イソブチル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.43(3H,d,J=6.2Hz),0.65(3H,d,J=6.2Hz),1.00−1.30(3H,m),1.41(18H,s),2.12−2.22(1H,m),2.81(1H,dd,J=10.7,J=13.2Hz),3.01−3.09(1H,m),3.14−3.24(2H,m),3.87(1H,dd,J=8.8,J=10.7Hz),5.16(2H,s),7.21−7.40(5H,m),7.73(2H,s),8.06(1H,s),8.92(1H,s),9.37(1H,s).
MS:m/e(ESI)477.2(MH+)
実施例9
2−(3−ベンジル−4−ブチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.68(3H,t,J=7.2Hz),0.80−1.30(6H,m),1.41(18H,s),2.02−2.15(1H,m),2.78−2.84(1H,dd,J=10.6,J=13.2Hz),3.02−3.09(1H,m),3.16−3.27(2H,m),3.81(1H,dd,J=7.2,J=10.6Hz),5.15(2H,s),7.24−7.38(5H,m),7.73(2H,s),8.90(1H,s),9.35(1H,s).
MS:m/e(ESI)477.2(MH+)
実施例10
2−(3−ベンジル−2−メチルイミノ−4−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.64(3H,t,J=7.6Hz),0.92−1.36(4H,m),1.40(18H,s),2.09(1H,dd,J=5.6,J=10.6Hz),2.78(1H,dd,J=10.6Hz,J=12.6Hz),3.03(3H,s),3.13(1H,dd,J=3.6Hz,J=12.6Hz),3.23(1H,d,J=12.6Hz),3.42(1H,dd,J=5.0Hz,J=10.6Hz),3.92(1H,dd,J=5.0Hz,J=10.6Hz),5.15(2H,s),7.24−7.42(5H,m),7.73(2H,s).
MS:m/e(ESI)477.3(MH+)
実施例11
N−{5−[2−(3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−アセチル]−3−第3ブチル−2−ヒドロキシ−フェニル}−N−メチル−メタンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.62(3H,t,J=7.8Hz),0.80−2.20(14H,m),2.82(1H,t,J=10.9Hz),3.00−3.40(9H,m),3.74−3.86(1H,m),5.11(2H,brs),7.20−7.40(5H,m),7.77(1H,brs),7.88(1H,brs),8.97(1H,brs),9.38(1H,brs),10.01(1H,brs).
MS:m/e(ESI)514.3(MH+)
実施例12
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(3−エチル−ペンチル)−2−イミノ−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.84(6H,t,J=7.2Hz),1.17−1.55(8H,m),1.40(18H,s),1.74−1.90(2H,m),2.23−2.34(1H,m),3.08−3.19(1H,m),3.53−3.70(2H,m),5.16(2H,s),7.72(2H,s),8.04(1H,s),8.76(1H,s),9.10(1H,s).
MS:m/e(ESI)429.3(MH+)
実施例13
2−(3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.69(3H,t,J=7.6Hz),0.82−1.50(5H,m),1.41(18H,s),2.86−3.00(1H,m),3.05−3.20(1H,m),3.41−3.45(1H,m),3.57−3.64(2H,m),5.24(2H,s),7.20−7.42(5H,m),7.74(2H,s).
実施例14
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(3−イミノ−8−オキサ−2−アザ−スピロ[4.5]デシ−2−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.39(18H,s),1.55−1.77(4H,m),2.88(2H,s),3.37−3.70(6H,m),5.17(2H,s),7.71(2H,s),7.93−8.11(1H,m),8.83(1H,brs),9.30(1H,brs).
MS:m/e(ESI)401.2(MH+)
実施例15
4−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−ピロリジン−2−カルボン酸 エチルエステル;トリフルオロ酢酸塩
1H−NMR(DMSO−d6)δ:
1.14(3H,t,J=7.0Hz),1.43(18H,s),2.05−2.13(1H,m),2.21−2.26(1H,m),2.78(1H,dd,J=11.2Hz,13.2Hz),3.36(1H,dd,J=3.2Hz,10.0Hz),4.02−4.20(2H,m),4.63(1H,dd,J=4.8Hz,8.8Hz),5.17(1H,d,J=18.4Hz),5.32(1H,d,J=18.4Hz),7.23−7.42(5H,m),7.74(2H,s),8.07(1H,s),9.33(1H,s),9.77(1H,s).
実施例16
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(3−イミノ−2−アザ−スピロ[4.5]デシ−2−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.20−1.65(28H,s),2.77(2H,s),3.44(2H,s),5.15(2H,s),7.72(2H,s),7.92−8.11(1H,m),8.76(1H,brs),9.21(1H,brs).
MS:m/e(ESI)399.2(MH+)
実施例17
N−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−ピロリジン−3−イル}−2−エチル−ブチルアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.80(3H,t,J=7.2Hz),0.83(3H,t,J=7.6Hz),1.40(18H,s),1.41−1.56(m,4H),1.99−2.10(2H,m),2.40−2.46(1H,m),3.55−3.70(2H,m),5.07(1H,q,J=8.0Hz),5.21(2H,s),7.73(2H,s),8.05(1H,br),8.67(1H,d,J=7.6Hz),8.78(1H,br),8.95(1H,br).
実施例18
2−(3−ベンジル−2−イミノ−4,4−ジメチル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.82(3H.s),1.05(3H.s),1.40(18.s),2.47(2H.s),2.85(1H.m),5.15(2H.s),7.20−7.38(5H.m),7.72(2H.s).
実施例19
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(4−エチル−4−ヒドロキシ−ヘキシル)−2−イミノ−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.77(6H,t,J=7.2Hz),1.22−1.42(8H,m),1.40(18H,s),1.49−1.56(1H,m),1.71−1.89(2H,m),2.21−2.33(1H,m),3.09−3.19(1H,m),3.53−3.66(1H,m),5.14(s,2H),7.71(2H,s),8.05(1H,br),8.74(1H,br),9.06(1H,br).
実施例20
2−(5−ベンズヒドロキシメチル−3−ベンジル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.40(18H,s),1.77−2.00(2H,m),2.70(1H,t,J=12.4Hz),3.40−3.60(2H,m),4.10−4.16(1H,m),5.06(1H,d,J=18.0Hz),5.17(1H,d,J=18.0Hz),5.39(1H,s),7.10−7.40(15H,m),7.69(2H,s),8.04(1H,s),8.97(1H,s),9.40(1H,s).
実施例21
2−(3−ベンジル−5−ヒドロキシメチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;トリフルオロ酢酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),1.91(2H,m),2.69(1H,t,J=12.4Hz),3.50(1H,m),3.68(1H,m),3.89(1H,m),4.99(1H,t,J=5.2Hz),5.15(1H,d,J=18.4Hz),5.20(1H,d,J=18.4Hz),7.24−7.40(5H,m),7.77(2H,s),8.07(1H,s),8.94(1H,s),9.35(1H,s).
実施例22
2−[2−(3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−アセチルアミノ]−N−第3ブチル−ベンズアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.53−1.30(7H,m),1.399(9H,s),2.15−2.26(1H,m),2.84(1H,dd,J=13.5,10.5Hz),3.04−3.18(1H,m),3.23−3.39(2H,m),3.86(1H,dd,J=10.5,8.4Hz),4.41(2H,s),7.17(1H,t,J=7.7Hz),7.21−7.39(6H,m),7.49(1H,brt,J=7.7Hz),7.72(1H,d,J=7.7Hz),8.15(1H,s),8.29(1H,brd,J=8.1Hz),11.43(1H,brs).
MS:m/e(ESI)449.2(MH+)
実施例23
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(2−フルオロ−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.63(3H,t,J=7.2Hz),0.93−1.32(4H,m),1.40(18H,s),2.01−2.12(1H,m),2.93(1H,dd,J=13.2,10.8Hz),3.08−3.15(1H,m),3.19−3.28(2H,m),3.81(1H,dd,J=11.2,7.2Hz),5.14(2H,s),7.20(1H,d,J=7.2Hz),7.24(1H,d,J=8.8Hz),7.35(1H,dd,J=8.2,7.2Hz),7.43(1H,dd,J=8.8,8.2Hz),7.71(2H,s),8.80−9.01(1H,brs),9.30−9.42(1H,brs).
実施例24
2−[3−(2−ベンジルオキシ−エチル)−2−イミノ−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン ;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.39(18H,s),1.75−1.86(1H,m),1.87−1.98(1H,m),2.11−2.32(2H,m),3.24−3.33(1H,m),3.53−3.66(4H,m),4.48(2H,ABq,J=10.0Hz),5.16(2H,s),7.26−7.37(5H,m),7.73(2H,s),8.79(1H,br),9.14(1H,br).
実施例25
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−メトキシ−ベンジル)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.61(3H,t,J=7.2Hz),0.90−1.20(4H,m),1.41(18H,s),2.00−2.12(1H,m),2.80−2.90(1H,m),3.10−3.46(4H,m),3.81(3H,s),5.18(2H,s),6.90−6.96(1H,m),7.22−7.30(2H,m),7.73(2H,s),8.80−8.90(1H,brs),9.24−9.30(1H,brs).
実施例26
2−(4−ベンジル−2−イミノ−3−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.79(3H,t,J=7.2Hz),1.12−1.48(2H,m),1.42(18H,s),1.48−1.70(2H,m),2.73−2.86(3H,m),3.25−3.38(3H,m),3.78(1H,dd,J=11.2,7.2Hz),5.15(1H,d,J=14.4Hz),5.20(1H,d,J=14.4Hz),7.20−7.36(3H,m),7.74(2H,s),8.06(1H,s),8.82(1H,brd,J=4.8Hz),9.19(1H,brd,J=4.4Hz).
実施例27
4−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−ピロリジン−3−カルボン酸 メチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),2.94(1H,dd,J=13.6,10.8Hz),3.14(1H,quintet,J=4.0Hz),3.27−3.36(1H,m),3.53(3H,s),3.74−3.82(2H,s),3.96(1H,dd,J=11.2,8.4Hz),5.22(1H,d,J=18.0Hz),5.28(1H,d,J=18.0Hz)7.25−7.40(5H,m),7.75(2H,s),8.08(1H,brs),9.26(1H,brs),9.75(1H,brs).
実施例28
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−{3−[(2−エチル−ブチル)−メチル−アミノ]−2−イミノ−ピロリジン−1−イル}−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.85(3H,t,J=7.2Hz),0.87(3H,t,J=7.2Hz),1.20−1.48(7H,m),1.43(18H,s),2.29−2.43(2H,m),3.54−3.60(1H,m),3.68−3.75(1H,m),4.18−4.24(1H,m),5.69(1H,d,J=15.9Hz),6.03(1H,d,J=15.9Hz),7.93(2H,s).
実施例29
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(2−エチル−ブチルアミノ)−2−イミノ−ピロリジン−1−イル]−エタノン;2塩酸塩
1H−NMR(DMSO−d6)δ:
0.82(3H,t,J=7.2Hz),0.83(3H,t,J=7.2Hz),1.13−1.42(6H,m),1.40(18H,s),1.58−1.64(1H,m),2.03−2.12(1H,m),2.37−2.44(1H,m),2.70−2.78(1H,m),3.07−3.15(1H,m),3.94−3.99(1H,m),5.33(2H,s),7.73(2H,s),8.37(2H,br).
実施例30
N−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−ピロリジン−3−イル}−N−(2−エチル−ブチル)−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7.4Hz),0.89(3H,t,J=7.4Hz),1.19−1.48(6H,m),1.39(18H,s),1.49−1.56(1H,m),2.01(3H,s),2.26−2.34(2H,m),3.52−3.69(2H,m),4.67−4.74(1H,m),5.23(2H,s),7.74(2H,s),8.03(1H,br),8.81(1H,br),9.03(1H,br).
実施例31
2−(3−ベンジル−4,4−ジエチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.09(3H.t.J=6.0Hz),1.20(3H.t.J=6.0Hz),1.40(18H.s),1.45−1.60(4H.m),2.91(1H.d.J=10.0Hz),3.12(1H.d.J=10.0Hz),3.32(1H.d.J=10.0Hz),3.58(1H.d.J=10.0Hz),5.23(2H.s),7.25(2H.m),7.30(3H.m),7.83(2H.s).
MS:m/e(ESI)477.2(MH+)
実施例32
2−(3−ベンジル−2−イミノ−5−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.82(3H,t,J=7.2Hz),1.00−1.30(3H,m),1.43(18H,s),1.50(1H,td,J=6.8Hz,13.2Hz),1.72(1H,m),2.26(1H,td,J=8.8Hz,13.2Hz),2.78(1H,dd,J=10.4Hz,13.6Hz),3.53(1H,m),3.75(1H,m),5.03(1H,d,J=18.0Hz),5.27(1H,d,J=18.0Hz),7.25−7.40(5H,m),7.78(2H,s),8.06(1H,s),8.91(1H,s),9.30(1H,s).
実施例33
2−(3−ベンジル−2−イミノ−5−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7.2Hz),1.05−1.35(3H,m),1.43(18H,s),1.65−1.85(2H,m),1.98(1H,m),2.75(1H,dd,J=11.2Hz,13.2Hz),3.28(1H,dd,J=4.0Hz,13.2Hz),3.52(1H,m),3.83(1H,m),5.06(1H,d,J=18.4Hz),5.25(1H,d,J=18.4Hz),7.20−7.40(5H,m),7.79(2H,s),8.06(1H,s),8.90(1H,s),9.35(1H,s).
実施例34
2−(4−ベンジル−5−イミノ−2,2−ジメチル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.21(3H,s),1.22(3H,s),1.44(18H,s),1.74(dd,J=8.0Hz,12.8Hz),1.98(1H,dd,J=8.8Hz,12.8Hz),2.70(1H,dd,J=11.2Hz,13.2Hz),3.45(1H,dd,J=3.6Hz,13.2Hz),3.64(1H,m),5.03(1H,d,J=18.8Hz),5.13(1H,d,J=18.8Hz),7.25−7.40(5H,m),7.81(2H,s),8.04(1H,s),8.78(1H,s),9.16(1H,s).
実施例35
2−(3−ベンジル−2−イミノ−4−メトキシメチル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),2.42(1H,m),2.87(1H,m),3.06(3H,s),3.08−3.16(2H,m),3.21−3.37(3H,m)3.76(1H,dd,J=10.8,7.6Hz),5.19(1H,d,J=18.4Hz),7.29(1H,m),7.32−7.40(4H,m),7.76(2H,s),8.07(1H,s),9.12(1H,brd,J=8.0Hz),9.65(1H,brd,J=6.8Hz).
実施例36
2−(4−ベンジル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.42(18H,s),2.72(1H,dd,J=17.6,4.8Hz),2.85(1H,m),3.06(1H,dd,J=17.6,7.6Hz),3.40(1H,dd,J=10.4,5.2Hz),3.68(1H,dd,J=10.4,6.8Hz),5.17(2H,s),7.20−7.36(5H,m),7.74(2H,s),8.07(1H,s),8.80(1H,m),9.25(1H,m).
実施例37
4−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−ピロリジン−2−カルボン酸 メチルエステル;トリフルオロ酢酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),1.89(1H,td,J=4.0Hz,13.6Hz),2.56(1H,td,J=10.0Hz,13.6Hz),2.66(1H,dd,J=10.8Hz,13.6Hz),3.28(1H,dd,J=4.0Hz,13.6Hz),3.61(1H,m),3.68(3H,s),4.58(1H,dd,J=4.0Hz,13.6Hz),5.13(2H,d,J=18.8Hz),5.38(1H,d,J=18.8Hz),7.20−7.40(5H,m),7.73(2H,s),8.08(1H,s),9.41(1H,s),9.93(1H,s).
実施例38
4−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−ピロリジン−2−カルボン酸 メチルエステル;トリフルオロ酢酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),2.11(1H,m),2.24(1H,m),2.78(1H,t,J=12.4Hz),3.60(1H,m),3.64(3H,s),4.64(1H,m),5.17(1H,d,J=18.0Hz),5.33(1H,d,J=18.0Hz),7.20−7.40(5H,m),7.74(2H,s),8.08(1H,s),9.38(1H,s),9.81(1H,s).
実施例39
4−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−ピロリジン−2−カルボン酸 エチルエステル;トリフルオロ酢酸塩
1H−NMR(DMSO−d6)δ:
1.16(3H,t,J=7.2Hz),2.56(1H,m),2.67(1H,dd,J=12.4Hz,12.8Hz),3.27(1H,m),3.59(1H,m),4.04−4.20(2H,m),4.57(1H,dd,J=4.0Hz,10.0Hz),5.13(1H,d,J=18.4Hz),5.35(1H,d,J=18.4Hz),7.20−7.40(5H,m),7.73(2H,s),8.08(1H,s),9.33(1H,s),9.85(1H,s).
実施例40
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−3−フェニル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.42(18H,s),2.03(1H,m),2.67(1H,m),3.72(1H,m),3.81(1H,m),4.51(1H,dd,J=9.6,5.6Hz),5.33(2H,s),7.36(1H,m),7.40−7.51(4H,m),7.77(2H,s),8.07(1H,brs),9.03(1H,brs).
実施例41
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−フェニル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.41(18H,s),3.05(1H,dd,J=17.6,7.6Hz),3.46(1H,dd,J=17.6,9.2Hz),3.67(1H,dd,J=10.4,6.4Hz),3.85(1H,m),4.03(1H,dd,J=10.4,8.4Hz),5.26(2H,s),7.29(1H,m),7.33−7.41(4H,m),7.75(2H,s),8.06(1H,brs),9.00(1H,brs),9.45(1H,brs).
実施例42
N−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−ピロリジン−3−イルメチル}−イソブチルアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.02(6H,t,J=6.8Hz),1.40(18H,s),1.89−1.98(1H,m),2.16−2.26(1H,m),2.41(1H,sept,J=6.8Hz),3.30−3.38(2H,m),3.48−3.62(3H,m),5.17(2H,s),7.72(2H,s),7.99−8.09(2H,m),8.83(1H,br),9.26(1H,br).
実施例43
2−{3−[2−(1−アセチル−ピペリジン−4−イル)−エチル]−2−イミノ−ピロリジン−1−イル}−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.88−0.97(1H,m),0.90−0.99(1H,m),1.27−1.33(1H,m),1.34−1.55(5H,m),1.39(18H,s),1.61−1.74(1H,m),1.80−1.90(1H,m),1.96(3H,s),2.93−3.03(1H,m),3.10−3.19(1H,m),3.52−3.64(2H,m),3.72−3.82(1H,m),4.31−4.38(1H,m),5.24(2H,s),7.72(2H,s),8.75(1H,br),9.09(1H,br).
実施例44
2−(4−ベンジル−5−イミノ−2,2−ジメチル−2,5−ジヒドロ−ピロール−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.03(3H,t,J=7Hz),1.37(6H,s),1.48(18H,s),1.55−1.62(2H,m),2.40(2H,m),3.80(2H,s),5.77(2H,s),5.80(brs,1H),7.15(2H,d,J=7Hz),7.28−7.39(3H,m),7.93(2H,s).
MS:m/e(ESI)489.3(MH+)
実施例45
2−(3−ベンジル−4−第3ブトキシメチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.00(9H,s),1.43(18H,s),2.30(1H,m),2.86(1H,dd,J=14.4,11.2Hz),3.01−3.16(2H,m),3.19−3.40(3H,m),3.74(1H,dd,J=10.4,8.0Hz),5.17(2H,s),7.24−7.42(5H,m),7.75(2H,s),8.07(1H,s),8.94(1H,brs),9.40(1H,brm).
実施例46
2−(3−ベンジル−4−ヒドロキシメチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),2.25(1H,m),2.88(1H,dd,J=14.8,11.2Hz),3.13−3.27(4H,m),3.41(1H,dd,J=10.8,8.0Hz),3.72(1H,dd,J=11.2,8.0Hz),5.17(2H,s),7.26−7.40(5H,m),7.75(2H,s),8.08(1H,s),8.91(1H,brm),9.40(1H,brm).
実施例47
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−ピペリジン−4−イル−エチル)−ピロリジン−1−イル]−エタノン;2臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.18−1.38(6H,m),1.45−1.58(2H,m),1.76−1.91(4H,m),2.22−2.32(1H,m),2.85(2H,brt,J=11.2Hz),3.12−3.21(1H,m),3.54−3.65(2H,m),5.18(2H,s),7.72(2H,s),8.06(1H,br),8.79(1H,br),9.14(1H,br).
実施例48
2−(3−ベンジル−5−ヒドロキシメチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.40(18H,s),1.88(1H,m),2.03(1H,dd,J=6.0Hz,13.2Hz),2.90(1H,dd,J=10.8Hz,13.2Hz),3.12(1H,dd,J=4.0Hz,13.2Hz),3.40(1H,m),3.81(2H,t,J=10.4Hz),3.98(1H,m),4.68(1H,d,J=10.4Hz),5.15(1H,d,J=18.4Hz),5.31(1H,d,J=18.4Hz),7.25−7.40(5H,m)7.78(2H,s).
実施例49
2−(3−ベンジリデン−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;塩酸塩
1H−NMR(DMSO−d6)δ:
1.41(18H,s),3.20−3.26(2H,m),3.77(2H,t,J=6.8Hz),5.32(2H,s),7.46−7.60(5H,m),7.65−7.68(1H,brs),7.75(2H,s),8.74−8.88(1H,brs),9.20−9.32(1H,brs).
実施例50
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−エタノン;塩酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7.6Hz),1.20−1.32(2H,m),1.44(18H,s),1.46−1.58(2H,m),2.42(1H,m),3.45(1H,dd,J=6.8,10.8Hz),3.92(1H,dd,J=8.4,10.8Hz),4.15(1H,d,J=6.8Hz),5.30(2H,s),7.36−7.50(5H,m),7.78(2H,s),8.08(1H,brs),8.86(1H,brs),8.95(1H,brs).
実施例51
N−(2−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−ピロリジン−3−イル}−エチル)−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.40(18H,s),1.80−2.00(2H,br),1.89(3H,s),2.16−2.40(2H,m),3.10−3.18(1H,m),3.32−3.41(1H,m),3.45−3.58(2H,m),3.68−3.80(1H,m),5.05(1H,d,J=18.2Hz),5.75(1H,d,J=18.2Hz),5.79(1H,s),7.79(2H,s).
MS:m/e(ESI)416.2(MH+)
実施例52
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[1−(3−エチル−ペンチル)−2−イミノ−ピロリジン−3−イル]−エタノン;塩酸塩
1H−NMR(DMSO−d6)δ:
0.86(6H,t,J=7Hz),1.23−1.60(7H,m),1.93(1H,m),2.46(1H,m),3.47−3.56(3H,m),3.64−3.77(3H,m),3.83(1H,td,J=10,6Hz),1.45(18H,s),5.80(1Hs),7.80(2H,s),9.03(1H,s),9.66(1H,s).
MS:m/e(ESI)429.3(MH+)
実施例53
2−(5−ベンジル−2−イミノ−3−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.90(3H,t,J=7.2Hz),1.10−1.40(3H,m),1.44(18H,s),1.58(1H,m),1.80(1H,m),2.22(1H,m),2.61(1H,dd,J=6.4Hz,13.2Hz),3.10(1H,m),3.18(1H,dd,J=4.0Hz,13.2Hz),4.11(1H,m),5.18(1H,d,J=18.8Hz),5.34(1H,d,J=18.8Hz),7.20−7.35(5H,m),7.78(2H,s),8.06(1H,s),8.83(1H,s),9.08(1H,s).
実施例54
2−(5−ベンジル−2−イミノ−3−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水 素酸塩
1H−NMR(DMSO−d6)δ:
0.88(3H,t,J=7.2Hz),1.10−1.40(3H,m),1.44(18H,s),1.80(2H,m),2.03(1H,m),2.71(1H,dd,J=9.6Hz,13.2Hz),3.02(1H,m),3.10(1H,dd,J=4.0Hz,13.2Hz),4.10(1H,m),5.18(1H,d,J=18.8Hz),5.28(1H,d,J=18.8Hz),7.20−7.35(5H,m),7.77(2H,s),8.06(1H,s),8.82(1H,s),9.05(1H,s).
実施例55
2−[3−(2−クロロ−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.60(3H,t,J=7.2Hz),0.80−1.26(4H,m),1.41(18H,s),2.06−2.16(1H,m),2.99−3.07(1H,m),3.16−3.38(3H,m),3.84−3.92(1H,m),5.18(2H,s),7.30−7.40(2H,m),7.46−7.52(2H,m),7.73(2H,s),9.25−9.30(1H,brs).
実施例56
2−(4−ベンジル−3−イミノ−5−プロピル−3H−イソキサゾール−2−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.86(3H,t,J=7Hz),1.47(18H,s),1.48−1.60(2H,m),2.43(2H,t,J=7Hz),3.74(2H,s),6.40(2H,s),7.18(2H,d,J=7Hz),7.27(1H,t,J=7Hz),7.35(2H,t,J=7Hz),7.89(2H,s).
MS:m/e(ESI)463.3(MH+)
実施例57
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チオフェン−3−イルメチル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.71(3H,t,J=6.0Hz),1.10(2H,m),1.33(1H,m),1.40(18H,s),1.60(2H,m),3.20(2H,m),3.65(1H,m),5.36(1H,d,J=14.0Hz),5.47(1H,d,J=14.0Hz),7.05(1H,d,J=4.5Hz),7.09(1H,brs),7.20(1H,d,J=4.5Hz),7.80(2H,s).
MS:m/e(ESI)469.2(MH+)
実施例58
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−イソプロポキシ−エチル)−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.09(3H,d,J=6.0Hz),1.10(3H,d,J=6.0Hz),1.40(18H,s),1.68−1.75(1H,m),1.89−1.98(1H,m),2.04−2.10(1H,m),2.22−2.31(1H,m),3.20−3.29(1H,m),3.42−3.48(1H,m),3.50−3.66(4H,m),5.15(2H,s),7.71(2H,s),8.05(1H,br),8.77(1H,br),9.09(1H,br).
実施例59
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−ニトロ−ベンジル)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.67(3H,t,J=6.8Hz),0.90−1.35(4H,m),1.48(18H,s),2.20−2.30(1H,m),3.20−3.27(1H,m),3.40−3.55(2H,m),3.60−3.73(1H,m),4.04−4.11(1H,m),5.38(1H,d,J=18Hz),5.73(1H,d,J=18Hz),5.84(1H,s),7.41(1H,t,J=7.4Hz),7.61(1H,t,J=7.4Hz),7.89(2H,s),7.92(1H,d,J=8.0Hz),8.03(1H,d,J=8.0Hz).
MS:m/e(ESI)508.3(MH+)
実施例60
2−[3−(2−アミノ−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.61(3H,t,J=7.2Hz),0.80−1.32(4H,m),1.47(18H,s),2.17−2.26(1H,m),2.58−2.67(1H,m),3.18(1H,dd,J=3.6Hz,J=10.4Hz),3.58−3.78(2H,m),3.92(1H,dd,J=8.0Hz,J=13.6Hz),5.21(1H,d,J=18Hz),5.81(1H,d,J=18Hz),5.84(1H,s),6.59−6.64(2H,m),6.96−7.05(2H,m),7.89(2H,s).
実施例61
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[5−(2−エチル−ブチル)−1−イミノ−3a,6a−ジメチル−ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.81(6H,t,J=7.2Hz),1.04(1H,q,12.0Hz),1.17−1.32(8H,m),1.40(18H,s),1.92−2.03(1H,m),2.09−2.16(1H,m),2.29−2.36(1H,m),2.81(1H,brt,J=8.4Hz),3.76(1H,dd,J=2.0,11.2Hz),3.59(1H,q,J=9.2Hz),3.79(1H,dd,J=8.4,11.2Hz),5.10(2H,s),7.71(2H,s),8.65(1H,br),9.14(1H,br).
実施例62
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チアゾール−2−イルメチル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.75(3H,t,J=6.0Hz),1.14(2H,m),1.23(1H,m),1.35(2H,m),1.40(18H,s),3.26(2H,m),3.47(2H,d,J=6.0Hz),3.76(1H,m),5.13(2H,s),7.68(1H,d,J=4.5Hz),7.70(2H,s),7.78(1H,d,J=4.5Hz).
MS:m/e(ESI)470.2(MH+)
実施例63
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チオフェン−2−イルメチル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.73(3H,t,J=6.0Hz),1.12(2H,m),1.30(3H,m),1.40(18H,s),3.07(2H,m),3.25(2H,d,J=6.0Hz),3.75(1H,m),5.12(2H,s),7.01(2H,m),7.42(1H,d,J=4.5Hz),7.70(2H,s).
MS:m/e(ESI)469.2(MH+)
実施例64
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(4−フルオロ−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.64(3H,t,J=7.2Hz),0.88−1.35(4H,m),1.40(18H,s),2.05−2.15(1H,m),2.85(1H,dd,J=12.8,10.8Hz),3.00−3.08(1H,m),3.15(1H,dd,J=12.8,,5.1Hz),3.22(1H,dd,J=12.8,4.6Hz),3.81(1H,dd,J=12.8,9.2Hz),5.15(2H,s).
実施例65
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[5−(2−エチル−2−ヒドロキシ−ブチル)−1−イミノ−ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.76(3H,t,J=6.9HZ),0.77(3H,t,J=6.9Hz),1.09−1.14(1H,m),1.20−1.27(1H,m),1.48−1.61(6H,m),1.92−2.02(1H,m),2.14−2.22(1H,m),2.39−2.48(1H,m),2.73−2.82(1H,m),3.33−3.35(1H,m),3.54(1H,dd,J=8.7,17.4Hz),3.77−3.82(1H,m),5.13(2H,s),7.73(2H,s),8.02(1H,br),8.64(1H,br),9.14(1H,br).
実施例66
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(1−イミノ−5−メトキシ−ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.39(18H,s),1.76(1H,brd,J=17.0Hz),1.95−2.03(2H,m),2.13(1H,brd,J=14.2Hz),2.87−2.97(1H,br),3.15(3H,s),3.40−3.46(1H,m),3.58−3.66(1H,m),3.83−3.87(2H,m),5.16−5.20(2H,m),7.73(2H,s),8.02(1H,br),8.61(1H,br),9.14(1H,br).
実施例67
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(1−イミノ−5−メトキシ−ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.39(18H,s),1.61−1.69(1H,m),1.90−2.07(2H,m),2.09−2.19(1H,m),2.90−2.99(1H,br),3.21(3H,s),3.30−3.38(1H,m),3.61−3.70(1H,m),3.85(1H,t,J=8.7Hz),3.93(1H,m),5.22(2H,s),7.71(2H,s),8.04(1H,br),8.72(1H,br),9.23(1H,br).
実施例68
2−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−1−イミノ−6−フェニル−ヘキサヒドロ−シクロペンタ[c]ピロール−5−オン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.38(18H,s),1.84−1.93(1H,m),2.55(1H,dd,J=4.6,18.4Hz),2.82(1H,dd,J=9.2,20.0Hz),3.63(1H,dd,J=4.5,10.8Hz),3.88(1H,d,=6.0Hz),3.95−4.40(2H,m),5.21(2H,s),7.25−7.43(5H,m),7.74(2H,s),9.25(1H,br),9.50(1H,br).
実施例69
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(3−イソプロポキシ−ベンジル)−5−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.82(3H,t,J=7.2Hz),1.00−1.40(3H,m),1.27(6H,d,J=6Hz),1.43(18H,s),1.52(1H,m),1,71(1H,m),2.27(1H,m),2.75(1H,dd,J=10.4Hz,13.2Hz),3.30(1H,m),3.53(1H,m),3.74(1H,m),4.69(1H,m),5.02(1H,d,J=19.2H),5.26(1H,d,J=19.2Hz),6.82(2H,m),6.86(1H,s),7.25(1H,t,J=7.6Hz),7.78(2H,s),8.06(1H,s),8.89(1H,s),9.26(1H,s).
実施例70
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(3−イソプロポキシ−ベンジル)−5−プロピル−ピロリジン−1−イル]−エタノン;塩酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7.2Hz),1.00−1.40(3H,m),1.27(6H,d,J=6.0Hz),1.43(18H,s),1.72(1H,m),1.79(1H,m),2.00(1H,m),2.73(1H,t,J=12.0Hz),3.21(1H,m),3.52(1H,m),3.81(1H,m),4.63(1H,m),5.05(1H,d,J=18.8Hz),5.25(1H,d,J=18.8Hz),6.82(1H,d,J=7.6Hz),6.87(1H,d,J=7.6Hz),6.89(1H,s),7.25(1H,t,J=7.6Hz),7.78(2H,s),8.06(1H,s),8.88(1H,s),9.30(1H,s).
実施例71
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(4−イソプロポキシ−ベンジル)−5−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.81(3H,t,J=7.2Hz),1.00−1.40(3H,m),1.26(6H,d,J=6Hz),1.43(18H,s),1.51(1H,m),1,70(1H,m),2.26(1H,m),2.73(1H,dd,J=10.0Hz,13.6Hz),3.24(1H,m),3.47(1H,m),3.74(1H,m),4.59(1H,m),5.01(1H,d,J=18.4H),5.26(1H,d,J=18.4Hz),6.89(2H,d,J=7.2Hz),7.18(1H,d,J=7.2Hz),7.78(2H,s),8.06(1H,s),8.87(1H,s),9.26(1H,s).
実施例72
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミ ノ−3−(4−イソプロポキシ−ベンジル)−5−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7.2Hz),1.00−1.40(3H,m),1.26(6H,d,J=6.0Hz),1.43(18H,s),1.71(1H,m),1.77(1H,m),1.98(1H,m),2.68(1H,dd,J=10.8Hz,13.2Hz),3.18(1H,dd,J=3.6Hz,13.2Hz),3.45(1H,m),3.81(1H,m),4.59(1H,m),5.04(1H,d,J=18.8Hz),5.23(1H,d,J=18.8Hz),6.89(2H,d,J=8.4Hz),7.22(2H,d,J=8.4Hz),7.78(2H,s),8.05(1H,s),8.87(1H,s),9.30(1H,s).
実施例73
2−[3−ベンジル−2−イミノ−4−(2−メトキシ−エチル)−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),1.44−1.60(2H,m),2.25(1H,m),2.87(1H,dd,J=11.2,14.4Hz),3.01(3H,s),3.02−3.25(5H,m),3.82(1H,dd,J=7.6,11.6Hz),5.19(2H,s),7.25−7.40(5H,m),7.75(2H,s),8.06(1H,brs),8.96(1H,brs),9.43(1H,brs).
実施例74
2−(3−ベンジル−4−エトキシメチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.98(3H,t,J=6.8Hz),1.43(18H,s),1.44−1.60(2H,m),2.44(1H,m),2.88(1H,dd,J=10.4,14.4Hz),3.10−3.40(7H,m),3.76(1H,dd,J=7.6,10.8Hz),5.15(1H,d,J=18.0Hz),5.20(1H,d,J=18.0Hz),7.25−7.40(5H,m),7.75(2H,s),8.06(1H,brs),8.96(1H,brs),9.42(1H,brs).
実施例75
2−(4−ベンジル−3−イミノ−2−アザ−スピロ[4.4]ノナ−2−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.40(18H,s),1.35−1.55(8H,m),3.03(2H,brs),3.25(2H,m),3.57(1H,d,J=8.0Hz),5.13(2H,s),7.23(1H,m),7.32(2H,t,J=8.0Hz),7.38(2H,d,J=8.0Hz),7.72(2H,s).
実施例76
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[1−イミノ−5−(4−ニトロ−フェノキシ)−ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.39(18H,s),1.91−2.01(1H,m),2.19−2.27(2H,m),2.32−2.36(1H,m),3.08−3.14(1H,m),3.43(1H,dd,J=2.0,8.4Hz),3.42−3.53(2H,m),5.17(2H,s),5.22(1H,brs),7.16(2H,d,J=12.4Hz),7.73(2H,s),8.05(1H,br),8.22(2H,d,J=12.0Hz),8.78(1H,brs),9.27(1H,brs).
実施例77
2−[5−(4−アミノ−フェノキシ)−1−イミノ−ヘキサヒドロ−シクロペンタ[c]ピロール−2−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.31(18H,s),1.76−1.84(1H,m),2.01−2.14(2H,m),2.16−2.28(1H,m),2.89−3.06(2H,m),3.51−3.58(1H,m),3.65−3.74(1H,m),3.82−3.90(1H,m),4.83(2H,s),6.49(2H,d,J=8.8Hz),6.66(2H,d,J=8.8Hz),7.14(2H,s),7.40(2H,br).
実施例78
N−(4−{2−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−1−イミノ−オクタヒドロ−シクロペンタ[c]ピロール−5−イルオキシ}−フェニル)−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.39(18H,s),1.82−1.91(1H,m),2.09−2.18(2H,m),2.46−2.34(1H,m),3.05−3.12(1H,m),3.40(1H,dd,J=2.4,12.0Hz),3.77(1H,dd,J=10.0,12.4Hz),3.88(1H,dd,J=6.8,12.0Hz),4.94(1H,br),5.14(2H,s),6.87(2H,d,J=12.4Hz),7.46(2H,d,J=11.6Hz),7.72(2H,s),8.75(1H,br),9.23(1H,br),9.80(1H,br).
実施例79
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−3−イソプロピル−4−プロピル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.92(3H,t,J=6.8Hz),0.98(3H,d,J=6.4Hz),1.04(3H,d,J=6.4Hz),1.23−1.42(3H,m),1.42(18H,s),2.20−2.36(2H,m),2.73(1H,brs),3.30(1H,d,J=11.2Hz),3.60(1H,m),3.79(1H,dd,J=8.0,10.4Hz),5.16(1H,d,J=18.4Hz),5.22(1H,d,J=18.4Hz),7.74(2H,s),8.05(1H,brs),8.80(1H,brs),9.10(1H,brs).
実施例80
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−3−イソプロピル−4−プロピル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.92(3H,t,J=7.2Hz),1.05(3H,d,J=6.8Hz),1.11(3H,d,J=6.8Hz),1.23−1.34(2H,m),1.42(18H,s),1.55(1H,m),2.20−2.36(2H,m),2.17(1H,m),2.68(1H,m),2.96(1H,dd,J=3.2,8.8Hz),3.44(1H,t,J=10.0Hz),3.55−3.64(2H,m),5.18(1H,d,J=18.0Hz),5.24(1H,d,J=18.0Hz),7.75(2H,s),8.04(1H,brs),8.86(1H,brs),8.96(1H,brs).
実施例81
2−(3−ベンジリデン−2−イミノ−4−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.85(3H,t,J=7.2Hz),1.20−1.55(4H,m),1.41(18H,s),3.49(1H,d,J=10.6Hz),3.70−3.80(1H,m),3.90(1H,dd,J=10.6,6.8Hz),5.27(1H,d,J=18.0Hz),5.34(1H,d,J=18.0Hz),7.46(1H,dd,J=7.2,7.2Hz),7.52(2H,t,J=7.2Hz),7.59(2H,t,J=7.2Hz),7.64(1H,brs),7.75(2H,s).
実施例82
2−(3−ベンジル−2−イミノ−5−メトキシメチル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),1.83(1H,m),1.97(1H,m),2.71(1H,t,J=12.0Hz),3.15(3H,s),3.36(2H,m),3.52(2H,m),4.04(1H,m),5.08(1H,d,J=17.6Hz),5.20(1H,d,J=17.6Hz),7.25−7.40(5H,m),7.76(2H,s),8.05(1H,s),8.99(1H,s),9.40(1H,s).
実施例83
4−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−ピロリジン−2−カルボン酸 アミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.42(18H,s),1.77(1HX0.5,td,J=4.4,13.6Hz),1.96(1HX0.5,m),2.17(1HX0.5,m),2.45(1HX0.5,m),2.75(1H,m),3.27(1H,m),3.55(1H,m),4.38(1HX0.5,dd,J=4.4,9.2Hz),4.44(1HX0.5,dd,J=4.8,8.4Hz),4.95(1H,d,J=18.8Hz),5.30(1HX0,5,d,J=18.8Hz),5.32(1HX0.5,d,J=18.8Hz),7.20−7.40(5H,m),7.46(1HX0.5,s),7.66(1HX0.5,s),7.73(2HX0.5,s),7.74(2HX0.5,s),8.06(1H,s),9.17(1HX0.5,s),9.19(1HX0.5,s),9.60(1HX0.5,s),9.62(1HX0.5,s).
実施例84
(4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イルメチル}−フェニル)−カルバミン酸第3ブチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.67(3H,t,J=6.8Hz),1.12−1.50(4H,m),1.40(18H,s),1.46(9H,s),2.06−2.14(1H,m),2.72−2.82(1H,m),2.97−3.11(2H,m),3.18−3.26(1H,m),3.71−3.84(1H,m),5.14(2H,s),7.18(2H,d,J=8.2Hz),7.41(2H,d,J=8.2Hz),7.71(2H,s),9.35(2H,s).
MS:m/e(ESI)578.3(MH+)
実施例85
2−[3−(4−アミノ−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;2塩酸塩
1H−NMR(DMSO−d6)δ:
0.64(3H,t,J=7.2Hz),0.85−1.30(4H,m),1.40(18H,s),2.04−2.13(1H,m),2.85(1H,dd,J=10.6Hz.J=12.8Hz),3.06−3.12(1H,m),3.18−3.28(2H,m),3.83(1H,dd,J=7.6Hz.J=10.6Hz),,5.22(2H,s),7.29(2H,d,J=8.4Hz),7.41(2H,d,J=8.4Hz),7.73(2H,s),8.05(1H,s),9.73(1H,s).
MS:m/e(ESI)478.2(MH+)
実施例86
N−(4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イルメチル}−フェニル)−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.65(3H,t,J=7.2Hz),0.90−1.30(4H,m),1.40(18H,s),2.02(3H,s),2.06−2.16(1H,m),2.74−2.82(1H,m),3.00−3.18(2H,m),3.20−3.26(1H,m),3.73−3.82(1H,m),5.13(2H,s),7.23(2H,d,J=8.6Hz),7.54(2H,d,J=8.6Hz),7.72(2H,s).
MS:m/e(ESI)520.3(MH+)
実施例87
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−ピリジン−2−イルメチレン−ピロリジン−1−イル) −エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.89(3H,t,J=6.0Hz),1.34−1.40(5H,m),1.40(18H,s),3.50(2H,d,J=10.0Hz),5.30(1H,s).7.42(1H,d,J=8.0Hz),7.60(1H,s).7.71(2H,s),7.92(1H,t,J=8.0Hz),8.73(1H,d,J=8.0Hz).
MS:m/e(ESI)462.2(MH+)
実施例88
5−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イリデンメチル}−チオフェン−2−カルボン酸 メチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.93(3H,t,J=6.0Hz),1.35−1.60(5H,m),1.40(18H,s),3.54(2H,d,J=10.0Hz),3.85(3H.s),5.28(1H,s),7.47(1H,d,J=4.5Hz),7.73(2H,s),7.86(1H,s),7.88(1H,d,J=4.5Hz).
実施例89
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[(3S,4S)−2−イミノ−3−(2−メトキシ−フェニル)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7.2Hz),1.20−1.32(2H,m),1.44(18H,s),1.40−1.56(2H,m),2.42(1H,m),3.41(1H,dd,J=6.4,10.8Hz),3.86(3H,s),3.86(1H,m),4.24(1H,d,J=7.2Hz),5.28(2H,s),7.03(1H,t,J=7.6Hz),7.10(1H,d,J=7.6Hz),7.37(1H,d,J=7.6Hz),7.78(2H,s),8.06(1H,brs),8.83(1H,brs),8.87(1H,brs).
実施例90
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(4−メトキシ−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.86(3H,t,J=7.2Hz),1.10−1.50(4H,m),1.29(18H,s),3.30−3.38(1H,m),3.39−3.46(1H,m),3.56−3.65(1H,m),3.81(3H,s),4.88(1H,d,J=17.2Hz),4.95(1H,d,J=17.2Hz),7.07(2H,d,J=8.8Hz),7.34(2H,br),7.51(1H,s),7.52(2H,d,J=8.8Hz).
MS:m/e(ESI)491.2(MH+)
実施例91
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−イソプロポキシ−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.74(3H,t,J=7.2Hz),1.10−1.50(4H,m),1.30(6H,t,J=6.0Hz),1.41(18H,s),3.42(1H,dd,J=2.0Hz,J=11.2Hz),3.58−3.69(1H,m),3.87(1H,dd,J=7.6Hz,J=11.2Hz),4.66−4.76(1H,m),5.28(1H,d,J=18.4Hz),5.34(1H,d,J=18.4Hz),7.01(1H,t,J=7.2Hz),7.14(1H,d,J=8.0Hz),7.36−7.44(1H,m),7.54(1H,d,J=6.8Hz),7.76(3H,s),8.71(1H,br),9.34(1H,br).
MS:m/e(ESI)519.2(MH+)
実施例92
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(2,4−ジメトキシ−ベンジリデン)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.82(3H,t,J=7.2Hz),1.20−1.40(4H,m),1.41(18H,s),3.42(1H,d,J=10.4Hz),3.80−3.85(1H,m),3.55−3.65(1H,m),3.83(3H,s),3.87(3H,s),5.23(1H,d,J=18.0Hz),5.29(1H,d,J=18.0Hz),6.66(1H,d,J=8.8Hz),6.67(1H,s),7.53(1H,d,J=8.8Hz),7.70(1H,s),7.74(2H,s),8.54−8.65(1H,brs),9.15−9.22(1H,brs).
実施例93
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(2−ヒドロキシメチル−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.58(3H,t,J=7.6Hz),0.80−1.35(4H,m),1.41(18H,s),2.10−2.20(1H,m),2.80(1H,dd,J=12.8,12.8Hz),3.10−3.40(3H,m),3.90(1H,dd,J=10.0,7.2Hz),4.58(2H,s),5.18(2H,s),5.10−5.22(1H,m),7.20−7.32(3H,m),7.40(1H,dd,J=4.8,4.0Hz),7.73(2H,s),8.90−9.00(1H,brs),9.25−9.35(1H,brs).
実施例94
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[(3S,4S)−2−イミノ−3−(4−メトキシ−フェニル)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.6Hz),1.15−1.30(2H,m),1.43(18H,s),1.40−1.55(2H,m),2.40(1H,m),3.43(1H,dd,J=8.8,10.4Hz),3.78(3H,s),3.88(1H,dd,J=8.4,10.4Hz),4.08(1H,d,J=7.2Hz),5.27(2H,s),7.02(2H,d,J=8.4Hz),7.34(2H,d,J=8.4Hz),7.77(2H,s),8.07(1H,brs),8.73(1H,brs),8.92(1H,brs).
実施例95
4−(3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イルメチル)−2,6−ジ第3ブチル−フェノール;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.62(3H,t,J=7.2Hz),0.95(2H,m),1.11(2H,m),1.37(18H,s),2.06(1H,m),2.84(1H,dd,J=8.8Hz,13.2Hz),3.05−3.16(3H,m),3.55(1H,dd,J=7.6Hz,11.2Hz),4.52(1H,d,J=19.2Hz),4.55(1H,d,J=19.2Hz),6.98(2H,s),7.22(1H,s),7.20−7.35(5H,m),9.28(1H,s),9.46(1H,s).
実施例96
2−(3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン 0−メチル−オキシム;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.43(3H,t,J=6.8Hz),0.55−0.80(4H,m),1.38(18H,s),1.81(1H,m),2,41(1H,m),2.77(1H,m),2.84(1H,m),2.99(1H,dd,J=3.6,12.8Hz),3.28(1H,m),3.55(1H,dd,J=7.2,10.8Hz),3.94(3H,s),4.71(1H,d,J=16.4Hz),4.83(1H,d,J=16.4Hz),7.15−7.35(7H,m),7.41(1H,s),9.34(1H,s),9.69(1H,s).
実施例97
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(4−メチル−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.86(3H,t,J=7.2Hz),1.20−1.60(4H,m),1.41(18H,s),2.36(3H,s),3.49(1H,d,J=10.6Hz),3.68−3.76(1H,m),3.89(1H,dd,J=6.8Hz,J=10.6Hz),5.28(1H,d,J=18.4Hz),5.34(1H,d,J=18.4Hz),7.34(2H,d,J=8.2Hz),7.49(2H,d,J=8.2Hz),7.61(1H,s),7.75(2H,s),8.07(1H,s),8.76(1H,s),9.21(1H,s).
MS:m/e(ESI)475.3(MH+)
実施例98
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(4−イソプロポキシ−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.88(3H,t,J=7.2Hz),1.20−1.60(4H,m),1.27(3H,d,J=2.2Hz),1.29(3H,d,J=2.2Hz),1.41(18H,s),3.48(1H,d,J=10.8Hz),3.63−3.70(1H,m),3.87(1H,dd,J=6.8Hz,J=10.8Hz),4.67−4.76(1H,m),5.26(1H,d,J=18.6Hz),5.33(1H,d,J=18.6Hz),7.06(2H,d,J=8.8Hz),7.52(2H,d,J=8.8Hz),7.57(1H,s),7.75(2H,s),8.06(1H,s),8.69(1H,s),9.15(1H,s).
MS:m/e(ESI)]519.4(MH+)
実施例99
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(4−ニトロ−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.00−1.50(4H,m),1.40(18H,s),3.52(1H,d,J=11.2Hz),3.75−3.83(1H,m),3.93(1H,dd,J=11.2,6.8Hz),5.20−5.35(2H,m),7.71(2H,s),7.74(1H,s),7.83(2H,d,J=8.8Hz),8.34(2H,d,J=8.8Hz).
実施例100
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(4−メチル−ベンジリデン)−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.41(18H,s),2.36(3H,s),3.18−3.28(2H,m),3.73−3.80(2H,m),5.29(2H,s),7.33(2H,d,J=8.0Hz),7.43(2H,d,J=8.0Hz),7.62(1H,s),7.73(2H,s).
実施例101
2−(3−ベンジル−2−エチルイミノ−4−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.67(3H,t,J=7.2Hz),0.96−1.25(2H,m),1.16(3H,t,J=7.2Hz),1.30(2H,q,J=7.2Hz),1.43(18H,s),2.09(1H,dd,J=7.2Hz,13.2Hz),2.82(1H,dd,J=10.8Hz,13.6Hz),3.09(1H,dd,J=3.6Hz,13.6Hz),3.25(1H,d,J=11.2Hz),3.43(1H,m),3.52(1H,m),3.93(1H,dd,J=6.8Hz,11.2Hz),5.16(1h,d,J=18.4Hz),5.21(1H,d,J=18.4Hz),7.25−7.45(5H,m),7.76(2H,s),8.08(1H,s),8.94(1H,s).
実施例102
2−[3−ベンジル−2−(2−ヒドロキシ−エチルイミノ)−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.64(3H,t,J=7.2Hz),0.96−1.22(2H,m),1.31(2H,q,J=7.2Hz),1.43(18H,s),2.09(1H,dd,J=7.2Hz,13.2Hz),2.81(1H,dd,J=12.0Hz,13.6Hz),3.14(1H,dd,J=3.6Hz,13.6Hz),3.27(1H,d,J=11.2Hz),3.35−3.60(5H,m),3.97(1H,dd,J=6.8Hz,10.8Hz),5.02(1H,t,J=4.8Hz),5.20(1h,d,J=18.4Hz),5.27(1H,d,J=18.4Hz),7.25−7.45(5H,m),7.77(2H,s),8.08(1H,s),9.04(1H,s).
実施例103
2−[3−ベンジル−2−(2−メトキシ−エチルイミノ)−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.66(3H,t,J=7.2Hz),0.96−1.06(1H,m),1.10−1.23(1H,m),1.31(2H,q,J=7.2Hz),1.43(18H,s),2.09(1H,m),2.82(1H,dd,J=10.4Hz,13.6Hz),3.14(1H,dd,J=4.0Hz,13.6Hz),3.27(1H,d,J=10.8Hz),3.28(3H,s),3.35−3.65(5H,m),3.96(1H,dd,J=6.8Hz,10.8Hz),5.20(1h,d,J=18.4Hz),5.26(1H,d,J=18.4Hz),7.25−7.45(5H,m),7.77(2H,s),8.08(1H,s),9.14(1H,s).
実施例104
[1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−4−(ヒドロキシ−フェニル−メチル)−5−イミノ−ピロリジン−3−イル]−酢酸メチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.46(18H,s),2.32(1H,dd,J=18,9Hz),2.36(1H,dd,J=18,10Hz),2.90(1H,t,J=8Hz),3.04(1H,m),3.18(1H,dd,J=10,8Hz),3.45(3H,s),3.77(1H,dd,J=10,9Hz),5.01(1H,d,J=9Hz),5.34(1H,d,J=18Hz),5.76(1H,d,J=18Hz),5.85(1H,s),7.27−7.43(5H,m),7.87(2H,s),8.75(1H,s),9.80(1H,s).
MS:m/e(ESI)509.4(MH+)
実施例105
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イルメチル}−ベンゾニトリル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.63(3H,t,J=7.2Hz),0.80−1.30(4H,m),1.38(18H,s),2.05−2.16(1H,m),2.96(1H,dd,J=12.8,10.0Hz),3.07−3.12(1H,m),3.20−3.35(2H,m),3.83(1H,dd,J=10.0,7.2Hz),5.09(2H,s),7.56(2H,d,J=8.4Hz),7.66(2H,s),7.84(2H,d,J=8.4Hz).
実施例106
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(3−メトキシ−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.85(3H,t,J=7.2Hz),1.20−1.58(4H,m),1.41(18H,s),3.49(1H,d,J=11.2Hz),3.70−3.80(1H,m),3.81(3H,s),3.89(1H,dd,J=11.2,7.2Hz),5.25(1H,d,J=18.4Hz),5.32(1H,d,J=18.4Hz),7.05(1H,dd,J=8.6,2.0Hz),7.09(1H,brs),7.16(1H,dd,J=8.6,1.2Hz),7.44(1H,dd,J=8.6,8.6Hz),7.59(1H,s),7.72(2H,s).
実施例107
4−{3−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−5−プロピル−シクロペンチリデンメチル}−安息香酸メチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.20−1.50(4H,m),1.41(18H,s),3.51(1H,d,J=10.6Hz),3.75−3.84(1H,m),3.87(3H,s),3.92(1H,dd,J=6.8Hz,J=10.6Hz),5.31(1H,d,J=18.4Hz),5.37(1H,d,J=18.4Hz),7.73(2H,d,J=8.8Hz),7.76(2H,s),8.07(2H,d,J=8.8Hz),8.07(1H,s),8.91(1H,s),9.35(1H,s).
MS:m/e(ESI)519.4(MH+)
実施例108
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イリデンメチル}−安息香酸;塩酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.22−1.53(4H,m),1.41(18H,s),3.50(1H,d,J=10.6Hz),3.74−3.83(1H,m),3.91(1H,dd,J=6.4Hz,J=10.6Hz),5.31(1H,d,J=18.6Hz),5.38(1H,d,J=18.6Hz),7.70(2H,d,J=8.4Hz),7.75(2H,s),7.79(1H,s),8.04(2H,d,J=8.4Hz).
MS:m/e(ESI)505.4(MH+)
実施例109
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(6−メチル−ピリジン−2−イルメチレン)−4−プロピル−ピロリ ジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.90(3H,t,J=7.2Hz),1.20−1.80(4H,m),1.41(18H,s),2.53(3H,s),3.51(1H,d,J=10.8Hz),3.88(1H,dd,J=6.4Hz,J=10.8Hz),4.04−4.12(1H,m),5.29(1H,d,J=18.4Hz),5.36(1H,d,J=18.4Hz),7.30(1H,d,J=7.8Hz),7.33(1H,d,J=7.8Hz),7.60(1H,d,J=1.6Hz),7.75(2H,s),7.81(1H,t,J=7.8Hz),8.85(1H,s),9.30(1H,s).
MS:m/e(ESI)476.3(MH+)
実施例110
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−メトキシ−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.76(3H,t,J=7.2Hz),1.15−1.48(4H,m),1.41(18H,s),3.40−3.45(2H,m),3.80−3.90(1H,m),3.87(3H,s),5.23(1H,d,J=18.4Hz),5.29(1H,d,J=18.4Hz),7.05(1H,dd,J=8.0,8.0Hz),7.14(1H,d,J=8.4Hz),7.45(1H,dd,J=8.4,8.0Hz),7.56(1H,d,J=8.0Hz),7.72(2H,s),7.77(1H,s).
実施例111
4−(3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−3−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−ブト−2−エンニトリル;塩酸塩
1H−NMR(DMSO−d6)δ:
0.39(3H,t,J=6.8Hz),0.45−0.70(2H,m),1.30−1.50(20H,m),1.81(1H,m),2.45(1H,m),2.80(2H,m),3.00(1H,m),3.57(1H,m),4.71(1H,d,J=16.4Hz),5.27(1H,d,J=16.4Hz),6.22(1H,s),7.15−7.35(7H,m),7.59(1H,s),9.77(1H,s),9.93(1H,s).
実施例112
4−(3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−3−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−ブト−2−エンニトリル;塩酸塩
1H−NMR(DMSO−d6)δ:
0.49(3H,t,J=6.8Hz),0.50−0.85(4H,m),1.40(18H,s),1.93(1H,m),2.88(1H,m),3.02(2H,m),3.60(1H,m),4.62(1H,d,J=17.6Hz),4.91(1H,d,J=17.6Hz),5.73(1H,s),7.20−7.40(7H,m),7.59(1H,s),9.55(1H,s),9.81(1H,s).
実施例113
N−{3−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−4−プロピル−ピロリジン−2−イリデン}−メタンスルフォンアミド
1H−NMR(DMSO−d6)δ:
0.61(3H,t,J=7.2Hz),0.88−1.30(4H,m),1.42(18H,s),2.03(1H,q,J=7.2Hz),2.64(1H,dd,J=11.2Hz,12.8Hz),3.08(1H,d,J=11.2Hz),3.35(1H,m),3.48(d,J=11.2Hz),3.75(1H,dd,J=7.2Hz,11.2Hz),4.91(1H,d,J=17.6Hz),4.96(1H,d,J=17.6Hz),7.20−7.35(5H,m),7.77(2H,s),7.98(1H,s).
実施例114
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−ピリジン−3−イル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.90(3H,s),1.29−1.38(2H,m),11.47(18H,s),1.59−1.66(2H,m),2.63(1H,hex,J=8Hz),3.62(1H,dd,J=11,8Hz),4.01(1H,dd,J=11,8Hz),4.30(1H,d,J=8Hz),5.25(2H,s),7.57(1H,ddd,J=8,5,1Hz),7.91(2H,s),8.00(1H,dt,J=8,1Hz),8.59(1H,dd,J=5,1Hz),8.66(1H,br.d,J=1Hz).
MS:m/e(ESI)450.3(MH+)
実施例115
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チオフェン−2−イル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.89(3H,t,J=7Hz),1.23−1.35(3H,m),1.47(18H,s),1.62−1.73(1H,m),2.75−2.84(1H,m),3.64(1H,t,J=10Hz),3.81(1H,dd,J=10,8Hz),4.37(1H,d,J=10Hz),5.56(1H,d,J=19Hz),5.86(1H,s),6.06(1H,d,J=19Hz),6.35(1H,s),7.08(1H,dd,J=10,8Hz),7.18(1H,dd,J=8,2Hz),7.39(1H,dd,J=5,2Hz),7.92(2H,s),10.83(1H,s).
MS:m/e(ESI)455.3(MH+)
実施例116
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2 −オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イリデンメチル}−N,N−ジメチル−ベンズアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.85(3H,t,J=7.2Hz),1.20−1.53(4H,m),1.41(18H,s),2.91(3H,s),2.99(3H,s),3.50(1H,d,J=10.4Hz),3.72−3.79(1H,m),3.91(1H,dd,J=7.2Hz,J=10.4Hz),5.28(1H,d,J=18.2Hz),5.35(1H,d,J=18.2Hz),7.54(2H,d,J=8.4Hz),7.63(2H,d,J=8.4Hz),7.65(1H,s),7.76(2H,s),8.08(1H,s),8.82(1H,s),9.28(1H,s).
MS:m/e(ESI)532.4(MH+)
実施例117
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(3−イソプロポキシ−ベンジリデン)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.85(3H,t,J=6.8Hz),1.20−1.30(6H,m),1.20−1.50(4H,m),1.41(18H,s),3.49(1H,d,J=11.0Hz),3.70−3.78(1H,m),3.88(1H,dd,J=11.0,6.8Hz),4.60−4.70(1H,m),5.25(1H,d,J=18.0Hz),5.32(1H,d,J=18.0Hz),7.03(1H,d,J=8.8Hz),7.06(1H,brs),7.12(1H,d,J=7.2Hz),7.42(1H,dd,J=8.8,7.2Hz),7.58(1H,s),7.73(2H,s).
実施例118
{3−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−4−プロピル−ピロリジン−2−イリデンアミノ}−酢酸第3ブチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.65(3H,t,J=7.2Hz),0.92−1.40(4H,m),1.43(18H,s),1.45(9H,s),2.10(1H,q,J=7.2Hz),2.79(1H,dd,J=11,2Hz,13.6Hz),3.05(1H,dd,J=4.4Hz,13.6Hz),3.29(1H,m),3.36(1H,m),3.94(1H,dd,J=6.0Hz,11.2Hz),4.28(2H,s),5.22(1H,d,J=18.4Hz),5.27(1H,d,J=18.4Hz),7.25−7.50(5H,m),7.76(2H,s).
実施例119
2−[3−ベンジル−4−プロピル−2−(2,2,2−トリフルオロ−エチルイミノ)−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.85(3HX0.5,t,J=7Hz),0.89(3HX0.5,t,J=7Hz),1.0−1.5(4H,m),1.43(18H,s),2.07−2.20(1H,s),2.80−2.90(1H,m),2.95−2.20(1H,m),3.20−3.40(2H,m),3.80(1H,m),4.40−4.80(2H,m),4.85(1HX0.5,d,J=18Hz),5.18(1HX0.5,d,J=18Hz),5,22(1HX0.5,d,J=18Hz),5.41(1HX0.5,d,J=18Hz),7.25−7.50(5H,m),7.70(2HX0.5,s),7.75(2HX0.5,s),8.10(1HX0.5,s),8.12(1HX0.5,s),10.22(1HX0.5,s),10.65(1HX0.5,s).
実施例120
{3−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−4−プロピル−ピロリジン−2−イリデンアミノ}−酢酸;塩酸塩
1H−NMR(DMSO−d6)δ:
0.66(3H,t,J=7.2Hz),0.92−1.40(4H,m),1.43(18H,s),2.09(1H,q,J=7.2Hz),2.80(1H,dd,J=11,2Hz,13.6Hz),3.07(1H,dd,J=4.0Hz,13.6Hz),3.31(1H,m),3.39(1H,m),3.95(1H,dd,J=6.4Hz,11.2Hz),4.22(2H,m),5.32(2H,s),7.25−7.45(5H,m),7.70(2H,s),8.08(1H,s),9.62(1H,s),13.37(1H,s).
実施例121
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(ヒドロキシ−フェニル−メチル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.59(3H,t,J=7Hz),0.64−0.73(1H,m),0.88−1.04(3H,m),1.47(18H,s).2.17(1H,brs),3.27−3.33(3H,m),3.72−3.81(1H,s),4.93(1H,d,J=8Hz),5.57(1H,d,J=18Hz),5.73(1H,d,J=18Hz),5.87(1H,s),7.29−7.44(5H,m),7.90(2H,s),8.43(1H,s),9.87(1H,s).
MS:m/e(ESI)479.3(MH+)
実施例122
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−ピリジン−2−イル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.94(3H,t,J=7Hz),1.28−1.40(4H,m),1.47(18H,s),3.04(1H,m),3.66(1H,t,J=9Hz),3.89(1H,t,J=9Hz),4.22(1H,d,J=9Hz),5.41(1H,d,J=18Hz),5.86(1H,s),6.17(1H,d,J=18Hz),7.36(1H,dd,J=8,6Hz),7.45(1H,d,J=8Hz),7.83(1H,t,J=8Hz),7.93(2H,s),8.06(1H,brs),8.63(1H,d,J=6Hz),10.54(1H,brs).
MS:m/e(ESI)450.3(MH+)
実施例123
2−[(3S,4S)−3−(3−クロロ−4−メトキシ−フェニル)−2−イ ミノ−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.16−1.30(2H,m),1.43(18H,s),1.40−1.55(2H,m),2.44(1H,m),3.44(1H,dd,J=6.8,10.8Hz),3.89(3H,s),3.89(1H,m),4.15(1H,d,J=8.0Hz),5.27(2H,s),7.24(1H,d,J=8.8Hz),7.38(1H,dd,J=2.0,8.8Hz),7.52(1H,d,J=2.0Hz),7.77(2H,s),8.07(1H,s),8.78(1H,brs),8.93(1H,brs).
実施例124
2−{3−ベンジル−1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−4−プロピル−ピロリジン−2−イリデンアミノ}−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.64(3H,t,J=7.2Hz),0.95−1.40(4H,m),1.43(18H,s),1.45(9H,s),2.09(1H,q,J=7.2Hz),2.78(1H,dd,J=11,2Hz,13.6Hz),3.08(1H,dd,J=3.6Hz,13.6Hz),3.29(2H,m)3.98(1H,dd,J=6.0Hz,10.6Hz),4.04(2H,s),5.22(1H,d,J=18.4Hz),5.28(1H,d,J=18.4Hz),7.25−7.45(5H,m),7.67(1H,s),7.76(2H,s),8.07(1H,s),9.29(1H,s).
実施例125
2−[3−(3−ベンジル−3H−イミダゾール−4−イル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.67(3H,t,J=7Hz),0.84−1.33(4H,m),1.47(18H,s),2.20(1H,m),3.33(1H,dd,J=10,6Hz),3.79(1H,dd,J=10,7Hz),4.13(1H,d,J=7Hz),5.31(1H,d,16Hz),5.48(1H,d,J=16Hz),5.54(1H,d,J=18Hz),5.85(2H,s),5.89(1H,d,J=18Hz),6.99(1H,s),7.13−7.40(5H,m),7.42(1H,s),7.88(2H,s).
MS:m/e(ESI)529.3(MH+)
実施例126
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(3H−イミダゾール−4−イル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.88(3H,t,J=7Hz),1.23−1.33(2H,m),1.45(18H,s),1.48−1.56(1H,m),1.60−1.71(1H,m),2.80(1H,m),3.56(1H,t,J=9Hz),3.79(1H,t,J=9Hz),4.09(1H,d,J=9Hz),5.28(1H,d,J=18Hz),5.86(1H,brs),6.02(1H,d,J=18Hz),7.02(1H,s),7.44(1H,s),7.88(1H,s),9.67(1H,brs).
MS:m/e(ESI)439.2(MH+)
実施例127
N−(3−第3ブチル−2−ヒドロキシ−5−{2−[(3S,4R)−2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−フェニル)−N−メチル−メタンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.38(9H,s),1.72−1.82(2H,m),2.75−2.87(1H,m),3.12(3H,s),3.15(3H,s),3.10−3.20(2H,m),3.30−3.42(1H,m),3.34(3H,s),3.50(1H,dd,J=10.8,6.8Hz),3.89(1H,dd,J=10.4,8.0Hz),4.23(1H,d,J=6.8Hz),5.24(2H,s),7.33−7.54(5H,m),7.80(1H,s),7.91(1H,s),8.87(1H,brs),8.98(1H,brs),10.02(1H,brs).
MS:m/e(ESI)516.3(MH+)
実施例128
N−(3−エチル−2−ヒドロキシ−5−{2−[(3S,4R)−2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−フェニル)−N−メチル−メタンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.19(3H,t,J=6.8Hz),1.54(9H,s),1.74−1.82(2H,m),2.78(q,2H,J=6.8Hz),3.09(3H,s),3.14(3H,s).
MS:m/e(ESI)488.2(MH+)
実施例129
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4R)−2−イミノ−4−プロピル−ピロリジン−3−イル}−安息香酸 エチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.82(3H,t,J=7.2Hz),1.24(2H,m),1.33(3H,t,J=7.2Hz),1.43(18H,s),1.53(2H,m),2.46(1H,q,J=7.2Hz),3.48(1H,dd,J=7.2Hz,10.4Hz),3.92(1H,dd,J=8.0Hz,10.8Hz),4.31(1H,m),4.35(2H,q,J=7.2Hz),5.30(2H,s),7.58(2H,d,J=8.0Hz),7.78(2H,s),8.03(2H,d,J=8.0Hz),8.09(1H,s),8.90(1H,s),8.99(1H,s).
実施例130
2−((3S,4R)−4−ベンジルオキシメチル−2−イミノ−3−フェニル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),2.69(1H,m),3.58(3H,m),3.97(1H,dd,J=8.0Hz,11.2Hz),4.29(1H,d,J=5.2Hz),4.53(1H,d,J=17.2Hz),4.55(1H,d,J=17.2Hz),5.27(1H,d,J=18.4Hz),5.34(1H,d,J=18.4Hz),7.30−7.50(10H,m),7.78(2H,s),8.09(1H,s),8.97(1H,s),9.04(1H,s).
実施例131
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−((3S,4R)−4−ヒドロキシメチル−2−イミノ−3−フェニル−ピロリジン−1− イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.44(18H,s),2.46(1H,m),3.53(3H,m),3.92(1H,dd,J=8.0Hz,11.2Hz),4.27(1H,d,J=5.2Hz),5.12(1H,t,J=5.2Hz),5.32(2H,s),7.35−7.50(5H,m),7.79(2H,s),8.08(1H,s),8.95(1H,s),9.06(1H,s).
実施例132
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4R)−2−イミノ−4−プロピル−ピロリジン−3−イル}−N,N−ジメチル−ベンズアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.25(2H,m),1.43(18H,s),1.53(2H,m),2.45(1H,m),2.94(3H,s),3.00(3H,s),3.47(1H,dd,J=6.8Hz,10.4Hz),3.92(1H,dd,J=8.4Hz,10.4Hz),4.22(1H,d,J=6.8Hz),5.30(2H,s),7.49(4H,s),7.78(2H,s),8.09(1H,s),8.90(1H,s),8.96(1H,s),
実施例133
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4R)−2−イミノ−4−プロピル−ピロリジン−3−イル}−安息香酸 第3ブチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.82(3H,t,J=7.2Hz),1.23(2H,m),1.43(18H,s),1.52(2H,m),1.56(9H,s),2.45(1H,m),3.47(1H,dd,J=7.6Hz,10.8Hz),3.91(1H,dd,J=8.0Hz,10.8Hz),4.29(1H,d,J=7.6Hz),5.30(2H,s),7.55(2H,d,J=8.4Hz),7.78(2H,s),7.97(2H,d,J=8.4Hz),8.09(1H,s),8.84(1H,s),8.98(1H,s).
実施例134
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イル}−安息香酸;塩酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.25(2H,m),1.43(18H,s),1.53(2H,m),1.56(9H,s),2.46(1H,m),3.47(1H,dd,J=7.2Hz,10.8Hz),3.92(1H,dd,J=8.0Hz,10.8Hz),4.29(1H,d,J=7.2Hz),5.32(2H,s),7.55(2H,d,J=8.4Hz),7.78(2H,s),8.01(2H,d,J=8.4Hz),8.05(1H,s),8.92(1H,s),9.06(1H,s),13.05(1H,s).
実施例135
N−{3−第3ブチル−2−ヒドロキシ−5−[2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−ベンジル}−N−メチル−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.80(3H,t,J=7.2Hz),1.06−1.54(4H,m),1.36(9H,s),2.10(3H,s),2.10−2.45(1H,m),3.09(3H,s),3.88−3.91(1H,m),4.14(1H,d,J=7.2Hz),4.46(2H,s),5.25(2H,s),7.32−7.48(5H,m),7.80(1H,d,J=2.0Hz),7.88(1H,d,J=2.0Hz),8.85(1H,s).
実施例136
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(3−ヒドロキシ−2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.79(3H,t,J=7Hz),1.08−1.17(2H,m),1.46(18H,s),1.47−1.56(2H,),2.61(1H,td,J=9,7Hz),3.74(1H,t,J=9Hz),3.78(1H,t,J=9Hz),5.00(1H,d,J=18Hz),5.85(1H,s),5.91(1H,s),6.22(1H,d,J=18Hz),7.01(1H,s),7.33(1H,t,J=8Hz),7.40(2H,t,J=8Hz),7.55(2H,d,J=8Hz),7.88(2H,s),9.22(1H,s).
MS:m/e(ESI)465.2(MH+)
実施例137
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−フェニル−3−プロピル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.89(3H,t,J=7.6Hz),1.32−1.52(2H,m),1.43(18H,s),1.75−1.83(2H,m),3.21(1H,m),3.57(1H,m),3.64(1H,m),4.08(1H,dd,J=8.8,10.8Hz),5.24(2H,s),7.31(1H,m),7.34−7.44(4H,m),7.77(2H,s),8.07(1H,s),8.99(1H,s),9.23(1H,s).
実施例138
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[(3S,4R)−3−(3−エトキシ−フェニル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7.2Hz),1.20−1.32(2H,m),1.36(3H,t,J=6.8Hz),1.44(18H,s),1.48−1.58(2H,m),2.44(1H,m),3.45(1H,dd,J=6.4,10.0Hz),3.92(1H,t,J=10.0Hz),4.02−4.14(3H,m),5.29(2H,s),6.91−7.02(3H,m),7.36(1H,t,J=8.0Hz),7.77(2H,s),8.07(1H,s),8.83(1H,s),8.95(1H,s).
実施例139
N−(4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4R)−2−イミノ−4−プロピル−ピロリジン−3−イル}−フェニル)−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=6.8Hz),1.15−1.30(2H,m),1.43(18H,s),1.36−1.60(2H,m),2.06(3H,s),2.42(1H,m),3.43(1H,dd,J=6.8,10.4Hz),3.89(1H,dd,J=7.6,10.4Hz),4.08(1H,d,J=7.6Hz),5.29(2H,s),7.32(2H,d,J=8.8Hz),7.64(2H,d,J=8.8Hz),7.77(2H,s),8.07(1H,brs),8.78(1H,s),8.95(1H,brs),10.06(1H,s).
実施例140
N−(4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4R)−2−イミノ−4−プロピル−ピロリジン−3−イル}−フェニル)−メタンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.12−1.30(2H,m),1.43(18H,s),1.32−1.60(2H,m),2.41(1H,m),3.03(3H,s),3.45(1H,dd,J=7.2,10.0Hz),3.90(1H,m),4.11(1H,d,J=7.6Hz),5.30(2H,s),7.26(2H,d,J=8.0Hz),7.38(2H,d,J=8.0Hz),7.78(2H,s),8.07(1H,s),8.81(1H,s),8.97(1H,brs),9.89(1H,s).
実施例141
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イル}−N−メチル−ベンズアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.24(2H,m),1.43(18H,s),1.53(2H,m),2.44(1H,q,J=7.2Hz),2.80(3H,d,J=4.4Hz),3.47(1H,dd,J=6.4Hz,10.8Hz),3.92(1H,dd,J=7.6Hz,10.8Hz),4.23(1H,d,J=7.2Hz),5.30(2H,s),7.51(2H,d,J=8.4Hz),7.78(2H,s),7.91(2H,D,J=8.4Hz),8.09(1H,s),8.48(1H,q,J=4.4Hz),8.90(1H,s),8.97(1H,s).
実施例142
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−メトキシ−フェニル)−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.85(3H,t,J=7Hz),1.20−1.27(2H,m),1.49(18H,s),1.58−1.78(2H,m),2.81(1H,m),3.57(1H,t,J=9Hz),3.85(1H,dd,J=9,8Hz),3.89(3H,s),4.14(1H,d,J=9Hz),5.57(1H,d,J=18Hz),5.87(1H,s),5.90(1H,s),6.12(1H,d,J=18Hz),6.97(1H,d,J=8Hz),7.03(1H,t,J=8Hz),7.20(1H,dd,J=8,2Hz),7.40(1H,td,J=8,2Hz),7.95(2H,s).
MS:m/e(ESI)479.3(MH+)
実施例143
N−[3−(4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4S)−2−イミノ−4−プロピル−ピロリジン−3−イル}−フェノキシ)−プロピル]−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.81(3H,t,J=7.2Hz),1.10−1.28(2H,m),1.30−1.50(2H,m),1.40(18H,s),1.78(3H,s),1.78−1.86(2H,m),2.34−2.40(1H,m),3.17(2H,dd,J=12.8,6.4Hz),3.41(1H,dd,J=11.1,7.6Hz),3.87(1H,dd,J=10.4,7.6Hz),3.96(2H,t,J=6.0Hz),4.06(1H,d,J=7.2Hz),5.23(2H,s),6.98(2H,d,J=8.8Hz),7.30(2H,d,J=8.8Hz),7.72(2H,s),7.85−7.95(1H,brs),8.68−8.71(1H,brs).
実施例144
4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4R)−2−イミノ−4−プロピル−ピロリジン−3−イル}−N−メチル−ベンゼンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.20−1.30(2H,m),1.44(18H,s),1.38−1.60(2H,m),2.45(1H,m),2.45(3H,d,J=6.0Hz),3.48(1H,dd,J=6.0,10.4Hz),3.93(1H,dd,J=7.2,10.4Hz),4.13(1H,d,J=7.2Hz),5.31(2H,s),7.54(1H,q,J=6.0Hz),7.66(2H,d,J=8.4Hz),7.78(2H,s),7.86(2H,d,J=8.4Hz),8.96(1H,brs),9.00(1H,brm).
実施例145
(4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4R)−2−イミノ−4−プロピル−ピロリジン−3−イル}−フェニル)−カルバミン酸 メチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.20−1.30(2H,m),1.43(18H,s),1.40−1.55(2H,m),2.41(1H,m),3.33(3H,s),3.43(1H,dd,J=7.2,10.4Hz),3.89(1H,dd,J=8.0,10.4Hz),4.07(1H,d,J=8.0Hz),5.27(2H,s),7.32(2H,d,J=8.4Hz),7.52(2H,d,J=8.4Hz),7.77(2H,s),8.07(1H,brs),8.77(1H,brs),8.93(1H,brs),9.76(1H,s).
実施例146
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[(3S,4R)−3−(4−エトキシ−フェニル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7.2Hz),1.17−1.30(2H,m),1.34(3H,t,J=6.8Hz),1.43(18H,s),1.38−1.56(2H,m),2.40(1H,m),3.43(1H,dd,J=7.2,11.2Hz),3.88(1H,dd,J=7.6,11.2Hz),4.00−4.12(3H,m),5.28(2H,s),7.00(2H,d,J=8.8Hz),7.32(2H,d,J=8.8Hz),7.77(2H,s),8.07(1H,s),8.74(1H,s),8.93(1H,brs).
実施例147
2−((3R,4S)−4−アジドメチル−2−イミノ−3−フェニル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.44(18H,s),2.65(1H,m),3.53(1H,dd,J=4.4Hz,11.2Hz),3.67(2H,d,J=6.4Hz),3.98(1H,dd,J=8.0Hz,11.2Hz),4.27(1H,d,J=4.4Hz),5.27(1H,d,J=18.0Hz),5.34(1H,d,J=18.0Hz),7.35−7.55(5H,m),7.78(2H,s),8.09(1H,s),9.00(1H,s),9.09(1H,s).
実施例148
2−((3S,4S)−4−アミノメチル−2−イミノ−3−フェニル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.39(18H,s),2.45(1H,m),2.85(2H,d,J=6.0Hz),3.57(1H,dd,J=4.4Hz,11.2Hz),3.92(1H,dd,J=8.0Hz,11.2Hz),4.27(1H,d,J=4.4Hz),5.18(2H,s),7.36−7.50(5H,m),7.64(2H,s).
実施例149
1−[(3R,4S)−2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−4−フェニル−ピロリジン−3−カルボン酸 メチルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),3.46(1H,td,J=5.6Hz,8.8Hz),3.71(3H,s),3.98(1H,dd,J=5.6Hz,11.2Hz),4.10(1H,dd,J=8.8Hz,11.2Hz),4.77(1H,d,J=5.6Hz),5.28(1H,d,J=18.4Hz),5.37(1H,d,J=18.4Hz),7.38−7.55(5H,m),7.78(2H,s),8.09(1H,s),9.08(1H,s),9.15(1H,s).
実施例150
1−[(3R,4S)−2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−4−フェニル−ピロリジン−3−カルボン酸 アミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),3.20(1H,td,J=5.2Hz,8.8Hz),3.76(1H,dd,J=5.2Hz,11.2Hz),4.05(1H,dd,J=8.8Hz,11.2Hz),4.64(1H,d,J=5.2Hz),5.29(1H,d,J=18.4Hz),5.36(1H,d,J=18.4Hz),7.30(1H,s),7.38−7.55(5H,m),7.64(1H,s),7.78(2H,s),8.09(1H,s),9.05(1H,s),9.11(1H,s).
実施例151
1−[(3R,4S)−2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−5−イミノ−4−フェニル−ピロリジン−3−カルボン酸 メチルアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),2.61(3H,d,J=4.8Hz),3.19(1H,td,J=5.6Hz,8.4Hz),3.74(1H,dd,J=5.6Hz,10.8Hz),4.03(1H,dd,J=8.4Hz,10.8Hz),4.64(1H,d,J=5.6Hz),5.29(1H,d,J=18.4Hz),5.35(1H,d,J=18.4Hz),7.37−7.55(5H,m),7.78(2H,s),8.09(1H,s),8.13(1H,q,J=4.8Hz),9.06(1H,s),9.09(1H,s).
実施例152
N−[2−(4−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3S,4S)−2−イミノ−4−プロピル−ピロリジン−3−イル}−フェノキシ)−エチル]−メタンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.81(3H,t,J=7.2Hz),1.15−1.28(2H,m),1.41(18H,s),1.40−1.51(2H,m),1.85−1.93(2H,m),2.35−2.42(1H,m),2.89(3H,s),3.09(2H,t,J=5.6Hz),3.38−3.45(1H,m),3.80−3.90(1H,m),4.03(2H,t,J=6.0Hz),4.06(1H,d,J=8.4Hz),5.25(2H,s),7.00(2H,d,J=8.4Hz),7.04−7.10(1H,m),7.31(2H,d,J=8.4Hz),7.75(2H,s),8.00−8.10(0.5H,brs),8.67−8.75(1H,brs),8.85−8.95(0.5H,brs).
実施例153
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−{(3S,4S)−2−イミノ−3−[4−(2−メトキシ−エトキシ)−フェニル]−4−プロピル−ピロリジン−1−イル}−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.81(3H,t,J=7.6Hz),1.18−1.27(2H,m),1.41(18H,s),1.38−1.52(2H,m),2.35−2.42(1H,m),3.28(3H,s),3.38−3.52(1H,m),3.64(2H,dd,J=4.4,3.2Hz),3.86(1H,dd,J=10.8,7.8Hz),4.05(1H,d,J=7.8Hz),4.08(2H,dd,J=4.4,3.2Hz),5.22(2H,s),7.00(2H,d,J=8.8Hz),7.31(2H,d,J=8.8Hz),7.75(2H,s).
実施例154
N−(2−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イル}−フェニル)−メタンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.92(3H,t,J=7Hz),1.21−1.32(2H,m),1.45(18H,s),1.48−1.60(2H,m),2.57(1H,dt,J=8,7Hz),3.35(3H,s),3.52(1H,dd,J=10,7Hz),4.04(1H,dd,J=10,8Hz),4.50(1H,d,J=7Hz),4.63(1H,d,J=19Hz),5.60(1H,d,J=19Hz),5.87(1H,s),7.03(1H,s),7.31(1H,d,J=7Hz),7.42(1H,t,J=7Hz),7.49(1H,td,J=7,2Hz),7.76(2H,s),7.87(1H,dd,J=7,2Hz),9.13(1H,s),10.61(1H,s).
MS:m/e(ESI)542.2(MH+)
実施例155
N−(2−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イル}−フェニル)−アセトアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.83(3H,t,J=7Hz),1.18−1.27(2H,m),1.48(18H,s),1.47−1.56(2H,m),2.20(3H,s),2.60(1H,m),3.54(1H,dd,J=10,7Hz),4.05(1H,dd,J=10,8Hz),4.55(1H,d,J=6Hz),5.08(1H,d,J=18Hz),5.88(1H,s),5.89(1H,d,J=18Hz),7.27−7.38(3H,m),7.51(1H,d,J=8Hz),7.89(2H,s),8.20(1H,s),8.86(1H,s),8.99(1H,s).
MS:m/e(ESI)506.3(MH+)
実施例156
酢酸2−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−2−イミノ−4−プロピル−ピロリジン−3−イル}−ベンジル エステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.86(3H,t,J=7Hz),1.19−1.27(2H,m),1.48(18H,s),1.53−1.64(2H,m),2.07(3H,s),2.83(1H,m),3.64(1H,t,J=9Hz),3.91(1H,dd,J=10,9Hz),4.38(1H,d,J=9Hz),5.08(1H,d,J=13Hz),5.28(1H,d,J=13Hz),5.77(1H,d,J=19Hz),5.83(1H,d,J=19Hz),5.87(1H,s),6.40(1H,s),7.37−7.51(4H,m),7.93(2H,s),10.78(1H,s).
MS:m/e(ESI)521.2(MH+)
実施例157
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−4−プロピル−3−(2−ピロリジン−1−イル−フェニル)−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.87(3H,t,J=7Hz),1.23−1.36(2H,m),1.48(18H,s),1.50−1.63(2H,m),1.93−2.05(4H,m),2.60(1H,m),2.96−3.02(2H,m),1.37−3.23(2H,m),3.54(1H,t,J=9Hz),3.91(1H,dd,J=10,9Hz),4.64(2H,br.d),5.19(1H,d,J=7Hz),7.11(1H,ddd,J=7,6,2Hz),7.34−7.41(3H,m).7.90(2H,s).
MS:m/e(ESI)518.2(MH+)
実施例158
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−{3−[4−(3−ヒドロキシ−プロポキシ)−フェニル]−2−イミノ−4−プロピル−ピロリジン−1−イル}−エタノン;塩酸塩
1H−NMR(DMSO−d6)δ:
0.80(3H,t,J=7.2Hz),1.18−1.40(2H,m),1.41(18H,s),1.43−1.53(2H,m),2.35−2.42(1H,m),3.41(1H,dd,J=10.8,7.6Hz),3.70(2H,t,J=5.2Hz),3.85(1H,dd,J=10.8,8.4Hz),3.99(2H,t,J=5.2Hz),4.06(1H,d,J=8.0Hz),4.80−4.88(1H,m),5.24(2H,s),7.00(2H,d,J=8.8Hz),7.30(2H,d,J=8.8Hz),7.74(2H,s),8.68−8.72(1H,brs),8.80−8.95(1H,brs).
実施例159
1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3R,4S)−5−イミノ−4−フェニル−ピロリジン−3−カルボン酸 ジメチルアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.43(18H,s),2.85(3H,s),2.87(3H,s),3.21(1H,td,J=4.4Hz,8.4Hz),3.77(1H,m),4.18(1H,dd,J=8.4Hz,10.8Hz),4.76(1H,d,J=4.4Hz),5.28(1H,d,J=18.4Hz),5.35(1H,d,J=18.4Hz),7.37−7.55(5H,m),7.78(2H,s),8.09(1H,s),9.15(1H,s).
実施例160
N−{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3R,4S)−5−イミノ−4−フェニル−ピロリジン−3−イルメチル}−N−メチル−メタンスルフォンアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.44(18H,s),2.72(3H,s),2.75(1H,m),2.93(3H,s),3.21(1H,dd,J=7.2Hz,13.6Hz),3.35(1H,m),3.48(1H,dd,J=4.0Hz,11.2Hz),3.99(1H,dd,J=7.2Hz,11.2Hz),4.32(1H,d,J=4.0Hz),5.33(2H,s),7.36−7.52(5H,m),7.79(2H,s),8.09(1H,s),9.03(1H,s),9.21(1H,s).
実施例161
{1−[2−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−オキソ−エチル]−(3R,4S)−5−イミノ−4−フェニル−ピロリジン−3−イルメチル}−メチルカルバミン酸 ベンジルエステル;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.44(18H,s),2.76(3H,s),2.80(1H,m),3.50(1H,dd,J=5.2Hz,11.2Hz),3.92(1H,dd,J=7.6Hz,11.2Hz),4.22(1H,m),5.08(2H,s),5.30(2H,s),7.25−7.55(10H,m),7.78(2H,s),8.09(1H,s),9.00(2H,s).
実施例162
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−((3S,4S)−2−イミノ−4−メチルアミノメチル−3−フェニル−ピロリジン−1−イル)−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.42(18H,s),2.31(3H,s),2.71(2H,m),3.53(1H,dd,J=4.4Hz,11.2Hz),3.93(1H,dd,J=7.6Hz,11.2Hz),4.31(1H,d,J=4.4Hz)5.24(2H,s),7.35−7.55(6H,m),7.72(2H,s),9.09(1H,s).
実施例163
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(2−ヒドロキシメチル−フェニル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.84(3H,t,J=7Hz),1.19−1.28(2H,m),1.46(18H,s),1.57−1.64(2H,m),2.83(1H,m),3.50(1H,dd,J=10,7Hz),4.02(1H,dd,J=10,9Hz),4.53(1H,d,J=13Hz),4.72(1H,d,J=7Hz),4.93(1H,d,J=13Hz),5.23(1H,d,J=18Hz),5.83(1H,s),6.02(1H,d,J=18Hz),7.27−7.41(4H,m),7.89(2H,s).
MS:m/e(ESI)479.2(MH+)
実施例164
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[2−イミノ−3−(2−メトキシメチル−フェニル)−4−プロピル−ピロリジン−1− イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.88(3H,t,J=7Hz),1.22−1.30(2H,m),1.48(18H,s),1.57−1.64(2H,m),2.87(1H,m),3.47(3H,s),3.56(1H,dd,J=10,7Hz),4.05(1H,t,J=10Hz),4.19(1H,d,J=7Hz),4.33(1H,d,J=11Hz),4.64(1H,d,J=11Hz),5.87(2H,brs),5.89(1H,s),7.31−7.50(4H,m),7.96(2H,s).
MS:m/e(ESI)493.3(MH+)
実施例165
4−{5−[2−(4−ベンジル−3−イミノ−5−プロピル−3H−イソキサゾール−2−イル)−アセチル]−3−第3ブチル−2−メトキシ−フェノキシ}−ブチルアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.91(3H,t,J=7Hz),1.38(9H,s),1.60(2H,m),2.18(2H,m),2.42−2.51(4H,m),3.69(1H,d,J=18Hz),3.78(1H,d,J=18Hz),3.96(3H,s),4.15(1H,m),4.27(1H,m),5.93(1H,brs),6.32(1H,brs),6.70(1H,s),7.17(2H,d,J=8Hz),7.22−7.33(3H,m),7.61(1H,s),7.63(1H,s).
MS:m/e(ESI)522.3(MH+)
実施例166
4−(3−第3ブチル−2−ヒドロキシ−5−{2−[2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−フェノキシ)−ブチルアミド;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
1.38(9H,s),1.82(2H,m),2.11(2H,quint,J=6Hz),2.43(2H,t,J=6Hz),2.75(1H,m),3.18(3H,s),3.31−3.37(2H,m),3.74(1H,dd,J=9,8Hz),3.95(1H,d,J=10,9Hz),4.06(1H,d,J=9Hz),4.20(2H,t,J=6Hz),5.48(1H,d,J=19Hz),5.70(1H,d,J=19Hz),5.71(1H,s),7.22(1H,s),7.28(1H,s),7.30−7.41(5H,m),7.61(1H,s),7.62(1H,s),11.36(2H,s).
MS:m/e(ESI)510.2(MH+)
実施例167
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(3−エチル−ペンチル)−2−メチルイミノ−2H−ピリジン−1−イル]−エタノン;臭化水素酸塩
1H−NMR(DMSO−d6)δ:
0.79(6H,t,J=7Hz),1.15−1.23(1H,m),1.23−1.32(6H,m),1.43(18H,s),2.58(2H,m),2.99(3H,s),4.66(2H,s),6.83(1H,dd,J=8,5Hz),7.42(1H,dd,J=8,2Hz),7.83(2H,s),8.06(1H,dd,J=5,2Hz).
MS:m/e(ESI)453.3(MH+)
実施例168
(4−{3−第3ブチル−5−[2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−ベンジル}−ピペラジン−1−イル)−酢酸 エチルエステル;臭化水素酸塩
MS:m/e(ESI)561.3(MH+)
実施例169
{2−第3ブチル−6−ジメチルアミノ−4−[2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−フェノキシ}−酢酸;臭化水素酸塩
MS:m/e(ESI)494.4(MH+)
実施例170
{2−第3ブチル−4−[2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−6−ピロリジン−1−イル−フェノキシ}−酢酸;臭化水素酸塩
MS:m/e(ESI)520.5(MH+)
実施例171
4−{3−第3ブチル−5−[2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−2−メトキシ−フェノキシ}−ブチルアミド;臭化水素酸塩
MS:m/e(ESI)508.5(MH+)
実施例172
4−{3−第3ブチル−2−ヒドロキシ−5−[2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−フェノキシ}−ブチルアミド;臭化水素酸塩
MS:m/e(ESI)494.5(MH+)
実施例173
(1−{3−第3ブチル−2−ヒドロキシ−5−[2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−フェニル}−ピロリジン−3−イルオキシ)−酢酸;臭化水素酸塩
MS:m/e(ESI)536.4(MH+)
実施例174
[4−(3−第3ブチル−5−{2−[2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−ベンジル)−ピペラジン−1−イル]−酢酸 エチルエステル;臭化水素酸塩
MS:m/e(ESI)577.4(MH+)
実施例175
(2−第3ブチル−6−ジメチルアミノ−4−{2−[2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−フ ェノキシ)−酢酸;臭化水素酸塩
MS:m/e(ESI)510.4(MH+)
実施例176
(2−第3ブチル−4−{2−[2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−6−ピロリジン−1−イル−フェノキシ)−酢酸;臭化水素酸塩
MS:m/e(ESI)536.5(MH+)
実施例177
4−(3−第3ブチル−5−{2−[2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−2−メトキシ−フェノキシ)−ブチルアミド;臭化水素酸塩
MS:m/e(ESI)524.5(MH+)
実施例178
4−(3−第3ブチル−2−ヒドロキシ−5−{2−[2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−フェノキシ)−ブチルアミド;臭化水素酸塩
MS:m/e(ESI)510.3(MH+)
実施例179
[1−(3−第3ブチル−2−ヒドロキシ−5−{2−[2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−アセチル}−フェニル)−ピロリジン−3−イルオキシ]−酢酸;臭化水素酸塩
MS:m/e(ESI)552.4(MH+)
試験例
本発明の化合物およびその塩の生化学的活性および医薬としての作用効果(トロンビン受容体結合能、血小板凝集抑制作用、平滑筋細胞の増殖抑制作用)を、以下の方法により評価した。
<試験例1>
[レセプターバインディングアッセイ]
1週間以内に薬物を服用していない健常人より採血を行い、凝固阻止剤として3.8%クエン酸(血液9に対して1の割合)を添加した。室温下、100gで10分間遠心することで多血小板血漿(PRP:platelet rich plasma)を得た。PRPを遠心して得た血小板沈渣をDounce homogenizerでホモジナイズし、40,000gで60分間遠心し血小板膜を得た。得られた血小板膜は、10mM MgCl2と1mM EGTA(エチレングリコール四酢酸)を含む50mMトリス塩酸緩衝液(緩衝液1)に1%の濃度になるようにDMSO(ジメチルスルホキサイド)を添加した溶液で懸濁し、−80℃で保存した。緩衝液1にウシアルブミンおよびDMSOをそれぞれ0.1%および20%となるように添加して、被検化合物の調製液とした。この調製液で種々の濃度に希釈した被検化合物(20μl)を96穴のマルチスクリーンプレートに添加した。その後、緩衝液1にて希釈した25nMの[3H]Ala−(4−fluoro)Phe−Arg−(cyclohexyl)Ala−(homo)Arg−Tyr−NH2(high affinity TRAP)80μlを添加して良く混和した。さらに、あらかじめ調製しておいた血小板膜溶液(0.4mg/ml)100μlを添加して混和した後、37℃で1時間インキュベーションした。反応液を吸引濾過後に、200μlの緩衝液1にて三回洗浄した。その後、液体シンチレーター30μlを添加してトップカウンター(パッカード)によりプレートの放射活性を測定し、被検化合物存在時の放射活性から非特異的結合分を差し引いた値を、特異的結合値(化合物非存在時の結合から非特異的結合分を差し引いた値)で除することにより結合率を求め、IC50値を算出した。なお、非特異的な結合は10μMのhigh affinity TRAPを添加した値とした。得られた結果を表1に示す。
<試験例2>
[多血小板血漿を利用した血小板凝集抑制作用]
1週間以内に薬物を服用していない健常人より採血を行い、凝固阻止剤として3.8%クエン酸(血液9に対して1の割合)を添加した。室温下、100gで10分間遠心することで多血小板血漿(PRP:platelet rich plasma)を得た。PRPを除去した血液をさらに1000gで10分間遠心することで乏血小板血漿(PPP:platelet poor plasma)を得た。血小板数は、多項目自動血球計数装置(K4500、シスメックス)で測定し、約30万/μlとなるようにPRPをPPPで希釈した。血小板凝集能は、アグリゴメーター(エムシーメディカル)を用いて次のようにして調べた。PRP(175μl)にFibrin重合阻止剤としてGPRP−NH2(最終濃度1mM、25μl)を添加し、さらにCa非含有タイロード液(コントロール)あるいは種々の濃度の被験化合物溶液(25μl)を添加して37℃で3分間保温した後、25μlの最大凝集を引き起こす最小濃度のトロンビン(最終濃度:0.5〜1.5units/mlのうちの至適濃度)を加え血小板凝集を惹起した。実験によっては、PRPとCa非含有タイロード液(コントロール)あるいは種々の濃度の検体調製液をあらかじめ37℃で3分間プレインキュベーションを行った後、血小板凝集の反応を行った。トロンビン添加後、6分間の凝集反応を調べ、凝集曲線の曲線下面積を比較することにより抑制率を求めIC50値を算出した。得られた結果を表1に示す。
<試験例3>
[ラット平滑筋細胞増殖アッセイ]
雄性SDラット大動脈からexplant法にて血管平滑筋細胞(rSMC)を単離した。増殖培地には、10%の牛胎児血清(GibcoBRL)、ストレプトマイシンおよびペニシリンを含むDMEM培地(Sigma)を用い、37℃、5%CO2存在下で継代培養した。増殖培地にて1x104cells/mlの濃度に懸濁したrSMC100μlを96穴プレートに加え培養を開始した。三日後にDMEM培地100μlにて二回洗浄した後、培地を0.1%アルブミンを含むDMEM培地(飢餓培地)100μlに交換して血清飢餓を開始した。血清飢餓二日後に培地を交換し、飢餓培地80μlおよび飢餓培地にて種々の濃度に希釈した被検化合物の10μlを添加し、さらに飢餓培地で溶解したトロンビン(最終濃度0.1units/ml)10μlを添加してさらに2日間インキュベーションした。
7.5mg/mlとなるようにDPBSで溶解したMTT(3−[4,5−dimethylthiazol−2−yl]−2,5−diphenyl−tetrazolium bromide)を20μl添加し、さらに4時間インキュベーションを行った。培地を吸引除去して50μlの10%SDS/0.029%ammonia溶液を添加してCO2インキュベーター内で2時間静置して細胞を完全に溶解した。細胞増殖の指標としてOD590nmをプレートリーダー(EL340、BIO−TEK instruments Inc.)で測定し、コントロールOD値(化合物非存在時のOD値)から被検化合物存在時のOD値を差し引いた値を、コントロールOD値からブランクOD値(トロンビン非刺激でのOD値)を差し引いた値で除することにより抑制率を求め、IC50値を算出した。得られた結果を表1に示す。
本発明の化合物およびその塩は、試験例1において優れたトロンビン受容体結合能を示し、特にトロンビンのPAR1受容体に対して選択的な結合能を示した。また、本発明の化合物およびその塩は、試験例2において優れた血小板凝集抑制作用を示した。さらに、本発明の化合物およびその塩は、試験例3において優れた平滑筋細胞の増殖抑制作用を示した。
産業上の利用可能性
本発明により、前記式(I)で表わされる新規なサイクリックアミジン誘導体およびその塩を提供することができる。そして、前記式(I)で表わされる本発明の化合物およびその塩は、優れたトロンビン受容体拮抗作用を有し、特にトロンビンのPAR1受容体に対して選択的に拮抗作用を示すものである。従って、本発明の化合物またはその塩によれば、トロンビンのフィブリノーゲンをフィブリンに変換する触媒活性を阻害することなくトロンビンによる血小板凝集などの細胞応答を抑制することができ、また、冠動脈血管形成術等により血管壁に損傷が生じたときに起こる血管平滑筋増殖に対してもPAR1選択的阻害に基づいて抑制することが可能となる。
よって、本発明の化合物またはその塩は、トロンビン受容体の拮抗剤(特にトロンビンのPAR1受容体の拮抗剤)、血小板凝集阻害剤(抗血栓薬)、平滑筋細胞の増殖阻害剤として有用であり、また、血管形成術中または術後の再狭窄、不安定狭心症、安定狭心症、心筋梗塞、脳梗塞、末梢動脈閉塞等の治療薬または予防薬として有用であり、更に、深部静脈血栓症、肺塞栓症、心房細動に伴う脳塞栓症等の静脈性血栓症、糸球体腎炎症候群等の治療薬または予防薬や、抗炎症剤、抗再狭窄剤としても有用である。
Claims (17)
- 式
R1、R2、R3、R4、R5およびR7は同一または相異なって(1)水素原子、(2)シアノ基、(3)ハロゲン原子または(4)下記置換基群aから選ばれるいずれか1の基を示し、
zは0または1を示し、
さらに、R2とR4は結合してC,NおよびOから選ばれる1乃至5個の原子を有する5〜6員環を形成してもよく、
R4およびR5は結合により一緒になって単結合を形成してもよい;
R6は(1)水素原子、(2)C1−6アルキル基、(3)アシル基、(4)カルバモイル基、(5)水酸基、(6)C1−6アルコキシ基、(7)C1−6アルキルオキシカルボニルオキシ基、(8)C3−8環状アルキル基、(9)アシルオキシ基で置換されていてもよいC1−6アルキルオキシカルボニル基または(10)それぞれ下記置換基群eから選ばれる少なくとも1の基で置換されていてもよいC6−14芳香族炭化水素環式基もしくは5乃至14員芳香族複素環式基を示し;
nは1を示し;
Y1は−CH 2 −を示し;
Y2 は−CO−を示し;
Arは式
R 10 およびR14は同一または相異なって(1)水素原子、(2)シアノ基、(3)ハロゲン原子、(4)ニトロ基または(5)下記置換基群bから選ばれるいずれか1の基を示し;
R 11 およびR 13 は同一または相異なって(1)シアノ基、(2)ハロゲン原子、(3)ニトロ基または(4)下記置換基群bから選ばれるいずれか1の基を示し;
R 12 は(1)水酸基または(2)カルボキシル基で置換されていてもよいC 1−6 アルコキシ基を示す。〕で表わされる基を示す。
<前記置換基群a>下記置換基群a’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、アルキリデン基、C2−6アルケニル基、C2−6アルキニル基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、スルホニルアミノ基、スルホニル基、スルファモイル基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群a’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子、C3−8環状アルキル基、含ヘテロ環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群を示し、更に、前記C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基は、それぞれC1−6アルキル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子およびC3−8環状アルキル基からなる群より選ばれる少なくとも1の基で置換されていてもよい;
<前記置換基群b>下記置換基群b’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、スルホニルアミノ基、スルホニル基、スルファモイル基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群b’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、オキソ基、シアノ基、C1−6シアノアシル基、C2−7アシル基、C1−6アルカノイル基、ベンゾイル基、アラルカノイル基、C1−6アルコキシアルキルカルボニル基、C1−6ヒドロキシアルキルカルボニル基、カルボキシル基、C1−6カルボキシルアルキル基、C1−6カルボキシルアルキルオキシ基、カルバモイル基、カルバモイルアルキルオキシ基、C1−6アルコキシカルボニル基、C1−10アルコキシカルボニルC1−6アルキル基、C1−10アルコキシカルボニルC1−6アルキルオキシ基、C1−6モノアルキルアミノカルボニル基、C2−6ジアルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C1−10アルコキシアルキル基、C1−10アラルキルオキシアルキル基、C1−6ヒドロキシアルキル基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、C1−6アルキルスルホニルアミノ基、フェニルスルホニルアミノ基、C1−6アルキルスルホニル基、フェニルスルホニル基、C1−6モノアルキルアミノスルホニル基、C2−6ジアルキルアミノスルホニル基、スルファモイル基、ハロゲノ基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基、含ヘテロ環状アミノカルボニル基、含ヘテロ環状アミノスルホニル基およびイソキサゾリニル基からなる群を示し、更に、前記5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基およびイソキサゾリニル基は、独立に、C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C1−6ジアルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、アルキルスルホニルアミノ基、アルキルスルホニル基、スルファモイル基、ハロゲノ基およびC3−8環状アルキル基からなる群より選ばれる少なくとも1の基で置換されていてもよい;
<前記置換基群e>C1−6アルキル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子およびC3−8環状アルキル基からなる群。]
で表わされる化合物またはその塩。 - R1、R2およびR3は同一または相異なって水素原子、C1−6アルキル基、C1−6アルコキシ基、アリールC1−6アルキル基およびアリールC1−6アルキリデン基からなる群から選ばれるいずれか1の基を示し、
R4、R5およびR7は同一または相異なって水素原子、C1−6アルキル基および水酸基からなる群から選ばれるいずれか1の基を示し、
zは0または1を示し、
さらに、R2とR4は結合してC,NおよびOから選ばれる1乃至5個の原子を有する5〜6員環を形成してもよく、
R4およびR5は結合により一緒になって単結合を形成してもよい;
R6は水素原子、C1−6アルキル基およびアシルオキシ基で置換されていてもよいC1−6アルキルオキシカルボニル基からなる群から選ばれるいずれか1の基を示し;
nは1を示し;
Y1は−CH 2 −を示し;
Y2 は−CO−を示し;
Arは式
R 10 およびR14は同一または相異なって水素原子、C1−6アルキル基、水酸基、C1−6アルコキシ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、5乃至14員非芳香族複素環式基およびC1−6アルキルオキシカルボニルオキシ基からなる群から選ばれるいずれか1の基を示し;
R 11 およびR 13 は同一または相異なってC 1−6 アルキル基、水酸基、C 1−6 アルコキシ基、C 1−6 アルキルアミノ基、C 3−8 環状アルキルアミノ基、アシルアミノ基、5乃至14員非芳香族複素環式基およびC 1−6 アルキルオキシカルボニルオキシ基からなる群から選ばれるいずれか1の基を示し;
R 12 は水酸基およびC 1−6 アルコキシ基からなる群から選ばれるいずれか1の基を示す。〕で表わされる基を示す、請求項1記載の化合物またはその塩。 - R10およびR14が水素原子である請求項1または2記載の化合物またはその塩。
- 式
R 1 、R 2 、R 3 、R 4 、R 5 およびR 7 は同一または相異なって(1)水素原子、(2)シアノ基、(3)ハロゲン原子または(4)下記置換基群aから選ばれるいずれか1の基を示し、
zは0または1を示し、
さらに、R 2 とR 4 は結合してC,NおよびOから選ばれる1乃至5個の原子を有する5〜6員環を形成してもよく、
R 4 およびR 5 は結合により一緒になって単結合を形成してもよい;
R 6 は(1)水素原子、(2)C 1−6 アルキル基、(3)アシル基、(4)カルバモイル基、(5)水酸基、(6)C 1−6 アルコキシ基、(7)C 1−6 アルキルオキシカルボニルオキシ基、(8)C 3−8 環状アルキル基、(9)アシルオキシ基で置換されていてもよいC 1−6 アルキルオキシカルボニル基または(10)それぞれ下記置換基群eから選ばれる少なくとも1の基で置換されていてもよいC 6−14 芳香族炭化水素環式基もしくは5乃至14員芳香族複素環式基を示し;
nは1を示し;
Y 1 は−CH 2 −を示し;
Y 2 は−CO−を示し;
Arは式
R11およびR13は同一または相異なって(1)シアノ基、(2)ハロゲン原子、(3)ニトロ基または(4)下記置換基群bから選ばれるいずれか1の基を示し;
R15は(1)水素原子または(2)下記置換基群hから選ばれるいずれか1の基を示す。
<前記置換基群h>下記置換基群h’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、アシル基、C1−6アルコキシカルボニル基、アミノカルボニル基、C1−6アルキルアミノカルボニル基、C3−8環状アルキル基、C1−6アミノアルキル基、スルホニル基、C3−8環状アルキルアミノ基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群h’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、オキソ基、シアノ基、C1−6シアノアルキル基、C2−7アシル基、C1−6アルカノイル基、ベンゾイル基、アラルカノイル基、C1−6アルコキシアルキルカルボニル基、C1−6ヒドロキシアルキルカルボニル基、カルボキシル基、C1−6カルボキシルアルキル基、C1−6カルボキシルアルキルオキシ基、カルバモイル基、カルバモイルアルキルオキシ基、C1−6アルコキシカルボニル基、C1−10アルコキシカルボニルC1−6アルキル基、C1−10アルコキシカルボニルC1−6アルキルオキシ基、C1−6モノアルキルアミノカルボニル基、C2−6ジアルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C1−10アルコキシアルキル基、C1−10アラルキルオキシアルキル基、C1−6ヒドロキシアルキル基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、C1−6アルキルスルホニルアミノ基、フェニルスルホニルアミノ基、C1−6アルキルスルホニル基、フェニルスルホニル基、C1−6モノアルキルアミノスルホニル基、C2−6ジアルキルアミノスルホニル基、スルファモイル基、ハロゲノ基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基、含ヘテロ環状アミノカルボニル基、含ヘテロ環状アミノスルホニル基およびイソキサゾリニル基からなる群を示し、更に、前記5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基およびイソキサゾリニル基は、独立に、C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C1−6ジアルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、アルキルスルホニルアミノ基、アルキルスルホニル基、スルファモイル基、ハロゲノ基およびC3−8環状アルキル基からなる群から選ばれる少なくとも1の基で置換されていてもよい。〕で表される基を示す。
<前記置換基群a>下記置換基群a’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC 1−6 アルキル基、アルキリデン基、C 2−6 アルケニル基、C 2−6 アルキニル基、アシル基、カルボキシル基、カルバモイル基、C 1−6 アルコキシカルボニル基、C 1−6 アルキルアミノカルボニル基、水酸基、C 1−6 アルコキシ基、C 3−8 環状アルキルオキシ基、アミノ基、C 1−6 アルキルアミノ基、C 3−8 環状アルキルアミノ基、アシルアミノ基、スルホニルアミノ基、スルホニル基、スルファモイル基、C 3−8 環状アルキル基、5乃至14員非芳香族複素環式基、C 6−14 芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群a’>C 1−6 アルキル基、C 2−6 アルケニル基、C 2−6 アルキニル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C 1−6 アルコキシカルボニル基、C 1−6 アルキルアミノカルボニル基、水酸基、C 1−6 アルコキシ基、C 3−8 環状アルキルオキシ基、アミノ基、C 1−6 アルキルアミノ基、C 3−8 環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子、C 3−8 環状アルキル基、含ヘテロ環状アルキル基、5乃至14員非芳香族複素環式基、C 6−14 芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群を示し、更に、前記C 6−14 芳香族炭化水素環式基および5乃至14員芳香族複素環式基は、それぞれC 1−6 アルキル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C 1−6 アルコキシカルボニル基、C 1−6 アルキルアミノカルボニル基、水酸基、C 1−6 アルコキシ基、C 3−8 環状アルキルオキシ基、ニトロ基、アミノ基、C 1−6 アルキルアミノ基、C 3−8 環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子およびC 3−8 環状アルキル基からなる群より選ばれる少なくとも1の基で置換されていてもよい;
<前記置換基群e>C 1−6 アルキル基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C 1−6 アルコキシカルボニル基、C 1−6 アルキルアミノカルボニル基、水酸基、C 1−6 アルコキシ基、C 3−8 環状アルキルオキシ基、アミノ基、C 1−6 アルキルアミノ基、C 3−8 環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレニレン基、スルホニルアミノ基、スルホニル基、スルファモイル基、ハロゲン原子およびC 3 −8 環状アルキル基からなる群。]
で表される化合物またはその塩。 - Arが式
<前記置換基群i>下記置換基群i’から選ばれる少なくとも1の基でそれぞれ置換されていてもよいC1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、アシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、C1−6アミノアルキル基、スルホニル基、スルファモイル基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基および5乃至14員芳香族複素環式基からなる群;
<前記置換基群i’>C1−6アルキル基、C2−6アルケニル基、C2−6アルキニル基、オキソ基、シアノ基、C1−6シアノアルキル基、C2−7アシル基、C1−6アルカノイル基、ベンゾイル基、アラルカノイル基、C1−6アルコキシアルキルカルボニル基、C1−6ヒドロキシアルキルカルボニル基、カルボキシル基、C1−6カルボキシルアルキル基、C1−6カルボキシルアルキルオキシ基、カルバモイル基、カルバモイルアルキルオキシ基、C1−6アルコキシカルボニル基、C1−10アルコキシカルボニルC1−6アルキル基、C1−10アルコキシカルボニルC1−6アルキルオキシ基、C1−6モノアルキルアミノカルボニル基、C2−6ジアルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C1−10アルコキシアルキル基、C1−10アラルキルオキシアルキル基、C1−6ヒドロキシアルキル基、C3−8環状アルキルオキシ基、アミノ基、C1−6アルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、C1−6アルキルスルホニルアミノ基、フェニルスルホニルアミノ基、C1−6アルキルスルホニル基、フェニルスルホニル基、C1−6モノアルキルアミノスルホニル基、C2−6ジアルキルアミノスルホニル基、スルファモイル基、ハロゲノ基、C3−8環状アルキル基、5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基、含ヘテロ環状アミノカルボニル基、含ヘテロ環状アミノスルホニル基およびイソキサゾリニル基からなる群を示し、更に、前記5乃至14員非芳香族複素環式基、C6−14芳香族炭化水素環式基、5乃至14員芳香族複素環式基およびイソキサゾリニル基は、独立に、C1−6アルキル基、オキソ基、シアノ基、アシル基、カルボキシル基、カルバモイル基、C1−6アルコキシカルボニル基、C1−6アルキルアミノカルボニル基、水酸基、C1−6アルコキシ基、C3−8環状アルキルオキシ基、ニトロ基、アミノ基、C1−6アミノアルキル基、C1−6アルキルアミノ基、C1−6ジアルキルアミノ基、C3−8環状アルキルアミノ基、アシルアミノ基、ウレイド基、ウレイレン基、アルキルスルホニルアミノ基、アルキルスルホニル基、スルファモイル基、ハロゲノ基およびC3−8環状アルキル基からなる群から選ばれる少なくとも1の基で置換されていてもよい。]
で表わされる基である請求項4記載の化合物またはその塩。 - 2−((3R,4R)−3−ベンジル−2−イミノ−4−プロピル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル4−ヒドロキシ−フェニル)−エタノン;
N−{3−第3ブチル2−ヒドロキシ−5−[2−((3S,4S)−2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−アセチル]−フェニル}−N−メチル−メタンスルフォンアミド;
1−(3,5−ジ−第3ブチル4−ヒドロキシ−フェニル)−2−[(3S,4S)−2−イミノ−4−(2−メトキシ−エチル)−3−フェニル−ピロリジン−1−イル]−エタノン;
1−(3,5−ジ−第3ブチル4−ヒドロキシ−フェニル)−2−[(3S,4S)−2−イミノ−4−(3−メトキシ−プロピル)−3−フェニル−ピロリジン−1−イル]−エタノン;
1−(3,5−ジ−第3ブチル4−ヒドロキシ−フェニル)−2−((3S,4S)−2−イミノ−4−メトキシメチル−3−フェニル−ピロリジン−1−イル)−エタノン;
2−(3−ベンジル−2−イミノ−4−イソブチル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;
2−(3−ベンジル−4−ブチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(2−フルオロ−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;
2−(3−ベンジル−2−イミノ−4−メトキシメチル−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−3−フェニル−4−プロピル−ピロリジン−1−イル)−エタノン;
2−[3−(2−クロロ−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チオフェン−3−イルメチル−ピロリジン−1−イル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チアゾール−2−イルメチル−ピロリジン−1−イル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チオフェン−2−イルメチル−ピロリジン−1−イル)−エタノン;
2−[3−ベンジル−2−イミノ−4−(2−メトキシ−エチル)−ピロリジン−1−イル]−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;
2−(3−ベンジル−4−エトキシメチル−2−イミノ−ピロリジン−1−イル)−1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(2−ヒドロキシメチル−ベンジル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[(3S,4S)− 2−イミノ−3−(4−メトキシ−フェニル)−4−プロピル−ピロリジン−1−イル]−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−ピリジン−3−イル−ピロリジン−1−イル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−チオフェン−2−イル−ピロリジン−1−イル)−エタノン;
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−[3−(ヒドロキシ−フェニル−メチル)−2−イミノ−4−プロピル−ピロリジン−1−イル]−エタノン;および
1−(3,5−ジ−第3ブチル−4−ヒドロキシ−フェニル)−2−(2−イミノ−4−プロピル−3−ピリジン−2−イル−ピロリジン−1−イル)−エタノン
からなる群から選ばれる化合物またはその塩。 - 請求項1〜7のいずれか1項記載の化合物またはその塩を含有してなる医薬組成物。
- トロンビン受容体の拮抗剤である請求項8記載の組成物。
- トロンビンのPAR1受容体の拮抗剤である請求項8記載の組成物。
- 血小板凝集阻害剤である請求項8記載の組成物。
- 平滑筋細胞の増殖阻害剤である請求項8記載の組成物。
- 内皮細胞、繊維芽細胞、腎細胞、骨肉腫細胞、筋細胞、ガン細胞および/またはグリア細胞の増殖阻害剤である請求項8記載の組成物。
- 血栓症、血管再狭窄、深部静脈血栓症、肺塞栓症、脳梗塞、心疾患、播種性血管内血液凝固症候群、高血圧、炎症性疾患、リウマチ、喘息、糸球体腎炎、骨粗鬆症、神経疾患および/または悪性腫瘍の治療剤または予防剤である請求項8記載の組成物。
- トロンビン容体拮抗剤の製造のための請求項1〜7のいずれか1項記載の化合物またはその塩の使用。
- トロンビン受容体拮抗剤がPAR1受容体拮抗剤である請求項15記載の使用。
- 血小板凝集阻害剤の製造のための請求項1〜7のいずれか1項記載の化合物またはその塩の使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001121829 | 2001-04-19 | ||
| JP2001121829 | 2001-04-19 | ||
| JP2001269422 | 2001-09-05 | ||
| JP2001269422 | 2001-09-05 | ||
| PCT/JP2002/003949 WO2002085850A1 (en) | 2001-04-19 | 2002-04-19 | Cyclic amidine derivative |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2002085850A1 JPWO2002085850A1 (ja) | 2004-08-12 |
| JP4220249B2 true JP4220249B2 (ja) | 2009-02-04 |
Family
ID=26613890
Family Applications (6)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002585394A Expired - Fee Related JP4251872B2 (ja) | 2001-04-19 | 2002-04-19 | 2−イミノイミダゾール誘導体(2) |
| JP2002585396A Expired - Fee Related JP4445201B2 (ja) | 2001-04-19 | 2002-04-19 | 2−イミノイミダゾール誘導体(1) |
| JP2002583382A Expired - Fee Related JP3795458B2 (ja) | 2001-04-19 | 2002-04-19 | 2−イミノピロリジン誘導体 |
| JP2002583377A Expired - Fee Related JP4220249B2 (ja) | 2001-04-19 | 2002-04-19 | サイクリックアミジン誘導体 |
| JP2006041255A Expired - Fee Related JP4464928B2 (ja) | 2001-04-19 | 2006-02-17 | 2−イミノピロリジン誘導体の製造方法 |
| JP2006041270A Expired - Fee Related JP4516922B2 (ja) | 2001-04-19 | 2006-02-17 | 2−イミノピロリジン誘導体 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002585394A Expired - Fee Related JP4251872B2 (ja) | 2001-04-19 | 2002-04-19 | 2−イミノイミダゾール誘導体(2) |
| JP2002585396A Expired - Fee Related JP4445201B2 (ja) | 2001-04-19 | 2002-04-19 | 2−イミノイミダゾール誘導体(1) |
| JP2002583382A Expired - Fee Related JP3795458B2 (ja) | 2001-04-19 | 2002-04-19 | 2−イミノピロリジン誘導体 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006041255A Expired - Fee Related JP4464928B2 (ja) | 2001-04-19 | 2006-02-17 | 2−イミノピロリジン誘導体の製造方法 |
| JP2006041270A Expired - Fee Related JP4516922B2 (ja) | 2001-04-19 | 2006-02-17 | 2−イミノピロリジン誘導体 |
Country Status (21)
| Country | Link |
|---|---|
| US (6) | US20040242627A1 (ja) |
| EP (6) | EP1391456B1 (ja) |
| JP (6) | JP4251872B2 (ja) |
| KR (2) | KR100749794B1 (ja) |
| CN (3) | CN1243735C (ja) |
| AT (3) | ATE425964T1 (ja) |
| AU (1) | AU2005202135B2 (ja) |
| BR (1) | BR0208985A (ja) |
| CA (1) | CA2446924C (ja) |
| CZ (1) | CZ303865B6 (ja) |
| DE (2) | DE60231608D1 (ja) |
| ES (1) | ES2462995T3 (ja) |
| HU (1) | HUP0400467A3 (ja) |
| IL (2) | IL158491A0 (ja) |
| MX (1) | MXPA03009497A (ja) |
| NO (1) | NO327849B1 (ja) |
| NZ (1) | NZ528820A (ja) |
| PL (1) | PL368109A1 (ja) |
| RU (1) | RU2270192C2 (ja) |
| WO (4) | WO2002085850A1 (ja) |
| ZA (1) | ZA200308064B (ja) |
Families Citing this family (99)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6346510B1 (en) | 1995-10-23 | 2002-02-12 | The Children's Medical Center Corporation | Therapeutic antiangiogenic endostatin compositions |
| US7235567B2 (en) | 2000-06-15 | 2007-06-26 | Schering Corporation | Crystalline polymorph of a bisulfate salt of a thrombin receptor antagonist |
| DK1379246T3 (da) | 2001-04-18 | 2009-01-26 | Euro Celtique Sa | Nocieptin-analoger |
| CN1243735C (zh) * | 2001-04-19 | 2006-03-01 | 卫材株式会社 | 2-亚氨基吡咯烷衍生物 |
| US8048917B2 (en) | 2005-04-06 | 2011-11-01 | Xenoport, Inc. | Prodrugs of GABA analogs, compositions and uses thereof |
| US6818787B2 (en) | 2001-06-11 | 2004-11-16 | Xenoport, Inc. | Prodrugs of GABA analogs, compositions and uses thereof |
| US7186855B2 (en) | 2001-06-11 | 2007-03-06 | Xenoport, Inc. | Prodrugs of GABA analogs, compositions and uses thereof |
| US7232924B2 (en) | 2001-06-11 | 2007-06-19 | Xenoport, Inc. | Methods for synthesis of acyloxyalkyl derivatives of GABA analogs |
| US7049333B2 (en) * | 2002-06-04 | 2006-05-23 | Sanofi-Aventis Deutschland Gmbh | Substituted thiophenes: compositions, processes of making, and uses in disease treatment and diagnosis |
| WO2004011429A1 (ja) * | 2002-07-26 | 2004-02-05 | Nihon Nohyaku Co., Ltd. | 新規なハロアルキルスルホンアニリド誘導体及び除草剤並びにその使用方法 |
| EP1602646A4 (en) * | 2003-02-19 | 2010-07-28 | Eisai R&D Man Co Ltd | PROCESS FOR PREPARING CYCLIC BENZAMIDINE DERIVATIVES |
| JP4786147B2 (ja) * | 2003-06-26 | 2011-10-05 | 武田薬品工業株式会社 | カンナビノイド受容体調節剤 |
| ATE536889T1 (de) * | 2003-07-08 | 2011-12-15 | Accumetrics Inc | Kontrollierte thrombozyten-aktivierung zur überwachung der behandlung von adp-antagonisten |
| US20070243632A1 (en) * | 2003-07-08 | 2007-10-18 | Coller Barry S | Methods for measuring platelet reactivity of patients that have received drug eluting stents |
| WO2005032464A2 (en) * | 2003-09-30 | 2005-04-14 | Merck & Co., Inc. | Phenyl pyrrolidine ether tachykinin receptor antagonists |
| WO2005035495A2 (en) * | 2003-10-08 | 2005-04-21 | Nicholas Piramal India Limited | Fibrinogen receptor antagonists and their use |
| MXPA06006035A (es) * | 2003-11-28 | 2007-01-26 | Sankyo Co | Derivado de amina ciclica que tiene un anillo heteroarilo. |
| JP4749702B2 (ja) * | 2003-11-28 | 2011-08-17 | 第一三共株式会社 | ヘテロアリール環を有する環状アミン誘導体 |
| AU2004312001B2 (en) * | 2003-12-19 | 2009-08-27 | Merck & Co., Inc. | Cyclic guanidines, compositions containing such compounds and methods of use |
| CN100515422C (zh) * | 2004-03-04 | 2009-07-22 | 卫材R&D管理有限公司 | 含有苄脒衍生物的组合物及苄脒衍生物的稳定化方法 |
| US7514450B2 (en) * | 2004-05-19 | 2009-04-07 | Neurosearch A/S | Azabicyclic aryl derivatives |
| US7585982B2 (en) | 2004-08-16 | 2009-09-08 | Eisai R&D Management Co., Ltd. | Methods for producing isoindole derivatives |
| WO2006018954A1 (ja) * | 2004-08-17 | 2006-02-23 | Eisai R & D Management Co., Ltd. | ジブロモフルオロベンゼン誘導体の製造方法 |
| WO2006023844A2 (en) * | 2004-08-20 | 2006-03-02 | Entremed, Inc. | Compositions and methods comprising proteinase activated receptor antagonists |
| JP4478157B2 (ja) * | 2004-10-13 | 2010-06-09 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | ヒドラジド誘導体 |
| JPWO2006051623A1 (ja) * | 2004-11-09 | 2008-05-29 | エーザイ株式会社 | トロンビン受容体アンタゴニストを有効成分とするくも膜下出血に伴う血管攣縮の治療剤 |
| JP2007084440A (ja) * | 2004-11-09 | 2007-04-05 | Eisai R & D Management Co Ltd | トロンビン受容体アンタゴニストを有効成分とするくも膜下出血に伴う血管攣縮の治療剤 |
| WO2006051648A1 (ja) * | 2004-11-09 | 2006-05-18 | Eisai R & D Management Co., Ltd. | トロンビン受容体アンタゴニストを有効成分とするくも膜下出血に伴う血管攣縮の治療剤 |
| DE102004061748A1 (de) * | 2004-12-22 | 2006-07-06 | Bayer Healthcare Ag | Azetidin-substituierte Pyrazoline |
| DE102004061750A1 (de) * | 2004-12-22 | 2006-07-06 | Bayer Healthcare Ag | Heteroaryl-substituierte Pyrazoline |
| CN100366595C (zh) * | 2005-02-28 | 2008-02-06 | 北京金源化学集团有限公司 | 一种经由中间体2-氟-6-卤代苯酚制备1,2-二烷氧基-3-氟苯的方法 |
| US7786330B2 (en) | 2005-02-28 | 2010-08-31 | Asahi Glass Company, Limited | Process for producing 1,2-dialkoxy-3-fluorobenzene |
| US7803822B2 (en) | 2005-04-06 | 2010-09-28 | Takeda Pharmaceutical Company Limited | Triazole derivative and use thereof |
| US7595169B2 (en) * | 2005-04-27 | 2009-09-29 | Accumetrics, Inc. | Method for determining percent platelet aggregation |
| US20090306059A1 (en) * | 2005-05-13 | 2009-12-10 | Tomio Kimura | Cyclic amine derivative having substituted alkyl group |
| JP2007001974A (ja) * | 2005-05-27 | 2007-01-11 | Sankyo Co Ltd | ヘテロアリール環を有する環状アミン誘導体を含有する医薬組成物 |
| US8921406B2 (en) | 2005-08-21 | 2014-12-30 | AbbVie Deutschland GmbH & Co. KG | 5-ring heteroaromatic compounds and their use as binding partners for 5-HT5 receptors |
| EP1926710B1 (en) * | 2005-09-15 | 2014-11-12 | UCB Pharma S.A. | 4-Substituted pyrrolidin-2-ones and their use |
| KR20080082661A (ko) * | 2006-01-12 | 2008-09-11 | 노키아 코포레이션 | 통신 시스템 내에서 파일럿 혼합화 |
| US20070232673A1 (en) * | 2006-01-19 | 2007-10-04 | Roth Gregory P | 2-Imino-benzimidazoles |
| WO2007102563A1 (ja) * | 2006-03-02 | 2007-09-13 | Eisai R & D Management Co., Ltd. | 炎症性マーカー測定によるトロンビン受容体アンタゴニストの効果の判定方法 |
| SI2000465T1 (sl) * | 2006-03-24 | 2011-04-29 | Eisai R&D Man Co Ltd | Derivat triazolona |
| TWI367112B (en) | 2006-06-30 | 2012-07-01 | Schering Corp | Immediate-release tablet formulations of a thrombin receptor antagonist |
| DE102006036023A1 (de) * | 2006-08-02 | 2008-02-07 | Sanofi-Aventis | Imino-imidazo-pyridinderivate mit antithrombotischer Aktivität |
| JPWO2008023438A1 (ja) * | 2006-08-25 | 2010-01-07 | 旭硝子株式会社 | 1,2−ジアルコキシ−3−フルオロベンゼンの製造方法 |
| WO2008026527A1 (fr) * | 2006-08-28 | 2008-03-06 | Kaneka Corporation | Procédé de fabrication d'un dérivé de 3-cyanopyrrolidine ou d'un de ses sels |
| GB2446652A (en) * | 2007-02-16 | 2008-08-20 | Inion Ltd | Osteogenic compounds |
| US20090022729A1 (en) * | 2007-04-13 | 2009-01-22 | Nigel Mackman | Methods and compositions for treating cardiac dysfunctions |
| US20080299587A1 (en) * | 2007-05-03 | 2008-12-04 | Dennis Durbin | Methods of measuring inhibition of platelet aggregation by thrombin receptor antagonists |
| TWI417100B (zh) * | 2007-06-07 | 2013-12-01 | Astrazeneca Ab | 二唑衍生物及其作為代謝型麩胺酸受體增效劑-842之用途 |
| US7807690B2 (en) * | 2007-09-21 | 2010-10-05 | Eisai R&D Management Co., Ltd. | 2,3-dihydro-iminoisoindole derivatives |
| WO2009068214A2 (de) * | 2007-11-30 | 2009-06-04 | Bayer Schering Pharma Aktiengesellschaft | Heteroaryl-substituierte piperidine |
| CN101917990B (zh) * | 2008-01-11 | 2012-11-28 | 卫材R&D管理有限公司 | 药物组合物、2-亚氨基吡咯烷衍生物用于制造药物组合物的用途和心脏病治疗用或改善用试剂盒 |
| ES2603302T3 (es) * | 2008-02-05 | 2017-02-24 | Sanofi | Imidazopiridazinas como inhibidores de PAR1, su obtención y empleo como medicamento |
| WO2009097972A1 (de) | 2008-02-05 | 2009-08-13 | Sanofi-Aventis | Sf5-derivate als par1-inhibitoren, ihre herstellung und verwendung als arzneimittel |
| MY148732A (en) | 2008-02-05 | 2013-05-31 | Sanofi Aventis | Triazolium salts as par1 inhibitors, production thereof, and use as medicaments |
| SI2240487T1 (sl) * | 2008-02-05 | 2012-04-30 | Sanofi Sa | Triazolopiridazini kot PAR1 inhibitorji, njihova priprava in uporaba kot zdravila |
| EP2268620A4 (en) * | 2008-03-27 | 2011-08-10 | Burnham Inst Medical Research | INHIBITORS OF THE ANTIGEN RECEPTOR-INDUCED ACTIVATION OF NF-KAPPA-B |
| US20100056519A1 (en) * | 2008-07-15 | 2010-03-04 | Serebruany Victor L | Composition and method for reducing platelet activation and for the treatment of thrombotic events |
| MX2011006000A (es) | 2008-12-08 | 2011-07-20 | Boehringer Ingelheim Int | Compuestos para tratar cancer. |
| WO2011015381A1 (en) * | 2009-08-05 | 2011-02-10 | Celltrend Gmbh | Method for prognosis of pulmonary arterial hypertension by detecting anti-par1-antibodies |
| EP2480531B1 (en) * | 2009-09-21 | 2014-11-05 | ChemoCentryx, Inc. | Pyrrolidinone carboxamide derivatives as chemerin-r (chemr23) modulators |
| US8673890B2 (en) * | 2009-10-29 | 2014-03-18 | Janssen Pharmaceutica Nv | 2,3-dihydro-1H-isoindol-1-imine derivatives useful as thrombin PAR-1 receptor antagonist |
| WO2011128421A1 (de) | 2010-04-16 | 2011-10-20 | Sanofi | Trizyklische pyridyl-vinyl-pyrrole als par1-inhibitoren |
| EP2558462B1 (de) | 2010-04-16 | 2014-10-22 | Sanofi | Pyridyl-vinyl-pyrazolo-chinoline als par1-inhibitoren |
| CN102241621A (zh) * | 2010-05-11 | 2011-11-16 | 江苏恒瑞医药股份有限公司 | 5,5-双取代-2-亚氨基吡咯烷类衍生物、其制备方法及其在医药上的应用 |
| WO2012014889A1 (ja) * | 2010-07-29 | 2012-02-02 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | フタロニトリル誘導体の製造方法 |
| CN102442965B (zh) * | 2010-09-30 | 2013-12-11 | 天津药物研究院 | 用于治疗血栓性疾病的par-1拮抗剂及其制备方法和用途 |
| CN102757396B (zh) * | 2011-04-28 | 2014-10-15 | 天津药物研究院 | 含苯并五元杂环的环外亚胺化合物、其制备方法和用途 |
| MX359634B (es) | 2011-12-21 | 2018-10-03 | Novira Therapeutics Inc | Agentes antivirales contra la hepatitis b. |
| JP6243844B2 (ja) * | 2012-09-20 | 2017-12-06 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | トロンビン受容体アンタゴニストを有効成分とする肺高血圧症の予防治療剤 |
| WO2014131847A1 (en) | 2013-02-28 | 2014-09-04 | Janssen R&D Ireland | Sulfamoyl-arylamides and the use thereof as medicaments for the treatment of hepatitis b |
| JO3603B1 (ar) | 2013-05-17 | 2020-07-05 | Janssen Sciences Ireland Uc | مشتقات سلفامويل بيرولاميد واستخدامها كادوية لمعالجة التهاب الكبد نوع بي |
| ES2695182T3 (es) | 2013-05-17 | 2019-01-02 | Janssen Sciences Ireland Uc | Derivados de sulfamoil tiofenamida y su uso como medicamentos para tratar la hepatitis B |
| ES2910848T3 (es) | 2013-09-26 | 2022-05-13 | Cadent Therapeutics Inc | Moduladores negativos de octahidro-ciclopenta[c]pirrol selectivos de NR2B |
| SI3102576T1 (sl) | 2014-02-03 | 2019-08-30 | Vitae Pharmaceuticals, Llc | Inhibitorji dihidropirolopiridina ROR-gama |
| CN104086501B (zh) * | 2014-07-23 | 2016-02-17 | 张远强 | 一种par-1拮抗剂、其制备方法和用途 |
| ES2715458T7 (es) | 2014-10-14 | 2020-05-28 | Vitae Pharmaceuticals Llc | Inhibidores de dihidropirrolopiridina de ROR-gamma |
| US9663515B2 (en) | 2014-11-05 | 2017-05-30 | Vitae Pharmaceuticals, Inc. | Dihydropyrrolopyridine inhibitors of ROR-gamma |
| US9845308B2 (en) | 2014-11-05 | 2017-12-19 | Vitae Pharmaceuticals, Inc. | Isoindoline inhibitors of ROR-gamma |
| WO2016085224A2 (en) * | 2014-11-25 | 2016-06-02 | Institute For Basic Science | N-heterocyclic carbene nitric oxide radical and application thereof |
| KR101657054B1 (ko) | 2014-11-25 | 2016-09-19 | 기초과학연구원 | N-헤테로고리 카벤 일산화질소 라디칼 화합물 및 그 응용 |
| WO2016114386A1 (ja) * | 2015-01-15 | 2016-07-21 | 国立研究開発法人国立精神・神経医療研究センター | 進行型免疫性脱髄疾患治療剤 |
| EP3331876B1 (en) | 2015-08-05 | 2020-10-07 | Vitae Pharmaceuticals, LLC | Modulators of ror-gamma |
| BR112018010018A2 (pt) | 2015-11-20 | 2018-11-21 | Vitae Pharmaceuticals Inc | moduladores de ror-gama |
| TWI757266B (zh) | 2016-01-29 | 2022-03-11 | 美商維它藥物有限責任公司 | ROR-γ調節劑 |
| AU2017248828A1 (en) | 2016-04-15 | 2018-11-01 | Janssen Sciences Ireland Uc | Combinations and methods comprising a capsid assembly inhibitor |
| US9481674B1 (en) | 2016-06-10 | 2016-11-01 | Vitae Pharmaceuticals, Inc. | Dihydropyrrolopyridine inhibitors of ROR-gamma |
| WO2019018975A1 (en) | 2017-07-24 | 2019-01-31 | Vitae Pharmaceuticals, Inc. | INHIBITORS OF ROR GAMMA |
| BR112020001246A2 (pt) | 2017-07-24 | 2020-07-21 | Vitae Pharmaceuticals, Llc | inibidores de rory |
| US10844044B2 (en) | 2018-06-14 | 2020-11-24 | Vanderbilt University | WDR5 inhibitors and modulators |
| CN109053546B (zh) * | 2018-07-05 | 2021-04-27 | 中国科学院兰州化学物理研究所 | 一种苯酞类衍生物及其制备方法和应用 |
| US10807959B2 (en) | 2018-08-16 | 2020-10-20 | Vanderbilt University | WDR5-MLL1 inhibitors and modulators |
| US20240043389A1 (en) * | 2020-09-01 | 2024-02-08 | Albert Einstein College Of Medicine | Compounds and methods for inhibition of bax-mediated cell death |
| KR102517368B1 (ko) * | 2020-09-03 | 2023-03-31 | 경희대학교 산학협력단 | 항진균 활성을 갖는 신규한 이미다졸 유도체의 염 및 이의 용도 |
| CN114181088B (zh) * | 2021-12-21 | 2024-05-17 | 大连大学 | 一种离子液体[TEA][TfOH]2催化制备α-卤代苯乙酮类化合物的方法 |
| KR102782945B1 (ko) * | 2022-05-24 | 2025-03-18 | 주식회사 이노보테라퓨틱스 | 벤조퓨라닐 히드록시페닐 메타논 옥심 유도체 및 이의 용도 |
| CN115521266A (zh) * | 2022-10-25 | 2022-12-27 | 广东医科大学 | 一种乙烯基异噁唑烷衍生物的制备方法 |
| CN116675677B (zh) * | 2023-08-02 | 2023-09-26 | 中国林业科学研究院林产化学工业研究所 | 一种c8漆酚衍生物及其制备方法和应用 |
Family Cites Families (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR8129E (fr) | 1906-03-09 | 1908-01-20 | Zeiss Carl Soc | Garniture de canon munie d'une lunette de visée |
| US6087380A (en) * | 1949-11-24 | 2000-07-11 | Boehringer Ingelheim Pharma Kg | Disubstituted bicyclic heterocycles, the preparations and the use thereof as pharmaceutical compositions |
| JPS4842875B1 (ja) | 1969-01-29 | 1973-12-14 | ||
| US3717648A (en) | 1970-10-21 | 1973-02-20 | Sterling Drug Inc | 1-phenyl-azacarbocyclic-2-imines |
| US4118504A (en) | 1970-11-05 | 1978-10-03 | Carlo Erba | Isoindoline derivatives for treating pain |
| DE2154525A1 (de) | 1970-11-05 | 1972-06-15 | Carlo Erba S.P.A., Mailand (Italien) | Isoindolinderivate und Verfahren zu ihrer Herstellung |
| GB1344663A (en) | 1970-11-10 | 1974-01-23 | Erba Carlo Spa | Isoindoline compounds |
| ZA722407B (en) | 1971-05-13 | 1973-01-31 | Richardson Merrell Inc | Substituted cycloalkyl lactamimides |
| JPS512868B2 (ja) | 1971-09-30 | 1976-01-29 | ||
| US3773788A (en) * | 1971-11-26 | 1973-11-20 | Standard Oil Co | Method for the preparation of n-(substituted phenyl)-2-iminopyrrolidines |
| US3920688A (en) | 1973-02-05 | 1975-11-18 | Monsanto Co | 2-imino derivatives of substituted imidazoles |
| US3859302A (en) * | 1973-02-05 | 1975-01-07 | Monsanto Co | Preparation of 2-imino-imidazole derivatives |
| US3904395A (en) * | 1973-02-05 | 1975-09-09 | Monsanto Co | 2-Imino derivatives of substituted imidazoles |
| US3887577A (en) * | 1973-07-05 | 1975-06-03 | Monsanto Co | Process for the preparation of 2-imino derivatives of substituted imidazoles |
| US4153235A (en) * | 1973-08-09 | 1979-05-08 | Richardson-Merrell Inc. | Substituted cycloalkyl lactamimides |
| DE2430354A1 (de) | 1974-06-25 | 1976-01-15 | Basf Ag | Neue substituierte 1-amino-isoindole, verfahren zu deren herstellung sowie diese enthaltende pharmazeutische zubereitungen |
| JPS5122720A (ja) | 1974-08-19 | 1976-02-23 | Sumitomo Chemical Co | Jukyobaifuanteigatadofutaroshianinganryono seizoho |
| GB1476949A (en) * | 1974-11-20 | 1977-06-16 | Wyeth John & Brother Ltd | Imidazo-1,2-a-benzimidazole and pyrimido-1,2-a-benzimidazole derivatives their preparation and their pharmaceutical compositions |
| GB1484615A (en) * | 1974-11-23 | 1977-09-01 | Lepetit Spa | Tricyclic n-containing derivatives |
| US4004016A (en) * | 1975-08-11 | 1977-01-18 | E. R. Squibb & Sons, Inc. | Amino-benzimidazole derivatives |
| JPS5371063A (en) | 1976-12-03 | 1978-06-24 | Grelan Pharmaceut Co Ltd | Preparation of 4-(1-9x9-2-isoindolinyl)acetophenone |
| WO1983002920A1 (fr) | 1982-02-27 | 1983-09-01 | Kabashima, Kazuo | Procede de coloration et materiau de formation de couleur |
| JPS6222760A (ja) | 1985-07-24 | 1987-01-30 | Sankyo Co Ltd | イソインドリン誘導体及びそれを有効成分とする農園芸用殺菌剤 |
| US5002941A (en) | 1985-12-12 | 1991-03-26 | Smithkline Beecham Corporation | Pyrrolo(1,2-a)imidazole and imidazo(1,2-a)pyridine derivatives and their use as 5-lipoxygenase pathway inhibitors |
| FR2595521B1 (fr) * | 1986-03-07 | 1988-10-21 | Electricite De France | Dispositif de telecomptage |
| ES2005450A6 (es) | 1987-11-16 | 1989-03-01 | Gema Sa | Procedimiento para la preparacion de derivados n(4-etil-2,3-dioxo)-piperacin-1-iln-carbonilo. |
| JP2805867B2 (ja) | 1989-07-19 | 1998-09-30 | 日本電気株式会社 | 電子写真感光体 |
| US5145818A (en) * | 1989-12-29 | 1992-09-08 | Mitsui Petrochemical Industries, Ltd. | Olefin polymerization catalyst and process for the polymerization of olefins |
| CA2048003A1 (en) | 1990-08-21 | 1992-02-22 | Serge Burner | Tricyclic pyridone derivatives |
| US5258387A (en) | 1990-08-21 | 1993-11-02 | Hoffmann-La Roche Inc. | Tricyclic pyridone derivatives |
| WO1992012590A1 (en) * | 1991-01-03 | 1992-07-23 | Sasktel | Data collection network apparatus and method |
| DE69213296T2 (de) * | 1991-04-16 | 1997-03-20 | Philips Electronics Nv | SMD-Widerstand |
| DE69429641T2 (de) | 1993-02-26 | 2002-08-29 | Otsuka Pharmaceutical Co., Ltd. | Thiazole oder imidazole derivate als maillard reaktion inhibitoren |
| JPH0732103A (ja) | 1993-07-19 | 1995-02-03 | Sumitomo Metal Ind Ltd | 溶融金属の鋳造用ノズル |
| AU688811B2 (en) * | 1993-10-21 | 1998-03-19 | G.D. Searle & Co. | Amidino derivatives useful as nitric oxide synthase inhibitors |
| DK0775702T3 (da) | 1994-08-12 | 2003-08-18 | Toyama Chemical Co Ltd | Hidtil ukendte quinolon- eller naphthylidoncarboxylsyrederivater eller salt deraf |
| US5629322A (en) | 1994-11-15 | 1997-05-13 | Merck & Co., Inc. | Cyclic amidine analogs as inhibitors of nitric oxide synthase |
| JP3666922B2 (ja) | 1995-02-21 | 2005-06-29 | 山本化成株式会社 | カルボン酸塩、その製造方法および該塩化合物を用いる感熱記録材料 |
| TW401408B (en) | 1995-07-21 | 2000-08-11 | Fujisawa Pharmaceutical Co | Heterocyclic compounds having prostaglandin I2 agonism |
| AU3440597A (en) | 1996-07-02 | 1998-01-21 | Novartis Ag | N-phenylimino heterocyclic derivatives and their use as herbicides |
| JP2707239B2 (ja) | 1996-07-26 | 1998-01-28 | 日本バイエルアグロケム株式会社 | シアノアルキルーヘテロ環式化合物及び殺虫剤 |
| UA62939C2 (uk) | 1996-10-02 | 2004-01-15 | Янссен Фармацевтика Н.В. | Похідне 2-ціаноіміноімідазолу, фармацевтична композиція та спосіб одержання сполуки |
| US5977134A (en) * | 1996-12-05 | 1999-11-02 | Merck & Co., Inc. | Inhibitors of farnesyl-protein transferase |
| FR2757053B1 (fr) | 1996-12-12 | 1999-01-22 | Oreal | Utilisation de derives de la di-imino-isoindoline ou de la 3-amino-isoindolone pour la teinture des fibres keratiniques et compositions de teinture les renfermant |
| PE121699A1 (es) * | 1997-02-18 | 1999-12-08 | Boehringer Ingelheim Pharma | Heterociclos biciclicos disustituidos como inhibidores de la trombina |
| US6187799B1 (en) * | 1997-05-23 | 2001-02-13 | Onyx Pharmaceuticals | Inhibition of raf kinase activity using aryl ureas |
| WO1999000127A1 (en) * | 1997-06-26 | 1999-01-07 | Eli Lilly And Company | Antithrombotic agents |
| US6465484B1 (en) * | 1997-09-26 | 2002-10-15 | Merck & Co., Inc. | Angiogenesis inhibitors |
| HUP0100607A3 (en) | 1997-11-25 | 2002-06-28 | Schering Corp | Thrombin receptor antagonists and pharmaceutical compositions containing them |
| EP1060166A1 (de) * | 1998-02-03 | 2000-12-20 | Boehringer Ingelheim Pharma KG | 5-gliedrige benzokondensierte heterocyclen als antithrombotika |
| US6114532A (en) | 1998-02-03 | 2000-09-05 | Boehringer Ingelheim Pharma Kg | Bicyclic heterocycles, the preparation thereof, and their use as pharmaceuticals |
| EP1091942B1 (en) | 1998-07-02 | 2005-03-30 | Neurosearch A/S | Potassium channel blocking agents |
| US6194447B1 (en) * | 1998-07-02 | 2001-02-27 | Neurosearch A/S | Bis (benzimidazole) derivatives serving as potassium blocking agents |
| EP1176141A4 (en) | 1999-03-05 | 2002-08-14 | Suntory Ltd | HETEROCYCLIC COMPOUNDS HAVING AN EFFECT ACTIVATING THE NICOTINE ACETYL CHOLINE -g (a) 4-g (b) 2-RECEPTOR |
| US6376530B1 (en) | 1999-05-10 | 2002-04-23 | Merck & Co., Inc. | Cyclic amidines useful as NMDA NR2B antagonists |
| JP3647338B2 (ja) * | 1999-11-11 | 2005-05-11 | 富士通株式会社 | 画像信号解像度変換方法及び装置 |
| DE60120748T2 (de) * | 2000-11-10 | 2007-05-16 | Eli Lilly And Co., Indianapolis | 3-substituierte oxindolderivate als beta-3-agonisten |
| JP2002155060A (ja) | 2000-11-15 | 2002-05-28 | Japan Tobacco Inc | イミダゾール化合物及びその用途 |
| CN1243735C (zh) | 2001-04-19 | 2006-03-01 | 卫材株式会社 | 2-亚氨基吡咯烷衍生物 |
| JP4151310B2 (ja) | 2001-05-22 | 2008-09-17 | Dic株式会社 | 硬化性不飽和樹脂組成物 |
| US6726177B2 (en) | 2002-07-02 | 2004-04-27 | Value Valves Co., Ltd. | Valve with improved junk ring structure |
| JP3725843B2 (ja) * | 2002-07-05 | 2005-12-14 | ローム株式会社 | 反射型センサ |
| EP1602646A4 (en) | 2003-02-19 | 2010-07-28 | Eisai R&D Man Co Ltd | PROCESS FOR PREPARING CYCLIC BENZAMIDINE DERIVATIVES |
-
2002
- 2002-04-19 CN CNB028085655A patent/CN1243735C/zh not_active Expired - Fee Related
- 2002-04-19 AT AT02720534T patent/ATE425964T1/de not_active IP Right Cessation
- 2002-04-19 DE DE60231608T patent/DE60231608D1/de not_active Expired - Lifetime
- 2002-04-19 CA CA2446924A patent/CA2446924C/en not_active Expired - Fee Related
- 2002-04-19 KR KR1020037013674A patent/KR100749794B1/ko not_active Expired - Fee Related
- 2002-04-19 KR KR1020057009505A patent/KR100749795B1/ko not_active Expired - Fee Related
- 2002-04-19 BR BR0208985-8A patent/BR0208985A/pt not_active IP Right Cessation
- 2002-04-19 JP JP2002585394A patent/JP4251872B2/ja not_active Expired - Fee Related
- 2002-04-19 US US10/475,045 patent/US20040242627A1/en not_active Abandoned
- 2002-04-19 AT AT05022069T patent/ATE538090T1/de active
- 2002-04-19 US US10/475,118 patent/US7304083B2/en not_active Expired - Fee Related
- 2002-04-19 WO PCT/JP2002/003949 patent/WO2002085850A1/ja not_active Ceased
- 2002-04-19 AT AT02724628T patent/ATE534627T1/de active
- 2002-04-19 WO PCT/JP2002/003961 patent/WO2002085855A1/ja not_active Ceased
- 2002-04-19 ES ES11166172.4T patent/ES2462995T3/es not_active Expired - Lifetime
- 2002-04-19 EP EP02718622A patent/EP1391456B1/en not_active Expired - Lifetime
- 2002-04-19 PL PL02368109A patent/PL368109A1/xx unknown
- 2002-04-19 IL IL15849102A patent/IL158491A0/xx unknown
- 2002-04-19 EP EP05022069A patent/EP1614680B1/en not_active Expired - Lifetime
- 2002-04-19 EP EP11166172.4A patent/EP2385039B1/en not_active Expired - Lifetime
- 2002-04-19 WO PCT/JP2002/003950 patent/WO2002088092A1/ja not_active Ceased
- 2002-04-19 EP EP02720536A patent/EP1394152A4/en not_active Withdrawn
- 2002-04-19 EP EP02720534A patent/EP1386912B1/en not_active Expired - Lifetime
- 2002-04-19 WO PCT/JP2002/003952 patent/WO2002088094A1/ja not_active Ceased
- 2002-04-19 JP JP2002585396A patent/JP4445201B2/ja not_active Expired - Fee Related
- 2002-04-19 CZ CZ20032824A patent/CZ303865B6/cs not_active IP Right Cessation
- 2002-04-19 JP JP2002583382A patent/JP3795458B2/ja not_active Expired - Fee Related
- 2002-04-19 EP EP02724628A patent/EP1391451B1/en not_active Expired - Lifetime
- 2002-04-19 CN CNB2005100804047A patent/CN100402499C/zh not_active Expired - Fee Related
- 2002-04-19 NZ NZ528820A patent/NZ528820A/en not_active IP Right Cessation
- 2002-04-19 MX MXPA03009497A patent/MXPA03009497A/es active IP Right Grant
- 2002-04-19 US US10/475,188 patent/US7244730B2/en not_active Expired - Fee Related
- 2002-04-19 RU RU2003133664/04A patent/RU2270192C2/ru not_active IP Right Cessation
- 2002-04-19 JP JP2002583377A patent/JP4220249B2/ja not_active Expired - Fee Related
- 2002-04-19 DE DE60233043T patent/DE60233043D1/de not_active Expired - Lifetime
- 2002-04-19 CN CNB2005100804032A patent/CN1321996C/zh not_active Expired - Fee Related
- 2002-04-19 US US10/475,060 patent/US7476688B2/en not_active Expired - Fee Related
- 2002-04-19 HU HU0400467A patent/HUP0400467A3/hu unknown
-
2003
- 2003-10-16 ZA ZA2003/08064A patent/ZA200308064B/en unknown
- 2003-10-16 NO NO20034632A patent/NO327849B1/no not_active IP Right Cessation
- 2003-10-19 IL IL158491A patent/IL158491A/en not_active IP Right Cessation
-
2005
- 2005-05-17 AU AU2005202135A patent/AU2005202135B2/en not_active Ceased
- 2005-06-22 US US11/158,941 patent/US20050245592A1/en not_active Abandoned
-
2006
- 2006-02-17 JP JP2006041255A patent/JP4464928B2/ja not_active Expired - Fee Related
- 2006-02-17 JP JP2006041270A patent/JP4516922B2/ja not_active Expired - Fee Related
-
2008
- 2008-07-17 US US12/175,015 patent/US20090215795A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4220249B2 (ja) | サイクリックアミジン誘導体 | |
| JP2006225393A5 (ja) | ||
| JP2006206595A5 (ja) | ||
| RU2142453C1 (ru) | ПРОИЗВОДНЫЕ 1-[ω-(3,4-ДИГИДРО-2-НАФТАЛИНИЛ)АЛКИЛ]ЦИКЛИЧЕСКОГО АМИНА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | |
| WO2007029078A2 (en) | Succinimide and glutarimide derivatives as adrenergic receptor antagonists | |
| JPH0235747B2 (ja) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050112 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20060814 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080819 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081007 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20081104 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20081113 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111121 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |