ES2939007T3 - Composiciones de extractos de plantas para formar recubrimientos protectores - Google Patents
Composiciones de extractos de plantas para formar recubrimientos protectores Download PDFInfo
- Publication number
- ES2939007T3 ES2939007T3 ES19214825T ES19214825T ES2939007T3 ES 2939007 T3 ES2939007 T3 ES 2939007T3 ES 19214825 T ES19214825 T ES 19214825T ES 19214825 T ES19214825 T ES 19214825T ES 2939007 T3 ES2939007 T3 ES 2939007T3
- Authority
- ES
- Spain
- Prior art keywords
- cutin
- esters
- oligomers
- alkenyl
- alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000203 mixture Substances 0.000 title claims description 257
- 239000011253 protective coating Substances 0.000 title claims description 26
- 239000000419 plant extract Substances 0.000 title description 34
- 229920000832 Cutin Polymers 0.000 claims abstract description 252
- 239000000178 monomer Substances 0.000 claims abstract description 169
- 238000000034 method Methods 0.000 claims abstract description 167
- 239000002904 solvent Substances 0.000 claims abstract description 158
- 238000010438 heat treatment Methods 0.000 claims abstract description 27
- 150000001875 compounds Chemical class 0.000 claims description 140
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 128
- 241000196324 Embryophyta Species 0.000 claims description 118
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 81
- 150000002148 esters Chemical class 0.000 claims description 75
- 230000008569 process Effects 0.000 claims description 75
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 67
- 239000000463 material Substances 0.000 claims description 67
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 64
- 239000000126 substance Substances 0.000 claims description 53
- 125000003118 aryl group Chemical group 0.000 claims description 52
- 125000001072 heteroaryl group Chemical group 0.000 claims description 47
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 46
- 235000021122 unsaturated fatty acids Nutrition 0.000 claims description 41
- 229910052736 halogen Inorganic materials 0.000 claims description 38
- 150000002367 halogens Chemical class 0.000 claims description 38
- 229920006395 saturated elastomer Polymers 0.000 claims description 33
- 125000003342 alkenyl group Chemical group 0.000 claims description 30
- -1 unsaturated fatty acid esters Chemical class 0.000 claims description 27
- 150000004670 unsaturated fatty acids Chemical class 0.000 claims description 27
- 125000004494 ethyl ester group Chemical group 0.000 claims description 26
- 125000000304 alkynyl group Chemical group 0.000 claims description 25
- 125000000217 alkyl group Chemical group 0.000 claims description 23
- 239000012298 atmosphere Substances 0.000 claims description 23
- 238000000605 extraction Methods 0.000 claims description 23
- 125000005908 glyceryl ester group Chemical group 0.000 claims description 23
- 238000009835 boiling Methods 0.000 claims description 20
- 239000007788 liquid Substances 0.000 claims description 17
- 239000002253 acid Substances 0.000 claims description 15
- 235000014113 dietary fatty acids Nutrition 0.000 claims description 14
- 239000000194 fatty acid Substances 0.000 claims description 14
- 229930195729 fatty acid Natural products 0.000 claims description 14
- 150000004671 saturated fatty acids Chemical class 0.000 claims description 14
- 238000004519 manufacturing process Methods 0.000 claims description 12
- 150000004702 methyl esters Chemical class 0.000 claims description 12
- 235000003441 saturated fatty acids Nutrition 0.000 claims description 12
- 235000013399 edible fruits Nutrition 0.000 claims description 11
- 150000004665 fatty acids Chemical class 0.000 claims description 11
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 10
- 125000004432 carbon atom Chemical group C* 0.000 claims description 10
- 125000000623 heterocyclic group Chemical group 0.000 claims description 10
- 239000007791 liquid phase Substances 0.000 claims description 7
- 238000012691 depolymerization reaction Methods 0.000 claims description 6
- 230000015572 biosynthetic process Effects 0.000 claims description 5
- 125000000392 cycloalkenyl group Chemical group 0.000 claims description 5
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 3
- 238000007385 chemical modification Methods 0.000 claims description 3
- 230000032050 esterification Effects 0.000 claims description 3
- 238000005886 esterification reaction Methods 0.000 claims description 3
- 241000894007 species Species 0.000 claims description 2
- 229920000642 polymer Polymers 0.000 claims 3
- 238000005809 transesterification reaction Methods 0.000 claims 1
- 230000002378 acidificating effect Effects 0.000 abstract description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 162
- 239000000047 product Substances 0.000 description 140
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 126
- 239000006227 byproduct Substances 0.000 description 68
- 238000000576 coating method Methods 0.000 description 38
- 239000006228 supernatant Substances 0.000 description 38
- 238000000944 Soxhlet extraction Methods 0.000 description 34
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 30
- 240000003768 Solanum lycopersicum Species 0.000 description 30
- VJZBXAQGWLMYMS-UHFFFAOYSA-N 10,16-Dihydroxyhexadecanoic acid Chemical compound OCCCCCCC(O)CCCCCCCCC(O)=O VJZBXAQGWLMYMS-UHFFFAOYSA-N 0.000 description 27
- 238000001816 cooling Methods 0.000 description 25
- 239000002244 precipitate Substances 0.000 description 25
- 244000025272 Persea americana Species 0.000 description 22
- 235000008673 Persea americana Nutrition 0.000 description 22
- 239000000284 extract Substances 0.000 description 20
- 239000000758 substrate Substances 0.000 description 19
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 19
- 238000006243 chemical reaction Methods 0.000 description 18
- 239000006184 cosolvent Substances 0.000 description 17
- 239000012535 impurity Substances 0.000 description 15
- 239000010410 layer Substances 0.000 description 15
- 238000004949 mass spectrometry Methods 0.000 description 14
- 238000002390 rotary evaporation Methods 0.000 description 13
- 239000011248 coating agent Substances 0.000 description 12
- 239000000287 crude extract Substances 0.000 description 12
- 235000021588 free fatty acids Nutrition 0.000 description 12
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- 239000000243 solution Substances 0.000 description 12
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 11
- 238000000354 decomposition reaction Methods 0.000 description 11
- 238000010932 ethanolysis reaction Methods 0.000 description 11
- 238000001914 filtration Methods 0.000 description 11
- YFRDEHYAUAROBO-UHFFFAOYSA-N 10,18-dihydroxyoctadecanoic acid Chemical compound OCCCCCCCCC(O)CCCCCCCCC(O)=O YFRDEHYAUAROBO-UHFFFAOYSA-N 0.000 description 10
- 239000007787 solid Substances 0.000 description 10
- 238000012512 characterization method Methods 0.000 description 9
- IPCSVZSSVZVIGE-UHFFFAOYSA-N palmitic acid group Chemical group C(CCCCCCCCCCCCCCC)(=O)O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 9
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- 239000000654 additive Substances 0.000 description 8
- 230000000996 additive effect Effects 0.000 description 8
- 239000000470 constituent Substances 0.000 description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 8
- 239000007789 gas Substances 0.000 description 8
- 230000003647 oxidation Effects 0.000 description 8
- 238000007254 oxidation reaction Methods 0.000 description 8
- 239000012043 crude product Substances 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- MEHUJCGAYMDLEL-UHFFFAOYSA-N Aleuretic Acid Chemical compound OCCCCCCC(O)C(O)CCCCCCCC(O)=O MEHUJCGAYMDLEL-UHFFFAOYSA-N 0.000 description 6
- 238000005481 NMR spectroscopy Methods 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 230000015556 catabolic process Effects 0.000 description 6
- FBBCRDRITUULHX-UHFFFAOYSA-N ethyl 10,16-dihydroxyhexadecanoate Chemical compound CCOC(=O)CCCCCCCCC(O)CCCCCCO FBBCRDRITUULHX-UHFFFAOYSA-N 0.000 description 6
- 210000000056 organ Anatomy 0.000 description 6
- 239000012071 phase Substances 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 239000007858 starting material Substances 0.000 description 6
- 238000005160 1H NMR spectroscopy Methods 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 5
- 239000002028 Biomass Substances 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- 241000233866 Fungi Species 0.000 description 5
- 239000006057 Non-nutritive feed additive Substances 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 238000000262 chemical ionisation mass spectrometry Methods 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- 238000006731 degradation reaction Methods 0.000 description 5
- 230000007613 environmental effect Effects 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 150000004676 glycans Chemical class 0.000 description 5
- 238000001027 hydrothermal synthesis Methods 0.000 description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 238000005457 optimization Methods 0.000 description 5
- 229920001282 polysaccharide Polymers 0.000 description 5
- 239000005017 polysaccharide Substances 0.000 description 5
- 238000012545 processing Methods 0.000 description 5
- 238000005057 refrigeration Methods 0.000 description 5
- 235000013311 vegetables Nutrition 0.000 description 5
- 239000001993 wax Substances 0.000 description 5
- UGAGPNKCDRTDHP-UHFFFAOYSA-N 16-hydroxyhexadecanoic acid Chemical compound OCCCCCCCCCCCCCCCC(O)=O UGAGPNKCDRTDHP-UHFFFAOYSA-N 0.000 description 4
- XWQVQSXLXAXOPJ-QNGMFEMESA-N 4-[[[6-[5-chloro-2-[[4-[[(2r)-1-methoxypropan-2-yl]amino]cyclohexyl]amino]pyridin-4-yl]pyridin-2-yl]amino]methyl]oxane-4-carbonitrile Chemical compound C1CC(N[C@H](C)COC)CCC1NC1=CC(C=2N=C(NCC3(CCOCC3)C#N)C=CC=2)=C(Cl)C=N1 XWQVQSXLXAXOPJ-QNGMFEMESA-N 0.000 description 4
- OISFHODBOQNZAG-UHFFFAOYSA-N 9,10,18-trihydroxyoctadecanoic acid Chemical compound OCCCCCCCCC(O)C(O)CCCCCCCC(O)=O OISFHODBOQNZAG-UHFFFAOYSA-N 0.000 description 4
- XSIHTLJPWOWWPE-UHFFFAOYSA-N 9,16-dihydroxy-palmitic acid Chemical compound OCCCCCCCC(O)CCCCCCCC(O)=O XSIHTLJPWOWWPE-UHFFFAOYSA-N 0.000 description 4
- BTDPBXZCKBVWTJ-UHFFFAOYSA-N 9,18-dihydroxyoctadecanoic acid Chemical compound OCCCCCCCCCC(O)CCCCCCCC(O)=O BTDPBXZCKBVWTJ-UHFFFAOYSA-N 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- 235000021314 Palmitic acid Nutrition 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 238000001035 drying Methods 0.000 description 4
- 150000002194 fatty esters Chemical class 0.000 description 4
- 239000012065 filter cake Substances 0.000 description 4
- 235000013305 food Nutrition 0.000 description 4
- 239000011491 glass wool Substances 0.000 description 4
- 238000005984 hydrogenation reaction Methods 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 4
- 230000000269 nucleophilic effect Effects 0.000 description 4
- 239000001301 oxygen Substances 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 239000011241 protective layer Substances 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 230000035484 reaction time Effects 0.000 description 4
- 238000001195 ultra high performance liquid chromatography Methods 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 150000001298 alcohols Chemical class 0.000 description 3
- 150000001299 aldehydes Chemical class 0.000 description 3
- 150000001335 aliphatic alkanes Chemical class 0.000 description 3
- 229930013930 alkaloid Natural products 0.000 description 3
- 150000001450 anions Chemical class 0.000 description 3
- 159000000032 aromatic acids Chemical class 0.000 description 3
- 230000004888 barrier function Effects 0.000 description 3
- 235000021466 carotenoid Nutrition 0.000 description 3
- 150000001747 carotenoids Chemical class 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 150000001768 cations Chemical class 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 239000000539 dimer Substances 0.000 description 3
- 229930003935 flavonoid Natural products 0.000 description 3
- 235000017173 flavonoids Nutrition 0.000 description 3
- 150000002215 flavonoids Chemical class 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- 229930013686 lignan Natural products 0.000 description 3
- 150000005692 lignans Chemical class 0.000 description 3
- 235000009408 lignans Nutrition 0.000 description 3
- 238000004806 packaging method and process Methods 0.000 description 3
- 238000010587 phase diagram Methods 0.000 description 3
- 150000002989 phenols Chemical class 0.000 description 3
- 238000005086 pumping Methods 0.000 description 3
- 239000007921 spray Substances 0.000 description 3
- 150000003505 terpenes Chemical class 0.000 description 3
- 230000007704 transition Effects 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- 238000005303 weighing Methods 0.000 description 3
- OISFHODBOQNZAG-DLBZAZTESA-N 9,10,18-Trihydroxyoctadecanoic acid Natural products OCCCCCCCC[C@H](O)[C@H](O)CCCCCCCC(O)=O OISFHODBOQNZAG-DLBZAZTESA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 208000034656 Contusions Diseases 0.000 description 2
- 238000007309 Fischer-Speier esterification reaction Methods 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- 240000000851 Vaccinium corymbosum Species 0.000 description 2
- 235000003095 Vaccinium corymbosum Nutrition 0.000 description 2
- 235000017537 Vaccinium myrtillus Nutrition 0.000 description 2
- 241000607479 Yersinia pestis Species 0.000 description 2
- 239000012736 aqueous medium Substances 0.000 description 2
- 230000004790 biotic stress Effects 0.000 description 2
- 235000021014 blueberries Nutrition 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 238000000151 deposition Methods 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- OWNLLILEAVFEFO-UHFFFAOYSA-N methyl 10,16-dihydroxyhexadecanoate Chemical compound COC(=O)CCCCCCCCC(O)CCCCCCO OWNLLILEAVFEFO-UHFFFAOYSA-N 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 235000014571 nuts Nutrition 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 239000003002 pH adjusting agent Substances 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 238000001782 photodegradation Methods 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 239000011343 solid material Substances 0.000 description 2
- 239000008247 solid mixture Substances 0.000 description 2
- 238000005507 spraying Methods 0.000 description 2
- 239000012134 supernatant fraction Substances 0.000 description 2
- 239000013638 trimer Substances 0.000 description 2
- 238000009834 vaporization Methods 0.000 description 2
- 230000008016 vaporization Effects 0.000 description 2
- RPQJFAIEPUKQHK-IWQZZHSRSA-N (9Z)-16-hydroxyhexadec-9-enoic acid Chemical compound OCCCCCC\C=C/CCCCCCCC(O)=O RPQJFAIEPUKQHK-IWQZZHSRSA-N 0.000 description 1
- DLTAWNZQSGEZLQ-HWKANZROSA-N (E)-16-hydroxyhexadec-10-enoic acid Chemical compound OCCCCC/C=C/CCCCCCCCC(=O)O DLTAWNZQSGEZLQ-HWKANZROSA-N 0.000 description 1
- DLTAWNZQSGEZLQ-HYXAFXHYSA-N (Z)-16-hydroxyhexadec-10-enoic acid Chemical compound OCCCCC\C=C/CCCCCCCCC(=O)O DLTAWNZQSGEZLQ-HYXAFXHYSA-N 0.000 description 1
- YFRMOIMZVUXHCF-HNQUOIGGSA-N 1,3-dihydroxypropan-2-yl (E)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC/C=C/CCCCCCCC(=O)OC(CO)CO YFRMOIMZVUXHCF-HNQUOIGGSA-N 0.000 description 1
- YFRMOIMZVUXHCF-IWQZZHSRSA-N 1,3-dihydroxypropan-2-yl (Z)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC\C=C/CCCCCCCC(=O)OC(CO)CO YFRMOIMZVUXHCF-IWQZZHSRSA-N 0.000 description 1
- CPMLBHCSPPPITL-UHFFFAOYSA-N 1,3-dihydroxypropan-2-yl 10,16-dihydroxyhexadecanoate Chemical compound OCCCCCCC(O)CCCCCCCCC(=O)OC(CO)CO CPMLBHCSPPPITL-UHFFFAOYSA-N 0.000 description 1
- CADWAGFKCYLGQI-UHFFFAOYSA-N 1,3-dihydroxypropan-2-yl 10,18-dihydroxyoctadecanoate Chemical compound OC(CCCCCCCCC(=O)OC(CO)CO)CCCCCCCCO CADWAGFKCYLGQI-UHFFFAOYSA-N 0.000 description 1
- YAKDEIAVAOMHMX-UHFFFAOYSA-N 1,3-dihydroxypropan-2-yl 10-hydroxyhexadec-15-enoate Chemical compound OC(CCCCCCCCC(=O)OC(CO)CO)CCCCC=C YAKDEIAVAOMHMX-UHFFFAOYSA-N 0.000 description 1
- KSGFJKSNZLTEDI-UHFFFAOYSA-N 1-[benzyl(methyl)amino]-3-[3-(trifluoromethyl)phenoxy]propan-2-ol Chemical compound C=1C=CC=CC=1CN(C)CC(O)COC1=CC=CC(C(F)(F)F)=C1 KSGFJKSNZLTEDI-UHFFFAOYSA-N 0.000 description 1
- VJZBXAQGWLMYMS-UHFFFAOYSA-M 10,16-dihydroxyhexadecanoate Chemical compound OCCCCCCC(O)CCCCCCCCC([O-])=O VJZBXAQGWLMYMS-UHFFFAOYSA-M 0.000 description 1
- RPQJFAIEPUKQHK-HNQUOIGGSA-N 16-hydroxy-9E-hexadecenoic acid Chemical compound OCCCCCC\C=C\CCCCCCCC(O)=O RPQJFAIEPUKQHK-HNQUOIGGSA-N 0.000 description 1
- HAFGDDFWCDLGEW-UHFFFAOYSA-N 2,2-dihydroxyhexadecanoic acid Chemical class CCCCCCCCCCCCCCC(O)(O)C(O)=O HAFGDDFWCDLGEW-UHFFFAOYSA-N 0.000 description 1
- PUTHBBXPAQTOMK-HNQUOIGGSA-N 2,3-dihydroxypropyl (E)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC/C=C/CCCCCCCC(=O)OCC(CO)O PUTHBBXPAQTOMK-HNQUOIGGSA-N 0.000 description 1
- PUTHBBXPAQTOMK-IWQZZHSRSA-N 2,3-dihydroxypropyl (Z)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC\C=C/CCCCCCCC(=O)OCC(CO)O PUTHBBXPAQTOMK-IWQZZHSRSA-N 0.000 description 1
- ZCSPMSRILJREOV-UHFFFAOYSA-N 2,3-dihydroxypropyl 10,16-dihydroxyhexadecanoate Chemical compound OCCCCCCC(O)CCCCCCCCC(=O)OCC(O)CO ZCSPMSRILJREOV-UHFFFAOYSA-N 0.000 description 1
- FCHDDNHFKIKCIJ-UHFFFAOYSA-N 2,3-dihydroxypropyl 10,18-dihydroxyoctadecanoate Chemical compound OC(CCCCCCCCC(=O)OCC(CO)O)CCCCCCCCO FCHDDNHFKIKCIJ-UHFFFAOYSA-N 0.000 description 1
- RHSNZPVMORXINW-UHFFFAOYSA-N 2,3-dihydroxypropyl 10-hydroxyhexadec-15-enoate Chemical compound OC(CCCCCCCCC(=O)OCC(CO)O)CCCCC=C RHSNZPVMORXINW-UHFFFAOYSA-N 0.000 description 1
- BBNYCLAREVXOSG-UHFFFAOYSA-N 2-palmitoylglycerol Chemical compound CCCCCCCCCCCCCCCC(=O)OC(CO)CO BBNYCLAREVXOSG-UHFFFAOYSA-N 0.000 description 1
- IUUBODMNDCMSEU-UHFFFAOYSA-N 3-[6-amino-3-(3-hydroxypropyl)-2,4,5,9-tetrahydropurin-2-yl]propan-1-ol Chemical compound NC1=NC(CCCO)N(CCCO)C2N=CNC12 IUUBODMNDCMSEU-UHFFFAOYSA-N 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- 241000207199 Citrus Species 0.000 description 1
- 235000005979 Citrus limon Nutrition 0.000 description 1
- 244000131522 Citrus pyriformis Species 0.000 description 1
- RBNPOMFGQQGHHO-UWTATZPHSA-M D-glycerate Chemical compound OC[C@@H](O)C([O-])=O RBNPOMFGQQGHHO-UWTATZPHSA-M 0.000 description 1
- 240000003133 Elaeis guineensis Species 0.000 description 1
- 235000001950 Elaeis guineensis Nutrition 0.000 description 1
- 240000009088 Fragaria x ananassa Species 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 240000008790 Musa x paradisiaca Species 0.000 description 1
- LOBOQEVQRNKDQD-GQCTYLIASA-N OCCCCC/C=C/CCCCCCCCC(=O)OC Chemical compound OCCCCC/C=C/CCCCCCCCC(=O)OC LOBOQEVQRNKDQD-GQCTYLIASA-N 0.000 description 1
- JRBLQTRVXDWLIZ-HWKANZROSA-N OCCCCC/C=C/CCCCCCCCC(=O)OC(CO)CO Chemical compound OCCCCC/C=C/CCCCCCCCC(=O)OC(CO)CO JRBLQTRVXDWLIZ-HWKANZROSA-N 0.000 description 1
- JIZWEWFMGMKLQC-FNORWQNLSA-N OCCCCC/C=C/CCCCCCCCC(=O)OCC Chemical compound OCCCCC/C=C/CCCCCCCCC(=O)OCC JIZWEWFMGMKLQC-FNORWQNLSA-N 0.000 description 1
- XZUWSCKOEICART-HWKANZROSA-N OCCCCC/C=C/CCCCCCCCC(=O)OCC(CO)O Chemical compound OCCCCC/C=C/CCCCCCCCC(=O)OCC(CO)O XZUWSCKOEICART-HWKANZROSA-N 0.000 description 1
- LOBOQEVQRNKDQD-XQRVVYSFSA-N OCCCCC\C=C/CCCCCCCCC(=O)OC Chemical compound OCCCCC\C=C/CCCCCCCCC(=O)OC LOBOQEVQRNKDQD-XQRVVYSFSA-N 0.000 description 1
- JRBLQTRVXDWLIZ-HYXAFXHYSA-N OCCCCC\C=C/CCCCCCCCC(=O)OC(CO)CO Chemical compound OCCCCC\C=C/CCCCCCCCC(=O)OC(CO)CO JRBLQTRVXDWLIZ-HYXAFXHYSA-N 0.000 description 1
- JIZWEWFMGMKLQC-ALCCZGGFSA-N OCCCCC\C=C/CCCCCCCCC(=O)OCC Chemical compound OCCCCC\C=C/CCCCCCCCC(=O)OCC JIZWEWFMGMKLQC-ALCCZGGFSA-N 0.000 description 1
- XZUWSCKOEICART-HYXAFXHYSA-N OCCCCC\C=C/CCCCCCCCC(=O)OCC(CO)O Chemical compound OCCCCC\C=C/CCCCCCCCC(=O)OCC(CO)O XZUWSCKOEICART-HYXAFXHYSA-N 0.000 description 1
- 235000019482 Palm oil Nutrition 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 238000005299 abrasion Methods 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- LFVVNPBBFUSSHL-UHFFFAOYSA-N alexidine Chemical compound CCCCC(CC)CNC(=N)NC(=N)NCCCCCCNC(=N)NC(=N)NCC(CC)CCCC LFVVNPBBFUSSHL-UHFFFAOYSA-N 0.000 description 1
- 239000012670 alkaline solution Substances 0.000 description 1
- 230000003113 alkalizing effect Effects 0.000 description 1
- VBIXEXWLHSRNKB-UHFFFAOYSA-N ammonium oxalate Chemical compound [NH4+].[NH4+].[O-]C(=O)C([O-])=O VBIXEXWLHSRNKB-UHFFFAOYSA-N 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 235000021015 bananas Nutrition 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 229920006025 bioresin Polymers 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 235000020971 citrus fruits Nutrition 0.000 description 1
- 239000008199 coating composition Substances 0.000 description 1
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 238000005112 continuous flow technique Methods 0.000 description 1
- 238000010411 cooking Methods 0.000 description 1
- 229920006037 cross link polymer Polymers 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 238000003618 dip coating Methods 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 239000012167 epicuticular wax Substances 0.000 description 1
- STICMCJKHUAQPR-HWKANZROSA-N ethyl (E)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC/C=C/CCCCCCCC(=O)OCC STICMCJKHUAQPR-HWKANZROSA-N 0.000 description 1
- STICMCJKHUAQPR-HYXAFXHYSA-N ethyl (Z)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC\C=C/CCCCCCCC(=O)OCC STICMCJKHUAQPR-HYXAFXHYSA-N 0.000 description 1
- QZDLRJYWXXLKPI-UHFFFAOYSA-N ethyl 10,18-dihydroxyoctadecanoate Chemical compound OC(CCCCCCCCC(=O)OCC)CCCCCCCCO QZDLRJYWXXLKPI-UHFFFAOYSA-N 0.000 description 1
- BGFYFLBWVQKPIG-UHFFFAOYSA-N ethyl 10-hydroxyhexadec-15-enoate Chemical compound OC(CCCCCCCCC(=O)OCC)CCCCC=C BGFYFLBWVQKPIG-UHFFFAOYSA-N 0.000 description 1
- 238000003810 ethyl acetate extraction Methods 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 150000002314 glycerols Chemical class 0.000 description 1
- 235000021384 green leafy vegetables Nutrition 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 230000033444 hydroxylation Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 229910000000 metal hydroxide Inorganic materials 0.000 description 1
- 150000004692 metal hydroxides Chemical class 0.000 description 1
- CTADAIAFJLTGMU-DUXPYHPUSA-N methyl (E)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC/C=C/CCCCCCCC(=O)OC CTADAIAFJLTGMU-DUXPYHPUSA-N 0.000 description 1
- CTADAIAFJLTGMU-RQOWECAXSA-N methyl (Z)-16-hydroxyhexadec-9-enoate Chemical compound OCCCCCC\C=C/CCCCCCCC(=O)OC CTADAIAFJLTGMU-RQOWECAXSA-N 0.000 description 1
- DBTSJZUVIGCMRU-UHFFFAOYSA-N methyl 10,18-dihydroxyoctadecanoate Chemical compound OC(CCCCCCCCC(=O)OC)CCCCCCCCO DBTSJZUVIGCMRU-UHFFFAOYSA-N 0.000 description 1
- AFPYFUCRDKPVSZ-UHFFFAOYSA-N methyl 10-hydroxyhexadec-15-enoate Chemical compound OC(CCCCCCCCC(=O)OC)CCCCC=C AFPYFUCRDKPVSZ-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000003595 mist Substances 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical class CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- 230000009965 odorless effect Effects 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229910000489 osmium tetroxide Inorganic materials 0.000 description 1
- 239000012285 osmium tetroxide Substances 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000020477 pH reduction Effects 0.000 description 1
- 239000005022 packaging material Substances 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 239000002540 palm oil Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 230000008832 photodamage Effects 0.000 description 1
- 235000017807 phytochemicals Nutrition 0.000 description 1
- 229930000223 plant secondary metabolite Natural products 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 235000013824 polyphenols Nutrition 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 235000013594 poultry meat Nutrition 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000000899 pressurised-fluid extraction Methods 0.000 description 1
- 150000003138 primary alcohols Chemical class 0.000 description 1
- 238000004886 process control Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 230000005070 ripening Effects 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 150000003333 secondary alcohols Chemical class 0.000 description 1
- 235000015170 shellfish Nutrition 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000002689 soil Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 235000021012 strawberries Nutrition 0.000 description 1
- 238000000194 supercritical-fluid extraction Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000009967 tasteless effect Effects 0.000 description 1
- 238000009283 thermal hydrolysis Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
- A01N25/32—Ingredients for reducing the noxious effect of the active substances to organisms other than pests, e.g. toxicity reducing compositions, self-destructing compositions
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/09—Preparation of carboxylic acids or their salts, halides or anhydrides from carboxylic acid esters or lactones
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
- A01N25/34—Shaped forms, e.g. sheets, not provided for in any other sub-group of this main group
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/06—Unsaturated carboxylic acids or thio analogues thereof; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/36—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing at least one carboxylic group or a thio analogue, or a derivative thereof, and a singly bound oxygen or sulfur atom attached to the same carbon skeleton, this oxygen or sulfur atom not being a member of a carboxylic group or of a thio analogue, or of a derivative thereof, e.g. hydroxy-carboxylic acids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D11/00—Solvent extraction
- B01D11/02—Solvent extraction of solids
- B01D11/028—Flow sheets
- B01D11/0284—Multistage extraction
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D11/00—Solvent extraction
- B01D11/02—Solvent extraction of solids
- B01D11/0288—Applications, solvents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/132—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by reduction of an oxygen containing functional group
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/17—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrogenation of carbon-to-carbon double or triple bonds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/347—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups
- C07C51/36—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups by hydrogenation of carbon-to-carbon unsaturated bonds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/347—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups
- C07C51/367—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups by introduction of functional groups containing oxygen only in singly bound form
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/347—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups
- C07C51/377—Preparation of carboxylic acids or their salts, halides or anhydrides by reactions not involving formation of carboxyl groups by splitting-off hydrogen or functional groups; by hydrogenolysis of functional groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C53/00—Saturated compounds having only one carboxyl group bound to an acyclic carbon atom or hydrogen
- C07C53/126—Acids containing more than four carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C57/00—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms
- C07C57/02—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms with only carbon-to-carbon double bonds as unsaturation
- C07C57/03—Monocarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C57/00—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms
- C07C57/02—Unsaturated compounds having carboxyl groups bound to acyclic carbon atoms with only carbon-to-carbon double bonds as unsaturation
- C07C57/03—Monocarboxylic acids
- C07C57/12—Straight chain carboxylic acids containing eighteen carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/01—Saturated compounds having only one carboxyl group and containing hydroxy or O-metal groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/01—Saturated compounds having only one carboxyl group and containing hydroxy or O-metal groups
- C07C59/10—Polyhydroxy carboxylic acids
- C07C59/105—Polyhydroxy carboxylic acids having five or more carbon atoms, e.g. aldonic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C59/00—Compounds having carboxyl groups bound to acyclic carbon atoms and containing any of the groups OH, O—metal, —CHO, keto, ether, groups, groups, or groups
- C07C59/40—Unsaturated compounds
- C07C59/42—Unsaturated compounds containing hydroxy or O-metal groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C63/00—Compounds having carboxyl groups bound to a carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C67/00—Preparation of carboxylic acid esters
- C07C67/03—Preparation of carboxylic acid esters by reacting an ester group with a hydroxy group
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C67/00—Preparation of carboxylic acid esters
- C07C67/08—Preparation of carboxylic acid esters by reacting carboxylic acids or symmetrical anhydrides with the hydroxy or O-metal group of organic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C67/00—Preparation of carboxylic acid esters
- C07C67/475—Preparation of carboxylic acid esters by splitting of carbon-to-carbon bonds and redistribution, e.g. disproportionation or migration of groups between different molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/02—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen
- C07C69/22—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen having three or more carbon atoms in the acid moiety
- C07C69/24—Esters of acyclic saturated monocarboxylic acids having the carboxyl group bound to an acyclic carbon atom or to hydrogen having three or more carbon atoms in the acid moiety esterified with monohydroxylic compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/52—Esters of acyclic unsaturated carboxylic acids having the esterified carboxyl group bound to an acyclic carbon atom
- C07C69/533—Monocarboxylic acid esters having only one carbon-to-carbon double bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/52—Esters of acyclic unsaturated carboxylic acids having the esterified carboxyl group bound to an acyclic carbon atom
- C07C69/533—Monocarboxylic acid esters having only one carbon-to-carbon double bond
- C07C69/58—Esters of straight chain acids with eighteen carbon atoms in the acid moiety
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/52—Esters of acyclic unsaturated carboxylic acids having the esterified carboxyl group bound to an acyclic carbon atom
- C07C69/587—Monocarboxylic acid esters having at least two carbon-to-carbon double bonds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/66—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety
- C07C69/67—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of saturated acids
- C07C69/675—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of saturated acids of saturated hydroxy-carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/66—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety
- C07C69/73—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of unsaturated acids
- C07C69/732—Esters of carboxylic acids having esterified carboxylic groups bound to acyclic carbon atoms and having any of the groups OH, O—metal, —CHO, keto, ether, acyloxy, groups, groups, or in the acid moiety of unsaturated acids of unsaturated hydroxy carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D303/00—Compounds containing three-membered rings having one oxygen atom as the only ring hetero atom
- C07D303/02—Compounds containing oxirane rings
- C07D303/38—Compounds containing oxirane rings with hydrocarbon radicals, substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G63/00—Macromolecular compounds obtained by reactions forming a carboxylic ester link in the main chain of the macromolecule
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G63/00—Macromolecular compounds obtained by reactions forming a carboxylic ester link in the main chain of the macromolecule
- C08G63/02—Polyesters derived from hydroxycarboxylic acids or from polycarboxylic acids and polyhydroxy compounds
- C08G63/06—Polyesters derived from hydroxycarboxylic acids or from polycarboxylic acids and polyhydroxy compounds derived from hydroxycarboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J11/00—Recovery or working-up of waste materials
- C08J11/04—Recovery or working-up of waste materials of polymers
- C08J11/10—Recovery or working-up of waste materials of polymers by chemically breaking down the molecular chains of polymers or breaking of crosslinks, e.g. devulcanisation
- C08J11/14—Recovery or working-up of waste materials of polymers by chemically breaking down the molecular chains of polymers or breaking of crosslinks, e.g. devulcanisation by treatment with steam or water
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J11/00—Recovery or working-up of waste materials
- C08J11/04—Recovery or working-up of waste materials of polymers
- C08J11/10—Recovery or working-up of waste materials of polymers by chemically breaking down the molecular chains of polymers or breaking of crosslinks, e.g. devulcanisation
- C08J11/18—Recovery or working-up of waste materials of polymers by chemically breaking down the molecular chains of polymers or breaking of crosslinks, e.g. devulcanisation by treatment with organic material
- C08J11/22—Recovery or working-up of waste materials of polymers by chemically breaking down the molecular chains of polymers or breaking of crosslinks, e.g. devulcanisation by treatment with organic material by treatment with organic oxygen-containing compounds
- C08J11/24—Recovery or working-up of waste materials of polymers by chemically breaking down the molecular chains of polymers or breaking of crosslinks, e.g. devulcanisation by treatment with organic material by treatment with organic oxygen-containing compounds containing hydroxyl groups
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09D—COATING COMPOSITIONS, e.g. PAINTS, VARNISHES OR LACQUERS; FILLING PASTES; CHEMICAL PAINT OR INK REMOVERS; INKS; CORRECTING FLUIDS; WOODSTAINS; PASTES OR SOLIDS FOR COLOURING OR PRINTING; USE OF MATERIALS THEREFOR
- C09D167/00—Coating compositions based on polyesters obtained by reactions forming a carboxylic ester link in the main chain; Coating compositions based on derivatives of such polymers
- C09D167/04—Polyesters derived from hydroxycarboxylic acids, e.g. lactones
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23B—PRESERVATION OF FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES; CHEMICAL RIPENING OF FRUIT OR VEGETABLES
- A23B2/00—Preservation of foods or foodstuffs, in general
- A23B2/70—Preservation of foods or foodstuffs, in general by treatment with chemicals
- A23B2/725—Preservation of foods or foodstuffs, in general by treatment with chemicals in the form of liquids or solids
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23B—PRESERVATION OF FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES; CHEMICAL RIPENING OF FRUIT OR VEGETABLES
- A23B7/00—Preservation of fruit or vegetables; Chemical ripening of fruit or vegetables
- A23B7/16—Coating with a protective layer; Compositions or apparatus therefor
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J2391/00—Characterised by the use of oils, fats or waxes; Derivatives thereof
- C08J2391/06—Waxes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09D—COATING COMPOSITIONS, e.g. PAINTS, VARNISHES OR LACQUERS; FILLING PASTES; CHEMICAL PAINT OR INK REMOVERS; INKS; CORRECTING FLUIDS; WOODSTAINS; PASTES OR SOLIDS FOR COLOURING OR PRINTING; USE OF MATERIALS THEREFOR
- C09D167/00—Coating compositions based on polyesters obtained by reactions forming a carboxylic ester link in the main chain; Coating compositions based on derivatives of such polymers
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09D—COATING COMPOSITIONS, e.g. PAINTS, VARNISHES OR LACQUERS; FILLING PASTES; CHEMICAL PAINT OR INK REMOVERS; INKS; CORRECTING FLUIDS; WOODSTAINS; PASTES OR SOLIDS FOR COLOURING OR PRINTING; USE OF MATERIALS THEREFOR
- C09D5/00—Coating compositions, e.g. paints, varnishes or lacquers, characterised by their physical nature or the effects produced; Filling pastes
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Polymers & Plastics (AREA)
- Zoology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Environmental Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Dentistry (AREA)
- Materials Engineering (AREA)
- Food Science & Technology (AREA)
- Sustainable Development (AREA)
- Toxicology (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Pretreatment Of Seeds And Plants (AREA)
- Storage Of Fruits Or Vegetables (AREA)
- Fertilizers (AREA)
Abstract
En el presente documento se describen métodos para preparar monómeros, oligómeros o combinaciones de los mismos derivados de cutina a partir de materia vegetal que contiene cutina. Los métodos pueden incluir calentar la materia vegetal derivada de la cutina en un solvente a temperatura y presión elevadas. En algunas realizaciones preferidas, los métodos se pueden llevar a cabo sin el uso de especies ácidas o básicas adicionales. (Traducción automática con Google Translate, sin valor legal)
Description
DESCRIPCIÓN
Composiciones de extractos de plantas para formar recubrimientos protectores
Campo técnico
La presente divulgación se refiere a composiciones de extractos de plantas y métodos para aislar monómeros, oligómeros y mezclas de los mismos derivados de plantas para aplicaciones en formulaciones de recubrimientos agrícolas.
Antecedentes
Los productos agrícolas comunes son susceptibles de degradación y descomposición (es decir, deterioro) cuando se exponen al medio ambiente. Tales productos agrícolas pueden incluir, por ejemplo, huevos, frutas, verduras, hortalizas, semillas, nueces, flores y/o plantas enteras (incluidas sus formas procesadas y semiprocesadas). Los productos no agrícolas (por ejemplo, vitaminas, dulces, etc.) también son vulnerables a la degradación cuando se exponen al medio ambiente. La degradación de los productos agrícolas puede ocurrir por medios abióticos como resultado de la pérdida de humedad evaporativa a partir de una superficie externa de los productos agrícolas hacia la atmósfera y/o la oxidación por oxígeno que se difunde en los productos agrícolas desde el medio ambiente y/o daños mecánicos a la superficie y/o degradación inducida por la luz (es decir, fotodegradación). Adicionalmente, los agentes de estrés bióticos tales como, por ejemplo, bacterias, hongos, virus y/o plagas también pueden infestar y descomponer los productos agrícolas.
Las metodologías convencionales para prevenir la degradación, mantener la calidad y aumentar la vida útil de los productos agrícolas incluyen refrigeración y/o empaques especiales. La refrigeración requiere equipos de alto coste en capital, exige un gasto de energía constante, puede causar daños o pérdida de calidad al producto si no se controla cuidadosamente, debe gestionarse activamente y sus beneficios se pierden al interrumpir una cadena de suministro de temperatura controlada. El empaque especial también puede requerir equipos costosos, consumir material de empaque, aumentar los costes de transporte y requerir una gestión activa. A pesar de los beneficios que puede ofrecer la refrigeración y el empaque especial, el manejo y el transporte de los productos agrícolas pueden causar abrasión o magulladuras en la superficie que desagradan estéticamente al consumidor y sirven como puntos de entrada para bacterias y hongos. Además, los gastos asociados con tales metodologías pueden aumentar el coste del producto agrícola.
Las células que forman la superficie aérea de la mayoría de las plantas (tal como las plantas superiores) incluyen una envoltura externa o cutícula, que proporciona diversos grados de protección contra la pérdida de agua, oxidación, daño mecánico, fotodegradación y/o agentes de estrés bióticos, dependiendo de la especie vegetal y el órgano de la planta (por ejemplo, frutas, semillas, corteza, flores, hojas, tallos, etc.). La cutina, que es un biopoliéster derivado de los lípidos celulares, forma el componente estructural principal de la cutícula y sirve para proporcionar protección a la planta contra los agentes de estrés ambientales (tanto abióticos como bióticos). El grosor, la densidad, así como la composición de la cutina (es decir, los diferentes tipos de monómeros que forman la cutina y sus proporciones relativas) pueden variar según la especie vegetal, el órgano de la planta dentro de la misma especie vegetal o diferentes, y según la etapa. de madurez de la planta. La porción de la planta que contiene cutina también puede contener compuestos adicionales (por ejemplo, ceras epicuticulares, fenólicos, antioxidantes, compuestos coloreados, proteínas, polisacáridos, etc.). Esta variación en la composición de cutina, así como el grosor y la densidad de la capa de cutina entre especies de plantas y/u órganos de plantas y/o una planta dada en diferentes etapas de maduración, puede conducir a grados variables de resistencia entre especies de plantas u órganos de plantas a ataque por agentes de estrés ambientales (es decir, pérdida de agua, oxidación, lesiones mecánicas y luz) y/o agentes de estrés bióticos (por ejemplo, hongos, bacterias, virus, insectos, etc.).
Herrero et al (Trends in Analytical Chemistry, vol. 43, 1 February 2013, pages 67-83) describe las técnicas de preparación y extracción de muestras para determinaciones de compuestos bioactivos naturales, señalando que las técnicas de preparación de muestras basadas en fluidos comprimidos (por ejemplo, extracción de fluidos supercríticos y extracción de líquidos presurizados) demuestran buenas capacidades. El documento WO-A-2015/028299 divulga un método para despolimerizar parcialmente la cutina de las cáscaras de tomate desechadas calentando las cáscaras de tomate en una solución alcalina a una temperatura de 100 °C durante aproximadamente 6 horas y luego tratando las bioresinas crudas resultantes con un ácido inorgánico. Hauff, S., et al (2010) Phytochemical analysis, 21 (6), págs. 582-589 divulga diversos procesos para extraer ácidos grasos derivados de la cutina y sus ésteres correspondientes obtenidos a partir de la cutina que se permitió que se descompusiera en el suelo por hasta 20 meses
Resumen
La invención está definida por las reivindicaciones.
La invención proporciona un método para formar un recubrimiento protector de acuerdo con la reivindicación 1.
Aquí se describen métodos para preparar monómeros, oligómeros o combinaciones de los mismos derivados de la cutina a partir de material vegetal que contiene cutina. El método puede comprender calentar el material vegetal que contiene cutina en un solvente a temperatura y presión elevadas.
En consecuencia, la presente divulgación describe un método para preparar monómeros, oligómeros o combinaciones de los mismos derivados de cutina a partir de material vegetal que contiene cutina, que comprende: obtener cutina a partir del material vegetal que contiene cutina;
añadir la cutina a un solvente para formar una primera mezcla, el teniendo el solvente un punto de ebullición a una primera temperatura a una presión de una atmósfera; y
calentar la primera mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y la segunda presión más alta que una atmósfera, para formar una segunda mezcla que comprende los monómeros, oligómeros derivados de la cutina, o combinaciones de los mismos.
La presente divulgación también describe un método para formar una composición de extracto vegetal, que comprende:
obtener cutina a partir de material vegetal que contiene cutina;
añadir la cutina a un primer solvente para formar una primera mezcla, teniendo el primer solvente un primer punto de ebullición a una primera temperatura a una presión de una atmósfera;
calentar la primera mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y la segunda presión más alta que una atmósfera, para formar una segunda mezcla que comprende monómeros, oligómeros derivados de la cutina o combinaciones de los mismos;
separar el primer solvente de los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina en la segunda mezcla; y
disolver los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina en un segundo solvente. La presente divulgación describe además un método para formar una composición de extracto vegetal, que comprende:
obtener cutina a partir de material vegetal que contiene cutina;
añadir la cutina a un primer solvente para formar una primera mezcla, teniendo el primer solvente un punto de ebullición a una primera temperatura y primera presión; y
calentar la primera mezcla a una segunda temperatura, siendo la segunda temperatura más alta que la primera temperatura, para formar una segunda mezcla que comprende monómeros, oligómeros o combinaciones de los mismos derivados de la cutina, en donde al menos una porción de los monómeros u oligómeros derivados de la cutina en la segunda mezcla es insaturada.
La presente divulgación describe además un método para preparar monómeros, oligómeros o combinaciones de los mismos derivados de cutina a partir de material vegetal que contiene cutina, que comprende:
obtener cutina del material vegetal que contiene cutina;
añadir la cutina a un solvente para formar una primera mezcla, teniendo el solvente un punto de ebullición a una primera temperatura a una presión de una atmósfera;
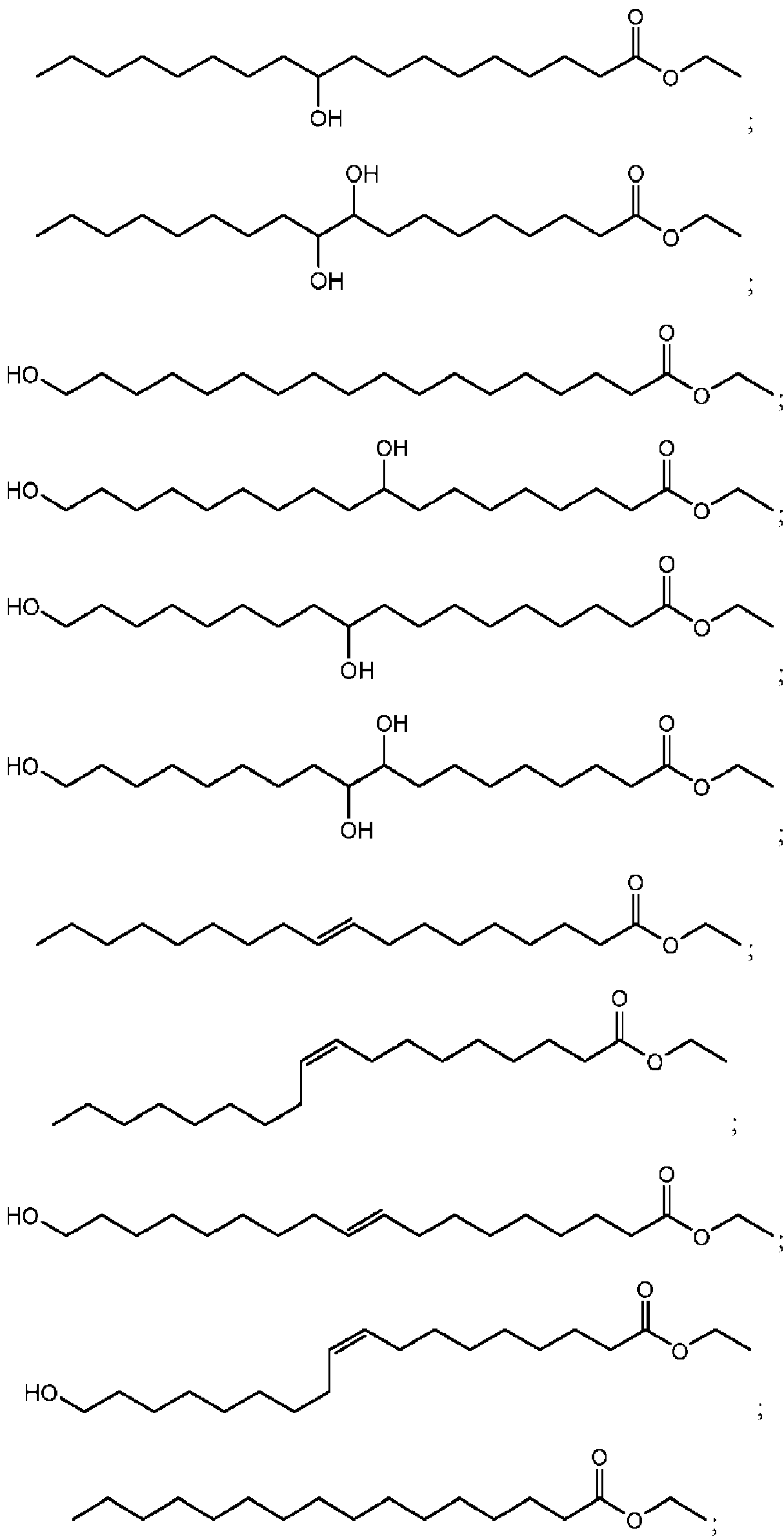
calentar la primera mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y la segunda presión más alta que una atmósfera, para formar una segunda mezcla que comprende un primer grupo de compuestos de Fórmula I:
en la que:
R1, R2, R3, R4, R5, R6, R7, R8, R9, y R10 son cada uno independientemente -H, -OR13, -NR13R14, -SR13, halógeno, alquilo-Ci-C6, alquenilo -C1.C6, alquinilo -C1.C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, o halógeno;
R13 y R14 son cada uno independientemente -H, alquilo-C1-C6, alquenilo -C1-C6 o alquinilo -C1-C6;
R11 es -H, -glicerilo, alquilo-C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, o halógeno;
R12 es -OH, -H, alquilo-C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, halógeno, -COOH, o-COOR11; y
m, n, y o son cada uno independientemente un entero en el rango de 0 a 30, y 0 < m+n+o < 30.
Otra parte de la divulgación describe un método para preparar una composición que comprende ésteres de ácidos grasos derivados de cutina. El método incluye obtener cutina a partir de material vegetal que contiene cutina y agregar la cutina a un solvente para formar una mezcla, teniendo el solvente un punto de ebullición a una primera temperatura a una presión de una atmósfera. El método incluye además calentar la mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y la segunda presión más alta que una atmósfera, formando así la composición que comprende los ésteres.
Otro aspecto de la divulgación describe un método para preparar una composición que comprende monómeros, oligómeros o combinaciones de los mismos de ácidos grasos libres derivados de la cutina. El método incluye la obtención de cutina a partir de material vegetal que contiene cutina, agregando la cutina al agua para formar una mezcla. El método incluye además calentar la mezcla desde una primera temperatura y primera presión hasta una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que el punto de ebullición del agua en una atmósfera y la segunda presión siendo más alta que una atmósfera, formando así la composición que comprende los monómeros, oligómeros de ácidos grasos libres o combinaciones de los mismos derivados de la cutina.
En otra divulgación, la presente descripción proporciona un método para formar un recubrimiento protector. El método incluye extraer una composición de una capa de cutícula de una primera especie vegetal, incluyendo la composición una pluralidad de monómeros, oligómeros o combinaciones de los mismos derivados de la cutina, y disponer la composición en una segunda especie vegetal que sea igual o diferente de la primera especie vegetal en formar la capa protectora sobre la segunda especie vegetal.
Otro método divulgado forma un recubrimiento protector. El método incluye extraer una composición de una capa de cutícula de material vegetal de una primera planta, incluyendo la composición una pluralidad de monómeros u oligómeros de ácidos grasos libres, ésteres de ácidos grasos, o combinaciones de los mismos derivados de cutina, y disponer la composición en material vegetal de una segunda planta diferente de la primera planta, formando así la capa protectora sobre el material vegetal vegetal de la segunda planta.
La presente divulgación también describe un método para preparar monómeros, oligómeros o combinaciones de los mismos derivados de cutina a partir de material vegetal que contiene cutina, que comprende:
obtener cutina del material vegetal que contiene cutina;
añadir la cutina a un solvente para formar una primera mezcla, teniendo el solvente un punto de ebullición a una primera temperatura a una presión de una atmósfera;
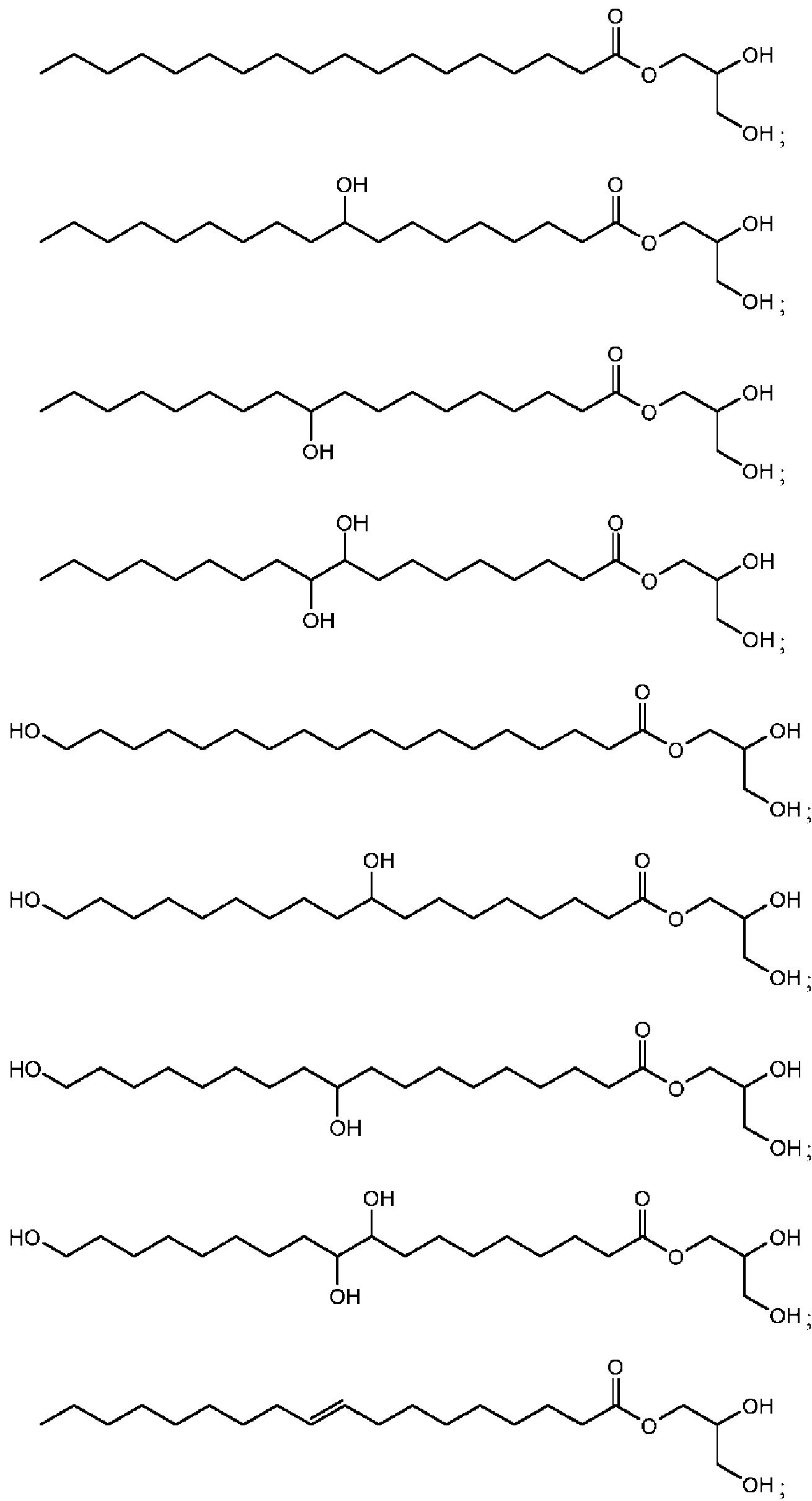
calentar la primera mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y la segunda presión más alta que una atmósfera, para formar una segunda mezcla que comprende un primer grupo de compuestos de Fórmula II:
en la que:
R1, R2, R4 y R5 son cada uno independientemente -H, -OR11, -NR11R12, -SR11, halógeno, alquilo-C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo,
alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR11, -NR11R12, -SR11, o halógeno;
R11 y R12 son cada uno independientemente -H, alquilo-C1-C6, alquenilo -C1-C6 o alquinilo -C1.C6;
el símbolo----- representa opcionalmente un enlace simple o doble cis o trans;
R3 es -OH y R3' se selecciona del grupo que consiste en -H, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7 y arilo cuando------entre R3 y R3' es un enlace sencillo, y R3 y R3' están ausentes cuando------entre R3 y R3' representa un doble enlace;
R6 es -OH y R6' se selecciona del grupo que consiste en -H, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7 y arilo cuando------entre R6 y R6' es un enlace sencillo, y R6 y R6' están ausentes cuando------entre R6 y R6' representa un doble enlace;
n es un entero en el rango de 0 a 11;
m es un entero en el rango de 0 a 25; y
0 < m+n < 25.
Otra parte de la divulgación describe un método para preparar monómeros, oligómeros o combinaciones de los mismos derivados de cutina a partir de material vegetal que contiene cutina, que comprende:
obtener cutina del material vegetal que contiene cutina;
añadir la cutina a un solvente para formar una primera mezcla, teniendo el solvente un punto de ebullición a una primera temperatura a una presión de una atmósfera;
calentar la primera mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y la segunda presión más alta que una atmósfera, para formar una segunda mezcla que comprende un primer grupo de compuestos de Fórmula III:
en la que:
R1, R2, R5, R6, R9, R10, R11, R12 y R13 son cada uno independientemente, en cada presencia, -H,-OR14, -NR14R15, -SR14, halógeno, alquilo -C1-C6, alquenilo C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo o heteroarilo, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno;
R3, R4, R7, y R8 son cada uno independientemente, en cada presencia, -H, -OR14, -NR14R15,-SR14, halógeno, alquilo -C1-C6, alquenilo -C2-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo o heteroarilo en la que cada alquilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno; o
R3 y R4 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros; y/o
R7 y R8 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros;
R14 y R15 son cada uno independientemente, en cada presencia, -H, alquilo -C1-C6, alquenilo -C2-C6 o alquinilo -C2-C6; el símbolo----- representa un enlace simple o un doble enlace cis o trans;
n es 0, 1, 2, 3, 4, 5, 6, 7 o 8;
m es 0, 1, 2 o 3;
q es 0, 1, 2, 3, 4 o 5; y
r es 0, 1, 2, 3, 4, 5, 6, 7 o 8; y
R se selecciona de -H, alquilo -C1-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3.C7, arilo, 1-glicerol, 2-glicerol o heteroarilo.
Los métodos y formulaciones descritos en el presente documento pueden incluir una o más de las siguientes etapas o características, bien sea solas o en combinación entre sí. La segunda mezcla se puede enfriar a una tercera temperatura, siendo la tercera temperatura más baja que la segunda temperatura. La etapa de enfriar la segunda mezcla puede comprender además reducir la segunda presión a una tercera presión, estando la tercera presión por debajo de la segunda presión. La tercera temperatura puede ser más baja que la primera temperatura. La tercera presión puede ser sustancialmente la misma que la primera presión. La tercera presión puede ser sobre una atmósfera. El método puede comprender además separar el solvente de la segunda mezcla para aislar los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina. La segunda temperatura puede ser al menos 5 % más alta que la primera temperatura. La segunda presión puede ser suficientemente alta para mantener al menos una porción del solvente en una fase líquida a la segunda temperatura. La segunda presión puede ser más alta que la primera presión. La cutina se puede separar al menos parcialmente de una porción que no contiene cutina del material vegetal antes de agregar la cutina al solvente.
El proceso de formar la segunda mezcla puede además dar como resultado la producción de ácidos grasos insaturados. El proceso de formar la segunda mezcla puede dar como resultado la producción de ácidos grasos tanto saturados como insaturados. La producción de ácidos grasos insaturados puede ser el resultado de la eliminación de un grupo hidroxi unido a la cadena de ácidos grasos. Una concentración de ácidos grasos saturados puede ser sustancialmente más alta que una concentración de ácidos grasos insaturados en la segunda mezcla. El proceso de formar la segunda mezcla puede además dar como resultado la producción de ácidos grasos insaturados. El proceso de formación de la segunda mezcla puede dar como resultado la producción de ésteres de ácidos grasos tanto saturados como insaturados. La producción de ésteres de ácidos grasos insaturados puede ser el resultado de la eliminación de un grupo hidroxi unido a la cadena de ácidos grasos. Una concentración de ésteres de ácidos grasos saturados puede ser sustancialmente mayor que una concentración de ésteres de ácidos grasos insaturados en la segunda mezcla.
El calentamiento de la primera mezcla puede realizarse mientras la primera mezcla está en un recipiente, y el método puede comprender además inyectar un gas o líquido en el recipiente durante el calentamiento de la primera mezcla. Una reacción de despolimerización a la segunda temperatura puede dar como resultado monómeros, oligómeros o combinaciones de los mismos derivados de la cutina sin carga. El solvente se puede seleccionar de tal manera que las concentraciones de aniones reactivos y cationes reactivos dispersados en el mismo mientras el solvente se mantiene a la segunda temperatura sean suficientes para despolimerizar al menos parcialmente la cutina y dar como resultado monómeros, oligómeros o combinaciones de los mismos derivados de la cutina sin carga. Una tasa de despolimerización de la cutina en el solvente puede ser al menos 100 veces mayor a la segunda temperatura y la segunda presión que a la primera temperatura a una presión de una atmósfera. Los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina en la segunda mezcla pueden ser sustancialmente solubles en el solvente a aproximadamente 298 K. La segunda temperatura puede ser mayor que aproximadamente 393 K. La segunda temperatura puede ser al menos aproximadamente 498 K. El solvente puede seleccionarse del grupo que consiste en agua, glicerol, metanol, etanol, CO2 líquido y CO2 supercrítico, o una combinación de los mismos. El solvente puede ser un solvente nucleofílico. El solvente puede ser agua. La primera mezcla puede incluir además un cosolvente. El cosolvente puede comprender CO2. El solvente puede estar sustancialmente libre de ácido o base añadidos.
La segunda temperatura puede ser de al menos aproximadamente 498 K y la segunda presión puede ser de al menos aproximadamente 360 psi, y la primera mezcla puede mantenerse a la segunda temperatura y la segunda presión durante al menos aproximadamente ocho horas. La segunda temperatura puede ser de al menos aproximadamente 523 K y la segunda presión puede ser de al menos aproximadamente 575 psi, y la primera mezcla puede mantenerse a la segunda temperatura y la segunda presión durante al menos aproximadamente dos horas. La primera mezcla puede incluir además un aditivo reactivo. El aditivo reactivo puede ser una enzima, NaOH, Na2CO3, ácido acético, un modificador de pH o una combinación de los mismos.
La cutina puede ser al menor separada parcialmente de una porción que no contiene cutina del material vegetal antes de agregar la cutina al primer solvente. Los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina en la segunda mezcla pueden filtrarse del residuo no despolimerizado y separarse del primer solvente. Al menos una porción de los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina pueden ser ácidos grasos insaturados. El método puede comprender además hidrogenar los ácidos grasos insaturados antes de agregarlos al segundo solvente. Los ácidos grasos insaturados se pueden disolver en el segundo solvente sin hidrogenación. Al menos una porción de los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina pueden ser ésteres de ácidos grasos insaturados. El método puede comprender además hidrogenar los ésteres de ácidos grasos insaturados antes de añadirlos al segundo solvente. Los ésteres de ácidos grasos insaturados se pueden disolver en el segundo solvente sin hidrogenación.
El método puede comprender además separar el primer solvente de los monómeros, oligómeros o combinaciones de los mismos derivados de cutina en la segunda mezcla, e hidrogenar los monómeros y oligómeros insaturados derivados de cutina para formar una tercera mezcla que comprende monómeros, oligómeros o combinaciones de los
mismos derivados de cutina, en donde sustancialmente todos los monómeros u oligómeros derivados de cutina en la tercera mezcla están saturados. Los monómeros y oligómeros insaturados derivados de la cutina en la segunda mezcla pueden separarse de los monómeros y oligómeros saturados derivados de la cutina en la segunda mezcla antes de la hidrogenación. En algunas realizaciones, los monómeros y oligómeros insaturados derivados de cutina en la segunda mezcla no se separan de los monómeros y oligómeros saturados derivados de cutina en la segunda mezcla antes de la hidrogenación. Entre aproximadamente el 10 % y el 98 % de los monómeros y oligómeros derivados de la cutina en la segunda mezcla pueden ser insaturados. Entre 0.5 % y 30 %, mayor que 0 % pero menor que 40 %, menor que 10 %, entre aproximadamente 1 % y 98 %, entre 1 % y 99 %, o sustancialmente todos los monómeros y oligómeros derivados de la cutina en la segunda mezcla puede ser insaturada. El método puede comprender además disolver la tercera mezcla en un segundo solvente.
El método puede producir además compuestos de Fórmula II:
en la que:
R1, R2, R4 y R5 son cada uno independientemente -H, -OR11, -NR11R12, -SR11, halógeno, alquilo-C-i-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3.C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR11, -NR11R12, -SR11, o halógeno;
R11 y R12 son cada uno independientemente -H, alquilo-C1-C6, alquenilo -C1-C6 o alquinilo -C1-C6;
el símbolo----- representa opcionalmente un enlace simple o doble cis o trans;
R3 es -OH y R3' se selecciona del grupo que consiste en -H, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7 y arilo cuando------entre R3 y R3' es un enlace sencillo, y R3 y R3' están ausentes cuando-------entre R3 y R3' representa un doble enlace;
R6 es -OH y R6' se selecciona del grupo que consiste en -H, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7 y arilo cuando------entre R6 y R6' es un enlace sencillo, y R6 y R6' están ausentes cuando-------entre R6 y R6' representa un doble enlace;
n es un entero en el rango de 0 a 11;
m es un entero en el rango de 0 a 25; y
0 < m+n < 25.
El método puede producir además un segundo grupo de compuestos de Fórmula I, siendo el segundo grupo de compuestos de Fórmula I diferente del primer grupo de compuestos de Fórmula I. El método puede producir compuestos de Fórmula II que luego pueden transformarse en compuestos de Fórmula I, por ejemplo, a través de transformación sintética convencional, en donde los compuestos de Fórmula I que se forman de este modo pueden diferir de los compuestos de Fórmula I producidos directamente por despolimerización térmica. Por ejemplo, un ácido formado por un método de despolimerización hidrotérmica como se establece en el presente documento puede convertirse subsecuentemente en un éster. La formación del recubrimiento protector puede comprender provocar que al menos algunos de los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina se entrecrucen en la segunda especie vegetal. El método puede incluir además modificar químicamente los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina antes de disponer la composición en la segunda especie vegetal. La modificación química de los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina puede comprender la gluceración de los monómeros, oligómeros o combinaciones de los mismos derivados de la cutina (por ejemplo, formando un éster de glicerol del correspondiente ácido o éster graso). Una composición química del recubrimiento protector puede ser diferente de una composición química de una capa de cutícula de la segunda especie vegetal. La extracción de la composición de la capa de cutícula de la primera especie vegetal puede comprender obtener cutina de la capa de cutícula de la primera especie vegetal, agregar la cutina a un solvente para formar una primera mezcla, teniendo el solvente un punto de ebullición a una primera temperatura a una presión de una atmósfera, y calentando la primera mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y la segunda presión más alta que una atmósfera, para formar una segunda mezcla que comprende los monómeros, oligómeros, o combinaciones de los mismos derivados de la cutina. El método puede comprender además modificar los compuestos de Fórmula II para formar compuestos de Fórmula I, donde la Fórmula II y la Fórmula I son como se describieron previamente. El
método puede comprender además modificar los compuestos de Fórmula III para formar compuestos de Fórmula I, donde la Fórmula III y la Fórmula I son como se describieron previamente.
El solvente en el que se agrega la cutina puede comprender etanol, y los ésteres de la composición resultante pueden comprender ésteres de etilo. El solvente en el que se agrega la cutina puede comprender metanol, y los ésteres de la composición resultante pueden comprender ésteres metílicos. El solvente en el que se agrega la cutina puede comprender glicerol, y los ésteres de la composición resultante pueden comprender ésteres de glicerilo. Como se usa en el presente documento, el término "sustrato" se refiere a cualquier objeto o material sobre el que se forma un recubrimiento o se deposita material. En implementaciones particulares, el sustrato es comestible para los humanos, y el recubrimiento es un recubrimiento comestible. Ejemplos de sustratos comestibles incluyen productos agrícolas y alimentos tales como frutas, verduras, hortalizas, semillas, nueces, carne de res, aves y mariscos. Aunque los recubrimientos pueden formarse sobre toda la superficie externa del sustrato, en algunas implementaciones los recubrimientos pueden cubrir una porción de la superficie externa del sustrato. Los recubrimientos también pueden incluir aberturas o regiones porosas que exponen una porción de la superficie externa del sustrato.
Como se usa en el presente documento, "material vegetal" se refiere a cualquier porción de una planta, por ejemplo, frutas (en el sentido botánico, incluidas las cáscaras de frutas y cavidades de jugo), hojas, tallos, cortezas, semillas, flores o cualquier otra porción de la planta.
Breve descripción de los dibujos
La Figura 1 es un diagrama de fase de H2O.
Las Figuras 2A, 2B, 2C, 2D, 2E y 2F muestran la estructura química del ácido 10,16-dihidroxihexadecanoico, ácido 10,18-dihidroxioctadecanoico, ácido 9,16-dihidroxihexadecanoico, ácido 9,18-dihidroxioctadecanoico, ácido 9,10,16-trihidroxihexadecanoico, ácido 9,10,18-trihidroxioctadecanoico, respectivamente.
Las Figuras 3A, 3B, 3C, 3D, 3E, 3F, 3G, 3H y 3I son subproductos que pueden resultar de la descomposición de monómeros y/u oligómeros de ácido 10,16-dihidroxihexadecanoico durante un proceso de despolimerización térmica.
Las Figuras 4A y 4B son gráficos cualitativos de las concentraciones relativas de productos de despolimerización directa y subproductos indirectos insaturados como función del tiempo que resultan de la despolimerización térmica de la cutina cuando se usa agua como solvente.
Las Figuras 5A, 5B y 5C son composiciones químicas de moléculas que pueden formarse a partir de subproductos indirectos insaturados de la despolimerización térmica de la cutina.
Las Figuras 6A y 6B son ésteres que pueden formarse por despolimerización térmica de la cutina en un solvente que incluye etanol.
Las Figuras 6C y 6D son ésteres que pueden formarse por despolimerización térmica de la cutina en un solvente que incluye metanol.
Las Figuras 6E, 6F, 6G y 6H son ésteres que pueden formarse por despolimerización térmica de la cutina en un solvente que incluye glicerol.
Las Figuras 7A, 7B, 7C, 7D, 7E, 7F, 7G, 7H y 7I son ésteres que pueden formarse por despolimerización térmica de la cutina en un solvente que incluye etanol.
Las Figuras 8A, 8B, 8C, 8D, 8E, 8F, 8G, 8H y 8I son ésteres que pueden formarse por despolimerización térmica de la cutina en un solvente que incluye metanol.
Las Figuras 9A, 9B, 9C, 9D, 9E, 9F, 9G, 9H y 9I son ésteres que pueden formarse por despolimerización térmica de cutina en un solvente que incluye glicerol.
Las Figuras 10A, 10B, 10C, 10D, 10E, 10F, 10G, 10H y 10I son ésteres que pueden formarse por despolimerización térmica de la cutina en un solvente que incluye glicerol.
La Figura 11 ilustra un proceso para formar un recubrimiento protector.
La Figura 12A ilustra un gráfico de la cantidad de monómeros y/u oligómeros de cutina cruda recuperados por despolimerización térmica de la cutina en agua para diversas temperaturas y duraciones de reacción.
La Figura 12B ilustra un gráfico de la cantidad de producto (producto saturado y/o subproducto insaturado) aislado de los monómeros y/u oligómeros de cutina cruda en el precipitado de heptano después de la extracción por Soxhlet para diversas temperaturas y tiempos de residencia.
La Figura 12C es un gráfico de la cantidad de subproducto insaturado aislado de los monómeros y/u oligómeros de cutina cruda en el sobrenadante de heptano después de la extracción por Soxhlet para diversas temperaturas y tiempos de residencia.
La Figura 12D ilustra un gráfico de la cantidad de producto saturado aislado de los monómeros y/u oligómeros de cutina cruda en el sobrenadante de acetato de etilo después de la extracción por Soxhlet para diversas temperaturas y tiempos de residencia.
La Figura 13 es una tabla que indica la naturaleza de los productos aislados después de la extracción por Soxhlet usando heptano y acetato de etilo después de la hidrólisis térmica en agua a diversas temperaturas y duraciones de reacción.
La Figura 14A es un gráfico del porcentaje de producto crudo recuperado por despolimerización térmica de la cutina en etanol para diversas temperaturas y tiempos de residencia.
La Figura 14B es un gráfico del porcentaje de producto recuperado de un precipitado de heptano durante la despolimerización térmica de la cutina en etanol para diversas temperaturas y tiempos de residencia.
La Figura 14C es un gráfico del porcentaje de producto recuperado de un sobrenadante de heptano durante la despolimerización térmica de la cutina en etanol para diversas temperaturas y tiempos de residencia.
La Figura 15 es una tabla que indica qué productos se recuperaron del precipitado de heptano y del sobrenadante de heptano a diversas temperaturas de despolimerización y tiempos de residencia para la despolimerización térmica de la cutina en etanol.
La Figura 16 es un gráfico de tasas de pérdida de masa de aguacates recubiertos con composiciones formadas por los métodos descritos en este documento.
La Figura 17 muestra trazas de UPLC de producto crudo recuperado después de la despolimerización hidrotérmica a 548 K durante una hora.
La Figura 18 muestra trazas de UPLC y análisis por espectrometría de masas de ácido 10,16-dihidroxihexadecanoico recuperado después de la despolimerización hidrotérmica a 548 K durante una hora antes de la extracción.
La Figura 19 muestra trazas de UPLC y análisis por espectrometría de masas de ácidos grasos insaturados recuperados después de la despolimerización hidrotérmica a 548 K durante una hora antes de la extracción.
La Figura 20 muestra trazas de UPLC y análisis por espectrometría de masas de ácido 10,16-dihidroxihexadecanoico recuperado del precipitado de heptano después de la despolimerización hidrotérmica a 548 K durante una hora y extracción por Soxhlet con heptano.
La Figura 21 muestra trazas de UPLC y análisis por espectrometría de masas de ácidos grasos insaturados recuperados del sobrenadante de heptano después de la despolimerización hidrotérmica a 548 K durante una hora y extracción por Soxhlet con heptano.
La Figura 22 muestra trazas de UPLC y análisis por espectrometría de masas de ácido 10,16-dihidroxihexadecanoico recuperado del sobrenadante de acetato de etilo después de la despolimerización hidrotérmica a 548 K durante una hora y extracción por Soxhlet con acetato de etilo.
La Figura 23 muestra trazas de UPLC del producto crudo recuperado después de la despolimerización por etanólisis a 548 K durante cuatro horas.
La Figura 24 muestra trazas de UPLC y análisis por espectrometría de masas de 10,16-dihidroxihexadecanoato de etilo recuperado del sobrenadante de heptano después de la despolimerización por etanólisis a 548 K durante cuatro horas y extracción por Soxhlet con heptano.
La Figura 25 muestra trazas de UPLC y análisis por espectrometría de masas de éster de etilo de ácido graso insaturado recuperado del sobrenadante de heptano después de la despolimerización por etanólisis a 548 K durante cuatro horas y extracción por Soxhlet con heptano.
Los símbolos de referencia similares en las diversas figuras indican elementos similares.
Descripción detallada
La biopoliéster cutina forma el principal componente estructural de la cutícula que compone la superficie aérea de la mayoría de las plantas terrestres y desempeña un papel importante en proporcionar a las plantas una barrera protectora contra los agentes de estrés abióticos y bióticos. El grosor, la densidad, así como la composición de la cutina (es decir, los diferentes tipos de monómeros que forman la cutina y sus proporciones relativas) pueden variar
según la especie de la planta, el órgano de la planta dentro de la misma o diferente especie vegetal, y por etapa de madurez de la planta. Estas variaciones pueden definir la cantidad, grado o calidad de protección (y grado de plasticidad) que ofrece la capa de cutina a la planta u órgano de la planta contra los agentes de estrés ambientales y/o bióticos. La cutina se forma a partir de una mezcla de ácidos grasos mono y/o polihidroxilados polimerizados y ceras cuticulares embebidas. Los ácidos grasos hidroxilados de la capa de la cutícula forman redes fuertemente unidas con alta densidad de entrecruzamiento, actuando así como una barrera contra la pérdida de humedad y la oxidación, además de proporcionar protección contra otros agentes de estrés ambientales.
Aquí se describen métodos para preparar y formar composiciones de extracto vegetal a partir de material vegetal. Las composiciones de extractos vegetales se forman a partir de la descomposición (por ejemplo, despolimerización) de cutina u otros polímeros entrecruzados (por ejemplo, poliésteres), e incluyen ácidos grasos hidroxi y ésteres grasos hidroxi (así como sus oligómeros y mezclas de los mismos) encontrados en la capa de la cutícula u otra red polimérica entrecruzada. Las composiciones de extracto vegetal se pueden aplicar subsecuentemente a otros productos vegetales o agrícolas con el fin de formar un recubrimiento protector sobre los productos, o para mejorar o modificar recubrimientos existentes (bien sea recubrimientos de origen natural o depositados) que se encuentran en la superficie externa de los productos. Los recubrimientos aplicados pueden servir, por ejemplo, para proteger los productos de agentes de estrés bióticos tales como bacterias, hongos, virus y/o plagas. Los recubrimientos aplicados también pueden (o alternativamente) servir para aumentar la vida útil del producto sin refrigeración, y/o controlar la tasa de maduración del producto. Los métodos para formar las composiciones de extracto vegetal pueden dar como resultado que las composiciones estén sustancialmente libres de otros compuestos derivados de plantas que lo acompañan (por ejemplo, proteínas, polisacáridos, fenoles, lignanos, ácidos aromáticos, terpenoides, flavonoides, carotenoides, alcaloides, alcoholes, alcanos y aldehídos), mejorando así la eficacia de los recubrimientos protectores subsecuentemente formados.
Como se describió anteriormente, las unidades de monómero y/u oligómero de las composiciones de extracto vegetal se pueden obtener de la cutina que se encuentra en el material vegetal vegetal. La material vegetal típicamente incluye algunas porciones que contienen cutina y/o tienen una alta densidad de cutina (por ejemplo, cáscaras de fruta, hojas, brotes, etc.), así como otras porciones que no contienen cutina o tienen una baja densidad de cutina (por ejemplo, pulpa de fruta, semillas, etc.). Las porciones que contienen cutina se pueden usar para producir composiciones de extracto vegetal que comprenden monómeros y/u oligómeros derivados de la cutina, y también pueden incluir otros constituyentes tales como proteínas, polisacáridos, fenoles, lignanos, ácidos aromáticos, terpenoides, flavonoides, carotenoides, alcaloides, alcoholes, alcanos y aldehídos. Las porciones de baja densidad de cutina o que no contienen cutina a menudo pueden carecer de las unidades de monómero y/u oligómero, o de otra manera incluir una relación mucho menor de unidades de monómero y/u oligómero con respecto a los otros constituyentes en comparación con las porciones que contienen cutina de mayor densidad.
Los métodos descritos en el presente documento para formar composiciones de extracto vegetal pueden incluir separar primero (o al menos parcialmente separar) porciones que contienen cutina de material vegetal de porciones que no contienen cutina, y obtener cutina de las porciones que contienen cutina (por ejemplo, cuando la porción que contiene es una cáscara de fruta, la cáscara está separada del cuerpo de la fruta y/o la cutina está separada de la cáscara). La cutina, o la cáscara que contiene la cutina, es entonces despolimerizada (o al menos parcialmente despolimerizada) usando un proceso térmico, descrito en detalle a continuación, con el fin de obtener una mezcla que incluye una pluralidad de monómeros, oligómeros o ácidos grasos, o combinaciones de los mismos derivados de la cutina. El proceso térmico para la despolimerización hace que la mayoría o sustancialmente todos (por ejemplo, al menos el 95 % de) los monómeros y/u oligómeros resultantes de la mezcla sean protonados o neutralizados (es decir, sin carga) sin requerir ningún proceso adicional (por ejemplo, acidificación). En otras palabras, los procesos de despolimerización descritos en el presente documento pueden llevarse a cabo en ausencia de base o ácido añadidos. Esto da como resultado que los monómeros y/u oligómeros estén en un estado tal que subsecuentemente puedan modificarse químicamente para proporcionar compuestos cuyas propiedades pueden adaptarse para aplicaciones específicas. Por ejemplo, las propiedades de barrera contra el oxígeno y el agua de los recubrimientos formados subsecuentemente pueden controlarse modificando químicamente los monómeros y/u oligómeros, y tales modificaciones pueden requerir que los monómeros y/u oligómeros primero sean protonados o neutralizados. Adicionalmente, la modificación química de los monómeros y/u oligómeros se puede adaptar para cambiar la solubilidad de la composición del extracto con el fin de permitir opciones ampliadas para la deposición del recubrimiento. Finalmente, la mezcla que incluye el ácido graso libre y/o las unidades de monómero y/u oligómero de éster graso libre se disuelve en otro solvente para formar una solución, dando como resultado de este modo una composición de extracto vegetal adecuada para aplicaciones de recubrimiento (por ejemplo, aplicaciones de recubrimiento agrícola). Opcionalmente, antes de formar la composición de extracto vegetal, las unidades de monómero y/u oligómero de ácido graso libre y/o éster graso libre de la mezcla se activan o modifican (por ejemplo, son glicerados), por ejemplo para formar una mezcla de 1-monoacilglicéridos y/o 2-monoacilglicéridos, y la mezcla de unidades modificadas de monómero y/u oligómero (por ejemplo, 1-monoacilglicéridos y/o 2-monoacilglicéridos) se disuelve en un solvente para formar una solución, dando como resultado de este modo la composición del extracto vegetal.
Como se describió anteriormente, para formar una composición de extracto vegetal derivada de cutina adecuada para aplicaciones de recubrimiento, las porciones de material vegetal que contienen cutina se separan primero (o al menos parcialmente se separan) de las porciones que no contienen cutina. Esto se puede lograr mediante un
número de métodos, ya sea solos o en combinación entre sí. Por ejemplo, el material vegetal vegetal puede tratarse térmica y/o mecánicamente y/o enzimática y/o químicamente para separar al menos parcialmente la porción que contiene cutina de la porción que no contiene cutina. O, el material vegetal vegetal puede someterse a temperatura y/o presión elevadas en un medio acuoso (por ejemplo, como en la cocción a presión) para separar parcialmente la porción que contiene cutina de la porción que no contiene cutina del material vegetal. Alternativamente, el material vegetal vegetal puede someterse a temperaturas más bajas (por ejemplo, como en congelación) para separar parcialmente la porción que contiene cutina de la porción que no contiene cutina del material vegetal. La material vegetal también puede someterse a sonicación en un medio acuoso para separar parcialmente la porción que contiene cutina de la porción que no contiene cutina del material vegetal. Opcionalmente, la porción que contiene cutina se puede calentar en una mezcla de oxalato de amonio y ácido oxálico para ayudar a la separación de la cutina de la porción que no contiene cutina (es decir, el resto de la cutícula y el material vegetal vegetal no deseada). Opcionalmente, esta separación se puede lograr (o ayudar) enzimáticamente usando enzimas capaces de hidrolizar enlaces éster y/o alternativamente usando enzimas capaces de romper polisacáridos que comprenden la porción de la planta que no contiene cutina. La porción que contiene cutina se puede someter a reflujo opcionalmente en al menos un solvente orgánico (tal como cloroformo y/o metanol) para eliminar ceras residuales y/o cualquier componente soluble restante de la cutina. Alternativamente, la eliminación de las ceras residuales y los componentes solubles restantes se puede lograr utilizando CO2 líquido o supercrítico.
Después de separar (o al menos separar parcialmente) las porciones que contienen cutina del material vegetal de las porciones que no contienen cutina, la cutina (o componente que contiene cutina) obtenida del material vegetal se agrega entonces a un solvente para formar un primer mezcla. El solvente puede ser, por ejemplo, un solvente nucleófilo tal como agua, metanol, etanol, glicerol o combinaciones de los mismos. La primera mezcla puede incluir opcionalmente un cosolvente tal como agua, metanol, etanol, glicerol, CO2 líquido o CO2 supercrítico. El cosolvente también puede ser nucleófilo (por ejemplo, cuando el cosolvente es agua, metanol, glicerol o etanol), o alternativamente, el cosolvente puede no ser nucleófilo (por ejemplo, cuando el cosolvente es CO2 líquido o CO2 supercrítico). Opcionalmente, el solvente puede servir como un modificador reactivo. Opcionalmente, el cosolvente puede servir como catalizador para despolimerizar la porción que contiene cutina, y el solvente puede servir para transesterificar el producto despolimerizado intermedio. Opcionalmente, el solvente también puede incluir un aditivo reactivo o auxiliar de procesamiento tal como una enzima, NaOH, Na2CO3, ácido acético, otro modificador de pH o combinaciones de los mismos. Si se incluye un aditivo reactivo o coadyuvante de procesamiento, la concentración del aditivo reactivo o coadyuvante de procesamiento puede ser lo suficientemente baja como para que no se produzca una despolimerización sustancial de la cutina en ausencia de las condiciones térmicas que se describen a continuación. Alternativamente, el aditivo reactivo o el auxiliar de procesamiento se pueden incluir en una concentración suficientemente alta para catalizar el proceso de despolimerización, y el proceso térmico se puede realizar para mejorar o aumentar aún más la tasa de reacción del proceso de despolimerización.
La primera mezcla que incluye el componente que contiene cutina en el solvente (y opcionalmente el cosolvente y/o el aditivo reactivo o coadyuvante de procesamiento) se somete entonces a temperatura y presión elevadas (es decir, un proceso térmico) durante un tiempo suficientemente largo para permitir que la cutina (o componente que contiene cutina) se despolimerice al menos parcialmente en monómeros, oligómeros, ésteres de los mismos o una combinación de los mismos derivados de la cutina, formando así una segunda mezcla que comprende los monómeros, oligómeros, ésteres de los mismos, o un combinación de los mismos derivados de la cutina. Por ejemplo, la primera mezcla se puede colocar en un recipiente de tal manera que aproximadamente el 50-100 % del volumen del recipiente se llene con la primera mezcla, y el recipiente y la primera mezcla incluida se pueden entonces sellar y calentar a una temperatura mayor que el punto de ebullición del solvente a presión atmosférica (es decir, la temperatura a la que el solvente habría hervido si se hubiera mantenido a 1 atm). Por ejemplo, el recipiente y la primera mezcla incluida pueden calentarse por encima de una temperatura que es al menos 5 %, al menos 10 %, al menos 15 %, al menos 20 % al menos 25 % al menos 30 %, al menos 40 %, al menos 45 %, al menos 50 %, al menos 55 %, al menos 60 %, al menos 65 %, al menos 70 %, al menos 75 %, al menos 80 %, al menos 85 %, al menos 90 %, o al menos 100 % mayor que el punto de ebullición del solvente a presión atmosférica (es decir, a 1 atm). En algunas implementaciones, el solvente es agua, y la mezcla se calienta hasta una temperatura de al menos 393 K, al menos 423 K, al menos 453 K, al menos 473 K, al menos 498 K, o al menos 523 K. En algunos implementaciones, la mezcla se mantiene por debajo de una temperatura de 1000 K.
Debido a la expansión térmica de la mezcla (y a cualquier aire u otro gas o fluido en el recipiente sellado), así como a la vaporización del solvente, la presión dentro del recipiente aumenta a la temperatura elevada y puede, por ejemplo, ser mayor que 1 atm, mayor que 5 atm, mayor que 10 atm o mayor que 100 atm. En algunas implementaciones, la presión se autoajusta a un valor en o cerca del punto de transición líquido-gas del solvente a la temperatura elevada, como se describe más adelante. La presión puede incrementarse opcionalmente dentro del recipiente, por ejemplo bombeando gas nitrógeno al recipiente, o bombeando solvente al recipiente con la presión mantenida por un flujo de retorno o regulador de presión. La primera mezcla se puede mantener a temperatura y presión elevadas durante una cantidad de tiempo predeterminado suficiente para causar la despolimerización del componente que contiene cutina en la primera mezcla en monómeros, oligómeros, ésteres o combinaciones de los mismos derivados de la cutina, formando así la segundo mezcla. Después de mantener la primera mezcla a temperatura y presión elevadas durante el tiempo predeterminado para formar la segunda mezcla, la segunda mezcla se enfría y se libera la presión.
Las abreviaturas que pueden usarse en el presente documento son DHPA [ácido de ácido 10,16-dihidroxihexadecanoico], MEHPA [ácido (E/Z)-16-hidroxihexadec-9-enoico], EtDHPA [10.16-dihidroxihexadecanoato de etilo] y EtMEHPA [(E/Z)-16-hidroxihexadec-9-enoato de etilo].
Como se usa en el presente documento, el término "temperatura" se refiere a temperatura absoluta, medida en unidades Kelvin (K). En consecuencia, si una primera temperatura es X % mayor que una segunda temperatura, la primera temperatura (medida en K) es al menos (1 X/100) veces la segunda temperatura (medida en K). Por ejemplo, en el caso del agua, que tiene un punto de ebullición de 373.15 K a 1 atm, una temperatura que es al menos un 5 % mayor que el punto de ebullición del agua a 1 atm corresponde a una temperatura superior a 391.81 K (es decir, mayor que 1.05 * 373.15 K).
En algunas implementaciones, los monómeros, oligómeros, ésteres o combinaciones de los mismos derivados de la cutina que resultan del proceso de despolimerización térmica son solubles en el solvente a la temperatura elevada a la que se lleva a cabo el proceso térmico, y también a la temperatura a la cual la segunda mezcla subsecuentemente es enfriada hasta (típicamente temperatura ambiente). Este puede ser el caso cuando el solvente es etanol o metanol, por ejemplo. En otras implementaciones, los monómeros, oligómeros, ésteres o combinaciones de los mismos derivados de la cutina que resultan del proceso de despolimerización térmica son insolubles en el solvente a la temperatura elevada a la que se lleva a cabo el proceso térmico, y también a la temperatura a la que la segundo mezcla se enfría subsecuentemente. En todavía otras implementaciones, los monómeros, oligómeros, ésteres o combinaciones de los mismos derivados de la cutina que resultan del proceso de despolimerización térmica son solubles en el solvente a la temperatura elevada a la que se lleva a cabo el proceso térmico, pero son insolubles a la temperatura a la que la segunda mezcla se enfría subsecuentemente hasta(por ejemplo, temperatura ambiente o aproximadamente 300 K). En este caso, los monómeros, oligómeros, ésteres o combinaciones de los mismos que se disuelven a la temperatura elevada precipitan a medida que la segunda mezcla se enfría hasta temperatura ambiente, dando como resultado la suspensión de los monómeros, oligómeros, ésteres o combinaciones de los mismos en el solvente. y, por ejemplo, que se entremezclan con otras materias vegetales no cutinas como un carbón sólido. Cuando se usa agua como solvente, por ejemplo, los monómeros, oligómeros, ésteres o combinaciones de los mismos derivados de la cutina pueden ser típicamente insolubles a temperatura ambiente, pero pueden o no ser solubles a temperatura y presión elevadas, dependiendo de la planta específica de la cual se obtiene la cutina. Como se describió anteriormente, mientras se calienta la primera mezcla y se mantiene a temperatura elevada, la presión dentro del recipiente se puede aumentar para garantizar que al menos el 50 % del solvente se mantenga en la fase líquida. Por ejemplo, considerar el diagrama de fase 100 del agua (H2O) que se muestra en la Figura 1. Cuando se usa agua, que tiene un punto de ebullición de aproximadamente 373 K a 1 atm, como solvente en la primera mezcla, la primera mezcla se puede calentar hasta una segunda temperatura mayor que 373 K (por ejemplo, temperatura 104 en la Figura 1) y se mantiene sustancialmente en la fase líquida si la presión también se incrementa a una segunda presión que es mayor o aproximadamente igual a la del límite de la fase líquido-gas para la temperatura particular. Por ejemplo, cuando la primera mezcla se calienta hasta la temperatura 104, la presión puede aumentar de tal manera que el agua en la mezcla esté en el punto 102 en el diagrama de fases 100 de la Figura 1)
Como se describió anteriormente, el aumento de la presión requerida para mantener al menos el 50 % del solvente en la fase líquida a la temperatura elevada se puede lograr, por ejemplo, sellando el recipiente de tal manera que la presión en el recipiente aumente a medida que aumenta la temperatura debido a la expansión térmica de la mezcla, la vaporización de alguna porción del solvente y/o la expansión térmica de cualquier aire u otro gas o fluido en el recipiente sellado. La presión resultante en el recipiente puede autoajustarse para que esté aproximadamente en el punto de transición líquido-gas. Por ejemplo, la presión puede ajustarse hasta un valor que esté dentro del 1 %, dentro del 2 % o dentro del 5 % del punto de transición líquido-gas a la temperatura elevada. El valor exacto de la presión resultante depende al menos parcialmente del volumen porcentual del recipiente que se llena con la mezcla. Sin embargo, si la relación de llenado es demasiado grande, por ejemplo, si la relación de llenado se aproxima a 1, la presión puede llegar a ser demasiado alta para que el recipiente la soporte mecánicamente. En consecuencia, en algunas implementaciones, más del 50 % pero menos del 99 % del volumen del recipiente se llena con la mezcla. Por ejemplo, entre el 60 % y el 95 % o entre el 70 % y el 95 % del volumen del recipiente puede llenarse con la mezcla. Adicionalmente, en algunas implementaciones, la presión en el recipiente a la temperatura elevada es suficiente para mantener al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, o sustancialmente todo el solvente en la fase líquida.
Adicionalmente, la presión dentro del recipiente puede ser aumentado adicionalmente bombeando gas o líquido adicional, por ejemplo nitrógeno, al recipiente. Esto puede permitir que la presión dentro del recipiente se controledirectamente por medio de un regulador de presión o un protector contra retrorreflujo para optimizar mejor el proceso de despolimerización, el cual es descrito adicionalmente más adelante. Adicionalmente, si el líquido contiene material adicional para ser procesado, se puede implementar una reacción de flujo pasante.
El solvente en el que la porción que contiene cutina se despolimeriza se puede seleccionar de tal manera que la porción que contiene cutina no se despolimerice sustancialmente a temperatura ambiente (por ejemplo, a 300 K) y/o no se despolimerice sustancialmente o tenga una tasa de despolimerización muy baja a temperaturas por debajo del punto de ebullición a 1 atm. Por lo tanto, en muchos casos, la tasa de despolimerización solo es lo suficientemente
alta como para que ocurra una despolimerización sustancial cuando la temperatura se eleva sustancialmente por encima del punto de ebullición atmosférica del solvente (por ejemplo, al menos 5 % o al menos 10 % por encima del punto de ebullición atmosférica). Como tal, con el fin de mantener el solvente en la fase líquida de tal manera que pueda ocurrir la despolimerización, la presión en el recipiente se eleva en consecuencia, como se describió previamente.
La despolimerización sustancial de la porción que contiene cutina se puede lograr alternativamente a temperatura ambiente o a temperaturas inferiores al punto de ebullición atmosférica del solvente acidificando o alcalinizando el solvente, por ejemplo añadiendo hidróxidos metálicos al solvente. Sin embargo, el proceso de despolimerización térmica descrito anteriormente puede proporcionar ciertas ventajas sobre tal proceso. Por ejemplo, el proceso de despolimerización térmica puede autogenerar tanto aniones como cationes reactivos en el solvente, despolimerizando así la cutina en unidades de monómero/oligómero. Los productos de despolimerización están inherentemente sin carga, lo que puede ser necesario o deseable para modificar subsecuentemente (por ejemplo, se pueden esterificar o glicerar) las unidades de monómero/oligómero y/o para formar recubrimientos protectores a partir de las unidades de monómero/oligómero. Por el contrario, la despolimerización en una base fuerte típicamente no da como resultado que los productos de monómero y/u oligómero del proceso de despolimerización se descarguen. Como tal, pueden requerirse etapas adicionales en los que los productos de monómero/oligómero se neutralizan para formar recubrimientos protectores que tengan propiedades deseables a partir de las unidades de monómero/oligómero. Adicionalmente, omitir el uso de ácidos y/o bases fuertes del proceso de despolimerización puede dar como resultado que el proceso sea reconocido como completamente orgánico.
Las temperaturas específicas a las que se lleva a cabo el proceso de despolimerización térmica, así como la composición del solvente, pueden seleccionarse de tal manera que las concentraciones de aniones reactivos y cationes reactivos en el solvente mientras el solvente se mantiene a temperatura elevada (y la presión elevada correspondiente) son suficientes para despolimerizar la cutina. La temperatura puede seleccionarse adicionalmente de tal manera que la tasa de despolimerización de la cutina en el solvente sea al menos 100 veces mayor a la temperatura elevada (y la presión elevada correspondiente) que a la temperatura y presión estándar. Por ejemplo, cuando se usa H2O como solvente para el proceso de despolimerización térmica, la temperatura puede ser mayor que 393 K, por ejemplo al menos 413 K, al menos 433 K, al menos 453 K, al menos 473 K, mayor que 483 K, mayor que 498 K, mayor que 513 K, mayor que 523 K, entre 473 K y 523 K, o entre 493 K y 533 K. En algunas implementaciones, el proceso de despolimerización térmica se lleva a cabo utilizando H2O supercrítico como solvente y opcionalmente utilizando CO2 supercrítico como cosolvente, en cuyo caso la temperatura elevada es superior a 647 K y la presión es superior a 218 atm (por ejemplo, entre 218 y 1000 atm). En algunas implementaciones, el proceso de despolimerización térmica se lleva a cabo utilizando etanol supercrítico como solvente y opcionalmente utilizando CO2 supercrítico como cosolvente, en cuyo caso la temperatura elevada puede ser superior a 514 K y la presión puede ser superior a 60.6 atm (por ejemplo, entre 60.6 y 1000 atm).
La Figura 2A muestra la composición química del ácido 10,16-dihidroxihexadecanoico (200 en la Figura 2A), y la Figura muestra la composición química del ácido 10,18-dihidroxioctadecanoico (202 en la Figura 2B), los cuales son productos monoméricos directos típicos del proceso de despolimerización térmica de cutina que se lleva a cabo con agua como solvente, y forman el bloque de construcción mayoritario de la cutina. Otros productos de monómero directo que pueden resultar del proceso de despolimerización térmica de cutina llevado a cabo con agua como solvente se muestran en las Figuras 2C, 2D, 2E y 2F, donde la Figura 2C muestra la composición química del ácido 9,16-dihidroxihexadecanoico (204 en la Figura 2C). La Figura 2D muestra la composición química del ácido 9,18-dihidroxioctadecanoico (206 en la Figura 2D), la Figura 2E muestra la composición química del ácido 9,10,16-trihidroxihexadecanoico (208 en la Figura 2E), y la Figura. 2F muestra la composición química del ácido 9,10,18-trihidroxioctadecanoico (210 en la Figura 2F). Los productos exactos que resultan directamente del proceso de despolimerización térmica dependen de la fuente de planta particular de la cutina y del solvente en el que se lleva a cabo el proceso de despolimerización térmica. Por ejemplo, la cutina de los tomates tiende a tener una alta proporción de ácidos C16 (por ejemplo, ácidos grasos que tienen una longitud de cadena de carbono de 16) tal como el de las Figuras 2A, 2C, 2E y 2G, mientras que la cutina de los arándanos tiende a tener una alta proporción de ácidos C18 tal como el de las Figuras 2B, 2D y 2F. En algunas implementaciones, el proceso de despolimerización térmica produce compuestos de Fórmula I:
en la que R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, m, n, y o son como se definieron previamente para la Fórmula I. En algunas realizaciones, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12 en la Fórmula I son H.
Además de los compuestos de Fórmula I, así como los monómeros y/u oligómeros de las moléculas 200, 202, 204, 206, 208 y 210 en las Figuras 2A-2F, respectivamente, también se pueden formar otros productos durante el
proceso de despolimerización térmica llevada a cabo en agua que no está formada por despolimerización de cutina por otros métodos. Por ejemplo, los productos insaturados 302, 304, 306, 308, 310, 312, 314, 316 y/o 318 en las Figuras 3A-3I, respectivamente, pueden formarse durante el proceso de despolimerización térmica llevado a cabo en agua. Aquí la Figura 3A ilustra el ácido (E)-16-hidroxihexadec-9-enoico (302). La Figura 3B ilustra el ácido (E)-16-hidroxihexadec-10-enoico (304). La Figura 3C ilustra el ácido (Z)-16-hidroxihexadec-9-enoico (306), la Figura 3D ilustra el ácido (Z)-16-hidroxihexadec-10-enoico (308), la Figura 3E ilustra el ácido 10-hidroxihexadec-15-enoico
(310), la Figura 3F ilustra el ácido (E)-hexadeca-9,15-dienoico (312), la Figura 3G ilustra el ácido (E)-hexadeca-10,15-dienoico (314), la Figura 3H ilustra el ácido (Z)-hexadeca-9,15-dienoico (316), y la Figura 3I ilustra el ácido (Z)-hexadeca-10,15-dienoico (318). En general, los métodos de despolimerización térmica descritos aquí pueden producir compuestos de Fórmula II:
en la que R1, R2, R3, R3, R R6, R6', m, y n son como se definieron previamente para la Fórmula II. En algu realizaciones, R1, R2, R3, R R5, R6, R6' en la Fórmula II son H.
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir compuestos de Fórmula III:
en la que:
R1, R2, R5, R6, R9, R10, R11, R12 y R13 son cada uno independientemente, en cada presencia, -H,-OR14, -NR14R15, -SR14, halógeno, alquilo -C1-C6, alquenilo C2-C6, alquinilo -C2-C6, cicloalquilo -C3.C7, arilo o heteroarilo, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno;
R3, R4, R7, y R8 son cada uno independientemente, en cada presencia, -H, -OR14, -NR14R15,-SR14, halógeno, alquilo -C1-C6, alquenilo -C2-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3.C7, arilo o heteroarilo en la que cada alquilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno; o
R3 y R4 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros; y/o
R7 y R8 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros;
R14 y R15 son cada uno independientemente, en cada presencia, -H, alquilo -C1-C6, alquenilo -C2-C6 o alquinilo -C2-C6;
el símbolo----- representa un enlace simple o un doble enlace cis o trans;
n es 0, 1, 2, 3, 4, 5, 6, 7 o 8;
m es 0, 1, 2 o 3;
q es 0, 1, 2, 3, 4 o 5; y
r es 0, 1, 2, 3, 4, 5, 6, 7 o 8; y
R se selecciona de -H, alquilo -C1-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo, 1-glicerol, 2-glicerol o heteroarilo.
En algunas realizaciones, R puede ser -H, -CH3 , o -CH2CH3.
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir compuestos de Fórmula III-A:
en la que:
cada Ra es independientemente -H o alquilo -C iC
cada Rb se selecciona independientemente de -H, alquilo -C1-C6 , o -OH;
R1, R2, R5, R6, R9, R10, R11, R12 y R13 son cada uno independientemente, en cada presencia, -H,-OR14, -NR14R15, -SR14, halógeno, alquilo -C1-C6, alquenilo C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo o heteroarilo, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno;
R3, R4, R7, y R8 son cada uno independientemente, en cada presencia, -H, -OR14, -NR14R15,-SR14, halógeno, alquilo -C1-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo, o heteroarilo en la que cada alquilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno; o R3 y R4 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros; y/o
R7 y R8 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros;
R14 y R15 son cada uno independientemente, en cada presencia, -H, alquilo -C1-C6 , alquenilo -C2-C6 o alquinilo -C2-C6; el símbolo----- representa un enlace simple o un doble enlace cis o trans;
n es 0, 1, 2, 3, 4, 5, 6, 7 o 8;
m es 0, 1, 2 o 3;
q es 0, 1, 2, 3, 4 o 5; y
res 0, 1, 2, 3, 4, 5, 6, 7 o 8.
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir compuestos de Fórmula III-B:
en la que:
cada Ra es independientemente -H o alquilo -C1-C6;
cada Rb se selecciona independientemente de -H, alquilo -C1-C6 , o -OH;
R1, R2, R5, R6, R9, R10, R11, R12 y R13 son cada uno independientemente, en cada presencia, -H,-OR14, -NR14R15, -SR14, halógeno, alquilo -C1-C6, alquenilo C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo o heteroarilo, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno;
R3, R4, R7, y R8 son cada uno independientemente, en cada presencia, -H, -OR14, -NR14R15,-SR14, halógeno, alquilo -C1-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo, o heteroarilo en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -Sr14, o halógeno; o
R3 y R4 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros; y/o
R7 y R8 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros;
R14 y R15 son cada uno independientemente, en cada presencia, -H, alquilo -C1-C6, alquenilo -C2-C6 o alquinilo -C2-C6; el símbolo----- representa un enlace simple o un doble enlace cis o trans;
n es 0, 1, 2, 3, 4, 5, 6, 7 o 8;
mes 0, 1, 2 o 3;
q es 0, 1, 2, 3, 4 o 5; y
res 0, 1, 2, 3, 4, 5, 6, 7 o 8.
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir uno o más de los siguientes compuestos de ácidos grasos:
o
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir uno o más de los siguientes compuestos de éster de metilo:
o
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir uno o más de los siguientes compuestos de etil éster:
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir uno o más de los siguientes compuestos de 2-glicerol éster:
En algunas realizaciones, los métodos de despolimerización térmica descritos en este documento pueden producir uno o más de los siguientes compuestos de 1 -glicerol éster:
En algunas realizaciones, cualquiera de los compuestos descritos en el presente documento (por ejemplo, compuestos de Fórmula I, II o III) se pueden entrecruzar para crear un dímero, trímero u oligómero. Por ejemplo, un dímero puede tener la estructura establecida a continuación:
Un experto en la técnica comprenderá que se pueden crear otros dímeros, trímeros u oligómeros entrecruzados de acuerdo con la presente divulgación. Además, un experto en la técnica comprenderá que a las temperaturas y presiones utilizadas para despolimerizar la cutina descrita en el presente documento, puede producirse oxidación de alcoholes primarios o secundarios. Por ejemplo, cuando se lleva a cabo en presencia de oxígeno (por ejemplo, aire), es posible que una unidad estructural de alcohol se pueda oxidar a una cetona correspondiente.
Sin desear limitarse a ninguna teoría, se cree que los productos saturados (por ejemplo, 200, 202, 204, 206, 208 y/o 210) están entrecruzados dentro de la capa de cutina y, por lo tanto, están aislados en unidades de monómero y/o de oligómero directamente a través de reacciones de despolimerización, mientras que los productos insaturados (por ejemplo, 302, 304, 306, 308, 310, 312, 314, 316, 318 y/o productos de Fórmula II) son subproductos indirectos que se forman por descomposición de los productos directos (por ejemplo, 200, 202, 204, 206, 208 y/o 210). La descomposición puede ocurrir, por ejemplo, si se mantienen condiciones de alta temperatura y/o alta presión durante un período de tiempo demasiado largo durante el proceso de despolimerización térmica, donde el tiempo necesario para producir los subproductos insaturados disminuye con el aumento de la temperatura. Sin embargo, puede ser posible que los productos insaturados (por ejemplo, 302, 304, 306, 308, 310, 312, 314, 316, 318 y/o productos de Fórmula II) estén presentes en la capa de cutina y se conviertan en componentes de la composición de extracto cuando la composición se forma mediante los métodos de despolimerización térmica descritos en este documento, pero que la producción de estos productos se suprime o inhibe cuando la despolimerización de cutina se lleva a cabo utilizando otros métodos (por ejemplo, despolimerización ácida o básica). O, los productos insaturados pueden generarse como parte del proceso de despolimerización térmica.
En algunas implementaciones, es preferible que los productos directos (por ejemplo, 200, 202, 204, 206, 208 y/o 210) de la despolimerización de cutina estén presentes en la segunda mezcla pero no los subproductos indirectos
insaturados (por ejemplo, 302, 304, 306, 308, 310, 312, 314, 316, 318 y/o productos de Fórmula II) resultantes de la descomposición (por ejemplo, eliminación) de los productos directos. Por ejemplo, cuando la segunda mezcla resultante se usa subsecuentemente para formar un recubrimiento protector, en muchos casos el recubrimiento puede tener cualidades deseables (por ejemplo, mayor densidad de entrecruzamiento, menor permeabilidad al agua y/u oxígeno) cuando la segunda mezcla incluye un gran fracción de productos de despolimerización saturados (por ejemplo, 200, 202, 204, 206, 208 y/o 210) mientras tiene una concentración lo más pequeña posible de los subproductos indirectos insaturados (por ejemplo, 302, 304, 306, 308, 310, 312, 314, 316, 318 y/o productos de Fórmula II). Como tal, las condiciones del proceso de despolimerización térmica (por ejemplo, composición del solvente, temperatura, presión, tiempo de residencia de la mezcla a alta temperatura y presión, y tiempo para calentar y enfriar la mezcla) pueden ajustarse de tal manera que la mezcla después de la despolimerización incluya una gran fracción de los productos directos, tal como los monómeros 200, 202, 204, 206, 208 y/o 210 (y opcionalmente oligómeros formados por los mismos).
En algunas implementaciones, la conversión (en masa) de cutina en unidades o ésteres de monómero y/u oligómero derivados de cutina (tanto productos directos como subproductos indirectos) usando los procesos de despolimerización descritos en el presente documento puede ser al menos 5 %, al menos 10 %, a al menos 20 %, al menos 30 %, al menos 40 %, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 % o al menos 95 %. Adicionalmente, de los productos de despolimerización de monómero y/u oligómero y/o éster resultantes (tanto productos directos como subproductos indirectos), al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, o al menos el 95 % pueden ser productos directos tales como monómeros 200 y/o 202 (y/u oligómeros formados por los mismos). Los productos de despolimerización pueden purificarse adicionalmente, por ejemplo mediante filtración selectiva, para formar una composición de extracto vegetal adecuada para aplicaciones de recubrimiento que es una composición sustancialmente pura de productos de despolimerización directa tales como monómeros 200, 202, 204, 206, 208 y/o 210 (y/u oligómeros formados de los mismos), o de compuestos esterificados o glucerados formados por los productos de despolimerización directa.
La duración del tiempo durante el cual la mezcla se mantiene a temperatura y presión elevadas durante el proceso de despolimerización térmica puede determinarse al menos parcialmente por los valores específicos de la temperatura y presión elevadas, así como por el tiempo requerido para calentar y enfriar la mezcla. Típicamente, las temperaturas y/o presiones más bajas requieren tiempos de residencia más largos para lograr una alta tasa de conversión de cutina en unidades de monómero y/u oligómero. Por lo tanto, puede ser preferible usar temperaturas y/o presiones más altas para reducir los tiempos de procesamiento. Sin embargo, una temperatura demasiado alta puede causar la descomposición de los monómeros/oligómeros directos (por ejemplo, los monómeros 200, 202, 204, 206, 208 o 210 de las Figuras 2A-2F, respectivamente) en otros subproductos, como se describió anteriormente (por ejemplo, en la Figura 3), que en muchos casos puede afectar negativamente la calidad de los recubrimientos que subsecuentemente se forman a partir de las composiciones de extracto vegetal. Por ejemplo, los tiempos de residencia superiores a una hora a 520 K pueden dar como resultado cantidades significativas de producto insaturado, y la descomposición se acelera adicionalmente a temperaturas aún más altas.
Las Figuras 4A y 4B son gráficos cualitativos de las concentraciones relativas de productos de despolimerización directa (por ejemplo, 200, 202, 204, 206, 208 y/o 210) y subproductos indirectos insaturados (por ejemplo, 302, 304, 306, 308, 310, 312, 314, 316 y/o 318) en la mezcla en función del tiempo para diferentes condiciones de despolimerización térmica cuando se usa agua como solvente. La Figura 4A corresponde a una temperatura de 498 K y una presión de aproximadamente 22.1 atm (aproximadamente 325 psi), mientras que la Figura 4B corresponde a una temperatura de 523 K y una presión de aproximadamente 37.4 atm (aproximadamente 550 psi). En ambos casos, la cutina se obtuvo de las pieles de tomate. 402 y 404 representan las concentraciones relativas de productos de monómeros de despolimerización directa (por ejemplo, monómeros de 200, 202, 204, 206, 208 y/o 210) en las mezclas en diferentes momentos durante el proceso de despolimerización térmica, mientras que 406 y 408 representan el concentraciones relativas de subproductos indirectos insaturados (por ejemplo, 302, 304, 306, 308, 310, 312, 314, 316 y/o 318) en las mezclas en diferentes momentos durante el proceso de despolimerización térmica.
Como se ve en las Figuras 4A y 4B, bajo ambas condiciones no existe una concentración sustancial de productos de despolimerización directa o indirecta en la mezcla en el tiempo t= 0 (al comienzo del proceso de despolimerización térmica). Con referencia ahora a la Figura 4A, a 498 K hay un aumento constante en la concentración de productos de monómero de despolimerización directa con el tiempo hasta que la concentración se satura después de casi 8 horas (véase 402). Sin embargo, si la temperatura elevada se mantiene más allá de aproximadamente 8 horas, la concentración de productos de monómero de despolimerización directa comienza a disminuir, lo que corresponde a la descomposición de los productos de monómero de despolimerización directa en los subproductos insaturados. En consecuencia, a 498 K, la concentración de subproductos insaturados permanece baja hasta aproximadamente 8 horas, momento en el que comienza a aumentar a medida que los productos de monómeros de despolimerización directa comienzan a descomponerse (véase 406).
Con referencia ahora a la Figura 4B, a 523 K, la concentración de productos de monómero de despolimerización directa sube de manera constante y luego se satura después de aproximadamente 1 hora (véase 404). Poco después, la concentración de productos de monómero de despolimerización directa comienza a disminuir, a medida que los productos de monómero de despolimerización directa comienzan a descomponerse en los subproductos
insaturados. En consecuencia, a 523 K la concentración de subproductos insaturados permanece baja hasta cerca de aproximadamente 1 hora, momento en el cual comienza a subir a medida que los productos de monómeros de despolimerización directa comienzan a descomponerse (ver 408). Durante tiempos superiores a aproximadamente 2 horas a 523 K, la concentración de subproductos insaturados aumenta a un valor mayor que el de los productos de monómero de despolimerización directa. Como tal, a 498 K y 22.1 atm en agua, la conversión sustancial de cutina derivada de las pieles de tomate a monómeros ocurre en el transcurso de aproximadamente 8 horas, pero a 523 K y 37.4 atm, la conversión lleva menos de 1 hora.
Está también ilustrado cualitativamente en la Figura 4A la concentración de oligómeros (n-mers) con 1 <n <10 en función del tiempo (410). Como se ve, inicialmente la concentración de oligómero sube a una tasa mucho más rápida que la concentración de monómero. Sin embargo, después de un tiempo mucho menor de 8 horas, la concentración de oligómero se satura y luego disminuye a un valor mucho menor que la concentración de monómero. Sin desear limitarse a ninguna teoría, se cree que a 498 K y 22.1 atm en agua, la cutina se descompone inicialmente principalmente en unidades oligoméricas (n-mers con 1 <n <10), y las unidades oligoméricas se escinden subsecuentemente en unidades de monómero.
La tasa de descomposición de los productos de monómero/oligómero directo (por ejemplo, 200, 202, 204, 206, 208 o 210 en las Figuras 2A-2F, respectivamente) en subproductos insaturados tales como los de las Figuras. 3A-3I a temperaturas y/o presiones más altas se ve afectado además por la tasa de calentamiento y/o enfriamiento hacia y desde la temperatura elevada. En algunas realizaciones, los tiempos de calentamiento y/o enfriamiento más largos pueden dar como resultado una mayor tasa de descomposición de monómero/oligómero en subproductos insaturados durante un tiempo de residencia dado a una temperatura y presión elevadas específicas. Como tal, con el fin de prevenir o suprimir esta descomposición, puede ser preferible calentar y enfriar la mezcla lo más rápido posible. Por ejemplo, en algunas implementaciones se prefieren tasas de calentamiento y enfriamiento superiores a 10 °C/min, superiores a 20 °C/min o superiores a 40 °C/min, siendo preferibles tasas más rápidas.
También se pueden usar otros métodos para someter las mezclas a temperatura y/o presión elevadas. En particular, los métodos que minimizan los tiempos de subida y bajada de la temperatura pueden ser preferibles, ya que pueden reducir la tasa de descomposición de los monómeros/oligómeros a temperaturas y/o presiones más altas y permitir un mejor control del proceso. Por ejemplo, se puede utilizar un proceso de alimentación en pasta o de flujo continuo, en el que la mezcla fluye continuamente dentro y fuera del recipiente a través de una serie de válvulas a través de las cuales puede fluir la mezcla, mientras que al mismo tiempo permite el control del temperatura y presión dentro del recipiente. O, el calentamiento dieléctrico también podría usarse para calentar las mezclas.
En algunas implementaciones, puede ser preferible algún porcentaje (por ejemplo, más del 20 %, más del 40 %, más del 60 %, más del 70 %, más del 80 % o más del 90 %) de los productos de despolimerización directa (por ejemplo, monómeros 200, 202, 204, 206, 208 y/o 210 de las Figuras 2A-2F, respectivamente) para descomponerse en otros subproductos de monómero/oligómero (por ejemplo, subproductos insaturados 302, 304, 306, 308, 310, 312, 314, 316 y 318 de las Figuras 3A-3I, respectivamente) que típicamente no resultan de la despolimerización de la cutina (o componentes que contienen cutina). Específicamente, los subproductos insaturados 302, 304, 306, 308, 310, 312, 314, 316 y 318 de las Figuras 3A-3I, respectivamente, así como los compuestos de Fórmula II, pueden aislarse y procesarse adicionalmente para formar otras moléculas saturadas tales como las mostradas en las Figuras 5A, 5B y 5C, donde la Figura 5A ilustra el ácido 9,10,16-trihidroxihexadecanoico (502), la Figura 5B ilustra el ácido 16-hidroxihexadecanoico (504), y la Figura 5C ilustra el ácido palmítico (506). De manera similar, los subproductos de éster insaturado, tales como los mostrados en las Figuras 7A-7I, 8A-8I, 9A-9I y 10A-10I y se describen con más detalle a continuación, cada uno puede aislarse y procesarse adicionalmente para formar otras moléculas saturadas tales como las mostradas en las Figuras 6A-6H (que también se describen con más detalle a continuación). Por ejemplo, haciendo referencia a la Figura 4B, la reacción para convertir los monómeros saturados en subproductos insaturados puede completarse, por ejemplo, llevando a cabo el proceso de despolimerización térmica a 523 K y 37.4 atm en agua durante más de 2 horas. Los subproductos insaturados se pueden hidrogenar luego con un catalizador, por ejemplo Ni o Pd, para formar ácido palmítico 506 o ácido 16-hidroxihexadecanoico 504. Por consiguiente, en tal proceso, el ácido palmítico se puede formar a partir de fuentes que no son de palma. La producción de aceite de palma a partir de las palmas de aceite tiene un gran impacto ambiental, incluida la deforestación y la pérdida de hábitat, así como los impactos sociológicos, ya que los pueblos indígenas a menudo son desplazados para dar cabida a grandes plantaciones en el mundo en desarrollo. Por estas razones, puede ser deseable obtener ácido palmítico de fuentes que no sean de palma.
Alternativamente, después de que la reacción para convertir los monómeros saturados en subproductos insaturados se completa, los subproductos insaturados se pueden hidroxilar con un catalizador (por ejemplo, tetraóxido de osmio u otro reactivo de hidroxilación) para formar, por ejemplo, ácido 9,10,16-trihidroxihexadecanoico (502) u otros compuestos de Fórmula I, donde la Fórmula I es como se definió previamente.
Las composiciones de extractos vegetales para formar recubrimientos protectores pueden formarse subsecuentemente a partir de cualquiera de las moléculas 200, 202, 204, 206, 208, 210, 502, 504 o 506 en las Figuras 2A, 2B, 2C, 2D, 2E, 2F, 5A, 5B y 5C, respectivamente, así como cualquier otro producto de despolimerización directa (por ejemplo, compuestos de Fórmula I). Los recubrimientos pueden formarse principalmente a partir de uno de estos tipos de moléculas, o alternativamente a partir de una combinación de estas
moléculas. Alternativamente, las moléculas pueden esterificarse primero (por ejemplo, se pueden glicerar para formar 1-monoacilglicéridos y/o 2-monoacilglicéridos), las composiciones de extracto vegetal pueden formarse a partir de los ésteres o moléculas gliceradas, y los recubrimientos pueden formarse a partir de los ésteres o moléculas gliceradas en las composiciones de extractos vegetales. La formación de recubrimientos a partir de composiciones de extractos vegetales formadas a partir de moléculas 502 o de moléculas 504, o de una combinación de moléculas 200, 202, 204, 206, 208, 210, 502, 504 y 506, o a partir de ésteres o moléculas gliceradas formados de las mismas pueden permitir un control adicional sobre las propiedades tanto de las composiciones de extracto como de los recubrimientos. Por ejemplo, la solubilidad de las moléculas 502, 504 y 506 (y los ésteres o moléculas gliceradas formados de las mismas) en diversos solventes es diferente a la de las moléculas 200, 202, 204, 206, 208 y 210, (y los ésteres o moléculas gliceradas formados de las mismas). Como tal, puede estar disponible una variedad más amplia de solventes para usar en la formación de composiciones de extractos vegetales a partir de moléculas 502, 504 o 506 (o ésteres o moléculas gliceradas formadas de los mismos), o de combinaciones de moléculas 200, 202, 204, 206, 208, 210, 502, 504 y 506 (o ésteres o moléculas gliceradas formados de las mismas), que pueden usarse para composiciones de extractos vegetales que solo incluyen cantidades sustanciales de subproductos directos de la despolimerización de cutina (por ejemplo, moléculas 200, 202, 204, 206, 208, y/o 210, o ésteres o moléculas gliceradas formados de las mismas). Adicionalmente, las propiedades de los recubrimientos formados a partir del extracto vegetal se pueden adaptar para aplicaciones específicas usando moléculas 502, 504 y 506 (y/o ésteres o moléculas gliceradas formados de las mismas), ya sea solos o en combinación con las moléculas 200, 202, 204, 206, 208, 210, y/o uno con otro. Por ejemplo, la densidad de entrecruzamiento de las películas protectoras resultantes puede variar dependiendo del porcentaje de masa de cada una de las moléculas 200, 202, 204, 206, 208, 210, 502, 504 y 506 (y/o ésteres o moléculas gliceradas formados de las mismas) en las composiciones de extracto vegetal, que pueden permitir que las propiedades de la película, tales como la densidad y la permeabilidad, se adapten específicamente para la aplicación específica en la que se usa la película. Adicionalmente, estas moléculas pueden modificarse químicamente para adaptar sus propiedades, por ejemplo, solubilidad, estabilidad y propiedades de formación de película.
Como se describió anteriormente, en algunas implementaciones, las moléculas/compuestos obtenidos directamente de la despolimerización (por ejemplo, compuestos 200, 202, 204, 206, 208 o 210) o indirectamente a través de etapas de procesamiento subsecuentes (por ejemplo, compuestos 502, 504 o 506) son glicerados para formar monómeros de 1-monoacilclicérido y/o de 2-monoacilglicérido, oligómeros formados por los mismos o combinaciones. En este caso, las composiciones de extracto vegetal a partir de las cuales se forman subsecuentemente los recubrimientos protectores incluyen los 1-monoacilclicéridos y/o 2-monoacilglicéridos opcionalmente disueltos en un solvente. La diferencia entre un 1-monoacilclicérido y un 2-monoacilglicérido es el punto de conexión del grupo glicérido. Los inventores de la divulgación han encontrado en muchos casos que los recubrimientos protectores formados sobre sustratos tales como frutas de formulaciones que incluyen combinaciones de 2-monoacilglicéridos y 1-monoacilclicéridos (u opcionalmente un aditivo diferente en lugar de los 1-monoacilclicéridos) muestran un desempeño superior en la prevención de la pérdida de agua y oxidación sin alterar la apariencia física del sustrato.
Mientras que los ésteres (por ejemplo, los ésteres de glicerilo) de los productos de despolimerización directa 200 o 202 pueden formarse mediante esterificación (por ejemplo, esterificación de Fischer) siguiendo los procesos de despolimerización térmica descritos en el presente documento, los ésteres alternativamente pueden formarse directamente durante los procesos de despolimerización térmica a través de una selección de solvente adecuada. Por ejemplo, cuando la despolimerización térmica de cutina se lleva a cabo en agua, los productos de despolimerización directa resultantes pueden ser ácidos grasos libres (por ejemplo, compuestos 200, 202, 204, 206, 208 o 210 de las Figuras 2A-2F). Sin embargo, la despolimerización térmica de la cutina en otros solventes (por ejemplo, etanol, metanol o glicerol) puede dar como resultado directamente la producción de ésteres.
Por ejemplo, las Figuras 6A y 6B muestran la estructura química del 10,16-dihidroxihexadecanoato de etilo 600 y 10,18-dihidroxioctadecanoato de etilo 602, respectivamente, que son ésteres de etilo de los compuestos respectivos ácido 10,16-dihidroxihexadecanoico (200 en la Figura 2A) y ácido 10,18- dihidroxioctadecanoico (202 en la Figura 2B). Los compuestos 600 y/o 602 pueden producirse directamente llevando a cabo la despolimerización térmica de cutina en etanol, o alternativamente llevando a cabo el proceso de despolimerización térmica en un solvente que incluye etanol, por ejemplo agua con etanol añadido como cosolvente.
Como otro ejemplo, las Figuras 6C y 6D muestran la estructura química del 10,16-dihidroxihexadecanoato de metilo 610 y el 10,18-dihidroxioctadecanoato de metilo 612, respectivamente, que son ésteres de metilo de los compuestos respectivos ácido 10,16-dihidroxihexadecanoico (200 en la Figura 2A) y ácido 10,18-dihidroxioctadecanoico (202 en la Figura 2B). Los compuestos 610 y/o 612 pueden producirse directamente llevando a cabo la despolimerización térmica de cutina en metanol, o alternativamente llevando a cabo el proceso de despolimerización térmica en un solvente que incluye metanol, por ejemplo en agua con metanol añadido como cosolvente.
Como aún otro ejemplo, las Figuras 6E, 6F, 6G y 6H muestran la estructura química del 2,3-dihidroxipropil 10,16-dihidroxihexadecanoato 620, 1,3-dihidroxipropan-2-il 10,16-dihidroxihexadecanoato 630, 2,3-dihidroxipropil 10,18-dihidroxioctadecanoato 622, y 1,3-dihidroxipropan-2-il 10,18-dihidroxioctadecanoato 632, respectivamente. Los compuestos 620 y 630 son ésteres de glicerilo de ácido 10,16-dihidroxihexadecanoico (200 en la Figura 2A), y los compuestos 622 y 632 son ésteres de glicerilo de ácido 10,18-dihidroxioctadecanoico (202 en la Figura 2B). Los
compuestos 620, 630, 622 y/o 632 pueden producirse directamente llevando a cabo la despolimerización térmica de cutina en glicerol, o alternativamente llevando a cabo el proceso de despolimerización térmica en un solvente que incluye glicerol, por ejemplo en agua con glicerol añadido como un cosolvente
Los ésteres de subproductos insaturados (por ejemplo, compuestos 302, 304, 306, 308, 310, 312, 314, 316 y 318 en las Figuras 3A-3I) también pueden formarse mediante esterificación (por ejemplo, esterificación de Fischer) siguiendo los procesos de despolimerización térmica descritos aquí. Por ejemplo, haciendo referencia a la Figura 4B, el proceso térmico para convertir monómeros saturados en subproductos insaturados (302, 304, 306, 308, 310, 312,
314, 316 y/o 318) puede ser conducido a la finalización, por ejemplo, llevando a cabo la despolimerización térmica de la cutina a 523 K y 37.4 atm en agua por más de 2 horas, y los subproductos insaturados pueden ser entonces esterificados. Alternativamente, de manera similar a los procesos descritos anteriormente para la formación directa de los ésteres 600, 602, 610. 612, 620, 622, 630 y 632, los ésteres de subproductos insaturados pueden formarse directamente durante los procesos de despolimerización térmica a través de una selección de solvente adecuada.
Específicamente, cuando la despolimerización térmica de la cutina se lleva a cabo en agua, los subproductos insaturados resultantes pueden ser ácidos grasos insaturados (por ejemplo, compuestos 302, 304, 306, 308, 310,
312, 314, 316 y/o 318). Sin embargo, la despolimerización térmica de la cutina en otros solventes (por ejemplo, etanol, metanol o glicerol) puede dar como resultado directamente la producción de ésteres grasos insaturados.
Por ejemplo, la Figura 7A muestra la estructura química del (E)-16-hidroxihexadec-9-enoato de etilo 702, la Figura
7B muestra la estructura química del (E)-16-hidroxihexadec-10-enoato de etilo 704, la Figura 7C muestra la estructura química del (Z)-16-hidroxihexadec-9-enoato de etilo 706, la Figura 7D muestra la estructura química del
(Z)-16-hidroxihexadec-10-enoato de etilo 708, la Figura 7E muestra la estructura química del 10-hidroxihexadec-15-enoato de etilo 710, la Figura 7F muestra la estructura química del (E)-hexadeca-9,15-dienoato de etilo 712, la Figura 7G muestra la estructura química del (E)-hexadeca-10,15-dienoato de etilo 714, la Figura 7H muestra la estructura química del (Z)-hexadeca-9,15-dienoato de etilo 716, y la Figura 7I muestra la estructura química del (Z)-hexadeca-10,15-dienoato de etilo 718. El compuesto 702 es un éster de etilo del compuesto 302, el compuesto 704 es un éster de etilo del compuesto 304, el compuesto 706 es un éster de etilo del compuesto 306, el com es un éster de etilo del compuesto 308, el compuesto 710 es un éster de etilo del compuesto 310, el com es un éster de etilo del compuesto 312, el compuesto 714 es un éster de etilo del compuesto 314, el com es un éster de etilo del compuesto 316, y el compuesto 718 es un éster de etilo del compuesto 318. Los compuestos
702, 704, 706, 708, 710, 712, 714, 716 y/o 718 se pueden producir directamente llevando a cabo la despolimerización térmica de la cutina en etanol a una temperatura suficientemente alta durante un tiempo suficientemente largo, o alternativamente llevando a cabo el proceso de despolimerización térmica en un solvente que incluye etanol, por ejemplo agua con etanol añadido como cosolvente.
Como otro ejemplo, la Figura 8A muestra la estructura química del (E)-16-hidroxihexadec-9-enoato de metilo 802, la Figura 8B muestra la estructura química del (E)-16-hidroxihexadec-10-enoato de metilo 804, la Figura 8C muestra la estructura química del (Z)-16-hidroxihexadec-9-enoato de metilo 806, la Figura 8D muestra la estructura química del
(Z)-16-hidroxihexadec-10-enoato de metilo 808, la Figura 8E muestra la estructura química del 10-hidroxihexadec-15-enoato de metilo 810, la Figura 8F muestra la estructura química del (E)-hexadeca-9,15-dienoato de metilo 812, la Figura 8G muestra la estructura química del (E)-hexadeca-10,15-dienoato de metilo 814, la Figura 8H muestra la estructura química del (Z)-hexadeca-9,15-dienoato de metilo 816, y la Figura 8I muestra la estructura química del
(Z)-hexadeca-10,15-dienoato de metilo 818. El compuesto 802 es un éster de metilo del compuesto 302, el compuesto 804 es un éster de metilo del compuesto 304, el compuesto 806 es un éster de metilo del compuesto
306, el compuesto 808 es un éster de metilo del compuesto 308, el compuesto 810 es un éster de metilo del compuesto 310, el compuesto 812 es un éster de metilo del compuesto 312, el compuesto 814 es un éster de metilo del compuesto 314, el compuesto 816 es un éster de metilo del compuesto 316, y el compuesto 818 es un éster de metilo del compuesto 318. Los compuestos 802, 804, 806, 808, 810, 812, 814, 816 y/u 818 pueden producirse directamente llevando a cabo la despolimerización térmica de la cutina en metanol a una temperatura suficientemente alta durante un tiempo suficientemente largo, o alternativamente llevando a cabo el proceso de despolimerización térmica en un solvente que incluye metanol, por ejemplo agua con metanol añadido como cosolvente.
Como aún otro ejemplo, la Figura 9A muestra la estructura química del 2,3-dihidroxipropil (E)-16-hidroxihexadec-9-enoato 902, la Figura 9B muestra la estructura química del 2,3-dihidroxipropil (E)-16-hidroxihexadec-10-enoato 904, la Figura 9C muestra la estructura química del 2,3-dihidroxipropil (Z)-16-hidroxihexadec-9-enoato 906, la Figura 9D muestra la estructura química del 2,3-dihidroxipropil (Z)-16-hidroxihexadec-10-enoato 908, la Figura 9E muestra la estructura química del 2,3-dihidroxipropil 10-hidroxihexadec-15-enoato 910, la Figura 9F muestra la estructura química del 2,3-dihidroxipropil (E)-hexadeca-9,15-dienoato 912, la Figura 9G muestra la estructura química del 2,3-dihidroxipropil (E)-hexadeca-10,15-dienoato 914, la Figura 9H muestra la estructura química del 2,3-dihidroxipropil
(Z)-hexadeca-9,15-dienoato 916, y la Figura 9I muestra la estructura química del 2,3-dihidroxipropil (Z)-hexadeca-10,15-dienoato 918. El compuesto 902 es un éster de glicerilo del compuesto 302, el compuesto 904 es un éster de glicerilo del compuesto 304, el compuesto 906 es un éster de glicerilo del compuesto 306, el compuesto 908 es un éster de glicerilo del compuesto 308, el compuesto 910 es un éster de glicerilo del compuesto 310, el compuesto 912 es un éster de glicerilo del compuesto 312, el compuesto 914 es un éster de glicerilo del compuesto 314, el compuesto 916 es un éster de glicerilo del compuesto 316, y el compuesto 918 es un éster de glicerilo del compuesto 318.
Como todavía otro ejemplo, la Figura 10A muestra la estructura química del 1,3-dihidroxipropan-2-il (E)-16-hidroxihexadec-9-enoato 1002, la Figura 10B muestra la estructura química del 1,3-dihidroxipropan-2-il (E)-16-hidroxihexadec-10-enoato 1004, la Figura 10C muestra la estructura química del 1,3-dihidroxipropan-2-il (Z)-16-hidroxihexadec-9-enoato 1006, la Figura 10D muestra la estructura química del 1,3-dihidroxipropan-2-il (Z)-16-hidroxihexadec-10-enoato 1008, la Figura 10E muestra la estructura química del 1,3-dihidroxipropan-2-il 10-hidroxihexadec-15-enoato 1010, la Figura 10F muestra la estructura química del 1,3-dihidroxipropan-2-il (E)-hexadeca-9,15-dienoato 1012, la Figura 10G muestra la estructura química del 1,3-dihidroxipropan-2-il (E)-hexadeca-10,15-dienoato 1014, la Figura 10H muestra la estructura química del 1,3-dihidroxipropan-2-il (Z)-hexadeca-9,15-dienoato 1016, y la Figura 10I muestra la estructura química del 1,3-dihidroxipropan-2-il (Z)-hexadeca-10,15-dienoato 1018. El compuesto 1002 es un éster de glicerilo del compuesto 302, el compuesto 1004 es un éster de glicerilo del compuesto 304, compuesto 1006 es un éster de glicerilo del compuesto 306, el compuesto 1008 es un éster de glicerilo del compuesto 308, el compuesto 1010 es un éster de glicerilo del compuesto 310, el compuesto 1012 es un éster de glicerilo del compuesto 312, el compuesto 1014 es un éster de glicerilo del compuesto 314, el compuesto 1016 es un éster de glicerilo del compuesto 316, y el compuesto 1018 es un éster de glicerilo del compuesto 318. Los compuestos 902, 904, 906, 908, 910, 912, 914, 916, 918, 1002, 1004, 1006, 1008, 1010, 1012, 1014, 1016 y/o 1018 pueden producirse directamente llevando a cabo la despolimerización térmica de cutina en glicerol a una temperatura suficientemente alta durante un tiempo suficientemente largo, o alternativamente llevando a cabo el proceso de despolimerización térmica en un solvente que incluye metanol, por ejemplo, agua con metanol añadido como cosolvente.
En algunas implementaciones, el solvente de la mezcla (es decir, el solvente en el que se lleva a cabo el proceso de despolimerización térmica) es un líquido a temperatura y presión estándar (es decir, aproximadamente 273 K y aproximadamente 1 atmósfera), pero experimenta un cambio de fase al menos parcialmente cuando se eleva a temperatura y presión elevadas. Por ejemplo, en los casos en que el solvente es agua (H2O), si la temperatura de la mezcla aumenta por encima de 647 K y la presión aumenta por encima de 218 atm, el H2O se vuelve supercrítico y el proceso de despolimerización térmica se lleva a cabo en H2O supercrítico. O, en los casos en que el solvente es etanol, si la temperatura de la mezcla aumenta por encima de 513.9 K y la presión aumenta por encima de 60.6 atm, el etanol se vuelve supercrítico y el proceso de despolimerización térmica se lleva a cabo en etanol supercrítico.
Debido a que la cutina obtenida de la porción que contiene cutina típicamente se entremezcla con muchos de los otros constituyentes descritos anteriormente, el extracto obtenido del proceso de despolimerización térmica puede tener un nivel más alto de constituyentes de impurezas que los que se pueden tolerar en aplicaciones de recubrimientos agrícolas. Como tal, la cutina se puede purificar eliminando o filtrando selectivamente los constituyentes de impurezas. El filtrado selectivo puede ocurrir antes o después del proceso de despolimerización, o tanto antes como después de la despolimerización. El filtrado selectivo puede incluir uno o más de los siguientes procesos:
(a) Antes de despolimerizar o despolimerizar parcialmente la cutina, lavar y/o calentar la cutina en un solvente selectivo para el cual la solubilidad de los constituyentes de las impurezas en el solvente selectivo es mayor que la solubilidad de la cutina. En este caso, las impurezas se disuelven en el solvente selectivo, dando como resultado menos impurezas en el primer extracto intermedio inmediatamente después de la despolimerización. Ejemplos de tal solvente pueden incluir cloroformo, éter dietílico, diclorometano, hexano, éter de petróleo, acetato de etilo, acetona, isopropanol, etanol, metanol, dióxido de carbono supercrítico, agua supercrítica, agua y mezclas de los mismos.
(b) Después de despolimerizar o despolimerizar parcialmente la cutina para obtener la segunda mezcla que comprende un primer extracto intermedio que incluye los productos de despolimerización en el solvente, lavar y/o calentar el primer extracto intermedio en un solvente selectivo (por ejemplo, heptano, acetato de etilo, acetonitrilo, etc.) para los cuales la solubilidad de los constituyentes de impurezas en el solvente selectivo es menor que la solubilidad de los monómeros y/u oligómeros. En este caso, los monómeros y/u oligómeros se disuelven en el solvente selectivo mientras que las impurezas no. Las impurezas se pueden entonces filtrar, dando como resultado un segundo extracto intermedio disuelto en el solvente selectivo, por lo que el segundo extracto intermedio tiene una pureza más alta que el primer extracto intermedio. El segundo extracto intermedio puede solidificarse subsecuentemente, por ejemplo, evaporando el solvente selectivo.
(c) Después de despolimerizar o despolimerizar parcialmente la cutina para obtener la segunda mezcla que comprende un primer extracto intermedio que incluye los productos de despolimerización en el solvente, lavar y/o calentar el primer extracto intermedio en un solvente selectivo (por ejemplo, cloroformo o hexano) para el cual la solubilidad de los constituyentes de impurezas en el solvente selectivo es mayor que la solubilidad de los monómeros y/u oligómeros. En este caso, las impurezas se disuelven en el solvente selectivo, eliminando así las impurezas del extracto, y se obtiene un segundo extracto intermedio que tiene una pureza mayor que el primer extracto intermedio.
(d) Después de obtener un compuesto que comprende cutina de una porción de material vegetal que contiene cutina y antes de despolimerizar o despolimerizar parcialmente la cutina, exponer el compuesto a dióxido de carbono supercrítico para reducir selectivamente una concentración de al menos una de proteínas, polisacáridos, fenoles, lignanos, ácidos aromáticos, terpenoides, flavonoides, carotenoides, alcaloides, alcoholes, alcanos, aldehídos, ceras, impurezas coloreadas no caracterizadas o cualquier otra impureza no incluida en la lista.
(e) Después de la despolimerización o la despolimerización parcial de la cutina para obtener la segunda mezcla que comprende un primer extracto intermedio que incluye los productos de despolimerización en el solvente, agregar un segundo solvente a la mezcla, en donde el primer y segundo solventes son inmiscibles, el segundo solvente tiene la propiedad de que las impurezas o los monómeros/oligómeros (pero no ambos) se segregan selectivamente en el segundo solvente sobre el primer solvente.
(f) Después de despolimerizar o despolimerizar parcialmente la cutina para obtener la segunda mezcla que comprende un primer extracto intermedio que incluye los productos de despolimerización disueltos en el solvente, hacer que los monómeros/oligómeros se cristalicen y filtrándolos de la mezcla, o alternativamente haciendo que las impurezas cristalicen y filtrarlos de la mezcla.
Se puede formar un recubrimiento protector a partir de las composiciones de extracto vegetal descritas anteriormente usando el proceso 1100 ilustrado en la Figura 11. Primero, una mezcla sólida de las unidades de monómero y/u oligómero se disuelve en un solvente (por ejemplo, agua, etanol o combinaciones de los mismos) para formar la composición de extracto vegetal (etapa 1102). La concentración de la mezcla sólida en el solvente puede, por ejemplo, estar en un rango de aproximadamente 0.1 a 100 mg/ml. A continuación, la solución que incluye las unidades de monómero y/u oligómero se aplica sobre la superficie del sustrato que se va a recubrir (etapa 1104), por ejemplo, mediante recubrimiento por aspersión del sustrato o sumergiendo el sustrato en la solución. En el caso del recubrimiento por aspersión, la solución puede, por ejemplo, colocarse en una botella de aspersión que genera una aspersión en niebla fina. La cabeza de la botella de aspersión se puede entonces sostener aproximadamente a seis a doce pulgadas del sustrato, y luego se asperja el sustrato. En el caso del recubrimiento por inmersión, el sustrato puede, por ejemplo, colocarse en una bolsa, la solución que contiene la composición se vierte en la bolsa, y entonces la bolsa se sella y agita ligeramente hasta que toda la superficie del sustrato esté húmeda. Después de aplicar la solución al sustrato, se deja secar el sustrato hasta que se haya evaporado todo el solvente, permitiendo así que se forme un recubrimiento compuesto por las unidades de monómero y/u oligómero sobre la superficie del sustrato (etapa 1106).
Los recubrimientos y métodos descritos en el presente documento ofrecen un número de características y ventajas distintas sobre los métodos actuales para mantener la frescura de los productos y alimentos agrícolas. Por ejemplo, los recubrimientos pueden evitar la pérdida de agua y proteger los productos agrícolas de amenazas tales como bacterias, hongos, virus y similares. Los recubrimientos también pueden proteger, por ejemplo, plantas y productos alimenticios del daño físico (por ejemplo, magulladuras), pérdida de agua, oxidación y fotodaño. En consecuencia, las composiciones, soluciones y recubrimientos se pueden usar para ayudar a almacenar productos agrícolas durante largos períodos de tiempo sin estropearse. En algunos casos, las composiciones y recubrimientos permiten que los alimentos se mantengan frescos en ausencia de refrigeración. Las composiciones y recubrimientos descritos aquí también pueden ser comestibles (es decir, los recubrimientos pueden ser no tóxicos para el consumo humano). Los métodos para formar los recubrimientos descritos aquí pueden ser completamente orgánicos. En algunas implementaciones, los recubrimientos son insípidos, incoloros y/o inodoros. Los recubrimientos pueden estar hechos de las mismas materias primas químicas que se encuentran naturalmente en la cutícula de la planta (por ejemplo, Ácidos hidroxi y/o dihidroxipalmíticos, y/o ácidos hidroxi oleico y esteárico) y, por lo tanto, pueden ser orgánicos y totalmente naturales.
En algunas implementaciones, se forma una composición de extracto vegetal a partir de monómeros y/u oligómeros derivados de la cutina y/o sus ésteres extraídos de la cutina de una primera especie vegetal (por ejemplo, utilizando los procesos de despolimerización térmica descritos anteriormente), y la composición se desecha entonces sobre material vegetal de la misma especie vegetal, de tal manera que los monómeros y/u oligómeros y/o ésteres extraídos forman una capa protectora sobre el material vegetal vegetal de la primera especie vegetal. Tal recubrimiento puede, por ejemplo, reforzar la capa de cutícula que existe naturalmente sobre el material vegetal vegetal. En otras implementaciones, se forma una composición de extracto vegetal a partir de monómeros y/u oligómeros y/o ésteres derivados de cutina extraídos de la cutina de una primera especie vegetal (por ejemplo, utilizando los procesos de despolimerización térmica descritos anteriormente), y la composición se desecha luego sobre el material vegetal vegetal de una segunda especie vegetal que es diferente (aunque en algunos casos podría ser la misma) de la primera especie vegetal, de tal manera que los monómeros y/u oligómeros y/o ésteres extraídos forman una capa protectora sobre el material vegetal vegetal de la segunda especies de planta. Por ejemplo, la composición del extracto vegetal se puede formar a partir de monómeros y/u oligómeros y/o ésteres extraídos de la cutina obtenida de las pieles de tomate o arándano y luego se aplica sobre fresas, plátanos, caviar cítrico, limones u otras especies de plantas diferentes de las especies de plantas de las que se obtuvo la cutina para formar un recubrimiento protector. Como tal, los recubrimientos protectores que se forman a partir de los monómeros y/u oligómeros y/o ésteres de la composición de extracto vegetal pueden proporcionar formas de protección contra agentes de estrés bióticos y abióticos para los cuales la capa de cutícula nativa de la segunda especie vegetal es inherentemente incapaz de proporcionar. Por ejemplo, los recubrimientos protectores depositados sobre los sustratos pueden proporcionar una protección superior contra la pérdida de agua y la oxidación que puede proporcionar inherentemente la capa de cutícula nativa. O bien, las composiciones de extracto vegetal pueden formularse para inhibir o proporcionar protección contra el crecimiento de hongos, para lo cual la capa de cutícula nativa proporciona poca o ninguna protección. En algunas implementaciones, los monómeros y/u oligómeros derivados de la cutina son glicerados para formar monoacilglicéridos antes de que la composición sea dispuesta sobre el material vegetal vegetal para formar el recubrimiento. Esto puede, por ejemplo, aumentar la reactividad de
los monómeros y/u oligómeros y permitir que se entrecrucen después de ser dispuestos sobre el material vegetal vegetal.
En algunas realizaciones, los productos saturados de las reacciones de despolimerización tales como, por ejemplo, los compuestos de ácidos grasos libres 200 y 202 en la Figura 2, puede separarse o al menos parcialmente separarse de los productos insaturados (o subproductos) de las reacciones de despolimerización descritas en el presente documento (por ejemplo, compuestos de ácidos grasos insaturados en las Figuras 3A-3I). En algunas realizaciones, la capacidad de separar o al menos parcialmente separar los diferentes tipos de productos de reacción se puede usar para purificar, por ejemplo, los productos saturados (es decir, compuestos en los que los grupos hidroxi no se han eliminado). En otras palabras, la extracción de los productos crudos de una reacción de despolimerización hidrotérmica establecida en el presente documento puede usarse para purificar o enriquecer el porcentaje de un producto dado dependiendo del solvente usado.
Como se expone en los Ejemplos a continuación (por ejemplo, los Ejemplos 2, 3 y 7), en el caso de la despolimerización térmica de la cutina en agua para generar ácidos grasos libres, el aislado crudo de una reacción de despolimerización se extrajo primero usando un aparato Soxhlet y heptano. Después de extraer durante la noche y enfriar el heptano resultante, se descubrió que una porción del producto extraído precipitó de la fase heptano. Se descubrió que el precipitado contenía productos saturados (por ejemplo, compuestos 200 y 202), productos insaturados (por ejemplo, compuestos 302 y 304) o una mezcla de productos tanto saturados como insaturados. Sin embargo, se descubrió que el sobrenadante de heptano contenía productos de despolimerización enriquecidos (por ejemplo, más del 90 %, más del 95 %, más del 96 %, más del 97 %, más del 98 % o más del 99 %) en ácidos grasos insaturados (por ejemplo, del tipo que se muestra en la Figura 3).
Después de la extracción por Soxhlet con heptano, el aislado crudo se extrajo nuevamente usando un aparato de Soxhlet y acetato de etilo. Se descubrió que la fase resultante de acetato de etilo contenía productos enriquecidos (por ejemplo, más del 90 %, más del 95 %, más del 96 %, más del 97 %, más del 98 % o más del 99 %) en ácidos grasos saturados, por ejemplo compuestos tales como 200 y 202.
La Figura 12A muestra un gráfico del aislado crudo recuperado después de la despolimerización térmica en agua a diversas temperaturas y tiempos de reacción usando 15 g de orujo de tomate como material de partida. Las recuperaciones se dan como un porcentaje de la entrada original de 15 g. Como se muestra en la Figura 12A, generalmente se recupera más aislado crudo (es decir, monómeros y oligómeros derivados de cutina) después de tiempos de reacción más largos (por ejemplo, aproximadamente 4 horas) y a temperaturas relativamente más altas (por ejemplo, aproximadamente 250 °C o más).
El aislado crudo de la Figura 12A se extrajo usando un extractor Soxhlet usando tanto heptano como acetato de etilo. La Figura 12B muestra la cantidad de aislado recuperado después de una primera extracción por Soxhlet usando heptano en relación con los 15 g iniciales de orujo de tomate. En particular, la Figura 12B muestra la cantidad de aislado que precipitó del heptano después de la extracción por Soxhlet. En contraste, la Figura 12C muestra la cantidad de aislamiento que permaneció disuelto en el sobrenadante de heptano después de la extracción por Soxhlet (en relación con los 15 g de orujo de tomate utilizados como material de partida). Sin desear limitarse a ninguna teoría, se descubrió que el sobrenadante de una extracción con hexano contenía principalmente (por ejemplo, más del 90 % o sustancialmente todos) subproductos de ácidos grasos libres insaturados (por ejemplo, compuestos tales como 3A-3I de la Figura 3) de las reacciones hidrotérmicas descritas aquí.
La Figura 12D muestra la cantidad de aislado recuperado del aislado crudo extraído con heptano después de una extracción por Soxhlet usando acetato de etilo como solvente. Las cantidades se dan en relación con los 15 g de orujo de tomate que se utilizó como material de partida. Sin desear limitarse a ninguna teoría, se descubrió que el material que se extrajo usando acetato de etilo contenía principalmente (por ejemplo, más del 90 % o sustancialmente todos) productos de ácidos grasos libres saturados (por ejemplo, compuestos tales como 200 y 202 de la Figura 2) de las reacciones hidrotérmicas descritas aquí.
La Figura 13 proporciona una tabla que resume los productos aislados del precipitado de heptano, el sobrenadante de heptano y el sobrenadante de acetato de etilo después de dos extracciones por Soxhlet de aislado crudo recuperado de la despolimerización hidrotérmica usando heptano y acetato de etilo, respectivamente. Las columnas a la izquierda dan las condiciones de reacción hidrotérmica que se usaron para despolimerizar la cutina para dar un aislado de cutina crudo.
La Figura 17 muestra trazas de UPLC de producto crudo recuperado después de la despolimerización hidrotérmica a 548 K durante una hora. La Figura 18 muestra trazas de UpLC y análisis por espectrometría de masas de ácido 10,16-dihidroxihexadecanoico recuperado después de la despolimerización hidrotérmica a 548 K durante una hora antes de la extracción. La Figura 19 muestra trazas de UPLC y análisis por espectrometría de masas de ácidos grasos insaturados recuperados después de la despolimerización hidrotérmica a 548 K durante una hora antes de la extracción. La Figura 20 muestra trazas de UPLC y análisis por espectrometría de masas de ácido 10,16-dihidroxihexadecanoico recuperado del precipitado de heptano después de la despolimerización hidrotérmica a 548 K durante una hora y extracción por Soxhlet con heptano. La Figura 21 muestra trazas de UPLC y análisis por espectrometría de masas de ácidos grasos insaturados recuperados del sobrenadante de heptano después de la
despolimerización hidrotérmica a 548 K durante una hora y extracción por Soxhlet con heptano. La Figura 22 muestra trazas de UPLC y análisis por espectrometría de masas de ácido 10,16-dihidroxihexadecanoico recuperado del sobrenadante de acetato de etilo después de la despolimerización hidrotérmica a 548 K durante una hora y extracción por Soxhlet con acetato de etilo.
Además de los productos de despolimerización hidrotérmica, los productos de etanólisis (es decir, ésteres de etilo) pueden separarse de manera similar o al menos parcialmente separados usando extracciones selectivas o al menos parcialmente selectivas (por ejemplo, extracciones por Soxhlet) y diferentes solventes (por ejemplo polaridad diferente).
Por ejemplo, como se expone en los Ejemplos a continuación (por ejemplo, los Ejemplos 4, 5 y 8), el producto crudo aislado de la etanólisis puede extraerse mediante Soxhlet usando heptano. En algunas realizaciones, los ésteres de etilo aislados de etanólisis pueden ser menos polares que los ácidos grasos libres aislados por hidrólisis. Como se expone en los Ejemplos a continuación, después de la extracción por Soxhlet durante una noche de material de etanólisis crudo usando heptano y subsecuente enfriamiento, se encontró que se formó un precipitado a partir del extracto de heptano. Se descubrió que el precipitado de heptano contenía productos enriquecidos (por ejemplo, más del 90 %, más del 95 %, más del 96 %, más del 97 %, más del 98 % o más del 99 %) en ésteres de etilo saturados (por ejemplo, productos hidroxilados tales como el compuesto 600 o el compuesto 602). Por el contrario, se descubrió que el sobrenadante contenía productos disueltos que estaban enriquecidos (por ejemplo, más del 90 %, más del 95 %, más del 96 %, más del 97 %, más del 98 % o más del 99 %) en ésteres de etilo insaturados, por ejemplo compuestos tales como los expuestos en la Figura 7A- Figura 7I. En algunas realizaciones, no se realizó extracción con acetato de etilo en el aislado de etanólisis extraído con heptano. Por ejemplo, en algunas realizaciones, la precipitación selectiva de productos saturados (por ejemplo, hidroxilados) de la extracción de heptano tras el enfriamiento fue suficiente para permitir la purificación de los productos hidroxilados (por ejemplo, por filtración).
La Figura 14A muestra un gráfico del aislado crudo recuperado después de la despolimerización térmica en etanol a diversas temperaturas y tiempos de reacción usando 15 g de orujo de tomate como material de partida. Las recuperaciones se dan como un porcentaje de la entrada original de 15 g. Como se muestra en la Figura 14A, generalmente se recupera más aislado crudo (es decir, monómeros y oligómeros derivados de cutina) después de tiempos de reacción más largos (por ejemplo, aproximadamente 4 horas) y a temperaturas relativamente más altas (por ejemplo, aproximadamente 523 K o más).
El aislado crudo de la Figura 14A se extrajo usando un extractor Soxhlet usando heptano. La Figura 14B muestra la cantidad de aislado recuperado después de una extracción por Soxhlet usando heptano en relación con los 15 g iniciales de orujo de tomate. En particular, la Figura 14B muestra la cantidad de aislado que precipitó del heptano después de la extracción por Soxhlet y enfriamiento. En contraste, la Figura 14C muestra la cantidad de aislado que permaneció disuelto en el sobrenadante de heptano después de la extracción por Soxhlet (en relación con los 15 g de orujo de tomate utilizados como material de partida). Sin desear limitarse a ninguna teoría, se descubrió que el sobrenadante de la extracción con hexano contenía principalmente (por ejemplo, más del 90 % o sustancialmente todos) subproductos de éster de etilo insaturado (por ejemplo, compuestos tales como 7A-7I de la Figura 7) de las reacciones hidrotérmicas descritas aquí (es decir, los ésteres de etilo insaturados permanecieron disueltos en el sobrenadante de heptano).
Sin querer limitarse a ninguna teoría, se encontró que el material que precipitó del heptano después de la extracción (que podría aislarse por filtración) contenía principalmente (por ejemplo, más del 90 % o sustancialmente todos) productos de éster de etilo saturado (por ejemplo, compuestos tales como 600 y 602 de la Figura 6) de las reacciones hidrotérmicas descritas en este documento.
La Figura 15 proporciona una tabla que resume los productos aislados del precipitado de heptano y el sobrenadante de heptano después de la extracción por Soxhlet del aislado crudo recuperado de la despolimerización por etanólisis. Las columnas a la izquierda dan las condiciones de reacción de etanólisis que se usaron para despolimerizar la cutina para dar un aislado de cutina crudo.
La Figura 23 muestra trazas de UPLC del producto crudo recuperado después de la despolimerización por etanólisis a 548 K durante cuatro horas. La Figura 24 muestra trazas de UPLC y análisis por espectrometría de masas de 10,16-dihidroxihexadecanoato de etilo recuperado del sobrenadante de heptano después de la despolimerización por etanólisis a 548 K durante cuatro horas y extracción por Soxhlet con heptano. La Figura 25 muestra trazas de UPLC y análisis por espectrometría de masas de éster de etilo de ácido graso insaturado recuperado del sobrenadante de heptano después de la despolimerización por etanólisis a 548 K durante cuatro horas y extracción por Soxhlet con heptano.
Ejemplos
La divulgación se ilustra adicionalmente mediante los siguientes ejemplos y ejemplos de síntesis. Debe entenderse que los ejemplos se proporcionan para ilustrar ciertas realizaciones y que por ello no se pretende limitar el alcance
de la divulgación. Todos los solventes y otros reactivos químicos se obtuvieron de fuentes comerciales (por ejemplo, Sigma-Aldrich (St. Louis, MO)) y se usaron sin purificación adicional a menos que se indique otra cosa.
Las siguientes etapas han sido llevadas a cabo para realizar uno o más de los procesos de despolimerización térmica descritos en este documento, en los que el material cuticular se procesó térmicamente en ácidos grasos libres. Para cada uno de los Ejemplos 2-5, los procesos completos se llevaron a cabo varias veces para recopilar datos estadísticamente significativos. Cuando corresponde en estos ejemplos, los datos presentados se proporcionan como un valor promedio de las diversas iteraciones, junto con la desviación estadística del promedio. Ejemplo 1: Método para preparar orujo de tomate antes de la despolimerización
El orujo de tomate obtenido de una instalación comercial de procesamiento de tomate se molió en un molino de corte y se tamizó para dar diferentes distribuciones de tamaño de partícula (por ejemplo,> 500 pm, 250-500 pm, 125 250 pm, etc.). La fracción correspondiente a 250-500 pm se sometió secuencialmente a extracciones por Soxhlet con cloroformo (CHCh) durante la noche y metanol durante la noche para eliminar las ceras superficiales y otros componentes solubles, seguido de secado bajo vacío (<1 torr). El orujo lavado se liofilizó entonces durante la noche (<0.02 torr) para eliminar el agua, y luego se almacenó en un desecador antes de su uso.
Ejemplo 2: Despolimerización de cutina en agua a 498K
Se añadieron 15 g del orujo de tomate extraído de 250-500 pm (del Ejemplo 1) a un reactor Parr 4563B con un volumen interno de 600 ml. A esto se añadieron 375 ml de agua, después de lo cual el sistema se selló y el reactor se montó en el sistema, seguido de calentamiento a una temperatura objetivo de aproximadamente 498K. El tiempo de calentamiento desde la temperatura ambiente (típicamente de aproximadamente 298 K) hasta la temperatura objetivo fue de aproximadamente 45 minutos. La mezcla se mantuvo entonces a 498 K durante aproximadamente 8 horas, después de lo cual se enfrió rápidamente mediante un circuito de enfriamiento interno a una temperatura entre 25 °C y 40 °C.
Después de enfriar, el reactor fue despresurizado, desmontado y sin sellar. Los componentes internos y las paredes del reactor se enjuagaron con acetato de etilo hasta que todo el material se soltó de las paredes, y la mezcla sólido/líquido resultante se filtró a través de una frita de filtro de porosidad media. El cuerpo del reactor se lavó con una segunda porción de acetato de etilo, y esto se filtró a través de la torta del filtro. La torta sólida, que daba el material 'carbonizado' o de residuo, se lavó con una porción adicional de acetato de etilo. El volumen total típico de los lavados con acetato de etilo fue de aproximadamente 350 ml. La mezcla de agua/acetato de etilo recolectada de la filtración se separó en un embudo separador de 1 l. Las fases se separaron, y la capa orgánica se recolectó y se secó mediante la adición de sulfato de magnesio antes de filtrar a través de una frita porosa. El acetato de etilo se eliminó luego de la fase orgánica mediante evaporación rotatoria y se secó adicionalmente bajo alto vacío (P <0.1 torr). La masa total de la composición de extracto crudo resultante, que incluía ácidos grasos tanto saturados como insaturados, fue en promedio 2.86 g [Promedio] ± 0.23 g (n = 3).
La recolección de la composición de extracto crudo fue seguida por purificación. Primero, el extracto crudo se disolvió en metanol, después de lo cual se añadió tres veces la masa de Celite 545. El metanol se eliminó por evaporación rotatoria, permitiendo que el material se depositara sobre el Celite. Esta mezcla se transfirió a un dedal de extracción de celulosa y se colocó lana de vidrio encima de la mezcla. El dedal se colocó en un extractor Soxhlet, se enjuagó con nitrógeno y se extrajo con 500 ml de heptano durante la noche.
Al enfriarse, parte del producto de monómero (por ejemplo, 200 en la Figura 2A) o subproducto insaturado (por ejemplo, 302, 306 y/o 308 en las Figuras 3A-3D, respectivamente) precipitó fuera de la solución. Se desmontó el aparato y se dejó a un lado el dedal de extracción. Luego se separó el heptano en el fondo redondo, denominado sobrenadante de heptano, y se eliminó el heptano mediante evaporación rotatoria. El precipitado y las fracciones de sobrenadante se mantuvieron separadas, con el precipitado con un peso de 0.594 g [Promedio] ± 0.18 g (n = 3), y el sobrenadante de heptano (que contiene solamente subproductos insaturados, por ejemplo, 302, 304) con un peso de 0.500 g [Promedio] ± 0.06 g (n = 3). El dedal de extracción se sometió a extracción por Soxhlet con acetato de etilo siguiendo el mismo procedimiento que la extracción por Soxhlet de heptano descrita anteriormente. Después de enfriar, el aparato se desmontó y el acetato de etilo en el fondo redondo se eliminó por evaporación rotatoria. Al secar bajo alto vacío, se recuperó un aceite viscoso que tenía una masa de 1.20 g [Promedio] ± 0.21 g (n = 3). La caracterización mostró que el producto comprendía predominantemente los compuestos 200 (Figura 2A). Sin desear limitarse a ninguna teoría, se encontró que las diferentes extracciones por Soxhlet aislaban selectivamente bien sea el producto monómero o el subproducto insaturado, con base en el solvente que se utilizó para la extracción. El subproducto insaturado se aisló selectivamente en el sobrenadante de heptano del Soxhlet, mientras que el producto monómero se aisló selectivamente en el sobrenadante de acetato de etilo del Soxhlet.
La conversión de la biomasa y la caracterización del producto se realizaron mediante experimentos gravimétricos de electroaspersión por cromatografía líquida de ultraalto rendimiento o espectrometría de masas por ionización química a presión atmosférica, y resonancia magnética nuclear. Los datos de 1HRMN para productos recuperados se dan a continuación.
Ácido 10,16-dihidroxipalmítico: 1H RMN (600 MHz, Metanol^) 83.53 (td, J = 6.8, 2.8 Hz, 2H), 3.49 (dq, J = 7.4, 3.7 Hz, 1H), 2.26 (t, J = 7.4 Hz, 3H), 1.60 (q, J = 7.2 Hz, 4H), 1.52 (q, J = 6.9 Hz, 4H), 1.43 (tt, J =9.1, 4.7 Hz, 6H), 1.39 -1.22 (m, 23H).
Ácido (E/Z)-16-hidroxihexadec-9-enoico: 1H RMN (600 MHz, Metanol^) 85.44 - 5.29 (m, 2H), 3.53 (td, J = 6.7, 2.3 Hz, 2H), 2.26 (t, J = 7.5 Hz, 3H), 2.03 (dd, J = 8.3, 4.8 Hz, 1H), 1.97 (p, J = 5.8 Hz, 3H), 1.59 (p, J = 7.2 Hz, 3H), 1.56 - 1.48 (m, 3H), 1.43 (dt, J =11.2, 4.2 Hz, 1H), 1.40 - 1.27 (m, 20H).
Ejemplo 3: Despolimerización de cutina en agua a 523K
Se añadieron 15 g del orujo de tomate extraído de 250-500 pm (del Ejemplo 1) a un reactor Parr 4563B con un volumen interno de 600 ml. A esto se le añadieron 375 ml de agua, después de lo cual el sistema se selló y el reactor se montó en el sistema, seguido de calentamiento a una temperatura objetivo de aproximadamente 523K. El tiempo de calentamiento desde la temperatura ambiente (típicamente de aproximadamente 298 K) hasta la temperatura objetivo fue de aproximadamente 45 minutos. La mezcla se mantuvo entonces a 523 K durante aproximadamente 2 horas, después de lo cual se enfrió rápidamente mediante un circuito de enfriamiento interno a una temperatura entre 25 °C y 40 °C.
Después de enfriar, el reactor fue despresurizado, desmontado y sin sellar. Los componentes internos y las paredes del reactor se enjuagaron con acetato de etilo hasta que todo el material se soltó de las paredes, y la mezcla sólido/líquido resultante se filtró a través de una frita de filtro de porosidad media. El cuerpo del reactor se lavó con una segunda porción de acetato de etilo, y esto se filtró a través de la torta del filtro. La torta sólida, que daba el material 'carbonizado' o residuo, se lavó con una porción adicional de acetato de etilo. El volumen total típico de los lavados con acetato de etilo fue de aproximadamente 350 ml. La mezcla de agua/acetato de etilo recolectada de la filtración se separó en un embudo separador de 1 l. Las fases se separaron, y la capa orgánica se recolectó y se secó mediante la adición de sulfato de magnesio antes de filtrar a través de una frita porosa. El acetato de etilo se eliminó luego de la fase orgánica mediante evaporación rotatoria y se secó adicionalmente bajo alto vacío (P <0.1 torr). La masa total de la composición de extracto crudo resultante, que incluía ácidos grasos tanto saturados como insaturados, fue de 3.30 g [Promedio] ± 0.08 g (n = 3).
La recolección de la composición de extracto crudo fue seguida por purificación. Primero, el extracto crudo se disolvió en metanol, después de lo cual se añadió tres veces la masa de Celite 545. El metanol se eliminó por evaporación rotatoria, permitiendo que el material se depositara sobre el Celite. Esta mezcla se transfirió a un dedal de extracción de celulosa y se colocó lana de vidrio encima de la mezcla. El dedal se colocó en un extractor Soxhlet, se enjuagó con nitrógeno y se extrajo con 500 ml de heptano durante la noche.
Al enfriar, parte del producto de monómero (por ejemplo, 200 en la Figura 2A) o subproducto insaturado (302, 304, 306 y/o 308 en las Figuras 3A-3D, respectivamente) precipitó fuera de la solución. Se desmontó el aparato y se dejó a un lado el dedal de extracción. Luego se separó el heptano en el fondo redondo, denominado sobrenadante de heptano, y se eliminó el heptano mediante evaporación rotatoria. El precipitado y las fracciones de sobrenadante se mantuvieron separadas, con el precipitado con un peso de 0.800 g y el sobrenadante de heptano (que contenía los subproductos insaturados (por ejemplo, 302, 304)) con un peso de 0.530 g. El dedal de extracción se sometió a extracción por Soxhlet con acetato de etilo siguiendo el mismo procedimiento descrito previamente para la extracción por Soxhlet de heptano. Después de enfriar, el aparato se desmontó y el acetato de etilo en el fondo redondo se eliminó por evaporación rotatoria. Al secar bajo alto vacío, se recuperó un aceite viscoso que tenía una masa de 1.35 g [Promedio] ±0.15 g (n = 3). Sin desear limitarse a ninguna teoría, la caracterización mostró que el producto comprendía predominantemente el compuesto 200 (véase la Figura 2A). La conversión de la biomasa y la caracterización del producto se realizaron mediante experimentos gravimétricos de electgroaspersión por cromatografía líquida de ultraalto rendimiento o espectrometría de masas por ionización química a presión atmosférica y resonancia magnética nuclear.
Ejemplo 4: Despolimerización de cutina en etanol a 498K
Se añadieron 15 g del orujo de tomate extraído de 250-500 pm (del Ejemplo 1) a un reactor Parr 4563B con un volumen interno de 600 ml. A esto se le añadieron 170 ml de etanol, después de lo cual el sistema se selló y el reactor se montó en el sistema, seguido de calentamiento a una temperatura objetivo de aproximadamente 498K. El tiempo de calentamiento desde la temperatura ambiente (típicamente de aproximadamente 298 K) hasta la temperatura objetivo fue de aproximadamente 45 minutos. La presión en el sistema de reactor sellado Parr 4563B era de aproximadamente 667 psi (aproximadamente 45.4 atm). La mezcla se mantuvo a 498 K durante aproximadamente 16 horas, después de lo cual se enfrió rápidamente mediante un circuito de enfriamiento interno a una temperatura entre 25 °C y 40 °C.
Después de enfriar, el reactor fue despresurizado, desmontado y sin sellar. La mezcla sólido/líquido se filtró a través de una frita de filtro de porosidad media, y el cuerpo del reactor y la torta del filtro se lavaron con etanol adicional hasta que el lavado salió transparente. El volumen total típico de los lavados fue de aproximadamente 350 ml. El etanol se eliminó de la porción líquida por evaporación rotatoria, después de lo cual el material se sometió a alto
vacío (P <0.1 torr). La masa total de la composición de extracto crudo resultante, que incluía ésteres de etilo de ácidos grasos saturados e insaturados, fue de 6.79 g [Promedio] ± 0.14 g (n = 3).
Los ésteres de etilo de ácido graso insaturado se separaron luego de la composición de extracto crudo como sigue. La mezcla resultante, que incluye los ésteres de etilo de ácidos grasos saturados e insaturados, se disolvió en acetato de etilo, y se añadió tres veces la masa de polvo de Celite 545. El acetato de etilo se eliminó por evaporación rotatoria, permitiendo que el material se depositara sobre el Celite. Esta mezcla se transfirió a un dedal de extracción de celulosa y se colocó lana de vidrio encima de la mezcla. El dedal se colocó en un extractor Soxhlet, se enjuagó con nitrógeno y se extrajo con 500 ml de heptano durante la noche. Después de enfriar hasta temperatura ambiente, el sistema se desarmó y el matraz de fondo redondo se dejó cristalizar a temperatura ambiente durante la noche. Los sólidos se separaron luego por filtración a través de un embudo Buchner y papel de filtro. Este material sólido, que comprendía ésteres de etilo de ácidos grasos saturados, pero no ésteres de etilo de ácidos grasos insaturados, tenía 2.28 g [Promedio] ± 0.25 g (n = 3). La conversión de la biomasa y la caracterización del producto se realizaron mediante experimentos gravimétricos de electroaspersión por cromatografía líquida ultraalta, o espectrometría de masas por ionización química a presión atmosférica, y resonancia magnética nuclear. A continuación se proporcionan datos de 1HRMN de ejemplo para productos recuperados a través de múltiples despolimerizaciones utilizando el procedimiento anterior.
10,16-dihidroxihexdecanoato de etilo: 1H RMN (600 MHz, Cloroformo-d) 64.11 (q, J = 7.1 Hz, 2H), 3.63 (t, J = 6.8 Hz, 2H), 3.57 (s, 1H), 2.27 (t, J = 7.6 Hz, 2H), 1.66-1.51 (m, 6H), 1.49 - 1.25 (m,21H), 1.24 (t, J =7.1 Hz, 3H). (E/Z)-16-hidroxihexadec-9-enoato de etilo: 1H RMN (600 MHz, Cloroformo-d) 65.45 - 5.27 (m, 2H), 4.11 (q, J = 7.1 Hz, 2H), 3.63 (t, J = 6.7 Hz, 2H), 2.27 (t, J = 7.6 Hz, 2H), 2.05 - 1.89 (m, 4H), 1.64 - 1.51 (m, 5H), 1.38 - 1.22 (m, 22H).
Ejemplo 5: Despolimerización de cutina en etanol a 548K
Se añadieron 15 g del orujo de tomate extraído de 250-500 pm (del Ejemplo 1) a un reactor Parr 4563B con un volumen interno de 600 ml. A esto se le añadieron 170 ml de etanol, después de lo cual el sistema se selló y el reactor se montó en el sistema, seguido de calentamiento a una temperatura objetivo de aproximadamente 548K. El tiempo de calentamiento desde la temperatura ambiente (típicamente alrededor de 298 K) hasta la temperatura objetivo fue de aproximadamente 60 minutos. La presión en el sistema de reactor sellado Parr 4563B era de aproximadamente 1348 psi (aproximadamente 91.7 atm). La mezcla se mantuvo a 548 K durante aproximadamente 2 horas, después de lo cual se enfrió rápidamente mediante un circuito de enfriamiento interno hasta una temperatura entre 25 °C y 40 °C.
Después de enfriar, el reactor fue despresurizado, desmontado y sin sellar. La mezcla sólido/líquido se filtró a través de una frita de filtro de porosidad media, y el cuerpo del reactor y la torta del filtro se lavaron con etanol adicional hasta que el lavado salió transparente. El volumen total típico de los lavados fue de aproximadamente 350 ml. El etanol se eliminó de la porción líquida por evaporación rotatoria, después de lo cual el material se sometió a alto vacío (P <0.1 torr). La masa total de la composición de extracto crudo resultante, que incluía ésteres de etilo de ácidos grasos tanto saturados como insaturados, fue de 7.95 g [Promedio] ± 0.25 g (n = 3).
Los ésteres de etilo de ácido graso insaturado se separaron luego de la composición de extracto crudo como sigue. La mezcla resultante, que incluye los ésteres de etilo de ácidos grasos saturados e insaturados, se disolvió en acetato de etilo, y se añadió tres veces la masa de polvo de Celite 545. El acetato de etilo se eliminó por evaporación rotatoria, permitiendo que el material se depositara sobre el Celite. Esta mezcla se transfirió a un dedal de extracción de celulosa y se colocó lana de vidrio encima de la mezcla. El dedal se colocó en un extractor Soxhlet, se enjuagó con nitrógeno y se extrajo con 500 ml de heptano durante la noche. Después de enfriar hasta temperatura ambiente, el sistema se desarmó y el matraz de fondo redondo se dejó cristalizar a temperatura ambiente durante la noche. Los sólidos se separaron luego por filtración a través de un embudo Buchner y papel de filtro. Sin desear limitarse a ninguna teoría, este material sólido, que comprendía éster de etilo de ácido graso saturado pero no ésteres de etilo de ácido graso insaturado, era 2.03 g [Promedio] ± 0.25 g (n = 3).
El sobrenadante de heptano se evaporó hasta sequedad utilizando un evaporador rotativo, antes de colocarse bajo alto vacío (P <0.1 torr). Este material aceitoso, que estaba compuesto de ácidos grasos insaturados, tenía 2.89 g [Promedio] ± 0.09 g (n = 3). La conversión de la biomasa y la caracterización del producto se realizaron mediante experimentos gravimétricos de electroaspersión por cromatografía líquida de ultraalto rendimiento o espectrometría de masas por ionización química a presión atmosférica, y resonancia magnética nuclear.
Ejemplo 6: Despolimerización de cutina en glicerol a 573K
Se añadieron 15 g del orujo de tomate extraído de 250-500 pm (del Ejemplo 1) a un reactor Parr 4563B con un volumen interno de 600 ml. A esto se añadieron 190 ml de glicerol y 10 ml de H2O, después de lo cual el sistema se selló y el reactor se montó en el sistema, seguido de calentamiento hasta una temperatura objetivo de aproximadamente 573K. El tiempo de calentamiento desde la temperatura ambiente (típicamente de aproximadamente 298 K) hasta la temperatura objetivo fue de aproximadamente 60 minutos. La presión en el sistema de reactor sellado Parr 4563B era de aproximadamente 290 psi (aproximadamente 19.7 atm). La mezcla se
mantuvo luego a 573 K durante aproximadamente 4 horas, después de lo cual se enfrió rápidamente mediante un circuito de enfriamiento interno hasta una temperatura entre 25 °C y 40 °C.
Después de enfriar, el reactor fue despresurizado, desmontado y sin sellar. Los componentes de la composición de extracto que permanecieron en las porciones líquidas y sólidas de la mezcla se extrajeron diluyendo la mezcla con 300 ml de agua. El producto deseado se extrajo luego con 400 ml de acetato de etilo. El glicerol residual se eliminó de la mezcla de acetato de etilo lavándolo con 1 l de agua. El acetato de etilo se eliminó por evaporación rotatoria. La masa final se registró una vez que el líquido se evaporó hasta completar la sequedad. Sin desear limitarse a ninguna teoría, la masa total de la composición cruda resultante, que se encontró enriquecida en ésteres de glicerol de ácidos grasos insaturados (por ejemplo, compuestos 902, 904, 906 y 908 en las Figuras 9A-9D, respectivamente), fue 8.01 g. La conversión de la biomasa y la caracterización del producto se realizó mediante experimentos gravimétricos de electroaspersión por cromatografía líquida de ultraalto rendimiento o espectrometría de masas por ionización química a presión atmosférica, y resonancia magnética nuclear. A continuación se proporcionan datos de ejemplo de 1H RMN para productos recuperados a través de múltiples despolimerizaciones utilizando el procedimiento anterior.
1H RMN (600 MHz, Metanol-c/4) 85.41 - 5.31 (m, 2H), 4.14 (dd, J =11.4, 4.3 Hz, 1H), 4.05 (dd, J = 11.3,6.3 Hz, 1H), 3.81 (p, J = 5.6 Hz, 1H), 3.65 (dtd, J = 16.8, 11.6, 5.2 Hz, 2H), 2.34 (t, J = 7.4 Hz, 4H), 2.03 (t, 2H), 1.97 (d, J = 7.2 Hz, 3H), 1.60 (s, 3H), 1.54 - 1.49 (m, 3H), 1.30 (m, 28H).
Ejemplo 7: Optimización de las condiciones de extracción y despolimerización de cutina en agua
También se realizaron diversas optimizaciones adicionales de las etapas descritas en los Ejemplos 2-3 anteriores. Por ejemplo, además de las temperaturas y los tiempos de residencia descritos en los Ejemplos 2-3 (despolimerización térmica en agua), la despolimerización de cutina en agua mediante los métodos descritos en el presente documento también se llevó a cabo a 225 °C (498K) durante 1 hora, 2 horas, 4 horas y 8 horas; a 250 °C (523K) durante 1 hora, 2 horas y 4 horas; y a 275 °C (548K) durante 1 hora, 2 horas y 4 horas. El porcentaje de ácidos grasos saturados e insaturados recuperados, en relación con los 15 g de orujo de tomate originalmente insertado en el reactor, se determinó en cada punto de temperatura y tiempo y se representó en la Figura 12A. Como se ve en la Figura 12A, el porcentaje de extracto crudo recuperado aumenta a temperaturas más altas y tiempos de residencia más largos.
Después de la purificación por Soxhlet, se determinó la cantidad de producto de monómero directo (por ejemplo, 200 en la Figura 2A) y subproducto insaturado (por ejemplo, 302, 304, 306 y 308 en las Figuras 3A-3D, respectivamente). Como se describió previamente y también se muestra a continuación con referencia a la Figura 13, o bien los productos de monómero directo, una mezcla del monómero directo y los subproductos insaturados, o los subproductos insaturados se recolectan en el precipitado de heptano, por lo que las cantidades relativas de cada uno en el precipitado de heptano dependen de la temperatura y el tiempo de residencia. Sin desear limitarse a ninguna teoría, se cree que esta variación en la composición del precipitado puede deberse a la alta temperatura del lavado con solvente que conduce a la fusión de los materiales y a la subsecuente salida de flujo del extractor de Soxhlet (un proceso no selectivo), en lugar de disolución en el solvente y eliminación como solución (un proceso más selectivo). Esto puede superarse mediante un diseño de equipo modificado (por ejemplo, un receptor enfriado) 0 el uso de presión para modular el punto de ebullición del solvente y, en consecuencia, la temperatura del solvente condensado. La Figura 12B representa las cantidades (como un porcentaje relativo a los 15 g iniciales de orujo de tomate) recuperados del precipitado de heptano. Como se describió previamente, el subproducto insaturado se aisló selectivamente en el sobrenadante de heptano, del cual la cantidad recuperada (como porcentaje relativo a los 15 g iniciales de orujo de tomate) se muestra en la Figura 12C. Recuérdese que el sobrenadante de acetato de etilo aísla selectivamente el producto de monómero directo, del cual la cantidad recuperada (como porcentaje relativo a los 15 g iniciales de orujo de tomate) se muestra en la Figura 12D. En general, los tiempos de residencia más largos y las temperaturas más altas dieron como resultado una mayor conversión a los subproductos.
Como se describió anteriormente, las extracciones por Soxhlet pueden aislar selectivamente bien sea el producto monomérico directo o el subproducto insaturado. Adicionalmente, ajustando los tiempos y las temperaturas puede determinar al menos parcialmente cual producto de ácido graso (producto de monómero directo o subproducto insaturado) se produce. La Figura 13 es una tabla que indica cuales productos se recuperaron del precipitado de heptano, del sobrenadante de heptano y del sobrenadante de acetato de etilo a las diversas temperaturas de despolimerización y tiempos de residencia probados. En la Figura 13, 'Sat' se refiere a productos de monómero directo (incluidos, por ejemplo, 200 en la Figura 2A), y 'Insat' se refiere a subproductos insaturados (que incluyen, por ejemplo, cualquiera de los compuestos 302, 304, 306 y 308 en las Figuras 3A-3D, respectivamente). Con referencia primero a los productos de precipitado de heptano, a temperaturas de despolimerización más bajas (por ejemplo, a 498 K), solamente se recuperaron los productos de monómero directo para todos los tiempos de residencia hasta 8 horas (y no se recuperó ningún producto sustancial de ningún tipo en un tiempo de residencia de 1 hora) A temperaturas intermedias de despolimerización (523 K), solo se recuperaron productos de monómero directo durante el tiempo de residencia de 1 hora, mientras que una mezcla de los productos de monómero directo y subproductos insaturados se recuperaron durante tiempos de residencia más largos (2 horas y 4 horas). A temperaturas de despolimerización más altas (548K), se recuperó una mezcla de productos de monómero directo y
subproductos insaturados para tiempos de residencia más cortos (1 hora y 2 horas), mientras que solo se recuperaron subproductos insaturados durante el tiempo de residencia más largo (4 horas).
Las Figuras 17-22 muestran datos de caracterización de UPLC para la despolimerización de orujo de tomate a 548 K durante 1 h en agua. Con referencia ahora a los productos sobrenadantes de heptano, en los que los subproductos insaturados se aíslan selectivamente, los subproductos insaturados no se observaron a baja temperatura de despolimerización (498 K) en tiempos de residencia de 4 horas o menos, pero se observaron a 498 K para el caso de un tiempo de residencia de 8 horas. A temperaturas de despolimerización intermedia y superior (523 K y 548 K, respectivamente), se observaron los subproductos insaturados para todos los tiempos de residencia (1 hora, 2 horas y 4 horas).
Con referencia ahora a los productos sobrenadantes de acetato de etilo, en los que los productos de monómero directo se aíslan selectivamente, los productos de monómero directo no se observaron a baja temperatura de despolimerización (498 K) en tiempos de residencia de 2 horas o menos, pero se observaron a 498 K durante los casos de 4 y 8 horas de residencia. A temperaturas intermedias de despolimerización (523 K), se observaron los productos de monómero directo para todos los tiempos de residencia (1 hora, 2 horas y 4 horas). A temperaturas de despolimerización más altas (548 K), los productos de monómero directo se observaron durante tiempos de residencia de 1 hora y 2 horas, pero no se observaron en el caso de un tiempo de residencia de 4 horas.
Ejemplo 8: Optimización de las condiciones de extracción y despolimerización de cutina en etanol
Además de la optimización de las etapas en los Ejemplos 2-3 (despolimerización térmica en agua) descritos en el Ejemplo 7 anterior, también se realizó una optimización adicional de las etapas descritas en los Ejemplos 4-5 (despolimerización térmica en etanol). Por ejemplo, además de las temperaturas y tiempos de residencia descritos en los Ejemplos 4-5, la despolimerización de cutina en etanol a través de los métodos descritos en el presente documento también se llevó a cabo a 225 °C (498K) durante 2 horas y 6 horas; a 250 °C (523K) durante 1 hora, 2 horas y 4 horas; a 275 °C (548K) durante 1 hora y 4 horas; y a 300 °C durante 1 hora, 2 horas y 4 horas. El porcentaje de ácidos grasos saturados e insaturados recuperados, en relación con los 15 g de orujo de tomate originalmente insertados en el reactor, se determinó en cada punto de temperatura y tiempo y se representó en la Figura 14A. Como se ve en la Figura 14A, el porcentaje de extracto crudo recuperado aumenta a temperaturas más altas y tiempos de residencia más largos.
Siguiendo el procedimiento de purificación de heptano por Soxhlet, la cantidad respectiva de producto de éster de etilo de monómero directo (por ejemplo, 600 en la Figura 6A) y subproducto de éster de etilo insaturado (por ejemplo, 702, 704, 706 y 708 en las Figuras 7A-7D, respectivamente) estaba determinada. Como se describió previamente, los productos de monómero directo se recogen en el precipitado de heptano, separando así los productos de monómero directo de los subproductos insaturados. La Figura 14B representa gráficamente las cantidades (como porcentaje relativo a los 15 g iniciales de orujo de tomate) recuperadas del precipitado de heptano. Como se describió previamente, el subproducto insaturado se aisló selectivamente en el sobrenadante de heptano, de los cuales la cantidad recuperada (como porcentaje relativo a los 15 g iniciales de orujo de tomate) se muestra en la Figura 14C. En general, los tiempos de residencia más largos y las temperaturas más altas dieron como resultado una mayor conversión a los productos deseados.
Como se describió anteriormente, las extracciones por Soxhlet pueden aislar selectivamente bien sea el producto éster monomérico directo o el subproducto éster insaturado. Adicionalmente, ajustando los tiempos y las temperaturas se puede determinar al menos parcialmente cual producto de éster de ácido graso (producto de éster de monómero directo o subproducto de éster insaturado) se produce. La Figura 15 es una tabla que indica cuales productos se recuperaron del precipitado de heptano y del sobrenadante de heptano a las diferentes temperaturas de despolimerización y tiempos de residencia probados. En la Figura 15, 'Sat' se refiere a productos de éster de monómero directo (por ejemplo, 600 en la Figura 6A) e 'Insat' se refiere a subproductos de éster insaturado (que incluyen, por ejemplo, cualquiera de los compuestos 702, 704, 706 y 708 en las Figuras 7A -7D, respectivamente). Con referencia primero a los productos de precipitado de heptano, a temperaturas de despolimerización más bajas (por ejemplo, a 498 K), solamente los productos de monómero directo se recuperaron durante tiempos de residencia de al menos 6 horas (y no se recuperó ningún producto sustancial de ningún tipo a las 2 horas de tiempo de residencia) A temperaturas de despolimerización más altas (523K y 573K), se recuperó el producto de monómero directo para tiempos de residencia de 1 hora, 2 horas y 4 horas. A una temperatura de despolimerización de 548 K, se recuperó el producto monómero directo para tiempos de residencia de 1 hora, 2 horas, 4 horas y 8 horas.
Con referencia ahora a los productos sobrenadantes de heptano, en los que los subproductos insaturados se aíslan selectivamente, los subproductos insaturados no se observaron a baja temperatura de despolimerización (498K) en tiempos de residencia de 2 horas, 4 horas o 16 horas. A temperaturas intermedias de despolimerización (523K), los subproductos insaturados no se observaron en tiempos de residencia de 2 horas o menos, pero se observaron a 523K para el caso de un tiempo de residencia de 4 horas. A temperaturas de despolimerización más altas (548K y 573K) se observaron los subproductos insaturados para todos los tiempos de residencia (1 hora, 2 horas y 4 horas). Las Figuras 23-25 dan datos de caracterización por UPLC después de la despolimerización de orujo de tomate a 548K durante 4 horas en etanol.
Ejemplo 9: Recubrimientos protectores formados sobre aguacates
Se formaron recubrimientos protectores sobre aguacates mediante la extracción de compuestos mediante el método descrito en este documento (despolimerización térmica de la cutina) y depositando los compuestos sobre la superficie externa de los aguacates (sin pelar). Luego se midieron las tasas de pérdida de masa de los aguacates y se compararon con las de los aguacates sin recubrimiento. Todos los recubrimientos se formaron sumergiendo los aguacates en una solución que comprendía los compuestos asociados disueltos en etanol sustancialmente puro a una concentración de 10 mg/ml, colocando los aguacates en bastidores de secado y permitiendo que los aguacates se secaran bajo condiciones ambientales a una temperatura ambiente. el rango de aproximadamente 23 °C - 27 °C y la humedad en el rango de aproximadamente 40 % -55 %. Los aguacates se mantuvieron a estas mismas condiciones de temperatura y humedad durante todo el tiempo que fueron probados.
Las tasas de pérdida de masa se muestran en la Figura 16 para aguacates no tratados (por ejemplo, Sin recubrimiento) en la barra 1602, para aguacates recubiertos con 10,16-dihidroxihexadecanoato de etilo (denominado "EtDHPA") en la barra 1604, y para aguacates recubiertos con una mezcla de EtDHPA y hexadecanoato de 1,3-dihidroxipropan-2-ilo (denominado "PA-2G") en la barra 1606, donde para la barra 1606 se mezclaron EtDHPA y PA-2G en una relación de masa de 30:70. Para las barras 1604 y 1606, el EtDHPA se formó por despolimerización térmica de la cutina en etanol como se describe en este documento, mientras que el PA-2G se formó mediante un proceso de múltiples etapas que utiliza ácido palmítico como material de partida, donde el proceso se describe en detalle en detalle en la solicitud de Patente U.S. número 15/530,403 titulada " PRECURSOR COMPOUNDS FOR MOLECULAR COATINGS”, Cada barra en el gráfico representa un grupo de 30 aguacates. Todos los aguacates se obtuvieron de la misma fuente, se recogieron aproximadamente al mismo tiempo y se encontraban en una etapa similar de maduración.
Como se ve en la Figura 16, la masa de los aguacates no recubiertos (barra 1602) disminuyó a una tasa promedio de aproximadamente 1.21 % por día, la masa de los aguacates recubiertos con EtDHPA (barra 1604) disminuyó a una tasa promedio de aproximadamente 1.06 % por día, y la masa de los aguacates recubiertos con la mezcla EtDHPA/PA-2G (barra 1606) disminuyó a una tasa promedio de aproximadamente 0.94 % por día. Como tal, la tasa de pérdida de masa promedio de aguacates recubiertos con EtDHPA (barra 1604) se redujo en más del 12 % en comparación con los aguacates sin recubrimiento (barra 1602), y la tasa de pérdida de masa promedio de aguacates recubiertos con la mezcla de EtDHPA/PA-2G (barra 1606) se redujo en más del 22 % en comparación con los aguacates sin recubrimiento (barra 1602).
Se han descrito diversas implementaciones de las composiciones y métodos. Sin embargo, debe entenderse que se han presentado únicamente a modo de ejemplo y no como limitación. Cuando los métodos y etapas descritos anteriormente indiquen ciertos eventos que ocurren en cierto orden, los expertos en la técnica que se benefician de esta divulgación reconocerán que el orden de ciertos etapas puede modificarse y dicha modificación está de acuerdo con las variaciones de la divulgación.
Claims (15)
1. Un método para formar un recubrimiento protector, que comprende las etapas de
(i) extraer una composición de una capa de cutícula de material vegetal de una primera planta, comprendiendo la composición monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos derivados de la cutina, en el que el método de extracción comprende:
obtener cutina a partir de la capa de la cutícula de la primera planta,
añadir la cutina a un solvente para formar una mezcla, teniendo el solvente un punto de ebullición a una primera temperatura a una presión de una atmósfera, en el que el solvente comprende agua, glicerol, metanol, etanol, CO2 líquido o CO2 supercrítico; y
calentar la mezcla a una segunda temperatura y segunda presión, siendo la segunda temperatura más alta que la primera temperatura y siendo la segunda presión más alta que una atmósfera, formando así la composición que comprende los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos derivados de la cutina; y
(ii) disponer la composición sobre material vegetal de una segunda planta diferente de la primera planta, para formar el recubrimiento protector sobre el material vegetal de la segunda planta.
2. El método de la reivindicación 1, en el que la primera planta y la segunda planta son especies diferentes, opcionalmente en el que la composición química del recubrimiento protector es diferente de la composición química de la capa de la cutícula de la segunda especie de planta.
3. El método de la reivindicación 1 o la reivindicación 2,
en el que los monómeros, oligómeros, ésteres o combinaciones de los mismos derivados de la cutina se modifican químicamente antes de desechar la composición en la segunda planta; o
en el que los monómeros, oligómeros, ésteres de los mismos, o combinaciones de los mismos comprenden ácidos grasos, y opcionalmente el método comprende además modificar químicamente al menos algunos de los ácidos grasos; o
en el que los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos comprenden ésteres, y opcionalmente el método comprende además modificar químicamente al menos algunos de los ésteres.
4. El método de la reivindicación 3, en el que la modificación química de los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos comprende esterificación, transesterificación o gliceración.
5. El método de la reivindicación 1, en el que el material vegetal comprende un polímero y en el que
una reacción de despolimerización del polímero a la segunda temperatura da como resultado la descarga de los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos; y/o
una tasa de despolimerización del polímero en el solvente es al menos 100 veces mayor a la segunda temperatura y la segunda presión que a la primera temperatura y la primera presión.
6. El método de la reivindicación 1, en el que
el solvente comprende etanol y los monómeros, oligómeros, ésteres del mismo o combinaciones de los mismos comprenden ésteres etílicos; o
el solvente comprende metanol y los monómeros, oligómeros, ésteres del mismo o combinaciones de los mismos comprenden ésteres metílicos; o
el solvente comprende glicerol y los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos comprenden ésteres de glicerilo.78
7. El método de la reivindicación 1, en el que al menos una porción de los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos son insaturados, comprendiendo además opcionalmente hidrogenar los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos insaturados.
8. El método de la reivindicación 1, en el que:
(i) la segunda temperatura es de al menos 413 K y el solvente es agua; o
(ii) la segunda temperatura es de al menos 393 K y la segunda presión es suficientemente alta para mantener al menos una porción del solvente en fase líquida a la segunda temperatura; o
(iii) la segunda temperatura es de al menos 523 K y la segunda presión es de al menos 575 psi; o (iv) la mezcla se mantiene a la segunda temperatura y segunda presión durante al menos dos horas.
9. El método de la reivindicación 1, en el que
el proceso de formación de la composición da como resultado la producción de ácidos grasos tanto saturados como insaturados, en el que opcionalmente la concentración de ácidos grasos saturados es mayor que la concentración de ácidos grasos insaturados; o
el proceso de formación de la composición da como resultado la producción de ésteres de ácidos grasos tanto saturados como insaturados, en el que opcionalmente la concentración de ésteres de ácidos grasos saturados es mayor que la concentración de ésteres de ácidos grasos insaturados.
10. El método de cualquiera de las reivindicaciones 1-9, en el que la mezcla está sustancialmente libre de ácido o base añadidos.
11. El método de cualquiera de las reivindicaciones 1-9, que comprende además separar el solvente de los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos para aislar los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos, que opcionalmente comprende además agregar los monómeros, oligómeros, ésteres aislados de los mismos o combinaciones de los mismos a un segundo solvente.
12. El método de cualquiera de las reivindicaciones 1-9, en el que los monómeros, oligómeros o combinaciones de los mismos comprenden compuestos de Fórmula I:
en la que:
R1, R2, R3, R4, R5, R6, R7, R8, R9, y R10 son cada uno independientemente -H, -OR13, -NR13R14, -SR13, halógeno, alquilo-C-i-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, o halógeno;
R13 y R14 son cada uno independientemente -H, alquilo-C1-C6, alquenilo -C1-C6 o alquinilo -C1C
R11 es -H, -glicerilo, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, o halógeno;
R12 es -OH, -H, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, halógeno, -COOH, o -COOR11; y
m, n, y o son cada uno independientemente un entero en el rango de 0 a 30, y 0 < m+n+o < 30.
13. El método de cualquiera de las reivindicaciones 1-9, en el que los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos comprenden compuestos de Fórmula II, ésteres de los mismos o compuestos de Fórmula III, en el que la Fórmula lI y la Fórmula III son:
en el que para la Fórmula II:
R1, R2, R4 y R5 son cada uno independientemente -H, -OR11, -NR11R12, -SR11, halógeno, alquilo -C1-C6, alquenilo -Ci-C6, alquinilo -C1.C6, cicloalquilo -C3.C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR11, -NR11R12, -SR11, o halógeno;
R11 y R12 son cada uno independientemente -H, alquilo-C1-C6, alquenilo -C1-C6 o alquinilo -C1-C6;
el símbolo----- representa opcionalmente un enlace simple o doble cis o trans;
el símbolo representa un doble enlace cis o trans;
R3 es -OH y R3' se selecciona del grupo que consiste en -H, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7 y arilo cuando------entre R3 y R3' es un enlace sencillo, y R3 y R3' están ausentes cuando------entre R3 y R3' representa un doble enlace;
n es un entero en el rango de 0 a 11;
m es un entero en el rango de 0 a 25; y
0 < m+n < 25;
en el que para la Fórmula III:
R1, R2, R5, R6, R9, R10, R11, R12 y R13 son cada uno independientemente, en cada presencia, -H,-OR14, -NR14R15, -SR14, halógeno, alquilo -C1-C6, alquenilo C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo o heteroarilo, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno;
R3, R4, R7, y R8 son cada uno independientemente, en cada presencia, -H, -OR14, -NR14R15,-SR14, halógeno, alquilo -C1-C6, alquenilo -C2-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo o heteroarilo en la que cada alquilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con uno o más -OR14, -NR14R15, -SR14, o halógeno; o
R3 y R4 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros; y/o
R7 y R8 puede combinarse con los átomos de carbono a los que están unidos para formar un cicloalquilo C3-C6, un cicloalquenilo C4-C6 o un heterociclo de anillo de 3 a 6 miembros;
R14 y R15 son cada uno independientemente, en cada presencia, -H, alquilo -C1-C6, alquenilo -C2-C6 o alquinilo -C2-C6; el símbolo----- representa un enlace simple o un doble enlace cis o trans;
el símbolo representa un doble enlace cis o trans;
n es 0, 1, 2, 3, 4, 5, 6, 7 o 8;
m es 0, 1, 2 o 3;
q es 0, 1, 2, 3, 4 o 5;
r es 0, 1, 2, 3, 4, 5, 6, 7 o 8; y
R se selecciona de -H, alquilo -C1-C6, alquenilo -C2-C6, alquinilo -C2-C6, cicloalquilo -C3-C7, arilo, 1-glicerol, 2-glicerol o heteroarilo.
14. El método de la reivindicación 13, que comprende además modificar los compuestos de Fórmula II, ésteres de los mismos, o compuestos de Fórmula III para formar compuestos de Fórmula I:
en la que para la Formula I:
R1, R2, R3, R4, R5, R6, R7, R8, R9, y R10 son cada uno independientemente -H, -OR13, -NR13R14, -SR13, halógeno, alquilo-Ci-C6, alquenilo -C1.C6, alquinilo -C1.C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, o halógeno;
R13 y R14 son cada uno independientemente -H, alquilo-C1-C6, alquenilo -C1-C6, o alquinilo -C1C
R11 es -H, -glicerilo, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, o halógeno;
R12 es -OH, -H, alquilo -C1-C6, alquenilo -C1-C6, alquinilo -C1-C6, cicloalquilo -C3-C7, arilo o heteroarilo de anillo de 5 a 10 miembros, en la que cada alquilo, alquenilo, alquinilo, cicloalquilo, arilo o heteroarilo está opcionalmente sustituido con -OR13, -NR13R14, -SR13, halógeno, -COOH, o -COOR11; y
m, n, y o son cada uno independientemente un entero en el rango de 0 a 30, y 0 < m+n+o < 30.
15. El método de acuerdo con cualquiera de las reivindicaciones anteriores, en el que:
el material vegetal de la segunda planta comprende un fruto; o
la formación del recubrimiento protector comprende hacer que al menos algunos de los monómeros, oligómeros, ésteres de los mismos o combinaciones de los mismos derivados de la cutina se entrecrucen en el material vegetal de la segunda planta.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562265726P | 2015-12-10 | 2015-12-10 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2939007T3 true ES2939007T3 (es) | 2023-04-18 |
Family
ID=57708794
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES16820459T Active ES2797697T3 (es) | 2015-12-10 | 2016-12-09 | Proceso para despolimerizar cutina |
| ES19214825T Active ES2939007T3 (es) | 2015-12-10 | 2016-12-09 | Composiciones de extractos de plantas para formar recubrimientos protectores |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES16820459T Active ES2797697T3 (es) | 2015-12-10 | 2016-12-09 | Proceso para despolimerizar cutina |
Country Status (7)
| Country | Link |
|---|---|
| US (5) | US9957215B2 (es) |
| EP (2) | EP3386303B1 (es) |
| JP (1) | JP6549326B2 (es) |
| CN (2) | CN112841185A (es) |
| ES (2) | ES2797697T3 (es) |
| IL (2) | IL259820B (es) |
| WO (1) | WO2017100636A1 (es) |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9744542B2 (en) | 2013-07-29 | 2017-08-29 | Apeel Technology, Inc. | Agricultural skin grafting |
| WO2016168319A1 (en) * | 2015-04-13 | 2016-10-20 | University Of South Florida | Cutin-like materials with advanced functionalities and methods of manufacture |
| WO2016187581A1 (en) | 2015-05-20 | 2016-11-24 | Apeel Technology, Inc. | Plant extract compositions and methods of preparation thereof |
| CN108135188B (zh) | 2015-09-16 | 2022-08-05 | 阿比尔技术公司 | 用于分子涂层的前体化合物 |
| EP3386303B1 (en) | 2015-12-10 | 2020-03-11 | Apeel Technology, Inc. | Process for depolymerising cutin |
| TWI731928B (zh) | 2016-01-26 | 2021-07-01 | 美商aPEEL科技公司 | 製備及保存經消毒產品之方法 |
| EP3541192B1 (en) | 2016-11-17 | 2025-06-25 | Apeel Technology, Inc. | Methods of preparing fatty acid esters from crosslinked polyesters |
| EP3716772A4 (en) | 2017-11-29 | 2021-10-13 | Stixfresh Usa, Inc. | FORMULATION AGAINST DETERIORATION AND PRESERVING FRESHNESS AND ITS MANUFACTURING PROCESS |
| US12245605B2 (en) | 2018-09-05 | 2025-03-11 | Apeel Technology, Inc. | Compounds and formulations for protective coatings |
| IL281209B2 (en) * | 2018-09-05 | 2025-05-01 | Apeel Tech Inc | Compounds and formulations for protective coatings |
| US11641865B2 (en) | 2020-03-04 | 2023-05-09 | Apeel Technology, Inc. | Compounds and formulations for protective coatings |
| EP4161280A1 (en) | 2020-06-07 | 2023-04-12 | Comestaag LLC | Selectively treating plant items |
| WO2021252403A1 (en) | 2020-06-07 | 2021-12-16 | Comestaag Llc | Barrier coating compositions for perishables and methods, kits and coated items relating thereto |
| MX2023000749A (es) | 2020-08-04 | 2023-02-13 | Apeel Tech Inc | Metodos de control de la maduracion de productos agricolas. |
| EP4237400A1 (en) * | 2020-10-30 | 2023-09-06 | Apeel Technology, Inc. | Compositions and methods of preparation thereof |
| CN112322156A (zh) * | 2020-11-25 | 2021-02-05 | 上海源育节能环保科技有限公司 | 一种天然清香环保涂料及其制备方法 |
| IT202100017945A1 (it) | 2021-07-07 | 2023-01-07 | Tomapaint S R L | Metodo di estrazione di cutina da scarti di lavorazione del pomodoro |
| CN118159138A (zh) | 2021-09-08 | 2024-06-07 | 阿比尔技术公司 | 用于保护性涂层的化合物和制剂 |
| WO2023150072A1 (en) * | 2022-02-01 | 2023-08-10 | Sinclair David A | Compositions and methods for the preservation of plant matter |
| IT202200006464A1 (it) * | 2022-04-01 | 2023-10-01 | Lamberti Spa | Metodo per rivestire un substrato di carta usando un estratto di cutina modificato |
| ES2954532B2 (es) * | 2022-04-13 | 2024-04-15 | Univ Alicante | Metodo para la obtencion de cutina a partir de residuos vegetales y cutina obtenida |
| ES2954422B2 (es) * | 2022-04-13 | 2024-04-09 | Univ Alicante | Procedimiento para la obtencion de cutina a partir de residuos vegetales y cutina obtenida |
| IT202300020556A1 (it) * | 2023-10-04 | 2025-04-04 | Lamberti Spa | Metodo per rivestire un substrato di carta mediante un estratto di cutina modificato ottenuto in presenza di amido o di un derivato di amido |
| EP4647481A1 (en) * | 2024-05-10 | 2025-11-12 | Universidad De Valladolid | Process for the obtention of a cutin-enriched product |
Family Cites Families (211)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1016761A (en) | 1909-04-16 | 1912-02-06 | Charles C Moore | Process of producing starch and glucose. |
| US1040737A (en) | 1911-01-18 | 1912-10-08 | Jeremiah L Mahoney | Apparatus for producing rubber bulbs for atomizers, syringes, &c. |
| US1026670A (en) | 1911-03-23 | 1912-05-21 | Russell J Goodnow | Fruit and nut squeezer. |
| US1051731A (en) | 1912-02-24 | 1913-01-28 | Michael Greenfeld | Belt-buckle. |
| US1056115A (en) | 1912-04-29 | 1913-03-18 | Arthur G Mumford | Valve-gear for fluid-pressure engines. |
| US1084399A (en) | 1913-08-05 | 1914-01-13 | Charles E Collins | Unbuttoning implement. |
| US1943468A (en) | 1932-11-22 | 1934-01-16 | Wilbur White Chemical Company | Wax emulsion coating, and coating process |
| US2363232A (en) | 1934-09-13 | 1944-11-21 | Brogdex Co | Processes of and compositions for protectively coating fresh fruits or vegetables |
| US2222000A (en) | 1937-06-02 | 1940-11-19 | Schmidt Erich Kurt Julius | Process for the preservation of eggs and fresh fruit |
| US2213557A (en) | 1937-08-26 | 1940-09-03 | Du Pont | Produce coating compositions |
| US2275659A (en) | 1939-02-25 | 1942-03-10 | Johnson & Son Inc S C | Water removable wax coating |
| US2324448A (en) | 1939-03-08 | 1943-07-13 | Wehrli Gottlieb | Method and product for producing a cleansing and preserving coating on fruits and vegetables |
| US2342063A (en) | 1940-07-31 | 1944-02-15 | Fmc Corp | Method for treating fruit |
| US2333887A (en) | 1941-07-26 | 1943-11-09 | Lorenz M Redlinger | Protective coating and process of manufacture therefor |
| GB587532A (en) | 1943-03-20 | 1947-04-29 | Colgate Palmolive Peet Co | Improvements in or relating to alcoholysis of fatty glycerides |
| GB647174A (en) | 1948-07-23 | 1950-12-06 | Nopco Chem Co | Improvements relating to the production of alkyl esters of fatty acids |
| BE500510A (es) | 1950-01-11 | |||
| US2840606A (en) | 1955-04-15 | 1958-06-24 | Du Pont | Nylon hydrolysis |
| US2857282A (en) | 1957-09-27 | 1958-10-21 | Eugene F Jansen | Inhibition of enzymes in plant tissue |
| US3189467A (en) | 1959-12-14 | 1965-06-15 | Fmc Corp | Preservation of perishable products |
| US3232765A (en) | 1962-12-17 | 1966-02-01 | Grace W R & Co | Water-in-oil chocolate emulsion |
| US3471303A (en) | 1966-03-07 | 1969-10-07 | Archer Daniels Midland Co | Edible coating compositions and method for coating food |
| US3715024A (en) | 1971-04-23 | 1973-02-06 | Fmc Corp | Fruit orienting apparatus |
| US3821421A (en) | 1971-07-06 | 1974-06-28 | Lever Brothers Ltd | Process for the flavouring of foods |
| US4002775A (en) | 1973-07-09 | 1977-01-11 | Kabara Jon J | Fatty acids and derivatives of antimicrobial agents |
| DE2505428C3 (de) | 1975-02-08 | 1981-04-09 | Müller's Mühle Müller GmbH & Co KG, 4650 Gelsenkirchen | Verwendung einer Emulsion zur Erzeugung eines Glasurüberzuges auf geschälten Erbsen |
| US3997674A (en) | 1975-02-25 | 1976-12-14 | Tsukihoshi Kasei Kabushiki Kaisha | Preservation of agricultural products |
| ZA791659B (en) | 1978-04-17 | 1980-04-30 | Ici Ltd | Process and apparatus for spraying liquid |
| IL59407A (en) | 1979-03-06 | 1983-12-30 | Sanofi Sa | Di-n-propylacetic acid diesters of glycerol,their preparation and pharmaceutical compositions containing them |
| US4654370A (en) | 1979-03-12 | 1987-03-31 | Abbott Laboratories | Glyceryl valproates |
| US4353962A (en) | 1980-05-15 | 1982-10-12 | Environmental Chemicals, Inc. | In-flight encapsulation of particles |
| JPS5889140A (ja) | 1981-11-24 | 1983-05-27 | Koutou Kk | 青果物の被膜剤組成物 |
| GB2119399A (en) | 1982-05-06 | 1983-11-16 | Hop Dev Ltd | Extraction of plant material by using carbon dioxide |
| US4421775A (en) | 1982-06-04 | 1983-12-20 | The United States Of America As Represented By The Secretary Of Agriculture | Method for removing the outer waxy cutin-containing layer from papaya |
| EP0104043A3 (en) | 1982-09-20 | 1984-06-06 | Ajinomoto Co., Inc. | Foodstuffs and pharmaceuticals |
| US4726898A (en) | 1982-09-30 | 1988-02-23 | Pennwalt Corporation | Apparatus for spinning fruit for sorting thereof |
| US5051448A (en) | 1984-07-24 | 1991-09-24 | The Mclean Hospital Corporation | GABA esters and GABA analog esters |
| FI77441C (fi) * | 1985-03-04 | 1989-03-10 | Kemira Oy | Foerfarande foer omvandling av vaextmaterial till kemikalier. |
| US4661359A (en) | 1985-06-03 | 1987-04-28 | General Mills, Inc. | Compositions and methods for preparing an edible film of lower water vapor permeability |
| US4710228A (en) | 1985-10-16 | 1987-12-01 | General Mills, Inc. | Edible coating composition and method of preparation |
| US4820533A (en) | 1985-10-16 | 1989-04-11 | General Mills, Inc. | Edible barrier for composite food articles |
| JPH0724544B2 (ja) | 1985-11-26 | 1995-03-22 | 三栄源エフ・エフ・アイ株式会社 | 生野菜の大腸菌殺菌と鮮度保持 |
| US4874618A (en) | 1985-12-27 | 1989-10-17 | General Mills, Inc. | Package containing a moisture resistant edible internal barrier |
| DE3622191A1 (de) | 1986-07-02 | 1988-01-07 | Ni I Sadovodstva Necernozemnoj | Gemisch zur obst- und gemuesefrischhaltung |
| GB8617527D0 (en) | 1986-07-17 | 1986-08-28 | Ici Plc | Spraying process |
| US4959232A (en) | 1989-04-26 | 1990-09-25 | Red Arrow Products Company, Inc. | Process for making liquid smoke compositions and resin treated liquid smoke compositions |
| US5126153A (en) | 1988-05-13 | 1992-06-30 | Basic American Foods, Inc. | Compositions and methods for inhibiting browning of processed produce |
| DE3825248A1 (de) | 1988-07-25 | 1990-02-01 | Peter Siegfried | Verfahren zur herstellung von reinen monoglyceriden und reinen diglyceriden aus einem gemisch, das mono-, di- und triglyceride enthaelt |
| US4960600A (en) | 1988-12-21 | 1990-10-02 | The Procter & Gamble Co. | Polyol polyesters as a protective moisture barrier for foods |
| US5019403A (en) | 1989-12-13 | 1991-05-28 | The United States Of America As Represented By The Secretary Of Agriculture | Coatings for substrates including high moisture edible substrates |
| JPH0416173A (ja) | 1990-05-09 | 1992-01-21 | Nippon Oil & Fats Co Ltd | 野菜類、果実類の鮮度保持剤 |
| US5137743A (en) | 1990-09-07 | 1992-08-11 | Opta Food Ingredients, Inc. | Foods having an oil phase thickened with an oil soluble polyester |
| US5198254A (en) | 1991-04-03 | 1993-03-30 | The United States Of America As Represented By The Secretary Of Agriculture | Composition and method of increasing stability of fruits, vegetables or fungi |
| US5366995A (en) | 1991-05-01 | 1994-11-22 | Mycogen Corporation | Fatty acid based compositions for the control of established plant infections |
| JP2969234B2 (ja) | 1991-07-19 | 1999-11-02 | 株式会社アドバンス | Acat阻害剤 |
| WO1993006735A1 (en) | 1991-10-10 | 1993-04-15 | Vioryl S.A. | Post-harvest fruit protection using components of natural essential oils in combination with coating waxes |
| USH1591H (en) | 1992-10-09 | 1996-09-03 | Fulcher; John | Preparation of flavor-enhanced reduced calorie fried foods |
| AU682864B2 (en) | 1993-05-13 | 1997-10-23 | Loders Croklaan B.V. | Process for production of human milk fat replacers |
| JPH0778098A (ja) | 1993-09-08 | 1995-03-20 | Fujitsu Ltd | ファイル管理システム |
| US5435633A (en) | 1994-01-03 | 1995-07-25 | Hayes Wheels International, Inc. | Aluminum full face vehicle wheel |
| US5483871A (en) | 1994-02-24 | 1996-01-16 | Sunkist Growers, Inc. | Apparatus for spray washing fruit in a brush bed |
| JPH0856564A (ja) | 1994-08-25 | 1996-03-05 | Mitsubishi Chem Corp | 青果物の果皮障害防止方法及びそのための剤 |
| SE518619C2 (sv) | 1994-12-09 | 2002-10-29 | Gs Dev Ab | Komposition för reglerad frisättning innehållande monokaproin |
| US5741505A (en) | 1995-01-20 | 1998-04-21 | Mars, Incorporated | Edible products having inorganic coatings |
| US20050233039A1 (en) | 1995-07-11 | 2005-10-20 | Wolfe Steven K | Method for cleaning, packing, and transporting vegetables |
| US5827553A (en) | 1995-11-06 | 1998-10-27 | Mantrose-Haeuser Co., Inc. | Edible adhesive |
| KR100443470B1 (ko) | 1996-03-26 | 2005-01-15 | 미네소타 마이닝 앤드 매뉴팩춰링 캄파니 | 정전보조에의해도포될수있는양이온중합성조성물 |
| JP3689983B2 (ja) | 1996-06-24 | 2005-08-31 | 凸版印刷株式会社 | 抗菌性高分子及び抗菌性を有する包装材料 |
| DE19706023A1 (de) | 1997-02-17 | 1998-08-20 | Bayer Ag | Abbau von biologisch abbaubaren Polymeren mit Enzymen |
| US6066316A (en) | 1997-03-21 | 2000-05-23 | Shiseido Co., Ltd. | Fine dispersion composition of wax, hair cosmetic preparation and glazing agent |
| KR20010013377A (ko) | 1997-06-04 | 2001-02-26 | 데이비드 엠 모이어 | 마일드한 잔류성 항균 조성물 |
| US5939117A (en) | 1997-08-11 | 1999-08-17 | Mantrose-Haeuser Co., Inc. | Methods for preserving fresh fruit and product thereof |
| MY129120A (en) | 1997-08-19 | 2007-03-30 | Global Palm Products Sdn Bhd | Process for the production of monoglyceride based on the glycerolysis of methyl ester |
| US6241971B1 (en) | 1997-09-25 | 2001-06-05 | The Procter & Gamble Company | Hair styling compositions comprising mineral salt, lipophilic material, and low levels of surfactant |
| US5925395A (en) | 1998-01-09 | 1999-07-20 | Mantrose-Haeuser Co., Inc. | Methods for preserving fresh vegetables |
| US6033705A (en) | 1998-07-08 | 2000-03-07 | Isaacs; Charles E. | Method for treating foodstuffs to reduce or prevent microbial activity |
| US8424243B1 (en) | 1998-10-27 | 2013-04-23 | The United States Of America As Represented By Secretary Of Agriculture | Use of coated protective agent to protect horticultural crops from disease |
| NL1010673C2 (nl) | 1998-11-27 | 2000-05-30 | Stork Pmt | Toevoegen van additief aan een vleesprodukt. |
| IL133827A (en) | 1999-01-13 | 2004-02-08 | Agway Inc | Process for preserving fresh produce and coating composition therefor |
| US6165529A (en) | 1999-01-13 | 2000-12-26 | Planet Polymer Technologies, Inc. | Process for preventing fresh produce and coating composition therefor |
| ES1041955Y (es) | 1999-02-01 | 2000-01-16 | Fernandez Ruben Benigno Lopez | Limpiadora automatica de frutos carnosos. |
| US6162475A (en) | 1999-03-30 | 2000-12-19 | The United States Of America As Represented By The Secretary Of Agriculture | Edible food coatings containing polyvinyl acetate |
| AU6605500A (en) | 1999-07-06 | 2001-01-22 | Regents Of The University Of California, The | Methods for the amelioration of neuropsychiatric disorders by inhibiting the inactivating transport of endogenous cannabinoid substances |
| US6392070B1 (en) * | 1999-08-10 | 2002-05-21 | Regents Of The University Of Minnesota | Birch bark processing and the isolation of natural products from birch bark |
| US6254645B1 (en) | 1999-08-20 | 2001-07-03 | Genencor International, Inc. | Enzymatic modification of the surface of a polyester fiber or article |
| EP1246526A1 (en) | 2000-01-14 | 2002-10-09 | The Procter & Gamble Company | Vase-added compositions for controlling plant and flower moisture transpiration rates |
| US6348217B1 (en) | 2000-08-04 | 2002-02-19 | Mantrose-Haeuser Co. Inc. | Method for preparing stable bleached shellac |
| US7785897B2 (en) | 2000-10-23 | 2010-08-31 | Simon Fraser University | Method and apparatus for producing a discrete droplet for subsequent analysis or manipulation |
| GB0104268D0 (en) | 2001-02-21 | 2001-04-11 | Unilever Plc | Antiperspirant or deodorant compositions |
| US6500974B2 (en) | 2001-02-28 | 2002-12-31 | Council Of Scientific And Industrial Research | Process for the preparation of a monoglyceride |
| JP3583380B2 (ja) | 2001-04-26 | 2004-11-04 | 高砂香料工業株式会社 | コーティング剤およびコーティング粉末 |
| US7294355B2 (en) | 2001-07-12 | 2007-11-13 | Advance Food Technologies, Inc. | Snack/convenience foods and the like having external and/or internal coating compositions |
| ATE406867T1 (de) | 2001-07-18 | 2008-09-15 | Unilever Nv | Zusammensetzungen für die behandlung von haaren und/oder kopfhaut |
| FR2828487B1 (fr) | 2001-08-09 | 2005-05-27 | Genfit S A | Nouveaux composes derives d'acides gras, preparation et utilisations |
| US7013232B2 (en) | 2001-08-15 | 2006-03-14 | National Insurance Corporation | Network-based system for configuring a measurement system using configuration information generated based on a user specification |
| US20030194445A1 (en) | 2001-11-12 | 2003-10-16 | Kuhner Carla H. | Compositions and methods of use of peptides in combination with biocides and/or germicides |
| US20040071845A1 (en) | 2002-06-07 | 2004-04-15 | Hekal Ihab M. | Methods for preserving fresh produce |
| US20040220283A1 (en) | 2002-07-29 | 2004-11-04 | Transform Pharmaceuticals, Inc. | Aqueous 2,6-diisopropylphenol pharmaceutical compositions |
| US7935375B2 (en) | 2002-08-02 | 2011-05-03 | Basf Corporation | Process and coating composition for extending the shelf life of post harvest produce |
| US20110240064A1 (en) | 2002-09-09 | 2011-10-06 | Reactive Surfaces, Ltd. | Polymeric Coatings Incorporating Bioactive Enzymes for Cleaning a Surface |
| US20100210745A1 (en) | 2002-09-09 | 2010-08-19 | Reactive Surfaces, Ltd. | Molecular Healing of Polymeric Materials, Coatings, Plastics, Elastomers, Composites, Laminates, Adhesives, and Sealants by Active Enzymes |
| BR0315027A (pt) | 2002-10-03 | 2005-09-06 | Agroshield Llc | Polìmeros para proteger materiais de danos |
| US7776926B1 (en) | 2002-12-11 | 2010-08-17 | Advanced Cardiovascular Systems, Inc. | Biocompatible coating for implantable medical devices |
| US8367047B2 (en) | 2002-12-20 | 2013-02-05 | L'oreal | Hair compositions |
| CA2424200C (en) | 2003-03-31 | 2009-08-04 | The Sunblush Technologies Corporation | Compound and method for preserving cut apples |
| JP4179034B2 (ja) | 2003-04-18 | 2008-11-12 | ソニー株式会社 | 通信システム、通信装置、通信方法及びプログラム |
| US6822105B1 (en) | 2003-08-12 | 2004-11-23 | Stepan Company | Method of making alkyl esters using glycerin |
| US8101221B2 (en) | 2003-08-28 | 2012-01-24 | Mantrose-Haeuser Co., Inc. | Methods for preserving fresh produce |
| CN102845422A (zh) | 2003-09-09 | 2013-01-02 | 3M创新有限公司 | 抗菌组合物和方法 |
| JP2005097437A (ja) | 2003-09-25 | 2005-04-14 | Fuji Photo Film Co Ltd | 静電インクジェット用インク組成物およびインクジェット記録方法 |
| ES2229948B1 (es) | 2003-10-14 | 2006-07-01 | Universidad Politecnica De Valencia | Preparacion de monoesteres de acidos grasos. |
| US7357957B2 (en) | 2004-05-07 | 2008-04-15 | Fractec Research & Development Inc. | Spreadable food product |
| FR2872068B1 (fr) | 2004-06-28 | 2006-10-27 | Centre Nat Rech Scient Cnrse | Procede et dispositif pour le depot de couches minces par pulverisation electrohydrodynamique, notamment en post-decharge |
| JP2006008968A (ja) * | 2004-06-29 | 2006-01-12 | Ono Yoshio | グミ植物種子成分抽出方法 |
| US20080026120A1 (en) | 2004-07-02 | 2008-01-31 | Basf Corporation | Process for Preserving Fresh Produce and Coating Composition Therefor |
| FR2874424B1 (fr) | 2004-08-17 | 2007-05-11 | Materiel Arboriculture | Dispositif d'analyse optique de produits tels que des fruits a eclairage indirect |
| DE102004043824A1 (de) | 2004-09-10 | 2006-03-16 | Cognis Ip Management Gmbh | Emulsionen mit ungesättigten Fettsäuren und deren Estern |
| DE102004049107A1 (de) | 2004-10-07 | 2006-04-13 | Behr Gmbh & Co. Kg | Beschichtungsverfahren |
| JP5414180B2 (ja) | 2005-02-04 | 2014-02-12 | リピッド・ニュートリション・ベスローテン・フェンノートシャップ | 脂肪酸の製造方法 |
| EP1693436A1 (en) | 2005-02-21 | 2006-08-23 | Cargill Inc. | Hardened vegetable oils and derivatives thereof |
| FI120684B (fi) | 2005-10-21 | 2010-01-29 | Valtion Teknillinen | Menetelmä oligo-/polyestereiden valmistamiseksi suberiinin ja/tai kutiinin karboksyylihapposeoksesta |
| US8247609B2 (en) | 2005-10-25 | 2012-08-21 | Pharamleads | Aminoacid derivatives containing a disulfanyl group in the form of mixed disulfanyl and aminopeptidase N inhibitors |
| FR2893628B1 (fr) | 2005-11-18 | 2008-05-16 | Expanscience Laboratoires Sa | Procede d'obtention d'une huile d'avocat raffinee riche en triglycerides et huile susceptible d'etre obtenue par un tel procede |
| GB0524979D0 (en) | 2005-12-07 | 2006-01-18 | Queen Mary & Westfield College | An electrospray device and a method of electrospraying |
| WO2007066446A1 (ja) | 2005-12-09 | 2007-06-14 | Kumamoto Technology And Industry Foundation | ポリエステルおよび不飽和ポリエステルの解重合方法、ならびに当該解重合方法を用いたポリエステルモノマーの回収方法 |
| US9248217B2 (en) | 2006-01-31 | 2016-02-02 | Nanocopocia, LLC | Nanoparticle coating of surfaces |
| AU2007221204B2 (en) | 2006-02-23 | 2012-06-07 | The Chemours Company Fc, Llc | Removable antimicrobial coating compositions and methods of use |
| CA2649704A1 (en) | 2006-04-18 | 2007-10-25 | Regents Of The University Of Minnesota | Depolymerization extraction of compounds from birch bark |
| US7732470B2 (en) | 2006-10-02 | 2010-06-08 | Medical College Of Georgia Research Institute | Compositions and methods for the treatment of renal and cardiovascular disease |
| US7550617B2 (en) | 2006-10-02 | 2009-06-23 | Medical College Of Georgia Research Institute | Compositions and methods for the treatment of renal and cardiovascular disease |
| US7968497B2 (en) | 2007-01-31 | 2011-06-28 | Valent Biosciences Corporation | Use of adjuvants to improve abscisic acid performance |
| WO2008120223A2 (en) | 2007-03-30 | 2008-10-09 | Reliance Life Sciences Pvt. Ltd. | An integrated process for the preparation of fatty acid methyl ester (biodiesel) |
| US20100278784A1 (en) | 2007-05-15 | 2010-11-04 | Puretech Ventures | Methods and compositions for treating skin conditions |
| US7997026B2 (en) | 2007-06-15 | 2011-08-16 | State of Oregon, by and through the State Board of Higher Education on behalf of Oregon State University | Perishable-fruit-bearing cut-limb preservation and distribution method, coating and shipping container therefor |
| FI120835B (fi) | 2007-07-10 | 2010-03-31 | Valtion Teknillinen | Uusia esteraaseja ja niiden käyttö |
| US7879384B2 (en) | 2007-11-08 | 2011-02-01 | Kraft Foods Global Brands Llc | Structured glycerol esters useful as edible moisture barriers |
| US20090142453A1 (en) | 2007-11-30 | 2009-06-04 | Lobisser George F | Nutraceutical Coatings fo Fruits and Vegetables |
| EP2244590B1 (en) | 2007-12-20 | 2012-05-16 | Novozymes A/S | Cutinase for detoxification of feed products |
| EP2229146A2 (en) | 2008-01-08 | 2010-09-22 | M.D. Lederman Consulting Ltd. | Emulsified wax compositions and uses thereof |
| US8652544B2 (en) | 2008-01-11 | 2014-02-18 | U.S. Nutraceuticals, LLC | Chia seed composition |
| EP2260105B1 (en) | 2008-02-29 | 2016-08-17 | The Trustees Of The University Of Pennsylvania | Production and use of plant degrading materials |
| TW200939956A (en) | 2008-03-26 | 2009-10-01 | Riken | Agent for controlling post-harvest disease and method for controlling post-harvest disease |
| US20110244095A1 (en) | 2008-09-22 | 2011-10-06 | Xeda International | Method for Coating Food Products |
| US8501445B2 (en) | 2008-10-27 | 2013-08-06 | Toyo Seikan Kaisha, Ltd. | Method for producing oligomer and/or monomer by degrading biodegradable resin |
| US20100186674A1 (en) | 2009-01-26 | 2010-07-29 | E. I. Du Pont De Nemours And Company | Methods and compositions for treating fertilized avian eggs |
| SE534010C2 (sv) | 2009-02-13 | 2011-03-29 | Stfi Packforsk Ab | Förfarande för omvandling av suberin- och/eller cutin-innehållande växtdelar till en blandning innehållande en suberinmonomer |
| WO2010124131A1 (en) | 2009-04-23 | 2010-10-28 | State Of Oregon Acting By And Through The State Board Of Higher Education On Behalf Of Oregaon State University | Flexible films and methods of making and using flexible films |
| US8252354B2 (en) | 2009-06-08 | 2012-08-28 | Mas Marketing Holding Company, Llc | Manufacture of seed derivative compositions |
| DE102009031053A1 (de) | 2009-06-30 | 2011-01-13 | Clariant International Ltd. | Kontinuierliches Verfahren zur Herstellung von Estern aliphatischer Carbonsäuren |
| CA2767935A1 (en) | 2009-07-31 | 2011-02-03 | Ecology Coatings, Inc. | Coated substrates and methods of preparing the same |
| WO2011025858A1 (en) | 2009-08-26 | 2011-03-03 | Mantrose-Haeuser Company, Inc. | Printed flexible film for food packaging |
| US20120251675A1 (en) | 2009-12-16 | 2012-10-04 | Basf Se | Coating composition for fresh produce comprising chitosan, surfactant and polyethylene glycol |
| US20130095141A1 (en) | 2010-03-08 | 2013-04-18 | Beverly A. Schad | Food grade dry film coating composition and methods of making and using the same |
| US9492395B2 (en) | 2010-05-11 | 2016-11-15 | Sensient Colors Llc | Film coating composition and methods of making and using the same |
| JP2011246463A (ja) | 2010-05-25 | 2011-12-08 | Rohm & Haas Co | 植物部分上のワックス状コーティング |
| US8586807B2 (en) * | 2010-06-24 | 2013-11-19 | Old Dominion University Research Foundation | Process for the selective production of hydrocarbon based fuels from plants containing aliphatic biopolymers utilizing water at subcritical conditions |
| US20120003356A1 (en) | 2010-06-30 | 2012-01-05 | Athula Ekanayake | Process for Producing Cassava Flour |
| US20120015093A1 (en) | 2010-07-16 | 2012-01-19 | Finney John M | Whole seed processing and controlled viscosity products |
| JP2013535499A (ja) | 2010-08-09 | 2013-09-12 | インスティテュート テクノロヒコ イ デ エステューディオス スペリオレス デ モンテレイ | 生物活性化合物が濃縮されたアボカド抽出物由来の抗菌、抗細菌、または芽胞発芽阻止活性 |
| US8263751B2 (en) | 2010-11-19 | 2012-09-11 | Daedalus Innovations Llc | Method for removing a protein from a metal chelate resin |
| US20130323378A1 (en) | 2011-01-12 | 2013-12-05 | Dsm Ip Assets B.V. | Reduction of weight loss of fruits |
| FI123867B (fi) | 2011-04-06 | 2013-11-29 | Teknologian Tutkimuskeskus Vtt | Uusia kutinaaseja, niiden tuottaminen ja käytöt |
| MX2011003856A (es) | 2011-04-11 | 2012-10-24 | Univ Mexico Nacional Autonoma | Composicion de nanoparticulas lipidicas solidas para la conservacion prolongada por recubrimiento de frutas, verduras, semillas, cereales y/o alimentos frescos. |
| US20140221308A1 (en) | 2011-07-01 | 2014-08-07 | Synedgen, Inc. | Methods and compositions of reducing and preventing bacterial growth and the formation of biofilm on a surface utilizing chitosan-derivative compounds |
| US20130209617A1 (en) | 2011-08-10 | 2013-08-15 | Pace International, Llc | Compositions and methods for use in promoting produce health |
| EP2581340B1 (de) | 2011-10-14 | 2017-02-22 | Evonik Degussa GmbH | Verbessertes Verfahren zur Behandlung von Wasser mit Chlordioxid |
| CN102335142B (zh) | 2011-10-25 | 2014-03-26 | 上海理工大学 | 一种能够原位自组装成难溶药物的纳米脂质体的复合微球及其制备方法 |
| US8708575B2 (en) | 2011-11-11 | 2014-04-29 | Sae Magnetics (H.K.) Ltd. | Active optical connector using audio port |
| JP5944303B2 (ja) | 2011-12-08 | 2016-07-05 | 花王株式会社 | 脂肪酸モノグリセライド含有混合物の製造方法。 |
| AU2013239074B2 (en) | 2012-03-29 | 2016-02-04 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd. | Edible coating for plant matter |
| MX2014011982A (es) | 2012-04-06 | 2015-03-13 | H R D Corp | Aplicacion para alto cizallamiento en el procesamiento de aceites. |
| US20140033926A1 (en) | 2012-08-03 | 2014-02-06 | Robert Scott Fassel | Filtration System |
| US9095152B2 (en) | 2012-09-12 | 2015-08-04 | Munger Bros., LLC | Method for disinfecting, sanitizing, and packaging ready-to-eat produce |
| US9388098B2 (en) | 2012-10-09 | 2016-07-12 | Elevance Renewable Sciences, Inc. | Methods of making high-weight esters, acids, and derivatives thereof |
| US20140199449A1 (en) | 2013-01-14 | 2014-07-17 | Andy Hernandez | Methods for extending the shelf life of processed cucurbita pepo vegetables |
| US10400128B2 (en) | 2013-03-14 | 2019-09-03 | Oregon State University | Nano-cellulose edible coatings and uses thereof |
| US10196496B2 (en) | 2013-03-31 | 2019-02-05 | Pranay Jain | Process for recycling a metalized polyester film |
| ES2643847T3 (es) | 2013-04-11 | 2017-11-24 | Purac Biochem Bv | Preparación de lactilatos directamente a partir de aceite |
| US9249252B2 (en) | 2013-04-26 | 2016-02-02 | Solazyme, Inc. | Low polyunsaturated fatty acid oils and uses thereof |
| CN105283535A (zh) | 2013-05-23 | 2016-01-27 | 自然封印公司 | 抗微生物清洗剂 |
| CN103283830B (zh) | 2013-05-24 | 2014-11-05 | 南京林业大学 | 银杏果复合保鲜剂及保鲜方法 |
| JP2016527208A (ja) | 2013-06-24 | 2016-09-08 | メリアル インコーポレイテッド | 無脊椎有害生物を駆除するためのイソチアゾリン化合物 |
| US9744542B2 (en) | 2013-07-29 | 2017-08-29 | Apeel Technology, Inc. | Agricultural skin grafting |
| ITPR20130066A1 (it) * | 2013-08-26 | 2015-02-27 | Chiesa Virginio | Metodo di estrazione di un polimero poliestere o cutina dagli scarti di pomodoro e polimero poliestere cosi' estratto. |
| EP3038602A4 (en) | 2013-08-28 | 2017-07-26 | Sensient Colors LLC | Edible coating compositions, edible coatings, and methods for making and using the same |
| FR3011467B1 (fr) | 2013-10-08 | 2016-02-12 | Centre Nat Rech Scient | Composes et compositions comprenant de tels composes pour la prevention ou le traitement des dyslipidemies |
| CA2930635A1 (en) | 2013-11-22 | 2015-05-28 | Agri-Neo Inc. | A novel composition and method of use to control pathogens and prevent diseases in seeds |
| CN103719261B (zh) | 2013-12-18 | 2015-10-28 | 广西科技大学 | 一种芒果保水杀菌涂膜液及其制备方法 |
| WO2015176020A1 (en) | 2014-05-16 | 2015-11-19 | Provivi, Inc. | Synthesis of olefinic alcohols via enzymatic terminal hydroxylation |
| WO2016126930A1 (en) | 2015-02-05 | 2016-08-11 | Nanomedex, Llc | Emulsion containing two oils and stabilizers |
| WO2016156363A1 (en) | 2015-03-30 | 2016-10-06 | Dentsply Detrey Gmbh | Dental composition |
| WO2016168319A1 (en) * | 2015-04-13 | 2016-10-20 | University Of South Florida | Cutin-like materials with advanced functionalities and methods of manufacture |
| US20160324172A1 (en) | 2015-05-04 | 2016-11-10 | Jones-Hamilton Co. | Post-Harvest Coating for Fresh Produce |
| WO2016187581A1 (en) | 2015-05-20 | 2016-11-24 | Apeel Technology, Inc. | Plant extract compositions and methods of preparation thereof |
| US9475643B1 (en) | 2015-06-12 | 2016-10-25 | Djt Investments, Llc. | Roller system for sorting produce |
| EP3346851B1 (en) | 2015-09-09 | 2022-08-17 | Arec Crop Protection B.V. | A new fungicidal composition comprising natamycin and fatty acid selected from palmitic acid, oleic acid and linoleic acid, or salts thereof |
| CN108135188B (zh) | 2015-09-16 | 2022-08-05 | 阿比尔技术公司 | 用于分子涂层的前体化合物 |
| EP3386303B1 (en) | 2015-12-10 | 2020-03-11 | Apeel Technology, Inc. | Process for depolymerising cutin |
| EP3195731A1 (en) | 2016-01-19 | 2017-07-26 | Liquidseal Holding B.V. | Coating for fruit |
| TWI731928B (zh) | 2016-01-26 | 2021-07-01 | 美商aPEEL科技公司 | 製備及保存經消毒產品之方法 |
| CN109561674B (zh) | 2016-04-01 | 2022-05-31 | 阿比尔技术公司 | 在贮藏和运输期间降低收获产品中的腐败的方法 |
| CN109561702B (zh) | 2016-07-08 | 2024-01-30 | 阿比尔技术公司 | 控制收获产品成熟速率的方法 |
| WO2018042435A1 (en) | 2016-08-31 | 2018-03-08 | Nontoxico Ltd | A pest control composition and method thereof |
| EP3541192B1 (en) | 2016-11-17 | 2025-06-25 | Apeel Technology, Inc. | Methods of preparing fatty acid esters from crosslinked polyesters |
| CN107794114A (zh) | 2017-11-20 | 2018-03-13 | 重庆汇达柠檬科技集团有限公司 | 一种冷榨制备脱苦柠檬籽油的加工工艺 |
| CN107828560B (zh) | 2017-12-04 | 2019-11-22 | 奇德喜 | 一种皂米的制作方法 |
| US12245605B2 (en) | 2018-09-05 | 2025-03-11 | Apeel Technology, Inc. | Compounds and formulations for protective coatings |
| CN110255947B (zh) | 2019-05-22 | 2022-03-04 | 湖南昌迪环境科技有限公司 | 一种助磨剂及其应用 |
| EP3986149A4 (en) | 2019-06-21 | 2023-02-01 | Apeel Technology, Inc. | COMPOUNDS EXTRACTED FROM PLANT MATERIAL AND PROCESS FOR THE PREPARATION THEREOF |
| EP4237400A1 (en) | 2020-10-30 | 2023-09-06 | Apeel Technology, Inc. | Compositions and methods of preparation thereof |
| CN112898630B (zh) | 2021-01-26 | 2022-06-17 | 佛山科学技术学院 | 一种聚酯类塑料的机械化学绿色降解方法 |
-
2016
- 2016-12-09 EP EP16820459.2A patent/EP3386303B1/en active Active
- 2016-12-09 WO PCT/US2016/065917 patent/WO2017100636A1/en not_active Ceased
- 2016-12-09 ES ES16820459T patent/ES2797697T3/es active Active
- 2016-12-09 EP EP19214825.2A patent/EP3649860B1/en active Active
- 2016-12-09 CN CN202110066463.8A patent/CN112841185A/zh active Pending
- 2016-12-09 CN CN201680079439.5A patent/CN108966638B/zh not_active Expired - Fee Related
- 2016-12-09 JP JP2018530034A patent/JP6549326B2/ja active Active
- 2016-12-09 ES ES19214825T patent/ES2939007T3/es active Active
-
2017
- 2017-08-18 US US15/680,541 patent/US9957215B2/en active Active
-
2018
- 2018-04-02 US US15/943,553 patent/US10561155B2/en active Active
- 2018-06-05 IL IL259820A patent/IL259820B/en active IP Right Grant
- 2018-10-03 US US16/151,268 patent/US10407377B2/en active Active
-
2019
- 2019-11-22 US US16/692,807 patent/US11028030B2/en not_active Expired - Fee Related
-
2020
- 2020-01-16 IL IL272083A patent/IL272083B/en unknown
-
2021
- 2021-06-07 US US17/340,952 patent/US11767278B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US20190031590A1 (en) | 2019-01-31 |
| IL259820A (en) | 2018-07-31 |
| WO2017100636A1 (en) | 2017-06-15 |
| US10407377B2 (en) | 2019-09-10 |
| JP2019501154A (ja) | 2019-01-17 |
| US20180222835A1 (en) | 2018-08-09 |
| US11767278B2 (en) | 2023-09-26 |
| CN108966638B (zh) | 2021-01-26 |
| US10561155B2 (en) | 2020-02-18 |
| CN112841185A (zh) | 2021-05-28 |
| IL272083A (en) | 2020-03-31 |
| IL272083B (en) | 2021-07-29 |
| EP3386303B1 (en) | 2020-03-11 |
| EP3649860B1 (en) | 2023-02-01 |
| US20210291074A1 (en) | 2021-09-23 |
| US20180044276A1 (en) | 2018-02-15 |
| US11028030B2 (en) | 2021-06-08 |
| EP3649860A1 (en) | 2020-05-13 |
| US9957215B2 (en) | 2018-05-01 |
| IL259820B (en) | 2020-02-27 |
| US20200100514A1 (en) | 2020-04-02 |
| CN108966638A (zh) | 2018-12-07 |
| EP3386303A1 (en) | 2018-10-17 |
| ES2797697T3 (es) | 2020-12-03 |
| JP6549326B2 (ja) | 2019-07-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2939007T3 (es) | Composiciones de extractos de plantas para formar recubrimientos protectores | |
| ES2973163T3 (es) | Composiciones de extractos de plantas y métodos de preparación de las mismas | |
| US11319275B2 (en) | Compositions formed from plant extracts and methods of preparation thereof | |
| HK40029950A (en) | Plant extract compositions for forming protective coatings | |
| HK40051184A (en) | Plant extract compositions for forming protective coatings |