RU2532549C2 - Медь- и марганецсодержащие катализаторы на основе неблагородных металлов для окисления монооксида углерода и летучих органических соединений - Google Patents
Медь- и марганецсодержащие катализаторы на основе неблагородных металлов для окисления монооксида углерода и летучих органических соединений Download PDFInfo
- Publication number
- RU2532549C2 RU2532549C2 RU2011147128/04A RU2011147128A RU2532549C2 RU 2532549 C2 RU2532549 C2 RU 2532549C2 RU 2011147128/04 A RU2011147128/04 A RU 2011147128/04A RU 2011147128 A RU2011147128 A RU 2011147128A RU 2532549 C2 RU2532549 C2 RU 2532549C2
- Authority
- RU
- Russia
- Prior art keywords
- catalyst
- base metal
- copper
- alumina
- oxide
- Prior art date
Links
- 239000003054 catalyst Substances 0.000 title claims abstract description 177
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 title claims abstract description 60
- 229910002091 carbon monoxide Inorganic materials 0.000 title claims abstract description 60
- 239000012855 volatile organic compound Substances 0.000 title claims abstract description 59
- 230000003647 oxidation Effects 0.000 title claims abstract description 18
- 238000007254 oxidation reaction Methods 0.000 title claims abstract description 18
- 229910000510 noble metal Inorganic materials 0.000 title abstract description 12
- HPDFFVBPXCTEDN-UHFFFAOYSA-N copper manganese Chemical compound [Mn].[Cu] HPDFFVBPXCTEDN-UHFFFAOYSA-N 0.000 title 1
- 239000010949 copper Substances 0.000 claims abstract description 74
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims abstract description 60
- GZUXJHMPEANEGY-UHFFFAOYSA-N bromomethane Chemical compound BrC GZUXJHMPEANEGY-UHFFFAOYSA-N 0.000 claims abstract description 45
- 239000000203 mixture Substances 0.000 claims abstract description 45
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 claims abstract description 42
- 239000011572 manganese Substances 0.000 claims abstract description 42
- 239000007789 gas Substances 0.000 claims abstract description 41
- 238000000034 method Methods 0.000 claims abstract description 40
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims abstract description 39
- PNEYBMLMFCGWSK-UHFFFAOYSA-N Alumina Chemical compound [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 claims abstract description 33
- 229910052802 copper Inorganic materials 0.000 claims abstract description 33
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 claims abstract description 30
- 229910052751 metal Inorganic materials 0.000 claims abstract description 30
- 239000002184 metal Substances 0.000 claims abstract description 30
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 claims abstract description 25
- MCMNRKCIXSYSNV-UHFFFAOYSA-N ZrO2 Inorganic materials O=[Zr]=O MCMNRKCIXSYSNV-UHFFFAOYSA-N 0.000 claims abstract description 25
- 239000000463 material Substances 0.000 claims abstract description 25
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims abstract description 24
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 claims abstract description 23
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 claims abstract description 22
- 229940102396 methyl bromide Drugs 0.000 claims abstract description 22
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 21
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 claims abstract description 19
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims abstract description 16
- 150000001875 compounds Chemical class 0.000 claims abstract description 16
- -1 platinum group metals Chemical class 0.000 claims abstract description 16
- CETPSERCERDGAM-UHFFFAOYSA-N ceric oxide Chemical compound O=[Ce]=O CETPSERCERDGAM-UHFFFAOYSA-N 0.000 claims abstract description 15
- 229910000422 cerium(IV) oxide Inorganic materials 0.000 claims abstract description 15
- 229910052748 manganese Inorganic materials 0.000 claims abstract description 14
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 claims abstract description 13
- 239000001273 butane Substances 0.000 claims abstract description 13
- IAQRGUVFOMOMEM-UHFFFAOYSA-N butene Natural products CC=CC IAQRGUVFOMOMEM-UHFFFAOYSA-N 0.000 claims abstract description 13
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 claims abstract description 13
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 claims abstract description 13
- 239000000377 silicon dioxide Substances 0.000 claims abstract description 12
- 239000004408 titanium dioxide Substances 0.000 claims abstract description 12
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 claims abstract description 11
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 claims abstract description 11
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 claims abstract description 9
- 230000003197 catalytic effect Effects 0.000 claims abstract description 9
- 229910017052 cobalt Inorganic materials 0.000 claims abstract description 9
- 239000010941 cobalt Substances 0.000 claims abstract description 9
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 claims abstract description 9
- 229910052759 nickel Inorganic materials 0.000 claims abstract description 9
- 239000011777 magnesium Substances 0.000 claims abstract description 8
- 239000010955 niobium Substances 0.000 claims abstract description 8
- 229910052684 Cerium Inorganic materials 0.000 claims abstract description 7
- 239000011575 calcium Substances 0.000 claims abstract description 7
- 229910052746 lanthanum Inorganic materials 0.000 claims abstract description 7
- FZLIPJUXYLNCLC-UHFFFAOYSA-N lanthanum atom Chemical compound [La] FZLIPJUXYLNCLC-UHFFFAOYSA-N 0.000 claims abstract description 7
- 229910052779 Neodymium Inorganic materials 0.000 claims abstract description 6
- 229910052777 Praseodymium Inorganic materials 0.000 claims abstract description 6
- QEFYFXOXNSNQGX-UHFFFAOYSA-N neodymium atom Chemical compound [Nd] QEFYFXOXNSNQGX-UHFFFAOYSA-N 0.000 claims abstract description 6
- PUDIUYLPXJFUGB-UHFFFAOYSA-N praseodymium atom Chemical compound [Pr] PUDIUYLPXJFUGB-UHFFFAOYSA-N 0.000 claims abstract description 6
- 229910052788 barium Inorganic materials 0.000 claims abstract description 5
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 claims abstract description 5
- VSZWPYCFIRKVQL-UHFFFAOYSA-N selanylidenegallium;selenium Chemical compound [Se].[Se]=[Ga].[Se]=[Ga] VSZWPYCFIRKVQL-UHFFFAOYSA-N 0.000 claims abstract description 5
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 claims abstract description 4
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 claims abstract description 4
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 claims abstract description 4
- GWXLDORMOJMVQZ-UHFFFAOYSA-N cerium Chemical compound [Ce] GWXLDORMOJMVQZ-UHFFFAOYSA-N 0.000 claims abstract description 4
- 229910052749 magnesium Inorganic materials 0.000 claims abstract description 4
- 229910052750 molybdenum Inorganic materials 0.000 claims abstract description 4
- 239000011733 molybdenum Substances 0.000 claims abstract description 4
- 229910052758 niobium Inorganic materials 0.000 claims abstract description 4
- GUCVJGMIXFAOAE-UHFFFAOYSA-N niobium atom Chemical compound [Nb] GUCVJGMIXFAOAE-UHFFFAOYSA-N 0.000 claims abstract description 4
- 229910052712 strontium Inorganic materials 0.000 claims abstract description 4
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 claims abstract description 4
- 229910052715 tantalum Inorganic materials 0.000 claims abstract description 4
- GUVRBAGPIYLISA-UHFFFAOYSA-N tantalum atom Chemical compound [Ta] GUVRBAGPIYLISA-UHFFFAOYSA-N 0.000 claims abstract description 4
- JBQYATWDVHIOAR-UHFFFAOYSA-N tellanylidenegermanium Chemical compound [Te]=[Ge] JBQYATWDVHIOAR-UHFFFAOYSA-N 0.000 claims abstract description 4
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 claims abstract description 3
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 claims abstract description 3
- 229910052791 calcium Inorganic materials 0.000 claims abstract description 3
- 239000010953 base metal Substances 0.000 claims description 54
- 238000004519 manufacturing process Methods 0.000 claims description 9
- 230000001590 oxidative effect Effects 0.000 claims description 6
- 229910052726 zirconium Inorganic materials 0.000 claims description 5
- 239000011651 chromium Substances 0.000 claims description 4
- 239000002131 composite material Substances 0.000 claims description 3
- 239000003381 stabilizer Substances 0.000 claims description 3
- 229910052784 alkaline earth metal Inorganic materials 0.000 claims description 2
- 150000001342 alkaline earth metals Chemical class 0.000 claims description 2
- 229910052782 aluminium Inorganic materials 0.000 claims description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims description 2
- 229910052804 chromium Inorganic materials 0.000 claims description 2
- 229910052727 yttrium Inorganic materials 0.000 claims description 2
- VWQVUPCCIRVNHF-UHFFFAOYSA-N yttrium atom Chemical compound [Y] VWQVUPCCIRVNHF-UHFFFAOYSA-N 0.000 claims description 2
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical group [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 claims 2
- DDPNPTNFVDEJOH-UHFFFAOYSA-N [O-2].[Zr+4].[O-2].[Ce+3] Chemical compound [O-2].[Zr+4].[O-2].[Ce+3] DDPNPTNFVDEJOH-UHFFFAOYSA-N 0.000 claims 1
- 150000001768 cations Chemical class 0.000 claims 1
- 239000002023 wood Substances 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 15
- 235000012239 silicon dioxide Nutrition 0.000 abstract description 2
- 239000000126 substance Substances 0.000 abstract description 2
- 230000005923 long-lasting effect Effects 0.000 abstract 1
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 abstract 1
- 238000006243 chemical reaction Methods 0.000 description 36
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 34
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 18
- 239000000758 substrate Substances 0.000 description 18
- 229910002651 NO3 Inorganic materials 0.000 description 11
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 11
- 230000032683 aging Effects 0.000 description 11
- 239000002245 particle Substances 0.000 description 10
- 229910052697 platinum Inorganic materials 0.000 description 9
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 8
- 239000000725 suspension Substances 0.000 description 8
- 239000007864 aqueous solution Substances 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 5
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 5
- 239000012876 carrier material Substances 0.000 description 5
- 238000010960 commercial process Methods 0.000 description 5
- 230000000052 comparative effect Effects 0.000 description 5
- 229910052742 iron Inorganic materials 0.000 description 5
- 229910052760 oxygen Inorganic materials 0.000 description 5
- 239000001301 oxygen Substances 0.000 description 5
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 4
- 239000000919 ceramic Substances 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 229910010052 TiAlO Inorganic materials 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- XTVVROIMIGLXTD-UHFFFAOYSA-N copper(II) nitrate Chemical compound [Cu+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O XTVVROIMIGLXTD-UHFFFAOYSA-N 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 150000008282 halocarbons Chemical class 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- MWUXSHHQAYIFBG-UHFFFAOYSA-N nitrogen oxide Inorganic materials O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 3
- 239000010970 precious metal Substances 0.000 description 3
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical group CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 238000001354 calcination Methods 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- 150000002430 hydrocarbons Chemical class 0.000 description 2
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 2
- 229910000480 nickel oxide Inorganic materials 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- 206010008428 Chemical poisoning Diseases 0.000 description 1
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 1
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 229910010413 TiO 2 Inorganic materials 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- UFMZWBIQTDUYBN-UHFFFAOYSA-N cobalt dinitrate Chemical compound [Co+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O UFMZWBIQTDUYBN-UHFFFAOYSA-N 0.000 description 1
- MZZUATUOLXMCEY-UHFFFAOYSA-N cobalt manganese Chemical compound [Mn].[Co] MZZUATUOLXMCEY-UHFFFAOYSA-N 0.000 description 1
- 229910001981 cobalt nitrate Inorganic materials 0.000 description 1
- 150000001879 copper Chemical class 0.000 description 1
- 150000002013 dioxins Chemical class 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 239000003344 environmental pollutant Substances 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- JEGUKCSWCFPDGT-UHFFFAOYSA-N h2o hydrate Chemical compound O.O JEGUKCSWCFPDGT-UHFFFAOYSA-N 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- MVFCKEFYUDZOCX-UHFFFAOYSA-N iron(2+);dinitrate Chemical compound [Fe+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O MVFCKEFYUDZOCX-UHFFFAOYSA-N 0.000 description 1
- 150000002696 manganese Chemical class 0.000 description 1
- MIVBAHRSNUNMPP-UHFFFAOYSA-N manganese(2+);dinitrate Chemical compound [Mn+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O MIVBAHRSNUNMPP-UHFFFAOYSA-N 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- KBJMLQFLOWQJNF-UHFFFAOYSA-N nickel(ii) nitrate Chemical compound [Ni+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O KBJMLQFLOWQJNF-UHFFFAOYSA-N 0.000 description 1
- GNRSAWUEBMWBQH-UHFFFAOYSA-N oxonickel Chemical compound [Ni]=O GNRSAWUEBMWBQH-UHFFFAOYSA-N 0.000 description 1
- MMKQUGHLEMYQSG-UHFFFAOYSA-N oxygen(2-);praseodymium(3+) Chemical compound [O-2].[O-2].[O-2].[Pr+3].[Pr+3] MMKQUGHLEMYQSG-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- 239000010457 zeolite Substances 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/70—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper
- B01J23/76—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper combined with metals, oxides or hydroxides provided for in groups B01J23/02 - B01J23/36
- B01J23/84—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper combined with metals, oxides or hydroxides provided for in groups B01J23/02 - B01J23/36 with arsenic, antimony, bismuth, vanadium, niobium, tantalum, polonium, chromium, molybdenum, tungsten, manganese, technetium or rhenium
- B01J23/889—Manganese, technetium or rhenium
- B01J23/8892—Manganese
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D53/00—Separation of gases or vapours; Recovering vapours of volatile solvents from gases; Chemical or biological purification of waste gases, e.g. engine exhaust gases, smoke, fumes, flue gases, aerosols
- B01D53/34—Chemical or biological purification of waste gases
- B01D53/74—General processes for purification of waste gases; Apparatus or devices specially adapted therefor
- B01D53/86—Catalytic processes
- B01D53/864—Removing carbon monoxide or hydrocarbons
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D53/00—Separation of gases or vapours; Recovering vapours of volatile solvents from gases; Chemical or biological purification of waste gases, e.g. engine exhaust gases, smoke, fumes, flue gases, aerosols
- B01D53/34—Chemical or biological purification of waste gases
- B01D53/74—General processes for purification of waste gases; Apparatus or devices specially adapted therefor
- B01D53/86—Catalytic processes
- B01D53/8668—Removing organic compounds not provided for in B01D53/8603 - B01D53/8665
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/002—Mixed oxides other than spinels, e.g. perovskite
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/50—Catalysts, in general, characterised by their form or physical properties characterised by their shape or configuration
- B01J35/56—Foraminous structures having flow-through passages or channels, e.g. grids or three-dimensional monoliths
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/207—Transition metals
- B01D2255/2073—Manganese
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/207—Transition metals
- B01D2255/20738—Iron
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/207—Transition metals
- B01D2255/20746—Cobalt
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/207—Transition metals
- B01D2255/20753—Nickel
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/20—Metals or compounds thereof
- B01D2255/207—Transition metals
- B01D2255/20761—Copper
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2255/00—Catalysts
- B01D2255/40—Mixed oxides
- B01D2255/407—Zr-Ce mixed oxides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2257/00—Components to be removed
- B01D2257/50—Carbon oxides
- B01D2257/502—Carbon monoxide
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D—SEPARATION
- B01D2257/00—Components to be removed
- B01D2257/70—Organic compounds not provided for in groups B01D2257/00 - B01D2257/602
- B01D2257/708—Volatile organic compounds V.O.C.'s
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2523/00—Constitutive chemical elements of heterogeneous catalysts
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Environmental & Geological Engineering (AREA)
- Materials Engineering (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Analytical Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Catalysts (AREA)
- Exhaust Gas Treatment By Means Of Catalyst (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Изобретение относится к способам (вариантам) окисления монооксида углерода (СО) и летучих органических соединений (ЛОС), а также к каталитической композиции для данных процессов, при этом способы включают стадию введения хвостовых газов способа получения очищенной терефталевой кислоты, содержащих водяные пары и указанные СО и ЛОС, в контакт с композицией катализатора, содержащей по меньшей мере один промотор на основе неблагородного металла и по меньшей мере один катализатор на основе неблагородного металла, нанесенные на оксидный носитель, включающий один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана, причем указанная композиция катализатора по существу не содержит металлов платиновой группы, а указанные соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена, при этом по меньшей мере один катализатор на основе неблагородного металла выбирают из группы, состоящей из меди (Cu), железа (Fe), кобальта (Co), никеля (Ni) и хрома (Cr), а по меньшей мере один промотор катализатора на основе неблагородного металла выбирают из группы, состоящей из неодима (Nd), бария (Ba), церия (Ce), лантана (La), празеодима (Pr), магния (Mg), кальция (Ca), марганца (Mn), цинка (Zn), ниобия (Nb), циркония (Zr), молибдена (Mo), олова (Sn), тантала (Ta) и стронция (Sr). Технический результат заключается в разработке альтернативных катализаторов, которые демонстрируют высокую активность и долговечность. 3 н. и 10 з.п. ф-лы, 11 ил., 14 пр.
Description
Область техники, к которой относится изобретение
Изобретение относится к способу и композиции катализатора для обработки выбросов в промышленных и коммерческих процессах.
Уровень техники
Каталитическое окисление широко используют для борьбы с выбросами монооксида углерода (СО) и летучих органических соединений (ЛОС) в промышленных процессах. Большинство катализаторов представляет собой нанесенные на носитель благородные металлы вследствие их высокой каталитической активности, хорошей термостойкости и превосходной стойкости к отравлению химическими веществами. Для областей применения, в которых требуется большой объем катализаторов, использование катализаторов окисления на основе благородных металлов требует большой величины капиталовложений в связи с дороговизной благородных металлов. Например, типичная установка каталитического окисления хвостовых газов в способе получения очищенной терефталевой кислоты (ОТК) требует использования 300 фут3 катализаторов на основе благородных металлов при загрузке 50 г/фут3 платины (Pt) и 30 г/фут3 палладия (Pd), что потребовало бы использования приблизительно 482 унций Pt и 289 унций Pd. Поэтому существует настоятельное желание разработки альтернативных катализаторов, которые демонстрируют активность и долговечность, по меньшей мере, сопоставимые с тем, что имеет место для катализаторов, содержащих благородные металлы.
Раскрытие изобретения
В соответствии с одним вариантом осуществления настоящего изобретения способ окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) включает введение газа, содержащего водяные пары и упомянутые СО и ЛОС, в контакт с композицией катализатора, содержащей, по меньшей мере, один промотор на основе неблагородного металла и, по меньшей мере, один катализатор на основе неблагородного металла, нанесенные на оксидный носитель, включающий один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана. Соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена.
В соответствии с еще одним вариантом осуществления настоящего изобретения способ окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) включает стадию введения газа, содержащего водяные пары и СО и ЛОС, в контакт с композицией катализатора, по существу состоящей из, по меньшей мере, одного промотора на основе неблагородного металла и, по меньшей мере, одного катализатора на основе неблагородного металла, нанесенных на оксидный носитель, включающий один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана. Соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена.
В соответствии с еще одним вариантом осуществления настоящего изобретения композиция катализатора окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) содержит, по меньшей мере, один промотор на основе неблагородного металла и, по меньшей мере, один катализатор на основе неблагородного металла, нанесенные на оксидный носитель, включающий один или несколько материалов, выбранных из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана.
В соответствии с еще одним вариантом осуществления настоящего изобретения композиция катализатора окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) по существу состоит из, по меньшей мере, одного промотора на основе неблагородного металла и, по меньшей мере, одного катализатора на основе неблагородного металла, нанесенных на оксидный носитель, включающий один или несколько материалов, выбранных из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана.
Краткое описание чертежей
Изобретение может быть понято после ознакомления со следующим далее подробным описанием осуществления изобретения при его прочтении в связи с прилагаемым графическим материалом. В графический материал включаются следующие далее фигуры:
фигура 1а представляет собой график, иллюстрирующий процентную величину конверсии метилбромида для температур и условий на выходе, моделирующих хвостовые газы способа получения ОТК, для катализатора на основе меди, соответствующего одному варианту осуществления настоящего изобретения, в сопоставлении с катализатором на основе металла платиновой группы;
фигура 1b представляет собой график, иллюстрирующий процентную величину конверсии бензола для температур и условий на выходе, моделирующих хвостовые газы способа получения ОТК, для катализатора на основе меди, соответствующего одному варианту осуществления настоящего изобретения, в сопоставлении с катализатором на основе металла платиновой группы;
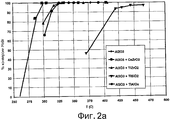
фигура 2а представляет собой график, иллюстрирующий процентную величину конверсии метилбромида для температур и условий, моделирующих хвостовые газы способа получения ОТК, для материалов носителей, соответствующих различным вариантам осуществления настоящего изобретения;
фигура 2b представляет собой график, иллюстрирующий процентную величину конверсии бензола для температур и условий, моделирующих хвостовые газы способа получения ОТК, для материалов носителей, соответствующих различным вариантам осуществления настоящего изобретения;
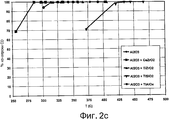
фигура 2с представляет собой график, иллюстрирующий процентную величину конверсии монооксида углерода для температур и условий, моделирующих хвостовые газы способа получения ОТК, для материалов носителей, соответствующих различным вариантам осуществления настоящего изобретения;
фигура 3 представляет собой график, иллюстрирующий процентную величину конверсии метанола для температур для катализатора на основе меди, соответствующего одному варианту осуществления настоящего изобретения, в сопоставлении с катализатором на основе металла платиновой группы;
фигура 4 представляет собой график, иллюстрирующий процентную величину конверсии метилэтилкетона для температур и условий для катализатора на основе меди, соответствующего одному варианту осуществления настоящего изобретения, в сопоставлении с катализатором на основе металла платиновой группы;
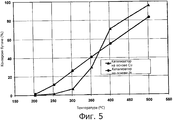
фигура 5 представляет собой график, иллюстрирующий процентную величину конверсии бутана для катализатора на основе меди, соответствующего одному варианту осуществления настоящего изобретения, в сопоставлении с катализатором на основе металла платиновой группы;
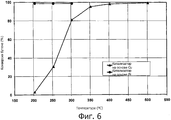
фигура 6 представляет собой график, иллюстрирующий процентную величину конверсии бутена для катализатора на основе меди, соответствующего одному варианту осуществления настоящего изобретения, в сопоставлении с катализатором на основе металла платиновой группы;
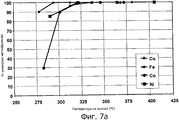
фигура 7а представляет собой график, иллюстрирующий процентную величину конверсии метилбромида для вариантов осуществления композиции катализатора, содержащей медь, железо, кобальт и никель, соответственно, в качестве катализатора на основе неблагородного металла; и
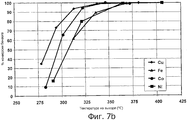
фигура 7b представляет собой график, иллюстрирующий процентную величину конверсии бензола для вариантов осуществления композиции катализатора, содержащей медь, железо, кобальт и никель, соответственно, в качестве катализатора на основе неблагородного металла.
Осуществление изобретения
Аспекты настоящего изобретения включают способы окисления и композиции катализаторов окисления монооксида углерода (СО) и летучих органических соединений (ЛОС). В соответствии с одним вариантом осуществления способ окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) включает введение газа, содержащего водяные пары и упомянутые СО и ЛОС, в контакт с композицией катализатора, содержащей, по меньшей мере, один промотор на основе неблагородного металла и, по меньшей мере, один катализатор на основе неблагородного металла, нанесенные на оксидный носитель, включающий один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана, где соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена. В соответствии с еще одним вариантом осуществления способ окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) включает введение газа, содержащего водяные пары и упомянутые СО и ЛОС, в контакт с композицией катализатора, по существу состоящей из, по меньшей мере, одного катализатора на основе неблагородного металла, нанесенного на оксидный носитель, включающий один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана, где соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена.
Каталитическое окисление широко используют для борьбы с выбросами ЛОС и СО в промышленных и коммерческих процессах. В способе окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) используют катализатор в контакте с газом, содержащим, по меньшей мере, водяные пары, СО и ЛОС. Газ может включать соединения ЛОС, такие как насыщенные и ненасыщенные углеводороды, ароматические углеводороды, их полигалогенированные производные, такие как галогенуглероды, диоксины, и углеводороды, содержащие один или несколько атомов серы, кислорода, азота, фосфора или брома. Газы могут выбрасываться в промышленном или коммерческом процессе. В соответствии с одним вариантом осуществления газ может представлять собой хвостовые газы способа получения очищенной терефталевой кислоты (ОТК).
В одном коммерческом способе получения ОТК терефталевая кислота может быть получена в результате окисления п-ксилола кислородом при использовании уксусной кислоты в качестве растворителя. Это может происходить в присутствии катализатора, такого как катализатор на основе кобальта-марганца, при использовании бромидного промотора. Продукт может быть очищен в результате гидрирования при нахождении в водном растворе, а после этого может быть охлажден. Хвостовые газы в способе получения очищенной терефталевой кислоты (ОТК) могут содержать кислород, азот, оксиды азота, метилбромид, бензол, метан, монооксид углерода, метилацетат и воду. Говоря конкретно, типичный способ получения ОТК может включать 30 частей на миллион частей (ч./млн) метилбромида, 10 ч./млн бензола, 100 ч./млн метана, 1000 ч./млн монооксида углерода, 500 ч./млн метилацетата, 1,5% (мол.) воды, 4% (мол.) кислорода и балансовое количество азота. В дополнение к перечисленным выше компонентам катализатор, соответствующий одному варианту осуществления настоящего изобретения, может также обеспечивать окисление и конверсию и других летучих органических соединений, таких как метилэтилкетон, метанол, бутан или бутен.
Способы получения ОТК могут включать приблизительно 2% (мол.) водяного пара/воды. Катализатор и носитель должны быть стабильными и способными эффективно функционировать в среде с влагой. Как известно, определенные катализаторы и носители, такие как цеолиты, в гидротермических условиях разлагаются, в особенности по истечении определенного периода времени. Однако композиции катализаторов настоящего изобретения способны противостоять воздействию окружения и эффективно работать в газе, содержащем водяные пары, например, от 1,5% (мол.) до 5% (мол.) влаги, при температуре, большей чем приблизительно 400°С, или в альтернативном варианте находящейся в диапазоне от приблизительно 200°С до приблизительно 400°С, от приблизительно 200°С до приблизительно 325°С, от приблизительно 200°С до приблизительно 300°С, от приблизительно 200°С до приблизительно 250°С, или в альтернативном варианте меньшей чем приблизительно 325°С, меньшей чем приблизительно 300°С или меньшей чем приблизительно 250°С.
В случае введения газа, такого как хвостовые газы от ОТК, содержащие водяные пары, СО и ЛОС, в контакт с композицией катализатора, соответствующей вариантам осуществления настоящего изобретения, монооксид углерода (СО) и летучие органические соединения (ЛОС) окислятся. Технологический отходящий поток может быть предварительно нагрет и перепущен через слой катализатора в присутствии избыточного кислорода, и компоненты потока, загрязняющие окружающую среду, окислятся с образованием диоксида углерода (СO2), воды (Н2O) и бромистого водорода. Бромистый водород по ходу технологического потока после катализатора легко может быть удален из отходящего потока в результате пропускания газа через щелочной скруббер, что, таким образом, удалит загрязнители окружающей среды из отходящего потока перед выбросом отработанных газов в атмосферу. Варианты осуществления настоящего изобретения продемонстрировали обеспечение конверсии метилбромида, бензола и монооксида углерода, по меньшей мере, настолько же эффективно и даже еще более эффективно, как и в случае сопоставимых катализаторов на основе металлов платиновой группы, что продемонстрировано, например, на фигурах 1а и 1b.
В случае содержания в газе других соединений ЛОС, таких как метанол, метилэтилкетон, бутан или бутен, катализатор на основе неблагородного металла, соответствующий вариантам осуществления настоящего изобретения, также был способен обеспечивать достижение сопоставимых конверсий, что и эталонный катализатор на основе металла платиновой группы, до тех пор, пока температура слоя катализатора не достигала определенного уровня, как это продемонстрировано, например, на фигурах 3-6.
Композиция катализатора содержит, по меньшей мере, один катализатор на основе неблагородного металла. По меньшей мере, один катализатор на основе неблагородного металла может быть выбран из меди (Сu), железа (Fe), кобальта (Со), никеля (Ni) и хрома (Сr). В одном примере варианта осуществления настоящего изобретения, по меньшей мере, один катализатор на основе неблагородного металла представляет собой медь. Использование в настоящем изобретении, по меньшей мере, одного катализатора на основе неблагородного металла, нанесенного на носители (описывающиеся в настоящем документе ниже) и промотированного, по меньшей мере, одним промотором на основе неблагородного металла, такого как марганец, исключает потребность в благородных металлах. Катализатор на основе неблагородного металла может быть добавлен в форме нитрата или ацетата. В частности, медь, например, в форме нитрата меди может быть импрегнирована на носитель или нанесена в виде покрытия на гранулы или монолит. Катализаторы настоящего изобретения демонстрируют превосходные активность (например, они являются высокоактивными катализаторами) и долговечность в сопоставлении с современными коммерческими катализаторами на основе благородных металлов. В случае борьбы с выбросами хвостовых газов от ОТК данные катализаторы будут способны лучше обеспечивать конверсию СО и ЛОС при пониженных температурах, чем катализаторы на основе металлов платиновой группы (МПГ) при подобных температурах. Данные катализаторы также демонстрируют превосходные долговечность и срок службы.
Композиция катализатора содержит, по меньшей мере, один промотор на основе неблагородного металла. В соответствии с использованием в настоящем документе термины «промотор» или «промотированный» понимаются как обозначение вещества, которое, будучи добавленным в катализатор, увеличивает активность катализатора. По меньшей мере, один промотор катализатора на основе неблагородного металла может быть выбран из неодима (Nd), бария (Ва), церия (Се), лантана (La), празеодима (Рr), магния (Mg), кальция (Са), марганца (Мn), цинка (Zn), ниобия (Nb), циркония (Zr), молибдена (Мо), олова (Sn), тантала (Та) или стронция (Sr). В одном иллюстративном варианте осуществления, по меньшей мере, один промотор катализатора на основе неблагородного металла представляет собой Мn. По меньшей мере, один промотор катализатора на основе неблагородного металла может быть добавлен, например, в форме нитрата в растворе или ацетата. Например, в случае использования Мn Мn может быть добавлен в форме нитрата Мn. По меньшей мере, один промотор катализатора на основе неблагородного металла и, по меньшей мере, один катализатор на основе неблагородного металла, например меди, могут быть импрегнированны из водного раствора на материал (материалы) оксидного носителя, могут быть добавлены в «washcoat», содержащее материал (материалы) оксидного носителя, или могут быть импрегнированны в носитель, на который предварительно нанесли покрытие «washcoat»a.
В одном примере варианта осуществления, по меньшей мере, один катализатор на основе неблагородного металла представляет собой медь, а, по меньшей мере, один. промотор на основе неблагородного металла представляет собой марганец. Без желания связывать себя какой-либо конкретной теорией заявители полагают, что в результате использования комбинации из Сu и Мn в качестве активных каталитических компонентов, нанесенных, по меньшей мере, на один оксидный носитель, Сu и Мn обеспечивают достижение повышенной активности катализатора, а Мn может дополнительно улучшить долговечность катализатора. В дополнение к этому и значительным образом Мn, по-видимому, обеспечивает достижение улучшенной активности катализатора при пониженных температурах. Как можно сказать при обращении к фигурам 1а и 1b, катализатор Сu:Мn демонстрирует превосходную конверсию ЛОС при пониженных температурах, например при температуре менее чем 325°С.
По меньшей мере, один промотор на основе неблагородного металла и, по меньшей мере, один катализатор на основе неблагородного металла наносят на оксидный носитель. Оксидный носитель может включать один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана. Оксидные носители могут представлять собой оксид алюминия (Al2O3), диоксид кремния (SiO2), диоксид циркония (ZrO2), диоксид церия (CeO2) и диоксид титана (ТiO2) или их смеси или их смеси с другими оксидными материалами, такими как перовскиты, оксид никеля (NiO), диоксид марганца (МnО2), оксид празеодима (III) (Рr2O3). Таким образом, оксидный носитель может включать композитные оксиды или смешанные оксиды из двух и более данных материалов (такие как смешанные оксиды CeZrO2, смешанные оксиды TiZrO2, смешанные оксиды TiSiO2 и оксиды TiAlOx, где х зависит от соотношения между количествами TiO2 и Аl2О3). Оксидный носитель может выполнять не только функцию носителя, но и связующего. Например, оксид алюминия может использоваться как в качестве носителя, так и в качестве связующего в оксиде алюминия и смешанном оксиде CeZrO2. Оксидный носитель может быть суспендирован, или в случае наличия более чем одного материала оксидные носители могут быть совместно суспендированы в воде с образованием «washcoat».
Оксидный носитель также может быть стабилизирован. Стабилизаторы могут быть выбраны из циркония (Zr), лантана (La), алюминия (Аl), иттрия (Y), празеодима (Рr), неодима (Nd) и их оксида, композитного оксида или смешанного оксида для любых двух и более данных материалов или, по меньшей мере, одного щелочноземельного металла, например бария (Ва). Стабилизаторы для каждого оксидного носителя могут быть идентичными или различными. В одном варианте осуществления оксидный носитель представляет собой Аl2О3 и СеO2. В случае оксидного носителя в виде Аl2О3 он может представлять собой, например, альфа-, гамма-, бета-, дельта- или тета-Аl2О3. В соответствии с одним вариантом осуществления оксидный носитель представляет собой La-стабилизированный Аl2О3 и Zr-стабилизированный СеO2. В еще одном варианте осуществления носитель содержит 20% (мол.) La-стабилизированного Аl2О3 и 80% (мол.) Zr-стабилизированного СеO2. В соответствии с еще одним вариантом осуществления носитель содержит Се и Zr, присутствующие с молярным соотношением, равным приблизительно 1:1. Например, в смешанном Zr-стабилизированном СеO2 будут присутствовать приблизительно 50% Се и приблизительно 50% Zr. Говоря более конкретно, носитель может содержать Се и Zr с молярным соотношением, в точности равным 1:1.
При получении композиции катализатора, содержащей, по меньшей мере, один промотор на основе неблагородного металла и, по меньшей мере, один катализатор на основе неблагородного металла, нанесенные на оксидный носитель, может быть использован следующий далее способ. Может быть получен «washcoat». Носитель в виде оксидного материала носителя может быть, а может и не быть размолот. В случае размалывания оксидный материал носителя может быть размолот до размера частиц, меньшего чем приблизительно 20 мкм или, говоря более конкретно, находящегося в диапазоне менее чем 15 мкм. Оксидный материал носителя может быть получен в виде суспензии при использовании воды. «Washcoat» может быть нанесен на подложку, например, при использовании нескольких проходов или нанесении нескольких покрытий. После этого носитель может быть импрегнирован водным раствором, по меньшей мере, одного катализатора на основе неблагородного металла, например меди, и, по меньшей мере, одного промотора на основе неблагородного металла, например марганца. Водный раствор может включать нитрат меди и нитрат марганца. В альтернативном варианте, соль, такая как соль марганца или соль меди, может быть добавлена непосредственно в «washcoat» до нанесения.
Один выгодный аспект настоящего изобретения заключается в возможности эффективного функционирования катализатора в отсутствие драгоценных металлов, а в определенных вариантах осуществления в возможности еще более эффективного функционирования в сопоставлении с тем, что имеет место для обычных катализаторов, содержащих драгоценные металлы. В соответствии с этим, композиция катализатора может не содержать металлов платиновой группы (МПГ). Например, катализаторы на основе Сu в вариантах осуществления настоящего изобретения продемонстрировали на удивление эффективную конверсию СО и ЛОС без использования каких-либо металлов платиновой группы. Собственно говоря, в определенных вариантах осуществления катализаторы на основе Сu демонстрируют лучшую активность и лучшую долговечность в сопоставлении с катализаторами на основе МПГ. Как можно сказать при обращении теперь к фигурам 1а и 1b, для катализаторов на основе меди продемонстрировали наличие превосходной активности в сопоставлении с тем, что имеет место для коммерческого катализатора на основе платины/палладия. Данное уменьшение количества драгоценного металла в катализаторе должно в результате приводить к значительной экономии затрат при получении композиций катализаторов.
В соответствии с еще одним вариантом осуществления композиция катализатора окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) содержит, по меньшей мере, один промотор на основе неблагородного металла и, по меньшей мере, один катализатор на основе неблагородного метала, нанесенные на оксидный носитель, включающий один или несколько материалов, выбранных из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана. В соответствии с еще одним вариантом осуществления композиция катализатора окисления монооксида углерода (СО) и летучих органических соединений (ЛОС) по существу состоит из, по меньшей мере, одного промотора на основе неблагородного металла и, по меньшей мере, одного катализатора на основе неблагородного металла, нанесенных на оксидный носитель, включающий один или несколько материалов, выбранных из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана. Термин «по существу состоящий из» обозначает исключение определенных других незаявленных заменителей, таких как металлы платиновой группы.
Композиция катализатора может быть нанесена на материал по существу инертной подложки, как это в общем случае известно на современном уровне техники. Подложка может иметь любую в общем случае подходящую форму. Например, подложка может включать проточный монолит, такой как керамическая или сотовая структура, или подложка может иметь форму пеноматериалов, или подложка может иметь форму гранул, частиц псевдоожиженного слоя или может включать частицы, такие как сферы или короткие экструдированные сегменты. Катализатор может быть нанесен в виде покрытия на подложки, или катализаторы могут быть экструдированы с образованием самонесущих гранул или бисерин. Как известно на современном уровне техники, катализатор, например гранулированный катализатор, может быть пополнен и заменен по мере надобности и по мере использования.
Настоящее изобретение предлагает композицию катализатора окисления, например, выбросов СО, углеводородов, галогенуглеродов и ЛОС, зачастую производимых в широком ассортименте промышленных и коммерческих процессов. Катализатор может быть размещен в надлежащем устройстве окисления, в котором можно регулировать температуры и расходы. По мере вхождения отходящего потока, содержащего, например, воду, СО и ЛОС, в контакт с катализатором компоненты отходящего потока в общем случае претерпевают конверсию в CO2, H2O, а для галогенуглеродов в галогенкислоту или газообразный галоген.
Необходимо понимать, что композиции катализаторов могут быть использованы в широком диапазоне температур, обычно встречающихся в отработанных газах промышленных, коммерческих или энергогенерирующих процессов. Катализатор, оксидные материалы носителей и носитель должны быть стабильными в данном широком диапазоне температур, а говоря конкретно, при высоких температурах газа. Как обсуждалось выше, композиция также должна быть стабильной и способной эффективно функционировать в газе, содержащем водяные пары. Композиции катализаторов настоящего изобретения способны противостоять воздействию окружения и эффективно работать в данных средах, например тех, которые обычно встречаются в хвостовых газах способа получения ОТК.
Как также было продемонстрировано, композиции, соответствующие вариантам осуществления настоящего изобретения, являются чрезвычайно долговечными даже по истечении недель старения. Старение может включать, например, продолжительное воздействие высоких температур, влаги и воздействие соединений ЛОС. Одна представительная среда старения может включать температуру, равную приблизительно 500°С, при уровне влагосодержания, равном приблизительно 1,5% (мол.), и 100 ч./млн метилбромида. Катализатор может подвергаться старению в течение периода времени продолжительностью от 2 недель вплоть до 35 недель. Как можно сказать при обращении опять-таки к фигурам 1а и 1b, очевидно то, что катализаторы на основе Сu в вариантах осуществления настоящего изобретения являлись более активными, чем сопоставимые катализаторы на основе МПГ, даже после значительного старения.
Примеры
Несмотря на иллюстрацию и описание изобретения в настоящем документе при обращении к конкретным вариантам осуществления изобретение не предполагает ограничения продемонстрированными деталями. Вместо этого в объеме и диапазоне эквивалентов формулы изобретения и без отклонения от изобретения в детали могут быть внесены различные модификации.
Пример 1
Оксид - оксид алюминия - размалывали до номинального размера частиц, меньшего чем 15 микронов, для получения суспензии. Суспензию в виде «washcoat» наносили на керамическую монолитную подложку, имеющую 400 ячеек на один квадратный дюйм до достижения загрузки 2,75 грамма на один кубический дюйм подложки. Блок высушивали при 60°С и прокаливали при 500°С. После этого блок импрегнировали смесью водного раствора нитрата Си и нитрата Мn. Целевые загрузки составляли 0,22 грамма СuО и 0,45 грамма МnО на один кубический дюйм подложки. Блок высушивали при 60°С и прокаливали при 500°С в течение 2 часов.
Пример 2
La-стабилизированный оксид алюминия и смешанный оксид CeZrO2 раздельно размалывали до номинального размера частиц <15 микронов для получения суспензий. Данные две суспензии перемешивали друг с другом для получения «washcoat», которая содержала 20% (мол.) La-стабилизированного оксида алюминия и 80% (мол.) смешанного оксида CeZrO2. «Washcoat» наносили в виде покрытия на керамическую монолитную подложку, имеющую 400 ячеек на один квадратный дюйм, до достижения загрузки 2,75 грамма на один кубический дюйм подложки. После высушивания и прокаливания блок импрегнировали при использовании Сu и Мn в соответствии с методиками, приведенными выше в примере 1.
Пример 3
Данный пример представлял собой то же самое, что и пример 2, за исключением использования вместо смешанного оксида CeZrO2 смешанного оксида TiZrO2.
Пример 4
Данный пример представлял собой то же самое, что и пример 2, за исключением использования вместо смешанного оксида CeZrO2 смешанного оксида TiSiO2.
Пример 5
Данный пример представлял собой то же самое, что и пример 2, за исключением использования вместо смешанного оксида CeZrO2 смешанного оксида TiAlOx.
Пример 6
В данном варианте осуществления первый оксид - La-стабилизированный оксид алюминия - размалывали до номинального размера частиц <15 микронов. До номинального размера частиц <15 микронов отдельно размалывали и второй оксид - смешанный оксид CeZrO2. Раздельно размолотые оксиды перемешивали и суспендировали. Добавляли и перемешивали кристаллы ацетата Мn вплоть до их полного растворения для получения однородного «washcoat». Конечный «washcoat» содержал 17% (мол.) La-стабилизированного оксида алюминия, 69% (мол.) смешанного оксида CeZrO2 и 14% (мол.) MnO. «Washcoat» наносили на монолитные подложки, имеющие 400 ячеек на один квадратный дюйм до достижения загрузки 3,20 грамма на один кубический дюйм подложки. Блок высушивали при 60°С и прокаливали при 500°С. После этого блок импрегнировали водным раствором нитрата Сu до достижения загрузки Сu 0,22 грамма СuО на один кубический дюйм подложки. Блок высушивали при 60°С и прокаливали при 500°С в течение 2 часов.
Пример 7
В данном варианте осуществления первый оксид - La-стабилизированный оксид алюминия - размалывали до номинального размера частиц <15 микронов. До номинального размера частиц <15 микронов отдельно размалывали и второй оксид - смешанный оксид CeZrO2. Раздельно размолотые оксиды перемешивали и суспендировали. Добавляли и перемешивали кристаллы ацетата Мn вплоть до их полного растворения для получения однородного «washcoat». После этого к вышеупомянутой суспензии добавляли и перемешивали кристаллы ацетата Сu вплоть до их полного растворения для получения однородного «washcoat». Конечный «washcoat» содержал 16% (мол.) La-стабилизированного оксида алюминия, 64% (мол.) смешанного оксида CeZrO2, 13% (мол.) МnО и 7% (мол.) CuO. «Washcoat» наносили на монолитные подложки, имеющие 400 ячеек на один квадратный дюйм, до достижения загрузки 3,42 грамма на один кубический дюйм подложки. Блок высушивали при 60°С и прокаливали при 500°С в течение 2 часов.
Пример 8
Как можно сказать при обращении теперь к фигурам 1а и 1b, получали катализатор на основе Cu, содержащий Cu нанесенную на носитель в виде Аl2О3 и оксидов CeZrO2 и промотированную с использованием Мn, подобно примеру 2 или примеру 6. Композиция не содержала металлов платиновой группы. В качестве сравнительного примера использовали коммерческий катализатор Pt50Pd30 (Pt 50 г/фут3 и Pd 30 г/фут3) (50:30:0/80). Количественные соотношения представляют собой Pt:Pd:Rh, а значение после соотношения представляет собой совокупную загрузку металла МПГ в г/фут-3.
Фигуры 1а и 1b иллюстрируют процентную величину конверсии метилбромида и конверсии бензола, соответственно, для температур и условий на выходе, моделирующих хвостовые газы способа получения ОТК, для катализатора на основе меди в сопоставлении с катализатором на основе металла платиновой группы.
Условия испытания моделировали условия в хвостовых газах способа получения ОТК, где часовая объемная скорость газа (ЧОСГ) равнялась 25000 час-1, падение давления равнялось 150 фунт/дюйм2 (изб.) и газовая смесь содержала 30 ч./млн метилбромида, 10 ч./млн бензола, 100 ч./млн метана, 1000 ч./млн СО, 500 ч./млн метилацетата, 1,5% (мол.) Н2О, 4,0% (мол.) O2 и N2 в качестве баланса. Условия старения представляли собой 550°С при 1,5% (мол.) воды, 100 ч./млн метилбромида и воздух в качестве баланса в течение 2 недель, 34 недель и 35 недель, соответственно, как это указывается на фигурах 1а и 1b.
Как ясно продемонстрировано на фигурах 1а и 1b, катализатор на основе Сu продемонстрировал превосходную активность в сопоставлении с коммерческим катализатором Pt50Pd30 как в случае более новых катализаторов (старение в течение 2 недель), так и по истечении продолжительного периода старения (старение в течение 34 или 35 недель). В соответствии с этим, композиции, по-видимому, являются чрезвычайно долговечными и сохраняют свою активность даже по истечении недель старения.
Пример 9
Как можно сказать при обращении теперь к фигурам 2а, 2b и 2с, получали катализатор на основе Сu, содержащий Сu, нанесенную на носитель в виде Аl2О3 индивидуально или совместно с другими указанными оксидами и промотированную с использованием Мn. Данные катализаторы на основе Сu не содержали металлов платиновой группы. Фигуры 2а, 2b и 2с иллюстрируют процентную величину конверсии метилбромида, конверсии бензола и конверсии СО, соответственно, для температур и условий, моделирующих хвостовые газы способа получения ОТК, для различных материалов носителей. Материалы носителей включали (1) один только Аl2О3; (2) 20% (мол.) Аl2O3+80% (мол.) смешанного оксида CeZrO2; (3) 20% (мол.) Аl2О3+80% (мол.) смешанного оксида TiZrO2; (4) 20% (мол.) Аl2О3+80% (мол.) смешанного оксида TiSiO2 и (5) 20% (мол.) Аl2О3+80% (мол.) смешанного оксида TiAlOx.
Условия испытания моделировали условия в хвостовых газах способа получения ОТК, где значение ЧОСГ равнялось 25000 час-1, падение давления равнялось 150 фунт/дюйм2 (изб.) и газовая смесь содержала 30 ч./млн метилбромида, 10 ч./млн бензола, 100 ч./млн метана, 1000 ч./млн СО, 500 ч./млн метилацетата, 1,5% (мол.) Н2О, 4,0% (мол.) O2 и N2 в качестве баланса. Условия старения представляли собой 550°С при 1,5% (мол.) воды, 100 ч./млн метилбромида и воздух в качестве баланса в течение 2 недель.
Как можно ясно видеть на фигурах 2а, 2b и 2с, все идентифицированные оксиды продемонстрировали хорошую каталитическую активность катализатора Сu:Мn, нанесенного на носители в виде оксидов. В соответствии с этим, катализаторы Сu:Мn, нанесенные на оксидные носители, являются эффективными в широком диапазоне температур. Также очевидно и то, что каталитическая активность катализатора Сu:Мn, нанесенного на носитель Аl2О3+CeZrO2, характеризовала наиболее активный катализатор.
Пример 10
Как можно сказать при обращении теперь к фигуре 3, получали катализатор на основе Сu, содержащий Сu, нанесенную на носитель в виде Аl2О3 и оксидов CeZrO2 и промотированную с использованием Мn. Катализатор на основе Сu не содержал металлов платиновой группы. В качестве сравнительного примера использовали коммерческий катализатор на основе платины. Фигура 3 иллюстрирует процентную величину конверсии метанола в зависимости от температур на выходе для катализатора на основе меди в сопоставлении с катализатором на основе металла платиновой группы.
На фигуре 3 условия испытания включали значение ЧОСГ, равное 50000 час-1, и газовая смесь содержала 1000 ч./млн метанола, 1000 ч./млн СО, 5% (мол.) Н2О, 15% (мол.) O2 и N2 в качестве баланса. Как ясно продемонстрировано на фигуре 3, в случае достижения температурой 300°С катализатор Сu:Мn может обеспечить достижение 100%-ной конверсии метанола.
Пример 11
Как можно сказать при обращении теперь к фигуре 4, получали катализатор на основе Сu, содержащий Сu, нанесенную на носитель в виде Аl2О3 и оксидов CeZrO2 и промотированную с использованием Мn. Катализатор на основе Сu не содержал металлов платиновой группы. В качестве сравнительного примера использовали коммерческий катализатор на основе платины. Фигура 4 иллюстрирует процентную величину конверсии метилэтилкетона (МЭК) в зависимости от температур на выходе для катализатора на основе меди в сопоставлении с катализатором на основе металла платиновой группы.
На фигуре 4 условия испытания включали значение ЧОСГ, равное 50000 час-1, и газовая смесь содержала 250 ч./млн метилэтилкетона, 1000 ч./млн СО, 5% (мол.) Н2O, 15% (мол.) O2 и N2 в качестве баланса. Как можно видеть на фигуре 4, в случае достижения температурой 300°С катализатор Сu:Мn будет сопоставимым с эталонным катализатором на основе платины, поскольку оба обеспечивали достижение приблизительно 100%-ной конверсии МЭК. В соответствии с этим, катализаторы на основе Сu настоящего изобретения продемонстрировали на удивление эффективную конверсию МЭК без использования каких-либо металлов платиновой группы.
Пример 12
Как можно сказать при обращении теперь к фигуре 5, получали катализатор на основе Сu, содержащий Сu, нанесенную на носитель в виде Аl2О3 и оксидов CeZrO2 и промотированную с использованием Мn. Катализатор на основе Сu не содержал металлов платиновой группы. В качестве сравнительного примера использовали коммерческий катализатор на основе платины. Фигура 5 иллюстрирует процентную величину конверсии бутана для катализатора на основе меди в сопоставлении с катализатором на основе металла платиновой группы.
На фигуре 5 условия испытания включали значение ЧОСГ, равное 50000 час-1, и газовая смесь содержала 250 ч./млн бутана, 1000 ч./млн СО, 5% (мол.) Н2О, 15% (мол.) O2 и N2 в качестве баланса. Как продемонстрировано на фигуре 5, катализатор Сu:Мn обнаружил эксплуатационные характеристики, сопоставимые с тем, что имеет место для катализатора на основе платины. В соответствии этим, по меньшей мере, один катализатор на основе неблагородного металла, например катализаторы на основе Сu, настоящего изобретения продемонстрировал эффективную конверсию бутана без использования каких-либо металлов платиновой группы.
Пример 13
Как можно сказать при обращении теперь к фигуре 6, получали катализатор на основе Сu, содержащий Сu, нанесенную на носитель в виде Аl2O3 и оксидов CeZrO2 и промотированную с использованием Мn. Катализатор на основе Сu не содержал никаких металлов платиновой группы. В качестве сравнительного примера использовали коммерческий катализатор на основе платины. Фигура 6 иллюстрирует процентную величину конверсии бутена для катализатора на основе меди в сопоставлении с катализатором на основе металла платиновой группы.
На фигуре 6 условия испытания включали значение ЧОСГ, равное 50000 час-1, и газовая смесь содержала 250 ч./млн бутена, 1000 ч./млн СО, 5% (мол.) Н2О, 15% (мол.) О2 и N2 в качестве баланса. Как можно видеть на фигуре 6, катализатор Сu:Мn не демонстрировал таких эффективных эксплуатационных характеристик, как катализатор на основе платины, но он сохранял хорошую активность по обеспечению конверсии бутена при повышенных температурах, в особенности, выше 300°С.
Пример 14
Данный пример представлял собой то же самое, что и пример 2, за исключением использования в каждом случае вместо нитрата меди нитрата железа, нитрата кобальта или нитрата никеля. В частности, La-стабилизированный оксид алюминия и смешанный оксид CeZrO2 раздельно размалывали до номинального размера частиц <15 микронов для получения суспензий. Данные две суспензии перемешивали друг с другом для получения «washcoat», который содержал 20% (мол.) La-стабилизированного оксида алюминия и 80% (мол.) смешанного оксида CeZrO2. «Washcoat» наносили в виде покрытия на керамическую монолитную подложку, имеющую 400 ячеек на один квадратный дюйм до достижения загрузки 2,75 грамма на один кубический дюйм подложки. После высушивания и прокаливания блока блок импрегнировали смесью водного раствора нитрата Сu (или при его замещении нитрата Fe, нитрата Со или нитрата Ni, соответственно) и нитрата Мn в соответствии с методиками, перечисленными выше в примере 1.
Как можно сказать при обращении теперь к фигурам 7а и 7b, фигура 7а иллюстрирует процентную величину конверсии метилбромида для катализаторов, включающих промотор на основе неблагородного металла и катализатор на основе неблагородного металла в виде меди, железа, кобальта или никеля, соответственно. Фигура 7b иллюстрирует процентную величину конверсии бензола для катализаторов, включающих промотор на основе неблагородного металла и катализатор на основе неблагородного металла в виде меди, железа, кобальта или никеля, соответственно. В то время как катализатор на основе меди с очевидностью продемонстрировал наилучшую активность при обеспечении конверсии метилбромида и бензола, катализаторы на основе железа, кобальта и никеля также сохраняют хорошую активность при обеспечении конверсии метилбромида и бензола.
Несмотря на демонстрацию и описание в настоящем документе предпочтительных вариантов осуществления изобретения необходимо понимать то, что такие варианты осуществления представлены только в качестве примера. Для специалистов в соответствующей области техники будут очевидными и многочисленные вариации, изменения и замещения без отклонения от сущности изобретения. В соответствии с этим, предполагается то, что прилагаемая формула изобретения включает все такие вариации, которые соответствуют сущности и объему изобретения.
Claims (13)
1. Способ окисления монооксида углерода (СО) и летучих органических соединений (ЛОС), включающий стадию:
введения хвостовых газов способа получения очищенной терефталевой кислоты, содержащих водяные пары и указанные СО и ЛОС, в контакт с композицией катализатора, содержащей по меньшей мере один промотор на основе неблагородного металла и по меньшей мере один катализатор на основе неблагородного металла, нанесенные на оксидный носитель, включающий один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана, причем указанная композиция катализатора по существу не содержит металлов платиновой группы, а указанные соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена, при этом по меньшей мере один катализатор на основе неблагородного металла выбирают из группы, состоящей из меди (Cu), железа (Fe), кобальта (Co), никеля (Ni) и хрома (Cr), а по меньшей мере один промотор катализатора на основе неблагородного металла выбирают из группы, состоящей из неодима (Nd), бария (Ba), церия (Ce), лантана (La), празеодима (Pr), магния (Mg), кальция (Ca), марганца (Mn), цинка (Zn), ниобия (Nb), циркония (Zr), молибдена (Mo), олова (Sn), тантала (Ta) и стронция (Sr).
введения хвостовых газов способа получения очищенной терефталевой кислоты, содержащих водяные пары и указанные СО и ЛОС, в контакт с композицией катализатора, содержащей по меньшей мере один промотор на основе неблагородного металла и по меньшей мере один катализатор на основе неблагородного металла, нанесенные на оксидный носитель, включающий один или несколько материалов, выбираемых из оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана, причем указанная композиция катализатора по существу не содержит металлов платиновой группы, а указанные соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена, при этом по меньшей мере один катализатор на основе неблагородного металла выбирают из группы, состоящей из меди (Cu), железа (Fe), кобальта (Co), никеля (Ni) и хрома (Cr), а по меньшей мере один промотор катализатора на основе неблагородного металла выбирают из группы, состоящей из неодима (Nd), бария (Ba), церия (Ce), лантана (La), празеодима (Pr), магния (Mg), кальция (Ca), марганца (Mn), цинка (Zn), ниобия (Nb), циркония (Zr), молибдена (Mo), олова (Sn), тантала (Ta) и стронция (Sr).
2. Способ по п.1, в котором по меньшей мере один промотор катализатора на основе неблагородного металла представляет собой Mn.
3. Способ по п.2, в котором по меньшей мере один катализатор на основе неблагородного металла представляет собой медь.
4. Способ по п.1, в котором указанный оксидный носитель представляет собой смешанный оксид в виде оксида алюминия и стабилизированного цирконием диоксида церия.
5. Способ по п.4, в котором указанный оксид алюминия представляет собой стабилизированный лантаном (La) оксид алюминия.
6. Способ окисления монооксида углерода (СО) и летучих органических соединений (ЛОС), включающий стадию:
введения газа, содержащего водяные пары и указанные СО и ЛОС, в контакт с композицией катализатора, нанесенной на оксидный носитель, которая состоит из по меньшей мере одного промотора на основе неблагородного металла, выбираемого из группы, состоящей из неодима (Nd), бария (Ba), церия (Ce), лантана (La), празеодима (Pr), магния (Mg), кальция (Ca), марганца (Mn), цинка (Zn), ниобия (Nb), циркония (Zr), молибдена (Mo), олова (Sn), тантала (Ta) и стронция (Sr), и по меньшей мере одного катализатора на основе неблагородного металла, выбираемого из группы, состоящей из меди (Cu) и железа (Fe), причем указанный оксидный носитель включает один или несколько материалов, выбираемых из стабилизированных оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана, при этом стабилизатор выбран из циркония, лантана, алюминия, иттрия, празеодима, неодима, их оксидов, композитных оксидов или смешанных оксидов любых двух или более из них или по меньшей мере одного щелочноземельного металла, а указанные соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена.
введения газа, содержащего водяные пары и указанные СО и ЛОС, в контакт с композицией катализатора, нанесенной на оксидный носитель, которая состоит из по меньшей мере одного промотора на основе неблагородного металла, выбираемого из группы, состоящей из неодима (Nd), бария (Ba), церия (Ce), лантана (La), празеодима (Pr), магния (Mg), кальция (Ca), марганца (Mn), цинка (Zn), ниобия (Nb), циркония (Zr), молибдена (Mo), олова (Sn), тантала (Ta) и стронция (Sr), и по меньшей мере одного катализатора на основе неблагородного металла, выбираемого из группы, состоящей из меди (Cu) и железа (Fe), причем указанный оксидный носитель включает один или несколько материалов, выбираемых из стабилизированных оксида алюминия, диоксида кремния, диоксида циркония, диоксида церия и диоксида титана, при этом стабилизатор выбран из циркония, лантана, алюминия, иттрия, празеодима, неодима, их оксидов, композитных оксидов или смешанных оксидов любых двух или более из них или по меньшей мере одного щелочноземельного металла, а указанные соединения ЛОС включают одно или несколько соединений, выбираемых из метилацетата, метана, метилбромида, бензола, метанола, метилэтилкетона, бутана и бутена.
7. Способ по п.6, в котором по меньшей мере один промотор на основе неблагородного металла содержит марганец.
8. Способ по п.7, в котором по меньшей мере один катализатор на основе неблагородного металла содержит медь.
9. Способ по п.7, в котором введение в контакт проводят при температуре в диапазоне от приблизительно 275°C до приблизительно 325°C.
10. Способ по п.7, в котором оксидный носитель содержит оксид алюминия и стабилизированный цирконием диоксид церия.
11. Способ по п.7, в котором оксид алюминия представляет собой стабилизированный лантаном оксид алюминия.
12. Каталитическое изделие для окисления монооксида углерода (СО) и летучих органических соединений (ЛОС), включающее композицию катализатора, нанесенную на оксидный носитель, которая состоит из по меньшей мере одного катализатора на основе неблагородного металла, выбранного из группы, состоящей из меди (Cu), железа (Fe), кобальта (Co) и никеля (Ni), и промотора на основе неблагородного металла, содержащего марганец (Mn), причем указанный оксидный носитель содержит смешанный оксид в виде оксида алюминия и стабилизированного цирконием диоксида церия.
13. Каталитическое изделие по п.12, в котором катализатор на основе неблагородного металла представляет собой медь.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/427,375 | 2009-04-21 | ||
| US12/427,375 US10792647B2 (en) | 2009-04-21 | 2009-04-21 | Base metal catalysts for the oxidation of carbon monoxide and volatile organic compounds |
| PCT/US2010/031036 WO2010123731A1 (en) | 2009-04-21 | 2010-04-14 | Copper and manganese containing base metal catalysts for the oxidation of carbon monoxide and volatile organic compounds |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011147128A RU2011147128A (ru) | 2013-05-27 |
| RU2532549C2 true RU2532549C2 (ru) | 2014-11-10 |
Family
ID=42728775
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011147128/04A RU2532549C2 (ru) | 2009-04-21 | 2010-04-14 | Медь- и марганецсодержащие катализаторы на основе неблагородных металлов для окисления монооксида углерода и летучих органических соединений |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US10792647B2 (ru) |
| EP (1) | EP2421646B1 (ru) |
| JP (3) | JP6383521B2 (ru) |
| KR (2) | KR20120007538A (ru) |
| CN (2) | CN102458655A (ru) |
| BR (1) | BRPI1013413B1 (ru) |
| ES (1) | ES2764483T3 (ru) |
| PL (1) | PL2421646T3 (ru) |
| PT (1) | PT2421646T (ru) |
| RU (1) | RU2532549C2 (ru) |
| TW (1) | TWI607981B (ru) |
| WO (1) | WO2010123731A1 (ru) |
Families Citing this family (58)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101816706B1 (ko) | 2010-03-17 | 2018-02-21 | 삼성전자주식회사 | 다공성 산화물 촉매 및 그의 제조방법 |
| US20120141351A1 (en) * | 2010-12-02 | 2012-06-07 | General Electric Company | Controlling the emission of volatile organic compounds from equipment for reclaiming oils |
| US20130004903A1 (en) * | 2011-06-28 | 2013-01-03 | Conocophillips Company | Combustion of Volatile Organic Compounds to CO2 and H2O with Low NOx Formation |
| KR101380193B1 (ko) * | 2012-02-03 | 2014-04-03 | 주식회사 이에스티 | 악취 및 휘발성 유기화합물 분해 제거용 촉매 및 그 제조방법 |
| CN103252242B (zh) * | 2012-02-16 | 2015-04-01 | 中国石油化工股份有限公司 | 一种pta尾气催化燃烧非贵金属催化剂及制备方法 |
| US8668890B2 (en) * | 2012-04-26 | 2014-03-11 | Basf Corporation | Base metal catalyst composition and methods of treating exhaust from a motorcycle |
| US8765085B2 (en) * | 2012-04-26 | 2014-07-01 | Basf Corporation | Base metal catalyst and method of using same |
| TWI448328B (zh) * | 2012-10-12 | 2014-08-11 | China Steel Corp | 脫除揮發性有機化合物的板狀觸媒及其製造方法暨應用 |
| US10350581B2 (en) * | 2012-12-27 | 2019-07-16 | Mitsui Mining & Smelting Co., Ltd. | Catalyst composition for exhaust gas purification and catalyst for exhaust gas purification |
| US20140255284A1 (en) * | 2013-03-08 | 2014-09-11 | Basf Corporation | Base Metal Catalyst And Method Of Using Same |
| US20140274662A1 (en) | 2013-03-15 | 2014-09-18 | Cdti | Systems and Methods for Variations of ZPGM Oxidation Catalysts Compositions |
| US9216408B2 (en) | 2013-04-04 | 2015-12-22 | Clean Diesel Technologies, Inc. | System and method for two and three way mixed metal oxide ZPGM catalyst |
| US9511350B2 (en) | 2013-05-10 | 2016-12-06 | Clean Diesel Technologies, Inc. (Cdti) | ZPGM Diesel Oxidation Catalysts and methods of making and using same |
| US9216383B2 (en) | 2013-03-15 | 2015-12-22 | Clean Diesel Technologies, Inc. | System and method for two and three way ZPGM catalyst |
| US9259716B2 (en) | 2013-03-15 | 2016-02-16 | Clean Diesel Technologies, Inc. | Oxidation catalyst systems compositions and methods thereof |
| US9227177B2 (en) | 2013-03-15 | 2016-01-05 | Clean Diesel Technologies, Inc. | Coating process of Zero-PGM catalysts and methods thereof |
| US9511355B2 (en) | 2013-11-26 | 2016-12-06 | Clean Diesel Technologies, Inc. (Cdti) | System and methods for using synergized PGM as a three-way catalyst |
| US8858903B2 (en) | 2013-03-15 | 2014-10-14 | Clean Diesel Technology Inc | Methods for oxidation and two-way and three-way ZPGM catalyst systems and apparatus comprising same |
| CN104107700B (zh) * | 2013-04-16 | 2016-06-15 | 中国科学院兰州化学物理研究所 | 一种工业有机废气的燃烧催化剂及其制备方法 |
| US9545626B2 (en) | 2013-07-12 | 2017-01-17 | Clean Diesel Technologies, Inc. | Optimization of Zero-PGM washcoat and overcoat loadings on metallic substrate |
| US8853121B1 (en) | 2013-10-16 | 2014-10-07 | Clean Diesel Technology Inc. | Thermally stable compositions of OSM free of rare earth metals |
| US9511358B2 (en) | 2013-11-26 | 2016-12-06 | Clean Diesel Technologies, Inc. | Spinel compositions and applications thereof |
| DE102015209987A1 (de) * | 2014-06-04 | 2015-12-10 | Johnson Matthey Public Limited Company | Nicht-PGM-Ammoniakschlupfkatalysator |
| CN104162440B (zh) * | 2014-08-04 | 2018-06-05 | 南昌大学 | 一种铜锰锡复合氧化物co氧化催化剂制备方法 |
| WO2016069856A1 (en) * | 2014-10-30 | 2016-05-06 | Basf Corporation | Base metal catalyst for treatment of ozone and volatile organic compounds present in air supply |
| EP3193165A1 (de) | 2016-01-18 | 2017-07-19 | C. Gerhardt GmbH & Co. KG | Verfahren zur elementaranalyse |
| CN106111154A (zh) * | 2016-06-20 | 2016-11-16 | 浙江大学 | 用于降解VOCs的四元复合氧化物型催化剂及其制备方法 |
| US10569256B2 (en) | 2017-02-14 | 2020-02-25 | Clariant Corporation | Low cost oxidation catalysts for VOC and halogenated VOC emission control |
| CN107233893B (zh) * | 2017-06-27 | 2020-09-01 | 包头稀土研究院 | 燃气热水器用非贵金属co催化净化材料及其制备方法 |
| CN107694509B (zh) * | 2017-10-24 | 2020-09-04 | 苏州金宏气体股份有限公司 | 一种去除八氟环丁烷中的六氟丙烯的吸附剂及其制备方法 |
| CN107817281B (zh) * | 2017-12-01 | 2020-04-10 | 无锡市尚沃医疗电子股份有限公司 | 一种用于呼气检测的no电化学传感器 |
| CN108144624A (zh) * | 2018-01-03 | 2018-06-12 | 上海盛剑环境系统科技有限公司 | 一种用于VOCs催化燃烧的催化剂及其制备方法 |
| CN108906046A (zh) * | 2018-07-17 | 2018-11-30 | 无锡威孚环保催化剂有限公司 | 一种精制对苯二甲酸尾气净化催化剂及制备方法 |
| CN109513447B (zh) * | 2018-08-01 | 2021-10-22 | 沈炳龙 | 一种脱一氧化碳催化剂及其制备方法 |
| CN108940296B (zh) * | 2018-08-02 | 2021-04-30 | 沈炳龙 | Co-Mo-Ni/TiO2-Al2O3催化剂在脱除CO中的应用 |
| CN109092304B (zh) * | 2018-08-07 | 2021-11-26 | 广东工业大学 | 一种Pt基催化剂及其制备方法和应用 |
| CN111054355B (zh) * | 2018-10-16 | 2022-10-11 | 中国石油化工股份有限公司 | 用于催化燃烧处理pta尾气的整体式非贵金属催化剂 |
| CN111054360B (zh) * | 2018-10-16 | 2023-01-24 | 中国石油化工股份有限公司 | 用于催化燃烧处理pta尾气的催化剂 |
| CN111054359B (zh) * | 2018-10-16 | 2022-08-12 | 中国石油化工股份有限公司 | 用于pta装置氧化尾气处理的催化剂及其用途 |
| CN111054368B (zh) * | 2018-10-16 | 2022-07-12 | 中国石油化工股份有限公司 | 用于pta装置氧化尾气处理的整体式非贵金属催化剂及用途 |
| CN111054374A (zh) * | 2018-10-16 | 2020-04-24 | 中国石油化工股份有限公司 | Pta氧化尾气的催化燃烧催化剂及其用途 |
| CN111054352B (zh) * | 2018-10-16 | 2022-07-12 | 中国石油化工股份有限公司 | 用于pta氧化尾气净化的整体式非贵金属催化剂及其制备方法 |
| CN109201028A (zh) * | 2018-11-02 | 2019-01-15 | 李其忠 | 降解化工染料行业VOCs废气的催化剂及其制备方法 |
| CN109201077A (zh) * | 2018-11-02 | 2019-01-15 | 李其忠 | 降解制药行业VOCs废气的催化剂及其制备方法 |
| CN109513445B (zh) * | 2018-11-08 | 2022-05-13 | 中国科学院工程热物理研究所 | 三元金属氧化物薄膜催化剂及其制备方法 |
| CN110898834B (zh) * | 2019-11-29 | 2022-08-12 | 金华铂锐催化科技有限公司 | 一种用于消除挥发性有机物的催化剂及其制备方法 |
| CN112058274B (zh) * | 2020-09-14 | 2021-07-13 | 山东大学 | 一种催化剂及制备方法与烟气co脱除-消白系统及方法 |
| CN114602536B (zh) * | 2020-12-03 | 2023-07-11 | 万华化学集团股份有限公司 | 一种催化剂的制备方法及降低聚醚多元醇中voc含量的方法 |
| CN112844459B (zh) * | 2021-02-04 | 2023-06-02 | 安徽省博广运环保科技有限公司 | 一种VOCs催化氧化催化剂及其制备方法和应用 |
| CN112958071B (zh) * | 2021-03-08 | 2023-08-15 | 上海睿筑环境科技有限公司 | 一种用于低温催化燃烧含氯挥发性有机物的高稳定催化剂及其制备方法 |
| CN113171774A (zh) * | 2021-04-26 | 2021-07-27 | 复旦大学 | 抗碱金属中毒的VOCs催化燃烧催化剂及其制备方法 |
| CN113198452B (zh) * | 2021-05-18 | 2022-08-12 | 贵州大学 | 一种金红石相固溶体脱硝催化剂及制备方法及应用 |
| CN113856455A (zh) * | 2021-08-25 | 2021-12-31 | 北京航空航天大学 | 再生铜烟气的净化方法及其净化装置 |
| CN117813147A (zh) | 2021-08-27 | 2024-04-02 | 庄信万丰股份有限公司 | 用于处理废气的方法和hvac系统 |
| CN114015152A (zh) * | 2021-11-01 | 2022-02-08 | 浙江嘉伟工艺品有限公司 | 一种降低室内VOCs的仿真植物材料 |
| CN114870855B (zh) * | 2022-05-24 | 2023-08-18 | 武汉丰泰威远科技有限公司 | 一种金属催化剂复合物及其制备方法 |
| CN114950469A (zh) * | 2022-06-16 | 2022-08-30 | 中晶环境科技股份有限公司 | 一氧化碳催化剂及其制备方法和用途 |
| CN114849731B (zh) * | 2022-06-21 | 2023-07-28 | 南京信息工程大学 | 一种菜花状LaMnO3-CuMnCeOx混复合氧化物催化剂、制备方法及其应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001045833A1 (en) * | 1999-12-20 | 2001-06-28 | Eltron Research, Inc. | CATALYSTS AND METHODS FOR LOW-TEMPERATURE DESTRUCTION OF VOCs IN AIR AND SELECTIVE REMOVAL OF CO |
| WO2003101612A2 (en) * | 2002-05-29 | 2003-12-11 | Johnson Matthey Public Limited Company | Catalyst for co and voc oxidation comprising alumina and ceria support |
| UA19718U (en) * | 2006-07-31 | 2006-12-15 | Round cellular rotor |
Family Cites Families (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3956189A (en) | 1972-02-14 | 1976-05-11 | Chemical Construction Corporation | Catalyst for treating combustion exhaust gas |
| US4059675A (en) * | 1976-05-24 | 1977-11-22 | Continental Oil Company | Decomposition of halogenated organic compounds |
| JPS5312768A (en) | 1976-07-23 | 1978-02-04 | Takeda Chem Ind Ltd | Removing method for organic compounds or carbon monoxide in exhaust gas |
| US4059677A (en) * | 1976-12-23 | 1977-11-22 | Ppg Industries, Inc. | Catalytic oxidation of C2 -C4 halogenated hydrocarbons |
| DE3045719A1 (de) * | 1980-12-04 | 1982-07-08 | Basf Ag, 6700 Ludwigshafen | Verfahren zur herstellung von cycloaliphatischen und/oder aromatischen aminen |
| AU559034B2 (en) | 1983-03-08 | 1987-02-19 | Uop | Catalyst for hydrogenation of alkynes |
| JPS60222145A (ja) | 1984-04-20 | 1985-11-06 | Hitachi Ltd | 耐熱性触媒の使用方法 |
| US4585752A (en) | 1984-08-15 | 1986-04-29 | W. R. Grace & Co. | Catalyst composition for ultra high temperature operation |
| AU595655B2 (en) * | 1986-11-04 | 1990-04-05 | Kabushiki Kaisha Toyota Chuo Kenkyusho | Catalyst for the purification of exhaust gas |
| DE3809226C2 (de) * | 1987-03-20 | 1994-10-27 | Toshiba Kawasaki Kk | Hochtemperatur-Verbrennungskatalysator und Verfahren zu seiner Herstellung |
| DE3740091A1 (de) | 1987-11-26 | 1989-06-15 | Paul J M Haufe | Filtermaterial |
| NL8800252A (nl) * | 1988-02-02 | 1989-09-01 | Veg Gasinstituut Nv | Katalysator op drager voor het niet-selectief oxyderen van organische verbindingen, werkwijze voor het niet-selectief oxyderen van, in het bijzonder, organische verbindingen. |
| DE3811038A1 (de) * | 1988-03-31 | 1989-10-12 | Ruhrchemie Ag | Verfahren zur herstellung nickel, aluminiumoxid und zirkondioxid enthaltender katalysatorzusammensetzungen |
| US5176897A (en) * | 1989-05-01 | 1993-01-05 | Allied-Signal Inc. | Catalytic destruction of organohalogen compounds |
| ATE110586T1 (de) | 1989-06-09 | 1994-09-15 | N E Chemcat Corp | Abgasreinigungskatalysator mit ausgezeichneter thermischer beständigkeit und verfahren zu seiner herstellung. |
| FR2652576B1 (fr) | 1989-10-04 | 1991-12-13 | Rhone Poulenc Chimie | Procede d'hydrogenation de derives halogeno nitroaromatiques en presence de catalyseurs a base de metaux nobles. |
| US5254519A (en) * | 1990-02-22 | 1993-10-19 | Engelhard Corporation | Catalyst composition containing platinum and rhodium components |
| US5457268A (en) | 1990-05-14 | 1995-10-10 | The University Of Akron | Selective oxidation catalysts for halogenated organics |
| DE69121711D1 (de) * | 1990-05-14 | 1996-10-02 | Univ Akron | Verfahren zum abbau halogenierter organischer substanzen |
| US5063193A (en) * | 1990-06-06 | 1991-11-05 | General Motors Corporation | Base metal automotive exhaust catalysts with improved activity and stability and method of making the catalysts |
| DE69231273T2 (de) | 1991-04-30 | 2001-03-15 | Nippon Catalytic Chem Ind | Verfahren zur Entsorgung einer organischen Halogenverbindung durch Oxidation |
| US5204309A (en) * | 1991-12-30 | 1993-04-20 | Tpct Chemicals, Inc. | Catalysts for neutralizing air and gaseous exhausts |
| CN1030285C (zh) | 1992-09-26 | 1995-11-22 | 中国石油化工总公司 | 非贵金属氧化物—氧化碳助燃剂及制备方法 |
| US5451388A (en) * | 1994-01-21 | 1995-09-19 | Engelhard Corporation | Catalytic method and device for controlling VOC. CO and halogenated organic emissions |
| JP3506767B2 (ja) | 1994-05-11 | 2004-03-15 | 日本化薬株式会社 | ハロゲン含有有機化合物の分解方法および触媒 |
| JP3508947B2 (ja) | 1994-05-30 | 2004-03-22 | 日本化薬株式会社 | ハロゲン含有有機化合物の分解方法および触媒 |
| US5578283A (en) * | 1994-12-30 | 1996-11-26 | Engelhard Corporation | Catalytic oxidation catalyst and method for controlling VOC, CO and halogenated organic emissions |
| JP3230427B2 (ja) * | 1995-01-05 | 2001-11-19 | 株式会社日本触媒 | 燻蒸排ガス浄化用触媒および燻蒸排ガスの浄化方法 |
| JPH08257362A (ja) | 1995-03-27 | 1996-10-08 | Mitsui Petrochem Ind Ltd | 芳香族カルボン酸の製造に際して生成する排ガスの処理方法 |
| KR100417938B1 (ko) * | 1995-06-06 | 2004-04-29 | 비피 코포레이션 노쓰 아메리카 인코포레이티드 | 휘발성화학물질방출을감소시키는방법 |
| JPH0947661A (ja) | 1995-08-04 | 1997-02-18 | Babcock Hitachi Kk | 排ガス浄化方法および浄化触媒 |
| CA2238034A1 (en) | 1995-11-17 | 1997-05-29 | Hydrocarbon Technologies, Inc. | Supported solid superacid catalysts and method for making them |
| JP3377676B2 (ja) * | 1996-04-05 | 2003-02-17 | ダイハツ工業株式会社 | 排ガス浄化用触媒 |
| US5948723A (en) | 1996-09-04 | 1999-09-07 | Engelhard Corporation | Layered catalyst composite |
| JPH10151348A (ja) | 1996-11-22 | 1998-06-09 | Toyota Central Res & Dev Lab Inc | 酸化触媒 |
| FR2765493B1 (fr) | 1997-07-04 | 1999-08-06 | Air Liquide | Procede et dispositif de traitement de flux gazeux par oxydation et/ou reduction catalytique |
| US5895636A (en) * | 1997-12-02 | 1999-04-20 | Engelhard Corporation | Catalytic compositions and methods for suppression of halogenation of organic compounds with oxidation products of halogenated organic compounds in gaseous emission streams |
| JPH11169728A (ja) | 1997-12-15 | 1999-06-29 | Toho Gas Co Ltd | メタン酸化触媒 |
| US6022825A (en) * | 1998-01-08 | 2000-02-08 | Johnson Matthey Public Limited Company | Thermally durable low H2 S three-way catalysts |
| JP2000167406A (ja) | 1998-01-30 | 2000-06-20 | Kobe Steel Ltd | 有機ハロゲン化合物除去剤および該除去剤を用いた排ガスの処理方法 |
| US6005143A (en) * | 1998-08-07 | 1999-12-21 | Air Products And Chemicals, Inc. | Use of a monolith catalyst for the hydrogenation of dinitrotoluene to toluenediamine |
| JP3648125B2 (ja) | 1999-06-25 | 2005-05-18 | 株式会社日本触媒 | 有機ハロゲン化合物の除去用触媒および有機ハロゲン化合物の除去方法 |
| KR20010067212A (ko) | 1999-09-24 | 2001-07-12 | 이마이 토모유키 | 유기할로겐 화합물 분해 촉매 |
| JP2002054427A (ja) | 2000-08-11 | 2002-02-20 | Toyota Central Res & Dev Lab Inc | 改質ガス添加制御装置及び改質ガス添加制御方法 |
| IT1319198B1 (it) * | 2000-10-11 | 2003-09-26 | Sued Chemie Mt Srl | Catalizzatori per ossidazione. |
| EP1199096A1 (en) | 2000-10-21 | 2002-04-24 | Degussa AG | Catalyst for destruction of CO, VOC, and halogenated organic emissions |
| KR100544693B1 (ko) | 2003-12-31 | 2006-01-23 | 주식회사 효성 | 휘발성 유기 화합물 및 일산화탄소 제거용 촉매 조성물 및이를 이용한 휘발성 유기 화합물의 산화제거 방법 |
| GB0420245D0 (en) * | 2004-09-13 | 2004-10-13 | Johnson Matthey Plc | Improvements in catalyst coatings |
| CA2583778A1 (en) * | 2004-10-14 | 2006-04-27 | Catalytic Solutions, Inc. | Platinum group metal-free catalysts for reducing the ignition temperature of particulates on a diesel particulate filter |
| CN100518894C (zh) | 2005-08-17 | 2009-07-29 | 中国石油化工股份有限公司 | 含有氯代甲烷工业废气的处理方法 |
| EP2040835A4 (en) * | 2006-06-12 | 2010-12-15 | Nanox Inc | PROCESS FOR OPTIMIZING THE CATALYTIC ACTIVITY OF A CATALYST BASED ON PEROVSKITE |
| JP2008119651A (ja) | 2006-11-15 | 2008-05-29 | Mitsubishi Heavy Ind Ltd | 窒素酸化物除去用の触媒、および排ガス処理方法 |
| DE102007037796A1 (de) | 2007-08-10 | 2009-02-12 | Süd-Chemie AG | Verfahren zur Entfernung von CO, H2 und/oder CH4 aus dem Anodenabgas einer Brennstoffzelle mit Mischoxidkatalysatoren umfassend Cu, Mn und gegebenenfalls mindestens ein Seltenerdmetall |
-
2009
- 2009-04-21 US US12/427,375 patent/US10792647B2/en active Active
-
2010
- 2010-04-14 PL PL10715413T patent/PL2421646T3/pl unknown
- 2010-04-14 CN CN2010800287270A patent/CN102458655A/zh active Pending
- 2010-04-14 CN CN201511031213.1A patent/CN105688657B/zh active Active
- 2010-04-14 KR KR1020117027264A patent/KR20120007538A/ko not_active Application Discontinuation
- 2010-04-14 WO PCT/US2010/031036 patent/WO2010123731A1/en active Application Filing
- 2010-04-14 KR KR1020187003758A patent/KR101959695B1/ko active IP Right Grant
- 2010-04-14 JP JP2012507261A patent/JP6383521B2/ja active Active
- 2010-04-14 RU RU2011147128/04A patent/RU2532549C2/ru active
- 2010-04-14 TW TW099111538A patent/TWI607981B/zh active
- 2010-04-14 BR BRPI1013413-1A patent/BRPI1013413B1/pt active IP Right Grant
- 2010-04-14 ES ES10715413T patent/ES2764483T3/es active Active
- 2010-04-14 EP EP10715413.0A patent/EP2421646B1/en active Active
- 2010-04-14 PT PT107154130T patent/PT2421646T/pt unknown
-
2016
- 2016-03-03 JP JP2016040996A patent/JP6571561B2/ja active Active
-
2019
- 2019-05-07 JP JP2019087331A patent/JP2019162629A/ja not_active Withdrawn
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001045833A1 (en) * | 1999-12-20 | 2001-06-28 | Eltron Research, Inc. | CATALYSTS AND METHODS FOR LOW-TEMPERATURE DESTRUCTION OF VOCs IN AIR AND SELECTIVE REMOVAL OF CO |
| WO2003101612A2 (en) * | 2002-05-29 | 2003-12-11 | Johnson Matthey Public Limited Company | Catalyst for co and voc oxidation comprising alumina and ceria support |
| UA19718U (en) * | 2006-07-31 | 2006-12-15 | Round cellular rotor |
Also Published As
| Publication number | Publication date |
|---|---|
| US10792647B2 (en) | 2020-10-06 |
| TW201041826A (en) | 2010-12-01 |
| BRPI1013413B1 (pt) | 2018-07-31 |
| JP2016175069A (ja) | 2016-10-06 |
| JP6571561B2 (ja) | 2019-09-04 |
| KR20180026534A (ko) | 2018-03-12 |
| KR101959695B1 (ko) | 2019-03-18 |
| ES2764483T3 (es) | 2020-06-03 |
| RU2011147128A (ru) | 2013-05-27 |
| PL2421646T3 (pl) | 2020-04-30 |
| WO2010123731A1 (en) | 2010-10-28 |
| CN105688657A (zh) | 2016-06-22 |
| EP2421646B1 (en) | 2019-10-23 |
| EP2421646A1 (en) | 2012-02-29 |
| TWI607981B (zh) | 2017-12-11 |
| CN105688657B (zh) | 2019-11-05 |
| BRPI1013413A2 (pt) | 2016-04-05 |
| KR20120007538A (ko) | 2012-01-20 |
| JP2012524658A (ja) | 2012-10-18 |
| US20100266473A1 (en) | 2010-10-21 |
| CN102458655A (zh) | 2012-05-16 |
| PT2421646T (pt) | 2020-01-30 |
| JP2019162629A (ja) | 2019-09-26 |
| JP6383521B2 (ja) | 2018-08-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2532549C2 (ru) | Медь- и марганецсодержащие катализаторы на основе неблагородных металлов для окисления монооксида углерода и летучих органических соединений | |
| US20200147592A1 (en) | Base Metal Catalyst and Method of Using Same | |
| JP4096176B2 (ja) | メタン含有排ガスの浄化用触媒およびメタン含有排ガスの浄化方法 | |
| TWI776842B (zh) | 用於voc(揮發性有機物)之低成本氧化催化劑及鹵化voc排放控制 | |
| US5061464A (en) | Oxidation process and catalyst for use therefor | |
| JP2012524658A5 (ru) | ||
| JP5030818B2 (ja) | 排ガス浄化用触媒および排ガス浄化方法 | |
| JPH08238430A (ja) | 酸化性化合物の化学量論過剰媒質中で窒素酸化物を分子状窒素に還元する触媒、その調製方法および使用 | |
| JP4901366B2 (ja) | 排ガス中のメタンの酸化除去用触媒および排ガス中のメタンの酸化除去方法 | |
| JP4025945B2 (ja) | メタン含有排ガスの浄化用触媒およびメタン含有排ガスの浄化方法 | |
| US11980868B2 (en) | Method for the treatment of an exhaust gas and an HVAC system | |
| JP4052866B2 (ja) | 排ガス中の炭化水素の酸化用触媒および排ガス中の炭化水素の酸化除去方法 | |
| CN117899860A (zh) | 一种贵金属涂层-载体催化剂、制备方法及其应用 |