RU2201217C2 - Таблетка с энтеросолюбильным покрытием и способ приготовления - Google Patents
Таблетка с энтеросолюбильным покрытием и способ приготовления Download PDFInfo
- Publication number
- RU2201217C2 RU2201217C2 RU2001104535/14A RU2001104535A RU2201217C2 RU 2201217 C2 RU2201217 C2 RU 2201217C2 RU 2001104535/14 A RU2001104535/14 A RU 2001104535/14A RU 2001104535 A RU2001104535 A RU 2001104535A RU 2201217 C2 RU2201217 C2 RU 2201217C2
- Authority
- RU
- Russia
- Prior art keywords
- pharmaceutical composition
- enteric coating
- composition according
- coating
- core
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7048—Compounds having saccharide radicals and heterocyclic rings having oxygen as a ring hetero atom, e.g. leucoglucosan, hesperidin, erythromycin, nystatin, digitoxin or digoxin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
- A61K9/2846—Poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4808—Preparations in capsules, e.g. of gelatin, of chocolate characterised by the form of the capsule or the structure of the filling; Capsules containing small tablets; Capsules with outer layer for immediate drug release
Abstract
Изобретение относится к медицине и касается таблетки с энтеросолюбильным покрытием и способа ее приготовления. Таблетка содержит лекарственное средство, чувствительное к низким значениям рН среды, ниже 3, такое как 2', 3'-дидезоксиинозин, энтеросолюбильное покрытие, полученное из сополимера метакриловой кислоты и пластификатора. Таблетки могут быть различного размера и могут приниматься перорально по отдельности или множество таблеток, достаточное для заданной дозы, может быть инкапсулировано в растворимой капсуле. Таблетки обладают превосходной устойчивостью к разрушению при рН ниже 3 и прекрасными свойствами по выделению лекарственного вещества при рН выше 4,5. 2 с. и 38 з.п. ф-лы, 4 табл.
Description
Изобретение относится к фармацевтической композиции в форме таблетки с энтеросолюбильньм покрытием, которая содержит неустойчивый в кислоте препарат с высокой лекарственной нагрузкой, такой как ddI, чувствительный к среде с рН менее 3, и которая включает энтеросолюбильное покрытие, такое как Eudragit L-30-D55 и пластификатор, не требующий подслоя (субпокрытия). Таблетки обладают превосходной устойчивостью к разрушению при рН менее 3, но прекрасными свойствами по выделению лекарственного вещества при рН выше 4,5. Также раскрывается новый способ приготовления указанной композиции.
Энтеросолюбильные покрытия много лет использовались для предотвращения высвобождения лекарственного вещества из перорально вводимых лекарственных форм. В зависимости от композиции и/или вязкости энтеросолюбильные покрытия устойчивы к желудочной кислоте в течение необходимого периода времени прежде, чем они начнут разрушаться, делая возможным медленное выделение лекарственного вещества в нижней части желудка или в верхней части тонкого кишечника. Примеры некоторых энтеросолюбильных покрытий даны в Патенте США 5225202, такие как пчелиный воск и глицеринмоностеарат; пчелиный воск, шеллак и целлюлоза; и цетиловый спирт, смола мастикового дерева и шеллак, а также шеллак и стеариновая кислота (Патент США 2809918); поливинилацетат и этилцеллюлоза (Патент США 3835221); и нейтральный сополимер эфиров полиметакриловой кислоты (Eudragit L30D) (F.W. Goodhart et al., Pharm. Tech., pp. 64-71, April 1984); сополимеры эфиров метакриловой кислоты и метилового эфира метакриловой кислоты (Эудрагиты, Eudragits), или нейтральный сополимер эфиров полиметакриловой кислоты, содержащий стеараты металлов (Mehta et al., Патенты США 4728512 и 4794001).
Большинство энтеросолюбильных полимеров начинает становиться растворимым при рН 5,5 и выше, причем максимальные скорости растворения достигаются при значениях рН выше 6,5.
Многие фармацевтические композиции, покрытые энтеросолюбильными оболочками и/или пролонгированного действия, и способы приготовления этих композиций описаны в технике. Композиции предыдущего уровня техники, однако, часто, помимо лекарственных веществ, содержат много дополнительных ингредиентов, таких как наполнители, агенты для буферизации, связующие и смазывающие вещества, которые добавляются для увеличения объема композиции и уменьшения количества активного лекарственного вещества, которое может содержаться в композиции. Процессы приготовления этих вышеуказанных фармацевтических композиций требуют множества длительных стадий, включая стадии нанесения подслоя (субпокрытия) и внешнего покрытия. Кроме того, многие из этих фармацевтических композиций предназначены для доставки в нижние области желудочно-кишечного тракта, т.е. в прямую кишку, в противоположность верхней части кишечника, т.е. двенадцатиперстной кишке тонкого кишечника.
В Патенте США 5225202 описаны фармацевтические композиции с энтеросолюбильными покрытиями, использующие покрытие из нейтрализованного полимера фталата гидроксипропилметилцеллюлозы (НРМСР). Описанные фармацевтические композиции содержат основу, дезинтегрант, один или более агентов для буферизации с целью обеспечения дополнительной защиты желудка, помимо энтеросолюбильного покрытия, а также энтеросолюбильное покрытие и пластификатор. Фармацевтическая композиция может также содержать один или более наполнителей - лактозу, сахар или крахмал. Согласно изобретению, охватываемому данной ссылкой, когда основу - ядро - составляет лекарственное вещество, не совместимое со слоем энтеросолюбильного покрытия, тогда для предотвращения взаимодействия неустойчивого в кислоте лекарственного вещества и кислым энтеросолюбильным покрытием используют дополнительный подслой, который ведет себя как физический барьер между ядром и внешним слоем энтеросолюбильной оболочки. Процесс растворения энтеросолюбильной оболочки из НРМСР начинается при рН 5,0. Способ приготовления такой фармацевтической композиции требует многостадийного процесса покрытия для создания подслоя, а затем энтеросолюбильной оболочки.
Патент США 5026560 охватывает фармацевтическую композицию и способ приготовления указанной фармацевтической композиции, отличающиеся тем, что фармацевтическая композиция содержит ядро размером с семя яблок "чудесница", получающееся путем покрытия сахарозы кукурузным крахмалом, напыления на ядро водного связующего в водном или этанольном растворе и напыляющего порошка, содержащего лекарственное вещество и гидроксипропилцеллюлозу с низкой степенью замещения с последующим нанесением энтеросолюбильного покрытия.
В Патенте США 4524060 описывается фармацевтическая композиция пролонгированного действия для терапевтического лечения больных гипертензией, которая содержит смесь тонкоизмельченного индорамина или его фармацевтически приемлемой соли водоканалообразователя, смачивающего агента, агента, вызывающего дезинтеграцию, причем смесь находится в виде непрессованной гранулы и имеет энтеросолюбильное покрытие пролонгированного действия, проницаемое для желудочного сока.
Патент США 5536507 относится к фармацевтической композиции с покрытием, обеспечивающим пролонгированное действие, или с энтеросолюбильным покрытием, при этом активный агент находится в таком виде, что основное количество лекарственного вещества выделяется близ входа в толстую кишку или в толстой кишке при рН примерно 6,4-7,0.
Фармацевтические композиции, содержащие лекарственное вещество, неустойчивое в кислой среде, такой как среда в желудке, и неадекватно забуференное, требуют энтеросолюбильного защитного покрытия для предотвращения высвобождения такого лекарственного вещества до попадания в кишечник.
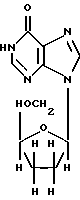
ddI (также известный как диданозин или 2',3'-дидезоксиинозин и выпускаемый Bristol-Myers Squibb Co. под торговой маркой Videx®) является неустойчивым в кислой среде лекарственным веществом формулы
и, как было показано, является эффективным для лечения больных, инфицированных вирусом ВИЧ, вызывающим СПИД. Сообщалось о составе и способе ингибирования ВИЧ-репликации с помощью 2',3'-дидезоксиинозина (см. Патенты США 4861759, 5254539 и 5616566). Совсем недавно Videx® стал широко применяться как компонент новых терапевтических коктейлей, используемых для лечения СПИД'а. Он также является лекарственным веществом, неустойчивым в кислой среде, чувствительным к низким значениям рН среды и разрушающимся в желудке.
и, как было показано, является эффективным для лечения больных, инфицированных вирусом ВИЧ, вызывающим СПИД. Сообщалось о составе и способе ингибирования ВИЧ-репликации с помощью 2',3'-дидезоксиинозина (см. Патенты США 4861759, 5254539 и 5616566). Совсем недавно Videx® стал широко применяться как компонент новых терапевтических коктейлей, используемых для лечения СПИД'а. Он также является лекарственным веществом, неустойчивым в кислой среде, чувствительным к низким значениям рН среды и разрушающимся в желудке.
Videx® обычно выпускают в различных дозировках для пролонгированного приема, включая жевательные/диспергируемые забуференные таблетки с содержанием диданозина 25, 50, 100 или 150 мг. Каждая таблетка забуферена карбонатом кальция и гидроксидом магния. Таблетки Videx® также содержат аспартам, сорбит, микрокристаллическую целлюлозу, полиплаздон (Polyplasdone®), ароматизатор с мандарино-апельсиновым запахом и стеарат магния. Videx® - забуференный порошок для перорального раствора выпускается для перорального приема в виде пакетов с однократной дозой, содержащих 100, 167 или 250 мг диданозина. Каждый пакет, наряду с дозой продукта, содержит также цитрат-фосфатный буфер (состоящий из двухосновного фосфата натрия, цитрата натрия и лимонной кислоты) и сахарозу. Выпускается также Videx® детский порошок для перорально вводимого раствора в стеклянных флаконах емкостью 4 или 8 унций (~ 118 мл и 236 мл), содержащих 2 или 4 грамма диданозина, соответственно, который надо перед приемом (через рот) смешивать с продажным антацидом.
При том, что при терапии делается акцент на таблетки, либо принимаемые индивидуально, либо как часть комбинации ("коктейль"), современные жевательные/диспергируемые забуференные таблетки не очень удобны с точки зрения простоты применения больным. В то время как другие продукты, являющиеся частью терапевтического коктейля при СПИД'е, являются капсулами или таблетками и легко глотаются, Videx® (в данном описании называемый "ddI") жевательные/диспергируемые забуференные таблетки нужно тщательно жевать, вручную измельчить или сделать однородную суспензию в воде перед приемом. Так как ddI быстро распадается при кислотных рН, ddI в жевательной/диспергируемой форме и в виде забуференного порошка для перорального раствора, содержит агенты для буферизации и вводится с антацидами в форме детского порошка. Однако присутствие в рецептуре больших количеств антацидных компонентов может привести к значительному ЖК-дисбалансу, что проявляется в виде сильной диареи. Многие больные также выражают недовольство необходимостью жевать большие таблетки ddI (доза=2 таблетки по 2,1 г каждая), вкусом таблеток или временем, требуемым для диспергирования таблеток и объемом жидкости (4 унции, 118 мл) на одну дозу. Все эти факты в сочетании с тем, что выпускаются лекарственные препараты других нуклеозидных аналогов в более доступной форме (например, капсулы или таблетки меньшего размера), требуют создания новой лекрственной формы ddI, которая легко глотается и не вызывает неприятных побочных эффектов.
В связи с этим предлагается таблетка, содержащая ядро лекарственного препарата и оболочку (покрытие), которая предотвращает выделение препарата в желудок и делает возможным высвобождение лекарственного вещества в тонкой кишке, что делает ненужным применение антацида, который при постоянном употреблении может вызвать ЖК-дисбаланс. Т.е. фармацевтические композиции, содержащие лекарственное вещество, неустойчивое в кислой среде, такой, как в желудке, требуют защитного покрытия для предотвращения высвобождения такого лекарственного вещества до попадания в кишечник.
В соответствии с данным изобретением предлагаются покрытая энтеросолюбильной оболочкой высоконагруженная фармацевтическая композиция и способ получения указанной фармацевтической композиции, содержащей лекарственное вещество, которое может распадаться в среде с низким рН, но не распадается, так как это предотвращает энтеросолюбильное покрытие. Фармацевтическая композиция по изобретению, преимущественно в форме таблеток, включает основу, содержащую лекарственное вещество, такое как ddI, чувствительное к среде с низкими значением рН, и при необходимости связующее или наполнитель, вещество, способствующее дезинтеграции, или вещество, способствующее набуханию, и смазку. Кроме того, имеется энтеросолюбильная оболочка, покрывающая основу, которая содержит сополимер метакриловой кислоты и пластификатор.
Новый фармацевтический препарат с энтеросолюбильным покрытием по изобретению обеспечивает защиту лекарственного вещества или терапевтически активного агента, такого как ddI, при рН ниже 3 (как в желудке), но разрешает высвобождение лекарствнного вещества при рН 4,5 или выше (как в верхней части кишечника).
Соответственно, фармацевтическая композиция по изобретению обычно содержит лекарственные вещества, химически неустойчивые в кислых средах. Фармацевтическая композиция по изобретению обеспечивает превосходную защиту в очень кислых средах (рН<3), не препятствуя быстрому высвобождению на участках с рН выше 4, независимо от того, происходит это в верхней части кишечника или в двенадцатиперстной кишке.
Большинство известных в технике материалов для энтеросолюбильного покрытия имеют кислую природу и, следовательно, при контакте с кислотонеустойчивыми ингредиентами могут быть причиной химической нестабильности. Это особенно справедливо при высокой температуре и во влажной атмосфере, при которых осуществляется процесс водного покрытия. Чтобы свести к минимуму эту обусловленную кислотой нестабильность, между частицами, шариками, гранулами, таблетками и т. д. и энтеросолюбильным покрытием обычно помещают защитное покрытие или подслой. Это защитное покрытие физически отделяет лабильное в кислоте лекрственное вещество от кислого энтеросолюбильного покрытия и, следовательно, повышает стабильность рецептуры. Процесс нанесения такого подслоя, однако, часто состоит из множества утомительных и длительных стадий. Кроме того, подслой может замедлять высвобождение лекарственного вещества.
Т. е. описывается способ, при котором таблетки, шарики, гранулы и/или частицы, содержащие неустойчивые в кислоте лекарственные вещества, можно с успехом покрывать энтеросолюбильной оболочкой в воде без применения защитного слоя или подслоя. Этот способ включает повышение величины рН суспензии энтеросолюбильного покрытия с помощью подщелачивающих агентов. Величину рН суспензии покрытия повышают до значения, более низкого, чем то, при котором может быть нарушена целостность полимера. Процесс может также включать введение связующих, таких как натрий-карбоксиметилцеллюлоза, наполнителей, таких как микрокристаллическая целлюлоза, веществ, способствующих дезинтеграции, таких как щелочной крахмал, и других эксципиентов, таких как оксид магния, имеющий относительно щелочной характер, в рецептуру предлагаемого энтеросолюбильного покрытия ядра. Повышение рН суспензии покрытия дает более стабильную композицию неустойчивого в кислоте лекарственного вещества в ядре. В результате отсутствует несовместимость и исчезает необходимость в защитном подслое между неустойчивым в кислой среде лекарственным веществом и кислым энтеросолюбильным покрытием. При этом способе не только отсутствует дополнительно увеличивающая стоимость стадия нанесения подслоя, но также достигается более быстрое высвобождение лекарственного вещества, так как дополнительный подслой замедляет выделение лекарственного вещества.
Способ по данному изобретению иллюстрирует приготовление таблеток с высоким содержанием (99,5% от непокрытой таблетки) неустойчивых в кислой среде лекарственных веществ, таких как ddI, с использованием водного метода. Не требуется никакого специального оборудования, так как было обнаружено, что для формования и покрытия таблеток годится обычное оборудование для перемешивания, прессования, таблетирования и нанесения покрытия.
В пищеварительном тракте покрытые таблетки проходят сначала через желудок. Время прохождения через жедудок составляет примерно два часа и рН на этом участке равен примерно 1-3. Компонент энтеросолюбильного покрытия позволяет ядру с лекарственньм веществом оставаться практически интактным и, следовательно, предотвращает выделение фармакологически активного вещества на этом участке или проникновение кислоты в ядро таблетки. Затем таблетка проходит через тонкий кишечник, при этом основная часть компонента энтеросолюбильного покрытия растворяется и высвобождает фармакологически активное вещество. При нормальном направлении потока тонкий кишечник состоит из двенадцатиперстной кишки и подвздошной кишки. Время прохождения через тонкий кишечник составляет примерно 2-4 часа и рН на этих участках равно примерно 5-7,2.
Применяемый в данном описании термин "энтеросолюбильное покрытие" означает полимерный материал или материалы, который(ые) покрывает(ют) ядро-основу с лекарственным веществом. Полимерный материал энтеросолюбильного покрытия по данному изобретению не содержит никаких активных соединений, т.е. никакого терапевтически активного агента, по данному соединению. Предпочтительно, чтобы значительное или все количество полимерного материала энтеросолюбильного покрытия растворялось, прежде чем лекарственное вещество или терапевтически активный агент высвобождается из лекарственной формы, так, чтобы достигалось пролонгированное растворение основы - лекарственного вещества. Пригодным рН-чувствительным полимером является такой, который растворяется в кишечных соках при более высоких значениях рН (рН выше 4,5), таких как в тонкой кишке, и, следовательно, позволяет высвобождение фармакологически активного вещества в области тонкого кишечника, а не в верхней области ЖК тракта, такой как желудок.
Полимерный материал покрытия выбирают так, чтобы терапевтически активный агент выделялся тогда, когда лекарственная форма достигнет тонкой кишки или участка, на котором рН выше 4,5. Предпочтительны рН-чувствительные материалы покрытия, которые остаются интактными при более низком значении рН среды в желудке, но разрушаются или растворяются при значениях рН, обычно наблюдаемых в тонкой кишке больного. Полимерный материал энтеросолюбильного покрытия начинает растворяться в водном растворе при рН примерно 4,5-5,5. Зависимость растворимости энтеросолюбильных полимеров по данному изобретению такова, что заметного растворения полимерного энтеросолюбильного покрытия не происходит до тех пор, пока лекарственная форма не покинет желудок. рН в тонкой кишке постепенно повышается примерно от 4,5 до 6,5 в луковице двенадцатиперстной кишки до примерно 7,2 в дистальных областях тонкого кишечника (подвздошная кишка). Чтобы обеспечить прогнозируемое растворение, соответствующее времени прохождения через тонкие кишки - около 3 часов, и воспроизводимое высвобождение в них, покрытие должно начать растворяться в интервале рН в двенадцатиперстной кишке и продолжать растворяться при значениях рН в тонких кишках. Следовательно, количество энтеросолюбильного полимерного покрытия должно быть таким, чтобы оно практически растворялось в течение примерно трех часов - времени прохождения через тонкую кишку.
Фармацевтическое лекарственное средство в сердцевине является неустойчивым в кислоте лекарственным веществом, таким как ddI, правастатин, эритромицин, дигоксин, панкреатин, ddA, ddC и т.п. Данное изобретение не ограничено этими лекарственными препаратами, другие лекарственные вещества также можно использовать. Данное изобретение особенно пригодно для фармацевтических композиций, таких как таблетки, которые в качестве лекарственного вещества содержат ddI. ddI присутствует в количестве, примерно, до 95% композиции в покрытых таблетках.
В ядре (основе) может присутствовать одно или более связующих или наполнителей. Микрокристаллическая целлюлоза (РН-101) является предпочтительным связующим, наиболее пригодным для использования по данному изобретению. Примеры других связующих, которые можно использовать включают натрий-карбоксиметилцеллюлозу AvicelTM PH101, AvicelTM RC 591, AvicelTM CL-611 (FMC Corp. ), Ceolus (FMC Corp.), ProSolvTM (Edward Mendell Co.), MethocelTM E-5 (Dow Corp. ), Starch 1500 (Colorcon, Ltd.), гидроксипропилметилцеллюлозу (НРМС) (Shin-Etsu Chemical Co., Ltd.), поливинилпирролидон, альгинат калия и альгинат натрия.
Ядро (основа) композиции по изобретению может также включать одно или более веществ, способствующих дезинтеграции (измельчению) или набуханию, таких как натриевое производное крахмала (щелочной крахмал), выпускаемое под торговой маркой EXPLOTAB (Edward Mendell Co.), Ac-Di-Sol (сшитая натрий-карбоксиметилцеллюлоза) (FMC Corp.), натрий-кроскармеллоза, кукурузный крахмал или сшитый поливинилпирролидон. Смазку, такую как стеарат магния, также можно использовать при приготовлении непокрытой таблетки, а именно в качестве смазки при прессовании и таблетировании.
Ядро (основу), используемое в фармацевтической композиции по изобретению, получают в форме таблетки, предпочтительно круглой, двояковыпуклой таблетки, примерно 3/16 дюйма (4,76 мм). Данное изобретение, однако, не ограничивает размера таблетки и таблетки можно готовить разного размера. Таблетки меньшего размера, однако, предпочтительны, так как они легче проходят через желудок, чем таблетки большего размера. Эксперименты показали, что таблетка по данному изобретению с ddI, содержащемся в ядре в качестве лекарственного вещества, имеет ту же биодоступность, что и гранула, описываемая в одновременно рассматриеваемой заявке США 09/083597, поданной 22 мая 1998. В зависимости от размера таблеток их можно глотать по отдельности, или множество таблеток, достаточное для получения конкретной дозы, можно инкапсулировать в растворимую капсулу.
В альтернативном варианте данного изобретения ядро можно приготовить по способу влажной грануляции, используя (если необходимо) одно из связующих для влажной грануляции, обычно применяемых в технике, такое как предварительно желатинированный крахмал, поливинилпирролидон, НРМС, натрий-карбоксиметилцеллюлоза, альгинат калия или натрия. Способ влажной грануляции содержит стадии приготовления гранул, пригодных для таблетирования путем смешения компонентов: лекарственного вещества, связующего и, при необходимости, вещества, способствующего измельчению, и наполнителя; добавления заданного количества воды или растворителя для грануляции для образования влажной смеси; рассева влажной смеси в гранулы, что способствует сушке; сушки влажных гранул для удаления избыточной влаги; рассева высушенных гранул в гранулы, пригодные для таблетирования, и добавления смазки, одного или более наполнителей, одного или более сухих связующих, при необходимости вещества, способствующего измельчению, и других эксципиентов, необходимых для таблетирования гранул.
Энтеросолюбильное покрытие по данному изобретению включает сополимер метакриловой кислоты, пластификатор и достаточное количество NaOH для корректировки рН суспензии. Можно также применять другие подщелачивающие агенты, такие как гидроксид калия, карбонат кальция, натрий-карбоксиметилцеллюлозу, оксид магния и гидроксид магния.
Для получения покрытой энтеросолюбильной оболочкой фармацевтической композиции по данному изобретению используется раствор энтеросолюбильного покрытия Eudragit L-30-D55. Eudragit L-30-D55 представляет собой водную дисперсию акрилового полимера; анионный сополимер, полученный из метакриловой кислоты и этилакрилата, с соотношением свободных карбоксильных групп к сложноэфирным примерно 1:1 и со средним молекулярным весом около 250000, выпускается в виде водной дисперсии, содержащей 30 вес.% сухого лака, и поставляется фирмой Rohn-Pharma Co., Германия. Так как покрытие на водной основе, то не используются никакие опасные или экологически вредные органические растворители.
Хотя Eudragit L-30-D55 является предпочтительным полимером для покрытия, изобретение не ограничено в этом отношении и можно применять другие энтеросолюбильные полимерные покрытия, такие как фталат гидроксипропилметилцеллюлозы НР50 (НРМСР-НР55) (USP/NF 220824), НР55 (НРМСР-НР55) (USP/NF тип 200731) и HP55S, выпускаемый Shin-Etsu Chemical, CoatericTM (поливинилацетатфталат) (Colorcon Ltd.), Sureteric Ф (поливинилацетатфталат) (Colorcon Ltd.) или AquatericTM (ацетатфталат целлюлозы) (FMC Corp.) и т.п.
Энтеросолюбильное покрытие предпочтительно содержит пластификатор, которым предпочтительно является диэтилфталат, хотя изобретение не ограничено в этом отношении и можно использовать другие пластификаторы, такие как триэтилцитрат (Citroflex-2), триацетин, трибутилсебацинат или полиэтиленгликоль.
Энтеросолюбильное покрытие, используемое в данном изобретении, значительно легче обрабатывать, чем ранее описанные системы для покрытия, и особенно предпочтительны при покрытиии частиц (таблеток) малого диаметра с малой массой, вызывая малые проблемы при работе (прилипание/сортировка) и не требуя органических растворителей.
Вообще, в тех случаях, когда ядро содержит лекарственное вещество, несовместимое с энтеросолюбильным покрытием, применяется подслой, который может содержать один или более пленкообразователей или пластификаторов, и который ведет себя как физический барьер между ядром и наружным слоем энтеросолюбильного покрытия. Однако в отличие от ранее описанных покрытий, таких как в Патенте США 5225202, новая фармацевтическая композиция по данному изобретению в результате нового способа, используемого при приготовлении композиции по данному изобретению, и корректировки рН покрытия не требуется подслоя, так как необходимость в таком изолирующем слое исчезает вследствие повышения рН водной суспензии покрытия. Так как покрытие создано так, чтобы разрушаться при рН 5,5, энтеросолюбильное покрытие при применении его при рН 5 обеспечивает относительно быстрое разрушение в кишечнике, так как требуется небольшое увеличение щелочности для достижения рН 5,5.
Предпочтительная рецептура для приготовления таблетки 50 мг без покрытия представлена в табл. 1.
Предпочтительная рецептура для приготовления суспензии энтеросолюбильного пленочного покрытия для нанесения на таблетки - 50 мг - без покрытия представлена в табл. 2.
Процентное содержание ингредиентов (интервалы) в вышепредставленных рецептурах для таблетки без покрытия и энтеросолюбильного пленочного покрытия представлены на табл. 3.
Фармацевтическую композицию в форме таблетки с энтеросолюбильным покрытием можно приготовить способом, который включает стадии смешения неустойчивого в кислой среде лекарственного вещества, связующего/наполнителя, такого как микрокристаллическая целлюлоза, вещества, способствующего измельчению, такого как щелочной (Na) крахмал, и первой порции смазки, такой как стеарат магния, для уплотнения в смесителе барабанного типа с образованием сухой смеси. Затем смесь проссеивают и снова помещают в смеситель для повторного перемешивания. Образовавшуюся смесь комкуют или уплотняют, а затем рассеивают с образованием малых гранул. Затем рассчитывают вторую порцию смазки - стеарата магния - для таблетирования и смешивают в барабанном смесителе с просеянными гранулами. Образовавшуюся смесь затем формуют в виде таблеток (без покрытия) с заданным весом и твердостью.
Затем таблетки можно покрывать суспензией энтеросолюбильного пленочного покрытия, содержащей Eudragit L-30-D55 и пластификатор (диэтилфталат) в аппарате с верхним соплом с псевдоожиженным слоем покрытия, таком как стол Aeromatic STREA-1, а затем сушить. При приготовлении суспензии пленочного покрытия к суспензии добавляют раствор NaOH до рН 5,0±0,1. Корректировка рН суспензии энтеросолюбильного пленочного покрытия до значения 5 избавляет от необходимости в подслое или в изолирующем слое. Преимущество здесь заключается в том, что нанесение энтеросолюбильного покрытия при рН 5 делает возможным его относительно быстрое разрушение в кишечнике, так как требуется лишь небольшое увеличение щелочности для доведения рН до 5,5. Корректировка рН суспензии до 5±0,1 не является опасной. Значение рН можно довести вплоть до 5,4, если это требуется для конкретной рецептуры. Хотя предпочтительным является аппарат с верхним соплом для псевдоожиженного слоя, изобретение не ограничено в этом отношении, и можно также использовать любые подходящие средства распыления покрытия, включая аппарат с нижним соплом или устройство для нанесения покрытий типа чана.
В зависимости от размера таблетки могут глотаться по отдельности или в другом варианте изобретения могут заполнять растворимые капсулы с твердой оболочкой, такие как желатиновые капсулы различных размеров в зависимости от дозировки заданного лекарственного вещества. Если таблетки нужно инкапсулировать, к покрытым пленкой таблеткам добавляют гидрофобный антиадгезив (0,1-4 вес.%) и перемешивают.
В примерах представлены предпочтительные варианты данного изобретения. Следующие примеры дополнительно описывают материалы и методы, используемые для осуществления данного изобретения и предназначены только для иллюстративных целей, но ни в коем случае не претендуют на ограничение объема или сущности данного изобретения или Формулы изобретения. Все температуры выдержаны в градусах Цельсия, если не указано иначе, и все размеры - количество меш - соответствуют стандартам ASTM.
ПРИМЕР 1
ddI-рецептура таблетки 50 мг следующего состава была приготовлена как описано в табл. 4.
ddI-рецептура таблетки 50 мг следующего состава была приготовлена как описано в табл. 4.
Получение ddI-таблеток начинают помещая ddI, микрокристаллическую целлюлозу, щелочной крахмал и первую порцию стеарата магния для уплотнения в барабанный смеситель. Ингредиенты смешивают 10±2 минуты. Перед смешением все начальные ингредиенты, содержащие комки, пропускают через сито #20 меш.
Смесь после перемешивания пропускают через сито #40 меш, снова переносят в барабанный смеситель и снова перемешивают 10±2 минуты. Образовавшуюся смесь затем штампуют пуансоном 3/4" с ровной поверхностью. Заготовки после штамповки пропускают через сита #10 и #20 меш для сортировки (рассева).
Затем вычисляют вторую порцию стеарата магния, необходимую для таблетирования, и вносят в барабанный смеситель с грануляцией для сортировки (рассева) зерен и перемешивают 10±2 минуты. Образовавшуюся смесь затем таблетируют для получения таблетки заданного веса и твердости.
Для получения пленочного покрытия в количествах, достаточных для нанесения на таблетки, Eudragit L-30-D55 пропускают через сито #60 меш, чтобы удалить все имеющиеся там комки. Профильтрованный Eudragit взвешивают и затем вносят при перемешивании в просмоленный сосуд, содержащий половину количества требуемой воды. Смесь непрерывно перемешивают в течение 5 минут или до тех пор, пока однородность смеси не станет явной. При непрерывном перемешивании в сосуд добавляют диэтилфталат и продолжают перемешивание 20 минут или до тех пор, пока однородность смеси не станет явной. Затем проводят стандартизацию рН-метра, используя буферы рН 4 и рН 7. При продолжающемся перемешивании в сосуд добавляют раствор NaOH до достижения значения рН 5,0±0,1. Рецептурного веса суспензии покрытия достигают корректируя количество воды и перемешивание продолжают еще 10 минут.
Для покрытия таблеток используют аппарат для работы в псевдоожиженном слое с верхним соплом и подходящей распределительной тарелкой, позволяющей осуществлять флюидизацию продукта (таблетки) в центре.
Перед нанесением покрытия таблетки предварительно нагревают в устройстве для нанесения покрытия до температуры 45-50oС. Было определено, что температура на входе 50±2oС является достаточной. Скорость распыления устанавливают такой, чтобы обеспечить равномерное покрытие и удовлетворительную сушку покрытия. Найдено, что увеличение веса на 8±0,5% за счет пленочного покрытия является достаточным. После нанесения покрытия таблетки сушат около 10 минут при температуре на входе около 50oС.
Найдено, что полученный таким образом покрытый энтеросолюбильной оболочкой ddI-продукт отлично защищает от желудочной кислоты (рН 3), но прекрасно выделяет ddI при рН>5.
ПРИМЕР 2
Предпочтительную рецептуру с 50 мг ddI в форме таблеток с энтеросолюбильным покрытием готовят как описано ниже. ddI (50,00 мг), микрокристаллическую целлюлозу (17,00 мг), щелочной крахмал (2,10 мг) и первую порцию стеарата магния для уплотнения (0,60 мг) загружают в соответствующий барабанный смеситель и перемешивают 10±2 минуты. Перед смешением, если требуется избавиться от комков в ингредиентах, их пропускают через сито #20 меш.
Предпочтительную рецептуру с 50 мг ddI в форме таблеток с энтеросолюбильным покрытием готовят как описано ниже. ddI (50,00 мг), микрокристаллическую целлюлозу (17,00 мг), щелочной крахмал (2,10 мг) и первую порцию стеарата магния для уплотнения (0,60 мг) загружают в соответствующий барабанный смеситель и перемешивают 10±2 минуты. Перед смешением, если требуется избавиться от комков в ингредиентах, их пропускают через сито #20 меш.
Затем смесь пропускают через сито #40 меш и снова помещают в барабанный смеситель и снова перемешивают 10±2 минуты. Затем полученную смесь штампуют с помощью 3/4" пуансонов с ровной поверхностью, получая заготовки весом 1±0,2 г и с твердостью 15-20 SCU. Заготовки затем пропускают через сита #10 и #20.
Затем в барабанный смеситель с заготовками вносят вторую порцию стеарата магния (0,3 г) для таблетирования и перемешивают 10±2 минуты. Полученную смесь затем таблетируют, используя 3/16" круглые, гладкие, глубоковогнутые пуансоны (штампы), в таблетки заданного веса при твердости их 3-6 SCU.
Количество (в г) суспензии пленочного покрытия на 100 г для покрытия таблеток, содержащих 50 мг ddI, получают, добавляют около 50 г воды в соответствующую емкость с мешалкой. При умеренной скорости перемешивания воды к ней медленно добавляют 33,33 г Eudragit L-30-D55. Перед добавлением в воду Eudragit L-30-D55 пропускают через сито #60 меш.
Продолжая перемешивание, к смеси вода/Eudragit прибавляют 1,50 г диэтилфталата до полного растворения диэтилфталата. При перемешивании медленно добавляют раствор гидроксида натрия (0,1-1 N) для того, чтобы довести рН суспензии до 5,0. Продолжая перемешивать, добавляют воду до достижения рецептурного веса и перемешивают суспензию еще 10 минут.
Для нанесения покрытия на таблетки используют Aeromatic Table-top (STREA-1) аппарат для псевдоожиженного слоя с верхним соплом и подходящей распределительной тарелкой, такой, чтобы флюидизация продуктов (таблетки) происходила в центре. Условия нанесения покрытия, используемые в процессе, следующие:
Загрузка - 250 г
Установка температуры - 60oС
Установка вентилятора - 14
Температура на входе - 50oС
Время предварительного нагрева - 5 мин
Скорость напыления в первые 5 мин - 4 г/мин
Скорость напыления конечная - 8 г/мин
Отверстие сопла - 1,1 мм
Воздушный объем - 120
Температура на выходе - 36oС
Прибавка в весе - 8%
Окончательная сушка при установке вентилятора 10 - 10 мин
Перед напылением таблетки предварительно нагревают в устройстве нанесения покрытия до температуры 45-50oС. Найдено, что температура на входе 50±2oС достаточна. Скорость впуска (напыления) регулируют, чтобы обеспечить равномерное покрытие и удовлетворительную его сушку. Найдено, что увеличение веса на 8±0,5% за счет пленочного покрытия является достаточным. После нанесения покрытия таблетки сушат около 10 минут при температуре на входе примерно 50oС.
Загрузка - 250 г
Установка температуры - 60oС
Установка вентилятора - 14
Температура на входе - 50oС
Время предварительного нагрева - 5 мин
Скорость напыления в первые 5 мин - 4 г/мин
Скорость напыления конечная - 8 г/мин
Отверстие сопла - 1,1 мм
Воздушный объем - 120
Температура на выходе - 36oС
Прибавка в весе - 8%
Окончательная сушка при установке вентилятора 10 - 10 мин
Перед напылением таблетки предварительно нагревают в устройстве нанесения покрытия до температуры 45-50oС. Найдено, что температура на входе 50±2oС достаточна. Скорость впуска (напыления) регулируют, чтобы обеспечить равномерное покрытие и удовлетворительную его сушку. Найдено, что увеличение веса на 8±0,5% за счет пленочного покрытия является достаточным. После нанесения покрытия таблетки сушат около 10 минут при температуре на входе примерно 50oС.
Было найдено, что полученный таким образом ddI-продукт с энтеросолюбильным покрытием обеспечивает отличную защиту от желудочной кислоты (при рН 3), но прекрасное выделение ddI при рН>5.
Claims (39)
1. Фармацевтическая композиция с энтеросолюбильным покрытием, состоящая из ядра в форме таблетки, содержащего неустойчивое в кислоте лекарственное вещество, такое же как 2'3'-дидеоксиинозин, правастатин, эритромицин, дигоксин, панкреатин, 2'3'-дидеоксиаденозин или 2'3'-дидеоксицитозин и не содержащего подщелачивающих агентов, и энтеросолюбильного покрытия, окружающего таблетку, причем указанное покрытие содержит по меньшей мере один подщелачивающий агент, повышающий рН материала энтеросолюбильного покрытия для сведения к минимуму несовместимости энтеросолюбильного покрытия и неустойчивого в кислоте ядра, причем покрытие защищает указанное ядро таким образом, что ядро становится защищенным при значениях рН среды 3 или ниже и в то же время способно высвобождать лекарственное вещество при рН 4,5 или выше, при этом между ядром и энтеросолюбильным покрытием нет защитного слоя.
2. Фармацевтическая композиция по п. 1, отличающаяся тем, что материал, используемый для формирования энтеросолюбильного покрытия, содержит энтеросолюбильный покрывающий полимер.
3. Фармацевтическая композиция по п. 2, отличающаяся тем, что рН материала энтеросолюбильного покрытия составляет от 4,9 до 5,4.
4. Фармацевтическая композиция по п. 2, отличающаяся тем, что неустойчивое в кислоте лекарственное вещество представляет собой 2'3'-дидеоксиинозин.
5. Фармацевтическая композиция по п. 2, отличающаяся тем, что указанное неустойчивое в кислоте лекарственное вещество представляет собой правастатин, эритромицин, дигоксин, панкреатин, 2'3'-дидеоксиаденозин или 2'3'-дидеоксицитозин.
6. Фармацевтическая композиция по п. 4, отличающаяся тем, что материал, используемый для формирования энтеросолюбильного покрытия, содержит энтеросолюбильный покрывающий полимер и по меньшей мере один подщелачивающий агент, повышающий рН материала энтеросолюбильного покрытия для сведения к минимуму несовместимости энтеросолюбильного покрытия и неустойчивого в кислоте ядра.
7. Фармацевтическая композиция по п. 6, отличающаяся тем, что рН материала энтеросолюбильного покрытия составляет от 4,9 до 5,4.
8. Фармацевтическая композиция по п. 6, отличающаяся тем, что подщелачивающий агент представляет собой NaOH.
9. Фармацевтическая композиция по п. 6, отличающаяся тем, что подщелачивающий агент выбран из группы, состоящей из гидроксида калия, карбоната кальция, натрийкарбоксиметилцеллюлозы, оксида магния и гидроксида магния.
10. Фармацевтическая композиция по п. 6, отличающаяся тем, что энтеросолюбильный покрывающий полимер выбран из группы, состоящей из фталата гидроксипропилметилцеллюлозы, поливинилацетатфталата и ацетатфталата целлюлозы.
11. Фармацевтическая композиция по п. 6, отличающаяся тем, что указанное энтеросолюбильное покрытие представляет собой сополимер метакриловой кислоты.
12. Фармацевтическая композиция по п. 11, отличающаяся тем, что указанный энтеросолюбильный покрывающий полимер содержит водную дисперсию акрилового полимера анионного сополимера, полученного из метакриловой кислоты и этилакрилата с соотношением свободных карбоксильных групп к эфирным приблизительно 1: 1 и со средним молекулярным весом около 250000, выпускаемой в виде водной дисперсии, содержащей 30 вес. % сухого лака (Eudragit® L-30-D55).
13. Фармацевтическая композиция по п. 11, отличающаяся тем, что указанное энтеросолюбильное покрытие дополнительно содержит пластификатор.
14. Фармацевтическая композиция по п. 13, отличающаяся тем, что указанный пластификатор представляет собой триэтилцитрат, триацетин, трибутилсебацинат или полиэтиленгликоль.
15. Фармацевтическая композиция по п. 13, отличающаяся тем, что указанный пластификатор представляет собой диэтилфталат.
16. Фармацевтическая композиция по п. 6, отличающаяся тем, что ядро дополнительно содержит связующее.
17. Фармацевтическая композиция по п. 16, отличающаяся тем, что связующее выбирают из группы, состоящей из натрий карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилпирролидона, альгината калия или альгината натрия.
18. Фармацевтическая композиция по п. 16, отличающаяся тем, что связующее представляет собой микрокристаллическую целлюлозу.
19. Фармацевтическая композиция по п. 16, отличающаяся тем, что ядро дополнительно содержит смазку.
20. Фармацевтическая композиция по п. 19, отличающаяся тем, что указанная смазка представляет собой стеарат магния.
21. Фармацевтическая композиция по п. 16, отличающаяся тем, что ядро дополнительно содержит вещество, способствующее измельчению.
22. Фармацевтическая композиция по п. 21, отличающаяся тем, что указанное вещество, способствующее измельчению, представляет собой Na щелочной крахмал, натрий-кроскармеллозу, кукурузный крахмал или сшитый поливинилпирролидон.
23. Фармацевтическая композиция по п. 21, отличающаяся тем, что указанное вещество, способствующее измельчению, представляет собой Na-щелочной крахмал.
24. Фармацевтическая композиция по п. 6, имеющая следующий состав, %:
Ядро
Лекарственное вещество (диданозин) - 15-97,5
Микрокристаллическая целлюлоза - 0-40
Na-щелочной крахмал - 0-6
Стеарат магния - 0-3
Покрытие Eudragit L-30-D55 - 2-30
Диэтилфталат - 0,5-6,0
25. Фармацевтическая композиция по п. 6, отличающаяся тем, что таблетка содержит 2', 3'-дидеоксиинозин в количестве, при приеме которого дважды в день достигается суточная доза.
Ядро
Лекарственное вещество (диданозин) - 15-97,5
Микрокристаллическая целлюлоза - 0-40
Na-щелочной крахмал - 0-6
Стеарат магния - 0-3
Покрытие Eudragit L-30-D55 - 2-30
Диэтилфталат - 0,5-6,0
25. Фармацевтическая композиция по п. 6, отличающаяся тем, что таблетка содержит 2', 3'-дидеоксиинозин в количестве, при приеме которого дважды в день достигается суточная доза.
26. Фармацевтическая композиция по п. 6, отличающаяся тем, что таблетка содержит 2', 3'-дидеоксиинозин в количестве, соответствующем суточной дозе, и принимается один раз в день.
27. Способ получения фармацевтической композиции с энтеросолюбильным покрытием, содержащий стадии (а) смешивания неустойчивого в кислоте лекарственного средства, такого как 2', 3'-дидеоксиинозин, правастатин, эритромицин, дигоксин, панкреатин, 2'3'-дидеоксиаденозин или 2', 3'-дидеоксицитозин и необязательных компонентов, за исключением подщелачивающих агентов, с получением смеси, пригодной для таблетирования, (б) таблетирования указанной смеси с получением ядра в виде таблетки, (в) смешивания энтеросолюбильного покрывающего полимера с подщелачивающим агентом, повышающим рН материала энтеросолюбильного покрытия для сведения к минимуму несовместимости энтеросолюбильного покрытия и неустойчивого в кислоте ядра, и (г) нанесения указанного материала энтеросолюбильного покрытия на ядро таблетки.
28. Способ по п. 27, отличающийся тем, что указанная смесь содержит неустойчивое в кислоте лекарственное вещество, связующее и смазку.
29. Способ по п. 27, отличающийся тем, что указанное неустойчивое в кислоте лекарственное вещество представляет собой 2', 3'-дидеоксиинозин.
30. Способ по п. 27, отличающийся тем, что указанное неустойчивое в кислоте лекарственное вещество представляет собой правастатин, эритромицин, дигоксин, панкреатин, 2', 3'-дидеоксиаденозин или 2', 3'-дидеоксицитозин.
31. Способ по п. 29, дополнительно включающий стадию скрининга ядер таблеток с удержанием ядер, для дальнейшего покрытия, имеющих размер приблизительно от # 10 до # 20 меш.
32. Способ по п. 29, отличающийся тем, что указанные таблетки имеют твердость 3-6 SCU.
33. Способ по п. 29, отличающийся тем, что получение указанного покрытия дополнительно включает стадии (а) смешивания энтеросолюбильного покрывающего полимера с водой с получением смеси полимер/вода, (б) смешивания пластификатора со смесью, полученной на стадии (а), и (в) смешивания подщелачивающего агента со смесью, полученной на стадии (б), для повышения рН смеси от 4,9 до 5,4.
34. Способ по п. 29, отличающийся тем, что указанная стадия нанесения покрытия дополнительно включает стадии (а) предварительного нагревания указанных таблеток в аппарате для напыления в псевдоожиженном слое примерно до 45-50oС, (б) напыления на указанные таблетки указанного покрытия, и (в) сушки указанных таблеток.
35. Способ по п. 29, отличающийся тем, что связующее представляет собой микрокристаллическую целлюлозу.
36. Способ по п. 29, отличающийся тем, что указанная смазка представляет собой стеарат магния.
37. Способ по п. 29, отличающийся тем, что указанное вещество, способствующее измельчению, представляет собой щелочной крахмал.
38. Способ по п. 29, отличающийся тем, что указанное энтеросолюбильное покрытие содержит сополимер метакриловой кислоты и пластификатор.
39. Способ по п. 38, отличающийся тем, что указанный пластификатор представляет собой диэтилфталат.
40. Способ по п. 38, отличающийся тем, что указанный сополимер метакриловой кислоты представляет собой Eudragit L-30-D55.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11841898A | 1998-07-17 | 1998-07-17 | |
| US09/118,418 | 1998-07-17 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2001104535A RU2001104535A (ru) | 2003-01-20 |
| RU2201217C2 true RU2201217C2 (ru) | 2003-03-27 |
Family
ID=22378467
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2001104535/14A RU2201217C2 (ru) | 1998-07-17 | 1998-08-06 | Таблетка с энтеросолюбильным покрытием и способ приготовления |
Country Status (35)
| Country | Link |
|---|---|
| US (2) | US6331316B1 (ru) |
| EP (1) | EP1098635B1 (ru) |
| JP (1) | JP2002520350A (ru) |
| KR (1) | KR100535954B1 (ru) |
| CN (1) | CN1195499C (ru) |
| AR (1) | AR019934A1 (ru) |
| AT (1) | ATE268165T1 (ru) |
| AU (1) | AU750388B2 (ru) |
| BG (1) | BG65443B1 (ru) |
| BR (1) | BR9815948A (ru) |
| CA (1) | CA2337885C (ru) |
| CO (1) | CO5090840A1 (ru) |
| CZ (1) | CZ301557B6 (ru) |
| DE (1) | DE69824319T2 (ru) |
| DK (1) | DK1098635T3 (ru) |
| EE (1) | EE05021B1 (ru) |
| EG (1) | EG23944A (ru) |
| ES (1) | ES2221188T3 (ru) |
| GE (1) | GEP20032912B (ru) |
| HU (1) | HU226492B1 (ru) |
| ID (1) | ID27019A (ru) |
| IL (1) | IL139701A0 (ru) |
| LT (1) | LT4844B (ru) |
| LV (1) | LV12638B (ru) |
| NO (1) | NO330554B1 (ru) |
| NZ (1) | NZ508298A (ru) |
| PL (1) | PL195587B1 (ru) |
| PT (1) | PT1098635E (ru) |
| RO (1) | RO121082B1 (ru) |
| RU (1) | RU2201217C2 (ru) |
| SK (1) | SK285152B6 (ru) |
| TR (1) | TR200003577T2 (ru) |
| UA (1) | UA73092C2 (ru) |
| WO (1) | WO2000003696A1 (ru) |
| ZA (1) | ZA993446B (ru) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2527766C2 (ru) * | 2009-03-13 | 2014-09-10 | Тояма Кемикал Ко., Лтд. | Таблетки и гранулированные порошки, содержащие 6-фтор-3-гидрокси-2-пиразинкарбоксамид |
| RU2648760C2 (ru) * | 2007-11-16 | 2018-03-28 | Вифор (Интернациональ) Аг | Фармацевтическая композиция, содержащая оксигидроксид железа, способ ее получения и применение |
| RU2668499C2 (ru) * | 2015-03-12 | 2018-10-01 | Закрытое Акционерное Общество "Фармфирма "Сотекс" | Фармацевтическая композиция в форме таблеток, покрытых кишечнорастворимой оболочкой, и способ ее получения |
Families Citing this family (121)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6569461B1 (en) * | 1999-03-08 | 2003-05-27 | Merck & Co., Inc. | Dihydroxy open-acid and salts of HMG-CoA reductase inhibitors |
| GB9920548D0 (en) * | 1999-08-31 | 1999-11-03 | Rhone Poulenc Rorer Sa | Treatment of hepatocellular carcinoma |
| US6420473B1 (en) * | 2000-02-10 | 2002-07-16 | Bpsi Holdings, Inc. | Acrylic enteric coating compositions |
| US6756811B2 (en) * | 2000-03-10 | 2004-06-29 | Easic Corporation | Customizable and programmable cell array |
| US9522217B2 (en) | 2000-03-15 | 2016-12-20 | Orbusneich Medical, Inc. | Medical device with coating for capturing genetically-altered cells and methods for using same |
| US8088060B2 (en) | 2000-03-15 | 2012-01-03 | Orbusneich Medical, Inc. | Progenitor endothelial cell capturing with a drug eluting implantable medical device |
| US6555581B1 (en) | 2001-02-15 | 2003-04-29 | Jones Pharma, Inc. | Levothyroxine compositions and methods |
| GB2377874B (en) * | 2001-07-23 | 2005-06-22 | Walcom Bio Chemicals Ind Ltd | Poultry feed and the use thereof |
| GB2379854B (en) * | 2001-09-19 | 2006-04-19 | Walcom Animal Science | Dairy cow feed and the use thereof |
| BR0212946A (pt) * | 2001-09-28 | 2004-10-26 | Mcneil Ppc Inc | Formas de dosagens de liberação modificada |
| US20030190359A1 (en) * | 2001-10-29 | 2003-10-09 | Franz G. Andrew | Levothyroxine compositions having unique triiodothyronine Tmax properties |
| AU2002362088A1 (en) * | 2001-12-06 | 2003-06-23 | Catholic University | Method and composition for inducing weight loss |
| TWI231760B (en) * | 2001-12-20 | 2005-05-01 | Chugai Pharmaceutical Co Ltd | Coated lozenge and manufacturing method thereof |
| WO2003057195A1 (en) * | 2002-01-11 | 2003-07-17 | Athpharma Limited | Pravastatin pharmaceutical formulations and methods of their use |
| EP1905431A1 (en) * | 2002-01-11 | 2008-04-02 | Circ Pharma Research and Development Limited | Pravastatin pharmaceutical formulations and methods of their use |
| ES2627842T3 (es) * | 2002-02-21 | 2017-07-31 | Valeant Pharmaceuticals Luxembourg S.À.R.L. | Formas de dosificación de liberación controlada |
| US8323692B2 (en) | 2002-02-21 | 2012-12-04 | Valeant International Bermuda | Controlled release dosage forms |
| US6982080B2 (en) * | 2002-03-15 | 2006-01-03 | Wyeth | Hydroxyethyl starch—containing polypeptide compositions |
| US20040028737A1 (en) * | 2002-08-12 | 2004-02-12 | Kopran Research Laboratories Limited | Enteric coated stable oral pharmaceutical composition of acid unstable drug and process for preparing the same |
| JP2006504686A (ja) * | 2002-09-03 | 2006-02-09 | バイオヴェイル ラボラトリーズ インコーポレイテッド | プラバスタチンの医薬品製剤およびそれらの使用方法 |
| MXPA05002899A (es) * | 2002-09-16 | 2005-05-27 | Wyeth Corp | Formulaciones de liberacion controlada para administracion oral de un agente terapeutico polipeptido y sus metodos de uso. |
| JP5248739B2 (ja) * | 2002-10-01 | 2013-07-31 | バナー ファーマキャップス, インコーポレーテッド | 腸溶性調製物 |
| WO2004041195A2 (en) * | 2002-10-31 | 2004-05-21 | Supergen, Inc. | Pharmaceutical formulations targeting specific regions of the gastrointestinal tract |
| SI21402A (sl) | 2003-02-12 | 2004-08-31 | LEK farmacevtska dru�ba d.d. | Obloženi delci in farmacevtske oblike |
| CN100415211C (zh) * | 2003-07-03 | 2008-09-03 | 上海现代药物制剂工程研究中心 | 抗艾滋病药去羟肌苷的肠溶微粒组合物及制备方法 |
| US8168228B2 (en) * | 2003-10-17 | 2012-05-01 | Sandoz Ag | Antibiotic clarithromycin micropellet compositions |
| US20050084540A1 (en) * | 2003-10-17 | 2005-04-21 | Indranil Nandi | Taste masking antibiotic composition |
| EP1699442A2 (en) * | 2003-12-31 | 2006-09-13 | Genzyme Corporation | Enteric coated aliphatic amine polymer bile acid sequestrants |
| JP2007522135A (ja) | 2004-01-30 | 2007-08-09 | ザ ジョンズ ホプキンス ユニバーシティ | ニトロキシル前駆化合物および使用方法 |
| US20100183714A1 (en) * | 2004-03-26 | 2010-07-22 | Lek Pharmaceuticals D.D. | Gastroresistant pharmaceutical dosage form comprising n-(2-(2- phthalimidoethoxy)-acetyl)-l-alanyl-d-glutamic acid (lk-423) |
| KR100598326B1 (ko) * | 2004-04-10 | 2006-07-10 | 한미약품 주식회사 | HMG-CoA 환원효소 억제제의 경구투여용 서방형 제제및 이의 제조방법 |
| US20050281876A1 (en) * | 2004-06-18 | 2005-12-22 | Shun-Por Li | Solid dosage form for acid-labile active ingredient |
| EP1765336A4 (en) | 2004-06-25 | 2010-03-10 | Univ Johns Hopkins | ANGIOGENESIS INHIBITORS |
| US20080126195A1 (en) | 2004-07-22 | 2008-05-29 | Ritter Andrew J | Methods and Compositions for Treating Lactose Intolerance |
| WO2006054175A2 (en) * | 2004-11-18 | 2006-05-26 | Aurobindo Pharma Limited | Stable dosage forms of acid labile drug |
| US20060134214A1 (en) * | 2004-11-18 | 2006-06-22 | Ismat Ullah | Enteric coated bead comprising epothilone or epothilone analog, and preparation and administration thereof |
| CA2588400A1 (en) * | 2004-11-18 | 2006-05-26 | Bristol-Myers Squibb Company | Enteric coated bead comprising ixabepilone, and preparation thereof |
| US20060280789A1 (en) * | 2004-12-27 | 2006-12-14 | Eisai Research Institute | Sustained release formulations |
| US20060246003A1 (en) * | 2004-12-27 | 2006-11-02 | Eisai Co. Ltd. | Composition containing anti-dementia drug |
| US20090208579A1 (en) * | 2004-12-27 | 2009-08-20 | Eisai R & D Management Co., Ltd. | Matrix Type Sustained-Release Preparation Containing Basic Drug or Salt Thereof, and Method for Manufacturing the Same |
| NZ555693A (en) * | 2004-12-27 | 2010-10-29 | Eisai R&D Man Co Ltd | Matrix type sustained-release preparation containing donepezil |
| CN100398122C (zh) * | 2005-01-28 | 2008-07-02 | 北京北大药业有限公司 | 一种治疗颈、腰椎病中药的肠溶包衣组合物 |
| US8673352B2 (en) | 2005-04-15 | 2014-03-18 | Mcneil-Ppc, Inc. | Modified release dosage form |
| BRPI0615972A2 (pt) | 2005-07-29 | 2011-05-31 | Concert Pharmaceuticals Inc | composto isolado, mistura, composição, item de manufatura, uso de um composto, método para determinar a concentração do composto em uma amostra biológica, kit de diagnóstico e método para avaliar a estabilidade metabólica de um composto |
| WO2007016338A2 (en) * | 2005-07-29 | 2007-02-08 | Goverment Of The U.S.A., As Represented By The Secretary, Department Of Health And Human Services | Use of chk2 kinase inhibitors for cancer treatment |
| CN101287443B (zh) | 2005-07-29 | 2013-05-29 | 斯蒂茨廷格罗宁根药物研究中心 | pH控制的脉冲释放系统、其制备方法和用途 |
| US20070092573A1 (en) * | 2005-10-24 | 2007-04-26 | Laxminarayan Joshi | Stabilized extended release pharmaceutical compositions comprising a beta-adrenoreceptor antagonist |
| HUE049307T2 (hu) | 2006-01-27 | 2020-09-28 | Univ California | Bélben oldódó bevonattal ellátott ciszteamin-bitartrát és cisztamin |
| NZ609381A (en) | 2006-03-17 | 2014-10-31 | Cardioxyl Pharmaceuticals Inc | N-hydroxylsulfonamide derivatives as new physiologically useful nitroxyl donors |
| WO2008015686A1 (en) * | 2006-08-01 | 2008-02-07 | Hetero Drugs Limited | Stable multiparticulate formulations of didanosine |
| US20110052688A1 (en) * | 2006-11-21 | 2011-03-03 | San-Laung Chow | Solid dispersion composition |
| US8551995B2 (en) | 2007-01-19 | 2013-10-08 | Xcovery Holding Company, Llc | Kinase inhibitor compounds |
| SG10201602375PA (en) * | 2007-09-26 | 2016-05-30 | Univ Johns Hopkins | N-Hydroxylsulfonamide Derivatives As New Physiologically Useful Nitroxyl Donors |
| ES2331501B1 (es) * | 2007-11-14 | 2010-10-21 | Blanver Farmoquimica, Ltda | Composicion farmaceutica solida de didanosina. |
| MX360827B (es) * | 2007-11-30 | 2018-11-16 | Univ California | Metodos para tratar la esteatohepatitis no alcoholica (nash) usando productos de cisteamina. |
| US20110223248A1 (en) * | 2007-12-12 | 2011-09-15 | Ritter Pharmaceuticals, Inc. | Methods and compositions for treating lactose intolerance |
| HUE030372T2 (en) | 2008-05-07 | 2017-05-29 | Cardioxyl Pharmaceuticals Inc | New nitroso compounds as nitroxyl donors and methods for their use |
| US20090317466A1 (en) * | 2008-06-18 | 2009-12-24 | Franco Lori | Fixed dose pharmaceutical composition comprising hyroxyurea and didanosine |
| CN102098917B (zh) | 2008-06-19 | 2016-03-16 | 艾科睿控股公司 | 作为激酶抑制剂化合物的取代的哒嗪羧酰胺化合物 |
| US8632805B2 (en) * | 2008-06-20 | 2014-01-21 | Mutual Pharmaceutical Company, Inc. | Controlled-release formulations, method of manufacture, and use thereof |
| US20110165248A1 (en) * | 2008-09-18 | 2011-07-07 | Meridith Lee Machonis | Pharmaceutical dosage forms comprising poly(e-caprolactone) |
| WO2010042163A2 (en) | 2008-10-06 | 2010-04-15 | The Johns Hopkins University | Quinoline compounds as inhibitors of angiogenesis, human methionine aminopeptidase, and sirt1, and methods of treating disorders |
| US8785160B2 (en) * | 2009-02-24 | 2014-07-22 | Ritter Pharmaceuticals, Inc. | Prebiotic formulations and methods of use |
| ES2600960T3 (es) * | 2009-02-24 | 2017-02-13 | Ritter Pharmaceuticals, Inc. | Formulaciones prebióticas y procedimientos de uso |
| WO2010103365A2 (en) | 2009-03-09 | 2010-09-16 | Council Of Scientific & Industrial Research | Sustained release composition of therapeutic agent |
| US20110160200A1 (en) * | 2009-11-23 | 2011-06-30 | Cardioxyl Pharmaceuticals, Inc. | Nitroxyl Progenitors for the Treatment of Pulmonary Hypertension |
| IN2012DN05028A (ru) * | 2009-12-07 | 2015-10-23 | Univ Johns Hopkins | |
| CN102753520B (zh) | 2009-12-07 | 2016-06-08 | 约翰斯霍普金斯大学 | N-酰氧基磺酰胺和n-羟基-n-酰基磺酰胺衍生物 |
| ES2610226T3 (es) | 2010-10-08 | 2017-04-26 | Xcovery Holding Company Llc | Compuestos de 6-amino-piridazin-3-il-carboxamida sustituidos como moduladores de proteínas cinasas |
| US20130084313A1 (en) * | 2011-09-30 | 2013-04-04 | Stomavite, Llc | Supplement for ostomy patients |
| CN108409662B (zh) | 2011-10-17 | 2021-10-26 | 约翰斯霍普金斯大学 | 作为hno供体的经羟胺取代的米氏酸、巴比妥酸和吡唑啉酮衍生物 |
| CN102357088A (zh) * | 2011-10-26 | 2012-02-22 | 河北山姆士药业有限公司 | 盐酸二甲双胍肠溶片 |
| CN102526746B (zh) * | 2012-02-04 | 2013-09-18 | 安徽山河药用辅料股份有限公司 | 肠溶型水分散体包衣材料的制备方法 |
| US9676708B2 (en) | 2012-11-01 | 2017-06-13 | The Johns Hopkins University | Controlled HNO release through intramolecular cyclization-elimination |
| US20140141075A1 (en) | 2012-11-21 | 2014-05-22 | Warner Chilcott Company, Llc | 5-aminosalicylic acid capsule formulation |
| SI2945621T1 (sl) | 2013-01-18 | 2019-01-31 | Cardioxyl Pharmaceuticals, Inc. | Farmacevtski sestavki, ki vsebujejo nitroksilne donatorje |
| KR102341899B1 (ko) | 2013-04-07 | 2021-12-21 | 더 브로드 인스티튜트, 인코퍼레이티드 | 개인맞춤화 신생물 백신을 위한 조성물 및 방법 |
| AR096628A1 (es) | 2013-06-17 | 2016-01-20 | Raptor Pharmaceuticals Inc | Formulación en perlas de cisteamina de liberación retardada y métodos de preparación y uso de ella |
| WO2015077717A1 (en) | 2013-11-25 | 2015-05-28 | The Broad Institute Inc. | Compositions and methods for diagnosing, evaluating and treating cancer by means of the dna methylation status |
| US11725237B2 (en) | 2013-12-05 | 2023-08-15 | The Broad Institute Inc. | Polymorphic gene typing and somatic change detection using sequencing data |
| NZ721908A (en) | 2013-12-20 | 2022-12-23 | Massachusetts Gen Hospital | Combination therapy with neoantigen vaccine |
| ES2734060T3 (es) | 2014-01-17 | 2019-12-04 | Cardioxyl Pharmaceuticals Inc | Donadores de nitroxilo de N-hidroximetanosulfonamida |
| EP3125905A4 (en) | 2014-04-04 | 2017-11-08 | Ritter Pharmaceuticals, Inc. | Methods and compositions for microbiome alteration |
| US9464061B2 (en) | 2014-05-27 | 2016-10-11 | The Johns Hopkins University | N-hydroxylamino-barbituric acid derivatives |
| WO2015183838A1 (en) | 2014-05-27 | 2015-12-03 | The Johns Hopkins University | N-hydroxylamino-barbituric acid derivatives as nitroxyl donors |
| EP3148972B1 (en) | 2014-05-27 | 2019-08-21 | Cardioxyl Pharmaceuticals, Inc. | Pyrazolone derivatives as nitroxyl donors |
| US9775814B2 (en) | 2014-06-20 | 2017-10-03 | Patheon Softgels Inc. | Enteric soft capsule compositions |
| EP3234130B1 (en) | 2014-12-19 | 2020-11-25 | The Broad Institute, Inc. | Methods for profiling the t-cell- receptor repertoire |
| US10975442B2 (en) | 2014-12-19 | 2021-04-13 | Massachusetts Institute Of Technology | Molecular biomarkers for cancer immunotherapy |
| MX2017008373A (es) | 2014-12-23 | 2017-10-19 | Cerecor Inc | Compuestos, composiciones y metodos. |
| CN108025048B (zh) | 2015-05-20 | 2022-10-25 | 博德研究所 | 共有的新抗原 |
| KR20180038440A (ko) | 2015-06-09 | 2018-04-16 | 렉산 파마슈티컬스, 인코포레이티드 | 플루오로사이클로펜테닐시토신 용도 및 제조 방법 |
| JP2018526392A (ja) | 2015-09-04 | 2018-09-13 | レクサン ファーマシューティカルズ インコーポレイテッド | キノキサリニル−ピペラジンアミドの使用方法 |
| EP4066846A1 (en) | 2015-11-03 | 2022-10-05 | The Brigham & Women's Hospital, Inc. | Therapeutic microbiota for the treatment and/or prevention of food allergy |
| WO2017087532A1 (en) | 2015-11-16 | 2017-05-26 | The Regents Of The University Of California | Methods of treating non-alcoholic steatohepatitis (nash) using cysteamine compounds |
| US10143665B2 (en) | 2015-11-17 | 2018-12-04 | Horizon Orphan Llc | Methods for storing cysteamine formulations and related methods of treatment |
| US20190111001A1 (en) * | 2016-03-30 | 2019-04-18 | University Of Maryland, Baltimore | Microparticulate system for colonic drug delivery |
| AU2017254477A1 (en) | 2016-04-18 | 2018-11-01 | Jennifer G. ABELIN | Improved HLA epitope prediction |
| ES2875320T3 (es) | 2016-05-04 | 2021-11-10 | Den Driessche Herman Van | Formulación de simmondsina |
| KR102399848B1 (ko) | 2016-10-03 | 2022-05-19 | 하이라이트ll 파머슈티컬 (하이난) 컴퍼니, 리미티드 | 신규한 jak1 선택적 억제제 및 그 용도 |
| EP3574116A1 (en) | 2017-01-24 | 2019-12-04 | The Broad Institute, Inc. | Compositions and methods for detecting a mutant variant of a polynucleotide |
| CA3088630A1 (en) | 2017-12-15 | 2019-06-20 | Solarea Bio, Inc. | Microbial compositions and methods for treating type 2 diabetes, obesity, and metabolic syndrome |
| JP2021522308A (ja) | 2018-05-04 | 2021-08-30 | トゥリーズ | 上皮細胞及び骨髄細胞の両方を活性化するtlr3リガンド |
| FR3083545A1 (fr) | 2018-07-04 | 2020-01-10 | Institut National De La Recherche Agronomique | Utilisation d'une souche de roseburia intestinalis pour la prevention et le traitement de l'inflammation de l'intestin |
| CA3111795A1 (en) | 2018-09-05 | 2020-03-12 | Solarea Bio, Inc. | Methods and compositions for treating musculoskeletal diseases |
| US20210382068A1 (en) | 2018-10-02 | 2021-12-09 | Dana-Farber Cancer Institute, Inc. | Hla single allele lines |
| US11122828B2 (en) | 2018-11-05 | 2021-09-21 | MarvelBiome, Inc. | Microbial compositions comprising ellagitannin and methods of use |
| WO2020131586A2 (en) | 2018-12-17 | 2020-06-25 | The Broad Institute, Inc. | Methods for identifying neoantigens |
| WO2020212822A1 (en) * | 2019-04-17 | 2020-10-22 | Amruth Gowda Doddaveerappa | Multi-component pharmaceutical single dosage forms and process employed thereof |
| EP3955923A1 (en) | 2019-04-18 | 2022-02-23 | The Regents Of The University Of Michigan | Combination with checkpoint inhibitors to treat cancer |
| CA3143713A1 (en) | 2019-06-19 | 2020-12-24 | Solarea Bio, Inc. | Microbial compositions and methods for producing upgraded probiotic assemblages |
| KR20210043779A (ko) * | 2019-10-11 | 2021-04-22 | 넨시스(주) | 판크레아틴 장용코팅 펠릿 제조방법 |
| CN110882228A (zh) * | 2019-11-29 | 2020-03-17 | 南京禾瀚医药科技有限公司 | 一种伊匹乌肽肠溶制剂 |
| CN116249774A (zh) | 2020-05-26 | 2023-06-09 | 迪奥尼斯治疗公司 | 核酸人工微型蛋白质组文库 |
| WO2021248093A1 (en) | 2020-06-05 | 2021-12-09 | Henry Ford Health System | Daclatasvir for use in treating lung and prostate cancer |
| EP4267554A1 (en) | 2020-12-22 | 2023-11-01 | Mekanistic Therapeutics LLC | Substituted aminobenzyl heteroaryl compounds as egfr and/or pi3k inhibitors |
| WO2022189861A1 (en) | 2021-03-08 | 2022-09-15 | Tollys | Carbohydrate conjugates of tlr3 ligands and uses thereof |
| WO2023016321A1 (zh) | 2021-08-10 | 2023-02-16 | 贝达药业股份有限公司 | 恩沙替尼或其盐在治疗携带met 14外显子跳跃突变的疾病中的用途 |
| WO2023076733A1 (en) | 2021-11-01 | 2023-05-04 | Dana-Farber Cancer Institute, Inc. | Biologically selected nucleic acid artificial mini-proteome libraries |
| WO2023092150A1 (en) | 2021-11-22 | 2023-05-25 | Solarea Bio, Inc. | Methods and compositions for treating musculoskeletal diseases, treating inflammation, and managing symptoms of menopause |
| US20230190834A1 (en) | 2021-12-21 | 2023-06-22 | Solarea Bio, Inc. | Immunomodulatory compositions comprising microbial entities |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2809918A (en) | 1955-10-17 | 1957-10-15 | Victor M Hermelin | Sustained release pharmaceutical preparations |
| DE2010416B2 (de) | 1970-03-05 | 1979-03-29 | Hoechst Ag, 6000 Frankfurt | Oral anwendbare Arzneiform mit Retardwirkung |
| FR2471186A1 (fr) | 1979-12-10 | 1981-06-19 | Roussel Uclaf | Nouveaux comprimes a delitescence colique, ainsi que leur procede de preparation |
| US4432996A (en) | 1980-11-17 | 1984-02-21 | Merck & Co., Inc. | Hypocholesterolemic fermentation products and process of preparation |
| ZA822995B (en) | 1981-05-21 | 1983-12-28 | Wyeth John & Brother Ltd | Slow release pharmaceutical composition |
| US4556552A (en) | 1983-09-19 | 1985-12-03 | Colorcon, Inc. | Enteric film-coating compositions |
| US4704295A (en) | 1983-09-19 | 1987-11-03 | Colorcon, Inc. | Enteric film-coating compositions |
| US4728512A (en) | 1985-05-06 | 1988-03-01 | American Home Products Corporation | Formulations providing three distinct releases |
| GB8512330D0 (en) | 1985-05-15 | 1985-06-19 | Wellcome Found | Antiviral compounds |
| US5254539A (en) | 1985-08-26 | 1993-10-19 | U.S. Government, Dept. Of Health And Human Services, C/O National Institutes Of Health | Method of treating HIV with 2',3'-dideoxyinosine |
| WO1987001284A1 (en) | 1985-08-26 | 1987-03-12 | United States Of America, Represented By The Unite | Inhibition of in vitro infectivity and cytopathic effect of htlv-iii/lav by 2',3'-dideoxynosine, 2',3'-dideoxyguanosine, or 2',3'-dideoxyadenosine |
| US4975283A (en) | 1985-12-12 | 1990-12-04 | Bristol-Myers Squibb Company | Stabilized enteric coated aspirin granules and process for preparation |
| US4775536A (en) | 1986-02-24 | 1988-10-04 | Bristol-Myers Company | Enteric coated tablet and process for making |
| US4794001A (en) | 1986-03-04 | 1988-12-27 | American Home Products Corporation | Formulations providing three distinct releases |
| GB2189698A (en) | 1986-04-30 | 1987-11-04 | Haessle Ab | Coated omeprazole tablets |
| GB2189699A (en) | 1986-04-30 | 1987-11-04 | Haessle Ab | Coated acid-labile medicaments |
| US5026560A (en) | 1987-01-29 | 1991-06-25 | Takeda Chemical Industries, Ltd. | Spherical granules having core and their production |
| US4808413A (en) | 1987-04-28 | 1989-02-28 | E. R. Squibb & Sons, Inc. | Pharmaceutical compositions in the form of beadlets and method |
| JP2643222B2 (ja) | 1988-02-03 | 1997-08-20 | エーザイ株式会社 | 多重層顆粒 |
| US4925675A (en) | 1988-08-19 | 1990-05-15 | Himedics, Inc. | Erythromycin microencapsulated granules |
| US5026559A (en) | 1989-04-03 | 1991-06-25 | Kinaform Technology, Inc. | Sustained-release pharmaceutical preparation |
| PH30058A (en) * | 1989-11-24 | 1996-11-08 | Biochemie Gmbh | Pancreation preparations |
| US5158777A (en) * | 1990-02-16 | 1992-10-27 | E. R. Squibb & Sons, Inc. | Captopril formulation providing increased duration of activity |
| US5175003A (en) * | 1990-04-06 | 1992-12-29 | Biosytes Usa, Inc. | Dual mechanism controlled release system for drug dosage forms |
| DE4031881C2 (de) * | 1990-10-08 | 1994-02-24 | Sanol Arznei Schwarz Gmbh | Lösungsmittelfreie, oral zu verabreichende pharmazeutische Zubereitung mit verzögerter Wirkstoffreisetzung und Verfahren zu deren Herstellung |
| US5422121A (en) * | 1990-11-14 | 1995-06-06 | Rohm Gmbh | Oral dosage unit form |
| CZ119793A3 (en) * | 1990-12-21 | 1994-01-19 | Richardson Vicks Inc | Pharmaceutical preparation |
| US5556839A (en) * | 1991-04-29 | 1996-09-17 | Eli Lilly And Company | Form II Dirithromycin |
| HU9202318D0 (en) * | 1991-07-22 | 1992-10-28 | Bristol Myers Squibb Co | Method for preparing medical preparatives containing didesoxi-purine nucleoside |
| US5326570A (en) * | 1991-07-23 | 1994-07-05 | Pharmavene, Inc. | Advanced drug delivery system and method of treating psychiatric, neurological and other disorders with carbamazepine |
| US5225202A (en) * | 1991-09-30 | 1993-07-06 | E. R. Squibb & Sons, Inc. | Enteric coated pharmaceutical compositions |
| US5350584A (en) | 1992-06-26 | 1994-09-27 | Merck & Co., Inc. | Spheronization process using charged resins |
| NZ253999A (en) | 1992-08-05 | 1996-07-26 | Faulding F H & Co Ltd | Pelletised substained release medicament |
| IT1265074B1 (it) * | 1993-05-18 | 1996-10-30 | Istituto Biochimico Italiano | Composizione farmaceutica a lento rilascio contenente come sostanza attiva un acido biliare |
| SE9302395D0 (sv) * | 1993-07-09 | 1993-07-09 | Ab Astra | New pharmaceutical formulation |
| US5536507A (en) | 1994-06-24 | 1996-07-16 | Bristol-Myers Squibb Company | Colonic drug delivery system |
| US5733575A (en) | 1994-10-07 | 1998-03-31 | Bpsi Holdings, Inc. | Enteric film coating compositions, method of coating therewith, and coated forms |
| US5686106A (en) | 1995-05-17 | 1997-11-11 | The Procter & Gamble Company | Pharmaceutical dosage form for colonic delivery |
| SG80553A1 (en) | 1995-07-20 | 2001-05-22 | Tanabe Seiyaku Co | Pharmaceutical preparation in form of coated capsule releasable at lower part of digestive tract |
| US5789014A (en) | 1995-12-25 | 1998-08-04 | Shin-Etsu Chemical Co., Ltd. | Method of manufacturing a solid preparation coated with non-solvent coating |
| DE19626045C2 (de) * | 1996-06-28 | 1998-12-03 | Klinge Co Chem Pharm Fab | Stabile Arzneiform zur oralen Verabreichung, welche Omeprazol als aktiven Wirkstoff enthält, sowie Verfahren zur Herstellung derselben |
| WO1999027917A1 (de) * | 1997-11-28 | 1999-06-10 | Byk Gulden Lomberg Chemische Fabrik Gmbh | Arzneimittelzubereitung in tabletten- oder pelletform für säurelabile wirkstoffe |
| UA69413C2 (ru) * | 1998-05-22 | 2004-09-15 | Брістол-Майерс Сквібб Компані | Фармацевтическая композиция, содержащая сердцевину и энтеросолюбильную оболочку, фармацевтическая композиция в виде сфероидальных гранул, способ получения фармацевтической композиции |
-
1998
- 1998-06-08 UA UA2001021131A patent/UA73092C2/ru unknown
- 1998-08-06 EE EEP200100033A patent/EE05021B1/xx unknown
- 1998-08-06 AT AT98940790T patent/ATE268165T1/de active
- 1998-08-06 GE GEAP19985714A patent/GEP20032912B/en unknown
- 1998-08-06 TR TR2000/03577T patent/TR200003577T2/xx unknown
- 1998-08-06 ES ES98940790T patent/ES2221188T3/es not_active Expired - Lifetime
- 1998-08-06 AU AU88983/98A patent/AU750388B2/en not_active Expired
- 1998-08-06 CA CA002337885A patent/CA2337885C/en not_active Expired - Fee Related
- 1998-08-06 DE DE69824319T patent/DE69824319T2/de not_active Expired - Lifetime
- 1998-08-06 PL PL98345774A patent/PL195587B1/pl unknown
- 1998-08-06 PT PT98940790T patent/PT1098635E/pt unknown
- 1998-08-06 ID IDW20010105A patent/ID27019A/id unknown
- 1998-08-06 JP JP2000559831A patent/JP2002520350A/ja active Pending
- 1998-08-06 BR BR9815948-8A patent/BR9815948A/pt not_active Application Discontinuation
- 1998-08-06 HU HU0102659A patent/HU226492B1/hu active IP Right Revival
- 1998-08-06 EP EP98940790A patent/EP1098635B1/en not_active Expired - Lifetime
- 1998-08-06 SK SK1883-2000A patent/SK285152B6/sk not_active IP Right Cessation
- 1998-08-06 IL IL13970198A patent/IL139701A0/xx not_active IP Right Cessation
- 1998-08-06 KR KR10-2001-7000742A patent/KR100535954B1/ko not_active IP Right Cessation
- 1998-08-06 WO PCT/US1998/016323 patent/WO2000003696A1/en active IP Right Grant
- 1998-08-06 RU RU2001104535/14A patent/RU2201217C2/ru active
- 1998-08-06 CN CNB988141736A patent/CN1195499C/zh not_active Expired - Lifetime
- 1998-08-06 RO ROA200100021A patent/RO121082B1/ro unknown
- 1998-08-06 CZ CZ20010215A patent/CZ301557B6/cs not_active IP Right Cessation
- 1998-08-06 NZ NZ508298A patent/NZ508298A/en not_active IP Right Cessation
- 1998-08-06 DK DK98940790T patent/DK1098635T3/da active
-
1999
- 1999-05-20 ZA ZA9903446A patent/ZA993446B/xx unknown
- 1999-07-03 EG EG80099A patent/EG23944A/xx active
- 1999-07-14 CO CO99044569A patent/CO5090840A1/es unknown
- 1999-07-16 AR ARP990103526A patent/AR019934A1/es not_active Application Discontinuation
-
2000
- 2000-04-14 US US09/549,455 patent/US6331316B1/en not_active Expired - Lifetime
-
2001
- 2001-01-12 LT LT2001003A patent/LT4844B/lt not_active IP Right Cessation
- 2001-01-16 NO NO20010260A patent/NO330554B1/no not_active IP Right Cessation
- 2001-01-31 BG BG105203A patent/BG65443B1/bg unknown
- 2001-02-12 LV LV010019A patent/LV12638B/xx unknown
- 2001-05-25 US US09/866,501 patent/US6569457B2/en not_active Expired - Lifetime
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2648760C2 (ru) * | 2007-11-16 | 2018-03-28 | Вифор (Интернациональ) Аг | Фармацевтическая композиция, содержащая оксигидроксид железа, способ ее получения и применение |
| RU2527766C2 (ru) * | 2009-03-13 | 2014-09-10 | Тояма Кемикал Ко., Лтд. | Таблетки и гранулированные порошки, содержащие 6-фтор-3-гидрокси-2-пиразинкарбоксамид |
| RU2668499C2 (ru) * | 2015-03-12 | 2018-10-01 | Закрытое Акционерное Общество "Фармфирма "Сотекс" | Фармацевтическая композиция в форме таблеток, покрытых кишечнорастворимой оболочкой, и способ ее получения |
| EA034816B1 (ru) * | 2015-03-12 | 2020-03-25 | Закрытое Акционерное Общество "Фармфирма "Сотекс" | Фармацевтическая композиция в форме таблетки, покрытой кишечнорастворимой оболочкой, и способ ее получения |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2201217C2 (ru) | Таблетка с энтеросолюбильным покрытием и способ приготовления | |
| JP3798625B2 (ja) | 腸溶性コーティング医薬組成物および製造方法 | |
| AU2003200059B2 (en) | Pharmaceutical pellets comprising tamsulosin and a process for making the same | |
| US7122207B2 (en) | High drug load acid labile pharmaceutical composition | |
| US20010024660A1 (en) | Enteric coated pharmaceutical composition and method of manufacturing | |
| WO2002039982A1 (fr) | Composition pharmaceutique a administration orale liberee au niveau colique et son procede de preparation | |
| EP1673064A1 (en) | Pharmaceutical composition comprising anticonvulsant with taste mask coating | |
| JP4705747B2 (ja) | 薬剤組成物 | |
| RU2440104C2 (ru) | Композиция покрытия, содержащая крахмал | |
| MXPA00011974A (en) | Enteric coated pharmaceutical tablet and method of manufacturing | |
| MXPA00010963A (en) | Enteric coated pharmaceutical composition and method of manufacturing |