KR20130058762A - 혈소판-유도된 성장인자 조성물 및 그의 사용방법 - Google Patents
혈소판-유도된 성장인자 조성물 및 그의 사용방법 Download PDFInfo
- Publication number
- KR20130058762A KR20130058762A KR1020137011627A KR20137011627A KR20130058762A KR 20130058762 A KR20130058762 A KR 20130058762A KR 1020137011627 A KR1020137011627 A KR 1020137011627A KR 20137011627 A KR20137011627 A KR 20137011627A KR 20130058762 A KR20130058762 A KR 20130058762A
- Authority
- KR
- South Korea
- Prior art keywords
- bone
- pdgf
- periodontal
- tcp
- rhpdgf
- Prior art date
Links
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 title claims abstract description 123
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 title claims abstract description 123
- 238000000034 method Methods 0.000 title abstract description 26
- 239000000203 mixture Substances 0.000 title abstract description 26
- 210000000988 bone and bone Anatomy 0.000 claims abstract description 117
- 210000000845 cartilage Anatomy 0.000 claims abstract description 20
- 210000003041 ligament Anatomy 0.000 claims abstract description 20
- 239000007788 liquid Substances 0.000 claims abstract description 19
- 230000012010 growth Effects 0.000 claims abstract description 18
- 239000007787 solid Substances 0.000 claims abstract description 8
- 241000124008 Mammalia Species 0.000 claims abstract description 7
- 239000007943 implant Substances 0.000 claims description 65
- 210000004261 periodontium Anatomy 0.000 claims description 6
- 239000000969 carrier Substances 0.000 claims 2
- 230000003239 periodontal effect Effects 0.000 abstract description 53
- 210000001519 tissue Anatomy 0.000 abstract description 39
- 230000001737 promoting effect Effects 0.000 abstract description 10
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 100
- 239000001506 calcium phosphate Substances 0.000 description 40
- 230000007547 defect Effects 0.000 description 38
- 238000011282 treatment Methods 0.000 description 38
- 239000000463 material Substances 0.000 description 36
- 108090000623 proteins and genes Proteins 0.000 description 36
- 235000011010 calcium phosphates Nutrition 0.000 description 34
- 229910000389 calcium phosphate Inorganic materials 0.000 description 33
- 238000001356 surgical procedure Methods 0.000 description 31
- 230000008929 regeneration Effects 0.000 description 30
- 238000011069 regeneration method Methods 0.000 description 30
- -1 poly (phosphoester) Polymers 0.000 description 28
- 102000004169 proteins and genes Human genes 0.000 description 28
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 24
- 210000004027 cell Anatomy 0.000 description 20
- 230000000694 effects Effects 0.000 description 20
- 239000003102 growth factor Substances 0.000 description 20
- 230000035876 healing Effects 0.000 description 20
- 230000011164 ossification Effects 0.000 description 20
- 241000282472 Canis lupus familiaris Species 0.000 description 19
- 210000002808 connective tissue Anatomy 0.000 description 19
- 239000013543 active substance Substances 0.000 description 18
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 18
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 18
- 239000000243 solution Substances 0.000 description 17
- 238000012360 testing method Methods 0.000 description 17
- 238000011049 filling Methods 0.000 description 16
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 15
- 239000003937 drug carrier Substances 0.000 description 14
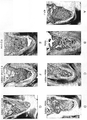
- 238000001000 micrograph Methods 0.000 description 13
- 108010017843 platelet-derived growth factor A Proteins 0.000 description 13
- 239000011780 sodium chloride Substances 0.000 description 13
- 238000002513 implantation Methods 0.000 description 12
- 210000002379 periodontal ligament Anatomy 0.000 description 12
- 239000011230 binding agent Substances 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 10
- 230000008468 bone growth Effects 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 10
- 239000000833 heterodimer Substances 0.000 description 9
- 239000002245 particle Substances 0.000 description 9
- 102000004196 processed proteins & peptides Human genes 0.000 description 9
- 108090000765 processed proteins & peptides Proteins 0.000 description 9
- 108010081589 Becaplermin Proteins 0.000 description 8
- 241001465754 Metazoa Species 0.000 description 8
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 8
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 8
- 239000000316 bone substitute Substances 0.000 description 8
- 230000004069 differentiation Effects 0.000 description 8
- 239000000710 homodimer Substances 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 239000003242 anti bacterial agent Substances 0.000 description 7
- 229940088710 antibiotic agent Drugs 0.000 description 7
- 210000004369 blood Anatomy 0.000 description 7
- 239000008280 blood Substances 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 239000012876 carrier material Substances 0.000 description 7
- 210000002381 plasma Anatomy 0.000 description 7
- 229920001184 polypeptide Polymers 0.000 description 7
- 239000007974 sodium acetate buffer Substances 0.000 description 7
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 7
- 238000002054 transplantation Methods 0.000 description 7
- 108010049931 Bone Morphogenetic Protein 2 Proteins 0.000 description 6
- 102100024506 Bone morphogenetic protein 2 Human genes 0.000 description 6
- 102100037596 Platelet-derived growth factor subunit A Human genes 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000000499 gel Substances 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 208000028169 periodontal disease Diseases 0.000 description 6
- 210000004623 platelet-rich plasma Anatomy 0.000 description 6
- 230000008439 repair process Effects 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 235000019731 tricalcium phosphate Nutrition 0.000 description 6
- 230000029663 wound healing Effects 0.000 description 6
- 108010049870 Bone Morphogenetic Protein 7 Proteins 0.000 description 5
- 102100022544 Bone morphogenetic protein 7 Human genes 0.000 description 5
- 241000282412 Homo Species 0.000 description 5
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 239000013060 biological fluid Substances 0.000 description 5
- 239000000306 component Substances 0.000 description 5
- 230000001976 improved effect Effects 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 102000005962 receptors Human genes 0.000 description 5
- 108020003175 receptors Proteins 0.000 description 5
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 4
- 229920001661 Chitosan Polymers 0.000 description 4
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 4
- 229910019142 PO4 Inorganic materials 0.000 description 4
- 206010052428 Wound Diseases 0.000 description 4
- 208000027418 Wounds and injury Diseases 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 238000001574 biopsy Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 4
- 229910003460 diamond Inorganic materials 0.000 description 4
- 239000010432 diamond Substances 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 208000014674 injury Diseases 0.000 description 4
- 239000011159 matrix material Substances 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 210000000963 osteoblast Anatomy 0.000 description 4
- XQYZDYMELSJDRZ-UHFFFAOYSA-N papaverine Chemical compound C1=C(OC)C(OC)=CC=C1CC1=NC=CC2=CC(OC)=C(OC)C=C12 XQYZDYMELSJDRZ-UHFFFAOYSA-N 0.000 description 4
- CPJSUEIXXCENMM-UHFFFAOYSA-N phenacetin Chemical compound CCOC1=CC=C(NC(C)=O)C=C1 CPJSUEIXXCENMM-UHFFFAOYSA-N 0.000 description 4
- 235000021317 phosphate Nutrition 0.000 description 4
- 239000000376 reactant Substances 0.000 description 4
- 238000002271 resection Methods 0.000 description 4
- 239000012064 sodium phosphate buffer Substances 0.000 description 4
- 230000009885 systemic effect Effects 0.000 description 4
- 230000008733 trauma Effects 0.000 description 4
- 229910000391 tricalcium phosphate Inorganic materials 0.000 description 4
- 229940078499 tricalcium phosphate Drugs 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 108010059616 Activins Proteins 0.000 description 3
- 229930003347 Atropine Natural products 0.000 description 3
- 108010049974 Bone Morphogenetic Protein 6 Proteins 0.000 description 3
- 102100022525 Bone morphogenetic protein 6 Human genes 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- RKUNBYITZUJHSG-UHFFFAOYSA-N Hyosciamin-hydrochlorid Natural products CN1C(C2)CCC1CC2OC(=O)C(CO)C1=CC=CC=C1 RKUNBYITZUJHSG-UHFFFAOYSA-N 0.000 description 3
- 102100026818 Inhibin beta E chain Human genes 0.000 description 3
- 102000002746 Inhibins Human genes 0.000 description 3
- 108010004250 Inhibins Proteins 0.000 description 3
- 239000004098 Tetracycline Substances 0.000 description 3
- 108010009583 Transforming Growth Factors Proteins 0.000 description 3
- 102000009618 Transforming Growth Factors Human genes 0.000 description 3
- 241000714205 Woolly monkey sarcoma virus Species 0.000 description 3
- 239000000488 activin Substances 0.000 description 3
- 238000000540 analysis of variance Methods 0.000 description 3
- 239000000935 antidepressant agent Substances 0.000 description 3
- 229940005513 antidepressants Drugs 0.000 description 3
- RKUNBYITZUJHSG-SPUOUPEWSA-N atropine Chemical compound O([C@H]1C[C@H]2CC[C@@H](C1)N2C)C(=O)C(CO)C1=CC=CC=C1 RKUNBYITZUJHSG-SPUOUPEWSA-N 0.000 description 3
- 229960000396 atropine Drugs 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 239000010836 blood and blood product Substances 0.000 description 3
- 229940125691 blood product Drugs 0.000 description 3
- 108091008816 c-sis Proteins 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- JUNWLZAGQLJVLR-UHFFFAOYSA-J calcium diphosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])(=O)OP([O-])([O-])=O JUNWLZAGQLJVLR-UHFFFAOYSA-J 0.000 description 3
- ROPDWRCJTIRLTR-UHFFFAOYSA-L calcium metaphosphate Chemical compound [Ca+2].[O-]P(=O)=O.[O-]P(=O)=O ROPDWRCJTIRLTR-UHFFFAOYSA-L 0.000 description 3
- 229940043256 calcium pyrophosphate Drugs 0.000 description 3
- 230000024245 cell differentiation Effects 0.000 description 3
- 239000004568 cement Substances 0.000 description 3
- 210000000349 chromosome Anatomy 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 230000001054 cortical effect Effects 0.000 description 3
- 235000019821 dicalcium diphosphate Nutrition 0.000 description 3
- OLSDWRNWUGHKSY-UHFFFAOYSA-J dicalcium;phosphonato phosphate;dihydrate Chemical compound O.O.[Ca+2].[Ca+2].[O-]P([O-])(=O)OP([O-])([O-])=O OLSDWRNWUGHKSY-UHFFFAOYSA-J 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 108010074702 enamel matrix proteins Proteins 0.000 description 3
- 210000002950 fibroblast Anatomy 0.000 description 3
- 210000004195 gingiva Anatomy 0.000 description 3
- KBQIPTXDQGPPIO-UHFFFAOYSA-K heptacalcium;phosphate Chemical compound [Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O KBQIPTXDQGPPIO-UHFFFAOYSA-K 0.000 description 3
- 229940088597 hormone Drugs 0.000 description 3
- 239000005556 hormone Substances 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 229960000905 indomethacin Drugs 0.000 description 3
- 239000000893 inhibin Substances 0.000 description 3
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 210000004373 mandible Anatomy 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 235000015097 nutrients Nutrition 0.000 description 3
- 229910000392 octacalcium phosphate Inorganic materials 0.000 description 3
- 230000002188 osteogenic effect Effects 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 108010000685 platelet-derived growth factor AB Proteins 0.000 description 3
- 239000011148 porous material Substances 0.000 description 3
- 208000006860 root resorption Diseases 0.000 description 3
- 210000004872 soft tissue Anatomy 0.000 description 3
- 239000007790 solid phase Substances 0.000 description 3
- YIGWVOWKHUSYER-UHFFFAOYSA-F tetracalcium;hydrogen phosphate;diphosphate Chemical compound [Ca+2].[Ca+2].[Ca+2].[Ca+2].OP([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O YIGWVOWKHUSYER-UHFFFAOYSA-F 0.000 description 3
- 235000019364 tetracycline Nutrition 0.000 description 3
- 150000003522 tetracyclines Chemical class 0.000 description 3
- BCXHDORHMMZBBZ-DORFAMGDSA-N (4r,4ar,7s,7ar,12bs)-9-methoxy-3-methyl-2,4,4a,7,7a,13-hexahydro-1h-4,12-methanobenzofuro[3,2-e]isoquinoline-7-ol;sulfuric acid Chemical compound OS(O)(=O)=O.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC.C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC BCXHDORHMMZBBZ-DORFAMGDSA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- YEJRWHAVMIAJKC-UHFFFAOYSA-N 4-Butyrolactone Chemical compound O=C1CCCO1 YEJRWHAVMIAJKC-UHFFFAOYSA-N 0.000 description 2
- 229930008281 A03AD01 - Papaverine Natural products 0.000 description 2
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 2
- 108010049951 Bone Morphogenetic Protein 3 Proteins 0.000 description 2
- 108010049955 Bone Morphogenetic Protein 4 Proteins 0.000 description 2
- 108010049976 Bone Morphogenetic Protein 5 Proteins 0.000 description 2
- 102100028726 Bone morphogenetic protein 10 Human genes 0.000 description 2
- 101710118482 Bone morphogenetic protein 10 Proteins 0.000 description 2
- 102100024504 Bone morphogenetic protein 3 Human genes 0.000 description 2
- 102100024505 Bone morphogenetic protein 4 Human genes 0.000 description 2
- 102100022526 Bone morphogenetic protein 5 Human genes 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- 102000008186 Collagen Human genes 0.000 description 2
- 108010035532 Collagen Proteins 0.000 description 2
- 229920000858 Cyclodextrin Polymers 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 2
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 2
- 102000016970 Follistatin Human genes 0.000 description 2
- 108010014612 Follistatin Proteins 0.000 description 2
- 102000027587 GPCRs class F Human genes 0.000 description 2
- 108091008884 GPCRs class F Proteins 0.000 description 2
- 102100035379 Growth/differentiation factor 5 Human genes 0.000 description 2
- 101710204282 Growth/differentiation factor 5 Proteins 0.000 description 2
- 102100035368 Growth/differentiation factor 6 Human genes 0.000 description 2
- 101710204281 Growth/differentiation factor 6 Proteins 0.000 description 2
- RPTUSVTUFVMDQK-UHFFFAOYSA-N Hidralazin Chemical compound C1=CC=C2C(NN)=NN=CC2=C1 RPTUSVTUFVMDQK-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 2
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108010025020 Nerve Growth Factor Proteins 0.000 description 2
- 102000007072 Nerve Growth Factors Human genes 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 101710103494 Platelet-derived growth factor subunit B Proteins 0.000 description 2
- 229920001244 Poly(D,L-lactide) Polymers 0.000 description 2
- 229920000954 Polyglycolide Polymers 0.000 description 2
- 229920000331 Polyhydroxybutyrate Polymers 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 229920005654 Sephadex Polymers 0.000 description 2
- 239000012507 Sephadex™ Substances 0.000 description 2
- 102000013275 Somatomedins Human genes 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- 208000002847 Surgical Wound Diseases 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- 108010049264 Teriparatide Proteins 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- 101100472152 Trypanosoma brucei brucei (strain 927/4 GUTat10.1) REL1 gene Proteins 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 description 2
- 238000010669 acid-base reaction Methods 0.000 description 2
- UCTWMZQNUQWSLP-UHFFFAOYSA-N adrenaline Chemical compound CNCC(O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-UHFFFAOYSA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- OFCNXPDARWKPPY-UHFFFAOYSA-N allopurinol Chemical compound OC1=NC=NC2=C1C=NN2 OFCNXPDARWKPPY-UHFFFAOYSA-N 0.000 description 2
- 229960003459 allopurinol Drugs 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 229960003437 aminoglutethimide Drugs 0.000 description 2
- 229940035676 analgesics Drugs 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 239000000730 antalgic agent Substances 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 229940125681 anticonvulsant agent Drugs 0.000 description 2
- 239000001961 anticonvulsive agent Substances 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 230000003416 augmentation Effects 0.000 description 2
- WZPBZJONDBGPKJ-VEHQQRBSSA-N aztreonam Chemical compound O=C1N(S([O-])(=O)=O)[C@@H](C)[C@@H]1NC(=O)C(=N/OC(C)(C)C(O)=O)\C1=CSC([NH3+])=N1 WZPBZJONDBGPKJ-VEHQQRBSSA-N 0.000 description 2
- 229960003644 aztreonam Drugs 0.000 description 2
- 239000012503 blood component Substances 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 210000002805 bone matrix Anatomy 0.000 description 2
- 230000010478 bone regeneration Effects 0.000 description 2
- 230000010072 bone remodeling Effects 0.000 description 2
- YYRMJZQKEFZXMX-UHFFFAOYSA-L calcium bis(dihydrogenphosphate) Chemical compound [Ca+2].OP(O)([O-])=O.OP(O)([O-])=O YYRMJZQKEFZXMX-UHFFFAOYSA-L 0.000 description 2
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 229940105329 carboxymethylcellulose Drugs 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 230000003399 chemotactic effect Effects 0.000 description 2
- YZIYKJHYYHPJIB-UUPCJSQJSA-N chlorhexidine gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O.C1=CC(Cl)=CC=C1NC(=N)NC(=N)NCCCCCCNC(=N)NC(=N)NC1=CC=C(Cl)C=C1 YZIYKJHYYHPJIB-UUPCJSQJSA-N 0.000 description 2
- 229960003333 chlorhexidine gluconate Drugs 0.000 description 2
- 102000006533 chordin Human genes 0.000 description 2
- 108010008846 chordin Proteins 0.000 description 2
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 2
- 229960003871 codeine sulfate Drugs 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 229920001577 copolymer Polymers 0.000 description 2
- 230000001186 cumulative effect Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- RBLGLDWTCZMLRW-UHFFFAOYSA-K dicalcium phosphate dihydrate Substances O.O.[Ca+2].[Ca+2].[O-]P([O-])([O-])=O RBLGLDWTCZMLRW-UHFFFAOYSA-K 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 238000011833 dog model Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000004821 effect on bone Effects 0.000 description 2
- 210000002889 endothelial cell Anatomy 0.000 description 2
- 239000002532 enzyme inhibitor Substances 0.000 description 2
- 229920000295 expanded polytetrafluoroethylene Polymers 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 229940126864 fibroblast growth factor Drugs 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 239000010408 film Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 229960001680 ibuprofen Drugs 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 238000001764 infiltration Methods 0.000 description 2
- 230000008595 infiltration Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 238000007726 management method Methods 0.000 description 2
- 210000002050 maxilla Anatomy 0.000 description 2
- 229910000150 monocalcium phosphate Inorganic materials 0.000 description 2
- 235000019691 monocalcium phosphate Nutrition 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 229960004715 morphine sulfate Drugs 0.000 description 2
- GRVOTVYEFDAHCL-RTSZDRIGSA-N morphine sulfate pentahydrate Chemical compound O.O.O.O.O.OS(O)(=O)=O.O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O.O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O GRVOTVYEFDAHCL-RTSZDRIGSA-N 0.000 description 2
- 229940035363 muscle relaxants Drugs 0.000 description 2
- 239000003158 myorelaxant agent Substances 0.000 description 2
- 229920005615 natural polymer Polymers 0.000 description 2
- 108700007229 noggin Proteins 0.000 description 2
- 102000045246 noggin Human genes 0.000 description 2
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 2
- 229960001789 papaverine Drugs 0.000 description 2
- 229960005489 paracetamol Drugs 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 229940056360 penicillin g Drugs 0.000 description 2
- 201000001245 periodontitis Diseases 0.000 description 2
- 229960003893 phenacetin Drugs 0.000 description 2
- 229960002895 phenylbutazone Drugs 0.000 description 2
- VYMDGNCVAMGZFE-UHFFFAOYSA-N phenylbutazonum Chemical compound O=C1C(CCCC)C(=O)N(C=2C=CC=CC=2)N1C1=CC=CC=C1 VYMDGNCVAMGZFE-UHFFFAOYSA-N 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- 108010017992 platelet-derived growth factor C Proteins 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001432 poly(L-lactide) Polymers 0.000 description 2
- 239000005015 poly(hydroxybutyrate) Substances 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 2
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 2
- 229920001610 polycaprolactone Polymers 0.000 description 2
- 239000004633 polyglycolic acid Substances 0.000 description 2
- 239000004626 polylactic acid Substances 0.000 description 2
- 239000004926 polymethyl methacrylate Substances 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 230000002980 postoperative effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 150000003180 prostaglandins Chemical class 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 108700021652 sis Genes Proteins 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 229960000894 sulindac Drugs 0.000 description 2
- MLKXDPUZXIRXEP-MFOYZWKCSA-N sulindac Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)=O)C=C1 MLKXDPUZXIRXEP-MFOYZWKCSA-N 0.000 description 2
- 238000011477 surgical intervention Methods 0.000 description 2
- 229920001059 synthetic polymer Polymers 0.000 description 2
- OGBMKVWORPGQRR-UMXFMPSGSA-N teriparatide Chemical compound C([C@H](NC(=O)[C@H](CCSC)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)C(C)C)[C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CNC=N1 OGBMKVWORPGQRR-UMXFMPSGSA-N 0.000 description 2
- GBNXLQPMFAUCOI-UHFFFAOYSA-H tetracalcium;oxygen(2-);diphosphate Chemical compound [O-2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O GBNXLQPMFAUCOI-UHFFFAOYSA-H 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 239000003634 thrombocyte concentrate Substances 0.000 description 2
- 230000008467 tissue growth Effects 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 210000001036 tooth cervix Anatomy 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 239000011800 void material Substances 0.000 description 2
- WWYNJERNGUHSAO-XUDSTZEESA-N (+)-Norgestrel Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](CC)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 WWYNJERNGUHSAO-XUDSTZEESA-N 0.000 description 1
- QCHFTSOMWOSFHM-WPRPVWTQSA-N (+)-Pilocarpine Chemical compound C1OC(=O)[C@@H](CC)[C@H]1CC1=CN=CN1C QCHFTSOMWOSFHM-WPRPVWTQSA-N 0.000 description 1
- DNXHEGUUPJUMQT-UHFFFAOYSA-N (+)-estrone Natural products OC1=CC=C2C3CCC(C)(C(CC4)=O)C4C3CCC2=C1 DNXHEGUUPJUMQT-UHFFFAOYSA-N 0.000 description 1
- PROQIPRRNZUXQM-UHFFFAOYSA-N (16alpha,17betaOH)-Estra-1,3,5(10)-triene-3,16,17-triol Natural products OC1=CC=C2C3CCC(C)(C(C(O)C4)O)C4C3CCC2=C1 PROQIPRRNZUXQM-UHFFFAOYSA-N 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- IVTMXOXVAHXCHI-YXLMWLKOSA-N (2s)-2-amino-3-(3,4-dihydroxyphenyl)propanoic acid;(2s)-3-(3,4-dihydroxyphenyl)-2-hydrazinyl-2-methylpropanoic acid Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1.NN[C@@](C(O)=O)(C)CC1=CC=C(O)C(O)=C1 IVTMXOXVAHXCHI-YXLMWLKOSA-N 0.000 description 1
- NBXPLBPWMYNZTC-IDYPWDAWSA-N (2s,5r,6r)-6-[[(2r)-2-[(4-ethyl-2,3-dioxopiperazine-1-carbonyl)amino]-2-phenylacetyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid;hydrate Chemical compound O.O=C1C(=O)N(CC)CCN1C(=O)N[C@H](C=1C=CC=CC=1)C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 NBXPLBPWMYNZTC-IDYPWDAWSA-N 0.000 description 1
- FZKWRPSUNUOXKJ-CVHRZJFOSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide;hydrate Chemical compound O.C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O FZKWRPSUNUOXKJ-CVHRZJFOSA-N 0.000 description 1
- FFTVPQUHLQBXQZ-KVUCHLLUSA-N (4s,4as,5ar,12ar)-4,7-bis(dimethylamino)-1,10,11,12a-tetrahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1C2=C(N(C)C)C=CC(O)=C2C(O)=C2[C@@H]1C[C@H]1[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]1(O)C2=O FFTVPQUHLQBXQZ-KVUCHLLUSA-N 0.000 description 1
- GUXHBMASAHGULD-SEYHBJAFSA-N (4s,4as,5as,6s,12ar)-7-chloro-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1([C@H]2O)=C(Cl)C=CC(O)=C1C(O)=C1[C@@H]2C[C@H]2[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]2(O)C1=O GUXHBMASAHGULD-SEYHBJAFSA-N 0.000 description 1
- HAKRSIFCTAKBRD-TYFJVFSVSA-N (8s,9s,10r,13s,14s,17s)-17-acetyl-1-methoxy-10,13-dimethyl-1,2,6,7,8,9,11,12,14,15,16,17-dodecahydrocyclopenta[a]phenanthren-3-one Chemical compound C1C[C@@H]2[C@@]3(C)C(OC)CC(=O)C=C3CC[C@H]2[C@@H]2CC[C@H](C(C)=O)[C@]21C HAKRSIFCTAKBRD-TYFJVFSVSA-N 0.000 description 1
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 description 1
- 229930182837 (R)-adrenaline Natural products 0.000 description 1
- WHTVZRBIWZFKQO-AWEZNQCLSA-N (S)-chloroquine Chemical compound ClC1=CC=C2C(N[C@@H](C)CCCN(CC)CC)=CC=NC2=C1 WHTVZRBIWZFKQO-AWEZNQCLSA-N 0.000 description 1
- TWBNMYSKRDRHAT-RCWTXCDDSA-N (S)-timolol hemihydrate Chemical class O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 TWBNMYSKRDRHAT-RCWTXCDDSA-N 0.000 description 1
- KFHHPVVJLXPHJL-UPHRSURJSA-N (z)-4-hydroperoxy-4-oxobut-2-enoic acid Chemical compound OOC(=O)\C=C/C(O)=O KFHHPVVJLXPHJL-UPHRSURJSA-N 0.000 description 1
- DBPWSSGDRRHUNT-CEGNMAFCSA-N 17α-hydroxyprogesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 DBPWSSGDRRHUNT-CEGNMAFCSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- GFRUPHOKLBPHTQ-UHFFFAOYSA-N 2-(2-cyclohexyl-2-hydroxy-1-oxo-2-phenylethoxy)ethyl-diethyl-methylammonium Chemical compound C=1C=CC=CC=1C(O)(C(=O)OCC[N+](C)(CC)CC)C1CCCCC1 GFRUPHOKLBPHTQ-UHFFFAOYSA-N 0.000 description 1
- QUCRZIVNKYXKAM-UHFFFAOYSA-N 2-(dimethylamino)-1-phenothiazin-10-ylpropan-1-one;hydron;chloride Chemical compound Cl.C1=CC=C2N(C(=O)C(N(C)C)C)C3=CC=CC=C3SC2=C1 QUCRZIVNKYXKAM-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- TYIRELDXFZWDBV-UHFFFAOYSA-N 2-amino-1-cyclooctylethanol;hydrochloride Chemical compound Cl.NCC(O)C1CCCCCCC1 TYIRELDXFZWDBV-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical compound N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- NYEZZYQZRQDLEH-UHFFFAOYSA-N 2-ethyl-4,5-dihydro-1,3-oxazole Chemical compound CCC1=NCCO1 NYEZZYQZRQDLEH-UHFFFAOYSA-N 0.000 description 1
- VDCDWNDTNSWDFJ-UHFFFAOYSA-N 3,5-dinitrocatechol Chemical compound OC1=CC([N+]([O-])=O)=CC([N+]([O-])=O)=C1O VDCDWNDTNSWDFJ-UHFFFAOYSA-N 0.000 description 1
- DVLFYONBTKHTER-UHFFFAOYSA-N 3-(N-morpholino)propanesulfonic acid Chemical compound OS(=O)(=O)CCCN1CCOCC1 DVLFYONBTKHTER-UHFFFAOYSA-N 0.000 description 1
- OFKWWALNMPEOSZ-UHFFFAOYSA-N 3-(hydrazinylmethyl)phenol Chemical compound NNCC1=CC=CC(O)=C1 OFKWWALNMPEOSZ-UHFFFAOYSA-N 0.000 description 1
- NOIIUHRQUVNIDD-UHFFFAOYSA-N 3-[[oxo(pyridin-4-yl)methyl]hydrazo]-N-(phenylmethyl)propanamide Chemical compound C=1C=CC=CC=1CNC(=O)CCNNC(=O)C1=CC=NC=C1 NOIIUHRQUVNIDD-UHFFFAOYSA-N 0.000 description 1
- UQTZMGFTRHFAAM-ZETCQYMHSA-N 3-iodo-L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(I)=C1 UQTZMGFTRHFAAM-ZETCQYMHSA-N 0.000 description 1
- DEHHYUARFKIUDI-UHFFFAOYSA-N 3-phenylprop-2-yn-1-amine Chemical compound NCC#CC1=CC=CC=C1 DEHHYUARFKIUDI-UHFFFAOYSA-N 0.000 description 1
- IICCLYANAQEHCI-UHFFFAOYSA-N 4,5,6,7-tetrachloro-3',6'-dihydroxy-2',4',5',7'-tetraiodospiro[2-benzofuran-3,9'-xanthene]-1-one Chemical compound O1C(=O)C(C(=C(Cl)C(Cl)=C2Cl)Cl)=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 IICCLYANAQEHCI-UHFFFAOYSA-N 0.000 description 1
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 1
- MFVJXLPANKSLLD-UHFFFAOYSA-N 6-[2-[4-[(4-fluorophenyl)-phenylmethylidene]-1-piperidinyl]ethyl]-7-methyl-5-thiazolo[3,2-a]pyrimidinone Chemical compound CC=1N=C2SC=CN2C(=O)C=1CCN(CC1)CCC1=C(C=1C=CC(F)=CC=1)C1=CC=CC=C1 MFVJXLPANKSLLD-UHFFFAOYSA-N 0.000 description 1
- RFRMMZAKBNXNHE-UHFFFAOYSA-N 6-[4,6-dihydroxy-5-(2-hydroxyethoxy)-2-(hydroxymethyl)oxan-3-yl]oxy-2-(hydroxymethyl)-5-(2-hydroxypropoxy)oxane-3,4-diol Chemical compound CC(O)COC1C(O)C(O)C(CO)OC1OC1C(O)C(OCCO)C(O)OC1CO RFRMMZAKBNXNHE-UHFFFAOYSA-N 0.000 description 1
- NOOBQTYVTDBXTL-UHFFFAOYSA-N 6-hydroxy-1,3-benzothiazole-2-sulfonamide Chemical compound C1=C(O)C=C2SC(S(=O)(=O)N)=NC2=C1 NOOBQTYVTDBXTL-UHFFFAOYSA-N 0.000 description 1
- BQQCJKQXLQZKTG-UHFFFAOYSA-N 7-hydrazinyl-3-prop-2-enyl-1,2,4,5,6,7,7a,13-octahydro-4,12-methanobenzofuro[3,2-e]isoquinoline-4a,9-diol Chemical compound NNC1CCC2(O)C(N(CC3)CC=C)CC4=CC=C(O)C5=C4C23C1O5 BQQCJKQXLQZKTG-UHFFFAOYSA-N 0.000 description 1
- 229930000680 A04AD01 - Scopolamine Natural products 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 229920001450 Alpha-Cyclodextrin Polymers 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- WZPBZJONDBGPKJ-UHFFFAOYSA-N Antibiotic SQ 26917 Natural products O=C1N(S(O)(=O)=O)C(C)C1NC(=O)C(=NOC(C)(C)C(O)=O)C1=CSC(N)=N1 WZPBZJONDBGPKJ-UHFFFAOYSA-N 0.000 description 1
- 108010001478 Bacitracin Proteins 0.000 description 1
- 206010065687 Bone loss Diseases 0.000 description 1
- 102000003928 Bone morphogenetic protein 15 Human genes 0.000 description 1
- 108090000349 Bone morphogenetic protein 15 Proteins 0.000 description 1
- 102100022545 Bone morphogenetic protein 8B Human genes 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 229920000049 Carbon (fiber) Polymers 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 229930186147 Cephalosporin Natural products 0.000 description 1
- 241001227713 Chiron Species 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- GHXZTYHSJHQHIJ-UHFFFAOYSA-N Chlorhexidine Chemical compound C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 GHXZTYHSJHQHIJ-UHFFFAOYSA-N 0.000 description 1
- 229920001287 Chondroitin sulfate Polymers 0.000 description 1
- 108010078777 Colistin Proteins 0.000 description 1
- 102400000739 Corticotropin Human genes 0.000 description 1
- 101800000414 Corticotropin Proteins 0.000 description 1
- 244000007835 Cyamopsis tetragonoloba Species 0.000 description 1
- VVNCNSJFMMFHPL-VKHMYHEASA-N D-penicillamine Chemical compound CC(C)(S)[C@@H](N)C(O)=O VVNCNSJFMMFHPL-VKHMYHEASA-N 0.000 description 1
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- FMTDIUIBLCQGJB-UHFFFAOYSA-N Demethylchlortetracyclin Natural products C1C2C(O)C3=C(Cl)C=CC(O)=C3C(=O)C2=C(O)C2(O)C1C(N(C)C)C(O)=C(C(N)=O)C2=O FMTDIUIBLCQGJB-UHFFFAOYSA-N 0.000 description 1
- 208000006558 Dental Calculus Diseases 0.000 description 1
- HCYAFALTSJYZDH-UHFFFAOYSA-N Desimpramine Chemical compound C1CC2=CC=CC=C2N(CCCNC)C2=CC=CC=C21 HCYAFALTSJYZDH-UHFFFAOYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 208000008960 Diabetic foot Diseases 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- VWLHWLSRQJQWRG-UHFFFAOYSA-O Edrophonum Chemical compound CC[N+](C)(C)C1=CC=CC(O)=C1 VWLHWLSRQJQWRG-UHFFFAOYSA-O 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010041308 Endothelial Growth Factors Proteins 0.000 description 1
- 229940121889 Endothelin A receptor antagonist Drugs 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102400001368 Epidermal growth factor Human genes 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- DNXHEGUUPJUMQT-CBZIJGRNSA-N Estrone Chemical compound OC1=CC=C2[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1 DNXHEGUUPJUMQT-CBZIJGRNSA-N 0.000 description 1
- BFPYWIDHMRZLRN-SLHNCBLASA-N Ethinyl estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 BFPYWIDHMRZLRN-SLHNCBLASA-N 0.000 description 1
- 239000001116 FEMA 4028 Substances 0.000 description 1
- 108010080379 Fibrin Tissue Adhesive Proteins 0.000 description 1
- 238000000729 Fisher's exact test Methods 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 244000060234 Gmelina philippensis Species 0.000 description 1
- 108010090290 Growth Differentiation Factor 2 Proteins 0.000 description 1
- 102100040898 Growth/differentiation factor 11 Human genes 0.000 description 1
- 101710194452 Growth/differentiation factor 11 Proteins 0.000 description 1
- 102100040892 Growth/differentiation factor 2 Human genes 0.000 description 1
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 102000003693 Hedgehog Proteins Human genes 0.000 description 1
- 108090000031 Hedgehog Proteins Proteins 0.000 description 1
- 102000003893 Histone acetyltransferases Human genes 0.000 description 1
- 108090000246 Histone acetyltransferases Proteins 0.000 description 1
- 101000899368 Homo sapiens Bone morphogenetic protein 8B Proteins 0.000 description 1
- 108010003272 Hyaluronate lyase Proteins 0.000 description 1
- 102000001974 Hyaluronidases Human genes 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920001612 Hydroxyethyl starch Polymers 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- STECJAGHUSJQJN-GAUPFVANSA-N Hyoscine Natural products C1([C@H](CO)C(=O)OC2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-GAUPFVANSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108090001117 Insulin-Like Growth Factor II Proteins 0.000 description 1
- 102000048143 Insulin-Like Growth Factor II Human genes 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102100039068 Interleukin-10 Human genes 0.000 description 1
- 108090000174 Interleukin-10 Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- NHTGHBARYWONDQ-JTQLQIEISA-N L-α-methyl-Tyrosine Chemical compound OC(=O)[C@](N)(C)CC1=CC=C(O)C=C1 NHTGHBARYWONDQ-JTQLQIEISA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- OJMMVQQUTAEWLP-UHFFFAOYSA-N Lincomycin Natural products CN1CC(CCC)CC1C(=O)NC(C(C)O)C1C(O)C(O)C(O)C(SC)O1 OJMMVQQUTAEWLP-UHFFFAOYSA-N 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 239000007993 MOPS buffer Substances 0.000 description 1
- 241000724182 Macron Species 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- XADCESSVHJOZHK-UHFFFAOYSA-N Meperidine Chemical compound C=1C=CC=CC=1C1(C(=O)OCC)CCN(C)CC1 XADCESSVHJOZHK-UHFFFAOYSA-N 0.000 description 1
- RJQXTJLFIWVMTO-TYNCELHUSA-N Methicillin Chemical compound COC1=CC=CC(OC)=C1C(=O)N[C@@H]1C(=O)N2[C@@H](C(O)=O)C(C)(C)S[C@@H]21 RJQXTJLFIWVMTO-TYNCELHUSA-N 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 102000014962 Monocyte Chemoattractant Proteins Human genes 0.000 description 1
- 108010064136 Monocyte Chemoattractant Proteins Proteins 0.000 description 1
- 101100175313 Mus musculus Gdf3 gene Proteins 0.000 description 1
- XKCWNEVAXQCMGP-YFKPBYRVSA-N N(5)-methyl-L-arginine Chemical compound NC(=N)N(C)CCC[C@H](N)C(O)=O XKCWNEVAXQCMGP-YFKPBYRVSA-N 0.000 description 1
- STECJAGHUSJQJN-UHFFFAOYSA-N N-Methyl-scopolamin Natural products C1C(C2C3O2)N(C)C3CC1OC(=O)C(CO)C1=CC=CC=C1 STECJAGHUSJQJN-UHFFFAOYSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- SXJIZQPZESTWLD-UHFFFAOYSA-N N-[6-(propan-2-ylthio)-1H-benzimidazol-2-yl]carbamic acid methyl ester Chemical compound C1=C(SC(C)C)C=C2NC(NC(=O)OC)=NC2=C1 SXJIZQPZESTWLD-UHFFFAOYSA-N 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- ONBWJWYUHXVEJS-ZTYRTETDSA-N Normorphine Chemical compound C([C@@H](NCC1)[C@@H]2C=C[C@@H]3O)C4=CC=C(O)C5=C4[C@@]21[C@H]3O5 ONBWJWYUHXVEJS-ZTYRTETDSA-N 0.000 description 1
- PHVGLTMQBUFIQQ-UHFFFAOYSA-N Nortryptiline Chemical compound C1CC2=CC=CC=C2C(=CCCNC)C2=CC=CC=C21 PHVGLTMQBUFIQQ-UHFFFAOYSA-N 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108010061100 Nucleoproteins Proteins 0.000 description 1
- 102000011931 Nucleoproteins Human genes 0.000 description 1
- 206010031252 Osteomyelitis Diseases 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 102400000050 Oxytocin Human genes 0.000 description 1
- 101800000989 Oxytocin Proteins 0.000 description 1
- XNOPRXBHLZRZKH-UHFFFAOYSA-N Oxytocin Natural products N1C(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CC(C)C)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C(C(C)CC)NC(=O)C1CC1=CC=C(O)C=C1 XNOPRXBHLZRZKH-UHFFFAOYSA-N 0.000 description 1
- 108091008606 PDGF receptors Proteins 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- 229930195708 Penicillin V Natural products 0.000 description 1
- QGMRQYFBGABWDR-UHFFFAOYSA-M Pentobarbital sodium Chemical compound [Na+].CCCC(C)C1(CC)C(=O)NC(=O)[N-]C1=O QGMRQYFBGABWDR-UHFFFAOYSA-M 0.000 description 1
- 108010047386 Pituitary Hormones Proteins 0.000 description 1
- 102000006877 Pituitary Hormones Human genes 0.000 description 1
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 1
- 102100040990 Platelet-derived growth factor subunit B Human genes 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229920002518 Polyallylamine hydrochloride Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 108010093965 Polymyxin B Proteins 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical class C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 1
- KNAHARQHSZJURB-UHFFFAOYSA-N Propylthiouracile Chemical compound CCCC1=CC(=O)NC(=S)N1 KNAHARQHSZJURB-UHFFFAOYSA-N 0.000 description 1
- 102000016611 Proteoglycans Human genes 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- QCHFTSOMWOSFHM-UHFFFAOYSA-N SJ000285536 Natural products C1OC(=O)C(CC)C1CC1=CN=CN1C QCHFTSOMWOSFHM-UHFFFAOYSA-N 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 208000002599 Smear Layer Diseases 0.000 description 1
- 229920002385 Sodium hyaluronate Polymers 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- WKDDRNSBRWANNC-UHFFFAOYSA-N Thienamycin Natural products C1C(SCCN)=C(C(O)=O)N2C(=O)C(C(O)C)C21 WKDDRNSBRWANNC-UHFFFAOYSA-N 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 102000005497 Thymidylate Synthase Human genes 0.000 description 1
- 208000031737 Tissue Adhesions Diseases 0.000 description 1
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 1
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 108010059993 Vancomycin Proteins 0.000 description 1
- GXBMIBRIOWHPDT-UHFFFAOYSA-N Vasopressin Natural products N1C(=O)C(CC=2C=C(O)C=CC=2)NC(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C1CC1=CC=CC=C1 GXBMIBRIOWHPDT-UHFFFAOYSA-N 0.000 description 1
- 108010004977 Vasopressins Proteins 0.000 description 1
- 102000002852 Vasopressins Human genes 0.000 description 1
- NJSSICCENMLTKO-HRCBOCMUSA-N [(1r,2s,4r,5r)-3-hydroxy-4-(4-methylphenyl)sulfonyloxy-6,8-dioxabicyclo[3.2.1]octan-2-yl] 4-methylbenzenesulfonate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)O[C@H]1C(O)[C@@H](OS(=O)(=O)C=2C=CC(C)=CC=2)[C@@H]2OC[C@H]1O2 NJSSICCENMLTKO-HRCBOCMUSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 229960005054 acepromazine Drugs 0.000 description 1
- NOSIYYJFMPDDSA-UHFFFAOYSA-N acepromazine Chemical compound C1=C(C(C)=O)C=C2N(CCCN(C)C)C3=CC=CC=C3SC2=C1 NOSIYYJFMPDDSA-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000003732 agents acting on the eye Substances 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940061720 alpha hydroxy acid Drugs 0.000 description 1
- 150000001280 alpha hydroxy acids Chemical class 0.000 description 1
- 108010027597 alpha-chymotrypsin Proteins 0.000 description 1
- HFHDHCJBZVLPGP-RWMJIURBSA-N alpha-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO HFHDHCJBZVLPGP-RWMJIURBSA-N 0.000 description 1
- 229940043377 alpha-cyclodextrin Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 229960004821 amikacin Drugs 0.000 description 1
- LKCWBDHBTVXHDL-RMDFUYIESA-N amikacin Chemical compound O([C@@H]1[C@@H](N)C[C@H]([C@@H]([C@H]1O)O[C@@H]1[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O1)O)NC(=O)[C@@H](O)CCN)[C@H]1O[C@H](CN)[C@@H](O)[C@H](O)[C@H]1O LKCWBDHBTVXHDL-RMDFUYIESA-N 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 229960000836 amitriptyline Drugs 0.000 description 1
- KRMDCWKBEZIMAB-UHFFFAOYSA-N amitriptyline Chemical compound C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KRMDCWKBEZIMAB-UHFFFAOYSA-N 0.000 description 1
- 229960002519 amoxapine Drugs 0.000 description 1
- QWGDMFLQWFTERH-UHFFFAOYSA-N amoxapine Chemical compound C12=CC(Cl)=CC=C2OC2=CC=CC=C2N=C1N1CCNCC1 QWGDMFLQWFTERH-UHFFFAOYSA-N 0.000 description 1
- 229960003022 amoxicillin Drugs 0.000 description 1
- LSQZJLSUYDQPKJ-NJBDSQKTSA-N amoxicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=C(O)C=C1 LSQZJLSUYDQPKJ-NJBDSQKTSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 229940030486 androgens Drugs 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000000708 anti-progestin effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000002921 anti-spasmodic effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000013059 antihormonal agent Substances 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 239000003080 antimitotic agent Substances 0.000 description 1
- 239000003418 antiprogestin Substances 0.000 description 1
- 239000000164 antipsychotic agent Substances 0.000 description 1
- 229940005529 antipsychotics Drugs 0.000 description 1
- 229940124575 antispasmodic agent Drugs 0.000 description 1
- 229910052586 apatite Inorganic materials 0.000 description 1
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 210000004618 arterial endothelial cell Anatomy 0.000 description 1
- 229960004099 azithromycin Drugs 0.000 description 1
- MQTOSJVFKKJCRP-BICOPXKESA-N azithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)N(C)C[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 MQTOSJVFKKJCRP-BICOPXKESA-N 0.000 description 1
- 229960003071 bacitracin Drugs 0.000 description 1
- 229930184125 bacitracin Natural products 0.000 description 1
- CLKOFPXJLQSYAH-ABRJDSQDSA-N bacitracin A Chemical compound C1SC([C@@H](N)[C@@H](C)CC)=N[C@@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]1C(=O)N[C@H](CCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2N=CNC=2)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)NCCCC1 CLKOFPXJLQSYAH-ABRJDSQDSA-N 0.000 description 1
- 239000000022 bacteriostatic agent Substances 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Natural products NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- WHGYBXFWUBPSRW-FOUAGVGXSA-N beta-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO WHGYBXFWUBPSRW-FOUAGVGXSA-N 0.000 description 1
- 235000011175 beta-cyclodextrine Nutrition 0.000 description 1
- 229960004853 betadex Drugs 0.000 description 1
- 210000004763 bicuspid Anatomy 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000003592 biomimetic effect Effects 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000036760 body temperature Effects 0.000 description 1
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 1
- 229960001736 buprenorphine Drugs 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 229960003669 carbenicillin Drugs 0.000 description 1
- FPPNZSSZRUTDAP-UWFZAAFLSA-N carbenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)C(C(O)=O)C1=CC=CC=C1 FPPNZSSZRUTDAP-UWFZAAFLSA-N 0.000 description 1
- QTAOMKOIBXZKND-PPHPATTJSA-N carbidopa Chemical compound O.NN[C@@](C(O)=O)(C)CC1=CC=C(O)C(O)=C1 QTAOMKOIBXZKND-PPHPATTJSA-N 0.000 description 1
- 229960004205 carbidopa Drugs 0.000 description 1
- 239000004917 carbon fiber Substances 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000022159 cartilage development Effects 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000008619 cell matrix interaction Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229940124587 cephalosporin Drugs 0.000 description 1
- 150000001780 cephalosporins Chemical class 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 238000000546 chi-square test Methods 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 229960003260 chlorhexidine Drugs 0.000 description 1
- OSLQQDMGHVQLCH-HRMPSQMFSA-N chlornaltrexamine Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CC[C@H]5N(CCCl)CCCl)O)CC1)O)CC1CC1 OSLQQDMGHVQLCH-HRMPSQMFSA-N 0.000 description 1
- 229940127069 chlornaltrexamine Drugs 0.000 description 1
- 229960003677 chloroquine Drugs 0.000 description 1
- WHTVZRBIWZFKQO-UHFFFAOYSA-N chloroquine Natural products ClC1=CC=C2C(NC(C)CCCN(CC)CC)=CC=NC2=C1 WHTVZRBIWZFKQO-UHFFFAOYSA-N 0.000 description 1
- SOYKEARSMXGVTM-UHFFFAOYSA-N chlorphenamine Chemical compound C=1C=CC=NC=1C(CCN(C)C)C1=CC=C(Cl)C=C1 SOYKEARSMXGVTM-UHFFFAOYSA-N 0.000 description 1
- 229960003291 chlorphenamine Drugs 0.000 description 1
- 229940059329 chondroitin sulfate Drugs 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- AHMIRVCNZZUANP-LPBAWZRYSA-N chrysalin Chemical compound CC(O)=O.CC(O)=O.C([C@@H](C(=O)N[C@@H](C(C)C)C(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](C)N)C1=CC=CC=C1.C([C@@H](C(=O)N[C@@H](C(C)C)C(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](C)N)C1=CC=CC=C1.C([C@@H](C(=O)N[C@@H](C(C)C)C(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](C)N)C1=CC=CC=C1 AHMIRVCNZZUANP-LPBAWZRYSA-N 0.000 description 1
- 229960001747 cinchocaine Drugs 0.000 description 1
- PUFQVTATUTYEAL-UHFFFAOYSA-N cinchocaine Chemical compound C1=CC=CC2=NC(OCCCC)=CC(C(=O)NCCN(CC)CC)=C21 PUFQVTATUTYEAL-UHFFFAOYSA-N 0.000 description 1
- 229960002626 clarithromycin Drugs 0.000 description 1
- AGOYDEPGAOXOCK-KCBOHYOISA-N clarithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@](C)([C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)OC)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 AGOYDEPGAOXOCK-KCBOHYOISA-N 0.000 description 1
- GKIRPKYJQBWNGO-OCEACIFDSA-N clomifene Chemical compound C1=CC(OCCN(CC)CC)=CC=C1C(\C=1C=CC=CC=1)=C(\Cl)C1=CC=CC=C1 GKIRPKYJQBWNGO-OCEACIFDSA-N 0.000 description 1
- 229960003608 clomifene Drugs 0.000 description 1
- 229960003326 cloxacillin Drugs 0.000 description 1
- LQOLIRLGBULYKD-JKIFEVAISA-N cloxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=CC=CC=C1Cl LQOLIRLGBULYKD-JKIFEVAISA-N 0.000 description 1
- 229960003920 cocaine Drugs 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 229960003346 colistin Drugs 0.000 description 1
- 229960005188 collagen Drugs 0.000 description 1
- 230000037319 collagen production Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 230000008473 connective tissue growth Effects 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 239000002826 coolant Substances 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- IDLFZVILOHSSID-OVLDLUHVSA-N corticotropin Chemical compound C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)NC(=O)[C@@H](N)CO)C1=CC=C(O)C=C1 IDLFZVILOHSSID-OVLDLUHVSA-N 0.000 description 1
- 229960000258 corticotropin Drugs 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000013211 curve analysis Methods 0.000 description 1
- 229960000500 cyclobenzaprine hydrochloride Drugs 0.000 description 1
- VXEAYBOGHINOKW-UHFFFAOYSA-N cyclobenzaprine hydrochloride Chemical compound Cl.C1=CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 VXEAYBOGHINOKW-UHFFFAOYSA-N 0.000 description 1
- 229960000978 cyproterone acetate Drugs 0.000 description 1
- UWFYSQMTEOIJJG-FDTZYFLXSA-N cyproterone acetate Chemical compound C1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 UWFYSQMTEOIJJG-FDTZYFLXSA-N 0.000 description 1
- POZRVZJJTULAOH-LHZXLZLDSA-N danazol Chemical compound C1[C@]2(C)[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=CC2=C1C=NO2 POZRVZJJTULAOH-LHZXLZLDSA-N 0.000 description 1
- 229960000766 danazol Drugs 0.000 description 1
- 238000013480 data collection Methods 0.000 description 1
- 238000005202 decontamination Methods 0.000 description 1
- 230000003588 decontaminative effect Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 229960002398 demeclocycline Drugs 0.000 description 1
- 210000004268 dentin Anatomy 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 229960003914 desipramine Drugs 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 229960002086 dextran Drugs 0.000 description 1
- 229960000633 dextran sulfate Drugs 0.000 description 1
- 239000003047 diacylglycerol kinase inhibitor Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- GJQPMPFPNINLKP-UHFFFAOYSA-N diclofenamide Chemical compound NS(=O)(=O)C1=CC(Cl)=C(Cl)C(S(N)(=O)=O)=C1 GJQPMPFPNINLKP-UHFFFAOYSA-N 0.000 description 1
- 229960005081 diclofenamide Drugs 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- XYYVYLMBEZUESM-UHFFFAOYSA-N dihydrocodeine Natural products C1C(N(CCC234)C)C2C=CC(=O)C3OC2=C4C1=CC=C2OC XYYVYLMBEZUESM-UHFFFAOYSA-N 0.000 description 1
- XEYBRNLFEZDVAW-ARSRFYASSA-N dinoprostone Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O XEYBRNLFEZDVAW-ARSRFYASSA-N 0.000 description 1
- 229960002986 dinoprostone Drugs 0.000 description 1
- NJDNXYGOVLYJHP-UHFFFAOYSA-L disodium;2-(3-oxido-6-oxoxanthen-9-yl)benzoate Chemical compound [Na+].[Na+].[O-]C(=O)C1=CC=CC=C1C1=C2C=CC(=O)C=C2OC2=CC([O-])=CC=C21 NJDNXYGOVLYJHP-UHFFFAOYSA-L 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 229960005426 doxepin Drugs 0.000 description 1
- ODQWQRRAPPTVAG-GZTJUZNOSA-N doxepin Chemical compound C1OC2=CC=CC=C2C(=C/CCN(C)C)/C2=CC=CC=C21 ODQWQRRAPPTVAG-GZTJUZNOSA-N 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000003062 endothelin A receptor antagonist Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 229960005139 epinephrine Drugs 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- PROQIPRRNZUXQM-ZXXIGWHRSA-N estriol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H]([C@H](O)C4)O)[C@@H]4[C@@H]3CCC2=C1 PROQIPRRNZUXQM-ZXXIGWHRSA-N 0.000 description 1
- 229960001348 estriol Drugs 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- 229960003399 estrone Drugs 0.000 description 1
- 229960002568 ethinylestradiol Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 1
- 229960004207 fentanyl citrate Drugs 0.000 description 1
- 239000000834 fixative Substances 0.000 description 1
- 230000009969 flowable effect Effects 0.000 description 1
- 229940124307 fluoroquinolone Drugs 0.000 description 1
- 229960001751 fluoxymesterone Drugs 0.000 description 1
- YLRFCQOZQXIBAB-RBZZARIASA-N fluoxymesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)C[C@@H]2O YLRFCQOZQXIBAB-RBZZARIASA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229940053641 forteo Drugs 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- GDSRMADSINPKSL-HSEONFRVSA-N gamma-cyclodextrin Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](CO)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)CO)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1CO GDSRMADSINPKSL-HSEONFRVSA-N 0.000 description 1
- 229940080345 gamma-cyclodextrin Drugs 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 208000007565 gingivitis Diseases 0.000 description 1
- 230000002518 glial effect Effects 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 150000002343 gold Chemical class 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 238000009499 grossing Methods 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000005802 health problem Effects 0.000 description 1
- VKYKSIONXSXAKP-UHFFFAOYSA-N hexamethylenetetramine Chemical compound C1N(C2)CN3CN1CN2C3 VKYKSIONXSXAKP-UHFFFAOYSA-N 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 238000002657 hormone replacement therapy Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 229960002773 hyaluronidase Drugs 0.000 description 1
- 229960002474 hydralazine Drugs 0.000 description 1
- LLPOLZWFYMWNKH-CMKMFDCUSA-N hydrocodone Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)CC(=O)[C@@H]1OC1=C2C3=CC=C1OC LLPOLZWFYMWNKH-CMKMFDCUSA-N 0.000 description 1
- 229960000240 hydrocodone Drugs 0.000 description 1
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 229940050526 hydroxyethylstarch Drugs 0.000 description 1
- 229960002899 hydroxyprogesterone Drugs 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 239000000960 hypophysis hormone Substances 0.000 description 1
- 229960002182 imipenem Drugs 0.000 description 1
- GSOSVVULSKVSLQ-JJVRHELESA-N imipenem hydrate Chemical compound O.C1C(SCCNC=N)=C(C(O)=O)N2C(=O)[C@H]([C@H](O)C)[C@H]21 GSOSVVULSKVSLQ-JJVRHELESA-N 0.000 description 1
- 229960004801 imipramine Drugs 0.000 description 1
- BCGWQEUPMDMJNV-UHFFFAOYSA-N imipramine Chemical compound C1CC2=CC=CC=C2N(CCCN(C)C)C2=CC=CC=C21 BCGWQEUPMDMJNV-UHFFFAOYSA-N 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 102000002467 interleukin receptors Human genes 0.000 description 1
- 108010093036 interleukin receptors Proteins 0.000 description 1
- 229940076144 interleukin-10 Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 230000002262 irrigation Effects 0.000 description 1
- 238000003973 irrigation Methods 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 229960004400 levonorgestrel Drugs 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- YECIFGHRMFEPJK-UHFFFAOYSA-N lidocaine hydrochloride monohydrate Chemical compound O.[Cl-].CC[NH+](CC)CC(=O)NC1=C(C)C=CC=C1C YECIFGHRMFEPJK-UHFFFAOYSA-N 0.000 description 1
- 229960005287 lincomycin Drugs 0.000 description 1
- OJMMVQQUTAEWLP-KIDUDLJLSA-N lincomycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@@H](C)O)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 OJMMVQQUTAEWLP-KIDUDLJLSA-N 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- RDOIQAHITMMDAJ-UHFFFAOYSA-N loperamide Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(C(=O)N(C)C)CCN(CC1)CCC1(O)C1=CC=C(Cl)C=C1 RDOIQAHITMMDAJ-UHFFFAOYSA-N 0.000 description 1
- 229960001571 loperamide Drugs 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 229940041033 macrolides Drugs 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- FQXXSQDCDRQNQE-UHFFFAOYSA-N markiertes Thebain Natural products COC1=CC=C2C(N(CC3)C)CC4=CC=C(OC)C5=C4C23C1O5 FQXXSQDCDRQNQE-UHFFFAOYSA-N 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 229960000901 mepacrine Drugs 0.000 description 1
- YECBIJXISLIIDS-UHFFFAOYSA-N mepyramine Chemical compound C1=CC(OC)=CC=C1CN(CCN(C)C)C1=CC=CC=N1 YECBIJXISLIIDS-UHFFFAOYSA-N 0.000 description 1
- 229960000582 mepyramine Drugs 0.000 description 1
- 229960001390 mestranol Drugs 0.000 description 1
- IMSSROKUHAOUJS-MJCUULBUSA-N mestranol Chemical compound C1C[C@]2(C)[C@@](C#C)(O)CC[C@H]2[C@@H]2CCC3=CC(OC)=CC=C3[C@H]21 IMSSROKUHAOUJS-MJCUULBUSA-N 0.000 description 1
- 239000003475 metalloproteinase inhibitor Substances 0.000 description 1
- NZWOPGCLSHLLPA-UHFFFAOYSA-N methacholine Chemical compound C[N+](C)(C)CC(C)OC(C)=O NZWOPGCLSHLLPA-UHFFFAOYSA-N 0.000 description 1
- 229960002329 methacholine Drugs 0.000 description 1
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 1
- 229960004011 methenamine Drugs 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 229960003085 meticillin Drugs 0.000 description 1
- 229960000282 metronidazole Drugs 0.000 description 1
- VAOCPAMSLUNLGC-UHFFFAOYSA-N metronidazole Chemical compound CC1=NC=C([N+]([O-])=O)N1CCO VAOCPAMSLUNLGC-UHFFFAOYSA-N 0.000 description 1
- 229960000198 mezlocillin Drugs 0.000 description 1
- YPBATNHYBCGSSN-VWPFQQQWSA-N mezlocillin Chemical compound N([C@@H](C(=O)N[C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C=1C=CC=CC=1)C(=O)N1CCN(S(C)(=O)=O)C1=O YPBATNHYBCGSSN-VWPFQQQWSA-N 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 229960003248 mifepristone Drugs 0.000 description 1
- 229960004023 minocycline Drugs 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 230000002297 mitogenic effect Effects 0.000 description 1
- 150000004682 monohydrates Chemical group 0.000 description 1
- 230000000921 morphogenic effect Effects 0.000 description 1
- 210000000663 muscle cell Anatomy 0.000 description 1
- JORAUNFTUVJTNG-BSTBCYLQSA-N n-[(2s)-4-amino-1-[[(2s,3r)-1-[[(2s)-4-amino-1-oxo-1-[[(3s,6s,9s,12s,15r,18s,21s)-6,9,18-tris(2-aminoethyl)-3-[(1r)-1-hydroxyethyl]-12,15-bis(2-methylpropyl)-2,5,8,11,14,17,20-heptaoxo-1,4,7,10,13,16,19-heptazacyclotricos-21-yl]amino]butan-2-yl]amino]-3-h Chemical compound CC(C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@H]([C@@H](C)O)CN[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CCN)NC1=O.CCC(C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@H]([C@@H](C)O)CN[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CCN)NC1=O JORAUNFTUVJTNG-BSTBCYLQSA-N 0.000 description 1
- NETZHAKZCGBWSS-CEDHKZHLSA-N nalbuphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]1(O)CC[C@@H]3O)CN2CC1CCC1 NETZHAKZCGBWSS-CEDHKZHLSA-N 0.000 description 1
- 229960000805 nalbuphine Drugs 0.000 description 1
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 1
- 229960004127 naloxone Drugs 0.000 description 1
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 1
- 229960003086 naltrexone Drugs 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 229960001499 neostigmine bromide Drugs 0.000 description 1
- LULNWZDBKTWDGK-UHFFFAOYSA-M neostigmine bromide Chemical compound [Br-].CN(C)C(=O)OC1=CC=CC([N+](C)(C)C)=C1 LULNWZDBKTWDGK-UHFFFAOYSA-M 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 239000003900 neurotrophic factor Substances 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 229960003057 nialamide Drugs 0.000 description 1
- 229960000564 nitrofurantoin Drugs 0.000 description 1
- NXFQHRVNIOXGAQ-YCRREMRBSA-N nitrofurantoin Chemical compound O1C([N+](=O)[O-])=CC=C1\C=N\N1C(=O)NC(=O)C1 NXFQHRVNIOXGAQ-YCRREMRBSA-N 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- HKOIXWVRNLGFOR-KOFBORESSA-N norcodeine Chemical compound O[C@H]([C@@H]1O2)C=C[C@H]3[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4 HKOIXWVRNLGFOR-KOFBORESSA-N 0.000 description 1
- 229950004392 norcodeine Drugs 0.000 description 1
- HKOIXWVRNLGFOR-UHFFFAOYSA-N norcodeine Natural products O1C2C(O)C=CC3C4CC5=CC=C(OC)C1=C5C23CCN4 HKOIXWVRNLGFOR-UHFFFAOYSA-N 0.000 description 1
- 229950006134 normorphine Drugs 0.000 description 1
- 229960001158 nortriptyline Drugs 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 229940125702 ophthalmic agent Drugs 0.000 description 1
- 239000002997 ophthalmic solution Substances 0.000 description 1
- 229940005483 opioid analgesics Drugs 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 210000002997 osteoclast Anatomy 0.000 description 1
- 230000002138 osteoinductive effect Effects 0.000 description 1
- 229940021317 other blood product in atc Drugs 0.000 description 1
- 229960001019 oxacillin Drugs 0.000 description 1
- UWYHMGVUTGAWSP-JKIFEVAISA-N oxacillin Chemical compound N([C@@H]1C(N2[C@H](C(C)(C)S[C@@H]21)C(O)=O)=O)C(=O)C1=C(C)ON=C1C1=CC=CC=C1 UWYHMGVUTGAWSP-JKIFEVAISA-N 0.000 description 1
- 229960002740 oxyphenonium Drugs 0.000 description 1
- XNOPRXBHLZRZKH-DSZYJQQASA-N oxytocin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@H](N)C(=O)N1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)NCC(N)=O)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 XNOPRXBHLZRZKH-DSZYJQQASA-N 0.000 description 1
- 229960001723 oxytocin Drugs 0.000 description 1
- LSQZJLSUYDQPKJ-UHFFFAOYSA-N p-Hydroxyampicillin Natural products O=C1N2C(C(O)=O)C(C)(C)SC2C1NC(=O)C(N)C1=CC=C(O)C=C1 LSQZJLSUYDQPKJ-UHFFFAOYSA-N 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 239000011236 particulate material Substances 0.000 description 1
- 229960001639 penicillamine Drugs 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 229940056367 penicillin v Drugs 0.000 description 1
- VSIIXMUUUJUKCM-UHFFFAOYSA-D pentacalcium;fluoride;triphosphate Chemical compound [F-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O VSIIXMUUUJUKCM-UHFFFAOYSA-D 0.000 description 1
- 229960002275 pentobarbital sodium Drugs 0.000 description 1
- 238000010647 peptide synthesis reaction Methods 0.000 description 1
- 229960000482 pethidine Drugs 0.000 description 1
- BPLBGHOLXOTWMN-MBNYWOFBSA-N phenoxymethylpenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)COC1=CC=CC=C1 BPLBGHOLXOTWMN-MBNYWOFBSA-N 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- CKRORYDHXIRZCH-UHFFFAOYSA-N phosphoric acid;dihydrate Chemical compound O.O.OP(O)(O)=O CKRORYDHXIRZCH-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 229960001416 pilocarpine Drugs 0.000 description 1
- 229960002292 piperacillin Drugs 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920006209 poly(L-lactide-co-D,L-lactide) Polymers 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 229920005583 poly(anhydride-co-imide) Polymers 0.000 description 1
- 229920000117 poly(dioxanone) Polymers 0.000 description 1
- 239000002745 poly(ortho ester) Substances 0.000 description 1
- 229920001042 poly(δ-valerolactone) Polymers 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920002643 polyglutamic acid Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229920000024 polymyxin B Polymers 0.000 description 1
- XDJYMJULXQKGMM-UHFFFAOYSA-N polymyxin E1 Natural products CCC(C)CCCCC(=O)NC(CCN)C(=O)NC(C(C)O)C(=O)NC(CCN)C(=O)NC1CCNC(=O)C(C(C)O)NC(=O)C(CCN)NC(=O)C(CCN)NC(=O)C(CC(C)C)NC(=O)C(CC(C)C)NC(=O)C(CCN)NC1=O XDJYMJULXQKGMM-UHFFFAOYSA-N 0.000 description 1
- KNIWPHSUTGNZST-UHFFFAOYSA-N polymyxin E2 Natural products CC(C)CCCCC(=O)NC(CCN)C(=O)NC(C(C)O)C(=O)NC(CCN)C(=O)NC1CCNC(=O)C(C(C)O)NC(=O)C(CCN)NC(=O)C(CCN)NC(=O)C(CC(C)C)NC(=O)C(CC(C)C)NC(=O)C(CCN)NC1=O KNIWPHSUTGNZST-UHFFFAOYSA-N 0.000 description 1
- 229960005266 polymyxin b Drugs 0.000 description 1
- 229920001299 polypropylene fumarate Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 150000004804 polysaccharides Chemical class 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 239000000583 progesterone congener Substances 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 229960002662 propylthiouracil Drugs 0.000 description 1
- XEYBRNLFEZDVAW-UHFFFAOYSA-N prostaglandin E2 Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O XEYBRNLFEZDVAW-UHFFFAOYSA-N 0.000 description 1
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 229960002601 protriptyline Drugs 0.000 description 1
- BWPIARFWQZKAIA-UHFFFAOYSA-N protriptyline Chemical compound C1=CC2=CC=CC=C2C(CCCNC)C2=CC=CC=C21 BWPIARFWQZKAIA-UHFFFAOYSA-N 0.000 description 1
- GPKJTRJOBQGKQK-UHFFFAOYSA-N quinacrine Chemical compound C1=C(OC)C=C2C(NC(C)CCCN(CC)CC)=C(C=CC(Cl)=C3)C3=NC2=C1 GPKJTRJOBQGKQK-UHFFFAOYSA-N 0.000 description 1
- PWZUUYSISTUNDW-VAFBSOEGSA-N quinestrol Chemical compound C([C@@H]1[C@@H](C2=CC=3)CC[C@]4([C@H]1CC[C@@]4(O)C#C)C)CC2=CC=3OC1CCCC1 PWZUUYSISTUNDW-VAFBSOEGSA-N 0.000 description 1
- 229960001424 quinestrol Drugs 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 229940116157 regranex Drugs 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 108090000064 retinoic acid receptors Proteins 0.000 description 1
- 102000003702 retinoic acid receptors Human genes 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 239000002342 ribonucleoside Substances 0.000 description 1
- 229930187593 rose bengal Natural products 0.000 description 1
- 229940081623 rose bengal Drugs 0.000 description 1
- STRXNPAVPKGJQR-UHFFFAOYSA-N rose bengal A Natural products O1C(=O)C(C(=CC=C2Cl)Cl)=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 STRXNPAVPKGJQR-UHFFFAOYSA-N 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 108010018091 rusalatide acetate Proteins 0.000 description 1
- 231100000279 safety data Toxicity 0.000 description 1
- 238000009738 saturating Methods 0.000 description 1
- STECJAGHUSJQJN-FWXGHANASA-N scopolamine Chemical compound C1([C@@H](CO)C(=O)O[C@H]2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-FWXGHANASA-N 0.000 description 1
- 229960002646 scopolamine Drugs 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- MEZLKOACVSPNER-GFCCVEGCSA-N selegiline Chemical compound C#CCN(C)[C@H](C)CC1=CC=CC=C1 MEZLKOACVSPNER-GFCCVEGCSA-N 0.000 description 1
- DUIOPKIIICUYRZ-UHFFFAOYSA-N semicarbazide Chemical compound NNC(N)=O DUIOPKIIICUYRZ-UHFFFAOYSA-N 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 239000000779 smoke Substances 0.000 description 1
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229940083542 sodium Drugs 0.000 description 1
- 229960002901 sodium glycerophosphate Drugs 0.000 description 1
- 229940010747 sodium hyaluronate Drugs 0.000 description 1
- YWIVKILSMZOHHF-QJZPQSOGSA-N sodium;(2s,3s,4s,5r,6r)-6-[(2s,3r,4r,5s,6r)-3-acetamido-2-[(2s,3s,4r,5r,6r)-6-[(2r,3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2- Chemical compound [Na+].CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 YWIVKILSMZOHHF-QJZPQSOGSA-N 0.000 description 1
- REULQIKBNNDNDX-UHFFFAOYSA-M sodium;2,3-dihydroxypropyl hydrogen phosphate Chemical compound [Na+].OCC(O)COP(O)([O-])=O REULQIKBNNDNDX-UHFFFAOYSA-M 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 239000003270 steroid hormone Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- MBGGBVCUIVRRBF-UHFFFAOYSA-N sulfinpyrazone Chemical compound O=C1N(C=2C=CC=CC=2)N(C=2C=CC=CC=2)C(=O)C1CCS(=O)C1=CC=CC=C1 MBGGBVCUIVRRBF-UHFFFAOYSA-N 0.000 description 1
- 229960003329 sulfinpyrazone Drugs 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 229910021653 sulphate ion Inorganic materials 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 230000003319 supportive effect Effects 0.000 description 1
- 210000000398 surgical flap Anatomy 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000012353 t test Methods 0.000 description 1
- YLJREFDVOIBQDA-UHFFFAOYSA-N tacrine Chemical compound C1=CC=C2C(N)=C(CCCC3)C3=NC2=C1 YLJREFDVOIBQDA-UHFFFAOYSA-N 0.000 description 1
- 229960001685 tacrine Drugs 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960005460 teriparatide Drugs 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- 229960000921 testosterone cypionate Drugs 0.000 description 1
- HPFVBGJFAYZEBE-ZLQWOROUSA-N testosterone cypionate Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(CCC(=O)C=C4CC3)C)CC[C@@]21C)C(=O)CCC1CCCC1 HPFVBGJFAYZEBE-ZLQWOROUSA-N 0.000 description 1
- 229960002372 tetracaine Drugs 0.000 description 1
- GKCBAIGFKIBETG-UHFFFAOYSA-N tetracaine Chemical compound CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 GKCBAIGFKIBETG-UHFFFAOYSA-N 0.000 description 1
- 229940040944 tetracyclines Drugs 0.000 description 1
- FQXXSQDCDRQNQE-VMDGZTHMSA-N thebaine Chemical compound C([C@@H](N(CC1)C)C2=CC=C3OC)C4=CC=C(OC)C5=C4[C@@]21[C@H]3O5 FQXXSQDCDRQNQE-VMDGZTHMSA-N 0.000 description 1
- 229930003945 thebaine Natural products 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- 229960004659 ticarcillin Drugs 0.000 description 1
- OHKOGUYZJXTSFX-KZFFXBSXSA-N ticarcillin Chemical compound C=1([C@@H](C(O)=O)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)C=CSC=1 OHKOGUYZJXTSFX-KZFFXBSXSA-N 0.000 description 1
- 229960000707 tobramycin Drugs 0.000 description 1
- NLVFBUXFDBBNBW-PBSUHMDJSA-N tobramycin Chemical compound N[C@@H]1C[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N NLVFBUXFDBBNBW-PBSUHMDJSA-N 0.000 description 1
- 229950003937 tolonium Drugs 0.000 description 1
- HNONEKILPDHFOL-UHFFFAOYSA-M tolonium chloride Chemical compound [Cl-].C1=C(C)C(N)=CC2=[S+]C3=CC(N(C)C)=CC=C3N=C21 HNONEKILPDHFOL-UHFFFAOYSA-M 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- LLPOLZWFYMWNKH-UHFFFAOYSA-N trans-dihydrocodeinone Natural products C1C(N(CCC234)C)C2CCC(=O)C3OC2=C4C1=CC=C2OC LLPOLZWFYMWNKH-UHFFFAOYSA-N 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 238000011277 treatment modality Methods 0.000 description 1
- IEDVJHCEMCRBQM-UHFFFAOYSA-N trimethoprim Chemical compound COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 IEDVJHCEMCRBQM-UHFFFAOYSA-N 0.000 description 1
- 229960001082 trimethoprim Drugs 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 230000001228 trophic effect Effects 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 229960003165 vancomycin Drugs 0.000 description 1
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 1
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 229960003726 vasopressin Drugs 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 239000003232 water-soluble binding agent Substances 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/28—Bones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/1858—Platelet-derived growth factor [PDGF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/0063—Periodont
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/02—Inorganic materials
- A61L27/025—Other specific inorganic materials not covered by A61L27/04 - A61L27/12
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/02—Inorganic materials
- A61L27/12—Phosphorus-containing materials, e.g. apatite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/22—Polypeptides or derivatives thereof, e.g. degradation products
- A61L27/227—Other specific proteins or polypeptides not covered by A61L27/222, A61L27/225 or A61L27/24
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/22—Polypeptides or derivatives thereof, e.g. degradation products
- A61L27/24—Collagen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/40—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/40—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
- A61L27/42—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having an inorganic matrix
- A61L27/425—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having an inorganic matrix of phosphorus containing material, e.g. apatite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/56—Porous materials, e.g. foams or sponges
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/58—Materials at least partially resorbable by the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/49—Platelet-derived growth factor [PDGF]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/02—Prostheses implantable into the body
- A61F2/28—Bones
- A61F2002/2835—Bone graft implants for filling a bony defect or an endoprosthesis cavity, e.g. by synthetic material or biological material
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2210/00—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2210/0004—Particular material properties of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof bioabsorbable
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/20—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices containing or releasing organic materials
- A61L2300/252—Polypeptides, proteins, e.g. glycoproteins, lipoproteins, cytokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
- A61L2300/414—Growth factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/06—Flowable or injectable implant compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/02—Materials or treatment for tissue regeneration for reconstruction of bones; weight-bearing implants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/06—Materials or treatment for tissue regeneration for cartilage reconstruction, e.g. meniscus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/10—Materials or treatment for tissue regeneration for reconstruction of tendons or ligaments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
- A61L2430/12—Materials or treatment for tissue regeneration for dental implants or prostheses
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Transplantation (AREA)
- Dermatology (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Inorganic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Composite Materials (AREA)
- Materials Engineering (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physical Education & Sports Medicine (AREA)
- Biophysics (AREA)
- Dispersion Chemistry (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Toxicology (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
Abstract
본 발명은 약제학적으로 허용되는 액체 담체 및 약제학적으로 허용되는 고체 담체 중에 약 0.1 ㎎/㎖ 내지 약 1.0 ㎎/㎖ 범위의 농도로 혈소판-유도된 성장인자를 포함하는 조성물을 골, 치주조직, 인대 또는 연골에 적용함으로써 포유동물에서 골, 치주조직, 인대 또는 연골의 성장을 촉진시키는 방법에 관한 것이다.
Description
본 발명은 골 및 결합조직의 치유에 관한 것이다.
성장인자는 세포표면 상의 수용체에 결합하여 일차적으로 세포 증식 및/또는 분화를 활성화시키는 결과를 갖는 단백질이다. 대부분의 성장인자들은 다수의 상이한 세포 타입에서 매우 다양하게 세포분화를 촉진시키는 반면에 다른 것들은 특정의 세포-타입에 대해서 특이적이다. 성장인자의 예로는 혈소판-유도된 성장인자 (PDG), 인슐린-유사 성장인자 (IGF-I 및 II), 변형성장인자 베타 (TGF-β), 표피성장인자 (EGF) 및 섬유아세포 성장인자 (FGF)가 포함된다. PDGF는 순환 혈소판의 과립, 혈관근육세포, 내피세포, 대식세포 및 각질세포를 포함하는 다양한 세포 타입에 존재하는 양이온성, 열안정성 단백질이며, 섬유아세포에 의한 시험관내 단백질 합성 및 콜라겐 생산을 촉진시키는 것으로 알려져 있다. 이것은 또한, 섬유아세포, 평활근 세포, 골아세포 및 신경교세포에 대한 시험관내 미토젠 및 화학주성제로 작용하는 것으로 알려져 있다.
재조합체 인간 PDGF-BB (rhPDGF-BB)는 동물 및 인간 둘 다에서 창상 치유 및 골재생을 촉진시키는 것으로 나타났다. 이것은 미국 및 유럽 모두에서 만성 당뇨병성 족통 (foot sore)의 치유를 가속화시키기 위하여 국소 적용하여 인간에게서 사용하도록 승인되었다. 재조합체 hPDGF-BB는 또한, 단독으로 또는 다른 성장인자와 함께 치주 재생, 즉 골, 시멘트질 및 치아 주위의 인대의 재성장을 개선시키는데 효과적인 것으로 나타났다 (참조예: 미국 특허 제 5,124,316 호, 이것은 본 명세서에 참고로 포함되어 있다).
본 발명에 따라서 본 발명자들은 저용량의 rhPDG (~0.1 내지 1.0 ㎎/㎖)가 골, 치주조직, 인대 및 연골의 복구를 촉진시키는 것을 입증하였다. 저용량의 rhPDG는 β-TCP에 흡착될 수 있으며, 이것은 생체내에서 rhPDG가 방출되도록 복구부위에 이식시킬 수 있다. β-TCP에 대한 rhPDG의 첨가는 비처리된 β-TCP에 비해서 골아세포 부착 및 증식을 증진시키는 것으로 나타났다.
첫번째 관점에서, 본 발명은 혈소판-유도된 성장인자 (PDG)를 약 1.0 ㎎/㎖ 미만의 농도로 함유하는 이식물질을 투여하여 이러한 이식물질이 골, 치주조직, 인대 또는 연골의 성장을 촉진시키도록 함으로써 포유동물, 예를 들어, 인간에게서 골, 치주조직, 인대 또는 연골 성장을 촉진시키는 방법을 특징으로 한다. 구체예에서, PDGF는 0.3 ㎎/㎖ 또는 그 미만의 양으로 투여된다. 또 다른 구체예에서, PDGF는 약 0.1 내지 약 1.0 ㎎/㎖ 범위의 양으로 투여된다. 몇가지 구체예에서, PDGF는 약 0.2 내지 약 0.75 ㎎/㎖, 약 0.25 내지 약 0.6 ㎎/㎖, 및 약 0.25 내지 약 0.5 ㎎/㎖의 양으로 투여된다. 구체예에서, PDGF는 약 0.1 ㎎/㎖, 0.3 ㎎/㎖, 또는 1.0 ㎎/㎖, 바람직하게는 0.3 ㎎/㎖의 양으로 투여된다. 또 다른 구체예에서, PDGF는 부분적으로, 또는 실질적으로 정제된다. 추가의 또 다른 구체예에서, PDGF는 다른 오염물질로부터 분리 또는 정제된다. 추가의 구체예에서, PDGF는 투여후 이식물질로부터 0.3 ㎎/일의 평균 비율로 방출된다. 또 다른 구체예에서, PDGF는 투여후 이식물질로부터 300 ㎍/일의 평균 비율로 방출된다. 추가의 또 다른 구체예에서, PDGF는 이식물질로부터 100 ㎍/일 미만, 50 ㎍/일 미만, 10 ㎍/일 미만, 또는 1 ㎍/일 미만의 평균 비율로 방출된다. 바람직하게는, PDGF는 몇일, 예를 들어, 1, 2, 5, 10, 15, 20 또는 25일에 걸쳐서, 또는 28일 또는 그 이상까지에 걸쳐서 송달된다.
본 발명의 두번째 관점은 이식물질이 골, 치주조직, 인대 또는 연골의 성장을 촉진시키도록 약 1.0 ㎎/㎖ 미만의 양의 혈소판-유도된 성장인자 (PDG) 및 약제학적으로 허용되는 담체를 함유하는 이식물질을 투여하고, 골, 치주조직, 인대 또는 연골이 성장하도록 함으로써 포유동물, 예를 들어, 인간에게서 골, 치주조직, 인대 또는 연골 성장을 촉진시키는 방법을 특징으로 한다. 바람직하게는, PDGF는 0.3 ㎎/㎖ 또는 그 미만이다. 구체예에서, PDGF는 약 0.1 내지 약 1.0 ㎎/㎖의 범위로 투여된다. 또 다른 구체예에서, PDGF의 양은 약 0.1 ㎎/㎖, 0.3 ㎎/㎖, 또는 1.0 ㎎/㎖, 바람직하게는 0.3 ㎎/㎖이다. 또 다른 구체예에서, PDGF는 부분적으로, 또는 실질적으로 정제된다. 추가의 또 다른 구체예에서, PDGF는 다른 오염물질로부터 분리 또는 정제된다. 이식물질을 포유동물에게 투여하기 전에, 이 방법은 추가로 피부의 외과적 피판 (surgical flap)을 생성시켜 골, 치주조직, 인대 또는 연골을 노출시키고, 피판을 대체하는 투여단계를 수행하는 포함할 수 있다. 또 다른 추가의 구체예에서, 외과적 피판을 생성시킨 후에, 그러나 이식물질을 골, 치주조직, 인대 또는 연골에 투여하기 전에, 이 방법은 추가로 골 또는 치주조직을 평활화하여 골 또는 치주조직으로부터 유기물질을 제거하는 단계를 더 포함할 수 있다. 또 다른 구체예에서, 이 방법은 손상되거나 병에 걸린 골, 치주조직, 인대 또는 연골의 성장을 촉진시킨다. 또 다른 구체예에서, 이 방법은 예를 들어, 발치, 치조제 증대술 (ridge augmentation), 심미적 이식술 (esthetic grafting) 및 상악동 거상술 (sinus lift)과 같은 외과적 개입의 결과로 새로운 골 형성이 필요한 위치에서 골의 성장을 촉진시킨다.
본 발명의 세번째 관점은 포유동물, 예를 들어, 인간에게서 골, 치주조직, 인대 또는 연골의 성장을 촉진시키기 위한 이식물질을 특징으로 한다. 이식물질은 약제학적으로 허용되는 담체 (예를 들어, 생체적합성 결합제, 골치환제, 액체 또는 겔), 및 약 1.0 ㎎/㎖의 농도로 존재하는 혈소판-유도된 성장인자 (PDGF)를 포함한다. 바람직하게는, PDGF는 약 0.3 ㎎/㎖ 또는 그 미만의 농도로 이식물질 중에 존재한다. 구체예로, PDGF는 약 0.1 내지 1.0 ㎎/㎖의 범위로 투여된다. 또 다른 구체예에서, PDGF의 양은 약 0.1 ㎎/㎖, 0.3 ㎎/㎖ 또는 1.0 ㎎/㎖이다. 한가지 구체예에서, 이식물질의 약제학적으로 허용되는 담체는 PDGF를 포함하는 용액 (즉, PDGF를 약 0.1 ㎎/㎖ 내지 약 1.0 ㎎/㎖ 범위의 농도로 함유하는 용액)을 흡수할 수 있는, 생체적합성 결합제 (예를 들어, 카복시메틸셀룰로즈) 또는 골치환제 (β-TCP)로 구성된 골격 (scaffold) 또는 매트릭스 (matrix)를 포함한다. 또 다른 구체예에서, 약제학적으로 허용되는 담체는 그 자신의 중량의 약 25% 이상에 해당하는 양의 PDGF 용액을 흡수할 수 있다. 또 다른 구체예에서, 약제학적으로 허용되는 담체는 그 자신의 중량의 약 50%, 75%, 100%, 200%, 250% 또는 300% 이상에 해당하는 양의 PDGF 용액을 흡수할 수 있다. 한가지 구체예에서, PDGF는 PDGF를 함유하는 용액에 약제학적으로 허용되는 담체를 침지시킴으로써 이식물질의 약제학적으로 허용되는 담체에 의해서 흡수된다. 바람직하게는, PDGF는 약 1.0 ㎎/㎖ 미만의 농도로 용액 중에 존재한다. 또 다른 구체예에서, PDGF는 약 0.3 ㎎/㎖ 또는 그 미만의 농도로 용액 중에 존재한다. 또 다른 구체예에서, PDGF는 약 0.1 내지 1.0 ㎎/㎖ 범위의 농도로 용액 중에 존재한다. 그 밖의 또 다른 구체예에서, PDGF는 약 0.1 ㎎/㎖, 0.3 ㎎/㎖ 또는 1.0 ㎎/㎖, 바람직하게는 0.3 ㎎/㎖의 양으로 용액 중에 존재한다. 또 다른 구체예에서, PDGF는 부분적으로 또는 실질적으로 정제된다. 추가의 또 다른 구체예에서, PDGF는 다른 오염물질로부터 분리 또는 정제된다.
본 발명의 네번째 관점은 포유동물, 예를 들어, 인간에게서 골, 치주조직, 인대 또는 연골의 성장을 촉진시키기 위한 이식물질을 제조하는 방법을 특징으로 한다. 이 방법은 부분적으로 정제되거나 정제된 혈소판-유도된 성장인자 (PDGF)를 약 1.0 ㎎/㎖ 미만의 양으로 약제학적으로 허용되는 담체 물질과 배합시키는 단계를 포함한다. 바람직하게는, PDGF는 약 0.3 ㎎/㎖ 또는 그 미만의 농도로 약제학적으로 허용되는 담체 물질과 배합시킨다. 구체예로, PDGF는 약 0.1 내지 1.0 ㎎/㎖의 범위의 양으로 약제학적으로 허용되는 담체 물질과 배합시킨다. 또 다른 구체예에서, PDGF는 0.1 ㎎/㎖, 0.3 ㎎/㎖ 또는 1.0 ㎎/㎖의 양으로 혼합시킨다. 또 다른 구체예에서, PDGF는 0.3 ㎎/㎖의 양으로 혼합시킨다. 추가의 또 다른 구체예에서, PDGF는 약제학적으로 허용되는 담체에 의해서 흡수되어 이식물질을 생성시킨다.
본 발명의 다섯번째 관점은 약제학적으로 허용되는 액체 중에 약 0.1 ㎎/㎖ 내지 약 1.0 ㎎/㎖ 범위의 농도로 혈소판-유도된 성장인자 (PDGF)를 갖는 바이알을 특징으로 한다. 본 발명의 이러한 관점의 구체예에서, 액체는 멸균 나트륨 아세테이트 완충액이다. 또 다른 구체예에서, 바이알은 약 0.3 ㎎/㎖의 농도로 PDGF를 함유한다. 추가의 또 다른 구체예에서, PDGF는 PDGF-BB이다. 그 밖의 또 다른 구체예에서, PDGF는 약 2℃ 내지 80℃ 범위의 온도에서 저장할 때에 나트륨 아세테이트 완충액 중에서 약 12개월 이상, 바람직하게는 약 18개월 이상, 더욱 바람직하게는 약 24개월 이상, 가장 바람직하게는 약 36개월 이상 동안 안정하다.
본 발명의 여섯번째 관점은 약 0.1 ㎎/㎖ 내지 약 1.0 ㎎/㎖ 범위의 농도로 혈소판-유도된 성장인자 (PDGF)를 함유하는 액체가 안에 흡착되어 있는 다공성 칼슘 포스페이트를 포함하는 이식물질을 특징으로 한다. 몇가지 구체예에서, PDGF의 농도는 약 0.3 ㎎/㎖이고, 칼슘 포스페이트는 트리칼슘 포스페이트, 하이드록시아파타이트, 불량한 결정성의 하이드록시아파타이트, 무정형 칼슘 포스페이트, 칼슘 메타포스페이트, 디칼슘 포스페이트 디하이드레이트, 헵타칼슘 포스페이트, 칼슘 파이로포스페이트 디하이드레이트, 칼슘 파이로포스페이트, 및 옥타칼슘 포스페이트로부터 선택되고, PDGF는 멸균 액체, 예를 들어, 나트륨 아세테이트 완충액 중에 제공된다.
본 발명의 일곱번째 관점은 약 0.1 ㎎/㎖ 내지 약 1.0 ㎎/㎖ 범위의 농도로 혈소판-유도된 성장인자 (PDGF)를 포함하는 멸균 액체 내에 칼슘 포스페이트 물질을 포화시킴으로써 이식물질을 제조하는 방법을 특징으로 한다. 몇가지 구체예에서, PDGF의 농도는 약 0.3 ㎎/㎖이고, 칼슘 포스페이트는 트리칼슘 포스페이트, 하이드록시아파타이트, 불량한 결정성의 하이드록시아파타이트, 무정형 칼슘 포스페이트, 칼슘 메타포스페이트, 디칼슘 포스페이트 디하이드레이트, 헵타칼슘 포스페이트, 칼슘 파이로포스페이트 디하이드레이트, 칼슘 파이로포스페이트, 및 옥타칼슘 포스페이트로부터 선택된다.
본 발명의 모든 관점의 구체예에서, PDGF는 PDGF 호모- 및 헤테로다이머, 예를 들어, PDGF-AA, PDGF-BB, PDGF-AB, PDGF-CC, 및 PDGF-DD, 및 이들의 배합물 및 유도체를 포함한다.
본 발명의 모든 관점의 구체예에서, 이식물질의 약제학적으로 허용되는 담체 물질은 다음의 성분들 중의 하나 또는 그 이상이거나, 추가로 이들을 포함한다: 생체적합성 결합제 (예를 들어, 천연 또는 합성 중합체), 골치환제, 액체 및 겔. 또 다른 바람직한 구체예에서, 이식물질은 약제학적으로 허용되는 고체 담체에 의해서 흡착된 약제학적으로 허용되는 액체 담체 내에 존재하는 PDGF를 포함한다.
본 발명의 모든 관점의 또 다른 구체예에서, 이식물질은 분리되거나, 부분적으로 정제되거나, 실질적으로 정제되거나, 정제된 PDGF를 0.1 내지 1.0 ㎎/㎖ 범위의 양, 더욱 바람직하게는 0.1 ㎎/㎖, 0.3 ㎎/㎖, 또는 1.0 ㎎/㎖, 가장 바람직하게는 0.3 ㎎/㎖, 또는 0.1 ㎎/㎖ 미만까지의 양으로 약제학적으로 허용되는 담체 물질, 예를 들어, 천연 또는 합성 중합체 (예를 들어, 콜라겐, 폴리글리콜산, 및 폴리락트산)와 같은 생체적합성 결합제, 골치환제 (예를 들어, 칼슘 포스페이트 (예를 들어, 트리칼슘 포스페이트 또는 하이드록시아파타이트), 칼슘 설페이트, 또는 탈회된 골 (예를 들어, 탈회된 동결건조된 피질 또는 해면모양의 골)), 또는 시판품으로 이용할 수 있는 겔 또는 액체 (즉, 점성 또는 불활성 겔 또는 액체)와 배합시킴으로써 제조된다.
몇가지 구체예에서, 이식물질의 담체 물질은 하나 또는 그 이상의 생체적합성 결합제이거나, 이들을 추가로 포함한다. 생체적합성 결합제는 결합된 물질들 사이의 응집 (cohesion)을 발생시키거나 촉진시키는 성분이다. 적합한 생체적합성 결합제의 비-제한적 예로는 폴리사카라이드, 핵산, 탄수화물, 단백질, 폴리펩타이드, 폴리(α-하이드록시산), 폴리(락톤), 폴리(아미노산), 폴리(안하이드라이드), 폴리(오르토에스테르), 폴리(안하이드라이드-코-이미드), 폴리(오르토카보네이트), 폴리(α-하이드록시 알카노에이트), 폴리(디옥사논), 폴리(포스포에스테르), 폴리락트산, 폴리(L-락티드) (PLLA), 폴리(D,L-락티드) (PDLLA), 폴리글리콜리드 (PGA), 폴리(락티드-코-글리콜리드) (PLGA), 폴리(L-락티드-코-D,L-락티드), 폴리(D,L-락티드-코-트리메틸렌 카보네이트), 폴리글리콜산, 폴리하이드록시부티레이트 (PHB), 폴리(ε-카프로락톤), 폴리(δ-발레로락톤), 폴리(γ-부티로락톤), 폴리(카프로락톤), 폴리아크릴산, 폴리카복실산, 폴리(알릴아민 하이드로클로라이드), 폴리(디알릴디메틸암모늄 클로라이드), 폴리(에틸렌이민), 폴리프로필렌 푸마레이트, 폴리비닐 알콜, 폴리비닐피롤리돈, 폴리에틸렌, 폴리메틸메타크릴레이트, 탄소섬유, 폴리(에틸렌 글리콜), 폴리(에틸렌 옥사이드), 폴리(비닐 알콜), 폴리(비닐피롤리돈), 폴리(에틸옥사졸린), 폴리(에틸렌 옥사이드)-코-폴리(프로필렌 옥사이드) 블록 코폴리머, 폴리(에틸렌 테레프탈레이트)폴리아미드, 및 이들의 코폴리머 및 혼합물로부터 선택된 중합체가 포함된다. 추가의 결합제로는 알긴산, 아라비아 고무, 구아 고무, 잔탄 고무, 젤라틴, 키틴, 키토산, 키토산 아세테이트, 키토산 락테이트, 콘드로이틴 설페이트, N,O-카복시메틸 키토산, 덱스트란 (예를 들어, α-사이클로덱스트린, β-사이클로덱스트린, γ-사이클로덱스트린, 또는 나트륨 덱스트란 설페이트), 피브린 글루 (fibrin glue), 글리세롤, 히알우론산, 나트륨 히알우로네이트, 셀룰로즈 (예를 들어, 메틸셀룰로즈, 카복시 메틸셀룰로즈, 하이드록시프로필 메틸셀룰로즈, 또는 하이드록시에틸 셀룰로즈), 글루코사민, 프로테오글리칸, 전분 (예를 들어, 하이드록시에틸 전분 또는 가용성 전분), 락트산, 플루로닉, 나트륨 글리세로포스페이트, 콜라겐, 글리코겐, 케라틴, 실크, 및 이들의 유도체 및 혼합물이 포함된다. 일부의 구체예에서, 생체적합성 결합제는 수용성이다. 수용성 결합제는 이식물질을 생체내에 이식한 지 잠시 후에 이식물질로부터 용해함으로써 이식물질 내로 마크로다공성 (macroporosity)을 도입시킨다. 이러한 마크로다공성은 이식부위에서 파골세포 및 골아세포의 어세스 (access) 및 따라서, 리모델링 (remodeling) 활성을 증진시킴으로써 이식물질의 골전도성을 증가시킨다.
생체적합성 결합제는 조성물의 제조 중의 다양한 단계에서 다양한 양으로 이식물질에 첨가될 수 있다. 본 기술분야에서 숙련된 전문가는 소정의 적용을 위해서 필요한 결합제의 양 및 포함시키는 방법을 결정할 수 있을 것이다.
한가지 구체예에서, 담체 물질은 물, 완충제 및 세포배양매질로부터 선택된 액체이거나, 이것을 포함한다. 액체는 어떤 pH 범위에서도 사용될 수 있으나, 가장 흔하게는 pH 5.0 내지 pH 8.0의 범위에서 사용될 수 있다. 한가지 구체예에서, pH는 이식물질 내에 존재하는 PDGF의 장기간 안정성 및 효능과, 또는 또 다른 원하는 생물학적 활성제의 장기간 안정성 및 효능과 상화적일 수 있다. 대부분의 구체예에서, 액체의 pH는 pH 5.5 내지 pH 7.4의 범위일 수 있다. 적합한 완충제에는 카보네이트, 포스페이트 (예를 들어, 포스페이트 완충된 식염수), 및 트리스 (Tris), HEPES 및 MOPS와 같은 유기 완충제가 포함되나, 이들로 제한되지는 않는다. 가장 흔하게는 완충제는 숙주조직과의 그의 상화성 및 생물학적 활성제와의 그의 상화성을 위해서 선택될 수 있다. 핵산, 펩타이드 또는 항생제가 이식물질 내에 포함되는 대부분의 적용을 위해서는 간단한 포스페이트 완충된 식염수가 충분할 것이다.
본 발명의 모든 관점의 또 다른 구체예에서, 이식물질의 담체 물질은 하나 또는 그 이상의 골치환제이거나, 이것을 추가로 포함한다. 골치환제는 영구적으로 또는 일시적으로 골을 대체하기 위하여 사용될 수 있는 것이다. 이식한 후에 골치환제는 신체에 의해서 보유될 수 있거나, 신체에 의해서 다시 흡수되어 골로 대체될 수 있다. 골치환제의 예로는 예를 들어, 칼슘 포스페이트 (예를 들어, 트리칼슘 포스페이트 (예를 들어, β-TCP), 하이드록시아파타이트, 불량한 결정성의 하이드록시아파타이트, 무정형 칼슘 포스페이트, 칼슘 메타포스페이트, 디칼슘 포스페이트 디하이드레이트, 헵타칼슘 포스페이트, 칼슘 파이로포스페이트 디하이드레이트, 칼슘 파이로포스페이트, 및 옥타칼슘 포스페이트), 칼슘 설페이트, 또는 탈회된 골 (예를 들어, 탈회된 동결건조된 피질 또는 해면모양의 골)가 포함된다. 한가지 구체예에서, 담체 물질은 생체흡수성이다. 또 다른 구체예에서, 골치환제는 미크론- 또는 서브미크론-크기 입자, 예를 들어, 나노-크기 입자의 매트릭스로 제공된다. 입자는 크기가 약 100 ㎛ 내지 약 5000 ㎛의 범위, 더욱 바람직하게는 약 200 ㎛ 내지 약 3000 ㎛의 범위, 가장 바람직하게는 약 250 ㎛ 내지 약 2000 ㎛의 범위일 수 있거나, 입자가 약 1 nm 내지 약 1000 nm의 범위, 바람직하게는 약 500 nm 미만, 더욱 바람직하게는 약 250 nm 미만일 수 있다. 또 다른 구체예에서, 골치환제는 다공성 조성물을 갖는다. 조성물의 다공성은 세포가 세포외 골 매트릭스를 분비할 수 있도록 조성물 내로의 세포 이동 및 침윤을 촉진시키기 때문에 바람직한 특징이다. 이것은 또한, 혈관신생을 위한 어세스를 제공한다. 다공성은 또한, 활성성분의 증진된 흡수 및 방출뿐만 아니라 증가된 세포-매트릭스 상호작용을 위한 큰 표면적을 제공한다. 바람직하게는, 조성물은 40% 초과, 더욱 바람직하게는 65% 초과, 가장 바람직하게는 90% 초과의 다공성을 갖는다. 조성물은 이식에 적합한 형상 (예를 들어, 구형, 실린더 또는 블럭)으로 제공될 수 있거나, 사용하기 전에 크기 및 형상을 만들 수 있다. 바람직한 구체예에서, 골치환제는 칼슘 포스페이트 (예를 들어, β-TCP)이다.
골치환제는 또한, 유동성의 성형가능한 페이스트 (paste) 또는 퍼티 (putty)로 제공될 수도 있다. 바람직하게는, 골치환제는 생체내 이식하기 전 또는 후에 경화된 칼슘 포스페이트를 형성하도록 자체-경화하는 칼슘 포스페이트 페이스트이다. 본 발명의 칼슘 포스페이트 성분은 본 기술분야에서 공지되어 있는 어떤 생체적합성 칼슘 포스페이트 물질이라도 될 수 있다. 칼슘 포스페이트 물질은 적합한 출발물질을 사용하여 다양한 방법들 중의 어느 하나에 의해서 생산될 수 있다. 예를 들어, 칼슘 포스페이트 물질은 무정형의 아파타이틱 (apatitic) 칼슘 포스페이트를 포함할 수 있다. 칼슘 포스페이트 물질은 결정성 하이드록시아파타이트 고체를 형성하는 결정성 칼슘 포스페이트 반응물의 고체상 산-염기 반응에 의해서 생산될 수 있다. 칼슘 포스페이트 물질을 제조하는 다른 방법도 본 기술분야에서 공지되어 있으며, 이들 중의 일부는 이하에 기술된다.
칼슘 포스페이트 물질은 불량한 결정성의 아파타이틱 (PCA) 칼슘 포스페이트 또는 하이드록시아파타이트 (HA)일 수 있다. PCA 물질은 모두 본 명세서에 참고로 포함되어 있는 출원들 미국 특허 제 5,650,176; 5,783,217; 6,027,742; 6,214,368; 6,287,34; 6,331,312; 및 6,541,037 호에 기술되어 있다. HA는 예를 들어, 미국 특허 제 Re. 33,221 및 Re. 33,161 호에 기술되어 있다. 이들 특허는 칼슘 포스페이트 광물질재보급 (remineralization) 조성물, 및 동일한 칼슘 포스페이트 조성물을 기초로 하는 미세결정성이고 비-세라미성이며 서서히 재흡수성인 하이드록시아파타이트 담체 물질의 제조를 시사한다. 테트라칼슘 포스페이트 (TTCP) 및 모노칼슘 포스페이트 (MCP) 또는 그의 모노하이드레이트 형태 (MCPM)로 구성된 유사한 칼슘 포스페이트 시스템은 미국 특허 제 5,053,212 및 5,129,905 호에 기술되어 있다. 이 칼슘 포스페이트 물질은 결정성 하이드록시아파타이트 고체를 형성하는 결정성 칼슘 포스페이트 반응물의 고체상 산-염기 반응에 의해서 생산된다.
결정성 HA 물질 (통상적으로는 다알라이트 (dahllite)로 불림)은 이들이 유동성이고, 성형가능하며 그 자리에서 경화할 수 있도록 제조될 수 있다 (참조: 미국 특허 제 5,962,028 호). 이들 HA 물질 (통상적으로는 탄소화된 하이드록시아파타이트로 불림)은 반응물을 비-수성 액체와 배합하여 실질적으로 균일한 혼합물을 제공하고, 혼합물을 필요에 따라서 성형하고, (예를 들어, 이식하기 전 또는 후에) 혼합물을 물의 존재하에서 경화하도록 함으로써 형성될 수 있다. 경화하는 중에, 혼합물은 고체이며 본질적으로 모노리식 (monolithic) 아파타이틱 구조로 결정화한다.
반응물은 일반적으로, 포스페이트 공급원, 예를 들어, 실질적으로 물을 함유하지 않는 인산 또는 포스페이트 염, 알칼리 금속염, 특히 칼슘 공급원, 임의로 결정성 핵, 특히 하이드록시아파타이트 또는 칼슘 포스페이트 결정, 칼슘 카보네이트, 및 본 명세서에 기술된 비-수성 액체와 같은 생리적으로 허용되는 윤활제로 구성될 수 있다. 건조 성분들은 혼합물로 전-제조되고, 이어서 실질적으로 균일한 혼합이 일어나는 조건 하에서 비-수성 액체 성분과 배합될 수 있다.
칼슘 포스페이트 물질은 그의 생물학적 재흡수성, 생체적합성, 및 그의 최소 결정도에 의해서 특정화된다. 그의 결정성 특징은 천연적인 골과 실질적으로 동일하다. 바람직하게는, 칼슘 포스페이트 물질은 5시간 미만에 경화하며, 생리적 조건 하에서는 실질적으로 약 1 내지 5시간에 경화한다. 바람직하게는, 이 물질은 실질적으로 약 10-30분 이내에 경화된다. 생리적 조건 하에서의 경화율은 본 명세서에 참고로 포함되어 있는 미국 특허 제 6,027,742 호에 기술된 바와 같이 몇가지 간단한 파라메터를 변형시킴으로써 치료학적 필요성에 따라서 변화될 수 있다.
구체예로, 생성된 생체흡수성 칼슘 포스페이트 물질은 하이드록시아파타이트에 대한 약 1.67의 이상적 화학량론적 값에 비해서 약 1.6 미만의 칼슘 대 포스페이트 몰비를 가지고 "칼슘 결핍성 (calcium deficient)"일 수 있다.
바람직한 칼슘 포스페이트는 습식환경 하에 체온 또는 대략 체온에서 5시간 이내, 바람직하게는 10-30분 이내에 경화할 수 있다. 바람직한 물질은 1-5 g의 펠릿으로 이식하면 1년 이내에 80% 이상이 재흡수되는 것이다. 바람직하게는, 이 물질은 완전히 재흡수될 수 있다.
본 발명의 모든 관점의 몇가지 구체예에서, 이식물질은 추가로 하나 또는 그 이상의 생물학적 활성제를 포함할 수 있다. 본 발명의 이식물질에 혼입될 수 있는 생물학적 활성제로는 유기분자, 무기물질, 단백질, 펩타이드, 핵산 (예를 들어, 유전자, 유전자 단편, 유전자 조절서열, 및 안티센스 분자), 뉴클레오프로테인, 폴리사카라이드, 글리코프로테인 및 리포프로테인이 포함되나, 이들로 제한되지는 않는다. 본 발명의 이식물질에 혼입될 수 있는 생물학적 활성화합물의 부류에는 항암제, 항생물질, 진통제, 진경제, 호르몬, 근육이완제, 항경련제, 안과용제, 프로스타글란딘, 항우울제, 항정신병성 물질, 영양인자 (trophic factors), 골유도성 단백질, 성장인자 및 백신이 포함되나, 이들로 제한되지는 않는다.
항암제는 알킬화제, 백금제, 항대사물질, 토포이소머라제 억제제, 항종양성 항생물질, 항유사분열제, 아로마타제 억제제, 티미딜레이트 신타제 어제제, DNA 길항제, 파르네실트랜스퍼라제 억제제, 펌프 억제제, 히스톤 아세틸트랜스퍼라제 억제제, 메탈로프로테이나제 억제제, 리보뉴클레오사이드 리덕타제 억제제, TNF 알파 작용제/길항제, 엔도텔린 A 수용체 길항제, 레티노산 수용체 작용제, 면역조절제, 호르몬제 및 항호르몬제, 광역학제 및 타이로신 키나제 억제제를 포함한다.
표 1에 열거된 생물학적 활성제 중의 어떤 것이라도 사용될 수 있다.
항생물질에는 아미노글리코사이드 (예를 들어, 겐타마이신, 토브라마이신, 네틸마이신, 스트렙토마이신, 아미카신, 네오마이신), 바시트라신, 코르바페넴 (예를 들어, 이미페넴/시스라스타틴), 세팔로스포린, 콜리스틴, 메테나민, 모노박탐 (예를 들어, 아즈트레오남), 페니실린 (예를 들어, 페니실린 G, 페니실린 V, 메티실린, 나트실린, 옥사실린, 클록사실린, 디클록사실린, 암피실린, 아목시실린, 카르베니실린, 티카르실린, 피페라실린, 메즐로실린, 아즐로실린), 폴리믹신 B, 퀴놀론, 및 반코마이신; 및 클로람페니콜, 클린다나이안, 마크로라이드 (예를 들어, 에리트로마이신, 아지트로마이신, 클라리트로마이신), 린코마이신, 니트로푸란토인, 설폰아미드, 테트라사이클린 (예를 들어, 테트라사이클린, 독시사이클린, 미노사이클린, 데메클로사이클린), 및 트리메토프림과 같은 정균제가 포함된다. 또한, 메트로니다졸, 플루오로퀴놀론 및 리탐핀도 포함된다.
효소 억제제는 효소적 반응을 억제하는 물질이다. 효소 억제제의 예로는 에드로포늄 클로라이드, N-메틸피조스티그민, 네오스티그민 브로마이드, 피조스티그민 설페이트, 타크린, 1-하이드록시 말리에이트, 요오도튜베르시딘, p-브로모테트라미졸, 10-(알파-디에틸아미노프로피오닐)-페노티아진 하이드로클로라이드, 칼미다졸륨 클로라이드, 헤미콜리늄-3, 3,5-디니트로카테콜, 디아실글리세롤 키나제 억제제 I, 디아실글리세롤 키나제 억제제 II, 3-페닐프로파길아민, N6-모노메틸-L-아르기닌 아세테이트, 카비도파, 3-하이드록시벤질하이드라진, 하이드랄라진, 클로르질린, 데프레닐, 하이드록실아민, 이프로니아지드 포스페이트, 6-MeO-테트라하이드로-9H-피리도-인돌, 니알라마이드, 파르질린, 퀴나크린, 세미카르바지드, 트래닐사이프로민, N,N-디에틸아미노에틸-2,2-디페닐발레레이트 하이드로클로라이드, 3-이소부틸-1-메틸잔탄, 파파베린, 인도메타신드, 2-사이클로옥틸-2-하이드록시에틸아민 하이드로클로라이드, 2,3-디클로로-a-메틸벤질아민 (DCMB), 8,9-디클로로-2,3,4,5-테트라하이드로-1H-2-벤즈아제핀 하이드로클로라이드, p-아미노글루테트이미드, p-아미노글루테트이미드 타트레이트, 3-요오도타이로신, 알파-메틸타이로신, 아세타졸라마이드, 디클로르펜아미드, 6-하이드록시-2-벤조티아졸설폰아미드 및 알로푸리놀이 포함된다.
항히스타민제에는 특히 피릴라민, 클로르페니라민, 및 테트라하이드라졸린이 포함된다.
항염증제로는 코르티코스테로이드, 비스테로이드성 항염증성 약물 (예를 들어, 아스피린, 페닐부타존, 인도메타신, 술린닥, 톨메틴, 이부프로펜, 피록시캄 및 페나메이트), 아세트아미노펜, 페나세틴, 금 염류, 클로로퀸, D-페니실라민, 메토트렉세이트 콜히친, 알로푸리놀, 프로베네시드 및 설핀피라존이 포함된다.
근육이완제는 메페네신, 메토카브로말, 사이클로벤자프린 하이드로클로라이드, 트리헥실페니딜 하이드로클로라이드, 레보도파/카비도파, 및 비페리덴을 포함한다.
항경련제에는 아트로핀, 스코폴라민, 옥시페노늄 및 파파베린이 포함된다.
진통제에는 아스피린, 페닐부타존, 인도메타신, 술린닥, 톨메틱, 이부프로펜, 피록시캄, 페나메이트, 아세트아미노펜, 페나세틴, 모르핀 설페이트, 코데인 설페이트, 메페리딘, 날로르핀, 오피오이드 (예를 들어, 코데인 설페이트, 펜타닐 시트레이트, 하이드로코돈 비타트레이트, 로페라마이드, 모르핀 설페이트, 노스카핀, 노르코데인, 노르모르핀, 테바인, 노르-비날토르피민, 부프레노르핀, 클로르날트렉사민, 푸날트렉사미온, 날부핀, 날로르핀, 날록손, 날록소나진, 날트렉손 및 날트린돌), 프로카인, 리도카인, 테트라카인 및 디부카인이 포함된다.
안과용제는 나트륨 플루오레세인, 로즈 벤갈 (rose bengal), 메타콜린, 아드레날린, 코카인, 아트로핀, 알파-카이모트립신, 히알우로니다제, 베탁사롤, 필로카르핀, 티모롤 염류 및 이들의 배합물이 포함된다.
프로스타글란딘은 인식되고 있는 기술이며, 다양한 생물학적 효과를 갖는 것으로, 천연적으로 존재하는 화학적으로 관련된 장쇄 하이드록시 지방산의 부류이다.
항우울제는 우울증을 예방 또는 완화시킬 수 있는 물질이다. 항우울제의 예로는 이미프라민, 아미트리프틸린, 노르트리프틸린, 프로트리프틸린, 데시프라민, 아목사핀, 독세핀, 마프로틸린, 트래닐사이프로민, 펜넬진 및 이소카르복사지드가 포함된다.
성장인자는 그의 지속적인 존재가 세포의 생존도 또는 수명을 개선시키는 인자이다. 영양인자는 호중구-활성화 단백질, 단핵세포 화학주성 단백질 (monocyte chemoattractant protein), 마크로파지-염증성 단백질, 혈소판 인자, 혈소판 기본 단백질, 및 흑색종 성장자극활성; 표피성장인자, 변형성장인자 (알파), 섬유아세포 성장인자, 혈소판-유도된 내피세포 성장인자, 인슐린-유사 성장인자 (IGF, 예를 들어, IGF-I 또는 IGF-II), 신경교 유도된 성장 신경영양인자, 섬모신경영양인자, 신경성장인자, 골 성장/연골-유도성 인자 (알파 및 베타), 골 형성 단백질 (BMPs), 인터로이킨 (예를 들어, 인터로이킨 1 내지 인터로아킨 10을 포함한 인터로이킨 억제제 또는 인터로이킨 수용체), 인터페론 (예를 들어, 인터페론 알파, 베타 및 감마), 에리트로포이에틴을 포함한 조혈인자, 과립구 콜로니 자극인자, 대식세포 콜로니 자극인자 및 과립구-대식세포 콜로니 자극인자; 종양괴사인자, 베타-1, 베타-2, 베타-3을 포함한 변형성장인자 (베타), 변형성장인자 (알파), 인히빈 및 액티빈; 및 OP-1, BMP-2 및 BMP-7과 같은 골 형성 단백질을 포함하나, 이들로 제한되지는 않는다.
호르몬에는 에스트로젠 (예를 들어, 에스트라디올, 에스트론, 에스트리올, 디에틸스틸베스트롤, 퀴네스트롤, 클로로트리아니센, 에티닐 에스트라디올, 메스트라놀), 안티-에스트로젠 (예를 들어, 클로미펜, 타목시펜), 프로제스틴 (예를 들어, 메드록시프로제스테론, 노르에틴드론, 하이드록시프로제스테론, 노르제스트렐), 안티프로제스틴 (미페프리스톤), 안드로젠 (예를 들어, 테스토스테론 사이피오네이트, 플루옥시메스테론, 다나졸, 테스토락톤), 안티-안드로젠 (예를 들어, 사이프로테론 아세테이트, 플루타미드), 갑상선 호르몬 (예를 들어, 트리요오도타이론, 타이록신, 프로필티오우라실, 메티마졸, 및 요오딕소드), 및 뇌하수체 호르몬 (예를 들어, 코르티코트로핀, 수무토트로핀, 옥시토신 및 바소프레신)이 포함된다. 호르몬은 통상적으로 호르몬 대체요법으로 및/또는 산아제한을 목적으로 사용된다. 프레드니손과 같은 스테로이드 호르몬도 또한 면역억제제 및 항염증제로 사용된다.
생물학적 활성제는 또한 바람직하게는 액티빈, 인히빈, 및 골 형성 단백질 (BMPs)를 포함하는 단백질의 변형성장인자-베타 (TGF-β) 슈퍼패밀리 (superfamily)로 알려진 단백질의 패밀리 (family)로부터 선택된다. 한가지 구체예에서, 활성제는 골형성 활성, 및 그 밖의 다른 성장 및 분화 타입 활성을 갖는 것으로 기술된, 일반적으로 BMPs로 알려진 단백질의 서브클래스로부터 선택된 하나 이상의 단백질을 포함한다. 이들 BMPs는 BMP 단백질인 미국 특허 제 5,108,922, 5,013,649, 5,116,738, 5,106,748, 5,187,076 및 5,141,905 호에 기술된 BMP-2, BMP-3, BMP-4, BMP-5, BMP-6 및 BMP-7; PCT 공개 WO91/18098에 기술된 BMP-8; 및 PCT 공개 WO93/00432에 기술된 BMP-9, PCT 출원 WO 94/26893에 기술된 BMP-10; PCT 출원 WO94/26892에 기술된 BMP-11, 또는 PCT 출원 WO 95/16035에 기술된 BMP-12 또는 BMP-13; BMP-14; 미국 특허 제 5,635,372에 기술된 BMP-15; 또는 미국 특허 제 5,965,403 호에 기술된 BMP-16을 포함한다. 본 발명의 칼슘 포스페이트 조성물에서 활성제로서 유용할 수 있는 그 밖의 다른 TGF-β 단백질에는 Vgr-2 (Jones et al., Mol . Endocrinol. 6:1961 (1992)), 및 PCT 출원 WO94/15965, WO94/15949, WO95/01801, WO95/01802, WO94/21681, WO94/15966, WO95/10539, WO96/01845, WO96/02559 등에 기술된 것을 포함한 성장 및 분화인자 (GDFs) 중의 어떤 것이라도 포함된다. 본 발명에서 또한 유용한 것은 WO94/01557에 기술된 BIP; JP 공개 제 7-250688에 기술된 HP00269; 및 PCT 출원 WO93/16099에 기술된 MP52일 수도 있다. 상기 출원의 모든 기술내용은 본 명세서에 참고로 포함되어 있다. 본 발명에서 사용될 수 있는 BMPs의 서브셋트 (subset)는 BMP-2, BMP-4, BMP-5, BMP-6, BMP-7, BMP-10, BMP-12, BMP-13, BMP-14 및 MP52를 포함한다. 활성제는 가장 바람직하게는 그의 서열이 미국 특허 제 5,013,649 호 (그의 기술내용은 본 명세서에 참고로 포함되어 있다)에 기술되어 있는 BMP-2이다. 특히, 테리파라티드 (포르테오 (Forteo™)), 크리살린 (Chrysalin™), 프로스타글란딘 E2, LIM 단백질, 오스테오제닌, 또는 탈회된 골 매트릭스 (DBM)와 같은 본 기술분야에서 공지되어 있는 그 밖의 다른 골형성제가 사용될 수도 있다.
생물학적 활성제는 화학적으로 합성될 수 있거나, 재조합적으로 생산될 수 있거나, 또는 생물학적 활성제가 천연적으로 존재하는 공급원으로부터 정제될 수 있다. 활성제가 BMP 또는 그 밖의 다른 다이머성 단백질과 같은 TGF-β라면, 이것은 호모다이머일 수 있거나, 다른 BMPs (예를 들어, BMP-2 및 BMP-6 각각의 하나의 모노머로 구성된 헤테로다이머)와, 또는 액티빈, 인히빈 및 TGF-β1와 같은 TGF-β 슈퍼패밀리의 다른 구성원 (예를 들어, BMP와 TGF-β 슈퍼패밀리의 관련된 구성원 각각의 하나의 모노머로 구성된 헤테로다이머)과의 헤테로다이머일 수 있다. 이러한 헤테로다이머 단백질의 예는 예를 들어, 공개된 PCT 특허출원 WO 93/09229 (그의 명세서는 본 명세서에 참고로 포함된다)에 기술되어 있다.
추가의 생물학적 활성제에는 헤지호그 (Hedgehog), 프래즐드 (Frazzled), 코르딘 (Chordin), 노긴 (Noggin) 및 폴리스타틴 (Follistatin) 단백질이 포함된다. 단백질의 이들 패밀리는 일반적으로 문헌 (Sasai et al., Cell 79:779-790 (1994) (Chordin); PCT 특허공개 WO94/05800 (Noggin); 및 Fukui et al., Devel . Biol . 159:131 (1993) (Follistatin))에 기술되어 있다. 헤지호그 단백질은 WO96/16668; WO96/17924; 및 WO95/18856에 기술되어 있다. 단백질의 프래즐드 패밀리는 프리즐드 (Frizzled)로 알려진 수용체 단백질 패밀리의 세포외 결합영역에 대해서 높은 상동성을 갖는 단백질의 최근에 발견된 패밀리이다. 유전자 및 단백질의 프리즐드 패밀리는 문헌 (Wang et al., J. Biol . Chem. 271:4468-4476 (1996))에 기술되어 있다. 활성제는 또한, PCT 특허공개 WO95/07982에 기술된 절두상 (truncated) 가용성 수용체와 같은 다른 가용성 수용체를 포함할 수도 있다. WO95/07982의 지침으로부터 본 기술분야에서 숙련된 전문가는 절두상 가용성 수용체가 다른 수많은 수용체 단백질을 위해서 제조될 수 있음을 인식할 수 있을 것이다. 상기 공개공보들은 본 명세서에 참고로 포함되어 있다.
원하는 활성, 예를 들어, 존재하거나 침윤성인 조상세포 또는 다른 세포의 증가된 골형성 활성을 자극하는데 효과적인 생물학적 활성 단백질, 예를 들어, 골형성 단백질의 양은 치료할 결손 (defect)의 크기 및 성질뿐만 아니라 사용되는 담체에 따라서 좌우될 수 있다. 일반적으로, 송달되는 단백질의 양은 약 0.1 내지 약 100 ㎎; 바람직하게는 약 1 내지 약 100 ㎎; 가장 바람직하게는 약 10 내지 약 80 ㎎의 범위이다.
상기-열거된 약제의 송달을 위한 표준 프로토콜 및 레지멘은 본 기술분야에서 공지되어 있다. 생물학적 활성제는 약제의 적절한 투액량이 이식부위에 송달되도록 하는 양으로 이식물질 내에 도입된다. 대부분의 경우에, 투약량은 의사에게 공지되어 있으며 해당하는 특정 약제에 적용할 수 있는 지침을 사용하여 결정된다. 본 발명의 이식물질 내에 포함되는 생물학적 활성제의 예시적인 양은 이상상태의 타입 및 정도, 특정 환자의 전반적인 건강상태, 활성제의 제형, 및 사용된 송달 비히클의 생체흡수성과 같은 변수에 따라 좌우될 수 있다. 표준 임상실험을 사용하여 특정의 생물학적 활성제에 대한 용량 및 투약빈도를 최적화시킬 수 있다.
본 발명의 모든 관점의 구체예에서, 조성물은 추가로 자가유래 골수 또는 자가유래 혈소판 추출물을 함유할 수 있다.
상기한 모든 관점의 또 다른 구체예에서, PDGF 및/또는 그 밖의 다른 성장인자는 천연 공급원 (예를 들어, 혈소판)으로부터 수득될 수 있거나, 또는 더욱 바람직하게는 재조합 DNA 기술에 의해서 생산될 수 있다. 천연 공급원으로부터 수득되는 경우에, PDGF 및/또는 그 밖의 다른 성장인자는 생물학적 유체로부터 수득될 수 있다. 생물학적 유체에는 살아있는 유기체와 연관된 처리되거나 비처리된 유체 (현탁액 포함), 특히 전혈액, 온 또는 냉 혈액, 및 저장되거나 신선한 혈액; 식염수, 영양소 및/또는 항응고 용액을 포함한 (단, 이들로 제한되지는 않는다) 하나 이상의 생리적 용액으로 희석한 혈액과 같은 처리된 혈액; 혈소판 농축물 (PC), 성분채집된 (apheresed) 혈소판, 혈소판-풍부 혈장 (PRP), 혈소판-빈약 혈장 (PPP), 혈소판-부재 혈장, 혈장, 혈청, 새로 동결된 혈장 (FFP), 혈장으로부터 수득된 성분, 농축적혈구 (packed red cells; PRC), 백혈구연층 (buffy coat; BC)과 같은 혈액 성분; 혈액 또는 혈액 성분으로부터 유도되거나 골수로부터 유도된 혈액 생성물; 혈장으로부터 분리되어 생리적 유체에 재현탁된 적혈구; 및 혈장으로부터 분리되어 생리적 유체에 재현탁된 혈소판을 포함한 혈액이 포함된다. 생물학적 유체는 본 발명에 따라서 가공되기 전에 일부의 백혈구를 제거하도록 처리될 수 있다. 본 명세서에서 사용된 것으로, 혈액 생성물 또는 생물학적 유체는 상술한 성분, 및 다른 방법에 의해서 수득되고 유사한 특성을 갖는 유사한 혈액 생성물 또는 생물학적 유체를 의미한다. 구체예에서, PDGF는 혈소판-풍부 혈장 (PRP)으로부터 수득된다. PRP의 제조는 예를 들어, 본 명세서에 참고로 포함되어 있는 미국 특허 제 6,649,072, 6,641,552, 6,613,566, 6,592,507, 6,558,307, 6,398,972 및 5,599,558 호에 기술되어 있다.
본 발명의 모든 관점의 구체예에서, 이식물질은 1일 이상의 지속기간 동안 이식부위에서 PDGF룰 송달한다. 몇가지 구체예에서, 이식물질은 7, 14, 21 또는 28일 이상 동안 이식부위에서 PDGF를 송달한다. 바람직하게는, 이식물질은 약 1일 내지 7, 14, 21 또는 28일 사이의 시간 동안 이식부위에서 PDGF를 송달한다. 또 다른 구체예에서, 이식물질은 약 1일 이상, 약 14일 미만의 기간 동안 이식부위에서 PDGF를 송달한다.
"생체흡수성 (bioresorbable)"은 생체내에서 재흡수되거나 리모델링되는 이식물질의 능력을 의미한다. 재흡수 과정은 체액, 효소 또는 세포의 작용을 통한 원래의 이식물질의 분해 및 제거를 수반한다. 재흡수된 물질은 숙주에 의해서 새로운 조직의 형성에 사용될 수 있거나, 이것은 숙주에 의해서 다른 식으로 재이용될 수 있거나, 배설될 수도 있다.
"분화인자 (differentiation factor)"는 하나 또는 그 이상의 표적세포의 연골 또는 골 형성 잠재력을 갖는 세포로의 분화를 자극하는, 6개 이상의 아미노산의 쇄를 포함하는 폴리펩타이드를 의미한다.
"나노미터-크기 입자"는 일반적으로 1000 나노미터 이하의 입자로 정의되는 서브미크론-크기 입자를 의미한다. 나노미터-크기 입자는 분자와 마크론 (macron) 물질 사이의 중간 상태인 고체 입자물질이다. 나노미터는 미터의 10억분의 1 (1 나노미터 = 109 m)로 정의된다. 나노미터 물질은 나노스케일 크기를 갖는 분말, 섬유, 필름 또는 블럭으로 알려져 있다.
"치주조직"은 치아를 둘러싸고 지지하는 조직을 의미한다. 치주조직은 치아를 지지하고, 보호하며, 치아에 영양분을 제공한다. 치주조직은 골, 시멘트질, 상악골과 하악골의 치조돌기, 치주 인대 및 치은으로 구성된다. 시멘트질은 치근의 상아질을 완전히 덮는 조직의 얇고 석회질화된 층이다. 시멘트질은 치근의 발달 중에 및 치아의 수명 전체에 걸쳐서 형성되며, 치주 인대섬유를 위한 부착영역으로 작용한다. 치조돌기는 치아가 매립되며, 치근이 지지되는 상악골과 하악골의 골질 (bony) 부분이다. 치조 (alveolar socket)는 치조돌기 내의 공동이며, 여기에서 치아의 뿌리가 치주 인대에 의해서 유지된다. 하나의 치조를 다른 것으로부터 구분하는 골을 치간중격 (interdental spetum)이라 부른다. 다근성 치아가 존재하는 경우에 골은 근간중격 (interradicular septum)이라 부른다. 치조돌기는 피질판 (cortical plate), 치조정 (alveolar crest), 수질골 (trabecular bone) 및 고유 치조골 (alveolar bone proper)을 포함한다.
"성장 촉진"은 골, 치주조직, 인대 또는 연골의 치유, 및 이러한 조직 및 구조의 재생을 의미한다. 바람직하게는 골, 치주조직, 인대 또는 연골은 손상되거나 상처를 입고, 재생 또는 치유를 필요로 한다.
"치주조직 성장을 촉진"은 질병 또는 외상에 의해서 손상된 치조골, 시멘트질 및 삽입된 치주 인대를 포함한 치아의 지지조직의 재생 또는 치유를 의미한다.
"정제된"은 담체 물질과 혼합시키기 전에 95 중량% 또는 그 이상인 성장 또는 분화 인자, 예를 들어, PDGF를 의미하며, 즉 인자는 천연적으로 결합되어 있는 다른 단백질, 지질 및 탄수화물을 실질적으로 함유하지 않는다. 용어 "실질적으로 정제된"은 예를 들어, 중량을 기준으로 하여 단지 5%-95%, 바람직하게는 65-95%의 인자를 갖는 더 낮은 순도의 인자를 의미한다. 정제된 단백질 제제는 일반적으로 폴리아크릴아미드 겔 상에서 단일의 주밴드를 수득할 수 있다. 가장 바람직하게는, 본 발명의 이식물질에서 사용된 정제된 인자는 아미노-말단 아미노산 서열 분석에 의해서 판단되는 것으로서 순수하다. 용어 "부분적으로 정제된"은 생산을 위해서 예를 들어, 원심분리에 의한 수집 및 분리가 필요한 PRP, PPP, FFP, 또는 그 밖의 다른 혈액 생성물과 관련하여 제공되는 PDGF를 의미한다.
예를 들어, ~50% 순수한 경우에 ~1.0 ㎎/㎖의 PDGF를 갖는 용액은 ~2.0 ㎎/㎖의 총단백질을 구성한다.
본 발명의 이식물질은 결합조직, 골 및 시멘트질의 성장을 촉진시킴으로써 적어도 부분적으로 치주조직의 재생을 돕는다. 이식물질은 이들이 결합조직, 골 및 시멘트질을 생산하는 세포의 성장 및 분화를 직접적으로 촉진시키도록 제조될 수 있다. 대신으로, 이식물질은 예를 들어, 결합조직, 골 및 시멘트질의 성장을 촉진시키는데 필요한 세포를 유인함으로써 간접적으로 작용하도록 제조될 수 있다. 본 발명의 조성물을 사용한 재생은 전신적 항생제 또는 외과적 창면절제술을 단독으로 사용하여 수득되는 것보다 치주질환 또는 골 창상에 대한 더 효과적인 치료법이다.
PDGF, 폴리펩타이드 성장인자, 및 분화인자는 고체상 펩타이드 합성에 의해서, 또는 재조합체 DNA 기술에 의해서 인체 조직 또는 세포, 예를 들어, 혈소판으로부터 수득될 수 있다. 따라서, 용어 "폴리펩타이드 성장인자" 또는 "분화인자"는 조직 또는 세포-유도되거나, 재조합체이거나, 합성된 물질을 의미한다. 인자가 다이머, 예를 들어, PDGF인 경우에, 재조합체 인자는 배양된 원핵 또는 진핵세포에 인자의 서브유니트 (subunit) 둘 다를 코드화한 DNA 서열을 삽입한 다음에, 해독된 서브유니트를 세포에 의해서 처리되어 헤테로다이머 (예를 들어, PDGF-AB)를 형성하도록 함으로써 제조된 재조합체 헤테로다이머일 수 있다. 대신으로, 서브유니트 중의 단지 하나 (예를 들어, PDGF B-쇄 또는 A-쇄)를 코드화한 DNA를 세포 내에 삽입시킨 다음에, 배양하여 호모다이머 인자 (예를 들어, PDGF-BB 또는 PDGF-AA 호모다이머)를 생성시킬 수 있다. 본 발명의 방법에서 사용하기 위한 PDGF는 PDGF 호모- 및 헤테로다이머, 예를 들어, PDGF-AA, PDGF-BB, PDGF-AB, PDGF-CC 및 PDGF-DD, 및 이들의 배합물 및 유도체를 포함한다.
본 발명의 PDGF 또는 다른 성장인자의 농도는 예를 들어, 본 명세서에 참고로 포함되어 있는 미국 특허 제 6,221,625, 5,747,273 및 5,290,708 호에 기술된 바와 같은 효소-결합된 면역측정법, 또는 단백질 농도를 측정하기 위하여 본 기술분야에서 공지되어 있는 그 밖의 다른 측정방법을 사용함으로써 측정될 수 있다. 본 명세서에 제공된 경우에, PDGF의 몰농도는 PDGF 다이머 (예를 들어, PDGF-BB; MW = 약 25 kDa)의 분자량을 기준으로 하여 측정된다.
본 발명의 방법 및 이식물질을 사용하여 포유동물의 골의 창상, 예를 들어, 골절, 이식물 수용부위, 및 치주질환의 부위를 치료하기 위해서 사용될 수 있다. 이식물질은 결합조직 성장 및 복구를 촉진시키며, 자연적인 치유 (즉, 첨가되는 외인적 약제가 없는 경우) 또는 전신적 항생제의 첨가에 의해서 보강된 치유에 비해서 골 형성을 증진시킨다. 자연적 치유, 통상적인 외과적 치료법 또는 항생제와는 달리, 본 발명의 이식물질은 손상되거나 질병에 걸린 조직 또는 치주질환 감염부위에 적용하는 경우에 증가된 골, 결합조직 (예를 들어, 연골 및 인대) 및 시멘트질 형성을 촉진시킨다. 이들 조직의 복구는 병에 걸린 영역에 대하여 개선된 예후를 유도한다. 새로운 골 형성을 자극하는 이들 인자의 능력은 또한, 이들을 다른 타입의 감염 또는 외과적 또는 사고에 의한 외상에 의해서 야기된 골의 결손을 치료하기 위하여 적용될 수 있게 한다.
본 발명의 다른 특징 및 이점은 그의 구체예에 대한 이하의 설명으로부터, 및 특허청구범위로부터 명백해 질 것이다.
본 발명에 따라, 저용량(~0.1 내지 1.0 ㎎/㎖)의 rhPDG를 β-TCP에 흡착시켜 생체내 rhPDG가 방출되도록 함으로써 골, 치주조직, 인대 및 연골의 복구를 촉진시킬 수 있게 되었으며, β-TCP에 대한 rhPDG의 첨가는 비처리된 β-TCP에 비해서 골아세포 부착 및 증식을 증진시키는 것으로 나타났다.
도 1A-1G는 치료한 지 8주일 후에 골 형성에 대한 효과를 나타내는 현미경사진이다. 도 1A는 골 형성에 대한 수술 단독의 효과를 나타내는 현미경사진이다. 도 1B는 골 형성에 대한 β-TCP 단독의 효과를 나타내는 현미경사진이다. 도 1C는 골 형성에 대한 β-TCP + 0.3 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다. 도 1D는 골 형성에 대한 β-TCP + 1.0 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다. 도 1E는 골 형성에 대한 탈회된 동결건조된 동종이식편 (DFDBA) 단독의 효과를 나타내는 현미경사진이다. 도 1F는 골 형성에 대한 탈회된 동결건조된 동종이식편 (DFDBA) + 0.3 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다. 도 1G는 골 형성에 대한 탈회된 동결건조된 동종이식편 (DFDBA) + 1.0 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다.
도 2A-2C는 치료한 지 16주일 후에 골 형성에 대한 효과를 나타내는 현미경사진이다. 도 2A는 골 형성에 대한 β-TCP 단독의 효과를 나타내는 현미경사진이다. 도 2B는 골 형성에 대한 β-TCP + 0.3 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다. 도 2C는 골 형성에 대한 β-TCP + 1.0 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다.
여기서 사용된 β-TCP는 Vitoss(등록상표)β-TCP로서, 당업계에서 골 결손의 복구를 위한 재흡수성 골 공극 충진제인 다공성 칼슘 포스페이트인 것으로 알려져 있다. Vitoss(등록상표)β-TCP는 인간 골해면질의 다방면으로 상호연결된 다공성과 유사한 섬유주 구조를 갖는 골 전달성의 다공성 이식물질이다.
도 2A-2C는 치료한 지 16주일 후에 골 형성에 대한 효과를 나타내는 현미경사진이다. 도 2A는 골 형성에 대한 β-TCP 단독의 효과를 나타내는 현미경사진이다. 도 2B는 골 형성에 대한 β-TCP + 0.3 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다. 도 2C는 골 형성에 대한 β-TCP + 1.0 ㎎/㎖ PDGF의 효과를 나타내는 현미경사진이다.
여기서 사용된 β-TCP는 Vitoss(등록상표)β-TCP로서, 당업계에서 골 결손의 복구를 위한 재흡수성 골 공극 충진제인 다공성 칼슘 포스페이트인 것으로 알려져 있다. Vitoss(등록상표)β-TCP는 인간 골해면질의 다방면으로 상호연결된 다공성과 유사한 섬유주 구조를 갖는 골 전달성의 다공성 이식물질이다.
본 발명자들은 이하에서 본 발명의 몇가지 구체예를 기술한다. 골 및 치주조직 치료제로서의 PDGF의 용도를 입증하는 두가지 실시예는 이하에 제시한다.
실시예
I:
PDGF
의 제조
부분적으로 정제되거나 정제된 PDGF를 상술한 약제학적으로 허용되는 담체 물질과 배합시킴으로써 본 발명에 따라, 예를 들어, 치주질환 또는 외상 이후의 골의 창상을 치료하고, 골, 시멘트질 및 결합조직을 포함하는 치주조직을 재생시킨다. 정제된 PDGF는 재조합체 공급원으로부터, 또는 인간 혈소판으로부터 수득할 수 있다. 시판품으로 이용할 수 있는 재조합체 PDGF는 알앤드디 시스템스 인코포레이티드 (R&D Systems Inc., Minneapolis, MN), 비디 바이오사이언시즈 (BD Biosciences, San Jose, CA) 및 케미콘, 인터내쇼날 (Chemicon, International, Temecula, CA)로부터 수득할 수 있다. 부분적으로 정제 및 정제된 PDGF는 또한 다음과 같이 제조될 수도 있다:
500 내지 1000 단위의 세척된 인간 혈소판 펠릿을 1 M NaCl (2 ㎖/혈소판 단위)에 현탁시키고, 100℃에서 15분 동안 가열한다. 그 후, 상등액을 원심분리에 의해서 제거하고, 침전을 1 M NaCl로 2 회 추출한다.
추출물을 합하여 0.08 M NaCl/0.01 M 나트륨 포스페이트 완충액 (pH 7.4)에 대해서 투석하고, 4℃에서 밤새 완충액으로 평형화된 CM-세파덱스 (Sephadex) C-50과 혼합시킨다. 그 후, 혼합물을 칼럼 (5×100 ㎝)에 붓고, 0.08 M NaCl/0.01 M 나트륨 포스페이트 완충액 (pH 7.4)으로 광범하게 세척하고, 1 M NaCl로 용출시키면서 10 ㎖ 분획을 수거한다.
활성분획을 모아서 0.3 M NaCl/0.01 M 나트륨 포스페이트 완충액 (pH 7.4)에 대해서 투석하고, 원심분리하고, 4℃에서 0.3 M NaCl/0.01 M 나트륨 포스페이트 완충액 (pH 7.4)으로 평형화된 블루 세파로즈 (blue sepharose; Pharmacia)의 2.5×25 ㎝ 칼럼을 통과시킨다. 그 후, 칼럼을 완충액으로 세척하고, 부분적으로 정제된 PDGF는 1 M NaCl과 에틸렌글리콜의 1:1 용액으로 용출시킨다.
부분적으로 정제된 PDGF 분획을 1 M NaCl로 희석하고 (1:1), 1 M 아세트산에 대해서 투석하고, 동결건조시킨다. 동결건조된 샘플을 0.8 M NaCl/0.01 M 나트륨 아세테이트 완충액 (pH 7.4)에 용해시키고, 완충액으로 평형화된 CM-세파덱스 C-50의 1.2×40 ㎝ 칼럼을 통과시킨다. 그 후, PDGF를 NaCl 구배 (0.08 내지 1 M)로 용출시킨다.
활성분획을 합하여 1 M 아세트산에 대해서 투석하고, 동결건조시켜 작은 용적의 1 M 아세트산에 용해시킨다. 0.5 ㎖ 부분을 1 M 아세트산으로 평형화된 바이오겔 (Biogel) P-150 (100 내지 200 메쉬)의 1.2×100 ㎝ 칼럼에 적용한다. 그 후, PDGF를 1 M 아세트산으로 용출시키면서 2 ㎖ 분획을 수거한다.
100 내지 200 ㎎의 단백질을 함유하는 각각의 활성분획을 동결건조시키고, 100 ㎖의 0.4% 트리플루오로아세트산에 용해시키고, 페닐 본다팩 칼럼 (phenyl Bondapak column; Waters) 상에서의 역상 고성능 액체 크로마토그라피에 적용한다. 선형 아세토니트릴 구배 (0 내지 60%)로 용출시켜 순수한 PDGF를 수득한다.
재조합체 DNA 기술에 의해서 만들어지는 PDGF 는 다음과 같은 제조될 수 있다:
인간 혈소판으로부터 유도된 혈소판-유도된 성장인자 (PDGF)는 두개의 폴리펩타이드 서열 (PDGF-B 및 PDGF-A 폴리펩타이드; Antoniades, H.N. and Hunkapiller, M., Science 220:963-965, 1983)을 함유한다. PDGF-B는 염색체 7 (Betsholtz, C. et al., Nature 320:695-699) 상에 국재화된 유전자에 의해서, PDGF-A는 염색체 22 (Dalla-Favera, R., Science 218:686-688, 1982) 상에 국재화된 sis 종양유전자 (Doolittle, R. et al., Science 221:275-277, 1983)에 의해서 코드화된다. sis 유전자는 PDGF-2 폴리펩타이드에 밀접하게 관련된 시미안 육종 바이러스 (Simian Sarcoma Virus; SSV)의 변형성 단백질을 코드화한다. 인간 세포성 c-sis는 또한 PDGF-A 쇄를 코드화한다 (Rao, C.D. et al., Proc . Natl . Acad . Sci. USA 83:2392-2396, 1986). PDGF의 두개의 폴리펩타이드 쇄는 별개의 염색체에서 국재화된 두개의 상이한 유전자에 의해서 코드화되기 때문에, 인간 PDGF가 PDGF-B와 PDGF-A의 디설파이드-결합된 헤테로다이머, 또는 두개의 호모다이머 (PDGF-BB 호모다이머 및 PDGF-AA 호모다이머)의 혼합물, 또는 헤테로다이머와 두개의 호모다이머의 혼합물로 구성될 가능성이 존재한다.
PDGF-A 쇄를 코드화하는 유전자를 함유하는 시미안 육종 바이러스에 의해서 감염된 배양물 내의 포유동물 세포는 PDGF-A 폴리펩타이드를 합성하고, 이것을 디설파이드-결합된 호모다이머로 가공하는 것으로 나타났다 (Robbins et al., Nature 305:605-608, 1983). 또한, PDGF-A 호모다이머는 인간 PDGF에 대항하여 야기된 항혈청과 반응한다. 또한, 분비된 PDGF-A 호모다이머의 기능적 특성은 이것이 배양된 섬유아세포에서 DNA 합성을 자극하고, 185 kD 세포막 단백질의 타이로신 잔기에서 포스포릴화를 유도하며, 특이적 세포 표면 PDGF 수용체에 결합하기 위하여 인간 (125I)-PDGF와 경쟁할 수 있다는 점에서 혈소판-유도된 PDGF의 특성과 유사하다 (Owen, A. et al., Science 225:54-56, 1984). 유사한 특성은 배양된 정상 인간 세포 (예를 들어, 인간 동맥 내피세포)로부터, 또는 sis//PDGF-2 유전자를 발현하는 인간 악성세포로부터 유도된 sis/PDGF-A 유전자 생성물에 대해서 나타났다 (Antoniades, H. et al., Cancer Cells 3:145-151, 1985).
재조합체 PDGF-B 호모다이머는 c-sis/PDGF-B 유전자의 cDNA 클론을 발현벡터를 사용하여 마우스 세포 내로 도입시킴으로써 수득된다. 발현을 위해서 사용된 c-sis/PDGF-B 클론은 정상 인간 배양된 내피세포로부터 수득되었다 (Collins, T., et al., Nature 216:748-750, 1985).
PDGF
의 용도
PDGF는 단독으로 또는 다른 성장인자와 함께 골의 치유, 골 성장, 및 외상 또는 질병에 의해서 손상된 치아의 지지구조의 재생 또는 치유를 촉진시키는데 유용하다. 이것은 또한, 발치 부위의 치유를 촉진시키거나, 하악 치조제 증대를 위해서, 또는 치아 이식부위에서 유용할 수 있다. 골 치유는 또한, 골절 부위에서 또는 감염된 영역, 예를 들어, 골수염에서, 또는 종양부위에서 증진될 수도 있다. PDGF는 또한, 인대, 예를 들어, 치주 인대, 및 시멘트질의 성장 및 치유를 촉진시키는데 유용할 수 있다.
사용시에 PDGF 또는 그 밖의 다른 성장 또는 분화 인자는 치유 또는 재생이 필요한 영역에 직접 적용된다. 일반적으로, 이것은 액체 또는 고체인 재흡수성 또는 비-재흡수성 담체 내에서 적용된 다음에, 그 부위를 붕대 또는 인접한 조직으로 덮어준다. 골 성장을 촉진시키는데 충분한 양은 일반적으로, 1 ㎠ 영역에 대해서 500 ng 내지 5 ㎎ 사이이지만, 상한선은 실제로 1 ㎠ 영역에 대해서 1 ㎎이며, 적용되는 PDGF의 바람직한 양은 0.3 ㎎/㎖이다.
실시예
II
:
rhPDGF
-
BB
처리된
골전도성
골격에 의한
치주
재생
치주조직 및 골 성장을 촉진시키는데 있어서의 PDGF의 유효성은 이하의 시험에 의해서 입증된다.
생체내
개 시험
비글 개는 추정상의 치주 재생물질 및 방법을 시험하기 위하여 가장 광범하게 사용되는 동물 모델이다 (Wikesjo et al., J. Clin . Periodontol . 15:73-78, 1988; Wikesjo et al., J. Clin . Periodontol . 16:116-119, 1999; Cho et al., J. Periodontol. 66:522-530, 1995; Giannobile et al., J. Periodontol . 69:129-137, 1998; 및 Clergeau et al., J. Periodontol . 67:140-149, 1996). 플라크 및 치석 축적은 변연골 상실 (marginal bone loss)을 야기할 수 있는 치은염증을 유도할 수 있으며, 개 및 인간에게서 치주염의 병인원은 동등할 수 있다. 그러나, 자연적으로 존재하는 질환에서는 결손 사이에 균일성이 결여된다. 추가로, 개 종축 집단에서의 구강 건강에 더 주의를 기울여야 하기 때문에, 자연적인 치주질환을 갖는 동물을 수득하는 것은 실행불가능하게 되었다. 따라서, 외과적으로-유도된 수평적 클래스 III 치근분기모델 (surgically-induced horizontal Class III furcation model)이 치주 치유 및 재생을 연구하기 위하여 가장 통상적으로 사용되는 모델 중의 하나가 되었다.
수평적 클래스 III 치근분기 결손을 갖는 비글 개를 본 발명의 PDGF 조성물을 사용하여 치료하였다. 15 마리의 성숙한 비글 개는 60 개의 치료된 결손을 제공하였다. 42 개의 결손을 치료한 지 2개월 후에 생검하고, 15 개의 결손은 치료한 지 4개월 후에 생검하였다.
결손 준비
다수의 연구자에 의해서 기술된 바와 같은 "임계-크기 (critical-size)" 치주결손 모델이 이용되었다 (참조예: Wikesjo, 1988 및 1999, supra; Giannobile, supra, 및 Park et al., J. Periodontol . 66:462-477, 1995). 전반적 및 구강 건강의 문제가 없는 16 마리의 비글 개 (2-3 세)에서 하악골 4분할부 두개가 사용되었다. 투약하기 1개월 전에, 동물은 펜토바르비탈 나트륨 (25 ㎎/㎏)을 IV 주사하여 마취시키기 약 30분 전에 아트로핀 (0.02 ㎎/㎏) 및 아세프로마진 (0.2 ㎎/㎏)을 피하주사하여 진정시켰다. 리도카인 HCl + 에피네프린 1:100,000으로 외과적 영역을 국소 침윤시킨 후에, 점막성골막 피판 (mucoperiosteal flap)의 전체 두께를 반전시키고, 첫번째 및 세번째 소구치 (P1 및 P3)를 발치하였다. 추가로, 첫번째 대구치의 크라운 (crown)의 중앙부분을 절제하였다.
그 후, 치조골을 끌 및 수-냉각된 카바이드 및 다이아몬드 버 (bur)를 사용하여 치근분기 영역을 포함한 P2 및 P4의 전체 원주 주위에서 제거하였다. 수평적 골 결손은 치근분기의 원개 (fornix)로부터 골의 크레스트 (crest) 사이에 5 ㎜의 간격이 있도록 생성되었다. 결손은 치아의 폭에 따라서 약 1 ㎝ 폭이었다. 모든 실험 치아의 뿌리는 큐렛 및 초음파 장치에 의해서 편평하게 하고, 테이퍼드 (tapered) 다이아몬드 버를 설치하여 시멘트질을 제거하였다. 표준화된 골 결손을 발생시킨 후에 치은피판 (gingival flap)을 봉합하여 일차적 폐쇄를 달성하였다. 동물에게 연식을 공급하고, 시험기간 중에는 매일 클로르헥시딘 세정을 수행하였다.
이식물질의 적용
15 마리의 동물의 각각의 하악골 4분할부에서 P2 및 P4의 치주결손은 밀봉된 봉투를 사용하여 처리하기 전에 무작위화하였다. 결손을 준비한 지 약 4주일 후에, 동물을 상술한 바와 같이 재마취시키고, 전체 두께의 피판을 두개의 하악골 4분할부 모두에서 반전시켰다. 1/2 라운드 버를 사용하여 나머지 골의 크레스트에서 치근 표면에 노치 (notch)를 배치시켜 추후의 조직학적 기준점으로 사용하였다. 이 부위를 멸균 식염수로 관주하고, 치근을 오염물제거 및 도말층의 제거의 목적으로 전술한 바와 같이 시트르산으로 처리하였다 (참조예: Cho, supra, 및 Park, supra). 이 기간 중에 치주결손을 충진시키기에 충분한 양의 β-TCP 또는 DFDBA를 rhPDGF-BB 용액 (0.3 또는 1.0 ㎎/㎖)으로 포화시키고, rhPDGF-BB/이식물 혼합물을 약 10분 동안 멸균 수술대 상에서 정치시켰다. 그 후, rhPDGF-BB 포화된 이식물을 골 재생의 이상적인 레벨까지 온화하게 압력을 가하면서 결손에 충전시켰다.
이식물질을 이식한 후에, 점막성골막 피판을 인접면 사이의 단절된 4.0 팽창 폴리테트라플루오로에틸렌 (ePTFE) 봉합사를 사용하여 대략 시멘트질에나멜질 경계 (cementoenamel junction; CEJ) 까지의 레벨을 봉합하였다. 피판을 봉합한 후에 클로르헥시딘 글루코네이트 겔을 치아 및 치은 주위에 부드럽게 배치시켰다.
처리군 및 대조군
결손은 다음 중의 하나를 수용하였다:
1. β-TCP
2. β-TCP + rhPDGF-BB (0.3 ㎎/㎖ rhPDGF-BB)
3. β-TCP + rhPDGF-BB (1.0 ㎎/㎖ rhPDGF-BB)
4. 개 DFDBA
5. 개 DFDBA + rhPDGF-BB (0.3 ㎎/㎖ rhPDGF-BB)
6. 개 DFDBA + rhPDGF-BB (1.0 ㎎/㎖ rhPDGF-BB)
7. 샴수술 (Sham surgery; 이식물이 없이 개방 피판 창면절제술 만으로 처리됨).
처리군당 6 개의 결손을 2개월째에 생검하였다 (총 42 개의 부위). 또한, 처리군 1, 2, 및 3에서의 5 개의 결손을 4개월째에 생검하였다 (총 15 개의 부위).
따라서, 8주일째에는 11 마리의 개에서 42 개의 부위를 7 개의 군으로 나누었다. 16주일째에는 4 마리의 개에서 15 개의 부위를 3 개의 군으로 나누었다 (한마리의 개가 8주일의 시간 간격을 두고 두가지의 처리 수술을 받았으며, 따라서 8 및 16주일 시점 각각에 대한 두개의 부위를 제공하였다).
수술-
후 처리
수술부위는 개에게 수술-후의 처음 4주일 동안 연식 (soft diet)을 공급함으로써 보호하였다. 최적의 치유를 보장하기 위해서, 페니실린 G 벤자틴에 의한 전신적 항생체 처리를 처음 2주일 동안 제공하고, 플라크 대조군은 실험 전과정에 걸쳐서 2% 클로르헥시딘 글루코네이트를 매일 관주함으로써 유지시켰다. 봉합은 3주일 후에 제거하였다.
데이타
수집
데이타
수집점에
대한 이론적 설명
8주일 시점은 이것이 문헌에서 이 모델에 대해서 보고된 가장 통상적인 시점이고 따라서 여기에서 실질적인 역사적 데이타가 있기 때문에, 선택되었다. 예를 들어, 문헌 (Wikesjo et al., supra, 및 Giannobile et al., supra)에서는 또한, 동일한 모델에서 BMP-2 및 OP-1의 재생효과를 각각 평가하기 위하여 8주일을 선택하였다. 추가로, 문헌 (Park et al., supra)에서는 8주일째에 비글 개 모델에서 CTR 막의 존재 및 부재 하에서 컨디쇼닝된 치근 표면에 직접 적용된 rhPDGF-BB의 효과를 평가하였다. 이들 연구는 8주일 기간이 다양한 처리 양식 중에서 잠재적인 중요한 효과를 설명하는데 최적임을 강력히 시사한다.
16주일 시점은 성장인자 처리의 장기간 효과를 평가하기 위해서 선택되었다. 이전의 연구 (Park et al., supra)는 이 시점에서는 골의 결손의 실질적인 자발적 치유가 있음을 시사한다. 그럼에도 불구하고, rhPDGF-BB 처리가 변화된 골 리모델링, 종양형성 또는 치근흡수와 같은 일상적이지 않거나 비정상적인 조직반응을 유도하는지 여부를 평가할 수 있다.
생검
및 처리 평가
생검시에 동물은 4% 파라포름알데히드로 관류시키고, 치사시켰다. 그 후, 하악골을 분리하여 고정액에 넣었다. 치근단 방사성사진을 찍고, 처리된 부위를 다이아몬트 톱을 사용하여 각각의 블럭으로 절단하였다. 코드화된 (맹검) 블럭을 거어즈로 싸고, 4% 포름알데히드의 용액에 액침시키고, 처리하여 분석하였다.
처리하는 중에 생검은 에탄올 중에서 탈수시키고, 침윤시켜 메틸메타크릴레이트 내에 매립하였다. 냉매와 함께 저속 다이아몬드 톱을 사용하여 두께가 약 300 ㎛인 석회질이 제거되지 않은 절편을 수득하였다. 이 절편을 유백색의 아크릴 글래스 상에 접착제로 접착시키고, 대략 80 ㎛의 최종 두께로 연마하여 톨루이딘 블루 및 염기성 푸크신으로 염색하였다. 단계적 연속 절편을 근심원심평면에서 수득하였다.
조직형태학적 분석은 차폐된 슬라이드 (masked slide) 상에서 수행하였다. 다음의 파라메터가 평가되었다:
1. CNAA (Complete New Attachment Apparatus)의 길이: 새로운 골과 새로운 시멘트질 사이에 기능적으로 배열된 치주 인대와 함께 새로운 시멘트질에 인접한 새로운 골만을 포함한, 오래된 골의 치관측 레벨과 새로운 골의 치관측 레벨 사이의 간격으로 측정된 치주 재생.
2. NB (New Bone Fill): 치근분기 내에 형성된 새로운 골의 단면적으로 측정됨.
3. CT (Connective Tissue Fill): 치은결합조직에 의해서 점유된 치근분기 내의 면적으로 측정됨.
4. VO (Void): 조직이 존재하지 않는 퇴축부 (recession)의 면적.
결과
A. 임상적 관찰결과
임상적으로 모든 부위는 잘 치유되었다. rhPDGF-BB로 처리된 부위는, 수술후 1주일 이내에 단단한 분홍색의 치은의 존재에 의해서 나타나는 바와 같이 더 빨리 치유되었다는 결과가 있었다. 처리된 부위의 시각적 검사에 의해서 평가되는 바와 같이 어떠한 처리군에서도 부작용이 나타나지 않았다. β-TCP 또는 DFDBA를 단독으로 투여한 군에서는 치은퇴축이 증가되는 것으로 나타났다.
B. 방사선사진 관찰결과
방사선사진에 의해서는, 다른 군들에 비해서 2군, 3군 (각각 β-TCP + rhPDGF-BB 0.3 및 1.0 ㎎/㎖) 및 6군 (DFDBA + rhPDGF-BB 1.0 ㎎/㎖)군에서의 증가된 방사선비투과성에 의해서 판단되는 바와 같이 2개월째에 증가된 골 형성이 입증되었다 (도 1A-G). 4개월째에는 2개월 시점에 비해서 모든 군에서 증가된 골 형성이 입증되었다. 어떤 군에서도 어떠한 비정상적인 골 리모델링, 치근 흡수 또는 강직증의 방사선사진 증거는 나타나지 않았다.
C. 조직형태학적 분석
새로운 골 충진, 결합조직 충진, 및 공극 공간뿐만 아니라 새로운 시멘트질, 새로운 골 및 새로운 치주 인대 (CNAA)의 길이의 조직형태학적 평가치를 평가하였으며, 백분율로 나타낸다. CNAA의 경우에 각각의 시험군에 대한 값은 CNAA 측정치 (㎜로 나타낸 길이) / 이용가능한 CNAA 총길이 (㎜) × 100%로 나타낸다. 골 충진, 결합조직 충진 및 공극 공간을 평가하였으며, 전체 치근분기 결손면적의 백분율로서 나타낸다.
일원분산분석 (one-way analysis of variance; ANOVA)을 사용하여 처리군들 사이의 전반적 차리에 대해서 시험하였으며, 쌍대비교 (pairwise comparison)는 스투던트 t-시험 (student's t-test)을 사용하여 이루어졌다. 코드화된 슬라이드의 분석에 의해서 군들 사이의 유의적인 차이가 나타났다. 표 4는 2개월째의 결과를 나타낸다.
이식이 없는 수술군 및 수술+β-TCP 단독군에서 치주 재생 (CNAA)의 평균 퍼센트는 각각 27% 및 37%였다. 반대로, rhPDGF-BB를 함유하는 β-TCP 군은 이식이 없는 수술 또는 DFDBA 단독인 경우에 비해서 유의적으로 더 큰 치주 재생을 나타내었다 (p<0.05) (0.3 및 1.0 ㎎/㎖ 농도의 경우에 각각 59% 및 46%에 대비하여 수술 단독인 경우는 27%이고 DFDBA 단독인 경우는 13%임). 마지막으로, 0.3 ㎎/㎖ rhPDGF-BB를 함유하는 β-TCP 군은 동종이식편과 배합된 동일한 농도의 rhPDGF-BB인 경우보다 유의적으로 더 큰 치주 재생을 나타내었다 (p<0.05) (59% 대 21%).
골 충진은 β-TCP 단독 (28.0%), 수술 단독 (34%) 또는 DFDBA 단독 (6%) 처리군에서 보다 β-TCP + 0.3 ㎎/㎖ rhPDGF-BB (84.0%) 및 β-TCP + 1.0 ㎎/㎖ rhPDGF-BB (74.2%)에서 유의적으로 더 컸다 (p<0.05). 또한, DFDBA + 0.3 ㎎/㎖ rhPDGF-BB 군에 비해서 β-TCP + 0.3 ㎎/㎖ rhPDGF-BB 군의 경우에 골 충진이 유의적으로 더 컸다 (p<0.05) (각각 84% 및 20%).
DFDBA 군 및 수술 단독군 (4, 5, 6 및 7 군)으로부터의 8-주일 데이타를 조사하는 분석군은 DFDBA 군과 수술 단독군 사이에 치주 재생 (CNAA)에 있어서 통계학적으로 유의적인 차이가 없음을 나타내었다. DFDBA 단독인 경우에 비해서 1.0 ㎎/㎖ rhPDGF-BB 증강된 DFDBA로 처리된 부위에서 더 큰 재생이 나타나는 경향이 있었다. DFDBA 단독인 경우보다 DFDBA + 1.0 ㎎/㎖ rhPDGF-BB로 처리된 부위에 대해서 유의적으로 더 큰 골 충진이 있었다 (p<0.05) (각각 46% 및 6%). DFDBA 단독이거나 수술 단독인 경우에 비해서 0.3 ㎎/㎖ rhPDGF-BB를 함유하는 DFDBA로 처리된 부위에서 더 큰 골 충진이 나타나는 경향이 있었다. 그러나, DFDBA 단독으로 처리된 부위는 수술 단독인 경우보다 결손에 대한 골 충진이 더 적었음을 나타내었으며 (각각 6 및 34%), 대부분의 결손은 어떤 충진물도 치은 (연질) 결합조직으로 구성된 충진물도 결여되어 있다.
처리 후의 4개월째에 치주 재생에 있어서의 유의적인 차이는 유지되었다. β-TCP 단독인 경우는 광범한 강직의 결과로 36% 재생을 제공한 반면에, rhPDGF-BB를 함유하는 β-TCP로 처리된 부위는 0.3 및 1.0 ㎎/㎖ rhPDGF-BB 농도에서 58% 및 49%의 평균 재생을 가졌다. 실질적인 골 충진은 3가지 처리군 모두에 존재하였다. β-TCP 단독인 경우는 70% 골 충진을 제공하였으며, β-TCP + 0.3 ㎎/㎖ rhPDGF는 100% 충진을 제공한 반면에 1.0 ㎎/㎖ rhPDGF 군은 75% 충진을 나타내었다.
D. 조직학적 평가
처리하는 중에 직면하게 된 어려움으로 인하여 평가가 불가능하였던 한가지를 제외하고 모든 생검에 대해서 조직학적 평가가 수행되었다.
대표적인 현미경사진은 도 1A-G 및 2A-C에서 나타내었다. 도 1A는 수술 단독 (이식 없음)으로 처리한 부위로부터의 결과를 나타낸 것이다. 이 검체는 노치 및 치관측으로 단지 짧은 거리를 연장한 영역에서 입증되는 바와 같이 제한된 치주 재생 (새로운 골 (NB), 새로운 시멘트질 (NC) 및 치주 인대 (PDL))을 나타낸다. 치근분기의 영역은 주로, 최소의 새로운 골 (NB) 형성과 함께 조밀한 연질 결합조직 (CT)에 의해서 점유된다.
β-TCP 단독으로 처리된 부위 (도 1B)의 경우에는 수술 단독인 경우의 검체에 대해서 관찰된 것과 유사한 것으로 노치의 기부로부터 치관측으로 짧은 거리를 연장한 치주 재생이 있다. 수술 단독인 검체에서 볼 수 있는 바와 같이, 새로운 골 형성은 매우 적었으며 치근분기의 최대 영역은 연질 결합조직에 의해서 점유되었다.
이와는 달리, 도 1C는 β-TCP + 0.3 ㎎/㎖ rhPDGF-BB로 처리한 부위에 대해서 수득된 결과를 나타낸 것이다. 치근분기의 전체 표면을 따라서 연장된 새로운 골, 새로운 시멘트질 및 치주 인대를 갖는 유의적인 치주 재생이 나타났다. 추가로, 치근분기의 영역은 치근분기의 전체 높이를 원개까지 연장하는 새로운 골로 충진된다.
β-TCP + 1.0 ㎎/㎖ rhPDGF-BB로 처리된 부위에 대한 대표적인 결과는 도 1D에 나타내었다. 치근분기에서 유의적인 치주 재생이 있지만, 이것은 치근분기의 전체 표면을 따라서 연장되지는 않는다. 새로운 골 형성은 치근분기의 원개에서 어떤 조직도 없는 작은 공간과 함께 결손의 치관측 부분에서 관찰되는 연질 결합조직과 함께 존재한다.
도 2A, 2B 및 2C는 동종이식편 처리군에 대해서 수득된 결과를 나타낸 것이다. DFDBA 단독군에 대한 대표적인 결과 (도 2A)는 치관측 방향으로 단지 약간 연장되는 노치의 영역으로 제한된 매우 불량한 치주 재생을 나타낸다. 새로운 골 형성은 제한되며, 잔류하는 DFDBA 이식물질의 표면을 따라 소량의 골 형성으로 구성된다 (더 연한 분홍색 섬을 따라서 암갈색 염색). 추가로, 새로운 골은 치관측으로 연장하여 치근분기 내에서 상당한 영역을 충진시키는 광범한 연질 결합조직에 의해서 둘러싸인다. 마지막으로, 큰 공극 공간이 연질 결합조직의 치관측 범위에서부터 치근분기의 원개까지 연장된다.
DFDBA + 0.3 및 1.0 ㎎/㎖ rhPDGF-BB에 대한 조직학적 결과는 각각 도 2B 및 2C에 나타내었다. 두가지 군은 모두 DFDBA 단독인 경우에 비해서 치근부에서 노치의 기부로부터 치관측으로 (화살표) 짧은 거리를 연장하는 완전히 새로운 부착장치 (새로운 골, 새로운 시멘트질 및 치주 인대)를 가지고 더 큰 치주 재생을 나타낸다. 이들은 또한, 치근분기의 영역에서 더 큰 골 충진을 가졌지만, 연질 결합조직에 의해서 치근분기의 상당부분이 충진되었다.
결론
시험의 결과를 기초로 하여, 적합한 담체 물질 (예를 들어, β-TCP)과 함께 0.3 ㎎/㎖ 또는 1.0 ㎎/㎖의 rhPDGF-BB를 사용한 치주 결손의 치료는 β-TCP 또는 골 동종이식편 단독에 의한 이식, 또는 이식이 없는 치주수술과 같은 현재의 제품 또는 방법보다 더 큰 치주 재생을 제공한다.
0.3 ㎎/㎖ 및 1.0 ㎎/㎖ 농도의 rhPDGF에 의한 치료는 치주 재생을 제공하였다. 0.3 ㎎/㎖ 농도의 rhPDGF는 β-TCP와 혼합한 경우에 1.0 ㎎/㎖ 농도의 rhPDGF에 비해서 더 큰 치주 재생 및 골 충진율을 나타내었다.
β-TCP는 어떤 노도의 rhPDGF-BB와 혼합한 경우에도 동종이식편보다 더 효과적이었다. 새로운 골은 모든 군에서 통상적으로 시간이 경과함에 따라서 (0, 8 및 16주일) 성숙하였다 (리모델링되었다). rhPDGF 군에서 강직증 또는 치근흡수의 증가는 없었다. 실제로, rhPDGF-BB를 투여한 부위는 대조부위보다 강직을 덜 나타내는 경향이 있다. 이러한 소견은 rhPDGF-BB가 치주 인대세포에 대해서 유사분열촉진성 및 화학주성이라는 사실에 기인할 수 있다.
물질 및 방법
이용된 물질: 시험 및 대조 제품
이용된 β-TCP는 치주에 사용하도록 최적화된 입자-크기 (0.25 ㎜-1.0 ㎜)를 가졌다. 개 모델을 사용한 시험을 기초로 하여, 투여된 β-TCP는 3개월 이내에 ~80% 재흡수되며, 치유과정 중에 자가유래하는 골에 의해서 대체된다.
DFDBA는 MTF (Musculoskeletal Transplant Foundation)에 의해서 공급되었다. 물질은 골격조직에 대한 효과를 갖지 않는 것으로 생각되는 수술방법을 시험한 또 다른 시험의 완료 후에 치사시킨 개의 골로부터 만들어진 개 동종이식편이었다.
재조합체 hPDGF-BB는 바이오미메틱 파마슈티칼스 (BioMimetic Pharmaceuticals)에 의해서 공급되었으며, 인간에게 사용하기 위한 FDA-승인 rhPDGF-BB의 유일한 공급자인 카이론, 인코포레이티드 (Chiron, Inc.)에 의해서 제조되었다. 이 rhPDGF-BB는 상품명 레그라넥스 (Regranex™)인 창상치유제품으로 FDA에 의해서 승인되었다.
두개의 별개의 농도의 멸균 rhPDGF-BB 0.5 ㎖를 함유하는 1 ㎖ 시린지는 인체 물질을 위한 FDA 기준에 순응하고, 현재 이용가능한 우수의약품제조방법 (current applicable Good Manufacturing Processes; cGMP)에 따라 제조되었다. 시험된 농도는 0.3 ㎎/㎖ 및 1.0 ㎎/㎖를 포함하였다.
β-TCP는 0.5 ㏄의 멸균 입자를 함유하는 바이알로 제공되었다.
DFDBA는 1.0 ㏄의 멸균된 탈회된 동결건조된 개 골 동종이식편을 함유하는 2.0 ㎖ 시린지로 제공되었다.
물질 제조
수술절차의 시기에 최종 이식된 이식물은 rhPDGF-BB 용액을 매트릭스 물질과 혼합시킴으로써 제조되었다. 간략하게, 골의 결손을 완전히 충진시키기에 충분한 양의 TCP 또는 동종이식편을 멸균 디쉬 (sterile dish) 내에 배치하였다. 그 후, 매트릭스를 완전히 포화시키는데 충분한 rhPDGF-BB 용액을 첨가하고, 물질을 혼합하여 골의 결손 내에 배치하기 전에 약 10분 동안 실온에서 외과적 트레이 (surgical tray) 상에 정치시켰다.
β-TCP 물질과의 10분의 배양시간은 성장인자의 최대 흡착을 수득하기에 충분하다 (참조: 부록 A). 이것은 또한, 임상적 셋팅 (clinical setting)에서 제품을 치주 결손에 배치시키기 전에 외과의사가 갖도록 하는데 적절한 양의 시간이다. 마찬가지로, 상업적 시장에서 rhPDGF-BB 및 매트릭스 물질은 키트 내의 별도의 용기에서 공급될 수 있으며, 이 물질은 배치시키기 직전에 혼합될 수 있다. 이러한 키트 개념은 제품 저장수명/안정성 문제를 매우 단순화시킬 수 있다.
실시예
III
: 인간에게서
치주골
결손의 치료를 위한
PDGF
의 용도
재조합체 인간 PDGF-BB (rhPDGF-BB)는 인간 피검자에게서 치주골의 재생에 대한 그의 효과에 대해서 시험하였다. 두개의 시험군에는 0.3 ㎎/㎖ (I 군) 또는 1.0 ㎎/㎖ (II 군)로 rhPDGF-BB를 투여하였다. rhPDGF-BB는 나트륨 아세테이트 완충액 중에서 제조되었으며, 베타-트리칼슘 포스페이트 (β-TCP)의 비히클 중에서 투여되었다. 대조군인 III 군은 나트륨 아세테이트 완충액 중의 β-TCP 만을 투여하였다.
임상시험의 목적은 1 내지 3 개의 벽 골내 치주 결손 (wall intra-osseous periodontal defects)의 관리시에 0.3 ㎎/㎖ 또는 1.0 ㎎/㎖의 rhPDGF-BB 및 β-TCP를 포함하는 이식물질의 안전성 및 유효성을 평가하고, 골 및 연조직에서 그의 재생능을 평가하기 위한 것이었다.
시험 디자인 및 치료기간
시험은 자연적인 치아상태에 인접한 골 결손을 치료하기 위한 외과적 개입을 필요로 하는 피검자에게서 이중-맹검식의 조절되고 예기되는 무작위화, 평행 디자인된 멀티-센터 임상실험 (double-blind, controlled, prospective, randomized, parallel designed, multi-center clinical trial)이었다. 피검자는 동일한 비율로 무작위 분류하여 각각 대략 60명씩으로 3 개의 치료군을 제공하였다 (총 180 명). 시험의 지속기간은 시험장치를 이식한 후 6개월이었다. 시험에는 180 명의 피검자가 참여하였다.
진단 및 주요 도입기준 (
entry
criteria
)
골 결손을 교정하기 위하여 외과적 치료를 필요로 하는 하나 이상의 부위에서 진행된 치주질환을 갖는 25-75 세의 남성 및 여성 피검자가 시험에 참여하였다. 그 밖의 다른 포함기준에는 다음이 포함된다: 1) 기준선 방문시에 7 ㎜ 또는 그 이상으로 측정되는 프로빙 포켓 (probing pocket) 깊이; 2) 외과적 창면절제술 후에 하나 이상의 골벽 (bony wall)을 갖는 4 ㎜ 또는 그 이상의 수직 골 결손 (BD); 3) 결손의 완전한 조직 보호를 허용하도록 충분히 케라틴화된 조직; 및 4) 치아의 첨단부까지 치관측으로 3 ㎜ 이상의 결손의 방사선사진 기부. 하루에 한 갑까지 흡연을 하고, 클래스 I 및 II 치근분기 침습이 있는 치아를 갖는 피검자가 특정적으로 허용되었다.
투여량 및 투여의
모드
모든 치료 키트는 0.25 g의 β-TCP (능동적 대조군) 및 0.5 ㎖ 나트륨 아세테이트 완충용액 단독 (III 군), 0.3 ㎎/㎖ rhPDGF-BB (I 군), 또는 1.0 ㎎/㎖ rhPDGF-BB (II 군)를 함유하였다.
철저한 창면절제술 및 치근 평활화 이후에, 시험용액을 멸균 용기 내에서 β-TCP가 완전히 포화되도록 β-TCP와 혼합시켰다. 치근 표면은 테트라사이클린, EDTA, 또는 시트르산을 사용하여 컨디쇼닝하였다. 그 후, 수화된 이식물을 골의 결손에 충전시키고, 조직 피판은 치간 봉합에 의해서 고정시켜 수술부위의 완전한 보호가 달성되도록 하였다.
유효성 측정
일차적 유효성 측정은 기준선과 수술-후 6개월 사이의 임상적 부착레벨 (clinical attachment level; CAL)의 변화를 포함하였다 (I 군 대비 III 군). 이차적 유효성 측정은 다음의 결과로 구성되었다: 1) 방사선사진 평가를 기초로 한 기준으로부터 수술-후 6개월까지의 선형 골 성장 (linear bone growth; LBG) 및 골 충진 % (%BF) (I 군 및 II 군 대비 III 군); 2) 기준선과 수술-후 6개월 사이에서의 CAL의 변화 (II 군 대비 III 군); 3) 기준선과 수술-후 6개월 사이에서의 프로빙 포켓 깊이 감소 (PDR) (I 군 및 II 군 대비 III 군); 4) 기준선과 수술-후 6개월 사이에서의 치은퇴축 (GR) (I 군 및 II 군 대비 III 군); 5) 수술-후 처음 3주일 동안에 수술부위의 창상 치유 (WH) (I 군 및 II 군 대비 III 군); 6 기준선과 3개월 및 6개월 사이에서의 CAL의 변화에 대한 곡선하면적 (I 군 및 II 군 대비 III 군); 7) 수술-후 6개월째에 %BF에 대한 95% 신뢰하한선 (lower confidence bound; LCB) (문헌 (Parashis et al., J. Periodontol. 69:751-758, 1998)에 공개된 바와 같이 I, II 및 III 군 대비 탈회된 동결건조된 골 동종이식편 (DFDBA)); 8) 수술-후 6개월째에 선형 골 성장에 대한 95% LCB (문헌 (Persson et al., J. Clin. Periodontol. 27:104-108, 2000)에 공개된 바와 같이 I, II 및 III 군 대비 탈회된 동결건조된 골 동종이식편 (DFDBA)); 9) 기준선과 6개월 사이에서 CAL에서의 변화에 대한 95% LCB (I, II 및 III 군 대비 엠도게인 (EMDOGAIN™) - PMA P930021, 1996); 및 10) 기준선과 6개월 사이에서 CAL에서의 변화에 대한 95% LCB (I, II 및 III 군 대비 펩진 (PEPGEN) P-15™ - PMA P990033, 1999).
통계학적 방법
안전성 및 유효성 데이타는 기술통계학에 의해서 검사하고 요약하였다. 카테고리별 측정치는 카운트 (counts) 및 퍼센트 (percents)로 나타내었으며, 연속변수 (continuous variables)는 평균치, 중앙값, 표준편차 및 범위로 나타내었다. 시험제품 치료군 (I 및 II 군)과 대조군 (III 군) 사이의 통계학적 비교는 카테고리별 변수에 대해서는 카이-스퀘어 (Chi-Square) 및 피셔 이그잭트 (Fisher's Exact) 시험을 사용하고, 연속변수에 대해서는 t-시험 또는 분산분석방법 (Analysis of Variance Methods; ANOVA)를 사용하여 이루어졌다. 순위변수 (ordinal variables)에 대한 치료군들 사이의 비교는 코르란-만텔-헨스젤 방법 (Cochran-Mantel-Haenszel method)을 사용하여 이루어졌다. CAL, LBG 및 %BF의 경우에 p≤0.05 (one-sided)는 통계학적으로 유의적인 것으로 간주되었다.
안전성 데이타는 임상적으로 및 방사선사진에 의해서 평가되는 것으로 부작용의 빈도 및 중증도에 의해서 평가되었다. 기준선에서는 3 개의 치료군들 사이에서 유의적인 차이가 없었다. 또한, 3 개의 치료군들 중에서 부작용 (AEs; 모든 원인)의 발생빈도에서 관찰되는 통계학적으로 유의적인 차이도 없었다. 안전성 분석은 피검자에 대하여 이식물질의 이식에 기인한 어떤 증가된 위험도 확인하지 못하였다.
유효성 결과의 요약
통계학적 분석으로 인한 결과는 β-TCP 단독인 능동적 대조군 (III 군) 및 DFDBA, 엠도게인 (EMDOGAIN™) 및 펩진 (PEPGEN) P-15™를 포함한 역사적 대조군에 비해서 두개의 치료군 (I 및 II 군)에 대해서 임상적 및 통계학적으로 모두 유의적인 이점을 나타내었다.
수술-후 3개월째에 기준선으로부터 통계학적으로 유의적인 CAL 증가가 III 군에 대비하여 I 군에서 바람직하게 관찰되었으며 (p = 0.041), 이것은 CAL의 증가에 대하여 PDGF가 유의적으로 빠른 이점이 있음을 시사하는 것이다. 수술-후 6개월째에 이러한 경향은 III 군보다 I 군에서 유리하게 계속되었으나, 이러한 차이는 통계학적으로 유의적이지 않았다 (p = 0.200). 기준선과 6개월 사이에서 CAL 증가에 대한 누적효과 (즉, 속도)를 나타내는 곡선하면적분석 (area under the curve analysis; AUC)은 III 군에 비해서 I 군에 바람직한 통계학적 유의성에 근접하였다 (p = 0.054). 또한, 모든 치료군에 대한 95% 신뢰하한선 (LCB) 분석은 엠도게인 (EMDOGAIN™) 및 펩진 (PEPGEN) P-15™에 대하여 6개월째에 관찰된 CAL 증가에 비해서 I 및 II 군의 유효성을 입증하였다.
CAL의 관찰된 임상적 이점 이외에도, 선형 골 성장 (Linear Bone Growth; LBG) 및 골 충진 퍼센트 (Percent Bone Fill; %BF)를 포함한 방사선사진 분석은 III 군에 대비하여 I 및 II 군에서 골 증가에 있어서의 통계학적으로 유의적인 개선을 나타내었다. %BF는 방사선사진에 의해서 측정된 것으로 새로운 골로 충진된 원래의 골 결손의 퍼센트로 정의되었다. LBG는 III 군 (0.9 ㎜, p<0.001)에 비해서 I 군 (2.5 ㎜)에서 유의적인 개선을 나타내었다. LBG는 또한, III 군에 비해서 II 군 (1.5 ㎜)의 경우에 유의적이었다 (p = 0.021).
골 충진 퍼센트 (%BF)는 III 군 (18%)에 비해서 I 군 (56%) 및 II 군 (34%)에서 수술-후 6게월째에 유의적으로 증가하였다 (각각 p<0.001 및 p = 0.019). 선형 골 성장 및 골 충진% 둘 다의 경우에 수술-후 6개월째의 신뢰구간의 95% 하한선은 치주 이식방법을 위해서 가장 광범하게 사용된 DFDBA에 대한 공개된 방사선사진 결과에 비해서 I 군 및 II 군의 유효성을 입증하였다.
3개월째에 CAL에 의해서 관찰된 유익한 효과와 일치하여 III 군에 비해서 I 군의 경우에 유의적으로 더 적은 치은퇴축 (GR)(p=0.041)이 존재하였다. 6개월째에 PDR 및 GR에서 통계학적으로 유의적인 차이는 관찰되지 않았다. 3개월째에 완전한 창상치유 (WH)를 나타내는 부위의 수에 대한 기술적 분석 (descriptive analysis)은 II 군 (60%) 및 III 군 (55%)에 비해서 I 군 (72%)에서의 개선을 나타내었으며, 이것은 개선된 치유경향을 시사하는 것이다.
임상적 및 방사선사진 결과에 대한 누적 유익효과를 평가하기 위해서, 복합적 유효성 분석을 수행하여 6개월째에 CAL > 2.7 ㎜ 및 LBG > 1.1 ㎜로 정의되는 바와 같은 성공적인 결과를 갖는 환자를 퍼센트를 측정하였다. 성공에 대한 CAL 및 LBG 벤치마크 (benchmark)는 상기 "유효성 측정" 항목에서 나타낸 바와 같이, 이식된 이식물에 의해서 이들 파라메터에 대해 달성된 평균 레벨에 의해서 설정되었다. 결과는 I 군 환자의 61.7% 및 II 군 환자의 37.9%가 III 군 환자의 30.4%에 비해서 성공에 대한 복합적 벤치마크를 충족시키거나, 이를 초과하여 I 군 대비 III 군의 통계학적으로 유의적인 이점을 제공하였다 (p<0.001). %BF는 0.003의 p-값으로 III 군 (44.6%)에 비해서 I 군 (70.0%)에서 유사한 이점을 나타내었다.
요약하면, I 군은 β-TCP 단독의 능동적 대조군 (III 군)에 비해서 3개월째의 CAL 및 GR뿐만 아니라, 6개월째의 LBG 및 %BF에 대해서 통계학적으로 이로운 결과를 달성하였다. 이들 결과의 임상적 유의성은 역사적 대조군과 비교함으로써 더 확인된다. PDGF-함유 이식물질은 치주골 결손의 치료에 관해서 6개월까지 임상적 및 방사선사진에 의한 유효성을 달성하는 것으로 나타났다고 결론이 내려진다.
PDGF를 0.3 ㎎/㎖ 및 1.0 ㎎/㎖로 함유하는 이식물질 (즉, β-TCP)은 6개월까지의 기간 동안 시험한 180 명의 피검자가 포함된 대규모 무작위 임상실험에서 치조골의 복구 및 중등도 내지 진행된 치주염을 갖는 치아 주위의 임상적 부착에 안전하고 효과적인 것으로 나타났다. 이들 결론은 이하에 요약하는 바와 같이 인증된 방사선사진 및 임상적 측정치를 기초로 한 것이다.
상기 언급한 PDGF-함유 이식물질의 생체적합성 데이타 및 각각의 개개 성분 (즉, β-TCP 단독 또는 PDGF 단독)의 역사적인 안전한 사용과 일치해서 이 시험은 국소적이거나 전신적인 부작용의 증거를 나타내지 않았다. 이식물질에 기인하는 해로운 결과는 없었으며, 안전한 것으로 밝혀졌다.
결론
PDGF를 0.3 ㎎/㎖ 및 1.0 ㎎/㎖로 함유하는 β-TCP의 이식은 능동적 대조군에 비해서 3개월째에 유의적으로 개선된 CAL에 의해서 나타나는 바와 같이 연조직 부착 레벨 및 골의 복구에 효과적인 치료법인 것으로 확인되었다. 본 발명자들의 소견은 또한, 기준선과 6개월 사이에 CAL 증가의 개선을 나타낸 AUC 분석과 일치한다. PDGF를 0.3 ㎎/㎖ 및 1.0 ㎎/㎖로 함유하는 β-TCP의 이식은 또한, 능동적 대조군에 비해서 유의적으로 개선된 LBG 및 %BF를 기초로 하여 효과적인 치료법인 것으로 확인되었다. β-TCP 단독인 능동적 대조군에 비해서 연조직 및 경조직 측정치 둘 다의 복합적 분석에 의해서 나타나는 바와 같은 유의적으로 개선된 임상적 결과는 또한, 상술한 치료 프로토콜의 유효성을 입증한다. 마지막으로, PDGF를 0.3 ㎎/㎖ 및 1.0 ㎎/㎖로 함유하는 β-TCP를 투여한 결과는 임상적으로 및 방사선사진 둘 다에 의해서 유효성의 설정된 벤치마크를 초과하는 것으로 확인되었다.
시험관내, 동물 및 인간 시험으로부터의 광범하고 확증적인 데이타와 함께 이 실험의 결과는 PDGF-함유 이식물질이 치주 결손에서 연조직 및 경조직 재생을 자극하는 것을 입증하지만, 효과는 0.1 내지 1.0 ㎎/㎖ 범위 (예를 들어, 0.1 ㎎/㎖, 0.3 ㎎/㎖, 또는 1.0 ㎎/㎖)의 PDGF를 이식물질에서 투여한 경우에 더 유의적이었다. 또한, 이식물질에서 0.3 ㎎/㎖의 양으로 투여된 PDGF는 연조직 및 골을 효과적으로 재생시켰다.
그 밖의 다른 구체예는 이하의 특허청구범위에 포함된다.
PDGF: 혈소판-유도된 성장인자
Claims (1)
- 약제학적으로 허용되는 액체 담체 및 약제학적으로 허용되는 고체 담체 중에 약 0.1 ㎎/㎖ 내지 약 1.0 ㎎/㎖ 범위의 농도로 혈소판-유도된 성장인자 (PDGF)를 포함하며, 골, 치주조직, 인대 또는 연골의 성장을 촉진시키는 이식물질을 포유동물에게 투여하는 것을 포함하는, 포유동물의 골, 치주조직, 인대 또는 연골의 성장을 촉진시키는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US96531904A | 2004-10-14 | 2004-10-14 | |
| US10/965,319 | 2004-10-14 | ||
| US11/159,533 US7473678B2 (en) | 2004-10-14 | 2005-06-23 | Platelet-derived growth factor compositions and methods of use thereof |
| US11/159,533 | 2005-06-23 | ||
| PCT/US2005/036447 WO2006044334A2 (en) | 2004-10-14 | 2005-10-12 | Platelet-derived growth factor compositions and methods of use thereof |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020077010708A Division KR101305922B1 (ko) | 2004-10-14 | 2005-10-12 | 혈소판-유도된 성장인자 조성물 및 그의 사용방법 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20130058762A true KR20130058762A (ko) | 2013-06-04 |
Family
ID=36203442
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137011627A KR20130058762A (ko) | 2004-10-14 | 2005-10-12 | 혈소판-유도된 성장인자 조성물 및 그의 사용방법 |
| KR1020107028561A KR20110013492A (ko) | 2004-10-14 | 2005-10-12 | 혈소판-유도된 성장인자 조성물 및 그의 사용방법 |
| KR1020077010708A KR101305922B1 (ko) | 2004-10-14 | 2005-10-12 | 혈소판-유도된 성장인자 조성물 및 그의 사용방법 |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107028561A KR20110013492A (ko) | 2004-10-14 | 2005-10-12 | 혈소판-유도된 성장인자 조성물 및 그의 사용방법 |
| KR1020077010708A KR101305922B1 (ko) | 2004-10-14 | 2005-10-12 | 혈소판-유도된 성장인자 조성물 및 그의 사용방법 |
Country Status (19)
| Country | Link |
|---|---|
| US (11) | US7473678B2 (ko) |
| EP (5) | EP2308501B1 (ko) |
| JP (2) | JP5137577B2 (ko) |
| KR (3) | KR20130058762A (ko) |
| CN (2) | CN101198343A (ko) |
| AT (1) | ATE476985T1 (ko) |
| AU (2) | AU2005295919B2 (ko) |
| BR (1) | BRPI0516105B8 (ko) |
| CA (2) | CA2583823C (ko) |
| DE (1) | DE602005022911D1 (ko) |
| DK (1) | DK1812076T3 (ko) |
| ES (2) | ES2454841T3 (ko) |
| IL (1) | IL182480A (ko) |
| MX (1) | MX2007004459A (ko) |
| NO (1) | NO20071974L (ko) |
| NZ (2) | NZ582976A (ko) |
| PT (1) | PT1812076E (ko) |
| WO (1) | WO2006044334A2 (ko) |
| ZA (1) | ZA200703515B (ko) |
Families Citing this family (96)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040081704A1 (en) | 1998-02-13 | 2004-04-29 | Centerpulse Biologics Inc. | Implantable putty material |
| US20020114795A1 (en) * | 2000-12-22 | 2002-08-22 | Thorne Kevin J. | Composition and process for bone growth and repair |
| US7166133B2 (en) | 2002-06-13 | 2007-01-23 | Kensey Nash Corporation | Devices and methods for treating defects in the tissue of a living being |
| US7473678B2 (en) | 2004-10-14 | 2009-01-06 | Biomimetic Therapeutics, Inc. | Platelet-derived growth factor compositions and methods of use thereof |
| EP1951327A2 (en) | 2005-11-17 | 2008-08-06 | Biomimetic Therapeutics, Inc. | Maxillofacial bone augmentation using rhpdgf-bb and a biocompatible matrix |
| EP2311505B1 (en) | 2006-02-09 | 2013-11-06 | BioMimetic Therapeutics, LLC | Compositions and methods for treating bone |
| AU2007269712B2 (en) * | 2006-06-30 | 2013-02-07 | Biomimetic Therapeutics, Llc | PDGF-biomatrix compositions and methods for treating rotator cuff injuries |
| US9161967B2 (en) | 2006-06-30 | 2015-10-20 | Biomimetic Therapeutics, Llc | Compositions and methods for treating the vertebral column |
| AU2013203287B2 (en) * | 2006-11-03 | 2015-12-17 | Biomimetic Therapeutics, Llc. | Compositions and methods for arthrodetic procedures |
| JP5552315B2 (ja) | 2006-11-03 | 2014-07-16 | バイオミメティック セラピューティクス, エルエルシー | アースロデティック術のための組成物および方法 |
| US7718616B2 (en) * | 2006-12-21 | 2010-05-18 | Zimmer Orthobiologics, Inc. | Bone growth particles and osteoinductive composition thereof |
| US20080154372A1 (en) * | 2006-12-21 | 2008-06-26 | Peckham Steven M | Osteochondral implant using a growth factor concentration gradient for repair of bone and cartilage tissue |
| US20080195476A1 (en) * | 2007-02-09 | 2008-08-14 | Marchese Michael A | Abandonment remarketing system |
| US20100151025A1 (en) * | 2007-02-20 | 2010-06-17 | Biomimetic Therapeutics, Inc. | Prevention and treatment for osteonecrosis and osteoradionecrosis of the jaw |
| FR2914191A1 (fr) * | 2007-03-29 | 2008-10-03 | Proteins & Peptides Man | Composition angiogenique. |
| CA2685956A1 (en) * | 2007-05-04 | 2008-11-13 | Perth Bone & Tissue Bank | A method for treating inflammation and controlled-release material capable of providing same |
| CN101820895A (zh) * | 2007-06-04 | 2010-09-01 | 生物模拟治疗公司 | 用于治疗脊柱的组合物和方法 |
| ES2327480B1 (es) | 2007-06-15 | 2010-08-10 | Bioiberica, S.A. | "disacaridos para el tratamiento de tendones, ligamentos y huesos". |
| CN101772350A (zh) | 2007-06-19 | 2010-07-07 | 巴克斯特国际公司 | 用于pdgf受控释放的纤维蛋白凝胶及其应用 |
| EP2192907B1 (en) | 2007-08-16 | 2018-04-18 | Remedor Biomed Ltd. | Erythropoietin and fibronectin compositions for therapeutic applications |
| WO2009093240A2 (en) * | 2008-01-24 | 2009-07-30 | Ademex Ltd. | Erythropoietin and fibronectin compositions for bone regeneration |
| CN102014977B (zh) * | 2008-02-07 | 2015-09-02 | 生物模拟治疗有限责任公司 | 用于牵引成骨术的组合物和方法 |
| FR2933304A1 (fr) * | 2008-07-07 | 2010-01-08 | Adocia | Composition synergique osteogenique |
| EA020753B1 (ru) | 2008-06-16 | 2015-01-30 | Бинд Терапьютикс, Инк. | Терапевтические полимерные наночастицы, содержащие алкалоиды vinca, и их применение |
| US8613951B2 (en) | 2008-06-16 | 2013-12-24 | Bind Therapeutics, Inc. | Therapeutic polymeric nanoparticles with mTor inhibitors and methods of making and using same |
| JP2012501965A (ja) | 2008-06-16 | 2012-01-26 | バインド バイオサイエンシズ インコーポレイテッド | 薬剤を装填したポリマーナノ粒子及びその製造方法と使用方法 |
| CN101357239B (zh) * | 2008-08-29 | 2013-01-09 | 广东省人民医院 | 偏磷酸钙作为非硬组织工程材料的用途 |
| NZ591338A (en) * | 2008-09-09 | 2013-02-22 | Biomimetic Therapeutics Inc | Platelet-derived growth factor compositions and methods for the treatment of tendon and ligament injuries |
| US8563041B2 (en) * | 2008-12-12 | 2013-10-22 | Bind Therapeutics, Inc. | Therapeutic particles suitable for parenteral administration and methods of making and using same |
| JP2012512175A (ja) * | 2008-12-15 | 2012-05-31 | バインド バイオサイエンシズ インコーポレイテッド | 治療薬を徐放するための長時間循環性ナノ粒子 |
| JP2012512728A (ja) * | 2008-12-19 | 2012-06-07 | バイオミメティック セラピューティクス, インコーポレイテッド | 低減したプロテアーゼ活性を有する骨移植片ならびに選択方法および使用法 |
| CN101486996B (zh) * | 2009-02-06 | 2012-10-10 | 浙江大学 | 一种非动物源性细胞培养血清替代物及其应用 |
| CA2754501A1 (en) * | 2009-03-05 | 2010-09-10 | Biomimetic Therapeutics, Inc. | Platelet-derived growth factor compositions and methods for the treatment of osteochondral defects |
| US8298567B2 (en) * | 2009-04-22 | 2012-10-30 | Michigan Molecular Institute | Hyperbranched polyurea delivery system for binding and release of growth factors |
| DE102009024616A1 (de) * | 2009-06-08 | 2010-12-23 | Telos Gmbh | Sterilisierbare Implantatbeschichtung und Verfahren zu deren Herstellung |
| EA036522B1 (ru) | 2009-12-11 | 2020-11-19 | Пфайзер Инк. | Фармацевтическая композиция, пригодная для лиофилизации, содержащая множество терапевтических частиц |
| EA201290499A1 (ru) | 2009-12-15 | 2013-01-30 | Байнд Байосайенсиз, Инк. | Композиции терапевтических полимерных наночастиц с высокой температурой стеклования и высокомолекулярными сополимерами |
| CN107080834A (zh) | 2010-02-22 | 2017-08-22 | 生物模拟治疗有限责任公司 | 用于治疗腱病的血小板衍生生长因子组合物和方法 |
| US10130736B1 (en) | 2010-05-14 | 2018-11-20 | Musculoskeletal Transplant Foundation | Tissue-derived tissuegenic implants, and methods of fabricating and using same |
| US9352003B1 (en) | 2010-05-14 | 2016-05-31 | Musculoskeletal Transplant Foundation | Tissue-derived tissuegenic implants, and methods of fabricating and using same |
| CN102397534B (zh) * | 2010-09-07 | 2013-10-23 | 中国人民解放军总医院 | 胰岛素在制备促进颌骨组织愈合的药物中的用途 |
| WO2012068135A1 (en) | 2010-11-15 | 2012-05-24 | Zimmer Orthobiologics, Inc. | Bone void fillers |
| JP6082901B2 (ja) * | 2011-01-31 | 2017-02-22 | オリンパス株式会社 | ワクチン・アジュバント |
| JP5990752B2 (ja) * | 2011-01-31 | 2016-09-14 | オリンパス株式会社 | 抗体療法の効果増強剤 |
| CN102652833B (zh) * | 2011-03-02 | 2013-07-31 | 中国科学院过程工程研究所 | 一种胃部靶向药物载体及其制备方法 |
| US9265830B2 (en) | 2011-04-20 | 2016-02-23 | Warsaw Orthopedic, Inc. | Implantable compositions and methods for preparing the same |
| WO2013062994A1 (en) | 2011-10-25 | 2013-05-02 | Biomimetic Therapeutics, Inc. | Compositions and methods for treating full thickness burn injuries |
| US20130108683A1 (en) | 2011-10-25 | 2013-05-02 | Biomimetic Therapeutics, Inc. | Compositions and methods for treating partial and full thickness wounds and injuries |
| US10207027B2 (en) | 2012-06-11 | 2019-02-19 | Globus Medical, Inc. | Bioactive bone graft substitutes |
| JP6356678B2 (ja) | 2012-09-17 | 2018-07-11 | ファイザー・インク | 治療用ナノ粒子を製造する方法 |
| CN104994886B (zh) * | 2012-12-20 | 2017-10-03 | 奥姆里克斯生物药品有限公司 | 病毒灭活的生物混合物 |
| CN103961693B (zh) * | 2013-01-24 | 2016-09-14 | 熊慧 | 一种恶性肿瘤治疗性疫苗及其组合物 |
| HK1194912A2 (en) * | 2013-09-17 | 2014-10-24 | Bestop Group Holdings Ltd | Growth factor concentrate and the use thereof |
| US9539286B2 (en) | 2013-10-18 | 2017-01-10 | Globus Medical, Inc. | Bone grafts including osteogenic stem cells, and methods relating to the same |
| US9486483B2 (en) | 2013-10-18 | 2016-11-08 | Globus Medical, Inc. | Bone grafts including osteogenic stem cells, and methods relating to the same |
| US20150140096A1 (en) * | 2013-11-21 | 2015-05-21 | Vivex Biomedical Inc. | Composition and method of preparation of bone allograft from endosteal portion of bone and isolated bone periosteum |
| US9579421B2 (en) | 2014-02-07 | 2017-02-28 | Globus Medical Inc. | Bone grafts and methods of making and using bone grafts |
| US9463264B2 (en) | 2014-02-11 | 2016-10-11 | Globus Medical, Inc. | Bone grafts and methods of making and using bone grafts |
| AP2016009494A0 (en) | 2014-03-14 | 2016-10-31 | Pfizer | Therapeutic nanoparticles comprising a therapeutic agent and methods of making and using same |
| HUE055062T2 (hu) * | 2014-05-30 | 2021-10-28 | Univ New York State Res Found | Készítmények és eljárások csontképzõdés elõsegítésére |
| CN104147595A (zh) * | 2014-08-29 | 2014-11-19 | 姜红江 | 自体细胞生长因子制剂、制备方法及其制备用途 |
| MX2017004520A (es) | 2014-10-14 | 2018-03-15 | Lynch Samuel | Composiciones para tratar heridas. |
| CN104587525A (zh) * | 2014-12-19 | 2015-05-06 | 深圳中元生物科技有限公司 | 包含血小板及透明质酸的支架及其制备方法 |
| CN105732809B (zh) * | 2014-12-31 | 2019-08-06 | 广东众生药业股份有限公司 | 抗血小板衍生因子的抗体 |
| CN104548212B (zh) * | 2014-12-31 | 2018-05-11 | 新科沃再生医学(苏州)有限公司 | 一种促进牙髓及牙本质再生的组合物 |
| CA2986702C (en) | 2015-05-21 | 2023-04-04 | David Wang | Modified demineralized cortical bone fibers |
| US10016529B2 (en) | 2015-06-10 | 2018-07-10 | Globus Medical, Inc. | Biomaterial compositions, implants, and methods of making the same |
| US11426489B2 (en) | 2015-06-10 | 2022-08-30 | Globus Medical, Inc. | Biomaterial compositions, implants, and methods of making the same |
| CN104983672B (zh) * | 2015-06-26 | 2017-11-14 | 青岛大学 | 一种温敏溶胶的制备方法 |
| CN105153612A (zh) * | 2015-08-31 | 2015-12-16 | 苏州莱特复合材料有限公司 | 用于矫形支架的复合材料及其制备方法 |
| WO2017214631A1 (en) * | 2016-06-10 | 2017-12-14 | Liden Brock | Systems and methods for treating a wound with a wound packing |
| CN106754658A (zh) * | 2016-12-22 | 2017-05-31 | 江西宜信堂医疗科技有限公司 | 一种培养牙髓干细胞的培养基及其制备方法 |
| CN106754678A (zh) * | 2016-12-24 | 2017-05-31 | 叶宗耀 | 一种适用于牙髓干细胞体外培养的培养基及其制备方法 |
| AU2018249816A1 (en) * | 2017-04-03 | 2019-10-17 | Wisconsin Alumni Research Foundation | Mineral coated microparticles for sustained delivery of biologically active molecules |
| CN107349468B (zh) * | 2017-07-02 | 2020-12-04 | 江西瑞济生物工程技术股份有限公司 | 一种羊膜干细胞凝胶及其制备方法和应用 |
| CN107456607A (zh) * | 2017-07-03 | 2017-12-12 | 广州医科大学附属口腔医院 | 一种双功能化的新型“sandwich”结构的引导牙周组织再生膜及其制备方法和应用 |
| CN107670103A (zh) * | 2017-09-15 | 2018-02-09 | 天津大学 | 聚乙烯吡络烷酮改性的骨水泥及制备方法 |
| KR20200136978A (ko) * | 2018-03-28 | 2020-12-08 | 보드 오브 리전츠, 더 유니버시티 오브 텍사스 시스템 | 치료제의 표적화된 전달을 위한 엑소좀의 용도 |
| CN108653817B (zh) * | 2018-05-24 | 2021-02-02 | 上海其胜生物制剂有限公司 | 一种新型胶原刺激剂的制备方法 |
| AU2020239268A1 (en) * | 2019-03-14 | 2021-10-21 | Biomimetic Therapeutics, Llc | Platelet-derived growth factor formulations for enhancing bone fusion |
| US20220249554A1 (en) * | 2019-07-12 | 2022-08-11 | Vasanthi PALANIVEL | Compositions and methods for managing female infertility |
| WO2021009662A1 (en) * | 2019-07-12 | 2021-01-21 | Vasanthi Palanivel | Compositions for treatment of infertility caused by poor semen quality, methods for preparing the same and applications thereof |
| WO2021009660A1 (en) * | 2019-07-12 | 2021-01-21 | Vasanthi Palanivel | Composition and methods for improving thickness and receptivity of endometrial lining |
| WO2021009659A1 (en) * | 2019-07-12 | 2021-01-21 | Vasanthi Palanivel | Compositions for treatment of erectile dysfunction, methods for preparing the same and applications thereof |
| US20220313784A1 (en) * | 2019-07-12 | 2022-10-06 | Vasanthi PALANIVEL | Compositions for treatment of asherman's syndrome, methods for preparing the same and applications thereof |
| WO2021009663A1 (en) * | 2019-07-15 | 2021-01-21 | Vasanthi Palanivel | Compositions for treatment of azoospermia, methods for preparing the same and applications thereof |
| CN111569004B (zh) * | 2020-06-15 | 2022-07-08 | 钟瑾 | 一种用于慢性牙周炎的药物凝胶及其制备方法与用途 |
| CN111533825B (zh) * | 2020-06-17 | 2022-03-01 | 昆山京昆油田化学科技有限公司 | 一种氨基葡萄糖接枝海藻酸钠衍生物及其制备方法和应用 |
| US11896736B2 (en) | 2020-07-13 | 2024-02-13 | Globus Medical, Inc | Biomaterial implants and methods of making the same |
| CN112121229B (zh) * | 2020-09-27 | 2022-09-09 | 天晴干细胞股份有限公司 | 一种抑制炎症和促进牙槽骨修复的组织工程材料及其制备方法和应用 |
| JP7025070B1 (ja) | 2021-05-14 | 2022-02-24 | セルソース株式会社 | 血液由来成長因子含有組成物及びその調製方法 |
| CN113476666B (zh) * | 2021-06-28 | 2022-09-09 | 苏州大学附属第一医院 | 一种可注射型长效缓释褪黑素的关节软骨修复材料、制备方法及其应用 |
| US11890154B2 (en) | 2021-06-30 | 2024-02-06 | Khalid AL HEZAIMI | Pulp capping methods |
| CN113827778B (zh) * | 2021-11-03 | 2022-10-21 | 浙江赛灵特医药科技有限公司 | 一种注射式骨修复剂及其应用 |
| CN115006609A (zh) * | 2022-05-24 | 2022-09-06 | 曹建中 | 一种适用于骨折内固定术前制作的可降解材料及其制备方法及应用 |
| CN115058053B (zh) * | 2022-06-30 | 2023-06-27 | 浙江大学滨江研究院 | 一种基于明胶衍生物冷冻大孔凝胶的制备方法及其应用 |
Family Cites Families (270)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US652473A (en) * | 1900-01-10 | 1900-06-26 | Allan A Cole | Trunk-brace. |
| US2124316A (en) * | 1937-10-23 | 1938-07-19 | Schonfeld Paul | Warp fabric |
| US3943072A (en) * | 1971-12-15 | 1976-03-09 | United Kingdom Atomic Energy Authority | Separation of molecules |
| USRE33221E (en) * | 1982-04-29 | 1990-05-22 | American Dental Association Health Foundation | Dental restorative cement pastes |
| USRE33161E (en) * | 1982-04-29 | 1990-02-06 | American Dental Association Health Foundation | Combinations of sparingly soluble calcium phosphates in slurries and pastes as mineralizers and cements |
| US4654314A (en) | 1983-07-09 | 1987-03-31 | Sumitomo Cement Co., Ltd. | Porous ceramic material and processes for preparing same |
| US5187263A (en) | 1984-10-12 | 1993-02-16 | Zymogenetics, Inc. | Expression of biologically active PDGE analogs in eucaryotic cells |
| US4766073A (en) * | 1985-02-25 | 1988-08-23 | Zymogenetics Inc. | Expression of biologically active PDGF analogs in eucaryotic cells |
| US4889919A (en) * | 1986-08-13 | 1989-12-26 | Zymogenetics, Inc. | Biologically active PDGF derived A-chain homodimers |
| US5165938A (en) | 1984-11-29 | 1992-11-24 | Regents Of The University Of Minnesota | Wound healing agents derived from platelets |
| US5629191A (en) | 1985-01-03 | 1997-05-13 | Integra Lifesciences Corporation | Method of making a porous matrix particle |
| US5516896A (en) | 1985-02-25 | 1996-05-14 | Zymogenetics, Inc. | Biologically active B-chain homodimers |
| US5045633A (en) | 1985-02-25 | 1991-09-03 | Zymogenetics, Inc. | Expression of biologically active PDGF analogs in eucaryotic cells |
| US5113354B1 (en) * | 1986-02-07 | 1993-11-09 | System for optimizing data transmissions associated with addressable buffer devices | |
| US5106748A (en) * | 1986-07-01 | 1992-04-21 | Genetics Institute, Inc. | Dna sequences encoding 5 proteins |
| US5108922A (en) * | 1986-07-01 | 1992-04-28 | Genetics Institute, Inc. | DNA sequences encoding BMP-1 products |
| ZA874681B (en) * | 1986-07-01 | 1988-04-27 | Genetics Inst | Novel osteoinductive factors |
| US5013649A (en) * | 1986-07-01 | 1991-05-07 | Genetics Institute, Inc. | DNA sequences encoding osteoinductive products |
| US5187076A (en) * | 1986-07-01 | 1993-02-16 | Genetics Institute, Inc. | DNA sequences encoding BMP-6 proteins |
| KR960005708B1 (ko) | 1986-11-14 | 1996-05-01 | 인스티튜트 오브 몰레큘러 바이올로지, 인코오포레이티드 | 외상 치료 및 뼈 재생용 조성물 |
| US5019559A (en) * | 1986-11-14 | 1991-05-28 | President And Fellows Of Harvard College | Wound healing using PDGF and IGF-II |
| US5124316A (en) * | 1986-11-14 | 1992-06-23 | President And Fellows Of Harvard College | Method for periodontal regeneration |
| CA1322714C (en) * | 1986-11-14 | 1993-10-05 | Harry N. Antoniades | Wound healing and bone regeneration |
| US5219759A (en) * | 1987-04-22 | 1993-06-15 | Chiron Corporation | Recombinant DNA encoding PDGF A-chain polypeptide and expression vectors |
| US5457093A (en) * | 1987-09-18 | 1995-10-10 | Ethicon, Inc. | Gel formulations containing growth factors |
| US4874746A (en) | 1987-12-22 | 1989-10-17 | Institute Of Molecular Biology, Inc. | Wound headling composition of TGF-alpha and PDGF |
| US5759815A (en) | 1988-02-11 | 1998-06-02 | Creative Biomolecules, Inc. | Production of platelet derived growth factor (PDGF) an muteins thereof |
| US4975526A (en) | 1989-02-23 | 1990-12-04 | Creative Biomolecules, Inc. | Bone collagen matrix for zenogenic implants |
| US6586388B2 (en) * | 1988-04-08 | 2003-07-01 | Stryker Corporation | Method of using recombinant osteogenic protein to repair bone or cartilage defects |
| US5129905A (en) * | 1988-04-20 | 1992-07-14 | Norian Corporation | Methods for in situ prepared calcium phosphate minerals |
| US5962028A (en) | 1988-04-20 | 1999-10-05 | Norian Corporation | Carbonated hydroxyapatite compositions and uses |
| US5053212A (en) | 1988-04-20 | 1991-10-01 | Norian Corporation | Intimate mixture of calcium and phosphate sources as precursor to hydroxyapatite |
| US4904259A (en) | 1988-04-29 | 1990-02-27 | Samuel Itay | Compositions and methods for repair of cartilage and bone |
| US5219576A (en) * | 1988-06-30 | 1993-06-15 | Collagen Corporation | Collagen wound healing matrices and process for their production |
| US5034375A (en) * | 1988-08-10 | 1991-07-23 | Institute Of Molecular Biology, Inc. | Process of wound healing using PDGF and EGF |
| US5422340A (en) * | 1989-09-01 | 1995-06-06 | Ammann; Arthur J. | TGF-βformulation for inducing bone growth |
| US5035887A (en) | 1989-09-07 | 1991-07-30 | Institute Of Moelcular Biology, Inc. | Wound healing composition of IL-1 and PDGF or IGF-1 |
| US5599558A (en) | 1989-09-15 | 1997-02-04 | Curative Technologies, Inc. | Selecting amounts of platelet releasate for efficacious treatment of tissue |
| US5112354A (en) | 1989-11-16 | 1992-05-12 | Northwestern University | Bone allograft material and method |
| US5011910A (en) | 1989-12-28 | 1991-04-30 | Washington University | Reagent and method for determining activity of retroviral protease |
| US5071655A (en) | 1990-01-12 | 1991-12-10 | Baylink David J | Pharmaceutical combination for treatment of bone-wasting diseases |
| EP0513201A1 (en) | 1990-02-01 | 1992-11-19 | University Of South Florida | Leukocyte-derived growth factor |
| TW199858B (ko) * | 1990-03-30 | 1993-02-11 | Fujirebio Kk | |
| WO1991015231A1 (en) | 1990-04-10 | 1991-10-17 | Institute Of Molecular Biology, Inc. | Wound healing |
| ES2168091T3 (es) | 1990-05-16 | 2002-06-01 | Genetics Inst | Proteinas de induccion osea y cartilaginosa. |
| EP1142581A3 (en) | 1990-11-27 | 2002-09-11 | American National Red Cross | Tissue sealant and growth factor containing compositions that promote accelerated wound healing |
| US5853746A (en) | 1991-01-31 | 1998-12-29 | Robert Francis Shaw | Methods and compositions for the treatment and repair of defects or lesions in cartilage or bone using functional barrier |
| US5149691A (en) * | 1991-03-12 | 1992-09-22 | Creative Biomolecules, Inc. | Issue repair and regeneration through the use of platelet derived growth factor (pdgf) in combination with dexamethasone |
| DE4120325A1 (de) * | 1991-06-20 | 1992-12-24 | Merck Patent Gmbh | Implantatwerkstoff |
| CA2108770C (en) | 1991-06-25 | 2007-04-03 | John M. Wozney | Bmp-9 compositions |
| US5837258A (en) | 1991-08-30 | 1998-11-17 | University Of South Florida | Induction of tissue, bone or cartilage formation using connective tissue growth factor |
| US5270300A (en) | 1991-09-06 | 1993-12-14 | Robert Francis Shaw | Methods and compositions for the treatment and repair of defects or lesions in cartilage or bone |
| ATE238417T1 (de) | 1991-11-04 | 2003-05-15 | Inst Genetics Llc | Rekombinante knochenmorphogenetische protein heterodimere, zusammensetzungen und verfahren zur verwendung |
| WO1993008825A1 (en) | 1991-11-04 | 1993-05-13 | Zymogenetics, Inc. | Pdgf gel formulation |
| DK0625989T3 (da) | 1992-02-12 | 2000-06-26 | Bioph Biotech Entw Pharm Gmbh | DNA-sekvenser kodende for hidtil ukendte vækst-/differentieringsfaktorer |
| WO1993020859A1 (en) | 1992-04-20 | 1993-10-28 | Board Of Regents Of The University Of Washington | Sustained release compositions for delivery of growth factors |
| IL106278A0 (en) | 1992-07-13 | 1993-11-15 | Sumitomo Metal Ind | Bone formation-inducing protein |
| ES2149823T3 (es) | 1992-09-03 | 2000-11-16 | Univ California | Factor y composiciones que afectan al tejido dorsal. |
| EP0678101A4 (en) | 1993-01-12 | 1997-07-16 | Univ Johns Hopkins Med | GROWTH DIFFERENTIATION FACTOR-9. |
| CA2153652A1 (en) | 1993-01-12 | 1994-07-21 | Se-Jin Lee | Growth differentiation factor-3 |
| WO1994015949A1 (en) | 1993-01-12 | 1994-07-21 | Johns Hopkins University School Of Medicine | Growth differentiation factor-5 |
| WO1994021681A1 (en) | 1993-03-19 | 1994-09-29 | Johns Hopkins University School Of Medicine | Growth differentiation factor-8 |
| CN1104257C (zh) | 1993-03-29 | 2003-04-02 | 津莫吉尼蒂克斯公司 | 含pdgf和维生素d的刺激成骨细胞生长的组合物 |
| WO1994026892A1 (en) | 1993-05-12 | 1994-11-24 | Genetics Institute, Inc. | Bmp-11 compositions |
| EP0698095B1 (en) | 1993-05-12 | 2004-04-28 | Genetics Institute, LLC | Bmp-10 compositions |
| WO1994028889A1 (en) | 1993-06-08 | 1994-12-22 | Neogenix, Inc. | Purified natural and synthetic compounds for the treatment of osteoarthritis |
| CA2165778A1 (en) | 1993-07-09 | 1995-01-19 | Se-Jin Lee | Growth differentiation factor-7 |
| JPH09503903A (ja) | 1993-07-09 | 1997-04-22 | ザ ジョーンズ ホプキンス ユニバーシティー スクール オブ メディシン | 増殖分化因子−6 |
| US5531794A (en) * | 1993-09-13 | 1996-07-02 | Asahi Kogaku Kogyo Kabushiki Kaisha | Ceramic device providing an environment for the promotion and formation of new bone |
| US6291206B1 (en) | 1993-09-17 | 2001-09-18 | Genetics Institute, Inc. | BMP receptor proteins |
| US6204047B1 (en) | 1993-10-08 | 2001-03-20 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-10 |
| US5518680A (en) * | 1993-10-18 | 1996-05-21 | Massachusetts Institute Of Technology | Tissue regeneration matrices by solid free form fabrication techniques |
| DE69434651T2 (de) | 1993-12-07 | 2007-03-08 | Genetics Institute, Inc., Cambridge | Bmp-12, bmp-13 und diese enthaltende sehne-induzierende zusammensetzungen |
| JP3362267B2 (ja) * | 1993-12-29 | 2003-01-07 | 日本特殊陶業株式会社 | 生体インプラント材料及びその製造方法 |
| NZ278765A (en) | 1993-12-30 | 1998-05-27 | Harvard College | Vertebrate proteins involved in spatial arrangements of differentiated tissues called hedgehog proteins, their production and use |
| US5460962A (en) | 1994-01-04 | 1995-10-24 | Organogenesis Inc. | Peracetic acid sterilization of collagen or collagenous tissue |
| JPH07250688A (ja) | 1994-01-28 | 1995-10-03 | Sagami Chem Res Center | TGF−βスーパーファミリー蛋白質をコードするヒト新規cDNA |
| AU1743495A (en) | 1994-02-04 | 1995-08-21 | Cell Therapeutics, Inc. | Composition for wound healing, neuron growth and vascularization |
| US5942496A (en) | 1994-02-18 | 1999-08-24 | The Regent Of The University Of Michigan | Methods and compositions for multiple gene transfer into bone cells |
| CA2187355C (en) | 1994-04-08 | 2009-10-13 | Richard L. Dunn | An adjunctive polymer system for use with medical device |
| WO1995028950A1 (en) * | 1994-04-20 | 1995-11-02 | Institute Of Molecular Biology, Inc. | Administration of platelet-derived growth factor and bone seeking drugs for osteoporosis and bone regeneration |
| US7963997B2 (en) * | 2002-07-19 | 2011-06-21 | Kensey Nash Corporation | Device for regeneration of articular cartilage and other tissue |
| WO1996001845A1 (en) | 1994-07-08 | 1996-01-25 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-11 |
| WO1996002559A1 (en) | 1994-07-13 | 1996-02-01 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-12 |
| US6180606B1 (en) * | 1994-09-28 | 2001-01-30 | Gensci Orthobiologics, Inc. | Compositions with enhanced osteogenic potential, methods for making the same and uses thereof |
| US5651766A (en) | 1995-06-07 | 1997-07-29 | Transfusion Technologies Corporation | Blood collection and separation system |
| WO1996013226A1 (en) | 1994-10-31 | 1996-05-09 | Sepracor Inc. | Method for the treatment of periodontal disease and a pharmaceutical composition useful in said method |
| US6281332B1 (en) | 1994-12-02 | 2001-08-28 | The Johns Hopkins University School Of Medicine | Hedgehog-derived polypeptides |
| US5614206A (en) * | 1995-03-07 | 1997-03-25 | Wright Medical Technology, Inc. | Controlled dissolution pellet containing calcium sulfate |
| US5635372A (en) * | 1995-05-18 | 1997-06-03 | Genetics Institute, Inc. | BMP-15 compositions |
| US6027742A (en) | 1995-05-19 | 2000-02-22 | Etex Corporation | Bioresorbable ceramic composites |
| US6541037B1 (en) * | 1995-05-19 | 2003-04-01 | Etex Corporation | Delivery vehicle |
| US6287341B1 (en) * | 1995-05-19 | 2001-09-11 | Etex Corporation | Orthopedic and dental ceramic implants |
| US5676976A (en) * | 1995-05-19 | 1997-10-14 | Etex Corporation | Synthesis of reactive amorphous calcium phosphates |
| ES2293137T3 (es) * | 1995-10-11 | 2008-03-16 | Novartis Vaccines And Diagnostics, Inc. | Combinacion de pdgf, kgf,igf e igfbp para curacion de heridas. |
| US5776193A (en) | 1995-10-16 | 1998-07-07 | Orquest, Inc. | Bone grafting matrix |
| US5783217A (en) * | 1995-11-07 | 1998-07-21 | Etex Corporation | Low temperature calcium phosphate apatite and a method of its manufacture |
| US5752974A (en) * | 1995-12-18 | 1998-05-19 | Collagen Corporation | Injectable or implantable biomaterials for filling or blocking lumens and voids of the body |
| US5747273A (en) * | 1996-05-07 | 1998-05-05 | Diagnostic Systems Laboratories, Inc. | Immunoassay of total insulin-like growth factor binding protein-1 |
| AU2759397A (en) * | 1996-05-28 | 1998-01-05 | 1218122 Ontario Inc. | Resorbable implant biomaterial made of condensed calcium phosphate particles |
| FR2749756B1 (fr) * | 1996-06-14 | 1998-09-11 | Bioland | Procede de preparation d'un materiau composite implantable, materiau obtenu, implant comprenant ce materiau et kit de mise en oeuvre |
| US5965403A (en) | 1996-09-18 | 1999-10-12 | Genetics Institute, Inc. | Nucleic acids encoding bone morphogenic protein-16 (BMP-16) |
| DE69738398T2 (de) | 1996-10-16 | 2008-12-04 | Etex Corp., Cambridge | Biokeramische zusammensetzung |
| US6037519A (en) | 1997-10-20 | 2000-03-14 | Sdgi Holdings, Inc. | Ceramic fusion implants and compositions |
| DE19646782C2 (de) | 1996-11-13 | 2000-05-25 | Merck Patent Gmbh | Bioresorbierbare Polymerisationsprodukte aus strahlungshärtbaren Bindemittelsystemen |
| ATE253120T1 (de) | 1996-12-13 | 2003-11-15 | Chiron Corp | Verfahren zur expression von heterologen proteinen in hefe |
| US5866165A (en) | 1997-01-15 | 1999-02-02 | Orquest, Inc. | Collagen-polysaccharide matrix for bone and cartilage repair |
| FR2758988B1 (fr) | 1997-02-05 | 2000-01-21 | S H Ind | Procede d'elaboration de substituts osseux synthetiques d'architecture poreuse parfaitement maitrisee |
| EP2332564A1 (en) * | 1997-02-07 | 2011-06-15 | Stryker Corporation | Matrix-free osteogenic devices, implants and methods thereof |
| WO1998038949A1 (en) * | 1997-03-04 | 1998-09-11 | Implico B.V. | An artefact suitable for use as a bone implant |
| US20020098222A1 (en) * | 1997-03-13 | 2002-07-25 | John F. Wironen | Bone paste |
| US7041641B2 (en) | 1997-03-20 | 2006-05-09 | Stryker Corporation | Osteogenic devices and methods of use thereof for repair of endochondral bone and osteochondral defects |
| US20010016646A1 (en) * | 1998-03-20 | 2001-08-23 | David C. Rueger | Osteogenic devices and methods of use thereof for repair of endochondral bone, osteochondral and chondral defects |
| JP3334558B2 (ja) * | 1997-04-23 | 2002-10-15 | 富士レビオ株式会社 | 酵素免疫測定方法及び試験片 |
| US20030032586A1 (en) | 1997-05-15 | 2003-02-13 | David C. Rueger | Compositions for morphogen-induced osteogenesis |
| GB2325934A (en) * | 1997-06-03 | 1998-12-09 | Polybiomed Ltd | Treating metal surfaces to enhance bio-compatibility and/or physical characteristics |
| US6063624A (en) | 1997-06-09 | 2000-05-16 | Baxter International Inc. | Platelet suspensions and methods for resuspending platelets |
| US20010014682A1 (en) | 1997-07-25 | 2001-08-16 | Smithkline Beecham Corporation | Fibrinogen receptor antagonists |
| DE69714035T2 (de) | 1997-08-14 | 2003-03-06 | Sulzer Innotec Ag | Zusammensetzung und Vorrichtung zur Reparatur von Knorpelgewebe in vivo bestehend aus Nanokapseln mit osteoinduktiven und/oder chondroinduktiven Faktoren |
| US6136029A (en) | 1997-10-01 | 2000-10-24 | Phillips-Origen Ceramic Technology, Llc | Bone substitute materials |
| US6090998A (en) | 1997-10-27 | 2000-07-18 | University Of Florida | Segmentally demineralized bone implant |
| WO1999030726A1 (en) | 1997-12-15 | 1999-06-24 | Page Roy C | Improved method for attaching dental and orthopedic implants, ligaments, and tendons to bone |
| US20020076429A1 (en) | 1998-01-28 | 2002-06-20 | John F. Wironen | Bone paste subjected to irradiative and thermal treatment |
| US20020018796A1 (en) * | 1998-01-28 | 2002-02-14 | John F. Wironen | Thermally sterilized bone paste |
| JP2000004875A (ja) | 1998-06-23 | 2000-01-11 | Teijin Ltd | 増殖因子の産生誘導方法 |
| SE514908C2 (sv) | 1998-07-13 | 2001-05-14 | Gs Dev Ab | Medel för benrekonstruktion |
| DE69813908T2 (de) | 1998-07-28 | 2004-02-05 | Synthes Ag Chur, Chur | Verwendung von kreatinsubstanzen zur behandlung von knochen- und knorpelzellen und geweben |
| US20030114936A1 (en) | 1998-10-12 | 2003-06-19 | Therics, Inc. | Complex three-dimensional composite scaffold resistant to delimination |
| US6224635B1 (en) * | 1998-11-06 | 2001-05-01 | Hospital For Joint Diseases | Implantation of surgical implants with calcium sulfate |
| US6663870B2 (en) * | 1998-12-07 | 2003-12-16 | Zymogenetics, Inc. | Methods for promoting growth of bone using zvegf3 |
| US6231528B1 (en) | 1999-01-15 | 2001-05-15 | Jonathan J. Kaufman | Ultrasonic and growth factor bone-therapy: apparatus and method |
| EP1025871A1 (en) | 1999-01-28 | 2000-08-09 | F. Hoffmann-La Roche Ag | Use of a melanoma inhibiting activity factor (MIA) for cartilage and bone repair |
| DE60006356T2 (de) | 1999-02-04 | 2004-09-09 | SDGI Holding, Inc., Wilmington | Hochmineralisierte osteogene schwammzusammensetzungen und ihre verwendung |
| US6294187B1 (en) * | 1999-02-23 | 2001-09-25 | Osteotech, Inc. | Load-bearing osteoimplant, method for its manufacture and method of repairing bone using same |
| BR0005368A (pt) * | 1999-03-15 | 2001-01-09 | Implant Innovations Inc | Sistema de coleta de plaquetas |
| US6296602B1 (en) * | 1999-03-17 | 2001-10-02 | Transfusion Technologies Corporation | Method for collecting platelets and other blood components from whole blood |
| AU4173000A (en) * | 1999-03-19 | 2000-10-09 | Regents Of The University Of Michigan, The | Mineralization and cellular patterning on biomaterial surfaces |
| ES2424618T3 (es) * | 1999-04-12 | 2013-10-07 | Harvest Technologies Corporation | Procedimiento y aparato para producir plasma rico en plaquetas y/o concentrado de plaquetas |
| SE515227C2 (sv) * | 1999-04-28 | 2001-07-02 | Bruce Medical Ab | Kropp för åstadkommande av in- och tillväxt av benvävnad och/ eller bindväv och sätt för framställning av kroppen |
| US6468543B1 (en) * | 1999-05-03 | 2002-10-22 | Zymogenetics, Inc. | Methods for promoting growth of bone using ZVEGF4 |
| US6710025B1 (en) | 1999-05-26 | 2004-03-23 | The Brigham And Women's Hospital, Inc. | Treatment of damaged tissue using agents that modulate the activity of alpha-smooth muscle actin |
| US6312952B1 (en) | 1999-05-27 | 2001-11-06 | The Research Foundation Of State University Of New York | In vitro cell culture device including cartilage and methods of using the same |
| DE19926083A1 (de) | 1999-06-08 | 2000-12-14 | Universitaetsklinikum Freiburg | Biologisches Gelenkkonstrukt |
| US6429013B1 (en) * | 1999-08-19 | 2002-08-06 | Artecel Science, Inc. | Use of adipose tissue-derived stromal cells for chondrocyte differentiation and cartilage repair |
| DE19940717A1 (de) * | 1999-08-26 | 2001-03-01 | Gerontocare Gmbh | Resorblerbares Knochenersatz- und Knochenaufbaumaterial |
| US6280191B1 (en) | 1999-09-03 | 2001-08-28 | Christopher B. Gordon | Distractor suitable for permanent implantation into bone |
| AU1430601A (en) | 1999-11-02 | 2001-05-14 | Eli Lilly And Company | Methods of using lp8, a pdgf-related protein, to treat musculoskeletal disorders |
| JP4809963B2 (ja) * | 1999-11-11 | 2011-11-09 | オリンパス株式会社 | 骨補填材 |
| US6451059B1 (en) * | 1999-11-12 | 2002-09-17 | Ethicon, Inc. | Viscous suspension spinning process for producing resorbable ceramic fibers and scaffolds |
| WO2001035932A2 (en) | 1999-11-18 | 2001-05-25 | The Regents Of The University Of Michigan | Sustained drug delivery from structural matrices |
| AU1979201A (en) | 1999-12-09 | 2001-06-18 | Bio Syntech Canada Inc | Mineral-polymer hybrid composition |
| US6479418B2 (en) * | 1999-12-16 | 2002-11-12 | Isotis N.V. | Porous ceramic body |
| US20030103960A1 (en) | 1999-12-22 | 2003-06-05 | Pierre Philippart | Sealant and bone generating product |
| JP2003518411A (ja) * | 1999-12-29 | 2003-06-10 | リジェネレーション テクノロジーズ インク. | ペースト再構成のためのシステムおよびその使用法 |
| CA2398517C (en) * | 2000-01-28 | 2009-08-11 | Dot Dunnschicht-Und Oberflachen-Technologie Gmbh | Inorganic resorbable bone substitute material and production method |
| AU2000251259A1 (en) | 2000-02-04 | 2001-08-14 | Zymogenetics Inc. | Methods for promoting growth of bone, ligament, and cartilage using zvegf4 |
| CA2399224A1 (en) | 2000-02-18 | 2001-08-23 | Regeneration Technologies, Inc. | Implantable tissues infused with growth factors and other additives |
| IT1316769B1 (it) * | 2000-02-18 | 2003-05-12 | Getters Spa | Pannello evacuato per isolamento termico con ridotta conduzione dicalore ai bordi |
| US7022506B2 (en) * | 2000-02-23 | 2006-04-04 | The Trustees Of The University Of Pennsylvania | Method and device for treating osteoarthritis, cartilage disease, defects and injuries in the human knee |
| US20030055511A1 (en) | 2000-03-03 | 2003-03-20 | Schryver Jeffrey E. | Shaped particle comprised of bone material and method of making the particle |
| WO2001066044A2 (en) | 2000-03-03 | 2001-09-13 | Smith & Nephew, Inc. | Shaped particle and composition for bone deficiency and method of making the particle |
| WO2001066130A1 (en) | 2000-03-09 | 2001-09-13 | Sulzer Biologics Inc. | Product and method for biological anchoring of connective tissue to bone |
| US20030125252A1 (en) * | 2000-03-14 | 2003-07-03 | Underhill T. Michael | Compositions and methods for affecting osteogenesis |
| US20020006437A1 (en) | 2000-05-01 | 2002-01-17 | Grooms Jamie M. | Non-migration tissue capsule |
| US20020022885A1 (en) | 2000-05-19 | 2002-02-21 | Takahiro Ochi | Biomaterial |
| WO2001088867A2 (en) * | 2000-05-19 | 2001-11-22 | Europrint Holdings Limited | Method and system for implementing a game |
| US7081240B1 (en) | 2000-06-28 | 2006-07-25 | Zimmer Orthobiologics, Inc. | Protein mixtures for wound healing |
| US20020082220A1 (en) | 2000-06-29 | 2002-06-27 | Hoemann Caroline D. | Composition and method for the repair and regeneration of cartilage and other tissues |
| SE517168C2 (sv) * | 2000-07-17 | 2002-04-23 | Bone Support Ab | En komposition för ett injicerbart ersättningsmaterial för benmineral |
| DK177997B1 (da) * | 2000-07-19 | 2015-02-23 | Ed Geistlich Söhne Ag Für Chemische Ind | Knoglemateriale og collagenkombination til opheling af beskadigede led |
| GB0020610D0 (en) | 2000-08-21 | 2000-10-11 | Dytech Corp Ltd | Uses of porous carriers |
| US6739112B1 (en) | 2000-08-21 | 2004-05-25 | Nu Vasive, Inc. | Bone allograft packaging system |
| US6773723B1 (en) | 2000-08-30 | 2004-08-10 | Depuy Acromed, Inc. | Collagen/polysaccharide bilayer matrix |
| WO2002036147A1 (en) | 2000-10-31 | 2002-05-10 | Orquest, Inc. | Mineralized collagen-polysaccharide matrix for bone and cartilage repair |
| CA2365376C (en) | 2000-12-21 | 2006-03-28 | Ethicon, Inc. | Use of reinforced foam implants with enhanced integrity for soft tissue repair and regeneration |
| US20020127265A1 (en) | 2000-12-21 | 2002-09-12 | Bowman Steven M. | Use of reinforced foam implants with enhanced integrity for soft tissue repair and regeneration |
| US7192604B2 (en) * | 2000-12-22 | 2007-03-20 | Ethicon, Inc. | Implantable biodegradable devices for musculoskeletal repair or regeneration |
| WO2002058755A2 (en) | 2001-01-25 | 2002-08-01 | Regeneration Technologies, Inc. | Injectable porous bone graft materials |
| US7005135B2 (en) * | 2001-01-30 | 2006-02-28 | Ethicon Inc. | Glass scaffolds with controlled resorption rates and methods for making same |
| US20020169122A1 (en) | 2001-02-23 | 2002-11-14 | Wyeth | Chondrogenic potential of human bone marrow-derived CD105+ cells by BMP |
| US6575986B2 (en) | 2001-02-26 | 2003-06-10 | Ethicon, Inc. | Scaffold fixation device for use in articular cartilage repair |
| US6743232B2 (en) * | 2001-02-26 | 2004-06-01 | David W. Overaker | Tissue scaffold anchor for cartilage repair |
| US20030049328A1 (en) * | 2001-03-02 | 2003-03-13 | Dalal Paresh S. | Porous beta-tricalcium phosphate granules and methods for producing same |
| US6949251B2 (en) | 2001-03-02 | 2005-09-27 | Stryker Corporation | Porous β-tricalcium phosphate granules for regeneration of bone tissue |
| US20040171630A1 (en) | 2001-06-19 | 2004-09-02 | Yuntae Kim | Tyrosine kinase inhibitors |
| JP2003010310A (ja) * | 2001-06-27 | 2003-01-14 | Olympus Optical Co Ltd | 頭蓋骨用骨補填材料および補填方法 |
| WO2003006025A1 (en) | 2001-07-09 | 2003-01-23 | Mayo Foundation For Medical Education And Research | Methods and materials for treating bone conditions |
| US7020382B2 (en) * | 2001-07-12 | 2006-03-28 | Thomson Licensing | Modifying video by inserting shadow intra pictures |
| ATE359836T1 (de) | 2001-09-24 | 2007-05-15 | Millenium Biologix Inc | Poröse keramische komposit-knochenimplantate |
| WO2003033677A2 (en) | 2001-10-19 | 2003-04-24 | Zymogenetics, Inc. | Dimerized growth factor and materials and methods for producing it |
| US6649072B2 (en) | 2001-11-16 | 2003-11-18 | Robert Brandt | Method for producing autologous platelet-rich plasma |
| WO2003043576A2 (en) | 2001-11-20 | 2003-05-30 | Depuy Products, Inc. | Flowable osteogenic and chondrogenic compositions |
| AU2002361860A1 (en) * | 2001-12-21 | 2003-07-15 | Richard J. Lagow | Calcium phosphate bone replacement materials and methods of use thereof |
| EP1499267A4 (en) | 2002-02-05 | 2008-10-29 | Depuy Mitek Inc | BIOREGRADABLE OSTEOCONDUCTIVE COMPOSITIONS FOR BONE REGENERATION |
| EP1483298A4 (en) | 2002-02-11 | 2007-03-14 | Zymogenetics Inc | MATERIALS AND METHODS FOR PREPARING DIMERED GROWTH FACTORS |
| WO2003070186A2 (en) | 2002-02-20 | 2003-08-28 | The Cleveland Clinic Foundation | Composition and method for inducing bone growth and healing |
| DK175356B1 (da) | 2002-02-28 | 2004-09-06 | Coloplast As | Stomiindretning |
| JP3739715B2 (ja) * | 2002-03-19 | 2006-01-25 | オリンパス株式会社 | 人工骨および組織工学用担体 |
| KR100460685B1 (ko) | 2002-04-10 | 2004-12-09 | 재단법인서울대학교산학협력재단 | 인산칼슘계 화합물을 이용한 인공 골 충진재 및 그 제조방법 |
| US7514248B2 (en) | 2002-04-18 | 2009-04-07 | University Of Florida Research Foundation, Inc. | Process for making organic/inorganic composites |
| EP1539185A4 (en) | 2002-05-02 | 2006-04-05 | Osteoscreen Inc | METHODS AND COMPOSITIONS FOR STIMULATING BONE GROWTH USING NITRIC OXIDE FREEZING BISPHOSPHONATE CONJUGATES |
| WO2003094617A2 (en) * | 2002-05-06 | 2003-11-20 | Genentech, Inc. | Use of vegf for treating bone defects |
| US7368125B2 (en) * | 2002-06-05 | 2008-05-06 | Ethicon, Inc. | Amphiphilic polymers for medical applications |
| US7166133B2 (en) | 2002-06-13 | 2007-01-23 | Kensey Nash Corporation | Devices and methods for treating defects in the tissue of a living being |
| US7041309B2 (en) | 2002-06-13 | 2006-05-09 | Neuropro Technologies, Inc. | Spinal fusion using an HMG-CoA reductase inhibitor |
| CA2432583A1 (en) | 2002-06-20 | 2003-12-20 | Merck Patent Gesellschaft Mit Beschraenkter Haftung | Method of preparing alpha- and beta-tricalcium phosphate powders |
| US20040002770A1 (en) * | 2002-06-28 | 2004-01-01 | King Richard S. | Polymer-bioceramic composite for orthopaedic applications and method of manufacture thereof |
| ATE295744T1 (de) * | 2002-07-11 | 2005-06-15 | Biomet Deutschland Gmbh | Verfahren zur herstellung poröser calciumphosphatstückchen und -granulaten aus der gelatineverarbeitung |
| US7744651B2 (en) * | 2002-09-18 | 2010-06-29 | Warsaw Orthopedic, Inc | Compositions and methods for treating intervertebral discs with collagen-based materials |
| CN1403165A (zh) * | 2002-09-26 | 2003-03-19 | 东南大学 | 用于硬组织修复的活性组合物及其制备方法 |
| ES2393321T3 (es) | 2002-10-10 | 2012-12-20 | Ono Pharmaceutical Co., Ltd. | Promotores de la producción de factores de reparación endógenos |
| US20040078090A1 (en) | 2002-10-18 | 2004-04-22 | Francois Binette | Biocompatible scaffolds with tissue fragments |
| US7824701B2 (en) | 2002-10-18 | 2010-11-02 | Ethicon, Inc. | Biocompatible scaffold for ligament or tendon repair |
| JP2004159971A (ja) * | 2002-11-14 | 2004-06-10 | Hideki Yoshikawa | 骨形成用部材およびその製造方法 |
| EP1592463B1 (en) | 2003-02-13 | 2006-08-16 | SYNTHES AG Chur | Injectable bone-replacement mixture |
| JP2006517842A (ja) | 2003-02-14 | 2006-08-03 | デピュイ スパイン、インコーポレイテッド | 原位置形成型椎骨間融合の装置および方法 |
| US20040243133A1 (en) | 2003-03-05 | 2004-12-02 | Therics, Inc. | Method and system for manufacturing biomedical articles, such as using biomedically compatible infiltrant metal alloys in porous matrices |
| US20040193270A1 (en) | 2003-03-31 | 2004-09-30 | Depuyacromed, Inc. | Implantable bone graft |
| US7901457B2 (en) | 2003-05-16 | 2011-03-08 | Musculoskeletal Transplant Foundation | Cartilage allograft plug |
| US7465446B2 (en) * | 2003-05-30 | 2008-12-16 | Medarex, Inc. | Surrogate therapeutic endpoint for anti-CTLA4-based immunotherapy of disease |
| CA2528086C (en) | 2003-06-11 | 2013-01-08 | Osteotech, Inc. | Osteoimplants and methods for their manufacture |
| US6974862B2 (en) | 2003-06-20 | 2005-12-13 | Kensey Nash Corporation | High density fibrous polymers suitable for implant |
| DE60321328D1 (de) | 2003-06-24 | 2008-07-10 | Robert Mathys Foundation Dr H | Prothesenvorrichtung zur Wiederherstellung von Knorpel |
| DE10328892A1 (de) | 2003-06-26 | 2005-05-12 | Curasan Ag | Knochenaufbaumittel und Herstellungsverfahren |
| PL1641914T3 (pl) | 2003-06-27 | 2017-01-31 | DePuy Synthes Products, Inc. | Komórki pochodzące z poporodowej tkanki łożyska oraz sposoby uzyskiwania i zastosowania tych komórek |
| FI20031120A0 (fi) | 2003-07-31 | 2003-07-31 | Bci Bioabsorbable Concepts Ltd | Monifunktionaalinen implanttilaite |
| CN1240637C (zh) * | 2003-08-12 | 2006-02-08 | 四川大学 | 多孔磷酸钙生物陶瓷材料及其制备方法 |
| US7163920B2 (en) | 2003-09-30 | 2007-01-16 | Ethicon, Inc. | Peptide with osteogenic activity |
| CN1893986A (zh) | 2003-10-15 | 2007-01-10 | 独立行政法人科学技术振兴机构 | 利用转录因子用于骨/软骨再生的植入物 |
| CU23352A1 (es) * | 2003-10-16 | 2009-03-16 | Centro Nacional De Investigaciones Cientificas | Biomateriales compuestos para implantes óseos |
| NZ581804A (en) | 2003-10-22 | 2011-10-28 | Encelle Inc | Bioactive hydrogel compositions for regenerating connective tissue |
| US20050098915A1 (en) | 2003-11-07 | 2005-05-12 | Smith & Nephew Inc. | Manufacture of bone graft substitutes |
| AU2004289287A1 (en) | 2003-11-10 | 2005-05-26 | Angiotech International Ag | Medical implants and fibrosis-inducing agents |
| MXPA06005358A (es) * | 2003-11-14 | 2006-07-10 | Univ Pennsylvania | Metodo y aparato para el tratamiento de la osteoartritis, enfermedades de los cartilagos, defectos y lesiones en la cadena humana. |
| DE10355559A1 (de) | 2003-11-21 | 2005-06-23 | Orthogen Ag | Transskin |
| EP1537839A1 (en) | 2003-12-02 | 2005-06-08 | Dr. h. c. Robert Mathys Foundation | Prosthetic device for cartilage repair |
| EP1708651A4 (en) | 2004-01-27 | 2011-11-02 | Osteotech Inc | STABILIZED BONE PROOF |
| US7189263B2 (en) | 2004-02-03 | 2007-03-13 | Vita Special Purpose Corporation | Biocompatible bone graft material |
| US11395865B2 (en) | 2004-02-09 | 2022-07-26 | DePuy Synthes Products, Inc. | Scaffolds with viable tissue |
| US7671012B2 (en) | 2004-02-10 | 2010-03-02 | Biosurface Engineering Technologies, Inc. | Formulations and methods for delivery of growth factor analogs |
| US7928059B2 (en) | 2004-02-24 | 2011-04-19 | Wisconsin Alumni Research Foundation | Use of neuropeptides for traumatic cartilage injury |
| KR101013999B1 (ko) * | 2004-03-19 | 2011-02-14 | 재단법인서울대학교산학협력재단 | 표면에 골조직 형성 증진 펩타이드가 고정된 차폐막 및임플란트 |
| US20070190101A1 (en) * | 2004-03-31 | 2007-08-16 | Chunlin Yang | Flowable bone grafts |
| US8163030B2 (en) | 2004-05-06 | 2012-04-24 | Degradable Solutions Ag | Biocompatible bone implant compositions and methods for repairing a bone defect |
| WO2006031388A2 (en) | 2004-08-20 | 2006-03-23 | Hyperbranch Medical Technology, Inc. | Dentritic polymers, crosslinked gels, and their uses in orthopedic applications |
| JP2008513159A (ja) | 2004-09-21 | 2008-05-01 | マサチューセッツ・インスティチュート・オブ・テクノロジー | 勾配骨組及びその作成方法 |
| US7473678B2 (en) | 2004-10-14 | 2009-01-06 | Biomimetic Therapeutics, Inc. | Platelet-derived growth factor compositions and methods of use thereof |
| US7250550B2 (en) | 2004-10-22 | 2007-07-31 | Wright Medical Technology, Inc. | Synthetic bone substitute material |
| WO2006050493A2 (en) | 2004-11-03 | 2006-05-11 | The Regents Of The University Of Michigan | Biodegradable implant for intertransverse process fusion |
| WO2007008250A2 (en) * | 2004-12-07 | 2007-01-18 | Gelwell Biotech Corporation | Biomaterials for guided tissue regeneration and target drug delivery |
| US7621963B2 (en) | 2005-04-13 | 2009-11-24 | Ebi, Llc | Composite bone graft material |
| WO2006133403A2 (en) | 2005-06-07 | 2006-12-14 | The Regents Of The University Of Colorado | Inhibitors of serine protease activity and their use in methods and compositions for treatment of graft rejection and promotion of graft survival |
| EP1951327A2 (en) | 2005-11-17 | 2008-08-06 | Biomimetic Therapeutics, Inc. | Maxillofacial bone augmentation using rhpdgf-bb and a biocompatible matrix |
| US7749555B2 (en) | 2006-01-25 | 2010-07-06 | Medtronic, Inc | Modification of chemical forces of bone constructs |
| CA2640601C (en) | 2006-01-27 | 2015-12-29 | The Regents Of The University Of California | Biomimetic fibrous polymer scaffolds |
| US20070178159A1 (en) | 2006-01-30 | 2007-08-02 | Alza Corporation | In-Situ Forming Porous Scaffold |
| EP2311505B1 (en) | 2006-02-09 | 2013-11-06 | BioMimetic Therapeutics, LLC | Compositions and methods for treating bone |
| US7833270B2 (en) | 2006-05-05 | 2010-11-16 | Warsaw Orthopedic, Inc | Implant depots to deliver growth factors to treat osteoporotic bone |
| US8460860B2 (en) | 2006-05-08 | 2013-06-11 | Nuvasive, Inc. | Cancellous bone treated with collagenase and essentially free of blood cells |
| US9161967B2 (en) | 2006-06-30 | 2015-10-20 | Biomimetic Therapeutics, Llc | Compositions and methods for treating the vertebral column |
| AU2007269712B2 (en) | 2006-06-30 | 2013-02-07 | Biomimetic Therapeutics, Llc | PDGF-biomatrix compositions and methods for treating rotator cuff injuries |
| JP5552315B2 (ja) | 2006-11-03 | 2014-07-16 | バイオミメティック セラピューティクス, エルエルシー | アースロデティック術のための組成物および方法 |
| US20100151025A1 (en) | 2007-02-20 | 2010-06-17 | Biomimetic Therapeutics, Inc. | Prevention and treatment for osteonecrosis and osteoradionecrosis of the jaw |
| CN101820895A (zh) | 2007-06-04 | 2010-09-01 | 生物模拟治疗公司 | 用于治疗脊柱的组合物和方法 |
| EP2167147B1 (en) | 2007-06-15 | 2017-03-29 | Warsaw Orthopedic, Inc. | Bone matrix compositions and methods |
| US7993679B2 (en) | 2007-09-25 | 2011-08-09 | Integra Lifesciences Corporation | Flowable wound matrix and its preparation and use |
| CN102014977B (zh) | 2008-02-07 | 2015-09-02 | 生物模拟治疗有限责任公司 | 用于牵引成骨术的组合物和方法 |
| NZ591338A (en) | 2008-09-09 | 2013-02-22 | Biomimetic Therapeutics Inc | Platelet-derived growth factor compositions and methods for the treatment of tendon and ligament injuries |
| JP2012512728A (ja) | 2008-12-19 | 2012-06-07 | バイオミメティック セラピューティクス, インコーポレイテッド | 低減したプロテアーゼ活性を有する骨移植片ならびに選択方法および使用法 |
| CA2754501A1 (en) | 2009-03-05 | 2010-09-10 | Biomimetic Therapeutics, Inc. | Platelet-derived growth factor compositions and methods for the treatment of osteochondral defects |
-
2005
- 2005-06-23 US US11/159,533 patent/US7473678B2/en active Active
- 2005-10-12 KR KR1020137011627A patent/KR20130058762A/ko not_active Application Discontinuation
- 2005-10-12 KR KR1020107028561A patent/KR20110013492A/ko not_active Application Discontinuation
- 2005-10-12 EP EP11152889.9A patent/EP2308501B1/en not_active Not-in-force
- 2005-10-12 MX MX2007004459A patent/MX2007004459A/es active IP Right Grant
- 2005-10-12 NZ NZ582976A patent/NZ582976A/en not_active IP Right Cessation
- 2005-10-12 CA CA2583823A patent/CA2583823C/en active Active
- 2005-10-12 CN CNA2005800423857A patent/CN101198343A/zh active Pending
- 2005-10-12 BR BRPI0516105A patent/BRPI0516105B8/pt not_active IP Right Cessation
- 2005-10-12 EP EP05803356A patent/EP1812076B1/en not_active Not-in-force
- 2005-10-12 DK DK05803356.4T patent/DK1812076T3/da active
- 2005-10-12 EP EP11152879.0A patent/EP2308500B1/en not_active Not-in-force
- 2005-10-12 KR KR1020077010708A patent/KR101305922B1/ko active IP Right Grant
- 2005-10-12 PT PT05803356T patent/PT1812076E/pt unknown
- 2005-10-12 WO PCT/US2005/036447 patent/WO2006044334A2/en active Application Filing
- 2005-10-12 EP EP16190856.1A patent/EP3170505B1/en active Active
- 2005-10-12 DE DE602005022911T patent/DE602005022911D1/de active Active
- 2005-10-12 ZA ZA200703515A patent/ZA200703515B/xx unknown
- 2005-10-12 CN CN201510736598.5A patent/CN105561384A/zh active Pending
- 2005-10-12 AT AT05803356T patent/ATE476985T1/de active
- 2005-10-12 ES ES11152879.0T patent/ES2454841T3/es active Active
- 2005-10-12 EP EP10166327.6A patent/EP2223698B1/en not_active Not-in-force
- 2005-10-12 ES ES05803356T patent/ES2346457T3/es active Active
- 2005-10-12 AU AU2005295919A patent/AU2005295919B2/en active Active
- 2005-10-12 JP JP2007536784A patent/JP5137577B2/ja not_active Expired - Fee Related
- 2005-10-12 CA CA 2726144 patent/CA2726144C/en active Active
- 2005-10-12 NZ NZ554511A patent/NZ554511A/en not_active IP Right Cessation
-
2007
- 2007-04-11 IL IL182480A patent/IL182480A/en not_active IP Right Cessation
- 2007-04-18 NO NO20071974A patent/NO20071974L/no not_active Application Discontinuation
- 2007-07-16 US US11/778,498 patent/US9545377B2/en active Active
-
2008
- 2008-11-25 US US12/323,183 patent/US20090074753A1/en not_active Abandoned
-
2009
- 2009-06-02 JP JP2009133405A patent/JP2009195739A/ja active Pending
- 2009-06-24 AU AU2009202532A patent/AU2009202532B2/en active Active
-
2015
- 2015-12-21 US US14/977,250 patent/US20160310639A1/en not_active Abandoned
-
2016
- 2016-07-15 US US15/211,986 patent/US11318230B2/en active Active
- 2016-07-15 US US15/211,906 patent/US11364325B2/en active Active
- 2016-07-15 US US15/211,965 patent/US20170014481A1/en not_active Abandoned
- 2016-07-15 US US15/211,979 patent/US11571497B2/en active Active
- 2016-07-15 US US15/211,994 patent/US20170014482A1/en not_active Abandoned
-
2021
- 2021-08-17 US US17/404,383 patent/US20220072204A1/en not_active Abandoned
- 2021-09-16 US US17/476,753 patent/US20220176021A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5137577B2 (ja) | 血小板由来成長因子組成物及びそれらの使用方法 | |
| Lee et al. | The bone regenerative effect of platelet‐derived growth factor‐BB delivered with a chitosan/tricalcium phosphate sponge carrier | |
| Kao et al. | The use of biologic mediators and tissue engineering in dentistry. | |
| JP5189763B2 (ja) | 骨誘導性骨材料 | |
| EP2431060B1 (en) | Maxillofacial bone augmentation using RHPDGF-BB and a biocompatible matrix | |
| JP4414218B2 (ja) | 骨誘導性タンパク質のためのリン酸カルシウム送達ビヒクル | |
| US8507008B2 (en) | Injectable calcium phosphate solid rods and pastes for delivery of osteogenic proteins | |
| EP0679097B1 (en) | Tgf-beta formulation for inducing bone growth | |
| JP2007533376A (ja) | 遅延凝固リン酸カルシウムペースト | |
| EP0830149A1 (en) | Biocompatible hydroxyapatite formulations and uses therefor | |
| JP2010518946A (ja) | 顎の骨壊死および顎の放射線骨壊死の予防および処置 | |
| Jung et al. | The efficacy of BMP‐2 preloaded on bone substitute or hydrogel for bone regeneration at peri‐implant defects in dogs | |
| Kasaj et al. | Clinical evaluation of anorganic bovine-derived hydroxyapatite matrix/cell-binding peptide (P-15) in the treatment of human infrabony defects | |
| Yiemwattana | The Promising Clinical Applications of Growth Factors in Periodontal Regeneration: A Literature Review | |
| Parimala | Comparative evaluation of bovine porous bone mineral (Bio-Oss) bone craft with and without platelet rich plasma (PRP) in the treatment of periodontal intrabony defects: a clinical study | |
| MX2008006373A (en) | Maxillofacial bone augmentation using rhpdgf-bb and a biocompatible matrix |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |