JP2017518281A - 有機発光ダイオード材料 - Google Patents
有機発光ダイオード材料 Download PDFInfo
- Publication number
- JP2017518281A JP2017518281A JP2016567427A JP2016567427A JP2017518281A JP 2017518281 A JP2017518281 A JP 2017518281A JP 2016567427 A JP2016567427 A JP 2016567427A JP 2016567427 A JP2016567427 A JP 2016567427A JP 2017518281 A JP2017518281 A JP 2017518281A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- structural formulas
- exemplary embodiments
- independently
- present
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000463 material Substances 0.000 title description 8
- 125000003118 aryl group Chemical group 0.000 claims description 68
- 229910052739 hydrogen Inorganic materials 0.000 claims description 39
- 229910052799 carbon Inorganic materials 0.000 claims description 35
- 125000001072 heteroaryl group Chemical group 0.000 claims description 21
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 17
- 125000004429 atom Chemical group 0.000 claims description 16
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 14
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 12
- 125000005843 halogen group Chemical group 0.000 claims description 10
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 8
- 125000005842 heteroatom Chemical group 0.000 claims description 8
- 239000012044 organic layer Substances 0.000 claims description 8
- 229910052731 fluorine Inorganic materials 0.000 claims description 6
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 6
- 229910052757 nitrogen Inorganic materials 0.000 claims description 5
- 150000001875 compounds Chemical class 0.000 description 401
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 111
- 238000004770 highest occupied molecular orbital Methods 0.000 description 65
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 63
- 238000010521 absorption reaction Methods 0.000 description 56
- 238000004020 luminiscence type Methods 0.000 description 56
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 54
- 239000000370 acceptor Substances 0.000 description 35
- 230000015572 biosynthetic process Effects 0.000 description 31
- 238000003756 stirring Methods 0.000 description 31
- 238000003786 synthesis reaction Methods 0.000 description 31
- 0 *[n]1c(ccc(-c(cc2)ccc2-[n]2c3ccccc3c3c2cccc3)c2)c2c2cc(-c(cc3)ccc3N[C@](C=CC=C3)C3=C(C=CC=C3)C3=C)ccc12 Chemical compound *[n]1c(ccc(-c(cc2)ccc2-[n]2c3ccccc3c3c2cccc3)c2)c2c2cc(-c(cc3)ccc3N[C@](C=CC=C3)C3=C(C=CC=C3)C3=C)ccc12 0.000 description 28
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 23
- 125000000217 alkyl group Chemical group 0.000 description 19
- 239000000203 mixture Substances 0.000 description 19
- 238000000746 purification Methods 0.000 description 19
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 18
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 18
- 125000001424 substituent group Chemical group 0.000 description 18
- 238000006243 chemical reaction Methods 0.000 description 17
- -1 butadienyl Chemical group 0.000 description 11
- 230000005281 excited state Effects 0.000 description 11
- 239000012634 fragment Substances 0.000 description 10
- 239000000243 solution Substances 0.000 description 10
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 9
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 9
- 229910052805 deuterium Inorganic materials 0.000 description 8
- 230000005284 excitation Effects 0.000 description 8
- 229910052763 palladium Inorganic materials 0.000 description 8
- 229910052698 phosphorus Inorganic materials 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 7
- 125000000304 alkynyl group Chemical group 0.000 description 7
- 125000002950 monocyclic group Chemical group 0.000 description 7
- 230000007704 transition Effects 0.000 description 7
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 6
- 125000003342 alkenyl group Chemical group 0.000 description 6
- 125000003545 alkoxy group Chemical group 0.000 description 6
- 125000004432 carbon atom Chemical group C* 0.000 description 6
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 6
- 239000007858 starting material Substances 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 5
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 5
- 229910052794 bromium Inorganic materials 0.000 description 5
- 125000003106 haloaryl group Chemical group 0.000 description 4
- 229910052736 halogen Inorganic materials 0.000 description 4
- 150000002367 halogens Chemical class 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- JSEQNGYLWKBMJI-UHFFFAOYSA-N 9,9-dimethyl-10h-acridine Chemical compound C1=CC=C2C(C)(C)C3=CC=CC=C3NC2=C1 JSEQNGYLWKBMJI-UHFFFAOYSA-N 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- VKFWHTYHLBFBPG-UHFFFAOYSA-N c(cc1)ccc1-c1nc(-c2ccccc2)nc(-c(cc2)ccc2-[n]2c(ccc(-[n]3c4ccccc4c4c3cccc4)c3)c3c3ccccc23)c1 Chemical compound c(cc1)ccc1-c1nc(-c2ccccc2)nc(-c(cc2)ccc2-[n]2c(ccc(-[n]3c4ccccc4c4c3cccc4)c3)c3c3ccccc23)c1 VKFWHTYHLBFBPG-UHFFFAOYSA-N 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 239000000460 chlorine Substances 0.000 description 3
- 230000003111 delayed effect Effects 0.000 description 3
- 125000001188 haloalkyl group Chemical group 0.000 description 3
- 125000001041 indolyl group Chemical group 0.000 description 3
- 229910052740 iodine Inorganic materials 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 238000000034 method Methods 0.000 description 3
- SKTCDJAMAYNROS-UHFFFAOYSA-N methoxycyclopentane Chemical compound COC1CCCC1 SKTCDJAMAYNROS-UHFFFAOYSA-N 0.000 description 3
- 125000003367 polycyclic group Chemical group 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- GBXQPDCOMJJCMJ-UHFFFAOYSA-M trimethyl-[6-(trimethylazaniumyl)hexyl]azanium;bromide Chemical compound [Br-].C[N+](C)(C)CCCCCC[N+](C)(C)C GBXQPDCOMJJCMJ-UHFFFAOYSA-M 0.000 description 3
- AUHZEENZYGFFBQ-UHFFFAOYSA-N 1,3,5-trimethylbenzene Chemical compound CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical group N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- CEWVZHDJGNPLJF-UHFFFAOYSA-N Cc(cc(cc1C)-c2nc(-c3ccccc3)nc(-c3ccccc3)n2)c1-[n]1c2ccccc2c2c1cccc2 Chemical compound Cc(cc(cc1C)-c2nc(-c3ccccc3)nc(-c3ccccc3)n2)c1-[n]1c2ccccc2c2c1cccc2 CEWVZHDJGNPLJF-UHFFFAOYSA-N 0.000 description 2
- 238000003775 Density Functional Theory Methods 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- NNBZCPXTIHJBJL-UHFFFAOYSA-N decalin Chemical compound C1CCCC2CCCCC21 NNBZCPXTIHJBJL-UHFFFAOYSA-N 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- 229910052741 iridium Inorganic materials 0.000 description 2
- UEEXRMUCXBPYOV-UHFFFAOYSA-N iridium;2-phenylpyridine Chemical compound [Ir].C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1.C1=CC=CC=C1C1=CC=CC=N1 UEEXRMUCXBPYOV-UHFFFAOYSA-N 0.000 description 2
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 2
- 239000013110 organic ligand Substances 0.000 description 2
- 239000011368 organic material Substances 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 2
- 125000002098 pyridazinyl group Chemical group 0.000 description 2
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 238000001429 visible spectrum Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 125000006698 (C1-C3) dialkylamino group Chemical group 0.000 description 1
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical group C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- 125000005916 2-methylpentyl group Chemical group 0.000 description 1
- 125000005917 3-methylpentyl group Chemical group 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- FKZDHTRZEYOOGJ-UHFFFAOYSA-N C(C1)C=CC=C1C(N=C(C1C=CC=CC1)N1)=NC1N(C(C1C2)=Cc3c2c(cccc2)c2[n]3-c2ccccc2)c2c1cccc2 Chemical compound C(C1)C=CC=C1C(N=C(C1C=CC=CC1)N1)=NC1N(C(C1C2)=Cc3c2c(cccc2)c2[n]3-c2ccccc2)c2c1cccc2 FKZDHTRZEYOOGJ-UHFFFAOYSA-N 0.000 description 1
- IGVUPWLKRJUAIN-UHFFFAOYSA-N C(C1C(C=C2)=Nc(cc3)c1cc3-c(cc1)ccc1N(c1ccccc1)c1ccccc1)=C2c(cc1)ccc1N(c1ccccc1)c1ccccc1 Chemical compound C(C1C(C=C2)=Nc(cc3)c1cc3-c(cc1)ccc1N(c1ccccc1)c1ccccc1)=C2c(cc1)ccc1N(c1ccccc1)c1ccccc1 IGVUPWLKRJUAIN-UHFFFAOYSA-N 0.000 description 1
- PXGPVOPPZMPDRL-ASXRURRBSA-N C(C1C=C(C(C2)C(N3C(CC4)=CC=C4c4cc(-[n]5c(C6=CC=CCC6C6=CCCC=C66)c6nc5)ccc4)=CC=C2/C(/c2ccccc2)=C/C2C=CC=CC2)C3=CC1)/C(/c1ccccc1)=C/C1=CC=CCC1 Chemical compound C(C1C=C(C(C2)C(N3C(CC4)=CC=C4c4cc(-[n]5c(C6=CC=CCC6C6=CCCC=C66)c6nc5)ccc4)=CC=C2/C(/c2ccccc2)=C/C2C=CC=CC2)C3=CC1)/C(/c1ccccc1)=C/C1=CC=CCC1 PXGPVOPPZMPDRL-ASXRURRBSA-N 0.000 description 1
- JMUOOSYGFDBACA-UHFFFAOYSA-N C1C=CC(N(C2=CC=CCC2)C(C=C2C3=CC=CCC33)=CCC2N3C(C=C2)=CCC2C(C2)=CC(c3ccccc3)=CC2c2ccccc2)=CC1 Chemical compound C1C=CC(N(C2=CC=CCC2)C(C=C2C3=CC=CCC33)=CCC2N3C(C=C2)=CCC2C(C2)=CC(c3ccccc3)=CC2c2ccccc2)=CC1 JMUOOSYGFDBACA-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N C1CCCCC1 Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- ONDZTJMYLQROPY-UHFFFAOYSA-N CC(C1)CC(c(cc2)ccc2N2c3ccccc3C(C)(C3CC3)C3C=CC=CC23)=CC1Br Chemical compound CC(C1)CC(c(cc2)ccc2N2c3ccccc3C(C)(C3CC3)C3C=CC=CC23)=CC1Br ONDZTJMYLQROPY-UHFFFAOYSA-N 0.000 description 1
- GAWABHDWVJKRQM-UHFFFAOYSA-N CC(C1=CC=CCC1)(c1ccccc1)C1=CCC(C(Cc(cc2)ccc2-c(c(C2CC2)c(c(I)c2F)F)c2F)c(cc2)c3cc2N(C2=CC=CC4C2C4)c2ccccc2)C3=C1 Chemical compound CC(C1=CC=CCC1)(c1ccccc1)C1=CCC(C(Cc(cc2)ccc2-c(c(C2CC2)c(c(I)c2F)F)c2F)c(cc2)c3cc2N(C2=CC=CC4C2C4)c2ccccc2)C3=C1 GAWABHDWVJKRQM-UHFFFAOYSA-N 0.000 description 1
- ZBMPEYFYKBQRQI-UHFFFAOYSA-N CC(C1C=CC=CC11)(c2ccccc2N1c(cc1)ccc1-c1cc(-c(cc2)cc3c2[o]cn3)cc(-c(cc2)cc3c2[o]cn3)c1)N=C=C Chemical compound CC(C1C=CC=CC11)(c2ccccc2N1c(cc1)ccc1-c1cc(-c(cc2)cc3c2[o]cn3)cc(-c(cc2)cc3c2[o]cn3)c1)N=C=C ZBMPEYFYKBQRQI-UHFFFAOYSA-N 0.000 description 1
- AHDSYMVAUJZCOP-UHFFFAOYSA-N CC1(C)OB(c(cc2)ccc2-[n]2c(cccc3)c3c3ccccc23)OC1(C)C Chemical compound CC1(C)OB(c(cc2)ccc2-[n]2c(cccc3)c3c3ccccc23)OC1(C)C AHDSYMVAUJZCOP-UHFFFAOYSA-N 0.000 description 1
- MMTDHZWCHYIEFJ-UHFFFAOYSA-N CC1(C)c(cccc2)c2N(c(cc2)ccc2-c2ccc3[nH]c(ccc(-c(cc4)ccc4N(c4ccccc4C4(C)C)c5c4cccc5)c4)c4c3c2)c2c1cccc2 Chemical compound CC1(C)c(cccc2)c2N(c(cc2)ccc2-c2ccc3[nH]c(ccc(-c(cc4)ccc4N(c4ccccc4C4(C)C)c5c4cccc5)c4)c4c3c2)c2c1cccc2 MMTDHZWCHYIEFJ-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- FNPGJPKNKADBGK-UHFFFAOYSA-N Cc(cc1)cc(C)c1-c1ccccc1 Chemical compound Cc(cc1)cc(C)c1-c1ccccc1 FNPGJPKNKADBGK-UHFFFAOYSA-N 0.000 description 1
- SQNZJJAZBFDUTD-UHFFFAOYSA-N Cc1cc(C)c(C)cc1C Chemical compound Cc1cc(C)c(C)cc1C SQNZJJAZBFDUTD-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 238000004057 DFT-B3LYP calculation Methods 0.000 description 1
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 1
- FEJJYLIDLAQVCY-UHFFFAOYSA-N FC(CC(CC1F)C(CC2)=CCC2N(c(c(C2=C3)c4)ccc4N(c4ccccc4)c4ccccc4)C2=CCC3N(c2ccccc2)c2ccccc2)C1F Chemical compound FC(CC(CC1F)C(CC2)=CCC2N(c(c(C2=C3)c4)ccc4N(c4ccccc4)c4ccccc4)C2=CCC3N(c2ccccc2)c2ccccc2)C1F FEJJYLIDLAQVCY-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- PBDKQFUZWRMMBW-UHFFFAOYSA-N N#CC(C(C(CC1)=CC=C1C(CC1)=CC=C1[n](cc1)c2c1cccc2)C(C#N)=C1c2ccc(C3C=CC([n](cc4)c5c4cccc5)=CC3)cc2)C(C(CC2)=CC=C2C2C=CC(N(CC3)C4=C3C=CCC4)=CC2)=C1C#N Chemical compound N#CC(C(C(CC1)=CC=C1C(CC1)=CC=C1[n](cc1)c2c1cccc2)C(C#N)=C1c2ccc(C3C=CC([n](cc4)c5c4cccc5)=CC3)cc2)C(C(CC2)=CC=C2C2C=CC(N(CC3)C4=C3C=CCC4)=CC2)=C1C#N PBDKQFUZWRMMBW-UHFFFAOYSA-N 0.000 description 1
- GFKSXYJMPBUNCS-UHFFFAOYSA-N N#CC1=C(c(cc2)ccc2-c2c(C(CC=C3)C4=CCCC=C4)c3cnc2)C(C#N)=C2c(cc3)ccc3C3=CCCc(cc4)c3[n]4-c(cc3)ccc3[N]#CC2C1C(C1C=C2)C1C=C2c1c(CCC(C=C2)c3ccccc3)c2cnc1 Chemical compound N#CC1=C(c(cc2)ccc2-c2c(C(CC=C3)C4=CCCC=C4)c3cnc2)C(C#N)=C2c(cc3)ccc3C3=CCCc(cc4)c3[n]4-c(cc3)ccc3[N]#CC2C1C(C1C=C2)C1C=C2c1c(CCC(C=C2)c3ccccc3)c2cnc1 GFKSXYJMPBUNCS-UHFFFAOYSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- BWLGBWXLFZJVJR-UHFFFAOYSA-N [BH+]c1ccc2[o]cnc2c1 Chemical compound [BH+]c1ccc2[o]cnc2c1 BWLGBWXLFZJVJR-UHFFFAOYSA-N 0.000 description 1
- 125000004054 acenaphthylenyl group Chemical group C1(=CC2=CC=CC3=CC=CC1=C23)* 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 125000003282 alkyl amino group Chemical group 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 125000005334 azaindolyl group Chemical group N1N=C(C2=CC=CC=C12)* 0.000 description 1
- VJBCNMFKFZIXHC-UHFFFAOYSA-N azanium;2-(4-methyl-5-oxo-4-propan-2-yl-1h-imidazol-2-yl)quinoline-3-carboxylate Chemical group N.N1C(=O)C(C(C)C)(C)N=C1C1=NC2=CC=CC=C2C=C1C(O)=O VJBCNMFKFZIXHC-UHFFFAOYSA-N 0.000 description 1
- 125000003828 azulenyl group Chemical group 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 125000004601 benzofurazanyl group Chemical group N1=C2C(=NO1)C(=CC=C2)* 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 239000004305 biphenyl Chemical group 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- SPPONIYAQHCYOB-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c(cc1)cc(Oc2c3)c1Nc2ccc3N(c1ccccc1)c1ccccc1 Chemical compound c(cc1)ccc1N(c1ccccc1)c(cc1)cc(Oc2c3)c1Nc2ccc3N(c1ccccc1)c1ccccc1 SPPONIYAQHCYOB-UHFFFAOYSA-N 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000004020 conductor Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- GBRBMTNGQBKBQE-UHFFFAOYSA-L copper;diiodide Chemical compound I[Cu]I GBRBMTNGQBKBQE-UHFFFAOYSA-L 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- NLUNLVTVUDIHFE-UHFFFAOYSA-N cyclooctylcyclooctane Chemical compound C1CCCCCCC1C1CCCCCCC1 NLUNLVTVUDIHFE-UHFFFAOYSA-N 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000003838 furazanyl group Chemical group 0.000 description 1
- 125000004612 furopyridinyl group Chemical group O1C(=CC2=C1C=CC=N2)* 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 230000005283 ground state Effects 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 125000002192 heptalenyl group Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000003427 indacenyl group Chemical group 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- NIXOIRLDFIPNLJ-UHFFFAOYSA-M magnesium;benzene;bromide Chemical compound [Mg+2].[Br-].C1=CC=[C-]C=C1 NIXOIRLDFIPNLJ-UHFFFAOYSA-M 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- UMRZSTCPUPJPOJ-KNVOCYPGSA-N norbornane Chemical compound C1C[C@H]2CC[C@@H]1C2 UMRZSTCPUPJPOJ-KNVOCYPGSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000010355 oscillation Effects 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- GJVFBWCTGUSGDD-UHFFFAOYSA-L pentamethonium bromide Chemical group [Br-].[Br-].C[N+](C)(C)CCCCC[N+](C)(C)C GJVFBWCTGUSGDD-UHFFFAOYSA-L 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 125000001828 phenalenyl group Chemical group C1(C=CC2=CC=CC3=CC=CC1=C23)* 0.000 description 1
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 1
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 230000036314 physical performance Effects 0.000 description 1
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 229910052717 sulfur Chemical group 0.000 description 1
- 239000011593 sulfur Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C225/00—Compounds containing amino groups and doubly—bound oxygen atoms bound to the same carbon skeleton, at least one of the doubly—bound oxygen atoms not being part of a —CHO group, e.g. amino ketones
- C07C225/22—Compounds containing amino groups and doubly—bound oxygen atoms bound to the same carbon skeleton, at least one of the doubly—bound oxygen atoms not being part of a —CHO group, e.g. amino ketones having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/56—Ring systems containing three or more rings
- C07D209/80—[b, c]- or [b, d]-condensed
- C07D209/82—Carbazoles; Hydrogenated carbazoles
- C07D209/86—Carbazoles; Hydrogenated carbazoles with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/56—Ring systems containing three or more rings
- C07D209/80—[b, c]- or [b, d]-condensed
- C07D209/82—Carbazoles; Hydrogenated carbazoles
- C07D209/88—Carbazoles; Hydrogenated carbazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D251/00—Heterocyclic compounds containing 1,3,5-triazine rings
- C07D251/02—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings
- C07D251/12—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D251/14—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hydrogen or carbon atoms directly attached to at least one ring carbon atom
- C07D251/24—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hydrogen or carbon atoms directly attached to at least one ring carbon atom to three ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D265/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one oxygen atom as the only ring hetero atoms
- C07D265/28—1,4-Oxazines; Hydrogenated 1,4-oxazines
- C07D265/34—1,4-Oxazines; Hydrogenated 1,4-oxazines condensed with carbocyclic rings
- C07D265/38—[b, e]-condensed with two six-membered rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/636—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising heteroaromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6576—Polycyclic condensed heteroaromatic hydrocarbons comprising only sulfur in the heteroaromatic polycondensed ring system, e.g. benzothiophene
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1022—Heterocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
- C09K2211/1033—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
- C09K2211/1048—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
- C09K2211/1062—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1074—Heterocyclic compounds characterised by ligands containing more than three nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1074—Heterocyclic compounds characterised by ligands containing more than three nitrogen atoms as heteroatoms
- C09K2211/1081—Heterocyclic compounds characterised by ligands containing more than three nitrogen atoms as heteroatoms with sulfur
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1092—Heterocyclic compounds characterised by ligands containing sulfur as the only heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/20—Delayed fluorescence emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Electroluminescent Light Sources (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Indole Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Quinoline Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Plural Heterocyclic Compounds (AREA)
- Compositions Of Macromolecular Compounds (AREA)
Abstract
Description
本願は、2014年5月14日に出願された米国仮特許出願第61/996,836号、2014年6月5日に出願された米国仮特許出願第61/997,579号、2014年7月23日に出願された米国仮特許出願第62/028,045号、2014年8月6日に出願された米国仮特許出願第62/033,869号、2014年9月10日に出願された米国仮特許出願第62/048,497、2014年10月8日に出願された米国仮特許出願第62/061,369号、2014年10月8日に出願された米国仮特許出願第62/061,460号、2014年11月5日に出願された米国仮特許出願第62/075,490号、2014年12月17日に出願された米国仮特許出願第62/093,097号、2015年2月17日に出願された米国仮特許出願第62/117,045号、2015年3月27日に出願された米国仮特許出願第62/139,336号、および2015年5月1日に出願された米国仮特許出願第62/155,764号の利益を主張する。上述のそれぞれの出願の全教示は、参照により本明細書に援用される。
有機発光ダイオード(OLED)は、2つの導電体の間に有機化合物のフィルムが設置され、電流などの励起に応答して光を放射する発光ダイオード(LED)である。OLEDは、テレビのスクリーン、コンピューターのモニター、携帯電話およびタブレットなどのディスプレイに有用である。OLEDディスプレイに固有の問題は、有機材料の寿命が限られることである。特に青色の光を発するOLEDは、緑色または赤色のOLEDと比較して非常に早い速度で分解する。
したがって、速く分解することなくより高い励起状態に到達し得るOLEDの必要性が存在する。現在、Hfiの最大化に反対するようなΔの最小化に頼る熱活性型遅延蛍光(thermally activated delayed fluorescence)(TADF)は、例えば110μsなどの関連のあるタイムスケールにおける一重項レベルと三重項下位レベルの間の集団を移行し得ることが発見されている。本明細書に記載される化合物は、以前に記載された化合物よりも高いエネルギー励起状態で蛍光または燐光を発光し得る。
E1、E2、E3、E4、E5およびE6は、それぞれ独立して、CHまたはNである。
R1およびR2は、それぞれ独立してH、C1-C6アルキル、C6-C18アリールまたは(5〜20)原子ヘテロアリールである。
R21、R22、R23およびR24は、それぞれ独立して、HまたはC1-C3アルキルである。
F1およびF2は、それぞれ独立して、CR'またはNであり、ここでR'は、H、C1-C6アルキル、C6-C18アリールまたは-(Ar5)q-Gである。
Ar4またはAr5は、それぞれ独立して、1〜4個のC1-C3アルキルで任意に置換されるフェニルである。
pは、0、1または2である。
qは、0または1である。
Gは、Hであるか、または以下の構造式:
の1つで表される部分である。
本発明の例示態様の記載を以下に示す。
用語「アルキル」は、本明細書で使用する場合、特定の数の炭素原子を有する飽和脂肪族の分岐または直鎖一価炭化水素ラジカルをいう。したがって、「C1-C6アルキル」は、直鎖または分岐の配列中に1〜6個の炭素原子を有するラジカルを意味する。「C1-C6アルキル」の例としては、n-プロピル、i-プロピル、n-ブチル、i-ブチル、sec-ブチル、t-ブチル、n-ペンチル、n-ヘキシル、2-メチルブチル、2-メチルペンチル、2-エチルブチル、3-メチルペンチルおよび4-メチルペンチルが挙げられる。アルキルは、ハロゲン、-OH、C1-C6アルキル、C1-C6アルコキシ、-NO2、-CNおよび-N(R1)(R2)で任意に置換され得、ここでR1およびR2は、それぞれ独立して、-HおよびC1-C3アルキルから選択される。
OLEDは典型的に、2つの電極の間の有機物質または化合物の層、陽極および陰極で構成される。該有機分子は、該分子の一部または全部の共役により生じるπ電子の非局在化の結果、導電性となる。電圧をかけると、電子は、陽極に存在する最高被占軌道(highest occupied molecular orbital)(HOMO)から陰極に存在する有機分子の最低被占軌道(lowest unoccupied molecular orbital)(LUMO)へと流れる。HOMOから電子を除去することは、HOMOへの電子正孔の挿入とも称される。静電力により、電子と正孔が互いに対して運ばれ、その後電子と正孔が再結合し、励起子(電子と正孔が結合した状態)が形成される。励起した状態が消失し、電子のエネルギーレベルが緩むと、可視スペクトル内の周波数を有する放射が発せられる。この放射の周波数は、HOMOとLUMOの間のエネルギーの差である物質のバンドギャップに依存する。
熱または電子的手段により励起させた場合、本発明の分子は、可視スペクトルの青色または緑色の領域の光を生じ得る。該分子は、少なくとも1つのドナー部分、少なくとも1つのアクセプター部分、および任意にブリッジ部分を含む分子断片を含む。
(A)m-(B)l-(D)p (I)
で定義される分子であり、式中、A、BおよびDは、第1および第2の局面に関して先に定義され、かつ
部分Dは、それぞれの出現について独立して、それぞれ独立してC1-C6アルキル、C2-C6アルケニル、C2-C6アルキニル、C6-C18アリール、(5〜20原子)ヘテロアリール、C1-C6アルコキシ、アミノ、C1-C3アルキルアミノ、C1-C3ジアルキルアミノまたはオキソから選択される1つ以上の置換基で任意に置換され、
部分Aは、それぞれの出現について独立して、C1-C6アルキル、C2-C6アルケニル、C2-C6アルキニル、C6-C18アリール、(5〜20原子)ヘテロアリール、C1-C6アルコキシ、-C(O)C1-C3ハロアルキル、-S(O2)H、-NO2、-CN、オキソ、ハロゲンまたはC6-C18ハロアリールから独立して選択される1つ以上の置換基で任意に置換され、
部分Bは、それぞれの出現について独立して、それぞれ独立してC1-C6アルキル、C2-C6アルケニル、C2-C6アルキニル、C6-C18アリールまたは(5〜20原子)ヘテロアリールから選択される1〜4個の置換基で任意に置換され、
mは、1より大きい整数であり、
pは、1より大きい整数であり、
lは、0または1より大きい整数のいずれかである。例示的態様において、lは1より大きい。別の例示的態様において、lは、0、1または2である。
(A)m-(B)l-(D)p (I)
で規定される分子であり、式中A、BおよびDは、本発明の第1または第2の局面に関して先に定義され、かつ
部分Dは、それぞれの出現について独立して、本発明の第3の局面に関して上述される置換基に加えて、-N(C6-C18アリール)2で任意に置換され、
部分Aは、それぞれの出現について独立して、本発明の第3の局面に関して上述されるように任意に置換され、
部分Bは、それぞれの出現について独立して、本発明の第3の局面に関して上述されるように任意に置換され、
mは、1より大きい整数であり、
pは、1より大きい整数であり、
lは、0または1より大きい整数のいずれかである。例示的態様において、lは1より大きい。別の例示的態様において、lは0、1または2である。
(A)m-(B)l-(D)p (I)
で定義される分子であり、式中、A、BおよびDは、本発明の第1および第2の局面に関して先に定義され、
部分Dは、それぞれの出現について独立して、第3および第4の局面に関して上述されるように任意に置換され、さらに各アルキル、アルケニル、アルキニル、アリールおよびヘテロアリールは、C1-C6アルキル、5〜20原子のヘテロアリールまたは-N(C6-C18アリール)2から選択される1つ以上の置換基で任意にさらに置換され、
部分Aは、それぞれの出現について独立して、本発明の第3の局面に関して上述されるように任意に置換され、
部分Bは、それぞれの出現について独立して、本発明の第3の局面に関して上述されるように任意に置換され、
mは、1より大きい整数であり、
pは、1より大きい整数であり、
lは、0または1より大きい整数のいずれかである。例示的態様において、lは1より大きい。別の例示的態様において、lは0、1または2である。
Qは、部分Aまたは部分B0-2-Aであり、各Mは、部分Aまたは部分B0-2-Aであり、
全ての基Qは同一であり、全ての基Mは同一であり、かつ
各基Qは任意の基Mと同一であるかまたは異なり、部分AおよびBは、本発明の第1、2および3の局面に関して定義される。
Qは、独立して、部分A、部分B0-2-A、H、C1-C3アルキル、C6-C18アリール、オキソ、(5〜20原子)ヘテロアリールおよび-N(C6-C18アリール)2からなる群より選択され、部分AおよびBは、本発明の第1、2および3の局面に関して先に定義される。
Qは、独立して部分A、部分B0-2-A、H、C1-C3アルキル、C6-C18アリール、オキソ、(5〜20原子)ヘテロアリールおよび-N(C6-C18アリール)2からなる群より選択され、
Mは、独立して、部分A、部分B0-2-A、H、C1-C3アルキル、C6-C18アリール、オキソ、(5〜20原子)ヘテロアリールおよび-N(C6-C18アリール)2からなる群より選択され、
QおよびMの少なくとも1つは、部分B0-2-Aであり、
全ての基Qは同一であり、全ての基Mは同一であり、かつ
各基Qは、任意の基Mと同一であるかまたは異なり、部分AおよびBは、本発明の第1、2および3の局面に関して先に定義される。
Wは、部分Dまたは部分B0-2-Dであり、各Xは、部分Dまたは部分B0-2-Dであり、
全ての基Wは同一であり、全ての基Xは同一であり、かつ
各基Wは、任意の基Xと同一であるかまたは異なり、部分DおよびBは、本発明の第1、2および3の局面に関して先に定義される。
Xは、部分D、部分B0-2-D、H、C1-C3アルキル、C6-C18アリール、オキソ、C1-C3ハロアルキル、-CN、-CF3、-C(O)C1-C3ハロアルキル、-Fおよび-S(O2)Hからなる群より選択され、部分DおよびBは、本発明の第1、2および3に関して先に定義される。
Xは、部分B0-2-D、H、C1-C3アルキル、C6-C18アリール、オキソ、C1-C3ハロアルキル、-CN、-CF3、-C(O)C1-C3ハロアルキル、-Fおよび-S(O2)Hからなる群より選択され、
Wは、部分B0-2-D、H、C1-C3アルキル、C1-C3アシルアルキル、C6-C18アリール、オキソ、C1-C3ハロアルキル、-CN、-CF3、-C(O)C1-C3ハロアルキル、-Fおよび-S(O2)Hからなる群より選択され、
WおよびXの少なくとも1つは、部分B0-2-Dであり、
全ての基Wは同一であり、全ての基Xは同一であり、かつ
各基Wは、任意の基Xと同一であるかまたは異なり、部分DおよびBは、本発明の第1、2および3の局面に関して先に定義される。
Yは、部分A、部分B0-1-A、部分Dまたは部分B0-1-Dであり、各Zは、部分A、部分B0-1-A、部分Dまたは部分B0-1-Dであり、
所定の分子中、全ての基Yは同一であり、全ての基Zは同一であり、かつ
各基Yは、任意の基Zと同一であるかまたは異なり、部分AおよびDは、本発明の第1、2および3の局面に関して先に定義される。
Zは、独立して、部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3アルキルおよびC6-C18アリールからなる群より選択され、部分AおよびDは、本発明の第1、2および3の局面に関して先に定義される。
Zは、部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3アルキルまたはC6-C18アリールであり、
Yは、部分A、部分B0-1-A、部分Dまたは部分B0-1-Dであり、各Zは、部分A、部分B0-1-A、部分Dまたは部分B0-1-Dであり、
所定の分子中、全ての基Yは同一であり、全ての基Zは同一であり、
各基Yは、任意の基Zと同一であるかまたは異なり、部分AおよびDは、本発明の第1、2および3の局面に関して先に定義される。
Yは、部分A、部分B0-1-A、部分Dまたは部分B0-1-Dであり、各Zは、部分A、部分B0-1-A、部分Dまたは部分B0-1-Dであり、
所定の分子中、全ての基Yは同一であり、全ての基Zは同一であり、
各基Yは、任意の基Zと同一であるかまたは異なり、部分AおよびDは、本発明の第1、2および3の局面に関して先に定義される。
Zは、部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3アルキルまたはC6-C18アリールであり、部分AおよびDは、本発明の第1、2および3の局面に関して先に定義される。
Zは、部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3アルキルまたはC6-C18アリールであり、
Yは、部分A、部分B0-1-A、部分D、部分B0-1-D、H、C1-C3アルキルまたはC6-C18アリールであり、
所定の分子中、全ての基Yは同一であり、全ての基Zは同一であり、
各基Yは、任意の基Zと同一であるかまたは異なり、部分AおよびDは、本発明の第1、2および3の局面に関して先に定義される。
E1、E2、E3、E4、E5およびE6は、それぞれ独立して、CHまたはNである。
R1およびR2は、それぞれ独立して、H、C1-C6アルキル、C6-C18アリールまたは(5〜20)原子ヘテロアリールである。例えば、R1およびR2は、それぞれ独立して、HまたはC6-C12アリールである。
R21、R22、R23およびR24は、それぞれ独立して、HまたはC1-C3アルキルである。例えば、R21、R22、R23およびR24は、それぞれHである。
F1およびF2は、それぞれ独立して、CR'またはNであり、ここでR'は、H、C1-C6アルキル、C6-C18アリールまたは-(Ar5)q-Gである。例えば、F1およびF2は、それぞれCR'である。別の例示態様において、F1はC-Hであり、F2はC-Gである。
Ar4またはAr5は、それぞれ独立して、1〜4個のC1-C3アルキルで任意に置換されるフェニルである。例えば、Ar4またはAr5は、それぞれ独立して、以下の構造式:
pは、0、1または2である。例えば、pは1である。
qは、0または1である。例えば、qは0である。
Gは、Hまたは以下の構造式:
可視発光の色などの所望の性質を有する本発明の例示分子は、下記のコンビナトリアル方法を使用して、上述のアクセプター、ドナーおよびブリッジの部分から構築され得る。ほんのわずかの例示化合物を以下に示すが、異なる部分の異なる組み合わせを使用して、化合物のコンビナトリアルライブラリーを生成し得ることが理解される。以下の例示部分は、本発明における概念を例示することのみが意図され、限定を意図するものではない。
化合物J78
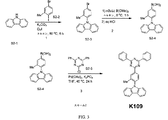
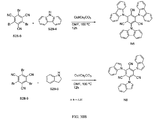
化合物J78は、図2に図示されるスキーム1に従って当業者により合成され得る。Alfa Aesarの開始物質S1-1(CAS No. 57102-42-8)が購入可能である。Acros Organicsの開始物質S1-2(CAS No. 95-51-2)が購入可能である。第1の工程において、化合物S1-1を、化合物S1-2、カリウムtert-ブトキシド、Pd(OAc)2およびPtBu3と、トルエン中120℃で24時間合わせて化合物S1-3を形成する。第2の工程において、化合物S1-3を、炭酸カリウム、Pd(OAc)2およびPtBu3HBF4と、DMA中180℃で24時間合わせて、化合物S1-4を形成する。第3の工程において、化合物S1-4を、化合物S1-5(Acros Organicsから販売、CAS No. 589-87-7)、K3PO4およびヨウ化銅と、トルエン中80℃で10分間合わせて、化合物S1-6を形成する。第4の工程において、化合物S1-6を、ヘキサン:シクロペンチルメチルエーテル溶液中0℃に冷却し、その後nBuLiを滴下し、次いでBu3SnClを滴下し、化合物S1-7を形成する。化合物S1-7を、化合物S1-8(Tokyo Chemical Industry Co.から販売、CAS No. 3740-92-9)と共にPd(OAc)2と合わせて、化合物J78を形成する。工程1、2、3、4および5は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物K109は、図3に図示されるスキーム2に従って当業者により合成され得る。第1の工程において、化合物S2-1(Acros Organicsから販売、CAS No. 86-74-8)を、化合物S2-2(Alfa Aesarから販売、CAS No. 116632-39-4)、K2CO3、およびCuIと、トルエン中80℃で合わせて、化合物S2-3を形成する。第2の工程において、化合物S2-3をヘキサンに添加して、0℃に冷却し、その後nBuLiを滴下し、次いでB(OMe)3を添加する。反応を撹拌させた後、水性HClでクエンチして、化合物S2-4を形成し得る。第3の工程において、化合物S2-4を、化合物S2-5(Alfa Aesarから販売、CAS No. 3842-55-5)、Pd(OAc)2およびK3PO4とTHF中、45℃で24時間合わせて、化合物K109を形成する。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物F57は、図4に図示されるスキーム3に従って当業者により合成され得る。第1の工程において、化合物S3-1(Combi-Blocks, Inc.から販売、CAS No. 206559-43-5)を、化合物S3-2(Acros Organicsから販売、CAS No. 494-19-9)、K2CO3およびCuIと、トルエン中80℃で合わせ、化合物S3-3を形成する。第2の工程において、化合物S3-3をヘキサン:シクロペンチルメチルエーテル溶液中で0℃に冷却し、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S3-4を形成する。第3の工程において、化合物S3-4を、化合物S3-5(Matrix Scientificから販売、CAS No. 1700-02-3)、Pd(OAc)2およびK3PO4と、THF中45℃で24時間合わせ、化合物F57を形成する。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
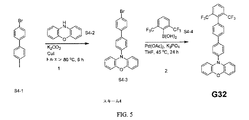
化合物G32は、図5に図示されるスキーム4に従って当業者により合成され得る。第1の工程において、化合物S4-1(Alfa Aesarから販売、CAS No. 105946-82-5)を、化合物S4-2(Acros Organicsから販売、CAS No. 135-67-1)、K2CO3およびCuIと、トルエン中80℃で合わせて、化合物S4-3を形成する。第2の工程において、化合物S4-3を、化合物S4-4(Alfa Aesarから販売、CAS No. 681812-07-7)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて、化合物G32を形成する。工程1および2は、過度の実験を要することなく当業者が実施および最適化することができることが理解される。
化合物I25は、図6に図示されるスキーム5に従って当業者により合成され得る。第1の工程において、化合物S5-1(Acros Organicsから販売、CAS No. 589-87-7)を、化合物S5-2(ArkPharm, Inc.から販売、CAS No. 6267-02-3)、nBuONaおよびCuIと、ジオキサン中80℃で6時間合わせて、化合物S5-3を形成する。第2の工程において、化合物S5-3をヘキサンに添加して0℃に冷却し、その後nBuLiを滴下して、次いでB(OMe)3を添加する。反応を撹拌させて、その後水性HClでクエンチして化合物S5-4を形成し得る。第3の工程において、化合物S5-4を、化合物S5-5(Acros Organicsから販売、CAS No 626-39-1)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて、化合物S5-6を形成し得る。第4の工程において、化合物S5-6を、化合物S5-7(Acros Organicsから販売、CAS No 1692-15-5)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて、化合物I25を形成し得る。工程1、2、3および4は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物L23は、図7に図示されるスキームに従って当業者により合成され得る。第1の工程において、化合物S6-1(ArkPharm, Inc.から販売、CAS No. 57103-02-3)を、化合物S6-2(Alfa Aesarから販売、CAS No. 201802-67-7)、Pd(OAc)2およびK3PO4と、THF:DMF中45℃で合わせて24時間撹拌して、化合物S6-3を得る。第2の工程において、化合物S6-3を、化合物S6-4(Alfa Aesarから販売、CAS No. 105946-82-5)、K2CO3およびCuIと、トルエン中80℃で合わせて、6時間撹拌させて、化合物S6-5を得る。第3の工程において、化合物S6-5を、化合物S6-6(Sigma-Alrdich Co.から販売、CAS No. 153435-63-3)およびPd(OAc)2と、THF中45℃で合わせて24時間撹拌させ、化合物L23を得る。工程、1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物J70は、図8に図示されるスキーム7に従って当業者により合成され得る。第1の工程において、化合物S7-1(Acros Organicsから販売、CAS No. 1592-95-6)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなくトルエン中でHNPh2、tBu3PおよびPd2dba3と合わせる。混合物を得て、精製することなくTFAと合わせて化合物S7-2を生成する。第2の工程において、化合物S7-2を、化合物S7-3(Acros Organicsから販売、CAS No. 589-87-7)、K3PO4およびCuIと、トルエン中80℃で合わせて6時間撹拌させ、化合物S7-4を形成する。第3の工程において、化合物S7-4をヘキサン溶液中-78℃に冷却し、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S7-5を形成する。
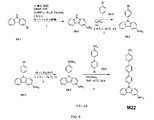
化合物M22は、図9に図示されるスキーム8に従って当業者により合成され得る。第1の工程において、化合物S8-1(Acros Organicsから販売、CAS No. 1592-95-6)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなくHNPh2、tBu3PおよびPd2dba3とトルエン中で合わせる。混合物を得て、精製することなくTFAと合わせ、化合物S8-2を生成する。第2の工程において、化合物S8-2を、化合物S8-3(Acros Organicsから販売、CAS No. 589-87-7)、K3PO4およびCuIと、トルエン中80℃で合わせ、6時間撹拌させて化合物S8-4を形成する。第3の工程において、化合物S8-4をヘキサン溶液中で-78℃に冷却し、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S8-5を形成する。第4の工程において、化合物S8-5を、化合物S8-6(A-Tech Chemicalsから販売、CAS No. 69231-87-4)およびPd(OAc)2とTHF中45℃で合わせて24時間撹拌させ、化合物M22を得る。工程1、2、3および4は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物B5は、図10に図示されるスキーム9に従って当業者により合成され得る。第1の工程において、化合物S9-1(A-Tech Chemicalsから販売、CAS No. 187275-73-6)を、HNPh2、K3PO4およびCuIと、トルエン中80℃で合わせて6時間撹拌して化合物S9-2を形成する。第2の工程において、化合物S9-2をヘキサンに添加して0℃に冷却し、その後nBuLiを滴下して、次いでB(OMe)3を添加する。反応を撹拌させて、その後水性HClでクエンチし、化合物S9-3を形成し得る。第3の工程において、化合物S9-3を、化合物S9-4(Matrix Scientificから販売、CAS No. 1700-02-3)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて、化合物B5を形成する。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物H52は、図11に図示されるスキーム10に従って当業者により合成され得る。第1の工程において、化合物S10-1(Acros Organicsから販売、CAS No. 5570-19-4)を、化合物S10-2(Acros Organicsから販売、583-53-9)、Pd(PPh3)4およびK2CO3と、トルエン中45℃で合わせて24時間撹拌させ、化合物S10-3を形成する。第2の工程において、化合物S10-4(Acros Organicsから販売、CAS No. 5122-99-6)を、化合物S10-5(Acros Organicsから販売、CAS No. 90-90-4)、Pd(OAc)2およびトリエチルアミンと、DMF:H2Oの溶液中45℃で合わせて24時間撹拌させ、化合物S10-6を形成する。第3の工程において、化合物S10-6および化合物S10-3を、K2CO3およびCuIとトルエン中80℃で合わせて6時間撹拌させ、化合物H52を得る。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物F33は、図12に図示されるスキーム11に従って当業者により合成され得る。第1の工程において、化合物S11-1(Acros Organicsから販売、CAS No. 589-87-7)を、化合物S11-2(Acros Organicsから販売、CAS No. 135-67-1)、K2CO3およびCuIとトルエン中80℃で合わせて化合物S11-3を形成する。第2の工程において、化合物S11-3を、化合物S11-4(Acros Organicsから販売、CAS 1692-15-5)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて化合物F33を形成する。工程1および2は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物E3は、図13に図示されるスキーム12に従って当業者により合成され得る。第1の工程において、化合物S12-1をSOCl2と合わせる。中間体を得て、精製することなく、PhMgBrとTHF中0℃で合わせて4時間撹拌して化合物S12-2を得る。第2の工程において、化合物S12-3(Sigma-Aldrich Co.から販売、CAS No. 78600-33-6)をヘキサンに添加して0℃に冷却し、その後nBuLiを添加する。B(OiPr)3を続けて添加して、反応を1時間撹拌させ、その後水性HClでクエンチして化合物S12-4を得る。第3の工程において、化合物S12-4および化合物S12-3をPd(OAc)2およびK3PO4とTHF中45℃で合わせて、24時間撹拌し、化合物E3を得る。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
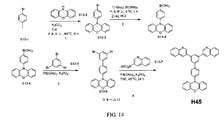
化合物H45は、図14に図示されるスキーム13に従って当業者により合成され得る。第1の工程において、化合物S13-1(Acros Organicsから販売、CAS No. 589-87-7)を、化合物S13-2(Acros Organicsから販売、CAS No. 135-67-14)、K2CO3およびCuIと、トルエン中80℃で6時間合わせて、化合物S13-3を形成する。第2の工程において、化合物S13-3をヘキサンに添加して0℃に冷却し、その後nBuLiを滴下して、次いでB(OMe)3を添加する。反応を撹拌させて、その後水性HClでクエンチして化合物S13-4を形成し得る。第3の工程において、化合物S13-4を、化合物S13-5(Acros Organicsから販売、CAS No 626-39-1)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて、化合物S13-6を形成する。第4の工程において、化合物S13-6を、化合物S13-7(Acros Organicsから販売、CAS No 191162-39-7)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせ、化合物H45を形成し得る。工程1、2、3および4は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物J62は、図15に図示されるスキーム14に従って当業者により合成され得る。第1の工程において、化合物S14-1(ArkPharm, Inc.から販売、CAS No. 57103-02-3)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなく、HNPh2、tBu3PおよびPd2dba3とトルエン中で合わせる。混合物を得て、精製することなく、TFAと合わせ、化合物S14-2を生成する。第2の工程において、化合物S14-2を、化合物S14-3(Alfa Aesarから販売、CAS No. 105946-82-5)、K3PO4およびCuIとトルエン中80℃で合わせ、6時間撹拌させて、化合物S14-4を形成する。第3の工程において、化合物S14-4を、化合物S14-5(Acros Organicsから販売、CAS No. 191162-39-7)、Pd(OAc)2およびK2CO3とTHF中45℃で合わせ、24時間撹拌させ、化合物J62を得る。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物L59は、図16に図示されるスキーム15に従って当業者により合成され得る。第1の工程において、化合物S15-1(ArkPharm, Inc.から販売、CAS No. 57103-02-3)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなく、HNPh2、tBu3PおよびPd2dba3とトルエン中で合わせる。混合物を得て、精製することなく、TFAと合わせて化合物S15-2を生成する。第2の工程において、化合物S15-2を、化合物S15-3(Alfa Aesarから販売、CAS No. 105946-82-5)、K3PO4およびCuIとトルエン中80℃で合わせ、6時間撹拌させ、化合物S15-4を形成する。第3の工程において、化合物S15-4を、化合物S15-5(Alfa Aesarから販売、CAS No. 1582-24-7)、Pd(OAc)2およびK2CO3とTHF中45℃で合わせ、24時間撹拌させ、化合物L59を得る。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物I99は、図17に図示されるスキーム16に従って当業者により合成され得る。第1の工程において、化合物S16-1(ArkPharm, Inc.から販売、CAS No. 23449-08-3)をヘキサンに添加して0℃に冷却し、その後nBuLiを滴下する。B(OiPr)3を続けて添加して、反応を1時間撹拌させ、その後水性HClでクエンチして、化合物S16-2を得る。第2の工程において、化合物16-3(Combi-Blocs, Inc.から販売、CAS No. 206559-43-5)を、化合物S16-4(Acros Organicsから販売、CAS No. 494-19-9)、K2CO3およびCuIとトルエン中80℃で合わせ、24時間撹拌させて、化合物S16-5を得る。第3の工程において、化合物16-5を、化合物16-5、Pd(OAc)2およびK3PO4とTHF中45℃で合わせ、24時間撹拌させ、化合物I99を得る。
化合物M31は、図18に図示されるスキーム17に従って当業者により合成され得る。第1の工程において、化合物S17-1(Acros Organicsから販売、CAS No. 1592-95-6)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなく、HNPh2、tBu3PおよびPd2dba3とトルエン中で合わせる。混合物を得て、精製することなくTFAと合わせて、化合物S17-2を生成する。第2の工程において、化合物S17-2を、化合物S17-3(Acros Organicsから販売、CAS No. 589-87-7)、K3PO4およびCuIとトルエン中80℃で合わせて、6時間撹拌させ、化合物S17-4を形成する。第3の工程において、化合物S17-4をヘキサン溶液中-78℃に冷却し、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S17-5を形成する。第4の工程において、化合物S17-6を、化合物S17-5およびPd(OAc)2とTHF中45℃で合わせて、24時間撹拌させ、化合物M31を得る。工程1、2、3および4は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
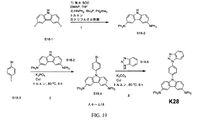
化合物K28は、図19に図示されるスキーム18に従って当業者により合成され得る。第1の工程において、化合物S18-1(ArkPharm, Inc.から販売、CAS No. 57103-02-3)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなく、HNPh2、tBu3PおよびPd2dba3とトルエン中で合わせる。混合物を得て、精製することなくTFAと合わせて、化合物S18-2を生成する。第2の工程において、化合物S18-2を、化合物S18-3(Acros Organicsから販売、CAS No. 589-87-7)、K3PO4およびCuIと、トルエン中80℃で合わせ、6時間撹拌して化合物S18-4を形成する。第3の工程において、化合物S18-4を、化合物S14-5(Acros Organicsから販売、CAS No. 95-14-7)、K2CO3およびCuIと、トルエン中80℃で合わせて6時間撹拌し、化合物K28を得る。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物H32は、図20に図示されるスキーム19に従って当業者により合成され得る。第1の工程において、化合物S19-1(Acros Organicsから販売、CAS No. 589-87-7)を、化合物S19-2(Acros Organicsから販売、CAS No. 135-67-1)、K2CO3およびCuIと、トルエン中80℃で合わせて化合物S19-3を形成する。第2の工程において、化合物S19-3を、化合物S19-4(Alfa Aesarから販売、CAS No. 913835-35-5)、Pd(OAc)2およびK3PO4と、THF中45℃で24時間合わせて、化合物H32を形成する。工程1および2は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
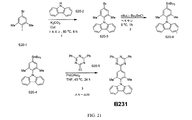
化合物B231は、図21に図示されるスキーム20に従って当業者により合成され得る。第1の工程において、化合物S20-1(Combi-Blocks, Inc.から販売、CAS No. 206559-43-5)を、化合物S20-2(Acros Organicsから販売、CAS No. 86-74-8)、K2CO3およびCuIと、トルエン中80℃で合わせて化合物S20-3を形成する。第2の工程において、化合物S20-3をヘキサン中で0℃に冷却して、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S20-4を形成する。第3の工程において、化合物S20-4を、化合物S20-5(Alfa Aesarから販売、CAS No. 3842-55-5)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて、化合物B231を形成する。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物F31は、図22に図示されるスキーム21に従って当業者により合成され得る。第1の工程において、化合物S21-1(Spectra Scientificから販売、CAS No. 149428-64-8)を、化合物S21-2(Acros Organicsから販売、CAS No. 86-74-8)、K2CO3およびCuIと、トルエン中80℃で合わせて化合物S21-3を形成する。第2の工程において、化合物S21-3を、化合物S21-4(Arch Bioscienceから販売、CAS No. 232275-35-3)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて化合物F31を形成する。工程1および2は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物I27は、図23に図示されるスキーム22に従って当業者により合成され得る。第1の工程において、化合物S22-1(Acros Organicsから販売、CAS No. 589-87-7)を、化合物S22-2(ArkPharm, Inc.から販売、CAS No. 6267-02-3)、nBuONaおよびCuIと、ジオキサン中80℃で6時間合わせて、化合物S22-3を形成する。第2の工程において、化合物S22-3をヘキサンに添加して0℃に冷却し、その後nBuLiを滴下して、次いでB(OMe)3を添加する。反応を撹拌させて、その後水性HClでクエンチして、化合物S22-4を形成し得る。第3の工程において、化合物S22-4を、化合物S22-5(Acros Organicsから販売、CAS No 626-39-1)、Pd(OAc)2およびK3PO4と、THF中45℃で24時間合わせて、化合物S22-6を形成し得る。第4の工程において、化合物S22-6を化合物S22-7(Anichem, Inc.から販売、CAS No. 1443112-43-3)、Pd(OAc)2およびK3PO4とTHF中45℃で24時間合わせて、化合物I27を形成し得る。工程1、2、3および4は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物K103は、図24に図示されるスキーム23に従って当業者により合成され得る。第1の工程において、化合物S23-1(Acros Organicsから販売、CAS No. 1592-95-6)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなく、HNPh2、tBu3PおよびPd2dba3とトルエン中で合わせる。混合物を得て、精製することなくTFAと合わせて、化合物S23-2を生成する。第2の工程において、化合物S23-2を、化合物S23-3(Acros Organicsから販売、CAS No. 589-87-7)、K3PO4およびCuIとトルエン中80℃で合わせて6時間撹拌し、化合物S23-4を形成する。第3の工程において、化合物S23-4をヘキサン溶液中-78℃に冷却して、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S23-5を形成する。第4の工程において、化合物S23-5を、化合物S23-6(eNovation Chemicalsから販売、CAS No. 40000-20-2)およびPd(OAc)2とTHF中45℃で合わせて、24時間撹拌し、化合物K103を得る。工程1、2、3および4は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
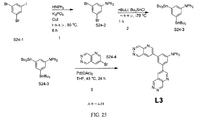
化合物L3は、図25に図示されるスキーム24に従って当業者により合成され得る。第1の工程において、化合物S24-1(Combi-Blocs, Inc.から販売、CAS No. 19752-57-9)を、HNPh2、K3PO4およびCuIとトルエン中80℃で合わせて6時間撹拌し、化合物S24-2を形成する。第2の工程において、化合物S24-2をヘキサン中-78℃に冷却し、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S24-3を形成する。第3の工程において、化合物24-3を、化合物24-4(Aces Pharmaから販売、CAS No. 23589-95-9)およびPd(OAc)2とTHF中45℃で合わせて24時間撹拌させ、化合物L3を得る。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物K45は、図26に図示されるスキーム25に従って当業者により合成され得る。第1の工程において、化合物S25-1(ArkPharm, Inc.から販売、CAS No. 57103-02-3)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなく、HNPh2、tBu3PおよびPd2dba3と、トルエン中で合わせる。混合物を得て、精製することなく、TFAと合わせて、化合物S25-2を形成する。第2の工程において、化合物S25-2を、化合物S25-3(Alfa Aesarから販売、CAS No. 202865-85-8)、K3PO4およびCuIと、トルエン中80℃で合わせて、6時間撹拌し、化合物S25-4を形成する。第3の工程において、化合物S25-4をヘキサン溶液中-78℃に冷却し、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S25-5を形成する。第4の工程において、化合物25-5を、化合物S25-6(Acros Organicsから販売、CAS No. 106-37-6)およびPd(OAc)2とTHF中45℃で合わせて24時間撹拌し、化合物S25-6を得る。第5の工程において、化合物S25-6をヘキサン溶液中-78℃に冷却し、その後nBuLiを滴下して、次いでBu3SnClを滴下して、化合物S25-7を形成する。第6の工程において、化合物S25-7を、化合物(compouns)S25-8(eNovation Chemicalsから販売、CAS No. 40000-20-2)およびPd(OAc)2とTHF中45℃で合わせて、24時間撹拌し、化合物K45を得る。工程1、2、3、4、5および6は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物M53は、図27に図示されるスキーム26に従って当業者により合成され得る。第1の工程において、化合物S26-1(Acros Organicsから販売、CAS No. 95-55-6)を、化合物S26-2(Matrix Chemicalsから販売、CAS No. 50670-58-1)とDMSO中で合わせて化合物26-3を形成する。第2の工程において、化合物26-4(ArkPharmから販売、CAS No. 57103-02-3)を、無水BOCおよびDMAPとTHF中で合わせる。混合物を得て、精製することなく、化合物26-5(Sigma-Aldrich Co.から販売、CAS No. 201802-67-7)と合わせる。混合物を得て、精製することなくTFAと合わせて化合物S26-6を生成する。第3の工程において、化合物26-6を、化合物26-3、K3PO4およびCuIとトルエン中80℃で合わせて24時間撹拌し、M53を得る。工程1、2および3は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物J64は、図28に図示されるスキーム27に従って当業者により合成され得る。第1の工程において、化合物S27-1(ArkPharmから販売、CAS No. 31574-87-5)をH2O2、H2OおよびAcOHと撹拌して化合物S27-2を形成する。第2の工程において、化合物S27-3(Alfa Aesarから販売、CAS No. 57102-42-8)を、化合物S27-4(Acros Organicsから販売、CAS No. 95-51-2)、tBuOK、Pd(OAc)2およびPtBu3とトルエン中120℃で合わせて24時間撹拌し、化合物S27-5を形成する。第3の工程において、化合物S27-5をK2CO3、Pd(OAc)2、PtBu3およびHBF4とDMA中180℃で合わせて24時間撹拌し、化合物S27-6を形成する。
化合物S28-8は、図30A〜Cに記載される反応スキームの開始物質である。化合物S28-8は、図29に図示されるスキーム28に従って当業者により合成され得る。第1の工程において、化合物S28-1(Sigma-Aldrich Co.から販売、CAS No. 108-67-8)を、臭素およびFeとクロロホルム中室温で合わせた。反応を24時間撹拌させ、90%の収率で化合物S28-2を生成した。第2の工程において、化合物28-2を、ジクロロエタン中臭素と合わせ、100℃に加熱し、光に曝露した。反応を12時間撹拌させ、95%の収率で化合物S28-3を生成した。第3の工程において、化合物S28-3を、酢酸中KOAcと合わせ、140℃に加熱した。反応を24時間撹拌させて、化合物S28-4を生成した。第4の工程において、化合物S28-4を、水中でKOHと合わせて100℃に加熱した。反応を12時間撹拌させて化合物S28-5を形成した。第5の工程において、化合物S28-5を、水中でKMnO4と合わせて100℃に加熱した。反応を12時間撹拌させて化合物S28-6を形成した。第6の工程において、化合物S28-6を、THF中SOCl2と合わせ、100%の収率で化合物S28-7を形成した。第7の工程において、化合物S28-7を、NH3・H2Oと0℃で合わせて6時間撹拌させ、S28-8を形成した。第8の工程において、化合物S28-8をPOCl3と合わせて化合物S28-9を形成した。工程1、2、3、4、5、6、7および8は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物N1〜N8およびM141は、図30Aに図示されるスキーム29に従って当業者により合成され得る。開始物質S28-9を、S29-1、S29-2、S29-3またはS29-7およびPd/K2CO3と、THF/H2O中で合わせ、85℃に加熱する。反応を12時間撹拌させて、化合物N1、N3、N4およびM141それぞれを生成し得る。これらの工程は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物N6およびN8は、図30Dに図示されるスキーム30に従って当業者により合成され得る。開始物質S28-9を、S29-4またはS29-6およびCuI/Cs2CO3とDMF中で合わせ、100℃に加熱する。反応を12時間撹拌させて、化合物N6およびN8それぞれを生成し得る。これらの工程は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
化合物N7は、図30Cに図示されるスキーム31に従って当業者により合成され得る。開始物質S28-9を、S29-5およびTEAと、1,4-ジオキサン中で合わせて80℃に加熱する。反応を24時間撹拌させて化合物N7を生成し得る。これらの工程は、過度の実験を要することなく当業者が実施および最適化することができると理解される。
Claims (15)
- 構造式(XII):
(式中、
E1、E2、E3、E4、E5およびE6は、それぞれ独立して、CR"またはNであり、ここでR"は、HまたはC1-C3アルキルであり;
R1およびR2は、それぞれ独立して、H、C1-C6アルキル、C6-C18アリールまたは(5〜20)原子ヘテロアリールであり;
R21、R22、R23およびR24は、それぞれ独立して、HまたはC1-C3アルキルであり;
F1およびF2は、それぞれ独立して、CR'またはNであり、ここでR'は、H、C1-C6アルキル、C6-C18アリールまたは-(Ar5)q-Gであり;
Ar4およびAr5は、それぞれ独立して、1〜4個のC1-C3アルキルで任意に置換されるフェニルであり;
pは、0、1または2であり;
qは、0または1であり;
Gは、H、または以下の構造式:
の1つで表される部分であり、
該構造式中、
E7、E8、E9およびE10は、それぞれ独立して、CHまたはNであり、
R3、R4、R5およびR6は、それぞれ独立して、C1-C3アルキル、C6-C18アリール、ハロまたは-CNであり、
ただし、E1、E2およびE3がそれぞれNであり、F1およびF2がそれぞれCR'である場合、各R'は、構造式
で表される部分ではない)
で表される分子。 - R1およびR2が、それぞれ独立して、HまたはC6-C12アリールであり;
pが1である、請求項1記載の分子。 - F1およびF2が、それぞれ独立して、CR'である、請求項1〜3いずれか記載の分子。
- qが0である、請求項1〜4いずれか記載の分子。
- 少なくとも1つの部分A;
少なくとも1つの部分D;および
任意に、1つ以上の部分Bを含み、
ここで、各部分Bは多価であり、部分Aは、部分Dとは異なり;
各部分Aは、部分Bの少なくとも1つまたは少なくとも1つの部分Dのいずれかに共結合され;
各部分Dは、部分Bの少なくとも1つまたは少なくとも1つの部分Aのいずれかに共有結合され;
各部分Bは、部分Aの少なくとも1つおよび部分Dの少なくとも1つに共有結合され;
部分Aは、それぞれの出現について独立して、リストA1、リストA2、リストA3またはそれらの任意の組合せから選択され;
部分Dは、それぞれの出現について独立して、リストD1、リストD2、リストD3、またはそれらの任意の組合せから選択され:
各部分Bは、それぞれの出現について独立して、リストB1、リストB2または両方から選択される、
を含む分子であって、
該分子は、表1〜14の構造式のいずれか1つで表され、
表1〜14に表される構造式中の(*)で示される炭素またはヘテロ原子は、非置換であるか、またはC1-C6アルキル、-OH、-CN、ハロ、C6-C12アリール、5〜20原子のヘテロアリール、-N(R19)2もしくは-N(R20)2で置換され、
ここで、各R19は、独立して、H、C1-C6アルキルまたはC5-C12シクロアルキルであり、各R20は、独立して、HまたはC6-C18アリールであり、
ただし、該分子は、表1〜14の構造式B4、J68、J79、K39、K55、K57、K100、K177またはN6で表されない、分子。 - 表15から選択されるいずれか1つの構造式で表される、請求項10記載の分子。
- 構造式(II)〜(XI):
(式中、
Ar1およびAr3は、それぞれの出現について独立して、リストM1から選択され、Ar1とAr3は異なることが理解され;
Ar2は、それぞれの出現について独立して、リストM2から選択される)
で表される分子であって、
さらに、該分子が、表1〜14の構造式のいずれか1つで表され、表1〜14に表される構造式中の(*)で示される炭素またはヘテロ原子は、非置換であるか、またはC1-C6アルキル、-OH、-CN、ハロ、C6-C12アリール、5〜20原子のヘテロアリール、-N(R19)2もしくは-N(R20)2で置換され、
ここで、各R19は、独立して、HまたはC1-C6アルキルまたはC5-C12シクロアルキルであり、各R20は、独立して、HまたはC6-C18アリールであり、
ただし、該分子は、表1〜14の構造式B4、J68、J79、K39、K55、K57、K100、K177またはN6で表されない、分子。 - 表15から選択される、請求項12記載の分子。
- 第1の電極;
第2の電極:および
該第1の電極と第2の電極の間に設置された有機層
を含む、有機発光デバイスであって、
該有機層が、少なくとも1つの請求項1〜14いずれか記載の分子を含む、有機発光デバイス。
Applications Claiming Priority (25)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461996836P | 2014-05-14 | 2014-05-14 | |
| US61/996,836 | 2014-05-14 | ||
| US201461997579P | 2014-06-05 | 2014-06-05 | |
| US61/997,579 | 2014-06-05 | ||
| US201462028045P | 2014-07-23 | 2014-07-23 | |
| US62/028,045 | 2014-07-23 | ||
| US201462033869P | 2014-08-06 | 2014-08-06 | |
| US62/033,869 | 2014-08-06 | ||
| US201462048497P | 2014-09-10 | 2014-09-10 | |
| US62/048,497 | 2014-09-10 | ||
| US201462061460P | 2014-10-08 | 2014-10-08 | |
| US201462061369P | 2014-10-08 | 2014-10-08 | |
| US62/061,369 | 2014-10-08 | ||
| US62/061,460 | 2014-10-08 | ||
| US201462075490P | 2014-11-05 | 2014-11-05 | |
| US62/075,490 | 2014-11-05 | ||
| US201462093097P | 2014-12-17 | 2014-12-17 | |
| US62/093,097 | 2014-12-17 | ||
| US201562117045P | 2015-02-17 | 2015-02-17 | |
| US62/117,045 | 2015-02-17 | ||
| US201562139336P | 2015-03-27 | 2015-03-27 | |
| US62/139,336 | 2015-03-27 | ||
| US201562155764P | 2015-05-01 | 2015-05-01 | |
| US62/155,764 | 2015-05-01 | ||
| PCT/US2015/030598 WO2015175678A1 (en) | 2014-05-14 | 2015-05-13 | Organic light-emitting diode materials |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017518281A true JP2017518281A (ja) | 2017-07-06 |
| JP2017518281A5 JP2017518281A5 (ja) | 2018-06-21 |
Family
ID=53284535
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016567427A Pending JP2017518281A (ja) | 2014-05-14 | 2015-05-13 | 有機発光ダイオード材料 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20170244049A1 (ja) |
| EP (1) | EP3143100A1 (ja) |
| JP (1) | JP2017518281A (ja) |
| KR (1) | KR20170005853A (ja) |
| CN (1) | CN106661001A (ja) |
| WO (1) | WO2015175678A1 (ja) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016082207A (ja) * | 2014-10-22 | 2016-05-16 | 三星ディスプレイ株式會社Samsung Display Co.,Ltd. | 有機エレクトロルミネッセンス素子用材料及びそれを用いた有機エレクトロルミネッセンス素子 |
| JP2017054972A (ja) * | 2015-09-10 | 2017-03-16 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、照明装置、π共役系化合物、及び発光性薄膜 |
| JP2018035129A (ja) * | 2015-10-27 | 2018-03-08 | 国立大学法人山形大学 | ピリミジン誘導体、それよりなる発光材料及びそれを用いた有機el素子 |
| JP2018113364A (ja) * | 2017-01-12 | 2018-07-19 | 日本放送協会 | 有機エレクトロルミネッセンス素子 |
| CN109942551A (zh) * | 2017-11-08 | 2019-06-28 | 辛诺拉有限公司 | 有机分子,特别是其在光电设备中的用途 |
| JP2021524867A (ja) * | 2018-09-27 | 2021-09-16 | 武漢尚賽光電科技有限公司Wuhan Sunshine Optoelectronics Tech Co Ltd | 1,2,4−チアジアゾール系化合物及びその製造方法と使用 |
| JP2021533580A (ja) * | 2018-08-03 | 2021-12-02 | ▲広▼▲東▼聚▲華▼印刷▲顯▼示技▲術▼有限公司 | 電子輸送材料及びその使用 |
Families Citing this family (132)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10934248B2 (en) | 2013-11-28 | 2021-03-02 | Kyulux, Inc. | Light-emitting material, organic light-emitting device, and compound |
| TWI637944B (zh) * | 2013-11-28 | 2018-10-11 | 九州有機光材股份有限公司 | 發光材料、有機發光元件及化合物 |
| WO2015175680A1 (en) * | 2014-05-14 | 2015-11-19 | President And Fellows Of Harvard College | Organic light-emitting diode materials |
| CN113793905A (zh) * | 2014-09-26 | 2021-12-14 | Udc 爱尔兰有限责任公司 | 具有高效率的荧光有机发光元件 |
| EP3218368B1 (de) * | 2014-11-11 | 2020-11-25 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3032605B1 (en) * | 2014-12-08 | 2019-08-21 | LG Display Co., Ltd. | Organic light emitting display device |
| WO2016111196A1 (ja) * | 2015-01-08 | 2016-07-14 | 国立大学法人九州大学 | 化合物、混合物、発光層、有機発光素子およびアシストドーパント |
| JP6764671B2 (ja) * | 2015-04-14 | 2020-10-07 | 株式会社半導体エネルギー研究所 | 複素環化合物、発光素子、発光装置、電子機器、および照明装置 |
| CN110838555B (zh) * | 2015-04-24 | 2022-03-08 | 株式会社Lg化学 | 有机发光器件 |
| GB201507340D0 (en) | 2015-04-29 | 2015-06-10 | Univ St Andrews | Light emitting devices and compounds |
| US20190296246A1 (en) * | 2015-06-23 | 2019-09-26 | Kaneka Corporation | Organic el material and organic el element employing same |
| WO2017014951A1 (en) * | 2015-07-17 | 2017-01-26 | Dow Global Technologies Llc | N-aryl-hydroacridines as light emitting elements for electroluminescent devices |
| GB201513037D0 (en) | 2015-07-23 | 2015-09-09 | Merck Patent Gmbh | Phenyl-derived compound for use in organic electronic devices |
| JP6674542B2 (ja) * | 2015-07-30 | 2020-04-01 | 四川知本快車創新科技研究院有限公司Sichuan Knowledge Express Institute For Innovative Technologies Co, Ltd. | 供与体と受容体との間に2つの非共役ブリッジを有する光電変換デバイス用の熱活性化遅延蛍光有機分子 |
| KR101897872B1 (ko) | 2015-09-24 | 2018-09-12 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR102572294B1 (ko) * | 2015-09-25 | 2023-08-30 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| JP6705148B2 (ja) * | 2015-10-15 | 2020-06-03 | コニカミノルタ株式会社 | π共役系化合物、有機エレクトロルミネッセンス素子材料、発光材料、発光性薄膜、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| CN105294670B (zh) | 2015-11-20 | 2019-07-09 | 上海天马有机发光显示技术有限公司 | 有机电致发光化合物及其有机光电装置 |
| TWI594476B (zh) * | 2015-12-11 | 2017-08-01 | 友達光電股份有限公司 | 螢光有機發光材料及有機電激發光裝置 |
| CN105567217B (zh) * | 2015-12-15 | 2017-12-01 | 华南理工大学 | 一种多刺激‑响应有机小分子发光材料及制备与应用 |
| MD3394033T2 (ro) | 2015-12-22 | 2021-04-30 | Incyte Corp | Compuși heterociclici ca imunomodulatori |
| DE102016212614B4 (de) * | 2015-12-25 | 2021-05-20 | Shanghai Tianma AM-OLED Co., Ltd. | Stickstoffhaltige heterocyclische Verbindung, organische fotoelektrische Vorrichtung und Verfahren zum Herstellen einer organischen fotoelektrischen Vorrichtung |
| CN105399696B (zh) * | 2015-12-25 | 2019-12-24 | 上海天马有机发光显示技术有限公司 | 有机电致发光化合物及其有机光电装置 |
| CN105418486A (zh) | 2015-12-25 | 2016-03-23 | 上海天马有机发光显示技术有限公司 | 有机电致发光化合物及其有机光电装置 |
| KR102659372B1 (ko) * | 2016-03-04 | 2024-04-22 | 주식회사 동진쎄미켐 | 신규 화합물 및 이를 포함하는 유기발광소자 |
| CN107056770A (zh) * | 2016-04-25 | 2017-08-18 | 中节能万润股份有限公司 | 一种以含氮五元杂环为核心的化合物及其在有机电致发光器件上的应用 |
| CN106279203B (zh) * | 2016-04-25 | 2018-08-14 | 中节能万润股份有限公司 | 一种含酮和氮杂环的化合物及其在有机电致发光器件上的应用 |
| CN107057682A (zh) * | 2016-04-25 | 2017-08-18 | 中节能万润股份有限公司 | 一种以吖啶酮为核心的化合物及其在有机电致发光器件上的应用 |
| KR102501267B1 (ko) * | 2016-04-26 | 2023-02-21 | 덕산네오룩스 주식회사 | 지연 형광 재료 및 이를 이용한 유기전기소자 및 그 전자 장치 |
| JP7253646B2 (ja) * | 2016-04-28 | 2023-04-06 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | π共役系化合物、有機エレクトロルミネッセンス素子材料、発光材料、電荷輸送材料、発光性薄膜、有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP7081898B2 (ja) * | 2016-04-28 | 2022-06-07 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| KR102651014B1 (ko) | 2016-05-26 | 2024-03-26 | 삼성디스플레이 주식회사 | 함질소 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| WO2017205464A1 (en) * | 2016-05-26 | 2017-11-30 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CN106045977B (zh) * | 2016-05-31 | 2019-03-15 | 太原理工大学 | 一种基于咔唑和1,2,4-三氮唑的双极性蓝色磷光主体材料 |
| CN106083825A (zh) * | 2016-06-07 | 2016-11-09 | 石家庄诚志永华显示材料有限公司 | 吡嗪衍生物及其在有机电致发光器件中的应用 |
| LT3472167T (lt) | 2016-06-20 | 2022-11-10 | Incyte Corporation | Heterocikliniai junginiai kaip imunomoduliatoriai |
| DE102016112377B4 (de) * | 2016-07-06 | 2020-06-04 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in organischen optoelektronischen Vorrichtungen |
| EP3483148B1 (en) * | 2016-07-07 | 2023-08-23 | Hodogaya Chemical Co., Ltd. | Compound having benzazole ring structure and organic electroluminescent element |
| US20180016260A1 (en) | 2016-07-14 | 2018-01-18 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| KR102631944B1 (ko) * | 2016-08-03 | 2024-02-02 | 삼성디스플레이 주식회사 | 방향족 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| CN106467533A (zh) * | 2016-08-08 | 2017-03-01 | 江苏三月光电科技有限公司 | 一种以吖啶酮为核心的化合物及其应用 |
| CN107778294B (zh) * | 2016-08-24 | 2021-07-09 | 西诺拉股份有限公司 | 有机分子,特别应用于有机光电装置中 |
| DE102016115854B3 (de) * | 2016-08-25 | 2018-01-25 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in organischen optoelektronischen Vorrichtungen |
| EP3287450B1 (de) * | 2016-08-25 | 2019-03-20 | cynora GmbH | Organische moleküle, insbesondere zur verwendung in organischen optoelektronischen vorrichtungen |
| JP6986737B2 (ja) * | 2016-08-30 | 2021-12-22 | 国立大学法人山形大学 | 新規イソニコチノニトリル誘導体、及びそれを用いた有機el素子 |
| CN107880027B (zh) * | 2016-09-30 | 2021-03-02 | 中节能万润股份有限公司 | 一种以三嗪为核心的化合物及其在有机电致发光器件上的应用 |
| DE102016120373B3 (de) * | 2016-10-25 | 2017-08-24 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in organischen optoelektronischen Vorrichtungen |
| US10971688B2 (en) * | 2016-10-25 | 2021-04-06 | Cynora Gmbh | Organic molecules for use in organic optoelectronic devices |
| KR101970863B1 (ko) * | 2016-10-31 | 2019-04-19 | 성균관대학교산학협력단 | 지연형광 재료 및 이를 포함하는 유기 발광장치 |
| TWI746682B (zh) * | 2016-11-01 | 2021-11-21 | 德商賽諾拉公司 | 有機分子,尤其是用於有機光電子裝置者 |
| US10897016B2 (en) * | 2016-11-14 | 2021-01-19 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US10833276B2 (en) | 2016-11-21 | 2020-11-10 | Universal Display Corporation | Organic electroluminescent materials and devices |
| CN106699659B (zh) * | 2016-12-14 | 2018-12-18 | 中节能万润股份有限公司 | 一种n-苯基吖啶酮类有机电致发光材料及其制备方法和应用 |
| BR112019012993A2 (pt) | 2016-12-22 | 2019-12-03 | Incyte Corp | derivados de benzo-oxazol como imunomoduladores |
| JP2018111751A (ja) * | 2017-01-10 | 2018-07-19 | 国立大学法人九州大学 | 発光材料、化合物および有機発光素子 |
| US11456426B2 (en) | 2017-02-07 | 2022-09-27 | Samsung Display Co., Ltd. | Organic molecules for use in organic optoelectronic devices |
| DE102017103542B3 (de) * | 2017-02-21 | 2018-03-29 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in optoelektronischen Vorrichtungen |
| KR20180098809A (ko) | 2017-02-27 | 2018-09-05 | 삼성전자주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| JP2020113557A (ja) * | 2017-03-28 | 2020-07-27 | 保土谷化学工業株式会社 | アザカルバゾール構造を有する化合物および有機エレクトロルミネッセンス素子 |
| CN106966955A (zh) * | 2017-04-21 | 2017-07-21 | 瑞声光电科技(常州)有限公司 | 联苯化合物及发光器件 |
| US10790455B2 (en) | 2017-05-18 | 2020-09-29 | Universal Display Corporation | Organic electroluminescent materials and devices |
| KR102072208B1 (ko) * | 2017-05-31 | 2020-01-31 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 조성물, 유기 광전자 소자 및 표시 장치 |
| DE102017112435B4 (de) * | 2017-06-06 | 2019-01-17 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in optoelektronischen Vorrichtungen |
| CN109111433A (zh) * | 2017-06-22 | 2019-01-01 | 北京鼎材科技有限公司 | 一种有机电致发光化合物及其用途和有机电致发光器件 |
| EP3421452A1 (en) * | 2017-06-27 | 2019-01-02 | Cynora Gmbh | Carbazole derivatives and their use in optoelectronic devices |
| DE102017114250B3 (de) * | 2017-06-27 | 2018-09-13 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in optoelektronischen Vorrichtungen |
| DE102017114372B3 (de) | 2017-06-28 | 2018-10-11 | Cynora Gmbh | Organische moleküle, insbesondere zur verwendung in optoelektronischen vorrichtungen |
| DE102017114345B4 (de) | 2017-06-28 | 2019-01-17 | Cynora Gmbh | Organische Moleküle, insbesondere zur Verwendung in organischen optoelektronischen Vorrichtungen |
| KR102577731B1 (ko) * | 2017-06-30 | 2023-09-14 | 솔루스첨단소재 주식회사 | 유기 화합물 및 이를 포함하는 유기 전계 발광 소자 |
| CN107417690B (zh) * | 2017-09-07 | 2019-01-29 | 南方科技大学 | 一种不对称催化合成吡咯吲哚啉的方法 |
| DE102017122471B3 (de) * | 2017-09-27 | 2019-01-24 | Cynora Gmbh | Organische moleküle, insbesondere zur verwendung in optoelektronischen vorrichtungen |
| CN109574909A (zh) * | 2017-09-29 | 2019-04-05 | 江苏三月光电科技有限公司 | 一种以酮类结构为核心的有机化合物及其在oled器件中的应用 |
| WO2019076965A1 (en) * | 2017-10-19 | 2019-04-25 | Cynora Gmbh | ORGANIC MOLECULES FOR USE IN OPTOELECTRONIC DEVICES |
| US11444250B2 (en) * | 2017-12-05 | 2022-09-13 | Kyulux, Inc. | Composition of matter for use in organic light-emitting diodes |
| CN108129381A (zh) * | 2017-12-14 | 2018-06-08 | 江苏第二师范学院 | 紫色延迟荧光材料及其制备方法、晶型和应用 |
| KR102148199B1 (ko) * | 2017-12-19 | 2020-08-26 | 재단법인대구경북과학기술원 | 전자수송용 유기반도체 소재 |
| KR102536247B1 (ko) * | 2017-12-22 | 2023-05-25 | 삼성디스플레이 주식회사 | 헤테로고리 화합물 및 이를 포함한 유기 발광 소자 |
| US11767324B2 (en) | 2018-01-04 | 2023-09-26 | Lg Chem, Ltd. | Compound and organic light-emitting device comprising same |
| CN108191853B (zh) * | 2018-01-10 | 2020-08-07 | 北京鼎材科技有限公司 | 一种有机电致发光材料与器件 |
| CN108178767B (zh) * | 2018-01-19 | 2020-09-22 | 华南理工大学 | 一种基于吡嗪受体单元的有机小分子发光材料及其制备方法和应用 |
| CN110066227A (zh) * | 2018-01-24 | 2019-07-30 | 北京鼎材科技有限公司 | 有机电致发光材料及发光器件 |
| KR102054489B1 (ko) * | 2018-03-06 | 2019-12-10 | 한남대학교 산학협력단 | 청색 인광 호스트 화합물 및 이의 제조방법 |
| KR20190118073A (ko) | 2018-04-09 | 2019-10-17 | 삼성전자주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| CN108658980A (zh) * | 2018-05-18 | 2018-10-16 | 长春海谱润斯科技有限公司 | 一种含有邻菲啰啉的芳胺类化合物及其有机电致发光器件 |
| WO2019218360A1 (zh) * | 2018-05-18 | 2019-11-21 | 深圳市柔宇科技有限公司 | 聚集诱导蓝光材料及其制备方法、显示装置 |
| KR102617841B1 (ko) * | 2018-05-29 | 2023-12-26 | 덕산네오룩스 주식회사 | 유기전기소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US11339143B2 (en) | 2018-06-26 | 2022-05-24 | Samsung Electronics Co., Ltd. | Condensed cyclic compound and organic light-emitting device including the same |
| CN109627233A (zh) * | 2018-07-27 | 2019-04-16 | 华南理工大学 | 一种基于咔唑衍生物取代的氮杂环分子的有机光电材料及其制备方法和应用 |
| CN108864068B (zh) * | 2018-07-27 | 2021-12-28 | 武汉天马微电子有限公司 | 一种化合物以及有机发光显示装置 |
| CN108912148A (zh) * | 2018-08-12 | 2018-11-30 | 瑞声科技(南京)有限公司 | 一种含有氮杂咔唑-咪唑单元的化合物及其应用 |
| CN108929322A (zh) * | 2018-08-12 | 2018-12-04 | 瑞声科技(南京)有限公司 | 一种含有氮杂咔唑单元的化合物及其应用 |
| EP3613744B1 (en) * | 2018-08-21 | 2024-03-20 | Samsung Display Co., Ltd. | Organic molecules for optoelectronic devices |
| US11485706B2 (en) * | 2018-09-11 | 2022-11-01 | Universal Display Corporation | Organic electroluminescent materials and devices |
| CN109096279B (zh) * | 2018-09-28 | 2020-11-03 | 武汉天马微电子有限公司 | 氮杂环化合物、显示面板以及显示装置 |
| CN109096252B (zh) * | 2018-09-29 | 2020-09-22 | 湘潭大学 | 基于2,10’-联吖啶衍生物的有机热活性延迟荧光材料及其应用 |
| CN109593079A (zh) * | 2018-11-15 | 2019-04-09 | 华南理工大学 | 含吡啶基团的通用型双极主体材料及其制备与在有机发光二极管中的应用 |
| CN109734608B (zh) * | 2018-11-29 | 2022-04-08 | 宇瑞(上海)化学有限公司 | 一种有机化合物及其使用该化合物的有机电致器件 |
| KR102329345B1 (ko) * | 2018-12-06 | 2021-11-19 | 한국생산기술연구원 | 벤조페논 작용기 함유 화합물, 상기 화합물의 광경화물을 포함한 유기물층을 구비한 유기전자소자 |
| CN109503481B (zh) * | 2018-12-17 | 2020-06-02 | 武汉华星光电半导体显示技术有限公司 | 热活化延迟荧光化合物及其制备方法与有机电致发光二极管器件 |
| CN111349040B (zh) * | 2018-12-21 | 2023-02-03 | 陕西师范大学 | 有机室温磷光和白光发光材料及其制备方法 |
| CN111377908A (zh) * | 2018-12-27 | 2020-07-07 | 北京鼎材科技有限公司 | 一种热活化延迟荧光化合物及其应用 |
| CN109942601B (zh) * | 2019-03-18 | 2021-09-21 | 深圳大学 | 一种荧光材料、制备方法及应用 |
| CN109913205B (zh) * | 2019-03-18 | 2021-12-07 | 深圳大学 | 一种荧光材料、制备方法及应用 |
| CN110003115B (zh) * | 2019-03-21 | 2022-09-20 | 北京大学深圳研究生院 | 一种蓝色有机发光材料、发光器件及制备方法 |
| CN111747933B (zh) * | 2019-03-29 | 2022-03-01 | 吉林省元合电子材料有限公司 | 一种取代的1,3,5-三嗪化合物、组合物及其应用 |
| CN111747937B (zh) * | 2019-03-29 | 2022-01-14 | 吉林省元合电子材料有限公司 | 一种1,3,5-三嗪类化合物、组合物及其应用 |
| KR20200118329A (ko) | 2019-04-05 | 2020-10-15 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 및 유기 전계 발광 소자용 화합물 |
| CN111808076A (zh) * | 2019-04-12 | 2020-10-23 | 冠能光电材料(深圳)有限责任公司 | 一种电子传输空穴阻挡有机材料及其在薄膜发光二极管应用 |
| CN110078754A (zh) * | 2019-05-27 | 2019-08-02 | 上海天马有机发光显示技术有限公司 | 化合物、显示面板以及显示装置 |
| CN110143960B (zh) * | 2019-05-30 | 2021-06-01 | 武汉华星光电半导体显示技术有限公司 | 绿光热活化延迟荧光材料及其制备方法、有机电致发光器件 |
| KR20210010711A (ko) * | 2019-07-17 | 2021-01-28 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 및 유기 전계 발광 소자용 다환 화합물 |
| CN110305121A (zh) * | 2019-07-25 | 2019-10-08 | 硕明(常州)光源科技有限公司 | 一种n-酰基咔唑类化合物及其制备方法和应用 |
| CN112430217B (zh) * | 2019-08-26 | 2024-03-19 | 北京鼎材科技有限公司 | 一种化合物及其应用 |
| CN110642842B (zh) * | 2019-09-30 | 2023-03-24 | 武汉天马微电子有限公司 | 化合物、显示面板以及显示装置 |
| CN110804047A (zh) * | 2019-11-06 | 2020-02-18 | 武汉华星光电半导体显示技术有限公司 | 热活化延迟荧光材料及其制备方法 |
| MX2022005651A (es) | 2019-11-11 | 2022-07-27 | Incyte Corp | Sales y formas cristalinas de un inhibidor de la proteina de muerte celular programada 1 (pd-1)/ligando de muerte celular programada 1 (pd-l1). |
| CN112851565B (zh) * | 2019-11-27 | 2023-02-10 | 杭州师范大学 | 一种室温磷光性能的有机发光材料及其制备方法和应用 |
| CN111171010A (zh) * | 2020-01-13 | 2020-05-19 | 北京大学深圳研究生院 | 一种阴极电刺激响应材料及其制备方法 |
| CN111484515B (zh) * | 2020-04-21 | 2023-04-14 | 濮阳惠成电子材料股份有限公司 | 一种均三嗪硼酸频那醇酯的合成方法 |
| CN111662286B (zh) * | 2020-05-19 | 2021-08-24 | 浙江虹舞科技有限公司 | 一种含有吡啶并三氮唑及衍生物受体结构单元的可见光延迟荧光材料及应用 |
| CN111620817B (zh) * | 2020-06-04 | 2022-09-27 | 常州大学 | 新型蓝色热活性延迟荧光材料及其应用 |
| CN111747938B (zh) * | 2020-07-03 | 2021-04-27 | 长春海谱润斯科技股份有限公司 | 一种芳胺化合物及其有机电致发光器件 |
| KR102517277B1 (ko) * | 2020-09-24 | 2023-04-04 | (주)랩토 | 시아노기가 치환된 아릴 또는 헤테로아릴 유도체 및 이를 포함한 유기전계발광소자 |
| CN112174959B (zh) * | 2020-11-04 | 2022-11-18 | 浙江虹舞科技有限公司 | 一类基于1,6-萘啶受体结构单元的有机发光材料及其应用 |
| AU2021373044A1 (en) | 2020-11-06 | 2023-06-08 | Incyte Corporation | Process for making a pd-1/pd-l1 inhibitor and salts and crystalline forms thereof |
| WO2022099018A1 (en) | 2020-11-06 | 2022-05-12 | Incyte Corporation | Process of preparing a pd-1/pd-l1 inhibitor |
| WO2022099075A1 (en) | 2020-11-06 | 2022-05-12 | Incyte Corporation | Crystalline form of a pd-1/pd-l1 inhibitor |
| CN113429388A (zh) * | 2021-06-28 | 2021-09-24 | 常州大学 | 基于三氟甲基吡啶衍生物受体的蓝色热活性延迟荧光材料及其应用 |
| CN113480410A (zh) * | 2021-07-07 | 2021-10-08 | 南京伊派森化学科技有限公司 | 一种2,4-二溴苯甲醇的合成方法 |
| CN113831343B (zh) * | 2021-07-23 | 2023-09-05 | 安徽秀朗新材料科技有限公司 | 一种基于咪唑并吡嗪受体材料的热活性延迟荧光材料、制备方法及其应用 |
| KR20230073104A (ko) * | 2021-11-12 | 2023-05-25 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| CN115160217B (zh) * | 2022-08-04 | 2023-09-22 | 山东达因海洋生物制药股份有限公司 | 一种吡仑帕奈的制备方法、合成中间体及降解杂质的制备方法 |
Citations (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02178670A (ja) * | 1988-12-29 | 1990-07-11 | Canon Inc | 電子写真感光体 |
| JPH02183259A (ja) * | 1989-01-10 | 1990-07-17 | Canon Inc | 電子写真感光体 |
| JP2009021335A (ja) * | 2007-07-11 | 2009-01-29 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| WO2009072587A1 (en) * | 2007-12-03 | 2009-06-11 | Semiconductor Energy Laboratory Co., Ltd. | Carbazole derivative, and light-emitting element, light-emitting device, and electronic device using carbazole derivative |
| WO2011013783A1 (ja) * | 2009-07-31 | 2011-02-03 | 富士フイルム株式会社 | 有機電界発光素子 |
| JP2011509247A (ja) * | 2007-12-28 | 2011-03-24 | ユニバーサル ディスプレイ コーポレイション | リン光発光ダイオード中の、カルバゾールを含む物質 |
| JP2011071474A (ja) * | 2009-07-31 | 2011-04-07 | Fujifilm Corp | 電荷輸送材料及び有機電界発光素子 |
| JP2012036164A (ja) * | 2010-06-17 | 2012-02-23 | ▲いく▼▲雷▼光電科技股▲分▼有限公司 | 有機エレクトロルミネッセンス装置に用いられる化合物及び有機エレクトロルミネッセンス装置 |
| US20120086329A1 (en) * | 2010-10-08 | 2012-04-12 | Universal Disolay Corporation | Novel 3, 9-Linked Oliogocarbazole-Based Hosts, Containing DBT and DBF Fragments, Separated by Aromatic Spacers |
| JP2013016717A (ja) * | 2011-07-06 | 2013-01-24 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP2013145791A (ja) * | 2012-01-13 | 2013-07-25 | ▲いく▼▲雷▼光電科技股▲分▼有限公司 | カルバゾール誘導体とそれを用いた有機エレクトロルミネセンス装置及びその製造方法 |
| US20130292659A1 (en) * | 2010-12-08 | 2013-11-07 | Hyung-Sun Kim | Compound for organic optoelectronic device, organic light emitting diode including the same, and display device including the organic light emitting diode |
| WO2013165192A1 (en) * | 2012-05-02 | 2013-11-07 | Rohm And Haas Electronic Materials Korea Ltd. | Novel organic electroluminescence compounds and organic electroluminescence device containing the same |
| US20140001449A1 (en) * | 2010-08-26 | 2014-01-02 | Solvay Sa | N-phenyl triscarbazole |
| WO2014014310A1 (en) * | 2012-07-20 | 2014-01-23 | Rohm And Haas Electronic Materials Korea Ltd. | A novel combination of a host compound and a dopant compound and an organic electroluminescence device comprising the same |
| WO2014133121A1 (ja) * | 2013-03-01 | 2014-09-04 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6830828B2 (en) * | 1998-09-14 | 2004-12-14 | The Trustees Of Princeton University | Organometallic complexes as phosphorescent emitters in organic LEDs |
| WO2003078541A1 (en) * | 2002-03-15 | 2003-09-25 | Idemitsu Kosan Co., Ltd. | Material for organic electroluminescent devices and organic electroluminescent devices made by using the same |
| JP4103491B2 (ja) * | 2002-08-07 | 2008-06-18 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子及び表示装置 |
| KR20130130757A (ko) * | 2010-11-24 | 2013-12-02 | 메르크 파텐트 게엠베하 | 유기 전계발광 소자용 재료 |
| EP2709183B1 (en) * | 2011-05-13 | 2019-02-06 | Joled Inc. | Organic electroluminescent multi-color light-emitting device |
| KR20140106631A (ko) * | 2011-12-02 | 2014-09-03 | 고쿠리쓰다이가쿠호진 규슈다이가쿠 | 유기 발광 소자 그리고 그것에 사용하는 지연 형광 재료 및 화합물 |
| US9209411B2 (en) * | 2012-12-07 | 2015-12-08 | Universal Display Corporation | Organic electroluminescent materials and devices |
-
2015
- 2015-05-13 JP JP2016567427A patent/JP2017518281A/ja active Pending
- 2015-05-13 CN CN201580038816.6A patent/CN106661001A/zh active Pending
- 2015-05-13 KR KR1020167034925A patent/KR20170005853A/ko unknown
- 2015-05-13 US US15/310,234 patent/US20170244049A1/en not_active Abandoned
- 2015-05-13 EP EP15727132.1A patent/EP3143100A1/en not_active Withdrawn
- 2015-05-13 WO PCT/US2015/030598 patent/WO2015175678A1/en active Application Filing
Patent Citations (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02178670A (ja) * | 1988-12-29 | 1990-07-11 | Canon Inc | 電子写真感光体 |
| JPH02183259A (ja) * | 1989-01-10 | 1990-07-17 | Canon Inc | 電子写真感光体 |
| JP2009021335A (ja) * | 2007-07-11 | 2009-01-29 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| WO2009072587A1 (en) * | 2007-12-03 | 2009-06-11 | Semiconductor Energy Laboratory Co., Ltd. | Carbazole derivative, and light-emitting element, light-emitting device, and electronic device using carbazole derivative |
| JP2011509247A (ja) * | 2007-12-28 | 2011-03-24 | ユニバーサル ディスプレイ コーポレイション | リン光発光ダイオード中の、カルバゾールを含む物質 |
| WO2011013783A1 (ja) * | 2009-07-31 | 2011-02-03 | 富士フイルム株式会社 | 有機電界発光素子 |
| JP2011071474A (ja) * | 2009-07-31 | 2011-04-07 | Fujifilm Corp | 電荷輸送材料及び有機電界発光素子 |
| JP2012036164A (ja) * | 2010-06-17 | 2012-02-23 | ▲いく▼▲雷▼光電科技股▲分▼有限公司 | 有機エレクトロルミネッセンス装置に用いられる化合物及び有機エレクトロルミネッセンス装置 |
| US20140001449A1 (en) * | 2010-08-26 | 2014-01-02 | Solvay Sa | N-phenyl triscarbazole |
| US20120086329A1 (en) * | 2010-10-08 | 2012-04-12 | Universal Disolay Corporation | Novel 3, 9-Linked Oliogocarbazole-Based Hosts, Containing DBT and DBF Fragments, Separated by Aromatic Spacers |
| US20130292659A1 (en) * | 2010-12-08 | 2013-11-07 | Hyung-Sun Kim | Compound for organic optoelectronic device, organic light emitting diode including the same, and display device including the organic light emitting diode |
| JP2013016717A (ja) * | 2011-07-06 | 2013-01-24 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子、表示装置及び照明装置 |
| JP2013145791A (ja) * | 2012-01-13 | 2013-07-25 | ▲いく▼▲雷▼光電科技股▲分▼有限公司 | カルバゾール誘導体とそれを用いた有機エレクトロルミネセンス装置及びその製造方法 |
| WO2013165192A1 (en) * | 2012-05-02 | 2013-11-07 | Rohm And Haas Electronic Materials Korea Ltd. | Novel organic electroluminescence compounds and organic electroluminescence device containing the same |
| WO2014014310A1 (en) * | 2012-07-20 | 2014-01-23 | Rohm And Haas Electronic Materials Korea Ltd. | A novel combination of a host compound and a dopant compound and an organic electroluminescence device comprising the same |
| WO2014133121A1 (ja) * | 2013-03-01 | 2014-09-04 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016082207A (ja) * | 2014-10-22 | 2016-05-16 | 三星ディスプレイ株式會社Samsung Display Co.,Ltd. | 有機エレクトロルミネッセンス素子用材料及びそれを用いた有機エレクトロルミネッセンス素子 |
| JP2017054972A (ja) * | 2015-09-10 | 2017-03-16 | コニカミノルタ株式会社 | 有機エレクトロルミネッセンス素子、表示装置、照明装置、π共役系化合物、及び発光性薄膜 |
| JP2018035129A (ja) * | 2015-10-27 | 2018-03-08 | 国立大学法人山形大学 | ピリミジン誘導体、それよりなる発光材料及びそれを用いた有機el素子 |
| JP2018113364A (ja) * | 2017-01-12 | 2018-07-19 | 日本放送協会 | 有機エレクトロルミネッセンス素子 |
| CN109942551A (zh) * | 2017-11-08 | 2019-06-28 | 辛诺拉有限公司 | 有机分子,特别是其在光电设备中的用途 |
| CN109942551B (zh) * | 2017-11-08 | 2022-12-30 | 三星显示有限公司 | 有机分子,特别是其在光电设备中的用途 |
| JP2021533580A (ja) * | 2018-08-03 | 2021-12-02 | ▲広▼▲東▼聚▲華▼印刷▲顯▼示技▲術▼有限公司 | 電子輸送材料及びその使用 |
| US11778906B2 (en) | 2018-08-03 | 2023-10-03 | Guangdong Juhua Printed Display Technology Co. Ltd | Electron transport material and application thereof |
| JP2021524867A (ja) * | 2018-09-27 | 2021-09-16 | 武漢尚賽光電科技有限公司Wuhan Sunshine Optoelectronics Tech Co Ltd | 1,2,4−チアジアゾール系化合物及びその製造方法と使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20170005853A (ko) | 2017-01-16 |
| CN106661001A8 (zh) | 2017-07-07 |
| WO2015175678A1 (en) | 2015-11-19 |
| US20170244049A1 (en) | 2017-08-24 |
| EP3143100A1 (en) | 2017-03-22 |
| CN106661001A (zh) | 2017-05-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2017518281A (ja) | 有機発光ダイオード材料 | |
| JP7192054B2 (ja) | 発光素子、発光装置、照明装置および電子機器 | |
| JP6927497B2 (ja) | 遅延蛍光有機電界発光素子 | |
| WO2017011531A2 (en) | Organic light-emitting diode materials | |
| TWI568047B (zh) | 發光元件 | |
| Xu et al. | Asymmetric tris-heteroleptic iridiumIII complexes containing a 9-phenyl-9-phosphafluorene oxide moiety with enhanced charge carrier injection/transporting properties for highly efficient solution-processed organic light-emitting diodes | |
| Lv et al. | Blue TADF emitters based on indenocarbazole derivatives with high photoluminescence and electroluminescence efficiencies | |
| Kisel et al. | Chromophore-functionalized phenanthro-diimine ligands and their Re (I) complexes | |
| Kim et al. | Aggregation-induced phosphorescence enhancement in deep-red and near-infrared emissive iridium (III) complexes for solution-processable OLEDs | |
| TW201523963A (zh) | 發光元件 | |
| WO2017176841A1 (en) | Compounds for organic light emitting diode materials | |
| Lee et al. | Simple molecular-engineering approach for enhancing orientation and outcoupling efficiency of thermally activated delayed fluorescent emitters without red-shifting emission | |
| KR20190096944A (ko) | 다환방향족 아미노 화합물 | |
| WO2017205425A1 (en) | Compounds for organic light emitting diode materials | |
| Chen et al. | Ratiometric tuning of luminescence: interplay between the locally excited and interligand charge-transfer states in pyrazolate-based boron compounds | |
| Feng et al. | Unsymmetric heteroleptic Ir (III) complexes with 2-phenylquinoline and coumarin-based ligand isomers for tuning character of triplet excited states and achieving high electroluminescent efficiencies | |
| Jhulki et al. | Nitrogen-free bifunctional bianthryl leads to stable white-light emission in bilayer and multilayer OLED devices | |
| TW202024303A (zh) | 有機電致發光化合物及包含此化合物之有機電致發光裝置 | |
| Li et al. | Ultrastable Copper Iodide Hybrid with Intrinsic Greenish White-Light Emission by Incorporating an Anionic Inorganic Functional Unit into an Extended Structure | |
| Li et al. | Electrospinning composite fibers doped with rhenium complex: Preparation, characterization and photophysical feature comparison | |
| WO2023199999A1 (ja) | 化合物、有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子及び電子機器 | |
| Rodella | Design and Properties of Novel Host Materials for Blue TADF OLEDs | |
| KR20230012400A (ko) | 유기 전계발광 물질 및 디바이스 | |
| CN117813935A (zh) | 组合物、有机电致发光元件用材料、有机电致发光元件和电子设备 | |
| JP2022060903A (ja) | 組成物、粉体、有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子の製造方法及び電子機器 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180509 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180509 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20181227 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190118 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190409 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190617 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190719 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200302 |