ES2860751T3 - Anticuerpos anti-GITR y procedimientos de uso de estos - Google Patents
Anticuerpos anti-GITR y procedimientos de uso de estos Download PDFInfo
- Publication number
- ES2860751T3 ES2860751T3 ES15729987T ES15729987T ES2860751T3 ES 2860751 T3 ES2860751 T3 ES 2860751T3 ES 15729987 T ES15729987 T ES 15729987T ES 15729987 T ES15729987 T ES 15729987T ES 2860751 T3 ES2860751 T3 ES 2860751T3
- Authority
- ES
- Spain
- Prior art keywords
- antibody
- gitr
- antigen
- human
- binding fragment
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/10—Cellular immunotherapy characterised by the cell type used
- A61K40/11—T-cells, e.g. tumour infiltrating lymphocytes [TIL] or regulatory T [Treg] cells; Lymphokine-activated killer [LAK] cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K40/00—Cellular immunotherapy
- A61K40/40—Cellular immunotherapy characterised by antigens that are targeted or presented by cells of the immune system
- A61K40/41—Vertebrate antigens
- A61K40/42—Cancer antigens
- A61K40/4202—Receptors, cell surface antigens or cell surface determinants
- A61K40/4214—Receptors for cytokines
- A61K40/4215—Receptors for tumor necrosis factors [TNF], e.g. lymphotoxin receptor [LTR], CD30
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/502—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K40/00
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K40/00 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K40/00
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K40/00 characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/20—Cytokines; Chemokines
- C12N2501/25—Tumour necrosing factors [TNF]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30 CD40 or CD95
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Virology (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- Communicable Diseases (AREA)
- Genetics & Genomics (AREA)
- Urology & Nephrology (AREA)
- Biotechnology (AREA)
- Hematology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Epidemiology (AREA)
- Cell Biology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Zoology (AREA)
- Microbiology (AREA)
- General Physics & Mathematics (AREA)
- Toxicology (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- Wood Science & Technology (AREA)
Abstract
Un anticuerpo agonista aislado que se une específicamente a la proteína relacionada con TNFR inducida por glucocorticoides humanos (GITR) que comprende una región variable de cadena pesada (VH) que comprende la secuencia de aminoácidos de la SEQ ID NO: 206 y que comprende una región variable de la cadena ligera (VL) que comprende la secuencia de aminoácidos de la SEQ ID NO: 208, en el que el anticuerpo comprende además una región constante de cadena pesada.
Description
DESCRIPCIÓN
Anticuerpos anti-GITR y procedimientos de uso de estos
1 Campo
La presente divulgación proporciona anticuerpos que se unen específicamente al receptor relacionado con la familia de TNFR inducido por glucocorticoides humanos (GITR) y composiciones que comprenden tales anticuerpos. En un aspecto específico, los anticuerpos se unen específicamente al GITR humano y modulan la actividad del GITR, por ejemplo, potencian, activan o inducen la actividad del GITR, mediante el uso de tales anticuerpos. La presente divulgación también proporciona procedimientos para tratar trastornos, tales como el cáncer y enfermedades infecciosas, mediante la administración de un anticuerpo que se une específicamente al GITR humano y modula la actividad del GITR, por ejemplo, potencia, activa, o induce la actividad del GITR.
2. Antecedentes
La proteína relacionada con TNFR inducida por glucocorticoides (GITR), un miembro de la superfamilia del TNFR, se expresa en muchos componentes del sistema inmunitario innato y adaptativo y estimula tanto la inmunidad adquirida como la innata (Nocentini G y otros, (1994) PNAS 94: 6216-6221; Hanabuchi S y otros, (2006) Blood 107:3617-3623; Nocentini G y Riccardi C (2005) Eur J Immunol 35: 1016-1022; Nocentini G y otros, (2007) Eur J Immunol 37:1165-1169). Esta se expresa en varias células y tejidos, que incluyen células T, B, dendríticas (DC) y asesinas naturales (NK) y se activa por su ligando, GITRL, que se expresa principalmente en células presentadoras de antígeno (APC), en células endoteliales, y también en células tumorales. El sistema GITR/GITRL participa en el desarrollo de respuestas autoinmunitarias/inflamatorias y potencia la respuesta a infección y tumores. Por ejemplo, el tratamiento de animales con la proteína de fusión GITR-Fc alivia las enfermedades autoinmunitarias/inflamatorias mientras que la activación de GITR es eficaz en el tratamiento de infecciones virales, bacterianas, y parasitarias, así como también en el reforzamiento de la respuesta inmunitaria contra tumores (Nocentini G y otros, (2012) Br J Pharmacol 165: 2089-99). Estos efectos se deben a varios mecanismos concurrentes que incluyen: coactivación de células T efectoras, inhibición de células T reguladoras (Treg), coactivación de células NK, activación de macrófagos, modulación de la función de células dendríticas, y regulación del procedimiento de extravasación. La expresión en membrana de GITR aumenta después de la activación de células T (Hanabuchi S y otros, (2006) más arriba; Nocentini G y Riccardi C más arriba). Esta activación coactiva los linfocitos T efectores (McHugh RS y otros, (2002) Immunity 16: 311-323; Shimizu J y otros, (2002) Nat Immunol 3: 135-142; Roncheti S y otros, (2004) Eur J Immunol 34: 613-622; Tone M y otros, (2003) PNa S 100: 15059-15064). La activación de GITR aumenta la resistencia a tumores e infecciones virales, está implicada en los procedimientos autoinmunitarios/inflamatorios y regula la extravasación de leucocitos (Nocentini G y Riccardi C (2005) más arriba; Cuzzocrea S y otros, (2004) J Leukoc Biol 76: 933-940; Shevach EM y Stephens GL (2006) Nat Rev Immunol 6: 613-618; Cuzzocrea S y otros, (2006) J Immunol 177: 631-641; Cuzzocrea S y otros, (2007) FASEB J 21: 117-129).
El GITR humano se expresa a muy bajos niveles en células T periféricas (no activadas). Después de la activación de células T, el GITR se regula fuertemente de forma positiva durante varios días tanto en células CD4+ como CD8+ (Kwon B y otros, (1999) J Biol Chem 274: 6056-6061; Gurney AL y otros, (1999) Curr Biol 9: 215-218; Ronchetti S y otros, (2004) más arriba; Shimizu J y otros, (2002) más arriba; Ji Hb y otros, (2004) más arriba; Ronchetti S y otros, (2002) Blood 100: 350-352; Li Z y otros, (2003) J Autoimmun 21: 83-92), donde las células CD4+ tienen una expresión de GITR mayor que las células CD8+ (Kober J y otros, (2008) Eur J Immunol 38(10): 2678-88; Bianchini R y otros, (2011) Eur J Immunol 41(8): 2269-78). El documento WO 2013/039954 divulga anticuerpos anti-GITR. El documento w O 2006/105021 divulga el anticuerpo 6C8 que se une a GITR.
Dado el papel del GITR humano en la modulación de las respuestas inmunitarias, en la presente memoria se proporcionan anticuerpos que se unen específicamente a GITR y el uso de estos anticuerpos para modular la actividad de GITR.
3 Sumario
En un aspecto, se proporcionan en la presente memoria anticuerpos y fragmentos de estos que se unen específicamente a GITR (por ejemplo, GITR humano). En un aspecto, un anticuerpo o fragmento de unión a antígeno de este que se une específicamente a GITR (por ejemplo, GITR humano) inhibe parcialmente la unión del ligando de GITR (por ejemplo, GITRL humano) a GITR según se evalúa mediante un procedimiento conocido por un experto en la técnica o descrito en la presente memoria (ver, por ejemplo, las Secciones 6.2.5.2 y 6.2.5.4, más abajo). En un aspecto específico, el anticuerpo o fragmento de unión a antígeno de este a una concentración de 1.000 ng/ml inhibe menos del 80 % de GITRL 0,5 nM (por ejemplo, GITRL humano) de la unión a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla con relación a la unión de GITRL 0,5 nM a las perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este inhibe del 40 % al 70 %, del 50 % al 70 %, del 50 % al 80 % o del 40 % al 80 % de la unión del GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR
humano). En otro aspecto específico, al menos el 20 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este en un ensayo: (a) acoplar GITR (por ejemplo, GITR humano) a perlas a una concentración de 5 pg/ml/perla; (b) incubar las perlas acopladas a GITR (por ejemplo, GITR humano) a una concentración de 40 perlas/pl con o sin el anticuerpo en un pocillo; (c) añadir GITRL etiquetado (por ejemplo, GITRL humano etiquetado) al pocillo para obtener una concentración final de 0,5 nM del GITRL (por ejemplo, GITRL humano) y 20 perlas/pl de las perlas acopladas a GITR; y (d) detectar el GITRL etiquetado (por ejemplo, GITRL humano) unido a las perlas acopladas a GITR (por ejemplo, GITR humano) mediante, por ejemplo, un ensayo de matriz de suspensión. En algunos aspectos, del 20 % al 60 %, del 20 % al 50 %, del 30 % al 60 % o del 30 % al 50 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este.
En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende:
(a) una región determinante de complementariedad (CDR) 1 de la región variable de la cadena pesada (VH) que comprende, que consiste en o consiste esencialmente en la secuencia de aminoácidos de X1YX2MX3 (SEQ ID NO: 1), en la que
Xi es D, E, G o A;
X2 es A, V, L, I, P, F, M o Y; y
X3 es Y, G, N, Q, S, T, C, W, F o H;
(b) una CDR2 de VH que comprende, que consiste en o consiste esencialmente en la secuencia de aminoácidos de X1IX2X3X4SGX5X6X7YX8QKFX9X10 (SEQ ID NO: 2), en la que
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que
X1 es F, A, V, L, I, P, M, Y, W, H o S;
X2 es A o D; y
X3 es Y, G, N, Q, S, T, C, W, F, H o V;
(d) una CDR1 de región variable de la cadena ligera (VL) que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de KSSQSX1X2X3X4X5X6X7KX8YLX9 (SEQ ID NO: 4), en la que:
X1 es L, A, V, I, P, F o M;
X2 es L, A, V, I, P, F, M o S;
X3 es N, G, Q, S, T, C, W, Y o A;
X4 es S, G, N, Q, T, C, W, Y o A;
X5 es G, N, Q, S, T, C, W, Y o A;
Xa es N, G, Q, S, T, C, W, Y o A;
X7 es Q, G, N, S, T, C, W, Y o A;
X8 es N, G, Q, S, T, C, W, Y o A; y
X9 es T, G, N, Q, S, C, W, Y, V, I o A;
(e) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de X1ASTRX2X3 (SEQ ID NO: 5), en la que:
X1 es W, G, N, Q, S, T, C, Y, F, H o A;
X2 es E, D o A; y
X3 es S, G, N, Q, T, C, W, Y o A; y
(f) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de QX1X2YX3X4PYT (SEQ ID NO: 6), en la que:
X1 es N, G, Q, S, T, C, W o Y;
X2 es D, E o Y; y
X3 es S, G, N, Q, T, C, W, Y o A, y
X4 es Y, G, N, Q, S, T, C, W, F, H, L o A.
En otros aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende:
(a) una CDR1 de región variable de la cadena pesada (VH) que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de X1YX2MX3 (SEQ ID NO: 7), en la que
X1 es D, E o G;
X2 es A o V; y
X3 es Y o H;
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de X1IX2TX3SGX4X5X6YNQKFX7X8 (SEQ ID NO: 8), en la que
X1 es V o L;
X2 es R, K o Q;
X3 es Y o F;
X4 es D, E o G;
X5 es V o L;
X6 es T o S;
X7 es K, R o Q; y
X8 es D, E o G;
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de SGTVRGFAY (SEQ ID NO: 9);
(d) una CDR1 de región variable de la cadena ligera (VL) que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de KSSQSLLNSX1NQKNYLX2 (SEQ ID NO: 10), en la que X1 es G o S; y
X2 es T o S;
(e) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de WASTRES (SEQ ID NO: 11); y
(f) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de QNX1YSX2PYT (SEQ ID NO: 12), en la que
X1 es D o E; y
X2 es Y, F o S.
En algunos aspectos, se proporciona en la presente memoria un anticuerpo o fragmento de unión a antígeno de este que se une específicamente a GITR (por ejemplo, GITR humano), que comprende:
(a) una región determinante de complementariedad (CDR) 1 de la región variable de la cadena pesada (VH) que comprende, que consiste en o consiste esencialmente en la secuencia de aminoácidos de X1YX2MX3 (SEQ ID NO: 1), en la que
X1 es D, E, G o A;
X2 es A, V, L, I, P, F, M o Y; y
X3 es Y, G, N, Q, S, T, C, W, F o H;
(b) una CDR2 de VH que comprende, que consiste en o consiste esencialmente en la secuencia de aminoácidos de X1IX2X3X4SGX5X6X7YX8QKFX9X10 (SEQ ID NO: 2), en la que
X1 es V, A, L, I, P, F, M o T;
X2 es R, K, H, Q o A;
X3 es T, G, N, Q, S, C, W, Y, V, I o P;
X4 es Y, G, N, Q, S, T, C, W, F, H o A;
X5 es D, E, G o A;
Xa es V, A, L, I, P, F, M o T;
X7 es T, G, N, Q, S, C, W, Y, V, I, P o A;
X8 es N, G, Q, S, T, C, W, Y o A;
X9 es K, R, H, Q o A; y
X10 es D, E, G o A;
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que
X1 es F, A, V, L, I, P, M, Y, W, H o S;
X2 es A o D; y
X3 es Y, G, N, Q, S, T, C, W, F, H o V;
(d) una CDR1 de región variable de la cadena ligera (VL) que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de KSSQSX1X2X3X4X5X6X7KX8YLX9 (SEQ ID NO: 4), en la que:
X1 es L, A, V, I, P, F o M;
X2 es L, A, V, I, P, F, M o S;
X3 es N, G, Q, S, T, C, W, Y o A;
X4 es S, G, N, Q, T, C, W, Y o A;
X5 es G, N, Q, S, T, C, W, Y o A;
Xa es N, G, Q, S, T, C, W, Y o A;
X7 es Q, G, N, S, T, C, W, Y o A;
X8 es N, G, Q, S, T, C, W, Y o A; y
X9 es T, G, N, Q, S, C, W, Y, V, I o A;
(e) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de X1ASTRX2X3 (SEQ ID NO: 5), en la que:
X1 es W, G, N, Q, S, T, C, Y, F, H o A;
X2 es E, D o A; y
X3 es S, G, N, Q, T, C, W, Y o A; y
(f) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de QX1X2YX3X4PYT (SEQ ID NO: 6), en la que:
Xi es N, G, Q, S, T, C, W o Y;
X2 es D, E o Y; y
X3 es S, G, N, Q, T, C, W, Y o A, y
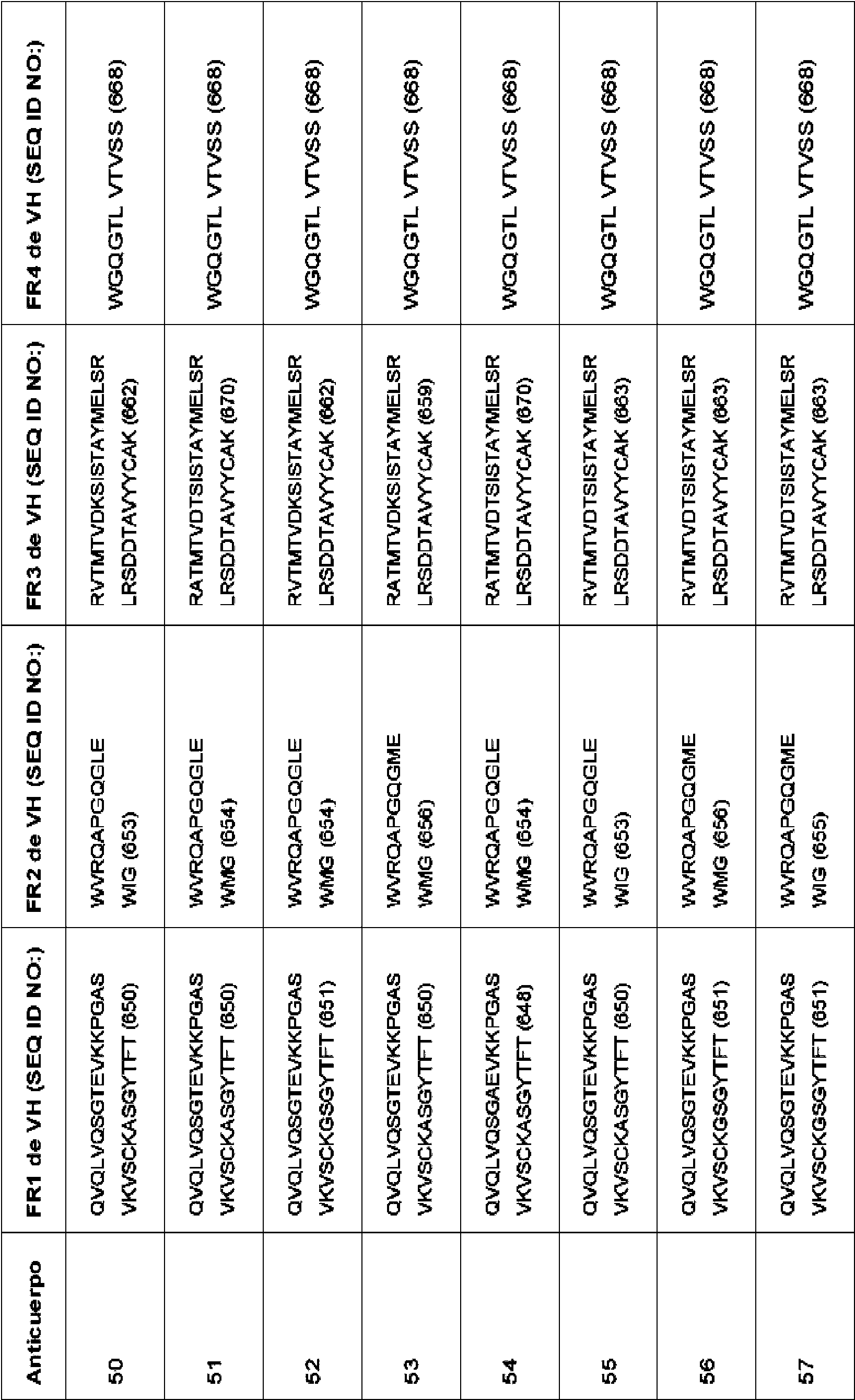
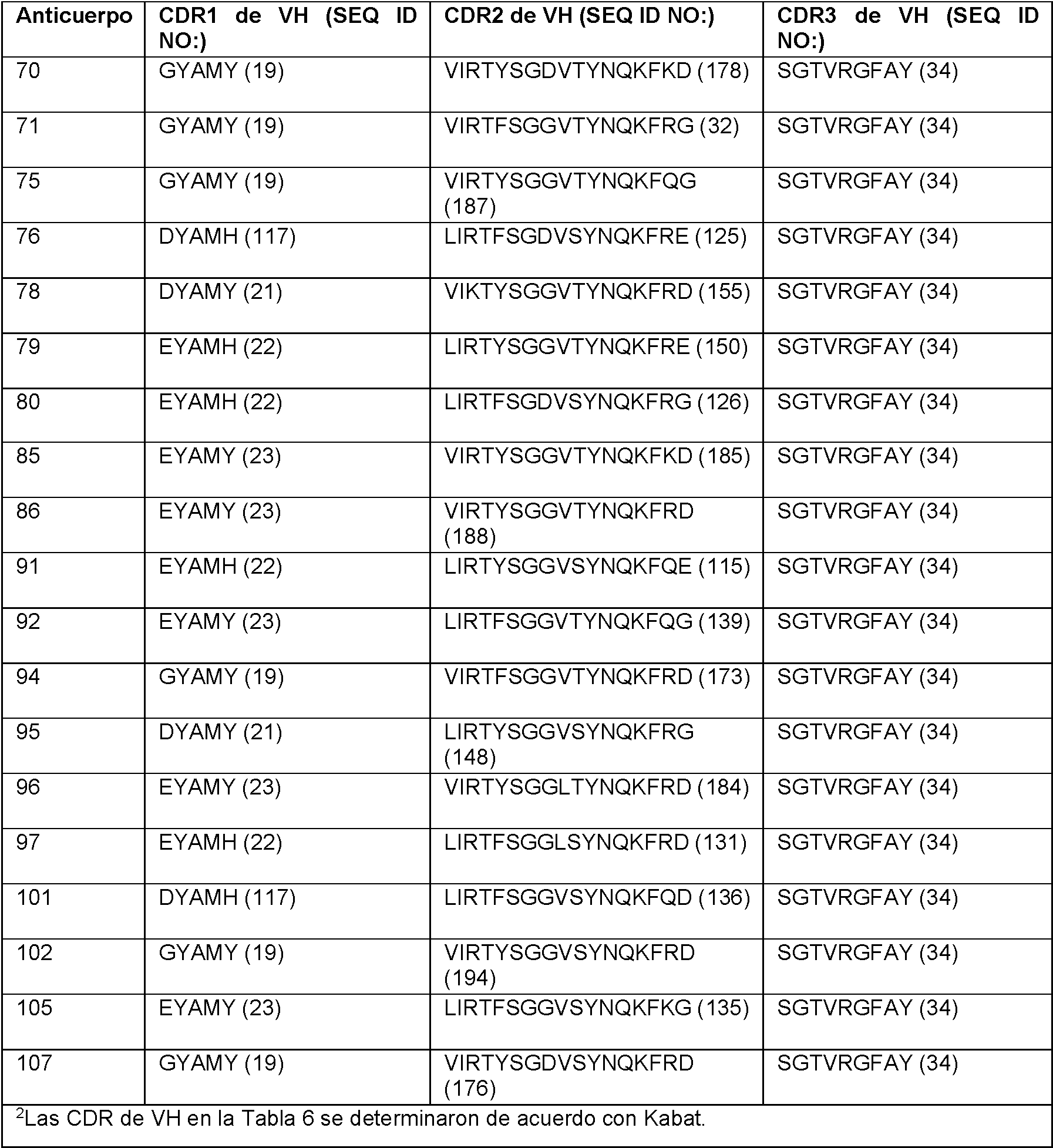
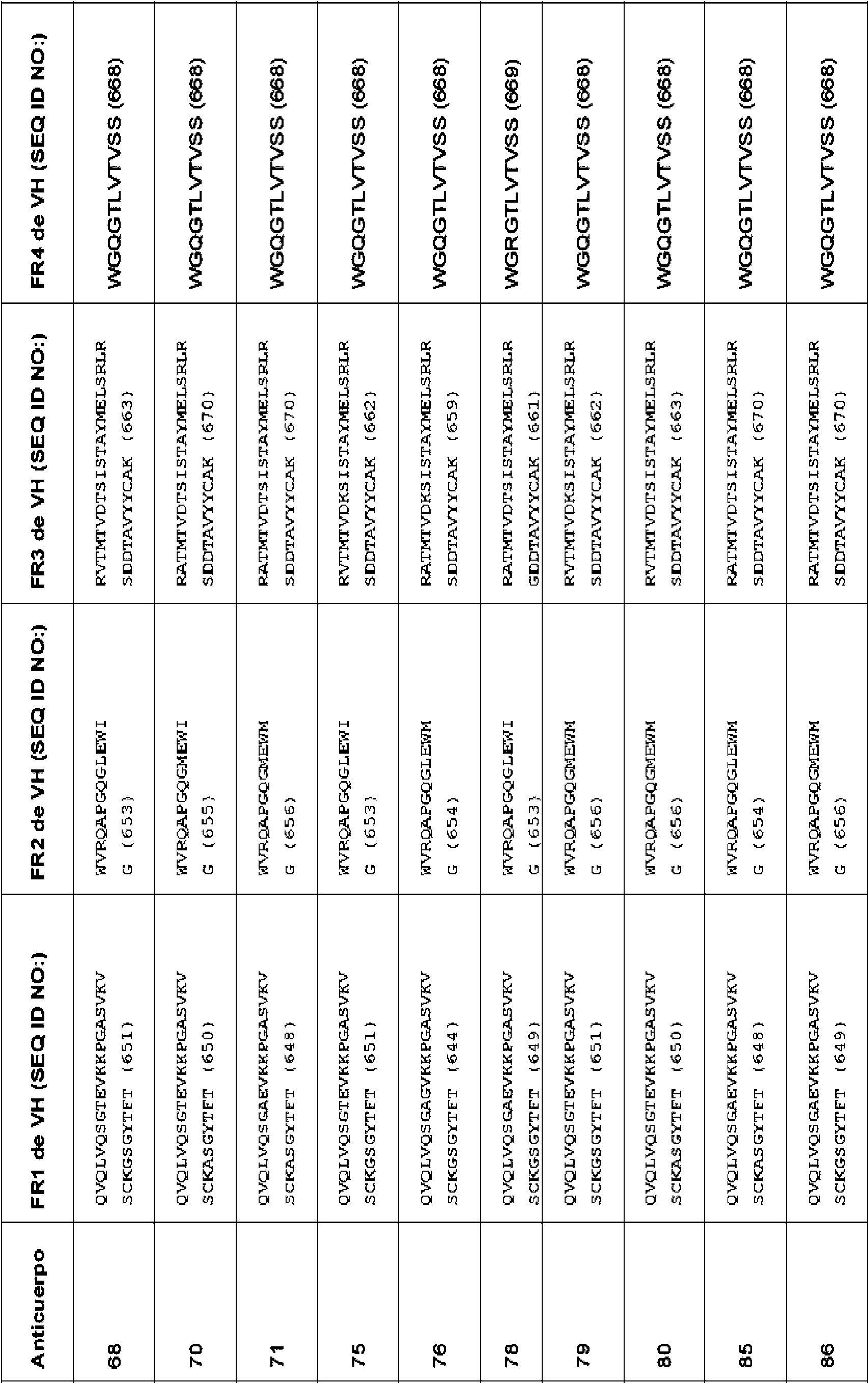
X4 es Y, G, N, Q, S, T, C, W, F, H, L o A. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR1 de VH que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 13, 19-23 y 117-119. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR1 de VH que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 35 y SEQ ID NO:116. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR2 de VH que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 14, 24 33 y 120-188. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR2 de VH que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 114, 115 y 194. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 15, 34 y 189. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR1 de VL que comprende, que consiste en, o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 16 y 101-104. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR2 de VL que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 17 y 105. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR3 de VL que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 18, 106-109, 192 y 193. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende la secuencia de aminoácidos de la CDR1 de VH, CDR2 de VH y CDR3 de VH de un anticuerpo en la Tabla 2. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las secuencias de aminoácidos de la CDR1 de VH, CDR2 de VH y CDR3 de VH de un anticuerpo en la Tabla 6. En otro aspecto específico, el anticuerpo o fragmento de unión a antígeno de este comprende la secuencia de aminoácidos de la CDR1 de VL, CDR2 de VL y CDR3 de VL de un anticuerpo en la Tabla 1. En otro aspecto específico, el anticuerpo o fragmento de unión a antígeno de este comprende las secuencias de aminoácidos de la CDR1 de VL, CDR2 de VL y CDR3
de VL de un anticuerpo en la Tabla 5. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este inhibe parcialmente la unión del GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) según se evalúa mediante un procedimiento conocido por un experto en la técnica o descrito en la presente memoria (ver, por ejemplo, las Secciones 6.2.5.2 y 6.2.5.4, más abajo). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este a una concentración de 1.000 ng/ml inhibe menos del 80 % de la unión del GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla con relación a la unión de GITRL 0,5 nM a las perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este inhibe del 40 % al 70 %, del 50 % al 70 %, del 50 % al 80 % o del 40 % al 80 % de la unión del GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano). En aspectos específicos, al menos el 20 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este en un ensayo que comprende las siguientes etapas: (a) acoplar GITR (por ejemplo, GITR humano) a perlas a una concentración de 5 pg/ml/perla; (b) incubar las perlas acopladas a GITR (por ejemplo, GITR humano) a una concentración de 40 perlas/pl con o sin el anticuerpo en un pocillo; (c) añadir GITRL etiquetado (por ejemplo, GITRL humano etiquetado) al pocillo para obtener una concentración final de 0,5 nM del GITRL (por ejemplo, GITRL humano) 20 perlas/pl de las perlas acopladas a GITR; y (d) detectar el GITRL etiquetado (por ejemplo, GITRL humano) unido a las perlas acopladas a GITR (por ejemplo, GITR humano) mediante, por ejemplo, un ensayo de matriz de suspensión. En algunos aspectos, del 20 % al 60 %, del 20 % al 50 %, del 30 % al 60 % o del 30 % al 50 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITr (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este.
En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de unión a antígeno de este que se une específicamente a GITR (por ejemplo, GITR humano), que comprende:
(a) una CDR1 de región variable de la cadena pesada (VH) que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de X1YX2MX3 (SEQ ID NO: 7), en la que
X1 es D, E o G;
X2 es A o V; y
X3 es Y o H;
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de X1 IX2TX3SGX4X5X6YNQKFX7X8 (SEQ ID NO: 8), en la que
X1 es V
X2 es R, K o Q;
X3 es Y
X4es D, G;
es V o L;
X6 es T o S;
X7 es K, R o Q; y
es D, E o G;
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de SGTVRGFAY (SEQ ID NO: 9);
(d) una CDR1 de región variable de la cadena ligera (VL) que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de KSSQSLLNSX1NQKNYLX2 (SEQ ID NO: 10), en la que X1 es G o S; y
X2 es T o S;
(e) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de WASTRES (SEQ ID NO: 11); y
(f) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos de QNX1YSX2PYT (SEQ ID NO: 12), en la que
X1 es D o E; y
X2 es Y, F o S.
En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo
que consiste en SEQ ID NO: 13, 19-23 y 117-119. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en 35 y 116. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR2 de VH que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 14, 24-33 y 120-188. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR2 de VH que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 114, 115 y 194. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 15, 34 y 189. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR1 de VL que comprende, que consiste en, o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 16 y 101-104. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR2 de VL que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 17 y 105.
En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una CDR3 de VL que comprende, que consiste en o consiste esencialmente en una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 18, 106-109, 192 y 193. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende la secuencia de aminoácidos de la CDR1 de VH, CDR2 de VH y CDR3 de VH de un anticuerpo en la Tabla 2. En otro aspecto específico, el anticuerpo o fragmento de unión a antígeno de este comprende la secuencia de aminoácidos de la CDR1 de VL, CDR2 de VL y CDR3 de VL de un anticuerpo en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este no impide la unión del GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) según se evalúa mediante un procedimiento conocido por un experto en la técnica o descrito en la presente memoria (ver, por ejemplo, las Secciones 6.2.5.2 y 6.2.5.4, más abajo). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este a una concentración de 1.000 ng/ml inhibe menos del 80 % de la unión del GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla con relación a la unión de GITRL 0,5 nM a las perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este inhibe del 40 % al 70 %, del 50 % al 70 %, del 50 % al 80 % o del 40 % al 80 % de la unión del GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano). En aspectos específicos, al menos el 20 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este en un ensayo que comprende las siguientes etapas: (a) acoplar GITR (por ejemplo, GITR humano) a perlas a una concentración de 5 pg/ml/perla; (b) incubar las perlas acopladas a GITR (por ejemplo, GITR humano) a una concentración de 40 perlas/pl con o sin el anticuerpo en un pocillo; (c) añadir GITRL etiquetado (por ejemplo, GITRL humano etiquetado) al pocillo para obtener una concentración final de 0,5 nM del GITRL (por ejemplo, GITRL humano) y 20 perlas/pl de las perlas acopladas a GITR; y (d) detectar el GITRL etiquetado (por ejemplo, GITRL humano) unido a las perlas acopladas a GITR (por ejemplo, GITR humano) mediante, por ejemplo, un ensayo de matriz de suspensión. En algunos aspectos, del 20 % al 60 %, del 20 % al 50 %, del 30 % al 60 % o del 30 % al 50 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este.
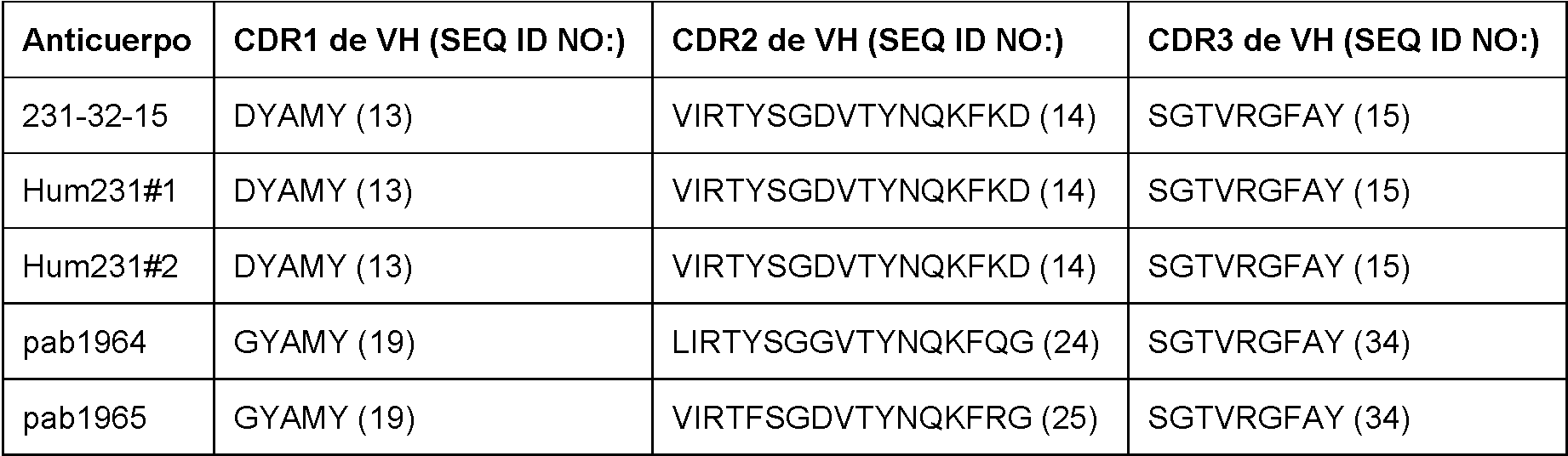
En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente al GITR humano, que comprende: (a) una CDR1 de la región variable de la cadena pesada (VH) que comprende la secuencia de aminoácidos de DYAMY (SEQ ID NO: 13); (b) una CDR2 de VH que comprende la secuencia de aminoácidos de VIRTYSGDVTYNQKFKD (SeQ ID NO: 14); (c) una CDR3 de VH que comprende la secuencia de aminoácidos de SGTVRGFAY (SEQ ID NO: 15); (d) una CDR1 de región variable de la cadena ligera (VL) que comprende la secuencia de aminoácidos de KSSQSlLnSGNQKNYLT (SEQ ID NO: 16); (e) una CDR2 de Vl que comprende la secuencia de aminoácidos de WASTRES (SEQ ID NO: 17); y (f) una CDR3 de VL que comprende la secuencia de aminoácidos de QNDYSYPYT (SEQ ID NO: 18). En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR humano, que comprende la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de un anticuerpo 22 en la Tabla 1 y la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este inhibe parcialmente la unión del GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) según se evalúa mediante un procedimiento conocido por un experto en la técnica o descrito en la presente memoria (ver, por ejemplo, las Secciones 6.2.5.2 y 6.2.5.4, más abajo). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este a una concentración de 1.000 ng/ml inhibe menos del 80 % de GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla con relación a la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a las perlas acopladas a GITR (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este inhibe del 50 % al 70 % de la unión del GITRL humano a GITR humano. En
aspectos específicos, al menos el 20 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este en un ensayo que comprende las siguientes etapas: (a) acoplar GITR (por ejemplo, GITR humano) a perlas a una concentración de 5 pg/ml/perla; (b) incubar las perlas acopladas a GITR (por ejemplo, GITR humano) a una concentración de 40 perlas/pl con o sin el anticuerpo en un pocillo; (c) añadir GITRL etiquetado (por ejemplo, GITRL humano etiquetado) al pocillo para obtener una concentración final de 0,5 nM del GITRL (por ejemplo, GITRL humano) y 20 perlas/pl de las perlas acopladas a GITR; y (d) detectar el GITRL etiquetado (por ejemplo, GITRL humano) unido a las perlas acopladas a GITR (por ejemplo, GITR humano) mediante, por ejemplo, un ensayo de matriz de suspensión. En algunos aspectos, del 20 % al 60 %, del 20 % al 50 %, del 30 % al 60 % o del 30 % al 50 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este. En algunos aspectos, del 30 % al 50 % de la cantidad de GITRL humano que se une a GITR humano en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR humano en presencia del anticuerpo o fragmento de unión a antígeno de este. El anticuerpo de la invención o fragmento de unión a antígeno de este es agonista.
En ciertos aspectos, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una secuencia de región variable de la cadena pesada que comprende una, dos, tres o cuatro de las regiones marco de la secuencia de región variable de la cadena pesada de SEQ ID NO: 203. En algunos aspectos, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco de una secuencia de región variable de la cadena pesada que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de una secuencia de región variable de la cadena pesada seleccionada del grupo que consiste en SEQ ID NO: 201, SEQ ID NO: 206, y las sec. con núms. de ident.: 215 a 389. En otro aspecto, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena pesada que tiene regiones marco derivadas de humanos. En otro aspecto, un anticuerpo o fragmento de unión a antígeno de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región marco variable de la cadena pesada que es o se deriva de una secuencia de aminoácidos codificada por un gen humano, en la que la secuencia de aminoácidos se selecciona del grupo que consiste en IGHV1-2*02 (SEQ ID NO: 601), IGHV1-3*01 (SEQ ID NO: 602), IGHV1-46*01 (SEQ ID NO: 603), IGHV1-18*01 (SEQ ID NO: 604), IGHV1-69*01 (SEQ ID NO: 605) e IGHV7-4-1*02 (SEQ ID NO: 606). En aspectos específicos, la región marco variable de la cadena pesada que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos con hasta 10 sustituciones, deleciones y/o inserciones de aminoácidos, preferentemente, hasta 10 sustituciones de aminoácidos. En un aspecto particular, la región marco variable de la cadena pesada que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos con 1, 2, 3, 4, 5, 6, 7, 8, 9 o 10 residuos de aminoácidos sustituidos para un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena pesada no humana correspondiente. En un aspecto específico, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITr humano), comprende una región marco variable de la cadena pesada que se deriva de la secuencia de aminoácidos SEQ ID NO: 601, en la que al menos uno, dos, tres, cuatro o cinco (en ciertos aspectos, hasta 10) aminoácidos de la secuencia de aminoácidos de SEQ ID NO: 601 está sustituido con un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena pesada no humana correspondiente. En ciertos aspectos, la sustitución de aminoácidos está en una posición de aminoácido seleccionada del grupo que consiste en 24, 48, 67, 71, 73 y 94, en la que la posición de aminoácido de cada miembro del grupo se indica de acuerdo con la numeración de Kabat. En aspectos específicos, la sustitución de aminoácidos se selecciona del grupo que consiste en 24G, 481, 67A, 71V, 73K y 94K, en la que la posición de aminoácido de cada miembro del grupo se indica de acuerdo con la numeración de Kabat
En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206 y sec. con núms. de ident.: 215 a 389. En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 203. En otro aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 206. La presente invención se refiere a un anticuerpo agonista aislado que se une específicamente a la proteína relacionada con TNFR inducida por glucocorticoides (GITR) humana que comprende una región variable de la cadena pesada (VH) que comprende la secuencia de aminoácidos de s Eq ID NO: 206 y que comprende una región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 208, en la que el anticuerpo comprende además una región constante de la cadena pesada.
En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en las sec. con núms. de ident.: 553, 554 y 567 a 570. En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITr (por ejemplo, GITR humano) que comprende una secuencia de cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en las sec. con núms. de ident.: 581 y 582.
En otro aspecto, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una secuencia de región variable de la cadena ligera que comprende una, dos, tres o cuatro regiones marco de la secuencia de región variable de la cadena ligera de SEQ ID NO: 204 o SEQ ID NO: 205. En otro aspecto, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco de una secuencia de región variable de la cadena ligera que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de una secuencia de región variable de la cadena ligera seleccionada del grupo que consiste en SEQ ID NO: 202, SEQ ID NO: 207, SEQ ID NO: 208, y sec. con núms. de ident.: 400-518. En otro aspecto, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco de una secuencia de región variable de la cadena ligera que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de la secuencia de la región variable de la cadena ligera de SEQ ID NO: 519. En otro aspecto, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una secuencia variable de la cadena ligera que tiene regiones marco derivadas de seres humanos. En otro aspecto, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITr (por ejemplo, GITR humano), comprende una región marco variable de la cadena ligera que es o deriva de una secuencia de aminoácidos codificada por un gen humano, en la que la secuencia de aminoácidos se selecciona del grupo que consiste en IGKV4-1*01 (SEQ ID NO: 607) e IGKV3-7*02 (SEQ ID NO: 608). En aspectos específicos, la región marco variable de la cadena ligera que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos, pero con la presencia de hasta 10 sustituciones, deleciones y/o inserciones de aminoácidos, preferentemente, hasta 10 sustituciones de aminoácidos. En un aspecto particular, la región marco variable de la cadena ligera que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos con 1, 2, 3, 4, 5, 6, 7, 8, 9 o 10 residuos de aminoácidos sustituidos por un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena ligera no humana correspondiente. En otro aspecto, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región marco variable de la cadena ligera que es o se deriva de la secuencia de aminoácidos de SEQ ID NO: 607 o SEQ ID NO: 608, en la que al menos uno, dos, tres, cuatro o cinco (en ciertos aspectos hasta 10) aminoácidos de la secuencia de aminoácidos de SEQ ID NO: 607 o SEQ ID NO: 608 está sustituido con un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena ligera no humana correspondiente. En ciertos aspectos, la sustitución del aminoácido está en la posición 87 del aminoácido, en la que la posición del aminoácido se indica de acuerdo con la numeración de Kabat. En aspectos específicos, la sustitución del aminoácido es una sustitución de aminoácidos de 87H, en la que la posición de los aminoácidos se indica de acuerdo con la numeración de Kabat.
En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena ligera que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 202, SEQ ID NO: 207, SEQ ID NO: 208 y sec. con núms. de ident.: 400 a 518. En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 519. En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 204 o SEQ ID NO: 205. En otro aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 207. En otro aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una secuencia de región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 208. La presente invención se refiere a un anticuerpo agonista aislado que se une específicamente a la proteína relacionada con TNFR inducida por glucocorticoides (GITR) humana que comprende una región variable de la cadena pesada (VH) que comprende la secuencia de aminoácidos de SEQ ID NO: 206 y que comprende una región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 208, en la que el anticuerpo comprende además una región constante de la cadena pesada.
En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITr (por ejemplo, GITR humano) que comprende una secuencia de cadena ligera que
comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 555, 556 y 571 a 576.
En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena pesada y una región variable de la cadena ligera que comprende las secuencias de aminoácidos de un anticuerpo en la tabla de la Figura 23 o cualquiera de las Figuras 24A-24C. En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena pesada y una región variable de la cadena ligera que comprende las secuencias de aminoácidos de un anticuerpo en la Tabla 17. En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende (a) una región variable de la cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 206; y (b) una región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 207. El anticuerpo que se une específicamente a GITR (por ejemplo, GITR humano) de la invención comprende (a) una región variable de la cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 206; y (b) una región variable de la cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 208.
En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena pesada (VH) que comprende una CDR1 de VH, una CDR2 de VH, una CDR3 de VH y regiones marco derivadas de una inmunoglobulina humana, en la que la CDR1 de VH comprende, consiste en, o consiste esencialmente en la secuencia de aminoácidos de DYAMY (SEQ ID NO: 13), la CDR2 de VH comprende, consiste en, o consiste esencialmente en la secuencia de aminoácidos de VIRt Ys GDVTYNQKFKD (SeQ ID NO: 14) y la CDR3 de VH comprende, consiste en, o consiste esencialmente en la secuencia de aminoácidos de SGTVRGFAY (SEQ ID NO: 15). En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena ligera (VL) que comprende una CDR1 de VL, una CDR2 de VL, una CDR3 de VL y regiones marco derivadas de una inmunoglobulina humana, en la que la CDR1 de VL comprende, consiste en, o consiste esencialmente en la secuencia de aminoácidos de KSSQSLLNSGNQKNYLT (SeQ ID NO: 16), la CDR2 de VL comprende, consiste en, o consiste esencialmente en la secuencia de aminoácidos de WASTRES (SEQ ID NO: 17) y la CDR3 de VL comprende, consiste en o consiste esencialmente en la secuencia de aminoácidos de QNDYSYPYT (SEQ ID NO: 18). En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena pesada (VH) que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 203, 206 y 215-389. En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena ligera (VL) que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 202, 204, 205, 207, 208 y 400-518. En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena ligera (VL) que comprende la secuencia de aminoácidos de SEQ ID NO: 519. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este inhibe parcialmente la unión del GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) según se evalúa mediante un procedimiento conocido por un experto en la técnica o descrito en la presente memoria (ver, por ejemplo, las Secciones 6.2.5.2 y 6.2.5.4, más abajo). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este a una concentración de 1.000 ng/ml inhibe menos del 80 % de la unión del GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla con relación a la unión de GITRL 0,5 nM a las perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En aspectos específicos, al menos el 20 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este en un ensayo que comprende las siguientes etapas: (a) acoplar GITR (por ejemplo, GITR humano) a perlas a una concentración de 5 pg/ml/perla; (b) incubar las perlas acopladas a GITR (por ejemplo, GITR humano) a una concentración de 40 perlas/pl con o sin el anticuerpo en un pocillo; (c) añadir GITRL etiquetado (por ejemplo, GITRL humano etiquetado) al pocillo para obtener una concentración final de 0,5 nM de GITRL (por ejemplo, GITRL humano) y 20 perlas/pl de perlas acopladas a GITR; y (d) detectar el GITRL etiquetado (por ejemplo, GITRL humano) unido a las perlas acopladas a GITR (por ejemplo, GITR humano) mediante, por ejemplo, un ensayo de matriz de suspensión. En algunos aspectos, del 20 % al 60 %, del 20 % al 50 %, del 30 % al 60 % o del 30 % al 50 % de la cantidad de GITRL (por ejemplo, GITRL humano) que se une a GITR (por ejemplo, GITR humano) en ausencia del anticuerpo o fragmento de unión a antígeno de este se une a GITR (por ejemplo, GITR humano) en presencia del anticuerpo o fragmento de unión a antígeno de este.
En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende una región variable de la cadena pesada (VH) y una región variable de la cadena ligera (VL), en el que la VH y la VL comprenden la secuencia de aminoácidos de un anticuerpo en la Figura 23 o cualquiera de las Figuras 24A-24C. En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR
humano) que comprende una región variable de la cadena pesada (VH) y una región variable de la cadena ligera (VL), en el que la VH y la VL comprenden la secuencia de aminoácidos de un anticuerpo en la Tabla 17.
En ciertos aspectos, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende regiones constantes de la cadena pesada y/o ligera. El anticuerpo de la invención comprende una región constante de la cadena pesada. En algunas realizaciones, la región constante de la cadena pesada se selecciona del grupo de inmunoglobulinas humanas que consiste en IgG-i, IgG2, IgG3, IgG4, IgA1 e IgA2. En ciertas realizaciones, la región constante de la cadena ligera se selecciona del grupo de inmunoglobulinas humanas que consiste en IgGK e IgGA. En una realización específica, la IgGi es IgG no fucosilada-i. En otra realización específica, el anticuerpo es una IgGi que comprende una mutación N297A o N297Q. En otra realización específica, el anticuerpo es una IgG4 que comprende una mutación S228P. En otra realización específica, el anticuerpo es una IgG2 que comprende una mutación C127S. En ciertos aspectos, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región constante de la cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 557-562. En ciertas realizaciones, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región constante de la cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 583 y 584. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región constante de la cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en sec. con núms. de ident.: 557-560 con una sustitución de aminoácidos de N por A o Q en la posición del aminoácido 180. En ciertos aspectos, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región constante de la cadena ligera que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 588-591. En ciertos aspectos, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región constante de la cadena ligera que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 563-566.
En un aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITr humano), comprende (a) una cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 553, 554 y 567 a 570; y (b) una región variable de la cadena ligera que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 555, 556 y 571 a 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de s Eq ID NO: 554; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 581; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 582; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 555. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 554; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 555. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 567; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 573. En otra realización específica, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 567; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576. En otra realización específica, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 554; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 581; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 582; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576.
En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553 con una sustitución de aminoácidos de N por A o Q en la posición de aminoácido 298; y (b) una cadena ligera que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 555, 556 y 571 a 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553 con una sustitución de aminoácidos de N por A o Q en la posición de aminoácido 298; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID nO: 553 con una sustitución de aminoácidos de N por A o Q en la posición de aminoácido 298; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 555.
En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une al mismo epítopo de GITR (por ejemplo, GITR humano) que el anticuerpo descrito en la presente memoria. En otro aspecto, se proporciona en la presente memoria un anticuerpo aislado que se une específicamente a cada uno de i) GITR humano, en el que el GITR humano comprende los residuos 26-241 de SEQ ID NO: 701 y ii) una variante de GITR de cynomolgus que comprende los residuos 26-234 de SEQ ID NO: 699, en el que el anticuerpo no se une específicamente al GITR de cynomolgus que comprende los residuos 26-234 de SEQ ID NO: 704. En otro aspecto, se proporciona en la presente memoria un anticuerpo aislado que se une específicamente a cada uno de i) GITR humano, en el que el GITR humano comprende los residuos 26-241 de SEQ ID NO: 701 y ii) una variante de GITR de cynomolgus que comprende los residuos 26-234 de SEQ ID NO: 699, en el que el anticuerpo no muestra una unión sustancial al GITR de cynomolgus que comprende los residuos 26-234 de SEQ ID NO: 704. En otro aspecto, se proporciona en la presente memoria un anticuerpo aislado que se une específicamente a GITR humano, en el que el GITR humano comprende los residuos 26-241 de SEQ ID NO: 701, en el que la unión entre el anticuerpo y una variante de GITR está sustancialmente debilitada con relación a la unión entre el anticuerpo y el GITR humano, y en el que la variante de GITR comprende los residuos 26-241 de SEQ ID NO: 701, excepto por una sustitución de aminoácidos seleccionada del grupo que consiste en D60A y G63A. En un aspecto, la sustitución es D60A. En otro aspecto, la sustitución es G63A. En otro aspecto, se proporciona en la presente memoria un anticuerpo aislado que se une específicamente a GITR humano, en el que el GITr humano comprende los residuos 26-241 de SEQ ID NO: 701, y en el que el anticuerpo se une a un epítopo que comprende los residuos 60-63 de SEQ ID NO: 701. En otro aspecto, se proporciona en la presente memoria un anticuerpo aislado que se une específicamente a GITR humano, en el que el GITr humano comprende los residuos 26-241 de SEQ ID NO: 701, y en el que el anticuerpo se une a al menos un residuo dentro de la secuencia de aminoácidos expuesta por los residuos 60-63 de SEQ ID NO: 701. En un aspecto, el anticuerpo se une a al menos un residuo seleccionado del grupo que consiste en los residuos 60, 62 y 63 de SEQ ID NO: 701. En un aspecto, el anticuerpo se une a al menos un residuo seleccionado del grupo que consiste en los residuos 62 y 63 de SEQ ID NO: 701. En un aspecto, el anticuerpo activa o potencia una actividad del GITR humano. En otro aspecto, se proporciona en la presente memoria un anticuerpo aislado que se une específicamente a GITR humano, en el que el GITR humano comprende los residuos 26-241 de SEQ ID NO: 701, y en el que el anticuerpo se une a un epítopo del GITR humano que comprende al menos uno de los residuos 60 o 63 de SEQ ID NO:701. En otro aspecto proporcionado en la presente memoria está un anticuerpo aislado que se une específicamente a GITR humano, en el que el anticuerpo exhibe, en comparación con la unión a GITR humano, unión reducida o ausente a una proteína idéntica al GITR humano excepto por la presencia de una sustitución de aminoácido D60A o G63A. En un aspecto, el anticuerpo induce, activa, o potencia una actividad del GITR humano. En otro aspecto, se proporciona en la presente memoria un anticuerpo o fragmento de unión a antígeno de este que compite con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano). En un aspecto específico, se proporciona en la presente memoria un anticuerpo o fragmento de unión a antígeno de este que compite con el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) hasta el punto de que el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria compite con sí mismo por unirse a GITr (por ejemplo, GITR humano). En otro aspecto específico, se proporciona en la presente memoria un primer anticuerpo o fragmento de unión a antígeno de este que compite con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano), en el que el primer anticuerpo o fragmento de unión a antígeno de este compite por la unión en un ensayo que comprende las siguientes etapas: (a) incubar células transfectadas con GITr con el primer anticuerpo o fragmento de unión a antígeno de este en forma no etiquetada en un recipiente; (b) añadir el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria en forma etiquetada a las células en el recipiente e incubar las células en el recipiente; y (c) detectar la unión del anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria en forma etiquetada a las células. En otro aspecto específico, se proporciona en la presente memoria un primer anticuerpo o fragmento de unión a antígeno de este que compite con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria por unirse a GITr (por ejemplo, GITR humano), en el que la competición se muestra como unión reducida del primer anticuerpo o fragmento de unión a antígeno de este a GITR (por ejemplo, GITR humano) en más del 80 % (por ejemplo, 85 %, 90 %, 95 % o 98 %, o entre 80 % a 85 %, 80 % a 90 %, 85 % a 90 % u 85 % a 95 %).
En ciertas realizaciones, un anticuerpo o fragmento de este proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), activa, induce o potencia una actividad de GITR (por ejemplo, GITR humano). En realizaciones específicas, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), es un anticuerpo humanizado, anticuerpo murino o anticuerpo quimérico. En ciertas realizaciones, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), se une a GITR (por ejemplo, GITR humano) con una Kd en el intervalo de aproximadamente 0,5 nM a 5 nM. En ciertas realizaciones, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una etiqueta detectable. En realizaciones específicas, se aísla un anticuerpo proporcionado en la presente memoria.
En ciertas realizaciones, un anticuerpo o fragmento descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce, activa o potencia una actividad del GITR humano en una célula independientemente de la activación del TCR. En realizaciones específicas, la célula es una célula T. En realizaciones específicas, la célula no es una célula T. En realizaciones específicas, la célula se selecciona del grupo que consiste en una célula B, una célula plasmática, una célula de memoria, una célula asesina natural, un granulocito, un neutrófilo, un eosinófilo, un basófilo, un mastocito, un monocito, una célula dendrítica, una célula dendrítica plasmocitoide, una célula NKT y un macrófago. En realizaciones específicas, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce, activa o potencia una actividad de NF-kB independientemente de la activación del t Cr . En ciertas realizaciones, la actividad de NF-kB puede evaluarse en, por ejemplo, un ensayo que comprende las siguientes etapas: (a) incubar células T (por ejemplo, células Jurkat) que expresan un constructo reportero de NF-KB-luciferasa (por ejemplo, constructo GloResponse NF-KB-luc2P) y GITR (por ejemplo, GITR humano) con el anticuerpo descrito en la presente memoria o un anticuerpo de control de isotipo a una concentración de anticuerpo de, por ejemplo, 12,5, 10, 5, 2,5, 1,25 o 0,625 |jg/ml, en ausencia de un anticuerpo anti-CD3; y (b) leer la señal de luciferasa después de, por ejemplo, 2, 5, 6, 8 o 18 horas de incubación mediante el uso de, por ejemplo, un lector multietiqueta EnVision 2100, en el que una señal de luciferasa positiva con relación al anticuerpo de control de isotipo indica actividad de NF-kB. En una realización particular, la señal de luciferasa se lee después de 5 horas de incubación.
En ciertas realizaciones, un anticuerpo o fragmento descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta el porcentaje de células T polifuncionales (IFNy+ TNFa+). En realizaciones específicas, el aumento en el porcentaje de células T polifuncionales (IFNy+ TNFa+) puede evaluarse en, por ejemplo, un ensayo que comprende las siguientes etapas: (a) incubar, por ejemplo, PBMC humanas con, por ejemplo, un anticuerpo anti-CD3 a diversas concentraciones subóptimas (por ejemplo, 0,3 5 jg/ml); y, por ejemplo, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), a, por ejemplo, 5 jg/ml o un anticuerpo de control de isotipo, durante, por ejemplo, 3-4 días a 37 °C y 5 % de CO2; (b) tratar células con, por ejemplo, Brefeldin A durante, por ejemplo, 6 horas a 37 °C y 5 % de CO2; (c) teñir la superficie de las células mediante el uso de, por ejemplo, un anticuerpo anti-CD3, un anticuerpo anti-CD4 y un anticuerpo anti-CD8a; (d) teñir intracelularmente mediante el uso de, por ejemplo, un anticuerpo anti-IFNy y un anticuerpo anti-TNFa; y (e) determinar el porcentaje de células T polifuncionales (IFNy+ TNFa+) con relación al anticuerpo de control de isotipo. En realizaciones específicas, las células T polifuncionales (IFNy+ TNFa+) se seleccionan del grupo que consiste en células T CD4+ polifuncionales (IFNy+ TNFa+) y células T CD8+ polifuncionales (IFNy+ TNFa+).
En realizaciones específicas, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), cuando se une a las células T reguladoras activadas, se une a los receptores Fc gamma activadores seleccionados del grupo que consiste en CD16, CD32A y CD64 en mayor medida (por ejemplo, 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces o 100 veces) que el anticuerpo, cuando se une a las células T efectoras activadas, se une a los receptores Fc gamma activadores seleccionados del grupo que consiste en CD16, CD32A y CD64, según se evalúa mediante procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo reportero del receptor Fc gamma IIIA (CD16) o como se describe en los Ejemplos, más abajo). En realizaciones específicas, los receptores Fc gamma activadores se expresan sobre una célula seleccionada del grupo que consiste en células efectoras de origen mieloide y células efectoras de origen linfoide. En una realización particular, el receptor Fc gamma activador es CD16.
En realizaciones específicas, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), cuando se une a las células T reguladoras activadas, provoca una activación más fuerte de los receptores Fc gamma activadores seleccionados del grupo que consiste en CD16, CD32A y CD64 que el anticuerpo, cuando se une a las células T efectoras activadas, provoca la activación de los receptores Fc gamma activadores seleccionados del grupo que consiste en CD16, CD32A y CD64. En realizaciones particulares, la activación de los receptores Fc gamma activadores, cuando el anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), está unido a células T reguladoras activadas, es al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50
veces, 60 veces, 70 veces, 80 veces, 90 veces o 100 veces más fuerte que la activación de los receptores Fc gamma activadores, cuando el anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), se une a células T efectoras activadas, según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo reportero del receptor Fc gamma IIIA (CD16) o como se describe en los Ejemplos, más abajo). En realizaciones específicas, los receptores Fc gamma activadores se expresan sobre una célula seleccionada del grupo que consiste en células efectoras de origen mieloide y células efectoras de origen linfoide. En una realización particular, el receptor Fc gamma activador es CD16.
En ciertos aspectos, un anticuerpo o fragmento descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la expresión en superficie de OX40 y/o PD-1 en células T activadas en al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces, 100 veces, 200 veces, 300 veces, 400 veces, 500 veces, 600 veces, 700 veces, 800 veces, 900 veces o 1.000 veces según se evalúa mediante los procedimientos descritos en la presente memoria y/o conocidos por un experto en la técnica, con relación a la expresión en superficie de OX40 y/o PD-1 en células T activadas sin el anticuerpo descrito en la presente memoria.
En otra realización, se proporcionan en la presente memoria moléculas de ácido nucleico que codifican una región variable de la cadena pesada y/o una región variable de la cadena ligera, o una cadena ligera y/o una cadena pesada de un anticuerpo de la invención. En una realización específica, la molécula de ácido nucleico codifica una región variable de la cadena pesada que comprende la secuencia de ácido nucleico de SEQ ID NO: 209. En otro aspecto específico, la molécula de ácido nucleico codifica una región variable de la cadena ligera que comprende la secuencia de ácido nucleico de SEQ ID NO: 210 o SEQ ID NO: 211. En realizaciones específicas, se aísla la molécula de ácido nucleico. En ciertas realizaciones, un vector (por ejemplo, un vector aislado) comprende una molécula de ácido nucleico que codifica una región variable de la cadena pesada y/o una región variable de la cadena ligera, o una cadena ligera y/o una cadena pesada de un anticuerpo de la invención. En ciertas realizaciones, una célula huésped comprende la molécula de ácido nucleico o el vector. Ejemplos de células huésped incluyen E. coli, Pseudomonas, Bacillus, Streptomyces, levadura, células CHO, YB/20, NS0, PER-C6, HEK-293T, NIH-3T3, HeLa, BHK, Hep G2, SP2/0, R1.1, B-W, L-M, COS 1, COS 7, BSC1, BSC40, BMT10, células vegetales, células de insectos, y células humanas en cultivo de tejidos. En una realización específica, se proporciona en la presente memoria un procedimiento de producción de un anticuerpo o fragmento de unión a antígeno de este que se une específicamente a GITR (por ejemplo, GITR humano) que comprende cultivar una célula huésped de modo que se exprese la molécula de ácido nucleico y se produzca el anticuerpo.
En otro aspecto, se proporciona en la presente memoria un procedimiento para mejorar la coestimulación de las células T que comprende incubar células T ex vivo, que se han estimulado con un agente estimulador del complejo del receptor de células T (TCR) (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28), con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En otro aspecto, se proporciona en la presente memoria un procedimiento para activar células T que comprende incubar células T ex vivo con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En algunos aspectos, el procedimiento comprende, además, antes, simultáneamente o después de la incubación con el anticuerpo anti-GITR o fragmento de unión a antígeno de este, incubar las células T ex vivo con un agente estimulador del complejo TCR (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En algunos aspectos, las células T se aislaron de un sujeto. En cierta divulgación, las células T estimuladas y/o activadas se infunden en un sujeto. En alguna divulgación, las células T que se infunden en el sujeto son autólogas o alogénicas. En una realización específica, el sujeto es un ser humano. En otra divulgación, se proporciona en la presente memoria un procedimiento para la expansión preferencial de células T efectoras por sobre las células T reguladoras en un sujeto, que comprende administrar al sujeto una cantidad eficaz de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En una divulgación específica, el sujeto es humano.
En otro aspecto, se proporciona en la presente memoria un procedimiento para potenciar la expansión de las células T (por ejemplo, células TCD4+ y/o CD8+) y/o la función efectora de las células T, que comprende incubar ex vivo las células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En algunos aspectos, el procedimiento comprende, además, antes, simultáneamente con o después de incubar las células T con el anticuerpo o fragmento de unión a antígeno de este, incubar las células T con un agente estimulador del complejo del receptor de células T (TCR) (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En ciertos aspectos, las células T se aislaron de un sujeto. En alguna divulgación, el procedimiento comprende además infundir las células T después de su expansión y/o después de que se potencia su función efectora en un sujeto. En cierta divulgación, las células T que se infunden en el sujeto son autólogas o alogénicas. En una divulgación específica, el sujeto es un ser humano.
En otro aspecto, se proporciona en la presente memoria un procedimiento para potenciar la expansión de células TCD8+, que comprende incubar ex vivo las células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En algunos aspectos, el procedimiento comprende, además, antes, simultáneamente con o después de incubar las células T con el anticuerpo o fragmento de unión a antígeno de este, incubar las células T con un agente estimulador del complejo del receptor de células T (TCR) (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En ciertos aspectos, las células T se aislaron de un sujeto. En alguna divulgación, el procedimiento comprende además infundir las células T después de su expansión y/o después de que se potencia su función efectora en un sujeto. En cierta divulgación, las células T que se infunden en el sujeto son autólogas o alogénicas. En una divulgación específica, el sujeto es un ser humano.
En otro aspecto, se proporciona en la presente memoria un procedimiento para mejorar la expansión de células TCD4+, que comprende incubar las células T ex vivo con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En algunos aspectos, el procedimiento comprende, además, antes, simultáneamente con o después de incubar las células T con el anticuerpo o fragmento de unión a antígeno de este, incubar las células T con un agente estimulador del complejo del receptor de células T (TCR) (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMa ), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En ciertos aspectos, las células T se aislaron de un sujeto. En alguna divulgación, el procedimiento comprende además infundir las células T después de su expansión y/o después de que se potencia su función efectora en un sujeto. En cierta divulgación, las células T que se infunden en el sujeto son autólogas o alogénicas. En una divulgación específica, el sujeto es un ser humano.
En otro aspecto, se proporciona en la presente memoria un procedimiento para activar GITR o activar NF-kB que comprende incubar células T ex vivo, que no se han estimulado con un agente estimulador del complejo del receptor de células T (TCR) (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28), con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En algunos aspectos, las células T se aislaron de un sujeto. En cierta divulgación, las células T activadas se infunden en un sujeto. En alguna divulgación, las células T que se infunden en el sujeto son autólogas o alogénicas. En una divulgación específica, el sujeto es un ser humano.
En otro aspecto, se proporciona en la presente memoria un procedimiento para activar células T independientemente de la activación del TCR que comprende poner en contacto las células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria.
En otro aspecto, se proporciona en la presente memoria un procedimiento para inducir, activar o potenciar una actividad de NF-kB independientemente de la activación de TCR que comprende poner en contacto células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria.
En otro aspecto, se proporciona en la presente memoria un procedimiento para aumentar el porcentaje de células T polifuncionales (IFNy+ TNFa+) que comprende poner en contacto células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria.
En otro aspecto, se proporciona en la presente memoria un procedimiento para aumentar la expresión en superficie de OX40 y/o PD-1 en células T activadas que comprende poner en contacto células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria.
En otra realización, se proporcionan en la presente memoria composiciones farmacéuticas que comprenden un anticuerpo, o una molécula de ácido nucleico de la invención, y un portador farmacéuticamente aceptable. La composición farmacéutica puede usarse para modular la respuesta inmunitaria y/o para tratar y/o prevenir un trastorno, tal como el cáncer o una enfermedad infecciosa. En una divulgación específica, se proporciona en la presente memoria un procedimiento para modular una respuesta inmunitaria en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica proporcionada descrita en la presente memoria. En un aspecto particular, la respuesta inmunitaria se potencia o se induce. En otra divulgación específica, se proporciona en la presente memoria un procedimiento para mejorar la expansión de las células T y/o la función efectora de las células T en un sujeto, que comprende administrar al sujeto una cantidad eficaz de una composición farmacéutica descrita en la presente memoria. En otra divulgación específica, se proporciona en la presente memoria un procedimiento para potenciar la expansión de células T CD8+ en un sujeto, que comprende administrar al sujeto una cantidad eficaz de una composición farmacéutica descrita en la presente memoria. En algunos aspectos, la divulgación proporciona el uso de un anticuerpo como se describe en la presente memoria en la fabricación de un medicamento para el tratamiento del cáncer. En ciertas realizaciones, la divulgación proporciona un anticuerpo como se describe en la presente memoria para su uso en el tratamiento del cáncer. En ciertos aspectos, la divulgación proporciona el uso de una composición farmacéutica como se describe en la presente memoria, para la fabricación de un medicamento para el tratamiento del cáncer. En ciertas realizaciones, la divulgación proporciona una composición farmacéutica como se describe en la presente memoria para su uso en el tratamiento del cáncer. En otra divulgación específica, se proporciona en la presente memoria un procedimiento para
tratar el cáncer en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica proporcionada en la presente memoria. En cierta divulgación, el procedimiento de tratamiento del cáncer comprende además administrar un agente contra el cáncer al sujeto. En la Sección 5.4 se describen ejemplos de agentes contra el cáncer que pueden administrarse a un sujeto en combinación con una composición farmacéutica descrita en la presente memoria, más abajo (por ejemplo, las Secciones 5.4.1 y 5.4.1.1). En un aspecto específico, el agente contra el cáncer es una vacuna. En un aspecto particular, la vacuna comprende un complejo peptídico de proteína de choque térmico (HSPPC), en el que el HSPPC comprende una proteína de choque térmico (por ejemplo, una proteína gp96) en complejo con uno o más péptidos antigénicos (por ejemplo, péptidos antigénicos asociados a tumores). En ciertas realizaciones, el cáncer tratado es cáncer de células escamosas, cáncer de pulmón de células pequeñas, cáncer de pulmón de células no pequeñas, cáncer gastrointestinal, linfoma de Hodgkin o no Hodgkin, cáncer de páncreas, glioblastoma, glioma, cáncer de cuello uterino, cáncer de ovario, cáncer de hígado, cáncer de vejiga, cáncer de mama, cáncer de colon, cáncer colorrectal, carcinoma de endometrio, mieloma, carcinoma de glándulas salivales, cáncer de riñón, carcinoma de células basales, melanoma, cáncer de próstata, cáncer de vulva, cáncer de tiroides, cáncer de testículo, cáncer de esófago o un tipo de cáncer de cabeza o cuello. En ciertas realizaciones, el cáncer tratado es melanoma desmoplásico, cáncer de mama inflamatorio, timoma, cáncer de recto, cáncer de ano o glioma de tronco encefálico tratable quirúrgicamente o no tratable quirúrgicamente. En una realización específica, el sujeto tratado es un ser humano.
En otra divulgación, se proporciona en la presente memoria un procedimiento para activar células T independientemente de la activación de TCR en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica descrita en la presente memoria.
En otra divulgación, se proporciona en la presente memoria un procedimiento para inducir, activar o mejorar una actividad de NF-kB independientemente de la activación de TCR en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica descrita en la presente memoria.
En otra divulgación, se proporciona en la presente memoria un procedimiento para aumentar el porcentaje de células T polifuncionales (|fNy+ TNFa+) en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica descrita en la presente memoria.
En otra divulgación, se proporciona en la presente memoria un procedimiento para aumentar la expresión en superficie de OX40 y/o PD-1 en células T activadas en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica descrita en la presente memoria.
El anticuerpo como se describe en la presente memoria puede usarse en combinación con un inhibidor de IDO para tratar el cáncer. En una divulgación, se proporciona en la presente memoria un procedimiento para tratar el cáncer en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica descrita en la presente memoria, en el que el procedimiento comprende además administrar al sujeto un inhibidor de la indolamina-2,3-dioxigenasa (IDO). El inhibidor de IDO como se describe en la presente memoria para su uso en el tratamiento del cáncer, está presente en una forma de dosificación sólida de una composición farmacéutica tal como un comprimido, una píldora o una cápsula, en la que la composición farmacéutica incluye un inhibidor de IDO y un excipiente farmacéuticamente aceptable. Como tal, el anticuerpo como se describe en la presente memoria y el inhibidor de IDO como se describe en la presente memoria pueden administrarse por separado, secuencialmente o simultáneamente como formas de dosificación separadas. En un aspecto, el anticuerpo se administra por vía parenteral y el inhibidor de IDO se administra por vía oral. En aspectos particulares, el compuesto se selecciona del grupo que consiste en epacadostat (Incyte Corporation), F001287 (Flexus Biosciences), indoximod (NewLink Genetics), y NLG919 (NewLink Genetics). Epacadostat se ha descrito en la Publicación PCT Núm. WO 2010/005958. En un aspecto, el inhibidor es epacadostat. En otro aspecto, el inhibidor es F001287. En otro aspecto, el inhibidor es indoximod. En otro aspecto, el inhibidor es NLG919.
El anticuerpo como se describe en la presente memoria puede usarse en combinación con un agente de direccionamiento a puntos de control para tratar el cáncer. En una divulgación, se proporciona en la presente memoria un procedimiento para tratar el cáncer en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica descrita en la presente memoria, en la que el procedimiento comprende además administrar al sujeto un agente de direccionamiento a puntos de control. En algunos aspectos, el agente de direccionamiento a puntos de control se selecciona del grupo que consiste en un antagonista de PD-1 (por ejemplo, un anticuerpo anti-PD-1 antagonista), un antagonista de PD-L1 (por ejemplo, un anticuerpo anti-PD-L1 antagonista), un antagonista de PD-L2 (por ejemplo, un anticuerpo anti-PD-L2 antagonista), un antagonista de CTLA-4 (por ejemplo, un anticuerpo anti-CTLA-4 antagonista), un antagonista de TIM-3 (por ejemplo, un anticuerpo anti-TIM-3 antagonista), un antagonista de LAG-3 (por ejemplo, un anticuerpo anti-LAG-3 antagonista) y un agonista de OX40 (por ejemplo, un anticuerpo anti-OX40 agonista). En algunos aspectos, un agente de direccionamiento a puntos de control, por ejemplo, un antagonista de PD-1 (por ejemplo, un anticuerpo anti-PD-1 antagonista) o un agonista de OX40 (por ejemplo, un anticuerpo anti-OX40 agonista) se administra simultáneamente con el anticuerpo anti-GITR. En algunos aspectos, un agente de direccionamiento a puntos de control, por ejemplo, un antagonista de PD-1 (por ejemplo, un anticuerpo anti-PD-1 antagonista) o un agonista de OX40 (por ejemplo, un anticuerpo anti-OX40 agonista) se administra antes de la administración del anticuerpo anti-GITR. En algunos aspectos, un agente de
direccionamiento a puntos de control, por ejemplo, un antagonista de PD-1 (por ejemplo, un anticuerpo anti-PD-1 antagonista) o un agonista de OX40 (por ejemplo, un anticuerpo anti-OX40 agonista) se administra después de la administración del anticuerpo anti-GITR.
El anticuerpo como se describe en la presente memoria puede usarse en combinación con un anticuerpo anti-CD25. En algunos aspectos, se administra un anticuerpo anti-CD25 simultáneamente con el anticuerpo anti-GITR. En algunos aspectos, se administra un anticuerpo anti-CD25 antes de la administración del anticuerpo anti-GITR. En algunos aspectos, se administra un anticuerpo anti-CD25 después de la administración del anticuerpo anti-GITR.
En otro aspecto específico de la divulgación, se proporciona en la presente memoria un procedimiento para tratar el cáncer en un sujeto que comprende administrar un anticuerpo anti-PD-1 antagonista a un sujeto que lo necesita y que ha recibido un anticuerpo anti-GITR, en el que el anticuerpo PD-1 se administra en un momento en el que el anticuerpo anti-GITR ha aumentado la expresión de PD-1 en el sujeto con relación a la expresión de PD-1 en el sujeto en el momento de la administración. En otra divulgación específica, se proporciona en la presente memoria un procedimiento para tratar el cáncer en un sujeto que comprende administrar un anticuerpo anti-OX40 agonista a un sujeto que lo necesita y que ha recibido un anticuerpo anti-GITR, en el que el anticuerpo OX40 se administra en un momento en el que el anticuerpo anti-GITR tiene una expresión aumentada de OX40 en el sujeto con relación a la expresión de OX40 en el sujeto en el momento de la administración. En ciertos aspectos, el anticuerpo anti-GITR induce, activa o potencia una actividad de GITR.
En otra divulgación específica, se proporciona en la presente memoria un procedimiento para tratar el cáncer en un sujeto que comprende administrar un anticuerpo anti-GITR a un sujeto que lo necesita, en el que el anticuerpo anti-GITR aumenta la expresión de PD-1 en el sujeto con relación a la expresión de PD-1 en el sujeto en el momento de la administración, y administrar un anticuerpo anti-PD-1 antagonista al sujeto cuando aumenta la expresión de PD-1. En otra divulgación específica, se proporciona en la presente memoria un procedimiento para tratar el cáncer en un sujeto que comprende administrar un anticuerpo anti-GITR a un sujeto que lo necesita, en el que el anticuerpo anti-GITR aumenta la expresión de OX40 en el sujeto con relación a la expresión de OX40 en el sujeto en el momento de la administración, y administrar un anticuerpo OX40 agonista al sujeto cuando aumenta la expresión de OX40. En ciertos aspectos, el anticuerpo anti-GITR induce, activa o potencia una actividad de GITR.
En otra divulgación específica, se proporciona en la presente memoria un procedimiento para tratar el cáncer o una infección viral en un sujeto, el procedimiento comprende las etapas de: (a) incubar células T ex vivo con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria; y (b) infundir las células T en el sujeto. En una divulgación específica, las células T infundidas en el sujeto son autólogas o alogénicas. En cierta divulgación, las células T se aislaron de un sujeto. En alguna divulgación, las células T no se incuban con un agente estimulador del complejo del receptor de células T (TCR) (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PmA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En cierta divulgación, el procedimiento comprende además, antes de la etapa (a): (1) analizar las células T para determinar la expresión de GITR en la superficie celular; y (2) si la etapa (1) no da como resultado la detección de GITR por encima de un valor umbral, inducir la expresión de GITR en la superficie de las células T al incubar las células T con un agente estimulador del complejo del receptor de células T (TCR) (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En alguna divulgación, el procedimiento comprende, además, antes, simultáneamente con o después de la etapa (a), incubar las células T con un agente estimulador del complejo del receptor de células T (TCR) fitohemaglutinina (PHA) y/o miristato de forbol acetato (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En un aspecto específico, el sujeto tratado es un ser humano.
En otra divulgación, se proporciona en la presente memoria un procedimiento para tratar y/o prevenir una enfermedad infecciosa en un sujeto que comprende administrar al sujeto una cantidad eficaz de una composición farmacéutica descrita en la presente memoria. Ver la Sección 5.4.1.2 más abajo para ejemplos de enfermedades infecciosas. En otra divulgación específica, se proporciona en la presente memoria un procedimiento para tratar una infección viral en un sujeto, que comprende administrar al sujeto una cantidad eficaz de la composición farmacéutica descrita en la presente memoria. En una realización, la invención se refiere a un anticuerpo de la invención, o la composición farmacéutica de la invención, para su uso en el tratamiento de una infección viral. En ciertas realizaciones, la infección viral tratada es provocada por un virus del papiloma humano (VPH), un virus del herpes simple u otro virus del herpes, virus de la hepatitis B (VHB), virus de la hepatitis C (VHC) u otro virus de la hepatitis, virus del sarampión, VIH o Virus de Epstein Barr (EBV). En ciertas realizaciones, el anticuerpo o la composición farmacéutica para su uso en el tratamiento de una infección viral comprende además administrar un agente antivírico al sujeto. En una realización específica, el sujeto tratado es un ser humano.
En otro aspecto específico, se proporciona en la presente memoria un procedimiento para identificar un anticuerpo anti-GITR que es capaz de inducir, activar o potenciar una actividad de GITR en ausencia de un agonista de t Cr que comprende poner en contacto una célula que expresa GITR con un anticuerpo anti-GITR en ausencia de un agonista de TCR y medir la actividad de GITR, en el que el aumento de la actividad de GITR en comparación con la actividad de GITR en ausencia del anticuerpo anti-GITR indica que el anticuerpo anti-GITR es capaz de inducir,
activar o potenciar una actividad de GITR en la ausencia de un agonista de TCR. En ciertos aspectos, la actividad de GITR se evalúa al medir la actividad de NF-kB. En ciertos aspectos, la actividad de GITR se evalúa al medir la activación de las rutas de señalización mediadas por el adaptador de TRAF, en el que el adaptador de TRAF se selecciona del grupo que consiste en TRAF1, TRAF2, TRAF3, TRAF4 y TRAF5. En ciertos aspectos, la actividad de GITR se evalúa al medir la activación de la vía MAPK/ERK. En ciertos aspectos, el anticuerpo anti-GITR aumenta la actividad de GITR al menos dos veces en comparación con la actividad de GITR en ausencia del anticuerpo anti-GITR. En ciertos aspectos, el anticuerpo anti-GITR aumenta la actividad de GITR de dos a veinte veces en comparación con la actividad de GITR en ausencia del anticuerpo anti-GITR. En ciertos aspectos, el anticuerpo anti-GITR aumenta la actividad de GITR de dos a diez veces en comparación con la actividad de GITR en ausencia del anticuerpo anti-GITR. En ciertos aspectos, la célula es una célula T. En ciertos aspectos, la célula no es una célula T.
En otra realización específica, se proporciona en la presente memoria un anticuerpo anti-GITR de la invención que se une específicamente al GITR humano, en el que dicho anticuerpo es capaz de inducir, activar o potenciar una actividad de GITR en una célula en ausencia de activación de TCR. En otra realización específica, se proporciona en la presente memoria un anticuerpo anti-GITR que se une específicamente al GITR humano, en el que dicho anticuerpo induce, activa o potencia una actividad de NF-kB en una célula en ausencia de activación de TCR. En otra divulgación específica, se proporciona en la presente memoria un procedimiento para tratar el cáncer que comprende administrar a un sujeto que lo necesita un anticuerpo anti-GITR que se une específicamente al GITR humano, en el que dicho anticuerpo es capaz de inducir, activar o potenciar una actividad de GITR y/o NF-kB en ausencia de activación de TCR.
3.1 Terminología
Como se usa en la presente memoria, los términos “aproximadamente” y “de manera aproximada”, cuando se usan para modificar un valor numérico o intervalo numérico, indican que las desviaciones de 5 % a 10 % por encima y 5 % a 10 % por debajo del valor o intervalo permanecen dentro del significado previsto del valor o intervalo mencionado.
Como se usa en la presente memoria, la unión entre un anticuerpo de prueba y un primer antígeno está “sustancialmente debilitada” con relación a la unión entre el anticuerpo de prueba y un segundo antígeno si la unión entre el anticuerpo de prueba y el primer antígeno se reduce en al menos 30 %, 40 %, 50 %, 60 %, 70 %, u 80 % con relación a la unión entre el anticuerpo de prueba y el segundo antígeno, por ejemplo, en un experimento dado, o mediante el uso de los valores medios de múltiples experimentos, según se evalúa mediante, por ejemplo, un ensayo que comprende las siguientes etapas: (a) expresar en la superficie de las células (por ejemplo, células 1624 5) el primer antígeno o el segundo antígeno; (b) teñir las células que expresan el primer antígeno o el segundo antígeno mediante el uso de, por ejemplo, 2 pg/ml del anticuerpo de prueba o un anticuerpo policlonal en un análisis de citometría de flujo y registrar los valores de intensidad media de fluorescencia (MFI), por ejemplo, como la media de más de una medición, en el que el anticuerpo policlonal reconoce tanto el primer antígeno como el segundo antígeno; (c) dividir el valor de MFI del anticuerpo de prueba para las células que expresan el segundo antígeno por el valor de MFI del anticuerpo policlonal para las células que expresan el segundo antígeno (relación2 MFI); (d) dividir el valor de MFI del anticuerpo de prueba para las células que expresan el primer antígeno por el valor de MFI del anticuerpo policlonal para las células que expresan el primer antígeno (relación MFI); y (e) determinar el porcentaje de reducción de la unión mediante el cálculo 100 %* (1-(relación1 MFI/relación2 MFI)).
Como se usa en la presente memoria, un anticuerpo no muestra una "unión sustancial" a un antígeno si cuando se mide en un análisis de citometría de flujo, el valor de intensidad de fluorescencia media (MFI) del anticuerpo contra el antígeno no es significativamente mayor que el valor de MFI de un anticuerpo de control de isotipo con respecto al antígeno o el valor de MFI en ausencia de cualquier anticuerpo.
Como se usa en la presente memoria, los términos “anticuerpo” y “anticuerpos” son términos de la técnica y pueden usarse indistintamente en la presente memoria y se refieren a una molécula con un sitio de unión a antígeno que se une específicamente a un antígeno.
Los anticuerpos pueden incluir, por ejemplo, anticuerpos monoclonales, anticuerpos producidos por vía recombinante, anticuerpos monoespecíficos, anticuerpos multiespecíficos (incluye anticuerpos biespecíficos), anticuerpos humanos, anticuerpos humanizados, anticuerpos quiméricos, inmunoglobulinas, anticuerpos sintéticos, anticuerpos tetraméricos que comprenden moléculas de dos cadenas pesadas y dos cadenas ligeras, un monómero de cadena ligera de anticuerpo, un monómero de cadena pesada de anticuerpo, un dímero de cadena ligera de anticuerpo, un dímero de cadena pesada de anticuerpo, un par cadena ligera de anticuerpo- cadena pesada de anticuerpo, intracuerpos, anticuerpos heteroconjugados, anticuerpos de dominio único, anticuerpos monovalentes, anticuerpos de cadena única o Fv de cadena única (scFv), anticuerpos camelizados, aficuerpos, fragmentos Fab, fragmentos F(ab')2, Fv unidos por enlace disulfuro (sdFv), anticuerpos antiidiotipo (anti-Id) (que incluyen, por ejemplo, anticuerpos anti-anti-Id), y fragmentos de unión a antígeno. En ciertos aspectos, los anticuerpos descritos en la presente memoria se refieren a poblaciones de anticuerpos policlonales. Los anticuerpos pueden ser de cualquier tipo (por ejemplo, IgG, IgE, IgM, IgD, IgA o IgY), cualquier clase (por ejemplo, IgG-i, IgG2, IgG3, IgG4, IgA1 o IgA2), o cualquier subclase (por ejemplo, IgG2a o IgG2b) de molécula de inmunoglobulina. En ciertas realizaciones,
los anticuerpos descritos en la presente memoria son anticuerpos IgG, o una clase (por ejemplo, IgGi o IgG4) o subclase de estos. En una realización específica, el anticuerpo es un anticuerpo monoclonal humanizado. En otra realización específica, el anticuerpo es un anticuerpo monoclonal humano, preferentemente, que es una inmunoglobulina. En ciertas realizaciones, un anticuerpo descrito en la presente memoria es un anticuerpo IgG1 o IgG4.
Como se usa en la presente memoria, los términos “dominio de unión a antígeno”, “región de unión a antígeno”, “sitio de unión a antígeno”, y términos similares se refieren a una porción de una molécula de anticuerpo que comprende los residuos de aminoácidos que confieren a la molécula de anticuerpo su especificidad por el antígeno (por ejemplo, las regiones determinantes de complementariedad (CDR)). La región de unión a antígeno puede derivarse de cualquier especie animal, tal como roedores (por ejemplo, ratón, rata, o hámster) y seres humanos.
Como se usa en la presente memoria, los términos “región variable” o “dominio variable” se usan indistintamente y son comunes en la técnica. La región variable se refiere típicamente a una porción de un anticuerpo, generalmente, una porción de una cadena ligera o pesada, típicamente aproximadamente los 110 a 120 aminoácidos del amino terminal en la cadena pesada madura y aproximadamente los 90 a 115 aminoácidos en la cadena ligera madura, que difieren ampliamente en la secuencia entre los anticuerpos y se usan en la unión y especificidad de un anticuerpo particular por su antígeno particular. La variabilidad de la secuencia se concentra en aquellas regiones llamadas regiones determinantes de complementariedad (CDR) mientras que las regiones más altamente conservadas en el dominio variable se llaman regiones marco (FR). Sin querer limitarse a ningún mecanismo o teoría particular, se piensa que las CDR de las cadenas ligeras y pesadas son responsables principalmente de la interacción y la especificidad del anticuerpo con el antígeno. En ciertas realizaciones, la región variable es una región variable humana. En ciertas realizaciones, la región variable comprende las CDR de roedores o murinas y las regiones marco (FR) humanas. En realizaciones particulares, la región variable es una región variable de primate (por ejemplo, primate no humano). En ciertas realizaciones, la región variable comprende las CDR de roedores o murinas y las regiones marco (FR) de primate (por ejemplo, primate no humano).
Los términos “VL” y “dominio VL” se usan indistintamente para referirse a la región variable de la cadena ligera de un anticuerpo.
Los términos “VH” y “dominio VH” se usan indistintamente para referirse a la región variable de la cadena pesada de un anticuerpo.
El término “numeración de Kabat” y términos similares se reconocen en la técnica y se refieren a un sistema de numeración de residuos de aminoácidos en las regiones variables de las cadenas ligera y pesada de un anticuerpo, o una porción de unión a antígeno de estas. En ciertos aspectos, las CDR de un anticuerpo pueden determinarse de acuerdo con el sistema de numeración de Kabat (ver, por ejemplo, Kabat EA y Wu TT (1971) Ann NY Acad Sci 190: 382-391 y Kabat EA y otros, (1991) Sequences of Proteins of Immunological Interest, Quinta Edición, Departamento de Salud y Servicios Humanos de Estados Unidos, Publicación de NIH núm. 91-3242). Mediante el uso del sistema de numeración de Kabat, las CDR dentro de una molécula de cadena pesada de anticuerpo se encuentran típicamente en las posiciones de aminoácidos 31 a 35, que opcionalmente pueden incluir uno o dos aminoácidos adicionales, después de la posición 35 (referidas en el esquema de numeración de Kabat como 35A y 35B) (CDR1), las posiciones de aminoácidos 50 a 65 (CDR2), y las posiciones de aminoácidos 95 a 102 (CDR3). Mediante el uso el sistema de numeración de Kabat, las CDR dentro de una molécula de cadena ligera de anticuerpo se encuentran típicamente en las posiciones de aminoácidos 24 a 34 (CDR1), las posiciones de aminoácidos 50 a 56 (CDR2), y las posiciones de aminoácidos 89 a 97 (CDR3). En una realización específica, las CDR de los anticuerpos descritos en la presente memoria se han determinado de acuerdo con el esquema de la numeración de Kabat.
Como se usa en la presente memoria, el término “región constante” o “dominio constante” son intercambiables y tienen su significado común en la técnica. La región constante es una porción de anticuerpo, por ejemplo, una porción carboxilo terminal de una cadena ligera y/o pesada que no está implicada directamente en la unión de un anticuerpo al antígeno pero que puede mostrar varias funciones efectoras, tales como interacción con el receptor de Fc. La región constante de una molécula de inmunoglobulina generalmente tiene una secuencia de aminoácidos más conservada con relación a un dominio variable de inmunoglobulina.
Como se usa en la presente memoria, el término “cadena pesada” cuando se usa en referencia a un anticuerpo puede referirse a cualquier tipo diferente, por ejemplo, alfa (a), delta (8), épsilon (e), gamma (y), y mu (p), en base a la secuencia de aminoácidos del dominio constante, los que dan origen a las clases de anticuerpos IgA, IgD, IgE, IgG, e IgM, respectivamente, que incluyen las subclases de IgG, por ejemplo, IgG-i, IgG2, IgG3 e IgG4.
Como se usa en la presente memoria, el término “cadena ligera” cuando se usa en referencia a un anticuerpo puede referirse a cualquier tipo diferente, por ejemplo, kappa (k) o lambda (A) en base a la secuencia de aminoácidos de los dominios constantes. Las secuencias de aminoácidos de cadena ligera se conocen bien en la técnica. En realizaciones específicas, la cadena ligera es una cadena ligera humana.
"Afinidad de unión" se refiere generalmente a la fortaleza de la suma total de las interacciones no covalentes entre un sitio de unión único de una molécula (por ejemplo, un anticuerpo) y su pareja de unión (por ejemplo, un antígeno). A menos que se indique de cualquier otra manera, como se usa en la presente memoria, “afinidad de unión” se refiere a la afinidad de unión intrínseca que refleja una interacción 1:1 entre los miembros de un par de unión (por ejemplo, anticuerpo y antígeno). La afinidad de una molécula X por su pareja Y puede representarse generalmente mediante la constante de disociación (Kd). La afinidad puede medirse y/o expresarse en una variedad de formas conocidas en la técnica, que incluyen, pero no se limitan a, constante de equilibrio de disociación (Kd), y constante de equilibrio de asociación (Ka). La Kd se calcula a partir del cociente de kdisoc/kasoc, mientras que la Ka se calcula a partir del cociente de kasoc/kdisoc. La kasoc se refiere a la constante de velocidad de asociación de, por ejemplo, un anticuerpo a un antígeno, y la kdisoc se refiere a la disociación de, por ejemplo, un anticuerpo a un antígeno. Las kasoc y kdisoc pueden determinarse mediante técnicas conocidas por un experto en la técnica, tales como BIAcore® o KinExA.
Como se usa en la presente memoria, una "sustitución conservadora de aminoácidos" es una en la que el residuo de aminoácido se reemplaza con un residuo de aminoácido que tiene una cadena lateral similar. Las familias de residuos de aminoácidos que tienen cadenas laterales similares se han definido en la técnica. Estas familias incluyen aminoácidos con cadenas laterales básicas (por ejemplo, lisina, arginina, histidina), cadenas laterales ácidas (por ejemplo, ácido aspártico, ácido glutámico), cadenas laterales polares no cargadas (por ejemplo, glicina, asparagina, glutamina, serina, treonina, tirosina, cisteína, triptófano), cadenas laterales no polares (por ejemplo, alanina, valina, leucina, isoleucina, prolina, fenilalanina, metionina), cadenas laterales beta-ramificadas (por ejemplo, treonina, valina, isoleucina) y cadenas laterales aromáticas (por ejemplo, tirosina, fenilalanina, triptófano, histidina). En ciertas realizaciones, uno o más residuos de aminoácidos dentro de una(s) CDR(s) o dentro de una región o regiones marco de un anticuerpo o fragmento de unión a antígeno de este pueden reemplazarse con un residuo de aminoácido con una cadena lateral similar.
Como se usa en la presente memoria, un “epítopo” es un término en la técnica y se refiere a una región localizada de un antígeno a la que un anticuerpo puede unirse específicamente. Un epítopo puede ser, por ejemplo, aminoácidos contiguos de un polipéptido (epítopo lineal o contiguo) o un epítopo puede formarse, por ejemplo, a partir de dos o más regiones no contiguas de un polipéptido o polipéptidos (epítopo conformacional, no lineal, discontinuo, o no contiguo). En ciertos aspectos, el epítopo al que un anticuerpo se une puede determinarse mediante, por ejemplo, espectroscopía de RMN, estudios de cristalografía por difracción de rayos X, ensayos ELISA, intercambio de hidrógeno/deuterio acoplado a espectrometría de masas (por ejemplo, espectrometría de masas por electropulverización con cromatografía líquida), ensayos de barrido de oligopéptidos basados en matrices, y/o mapeo por mutagénesis (por ejemplo, mapeo por mutagénesis dirigida a sitio). Para la cristalografía por rayos X, la cristalización puede realizarse mediante el uso de cualquiera de los procedimientos conocidos en la técnica (por ejemplo, Giegé R y otros, (1994) Acta Crystallogr D Biol Crystallogr 50(Pt 4): 339-350; McPherson A (1990) Eur J Biochem 189: 1-23; Chayen NE (1997) Structure 5: 1269-1274; McPherson A (1976) J Biol Chem 251: 6300-6303). Los cristales de anticuerpo:antígeno pueden estudiarse mediante el uso de técnicas de difracción de rayos X bien conocidas y pueden refinarse mediante el uso de softwares informáticos tales como X-PLOR (Universidad de Yale, 1992, distribuido por Molecular Simulations, Inc.; ver, por ejemplo, Meth Enzymol (1985) volúmenes 114 y 115, eds Wyckoff HW y otros; documento U.S. 2004/0014194), y BUSTER (Bricogne G (1993) Acta Crystallogr D Biol Crystallogr 49(Pt 1): 37-60; Bricogne G (1997) Meth Enzymol 276A: 361-423, ed Carter CW; Roversi P y otros (2000) Acta Crystallogr D Biol Crystallogr 56(Pt 10): 1316-1323). Los estudios de mapeo por mutagénesis pueden realizarse mediante el uso de cualquier procedimiento conocido por un experto en la técnica. Ver, por ejemplo, Champe M y otros, (1995) J Biol Chem 270: 1388-1394 y Cunningham BC y Wells JA (1989) Science 244: 1081-1085 para una descripción de técnicas de mutagénesis, que incluyen técnicas de mutagénesis por barrido de alanina. En un aspecto específico, el epítopo de un anticuerpo o fragmento de unión a antígeno de este se determina mediante el uso de estudios de mutagénesis de barrido de alanina, como se describe en la Sección 6, más abajo.
Como se usa en la presente memoria, los términos “se une inmunoespecíficamente”, “reconoce inmunoespecíficamente”, “se une específicamente”, y “reconoce específicamente” son términos análogos en el contexto de los anticuerpos y se refieren a moléculas que se unen a un antígeno (por ejemplo, epítopo o complejo inmunitario) del modo en que tal unión se entiende por un experto en la técnica. Por ejemplo, una molécula que se une específicamente a un antígeno puede unirse a otros péptidos o polipéptidos, generalmente con menor afinidad según se determina mediante, por ejemplo, inmunoensayos, BIAcore®, instrumento KinExA 3000 (Sapidyne Instruments, Boise, ID), u otros ensayos conocidos en la técnica. En una realización específica, las moléculas que se unen inmunoespecíficamente a un antígeno se unen al antígeno con una Ka que es al menos 2 logaritmos, 2,5 logaritmos, 3 logaritmos, 4 logaritmos o mayor que la Ka cuando las moléculas se unen a otro antígeno.
En otra realización específica, las moléculas que se unen inmunoespecíficamente a un antígeno no tienen reacción cruzada con otras proteínas en condiciones de unión similares. En otra modalidad específica, las moléculas que se unen inmunoespecíficamente a un antígeno no tienen reactividad cruzada con otras proteínas que no sean GITR. En una realización específica, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une a GITR con mayor afinidad que a otro antígeno no relacionado. En ciertas realizaciones, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une a GITR (por ejemplo, GITR humano) con un 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 % o mayor afinidad que a otro
antígeno no relacionado, según se mide mediante, por ejemplo, un radioinmunoensayo, resonancia de plasmones de superficie, o ensayo de exclusión cinética. En una realización específica, el grado de unión de un anticuerpo anti-GITR o fragmento de unión a antígeno de este descrito en la presente memoria a una proteína que no sea GITR, no relacionada, es menor que 10 %, 15 %, o 20 % de la unión del anticuerpo a la proteína GITR según se mide mediante, por ejemplo, un radioinmunoensayo.
En una realización específica, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une a GITR humano con mayor afinidad que a otra especie de GITR. En ciertas realizaciones, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une al GITR humano con un 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o mayor afinidad que con otra especie de GITR según se mide mediante, por ejemplo, un radioinmunoensayo, resonancia de plasmones de superficie o ensayo de exclusión cinética. En una realización específica, un anticuerpo o fragmento de este descrito en la presente memoria, que se une al GITR humano, se unirá a otra especie de proteína GITR con menos del 10 %, 15 % o 20 % de la unión del anticuerpo o fragmento de este a la proteína GITR humana según se mide mediante, por ejemplo, un radioinmunoensayo, resonancia de plasmones de superficie o ensayo de exclusión cinética.
Como se usa en la presente memoria, los términos “receptor relacionado con la familia de TNFR inducido por glucocorticoides” o “GITR” o “polipéptido de GITR” se refieren a GITR que incluye, pero no se limita a, GITR nativo, una isoforma de GITR, o un homólogo de GITR interespecies de GITR. GITR es una proteína transmembrana de tipo I de 26 kDa. Los números de acceso de GenBank™ BC152381 y BC152386 proporcionan las secuencias de ácidos nucleicos de GITR humano ilustrativas. El número de acceso de Swiss-Prot Q9Y5U5-1 (TNR18_HUMAN; SEQ ID NO: 701) y el número de acceso de GenBank™ NP_004186 proporcionan secuencias de aminoácidos de GITR humano ilustrativas de la isoforma 1. Esta secuencia de aminoácidos es de 241 aminoácidos de longitud con los primeros 25 residuos de aminoácidos que codifican la secuencia señal. La isoforma 1 es una proteína de membrana de tipo I. Una secuencia de aminoácidos madura ilustrativa de GITR humano se proporciona como la SEQ ID NO: 700. Por el contrario, la isoforma 2 es una forma secretada de GITR humano y es de aproximadamente 255 aminoácidos de longitud. El número de acceso de Swiss-Prot Q9Y5U5-2 y el número de acceso de GenBank™ NP_683699 proporcionan secuencias de aminoácidos de GITR humano ilustrativas de la isoforma 2. La isoforma 3 de GITR humano es de aproximadamente 234 aminoácidos de longitud. El número de acceso de Swiss-Prot Q9Y5U5-3 y el número de acceso de GenBank™ NP_683700 (precursor de la isoforma 3) proporcionan secuencias de aminoácidos de GITR humano ilustrativas de la isoforma 3. En una realización específica, el GITR es GITR humano. En otra realización específica, el GITR es la isoforma 1 de GITR humano (SEQ ID NO: 701). En ciertas realizaciones, el GITR es la isoforma 2 (SEQ ID NO: 702) o la isoforma 3 (SEQ ID No : 703) de GITR humano. El GITR también se conoce como miembro 18 de la superfamilia del receptor del factor de necrosis tumoral (TNFTSF18), receptor de la familia de TNFR inducible por activación (AITR), G iTR-D y CD357. El GITR humano se designa como GeneID: 8784 en Entrez Gene.
La secuencia de aminoácidos de una forma inmadura de una proteína GITR ilustrativa de mono cynomolgus se proporciona en SEQ ID NO: 704. La forma madura de esta proteína ilustrativa son los aminoácidos 26-234 de SEQ ID NO: 704.
Como se usa en la presente memoria, los términos “ligando de GITR” y “GITRL” se refieren a ligando de la proteína relacionada con TNFR inducida por glucocorticoides. El GITRL también se conoce como ligando relacionado con TNF inducido por activación (AITRL) y como miembro 18 de la superfamilia de ligandos del factor de necrosis tumoral (TNFSF18). El número de acceso de GenBank™ AF125303 proporciona una secuencia de ácido nucleico de GITRL humano ilustrativa. El número de acceso de GenBank™ NP_005083 y el número de acceso de Swiss-Prot Q9UNG2 proporcionan secuencias de aminoácidos de GITRL humano ilustrativas. En una realización particular, el GITRL es un GITRL humano de SEQ ID NO: 716.
Como se usa en la presente memoria, el término “célula huésped” puede ser cualquier tipo de célula, por ejemplo, una célula primaria, una célula en cultivo, o una célula de una línea celular. En realizaciones específicas, el término “célula huésped” se refiere a una célula transfectada con una molécula de ácido nucleico y la progenie o la progenie potencial de tal célula. La progenie de tal célula no es necesariamente idéntica a la célula parental transfectada con la molécula de ácido nucleico, por ejemplo, debido a mutaciones o influencias ambientales que pueden producirse en generaciones sucesivas o la integración de la molécula de ácido nucleico en el genoma de la célula huésped.
Como se usa en la presente memoria, el término “cantidad eficaz” en el contexto de la administración de una terapia a un sujeto se refiere a la cantidad de una terapia que logra un efecto profiláctico o terapéutico deseado. En la Sección 5.4.1.3 se proporcionan ejemplos de cantidades eficaces, más abajo.
Como se usan en la presente memoria, los términos "sujeto" y "paciente" se usan indistintamente. El sujeto puede ser un animal. En algunas realizaciones, el sujeto es un mamífero tal como un no primate (por ejemplo, vaca, cerdo, caballo, gato, perro, rata, etc.) o un primate (por ejemplo, mono o ser humano), con la máxima preferencia, un ser humano. En ciertas realizaciones, tales términos se refieren a un animal no humano (por ejemplo, un animal no humano tal como un cerdo, caballo, vaca, gato, o perro). En algunas realizaciones, tales términos se refieren a una mascota o un animal de granja. En realizaciones específicas, tales términos se refieren a un ser humano.
reve descripción de las figuras
La Figura 1 es una transferencia de Western en condiciones no reductoras que muestra la especificidad del anticuerpo anti-GITR 231-32-15 frente a un control de isotipo. El anticuerpo se transfiere contra proteína recombinante GITR humana (proteína recombinante Hu GITR), proteína recombinante GITR de ratón (proteína recombinante Mu GITR), células CMS5A que expresan GITR humano recombinante (CMS5A-huGITR), células CMS5A de tipo silvestre (CMS5A-wt), proteína de células activadas CD4+ (CD4+ activada) y proteína de células sin tratar CD4+ (CD4+ sin tratar). Se observa reactividad de 231-32-15 contra GITR humano, GITR humano recombinante en células CMS5A y GITR humano natural en células CD4+ activadas.
Las Figuras 2A y 2B muestran el análisis FACS de la unión competitiva de los anticuerpos anti-GITR frente al AcM anti-GITR comercial (R&D Systems). En la Figura 2A, el bloqueo del AcM de R&D Systems se prueba mediante el uso del AcM de R&D y los anticuerpos de prueba (anticuerpo 1042-7, anticuerpo 1039-45, anticuerpo 1333-21 y anticuerpo 32-15) como se indica en la figura. La condición 'sin anticuerpo' muestra la unión del AcM de R&D Systems solo, en ausencia de anticuerpos de prueba. La Figura 2B muestra el bloqueo del anticuerpo anti-GITR 231-1039-45 sin AcM, el AcM de R&D Systems y los anticuerpos de prueba (anticuerpo 1042-7, anticuerpo 1039-45, anticuerpo 1333-21 y anticuerpo 32-14) como se indica en la figura. La condición 'sin anticuerpo' muestra la unión del anticuerpo 231-1039-45 solo, en ausencia de anticuerpos de prueba.
Figuras 3A, 3B y 3C: La Figura 3A representa la tinción de CMS5A-GITR por anticuerpos 1333-21 lote 1, 1333 21 lote 2 y anticuerpo de R&D a concentraciones variables de anticuerpo. La Figura 3B representa gráficamente la intensidad de fluorescencia de las células PBMC CD3-CD19-GITR+ y CD4+CD25+GITR+ ex-vivo en la tinción con los anticuerpos 1042-7, 32-15, 1039-45, 1333-21 y el anticuerpo de R&D. La Figura 3C proporciona el análisis FACS de células CD3-CD19-GITR+ y CD4+CD25+GITR+ por el anticuerpo 1333-21 y el anticuerpo de R&D Systems.
La Figura 4 representa una evaluación del efecto coestimulador del anticuerpo anti-GITR sobre las células T CD4+ en combinación con concentraciones variables de anticuerpo anti-CD3 (OKT3). En el panel superior, el % de células con bajo contenido de CFSE se representa para cada anticuerpo ensayado (control con PBS, R&D, 1042-7, 32-15, 1039-45 y 1333-21) en combinación con concentraciones decrecientes de anticuerpo OKT3 (5 |jg/ml, 1 |jg/ml, 0,2 jg/ml, 0,04 jg/ml y 0 jg/ml). En el panel inferior, se representa gráficamente la concentración de IFNy (pg/ml) para cada anticuerpo ensayado (control con PBS, R&D, 1042-7, 32-15, 1039-45 y 1333-21) en combinación con concentraciones decrecientes del anticuerpo OKT3 (5 jg/ml, 1 jg/ml, 0,2 jg/ml, 0,04 jg/ml y 0 jg/ml).
La Figura 5 muestra la unión de GITRL-PE a GITR en presencia de anticuerpos anti-GITR parental quimérico 231-32-15 y m6C8. Un anticuerpo adicional SK48E26, que reconoce IL-1p, se usó como control negativo. El porcentaje de unión de GITRL-Pe se midió mediante tecnología de matriz de suspensión (sistema Luminex® 200) en presencia de concentraciones crecientes de anticuerpos (12, 37, 111, 333, 1.000, 3.000 y 9.000 ng/ml). La Figura 5 muestra los resultados de cuatro repeticiones independientes de este ensayo realizado por duplicado y se determinó la desviación estándar de n=8.
La Figura 6 es un gráfico similar al que se muestra en la Figura 5 donde el porcentaje de unión de GITRL-PE se midió mediante tecnología de matriz de suspensión (sistema Luminex® 200) en presencia de concentraciones crecientes de anticuerpos (12, 37, 111, 333, 1.000, 3.000 y 9.000 ng/ml). Los anticuerpos anti-GITR ensayados fueron el anticuerpo parental quimérico 231-32-15 y las dos variantes humanizadas Hum231#1 y Hum231#2. Esta figura muestra los resultados de un experimento realizado por duplicado.
La Figura 7 muestra la unión del ligando de GITR a GITR en presencia de varios AcM medido por resonancia de plasmones de superficie (BIAcore® T100/200). Los anticuerpos anti-GITR ensayados fueron parental quimérico 231-32-15, variantes humanizadas Hum231#1 y Hum231#2 y m6C8. El control negativo fue el anticuerpo anti-IL-1P SK48E26.
Las Figuras 8A y 8B muestran gráficos FACS de los resultados de un ensayo de estimulación de CD3 subóptima para evaluar los efectos de la estimulación de anticuerpos anti-GITR sobre células T CD4+ enriquecidas a partir de dos capas leucocitarias diferentes. La Figura 8A muestra el análisis FACS del número de células y la proliferación de células T CD4 de un respondedor alto a la estimulación (capa leucocitaria 6), mientras que la Figura 8B muestra el análisis FACS para un respondedor bajo (capa leucocitaria 8). Se muestra la proliferación celular (CFSE; eje x) para 10 jg/ml de anticuerpo anti-GITR (anticuerpo parental quimérico 231-32-15 y variantes humanizadas Hum231#1 y Hum231#2). Los controles usados fueron ya sea anticuerpo anti-CD3/anti-CD28 solo o sin estimulación. El ensayo se realizó por triplicado.
Las Figuras 9A y 9B son histogramas que muestran el efecto de las variantes de anticuerpos humanizados anti-GITR Hum231#1 y Hum231#2 sobre la proliferación de células T CD4 enriquecidas (Figura 9A) y el número de células (Figura 9B), en comparación con el anticuerpo m6C8, en un ensayo de estimulación de CD3 subóptima. Los anticuerpos se usaron a una concentración de 10 jg/ml. La columna final (relleno negro sólido; Figuras 9A y 9B) indica estimulación anti-CD3/anti-CD28 sin la adición de ningún anticuerpo anti-GITR.
Las Figuras 10A, 10B, 10C y 10D muestran el análisis de la producción de citocinas para IFNy, IL-6, IL-10 y TNFa, respectivamente, inducida por la administración de anticuerpos anti-GITR en un ensayo de estimulación de CD3 subóptima. Los anticuerpos anti-GITR ensayados fueron parental quimérico 231-32-15 y variantes humanizadas Hum231#1 y Hum231#2 a concentraciones de 10 pg/ml y 5 pg/ml.
La Figura 11 es un histograma que muestra la titulación adicional de anticuerpos anti-GITR y su efecto sobre la proliferación celular en un ensayo de estimulación de CD3 subóptima. El anticuerpo parental quimérico 231-32 15 y las variantes humanizadas Hum231#1 y Hum231#2 se usaron a concentraciones de 10 pg/ml, 5 pg/ml y 2,5 pg/ml.
Las Figuras 12A y 12B muestran la titulación adicional de anticuerpos anti-GITR y su efecto sobre la producción de IFNy en un ensayo de estimulación de CD3 subóptima. El anticuerpo parental quimérico 231-32-15 y las variantes humanizadas Hum231#1 y Hum231#2 se usaron en concentraciones de 10 pg/ml, 5 pg/ml y 2,5 pg/ml como unidas a placa (Figura 12A) o 20 pg/ml, 10 pg/ml y 5 pg/ml como anticuerpos solubles (Figura 12b ).
La Figura 13 es un conjunto de gráficos de barras que muestran los resultados de la coestimulación con 5 pg/ml de Hum231#2 unido a placa sobre la secreción de citocinas por PBMC en un ensayo de estimulación de CD3 subóptima. Los datos mostrados en la Figura 13 son de dos donantes ensayados el día 2 y el día 4 después de la estimulación. Se representó gráficamente la inducción máxima en veces sobre el control de isotipo para seis citocinas diferentes (IFNy, IL-2, TNFa, IL-10, IL-13 e IL-4). Las barras de error representan la desviación estándar para una réplica de dos para cada citocina. Cada donante se ha ensayado en al menos tres experimentos individuales.
Las Figuras 14A, 14B y 14C son resultados de ensayos de tinción de citocinas intracelulares que miden la producción de IFNy y TNFa, inducida por Hum231#2, Hum23 1#2w o pab1989 unidos a placa (la contraparte IgG4 de Hum231#2w) en estimulación de CD3 subóptima. La Figura 14A es un conjunto de gráficos de citometría de flujo que muestran la tinción conjunta de IFNy y TNFa para células T CD4+ y CD8+. El porcentaje de células T monofuncionales IFNy+, células T monofuncionales TNFa+ o células T polifuncionales IFNy+ TNFa+ se representó para Hum231#2, Hum231#2w, pab1989 o control de isotipo en un intervalo de concentraciones de anticuerpos anti-CD3 subóptimas (Figuras 14B y 14C). Cada punto en las Figuras 14B y 14C representa una réplica de dos para la condición ensayada. Las barras de error representan la desviación estándar. Los anticuerpos anti-GITR se usaron a una concentración de 5 pg/ml. Los gráficos son representativos de experimentos que usan PBMC de seis (Figuras 14A y 14B) y cuatro (Figura 14C) donantes diferentes, respectivamente.
Las Figuras 15A, 15B y 15C son un conjunto de gráficos de barras que muestran los resultados de experimentos que comparan el anticuerpo anti-GITR Hum231#2 en diferentes condiciones de reticulación. La Figura 15A es un gráfico de barras que muestra la inducción máxima en veces del control de isotipo para el porcentaje de células T CD8+ polifuncionales IFNy+ TNFa+ mediante el uso de PBMC coestimuladas por 5 pg/ml de Hum231#2 unido a placa (PB) o soluble o control de isotipo. Las barras de error representan la desviación estándar. * representa p < 0,05 y ** representa p < 0,005 (prueba T no pareada). En las Figuras 15B y 15C, se representó gráficamente la inducción máxima en veces sobre el control de isotipo para seis citocinas diferentes para ya sea Hum231#2 unido a placa (Figura 15B) o Hum231#2 reticulado anti-Fc (Figura 15C). Las barras de error representan la desviación estándar de una réplica de dos para cada citocina.
Las Figuras 16A y 16B muestran los resultados de la estimulación de anticuerpos anti-CD3/anti-CD28 y anti-GITR sobre células T efectoras (T-eff) y T reguladoras (Tregs). La Figura 16A muestra que las células T-efectoras y T reguladoras activadas expresan GITR en su superficie celular después de la estimulación con anti-CD3/anti-CD28 solo o junto con anticuerpos anti-GITR. Sin embargo, como se muestra en la Figura 16B, la coestimulación con anticuerpos anti-GITR expande, preferentemente, las células T efectoras por sobre las células T reguladoras. Se muestra la expansión/proliferación celular (CFSE; eje y) para 10 pg/ml de anticuerpos anti-GITR (anticuerpo parental quimérico 231-32-15 y variantes humanizadas Hum231#1 y Hum231#2) en la capa leucocitaria 8. Los controles usados fueron ya sea anticuerpo anti-CD3/anti-CD28 a 125 ng/ml solo o sin estimulación.
Las Figuras 17A y 17B muestran los resultados sobre la proliferación de células T por los anticuerpos anti-GITR ensayados. La Figura 17A muestra la proliferación de células CD4 y la Figura 17B muestra la proliferación de células CD8 en PBMC totales estimuladas con 31,25 ng/ml de anticuerpo anti-CD3. Se ensayaron el anticuerpo parental quimérico 231-32-15 y las variantes humanizadas Hum231#1 y Hum231#2 a una concentración de 10 pg/ml.
Las Figuras 18A, 18B y 18C son gráficos que muestran los resultados de un ensayo reportero de NF-kB-luciferasa de GITR en ausencia o presencia de 0,3 pg/ml de un anticuerpo anti-CD3 unido a placa (Clon SP34). La Figura 18A es un gráfico que muestra las unidades relativas de luz de luciferasa (RLU) en un intervalo de concentraciones de anticuerpo anti-GITR a las 18 horas posteriores a la estimulación en presencia del anticuerpo
anti-CD3. La Figura 18B es un gráfico que muestra las RLU de luciferasa a diferentes concentraciones de anticuerpo anti-GITR a las 5 horas posteriores a la estimulación en ausencia del anticuerpo anti-CD3. La Figura 18C es un gráfico que muestra las mayores proporciones de expresión de luciferasa (Ac de GITR/control de isotipo) a las 0, 2, 5, 6, 8 y 18 horas posteriores a la estimulación. Las barras de error representan la desviación estándar de los duplicados. Los anticuerpos anti-GITR ensayados fueron Hum231#2w y m6C8. Los datos mostrados son representativos de cuatro experimentos con anticuerpo anti-CD3 o dos experimentos sin anticuerpo anti-CD3.
La Figura 19A es un gráfico de barras que muestra la densidad normalizada del receptor de GITR humano en nTregs activados, células T CD4+ o células T CD8+ según se mide mediante citometría de flujo. El anticuerpo anti-GITR usado fue un anticuerpo anti-GITR humano de ratón conjugado con PE (Biolegend: 621; 311604/B171072). Las barras de error representan la desviación estándar. La Figura 19B es un gráfico que examina el anticuerpo anti-GITR Hum231#2w mediante el uso de una línea celular indicadora del receptor Fc gamma IIIA (CD16). Células reporteras de NFAT-luciferasa Jurkat que sobreexpresan CD16A con el polimorfismo 158 V/V de alta afinidad se cultivaron conjuntamente con nTregs primarios activados y células T efectoras durante 20 horas a 37 °C en presencia de Hum231#2w o un control de isotipo. Las unidades relativas de luz (RLU) se registraron después de 20 horas, lo que representa la unión de CD16A. A RLU representa las RLU del anticuerpo anti-GITR menos las del control de isotipo. Las barras de error representan la desviación estándar (n=2). Los datos mostrados son representativos de experimentos que usan células de tres donantes. La Figura 19C es un conjunto de histogramas que muestran la expresión en superficie de GITR medida por citometría de flujo. Se recolectaron muestras de sangre de donantes humanos sanos (a-c, n=3) o de tejidos tumorales de pacientes con cáncer de pulmón de células no pequeñas (NSCLC) (d-f, n=3). Las poblaciones celulares se definieron como: Tconv (c D3+, CD4+, CD8a-, CD25baja, FOXP3-) o Treg (CD3+, c D4+, CD8a-, CD25alta, FOXP3+).
Las Figuras 20A, 20B y 20C son los resultados de experimentos que usan PBMC de mono verde africano (AGM). La Figura 20A es un conjunto de gráficos de citometría de flujo de la tinción de células T CD4+ y CD8+ activadas de mono verde africano (AGM) mediante el uso del anticuerpo anti-GITR Hum231#2 y un anticuerpo anti-PD-1. Se activaron PBMC de AGM sanas con anticuerpo anti-CD3 (clon SP34.2) o ConA más IL-2 (20 U/ml) durante 3 días. Los gráficos de citometría de flujo son representativos de experimentos que usan PBMC de tres AGM diferentes. Las Figuras 20B y 20C son resultados de un ensayo de subestimulación de CD3 mediante el uso de PBMC de AGM. La Figura 20B es un par de gráficos de citometría de flujo que muestran la tinción conjunta de CD8 e IFNy para células coestimuladas por Hum231#2w o control de isotipo. En la Figura 20C, se representó gráficamente el porcentaje de células T IFNy+ de AGM CD8+ para diferentes concentraciones de anticuerpos anti-GITR. Cada punto representa una réplica de dos pocillos y las barras de error representan la desviación estándar. Los datos mostrados en las Figuras 20B y 20C son representativos de experimentos que usan PBMC de dos AGM.
Las Figuras 21A y 21B son los resultados de la tinción de OX40 y PD-1 en superficie en células T CD4+ y CD8+ estimuladas con 0,8 pg/ml de un anticuerpo anti-CD3 unido a placa y 5 pg/ml del anticuerpo anti-GITR Hum231#2. La Figura 2 lA es un conjunto de histogramas y gráficos de citometría de flujo que muestran la tinción conjunta de OX40 y PD-1. En la Figura 21B, cada barra representa el valor de MFI para PD-1 y OX40 en células T CD4+ y CD8+ estimuladas con Hum231#2 (barras negras), control de isotipo (barras grises) o solo medio (barras blancas). Las barras de error representan la desviación estándar. Los diagramas y gráficos de citometría de flujo son representativos de experimentos que usan PBMC de un donante.
Las Figuras 22A y 22B muestran el diseño de las bibliotecas mutadas para la generación de variantes de anticuerpos de línea germinal. Las diferentes posiciones de marco y CDR incluidas en la biblioteca en base a la línea germinal humana IGHV1-2*02 VH se muestran en la Figura 22a (SEQ ID NOS 37-53, respectivamente, en orden de aparición) y para la biblioteca en base a la línea germinal humana IGKV4-1*01 VL en la Figura 22B (SEQ ID nOs 54-71, respectivamente, en orden de aparición).
La Figura 23 es una tabla que enumera 17 variantes de anticuerpos de línea germinal y que detalla sus regiones variables de cadena pesada y ligera con los correspondientes números de identidad de secuencia. La tabla muestra el número de aminoácidos extra de la línea germinal y la afinidad relativa media de las variantes de anticuerpos en comparación con el anticuerpo parental quimérico 231-32-15.
Las Figuras 24A-C son una tabla que enumera 107 variantes de anticuerpos de línea germinal y que detallan sus regiones variables de cadena pesada y ligera con los correspondientes números de identidad de secuencia.
Las Figuras 25A y 25B muestran la unión de GITRL-PE a GITR en presencia de una selección de variantes de anticuerpos anti-GITR de línea germinal. El porcentaje de unión de GITRL-PE se midió mediante tecnología de matriz de suspensión (sistema Luminex® 200) en presencia de concentraciones crecientes de anticuerpos (12, 37, 111, 333, 1.000, 3.000 y 9.000 ng/ml).
Las Figuras 26A y 26B muestran el efecto sobre la proliferación celular (% CFSE bajo) de las variantes de anticuerpos de línea germinal en comparación con el anticuerpo parental quimérico 231-32-15 y las variantes humanizadas Hum231#1 y Hum231#2 en células T CD4 enriquecidas de dos capas leucocitarias, BC4 (Figura 26A) y BC9 (Figura 26B). Se realizó un ensayo de estimulación de CD3 subóptima mediante el uso de anticuerpo anti-CD3 unido a placa a 125 ng/ml con ya sea control de isotipo unido a placa o soluble. Se usaron anticuerpos anti-GITR a una concentración de 10 pg/ml.
Las Figuras 27A y 27B muestran el efecto sobre la liberación de citocinas de IFNy e IL-10, respectivamente, de las variantes de anticuerpos de línea germinal en comparación con el anticuerpo parental quimérico 231-32-15 y las variantes humanizadas Hum231#1 y Hum231#2 en células T CD4 enriquecidas de capa leucocitaria BC4. Se realizó un ensayo de estimulación de CD3 subóptima mediante el uso de anticuerpo anti-CD3 unido a placa a 125 ng/ml con ya sea control de isotipo unido a placa o soluble. Se usaron anticuerpos anti-GITR a una concentración de 10 pg/ml y se midieron los niveles de citocinas en el sobrenadante del cultivo.
Las Figuras 28A y 28B muestran el efecto sobre la liberación de citocinas de IFNy e IL-10, respectivamente, de las variantes de anticuerpos de línea germinal en comparación con el anticuerpo parental quimérico 231-32-15 y las variantes humanizadas Hum231#1 y Hum231#2 en células T CD4 enriquecidas de la capa leucocitaria BC9. Se realizó un ensayo de estimulación de CD3 subóptima mediante el uso de anticuerpo anti-CD3 unido a placa a 125 ng/ml con ya sea control de isotipo unido a placa o soluble. Se usaron anticuerpos anti-GITR a una concentración de 10 pg/ml y se midieron los niveles de citocinas en el sobrenadante del cultivo.
Las Figuras 29A y 29B muestran el porcentaje de células T CD4+ positivas para IFNy (medidas mediante tinción intracelular) de variantes de anticuerpos de línea germinal en comparación con el anticuerpo parental quimérico 231-32-15 y las variantes humanizadas Hum231#1 y Hum231#2 en células T CD4 enriquecidas de dos capas leucocitarias. La Figura 29A muestra los resultados de la capa leucocitaria 13 (BC13) y la Figura 29B muestra los resultados de la capa leucocitaria 18 (BC18).
Las Figuras 30A-C son un conjunto de gráficos que muestran los resultados de un ensayo reportero de GITR NF-KB-luciferasa en presencia de 0,3 pg/ml de anticuerpo anti-CD3. Los anticuerpos anti-GITR ensayados en este ensayo fueron Hum231#2w y 20 variantes de la línea germinal: pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, pab2159, pab2160 y pab2161. En las Figuras 30A-C, se representó gráficamente las RLU de luciferasa a las 18 horas posteriores a la estimulación para diferentes concentraciones de anticuerpos anti-GITR ensayadas. Las barras de error representan la desviación estándar. Las Figuras 30D-F son un conjunto de gráficos que muestran los resultados de un ensayo reportero de GITR NF-KB-luciferasa en ausencia de un anticuerpo anti-CD3. Los anticuerpos anti-GITR ensayados en este ensayo fueron m6C8, Hum231#2w y 20 variantes de la línea germinal: pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, pab2159, pab2160 y pab2161. En las Figuras 30D-F, se representó gráficamente las RLU de luciferasa a las 6 horas posteriores a la estimulación para diferentes concentraciones de anticuerpos anti-GITR ensayadas. Las barras de error representan la desviación estándar. Los gráficos y diagramas son representativos de los datos de dos experimentos (Figuras 30A-C) o un experimento (Figuras 30D-F).
La Figura 31 muestra la pérdida de unión de células pre-B 1624-5 que expresan el anticuerpo parental quimérico 231-32-15 a GITR biotinilado (GITR-bio) cuando GITR-bio se preincubó con anticuerpo parental quimérico 231 32-15, Hum231#1 o Hum231#2. El perfil de la derecha de la Figura 31 representa la unión de células pre-B 1624 5 que expresan el anticuerpo parental quimérico 231-32-15 a GITR-bio. En el perfil de la izquierda, sin embargo, existe pérdida de unión de células 1624-5 que expresan el anticuerpo parental quimérico 231-32-15 a GITR-bio después de la preincubación de GITR-bio con ya sea los anticuerpos parental quimérico 231-32-15, Hum231#1 o Hum231#2.
La Figura 32 muestra los resultados de un ensayo de competencia por epítopo medido mediante resonancia de plasmones de superficie (BIAcore® T100/200). El antígeno GITR se inmovilizó en un chip sensor CM5 y los anticuerpos anti-GITR se aplicaron a una concentración de 300 nM. El anticuerpo parental quimérico 231-32-15 se aplicó primero seguido de la aplicación del anticuerpo murino 6C8.
La Figuras 33A y 33B son los resultados de un experimento de mapeo de epítopos mediante el uso de una biblioteca celular que expresa variantes de GITR generadas mediante PCR propensa a error. En las Figuras 33A y 33B se muestra una alineación de secuencias de las variantes de GITR que se unen a un anticuerpo policlonal anti-GITR, pero no se unen al anticuerpo parental quimérico 231-32-15 anti-GITR.
La Figuras 34A y B son el resultado de un experimento de mapeo de epítopos mediante el uso de barrido de alanina. Las siguientes posiciones en el GITR humano (enumeradas de acuerdo con SEQ ID NO: 701) se mutaron por separado a una alanina: P28A, T29A, G30A, G31A, P32A, T54A, T55A, R56A, C57A, C58A, r59A, D60A, Y61A, P62A, G63A, E64A, E65A, C66A, C67A, S68A, E69A, W70A, D71A, C72A, M73A, C74A, V75A y Q76A. Los anticuerpos ensayados en el experimento que se muestra en la Figura 34A incluyeron: los
anticuerpos monoclonales Hum231#2, tres variantes de la línea germinal (pab1967, pab1975 y pab1979) y el anticuerpo m6C8; y un anticuerpo anti-GITR policlonal (AF689, R&D systems). La Figura 34A es una tabla que resume la unión de Hum231#2, tres variantes de la línea germinal (pab1967, pab1975 y pab1979) y el anticuerpo de referencia m6C8 a células 1624-5 que expresan mutantes de alanina de GITR humano. La Figura 34B es un conjunto de gráficos de citometría de flujo que muestran la tinción de células 1624-5 que expresan GITR humano de tipo silvestre, mutante D60A, o mutante G63A mediante el uso de los anticuerpos monoclonales 231-32-15, Hum231#2 o m6C8, o un anticuerpo policlonal. El porcentaje de células positivas a GITR se indica en cada gráfico.
La Figura 35A es una alineación de secuencias de GITR humano, GITR de cynomolgus V1M, y GITR de cynomolgus V1M/Q62P/S63G, y se resaltan las posiciones 62 y 63 donde dos aminoácidos de GITR de cynomolgus (GlnSer) se reemplazaron por los residuos correspondientes en el GITR humano (ProGly). La Figura 35B es un conjunto de gráficos de citometría de flujo que muestran la tinción de células 1624-5 que expresan GITR humano, GITR de cynomolgus V1M, o GITR de cynomolgus V1M/Q62P/S63G mediante el uso de los anticuerpos monoclonales 231-32-15, Hum231#2 o m6C8, o un anticuerpo policlonal anti-GITR.
5 Descripción detallada
En la presente memoria se proporcionan anticuerpos (por ejemplo, anticuerpos monoclonales), y fragmentos de unión a antígeno de este, que se unen específicamente a GITR (por ejemplo, GITR humano) y modulan la actividad de GITR. Por ejemplo, en un aspecto, se proporciona en la presente memoria un anticuerpo(s) o fragmento(s) de este que se une(n) específicamente a GITR y potencian, inducen o aumentan una o más actividades de GITR. En una realización específica, se aísla el(los) anticuerpo(s) o fragmento(s) de unión a antígeno.
También se proporcionan ácidos nucleicos aislados (polinucleótidos), tales como ADN complementario (ADNc), que codifican tales anticuerpos, y fragmentos de unión a antígeno de estos. Además, se proporcionan vectores (por ejemplo, vectores de expresión) y células (por ejemplo, células huésped) que comprenden ácidos nucleicos (polinucleótidos) que codifican tales anticuerpos o fragmentos de unión a antígeno de estos. También se proporcionan procedimientos para producir tales anticuerpos. En otros aspectos, se proporcionan en la presente procedimientos y usos para inducir, aumentar, o potenciar una actividad de GITR, y tratar ciertas afecciones, tales como cáncer y enfermedades infecciosas. También se proporcionan composiciones (por ejemplo, composiciones farmacéuticas), kits, y procedimientos de detección relacionados.
5.1 Anticuerpos
En un aspecto específico, se proporcionan en la presente memoria anticuerpos (por ejemplo, anticuerpos monoclonales, tales como anticuerpos quiméricos o humanizados) y fragmentos de estos que se unen específicamente a GITR (por ejemplo, GITR humano) como se define en las reivindicaciones. En algunos aspectos, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria inhibe parcialmente la unión de GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano). En ciertas realizaciones, un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria inhibe la unión de GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % según se evalúa mediante un ensayo conocido por un experto en la técnica o descrito en la presente memoria. En una realización específica, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria inhibe la unión de GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % según se evalúa mediante el ensayo descrito en el Ejemplo 2, más abajo (por ejemplo, las Secciones 6.2.5.2 o 6.2.5.4, más abajo). En otra realización específica, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 1.000 ng/ml, 950 ng/ml, 900 ng/ml, 850 ng/ml, 800 ng/ml, 750 ng/ml, 700 ng/ml, 650 ng/ml, 600 ng/ml, 550 ng/ml, 500 ng/ml, 450 ng/ml, 400 ng/ml, 350 ng/ml, 333 ng/ml, 300 ng/ml, 250 ng/ml, 200 ng/ml, 100 ng/ml, 50 ng/ml o 10 ng/ml inhibe la unión de 1,5 nM, 1.4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL-PE) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión al antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otra realización específica, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 1.000 ng/ml a 750 ng/ml, 1.000 ng/ml a 500 ng/ml, 850 ng/ml a 500 ng/ml, 750 ng/ml a 500 ng/ml, 600 ng/ml a 500 ng/ml, 500 ng/ml a 400 ng/ml, 400 ng/ml a 300 ng/ml o 300 ng/ml a 200 ng/ml inhibe la unión de 1.5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM, 0,1 nM de GITRL etiquetado (por ejemplo, GITRL-PE) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o
10 % con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otra realización específica, un anticuerpo o fragmento de unión a antígeno de este a una concentración de 1.000 ng/ml inhibe menos del 80 % (en algunas realizaciones, 40 % a 70 %, 50 % a 80 % o 40 % a 80 %) de 0,5 nM de la unión de GITRL etiquetado (por ejemplo, GITRL humano) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anti-GITR anticuerpo o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión.
En otra realización específica, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 3.500 ng/ml, 3.400 ng/ml, 3.300 ng/ml, 3.200 ng/ml, 3.100 ng/ml, 3.000 ng/ml, 2.900 ng/ml, 2.800 ng/ml, 2.700 ng/ml, 2.600 ng/ml, 2.500 ng/ml, 2.400 ng/ml, 2.300 ng/ml, 2.200 ng/ml, 2.100 ng/ml, 2.000 ng/ml, 1.900 ng/ml, 1.800 ng/ml, 1.700 ng/ml, 1.600 ng/ml, 1.500 ng/ml, 1.400 ng/ml, 1.300 ng/ml, 1.200 ng/ml o 1.100 ng/ml inhibe la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL-PE) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión al antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otra realización específica, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL marcado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en presencia de 1.000 ng/ml, 950 ng/ml, 900 ng/ml, 850 ng/ml, 800 ng/ml, 750 ng/ml, 700 ng/ml, 650 ng/ml, 600 ng/ml, 550 ng/ml, 500 ng/ml, 450 ng/ml, 400 ng/ml, 350 ng/ml, 333 ng/ml, 300 ng/ml, 250 ng/ml o 200 ng/ml de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 3.000 ng/ml inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 % o menos del 80 % (en algunas realizaciones, 60 % a 85 %, 60 % a 80 %, 70 % a 85 % o 70 % a 80 %) cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 1.000 ng/ml inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 %, menos del 80 % o menos del 75 % (en algunas realizaciones, 60 % a 85 %, 60 % a 80 %, 70 % a 85 % o 70 % a 80 %) cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 333 ng/ml inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 70 % o menos del 65 % (en algunas realizaciones, 50 % a 70 %, 55 % a 70 %, 50 % a 65 % o 50 % a 60 %) cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 111 ng/ml inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 65 %, menos del 60 % o menos del 55 % (en algunas realizaciones, del 40 % al 65 %, del 40 % al 60 %, del 40 % al 55 % o del 30 % al 60 %) cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 37 ng/ml inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a
GITR (por ejemplo, GITR humano) en menos del 40 % (en algunas realizaciones, 20 % a 40 %, 20 % a 30 % o 15 % a 35 %) cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 12 ng/ml inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 20 % (en algunas realizaciones, 10 % a 20 %) cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En ciertas realizaciones, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de GITRL (por ejemplo, GITRL humano) se une a GITR (por ejemplo, GITR humano) en presencia de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria evaluado mediante un ensayo conocido por un experto en la técnica o descrito en la presente memoria. En una realización específica, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de GITRL (por ejemplo, GITRL humano) se une a GITR (por ejemplo, GITR humano) en presencia de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria según se evalúa mediante el ensayo descrito en el Ejemplo 2, más abajo (por ejemplo, la Sección 6.2.5.2 o 6.2.5.4, más abajo). En otra realización específica, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITr humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en presencia de 1.000 ng/ml, 950 ng/ml, 900 ng/ml, 850 ng/ml, 800 ng/ml, 750 ng/ml, 700 ng/ml, 650 ng/ml, 600 ng/ml, 550 ng/ml, 500 ng/ml, 450 ng/ml, 400 ng/ml, 350 ng/ml, 333 ng/ml, 300 ng/ml, 250 ng/ml o 200 ng/ml de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión al antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otra realización específica, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en presencia de 1.000 ng/ml a 900 ng/ml, 1.000 ng/ml a 850 ng/ml, 900 ng/ml a 800 ng/ml, o 850 ng/ml a 750 ng/ml, o 800 a 750 ng/ml con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otra realización específica, al menos el 20 %, al menos el 25 % o al menos el 30 % de 0,5 nM de GITRL etiquetado (por ejemplo, GITRl humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en presencia de 1.000 ng/ml de un anticuerpo o fragmento de unión a antígeno de este con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR en una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión al antígeno de este en un ensayo de matriz de suspensión.
En otra realización específica, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM, 0,1 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en presencia de 3.500 ng/ml, 3.400 ng/ml, 3.300 ng/ml, 3.200 ng/ml, 3.100 ng/ml, 3.000 ng/ml, 2.900 ng/ml, 2.800 ng/ml, 2.700 ng/ml, 2.600 ng/ml, 2.500 ng/ml, 2.400 ng/ml, 2.300 ng/ml, 2.200 ng/ml, 2.100 ng/ml, 2.000 ng/ml, 1.900 ng/ml, 1.800 ng/ml, 1.700 ng/ml, 1.600 ng/ml, 1.500 ng/ml, 1.400 ng/ml, 1.300 ng/ml, 1.200 ng/ml, 1.100 ng/ml o 1.000 ng/ml de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1.1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otra realización específica, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml
por perla en presencia de 3.500 ng/ml a 3.200 ng/ml, 3.500 ng/ml a 3.000 ng/ml, 3.200 ng/ml a 2.500 ng/ml, 3.000 a 2.200 ng/ml, 2.500 ng/ml a 1.800 ng/ml, 2.000 ng/ml a 1.500 ng/ml, 1.700 ng/ml a 1.200 ng/ml, o 1.500 ng/ml a 1.000 ng/ml de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En otra realización específica, al menos el 20 %, al menos el 25 % o al menos el 30 % de 0,5 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en presencia de 3.000 ng/ml de un anticuerpo o fragmento de unión a antígeno de este con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR en una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En otra realización específica, al menos el 25 %, al menos el 30 %, al menos el 40 % o al menos el 50 % (en algunas realizaciones, del 25 % al 60 %, del 40 % al 60 %, del 40 % al 70 % o 25 % a 50 %) de 0,5 nM de GIt Rl etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en presencia de 1.000 ng/ml de un anticuerpo o fragmento de unión a antígeno de este con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR en una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En otra realización específica, al menos 30 %, al menos 40 %, al menos 50 % o al menos 60 % (en algunas realizaciones, 30 % a 60 %, 40 % a 60 %, 40 % a 70 % o 30 % al 50 %) de 0,5 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en presencia de 333 ng/ml de un anticuerpo o fragmento de unión a antígeno de este con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR en una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En otra realización específica, al menos 40 %, al menos 50 %, al menos 60 % o al menos 65 % (en algunas realizaciones, 40 % a 70 %, 40 % a 60 %, 40 % a 65 % o 40 % al 50 %) de 0,5 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en presencia de 111 ng/ml de un anticuerpo o fragmento de unión a antígeno de este con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR en una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En otra realización específica, al menos el 60 %, al menos el 70 % o al menos el 80 % (en algunas realizaciones del 60 % al 80 %, del 70 % al 80 % o del 75 % al 85 %) de 0,5 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en presencia de 37 ng/ml de un anticuerpo o fragmento de unión a antígeno de este con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR en una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión. En otra realización específica, al menos el 80 %, al menos el 85 % o al menos el 90 % (en algunas realizaciones del 80 % al 90 % o del 85 % al 95 %) de 0,5 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml/perla en presencia de 12 ng/ml de un anticuerpo o fragmento de unión a antígeno de este con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR en una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión
En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 3.000 ng/ml no inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 15 % o más del 20 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 1.000 ng/ml no inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 15 %, más del 20 % o más del 25 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 333 ng/ml no inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 30 % o más del 35 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o
fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 111 ng/ml no inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 35 %, más del 40 % o más del 45 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 37 ng/ml no inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 60 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En una cierta realización, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 12 ng/ml no inhibe la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 80 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este, en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En otra realización, una cierta cantidad de GITRL etiquetado (por ejemplo, GITRL-PE humano) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) en presencia de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria en un procedimiento que comprende: (a) acoplar GITR (por ejemplo, GITR humano) a perlas a una concentración de aproximadamente 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla; (b) incubar las perlas acopladas a GITR a una concentración de aproximadamente 30 perlas/pl, 40 perlas/pl o 50 perlas/pl con 3.000 ng/ml, 2.500 ng/ml, 2.000 ng/ml, 1.500 ng/ml, 1.000 ng/ml, 750 ng/ml, 500 ng/ml, 250 ng/ml, 100 ng/ml, 50 ng/ml, 25 ng/ml o 10 ng/ml de un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria en un pocillo durante un primer período de tiempo (por ejemplo, 30 minutos, 60 minutos, 1,5 horas, 2 horas, 2,5 horas o 3 horas); (c) añadir GITRL etiquetado (por ejemplo, GITRL-PE humano) al pocillo para obtener una concentración final de aproximadamente 1,5 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM del GITRL etiquetado y aproximadamente 15 perlas/pl, 20 perlas/pl o 25 perlas/pl, e incubar durante un segundo período de tiempo (por ejemplo, 30 minutos, 1 hora, 1,5 horas, 2 horas, 2,5 horas o 3 horas); y (d) detectar el GITRl etiquetado unido a las perlas acopladas a GITR en, por ejemplo, un ensayo de matriz de suspensión tal como el sistema Luminex® 200. En realizaciones específicas, la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en presencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este se determina con relación a la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en ausencia del anticuerpo anti-GITR o su fragmento de unión a antígeno. En ciertas realizaciones, la ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este significa que no está presente en el pocillo ningún anticuerpo o fragmento de unión a antígeno de este. En otras realizaciones, la ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este significa que un anticuerpo de control de isotipo que no se une a GITR está presente en el pocillo. De acuerdo con estas realizaciones, se determina que la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en presencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este es, en algunas realizaciones, al menos 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 % o 60 % o 15 % a 60 %, 20 % a 60 %, 30 % a 70 % o 20 % a 50 % de la cantidad del GITRL etiquetado unido a las perlas acopladas a GITR en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este.
En otra realización, una cierta cantidad de GITRL etiquetado (por ejemplo, GITRL-PE humano) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) en presencia de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria en un procedimiento que comprende: (a) acoplar GITR (por ejemplo, GITR humano) a perlas a una concentración de aproximadamente 5 pg/ml por perla; (b) incubar las perlas acopladas a GITR a una concentración de aproximadamente 40 perlas/pl con 3.000 ng/ml, 2.500 ng/ml, 2.000 ng/ml, 1.500 ng/ml, 1.000 ng/ml, 750 ng/ml, 500 ng/ml, 250 ng/ml, 100 ng/ml, 50 ng/ml o 10 ng/ml de un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria en un pocillo durante un primer período de tiempo (por ejemplo, 30 minutos, 60 minutos, 1,5 horas, 2 horas, 2,5 horas o 3 horas); (c) añadir GITRL etiquetado (por ejemplo, GITRL-PE humano) al pocillo para obtener una concentración final de 0,5 nM del GITRL etiquetado y aproximadamente 20 perlas/pl, e incubar durante un segundo período de tiempo (por ejemplo, 30 minutos, 1 hora, 1,5 horas, 2 horas, 2,5 horas o 3 horas); y (d) detectar el GITRL etiquetado unido a las perlas acopladas a GITR en, por ejemplo, un ensayo de matriz de suspensión tal como el sistema Luminex® 200. En realizaciones específicas, la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en presencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este se determina con relación a la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en ausencia del anticuerpo anti-GITR o su fragmento de unión a antígeno. En ciertas realizaciones, la ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este significa que no está presente en el pocillo ningún anticuerpo o fragmento de unión a antígeno de este. En otras realizaciones, la ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este significa que un anticuerpo de control de isotipo que no se une a GITR está presente en el pocillo. De acuerdo con estas realizaciones, se determina que la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en presencia
del anticuerpo anti-GITR o fragmento de unión a antígeno de este es, en algunas realizaciones, al menos 20 %,
25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 % o 60 % o 20 a 70 %, 20 % a 60 %, 30 % a 70 % o 20 % a 50 % de la cantidad del GITRL etiquetado unido a las perlas acopladas a GITR en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este.
En ciertas realizaciones, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 150 nM, 145 nM, 140 nM, 135 nM, 130 nM, 125 nM, 120 nM, 115 nM, 110 nM, 105 nM o
100 nM se une a GITR (por ejemplo, GITR humano) inmovilizado en un chip (por ejemplo, chip sensor CM5) inhibe la unión de 150 nM, 145 nM, 140 nM, 135 nM, 130 nM, 125 nM, 120 nM, 115 nM, 110 nM, 105 nM o 100 nM de GITRL (por ejemplo, trímero no unido covalentemente de GITRL humano) al GITR inmovilizado en el chip por menos del 60 %, menos del 55 %, menos del 50 %, menos del 45 %, menos del 40 %, menos del 35 %, menos del 30 %, menos del 25 %, menos del 20 % o menos del 15 %. En ciertas realizaciones, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria a una concentración de 125 nM unido a GITR (por ejemplo, GITR humano) inmovilizado en un chip (por ejemplo, chip sensor CM5) inhibe la unión de 125nM de GITRL (por ejemplo, trímero unido no covalentemente de GITRL humano) al GITR inmovilizado en el chip en menos del 60 %, menos del
55 %, menos del 50 %, menos del 45 %, menos del 40 %, menos del 35 %, menos del 30 %, menos del 25 %, menos del 20 % o menos del 15 %.
En ciertas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria se une a GITR (por ejemplo, GITR humano) con una constante de velocidad de disociación (kdisoc) de 8,5 x 10-3 s-1 o menos, 3,5 x 10-3 s-1 o menos, 5 x 10-3 s-1 o menos, 2,5 x 10-3 s-1 o menos, 1 x 10-3 s-1 o menos, 8,5 x 10-4 s-1 o menos, 5 x10-4 s-1 o menos, 3,5 x 10-4 s-1 o menos, 2,5 x 10-4 s-1 o menos, 1 x 10-4 s-1 o menos, 8,5 x 10-5- s-1 o menos, 3,5 x 10-5- s-1 o menos, 5 x 10-5- s-1 o menos, 2,5 x 10-5- s-1 o menos, 1 x 10-5- s-1 o menos, 8,5 x 10-6- s-1 o menos, 5 x10-6- s-1 o menos, 3,5 x 10-6- s-1 o menos, 2,5 x 10-6- s-1 o menos, 1 x 10-6- s-1 o menos, 8,5 x 10-7- s-1 o menos, 5 x 10-7- s-1 o menos, 2,5 x 10-7- s-1 o menos, 1 x 10-7- s-1 o menos, 8,5 x 10-8- s-1 o menos, 5 x 10-8- s-1 o menos, 2,5 x 10-8- s-1 o menos, 1 x 10-8- s-1 o menos, 8,5 x 10-9- s-1 o menos, 5 x 10-9 s-1 o menos, 2,5 x 10-9- s-1 o menos, o 1 x 10-9- s-1 o menos. En algunas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria se une a GITR
(por ejemplo, GITR humano) con una kdisoc de entre 9,5 x 10-5- s-1 a 1 x 10-9- s-1, 8,5 x 10-5- s-1 a 1 x 10-9- s-1, 5 x 10-5-s-1 a 1 x 10-9- s-1, 9,5 x 10-5- s-1 a 1 x 10-8- s-1, 5 x 10-5 s-1 a 1 x 10-8- s-1, 9,5 x 10-5- s-1 a 1 x 10-7- s-1, 5 x 10-5- s-1 a 1 x
10-7- s-1, 9,5 x 10-5- s-1 a 5 x 10-6- s-1, 9,5 x 10-5- s-1 a 1 x 10-5- s-1, 8,5 x 10-3 s-1 a 1 x 10-4 s-1, 5 x 10-3 s-1 a 2,5 x 10-4 s-1, 8,5 x 10-3 s-1, a 1 x 10-5 s-1, 8,5 x 10-5- s-1 a 5 x 10-5- s-1. En ciertas realizaciones, la kdisoc se determina mediante el uso de un anticuerpo monovalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En otras realizaciones, la kdisoc se determina mediante el uso de un anticuerpo bivalente según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En una realización particular, la kdisoc se determina mediante el uso de un ensayo descrito en la Sección
6, más abajo.
En ciertas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria se une a GITR (por ejemplo, GITR humano) con una constante de velocidad de asociación (kasoc) de al menos 105 M-1s-1, al menos 2,5 x
105 M-1S-1, al menos 3,5 x 105 M-1s-1, al menos 5 x 105 M-1S-1, al menos 106 M-1s-1, al menos 2,5 menos 3,5 x 106 M-1 s-1, al menos 5 x 106 M-1s-1, al menos 107 M-1 s-1, al menos 5 x 107 M-1 s-1, al menos 108 M-1s-1, al menos 5108 M-1s-1 o al menos 109 M-1s-1. En algunas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria se une a GITR (por ejemplo, GITR humano) con una kasoc de entre 1 x 105 m-1s-1 a 5 x 105 M-1s-1, 1 x 105 m-1s-1 a 1 x 106 M-1s-1, 3,5 x 105 m-1s-1 a 2,5 x 106 M-1s-1, 3,5 x 105 m-1s-1 a 3,5 x 106 M-1s-1, 1 x 105 m-1s-1 a
5 x 106 M-1s-1, 1 x 105 M-1s- a 1 x 107 M-1s-1, 1 x 105 M-1s-1 a 5 x 107 M-1S-1, 1 x 105 M-1s-1 a 108 M-1s-1, 1 x 105 M-1s-1 a 1 x 109 m-1s-1, 1 x 106 M-1s- a 1 x 107 M-1s-1, 1 x 106 m-1s-1 a 1 x 108 M-1s-1, 1 x 106 m-1s-1 a 1 x 109 M-1s-1, 1 x 107 m-1s-1 a 1 x 108 M-1s-1, 1 x 107 m-1s-1 a 1 x 109 M-1s-1, 1 x 108 m-1s-1 a 1 x 109 M-1s-1, En ciertas realizaciones, la kasoc se determina mediante el uso de un anticuerpo monovalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie de BIAcore®. En otras realizaciones, la kasoc se determina mediante el uso de un anticuerpo bivalente medido mediante, por ejemplo, tecnología de resonancia de plasmones de superficie de BIAcore®. En una realización particular, la kasoc se determina mediante el uso de un ensayo descrito en la Sección 6, más abajo.
En ciertas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria se une a GITR (por ejemplo, GITR humano) con una Kd de menos de 7 nM, 6 nM, 5 nM, 4,5 nM, 4 nM, 3,5 nM, 3 nM, 2,5 nM, 2 nM,
1,5 nM, 1 nM, 0,75 nM, 0,5 nM, 0,25 nM o 0,1 nM. En algunas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria se une a GITR (por ejemplo, GITR humano) con una Kd de aproximadamente 7 nM,
6 nM, 5 nM, 4,5 nM, 4 nM, 3,5 nM, 3 nM, 2,5 nM, 2 nM, 1,5 nM, 1 nM, 0,75 nM, 0,5 nM, 0,25 nM o 0,1 nM. En ciertas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria se une a GITR (por ejemplo, GITR humano) con una Kd de 7 nM a 2 nM, 5 nM a 3 nM, 5 nM a 1 nM, 4 nM a 3 nM, 4 nM a 2 nM, 3 nM a 2 nM, 3 nM a
1 nM, 2 nM a 1 nM, 3 nM a 0,1 nM, 2 nM a 0,1 nM, 1 nM a 0,1 nM o 0,5 nM a 0,1 nM. En ciertas realizaciones, la Kd se calcula como el cociente de kdisoc/kasoc y la kasoc y la kdisoc se determinan mediante el uso de un anticuerpo monovalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En otras realizaciones, la Kd se calcula como el cociente de kdisoc/kasoc y la kasoc y la kdisoc se determinan mediante el uso de un anticuerpo bivalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En una realización
específica, la Kd se determina como se expone en los Ejemplos de la Sección 6, más abajo (por ejemplo, Ejemplo 2).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) que comprende:
(a) una CDR1 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSX1X2X3X4X5X6X7KX8YLX9 (SEQ ID NO: 4), en la que:
X1 es L, A, V, I, P, F o M
X2 es L, A, V, I, P, F, M o S
X3 es N, G, Q, S, T, C, W, Y o A
X4 es S, G, N, Q, T, C, W, Y o A
X5 es G, N, Q, S, T, C, W, Y o A
Xa es N, G, Q, S, T, C, W, Y o A
X7 es Q, G, N, S, T, C, W, Y o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es T, G, N, Q, S, C, W, Y, V, I o A; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1ASTRX2X3 (SEQ ID NO: 5), en la que:
X1 es W, G, N, Q, S, T, C, Y, F, H o A
X2 es E, D o A
X3 es S, G, N, Q, T, C, W, Y o A; y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QX1X2YX3X4PYT (SEQ ID NO: 6), en la que:
X1 es N, G, Q, S, T, C, W o Y
X2 es D, E o Y
X3 es S, G, N, Q, T, C, W, Y o A
X4 es Y, G, N, Q, S, T, C, W, F, H, L o A.
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VL de uno de los anticuerpos en la Tabla 1. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la c DR3 de VL de uno de los anticuerpos en la Tabla 1. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL de uno de los anticuerpos en la Tabla 1 (por ejemplo, las CDR de VL en una fila de la Tabla 1, por ejemplo, todas las CDR de VL son del anticuerpo 231-32-15). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL descritas en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco (FR) de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila de la Tabla 3).
En otro aspecto, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena pesada (VH) que comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID NO: 1), en la que
X1 es D, E, G o A
X2 es A, V, L, I, P, F, M o Y
X3 es Y, G, N, Q, S, T, C, W, F o H; y/o
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1IX2X3X4SGX5X6X7YX8QKFX9X10 (SEQ ID NO: 2), en la que
X1 es V, A, L, I, P, F, M o T
X2 es R, K, H, Q o A
X3 es T, G, N, Q, S, C, W, Y, V, I o P
X4 es Y, G, N, Q, S, T, C, W, F, H o A
X5 es D, E, G o A
Xa es V, A, L, I, P, F, M o T
X7 es T, G, N, Q, S, C, W, Y, V, I, P o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es K, R, H, Q o A
X10 es D, E, G o A; y/o
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que
X1 es F, A, V, L, I, P, M, Y, W, H o S
X2 es A o D
X3 es Y, G, N, Q, S, T, C, W, F, H o V.
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VH de uno de los anticuerpos en la Tabla 2. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 2 (por ejemplo, las CDR de VH en una fila de la Tabla 2, por ejemplo, todas las CDR de VH son del anticuerpo 231-32-15). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende los marcos de VH descritos en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila de la Tabla 4).
Tabla 1. Secuencias de aminoácidos de CDR de VL
(continuación)
(continuación)
(continuación)
(continuación)
Tabla 2. Secuencias de aminoácidos de CDR de VH2
(continuación)
(continuación)
(continuación)
(continuación)
(continuación)
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GlTR humano), comprende una región variable de la cadena ligera (VL) que comprende:
(a) una CDR1 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSX1X2X3X4X5X6X7KX8YLX9 (SEQ ID NO: 4), en la que:
X1 es L, A, V, I, P, F o M
X2 es L, A, V, I, P, F, M o S
X3 es N, G, Q, S, T, C, W, Y o A
X4 es S, G, N, Q, T, C, W, Y o A
X5 es G, N, Q, S, T, C, W, Y o A
Xa es N, G, Q, S, T, C, W, Y o A
X7 es Q, G, N, S, T, C, W, Y o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es T, G, N, Q, S, C, W, Y, V, I o A; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1ASTRX2X3 (SEQ ID NO: 5), en la que:
X1 es W, G, N, Q, S, T, C, Y, F, H o A
X2 es E, D o A
X3 es S, G, N, Q, T, C, W, Y o A; y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QX1X2YX3X4PYT (SEQ ID NO: 6), en la que:
X1 es N, G, Q, S, T, C, W o Y
X2 es D, E o Y
X3 es S, G, N, Q, T, C, W, Y o A
X4 es Y, G, N, Q, S, T, C, W, F, H, L o A.
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VL de uno de los anticuerpos en la Tabla 5. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VL de uno de los anticuerpos en la Tabla 5. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la c DR3 de VL de uno de los anticuerpos en la Tabla 5. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL de uno de los anticuerpos en la Tabla 5 (por ejemplo, las CDR de VL en una fila de la Tabla 5, por ejemplo, todas las CDR de VL son del anticuerpo 231-32-15). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL descritas en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco (FR) de VL de un anticuerpo expuestas en la Tabla 7 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila de la Tabla 7).
En otro aspecto, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena pesada (VH) que comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID NO: 1), en la que
X1 es D, E, G o A
X2 es A, V, L, I, P, F, M o Y
X3 es Y, G, N, Q, S, T, C, W, F o H; y/o
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1IX2X3X4SGX5X6X7YX8QKFX9X10 (SEQ ID NO: 2), en la que
X1 es V, A, L, I, P, F, M o T
X2 es R, K, H, Q o A
X3 es T, G, N, Q, S, C, W, Y, V, I o P
X4 es Y, G, N, Q, S, T, C, W, F, H o A
X5 es D, E, G o A
Xa es V, A, L, I, P, F, M o T
X7 es T, G, N, Q, S, C, W, Y, V, I, P o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es K, R, H, Q o A
X10 es D, E, G o A; y/o
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que
X1 es F, A, V, L, I, P, M, Y, W, H o S
X2 es A o D
X3 es Y, G, N, Q, S, T, C, W, F, H o V.
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VH de uno de los anticuerpos en la Tabla 6. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VH de uno de los anticuerpos en la Tabla 6. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VH de uno de los anticuerpos en la Tabla 6. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 6 (por ejemplo, las CDR de VH en una fila de la Tabla 6, por ejemplo, todas las CDR de VH son del anticuerpo 231-32-15). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende los marcos de VH descritos en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 8 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila de la Tabla 8).
Tabla 5. Secuencias de aminoácidos de CDR de VL
(continuación)
(continuación)
Tabla 6. Secuencias de aminoácidos de CDR de VH2
(continuación)
(continuación)
En otro aspecto, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende:
(a) una CDR1 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSX1X2X3X4X5X6X7KX8YLX9 (SEQ ID NO: 4), en la que:
X1 es L, A, V, I, P, F o M
X2 es L, A, V, I, P, F, M o S
X3 es N, G, Q, S, T, C, W, Y o A
X4 es S, G, N, Q, T, C, W, Y o A
X5 es G, N, Q, S, T, C, W, Y o A
Xa es N, G, Q, S, T, C, W, Y o A
X7 es Q, G, N, S, T, C, W, Y o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es T, G, N, Q, S, C, W, Y, V, I o A; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1ASTRX2X3 (SEQ ID NO: 5), en la que:
X1 es W, G, N, Q, S, T, C, Y, F, H o A
X2 es E, D o A
X3 es S, G, N, Q, T, C, W, Y o A; y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QX1X2YX3X4PYT (SEQ ID NO: 6), en la que:
X1 es N, G, Q, S, T, C, W o Y
X2 es D, E o Y
X3 es S, G, N, Q, T, C, W, Y o A
X4 es Y, G, N, Q, S, T, C, W, F, H, L o A; y/o
(d) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID NO: 1), en la que
X1 es D, E, G o A
X2 es A, V, L, I, P, F, M o Y
X3 es Y, G, N, Q, S, T, C, W, F o H; y/o
(e) una CDR2 de VH que comprende, que consiste en o consiste esencialmente en la secuencia de aminoácidos X1IX2X3X4SGX5X6X7YX8QKFX9X10 (SEQ ID NO: 2), en la que
X1 es V, A, L, I, P, F, M o T
X2 es R, K, H, Q o A
X3 es T, G, N, Q, S, C, W, Y, V, I o P
X4 es Y, G, N, Q, S, T, C, W, F, H o A
X5 es D, E, G o A
Xa es V, A, L, I, P, F, M o T
X7 es T, G, N, Q, S, C, W, Y, V, I, P o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es K, R, H, Q o A
X10 es D, E, G o A; y/o
(f) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que
Xi es F, A, V, L, I, P, M, Y, W, H o S
X2 es A o D
X3 es Y, G, N, Q, S, T, C, W, F, H o V.
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres, cuatro, cinco o las seis CDR anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VL de uno de los anticuerpos en la Tabla 1. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o
fragmento de unión a antígeno de este comprende la CDR2 de VH de uno de los anticuerpos en la Tabla 2. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 2 (por ejemplo, las CDR de VH en una fila de la Tabla 2, por ejemplo, todas las CDR de VH son del anticuerpo 231-32-15). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL de uno de los anticuerpos en la Tabla 1 (por ejemplo, las CDR de VL en una fila de la Tabla 1, por ejemplo, todas las CDR de VL son del anticuerpo 231-32-15).
En otro aspecto, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) y una región variable de la cadena pesada (VH), en la que
(i) la VL comprende:
(a) una CDR1 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSX1X2X3X4X5X6X7KX8YLX9 (SEQ ID NO: 4), en la que:
X1 es L, A, V, I, P, F o M
X2 es L, A, V, I, P, F, M o S
X3 es N, G, Q, S, T, C, W, Y o A
X4 es S, G, N, Q, T, C, W, Y o A
X5 es G, N, Q, S, T, C, W, Y o A
Xa es N, G, Q, S, T, C, W, Y o A
X7 es Q, G, N, S, T, C, W, Y o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es T, G, N, Q, S, C, W, Y, V, I o A; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1ASTRX2X3 (SEQ ID NO: 5), en la que:
X1 es W, G, N, Q, S, T, C, Y, F, H o A
X2 es E, D o A
X3 es S, G, N, Q, T, C, W, Y o A; y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QX1X2YX3X4PYT (SEQ ID NO: 6), en la que:
X1 es N, G, Q, S, T, C, W o Y
X2 es D, E o Y
X3 es S, G, N, Q, T, C, W, Y o A
X4 es Y, G, N, Q, S, T, C, W, F, H, L o A; y
(ii) la VH comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID No : 1), en la que
X1 es D, E, G o A
X2 es A, V, L, I, P, F, M o Y
X3 es Y, G, N, Q, S, T, C, W, F o H; y/o
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1IX2X3X4SGX5X6X7YX8QKFX9X10 (SEQ ID NO: 2), en la que
X1 es V, A, L, I, P, F, M o T
X2 es R, K, H, Q o A
X3 es T, G, N, Q, S, C, W, Y, V, I o P
X4 es Y, G, N, Q, S, T, C, W, F, H o A
X5 es D, E, G o A
Xa es V, A, L, I, P, F, M o T
X7 es T, G, N, Q, S, C, W, Y, V, I, P o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es K, R, H, Q o A
X10 es D, E, G o A; y/o
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que
X1 es F, A, V, L, I, P, M, Y, W, H o S
X2 es A o D
X3 es Y, G, N, Q, S, T, C, W, F, H o V.
En aspectos específicos, la VL comprende dos o las tres CDR de VL anteriores y/o la VH comprende dos o las tres CDR de VH anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VL de uno de los anticuerpos en la Tabla 1. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VH de uno de los anticuerpos en la Tabla 2. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VH de uno de los anticuerpos en la Tabla 2. En ciertas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VH de uno de los anticuerpos en la Tabla 2. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 2 (por ejemplo, las CDR de VH en una fila de la Tabla 2). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL de uno de los anticuerpos en la Tabla 1 (por ejemplo, las CDR de VL en una fila en la Tabla 1).
En otro aspecto, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) que comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSLLNSX1NQKNYLX2 (SEQ ID NO: 10), en la que
X1 es G o S
X2 es T o S; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos WASTRES (SEQ ID NO: 11); y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QNX1YSX2PYT (SEQ ID NO: 12), en la que
X1 es D o E
X2 es Y, F o S.
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VL de uno de los anticuerpos en la Tabla 1. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la c DR3 de VL de uno de los anticuerpos en la Tabla 1. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL de uno de los anticuerpos en la Tabla 1 (por ejemplo, las CDR de VL en una fila de la Tabla 1). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL descritas en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco (FR) de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila de la Tabla 3).
En otro aspecto, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena pesada (VH) que comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID NO: 7), en la que
X1 es D, E o G
X2 es A o V
X3 es Y o H; y/o
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1IX2TX3SGX4X5X6YNQKFX7X8 (SEQ ID NO: 8), en la que
X1 es V o L
X2 es R, K o Q
X3 es Y
X4es D, G
es V o L
X6es T o S
X7 es K, R o Q
es D, E o G; y/o
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGFAY (SEQ ID NO: 9).
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VH de uno de los anticuerpos en la Tabla 2. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 2 (por ejemplo, las CDR de VH en una fila de la Tabla 2). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende los marcos de VH descritos en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en las Tablas 4 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila de la Tabla 4). En un aspecto particular, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSLLNSX1NQKNYLX2 (SEQ ID NO: 10), en la que
X1 es G o S
X2 es T o S; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos WASTRES (SEQ ID NO: 11); y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QNX1YSX2PYT (SEQ ID NO: 12), en la que
X1 es D o E
X2 es Y, F o S.
(d) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID NO: 7), en la que
X1 es D, E o G
X2 es A o V
X3 es Y o H; y/o
(e) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1IX2TX3SGX4X5X6YNQKFX7X8 (SEQ ID NO: 8), en la que
X1 es V o L
X2 es R, K o Q
X3 es Y o F
X4 es D, E o G
X5 es V o L
X6 es T o S
X7 es K, R o Q
X8 es D, E o G; y/o
(f) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGFAY (SEQ ID NO: 9).
En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres, cuatro, cinco o las seis CDR anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VL de uno de los anticuerpos en la Tabla 1. En
ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VH de uno de los anticuerpos en la Tabla 2. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 2 (por ejemplo, las CDR de VH en una fila de la Tabla 2). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL de uno de los anticuerpos en la Tabla 1 (por ejemplo, las CDR de VL en una fila en la Tabla 1).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) y una región variable de la cadena pesada (VH), en la que
(i) la VL comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSLLNSX1NQKNYLX2 (SEQ ID NO: 10), en la que
X1 es G o S
X2 es T o S; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos WASTRES (SEQ ID NO: 11); y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QNX1YSX2PYT (SEQ ID NO: 12), en la que
X1 es D o E
X2 es Y, F o S; y
(ii) la VH comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID No : 7), en la que
X1 es D, E o G
X2 es A o V
X3 es Y o H; y/o
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1IX2TX3SGX4X5X6YNQKFX7X8 (SEQ ID NO: 8), en la que
X1 es V o L
X2 es R, K o Q
X3 es Y o F
X4 es D, E o G
X5 es V o L
X6 es T o S
X7 es K, R o Q
X8 es D, E o G; y/o
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGFAY (SEQ ID NO: 9).
En aspectos específicos, la VL comprende dos o las tres CDR de VL anteriores y/o la VH comprende dos o las tres CDR de VH anteriores. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VL de uno de los anticuerpos en la Tabla 1. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VL de uno de los anticuerpos en la Tabla 1. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR1 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR2 de VH de uno de los anticuerpos en la Tabla 2. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende la CDR3 de VH de uno de los anticuerpos en la Tabla 2. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VH de uno de los anticuerpos en la Tabla 2 (por ejemplo, las CDR de VH
en una fila de la Tabla 2). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos o las tres CDR de VL de uno de los anticuerpos en la Tabla 1 (por ejemplo, las CDR de VL en una fila en la Tabla 1).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) y una región variable de la cadena pesada (VH), en la que
(i) la VL comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos KSSQSLLNSX1NQKNYLX2 (SEQ ID NO: 10), en la que
X1 es G o S
X2 es T o S; y/o
(b) una CDR2 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos WASTRES (SEQ ID NO: 11); y/o
(c) una CDR3 de VL que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos QNX1YSX2PYT (SEQ ID NO: 12), en la que
X1 es D o E
X2 es Y, F o S; y
(ii) la VH comprende:
(a) una CDR1 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1YX2MX3 (SEQ ID No : 7), en la que
X1 es D, E o G
X2 es A o V
X3 es Y o H; y/o
(b) una CDR2 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos X1IX2TX3SGX4X5X6YNQKFX7X8 (SEQ ID NO: 8), en la que
X1 es V o L
X2 es R, K o Q
X3 es Y o F
X4 es D, E o G
X5 es V o L
X6 es T o S
X7 es K, R o Q
X8 es D, E o G; y/o
(c) una CDR3 de VH que comprende, que consiste en, o consiste esencialmente en la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que
X1 es F, A, V, L, I, P, M, Y, W, H o S
X2 es A o D
X3 es Y, G, N, Q, S, T, C, W, F, H o V.
En ciertos aspectos, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) y comprende una, dos o tres de las regiones determinantes de complementariedad (CDR) de la región variable de la cadena ligera (VL) de un anticuerpo en la Tabla 1 (por ejemplo, las CDR de VL en una fila de la Tabla 1). En algunos aspectos, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITr (por ejemplo, GITR humano) y comprende una, dos o tres de las CDR de la región variable de la cadena pesada (VH) de cualquiera de los anticuerpos en la Tabla 2 (por ejemplo, las CDR de VH en una fila de la Tabla 2).
En ciertos aspectos, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) y comprende una región variable de la cadena ligera (VL) que comprende una, dos o las tres CDR de VL de un anticuerpo en la Tabla 1 (por ejemplo, las CDR de VL en una fila de la Tabla 1). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres o las cuatro regiones marco de VL descritas en la presente memoria. En aspectos específicos, el anticuerpo o
fragmento de unión a antígeno de este comprende una, dos, tres o las cuatro regiones marco (FR) de VL expuestas en la Tabla 3 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila en la Tabla 3).
En ciertos aspectos, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) y comprende una región variable de la cadena pesada (VH) que comprende una, dos o las tres CDR de VH de un anticuerpo en la Tabla 2 (por ejemplo, las CDR de VH en una fila de la Tabla 2). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres o las cuatro regiones marco de VH descritas en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres o las cuatro regiones marco (FR) de VH expuestas en la Tabla 4 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila en la Tabla 4).
En ciertos aspectos, se proporciona en la presente memoria un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) y comprende las CDR de la región variable de la cadena ligera (VL) y las CDR de la región variable de la cadena pesada (VH) de cualquiera de los anticuerpos Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, por ejemplo, como se expone en las Tablas 1 y 2 (por ejemplo, las CDR de VH y las CDR de VL en la misma fila son todas del mismo anticuerpo designado por el nombre del anticuerpo en la primera columna de las Tablas 1 y 2, por ejemplo, las CDR de VL y las CDR de VH en la primera fila de las Tablas 1 y 2, respectivamente, son todas del anticuerpo 231-32-15). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y los marcos de VH descritos en la presente memoria. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco (FR) de VL y las regiones marco de VH expuestas en las Tablas 3 y 4 (por ejemplo, las FR de VL y las FR de VH son todas del mismo anticuerpo).
En un aspecto particular, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) que comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL como se expone en la Tabla 1, por ejemplo, CDR1 de v L, CDR2 de VL y CDR3 de VL de cualquiera de los anticuerpos Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, (por ejemplo, las CDR de VL están en una fila de la Tabla 1). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila en la Tabla 3). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una secuencia de la región variable de la cadena ligera que comprende una, dos, tres o cuatro de las regiones marco de la secuencia de región variable de la cadena ligera de SEQ ID NO: 204 o SEQ ID NO: 205. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres o cuatro de las regiones marco de una secuencia de la región variable de la cadena ligera que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de una secuencia de región variable de la cadena ligera seleccionada del grupo que consiste en la SEQ ID NO: 202, SEQ ID NO: 207, SEQ ID NO: 208, y sec. con núms. de ident.: 400-518. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres o cuatro de las regiones marco de una secuencia de región variable de la cadena ligera que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de la secuencia de la región variable de la cadena ligera de SEQ ID NO: 519. En ciertos aspectos, un anticuerpo o fragmento de unión a antígeno de este comprende una región marco variable de la cadena ligera que es o se deriva de una secuencia de aminoácidos codificada por un gen humano, en la que la secuencia de aminoácidos se selecciona del grupo que consiste en IGKV4-1*01 (SEQ ID NO: 607) y IGKV3-7*02 (SEQ ID NO: 608). En aspectos específicos, la región marco variable de la cadena ligera que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos, pero con la presencia de hasta 10 sustituciones, deleciones y/o inserciones de aminoácidos, preferentemente, hasta 10 sustituciones de aminoácidos. En un aspecto particular, la región marco variable de la cadena ligera que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos con 1, 2, 3, 4, 5, 6, 7, 8, 9 o 10 residuos de aminoácidos sustituidos por un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena ligera no humana correspondiente. En algunos aspectos, un anticuerpo o fragmento de unión a antígeno de este comprende una región marco variable de la cadena ligera que se deriva de la secuencia de aminoácidos de SEQ ID NO: 607 o SEQ ID NO: 608, en la que al menos un aminoácido en la secuencia de aminoácidos de SEQ ID NO: 607 o SEQ ID NO: 608 está sustituido con un aminoácido en una posición análoga en una región marco variable de la cadena ligera no humana correspondiente. En un aspecto específico, la sustitución de aminoácidos está en la posición de aminoácidos 87, en la que la posición de aminoácidos se indica de acuerdo con la numeración de Kabat. En aspectos particulares, la sustitución de aminoácidos es 87H, en la que la posición del aminoácido se indica de acuerdo con la numeración de Kabat.
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de Hum231#1, por ejemplo, la CDR1 de VL, CDR2 de VL y c Dr3 de VL de Hum231#1 como se expone en la Tabla 1 (sec. con núms. de ident.: 16, 17 y 18, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a
antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de Hum231#1).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de Hum231#2, por ejemplo, la CDR1 de VL, CDR2 de VL y c Dr3 de VL de Hum231#2 como se expone en la Tabla 1 (sec. con núms. de ident.: 16, 17 y 18, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de Hum231#2).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl964, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pabl964 como se expone en la Tabla 1 (sec. con núms. de ident.: 101, 105 y 106, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1964).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de A pab1965, por ejemplo, la CDr 1 de VL, CDR2 de VL y CDR3 de VL de pab1965 como se expone en la Tabla 1 (sec. con núms. de ident.: 102, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1965).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab1966, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pab1966 como se expone en la Tabla 1 (sec. con núms. de ident.: 102, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1966).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl967, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDR3 de VL de pabl967 como se expone en la Tabla 1 (SEQ ID NOS: 103, 105 y 108, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1967).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl968, por ejemplo, la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl968 como se expone en la Tabla 1 (sec. con núms. de ident.: 101, 105, y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1968).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GlTR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl969, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pabl969 como se expone en la Tabla 1 (sec. con núms. de ident.: 103, 105 y 109, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1969).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab1970, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pab1970 como se expone en la Tabla 1 (sec. con núms. de ident.: 101, 105 y 109, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1970).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab1971, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDR3 de VL de pabl971 como se expone en la Tabla 1 (sec. con núms. de ident.: 103, 105, y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab 1971).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab1972, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pab1972 como se expone en la Tabla 1 (sec. con núms. de ident.: 104, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1972).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab1973, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pab1973 como se expone en la Tabla 1 (sec. con núms. de ident.: 103, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1973).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl975, por ejemplo, la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl975 como se expone en la Tabla 1 (sec. con núms. de ident.: 102, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1975).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl976, por ejemplo, la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl976 como se expone en la Tabla 1 (sec. con núms. de ident.: 101, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además
una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1976).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl977, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pabl977 como se expone en la Tabla 1 (sec. con núms. de ident.: 103, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1977).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl979, por ejemplo, la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl979 como se expone en la Tabla 1 (sec. con núms. de ident.: 102, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pabl979).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl980, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pabl980 como se expone en la Tabla 1 (sec. con núms. de ident.: 101, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1980).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pabl981, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pabl981 como se expone en la Tabla 1 (sec. con núms. de ident.: 103, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1981).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab1983, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pab1983 como se expone en la Tabla 1 (sec. con núms. de ident.: 102, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab1983).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab2159, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pab2159 como se expone en la Tabla 1 (sec. con núms. de ident.: 102, 105 y 109, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab2159). En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y Cd R3 de VL de pab2160, por ejemplo, la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab2160 como se expone en la Tabla 1 (sec. con núms. de
ident.: 102, 105 y 107, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab2160).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL de pab2161, por ejemplo, la Cd R1 de VL, CDR2 de VL y CDr3 de VL de pab2161 como se expone en la Tabla 1 (sec. con núms. de ident.: 103, 105 y 109, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de una subfamilia kappa variable de la cadena ligera humana. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3 (por ejemplo, las regiones marco de pab2161).
En un aspecto particular, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena pesada (VH) que comprende la CDR1 de VH, CDR2 de VH y CDR3 de Vh como se expone en la Tabla 2, por ejemplo, la Cd R1 de Vh , CDR2 de VH y CDR3 de VH de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, (por ejemplo, las CDR de VH en una fila en la Tabla 2). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, una, dos, tres o cuatro de las regiones marco en una fila en la Tabla 4). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres o las cuatro regiones marco de la secuencia de la región variable de la cadena pesada de SEQ ID NO: 203. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una, dos, tres o cuatro de las regiones marco de una secuencia de región variable de la cadena pesada que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de una secuencia de región variable de la cadena pesada seleccionada del grupo que consiste en SEQ ID NO: 201, SEQ ID NO: 206, y las sec. con núms. de ident.: 215 a 389. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende una región marco variable de la cadena pesada que es o se deriva de una secuencia de aminoácidos codificada por un gen humano, en la que la secuencia de aminoácidos se selecciona del grupo que consiste en IGHV1-2*02 (SEQ ID NO: 601), IGHV1-3*01 (SEQ ID NO: 602), IGHV1-46*01 (SEQ ID NO: 603), IGHV1-18*01 (SEQ ID NO: 604), IGHV1-69*01 (SEQ ID NO: 605) y IGHV7-4-1*02 (SEQ ID NO: 606). En aspectos específicos, la región marco variable de la cadena pesada que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos, pero con la presencia de hasta 10 sustituciones, deleciones y/o inserciones de aminoácidos, preferentemente, hasta 10 sustituciones de aminoácidos. En un aspecto particular, la región marco variable de la cadena pesada que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos con 1, 2, 3, 4, 5, 6, 7, 8, 9 o 10 residuos de aminoácidos sustituidos para un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena pesada no humana correspondiente. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este comprende una región marco variable de la cadena pesada que se deriva de la secuencia de aminoácidos de SEQ ID NO: 601, en la que al menos un aminoácido de la secuencia de aminoácidos de SEQ ID NO: 601 está sustituido con un aminoácido en una posición análoga en una región marco variable de la cadena pesada no humana correspondiente. En ciertos aspectos, la sustitución de aminoácidos está en una posición de aminoácido seleccionada del grupo que consiste en 24, 48, 67, 71, 73 y 94, en la que la posición de aminoácido de cada miembro del grupo se indica de acuerdo con la numeración de Kabat. En aspectos específicos, la sustitución de aminoácidos se selecciona del grupo que consiste en 24G, 48I, 67A, 71V, 73K y 94K, en la que la posición de aminoácido de cada miembro del grupo se indica de acuerdo con la numeración de Kabat.
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de Hum231#1, por ejemplo, la CDR1 de VH, CDR2 de VH y c Dr3 de VH de Hum231#1 como se expone en la Tabla 2 (sec. con núms. de ident.: 13, 14 y 15, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de Hum231#1).
En un asp ec to pa rticu la r, un an ticu e rp o o fra g m e n to de es te de sc rito en la p re sen te m em oria , que se une e sp e c ífica m e n te a G IT R (p o r e jem p lo , G iT R hum ano), co m p re n d e la CDR1 de VH, C D R 2 de V H y C D R 3 de V H de H um 231#2 , po r e jem p lo , la CDR1 de VH, C D R 2 de V H y c D r 3 de V H de H u m 231 # 2 com o se e xp on e en la T ab la 2
(sec. con núms. de ident: 13, 14 y 15, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de Hum231#2).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1964, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1964 como se expone en la Tabla 2 (sec. con núms. de ident: 19, 24 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1964).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1965, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1965 como se expone en la Tabla 2 (sec. con núms. de ident: 19, 25 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1965).
En una realización particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VH, CDR2 de VH y CDr3 de VH de pab1966, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1966 como se expone en la Tabla 2 (sec. con núms. de ident: 19, 26 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1966).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GiTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1967, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1967 como se expone en la Tabla 2 (sec. con núms. de ident: 20, 27 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1967).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1968, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1968 como se expone en la Tabla 2 (sec. con núms. de ident: 21, 28 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1968).
En una rea liza c ió n pa rticu la r, un a n ticu e rp o o fra g m e n to de este de sc rito en la p re sen te m em oria , que se une e sp e c ífica m e n te a G IT R (p o r e jem p lo , G IT R hum ano), co m p re n d e la CDR1 de VH, C D R 2 de V H y C D r 3 de V H de pab1969, po r e jem p lo , la C d R 1 de VH, C D R 2 de V H y C D R 3 de V H de pa b1969 com o se e xp on e en la T ab la 2 (sec.
con núms. de ident: 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1969).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1970, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1970 como se expone en la Tabla 2 (sec. con núms. de ident: 21, 24 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1970).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1971, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pabl971 como se expone en la Tabla 2 (sec. con núms. de ident: 21, 177 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1971).
En una realización particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VH, CDR2 de VH y CDr3 de VH de pab1972, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1972 como se expone en la Tabla 2 (sec. con núms. de ident: 23, 31 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1972).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GiTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1973, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1973 como se expone en la Tabla 2 (sec. con núms. de ident: 19, 32 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab 1973).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1975, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1975 como se expone en la Tabla 2 (sec. con núms. de ident: 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1975).
En un asp ec to pa rticu la r, un an ticu e rp o o fra g m e n to de es te de sc rito en la p re sen te m em oria , que se une e sp e c ífica m e n te a G IT R (p o r e jem p lo , G iT R hum ano), co m p re n d e la CDR1 de VH, C D R 2 de V H y C D R 3 de V H de pab1976, po r e jem p lo , la C d R 1 de VH, C D R 2 de V H y C D R 3 de V H de pa b1976 com o se e xp on e en la T ab la 2 (sec.
con núms. de ident: 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1976).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1977, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1977 como se expone en la Tabla 2 (sec. con núms. de ident: 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1977).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1979, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1979 como se expone en la Tabla 2 (sec. con núms. de ident: 22, 33 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1979).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GiTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pabl980, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pabl980 como se expone en la Tabla 2 (sec. con núms. de ident: 22, 33 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1980).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GiTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1981, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1981 como se expone en la Tabla 2 (sec. con núms. de ident: 22, 33 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1981).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GiTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1983, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab1983 como se expone en la Tabla 2 (sec. con núms. de ident: 19, 24 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab1983).
En un asp ec to pa rticu la r, un an ticu e rp o o fra g m e n to de es te de sc rito en la p re sen te m em oria , que se une e sp e c ífica m e n te a G IT R (p o r e jem p lo , G iT R hum ano), co m p re n d e la CDR1 de VH, C D R 2 de V H y C D R 3 de V H de pab2159, po r e jem p lo , la C d R 1 de VH, C D R 2 de V H y C D R 3 de V H de pa b2159 com o se e xp on e en la T ab la 2 (sec.
con núms. de ident: 19, 144 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab2159).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2160, por ejemplo, la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2160 como se expone en la Tabla 2 (sec. con núms. de ident: 119, 162 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab2160).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, G iTR humano), comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2161, por ejemplo, la Cd R1 de VH, CDR2 de VH y CDR3 de VH de pab2161 como se expone en la Tabla 2 (sec. con núms. de ident: 22, 121 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VH derivadas de una subfamilia variable de cadena pesada humana (por ejemplo, una de las subfamilias 1 a 7). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VH de un anticuerpo expuestas en la Tabla 4 (por ejemplo, las regiones marco de pab2161).
En un aspecto particular, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (i) una región variable de la cadena pesada (VH) que comprende la CDR1 de VH, CDR2 de VH y CDR3 de VH como se expone en la Tabla 2, por ejemplo, la Cd R1 de VH, Cd R2 de VH y CDR3 de VH de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, (por ejemplo, las CDR de VH en una fila en la Tabla 2), y (ii) una región variable de la cadena ligera (VL) que comprende la CDR1 de VL, CDR2 de VL y CDR3 de VL como se expone en la Tabla 1, por ejemplo, la CDR1 de VL, c Dr2 de VL y CDR3 de VL de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, (por ejemplo, las CDR de VL en una fila en la Tabla 1). En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de un solo anticuerpo como se designa por su nombre, por ejemplo, todas las FR son de Hum231#1 o Hum231#2).
En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una, dos, tres o cuatro regiones marco de una secuencia de región variable de la cadena pesada que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de una secuencia de la región variable de la cadena pesada seleccionada del grupo que consiste en SEQ ID NO: 201, SEQ ID NO: 206, y las sec. con núms. de ident.: 215 a 389. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una región marco variable de la cadena pesada que es o se deriva de una secuencia de aminoácidos codificada por un gen humano, en la que la secuencia de aminoácidos se selecciona del grupo que consiste en IGHV1-2*02 (SEQ ID NO: 601), IGHv 1-3*01 (SEQ ID NO: 602), IGHV1-46*01 (SEQ ID NO: 603), IGHV1-18*01 (SEQ ID NO: 604), IGHV1-69*01 (SEQ ID NO: 605) y IGHV7-4-1*02 (SEQ ID NO: 606). En aspectos específicos, la región marco variable de la cadena pesada que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos, pero con la presencia de hasta 10 sustituciones, deleciones y/o inserciones de aminoácidos, preferentemente, hasta 10 sustituciones de aminoácidos. En un aspecto particular, la región marco variable de la cadena pesada que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos con 1, 2, 3, 4, 5, 6, 7, 8, 9 o 10 residuos de aminoácidos sustituidos para un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena pesada no humana correspondiente. En aspectos específicos, el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una región marco variable de la cadena pesada que se deriva de la secuencia de aminoácidos de SEQ iD NO: 601, en la que al menos un aminoácido en la secuencia de aminoácidos de SEQ ID NO: 601 está sustituido con un aminoácido en una posición análoga en una región marco variable de la cadena ligera no humana correspondiente. En ciertos aspectos, la sustitución de aminoácidos está en
una posición de aminoácido seleccionada del grupo que consiste en 24, 48, 67, 71, 73 y 94, en la que la posición de aminoácido de cada miembro del grupo se indica de acuerdo con la numeración de Kabat. En aspectos específicos, la sustitución de aminoácidos se selecciona del grupo que consiste en 24G, 48I, 67A, 71V, 73K y 94K, en la que la posición de los aminoácidos de cada miembro del grupo se indica de acuerdo con la numeración de Kabat.
En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende las regiones marco de VL de un anticuerpo expuestas en la Tabla 3. En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una secuencia de región variable de la cadena ligera que comprende una, dos, tres o cuatro de las regiones marco de la secuencia de región variable de la cadena ligera de SEQ ID NO: 204 o SEQ ID NO: 205. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una, dos, tres o cuatro regiones marco de una secuencia de región variable de la cadena ligera que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de una secuencia de región variable de la cadena ligera seleccionada del grupo que consiste en SEQ ID NO: 202, SEQ ID NO: 207, SEQ ID NO: 208, y sec. con núms. de ident.: 400-518. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una, dos, tres o cuatro regiones marco de una secuencia de región variable de la cadena ligera que es al menos 75 %, 80 %, 85 %, 90 %, 95 % o 100 % idéntica a una, dos, tres o cuatro de las regiones marco de la secuencia de la región variable de la cadena ligera de SEQ ID NO: 519. En ciertos aspectos, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una región marco variable de la cadena ligera que es o se deriva de una secuencia de aminoácidos codificada por un gen humano, en la que la secuencia de aminoácidos se selecciona del grupo que consiste en IGKV4-1*01 (SEQ ID NO: 607) y IGKV3-7*02 (SEQ ID NO: 608). En aspectos específicos, la región marco variable de la cadena ligera que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos, pero con la presencia de hasta 10 sustituciones, deleciones y/o inserciones de aminoácidos, preferentemente, hasta 10 sustituciones de aminoácidos. En un aspecto particular, la región marco variable de la cadena ligera que se deriva de dicha secuencia de aminoácidos consiste en dicha secuencia de aminoácidos con 1, 2, 3, 4, 5, 6, 7, 8, 9 o 10 residuos de aminoácidos sustituidos por un aminoácido que se encuentra en una posición análoga en una región marco variable de la cadena ligera no humana correspondiente. En algunos aspectos, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una región marco variable de la cadena ligera que se deriva de la secuencia de aminoácidos de SEQ ID NO: 607 o SEQ ID NO: 608, en la que al menos un aminoácido de la secuencia de aminoácidos de SEQ ID NO: 607 o SEQ ID NO: 608, con un aminoácido en una posición análoga en una región marco variable de la cadena ligera no humana correspondiente. En un aspecto específico, la sustitución de aminoácidos está en la posición de aminoácidos 87, en la que la posición de aminoácidos se indica de acuerdo con la numeración de Kabat. En aspectos particulares, la sustitución de aminoácidos es 87H, en la que la posición del aminoácido se indica de acuerdo con la numeración de Kabat.
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de Hum231#1, por ejemplo, CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH, y CDR3 de VH de Hum231#1 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 16, 17, 18, 13, 14 y 15, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VH de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de Hum231#1).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de Hum231#2, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de Hum231#2 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 16, 17, 18, 13, 14 y 15, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, los marcos de un solo anticuerpo como se designa por su nombre, por ejemplo, las regiones marco de Hum231#1 o Hum231#2).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1964, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1964 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 101, 105, 106, 19, 24 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de
prim ate . En a lgu nos aspec tos , el an ticu e rp o o fra g m e n to de un ión a a n tíg e n o de es te c o m p re n d e las re g io n e s m arco de V L y las reg io nes m arco de V H de un an ticu e rp o e xp u e s ta s en las T ab las 3 y 4, re sp e c tiva m e n te (p o r e jem p lo , las reg io nes m arco de pab1964).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1965, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1965 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 102, 105, 107, 19, 25 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1965).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1966, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1966 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 102, 105, 107, 19, 26 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1966).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1967, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1967 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 103, 105, 108, 20, 27 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1967).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1968, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1968 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 101, 105, 107, 21, 28 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1968).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1969, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1969 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 103, 105, 109, 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1969).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1970, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1970 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 101, 105, 109, 21, 24 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de
prim ate . En a lgu nos aspec tos , el an ticu e rp o o fra g m e n to de un ión a a n tíg e n o de es te c o m p re n d e las re g io n e s m arco de V L y las reg io nes m arco de V H de un an ticu e rp o e xp u e s ta s en las T ab las 3 y 4, re sp e c tiva m e n te (p o r e jem p lo , las reg io nes m arco de pab1970).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1971, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1971 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 103, 105, 107, 21, 177 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1971).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1972, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1972 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 104, 105, 107, 23, 31 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1972).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pabl973, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1973 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 103, 105, 107, 19, 32 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1973).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1975, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1975 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 102, 105, 107, 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1975).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pabl976, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1976 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 101, 105, 107, 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1976).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1977, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1977 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 103, 105, 107, 22, 29 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de
prim ate . En a lgu nos aspec tos , el an ticu e rp o o fra g m e n to de un ión a a n tíg e n o de es te c o m p re n d e las re g io n e s m arco de V L y las reg io nes m arco de V H de un an ticu e rp o e xp u e s ta s en las T ab las 3 y 4, re sp e c tiva m e n te (p o r e jem p lo , las reg io nes m arco de pab1977).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pabl979, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1979 como se expone en las Tablas 1 y 2 (SEQ ID NO: 102, 105, 107, 22, 33 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1979).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1980, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1980 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 101, 105, 107, 22, 33 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1980).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1981, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1981 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 103, 105, 107, 22, 33 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1981).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1983, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab1983 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 102, 105, 107, 19, 24 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab1983).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2159, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2159 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 102, 105, 109, 19, 144 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab2159).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2160, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2160 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 102, 105, 107, 119, 162 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de
prim ate . En a lgu nos aspec tos , el an ticu e rp o o fra g m e n to de un ión a a n tíg e n o de es te c o m p re n d e las re g io n e s m arco de V L y las reg io nes m arco de V H de un an ticu e rp o e xp u e s ta s en las T ab las 3 y 4, re sp e c tiva m e n te (p o r e jem p lo , las reg io nes m arco de pab2160).
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende la CDR1 de VL, Cd R2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2161, por ejemplo, la CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y CDR3 de VH de pab2161 como se expone en las Tablas 1 y 2 (sec. con núms. de ident.: 103, 105, 109, 22, 121 y 34, respectivamente). En ciertos aspectos, el anticuerpo o fragmento de unión a antígeno comprende además una, dos, tres o las cuatro regiones marco de VL derivadas de la VL de un anticuerpo humano o de primate y una, dos, tres o las cuatro regiones marco de VH derivadas de la VH de un anticuerpo humano o de primate. En algunos aspectos, el anticuerpo o fragmento de unión a antígeno de este comprende las regiones marco de VL y las regiones marco de VH de un anticuerpo expuestas en las Tablas 3 y 4, respectivamente (por ejemplo, las regiones marco de pab2161).
En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la secuencia de aminoácidos de un dominio VL de un anticuerpo enumerado en la Figura 23 o cualquiera de las Figuras 24A-24C (por ejemplo, el dominio VL en una fila de la Figura 23 o cualquiera de las Figuras 24A-24C). En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la secuencia de aminoácidos de un dominio VL de un anticuerpo enumerado en la Tabla 17 (por ejemplo, el dominio VL en una fila de la Tabla 17). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 207 (por ejemplo, anticuerpo Hum231#1). El anticuerpo que se une específicamente a GITR (por ejemplo, GITR humano) de la invención comprende un dominio VL que comprende la SEQ ID NO: 208 (por ejemplo, anticuerpo Hum231#2). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 435 (por ejemplo, anticuerpo pab1964). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 437 (por ejemplo, anticuerpo pab1965). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 440 (por ejemplo, anticuerpo pab1966). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 441 (por ejemplo, anticuerpo pab1967). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 444 (por ejemplo, anticuerpo pab1968). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 458 (por ejemplo, anticuerpo pab1969). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 459 (por ejemplo, anticuerpo pab1970). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 453 (por ejemplo, anticuerpo pab1971). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 463 (por ejemplo, anticuerpo pab1972). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 519 (por ejemplo, anticuerpo pab1973). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 440 (por ejemplo, anticuerpo pab1975). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 444 (por ejemplo, anticuerpo pab1976). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 453 (por ejemplo, anticuerpo pab1977). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 440 (por ejemplo, anticuerpo pab1979). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 444 (por ejemplo, anticuerpo pab1980). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 453 (por ejemplo, anticuerpo pab1981). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 440 (por ejemplo, anticuerpo pab1983). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 408 (por ejemplo, anticuerpo pab2159). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la s Eq ID NO: 423 (por ejemplo, anticuerpo pab2160). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 486 (por ejemplo, anticuerpo pab2161).
En algunos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio Vl que consiste en o consiste esencialmente en la secuencia de aminoácidos de un dominio VL de un anticuerpo enumerado en la Figura 23 o cualquiera de las Figuras 24A-24C (por ejemplo, el dominio VL en una fila de la Figura 23 o cualquiera de las Figuras 24A-24C). En algunos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la secuencia de aminoácidos de un dominio VL de un anticuerpo enumerado en la Tabla 17 (por ejemplo, el dominio VL en una fila de la Tabla 17). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 207 (por ejemplo, anticuerpo Hum231#1). En una realización específica, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 208 (por ejemplo, anticuerpo Hum231#2). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 435 (por ejemplo, anticuerpo pab1964). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 437 (por ejemplo, anticuerpo pab1965). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 440 (por ejemplo, anticuerpo pab1966). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 441 (por ejemplo, anticuerpo pab1967). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 444 (por ejemplo, anticuerpo pab1968). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 458 (por ejemplo, anticuerpo pab1969). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 459 (por ejemplo, anticuerpo pab1970). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 453 (por ejemplo, anticuerpo pab1971). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 463 (por ejemplo, anticuerpo pab1972). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 519 (por ejemplo, anticuerpo pab1973). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 440 (por ejemplo, anticuerpo pab1975). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 444 (por ejemplo, anticuerpo pab1976). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 453 (por ejemplo, anticuerpo pab1977). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 440 (por ejemplo, anticuerpo pab1979). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 444 (por ejemplo, anticuerpo pab1980). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 453 (por ejemplo, anticuerpo pab1981). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 440 (por ejemplo, anticuerpo pab1983). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 408 (por ejemplo, anticuerpo pab2159). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 423 (por ejemplo, anticuerpo pab2160). En un aspecto específico, un dominio de unión a antígeno que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que consiste en o consiste esencialmente en la SEQ ID NO: 486 (por ejemplo, anticuerpo pab2161).
En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la secuencia de aminoácidos de un dominio VH de un anticuerpo enumerado en la Figura 23 o cualquiera de las Figuras 24A-24C (por ejemplo, el dominio VH en una fila en la Figura 23 o cualquiera de las Figuras 24A-24C). En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la secuencia de aminoácidos de un dominio VH de un anticuerpo enumerado en la Tabla 17 (por ejemplo, el dominio VH en una fila en la Tabla 17). Un anticuerpo que se une específicamente a GITR (por ejemplo, G itR humano) de la invención comprende un dominio VH que comprende la s Eq ID NO: 206 (por ejemplo, anticuerpo Hum231#1 Un anticuerpo que se une específicamente a GITR (por ejemplo, GITR humano) de la invención comprende un dominio VH que
comprende la SEQ ID NO: 206 (por ejemplo, anticuerpo Hum231#2). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1964). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 251 (por ejemplo, anticuerpo pab1965). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 254 (por ejemplo, anticuerpo pab1966). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 255 (por ejemplo, anticuerpo pab1967). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 259 (por ejemplo, anticuerpo pab1968). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1969). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 277 (por ejemplo, anticuerpo pab1970). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 280 (por ejemplo, anticuerpo pab1971). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 284 (por ejemplo, anticuerpo pab1972). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 304 (por ejemplo, anticuerpo pab1973). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1975). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1976). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1977). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1979). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1980). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1981). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1983). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 224 (por ejemplo, anticuerpo pab2159). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ ID NO: 237 (por ejemplo, anticuerpo pab2160). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que comprende la SEQ Id NO: 315 (por ejemplo, anticuerpo pab2161).
En algunos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio Vh que consiste en o consiste esencialmente en la secuencia de aminoácidos de un dominio VH de un anticuerpo enumerado en la Figura 23 o cualquiera de las Figuras 24A-24C (por ejemplo, el dominio VH en una fila en la Figura 23 o cualquiera de las Figuras 24A-24C). En algunos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la secuencia de aminoácidos de un dominio VH de un anticuerpo enumerado en la Tabla 17 (por ejemplo, el dominio VH en una fila en la Tabla 17). Un anticuerpo que se une específicamente a GITR (por ejemplo, GITR humano) de la invención comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 206 (por ejemplo, anticuerpo Hum231#1). Un anticuerpo que se une específicamente a GITR (por ejemplo, GITR humano) de la invención comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 206 (por ejemplo, anticuerpo Hum231#2). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1964). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 251 (por ejemplo, anticuerpo pab1965). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 254 (por ejemplo, anticuerpo pab1966). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio Vh que consiste en o consiste esencialmente en la SEQ ID NO: 255 (por ejemplo, anticuerpo pab1967). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 259 (por ejemplo, anticuerpo pab1968). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo
pab1969). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 277 (por ejemplo, anticuerpo pab1970). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 280 (por ejemplo, anticuerpo pab1971). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 284 (por ejemplo, anticuerpo pab1972). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 304 (por ejemplo, anticuerpo pab1973). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1975). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITr (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1976). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1977). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1979). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1980). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITr (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1981). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1983). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 224 (por ejemplo, anticuerpo pab2159). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 237 (por ejemplo, anticuerpo pab2160). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITr (por ejemplo, GITR humano) comprende un dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 315 (por ejemplo, anticuerpo pab2161).
En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH y un dominio VL, en el que el dominio VH y el dominio VL comprenden la secuencia de aminoácidos de un dominio VH y un dominio VL de un anticuerpo enumerado en la Figura 23 o cualquiera de las Figuras 24A-24C (por ejemplo, el dominio VH y el dominio Vl en una fila de la Figura 23 o cualquiera de las Figuras 24A-24C). En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH y un dominio VL, en el que el dominio VH y el dominio VL comprenden la secuencia de aminoácidos de un dominio VH y un dominio VL de un anticuerpo enumerado en la Tabla 17 (por ejemplo, el dominio VH y el dominio VL en una fila de la Tabla 17). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 207 y un dominio VH que comprende la SEQ ID NO: 206 (por ejemplo, anticuerpo Hum231#1). Un anticuerpo que se une específicamente a GITR (por ejemplo, GITR humano) de la invención comprende un dominio VL que comprende la s Eq ID NO: 208 y un dominio VH que comprende la SEQ ID NO: 206 (por ejemplo, anticuerpo Hum231#2). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 435 y un dominio VH que comprende la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1964). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 437 y un dominio VH que comprende la SEQ ID NO: 251 (por ejemplo, anticuerpo pab1965). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 440 y un dominio VH que comprende la SEQ ID NO: 254 (por ejemplo, anticuerpo pab1966). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 441 y una región VH que comprende la SEQ ID NO: 255 (por ejemplo, anticuerpo pab1967). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 444 y un dominio VH que comprende la SEQ ID NO: 259 (por ejemplo, anticuerpo pab1968). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 458 y un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1969). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 459 y un dominio VH que comprende la SEQ ID NO: 277 (por ejemplo, anticuerpo pab1970). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 453 y un dominio VH que comprende la SEQ ID NO: 280 (por ejemplo, anticuerpo pab1971). En un aspecto específico, un anticuerpo o
fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 463 y un dominio VH que comprende la SEQ ID NO: 284 (por ejemplo, anticuerpo pab1972). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 519 y un dominio VH que comprende la SEQ ID NO: 304 (por ejemplo, anticuerpo pab1973). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 440 y un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1975). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 444 y un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1976). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 453 y un dominio VH que comprende la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1977). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 440 y un dominio VH que comprende la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1979). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 444 y un dominio VH que comprende la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1980). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 453 y un dominio VH que comprende la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1981). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 440 y un dominio VH que comprende la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1983). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 408 y un dominio VH que comprende la SEQ ID NO: 224 (por ejemplo, anticuerpo pab2159). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 423 y un dominio VH que comprende la SEQ ID NO: 237 (por ejemplo, anticuerpo pab2160). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL que comprende la SEQ ID NO: 486 y un dominio VH que comprende la SEQ ID NO: 315 (por ejemplo, anticuerpo pab2161).
En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH y un dominio VL, en el que el dominio VH y el dominio VL consisten en o consisten esencialmente en la secuencia de aminoácidos de un dominio VH y un dominio VL de un anticuerpo enumerado en la Figura 23 o cualquiera de las Figuras 24A-24C (por ejemplo, el dominio VH y el dominio VL en una fila de la Figura 23 o cualquiera de las Figuras 24A-24C). En ciertos aspectos, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VH y un dominio VL, en el que el dominio VH y el dominio VL consisten en o consisten esencialmente en la secuencia de aminoácidos de un dominio VH y un dominio VL de un anticuerpo enumerado en la Tabla 17 (por ejemplo, el dominio VH y el dominio VL en una fila de la Tabla 17). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 207 y el dominio VH que consiste en o consiste esencialmente en la SEQ ID NO: 206 (por ejemplo, anticuerpo Hum231#1). En una realización específica, un anticuerpo que se une específicamente a GITR (por ejemplo, GITr humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 208 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 206 (por ejemplo, anticuerpo Hum231#2). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 435 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1964). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 437 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 251 (por ejemplo, anticuerpo pab1965). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 440 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 254 (por ejemplo, anticuerpo pab1966). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 441 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 255 (por ejemplo, anticuerpo pab1967). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 444 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 259 (por ejemplo, anticuerpo pab1968). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 458 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1969). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a
GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 459 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 277 (por ejemplo, anticuerpo pab1970). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 453 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 280 (por ejemplo, anticuerpo pab1971). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 463 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 284 (por ejemplo, anticuerpo pab1972). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 519 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 304 (por ejemplo, anticuerpo pab1973). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 440 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1975). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 444 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1976). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 453 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 276 (por ejemplo, anticuerpo pab1977). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 440 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1979). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 444 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1980). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 453 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 345 (por ejemplo, anticuerpo pab1981). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 440 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 249 (por ejemplo, anticuerpo pab1983). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 408 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 224 (por ejemplo, anticuerpo pab2159). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 423 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 237 (por ejemplo, anticuerpo pab2160). En un aspecto específico, un anticuerpo o fragmento de este que se une específicamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH, en el que el dominio VL consiste en o consiste esencialmente en la SEQ ID NO: 486 y el dominio VH consiste en o consiste esencialmente en la SEQ ID NO: 315 (por ejemplo, anticuerpo pab2161).
En ciertos aspectos, un anticuerpo descrito en la presente memoria puede describirse por su dominio VL solo, o su dominio VH solo, o por sus 3 CDR de VL solas, o sus 3 CDR de VH solas. Ver, por ejemplo, Rader C y otros, (1998) PNAS 95: 8910-8915, que describe la humanización del anticuerpo anti-avp3 de ratón mediante la identificación de una cadena ligera o una cadena pesada complementaria, respectivamente, a partir de una biblioteca de cadenas ligeras o cadenas pesadas humanas, lo que da como resultado variantes de anticuerpos humanizados que tienen afinidades tan altas o mayores que la afinidad del anticuerpo original. Ver, además, Clackson T y otros, (1991) Nature 352: 624-628, que describe procedimientos de producción de anticuerpos que se unen a un antígeno específico mediante el uso de un dominio VL específico (o dominio VH) y el cribado de una biblioteca para los dominios variables complementarios. El cribado produjo 14 nuevas parejas para un dominio VH específico y 13 nuevas parejas para un dominio VL específico, que eran enlazadores fuertes, como se determinó mediante ELISA. Ver, además, Kim SJ y Hong HJ, (2007) J Microbiol 45: 572-577, que describe procedimientos de producción de anticuerpos que se unen a un antígeno específico mediante el uso de un dominio VH específico y el cribado de una biblioteca (por ejemplo, biblioteca de VL humana) para dominios VL complementarios; los dominios VL seleccionados a su vez podrían usarse para guiar la selección de dominios VH complementarios adicionales (por ejemplo, humanos).
En ciertos aspectos, las CDR de un dominio de unión a antígeno pueden determinarse de acuerdo con el esquema de numeración de Chothia, que se refiere a la ubicación de lazos estructurales de inmunoglobulina (ver, por ejemplo, Chothia C y Lesk AM, (1987), J Mol Biol 196: 901-917; Al-Lazikani B y otros, (1997) J Mol Biol 273: 927-948; Chothia C y otros, (1992) J Mol Biol 227: 799-817; Tramontano A y otros, (1990) J Mol Biol 215(1): 175-82; y la Patente de
Estados Unidos núm. 7,709,226). Típicamente, cuando se usa la convención de numeración de Kabat, el lazo CDR-H1 de Chothia está presente en los aminoácidos de cadena pesada 26 a 32, 33, o 34, el lazo H2 de CDR de Chothia está presente en los aminoácidos de cadena pesada 52 a 56, y el lazo H3 de CDR de Chothia está presente en los aminoácidos de cadena pesada 95 a 102, mientras que el lazo L1 de CDR de Chothia está presente en los aminoácidos de cadena ligera 24 a 34, el lazo L2 de CDR de Chothia está presente en los aminoácidos de cadena ligera 50 a 56, y el lazo L3 de CDR de Chothia está presente en los aminoácidos de cadena ligera 89 a 97. El extremo del lazo CDR-HI de Chothia, cuando se enumera mediante el uso de la convención de numeración de Kabat, varía entre H32 y H34 en función de la longitud del lazo (esto se debe a que el esquema de numeración de Kabat sitúa las inserciones en H35A y H35B; si ni 35A ni 35B está presente, el lazo termina en 32; si solo 35A está presente, el lazo termina en 33; si tanto 35A como 35B están presentes, el lazo termina en 34).
En ciertos aspectos, se proporciona en la presente memoria anticuerpos o fragmentos de estos que se unen específicamente a GITR (por ejemplo, GITR humano) y comprenden una o más CDR de VL de Chothia de una VL de cualquiera de los anticuerpos descritos en la presente memoria, (por ejemplo, cualquiera de Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o los anticuerpos 1-107, o los anticuerpos pab2159, pab2160 o pab2161) y/o una o más CDR de VH de Chothia una VH de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161). En ciertos aspectos, los anticuerpos o fragmentos de estos que se unen específicamente a GITR (por ejemplo, GITR humano) comprenden una o más CDR, en las que las CDR de Chothia y Kabat tienen la misma secuencia de aminoácidos. En ciertos aspectos, se proporciona en la presente memoria anticuerpos o fragmentos de los mismos que se unen específicamente a GITr (por ejemplo, GITR humano) y comprenden combinaciones de las CDR de Kabat y las CDR de Chothia. En un aspecto particular, se proporcionan en la presente memoria anticuerpos o fragmentos de estos que se unen específicamente a GITR (por ejemplo, GITR humano) y comprenden las CDR de Chothia de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161).
En ciertos aspectos, las CDR de un anticuerpo pueden determinarse de acuerdo con el sistema de numeración de IMGT como se describe en Lefranc M-P, (1999) The Immunologist 7: 132-136 y Lefranc M-P y otros, (1999) Nucleic Acids Res 27: 209-212. De acuerdo con el esquema de numeración de IMGT, la CDR1 de VH se encuentra en las posiciones 26 a 35, la CDR2 de VH se encuentra en las posiciones 51 a 57, la CDR3 de VH se encuentra en las posiciones 93 a 102, la CDR1 de VL se encuentra en las posiciones 27 a 32, la CDR2 de VL se encuentra en las posiciones 50 a 52, y la CDR3 de VL se encuentra en las posiciones 89 a 97. En un aspecto particular, se proporcionan en la presente memoria anticuerpos o fragmentos de estos que se unen específicamente a GITR (por ejemplo, GITR humano) y comprenden las CDR de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), que se determinan mediante el sistema de numeración IMGT, por ejemplo, como se describe en Lefranc MP (1999) más arriba y Lefranc MP y otros, (1999) más arriba).
En ciertos aspectos, las CDR de un anticuerpo pueden determinarse de acuerdo con MacCallum RM y otros, (1996) J Mol Biol 262: 732-745. Ver, además, por ejemplo, Martin A. “Protein Sequence and Structure Analysis of Antibody Variable Domains”, en Antibody Engineering, Kontermann y Dübel, eds., Capítulo 31, páginas 422-439, Springer-Verlag, Berlín (2001). En un aspecto particular, se proporcionan en la presente memoria anticuerpos o fragmentos de estos que se unen específicamente a GITR (por ejemplo, GITR humano) y comprenden las CDR de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), que se determinan mediante el procedimiento de MacCallum RM y otros.
En ciertos aspectos, las CDR de un anticuerpo pueden determinarse de acuerdo con el esquema de numeración de AbM, que se refiere a regiones hipervariables de AbM que representan un compromiso entre las CDR de Kabat y los lazos estructurales de Chothia, y se usan mediante el programa informático de modelado de anticuerpos AbM de Oxford Molecular (Oxford Molecular Group, Inc.). En un aspecto particular, se proporcionan en la presente memoria anticuerpos o fragmentos de los mismos que se unen específicamente a G itR (por ejemplo, GITR humano) y comprenden las CDR de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), que están determinados por el esquema de numeración AbM.
En un aspecto específico, la posición de una o más CDR a lo largo de la región VH (por ejemplo, CDR1, CDR2, o CDR3) y/o la región VL (por ejemplo, CDR1, CDR2, o CDR3) de un dominio de unión a antígeno descrito en la presente memoria pueden variar en una, dos, tres, cuatro, cinco, o seis posiciones de aminoácidos siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantenga (por ejemplo, se mantenga sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). Por ejemplo, en un aspecto, la posición que define una CDR de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o los anticuerpos 1-107, o los anticuerpos pab2159, pab2160 o pab2161) pueden variar al cambiar el límite N-terminal y/o C-terminal de la CDR por uno, dos, tres, cuatro, cinco o seis aminoácidos, con relación a la posición de la CDR de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, identificados en, por ejemplo, Tabla 1), siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantiene (por ejemplo, se mantiene sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). En otro aspecto, la longitud de una o más CDR a lo largo de la región VH (por ejemplo, CDR1, CDR2 o CDR3) y/o VL (por ejemplo, CDR1, CDR2 o CDR3) de un anticuerpo descrito en la presente memoria puede variar (por ejemplo, ser más corta o más larga) por uno, dos, tres, cuatro, cinco o más aminoácidos, siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantiene (por ejemplo, se mantiene sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %).
En un aspecto, una CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y/o CDR3 de VH descrita en la presente memoria puede ser uno, dos, tres, cuatro, cinco o más aminoácidos más corta que una o más de las CDR descritas en la presente memoria (por ejemplo, SEQ ID NO: 1-34, 101-109 o 114-189 o SEQ ID NO: 35 o 191 194) siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantenga (por ejemplo, se mantenga sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). En otro aspecto, una CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y/o CDR3 de VH descrita en la presente memoria puede ser uno, dos, tres, cuatro, cinco o más aminoácidos más larga que una o más de las CDR descritas en la presente memoria (por ejemplo, SEQ ID NO: 1-34, 101-109 o 114 189 o SEQ ID NO: 35 o 191-194) siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantenga (por ejemplo, se mantenga sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). En otro aspecto, el extremo terminal de una CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y/o CDR3 de VH descrita en la presente memoria puede extenderse por uno, dos, tres, cuatro, cinco o más aminoácidos en comparación con una o más de las CDR descritas en la presente memoria (por ejemplo, SEQ ID NO: 1-34, 101-109 o 114-189 o SEQ ID NO: 35 o 191-194) siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantenga (por ejemplo, se mantenga sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). En otro aspecto, el carboxilo terminal de una CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y/o CDR3 de VH descrita en la presente memoria puede extenderse por uno, dos, tres, cuatro, cinco o más aminoácidos en comparación con una o más de las CDR descritas en la presente memoria (por ejemplo, SEQ ID NO: 1-34, 101-109 o 114-189 o SEQ ID NO: 35 o 191-194) siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantenga (por ejemplo, se mantenga sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). En otro aspecto, el amino terminal de una CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y/o CDR3 de VH descrita en la presente memoria puede acortarse por uno, dos, tres, cuatro, cinco o más aminoácidos en comparación con una o más de las CDR descritas en la presente memoria (por ejemplo, SEQ ID NO: 1-34, 101-109 o 114-189 o SEQ ID NO: 35 o 191 194) siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantenga (por ejemplo, se mantenga sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). En un aspecto, el carboxi terminal de una CDR1 de VL, CDR2 de VL, CDR3 de VL, CDR1 de VH, CDR2 de VH y/o CDR3 de VH descrita en la presente memoria puede acortarse en uno, dos, tres, cuatro, cinco o más aminoácidos en comparación con una o más de las CDR descritas en la presente memoria (por ejemplo, SEQ ID NO: 1-34, 101-109 o 114-189 o SEQ ID NO: 35 o 191-194) siempre que la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantenga (por ejemplo, se mantenga sustancialmente, por ejemplo, al menos 50 %, al menos 60 %, al menos 70 %, al menos 80 %, al menos 90 %, al menos 95 %). Cualquier procedimiento conocido en la técnica puede usarse para determinar si la unión inmunoespecífica a GITR (por ejemplo, GITR humano) se mantiene, por ejemplo, los ensayos de unión y las condiciones descritas en la sección de “Ejemplos” (Sección 6) proporcionada en la presente memoria.
En aspectos específicos, se proporciona en la presente memoria un anticuerpo que comprende una cadena ligera y una cadena pesada de anticuerpo, por ejemplo, una cadena ligera y una cadena pesada separadas. Con respecto a la cadena ligera, en una realización específica, la cadena ligera de un anticuerpo descrito en la presente memoria es una cadena ligera kappa. En otra realización específica, la cadena ligera de un anticuerpo descrito en la presente memoria es una cadena ligera lambda. En aún otra realización específica, la cadena ligera de un anticuerpo descrito en la presente memoria es una cadena ligera kappa humana o una cadena ligera lambda humana. En un aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a un polipéptido de
GITR (por ejemplo, GITR humano) comprende una cadena ligera en la que la secuencia de aminoácidos del dominio VL comprende cualquier secuencia descrita en la presente memoria (por ejemplo, SEQ ID NO: 202, 204, 205, 207, 208 o 400-518) y en la que la región constante de la cadena ligera comprende la secuencia de aminoácidos de una región constante de la cadena ligera kappa humana. En un aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a un polipéptido de GITr (por ejemplo, GITR humano) comprende una cadena ligera en la que la secuencia de aminoácidos del dominio VL comprende cualquier secuencia descrita en la presente memoria (por ejemplo, SEQ ID NO: 519) y en la que la región constante de la cadena ligera comprende la secuencia de aminoácidos de una región constante de la cadena ligera kappa humana. En otro aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) comprende una cadena ligera en la que la secuencia de aminoácidos del dominio VL puede comprender cualquier secuencia descrita en la presente memoria (por ejemplo, SEQ ID NO: 202, 204, 205, 207, 208 o 400-518) y en la que la región constante de la cadena ligera comprende la secuencia de aminoácidos de una región constante de la cadena ligera lambda humana. En otro aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) comprende una cadena ligera en la que la secuencia de aminoácidos del dominio VL puede comprender cualquier secuencia descrita en la presente memoria (por ejemplo, SEQ ID NO: 519) y en la que la región constante de la cadena ligera comprende la secuencia de aminoácidos de una región constante de la cadena ligera lambda humana. En un aspecto específico, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) comprende una cadena ligera en la que la secuencia de aminoácidos del dominio VL comprende (sec. con núms. de ident.: 207 o 208) y en la que la región constante de la cadena ligera comprende la secuencia de aminoácidos de una región constante de la cadena ligera kappa o lambda humana. Los ejemplos no limitantes de secuencias de región constante humana se han descrito en la técnica, por ejemplo, ver la patente de Estados Unidos núm.
5,693,780 y Kabat EA y otros, (1991) más arriba.
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano) comprende una cadena ligera que comprende la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 555, 556, 571-576 y 580. En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano) comprende una cadena ligera que comprende la secuencia de aminoácidos seleccionada del grupo que consiste en sec. con núms. de ident.: 571-576.
Con respecto a la cadena pesada, en una realización específica, la cadena pesada de un anticuerpo descrito en la presente memoria puede ser una cadena pesada alfa (a), delta (8), épsilon (e), gamma (y) o mu (p). En otra realización específica, la cadena pesada de un anticuerpo descrito puede comprender una cadena pesada alfa (a), delta (8), épsilon (e), gamma (y) o mu (p) humana. En un aspecto particular, un dominio de unión a antígeno descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende una cadena pesada en la que la secuencia de aminoácidos del dominio VH puede comprender cualquier secuencia de aminoácidos descrita en la presente memoria (por ejemplo, cualquiera de SEQ ID NO: 201, 203, 206 o 215-389) y en la que la región constante de la cadena pesada comprende la secuencia de aminoácidos de una región constante de la cadena pesada gamma (y) humana. En un aspecto específico, un anticuerpo descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una cadena pesada en la que la secuencia de aminoácidos del dominio VH comprende una secuencia de aminoácidos seleccionada del grupo que consiste en sec. con núms. de ident.: 553, 554, 567-570 y 579, y en la que la región constante de la cadena pesada comprende el aminoácido de una cadena pesada humana descrita en la presente memoria o conocida en la técnica. En un aspecto específico, un anticuerpo descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una cadena pesada en la que la secuencia de aminoácidos del dominio VH comprende una secuencia de aminoácidos seleccionada del grupo que consiste en sec. con núms. de ident.: 581 y 582, y en la que la región constante de la cadena pesada comprende el aminoácido de una cadena pesada humana descrita en la presente memoria o conocida en la técnica. Los ejemplos no limitantes de secuencias de región constante humana se han descrito en la técnica, por ejemplo, ver la patente de Estados Unidos núm. 5,693,780 y Kabat EA y otros, (1991) más arriba.
En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una cadena pesada que comprende la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 553, 554, 567-570 y 579. En un aspecto particular, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una cadena pesada que comprende la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 581 y 582. En un aspecto específico, un anticuerpo o fragmento de este, que se une a GITR (por ejemplo, GITR humano), comprende una cadena pesada que comprende la secuencia de aminoácidos de sec. con núms. de ident.: 567-570.
En una realización específica, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH que comprenden las secuencias de aminoácidos de la invención, y en la que las regiones constantes comprenden las secuencias de aminoácidos de las regiones constantes de una molécula de inmunoglobulina IgG, IgE, IgM, IgD, IgA o IgY, o de una molécula de inmunoglobulina IgG, IgE, IgM, IgD, IgA o IgY humana. En otra realización específica, un anticuerpo descrito en la
presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) comprende un dominio VL y un dominio VH que comprenden cualquiera de las secuencias de aminoácidos de la invención, y en la que las regiones constantes comprenden las secuencias de aminoácidos de las regiones constantes de una molécula de inmunoglobulina IgG, IgE, IgM, IgD, IgA o IgY, cualquier clase (por ejemplo, IgG-i, IgG2, IgG3, IgG4, IgA1 e IgA2), o cualquier subclase (por ejemplo, IgG2a e IgG2b) de molécula de inmunoglobulina. En una realización particular, las regiones constantes comprenden las secuencias de aminoácidos de las regiones constantes de una molécula de inmunoglobulina IgG, IgE, IgM, IgD, IgA o IgY humana, cualquier clase (por ejemplo, IgG-i, IgG2, IgG3, IgG4, IgA-i, e IgA2), o cualquier subclase (por ejemplo, IgG2a e IgG2b) de molécula de inmunoglobulina.
En otra realización específica, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VL y un dominio VH que comprenden las secuencias de aminoácidos de la invención, y en la que las regiones constantes comprenden las secuencias de aminoácidos de las regiones constantes de una IgG1 humana (por ejemplo, alotipos G1m3, G1m17,1 o G1m17, 1, 2), o IgG4 humana. En una realización particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VL y un dominio VH que comprenden las secuencias de aminoácidos de la invención, y en la que las regiones constantes comprenden las secuencias de aminoácidos de la región constante de una IgG1 humana (alotipo Glm3). Ejemplos no limitantes de regiones constantes humanas se describen en la técnica, por ejemplo, ver Kabat EA y otros, (1991) más arriba.
En otro aspecto, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano) comprende una cadena ligera que comprende la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 555, 556, 571-576 y 580 y una cadena pesada que comprende la secuencia de aminoácidos seleccionada del grupo que consiste en s Eq ID NO: 553, 554, 567-570 y 579. En otro aspecto, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano) comprende una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576 y una cadena pesada que comprende la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 581 y 582. En un aspecto específico, un anticuerpo o fragmento de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 555 o 556 y una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 554.
En ciertas realizaciones, se introducen una, dos, o más mutaciones (por ejemplo, sustituciones de aminoácidos) en la región Fc de un anticuerpo descrito en la presente memoria (por ejemplo, dominio CH2 (residuos 231-340 de IgG1 humana) y/o dominio CH3 (residuos 341-447 de IgG1 humana) y/o la región bisagra, con numeración de acuerdo con el sistema de numeración de Kabat (por ejemplo, el índice Eu en Kabat)) para alterar una o más propiedades funcionales del anticuerpo, tales como vida media en suero, fijación del complemento, unión al receptor de Fc y/o citotoxicidad celular dependiente de antígeno.
En ciertas realizaciones, se introducen una, dos, o más mutaciones (por ejemplo, sustituciones de aminoácidos) en la región bisagra de la región Fc (dominio CH1) de manera que el número de residuos de cisteína en la región bisagra se altera (por ejemplo, aumenta o disminuye) como se describe en, por ejemplo, la patente de Estados Unidos núm. 5,677,425. El número de residuos de cisteína en la región bisagra del dominio CH1 puede alterarse, por ejemplo, para facilitar el ensamblaje de las cadenas ligeras y pesadas, o para alterar (por ejemplo, aumentar o disminuir) la estabilidad del anticuerpo.
En algunas realizaciones, se introducen una, dos, o más mutaciones (por ejemplo, sustituciones de aminoácidos) en la región Fc de un anticuerpo descrito en la presente memoria (por ejemplo, dominio CH2 (residuos 231-340 de IgG1 humana) y/o dominio CH3 (residuos 341-447 de IgG1 humana) y/o la región bisagra, con numeración de acuerdo con el sistema de numeración de Kabat (por ejemplo, el índice EU en Kabat)) para aumentar o disminuir la afinidad del anticuerpo por un receptor de Fc (por ejemplo, un receptor de Fc activado) en la superficie de una célula efectora. Las mutaciones en la región Fc de un anticuerpo o fragmento de este que disminuyen o aumentan la afinidad de un anticuerpo por un receptor de Fc y las técnicas para introducir tales mutaciones en el receptor de Fc o fragmento de este se conocen por un experto en la técnica. Los ejemplos de mutaciones en el receptor de Fc de un anticuerpo que pueden hacerse para alterar la afinidad del anticuerpo por un receptor de Fc se describen en, por ejemplo, Smith P y otros, (2012) PNAS 109: 6181-6186, la patente de Estados Unidos núm. 6,737,056, y las publicaciones internacionales núms. WO 02/060919; WO 98/23289; y WO 97/34631.
En una realización específica, una, dos, o más mutaciones de aminoácidos (es decir, sustituciones, inserciones o deleciones) se introducen en un dominio constante de IgG, o fragmento de unión a FcRn de este (preferentemente, un fragmento de dominio de Fc o Fc-bisagra) para alterar (por ejemplo, disminuir o aumentar) la vida media del anticuerpo in vivo. Ver, por ejemplo, las publicaciones internacionales núms. WO 02/060919; WO 98/23289; y WO 97/34631; y las patentes de Estados Unidos núms. 5,869,046, 6,121,022, 6,277,375 y 6,165,745 para ejemplos de mutaciones que alterarán (por ejemplo, disminuirán o aumentarán) la vida media de un anticuerpo in vivo. En algunas realizaciones, se introducen una, dos o más mutaciones de aminoácidos (es decir, sustituciones, inserciones, o deleciones) en un dominio constante de IgG, o fragmento de unión a FcRn de este (preferentemente, un fragmento de dominio de Fc o Fc-bisagra) para disminuir la vida media del anticuerpo in vivo. En otras realizaciones, se introducen una, dos o más mutaciones de aminoácidos (es decir, sustituciones, inserciones o
deleciones) en un dominio constante de IgG, o fragmento de unión a FcRn de este (preferentemente, un fragmento de dominio de Fc o Fc-bisagra) para aumentar la vida media del anticuerpo in vivo. En una realización específica, los anticuerpos pueden tener una o más mutaciones de aminoácidos (por ejemplo, sustituciones) en el segundo dominio constante (CH2) (residuos 231-340 de IgG1 humana) y/o el tercer dominio constante (CH3) (residuos 341-447 de IgG1 humana), con numeración de acuerdo con el índice EU en Kabat (Kabat y otros, (1991) más arriba. En una realización específica, la región constante de la IgG1 de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende una sustitución de metionina (M) por tirosina (Y) en la posición 252, una sustitución de serina (S) por treonina (T) en la posición 254, y una sustitución de treonina (T) por ácido glutámico (E) en la posición 256, enumeradas de acuerdo con el sistema EU como en Kabat. Ver la patente de Estados Unidos núm. 7,658,921. Se ha demostrado que este tipo de IgG mutante, referido como “mutante YTE” presenta un aumento de la vida media de cuatro veces en comparación con versiones de tipo silvestre del mismo anticuerpo (ver Dall'Acqua WF y otros, (2006) J Biol Chem 281: 23514-24). En ciertas realizaciones, un anticuerpo o fragmento de unión a antígeno de este comprende un dominio constante de IgG que comprende una, dos, tres o más sustituciones de aminoácidos de residuos de aminoácidos en las posiciones 251-257, 285-290, 308-314, 385-389 y 428-436, enumeradas de acuerdo con el índice EU como en Kabat.
En una realización adicional, se introducen una, dos, o más sustituciones de aminoácidos en una región Fc de dominio constante de IgG para alterar la función o las funciones efectoras del anticuerpo. Por ejemplo, uno o más aminoácidos seleccionados de los residuos de aminoácidos 234, 235, 236, 237, 297, 318, 320 y 322, enumerados de acuerdo con el índice EU como en Kabat, pueden reemplazarse con un residuo de aminoácido diferente de manera que el anticuerpo tenga una afinidad alterada por un ligando efector, pero conserve la capacidad de unión a antígeno del anticuerpo parental. El ligando efector para el cual se altera la afinidad puede ser, por ejemplo, un receptor de Fc o el componente C1 del complemento. Este enfoque se describe con más detalle en las patentes de Estados Unidos núms. 5,624,821 y 5,648,260. En algunas realizaciones, la deleción o inactivación (a través de mutaciones puntuales u otros métodos) de un dominio de región constante puede reducir la unión al receptor de Fc del anticuerpo circulante aumentando de este modo la localización del tumor. Ver, por ejemplo, las patentes de Estados Unidos núms. 5,585,097 y 8,591,886 para una descripción de las mutaciones que eliminan o inactivan el dominio constante y aumentan de este modo la localización del tumor. En ciertas realizaciones, una o más sustituciones de aminoácidos pueden introducirse en la región Fc de un anticuerpo descrito en la presente memoria para eliminar sitios potenciales de glicosilación en la región Fc, lo que puede reducir la unión al receptor de Fc (ver, por ejemplo, Shields RL y otros, (2001) J Biol Chem 276: 6591-604). En diversas realizaciones, pueden hacerse una o más de las siguientes mutaciones en la región constante de un anticuerpo descrito en la presente memoria: una sustitución N297A; una sustitución N297Q; una sustitución L235A y una sustitución L237A; una sustitución L234A y una sustitución L235A; una sustitución E233P; una sustitución L234V; una sustitución L235A; una deleción C236; una sustitución P238A; una sustitución D265A; una sustitución A327Q; o una sustitución P329A, enumeradas de acuerdo con el índice EU como en Kabat.
En una realización específica, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria comprende el dominio constante de una IgG1 con una sustitución de aminoácidos N297Q o N297A.
En ciertas realizaciones, uno o más aminoácidos seleccionados de los residuos de aminoácidos 329, 331 y 322 en la región constante de un anticuerpo descrito en la presente memoria, enumerados de acuerdo con el índice EU como en Kabat, pueden reemplazarse con un residuo de aminoácido diferente de manera que el anticuerpo tiene una unión a C1q alterada y/o una citotoxicidad dependiente del complemento (CDC) reducida o suprimida. Este enfoque se describe con más detalle en la patente de Estados Unidos núm. 6,194,551 (Idusogie y otros). En algunas realizaciones, uno o más residuos de aminoácidos dentro de las posiciones de aminoácidos 231 a 238 en la región N-terminal del dominio CH2 de un anticuerpo descrito en la presente memoria se alteran para alterar de este modo la capacidad del anticuerpo de fijar el complemento. Este enfoque se describe adicionalmente en la publicación internacional núm. WO 94/29351. En ciertas realizaciones, la región Fc de un anticuerpo descrito en la presente memoria se modifica para aumentar la capacidad del anticuerpo de mediar la citotoxicidad celular dependiente de anticuerpo (ADCC) y/o para aumentar la afinidad del anticuerpo por un receptor de Fc mediante la mutación de uno o más aminoácidos (por ejemplo, al introducir sustituciones de aminoácidos) en las siguientes posiciones: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 o 439, enumeradas de acuerdo con el índice EU como en Kabat. Este enfoque se describe adicionalmente en la publicación internacional núm. WO 00/42072.
En ciertas realizaciones, un anticuerpo descrito en la presente memoria comprende la región constante de un anticuerpo IgG4 y la serina en el residuo de aminoácido 228 de la cadena pesada, enumerado de acuerdo con el índice EU como en Kabat, se sustituye por prolina.
Se ha informado que los anticuerpos con contenido de fucosa reducido tienen una afinidad aumentada por los receptores de Fc, tales como, por ejemplo, FcYRIIIa. En consecuencia, en ciertas realizaciones, los anticuerpos o fragmentos de unión a antígeno de estos, descritos en la presente memoria, tienen contenido de fucosa reducido o no tienen contenido de fucosa. Tales anticuerpos pueden producirse mediante el uso de técnicas conocidas por un
experto en la técnica. Por ejemplo, los anticuerpos pueden expresarse en células deficientes o carentes de la capacidad de fucosilación. En un ejemplo específico, las líneas celulares con una desactivación de ambos alelos de la a1,6-fucosiltransferasa pueden usarse para producir anticuerpos con contenido de fucosa reducido. El sistema Potelligent® (Lonza) es un ejemplo de tal sistema que puede usarse para producir anticuerpos con contenido de fucosa reducido. Alternativamente, los anticuerpos o fragmentos de unión a antígeno con contenido de fucosa reducido o sin contenido de fucosa pueden producirse mediante, por ejemplo: (i) cultivo de células en condiciones que impiden o reducen la fucosilación; (ii) eliminación postraduccional de fucosa (por ejemplo, con una enzima fucosidasa); (iii) adición postraduccional del carbohidrato deseado, por ejemplo, después de la expresión recombinante de una glicoproteína no glicosilada; o (iv) purificación de la glicoproteína para seleccionar anticuerpos o fragmentos de unión a antígeno de estos que no están fucosilados. Ver, por ejemplo, Longmore GD & Schachter H (1982) Carbohydr Res 100: 365-92 e Imai-Nishiya H y otros, (2007) BMC Biotechnol. 7: 84 para procedimientos para producir anticuerpos o fragmentos de unión a antígeno de estos sin contenido de fucosa o contenido de fucosa reducido.
En ciertas realizaciones, los anticuerpos o fragmentos de unión a antígeno de estos descritos en la presente memoria tienen una afinidad aumentada por CD32B (también conocido como FcyRIIB o FCGR2B), por ejemplo, en comparación con un anticuerpo con una región Fc de tipo silvestre, por ejemplo, una Fc de IgG1. En ciertas realizaciones, los anticuerpos o fragmentos de unión a antígeno de estos descritos en la presente memoria tienen una afinidad aumentada selectivamente por CD32B (FcyRIIB) sobre tanto CD32A (FcyRIIA) como CD16 (FcyRIIIA). Las alteraciones de la secuencia que dan como resultado una mayor afinidad por CD32B se proporcionan, por ejemplo, en Mimoto y otros, Protein Engineering, Design & Selection 10: 589-598 (2013), Chu y otros, Molecular Immunology 45: 3926-3933 (2008), y Strohl, Current Opinion in Biology 20: 685-691 (2009). En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende una mutación seleccionada del grupo que consiste en: G236D, P238D, S239D, S267E, L328F, L328E, una arginina insertada después de la posición 236, y combinaciones de estas, enumeradas de acuerdo con el índice EU (Kabat y otros, Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, Bethesda (1991)). En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende las sustituciones S267E y L328F. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende las sustituciones P238D y L328E. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende una sustitución P238D y una sustitución seleccionada del grupo que consiste en E233D, G237D, H268D, P271G, A330R y combinaciones de estas. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende las sustituciones P238D, E233d , G237D, H268D, P271G y A330R. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende G236D y S267E. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende S239D y S267E. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende S267E y L328F. En algunas realizaciones, el anticuerpo o fragmento de unión a antígeno con una afinidad aumentada por CD32B comprende una región constante de la cadena pesada, por ejemplo, una región constante de IgG1, o un fragmento de esta que comprende una arginina insertada después de la posición 236 y L328R.
En otro aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende una cadena ligera y una cadena pesada, en la que (i) la cadena ligera comprende un dominio VL que comprende una CDR1 de VL, CDR2 de VL, y CDR3 de VL que tiene las secuencias de aminoácidos de cualquiera de Hum231#2, pab 1964, pab 1965, pab 1966, pab 1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, los enumerados en la Tabla 1); (ii) la cadena pesada comprende un dominio VH que comprende una CDR1 de VH, CDR2 de VH y CDR3 de VH que tiene las secuencias de aminoácidos de cualquiera de Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, los enumerados en la Tabla 2); (iii) la cadena ligera comprende además un dominio de cadena ligera constante que comprende la secuencia de aminoácidos del dominio constante de una cadena ligera kappa humana; y (iv) la cadena pesada comprende además un dominio de cadena pesada constante que comprende la secuencia de aminoácidos del dominio constante de una cadena pesada de IgG 1 humana (opcionalmente IgG1 (alotipo Glm3)).
En otro aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende una cadena ligera y una cadena pesada, en la que (i) la cadena ligera comprende un dominio VL que comprende la secuencia de aminoácidos de cualquiera de los anticuerpos Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161por ejemplo, SeQ ID NO: 202, 204, 205, 207, 208 o 400-518 o SEQ ID NO: 519); (ii) la cadena pesada comprende un dominio VH que comprende la secuencia de aminoácidos y uno de los anticuerpos Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, (por ejemplo, SEQ ID NO: 201, 203, 206 o 215 389); (iii) la cadena ligera comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena ligera kappa humana; y (iv) la cadena pesada comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena pesada de IgG1 humana (opcionalmente IgG1 (alotipo Glm3)).
En otra realización particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende una cadena ligera y una cadena pesada, en la que (i) la cadena ligera comprende un dominio VL que comprende la secuencia de aminoácidos de Hum231#2 (por ejemplo, SEQ ID NO: 208); (ii) la cadena pesada comprende un dominio VH que comprende la secuencia de aminoácidos de Hum231#2 (por ejemplo, SEQ ID NO: 206); (iii) la cadena ligera comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena ligera kappa humana; y (iv) la cadena pesada comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena pesada de IgG1 humana (opcionalmente IgG1 (alotipo Glm3)).
En otro aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende una cadena ligera y una cadena pesada, en la que (i) la cadena ligera comprende un dominio VL que comprende una CDR1 de VL, CDR2 de VL, y CDR3 de Vl que tiene las secuencias de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, los enumerados en la Tabla 1); (ii) la cadena pesada comprende un dominio VH que comprende un CDR1 de VH, CDR2 de VH y CDR3 de VH que tiene las secuencias de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, los enumerados en la Tabla 2); (iii) la cadena ligera comprende además un dominio de cadena ligera constante que comprende la secuencia de aminoácidos del dominio constante de una IgG4 humana; y (iv) la cadena pesada comprende además un dominio de cadena pesada constante que comprende la secuencia de aminoácidos del dominio constante de una cadena pesada de IgG4 humana.
En otro aspecto particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende una cadena ligera y una cadena pesada, en la que (i) la cadena ligera comprende un dominio VL que comprende la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, SEQ ID NO: 202, 204, 205, 207, 208 o 400-518 o SEQ ID NO: 519); (ii) la cadena pesada comprende un dominio VH que comprende la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107 o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, SeQ ID NO: 201, 203, 206 o 215-389); (iii) la cadena ligera comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena ligera de IgG4 humana; y (iv) la cadena pesada comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena pesada de IgG4 humana.
En otra realización particular, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende una cadena ligera y una cadena pesada, en la que (i) la cadena ligera comprende un dominio VL que comprende la secuencia de aminoácidos de Hum231#2 (por ejemplo, SEQ ID NO: 208); (ii) la cadena pesada comprende un dominio VH que comprende la secuencia de aminoácidos de Hum231#2 (por ejemplo, SEQ ID NO: 206); (iii) la cadena ligera comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena ligera de IgG4 humana; y (iv) la cadena pesada comprende además un dominio constante que comprende la secuencia de aminoácidos del dominio constante de una cadena pesada de IgG4 humana.
En un aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GlTR humano), comprende (a) una cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 553, 554 y 567 a 570; y (b) una región variable de la cadena ligera que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 555, 556 y 571 a 576. En un aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 581 o 582; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 554; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 581; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 582; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 555. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 554; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 555. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 567; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 573. En otra realización específica, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 567; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576. En otra realización específica, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 554; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 581; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 582; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 576.
En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553 con una sustitución de aminoácidos de N por A o Q en la posición de aminoácido 298; y (b) una cadena ligera que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 555, 556 y 571 a 576. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 553 con una sustitución de aminoácidos de N por A o Q en la posición de aminoácido 298; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 556. En otro aspecto específico, un anticuerpo proporcionado en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende (a) una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID nO: 553 con una sustitución de aminoácidos de N por A o Q en la posición de aminoácido 298; y (b) una cadena ligera que comprende la secuencia de aminoácidos de SEQ ID NO: 555.
En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco (FR) de VL que tienen la secuencia de aminoácidos descrita en la presente memoria para cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, ver Tabla 3). En algunos aspectos, un anticuerpo o fragmento de este, que se une específicamente a GITR (por ejemplo, GITR humano) comprende una, dos, tres o cuatro regiones marco (FR) de VH que tienen la secuencia de aminoácidos descrita en la presente memoria para cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o
anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, ver Tabla 4). En ciertos aspectos, un anticuerpo o fragmento de este, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres, cuatro, cinco, seis, siete u ocho de las FR de uno de los anticuerpos descritos en la presente memoria (por ejemplo, Hum231#1 Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161). En aspectos específicos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende regiones marco (por ejemplo, regiones marco del dominio VL y/o el dominio VH) que son regiones marco humanas o derivadas de regiones marco humanas. Los ejemplos no limitantes de regiones marco humanas se describen en la técnica, por ejemplo, ver Kabat EA y otros, (1991) más arriba). En cierta modalidad, un anticuerpo descrito en la presente memoria comprende regiones marco (por ejemplo, regiones marco del dominio VL y/o el dominio VH) que son regiones marco de primate (por ejemplo, primate no humano) o derivadas de regiones marco de primate (por ejemplo, primate no humano).
Por ejemplo, las CDR de los anticuerpos no humanos específicos de antígeno, típicamente originados de roedor (por ejemplo, ratón o rata), se injertan en marcos aceptores homólogos de primate humano o no humano. En un aspecto, los marcos aceptores de primate no humano son de simios del Viejo Mundo. En un aspecto específico, el marco aceptor de simios del Viejo Mundo es de Pan troglodytes, Pan paniscus o Gorilla gorila. En un aspecto particular, los marcos aceptores de primate no humano son del chimpancé Pan troglodytes. En un aspecto particular, los marcos aceptores de primate no humano son marcos aceptores de monos del Viejo Mundo. En un aspecto específico, los marcos aceptores de monos del Viejo Mundo son del género Macaca. En un cierto aspecto, los marcos aceptores de primate no humano se derivan del mono cinomolgo Macaca cynomolgus. Las secuencias marco de primate no humano se describen en la publicación de solicitud de patente de Estados Unidos núm. US 2005/0208625.
En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos o más regiones marco (FR) de VL que tienen las secuencias de aminoácidos descritas en la presente memoria para cualquiera de los anticuerpos expuestos en la Tabla 3, más arriba. En algunos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos o más regiones marco (FR) de VH que tienen las secuencias de aminoácidos descritas en la presente memoria para cualquiera de los anticuerpos expuestos en la Tabla 4, más arriba. En aspectos específicos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos o más regiones marco de VL que tienen las secuencias de aminoácidos descritas en la presente memoria para cualquiera de los anticuerpos establecidos en la Tabla 3, más arriba, y una, dos o más regiones marco de VH que tienen las secuencias de aminoácidos descritas en la presente memoria para los anticuerpos expuestos en la Tabla 4, más arriba.
En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende las regiones marco del dominio VL que tienen la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-452, 454-464, 467-477, 481-486, 488-513 o 515-518 y/o las regiones marco del dominio VH que tienen la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206, 215, 217 234, 236-256, 258, 259, 261-265, 267, 268, 271-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296 299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 345, 350, 354-356,
358-360, 362-368, 380, 384 o 387. En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende las regiones marco del dominio VL que tienen la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-464, 467-477, 481-486, 488-513 o 515-519 y/o las regiones del marco del dominio VH que tienen la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261-265, 267, 268, 270-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 345, 350, 354-356, 358-360 o 362-368. En algunos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco del dominio VL que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107 (por ejemplo, SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-452, 454-464, 467-477, 481-486, 488-513 o 515-518) con 1, 2, 3, 4, 5, 6, 7, 8, 9 o más mutaciones de aminoácidos (por ejemplo, sustituciones de aminoácidos, tales como sustituciones de aminoácidos conservadoras) y/o las regiones marco del dominio VH que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107 (por ejemplo, SEQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261-265, 267, 268, 271-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 345, 350, 354-356, 358-360, 362-368, 380, 384 o 387). En algunos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria,
que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco del dominio VL que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231 32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-464, 467-477, 481-486, 488-513 o 515-519) con 1, 2, 3, 4, 5, 6, 7, 8, 9 o más mutaciones de aminoácidos (por ejemplo, sustituciones de aminoácidos, tales como sustituciones de aminoácidos conservadoras) y/o las regiones marco del dominio VH que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, SEQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261-265, 267, 268, 270-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 345, 350, 354-356, 358-360 o 362-368). En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GlTR humano), comprende una, dos, tres o cuatro regiones marco del dominio VH que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967,npab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 (por ejemplo, SEQ ID NO: 201, 203, 206 o 215-389) con 1, 2, 3, 4, 5, 6, 7, 8, 9 o más mutaciones de aminoácidos (por ejemplo, sustituciones de aminoácidos, tales como sustituciones de aminoácidos conservadoras) y/o las regiones marco del dominio VL que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, SEQ ID NO: 201, 203, 206 o 215-389). En algunos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco del dominio VL que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107 (por ejemplo, SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-452, 454-464, 467-477, 481-486, 488-513 o 515-518) con 1, 2, 3, 4, 5, 6, 7, 8, 9 o más mutaciones de aminoácidos (por ejemplo, sustituciones de aminoácidos, tales como sustituciones de aminoácidos conservadoras) y/o una, dos, tres o cuatro regiones marco del dominio VH que tienen la secuencia de aminoácidos de SEQ ID NO: 201, 203, 206 o 215-389 con 1, 2, 3, 4, 5, 6, 7, 8, 9 o más mutaciones de aminoácidos (por ejemplo, sustituciones de aminoácidos, tales como sustituciones conservadoras de aminoácidos). En algunos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende una, dos, tres o cuatro regiones marco del dominio VL que tienen la secuencia de aminoácidos de cualquiera de los anticuerpos descritos en la presente memoria, por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450 464, 467-477, 481-486, 488-513 o 515-519) con 1, 2, 3, 4, 5, 6, 7, 8, 9 o más mutaciones de aminoácidos (por ejemplo, sustituciones de aminoácidos, tales como sustituciones de aminoácidos conservadoras) y/o una, dos, tres o cuatro regiones marco del dominio VH que tienen la secuencia de aminoácidos de SEQ ID NO: 201, 203, 206 o 215 389 con 1, 2, 3, 4, 5, 6, 7, 8, 9 o más mutaciones de aminoácidos (por ejemplo, sustituciones de aminoácidos, tales como sustituciones conservadoras de aminoácidos).
En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende regiones marco (FR) de VL que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VL descritas en la presente memoria en la Tabla 3, más arriba. En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende regiones marco (FR) de VH que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VH descritas en la presente memoria Tabla 4, más arriba. En algunos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende regiones marco (FR) de VH que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VH descritas en la presente Tabla 4, supra, y regiones marco (FR) de VL que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VL descritas en la presente memoria Tabla 3, más arriba.
En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende regiones marco (FR) de VL que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VL descritas en la presente memoria para el anticuerpo Hum231#1, Hum231#2, pab1964, pab1965,
pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, como se expone en la Tabla 3). En algunos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITR (por ejemplo, GITR humano), comprende regiones marco (FR) de VH que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VH descritas en la presente memoria para el anticuerpo Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, como se expone en la Tabla 4). En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une específicamente a GITr (por ejemplo, GITR humano), comprende: (i) regiones marco de VL (FR) que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VL descritas en la presente memoria para Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, como se expone en la Tabla 3); y (ii) regiones marco (FR) de VH que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con las regiones marco de VH descritas en la presente memoria para Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, como se expone en la Tabla 4).
La determinación del por ciento de identidad entre dos secuencias (por ejemplo, secuencias de aminoácidos o secuencias de ácidos nucleicos) puede realizarse también mediante el uso de un algoritmo matemático. Un ejemplo específico no limitante de un algoritmo matemático utilizado para la comparación de dos secuencias es el algoritmo de Karlin S y Altschul SF (1990) PNAS 87: 2264-2268, modificado como en Karlin S y Altschul SF (1993) PNAS 90: 5873-5877. Tal algoritmo se incorpora en los programas NBLAST y XBLAST de Altschul SF y otros, (1990) J Mol Biol 215: 403. Las búsquedas de nucleótidos en BLAST pueden realizarse con el conjunto de parámetros del programa de nucleótidos NBLAST, por ejemplo, para puntuación=100, longitud de palabra=12 para obtener secuencias de nucleótidos homólogas a unas moléculas de ácidos nucleicos descritas en la presente memoria. Las búsquedas de proteínas en BLAST pueden realizarse con el conjunto de parámetros del programa XBLAST, por ejemplo, para puntuación 50, longitud de palabra=3 para obtener secuencias de aminoácidos homólogas a una molécula proteica descrita en la presente memoria. Para obtener alineaciones interrumpidas para propósitos de comparación, puede utilizarse Gapped BLAST como se describe en Altschul SF y otros, (1997) Nuc Acids Res 25: 3389 3402. Alternativamente, puede usarse PSI BLAST para realizar una búsqueda iterada que detecta relaciones distantes entre moléculas (Id.). Cuando se utilizan los programas BLAST, Gapped BLAST, y PSI Blast, pueden usarse los parámetros por defecto de los respectivos programas (por ejemplo, de XBLAST y NBLAST) (ver, por ejemplo, National Center for Biotechnology Information (NCBI) en la web mundial, ncbi.nlm.nih.gov). Otro ejemplo específico no limitante de un algoritmo matemático utilizado para la comparación de secuencias es el algoritmo de Myers y Miller, 1988, CABIOS 4:11 17. Tal algoritmo se incorpora en el programa ALIGN (versión 2.0) que es parte del paquete de programas informáticos de alineación de secuencias GCG. Cuando se utiliza el programa ALIGN para comparar secuencias de aminoácidos, pueden usarse una tabla de residuos ponderados PAM120, una penalización de longitud de interrupción de 12, y una penalización por interrupción de 4.
El por ciento de identidad entre dos secuencias puede determinarse mediante el uso de técnicas similares a las descritas anteriormente, con o sin interrupciones permitidas. En el cálculo del por ciento de identidad, se cuentan, típicamente, solo las coincidencias exactas.
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VL de cualquiera de los anticuerpos Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (por ejemplo, SEQ ID NO: 202, 204, 205, 207, 208 o 400-518 o SEQ ID NO: 519). En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VL de cualquiera de los anticuerpos Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, Hum231#1, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, (por ejemplo, SEQ ID NO: 202, 204, 205, 207, 208 o 400-518 o SEQ ID NO: 519), en la que el anticuerpo o fragmento de unión al antígeno comprende CDR (por ejemplo, CDR de VL) que son idénticos a las CDR (por ejemplo, CDR de VL) de un anticuerpo expuestas en la Tabla 1 y/o la Tabla 2 (por ejemplo, las CDR son idénticas a las CDR de un anticuerpo particular mencionado por su nombre en las Tablas 1 y/o 2).
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VL que comprende regiones marco de VL que tienen al menos 80 %, al
menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de las regiones marco seleccionadas del grupo que consiste en SEQ ID NO: 202, 204, 205, 207, 208 y 400-518. En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VL que comprende regiones marco de VL que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de SEQ ID NO: 519. En un aspecto particular, el anticuerpo comprende CDR de VL que son idénticas a las CDR de VL de un anticuerpo expuestas en la Tabla 1 (por ejemplo, las CDR de VL en una fila en la Tabla 1).
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VH que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VH de SEQ ID NO: 201, 203, 206 o 215-389. En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VH que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VH de SEQ ID NO: 201, 203, 206 o 215-389, en la que el anticuerpo o fragmento de unión a antígeno comprende CDR (por ejemplo, CDR de VL) que son idénticas a los CDR (por ejemplo, CDR de VL) de un anticuerpo expuestas en la Tabla 1 y/o la Tabla 2 (por ejemplo, las CDR son idénticas a las CDR de un anticuerpo con nombre particular mencionado por su nombre en las Tablas 1 y/o 2).
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VH que comprende regiones marco de VH que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de las regiones marco seleccionadas del grupo que consiste en SEQ ID NO: 201, 203, 206 y 215-389. En un aspecto particular, el anticuerpo comprende CDR de VH que son idénticas a las CDR de VH de un anticuerpo expuestas en la Tabla 2 (por ejemplo, las CDR de VH en una fila en la Tabla 2).
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende: (i) un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 %, o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VL seleccionado del grupo que consiste en SEQ ID NO: 202, 204, 205, 207, 208 y 400-518; y (ii) un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VH de SEQ ID NO: 201, 203, 206 o 215-389. En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende: (i) un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 %, o al menos 98 % de identidad de secuencia con la SEQ ID NO: 519; y (ii) un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VH de SEQ ID NO: 304. En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende: (i) un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 %, o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VL seleccionado del grupo que consiste en SEQ ID NO: 202, 204, 205, 207, 208 y 400-518; y (ii) un dominio VH que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VH seleccionado del grupo de SEQ ID NO: 201, 203, 206 y 215-389, en el que el anticuerpo o el fragmento de unión al antígeno comprende CDR (por ejemplo, CDR de VL) que son idénticas a las CDR (por ejemplo, CDR de VL) de un anticuerpo expuestas en la Tabla 1 y/o la Tabla 2 (por ejemplo, las CDR son idénticas a las CDR de un anticuerpo particular mencionado por su nombre en las Tablas 1 y/o 2). En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende: (i) un dominio VL que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de SEQ ID NO: 519; y (ii) un dominio VH que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de SEQ ID NO: 304, en la que el anticuerpo o el fragmento de unión a antígeno comprende CDR (por ejemplo, CDR de VL) que son idénticas a las CDR (por ejemplo, CDR de VL) de un anticuerpo expuestas en la Tabla 1 y/o la Tabla 2 (por ejemplo, las CDR son idénticas a las CDR de un anticuerpo particular mencionado por su nombre en las Tablas 1 y/o 2).
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende: (i) un dominio VL que comprende regiones marco de VL que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de las regiones marco seleccionadas del grupo que consiste en SEQ ID NO: 202, 204, 205, 207 y 208; y (ii) un dominio VH que comprende regiones marco de Vh que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de las regiones marco seleccionadas del grupo que consiste en SEQ ID NO: 201, 203, 206 y 215-389. En un aspecto particular, el anticuerpo comprende CDR de VL que son idénticas a las CDR de VL de un anticuerpo expuestas en la Tabla 3 y/o CDR de VH que son idénticas a las CDR de VH de un anticuerpo expuestas en la Tabla 4.
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VH que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VH seleccionado del grupo de SEQ ID NO: 201, 203, 206 y 215-389. En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VH que tiene al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos del dominio VH seleccionado del grupo de SEQ ID NO: 201, 203, 206 y 215-389, en el que el anticuerpo o fragmento de unión a antígeno comprende CDR (por ejemplo, VL CDR) que son idénticas a las CDR (por ejemplo, CDR de VL) de un anticuerpo expuestas en la Tabla 1 y/o la Tabla 2 (por ejemplo, las CDR son idénticas a las CDR de un anticuerpo particular mencionado en las Tablas 1 y/o 2).
En ciertos aspectos, un anticuerpo o fragmento de este, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), comprende un dominio VH que comprende regiones marco de VH que tienen al menos 80 %, al menos 85 %, al menos 90 %, al menos 95 % o al menos 98 % de identidad de secuencia con la secuencia de aminoácidos de las regiones marco seleccionadas del grupo que consiste en SEQ ID NO: 201, 203, 206 y 215-389. En un aspecto particular, el anticuerpo comprende CDR de VH que son idénticas a las CDR de VH de un anticuerpo expuestas en la Tabla 2 (por ejemplo, las CDR de VH en una fila en la Tabla 2).
En otro aspecto, se proporcionan en la presente memoria anticuerpos que se unen al mismo o un epítopo solapado de GITR (por ejemplo, un epítopo de GITR humano) que un anticuerpo descrito en la presente memoria (por ejemplo, anticuerpo Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107), o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w. En ciertos aspectos, el epítopo de un anticuerpo puede determinarse mediante, por ejemplo, espectroscopía de RMN, estudios de cristalografía por difracción de rayos X, ensayos ELISA, intercambio de hidrógeno/deuterio acoplado a espectrometría de masas (por ejemplo, espectrometría de masas por electrospray con cromatografía líquida), ensayos de barrido de oligopéptidos basados en arreglos, y/o mapeo por mutagénesis (por ejemplo, mapeo por mutagénesis dirigido a sitio). Para la cristalografía por rayos X, la cristalización puede realizarse mediante el uso de cualquiera de los procedimientos conocidos en la técnica (por ejemplo, Giegé R y otros, (1994) Acta Crystallogr D Biol Crystallogr 50(Pt 4): 339-350; McPherson A (1990) Eur J Biochem 189: 1-23; Chayen NE (1997) Structure 5: 1269-1274; McPherson A (1976) J Biol Chem 251: 6300-6303). Los cristales de anticuerpo:antígeno pueden estudiarse mediante el uso de técnicas de difracción de rayos X bien conocidas y pueden refinarse mediante el uso de software informáticos tales como X-PLOR (Universidad de Yale, 1992, distribuido por Molecular Simulations, Inc.; ver, por ejemplo, Meth Enzymol (1985) volúmenes 114 y 115, eds Wyckoff HW y otros; la solicitud de patente de Estados Unidos núm. 2004/0014194), y BUSTER (Bricogne G (1993) Acta Crystallogr D Biol Crystallogr 49(Pt 1): 37-60; Bricogne G (1997) Meth Enzymol 276A: 361-423, ed Carter CW; Roversi P y otros, (2000) Acta Crystallogr D Biol Crystallogr 56(Pt 10): 1316-1323). Los estudios de mapeo por mutagénesis pueden realizarse mediante el uso de cualquier procedimiento conocido por un experto en la técnica. Ver, por ejemplo, Champe M y otros, (1995) más arriba y Cunningham BC y Wells JA (1989) más arriba para una descripción de las técnicas de mutagénesis, que incluyen técnicas de mutagénesis por barrido de alanina. En un aspecto específico, el epítopo de un anticuerpo o fragmento de unión a antígeno de este se determina mediante el uso de estudios de mutagénesis de barrido de alanina, como se describe en la Sección 6, más abajo. Además, los anticuerpos que reconocen y se unen al mismo epítopo o a epítopos solapados de GITR (por ejemplo, GITR humano) pueden identificarse mediante el uso de técnicas de rutina tales como un inmunoensayo, por ejemplo, mediante la demostración de la capacidad de un anticuerpo de bloquear la unión de otro anticuerpo a un antígeno objetivo, es decir, un ensayo de unión competitiva. Los ensayos de unión competitiva también pueden usarse para determinar si dos anticuerpos tienen especificidad de unión similar por un epítopo. La unión competitiva puede determinarse en un ensayo en el que la inmunoglobulina a prueba inhibe la unión específica de un anticuerpo de referencia a un antígeno común, tal como GITR. Se conocen numerosos tipos de ensayos de unión competitiva, por ejemplo: radioinmunoensayo (RIA) directo o indirecto en fase sólida, inmunoensayo enzimático (EIA) directo o indirecto en fase sólida, ensayo de competencia de tipo sándwich (ver Stahli C y otros, (1983) Methods Enzymol 9:242-253); EIA de biotina-avidina directo en fase sólida (ver Kirkland TN y otros, (1986) J Immunol 137: 3614-9); ensayo de etiquetado directo en fase sólida, ensayo de tipo sándwich de etiquetado directo en fase sólida (ver Harlow E y Lane D, (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Press); RIA de etiquetado directo en fase sólida mediante el uso de la etiqueta 1-125 (ver Morel GA y otros, (1988) Mol. Immunol 25(1): 7-15); EIA de biotina-avidina directo en fase sólida (Cheung RC y otros, (1990) Virology 176: 546-52); y RIA de etiquetado directo. (Moldenhauer G y otros, (1990) Scand J Immunol 32: 77-82). Típicamente, tal ensayo implica el uso del antígeno purificado (por ejemplo, GITR tal como GITR humano) unido a una superficie sólida o células que portan cualquiera de estos, una inmunoglobulina de prueba no etiquetada y una inmunoglobulina de referencia etiquetada. La inhibición competitiva puede medirse mediante la determinación de la cantidad de etiqueta unida a la superficie sólida o a las células en presencia de la inmunoglobulina de prueba. Por lo general, la inmunoglobulina de prueba está presente en exceso. Generalmente, cuando un anticuerpo competidor está presente en exceso, inhibirá la unión específica de un anticuerpo de referencia a un antígeno común al menos en un 50-55 %, 55-60 %, 60-65 %, 65-70 % 70-75 % o más. Un ensayo de unión competitiva puede configurarse en una gran cantidad de formatos diferentes mediante el uso ya sea de antígeno etiquetado o un anticuerpo etiquetado. En una versión común de este ensayo, el antígeno se inmoviliza en una placa de 96 pocillos. La capacidad de los anticuerpos no etiquetados de bloquear la unión de anticuerpos etiquetados al antígeno se mide después mediante
el uso de etiquetas radioactivas o enzimáticas. Para detalles adicionales ver, por ejemplo, Wagener C y otros, (1983) J Immunol 130: 2308-2315; Wagener C y otros, (1984) J Immunol Methods 68: 269-274; Kuroki M y otros, (1990) Cancer Res 50: 4872-4879; Kuroki M y otros, (1992) Immunol Invest 21: 523-538; Kuroki M y otros, (1992) Hybridoma 11: 391-407 y Antibodies: A Laboratory Manual, Ed Harlow E y Lane D editores más arriba, páginas 386 389.
En un aspecto, un ensayo de competencia se realiza mediante el uso de resonancia de plasmones de superficie (BIAcore®), por ejemplo, mediante un 'enfoque en serie' tal como el descrito por Abdiche YN y otros, (2009) Analytical Biochem 386: 172-180, por el cual el antígeno GITR se inmoviliza en la superficie del chip, por ejemplo, un chip sensor CM5 y los anticuerpos anti-GITR se pasan después por el chip. Para determinar si un anticuerpo compite con un anticuerpo anti-GITR o fragmento de unión a antígeno descrito en la presente memoria, el anticuerpo anti-GITR se pasa primero por la superficie del chip para lograr la saturación y después se añade el anticuerpo potencial, competitivo. La unión del anticuerpo competitivo puede determinarse y cuantificarse después con relación a un control no competitivo.
En ciertos aspectos, los ensayos de unión competitiva pueden usarse para determinar si un anticuerpo se bloquea de forma competitiva, por ejemplo, en una manera dependiente de dosis, por otro anticuerpo por ejemplo, un anticuerpo se une esencialmente al mismo epítopo, o a epítopos solapados, que un anticuerpo de referencia, cuando los dos anticuerpos reconocen epítopos idénticos o estéricamente solapados en los ensayos de unión competitiva tales como ensayos ELISA competitivos, que pueden configurarse en toda una serie de formatos diferentes, mediante el uso ya sea de antígeno etiquetado o anticuerpo etiquetado. En un aspecto particular, puede probarse un anticuerpo en ensayos de unión competitiva con un anticuerpo descrito en la presente memoria (por ejemplo, anticuerpo Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w), o un anticuerpo quimérico o Fab de este, o un anticuerpo que comprende las CDR de VH y las CDR de VL de un anticuerpo descrito en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231 32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w).
En otro aspecto, se proporcionan en la presente memoria anticuerpos que compiten (por ejemplo, de una manera dependiente de la dosis) para unirse a GITR (por ejemplo, GITR humano) con un anticuerpo descrito en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231 32-15, o anticuerpos 1-107), o los anticuerpos pab2159, pab2160, pab2161 o Hum231#2w, según se determina mediante el uso de ensayos conocidos por un experto en la técnica o descritos en la presente memoria (por ejemplo, ensayos competitivos de ELISA o resonancia de plasmones de superficie). En otro aspecto, se proporcionan en la presente memoria anticuerpos que inhiben competitivamente (por ejemplo, de una manera dependiente de la dosis) un anticuerpo descrito en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w) de la unión a GITR (por ejemplo, GITR humano), según se determina mediante el uso de ensayos conocidos por un experto en la técnica o descritos en la presente memoria (por ejemplo, ensayos competitivos de ELISA, o ensayo de resonancia de plasmones de superficie o matriz de suspensión descritos en el Ejemplo 6, más abajo). En aspectos particulares, tal anticuerpo de bloqueo competitivo activa, induce o potencia una o más actividades de GITR. En aspectos específicos, se proporciona en la presente memoria un anticuerpo que compite (por ejemplo, de una manera dependiente de la dosis) para la unión específica a GITR (por ejemplo, GITR humano), con un anticuerpo que comprende las secuencias de aminoácidos descritas en la presente memoria (por ejemplo, secuencias de aminoácidos de VL y/o VH de anticuerpo Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161, o Hum231#2w), según se determina mediante el uso de ensayos conocidos por un experto en la técnica o descritos en la presente memoria (por ejemplo, ensayos competitivos ELISA, o ensayo de resonancia de plasmones de superficie o matriz de suspensión descritos en el Ejemplo 6, más abajo).
En ciertos aspectos, se proporciona en la presente memoria un anticuerpo que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) en la misma medida en que el anticuerpo descrito en la presente memoria compite con sí mismo por unirse a GITR (por ejemplo, GITR humano). En algunos aspectos, se proporciona en la presente memoria un primer anticuerpo que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano), en el que el primer anticuerpo compite por unirse en un ensayo que comprende las siguientes etapas: (a) incubar células transfectadas que expresan GITr con el primer anticuerpo en forma no etiquetada en un recipiente; y (b) añadir un fragmento de anticuerpo descrito en la presente memoria en forma etiquetada en el recipiente e incubar las células en el recipiente; y (c) detectar la unión del anticuerpo de unión descrito en la presente memoria en forma etiquetada a las células. En ciertos aspectos, se proporciona en la presente memoria un primer anticuerpo que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano), en el que la competencia se muestra como una unión
reducida del primer anticuerpo a GITR en más del 80 % (por ejemplo, 85 %, 90 %, 95 % o 98 %, o entre 80 % a 85 %, 80 % a 90 %, 85 % a 90 % o 85 % a 95 %).
En aspectos específicos, se proporciona en la presente memoria un anticuerpo que compite (por ejemplo, de una manera dependiente de la dosis) para la unión específica a GITR (por ejemplo, GITR humano), con un anticuerpo que comprende un dominio VL que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en s Eq ID NO 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-452, 454-464, 467-477, 481-486, 488-513 y 515 518, y un dominio VH que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261-265, 267, 268, 271-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 350, 354-356, 358-360, 362-368, 380, 384 y 387. En aspectos específicos, se proporciona en la presente memoria un anticuerpo que compite (por ejemplo, de una manera dependiente de la dosis) por la unión específica a GITR (por ejemplo, GITR humano), con un anticuerpo que comprende un dominio VL que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-452, 454-464, 467-477, 481-486, 488-513 y 515-519, y un dominio VH que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en SeQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261-265, 267, 268, 270-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 345, 350, 354-356, 358-360 y 362-368.
En aspectos específicos, se proporciona en la presente memoria un anticuerpo que compite (por ejemplo, de una manera dependiente de la dosis) por la unión específica a GITR (por ejemplo, GITR humano), con un anticuerpo que comprende (i) un dominio VL que comprende una CDR1 de VL, CDR2 de VL y CDR3 de VL que tiene las secuencias de aminoácidos de las CDR de VL de un anticuerpo enumerado en la Tabla 1; y (ii) un dominio VH que comprende una CDR1 de VH, CDR2 de VH y CDR3 de VH que tiene las secuencias de aminoácidos de las CDR de un anticuerpo enumerado en la Tabla 2 (por ejemplo, las CDR de VH de un anticuerpo particular al que se hace referencia por su nombre en la Tabla 1, tal como 231-32-15, Hum231#1 o Hum231#2).
En un aspecto particular, se proporciona en la presente memoria un anticuerpo que compite (por ejemplo, de una manera dependiente de la dosis), por la unión específica a GITR (por ejemplo, GITR humano), con un anticuerpo que comprende las CDR de VH y VL de 231-32-15 (SEQ ID NO: 201 y 202).
En un aspecto específico, un anticuerpo descrito en la presente memoria es uno que está bloqueado competitivamente (por ejemplo, de una manera dependiente de la dosis) por un anticuerpo que comprende un dominio VL que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-452, 454-464, 467-477, 481-486, 488-513 y 515-518 y un dominio VH que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206, 215, 217 234, 236-256, 258, 259, 261-265, 267, 268, 271-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296 299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 345, 350, 354-356, 358-360, 362-368, 380, 384 y 387, por la unión específica a GITR (por ejemplo, GITR humano). En un aspecto específico, un anticuerpo descrito en la presente memoria es uno que está bloqueado competitivamente (por ejemplo, de una manera dependiente de la dosis) por un anticuerpo que comprende un dominio VL que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en SeQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-464, 467-477, 481-486, 488-513 y 515-519 y un dominio VH que tiene la secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261 265, 267, 268, 270-273, 276, 277, 280, 281, 283-285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313 316, 319, 320, 322-325, 327, 328, 333, 336, 338-340, 342, 343, 345, 350, 354-356, 358-360 y 362-368, por la unión específica a GITR (por ejemplo, GITR humano).
En un aspecto, un anticuerpo descrito en la presente memoria es uno que está bloqueado competitivamente por un anticuerpo que comprende un dominio VL que tiene la secuencia de aminoácidos de SEQ ID NO: 207 o 208 y un dominio VH que tiene la secuencia de aminoácidos de SEQ ID NO: 206 por la unión específica a GITR (por ejemplo, GITR humano).
En otro aspecto específico, un anticuerpo descrito en la presente memoria es uno que está bloqueado competitivamente (por ejemplo, de una manera dependiente de la dosis) por un anticuerpo que comprende (i) un dominio VL que comprende una CDR1 de VL, CDR2 de VL y CDR3 de VL que tiene las secuencias de aminoácidos de las CDR del anticuerpo enumeradas en la Tabla 1 (por ejemplo, las CDR de VL de un anticuerpo particular mencionado por su nombre en la Tabla 1); y (ii) un dominio VH que comprende una CDR1 de VH, c DR2 de VH y CDR3 de VH que tiene las secuencias de aminoácidos de las CDR del anticuerpo enumeradas en la Tabla 2.
En aspectos específicos, se proporciona en la presente memoria un anticuerpo, o un fragmento de unión a antígeno de este, que se une inmunoespecíficamente al mismo epítopo que el de un anticuerpo (por ejemplo, cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w) que comprende las secuencias de aminoácidos descritas en la presente memoria (ver, por ejemplo, Tablas 1-4) por la unión específica a GITR (por
ejemplo, GITR humano). Pueden usarse ensayos conocidos por un experto en la técnica o descritos en la presente memoria (por ejemplo, cristalografía de rayos X, ensayos ELISA, etc.) para determinar si dos anticuerpos se unen al mismo epítopo.
En un aspecto específico, un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria se une inmunoespecíficamente al mismo epítopo que el de un anticuerpo (por ejemplo, cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107) que comprenden un dominio VL que tiene una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 202, 207, 208, 400-411, 413-416, 418-421, 423-448, 450-452, 454-464, 467-477, 481-486, 488-513 y 515-518, y un VH dominio que tiene una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261-265, 267, 268, 271-273, 276, 277, 280, 281, 283 285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338 340, 342, 343, 345, 350, 354-356, 358-360, 362-368, 380, 384 y 387). En un aspecto específico, un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria se une inmunoespecíficamente al mismo epítopo que el de un anticuerpo (por ejemplo, cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w) que comprende un dominio VL que tiene una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 202, 207, 208, 400-411,413-416, 418-421, 423-448, 450-464, 467-477, 481-486, 488-513 y 515-519, y un dominio VH que tiene una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID NO: 201, 206, 215, 217-234, 236-256, 258, 259, 261-265, 267, 268, 270-273, 276, 277, 280, 281, 283 285, 287, 288, 290, 291, 294, 296-299, 301, 304-306, 308, 313-316, 319, 320, 322-325, 327, 328, 333, 336, 338 340, 342, 343, 345, 350, 354-356, 358-360 y 362-368).
En un aspecto específico, un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria se une inmunoespecíficamente al mismo epítopo que el unido por un anticuerpo que comprende el dominio VH y el dominio VL del anticuerpo Hum231#1 o Hum231#2 (sec. con núms. de ident.: 206 y 207 o sec. con núms. de ident.: 206 y 208, respectivamente), o un epítopo que solapa al epítopo del anticuerpo que comprende el dominio VH y el dominio VL del anticuerpo Hum231#1 o Hum231#2 (sec. con núms. de ident.: 206 y 207 o sec. con núms. de ident.: 206 y 208, respectivamente).
En otro aspecto específico, un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria, se une inmunoespecíficamente al mismo epítopo que el de un anticuerpo que comprende (i) un dominio VL que comprende una CDR1 de VL, CDR2 de VL y CDR3 de VL que tiene las secuencias de aminoácidos de las CDR del anticuerpo enumeradas en la Tabla 1 (por ejemplo, las CDR de VL de un anticuerpo particular mencionado por su nombre en la Tabla 1) y (ii) un dominio VH que comprende una CDR1 de VH, CDR2 de VH y CDR3 de VH que tiene las secuencias de aminoácidos de las CDR del anticuerpo enumeradas en la Tabla 2 (por ejemplo, las CDR de VH de un anticuerpo particular mencionado por su nombre en la Tabla 2).
En un aspecto particular, un anticuerpo descrito en la presente memoria o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano) y bloquea competitivamente (por ejemplo, de una manera dependiente de la dosis) la unión del anticuerpo 231-32-15, Hum231#1, Hum231#2 o Hum231#2w a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) y una región variable de la cadena pesada (VH), en las que
(i) la VL comprende:
(a) una CDR1 de VL que comprende la secuencia de aminoácidos KSSQSX1X2X3X4X5X6X7KX8YLX9 (SEQ ID NO: 4), en la que:
X1 es L, A, V, I, P, F o M
X2 es L, A, V, I, P, F, M o S
X3 es N, G, Q, S, T, C, W, Y o A
X4 es S, G, N, Q, T, C, W, Y o A
X5 es G, N, Q, S, T, C, W, Y o A
X6 es N, G, Q, S, T, C, W, Y o A
X7 es Q, G, N, S, T, C, W, Y o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es T, G, N, Q, S, C, W, Y, V, I o A; y/o
(b) una CDR2 de VL que comprende la secuencia de aminoácidos X1ASTRX2X3 (SEQ ID NO: 5), en la que: X1 es W, G, N, Q, S, T, C, Y, F, H o A
X2 es E, D o A
X3 es S, G, N, Q, T, C, W, Y o A; y/o
(c) una CDR3 de VL que comprende la secuencia de aminoácidos QX1X2YX3X4PYT (SEQ ID NO: 6), en la que:
X1 es N, G, Q, S, T, C, W o Y
X2 es D, E o Y
X3 es S, G, N, Q, T, C, W, Y o A
X4 es Y, G, N, Q, S, T, C, W, F, H, L o A; y (ii) la VH comprende:
(a) una CDR1 de VH que comprende la secuencia de aminoácidos X1YX2MX3 (SEQ ID NO: 1), en la que X1 es D, E, G o A
X2 es A, V, L, I, P, F, M o Y
X3 es Y, G, N, Q, S, T, C, W, F o H; y/o
(b) una CDR2 de VH que comprende la secuencia de aminoácidos X1IX2X3X4SGX5X6X7YX8QKFX9X10 (SEQ ID NO: 2), en la que
X1 es V, A, L, I, P, F, M o T
X2 es R, K, H, Q o A
X3 es T, G, N, Q, S, C, W, Y, V, I o P
X4 es Y, G, N, Q, S, T, C, W, F, H o A
X5 es D, E, G o A
Xa es V, A, L, I, P, F, M o T
X7 es T, G, N, Q, S, C, W, Y, V, I, P o A
X8 es N, G, Q, S, T, C, W, Y o A
X9 es K, R, H, Q o A
X10 es D, E, G o A; y/o
(c) una CDR3 de VH que comprende la secuencia de aminoácidos SGTVRGX1X2X3 (SEQ ID NO: 3), en la que X1 es F, A, V, L, I, P, M, Y, W, H o S
X2 es A o D
X3 es Y, G, N, Q, S, T, C, W, F, H o V.
En un aspecto particular, un anticuerpo descrito en la presente memoria, o un fragmento de unión a antígeno de este, que se une específicamente a GITR (por ejemplo, GITR humano) y bloquea competitivamente (por ejemplo, de una manera dependiente de la dosis) la unión del anticuerpo 231-32-15, Hum231#1, Hum231#2 o Hum231#2w a GITR (por ejemplo, GITR humano), comprende una región variable de la cadena ligera (VL) y una región variable de la cadena pesada (VH), en la que
(i) la VL comprende:
(a) una CDR1 de VL que comprende la secuencia de aminoácidos KSSQSLLNSX1NQKNYLX2 (SEQ ID NO: 10), en la que
X1 es G o S
X2 es T o S; y/o
(b) una CDR2 de VL que comprende la secuencia de aminoácidos WASTRES (SEQ ID NO: 11); y/o (c) una c Dr3 de VL que comprende la secuencia de aminoácidos de QNX1YSX2PYT (SEQ ID NO: 12), en la que X1 es D o E
X2 es Y, F o S y (ii) la VH comprende:
(a) una CDR1 de VH que comprende la secuencia de aminoácidos X1YX2MX3 (SEQ ID NO: 7), en la que
X1 es D, E o G
X2 es A o V
X3 es Y o H; y/o
(b) una CDR2 de VH que comprende la secuencia de aminoácidos X1IX2TX3SGX4X5X6YNQKFX7X8 (SEQ ID NO: 8), en la que
X1 es V o L
X2 es R, K o Q
X3 es Y
X4es D, G
es V o L
X6es T o S
X7 es K, R o Q
es D, E o G; y/o
(c) una CDR3 de VH que comprende la secuencia de aminoácidos SGTVRGFAY (SEQ ID NO: 9).
En algunos aspectos, un anticuerpo que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o a un epítopo solapado de un anticuerpo descrito en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w) impide la unión de GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % según se evalúa mediante un ensayo conocido por un experto en la técnica o descrito en la presente memoria. En un aspecto específico, un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, inhibe la unión de GITRL (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % según se evalúa mediante el ensayo descrito en el Ejemplo 2, más abajo (por ejemplo, la Sección 6.2.5.2 o 6.2.5.4, más abajo). En otro aspecto específico, un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 1.000 ng/ml, 950 ng/ml, 900 ng/ml, 850 ng/ml, 800 ng/ml, 750 ng/ml, 700 ng/ml, 650 ng/ml, 600 ng/ml, 550 ng/ml, 500 ng/ml, 450 ng/ml, 400 ng/ml, 350 ng/ml, 333 ng/ml, 300 ng/ml, 250 ng/ml, 200 ng/ml, 100 ng/ml, 50 ng/ml o 10 ng/ml inhibe la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL-PE) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otro aspecto específico, un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 1.000 ng/ml a 750 ng/ml, 1.000 ng/ml a 500 ng/ml, 850 ng/ml a 500 ng/ml, 750 ng/ml a 500 ng/ml, 600 ng/ml a 500 ng/ml, 500 ng/ml a 400 ng/ml, 400 ng/ml a 300 ng/ml o 300 ng/ml a 200 ng/ml inhibe la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1.2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL-PE) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En otro aspecto específico, un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 3.500 ng/ml, 3.400 ng/ml, 3.300 ng/ml, 3.200 ng/ml, 3.100 ng/ml, 3.000 ng/ml, 2.900 ng/ml, 2.800 ng/ml, 2.700 ng/ml, 2.600 ng/ml, 2.500 ng/ml, 2.400 ng/ml, 2.300 ng/ml, 2.200 ng/ml, 2.100 ng/ml, 2.000 ng/ml, 1.900 ng/ml, 1.800 ng/ml, 1.700 ng/ml, 1.600 ng/ml, 1.500 ng/ml, 1.400 ng/ml, 1.300 ng/ml, 1.200 ng/ml o 1.100 ng/ml inhibe la unión de 1,5 nM, 1,4 nM, 1.3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL-PE) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otro aspecto específico, un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 3.500 ng/ml a 3.200 ng/ml, 3.500 ng/ml a
3.000 ng/ml, 3.200 ng/ml a 2.500 ng/ml, 3.000 a 2.200 ng/ml, 2.500 ng/ml a 1.800 ng/ml, 2.000 ng/ml a 1.500 ng/ml, 1.700 ng/ml a 1.200 ng/ml o 1.500 ng/ml a 1.000 ng/ml inhibe la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL-PE) a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en menos del 85 %, 80 %, 75 %, 70 %, 65 %, 60 %, 55 %, 50 %, 45 %, 40 %, 35 %, 30 %, 25 %, 20 % o 10 % con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 3.000 ng/ml impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 % o menos del 80 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 1.000 ng/ml impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 85 %, menos del 80 % o menos del 75 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 333 ng/ml impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 70 % o menos del 65 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o a un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 111 ng/ml impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 65 %, menos del 60 % o menos del 55 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 37 ng/ml impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 40 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 12 ng/ml impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en menos del 20 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRl etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En otro aspecto, una cierta cantidad de GITRL etiquetado (por ejemplo, GITRL-PE humano) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) en presencia de un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR o se une al mismo o a un epítopo solapado de un anticuerpo descrito en la presente memoria, en un procedimiento que comprende: (a) acoplar GITr (por ejemplo, GITR humano) a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 5 pg/ml por perla; (b) incubar las perlas acopladas a GITR a una concentración de 40 perlas/pl con 3.000 ng/ml, 2.500 ng/ml, 2.000 ng/ml, 1.500 ng/ml, 1.000 ng/ml, 750 ng/ml, 500 ng/ml, 250 ng/ml, 100 ng/ml, 50 ng/ml o 10 ng/ml del anticuerpo competidor o del anticuerpo que se une al mismo epítopo o a un epítopo solapado en un pocillo durante un primer período de tiempo (por ejemplo, 30 minutos, 60 minutos, 1,5 horas, 2 horas, 2,5 horas o 3 horas),
en el que el pocilio contiene 700, 750, 800, 850, 900, 950, 1.000, 1.100, 1.200, 1.300, 1.400 o 1.500 perlas; (c) añadir GITRL etiquetado (por ejemplo, GITRL-PE humano) al pocillo para obtener una concentración final de 1,5 nM, 1.4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM (en aspectos específicos, 0,5 nM) del GITRL etiquetado y 20 perlas/pl de las perlas acopladas a GITR, e incubar durante un segundo período de tiempo (por ejemplo, 30 minutos, 1 hora, 1,5 horas, 2 horas, 2,5 horas o 3 horas); y (d) detectar el GlTRL etiquetado unido a las perlas acopladas a GITR en, por ejemplo, un ensayo de matriz de suspensión tal como el sistema Luminex® 200. En aspectos específicos, la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en presencia del anticuerpo competidor o el anticuerpo que se une al mismo epítopo o a un epítopo solapado, se determina con relación a la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en la ausencia del anticuerpo competidor o del anticuerpo que se une al mismo epítopo o a un epítopo solapado. En ciertos aspectos, la ausencia del anticuerpo competidor o del anticuerpo que se une al mismo epítopo o a un epítopo solapado significa que no está presente en el pocillo ningún anticuerpo o fragmento de unión a antígeno de este. En otros aspectos, la ausencia del anticuerpo competidor o del anticuerpo que se une al mismo epítopo o a un epítopo solapado significa que un anticuerpo de control de isotipo que no se une a GITR está presente en el pocillo. De acuerdo con estos aspectos, se determina que la cantidad de GITRL etiquetado unido a las perlas acopladas a GITR en presencia del anticuerpo competidor o del anticuerpo que se une al mismo epítopo o a un epítopo solapado es, en algunos aspectos, al menos el 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 % o 60 %, o 20 % a 60 %, 30 % a 50 %, o 20 % a 70 % de la cantidad del GITRL etiquetado unido a las perlas acopladas a GITR en ausencia del anticuerpo competidor o del anticuerpo que se une al mismo epítopo o a un epítopo solapado.
En ciertos aspectos, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de GITRL (por ejemplo, GITRL humano) se une a GITR (por ejemplo, GITR humano) en presencia de un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, evaluado mediante un ensayo conocido por un experto en la técnica o descrito en la presente memoria. En un aspecto específico, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de GITRL (por ejemplo, GITRL humano) se une a GITR (por ejemplo, GITR humano) en presencia de un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, según se evalúa mediante el ensayo descrito en el Ejemplo 2, más abajo (por ejemplo, las Secciones 6.2.5.2 o 6.2.5.4, más abajo). En otro aspecto específico, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de 1,5 nM, 1.4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL humano etiquetado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en presencia de 1.000 ng/ml, 950 ng/ml, 900 ng/ml, 850 ng/ml, 800 ng/ml, 750 ng/ml, 700 ng/ml, 650 ng/ml, 600 ng/ml, 550 ng/ml, 500 ng/ml, 450 ng/ml, 400 ng/ml, 350 ng/ml, 333 ng/ml, 300 ng/ml, 250 ng/ml, 200 ng/ml, 100 ng/ml, 50 ng/ml o 10 ng/ml de un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En otro aspecto específico, al menos el 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 % o 75 % de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado (por ejemplo, GITRL humano marcado, tal como hGITRL-PE) se une a GITR acoplado a perlas (por ejemplo, GITR humano acoplado a perlas Luminex®) a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en presencia de 3.500 ng/ml, 3.400 ng/ml, 3.300 ng/ml, 3.200 ng/ml, 3.100 ng/ml, 3.000 ng/ml, 2.900 ng/ml, 2.800 g/ml, 2.700 ng/ml, 2.600 ng/ml, 2.500 ng/ml, 2.400 ng/ml, 2.300 ng/ml, 2.200 ng/ml, 2.100 ng/ml, 2.000 ng/ml, 1.900 ng/ml, 1.800 ng/ml, 1.700 ng/ml, 1.600 ng/ml, 1.500 ng/ml, 1.400 ng/ml, 1.300 ng/ml, 1.200 ng/ml o 1.100 ng/ml de un anticuerpo o fragmento de unión a antígeno de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o epítopo solapado de un anticuerpo descrito en la presente memoria, con relación a la unión de 1,5 nM, 1,4 nM, 1,3 nM, 1,2 nM, 1,1 nM, 1 nM, 0,9 nM, 0,8 nM, 0,7 nM, 0,6 nM, 0,5 nM, 0,4 nM, 0,3 nM, 0,2 nM o 0,1 nM de GITRL etiquetado a las perlas acopladas a GITR a una concentración de 9 pg/ml, 8 pg/ml, 7 pg/ml, 6 pg/ml, 5 pg/ml, 4 pg/ml o 3 pg/ml por perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200).
En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se una al mismo epítopo o a un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 3.000 ng/ml no impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 15 % o más del 20 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de
5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con
un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o a
un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 1.000 ng/ml no
impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del
15 %, más del 20 % o más del 25 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo,
perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a
perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de
unión a antígeno de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a
GITR (por ejemplo, GITR humano) o se une al mismo o a un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 333 ng/ml no impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 30 % o más del 35 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a
la unión de 0,5 nM de GITRl etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este en un ensayo de matriz de suspensión
(por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 111 ng/ml no impide la unión de
GITRL 0,5 nM (por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 35 %, más del 40 % o
más del 45 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml por perla con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a
GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno
de este en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 37 ng/ml no impide la unión de GITRL 0,5 nM (por ejemplo, GITRL humano) a
GITR (por ejemplo, GITR humano) en más del 60 % cuando GITR (por ejemplo, GITR humano) se acopla a perlas
(por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml con relación a la unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia del anticuerpo anti-GITR o fragmento de unión a antígeno de este por perla en un ensayo de matriz de suspensión (por ejemplo, sistema Luminex® 200). En ciertos aspectos, un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo o a un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 12 ng/ml no impide la unión de GITRL 0,5 nM
(por ejemplo, GITRL humano) a GITR (por ejemplo, GITR humano) en más del 85 % cuando GITR (por ejemplo,
GITR humano) se acopla a perlas (por ejemplo, perlas Luminex®) a una concentración de 5 pg/ml con relación a la
unión de 0,5 nM de GITRL etiquetado a perlas acopladas a GITR a una concentración de 5 pg/ml/perla en ausencia
del anticuerpo anti-GITR o fragmento de unión a antígeno de este por perla en un ensayo de matriz de suspensión
(por ejemplo, sistema Luminex® 200).
En ciertos aspectos, se proporciona en la presente memoria un anticuerpo, que compite por unirse con un anticuerpo descrito en la presente memoria para unirse a GITR (por ejemplo, GITR humano) o se une al mismo o a
un epítopo solapado de un anticuerpo descrito en la presente memoria, a una concentración de 150 nM, 145 nM,
140 nM, 135 nM, 130 nM, 125 nM, 120 nM, 115 nM, 110 nM, 105 nM o 100 nM unido a GITR (por ejemplo, GITR humano) inmovilizado en un chip (por ejemplo, chip sensor CM5) inhibe la unión de 150 nM, 145 nM, 140 nM,
135 nM, 130 nM, 125 nM, 120 nM, 115 nM, 110 nM, 105 nM o 100 nM de GITRL (por ejemplo, trímero no unido covalentemente de GITRL humano) al GITR inmovilizado en el chip en menos del 60 %, menos del 55 %, menos del
50 %, menos del 45 %, menos del 40 %, menos del 35 %, menos del 30 %, menos del 25 %, menos del 20 % o
menos del 15 %. En ciertos aspectos, se proporciona en la presente memoria un anticuerpo, que compite por unirse
con un anticuerpo descrito en la presente memoria para unirse a GITR (por ejemplo, GITR humano) o se une al mismo o a un epítopo solapado de un anticuerpo descrito en la presente memoria, en el que el anticuerpo competidor o el anticuerpo que se une al mismo epítopo o a un epítopo solapado a una concentración de 125 nM
unido a GITR (por ejemplo, GITR humano) inmovilizado en un chip (por ejemplo, chip sensor CM5) inhibe la unión
de 125 nM de GITRL (por ejemplo, trímero unido no covalentemente de GITRL humano) al GITR inmovilizado en el chip en menos del 60 %, menos del 55 %, menos del 50 %, menos del 45 %, menos del 40 %, menos del 35 %, menos del 30 %, menos del 25 %, menos del 20 % o menos del 15 %.
En ciertos aspectos, un anticuerpo o fragmento de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, se une a GITR (por ejemplo, GITR humano) con una constante de velocidad de disociación (kdisoc) de 8,5 x 10'3 s_1 o menos, 3,5 x 10'3 s_1 o menos, 5 x 10'3 s_1 o menos, 2,5 x 10'3 s_1 o menos, 1 x 10'3 s1 o menos, 8,5 x 10'4 s_1 o menos, 5 x10'4 s_1 o menos, 3,5 x 10'4 s_1 o menos, 2,5 menos, 1 x menos, 8,5 x 10'5' s_1 o menos, 3,5 x 10'5' s_1 o menos, 5 x 10'5' s_1 o menos, 2,5 x 10' menos, 1 x _ menos, 8,5 x 10'6' s_1 o menos, 5x10'6' s_1 o menos, 3,5 x 10'6' s_1 o menos, 2,5 menos, 1 x 10'6' s_1 o menos, 8,5 x 10'7' s_1 o menos, 5 x 10'7' s_1 o menos, 2,5 x 10'7' s_1 o menos, 1 menos, 8,5 x 10'8' s_1 o menos, 5 x 10'8' s_1 o menos, 2,5 x 10'8' s_1 o menos, 1 x 10'8' s_1 o menos, 8,5 x 10'9' s_1 o
menos, 5 x 10-9 s-1 o menos, 2,5 x 10-9- s-1 o menos o 1 x 10-9- s-1 o menos. En algunos aspectos, un anticuerpo o fragmento de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, se une a GITR (por ejemplo, GITR humano) con una kdisoc de entre 9,5 x 10-5- s-1 a 1 x 10-9- s-1, 8,5 x 10-5- s-1 a 1 x 10-9- s-1, 5 x 10-5- s-1 a 1 x 10-9- s-1, 9,5 x 10-5- s-1 a 1 x 10-8- s-1, 5 x 10-5 s-1 a 1 x 10-8- s-1, 9,5 x 10-5- s-1 a 1 x 10-7- s-1, 5 x 10-5- s-1 a 1 x 10-7- s-1, 9,5 x 10-5- s-1 a 5 x 10-6- s-1, 9,5 x 10-5- s-1 a 1 x 10-5- s-1, 8,5 x 10-3 s-1 a 1 x 10-4 s-1, 5 x 10-3 s-1 a 2,5 x 10-4 s-1, 8,5 x 10-3 s-1, a 1 x 10-5 s-1, 8,5 x 10-5- s-1 a 5 x 10-5- s-1. En ciertos aspectos, la kdisoc se determina mediante el uso de un anticuerpo monovalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En otros aspectos, la kdisoc se determina mediante el uso de un anticuerpo bivalente según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En un aspecto particular, la kdisoc se determina mediante el uso de un ensayo descrito en la Sección 6, más abajo.
En ciertos aspectos, un anticuerpo o fragmento de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, se une a GITR (por ejemplo, GITR humano) con una constante de velocidad de asociación (kasoc) de al menos 105 M-1s-1, al menos 2,5 x 105 M-1s-1, al menos 3,5 x 105 M-1s-1, al menos 5 x 105 M-1s-1, al menos 106 M-1s-1, al menos 2,5 x 106 M-1s-1, al menos 3,5 x 106 M-1s-1, al menos 5 x 106 M-1s-1, al menos 107 M-1s-1, al menos 5 x 107 M-1s-1, al menos 108 M-1s-1, al menos 5 108 M-1s-1 o al menos 109 M-1s-1. En algunos aspectos, un anticuerpo o fragmento de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, se une a GITR (por ejemplo, GITR humano) con una kasoc de entre 1 x 105 M-1s-1 a 5 x 105 M-1s-1, 1 x 105 M-1s-1 a 1 x 106 M-1s-1, 3,5 x 105 M-1s-1 a 2,5 x 106 M-1s-1, 3,5 x 105 M-1s-1 a 3,5 x 106 M-1s-1, 1 x 105 M-1s-1 a 5 x 106 M-1s-1, 1 x 105 M-1s- a 1 x 107 M-1s-1, 1 x 105 M-1s-1 a 5 x 107 M-1s-1, 1 x 105 M-1s-1 a 108 M-1s-1, 1 x 105 M-1s-1 a 1 x 109 M-1s-1, 1 x 106 M-1s- a 1 x 107 M-1s-1, 1 x 106 M-1s-1 a 1 x 108 M-1s-1, 1 x 106 M-1s-1 a 1 x 109 M-1s-1, 1 x 107 M-1s-1 a 1 x 108 M-1s-1, 1 x 107 M-1s-1 a 1 x 109 M-1s-1, 1 x 108 M-1s-1 a 1 x 109 M-1s-1. En ciertos aspectos, la kasoc se determina mediante el uso de un anticuerpo monovalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En otros aspectos, la kasoc se determina mediante el uso de un anticuerpo bivalente según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En un aspecto particular, la kasoc se determina mediante el uso de un ensayo descrito en la Sección 6, más abajo.
En ciertos aspectos, un anticuerpo o fragmento de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, se une a GITR (por ejemplo, GITR humano) con una Kd de menos de 7 nM, 6 nM, 5 nM, 4,5 nM, 4 nM, 3,5 nM, 3 nM, 2,5 nM, 2 nM, 1,5 nM, 1 nM, 0,75 nM, 0,5 nM, 0,25 nM o 0,1 nM. En algunos aspectos, un anticuerpo o fragmento de este, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, se une a GITR (por ejemplo, GITR humano) con una Kd de aproximadamente 7 nM, 6 nM, 5 nM, 4,5 nM, 4 nM, 3,5 nM, 3 nM, 2,5 nM, 2 nM, 1,5 nM, 1 nM, 0,75 nM, 0,5 nM, 0,25 nM o 0,1 nM. En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que compite con un anticuerpo descrito en la presente memoria por unirse a GITR (por ejemplo, GITR humano) o se une al mismo epítopo o un epítopo solapado de un anticuerpo descrito en la presente memoria, se une a GITR (por ejemplo, GITR humano) con una Kd de 7 nM a 4 nM, 7 nM a 5 nM, 6 nM a 4 nM, 5 nM a 3 nM, 5 nM a 1 nM, 5 nM a 0,5 nM, 4 nM a 3 nM, 4 nM a 2 nM, 4 nM a 1 nM, 4 nM a 0,5 nM, 3 nM a 2 nM, 3 nM a 1 nM, 3 nM a 0,5 nM, 2 nM a 1 nM, 2 nM a 0,5 nM, 3 nM a 0,1 nM, 2 nM a 0,1 nM, 1 nM a 0,1 nM o 0,5 nM a 0,1 nM. En ciertos aspectos, la Kd se calcula como el cociente de kdisoc/kasoc y la kasoc y kdisoc se determinan mediante el uso de un anticuerpo monovalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En otros aspectos, la Kd se calcula como el cociente de kdisoc/kasoc y la kasoc y kdisoc se determinan mediante el uso de un anticuerpo bivalente, tal como un fragmento Fab, según se mide mediante, por ejemplo, tecnología de resonancia de plasmones de superficie BIAcore®. En un aspecto específico, la Kd se determina como se expone en los Ejemplos de la Sección 6, más abajo (por ejemplo, Ejemplo 2).
En ciertos aspectos, el epítopo de un dominio de unión a antígeno descrito en la presente memoria se usa como un inmunógeno para producir anticuerpos. Ver, por ejemplo, la Sección 5.2 más abajo para los procedimientos para producir anticuerpos.
En aspectos específicos, un anticuerpo o fragmento de este descrito, que se une específicamente a GITR (por ejemplo, GITR humano), no inhibe (por ejemplo, de una manera dependiente de la dosis) la unión del anticuerpo murino 6C8 a GITR (por ejemplo, GITR humano) en un ensayo conocido por un experto en la técnica o descrito en la presente memoria. Ver, por ejemplo, la Patente de Estados Unidos núm. 7,812,135 para una descripción del anticuerpo murino 6C8. En ciertos aspectos, al menos 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 % o más del anticuerpo murino 6C8 se une a GITR (por ejemplo, GITR humano) en presencia de un anticuerpo o fragmento de este descrito, que se une específicamente a GITR (por ejemplo, GITR humano), según se evalúa en un ensayo conocido por un experto en la técnica o descrito en la presente memoria. En un aspecto específico, un anticuerpo o fragmento de este descrito, que se une
específicamente a GITR (por ejemplo, GITR humano), no inhibe (por ejemplo, de una manera dependiente de la dosis) la unión del anticuerpo murino 6C8 a GITR (por ejemplo, GITR humano) según se evaluó en el ensayo descrito en el Ejemplo 6, más abajo. En ciertos aspectos, al menos 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 % o más del anticuerpo murino 6C8 se une a GITR (por ejemplo, GITR humano) en presencia de un anticuerpo o fragmento de este descrito, que se une específicamente a GITR (por ejemplo, GITR humano), según se evaluó en el ensayo descrito en el Ejemplo 6, más abajo.
En algunas realizaciones, los anticuerpos anti-GITR descritos en la presente memoria pueden ser anticuerpos multiespecíficos, por ejemplo, anticuerpos biespecíficos. En una realización particular, un anticuerpo anti-GITR descrito en la presente memoria es un anticuerpo biespecífico, en el que el anticuerpo tiene especificidades para al menos dos epítopos diferentes, típicamente no solapados. En una realización particular, un anticuerpo biespecífico comprende un brazo que comprende un anticuerpo descrito en la presente memoria con especificidad para GITR (por ejemplo, GITR humano) y un segundo brazo que comprende un anticuerpo con especificidad por un epítopo diferente en GITR (por ejemplo, GITR humano) o un epítopo en una molécula diferente, por ejemplo, PD-1, PD-L1, PD-L2, CTLA-4, TIM-3, LAG-3 u OX40. Por ejemplo, el anticuerpo biespecífico puede comprender un brazo que comprende un anticuerpo descrito en la presente memoria con especificidad para GITR (por ejemplo, GITR humano) y un segundo brazo que comprende un anticuerpo con especificidad para CTLA-4, tal como tremelimumab (Pfizer), ipilimumab (Yervoy®, Bristol-Meyers Squibb), un anticuerpo que se une al mismo epítopo que tremelimumab o un epítopo que solapa al mismo, o un anticuerpo que se une al mismo epítopo que ipilimumab o un epítopo que solapa al mismo.
En aspectos específicos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), funciona como agonista.
En ciertas realizaciones, un dominio de unión a antígeno descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la actividad de GITR (por ejemplo, GITR humano), cuando está presente en una forma bivalente monoespecífica, en al menos aproximadamente de 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces, o 100 veces según se evalúa mediante los procedimientos descritos en la presente memoria y/o conocidos por un experto en la técnica, con relación a la actividad de GITR (por ejemplo, GITR humano) en presencia o ausencia de estimulación con GITRL (por ejemplo, GITRL humano) sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR). En ciertas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la actividad de GITR (por ejemplo, GITR humano), en al menos 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 % o 99 % según se evalúa mediante los procedimientos descritos en la presente memoria y/o conocidos por un experto en la técnica, con relación a la actividad de GITR (por ejemplo, GITR humano) en presencia o ausencia de estimulación de GITRL (por ejemplo, GITRL humano sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR). Los ejemplos no limitantes de la actividad de GITr (por ejemplo, GITr humano) pueden incluir la proliferación celular, la señalización de GITR (por ejemplo, GITR humano), la sobrevivencia celular, y la producción de citocinas (por ejemplo, IL-2, IL-6, IL-10, TNF-a e IFN-y). En realizaciones específicas, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce o aumenta una actividad de GITR (por ejemplo, GITR humano) junto con GITRL (por ejemplo, GITRL humano). En ciertas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce, potencia o aumenta una actividad de GITR (por ejemplo, GITR humano) en ausencia de GITRL (por ejemplo, GITRL humano). En realizaciones específicas, el anticuerpo o el fragmento de unión al anticuerpo induce, potencia o aumenta la actividad de GITR y no inhibe (por ejemplo, no inhibe completamente o solo inhibe parcialmente) la unión de GITRL a GITR. En realizaciones específicas, un aumento en una actividad de GITR se evalúa como se describe en los Ejemplos, más abajo.
En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce, potencia o aumenta la proliferación celular de células que expresan GITR y que responden a la señalización de GITR (por ejemplo, células que proliferan en respuesta a la estimulación de GITR y la señalización de GITR, tal como células T). Los ensayos de proliferación celular se describen en la técnica, tal como un ensayo de incorporación de 3H-timidina, ensayo de incorporación de BrdU o ensayo de CFSE, tal como se describe en el Ejemplo 3, y puede llevarse a cabo fácilmente por un experto en la técnica. En realizaciones específicas, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T o un agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITr humano), tienen aumentada la proliferación celular con relación a las células T solo estimuladas con el mitógeno de células T o el agente estimulador del complejo del receptor de células T fitohemaglutinina (PHA) y/o miristato de forbol acetato (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). Ver
Ejemplo 3, más abajo, que demuestra un aumento en la proliferación de células T en presencia de un anticuerpo descrito en la presente memoria que se une inmunoespecíficamente a GITR.
En una realización, células T CD8+ estimuladas con un mitógeno de células T o un agente estimulador del complejo del receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une a GITR (por ejemplo, GITR humano), tienen aumentada la proliferación celular con relación a las células T solo estimuladas con el mitógeno de células T o el agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo t Cr , tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En otra realización, células T CD4+ estimuladas con un mitógeno de células T o un agente estimulador del complejo del receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une a GITR (por ejemplo, GITR humano), tienen aumentada la proliferación celular con relación a las células T solo estimuladas con el mitógeno de células T o el agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En otra realización, células T CD4+ y células T CD8+ estimuladas con un mitógeno de células T o un agente estimulador del complejo del receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), tienen aumentada la proliferación celular con relación a las células T solo estimuladas con el mitógeno de células T o el agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28). En algunas realizaciones, las células T que no se han estimulado con un mitógeno de células T o un agente estimulador del complejo del receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une a GITR (por ejemplo, GITR humano) tienen una actividad de GITR aumentada y/o una actividad de NF-kB aumentada con relación a las células T que no están en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano).
En realizaciones específicas, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la proliferación celular (por ejemplo, células T, tales como células T efectoras CD4 y CD8) en al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces o 100 veces, según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, ensayo de incorporación de 3H-timidina, ensayo de incorporación de BrdU o ensayo CFSE, tal como se describe en el Ejemplo 3, más abajo), con relación a GITR (por ejemplo, GITR humano) en presencia o ausencia de GITRL (por ejemplo, GITRL humano) sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR). En realizaciones específicas, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la proliferación celular (por ejemplo, células T, tales como células T efectoras CD4 y CD8) en al menos al menos aproximadamente 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 % o 99 %, según se evalúa mediante procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, ensayo de incorporación de 3H-timidina, ensayo de incorporación de BrdU o ensayo CFSE, tal como se describe en el Ejemplo 3, más abajo), con relación a GITR (por ejemplo, GITR humano) en presencia o ausencia de GITRL (por ejemplo, GITRL humano) sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR).
En algunas realizaciones, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T (por ejemplo, un anticuerpo anti-CD3 o éster de forbol) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), tienen aumentada la proliferación celular en al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces o 100 veces con relación a las células T solo estimuladas con el mitógeno de células T, según se evalúa mediante procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, ensayo de incorporación de 3H-timidina, ensayo de incorporación de BrdU o ensayo CFSE, tal como se describe en el Ejemplo 3, más abajo). En algunas realizaciones, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T o un agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo t Cr , tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente
memoria, que se une a GITR (por ejemplo, GITR humano), tienen aumentada la proliferación celular en al menos un 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 % o 99 % con relación a las células T solo estimuladas con el mitógeno de células T o el agente estimulador del complejo del receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, como un anticuerpo anti-CD3 y un anticuerpo anti-CD28), según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, ensayo de incorporación de 3H-timidina, ensayo de incorporación de BrdU o ensayo CFSE, tal como se describe en el Ejemplo 3, más abajo). En una realización específica, la proliferación celular se evalúa como se describe en el Ejemplo 3, más abajo.
En ciertos aspectos, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la supervivencia de las células (por ejemplo, células T, tales como células T efectoras CD4 y CD8). En una realización específica, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T o un agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), tienen aumentada la supervivencia con relación a las células T solo estimuladas con el mitógeno de las células T. Los ensayos de supervivencia celular se describen en la técnica (por ejemplo, un ensayo de exclusión con azul tripán) y pueden llevarse a cabo fácilmente por un experto en la técnica.
En realizaciones específicas, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la supervivencia celular (por ejemplo, células T, tales como células efectoras CD4 y CD8), en al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces, o 100 veces según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo de exclusión por tripán azul) con relación a la supervivencia celular en presencia o ausencia de estimulación por GITRL (por ejemplo, GITRL humano) sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR). En realizaciones específicas, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), aumenta la supervivencia celular (por ejemplo, células T, tales como células T efectoras CD4 y Cd8) en al menos aproximadamente 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 % o 99 %, según se evalúa mediante procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo de exclusión con azul tripán), con relación a la supervivencia celular en presencia o ausencia de GITRL (por ejemplo, GITRL humano) sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR).
En algunas realizaciones, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T (por ejemplo, un anticuerpo anti-CD3 o éster de forbol) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), tienen aumentada la supervivencia celular en al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces o 100 veces con relación a las células T solo estimuladas con el mitógeno de células T o agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28), según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo de exclusión con azul tripán). En algunas realizaciones, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T o un agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une a GITR (por ejemplo, GITR humano), tienen aumentada la supervivencia celular en al menos un 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 % o 99 % con relación a las células T solo estimuladas con el mitógeno de células T, según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo de exclusión con azul tripán).
En ciertas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), protege las células T efectoras (por ejemplo, células T efectoras CD4+ y CD8+) de la muerte celular inducida por activación. En algunas realizaciones, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce la resistencia de las células T efectoras (por ejemplo, células T efectoras CD4+ y CD8+) a la supresión mediada por Treg.
En realizaciones específicas, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce, potencia o aumenta la producción de citocinas (por ejemplo, IL-2, IL-6, IL-10, TNF-a e IFN-y) en al menos aproximadamente 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 % o 99 %, según se evalúa mediante los procedimientos descritos en la presente memoria (ver los ejemplos, más abajo, tal como el Ejemplo 3) o conocidos por un experto en la técnica, con relación a la producción de citocinas en presencia o ausencia de GITRL (por ejemplo, GITRL humano) sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR). En realizaciones específicas, un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce o potencia la producción de citocinas (por ejemplo, IL-2, IL-6, IL-10, TNF-a e IFN-y) en al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces, o 100 veces, según se evalúa mediante los procedimientos descritos en la presente memoria (ver los ejemplos, más abajo, tal como el Ejemplo 3) o conocidos por un experto en la técnica, con relación a la producción de citocinas en presencia o ausencia de GITRL (por ejemplo, GITRl humano) sin ningún anticuerpo o con un anticuerpo no relacionado (por ejemplo, un anticuerpo que no se une inmunoespecíficamente a GITR).
En ciertas realizaciones, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T o un agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), tienen aumentada la producción de citocinas (por ejemplo, IL-2, IL-6, IL-10, TNF-a e IFN-y) en al menos aproximadamente 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 % o 99 % con relación a las células T solo estimuladas con el mitógeno de células T o agente estimulador del complejo del receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28), según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo ELISA o como se describe en los Ejemplos, más abajo). En algunas realizaciones, las células T (por ejemplo, células T efectoras CD4+ o CD8+) estimuladas con un mitógeno de células T o un agente estimulador del complejo receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) en presencia de un anticuerpo o fragmento de este descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), tienen aumentada la producción de citocinas (por ejemplo, IL-2, IL-6, IL-10, TNF-a e IFN-y) en al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces o 100 veces con relación a las células T solo estimuladas con el mitógeno de células T o el agente estimulador del complejo del receptor de células T (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulador del complejo TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28), según se evalúa mediante los procedimientos descritos en la presente memoria o conocidos por un experto en la técnica (por ejemplo, un ensayo ELISA o como se describe en los Ejemplos, más abajo).
En ciertas realizaciones, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este induce, potencia o activa una actividad de GITR, en ausencia de un agonista de TCR (por ejemplo, un anticuerpo anti-CD3). La actividad de GITR puede evaluarse al medir la activación de las vías de NF-kB canónicas y no canónicas. La actividad de GITR puede evaluarse al medir la activación de las vías de señalización mediadas por el adaptador TRAF. El adaptador TRAF se selecciona del grupo que consiste en TRAF1, TRAF2, TRAF3, TRAF4 y TRa F5. La actividad de GITR puede evaluarse al medir la activación de la vía MAPK/ERK (también llamada la vía Ras-Raf-MEK-ERK). Los ejemplos de "un agonista de TCR" incluyen, pero no se limitan a, anticuerpos dirigidos al complejo receptor de células T (por ejemplo, un anticuerpo anti-CD3) y péptidos unidos a antígenos leucocitarios humanos, por ejemplo, MHC de clase I y MHC de clase II, en los que los péptidos se derivan de proteínas propias, propias mutadas o asociadas a patógenos (por ejemplo, virales o bacterianas).
Un anticuerpo anti-GITR o fragmento de unión a antígeno de este puede fusionarse o conjugarse (por ejemplo, unirse covalentemente o no covalentemente) a una etiqueta o sustancia detectable. Los ejemplos de etiquetas o sustancias detectables incluyen etiquetas enzimáticas, tales como, glucosa oxidasa; radioisótopos, tales como yodo (125I, 121I), carbono (14C), azufre (35S), tritio (3H), indio (121In), y tecnecio (99Tc); etiquetas luminiscentes, tales como luminol; y etiquetas fluorescentes, tales como fluoresceína y rodamina, y biotina. Tales anticuerpos marcados o fragmentos de unión a antígeno pueden usarse para detectar GITR (por ejemplo, proteína GITR humana). Ver, por ejemplo, la Sección 5.4.2, más abajo.
5.2 Producción de anticuerpos
Los anticuerpos o fragmentos de estos que se unen inmunoespecíficamente a GITR (por ejemplo, GITR humano) pueden producirse mediante cualquier procedimiento conocido en la técnica para la síntesis de anticuerpos, por ejemplo, mediante síntesis química o mediante técnicas de expresión recombinante. Los procedimientos descritos en la presente memoria emplean, a menos que se especifique de cualquier otra manera, técnicas convencionales en biología molecular, microbiología, análisis genético, ADN recombinante, química orgánica, bioquímica, PCR, síntesis y modificación de oligonucleótidos, hibridación de ácidos nucleicos, y campos relacionados dentro de la experiencia en la técnica. Estas técnicas se describen, por ejemplo, en las referencias citadas en la presente memoria y se explican completamente en la bibliografía. Ver, por ejemplo, Maniatis T y otros, (1982) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; Sambrook J y otros, (1989), Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press; Sambrook J y otros, (2001) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Ausubel FM y otros, Current Protocols in Molecular Biology, John Wiley & Sons (1987 y actualizaciones anuales); Current Protocols in Immunology, John Wiley & Sons (1987 y actualizaciones anuales) Gait (ed.) (1984) Oligonucleotide Synthesis: A Practical Approach, IRL Press; Eckstein (ed.) (1991) Oligonucleotides and Analogues: A Practical Approach, IRL Press; Birren B. y otros, (eds.) (1999) Genome Analysis: A Laboratory Manual, Cold Spring Harbor Laboratory Press.
En una realización específica, un anticuerpo descrito en la presente memoria es un anticuerpo (por ejemplo, anticuerpo recombinante) preparado, expresado, creado o aislado mediante cualquier medio que implica la creación, por ejemplo, por medio de síntesis, por ingeniería genética de secuencias de ADN. En ciertas realizaciones, tal anticuerpo comprende secuencias (por ejemplo, secuencias de ADN o secuencias de aminoácidos) que no existen de manera natural dentro del repertorio de líneas germinales de anticuerpos de un animal o mamífero (por ejemplo, ser humano) in vivo.
En un aspecto determinado, en la presente memoria se proporciona un procedimiento de producción de un anticuerpo o un fragmento de unión a antígeno de este que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) que comprende cultivar una célula o células huésped descrita en la presente memoria. En un aspecto determinado, en la presente memoria se proporciona un procedimiento de producción de un anticuerpo o un fragmento de unión a antígeno de este que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) que comprende expresar (por ejemplo, expresar recombinantemente) el anticuerpo o fragmento de unión a antígeno de este mediante el uso de una célula o célula huésped descrita en la presente memoria (por ejemplo, una célula o una célula huésped que comprende polinucleótidos que codifican un anticuerpo descrito en la presente memoria). En una realización particular, la célula es una célula aislada. En una realización particular, los polinucleótidos exógenos se han introducido en la célula. En una realización particular, el procedimiento comprende además la etapa de purificar el anticuerpo o el fragmento de unión a antígeno de este obtenido a partir de la célula o célula hospedera.
Los procedimientos para producir anticuerpos policlonales se conocen en la técnica (ver, por ejemplo, Capítulo 11 en: Short Protocols in Molecular Biology, (2002) 5th Ed., Ausubel FM y otros, eds., John Wiley and Sons, Nueva York).
Los anticuerpos monoclonales pueden prepararse mediante el uso de una amplia variedad de técnicas conocidas en la técnica que incluyen el uso de tecnologías de hibridoma, recombinantes, y de presentación en fagos, o una combinación de estas. Por ejemplo, los anticuerpos monoclonales pueden producirse mediante el uso de técnicas de hibridoma que incluyen las conocidas en la técnica y que se enseñan, por ejemplo, en Harlow E y Lane D, Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling GJ y otros, en: Monoclonal Antibodies and T-Cell Hybridomas 563 681 (Elsevier, Nueva York, 1981). El término “anticuerpo monoclonal” como se usa en la presente memoria no se limita a los anticuerpos producidos mediante la tecnología de hibridomas. Por ejemplo, los anticuerpos monoclonales pueden producirse por vía recombinante a partir de células huésped que expresan de manera exógena un anticuerpo descrito en la presente memoria o un fragmento de este, por ejemplo, una cadena pesada y/o cadena ligera de tal anticuerpo.
En realizaciones específicas, un "anticuerpo monoclonal", como se usa en la presente memoria, es un anticuerpo producido por una sola célula (por ejemplo, hibridoma o célula huésped que produce un anticuerpo recombinante), en el que el anticuerpo se une inmunoespecíficamente a GITR (por ejemplo, GITR humano) según lo determinado, por ejemplo, mediante ELISA u otro ensayo de unión competitiva o de unión a antígeno conocido en la técnica o en los Ejemplos proporcionados en la presente memoria. En realizaciones particulares, un anticuerpo multiespecífico puede ser un anticuerpo quimérico o un anticuerpo humanizado. En ciertas realizaciones, un anticuerpo monoclonal es un anticuerpo monovalente o un anticuerpo multivalente (por ejemplo, bivalente). En realizaciones particulares, un anticuerpo monoclonal es un anticuerpo monoespecífico o multiespecífico (por ejemplo, anticuerpo biespecífico). Los anticuerpos monoclonales descritos en la presente memoria pueden producirse, por ejemplo, mediante el procedimiento de hibridomas como se describe en Kohler G y Milstein C (1975) Nature 256: 495 o pueden aislarse, por ejemplo, a partir de bibliotecas de fagos mediante el uso de las técnicas como se describe en la presente memoria, por ejemplo. Otros procedimientos para la preparación de líneas celulares clonales y de anticuerpos monoclonales expresados de esta manera se conocen bien en la técnica (ver, por ejemplo, Capítulo 11 en: Short Protocols in Molecular Biology, (2002) 5th Ed., Ausubel FM y otros, más arriba).
Los procedimientos para producir y cribar anticuerpos específicos mediante el uso de tecnología de hibridomas son rutinarios y bien conocidos en la técnica. Por ejemplo, en el procedimiento del hibridoma, un ratón u otro animal hospedero adecuado, tal como una oveja, cabra, conejo, rata, hámster o mono macaco, se inmuniza para obtener linfocitos que producen o son capaces de producir anticuerpos que se unirán específicamente a la proteína (por ejemplo, GITR (por ejemplo, GITR humano)) usada para la inmunización. Alternativamente, los linfocitos pueden inmunizarse in vitro. Los linfocitos después se fusionan con las células de mieloma mediante el uso un agente de fusión adecuado, tal como polietilenglicol, para formar una célula de hibridoma (Goding JW (Ed), Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)). Además, puede usarse una técnica RIMMS (inmunización repetitiva en múltiples sitios) para inmunizar a un animal (Kilpatrick KE y otros, (1997) Hybridoma 16: 381-9).
En algunos aspectos, los ratones (u otros animales, tal como ratas, monos, burros, cerdos, ovejas, hámsteres o perros) pueden inmunizarse con un antígeno (por ejemplo, GITR (por ejemplo, GITR humano)) y una vez que se detecta una respuesta inmune, por ejemplo, se detectan anticuerpos específicos para el antígeno en el suero del ratón, se recolecta el bazo del ratón y se aíslan los esplenocitos. A continuación, los esplenocitos se fusionan mediante técnicas bien conocidas a cualquier célula de mieloma adecuada, por ejemplo, células de la línea celular SP20 disponibles de la American Type Culture Collection (ATCC®) (Manassas, VA), para formar hibridomas. Los hibridomas se seleccionan y clonan mediante dilución limitada. En ciertos aspectos, los ganglios linfáticos de los ratones inmunizados se recolectan y fusionan con células de mieloma NS0.
Las células de hibridoma así preparadas se siembran y cultivan en un medio de cultivo adecuado que preferentemente contiene una o más sustancias que inhiben el crecimiento o supervivencia de las células de mieloma parentales, no fusionadas. Por ejemplo, si las células de mieloma parentales carecen de la enzima hipoxantina guanina fosforibosil transferasa (HGPRT o HPRT), el medio de cultivo para los hibridomas típicamente incluirá hipoxantina, aminopterina, y timidina (medio HAT), cuyas sustancias evitan el crecimiento de células deficientes en HGPRT.
Aspectos específicos emplean las células de mieloma que se fusionan eficazmente, soportan la producción de alto nivel, estable del anticuerpo por las células seleccionadas que producen anticuerpos, y son sensibles a un medio tal como un medio HAT. Entre estas líneas celulares de mieloma se encuentran las líneas de mieloma murino, como la línea celular NS0 o aquellas derivadas de tumores de ratón MOPC-21 y MPC-11 disponibles en el Centro de Distribución Celular del Instituto Salk, San Diego, CA, Estados Unidos, y SP-2 o células X63-Ag8.653 disponibles en American Type Culture Collection, Rockville, MD, Estados Unidos. Las líneas celulares de mieloma humano y heteromieloma de ratón humano se describen también para la producción de anticuerpos monoclonales humanos (Kozbor D (1984) J Immunol 133: 3001-5; Brodeur y otros, Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., Nueva York, 1987)).
El medio de cultivo en el cual las células de hibridoma crecen se ensayó para la producción de anticuerpos monoclonales dirigidos contra el GITR (por ejemplo, GITR humano). La especificidad de unión de los anticuerpos monoclonales producidos por células de hibridoma se determina mediante procedimientos conocidos en la técnica, por ejemplo, por inmunoprecipitación o por un ensayo de unión in vitro, tal como radioinmunoensayo (RIA) o ensayo inmunoabsorbente ligado a enzimas (ELISA).
Después de identificar las células de hibridoma que producen anticuerpos de la especificidad, afinidad y/o actividad deseadas, los clones pueden subclonarse mediante procedimientos de dilución limitante y crecer mediante procedimientos estándar (Goding JW (Ed), Monoclonal Antibodies: Principles and Practice, más arriba). Los medios de cultivo adecuados para este propósito incluyen, por ejemplo, medio D-MEM o RPMI-1640. Además, las células de hibridoma pueden crecer in vivo como tumores de ascitis en un animal.
Los anticuerpos monoclonales secretados por los subclones se separan adecuadamente del medio de cultivo, fluido de ascitis o suero mediante procedimientos convencionales de purificación de inmunoglobulinas tales como, por ejemplo, proteína A-Sepharosa, cromatografía de hidroxilapatita, electroforesis en gel, diálisis, o cromatografía de afinidad.
Los anticuerpos descritos en la presente memoria incluyen fragmentos de anticuerpos que reconocen un GITR específico (por ejemplo, GITR humano) y puede generarse mediante cualquier técnica conocida por los expertos en la técnica. Por ejemplo, los fragmentos Fab y F(ab')2 que se describen en la presente memoria pueden producirse por escisión proteolítica de moléculas de inmunoglobulina, mediante el uso enzimas tales como papaína (para producir fragmentos Fab) o pepsina (para producir fragmentos F(ab')2). Un fragmento Fab corresponde a uno de los dos brazos idénticos de una molécula de anticuerpo y contiene la cadena ligera completa emparejada con los dominios VH y CH1 de la cadena pesada. Un fragmento F(ab')2 contiene los dos brazos de unión a antígeno de una molécula de anticuerpo unida mediante enlaces disulfuro en la región bisagra.
Además, los anticuerpos descritos en la presente memoria o los fragmentos de unión a antígeno de estos también pueden generarse mediante el uso de varios procedimientos de presentación en fagos conocidos en la técnica. En los procedimientos de presentación de fagos, los dominios funcionales del anticuerpo se presentan en la superficie
de las partículas de fago los cuales portan las secuencias de polinucleótidos codificándolas. En particular, las secuencias de ADN que codifican los dominios VH y VL se amplifican a partir de bibliotecas de ADNc animal (por ejemplo, bibliotecas de ADNc humano o murino de tejidos afectados). El ADN que codifica los dominios VH y VL se recombina junto con un enlazador scFv por PCR y se clona en un vector fagémido. El vector se somete a electroporación en E. coli y la E. coli se infecta con el fago auxiliar. Los fagos usados en estos procedimientos son fagos típicamente filamentosos que incluyen fd y M13, y los dominios VH y VL por lo general se fusionan por vía recombinante ya sea al gen III o al gen VIII del fago. El fago que expresa un dominio de unión a antígeno que se une a un antígeno particular puede seleccionarse o identificarse con antígeno, por ejemplo, mediante el uso de antígeno etiquetado o antígeno unido a o capturado en una superficie sólida o perla. Los ejemplos de procedimientos de presentación en fagos que pueden usarse para producir los anticuerpos descritos en la presente descripción incluyen los que se divulgan en Brinkman U y otros, (1995) J Immunol Methods 182: 41-50; Ames RS y otros, (1995) J Immunol Methods 184: 177-186; Kettleborough cA y otros, (1994) Eur J Immunol 24: 952-958; Persic L y otros, (1997) Gene 187: 9-18; Burton DR y Barbas CF (1994) Advan Immunol 57: 191-280; la solicitud de PCT núm. PCT/GB91/001134; las publicaciones internacionales núms. WO 90/02809, WO 91/10737, WO 92/01047, WO 92/18619, WO 93/1 1236, WO 95/15982, WO 95/20401, WO 97/13844; y las patentes de Estados Unidos núms.
5,698,426, 5,223,409, 5,403,484, 5,580,717, 5,427,908, 5,750,753, 5,821,047, 5,571,698, 5,427,908, 5,516,637, 5,780,225, 5,658,727, 5,733,743 y 5,969,108.
Como se describe en las referencias anteriores, después de la selección de fagos, las regiones que codifican el anticuerpo a partir del fago pueden aislarse y usarse para generar anticuerpos completos, que incluyen anticuerpos humanos, o cualquier otro fragmento de unión a antígeno deseado, y expresarse en cualquier huésped deseado, que incluyen células de mamífero, células de insecto, células de planta, levaduras y bacterias, por ejemplo, como se describe más abajo. Las técnicas para producir fragmentos de anticuerpos por vía recombinante tales como Fab, Fab' y F(ab')2 también pueden emplearse mediante el uso de procedimientos conocidos en la técnica tales como los que se divulgan en la publicación PCT núm. WO 92/22324; Mullinax RL y otros, (1992) BioTechniques 12(6): 864-9; Sawai H y otros, (1995) Am J Reprod Immunol 34: 26-34; y Better M y otros, (1988) Science 240: 1041-1043.
En un aspecto, para generar anticuerpos completos, pueden usarse cebadores de la PCR que incluyen secuencias de nucleótidos de VH o VL, un sitio de restricción, y una secuencia flanqueadora para proteger el sitio de restricción para amplificar las secuencias de VH o VL a partir de una plantilla, por ejemplo, clones de scFv. Mediante el uso de técnicas de clonación conocidas por los expertos en la técnica, los dominios VH amplificados por la PCR pueden clonarse en vectores que expresan una región constante de VH, y los dominios VL amplificados por PCR pueden clonarse en vectores que expresan una región constante de VL, por ejemplo, regiones constantes kappa o lambda humanas. Los dominios VH y VL también pueden clonarse en un vector que expresa las regiones constantes necesarias. Los vectores de conversión de cadena pesada y los vectores de conversión de cadena ligera se cotransfectan después en líneas celulares para generar líneas celulares estables o transitorias que expresan anticuerpos de total longitud, por ejemplo, IgG, mediante el uso de técnicas conocidas por los expertos en la técnica.
Un anticuerpo quimérico es una molécula en la que las diferentes porciones del anticuerpo se derivan de diferentes moléculas de inmunoglobulina. Por ejemplo, un anticuerpo quimérico puede contener una región variable de un anticuerpo monoclonal de ratón o rata fusionada a una región constante de un anticuerpo humano. Los procedimientos para producir anticuerpos quiméricos se conocen en la técnica. Ver, por ejemplo, Morrison SL (1985) Science 229: 1202-7; Oi VT y Morrison s L (1986) BioTechniques 4: 214-221; Gillies SD y otros, (1989) J Immunol Methods 125: 191-202; y las patentes de Estados Unidos núms. 5,807,715, 4,816,567, 4,816,397, y 6,331,415.
Un anticuerpo humanizado es capaz de unirse a un antígeno predeterminado y que comprende una región marco que tiene sustancialmente la secuencia de aminoácidos de una inmunoglobulina humana y las CDR que tienen sustancialmente la secuencia de aminoácidos de una inmunoglobulina no humana (por ejemplo, una inmunoglobulina murina). En realizaciones particulares, un anticuerpo humanizado comprende además al menos una porción de una región constante de inmunoglobulina (Fc), típicamente la de una inmunoglobulina humana. El anticuerpo también puede incluir las regiones CH1, bisagra, CH2, CH3, y CH4 de la cadena pesada. El anticuerpo humanizado puede seleccionarse de cualquier clase de inmunoglobulinas, que incluye IgM, IgG, IgD, IgA e IgE, y cualquier isotipo, que incluye IgG-i, IgG2, IgG3 e IgG4. Los anticuerpos humanizados pueden producirse mediante el uso de una variedad de técnicas conocidas en la técnica, que incluyen, pero no se limitan a, injerto de CDR (patente europea núm. EP 239400; publicación internacional núm. WO 91/09967; y patentes de Estados Unidos núms.
5,225,539, 5,530,101, y 5,585,089), inactivación o acondicionamiento de superficie (patentes europeas núms. EP 592106 y EP 519596; Padlan EA (1991) Mol Immunol 28(4/5): 489-498; Studnicka GM y otros, (1994) Prot Engineering 7(6): 805-814; y Roguska MA y otros, (1994) p Na S 91: 969-973), barajado de cadenas (patente de Estados Unidos núm. 5,565,332), y las técnicas que se divulgan en, por ejemplo, la patente de Estados Unidos núm.
6,407,213, la patente de Estados Unidos núm. 5,766,886, la publicación internacional núm. WO 93/17105; Tan P y otros, (2002) J Immunol 169: 1119-25; Caldas C y otros, (2000) Protein Eng. 13(5): 353-60; Morea V y otros, (2000) Methods 20(3): 267-79; Baca M y otros, (1997) J Biol Chem 272(16): 10678-84; Roguska MA y otros, (1996) Protein Eng 9(10): 895 904; Couto JR y otros, (1995) Cancer Res. 55(23 Supp): 5973s-5977s; Couto JR y otros, (1995) Cancer Res. 55(8): 1717-22; Sandhu JS (1994) Gene 150(2): 409-10 y Pedersen JT y otros, (1994) J Mol Biol 235(3): 959-73. Ver también la solicitud de patente de los Estados Unidos núm. 2005/0042664 A1 (24 de febrero, 2005).
Los procedimientos para hacer multiespecífico (por ejemplo, anticuerpos biespecíficos), se han descrito, ver, por ejemplo, Patentes de Estados Unidos Núms. 7,951,917; 7,183,076; 8,227,577; 5,837,242; 5,989,830; 5,869,620; 6,132,992 y 8,586,713.
Los anticuerpos de dominio único, por ejemplo, anticuerpos que carecen de cadenas ligeras, pueden producirse mediante procedimientos bien conocidos en la técnica. Ver Riechmann L y Muyldermans S (1999) J Immunol 231: 25-38; Nuttall SD y otros, (2000) Curr Pharm Biotechnol 1(3): 253-263; Muyldermans S, (2001) J Biotechnol 74(4): 277-302; la patente de Estados Unidos Núm. 6,005,079; y las publicaciones internacionales núms. WO 94/04678, WO 94/25591 y WO 01/44301.
Además, los anticuerpos que se unen inmunoespecíficamente a un antígeno del GITR pueden, a su vez, utilizarse para generar anticuerpos antiidiotipo que "imitan" un antígeno mediante el uso de técnicas bien conocidas por los expertos en la técnica. (Ver, por ejemplo, Greenspan NS y Bona CA (1989) FASEB J 7(5): 437-444; y Nissinoff A (1991) J Immunol 147(8): 2429-2438).
En aspectos particulares, un anticuerpo descrito en la presente memoria, que se une al mismo epítopo de GITR (por ejemplo, GITR humano) que un anticuerpo anti-GITR descrito en la presente memoria, es un anticuerpo humano o un fragmento de unión a antígeno de este. En aspectos particulares, un anticuerpo descrito en la presente memoria, que bloquea competitivamente (por ejemplo, de una manera dependiente de la dosis) cualquiera de los anticuerpos descritos en la presente memoria, (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w) de la unión al GITR (por ejemplo, GITR humano), es un anticuerpo humano o un fragmento de unión a antígeno de este. Los anticuerpos humanos pueden producirse mediante el uso de cualquier procedimiento conocido en la técnica. Por ejemplo, pueden usarse ratones transgénicos que son incapaces de expresar inmunoglobulinas endógenas funcionales, pero que pueden expresar genes de inmunoglobulina. En particular, los complejos de genes de inmunoglobulina de cadenas pesadas y ligeras humanas pueden introducirse mediante recombinación homóloga o aleatoriamente en células madre embrionarias de ratón. Alternativamente, la región variable, la región constante, y la región de diversidad humanas pueden introducirse en células madre embrionarias de ratón además de los genes de cadenas pesadas y ligeras humanas. Los genes de inmunoglobulina de cadenas pesadas y ligeras de ratón pueden volverse no funcionales por separado o simultáneamente con la introducción de loci de inmunoglobulina humana mediante recombinación homóloga. En particular, la deleción homocigota del gen de la región Jh evita la producción de anticuerpos endógenos. Las células madre embrionarias modificadas se expanden y microinyectan en blastocistos para producir ratones quiméricos. Los ratones quiméricos se reproducen después para producir crías homocigotas que expresan anticuerpos humanos. Los ratones transgénicos se inmunizan de manera normal con un antígeno seleccionado, por ejemplo, la totalidad o una porción de un antígeno (por ejemplo, GITR). Los anticuerpos monoclonales dirigidos contra el antígeno pueden obtenerse de los ratones transgénicos inmunizados, mediante el uso de tecnología de hibridoma convencional. Los transgenes de inmunoglobulina humana albergados en los ratones transgénicos se reordenan durante la diferenciación de células B, y posteriormente experimentan el cambio de clase y la mutación somática. Por lo tanto, mediante el uso de una técnica de ese tipo, es posible producir anticuerpos terapéuticamente útiles como IgG, IgA, IgM e IgE. Para una visión general de esta tecnología para producir anticuerpos humanos, ver Lonberg N y Huszar D (1995) Int Rev Immunol 13: 65-93. Para un análisis detallado de esta tecnología para producir anticuerpos humanos y anticuerpos monoclonales humanos y los protocolos para producir tales anticuerpos, ver, por ejemplo, las publicaciones internacionales núms. WO 98/24893, WO 96/34096 y WO 96/33735; y las patentes de Estados Unidos núms. 5,413,923, 5,625,126, 5,633,425, 5,569,825, 5,661,016, 5,545,806, 5,814,318 y 5,939,598. Los ejemplos de ratones capaces de producir anticuerpos humanos incluyen el XenomouseTM (Abgenix, Inc.; las patentes de Estados Unidos núms. 6,075,181 y 6,150,184), e1HuAb-MouseTM (Mederex, Inc./Gen Pharm; las patentes de Estados Unidos núms. 5,545,806 y 5,569,825), el Trans Chromo MouseTM (Kirin) y el KM MouseTM (Medarex/Kirin).
Los anticuerpos humanos que se unen específicamente al GITR (por ejemplo, GITR humano) pueden producirse mediante una variedad de procedimientos conocidos en la técnica que incluyen los procedimientos de presentación en fagos descritos anteriormente mediante el uso de bibliotecas de anticuerpos derivadas de secuencias de inmunoglobulinas humanas. Ver además las patentes de Estados Unidos núms. 4,444,887, 4,716,111 y 5,885,793; y las publicaciones internacionales núms. WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 y WO 91/10741.
En algunos aspectos, los anticuerpos humanos pueden producirse mediante el uso de hibridomas de ratónhumanos. Por ejemplo, los linfocitos de sangre periférica humana transformados con el virus Epstein-Barr (EBV) pueden fusionarse con células de mieloma de ratón para producir hibridomas de ratón-humanos que secretan anticuerpos monoclonales humanos, y estos hibridomas de ratón-humanos pueden cribarse para determinar cuáles secretan anticuerpos monoclonales humanos que se unen inmunoespecíficamente a un antígeno diana (por ejemplo, GITR (por ejemplo, GITR humano)). Tales procedimientos se conocen y se describen en la técnica, ver, por ejemplo, Shinmoto H y otros, (2004) Cytotechnology 46: 19-23; Naganawa Y. y otros, (2005) Human Antibodies 14: 27-31.
5.2.1 Polinucleótidos
En ciertos aspectos, en la presente memoria se proporcionan polinucleótidos que comprenden una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria o un fragmento de este (por ejemplo, una región variable de cadena ligera y/o una región variable de cadena pesada) que se une inmunoespecíficamente a un antígeno GITR (por ejemplo, GITR humano), y vectores, por ejemplo, vectores que comprenden tales polinucleótidos para la expresión recombinante en células huésped (por ejemplo, E. coli y células de mamífero). En la presente memoria se proporcionan polinucleótidos que comprenden secuencias de nucleótidos que codifican cualquiera de los anticuerpos proporcionados en la presente memoria, así como también vectores que comprenden tales secuencias de polinucleótidos, por ejemplo, vectores de expresión para su expresión eficiente en células hospederas, por ejemplo, células de mamífero.
Como se usa en la presente memoria, una molécula de polinucleótido o ácido nucleico “aislada” es una que se separa de otras moléculas de ácido nucleico que están presentes en la fuente natural (por ejemplo, en un ratón o un ser humano) de la molécula de ácido nucleico. Además, una molécula de ácido nucleico “aislada”, tal como una molécula de ADNc, puede estar sustancialmente libre de otro material celular, o medio de cultivo cuando se produce mediante técnicas recombinantes, o sustancialmente libre de precursores químicos u otras sustancias químicas cuando se sintetiza químicamente. Por ejemplo, el lenguaje “sustancialmente libre” incluye preparaciones de moléculas de polinucleótido o ácido nucleico que tienen menos de aproximadamente 15 %, 10 %, 5 %, 2 %, 1 %, 0,5 %, o 0,1 % (en particular menos de aproximadamente 10 %) de otro material, por ejemplo, material celular, medio de cultivo, otras moléculas de ácido nucleico, precursores químicos y/u otras sustancias químicas. En una realización específica, una(s) molécula(s) de ácido(s) nucleico(s) que codifican un anticuerpo descrito en la presente memoria se aísla(n) o purifica(n).
En aspectos particulares, en la presente memoria se proporcionan polinucleótidos que comprenden secuencias de nucleótidos que codifican anticuerpos o fragmentos de unión a antígeno de estos, que se unen inmunoespecíficamente a un polipéptido GITR (por ejemplo, GITR humano) y comprende una secuencia de aminoácidos como se describe en la presente memoria, así como también anticuerpos que compiten con tales anticuerpos por unirse a un polipéptido GITR (por ejemplo, de una manera dependiente de la dosis), o que se une al mismo epítopo que el de tales anticuerpos.
En ciertos aspectos, en la presente memoria se proporcionan polinucleótidos que comprenden una secuencia de nucleótidos que codifica la cadena ligera o la cadena pesada de un anticuerpo descrito en la presente descripción. Los polinucleótidos pueden comprender secuencias de nucleótidos que codifican una cadena ligera que comprende las CDR y las FR de VL de anticuerpos descritos en la presente memoria (ver, por ejemplo, las Tablas 1 y 3). Los polinucleótidos pueden comprender secuencias de nucleótidos que codifican una cadena pesada que comprende las CDR y las FR de VH de anticuerpos descritos en la presente memoria (ver, por ejemplo, las Tablas 2 y 4). En aspectos específicos, un polinucleótido descrito en la presente memoria codifica un dominio VL que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en la SEQ ID NO: 202, 204, 205, 207, 208 y 400 518. En aspectos específicos, un polinucleótido descrito en la presente memoria codifica un dominio VL que comprende una secuencia de aminoácidos de la SEQ ID NO: 519. En aspectos específicos, un polinucleótido descrito en la presente memoria codifica un dominio VH que comprende una secuencia de aminoácidos seleccionada del grupo que consiste en las SEQ ID NO: 201, 203, 206 y 215-389. En aspectos específicos, un polinucleótido descrito en la presente memoria codifica un dominio VL que comprende la secuencia de aminoácidos de cualquiera de los anticuerpos 231-32-15, Hum231#1 o Hum231#2 (por ejemplo, las SEQ ID NO: 202, 207 o 208). En aspectos específicos, un polinucleótido descrito en la presente memoria codifica un dominio VH que comprende la secuencia de aminoácidos de cualquiera de los anticuerpos 231-32-15, Hum231#1 o Hum231#2 (por ejemplo, las SEQ ID NO: 201 o 206). En aspectos específicos, un polinucleótido descrito en la presente memoria codifica un dominio VH y un dominio VL que comprende la secuencia de aminoácidos de cualquiera de los anticuerpos 231-32 15, Hum231#1 o Hum231#2 (por ejemplo, las SEQ ID NO: 201-202 y/o 206-208).
En aspectos particulares, en la presente memoria se proporcionan polinucleótidos que comprenden una secuencia de nucleótidos que codifica un anticuerpo anti-GITR que comprende tres CDR de cadenas de VL, por ejemplo, que contienen CDR1 de VL, CDR2 de VL y CDR3 de VL de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, ver la Tabla 1, por ejemplo, las CDR de VL en una fila en la Tabla 1). En aspectos específicos, en la presente memoria se proporcionan polinucleótidos que comprenden tres CDR de cadena de VH, por ejemplo, que contienen CDR1 de VH, CDR2 de VH y CDR3 de VH de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, ver la Tabla 2, por ejemplo, las CDR de VH en una fila en la Tabla 2). En aspectos específicos, en la presente memoria se proporcionan polinucleótidos que comprenden una secuencia de nucleótidos que codifica un anticuerpo anti-GITR que comprende tres CDR de cadena de VH, por ejemplo, que contiene CDR1 de VL, CDR2 de VL y CDR3 de VL de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, ver la Tabla 1, por ejemplo, las CDR de VL en una fila de la Tabla 1) y tres CDR de cadena de VH, por ejemplo, que contienen CDR1 de VH, CDR2 de VH y CDR3 de VH de cualquiera de los anticuerpos descritos en la presente memoria (por ejemplo, ver la Tabla 2, por ejemplo, las CDR de VH en una fila en la Tabla 2). En aspectos específicos, un polinucleótido descrito en la presente memoria codifica las CDR de VL de cualquiera de los anticuerpos 231-32-15, Hum231#1 o Hum231#2 (por ejemplo, las SEQ ID NO: 16, 17 o 18). En aspectos
específicos, un polinucleótido descrito en la presente memoria codifica las CDR de VH de cualquiera de los anticuerpos 231-32-15, Hum231#1 o Hum231#2 (por ejemplo, las SEQ ID NO: 13, 14 o 15). En aspectos específicos, un polinucleótido descrito en la presente memoria codifica las CDR de VH y las CDR de VL de cualquiera de los anticuerpos 231-32-15, Hum231#1 o Hum231#2 (por ejemplo, las SEQ ID nO: 13-18).
En aspectos particulares, en la presente memoria se proporcionan polinucleótidos que comprenden una secuencia de nucleótidos que codifica un anticuerpo anti-GITR que comprende un dominio VL, por ejemplo, que contiene FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, que comprende una secuencia de aminoácidos descrita en la presente memoria (por ejemplo, ver las Tablas 1 y 3, por ejemplo, las CDR de VL y las FR de VL de un anticuerpo particular identificado por su nombre en las tablas). En aspectos específicos, en la presente memoria se proporcionan polinucleótidos que comprenden una secuencia de nucleótidos que codifica un anticuerpo anti-GITR que comprende un dominio VH, por ejemplo, que contiene FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, que comprende una secuencia de aminoácidos descrita en la presente memoria (por ejemplo, ver las Tablas 2 y 4, por ejemplo, las CDR de VL y las FR de VL de un anticuerpo particular identificado por su nombre en las Tablas).
En ciertos aspectos, un polinucleótido descrito en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo proporcionado en la presente memoria que comprende una región variable de cadena ligera que comprende una secuencia de aminoácidos descrita en la presente memoria (por ejemplo, las SEQ ID NO: 202, 204, 205, 207, 208 y 400-518 o la SEQ ID NO: 519), en la que el anticuerpo se une inmunoespecíficamente a GITR (por ejemplo, GITR humano). En un aspecto determinado, un polinucleótido descrito en la presente memoria comprende una secuencia de nucleótidos que codifica los anticuerpos Hum231#1 o Hum231#2 o Hum231#2w proporcionados en la presente memoria que comprende una región variable de cadena ligera que comprende una secuencia de aminoácidos descrita en la presente memoria (por ejemplo, las SEQ ID NO: 207 o 208).
En ciertos aspectos, un polinucleótido descrito en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo proporcionado en la presente memoria que comprende una región variable de cadena pesada que comprende una secuencia de aminoácidos descrita en la presente memoria (por ejemplo, las SEQ ID NO: 201, 203, 206 y 215-389), en la que el anticuerpo se une inmunoespecíficamente a GITR (por ejemplo, GITR humano). En una cierta realización, un polinucleótido descrito en la presente memoria comprende una secuencia de nucleótidos que codifica los anticuerpos Hum231#1, Hum231#2 o Hum231#2w proporcionados en la presente memoria que comprende una región variable de cadena pesada que comprende una secuencia de aminoácidos descrita en la presente memoria (por ejemplo, la SEQ ID NO: 206).
En ciertos aspectos, un polinucleótido comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria que comprende un dominio VL que comprende una o más FR de VL que tienen la secuencia de aminoácidos descrita en la presente memoria (por ejemplo, ver la Tabla 3, por ejemplo, las regiones marco en una fila de la tabla), en la que el anticuerpo se une inmunoespecíficamente a GITr (por ejemplo, GITR humano). En ciertos aspectos, un polinucleótido comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria que comprende un dominio VH que comprende una o más FR de VH que tienen la secuencia de aminoácidos descrita en la presente memoria (por ejemplo, ver la Tabla 4, por ejemplo, las regiones marco en una fila de la tabla), en la que el anticuerpo se une inmunoespecíficamente a GITR (por ejemplo, GITR humano).
En aspectos específicos, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria que comprende: regiones marco (por ejemplo, regiones marco del dominio VL y dominio VH) que son regiones marco humanas, en las que el anticuerpo se une inmunoespecíficamente a GITR (por ejemplo, GITR humano). En ciertos aspectos, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo o fragmento de este (por ejemplo, las CDR o dominio variable) descritos en la Sección 5.1 anterior.
En aspectos específicos, en la presente memoria se proporciona un polinucleótido que comprende una secuencia de nucleótidos que codifica un anticuerpo que comprende una cadena ligera y una cadena pesada, por ejemplo, una cadena ligera y una cadena pesada separadas. Con respecto a la cadena ligera, en una realización específica, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica una cadena ligera kappa. En otra realización específica, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica una cadena ligera lambda. En aún otra realización específica, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria que comprende una cadena ligera kappa humana y una cadena ligera lambda humana. En un aspecto particular, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), en la que el anticuerpo comprende una cadena ligera, y en la que la secuencia de aminoácidos del dominio VL puede comprender cualquier secuencia de aminoácidos descrita en la presente memoria (por ejemplo, las SEQ ID No : 202, 204, 205, 207, 208 y 400-518 o la SEQ ID NO: 519) y en la que la región constante de la cadena ligera comprende la secuencia de aminoácidos de una región constante de cadena ligera kappa humana. En otro aspecto particular, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), y comprende una cadena ligera,
en la que la secuencia de aminoácidos del dominio VL puede comprender cualquier secuencia de aminoácidos descrita en la presente memoria (por ejemplo, las SEQ ID NO: 202, 204, 205, 207, 208 y 400-518 o la SEQ ID NO: 519) y en la que la región constante de la cadena ligera comprende la secuencia de aminoácidos de una región constante de cadena ligera lambda humana. Por ejemplo, las secuencias de la región constante humana pueden ser las descritas en la patente de Estados Unidos núm. 5,693,780.
En un aspecto particular, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), en el que el anticuerpo comprende una cadena pesada, en la que la secuencia de aminoácidos del dominio VH puede comprender la secuencia de aminoácidos descrita en la presente memoria (por ejemplo, las SEQ ID NO: 201, 203, 206 y 215-389), y en la que la región constante de la cadena pesada comprende la secuencia de aminoácidos de una región constante de cadena pesada gamma (y) humana.
En un aspecto determinado, un polinucleótido proporcionado en la presente memoria comprende una(s) secuencia(s) de nucleótido(s) que codifica(n) un dominio VH y/o un dominio VL de un anticuerpo descrito en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231 32-15, o anticuerpos 1-107 tales como las SEQ ID NO: 209 u 800-974 para el dominio VH o las SEQ ID NO: 210, 211 o 1.001-1.126 para el dominio VL), que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano). En un aspecto determinado, un polinucleótido proporcionado en la presente memoria comprende una(s) secuencia(s) de nucleótido(s) que codifica(n) un dominio VH y/o un dominio VL de un anticuerpo descrito en la presente memoria (por ejemplo, Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 tales como las s Eq ID NO: 209 u 800-974 para el dominio VH o las SEQ ID NO: 210, 211 o 1.000-1.118 para el dominio VL), que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano). En un aspecto determinado, en la presente memoria se proporciona un polinucleótido que comprende una secuencia(s) de nucleótido(s) que codifica(n) un dominio VH y/o un dominio VL del anticuerpo Hum231#1 o Hum231# (por ejemplo, las SEQ ID No : 209-211).
Aún en otro aspecto específico, un polinucleótido proporcionado en la presente memoria comprende una secuencia de nucleótidos que codifica un anticuerpo descrito en la presente memoria (o un fragmento de unión a antígeno de este) que se une específicamente a GITR (por ejemplo, GITR humano), en el que el anticuerpo comprende un dominio VL y un dominio VH que comprende cualquiera de las secuencias de aminoácidos descritas en la presente memoria, y en la que las regiones constantes comprenden las secuencias de aminoácidos de las regiones constantes de una IgG1 humana (por ejemplo, alotipo 1, 17, o 3) o IgG4 humana.
En un aspecto específico, en la presente memoria se proporcionan polinucleótidos que comprenden una secuencia de nucleótidos que codifica un anticuerpo anti-GITR, o un fragmento de unión a antígeno o dominio de este, designado en la presente memoria, ver, por ejemplo, Tablas 1-4, por ejemplo anticuerpo Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15, o anticuerpos 1-107, o anticuerpos pab2159, pab2160, pab2161 o Hum231#2w.
En la presente memoria también se proporcionan polinucleótidos que codifican un anticuerpo anti-GITR o un fragmento de este que se optimizan, por ejemplo, mediante la optimización de codones/ARN, reemplazo con secuencias señales heterólogas y la eliminación de elementos de inestabilidad del ARNm. Los procedimientos para generar ácidos nucleicos optimizados que codifican un anticuerpo anti-GITR o un fragmento de este (por ejemplo, cadena ligera, cadena pesada, dominio VH o dominio VL) para la expresión recombinante mediante la introducción de cambios en los codones y/o la eliminación de regiones inhibidoras en el ARNm pueden llevarse a cabo mediante la adaptación de los procedimientos de optimización descritos en, por ejemplo, las patentes de Estados Unidos núms. 5,965,726; 6,174,666; 6,291,664; 6,414,132 y 6,794,498, en consecuencia. Por ejemplo, los sitios de escisión y los elementos de inestabilidad potenciales (por ejemplo, los elementos ricos en A/T o A/U) dentro del ARN pueden mutarse sin alterar los aminoácidos codificados por las secuencias de ácidos nucleicos para aumentar la estabilidad del ARN para la expresión recombinante. Las alteraciones utilizan la degeneración del código genético, por ejemplo, mediante el uso de un codón alternativo para un aminoácido idéntico. En algunos aspectos, puede ser conveniente alterar uno o más codones para codificar una mutación conservadora, por ejemplo, un aminoácido similar con estructura química y propiedades y/o función similares a las del aminoácido original. Tales procedimientos pueden aumentar la expresión de un anticuerpo anti-GITR o un fragmento de este en al menos 1 vez, 2 veces, 3 veces, 4 veces, 5 veces, 10 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces o 100 veces o más en relación con la expresión de un anticuerpo anti-GITR codificado por polinucleótidos que no se han optimizado.
En ciertas realizaciones, una secuencia de polinucleótido optimizada que codifica un anticuerpo anti-GITR descrito en la presente memoria o un fragmento de este (por ejemplo, dominio VL y/o dominio VH) puede hibridarse a un polinucleótido antisentido (por ejemplo, complementario) de una secuencia de polinucleótido no optimizada que codifica un anticuerpo anti-GITR descrito en la presente memoria o un fragmento de este (por ejemplo, dominio VL o
dominio VH). En realizaciones específicas, una secuencia de nucleótidos optimizada que codifica un anticuerpo anti-GITR descrito en la presente memoria o un fragmento se hibrida en condiciones de alta rigurosidad al polinucleótido antisentido de una secuencia de polinucleótido no optimizada que codifica un anticuerpo anti-GITR descrito en la presente memoria o un fragmento de este. En una realización específica, una secuencia de nucleótidos optimizada que codifica un anticuerpo anti-GITR descrito en la presente memoria o un fragmento de este se hibrida en condiciones de hibridación de alta rigurosidad, rigurosidad intermedia, o baja rigurosidad a un polinucleótido antisentido de una secuencia de nucleótidos no optimizada que codifica un anticuerpo anti-GITR descrito en la presente memoria o un fragmento de este. La información con respecto a las condiciones de hibridación se ha descrito, ver, por ejemplo, la publicación de solicitud de patente de Estados Unidos núm. US 2005/0048549 (por ejemplo, párrafos 72-73).
Los polinucleótidos pueden obtenerse, y la secuencia de nucleótidos de los polinucleótidos determinarse, por cualquier procedimiento conocido en la técnica. Las secuencias de nucleótidos que codifican anticuerpos descritos en la presente memoria, por ejemplo, los anticuerpos descritos en las Tablas 1-4, y las versiones modificadas de estos anticuerpos pueden determinarse mediante el uso de procedimientos bien conocidos en la técnica, es decir, los codones de nucleótidos que se sabe que codifican aminoácidos particulares se ensamblan de tal manera que generan un ácido nucleico que codifica el anticuerpo. Puede ensamblarse tal polinucleótido que codifica el anticuerpo a partir de los oligonucleótidos sintetizados químicamente (por ejemplo, como se describe en Kutmeier y otros, (1994), BioTechniques 17: 242-6), lo que brevemente, implica la síntesis de los oligonucleótidos que se solapan y que contienen las porciones de la secuencia que codifica el anticuerpo, hibridación y unión de los oligonucleótidos, y después la amplificación de los oligonucleótidos unidos por la PCR.
Alternativamente, puede generarse un polinucleótido que codifica un anticuerpo descrito en la presente memoria a partir de ácido nucleico de una fuente adecuada (por ejemplo, un hibridoma) mediante el uso procedimientos bien conocidos en la técnica (por ejemplo, PCR y otros procedimientos de clonación molecular). Por ejemplo, la amplificación por PCR mediante el uso de cebadores sintéticos que pueden hibridar con los extremos 3' y 5' de una secuencia conocida puede realizarse mediante el uso de ADN genómico obtenido de células de hibridoma que producen el anticuerpo de interés. Tales procedimientos de amplificación por PCR pueden usarse para obtener ácidos nucleicos que comprenden la secuencia que codifica la cadena ligera y/o la cadena pesada de un anticuerpo. Tales procedimientos de amplificación por PCR pueden usarse para obtener ácidos nucleicos que comprenden la secuencia que codifica la región variable de cadena ligera y/o la región variable de cadena pesada de un anticuerpo. Los ácidos nucleicos amplificados pueden clonarse en vectores para expresión en células huésped y para la clonación adicional, por ejemplo, para generar anticuerpos quiméricos y humanizados.
Si no se dispone de un clon que contiene un ácido nucleico que codifica un anticuerpo particular, pero se conoce la secuencia de la molécula de anticuerpo, puede sintetizarse químicamente u obtenerse de una fuente adecuada un ácido nucleico que codifica el anticuerpo (por ejemplo, una biblioteca de ADNc de anticuerpos, o una biblioteca de ADNc generada a partir de, o ácido nucleico, preferentemente ARN poliA+, aislado de cualquier tejido o células que expresan el anticuerpo, tales como células de hibridoma seleccionadas para expresar un anticuerpo descrito en la presente memoria) mediante amplificación por PCR mediante el uso de cebadores sintéticos hibridables a los extremos 3' y 5' de la secuencia o mediante clonación, mediante el uso de una sonda de oligonucleótidos específica para la secuencia génica particular a identificar, por ejemplo, un clon de ADNc de una biblioteca de ADNc que codifica el anticuerpo. Los ácidos nucleicos amplificados generados mediante la PCR pueden clonarse después en vectores de clonación replicables mediante el uso de cualquier procedimiento bien conocido en la técnica.
El ADN que codifica los anticuerpos anti-GITR descritos en la presente memoria pueden aislarse y secuenciarse fácilmente mediante el uso de procedimientos convencionales (por ejemplo, mediante el uso de sondas de oligonucleótidos que son capaces de unirse específicamente a genes que codifican las cadenas ligera y pesada de los anticuerpos anti-GITR). Las células de hibridoma pueden servir como fuente de tal ADN. Una vez aislado, el ADN puede colocarse en vectores de expresión, los cuales se transfectan después en las células huésped tales como células de E. coli, células COS de simio, células de ovario de hámster chino (CHO) (por ejemplo, células CHO del CHO GS SystemTM (Lonza)) o células de mieloma que de cualquier otra manera no producen proteína de inmunoglobulina, para obtener la síntesis de anticuerpos anti-GITR en las células huésped recombinantes.
Para generar anticuerpos completos, pueden usarse cebadores de la PCR que incluyen secuencias de nucleótidos de VH o VL, un sitio de restricción, y una secuencia flanqueadora para proteger el sitio de restricción para amplificar las secuencias de VH o VL en clones de scFv. Mediante el uso de técnicas de clonación conocidas por los expertos en la técnica, los dominios VH amplificados por la PCR pueden clonarse en vectores que expresan una región constante de cadena pesada, por ejemplo, la región constante gamma 4 humana, y los dominios VL amplificados por PCR pueden clonarse en vectores que expresan una región constante de cadena ligera, por ejemplo, regiones constantes kappa o lambda humanas. En ciertas realizaciones, los vectores para expresar los dominios VH o VL comprenden un promotor EF-1a, una señal de secreción, un sitio de clonación para el dominio variable, dominios constantes y un marcador de selección tal como neomicina. Los dominios VH y VL también pueden clonarse en un vector que expresa las regiones constantes necesarias. Los vectores de conversión de cadena pesada y los vectores de conversión de cadena ligera se cotransfectan después en líneas celulares para generar líneas celulares
estables o transitorias que expresan anticuerpos de total longitud, por ejemplo, IgG, mediante el uso de técnicas conocidas por los expertos en la técnica.
El ADN puede modificarse, además, por ejemplo, mediante la sustitución de la secuencia codificante de los dominios constantes de cadena pesada y de cadena ligera humanas en lugar de las secuencias murinas, o mediante la unión covalente a la secuencia codificante de inmunoglobulina de la totalidad o parte de la secuencia codificante de un polipéptido no inmunoglobulínico.
También se proporcionan polinucleótidos que se hibridan en condiciones de alta rigurosidad, rigurosidad intermedia o baja a polinucleótidos que codifican un anticuerpo descrito en la presente memoria. En realizaciones específicas, los polinucleótidos descritos en la presente memoria se hibridan en condiciones de hibridación de alta rigurosidad, rigurosidad intermedia o baja a polinucleótidos que codifican un dominio VH (por ejemplo, las SEQ ID NO: 201, 203, 206 y 215-389) y/o un dominio VL (por ejemplo, las SEQ ID NO: 202, 204, 205, 207, 208 y 400-518 o la SEQ ID NO: 519) proporcionado en la presente memoria.
Las condiciones de hibridación se han descrito en la técnica y se conocen por un experto en la técnica. Por ejemplo, la hibridación en condiciones rigurosas puede implicar la hibridación a a Dn unido a filtro en cloruro sódico/citrato sódico (SSC) 6x a aproximadamente 45 °C seguido de uno o más lavados en SSC 0,2x/SDS al 0,1 % a aproximadamente 50-65 °C; la hibridación en condiciones altamente rigurosas puede implicar la hibridación a ácido nucleico unido a filtro en SSC 6x a aproximadamente 45 °C seguido de uno o más lavados en SSC 0,1x/SDS al 0,2 % a aproximadamente 68 °C. La hibridación en otras condiciones de hibridación rigurosas se conoce por los expertos en la técnica y se ha descrito, ver, por ejemplo, Ausubel FM y otros, eds., (1989) Current Protocols in Molecular Biology, Vol. I, Green Publishing Associates, Inc. y John Wiley & Sons, Inc., Nueva York en las páginas 6.3.1-6.3.6 y 2.10.3.
5.2.2 Células y vectores
En ciertos aspectos, en la presente memoria se proporcionan células (por ejemplo, células hospederas) que expresan (por ejemplo, por vía recombinante) anticuerpos descritos en la presente memoria (o un fragmento de unión a antígeno de este) que se unen específicamente a GITR (por ejemplo, GITR humano) y a polinucleótidos y vectores de expresión relacionados. En la presente memoria se proporcionan vectores (por ejemplo, vectores de expresión) que comprenden polinucleótidos que comprenden secuencias de nucleótidos que codifican anticuerpos anti-GITR o un fragmento para la expresión recombinante en células hospederas, preferentemente en células de mamífero. En la presente memoria también se proporcionan células huésped que comprenden tales vectores para la expresión por vía recombinante de anticuerpos anti-GITR descritos en la presente memoria (por ejemplo, anticuerpo humano o humanizado). En un aspecto particular, en la presente memoria se proporcionan procedimientos para producir un anticuerpo descrito en la presente memoria, que comprenden expresar tal anticuerpo en una célula hospedera.
La expresión recombinante de un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo de longitud completa, cadena pesada y/o ligera de un anticuerpo, o un anticuerpo monocatenario descrito en la presente memoria) que se une específicamente a GITR (por ejemplo, GITR humano) implica la construcción de un vector de expresión que contiene un polinucleótido que codifica el anticuerpo. Una vez que se ha obtenido un polinucleótido que codifica un anticuerpo o fragmento de este (por ejemplo, dominios variables de cadena pesada y/o ligera) descrito en la presente memoria, el vector para la producción de la molécula de anticuerpo puede producirse mediante la tecnología de ADN recombinante mediante el uso de técnicas bien conocidas en la técnica. Por lo tanto, en la presente memoria se describen procedimientos para preparar una proteína mediante la expresión de un polinucleótido que contiene una secuencia de nucleótidos que codifica un anticuerpo o fragmento de anticuerpo (por ejemplo, cadena ligera o cadena pesada). Los procedimientos que son bien conocidos por los expertos en la técnica pueden usarse para construir vectores de expresión que contengan las secuencias codificantes de un anticuerpo o fragmento de anticuerpo (por ejemplo, cadena ligera o cadena pesada) y señales de control transcripcional y traduccional adecuadas. Estos procedimientos incluyen, por ejemplo, técnicas de ADN recombinante in vitro, técnicas de síntesis y recombinación genética in vivo. También se proporcionan vectores replicables que comprenden una secuencia de nucleótidos que codifica una molécula de anticuerpo descrita en la presente memoria, una cadena pesada o ligera de un anticuerpo, un dominio variable de cadena pesada o ligera de un anticuerpo o un fragmento de este, o una CDR de cadena pesada o ligera, unida operativamente a un promotor. Tales vectores pueden incluir, por ejemplo, la secuencia de nucleótidos que codifica la región constante de la molécula de anticuerpo (ver, por ejemplo, las publicaciones internacionales núms. WO 86/05807 y WO 89/01036; y la patente de Estados Unidos núm. 5,122,464) y los dominios variables del anticuerpo pueden clonarse en un vector tal para la expresión de la cadena pesada entera, la cadena ligera entera, o ambas cadenas pesadas y ligeras enteras.
Un vector de expresión puede transferirse a una célula (por ejemplo, célula hospedera) mediante técnicas convencionales y las células resultantes pueden cultivarse después mediante técnicas convencionales para producir un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970,
pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o los anticuerpos 1-107, o los anticuerpos pab2159, pab2160 o pab2161) o un fragmento de estos. Por tanto, en la presente memoria se proporcionan células huésped que contienen un polinucleótido que codifica un anticuerpo descrito en la presente memoria o fragmentos de este, o una cadena pesada o ligera de este, o un fragmento de esta, o un anticuerpo monocatenario descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), unidos operativamente a un promotor para la expresión de tales secuencias en la célula hospedera. En ciertas realizaciones, para la expresión de anticuerpos de doble cadena, los vectores que codifican tanto las cadenas pesadas como las ligeras, pueden coexpresarse, individualmente, en la célula huésped para la expresión de la molécula de inmunoglobulina entera, como se detalla más abajo. En ciertas realizaciones, una célula huésped contiene un vector que comprende un polinucleótido que codifica tanto la cadena pesada como la cadena ligera de un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), o un fragmento de estos. En realizaciones específicas, una célula huésped contiene dos vectores diferentes, un primer vector que comprende un polinucleótido que codifica una cadena pesada o una región variable de cadena pesada de un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), o un fragmento de este, y un segundo vector que comprende un polinucleótido que codifica una cadena ligera o una región variable de cadena ligera de un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), o un fragmento de estos. En otras realizaciones, una primera célula huésped comprende un primer vector que comprende un polinucleótido que codifica una cadena pesada o una región variable de cadena pesada de un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), o un fragmento de estos, y una segunda célula huésped que comprende un segundo vector que comprende un polinucleótido que codifica una cadena ligera o una región variable de cadena ligera de un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231 32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161). En realizaciones específicas, una cadena pesada/región variable de cadena pesada expresada por una primera célula asociada con una cadena ligera/región variable de cadena ligera de una segunda célula para formar un anticuerpo anti-GITR descrito en la presente memoria (por ejemplo, anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161) o un fragmento de unión a antígeno de estos. En ciertas realizaciones, en la presente memoria se proporciona una población de células huésped que comprende tal primera célula huésped y tal segunda célula hospedera.
En una realización particular, en la presente memoria se proporciona una población de vectores que comprende un primer vector que comprende un polinucleótido que codifica una cadena ligera/región variable de cadena ligera de un anticuerpo anti-GITR descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231 32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161), y un segundo vector que comprende un polinucleótido que codifica una cadena pesada/región variable de cadena pesada de un anticuerpo anti-GITR descrito en la presente memoria (por ejemplo, anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161).
Puede utilizarse una variedad de sistemas de vector de expresión de hospederos para expresar las moléculas de anticuerpos descritas en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161 (ver, por ejemplo, la patente de Estados Unidos núm. 5,807,715). Tales sistemas de expresión en hospederos representan vehículos mediante los cuales pueden producirse y purificarse posteriormente las secuencias codificantes de interés, pero además representan las células
que pueden, cuando se transforman o transfectan con las secuencias de nucleótidos codificantes adecuadas, expresar la molécula de anticuerpo descrita en la presente memoria in situ. Estos incluyen pero no se limitan a microorganismos tales como bacterias (por ejemplo, E. coli y B. subtilis) transformadas con vectores de expresión recombinante de ADN de bacteriófago, ADN plasmídico o ADN de cósmido que contienen secuencias codificantes de anticuerpos; levaduras (por ejemplo, Saccharomyces pichia)) transformadas con vectores de expresión recombinante de levadura que contienen secuencias codificantes de anticuerpos; sistemas de células de insectos infectadas con vectores de expresión recombinante de virus (por ejemplo, baculovirus) que contienen secuencias codificantes de anticuerpos; sistemas de células vegetales (por ejemplo, algas verdes tales como Chlamydomonas reinhardtii) infectadas con vectores de expresión recombinante de virus (por ejemplo, virus del mosaico de la coliflor, CaMV; virus del mosaico del tabaco, TMV) o transformadas con vectores plasmídicos de expresión recombinante (por ejemplo, plásmido Ti) que contienen secuencias codificantes de anticuerpos; o sistemas de células de mamífero (por ejemplo, células COS (por ejemplo,, COS1 o COS), células CHO, BHK, MDCK, HEK293, NS0, PER.C6, VERO, CRL7O3O, HsS78Bst, HeLa, y NIH 3T3, HEK-293T, HepG2, SP210, R1.1, B-W, L-M, BSC1, BSC40, YB/20 y BMT10) que albergan constructos de expresión recombinante que contienen promotores derivados del genoma de células de mamífero (por ejemplo, promotor de metalotioneína) o de virus de mamíferos (por ejemplo, el promotor tardío de adenovirus; el promotor 7,5K del virus vacuna). En una realización específica, las células para expresar anticuerpos descritas en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o los anticuerpos 1-107, o los anticuerpos pab2159, pab2160 o pab2161) o un fragmento de unión a antígeno de estos son células CHO, por ejemplo células CHO del CHO GS System™ (Lonza). En una realización particular, las células para la expresión de los anticuerpos descritos en la presente memoria son células humanas, por ejemplo, líneas celulares humanas. En una realización específica, un vector de expresión de mamífero es pOptiVEC™ o pcDNA3.3. En una realización particular, las células bacterianas tales como Escherichia coli, o las células eucariotas (por ejemplo, células de mamífero), especialmente para la expresión de una molécula completa de anticuerpo recombinante, se usan para la expresión de una molécula de anticuerpo recombinante. Por ejemplo, las células de mamífero tales como las células de ovario de hámster chino (CHO), junto con un vector tal como el elemento principal del promotor del gen temprano intermedio del citomegalovirus humano es un sistema de expresión efectivo para anticuerpos (Foecking MK y Hofstetter H (1986) Gene 45: 101-5; y Cockett y otros, (1990) Biotechnology 8(7): 662-7). En ciertas realizaciones, los anticuerpos descritos en la presente memoria se producen en células CHO o NS0. En una realización específica, la expresión de secuencias de nucleótidos que codifican los anticuerpos descritos en la presente memoria que se unen específicamente a GITR (por ejemplo, GITR humano) se regula por un promotor constitutivo, un promotor inducible o un promotor específico de tejidos.
En sistemas bacterianos, una serie de vectores de expresión puede seleccionarse ventajosamente en dependencia del uso previsto para la molécula de anticuerpo que se expresa. Por ejemplo, cuando va a producirse una gran cantidad de tal anticuerpo de este tipo, para la generación de composiciones farmacéuticas de una molécula de anticuerpo, pueden ser convenientes los vectores que dirigen la expresión de altos niveles de productos de proteínas de fusión que se purifican fácilmente. Tales vectores incluyen, pero no se limitan, al vector de expresión pUR278 de E. coli (Ruther U y Mueller-Hill B (1983), EMBO J 2: 1791-1794), en el que la secuencia que codifica el anticuerpo puede unirse individualmente al vector en el marco con la región codificante lac Z de manera que se produce una proteína de fusión; vectores pIN (Inouye S y Inouye M (1985) Nuc Acids Res 13: 3101-3109; Van Heeke G y Schuster SM (1989) J Biol Chem 24: 5503-5509); y similares. Por ejemplo, los vectores pGEX pueden usarse además para expresar polipéptidos foráneos como las proteínas de fusión con glutatión 5-transferasa (GST). Generalmente, tales proteínas de fusión son solubles y pueden purificarse fácilmente a partir de células lisadas mediante adsorción y unión a una matriz de perlas de agarosa y glutatión seguido por la elución en presencia de glutatión libre. Los vectores pGEX se diseñan para incluir sitios de escisión para trombina o proteasa factor Xa tal que el producto génico objetivo clonado puede liberarse del resto GST.
En un sistema de insecto, el virus de la poliedrosis nuclear Autographa californica (AcNPV), por ejemplo, puede usarse como un vector para expresar genes foráneos. El virus crece en las células de Spodoptera frugiperda. La secuencia codificante de anticuerpo puede clonarse individualmente en regiones no esenciales (por ejemplo, el gen polihedrina) del virus y colocarse bajo el control de un promotor AcNPV (por ejemplo, el promotor de la polihedrina).
En células huésped de mamíferos, puede usarse una serie de sistemas de expresión basados en virus. En los casos donde se usa un adenovirus como un vector de expresión, la secuencia codificante del anticuerpo de interés puede estar ligada a un complejo de control de la transcripción/traducción de adenovirus, por ejemplo, el promotor tardío y la secuencia líder tripartita. Este gen quimérico puede insertarse después en el genoma del adenovirus mediante recombinación in vitro o in vivo. La inserción en una región no esencial del genoma viral (por ejemplo, región El o E3) resultará en un virus recombinante que es viable y capaz de expresar la molécula de anticuerpo en hospederos infectados (por ejemplo, ver Logan J y Shenk T (1984) PNAS 81(12): 3655-9). Las señales de iniciación específicas pueden ser necesarias además para la traducción eficiente de las secuencias codificantes del anticuerpo insertadas. Estas señales incluyen el codón de iniciación ATG y las secuencias adyacentes. Además, el codón de iniciación debe estar en fase con el marco de lectura de la secuencia codificante deseada para asegurar la traducción del inserto entero. Estas señales de control traduccional exógenas y codones de iniciación pueden proceder de una variedad de orígenes, tanto natural como sintético. La eficacia de la expresión puede mejorarse por la inclusión de
elementos potenciadores adecuados de la transcripción, terminadores de la transcripción, etc. (ver, por ejemplo, Bitter G y otros, (1987) Methods Enzymol. 153: 516-544).
Además, puede elegirse una cepa de la célula huésped que module la expresión de las secuencias insertadas, o modifique y procese el producto génico de la manera específica deseada. Tales modificaciones (por ejemplo, glucosilación) y procesamiento (por ejemplo, escisión) de productos proteicos pueden ser importantes para la función de la proteína. Las diferentes células hospederos tienen mecanismos característicos y específicos para el procesamiento postraduccional y la modificación de proteínas y productos génicos. Pueden elegirse líneas celulares o sistemas de hospederos apropiados para asegurar la correcta modificación y procesamiento de la proteína exógena expresada. Para esta finalidad, pueden usarse células huésped eucariotas que poseen la maquinaria celular para el procesamiento adecuado del transcrito primario, la glucosilación, y la fosforilación del producto génico. Tales células huésped de mamífero incluyen, pero no se limitan a células CHO, VERO, BHK, Hela, MDCK, HEK 293, NIH 3T3, W138, BT483, Hs578T, HTB2, BT2O y T47D, NS0 (una línea celular de mieloma murino que no produce endógenamente ninguna de las cadenas de inmunoglobulinas), CRL7O3O, COS (por ejemplo, COS1 o COS), PER.C6, VERO, HsS78Bst, HEK-293T, HepG2, SP210, R1.1, B-W, L-M, BSC1, BSC40, YB/20, BMT10 y HsS78Bst. En ciertas realizaciones, los anticuerpos descritos en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o los anticuerpos 1-107, o los anticuerpos pab2159, pab2160 o pab2161) se producen en células de mamífero, tales como células CHO.
En una realización específica, los anticuerpos descritos en la presente memoria o fragmentos de unión a antígeno de estos tienen contenido de fucosa reducido o no tienen contenido de fucosa. Tales anticuerpos pueden producirse mediante el uso de técnicas conocidas por un experto en la técnica. Por ejemplo, los anticuerpos pueden expresarse en células deficientes o que carecen de la capacidad de fucosilar. En un ejemplo específico, las líneas celulares con una desactivación de ambos alelos de la a1,6-fucosiltransferasa pueden usarse para producir anticuerpos o fragmentos de unión a antígeno de estos con contenido de fucosa reducido. El sistema Potelligent® (Lonza) es un ejemplo de un sistema tal que puede usarse para producir anticuerpos o fragmentos de unión a antígeno con contenido de fucosa reducido.
Para la producción a largo plazo, de alto rendimiento de proteínas recombinantes, pueden generarse células de expresión estable. Por ejemplo, líneas celulares que expresan de manera estable un anticuerpo anti-GITR descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o los anticuerpos 1-107, o los anticuerpos pab2159, pab2160 o pab2161) o puede diseñarse un fragmento de unión a antígeno de estos. En realizaciones específicas, una célula proporcionada en la presente memoria expresa de manera estable una cadena ligera/un dominio variable de cadena ligera expresada y una cadena pesada/un dominio variable de cadena pesada que están asociadas para formar un anticuerpo descrito en la presente memoria (por ejemplo, un anticuerpo que comprende las CDR de cualquiera de los anticuerpos Hum231#1, Hum231#2, pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, 231-32-15 o anticuerpos 1-107, o anticuerpos pab2159, pab2160 o pab2161) o un fragmento de unión a antígeno de estos.
En ciertos aspectos, en lugar de usar vectores de expresión que contienen orígenes de replicación viral, las células huésped pueden transformarse con el ADN controlado mediante elementos de control de la expresión adecuados (por ejemplo, promotor, potenciador, secuencias, terminadores de la transcripción, sitios de poliadenilación, etc.) y un marcador seleccionable. Seguido de la introducción del ADN/polinucleótido exógeno, pueden dejarse crecer las células genéticamente manipuladas durante 1-2 días en un medio enriquecido y después se cambian a un medio selectivo. El marcador seleccionable del plásmido recombinante confiere resistencia a la selección y permite a las células integrar el plásmido de forma estable dentro de sus cromosomas y crecer para formar focos, que a su vez pueden clonarse y expandirse en líneas celulares. Este procedimiento puede usarse ventajosamente para diseñar líneas celulares que expresen un anticuerpo anti-GITR descrito en la presente memoria o un fragmento de este. Tales líneas celulares modificadas por ingeniería genética pueden ser particularmente útiles en el cribado y la evaluación de los compuestos que interactúan directamente o indirectamente con la molécula de anticuerpo.
Pueden usarse varios sistemas de selección, que incluyen, pero no se limitan a, la timidina quinasa del virus del herpes simple (Wigler M. y otros, (1977) Cell 11(1): 223-32), hipoxantina-guanina fosforribosiltransferasa (Szybalska EH y Szybalski W (1962) PNAS 48(12): 2026-2034), y adenina fosforribosiltransferasa (Lowy I y otros, (198o) Cell 22(3): 817-23), pueden emplearse genes en células tk-, hgprt- o aprt-, respectivamente. Además, la resistencia a los antimetabolitos puede usarse como base para la selección de los siguientes genes: dhfr, que confiere resistencia al metotrexato (Wigler M y otros, (1980) PNAS 77(6): 3567-70; O'Hare K y otros, (1981) PNAS 78: 1527-31); gpt, que confiere resistencia al ácido micofenólico (Mulligan RC y Berg P (1981) PNAS 78(4): 2072-6); neo, que confiere resistencia al aminoglucósido G-418 (Wu Gy y Wu CH (1991) Biotherapy 3: 87-95; Tolstoshev P (1993) Ann Rev Pharmacol Toxicol 32: 573-596; Mulligan RC (1993) Science 260: 926-932; y Morgan RA y Anderson WF (1993) Ann Rev Biochem 62: 191-217; Nabel GJ y Felgner PL (1993) Trends Biotechnol 11(5): 211-5); y hygro, que confiere
resistencia a la higromicina (Santerre RF y otros, (1984) Gene 30(1-3): 147-56). Los procedimientos comúnmente conocidos en la técnica de la tecnología de ADN recombinante pueden aplicarse de forma rutinaria para seleccionar el clon recombinante deseado y tales procedimientos se describen, por ejemplo, en Ausubel FM y otros, (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, Nueva York (1993); Kriegler M, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, Nueva York (1990); y en Capítulos 12 y 13, Dracopoli NC y otros, (eds.), Current Protocols in Human Genetics, John Wiley & Sons, Nueva York (1994); Colbére-Garapin F y otros, (1981) J Mol Biol 150: 1-14.
Los niveles de expresión de una molécula de anticuerpo pueden incrementarse mediante la amplificación del vector (para una revisión, ver Bebbington CR y Hentschel CCG, The use of vectors ebased on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol. 3 (Academic Press, Nueva York, 1987)). Cuando es amplificable un marcador del sistema vector que expresa el anticuerpo, el incremento del nivel de inhibidor presente en el cultivo de la célula huésped incrementará el número de copias del gen marcador. Dado que la región amplificada está asociada con el gen del anticuerpo, la producción del anticuerpo incrementará también (Crouse GF. y otros, (1983) Mol Cell Biol 3: 257-66).
La célula huésped puede cotransfectarse con dos o más vectores de expresión descritos en la presente memoria, el primer vector que codifica un polipéptido derivado de la cadena pesada y el segundo vector que codifica un polipéptido derivado de la cadena ligera. Los dos vectores pueden contener marcadores seleccionables idénticos, lo que permite la expresión por igual de polipéptidos de cadena pesada y ligera. Las células huésped pueden cotransfectarse con diferentes cantidades de los dos o más vectores de expresión. Por ejemplo, las células huésped pueden transfectarse con cualquiera de las siguientes proporciones de un primer vector de expresión y un segundo vector de expresión: 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:12, 1:15, 1:20, 1:25, 1:30, 1:35, 1:40, 1:45 o 1:50.
Alternativamente, puede usarse un solo vector que codifica y es capaz de expresar polipéptidos de cadena pesada y ligera. En tales situaciones, la cadena ligera debe situarse antes de la cadena pesada para evitar un exceso de cadena pesada libre de tóxico (Proudfoot NJ (1986) Nature 322: 562-565; y Kohler G (1980) PNAS 77: 2197-2199). Las secuencias codificantes para las cadenas pesada y ligera pueden comprender ADNc o ADN genómico. El vector de expresión puede ser monocistrónico o multicistrónico. Un constructo de ácido nucleico multicistrónico puede codificar 2, 3, 4, 5, 6, 7, 8, 9, 10 o más, o en el intervalo de 2-5, 5-10 o 10-20 genes/secuencias de nucleótidos. Por ejemplo, un constructo de ácido nucleico bicistrónico puede comprender en el siguiente orden un promotor, un primer gen (por ejemplo, cadena pesada de un anticuerpo descrito en la presente memoria), y un segundo gen y (por ejemplo, cadena ligera de un anticuerpo descrito en la presente memoria). En tal vector de expresión, la transcripción de ambos genes puede ser impulsada por el promotor, mientras que la traducción del ARNm del primer gen puede realizarse mediante un mecanismo de barrido dependiente de la tapa y la traducción del ARNm del segundo gen puede realizarse mediante un mecanismo independiente de la tapa, por ejemplo, mediante un IRES.
Una vez que se ha producido una molécula de anticuerpo descrita en la presente memoria mediante expresión recombinante, esta puede purificarse mediante cualquier procedimiento conocido en la técnica para la purificación de una molécula de inmunoglobulina, por ejemplo, mediante cromatografía (por ejemplo,, cromatografía de intercambio iónico, de afinidad, particularmente mediante la afinidad por el antígeno específico después de proteína A, y de exclusión por tamaño en columna), centrifugación, solubilidad diferencial, o mediante cualquier otra técnica estándar para la purificación de proteínas. Además, los anticuerpos descritos en la presente memoria pueden fusionarse a secuencias polipeptídicas heterólogas descritas en la presente memoria o conocidas de cualquier otra manera en la técnica para facilitar la purificación.
En realizaciones específicas, un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria se aísla o se purifica. En general, un anticuerpo aislado es uno que está sustancialmente libre de otros anticuerpos con especificidades antigénicas diferentes a la del anticuerpo aislado. Por ejemplo, en una realización particular, una preparación de un anticuerpo descrito en la presente memoria está sustancialmente libre de material celular y/o precursores químicos. El lenguaje “sustancialmente libre de material celular” incluye las preparaciones de un anticuerpo en las que el anticuerpo está separado de los componentes celulares de las células a partir de las cuales se aísla o se produce por vía recombinante. Por lo tanto, un anticuerpo que está sustancialmente libre de material celular incluye las preparaciones de anticuerpo que tienen menos de aproximadamente 30 %, 20 %, 10 %, 5 %, 2 %, 1 %, 0,5 %, o 0,1 % (en peso seco) de proteína heteróloga (también referida en la presente memoria como una “proteína contaminante”) y/o variantes de un anticuerpo, por ejemplo, diferentes formas modificadas postraduccionalmente de un anticuerpo u otra versión diferente de un anticuerpo (por ejemplo, fragmentos de anticuerpo). Cuando el anticuerpo se produce por vía recombinante, generalmente este también está sustancialmente libre de medio de cultivo, es decir, el medio de cultivo representa menos de aproximadamente 20 %, 10 %, 2 %, 1 %, 0,5 %, o 0,1 % del volumen de la preparación proteica. Cuando el anticuerpo se produce mediante síntesis química, este generalmente está sustancialmente libre de precursores químicos u otras sustancias químicas, es decir, está separado de precursores químicos u otras sustancias químicas que están implicadas en la síntesis de la proteína. En consecuencia, tales preparaciones del anticuerpo o fragmento tienen menos de aproximadamente 30 %, 20 %, 10 % o 5 % (en peso seco) de precursores químicos o compuestos diferentes al
anticuerpo de interés. En una realización específica, los anticuerpos descritos en la presente memoria se aíslan o se purifican.
5.3 Composiciones farmacéuticas
En la presente memoria se proporcionan composiciones que comprenden un anticuerpo o fragmentos de unión a antígeno de este descrito en la presente memoria que tiene el grado de pureza deseado en un portador, excipiente o estabilizador fisiológicamente aceptable (Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Easton, PA). Los portadores, excipientes, o estabilizadores aceptables son no tóxicos para los recipientes a las dosificaciones y concentraciones empleadas, e incluyen tampones tales como fosfato, citrato, y otros ácidos orgánicos; antioxidantes que incluyen ácido ascórbico y metionina; conservantes (tales como octadecildimetilbencil cloruro de amonio; cloruro de hexametonio; cloruro de benzalconio, cloruro de bencetonio; fenol, alcohol butílico o bencílico; alquil parabenos tales como metilo o propilparabén; catacol; resorcina; ciclohexanol; 3-pentanol; y mcresol); polipéptidos de bajo peso molecular (menos que aproximadamente 10 residuos); proteínas, tales como albúmina sérica, gelatina, o inmunoglobulinas; polímeros hidrófilos tales como polivinilpirrolidona; aminoácidos tales como glicina, glutamina, asparagina, histidina, arginina o lisina; monosacáridos, disacáridos, y otros carbohidratos que incluyen glucosa, manosa, o dextrinas; agentes quelantes tales como EDTA; azúcares tales como sacarosa, manitol, trehalosa o sorbitol; contraiones formadores de sal tales como sodio; complejos de metal {por ejemplo, complejos de Zn-proteína); y/o surfactantes no-iónicos tales como TWEEN™, PLURONICS™ o polietilenglicol (PEG).
En una realización específica, las composiciones farmacéuticas comprenden un anticuerpo de la invención y, opcionalmente, uno o más agentes profilácticos o terapéuticos adicionales, en un portador farmacéuticamente aceptable. En una realización específica, las composiciones farmacéuticas comprenden una cantidad efectiva de un anticuerpo de la invención y, opcionalmente, uno o más agentes profilácticos o terapéuticos adicionales, en un portador farmacéuticamente aceptable. Ver Sección 5.4, más abajo, para ejemplo de agentes profilácticos o terapéuticos. En algunas realizaciones, el anticuerpo es el único ingrediente activo que se incluye en la composición farmacéutica. Las composiciones farmacéuticas descritas en la presente memoria pueden ser útiles para potenciar, inducir, o activar una actividad de GITR y tratar una afección, tal como cáncer o una enfermedad infecciosa.
Los vehículos farmacéuticamente aceptables usados en preparaciones parenterales incluyen vehículos acuosos, vehículos no acuosos, agentes antimicrobianos, agentes isotónicos, tampones, antioxidantes, anestésicos locales, agentes de suspensión y dispersión, agentes emulsionantes, agentes secuestrantes o quelantes y otras sustancias farmacéuticamente aceptables. Los ejemplos de vehículos acuosos incluyen Inyección de Cloruro de Sodio, Inyección de Ringer, Inyección de Dextrosa Isotónica, Inyección de Agua Estéril, Inyección de Ringer Dextrosa y Lactato. Los vehículos parenterales no acuosos incluyen aceites fijos de origen vegetal, aceite de semilla de algodón, aceite de maíz, aceite de sésamo y aceite de cacahuete. Pueden añadirse agentes antimicrobianos en concentraciones bacteriostáticas o fungistáticas a preparaciones parenterales envasadas en recipientes de dosis múltiples que incluyen fenoles o cresoles, mercuriales, alcohol bencílico, clorobutanol, ésteres de ácido metil y propil p-hidroxibenzoico, timerosal, cloruro de benzalconio y cloruro de bencetonio. Los agentes isotónicos incluyen cloruro de sodio y dextrosa. Los tampones incluyen fosfato y citrato. Los antioxidantes incluyen bisulfato de sodio. Los anestésicos locales incluyen clorhidrato de procaína. Los agentes de suspensión y dispersión incluyen carboximetilcelulosa de sodio, hidroxipropilmetilcelulosa y polivinilpirrolidona. Los agentes emulsionantes incluyen Polysorbate 80 (TWEEN® 80). Un agente secuestrante o quelante de iones metálicos incluye EDTA. Los portadores farmacéuticos también incluyen alcohol etílico, polietilenglicol y propilenglicol para vehículos miscibles en agua; e hidróxido de sodio, ácido clorhídrico, ácido cítrico o ácido láctico para ajustar el pH.
Puede formularse una composición farmacéutica para cualquier vía de administración a un sujeto. Los ejemplos específicos de vías de administración incluyen intranasal, oral, pulmonar, transdérmica, intradérmica y parenteral. La administración parenteral, caracterizada por inyección subcutánea, intramuscular o intravenosa, también se contempla en la presente memoria. Las formulaciones inyectables pueden prepararse en formas convencionales como soluciones líquidas o suspensiones, formas sólidas adecuadas para solución o suspensión en el líquido antes de la inyección, o como emulsiones. Las soluciones y emulsiones inyectables también contienen uno o más excipientes. Los excipientes adecuados son, por ejemplo, agua, solución salina, dextrosa, glicerol o etanol. Además, si se desea, las composiciones farmacéuticas que se administran pueden contener además cantidades menores de sustancias auxiliares no tóxicas tales como agentes humectantes o emulsionantes, agentes amortiguadores del pH, estabilizantes, potenciadores de la solubilidad y otros agentes, tales como, por ejemplo, acetato de sodio, monolaurato de sorbitán, oleato de trietanolamina y ciclodextrinas.
Las preparaciones para la administración parenteral de un anticuerpo incluyen soluciones estériles listas para inyección, productos solubles secos estériles, tales como polvos liofilizados, listos para combinarse con un disolvente justo antes de su uso, que incluye tabletas hipodérmicas, suspensiones estériles listas para inyección, productos insolubles secos estériles listos para ser combinados con un vehículo justo antes de su uso y emulsiones estériles. Las soluciones pueden ser tanto acuosas como no acuosas.
Si se administra por vía intravenosa, los portadores adecuados incluyen solución salina fisiológica, solución salina tamponada con fosfato (PBS), y soluciones que contienen agentes espesantes y solubilizantes, tales como glucosa, polietilenglicol, polipropilenglicol y mezclas de estos.
Las mezclas tópicas que comprenden un anticuerpo se preparan como se describe para la administración local y sistémica. La mezcla resultante puede ser una solución, suspensión, emulsiones o similares y puede formularse como cremas, geles, ungüentos, emulsiones, soluciones, elíxires, lociones, suspensiones, tinturas, pastas, espumas, aerosoles, irrigaciones, pulverizaciones, supositorios, vendajes, parches dérmicos o cualquier otra formulación adecuada para la administración tópica.
Un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria puede formularse como un aerosol para aplicación tópica, tal como por inhalación (ver, por ejemplo, las patentes de Estados Unidos núms.
4,044,126, 4,414,209 y 4,364,923, que describen aerosoles para la administración de un esteroide útil para el tratamiento de enfermedades inflamatorias, particularmente asma). Estas formulaciones para administración en el tracto respiratorio pueden estar en forma de aerosol o solución para nebulizador, o como polvo microfino para insuflaciones, solo o en combinación con un portador inerte como lactosa. En tal caso, las partículas de la formulación, en un aspecto, tendrán diámetros de menos de 50 micrómetros, en un aspecto menos de 10 micrómetros.
Un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria puede formularse para aplicación local o tópica, como para aplicación tópica a la piel y membranas mucosas, tales como en el ojo, en forma de geles, cremas y lociones y para aplicación en el ojo o para aplicación intracisternal o intraespinal. Se contempla la administración tópica para la administración transdérmica y también para la administración a los ojos o mucosas, o para terapias de inhalación. También pueden administrarse soluciones nasales del anticuerpo solas o en combinación con otros excipientes farmacéuticamente aceptables.
Los parches transdérmicos, que incluye los dispositivos iontoforéticos y electroforéticos, son bien conocidos por los expertos en la técnica y pueden usarse para administrar un anticuerpo. Por ejemplo, tales parches se divulgan en las patentes de Estados Unidos núms. 6,267,983, 6,261,595, 6,256,533, 6,167,301, 6,024,975, 6,010715, 5,985,317, 5,983,134, 5,948,433 y 5,860,957.
En ciertas realizaciones, una composición farmacéutica que comprende un anticuerpo de la invención es un polvo liofilizado, que puede reconstituirse para su administración como soluciones, emulsiones y otras mezclas. También puede reconstituirse y formularse como sólidos o geles. El polvo liofilizado se prepara mediante la disolución de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria, o un derivado farmacéuticamente aceptable de este, en un disolvente adecuado. En algunas realizaciones, el polvo liofilizado es estéril. El disolvente puede contener un excipiente que mejore la estabilidad u otro componente farmacológico del polvo o solución reconstituida, preparada a partir del polvo. Los excipientes que pueden usarse incluyen, pero no se limitan a, dextrosa, sorbitol, fructosa, jarabe de maíz, xilitol, glicerina, glucosa, sacarosa u otro agente adecuado. El disolvente también puede contener un tampón, tal como citrato, fosfato de sodio o potasio u otro tampón conocido por los expertos en la técnica, en una realización, a aproximadamente un pH neutro. La subsiguiente filtración estéril de la solución seguida de liofilización en condiciones estándar conocidas por los expertos en la técnica proporciona la formulación deseada. En una realización, la solución resultante se distribuirá en viales para liofilización. Cada vial contendrá una dosis única o múltiples dosis del compuesto. El polvo liofilizado puede almacenarse en condiciones apropiadas, tales como entre 4 °C y temperatura ambiente.
La reconstitución de este polvo liofilizado con agua para inyección proporciona una formulación para su uso en administración parenteral. Para la reconstitución, el polvo liofilizado se agrega a agua estéril u otro portador adecuado. La cantidad precisa depende del compuesto seleccionado. Esta cantidad puede determinarse empíricamente.
Los anticuerpos o fragmentos de unión a antígeno de estos descritos en la presente memoria y otras composiciones proporcionadas en la presente memoria también pueden formularse para dirigirse a un tejido, receptor u otra área particular del cuerpo del sujeto a tratar. Muchos de estos procedimientos de direccionamiento son bien conocidos por los expertos en la técnica. Todos estos procedimientos de direccionamiento se contemplan en la presente memoria para su uso en las presentes composiciones. Para ejemplos no limitantes de procedimientos de direccionamiento, ver, por ejemplo, las Patentes de Estados Unidos núms. 6,316,652, 6,274,552, 6,271,359, 6,253,872, 6,139,865, 6,131,570, 6,120,751, 6,071,495, 6,060,082, 6,048,736, 6,039,975, 6,004,534, 5,985,307, 5,972,366, 5,900,252, 5,840,674, 5,759,542 y 5,709,874. En un aspecto específico, un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria se dirige a un tumor.
Las composiciones a usar para la administración in vivo pueden ser estériles. Esto se realiza fácilmente, por ejemplo, mediante la filtración a través de membranas de filtración estériles.
5.4 Usos y procedimientos
5.4.1 Usos y procedimientos terapéuticos
En un aspecto, en la presente memoria se presentan los procedimientos para modular una o más funciones o respuestas inmunitarias en un sujeto, que comprenden administrar a un sujeto que lo necesita un anticuerpo anti-GITR o fragmento de unión a antígeno de este descrito en la presente memoria, o una composición de este. En una divulgación específica, en la presente memoria se presentan los procedimientos para activar, potenciar o inducir una o más funciones o respuestas inmunitarias en un sujeto, que comprenden administrar a un sujeto que lo necesita un anticuerpo anti-GITR o fragmento de unión a antígeno de este, o una composición de este. En una divulgación específica, en la presente memoria se presentan procedimientos para evitar y/o tratar enfermedades en las que es conveniente activar o potenciar una o más funciones o respuestas inmunitarias, que comprenden administrar a un sujeto que lo necesita un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria o una composición de este. En otra divulgación específica, el procedimiento comprende una terapia de combinación, en la que el anticuerpo anti-GITR o un fragmento de unión a antígeno de este se administra a un sujeto en combinación con otra terapia, tales como las descritas más abajo, para activar o potenciar una o más funciones inmunes o respuestas. En una divulgación determinada, el anticuerpo anti-GITR o un fragmento de unión a antígeno de este se administra como adyuvante en combinación con una composición antigénica. En ciertos aspectos, la composición antigénica comprende un antígeno canceroso o tumoral (por ejemplo, el antígeno bcr/abl en la leucemia, los antígenos HPVE6 y E7 del virus oncogénico asociado con el cáncer de cuello uterino, los antígenos MAGE1 y MZ2-E en o asociados con el melanoma, o los antígenos MVC-1 y HER-2 en o asociados con el cáncer de mama). En algunos aspectos, la composición antigénica comprende un antígeno derivado de un patógeno (por ejemplo, un antígeno viral, antígeno parasitario, antígeno bacteriano o antígeno fúngico). Los ejemplos de antígenos virales incluyen la nucleoproteína (NP) del virus de la influenza, los antígenos del VIH (por ejemplo, proteínas gag del VIH, proteína env del VIH (por ejemplo, gp120 y/o gp41), proteína Nef del VIH, proteínas Pol del VIH, transcriptasa inversa del VIH o proteasa del VIH), antígenos del virus del Ébola (EBOV) (por ejemplo, Antígenos de la viruela, antígenos del virus de la hepatitis A, B o C, antígenos del rinovirus humano, antígenos del virus del herpes simple, antígenos del poliovirus, antígenos del virus de la fiebre aftosa (FMDV), antígenos del virus de la rabia, antígenos del rotavirus, antígenos del virus coxsackie y antígenos del virus del papiloma humano (VPH). Los ejemplos de antígenos bacterianos incluyen Bordetella pertussis (por ejemplo, proteína P69 y antígenos de hemaglutinina filamentosa (FHA)), Vibrio cholerae, Bacillus anthracis, y E. coli antígenos de E. coli tal como la subunidad B de la toxina Lábil al calor (LT-B), antígenos K88 de E. coli y antígenos enterotoxigénicos de E. coli.
Como se usa en la presente memoria, el término "en combinación" se refiere al uso de más de una terapia (por ejemplo, un agente profiláctico y/o terapéutico). El uso del término "en combinación" no restringe el orden en el que se administran las terapias a un sujeto con una enfermedad o trastorno, o la vía de administración. Una primera terapia (por ejemplo, un agente profiláctico o terapéutico) puede administrarse antes de (por ejemplo, 5 minutos, 15 minutos, 30 minutos, 45 minutos, 1 hora, 2 horas, 4 horas, 6 horas, 12 horas, 24 horas, 48 horas, 72 horas, 96 horas, 1 semana, 2 semanas, 3 semanas, 4 semanas, 5 semanas, 6 semanas, 8 semanas o 12 semanas antes), concomitantemente con, o subsecuentemente a (por ejemplo, 5 minutos, 15 minutos, 30 minutos, 45 minutos, 1 hora, 2 horas, 4 horas, 6 horas, 12 horas, 24 horas, 48 horas, 72 horas, 96 horas, 1 semana, 2 semanas, 3 semanas, 4 semanas, 5 semanas, 6 semanas, 8 semanas, o 12 semanas después) la administración de una segunda terapia (por ejemplo, un agente profiláctico o terapéutico) a un sujeto con una enfermedad o trastorno o un síntoma de esta. En una divulgación determinada, una terapia (por ejemplo, un agente) administrado en combinación con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este a un sujeto se administra en la misma composición (por ejemplo, composición farmacéutica). En otra divulgación, una terapia (por ejemplo, un agente) administrado en combinación con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este se administra a un sujeto en una composición diferente (por ejemplo, dos o más composiciones farmacéuticas). Las dos composiciones pueden administrarse al mismo tiempo o en momentos diferentes y/o mediante la misma o diferentes vías de administración. En una divulgación particular, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria se administra a un sujeto en combinación con una composición de vacuna para inducir, activar o mejorar la respuesta inmunitaria provocada por la composición de vacuna. En un aspecto, la composición de la vacuna es una vacuna contra el cáncer. Una vacuna contra el cáncer es un agente, molécula o inmunógeno que estimula o provoca una respuesta inmunitaria endógena en un individuo o sujeto contra uno o más antígenos del cáncer. El antígeno del cáncer puede ser un péptido asociado a un tumor, o una proteína que induce o potencia la respuesta inmunitaria y se deriva a partir de genes asociados a un tumor y codifica proteínas que incluyen, por ejemplo, MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-A10, MAGE-A11, MAGE-A12, MAGE-A13, GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, BAGE-1, RAGE-1, LB33/MUM-1, PRAME, NAG, MAGE-Xp2 (MAGE-B2), MAGEXp3 (MAGE-B3), MAGE-Xp4 (AGE-B4), tirosinasa, fosforilasa de glicógeno cerebral, Melan-A, MAGE-C1, m Ag E-C2, NY-ESO-1, LAGE-1, SSX-1, SSX-2(HOM-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1, CT-7, alfa-actinina-4, proteína de fusión Bcr-Abl, Casp-8, beta-catenina, cdc27, cdk4, cdkn2a, coa-1, proteína de fusión dek-can, EF2, proteína de fusión ETV6-AML1, proteína de fusión LDLR-fucosiltransferasa, HLA-A2, HLA-A11, hsp70-2, KIAAO205, Mart2, Mum-2, and 3, neo-PAP, miosina de la clase I, OS-9, proteína de fusión pml-RARa, PTPRK, K-ras, N-ras, isomerasa triosafosfato, GnTV, Herv-K-mel, Lage-1, Mage-C2, NA-88, /Lage-2, SP17, y TRP2-Int2, (MART-I), gp100 (Pmel 17), TRP-1, TRP-2, MAGE-1, MAGE-3, p15(58), CEA, NY-ESO (LAGE), SCP-1, Hom/Mel-40, p53, H-Ras, HER-2/neu, BCR-ABL, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, antígenos del virus de Epstein Barr, EBNA, antígenos E6 y E7 del virus del papiloma humano (HPV), TSP-180, MAGE-4, MAGE-5, MAGE-6, p185erbB2, p180erbB-3, c-met, nm
23H1, PSA, TAG-72-4, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, beta-catenina, CDK4, Mum-1, p16, TAGE, PSMA, PSCA, CT7, telomerase, 43-9F, 5T4, 791Tgp72, alfa-fetoproteína, 13HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29\BCAA), CA 195, CA 242, CA-50, CAM43, CD68\KP1, CO-029, FGF-5, G250, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB\170K, NYCO-1, RCAS1, SDCCAG16, TA-90 (proteína de unión Mac-2\proteína asociada a la ciclofilina C), TAAL6, TAG72, TLP y TPS. Las vacunas contra el cáncer son útiles tanto para aumentar el reconocimiento de las células cancerígenas por parte del sistema inmunológico como para mejorar la respuesta antitumoral mediante la activación de los linfocitos. Las células T efectoras se han generado con éxito mediante inmunización con células tumorales intactas o extracto, antígenos purificados, uso de péptidos optimizados para unirse tanto a MHC como a TcR, péptidos inmunodominantes, ADN que codifica antígenos tumorales, virus recombinantes que codifican antígenos tumorales o antígenos pulsados por células presentadoras de antígenos. En algún aspecto, la potenciación del reconocimiento inmunológico y la expansión celular puede mejorarse mediante el uso de coestimuladores y citoquinas, inyección de vectores para expresar citoquinas, células dendríticas autólogas activadas y pulsadas por antígeno in vitro y mediante el bloqueo de moduladores negativos (por ejemplo, mediante el uso agentes de control de puntos de control inmunes) y el agotamiento de las células T reguladoras.
En un aspecto específico, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria se administra a un sujeto en combinación con una vacuna tumoral basada en proteínas de choque térmico o una vacuna patógena basada en proteínas de choque térmico. Ver las Secciones 5.4.1.1 y 5.4.1.2 más abajo con respecto a las vacunas tumorales basadas en proteínas de choque térmico o vacunas patógenas basadas en proteínas de choque térmico para su uso en combinación con un anticuerpo anti-GITR o fragmento de unión a antígeno de este descrito en la presente memoria.
En un aspecto particular, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria se administra en combinación con un adyuvante para inducir, activar o potenciar los efectos agonistas del anticuerpo anti-GITR. Pueden usarse varios adyuvantes en función del contexto del tratamiento. Los ejemplos no limitantes de adyuvantes apropiados incluyen, por ejemplo, adyuvante completo de Freund (CFA), adyuvante incompleto de Freund (IFA), motanida ISA (adyuvante séptico incompleto), el sistema adyuvante Ribi (RAS), Titer Max, péptidos de muramilo, adyuvante Syntex Formulación (SAF), alumbre (hidróxido de aluminio y/o fosfato de aluminio), adyuvantes de sal de aluminio, adyuvantes Gerbu®, antígeno absorbido por nitrocelulosa, antígeno encapsulado o atrapado, complejos inmunoestimulantes como saponinas, Quil A, QS-21 y otros. Otros adyuvantes incluyen oligonucleótidos CpG y moléculas de ARN de doble cadena, tales como poli(A), poli(U). También pueden usarse combinaciones de los adyuvantes anteriores. En algunas realizaciones, uno o más adyuvantes son una saponina, tal como QS-21, QS-21 y monofosforil lípido A 3 De-O-acilado (3 D-MPL) y oligonucleótidos inmunoestimuladores y adyuvantes de saponina como se describe en las patentes de Estados Unidos núms. 6,645,495; 7,029,678 y 7,858,589, respectivamente.
En ciertos aspectos, en la presente memoria se proporcionan procedimientos para mejorar la estimulación de las células que responden al GITR (por ejemplo, células T, tales como células T efectoras) que comprenden incubar las células que responden al GITR ex vivo (por ejemplo, células T) con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En algunos aspectos, las células que responden al GITR se incuban con un agente estimulante (por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulante del complejo TCR, como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) antes de, simultáneamente con o después de la incubación con el anticuerpo anti-GITR o fragmento de unión a antígeno de este. En ciertos aspectos, las células que responden al GITR (por ejemplo, células T) se aislaron de un sujeto (por ejemplo, un humano). En alguna divulgación, las células que responden al GITR después de la estimulación con el anticuerpo anti-GITR o un fragmento de unión a antígeno de este se administran a un sujeto (por ejemplo, un humano). Las células que responden al GITR (por ejemplo, células T) pueden administrarse al mismo sujeto o a un sujeto diferente del que se aislaron originalmente las células.
En algunos aspectos, en la presente memoria se proporcionan procedimientos para activar las células que responden al GITR (por ejemplo, células T) que comprenden incubar las células que responden al GITR (por ejemplo, células T) con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En ciertos aspectos, las células que responden al GITR se incuban con un agente estimulante (por ejemplo, un agente estimulante ligado con un receptor de células T tales como, por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulante del complejo TCR, como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) antes de, simultáneamente con o después de la incubación con el anticuerpo anti-GITR o fragmento de unión a antígeno de este. En algunos aspectos, las células que responden al GITR (por ejemplo, células T) se aislaron de un sujeto (por ejemplo, un humano). En ciertos aspectos, las células que responden al GITR después de la activación con el anticuerpo anti-GITR o un fragmento de unión a antígeno de este se administran a un sujeto (por ejemplo, un humano). Las células que responden al GITR (por ejemplo, células T) pueden administrarse al mismo sujeto o a un sujeto diferente del que se aislaron originalmente las células.
En alguna divulgación, las células que responden al GITR (es decir, células sensibles al GITR) se incuban en cultivo celular con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria, y se administran a un sujeto para mejorar la función inmunológica (por ejemplo, para mejorar la expansión/proliferación de células que responden al GITR, como las células T, y/o mejorar la función efectora de las
células T) y/o para tratar el cáncer y/o prevenir o tratar una enfermedad infecciosa. Los ejemplos de cánceres y enfermedades infecciosas se proporcionan en la presente memoria. Ver, por ejemplo, Ejemplo 7 más abajo para los procedimientos ilustrativos. En realizaciones específicas, las células que responden al G itR son células T efectoras (por ejemplo, CD4+ y CD8+). En algunos aspectos, las células que responden al GITR se aíslan de un sujeto. En algunos aspectos, las células que responden al GITR se evalúan para la expresión de GITR antes de la incubación con un anticuerpo anti-GITR o fragmento de unión a antígeno de este descrito en la presente memoria. En ciertos aspectos, las células que responden al GITR se incuban con un mitógeno (por ejemplo, un mitógeno de células T tales como, por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulante del complejo TCR, como un anticuerpo anti-CD3 y un anticuerpo anti-CD28) antes de, simultáneamente con o después de la incubación con un anticuerpo anti-GITR o fragmento de unión a antígeno de este descrito en la presente memoria. Las células que responden al GITR pueden incubarse con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria durante, por ejemplo, 5 minutos, 10 minutos, 15 minutos, 30 minutos, 45 minutos, 1 hora, 2 horas, 3 horas, 4 horas, 5 horas, 6 horas, 8 horas, 12 horas, 18 horas, 24 horas o más. En una divulgación determinada, las células que responden al GITR que se administran a un sujeto se derivaron del sujeto (es decir, las células que responden al GITR son autólogas). En otra divulgación, las células que responden al GITR que se administran a un sujeto se derivaron de un sujeto diferente. Las células que responden al GITR después de la incubación con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este pueden administrarse local o sistémicamente a un sujeto a través de cualquier ruta conocida por un experto en la técnica (por ejemplo, administración parenteral, tal como administración subcutánea, intravenosa o intramuscular, o administración intratumoral). En ciertos aspectos, una dosis adecuada de células que responden al GITR después de la incubación con anticuerpo anti-GITR o un fragmento de unión a antígeno de este administrado al sujeto puede ser de al menos 100, 200, 300, 400, 500, 700, 1.000, 5.000, 10.000, 25.000, 50.000, 100.000, 1 x 106, 1 x 107 o 1 x 108 células. Las células que responden al GITR después de la incubación con anticuerpo anti-GITR o fragmento de unión a antígeno de este pueden administrarse 1, 2, 3, 4, 5, 6, 7, 8 o más veces. La frecuencia y dosis de las células que responden al GITR después de la incubación con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este que se administra a un sujeto variará en función de varios factores, que incluyen, por ejemplo, la condición del paciente. En otra divulgación, en la presente memoria se proporciona un procedimiento para mejorar la expansión de las células T (por ejemplo, linfocitos T CD4+ y/o CD8+) en un sujeto, que comprende administrar al sujeto una cantidad efectiva de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria, o una composición farmacéutica descrita en la presente memoria. En otra divulgación, en la presente memoria se proporciona un procedimiento para mejorar la expansión de las células T CD8+ en un sujeto, que comprende administrar al sujeto una cantidad efectiva de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria, o una composición farmacéutica descrita en la presente memoria. En otra divulgación, en la presente memoria se proporciona un procedimiento para mejorar la expansión de las células T CD4+ en un sujeto, que comprende administrar al sujeto una cantidad efectiva de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria, o una composición farmacéutica descrita en la presente memoria. En un aspecto específico, el sujeto es humano.
En otra divulgación, en la presente memoria se proporciona un procedimiento para mejorar la expansión de las células T (por ejemplo, linfocitos T CD4+ y/o c D8+) y/o la función efectora en las células T en un sujeto, que comprende administrar al sujeto una cantidad efectiva de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria, o una composición farmacéutica descrita en la presente memoria. En otra divulgación, en la presente memoria se proporciona un procedimiento para mejorar la expansión de las células T CD8+ y/o la función efectora de las células T en un sujeto, que comprende administrar al sujeto una cantidad efectiva de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria, o una composición farmacéutica descrita en la presente memoria. En otra divulgación, en la presente memoria se proporciona un procedimiento para mejorar la expansión de las células T CD4+ y/o la función efectora de las células T en un sujeto, que comprende administrar al sujeto una cantidad efectiva de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria, o una composición farmacéutica descrita en la presente memoria. En un aspecto específico, el sujeto es humano.
En otro aspecto, en la presente memoria se proporciona un procedimiento para la expansión preferencial de las células T efectoras sobre la expansión de las células T reguladoras, que comprende incubar células T ex vivo con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En ciertos aspectos, el anticuerpo anti-GITR o el fragmento de unión a antígeno de este expande las células T efectoras sobre las células T reguladoras en un 10 %, 15 %, 20 %, 25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 % o más. En algunos aspectos, el anticuerpo anti-GITR o el fragmento de unión a antígeno de este expande las células T efectoras sobre las células T reguladoras de 10 % a 20 %, de 15 % a 25 %, de 25 % a 50 %, de 30 % a 60 %, de 50 % a 75 % o de 65 % a 85 %. Las células T efectoras y las células T reguladoras pueden distinguirse entre sí mediante marcadores de superficie celular, como los divulgados en los ejemplos más abajo. En algunos aspectos, las células T se aislaron de un sujeto (por ejemplo, un humano). En una divulgación determinada, las células T después de la expansión se administran a un sujeto (por ejemplo, un humano).
En otra divulgación, en la presente memoria se proporciona un procedimiento para la expansión preferencial de las células T efectoras sobre la expansión de las células T reguladoras en un sujeto, que comprende administrar al sujeto una cantidad efectiva de un anticuerpo o fragmento de unión a antígeno de este descrito en la presente
memoria, o una composición de esta. En una divulgación determinada, el anticuerpo anti-GITR o el fragmento de unión a antígeno de este expande las células T efectoras sobre las células T reguladoras en un 10 %, 15 %, 20 %,
25 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 %, 60 %, 65 %, 70 %, 75 %, 80 % o más. En algunas divulgaciones, el anticuerpo anti-GITR o el fragmento de unión a antígeno de este expande las células T efectoras sobre las células T reguladoras de 10 % a 20 %, de 15 % a 25 %, de 25 % a 50 %, de 30 % a 60 %, de 50 % a 75 % o de 65 % a 85 %.
Las células T efectoras y las células T reguladoras pueden distinguirse entre sí mediante marcadores de superficie celular y/o marcadores intracelulares, como los divulgados en los ejemplos más abajo. En un aspecto específico, el sujeto es humano.
En ciertas realizaciones, el tratamiento de un sujeto con un anticuerpo anti-GITR o un fragmento de unión a antígeno descrito en la presente memoria, o una composición de este, logra uno, dos, tres, cuatro o más de los siguientes efectos: (i) reducción o mejora de la gravedad de una enfermedad o síntoma asociado con la misma; (ii) reducción de la duración de un síntoma asociado con una enfermedad; (iii) inhibición de la progresión de una enfermedad o síntoma asociado con la misma; (iv) regresión de una enfermedad o síntoma asociado con la misma; (v) prevención del desarrollo o aparición de un síntoma asociado con una enfermedad que está presente en el paciente; (vi) inhibición de la recurrencia de un síntoma asociado con una enfermedad; (vii) reducción de la hospitalización de un sujeto; (viii) reducción de la duración de la hospitalización; (ix) un aumento en la supervivencia de un sujeto con una enfermedad; (x) una reducción en el número de síntomas asociados con una enfermedad y (xi) un aumento, mejora, suplementación, complementación o aumento de los efectos terapéuticos de otra terapia. En un aspecto alternativo, se usa un anticuerpo anti-GITR o un fragmento de unión a antígeno de este para prevenir un trastorno, tal como una enfermedad infecciosa.
En alguna divulgación, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este, o una composición de este, se administra a un sujeto en combinación con un agente inmunoterapéutico. Los agentes inmunoterapéuticos para su uso en las terapias de combinación divulgadas en la presente memoria incluyen, pero no se limitan a, un anticuerpo del receptor Her2/neu como trastuzumab (comercializado como Herceptin®), un anticuerpo anti-CD52 tal como alemtuzumab (comercializado como Campath®. MabCampath® o Campath-1H), un anticuerpo anti-CD33 tal como gemtuzumab unido a caliqueamicina (comercializado como Mylotarg®), un anticuerpo anti-CD20 tal como rituximab (comercializado como Rituxan® y MabThera®), Ibritumomab tiuxetan (comercializado como Zevalin®), anticuerpos anti-TNFa tal como infliximab (comercializado como Remicade®) o adalimmumab (comercializado como Humira®), una molécula TNFR2 soluble como etanercept (comercializada como Enbrel®), un anticuerpo contra la cadena CD25 del receptor de IL-2 como como basiliximab (comercializado como Simulect®), un anticuerpo anti-CD40/CD40L tal como el anticuerpo humano anti-CD40 IgG1 (SGN-40), agonistas del receptor de tipo Toll como monofosforil lípido A (MPL®), CpG, ARN monocatenario, nucleótidos, análogo de nucleótido, CL087 (un ligando específico de TLR7), loxoribina, polinosina policitidílico ácido, flagelina, resiquimod, immiquimod, gardiquimod, ligandos NOD como muramil dipéptido, murabutida, peptidoglicano y muramildipeptido, agonistas de CD1d, como agalactosil ceramida (a-GalCer) y treitol ceramida (un anticuerpo como ThrCer) (GC1008), un anticuerpo que se dirige a una inhibición de las isoformas 1, 2 o 3 de TGF-beta, una fusión de Fc, Dalantercept (Alk-Fc) y la molécula pequeña LY2157299 (inhibidor de la quinasa del receptor).
Las enfermedades que pueden tratarse mediante una mejora de la función inmunológica incluyen el cáncer y las enfermedades infecciosas. Más abajo se describen varios cánceres y enfermedades infecciosas. En un aspecto específico, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria puede usarse para tratar una afección asociada con el cáncer o una afección resultante de la administración de una terapia contra el cáncer (como, por ejemplo, quimioterapia o radiación). En un aspecto particular, puede usarse un anticuerpo anti-GITR o un fragmento de unión a antígeno de este para tratar o controlar la linfocitopenia. En otra divulgación, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este se administra a un paciente diagnosticado con cáncer para aumentar la proliferación y/o la función efectora de una o más poblaciones de células inmunitarias (por ejemplo, células efectoras de células T, tales como células T CD4+ y CD8+) en el paciente.
En una realización específica, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria activa o induce una o más funciones o respuestas inmunitarias en un sujeto en al menos 99 %, al menos 98 %, al menos 95 %, al menos 90 %, al menos 85 %, al menos 80 %, al menos 75 %, al menos 70 %, menos 60 %, al menos 50 %, al menos 45 %, al menos 40 %, al menos 45 %, al menos 35 %, al menos 30 %, menos 25 %, al menos 20 %, o al menos 10%, o en el intervalo de entre 10 % a 25 %, 25 % a 50 %, 50 % a 75 %, o 75 % a 95 % con relación a la función inmunitaria en un sujeto al que no se le administra el anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria mediante el uso de ensayos bien conocidos en la técnica, por ejemplo, ELISPOT, ELISA, y los ensayos de proliferación celular. En una realización específica, la función inmunitaria es la producción de citocinas (por ejemplo, interferón-gamma, IL-2, IL-5, IL-10, IL-12 o producción de factor de crecimiento transformante (TGF)alfa). En otra realización, la función inmunitaria es la proliferación/expansión de células T, que puede analizarse, por ejemplo, mediante citometría de flujo para detectar el número de células que expresan marcadores de células T (por ejemplo, CD3, CD4, o CD8). En otra realización, la función inmunitaria es la producción de anticuerpos, que puede analizarse, por ejemplo, mediante ELISA. En algunas realizaciones, la función inmunitaria es la función efectora, que puede analizarse, por ejemplo, mediante un ensayo de citotoxicidad u otros ensayos bien conocidos en la técnica. En otra realización, la función inmunitaria es
una respuesta Th1. En otra realización, la función inmunitaria es una respuesta Th2. En otra realización, la función inmunitaria es una respuesta de memoria.
En realizaciones específicas, los ejemplos no limitantes de funciones inmunitarias que pueden potenciarse o inducirse por un anticuerpo anti-GITR o un fragmento de unión a antígeno de este son la proliferación/expansión de linfocitos efectores (por ejemplo, aumento del número de linfocitos T efectores), y la inhibición de la apoptosis de linfocitos efectores (por ejemplo, linfocitos T efectores) y supresión de Tregs. En realizaciones particulares, una función inmunitaria potenciada o inducida por un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria es la proliferación/expansión en el número de o la activación de células T CD4+ (por ejemplo, células T auxiliares Th1 y Th2), células CD8+ T (por ejemplo, linfocitos T citotóxicos, células T alfa/beta y células T gamma/delta), células B (por ejemplo, células plasmáticas), células T de memoria, células B de memoria, células T residentes de tumor, células T CD122+, células asesinas naturales (NK)), macrófagos, monocitos, células dendríticas, mastocitos, eosinófilos, basófilos o leucocitos polimorfonucleados. En una realización, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria activa o mejora la proliferación/expansión o el número de progenitores de linfocitos. En algunas realizaciones, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria aumenta el número de células T CD4+ (por ejemplo, células T auxiliares Th1 y Th2), células T CD8+ (por ejemplo, linfocitos T citotóxicos, células T alfa/beta, y células T gamma/delta), células B (por ejemplo, células plasmáticas), células T de memoria, células B de memoria, células T residentes de tumor, células T CD122+, células asesinas naturales (células NK), macrófagos, monocitos, células dendríticas, mastocitos, eosinófilos, basófilos o leucocitos polimorfonucleados en aproximadamente al menos 99 %, al menos 98 %, al menos 95 %, al menos 90 %, al menos 85 %, al menos 80 %, al menos 75 %, al menos 70 %, al menos 60 %, al menos 50 %, al menos 45 %, al menos 40 %, al menos 45 %, al menos 35 %, al menos 30 %, al menos 25 %, al menos 20 %, o al menos 10 %, o en el intervalo de entre 10 % a 25 %, 25 % a 50 %, 50 % a 75 %, o 75 % a 95 % con relación a un control negativo (por ejemplo, número de las células respectivas no tratadas, cultivadas, o en contacto con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria).
En realizaciones particulares, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce, activa o mejora una actividad del GITR humano independientemente de la activación del TCR. En realizaciones específicas, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente a GITR (por ejemplo, GITR humano), induce, activa o mejora una actividad de NF-kB independiente de la activación de TCR. En ciertas realizaciones, la actividad de NF-kB puede evaluarse en, por ejemplo, un ensayo que comprende las siguientes etapas: (a) incubación de células T (por ejemplo, células Jurkat) que expresan un constructo reportero de NF-KB-luciferasa (por ejemplo, constructo GloResponse NF-KB-luc2P) y GITR (por ejemplo, GITR humano) con el anticuerpo descrito en la presente memoria o un anticuerpo de control de isotipo a una concentración de anticuerpo de, por ejemplo, 12,5, 10, 5, 2,5, 1,25 o 0,625 pg/ml, en ausencia de un anticuerpo anti-CD3; y (b) leer la señal de luciferasa después, por ejemplo, 2, 5, 6, 8 o 18 horas de incubación mediante el uso, por ejemplo, de un lector 2.100 de múltiples etiquetas EnVision, en el que una señal de luciferasa positiva en relación con el anticuerpo de control de isotipo indica la actividad de NP-kB. En una realización particular, la señal de luciferasa se lee después de 5 horas de incubación.
En otro aspecto, en la presente memoria se proporciona un procedimiento para activar las células T independientemente de la activación del TCR que comprende poner en contacto las células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En aspectos particulares, en la presente memoria se proporciona un procedimiento para inducir, activar o potenciar una actividad de NF-kB independiente de la activación de TCR que comprende poner en contacto células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. En ciertos aspectos, la actividad de NF-kB puede evaluarse en, por ejemplo, un ensayo que comprende las siguientes etapas: (a) incubación de células T (por ejemplo, células Jurkat) que expresan un constructo reportero de NP-KB-luciferasa (por ejemplo, constructo GloResponse NF-kB-luc2P) y GITR (por ejemplo, GITR humano) con el anticuerpo descrito en la presente memoria o un anticuerpo de control de isotipo a una concentración de anticuerpo de, por ejemplo, 12,5, 10, 5, 2,5, 1,25 o 0,625 pg/ml, en ausencia de un anticuerpo anti-CD3; y (b) leer la señal de luciferasa después, por ejemplo, 2, 5, 6, 8 o 18 horas de incubación mediante el uso, por ejemplo, de un lector 2.100 de múltiples etiquetas EnVision, en el que una señal de luciferasa positiva en relación con el anticuerpo de control de isotipo indica la actividad de NF-kB. En un aspecto particular, la señal de luciferasa se lee después de 5 horas de incubación.
En aspectos particulares, en la presente memoria se proporciona un procedimiento para aumentar el porcentaje de células T polifuncionales (IFNy+ TNPa+) que comprenden poner en contacto células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. Puede evaluarse un aumento en el porcentaje de células T polifuncionales (IFNy+ TNPa+) en, por ejemplo, un ensayo que comprende las siguientes etapas: (a) incubación, por ejemplo, PBMC humanas con, por ejemplo, un anticuerpo anti-CD3 en varias concentraciones subóptimas (por ejemplo, 0,3-5 pg/ml); y, por ejemplo, un anticuerpo descrito en la presente memoria, que se une inmunoespecíficamente al GITR (por ejemplo, GITR humano), en, por ejemplo, 5 pg/ml o un anticuerpo de control de isotipo, para, por ejemplo, 3-4 días a 37 °C y CO2 al 5 %; (b) tratar células con, por ejemplo, Brefeldin A para, por ejemplo, 6 horas a 37 °C y CO2 al 5 %; (c) teñir la superficie de las células mediante el uso, por ejemplo, un anticuerpo anti-CD3, un anticuerpo anti-CD4 y un anticuerpo anti-CD8a; (d) tinción intracelular mediante
el uso, por ejemplo, de un anticuerpo anti-IFNy y un anticuerpo anti-TNFa; y (e) determinar el porcentaje de células T polifuncionales (IFNy+ TNPa+) con respecto al anticuerpo de control de isotipo. En aspectos específicos, las células T polifuncionales (IFNy+ TNPa+) son seleccionadas del grupo que consiste en células T CD4+ polifuncionales (IFNy+ TNPa+) y células T CD8+ polifuncionales (IFNy+ TNPa+).
En aspectos particulares, en la presente memoria se proporciona un procedimiento para aumentar la expresión superficial de OX40 y PD-1 en células T activadas que comprende poner en contacto células T con un anticuerpo o fragmento de unión a antígeno de este descrito en la presente memoria. La expresión superficial de OX40 y PD-1 en células T activadas puede incrementarse al menos aproximadamente 1,2 veces, 1,3 veces, 1,4 veces, 1,5 veces, 2 veces, 2,5 veces, 3 veces, 3,5 veces, 4 veces, 4,5 veces, 5 veces, 6 veces, 7 veces, 8 veces, 9 veces, 10 veces, 15 veces, 20 veces, 30 veces, 40 veces, 50 veces, 60 veces, 70 veces, 80 veces, 90 veces, 100 veces, 200 veces, 300 veces, 400 veces, 500 veces, 600 veces, 700 veces, 800 veces, 900 veces o 1.000 veces según se evalúa mediante los procedimientos descritos en la presente memoria y/o conocidos por un experto en la técnica, en relación con la expresión superficial de OX40 y PD-1 en células T activadas sin el anticuerpo descrito en la presente memoria.
5.4.1.1 Cáncer
En un aspecto específico, en la presente memoria se presentan procedimientos para tratar el cáncer, que comprenden administrar a un sujeto que lo necesite una cantidad efectiva de un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria o una composición de este. En una realización, la presente invención se refiere a un anticuerpo de la invención, o una composición farmacéutica de la invención, para su uso en el tratamiento del cáncer. En una realización específica, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria o una composición de este es el único agente activo administrado a un sujeto.
El efecto de un anticuerpo anti-GITR o de un fragmento de unión a antígeno de este descrito en la presente memoria sobre la proliferación de células cancerígenas puede detectarse mediante ensayos de rutina, tales como ensayos que miden la captación de timidina radiomarcada. Alternativamente, la viabilidad celular puede medirse mediante ensayos que miden la lactato deshidrogenasa (LDH), una enzima citosólica estable que se libera tras la lisis celular, o mediante la liberación de [51Cr] tras la lisis celular. En un aspecto, la necrosis medida por la capacidad o incapacidad de una célula para absorber un tinte como rojo neutro, azul tripán o azul ALAMAR™ (Page B y otros, (1993) Intl J Oncology 3: 473-6). En tal ensayo, las células se incuban en un medio que contiene el tinte, las células se lavan y el tinte restante, que refleja la captación celular del tinte, se mide mediante espectrofotometría.
En otro aspecto, el colorante es sulforrodamina B (SRB), cuya unión a proteínas puede usarse como medida de citotoxicidad (Skehan P y otros, (1990) J Nat Cancer Inst 82: 1107-12). En aún otro aspecto, una sal de tetrazolio, tal como MTT, se usa en un ensayo colorimétrico cuantitativo para la supervivencia y proliferación de células de mamíferos mediante la detección de células vivas, pero no muertas (ver, por ejemplo, Mosmann T (1983) J Immunol Methods 65: 55-63).
En otros aspectos, las células apoptóticas se miden tanto en el compartimento unido como en el "flotante" de los cultivos. Ambos compartimentos se recogen al eliminar el sobrenadante, tripsinizar las células unidas y combinar ambas preparaciones tras una etapa de lavado por centrifugación (10 minutos, 2.000 rpm). El protocolo para el tratamiento de cultivos de células tumorales con sulindac y compuestos relacionados para obtener una cantidad significativa de apoptosis se ha descrito en la literatura (ver, por ejemplo, Piazza GA y otros, (1995) Cancer Res 55: 3110-6). Las características de este procedimiento incluyen la recolección de células flotantes y adheridas, la identificación de los tiempos de tratamiento óptimos y el rango de dosis para observar la apoptosis y la identificación de las condiciones óptimas de cultivo celular.
En otro aspecto, la apoptosis se cuantifica al medir la fragmentación del ADN. Los procedimientos fotométricos comerciales para la determinación cuantitativa in vitro de la fragmentación del ADN están disponibles. Ejemplos de tales ensayos, incluido TUNEL (que detecta la incorporación de nucleótidos marcados en ADN fragmentado) y ensayos basados en ELISA, se describen en Biochemica, (1999) 2: 3437 (Roche Molecular Biochemicals). En aún otro aspecto, la apoptosis puede observarse morfológicamente.
Los expertos en la técnica conocen bien las líneas de células cancerígenas en las que pueden realizarse tales ensayos. También pueden realizarse ensayos de apoptosis, necrosis y proliferación en células primarias, por ejemplo, un explante de tejido.
En realizaciones específicas, la administración de un anticuerpo anti-GITR o una composición de este para el uso de la invención a un sujeto con cáncer (en algunas realizaciones, un modelo animal de cáncer) logra al menos uno, dos, tres, cuatro o más de los siguientes efectos: (i) la reducción o mejora de la gravedad de uno o más síntomas de cáncer; (ii) la reducción en la duración de uno o más síntomas asociados con el cáncer; (iii) la prevención de la recurrencia de un síntoma asociado al cáncer; (iv) la reducción de la hospitalización de un sujeto; (v) reducción de la duración de la hospitalización; (vi) el aumento de la supervivencia de un sujeto; (vii) el aumento o mejora del efecto terapéutico de otra terapia; (viii) la inhibición del desarrollo o aparición de uno o más síntomas asociados con el
cáncer; (ix) la reducción del número de síntomas asociados con el cáncer; (x) mejora en la calidad de vida evaluada mediante procedimientos bien conocidos en la técnica; (x) inhibición de la recurrencia de un tumor; (xi) la regresión de tumores y/o uno o más síntomas asociados con ellos; (xii) la inhibición de la progresión de tumores y/o uno o más síntomas asociados con ellos; (xiii) una reducción en el crecimiento de un tumor; (xiv) una disminución en el tamaño del tumor (por ejemplo, volumen o diámetro); (xv) una reducción en la formación de un tumor recién formado; (xvi) erradicación, extirpación o control de tumores primarios, regionales y/o metastásicos; (xvii) una disminución en el número o tamaño de metástasis; (xviii) reducción de la mortalidad; (xix) un aumento en la supervivencia libre de recaídas; (xx) el tamaño del tumor se mantiene y no aumenta o aumenta en menos que el aumento de un tumor después de la administración de una terapia estándar según lo medido por procedimientos convencionales disponibles para un experto en la técnica, tales como imágenes por resonancia magnética (MRI), MRI con contraste dinámico (DCE-MRI), rayos X y tomografía computarizada (CT), o una tomografía por emisión de positrones (PET); y/o (xxi) un aumento en la duración de la remisión en los pacientes.
En ciertas realizaciones, se administran a un sujeto dos o más anticuerpos anti-GITR diferentes. En algunas realizaciones, se administra un anticuerpo anti-GITR a un sujeto en combinación con una o más de otras terapias, por ejemplo, agentes anticancerígenos, citocinas, vacunas celulares o agentes antihormonales, para tratar el cáncer.
En una realización específica, se administra un anticuerpo anti-GITR en combinación con radioterapia que comprende, por ejemplo, el uso de rayos X, rayos gamma y otras fuentes de radiación para destruir las células cancerígenas. En realizaciones específicas, el tratamiento con radiación se administra como radiación de haz externo o teleterapia en la que la radiación se dirige desde una fuente remota. En otras realizaciones, el tratamiento con radiación se administra como terapia interna o braquiterapia en la que se coloca una fuente radiactiva dentro del cuerpo cerca de las células cancerígenas o una masa tumoral. En un aspecto, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria puede activar o mejorar la función o respuesta inmune en un paciente con cáncer con un sistema inmunitario comprometido debido a la terapia contra el cáncer.
En otra realización, se administra un anticuerpo anti-GITR a un sujeto en combinación con quimioterapia. En una realización, puede usarse un anticuerpo anti-GITR antes, durante o después de la radioterapia o quimioterapia. Los ejemplos de agentes quimioterapéuticos incluyen ciclofosfamida, metotrexato, ciclosporina A, leflunomida, cisplatino, ifosfamida, taxanos como taxol y paclitaxol, inhibidores de la topoisomerasa I (por ejemplo, CPT 11, topotecan, 9 AC y GG 211), gemcitabina, vinorelbina, oxaliplatino, 5-fluorouracilo (5-FU), leucovorina, vinorelbina, temodal, citocalasina B, gramicidina D, emetina, mitomicina, etopósido, tenopósido, vincristina, vinblastina, colchicina, doxorrubicina, daunorrubicina, dihidroxi antracina diona, mitoxantrona, mitramicina, actinomicina D, 1 deshidrotestosterona, glucocorticoides, procaína, tetracaína, lidocaína, propranolol y puromicina, y homólogos de citoxina.
En una realización, se administra un anticuerpo anti-GITR a un sujeto en combinación con ciclofosfamida, por ejemplo, una dosis baja de ciclofosfamida. La ciclofosfamida (Elostan, Cytoxan) es un agente quimioterapéutico que tiene una función inmunomoduladora cuando se usa en dosis bajas (por ejemplo, hasta 300 mg/m2, 300 mg/m2 o aproximadamente 300 mg/m2 cuando se administra por vía intravenosa). Específicamente, dosis bajas de ciclofosfamida pueden reducir el número y la capacidad proliferativa de las células T reguladoras (Treg) (por ejemplo, células CD4+CD25+FoxP3+ o, alternativamente, CD45+CD3+CD4+CD8-FOXP3+CD25hiCD127low) y modulan las redes inmunosupresoras. En algunas realizaciones, la dosis de una administración de ciclofosfamida es de aproximadamente 50 mg/m2, 100 mg/m2, 200 mg/m2, 300 mg/m2, 500 mg/m2, o más. En algunas realizaciones, la dosis de una administración de ciclofosfamida está en un rango de 10 mg/m2 hasta 100 mg/m2, 50 mg/m2 hasta 200 mg/m2, 50 mg/m2 hasta 300 mg/m2, 50 mg/m2 hasta 500 mg/m2. En algunas realizaciones, la ciclofosfamida se administra al sujeto dentro de 1 hora, 2 horas, 3 horas, 4 horas, 8 horas, 12 horas, 1 día, 5 días o más antes o después de una administración inicial de un anticuerpo anti-GITR o fragmento de unión a antígeno de este descrito en la presente memoria. En algunas realizaciones, el anticuerpo anti-GITR o fragmento de unión a antígeno descrito en la presente memoria se usa en combinación con ciclofosfamida, por ejemplo, ciclofosfamida en dosis bajas, para el tratamiento del carcinoma de células renales metastásico (RCC).
En una realización, se administra un anticuerpo anti-GITR a un sujeto en combinación con un agente inhibidor de Treg. Ejemplos de agentes inhibidores de Treg incluyen Zenapax® (daclizumab) (Roche), que es un anticuerpo monoclonal anti-CD25 humano usado, por ejemplo, para inducir la inmunosupresión en el trasplante de órganos. Daclizumab bloquea la unión de IL-2 a CD25, que también es una señal para el mantenimiento de las Treg. Otro agente que inhibe las Treg es Sutent® (Sunitinib) (Pfizer), que es un inhibidor de tirosina quinasa de molécula pequeña y multidireccional aprobado para el tratamiento del carcinoma de células renales (RCC) y otros cánceres. Otro agente que puede inhibir las Treg es el 1-metil-D-triptófano (1-MT), un inhibidor competitivo de la indolamina 2,3-dioxigenasa (IDO). La IDO es un agente inmunosupresor expresado en ciertas células normales y neoplásicas y puede estar asociado con un aumento de las Treg en pacientes con cáncer. Los inhibidores de las Treg adicionales incluyen agentes que bloquean el tráfico de las Treg al microambiente tumoral. Tales agentes pueden incluir anticuerpos contra determinadas quimiocinas y receptores de quimiocinas como CCL17, CCL22 y CCR4.
En las siguientes solicitudes de patente se describen ejemplos adicionales de agentes inhibidores de las Treg que pueden usarse de acuerdo con los procedimientos descritos en la presente memoria: Publicaciones de patente de Estados Unidos núms. US 2009/0214533, US 2012/0142750, US 2011/0305713, US 2009/0004213, US 2012/0219559, US 2010/0278844, US 2013/0323283 y US 2008/0152665.
En otra realización, puede administrarse un anticuerpo anti-GITR a un sujeto antes, durante o después de la cirugía.
En unas ciertas realizaciones, se administra un anticuerpo anti-GITR a un sujeto en combinación con un modulador o anticuerpo inmunitario. Los inmunomoduladores o anticuerpos pueden ser, entre otros, adyuvantes, antígenos, anti-CD3 (por ejemplo, OKT3), agentes o moduladores dirigidos a puntos de control, o interleucinas. Los términos "agente dirigido a puntos de control" o "modulador de puntos de control" pueden usarse indistintamente y se refieren a un agente que modula selectivamente la expresión o la actividad de una molécula reguladora (por ejemplo, una molécula de punto de control co-inhibitoria (por ejemplo, una proteína) o una molécula de punto de control coestimuladora (por ejemplo, proteína), que puede ser, por ejemplo, un receptor o un ligando) de un punto de control del sistema inmunológico. Los agentes dirigidos a puntos de control pueden seleccionarse del grupo que consiste en un agonista de una molécula de punto de control, un antagonista de una molécula de punto de control, un polipéptido (por ejemplo, un ligando peptídico, un anticuerpo, un fragmento de anticuerpo) que se dirige selectivamente a una molécula de punto de control; una pequeña molécula que se dirige selectivamente a una molécula de control; y un ácido nucleico regulador (por ejemplo, un ARNsi, ARNmi) que modula selectivamente la expresión o actividad de una molécula de punto de control. En un aspecto, puede seleccionarse un agente dirigido a puntos de control del grupo que consiste en un antagonista de PD-1, un antagonista de PD-L1, un antagonista de PD-L2, un antagonista de CTLA-4, un antagonista de TIM-3, un antagonista de LAG-3, un agonista de GITR y un agonista de OX40. Por lo tanto, en algunos aspectos, un anticuerpo agonista anti-GITR (por ejemplo, Hum231#1, Hum231#2 o Hum231#2w) o un fragmento de unión a antígeno de este, puede administrarse en combinación con, por ejemplo, un anticuerpo anti-antagonista de CTLA-4 o un fragmento de unión a antígeno de este, u otro agente de dirección de puntos de control, ya sea en una única composición farmacéutica o en composiciones farmacéuticas separadas administradas juntas o por separado.
En alguna divulgación, en la presente memoria se proporcionan procedimientos para tratar el cáncer en un sujeto que comprenden administrar al sujeto un anticuerpo anti-GITR o un fragmento de unión a antígeno de este y un agonista de OX40 y/o un(os) antagonista(s) de LAG-3, TIM-3, PD-1 y/o CTLA-4. En algunas realizaciones, el cáncer se selecciona de glioblastoma multiforme, melanoma metastásico, melanoma metastásico resistente, cáncer de ovario metastásico, carcinoma de células renales metastásico, cáncer de cabeza y cuello, cáncer gástrico, cáncer de esófago, cáncer de pulmón de células no pequeñas, tumores cerebrales pediátricos, astrocitoma de bajo grado, ependimoma y meduloblastoma.
En un aspecto específico, se administra un anticuerpo anti-GITR a un sujeto en combinación con un agente que inhibe (parcial o completamente) la transducción de señales de CTLA-4, como un anticuerpo que se une específicamente a CTLA-4 humano (por ejemplo, tremelimumab (Pfizer); ipilimumab (Yervoy®, Bristol-Myers Squibb)) o una proteína de fusión CTLA-4-Ig. En algunas realizaciones, se usa un anticuerpo anti-GITR de la invención en combinación con un antagonista de CTLA-4 (por ejemplo, tremelimumab o ipilimumab) para el tratamiento del cáncer de ovario metastásico. En algunas realizaciones, se usa un anticuerpo anti-GITR de la invención en combinación con un antagonista de CTLA-4 (por ejemplo, tremelimumab o ipilimumab) para el tratamiento del cáncer de ovario metastásico que es resistente a un antagonista de CTLA-4 (por ejemplo, tremelimumab o ipilimumab). En algunas realizaciones, se usan un anticuerpo anti-GITR de la invención y un antagonista de CTLA-4 (por ejemplo, tremelimumab o ipilimumab) para el tratamiento del cáncer de gioblastoma multiforme. En algunas realizaciones, el glioblastoma multiforme es recurrente. En algunas realizaciones, el glioblastoma multiforme es diagnosticado recientemente. En algunas realizaciones, el glioblastoma multiforme está en un sujeto que tiene promotores MGMT no metilados. En algunas realizaciones, el glioblastoma multiforme es refractario a la terapia con Bevacizumab. En algunas realizaciones, el glioblastoma multiforme está en un sujeto que no ha recibido terapia con Bevacizumab. Ejemplos de anticuerpos anti-CTLA-4 que pueden usarse en los procedimientos de tratamiento divulgados en la presente memoria se divulgan en las siguientes patentes y solicitudes de patentes: publicaciones internacionales núms. WO 00/037504, WO 01/014424 y WO 09/100140; patentes de Estados Unidos núms. 6,207,156 y 7,034,121. Ejemplos adicionales de anticuerpos anti-CTLA-4 que pueden usarse de acuerdo con los procedimientos descritos en la presente memoria se divulgan en las siguientes patentes y solicitudes de patentes: patentes de Estados Unidos núms. 7,465,446, 8,263,073; 8,142,778 y 8,226,946; y las solicitudes de Estados Unidos núms. US 2003/086930, US 2005/226875, US 2007/243184, US 2009/123477 y US 2011/044953.
En otra realización, se administra un anticuerpo anti-GITR de la invención en combinación con un agente que inhibe (parcial o completamente) la transducción de señales de LAG-3, tal como un anticuerpo que se une específicamente al LAG-3 humano. Los ejemplos de anticuerpos anti-LAG-3 o fragmentos de anticuerpos de estos que pueden usarse en los procedimientos de tratamiento descritos en la presente memoria se divulgan en las siguientes patentes y solicitudes de patente: patentes de Estados Unidos núms. 6,143,273 y 6,197,524; publicaciones de patente de Estados Unidos núms. US 2011/0150892, US 2010/0233183 y US 2010/196394.
En otra realización, se administra un anticuerpo anti-GITR de la invención en combinación con un agente que inhibe (parcial o completamente) la transducción de señales de TIM-3, tal como un anticuerpo que se une específicamente al TIM-3 humano. Los ejemplos de anticuerpos anti-TIM-3 o fragmentos de anticuerpos de estos que pueden usarse en los procedimientos de tratamiento descritos en la presente memoria se divulgan en las siguientes patentes y solicitudes de patente: patentes de Estados Unidos núms. 7,470,428 y 8,101,176; publicaciones de patente de Estados Unidos núms. US 2013/0022623, US 2010/0100131, US 2010/0100131 y US 2010/061992.
En otra realización, se administra un anticuerpo anti-GITR de la invención en combinación con un agente que inhibe (parcial o completamente) la transducción de señales de PD-1, tal como un anticuerpo que se une específicamente al PD-1 humano. En algunas realizaciones, un anticuerpo anti-PD-1 o un fragmento de anticuerpo de este se administra a un sujeto como se describe en la presente memoria. En algunas realizaciones, el anticuerpo anti-PD-1 es Nivolumab (BMS-936558 o MDX1106) o Lambrolizumab (MK-3475) o Pidilizumab (CT-011). Ejemplos adicionales no limitantes de anticuerpos anti-PD-1 que pueden usarse en los procedimientos de tratamiento divulgados en la presente memoria se divulgan en las siguientes patentes y solicitudes de patentes: patentes de Estados Unidos núms. 6,808,710; 7,488,802; 8,008,449; 8,114,845 y 8,168,757, publicación de Estados Unidos núm. US 2013/0202623 y publicación PCT núm. WO 2013/033091.
En otra realización, se administra un anticuerpo anti-GITR de la invención en combinación con un agente que inhibe (parcial o completamente) la actividad de PD-L1, tal como un anticuerpo que se une específicamente al PD-L1 humano. En algunas realizaciones, el anticuerpo anti-PD-L1 es BMS-936559, MPDL3280A, MEDI4736 o MSB0010718C. Ejemplos adicionales no limitantes de anticuerpos anti-PD-L1 que pueden usarse en los procedimientos de tratamiento divulgados en la presente memoria se divulgan en las siguientes patentes y solicitudes de patentes: patentes de Estados Unidos núms. 8,168,179 y publicaciones de patente de Estados Unidos núms. US 2010/0203056 y US 2003/0232323. En otra realización, se administra un anticuerpo anti-GITR de la invención en combinación con un agente que inhibe (parcial o completamente) la actividad de PD-L2, tal como un anticuerpo que se une específicamente al PD-L2 humano.
En otra realización, se administra un anticuerpo anti-GITR de la invención en combinación con un agente que activa o potencia la transducción de señales de OX-40, tal como un anticuerpo que se une específicamente al OX-40 humano. Los ejemplos de anticuerpos anti-OX40 o fragmentos de anticuerpos de estos que pueden usarse en los procedimientos de tratamiento descritos en la presente memoria se divulgan en las siguientes patentes y solicitudes de patente: patentes de Estados Unidos núms. 7,550,140; 7,807,156; 8,283,450; 8,614,295 y 7,531,170; publicaciones de patente de Estados Unidos núms. US 2010/0196359, US 2010/0136030 y US 2013/0183315.
En otra realización, se administra un anticuerpo anti-GITR de la invención a un sujeto en combinación con una vacuna, tal como se describe en la presente memoria, que incluye la Sección 5.4.1 anterior. En una realización específica, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con una vacuna tumoral basada en proteínas de choque térmico. Las proteínas de choque térmico (HSP) son una familia de proteínas altamente conservadas que se encuentran de forma ubicua en todas las especies. Su expresión puede inducirse poderosamente a niveles mucho mayores como un resultado del choque térmico u otras formas de estrés, que incluyen la exposición a toxinas, estrés oxidativo o privación de glucosa. Se han clasificado cinco familias de acuerdo con el peso molecular: HSP-110, -90, -70, -60 y -28. Las HSP suministran péptidos inmunogénicos a través de la vía de presentación cruzada en células presentadoras de antígeno (APC) tales como macrófagos y células dendríticas (CD), que conduce a la activación de células T. Las HSP funcionan como portadores acompañantes de péptidos antigénicos asociados a tumor que forman complejos capaces de inducir inmunidad específica del tumor. Tras la liberación de las células tumorales moribundas, los complejos de HSP-antígeno son captados por las células presentadoras de antígeno (APC) en las que los antígenos se procesan a péptidos que se unen a las moléculas de MHC clase I y clase II lo que conduce a la activación de células T CD8+ y CD4+ antitumorales. La inmunidad provocada por los complejos de HSP derivados de las preparaciones tumorales se dirige específicamente contra el repertorio único de péptidos antigénicos expresados por el cáncer de cada sujeto.
Un complejo de proteína de choque térmico y péptido (HSPPC) es un complejo de proteína y péptido que consiste en una proteína de choque térmico que forma un complejo no covalente con péptidos antigénicos. Los HSPPC provocan respuestas inmunitarias tanto innatas como adaptativas. En una realización específica, el(los) péptido(s) antigénico(s) presenta(n) antigenicidad para el cáncer que se trata. Los HSPPC se capturan eficientemente por las APC por medio de receptores de membrana (principalmente CD91) o mediante la unión a receptores de tipo Toll. La internalización de los HSPPC da como resultado la maduración funcional de las APC con la producción de quimiocinas y citoquinas que conduce a la activación de células asesinas naturales (NK), monocitos y respuestas inmunitarias mediadas por Th1 y Th-2. En algunas realizaciones, los HSPPC usados en los procedimientos descritos en la presente memoria comprenden una o más proteínas de choque térmico de la familia de hsp60, hsp70, o hsp90 de proteínas de estrés que forman complejos con péptidos antigénicos. En algunas realizaciones, los HSPPC comprenden hsc70, hsp70, hsp90, hsp110, grp170, gp96, calreticulina, o combinaciones de dos o más de estas.
En una realización específica, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con un complejo de proteína de choque térmico (HSPPC), por ejemplo, complejo de proteína de choque térmico y péptido-96 (HSPPC-96), para tratar el cáncer, por ejemplo, glioblastoma multiforme. E1HSPPC-96 comprende una
proteína de choque térmico (Hsp) de 96 kDa, gp96, que forma complejo con péptidos antigénicos. E1HSPPC-96 es una inmunoterapia contra el cáncer fabricado a partir del tumor de un sujeto y contiene la “huella” antigénica del cáncer. En algunas realizaciones, esta huella contiene antígenos únicos que están presentes solamente en las células cancerígenas específicas de un sujeto particular y la inyección de la vacuna pretende estimular al sistema inmunitario del sujeto para que reconozca y ataque cualquier célula con la huella de cáncer específica.
En algunas realizaciones, el HSPPC, por ejemplo, HSPPC-96, se produce a partir del tejido tumoral de un sujeto. En una realización específica, el HSPPC (por ejemplo, HSPPC-96) se produce a partir de un tumor del tipo de cáncer o metástasis de este que se trata. En otra realización específica, el HSPPC (por ejemplo, HSPPC-96) es autólogo para el sujeto que se trata. En algunas realizaciones, el tejido tumoral es tejido tumoral no necrótico. En algunas realizaciones, al menos 1 gramo (por ejemplo, al menos 1, al menos 2, al menos 3, al menos 4, al menos 5, al menos 6, al menos 7, al menos 8, al menos 9, o al menos 10 gramos) de tejido tumoral no necrótico se usa para producir un régimen de vacuna. En algunas realizaciones, después de la resección quirúrgica, el tejido tumoral no necrótico se congela antes de su uso en la preparación de la vacuna. En algunas realizaciones, e1HSPPC, por ejemplo, HSPPC-96, se aísla a partir del tejido tumoral mediante técnicas de purificación, se filtra y se prepara para una vacuna inyectable. En algunas realizaciones, a un sujeto se le administra de 6-12 dosis de1HSPPC, por ejemplo, HSPCC-96. En tales realizaciones, la dosis de HSPPC, por ejemplo, HSPPC-96, puede administrarse una vez a la semana para las primeras 4 dosis y después dos veces a la semana para las 2-8 dosis adicionales.
En algunas realizaciones, se usa un anticuerpo anti-GITR de la invención en combinación con HSPPC-96 para el tratamiento de melanoma metastásico (por ejemplo, melanoma metastásico resistente), cáncer de ovario metastásico o carcinoma de células renales metastásico. En algunas realizaciones, se usa un anticuerpo anti-GITR de la invención en combinación con HSPPC-96 para el tratamiento del glioblastoma multiforme. En algunas realizaciones, se usan un anticuerpo anti-GITR de la invención y un antagonista de CTLA-4 en combinación con HSPPC-96 para el tratamiento del glioblastoma multiforme. En algunas realizaciones, el sujeto que va a tratarse está inmunosuprimido (por ejemplo, debido a una infección, por ejemplo, VIH, o por haber sido sometido a terapia anticancerígena (por ejemplo, radiación de quimioterapia) antes de la administración de1HSPPC.
Ejemplos adicionales de HSPPCs que pueden usarse de acuerdo con los procedimientos descritos en la presente memoria se divulgan en las siguientes patentes y solicitudes de patentes: patentes de Estados Unidos núms.
6,391,306, 6,383,492, 6,403,095, 6,410,026, 6,436,404, 6,447,780, 6,447,781 y 6,610,659.
En algunas realizaciones, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con un compuesto dirigido a una(s) enzima(s) inmunomoduladora(s) tal(es) como IDO (indolamina-(2,3)-dioxigenasa) y TDO (triptófano 2,3-dioxigenasa). En realizaciones particulares, tal compuesto es seleccionado del grupo que consiste en epacadostat (Incyte Corporation), F001287 (Flexus Biosciences), indoximod (NewLink Genetics) y NLG919 (NewLink Genetics). En una realización, el compuesto es epacadostat. En otra realización, el compuesto es F001287. En otra realización, el compuesto es indoximod. En otra realización, el compuesto es NLG919.
Números elevados de las Treg CD4+CD25+ en pacientes con cáncer evitan que el huésped genere una respuesta inmunitaria antitumoral efectiva. Además, las altas frecuencias de Treg se asocian con una reducción de la supervivencia del paciente (Curiel TJ y otros, (2004) Nat Medicine 10(9): 942-9; Woo EY y otros, (2002) J Immunol 168: 4272-6). Sin embargo, se observó una mejora de la actividad inmunitaria en las PBMC de los pacientes con cáncer después del agotamiento de las células T reguladoras (Dannull J y otros, (2005) J Clin Invest 115(12): 3623 33). Las Treg que expresan altos niveles de GITR en su superficie pueden agotarse con el anticuerpo anti-GITR, DTA-1 (Coe D y otros, (2010) Cancer Immunol Immunother 59: 1367-77). En una realización, una estrategia inmunitaria puede incorporar el agotamiento de Treg ex-vivo o in vivo con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este que provoca el agotamiento de las células Treg positivas para GITR.
En ciertas realizaciones, se administra un anticuerpo anti-GITR de la invención a un sujeto en combinación con un virus oncolítico como Talimogene laherparepvec (OncoVEX GM-CSF) y CGTG-102 (Ad5/3-D24-GMCSF).
En ciertas realizaciones, se administra un anticuerpo anti-GITR de la invención a un sujeto en combinación con una(s) citoquina(s) que es(son) efectiva(s) para inhibir el crecimiento/metástasis tumoral. Tales citocinas, linfocinas u otros factores hematopoyéticos incluyen, pero no se limitan a, M-CSF, GM-CSF, TNF, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IFN, TNFa, TNF1, TNF2, G-CSF, Meg-CSF, GM-CSF, trombopoyetina, factor de células madre y eritropoyetina.
En ciertas realizaciones, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con un inhibidor o inhibidores de la tirosina quinasa del receptor, como el mesilato de imatinib (comercializado como Gleevec® o Glivac®), erlotinib (un inhibidor del receptor de EGF) ahora comercializado como Tarveca o sunitinib (comercializado como Sutent®).
En ciertas realizaciones, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con un anticuerpo antagonista de TGF-beta, como Fresolimumab® (GC1008), un anticuerpo que se dirige e inhibe las isoformas 1, 2 o 3 de TGF-beta.
En algunas realizaciones, un anticuerpo anti-GITR de la invención o una composición de este se administra a un sujeto que padece o se diagnostica con cáncer. En una realización específica, se administra un anticuerpo anti-GITR 0 una composición de este a un sujeto que padece o se le diagnostica un glioblastoma multiforme. En algunas realizaciones, el glioblastoma multiforme es recurrente. En algunas realizaciones, el glioblastoma multiforme es diagnosticado recientemente. En algunas realizaciones, el glioblastoma multiforme está en un sujeto que tiene promotores MGMT no metilados. En algunas realizaciones, el glioblastoma multiforme es recurrente. En algunas realizaciones, el glioblastoma multiforme es diagnosticado recientemente. En algunas realizaciones, el glioblastoma multiforme está en un sujeto que tiene promotores MGMT no metilados. En algunas realizaciones, el glioblastoma multiforme es refractario a la terapia con Bevacizumab. En algunas realizaciones, el glioblastoma multiforme está en un sujeto que no ha recibido terapia con Bevacizumab.
En ciertas realizaciones, los pacientes que están siendo tratados de acuerdo con los anticuerpos de la invención descritos en la presente memoria son pacientes que ya están siendo tratados con antibióticos, agentes anticancerígenos u otra terapia/inmunoterapia biológica. Entre estos pacientes se encuentran pacientes refractarios, pacientes que son demasiado jóvenes para las terapias convencionales y pacientes con infecciones virales recurrentes a pesar del manejo o tratamiento con terapias existentes.
En algunas realizaciones, el sujeto al que se le administra un anticuerpo anti-GITR de la invención o una composición de este no ha recibido una terapia antes de la administración del anticuerpo o composición de este. En otras realizaciones, un anticuerpo anti-GITR de la invención o una composición de este se administra a un sujeto que ha recibido una terapia antes de la administración del anticuerpo o composición de este.
En ciertas realizaciones, un anticuerpo anti-GITR de la invención, o una composición de este, se administra a un sujeto que recibe o se recupera de una terapia inmunosupresora. En ciertas realizaciones, se administra un anticuerpo anti-GITR de la invención a un sujeto con cáncer y las células cancerígenas expresan GITRL. En algunas realizaciones, el sujeto que va a tratarse de acuerdo con los anticuerpos de la invención está inmunosuprimido (por ejemplo, debido a una infección, por ejemplo, VIH, o por haber sido sometido a terapia anticancerígena (por ejemplo, radiación de quimioterapia).
Como se describe en la presente memoria, los anticuerpos anti-GITR afectan la expresión superficial de proteínas que incluyen OX40, CD25 y PD-1. En consecuencia, en ciertas realizaciones, se administra un anticuerpo anti-GITR de la invención o una composición de este antes de la administración de un anticuerpo o fragmento de unión a antígeno de este que se une a OX40, CD25 o PD-1.
Puede administrarse un anticuerpo antagonista de PD-1 o un fragmento de unión a antígeno de este en un momento en el que el anticuerpo agonista de GITR o su fragmento de unión a antígeno tiene una expresión de superficie aumentada de PD-1 en un sujeto en relación con la expresión de PD-1 en el sujeto en el momento de la administración. Por ejemplo, un anticuerpo antagonista de PD-1 o un fragmento de unión a antígeno de este puede administrarse al menos 12 horas, al menos 1 día, al menos 2 días, al menos 3 días, al menos 4 días, al menos 5 días, al menos 6 días, o al menos 7 días después de la administración del anticuerpo agonista GITR. Un anticuerpo antagonista de PD-1 o un fragmento de unión a antígeno de este puede administrarse de 12 horas a dos semanas, de 1 día a dos semanas, de 2 días a dos semanas, o de 3 días a dos semanas después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este. Un anticuerpo antagonista de PD-1 o un fragmento de unión a antígeno de este puede administrarse de 12 horas a una semana, de 1 día a una semana, de 2 días a una semana, o de 3 días a una semana después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este.
Puede administrarse un anticuerpo agonista de OX40 o un fragmento de unión a antígeno de este en un momento en el que el anticuerpo agonista de GITR o su fragmento de unión a antígeno tiene una expresión de superficie aumentada de OX40 en un sujeto en relación con la expresión de OX40 en el sujeto en el momento de la administración. Por ejemplo, un anticuerpo agonista de OX40 o un fragmento de unión a antígeno de este puede administrarse al menos 12 horas, al menos 1 día, al menos 2 días, al menos 3 días, al menos 4 días, al menos 5 días, al menos 6 días, o al menos 7 días después de la administración del anticuerpo agonista GITR. Un anticuerpo agonista de OX40 o un fragmento de unión a antígeno de este puede administrarse de 12 horas a dos semanas, de 1 día a dos semanas, de 2 días a dos semanas, o de 3 días a dos semanas después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este. Un anticuerpo agonista de OX40 o un fragmento de unión a antígeno de este puede administrarse de 12 horas a una semana, de 1 día a una semana, de 2 días a una semana, o de 3 días a una semana después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este.
Puede administrarse un anticuerpo anti-CD25 o un fragmento de unión a antígeno de este en un momento en el que el anticuerpo agonista de GITR o su fragmento de unión a antígeno tiene una expresión de superficie aumentada de CD25 en un sujeto en relación con la expresión de CD25 en el sujeto en el momento de la administración. Por ejemplo, un anticuerpo anti-CD25 o un fragmento de unión a antígeno de este puede administrarse al menos 12 horas, al menos 1 día, al menos 2 días, al menos 3 días, al menos 4 días, al menos 5 días, al menos 6 días, o al menos 7 días después de la administración del anticuerpo agonista GITR. Un anticuerpo anti-CD25 o un fragmento
de unión a antígeno de este puede administrarse de 12 horas a dos semanas, de 1 día a dos semanas, de 2 días a dos semanas, o de 3 días a dos semanas después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este. Un anticuerpo anti-CD25 o un fragmento de unión a antígeno de este puede administrarse de 12 horas a una semana, de 1 día a una semana, de 2 días a una semana, o de 3 días a una semana después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este.
Un anticuerpo antagonista de CTLA-4 o un fragmento de unión a antígeno de este puede administrarse después de la administración de un anticuerpo de GITR agonista o un fragmento de unión a antígeno. Por ejemplo, un anticuerpo antagonista de CTLA-4 o un fragmento de unión a antígeno de este puede administrarse al menos 12 horas, al menos 1 día, al menos 2 días, al menos 3 días, al menos 4 días, al menos 5 días, al menos 6 días, o al menos 7 días después de la administración del anticuerpo agonista GITR. Un anticuerpo antagonista de CTLA-4 o un fragmento de unión a antígeno de este puede administrarse de 12 horas a dos semanas, de 1 día a dos semanas, de 2 días a dos semanas, o de 3 días a dos semanas después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este. Un anticuerpo antagonista de CTLA-4 o un fragmento de unión a antígeno de este puede administrarse de 12 horas a una semana, de 1 día a una semana, de 2 días a una semana, o de 3 días a una semana después de la administración del anticuerpo agonista GITR o fragmento de unión a antígeno de este.
Los ejemplos de cáncer que pueden tratarse de acuerdo con los procedimientos descritos en la presente memoria incluyen, pero no se limitan a, linfomas de células B (por ejemplo, leucemia linfocítica crónica de células B, linfoma no Hodgkin de células B, linfoma cutáneo de células B, linfoma difuso de células B grandes), carcinoma de células basales, cáncer de vejiga, blastoma, metástasis de cerebro, cáncer de mama, linfoma de Burkitt, carcinoma (por ejemplo, adenocarcinoma (por ejemplo, de la unión gastroesofágica)), cáncer de cuello uterino, cáncer de colon, cáncer colorrectal (cáncer de colon y cáncer de recto), carcinoma del endometrio, cáncer esofágico, sarcoma de Ewing, linfoma folicular, cáncer gástrico, carcinoma de la unión gastroesofágica, cáncer gastrointestinal, glioblastoma (por ejemplo, glioblastoma multiforme, por ejemplo, recién diagnosticado o recurrente), glioma, cáncer de cabeza y cuello (por ejemplo, carcinoma de células escamosas de cabeza y cuello), metástasis hepática, linfoma de Hodgkin y no Hodgkin, cáncer de riñón (por ejemplo, carcinoma de células renales y tumores de Wilms), cáncer de laringe, leucemia (por ejemplo, leucemia mielocítica crónica, leucemia de células pilosas), cáncer de hígado (por ejemplo, carcinoma hepático y hepatoma), cáncer de pulmón (por ejemplo, cáncer de pulmón de células no pequeñas y cáncer de pulmón de células pequeñas), linfoma linfoblástico, linfoma, linfoma de células del manto, tumor de cerebro metastásico, cáncer metastásico, mieloma (por ejemplo, mieloma múltiple), neuroblastoma, melanoma ocular, cáncer orofaríngeo, osteosarcoma, cáncer de ovario, cáncer de páncreas (por ejemplo, adenocarcinoma ductal de páncreas), cáncer de próstata (por ejemplo, refractario a hormonas (por ejemplo, resistente a la castración), metastásico, metastásico refractario a hormonas (por ejemplo, resistente a la castración, independiente de andrógenos)), carcinoma de células renales(por ejemplo, metastásico), carcinoma de glándulas salivales, sarcoma (por ejemplo, rabdomiosarcoma), cáncer de piel (por ejemplo, melanoma (por ejemplo, melanoma metastásico)), sarcoma de tejido blando, tumor sólido, carcinoma de células escamosas, sarcoma de la sinovia, cáncer testicular, cáncer de tiroides, cáncer de células transicionales (cáncer de células uroteliales), melanoma uveal (por ejemplo, metastásico), carcinoma verrugoso, cáncer de vulva, y macroglobulinemia de Waldenstrom.
En algunas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es un sarcoma o carcinoma humano, por ejemplo, fibrosarcoma, mixosarcoma, liposarcoma, condrosarcoma, sarcoma osteogénico, cordoma, angiosarcoma, endoteliosarcoma, linfangiosarcoma, linfangioendoteliosarcoma, sinovioma, mesotelioma, tumor de Ewing, leiomiosarcoma, rabdomiosarcoma, cáncer de mama, cáncer de colon, carcinoma de ovariosarcoma, cáncer de colon carcinoma de células, carcinoma de células basales, adenocarcinoma, carcinoma de glándulas sudoríparas, carcinoma de glándulas sebáceas, carcinoma papilar, adenocarcinomas papilares, cistadenocarcinoma, carcinoma medular, carcinoma broncogénico, carcinoma de células renales (por ejemplo, metastásico), hepatoma, carcinoma biliar carcinoma embrionario, tumor de Wilms, cáncer de cuello uterino, tumor testicular, carcinoma de pulmón, carcinoma de pulmón de células pequeñas, carcinoma de vejiga, carcinoma epitelial, glioma, glioblastoma multiforme, astrocitoma, meduloblastoma, craneofaringioma, ependimoma, pinealoma, heigomangioblastoma, meniomagloma , melanoma, neuroblastoma , retinoblastoma. En ciertas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es una leucemia linfocítica aguda o leucemia mielocítica aguda (por ejemplo, mieloblástica, promielocítica, mielomonocítica, monocítica y eritroleucemia); leucemia crónica (leucemia mielocítica (granulocítica) crónica o leucemia linfocítica crónica); enfermedad de Hodgkin; enfermedad no Hodgkin; leucemia mieloide aguda; linfoma de células B; linfoma de células T; linfoma anaplásico de células grandes; linfoma intraocular; linfoma folicular; linfoma de intestino delgado; linfoma esplénico de la zona marginal. En ciertas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es mieloma múltiple, macroglobulinemia de Waldenstrom, enfermedad de cadenas pesadas, tumores del estroma gastrointestinal, cáncer de cabeza y/o cuello (por ejemplo, carcinoma de células escamosas de la hipofaringe, carcinoma de células escamosas de la laringe, carcinoma de células de la orofaringe o carcinoma verrugoso de la laringe), sarcoma del estroma endometrial, sarcoma de mastocitos, sarcoma de tejido blando del adulto, sarcoma uterino, carcinoma de células de Merkel, carcinoma urotelial, melanoma con metástasis cerebrales, melanoma uveal, melanoma uveal con metástasis hepáticas, cáncer de pulmón de células no pequeñas, cáncer rectal o síndrome mielodisplásico. En algunas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es metastásico.
En ciertas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención descritos en la presente memoria incluye cáncer de próstata, cáncer de mama, cáncer de pulmón, cáncer colorrectal, melanoma, cáncer de bronquios, cáncer de vejiga, cáncer de cerebro o del sistema nervioso central, cáncer del sistema nervioso periférico, cáncer de útero o endometrio, cáncer de cavidad oral o faringe, linfoma no Hodgkin, cáncer de tiroides, cáncer de riñón, cáncer de vías biliares, cáncer de intestino delgado o de apéndice, cáncer de glándulas salivales, cáncer de glándula tiroides, cáncer de glándulas suprarrenales, cáncer de células escamosas, mesotelioma, osteocarcinoma, timoma/carcinoma tímico, glioblastoma, síndrome mielodisplásico, sarcoma de tejido blando, DIPG, adenocarcinoma, osteosarcoma, condrosarcoma, leucemia o cáncer de páncreas. En algunas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención incluye un carcinoma (por ejemplo, un adenocarcinoma), linfoma, blastoma, melanoma, sarcoma o leucemia. En ciertas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención incluye cáncer de células escamosas, cáncer de pulmón de células pequeñas, cáncer de pulmón de células no pequeñas, cáncer gastrointestinal, linfoma de Hodgkin, linfoma no Hodgkin, cáncer de páncreas, glioblastoma, glioma, cáncer de cuello uterino, cáncer de ovario, cáncer de hígado (por ejemplo, carcinoma hepático y hepatoma), cáncer de vejiga, cáncer de mama, cáncer de mama inflamatorio, carcinoma de células de Merkel, cáncer de colon, cáncer colorrectal, cáncer de estómago, cáncer de vejiga urinaria, carcinoma endometrial, mieloma (por ejemplo, mieloma múltiple), glándula salival, carcinoma, cáncer de riñón (por ejemplo, carcinoma de células renales y tumores de Wilms), carcinoma de células basales, melanoma, cáncer de próstata, cáncer de vulva, cáncer de tiroides, cáncer testicular, cáncer de esófago, adenocarcinoma seroso o varios tipos de cáncer de cabeza y cuello. En ciertas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención incluye melanoma desmoplásico, cáncer de mama inflamatorio, timoma, cáncer de recto, cáncer de ano o glioma de tronco encefálico tratable quirúrgicamente o no tratable quirúrgicamente. En una realización específica, el cáncer es un tumor sólido. En una realización específica, el cáncer es glioblastoma multiforme. En algunas realizaciones, el glioblastoma multiforme es recurrente. En algunas realizaciones, el glioblastoma multiforme es diagnosticado recientemente. En algunas realizaciones, el glioblastoma multiforme está en un sujeto que tiene promotores MGMT no metilados. En algunas realizaciones, el glioblastoma multiforme es refractario a la terapia con Bevacizumab. En algunas realizaciones, el glioblastoma multiforme está en un sujeto que no ha recibido terapia con Bevacizumab.
En algunas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es melanoma metastásico (por ejemplo, melanoma metastásico resistente), cáncer de ovario metastásico o carcinoma de células renales metastásico. En ciertas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es un melanoma resistente a ipilimumab. En algunas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es un melanoma resistente a nivolumab. En algunas realizaciones, el cáncer tratado de acuerdo con los anticuerpos de la invención es un melanoma resistente a ipilimumab y nivolumab.
5.4.1.2 Enfermedades infecciosas
En un aspecto específico, en la presente memoria se presentan procedimientos para prevenir y/o tratar una enfermedad infecciosa, que comprenden administrar a un sujeto que lo necesite una cantidad efectiva de un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria o una composición de este. En una divulgación, en la presente memoria se proporcionan procedimientos para prevenir y/o tratar una infección (por ejemplo, una infección viral, una infección bacteriana, una infección por hongos, una infección por protozoos o una infección parasitaria). La infección prevenida y/o tratada de acuerdo con los procedimientos puede ser causada por un agente infeccioso identificado en la presente memoria. En una realización, la presente invención se refiere a un anticuerpo de la invención, o la composición farmacéutica de la invención, para su uso en el tratamiento de una infección viral. En una realización específica, un anticuerpo anti-GITR de la invención o una composición de este es el único agente activo administrado a un sujeto. En algunos aspectos, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria o una composición de este se usa en combinación con intervenciones antiinfecciosas (por ejemplo, antivirales, antibacterianos, antifúngicos o antihelmínticos) para el tratamiento de enfermedades infecciosas.
Las enfermedades infecciosas que pueden tratarse y/o prevenirse mediante un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria son causadas por agentes infecciosos que incluyen, entre otros, bacterias, parásitos, hongos, protozoos y virus. En una realización específica, la enfermedad infecciosa tratada por un anticuerpo anti-GITR de la invención es causada por un virus. Las enfermedades virales que pueden prevenirse y/o tratarse de acuerdo con los procedimientos descritos en la presente memoria incluyen, pero sin limitarse a, aquellas causadas por hepatitis tipo A, hepatitis tipo B, hepatitis tipo C, influenza (por ejemplo, influenza A o influenza B), varicela, adenovirus, herpes simplex tipo I (HSV-I), herpes simplex tipo II (HSV-II), peste bovina, rinovirus, ecovirus, rotavirus, virus sincitial respiratorio, virus del papiloma, virus papova, citomegalovirus, equinovirus, arbovirus, hantavirus, virus coxsackie, virus de las paperas, virus del sarampión, virus de la rubéola, virus de la polio, viruela, virus de Epstein Barr, virus de la inmunodeficiencia humana tipo I (VIH-I), virus de la inmunodeficiencia humana tipo II (VIH-II), y agentes de enfermedades virales tales como meningitis viral, encefalitis, dengue o viruela.
Las infecciones bacterianas que pueden prevenirse y/o tratarse incluyen infecciones causadas por Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus, Enterococcus faecalis, Proteus vulgaris, Staphylococcus viridans, y
Pseudomonas aeruginosa. Enfermedades bacterianas causadas por bacterias (por ejemplo, Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus, Enterococcus faecalis, Proteus vulgaris, Staphylococcus viridans, y Pseudomonas aeruginosa) que pueden prevenirse y/o tratarse de acuerdo con los procedimientos descritos en la presente memoria incluyen, pero no se limitan a, Rickettsia por micobacterias, Micoplasma, Neisseria, S. neumonía, Borrelia burgdorferi (Enfermedad de Lyme), Bacillus antracis (ántrax), tétanos, Estreptococo, Estafilococo, micobacteriapertissus, cólera, peste, difteria, clamidia, S. aureus y legionella.
Las enfermedades por protozoarias o infecciones por protozoarias causadas por protozoos que pueden prevenirse y/o tratarse de acuerdo con los procedimientos descritos en la presente memoria incluyen, pero no se limitan a, leishmania, coccidiosis, tripanosoma, esquistosoma o malaria. Las enfermedades parasitarias o infecciones parasitarias causadas por parásitos que pueden prevenirse y/o tratarse de acuerdo con los procedimientos descritos en la presente memoria incluyen, pero no se limitan a, clamidia y rickettsia.
Las enfermedades fúngicas o infecciones fúngicas que pueden prevenirse y/o tratarse de acuerdo con los procedimientos descritos en la presente memoria incluyen, pero no se limitan a, las causadas por infecciones de Candida, cigomicosis, Candida mastitis, tricosporonosis diseminada progresiva con tricosporonemia latente, candidiasis diseminada, paracoccidioidomicosis pulmonar, aspergilosis pulmonar, Pneumocystis carinii neumonía, meningitis criptocócica, coccidioidal meningoencefalitis y vasculitis cerebroespinal, Aspergillus niger infección, Queratitis por fusarium, micosis de los senos paranasales, Aspergillus fumigatus endocarditis, discondroplasia tibial, Candida glabrata vaginitis, candidiasis orofaríngea, enfermedad granulomatosa crónica ligada al cromosoma X, tinea pedis, candidiasis cutánea, placentitis micótica, tricosporonosis diseminada, aspergilosis broncopulmonar alérgica, queratitis micótica, Cryptococcus neoformans infección, peritonitis micótica, Curvularia geniculata infección, endoftalmitis estafilocócica, esporotricosis y dermatofitosis.
En ciertas realizaciones, la administración de un anticuerpo anti-GITR de la invención o una composición de este a un sujeto (en algunas realizaciones, un modelo animal) logra uno, dos, tres, cuatro o más de los siguientes efectos: (i) reducción o mejora de la gravedad de una enfermedad infecciosa, una infección o síntoma asociado con la misma; (ii) reducción de la duración de una enfermedad infecciosa, una infección o síntoma asociado a la misma; (iii) inhibición de la progresión de una enfermedad infecciosa, una infección o síntoma asociado con la misma; (iv) regresión de una enfermedad infecciosa, una infección o síntoma asociado a la misma; (v) inhibición del desarrollo o aparición de una enfermedad infecciosa, una infección o síntoma asociado con la misma; (vi) inhibición de la recurrencia de una enfermedad infecciosa o síntoma asociado a la misma; (vii) reducción o inhibición de la propagación de un agente infeccioso de una célula a otra célula, de un tejido a otro tejido o de un órgano a otro órgano; (viii) inhibición o reducción de la propagación/transmisión de un agente infeccioso de un sujeto a otro sujeto; (ix) reducción de la insuficiencia orgánica asociada a una enfermedad infecciosa; (x) reducción de la hospitalización de un sujeto; (xi) reducción del tiempo de hospitalización; (xii) un aumento en la supervivencia de un sujeto con una enfermedad infecciosa o una infección; (xiii) eliminación de una enfermedad infecciosa o una infección; (xiii) inhibición o reducción de la replicación de un agente infeccioso o una infección; (xiv) inhibición o reducción de la entrada de un agente infeccioso en una(s) célula(s); (xv) inhibición o reducción de la replicación del genoma de un agente infeccioso; (xvi) inhibición o reducción de la síntesis de proteínas de agentes infecciosos; (xvii) inhibición o reducción del ensamblaje de agentes infecciosos; (xviii) inhibición o reducción de la liberación de agentes infecciosos de una(s) célula(s); (xviii) reducción del número o título de un agente infeccioso; (xix) la reducción del número de síntomas asociados con una enfermedad infecciosa o una infección; (xx) mejora, mejora, suplementación, complementación o aumento de los efectos profilácticos o terapéuticos de otra terapia; y/o (xxi) prevención de la aparición o progresión de una infección secundaria asociada con una enfermedad infecciosa.
En ciertas realizaciones, se administran a un sujeto dos o más anticuerpos anti-GITR diferentes de la invención. En algunas realizaciones, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con una o más de otras terapias. En un aspecto, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria se administra en combinación con uno o más antifúngicos.
En un aspecto específico, un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria se administra a un sujeto en combinación con uno o más antibióticos. Los ejemplos de antibióticos que pueden usarse en combinación con un anticuerpo anti-GITR o fragmento de unión a antígeno de este descrito en la presente memoria incluyen antibióticos aminoglucósidos, glicopéptidos, antibióticos anfenicol, antibióticos ansamicina, cefalosporinas, cefamicinas, oxazolidinonas, penicilinas, quinolonas, estreptogaminas, análogos de estos.
En otra realización, un anticuerpo anti-GITR de la invención se administra en combinación con una o más antivirales. Los ejemplos de agentes antivirales que pueden usarse en combinación con un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descritos en la presente memoria incluyen inhibidores de transcriptasa inversa no nucleósidos, inhibidores de transcriptasa inversa nucleósidos, inhibidores de proteasa e inhibidores de fusión. En una realización, el agente antiviral es amantadina, fosfato de oseltamivir, rimantadina y zanamivir. En otra realización, el agente antiviral es un inhibidor de la transcriptasa inversa no nucleósido tal como delavirdina, efavirenz o nevirapina. En otra realización, el agente antiviral es un inhibidor nucleósido de la transcriptasa inversa tal como abacavir, didanosina, emtricitabina, emtricitabina, lamivudina, estavudina, tenofovir DF, zalcitabina o
zidovudina. En otra realización, el agente antiviral es un inhibidor de proteasa como amprenavir, atazanavir, fosamprenav, indinavir, lopinavir, nelfinavir, ritonavir o saquinavir. En otra realización, el agente antivírico es un inhibidor de la fusión, como enfuvirtida. En otra realización, el agente antiviral es fosfato de oseltamivir, anfotericina B o palivizumab.
En una realización específica, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con una vacuna que es una preparación de proteína de choque térmico que comprende una proteína de choque térmico unida con péptidos antigénicos que comprenden un antígeno de un patógeno (por ejemplo, virus, bacterias, hongos, etc.). En algunas realizaciones, un anticuerpo anti-GITR de la invención se administra a un sujeto en combinación con una vacuna que es una preparación de proteína de choque térmico que comprende proteínas de choque térmico unida con péptidos antigénicos que comprenden antígenos virales (por ejemplo, antígenos de HSV-1 o HSV-2). En algunas realizaciones, la preparación de proteína de choque térmico que comprende proteínas de choque térmico unida con péptidos antigénicos que comprenden antígenos virales (por ejemplo, antígenos de HSV-1 o HSV-2) está combinado con un adyuvante, tal como QS-21. En algunas realizaciones, la vacuna es HerpV (Agenus Inc.), que es una vacuna para el tratamiento de infecciones por herpes. Un ejemplo no limitante de una vacuna adecuada se divulga en Mo A., y otros, (2011), Vaccine 29: 8530-8541. Ejemplos adicionales no limitantes se divulgan en la patente de Estados Unidos no. 8,541,002.
En algunas realizaciones, un anticuerpo anti-GITR de la invención, o composición de este se administra a un sujeto que padece una enfermedad infecciosa causada por virus. En ciertas realizaciones, un anticuerpo anti-GITR de la invención, o composición de este se administra a un sujeto que se le diagnostica que tiene una enfermedad infecciosa causada por virus. En algunas realizaciones, un anticuerpo anti-GITR de la invención o una composición de este se administra a un sujeto con una infección viral. En algunas realizaciones, el sujeto tratado de acuerdo con el anticuerpo de la invención está inmunocomprometido o inmunodeprimido. En ciertas realizaciones, el sujeto tratado de acuerdo con el anticuerpo de la invención tiene, recibe o recibirá otra terapia (por ejemplo, un agente antiviral, antibiótico o antifúngico).
5.4.1.3 Vías de administración y dosificación
Un anticuerpo o composición de la invención puede suministrarse a un sujeto mediante una variedad de vías. Estos incluyen, pero no se limitan a, las vías parenteral, intranasal, intratraqueal, oral, intradérmica, tópica, intramuscular, intraperitoneal, transdérmica, intravenosa, intratumoral, conjuntival y subcutánea. La administración pulmonar también puede emplearse, por ejemplo, mediante el uso de un inhalador o nebulizador, y la formulación con un agente de atomización para su uso como un aerosol.
La cantidad de un anticuerpo o composición de la invención que será efectivo en el tratamiento y/o prevención de una afección dependerá de la naturaleza de la enfermedad, y puede determinarse mediante técnicas clínicas estándar.
La dosis precisa a emplear en una composición dependerá además de la vía de administración, y la gravedad de la infección o enfermedad causada por esta, y debe decidirse de acuerdo con el criterio del médico y las circunstancias de cada sujeto. Por ejemplo, las dosis efectivas pueden variar además en dependencia de los medios de administración, el sitio diana, el estado fisiológico del paciente (que incluye edad, peso corporal y salud), si el paciente es un ser humano o un animal, otros medicamentos administrados, o si el tratamiento es profiláctico o terapéutico. Usualmente, el paciente es un ser humano, pero también pueden tratarse mamíferos no humanos que incluyen mamíferos transgénicos. Las dosificaciones de tratamiento se titulan de manera óptima para optimizar la seguridad y la eficacia.
En ciertas realizaciones, un ensayo in vitro se emplea para ayudar a identificar los intervalos de dosificación óptimos. Las dosis efectivas pueden extrapolarse a partir de las curvas de dosis-respuesta derivadas de los sistemas de prueba in vitro o de modelo animal.
Para la inmunización pasiva con un anticuerpo (o un fragmento de unión a antígeno de este), la dosis varía de aproximadamente 0,0001 a 100 mg/kg, y más habitualmente de 0,01 a 15 mg/kg, del peso corporal del paciente. Por ejemplo, las dosis pueden ser de 1 mg/kg de peso corporal, 10 mg/kg de peso corporal o dentro del intervalo de 1-10 mg/kg o, en otras palabras, 70 mg o 700 mg o dentro del rango de 70-700 mg, respectivamente, para un paciente de 70 kg. En algunas realizaciones, la dosis administrada al paciente es de aproximadamente 1 mg/kg a aproximadamente 20 mg/kg del peso corporal del paciente. Generalmente, los anticuerpos humanos tienen una vida media dentro del cuerpo del humano más prolongada que los anticuerpos de otras especies debido a la respuesta inmune frente a los polipéptidos exógenos. Por tanto, son frecuentemente posible las dosificaciones inferiores de anticuerpos humanos y la administración menos frecuente.
Un régimen de tratamiento ilustrativo implica la administración una vez cada dos semanas o una vez al mes o una vez cada 3 a 6 meses durante un período de un año o durante varios años, o durante varios intervalos de años. En algunos procedimientos, se administran simultáneamente a un sujeto dos o más anticuerpos o fragmentos de unión a antígeno de estos con diferentes especificidades de unión. Un anticuerpo o fragmento de unión a antígeno de este
se administra habitualmente en múltiples ocasiones. Los intervalos entre dosificaciones individuales pueden ser semanales, mensuales, cada 3 meses, cada 6 meses o anualmente.
5.4.2 Usos de detección y diagnóstico
Un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria (ver, por ejemplo, la Sección 5.1) puede usarse para analizar los niveles de la proteína GITR en una muestra biológica mediante el uso de los procedimientos inmunohistológicos clásicos conocidos por los expertos en la técnica, que incluyen inmunoensayos, tales como el ensayo de inmunoadsorción ligado a enzima (ELISA), inmunoprecipitación, o transferencia Western. Las etiquetas adecuadas para ensayos de anticuerpos se conocen en la técnica e incluyen etiquetas enzimáticas, tales como, glucosa oxidasa; radioisótopos tales como yodo (125I, 121I), carbono (14C), azufre (35S), tritio (3H), indio (121In), y tecnecio (99Tc); etiquetas luminiscentes, tales como luminol; y etiquetas fluorescentes, tales como fluoresceína y rodamina, y biotina. tales marcadores pueden usarse para marcar un anticuerpo o un fragmento de unión a antígeno de este descrito en la presente memoria. Alternativamente, un segundo anticuerpo que reconoce un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria puede marcarse y usarse en combinación con un anticuerpo anti-GITR o fragmento de unión a antígeno de este para detectar niveles de proteína GITR.
Se pretende que el análisis del nivel de expresión de la proteína GITR incluya medir o estimar cualitativamente o cuantitativamente el nivel de una proteína GITR en una primera muestra biológica ya sea directamente (por ejemplo, mediante la determinación o estimación del nivel absoluto de proteína) o relativamente (por ejemplo, mediante la comparación con el nivel de proteína asociado a enfermedad en una segunda muestra biológica). El nivel de expresión del polipéptido de GITR en la primera muestra biológica puede medirse o estimarse y compararse con un nivel de proteína GITR estándar, el estándar se toma de una segunda muestra biológica obtenida de un individuo que no tiene el trastorno o se determina mediante el promedio de los niveles de una población de individuos que no tienen el trastorno. Como se apreciará en la técnica, una vez que se conoce el nivel “estándar” del polipéptido de GITR, este puede usarse repetidamente como un estándar para la comparación.
Como se usa en la presente memoria, el término “muestra biológica” se refiere a cualquier muestra biológica obtenida de un sujeto, línea celular, tejido, u otra fuente de células que expresan potencialmente GITR. Los procedimientos para obtener biopsias de tejidos y fluidos corporales de animales (por ejemplo, seres humanos) se conocen bien en la técnica. Las muestras biológicas incluyen células de la sangre mononucleares periféricas.
Un anticuerpo anti-GITR o un fragmento de unión a antígeno de este descrito en la presente memoria puede usarse para las aplicaciones de pronóstico, diagnóstico, control y cribado, que incluyen aplicaciones in vitro e in vivo bien conocidas y estándares para el experto y en base a la presente descripción. Los análisis y kits de pronóstico, diagnóstico, control y cribado para la valoración y evaluación in vitro del estado del sistema inmunitario y/o la respuesta inmunitaria pueden utilizarse para predecir, diagnosticar y controlar para evaluar las muestras de pacientes que incluyen los que tienen o se sospecha que tienen una disfunción del sistema inmunitario o con respecto a una respuesta del sistema inmunitario, respuesta a antígeno o respuesta a vacuna prevista o deseada. La valoración y evaluación del estado del sistema inmunitario y/o la respuesta inmunitaria es útil además para determinar la idoneidad de un paciente para un ensayo clínico de un fármaco o para la administración de un agente quimioterapéutico o un anticuerpo o fragmento de unión a antígeno de este, que incluye las combinaciones de estos, frente a diferentes agentes o anticuerpos o fragmentos de unión a antígeno de estos. Este tipo de control y valoración del pronóstico y el diagnóstico ya está en práctica con la utilización de anticuerpos contra la proteína HER2 en el cáncer de mama (HercepTestTM, Dako) donde el ensayo se usa además para evaluar los pacientes de la terapia de anticuerpos mediante el uso Herceptin®. Las aplicaciones in vivo incluyen la terapia celular dirigida y la modulación del sistema inmunitario y la formación de radioimágenes de las respuestas inmunitarias.
En una realización, un anticuerpo anti-GITR puede usarse en la inmunohistoquímica de muestras de biopsia.
En otra realización, un anticuerpo anti-GITR puede usarse para detectar niveles de GITR, o niveles de células que contienen GITR en su superficie de membrana, cuyos niveles pueden asociarse después con ciertos síntomas de la enfermedad. Los anticuerpos anti-GITR o los fragmentos de unión a antígeno de estos descritos en la presente memoria pueden llevar una etiqueta detectable o funcional. Cuando se usan etiquetas fluorescentes, pueden utilizarse los procedimientos de microscopía y análisis de clasificación de células activadas por fluorescencia actualmente disponibles (FACS) o la combinación de ambos procedimientos conocidos en la técnica para identificar y cuantificar los miembros de unión específicos. Los anticuerpos anti-GITR o los fragmentos de unión a antígeno de estos descritos en la presente memoria pueden llevar una etiqueta fluorescente. Las etiquetas fluorescentes ilustrativas incluyen, por ejemplo, sondas reactivas y conjugadas, por ejemplo, Aminocumarina, Fluoresceína y rojo Texas, colorantes Alexa Fluor, colorantes Cy y colorantes DyLight. Un anticuerpo anti-GITR o fragmento de unión a antígeno de este puede portar una etiqueta radioactiva, tal como los isótopos 3H, 14C, 32P, 35S, 36Cl, 51Cr, 57Co, 58Co, 59Fe, 67Cu, 90Y, 99Tc, 111In, 117Lu, 121I, 124I, 125I, 131I, 198Au, 211At, 213Bi, 225Ac y 186Re. Cuando se usan etiquetas radioactivas, pueden utilizarse los procedimientos de recuento disponibles actualmente conocidos en la técnica para identificar y cuantificar la unión específica del anticuerpo anti-GITR o fragmento de unión a antígeno de este a GITR (por ejemplo, GITR humano). En el caso donde la etiqueta es una enzima, la detección puede realizarse mediante
cualquiera de las técnicas colorimétricas, espectrofotométricas, fluoroespectrofotométricas, amperométricas o gasométricas utilizadas actualmente como se conoce en la técnica. Esto puede lograrse al poner en contacto una muestra o una muestra de control con un anticuerpo anti-GITR o fragmento de unión a antígeno de este en condiciones que permiten la formación de un complejo entre el anticuerpo o fragmento de unión a antígeno de este y GITR. Cualquiera de los complejos formado entre el anticuerpo o fragmento de unión a antígeno de este y GITR se detectan y comparan en la muestra y el control. A la luz de la unión específica de los anticuerpos descritos en la presente memoria para GITR, los anticuerpos o fragmentos de unión a antígeno de estos pueden usarse para detectar específicamente la expresión de GITR en la superficie de las células. Los anticuerpos o fragmentos de unión a antígeno de estos descritos en la presente memoria también pueden usarse para purificar GITR mediante purificación por inmunoafinidad.
En la presente memoria también se incluye un sistema de ensayo que puede prepararse en la forma de un kit de prueba para el análisis cuantitativo del grado de la presencia de, por ejemplo, GITR o los complejos GITR/GITRL. El sistema o kit de prueba puede comprender un componente etiquetado, por ejemplo, un anticuerpo etiquetado, y uno o más reactivos inmunoquímicos adicionales. Ver, por ejemplo, la Sección 5.5 más abajo para más información sobre los kits.
5.5 Kits
En la presente memoria se proporcionan kits que comprenden uno o más anticuerpos descritos en la presente memoria, o fragmentos de unión a antígeno de estos, o conjugados de los mismos. En una realización específica, en la presente memoria se proporciona un paquete o kit farmacéutico que comprende uno o más recipientes llenos con uno o más de los ingredientes de las composiciones farmacéuticas descritas en la presente memoria, tales como uno o más los anticuerpos proporcionados en la presente memoria o un fragmento de unión a antígeno de los mismos. En algunas realizaciones, los kits contienen una composición farmacéutica descrita en la presente memoria y cualquier agente profiláctico o terapéutico, tal como los descritos en la presente memoria. En ciertas realizaciones, los kits pueden contener un mitógeno de células T, tal como, por ejemplo, fitohemaglutinina (PHA) y/o forbol miristato acetato (PMA), o un anticuerpo estimulador del complejo de TCR, tal como un anticuerpo anti-CD3 y un anticuerpo anti-CD28. Opcionalmente, puede haber un aviso asociado con tal(es) recipiente(s) en la forma prescrita por una agencia gubernamental reguladora de la fabricación, uso o venta de los productos farmacéuticos o biológicos, donde el aviso refleja la aprobación por la agencia de la fabricación, uso o venta para la administración humana.
En la presente memoria también se proporcionan kits que pueden usarse en los procedimientos anteriores. En un aspecto, un kit comprende un anticuerpo descrito en la presente memoria, preferentemente un anticuerpo purificado, en uno o más recipientes. En un aspecto específico, los kits descritos en la presente memoria contienen un antígeno GITR sustancialmente aislado (por ejemplo, GITR humano) como un control. En otro aspecto específico, los kits descritos en la presente memoria comprenden además un anticuerpo control que no reacciona con un antígeno GITR. En otra realización específica, los kits descritos en la presente memoria contienen uno o más elementos para detectar la unión de un anticuerpo a un antígeno GITR (por ejemplo, el anticuerpo puede conjugarse a un sustrato detectable tal como un compuesto fluorescente, un sustrato enzimático, un compuesto radioactivo o un compuesto luminiscente, o un segundo anticuerpo que reconoce el primer anticuerpo puede conjugarse a un sustrato detectable). En aspectos específicos, un kit proporcionado en la presente memoria puede incluir un antígeno GITR producido por vía recombinante o sintetizado químicamente. El antígeno GITR proporcionado en el kit también puede unirse a un soporte sólido. En una realización más específica, los medios de detección del kit descrito anteriormente incluyen un soporte sólido al que se une un antígeno GITR. Un kit de este tipo también puede incluir un anticuerpo anti-humano o un anticuerpo anti-ratón/rata no unido etiquetado con reportero. En este aspecto, la unión del anticuerpo al antígeno GITR puede detectarse mediante la unión del dicho anticuerpo etiquetado con reportero.
Los siguientes ejemplos se ofrecen a modo de ilustración y no a modo de limitación.
6. Ejemplos
Los ejemplos en esta Sección (es decir, la Sección 6) se ofrecen en forma de ilustración, y no en forma de limitación.
6.1 Ejemplo 1: Generación de anticuerpos novedosos contra el GITR humano
Este ejemplo describe la generación y caracterización de anticuerpos murinos que se unen al GITR humano. En particular, este ejemplo describe la generación de anticuerpos murinos que se unen específicamente al GITR humano y exhiben un efecto coestimulador sobre las células T CD4+.
Para generar anticuerpos novedosos contra GITR, se usaron células CMS5a de ratón transfectadas con GITR humano como inmunógeno en combinación con un adyuvante (monofosforil lípido A (MPL), dimiocloato de trehalosa (TDM), dipéptido de muramil (MDP) y adyuvante de Freund (FA)) en ratones BALB/c. Se fusionaron células de bazo de ratones inmunizados con la línea celular de mieloma de ratón SP2/0. Se seleccionaron los sobrenadantes de los
clones recién generados en ensayos de hemadsorción mixta en células CMS5a transfectadas con hGITR y CMS5a de tipo salvaje. Los sobrenadantes seleccionados se analizaron adicionalmente mediante ELISA en proteína hGITR recombinante (HGITR-Fc, Sigma). La fusión #231 dio como resultado cuatro hibridomas (231-32-15, 231-1039-45, 231-1042-7 y 231-1333-21) con reactividad selectiva para GITR humano (a veces denominado en la presente memoria hGITR o huGITR) por MHA y ELISA. Los anticuerpos (todos IgG-i) se purificaron mediante cromatografía de afinidad de la proteína G para pruebas adicionales.
La especificidad de los anticuerpos anti-GITR se probó mediante transferencia Western contra GITR humano recombinante purificado, GITR de ratón recombinante, células CMS5a transfectadas con GITR humano, células CMS5a de tipo salvaje, células T CD4+ activadas y células T CD4+ sin tratar. La transferencia Western, en condiciones no reductoras, se muestra en la Figura 1. Los anticuerpos anti-GITR fueron reactivos con GITR humano recombinante purificado, no reactivos con GITR recombinante de ratón, reactivos con GITR humano recombinante en células CMS5a y reactivos con GITR humano natural en las células T CD4+ activadas.
El análisis de la unión del ligando (GITR-L) y del anticuerpo monoclonal a huGITR inmovilizado se realizó mediante resonancia de plasmón de superficie y se midió en BIAcore®. El GITR (~1.100 RU) se inmovilizó en un chip sensor CM5 mediante el uso acoplamiento de amina estándar. Los analitos se inyectaron sobre el GITR inmovilizado durante 15 minutos a una velocidad de flujo de 5 pl/min seguido de un período de disociación de 10 minutos. Después de realizadas las pruebas cinéticas, se calcularon simultáneamente las constantes de afinidad y disociación mediante el software BiaEvaluation® (Biacore Life Sciences). La unión de GITR-L humano se analizó en un intervalo de concentración de 12,5-200 nM y los anticuerpos monoclonales anti-GITR murinos se analizaron en una concentración de 6,25-100 nM. Los anticuerpos no se unieron al GITR de ratón inmovilizado. Las constantes de afinidad y disociación de los anticuerpos se tabulan más abajo en la Tabla 9.
Tabla 9
Se secuenciaron los hibridomas 231-32-15, 231-1039-45, 231-1042-7 y 231-1333-21 y se encontró que tenían las mismas secuencias de ADNc y de proteínas. Las secuencias de proteínas de VH y VL se confirmaron mediante secuenciación de proteínas N-terminal y espectrometría de masas (MS) de digestiones trípticas. La secuencia de cadena pesada variable de los anticuerpos anti-GITR es la SEQ ID NO: 201 y la secuencia de cadena ligera variable de los anticuerpos anti-GITR es la SEQ ID NO: 202. Las secuencias de la región determinante de complementariedad (CDR) de la región variable de la cadena pesada (VH), VH CDR1, VH CDR2 y VH CDR3 tienen las sec. con núms. de ident.: 13, 14 y 15, respectivamente, y las secuencias CDR de la región variable de la cadena ligera (VL), VL CDR1, VL CDR2 y VL CDR3 tienen las sec. con núms. de ident.: 16, 17 y 18, respectivamente.
La unión competitiva de los nuevos anticuerpos 231-GITR se comparó con un anticuerpo monoclonal anti-GITR disponible comercialmente (R&D Systems mAb689 clon 110416). Se usaron células CMS5a transfectadas con GITR y se incubaron con un AcM anti-GITR sin marcar, seguido de la adición de AcM R&D conjugado con PE o anticuerpo 231-1039-45 o 213-1333-21 conjugado con Alexa 488 (datos no mostrados para Alexa 448- anticuerpo 213-1333-21 conjugado), con resultados evaluados mediante análisis FACS. Los estudios de bloqueo de los sistemas R&D de AcM anti-GITR se representan en la Figura 2A y los estudios de bloqueo de un anticuerpo 231 (1039-45) se representan en la Figura 2B. En estos estudios, no se añadieron en primer lugar anticuerpos, anticuerpos de R&D sin marcar o anticuerpos de prueba sin marcar (anticuerpos 1042-7, 1039-45, 1331-21 o 32-15) y se incubaron con células transfectadas con M5Sa-GITR. A continuación, se añadió el anticuerpo de sistemas R&D marcado (Figura 2A) o el anticuerpo anti-GITR 231 marcado 1039-45 (Figura 2B). Los nuevos anticuerpos 231 (1042-7, 1039-45, 1333-21 o 32-15) solo bloquearon parcialmente la unión del anticuerpo de R&D, posiblemente debido al impedimento estérico (Figura 2A). La Figura 2B muestra que el anticuerpo de R&D no bloqueó la unión del anticuerpo 231-1039-45. La unión de 1039-45 fue inhibida por cualquiera de los anticuerpos 231 (es decir, por 1042 7, 1039-45, 1333-21 o 32-15).
Las características de unión de los anticuerpos 231-GITR se analizaron mediante FACS y los resultados se representan en las Figuras 3A-C. La Figura 3A muestra la tinción de células CMS5a-GITR con el anticuerpo 1333-21 IgG1 anti-GITR humano de dos lotes diferentes (1 y 2) y anticuerpo de R&D Systems. En la Figura 3B, la intensidad de fluorescencia de PMBC derivado ex vivo de Cd3'CD19‘ GITR+ y CD4+CD25+ GITR+ se muestra tras la tinción con 1042-7, 32-15, 1039-45, 1333-21 y los anticuerpos de R&D Systems. Análisis de FACS de estas células derivadas de PBMC en vivo después de 1333-21 o la unión del anticuerpo de los sistemas R&D (clon 110.416 de mAb689) se muestra en la Figura 3C.
A continuación, se realizaron estudios para evaluar el efecto coestimulador del anticuerpo anti-GITR sobre las células T CD4+en combinación con anticuerpo anti-CD3 (OKT3). El efecto coestimulador relativo más significativo se observó al combinar anticuerpos anti-GITR (231-1042-7, 231-32-15, 231-1039-45, 231-1333-21) con una concentración subóptima (0,2 pg/ml) de OKT3. El anticuerpo anti-GITR (5 pg/ml) y el anticuerpo OKT-3 en concentraciones variables se unieron a placas de cultivo de tejidos y después se incubaron con células CD4+ etiquetadas con CSFE. Se añadió IL-2 (10 U/ml) al medio y las células y los anticuerpos se incubaron durante 5 días más. Al final de los 5 días, se evaluó la intensidad de CFSE con células divididas que tenían baja intensidad de CFSE. También se midió IFNy. Los resultados de los anticuerpos anti-GITR se muestran en la Figura 4. A una concentración subóptima de anticuerpo OKT3 (0,2 pg/ml), los anticuerpos anti-GITR tuvieron un efecto relativo significativo sobre la proliferación de las células CD4+. Se observó un aumento de IFNy en comparación con los controles en presencia del anticuerpo anti-GITR combinado con todos los niveles de OKT3 probados, con el efecto más pronunciado observado a 0,2 pg/ml y 0,04 pg/ml. La variación entre los anticuerpos probados puede atribuirse a la variabilidad intraensayo y una variabilidad natural entre cada preparación de anticuerpo (por ejemplo, preparación separada). En particular, en ausencia de OKT3, no hay estimulación por los anticuerpos anti-GITR. El efecto coestimulador de los anticuerpos anti-GITR con OKT3 fue dependiente de la dosis de la cantidad de anticuerpos anti-GITR (datos no mostrados).
En conclusión, se han aislado nuevos anticuerpos anti-GITR que son específicos para GITR humano y reconocen el GITR recombinante y natural. Estos anticuerpos se unen a hGITR expresado en células CMS5a transfectadas con hGITR a 2,5-5 ng/ml y muestran una buena unión mediante análisis FACS. Los anticuerpos también se unieron a PBMC humanas, que incluye las células T que expresan hGITR natural. Su afinidad por GITR mediante BIAcore® es Ka (1/M) aproximadamente 4,2 x 108, Kd (M) 2,4 x 10'9 (versus GITRL (ligando) Ka de 1,8 x 108 y Kd 5,5 x 10'9). Los anticuerpos se unen a un sitio diferente en hGITR frente a un AcM GITR disponible comercialmente (R&D).
Un efecto coestimulador del anticuerpo monoclonal anti-GITR con concentraciones subóptimas (0,2 pg/ml y 0,04 pg/ml) de AcM anti-CD3 (OKT3) en CD4+ se ha demostrado la presencia de células T. A pesar de la presencia de células T reguladoras en la población de células T CD4+ enriquecidas, los anticuerpos anti-GITR mejoraron la actividad de las células T CD4.
6.2 Ejemplo 2: Humanización del anticuerpo monoclonal de ratón 231-32-15
Este ejemplo describe la humanización del anticuerpo murino 231-32-15 y la caracterización de los anticuerpos humanizados.
6.2.1 Humanización del anticuerpo murino 231-32-15
En la presente memoria se describe la humanización del anticuerpo de ratón anti-GITR humano 231-32-15 que incluye la selección de estructuras aceptoras humanas.
6.2.2 Quimerización del anticuerpo murino 231-32-15
Las regiones variables (kappa) murinas VH y VL de murino 231-32-15 que tienen las sec. con núms. de ident.: 201 y 202, respectivamente, se sintetizaron por GeneArt® (Life Technologies™). Las secuencias líder naturales de los dominios variables murinos originales se incluyeron junto con adaptadores con sitios de restricción para permitir la clonación de estas regiones variables directamente en IgG1 humana estándar interna Vector Vh (dominios CH1-2-3) y vector Vk (Ck1), para crear genes quiméricos con Vh o Vk murino y regiones constantes humanas. Los vectores de expresión quiméricos de cadena pesada y ligera se cotransfectaron después en células CHO en suspensión para producir proteína de anticuerpo quimérico para su uso en los ensayos realizados más abajo. Este anticuerpo quimérico se denomina en los Ejemplos de la Sección 6 "anticuerpo quimérico parental 231-32-15". Este anticuerpo quimérico parental 231-32-15 contiene una sustitución T109S (es decir, sustitución de treonina por serina en la posición 109 relativa a la secuencia Fc de tipo salvaje), numerada según Kabat, en el dominio constante de cadena ligera, lo que facilita la clonación de la región variable en marco a la región constante. Esta mutación es una modificación conservadora que no afecta la unión o función del anticuerpo.
Se usó el emparejamiento de homología para elegir estructuras aceptoras humanas para injertar las CDR del anticuerpo 231-32-15. Bases de datos, por ejemplo, una base de datos de genes variables de la línea germinal de los loci de inmunoglobulina de humanos y ratones (la base de datos IMGT (el sistema internacional de información ImMunoGeneTics®; Lefranc MP y otros, (1999) Nucleic Acids Res 27(1): 209-12; Ruiz M y otros, (2000) Nucleic Acids Res 28(1): 219-21; Lefranc MP (2001) Nucleic Acids Res 29(1): 207-9; Lefranc MP (2003) Nucleic Acids Res 31(1): 307-10; Lefranc MP y otros, (2005) Dev Compo Immunol 29(3): 185-203; Kaas Q y otros, (2007) Briefings in Functional Genomics & Proteomics 6(4): 253-64) o el VBASE2 (Retter I y otros, (2005) Nucleic Acids Res 33, número de base de datos D671-D674) o la base de datos de Kabat (Johnson G y otros, (2000) Nucleic Acids Res 28: 214-218)) o publicaciones (por ejemplo, Kabat EA y otros, más arriba) puede usarse para identificar las subfamilias humanas a las que pertenecen las regiones variables de la cadena pesada y ligera murina y determinar el marco de línea germinal humano que mejor se ajusta a usar como molécula aceptora. La selección de secuencias de la región variable de la cadena pesada y ligera (VH y VL) dentro de estas subfamilias para su uso como aceptor
puede basarse en la homología de secuencia y/o una coincidencia de la estructura de las regiones CDR1 y CDR2 para ayudar a preservar la presentación relativa apropiada de la seis CDR después del injerto.
La búsqueda en la base de datos IMGT mediante el uso IgBLAST (disponible en el sitio web del NCBI) indicó una buena homología entre el marco de la región variable de la cadena pesada 231-32-15 y los miembros de las subfamilias 1 y 7 de la región variable de la cadena pesada humana. Se observaron las homologías e identidades más altas tanto de la CDR como de secuencias marco para la secuencia de la línea germinal: IGHV1-2*02 (también conocido como DP75; SEQ ID NO: 601) (59,2 % de identidad; 58 residuos de aminoácidos de 98), IGHV1-3*01 (SEQ ID NO: 602) (58,2 % de identidad; 57/98), IGHV1-46*01 (SEQ ID NO: 603) (57,1 % de identidad; 56/98), IGHV1-18*01 (SEQ ID NO: 604) y IGHV1-69*01 (SEQ ID NO: 605) (ambos 56,1 % de identidad; 55/98) e IGHV7-4-1*02 (SEQ ID NO: 606) (54,1 % de identidad; 53/98).
Mediante el uso del mismo enfoque, la secuencia del dominio variable de la cadena ligera 231-32-15 mostró una buena homología con los miembros de las subfamilias 3 y 4 kappa del dominio variable de la cadena ligera humana. Se observaron las homologías e identidades más altas tanto de las CDR como de secuencias marco para las secuencias de la línea germinal: IGKV4-1*01 (SEQ ID NO: 607) (79,2 % de identidad; 80 residuos de aminoácidos de 101) e IGKV3-7*02 (SEQ ID NO: 608) (64,4 % de identidad; 65/101).
Como punto de partida para el procedimiento de humanización, se generó una versión injertada con la CDR de VH 231-32-15 de ratón mediante el uso de IGHV1-2 humano*02 como aceptor de marco humano. Se realizaron varias mutaciones inversas en posiciones de residuos que pueden afectar las conformaciones de las CDR o el empaquetamiento de dominios intervariables y, por lo tanto, pueden ser estructuralmente importantes para mantener la actividad completa del anticuerpo. En el marco 1, el residuo Kabat H24 se mantuvo como ratón porque es un residuo canónico para la CDR1 (bucle de residuo de 5 aminoácidos de longitud según lo definido por Kabat). Es una Gly en la secuencia murina y una Ala en la línea germinal humana. En el marco 2, el residuo Kabat H48 se mantuvo en ratón porque se conoce como residuo Vernier (es decir, muy cerca de las CDR). Es una Ile en la secuencia murina y una Met en la línea germinal humana. En el marco 3, los residuos Kabat H67 y 73, que son residuos Vernier, se mantuvieron en el ratón. H67 es una Ala en la secuencia murina y Val en IGHV1-2 humano*02 línea germinal. H73 es Lys en la secuencia murina y Thr en IGHV1-2 humano*02 línea germinal. El residuo H71, que es un residuo canónico crítico para la CDR2, se ha mantenido en ratón (es un Arg en la línea germinal humana y una Val en la secuencia murina). El residuo Kabat H94, que es un residuo canónico para la CDR1, se ha mantenido en ratón (es un Arg en la línea germinal humana y una Lys en la secuencia de ratón). La secuencia humanizada final se denominó Versión VH A (SEQ ID NO: 206) y tenía una identidad del 79,6 % (78 residuos de aminoácidos de 98) con la línea germinal humana IGHV1-2*02.
Se generó una primera versión con injerto de la CDR del VL 231-32-15 de ratón mediante el uso de IGKV3-7 humano*02 como aceptor de marco humano. Se consideraron mutaciones inversas en varias posiciones de residuos y, como resultado, en el marco 3, el residuo Kabat L87 se mantuvo en el ratón ya que podría desempeñar un papel crítico en la interfaz VH/VL. L87 es una His en la secuencia murina y Tyr en IGKV3-7*02 línea germinal humana. La secuencia humanizada final se denominó Versión VK A1 (SEQ ID NO: 207) y tenía una identidad del 81,2 % (82 residuos de aminoácidos de 101) con la línea germinal humana IGKV3-7*02.
Se generó una segunda versión con injerto de la CDR del VL 231-32-15 de ratón mediante el uso de IGKV4-1*01 humano como aceptor de marco humano. Se consideraron mutaciones inversas en varias posiciones de residuos y, como resultado, en el marco 3, el residuo Kabat L87 se mantuvo como ratón ya que podría desempeñar un papel crítico en la interfaz VH/VL. L87 es una His en la secuencia murina y Tyr en la línea germinal humana IGKV4-1*01. La secuencia humanizada final se denominó Versión VK A2 (SEQ ID NO: 208) y tenía una identidad del 91,1 % (92 residuos de aminoácidos de 101) con la línea germinal humana IGKV4-1*01.
La Tabla 10 muestra los residuos (numeración de Kabat) que difieren entre los marcos de anticuerpos humanos y de ratón en las versiones injertadas con CDR de VH y VL de 231-32-15 de ratón descritas anteriormente.
Tabla 10: Comparación de 231-32-15 y el marco variable de cadena pesada del aceptor humano IGHV1-2*02 y el marco variable de cadena ligera aceptora humana IGKV4-1*01 y IGKV3-7*02.
6.2.3 Expresión de variantes humanizadas
Las regiones variables de IGHV1-2*02, IGK4-1*01 y IGK3-7*02 se sintetizaron por Life Technologies™ y se clonaron en vectores de expresión estándar (pPEP), como se describe más abajo. Estas construcciones se usaron posteriormente para transfectar células CHO y los anticuerpos expresados se probaron mediante el uso de tecnología de matriz de suspensión (sistema Luminex® 200, Millipore) y resonancia de plasmón de superficie (BIAcore®, GE Healthcare) como se describe más abajo. El término "región variable" en este ejemplo significa genes reordenados de VDJ para las cadenas pesadas IGHV1-2*02 y genes reorganizados VJ para las cadenas ligeras IGK4-1*01 y IGK3-7*02. El vector de expresión contenía un promotor de CMV, una región constante de inmunoglobulina, un elemento WPRE (elemento de respuesta postranscripcional) y una señal de poliadenilación de BGH. Se usaron tres variantes de vector de expresión diferentes para la clonación de la región variable IGHV1-2*02. Dos variantes del vector de expresión contenían diferentes regiones constantes de inmunoglobulina - IGHG1 e IGHG4 y la tercera variante del vector de expresión contenía un fragmento de IGHG1 para producir fragmentos Fab de anticuerpos. Las regiones variables de las cadenas ligeras IGK4-1*01 y IGK3-7*02 se clonaron en un vector de expresión que contenía la región constante de inmunoglobulina IGKC.
6.2.3.1 Clonación en vectores de expresión para la transfección de células CHO
Las regiones variables sintetizadas se clonaron en un vector de expresión de pPEP que contenía la región constante de inmunoglobulina apropiada. Para la clonación de regiones variables de cadena pesada de IGHV1-2*02, las construcciones 3592 (pPEP-InsX-Cg (iso3), 4192 (pPEP-InsX-IgG4) y 4215 (pPEP-InsX-Fab-Xa-6xHis) ("6xHis" descrito como SEQ ID NO: 36) se digirieron con HindIII /Eco47NI a 37 °C durante 4 horas. Después de la digestión, las bandas con un tamaño de 4.952 pb, 4.952 pb y 4.313 pb se purificaron en gel (Macherey & Nagel, NucleoSpin Gel y limpieza de la PCR). Para la clonación de regiones variables de cadena ligera kappa iGK4-1*01 y IGK3-7*02, la construcción 3593 (pPEP-Ins-Ck) se digirió con HindIII/Eco47III a 37 °C durante 4 horas y la banda con un tamaño de 4.474 pb se purificó en gel. Las regiones variables de anticuerpos sintetizadas se digirieron con HindIII/Eco47III a 37 °C durante 4 horas y las bandas con un tamaño de 422 pb (IGHV1-2*02) y 411 pb (IGK4-1*01 y IGK3-7*02) se purificaron en gel.
Las regiones de anticuerpos variables digeridas y purificadas (IGHV1-2*02, IGK4-1*01, IGK3-7*02) se ligaron en marco en vectores pPEP (50 ng) que contenían las regiones constantes de inmunoglobulina apropiadas. La ligadura se realizó durante la noche a 16 °C con una relación de vector a inserción de 1:3. La reacción de ligazón se sometió a electroporación en células DH10B (células electrocompetentes ElectroMax DH10B de E. coli, Invitrogen; 1.900 V/5 ms). A continuación, se sembraron en placa 5-50 j l de las bacterias electroporadas en placas de agar LB 100 |jg/ml de ampicilina. De cada construcción se recogieron aproximadamente 2-3 colonias y se cultivaron durante la noche.
De cada clon se realizó una preparación de plásmido de ADN a pequeña escala (Macherey & Nagel, NucleoSpin Plasmid). Se realizó una digestión para verificar la presencia y el tamaño correcto del inserto clonado con HindIII/Eco47III (H/E) y se usó un ApaLI (A) en la digestión para verificar la estructura correcta del vector. La integridad del vector se probó mediante la separación del ADN plasmídico sin cortar. De cada clon y ADN positivo, la preparación se escaló, se digirió el control y se secuenció mediante el uso el cebador 892-Je (Secuencia: 5 'gaccaatagaaactgggcttgtc 3'; SEQ ID NO: 705). Cada construcción recibió un número de construcción, como identificador único, y se preparó una reserva de glicerol.
Tabla 11: Caracterización de construcciones en vectores de expresión
6.2.3.2 Clonación en vectores de expresión retrovirales
Las regiones variables de IGHV1-2*02, IGK3-7*02 y IGK4-1*01 se sintetizaron por Life Technologeis™ y se clonaron en vectores de expresión retrovirales (pCMA). Estas construcciones se usaron posteriormente para transducir células preB y expresar anticuerpos en la superficie mediante el uso de tecnología Retrocyte Display®. El vector de expresión retroviral contenía LTR 5' y 3' basadas en MSCV, región constante de inmunoglobulina (IGHG1 o IGKC) que comprende la fracción de anclaje de membrana (IGHG1) y un gen marcador de superficie CD8.
Las regiones variables sintetizadas se clonaron en un vector de expresión retroviral que contenía la región constante de inmunoglobulina apropiada. Para la clonación de la región variable de la cadena pesada, se digirió la
construcción 3.956 (pCMA-InsX Cg (iso3) loxP2-I-tr_huCD8-loxP) con HindIII/Eco47III a 37 °C durante 4 horas y la banda de tamaño de 7.616 pb se purificó en gel. Para la clonación de las regiones variables de la cadena ligera kappa, se digirió la construcción 3.957 (pCMA-InsX Ck-I-tr_huCD8) con HindIII/Eco47III a 37 °C durante 4 horas y la banda de tamaño de 6.718 pb se purificó en gel. Las regiones variables del anticuerpo sintetizado se digirieron como se describe en la Sección 6.2.1 anterior.
Las regiones de anticuerpos variables digeridas y purificadas se ligaron en marco en vectores de expresión retrovirales (50 ng) que contenían las regiones constantes de inmunoglobulina apropiadas. La ligadura, la transformación y la verificación del clon se realizaron como se describe en la Sección 6.2.3.1 anterior. Las preparaciones de plásmido de ADN a mayor escala se secuenciaron mediante el uso del cebador 327-Je (Secuencia: 5 'ctcgatcctccctttatccag 3'; SEQ ID NO: 706). Cada construcción recibió un número de construcción, como identificador único, y se preparó una reserva de glicerol.
Tabla 12: Caracterización de construcciones en vectores de expresión retroviral
6.2.4 Expresión de anticuerpos recombinantes
Los anticuerpos recombinantes se expresaron mediante transfección transitoria de células FreeStyleCHO-S (Invitrogen, R800-07) en suspensión. Brevemente, la densidad celular se ajustó a 8 x 106 célula/ml en medio PowerCHO2 (Lonza, 12-771Q) suplementado con L-glutamina 4 mM (Biochrom, K 0283) y suplemento 1X HT (GIBCO, 11067-030). El ADN correspondiente a la cadena ligera del anticuerpo (2,5 pg/ml) y la cadena pesada (2,5 pg/ml) se añadió a la suspensión celular con ligera agitación. Después de la adición de ADN, la suspensión de células se complementó con 10 pl/ml de reactivo de transfección TransIT-Pro (MIRUS, MIR5700) y ácido valproico 0,5 mM (concentración final) (Sigma-Aldrich, P4543). La suspensión celular se incubó durante 6 días a 31 °C, CO2 al 8 % con agitación (200 rpm).
El sobrenadante del cultivo se recogió mediante centrifugación (9.000 g, 10 min a 10 °C) y se filtró a través de un filtro de 0,45 um. Se usó un dispositivo de ultrafiltración Vivaspin 20 (Sartorius, VS2032, MWCO 50 kDa) para concentrar el sobrenadante hasta un volumen final de 0,6 ml a 1.000 g, 10 °C durante aproximadamente 60 minutos. Para la purificación del anticuerpo recombinante, se equilibró una columna de proteína A HP Spin Trap (GE Healthcare, 28-9031-32) con tampón de unión (tampón fosfato 20 mM pH 7,0) y se cargaron 0,6 ml de concentrado. La columna se selló con una tapa y se incubó en un mezclador de extremo a extremo a temperatura ambiente. Después de 30 min, la columna se lavó 2 veces mediante la aplicación de 600 pl de tampón de unión y la posterior centrifugación a 100 g durante 1 minuto. El anticuerpo recombinante unido se eluyó de la columna de rotación añadiendo 400 pl de tampón de elución (glicina 100 mM, pH 2,0) y centrifugación a 100 g durante 1 minuto. Los eluidos se neutralizaron inmediatamente con 40 pl de tampón de neutralización (Tris-HCl 1 M, pH 9,0). El anticuerpo recombinante purificado se almacenó en tubos de proteína LoBind (Eppendorf, 0030 108.116) a 4 °C hasta su posterior procesamiento para estudios de caracterización.
Para la cuantificación, los sobrenadantes del cultivo celular y las muestras purificadas que contenían IgG humana se diluyeron en tampón de ensayo (Roche, 11112589001) y las diluciones se evaluaron por duplicado en una placa de 96 medios pocillos (Corning, 3884). En resumen, se incubaron muestras de 25 pl en la oscuridad (20 °C, 650 rpm) durante 1 hora con 5 pl que contenían 1.200 perlas Luminex-COOH cargadas mediante acoplamiento de amina con anti-IgG humana de cabra, fragmento F(ab')2 específico (Jackson ImmunoResearch, 109-006-09). Se generaron curvas estándar mediante el uso de duplicados de 25 pl de una serie de diluciones 1:3 (0,08 - 60 ng/ml) de molécula entera de IgG humana ChromPure (Jackson ImmunoResearch, 009-000-003). La detección se realizó mediante la adición de 30 pl de anti-IgG humana, específica de Fc etiquetada con R-PE (5 pg/ml; Jackson ImmunoResearch, 109-116-098) y una incubación adicional durante 1 hora. Las placas se leyeron y analizaron mediante el uso un instrumento Luminex® 200 (Millipore) mediante el uso los siguientes ajustes: 100 perlas, 50 pl de tamaño de muestra.
El control de calidad de las muestras purificadas incluyó el análisis por SDS-PAGE y la cromatografía de exclusión por tamaño (SEC) en HPLC. El análisis SDS-PAGE se realizó en condiciones reductoras y no reductoras en geles de poliacrilamida al 12 % y 8 %, respectivamente, siguiendo el protocolo de Laemmli (Laemmli UK (1970) Nature, 227(5259): 680-5). Se tiñeron geles de poliacrilamida con solución azul brillante Commassie para visualización. La SEC se realizó en un sistema Agilent Infinity 1.260 (Agilent Technologies) equipado con una bomba binaria, una
unidad de desgasificación, una unidad de muestreo automática y un detector de matriz de diodos UV. Para la separación se utilizó una columna Zenix-C 300 (tamaño de partícula de 3 |jm, 4,5 x 300 mm, Sepax, 233300-4630). Se cargaron 3 jg de cada muestra y se separaron en tampón fosfato 100 mM pH 7,0 (suplementado con NaCl 150 mM) a 0,35 ml/min durante 15 minutos y la detección fue a 220 nm.
6.2.5 Caracterización de variantes humanizadas
Las propiedades de unión de ambas variantes humanizadas (Hum231#1: IGHV1-2*02 y IGK3-7*02; Hum231#2: IGHV1-2*02 y IGK4-1*01) y el anticuerpo parental quimérico 231-32-15 se caracterizaron en varios ensayos como se describe más abajo.
6.2.5.1 Cuantificación y análisis de unión mediante tecnología de matriz de suspensión
El material purificado de ambas variantes humanizadas y el anticuerpo parental quimérico 231-32-15 se diluyó en tampón de ensayo (Roche 11112589001) 1:10.000 y 1:100.000. Brevemente, se incubaron 25 ul de cada dilución en la oscuridad (20 °C, 650 rpm) con 1.500 perlas Luminex® (en 5 ul de tampón de ensayo) durante 1 hora en placas de filtro de 96 medio pocillo (Millipore, MABVN1250). Las perlas Luminex® (Luminex Corp, #5 LC10005-01 y #14 LC10014-01) se acoplaron con anti-IgG humana (F(ab)2-específico, JIR, 105-006-097) o antígeno GITR (sistemas de R&D, homodímero unido por disulfuro; 689-GR) mediante acoplamiento de amina con la superficie de la perla de COOH. Se generaron curvas estándar mediante el uso de duplicados de 25 j l de la molécula completa ChromPure IgG (JIR 009-000-003) con una serie de diluciones 1:3 (0,08 - 540 ng/ml) para versiones de IgG-i. Para anticuerpos en formato de IgG4, se usó un estándar diferente: inmunoglobulina purificada (Sigma, 14639). La detección se realizó mediante el uso de 60 j l de anti-IgG humana F(ab)2 de cabra etiquetado con R-PE (2,5 jg/ml; JIR 109-116 098, kit de conjugación rápida de anticuerpos AbDSerotec RPE, LNK022RPE) y 1 hora de tiempo de incubación (20 °C, 650 rpm). Las placas se analizaron mediante el uso un sistema Luminex® 200 (Millipore). Se contaron un número de 100 perlas por pocillo en un volumen de muestra de 48 jl. Las afinidades relativas se calcularon en relación con los valores de MFI del anticuerpo 231-32-15 parental quimérico (fijado al 100 % de unión) y de acuerdo con los valores de IgG presentes en la muestra. Ambas variantes humanizadas mostraron afinidades relativas cercanas al 100 %.
6.2.5.2 Actividad de bloqueo de ligandos mediante el uso de tecnología de matriz de suspensión
Para determinar si los anticuerpos anti-GITR bloqueaban la unión del ligando (GITRL) a GITR, se realizó una configuración de ensayo de clasificación mediante el uso de tecnología de matriz de suspensión. Se añadieron 1.200 perlas Luminex® en 5 j l de tampón de ensayo (Luminex Corp, #14 LC10014-01) a cada pocillo de placas de media área de 96 pocillos (Corning, Inc., 3884). Las perlas se acoplaron con el antígeno GITR (sistemas de R&D, homodímero unido por di-sulfuro; 689-GR) mediante acoplamiento de amina con la superficie de la perla COOH. La reacción de acoplamiento se realizó mediante el uso de 50 jg/ml de antígeno GITR y 1 x 107 Perlas Luminex por ml. Se usó la química estándar del éster NHS para formar enlaces de carbodiimida entre los grupos amina primaria del antígeno y los grupos carboxilo en la superficie de la perla (libro de cocina de Luminex Xmap capítulo 3).
El acoplamiento de antígenos para proteínas es un procedimiento de carbodiimida simple de dos pasos durante el cual los grupos carboxilo de microesferas se activan primero con reactivo EDC (clorhidrato de 1-etil-3-[3-dimetilaminopropil]carbodiimida) en presencia de Sulfo-NHS (N-hidroxisulfosuccinimida) para formar un intermedio de sulfo-NHS-éster. El intermedio reactivo se reemplaza después por reacción con la amina primaria de la molécula diana (anticuerpo, proteína o péptido) para formar un enlace amida covalente. Las perlas acopladas se incubaron con diferentes concentraciones de anticuerpos anti-GITR (concentraciones de 9.000 ng/ml a 12 ng/ml en 25 j l de tampón de ensayo por pocillo) durante 1 hora a 20 °C y 650 rpm. Posteriormente, se añadieron a cada pocillo 30 pl de ligando GITR etiquetado con R-PE (concentración 1 nM; monomérico, sistemas de R&D 694-GF/CF), lo que dio un volumen total de pozo de 60 pl (1.200 perlas por pozo y una concentración final de 0,5 nM de GITRL etiquetado). El marcaje del ligando se realizó internamente mediante el uso de kits de marcaje de R-PE (AbDSerotec, LYNX Rapid RPE Antibody Conjugation Kit, LNK023RPE) de acuerdo con el protocolo del fabricante. Las placas se analizaron mediante el uso un sistema Luminex® 200 (Millipore). Se contaron un número de 100 perlas por pocillo en un volumen de muestra de 50 jl. El potencial de bloqueo del ligando se calculó mediante el uso los valores de MFI de la señal no competida (unión del 100 %) del control de ligando solamente. Una señal detectable de PE indicó la unión del ligando al antígeno.
En un primer ensayo, los anticuerpos anti-GITR parentales quiméricos 231-32-15 y m6C8 (documento WO 06/105021) así como un anticuerpo de control que reconoce IL-1p (SK48E26; publicación internacional núm. WO 95/001997) fueron probados. El anticuerpo m6C8 se generó en base a las regiones variables del anticuerpo 6C8 proporcionado en el documento WO 06/105021. La cadena pesada de m6C8 que comprende la secuencia de aminoácidos de la SEQ ID NO: 585. La cadena ligera de m6C8 que comprende la secuencia de aminoácidos de la SEQ ID NO: 586. Los resultados de este ensayo se muestran en la Figura 5, donde puede observarse que a concentraciones del anticuerpo 6C8 por encima de 333 ng/ml, no se detectó señal de PE y por lo tanto no se produjo unión de GITRL a GITR. Por el contrario, para el anticuerpo 231-32-15 parental quimérico, en todas las concentraciones ensayadas, se detectó una señal de PE que indica que GITRL todavía era capaz de unirse a GITR
cuando el anticuerpo 231-32-15 parental quimérico también estaba unido a GITR. Los datos que se muestran en la Figura 5 son de cuatro repeticiones de este ensayo, realizado por duplicado, con la desviación estándar calculada para n = 8.
En un segundo ensayo, se probó la unión de GITRL-PE a GITR en presencia del anticuerpo anti-GITR 231-32-15 parental quimérico y las variantes humanizadas Hum231#1 y Hum231#2. La Figura 6 muestra que estos tres anticuerpos anti-GITR cuando se unen a GITR, aún permiten la unión de GITRL a GITR y los tres anticuerpos muestran una actividad de bloqueo de ligando comparable.
6.2.5.3 Análisis cinético por resonancia de plasmón superficial
Se usó resonancia de plasmón de superficie para determinar la afinidad de las variantes humanizadas y el anticuerpo 231-32-15 parental quimérico (sistema mejorado de sensibilidad BIAcore® T100/T200 (GE Healthcare) y un ensayo de captura de Fab). Todas las interacciones se analizaron a 25 °C mediante el uso de 1xDPBS (PAA, H15-002) más P20 (0,05 %, Pierce, 28320) como tampón de ejecución. Los anticuerpos anti-GITR (8 pg/ml en tampón de ejecución) se capturaron en la superficie del chip de un chip sensor CM5 (GE Healthcare, Serie S CM5, BR-1005-30) mediante un anticuerpo Fab antihumano inmovilizado (GE Healthcare, Fab Kit de captura, 28958325). Para detectar interacciones inespecíficas del antígeno GITR, la captura de anticuerpos solo se realizó en la celda de flujo 2, mientras que en la celda de flujo 1 solo se inmovilizó el anticuerpo de captura. Además, un anticuerpo no relacionado (anti-IL-1p; SK48E26; publicación internacional núm. WO 95/001997) se usó para evaluar la especificidad de la unión de GITR. Después de la captura de los anticuerpos anti-GITR, se pasó el antígeno GITR (sistemas de R&D, homodímero unido por disulfuro; 689-GR) a través de ambas celdas de flujo en diferentes cantidades (40 nM, 10 nM y 2,5 nM) para cada anticuerpo. También se incluyó una curva en blanco (solo en búfer de ejecución) en cada ejecución. La asociación se ejecutó durante 90 segundos y la disociación durante 600 segundos con un caudal de 10 pl/min. Después de cada ejecución, se realizó una etapa de regeneración con glicina 10 mM pH 2,0 (GE Healthcare, BR-1003-55) durante 60 segundos con 30 pl/min. Las curvas de unión se evaluaron mediante el uso del software de evaluación BIAcore® T200 versión 2.0.1 con la aplicación de un modelo Langmuir 1:1 con ajuste global de Rmax.
A partir de estos valores, un valor de afinidad (Kd (M)) y los valores se muestran en la Tabla 13 más abajo. Las variantes humanizadas Hum231#1 y Hum123#2 mostraron tasas de activación mejoradas, pero tasas de desactivación disminuidas que dieron como resultado valores de Kd de 0,7 nM y 0,6 nM, respectivamente. El anticuerpo quimérico parental 231-32-15 tenía una afinidad de 2 nM.
Tabla 13: Resumen de tasas de entrada y salida y Kd (M) calculada
6.2.5.4 Análisis de bloqueo del ligando por resonancia de plasmón superficial
Se esperaba que ambas variantes humanizadas Hum231#1 y Hum231#2 mostraran la misma cinética de bloqueo de ligando que el anticuerpo quimérico parental 231-32-15. Esto se confirmó mediante el uso un ensayo de bloqueo de ligando medido por resonancia de plasmón de superficie (sistema mejorado de sensibilidad BIAcore® T100/T200 (GE Healthcare)).
En un primer experimento, se evaluó la unión del ligando de GITR al antígeno GITR inmovilizado. Se inmovilizó el antígeno GITR (sistemas de R&D, homodímero ligado por disulfuro; 689-GR) a alta densidad (4.371 RU) en un chip sensor CM5 (GE Healthcare, Serie S CM5, BR-1005-30). En otra célula de flujo de ovoalbúmina (1.289 RU, Pierce ThermoFisher 77.120) se inmovilizó para referencia. La inmovilización se realizó de acuerdo con un protocolo estándar del fabricante (GE Healthcare) para el acoplamiento de aminas (activación de la superficie con e Dc 0,4 M y NHS 0,1 M, kit de acoplamiento de aminas de g E Healthcare, BR-1000-50). Los grupos que no reaccionaron se inactivaron con etanol-amina-HCl 1 M, pH 8,5. Posteriormente, se pasaron dos ligandos de GITR (R&D de monómero, 694-GL y R&D de homotrímero unido no covalentemente, 6.987) a través de la superficie del chip en diferentes cantidades (500 nM, 250 nM y 125 nM) para determinar las condiciones de saturación. Se usó un tiempo de asociación de 240 segundos y un tiempo de disociación de 300 segundos con un caudal de 5 pl/min. La regeneración de la superficie del chip se realizó mediante el uso glicina 10 mM pH 2,0 (GE Healthcare, BR-1003-55) durante 60 segundos a 10 pl/min. Las condiciones de saturación más favorables se lograron con el ligando trimérico de GITR a 125 nM y, por lo tanto, esta configuración se usó con anticuerpos anti-GITR en la misma cantidad. En otro experimento, se usó la configuración inversa para que los anticuerpos anti-GITR (125 nM) se unieran primero al antígeno GITR en el chip y después se agregara el ligando GITR (trímero unido no covalentemente a 125 nM).
Como se muestra en la Figura 7, cuando se inmovilizó el antígeno GITR en el chip y se añadió GITRL en presencia de los anticuerpos anti-GITR, el anticuerpo quimérico 231-32-15, Hum231#1 y Hum231#2, se observó la unión de
GITRL. Por el contrario, no se observó unión de GITRL en presencia del anticuerpo anti-GITR m6C8. Estos datos indican que el anticuerpo quimérico 231-32-15, Hum231#1 y Hum231#2 no inhiben la unión de GITR humano a GITRL.
6.3 Ejemplo 3: Caracterización funcional de anticuerpos humanizados
Este ejemplo demuestra la capacidad de los anticuerpos anti-GITR humanizados generados por los procedimientos descritos anteriormente para funcionar como agonistas de GITR. El anticuerpo anti-GITR Hum231#2 comprende una cadena pesada que comprende la secuencia de aminoácidos de SEQ ID NO: 567 y una cadena ligera que comprende la secuencia de aminoácidos de la SEQ ID NO: 587. El anticuerpo Hum231#2 es un anticuerpo de IgG1 humana que contiene una sustitución T109S (es decir, sustitución de treonina por serina en la posición 109 relativa a la secuencia Fc de tipo salvaje), numerada según Kabat, en el dominio constante de cadena ligera, lo que facilita la clonación de la región variable en marco a la región constante. Esta mutación es una modificación conservadora que no afecta la unión o función del anticuerpo. También se generó la contraparte de tipo salvaje, denominada Hum231#2w, que contiene una treonina en la posición 109, numerada según Kabat. El anticuerpo Hum231#2w es un anticuerpo IgG1 humano que comprende una cadena pesada de SEQ ID NO: 567 y una cadena ligera de SEQ ID NO: 576.
Estos anticuerpos anti-GITR también se analizaron para determinar su capacidad de coestimular células T CD4+ o CD8+ humanas primarias. Este trabajo, como se describe en la Sección 6.3.1 a 6.3.3 y 6.3.7 más abajo, se realizó con materiales de múltiples donantes. Los leucocitos humanos usados en el cribado y la prueba de anticuerpos candidatos se obtuvieron del New York Blood Center (Ciudad de Nueva York).
La actividad funcional de los anticuerpos anti-GITR se demostró en las células T CD4 positivas enriquecidas (también conocido como CD4+), células T CD8 positivas (también conocidas como CD8+) y PBMC. Para los estudios de proliferación de células T humanas, se recolectaron y procesaron leucocitos empaquetados de donantes recién preparados mediante el uso de técnicas de cultivo de tejidos estériles. Los leucocitos se procesaron para recolectar células inmunes mononucleares (PBMC) por gradiente de densidad (Lymphocyte Separation Media, Corning). Las PBMC se encuentran en la capa de leucocitos del gradiente de densidad de Ficol.
Se prepararon células CD4 enriquecidas a partir de PBMC mediante selección negativa mediante el uso de RosetteSep® Human Cóctel de enriquecimiento de células T CD4+ (Stemcell Technologies, Vancouver, BC Canadá). Las preparaciones de células T CD4+ enriquecidas se separaron de los glóbulos rojos mediante centrifugación por densidad sobre medio de separación de linfocitos (Corning). Las células recolectadas se lavaron y se dividieron en alícuotas para su almacenamiento en nitrógeno líquido. Para tener en cuenta la variabilidad en la respuesta del donante a la estimulación, se usaron concentraciones variables de anti-CD3 para ajustar la capacidad de respuesta específica del donante. Por lo tanto, antes del cribado de anticuerpos anti-GITR, se evaluó la capacidad de las capas leucocíticas para la liberación y proliferación de citocinas en respuesta a la estimulación de c D3 con niveles titulados de anti-CD3 (clon SP34; b D Pharmingen; concentración que varía de 31,5 ng/ml a 250 ng/ml), con o sin anticuerpo 231-32-15 parental quimérico anti-GITR de referencia para establecer la proliferación de células T de referencia y su producción de citocinas y determinar las condiciones de estimulación apropiadas para cada capa leucocitaria donante.
6.3.1 Efecto de los anticuerpos anti-GITR agonistas sobre la proliferación de células T CD4+ estimuladas por anti-CD3
Se evaluó la actividad agonista de los anticuerpos anti-GITR mediante su coestimulación de las células T CD4+. La actividad agonista del anticuerpo 231-32-15 parental quimérico se comparó con las dos versiones humanizadas: Hum231#1 y Hum231#2. El ensayo de coestimulación se realizó de la siguiente manera: Para las condiciones de estimulación unida a placa, se recubrieron anticuerpos anti-CD3, anticuerpos anti-GITR y, cuando se indique, control de isotipo, sobre placas de cultivo de tejidos estériles de fondo plano o de fondo redondo durante dos horas y se eliminó el exceso de anticuerpos mediante lavado. Para condiciones de coestimulación soluble, se recubrió una placa con anticuerpo anti-CD3 mientras que se proporcionó en solución la coestimulación con anticuerpos anti-GITR. Los anticuerpos anti-GITR probados fueron Hum231#1 y Hum231#2, anticuerpo quimérico parental 231-32-15 (también conocido como REF-231) o controles de isotipo negativos (pAB1915). Además, para las condiciones de coestimulación soluble y unida a placa, también se proporcionaron en solución anticuerpo anti-CD28 (125 ng/ml; BD Pharmingen) y 10U de IL-2.
La proliferación celular se determinó al controlar la dilución del tinte de éster succinimidílico de diacetato de carboxifluoresceína (CFSE) dentro de las células divididas (Quah BJ y otros, (2007) Nat Protocols, 2(9): 2049-56). Las células T CD4+ enriquecidas se etiquetaron con CFSE 1-2 pM. Las células T CD4+ enriquecidas etiquetadas con CFSE se lavaron y después se estimularon con anti-CD3 unido a placa (125 ng/ml), anti-CD28 soluble (125 ng/ml) y 10 U de IL-2, junto con 5 pg/ml o 10 pg/ml de anti-GITR unido a placa anticuerpos o ningún anticuerpo. Se permitió que las células se dividieran durante 3 a 6 días en cultivo a 37 °C en función de la activación óptima de cada célula donante, momento en el que se recogieron los sobrenadantes de cultivo y las células de la placa.
Las Figuras 8A y 8B muestran un análisis FACS representativo de la proliferación de las células T CD4+ inducida por coestimulación con anticuerpos anti-GITR realizada por triplicado en la capa leucocitaria 6 y la capa leucocitaria 8, respectivamente. Estas figuras muestran el número de células (eje Y) y el nivel de fluorescencia emitido (eje X) por las células T CD4+ etiquetadas con CFSE. Se usaron 10 pg/ml de anticuerpos anti-GITR (parental quimérico 231-32 15 (REF 231-32-15), Hum231#1 y Hum231#2). La proliferación de células T CD4+se muestra por un mayor porcentaje de células con un nivel disminuido de fluorescencia emitida por CFSE (CFSE bajo). Las Figuras 8A y 8B ilustran que los anticuerpos anti-GITR (parental quimérico 231-32-15 (REF 231-32-15), Hum231#1 y Hum231#2) demostraron actividad agonista cuando se agregaron a células activadas con concentraciones subóptimas de anti-CD3 anticuerpo tanto para células de alta respuesta (capa leucocitaria 6, Figura 8A) como incluso para células de baja respuesta (capa leucocitaria 8; Figura 8B).
Las Figuras 9A y 9B son gráficos de histograma de los resultados representativos del estudio anterior para anticuerpos anti-GlTR unidos a placa (anticuerpo quimérico parental 231-32-15, Hum231#1, Hum231#2 y m6C8) a una concentración de 10 pg/ml. En el ejemplo mostrado en la Figura 9A, la coestimulación con Hum231#1 o Hum231#2 indujo la proliferación de células T CD4+ a 10 pg/ml. Aproximadamente más del 50 % de la proliferación de las células T CD4+ (células CFSE bajas) cuando se coestimularon con 10 pg/ml de Hum231#1 o Hum231#2. En contraste, bajo estimulación anti-CD3/anti-CD28 sin coestimulación mediada por anticuerpos anti-GITR, solo aproximadamente el 35 % de las células T CD4+ proliferaron (células bajas CFSE). La Figura 9B ilustra que la adición de coestimulación anti-GITR a la estimulación mediada por anti-CD3/anti-CD28 también provocó un aumento en el número absoluto de las células T CD4+ en cultivo durante 5 días en comparación con la estimulación con anti-CD3/anti-CD28 solo. Por ejemplo, la estimulación con anti-CD3/anti-CD28 junto con 10 pg/ml de anticuerpo quimérico parental 231-32-15 (REF 231) provocó la expansión, inducida por la coestimulación del GITR de las células T CD4+, de los números de 7,5 x 104 hasta 12,0 x 104
Además, la coestimulación mediada por Hum231#1 a 10 pg/ml también indujo la expansión de células T CD4+ de 7,5 x 104 hasta 11,5 x 104 A una concentración de anticuerpo de 10 pg/ml, la coestimulación por Hum231#2 también indujo la proliferación de células T CD4+ de 7,5 x 104 hasta 10,6 x 104 En particular, la coestimulación de las células T c D4+ con 10 pg/ml de m6C8 (publicación internacional núm: WO 06/105021) no provocó aumentos adicionales en el número absoluto de células después de 5 días de cultivo sobre el observado con la estimulación anti-CD3/anti-CD28 sola.
6.3.2 Efecto de los anticuerpos anti-GITR agonistas sobre la producción de citocinas de células T CD4+ inducida por anti-CD3
Como evidencia adicional de la actividad coestimuladora agonista de los anticuerpos anti-GITR, las citocinas (IFNy, IL-6, TNFa e IL-10) liberadas por las células T CD4+ se midieron mediante ELISA multiplex (Flowcytomix, ELISA de citocinas basado en perlas FACS, eBioscience). Los sobrenadantes recolectados de los ensayos de proliferación se recogieron y se usaron para el análisis de citocinas. Las Figuras 10A a 10D muestran el efecto de 10 pg/ml o 5 pg/ml de anticuerpos anti-GITR parentales quiméricos 231-32-15, Hum231#1 o Hum231#2 sobre la producción de citocinas por células T CD4+ humanas. La adición de 10 pg/ml o 5 pg/ml de anticuerpo quimérico parental 231-32-15, Hum231#1 o Hum231#2 a células T estimuladas con anti-CD3/anti-CD28 aumentó significativamente la producción de IFNy, TNFa, IL -10 e IL-6 en comparación con el estímulo anti-CD3/anti-CD28 solo. No se observó actividad coestimuladora para los anticuerpos anti-GITR agonistas en ausencia de estímulo anti-CD3/anti-CD28.
6.3.3 Titulación de clones 231-32-15 humanizados
Para evaluar el intervalo de concentraciones de anticuerpos anti-GITR que inducen la proliferación de células T y la producción de citocinas, las células T CD4+ enriquecidas se estimularon con 125 ng/ml anti-CD3/anti-CD28 y se coestimularon con anticuerpos anti-GITR parentales quiméricos unidos a placa titulados 231-32-15, Hum231#1 o Hum231#2. El resultado mostrado en la Figura 11 indica que la coestimulación parental quimérica 231-32-15, Hum231#1 y Hum231#2 a una concentración de 10 pg/ml, 5 pg/ml o 2,5 pg/ml induce la proliferación de células T según se controla mediante dilución de CFSE. Además, en ausencia de cualquier estímulo anti-CD3/anti-CD28, los anticuerpos anti-GITR no estimulan la proliferación de las células T CD4+.
La Figura 12A muestra que la estimulación anti-CD3/anti-CD28 y la coestimulación con anticuerpos anti-GITR (parental quimérico 231-32-15, Hum231#1 o Hum231#2) en un intervalo de concentraciones (10 pg/ml, 5 pg/ml o 2,5 pg/ml) de producción de células T CD4+ mejorado de IFNy. Notablemente, en ausencia de estimulación anti-CD3/anti-CD28, los anticuerpos anti-GITR (parental quimérico 231-32-15, Hum231#1 o Hum231#2) no indujeron la producción de IFNy.
Para examinar más a fondo la actividad funcional de los anticuerpos anti-GITR parentales quiméricos 231-32-15, Hum231#1 o Hum231#2 en solución, las células T CD4+ enriquecidas se estimularon con 125 ng/ml de anti-CD3/anti-CD28 y se coestimularon con anticuerpos anti-GITR solubles titulados. Los anticuerpos anti-GITR solubles Hum231#1 o Hum231#2 también coestimulan la producción de células T CD4+ de IFNy, como se muestra en la Figura 12B.
6.3.4 Efecto del anticuerpo anti-GITR agonista sobre la producción de citocinas de PBMC inducida por anti-CD3 En este ejemplo, se examinó la producción de citocinas inducida por coestimulación con el anticuerpo anti-GITR Hum231#2 mediante el uso PBMc . Las PBMC aisladas mediante gradiente de ficoll de capas leucocíticas de donantes sanos (Research Blood Components, LLC) se almacenaron en nitrógeno líquido y se descongelaron el día del experimento. Las células se resuspendieron en medio de cultivo celular (RPMI FBS al 10 % 20 U/ml de IL-2) y se añadieron a placas de cultivo de 96 pocillos que contenían anticuerpo anti-CD3 unido a la placa en varias concentraciones subóptimas (0,3-5 pg/ml) y 5 pg/ml de anticuerpo anti-GITR unido a placa o un anticuerpo IgG1 de control de isotipo. Las muestras se incubaron durante 4 días a 37 °C y CO2 al 5 % y los sobrenadantes del cultivo celular se recogieron el día 2 y el día 4. Las muestras se analizaron mediante el uso del kit V-PLEX Proinflammination Panell (humano) (Meso Scale Discovery) para medir las citocinas secretadas (IFNy, IL-2, TNFa, IL-10, IL-13 e IL-4) de acuerdo con las instrucciones del fabricante.
Como se muestra en la Figura 13, la coestimulación con el anticuerpo anti-GITR unido a placa Hum231#2 indujo la secreción de múltiples citocinas en PBMC de dos donantes diferentes.
6.3.5 Efecto de los anticuerpos anti-GITR agonistas sobre la producción de citocinas medida por tinción de citocinas intracelulares
La actividad agonista de Hum231#2 sobre la producción de citocinas se analizó adicionalmente mediante tinción de citocinas intracelulares. Las PBMC aisladas mediante gradiente de ficoll de capas leucocíticas de donantes sanos (Research Blood Components, LLC) se almacenaron en nitrógeno líquido y se descongelaron el día del experimento. Las células se resuspendieron en medio de cultivo celular (RPMI FBS al 10 % 20 U/ml de IL-2) y se añadieron a placas de cultivo de 96 pocillos que contenían anticuerpo anti-CD3 unido a la placa en varias concentraciones subóptimas (0,3-5 pg/ml) y 5 pg/ml de anticuerpo anti-GITR unido a placa o un anticuerpo IgG1 de control de isotipo. Las muestras se incubaron durante 3-4 días a 37 °C y CO2 al 5 %. Después de la activación, para inhibir el transporte de proteínas intracelulares, las células se trataron con Brefeldin A (BD Biosciences) según las instrucciones del fabricante y las muestras se incubaron durante 6 horas a 37 °C y CO2 al 5 %. Después de la incubación, las células se tiñeron con un tinte de amina de viabilidad FITC (tecnologías Life) para teñir las células muertas. Después de lavar con tampón FACS frío (1 x PBS FBS al 2 %, pH 7,2), un cóctel de anticuerpos que contiene anticuerpos contra CD3 (APC Cy7, SP34,2), CD4 (PercP Cy5,5, L200) y CD8a (PE Cy7, SK1) diluido en tampón FACS frío se añadió a cada muestra y se incubó durante 10 minutos a 4 °C. Las células se fijaron y se permeabilizaron con Cytofix-Cytoperm (BD Biosciences) para tinción intracelular de acuerdo con las instrucciones del fabricante. Las PBMC se tiñeron con anticuerpos contra IFNy (Alexa647, B27) y TNFa (PE, Mab11) y se incubaron a temperatura ambiente durante 10 minutos. Las muestras se lavaron mediante el uso 1 x tampón de lavado Perm (BD Biosciences) y se adquirieron mediante el uso de un citómetro de flujo FACScanto (BD Biosciences). Los gráficos de citometría de flujo se analizaron mediante el uso del software Flojo. Los diagramas y gráficos de citometría de flujo son representativos de experimentos que usan las PBMC de seis donantes diferentes. El anticuerpo GITR Hum231#2 demostró actividad coestimuladora en células T humanas, induciendo células T monofuncionales IPNy +, células T monofuncionales TNFa así como células T polifuncionales IFNy + TNFa en un rango de concentraciones de anticuerpos anti-CD3 subóptimas (Figuras 14A y 14B).
A continuación, Hum231#2w, que es un anticuerpo IgG1 humano, se convirtió en un anticuerpo IgG4 humano llamado pab1989. El anticuerpo pab1989 comparte la misma región variable de cadena pesada y la misma cadena ligera que Hum231#2w, pero comprende una región constante de IgG4 humana. El anticuerpo pab1989 comprende una secuencia de cadena pesada de SEQ ID NO: 554 y una secuencia de cadena ligera de la s Eq ID NO: 576. El anticuerpo IgG4 pab1989 se ensayó en paralelo con el anticuerpo IgG1 Hum231#2w en el experimento de tinción de citocinas intracelulares descrito anteriormente. El anticuerpo anti-CD3 se utilizó a 0,7, 0,8 y 0,9 pg/ml y los anticuerpos anti-GITR a 5 pg/ml. Las muestras se incubaron durante 3-4 días a 37 °C y CO2 al 5 %. Como se muestra en la Figura 14C, pab1989 exhibió una actividad agonista similar a Hum231#2w, al inducir células T CD4+ polifuncionales IFNy+ TNFa+ y células T CD4+ monofuncionales TNFa+. Los gráficos son representativos de experimentos que usan las PBMC de cuatro donantes diferentes.
6.3.6 Efecto de la reticulación sobre la actividad agonista del anticuerpo anti-GITR
Se examinó el efecto de la reticulación sobre la actividad funcional del anticuerpo anti-GITR Hum231#2 mediante el uso PBMC estimuladas con anti-CD3.
Se probó Hum231 # 2 unido a placa o soluble para la inducción de células T polifuncionales de IFNy+ TNFa+ en un ensayo de estimulación de CD3 subóptimo como se describe en la Sección 6.3.5. Como se muestra en la Figura 15A, solo Hum231#2 unido a placa, pero no soluble, aumentó el porcentaje de células T CD8+ polifuncionales IFNy+ TNFa+, en comparación con el control de isotipo.
Se repitió el ensayo de secreción de citoquinas de PBMC como se describe en la Sección 6.3.4 para Hum231#2 o Hum231#2 unidos a placa reticulados con un anticuerpo anti-Fc. El sobrenadante del cultivo se recogió el día 4 para medir las citocinas secretadas (IFNy, IL-2, TNFa, IL-10, IL-13 e IL-4). Coestimulación con secreción de citocina inducida por Hum231#2 unida a placa (Figura 15B) o anti-Fc reticulado (Figura 15C).
6.3.7 Actividad de los clones humanizados 231-32-15 en la capa leucocitaria 8 (BC8) y medición de células T efectoras o células T reguladoras
En este ejemplo, los efectos de los anticuerpos anti-GITR agonistas sobre células T efectoras CD4+ o células T reguladoras CD4+ se midieron las células T reguladoras controlando su proliferación. Las células T CD4+ enriquecidas se marcaron con CFSE y se estimularon con 125 ng/ml de anticuerpo anti-CD3 unido a placa. Las células T CD4+ enriquecidas y proliferadas se controlaron mediante dilución de CFSE después de 5 días en cultivo. Las células T efectoras CD4+ o la población de células T reguladoras dentro de la población de células T CD4+ se muestra en las Figuras 16A y 16B se identificó mediante tinción por citometría de flujo mediante sus marcadores de superficie celular. Las células efectoras T CD4+ se caracterizaron como CD25+, CD45RA- CD127Medio/Baj° y Foxp3Neg/Bajo Las células T reguladoras CD4+ se identificaron como CD4+, CD25+, CD45RA-, CD127Bajoy Foxp3Alto La tinción FACS se realizó de acuerdo con la Tabla 14 más abajo:
Tabla 14: Panel de tinción FACS
Los resultados del ensayo de estimulación se muestran en los gráficos FACS de las Figuras 16A y 16B. Gating en Treg CD4+ (CD4+, CD25+, CD45RA', CD127Bajo y Foxp3Alto) o CD4 activado+ células efectoras T (CD25+, CD45RA', CD127Medi°/Baj° y Foxp3Neg/Baj°) muestra que la estimulación anti-CD3/anti-CD28 de 125 ng/ml sola y junto con la coestimulación anti-GlTR regulaba positivamente la expresión de GITR tanto en células T efectoras como reguladoras.
La Figura 16A representa el análisis FACS de células T efectoras y reguladoras. Ambos tipos de células expresaron GITR en su superficie celular después de la estimulación con anti-CD3 solo o junto con anticuerpos anti-GITR. Sin embargo, la coestimulación con anticuerpos anti-GITR expande preferentemente las células efectoras T sobre las células T reguladoras, lo que conduce a un aumento de la relación Teff/Treg (Figura 16B).
Como evidencia adicional de la actividad agonista de los anticuerpos anti-GITR en las células T en el contexto de la inmunidad celular, se evaluaron las respuestas de las células T después de la estimulación de las PBMC.
La estimulación de PBMC se tituló mediante el ajuste de la proliferación inducida por anti-CD3 en PBMC. En las Figuras 17A y 17B se ilustran PBMC marcadas con CFSE estimuladas con 31,25 ng/ml de anti-CD3/anti-CD28 unido a placa junto con anticuerpos anti-GITR unidos a placa o control de isotipo. Como control positivo de la actividad de los anticuerpos anti-GITR, se utilizó la misma condición de estimulación para estimular las células T CD4+ enriquecidas (datos no mostrados).
Las células T CD4+ o CD8+ en la población de PBMC se identificaron por su tinción con anti-CD3 y anti-CD4 o anti-CD3 y anti-CD8. El Análisis FloJo (Tree Star, Inc.) de muestras FACS adquiridas seleccionadas en células T CD4+CD3+ o células T o CD8+CD3+ mostraron anti-GITR parental quimérico 231-32-15 (REF 231), los anticuerpos Hum231#1 y Hum231#2 estimularon la proliferación de células T (% CFSE bajo). En particular, el experimento representado en la Figura 17B reveló que los anticuerpos parentales quiméricos anti-GITR 231-32-15 (REF 231), Hum231#1 y Hum231#2 tienen actividad sobre las células T CD8+.
6.3.8 Efecto de los anticuerpos anti-GITR agonistas en la línea celular indicadora de GITR NF-KB-luciferasa Se diseñó una línea celular indicadora de GITR NF-KB-luciferasa humana (Promega) para sondear la actividad coestimuladora de anticuerpos agonistas anti-GITR. Se ha informado que la activación de GITR por anticuerpo agonista anti-GITR o ligando GITR activa NF-kB (Snell LM y otros, (2010) J Immunol 185: 7223-7234; Bulliard Y otros, (2013) J Exp Med 210: 1685-1693; Yu KY y otros, (2003) Biochem Biophys Res Commun 310: 433-438). Como tales, las células Jurkat se modificaron genéticamente para expresar de manera estable la construcción GloResponse NF-KB-luc2P y GITR humano. Las células informadoras se resuspendieron en medio de ensayo (RPMI FBS al 1 %) y se incubaron con diversas concentraciones (12,5, 10, 5, 2,5, 1,25 y 0,625 pg/ml) de anticuerpos anti-GITR unidos a placa Hum231#2w, m6C8 o un control de isotipo IgG1 en ausencia o presencia de 0,3 pg/ml de un
anticuerpo anti-CD3 unido a placa (Clon SP34). Las placas incubadas con el anticuerpo anti-CD3 se leyeron después de 6 o 18 horas de incubación. Las placas sin el anticuerpo anti-CD3 se leyeron después de 2, 5, 6, 8 o 18 horas de incubación. Después de la incubación, las placas se equilibraron a temperatura ambiente y después se añadió un volumen igual de reactivo Bio-Glo (Promega) a temperatura ambiente. La luminiscencia se leyó mediante el uso un lector de etiquetas múltiples EnVision 2100.
Para el ensayo con el anticuerpo anti-CD3, se representó gráficamente el RLU de luciferasa a las 18 horas después de la estimulación para cada concentración de anticuerpo ensayada (Figura 18A). De manera similar, para el ensayo sin el anticuerpo anti-CD3, la Figura 18B es un gráfico que muestra las unidades de luz relativa de luciferasa (RLU) a las 5 horas después de la estimulación para diversas concentraciones de anticuerpos ensayadas. En la Figura 18C, se muestran las proporciones más altas de expresión de luciferasa (GITR Ab/control de isotipo) sin el anticuerpo anti-CD3, entre varias concentraciones de anticuerpo ensayadas, a las 0, 2, 5, 6, 8 y 18 horas después de la estimulación. Los datos mostrados son representativos de cuatro experimentos con el anticuerpo anti-CD3 o dos experimentos sin el anticuerpo anti-CD3.
En presencia del anticuerpo anti-CD3, aunque m6C8 mostró una actividad agonista más fuerte a las 6 horas (datos no mostrados), a las 18 horas posteriores a la estimulación, Hum231#2w y m6C8 indujeron una activación similar de la línea celular informadora GITR (Figura 18A). Sin embargo, en ausencia del anticuerpo anti-CD3, sólo Hum231#2w, pero no m6C8 indujo la activación de la línea celular indicadora de GITR (Figura 18B).
6.3.9 Efecto del anticuerpo anti-GITR agonista sobre la línea celular indicadora del receptor IIIA de Fc gamma (CD16)
En este ejemplo, se examinó la expresión del GITR humano por células nTreg activadas y células efectoras T. Las PBMC aisladas de donantes sanos se enriquecieron en células T CD3+ (Teff) o células T CD4+CD25+CD45RA+ (nTregs) mediante el uso de técnicas de separación de base magnética. A continuación, los linfocitos T se activaron con perlas de expansión CD3-CD28 con 500 U de rIL-2 durante 4 días y 50 U de rIL-2 durante 5 días más. La cuantificación del receptor GITR se determinó mediante citometría de flujo mediante la activación de CD4+ y CD8+ Teff versus nTreg. Se procesaron simultáneamente perlas de Quantibrite (BD Biosciences) y se usaron para cuantificar la densidad de la superficie del receptor de GITR.
Como se muestra en la Figura 19A, la expresión de superficie de GITR humano en células nTreg activadas el día 9 (y todos los puntos de tiempo evaluados) fue mayor que la de las células efectoras T CD4+ o CD8+ activadas.
A continuación, la capacidad del anticuerpo anti-GITR Hum231#2w para co-activar GITR y señalizar vía la activación de los receptores Fc gamma se evaluó mediante el uso una línea celular indicadora que expresaba el receptor Fc gamma IIIA (CD16) junto con células efectoras T activadas (Teff) o nTreg, generadas como se describe. Se incubaron células Teff o nTreg expandidas con diferentes dosis de Hum231#2w o un control de isotipo IgG1. Se añadieron a las muestras células indicadoras de Jurkat NFAT-luciferasa que sobreexpresan CD16 (polimorfismo 158 V/V). La unión del complejo anticuerpo/antígeno, en el que el antígeno se ubica en la superficie de las células diana, a CD16 envía señales a la construcción promotor/reportero de las células efectoras y da como resultado la transcripción del gen de luciferasa. Las placas se incubaron durante 20 horas a 37 °C y 5 % de CO2. Después de esta incubación, el reactivo del ensayo de luciferasa Bio-Glo (Promega) se descongeló a temperatura ambiente y se añadieron 75 pl a cada pocillo de las placas de ensayo blancas de 96 pocillos. En 5-10 minutos, se midió la luminiscencia. Se restó la luminiscencia de fondo (pocillos exteriores blancos) de cada lectura de muestra y se registraron las unidades relativas de luz (RLU) ajustadas. A RLU representa el RLU del anticuerpo anti-GITR menos el del control de isotipo.
De acuerdo con la expresión de GITR de superficie diferencial entre nTregs activados y células efectoras T CD4+ o CD8+ activadas (Figura 19A), el anticuerpo anti-GITR Hum231#2w activaba preferentemente CD16 cuando se unía a células nTreg activadas (Figura 19B).
Para evaluar si la sobreexpresión de GITR era una característica de las células T reguladoras ubicadas dentro del microambiente tumoral, se comparó la expresión de GITR en células T aisladas de la sangre de donantes humanos sanos (Figura 19C, ac, n = 3) o de tejidos tumorales de no pequeños pacientes con cáncer de pulmón celular (NSCLC) (Figura 19C, gl, n = 3). Para eliminar la unión de fondo de los anticuerpos a las poblaciones inmunes, todas las células se incubaron con anticuerpo CD16/32 purificado (10 pg/ml, 20 minutos a temperatura ambiente) antes de la adición de anticuerpos intracelulares y de superficie celular. Después del bloqueo de FcR, todas las muestras se incubaron con anticuerpo anti-GITR conjugado con APC (clon 110416, sistemas de R&D) o control de isotipo y un cóctel de linaje de anticuerpos de superficie celular (CD3-FITC, CD25-PECy7, CD4-BV650 y CD8a-PE) durante 45 minutos en hielo (1 pg/ml cada uno), se lavó tres veces con tampón FACS (PBS, EDTA y BSA al 0,5 %), seguido de fijación/permeabilización e incubación con FOXP3 conjugado con azul del Pacífico (fix/perm e incubación cada 45 minutos en hielo, 1 pg/ml). Las muestras teñidas se analizaron después mediante el uso de un citómetro de flujo LSRFortessa (BD Biosciences). Las poblaciones de células en la Figura 19C se definieron como: Tconv (CD3+, CD4+, CD8a-, CD25low, FOXP3-) o Treg (CD3+, CD4+, CD8a-, CD25high, FOXP3+).
Como se demuestra en la Figura 19C, la expresión de superficie de GITR fue máxima en células T reguladoras aisladas de los tejidos tumorales de pacientes con NSCLC, con un nivel detectable pequeño o nulo en células Treg o T convencionales de donantes sanos.
6.3.10 Efecto del anticuerpo anti-GITR agonista sobre la producción de citocinas de células T del mono verde africano
Para probar la reactividad cruzada de especies, se evaluó la unión de Hum231#2 a GITR del mono verde africano (AGM). Brevemente, se descongelaron y contaron las PBMC (primates mundiales) de AGM. Las PBMC se resuspendieron en medio de cultivo celular (RPMI FBS al 10 %) y se estimularon con un anticuerpo anti-CD3 (clon SP34.2, BD) o ConA (Sigma) más IL-2 (20 U/ml) durante 3 días a 37 °C y CO2 al 5 %. Después de la activación, las células se tiñeron con tinte de amina FITC (Life Technologies) durante 15 minutos a temperatura ambiente. Las células se lavaron con tampón FACS frío (1 X PBS FBS al 2 %, pH 7,2) y un cóctel de anticuerpos diluido en tampón FACS frío que contenía anticuerpos contra CD3 (APC Cy7, s P34.2), CD4 (PercP, L200), Se añadieron CD8 (PE Cy7, SK1) y PD-1 (PE, EH12.2H7) y se incubaron durante 10 minutos a 4 °C. Las células se lavaron y se incubaron con 2,5 |jg por pocillo de Hum231#2 o control de isotipo IgG1 durante 10 minutos a 4 °C. Las células se lavaron y después se tiñeron con un anticuerpo secundario anti-Fc F(ab')2 conjugado con Alexa647 durante 10 minutos a 4 °C. Las células se lavaron y fijaron con paraformaldehído al 1,6 % antes de la adquisición mediante el uso de un citómetro de flujo FACSCanto (BD Biosciences). Los archivos FACS se analizaron mediante el uso del software FACS DIVA.
Como se muestra en la Figura 20A, el anticuerpo anti-GITR Hum231#2 se une a las células T AGM CD4+ y CD8+ activadas. Las células T no estimuladas de AGM no expresan niveles de línea base de GITR y los niveles de GITR en la superficie celular se regulan positivamente con la activación de las células T. Las gráficas que se muestran en la Figura 20A son representativas de experimentos que usan PBMC de tres AGM diferentes.
A continuación, se realizó un ensayo de subestimulación de CD3 mediante el uso PBMC de mono verde africano (AGM) para examinar la actividad agonista de Hum231#2w. Se aislaron PBMC humanas (Research Blood Components, LLC) o AGM (Primates mundiales) mediante gradiente de ficoll de donantes sanos y se almacenaron en nitrógeno líquido y se descongelaron el día del experimento. Las células se resuspendieron en medio de cultivo celular (RPMI FBS al 10 % 20 U/ml de IL-2) y se añadieron a placas de cultivo de 96 pocillos que contenían anticuerpo anti-CD3 unido a la placa (0,8 ug/ml) y varias concentraciones (2, 4, 5, 6 y 9 jg/ml) de anticuerpo anti-GITR unido a placa o un anticuerpo IgG1 de control de isotipo. Las muestras se incubaron durante 4 días a 37 °C y CO2 al 5 %. Después de la activación, para inhibir el transporte de proteínas intracelulares, las células se trataron con Brefeldin A (Bd Biosciences) según las instrucciones del fabricante y las muestras se incubaron durante 6 horas a 37 °C y CO2 al 5 %. Después de la incubación, las células se tiñeron con un tinte de amina de viabilidad FITC (tecnologías Life) para teñir las células muertas. Después de lavar con tampón FACS frío (1 x PBS FBS al 2 %, pH 7,2), un cóctel de anticuerpos que contiene anticuerpos contra CD3 (APC Cy7, SP34,2), Cd4 (PercP Cy5,5, L200) y CD8a (PE Cy7, SK1) diluido en tampón FACS frío se añadió a cada muestra y se incubó durante 10 minutos a 4 °C. Las células se fijaron y se permeabilizaron con Cytofix-Cytoperm (BD Biosciences) para tinción intracelular de acuerdo con las instrucciones del fabricante. Las PBMC se tiñeron con anticuerpos contra IFNy (Alexa647, B27) y TNFa (PE, Mab11, solo para PBMC humanas) y se incubaron a temperatura ambiente durante 10 minutos. Las muestras se lavaron mediante el uso 1 x tampón de lavado Perm (BD Biosciences) y se adquirieron mediante el uso de un citómetro de flujo FACScanto (BD Biosciences). Los gráficos de citometría de flujo se analizaron mediante el uso del software Flojo.
Como se muestra en las Figuras 20B y 20C, la coestimulación con el anticuerpo anti-GITR Hum231#2w induce la producción de IFNy por las células T CD8+ del AGM. Los diagramas y gráficos de citometría de flujo son representativos de experimentos que usan las PBMC de dos AGM.
6.3.11 Efecto de la unión simultánea del ligando de GITR humano recombinante y los clones 231-32-15 humanizados en células T CD4+ estimuladas con anti-CD3
Un anticuerpo anti-GITR agonista que no previene la unión de GITR al ligando de GITR (GITRL) puede resultar en una respuesta inmune mejorada, caracterizada por aumentar la proliferación y/o la función efectora de las células T efectoras y/o regular negativamente la función supresora de células T reguladoras.
Los anticuerpos anti-GITR, solos o en combinación con GITRL humano recombinante, se prueban para determinar su actividad agonista en las células T CD4+. Las células T CD4+ enriquecidas se etiquetan con CFSE 1-2 jM, se lavan y después se estimulan con anti-CD3 unido a placa (125 ng/ml), anti-CD28 soluble (125 ng/ml) y 10 U de IL-2, junto con 10 jg/ml parental quimérico 231-32-15, 10 jg/ml de Hum231#1, 10 jg/ml de Hum231#2, 10 jg/ml de GITRL, una combinación de 10 jg/ml de anticuerpo quimérico parental 231-32-15 con 10 jg/ml de GITRL, una combinación de 10 jg/ml de Hum231#1 con 10 jg/ml de GITRL, o una combinación de 10 jg/ml de Hum231#2 con 10 jg/ml de GITRL, a 37 °C durante 3 a 6 días. A continuación, se recogen de las placas los sobrenadantes de cultivo y las células. La proliferación celular y la liberación de citocinas se examinan como se describe en las Secciones 6.3.1 y 6.3.2, respectivamente. Los efectos de la unión simultánea de anticuerpos anti-GITR y GITRL en
células T efectoras CD4+ o células T reguladoras CD4+ pueden someterse a pruebas adicionales como se describe en la Sección 6.3.7. Este estudio puede mostrar un efecto sinérgico o aditivo entre GITRL y anticuerpos anti-GITR (parental quimérico 231-32-15, Hum231#1 y Hum231#2) en la mejora de las respuestas inmunes.
Como alternativa al uso de GITRL humano recombinante soluble para ensayar la actividad coagonista en combinación con los anticuerpos anti-GITR descritos en la presente memoria, también es posible usar células presentadoras de antígeno que se inducen a expresar GITRL. Estas APC inducidas pueden cultivarse con células T efectoras CD4+ o células T reguladoras CD4+, como se describió anteriormente, en presencia o ausencia de los anticuerpos anti-GITR y la función de las células T evaluada. Para inducir la expresión de GITRL, las células presentadoras de antígeno, como los macrófagos o las células dendríticas, se incuban con un ligando TLR4 (por ejemplo, LPS) durante 1, 2, 4, 6 o 12 horas como se describe, por ejemplo, in Tone M y otros, (2003) PNAS 100: 15.059-15.064; o con partículas completas de p-glicanos (WGP) purificadas de la pared celular de Saccharomyces cerevisiae durante 6, 12, 24, 48 o 72 horas, como se describe, por ejemplo, en Tian J y otros, (2012) PLoS One, 7(10): e46936.
6.3.12 Efecto del anticuerpo anti-GITR agonista sobre la expresión de superficie de OX40 y PD-1 en células T En este ejemplo, el anticuerpo anti-GITR agonista se evaluó por su impacto en la expresión de superficie de OX40 y PD-1 en las células T. Las PBMC aisladas mediante gradiente de ficoll de capas leucocíticas de donantes sanos (Research Blood Components, LLC) se almacenaron en nitrógeno líquido y se descongelaron el día del experimento. Las células se resuspendieron en medio de cultivo celular (RPMI FBS al 10 % 20 U/ml de IL-2) y se añadieron a placas de cultivo de 96 pocillos que contenían anticuerpo anti-CD3 unido a la placa (clon SP34) a varias concentraciones subóptimas (0, 0,7, 0,8 y 0,9 pg/ml) y 5 ug/ml de anticuerpo anti-GITR Hum231#2 unido a placa o un anticuerpo IgG1 de control de isotipo. Las muestras se incubaron durante 4 días a 37 °C y CO2 al 5 %. Después de la incubación, las células se tiñeron con un tinte de amina de viabilidad FITC (tecnologías Life) para teñir las células muertas. Después de lavar con tampón FACS frío (1 x PBS FBS al 2 %, pH 7,2), se añadió un anticuerpo anti-OX40 y se incubó durante 10 minutos a 4°C. Las células se lavaron y un anti-Fc F(ab')2 humano. Se añadió Alexa647 y se incubó durante 10 minutos a 4 °C. Después de la centrifugación y un paso de lavado, un cóctel de anticuerpos que contiene anticuerpos contra CD3 (APC Cy7, SP34.2), CD4 (PercP Cy5.5, L200), CD8a (PE Cy7, SK1) y PD-1 (PE, EH12.2H7) diluido en tampón FACS frío se añadió a cada muestra y se incubó durante 10 minutos a 4 °C. Las muestras se lavaron y se resuspendieron en 200 pl de paraformaldehído al 1,6 % antes de la adquisición mediante el uso de un citómetro de flujo FACScanto (BD Biosciences). Los gráficos de FACS se analizaron mediante el uso del software Flojo. Los diagramas y gráficos de citometría de flujo son representativos de experimentos que usan las PBMC de un donante.
Como se muestra en la Figura 21, la coestimulación con el anticuerpo anti-GITR Hum231#2 aumenta la expresión superficial de OX40 y PD-1 en células T humanas CD4+ y CD8+.
6.4 Ejemplo 4: Línea germinal de variante humanizada
Este ejemplo describe la generación de variantes humanizadas de línea germinal.
6.4.1 Diseño de biblioteca
Se usó un enfoque de biblioteca para generar variantes humanizadas con un mayor contenido de línea germinal humana mediante la introducción de mutaciones dirigidas al sitio a través de codones degenerados en regiones variables de cadena pesada y ligera. La región variable de la cadena VH se mutó reemplazando posiciones de 17 aminoácidos con 2 a 4 aminoácidos, lo que resultó en una diversidad final de 1,3E+06. La región variable de la cadena ligera se mutó en 9 posiciones de aminoácidos (2-3 aminoácidos por posición), dando como resultado una diversidad final de 7,7E+02. Las diferentes posiciones de marco y CDR incluidas en la biblioteca se muestran en la Figura 22. Las bibliotecas se diseñaron mediante el uso de la línea germinal humana IGHV1-2*02 VH (Figura 22A) y la línea germinal humana IGKV4-1*01 VL (Figura 22B).
6.4.2 Generación de bibliotecas
Las regiones variables humanizadas mutadas se clonaron en vectores de expresión retrovirales (pCMA). Estas construcciones se usaron posteriormente para transducir células preB y expresar anticuerpos en la superficie mediante el uso de tecnología Retrocyte Display®. El vector de expresión retroviral contenía LTR 5' y 3' basadas en MSCV, región constante de inmunoglobulina (IGHG1 o IGKC) que comprende la fracción de anclaje de membrana (IGHG1) y un gen marcador de superficie CD4. El marcador de superficie y la inmunoglobulina están acoplados por IRES (sitio de entrada de ribosoma interno). El término "región variable" en este ejemplo significa genes reordenados de VDJ para la cadena pesada y genes reorganizados VJ para las cadenas ligeras.
.4.2.1 Generación de una biblioteca de cadenas pesadas humanizada
Se clonaron regiones de cadena pesada variable humanizadas sintetizadas (Eurofins MWG GmbH) en el vector de expresión retrovírico que contiene la región constante de inmunoglobulina (IGHG1) que comprende la fracción de anclaje de membrana. La digestión y la ligadura se realizaron en una solo etapa y en un tubo mediante el uso de la enzima de restricción typeIIS LguI y T4-ADN ligasa a 37 °C durante 1 hora. El material de biblioteca de cadenas pesadas humanizado sintetizado (128,7 ng) se ligó en marco en un vector de expresión retroviral pCMA (1 |jg) en una relación de vector a inserto de 1:3. A continuación, la reacción de ligación se precipitó y se concentró (8,3 veces) hasta una concentración final de ADN de 94 ng/jl.
La reacción de ligazón concentrada (3 x 4 ul) completa se sometió a electroporación en 80 ul de células DH10B (células electrocompetentes ElectroMax DH10B de E. coli, Invitrogen; núm. de cat. 12033-015) (1.900 V/5 ms). Se añadieron 1.000 ul de medio SOC (Invitrogen, núm. de cat. 15544-034) y las células DH10B transformadas se recuperaron a 37 °C durante 1 hora. Se realizó una dilución 1:1.000 para determinar la complejidad de la biblioteca. Todas las reacciones de transformación se sembraron en placas de agar LB ampicilina de 100 jg/ml y se incubaron durante la noche a 37 °C. Se determinó que la complejidad de la biblioteca de cadenas VH humanizada era 7,3E+07 y, por lo tanto, se recuperó toda la diversidad de la biblioteca.
Todas las bacterias electroporadas se rasparon de las placas y se prepararon 2 reservas de glicerol para almacenamiento a largo plazo a -80 °C. Se realizó una preparación de plásmido de ADN a gran escala (Macherey & Nagel, NucleoBond Xtra Maxi Plus Kit). Se realizó una digestión para verificar la presencia y el tamaño correcto del material de biblioteca de cadenas VH humanizado de inserto clonado con HindIII/Eco47III (H/E). Para verificar la columna vertebral correcta del vector a Kpnl/Bsr se utilizó digestión GI (K/B). Como control, el ADN plasmídico de la biblioteca de cadenas VH humanizado también se digirió con LguI para verificar las cantidades del vector sin inserciones de cadenas VH humanizadas y la integridad del vector se probó mediante la separación del ADN plasmídico sin cortar.
Se seleccionaron 96 clones individuales y se enviaron para secuenciación para determinar la diversidad de la biblioteca final mediante el uso el cebador 89-AL (Secuencia: 5' gcctccgcctcctcttcctccatcc 3'; SEQ ID NO: 707). No se identificaron secuencias redundantes en el control de calidad. La diversidad teórica es 1,3E+06 variantes diferentes, por lo que la cobertura de cada secuencia única es aproximadamente 50 veces. El 35 % de los clones de la biblioteca tenían el patrón de mutación deseado (= 2,5E+07) y todas las variantes deseadas estaban presentes en la biblioteca.
6.4.2.2 Generación de una biblioteca de cadena ligera humanizada
Se clonaron regiones de cadena ligera variable humanizadas sintetizadas (Eurofins MWG GmbH) en el vector de expresión retroviral que contiene la región constante de inmunoglobulina (IGKC). La digestión y la ligadura se realizaron como se describe en la sección 6.4.2.1. El material de biblioteca de cadenas ligeras humanizado sintetizado (227,9 ng) se ligó en marco en un vector de expresión retroviral pCMA (0,5 jg ) en una relación de vector a inserto de 1:10. Posteriormente, se precipitó la reacción de ligación y se concentró 3,6 veces hasta una concentración final de ADN de 52 ng/jl.
La transformación se realizó como se describe en la Sección 6.4.2.1 anterior. La reacción de ligazón concentrada 2 x 4 ul se sometió a electroporación en 80 ul de células DH10B (células electrocompetentes ElectroMax DH10B de E. coli, Invitrogen; núm. de cat. 12033-015) (1.900 V/5 ms). Se determinó que la complejidad de la biblioteca de cadenas VL humanizada era 4,6E+07 y, por lo tanto, se recuperó toda la diversidad de la biblioteca. La preparación del ADN plasmídico de la biblioteca y la verificación del ADN plasmídico se realizaron como se describe en la Sección 6.4.2.1. Solo se identificó una secuencia redundante en el control de calidad. La diversidad teórica es 7,7E+02 variantes diferentes, por lo que la cobertura de cada secuencia única es aproximadamente 60.000 veces. El 65 % de los clones de la biblioteca tenían el patrón de mutación deseado y todas las variantes deseadas estaban presentes en la biblioteca.
6.4.3 Recuperación de cadenas pesadas y ligeras germinadas a partir de clones de células preB preseleccionados
El material de biblioteca humanizado generado como se describe anteriormente (Secciones 6.4.2.1 y 6.4.2.2) se usó en una pantalla Retrocyte Display® de maduración por afinidad para identificar anticuerpos con un alto contenido de genes de línea germinal y propiedades biológicas y bioquímicas mejoradas. De dos placas de 96 pocillos, que contenían 80 y 96 clones de células preB preseleccionados, se recuperaron las cadenas pesada y ligera. Las células se lisaron (Phusion Human Specimen Direct PCR Kit, Thermo Scientific/Finnzymes núm. de cat. F-150) y las regiones variables se amplificaron directamente mediante PCR (ver Tabla 15). La PCR se realizó con un cebador específico 5' directo y 3' inverso (ver Tabla 16). Como molde para la PCR se usaron 2 ul de lisado de células preB. Las regiones variables amplificadas se purificaron (NucleoFast 96 PCR (Macherey - Nagel)) y se clonaron en los vectores de expresión CHO (pPEP) que contienen la región constante de inmunoglobulina (IGHG1, IGKC).
Tabla 15: Programas de PCR
Tabla 16: Cebadores para amplificar las regiones variables de la cadena ligera kappa y pesada
Para clonar las regiones variables preseleccionadas de cadena ligera y pesada germinadas, la digestión y la ligadura se realizaron en una sola etapa y en un tubo mediante el uso de la enzima de restricción typeIIS. LguI y T4-ADN ligasa a 37 ° durante 1 hora y una etapa final a 80 °C durante 10 minutos, y las regiones variables de cadena ligera o pesada con germinación preseleccionada (~60 ng) se ligaron en marco en vectores de expresión de pPEP (50 |jg). Se usó una proporción de vector a inserto de 1:12.
Se cotransformaron 2 ul de reacciones de ligación de cadenas pesadas de línea germinal preseleccionadas y 6 ul de reacciones de ligadura de cadena ligera kappa preseleccionadas en células DH10B químicamente competentes (30 ul) mediante transformación por choque térmico. Se añadieron 1.000 ul de medio SOC (Invitrogen, núm. de cat.
15544-034) y las células DH10B transformadas se recuperaron a 37 °C durante 1 hora. Finalmente, se añadieron 1.000 j l de medio LB ampicilina (concentración final: 100 jg/ml) y se incubaron las células de E. coli transformadas incubadas durante la noche a 37 °C. Se realizó una preparación de plásmido de ADN a pequeña escala (Macherey & Nagel, NucleoSpin 96 Plasmid) y se realizó una digestión para verificar la presencia y el tamaño correcto de regiones variables clonadas con HindIII/NoI (cadenas VH) y NcoI (cadenas VK). La integridad del vector se probó mediante la separación del ADN plasmídico sin cortar. Las preparaciones de plásmido de ADN se usaron posteriormente para transfectar células CHO y los anticuerpos expresados se probaron mediante el uso tecnología de matriz de suspensión y en análisis cinético por Octet. Las secuencias de anticuerpos se verificaron mediante la PCR.
6.4.4 Selección de variantes de la línea germinal
Se seleccionaron varios cientos de anticuerpos ligados a la línea germinal basándose en la cinética de unión determinada por las mediciones de Octet (sistema Octet RED 96; ForteBio™ Inc., Menlo Park, CA). El procedimiento experimental se configuró de acuerdo con el manual de instrucciones del instrumento. Se unió biotina-GITR al biosensor de estreptavidina (SA) y se utilizó PBS (pH 7,4) como control en blanco. Brevemente, los análisis de interacción se realizaron a 30 °C en tampón de funcionamiento (PBS, Tween al 0,05 %, pH 7,4). Las puntas de los sensores se humedecieron previamente durante 10 minutos en tampón de funcionamiento inmediatamente antes de su uso, y las microplacas utilizadas en el Octet se llenaron con 200 j l de muestra o tampón por pocillo y se agitaron a 800 rpm. Para los experimentos, se usaron puntas SA prerrevestidas comercialmente disponibles. Se cargó GITR biotinilado en las fibras ForteBio SA en PBS pH 7,4 durante 10 minutos y se lavó durante 4 minutos. Para la fase de asociación, las puntas de SA recubiertas de ligando se sumergieron durante 5 minutos en sobrenadante de cultivo celular que se diluyó 1:10 en tampón de ejecución antes de la medición. Se midió la disociación del complejo anticuerpo-antígeno en pocillos que contenían el tampón Octet solo durante 5 minutos. Después de cada ejecución, las puntas se regeneraron con glicina (10 mM, pH 2,0). La afinidad, Kon y Koff se determinaron con el software de evaluación Octet v6.3 mediante el uso de un modelo de unión 1:1 con ajuste completo local. La Tabla 17 enumera la composición de las regiones variables de la cadena pesada y las regiones variables de la cadena ligera de 56 variantes seleccionadas de la línea germinal y su afinidad, Kon y Koff valores medidos por Octet.
Tabla 17: Análisis cinético de variantes de la línea germinal
(continuación)
(continuación)
De estos anticuerpos, se eligieron varios para análisis posteriores en base a valores de octetos adicionales y su homología de línea germinal. A partir de estos, se caracterizó una muestra de anticuerpos, que eran todos agonistas en un ensayo de células T (datos no mostrados), con más detalle como se describe más abajo. La Figura 23 detalla la composición de las regiones variables de cadena ligera y pesada de estas variantes de línea germinal seleccionadas. Las Figuras 24A, 24B y 24C detallan la composición de las regiones de cadena pesada y ligera de otras variantes de línea germinal reales o proféticas seleccionadas.
6.4.5 Análisis cinético de variantes de la línea germinal
El análisis de cuantificación y unión de los anticuerpos variantes de la línea germinal anti-GITR se determinó mediante el uso de tecnología de matriz de suspensión siguiendo los procedimientos descritos en la Sección 6.2.5.1. Las afinidades relativas medias de las variantes de la línea germinal en comparación con el anticuerpo 231-32-15 parental quimérico se muestran en la Figura 23.
Además, también se llevó a cabo una evaluación de la actividad de bloqueo del ligando mediante el uso tecnología de matriz de suspensión de acuerdo con el procedimiento descrito en el Ejemplo 6.2.5.2. Como puede verse en las Figuras 25A y 25B, la unión de GITRL-PE a GITR en presencia de una selección de anticuerpos variantes de la línea germinal siguió un patrón muy similar para los anticuerpos ensayados.
Estos anticuerpos variantes de la línea germinal se caracterizaron adicionalmente en ensayos funcionales como se describe más abajo en el Ejemplo 5.
6.5 Ejemplo 5: Actividad funcional de variantes de la línea germinal
6.5.1 Efecto de las variantes de la línea germinal sobre la proliferación de células T CD4+ estimuladas por anti-CD3 y la producción de citocinas
Para evaluar la actividad de las nuevas variantes de la línea germinal generadas como se describe en el Ejemplo 4, estas variantes se compararon con los anticuerpos humanizados Hum231#1 y Hum231#2 y el anticuerpo quimérico parental 231-32-15 en células T CD4 enriquecidas de cuatro preparaciones de revestidas, BC4, BC9, BC13 y BC18. Se realizó un ensayo de estimulación de CD3 subóptimo como se describe en la Sección 6.3.1 anterior con tinción de citocinas intracelulares (BC13 y BC18), liberación de citocinas (BC4 y BC9) y dilución de CFSE (BC4 y BC9) medida 5 días después de que se realizó el ensayo de estimulación. Se usaron anticuerpos anti-CD3 unidos a placa y anti-CD28 solubles con anticuerpos anti-GITR unidos a placa, sin anticuerpo (CD3 solo) y un control de isotipo (anticuerpo MSC8). Se usaron anticuerpos anti-GITR a una concentración de 10 pg/ml. Para las capas leucocíticas 4 y 9, se usó el anticuerpo anti-CD3 a una concentración de 125 ng/ml, el anticuerpo anti-CD28 a una concentración de 125 ng/ml y 10 U de IL-2. Para la capa leucocítica 13, se usó el anticuerpo anti-CD3 a una concentración de 500 ng/ml y el anticuerpo anti-CD28 a una concentración de 100 ng/ml. Para la capa leucocítica 18, se usó el anticuerpo anti-CD3 a una concentración de 31,25 ng/ml y el anticuerpo anti-CD28 a una concentración de 100 ng/ml.
Para las preparaciones de capa leucocítica BC4 y BC9, los sobrenadantes y las células se recogieron de la placa después de 5 días en cultivo. Se determinó la proliferación celular y se muestra como porcentaje de CFSE bajo (Figuras 26A y 26B) y los sobrenadantes se usaron para el análisis de citocinas (IFNy e IL-10). Las Figuras 27A y 27B muestran la liberación de citocinas para BC4 y las Figuras 28A y 28B muestran la liberación de citocinas para BC9.
Para las preparaciones de capa leucocítica BC13 y BC18, después de 5 días de cultivo, se añadió monensina (eBioscience) a todas las muestras durante 6 horas para permitir la retención intracelular de IFNy. después, las muestras se tiñeron intracelularmente para IFNy-PE (eBioscience) mediante el uso el kit BD Cytofix/Cytoperm (BD Biosciences) después de la detección por citometría de flujo en BD FACSAria I (BD Biosciences) y se analizaron
mediante el uso el software FlowJo (Tree Star). Los resultados del efecto de las variantes de línea germinal sobre el porcentaje de células T CD4 positivas para IFNy de BC13 y BC18 se muestran en las Figuras 29A y 29B, respectivamente. Después del contacto con las variantes de la línea germinal, el anticuerpo 231-32-15 parental quimérico o las variantes humanizadas Hum231#1 y Hum231#2, el porcentaje de células T CD4 positivas para IFNy inducidas por estos anticuerpos anti-GITR fueron comparables. Sin embargo, como se esperaba, existe una ligera variación entre los donantes.
6.5.2 Efecto de las variantes de la línea germinal sobre la línea celular indicadora de GITR NF-KB-luciferasa En este ejemplo, las variantes de la línea germinal generadas como se describe en el Ejemplo 4 se probaron mediante el uso la línea celular indicadora de GITR NF-KB-luciferasa (Promega) descrita en la Sección 6.3.8.
La línea celular indicadora (Promega) se mantuvo en cultivo de acuerdo con las instrucciones del fabricante. El día del experimento, las células se resuspendieron en medio de ensayo (RPMI FBS al 1 %). Las células (100.000 células por pocillo) se añadieron a una placa de 96 pocillos que contenía anticuerpo anti-CD3 unido a la placa (clon SP34, 0,3 |jg/ml) y varias concentraciones (12,5, 10, 5, 2,5, 1,25, 0,625 y 0 jg/ml) de anticuerpos anti-GITR unidos a placa. Las células informadoras se incubaron durante 18 horas a 37 °C y CO2 al 5 %. Después de la incubación, se detectó la expresión de luciferasa mediante el uso Bio-Glo (Promega) y un lector de etiquetas múltiples EnVision 2.100.
Los anticuerpos anti-GITR probados en este ensayo fueron Hum231#2w y 20 variantes de la línea germinal: pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, pab2159, pab2160 y pab2161. Como se muestra en las Figuras 30A-C, todas las variantes de la línea germinal mostraron actividad agonista en el ensayo del indicador GITR NF-KB-luciferasa.
Las variantes de la línea germinal también se ensayaron para determinar la actividad agonista en ausencia de anticuerpo anti-CD3. El día del experimento, las células informadoras de GITR NF-KB-luciferasa (Promega) se resuspendieron en medio de ensayo (RPMI FBS al 1 %). Las células (100.000 células por pocillo) se añadieron a una placa de 96 pocillos que contenía varias concentraciones (12,5, 10, 5, 2,5, 1,25 y 0,625) de anticuerpos anti-GITR unidos a placa. Las células informadoras se incubaron durante 6 horas a 37 °C y CO2 al 5 %. Después de la incubación, se detectó la expresión de luciferasa mediante el uso Bio-Glo (Promega) y un lector de etiquetas múltiples EnVision 2.100.
Los anticuerpos anti-GITR probados en este ensayo fueron m6C8, Hum231#2w y 20 variantes de la línea germinal: pab1964, pab1965, pab1966, pab1967, pab1968, pab1969, pab1970, pab1971, pab1972, pab1973, pab1975, pab1976, pab1977, pab1979, pab1980, pab1981, pab1983, pab2159, pab2160 y pab2161. Todas las variantes de la línea germinal indujeron una activación dependiente de la dosis de la línea celular indicadora en ausencia de un anticuerpo anti-CD3 (Figuras 30D-F).
6.6 Ejemplo 6: Caracterización de epítopos de anticuerpos anti-GITR
Para caracterizar el epítopo en el GITR humano al que reconocen el anticuerpo 231-32-15 parental quimérico y los anticuerpos anti-GITR humanizados, se realizaron estudios adicionales como se describe a continuación.
6.6.1 Competencia por epítopo - ensayo de unión celular
Para confirmar que las variantes de anticuerpos humanizados conservaban la especificidad por el epítopo del anticuerpo parental quimérico 231-32-15, se realizó un ensayo de unión celular. Se cosecharon células pre-B 1624-5 que expresan el anticuerpo parental quimérico 231-32-15 y se resuspendieron 1 x 106 células en 200 pl de tampón de FACS más: i) GITR biotinilado (GITR-bio) (1:1.000), preincubado durante 15 minutos con 2 pg de anticuerpo parental quimérico 231-32-15; ii) GITR-bio (1:1.000), preincubado durante 15 minutos con 2 pg de Hum231#1; iii) GITR-bio (1:1.000), preincubado durante 15 minutos con 2 pg de Hum231#2; o iv) GITR-bio (1:1.000). Las células se incubaron durante 20 minutos a 4 °C y después se lavaron con 4 ml de tampón FACS y se centrifugaron durante 5 minutos a 300 g a 4 °C. El sedimento celular se resuspendió en 200 j l de tampón FACS más estreptavidina-PE (1:1.000) y después se incubó y se lavó como antes. A continuación, las células se resuspendieron en 200 j l de tampón FACS para el análisis mediante el uso un FACSAriaII (BD Biosciences).
La Figura 31 muestra que las variantes de anticuerpos humanizados conservaban la especificidad por el anticuerpo del anticuerpo parental quimérico 231-32-15. El perfil de la derecha muestra la unión de GITR-bio a células pre-B 1624-5 que expresan el anticuerpo progenitor quimérico 231-32-25. Sin embargo, cuando GITR-bio se preincubó con los anticuerpos progenitores quiméricos 231-32-15, Hum231#1 o Hum231#2, hubo una pérdida de unión de GITR-bio a las células 1624-5 (perfil de la izquierda). Los perfiles de FACS solapados indican que las variantes humanizadas también muestran propiedades de unión a GITR muy similares entre sí y al anticuerpo progenitor quimérico 231-32-15.
6.6.2 Competencia por epítopo - tecnología de arreglo en suspensión
Los anticuerpos anti-GITR (25 |jl) se diluyeron a 2 |jg/ml en tampón de ensayo (Roche 11112589001) y se incubaron con 1.500 perlas Luminex® (5 jl, Luminex Corp, núm. 5 LC10005-01) acopladas con anti-IgG humana (específica de F(ab)2, JlR, 105-006-097) durante toda la noche en tubos LoBind de 0,5 ml (Eppendorf, 0030108.116) en condiciones de agitación, en la oscuridad. Después esta mezcla se transfirió a placas de filtro de 96 pocillos prehumedecidas (Millipore, MABVN1250). Las placas se lavaron dos veces con 200 pl/pocillo de PBS para eliminar el anticuerpo no unido. Al mismo tiempo 20 pg/ml de los mismos anticuerpos anti-GlTR, diferentes anticuerpos anti-GITR, o tampón de ensayo se incubaron con 20 pl (1 pg/ml) de antígeno GITR etiquetado con R-PE (sistemas R&D, homodímero unido por disulfuro; 689-GR; etiquetado en el laboratorio con el kit AbDSerotec LYNX, LNK022RPE) durante 1 hora en la oscuridad a 650 rpm. La mezcla de perlas y la mezcla de antígeno/anticuerpo se mezclaron 1:1 (20 pl de cada uno) y se incubaron durante una hora adicional en condiciones de agitación (20 °C, 650 rpm). Directamente antes de la medición, se añadieron 40 pl de tampón de ensayo a cada pocillo y el análisis se realizó mediante el uso un sistema Luminex® 200 (Millipore) y una lectura de 100 perlas en un volumen de muestra de 48 pl. La unión se determinó mediante el uso de los valores de MFI del control sin competir (100 % de unión, solo tampón de ensayo como compuesto competitivo).
Cuando se usó el anticuerpo progenitor quimérico 231-32-15 como el anticuerpo capturado, se observó una competencia de unión completa con ambas variantes de anticuerpos humanizadas. Cuando se usó el anticuerpo anti-GITR m6C8 como el anticuerpo capturado, no se observó competencia de unión con el anticuerpo progenitor quimérico 231-32-15 o con las dos variantes humanizadas (datos no mostrados). Estos resultados indican que m6C8 y los anticuerpos anti-GITR descritos en la presente memoria reconocen diferentes epítopos en GITR humano.
6.6.3 Competencia por epítopo - resonancia de plasmones superficiales
Para la discretización de epítopos mediante el uso de resonancia de plasmones superficiales se usó el “enfoque en serie” (Abdiche YN y otros, (2009) Analytical Biochemistry, 386: 172-180). Para este propósito se generaron diferentes superficies de chip en un chip sensor CM5 (GE Healthcare, Serie S CM5, BR-1005-30) mediante el uso de la inmovilización de diferentes densidades de antígeno GITR (R&D systems, homodímero unido por disulfuro, 689-GR). La celda de flujo 2 contenía el antígeno GITR a baja densidad (667 RU), la densidad media se valoró en la celda de flujo 3 (1595 RU) y en la celda de flujo 4, se logró una alta densidad (4371 RU). En la celda de flujo 1, la ovoalbúmina (1.289 RU, Pierce ThermoFisher 77120) se inmovilizó para referencia. La inmovilización se realizó de acuerdo con un protocolo estándar del fabricante (GE Healthcare) para el acoplamiento de aminas (activación de la superficie con e Dc 0,4 M y NHS 0,1 M, kit de acoplamiento de aminas de GE Healthcare, BR-1000-50). Los grupos que no reaccionaron se inactivaron con etanol-amina-HCl 1 M, pH 8,5. Posteriormente los anticuerpos anti-GITR se pasaron por las diferentes superficies a una concentración de 300 nM (45 pg/ml) durante 240 segundos a 5 pl/min. Mediante el uso de estas condiciones se debería haber alcanzado la saturación de la superficie de GITR. Se incluyó un tiempo de disociación de 60 segundos antes de agregar el anticuerpo competidor (300 nM, 5 jl/min). La regeneración de la superficie del chip se realizó mediante el uso de glicina 10 mM pH 2,0 (GE Healthcare, BR-1003-55) durante 60 segundos a 10 pl/min. La discretización se realizó mediante el uso de las unidades de respuesta (RU) del control sin competir (100 % de unión, condiciones de saturación).
Como se muestra en la Figura 32, cuando el anticuerpo progenitor quimérico 231-32-15 se une primero a GITR, no se produce unión adicional de este anticuerpo. Sin embargo, cuando el anticuerpo progenitor quimérico 231-32-15 se une primero a GITR y se aplica el anticuerpo m6C8, este anticuerpo todavía es capaz de unirse a GITR.
6.6.4 Mapeo de epítopos de anticuerpos anti-GITR
Para mapear el epítopo en GITR al que se unen los anticuerpos anti-GITR descritos en la presente memoria, se usó una PCR propensa a errores para generar variantes del antígeno GITR humano. Las variantes de proteínas GITR se expresaron en la superficie de las células en una biblioteca celular y estas células se tamizaron en cuanto a la unión de los anticuerpos anti-GITR. Como un control positivo, se usó un anticuerpo policlonal anti-GITR para confirmar el plegamiento adecuado de la proteína GITR. Para variantes del antígeno GITR humano en las que se produjo una unión a anticuerpo reducida o nula, se realizó mutagénesis por barrido de alanina para determinar los residuos de epítopo precisos que se requerían para la unión a los anticuerpos anti-GITR descritos en la presente memoria.
6.6.4.1 Generación de variantes de GITR humano
Se utilizó mutagénesis por PCR propensa a errores para generar variantes de GITR humano con mutaciones aleatorias en el dominio extracelular. Para la PCR propensa a errores, se utilizó el kit de mutagénesis aleatoria GeneMorphII (Stratagene), de acuerdo con las instrucciones del fabricante. En resumen, se realizaron 20 ciclos de PCR en un volumen de 50 pl mediante el uso de un constructo del laboratorio como plantilla (13 ng, número de construcción 4.377 pMA-T-huGITR), 0,05 U/pl de ADN polimerasa Mutazyme II, tampón de reacción de Mutazyme II 1x, 0,2 pM de cada cebador (1.152-Je (Secuencia 5' gagctcctcgaggccaccatg 3'; SEQ ID NO: 712) y 1.204-Je (Secuencia 5' cgcggccgcgaattctta 3'; SEQ ID NO: 713)) y 0,2 mM de cada desoxinucleósido trifosfato (dATP, dCTP, dGTP y dTTP). Las muestras se amplificaron por pCr (Eppendorf, Alemania) mediante el uso del siguiente
programa: 95 °C durante 2 minutos; 20 ciclos de 95 °C durante 30 segundos, 56 °C durante 30 segundos, 72 °C durante 1 minuto; y una etapa de extensión final de 72 °C durante 10 minutos. El producto de la PCR se purificó en gel mediante el uso de gel de agarosa al 1 %, se cortó la banda de ADN correspondiente al tamaño esperado de 720 pb y se realizó la extracción de gel mediante el uso de un kit de limpieza de gel y PCR NucleoSpin de Macherey & Nagel de acuerdo con el manual del producto. El ADN purificado se ligó en un vector de expresión del laboratorio por medio de los sitios XhoI / EcoRI mediante el uso de ADN ligasa de T4 y una relación de 1:3 (vector: inserto). La ligazón (25 °C) se detuvo después de 2 horas con una etapa de desnaturalización por calor durante 10 min a 65 °C. El ADN de la reacción de ligazón se precipitó con EtOH mediante el uso t-ARN de levadura. Se usaron técnicas estándar de digestión y ligazón. La reacción de ligazón se sometió a electroporación en células DH10B (células electrocompetentes ElectroMax DH10B de E. coli, Invitrogen; 1900V/ 5 ms). Las bacterias sometidas a electroporación se sembraron en placas de LB agar 100 pg/ml de ampicilina y se obtuvieron aproximadamente 1.9x108colonias.
Después todas las bacterias sometidas a electroporación se rasparon de las placas y se usaron para la preparación de plásmidos de ADN a gran escala (Macherey&Nagel, Kit NucleoBond Xtra Maxi Plus), de acuerdo con las instrucciones del fabricante para generar una biblioteca de ADN. Se realizó una digestión con enzimas de restricción con Xhol/EcoRI y BsrGI/EcoRI para controlar la calidad de la biblioteca. Se seleccionaron clones individuales y se enviaron para secuenciación para determinar la diversidad de la biblioteca final mediante el uso del cebador 1155-Je (fWd; Secuencia 5' ccttgaacctcctcgttcg 3'; SEQ ID NO: 714).
6.6.4.2 Generación de una biblioteca celular con variantes de GITR humano
Se usaron técnicas estándar de transfección seguidas de transducción para expresar mutantes de GITR humano en la superficie de células 1624-5. Para la generación de partículas retrovirales, una biblioteca de ADN y vectores que expresan las proteínas retrovirales Gag, Pol y Env se transfectaron en una línea celular de empaquetamiento retroviral (células HEK) mediante el uso del reactivo de transfección de ADN X-tremeGENE 9 (Roche Diagnostics GmbH, Alemania). Las partículas retrovirales resultantes se acumularon en el sobrenadante del cultivo celular de las células de empaquetamiento retroviral. Dos días después de la transfección se cosecharon los sobrenadantes que contenían las partículas del vector viral libres de células y se sometieron a infección por centrifugación de células 1624-5. Se obtuvo una eficiencia de transducción (% de células que expresan GITR humano) de aproximadamente 4 %. Tras el cultivo continuo durante al menos un día adicional, las células se seleccionaron mediante el uso de puromicina (1,5 pg/ml). Las células no transducidas sirvieron como controles negativos (NC). Después de la selección con antibiótico, la mayoría de las células expresaron establemente la biblioteca de antígenos GITR humanos en la superficie celular. Las células no viables se eliminaron por medio de una etapa de separación con Ficoll.
Se usó FACS para seleccionar células que expresan mutantes de GITR humano plegados correctamente mediante el uso de un anticuerpo policlonal anti-GITR y posteriormente seleccionar células individuales que expresan variantes de GITR humano que no se unen al anticuerpo progenitor quimérico 231-32-15 anti-GITR. En resumen, las células que se unen al anticuerpo se analizaron mediante FACS y las células que muestran unión específica al anticuerpo se separaron de la población de células que no se unen mediante FACS preparativa, de alta velocidad (FACSAriaII, BD Biosciences). Los grupos de células reactivas o no reactivas al anticuerpo se expandieron nuevamente en cultivo de tejidos y, debido al fenotipo de expresión estable de las células transducidas retroviralmente, se repitieron ciclos de clasificación de células dirigida por anticuerpo y de expansión en cultivo de tejidos, hasta el punto en que se obtuvo una población claramente detectable de células no reactivas al anticuerpo anti-GITR (progenitor quimérico 231-32-15). Esta población de células no reactivas al anticuerpo anti-GITR (progenitor quimérico 231-32-15) se sometió a una etapa final de clasificación de células individuales. Después de varios días de expansión celular, las células clasificadas en células individuales se probaron nuevamente en cuanto a la no unión al anticuerpo progenitor quimérico 231-32-15 y para la unión a un anticuerpo policlonal anti-GITR mediante el uso de un análisis de placas de 96 pocillos en un FACSCalibur (BD Biosciences).
6.6.4.3 Análisis de epítopos
Para asociar el fenotipo (progenitor quimérico 231-32-15, policlonal anti-GITR+) con el genotipo, se realizó la secuenciación de las variantes de huGITR clasificadas en células individuales. La Figura 33 muestra la alineación de las secuencias de estas variantes. Los residuos de aminoácidos en la Figura 33 se enumeran de acuerdo con la secuencia de aminoácidos inmadura de GITR humano (SEQ ID NO: 701). La secuenciación identificó regiones con aumento de mutaciones o "puntos calientes" (por ejemplo, P62 y G63), lo que proporciona una indicación del epítopo en GITR humano reconocido por el anticuerpo progenitor quimérico 231-32-15 anti-GITR.
Para confirmar los aminoácidos precisos del GITR humano implicados en la unión a anticuerpos anti-GITR, se realizó el reemplazo con alanina de los aminoácidos de los puntos calientes. Las siguientes posiciones (enumeradas de acuerdo con la SEQ ID NO: 701) se mutaron por separado a una Alanina: P28A, T29a , G30A, G31A, P32A, T54A, T55A, R56A, C57A, C58A, R59A, D60A, Y61A, P62A, G63A, E64A, E65A, C66A, C67A, S68A, E69A, W70A, D71A, C72A, M73A, C74A, V75A, y Q76A. Se usaron técnicas estándar de transfección seguidas de transducción para expresar estos mutantes de alanina de GITR humano en la superficie de células 1624-5.
Por último, los mutantes de alanina expresados en células 1624-5 se probaron en citometría de flujo (FACSCalibur; BD Biosciences) para la unión de las variantes de anticuerpos anti-GITR humanizados Hum231#2, tres variantes de línea germinal (pab1967, pab1975 y pab1979) y el anticuerpo de referencia m6C8. Brevemente, se incubaron células 1624-5 que expresan mutantes de alanina de GITR humano individuales con 2 pg/ml de los anticuerpos monoclonales anti-GITR Hum231#2, tres variantes de línea germinal (pab1967, pab1975 y pab1979), o el anticuerpo m6C8; o un anticuerpo policlonal anti-GITR (AF689, sistemas R&D) conjugado con APC, y bloque de receptor Fc (1:200; BD n-um. de cat. 553.142) diluido en 100 pl de tampón FACS (PBS FCS al 2 %) durante 20 minutos a 4 °C. Después del lavado, las células se incubaron con un anticuerpo anti-IgG secundario si fuera necesario para la detección (conjugado con APC; núm de cat. BD 109-136-097) diluido en 100 pl de tampón FACS (PBS FCS al 2 %) durante 20 minutos a 4 °C. Después, las células se lavaron y adquirieron mediante el uso un citómetro de flujo (BD Biosciences). El valor de intensidad media de fluorescencia (MFI) del anticuerpo monoclonal probado se dividió por el valor de MFI del anticuerpo policlonal, lo que generó una relación de MFI (anticuerpo monoclonal/anticuerpo policlonal) para mutantes de alanina de GITR individuales. Se calculó una relación de iMf promedio (“proporción AMFI”) en base a las proporciones individuales de MFI para todos los mutantes. La Figura 34A es una tabla que resume la unión de Hum231#2, tres variantes de línea germinal (pab1967, pab1975, pab1979) y el anticuerpo de referencia m6C8 a células 1624-5 que expresan mutantes de alanina de GITR humano. Una proporción individual de MFI que se encuentra por encima del 60 % de la proporción AMFI se considera que indica una unión similar, después de la normalización, a la del anticuerpo policlonal y se representa por “+” en la Figura 34A. Una proporción individual de MFI que se encuentra entre 30 % y 60 % de la proporción AMFI se representa por “+/-” en la Figura 34A. Una proporción individual de MFI que se encuentra por debajo del 30 % de la proporción AMFI se representa por “-” en la Figura 34A.
Como se muestra en la Figura 34A, el mutante D60A y el mutante G63A, numerados de acuerdo con la SEQ ID NO: 701, interrumpió o debilitó específicamente la unión de la variante humanizada anti-GITR Hum231#2 y las tres variantes de línea germinal (pab1967, pab1975 y pab1979), pero no la del anticuerpo de referencia m6C8. El mutante C58A interrumpe la unión de los cinco anticuerpos y es probable que sea una mutación estructural en lugar de una específica del epítopo. El mutante C74A tuvo una expresión débil y no pudo usarse para la comparación de la unión.
Además, los anticuerpos anti-GITR 231-32-15, Hum231#2 y m6C8 se compararon en cuanto a su unión a GITR humano de tipo salvaje frente a mutante. Brevemente, se expresaron GITR humano de tipo salvaje y dos mutantes de alanina de GITR (el mutante D60A y el mutante G63A, enumerados de acuerdo con la SEQ ID NO: 701) en la superficie de células 1624-5 como se describió anteriormente y se probaron en un análisis de citometría de flujo como se describió anteriormente donde las células se tiñeron primero mediante el uso de 2 pg/ml de los anticuerpos monoclonales 231-32-15, Hum231#2 y m6C8, o un anticuerpo policlonal conjugado a APC, y después se tiñeron mediante el uso de un anticuerpo anti-IgG secundario si era necesario para la detección (conjugado a APC; 1:1.000; núm. de cat. BD 109-136-097). Todos los valores de intensidad media de fluorescencia (MFI) se calcularon como la media de dos mediciones. El valor de MFI del anticuerpo monoclonal probado para un tipo de célula particular se dividió por el valor de MFI del anticuerpo policlonal para el mismo tipo de célula, lo que generó un total de nueve proporciones de MFI (anticuerpo monoclonal/anticuerpo policlonal): proporción de MFI231-32-15, wt, proporción de MFIHum231#2, wt, proporción de MFIm6C8, wt, proporción de MFI231-32-15, D60A, proporción de MFIHum231#2, D60A, proporción de MFIm6C8, D60A, proporción de MFI231-32-15, G63A, proporción de MFIHum231#2, G63A, y proporción de MFIm6C8, G63A. El porcentaje de unión de un anticuerpo a los mutantes de alanina de GITR con relación al GITR de tipo silvestre se calculó al dividir una relación particular de MFI para los mutantes de alanina de GITR por la relación de MFI correspondiente para el tipo salvaje (por ejemplo, al dividid la proporción de IMFHum231#2, D60A por la proporción de IMFHum231#2, wt). El porcentaje de reducción de la unión se determinó mediante el cálculo, por ejemplo, 100 %*(1-(proporción de MFIHum231#2, D60A/proporción de MFIHum231#2, wt)).
Como se muestra en la Figura 34B, el mutante D60A y el mutante G63A interrumpen o debilitan específicamente la unión de 231-32-15 y Hum231#2, pero no la de m6C8. Los porcentajes mostrados en la Figura 34B son los porcentajes de células positivas a GITR en cada gráfico. Cuando se probó mediante el uso de las células que expresan GITR D60A, la unión del anticuerpo se redujo en 82 % y 88 % para 231-32-15 y Hum231#2, respectivamente, en comparación con una reducción del 10 % para m6C8. De forma similar, cuando se probó mediante el uso de las células que expresan GITR G63A, la unión de 231-32-15 y Hum231#2 se redujo en 37 % y 59 %, respectivamente, mientras que la unión de m6C8 aumentó en 62 %.
Como evidencia adicional de las características de unión de los anticuerpos anti-GITR, se comparó la unión de los anticuerpos a GITR de cynomolgus. La proteína inmadura de GITR de cynomolgus comprende la secuencia de aminoácidos de la SEQ ID NO: 704. Para aumentar la expresión de proteínas, el primer residuo del péptido señal de GITR de cynomolgus se reemplazó con metionina, lo que generó GITR de cynomolgus VIM. Después se generó un GITR de cynomolgus mutante V1M/Q62P/S63G, donde los residuos de aminoácidos en las posiciones 62 y 63 (GlnSer), enumeradas de acuerdo con la SEQ ID NO: 704, fueron reemplazados por los residuos correspondientes en GITR humano (ProGly). La Figura 35A es una alineación de secuencias entre GITR humano, GITR de cynomolgus VIM y GITR de cynomolgus V1M/Q62P/S63G. Las tres proteínas mostradas en la Figura 35A en la superficie de células 1624-5 como se describió anteriormente y se probaron en un análisis de citometría de flujo como se describió anteriormente donde las células se tiñeron primero mediante el uso de 2 pg/ml de los anticuerpos
m o n o c lo n a le s 231 -32 -15 , H u m 231#2 y m 6C 8, o un a n ticu e rp o po lic lona l co n ju g a d o a A P C , y de sp u é s se tiñe ron m ed ia n te el uso de un a n ticu e rp o an ti-Ig G s e cu n d a rio si e ra ne cesa rio para la de tecc ió n (co n ju g a d o a A P C ; 1:1.000; núm . de cat. BD 109-136-097 ).
Como se muestra en la Figura 35B, los anticuerpos anti-GITR 231-32-15 y Hum231#2 presentaron unión solamente a las células que expresan GITR de cynomolgus V1M/Q62P/S63G, pero no a las células que expresan GITR de cynomolgus VIM.
6.7 Ejemplo 7: Tratamiento de células T in vitro con anticuerpos anti-GITR agonistas seguidos de infusión de células T
Las células T que expresan GITR, lo que indica un estado activado, pueden activarse adicionalmente para matar las células diana, tales como las células tumorales, si se cultivan con un anticuerpo agonista de GITR, por ejemplo, Hum231#1, Hum231#2, Hum231#2w, u otro anticuerpo agonista de GITR descrito en la presente memoria, antes de la infusión en un sujeto, por ejemplo, un sujeto humano que tiene cáncer.
El nivel de expresión de GITR en células T aisladas de un sujeto, por ejemplo, un sujeto humano, se evalúa mediante técnicas estándar, por ejemplo, Análisis FACS. La fuente de células T es, por ejemplo, sangre periférica, una biopsia/muestra quirúrgica de un ganglio linfático que drena el sitio del tumor, o una biopsia/muestra quirúrgica del propio tumor en la que pueden haberse infiltrado células T. Las células T están aisladas, por ejemplo, a partir de PBMC totales, tejido linfático o tejido tumoral mediante técnicas estándar. Si se observa que GITR se expresa en la superficie de las células T, las células pueden incubarse con un anticuerpo agonista de GITR, por ejemplo, Hum231#1, Hum231#2, Hum231#2w, u otro anticuerpo agonista de GITR descrito en la presente memoria, en concentraciones que varían de, por ejemplo, 1 pg/ml a 1 mg/ml, para, por ejemplo, 30 minutos, 1 hora, 2 horas, 3 horas, 4 horas, 6 horas, 12 horas, 24 horas, 36 horas, 48 horas o 72 horas, seguido de, por ejemplo, infusión intravenosa de las células T en un sujeto.
Si no se observa que GITR se exprese en células T aisladas de un sujeto, su expresión puede inducirse mediante la co-incubación de las células T con un agente estimulante del complejo TCR, como por ejemplo, fitohemaglutinina (PHA) y/o acetato de miristato de forbol (PMA), o un anticuerpo estimulante del complejo TCR, como un anticuerpo anti-CD3 y un anticuerpo anti-CD28, (en concentraciones que oscilan entre, por ejemplo, 1 pg/ml a 1 mg/ml, durante, por ejemplo, 30 minutos, 1 hora, 2 horas, 3 horas, 4 horas, 6 horas, 12 horas, 24 horas, 36 horas, 48 horas o 72 horas). Alternativamente, puede ser preferible incubar primero las células T con un anticuerpo anti-CD3 solo seguido de la adición del anticuerpo agonista GITR 30 minutos, 1 hora, 2 horas, 3 horas, 4 horas, 6 horas, 12 horas, 24 horas, 36 horas, 48 horas o 72 horas después. También puede ser deseable estimular las células T con un antígeno tumoral, por ejemplo, en forma de péptidos o proteínas, en presencia de células presentadoras de antígeno para activar y expandir el número de células T específicas de tumor. Después de la estimulación del antígeno, las células T pueden cultivarse con un anticuerpo agonista de GITR para mejorar su estado de activación antes de la infusión. Las células T pueden infundirse en el sujeto durante un período de, por ejemplo, 30 minutos, 1 hora, 2 horas, 3 horas, 4 horas, 6 horas, 12 horas o 24 horas, y puede infundirse en el sujeto una, dos, tres, cuatro o más veces, por ejemplo, separadas por 1, 2, 3 o 4 semanas, o 1, 2, 3, 4, 5 o 6 meses. El número de células T infundidas puede determinarse mediante procedimientos experimentales estándar y puede incluir, por ejemplo, 1 * 106 células, 1 * 107 células, 1 * 108 células, 1 * 109 células o más.
En algunas realizaciones, las células T pueden ponerse en contacto con un agente como un mitógeno (por ejemplo, PHA) o una citocina (por ejemplo, IL-2) para expandir no específicamente la población de células T antes, durante o después del tratamiento con el anticuerpo agonista de GITR.
En algunas realizaciones, las células T pueden ponerse en contacto con un agonista adicional además del anticuerpo agonista de GITR, por ejemplo, un anticuerpo agonista de OX40.
Claims (30)
1. Un anticuerpo agonista aislado que se une específicamente a la proteína relacionada con TNFR inducida por glucocorticoides humanos (GITR) que comprende una región variable de cadena pesada (VH) que comprende la secuencia de aminoácidos de la SEQ ID NO: 206 y que comprende una región variable de la cadena ligera (VL) que comprende la secuencia de aminoácidos de la SEQ ID NO: 208, en el que el anticuerpo comprende además una región constante de cadena pesada.
2. El anticuerpo de la reivindicación 1, en el que la región constante de la cadena pesada es IgG1 de inmunoglobulina humana.
3. El anticuerpo de la reivindicación 1, en el que la región constante de la cadena pesada es IgG4 de inmunoglobulina humana.
4. El anticuerpo de una cualquiera de las reivindicaciones 1 o 2, que comprende una cadena pesada que comprende la secuencia de aminoácidos de la SEQ ID NO: 567, y/o que comprende una cadena ligera que comprende la secuencia de aminoácidos de la SEQ ID NO: 576.
5. El anticuerpo de una cualquiera de las reivindicaciones 1 o 3, que comprende una cadena pesada que comprende la secuencia de aminoácidos de la SEQ ID NO: 554, y/o que comprende una cadena ligera que comprende la secuencia de aminoácidos de la SEQ ID NO: 576.
6. El anticuerpo de una cualquiera de las reivindicaciones 1-5, en el que el anticuerpo induce, activa, o potencia una actividad de GITR humano, opcionalmente en una célula independiente de la activación por TCR.
7. Una molécula de ácido nucleico aislada que codifica VH y/o VL, o la cadena ligera y/o la cadena pesada, del anticuerpo de una cualquiera de las reivindicaciones 1-6.
8. La molécula de ácido nucleico aislada de la reivindicación 7, que codifica la VH del anticuerpo de una cualquiera de las reivindicaciones 1-6 o que codifica la cadena pesada del anticuerpo de una cualquiera de las reivindicaciones 1-6.
9. La molécula de ácido nucleico aislada de la reivindicación 7, que codifica la VL del anticuerpo de una cualquiera de las reivindicaciones 1-6 o que codifica la cadena ligera del anticuerpo de una cualquiera de las reivindicaciones 1-6.
10. La molécula de ácido nucleico aislada de la reivindicación 7, que codifica la VH y la VL del anticuerpo de una cualquiera de las reivindicaciones 1-6 o que codifica la cadena ligera y la cadena pesada del anticuerpo de una cualquiera de las reivindicaciones 1-6.
11. Una composición farmacéutica que comprende el anticuerpo de una cualquiera de las reivindicaciones 1-6 o la molécula de ácido nucleico de una cualquiera de las reivindicaciones 7-10, y un portador o excipiente farmacéuticamente aceptable.
12. El anticuerpo de una cualquiera de las reivindicaciones 1-6; la composición farmacéutica de la reivindicación 11, para su uso en el tratamiento del cáncer.
13. El anticuerpo o la composición farmacéutica para su uso de la reivindicación 12, en el que el cáncer es cáncer de endometrio, cáncer gástrico, cáncer de estómago, cáncer de esófago, carcinoma de la unión gastroesofágica, carcinoma de células escamosas de cabeza y cuello, melanoma, cáncer de pulmón de células no pequeñas o carcinoma de células renales.
14. El anticuerpo de una cualquiera de las reivindicaciones 1-6 o la composición farmacéutica de la reivindicación 11, para su uso en el tratamiento de una infección viral.
15. El anticuerpo de una cualquiera de las reivindicaciones 1-6, en el que el anticuerpo es biespecífico.
16. Un vector aislado que comprende la molécula de ácido nucleico de una cualquiera de las reivindicaciones 7-10.
17. El vector aislado de la reivindicación 16, que comprende la molécula de ácido nucleico de la reivindicación 8.
18. El vector aislado de la reivindicación 16, que comprende la molécula de ácido nucleico de la reivindicación 9.
19. El vector aislado de la reivindicación 16, que comprende la molécula de ácido nucleico de la reivindicación 10.
20. Una población de vectores que comprende un primer vector que comprende un ácido nucleico que codifica la cadena ligera o la VL del anticuerpo de una cualquiera de las reivindicaciones 1-6, y un segundo vector que comprende un ácido nucleico que codifica la cadena pesada o la VH del anticuerpo de una cualquiera de las reivindicaciones 1-6.
21. Una célula huésped que comprende la molécula de ácido nucleico aislada de una cualquiera de las reivindicaciones 7-10, o el vector aislado de una cualquiera de las reivindicaciones 16-19, o la población de vectores de la reivindicación 20.
22. La célula huésped de la reivindicación 21, que comprende:
(i) el ácido nucleico aislado de la reivindicación 8, en el que el ácido nucleico aislado codifica la VH del anticuerpo de la reivindicación 4 o codifica la cadena pesada del anticuerpo de la reivindicación 4, y el ácido nucleico aislado de la reivindicación 9, en el que el ácido nucleico aislado codifica la VL del anticuerpo de la reivindicación 4 o codifica la cadena ligera del anticuerpo de la reivindicación 4, o
(ii) el ácido nucleico aislado de la reivindicación 10, en el que el ácido nucleico aislado codifica la VH y la VL del anticuerpo de la reivindicación 4, o codifica la cadena ligera y la cadena pesada del anticuerpo de la reivindicación 4, o
(iii) el vector aislado de la reivindicación 17, en el que el vector aislado comprende la molécula de ácido nucleico que codifica la VH del anticuerpo de la reivindicación 4 o que codifica la cadena pesada del anticuerpo de la reivindicación 4, y el vector aislado de la reivindicación 18, en el que el vector aislado comprende la molécula de ácido nucleico que codifica la VL del anticuerpo de la reivindicación 4 o que codifica la cadena ligera del anticuerpo de la reivindicación 4, o
(iv) el vector aislado de la reivindicación 19, en el que el vector aislado comprende la molécula de ácido nucleico que codifica la VH del anticuerpo de la reivindicación 4 y la VL del anticuerpo de la reivindicación 4, o en el que el vector aislado comprende la molécula de ácido nucleico que codifica la cadena ligera del anticuerpo de la reivindicación 4 y la cadena pesada del anticuerpo de la reivindicación 4, o
(v) la población de vectores de la reivindicación 20, en la que la población de vectores comprende un primer vector que comprende un ácido nucleico que codifica la cadena ligera o la VL del anticuerpo de la reivindicación 4, y un segundo vector que comprende un ácido nucleico que codifica la cadena pesada o la VH del anticuerpo de la reivindicación 4.
23. La célula huésped de la reivindicación 21, en la que
a) la célula huésped contiene un vector que comprende una molécula de ácido nucleico que codifica la cadena pesada y la cadena ligera de un anticuerpo de una cualquiera de las reivindicaciones 1-6, o b) la célula huésped contiene dos vectores diferentes, un primer vector que comprende una molécula de ácido nucleico que codifica una cadena pesada o una región variable de cadena pesada de un anticuerpo de una cualquiera de las reivindicaciones 1-6, y un segundo vector que comprende una molécula de ácido nucleico que codifica una cadena ligera o región variable de cadena ligera de un anticuerpo de una cualquiera de las reivindicaciones 1-6.
24. La célula huésped de la reivindicación 21, en la que la molécula de ácido nucleico codifica una cadena ligera y/o una cadena pesada del anticuerpo de la reivindicación 4, o en la que el(los) vector(es) comprende(n) una molécula de ácido nucleico que codifica una cadena ligera y/o una cadena pesada del anticuerpo de la reivindicación 4.
25. La célula huésped de la reivindicación 21, en la que la molécula de ácido nucleico codifica una cadena ligera y/o una cadena pesada del anticuerpo de la reivindicación 5, o donde el(los) vector(es) aislado(s) comprenden una molécula de ácido nucleico que codifica una cadena ligera y/o una cadena pesada del anticuerpo de la reivindicación 5.
26. La célula huésped de cualquiera de las reivindicaciones 21-25, que es una célula CHO.
27. Un procedimiento de producción de un anticuerpo agonista que se une al GITR humano que comprende cultivar la célula huésped de una cualquiera las reivindicaciones 21-26, de manera que la(s) molécula(s) de ácido nucleico se exprese(n) y el anticuerpo se produzca.
28. El procedimiento de producción de un anticuerpo agonista que se une al GITR humano de la reivindicación 27, que comprende cultivar la célula huésped de la reivindicación 22 o 24, en el que la célula huésped es una célula CHO.
29. El procedimiento de producción de un anticuerpo que se une al GITR humano de la reivindicación 27, que comprende cultivar la célula huésped de la reivindicación 25, en el que la célula huésped es una célula CHO.
30. El procedimiento de producción de un anticuerpo agonista que se une al GITR humano de la reivindicación 27, en el que una primera célula huésped comprende un primer vector que comprende una molécula de ácido
nucleico que codifica una cadena pesada o una región variable de cadena pesada de un anticuerpo de una
cualquiera de las reivindicaciones 1-6, y una segunda célula huésped comprende un segundo vector que
comprende una molécula de ácido nucleico que codifica una cadena ligera o una región variable de cadena ligera
de un anticuerpo de una cualquiera de las reivindicaciones 1-6, y el que la cadena pesada o región variable de la
cadena pesada expresada por la primera la célula se asocia con la cadena ligera o la región variable de la
cadena ligera de la segunda célula, para formar el anticuerpo.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462004071P | 2014-05-28 | 2014-05-28 | |
| US201562161250P | 2015-05-13 | 2015-05-13 | |
| PCT/US2015/032895 WO2015184099A1 (en) | 2014-05-28 | 2015-05-28 | Anti-gitr antibodies and methods of use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2860751T3 true ES2860751T3 (es) | 2021-10-05 |
Family
ID=53433276
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES15729987T Active ES2860751T3 (es) | 2014-05-28 | 2015-05-28 | Anticuerpos anti-GITR y procedimientos de uso de estos |
Country Status (27)
| Country | Link |
|---|---|
| US (9) | US10155818B2 (es) |
| EP (2) | EP3498295A1 (es) |
| JP (3) | JP6847666B2 (es) |
| KR (2) | KR20220116578A (es) |
| CN (2) | CN108064242B (es) |
| AU (3) | AU2015266958A1 (es) |
| CA (1) | CA2949998A1 (es) |
| CY (1) | CY1124787T1 (es) |
| DK (1) | DK3148579T3 (es) |
| EA (1) | EA201692458A1 (es) |
| ES (1) | ES2860751T3 (es) |
| HR (1) | HRP20210364T1 (es) |
| HU (1) | HUE053857T2 (es) |
| IL (3) | IL293212B2 (es) |
| LT (1) | LT3148579T (es) |
| MA (2) | MA40041B1 (es) |
| MX (2) | MX377844B (es) |
| NZ (2) | NZ764826A (es) |
| PH (2) | PH12016502345B1 (es) |
| PL (1) | PL3148579T3 (es) |
| PT (1) | PT3148579T (es) |
| RS (1) | RS61678B1 (es) |
| SG (2) | SG11201609721WA (es) |
| SI (1) | SI3148579T1 (es) |
| SM (1) | SMT202100116T1 (es) |
| TW (2) | TW202132337A (es) |
| WO (1) | WO2015184099A1 (es) |
Families Citing this family (147)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2636503C2 (ru) | 2011-09-08 | 2017-11-23 | Иеда Рисеч Энд Девелопмент Ко. Лтд. | Т-клетки центральной памяти против третьей стороны, способы их получения и их применение в трансплантации и лечении заболеваний |
| KR101549637B1 (ko) | 2012-06-08 | 2015-09-03 | 국립암센터 | 신규한 Th1 세포 전환용 에피토프 및 이의 용도 |
| TW202132337A (zh) | 2014-05-28 | 2021-09-01 | 美商艾吉納斯公司 | 抗糖皮質素誘導性tnfr家族相關性受體(gitr)抗體類及使用彼等之方法 |
| AU2015271709B2 (en) | 2014-06-06 | 2020-11-26 | Bristol-Myers Squibb Company | Antibodies against glucocorticoid-induced tumor necrosis factor receptor (GITR) and uses thereof |
| BR112017008809A2 (pt) | 2014-11-05 | 2017-12-19 | Flexus Biosciences Inc | agentes imunorreguladores |
| UY36390A (es) * | 2014-11-05 | 2016-06-01 | Flexus Biosciences Inc | Compuestos moduladores de la enzima indolamina 2,3-dioxigenasa (ido), sus métodos de síntesis y composiciones farmacéuticas que los contienen |
| SI3218005T1 (sl) | 2014-11-12 | 2023-06-30 | Seagen Inc. | Z glikanom delujoče spojine, in postopki uporabe |
| KR20250004095A (ko) | 2015-04-17 | 2025-01-07 | 브리스톨-마이어스 스큅 컴퍼니 | 항-pd-1 항체 및 또 다른 항체의 조합물을 포함하는 조성물 |
| KR20190080992A (ko) | 2015-05-21 | 2019-07-08 | 하푼 테라퓨틱스, 인크. | 삼중특이성 결합 단백질 및 사용 방법 |
| CA2988115A1 (en) | 2015-06-03 | 2016-12-08 | Bristol-Myers Squibb Company | Anti-gitr antibodies for cancer diagnostics |
| CN108135938A (zh) | 2015-07-16 | 2018-06-08 | 耶达研究及发展有限公司 | 基因修饰的抗第三方中央型记忆t细胞及其在免疫疗法中的用途 |
| RU2753439C2 (ru) | 2015-07-23 | 2021-08-16 | Инхибркс, Инк. | Поливалетные и полиспецифичные gitr-связывающие слитые белки |
| JP7084870B2 (ja) | 2015-10-22 | 2022-06-15 | アブリンクス エン.ヴェー. | Gitrアゴニスト |
| CA3002097A1 (en) | 2015-11-12 | 2017-05-18 | Siamab Therapeutics, Inc. | Glycan-interacting compounds and methods of use |
| JP6983776B2 (ja) | 2015-11-19 | 2021-12-17 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | グルココルチコイド誘発腫瘍壊死因子受容体(gitr)に対する抗体およびその使用 |
| CA3007022A1 (en) * | 2015-12-02 | 2017-06-08 | Agenus Inc. | Anti-gitr antibodies and methods of use thereof |
| WO2017096276A1 (en) * | 2015-12-02 | 2017-06-08 | Agenus Inc. | Anti-gitr antibodies and methods of use thereof |
| EP3383430A4 (en) | 2015-12-02 | 2019-12-18 | Agenus Inc. | ANTIBODIES AND METHOD FOR USE THEREOF |
| UA126115C2 (uk) | 2016-03-08 | 2022-08-17 | Янссен Байотек, Інк. | Антитіло до gitr |
| TWI755395B (zh) | 2016-05-13 | 2022-02-21 | 美商再生元醫藥公司 | 抗-pd-1抗體與輻射治療癌症之組合 |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| EA201892587A1 (ru) | 2016-05-20 | 2019-04-30 | Биохэйвен Фармасьютикал Холдинг Компани Лтд. | Использование глутамат-модулирующих средств вместе с иммунотерапией для лечения рака |
| TWI895621B (zh) | 2016-05-27 | 2025-09-01 | 美商艾吉納斯公司 | 抗-tim-3抗體及其使用方法 |
| EP3463405A4 (en) | 2016-05-27 | 2020-02-26 | DNAtrix, Inc. | ADENOVIRUS AND IMMUNO MODULATOR COMBINATION THERAPY |
| EP3470424B1 (en) | 2016-06-08 | 2025-04-23 | Shanghai Jiao Tong University School of Medicine | Sequence of antibody heavy chain constant region for enhancing agonist antibody activity |
| MY200162A (en) | 2016-06-10 | 2023-12-09 | Regeneron Pharma | Anti-gitr antibodies and uses thereof |
| JP7461741B2 (ja) | 2016-06-20 | 2024-04-04 | カイマブ・リミテッド | 抗pd-l1およびil-2サイトカイン |
| EP3478721A1 (en) * | 2016-07-01 | 2019-05-08 | Five Prime Therapeutics, Inc. | Combined anti tumor therapy with a gitr agonist and cpg |
| EP4512829A3 (en) | 2016-07-14 | 2025-06-11 | Bristol-Myers Squibb Company | Antibodies against tim3 and uses thereof |
| WO2018017889A1 (en) * | 2016-07-20 | 2018-01-25 | Igm Biosciences, Inc. | Multimeric gitr binding molecules and uses thereof |
| SG11201900500TA (en) * | 2016-07-22 | 2019-02-27 | Dana Farber Cancer Inst Inc | Glucocorticoid-induced tumor necrosis factor receptor (gitr) antibodies and methods of use thereof |
| WO2018089628A1 (en) * | 2016-11-09 | 2018-05-17 | Agenus Inc. | Anti-ox40 antibodies, anti-gitr antibodies, and methods of use thereof |
| WO2018094144A1 (en) * | 2016-11-17 | 2018-05-24 | Siamab Therapeutics, Inc. | Compositions and methods for treating cancer |
| EP3541847A4 (en) | 2016-11-17 | 2020-07-08 | Seattle Genetics, Inc. | COMPOUNDS INTERACTING WITH GLYCANE AND METHODS OF USE |
| JOP20190100A1 (ar) * | 2016-11-19 | 2019-05-01 | Potenza Therapeutics Inc | بروتينات ربط مولد ضد مضاد لـ gitr وطرق استخدامها |
| CN110392736A (zh) | 2017-01-18 | 2019-10-29 | 耶达研究及发展有限公司 | 遗传修饰的反抑细胞及其在免疫治疗中的用途 |
| US10751368B2 (en) | 2017-01-18 | 2020-08-25 | Yeda Research And Development Co. Ltd. | Methods of transplantation and disease treatment |
| RU2019125975A (ru) | 2017-01-27 | 2021-03-01 | Ультрахьюман Уан Лимитед | Связывающие агенты |
| MX2019009619A (es) * | 2017-02-10 | 2019-12-18 | Eutilex Co Ltd | Anticuerpo anti-cancer convertible de celula t regulatoria inducible por ifn-gamma (irtca) y usos del mismo. |
| IL268479B2 (en) | 2017-02-21 | 2024-06-01 | Regeneron Pharma | Anti-PD-1 antibodies for the treatment of lung cancer |
| EP3589319A4 (en) * | 2017-03-03 | 2021-07-14 | Seagen Inc. | COMPOUNDS INTERACTING WITH GLYCAN AND METHODS OF USE |
| CA3058175A1 (en) | 2017-03-31 | 2018-10-04 | Bristol-Myers Squibb Company | Methods of treating tumor |
| WO2018185618A1 (en) | 2017-04-03 | 2018-10-11 | Novartis Ag | Anti-cdh6 antibody drug conjugates and anti-gitr antibody combinations and methods of treatment |
| AR111651A1 (es) | 2017-04-28 | 2019-08-07 | Novartis Ag | Conjugados de anticuerpos que comprenden agonistas del receptor de tipo toll y terapias de combinación |
| SG10202107880XA (en) | 2017-05-12 | 2021-09-29 | Harpoon Therapeutics Inc | Mesothelin binding proteins |
| KR20200006115A (ko) | 2017-05-16 | 2020-01-17 | 브리스톨-마이어스 스큅 컴퍼니 | 항-gitr 효능제 항체에 의한 암의 치료 |
| WO2018229715A1 (en) | 2017-06-16 | 2018-12-20 | Novartis Ag | Compositions comprising anti-cd32b antibodies and methods of use thereof |
| CN109136275B (zh) | 2017-06-19 | 2021-03-16 | 百奥赛图(北京)医药科技股份有限公司 | 人源化gitr基因改造动物模型的制备方法及应用 |
| WO2018235056A1 (en) | 2017-06-22 | 2018-12-27 | Novartis Ag | Il-1beta binding antibodies for use in treating cancer |
| WO2018234879A1 (en) | 2017-06-22 | 2018-12-27 | Novartis Ag | Il-1beta binding antibodies for use in treating cancer |
| EP3642240A1 (en) | 2017-06-22 | 2020-04-29 | Novartis AG | Antibody molecules to cd73 and uses thereof |
| KR20200021087A (ko) | 2017-06-22 | 2020-02-27 | 노파르티스 아게 | Cd73에 대한 항체 분자 및 이의 용도 |
| JP2020525483A (ja) | 2017-06-27 | 2020-08-27 | ノバルティス アーゲー | 抗tim−3抗体のための投与レジメンおよびその使用 |
| MX383313B (es) * | 2017-06-30 | 2025-03-13 | Bristol Myers Squibb Co | Compuestos de quinolinilciclohexilpropanamida sustituidos y metodos mejorados para su preparacion |
| CN110461874B (zh) | 2017-06-30 | 2022-04-12 | 江苏恒瑞医药股份有限公司 | 抗gitr抗体、其抗原结合片段及其医药用途 |
| CN111163798A (zh) | 2017-07-20 | 2020-05-15 | 诺华股份有限公司 | 用于抗lag-3抗体的给药方案及其用途 |
| JP7241080B2 (ja) * | 2017-08-28 | 2023-03-16 | アンジーエックス・インコーポレーテッド | 抗tm4sf1抗体およびそれを使用する方法 |
| IL315737A (en) | 2017-10-13 | 2024-11-01 | Harpoon Therapeutics Inc | B-cell maturation antigen-binding proteins |
| PL3694529T3 (pl) | 2017-10-13 | 2024-12-16 | Harpoon Therapeutics, Inc. | Trójswoiste białka i sposoby zastosowania |
| JP2020536894A (ja) | 2017-10-15 | 2020-12-17 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 腫瘍処置法 |
| EP3700933A1 (en) | 2017-10-25 | 2020-09-02 | Novartis AG | Antibodies targeting cd32b and methods of use thereof |
| RU2020119578A (ru) | 2017-11-16 | 2021-12-17 | Новартис Аг | Комбинированные терапии |
| CN120192415A (zh) | 2018-01-12 | 2025-06-24 | 百时美施贵宝公司 | 抗tim3抗体及其用途 |
| WO2019173420A1 (en) * | 2018-03-08 | 2019-09-12 | Phanes Therapeutics, Inc. | Anti-claudin 18.2 antibodies and uses thereof |
| KR20250154550A (ko) | 2018-03-21 | 2025-10-28 | 파이브 프라임 테라퓨틱스, 인크. | 산성 pH에서 VISTA에 결합하는 항체 |
| PE20210665A1 (es) | 2018-03-23 | 2021-03-31 | Bristol Myers Squibb Co | Anticuerpos contra mica y/o micb y sus usos |
| JP7611700B2 (ja) | 2018-03-27 | 2025-01-10 | ブリストル-マイヤーズ スクイブ カンパニー | 紫外線シグナルを使用した力価のリアルタイムモニタリング |
| EP3774911A1 (en) | 2018-03-30 | 2021-02-17 | Bristol-Myers Squibb Company | Methods of treating tumor |
| US20210147547A1 (en) | 2018-04-13 | 2021-05-20 | Novartis Ag | Dosage Regimens For Anti-Pd-L1 Antibodies And Uses Thereof |
| TWI869346B (zh) | 2018-05-30 | 2025-01-11 | 瑞士商諾華公司 | Entpd2抗體、組合療法、及使用該等抗體和組合療法之方法 |
| WO2019232244A2 (en) | 2018-05-31 | 2019-12-05 | Novartis Ag | Antibody molecules to cd73 and uses thereof |
| CN112638375A (zh) | 2018-06-15 | 2021-04-09 | 旗舰创业创新五公司 | 通过后细胞信号传导因子的调节来增加免疫活性 |
| MY201995A (en) | 2018-07-09 | 2024-03-28 | Five Prime Therapeutics Inc | Antibodies binding to ilt4 |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| PL3820573T3 (pl) | 2018-07-10 | 2024-02-19 | Novartis Ag | Pochodne 3-(5-hydroksy-1-oksoizoindolin-2-ylo)piperydyno-2,6-dionu i ich zastosowanie w leczeniu chorób zależnych od palca cynkowego z rodziny ikaros 2 (ikzf2) |
| JP7700036B2 (ja) | 2018-07-11 | 2025-06-30 | ファイヴ プライム セラピューティクス インク | 酸性pHでVISTAと結合する抗体 |
| WO2020021465A1 (en) | 2018-07-25 | 2020-01-30 | Advanced Accelerator Applications (Italy) S.R.L. | Method of treatment of neuroendocrine tumors |
| KR102753455B1 (ko) * | 2018-08-08 | 2025-01-10 | 세다르스-신나이 메디칼 센터 | 암 및 자가면역 질환을 치료하기 위한 조성물 및 방법 |
| US12195544B2 (en) | 2018-09-21 | 2025-01-14 | Harpoon Therapeutics, Inc. | EGFR binding proteins and methods of use |
| CN113286817B (zh) | 2018-09-25 | 2025-01-28 | 哈普恩治疗公司 | Dll3结合蛋白及使用方法 |
| US20230053449A1 (en) | 2018-10-31 | 2023-02-23 | Novartis Ag | Dc-sign antibody drug conjugates |
| CN113271945A (zh) | 2018-12-20 | 2021-08-17 | 诺华股份有限公司 | 包含3-(1-氧代异吲哚啉-2-基)哌啶-2,6-二酮衍生物的给药方案和药物组合 |
| CN113227137A (zh) | 2018-12-21 | 2021-08-06 | 诺华股份有限公司 | IL-1β抗体在骨髓增生异常综合征的治疗或预防中的用途 |
| US20220025036A1 (en) | 2018-12-21 | 2022-01-27 | Novartis Ag | Use of il-1beta binding antibodies |
| KR20210108422A (ko) | 2018-12-21 | 2021-09-02 | 노파르티스 아게 | IL-1β 결합 항체의 용도 |
| WO2020128637A1 (en) | 2018-12-21 | 2020-06-25 | Novartis Ag | Use of il-1 binding antibodies in the treatment of a msi-h cancer |
| EP3924055B1 (en) | 2019-02-15 | 2024-04-03 | Novartis AG | Substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| JP7483732B2 (ja) | 2019-02-15 | 2024-05-15 | ノバルティス アーゲー | 3-(1-オキソ-5-(ピペリジン-4-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン誘導体及びその使用 |
| US20220135619A1 (en) | 2019-02-24 | 2022-05-05 | Bristol-Myers Squibb Company | Methods of isolating a protein |
| US12428477B2 (en) | 2019-02-27 | 2025-09-30 | Angiex, Inc. | Antibody-drug conjugates comprising anti-TM4SF1 antibodies and methods of using the same |
| RU2734432C1 (ru) * | 2019-04-23 | 2020-10-16 | Закрытое Акционерное Общество "Биокад" | Моноклональное антитело, которое специфически связывается с GITR |
| EP3962493A2 (en) | 2019-05-03 | 2022-03-09 | Flagship Pioneering Innovations V, Inc. | Methods of modulating immune activity/level of irf or sting or of treating cancer, comprising the administration of a sting modulator and/or purinergic receptor modulator or postcellular signaling factor |
| US20220220430A1 (en) | 2019-05-23 | 2022-07-14 | Bristol-Myers Squibb Company | Methods of monitoring cell culture media |
| CN114174538A (zh) | 2019-05-30 | 2022-03-11 | 百时美施贵宝公司 | 适合于免疫肿瘤学疗法的多肿瘤基因特征 |
| EP3977132A1 (en) | 2019-05-30 | 2022-04-06 | Bristol-Myers Squibb Company | Cell localization signature and combination therapy |
| KR20220016155A (ko) | 2019-05-30 | 2022-02-08 | 브리스톨-마이어스 스큅 컴퍼니 | 면역-종양학 (i-o) 요법에 적합한 대상체를 확인하는 방법 |
| WO2021026522A2 (en) * | 2019-08-08 | 2021-02-11 | Cedars-Sinai Medical Center | Method of generating activated t cells for cancer therapy |
| CN114502590A (zh) | 2019-09-18 | 2022-05-13 | 诺华股份有限公司 | Entpd2抗体、组合疗法、以及使用这些抗体和组合疗法的方法 |
| MX2022003204A (es) | 2019-09-19 | 2022-04-18 | Bristol Myers Squibb Co | Anticuerpos de union al supresor de activacion de linfocitos t que contiene inmunoglobulina con dominio v (vista) a ph acido. |
| MX2022004766A (es) | 2019-10-21 | 2022-05-16 | Novartis Ag | Terapias combinadas con venetoclax e inhibidores de tim-3. |
| TW202128191A (zh) | 2019-10-21 | 2021-08-01 | 瑞士商諾華公司 | Tim-3抑制劑及其用途 |
| WO2021127217A1 (en) | 2019-12-17 | 2021-06-24 | Flagship Pioneering Innovations V, Inc. | Combination anti-cancer therapies with inducers of iron-dependent cellular disassembly |
| TW202135859A (zh) | 2019-12-20 | 2021-10-01 | 瑞士商諾華公司 | 組合療法 |
| BR112022012310A2 (pt) | 2020-01-17 | 2022-09-06 | Novartis Ag | Combinação compreendendo um inibidor de tim-3 e um agente hipometilante para uso no tratamento de síndrome mielodisplásica ou leucemia mielomonocítica crônica |
| PH12022552295A1 (en) | 2020-03-06 | 2024-01-22 | Regeneron Pharma | Anti-gitr antibodies and uses thereof |
| WO2021225159A1 (ja) * | 2020-05-08 | 2021-11-11 | 国立大学法人三重大学 | Gitr結合性分子 |
| KR20230024967A (ko) | 2020-06-11 | 2023-02-21 | 노파르티스 아게 | Zbtb32 억제제 및 이의 용도 |
| KR20230027056A (ko) | 2020-06-23 | 2023-02-27 | 노파르티스 아게 | 3-(1-옥소이소인돌린-2-일)피페리딘-2,6-디온 유도체를 포함하는 투약 요법 |
| CN111732658B (zh) * | 2020-06-28 | 2022-04-26 | 英诺湖医药(杭州)有限公司 | 一组gitr单克隆抗体及其医药用途 |
| EP4172323A1 (en) | 2020-06-29 | 2023-05-03 | Flagship Pioneering Innovations V, Inc. | Viruses engineered to promote thanotransmission and their use in treating cancer |
| US20230271940A1 (en) | 2020-08-03 | 2023-08-31 | Novartis Ag | Heteroaryl substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| CA3190660A1 (en) | 2020-08-31 | 2022-03-03 | George C. Lee | Cell localization signature and immunotherapy |
| WO2022043557A1 (en) | 2020-08-31 | 2022-03-03 | Advanced Accelerator Applications International Sa | Method of treating psma-expressing cancers |
| US20230338587A1 (en) | 2020-08-31 | 2023-10-26 | Advanced Accelerator Applications International Sa | Method of treating psma-expressing cancers |
| JP2023544410A (ja) | 2020-10-05 | 2023-10-23 | ブリストル-マイヤーズ スクイブ カンパニー | タンパク質を濃縮するための方法 |
| WO2022076840A1 (en) * | 2020-10-08 | 2022-04-14 | The Brigham And Women's Hospital, Inc. | Kidney targeted delivery of drugs |
| WO2022117572A2 (en) | 2020-12-02 | 2022-06-09 | Oncurious Nv | An ltbr agonist in combination therapy against cancer |
| WO2022120179A1 (en) | 2020-12-03 | 2022-06-09 | Bristol-Myers Squibb Company | Multi-tumor gene signatures and uses thereof |
| CA3196999A1 (en) | 2020-12-28 | 2022-07-07 | Masano HUANG | Methods of treating tumors |
| SMT202500208T1 (it) | 2020-12-28 | 2025-07-22 | Bristol Myers Squibb Co | Composizioni anticorpali e metodi per il loro uso |
| AU2021414400A1 (en) | 2020-12-31 | 2023-08-17 | Innate Pharma | Multifunctional natural killer (nk) cell engagers binding to nkp46 and cd123 |
| WO2022159620A1 (en) * | 2021-01-21 | 2022-07-28 | Twist Bioscience Corporation | Methods and compositions relating to adenosine receptors |
| TW202246334A (zh) | 2021-02-02 | 2022-12-01 | 美商美國禮來大藥廠 | Gitr拮抗劑及其使用方法 |
| KR20230165276A (ko) | 2021-03-31 | 2023-12-05 | 플래그쉽 파이어니어링 이노베이션스 브이, 인크. | 타노트랜스미션 폴리펩티드 및 암의 치료에서의 이의 용도 |
| EP4314068A1 (en) | 2021-04-02 | 2024-02-07 | The Regents Of The University Of California | Antibodies against cleaved cdcp1 and uses thereof |
| CN113035298B (zh) * | 2021-04-02 | 2023-06-20 | 南京信息工程大学 | 递归生成大阶数行限制覆盖阵列的药物临床试验设计方法 |
| TW202304979A (zh) | 2021-04-07 | 2023-02-01 | 瑞士商諾華公司 | 抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途 |
| AU2022272117A1 (en) * | 2021-05-10 | 2024-01-04 | Medimabbio Inc. | Anti-gitr antibodies and uses thereof |
| AR125874A1 (es) | 2021-05-18 | 2023-08-23 | Novartis Ag | Terapias de combinación |
| AU2022303363A1 (en) | 2021-06-29 | 2024-01-18 | Flagship Pioneering Innovations V, Inc. | Immune cells engineered to promote thanotransmission and uses thereof |
| WO2023173011A1 (en) | 2022-03-09 | 2023-09-14 | Bristol-Myers Squibb Company | Transient expression of therapeutic proteins |
| MX2024011278A (es) | 2022-03-15 | 2024-09-25 | Compugen Ltd | Anticuerpos antagonistas de il-18bp y su uso en monoterapia y terapia de combinacion en el tratamiento del cancer. |
| CA3243774A1 (en) | 2022-03-15 | 2023-09-21 | Yeda Research And Development Co. Ltd. | Anti-Glucocorticoid-Induced TNFR-Related Protein (GITR) Antibodies and Their Uses |
| KR20240159621A (ko) | 2022-03-18 | 2024-11-05 | 브리스톨-마이어스 스큅 컴퍼니 | 폴리펩티드를 단리하는 방법 |
| AU2023274452A1 (en) | 2022-05-27 | 2025-01-16 | Innate Pharma | Natural killer (nk) cell engagers binding to nkp46 and bcma variants with fc-engineering |
| WO2023235847A1 (en) | 2022-06-02 | 2023-12-07 | Bristol-Myers Squibb Company | Antibody compositions and methods of use thereof |
| WO2024058404A1 (ko) | 2022-09-15 | 2024-03-21 | 주식회사 엘지에너지솔루션 | 배터리 관리 시스템, 배터리 팩, 전기 차량 및 배터리 충전 시간 예측 방법 |
| US20240174732A1 (en) | 2022-10-05 | 2024-05-30 | Flagship Pioneering Innovations V, Inc. | Nucleic acid molecules encoding trif and additional polypeptides and their use in treating cancer |
| TW202421194A (zh) * | 2022-11-03 | 2024-06-01 | 美商英塞特公司 | 包含抗gitr抗體之用於治療癌症的組合療法 |
| US20240269251A1 (en) | 2023-01-09 | 2024-08-15 | Flagship Pioneering Innovations V, Inc. | Genetic switches and their use in treating cancer |
| CN120981564A (zh) | 2023-03-17 | 2025-11-18 | 圭尔医疗有限公司 | 调节性t细胞疗法 |
| TW202515608A (zh) | 2023-06-26 | 2025-04-16 | 以色列商坎布根有限公司 | Il—18bp拮抗抗體及其於癌症治療之單一療法及組合療法的用途 |
| CN117777306B (zh) * | 2023-07-04 | 2024-08-20 | 深圳豪石生物科技有限公司 | 一种靶向cldn18.2的增强型嵌合抗原受体及其用途 |
| WO2025038763A1 (en) | 2023-08-15 | 2025-02-20 | Bristol-Myers Squibb Company | Ceramic hydroxyapatite chromatography flow through method |
| CN117777307B (zh) * | 2023-09-26 | 2024-08-20 | 深圳豪石生物科技有限公司 | 一种cldn18.2特异性嵌合t细胞受体、嵌合t细胞受体免疫细胞及其应用 |
| US20250179203A1 (en) * | 2023-12-01 | 2025-06-05 | The General Hospital Corporation | Antibodies with fc modifications and methods of using the same |
| US20250215087A1 (en) | 2023-12-29 | 2025-07-03 | Bristol-Myers Squibb Company | Combination therapy of kras inhibitor and treg depleting agent |
Family Cites Families (239)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4044126A (en) | 1972-04-20 | 1977-08-23 | Allen & Hanburys Limited | Steroidal aerosol compositions and process for the preparation thereof |
| GB1429184A (en) | 1972-04-20 | 1976-03-24 | Allen & Hanburys Ltd | Physically anti-inflammatory steroids for use in aerosols |
| US4444887A (en) | 1979-12-10 | 1984-04-24 | Sloan-Kettering Institute | Process for making human antibody producing B-lymphocytes |
| US4716111A (en) | 1982-08-11 | 1987-12-29 | Trustees Of Boston University | Process for producing human antibodies |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| CA1319120C (en) | 1985-04-01 | 1993-06-15 | John Henry Kenten | Transformed myeloma cell-line and a process for the expression of a gene coding for a eukaryotic polypeptide employing same |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US5869620A (en) | 1986-09-02 | 1999-02-09 | Enzon, Inc. | Multivalent antigen-binding proteins |
| DE3883899T3 (de) | 1987-03-18 | 1999-04-22 | Sb2, Inc., Danville, Calif. | Geänderte antikörper. |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| US5677425A (en) | 1987-09-04 | 1997-10-14 | Celltech Therapeutics Limited | Recombinant antibody |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| DE768377T1 (de) | 1988-09-02 | 1998-01-02 | Dyax Corp | Herstellung und Auswahl von Rekombinantproteinen mit verschiedenen Bindestellen |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5413923A (en) | 1989-07-25 | 1995-05-09 | Cell Genesys, Inc. | Homologous recombination for universal donor cells and chimeric mammalian hosts |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5585112A (en) | 1989-12-22 | 1996-12-17 | Imarx Pharmaceutical Corp. | Method of preparing gas and gaseous precursor-filled microspheres |
| WO1991010737A1 (en) | 1990-01-11 | 1991-07-25 | Molecular Affinities Corporation | Production of antibodies using gene libraries |
| US5780225A (en) | 1990-01-12 | 1998-07-14 | Stratagene | Method for generating libaries of antibody genes comprising amplification of diverse antibody DNAs and methods for using these libraries for the production of diverse antigen combining molecules |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| ATE139258T1 (de) | 1990-01-12 | 1996-06-15 | Cell Genesys Inc | Erzeugung xenogener antikörper |
| IT1246382B (it) | 1990-04-17 | 1994-11-18 | Eurand Int | Metodo per la cessione mirata e controllata di farmaci nell'intestino e particolarmente nel colon |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| AU8507191A (en) | 1990-08-29 | 1992-03-30 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5698426A (en) | 1990-09-28 | 1997-12-16 | Ixsys, Incorporated | Surface expression libraries of heteromeric receptors |
| US5543390A (en) | 1990-11-01 | 1996-08-06 | State Of Oregon, Acting By And Through The Oregon State Board Of Higher Education, Acting For And On Behalf Of The Oregon Health Sciences University | Covalent microparticle-drug conjugates for biological targeting |
| CA2095633C (en) | 1990-12-03 | 2003-02-04 | Lisa J. Garrard | Enrichment method for variant proteins with altered binding properties |
| WO1992018619A1 (en) | 1991-04-10 | 1992-10-29 | The Scripps Research Institute | Heterodimeric receptor libraries using phagemids |
| DE69233482T2 (de) | 1991-05-17 | 2006-01-12 | Merck & Co., Inc. | Verfahren zur Verminderung der Immunogenität der variablen Antikörperdomänen |
| AU2238292A (en) | 1991-06-14 | 1993-01-12 | Xoma Corporation | Microbially-produced antibody fragments and their conjugates |
| EP0940468A1 (en) | 1991-06-14 | 1999-09-08 | Genentech, Inc. | Humanized antibody variable domain |
| US5637481A (en) | 1993-02-01 | 1997-06-10 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| MX9204374A (es) | 1991-07-25 | 1993-03-01 | Idec Pharma Corp | Anticuerpo recombinante y metodo para su produccion. |
| US5565332A (en) | 1991-09-23 | 1996-10-15 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| ES2341666T3 (es) | 1991-12-02 | 2010-06-24 | Medimmune Limited | Produccion de autoanticuerpos de repertorios de segmentos de anticue rpos expresados en la superficie de fagos. |
| ATE249840T1 (de) | 1991-12-13 | 2003-10-15 | Xoma Corp | Verfahren und materialien zur herstellung von modifizierten variablen antikörperdomänen und ihre therapeutische verwendung |
| GB9203459D0 (en) | 1992-02-19 | 1992-04-08 | Scotgen Ltd | Antibodies with germ-line variable regions |
| GB9206422D0 (en) | 1992-03-24 | 1992-05-06 | Bolt Sarah L | Antibody preparation |
| US5733743A (en) | 1992-03-24 | 1998-03-31 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| US6174666B1 (en) | 1992-03-27 | 2001-01-16 | The United States Of America As Represented By The Department Of Health And Human Services | Method of eliminating inhibitory/instability regions from mRNA |
| US6010715A (en) | 1992-04-01 | 2000-01-04 | Bertek, Inc. | Transdermal patch incorporating a polymer film incorporated with an active agent |
| US6024975A (en) | 1992-04-08 | 2000-02-15 | Americare International Diagnostics, Inc. | Method of transdermally administering high molecular weight drugs with a polymer skin enhancer |
| EP0640094A1 (en) | 1992-04-24 | 1995-03-01 | The Board Of Regents, The University Of Texas System | Recombinant production of immunoglobulin-like domains in prokaryotic cells |
| US6005079A (en) | 1992-08-21 | 1999-12-21 | Vrije Universiteit Brussels | Immunoglobulins devoid of light chains |
| DE69330523D1 (de) | 1992-08-21 | 2001-09-06 | Vrije Universiteit Brussel Bru | Immunoglobuline ohne leichte ketten |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| DK0672142T3 (da) | 1992-12-04 | 2001-06-18 | Medical Res Council | Multivalente og multispecifikke bindingsproteiner samt fremstilling og anvendelse af disse |
| US6274552B1 (en) | 1993-03-18 | 2001-08-14 | Cytimmune Sciences, Inc. | Composition and method for delivery of biologically-active factors |
| US5523092A (en) | 1993-04-14 | 1996-06-04 | Emory University | Device for local drug delivery and methods for using the same |
| US5985307A (en) | 1993-04-14 | 1999-11-16 | Emory University | Device and method for non-occlusive localized drug delivery |
| ES2162863T3 (es) | 1993-04-29 | 2002-01-16 | Unilever Nv | Produccion de anticuerpos o fragmentos (funcionalizados) de los mismos derivados de inmunoglobulinas de cadena pesada de camelidae. |
| WO1994029351A2 (en) | 1993-06-16 | 1994-12-22 | Celltech Limited | Antibodies |
| WO1995001997A1 (en) | 1993-07-09 | 1995-01-19 | Smithkline Beecham Corporation | RECOMBINANT AND HUMANIZED IL-1β ANTIBODIES FOR TREATMENT OF IL-1 MEDIATED INFLAMMATORY DISORDERS IN MAN |
| US6004534A (en) | 1993-07-23 | 1999-12-21 | Massachusetts Institute Of Technology | Targeted polymerized liposomes for improved drug delivery |
| EP0733070A1 (en) | 1993-12-08 | 1996-09-25 | Genzyme Corporation | Process for generating specific antibodies |
| GB9326253D0 (en) | 1993-12-23 | 1994-02-23 | Smithkline Beecham Biolog | Vaccines |
| US5997873A (en) | 1994-01-13 | 1999-12-07 | Mount Sinai School Of Medicine Of The City University Of New York | Method of preparation of heat shock protein 70-peptide complexes |
| EP1231268B1 (en) | 1994-01-31 | 2005-07-27 | Trustees Of Boston University | Polyclonal antibody libraries |
| RU2178306C2 (ru) | 1994-05-06 | 2002-01-20 | Энститю Гюстав Русси | Растворимые полипептидные фракции протеина lag-3, способ получения, терапевтическая композиция, антитело |
| US5516637A (en) | 1994-06-10 | 1996-05-14 | Dade International Inc. | Method involving display of protein binding pairs on the surface of bacterial pili and bacteriophage |
| US5759542A (en) | 1994-08-05 | 1998-06-02 | New England Deaconess Hospital Corporation | Compositions and methods for the delivery of drugs by platelets for the treatment of cardiovascular and other diseases |
| US5660854A (en) | 1994-11-28 | 1997-08-26 | Haynes; Duncan H | Drug releasing surgical implant or dressing material |
| US6121022A (en) | 1995-04-14 | 2000-09-19 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5983134A (en) | 1995-04-23 | 1999-11-09 | Electromagnetic Bracing Systems Inc. | Electrophoretic cuff apparatus drug delivery system |
| EP0822830B1 (en) | 1995-04-27 | 2008-04-02 | Amgen Fremont Inc. | Human anti-IL-8 antibodies, derived from immunized xenomice |
| EP0823941A4 (en) | 1995-04-28 | 2001-09-19 | Abgenix Inc | HUMAN ANTIBODIES DERIVED FROM IMMUNIZED XENO MOUSES |
| US6316652B1 (en) | 1995-06-06 | 2001-11-13 | Kosta Steliou | Drug mitochondrial targeting agents |
| JP2000508226A (ja) | 1995-07-21 | 2000-07-04 | アプライド リサーチ システムズ アース ホールディング エヌ.ヴィ. | Lag−3タンパク質によるth1リンパ球を検出、同定、単離並びに選択的に標識およびターゲッティングする方法 |
| US6167301A (en) | 1995-08-29 | 2000-12-26 | Flower; Ronald J. | Iontophoretic drug delivery device having high-efficiency DC-to-DC energy conversion circuit |
| US5935576A (en) | 1995-09-13 | 1999-08-10 | Fordham University | Compositions and methods for the treatment and prevention of neoplastic diseases using heat shock proteins complexed with exogenous antigens |
| GB9601081D0 (en) | 1995-10-06 | 1996-03-20 | Cambridge Antibody Tech | Specific binding members for human transforming growth factor beta;materials and methods |
| US5989830A (en) | 1995-10-16 | 1999-11-23 | Unilever Patent Holdings Bv | Bifunctional or bivalent antibody fragment analogue |
| US6039975A (en) | 1995-10-17 | 2000-03-21 | Hoffman-La Roche Inc. | Colon targeted delivery system |
| JP2978435B2 (ja) | 1996-01-24 | 1999-11-15 | チッソ株式会社 | アクリロキシプロピルシランの製造方法 |
| JP4046354B2 (ja) | 1996-03-18 | 2008-02-13 | ボード オブ リージェンツ,ザ ユニバーシティ オブ テキサス システム | 増大した半減期を有する免疫グロブリン様ドメイン |
| TW345603B (en) | 1996-05-29 | 1998-11-21 | Gmundner Fertigteile Gmbh | A noise control device for tracks |
| US6111090A (en) | 1996-08-16 | 2000-08-29 | Schering Corporation | Mammalian cell surface antigens; related reagents |
| US6027947A (en) | 1996-08-20 | 2000-02-22 | Ramtron International Corporation | Partially or completely encapsulated top electrode of a ferroelectric capacitor |
| US5985317A (en) | 1996-09-06 | 1999-11-16 | Theratech, Inc. | Pressure sensitive adhesive matrix patches for transdermal delivery of salts of pharmaceutical agents |
| HUP0000116A3 (en) | 1996-10-01 | 2000-08-28 | Stanford Res Inst Int | Taste-masked microcapsule compositions and methods of manufacture |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| US6131570A (en) | 1998-06-30 | 2000-10-17 | Aradigm Corporation | Temperature controlling device for aerosol drug delivery |
| WO1998023289A1 (en) | 1996-11-27 | 1998-06-04 | The General Hospital Corporation | MODULATION OF IgG BINDING TO FcRn |
| EP1500329B1 (en) | 1996-12-03 | 2012-03-21 | Amgen Fremont Inc. | Human antibodies that specifically bind human TNF alpha |
| US5860957A (en) | 1997-02-07 | 1999-01-19 | Sarcos, Inc. | Multipathway electronically-controlled drug delivery system |
| US6017540A (en) | 1997-02-07 | 2000-01-25 | Fordham University | Prevention and treatment of primary and metastatic neoplastic diseases and infectious diseases with heat shock/stress protein-peptide complexes |
| US6277375B1 (en) | 1997-03-03 | 2001-08-21 | Board Of Regents, The University Of Texas System | Immunoglobulin-like domains with increased half-lives |
| AU6703198A (en) | 1997-03-21 | 1998-10-20 | Brigham And Women's Hospital | Immunotherapeutic ctla-4 binding peptides |
| US6120751A (en) | 1997-03-21 | 2000-09-19 | Imarx Pharmaceutical Corp. | Charged lipids and uses for the same |
| DE69800716T2 (de) | 1997-04-14 | 2001-09-20 | Micromet Gesellschaft Fuer Biomedizinische Forschung Mbh | Neues verfahren zur herstellung von anti-humanen antigenrezeptoren und deren verwendungen |
| US6060082A (en) | 1997-04-18 | 2000-05-09 | Massachusetts Institute Of Technology | Polymerized liposomes targeted to M cells and useful for oral or mucosal drug delivery |
| US7951917B1 (en) | 1997-05-02 | 2011-05-31 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| US20020062010A1 (en) | 1997-05-02 | 2002-05-23 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| US5948433A (en) | 1997-08-21 | 1999-09-07 | Bertek, Inc. | Transdermal patch |
| CA2654522C (en) | 1997-08-29 | 2014-01-28 | Antigenics Inc. | Compositions comprising the adjuvant qs-21 and polysorbate or cyclodextrin as exipient |
| US6503184B1 (en) | 1997-10-21 | 2003-01-07 | Human Genome Sciences, Inc. | Human tumor necrosis factor receptor-like proteins TR11, TR11SV1 and TR11SV2 |
| US6509173B1 (en) | 1997-10-21 | 2003-01-21 | Human Genome Sciences, Inc. | Human tumor necrosis factor receptor-like proteins TR11, TR11SV1, and TR11SV2 |
| EP0968711B9 (en) | 1997-10-28 | 2008-05-28 | Bando Chemical Industries, Ltd. | Dermatological patch sheet and process for producing base sheet therefor |
| US5948646A (en) | 1997-12-11 | 1999-09-07 | Fordham University | Methods for preparation of vaccines against cancer comprising heat shock protein-peptide complexes |
| CA2319236A1 (en) | 1998-02-09 | 1999-08-12 | Genentech, Inc. | Novel tumor necrosis factor receptor homolog and nucleic acids encoding the same |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| EP1073464B1 (en) | 1998-04-28 | 2004-10-06 | Smithkline Beecham Corporation | Monoclonal antibodies with reduced immunogenicity |
| US6048736A (en) | 1998-04-29 | 2000-04-11 | Kosak; Kenneth M. | Cyclodextrin polymers for carrying and releasing drugs |
| PT1104306E (pt) | 1998-08-10 | 2006-05-31 | Antigenics Inc | Composicoes de cpg e adjuvantes de saponina e seus metodos |
| SI2112166T1 (sl) | 1998-12-23 | 2019-05-31 | Pfizer Inc. | Človeška monoklonska protitelesa proti CTLA-4 |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| KR101077001B1 (ko) | 1999-01-15 | 2011-10-26 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| US6271359B1 (en) | 1999-04-14 | 2001-08-07 | Musc Foundation For Research Development | Tissue-specific and pathogen-specific toxic agents and ribozymes |
| US6256533B1 (en) | 1999-06-09 | 2001-07-03 | The Procter & Gamble Company | Apparatus and method for using an intracutaneous microneedle array |
| DK1210428T3 (en) | 1999-08-23 | 2015-06-15 | Dana Farber Cancer Inst Inc | PD-1, a receptor for B7-4 AND USE THEREOF |
| CN1371416B (zh) | 1999-08-24 | 2012-10-10 | 梅达里克斯公司 | 人ctla-4抗体及其应用 |
| ES2331051T3 (es) | 1999-11-29 | 2009-12-21 | Bac Ip B.V. | Inmovilizacion de moleculas de union de antigenos de un dominio. |
| AU2001233027A1 (en) | 2000-01-27 | 2001-08-07 | Genetics Institute, Llc | Antibodies against ctla4 (cd152), conjugates comprising same, and uses thereof |
| US6261595B1 (en) | 2000-02-29 | 2001-07-17 | Zars, Inc. | Transdermal drug patch with attached pocket for controlled heating device |
| MXPA02010011A (es) | 2000-04-11 | 2003-04-25 | Genentech Inc | Anticuerpos multivalentes y usos para los mismos. |
| DK1355919T3 (da) | 2000-12-12 | 2011-03-14 | Medimmune Llc | Molekyler med længere halveringstider, sammensætninger og anvendelser deraf |
| US7658921B2 (en) | 2000-12-12 | 2010-02-09 | Medimmune, Llc | Molecules with extended half-lives, compositions and uses thereof |
| IL149701A0 (en) | 2001-05-23 | 2002-11-10 | Pfizer Prod Inc | Use of anti-ctla-4 antibodies |
| WO2003006058A1 (en) | 2001-07-12 | 2003-01-23 | Wyeth | Cd25+ differential markers and uses thereof |
| US6881557B2 (en) | 2001-07-12 | 2005-04-19 | Arrowsmith Technologies Llp | Super humanized antibodies |
| WO2003042402A2 (en) | 2001-11-13 | 2003-05-22 | Dana-Farber Cancer Institute, Inc. | Agents that modulate immune cell activation and methods of use thereof |
| AU2003303082B2 (en) | 2002-01-30 | 2009-07-02 | Dana-Farber Cancer Institute, Inc. | Compositions and methods related to TIM-3, a Th1-specific cell surface molecule |
| AUPS054702A0 (en) | 2002-02-14 | 2002-03-07 | Immunaid Pty Ltd | Cancer therapy |
| US20040014194A1 (en) | 2002-03-27 | 2004-01-22 | Schering Corporation | Beta-secretase crystals and methods for preparing and using the same |
| BR0309254A (pt) | 2002-04-12 | 2005-03-01 | Medarex Inc | Uso de um anticorpo anti-ctla-4 |
| US7550140B2 (en) | 2002-06-13 | 2009-06-23 | Crucell Holland B.V. | Antibody to the human OX40 receptor |
| EP1537878B1 (en) | 2002-07-03 | 2010-09-22 | Ono Pharmaceutical Co., Ltd. | Immunopotentiating compositions |
| US7291331B1 (en) | 2002-09-11 | 2007-11-06 | La Jolla Institute For Allergy And Immunology | Methods of treating OX40 medicated recall immune responses |
| WO2004056875A1 (en) | 2002-12-23 | 2004-07-08 | Wyeth | Antibodies against pd-1 and uses therefor |
| US9068234B2 (en) | 2003-01-21 | 2015-06-30 | Ptc Therapeutics, Inc. | Methods and agents for screening for compounds capable of modulating gene expression |
| EP1596871A4 (en) | 2003-02-28 | 2006-08-23 | Drew M Pardoll | T-CELL REGULATION |
| MXPA05012475A (es) | 2003-05-23 | 2006-05-25 | Wyeth Corp | Anticuerpos y moleculas relacionadas con el ligando para el receptor tnf inducido por glucorticoides (gitr) y el ligando (gitr) y usos de los mismos. |
| US7465446B2 (en) | 2003-05-30 | 2008-12-16 | Medarex, Inc. | Surrogate therapeutic endpoint for anti-CTLA4-based immunotherapy of disease |
| US20050048054A1 (en) | 2003-07-11 | 2005-03-03 | Shino Hanabuchi | Lymphocytes; methods |
| EP1660534A2 (en) | 2003-08-22 | 2006-05-31 | MedImmune, Inc. | Humanization of antibodies |
| US8541002B2 (en) | 2003-09-12 | 2013-09-24 | Agenus Inc. | Vaccine for treatment and prevention of herpes simplex virus infection |
| WO2005040816A1 (en) | 2003-10-24 | 2005-05-06 | Immunaid Pty Ltd | Method of therapy |
| WO2005092927A1 (en) | 2004-03-23 | 2005-10-06 | Biogen Idec Ma Inc. | Receptor coupling agents and therapeutic uses thereof |
| KR100845354B1 (ko) | 2004-03-26 | 2008-07-09 | 화이자 프로덕츠 인코포레이티드 | 항-ctla-4 항체의 용도 |
| DE102004063494A1 (de) | 2004-12-23 | 2006-07-13 | Tegenero Ag | Antikörper |
| EP1866339B8 (en) | 2005-03-25 | 2021-12-01 | GITR, Inc. | Gitr binding molecules and uses therefor |
| EP2418278A3 (en) | 2005-05-09 | 2012-07-04 | Ono Pharmaceutical Co., Ltd. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| US20110305713A1 (en) | 2005-10-21 | 2011-12-15 | Medical College Of Georgia Research Institute, Inc | Methods and compositions to enhance vaccine efficacy by reprogramming regulatory t cells |
| TW200732350A (en) | 2005-10-21 | 2007-09-01 | Amgen Inc | Methods for generating monovalent IgG |
| US20070243184A1 (en) | 2005-11-08 | 2007-10-18 | Steven Fischkoff | Prophylaxis and treatment of enterocolitis associated with anti-ctla-4 antibody therapy |
| EP1955708A4 (en) | 2005-11-24 | 2013-02-06 | Dainippon Sumitomo Pharma Co | NEW CYTOTOXIC LYMPHOCYTIC T INDUCTION POTENTIATOR WITH MEMORY |
| TWI461436B (zh) | 2005-11-25 | 2014-11-21 | Kyowa Hakko Kirin Co Ltd | 人類cd134(ox40)之人類單株抗體及其製造及使用方法 |
| EP1981534A4 (en) | 2006-01-07 | 2012-04-04 | Med College Georgia Res Inst | INDOLAMINE-2,3-DIOXYGENASE WAYS IN GENERATING REGULATORY T CELLS |
| US20110212086A1 (en) | 2006-01-19 | 2011-09-01 | Genzyme Corporation | GITR Antibodies For The Treatment of Cancer |
| GB0603081D0 (en) | 2006-02-15 | 2006-03-29 | Dynal Biotech Asa Oslo | Method |
| AU2007241023B2 (en) | 2006-03-30 | 2013-11-28 | University Of California | Methods and compositions for localized secretion of anti-CTLA-4 antibodies |
| EP2418223A3 (en) | 2006-06-12 | 2013-01-16 | Emergent Product Development Seattle, LLC | Single-chain multivalent binding proteins with effector function |
| WO2008073160A2 (en) | 2006-08-17 | 2008-06-19 | The Trustees Of Columbia University In The City Of New York | Methods for converting or inducing protective immunity |
| EP1894941A1 (en) | 2006-09-01 | 2008-03-05 | Institut Pasteur | Treatment of cervical carcinoma with a recombinant adenylate cyclase carrying HPV antigens |
| US20100061992A1 (en) | 2006-11-15 | 2010-03-11 | The Brigham And Women's Hospital, Inc. | Therapeutic uses of tim-3 modulators |
| RU2009135824A (ru) | 2007-02-27 | 2011-04-10 | Дженентек, Инк. (Us) | Антитела-антагонисты против ох40 и их применение в лечении воспалительных и аутоиммунных заболеваний |
| US20090004213A1 (en) | 2007-03-26 | 2009-01-01 | Immatics Biotechnologies Gmbh | Combination therapy using active immunotherapy |
| EP1987839A1 (en) | 2007-04-30 | 2008-11-05 | I.N.S.E.R.M. Institut National de la Sante et de la Recherche Medicale | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| JP2008278814A (ja) | 2007-05-11 | 2008-11-20 | Igaku Seibutsugaku Kenkyusho:Kk | アゴニスティック抗ヒトgitr抗体による免疫制御の解除とその応用 |
| EP2175884B8 (en) | 2007-07-12 | 2017-02-22 | GITR, Inc. | Combination therapies employing gitr binding molecules |
| GB0718167D0 (en) | 2007-09-18 | 2007-10-31 | Cancer Rec Tech Ltd | Cancer marker and therapeutic target |
| US20100285001A1 (en) | 2007-10-02 | 2010-11-11 | University Of Rochester | Method and Compositions Related to Synergistic Responses to Oncogenic Mutations |
| US8227577B2 (en) | 2007-12-21 | 2012-07-24 | Hoffman-La Roche Inc. | Bivalent, bispecific antibodies |
| EP2240204A1 (en) | 2008-02-04 | 2010-10-20 | Medarex, Inc. | Anti-clta-4 antibodies with reduced blocking of binding of ctla-4 to b7 and uses thereof |
| US8168757B2 (en) | 2008-03-12 | 2012-05-01 | Merck Sharp & Dohme Corp. | PD-1 binding proteins |
| SG10201805844QA (en) | 2008-07-08 | 2018-08-30 | Incyte Holdings Corp | 1,2,5-oxadiazoles as inhibitors of indoleamine 2,3-dioxygenase |
| US7993640B2 (en) | 2008-08-06 | 2011-08-09 | Light Sciences Oncology, Inc. | Enhancement of light activated therapy by immune augmentation using anti-CTLA-4 antibody |
| AR072999A1 (es) | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| EA023148B1 (ru) | 2008-08-25 | 2016-04-29 | Эмплиммьюн, Инк. | Композиции на основе антагонистов pd-1 и их применение |
| US9301785B2 (en) | 2008-10-21 | 2016-04-05 | K2M, Inc. | Spinal buttress plate |
| TWI729512B (zh) | 2008-12-09 | 2021-06-01 | 美商建南德克公司 | 抗pd-l1抗體及其於增進t細胞功能之用途 |
| BRPI1008692B8 (pt) | 2009-02-17 | 2021-05-25 | Ucb Biopharma Sprl | anticorpo antagonista tendo especificidade para ox40 humano, sequência de dna isolado, vetor de clonagem ou de expressão, célula hospedeira, processo para a produção do referido anticorpo, composição farmacêutica, uso do 5 referido anticorpo e proteína de fusão |
| PL2426148T3 (pl) | 2009-04-27 | 2016-01-29 | Kyowa Hakko Kirin Co Ltd | Przeciwciało anty-IL-3RA do stosowania w leczeniu nowotworu krwi |
| US20120141501A1 (en) | 2009-05-29 | 2012-06-07 | Forerunner Pharma Research Co. Ltd | Pharmaceutical Composition Containing Antagonist of EGF Family Ligand as Component |
| MX368932B (es) | 2009-06-26 | 2019-10-22 | Regeneron Pharma | Anticuerpos biespecificos facilmente aislados con formato de inmunoglobulina original. |
| EP3381937A3 (en) | 2009-08-13 | 2018-10-31 | The Johns Hopkins University | Methods of modulating immune function |
| CN102574924A (zh) | 2009-09-03 | 2012-07-11 | 先灵公司 | 抗-gitr抗体 |
| KR101853702B1 (ko) | 2009-12-07 | 2018-05-03 | 더 보드 오브 트러스티스 오브 더 리랜드 스탠포드 쥬니어 유니버시티 | 항-종양 항체 치료를 향상시키는 방법 |
| CA2790134A1 (en) | 2010-02-16 | 2011-08-25 | Valorisation-Recherche, Limited Partnership | Pd-1 modulation and uses thereof for modulating hiv replication |
| JP6066732B2 (ja) | 2010-03-05 | 2017-01-25 | ザ・ジョンズ・ホプキンス・ユニバーシティー | 標的免疫調節抗体および融合タンパク質に基づく組成物および方法 |
| US20120014947A1 (en) | 2010-07-16 | 2012-01-19 | The University Of Chicago | Methods and compositions to reduce liver damage associated with conditions or therapies that affect the immune system |
| WO2012064760A2 (en) | 2010-11-08 | 2012-05-18 | Biovest International, Inc. | Materials and methods for directing an immune response to an epitope |
| WO2012075291A1 (en) | 2010-12-01 | 2012-06-07 | The Children's Hospital Of Philadelphia | Compositions and methods for treating foxp3+ treg related diseases |
| CN107936121B (zh) | 2011-05-16 | 2022-01-14 | 埃泰美德(香港)有限公司 | 多特异性fab融合蛋白及其使用方法 |
| DK2714738T3 (en) | 2011-05-24 | 2019-01-28 | Zyngenia Inc | MULTIVALENT AND MONOVALENT MULTISPECIFIC COMPLEXES AND THEIR APPLICATIONS |
| WO2013006490A2 (en) | 2011-07-01 | 2013-01-10 | Cellerant Therapeutics, Inc. | Antibodies that specifically bind to tim3 |
| PH12014500089A1 (en) | 2011-07-11 | 2014-02-17 | Ichnos Sciences SA | Antibodies that bind to ox40 and their uses |
| US8920075B2 (en) | 2011-09-01 | 2014-12-30 | Halo Maritime Defense Systems, Inc. | Marine barrier and gate |
| WO2013039954A1 (en) | 2011-09-14 | 2013-03-21 | Sanofi | Anti-gitr antibodies |
| US9382319B2 (en) | 2011-09-26 | 2016-07-05 | Jn Biosciences Llc | Hybrid constant regions |
| WO2013049307A2 (en) | 2011-09-30 | 2013-04-04 | University Of Miami | Enhanced immune memory development by aptamer targeted mtor inhibition of t cells |
| TW201333040A (zh) | 2012-01-06 | 2013-08-16 | Bioalliance Cv | 抗-輸鐵蛋白受器之抗體及其使用方法 |
| AU2013222185B2 (en) | 2012-02-23 | 2018-07-26 | Sloan-Kettering Institute For Cancer Research | Prediction of responsiveness to treatment with immunomodulatory therapeutics and method of monitoring abscopal effects during such treatment |
| US20150086584A1 (en) | 2012-03-22 | 2015-03-26 | University Of Miami | Multi-specific binding agents |
| KR101549637B1 (ko) | 2012-06-08 | 2015-09-03 | 국립암센터 | 신규한 Th1 세포 전환용 에피토프 및 이의 용도 |
| CN112587658A (zh) | 2012-07-18 | 2021-04-02 | 博笛生物科技有限公司 | 癌症的靶向免疫治疗 |
| WO2014022592A1 (en) | 2012-08-02 | 2014-02-06 | Jn Biosciences Llc | Antibodies or fusion proteins multimerized via cysteine mutation and a mu tailpiece |
| CN104968364A (zh) | 2012-12-03 | 2015-10-07 | 百时美施贵宝公司 | 强化免疫调变性Fc融合蛋白的抗癌活性 |
| EP2951199A4 (en) | 2013-01-31 | 2016-07-20 | Univ Jefferson | Fusion proteins for the modulation of regulatory and effector T cells |
| WO2014121099A1 (en) | 2013-01-31 | 2014-08-07 | Thomas Jefferson University | Agonist fusion protein for cd40 ox40 and uses thereof |
| US20140377253A1 (en) | 2013-03-15 | 2014-12-25 | Abbvie Biotherapeutics Inc. | Fc variants |
| EP3421495A3 (en) | 2013-03-15 | 2019-05-15 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| FR3008408B1 (fr) | 2013-07-11 | 2018-03-09 | Mc Saf | Nouveaux conjugues anticorps-medicament et leur utilisation en therapie |
| RU2702108C2 (ru) | 2013-07-16 | 2019-10-04 | Дженентек, Инк. | Способы лечения рака с использованием антагонистов, связывающих с осью pd-1, и ингибиторов tigit |
| US20150038682A1 (en) | 2013-08-02 | 2015-02-05 | Jn Biosciences Llc | Antibodies or fusion proteins multimerized via homomultimerizing peptide |
| AR097306A1 (es) | 2013-08-20 | 2016-03-02 | Merck Sharp & Dohme | Modulación de la inmunidad tumoral |
| TW201605896A (zh) | 2013-08-30 | 2016-02-16 | 安美基股份有限公司 | Gitr抗原結合蛋白 |
| EP3082853A2 (en) | 2013-12-20 | 2016-10-26 | The Broad Institute, Inc. | Combination therapy with neoantigen vaccine |
| EP3590967A1 (en) | 2014-03-24 | 2020-01-08 | Cancer Research Technology Limited | Modified antibodies containing modified igg2 domains which elicit agonist properties and use thereof |
| US20150307620A1 (en) | 2014-04-16 | 2015-10-29 | University Of Connecticut | Linked immunotherapeutic agonists that costimulate multiple pathways |
| TW202132337A (zh) | 2014-05-28 | 2021-09-01 | 美商艾吉納斯公司 | 抗糖皮質素誘導性tnfr家族相關性受體(gitr)抗體類及使用彼等之方法 |
| AU2015271709B2 (en) | 2014-06-06 | 2020-11-26 | Bristol-Myers Squibb Company | Antibodies against glucocorticoid-induced tumor necrosis factor receptor (GITR) and uses thereof |
| US20160355589A1 (en) | 2014-08-19 | 2016-12-08 | Merck Sharp & Dohme Corp. | Anti-tigit antibodies |
| JO3663B1 (ar) | 2014-08-19 | 2020-08-27 | Merck Sharp & Dohme | الأجسام المضادة لمضاد lag3 وأجزاء ربط الأنتيجين |
| CA2962976A1 (en) | 2014-10-03 | 2016-04-07 | Dana-Farber Cancer Institute, Inc. | Glucocorticoid-induced tumor necrosis factor receptor (gitr) antibodies and methods of use thereof |
| MA41044A (fr) | 2014-10-08 | 2017-08-15 | Novartis Ag | Compositions et procédés d'utilisation pour une réponse immunitaire accrue et traitement contre le cancer |
| HRP20201756T8 (hr) | 2014-11-21 | 2021-08-20 | Bristol-Myers Squibb Company | Antitijela koja sadrže modificirane regije teškog lanca |
| WO2016090347A1 (en) | 2014-12-05 | 2016-06-09 | Immunext, Inc. | Identification of vsig8 as the putative vista receptor and its use thereof to produce vista/vsig8 modulators |
| TWI595006B (zh) | 2014-12-09 | 2017-08-11 | 禮納特神經系統科學公司 | 抗pd-1抗體類和使用彼等之方法 |
| CN108064252A (zh) | 2014-12-19 | 2018-05-22 | 达纳-法伯癌症研究所公司 | 嵌合抗原受体及其使用方法 |
| GB201500319D0 (en) | 2015-01-09 | 2015-02-25 | Agency Science Tech & Res | Anti-PD-L1 antibodies |
| EP3273944B1 (en) | 2015-03-25 | 2024-11-20 | The Regents of The University of Michigan | Compositions and methods for delivery of biomacromolecule agents |
| KR20250004095A (ko) | 2015-04-17 | 2025-01-07 | 브리스톨-마이어스 스큅 컴퍼니 | 항-pd-1 항체 및 또 다른 항체의 조합물을 포함하는 조성물 |
| EP3383430A4 (en) | 2015-12-02 | 2019-12-18 | Agenus Inc. | ANTIBODIES AND METHOD FOR USE THEREOF |
| WO2017096276A1 (en) | 2015-12-02 | 2017-06-08 | Agenus Inc. | Anti-gitr antibodies and methods of use thereof |
| CA3007022A1 (en) | 2015-12-02 | 2017-06-08 | Agenus Inc. | Anti-gitr antibodies and methods of use thereof |
| WO2018089628A1 (en) | 2016-11-09 | 2018-05-17 | Agenus Inc. | Anti-ox40 antibodies, anti-gitr antibodies, and methods of use thereof |
-
2015
- 2015-05-28 TW TW109136463A patent/TW202132337A/zh unknown
- 2015-05-28 ES ES15729987T patent/ES2860751T3/es active Active
- 2015-05-28 PH PH1/2016/502345A patent/PH12016502345B1/en unknown
- 2015-05-28 NZ NZ764826A patent/NZ764826A/en unknown
- 2015-05-28 IL IL293212A patent/IL293212B2/en unknown
- 2015-05-28 KR KR1020227027870A patent/KR20220116578A/ko active Pending
- 2015-05-28 MA MA40041A patent/MA40041B1/fr unknown
- 2015-05-28 SI SI201531531T patent/SI3148579T1/sl unknown
- 2015-05-28 DK DK15729987.6T patent/DK3148579T3/da active
- 2015-05-28 EP EP18204948.6A patent/EP3498295A1/en active Pending
- 2015-05-28 MX MX2016015614A patent/MX377844B/es unknown
- 2015-05-28 KR KR1020167036746A patent/KR102433464B1/ko active Active
- 2015-05-28 SG SG11201609721WA patent/SG11201609721WA/en unknown
- 2015-05-28 HR HRP20210364TT patent/HRP20210364T1/hr unknown
- 2015-05-28 EP EP15729987.6A patent/EP3148579B1/en active Active
- 2015-05-28 AU AU2015266958A patent/AU2015266958A1/en not_active Abandoned
- 2015-05-28 PH PH1/2022/550194A patent/PH12022550194A1/en unknown
- 2015-05-28 MA MA047849A patent/MA47849A/fr unknown
- 2015-05-28 JP JP2016569715A patent/JP6847666B2/ja active Active
- 2015-05-28 RS RS20210303A patent/RS61678B1/sr unknown
- 2015-05-28 CN CN201580041149.7A patent/CN108064242B/zh active Active
- 2015-05-28 SM SM20210116T patent/SMT202100116T1/it unknown
- 2015-05-28 LT LTEP15729987.6T patent/LT3148579T/lt unknown
- 2015-05-28 PL PL15729987T patent/PL3148579T3/pl unknown
- 2015-05-28 NZ NZ726513A patent/NZ726513A/en unknown
- 2015-05-28 CA CA2949998A patent/CA2949998A1/en active Pending
- 2015-05-28 TW TW104117180A patent/TWI709573B/zh not_active IP Right Cessation
- 2015-05-28 SG SG10201912986PA patent/SG10201912986PA/en unknown
- 2015-05-28 IL IL249092A patent/IL249092B/en unknown
- 2015-05-28 HU HUE15729987A patent/HUE053857T2/hu unknown
- 2015-05-28 WO PCT/US2015/032895 patent/WO2015184099A1/en not_active Ceased
- 2015-05-28 PT PT157299876T patent/PT3148579T/pt unknown
- 2015-05-28 EA EA201692458A patent/EA201692458A1/ru unknown
- 2015-05-28 US US14/724,452 patent/US10155818B2/en active Active
- 2015-05-28 CN CN202211180038.2A patent/CN115925946A/zh active Pending
-
2016
- 2016-11-28 MX MX2020013062A patent/MX2020013062A/es unknown
-
2018
- 2018-04-25 US US15/962,752 patent/US10800849B2/en active Active
- 2018-04-25 US US15/962,667 patent/US20180244793A1/en not_active Abandoned
- 2018-04-25 US US15/962,673 patent/US10577426B2/en active Active
- 2018-10-30 US US16/175,453 patent/US10280226B2/en active Active
-
2019
- 2019-03-15 US US16/355,268 patent/US10829559B2/en active Active
- 2019-12-27 JP JP2019238784A patent/JP2020048584A/ja active Pending
-
2020
- 2020-01-15 US US16/744,163 patent/US11401335B2/en active Active
- 2020-08-21 US US16/999,374 patent/US11897962B2/en active Active
-
2021
- 2021-01-29 AU AU2021200582A patent/AU2021200582B2/en active Active
- 2021-03-12 CY CY20211100215T patent/CY1124787T1/el unknown
-
2022
- 2022-06-22 US US17/808,248 patent/US20230039577A1/en not_active Abandoned
- 2022-08-12 AU AU2022215304A patent/AU2022215304A1/en not_active Abandoned
- 2022-12-19 JP JP2022202168A patent/JP2023021446A/ja active Pending
-
2023
- 2023-07-02 IL IL304178A patent/IL304178A/en unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2860751T3 (es) | Anticuerpos anti-GITR y procedimientos de uso de estos | |
| WO2022236284A1 (en) | Anti-tigit antibodies and methods of use thereof | |
| HK40010126A (en) | Anti-gitr antibodies and methods of use thereof | |
| HK1232467B (en) | Anti-gitr antibodies and methods of use thereof | |
| EA040077B1 (ru) | Анти-gitr антитела и способы их применения |