ES2704136T3 - Método de esterilización - Google Patents
Método de esterilización Download PDFInfo
- Publication number
- ES2704136T3 ES2704136T3 ES16160873T ES16160873T ES2704136T3 ES 2704136 T3 ES2704136 T3 ES 2704136T3 ES 16160873 T ES16160873 T ES 16160873T ES 16160873 T ES16160873 T ES 16160873T ES 2704136 T3 ES2704136 T3 ES 2704136T3
- Authority
- ES
- Spain
- Prior art keywords
- hydrogen peroxide
- chamber
- sterilization
- ozone
- pressure
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 230000001954 sterilising effect Effects 0.000 title claims abstract description 193
- 238000004659 sterilization and disinfection Methods 0.000 title claims abstract description 182
- 238000000034 method Methods 0.000 title claims abstract description 62
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 claims abstract description 299
- 238000002347 injection Methods 0.000 claims abstract description 41
- 239000007924 injection Substances 0.000 claims abstract description 41
- 239000000243 solution Substances 0.000 claims abstract description 32
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 28
- 238000009833 condensation Methods 0.000 claims abstract description 27
- 230000005494 condensation Effects 0.000 claims abstract description 25
- 238000001704 evaporation Methods 0.000 claims abstract description 11
- 239000007864 aqueous solution Substances 0.000 claims abstract description 7
- 230000007423 decrease Effects 0.000 claims abstract description 7
- 230000001965 increasing effect Effects 0.000 claims abstract description 4
- 238000007789 sealing Methods 0.000 abstract description 2
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 130
- 229910052760 oxygen Inorganic materials 0.000 description 61
- 239000001301 oxygen Substances 0.000 description 60
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 59
- 239000007789 gas Substances 0.000 description 50
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 32
- 230000008569 process Effects 0.000 description 29
- 238000001816 cooling Methods 0.000 description 17
- JCXJVPUVTGWSNB-UHFFFAOYSA-N nitrogen dioxide Inorganic materials O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 17
- 239000003054 catalyst Substances 0.000 description 15
- 238000012360 testing method Methods 0.000 description 14
- 238000000354 decomposition reaction Methods 0.000 description 13
- 238000010586 diagram Methods 0.000 description 13
- 230000036512 infertility Effects 0.000 description 12
- 239000000203 mixture Substances 0.000 description 12
- 239000007788 liquid Substances 0.000 description 11
- 238000009423 ventilation Methods 0.000 description 10
- 230000008020 evaporation Effects 0.000 description 8
- 238000002156 mixing Methods 0.000 description 8
- 150000003254 radicals Chemical class 0.000 description 8
- 230000000694 effects Effects 0.000 description 7
- 238000010438 heat treatment Methods 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 230000003750 conditioning effect Effects 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 239000004809 Teflon Substances 0.000 description 5
- 229920006362 Teflon® Polymers 0.000 description 5
- 238000009835 boiling Methods 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 4
- 238000004891 communication Methods 0.000 description 4
- 230000003247 decreasing effect Effects 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- -1 hydroxyl ions Chemical class 0.000 description 4
- 150000002500 ions Chemical class 0.000 description 4
- 125000004430 oxygen atom Chemical group O* 0.000 description 4
- 239000003507 refrigerant Substances 0.000 description 4
- 241000193385 Geobacillus stearothermophilus Species 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 230000002779 inactivation Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 230000036961 partial effect Effects 0.000 description 3
- 230000035515 penetration Effects 0.000 description 3
- 150000002978 peroxides Chemical class 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 2
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- IOVCWXUNBOPUCH-UHFFFAOYSA-N Nitrous acid Chemical compound ON=O IOVCWXUNBOPUCH-UHFFFAOYSA-N 0.000 description 2
- OGIIWTRTOXDWEH-UHFFFAOYSA-N [O].[O-][O+]=O Chemical compound [O].[O-][O+]=O OGIIWTRTOXDWEH-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000001276 controlling effect Effects 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 229910001882 dioxygen Inorganic materials 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 230000005484 gravity Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 239000005022 packaging material Substances 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000001179 sorption measurement Methods 0.000 description 2
- 229910001220 stainless steel Inorganic materials 0.000 description 2
- 239000010935 stainless steel Substances 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 238000002604 ultrasonography Methods 0.000 description 2
- MGWGWNFMUOTEHG-UHFFFAOYSA-N 4-(3,5-dimethylphenyl)-1,3-thiazol-2-amine Chemical compound CC1=CC(C)=CC(C=2N=C(N)SC=2)=C1 MGWGWNFMUOTEHG-UHFFFAOYSA-N 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 241000316430 Geobacillus stearothermophilus ATCC 7953 Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 238000005273 aeration Methods 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical class [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 230000001174 ascending effect Effects 0.000 description 1
- 239000003637 basic solution Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 239000002826 coolant Substances 0.000 description 1
- 239000000498 cooling water Substances 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000009795 derivation Methods 0.000 description 1
- 239000000645 desinfectant Substances 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- PUFKGWVZPFANLN-UHFFFAOYSA-N dioxomanganese oxocopper Chemical compound O=[Cu].O=[Mn]=O PUFKGWVZPFANLN-UHFFFAOYSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 238000004880 explosion Methods 0.000 description 1
- 239000002360 explosive Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000009434 installation Methods 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000003206 sterilizing agent Substances 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L sulfate group Chemical group S(=O)(=O)([O-])[O-] QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000010891 toxic waste Substances 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 150000003624 transition metals Chemical class 0.000 description 1
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- 239000010937 tungsten Substances 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000002912 waste gas Substances 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2/00—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor
- A61L2/16—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor using chemical substances
- A61L2/20—Gaseous substances, e.g. vapours
- A61L2/202—Ozone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2/00—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor
- A61L2/16—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor using chemical substances
- A61L2/20—Gaseous substances, e.g. vapours
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2/00—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor
- A61L2/16—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor using chemical substances
- A61L2/20—Gaseous substances, e.g. vapours
- A61L2/208—Hydrogen peroxide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2/00—Methods or apparatus for disinfecting or sterilising materials or objects other than foodstuffs or contact lenses; Accessories therefor
- A61L2/24—Apparatus using programmed or automatic operation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B65—CONVEYING; PACKING; STORING; HANDLING THIN OR FILAMENTARY MATERIAL
- B65D—CONTAINERS FOR STORAGE OR TRANSPORT OF ARTICLES OR MATERIALS, e.g. BAGS, BARRELS, BOTTLES, BOXES, CANS, CARTONS, CRATES, DRUMS, JARS, TANKS, HOPPERS, FORWARDING CONTAINERS; ACCESSORIES, CLOSURES, OR FITTINGS THEREFOR; PACKAGING ELEMENTS; PACKAGES
- B65D23/00—Details of bottles or jars not otherwise provided for
- B65D23/001—Supporting means fixed to the container
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2202/00—Aspects relating to methods or apparatus for disinfecting or sterilising materials or objects
- A61L2202/10—Apparatus features
- A61L2202/12—Apparatus for isolating biocidal substances from the environment
- A61L2202/122—Chambers for sterilisation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2202/00—Aspects relating to methods or apparatus for disinfecting or sterilising materials or objects
- A61L2202/10—Apparatus features
- A61L2202/13—Biocide decomposition means, e.g. catalysts, sorbents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2202/00—Aspects relating to methods or apparatus for disinfecting or sterilising materials or objects
- A61L2202/10—Apparatus features
- A61L2202/14—Means for controlling sterilisation processes, data processing, presentation and storage means, e.g. sensors, controllers, programs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2202/00—Aspects relating to methods or apparatus for disinfecting or sterilising materials or objects
- A61L2202/20—Targets to be treated
- A61L2202/24—Medical instruments, e.g. endoscopes, catheters, sharps
Landscapes
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Chemical & Material Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Mechanical Engineering (AREA)
- Apparatus For Disinfection Or Sterilisation (AREA)
- Feeding, Discharge, Calcimining, Fusing, And Gas-Generation Devices (AREA)
- Medical Preparation Storing Or Oral Administration Devices (AREA)
- Physics & Mathematics (AREA)
- Plasma & Fusion (AREA)
- Food Preservation Except Freezing, Refrigeration, And Drying (AREA)
Abstract
Un método para inyectar una solución evaporada de peróxido de hidrógeno en una cámara de esterilización sellada evacuada que incluye un artículo a esterilizar para controlar la condensación del peróxido de hidrógeno durante la esterilización del artículo en la cámara de esterilización a una temperatura preseleccionada dentro de la cámara de esterilización, comprendiendo el método las etapas de sellar la cámara; aplicar a la cámara sellada un vacío de una primera presión para crear la cámara evacuada y sellada, siendo la primera presión suficiente para mantener evaporada una solución acuosa de peróxido de hidrógeno que tiene una primera concentración de peróxido de hidrógeno a la temperatura preseleccionada; evaporar la solución acuosa de peróxido de hidrógeno para formar una solución evaporada de peróxido de hidrógeno que tiene un componente de vapor de agua y un componente de vapor de peróxido de hidrógeno; inyectar en la cámara evacuada y sellada pulsos repetidos de la solución evaporada de peróxido de hidrógeno, teniendo los pulsos un volumen seleccionado para evitar la condensación en el que el peróxido de hidrógeno se inyecta en la cámara y terminar la inyección a una segunda presión, más alta que la primera presión a la que aparece una capa de microcondensación de peróxido de hidrógeno sobre el artículo, como puede observarse mediante la concentración del vapor de peróxido de hidrógeno en la cámara, que disminuye a presión en aumento en la cámara, capa que tiene una segunda concentración de peróxido de hidrógeno más alta que la primera concentración de peróxido de hidrógeno.
Description
DESCRIPCIÓN
Método de esterilización
Campo de la invención
La presente invención se refiere, generalmente, a un método para inyectar una solución evaporada de peróxido de hidrógeno en una cámara de esterilización sellada evacuada que incluye un artículo a esterilizar para controlar la condensación del peróxido de hidrógeno durante la esterilización del artículo en la cámara de esterilización a una temperatura preseleccionada dentro de la cámara de esterilización.
Antecedentes de la invención
La esterilización es la destrucción de cualquier virus, bacteria, hongo u otro microorganismo, ya sea en un estado vegetativo o en uno de espora latente y se define por una reducción de 10-6 en el nivel de bacterias. Los procedimientos de procesamiento estériles convencionales para instrumentos médicos implican alta temperatura (tales como vapor y unidades de calor seco) o productos químicos (tales como gas de óxido de etileno, peróxido de hidrógeno u ozono).
Los métodos y aparatos de esterilización que usan esterilizantes gaseosos son bien conocidos. Los esterilizantes que usan peróxido de hidrógeno como esterilizante se usan ampliamente. El peróxido de hidrógeno se suministra, generalmente, como una solución acuosa y se evapora antes de la inyección a una cámara de esterilización del esterilizante, calentando la solución o aplicando un vacío a la cámara de esterilización, o ambos. Después de la evaporación de la solución, la atmósfera de esterilización en la cámara de esterilización incluye vapor de agua y gas peróxido de hidrógeno. Es una desventaja de este proceso que el vapor de agua tienda a condensarse en los artículos en la cámara a medida que avanza la esterilización. La capa resultante de agua condensada en los artículos a esterilizar interfiere con la acción esterilizante del peróxido de hidrógeno. Se han desarrollado numerosas modificaciones de aparatos y procesos para abordar este problema, todos los cuales se dirigen a limitar la humedad relativa en la atmósfera de esterilización durante el proceso de esterilización. Sin embargo, estas modificaciones aumentan invariablemente el coste de funcionamiento y/o los tiempos del ciclo de esterilización.
Los esterilizantes que usan gas que contiene ozono como esterilizante también se conocen. El gas ozono, generalmente, se produce de forma externa a la cámara de esterilización y se suministra en la cámara al vacío para aumentar la penetración del gas esterilizante en los espacios restringidos de los artículos a esterilizar. Con el fin de mejorar el efecto de esterilización del gas ozono, la atmósfera de esterilización se humidifica, generalmente, con agua antes de la inyección del gas ozono en la cámara de esterilización. Sin embargo, la cantidad de gas ozono necesaria es relativamente alta (85 mg/l) y los tiempos de ciclo de esterilización son relativamente largos, haciendo que los procesos de esterilización basados en ozono sean comparativamente caros. Adicionalmente, muchos artículos a esterilizar se dañan por los altos niveles de ozono requeridos para lograr la esterilización completa y, por lo tanto, pueden no esterilizarse en un proceso de esterilización de ozono.
Los procesos de esterilización que usan tanto gas peróxido de hidrógeno como gas ozono se han usado, pero con resultados no satisfactorios, especialmente con respecto a la esterilización de artículos con lúmenes internos largos, tales como gastroscopios y colonoscopios, y con respecto a los tiempos de ciclo y el coste de esterilización. Aunque los procesos basados en ozono son satisfactorios con respecto a la esterilización de artículos con largos lúmenes, la compatibilidad del material representa un problema. Los procesos basados en peróxido de hidrógeno son, generalmente, no satisfactorios con respecto a la esterilización de lúmenes largos.
El documento US 2007/098591 A1 desvela un método para controlar la condensación no deseada del peróxido de hidrógeno en una cámara de esterilización a una temperatura seleccionada, que comprende las etapas de mantener la cámara a presión reducida, evaporar pulsos de peróxido de hidrógeno, inyectar el peróxido evaporado en la cámara y terminar la inyección una vez que se detecta una segunda presión predeterminada.
El documento US 4 642 165 A desvela la inyección de micropulsos de peróxido de hidrógeno en una cámara evacuada para evitar la condensación.
Por lo tanto, se desean un método y un aparato que aborden al menos una de las desventajas de los procesos de esterilización conocidos que usan esterilizantes gaseosos.
Sumario de la invención
Un objeto de la presente invención es obviar o mitigar al menos una desventaja de los procesos de esterilización anteriores que usan esterilizantes gaseosos.
En un primer aspecto, la invención proporciona un método con los rasgos de la reivindicación 1. Los desarrollos adicionales de la invención se representan en las reivindicaciones dependientes.
Otros aspectos y rasgos de la presente invención resultarán evidentes para aquellos expertos habituales en la materia tras la revisión de la siguiente descripción de realizaciones específicas de la invención, junto con las figuras adjuntas.
Breve descripción de los dibujos
A continuación, se describirán las realizaciones de la presente invención a modo de ejemplo únicamente, con referencia a las Figuras adjuntas, en las que:
la Figura 1 muestra un diagrama esquemático de un aparato de acuerdo con la invención, desglosándose las partes ilustradas del aparato en la Tabla III;
la Figura 2 muestra un diagrama esquemático de un sistema de suministro de peróxido de hidrógeno de acuerdo con la invención, desglosándose las partes ilustradas del aparato en la Tabla III;
la Figura 3 es un diagrama de flujo de un método de esterilización preferido de acuerdo con la invención;
la Figura 4 es un gráfico que ilustra un primer ciclo de esterilización ejemplar de acuerdo con la invención; la Figura 5 es un gráfico que ilustra un segundo ciclo de esterilización ejemplar de acuerdo con la invención; la Figura 6 es un gráfico que ilustra un tercer ciclo de esterilización ejemplar de acuerdo con la invención;
la Figura 7 muestra una realización ejemplar de una unidad de suministro de peróxido de hidrógeno de acuerdo con la invención;
la Figura 8 muestra una realización ejemplar de un conjunto de depósito, medición y evaporación de peróxido de hidrógeno de acuerdo con la invención;
la Figura 9 es un diagrama esquemático de un sistema de control para un aparato de acuerdo con la invención; la Figura 10a es una vista en perspectiva de un recipiente de esterilizante de acuerdo con la invención;
la Figura 10b es una vista en sección transversal del recipiente de la Figura 10a;
la Figura 10c es una vista en alzado lateral del recipiente de la Figura 10a; y
la Figura 10d es un detalle B ampliado del recipiente mostrado en la Figura 10b.
Descripción detallada de la realización preferida
Generalmente, la presente invención proporciona un método para la esterilización de un artículo en una atmósfera de esterilización gaseosa añadiendo secuencialmente peróxido de hidrógeno evaporado y ozono.
En una realización, como se ilustra en el diagrama de flujo de la Figura 3 y los gráficos de ciclo de las Figuras 4 a 6, la invención proporciona un método de esterilización de un artículo exponiendo un artículo a esterilizar secuencialmente a peróxido de hidrógeno y ozono. El artículo se expone preferentemente al vacío en primer lugar a una solución acuosa evaporada de peróxido de hidrógeno y, posteriormente, a un gas que contiene ozono. Preferentemente, la exposición se lleva a cabo sin reducir el contenido de vapor de agua de la atmósfera de esterilización, derivándose el contenido de vapor de agua del disolvente acuoso de la solución de peróxido de hidrógeno y de la descomposición del peróxido de hidrógeno en agua y oxígeno. Lo más preferentemente, el proceso de esterilización completa se logra mientras la cámara permanece sellada y sin la retirada de ningún componente de la atmósfera de esterilización. Con este fin, la cámara se evacúa inicialmente a una primera presión de vacío suficiente como para provocar la evaporación del peróxido de hidrógeno acuoso a la temperatura de la atmósfera de la cámara. La cámara se sella después y se añaden secuencialmente el peróxido de hidrógeno y el gas que contiene ozono a la cámara y se mantienen en la cámara durante un tiempo de exposición preseleccionado. Toda retirada de cualquier componente en la atmósfera de esterilización se detiene durante la adición de los esterilizantes y durante la duración del tiempo de exposición.
La solución acuosa de peróxido de hidrógeno se evapora y se inyecta directamente en la cámara de esterilización sin ninguna medida para reducir el contenido de vapor de agua. Los inventores de la presente solicitud han descubierto sorprendentemente que la cantidad de esterilizantes usada y la longitud del ciclo de esterilización pueden reducirse significativamente, cuando se omiten cualquiera y todas las etapas para reducir el contenido de vapor de agua en la cámara y la etapa de esterilización de peróxido de hidrógeno va seguida de una etapa de esterilización de ozono, ya que el vapor de agua generado durante la etapa de esterilización de peróxido de hidrógeno puede usarse para humidificar suficientemente la atmósfera en la cámara para mejorar la etapa de esterilización de ozono. Pueden usarse cantidades mucho menores de peróxido de hidrógeno y ozono que en los procesos de la técnica anterior que usan los mismos esterilizantes, mientras se logra una esterilización completa También, las cantidades requeridas de los esterilizantes de acuerdo con la presente invención son menores que lo que se esperaría de usar simplemente los dos esterilizantes en el mismo ciclo. De esta manera, el mantenimiento de la cámara sellada a lo largo de todas las etapas de esterilización sin ninguna medida para controlar la humedad en la atmósfera de esterilización parece dar como resultado un efecto sinérgico.
Un esterilizante de acuerdo con la invención, como se ilustra esquemáticamente en la Figura 1, funciona, generalmente, de la siguiente manera. Un artículo para esterilizarse (no mostrado) se coloca en una cámara 10 de esterilización y la cámara se sella. Se aplica un vacío a la cámara 10. La solución de peróxido de hidrógeno evaporada se suministra a la cámara 10 de esterilización desde una unidad 30 de suministro (véase la Figura 8), que se analizará con más detalle a continuación. El peróxido de hidrógeno evaporado suministrado en la cámara
proporciona una esterilización parcial del artículo. El oxígeno de calidad médica se somete en un generador 22 de ozono a un campo eléctrico, que convierte el oxígeno en gas que contiene ozono. El gas que contiene ozono se alimenta después a la cámara 10, que se ha humidificado por la inyección de la solución de peróxido de hidrógeno evaporada y la descomposición del peróxido de hidrógeno en radicales libres (hidroxilos), agua y oxígeno. El gas que contiene ozono finaliza la esterilización del artículo. Los gases esterilizantes restantes se descomponen posteriormente en agua y oxígeno usando un catalizador 52. Los únicos residuos que quedan al final del ciclo de esterilización son oxígeno y agua limpia.
El método de esterilización de ozono de la invención se lleva a cabo preferentemente a temperatura ambiente y, de esta manera, no requiere sustancialmente aireación o enfriamiento de los artículos esterilizados, de tal manera que puedan usarse inmediatamente después del ciclo de esterilización. Además, los gases usados se difunden más rápidamente en lúmenes largos a esterilizar, reduciendo los tiempos de ciclo requeridos para la esterilización. Esto permite a los hospitales reducir el coste de inventarios de dispositivos médicos caros. El método de esterilización de la invención ofrece varias ventajas adicionales. No produce desechos tóxicos, no requiere el manejo de cilindros de gas peligrosos y no representa una amenaza para el medio ambiente o la salud del usuario. Los instrumentos de acero inoxidable y los instrumentos sensibles al calor pueden tratarse simultáneamente, lo que, para algunos usuarios, obviará la necesidad de dos esterilizantes separados.
El aparato de esterilización preferido de acuerdo con la invención, como se ilustra esquemáticamente en la Figura 1, incluye una cámara 10 de esterilización que puede sellarse para contener vacío. Esto se logra con una puerta 12 de acceso, que puede abrirse selectivamente para acceder a la cámara y que sella la cámara en la condición cerrada. El aparato incluye, además, un generador 22 de ozono para suministrar gas que contiene ozono a la cámara de esterilización, una unidad 30 de suministro de peróxido de hidrógeno para suministrar peróxido de hidrógeno evaporado a la cámara 10 de esterilización y una bomba 40 de vacío (CM-005-052 TSO3 , Inc.). La bomba 40 de vacío se usa para la aplicación de un vacío suficiente a la cámara 10 de esterilización para aumentar la penetración del gas esterilizante y para ser capaz de generar una solución evaporada de peróxido de hidrógeno a una temperatura por debajo de la temperatura dentro de la cámara de esterilización. La bomba 40 de vacío en la realización preferida es capaz de producir un vacío suficiente en la cámara de esterilización para disminuir el punto de ebullición del agua en la cámara por debajo de la temperatura real de la atmósfera en la cámara. En el aparato preferido, la bomba de vacío es capaz de producir un vacío de 133 Pa (1 Torr (1,33 mbar)). El ozono producido en el generador 22 de ozono se destruye en un catalizador 52 de ozono al que se alimenta gas que contiene ozono bien después del paso a través de la cámara 10 de esterilización o bien directamente desde el generador 22 de ozono a través de la válvula 29b de derivación. El catalizador 52 de ozono (AM-004-001, TSO3, Inc.) se conecta en serie después de la bomba 40 de vacío para evitar que el gas ozono escape al ambiente. El material que descompone ozono en el catalizador 52 preferido es carulita. Por razones económicas y prácticas, se prefiere usar un catalizador para la descomposición del ozono en el gas de esterilización de escape de la cámara 10 de esterilización. El catalizador destruye el peróxido de hidrógeno y el ozono al contactar y los retransforma en oxígeno y agua produciéndose una determinada cantidad de calor. Los catalizadores de este tipo y su fabricación son bien conocidos por la persona experta en la materia de generadores de ozono y no necesitan describirse con detalle en el presente documento. Adicionalmente, otros medios para destruir el ozono y el peróxido de hidrógeno contenidos en el gas de esterilización resultarán fácilmente evidentes para una persona experta en la materia. Por ejemplo, el gas puede calentarse durante un tiempo preseleccionado a una temperatura a la que se acelera la descomposición del esterilizante, por ejemplo, a 300 °C durante un período de 3 segundos.
La unidad 30 de suministro de peróxido de hidrógeno incluye un depósito 220 (AM-213-010, TSO3 Inc.), una unidad 240 de medición y una unidad 260 evaporadora (FM-213-003, TSO3 Inc.) conectada directamente a la cámara 10 de esterilización a través de un conducto 280 (AM-213-003, TSO3 Inc.). El depósito 220 está equipado con un sensor 222 de nivel para asegurar siempre un nivel suficientemente alto de peróxido de hidrógeno para la ejecución de otro ciclo de esterilización. Se suministra una solución de peróxido de hidrógeno (3-59 %) al depósito desde una unidad 200 de suministro de peróxido de hidrógeno (véase la Figura 7), que se analizará con más detalle a continuación. La solución de peróxido de hidrógeno se suministra a la unidad 200 de suministro desde una botella 180 sellada (véase la Figura 7). La solución evaporada de peróxido de hidrógeno producida en la unidad 260 evaporadora entra directamente a la cámara 10 de esterilización sin restricción de flujo o válvula intermedias. La unidad evaporadora se equipa preferentemente con un dispositivo de calentamiento (no mostrado) que mantiene la temperatura de la solución de peróxido de hidrógeno suficientemente alta para lograr una velocidad de evaporación más alta y evitar la congelación de la solución.
El generador 22 de ozono (OZ, modelo 14a, TSO3 Inc.) es del tipo de descarga de corona y se enfría para disminuir la velocidad de descomposición de ozono, todo lo que se conoce bien en la técnica. La generación de ozono se asocia a la pérdida de energía en forma de calor. Ya que el calor acelera la descomposición del ozono en oxígeno, debería retirarse tan rápido como sea posible mediante el enfriamiento del generador 22 de ozono. El generador de ozono en el aparato se mantiene a una temperatura relativamente baja de 3 a 6 °C mediante un sistema 60 de enfriamiento, que es bien un sistema de enfriamiento indirecto con recirculación de agua de enfriamiento o bien un sistema de enfriamiento directo con una unidad de enfriamiento de aire o una unidad de refrigeración para el enfriamiento (no ilustrado). El sistema de enfriamiento se mantiene preferentemente a la temperatura de 3 a 6 °C. En la realización preferida, el sistema de enfriamiento se mantiene a 4 °C, de tal manera que el gas que contiene ozono
generado por el generador 22 está a la temperatura ambiente de alrededor de 20 a 35 °C. De esta manera, el gas que contiene ozono que entra a la cámara de esterilización para la humidificación y la esterilización se mantiene a temperaturas ambiente de 20 a 35 °C. Esto significa que la descomposición del ozono se minimiza y el proceso de esterilización es más eficaz. El generador 22 de ozono se suministra preferentemente con oxígeno de calidad médica. El oxígeno puede suministrarse también directamente a la cámara 10 de esterilización a través de la válvula 21 de suministro de oxígeno. El aparato puede conectarse a una salida de oxígeno de pared común en los hospitales o a un cilindro de oxígeno o a cualquier otra fuente capaz de suministrar la calidad y el flujo requeridos. El suministro de oxígeno al generador 22 tiene lugar a través de un filtro 23, un regulador 24 de presión, un medidor 25 de flujo y una válvula 26 de cierre de oxígeno. El generador está protegido contra la sobrepresión de oxígeno mediante un conmutador 27 de presión de seguridad. La mezcla de ozono-oxígeno generada por el generador 22 se dirige a la cámara 10 de esterilización a través de un orificio 28 regulador del flujo y una válvula 29a solenoide de suministro de mezcla. La mezcla también puede suministrarse directamente al catalizador 52 de ozono mediante una válvula 29b solenoide de derivación (opcional). En una realización preferida en la que se usa una cámara de esterilización de 125 litros, el regulador 24 de presión y la válvula 28 reguladora controlan preferentemente la entrada de oxígeno a una presión de aproximadamente 13,8 KPa (2 psig) y un caudal de aproximadamente 1,5 litros por minuto. Sin embargo, resultará fácilmente evidente para la persona experta que puedan usarse otros caudales dependiendo de la fabricación y el modelo del generador 22 de ozono y el tamaño de la cámara de esterilización.
El vacío en la cámara 10 de esterilización se produce por medio de la bomba 40 de vacío y la válvula 44 de drenaje de la cámara de esterilización.
Las válvulas 29a y 29b son válvulas de solenoide de Teflón (CM-900-156, TSO3 Inc.). La válvula 26 y la válvula 44 de vacío son válvulas solenoides (CM-015-004, TSO3 Inc.).
El generador de ozono preferido usado en el proceso y el aparato de la invención es un generador del tipo de descarga de corona, que es bien conocido por la persona experta en la materia y no necesita describirse adicionalmente en el presente documento.
Funcionamiento
Un método de esterilización preferido de acuerdo con la invención incluye las siguientes etapas generales, como se ilustra por el diagrama de flujo de la Figura 3. Los artículos para esterilizarse, tales como instrumentos médicos, pueden colocarse directamente en la cámara de esterilización, pero se sellan preferentemente en recipientes de envasado estériles, envolturas estériles o bolsitas, tal como se usan generalmente en el entorno de hospital y, después, se colocan en la cámara de esterilización. Diversos tipos diferentes de dichos recipientes o bolsitas se conocen bien por la persona experta en la materia y no necesitan describirse adicionalmente en el presente documento.
Después de la inserción del artículo a esterilizar que se ha colocado en la cámara de esterilización en la etapa 320, la puerta de la cámara de esterilización se cierra y la cámara se sella en la etapa 340 y se aplica vacío a la cámara de esterilización en la etapa 350 hasta que se alcanza una primera presión de 133 Pa (1 Torr (1,33 mbar)) en la cámara. Las paredes de la cámara de esterilización se han precalentado preferentemente en una etapa 310 de calentamiento a una temperatura de 40 °C. La solución evaporada de peróxido de hidrógeno se admite en la cámara de esterilización en la etapa 360 de humidificación para esterilizar y humidificar parcialmente el contenido de la cámara. La inyección de la solución evaporada de peróxido de hidrógeno se detiene una vez que se ha logrado un aumento de presión de 2533 Pa (19 Torr) en la cámara. La cámara puede mantenerse sellada durante un primer período 370 de exposición (preferentemente 2 minutos) durante el que el peróxido de hidrógeno se descompone al menos parcialmente en radicales libres, agua y oxígeno. Preferentemente, este período de exposición también puede omitirse. Después, se suministra un gas que contiene ozono, preferentemente en forma de una mezcla de ozono seco y oxígeno, a la cámara en la etapa 380 de inyección de ozono y la cámara se mantiene sellada durante un segundo período 390 de exposición preseleccionado. No se lleva a cabo humidificación del gas que contiene ozono, o incluso ni es necesario, ya que la atmósfera de la cámara se ha humidificado por la solución de peróxido de hidrógeno. Entre la aplicación del vacío, antes de la etapa de evaporación de peróxido de hidrógeno y al final del segundo período de exposición, se interrumpe toda retirada de cualquier componente de la atmósfera de esterilización, de tal manera que ninguno de los componentes de la atmósfera se retira antes del final del segundo período de exposición. Las etapas de la aplicación de vacío, la inyección de peróxido de hidrógeno con el primer período de exposición y la inyección de gas ozono con el segundo período de exposición se repiten preferentemente al menos una vez, determinándose el número de repeticiones en la etapa 395 en base al ciclo elegido previamente en la etapa 330. Para retirar todos los esterilizantes restantes de la cámara 10 de esterilización, después de que se complete el ciclo de esterilización, se comienza una fase 400 de ventilación, que incluye preferentemente múltiples ciclos de evacuación de la cámara y lavado con oxígeno. Después de la fase 400 de ventilación, la puerta se desbloquea en la etapa 410 y los artículos esterilizados pueden tomarse de la cámara. La temperatura del suelo y la puerta de la cámara y de la unidad evaporadora se controla preferentemente a lo largo de todo el proceso de esterilización.
En un aparato de esterilización ejemplar, el usuario tiene la elección de múltiples ciclos de esterilización diferentes. En un método preferido, el usuario puede elegir en la etapa 330 de selección de ciclo del proceso entre tres ciclos que tienen las características respectivas mostradas en la Tabla 1 y analizadas a continuación.
Tabla I
Aunque se prefiere hacer funcionar el presente proceso de esterilización usando una solución de peróxido de hidrógeno al 50 %, el proceso puede hacerse funcionar con soluciones que incluyen peróxido de hidrógeno al 3 % -50 %. Las condiciones ejemplares para el proceso cuando se hace funcionar con una solución de peróxido de hidrógeno al 3 %, al 30 % y al 50 % son las siguientes.
La presión de inyección máxima es la presión a la que se detiene la inyección de la solución evaporada de peróxido de hidrógeno. El tiempo de acondicionamiento representa un período de tiempo después del sellado de la cámara y antes de la aplicación de vacío en el que los artículos a esterilizar se mantienen en la cámara de esterilización y gradualmente se calientan desde la temperatura ambiente debido a las paredes, el suelo y la puerta de la cámara que se calientan a aproximadamente 40 °C. Este calentamiento de la carga en la cámara se requiere para evitar la condensación indebida del agua en la carga en la inyección de la solución evaporada de peróxido de hidrógeno. El riesgo de condensación aumenta con las concentraciones en disminución de la solución de peróxido de hidrógeno.
Una vez que el usuario ha elegido uno de los tres ciclos, el usuario cierra la puerta de la cámara de esterilización y aprieta el botón de inicio. El sistema de control del esterilizador (véase la Figura 9) iniciará después, con el control de un software de funcionamiento construido en él, el proceso de esterilización de acuerdo con el ciclo elegido y usando los parámetros preseleccionados para el ciclo elegido. No hay preacondicionamiento de la carga de esterilización. El ciclo comienza con la generación de vacío en la cámara de esterilización de aproximadamente 133 Pa (1 Torr (1,33 mbar)). Posteriormente, se inyecta una solución evaporada de peróxido de hidrógeno en la cámara a través de la unidad evaporadora para esterilizar y humidificar parcialmente la carga. Antes de entrar a la unidad evaporadora, la solución de peróxido de hidrógeno se hace pasar a través de la unidad 240 de medición mostrada en la Figura 8. La unidad 240 de medición se conecta directamente con la unidad 260 evaporadora y, de esta manera, se somete a la presión de vacío presente en la cámara. La unidad 240 de medición incluye un bloque 241 base que tiene un paso de un volumen fijo, conocido (no mostrado) y conectado por una válvula 242 de entrada en un extremo aguas abajo del paso al depósito 220 de peróxido de hidrógeno y por una válvula 243 de escape en un extremo aguas abajo del paso a la unidad 260 evaporadora. El flujo de la solución de peróxido de hidrógeno a través de la unidad 240 de medición puede controlarse exactamente por medio de las válvulas 242, 243, que se conmutan de forma opuesta y no se superponen, de tal manera que una válvula siempre está cerrada mientras que la otra esté abierta y ambas válvulas nunca están abiertas al mismo tiempo. De esta manera, el paso se evacúa cuando la válvula 243 de escape está abierta y la válvula 242 de entrada está cerrada, se llena con solución de peróxido de hidrógeno cuando la válvula 243 de escape está cerrada y la válvula 242 de entrada está abierta y se evacúa de nuevo cuando la válvula 243 de escape está de nuevo abierta y la válvula 242 de entrada está de nuevo cerrada. Ya que se conoce el volumen exacto del paso, se conoce la cantidad de solución de peróxido de hidrógeno suministrada por el ciclo de válvula y puede calcularse la cantidad total de peróxido de hidrógeno en base al número
de ciclos de conmutación de válvulas. El número de veces y la frecuencia en que las válvulas 242, 243 se abren y se cierran se controlan y se monitorizan mediante el software del aparato y pueden usarse para determinar la cantidad de solución de peróxido de hidrógeno retirada del depósito y para calcular la cantidad teóricamente restante de la solución en el depósito, basándose en la cantidad total aspirada desde la botella de suministro y la cantidad medida. Los inventores de los presentes aparato y método han descubierto que, al contrario que el conocimiento general común, la cantidad exacta de peróxido de hidrógeno evaporado suministrada a la cámara no es crítica. Por el contrario, los inventores de la presente solicitud han descubierto sorprendentemente que el determinante más fiable de la eficacia de esterilización del vapor de peróxido de hidrógeno es la presión en la cámara. La eficacia de esterilización es dependiente del nivel de saturación de la atmósfera de esterilización con peróxido de hidrógeno. Sin embargo, el nivel de saturación no puede calcularse de forma fiable a partir de la cantidad de solución inyectada, ya que depende en gran medida de la carga en la cámara y de las características de adsorción de los materiales en la carga. El nivel de saturación, sin embargo, es directamente proporcional a la presión en la cámara. Por lo tanto, el nivel de saturación en la cámara puede determinarse solamente en base a la presión de la cámara, en lugar de mediante la medición del flujo o de la cantidad de la solución de peróxido de hidrógeno inyectada en la cámara. Como resultado, el número de ciclos de conmutación de válvula durante la etapa 360 de inyección de peróxido de hidrógeno en una realización de la presente invención es completamente dependiente de la presión a alcanzarse en la cámara 10 al completarse la inyección de peróxido de hidrógeno. En una realización preferida, se usa una solución acuosa de peróxido de hidrógeno al 50 % y el aumento de presión a alcanzarse en la cámara es 2533 Pa (19 Torr). Un tiempo de permanencia opcional de 2 minutos sigue el alcance del aumento de presión preajustado de 2533 Pa (19 Torr). Después, se inyecta una dosis de gas que contiene ozono seco seguido de un segundo tiempo de exposición. La dosis de ozono depende del ciclo elegido por el usuario. Cuando se alcanza el número deseado de repeticiones de la primera y la segunda etapas de esterilización parcial, se lleva a cabo la ventilación de la cámara 10 de esterilización evacuando y recargando la cámara 3 veces con oxígeno para retirar los residuos de los esterilizantes de peróxido de hidrógeno y de ozono.
Con el fin de determinar si una variación en el volumen de peróxido de hidrógeno inyectado por cada pulso durante la fase de acondicionamiento tiene un impacto en la eficacia de esterilización y en la cantidad de condensación observada en la carga, el solicitante realizó ensayos de esterilización con diferentes cantidades de pulso de inyección. Teóricamente, la velocidad de inyección/evaporación del peróxido de hidrógeno podría tener un impacto en la eficacia de esterilización. Mediante la inyección de un volumen mucho más grande durante cada pulso, la solución se empuja más rápido en la cámara y el tiempo para que el líquido se evapore disminuye. La probabilidad de tener más condensación en el instrumento o en el material de envasado, por lo tanto, es mayor. Se espera que la condensación demasiado pronunciada genere dos problemas. En primer lugar, la condensación pronunciada podría limitar la capacidad del ozono de alcanzar las esporas en la superficie de los instrumentos. En segundo lugar, el líquido de peróxido de hidrógeno puede quedar atrapado en el material de envasado, siendo peligroso para la gente que maneja en lo sucesivo la carga esterilizada. Si la cantidad de líquido de peróxido de hidrógeno atrapado es demasiado grande, la ventilación de la cámara y el envasado al final del ciclo de esterilización pueden no ser suficientes, para retirar todas las trazas de condensado de peróxido de hidrógeno.
Cuando la presión en la cámara de esterilización disminuye por debajo de la presión atmosférica, cualquier líquido presente o inyectado en la cámara hervirá a una temperatura menor que en condiciones atmosféricas. En la realización anteriormente descrita del presente proceso, la presión en la cámara primero disminuye y, después, se inyecta un volumen de peróxido de hidrógeno en forma de vapor. El volumen total de peróxido de hidrógeno usado se inyecta en pequeños aumentos. Durante la inyección, la presión en la cámara aumenta hasta que se alcanza una presión final de 2666 Pa (20 Torr) (133 Pa (1 Torr) de presión de partida 2533 Pa (19 Torr) de aumento de presión). El peróxido de hidrógeno se evapora a una temperatura más alta que el agua (el punto de ebullición del peróxido de hidrógeno al 50 % es de 114 °C y el punto de ebullición del agua es de 100 °C). Por lo tanto, el condensado estará más concentrado en peróxido de hidrógeno que la solución inicial que entra en la cámara. Este fenómeno se observó con una lámpara UV colocada en la cámara. Si bien la presión de la cámara estaba aumentando, la concentración de peróxido de hidrógeno en el vapor leída por la lámpara UV estaba disminuyendo. También se valoró la concentración de la primera gotita de peróxido de hidrógeno (1333 Pa (10 Torr)). Se descubrió que el líquido era peróxido de hidrógeno concentrado aproximadamente al 85 %.
A una presión de aproximadamente 1333 Pa (10 Torr), apareció una capa de micro-condensación del peróxido de hidrógeno en los objetos de la cámara. El espesor de la micro-condensación se calculó que era un espesor de solamente unas pocas moléculas, pero puede ayudar a la esterilización, ya que es bien sabido que el peróxido de hidrógeno puede esterilizar en forma de vapor, así como en forma líquida (Chung et al., 2006; Unger-Bimczok et al., 2008). También, el ozono es más soluble en peróxido de hidrógeno y puede formar radicales justo en la superficie, en la que están presentes las esporas.
Con el fin de inyectar un alto volumen de una vez, se usó una válvula separada por tubos de Teflón, en lugar de la microválvula normalmente usada (AM-213-001, TSO3 Inc.). La longitud de los tubos se determinó por el volumen a inyectar. Ya que el volumen contenido en la válvula es significativo, se usaron dos tamaños de válvulas. El primer tipo (TSO3 n.°: CM-900-157) con un orificio de 0,157 cm (0,062'') se usó para un volumen de hasta 1,5 ml. El segundo tipo Neptune, con un orificio de 0,396 cm (0,156''), (CM-900-156, TSO3 Inc.), se usó para un volumen de hasta 3,5 ml. El tamaño de válvula más grande ayuda también a empujar el gran volumen de líquido en la cámara.
Para el volumen de 35 pl, se usó una microbomba Burket 7616 (CM-113-001, TSO3 Inc.). Para el volumen de 23 pl, se usó un bloque más grande fabricado de manera especial.
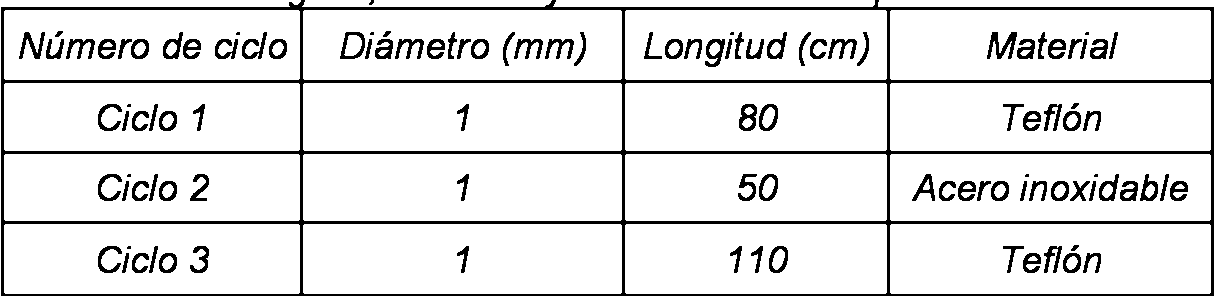
Se usaron dos ciclos para este experimento. Para ensayar la esterilidad, se usó el Ciclo 1 (medio ciclo), en el que la etapa de inyección de la fase de acondicionamiento se modificó con una variación en el volumen y el pulso para cada intento, como se ha descrito previamente. En cuanto al efecto de condensación, se utilizó el Ciclo 3, que consistía en cuatro fases. Este ciclo se eligió debido al hecho de que se inyectó una cantidad mayor de peróxido de hidrógeno para el ciclo, haciéndolo el escenario del peor caso. Se realizó un tercer ensayo para el ensayo de la esterilidad. Se inocularon lúmenes (Teflón de 1 mm * 80 cm) usando la técnica de cable de acuerdo con MCB-09-A07. Después de la exposición a medio ciclo del Ciclo 1, se determinó la esterilidad de cada lumen de acuerdo con MCB-09-A04 rev.7 por recuperación cuantitativa usando la técnica de ultrasonidos seguida de filtración.
Se conectó una bureta al sistema de válvulas con el fin de determinar de forma precisa el volumen inyectado. Este volumen se dividió después por el número de pulsos. Los tres ciclos de TSO3 se ensayaron con una carga especial que representa una carga promedio para estos tres ciclos. La carga siempre estuvo a temperatura ambiente al principio del ciclo. También se instaló una lámpara UV en el esterilizador usado. Esto permitió el análisis del vapor de peróxido de hidrógeno durante la fase de acondicionamiento.
La esterilidad se verificó con cables de Teflón (1 mm * 80 cm) insertados en los tubos y se ensayó en medio ciclo del Ciclo 1. El primer volumen inyectado por cada pulso durante la fase de acondicionamiento fue de 1,5 ml. En el caso de un buen resultado para la eficacia estéril, el volumen se doblaría. Si el resultado no fuera satisfactorio, entonces se ensayaría la mitad del volumen. Ya que el resultado para el ensayo que usa 1,5 ml por pulso fue bueno, el ensayo se repitió con 2,5 ml y 3,4 ml. El ensayo se detuvo a 3,4 ml de inyección debido a que solo fueron necesarios dos pulsos para alcanzar la presión deseada de 2399 Pa (18 Torr). La fase de acondicionamiento normal se detuvo a 2533 Pa (19 Torr), pero para asegurar que la presión no se excediera, la microválvula se usó entre 2399 y 2533 Pa (18 y 19 Torr).
La esterilidad se logró con 3,4 ml (todos los ensayos estuvieron a cero para el recuento de esporas). De esta manera, el solicitante descubrió que las variaciones en el volumen de pulso no tenían efecto en la eficacia de esterilización. Sin embargo, se observó durante el ensayo de esterilidad que la condensación estaba presente exactamente cuando el peróxido de hidrógeno se inyectaba en la cámara. Por lo tanto, se realizaron más ensayos con el fin de determinar el volumen máximo que podría inyectarse por cada pulso sin condensación.
El primer volumen inyectado fue de nuevo de 1,5 ml. La condensación estaba presente en la carga en el sitio de inyección. La cantidad de condensado líquido medida fue similar a la observada con un pulso de inyección de 3,4 ml. La cantidad de pulso se disminuyó, después, gradualmente reduciendo la cantidad inyectada a la mitad cada vez hasta que no era visible más condensación. A 75 pl, la condensación fue de nuevo similar a aquella con un pulso de inyección de 3,4 ml. Se observó una reducción significativa en la condensación construida por debajo de un volumen de pulso de 75 pl. A 35 pl, la condensación aún era visible, pero se redujo mucho. A 23 pl, la condensación casi no era visible. A un volumen de pulso de 16 pl no se observó absolutamente nada de condensación. Se descubrió que la condensación se producía a volúmenes de pulso por encima de 20 pl. De esta manera, para controlar la cantidad de condensación no deseada de peróxido de hidrógeno, se prefiere usar un volumen de inyección de pulso de menos de 75 pl, más preferentemente por debajo de 35 pl, lo más preferentemente de aproximadamente 20 pl. En un proceso ejemplar de acuerdo con la invención, las paredes de la cámara de esterilización se mantienen a una temperatura de 40 °C, mientras que la temperatura de carga puede variar entre 20 °C y 25 °C. La concentración de la solución de peróxido de hidrógeno usada es preferentemente el 50 %, pero pueden usarse concentraciones tan bajas como el 3 % y tan altas como el 59 %. La presión alcanzada dentro de la cámara es una función de la concentración de peróxido de hidrógeno usada (véase la Tabla II). Incluso aunque la presión alcanzada es la misma para cada ciclo analizado anteriormente, el volumen de la solución de peróxido de hidrógeno requerido depende de la concentración de la solución, del tipo de carga en la cámara y de la capacidad de adsorción de peróxido de hidrógeno de la carga. El nivel de humidificación en la atmósfera de esterilización antes de la inyección de ozono puede ajustarse usando diferentes concentraciones de la solución de peróxido de hidrógeno.
La dosis de ozono varía entre 2 mg/l para el ciclo n.° 1 y 10 mg/l para el ciclo n.° 2 y su tiempo de exposición varía entre 5 minutos para el ciclo n.° 1 y 10 minutos para el ciclo n.° 3.
Las cantidades de ozono usadas en los procesos de esterilización de la técnica anterior que emplean ozono humidificado como gas de esterilización, generalmente, son de aproximadamente 85 mg/l. El uso de peróxido de hidrógeno para la esterilización parcial, así como la humidificación de la carga antes de la inyección de ozono, permite una reducción significativa de la cantidad de ozono requerida para lograr la esterilización (SAL 10-6) hasta una dosis de entre 2 mg/l y 10 mg/l, dependiendo del ciclo elegido. Esta reducción es mucho mayor de lo que se esperaría solo por el hecho de que el peróxido de hidrógeno y el ozono se usan en el mismo ciclo de esterilización. De hecho, la solución evaporada de peróxido de hidrógeno inyectada en la cámara no es suficiente para lograr la esterilización, aunque se ha observado una reducción de 4 log en las esporas. Sin embargo, la adición de solamente
una cantidad muy pequeña de ozono en el intervalo de 1-10 mg de ozono por litro de atmósfera de esterilización da como resultado una esterilización entera y completa al nivel requerido según la normativa de Security Assurance Level de la FDA o las normativas mundiales, tales como ISO (SAL 10'6). Dicha esterilización completa podría no lograrse usando solamente la inyección de la solución evaporada de peróxido de hidrógeno, independientemente de la cantidad de solución de peróxido de hidrógeno usada y la concentración de la solución. Además, las concentraciones altas de peróxido de hidrógeno reducen la compatibilidad con algunos instrumentos. Adicionalmente, un tiempo de permanencia más largo después de la inyección de peróxido de hidrógeno, por ejemplo, 3 minutos, en lugar de 2 minutos, no potencia la eficacia de esterilización. De hecho, el tiempo de permanencia después de la inyección de peróxido de hidrógeno parece no tener efecto en la eficacia de esterilización. Sin embargo, la adición de solamente la cantidad minoritaria de ozono, como se ha analizado anteriormente, conduce sorprendentemente a la esterilización completa.
Durante la etapa 350 de evacuación (véase la Figura 3), las válvulas 21 y 26 de suministro de oxígeno, la válvula 29a de suministro de mezcla y la válvula 29b de derivación de mezcla están cerradas y la válvula 44 de drenaje de la cámara está abierta. La cámara 10 de esterilización se evacúa a una presión de vacío de aproximadamente 133 Pa (1 Torr (1,33 mbar)). Una vez que se alcanza esta presión, que se determina por medio de un sensor 13 de presión en la cámara de esterilización, la válvula 44 de drenaje de la cámara se cierra y la unidad 240 de medición se activa para suministrar solución de peróxido de hidrógeno a la unidad 260 evaporadora en la que la solución se evapora y, posteriormente, fluye libremente en la cámara 10 de esterilización. Una vez que se alcanza un aumento de presión de 2533 Pa (19 Torr) en la cámara 10 de esterilización, como se determina mediante el sensor 13 de presión, la unidad 240 de medición se desactiva y se detiene el suministro de solución de peróxido de hidrógeno al evaporador 260. La cámara puede mantenerse sellada de tal manera que no se produce la inyección de ninguna sustancia durante un siguiente primer período 370 de exposición, que puede durar 2 minutos. Sin embargo, ese período de exposición es completamente opcional. Poco antes del final de la etapa 360 de inyección de peróxido de hidrógeno (de forma habitual de aproximadamente 2 a 6 min), el generador de ozono se activa para asegurar un suministro del gas que contiene ozono. El flujo de la mezcla de oxígeno/ozono que sale del generador de ozono se controla todas las veces mediante el orificio 28 regulador capaz de resistir el vacío y de ajustar el flujo a entre 1 y 3 litros por minuto. La activación del generador 22 de ozono incluye la apertura de la válvula 26 de suministro y la válvula 29b de derivación de mezcla. La válvula 26 de suministro deja entrar el oxígeno al generador. La mezcla de ozonooxígeno producida por el generador, después, se guía directamente al catalizador 52 de ozono a través de la válvula 29b de derivación de mezcla. Después de completarse la etapa 370, la mezcla de oxígeno-ozono producida por el generador 22 se guía hacia la cámara 10 de esterilización abriendo la válvula 29a de suministro de mezcla y cerrando la válvula 29b de derivación de mezcla. La mezcla de oxígeno-ozono entra en la cámara 10 hasta que se alcanza la concentración deseada de ozono de acuerdo con el ciclo elegido en la cámara. El tiempo requerido para esta etapa es dependiente del caudal y la concentración del gas ozono en la mezcla (preferentemente de 160 a 200 mg/l de NTP), como se determina por un monitor 15 de ozono de un tipo bien conocido en la materia. Una vez alcanzada la concentración deseada, la válvula 29a de suministro de mezcla se cierra para sellar la cámara de esterilización y para mantener la mezcla de gas ozono/oxígeno en la cámara al vacío.
Una vez que se detiene el suministro del gas de esterilización (mezcla de gas oxígeno y ozono) en la cámara, se detiene el generador 22 y se cierra la válvula 26 de suministro de oxígeno. La cámara se mantiene sellada durante un período de exposición de 5 a 10 minutos, dependiendo del ciclo de esterilización elegido por el usuario. También dependiendo del ciclo elegido, se repiten las etapas 350 a 390 de 1 a 3 veces más, antes de que la esterilización se complete. Esta configuración es conforme a la normativa de Security Assurance Level de 10'6 (SAL 10'6).
Para retirar todo el peróxido de hidrógeno, el ozono y la humedad restantes en la cámara 10 de esterilización después de la esterilización completa, se activa la fase 400 de ventilación. La fase de ventilación comienza después del último período 390 de exposición. La válvula 44 de drenaje de la cámara se abre y se aplica vacío a aproximadamente 650 Pa (6,5 mbar). Una vez que se obtiene la presión de vacío de 650 Pa (6,5 mbar), la válvula 44 de drenaje se cierra y se abre la válvula 21 de suministro de oxígeno, admitiendo el oxígeno en la cámara 10 de esterilización. Una vez alcanzada la presión atmosférica, se cierra la válvula 21 de suministro de oxígeno, se abre la válvula 44 de drenaje de la cámara de esterilización y se reaplica vacío hasta que se alcanza una presión de 130 Pa (1,3 mbar). Este último ciclo de ventilación, hasta 130 Pa (1,3 mbar), se repite una vez para un total de tres ciclos de ventilación. Una vez alcanzada la presión atmosférica después del último ciclo, el mecanismo de la puerta de la cámara de esterilización se activa en la etapa 410 para permitir el acceso al contenido de la cámara de esterilización. La fase de ventilación tiene dos funciones. En primer lugar, retirar todos los residuos de esterilizante en la cámara de esterilización antes de abrir la puerta de acceso y, en segundo lugar, secar el material esterilizado por evaporación, cuando se aplica la presión de vacío. Por supuesto, pueden usarse diferentes presiones de vacío, tiempos de ciclo y número de repeticiones, siempre que se logren la retirada y secado del esterilizante deseados.
Los esterilizantes y el gas que contiene humedad evacuados de la cámara 10 de esterilización se hacen pasar sobre el catalizador 52 antes de escapar el gas a la atmósfera para asegurar una completa deposición de los esterilizantes. El catalizador 52 se usa solamente durante dos partes del ciclo de esterilización, la activación del generador 22 (con las válvulas 26 y 29b) y la evacuación de la cámara 10 de esterilización. Durante la fase de puesta en marcha del generador 22, la válvula 29b de derivación de mezcla se abre y el ozono se guía a través del catalizador 52. Una vez que se completa la fase de puesta en marcha del generador 22, la válvula 29b de derivación
se cierra. Durante la ventilación de la cámara 10 de esterilización, la válvula 44 de drenaje de la cámara de esterilización se abre y el gas de desecho de esterilización que contiene ozono se guía al catalizador 52. Una vez que se completa la evacuación de la cámara 10 de esterilización, la válvula 44 de drenaje se cierra. La circulación del ozono se asegura mediante la bomba 40 de vacío. El catalizador 52 puede localizarse aguas arriba o aguas abajo de la bomba 40 de vacío.
De hecho, a 20 °C, el agua hierve a una presión absoluta de 2330 Pa (23,30 mbar) y, a 35 °C, el agua hierve a una presión absoluta de 5630 Pa (56,3 mbar). El vacío en la cámara de esterilización se ajusta preferentemente a una presión en la que la temperatura de ebullición del agua se disminuye por debajo de la temperatura en la cámara de esterilización. Esa temperatura de ebullición puede ser tan baja que la temperatura de la solución de peróxido de hidrógeno en la unidad evaporadora disminuiría rápidamente y, dependiendo de la energía disponible de la estructura circundante, puede congelarse si no se proporciona ningún suministro de energía. La energía necesaria para evaporar la solución de peróxido de hidrógeno se toma de muchas fuentes. Se toma principalmente del cuerpo principal de la unidad 260 evaporadora, que está en forma de un bloque de aluminio provisto de una disposición de calentamiento (no mostrada). El proceso de evaporación también puede enfriar el humidificador hasta un punto en el que la humedad se condensa en las paredes de la cámara de esterilización. Esto se evita calentando las paredes de la cámara suficientemente para mantenerlas al menos a temperatura ambiente, preferentemente a 40 °C. Esto se logra con una disposición de calentamiento (no ilustrada), que puede ser fácilmente evidente para la persona experta en la materia.
La solución evaporada de peróxido de hidrógeno inyectada en la cámara aumenta la humedad relativa en la cámara de esterilización. Esta humidificación mejora significativamente la eficacia de la etapa de esterilización de ozono. El gas de esterilización que contiene oxígeno/ozono se inyecta en la cámara de esterilización humidificada a una temperatura cercana a la ambiental. El gas que contiene ozono no se calienta antes de la inyección.
El peróxido de hidrógeno tiene sus limitaciones cuando va con los instrumentos médicos esterilizantes. E1H2O2 es menos estable cuando entra en contacto con un metal, como, por ejemplo, el acero inoxidable. Este problema se agrava a presiones bajas, a las que se aceleran las reacciones químicas. Por lo tanto, la descomposición del peróxido de hidrógeno se acelerará al vacío, limitando el tiempo disponible para esterilizar tubos de metal largos. Además, la difusión del H2O2 está limitada, ya que no es un gas. El peróxido de hidrógeno podría alcanzar el final de los tubos largos por medio de difusión, pero, para ese momento, su concentración habrá disminuido, debido a la descomposición acelerada, a un nivel en el que ya no es suficiente para la esterilización.
Los solicitantes han descubierto, como se ha desvelado anteriormente, que estos problemas no solamente pueden superarse por la adición de un gas esterilizante, tal como ozono, sino que la humidificación de la cámara por la descomposición del peróxido de hidrógeno en radicales libres mejora la eficacia del gas esterilizante. Además, los solicitantes han descubierto sorprendentemente que el ozono puede reemplazarse ventajosamente por monóxido de nitrógeno u óxido nítrico. Los solicitantes descubrieron que el agua y el oxígeno generados durante la descomposición del peróxido de hidrógeno también mejoran la eficacia del óxido nítrico.
El monóxido de nitrógeno (u óxido nítrico) se sabe que es tóxico para las células a bajas concentraciones. En presencia de agua y oxígeno, el NO reacciona para formar dióxido de nitrógeno, NO2 , que también es altamente tóxico. En ausencia de oxígeno, el NO no forma NO2 , pero reacciona para formar ácido nítrico, que es muy corrosivo para otros materiales.
2 NO 3 H2O2 ^ 2 HNO3 + 2 H2O (1)
2 NO2 + H2O2 ^ 2 HNO3 (2)
El problema de la formación de ácido nítrico se minimiza mezclando el óxido nítrico con peróxido de hidrógeno, en lugar de agua, ya que la concentración de NO requerida después del preacondicionamiento del peróxido de hidrógeno es muy baja. El tratamiento con H2O2 debilita la cubierta de la espora y el peróxido de hidrógeno y el óxido nítrico, cuando se mezclan juntos, forman radicales libres, de forma similar a la reacción del ozono, cuando se mezcla con peróxido de hidrógeno.
HO H2O2 ^ H2O HO2. (3)
HO2. NO ^ HO. NO2 (4)
HO. NO ^ HONO (5)
Esos radicales reaccionarán rápidamente con todas las sustancias orgánicas, oxidándolas. La velocidad de oxidación estará en el orden de 109, en lugar de 101, para NO u O3 solos.
Los solicitantes ensayaron la eficacia del reemplazo del gas ozono originalmente ensayado por otro gas, tal como oxígeno y óxido nítrico. El ensayo evaluó la eficacia estéril en dispositivos inoculados. Los cables inoculados se
insertaron en tubos y, en lo sucesivo, en bolsitas. Las bolsitas también se colocaron en la parte superior del carro de carga en la cámara de esterilización. Esta zona se considera el punto de menos eficacia en la cámara.
Ejemplos
Se usaron las mismas cargas para las tres series de ensayos realizados: ozono, oxígeno y óxido nítrico. La longitud, el diámetro, el material y el tipo de tubos fueron diferentes para cada ciclo y se describen en la Tabla 3. Los lúmenes inoculados se colocaron en una carga especial que representa una carga promedio para los tres ciclos.
Los lúmenes usados para evaluar la eficacia estéril se inocularon de acuerdo con el protocolo MCB-09-A07 rev.9. Se usó el método del cable. Los cables se inocularon con 10 |jl de una suspensión de esporas de G. stearothermophilus ATCC 7953 de 1,0 * 106 a 2,5 * 106 UFC/10 jl. Los cables inoculados se dejaron secar durante toda la noche en condiciones ambientales normales.
Las cargas de ensayo se expusieron a medio ciclo de cada ciclo. Para el experimento con oxígeno y óxido de nitrógeno, se reemplazó el ozono por el gas a ensayar. También se colocó una bureta en el sistema de válvulas con el fin de determinar de forma precisa el volumen inyectado de H2O2. Después de la exposición, se determinó la esterilidad de cada lumen de acuerdo con MCB-09-A04 rev.7 por recuperación cuantitativa usando la técnica de ultrasonidos seguida de filtración.
Ozono
El valor basal de la eficacia estéril en los lúmenes inoculados usados en cada ciclo se estableció usando solamente peróxido de hidrógeno. Se realizaron ciclos usando peróxido de hidrógeno y ozono para comparar la eficacia del oxígeno y el óxido de nitrógeno con el ozono.
Oxígeno
El oxígeno se inyectó en la cámara usando el mismo sistema que aquel usado para el ozono. El generador de ozono se apagó.
Óxido nítrico
El NO se inyectó, sin embargo, directamente en la cámara a partir de un cilindro de NO independiente (Praxair). Se usó para esta inyección una válvula Neptune con un orificio de 0,396 cm (0,156'') (CM-900-156, TSO3 Inc.), separada por un tubo de Teflón. Haciendo esto, el gas se forzó hacia la cámara.
Todos los ensayos se realizaron fuera con el fin de limitar posibles daños de fugas accidentales. Se usó un detector de NO. Se conectó un tubo largo en la unidad convertidora de catalizador para permitir que el NO se eliminara lejos de la instalación. Se realizó un cálculo (véase a continuación) para determinar el número de inyecciones de válvula necesarias para obtener una concentración de 2 mg/l.
Volumen de la válvula: 3,3 ml (volumen calculado en R-1937)
Densidad NTP de NO: 1,25 g/l
Volumen de la cámara de esterilización: 125 l
Concentración final deseada: 2 mg/l
Presión de NO: 20,68 KPa (3 psig)
Volumen corregido: 3300 x ((14,7 3)/14,7) = 3973,2 j l
Masa para inyectarse: 0,002 g/l x 125 l = 0,25 gno
Masa inyectada por cada inyección: 1,25 g/l x 0,003974 l = 4,9665 X 10-3 g/inyección
Número requerido de inyecciones: 0,25 gno / 4,9665 X 10-3 g/inyección = 50 inyecciones
Estuvieron presentes dos lentes en la cámara, una en la parte inferior trasera y la otra en la parte superior trasera. Se alinearon de forma exacta una encima de la otra. Una lente emitía luz UV a partir de una fuente de tungsteno y la otra lente se conectó a un detector UV. Esta configuración permitió la medición del vapor de peróxido de hidrógeno en la cámara.
El peróxido de hidrógeno tiene algo de actividad de inactivación frente a las esporas de G. stearothermophilus. Sin embargo, el porcentaje de esterilidad logrado en los lúmenes no es suficiente para usarlo solo, especialmente para lúmenes rígidos y flexibles largos. Los resultados para el peróxido de hidrógeno y otros gases mezclados con el peróxido de hidrógeno se resumen en la Tabla 4.
Tabla 4. Porcentaje de esterilidad para los tres ciclos de TSO3 con diferentes agentes esterilizantes mezclados con eróxido de hidró eno.
En el caso del oxígeno mezclado con peróxido de hidrógeno, se usaron concentraciones equivalentes a la dosis de ozono en cada ciclo, en otras palabras, 2 mg de O2/l para el ciclo 1, 10 mg/l para el ciclo 2 y, finalmente, 3 mg/l para el ciclo 3. El oxígeno obstaculizó la eficacia del proceso en los Ciclos 1 y 2, en comparación con el peróxido de hidrógeno solo o mezclado con ozono. En el Ciclo 3, la eficacia del proceso con oxígeno u ozono es equivalente. En consecuencia, se halló que el oxígeno era ineficaz para reemplazar al ozono.
Aunque el óxido nítrico es un agente desinfectante bien conocido, nunca se mezcló con peróxido de hidrógeno, ya que la mezcla puede ser explosiva a altas concentraciones. Para minimizar el peligro de explosión, la concentración de NO se limitó a 2 mg/l para los tres ciclos de una primera serie de ensayos. La esterilidad se logró para algunas muestras en todos los ciclos, de manera que la concentración de monóxido de nitrógeno no se aumentó adicionalmente. Los resultados fueron muy concluyentes, es decir, mejores que o similares al ozono mezclado con peróxido de hidrógeno.
Aunque no se realizaron controles para verificar la inactivación de las esporas de G. stearothermophilus por NO en este estudio, se demostró en múltiples estudios que la tasa de inactivación del NO es baja. Cuando se inyecta NO en una cámara de esterilización y se combina con aire húmedo, el NO reacciona con el oxígeno a una velocidad predecible para formar NO2, que es letal para las esporas de G. stearothermophilus. Cuando se inyecta NO en una cámara de esterilización sin átomos de oxígeno presentes, el NO no forma NO2 y las esporas no se esterilizan (http://www.mddionline.com/article/sterilizing-combination- products-using-oxides-nitrogen). Basándose en los datos del editor del proceso de esterilización Noxilizer, a 5,12 mg/l de NO2, el valor D es solamente 0,3 minutos. A 3 mg/l, el valor D es aproximadamente 1,9 minutos.
En este experimento, la cantidad de NO inyectada fue 2 mg/l. Considerando que todas las moléculas de NO se transformaron en NO2, un valor D de 1,9 minutos para una concentración de 2 mg/l de NO2, solamente 2,5 log de esporas se habrían inactivado por el NO2. Esto es menos de los 6 log presentes en los dispositivos inoculados. En la realidad, la tasa de conversión de NO en NO2 probablemente no es el 100 % y el valor D es más de 1,9 minutos. De esta manera, el número de esporas inactivadas solo por NO probablemente es más de alrededor de 1 log.
La sustitución de ozono por otro gas se ensayó en los tres ciclos del presente proceso. La inyección de peróxido de hidrógeno se realizó como es habitual. Se ensayaron dos gases. El primero, el oxígeno, no logró resultados concluyentes. La esterilidad no se logró en dos de los tres ciclos.
También se ensayó el óxido nítrico. Los resultados muestran una esterilidad completa en los tres ciclos. La concentración usada para todos los ensayos fue baja. Solamente se inyectaron 2 mg/l para los tres ensayos. El uso de este producto químico podría considerarse en el futuro. Sin embargo, deberán realizarse cambios significativos en el esterilizante para adaptarse a esto. Ya que el NO2 se forma durante los ciclos, solamente podrían usarse materiales compatibles. También, debería considerarse un equipo protector, como, por ejemplo, un detector de NO. Otros gases esterilizantes que pueden interactuar con peróxido de hidrógeno para continuar la formación de radicales libres podrían usarse en el reemplazo del ozono, tales como dióxido de cloruro.
Por otro lado, muchas moléculas diferentes pueden tener el mismo efecto que el peróxido de hidrógeno en el ozono. Algunos iones pueden tener el efecto catalítico del peróxido de hidrógeno en el ozono. Los iones Co2+, N¡2+, Cu2+, Mn2+, Zn2+, Cr2+ y Fe2+, T¡2+ potencian la descomposición del ozono (Ahmed et al., 2005). Todos los metales de transición que pueden formar una molécula con oxígeno descompondrán el ozono. Los iones positivos intentarán volverse neutros cogiendo un átomo de oxígeno de la molécula de ozono. La molécula de ozono que es más o menos estable dará fácilmente el átomo de oxígeno. El agua con un pH básico será más rica en iones hidroxilo. Los iones hidroxilo descomponen el ozono en oxígeno atómico. Esos átomos de oxígeno pueden formar en lo sucesivo
radicales hidroxilo. Por lo tanto, cualquier molécula que pueda usarse para hacer el pH de la solución básico favorecerá la descomposición del ozono. Los buenos ejemplos son NaOH o KOH.
Otra fuente de radicales hidroxilo son todos los disolventes que contienen un grupo alcohol. Esos disolventes proporcionarán iones OH y favorecerán la dilución del ozono. En la misma línea, el formiato y las sustancias húmicas pueden iniciar la cadena hacia la formación de radicales (Glaze et al., 1987). Algunos ácidos también pueden usarse, tales como el ácido acético y el ácido para-acético. El ozono, que es más soluble y estable en solución ácida, será capaz de reaccionar más tiempo y estar más concentrado. Cualquier molécula que contiene un grupo carbonato, bromo, fosfato o sulfato también descompondrá el ozono (Beltrán, 2004).
Como se muestra en las Figuras 2 y 7, la unidad 200 de suministro incluye un soporte 202 para botellas para recibir una botella 180 sellada de solución de peróxido de hidrógeno. El soporte tiene un asiento 204 de botella en el que la botella 180 se recibe adecuadamente. La botella 180, que se analizará con más detalle adicionalmente a continuación, se mantiene en el asiento 204 por gravedad solamente. El soporte 202 está montado rotativamente en el pivote 203 para el movimiento entre una posición abierta, como se ilustra en la Figura 7, en la que la botella 180 puede colocarse en o retirarse del soporte y una posición cerrada en la que el soporte está completamente dentro de la cabina esterilizadora (no mostrada) y una cubierta 205 frontal del soporte cierra todo el acceso al soporte desde fuera de la cabina. Cuando el soporte 202 está en la posición cerrada, una disposición 207 de drenaje dirigida neumáticamente, que incluye un accionamiento de aguja, en esta realización, un cilindro 208 neumático verticalmente orientado y una aguja 209 de drenaje montada en el rodillo 210 de pistón del cilindro, se activa para drenar toda la solución de peróxido de hidrógeno de la botella 180. Esto se logra activando el cilindro 208 para forzar a la aguja 209 a través del sello de la botella hasta que la punta de la aguja alcanza la parte inferior de la botella 180. La aguja 209 se conecta fluidamente al depósito 240 (véase la Figura 8) y la solución se aspira de la botella 180 y en el depósito 240 usando el vacío generado por la bomba 44 de vacío a la que el depósito 240 puede conectarse fluidamente por el conducto 211 y la válvula 212 (véase la Figura 1). Una vez que el contenido de la botella 180 se ha aspirado, el soporte puede abrirse y la botella retirarse o la botella vacía puede mantenerse en el soporte hasta que se requiera una recarga del depósito 240. El depósito 240 está provisto de un sensor 242 de nivel que proporciona una señal al sistema de control del nivel del líquido en el depósito. Basándose en la señal recibida a partir del sensor 242, el sistema de control notifica al usuario si la cantidad de líquido en el depósito 240 es insuficiente para la ejecución del ciclo seleccionado por el usuario.
En una realización alternativa, el sistema de suministro de peróxido de hidrógeno no incluye un depósito. En su lugar, la propia botella 180 se enfría (CS-01) para evitar la rápida degradación del peróxido de hidrógeno acuoso. Un sensor (S14) mide la cantidad de solución que queda en la botella. Cuando la solución alcanza un 1er nivel preseleccionado, aparece un 1er aviso en la pantalla y, cuando se alcanza un 2° nivel preseleccionado menor, el mensaje generado del software al operador especifica que solamente puede realizarse un ciclo de esterilización n.° 1 o n.° 2 más con la solución restante en la botella. El operario tendrá, después, que recargar el sistema de suministro con una botella llena nueva.
Como se muestra en las Figuras 10a a 10d, la botella 180 tiene una parte inferior 182 cónica para asegurar un drenaje completo de todo el líquido en la botella, reduciendo de esta manera el peligro de derrames o contaminación al retirar una botella drenada. Con el fin de asegurar que la botella 180 se mantiene hacia arriba de forma segura, se fija un pie 180 al final de la parte inferior de la botella. El pie 184 incluye una copa 185 invertida encajada en una ranura 186 circunferencial en la pared 187 exterior de la botella. La aguja 209 se alinea con el punto más bajo en la parte inferior de la botella y puede moverse en la botella, a través del sello de la botella, hasta que alcanza el punto más bajo de la botella. Se proporcionan estructuras y funciones de control mecánicas, electrónicas o de otro tipo y para asegurar el contacto de la aguja con la parte inferior de la botella, mientras que se evita la penetración de la parte inferior de la botella. Se incorpora preferentemente un sensor de presión en el accionamiento de aguja recíproco y/o el montaje de la aguja (no mostrados).
Sistema de control
El aparato de esterilización se controla preferentemente mediante el esquema presentado en el diagrama de bloque eléctrico (Figura 9 y Diagrama de Flujo de Proceso (Figura 3). El sistema de control se construye alrededor de una estantería de PLC (Controlador Lógico Programable, por sus siglas en inglés). Esta estantería contiene un suministro (107) de potencia, una unidad (108) CPU, un transceptor de (109) dispositivo de red, un módulo (110) de entrada separado de voltaje de CC 32 x 34, un módulo (111) de salida separado de V de CA 16 x 120 y, finalmente, un módulo (112) de salida separado de transistor 16, un módulo de comunicación RS232C. Todos esos módulos se colocan juntos mediante un sistema de conexión intrínseco que contiene un bus de datos y direcciones.
El Dispositivo de Red es un protocolo de comunicación en serie industrial ampliamente usado en la industria para la instrumentación y el control. En este aparato de esterilización, el transceptor (109) de dispositivo de red se usa para comunicar en dúplex completo los datos entre la CPU (109) y el convertidor (106) A/D de 15 bits, un convertidor (125) D/A de 15 bits y ambas Interfaces (120), (121) de Temperatura Digital.
La CPU de PLC posee tres puertos RS232. Uno se usa para recibir y enviar datos al Terminal (118) de Pantalla Táctil, otro se usa para enviar datos a una impresora (119) térmica y el último puerto se usa como puerto de servicio
en el que un PC (ordenador personal, por sus siglas en inglés) puede conectarse para comunicarse con la CPU (108) de PLC para cargar el programa de protocolo de control (El Programa de Protocolo de Control no está en el ámbito del presente documento).
El Terminal (118) de Pantalla Táctil se localiza al frente del esterilizador, al lado de la impresora (119) térmica. El Terminal de Pantalla Táctil y la impresora térmica constituyen un terminal de Interfaz de Usuario.
La potencia necesaria para: “impresora (119) térmica, Enlace (109), (106), (120), (121), (125) de dispositivo de red, Sensor (104) de presión de cámara, regulador (126) de oxígeno electrónico y entradas (111) separadas de PLC y salidas (112) separadas se proporciona mediante el Suministro (103) de Potencia de CC.
El Sensor (104) de Presión de Cámara y el Monitor (105) de Ozono tienen una señal convencional de salida de 0 a 10 V de CC. El Regulador de Oxígeno Electrónico tiene una salida de 0 a 5 V de CC. Todas las señales se envían a un convertidor A/D de 15 bits. Todas las señales convertidas se envían a la CPU mediante el enlace digital de dispositivo de red para el procesamiento.
La entrada (100) de potencia del esterilizador es de tipo de fase única de tres cables de 208 a 240 V de CA sin neutro. La potencia de entrada se filtra para evitar RFI (101) de conducción. La potencia se distribuye mediante el bus (102) de distribución de potencia a los diversos sistemas eléctricos del aparato esterilizador.
Se usa un sistema (60) de enfriamiento para enfriar el generador de ozono. Este sistema incluye la unidad (114) de enfriamiento y la bomba (113) de circulación de refrigerante. La temperatura del refrigerante en el generador se detecta mediante un RTD localizado en el generador. La temperatura se envía a la CPU (108) mediante el Sistema (109) (120) (121) de Dispositivo de Red. El circulador (113) de refrigerante y la unidad (114) de enfriamiento se controlan mediante contactores dirigidos por salidas (111) de PLC que, a su vez, están controladas por el protocolo de software. Todas las entradas y salidas requeridas para lograr el control del sistema de enfriamiento se desglosan en el diagrama de bloque eléctrico como: relé de bomba de circulador, relé de sistema de enfriamiento, sensor de sobrecarga del circulador, sistema de sobrecarga del sistema de enfriamiento, refrigerante de presión baja y conmutador de flujo de refrigerante.
El sistema de control de vacío incluye la bomba 40 de vacío y un sensor 104 de presión. Las funciones de inicio y detención de la bomba de vacío se controlan de acuerdo con el protocolo de control. Todas las entradas y salidas requeridas para el sistema de vacío se desglosan en el diagrama: Contactor de Bomba de Vacío, Sensor de no funcionamiento de la Bomba de Vacío, Sensor de Sobrecarga de la Bomba de Vacío, Válvula (44) de Vacío a Cámara, Válvula (18) de Pulso de Aire y Válvula (21) de Oxígeno a Cámara. La salida del sensor de presión se convierte mediante el conversor (106) A/D de 15 bits y se envía a la CPU mediante el Enlace (109) digital de Dispositivo de Red. El sensor de presión también posee dos salidas separadas que indican a la CPU (108) las siguientes condiciones: Sensor de Presión de la Cámara a Temperatura y Fallo del Calentador de Sensor de Presión de la Cámara. Esas dos señales se desglosan en el diagrama de bloque eléctrico como entradas de PLC.
El sistema accionador de la puerta de la cámara de esterilización incluye un accionamiento eléctrico de tipo tornillo y cuatro sensores inductivos que permiten la detección del cierre de la puerta y la posición bloqueada o desbloqueada del accionador como parte del protocolo de control. El sistema de apertura de la puerta también se usa en el protocolo de gestión de condiciones de alarma para asegurar la seguridad del usuario. Todas las entradas y salidas requeridas para lograr el sistema accionador de la puerta se desglosan en el diagrama de bloque eléctrico como: Relé de Puerta Bloqueada, Relé de Puerta Desbloqueada, Sensor (S2) Inferior de Puerta cerrada, Sensor (S1) Superior de Puerta cerrada, Sensor (S4) de Puerta Bloqueada y Sensor (S3) de Puerta Desbloqueada.
El suministro (116) de potencia de ozono incluye un rectificador de onda completa, un circuito oscilador y un transformador de alto voltaje. La salida del transformador se conecta al generador (22) de ozono. El suministro (116) de potencia se monta como un resonador usando las características no ideales del transformador de alto voltaje. La CPU 108 controla la producción de ozono y asegura por medio del monitor 104 de ozono y del regulador (126) de oxígeno electrónico, que se logra la concentración deseada para la esterilización y se mantiene a lo largo de todo el ciclo de esterilización. Todas las entradas y salidas requeridas por el Sistema de Generación de Ozono se desglosan en el diagrama como: Válvula (26) de Suministro de Oxígeno, Válvula (29a) de Ozono a Cámara, Válvula (29b) de Vertido de Ozono a Catalizador, Puesta a Cero de Monitor de ozono, Relé de Espera de Alto Voltaje, Limitador de Corriente de Alto Voltaje, Sensor de Sobrecarga de Alto Voltaje de ozono, Sensor Rectificador de Alta Temperatura, Fallo del Monitor de Ozono.
El sistema de suministro de oxígeno es una unidad denominada Regulador de Presión de Oxígeno Electrónico. Una Válvula (26) proporcional, que también cierra el oxígeno, se controla mediante un circuito PID integrado que convierte una señal analógica de un sensor (27) de presión absoluta. Después, el PID envía la corriente adecuada de ciclo de trabajo a la válvula (26) proporcional. Con el orificio 28 este sistema constituye un regulador del flujo de oxígeno. El regulador 24 mecánico se usa como regulador de primera fase para disminuir la presión de oxígeno de 413 KPa a 69 KPa (60 psi a 10 psi). El regulador electrónico también proporciona el protocolo de condición de alarma para asegurar la protección del usuario. Las entradas usadas para la condición de alarma se desglosan en el
diagrama de bloque eléctrico como: Sensor de Alta Presión de Oxígeno y Sensor de Baja Presión de Oxígeno. También, el regulador de presión de oxígeno electrónico proporcionó una salida analógica de 0 a 5 V de CC leída por el convertidor 106 A/D a través del circuito del dispositivo de red.
El sistema de control está provisto de una interfaz 118 de usuario. En la realización preferida, esta interfaz incluye una pantalla 118 de visualización de cristal líquido (LCD, por sus siglas en inglés) sensible al tacto, una impresora 119 para los informes de rendimiento y un puerto 153 de comunicaciones (Serie RS-232), que permite al usuario recibir y transmitir información necesaria para el uso del aparato. Resultará fácilmente evidente para la persona experta en la materia que pueden usarse otros tipos de interfaces de usuario, tales como paneles sensibles al tacto, teclados o similares, y otros tipos de interfaces de comunicación. Las entradas de estado de la impresora térmica aparecen en el diagrama de bloque eléctrico como: Sensor de Impresora Fuera de Línea e Impresora Sin Papel.
Procesamiento de control del sistema de dispensación de H2O2
Por el momento, son posibles dos configuraciones de un sistema de dispensación de H2O2. El sistema de control podría usarse para ambos sistemas. El primer sistema representado en la presente solicitud en la Figura 7 y la Figura 8 es principalmente una botella (180) de H2O2 vertida en un depósito (240) controlado por temperatura de la Figura 8. Este primer sistema se describirá con referencia a las Figuras 7, 8, 9 y 2. Todos los sensores de entrada y salida descritos en lo siguiente aparecen en la lista de entradas y salidas del sistema de control desglosado en la Figura 9. Cuando el esterilizador se inicializa la primera vez, la puerta 12 se cierra y la posición cerrada se detecta mediante el conmutador S7. Si no se detecta ninguna botella en el soporte mediante (S6), la aguja de punción también se retrae a la posición superior por el cilindro (208) PA-01. S8 y S9 proporcionan detección para la posición ascendente y descendente del cilindro (208). También, el accionador PA-02 se retrae en la posición desbloqueada del soporte. El usuario es invitado mediante el mensaje en la pantalla (118) a abrir la puerta (205) e insertar una botella de H2O2 en el soporte. De manera que, cuando la botella se detecta mediante S6, otro mensaje en la pantalla (118) invita al usuario a cerrar la puerta (205) que se detecta mediante S7. El control del software se lleva a cabo mediante la CPU (108) y los sensores de condición. La botella se ajusta por gravedad en una base (209) rotatoria. La CPU inicia el motor M-02 para rotar la botella 180. Un lector (122) bS-01 de código de barras (Figura 2 ) de la Figura 9 lee un código de barras en la botella. La CPU verifica la fecha de caducidad de la botella y si la botella ha pasado su fecha de caducidad, la puerta 205 se mantiene desbloqueada y un mensaje en la pantalla (118) invita al usuario a cambiar la botella por otra. Si la fecha es correcta, la CPU detiene el motor M-02 y bloquea la puerta (205) accionando PA-02 (Figura 2). Después, la CPU acciona el cilindro (208) para que la aguja 209 puncione la tapa sellada de la botella hasta que S9 detecta la aguja en la posición descendente. Después, la botella se vacía totalmente en el depósito 240 por succión proporcionada a través de la válvula (212) y vacío de la bomba (40). La puerta (205) se mantiene bloqueada hasta que se ha usado todo el H2O2 en el depósito. Los sensores S10 y S11 de nivel proporcionan las condiciones necesarias para que la CPU estime si se necesita otra botella. Si es así, la aguja se retrae de la botella y la puerta (205) se desbloquea y el usuario es invitado mediante un mensaje en la botella (118) a reemplazar la botella de H2O2.
Descripción del sistema de dispensación de H2O2 alternativo y preferido
El siguiente sistema de dispensación no incluye el depósito (240) enfriado. En su lugar, e1H2O2 se mantiene en la botella (180). Los detectores S10 y S11 de nivel se retiran y se reemplazan por un detector de nivel ultrasónico, que se carga por resorte contra un lado de la botella cerca de la parte inferior y se usa como detector de nivel bajo para indicar a la CPU una botella vacía. Debido a que este sensor se carga por resorte, este añade demasiada fricción a la botella para usar el motor M-02. Por lo tanto, el usuario es invitado mediante un mensaje en la pantalla (118) a rotar la botella manualmente hasta que el código de barras se lee mediante (BS-01) en la Figura 2 o (122) en la Figura 9. Si la botella no está caducada, el usuario es invitado a cerrar la puerta (205) y la CPU bloquea el compartimento del soporte de la botella y se acciona (208) para puncionar hacia abajo la aguja. En esa realización preferida, el soporte de H2O2 está controlado por temperatura mediante una unidad de célula Peltier. Un RTD fijado al soporte y conectado a la interfaz (121) de temperatura envía datos a la CPU (108) mediante el circuito del dispositivo de red y la CPU controla mediante la función PID la cantidad de potencia a aplicar a la unidad de célula Peltier. La unidad Peltier se suministra mediante el suministro (121) de potencia de 12 V de CC usado también para el compresor de aire que dirige el sistema neumático compuesto por SV-15, SV-16, accionadores (PA-02 y PA-01) en la Figura 2. Entre cada ciclo, la línea conectada entre la botella (180) de H2O2 y el módulo (240) de microválvula se purgarán mediante SV20. Cerca de la entrada del módulo (240), un detector óptico de espuma encendido en la línea de H2O2 indicará la recarga total de la línea sin aire en la línea.
Para ese punto, ambos sistemas de dispensación de H2O2 pueden suministrar el módulo (240) de microválvulas. Las microválvulas (SV-18 y SV-19) trabajan recíprocamente durante un programa de ciclo de trabajo preestablecido en un circuito microcontrolador a bordo que genera los pulsos de tiempo adecuados para ambas microválvulas. Ese circuito electrónico se activa mediante una señal desde la CPU (108) denominada señal de controlador de bomba de H2O2 en la Figura 9. Con el control de software, se permite una cantidad adecuada de H2O2 en el colector de distribución (260, Figura 1) humidificador. Este colector de distribución se controla por temperatura mediante la CPU (108) usando datos de RTD (TT-04, Figura 1) y controlando el calentador HTR-01 (Figura 1) mediante la función
PID. Después, el H2O2 se evapora en el colector de distribución (260) y el vapor se envía a la cámara al vacío a través de tuberías (280, Figura 1).
En la descripción anterior, para los fines de explicación, se exponen numerosos detalles con el fin de proporcionar una comprensión exhaustiva de las realizaciones de la invención. Sin embargo, resultará evidente para un experto en la materia que estos detalles específicos no se requieren con el fin de practicar la invención. En otros casos, las estructuras y los circuitos de esterilizador bien conocidos se muestran en diagrama de bloques o en forma de símbolo con el fin de no complicar la invención. Por ejemplo, los detalles específicos no se proporcionan si determinadas partes de los controles del esterilizador se implementan como rutina de software, circuito de hardware, firmware o una combinación de los mismos.
Las realizaciones descritas anteriormente de la invención pretenden ser solamente ejemplos. Los expertos en la materia pueden efectuar alteraciones, modificaciones y variaciones en las realizaciones particulares sin alejarse del ámbito de la invención, que se define solamente por las reivindicaciones adjuntas a la misma.
TABLA III
Claims (10)
1. Un método para inyectar una solución evaporada de peróxido de hidrógeno en una cámara de esterilización sellada evacuada que incluye un artículo a esterilizar para controlar la condensación del peróxido de hidrógeno durante la esterilización del artículo en la cámara de esterilización a una temperatura preseleccionada dentro de la cámara de esterilización, comprendiendo el método las etapas de
sellar la cámara;
aplicar a la cámara sellada un vacío de una primera presión para crear la cámara evacuada y sellada, siendo la primera presión suficiente para mantener evaporada una solución acuosa de peróxido de hidrógeno que tiene una primera concentración de peróxido de hidrógeno a la temperatura preseleccionada;
evaporar la solución acuosa de peróxido de hidrógeno para formar una solución evaporada de peróxido de hidrógeno que tiene un componente de vapor de agua y un componente de vapor de peróxido de hidrógeno; inyectar en la cámara evacuada y sellada pulsos repetidos de la solución evaporada de peróxido de hidrógeno, teniendo los pulsos un volumen seleccionado para evitar la condensación en el que el peróxido de hidrógeno se inyecta en la cámara y
terminar la inyección a una segunda presión, más alta que la primera presión a la que aparece una capa de microcondensación de peróxido de hidrógeno sobre el artículo, como puede observarse mediante la concentración del vapor de peróxido de hidrógeno en la cámara, que disminuye a presión en aumento en la cámara, capa que tiene una segunda concentración de peróxido de hidrógeno más alta que la primera concentración de peróxido de hidrógeno.
2. El método de la reivindicación 1, en el que la primera presión es 133 Pa (1 Torr).
3. El método de la reivindicación 2, en el que la segunda presión preseleccionada está en el intervalo de 2266 7199 Pa (17-54 Torr).
4. El método de la reivindicación 1, en el que el volumen del pulso es como mucho 75 |jl.
5. El método de la reivindicación 4, en el que el volumen del pulso es menos de 35 jl.
6. El método de la reivindicación 5, en el que el volumen del pulso es aproximadamente 20 jl.
7. El método de la reivindicación 1, en el que la segunda presión preseleccionada está en el intervalo de 2266 7199 Pa (17-54 Torr) y el volumen del pulso es como mucho 75 jl.
8. El método de la reivindicación 2, en el que la segunda presión preseleccionada es 2666 Pa (20 Torr).
9. El método de la reivindicación 8, en el que la primera concentración de peróxido de hidrógeno es un 3-59 %.
10. El método de la reivindicación 9, en el que la primera concentración de peróxido de hidrógeno es un 50 %.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US24719709P | 2009-09-30 | 2009-09-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2704136T3 true ES2704136T3 (es) | 2019-03-14 |
Family
ID=43780606
Family Applications (8)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES16160873T Active ES2704136T3 (es) | 2009-09-30 | 2010-09-29 | Método de esterilización |
| ES13158395.7T Active ES2586831T3 (es) | 2009-09-30 | 2010-09-29 | Método de esterilización |
| ES13158399.9T Active ES2562626T3 (es) | 2009-09-30 | 2010-09-29 | Recipiente y sistema de suministro de peróxido de hidrógeno |
| ES13158404.7T Active ES2545154T3 (es) | 2009-09-30 | 2010-09-29 | Unidad de dosificación de peróxido de hidrógeno |
| ES10819766.6T Active ES2586568T3 (es) | 2009-09-30 | 2010-09-29 | Método de esterilización |
| ES13158381.7T Active ES2543704T3 (es) | 2009-09-30 | 2010-09-29 | Procedimiento de dosificación de peróxido de hidrógeno |
| ES13158378.3T Active ES2469396T3 (es) | 2009-09-30 | 2010-09-29 | Método de esterilización con peróxido de hidrógeno |
| ES13158388.2T Active ES2531976T3 (es) | 2009-09-30 | 2010-09-29 | Método de dosificación de peróxido de hidrógeno |
Family Applications After (7)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES13158395.7T Active ES2586831T3 (es) | 2009-09-30 | 2010-09-29 | Método de esterilización |
| ES13158399.9T Active ES2562626T3 (es) | 2009-09-30 | 2010-09-29 | Recipiente y sistema de suministro de peróxido de hidrógeno |
| ES13158404.7T Active ES2545154T3 (es) | 2009-09-30 | 2010-09-29 | Unidad de dosificación de peróxido de hidrógeno |
| ES10819766.6T Active ES2586568T3 (es) | 2009-09-30 | 2010-09-29 | Método de esterilización |
| ES13158381.7T Active ES2543704T3 (es) | 2009-09-30 | 2010-09-29 | Procedimiento de dosificación de peróxido de hidrógeno |
| ES13158378.3T Active ES2469396T3 (es) | 2009-09-30 | 2010-09-29 | Método de esterilización con peróxido de hidrógeno |
| ES13158388.2T Active ES2531976T3 (es) | 2009-09-30 | 2010-09-29 | Método de dosificación de peróxido de hidrógeno |
Country Status (14)
| Country | Link |
|---|---|
| US (11) | US9101679B2 (es) |
| EP (9) | EP3485917A3 (es) |
| JP (8) | JP5480975B2 (es) |
| KR (8) | KR101761728B1 (es) |
| AU (1) | AU2010302888B2 (es) |
| BR (7) | BR122013010299A2 (es) |
| CA (7) | CA2767726C (es) |
| ES (8) | ES2704136T3 (es) |
| MX (7) | MX337243B (es) |
| PL (3) | PL2482859T3 (es) |
| PT (1) | PT3056224T (es) |
| TR (1) | TR201900045T4 (es) |
| WO (1) | WO2011038487A1 (es) |
| ZA (1) | ZA201201389B (es) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12064527B2 (en) | 2022-09-16 | 2024-08-20 | Soclean, Inc. | Disinfection systems and methods |
| US12083239B2 (en) | 2011-07-15 | 2024-09-10 | Soclean, Inc. | Devices, systems and methods for treating medical devices having passageways with ozone gas |
| US12280169B2 (en) | 2019-03-19 | 2025-04-22 | Soclean, Inc. | Technologies for sanitizing medical devices |
| US12280170B2 (en) | 2022-09-16 | 2025-04-22 | Soclean, Inc. | Disinfection systems and methods |
Families Citing this family (126)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| USRE47582E1 (en) | 2009-07-28 | 2019-08-27 | Sterifre Medical, Inc. | Free radical sterilization system and method |
| TR201900045T4 (tr) | 2009-09-30 | 2019-01-21 | Tso3 Inc | Steri̇li̇zasyon yöntemi̇. |
| WO2011047127A1 (en) | 2009-10-15 | 2011-04-21 | Minntech Corporation | Room fogging disinfection system |
| JP2013512080A (ja) | 2009-12-03 | 2013-04-11 | ミンテック コーポレーション | 医療装置を噴霧によって浄化する容器及びシステム |
| CN102178968B (zh) * | 2011-04-26 | 2014-02-26 | 中国人民解放军军事医学科学院卫生装备研究所 | 一种气体二氧化氯消毒装置 |
| WO2012173756A1 (en) | 2011-05-27 | 2012-12-20 | Minntech Corporation | Decontamination system including environmental control using a decontaminating substance |
| US10427961B2 (en) | 2011-07-15 | 2019-10-01 | Soclean, Inc. | Technologies for sanitizing reservoirs |
| EP2731632B1 (en) | 2011-07-15 | 2017-08-30 | SoClean, Inc. | CPAP device with ozone generator |
| US10434204B2 (en) | 2011-07-15 | 2019-10-08 | Soclean, Inc. | Technologies for sanitizing mist humidifiers |
| ITMI20111507A1 (it) | 2011-08-05 | 2013-02-06 | Absolute Up S R L | Sterilizzatrice a vapore |
| CN104159734B (zh) * | 2011-08-15 | 2017-11-21 | 纳幕尔杜邦公司 | 用于保护批量运输和冷链用途的可透气产品 |
| US8641985B2 (en) * | 2011-08-25 | 2014-02-04 | Tuttnauer Ltd. | Control system for ozone sterilization in multiple compact chambers |
| WO2013040415A1 (en) * | 2011-09-16 | 2013-03-21 | The Trustees Of The University Of Pennsylvania | Rapid surface disinfection method and apparatus |
| JP5668666B2 (ja) * | 2011-10-31 | 2015-02-12 | キヤノンマーケティングジャパン株式会社 | 滅菌装置、滅菌方法 |
| KR101324567B1 (ko) | 2011-10-28 | 2013-11-01 | 주식회사 리노셈 | 의료기구의 멸균방법 |
| DE102011056438A1 (de) * | 2011-12-14 | 2013-06-20 | Krones Ag | Verdampfervorrichtung, Getränkeabfüllanlage und/oder Getränkebehälterherstellanlage, Verfahren zum Betreiben einer Verdampfervorrichtung und Verwendung einer Sterilisationsgemisch-Abführeinrichtung |
| ITMI20112334A1 (it) * | 2011-12-21 | 2013-06-22 | Absolute Up S R L | Sterilizzatrice a vapore |
| JP2013158699A (ja) * | 2012-02-03 | 2013-08-19 | Ihi Shibaura Machinery Corp | 酸化処理方法および酸化処理システム |
| US20130251863A1 (en) * | 2012-03-20 | 2013-09-26 | The Ohio State University Research Foundation | Apparatus for Treating Items with Gas |
| CA2867883C (en) * | 2012-03-28 | 2020-06-02 | Rasirc, Inc. | Method of delivering a process gas from a multi-component solution |
| US20130294969A1 (en) | 2012-05-02 | 2013-11-07 | Nellcor Puritan Bennett Llc | Wireless, Reusable, Rechargeable Medical Sensors and System for Recharging and Disinfecting the Same |
| CN102671225B (zh) * | 2012-05-28 | 2015-08-26 | 上海东富龙爱瑞思科技有限公司 | 一种过氧化氢蒸汽灭菌装置 |
| US9459233B2 (en) | 2012-06-25 | 2016-10-04 | Steris Corporation | Amperometric gas sensor |
| JP6253223B2 (ja) * | 2012-07-25 | 2017-12-27 | 株式会社Ihi | 殺菌装置 |
| DE102012018109A1 (de) * | 2012-09-04 | 2014-03-27 | Linde Aktiengesellschaft | Verfahren zur Durchführung eines Drucktests an einem Tank und Betankungseinrichtung |
| JP5696740B2 (ja) * | 2012-12-13 | 2015-04-08 | キヤノンマーケティングジャパン株式会社 | 滅菌装置、滅菌方法、プログラム |
| JP5943102B2 (ja) * | 2012-12-13 | 2016-06-29 | キヤノンマーケティングジャパン株式会社 | 滅菌装置、滅菌方法、プログラム |
| CN103041417A (zh) * | 2013-01-30 | 2013-04-17 | 杭州盈天科学仪器有限公司 | 具有灭菌功能的传递舱 |
| US9675722B2 (en) | 2013-02-26 | 2017-06-13 | 3M Innovative Properties Company | Biological indicator for monitoring a low-temperature sterilization process |
| KR101469943B1 (ko) * | 2013-03-25 | 2014-12-09 | (주)푸르고팜 | 이산화염소 훈증장치, 및 이에 의한 훈증방법 |
| WO2014178740A1 (en) * | 2013-04-30 | 2014-11-06 | Gonçalves Da Costa Helder | Packaging and transportation kit for hydrogen peroxide or other chemical product used in sterilization or disinfection equipments and respective supplying system |
| KR101465563B1 (ko) * | 2013-08-26 | 2014-11-26 | (주)옥시테라피 | 습윤이산화염소가스를 이용한 멸균장치 및 멸균방법 |
| US9302021B2 (en) * | 2013-08-30 | 2016-04-05 | American Sterilizer Company | Method of performing sterilization cycle |
| US10709803B2 (en) | 2013-09-06 | 2020-07-14 | Ts03 Inc. | Sterilization apparatus and adaptive control thereof |
| AU2014317768B2 (en) * | 2013-09-06 | 2017-11-16 | Stryker Corporation | Sterilization methods and apparatus and adaptive control thereof |
| GB2518239A (en) | 2013-09-17 | 2015-03-18 | Tristel Plc | Decontamination System |
| BR102013030702B1 (pt) * | 2013-11-28 | 2019-12-24 | Cisabrasile Ltda | sistema de vácuo para equipamentos de esterilização sem utilização de água ilimitado ao vapor saturado |
| EP3116553B1 (en) | 2014-03-09 | 2022-09-28 | Lynch, Edward | Disinfection apparatus |
| CN103920176B (zh) * | 2014-04-25 | 2018-08-31 | 上海净达制药设备系统工程有限公司 | 电离过氧化氢综合等离子体灭菌技术 |
| US10463754B2 (en) | 2014-04-28 | 2019-11-05 | American Sterilizer Company | Process for decontaminating or sterilizing an article |
| US10869479B2 (en) | 2014-04-28 | 2020-12-22 | American Sterilizer Company | Wipe for killing spores |
| US20150305344A1 (en) * | 2014-04-28 | 2015-10-29 | American Sterilizer Company | Decontamination or sterilization process |
| US9907872B2 (en) | 2014-05-06 | 2018-03-06 | Soclean, Inc. | Devices, systems and methods for ozone sanitization of continuous positive airway pressure devices |
| EP3142712B1 (en) | 2014-05-13 | 2019-08-07 | Rasirc, Inc. | Method of delivering hydrogen peroxide for decontaminating a material |
| EP2952474A1 (en) * | 2014-06-03 | 2015-12-09 | Steris Europe, Inc. Suomen Sivuliike | Method and device for generating steam and gaseous hydrogen peroxide |
| CN104190686A (zh) * | 2014-07-01 | 2014-12-10 | 栖霞中泰环保设备有限公司 | 医疗废弃物处理设备预真空抽气机构 |
| CN104083787B (zh) * | 2014-07-09 | 2017-01-25 | 张家港市嘉瑞制药机械有限公司 | 乙醇灭菌装置 |
| WO2016025934A1 (en) * | 2014-08-15 | 2016-02-18 | The United States Of America As Represented By The Secretary Of The Navy | Self-contained portable ozone sterilizer for small medical equipment |
| JP6426283B2 (ja) * | 2014-10-22 | 2018-11-21 | エルデル、ダ、コスタ、ゴンカルベスHelder Da Costa Goncalves | マルチキャピラリーチューブを通して気化および配合される過酸化水素およびオゾンを使用する殺菌装置 |
| US10150048B2 (en) | 2014-10-23 | 2018-12-11 | Rasirc, Inc. | Method, system, and device for delivery of process gas |
| JP6272214B2 (ja) | 2014-12-02 | 2018-01-31 | 三菱重工機械システム株式会社 | 容器の殺菌方法、及び、殺菌システム |
| WO2016086299A1 (en) | 2014-12-03 | 2016-06-09 | Tso3 Inc. | Method for establishing resistance characteristics of a biological indicator |
| JP6520112B2 (ja) * | 2014-12-24 | 2019-05-29 | キヤノンマーケティングジャパン株式会社 | 滅菌装置、及びその制御方法 |
| KR101653173B1 (ko) * | 2015-02-03 | 2016-09-02 | (주) 씨엠테크 | 과산화수소수 공급장치 |
| JP6761563B2 (ja) * | 2015-02-20 | 2020-09-30 | 三浦工業株式会社 | 除染装置および除染方法 |
| CN104800874B (zh) * | 2015-04-21 | 2017-08-15 | 佛山皓明拓普新材料科技有限公司 | 一种杀菌消毒祛味机 |
| JP6411286B2 (ja) * | 2015-06-02 | 2018-10-24 | 日本エアーテック株式会社 | 過酸化水素ガス除去装置 |
| JP2017012400A (ja) * | 2015-06-30 | 2017-01-19 | 株式会社大林組 | 除染方法及び除染システム |
| KR101732677B1 (ko) * | 2015-10-13 | 2017-05-04 | 주식회사 큐브인스트루먼트 | 부피 가변식 챔버를 가지는 저온 멸균장치 |
| EP3370782A4 (en) * | 2015-11-02 | 2019-07-24 | Pura Scents, Inc. | SCENT SUPPLY |
| RU2729478C2 (ru) | 2015-12-14 | 2020-08-07 | Сарая Ко., Лтд. | Система подачи жидкости и способ приведения ее в действие |
| CN108698005B (zh) * | 2015-12-14 | 2021-04-16 | 山东新华医疗器械股份有限公司 | 液体供给系统 |
| US20200360552A1 (en) * | 2015-12-18 | 2020-11-19 | Caron Products And Services, Inc. | System and method for vaporized hydrogen peroxide cleaning of contents of a chamber of a container |
| US10738271B2 (en) | 2015-12-18 | 2020-08-11 | Caron Products And Services, Inc. | System and method for vaporized hydrogen peroxide cleaning of an incubation chamber |
| US10039850B2 (en) | 2016-01-13 | 2018-08-07 | Sterio3, Llc | Sterilization device and methods |
| CA3011166C (en) | 2016-01-13 | 2023-07-18 | Sterio3, Llc | Sterilization device and methods |
| FR3046730B1 (fr) * | 2016-01-15 | 2024-05-31 | Sidel Participations | Procede et dispositif pour la sterilisation de moyens de filtration de gaz, notamment d’air de soufflage |
| JP2017176778A (ja) * | 2016-03-31 | 2017-10-05 | キヤノンマーケティングジャパン株式会社 | 滅菌装置、滅菌方法、プログラム |
| JP2019523038A (ja) | 2016-06-17 | 2019-08-22 | ステリファー・メディカル・インコーポレイテッドSterifre Medical, Inc. | 滅菌、消毒、衛生化、除染および治療の装置、システム、ならびに方法 |
| US11696967B2 (en) | 2016-06-30 | 2023-07-11 | Asp Global Manufacturing Gmbh | Apparatus and method for sterilizing endoscope |
| US10314929B2 (en) | 2016-06-30 | 2019-06-11 | Ethicon, Inc. | Apparatus and method for sterilizing endoscope |
| KR101867904B1 (ko) | 2016-08-05 | 2018-06-18 | 한국과학기술연구원 | 멸균제 훈증 장치 |
| KR101846251B1 (ko) * | 2016-08-17 | 2018-04-09 | 주식회사 큐브인스트루먼트 | 저온 멸균 방법 |
| US10328170B2 (en) * | 2016-10-21 | 2019-06-25 | Ethicon, Inc. | Dynamic disinfectant dosage with concentrate degradation compensation |
| US10610610B2 (en) * | 2017-01-05 | 2020-04-07 | Biosense Webster (Israel) Ltd. | Hydrogen peroxide sterilizer with multiple UV sensors |
| US10918754B2 (en) | 2017-03-27 | 2021-02-16 | Regeneron Pharmaceuticals, Inc. | Sterilisation method |
| CN108686240B (zh) * | 2017-04-10 | 2022-03-04 | 山东新华医疗器械股份有限公司 | 灭菌方法和灭菌装置 |
| KR101985173B1 (ko) | 2017-05-08 | 2019-06-04 | 한국과학기술연구원 | 과산화수소 증기 멸균 및 제독 시스템 |
| US10889848B2 (en) | 2017-07-14 | 2021-01-12 | American Sterilizer Company | Process for determining viability of test microorganisms of biological indicator and sterilization detection device for determining same |
| US10876144B2 (en) | 2017-07-14 | 2020-12-29 | American Sterilizer Company | Process for determining viability of test microorganisms of biological indicator and sterilization detection device for determining same |
| US10900062B2 (en) | 2017-07-14 | 2021-01-26 | American Sterilizer Company | Process for determining viability of test microorganisms of biological indicator and sterilization detection device for determining same |
| KR101899786B1 (ko) * | 2017-07-27 | 2018-09-20 | 이승재 | 과산화수소용액 분사 구동신호 제어장치를 부착한 과산화수소연무발생장치 |
| WO2019084203A1 (en) | 2017-10-25 | 2019-05-02 | Sterifre Medical Inc. | DEVICES, SYSTEMS AND METHODS FOR STERILIZATION, DISINFECTION, ANTISEPTIC CLEANING AND DECONTAMINATION |
| WO2019113434A1 (en) * | 2017-12-08 | 2019-06-13 | Oshkosh Corporation | Ozone cleaning system |
| WO2019118588A1 (en) | 2017-12-13 | 2019-06-20 | Regeneron Pharmaceuticals, Inc. | Devices and methods for precision dose delivery |
| KR102114684B1 (ko) * | 2017-12-28 | 2020-05-25 | 주식회사 이노켐텍 | 살균기 |
| US20210052753A1 (en) * | 2017-12-31 | 2021-02-25 | Purogen Laboratories, Llc | Methods and apparatuses for pressurized purification and infusion of plant matter and cellulose-based organic cellular material |
| JP6607277B2 (ja) * | 2018-04-03 | 2019-11-20 | 株式会社三洋物産 | 遊技機 |
| JP7115139B2 (ja) * | 2018-08-23 | 2022-08-09 | 株式会社Ihi | Ohラジカル処理装置、および、ohラジカル処理方法 |
| US20220117466A1 (en) | 2018-11-30 | 2022-04-21 | Tso3 Inc. | Endoscopes With Improved Compatibility To Oxidative Processings And Methods For Manufacturing And Repairing The Same |
| US11007289B2 (en) | 2019-02-14 | 2021-05-18 | American Sterilizer Company | Method for pressurizing a steam sterilization chamber |
| US10792613B1 (en) * | 2019-03-11 | 2020-10-06 | Oshkosh Corporation | Cleaning device |
| CN113195007B (zh) * | 2019-03-14 | 2024-05-07 | 三浦工业株式会社 | 灭菌方法以及灭菌装置 |
| US20230007917A1 (en) * | 2019-03-19 | 2023-01-12 | Soclean, Inc. | Technologies for sanitizing/disinfecting medical devices |
| US12161770B2 (en) | 2019-03-29 | 2024-12-10 | Advanced Sterilization Products, Inc. | Load volume determination method for a sterilization apparatus |
| CN118718181A (zh) | 2019-06-05 | 2024-10-01 | 里珍纳龙药品有限公司 | 用于精确剂量递送的装置及方法 |
| US11291740B2 (en) | 2019-08-12 | 2022-04-05 | Gcmg Companies, Llc | Fogging system and methods for enclosed chambers |
| MX2022002980A (es) * | 2019-09-16 | 2022-04-06 | Amgen Inc | Metodo para la esterilizacion externa de un dispositivo de suministro de farmacos. |
| CN110448710A (zh) * | 2019-09-18 | 2019-11-15 | 好空气科技发展有限公司 | 一种织品高效率消毒的方法 |
| CN110507837A (zh) * | 2019-09-18 | 2019-11-29 | 好空气科技发展有限公司 | 一种真空臭氧高效消毒装置 |
| WO2021154959A1 (en) * | 2020-01-28 | 2021-08-05 | Tekdry International, Inc. | Molecular mobility enhancer or molecular drying enhancer |
| CN111150867B (zh) * | 2020-02-18 | 2020-12-29 | 青岛大学附属医院 | 一种针管消毒设备 |
| AU2021225781A1 (en) * | 2020-02-26 | 2022-09-29 | Carefusion Corporation | Systems and methods for sterilizing iodophor compositions |
| JP7468060B2 (ja) * | 2020-03-27 | 2024-04-16 | 三浦工業株式会社 | 滅菌方法及び滅菌装置 |
| JP6930684B1 (ja) * | 2020-03-27 | 2021-09-01 | 三浦工業株式会社 | 滅菌方法及び滅菌装置 |
| JP2021153912A (ja) * | 2020-03-27 | 2021-10-07 | 三浦工業株式会社 | 滅菌方法及び滅菌装置 |
| US20230141766A1 (en) * | 2020-03-27 | 2023-05-11 | Miura Co., Ltd. | Sterilizing method and sterilizer |
| JP7547754B2 (ja) * | 2020-03-27 | 2024-09-10 | 三浦工業株式会社 | 滅菌装置 |
| CN111392221B (zh) * | 2020-04-02 | 2021-09-14 | 上海久正医用包装材料有限公司 | 一种药用包装袋及其生产工艺 |
| WO2021205226A2 (en) * | 2020-04-08 | 2021-10-14 | Asp Global Manufacturing Gmbh | Method for sterilizing endoscope |
| GB202007453D0 (en) * | 2020-05-19 | 2020-07-01 | Aseptick Ltd | Apparatus and methods for decontaminating enclosed spaces |
| CN111920971B (zh) * | 2020-07-03 | 2022-07-26 | 义乌市宏博机械科技有限公司 | 一种依据手术用品自重来调控高温水蒸气量的消毒装置 |
| JP2022044186A (ja) * | 2020-09-07 | 2022-03-17 | 三浦工業株式会社 | 除染方法及び除染装置 |
| JP7523018B2 (ja) * | 2020-09-07 | 2024-07-26 | ウシオ電機株式会社 | 殺菌処理方法及び殺菌処理装置 |
| CN112618757A (zh) * | 2020-12-21 | 2021-04-09 | 王铁军 | 一种药瓶杀菌装置 |
| JP7584660B2 (ja) * | 2020-12-21 | 2024-11-15 | ザ プロクター アンド ギャンブル カンパニー | ヒトの代謝に由来する有機化合物によって汚染された使用済み吸収性衛生製品を滅菌及び除染するための方法 |
| AU2021407373A1 (en) * | 2020-12-21 | 2023-07-13 | Asp Global Manufacturing Gmbh | A method and a system for adjusting a cycle time of a treatment process for an object |
| CN112972723B (zh) * | 2021-02-24 | 2021-11-30 | 西安交通大学 | 氮氧化物模式与臭氧模式相结合的放电等离子体消毒装置 |
| IL306071A (en) * | 2021-04-08 | 2023-11-01 | Regeneron Pharma | Methods and systems for sterilization |
| WO2023281501A1 (en) * | 2021-07-06 | 2023-01-12 | Novagreen Technologies Ltd | Methods for preserving plant matter |
| KR102652622B1 (ko) | 2021-11-12 | 2024-03-29 | 주식회사 퓨어텍 | 과산화수소를 이용하여 살균하는 방법 및 장치 |
| US12121853B2 (en) | 2022-01-12 | 2024-10-22 | Thalo Labs, Inc. | System for capturing a constituent gas from a gas supply |
| US12491280B2 (en) | 2022-04-25 | 2025-12-09 | Sterilucent, Inc. | Sterilization cycle with enhanced diffusion |
| KR102589748B1 (ko) * | 2023-05-31 | 2023-10-16 | (주)대성하이텍 | 건식 멸균 소독장치 |
| KR20250104378A (ko) | 2023-12-29 | 2025-07-08 | 최보규 | OpenCV 및 TVC Nozzle을 활용한 자동 화점 추적 소화 장치 |
| JP7658022B1 (ja) * | 2024-10-24 | 2025-04-07 | 荏原実業株式会社 | 濃度測定装置 |
Family Cites Families (94)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB264936A (en) | 1925-10-30 | 1927-01-31 | British Celanese | Improvements in or relating to the treatment of yarns and fabrics |
| GB1324660A (en) * | 1969-09-30 | 1973-07-25 | Sprinter Pack Ab | Container with lid for liquids especially carbonized beverages |
| US3978232A (en) | 1970-12-30 | 1976-08-31 | Edward Dodsworth | Thin walled containers for pressurized liquids |
| US3880011A (en) | 1974-02-14 | 1975-04-29 | Harsco Corp | Automatic sampler |
| US4082200A (en) | 1976-06-29 | 1978-04-04 | Owens-Illinois, Inc. | Plastic container with support base, and method of assembly |
| US4300404A (en) * | 1977-12-01 | 1981-11-17 | Becton, Dickinson And Company | Liquid specimen container |
| JPS54163993U (es) * | 1978-05-10 | 1979-11-16 | ||
| FR2427343A1 (fr) | 1978-05-31 | 1979-12-28 | Dia Prosim | Procede de bromation de resines a base de copolymeres vinylaromatiques reticules |
| JPS57192067A (en) | 1981-05-22 | 1982-11-26 | Hitachi Ltd | Erasable and programmable read only memory unit |
| US4434820A (en) * | 1982-05-05 | 1984-03-06 | Glass John P | Syringe loader and method |
| JPS5969077A (ja) | 1982-10-12 | 1984-04-19 | アメリカン・ステリライザ−・コムパニ− | 過酸化水素の液体膜による殺菌方法 |
| US4548348A (en) | 1984-02-27 | 1985-10-22 | Solo Cup Company | Disposable cup assembly |
| US4642165A (en) * | 1984-12-21 | 1987-02-10 | American Sterilizer Company | Method of vaporizing multicomponent liquids |
| US5037623A (en) * | 1986-02-06 | 1991-08-06 | Steris Corporation | Sterilant concentrate injection system |
| JPS63246676A (ja) * | 1987-03-31 | 1988-10-13 | Shimadzu Corp | 試料導入装置 |
| CA1303811C (en) | 1987-07-06 | 1992-06-23 | Robert W. Childers | Flow-through vapor phase sterilization system |
| US4838887A (en) * | 1987-12-15 | 1989-06-13 | Shiley Infusaid Inc. | Programmable valve pump |
| US4956145A (en) * | 1987-12-30 | 1990-09-11 | American Sterilizer Company | Optimum hydrogen peroxide vapor sterilization method |
| US4952370A (en) * | 1988-05-06 | 1990-08-28 | American Sterilizer Company | Hydrogen peroxide sterilization method |
| JPH0219742U (es) * | 1988-07-27 | 1990-02-08 | ||
| JPH02301308A (ja) | 1989-05-16 | 1990-12-13 | Iwatsu Electric Co Ltd | ゲイン可変回路 |
| JPH03182658A (ja) | 1989-12-13 | 1991-08-08 | Nissan Motor Co Ltd | 内燃機関の制御装置 |
| US5122344A (en) * | 1990-01-31 | 1992-06-16 | Mdt Corporation | Chemical sterilizer system |
| JPH0422761A (ja) * | 1990-05-17 | 1992-01-27 | Mitsubishi Electric Corp | 内燃機関点火制御装置及び方法 |
| JPH0454698A (ja) | 1990-06-22 | 1992-02-21 | Matsushita Refrig Co Ltd | 自動販売機の商品収納装置 |
| JP2583804B2 (ja) * | 1990-07-17 | 1997-02-19 | 三菱重工業株式会社 | 缶状容器の液体回収方法 |
| JPH0698998B2 (ja) * | 1990-08-27 | 1994-12-07 | 麒麟麦酒株式会社 | 缶内液体回収装置 |
| US5244629A (en) * | 1990-08-31 | 1993-09-14 | Caputo Ross A | Plasma sterilizing process with pulsed antimicrobial agent pretreatment |
| JPH0711919Y2 (ja) * | 1990-09-13 | 1995-03-22 | 麒麟麦酒株式会社 | 穿孔用ポンチ |
| US5700426A (en) | 1991-03-08 | 1997-12-23 | Foundation Nationale De Transfusion Sanguine | Method for decontaminating or sterilizing "in situ" a vacuum sealed container and device for implementing such method |
| JP3182658B2 (ja) | 1991-12-27 | 2001-07-03 | 四国化工機株式会社 | 過酸化水素水ノズルの噴霧量測定装置 |
| GB9205255D0 (en) | 1992-03-11 | 1992-04-22 | Process Containment Tech | Sterilisation unit |
| EP0583465A1 (en) * | 1992-03-13 | 1994-02-23 | American Sterilizer Company | Sterilization apparatus and method for multicomponent sterilant |
| US5445792A (en) * | 1992-03-13 | 1995-08-29 | American Sterilizer Company | Optimum hydrogen peroxide vapor sterlization method |
| JP3549883B2 (ja) * | 1992-10-01 | 2004-08-04 | アメリカン ステリライザー カンパニー | アキュムレータに基づく液体計量分与システムおよび計量分与方法 |
| US5527508A (en) * | 1992-11-12 | 1996-06-18 | American Sterilizer Company | Method of enhanced penetration of low vapor pressure chemical vapor sterilants during sterilization |
| US5517867A (en) * | 1994-07-15 | 1996-05-21 | E. I. Du Pont De Nemours And Company | Liquid extraction apparatus |
| JPH08238305A (ja) * | 1995-03-06 | 1996-09-17 | Zexel Corp | 窒素ラジカルによる殺菌消臭方法 |
| JP3803417B2 (ja) | 1995-04-11 | 2006-08-02 | テルモ カーディオバスキュラー システムズ コーポレイション | センサーを壁に取付ける取付けパッド及びレベルセンサーの超音波変換器と取付け機構との組合せ |
| JPH08285658A (ja) * | 1995-04-17 | 1996-11-01 | Yokogawa Denshi Kiki Kk | 定量注出装置 |
| US5851485A (en) | 1996-12-20 | 1998-12-22 | Johnson & Johnson Medical, Inc. | Process for sterilization with liquid sterilant using controlled pumpdown rate |
| US6070761A (en) | 1997-08-22 | 2000-06-06 | Deka Products Limited Partnership | Vial loading method and apparatus for intelligent admixture and delivery of intravenous drugs |
| US6475183B1 (en) | 1998-06-03 | 2002-11-05 | Baxter International Inc. | Direct dual filling device for sealing agents |
| US6096266A (en) | 1998-07-10 | 2000-08-01 | Box 03 International | Method for disinfecting and sterilizing microbial contaminated materials |
| US6378126B2 (en) | 1998-09-29 | 2002-04-23 | International Business Machines Corporation | Compilation of embedded language statements in a source code program |
| US7569180B2 (en) * | 2004-10-12 | 2009-08-04 | Ethicon, Inc. | Sterilization system and method and orifice inlet control apparatus therefor |
| DE60028964T2 (de) * | 1999-03-17 | 2007-02-08 | Ethicon, Inc. | Behälter für sterilisierungsmittelkapseln und sterilisator |
| US6363802B1 (en) | 1999-03-25 | 2002-04-02 | Coulter International Corp. | Apparatus for aspirating liquid from a vessel |
| US7588720B2 (en) * | 1999-04-30 | 2009-09-15 | Tso3, Inc. | Method and apparatus for ozone sterilization |
| GB2351664A (en) * | 1999-06-04 | 2001-01-10 | Microflow Ltd | Sterilizing enclosures |
| US6732330B1 (en) | 1999-09-30 | 2004-05-04 | International Business Machines Corporation | Scripting language blocks to support multiple scripting languages in a single web page |
| US6279622B1 (en) | 2000-02-07 | 2001-08-28 | Ethicon, Inc. | Method and system for delivering and metering liquid sterilant |
| US7636945B2 (en) | 2000-07-14 | 2009-12-22 | Computer Associates Think, Inc. | Detection of polymorphic script language viruses by data driven lexical analysis |
| US20040022673A1 (en) | 2000-07-26 | 2004-02-05 | Jacques Protic | Sterilisation process and apparatus therefor |
| DE10042416A1 (de) | 2000-08-30 | 2002-03-14 | Ruediger Haaga Gmbh | Verfahren zum Sterilisieren von Gegenständen |
| US6699434B1 (en) | 2000-09-08 | 2004-03-02 | Ethicon, Inc. | Metering valve to deliver liquid |
| US20020098111A1 (en) * | 2000-12-04 | 2002-07-25 | Nguyen Nick N. | Vaporizer |
| US7101512B2 (en) * | 2000-12-15 | 2006-09-05 | Ethicon, Inc. | Cassette and delivery system |
| JP4360049B2 (ja) | 2001-06-07 | 2009-11-11 | 株式会社Ihi | 過酸化水素滅菌装置 |
| JP2002360673A (ja) * | 2001-06-08 | 2002-12-17 | Ishikawajima Harima Heavy Ind Co Ltd | オゾン滅菌装置 |
| JP2003095392A (ja) * | 2001-09-25 | 2003-04-03 | Kirin Brewery Co Ltd | 缶内液体排出装置 |
| US20030066346A1 (en) * | 2001-10-05 | 2003-04-10 | Goloby Mark V. | Chemical injection pulse generator |
| US8156471B2 (en) | 2001-11-09 | 2012-04-10 | Oracle International Corporation | Multi-language execution method |
| EP1490115B1 (en) * | 2002-04-02 | 2005-11-09 | Plasmasol Corporation | System and method for injection of an organic based reagent into weakly ionized gas to generate chemically active species |
| KR100414360B1 (ko) * | 2002-11-08 | 2004-01-16 | 주식회사 휴먼메디텍 | 플라즈마 처리기가 부착된 멸균장치 및 멸균방법 |
| DE10302344A1 (de) | 2003-01-17 | 2004-07-29 | Rüdiger Haaga GmbH | Sterilisationskammer zum Sterilisieren von Gegenständen |
| FR2852849B3 (fr) | 2003-03-28 | 2005-05-27 | Alphonse Graffeo | Appareil et un procede de desinfection des dechets de soins hospitaliers a risque infectieux |
| US20050129571A1 (en) * | 2003-12-10 | 2005-06-16 | Steris Inc. | Ozone enhanced vaporized hydrogen peroxide decontamination method and system |
| US8017074B2 (en) * | 2004-01-07 | 2011-09-13 | Noxilizer, Inc. | Sterilization system and device |
| EP1701747B1 (en) * | 2004-01-07 | 2014-03-12 | Noxilizer, Inc. | Sterilisation method |
| CN100502951C (zh) | 2004-03-31 | 2009-06-24 | 株式会社汤山制作所 | 杀菌方法及杀菌装置 |
| JP2006036343A (ja) | 2004-07-30 | 2006-02-09 | Toppan Printing Co Ltd | 噴霧殺菌装置 |
| US7811530B2 (en) * | 2004-10-29 | 2010-10-12 | Ethicon, Inc. | Sterilization cassette and packaging |
| ES2384330T3 (es) | 2004-11-26 | 2012-07-03 | Human Meditek Co., Ltd | Esterilizador de vapor de peróxido de hidrógeno y procedimientos de esterilización que usan el mismo |
| JP2006320613A (ja) * | 2005-05-20 | 2006-11-30 | Mitsubishi Electric Corp | 空気清浄装置 |
| FR2887610B1 (fr) | 2005-06-24 | 2008-12-19 | Gewiss France Sa Sa | Montant et element d'un dispositif de support et dispositif de support |
| US7429353B2 (en) * | 2005-07-21 | 2008-09-30 | American Sterilizer Company | Method and apparatus for injecting a metered quantity of a liquid into a chamber |
| GB2428578B (en) | 2005-07-28 | 2010-06-09 | Bioquell | Determining bacterial kill by vaporised sterilants |
| US20070098591A1 (en) * | 2005-10-31 | 2007-05-03 | Georg Frinke | Method and apparatus for low energy vaporization of liquid oxidizing agents or solutions |
| US7374034B2 (en) * | 2006-01-12 | 2008-05-20 | Keith Investments, Llc | Reciprocating slat conveyor with bearing planks on fixed slats between moving slats |
| ATE457743T1 (de) * | 2006-05-01 | 2010-03-15 | American Sterilizer Co | Wasserstoffperoxid-zerstäuber |
| DE102006036475A1 (de) * | 2006-08-04 | 2008-02-07 | Khs Ag | Verfahren zur Sterilisation von Reinräumen für die Behandlung und/oder das Füllen und Verschließen von Behältern |
| BRPI0715988A2 (pt) * | 2006-10-18 | 2013-08-06 | Tso 3 Inc | mÉtodo para a esterilizaÇço de um artigo em uma atmosfera de gÁs de esterilizaÇço |
| JP4773982B2 (ja) | 2007-01-23 | 2011-09-14 | 株式会社Ihiシバウラ | 殺菌ガス浸透装置 |
| WO2008109877A1 (en) | 2007-03-08 | 2008-09-12 | Virent Energy Systems, Inc. | Synthesis of liquid fuels and chemicals from oxygenated hydrocarbons |
| AU2013203267B2 (en) | 2007-03-08 | 2015-04-30 | Virent, Inc. | Synthesis of liquid fuels and chemicals from oxygenated hydrocarbons |
| KR100782040B1 (ko) * | 2007-06-29 | 2007-12-04 | 주식회사 리노셈 | 과산화수소 및 오존을 사용하는 멸균방법 및 그 방법에따른 장치 |
| KR200438487Y1 (ko) * | 2007-06-29 | 2008-02-20 | 주식회사 리노셈 | 복수의 멸균 챔버를 구비한 멸균 장치 |
| WO2009008755A1 (en) | 2007-07-10 | 2009-01-15 | Helder Da Costa Goncalves | Hydrogen peroxide sterilization process and device |
| JP4292234B1 (ja) * | 2008-08-29 | 2009-07-08 | 株式会社 ウイズシステムズ | 滅菌ガス発生装置、その滅菌ガス発生装置に適用される触媒カートリッジ、並びに滅菌処理装置 |
| US8697924B2 (en) | 2008-09-05 | 2014-04-15 | Shell Oil Company | Liquid fuel compositions |
| US20110076191A1 (en) * | 2009-09-25 | 2011-03-31 | Germgard Lighting, Llc. | Ozone Based Method and System for Tool Sterilization |
| TR201900045T4 (tr) * | 2009-09-30 | 2019-01-21 | Tso3 Inc | Steri̇li̇zasyon yöntemi̇. |
| EP3023479A1 (en) | 2014-11-24 | 2016-05-25 | Centre National De La Recherche Scientifique | Process for the deoxygenation of alcohols and use thereof |
-
2010
- 2010-09-29 TR TR2019/00045T patent/TR201900045T4/tr unknown
- 2010-09-29 ES ES16160873T patent/ES2704136T3/es active Active
- 2010-09-29 EP EP18194271.5A patent/EP3485917A3/en not_active Ceased
- 2010-09-29 EP EP10819766.6A patent/EP2482859B1/en not_active Not-in-force
- 2010-09-29 MX MX2012003502A patent/MX337243B/es active IP Right Grant
- 2010-09-29 WO PCT/CA2010/001518 patent/WO2011038487A1/en not_active Ceased
- 2010-09-29 KR KR1020167031134A patent/KR101761728B1/ko not_active Expired - Fee Related
- 2010-09-29 EP EP16160873.2A patent/EP3056224B1/en not_active Not-in-force
- 2010-09-29 BR BR122013010299A patent/BR122013010299A2/pt not_active IP Right Cessation
- 2010-09-29 MX MX2013002684A patent/MX352578B/es unknown
- 2010-09-29 KR KR1020137006487A patent/KR101827461B1/ko not_active Expired - Fee Related
- 2010-09-29 PL PL10819766.6T patent/PL2482859T3/pl unknown
- 2010-09-29 MX MX2013002682A patent/MX345910B/es unknown
- 2010-09-29 BR BR122013010293-0A patent/BR122013010293B1/pt not_active IP Right Cessation
- 2010-09-29 EP EP20130158381 patent/EP2601977B1/en not_active Not-in-force
- 2010-09-29 ES ES13158395.7T patent/ES2586831T3/es active Active
- 2010-09-29 MX MX2013002686A patent/MX351399B/es unknown
- 2010-09-29 PL PL16160873T patent/PL3056224T3/pl unknown
- 2010-09-29 JP JP2012531191A patent/JP5480975B2/ja not_active Expired - Fee Related
- 2010-09-29 ES ES13158399.9T patent/ES2562626T3/es active Active
- 2010-09-29 EP EP20130158404 patent/EP2601980B1/en not_active Not-in-force
- 2010-09-29 EP EP13158388.2A patent/EP2601978B1/en not_active Not-in-force
- 2010-09-29 KR KR1020137006490A patent/KR101785994B1/ko not_active Expired - Fee Related
- 2010-09-29 AU AU2010302888A patent/AU2010302888B2/en not_active Ceased
- 2010-09-29 ES ES13158404.7T patent/ES2545154T3/es active Active
- 2010-09-29 PL PL13158395T patent/PL2601979T3/pl unknown
- 2010-09-29 BR BR122013010296A patent/BR122013010296A2/pt not_active IP Right Cessation
- 2010-09-29 KR KR1020137006489A patent/KR101863560B1/ko not_active Expired - Fee Related
- 2010-09-29 CA CA2767726A patent/CA2767726C/en active Active
- 2010-09-29 KR KR1020137006486A patent/KR101863045B1/ko not_active Expired - Fee Related
- 2010-09-29 US US12/893,742 patent/US9101679B2/en active Active
- 2010-09-29 EP EP13158399.9A patent/EP2609937B1/en not_active Not-in-force
- 2010-09-29 CA CA2808705A patent/CA2808705C/en active Active
- 2010-09-29 CA CA2808561A patent/CA2808561C/en active Active
- 2010-09-29 MX MX2013002685A patent/MX348497B/es unknown
- 2010-09-29 ES ES10819766.6T patent/ES2586568T3/es active Active
- 2010-09-29 BR BR112012006740-0A patent/BR112012006740B1/pt not_active IP Right Cessation
- 2010-09-29 MX MX2013002683A patent/MX348647B/es unknown
- 2010-09-29 BR BR122013010298A patent/BR122013010298A2/pt not_active IP Right Cessation
- 2010-09-29 PT PT16160873T patent/PT3056224T/pt unknown
- 2010-09-29 EP EP13158395.7A patent/EP2601979B1/en not_active Not-in-force
- 2010-09-29 MX MX2013002688A patent/MX351186B/es unknown
- 2010-09-29 CA CA2808897A patent/CA2808897C/en active Active
- 2010-09-29 BR BR122013010297A patent/BR122013010297A2/pt not_active IP Right Cessation
- 2010-09-29 CA CA2808544A patent/CA2808544C/en active Active
- 2010-09-29 ES ES13158381.7T patent/ES2543704T3/es active Active
- 2010-09-29 CA CA2808703A patent/CA2808703C/en active Active
- 2010-09-29 KR KR1020127010807A patent/KR101789754B1/ko not_active Expired - Fee Related
- 2010-09-29 EP EP13158378.3A patent/EP2601976B1/en not_active Not-in-force
- 2010-09-29 ES ES13158378.3T patent/ES2469396T3/es active Active
- 2010-09-29 KR KR1020137006491A patent/KR101827462B1/ko not_active Expired - Fee Related
- 2010-09-29 ES ES13158388.2T patent/ES2531976T3/es active Active
- 2010-09-29 CA CA2808717A patent/CA2808717C/en active Active
- 2010-09-29 BR BR122013010289A patent/BR122013010289A2/pt not_active IP Right Cessation
- 2010-09-29 KR KR1020137006488A patent/KR101782118B1/ko not_active Expired - Fee Related
-
2012
- 2012-02-24 ZA ZA2012/01389A patent/ZA201201389B/en unknown
-
2013
- 2013-02-27 US US13/779,168 patent/US9402928B2/en active Active
- 2013-02-27 US US13/779,193 patent/US9480763B2/en not_active Expired - Fee Related
- 2013-02-27 US US13/779,200 patent/US9480764B2/en not_active Expired - Fee Related
- 2013-02-27 US US13/779,132 patent/US9474815B2/en not_active Expired - Fee Related
- 2013-02-28 US US13/780,656 patent/US9427485B2/en active Active
- 2013-02-28 US US13/780,464 patent/US9480765B2/en not_active Expired - Fee Related
- 2013-04-11 JP JP2013083152A patent/JP5785208B2/ja not_active Expired - Fee Related
- 2013-04-11 JP JP2013083146A patent/JP5785207B2/ja not_active Expired - Fee Related
- 2013-04-11 JP JP2013083238A patent/JP5785211B2/ja not_active Expired - Fee Related
- 2013-04-11 JP JP2013083142A patent/JP5855045B2/ja not_active Expired - Fee Related
- 2013-04-11 JP JP2013083154A patent/JP5785209B2/ja not_active Expired - Fee Related
- 2013-04-11 JP JP2013083229A patent/JP5785210B2/ja not_active Expired - Fee Related
-
2015
- 2015-08-07 US US14/820,965 patent/US9814795B2/en not_active Expired - Fee Related
- 2015-12-07 JP JP2015238619A patent/JP6141950B2/ja not_active Expired - Fee Related
-
2016
- 2016-08-25 US US15/247,450 patent/US10383966B2/en active Active
-
2019
- 2019-06-28 US US16/456,979 patent/US11097029B2/en not_active Expired - Fee Related
-
2021
- 2021-08-16 US US17/403,612 patent/US20210369899A1/en not_active Abandoned
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12083239B2 (en) | 2011-07-15 | 2024-09-10 | Soclean, Inc. | Devices, systems and methods for treating medical devices having passageways with ozone gas |
| US12280169B2 (en) | 2019-03-19 | 2025-04-22 | Soclean, Inc. | Technologies for sanitizing medical devices |
| US12064527B2 (en) | 2022-09-16 | 2024-08-20 | Soclean, Inc. | Disinfection systems and methods |
| US12257358B2 (en) | 2022-09-16 | 2025-03-25 | Soclean, Inc. | Disinfection systems and methods |
| US12280170B2 (en) | 2022-09-16 | 2025-04-22 | Soclean, Inc. | Disinfection systems and methods |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2704136T3 (es) | Método de esterilización | |
| HK1224601A (en) | Sterilization method | |
| HK1224601A1 (en) | Sterilization method | |
| BR122013010299B1 (pt) | Unidade de medição de peróxido de hidrogênio para um esterilizador de peróxido de hidrogênio | |
| HK1185817B (en) | Sterilisation method | |
| HK1167618B (en) | Sterilization method | |
| BR122013010289B1 (pt) | Método de controle de uma condensação indesejada de peróxido de hidrogênio em uma câmara de esterilização em uma temperatura pré- selecionada |