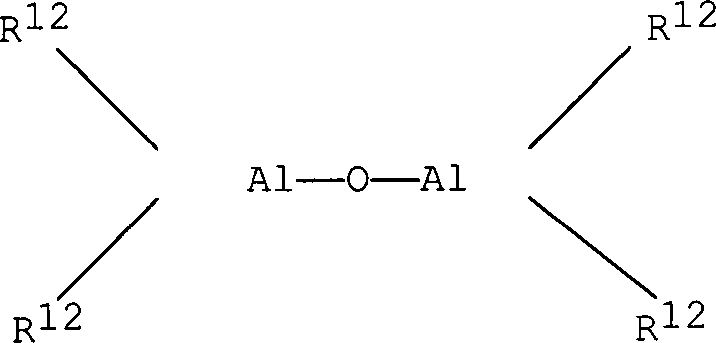-
Die
vorliegende Erfindung betrifft eine Klasse von mit einer Brücke versehenen
Metallocenverbindungen, Verfahren zu ihrer Herstellung und die Verwendung
dieser Metallocene als Katalysatorkomponenten für die Polymerisation von Olefinen.
-
Metallocenverbindungen
mit zwei, mit einer Brücke
versehenen Cyclopentadienylgruppen sind als Katalysatorkomponenten
für die
Polymerisation von Olefinen bekannt.
-
Beispielsweise
beschreibt EP-A-129 368 ein Katalysatorsystem für die Polymerisation von Olefinen, das
einen Biscyclopentadienyl-Koordinationskomplex
mit einem Übergangsmetall
umfasst, wobei die beiden Cyclopentadienylgruppen mit einer Brückengruppe
verbunden sein können.
-
Bei
diesem Typ von Metallocenverbindungen sind die zwei Cyclopentadienylgruppen
im allgemeinen durch zweiwertige Reste mit zwei oder mehr Kohlenstoffatomen,
wie eine Ethylidengruppe, oder mit von Kohlenstoff abweichenden
Atomen, wie eine Dimethylsilandiylgruppe, als Brückengruppe verbunden.
-
Es
sind Metallocenverbindungen bekannt, bei denen zwei Cyclopentadienylgruppen
mit einem einzigen Kohlenstoffatom als Brückengruppe verbunden sind.
Insbesondere sind Metallocenverbindungen dieses Typs mit zwei unterschiedlichen
Cyclopentadienylgruppen bekannt.
-
Beispielsweise
beschreibt EP-A-351 392 einen Katalysator, der für die Herstellung von syndiotaktischen
Polyolefinen verwendet werden kann und eine Metallocenverbindung
mit zwei Cyclopentadienylgruppen enthält, die durch eine zwischenliegende
Brücke
verbunden sind, wobei eine der beiden Cyclopentadienylgruppen anders
substituiert ist als die andere Gruppe. Als bevorzugte Verbindung
wird Isopropyliden-(fluorenyl)-(cyclopentadienyl)-hafniumdichlorid
angegeben.
-
Was
Metallocenverbindungen mit zwei gleichartig substituierten Cyclopentadienylgruppen,
die mit einem einzigen Kohlenstoffatom als Brücke verbunden sind, betrifft,
wird in EP-A-416 566 die Polymerisation von Propylen beschrieben,
die in einem flüssigen
Monomeren in Gegenwart eines Katalysators durchgeführt wird, wobei
der Katalysator aus (A) einem Alumoxan und (B) einer Metallocenverbindung
besteht, bei der Cyclopentadienylringe, die gleich oder verschieden
sein können, über eine
Brücke
der Formel -R5CR6-
verbunden sind, wobei R5 und R6 unterschiedliche
Bedeutungen haben können.
Die einzige Verbindung, die als Beispiel angegeben wird, ist Isopropyliden-bis-(indenyl)-zirconiumdichlorid.
Jedoch weisen die auf diese Weise erhältlichen Propylen-Polymeren
ein sehr niedriges Molekulargewicht auf.
-
I.
F. Urazowski et al. stellte bei der am 5. bis 10. September 1993
in Agia Pelagia, Kreta, Griechenland, gehaltenen X. Fechem Conference
on Organometallic Chemistry Metallocen-Komplexe von Ti und Zr vor,
die aus zwei Dicyclopentadienyl-dimethyl-methanen erhalten wurden,
nämlich
Produkte mit einem Isopropyl- oder tert.-Butylsubstituenten in der
3-Stellung der einzelnen
Cyclopentadienylringe. Jedoch wurden dabei lediglich Mechanismen über die
Bildung dieser Komplexe und ihre strukturellen Merkmale auf der
Basis einer Röntgenanalyse
erörtert.
-
Bei
einer weiteren, für
die vorliegende Anmeldung einschlägigen Druckschrift handelt
es sich um EP-516 018.
-
Es
wurde nunmehr eine neue Klasse von Metallocenverbindungen aufgefunden,
die zwei identische Cyclopentadienyl-Liganden aufweisen, die über eine
Alkylidenbrücke
miteinander verbunden sind und die in vorteilhafter Weise als Katalysatorkomponenten
für die
Polymerisation von Olefinen eingesetzt werden können.
-
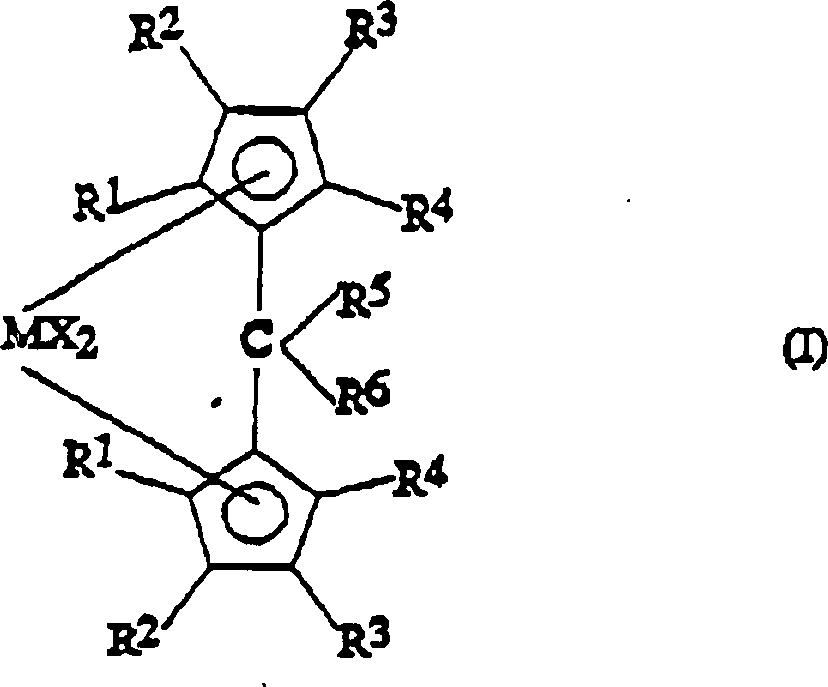
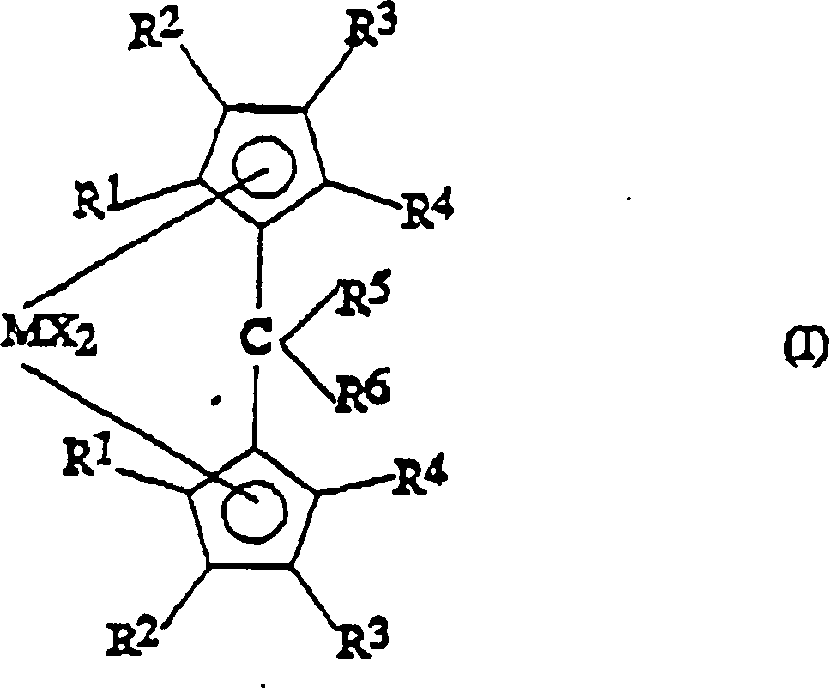
Ein
Gegenstand der vorliegenden Erfindung ist somit eine Metallocenverbindung
der Formel (I):
worin R
1,
R
2, R
3 und R
4, die gleich oder verschieden sein können, Wasserstoffatome
oder C
1-C
20-Alkyl-, C
3-C
20-Cycloalkyl-,
C
2-C
20-Alkenyl-,
C
6-C
20-Aryl-, C
7-C
20-Alkylaryl-
oder C
7-C
20-Arylalkylreste
bedeuten, die Silicium- oder Germaniumatome enthalten können, wobei
sich R
3 von R
2 und
von einem Wasserstoffatom unterscheidet und wobei R
1 und
R
2 am gleichen Cyclopentadienylring einen
Ring mit 5 bis 8 Kohlenstoffatomen bilden können;
R
5 ein
Wasserstoffatom oder einen -CHR
7R
8-Rest bedeutet;
R
6 einen
C
6-C
20-Arylrest
oder einen -CHR
9R
10-Rest
bedeutet;
R
5 und R
6 einen
Ring mit 3 bis 8 Kohlenstoffatomen, der Heteroatome enthalten kann,
bilden können;
R
7, R
8, R
9 und
R
10, die gleich oder verschieden sein können, Wasserstoffatome
oder C
1-C
20-Alkyl-,
C
3-C
20-Cycloalkyl-,
C
2-C
20-Alkenyl-,
C
6-C
20-Aryl-, C
7-C
20-Alkylaryl-
oder C
7-C
20-Arylalkylreste
bedeuten, die Heteroatome, wie Stickstoff, Phosphor, Sauerstoff
oder Schwefel, enthalten können,
und zwei der Substituenten R
7, R
8, R
9 und R
10 einen Ring mit 3 bis 8 Kohlenstoffatomen,
der Heteroatome enthalten kann, bilden können;
M ein Übergangsmetallatom,
das aus den Gruppen 3, 4, 5 und 6 des Periodensystems der Elemente
(neue IUPAC-Version) ausgewählt
ist, bedeutet;
die Substituenten X, die gleich oder verschieden
sein können,
Wasserstoffatome, Halogenatome oder R-, OR-, SR-, NR
2-
oder PR
2-Reste bedeuten, wobei es sich bei
den Substituenten R um C
1-C
20-Alkyl-,
C
3-C
20-Cycloalkyl-,
C
2-C
20-Alkenyl-,
C
6-C
20-Aryl-, C
7-C
20-Alkylaryl-
oder C
7-C
20-Arylalkylreste
handelt, die Siliciumatome oder Germaniumatome enthalten können;
mit
der Maßgabe,
dass dann, wenn die Substituenten R
1, R
2 und R
4 Wasserstoffatome
bedeuten und die Substituenten R
5 und R
6 Methylgruppen bedeuten, die R
3-Substituenten
keinen Isopropyl- oder tert.-Butylrest bedeuten.
-
Das Übergangsmetall
M wird vorzugsweise unter Titan, Zirconium und Hafnium ausgewählt. Insbesondere
handelt es sich um Zirconium.
-
Die
Substituenten X bedeuten vorzugsweise Chloratome oder Methylreste.
-
Eine
besonders interessante Klasse von erfindungsgemäßen Metallocenen besteht in
Verbindungen der Formel (I), in der die Substituenten R2 Wasserstoffatome
bedeuten. Die Substituenten R1 unterscheiden sich
vorzugsweise von Wasserstoffatomen. Die Substituenten R3 bedeuten
vorzugsweise Kohlenstoff-, Silicium- oder Germaniumatome, die mit
3 Alkyl-, Cycloalkyl-, Aryl-, Alklyaryl- oder Arylalkylgruppen mit
1 bis 10 Kohlenstoffatomen substituiert sind. Bei den Substituenten
R4 handelt es sich vorzugsweise um Wasserstoffatome.
Nachstehend sind nicht beschränkende
Beispiele für
Metallocenverbindungen dieser Klasse aufgeführt:
Isopropyliden-bis-(3-methylcyclopentadienyl)-zirconiumdichlorid
Isopropyliden-bis-(3-isopropylcyclopentadienyl)-zirconiumdichlorid
Isopropyliden-bis-(3-tert.-butylcyclopentadienyl)-zirconiumdichlorid
Isopropyliden-bis-(2,4-dimethylcyclopentadienyl)-zirconiumdichlorid
Isopropyliden-bis-(2-methyl-4-tert.-butylcyclopentadienyl)-irconiumdichlorid
und
Isopropyliden-bis-(2-methyl-4-phenyl-cyclopentadienyl)-zirconiumdichlorid.
-
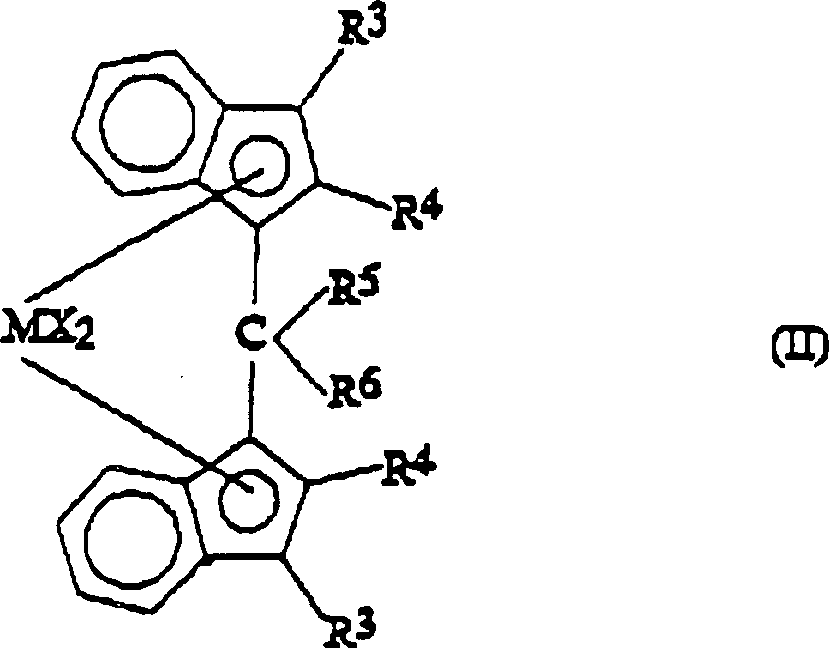
Eine
weitere besonders interessante Klasse von erfindungsgemäßen Metallocenen
sind Verbindungen der Formel (II):
und die entsprechenden Bis-4,5,6,7-tetrahydroindenylverbindungen,
wobei R
3, R
4, R
5, R
6, M und X, die
vorstehend definierten Bedeutungen haben und die 6 Kohlenstoffatome
aufweisenden Ringe der Indenylliganden gegebenenfalls substituiert
sind.
-
Die
Substituenten R3 bedeuten vorzugsweise Kohlenstoff-,
Silicium- oder Germaniumatome,
die mit 3 Alkyl-, Cycloalkyl-, Aryl-, Alklyaryl- oder Arylalkylgruppen mit 1 bis 10
Kohlenstoffatomen substituiert sind. Die Substituenten R4 bedeuten vorzugsweise Wasserstoffatome.
Nichtbeschränkende
Beispiele für
Metallocenverbindungen dieser Klasse sind nachstehend aufgeführt:
Isopropyliden-bis-(3-methylindenyl)-zirconiumdichlorid
Isopropyliden-bis-(3-ethylindenyl)-zirconiumdichlorid
Isopropyliden-bis-(3-isopropylindenyl)-zirconiumdichlorid
Isopropyliden-bis-(3-tert.-butylindenyl)-zirconiumdichlorid
Isopropyliden-bis-(3-trimethylsilylindenyl)-zirconiumdichlorid
Isopropyliden-bis-(3-trimethylgermylindenyl)-zirconiumdichlorid
und
Isopropyliden-bis-(3-tert.-butyl-4,5,6,7-tetrahydroindenyl)-zirconiumdichlorid.
-
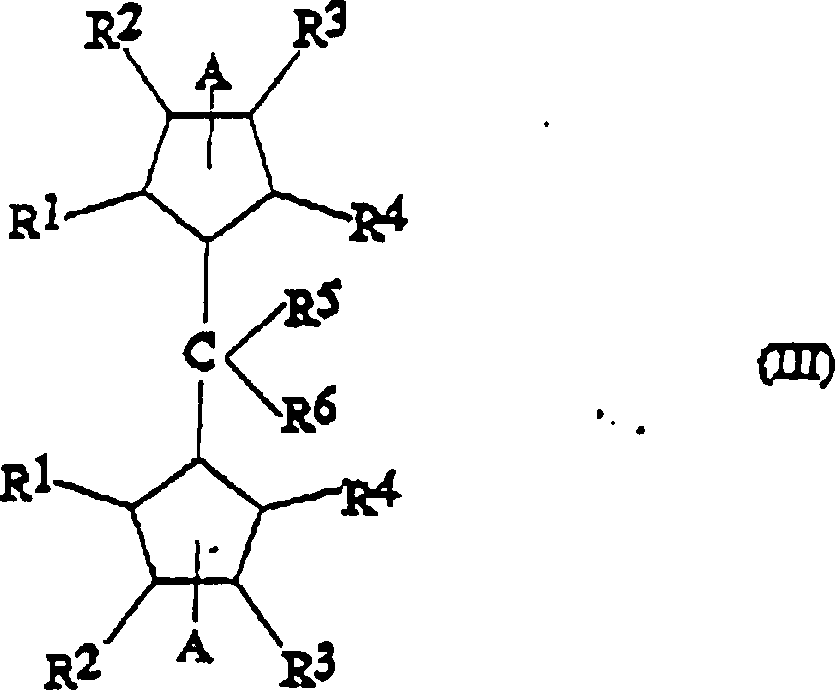
Die
Metallocenverbindungen der Formel (I) lassen sich nach einem Verfahren
herstellen, das einen weiteren Gegenstand der vorliegenden Erfindung
darstellt und das die Umsetzung der entsprechenden Bis-Cyclopentadienylliganden
der Formel (III) umfasst:
worin R
1,
R
2, R
3, R
4, R
5 und R
6 die vorstehend definierten Bedeutungen
haben und A eine geeignete austretende Gruppe bedeutet, mit einer
Verbindung der Formel MX
4, worin M und X
die vorstehend definierten Bedeutungen haben.
-
Die
Doppelbindungen der Cyclopentadienylringe in den Liganden der Formel
(III) können
in beliebigen erlaubten Stellungen vorliegen. Die Liganden der Formel
(III) lassen sich beispielsweise gemäß dem Verfahren der gleichzeitig
anhängigen
italienischen Patentanmeldung MI/95A/100 der gleichen Anmelderin
herstellen.
-
Für den Fall,
das es sich bei mindestens einem Substituenten X in der herzustellenden
Metallocenverbindung der Formel (I) nicht um ein Halogenatom handelt,
ist es erforderlich, mindestens einen Substituenten X im erhaltenen
Metallocen durch mindestens einen von Halogen abweichenden Substituenten
X zu ersetzen.
-
Die
Umsetzung von X-Substituenten durch von Halogen abweichenden Substituenten
X lässt
sich unter Heranziehung allgemein angewendeter Verfahren durchführen. Wenn
es sich beispielsweise bei den gewünschten Substituenten X um
Alkylgruppen handelt, lassen sich die Metallocene durch Umsetzung
mit Alkylmagnesiumhalogeniden (Grignard-Reagenzien) oder mit Alkyllithiumverbindungen
herstellen.
-
Die
erfindungsgemäßen Metallocenverbindungen
lassen sich zweckmäßigerweise
als Katalysatorkomponenten für
die Polymerisation von Olefinen verwenden.
-
Ein
weiterer Gegenstand der Erfindung besteht somit in einem Katalysator
für die
Polymerisation von Olefinen, der aus dem Reaktionsprodukt aus
- (a) einer erfindungsgemäßen Metallocenverbindung und
- (b) einem Alumoxan oder einer Verbindung, die zur Bildung eines
Alkylmetallocenkations befähigt
ist, besteht.
-
Im
Katalysator, der im erfindungsgemäßen Verfahren eingesetzt wird,
können
sowohl die Metallocenverbindung der Formel (I) als auch das Alumoxan
in Form eines Reaktionsprodukts mit einer organometallischen Aluminiumverbindung
der Formel AlR11 3 oder
Al2R11 6 vorliegen,
wobei die Substituenten R11, die gleich oder
verschieden sein können,
den Definitionen für
die Substituenten R entsprechen oder Halogenatome sind.
-
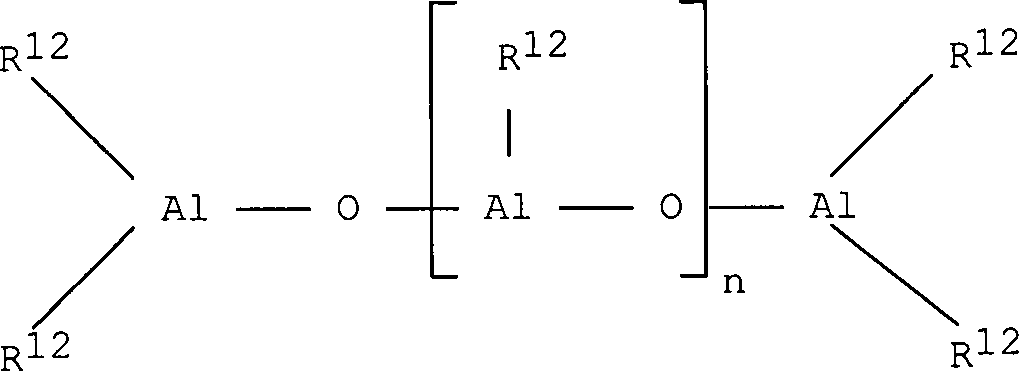
Bei
dem im erfindungsgemäßen Katalysator
verwendeten Alumoxan handelt es sich um eine lineare, verzweigte,
oder cyclische Verbindung, die mindestens eine Gruppe des Typs
enthält, wobei die Substituenten
R
12, die gleich oder verschieden sein können, der
Definition für
den Substituenten R entsprechen oder eine Gruppe der Formel -O-Al(R
12)
2 bedeuten und
gegebenenfalls einige Reste R
12 Halogenatome
sein können.
-
Insbesondere
können
Alumoxane der Formel
im Fall von linearen Verbindungen
verwendet werden, wobei n 0 oder eine ganze Zahl von 1 bis 40 bedeutet und
die Substituenten R
12 der Definition für die Substituenten
R entsprechen, oder es können
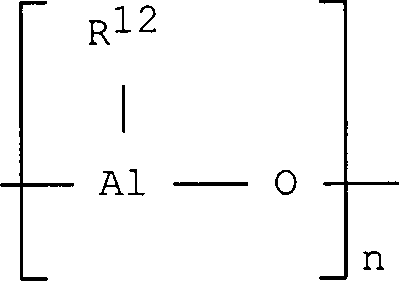
Alumoxane der Formel
im Fall von cyclischen Verbindungen
verwendet werden, wobei n eine ganze Zahl von 2 bis 40 bedeutet
und die Substituenten R
12 der Definition
für die
Substituenten R entsprechen.
-
Bei
den Substituenten R12 handelt es sich vorzugsweise
um Methyl, Ethyl, Isobutyl oder 2,4,4-Trimethylpentyl.
-
Beispiele
für erfindungsgemäß geeignete
Alumoxane sind Methylalumoxan (MAO), Isobutylalumoxan (TIBAO) und
2,4,4-Trimethylpentylalumoxan
(TIOAO). Nicht-beschränkende
Beispiele für
Aluminiumverbindungen der Formeln AlR11 3 oder Al2R11 6 sind:
Al(Me)3, Al(Et)3, AlH(Et)2, Al(iBu)3, AlH(iBu)2, Al(iHex)3, Al(iOct)3, Al(C6H5)3, Al(CH2C6H5)3, Al(CH2CMe3)3, Al(CH2SiMe3)3,
Al(Me)2iBu, Al(Me)2Et,
AlMe(Et)2, AlMe(iBu)2,
Al(Me)2iBu, Al(Me)2Cl,
Al(Et)2Cl, und Al(Et)3Cl3, wobei Me = Methyl, Et = Ethyl, iBu = Isobutyl,
iHex = Isohexyl und iOct = 2,4,4-Trimethylpentyl.
-
Unter
den vorstehenden Aluminiumverbindungen werden Trimethylaluminium
(TMA) und Triisobutylaluminium (TIBAL) bevorzugt.
-
Nicht-beschränkende Beispiele
für Verbindungen,
die zur Bildung eines Alkylmetallocenkations geeignet sind, sind
Verbindungen der Formel Y+Z-,
worin Y+ eine Brönsted-Säure bedeutet, die zum Spenden
eines Protons und zur irreversiblen Umsetzung mit einem Substituenten
X der Verbindung der Formel (I) befähigt ist und Z- ein
verträgliches
Anion bedeutet, das keine Koordination eingeht und das zur Stabilisierung
der aktiven katalytischen Spezies, die sich aus der Umsetzung der
beiden Verbindungen ergibt, befähigt
ist und die ausreichend labil ist, dass sie durch ein Olefinsubstrat
verdrängbar
ist. Vorzugsweise besteht das Anion Z- aus
einem oder mehreren Boratomen. Insbesondere bedeutet das Anion Z
ein Anion der Formel Br4(-), wobei die Substituenten
Ar, die gleich oder verschieden sein können, Arylreste, wie Phenyl,
Pentafluorphenyl oder Bis-(trifluormethyl)-phenyl bedeuten. Tetrakis-pentafluorphenylborat
wird besonders bevorzugt. Außerdem können zweckmäßigerweise
Verbindungen der Formel Br3 eingesetzt werden.
-
Die
erfindungsgemäßen Katalysatoren
können
auch auf inerten Trägern
verwendet werden. Dies wird erreicht in dem man die Metallocenverbindungen
(A) oder deren Reaktionsprodukt mit der Komponente (B) oder die
Komponente (B) und anschließend
die Metallocenverbindung (A) auf inerten Trägern, wie Siliciumdioxid, Aluminiumoxid,
Styrol/Divinylbenzol-copolymeren oder Polyethylen, abscheidet.
-
Die
auf diese Weise erhaltene feste Verbindung wird gegebenenfalls unter
weiterer Zugabe der Alkylaluminiumverbindung entweder als solcher
oder nach vorheriger Umsetzung mit Wasser in zweckmäßiger Weise
bei der Gasphasenpolymerisation eingesetzt.
-
Ein
weiterer Gegenstand der Erfindung ist ein Verfahren zur Polymerisation
von Olefinen, das die Polymerisationsreaktion von einem oder mehreren
Olefin-Monomeren in Gegenwart eines vorstehend beschriebenen Katalysators
umfasst.
-
Bevorzugte
Olefin-Monomere sind Ethylen, die α-Olefine und die Cycloolefine.
Die erfindungsgemäßen Katalysatoren
können
zweckmäßigerweise
z.B. bei Homopolymerisationsreaktionen von Ethylen oder von α-Olefinen,
wie Propylen und 1-Buten, bei Copolymerisationsreaktionen von Ethylen
mit α-Olefinen,
wie Propylen und 1-Buten, und auch bei Copolymerisationsreaktionen
von Propylen mit C4-C10-α-Olefinen,
wie 1-Buten, verwendet werden. Besonders interessante Ergebnisse
werden erzielt, wenn die erfindungsgemäßen Katalysatoren für die Polymerisation
von Propylen verwendet werden.
-
Somit
wird gemäß einer
Ausführungsform
des erfindungsgemäßen Verfahrens
zur Polymerisation von Olefinen Propylen in Gegenwart einer Metallocenverbindung
der Formel (II) polymerisiert, wobei es sich bei den Substituenten
R3 um Kohlenstoff-, Silicium- oder Germaniumatome
handelt, die mit 3 Alkyl-, Cycloalkyl-, Aryl-, Alkylaryl- oder Arylalkylgruppen
mit 1 bis 10 Kohlenstoffatomen substituiert sind und wobei R4, R5, R6,
M und X die vorstehend definierten Bedeutungen haben. Bei den Substituenten
R4 handelt es sich vorzugsweise um Wasserstoffatome.
Nachstehend sind Beispiele für
derartige Metallocenverbindungen aufgeführt:
Isopropyliden-bis-(3-tert.-butylindenyl)-zirconiumdichlorid,
Isopropyliden-bis-(3-trimethylsilylindenyl)-zirconiumdichlorid
und
Isopropyliden-bis-(3-trimethylgermylindenyl)-zirconiumdichlorid.
-
Die
auf diese Weise erhältlichen
Propylen-Polymeren weisen enge Molekulargewichtsverteilungen in Verbindung
mit hohen isotaktischen Indices und sehr hohen Graden der Regioregularität auf. Tatsächlich zeigen
an diesen Polymeren durchgeführte 13C-NMR-Analysen keine Struktureinheiten
aufgrund von regioirregulären
Einschüben.
Diesbezüglich
wird Bezug genommen auf Macromolecules, Bd. 28 (1995), S. 6667–6676.
-
Wenn
die Polymerisation von Propylen in Gegenwart einer Bis-4,5,6,7-tetrahydroindenylmetallocenverbindung,
die den vorstehenden Verbindungen der Formel (II) entspricht, durchgeführt wird,
wird ein sehr niedermolekulares Polypropylenwachs erhalten. Trotz
des niedrigen Molekulargewichts weisen diese Wachse recht hohe isotaktische
Indices auf, wie das Vorliegen eines Schmelzpunktes und die Werte
von isotaktischen (m) Diaden, bestimmt durch 13C-NMR-Analyse,
zeigt, die im allgemeinen über
90 % liegen.
-
Gemäß einer
weiteren Ausführungsform
des erfindungsgemäßen Verfahrens
zur Polymerisation von Olefinen wird Propylen in Gegenwart einer
Metallocenverbindung der Formel (I) polymerisiert, wobei es sich bei
den Substituenten R2 um Wasserstoffatome
handelt und die R3-Substituenten Kohlenstoff-,
Silicium- oder Germaniumatome bedeuten, die mit 3 Alkyl-, Cycloalkyl-,
Aryl-, Alklyaryl- oder Arylalkylgruppen mit 1 bis 10 Kohlenstoffatomen
substituiert sind. Bei den Substituenten R4 handelt
es sich vorzugsweise um Wasserstoffatome. Nachstehend sind Beispiele
für derartige
Metallocenverbindungen aufgeführt:
Isopropyliden-bis-(3-tert.-butylcyclopentadienyl)-zirconiumdichlorid
und
Isopropyliden-bis-(2-methyl-4-tert.-butylcyclopentadienyl)-zirconiumdichlorid.
-
Die
auf diese Weise erhältlichen
Propylen-Polymeren zeigen neben ihrer engen Molekulargewichtsverteilung
sehr hohe isotaktische Indices, wie sich aus ihren hohen Schmelzpunkten
ergibt, die üblicherweise über 155°C und sogar über 160°C liegen.
-
Die
Werte der isotaktischen (mmmm) Pentaden für diese Polymeren können sogar
99 % und darüber betragen.
-
Diese
Polymeren zeigen einen sehr hohen Grad der Regioregularität. Die mit
einem 300 MHz-Instrument an diesen Polymeren durchgeführte 13C-NMR-Analyse
zeigt im allgemeinen das Vorliegen einer geringen Menge an Struktureinheiten,
die auf regioirreguläre
Einschübe,
wie 1,3-Einschübe,
zurückzuführen sind.
-
Besonders
interessante Ergebnisse werden erzielt, wenn sich in den vorstehenden
speziellen Metallocenverbindungen der Formel (I) die Substituenten
von R1 von Wasserstoffatomen unterscheiden,
z.B. bei Isopropyliden-bis-(2-methyl-4-tert.-butylcyclopentadienyl)-zirconiumdichlorid.
Somit ist es möglich,
Propylen-Polymere mit sehr hohen isotaktischen Indices zu erhalten,
wie sich aus deren Schmelzpunkten ergibt, die auch bei Polymerisationstemperaturen
von industriellem Interesse, z.B. 50°C und darüber, höher als 160°C liegen können.
-
Die
durch das erfindungsgemäße Verfahren
erhältlichen
Propylen-Polymeren
weisen geringe, in Xylol lösliche
Fraktionen auf, im allgemeinen unter 5 Gew.-%, vorzugsweise unter
3 Gew.-% und insbesondere unter 1 Gew.-%.
-
Die
erfindungsgemäße Polymerisationsreaktion
von Propylen kann in Gegenwart eines C4-C10-α-Olefin-Comonomeren,
wie 1-Buten, durchgeführt
werden. Dabei ist es möglich,
Propylen-Copolymere mit 0,1–10 Mol-%
eines C4-C10-α-Olefin-Comonomeren
zu erhalten, deren Eigenschaften ähnlich den Eigenschaften des entsprechenden
Homopolymeren sind, die aber einen niedrigeren Schmelzpunkt aufweisen.
Trotz des Vorliegens eines Comonomeren weisen diese Copolymeren
immer noch äußerst geringe,
in Xylol lösliche
Fraktionen auf, im allgemeinen unter 3 Gew.-%, vorzugsweise unter
2 Gew.-% und insbesondere unter 1 Gew.-%.
-
Das
erfindungsgemäße Verfahren
zur Polymerisation von Olefinen kann in flüssiger Phase in Gegenwart oder
Abwesenheit eines inerten Kohlenwasserstofflösungsmittels oder in der Gasphase
durchgeführt
werden. Das Kohlenwasserstofflösungsmittel
kann entweder aromatisch sein, wie Toluol, oder aliphatisch, wie Propan,
Hexan, Heptan, Isobutan oder Cyclohexan.
-
Die
Polymerisationstemperatur liegt im allgemeinen zwischen –100°C und +80°C und insbesondere zwischen –50°C und +50°C. Je niedriger
die Polymerisationstemperatur ist, desto höhere Molekulargewichte der
Polymeren werden erzielt.
-
Das
Molekulargewicht der Polymeren kann auch variiert werden, indem
man den Typ oder die Konzentration der Katalysatorkomponenten variiert
oder indem man Molekulargewichtsregler, wie Wasserstoff, einsetzt.
-
Die
Molekulargewichtsverteilung kann. variiert werden, indem man Gemische
von unterschiedlichen Metallocenverbindungen verwendet, oder indem
man die Polymerisation in mehreren Stufen bei verschiedenen Polymerisationstemperaturen
und/oder verschiedenen Konzentrationen der Molekulargewichtsregler durchführt.
-
Die
Polymerisationsausbeuten hängen
von der Reinheit der Metallocenverbindung des Katalysators ab. Die
nach dem erfindungsgemäßen Verfahren
erhaltenen Metallocenverbindungen können somit direkt als solche
verwendet werden oder sie können
Reinigungsbehandlungen unterworfen werden.
-
Die
Komponenten des Katalysators können
vor der Polymerisation miteinander in Kontakt gebracht werden. Die
Kontaktzeit beträgt
im allgemeinen 1 bis 60 Minuten und vorzugsweise 5 bis 20 Minuten.
Die Konzentrationen vor der Kontaktherstellung betragen 10-2 bis 10-8 mol/l
für die
Metallocenkomponente (A), während
sie für
die Komponente (B) zwischen 10 und 10-3 mol/l
liegt. Der vorherige Kontakt wird im allgemeinen in Gegenwart eines
Kohlenwasserstofflösungsmittels
und gegebenenfalls in Gegenwart von geringen Mengen an Monomerem
vorgenommen.
-
Die
folgenden Beispiele dienen Erläuterungszwecken,
ohne die Erfindung zu beschränken.
-
Charakterisierung
-
Die 1H-NMR-Analysen wurden an einem Bruker-200
MHz-Instrument mit einer Pulsamplitude von 40° und einem Abstand von 1 Sekunde
zwischen den Pulsen durchgeführt.
128 bis 512 Datenpunkte wurden je nach der Löslichkeit der verschiedenen
Verbindungen für
jede Probe gesammelt. Die 13C-NMR-Analysen
wurden an einem Varian UNITY-300-Instrument bei 75,4 MHz durchgeführt. Die
Proben wurden in einer 15 prozentigen Lösung in Deuteroethantetrachlorid
bei 130°C
analysiert. Für
jede Probe wurden 6000 Datenpunkte mit einem Abstand von 12 Sekunden
zwischen den einzelnen Pulsen gesammelt.
-
Die
innere Viskosität
(n) wurde in Tetralin bei 135°C
gemessen.
-
Die
Differentialscanning-Kalorimetrie-Messungen (DSC) wurden mit einem
DSC 7-Instrument der Firma Perkin Elmer Co. Ltd. nach folgendem
Verfahren durchgeführt.
Etwa 10 mg einer Probe, die bei der Polymerisation erhalten worden
war, wurden auf –25°C gekühlt und
anschließend
mit einer Abtastgeschwindigkeit von 10°C pro Minute auf 200°C erwärmt. Die
Probe wurde 5 Minuten bei 200°C
belassen und sodann mit einer Abtastgeschwindigkeit von 10°C pro Minute
abgekühlt.
Sodann wurde ein zweiter Abtastvorgang unter den gleichen Modalitäten wie
beim ersten Vorgang durchgeführt.
Die aufgeführten
Werte sind die beim ersten Abtastvorgang ermittelten Werte.
-
Die
Molekulargewichtsverteilung wurde durch Gelpermeationschromatographie
an einem WATERS 150-Instrument in Orthodichlorbenzol bei 135°C durchgeführt.
-
Die
Löslichkeit
der Propylen-Polymeren in Xylol wurde bestimmt, indem man 2 g Polymeres
in 250 ml Xylol bei 135°C
löste und
das System rührte.
Nach 20 Minuten wurde die Lösung
auf 25°C
abgekühlt.
Nach 30 Minuten wurde das ausgefällte
Material abfiltriert. Die Lösung
wurde unter einem Stickstoffstrom eingedampft. Der Rückstand
wurde bei 80°C
getrocknet. Auf diese Weise wurden der prozentuale Anteil des in
Xylol bei Raumtemperatur löslichen
Polymeren (XSRT) sowie der prozentuale Anteil an unlöslichem
Polymeren berechnet.
-
Herstellung
der Metallocene
-
Sämtliche
Vorgänge
wurden in einer Atmosphäre
von trockenem Stickstoff unter Anwendung herkömmlicher Techniken für die Handhabung
von Verbindungen, die gegenüber
Luft empfindlich sind, durchgeführt.
THF
= Tetrahydrofuran
Et2O = Ethylether
DME
= Dimethoxyethan
-
Beispiel 1
-
rac-Isopropyliden-bis-(3-trimethylsilylindenyl)-zirconiumdichlorid
-
a) Herstellung von 2,2-Bis-(indenyl)-propan
-
23,5
ml (200 mmol) Indol wurden innerhalb von 0,5 h zu einer Suspension
von 15 g gemahlenem KOH in 150 ml DME gegeben. Das Gemisch wurde
unter Rückfluss
erwärmt.
Sodann wurden innerhalb von 0,5 h 7,5 ml (100 mmol) Aceton zugetropft.
Das Gemisch wurde weitere 2 h unter Rückfluss erwärmt. Das erhaltene Gemisch
wurde abgekühlt,
bis zur Neutralisation mit 200 ml verdünnter Phosphorsäure und
sodann mit 100 ml Diethylether behandelt. Die organische Phase wurde
abgetrennt, mit Wasser gewaschen und über Na2SO4 getrocknet. Sodann wurde das Lösungsmittel
unter Vakuum entfernt. Der Rückstand
wurde bei 130–160°C und 1,333
Pa (0,01 Torr) destilliert. Die breite Fraktion wurde gewonnen und
aus einem Ether/Hexan-Gemisch (1:1) umkristallisiert. Man erhielt
20,4 g Produkt (Ausbeute 72 %). 1H-NMR (Aceton-d8, 30°C) δ: 7,37 (d,
2H); 7,32 (d, 2H); 6,98 (m, 4H); 6,60 (t, 2H) {=CH-}; 3,38 (d, 4H,
-CH2-); 1,74 (s, 6H, -CH3).
-
b) Herstellung von 2,2-Bis-(3-trimethylsilylindenyl)-propan
-
5,45
g (20 mmol) 2,2-Bis-(indenyl)-propan wurden in 100 ml Ether gelöst. Die
erhaltene Lösung
wurde auf –20°C gebracht
und mit 22 ml einer 2,0 M Lösung
von n-Butyllithium in Pentan versetzt. Man erhielt eine Suspension
von Dilithium-2,2-bis-(indenyl)-propan. 8,77 g (30,85 mmol) Dilithium-2,2-bis-(indenyl)-propan wurden
in 100 ml Ether gelöst
und bei einer Temperatur von –40°C mit 10
ml Me3SiCl (Überschuss) versetzt. Sodann
ließ man
das erhaltene Gemisch auf Raumtemperatur erwärmen. Die organische Phase
wurde abgetrennt, das Lösungsmittel
entfernt und das Produkt unter Vakuum getrocknet.
-
c) Herstellung von rac-Isopropyliden-bis-(3-trimethylsilylindenyl)-zirconiumdichlorid
-
8,34
g (20 mmol) 2,2-Bis-(3-trimethylsilylindenyl)-propan wurden in 100
ml Ether gelöst.
Die erhaltene Lösung
wurde auf –20°C gebracht
und mit 22 ml einer 2,0 M Lösung
von n-Butyllithium in Pentan versetzt. Man erhielt eine Suspension
von Dilithium-2,2-bis-(3-trimethylsilylindenyl)-propan. Diese Suspension wurde zunächst auf
Raumtemperatur erwärmt
und sodann auf –40°C abgekühlt und
mit 12,06 g (50 mmol) Triethylstannylchlorid versetzt. Die organische
Phase wurde abgetrennt, eingedampft und mit 50 ml Toluol versetzt.
Sodann wurden 4,66 g (20 mmol) ZrCl4 zugegeben.
Das erhaltene Gemisch wurde auf 80°C gebracht und weitere 6 h gerührt. Sodann
wurde das Toluol entfernt. Das Produkt wurde mit DME (5 × 50 ml)
gewaschen und aus DME umkristallisiert. Man erhielt 3,69 g reines
rac-Isopropyliden-bis-(3-trimethylsilylindenyl)-zirconiumdichlorid (Ausbeute 32 %). 1H-NMR (CD2Cl2, 30°C) δ: 7,80 (d,
2H); 7,55 (d, 2H); 7,30 (t, 2H); 7,06 (t, 2H); 6,06 (s, 2H); 2,38
(s, 6H); 0,23 (s, 18H).
-
Beispiel 2
-
rac-Isopropyliden-bis-(3-methylindenyl)-zirconiumdichlorid
-
a) Herstellung von 2,2-Bis-(3-methylindenyl)-propan
-
Das
Verfahren von Abschnitt (a) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von Inden 200 mmol 3-Methylinden verwendet
wurden und nach der Zugabe von Aceton 3 h unter Rückfluss
gerührt
wurde. Die Destillationstemperatur betrug 135–165°C. Das Produkt wurde als Dilithiumsalz
isoliert (Ausbeute 65 %) 1H-NMR (THF-d8, 30°C) δ: 7,42 ("d", 2H); 7,10 ("d",
2H); 6,26 ("t", 2H); 6,18 ("t", 2H) {ABCD, J=9Hz}; 6,47 (s, 2H); 2,33
(s, 6H, Ind-CH3); 1,90 (s, 6H,>CMe2).
-
b) Herstellung von rac-Isopropyliden-bis-(3-methylindenyl)-zirconiumdichlorid
-
Das
Verfahren von Abschnitt (c) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von 2,2-Bis-(3-trimethylsilylindenyl)-propan 20
mmol des Dilithiumsalzes von 2,2-Bis-(3-methylindenyl)-propan verwendet
wurden und dass das Produkt aus Toluol umkristallisiert wurde. Man
erhielt reines rac-Isopropyliden-bis-(3-methylindenyl)-zirconiumdichlorid. 1H-NMR (CD2Cl2, 30°C) δ: 7,64 (d,
2H); 7,42 (d, 2H); 7, 22 (m, 2H); 6,96 (m, 2H); 5,83 (s, 2H); 2,30
(s, 6H); 2,28 (s, 6H).
-
Beispiel 3
-
rac-Isopropyliden-bis-(3-isopropylindenyl)-zirconiumdichlorid
-
a) Herstellung von 2,2-Bis-(3-isopropylindenyl)-propan
-
Das
Verfahren von Abschnitt (a) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von Inden 200 mmol 3-Isopropylinden verwendet
wurden und dass nach der Zugabe von Aceton das Gemisch 4 h unter
Rückfluss
erwärmt
wurde. Die Destillationstemperatur betrug 140–175°C. Das Produkt wurde als Dilithiumsalz
isoliert (Ausbeute 63 %). 1H-NMR (THF-d8, 30°C) δ: 7,45 ("d", 2H); 7,27 ("d",
2H); 6,30 ("t", 2H); 6,23 ("t", 2H) {ABCD, J=8,0Hz}; 6,63 (s, 2H);
3,30 (sept, J=7,0Hz, 2H, -CH(CH3)2); 1,98 (s, 6H, >CMe2)
1,35 (d, J=7,0Hz, 12H, -CH(CH3)2).
-
b) Herstellung von rac-Isopropyliden-bis-(3-isopropylindenyl)-zirconiumdichlorid
-
Das
Verfahren von Abschnitt (c) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von 2,2-Bis-(3-trimethylsilylindenyl)-propan
20 mmol des Dilithiumsalzes von 2,2-Bis-(3-isopropylindenyl)-propan verwendet
wurden und dass das Produkt aus DME umkristallisiert wurde. Man
erhielt reines rac-Isopropyliden-bis-(3-isopropylindenyl)-zirconiumdichlorid. 1H-NMR (Toluol-d8,
30°C) δ: 7,34 (m,
4H); 6,98 (m, 2H); 6,69 (m, 2H); 5,78 (s, 2H); 3,14 (sept, 2H);
1,81 (s, 6H); 1,20 (d, 12H).
-
Beispiel 4
-
rac-Isopropyliden-bis-(3-tert.-butylindenyl)-zirconiumdichlorid
-
a) Herstellung von 2,2-Bis-(3-tert.-butylindenyl)-propan
-
Das
Verfahren von Abschnitt (a) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von Inden 200 mmol 3-tert.-Butylinden
verwendet wurden und dass nach der Zugabe von Aceton das Gemisch
4 h unter Rückfluss
gerührt
wurde. Die Destillationstemperatur betrug 145–185°C. Das Produkt wurde als Dilithiumsalz
isoliert (Ausbeute 48 %). 1H-NMR (THF-d8, 30°C) δ: 8,17 ("t", 4H); 6,95 (mm, 4K) {ABCD}; 7,36 (s, 2H);
2,70 (s, 6H, >CMe2); 2,19 (s, 18H, -CMe3).
-
b) Herstellung von rac-Isopropyliden-bis-(3-tert.-butylindenyl)-zirconiumdichlorid
-
Das
Verfahren von Abschnitt (c) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von 2,2-Bis-(3-trimethylsilylindenyl)-propan
20 mmol des Dilithiumsalzes von 2,2-Bis-(3-tert.-butylindenyl)-propan verwendet
wurden und dass das Produkt aus DME umkristallisiert wurde. Man
erhielt reines rac-Isopropyliden-bis-(3-tert.-butylindenyl)-zirconiumdichlorid. 1H-NMR (CD2Cl2, 30°C) δ: 7,75 (m,
4H); 7,25 (dd, 2H); 6,97 (dd, 2H); 5,97 (s, 2H); 2,33 (s, 6H); 1,37
(s, 18H).
-
Beispiel 5
-
rac-Isopropyliden-bis-(3-tert.-butyl-4,5,6,7-tetrahydroindenyl)-zirconiumdichlorid
-
In
einen 100 ml fassenden Glasautoklaven wurden 0,66 g rac-Isopropyliden-bis-(3-tert.-butylindenyl)-zirconiumdichlorid,
40 mg PtO2 und 50 ml CH2Cl2 gegeben. Das Gemisch wurde mit H2 auf einen Druck von 5 at gebracht und 4
h bei Raumtemperatur gerührt.
Sodann wurde das Gemisch filtriert. Das Filtrat wurde zur Trockne
eingedampft. 0,56 g eines gelben Feststoffes wurden isoliert, der
durch Waschen mit Hexan und Et2O weiter
gereinigt wurde. Auf diese Weise erhielt man 0,22 g eines gelben
Pulvers. 1H-NMR (CDCl3):
5,3 (s), 2,6–2,9
(m), 2,2–2,4
(m), 1,85 (s), 1,4–1,8
(m), 1,3 (s).
-
Beispiel 6
-
rac-Isopropyliden-bis-(3-tert.-butylcyclopentadienyl)-zirconiumdichlorid
-
a) Herstellung von 2,2-bis-(3-tert.-butylcyclopentadienyl)-propan
-
10
g KOH, 150 mmol tert.-Butylcyclopentadien und 4,35 g Aceton wurden
in 100 ml DME suspendiert. Das erhaltene Gemisch wurde unter Rückfluss
erwärmt
und 2 h gerührt.
Sodann wurde das Gemisch abgekühlt
und mit 200 ml Wasser und 100 ml Diethylether behandelt. Die organische
Phase wurde abgetrennt, mit Wasser gewaschen und über CaCl2 getrocknet. Anschließend wurde das Lösungsmittel
unter Vakuum abgedampft. Der Rückstand
wurde bei einer Temperatur von 145–165°C destilliert. Die breite Fraktion
wurde gewonnen und umkristallisiert (Ausbeute 81 %). 1H-NMR (CDCl3) δ:
6,3–5,7
(m, 4H), 3,0–2,8
(m, 4H), 1,5–1,4
(m, 6H), 1,3–1,2
(m, 18H).
-
b) Herstellung von rac-Isopropyliden-bis-(3-tert.-butylcyclopentadienyl)-zirconiumdichlorid
-
Das
Verfahren von Abschnitt (c) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von 2,2-Bis-(3-trimethylsilylindenyl)-propan
6,01 g (20 mmol) 2,2-Bis-(3-tert.-butylcyclopentadienyl)-propan
verwendet wurden und dass das Produkt mit 50 ml Pentan gewaschen
und anschließend
aus Ether umkristallisiert wurde. Man erhielt 1,97 g reines rac-Isopropyliden-bis-(3-tert.-butylcyclopentadienyl)-zirconiumdichlorid
(Ausbeute 22 %). 1H-NMR (THF-d8,
30°C) δ: 5,65 (t,
2H); 5,53 (t, 2H); 1,60 (s, 6H); 1,23 (s, 8H).
-
Beispiel 7
-
Isopropyliden-bis-(2-methyl-4-tert.-butylcyclopentadienyl)-zirconiumdichlorid
-
a) Herstellung von 2,2-Bis-(2-methyl-4-tert.-butylcyclopentadienyl)-propan
-
17,8
g (131 mmol) 2-Methyl-4-tert.-butylcyclopentadien wurden innerhalb
von 0,5 h unter heftigem Rühren
zu einer Suspension von 10 g KOH-Pulver in 100 ml DME gegeben. Das
erhaltene Gemisch wurde unter Rückfluss
erwärmt.
Sodann wurden innerhalb von 0,5 h tropfenweise 4,8 ml (66 mmol)
Aceton zugegeben. Das Gemisch wurde weitere 6 h unter Rückfluss
erwärmt.
Sodann wurde das erhaltene Gemisch abgekühlt und zur Neutralisation
mit 200 ml verdünnter
Phosphorsäure
und anschließend
mit 100 ml Diethylether behandelt. Die organische Phase wurde abgetrennt,
mit Wasser gewaschen und über
Na2SO4 getrocknet.
Sodann wurde das Lösungsmittel
unter Vakuum entfernt. Der Rückstand
wurde bei 1,333 Pa (0,01 Torr) destilliert. Die breite Fraktion
von 130–160°C wurde gesammelt,
mit 30 ml Et2O verdünnt und mit 60 ml einer 2,0
M Lösung
von n-Butyllithium in Hexan behandelt. Das Produkt wurde in Form
eines weißen
kristallinen Niederschlags isoliert, zweimal mit 20 ml Et2O gewaschen und unter Vakuum getrocknet
(Ausbeute 60 %). 1H-NMR (THF-d8,
30°C) δ: 5,52 ("d", 2H); 5,22 ("d",
2H); 3,58 (s, 6H); 1,58 (s, 6H); 1,18 (s, 18H).
-
b) Herstellung von Isopropyliden-bis-(2-methyl-4-tert.-butylcyclopentadienyl)-zirconiumdichlorid
-
3,24
g (10 mmol) des in Stufe (a) erhaltenen Produkts wurden mit 3,98
g (20 mmol) Trimethylstannylchlorid, das in 50 ml Et2O
verdünnt
war, behandelt. Die Lösung
wurde vom LiCl-Niederschlag dekantiert. Das Lösungsmittel wurde entfernt
und der Rückstand
mit 40 ml Toluol verdünnt.
Die erhaltene Lösung
wurde mit 2,33 g (10 mmol) ZrCl4 behandelt.
Das Gemisch wurde gerührt,
bis das ZrCl4 gelöst war. Sodann wurde das Lösungsmittel
entfernt und der verbleibende Feststoff aus Heptan umkristallisiert.
Man erhielt ein rac/meso-Gemisch (1:1) von Isopropyliden-bis-(2-methyl-4-tert.-butylcyclopentadienyl)-zirkoniumdichlorid
(Ausbeute 87 %). Die Umkristallisation aus DME ergab ein rac/meso-Gemisch
(2:1). 1H-NMR (CD2Cl2; 30°C)
rac-Form δ: 6,29
(d, J=3,0Hz, 2H); 5,51 (d, J=3,0Hz, 2H) [Cyclopentadienylring];
2,16 (s, 6H, >C(-CH3)2); 1,28 (s, 18
H -C(CH3)3). meso-Form δ: 6,08 (d,
J=3,0Hz, 2H); 5,65 (d, 2H) [Cyclopentadienylring]; 2,29 (s, 6H,
-CH3 im Ring); 2,01, 1,88 (s, 2×3H, >C(-CH3)2); 1,23 (s, 18H, -C(CH3)3). 13C-NMR (-"-) δ: 145,5;
118,2 [quat. C im Ring]; 120,7; 106,2; 100,2 [tert. C im Ring];
37,0; 33,0; [>C<]; 30,1 [C(CH3)3]; 24,2 [>C(CH3)2].
-
Beispiel 8
-
pseudorac-Benzyliden-bis-(indenyl)-zirconiumdichlorid
-
a) Herstellung von Bis-(indenyl)-phenylmethan
-
Das
Verfahren von Abschnitt (a) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von Aceton 100 mmol Benzaldehyd verwendet
wurden und dass nach Zugabe des Benzaldehyds das Gemisch 5 h gerührt wurde.
Die Destillationstemperatur betrug 140–170 °C. Die gewonnene Fraktion wurde
aus Heptan umkristallisiert (Ausbeute 60 %) 1H-NMR
(Aceton-d6, 30°C) δ: 7,52–7,18 (mm, 13H,) 6,05 (q, 2H,
=CH-); 5,39 (m, 1H, >CH-);
3,40 (br s, 4H, -CH2-). 13C-NMR
(CD2Cl2, 30°C) δ: 145,6;
145,1; 141,5 (=C<);
131,8; 129,3; 128,7; 127,0; 126,2; 124,1; 120,2 (=CH-); 44,5 (>CH-); 38,1 (-CH2-).
-
b) Herstellung von pseudorac-Benzyliden-bis-(indenyl)-zirconiumdichlorid
-
Das
Verfahren von Abschnitt (c) von Beispiel 1 wurde wiederholt, mit
der Ausnahme, das anstelle von 2,2-Bis-(3-trimethylsilylindenyl)-propan
20 mmol des Dilithiumsalzes von Bis-(indenyl)-phenylmethan verwendet
wurden und dass das Produkt aus DME umkristallisiert wurde. Man
erhielt pseudorac-Benzyliden-bis-(indenyl)-zirconiumdichlorid (aufgrund
der unsymmetrischen Brücke
kann das anti-Isomere nicht das genaue rac-Isomere darstellen). 1H-NMR (CD2Cl2, 30°C) δ: 7,84–7,12 (Gruppen
von Multipletts, 12 H); 6,76 (t, 1H); 6,70 (d, 1H); 6,60 (d,1H);
6,11 (zwei Dubletts, 1H+1H); 6,51 (br s, 1H).
-
Polymerisation von Propylen
-
Modifiziertes Methylalumoxan
(M-MAO)
-
Ein
handelsübliches
Produkt (ALBEMARLE) wurde direkt in einer Isopar C-Lösung verwendet
(62 g Al/Liter).
-
Beispiele 9–10
-
Ein
1 Liter fassender Stahlautoklav, der mit einem Mantel, einem Rührsystem
und einer Widerstandsheizvorrichtung, die zur Temperatursteuerung
mit einem Thermostaten verbunden war, ausgerüstet war und vorher mit einer
Lösung
von AliBu3 in Hexan gereinigt und anschließend bei
60°C unter
einem Stickstoffstrom getrocknet worden war, wurde mit 0,4 Liter
Propylen beschickt. Anschließend
wurde der Autoklav auf die gewünschte
Temperatur gebracht und mit 2,25 ml einer Lösung von M-MAO in Isopar C
und 0,5 ml Toluol mit einem Gehalt an 1 mg des Metallocens von Beispiel
1, die 10 Minuten gealtert worden war, versetzt. Die Polymerisation
wurde 1 h durchgeführt.
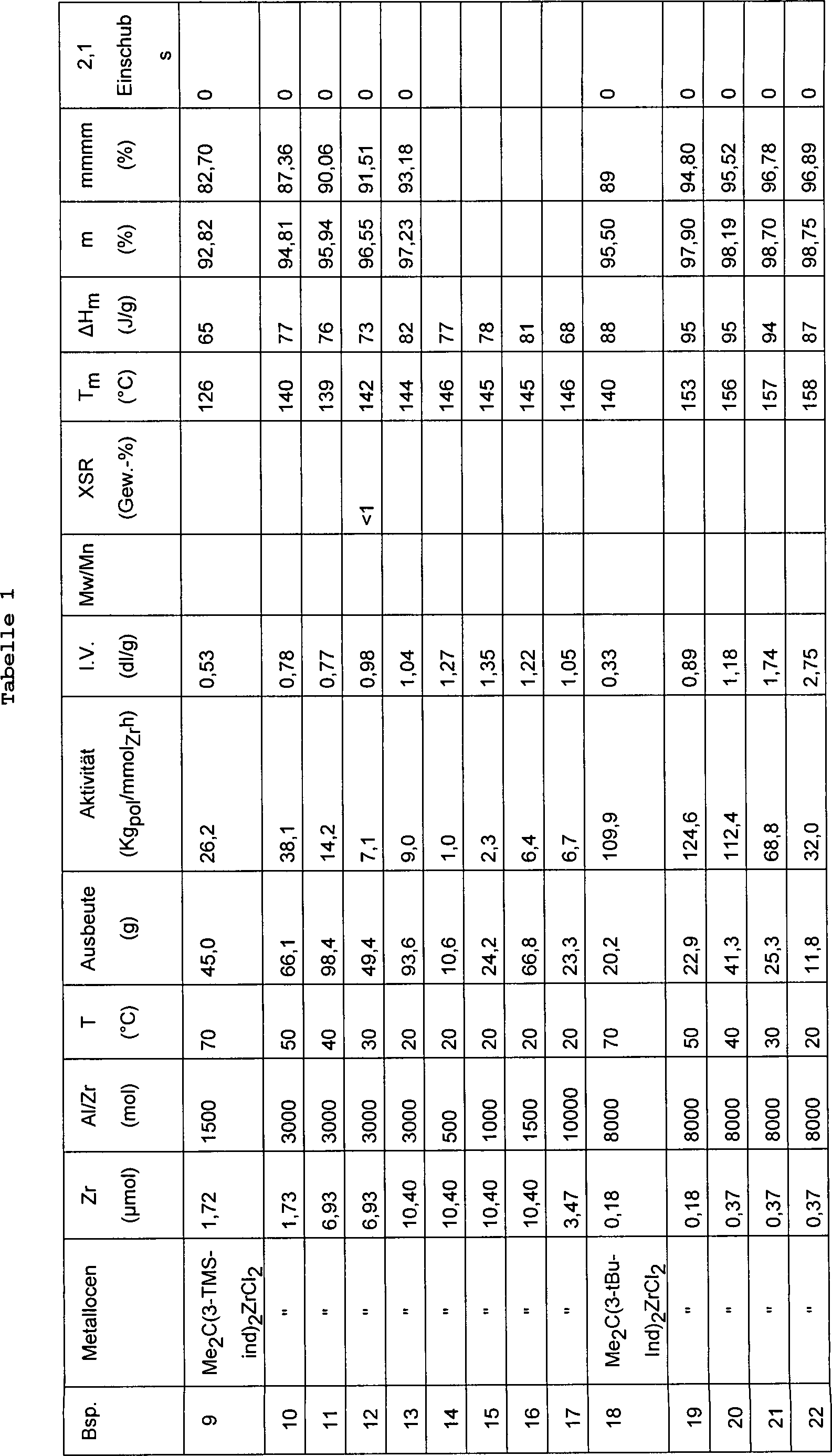
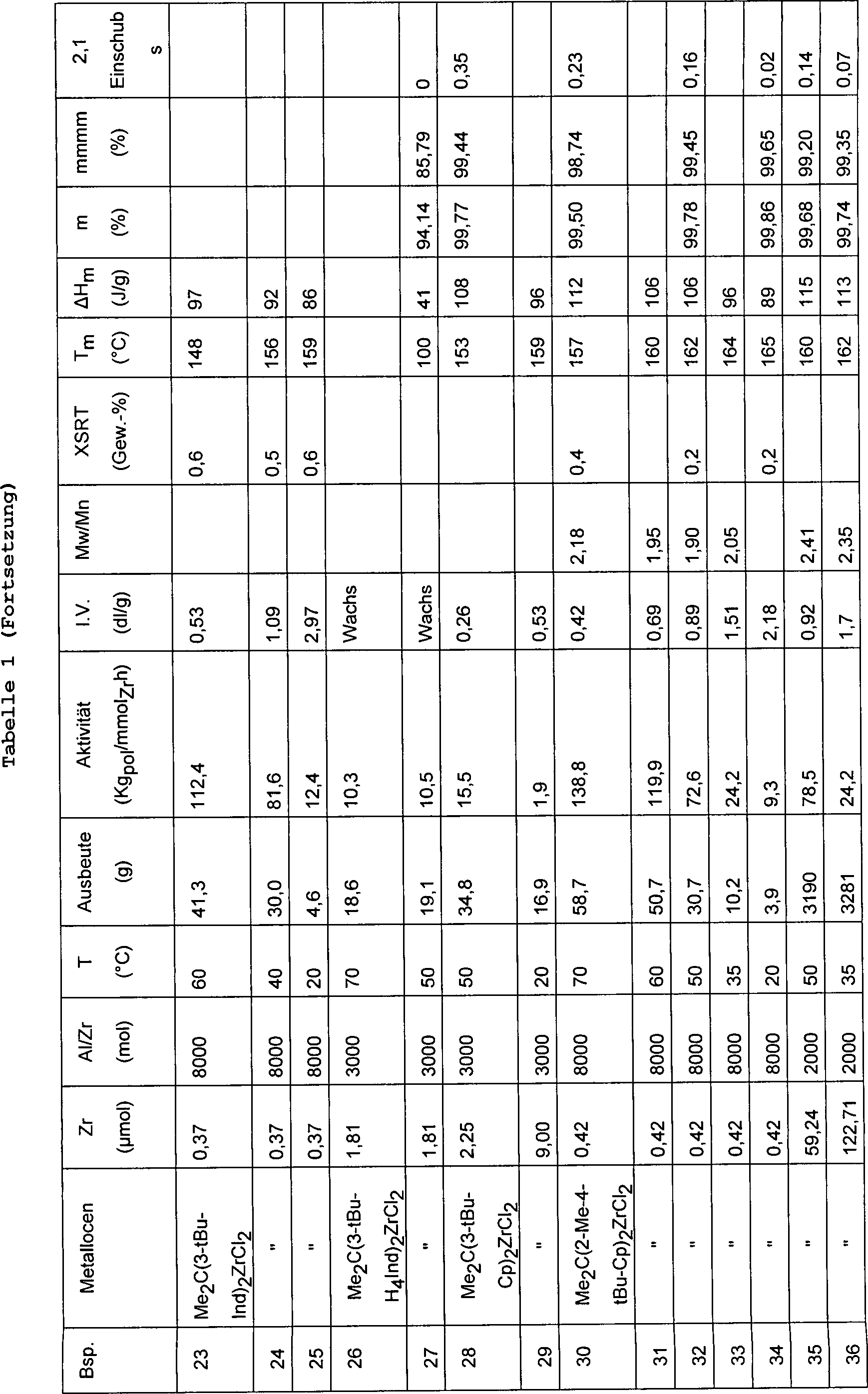
Die Polymerisationsbedingungen und die Daten bezüglich der Charakterisierung
der erhaltenen Polymeren sind in Tabelle 1 aufgeführt.
-
Beispiele 11–17
-
Das
Verfahren der Beispiele 9–10
wurde unter Verwendung eines 2,3 Liter fassenden Stahlautoklaven, der
mit einem Mantel, einem Rührer
und einer Widerstandsheizung ausgerüstet und zur Temperatursteuerung mit
einem Thermostaten verbunden war, wiederholt. Die Polymerisationsbedingungen
und die Daten bezüglich der
Charakterisierung der erhaltenen Polymeren sind in Tabelle 1 aufgeführt.
-
Beispiele 18–22
-
Das
Verfahren der Beispiele 9–10
wurde wiederholt, mit der Ausnahme, dass das Metallocen von Beispiel
4 verwendet wurde. Die Polymerisationsbedingungen und die Daten
bezüglich
der Charakterisierung der erhaltenen Polymeren sind in Tabelle 1
aufgeführt.
-
Beispiele 23–25
-
Das
in den Beispielen 18–22
beschriebene Verfahren wurde wiederholt, mit der Ausnahme, dass
das Metallocen von Beispiel 4 in Form eines rac/meso-Gemisches (7:3),
das vor der Umkristallisation erhalten worden war, verwendet wurde.
Die Polymerisationsbedingungen und die Daten bezüglich der Charakterisierung der
erhaltenen Polymeren sind in Tabelle 1 aufgeführt.
-
Beispiele 26–27
-
Das
in den Beispielen 9–10
beschriebene Verfahren wurde wiederholt, mit der Ausnahme, dass
das Metallocen von Beispiel 5 verwendet wurde. Die Polymerisationsbedingungen
und die Daten bezüglich
der Charakterisierung der erhaltenen Polymeren sind in Tabelle 1
aufgeführt.
-
Beispiel 28
-
Das
in den Beispielen 9–10
beschriebene Verfahren wurde unter Verwendung von 1 mg des Metallocens
von Beispiel 6 wiederholt. Die Polymerisationsbedingungen und die
Daten bezüglich
der Charakterisierung der erhaltenen Polymeren sind in Tabelle 1
aufgeführt.
-
Beispiel 29
-
Das
in den Beispielen 11–17
beschriebene Verfahren wurde unter Verwendung von 1 mg des Metallocens
von Beispiel 6 wiederholt. Die Polymerisationsbedingungen und die
Daten bezüglich
der Charakterisierung der erhaltenen Polymeren sind in Tabelle 1
aufgeführt.
-
Beispiele 30–34
-
Das
in den Beispielen 9–10
beschriebene Verfahren wurde wiederholt, mit der Ausnahme, dass
das Metallocen von Beispiel 7 verwendet wurde. Die Polymerisationsbedingungen
und die Daten bezüglich
der Charakterisierung der erhaltenen Polymeren sind in Tabelle 1
aufgeführt.
-
Beispiele 35–36
-
Das
in den Beispielen 30–34
beschriebene Verfahren wurde wiederholt, mit der Ausnahme, dass
ein 100 Liter fassender Autoklav verwendet wurde. Die Polymerisationsbedingungen
und die Daten bezüglich
der Charakterisierung der erhaltenen Polymeren sind in Tabelle 1
aufgeführt.
-
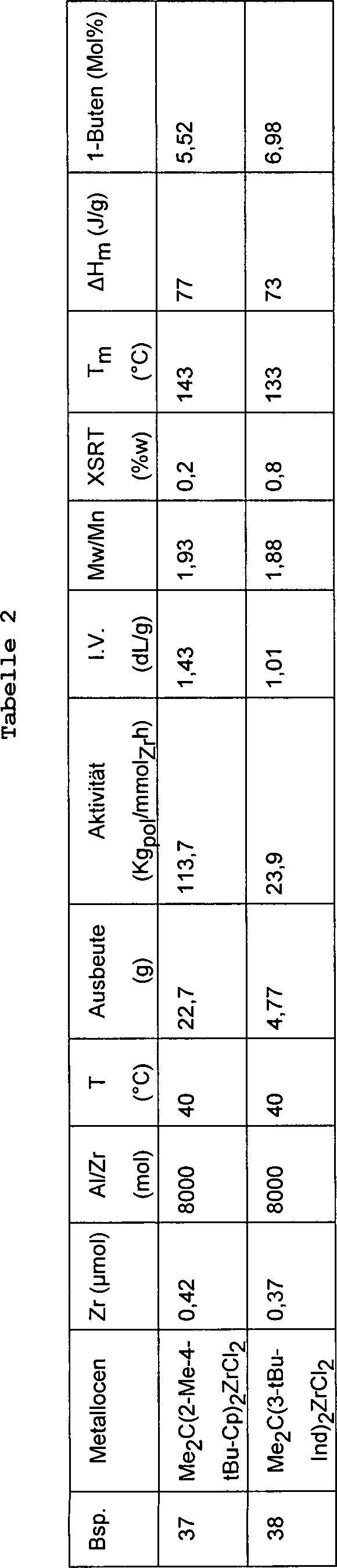
Beispiele 37–38
-
Das
in den Beispielen 9–10
beschriebene Verfahren wurde wiederholt, mit der Ausnahme, dass
235 g (0,45 Liter) Propylen und 28 g 1-Buten in den Autoklaven gegeben
wurden.
-
Das
verwendete Metallocen, die Polymerisationsbedingungen und die Daten
bezüglich
der Charakterisierung der erhaltenen Copolymeren sind in Tabelle
2 aufgeführt.
-
-
-