CN1289690C - Rna序列扩增的方法和组合物 - Google Patents
Rna序列扩增的方法和组合物 Download PDFInfo
- Publication number
- CN1289690C CN1289690C CNB028028279A CN02802827A CN1289690C CN 1289690 C CN1289690 C CN 1289690C CN B028028279 A CNB028028279 A CN B028028279A CN 02802827 A CN02802827 A CN 02802827A CN 1289690 C CN1289690 C CN 1289690C
- Authority
- CN
- China
- Prior art keywords
- primer
- rna
- dna
- composite
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/6853—Nucleic acid amplification reactions using modified primers or templates
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Engineering & Computer Science (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Physics & Mathematics (AREA)
- General Health & Medical Sciences (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Analytical Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Crystallography & Structural Chemistry (AREA)
- Plant Pathology (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Saccharide Compounds (AREA)
Abstract
本发明提供了等温扩增RNA的方法。这些方法尤其适用于扩增样品中多种RNA样本。这些方法使用复合引物、第二引物和链置换以产生多拷贝的包含与目的RNA序列具互补序列的DNA产物。另一方面,这些方法使用了单引物(其为复合引物)和链置换来产生多拷贝的包含与目的RNA序列具互补序列的DNA产物。在一些实施方案中,包括转录步骤以产生目的RNA序列的多拷贝正义RNA。这些方法用于制备核酸文库和基片来分析生物样品中细胞的基因表达。本发明还提供了用于实践这些扩增方法的组合物和试剂盒,并提供了使用扩增产物的方法。
Description
相关申请的相互参照
本申请要求美国临时专利申请(系列号60/274,550,2001年3月9日申请)的优先权,所述专利申请的全部内容在此引用作为参考。
技术领域
本发明涉及多核苷酸扩增领域。更具体地,本发明提供了使用RNA/DNA复合引物以及任选地转录来扩增(即制备多拷贝)目的RNA序列的方法、组合物和试剂盒。
背景领域
扩增核糖核酸(RNA)的能力是致力于阐明生物过程的一个重要方面。到目前为止,RNA(通常为mRNA)扩增最常见的是利用反转录酶-聚合酶链反应(RT-PCR)及其变化方法来进行。这些方法基于利用反转录酶来复制RNA以形成互补于RNA的单链DNA(cDNA),其后是利用聚合酶链反应(PCR)扩增以产生多拷贝双链DNA。尽管这些方法最常使用,但它们具有一些明显的弊端:a)反应需要热循环;b)产物为双链,因此使得它们不易与探针结合;c)反应易于为前扩增产物所污染,因此反应混合物需要严格的防范措施;以及d)这些方法扩增的指数性质使得它们易于产生并不能真实反映输入的总RNA样品中代表不同RNA序列的产物池,这由于不同序列扩增效率的不同以及基于扩增产物的复制而不是基于输入靶RNA的连续复制的指数性扩增性质。
细胞内总mRNA代表某一特定时期基因表达活性。基因表达受细胞周期进程、发育调节、对内外刺激的反应等的影响。有机体中任何细胞类型的表达基因谱都反映了正常或疾病状态、对不同刺激的反应、发育时期、细胞分化等。
近年来已经发展了多种分析基因表达的方法。参见例如美国专利号5,774,308;6,143,495;5,824,517;5,829,547;5,888,779;5,545,522;5,716,785;5,409,818;EP0971039A2;EP0878553A2。这些包括了特定mRNA的定量和多种mRNA的同时定量,以及已知和未知基因表达模式的检测与定量。基因表达谱分析是目前在不同有机体、特别是在人的细胞分化和细胞发育研究以及正常或疾病状态的研究中最为有力的工具之一。这种分析对基因发现、分子药物和药物发现过程极其重要。
对基因表达谱而言,扩增制备自任一细胞或组织的细胞内总mRNA通常极其重要。尽管分析非扩增mRNA也是可行的,但这需要显著量的起始mRNA。然而,可得到的样品mRNA的总量经常由于其来源的生物样品的量有限而受限。生物学样品经常在量上有限而且是宝贵的。此外,不同种mRNA的量也不相等;一些种类的mRNA较其他拷贝更为丰富,且前者就更可能和更易于分析。扩增mRNA序列的能力使得较低丰度、稀有mRNA的分析成为可能。通过核酸扩增来分析小量样品的能力也有利于设计参数,大量筛选效应子分子文库,对此而言,进行很大规模筛选或超高通量筛选的能力以及鉴于文库组分的有限量来说,主要的考虑是减少样品体积。
因此,这就需要有克服现有方法弊端的改良RNA扩增方法。于此提供的本发明满足此项需要,并提供其它的好处。
于此引用的所有参考文献,包括专利申请和出版物全文引用作为参考。
本发明的公开
本发明提供了用于RNA扩增的方法、组合物和试剂盒,以及本扩增方法的应用。
因此,一方面,本发明提供了产生多拷贝与目的RNA序列互补的多核苷酸序列的方法,所述方法包括下列步骤:(a)利用RNA-依赖的DNA聚合酶延伸与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物,由此产生了包含第一引物延伸产物和靶RNA的复合体;(b)应用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)中的复合体上的RNA;(c)利用DNA-依赖的DNA聚合酶延伸与第一引物延伸产物杂交的第二引物,由此产生了第二引物延伸产物,从而形成第一和第二引物延伸产物复合体;(d)应用从RNA/DNA杂合体上切割RNA的酶切割第一和第二引物延伸产物复合体中复合引物的RNA,以使复合引物与第二引物延伸产物杂交,其中复合引物包含RNA部分和3’DNA部分;(e)利用DNA-依赖的DNA聚合酶延伸与第二引物延伸产物杂交的复合引物;由此上述第一引物延伸产物被置换,并且由此多拷贝与目的RNA序列互补的多核苷酸序列得以产生。
另一方面,本发明提供了产生多拷贝与目的RNA序列互补的多核苷酸序列的方法,所述方法包括下列步骤:(a)利用DNA-依赖的DNA聚合酶延伸与第一引物延伸产物杂交的第二引物,其中第一引物延伸产物在其5’端包含RNA部分,所述第一引物延伸产物包含与RNA序列互补的序列,由此产生第二引物延伸产物,从而形成第一和第二引物延伸产物复合体;(b)应用从RNA/DNA杂合体上切割RNA的酶切割第一和第二引物延伸产物复合体中的RNA,以使复合引物与第二引物延伸产物杂交,其中复合引物包含RNA部分和3’DNA部分;(c)利用DNA-依赖的DNA聚合酶延伸与第二引物延伸产物杂交的复合引物;由此上述第一引物延伸产物被置换,并且由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生。在本发明的一些实施方案中,第一引物延伸产物通过利用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物产生,其中第一引物为包含RNA部分和3’DNA部分的复合引物。
另一方面,本发明提供了产生与目的RNA序列互补的多核苷酸序列多拷贝的方法,所述方法包括下列步骤:(a)应用从RNA/DNA杂合体上切割RNA的酶切割第一和第二引物延伸产物复合体上的RNA,以使复合引物与第二引物延伸产物杂交,其中复合引物包含RNA部分和3’DNA部分,其中第一引物延伸产物通过利用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物产生,其中第一引物为包含RNA部分和3’DNA部分的复合引物;(b)将复合引物与第二引物延伸产物杂交并且利用DNA依赖的DNA聚合酶延伸该复合引物;由此所述第一引物延伸产物被置换,并且由此与目的RNA序列互补的多核苷酸序列的多拷贝得以产生。
另一方面,本发明提供了产生与目的RNA序列互补的多核苷酸序列多拷贝的方法,所述方法包括下列步骤:延伸复合体中的复合引物,所述复合体包含:(i)第一和第二引物延伸产物复合体,其中第一引物延伸产物通过利用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物产生,其中第一引物为包含RNA部分和3’DNA部分的复合引物,其中第二引物延伸产物通过延伸与第一引物延伸产物杂交的第二引物产生,并且其中第一和第二引物延伸产物复合体中的RNA应用从RNA/DNA杂合体中切割RNA的酶切割;以及(ii)复合引物,所述复合引物包含RNA部分和3’DNA部分,其中复合引物与第二引物延伸产物杂交,并且其中复合引物可以与第一引物相同或不同;由此所述第一引物延伸产物被置换,并且由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生。
另一方面,本发明提供了产生与目的RNA序列互补的多核苷酸序列多拷贝的方法,所述方法包括下列步骤:(a)延伸与第二引物延伸产物杂交的复合引物,其中所述引物延伸产物(i)包含由延伸与模板RNA杂交的第一引物产生的第一引物延伸产物序列或其互补序列,其中第一引物为包含RNA部分和3’DNA部分的复合引物;并且(ii)与第二引物延伸产物杂交,所述第二延伸产物通过延伸与第一引物延伸产物杂交的第二引物产生,并应用从RNA/DNA杂合体中切割RNA的酶从第一引物中切割RNA;由此上述第一引物延伸产物被置换,并且由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生。
另一方面,本发明提供了产生目的RNA序列多拷贝的方法,所述方法包括下列步骤:
在允许RNA聚合酶发生转录的条件下,将包含前启动子和可与被置换第一引物延伸产物杂交区域的多核苷酸与被置换的第一引物延伸产物杂交,以使产生包含与被置换的第一引物延伸产物互补的序列的RNA转录本,上述被置换的第一引物延伸产物来自任一此处所述的产生与目的RNA序列互补的多核苷酸序列多拷贝的方法,由此目的RNA序列多拷贝得以产生。
另一方面,本发明提供了产生目的RNA序列多拷贝的方法,所述方法包括下列步骤:在允许RNA聚合酶发生转录的条件下,将包含前启动子和可与被置换第一引物延伸产物杂交区域的多核苷酸与第一引物延伸产物杂交,以使产生包含与被置换的第一引物延伸产物互补的序列的RNA转录本,上述第一引物延伸产物来自任一此处所述的产生与目的RNA序列互补的多核苷酸序列多拷贝的方法,其中引物延伸产物为被置换的引物延伸产物,其由下述产生:(a)利用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物,由此产生了包含第一引物延伸产物和靶RNA的复合体;(b)应用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体中的RNA;(c)利用DNA-依赖的DNA聚合酶延伸与第一引物延伸产物杂交的第二引物,由此产生了第二引物延伸产物,从而形成第一和第二引物延伸产物复合体;(d)应用从RNA/DNA杂合体上切割RNA的酶切割第一和第二引物延伸产物复合体中复合引物上的RNA,以使复合引物与第二引物延伸产物杂交,其中复合引物包含RNA部分和3’DNA部分;(e)利用DNA-依赖的DNA聚合酶延伸与第二引物延伸产物杂交的上述复合引物,由此上述第一引物延伸产物被置换;并且由此多拷贝目的RNA序列得以产生。
另一方面,本发明提供了产生与目的RNA序列互补的多核苷酸序列多拷贝(扩增)的方法,所述方法包括下列步骤:(a)第一引物与靶RNA杂交,其中第一引物为包含RNA部分和3’DNA部分的复合引物;(b)利用RNA-依赖的DNA聚合酶延伸第一引物,由此产生了包含第一引物延伸产物和靶RNA的复合体;(c)应用从RNA/DNA杂合体上切割RNA的试剂(比如酶)切割步骤(b)中的复合体上的RNA;(d)将第二引物与第一引物延伸产物杂交;(e)利用DNA-依赖的DNA聚合酶延伸第二引物,由此产生了第二引物延伸产物,从而形成第一和第二引物延伸产物复合体;(f)应用从RNA/DNA杂合体上切割RNA的试剂(比如酶)切割第一和第二引物延伸产物复合体中复合引物上的RNA,以使复合引物(其可以与第一引物相同或不同)可与第二引物延伸产物杂交,其中上述复合引物包含RNA部分和3’DNA部分;(g)利用DNA-依赖的DNA聚合酶延伸上述步骤(f)中的复合引物,由此上述第一引物延伸产物被置换,并且由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生。
在一些方面中,本发明提供了产生与目的RNA序列互补的多核苷酸序列多拷贝的方法,所述方法包括下列步骤:组合并反应:上述步骤(e)中第一和第二引物延伸产物复合体;可与第二引物延伸产物杂交的复合引物(其与第一引物可以相同或不同),其中所述复合引物包含RNA部分和3’DNA部分;DNA依赖的DNA聚合酶;从RNA/DNA杂合体上切割RNA的试剂(比如酶);其中混合物在一定条件(包括必要的底物和缓冲条件)下孵育,所述孵育条件为允许引物杂交、RNA切割和当上述步骤(e)复合体的RNA被切割且复合引物结合到复合体的第二引物延伸产物上后步骤(e)复合体中第一引物延伸产物的置换。
对本领域熟练人员而言显而易见的是,所指产生目的RNA序列多拷贝或与目的RNA序列互补的多核苷酸序列多拷贝是指包括、包含或由这些序列组成的产物。对本领域熟练人员而言显而易见的是,所指所得混合物的组合与孵育方面也包括含有孵育多种混合物(以多种组合和/或亚组合)的方法实施方案,从而形成所期望的产物。
另一方面,本发明提供了产生与目的RNA序列互补的多核苷酸序列多拷贝的方法,所述方法包括孵育反应混合物,所述反应混合物包含:(a)靶RNA;(b)可与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;(c)可与第一引物延伸产物杂交的第二引物;(d)RNA依赖的DNA聚合酶;(e)DNA依赖的DNA聚合酶;(f)从RNA/DNA杂合体上切割RNA的酶;其中孵育条件为允许引物杂交、第一和第二引物延伸以形成包含第一和第二引物延伸产物的复合体、RNA切割,以及当复合体中的RNA被切割且复合引物结合到复合体中第二延伸产物上并延伸时第一引物延伸产物的置换,由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生。
另一方面,本发明提供了产生目的RNA序列多拷贝(扩增)的方法,所述方法包括下列步骤:(a)第一引物与靶RNA杂交,其中第一引物为包含RNA部分和3’DNA部分的复合引物;(b)利用RNA依赖的DNA聚合酶延伸第一引物,由此产成包含第一引物延伸产物和靶RNA的复合体;(c)应用从RNA/DNA杂合体上切割RNA的试剂(比如酶)切割步骤(b)复合体上的RNA;(d)将第二引物与第一引物延伸产物杂交;(e)利用DNA-依赖的DNA聚合酶延伸第二引物,由此产生第二引物延伸产物,从而形成第一和第二引物延伸产物复合体;(f)应用从RNA/DNA杂合体上切割RNA的试剂(如酶)切割第一和第二引物延伸产物复合体中复合引物上的RNA,以使复合引物(其可以与第一引物相同或不同)与第二引物延伸产物杂交,其中所述复合引物包含RNA部分和3’DNA部分;(g)利用DNA-依赖的DNA聚合酶延伸上述步骤(f)中复合引物,由此上述第一引物延伸产物被置换;(h)在允许RNA聚合酶发生转录的条件下,将包含前启动子和可与被置换第一引物延伸产物杂交区域的多核苷酸与被置换的第一引物延伸产物杂交,以使产生包含与被置换的引物延伸产物互补的序列的RNA转录本,由此目的RNA序列多拷贝得以产生。在一些实施方案中,本发明提供了产生目的RNA序列多拷贝的方法,所述方法包括下列步骤:(a)组合:第一复合体,其中第一复合体为本段中上述步骤(e)中第一和第二引物延伸产物复合体;可与第二引物延伸产物杂交的复合引物(其与第一引物相同或不相同),其中所述复合引物包含RNA部分和3’DNA部分;DNA依赖的DNA聚合酶;RNA聚合酶;包含前启动子和与第二引物延伸产物杂交的区域的前启动子多核苷酸;以及从RNA/DNA杂合体上切割RNA的试剂(如酶);和(b)孵育步骤(a)的混合物,孵育条件(包括必需的底物与缓冲条件)为允许引物杂交、RNA切割、当第一复合体中的RNA被切割且复合引物结合到第一复合体中第二延伸产物上时第一复合体中第一引物延伸产物的置换、前启动子多核苷酸与被置换的第一引物延伸产物杂交以形成包含被置换的引物延伸产物和前启动子多核苷酸的第二复合体以及从上述第二复合体上进行RNA转录。
另一方面,本发明提供了产生目的RNA序列多拷贝的方法,所述方法包括孵育反应混合物,所述反应混合物包含:(a)靶RNA;(b)可与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;(c)可与第一引物延伸产物杂交的第二引物;(d)RNA依赖的DNA聚合酶;(e)DNA依赖的DNA聚合酶;(f)RNA聚合酶;(g)包含前启动子和可与第二引物延伸产物杂交的区域的前启动子多核苷酸;和(h)从RNA/DNA杂合体上切割RNA的酶;其中孵育条件为允许引物杂交、第一和第二引物延伸以形成包含第一和第二引物延伸产物的第一复合体、RNA切割、当第一复合体中的RNA被切割且复合引物结合到第一复合体中第二延伸产物上时第一引物延伸产物从第一复合体的置换、前启动子多核苷酸与被置换的第一引物延伸产物杂交以形成包含被置换的引物延伸产物和前启动子多核苷酸第二复合体、以及从上述第二复合体上RNA的转录,由此目的RNA序列多拷贝得以产生。
又一方面,本发明提供了产生目的RNA序列多拷贝(扩增)的方法,所述方法包括孵育反应混合物,所述反应混合物包含:(a)靶RNA;(b)可与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;(c)可与第一引物延伸产物杂交的第二引物;(d)RNA依赖的DNA聚合酶;(e)DNA依赖的DNA聚合酶;和(f)从RNA/DNA杂合体上切割RNA的酶;其中孵育是在一定条件下进行的,所述条件(包括必需的底物与缓冲条件)为允许引物杂交、从第一引物和第二引物延伸以形成包含第一和第二引物延伸产物的复合体、RNA切割、以及当复合体中的RNA被切割且另一第一引物结合到复合体中的第二引物延伸产物上时复合体中第一引物延伸产物的置换,由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生。
另一方面,本发明提供了产生目的RNA序列多拷贝(扩增)的方法,所述方法包括下列步骤:(a)孵育反应混合物,所述反应混合物包含(i)靶RNA;和(ii)可与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;以及(iii)RNA依赖的DNA聚合酶;其中孵育条件为允许引物杂交和包含第一引物延伸产物和靶RNA的复合体的形成;(b)孵育反应混合物,所述反应混合物包含:(i)包含第一引物延伸产物和靶RNA的复合体;以及(ii)可从RNA/DNA杂合体上切割RNA的酶;其中孵育条件为允许在包含第一引物延伸产物和靶RNA的复合体上切割RNA;(c)孵育反应混合物,所述反应混合物包含:(i)第一引物延伸产物;(ii)可与第一引物延伸产物杂交的第二引物;以及(iii)DNA依赖的DNA聚合酶;其中孵育条件为允许引物杂交和包含第一引物延伸产物和第二引物延伸产物的复合体的形成;(d)孵育反应混合物,所反应混合物包含:(i)含有第一引物延伸产物和第二引物延伸产物的复合体;(ii)可从RNA/DNA杂合体上切割RNA的酶;其中孵育条件为允许在包含第一引物延伸产物和第二引物延伸产物的复合体上切割RNA;(e)孵育反应混合物,所述反应混合物包含:(i)复合引物,其中复合引物包含RNA部分和3’DNA部分;(ii)切割过的包含第一引物延伸产物和第二引物延伸产物的复合体;和(iii)DNA依赖的DNA聚合酶;其中孵育条件为允许复合引物杂交、包含第一引物延伸产物和第二引物延伸产物的复合体上第一引物延伸产物的置换;由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生。
反应混合物可以与一种或多种上述组合的反应混合物以任何方式组合(因此减少孵育的数目)。因此,在一些实施方案中,步骤(a)和(b)的反应混合物为同一反应混合物(四步孵育或孵育步骤)。在另一实施方案中,步骤(d)和(e)的反应混合物为同一反应混合物(四步孵育或孵育步骤)。又在另一实施方案中,步骤(a)和(b)的反应混合物为同一反应混合物且步骤(d)和(e)的反应混合物为同一反应混合物(三步孵育或孵育步骤)。又在另一实施方案中步骤(a)-(c)的反应混合物为同一反应混合物(三步孵育或孵育步骤)。又在另一实施方案中,步骤(a)-(c)的反应混合物为同一反应混合物并且步骤(d)和(e)的反应混合物为同一反应混合物(两步孵育或孵育步骤)。在另一实施方案中,步骤(a)-(d)的反应混合物为同一反应混合物(两步孵育或孵育步骤)。在另一实施方案中,步骤(b)和(c)的反应混合物为同一反应混合物(四步孵育或孵育步骤)。在另一实施方案中,步骤(c)和(d)的反应混合物为同一反应混合物(四步孵育或孵育步骤)。又在另一实施方案中,步骤(a)-(e)的反应混合物为同一反应混合物(一步孵育)。可以理解,这些孵育步骤的任意组合和任何单独孵育步骤,及至对孵育的扩展均作为此处所述任一方法的一部分而进行的,都在本发明的范围内。
本发明的另一方面,产生目的RNA序列多拷贝(扩增)的方法还包括:(a)孵育反应混合物,所反应混合物包含(i)与目的RNA互补的多核苷酸序列的拷贝;和(ii)包含前启动子和与目的RNA互补的多核苷酸序列拷贝杂交的区域的前启动子多核苷酸;以及RNA聚合酶;并且孵育条件为允许前启动子多核苷酸和与目的RNA互补的多核苷酸序列的拷贝杂交从而形成包含与目的RNA互补的多核苷酸序列拷贝和前启动子多核苷酸的第二复合体,以及从上述第二复合体上RNA的转录。
又一方面,本发明提供了产生目的RNA序列多拷贝(扩增)的方法。所述方法包括下列步骤:(a)组合:靶RNA;可与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;与第一引物延伸产物杂交的第二引物;RNA依赖的DNA聚合酶;DNA依赖的DNA聚合酶;RNA聚合酶;包含前启动子和可与第二引物延伸产物杂交的区域的前启动子多核苷酸;以及从RNA/DNA杂合体上切割RNA的试剂(如酶);和(b)孵育步骤(a)的反应混合物,孵育条件(包括必需的底物和缓冲条件)为允许引物杂交、第一引物和第二引物的延伸以形成包含第一和第二引物延伸产物的第一复合体、RNA切割、当第一复合体中的RNA被切割且另一第一引物结合到第一复合体中第二延伸产物上时第一复合体中第一引物延伸产物的置换、前启动子多核苷酸与被置换的第一引物延伸产物杂交以形成包含被置换的引物延伸产物和前启动子多核苷酸的第二复合体,以及从上述第二复合体上RNA转录,由此目的RNA序列的多拷贝得以产生。
又一方面,本发明提供了产生与目的RNA互补的多核苷酸序列多拷贝(扩增)的方法,所述方法包括下列步骤:(a)引物与靶RNA杂交,其中引物为包含RNA部分和3’DNA部分的复合引物;(b)利用RNA依赖的DNA聚合酶延伸引物,由此产生包含第一引物延伸产物和靶RNA的复合体;(c)应用从RNA/DNA杂合体上切割RNA的试剂(比如酶)切割步骤(b)复合体上的RNA,以使至少一个靶RNA片段仍与引物延伸产物杂交;(d)利用DNA依赖的DNA聚合酶延伸至少一个靶RNA片段,由此产生包含目的序列的片段延伸产物,形成引物和片段延伸产物复合体;(e)应用从RNA/DNA杂合体上切割RNA的试剂(比如酶)切割引物和片段延伸产物的复合体中复合引物上的RNA,以使包含RNA部分和3’DNA部分的复合引物(其与第一引物可以相同或不相同)与片段延伸产物杂交,并且通过链置换重复引物延伸;由此产生与目的RNA互补多核苷酸的多拷贝。在一些实施方案中,本发明提供了产生与目的RNA互补的多核苷酸序列多拷贝的方法,所述方法包括下列步骤:(a)组合:本段上述步骤(d)中的引物和片段延伸产物复合体;可与片段延伸产物杂交的复合引物(其与第一引物可以相同或不相同),其中所述复合引物包含RNA部分和3’DNA部分;DNA依赖的DNA聚合酶;以及从RNA/DNA杂合体上切割RNA的试剂(比如酶);并且(b)孵育步骤(a)的反应混合物,孵育条件(包括必需的底物和缓冲条件)为允许引物杂交、RNA切割以及当本段中上述步骤(d)所述复合体中RNA被切割且复合引物结合到片段延伸产物上时复合体中引物延伸产物的置换。
又一方面,本发明提供了产生目的RNA序列多拷贝(扩增)的方法,所述方法包括下列步骤:(a)将第一引物与靶RNA杂交,其中第一引物为包含RNA部分和3’DNA部分的复合引物;(b)利用RNA依赖的DNA聚合酶延伸第一引物,由此产生包含第一引物延伸产物和靶RNA的复合体;(c)应用从RNA/DNA杂合体上切割RNA的试剂(比如酶)切割步骤(a)复合体上的靶RNA,这样残留的靶RNA片段仍与第一引物延伸产物杂交;(d)利用DNA依赖的DNA聚合酶延伸靶RNA的至少一个片段,由此产生了包含目的序列的片段延伸产物,以形成引物和片段延伸产物的复合体;(e)应用从RNA/DNA杂合体上切割RNA的试剂(比如酶)切割引物和片段延伸产物复合体中复合引物上的RNA,以使复合引物(其与第一引物可以相同或不相同)与片段延伸产物杂交并通过链置换重复引物延伸,其中所述复合引物包含RNA部分和3’DNA部分;(f)在允许利用RNA聚合酶发生转录的条件下,用包含前启动子和可与被置换引物延伸产物杂交的区域的前启动子多核苷酸与被置换引物延伸产物杂交,以使产生包含与被置换引物延伸产物具互补序列的RNA转录本,由此目的RNA序列的多拷贝得以产生。在一些实施方案中,本发明提供了产生目的RNA序列多拷贝的方法,所述方法包括下列步骤:(a)组合:第一复合体,其中第一复合体为本段步骤(d)所述引物和片段延伸产物复合体;可与片段延伸产物杂交的复合引物(其与第一引物可以相同或不相同),其中复合引物包含RNA部分和3’DNA部分;DNA依赖的DNA聚合酶;RNA聚合酶;包含前启动子和与第二引物延伸产物杂交的区域的前启动子多核苷酸;以及从RNA/DNA杂合体上切割RNA的试剂(比如酶);和(b)孵育步骤(a)混合物,孵育条件(其包括必需的底物和缓冲条件)为允许引物杂交、RNA切割、当第一复合体的RNA被切割和复合引物结合到第一复合体的片段延伸产物时从第一复合体置换引物延伸产物、前启动子多核苷酸与置换的引物延伸产物杂交以形成包含置换的引物延伸产物和前启动子多核苷酸的第二复合体,并从上述第二复合体上进行RNA转录。
又一方面,本发明提供了产生与目的RNA序列互补的多核苷酸序列多拷贝(扩增)的方法,所述方法包括下列步骤:(a)组合:靶RNA;可与靶RNA杂交的引物,其中引物为包含RNA部分和3’DNA部分的复合引物;RNA依赖的DNA聚合酶;DNA依赖的DNA聚合酶;以及从RNA/DNA杂合体上切割RNA的试剂(比如酶),和(b)孵育步骤(a)混合物,孵育条件(其包括必需的底物和缓冲条件)为允许引物杂交、RNA切割(其中包含靶RNA和引物延伸产物的第一复合体的RNA切割为使残留的靶RNA片段仍与引物延伸产物杂交)、从引物和靶RNA的片段上进行引物延伸以形成包含引物延伸产物和片段延伸产物的第二复合体(上述片段延伸产物包含目的序列)以及当第二复合体的RNA被切割且另一引物结合至第二复合体的片段延伸产物时从第二复合体上置换引物延伸产物,由此与目的RNA序列互补的多核苷酸序列的多拷贝得以产生。
另一方面,本发明提供了产生目的RNA序列多拷贝(扩增)的方法,所述方法包括下列步骤:(a)组合:靶RNA;可与靶RNA杂交的引物,其中引物为包含RNA部分和3’DNA部分的复合引物;RNA依赖的DNA聚合酶;DNA依赖的DNA聚合酶;RNA聚合酶;前启动子多核苷酸;以及从RNA/DNA杂合体上切割RNA的试剂(比如酶),和(b)孵育步骤(a)混合物,孵育条件(其包括必需的底物和缓冲条件)为允许引物杂交、RNA切割(其中包含靶RNA和引物延伸产物的第一复合体的RNA切割为使残留的靶RNA片段仍与引物延伸产物杂交)、从引物和靶RNA片段上引物延伸以形成包含引物延伸产物和片段延伸产物的第二复合体(上述片段延伸产物包含目的序列)以及当第二复合体的RNA被切割且另一引物与第二复合体结合时从第二复合体上置换引物延伸产物、前启动子多核苷酸与置换的引物延伸产物杂交以形成包含前启动子多核苷酸与置换的引物延伸产物的第三复合体,以及从上述第三复合体上进行转录,由此目的RNA序列的多拷贝得以产生。
在另一方面,本发明提供了产生多拷贝存在于靶RNA上的目的RNA序列的方法,所述方法包括:根据任一此处所述方法形成包含3′单链部分的第一和第二引物延伸产物复合体;(c)将前启动子寡核苷酸与步骤(b)的3′单链部分杂交;和(d)用DNA依赖的RNA聚合酶转录,由此产生多拷贝的正义DNA产物。
另一方面,本发明提供了产生与存在于靶RNA上的目的RNA序列的互补序列多拷贝的方法和产生存在于靶RNA序列上目的RNA序列多拷贝的方法,所述方法包括下列步骤:(a)利用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物,由此产生包含第一引物延伸产物和靶RNA的复合体;(b)应用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体上的RNA;(c)利用DNA依赖的DNA聚合酶延伸与第一引物延伸产物杂交的第二引物,其中第二引物为包含RNA部分和3’DNA部分的复合引物,由此产生第二引物延伸产物,以形成第一和第二引物延伸产物的复合体;(d)应用从RNA/DNA杂合体上切割RNA的酶切割第一和第二引物延伸产物复合体上第一和第二复合引物上的RNA,以使另一复合引物与第二引物延伸产物杂交以及另一复合引物与第一引物延伸产物杂交;(e)利用DNA依赖的DNA聚合酶延伸上述步骤(d)中的复合引物;由此上述第一引物延伸产物被置换,且由此与目的RNA序列互补的多核苷酸序列多拷贝得以产生;并由此上述第二引物延伸产物被置换,且由此目的RNA序列的多拷贝得以产生。
另一方面,产生与目的RNA序列互补的多核苷酸序列多拷贝的方法包括产生与两个或更多不同目的序列互补的多核苷酸序列多拷贝。
在另一方面,产生目的RNA序列多拷贝的方法包括产生两个或更多不同目的序列的多拷贝。
此处描述了本发明方法中所用复合引物和第二引物的多个实施方案。例如,在一些实施方案中,复合引物的RNA部分相对于其3’DNA部分为5’。又在其它实施方案中,5’RNA与3’DNA毗邻。在一些实施方案中,在复合引物与靶RNA杂交的条件下,复合引物包含不可与靶RNA杂交的5’部分(例如5’RNA部分)。又在其它实施方案中,复合引物包含含有随机序列的3’部分(例如3’DNA部分)。在一些靶RNA为mRNA的实施方案中,复合引物可以包含多聚序列。在另外的实施方案中,复合引物为随机引物。又在另外的实施方案中,多种复合引物用于与靶RNA杂交。在一些实施方案中,与靶RNA杂交的复合引物和与第二引物延伸产物杂交的复合引物相同。在一些实施方案中,与靶RNA杂交的复合引物和与第二引物延伸产物杂交的复合引物不相同。
又在另外的实施方案中,第二引物为包含DNA的引物(在一些实施方案中,其由DNA组成)。在另外的实施方案中,第二引物包含与第一引物延伸产物杂交的一个或多个靶RNA片段,上述一个或多个靶RNA片段应用从RNA/DNA杂合体上切割RNA的酶切割靶RNA与第一引物延伸产物复合体上的RNA而产生。在另外的实施方案中,第二引物包含含有随机序列的部分(例如3’部分)。又在另一实施方案中,第二引物为随机引物。在一些实施方案中,第二引物包含不可与第一引物延伸产物杂交的5’部分。对于此处描述的方法,可以使用一个或多个复合引物或第二引物。
此处描述了可在方法和组合物中使用的酶。例如切割RNA的试剂(如酶)可以是RNaseH,以及RNA依赖的DNA聚合酶可以是反转录酶。RNA依赖的DNA聚合酶可包含RNaseH酶活性,或可使用单独的酶。相似地,DNA聚合酶可包含RNA依赖的和DNA依赖的DNA聚合酶活性,或可使用单独的酶。DNA依赖的DNA聚合酶和切割RNA的酶也可以是同一种酶。DNA依赖的DNA聚合酶、RNA依赖的DNA聚合酶和切割RNA的酶也可以是同一种酶。
在一些实施方案中,本发明方法用于产生标记的多核苷酸产物(通常是DNA或RNA产物)。在用于产生标记DNA产物的方法的一些实施方案中,至少一种类型的dNTP为标记的dNTP。在用于产生标记RNA产物的方法的一些实施方案中,至少一种类型的rNTP为标记的rNTP。在另外的用于产生标记DNA产物的方法的实施方案中,使用标记的复合引物。
在一些方面中,前启动子多核苷酸(例如PTO)在3’末端包含与置换的引物延伸产物杂交的区域,由此DNA聚合酶延伸置换的延伸产物产生双链的启动子,转录从上述双链启动子发生。
本方法适用于扩增任何RNA靶,包括例如mRNA和核糖体RNA。一步或多步步骤可以组合和/或顺次进行(通常以任何次序,只要所要求的产物可以形成),并且显而易见的是,本发明包括此描述步骤的多种组合。同样显而易见并此处描述的是,本发明包括其中起始步骤为此处描述的任何步骤的方法。例如,本发明的方法不需要第一步为从RNA模板上产生第一引物延伸产物。本发明方法包括其中较后的“下游”步骤为起始步骤的实施方案。
此外,在本发明的多个实施方案中,应理解第一引物延伸产物包含(a)与RNA序列互补的序列和(b)5’部分(优选地5’末端)为RNA。正如所述,此产物一般是由具RNA部分的复合引物沿RNA模板进行引物延伸产生。正因如此,提及第一引物延伸产物指包含上述(a)和(b)的产物。
本发明也提供了应用(通常为分析)本发明扩增方法的产物的方法,如测序,序列变化的检测(例如基因分型或核苷酸突变检测);确定目的序列的存在与否;基因表达谱;消减杂交(subtractive hybridization);消减杂交探针的制备;差异扩增;文库(包括cDNA文库和差异表达文库)制备;固定化核酸(其可以是固定于微阵列上的核酸)的制备,以及鉴定(包括检测与/或定量)由本发明方法产生的扩增核酸产物。
在一些方面中,本发明提供了目的RNA的测序方法,所述方法包括在dNTP和dNTP类似物(其可被标记或未被标记)混合物存在时利用本发明扩增方法扩增包含目的序列的靶RNA,于是由于掺入标记或未标记的dNTP类似物引物延伸被终止,并分析扩增引物来确定序列。在其中扩增产物为RNA转录本的实施方案中,方法可以包括(a)在rNTP和rNTP类似物(其可被标记或未被标记)混合物存在时,利用本发明扩增方法扩增包含目的序列的靶RNA,于是由于掺入的标记或未标记的rNTP类似物,RNA转录被终止,并且(b)通过分析扩增产物来确定序列。
一方面,本发明提供了在靶RNA中检测突变(或者,在一些方面中为鉴定序列)的方法,其包括:(a)通过此所述的方法扩增靶RNA;和(b)分析本方法扩增产物的单链构象,其中与参考单链RNA相比较,不同的构象就显示出靶RNA的突变。在另外的实施方案中,本发明提供在靶RNA中检测突变(或者,在一些方面中为鉴定序列)的方法,其包括分析此处描述的任何方法的扩增产物的单链构象,其中与参考单链RNA相比较,不同的构象就显示出靶RNA的突变(或者,在一些方面中为鉴定靶序列)。
另一方面,本发明提供了确定目的序列存在与否的方法,所述方法包括(i)扩增包含目的序列的靶RNA,所述扩增包括延伸复合引物,其中所述复合引物与通过任一此处所述方法制备的被切割第一和第二引物延伸产物复合体杂交,其中复合引物的RNA部分的序列已知,和(ii)将从步骤(i)中的扩增产物(其如果存在)与从参考模板扩增产物的量相比;其中(1)和从包含可与复合引物的RNA部分杂交的区域的参考模板扩增的产物量相比从该模板产生更少量扩增产物显示出第二引物延伸产物不包含可与复合引物的RNA部分杂交的序列,并显示出第二引物延伸产物为与复合引物RNA部分杂交的序列的序列变体;或(2)和从不包含可与复合引物的RNA部分杂交的区域的参考模板扩增的产物量相比从该模板产生更多量扩增产物显示出第二引物延伸产物包含可与复合引物的RNA部分杂交的序列,并显示出第二引物延伸产物不是与复合引物RNA部分杂交的序列的序列变体。
另一方面,本发明提供了产生固定于基片上的核酸的方法(其包括产生微阵列的方法),包括(a)通过此处描述的任一方法扩增靶RNA;和(b)将扩增产物固定到基片上。扩增产物可为标记或未标记的。另一方面,本发明提供了产生微阵列的方法,包括(a)通过此处描述的任一方法扩增靶RNA;和(b)将扩增产物固定到基片上(其可以是固体或半固体)。在一些实施方案中,微阵列通过固定扩增产物到基片上形成扩增产物的微矩阵而产生。微阵列可以包括至少一种固定到固体或半固体基片上的扩增产物,上述基片制备材料选自纸、玻璃、陶瓷、塑料、聚苯乙烯、聚丙烯、尼龙、聚丙烯酰胺、硝化纤维、硅和其他金属、以及光纤。扩增产物固定在二维结构或三维结构的基片上,其中二维或三维结构包括针、棒、纤维、带、细线、珠、颗粒、微量滴定孔、毛细管和圆柱体。
本发明的任一方法可以用于产生多核苷酸产物(一般是DNA或RNA),其适于鉴定样品中目的RNA序列。在一个实施方案中,本发明提供鉴定目的RNA序列(例如检测(存在与否)和/或定量)的方法,包括:(a)通过此处所述的任一方法扩增靶RNA;和(b)分析扩增产物。步骤(b)的分析扩增产物可以利用本领域已知或此处描述的任一方法来进行,例如通过检测和/或定量与探针杂交的扩增产物。这些扩增产物可以标记或未标记。本发明的任一方法均可用于产生标记的DNA或RNA产物,上述标记的DNA或RNA产物通过在本方法中合适的步骤掺入标记的核苷酸和/或标记的复合引物而被标记。这些标记产物尤其适用于通过本领域已知的方法定量和/或鉴定,其包括使用阵列,比如cDNA阵列和寡核苷酸阵列。一方面,本发明提供了鉴定目的RNA序列的方法,包括(a)通过此处所述的方法扩增靶RNA以产生标记的DNA产物;和(b)分析标记的DNA产物。在一些实施方案中,分析DNA产物的步骤包括对上述产物的定量,由此确定样品中存在的目的RNA序列的量。
另一方面,本发明提供了鉴定目的RNA的方法,包括(a)通过此处所述的方法扩增靶RNA以产生标记的RNA产物;和(b)分析标记的RNA产物。在一些实施方案中,分析RNA产物的步骤包括对上述产物的定量,由此确定样品中存在的目的RNA序列的量。例如DNA或RNA产物可以通过接触至少一种探针来分析。在一些实施方案中,至少一种探针以微阵列形式提供。微阵列可以包括固定在固体或半固体基片上的至少一种探针,上述基片可由选自以下材料:纸、玻璃、陶瓷、塑料、聚丙烯、聚苯乙烯、尼龙、聚丙烯酰胺、硝化纤维、硅和其他金属、以及光纤。探针固定在二维结构或三维结构的基片上,其中二维或三维结构包括针、棒、纤维、带、细线、珠、颗粒、微量滴定孔、毛细管和圆柱体。
另一方面,本发明提供了确定样品中基因表达谱的方法,所述方法包括:(a)利用此处所述的任一方法扩增样品中至少一种目的RNA序列;和(b)确定每一目的RNA序列的扩增产物的量,其中每一所述量是样品中每一目的RNA序列量的指示,由此样品的基因表达谱被确定。
另一方面,本发明提供了制备文库(包括cDNA和消减杂交文库)的方法,上述方法包括利用此处所述的任一方法扩增至少一种目的RNA序列以产生单链或双链核酸产物。
另一方面,本发明提供了制备消减杂交探针的方法,所述方法包括利用此处所述的任一方法从第一RNA群体中产生与至少一种目的RNA序列互补的单链多核苷酸(优选DNA)的多拷贝。
另一方面,本发明提供了进行消减杂交的方法,所述方法包括:(a)用此处所述的任一方法从第一RNA群体中产生与至少一种目的RNA序列互补的单链多核苷酸的多拷贝;和(b)将多拷贝与第二mRNA群体杂交,由此第二mRNA群体的亚群体与DNA拷贝的复合体。在一些实施方案中,方法还包括:(c)应用从RNA/DNA杂合体上切割RNA的酶切割步骤(b)复合体上的RNA;和(d)扩增第二mRNA群体杂交的未杂交亚群体(利用任何方法,包括此处所述的方法),由此产生第二mRNA群体的未杂交亚群体的互补的单链DNA多拷贝。
另一方面,本发明提供了差异扩增的方法,方法包括:(a)利用此处所述的任一方法产生第一RNA群体的至少一种目的RNA序列的互补核酸序列(一般为DNA)的多拷贝;(b)将多拷贝与第二mRNA群体杂交,由此第二mRNA群体的亚群体形成了与DNA拷贝的复合体;(c)应用从RNA/DNA杂合体上切割RNA的酶切割步骤(b)中复合体上的RNA;和(d)利用任一方法包括此处所述的方法扩增第二mRNA群体的未杂交亚群体,由此产生第二mRNA群体的未杂交亚群体的互补的单链DNA的多拷贝。
另一方面,本发明提供制备文库的方法,所述方法包括如此处所述制备消减杂交探针或如此处所述进行差异扩增。
这些应用的任何一项可以使用此处所述的扩增方法(包括多种组分和任一组分的多种实施方案)。例如,使用的复合引物可以具有5’RNA部分,其可以和3’DNA部分毗邻。
本发明也提供用于此处所述扩增方法的组合物、试剂盒、复合体、反应混合物和包含多种组分的体系(以及组分的多种组合)。一方面例如,本发明提供了包含复合引物和第二引物的组合物,其中复合引物包含RNA部分和3’DNA部分,其中第二引物为随机引物。在一些实施方案中,这些组合物还包含RNA依赖的DNA聚合酶(其可以是反转录酶)。在另外的实施方案中,本发明提供了包含复合引物和第二引物的组合物,所述第二引物包含不可与复合引物延伸产物杂交(在引物的一个区域可以杂交的条件下)的序列(通常但并非必需的是:使用这种引物产生前启动子多核苷酸可与之杂交的引物延伸产物)。在一些实施方案中,复合引物的5’RNA部分与它的3’DNA部分毗邻。又在另外的实施方案中,复合引物的5’RNA部分为约5到约20个核苷酸且3’DNA部分为约5到约15个核苷酸。在一些实施方案中,前启动子多核苷酸为前启动子模板寡核苷酸(PTO)。又在另外的实施方案中,本发明提供了组合物,其包含:(a)复合引物;(b)第二引物(其可以为随机引物);以及(c)前启动子多核苷酸(在一些实施方案中,其为PTO)。
另一方面,本发明提供包含此处所述任何一种复合体(其一般被认为是相对于最终扩增产物的中间产物)的组合物(也参见于这些不同复合体的例示性示意图)。例如,本发明提供了包含以下复合体的组合物,上述复合体为:(a)第一引物延伸链,其中第一引物为包含RNA部分和3’DNA部分的复合引物;和(b)靶RNA链。又在另一方面,本发明提供了包含复合体的组合物,上述复合体为:(a)第一引物延伸产物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;和(b)第二引物(或片段)延伸产物。又在另一方面,本发明提供了包含(a)切割的引物延伸产物,其中引物为包含RNA部分和3’DNA部分的复合引物;和(b)第二引物(或片段)延伸产物;以及(c)复合引物的复合体。
另一方面,本发明包括任何一种或多种产物(包括中间产物)和包含产物(包括中间产物)的组合物,上述产物和组合物由本发明方法的任何一方面产生。产物包括文库和产生的任何其他群体,其一般基于此处所述方法中所用引物的特性。
另一方面,本发明提供了反应混合物(或包含反应混合物的组合物),其包含此处所述组分的多种组合。例如,本发明提供了这样的反应混合物,其包括(a)靶RNA;(b)包含3’DNA部分和RNA部分的复合引物;(c)第二引物;和(d)DNA聚合酶。正如此处所述,任何复合引物可以存在于反应混合物中(或多种复合引物),包括含有与3’DNA部分毗邻的5’RNA部分的复合引物。反应混合物也可还包含从RNA/DNA杂合体上切割RNA的酶,比如RNaseH。本发明的反应混合物也可包括前启动子多核苷酸(在一些实施方案中,其为PTO),和/或RNA聚合酶。本发明反应混合物也可包括(a)置换的引物延伸产物(其含有与复合引物3’DNA部分互补的5’末端序列,而不含有与复合引物RNA部分互补的序列);(b)前启动子多核苷酸(比如PTO);和(c)RNA聚合酶。
另一方面,本发明提供进行此处所述方法的试剂盒。这些试剂盒包含用于扩增方法的一个或多个的组分,所述试剂盒以合适的包装和通常(但并非必需)包含适当的说明书。例如,本发明提供了包含复合引物和第二引物的试剂盒(其可以单独包装或不单独包装),所述复合引物包含3’DNA部分和RNA部分(其可以在5’端并还可以与3’DNA部分毗邻)。在一些实施方案中,这些试剂盒还包含利用引物来扩增RNA的说明书。试剂盒中的复合引物可以是此处所述的任何一种。试剂盒可以包含更多的组分,比如任意下述:(a)前启动子多核苷酸(比如PTO);和(b)此处所述的任一种酶,比如从RNA/DNA杂合体上切割RNA的酶(例如RNaseH)、DNA聚合酶(RNA依赖的或DNA依赖的)和RNA聚合酶。任何这些试剂盒还可以包含使用组分扩增RNA的说明书。
另一方面,本发明提供了实现此处所述扩增方法的体系。例如,本发明提供了扩增靶RNA的体系,包含(a)含有3’DNA部分和RNA部分的复合引物;(b)第二引物;(c)RNA依赖的DNA聚合酶;(d)DNA依赖的DNA聚合酶;和(e)一种从RNA/DNA杂合体上切割RNA的酶(比如RNaseH)。复合引物可以是任一(一种或多种)此处所述的复合引物,包括含有与3’DNA毗邻的5’RNA部分的复合引物。体系还可以包含前启动子多核苷酸(比如PTO)和/或RNA聚合酶。正如此处所述,本发明的体系一般包含一种或多种适于实施本发明方法的设备。
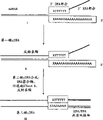
附图简述
图1A-1B显示线性等温RNA扩增过程的图解,上述扩增过程使用复合引物、第二引物和链置换来产生包含与靶RNA互补的序列的多拷贝单链DNA产物。
图2A-C显示增强的线性等温RNA扩增过程的图解,上述扩增过程使用复合引物、第二引物、链置换和转录来产生多拷贝靶RNA。
图3A-B显示线性等温RNA扩增过程的图解,上述扩增过程使用单复合引物和链置换来产生包含与靶RNA互补的序列的多拷贝单链DNA产物。
图4A-B显示增强的线性等温RNA扩增过程的图解,上述扩增过程使用单复合引物、链置换和转录来产生多拷贝靶RNA。
图5显示线性等温RNA扩增过程的图解,上述扩增过程使用含有多聚序列的单复合引物和链置换来产生包含与靶RNA互补的序列的多拷贝单链DNA产物。
图6显示线性等温RNA扩增过程的图解,上述扩增过程使用含有随机序列的单复合引物和链置换来产生包含与靶RNA互补的序列的多拷贝单链DNA产物。
图7显示增强的等温RNA扩增过程的图解,上述扩增过程使用单复合引物和转录来产生包含与靶RNA互补的序列的多拷贝单链RNA产物。
图8A-C显示线性等温RNA扩增过程的图解,上述扩增过程使用两个复合引物和链置换来产生包含与靶RNA互补的序列以及与靶RNA相同序列的多拷贝单链DNA产物。
图9显示凝胶照片,其显示扩增自在第二链cDNA上包含特定附加序列的双链cDNA(其利用线性等温RNA扩增制备)的PCR产物。
图10显示利用实时PCR实验定量利用线性等温RNA扩增产生的产物的结果图。
本发明的实施模式
本发明及其优势概述
本发明公开了扩增RNA序列的新方法、组合物和试剂盒。本方法提供单个RNA样本或RNA样本库的等温扩增。提供了一些方法用于产生包含与目的RNA互补的序列的多拷贝DNA。另一些方法提供了用于产生目的RNA序列多拷贝。这些方法适用于例如产生cDNA文库和消减杂交探针。它们产生单链DNA或RNA产物,上述产物易用于多种用途,包括表达谱(例如通过使用微阵列技术的多元分析)以及建立在电泳上的技术比如差异显示。本方法可以自动化并且不需要热循环。
本发明的方法涉及一个或更多RNA样本的扩增,如RNA序列库,并且本发明方法尤其适用于对生物样本中总RNA的制备物中所有RNA(比如mRNA)序列的扩增。因此,本发明方法的主要优点之一是扩增全部序列库的能力,这种能力对分析细胞(如目的生物样本中的细胞)的基因表达谱极其重要。本发明方法也用于扩增特异目的RNA序列或多个RNA(例如相关RNA家族的成员)。本方法也适用于扩增样品中大量,且最优选地所有RNA(比如mRNA)序列。
由于许多mRNA具有特有的多聚A 3’末端,对制备cDNA文库和其后为确定基因表达谱的序列分析或其它应用而言,扩增一般灵从mRNA的3’末端序列起始。本发明方法同样适用于mRNA 3’部分扩增的文库的制备。本发明方法中使用的复合引物可以通过使用随机引物设计其可与多种或全部种类的mRNA杂交(按照本领域已知方法)。另外,如果欲扩增选择的RNA或相关RNA,复合引物可以包含与选择的RNA或相关的RNA杂交的序列。
本方法通常包括使用特异设计的引物(通常一种或多种RNA/DNA复合引物)来产生第一和第二链cDNA复合体,其包含具有特别性质(例如可被酶切割)的部分。应当理解,于此所用的cDNA是指多核苷酸引物延伸产物。通常,复合体在双链cDNA复合体的末端包含RNA/DNA异质双链体。双链cDNA复合体末端的RNA/DNA异质双链体可以包含特定末端序列,其通常通过复合引物RNA部分引入。本发明方法的复合引物包含通常设计用来与靶RNA杂交的3’DNA部分。复合引物的剩余部分(如5’RNA部分)通常但并非必需包含不与靶RNA杂交的序列(当引物结合到靶RNA上时,其构成尾部)。因此,正如于此所阐明,谈到与序列(或杂交模板)杂交的引物包含其中引物的至少一部分杂交的实施方案以及整个引物杂交的实施方案。
双链cDNA复合体作为如下所述的线性扩增的底物:从RNA/DNA杂合体上切割RNA的酶(如RNaseH)切割杂合体上的RNA,使第二链cDNA的3’DNA序列可被复合引物结合,其中所述复合引物可与第一复合引物相同或不相同。利用DNA聚合酶延伸结合的复合引物产生引物延伸产物,其置换以前结合的被切割的第一引物延伸产物,由此单链DNA产物积聚。单链DNA产物为靶RNA的互补链的拷贝(或反义DNA)。这种线性扩增称为“SPIA”(Single Primer Linear Amplification,单引物线性扩增),且见Kurn等人在美国专利号6,251,639B1中描述。
一方面,本发明按如下所述进行:复合RNA/DNA引物形成了模板RNA复制的基础。复合引物(于此也称为第一引物)与包含目的RNA序列的模板RNA杂交,且通过利用RNA依赖的DNA聚合酶延伸复合引物以形成第一引物延伸产物(可互换称为“复合引物延伸产物”或“第一链cDNA”)。经过模板RNA的切割,第二引物延伸产物(可互换称为“第二链cDNA”)以与第一引物延伸产物复合体的形式形成(如下所述)。由于第一引物延伸产物中存在复合引物,第一和第二引物延伸产物复合体在其一端由RNA/DNA杂合体组成。应用从RNA/DNA杂合体上切割RNA的试剂如酶(如RNaseH)切割杂合体上的RNA序列,使第二引物延伸产物可与另一复合引物结合,上述复合引物可与第一复合引物相同或不相同。利用DNA聚合酶产生另一第一(复合)引物延伸产物,其置换以前结合的被切割的第一引物延伸产物,由此产生置换的切割第一引物延伸产物。
在本发明的一些实施方案中,第二引物延伸产物的形成如下所述:RNA模板切割后,将第二引物与第一引物延伸产物杂交并且延伸形成第二引物延伸产物,其与第一引物延伸产物形成复合体。由于第一引物延伸产物中存在复合引物,第一和第二引物延伸产物复合体在其一端由RNA/DNA杂合体组成。第二引物为可与第一DNA链杂交的任何序列,因此其可通过利用DNA聚合酶沿第一引物延伸产物延伸形成第二引物延伸产物。因此,在一些实施方案中,第二引物为可以包含或不包含随机序列的寡核苷酸(即设计用来与样品中一种或多种序列杂交(在一组给定的条件下)的序列)。在另外的实施方案中,它包含第一DNA链的序列(一般在3’端),上述序列可以与第一DNA链中的序列杂交(例如发卡或自身退火结构)。
在本扩增方法的另一方面,靶RNA的一个或多个片段作为第二引物延伸产物的引物。包含靶RNA和第一引物延伸产物的起始复合体中的靶RNA被一种试剂(比如RNaseH)切割,以使模板RNA的至少一个片段仍与第一引物延伸产物杂交。在本发明的这一方面,一个(或多个)模板RNA片段以上述方式作为第二“引物”以产生片段延伸产物,上述片段延伸产物具有上文所述扩增方法中第二延伸产物相同的功能。本发明方法中合适RNA片段的长度足以使其不至于从第一链cDNA上解离,优选地从约3到约30,更优选地从约5到约25,甚至更优选地从约10到约20,并且最优选地从约12到约17个核苷酸长度。
在涉及转录(于此称为“增强的”方法)的实施方案中,第二引物还可以包含一段序列,以使置换的第一引物延伸产物(而不是最先的复合引物延伸产物)含有包含前启动子的多核苷酸(于此也称为“前启动子多核苷酸”)可与之杂交的序列。前启动子多核苷酸与置换的引物延伸产物杂交,并延伸置换的第一引物延伸产物的3’末端(如果有突出端的话),这样产生双链的启动子区域,其推动转录产生正义RNA产物。这种“增强的”方法在Kurn等人美国专利号6,251,639B1中描述。
因此,本发明提供了产生至少一个拷贝的与目的RNA序列互补的多核苷酸序列的方法,其包括如下所述组分的组合和反应:(a)包含目的RNA序列的靶RNA;(b)包含RNA部分和3’DNA部分的第一(复合)引物;(c)可与复合引物延伸产物杂交的第二引物;(d)RNA依赖的DNA聚合酶;(e)DNA依赖的DNA聚合酶;(f)从RNA/DNA杂合体上切割RNA的试剂(比如酶);以及(g)脱氧核糖核苷三磷酸或合适的类似物(其可被标记或未被标记)。在包括转录的实施方案(即增强的方法)中,扩增反应中还包括如下所述组分(与以上列出的组分同时加入或单独加入):(h)包含前启动子和可与第一引物延伸产物(置换的引物延伸产物)杂交的区域的前启动子多核苷酸;(i)RNA聚合酶;以及(j)核糖核苷三磷酸或合适的类似物(其可被标记或未被标记)。此组合物在合适的条件下进行引物杂交、引物延伸、RNA切割、以及当第一引物延伸产物上的RNA被切割且另一第一引物结合到切割的RNA空出的位点时第一引物延伸产物的置换。在包括转录的实施方案中,使用的条件也适合前启动子多核苷酸与置换的切割过的第一引物延伸产物杂交、延伸切割过的第一引物延伸产物3’末端(如果需要的话),以形成双链启动子区域,以及启动子驱动的RNA转录。正如此处描述和举例阐述的,上述反应混合物可进一步分成两个或更多的反应混合物,用于与扩增过程的不同方面相对应的单独的通常为顺次的孵育过程(参见如实施例1)。
在扩增方法的另一方面,靶RNA片段作为第二DNA链合成的引物。在包含靶RNA和复合引物延伸产物的起始复合体中的靶RNA被一种酶(比如RNaseH)切割,以使模板RNA的至少一个片段仍保持与复合引物延伸产物杂交。在本发明的这一方面,一个(或多个)模板RNA片段以上述方式作为第二“引物”,以产生片段延伸产物,上述片段延伸产物具有上文所述扩增方法中第二延伸产物相同的功能。
在一些实施方案中,本发明提供了产生至少一个拷贝的与目的RNA序列互补的多核苷酸序列的方法,所述方法包括组合和反应如下组分:(a)第一和第二引物延伸产物复合体;(b)包含RNA部分和3’DNA部分的第一(复合)引物;(c)DNA依赖的DNA聚合酶;(d)从RNA/DNA杂合体上切割RNA的试剂(如酶);以及(e)脱氧核糖核苷三磷酸或合适的类似物(其可被标记或未被标记)。在包括转录的实施方案中,扩增反应中还包括如下组分(与以上列出组分同时加入或单独加入):(f)包含前启动子和与第一引物延伸产物(置换的引物延伸产物)杂交的区域的前启动子多核苷酸;(g)RNA聚合酶;以及(h)核糖核苷三磷酸或合适的类似物(其可被标记或未被标记)。此组合物在合适的条件下对引物杂交、引物延伸、RNA切割、以及当第一引物延伸产物上的RNA被切割且另一第一引物结合到切割的RNA空出的位点时第一引物延伸产物的置换。在包括转录的实施方案中,使用的条件也适合前启动子多核苷酸与置换的第一引物延伸产物杂交、延伸切割过的第一引物延伸产物3’末端(如果需要的话)以形成双链启动子区域、以及启动子驱动的RNA转录。
另一方面,本发明提供了利用第一复合引物、第二复合引物(称为“反向复合”引物)和靶RNA片段产生目的RNA序列的单链反义和正义DNA拷贝的方法。方法涉及:(a)双链cDNA的形成,所述双链cDNA在双链cDNA的每一末端包含RNA-DNA异质双链体;和(b)第一链(正义)和第二链(反义)cDNA的线性扩增,上述线性扩增通过延伸两个复合引物和链置换进行。由此产生单链第一和第二链cDNA产物。这种产物在例如产生cDNA文库上有用。在本发明的这一方面,显而易见第二引物延伸产物由复合引物起始。
本发明方法包括使用扩增产物的方法(称为“应用”)。在一些实施方案中,本发明提供了RNA序列测序的方法。当测序方法基于此处描述的其中扩增产物为DNA的方法时,使用了适当的dNTP或其类似物(可被标记或未被标记)。当测序方法基于此处描述的其中扩增产物为RNA的方法时,使用适当的rNTP或其类似物(可以标记或未标记)。
在另一实施方案中,本发明提供了测定核酸序列突变的方法。在一个实施方案中,扩增产物用于测定和/或鉴定靶多核苷酸中的单链构象多态性。
本发明提供鉴定(例如检测存在与否和/或定量)目的RNA的方法,所述方法系指通过利用本发明扩增方法产生DNA或RNA产物并通过利用检测/定量方法来分析产物,其中所述检测/定量方法如基于阵列的技术或液相技术。这些扩增产物可以标记或未标记。
又在另外的实施方案中,本发明提供了固定核酸的方法,包括利用本发明扩增方法的扩增产物来产生核酸(DNA或RNA)微阵列的方法。
在另外的实施方案中,本发明提供了产生cDNA文库、消减杂交探针和消减杂交文库的方法。
近年来已研发了检测和定量基因表达水平的多种方法。例如微阵列使给定样品中多基因表达的检测和/或定量成为可能,以上所述的微阵列是在如固体或半固体基片上的分立位点处固定特定的cDNA或寡核苷酸。
利用这些以前已知的方法来检测样品多种mRNA存在与否和/或定量,其接下来用作基因表达谱的定量,它一般要求cDNA的直接标记,这需要大量的总RNA的输入,这部分是因为mRNA仅仅代表总RNA库的一小部分。因此,当使用来自一个给定的细胞或组织样品中的总RNA制备物时,利用比如阵列的方法分析样品中的基因表达就需要相当大量的输入RNA,其一般从50到200μg。相似地,利用阵列技术进行基因表达谱的单次分析一般需要2到5μg纯化自总RNA制备物的mRNA。这是比如那些基于阵列的方法的明显局限,因为需要的细胞数或组织样品的大小非常大,并且这些细胞或组织样品对试验而言经常很难得到或它们太宝贵。这种局限在临床样品的研究和效应分子文库的高通量筛选上尤其严重,上述临床样品的研究中被研究的细胞稀少并且/或者在体外很难培养。而且,以前基于转录的扩增mRNA的方法为DNA依赖的RNA聚合酶的扩增效率所限制(所述方法描述在例如Lockhart等人,自然生物技术(NatureBiotechnology)(1996),14,1675-1680;van Gelder等人,美国专利号5,716,785),并且一些这类方法需要多个步骤。而且,聚合酶启动子序列掺入的过程易于产生非特异性扩增。
本发明方法在提供靶扩增的高特异性的条件下提供有效扩增mRNA的能力,上述扩增的mRNA一般反映其在输入RNA中的分布。因此,一些可以利用本发明扩增产物的检测/定量方法的使用得到很大的增强,上述方法如那些基于有力的阵列技术、实时PCR、定量TaqMan、利用分子信号定量PCR等的方法。
本发明扩增方法的线性特征极大地增加了靶扩增的特异性。由于产生目的序列的多拷贝既不依赖于也不基于扩增产物的循环、指数扩增,因此极大地增强了所得产物的特异性。多种扩增产物的分布通常反映其在输入RNA中的分布。
尽管不同的步骤可以在不同的温度下进行,但本发明方法不需要热循环,并且所有步骤可以等温进行。该性质提供很多的优势,包括利于自动化和适应高通量方法。等温反应要较热循环快,并且使本发明方法适于在小型的设备进行。
包含RNA/DNA异质双链体的中间双链cDNA复合体提供了线性扩增的底物。RNA/DNA异质双链体中RNA部分的切割允许在不需要双链cDNA中间复合体变性条件下进一步的扩增。而且,由于切割的双链cDNA复合体主要还是双链,单链模板的二级结构更不太可能影响随后的扩增。
最后,大多数的本发明方法产生单链产物,因此使得它们更容易结合以均一方式(即在溶液中)的探针或结合固定于固体支持物上的探针。本发明方法的双链产物在例如产生cDNA文库中有用。
在提供靶扩增的高特异性的条件下有效扩增mRNA(或任何其它目的RNA种类或群体)并且上述有效扩增一般不会改变在制备物中多种mRNA的表现的能力会极大地增强使用例如那些基于有力的阵列技术的检测/定量方法。
一般技术
除非另外指明,本发明的实施采用了常规分子生物学技术(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学技术,上述技术均包括在本领域的技术范畴内。这些技术在文献中详细阐明,所述文献如“分子克隆:实验室手册”,第二版(Sambrook等人,1989);“寡核苷酸合成”(M.J.Gait编辑,1984);“动物细胞培养”(R.I.Freshney编辑,1987);“酶学方法”(学院出版社);“分子生物学最新方法”(F.M.Ausubel等人编辑(1987)及其更新期刊);“PCR:聚合酶链反应”(Mullis等人编辑,1994)。
本发明使用的引物、寡核苷酸和多核苷酸利用本领域已知的标准技术产生。
定义
此处所用的“靶序列”、“靶核酸”或“靶RNA”是指包含目的序列的多核苷酸,其为需要扩增的多核苷酸。至于其实际序列可以是已知或未知。在一些实施例中,术语“靶”、 模板”及其变化的说法可以交换使用。
此处所用的“扩增反应”或“扩增”通常是指产生多拷贝目的序列的过程。“多拷贝”指至少2个拷贝。“拷贝”并不必须与模板序列完全互补或相同。例如,拷贝可以包含核苷类似物(如脱氧肌苷)、特意进行的序列改变(例如通过由包含可杂交但并非与模板互补的序列的引物引入的序列改变),和/或扩增过程中发生的序列错误。“扩增”一段序列通常指制备一段序列或其互补链的拷贝,正如上述,所谓拷贝并不必须与模板序列完全互补或相同。
“多核苷酸”或“核酸”此处可互用,系指任何长度的核苷酸聚合物,且包括DNA和RNA。核苷酸可为脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基和/或它们的类似物,或可由DNA或RNA聚合酶掺入聚合物的任一底物。多核苷酸可包含修饰的核苷酸,如甲基化核苷酸及它们的类似物。如果存在修饰的话,对核苷酸结构的修饰可在多聚体装配之前或之后进行。核苷酸的序列可由非核苷酸组分打断。多核苷酸可在聚合后进一步修饰,例如与标记组分连接。其它类型的修饰包括如“加帽”、将一种或多种天然存在的核苷酸置换为其类似物、核苷酸间修饰,例如那些带有无电荷键(如膦酸甲酯、磷酸三酯、磷酰胺、氨基甲酸酯等)的多核苷酸和那些带电荷键(如硫代磷酸酯、二硫代磷酸酯等)的多核苷酸,那些包含悬挂部分的多核苷酸,其中所述悬挂部分如蛋白质(如核酸酶、毒素、抗体、信号肽、聚L-赖氨酸等),那些带有嵌入剂(例如吖啶、补骨脂素等)的多核苷酸,那些包含螯合剂(如金属、放射活性金属、硼、氧化金属等)的多核苷酸,那些包含烷化剂的多核苷酸,那些具已改变键的多核苷酸(如α-端基异构核酸等),以及多核苷酸的未改变形式。此外,任何通常存在于糖中的羟基可被膦酸基、磷酸基置换,可用标准保护基团保护,或可被活化以制备与其它核苷酸连接的其它键,或可被连接至固相载体。5′和3′末端的OH可被磷酸化或用胺或1-20个碳原子的有机加帽基团取代。其它羟基也可被衍生为标准的保护基团。多核苷酸也可包含通常在领域内已知的核糖或脱氧核糖的类似物形式,包括如2′--O-甲基-、2′-O-烯丙基、2′-氟-或2′-叠氮基-核糖、碳环形糖类似物、α-端基异构糖、差向异构糖(如阿拉伯糖、木糖或来苏糖)、吡喃糖、呋喃糖、景天庚酮糖、无环类似物和无碱基核苷类似物(如甲基核苷)。一个或多个磷酸二酯键可由其它连接基取代。这些其它连接基包括但不限于以下实施方案,在实施方案中磷酸酯被P(O)S(“硫酯”)、P(S)S(“二硫酯”)、(O)NR2(“酰胺化物”)、P(O)R、P(O)OR′、CO或CH2(“formacetal”)取代,其中每一R或R′独立地为H或者为取代或未取代烷基(1-20 C),取代或未取代烷基任选地包含醚(-O-)键、芳基、链烯基、环烷基、环链烯基或芳烷基。多核苷酸中并非所有的键都需要相同。前面的描述适用于所有此处提及的多核苷酸,包括RNA和DNA。
此处所用的“标记的dNTP”或“标记的rNTP”分别是指直接或间接与标记相连的dNTP或rNTP,或它们的类似物。例如,标记的dNTP或rNTP可为直接用如染料和/或可检测部分标记的dNTP或rNTP,其中所述可检测部分如特异结合对(如生物素-亲合素)。标记的dNTP或rNTP也可以通过将其结合到如标记可结合的部分而进行间接标记。dNTP或rNTP可以包含这样一个部分(例如氨基),其可以在dNTP或rNTP掺入延伸产物后该部分结合标记。本发明中有用的标记包括荧光染料(如异硫氰酸荧光素、德克萨斯红、罗丹明、绿色荧光蛋白等)、放射性同位素(如3H、35S、32P、33P、125I或14C)、酶(如LacZ、辣根过氧化物酶、碱性磷酸酶)、地高辛配基和显色标记如胶体金或有色玻璃或塑料(聚苯乙烯,聚丙烯,乳胶)珠。可应用多种抗配基与配基(标记标记本身或用作结合标记的物质)。当配基具有天然抗配基(例如生物素、甲状腺素和氢化可的松)时,该配基可用于连接标记的抗配基。
此处所用的dNTP或rNTP的“类型”是指核苷中的特定碱基,即腺嘌呤,胞嘧啶,胸腺嘧啶,尿嘧啶或鸟嘌呤。
此处所用的“寡核苷酸”通常指短的、通常为单链、通常为合成的多核苷酸,其长度通常但并非必需少于约200个核苷酸。本发明的寡核苷酸包括复合引物和前启动子多核苷酸(如PTO)。术语“寡核苷酸”和“多核苷酸”并不相互排斥。以上所述关于多核苷酸的描述同样完全适用于寡核苷酸。
“引物”通常是指带有游离3′-OH基团的核苷酸序列,其可与模板序列(如靶RNA或引物延伸产物)杂交,且可启动与模板互补的多核苷酸的聚合。“引物”可为如一段寡核苷酸。它也可为如与模板自身序列杂交(例如作为发卡环)的一段模板序列(如引物延伸产物或在模板-DNA复合体被RNase切割后产生的模板片段),且可启动核苷酸的聚合。因此引物可以是外源(如加入)引物或内源(如模板片段)引物。
此处所用的“随机引物”是指引物包含的序列并非基于特定或具体的模板序列而设计,而是基于可与模板中的一段或多段序列杂交(在特定条件下)的统计学预期序列(随机引物的序列)。随机引物的序列(或其互补序列)可为或不为天然存在的序列,或存在于目的样本的序列池中。在单一反应混合物中扩增多种RNA样本,通常需利用随机引物的多重性(优选地为大的多重性)。如本领域已经熟知,“随机引物”也可指设计为与所需和/或大量的靶序列杂交的引物群(大量的随机引物)中的一员。随机引物可在核酸序列的多个位点进行杂交。随机引物的使用提供了不需预先了解靶的确切序列而通过聚合酶产生与靶核苷酸互补的引物延伸产物的方法。
此处应用的“原启动子序列”和“前启动子序列”是指单链DNA序列区域,其双链形式可介导RNA转录。在一些情况下,“原启动子序列”、“原启动子”、“前启动子序列”、“前启动子”、“启动子序列”和“启动子”可以互用。
此处所用的“前启动子多核苷酸”是指包含前启动子序列的多核苷酸。前启动子多核苷酸的实例有前启动子模板寡核苷酸(PTO)。
此处所用的“前启动子模板寡核苷酸”(PTO)和“启动子模板寡核苷酸”(PTO)是指包含前启动子序列和可与引物延伸产物的3’区域杂交(在给定的条件下)部分(通常为3’区域)的寡核苷酸。前启动子序列与可杂交的部分可以相同、不同或重叠核苷酸。
“抑制”是指与参考相比活性、功能和/或量的降低或减少。
“复合体”是组分的装配。复合体可稳定或不稳定,且可被直接或间接检测到。例如,如此处所述,如果给定反应的组分以及反应产物的类型,可推知复合体的存在。对本发明而言,复合体相对于最终扩增产物而言通常为一个中间产物。复合体的一个实例是包含第一引物延伸产物和第二引物延伸产物的核酸双链体。
于此可互换使用的多核苷酸或寡核苷酸的“部分”或“区域”为2个或更多碱基的相邻序列。在另它实施方案中,区域和部分至少为约3、5、10、15、20、25个相邻核苷酸中的任一种。
与另一序列“相邻的”区域、部分或序列直接毗邻该另一区域、部分或序列。例如,与复合引物的的5’DNA部分相邻的RNA部分直接与5’DNA区域毗邻。此实例的阐述见图1A和2A。
反应混合物是指组分的集合,所述组分在合适的条件下反应并形成复合体(可为中间体)和/或产物。
“A”、“an”和“the”等除非特别指出均表明包括复数形式。
“包含”指包括。
“允许”事件发生的条件或“适于”事件发生的条件(如杂交、链延伸等)或“合适的”条件为不阻止此类事件发生的条件。因此,这些条件允许、增强、促进和/或有利于事件的发生。本领域内并在此描述的这些条件取决于诸如核苷酸序列的性质、温度和缓冲液。这些条件也取决于所需进行的事件如杂交、切割、链延伸或转录。
此处使用的序列“突变”是指目的序列中与参考序列相比的任何序列改变。参考序列可为野生型序列或希望与目的序列进行对比的序列。序列突变包括由于置换、缺失或插入机制引起的序列中单核苷酸改变或多于一个核苷酸的变化。单核苷酸多态性(SNP)也为此处描述的序列突变。
此处所用的“单链构象多态性”和“SSCP”通常指单链核酸受其特定核酸序列影响的特定构象,单链多核苷酸序列的改变如单核苷酸的置换、缺失或插入导致单链多核苷酸构象的改变或多态性。多核苷酸的构象通常可用本领域已知的方法(如通过凝胶电泳、毛细管电泳测定电泳迁移率和/或对核酸内切酶消化的易感性)进行检测、鉴定和/或区别。
此处可互用的“微阵列”和“阵列”包括带有生化样本(靶,通常具有未确定的特性)推断的结合(如通过杂交)位点的阵列(优选地为规则阵列)的表面。在一个优选的实施方案中,微阵列指固定在基片特定部位的不同的多核苷酸或寡核苷酸探针的集合。阵列在基片上形成,其中制作基片的材料如纸、玻璃、塑料(如聚丙烯、尼龙、聚苯乙烯)、聚丙烯酰胺、硝酸纤维、硅、光纤或任何其它合适的固体或半固体支持物,并制成二维(如玻璃片、硅芯片)或三维(例如针、纤维、珠、微粒、微滴定孔、毛细管)形状。构成阵列的探针可通过多种方式固定到基片上,包括(i)用照相平版印刷技术进行原位合成(如高密度寡核苷酸阵列)(见Fodor等,科学(1991),251:767-773;Pease等,美国国家科学院院报(1994),91:5022-5026;Lockhart等,自然生物技术(1996),14:1675;美国专利号5,578,832;5,556,752和5,510,270);(ii)以中到低密度点样/印制(如cDNA探针)到玻璃、尼龙或硝酸纤维上(Schena等,科学(1995),270:467-470,DeRisi等,自然遗传学(1996),14:457-460;Shalon等,基因组研究(1996),6:639-645;和Schena等,美国国家科学院院报(1995),93:10539-11286);(iii)通过掩模(Maskos和Southern,核酸研究(1992),20:1679-1684)和(iv)通过在尼龙或硝酸纤维杂交膜上斑点印迹(见例如Sambrook等编辑,1989,分子克隆:实验室手册,第二版,1-3卷,冷泉港实验室(冷泉港,纽约))。探针也可通过与锚杂交、通过磁珠或如在微滴定板或毛细管的液相中非共价固定片上。探针分子通常为核酸如DNA、RNA、PNA和cDNA,但也可包括蛋白质、多肽、寡糖、细胞、组织和其任一可特异结合靶分子的变化形式。
术语“3’”通常指这样的区域或位置,其在同一多核苷酸或寡核苷酸中为另一区域或位置的3’(下游)。
术语“5’”通常指这样的区域或位置,其在同一多核苷酸或寡核苷酸中为另一区域或位置的5’(上游)。
术语“3′-DNA部分”、“3′-DNA区域”、“3′-RNA部分”和“3′-RNA区域”是指位于朝向多核苷酸或寡核苷酸3’末端的多核苷酸或寡核苷酸部分或区域,可包括或不包括同一多核苷酸或寡核苷酸的3’最末端核苷酸或与3’最末端核苷酸连接的部分。3’最末端核苷酸优选地为从约1到约50个核苷酸,更优选地为从约10到约40个核苷酸,且更优选地为从约20到约30个核苷酸。
术语“5′ DNA部分”、“5′DNA区域”、“5′RNA部分”和“5′RNA区域”是指位于朝向多核苷酸或寡核苷酸5’末端的核苷酸或寡核苷酸的部分或区域,可包括或不包括同一多核苷酸或寡核苷酸的5’最末端核苷酸或与5’最末端核苷酸连接的部分。5’最末端核苷酸优选地为从约1到约50个核苷酸,更优选地为从约10到约40个核苷酸,且更优选地为从约20到约30个核苷酸。
正如本领域技术人员所完全理解的,引物的“尾部”序列是指在引物的其它区域或部分与靶杂交的情况下不与靶序列杂交的序列。
此处所用的产物的“缺少”或“缺乏”以及“无检测产物”包括由于经过循环而缺少产物的显著的聚集,而以可忽略的或极低水平产生。
本发明扩增方法
以下是本发明的扩增方法的实例。应当理解即使提供了一般性的描述,也可应用多种其它实施方案。例如,谈到使用复合引物意指可使用此处描述的任何复合引物。
一方面,本发明提供了利用复合引物和第二引物产生与目的RNA序列互补的多核苷酸(DNA)序列多拷贝的方法。在这种方法中,利用两种引物(复合引物和第二引物)和链置换来达到等温线性核酸序列扩增。在一些实施方案中包括转录步骤(即“增强”的方法),并且产生正义RNA形式的扩增产物。
另一方面,本发明提供利用单引物(其为复合引物)产生与目的RNA序列互补的DNA序列多拷贝(扩增)的方法。在这种方法中,利用单复合引物、靶RNA片段(其作为内源引物)和链置换来达到等温线性核酸序列扩增。在一些实施方案中包括转录步骤(即“增强”的方法),并且产生正义RNA形式的扩增产物。
正如此处所述,本发明扩增方法还可以包括转录步骤。如果待转录的引物延伸产物包含前启动子序列,通常利用包含前启动子的多核苷酸(于此也称做“前启动子多核苷酸”)与引物延伸产物杂交来产生双链启动子区域。如果引物延伸产物不包含所需的前启动子序列,转录步骤通常依赖于RNA聚合酶前启动子序列的掺入,通过使用前启动子多核苷酸诸如启动子序列寡核苷酸(PTO)来进行。前启动子多核苷酸如PTO作为单链引物延伸产物延伸和部分双链体形成的模板,上述部分双链体在其一端包含双链启动子。单链产物与前启动子多核苷酸(如PTO)杂交的能力一般通过产生具有特定3’末端序列的引物延伸产物来获得,上述特定3’末端序列与前启动子多核苷酸3’末端序列互补。
本发明方法一方面包括可与RNA序列(如多种RNA序列)杂交的引物的设计,上述引物的设计是为了启动引物延伸起始以及产生扩增底物和产物。
利用复合引物和第二引物的线性核酸序列扩增
本发明提供通过使用复合引物和第二引物以及链置换扩增目的RNA序列的方法。使用这些方法的扩增为线性扩增,而且可以等温进行。在不包括转录步骤的实施方案中,扩增产物为包含与靶RNA中目的RNA序列具互补序列的单链DNA。在包括转录步骤的实施方案中,扩增产物为靶RNA中目的RNA序列的正义RNA拷贝。
基于复合引物、第二引物和链置换的本发明方法的一个实施方案的示意图在图1A-B和2A-C中给出。图1A-B图解了非增强线性方法。图2A-C图解了增强(即包括转录步骤)方法。方法包括下述步骤:(a)形成与输入RNA同义的第二链cDNA;(b)第二链cDNA的互补链的线性扩增,其通过沿第二链cDNA进行引物延伸(从复合引物)和链置换实现;以及,在增强方法中(c)线性扩增步骤产物的转录,以产生多拷贝正义RNA产物。如图所示,尽管每一步骤的温度可以相同或不相同,所有步骤可以等温进行。
图1A-B图示的实施方案使用两种寡核苷酸:用于扩增的复合引物(标为1);和用于正义互补链DNA(cDNA)(可互换地称做“第二引物延伸产物”或“第二链cDNA”)形成的第二引物(标为2)。图2A-C图示的实施方案使用三种寡核苷酸:用于扩增的复合引物(标为1);用于第二链(正义)cDNA形成的第二引物(标为2);和包含DNA依赖的RNA聚合酶的前启动子序列的多核苷酸,即前启动子模板寡核苷酸(PTO)(标为3)。
根据想要扩增的RNA的类型、分类、群体和/或种类,复合引物的3’部分可以设计为许多方法的任何一种(根据序列来设计)。在一些实施方案中,如图1和2中所示,复合引物1的3’部分包含与mRNA的多聚A尾互补的序列,并且在3’部分的3’末端还可以包含额外的随机序列(通常不与多聚A序列互补)。在另外的实施方案中,复合引物1的3’部分为包含可与多种RNA(其可以从2或更多到许多成百上千或更多)杂交的序列的随机引物。随机引物为本领域公知,例如,它们广泛用于基于PCR方法的cDNA文库的制备。正如本领域所充分理解的那样,“随机引物”可以指一个引物群(多种随机引物)中的一种,上述引物群为与一个想要的和/或大量的靶序列杂交而共同被设计。随机引物可以与核酸序列的多个位点杂交。
在另外的实施方案中,复合引物1的3’部分可以包含与一个特异RNA或RNA家族(或其部分)互补或杂交的序列。
在如图1和2所示的一些实施方案中,复合引物1的5’部分可以是不可与靶序列杂交(在3’部分与靶RNA杂交的条件下)的序列,如在引物与靶杂交时形成“尾”的序列。这个“尾”序列通常掺入第一引物延伸产物(第一链cDNA),并且这个尾的互补序列掺入第二引物延伸产物(第二链cDNA)的3’末端。因此,在一些实施方案中,复合引物1为包含相同5’RNA部分和多种3’DNA部分的复合引物的混合物,选择用以扩增多种(其可以是很小到很大)目的RNA序列。在另外的实施方案中,复合引物1的5’部分可以与靶RNA杂交。尽管图1和2描绘的与靶序列杂交的3’部分为DNA部分,并且不与靶杂交的5’部分为RNA部分,应理解DNA部分可以包含“尾”的一部分,并且反过来RNA部分可以和靶RNA杂交。例如,复合引物的5’RNA部分可部分杂交而部分不杂交,或复合引物的DNA部分可部分杂交而部分不杂交,或两者都是。
正如这些图解阐明的,复合引物1在其3’末端包含DNA部分A和在其5’末端包含RNA部分B。正如于此所讨论,也可能使用这样一种复合引物,所述复合引物3’DNA后在其5’方向上是RNA部分,其后是DNA部分。每一这些部分的长度一般由最大扩增效率来确定。在图1A-B和图2A-C中显示的复合引物只有两部分(即3’-DNA-RNA-5’)。
如图1A-B和图2A-C所示,引物2可由但并非必需由DNA组成,并且可以包含2个部分(可互换地称为“部分”或“区域”)。引物2的3’部分F可以选择用以随机引发生物样品中许多、大部分和/或所有可能的mRNA序列。随机引物为本领域公知,例如,它们广泛用于基于PCR方法的cDNA文库制备。引物2的5’部分E可以为不与特异靶序列互补且基本上不可杂交的序列,即其不发生杂交(在3’部分与靶RNA杂交的情况下),并且形成尾。“尾”序列通常掺入第二引物延伸产物,并且在线性扩增步骤的DNA产物的3’末端序列中通常包含该序列的互补序列。在另外的实施方案中,如果不需要进行增强的扩增(如下所述),引物2的5’末端部分E可以与第一引物延伸产物中的靶序列杂交。
正如图2A-C所示,启动子模板寡核苷酸3(PTO)可以按如下设计:3’部分与引物2的E部分相同。这种设计使PTO与线性扩增产物的3’末端杂交成为可能。PTO的5’最末端部分为DNA依赖的RNA聚合酶的启动子序列,其如前所述用于本发明扩增方法的某些(即增强方法)的实施方案中。一般地,这两个部分之间的序列设计用以实现所选的聚合酶的最佳转录。这种序列的选择和设计的标准本领域公知。
为方便起见,图1和2中仅描述和图解一种第一引物延伸产物(第一链cDNA)和第二引物延伸产物(第二链cDNA)。应当理解,本发明方法不仅对于产生大量的一种特异核酸序列有用,而且可以用于同时扩增位于相同或不同靶核酸分子上的多于一种的不同特异核酸序列。例如,本发明方法用于扩增样品中所有的mRNA,或用于扩增样品中多种特异的RNA或RNA家族。
正如图1A-B所示,在一个实施方案中,本发明扩增方法的过程如下所述,所述过程导致产生基于RNA的包含与目的RNA序列具互补序列的DNA产物:
A)线性扩增的双链cDNA底物的形成
1.通过随机序列A部分(其可以至少部分基于mRNA的多聚A序列)的杂交,引物1结合到样品中的RNA上,形成复合体I(图1A)。
2.反转录酶(表示为RT)沿引物1杂交的靶RNA链延伸杂交的引物1,形成RNA/DNA双链体。RNaseH降解杂合双链体的靶RNA链产生单链第一链cDNA(标为II)。II的5’末端为引物1。
3.通过序列F的杂交,引物2结合到第一链cDNA上形成复合体III。
4.引物2通过DNA聚合酶沿cDNA链II延伸形成双链产物(标为IV)。利用RNA依赖的DNA聚合酶比如反转录酶沿II的5’RNA部分的引物延伸导致在复合体IV的一个末端产生RNA/DNA杂合体。
5.RNaseH降解在复合体IV的一个末端的RNA/DNA杂合体上的RNA部分,产生具有3’DNA单链末端的部分双链复合体(标为V),所述3’DNA单链末端具有复合引物1B部分的互补序列。RNaseH活性可以由RNA依赖的DNA聚合酶(如反转录酶)提供或者可以由单独的酶提供。用于本方法的反转录酶可以具有或不具有RNaseH活性。
B)等温线性扩增
1.通过RNA B部分和与其互补的单链DNA末端的杂交,引物1结合到复合体V上形成复合体VI。引物1的3’DNA序列并不杂交。
2.复合体VI上结合的引物1的3’末端和DNA链紧挨着的上游5’末端相同,并且会竞争与相反链的杂交。不被理论所束缚,认为:DNA聚合酶与杂交引物的3’末端的高亲合性会使两种竞争结构的平衡向新引物3’末端的杂交和以前引物延伸产物(标为VII)5’末端的置换的方向进行。沿第二链(正义)cDNA链的引物延伸导致以前第二引物延伸产物(VII)的置换,和引物2序列E的复制,形成复合体VIII。
3.复合体VIII在其一端具有由序列B及其互补序列构成的RNA/DNA杂合体。杂合体的RNA部分被RNaseH降解,形成复合体IX,其导致单链3’末端的形成,新的引物1可以通过其5’B部分结合到所述单链3’末端。
4.双链体中以前引物延伸产物的5’最末端的置换而导致的结合的引物1的3’末端序列A的杂交、引物延伸和以前产物的置换,上述进程如图1A-B所示连续进行,并导致多拷贝反义单链DNA产物(标为VII)积聚。这些产物在其3’末端具有与引物2的E部分互补的序列,并且在其5’末端具有与复合引物序列A基本相同(通常相同)的序列。Kurn美国专利号6,251,639B1。
增强方法的一个实施方案在图2A-C中阐明。在这个实施方案中,在产生包含目的RNA序列互补序列的DNA产物后,进行下述步骤。
C)DNA产物的转录
1.PTO(参见图2C)通过其3’末端序列与DNA产物XII的3’末端序列杂交而结合到DNA产物XII上形成复合体XIII。优选但不必需封闭PTO3’末端以使其不能被DNA聚合酶延伸。
2.DNA聚合酶沿PTO模板延伸复合体XIII中产物XII的3’末端,以形成在其一端包含双链启动子序列的复合体XIV。
3.DNA依赖的RNA聚合酶结合到复合体XIV的双链启动子,转录反义单链DNA产物以产生多拷贝正义RNA产物(标为XV)。多种产物XV代表输入RNA库中多序列的多种拷贝。Kurn美国专利号6,251,639B1。
本发明方法可以用于产生样品中多种RNA序列的多拷贝。例如,复合引物可以包含多聚dT序列,其预期会与样品中所有mRNA的多聚A尾杂交,或者复合引物通常可包含至少与随机或部分随机序列(如包含多聚dT序列和随机序列,其预期与mRNA的多聚A尾的开始部分杂交)杂交的3’部分。另一方面,本发明方法可以用于产生特异种类的RNA或RNA种类的一类(如RNA种类的家族或超家族)的多拷贝。在后一所述的情况中,复合引物通常包含与特异RNA靶(或RNA靶家族)序列互补的3’部分。
复合引物的5’RNA部分可以与特异RNA靶序列相关或不相关,并且可以或不可以与RNA靶杂交,例如,其可如此处另外所述形成尾。
尽管上述实施方案中仅叙述了一种复合引物,应当理解,在上述步骤(b)中可以使用不同的复合引物。不同的复合引物包含可与上述复合体IX的单链DNA部分杂交的序列。第二复合引物还可包含与第二引物延伸产物序列的一个部分杂交的序列,其中的述第二引物延伸产物序列的部分位于紧挨复合体IX的单链DNA的5’部分。第二复合引物通常包含与第一复合引物的重叠序列。第二复合引物与第二引物延伸产物杂交并通过引物延伸而延伸。利用RNase对DNA-RNA异质双链体的切割允许另一第二复合引物的结合、延伸和链置换,由此产生多拷贝单链产物。
为方便起见,图1和2中仅描述和图解了一种第一引物延伸产物(第一链cDNA)和第二引物延伸产物(第二链cDNA)。应当理解,本发明方法不仅用于产生大量的一种特异核酸序列,而且用于同时扩增位于相同或不同靶核酸分子上的多于一种的不同特异核酸序列。例如,本发明方法用于扩增样品中所有的mRNA,或用于扩增样品中多种特异的RNA样本(在这种情况下,可使用多种第一复合引物,其中的每种第一复合引物包含可与特异RNA样本的特异序列杂交的3’部分)或用于扩增RNA样本的家族。
利用单复合引物和靶RNA片段进行线性核酸序列扩增
本发明还提供利用单引物(其为复合引物)、靶RNA片段和链置换来扩增目的RNA的方法。利用这些方法的扩增为线性扩增,并且可以等温进行。在不包括转录步骤的实施方案中,扩增产物为包含与靶RNA中目的RNA序列具互补序列的DNA。在包括转录步骤的实施方案中,扩增产物为靶RNA中目的RNA序列的正义RNA拷贝。
基于单复合引物和链置换的本发明方法的一个非增强(线性)实施方案的示意图在图3A-B中给出。方法包括下述步骤:(a)引物延伸形成靶RNA和第一链cDNA的RNA/DNA异质双链体;(b)异质双链体中RNA靶的不完全降解,以形成第一链cDNA和至少一个接下来能作为引物的RNA片段;(c)形成与输入靶RNA同义的第二链cDNA;(d)通过沿第二链cDNA(由复合引物进行)的引物延伸和链置换线性扩增第二链DNA的互补链,以产生多拷贝反义单链DNA产物。如图所示,尽管每一步骤的温度可以相同或不相同,所有步骤可以等温进行。基于单复合引物和链置换的增强的本发明方法的一个实施方案的示意图在图4A-B中给出。方法包括下述步骤:(a)引物延伸形成靶RNA和第一链cDNA的RNA/DNA异质双链体;(b)异质双链体中RNA靶的不完全降解,以形成第一链cDNA和至少一个接下来能作为引物的RNA片段;(c)形成与输入靶RNA同义的第二链cDNA;(d)通过沿第二链cDNA(由复合引物进行)的引物延伸和链置换线性扩增第二链DNA的互补链,以产生多拷贝反义单链DNA产物;以及(e)线性扩增步骤产物的转录以产生多拷贝正义RNA产物。
此处所述的复合引物用于这些方法中的扩增。如图3A和4A所示,单(复合)引物(标为1)可以由3’-DNA部分(标为A)和5’RNA部分(标为B)组成,上述3’-DNA部分与靶RNA上的序列互补,上述5’-RNA部分含有靶不相关序列(即在一组给定的条件下不可与靶RNA上的序列互补/杂交的序列)。复合引物的3’-DNA部分可以含有多聚dT核苷酸,这使得其(在一组给定的条件下)可与来自真核细胞的mRNA的多聚A3’末端互补/杂交。
与靶RNA杂交的复合引物利用RNA依赖的DNA聚合酶如反转录酶延伸以形成靶RNA和第一链cDNA的RNA/DNA异质双链体。然后利用核糖核酸酶(如RNaseH)降解异质双链体中的靶RNA形成第一链cDNA和一个或多个RNA片段(寡核苷酸)的复合体。RNaseH活性可由RNA依赖的DNA聚合酶(如反转录酶)提供,或者由单独的酶提供。用于本方法的反转录酶可以具有或不具有RNaseH活性。片段是异质双链体中靶RNA的不完全降解产物。这些片段作为DNA依赖的DNA聚合酶的引物起作用,以形成第二链cDNA。Okayama和Berg,分子和细胞生物学(Molecular and Cell Biology)(1982),2:161;和Gubler和Hoffman,基因(Gene)(1983),25:263。然后反转录酶沿复合引物延伸产物(第一链延伸cDNA)的5’RNA序列延伸双链体中第二链cDNA的3’末端,以在双链cDNA产物的末端形成RNA/DNA异质双链体。
存在于双链cDNA末端的异质双链体是RNaseH的底物。RNaseH降解第一链cDNA的5’RNA部分,以产生复合引物的杂交位点,上述复合引物通过其5’RNA部分与双链体cDNA中第二链cDNA的3’末端杂交。新引物的3’DNA部分通过与第二链cDNA上其互补序列的杂交而置换第一链cDNA的5’末端。然后具有强链置换活性的DNA聚合酶沿第二链cDNA延伸新引物,并置换以前形成的cDNA产物。RNaseH降解异质双链体上新引物延伸产物的5’部分,以产生用于新复合引物杂交的游离位点,这样导致了靶序列的连续线性扩增,并产生了多拷贝的与靶RNA序列反义的单链DNA产物。
如图4A-B所描绘和从此处描述显而易见,单复合引物扩增方法也可以包括转录步骤,上述转录步骤以与利用复合引物和第二引物的增强的扩增方法中所述相同的方式使用前启动子多核苷酸。
本发明方法可用于产生样品中多种RNA序列的多拷贝或用于产生特异RNA样本或RNA样本群体的多拷贝。在后一种情况下,复合引物通常包含与特异RNA靶或靶群体(如同源RNA靶或为序列家族或超家族中成员的靶)互补和/或杂交的3’部分。例如引物可以包括引物序列的集合(如在多于一个靶序列存在的情况下)。
本发明方法的另一个应用是检测共有序列侧翼的多变区。通过设计识别共有序列的第一复合引物,产生的单链DNA或RNA产物不仅仅包含引物识别的共有区域,而且包含用于检测序列变体的5’侧翼区域。因此,例如可从有限量的临床材料中产生出单链DNA或RNA产物,上述产物使得可按照常规技术鉴定病原体特异序列(如那些不同的病毒类型)、检测基因多态性或鉴定另外的剪接变体。在另外的实施方案中,产生的单链DNA或RNA产物不仅仅包含引物识别的共有区域(例如保守的或功能序列基序),而且还包含5’侧翼序列,上述5’侧翼序列使得可鉴定含有相似序列基序的RNA样本群。
复合引物的5’RNA部分可以与特异RNA靶序列相关或不相关,并且可以与RNA靶杂交或不杂交。利用“尾”复合引物的本发明方法在于此进一步叙述。
利用单复合引物和靶RNA片段的线性mRNA扩增
正如此处所述,总mRNA可以利用包含足够长度Poly-(T)的复合引物(即Poly-(T)n,其中n一般从约5到50或更多)与基本上全部信使群体杂交来扩增。图5为举例说明的基于链置换的本发明方法的非增强实施方案的示意图,上述方法包括单复合引物的使用,上述单复合引物包含含有多聚dT序列且还含有位于多聚dT序列3’的机序列的3’DNA部分多聚dT序列。复合引物1还包含基本上不与RNA靶序列杂交的5’RNA部分(即在多聚dT序列杂交的情况下形成尾序列)。任选地,第二复合引物可以按如下所述使用。
本方法包括下列步骤:(a)引物延伸以形成靶RNA和第一链cDNA的RNA/DNA异质双链体;(b)形成与输入靶RNA同义的第二引物延伸产物(第二链cDNA)。第二引物延伸产物通常包含与复合引物的5’RNA部分(即尾)互补的3’部分;(c)通过引物延伸(从复合引物)和链置换线性扩增第二链cDNA的互补链,以产生反义单链DNA产物(其与目的RNA序列互补)的多拷贝。
图6为举例说明的基于链置换的本发明方法的非增强实施方案的示意图,上述方法包括单复合引物的使用,上述单复合引物包含含有随机序列的3’DNA部分,并且还包含基本上不与RNA靶序列杂交(即在随机序列杂交的情况下形成尾)的5’RNA序列。任选地,第二复合引物可以按如下所述使用。
本方法包括下列步骤:(a)引物延伸以形成靶RNA和第一链cDNA的RNA/DNA异质双链体;(b)形成与输入靶RNA同义的第二引物延伸产物(第二链cDNA)。第二引物延伸产物通常包含与复合引物的5’RNA部分(即尾)互补的3’部分;(c)通过从复合引物的引物延伸和链置换线性扩增正义DNA链,以产生与目的RNA序列互补的反义单链DNA产物的多拷贝。
如在这些实施方案中所阐明,尽管每一步骤的温度可以相同或不同,但所有的步骤为等温进行。应当理解,在上述提供的一般性描述下,可以进行多种其它的实施方案。还应当理解,第二引物延伸产物的形成可以通过本领域公知或此处描述的任何方法(如通过延伸杂交的第二引物或RNA片段)来进行。
从此处描述显而易见的是,扩增方法也可以包括转录步骤,上述转录步骤以与利用复合引物和第二引物的增强的扩增方法中所述相同的方式使用前启动子多核苷酸。增强的扩增方法的单链RNA产物一般包含与第一复合引物5’RNA部分互补的3’区域。
图7为举例说明的基于链置换的本发明方法的增强实施方案的示意描述,上述方法包括(a)单复合引物的使用,上述单复合引物包含含有随机序列的3’DNA部分,且还包含5’RNA部分,上述5’RNA部分基本上不与RNA靶序列杂交(即在随机序列杂交的情况下形成尾);和(b)前启动子寡核苷酸的使用。任选地,第二复合引物可以按此处所述使用。
本方法包括下列步骤:(a)引物延伸以形成靶RNA和第一链cDNA的RNA/DA异质双链体;(b)形成与输入靶RNA同义的第二引物延伸产物(第二链cDNA),以及利用可切割存在于RNA/DNA异质双链体上RNA的试剂(如RNaseH)切割存在于RNA/DNA异质双链体上的RNA,由此产生包含3’单链部分的第一和第二引物延伸产物的双链复合体(图8中的复合体IX,其对应于图1中所示的复合体IX);和(c)PTO结合到双链产物IX形成复合体X,如图8所示。DNA聚合酶沿PTO模板延伸复合体XIII中的第二引物延伸产物的3’末端,形成复合体XI,上述复合体XI在其一端包含双链启动子序列;和(d)利用DNA依赖的RNA聚合酶转录,产生正义RNA产物的多拷贝。正如所图解,尽管每一步骤的温度可以相同或不相同,所有步骤都等温进行。
如图8中所示,启动子模板寡核苷酸3(PTO)可按如下设计:3’部分与第一复合引物的5’RNA部分(其与模板RNA杂交)相同。这种设计使PTO与第二引物延伸产物(其存在于和第一引物延伸产物的复合体中)中的单链3’部分杂交成为可能。PTO的5’最末端部分为DNA依赖的RNA聚合酶的启动子序列,如上所述,其用于本发明扩增方法的某些(即其它的增强方法)的实施方案中。
利用第一复合引物、第二复合引物和靶RNA的线性mRNA扩增
本发明提供了产生目的RNA序列的单链反义和正义多核苷酸(一般为DNA)拷贝的方法,上述方法利用第一复合引物、第二复合引物和靶RNA,上述第二复合引物用于产生第二链cDNA。在本发明的这一方面,第一复合引物用于产生第一延伸产物(一般为cDNA),如前所述其作为利用复合引物进行线性扩增的底物。另外,第二复合引物用于产生作为线性扩增底物的第二链cDNA,于是导致了目的RNA序列的单链多核苷酸拷贝的产生。
本方法包括如下步骤:(a)双链cDNA的形成,在其每一末端包含RNA-DNA异质双链体;和(b)第一链(正义)cDNA和第二链(反义)cDNA的线性扩增,其通过从第一复合引物和第二复合引物(其结合第一链cDNA)的引物延伸和链置换实现。于是产生了单链第一和第二链cDNA产物,其用于例如产生cDNA文库。显而易见的是:在本发明的这一方面,第二引物延伸产物由复合引物引发。
图8用于阐明本发明的一个实施方案。包含不同“尾”序列的两个复合引物用于产生双链cDNA,上述双链cDNA在其每一cDNA末端包含RNA-DNA异质双链体。利用从RNA/DNA异质双链体上切割RNA的试剂切割RNA,允许另一第一复合引物、另一第二复合引物(其与第一引物延伸产物杂交)的结合、延伸和链置换,由此产生反义单链产物的多拷贝和正义单链DNA产物的多拷贝。正义和反义单链cDNA产物的组合可产生双链cDNA。导致单链cDNA产物产生的本发明扩增方法的过程如下(在图7中所阐明的一个实施方案),其中上述单链cDNA产物包括与目的RNA序列互补的序列和含有目的RNA序列的序列:
A)用于线性扩增的双链cDNA底物的形成
1.通过引物A部分(其可以至少部分基于mRNA的多聚A序列)的杂交,复合引物1结合到样品中RNA靶序列上形成复合体I。
2.反转录酶沿引物1杂交的靶RNA链延伸杂交的引物1,形成RNA/DNA双链体,标为II。用试剂(如RNaseH)降解杂合双链体中的靶RNA链以产生单链第一链cDNA(标为III)。III的5’末端为引物1。
3.通过序列F的杂交,复合引物2结合到第一链cDNA(III),以形成复合体IV。
4.利用DNA聚合酶沿cDNA链III延伸复合引物2,形成由第一和第二链cDNA组成的双链产物(标为V)。利用RNA依赖的DNA聚合酶如反转录酶沿IV的5’RNA部分延伸引物,导致在复合体V的一个末端形成RNA/DNA杂合部分。
5.用试剂(如RNaseH)降解在复合体V一个末端的RNA/DNA杂合体中的RNA部分,产生具有3’DNA单链末端的部分双链复合体(标为VI),其具有复合引物1的B部分的互补序列。
6.通过RNA部分与和RNA部分互补的单链DNA末端的杂交,复合引物1结合到复合体VI上形成复合体VII。
7.沿正义cDNA链延伸结合到复合体VII上的引物1,导致以前引物延伸产物(VII)的置换以及第二复合引物“G”部分的复制,形成复合体VIII。
8.用试剂(如RNaseH)降解RNA/DNA异质双链体上的RNA部分,形成复合体VIII。复合体VIII具有两个RNA/DNA异质双链体,这两个RNA/DNA异质双链体包括在复合体VIII一端的复合引物1及其互补链,在复合体VIII另一端的第二复合引物及其互补链。复合体VIII作为随后称为A和B反应的底物。
B)等温线性扩增
1.在A反应中,第一复合引物结合至复合体VIII。引物延伸和置换产生第一置换产物A。RNase切割产生第一复合引物的结合位点,并且随后引物延伸,由此单链反义DNA产物积聚。
2.在B反应中,第二复合引物结合至复合体VIII(或结合到第一置换产物A)。引物延伸和置换产生单链正义DNA产物。
单链产物可以退火形成第一和第二链cDNA的双链复合体,或可以防止退火(或随后的变性)以产生单链第一和第二链cDNA的混合物。
本发明方法中使用的组分和反应条件
模板核酸
待扩增的RNA靶包括任何来源以纯化或非纯化形式的RNA,其可以是RNA和它的片段,上述RNA诸如总RNA、tRNA、mRNA、rRNA、线粒体RNA、叶绿体RNA、DNA-RNA杂合体、或它们的混合物,上述RNA来源于任何来源和/或种类,包括人、动物、植物和微生物,诸如细菌、酵母、病毒、类病毒、霉菌、真菌、植物。RNA可以利用本领域常规技术获得和纯化。DNA靶(包括基因组DNA靶)的扩增需要将DNA靶起始转录成RNA形式。其可以利用公开在Kurn美国专利号6,251,639B1上的方法和本领域公知的其他技术实现。DNA-RNA杂合体的扩增需要杂合体的变性以获得ssRNA,或在DNA链转录后变性,以获得RNA。靶RNA可以是复杂混合物诸如生物样品的仅仅一小部分,并可以利用本领域公知的方法从多种生物材料中获得。靶RNA可以是已知的或未知的,并且可以包含多于一种想要的特异目的核酸序列,每一目的核酸序列彼此之间可以相同或不同。因此,扩增过程不仅用于产生大量的一种特异核酸序列,而且用于同时扩增位于同一或不同核酸分子上的多于一种的不同特异核酸序列。
靶RNA序列扩增的起始步骤是获得单链靶序列。如果靶核酸为双链(如RNA/DNA杂合体),起始步骤为靶变性。变性也可以用于去除存在于RNA靶分子上的二级结构。变性步骤可为领域内已知的热变性或任一其它方法。
复合引物
本发明方法使用包含RNA部分和DNA部分的复合引物。如此处所述,当用于此处描述的RNA扩增方法的杂交和起始时,复合引物通常包含与RNA靶序列杂交的DNA部分(其依据设计用于扩增的RNA的性质(是样本还是一个群体),如此所述可以具有任何数目的序列变化)。当用于扩增通过此处所述的本发明方法产生的cDNA链时,复合引物的设计使得随后通过结合一个新的(另外的)复合引物而进行的引物延伸产物的置换和通过聚合酶而进行的新引物延伸得以实现。另外,引物延伸产物中RNA部分的切割导致产生的扩增产物,不是用于复合引物扩增的底物。应当理解,在以下部分一般性描述用于本发明方法的复合引物的方面时,如果用于RNA扩增(产生第一延伸产物)的杂交和起始和/或线性置换扩增时,描述的特性可以应用于引物。
在本发明方法和组合物中使用的复合引物包含可与靶RNA杂交的序列。可与靶RNA杂交的序列可基于特异靶RNA(例如特定基因的mRNA)的特定序列,或者基于已知存在于多种RNA样本中的较普遍存在的序列类型,如多聚A尾序列在本领域中广泛认为存在于所有真核mRNA中。另外,可与靶RNA杂交的序列可以包含与mRNA的多聚A尾互补的序列,且还可以在其3’部分的3’末端包含额外的随机序列(其通常不与多聚A序列互补)(或者包含随机序列群体)。
可与靶RNA杂交的序列也可以包含随机序列。随机引物为本领域公知, (参见例如,)并且至少包括下列引物:可与样品中两个或多个序列杂交的引物;以及包含可与样品中多种RNA(如所有的mRNA)杂交的多聚dT序列的引物。为方便起见,以上讨论的是单随机引物。然而,应当理解,术语“随机引物”可以指一群引物中的一个成员引物,上述引物群共同设计用于针对一个想要的和/或大量靶序列群。
还应当理解,在单一反应混合物中扩增多种mRNA样本可以但并非必需使用多种(从两种到许多种)引物。因此,当在单一反应混合物中扩增多种mRNA样本时,发明考虑使用多种不同的复合引物(随机或非随机引物)。
在一些实施方案中,本发明方法使用第一复合引物,包括涉及第二链cDNA链的线性置换扩增(SPIA)的那些步骤。在另外的实施方案中,本发明方法使用不同的第一和第二复合引物。第二复合引物用于线性置换扩增(SPIA)步骤,并且可以包含第一复合引物的一些或所有序列,并且第一复合引物可以包含第二复合引物的一些或所有序列。在一些实施方案中,第二复合引物包含与第一复合引物不同的序列。
在一些实施方案中,复合引物设计为使整个引物与靶RNA杂交。在另外的实施方案中,复合引物包含(在给定的条件下)不与靶序列杂交的序列(优选地在其5’末端)(例如,当引物与靶结合时,形成“尾”的非杂交5’部分)。复合引物的单独DNA和RNA部分可以与靶RNA完全或部分杂交。例如,复合引物的5’RNA部分可以部分杂交和部分不杂交,或者复合引物的DNA部分可以部分杂交和部分不杂交,或两者都有。另外,DNA部分可以组成“尾”的一部分,并且RNA部分可以与靶RNA部分或完全杂交。例如,复合引物的5’RNA部分可以部分杂交和部分不杂交,或者复合引物的DNA部分可以部分杂交和部分不杂交,或两者都有。
对用于线性置换扩增而言,复合引物包含至少一个RNA部分,其可以(a)与第二链cDNA(可互换地称为“第二引物延伸产物”或“复合引物延伸产物”)上的序列结合(杂交),上述结合(杂交)不依赖于DNA部分与同一第二链cDNA上序列的杂交;和(b)当与第二引物或片段延伸产物杂交后可用试剂如核糖核酸酶切割。复合引物结合到第二链cDNA形成部分异质双链体,在接触切割RNA/DNA杂合体中的RNA的试剂(如酶,如核糖核酸酶(如RNaseH))时,只有上述异质双链体中的引物的RNA部分被切割,而第二链cDNA保持完整,这样使得另一复合引物的退火成为可能。
当复合引物用于此处所述的线性置换扩增时,复合引物也包含可与第二链cDNA上序列杂交的3’DNA部分,这样该复合引物与第二链cDNA的杂交优于该复合引物与通过DNA聚合酶从第二链cDNA置换的核酸链的杂交。这些引物可以在熟知影响核酸结合亲和力因素的基础上合理设计,上述影响核酸结合亲和力的因素如序列长度和/或同一性,以及杂交条件。在一个优选的实施方案中,复合引物的3’DNA部分与第二链cDNA上互补序列的杂交要优于置换链的5’末端的同源序列与第二链cDNA的杂交。
产生适用于通过聚合作用延伸的引物为本领域公知,诸如在PCT公开号WO99/42618(及其中引用的参考文献)中所描述。复合引物包含RNA和DNA的组合(参见上述定义),其3’末端核苷酸为适于核酸延伸的核苷酸。3’末端核苷酸当存在于引物中时可为任一在DNA聚合酶作用下可延伸的核苷酸或类似物。通常3’末端核苷酸具有3’-OH。合适的引物包括那些包含至少一个RNA部分和至少一个DNA部分的引物。例如,复合引物可以包含5’RNA部分和3’DNA部分(其中RNA部分与3’DNA部分毗邻);或5’和3’DNA部分中间插有RNA部分。因此,在一个实施方案中,复合引物包含5’RNA部分和3’DNA部分,优选地其中RNA部分与3’DNA部分毗邻。在另一实施方案中,复合引物包含5’和3’DNA部分和至少一个插入RNA部分(即RNA部分在两个DNA部分之间)。又在另一实施方案中,本发明的复合引物包含3’DNA部分和至少一个插入RNA部分(即RNA部分在DNA部分之间)。
包含3’DNA部分和RNA部分的复合引物中RNA部分的长度可以优选地从约1到约50,更优选地从约3到约20,甚至更优选地从约4到约15,且最优选地从约5到约10个核苷酸。在包含3’DNA部分和RNA部分的复合引物的一些实施方案中,RNA部分可至少为约1、3、4、5个核苷酸中的任何一种,其上限为约10、15、20、25、30、50个核苷酸中的任何一种。
包含5’RNA部分和3’DNA部分的复合引物中5’RNA部分的长度可以优选地从约3到约50,更优选地从约5到约20,甚至更优选地从约7到约18,优选地从约8到约17个核苷酸,且最优选地从约10到约15个核苷酸。在包含5’RNA部分和3’DNA部分的复合引物另外的实施方案中,5’RNA部分可以至少为约3、5、7、8、10个核苷酸中的任何一种,其上限为约15、17、18、20、50个核苷酸中的任何一种。在一个实施方案中,复合引物具有约14个核苷酸的RNA部分。
在包含5’RNA部分和3’DNA部分且还包含非5’RNA部分的复合引物的实施方案中,非5’RNA部分可以优选地从约1到约7,更优选地从约2到约6,且最优选地从约3到约5个核苷酸。在某些包含5’RNA部分和3’DNA部分且还包含非5’RNA部分的复合引物的实施方案中,非5’RNA部分可以至少为约1、2、3、5个核苷酸中的任何一种,其上限为约5、6、7、10个核苷酸中的任何一种。
在包含5’RNA部分和3’DNA部分且其中5’RNA部分与3’DNA部分毗邻的复合引物的实施方案中,5’RNA部分的长度可以优选地从约3到约50,更优选地从约5到约20,甚至更优选地从约7到约18个核苷酸,优选地从约8到约17个核苷酸,且最优选地从约10到约15个核苷酸。在某些包含5’RNA部分和3’DNA部分且其中5’RNA部分与3’DNA部分毗邻的复合引物的实施方案中,5’RNA部分可以至少为约3、5、7、8、10个核苷酸中的任何一种,其上限为约15、17、18、20、50个核苷酸中的任何一种。
在包含5’和3’DNA部分并具有至少一个插入RNA部分的复合引物中,插入RNA部分的长度可以优选地从约1到约7,更优选地从约2到约6,且最优选地从约3到约5个核苷酸。在包含5’和3’DNA部分且具有至少一个插入RNA部分的复合引物的一些实施方案中,插入RNA部分可以至少为约1、2、3、5个核苷酸中的任何一种,其上限为约5、6、7、10个核苷酸中的任何一种。在包含3’DNA部分和至少一个插入RNA部分的复合引物中,插入RNA部分的长度可以优选地从约1到约7,更优选地从约2到约6,且最优选地从约3到约5个核苷酸。在包含3’DNA部分和至少一个插入RNA部分的复合引物的一些实施方案中,插入RNA部分可以至少为约1、2、3、5个核苷酸中的任何一种,其上限为约5、6、7、10个核苷酸中的任何一种。包含3’DNA部分和至少一个插入RNA部分且还包含5’RNA部分的复合引物中,5’RNA部分的长度可以优选地从约3到约25,更优选地从约5到约20,甚至更优选地从约7到约18个核苷酸,优选地从约8到约17个核苷酸,且最优选地从约10到约15个核苷酸。在包含3’DNA部分和至少一个插入RNA部分且还包含5’RNA部分的复合引物的一些实施方案中,5’RNA部分可以至少为约3、5、7、8、10个核苷酸中的任何一种,其上限为约15、17、18、20个核苷酸中的任何一种。
在包含3’DNA部分和RNA部分的复合引物中,3’DNA部分的长度可以优选地从约1到约20,更优选地从约3到约18,更优选地从约5至约15,且最优选地从约7到约12个核苷酸。在包含3’DNA部分和RNA部分的复合引物的一些实施方案中,3’DNA部分可以为至少约1、3、5、7、10个核苷酸中的任何一种,其上限为约10、12、15、18、20、22个核苷酸中的任何一种。
在包含5’RNA部分和3’DNA部分的复合引物中,3’DNA部分的长度可以优选地从约1到约20,更优选地从约3到约18,甚至更优选地从约5到约15,且最优选地从约7到约12个核苷酸。在包含5’RNA部分和3’DNA部分的复合引物的一些实施方案中,3’DNA部分可以为至少约1、3、5、7、10个核苷酸中的任何一种,其上限为约10、12、15、18、20、22个核苷酸中的任何一种。
在包含5’RNA部分和3’DNA部分且还包含非3’DNA部分的复合引物的实施方案中,非3’DNA部分可以优选地从约1到约10,更优选地从约2到约8,且最优选地从约3到约6个核苷酸。在包含5’RNA部分和3’DNA部分且还包含非3’DNA部分的复合引物的一些实施方案中,非3’DNA部分可以为至少约1、2、3、5个核苷酸中的任何一种,其上限为约6、8、10、12个核苷酸中的任何一种。
在包含5’RNA部分和3’DNA部分且其中5’RNA部分与3’DNA部分毗邻的复合引物的实施方案中,3’DNA部分的长度可以优选地从约1到约20,更优选地从约3到约18,甚至更优选地从约5到约15,且最优选地从约7到约12个核苷酸。在包含5’RNA部分和3’DNA部分且其中5’RNA部分与3’DNA部分毗邻的复合引物的一些实施方案中,3’DNA部分可以为至少约1、3、5、7、10个核苷酸中的任何一种,其上限为约10、12、15、18、20、22个核苷酸中的任何一种。
在包含5’和3’DNA部分且具有至少一个插入RNA部分的复合引物中,非3’DNA部分的长度可以优选地从约1到约10,更优选地从约2到约8,且最优选地从约3到约6个核苷酸。在包含5’和3’DNA部分且具有至少一个插入RNA部分的复合引物的实施方案中,非3’DNA部分可以为至少约1、2、3、5个核苷酸中的任何一种,其上限为约6、8、10、12个核苷酸中的任何一种。
在包含5’和3’DNA部分且具有至少一个插入RNA部分的复合引物中,3’DNA部分的长度可以优选地从约1到约20个核苷酸,更优选地从约3到约18个核苷酸,甚至更优选地从约5到约15个核苷酸,且最优选地从约7到约12个核苷酸。在包含5’和3’DNA部分且具有至少一个插入RNA部分的复合引物的实施方案中,3’DNA部分可以为至少约1、2、5、7、10个核苷酸中的任何一种,其上限为约10、12、15、18、20、22个核苷酸中的任何一种。
在包含3’DNA部分且具有至少一个插入RNA部分的复合引物中,非3’DNA部分(即除3’DNA部分以外的任何DNA部分)的长度可以优选地从约1到约10个核苷酸,更优选地从约2到约8个核苷酸,且最优选地从约3到约6个核苷酸。在包含3’DNA部分且具有至少一个插入RNA部分的复合引物的一些实施方案中,非3’DNA部分可以为至少约1、3、5、7、10个核苷酸中的任何一种,其上限为约6、8、10、12个核苷酸中的任何一种。在包含3’DNA部分且具有至少一个插入RNA部分的复合引物中,3’DNA部分的长度可以优选地从约1到约20个核苷酸,更优选地从约3到约18个核苷酸,甚至更优选地从约5到约15个核苷酸,且最优选地从约7到约12个核苷酸。在包含3’DNA部分和至少一个插入RNA部分的复合引物的一些实施方案中,3’DNA部分可以为至少约1、3、5、7、10个核苷酸中的任何一种,其上限为约10、12、15、18、20、22个核苷酸中的任何一种。应当理解,为在本发明方法的反应条件下合适,不同部分的长度可以更多或更少。
在一些实施方案中,复合引物的5’DNA部分包含引物的最5’端核苷酸。在一些实施方案中,复合引物的5’RNA部分包含引物的最5’端核苷酸。在另外的实施方案中,复合引物的3’DNA部分包含引物的最3’端核苷酸。在一些另外的实施方案中,3’DNA部分与5’RNA部分毗邻,并包含引物的最3’端核苷酸(并且5’RNA部分包含引物的最5’端核苷酸)。
复合引物的总长度可以优选地从约10到约50个核苷酸,更优选地从约15到约30个核苷酸,且最优选地从约20到约25个核苷酸。在一些实施方案中,长度可以为至少约10、15、20、25个核苷酸中的任何一种,其上限为约25、30、50、60个核苷酸中的任何一种。应当理解,在本发明方法的反应条件下,适当时不同部分的长度可以更长或更短。
在一些实施方案中,复合引物的5′-DNA部分包括该引物5′的最末端核苷酸。在一些实施方案中,复合引物的5′-RNA部分包括该引物5′的最末端核苷酸。在其它实施方案中,复合引物的3′-DNA部分包括该引物3′的最末端核苷酸。在其它实施方案中,3′-DNA部分邻近于5′-RNA部分,并包括该引物3′的最末端核苷酸(且5′-RNA部分包括该引物5′的最末端核苷酸)。
复合引物的总长度可优选地从约10-约50个核苷酸、更为优选地从约15-约30个核苷酸、以及最为优选地从约20-约25个核苷酸。在一些实施方案中,该长度可至少为约10、15、20、25个核苷酸中的任何一种,上限为约25、30、50、60个核苷酸中的任何一种。据认为,该长度在本发明方法的反应条件下适当时可更长或更短。
为实现与靶核酸的杂交(如本领域已众所周知和了解的一样,它取决于其它因素如离子强度和温度),可与靶多核苷酸杂交的引物部分优选地与靶多核苷酸的互补性至少约为60%、更为优选地至少约为75%、甚至更为优选地至少约为90%、以及最为优选地至少约为95%。
如此处所述,在扩增反应中可使用一种或多种复合引物。
第二引物
本发明方法中的第二引物(其引发第二引物延伸产物的产生,其中第二引物延伸产物可互换地称为第二链cDNA,)包含可与第一链cDNA(可互换地称为第一引物延伸产物)在第一链cDNA的位点上杂交(在给定的条件下)的序列(其可以是或不是引物的全部),这样第二链cDNA包括目的RNA序列。在一些实施方案中,第二引物的可杂交序列根据第一链cDNA上想要结合的位点的已知序列设计。在另外的实施方案中,可杂交序列根据例如本领域公知的适合随机引发第一链cDNA的随机序列,上述第一链cDNA从多种RNA样本中产生。在另外的实施方案中,第二引物包含链转换寡核苷酸(在美国专利号5,962,271和5,962,272中描述),其可以与存在于mRNA上的帽序列杂交,并引起反转录酶从mRNA模板转换到转换寡核苷酸,导致由“转换寡核苷酸”引发的第二链cDNA的产生。或者,将同聚物尾序加到第一引物延伸产物的3’末端,这样第二引物包含同聚物尾序的互补序列。
在一些实施方案中,第二引物包含DNA。在其它实施方案中,第二引物由DNA组成。在其它实施方案中(如此处所述)第二引物为靶RNA的片段,上述片段由RNA靶序列的切割产生。
在一些实施方案中,第二引物(其引发第二链cDNA的产生)为复合引物(如上所述)。在这些实施方案中,方法包括下列步骤:(a)双链cDNA的形成,上述双链cDNA在其一端包含RNA-DNA异质双链体;和(b)第一链(正义)cDNA的线性扩增,由此产生单链第一链cDNA的多拷贝。
为与第一链cDNA杂交(正如本领域所知和理解的,这取决于其它因素例如离子强度和温度),第二引物中可与第一链cDNA杂交的序列与第一链cDNA的互补性优选地至少约60%,更优选地至少约75%,甚至更优选地至少约90%,且最优选地至少约95%。
在某些实施方案(通常但并非必需为包括转录的实施方案)中,第二引物也可包含在一组给定的条件下不可与第一链cDNA杂交的序列,优选地为在5’端的序列(其通常包括5’最末端的核苷酸)。该序列使第二链cDNA的5’末端产生特定末端序列(并且因此,随后使单链DNA产物的3’末端产生特定序列)成为可能。单链DNA产物的3’末端具有特定末端序列对于在随后的步骤中前启动子多核苷酸与置换的第一引物延伸产物的杂交特别有利。在某些实施方案中,5’非杂交序列包含其互补序列可被前启动子多核苷酸杂交的序列。包含3’特定末端序列的单链DNA产物对与连接在结合对或基片上的互补寡核苷酸的杂交也是有用的,其中所述基片如此处所述的基因微阵列。
在一个实施方案中,第二引物包含DNA。在另一实施方案中,第二引物包含RNA。又在另一实施方案中,第二引物包含DNA和RNA。
在一些实施方案中,第二引物通过复合引物延伸产物3’末端的自身引发(例如通过发卡环)提供。在这些实施方案中,复合引物延伸产物3’末端的序列与复合引物延伸产物自身的另一序列杂交,例如正如美国专利号6,132,997中所述。在这些实施方案中,在复合引物延伸产物3’端的所述序列通常在其与复合引物延伸产物杂交和/或其沿复合引物延伸产物延伸后被切割(例如,利用S1核酸酶)。美国专利号6,132,997。
在一些实施方案中,第二引物由一个或多个靶RNA片段提供。这种靶RNA片段可以由靶RNA和第一引物延伸产物复合体上的靶RNA被切割RNA/DNA杂合体上RNA的试剂(比如酶)不完全降解而产生,于是一个或多个靶RNA片段仍与第一引物延伸产物保持结合。
包含前启动子并包含与引物延伸产物杂交的区域的多核苷酸
一些实施方案使用了包含前启动子并包含与引物延伸产物产物杂交的区域的前启动子多核苷酸。在一些实施方案中,前启动子多核苷酸作为PTO提供,这一点如下详述。
前启动子模板寡核苷酸
在一些实施方案中,方法使用由前启动子模板寡核苷酸(PTO)提供的用于转录的启动子序列。
在本发明方法和组合物中使用的PTO为单链多核苷酸,一般为DNA,其包含设计用于形成RNA聚合酶的双链启动子的前启动子序列,并包含可与引物延伸产物的3’末端杂交的部分。在本发明的实施方案中,可与引物延伸产物的3’末端杂交的部分包含这样的序列,该序列的互补序列可与第二引物延伸产物的特定末端序列杂交(并且因此,接下来与单链DNA产物的3’末端杂交)。在另一实施方案中,可与引物延伸产物的3’末端杂交的部分包含随机序列。在另一实施方案中,可与引物延伸产物的3’末端杂交的部分包含这样的序列,该序列的互补序列可与多种第一链cDNA的3’末端序列杂交。
在一个优选的实施方案中,前启动子序列位于寡核苷酸的5’部分,并且杂交序列位于寡核苷酸的3’部分。在一个实施方案中,并且最为典型的是,启动子和杂交序列为不同的序列。在另一实施方案中,启动子和杂交序列在序列同一性上有重叠。又在另一实施方案中,启动子和杂交序列为相同的序列,并因此位于PTO的同一位置。在PTO与引物延伸产物杂交导致产生包含突出端(不与置换的引物延伸产物杂交的PTO的5’末端一般包含全部或部分前启动子序列)的双链体的实施方案中,用DNA聚合酶填平突出端,以产生可通过合适的RNA聚合酶实现转录的双链启动子。
允许模板DNA转录的启动子序列为本领域公知并在以上进行了讨论。优选地,选择启动子序列以提供所使用的特定RNA聚合酶的最佳转录活性。此类选择的标准,即尤其为特定RNA聚合酶所偏好的特定启动子序列也为本领域公知。例如,通过T7 DNA依赖的RNA聚合酶和SP6转录的启动子序列为本领域公知。启动子序列可来自于原核或真核源。
在一些实施方案中,PTO在前启动子序列和可与引物延伸产物的3’末端杂交的部分之间包含插入序列。可由经验确定插入序列的合适长度,并且该长度可以至少约为1、2、4、6、8、10、12、15个核苷酸。插入序列合适的序列组成也可以由经验确定,并且与省略这段序列相比,此序列设计优选但不必需增强扩增的程度。在一个实施方案中,插入序列是设计用以提供增强或更优化所使用RNA聚合酶的转录的序列。通常该序列与靶核酸无关(即其基本上不与靶核酸杂交)。当启动子可操作地与该序列连接且从这样的启动子的进行的聚合酶转录活性高于来自没有这样连接的启动子时,更为优化的转录就发生了。需要用于优化转录的序列通常在本领域内是众所周知的,如以前对多种DNA依赖的RNA聚合酶的描述,如在美国专利号5766849和5654142中所描述的,并且也可由经验来确定。
在另一实施方案中,PTO包含前启动子序列5’的序列,即PTO包含位于前启动子序列5’的额外的核苷酸(其可以是或可以不是转录调节序列)。该序列通常但并非必需(在一组给定的条件下)不与引物延伸产物杂交。
在一个实施方案中,PTO不能作为引物有效行使核酸延伸的功能。阻断PTO引物功能的技术包括阻止DNA聚合酶在PTO的3′末端添加核苷酸的任一技术。这些技术在本领域已众所周知,包括例如在PTO的3′最末端进行置换或修饰3′羟基、或掺入修饰的核苷酸,如双脱氧核苷酸,这样使DNA聚合酶不能在PTO的3’最末端锚上额外的核苷酸。可用标记或特异结合对中一员的小分子如生物素封闭3′末端。也可通过加入不与引物延伸产物杂交的核苷酸来使3′末端不可延伸,这归因于非互补性或不支持氢键的结构修饰。在其它实施方案中,PTO未被封闭。
与目的引物延伸产物杂交的PTO部分的长度优选地从约5个至约50个核苷酸,更优选地从约10个至约40个核苷酸,甚至更为优选地从约15个至约35个核苷酸,以及最为优选地从约20个至约30个核苷酸。在一些实施方案中,杂交部分至少约为下述之一:3、5、10、15、20个核苷酸;并小于约下述之一:30、40、50、60个核苷酸。杂交部分与它在目的引物延伸产物上预期结合序列的互补性优选地至少约25%,更为优选地至少约50%,甚至更为优选地至少约75%,以及最为优选地至少约90%。
DNA聚合酶、可切割RNA-DNA杂合体的试剂和RNA聚合酶
本发明扩增方法使用下述酶:RNA依赖的DNA聚合酶、DNA依赖的DNA聚合酶和可切割RNA-DNA杂合体上RNA链的试剂(如核糖核酸酶,诸如RNaseH),以及在一些方面使用了DNA依赖的RNA聚合酶。在单一酶中可找到和使用这些活性中的一种或多种。例如,RNaseH活性可由RNA依赖的DNA聚合酶(如反转录酶)提供,或由单独的酶提供。用于本方法的反转录酶可以具有或不具有RNaseH活性。
本发明的一个方面是从引物-RNA复合体形成双链cDNA。该过程通常利用RNA依赖的DNA聚合酶、DNA依赖的DNA聚合酶和可切割RNA/DNA杂合体上RNA的试剂(如RNaseH)的酶活性。
本发明的方法和组合物中使用的RNA依赖的DNA聚合酶可根据本发明的方法实现引物延伸。因此,优选的RNA依赖的DNA聚合酶是可沿着核酸模板延伸核酸引物的酶,其中所述模板至少主要由核糖核苷酸组成。本发明的方法和组合物中使用的合适RNA依赖的DNA聚合酶包括反转录酶。许多反转录酶如那些来源于鸟成髓细胞性白血病病毒(AMV-RT)和莫洛尼鼠白血病病毒(MMLV-RT)的反转录酶包含一种以上的活性(例如聚合酶活性和核糖核酸酶活性),并可在cDNA分子形成中发挥作用。然而,在一些实例中,优选采用无RNaseH活性的反转录酶。无RNaseH活性的反转录酶在本领域中已众所周知,此类酶包括那些在野生型反转录酶中具有可消除RNaseH活性的突变的反转录酶。在这些情况下,可采用加入其它来源的RNaseH,如分离自大肠杆菌的RNaseH,来形成cDNA。
本发明的方法和组合物中使用的DNA依赖的DNA聚合酶可根据本发明的方法实现引物延伸。因此,优选的聚合酶是可沿着核酸模板延伸核酸引物的酶,其中所述模板至少主要包含脱氧核糖核苷酸。可通过具有RNA依赖的DNA聚合酶和DNA依赖的DNA聚合酶酶活性的反转录酶实施双链cDMA的形成。根据本发明的某些方法,对RNA序列的扩增涉及到使用可从置换链结合的多核苷酸上置换该核酸链的DNA聚合酶,并且可优选显示更强链置换能力(即与其它没有如此链置换能力的聚合酶相比)的聚合酶。优选地,DNA聚合酶对杂交于核酸链的寡核苷酸的3′末端有高亲和力。优选地,DNA聚合酶不具有相当大的缺口填补活性。一般地,为将引物的降解或引物延伸多核苷酸的降解减至最小,聚合酶优选地具有极少或无5′-3′核酸外切酶活性。通常该核酸外切酶活性依赖于多种因素,如pH、盐浓度、模板是双链或是单链等,所有这些是本领域技术人员所熟悉的。5′-3′核酸外切酶活性已被删除的突变DNA聚合酶在本领域中已众所周知,并且适合于此处描述的扩增方法。缺少5’至3’外切酶活性和3’至5’外切酶活性的突变DNA聚合酶也已有描述,例如,exo-/-Klenow DNA聚合酶。优选的是,DNA聚合酶以该聚合酶和引物延伸产物5’末端间的至少约25%的接触几率,更为优选地至少约50%,甚至更为优选地至少约75%,以及最为优选地至少约90%的接触机率从模板核酸上置换引物延伸产物。在一些实施方案中,优选使用具有链置换活性的热稳定DNA聚合酶。这种聚合酶为本领域公知,诸如在美国专利号5744312中所述(于此引用作为参考)。优选地,DNA聚合酶具有极小的或无校正活性。
本发明方法和组合物中适用的DNA聚合酶包括那些公开在美国专利号5648211和5744312中的聚合酶,其包括exo-Vent(New EnglandBiolabs)、exo-Deep Vent(New England Biolabs)、Bst(BioRad)、exo-Pfu(Stratagene)、Bca(Panvera)、测序级Taq(Promega)、exo-/-KlenowDNA聚合酶和来自thermoanaerobacter thermoh ydrosulfuricus的热稳定DNA聚合酶。
本发明方法和组合物使用的核糖核酸酶可切割RNA/DNA杂合体上核糖核苷酸。优选地,核糖核酸酶切割RNA/DNA杂合体上的核糖核苷酸,而不管与被切割核糖核苷酸相邻的核苷酸的特征和类型。核糖核酸酶的切割不依赖于序列特征是优选的。本发明方法和组合物中适用的核糖核酸酶的实例为本领域公知,包括核糖核酸酶H(RNaseH),后者包括Hybridase。
本发明的方法和组合物中使用的DNA依赖的RNA聚合酶在本领域已众所周知。可使用真核或原核聚合酶。其实例包括T7、T3和SP6 RNA聚合酶。通常所选择的RNA聚合酶可从此处所述的前启动子多核苷酸提供的启动子序列进行转录。通常RNA聚合酶是DNA依赖的聚合酶,只要启动子区域是双链的,该酶优选地可从单链DNA模板进行转录。
总之,本发明的方法和组合物中所用的酶不应使所述方法和组合物的核酸成分产生相当多的降解。
反应条件和检测
实施本发明方法的合适反应介质和条件是那些根据本发明的方法允许核酸扩增的反应介质和条件。这些介质和条件已为本领域的技术人员所熟知,并且在多个公开专利中有所描述,如美国专利号5,554,516、5,716,785、5,130,238、5,194,370、6,090,591、5,409,818、5,554,517、5,169,766、5,480,784、5,399,491和5,679,512以及PCT公开号WO99/42618。例如缓冲液可以是Tris缓冲液,虽然也可使用其它缓冲液,但条件是只要缓冲液成分不抑制本发明方法的酶成分。pH优选地从约5至约11,更为优选地从约6至约10,甚至更为优选地从约7至约9,以及最为优选地从约7.5至约8.5。反应介质也可包括双价金属离子,如Mg2+或Mn2+,游离离子的终浓度在约0.01至约15mM的范围内,并且最为优选地从约1至10mM。反应介质也可包括有助于介质总离子强度的其它盐,如KCl或NaCl。例如,盐如KCl的范围优选地从约0至约125mM,更为优选地从约0至约100mM,以及最为优选地从约0至约75mM。反应介质还可包括可影响扩增反应进行,但不是构成本方法酶成分活性的添加剂。这样的添加剂包括蛋白质如BSA、单链结合蛋白(例如T4基因32蛋白),以及非离子去污剂如NP40或Triton。也可包括能维持酶活性的试剂,如DTT。这样的试剂在本领域中众所周知。适当时,也可包括不抑制本方法采用的RNase活性的RNase抑制剂(如RNasin)。本发明方法的任一方面可在相同或不同温度下进行。优选的是,在等温下进行扩增反应(尤其是引物延伸(而不是第一链和第二链cDNA合成步骤)和链置换),这避免了烦琐的热循环过程。扩增反应在某一温度下进行,该温度使得本发明的寡核苷酸(引物和/或PTO)与模板多核苷酸和引物延伸产物杂交,并且基本上不抑制所使用酶的活性。温度优选地在约25℃到约85℃,更优选地从约30℃到约80℃,且最优选地从37℃到约75℃的范围内。在一些包括RNA转录的实施方案中,转录步骤的温度低于之前步骤的温度。在这些实施方案中,转录步骤的温度可以优选地从约25℃到约85℃,更优选地从约30℃到约75℃,且最优选地从37℃到约70℃的范围内。
可用于合成本发明方法中引物延伸产物的核苷酸和/或核苷酸类似物(如脱氧核糖核苷酸三磷酸)的量优选地从约50到约2500μM,更优选地从约100到约2000μM,甚至更优选地从约200到约1700μM,且最优选地从约250到1500μM。在一些实施方案中,包括在引物延伸链中存在可增强链置换(例如,通过引起弱于常规AT、CG碱基对的碱基配对)的核苷酸或核苷酸类似物。这些核苷酸或核苷酸类似物为本领域公知,包括脱氧肌苷和其它修饰碱基。本发明方法中用于合成RNA转录本的核苷酸和/或类似物(如核糖核苷酸三磷酸)的量优选地从约0.25到约6mM,更优选地从约0.5到约5mM,甚至更优选地从约0.75到约4mM,且最优选地从约1到3mM。
本发明扩增反应的寡核苷酸成分通常超过欲扩增的靶核酸序列数。它们的供给约为或至少约为下述之一:10、102、104、106、108、1010、1012倍于靶核酸的量。复合引物和PTO各自的供给约为或至少约为下述浓度之一:50nM、100nM、500nM、1000nM、2500nM、5000nM。
在一个实施方案中,在扩增过程的开始阶段同时加入上述的组分。在另一实施方案中,在扩增反应需要和/或允许的情况下,于扩增过程期间的适当时间点之前或之后,按任意次序加入组分。本领域中的技术人员容易确定这样的时间点,这样的一些时间点在下面有记录。在靶核酸变性步骤之前,将用于本发明方法的核酸扩增的酶加入反应混合物,随后进行变性步骤,或在引物与靶多核苷酸杂交后,将用于本发明方法的核酸扩增的酶加入反应混合物,这由它们的热稳定性和/或其它为本领域技术人员所熟知的因素决定。第一链cDNA(复合引物延伸产物)和第二链cDNA(第二引物延伸产物)合成反应可以连续地进行,紧随其后的是扩增步骤(被另一复合引物结合,引物延伸和链置换)。在这些实施方案中,不同反应的反应条件和组分可以不同。
扩增过程可以在不同的时间点终止,并且可以在随后的时间重新开始。所述时间点可以被本领域技术人员容易地认定。一个时间点是在第一链cDNA合成结束时。另一个时间点是在第二链cDNA合成结束时。终止反应的方法为本领域公知,包括例如冷却反应混合物到抑制酶活性的温度或加热反应混合物到破坏酶活性的温度。重新开始反应的方法为本领域公知,包括例如将反应混合物温度提高至允许酶活性的温度,或重新补充破坏(消耗)的酶。在一些实施方案中,在反应重新开始之前、开始时或之后补充反应的一种或多种组分。例如,如果使用同一复合引物,在开始线性扩增反应前可能必需补充复合引物。或者让反应没有间断地进行(即从开始至结束)。
反应可以不必纯化中间产物(如去除引物)地进行。产物可以在多个时间点纯化,上述时间点易于被本领域技术人员确定。一个时间点是在第一链cDNA合成结束时。另一个时间点是在第二链cDNA合成结束时。我们已经观察到第一和第二cDNA的常规纯化导致在随后的线性扩增步骤中产生稍高的扩增效率。
扩增产物的检出表明存在靶序列。定量分析也是可行的。直接和间接检测方法(包括定量)在本领域广为人知。例如,通过比较从包含未知量的含有靶序列的多核苷酸的测试样品中的扩增产物量和具有已知量的靶序列的多核苷酸的参照样品的扩增产物量,可确定测试样品中靶序列的量。本发明的方法也可延伸至用于序列改变的分析和靶核酸的测序。而且可通过例如检查来自RNA扩增产物的翻译产物可实现检测。
本发明的组合物和试剂盒
本发明也提供了此处所述方法中使用的组合物和试剂盒。这些组合物可为是此处所述的任一组分、反应混合物和/或中间体以及它们的任一组合。例如,本发明提供了包含复合引物和第二引物的组合物,其中第二引物为随机引物。在一些实施方案中,第二引物包含DNA。在另外的实施方案中,第二引物由DNA组成。又在另一实施方案中,组合物包含含有非靶序列的复合引物和第二引物其中所述非靶序列的包含目的在于产生前启动子多核苷酸可杂交的置换的引物延伸产物。该第二引物也可以为随机引物。
在一些实施方案中,复合引物包含与DNA部分毗邻的RNA部分。在另外的实施方案中,复合引物包含具有至少一个插入RNA部分的5,-和3’-DNA部分。在其它实施方案中,复合引物包含多聚dT部分。在另一实施方案中,本发明包含的复合引物为随机引物。在一些实施方案中,包含多聚dT部分的随机复合引物或复合引物还包含不与靶杂交的部分(在引物的一部分与靶序列杂交的条件下)。在另外的实施方案中,本发明提供了包含这样的复合引物的组合物,该复合引物还通过与这样的部分连接而衍生,该部分可实现将包含该复合引物的多核苷酸连接至用于制备核酸微阵列的固体基片上。在一些实施方案中,复合引物还可以通过与正电荷部分如胺相连而衍生。
在一些实施方案中,本发明提供了包含复合引物并包含含有前启动子序列的多核苷酸如PTO(即此处所述那些实施方案中的任何一种)的组合物。至于含有随机引物的组合物,这些组合物也可以含有多种随机引物(即具有不同序列的随机引物群)。
在某些实施方案中,组合物包含(a)复合引物;(b)第二引物(其可以是随机引物);以及(c)反转录酶。在另外的实施方案中,组合物包含(a)复合引物;(b)第二引物(其可以是随机引物);(c)反转录酶;以及(d)DNA聚合酶。在一些实施方案中,组合物包含(a)复合引物;(b)第二引物(其可以是随机引物);以及(c)包含前启动子序列的多核苷酸(其可以是PTO)。上述组合物中的任何一种组合物还可以包含靶RNA(其含有目的RNA序列)和/或此处描述的任一种酶(诸如DNA聚合酶如反转录酶、RNaseH和/或RNA聚合酶)。组合物一般以冷冷冻干燥燥或液态形式存在,优选地在合适的缓冲液中。
本发明也提供了包含此处描述的扩增产物的组合物。因此,本发明提供了为靶序列的拷贝或互补序列的DNA或RNA分子群,其通过此处描述的任何方法(或包含产物的组合物)产生。
另一方面,本发明提供了为靶序列拷贝或互补序列的正义多核苷酸(优选DNA)分子群和反义多核苷酸(优选DNA)分子群,其通过此处描述的任何方法产生。本发明也包括这些群体的组合物和多种结构(如阵列),其可以是同源的(相同序列)或异源的(不同序列)。这些群体可以是此处描述方法获得的序列的任意组合,包括建立在mRNA,以及某些mRNA样本或类型。
虽然组合物可以冷冻干燥状态存在,但它们通常溶于适当的介质中。适当的介质包括但不限于含水介质(如纯水或缓冲液)。
本发明提供了用于进行本发明方法的试剂盒。因此,以适当的包装提供了多种试剂盒。试剂盒可用于任何一种或多种此处所述的用途,并且因此应包括任何一种或多种下述用途的说明书:扩增RNA序列;目的RNA序列的测序;在扩增RNA序列的基础上检测序列突变(即基因分型或核酸突变检测);确定目的序列存在与否;表达谱的方法;消减杂交的方法;消减杂交探针制备方法;差异扩增方法;文库制备方法(包括cDNA文库和差异表达文库);固定化核酸的制备方法(其可以为固定于微阵列上的核酸),以及鉴定用本发明方法产生的扩增的核酸产物的方法。
本发明的试剂盒包含一个或多个容器,它们含有此处所述组分的任一组合,试剂盒可以包括此处描述的任何复合引物。在一些实施方案中,试剂盒包含2种或多种复合引物和第二引物,其可以单独包装或不单独包装。试剂盒可以包含复合引物并包含含有前启动子序列的多核苷酸(其可以是PTO)。试剂盒还可以包含第二引物(其可以是随机引物)。复合引物可以标记或未标记。试剂盒也还可以任选地包含任意一种或多种此处描述的酶(例如RNA依赖的DNA聚合酶诸如反转录酶,以及核糖核酸酶诸如RNaseH),以及脱氧核糖核苷酸三磷酸(标记或未标记)和/或核糖核苷酸三磷酸(标记或未标记)。试剂盒也可以包含一种或多种合适的缓冲液(如此处所述)。用于核酸测序的试剂盒可以任选地包括标记或未标记的核苷酸类似物,其在掺入引物延伸产物或RNA转录本后实现核苷酸聚合的终止。试剂盒中的一种或多种试剂可以干粉的形式提供,通常是冷冻干燥粉,其中所述试剂包括赋形剂,溶解后使试剂溶液具有适当的浓度,以进行此处所述的任何方法。每一组分可包装在分开的容器中,或当交叉反应性和保存期限允许时,可将一些组分合并置于一个容器中。
本发明的试剂盒可任选地包括一套说明书,通常为与本发明方法的组分使用相关的书面说明书,用于扩增预期核酸和/或适当的话用于将扩增产物用作进行如核酸测序和检测序列突变,含有说明书的电子存储介质(如磁盘或光盘)是可接受的提供说明书的模式。包含在试剂盒内的说明书通常包括关于开展本发明方法所必需的试剂(包含或不包含在试剂盒内)、怎样使用试剂盒的说明和/或适当的反应条件的信息。例如,本发明试剂盒可以包含:复合引物(其可以包含多聚dT部分和/或为随机引物)、第二引物(其可以为随机引物),以及根据本发明方法使用这些引物扩增RNA的说明书。在另一实施例中,本发明的试剂盒包含复合引物(其可以包含多聚dT部分和/或为随机引物),以及根据本发明方法使用此引物扩增RNA的说明书。在另一实施例中,本发明的试剂盒包含:复合引物、第二引物(其可以为随机引物),以及根据本发明的方法从RNA靶产生双链互补DNA和/或扩增RNA的说明书。又在另一实施例中,这些试剂盒中的任一试剂盒还包含前启动子多核苷酸以及根据本发明方法产生引物延伸产物和前启动子多核苷酸双链体以使双链启动子区域产生和/或扩增RNA的说明书。在另一实施例中,本发明的试剂盒包含能产生第一链cDNA的复合引物(其可包含多聚dT部分和/或为随机引物)、能与第一链cDNA杂交的第二复合引物,以及根据任一本发明方法使用这些引物产生双链cDNA的说明书。在另一实施例中,本发明的试剂盒包含双链cDNA复合体(包含第一和第二链cDNA),其含有3’单链DNA部分。又在另外的实施方案中,任一这些试剂盒中还包含一个或多个对照(其可以是例如RNA模板、复合引物和/或含有3’单链DNA部分的双链cDNA复合体(包含第一和第二链cDNA))。
试剂盒的组分可以以任何方便、适当的包装提供。组分可以单独包装或以一个或多个组合包装。其中试剂盒提供用于进行涉及转录的本发明扩增方法时,RNA聚合酶(如果包括的话)不与转录步骤之前的步骤中所用的组分一同提供,优选地单独提供。
试剂盒中不同组分的相对量可有很大不同,以提供相当程度上优化操作此处公开方法进行的反应的试剂浓度和/或提供进一步优化任一实验的敏感性的试剂浓度。
本发明也提供了实现此处所述方法的体系。这些系统包括上述讨论的组分的多种组合。例如,在一些实施方案中,本发明提供了适于产生靶多核苷酸序列(或扩增靶多核苷酸序列)的体系,上述体系包含:(a)复合引物(任一此和所述的复合引物),(b)DNA聚合酶;和(c)核糖核酸酶。在一些实施方案中,体系还包含含有前启动子序列的多核苷酸(其可以是为PTO)和DNA依赖的RNA聚合酶。在另外的实施方案中,体系还包含RNA依赖的DNA聚合酶。任一体系实施方案也可以包含此处描述的模板(靶)序列。体系通常可包括一种或多种用于开展本发明的扩增方法的仪器。这样的仪器包括如加热设备(如加热部件或水浴)和实现此处所述方法的一步或多步的自动化仪器。由于任何步骤都不需要热循环,故本发明方法尤其适于使用小型装置。合适装置的非限制性实例包括BioAnalyzer(Agilant和Caliper)和eSensor。
本发明也提供了包含此处所述组分的多种组合的反应混合物(或包含反应混合物的组合物)。已对反应混合物的实例进行了描述。在一些实施方案中,本发明提供的反应混合物包括(a)靶RNA;(b)包含3’DNA部分和RNA部分的复合引物;(c)第二引物;以及(d)DNA聚合酶。正如此处所述,反应混合物可以包含任一复合引物(或多种复合引物),包含含有与3’DNA部分毗邻的5’RNA部分的复合引物。反应混合物也可以进一步包括从RNA/DNA杂合体上切割RNA的酶,诸如RNaseH。本发明的反应混合物还可包含含有此处所述的前启动子序列的多核苷酸。反应混合物的另一实例是:(a)置换的引物延伸产物(且在其5’末端含有与复合引物3’DNA部分互补的序列,但不含与复合引物的RNA部分互补的序列);(b)包含前启动子序列的多核苷酸(例如PTO);以及(c)RNA聚合酶。其它的反应混合物在此处描述,并为本发明所包括。
本发明也包括含有此处所述任一复合体(为此处所述方法的中间体)的组合物。这样的复合体的实例于图1-8中示意描述。作为实例,一种本发明的复合体包含(a)靶RNA链;和(b)复合引物,所述复合引物包含3’DNA部分和RNA部分。复合引物可以具有与3’DNA部分毗邻的5’RNA部分。作为另一个实例,一种本发明的复合体包含(a)复合引物延伸产物;和(b)靶RNA链。又在另外的实例中,一种本发明的复合体包含(a)第一引物延伸产物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;和(b)第二引物。又在另外的实例中,一种本发明的复合体包含(a)第一引物延伸产物,其中第一引物为包含RNA部分和3’DNA部分的复合引物;和(b)第二引物延伸产物。又在另外的实例中,一种本发明的复合体包含(a)置换的引物延伸产物,其中引物为包含RNA部分和3’DNA部分的复合引物;和(b)前启动子多核苷酸(例如PTO)。
又在另外的实例中,本发明的复合体为通过此处所述的任一方法制备的在其一个末端还包含RNA/DNA部分的双链cDNA复合体。在一些实施方案中,双链cDNA复合体在其第二个末端还包含第二RNA/DNA部分。又在另外的实例中,本发明的复合体为包含3’单链DNA部分的第一和第二引物延伸产物,其通过此处所述任一方法产生。在一些实施方案中,组合物还包含第二3’单链区域。在另一个实例中,本发明的复合体为(a)包含3’单链DNA部分的第一和第二引物延伸产物复合体,和(b)与第二引物延伸产物杂交的复合引物。在另一个实例中,本发明的复合体为第一链cDNA和第二链cDNA(其由引物沿第一链cDNA延伸产生)的复合体。在一些实施方案中,引物包含与第一链cDNA杂交的模板RNA片段。在一些实施方案中,引物为DNA。
使用本发明的扩增方法和组合物的方法
本发明的方法和组合物可用于多种用途。为阐明用途,这里描述了测序方法、基因分型(核酸突变检测)、确定目的序列存在与否、固定化核酸(其可以是固定于微阵列上的核酸)的制备以及用本发明方法产生的扩增核酸产物来鉴定核酸。这里也描述了表达谱的方法、消减杂交方法和制备消减杂交探针的方法和制备文库的方法(其可以是cDNA文库和/或差异杂交文库)。
用本发明的方法对RNA靶测序
例如,本发明的扩增方法用于目的RNA序列的测序。通过使用此处所述的任一方法扩增含有目的序列的靶RNA而进行测序。引物延伸中核苷酸的加入利用本领域共知的方法分析,所述本领域公知的方法例如终止核苷酸的掺入或利用合成测序(如pyrosequencing技术)。
在其中终产物为置换的DNA引物延伸产物形式的实施方案中,除用于扩增方法的核苷酸诸如天然的脱氧核糖核酸三磷酸(dNTP)外,反应混合物中可以加入适当的标记或未标记的核苷酸类似物,其掺入引物延伸产物后实现引物延伸的终止。优选地,dNTP类似物在自扩增反应起始足够量的时间后加入,以使产生所需量的第二引物延伸产物或片段延伸产物。所述时间量可由本领域技术人员的经验确定。
在其中终产物为RNA产物形式的实施方案中,测序可基于实现RNA转录的过早(故意)终止。rNTP类似物的掺入将导致产生截短的RNA产物,这是因为在类似物掺入的位点处阻断了RNA聚合酶的作用,其中所述rNTP类似物可为标记的或未标记的rNTP类似物,其在掺入RNA转录本后将实现反应混合物中rNTP聚合作用的终止。
合适的类似物(dNTP和rNTP)包含那些通常用于其它测序方法并且为本领域公知的类似物。dNTP类似物的实例包括双脱氧核苷酸。rNTP类似物(诸如RNA聚合酶终止子)的实例包括3’dNTP。Sasaki等人,生物化学(Biochemistry)(1998)95:3455-3460。这些类似物可以用例如荧光染料或放射性同位素标记。标记物也可以为适用于质谱的标记物。标记物也可为特异结合对之成员的小分子,并且可在随后与特异结合对中的另一成员结合,如特异结合对分别为生物素和链亲合素,其中该结合对的后一成员与酶结合,该酶可催化产生可被诸如比色法、荧光测定法、化学发光法检测到的信号,由此可被检测到。所有上述实施例在本领域已众所周知。它们通过聚合酶掺入引物延伸产物或RNA转录本,并终止沿模板的进一步延伸。产生的截短聚合产物被标记。累积的截短产物在长度上根据每种类似物掺入位点的不同而不同,其代表模板序列上互补核苷酸的不同序列定位。
为阐明序列信息,可使用本领域众所周知的多种方法中的任何一种进行反应产物的分析。这样的方法包括凝胶电泳并使用适当的扫描仪检测标记条带、测序凝胶电泳并使用如分子动力读数仪直接通过磷光检测放射标记的条带、装配有对反应中所使用标记物特异的检测仪的毛细管电泳等。标记物也可为结合蛋白的配体,用于检测标记物与连接有酶的结合蛋白的结合,如生物素标记的链终止子和与酶连接的链亲合素。该标记物通过酶的酶促活性检测,它产生可检测的信号。与本领域公知的其它测序方法一样,对不同核苷酸类型(A、C、G、T或U)的测序反应在单一或分开(每一容器代表不同核苷酸类型中的一种)的反应容器中进行。使用方法的选择取决于本领域技术人员相当明显的实际考虑,如使用核苷三磷酸类似物和/或使用标记物。因此,例如当每种类似物被不同标记时,测序反应可在单一容器中进行。用于优化根据本发明方法进行序列分析的试剂和反应条件的选择因素类似于其它以前描述的测序方法。试剂和反应条件为如上所述的用于本发明的核酸扩增方法。
利用本发明的扩增方法检测突变,包括基于单链构象多态性检测突变
按照本发明方法产生的DNA或RNA扩增产物也适用于靶核酸序列中任何改变的检测分析,其通过与参考核酸序列比较实现,上述参考核酸序列与靶核酸序列而不是与序列改变相同。序列改变可以是存在于基因组序列的改变,也可以是不反映在基因组DNA序列中的序列改变,例如来自转录后的改变,和/或mRNA过程的改变,包括剪接变体。序列改变(互换地称作“突变”)包括一个或多个核苷酸的删除、置换、插入和/或碱基颠换。
本扩增方法产生的DNA或RNA产物适用于基于单链构象多态性(SSCP或rSSCP)的突变检测。本发明的扩增方法可直接与合适的方法联合,用于检测单链构象多态性,其中所述合适的方法如电泳分离方法,其用于鉴定单链DNA或RNA产物的特异迁移模式,用于阐明特定序列特征的存在,和/或与参照核酸相比用于阐明试验核酸中任何差异的存在。
基于凝胶电泳或毛细管电泳的方法可用于检测和分析多种单链构象异构体。另外也可用识别序列依赖性二级结构的核酸酶切割单链DNA或RNA产物产物用于确定序列特异的构象多态性。这些核酸酶为本领域公知,诸如Cleavase测定法(Third Wave)。电泳方法潜在地更适于高通量突变或基因分型的检测方法。
对给定的核酸序列确定序列特异的电泳模式可用于例如检测测试序列的特异等位基因。此外,期望不同等位基因的电泳迁移模式可有大的差异,这样使得可从单一个体的核酸样品中检测两个等位基因,这为杂合基因型或多等位基因所需要。测试核酸序列的任何改变如碱基置换、插入或缺失均可用本方法检测。本方法预期可用于检测特异的单碱基多态性、SNP和发现新SNP。因此,本发明也提供了用于检测包含单核苷酸多态性的多核苷酸的方法,其包括:(a)用此处所述的任一方法扩增靶多核苷酸;以及(b)分析扩增产物的单链构象,其中与参照的单链多核苷酸相比,构象的差异显示靶多核苷酸中的单核苷酸多态性,由此检测包含单核苷酸多态性的多核苷酸。
其它本领域认可的与参考核酸序列相比较检测靶核酸序列的任何改变分析方法适用于本发明扩增方法得到的单链核酸产物。这些方法为本领域所公知,并且包括用于检测特定已知序列的多种方法,包括基于等位基因特异的引物延伸、等位基因特异的探针连接、差异探针杂交和限制性引物延伸的方法。参见例如Kurn等人,美国专利号6,251,639B1;美国专利号5,888,819;6,004,744;5,882,867;5,854,033;5,710,028;6,027,889;6,004,745;5,763,178;5,011,769;5,185,243;4,876,187;5,882,867;5,731,146;WOUS88/02746;WO99/55912;WO92/15712;WO00/09745;WO97/32040;WO00/56925和5,660,998。因此,本发明也提供检测包含单核苷酸多态性的目的RNA序列中的突变的方法,包括(a)利用此处所述任何方法扩增靶RNA;和(b)与参考单链多核苷酸相比分析扩增产物存在的改变(突变)。
确定目的序列存在与否的方法
本发明的等温扩增方法所使用的复合引物的独特特性给用等温方法在靶核酸序列上检测特定突变(其定义为:突变的定位是明确的)或多态位点(如SNP)提供了基础。本方法用于基因分型、检测导致药物抗性的突变等等。
复合引物的RNA部分设计为可与其中怀疑存在序列改变的测试靶RNA杂交。换言之,引物包含含有与参考RNA序列(如野生型序列)杂交的序列的RNA部分,测试靶RNA序列与上述参考RNA序列相比。在一些实施方案中,改变的序列(即包含序列改变的序列)和参考序列为等位基因。序列改变可以是单核苷酸置换、删除或插入。
在另一实施方案中,复合引物的RNA部分设计为与怀疑存在于测试靶RNA中的改变序列杂交。换言之,引物包括含有与测试靶RNA杂交的序列的RNA部分,并且因此不与参考序列(例如野生型序列)杂交,测试靶RNA中的序列与上述参考RNA序列相比。在一些实施方案中,改变的序列(即包含序列改变的序列)和参考序列为等位基因。
复合引物的RNA部分通常是5′RNA部分包含可与已知标准野生型序列或已知突变子或多态性基因型杂交的序列。通常,如果靶核酸序列包含可与复合引物RNA部分杂交的序列,将此情况与如果存在错配(即引物有突变序列而靶没有,或反之亦然)的情况相比,则合适的复合引物包含使得该引物优先地与前一种情况的靶核酸杂交的RNA部分,其中靶核酸具有结合的引物延伸产物,并且引物延伸产物的5′-RNA部分已被切除。序列改变的存在一般不会阻止扩增的起始步骤,这样形成包含RNA/DNA异质双链体的第一和第二引物延伸产物的双链复合体。随后核糖核酸酶如RNaseH切割RNA/DNA异质双链体的RNA部分。虽然错配基对的存在可能影响RNA/DNA杂合体的切割模式,但切割仍可能发生。错配将会抑制,优选地阻止下一步另一复合引物与复合体通过5′-RNA部分杂交而进行的结合步骤。这种作用取决于多种因素,如杂交寡核苷酸的大小和反应条件的严紧性。根据本领域众所周知的技术和常规,在设计复合引物时,这些因素得到考虑。错配也可能会抑制切割复合引物的RNA部分,因此阻止第二引物延伸产物的扩增。另一种可能性是,错配将导致低效率切割引物的RNA部分,因此导致较低效率扩增或产生较少的扩增产物。在扩增的这一步,复合引物不能与靶杂交会阻止后续步骤中引物延伸链的置换和多拷贝扩增产物的产生。据认为,通过本发明的方法检测突变可基于有无单链扩增产物或定量比较累积的扩增产物的量而进行。例如,当复合引物包含参照序列(例如野生型)时,靶链中突变的存在可导致检测不到扩增产物;或者是,可导致能检测到产物,但产物量少于从无突变的模板链产生的量。
当复合引物包含可完全与突变基因型杂交的RNA部分通常是5′RNA部分时,将阻止正常基因型序列的扩增,而突变基因型靶将得到扩增。因此,在这种情况下,多拷贝扩增产物的检出和/或定量确定将表明突变基因型靶序列的存在。例如,可运行包括目的核酸样品或具野生型序列的靶核酸参照样品的平行反应。与后一个反应相比,前一反应积累较多的扩增产物表明在目的样品中存在突变基因型。另外,当复合引物包含完全可与试验靶的标准基因型序列杂交的5′RNA序列时,将阻止突变基因型靶序列的扩增,并且扩增产物的检出和/或定量确定表明存在标准基因型。
发明的任一扩增方法适用于检测如上所述的突变。
因此,本发明提供了确定目的序列存在与否的方法,所述方法包括(i)扩增含有目的序列的靶RNA,所述扩增包括延伸与由此处所述任一方法制备的切割的第一和第二引物延伸产物复合体杂交的复合引物,其中复合引物的RNA部分的序列已知,和(ii)将来自步骤(i)的扩增产物量(如果有的话)与来自参考模板的扩增产物量比较,其中(1)从模板产生的可检测出的扩增产物量少于从包含可与复合引物RNA部分杂交区域的参考模板中扩增的产物量,说明第二引物延伸产物不包含可与复合引物RNA部分杂交的序列,且相对于可与复合引物RNA部分杂交的序列而言为一序列变体;或(2)从模板产生的可检测出的扩增产物量多于从不包含可与复合引物RNA部分杂交区域的参考模板中扩增的产物量,说明第二引物延伸产物包含可与复合引物RNA部分杂交的序列,且相对于可与复合引物RNA部分杂交的序列而言为非序列变体。
制备固定于基片的核酸,包括核酸微阵列的方法
部分本发明扩增方法的单链产物适于固定于表面。单链产物尤其适用于制备包含单链扩增产物的微阵列。
单链扩增产物可附着在例如由玻璃、塑料(如聚苯乙烯、聚丙烯、尼龙)、聚丙烯酰胺、硝酸纤维或其它材料制成的固相或半固相载体或表面。
几种将核酸附着在于固体基片如玻璃片的技术在本领域已众所周知。一种方法是将包含可吸附于固相基片的部分如胺类、胺类衍生物或另一带正电荷的基团的修饰碱基或类似物掺入扩增的核酸。然后将扩增产物与固相基片如玻璃片结合,该玻璃片用醛或另一的反应基包被,其中所述醛或另一反应基将与扩增产物上的反应基形成共价连接并共价附着于玻璃片。含有扩增产物的微阵列可用Biodot(BioDot,Inc.Irvine,CA)点样装置和醛包被的玻璃片(CEL Associates,Houston,TX)制备。将扩增产物点样于醛包被的载玻片上,并根据发表的步骤(Schena等,美国国家科学院院报(1996),93:10614-10619)进行加工。阵列也可通过机器人技术打印在玻璃、尼龙(Ramsay,G.,自然生物技术(Nature Biotechnol.)(1998,16:40-44)、聚丙烯(Matson等,生物化学年鉴纪事(Anal Biochem.)(1995),224(1):110-6)和硅氧烷载玻片(Marshall,A和Hodgson,J.,自然生物技术,(1998),16:27-31)上。其它阵列装配的方法包括电子领域中灵敏的微量点样(Marshall和Hodgson,同上)并直接将多核苷酸点样在带正电的包被板上。如那些使用氨基丙基硅表面化学的方法在本领域内也是公知的,如在http://www.cmt.corning.Com和http://cmgm.stanford.edu/pbrown/所公开的那样。
制备微阵列的一种方法是制备高密度的多核苷酸阵列。迅速沉积多核苷酸的技术已众所周知(Blanchard等,Biosensors & Bioelectronics,11:687-690)。也可使用其它制备微阵列的方法,如通过掩模制备微阵列(Maskos和Southern,核酸研究.(1992),20:1679-1684)。原则上,如上所提到的,可使用任何类型的阵列,例如使用尼龙杂交膜上的斑点印迹。然而,如将被本领域熟练人员所认可的那样,往往优选极小的阵列,因为杂交体积将更小。
扩增的多核苷酸可以矩阵点样在包括纸、玻璃、塑料、聚苯乙烯、聚丙烯、尼龙、聚丙烯酰胺、硝酸纤维、硅、光纤或任何其它合适的固相或半固相(如聚丙烯酰胺凝胶薄层(Khrapko等,DNA序列(DNASequence)(1991),1:375-388))的基片表面上。
阵列可在平坦的基片上装配成二维矩阵,或者阵列可具有包括针、杆、纤维、带、细线、珠、颗粒、微量滴定孔、毛细管、圆柱体和任何其它适于杂交和检测靶分子排列的三维构型。在一个实施方案中,扩增产物附着的基片是磁珠或颗粒。在另一实施方案中,固相基片包含光纤。又在另一实施方案中,扩增产物分散在毛细管内的流动相中,其接下来被固定于固相。
核酸的鉴定
通过本发明方法获得的扩增产物尤其适合于进一步鉴定。本方法部分产物的单链特性便于鉴定。本发明方法产生的单链产物尤其可以进行定量分析,因为产生了足量的单链DNA和RNA产物,这些产物通常精确地代表在起始材料中不同的mRNA。
扩增的多核苷酸产物,无论DNA或RNA(即任一此处所述扩增方法的产物)可以用例如本领域公知的探针杂交技术来分析,所述探针杂交技术诸如Southern和Northern印迹以及与探针阵列杂交。它们也可以用基于电泳的技术分析,诸如差异显示和大小鉴定,其为本领域所公知。另外,单链DNA和RNA产物可以作为其它起始材料的起始材料,所述其它起始材料用于本领域公知的其它分析和/或定量方法,诸如实时PCR、定量TaqMan、利用分子信号的定量PCR,方法描述在Kurn,美国专利号6,251,639等。因此,本发明包括应用任何此处所述方法产物的进一步分析和/或定量的方法。
在一个实施方案中,本发明扩增方法用于产生多拷贝单链产物,并通过与探针接触来分析单链产物。
在一个实施方案中,本发明扩增方法用于产生多拷贝单链多核苷酸(通常DNA)产物,其通过使用标记的复合引物(在不被切割的部分标记)而被标记。在另一个实施方案中,本发明扩增方法用于产生这样的单链多核苷酸(DNA或RNA)产物的多拷贝,其通过在DNA或RNA聚合的过程中掺入标记的核苷酸而被标记。例如,根据本发明方法的扩增可以用合适的标记dNTP或rNTP进行。这些标记的核苷酸可以直接与标记物相连,或者可以包括能与标记物相连的部分。标记物可以与扩增产物共价或非共价相连。合适的标记物为本领域公知,并且包括例如作为特异结合对一个成员的配基,其可以利用可检测的结合对的第二成员检测/定量。因此,在例如Cy3-dUTP或Cy5-dUTP存在下根据本发明方法扩增总mRNA导致这些核苷酸掺入扩增产物。
标记的扩增产物尤其适用于通过将它们与如含有适当探针如cDNA和/或寡核苷酸探针的微阵列(具有任何适合的表面,包括玻璃、芯片、塑料)、珠或颗粒接触,而进行分析(例如检测和/或定量)。因此,本发明提供了通过使用本发明的扩增方法产生标记的多核苷酸(通常DNA或RNA)产物并分析标记产物来鉴定(如检测或定量)目的RNA序列的方法。例如通过将标记的扩增产物与例如固定于固体或半固体基片上特定位置的探针、固定于特定颗粒上的探针或固定于斑点(如膜)上的探针如阵列杂交,可进行标记产物的分析,这在上面已描述过。其它分析标记产物的方法在本领域已众所周知,如通过将它们与含有探针的溶液接触,然后从溶液中提取含有标记扩增产物和探针的复合体。探针的特征提供了对扩增产物的序列特征,并且因此推断存在于样品中的RNA的特性。标记产物的杂交是可检测到的,并且可检测到的特异标记物的量与特异目的RNA序列的标记扩增产物的量成比例。这种测量方法用于例如测量样品中多种RNA样本的相对量,正如此处所述,多种RNA样本的相对量与基因表达的相对水平相关。杂交在阵列上特定位置的标记产物的量(其通过例如标记物相关的可检测信号)可以显示出样品中相应靶RNA样本的检测和/或定量。
另一方面,本发明提供了单链多核苷酸(通常DNA或RNA)定量的方法,所述方法包括已知序列寡核苷酸(探针)的使用(其可以固定于例如微阵列上)。在本发明的这一方面,在5’和/或3’末端包含特定序列(如此处所述用“尾”第一和第二引物导入)的标记单链多核苷酸(通常DNA或RNA)产物可与特定寡核苷酸杂交,其中所述寡核苷酸包含在5’和/或3’末端引入的特定序列的互补序列。在一些实施方案中,利用复合引物和/或第二引物扩增特异mRNA样本,上述复合引物和/或第二引物的尾部具有可与固定在阵列上的序列杂交的特定序列(这取决于是否将特定序列引入复合引物或第二引物)。例如,在一个实施方案中,第一复合引物包含3’部分,所述3’部分可与特异RNA样本的序列杂交,并且其5’部分不可与特异RNA模板杂交,但却可与特定寡核苷酸杂交。在另一实施方案中,第二引物包含可与第一引物延伸产物的序列杂交的3’部分以及不可与第一引物延伸产物杂交但包含特定寡核苷酸序列的5’部分。产生的多拷贝单链标记DNA或RNA产物可与寡核苷酸杂交。应当理解,尽管上述讨论单RNA样本,多种样本也可以同时扩增,每一种用包含可与不同特定寡核苷酸杂交的“尾”的复合引物或第二引物扩增。
基因表达谱的确定
由于此处所述的方法可扩增同一样品中的一种或多种,优选地多种靶RNA,所以本发明的扩增方法尤其适用于确定样品中一种或多种基因表达水平。如上所述,扩增产物可通过此处所述和/或本领域已众所周知的多种方法进行检测和定量。因为RNA是基因表达的产物,样品中不同RNA类型,如不同的mRNA的水平显示不同基因的相对表达水平(基因表达谱)。因此,通过定量序列扩增产物所确定的存在于样品中的目的序列的量可提供用作确定样品源中的基因表达谱。
因此,本发明提供确定样品中基因表达谱的方法,所述方法包括:用此处所述的任一方法从样品中至少一个目的RNA序列扩增单链产物;并且确定每一目的RNA序列扩增产物的量,其中每一所述量显示出样品中每一目的RNA序列的量,由此样品的表达谱被确定。通常,产生的是标记产物。在一个实施方案中,靶RNA为mRNA。又在另外的实施方案中,复合引物包含多聚dT序列(于是样品中mRNA被扩增)。应当理解,扩增产物的量可以利用定量和/或定性方法确定。扩增产物量的确定包括确定扩增产物存在与否。因此,表达谱可以包含一个或多个目的RNA序列存在与否的信息。此处所用的产物的“存在”或“不存在”,以及“未检测到产物”包括可忽略的极少产物。
表达谱方法在多种分子诊断上有用,并且尤其在研究几乎所有的哺乳动物细胞(包括单细胞)或细胞群的基因表达上有用。细胞或细胞群(如组织)可以来自例如血液、脑、脾、骨、心脏、血管、肺、肾、垂体、内分泌腺、胚胎细胞、肿瘤等等。表达谱也用于比较测试样品与对照(正常)样品,所述测试样品包括不同时间收集的测试样品,包括在发育、处理等之前、之后和/或过程中收集的测试样品。
制备文库的方法
本发明方法的单链DNA和RNA产物在制备文库,包括cDNA文库和消减杂交文库上有用。利用本发明方法,文库可以从有限量的起始材料例如从有限量组织或甚至是单细胞中提取的mRNA中制备。因此,一方面,本发明方法提供从本发明单链DNA或RNA产物中制备文库的方法。另一方面,本发明提供从本发明方法产生的包含两种复合引物的双链cDNA中制备文库的方法。从双链cDNA中制备文库的方法为本领域公知。又在另一方面,本发明提供建文库的方法,所述方法包括:利用此处所述的任一方法制备消减杂交探针。
在一些实施方案中,第一复合引物可与几乎在所有mRNA中发现的多聚A序列杂交。在另外的实施方案中,第一复合引物为随机引物。
消减杂交的方法
本发明的扩增方法尤其适用于消减杂交方法,其中(至少)比较第一和第二靶RNA群体,因为此处所述的方法可在同一样品中扩增多种靶RNA,并且本发明方法适用于产生大量单链反义核酸,上述反义核酸适用于在消减杂交中作为“传动器”。例如,两个核酸群体,一个正义一个反义,可以被允许与一个摩尔过量(“传动器”)的群体混合。存在于两个群体的序列会形成杂合体,而存在于仅仅一个群体的序列保持单链。随后,使用多种已知技术分离代表差异表达序列的未杂交分子。参见例如Hamson等人,美国专利号5589339;Van Gelder,美国专利号6,291,170。
因此,本发明提供了用于进行消减杂交的方法,所述方法包括:(a)利用此处所述任一扩增方法从第一RNA群体制备至少一个目的RNA序列的互补多拷贝DNA;和(b)多拷贝与第二mRNA群体杂交,由此第二mRNA群体的亚群体与核苷酸DNA拷贝形成复合体。本发明也提供用于进行消减杂交的方法,所述方法包括:利用任一此处所述任何扩增方法从第一RNA群体中制备至少一个目的RNA序列互补链的多拷贝,将其与第二mRNA群体杂交,由此第二mRNA群体的亚群体与拷贝形成复合体。在一些实施方案中,本发明方法的“传动子”单链反义DNA产物与试验(正义)mRNA样本结合。在一些实施方案中,“传动子”单链反义核酸(通常为DNA)产物用此处所述本发明方法产生,且第一复合引物可与多聚A序列杂交(几乎扩增所有的mRNA样本)。在另外的实施方案中,第一复合引物为随机引物。
另一方面,本发明了提供差异扩增的方法,在所述差异扩增中,与试验者mRNA序列杂交的单链传动器(反义)DNA序列被切割DNA/RNA杂合体上RNA的试剂诸如RNaseH切割。mRNA的切割导致从测试mRNA链上无力产生单链DNA产物。相反地,非切割试验者(即不与传动器DNA分子杂交的试验者mRNA)可以作为随后扩增的底物。扩增的差异表达产物有许多用途,包括作为差异表达探针,去产生差异表达文库。因此,本发明提供了用于一个或多个目的RNA序列差异扩增的方法,所述方法包括:(a)用此处所述任一扩增方法从第一RNA群体制备至少一个目的RNA序列的互补多核苷酸(通常为DNA)的多拷贝;(b)多拷贝与第二mRNA群体杂交,由此第二mRNA群体的亚群体与DNA拷贝形成复合体;(c)利用从RNA/DNA杂合体上切割RNA的酶切割步骤(b)复合体中的RNA;和(d)扩增第二mRNA群体中未杂交亚群体,由此产生与第二mRNA群体中未杂交亚群体互补的单链DNA的多拷贝。在一些实施方案中,步骤(d)用任一此处所述的扩增方法进行。在一些实施方案中,本方法包括将用任一此处所述的扩增方法从第一RNA群体中至少一个目的RNA序列的互补链的多核苷酸(通常为DNA)拷贝与第二mRNA群体杂交,由此第二mRNA群体的亚群体与DNA拷贝形成复合体;(b)利用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体中的RNA;和(c)扩增第二mRNA群体中未杂交亚群体,由此产生与第二mRNA群体中未杂交亚群体互补的单链DNA的多拷贝。
下述实施例用于阐明但不用于限制本发明。
实施例
实施例1:总多聚A mRNA的扩增
来源于MOLT-4细胞系(CLONTECH 6587-1)的多聚A mRNA作为扩增反应的靶。扩增过程分成三步:1)从样品的总mRNA合成第一cDNA链;2)从样品的总mRNA合成第二cDNA链以产生双链cDNA;3)总mRNA的扩增。双链cDNA产物在其一个末端包含RNA/DNA异质双链体,其为RNaseH的底物。该异质双链体部分的两条链的序列与靶序列无关,并且其通过复合(第一)引物掺入。
引物序列:
MTA1:GACGGAUGCGGUCUTTTTTTT
MTA2:GACGGAUGCGGUCUTTTTTTTN
MTA3:GACGGAUGCGGUCUTTTTTTTNN
其中斜体核苷酸表示核糖核苷酸,且“N”表示简并核苷酸(即其可以是A、T、C或G)。
步骤1:从多聚A mRNA合成第一链cDNA
0.1μg总多聚A mRNA与下述试剂混合,总体积为10μl:
0.2μl引物MTA3(100μM)
0.5μl dNTPs(25mM)
0.1μl Rnasin
0.1μl DTT
2μl 5×AMV反转录酶反应缓冲液
加DEPC处理水至10μl总体积
将反应混合物75℃孵育2分钟,并且随后冷却至37℃。加1μl AMV反转录酶(USB 70041Y,15U/μl)至每一反应,并且反应混合物进一步在此温度下孵育60分钟。
步骤2:合成第二链cDNA
10μl第二链cDNA合成混合物与第一链cDNA反应混合物混合,所述第二链cDNA合成混合物包括:
1μl 10×Klenow反应缓冲液
0.1μl dNTPs(25mM)
0.5μl Klenow(USB 2141Y,5U/μl)DNA聚合酶
8.4μl 水
反应混合物37℃孵育30分钟,随后加热至75℃5分钟使酶失活终止反应。
步骤3:总cDNA的扩增
试验两种复合引物——MTA1和MTA2。
反应在总体积为20μl下进行,包括如下成分:
1μl cDNA反应液
0.2μl 引物MTA1或MTA2(均为100μM)
0.2μl 25mM dNTPs
0.1μl Rnasin
0.1μl DTT
17.2μl 水
上述混合物94℃孵育20秒,并且随后冷却至50℃。加入2U BCA,0.02UHybridase(RNaseH)和0.4μg T4 Gene 32蛋白质(单链DNA结合蛋白)的混合物,并且反应混合物孵育于60分钟。
每一反应混合物取5μl在5-20%PAGE(Novex)上电泳分析。通过扩增的总mRNA的反应产物显示成功的扩增为出现成片电泳条带,其由于多种mRNA的扩增而出现。在进行没有下述某一个组分的反应时,不会出现反应产物:a.双链cDNA;b.用于第一链合成的引物;以及c.用于第一链cDNA合成的mRNA。
实施例2:鉴定实施例1中步骤2和步骤3的反应产物
在实施例1的扩增反应中,由于使用的复合引物的5’RNA部分的“特有”序列,“特有”序列(即不与RNA模板杂交的序列)预期在第二链cDNA的3’末端产生。(第二链cDNA3’末端)的该序列与复合引物的5’RNA部分互补,并且与靶RNA无关。为确定获得的第二链cDNA中此序列的存在,利用与第二链cDNA的3’末端预期序列互补的引物作为正向引物,且G3PDH-特异引物作为反向PCR引物,进行反应产物(出现于实施例1的步骤2反应混合物中)的PCR扩增。上述引物对预期从具有“特有”序列的双链cDNA中扩增出特异产物。然而不应该从反义DNA产物(出现于实施例1的步骤3反应混合物中)的PCR扩增中产生特异产物,因为这些产物不应该含有“特有”序列(其通过复合引物的RNA部分引入,上述复合引物被RNaseH切割)。由于实施例1的步骤3反应混合物中主要含有扩增的DNA产物(其不应含有“特有”序列),该反应混合物的PCR扩增应该比实施例1步骤2反应混合物(其主要含有双链cDNA产物)的PCR扩增效率低(并因此产生相当少的产物)。
PCR反应按照如下进行:
每50μl PCR反应含有:
每一种引物0.4μM(Biosource International)
每一种dNTP 100μM(Epicenter)
2mM氯化镁(Epicenter)
1-2单位聚合酶(MasterAmp taq或MasterAmp Tfl,都来自Epicenter)
5μl 10×缓冲液,随酶提供
来自实施例1的步骤3的0.5μl线性扩增反应液或实施例1步骤2产生的cDNA的1∶20稀释液
PCR扩增循环为94℃30秒、51℃30秒和72℃30秒。一般地,样品经过20或25个循环。在样品保持在4℃之前有一个最后的72℃5分钟的延伸。
相似的反应用MOLT细胞系表达的T细胞受体(TCR)特异mRNA的特异引物进行。
使用G3PDH引物预期的PCR产物大小(碱基对)
| 反向引物 | 正向引物G3PDH | 正向引物dMTA1 |
| G3PDH5-2 | 18 | 62 |
| G3PDH5-3 | 110 | 156 |
| G3PDH5-4 | 157 | 203 |
| G3PDH5 | 253 | 299 |
| G3PDH5-6 | 309 | 354 |
| G3PDH5-7 | 361 | 405 |
引物序列
G3PDH5:5’TTT CCT GGT ATG ACA ACG AA
G3PDH5-4:5’CCA GCA AGA GCA CAA GAG GA
G3PDH3:5’GAT GGT ACA TGA CAA GGT
dMTA1:5’GAC GGA TGC GGT CTT TTT TTT
使用T细胞受体引物时预期的PCR产物大小(碱基对)
| TCR3 | DMTA1 | |
| TCR5-2 | 160 | 约440 |
| TCR5 | 238 | 约500 |
引物序列
TCR5:5’CCC GCA ACC ACT TCC GCT GTC
TCR5-2:5’CAA ACC CGT CAC CCA GAT CGT
TCR3:5’CAA CAC AAG GGC GCT GAC C
结果显示特有序列掺入第二链cDNA,这一点通过当使用引物DMTA1和G3PDH5 PCR扩增(G3PDH mRNA的序列扩增)步骤2反应混合物时长度约250碱基对的产物存在和当使用引物DMTA1和TCR5-2扩增(TCRβ链mRNA的序列扩增)时长度约400碱基对的产物存在而显示出。相反,使用相同的引物对PCR扩增步骤3的反应混合物显示扩增产物量很大程度的减少。因此,结果表明双链cDNA产物中掺入了(实施例1中使用的复合引物的RNA部分)“特有”序列,而在最终扩增的DNA产物中(由于RNA部分的切割)不存在特有序列。
实施例3:用总RNA制备物扩增总mRNA
从总RNA制备物中扩增总mRNA的能力通过省略mRNA纯化步骤而大大简化了方法。用市售的来源于乳腺癌肿瘤的总RNA制备物(CLONTECH;货号:64015-1)进行利用本发明方法的从总RNA制备物扩增总mRNA的实验演示。总mRNA扩增的过程按照下述的三步进行。
引物序列:
MTB2:GAC GGA UGC GGU CUTTTTTTTTTTTTTTNN
BA5:AAC TAC CTT CAA CTC CAT CA
BA3:GGA CTC GTC ATA CTC CTG C
其中斜体核苷酸表示核糖核苷酸,且“N”表示简并核苷酸(即其可以是A、T、C或G)。
步骤1:第一链cDNA的合成
4μl 5×缓冲液(250mM Tris-HCl,pH 8.3;375mM KCl,15mM MgCl2)
MTB2引物@1μM
25mM dNTPs
0.2μl RNasin核糖核酸酶抑制剂(Promege N2511,40u/μl)
1μl 0.1M DTT
每一反应使用5μg、1μg、0.2μg或40ng总RNA
DEPC处理水至19μl总体积
反应混合物75℃孵育2分钟,并且随后冷却至42℃。加SuperScript IIRNase H-反转录酶(200U,BRL 18064-022)至每一反应,并且反应混合物进一步在42℃孵育50分钟。
步骤2:第二链cDNA合成
第一链cDNA合成的反应混合物10μl分装至单个的反应管中。向每一管中加入第二链合成的贮存反应混合物20μl。所述第二链合成的贮存反应混合物包含如下成分:
2μl 10×Klenow反应缓冲液(10×缓冲液:500mM Tris-HCl,pH 8.0;100mM MgCl2,500mM NaCl)
2U Klenow DNA聚合酶(BRL18012-021)
0.1μl AMV反转录酶(BRL18020-016,25U/μl)
0.2μl大肠杆菌核糖核酸酶H(BRL18021-014,4U/μl)
0.2μl(25mM)dNTPs
0或0.2μl大肠杆菌DNA连接酶(BRL18052-019,10U/μl)
反应混合物37℃孵育30分钟。加热至75℃5分钟使酶失活终止反应。
步骤3:总cDNA的扩增
利用上述第二链cDNA反应混合物1μl,在T4基因32蛋白存在下使用MTA1复合引物在50℃60分钟进行扩增。
每一反应混合物包含如下成分:
2μl 10×缓冲液(200mM Tris-HCl,pH 8.5;50mM MgCl2,1%NP-40)
0.2μl dNTPs(25mM)
0.2μl MTA1(100μM)
1μl第二链cDNA合成混合物
0.1μl Rnasin
0.1μl DTT(0.1M)
加DEPC处理水至总体积18.8μl
反应混合物94℃孵育20秒,并且随后冷却至50℃。加2U Bca(Takara货号2710A),0.02U Hybridase热稳定RNase H(Epicentre H39100)和0.4μgT4基因32蛋白(USB70029Z),并且反应混合物进一步在此温度下孵育60分钟。
步骤3的反应混合物(预期含有扩增的DNA产物)通过凝胶电泳(5-20%PAGE,Novex)分析。总mRNA扩增产物显示为成片电泳条带表明为成功的扩增,其中的成片电泳条带预计是由于对样品中多种mRNA的扩增而产生。
利用特异引物对的PCR扩增显示出“特有”(特定)序列(与所用复合引物的5’末端RNA部分互补的序列)掺入第二链cDNA。步骤2和步骤3反应混合物的一部分用引物G3PDH5-4/G3PDH3或BA5/BA3(β肌动蛋白)在上述实施例2中所述条件下PCR扩增。步骤2反应混合物的扩增产生大量正确大小的产物,而步骤3反应混合物的扩增产生相当少量的相同产物。因此,结果显示(本实施例所用复合引物的RNA部分的) “特有”序列掺入双链cDNA产物,并且在最终扩增的DNA产物中(由于RNA部分的切割)无此序列。
实施例4:从总RNA制备物和纯化的mRNA中制备在其第二链cDNA中包含附加特定序列的双链cDNA
制备自HCT116细胞系的总RNA(1μg)或制备自MOLT4细胞系(Clontech)的mRNA(100ng)作为靶用于产生中间双链cDNA产物,所述双链cDNA产物在其第二链cDNA包含附加特定序列。附加序列通过利用复合(第一)引物掺入。
制备第一和第二链cDNA的过程基本上按照实施例1和3所述进行,并且通常包括下述步骤:(1)第一链cDNA的合成;(2)第二链cDNA的合成以产生在其一个末端包含RNA/DNA异质双链体的双链cDNA,所述RNA/DNA异质双链体是RNaseH的底物。双链cDNA中间产物预期包含来自靶RNA样品的多种RNA的cDNA拷贝,每一cDNA具有相同的附加特定序列。附加特定序列的序列预期是与靶RNA杂交的复合(第一)引物的5’RNA部分的互补序列。
进行PCR实验以确认第二链cDNA的存在,所述第二链cDNA包含(a)GAPDH mRNA序列的第二链cDNA拷贝其中所述GAPDHmRNA已知存在于上述两种RNA靶样品的mRNA中;以及(b)3’末端的“特有”序列(即第一复合引物5’RNA部分的互补序列)。所用PCR引物对如下:
1)与特有序列互补的引物(DMTA1)和与GAPDH mRNA的序列互补的引物(GAPDH5-4)用于产生203bp产物,其取决于第二链cDNA3’末端的附加序列。
2)与GAPDH mRNA序列互补的两条引物GAPDH3以及引物GAPDH5-4,用于产生157bp GAPDH的特异产物,其不依赖于在第二链cDNA3’末端附加特定序列。
PCR按照实施例1和2所述进行,其利用两个单独的如上所述来自每一起始模板的cDNA制备物。PCR反应利用凝胶电泳分析。结果显示在图9。泳道对应含有下述模板和引物对的反应混合物:
1.标记物
2.来自HCT116的cDNA GAPDH3/GAPDH5-4
3.来自HCT116的cDNA GAPDH3/GAPDH5-4
4.来自MOLT4的cDNA GAPDH3/GAPDH5-4
5.来自MOLT4的cDNA GAPDH3/GAPDH5-4
6.无模板 GAPDH3/GAPDH5-4
7.来自HCT116的cDNA dMTA1/GAPDH5-4
8.来自HCT116的cDNA dMTA1/GAPDH5-4
9.来自MOLT4的cDNA dMTA1/GAPDH5-4
10.来自MOLT4的cDNA dMTA1/GAPDH5-4
11.无模板 dMTA1/GAPDH5-4
箭头指示预期的PCR产物的位置。
正如所期望,在利用引物对(1)扩增HCT116和MOLT4样品时,产生较长的片段,且在利用引物对(2)扩增HCT116和MOLT4样品时,产生较短的片段。在不加模板的对照样品中无产物产生。该实施例表明利用此处所述的方法在第二链cDNA的3’末端产生高效率的特定序列的附加。
实施例5:利用实时PCR扩增总polyA mRNA并定量产物
来自人Colon肿瘤总RNA(Clontech货号64014-1)的总RNA 200ng用于作为扩增反应的靶。第一和第二链cDNA的制备和随后的扩增步骤基本上按照实施例3所述进行,且有如下修改:
(1)第二链cDNA合成的反应混合物含有Klenow DNA聚合酶其缺少3’和5’外切酶活性),并且缺少连接酶。
(2)所得cDNA的扩增用Bst聚合酶(4单位,NEB)代替Bca聚合酶进行。
根据下列方法对使用对应于4种不同mRNA的4种引物对产生的cDNA中间产物(第二链cDNA)和反义扩增产物进行定量和实时PCR:
cDNA或扩增产物在TE缓冲液中1∶10或1∶100稀释。
实时PCR的反应混合物总体积设定为20μl,如下所述:
每一反应包含:
10μl 2×ABI SYBR Green基本混合物(ABI货号4309155)
0.6μl 10μM正向引物
0.6μl 10μM反向引物
1μl模板(上述特异cDNA或扩增产物的稀释液)
7.8μl水
使用下列引物对定量按如上所述产生的cDNA或扩增产物形式的4种特异表达基因:
G6PD
G6PD5 5′AGGCAGCCTCTCTGCTATAAGAAA 3′
G6PD3 5′GCAGGGCATTGAGGTTGG 3′
LGALS1
LGALS15 5′ATGGCAGCTGACGGTGACTT 3′
LGALS13 5′CATGGGCTGGCTGATTT 3′
MT2A
MT2A5 5′CGCCTGATGCTGGGACAG 3′
MT2A3 5′GTTGTACATAAAAAATCCAGGTTTGTG 3′
RPL27
RPL275 5′GATCCTGCTCTTAAACGCAAGG 3′
RPL273 5′TGCCTGTCTTGTATCTCTCTTCAAAC 3′
PCR反应在iCycler(BioRad)上利用下述热循环程序进行:
94℃10分钟以活化DNA聚合酶
40个循环:94℃30秒,随后60℃30秒
数据分析按照制造商推荐方法进行。
图10显示4个示踪的荧光读数与用PCR反应定量cDNA产物(通过扩增第二链cDNA)或定量相应SPIA扩增产物(通过扩增积聚的第二链cDNA)而进行的PCR反应循环数间的关系。图片显示了分别使用(从上至下):MTA2、RPL27、LGALS1和G6PD引物对进行定量实验的结果。每一图片显示利用扩增产物制备物(标为“SPIA”)的6个实验和利用cDNA产物制备物(标为“cDNA”)的2个实验的结果。X轴为PCR循环,且Y轴为减去RFU的PCR基线。
利用本发明方法的每一基因产物(使用cDNA产物模板的反应和使用相应扩增产物作为模板的反应间)的扩增水平通过产生定义阈值之上的荧光信号所需PCR循环的不同数目(标为“CT”)而定义。表1显示每一基因产物的“ΔCT”值的计算结果(反映了对使用cDNA产物模板的反应和使用相应扩增产物作为模板的反应的CT值的比较),并且其揭示:不管在输入总RNA中它们的表达水平如何,对应于样品中4种基因产物的mRNA被本发明方法同等地扩增。
表1:每一基因产物的“ΔCT”值的计算结果
| 基因 | cDNA CT | SPIA CT | ΔCT |
| MT2A | 31 | 26 | 11 |
| RPL27 | 30 | 19 | 11 |
| LGAL | 31 | 21 | 10 |
| G6PD | 35 | 26 | 9 |
虽然为了清楚地理解,通过例证和实施例方式已详细描述了上述发明,但本领域技术人员显然可进行某些改变和改进。因此,此处的描述和实施例不应构成对本发明范围的限制,本发明的范围在附上的权利要求中有所描述。
Claims (276)
1.产生多拷贝的与目的RNA序列互补的多核苷酸序列的方法,所述方法包括下列步骤:
(a)用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3′DNA部分的复合引物,由此产生包含第一引物延伸产物和靶RNA的复合体;
(b)用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体中的RNA;
(c)用DNA依赖的DNA聚合酶和RNA依赖的DNA聚合酶延伸与第一引物延伸产物杂交的第二引物,由此产生第二引物延伸产物,以形成第一和第二引物延伸产物复合体;
(d)用从RNA/DNA杂合体上切割RNA的酶从第一和第二引物延伸产物复合体的第一引物上切割RNA,以使复合扩增引物与第二引物延伸产物杂交,其中所述复合扩增引物包含RNA部分和3′DNA部分;
(e)用DNA依赖的DNA聚合酶延伸所述复合扩增引物;
由此所述第一引物延伸产物被置换,RNA从复合扩增引物上被切割下来,且另一复合扩增引物杂交,由此重复引物延伸和链置换,且由此产生多拷贝的与目的RNA序列互补的多核苷酸序列。
2.产生多拷贝目的RNA序列的方法,所述方法包括下列步骤:
(a)用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物,由此产生包含第一引物延伸产物和靶RNA的复合体;
(b)用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体中的RNA;
(c)用DNA依赖的DNA聚合酶和RNA依赖的DNA聚合酶延伸与第一引物延伸产物杂交的第二引物,由此产生第二引物延伸产物,以形成第一和第二引物延伸产物复合体;
(d)用从RNA/DNA杂合体上切割RNA的酶从第一和第二引物延伸产物的复合体中的第一引物上切割RNA,以使复合扩增引物与第二引物延伸产物杂交,其中所述复合扩增引物包含RNA部分和3′DNA部分;
(e)用DNA依赖的DNA聚合酶延伸与第二引物延伸产物杂交的上述复合扩增引物;由此置换上述第一引物延伸产物,RNA从复合扩增引物上被切割下来,且另一复合引物杂交,由此重复引物延伸和链置换;
(f)在允许RNA聚合酶发生转录的条件下,用置换的第一引物延伸产物与包含前启动子并包含可与置换的第一引物延伸产物杂交的区域的多核苷酸杂交,以便产生包含与置换的第一引物延伸产物互补的序列的RNA转录本,
由此产生多拷贝目的RNA序列。
3.权利要求2的方法,其中前启动子多核苷酸的3′端包含与置换的引物延伸产物杂交的区域,由此DNA聚合酶延伸置换的引物延伸产物而产生双链启动子,从所述双链启动子可开始进行转录。
4.权利要求2的方法,其中前启动子多核苷酸为前启动子模板寡核苷酸(PTO)。
5.权利要求3或4的方法,其还包括使用经标记的rNTP,由此产生标记的产物。
6.权利要求1或2的方法,其中第二引物包含与引物延伸产物杂交的靶RNA的片段,所述片段通过用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体中的RNA而产生。
7.权利要求1或2的方法,其中第二引物包含DNA。
8.权利要求1或2的方法,其中第一引物的RNA部分相对于该第一引物的3′DNA部分而言为5′。
9.权利要求8的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻。
10.权利要求1或2的方法,其中复合扩增引物的RNA部分相对于该复合扩增引物的3′DNA部分而言为5′。
11.权利要求10的方法,其中复合扩增引物的RNA部分与该复合扩增引物的3′DNA部分毗邻。
12.权利要求11的方法,其中所述复合扩增引物的RNA部分包含至少约5个核苷酸,且所述复合扩增引物的DNA部分包含至少1个核苷酸。
13.权利要求12的方法,其中所述复合扩增引物的RNA部分由约5个至约50个核苷酸组成,且所述复合扩增引物的DNA部分由约1个至约20个核苷酸组成。
14.权利要求1或2的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分。
15.权利要求1或2的方法,其中第一引物包含多聚dT序列。
16.权利要求15的方法,其中第一引物在3′端包含至少1个随机核苷酸。
17.权利要求1或2的方法,其中靶RNA为mRNA。
18.权利要求15的方法,其中靶RNA为mRNA。
19.权利要求1或2的方法,其中第一引物包含随机引物序列。
20.权利要求1或2的方法,其中靶RNA为mRNA,并且第一引物包含多聚dT序列,且其进一步为包含在该第一引物与靶mRNA杂交的条件下不可与靶mRNA杂交的5′部分的有尾引物。
21.权利要求1或2的方法,其中将多种不同的第一引物用于与靶RNA杂交。
22.权利要求1或2的方法,其中第二引物为随机引物。
23.权利要求1或2的方法,其中第二引物为包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5′部分的有尾引物。
24.权利要求23的方法,其中从RNA/DNA杂合体上切割RNA的酶为RNaseH。
25.权利要求1或2的方法,其中RNA依赖的DNA聚合酶和DNA依赖的DNA聚合酶为同一种酶。
26.权利要求1或2的方法,其中RNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶为同一种酶。
27.权利要求1或2的方法,其中DNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶为同一种酶。
28.权利要求1或2的方法,其中DNA依赖的DNA聚合酶、RNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶为同一种酶。
29.权利要求1的方法,其还包括使用经标记的dNTP,由此产生标记的产物。
30.权利要求1或2的方法,其中第一引物和复合扩增引物相同。
31.权利要求1或2的方法,其中第一引物和复合扩增引物不相同。
32.权利要求1或2的方法,其中所述的目的RNA序列为两种或多种不同的目的序列。
33.权利要求32的方法,其中所述方法包括至少两种不同的第一引物。
34.权利要求33的方法,其中每一第一引物包含多聚dT部分。
35.权利要求33的方法,其中每一第一引物包含随机引物序列。
36.权利要求9的方法,其中第一引物的RNA部分包含至少约5个核苷酸,且第一引物的DNA部分包含至少约5个核苷酸。
37.权利要求36的方法,其中复合引物的RNA部分由约145至约50个核苷酸组成,且复合引物的DNA部分由约5至约20个核苷酸组成。
38.权利要求1或2的方法,其中复合引物的RNA部分包含下列核苷酸序列:5′-GACGGAUGCGGUCU-3′(SEQ ID NO:25)。
39.权利要求1或2的方法,其中RNA依赖的DNA聚合酶和DNA依赖的DNA聚合酶分别为不同的酶。
40.权利要求1或2的方法,其中RNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶分别为不同的酶。
41.权利要求1或2的方法,其中DNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶分别为不同的酶。
42.权利要求1或2的方法,其中DNA依赖的DNA聚合酶活性、RNA依赖的DNA聚合酶活性和从RNA/DNA杂合体上切割RNA的酶分别为不同的酶。
43.权利要求1或2的方法,其中第一引物的RNA部分相对于该第一引物的3′DNA部分而言为5′,且复合扩增引物的RNA部分相对于该复合扩增引物的3′DNA部分而言为5′。
44.权利要求43的方法,其中第一引物的5′RNA部分与该第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与该复合扩增引物的3′DNA部分毗邻。
45.权利要求43的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分。
46.权利要求43的方法,其中第一引物包含随机引物序列。
47.权利要求43的方法,其中第一引物包含多聚dT序列。
48.权利要求43的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分,且其中第一引物还包含随机引物序列。
49.权利要求43的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分,且其中第一引物还包含多聚dT序列。
50.权利要求43的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分,且其中第一引物还包含多聚dT序列,且其中第一引物在3′端还包含至少1个随机核苷酸。
51.权利要求43的方法,其中第二引物为有尾引物,其包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5′部分。
52.权利要求45的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与所述复合扩增引物的3′DNA部分毗邻。
53.权利要求46的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与所述复合扩增引物的3′DNA部分毗邻。
54.权利要求47的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与所述复合扩增引物的3′DNA部分毗邻。
55.权利要求48的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与所述复合扩增引物的3′DNA部分毗邻。
56.权利要求49的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与所述复合扩增引物的3′DNA部分毗邻。
57.权利要求50的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与所述复合扩增引物的3′DNA部分毗邻。
58.权利要求51的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻,且复合扩增引物的5′RNA部分与所述复合扩增引物的3′DNA部分毗邻。
59.产生与目的RNA序列互补的多核苷酸序列的多个拷贝的方法,其包括孵育反应混合物,上述反应混合物包含:
(a)第一引物延伸产物和第二引物延伸产物的复合体,其中第一引物延伸产物与第二引物延伸产物杂交,且其中第二引物延伸产物包含3’单链部分,其中3’单链部分包含有与第一引物的一部分互补的序列,其中第一引物为包含RNA部分和3′DNA部分的复合引物且为包含不可与靶RNA杂交的5′部分的有尾引物,其中第一引物延伸产物和第二引物延伸产物的部分双链复合体通过这样的方法产生,所述方法包括用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物,以及用从RNA/DNA杂合体上切割RNA的酶切割第一引物延伸产物和第二引物延伸产物复合体中第一引物的RNA;
(b)可与所述3’单链部分杂交的复合扩增引物,其中所述复合扩增引物包含RNA部分和3′DNA部分;
(c)DNA依赖的DNA聚合酶;和
(d)从RNA/DNA杂合体上切割RNA的酶;
其中孵育条件为允许引物杂交、引物延伸、RNA切割和当另一复合扩增引物与所述3’单链部分杂交时置换第一引物延伸产物,从而引物延伸和链置换得以重复,由此产生多拷贝与目的RNA序列互补的多核苷酸序列。
60.产生多拷贝目的RNA序列的方法,其包括孵育反应混合物,上述反应混合物包含:
(a)第一引物延伸产物和第二引物延伸产物的复合体,其中第一引物延伸产物与第二引物延伸产物杂交,且其中第二引物延伸产物包含3’单链部分,其中3’单链部分包含有与第一引物的一部分互补的序列,其中第一引物为包含RNA部分和3′DNA部分的复合引物,其中第一引物为包含不可与靶RNA杂交的5′部分的有尾引物,且其中部分双链多核苷酸通过这样的方法产生,所述方法包括用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物;
(b)可与所述3’单链部分杂交的复合扩增引物,其中所述复合扩增引物包含RNA部分和3’DNA部分;
(c)DNA依赖的DNA聚合酶;
(d)RNA聚合酶;
(e)包含前启动子并包含与第一引物延伸产物杂交的区域的前启动子多核苷酸;和
(f)从RNA/DNA杂合体上切割RNA的酶;
其中孵育条件为允许引物杂交、引物延伸、RNA切割和当另一复合扩增引物与所述3’单链部分杂交时置换第一引物延伸产物从而引物延伸和链置换得以重复、前启动子多核苷酸与置换的第一引物延伸产物杂交以形成包含置换的引物延伸产物和前启动子多核苷酸的第二复合体、以及从所述第二复合体进行RNA转录,由此产生多拷贝的目的RNA序列。
61.权利要求59或60的方法,其中从RNA/DNA杂合体上切割RNA的酶为RNaseH。
62.权利要求60的方法,其中前启动子多核苷酸在其3′末端包含与置换的引物延伸产物杂交的区域,由此用DNA聚合酶延伸置换的引物延伸产物产生双链启动子,从所述双链启动子发生转录。
63.权利要求60或62的方法,其中反应混合物还包含经标记的rNTP,由此产生标记的产物。
64.权利要求59的方法,其中反应混合物还包含经标记的dNTP,由此产生标记的产物。
65.权利要求59或60的方法,其中第一引物的RNA部分相对于该第一引物的3′DNA部分而言为5′。
66.权利要求65的方法,其中第一引物的5′RNA部分与所述第一引物的3′DNA部分毗邻。
67.权利要求66的方法,其中第一引物的RNA部分包含至少约5个核苷酸,且该第一引物的DNA部分包含至少约5个核苷酸。
68.权利要求67的方法,其中第一引物的RNA部分由约5至约50个核苷酸组成,且该第一引物的DNA部分由约5至约20个核苷酸组成。
69.权利要求59或60的方法,其中复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
70.权利要求69的方法,其中复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
71.权利要求70的方法,其中复合扩增引物的RNA部分包含至少约5个核苷酸,且该复合扩增引物的DNA部分包含至少1个核苷酸。
72.权利要求71的方法,其中复合扩增引物的RNA部分由约5至约50个核苷酸组成,且该复合扩增引物的DNA部分由约1至约20个核苷酸组成。
73.权利要求59或60的方法,其中第一引物的RNA部分相对于该第一引物的3’DNA部分而言为5’,且复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
74.权利要求73的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
75.权利要求73的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分。
76.权利要求73的方法,其中第一引物包含随机引物序列。
77.权利要求73的方法,其中第一引物包含多聚dT序列。
78.权利要求73的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含随机引物序列。
79.权利要求的方法73,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列。
80.权利要求73的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列,且其中第一引物还在3′端包含至少1个随机核苷酸。
81.权利要求73的方法,其中第二引物为包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5’部分的有尾引物。
82.权利要求75的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
83.权利要求76的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
84.权利要求77的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
85.权利要求78的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
86.权利要求79的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
87.权利要求80的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
88.权利要求81的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
89.产生多拷贝与目的RNA序列互补的多核苷酸序列的方法,其包括:
(a)孵育反应混合物,所述反应混合物包含:
(i)靶RNA;
(ii)可与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3′DNA部分的复合引物;
(iii)RNA依赖的DNA聚合酶;
其中孵育条件为允许引物杂交、形成包含第一引物延伸产物和靶RNA的复合体;
(b)孵育反应混合物,所述反应混合物包含:
(i)第一引物延伸产物;
(ii)DNA依赖的DNA聚合酶;
(iii)RNA依赖的DNA聚合酶;
(iv)第二引物;
其中孵育条件为允许形成包含第一引物延伸产物和第二引物延伸产物的复合体;以及
(c)孵育反应混合物,所述反应混合物包含:
(i)包含第一引物延伸产物和第二引物延伸产物的复合体;
(ii)可从RNA/DNA杂合体上切割RNA的酶;
(iii)复合扩增引物,其中该复合扩增引物包含RNA部分和3′DNA部分;和
(iv)DNA依赖的DNA聚合酶,
其中孵育条件为允许切割RNA、复合引物杂交、以及从包含第一引物延伸产物和第二引物延伸产物的复合体上置换第一引物延伸产物,由此另一复合扩增引物杂交,并且重复引物延伸和链置换;
由此产生多拷贝的与目的RNA序列互补的多核苷酸序列。
90.权利要求89的方法,其中步骤(b)的反应混合物还包含可从RNA/DNA杂合体上切割RNA的酶。
91.权利要求89的方法,其中步骤(b)的第二引物为包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5’部分的有尾引物,并且其中孵育在允许该第二引物杂交的条件下进行。
92.权利要求91的方法,其中第二引物包含DNA。
93.权利要求89至92中任意一项所述的方法,其中第一引物的RNA部分相对于该第一引物的3′DNA部分而言为5′。
94.权利要求93的方法,其中第一引物的5′RNA部分与该第一引物的3′DNA部分毗邻。
95.权利要求89-92中任意一项所述的方法,其中复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
96.权利要求95的方法,其中复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
97.权利要求96的方法,其中复合扩增引物的RNA部分包含至少约5个核苷酸,且复合扩增引物的DNA部分包含至少1个核苷酸。
98.权利要求97的方法,其中复合扩增引物的RNA部分由约5至约50个核苷酸组成,且该复合扩增引物的DNA部分由约1至约20个核苷酸组成。
99.权利要求89-92中任意一项所述的方法,其中第一引物的RNA部分相对于该第一引物的3’DNA部分而言为5’,且复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
100.权利要求99的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
101.权利要求99的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分。
102.权利要求99的方法,其中第一引物包含随机引物序列。
103.权利要求99的方法,其中第一引物包含多聚dT序列。
104.权利要求99的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含随机引物序列。
105.权利要求99的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列。
106.权利要求99的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列,且其中第一引物在3’端还包含至少1个随机核苷酸。
107.权利要求99的方法,其中第二引物为包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5’部分的有尾引物。
108.权利要求101的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
109.权利要求102的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
110.权利要求103的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
111.权利要求104的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
112.权利要求105的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
113.权利要求106的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
114.权利要求107的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
115.权利要求89至92中任意一项所述的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分。
116.权利要求89至92中任意一项所述的方法,其中第一引物包含多聚dT序列。
117.权利要求89至92中任意一项所述的方法,其中靶RNA为mRNA。
118.权利要求116的方法,其中靶RNA为mRNA。
119.权利要求116的方法,其中第一引物在3’端包含至少1个随机核苷酸。
120.权利要求89至92中任意一项所述的方法,其中第一引物包含随机序列。
121.权利要求89至92中任意一项所述的方法,其中靶RNA为mRNA,并且与靶RNA杂交的第一引物包含多聚dT序列,且为包含在该复合引物与靶mRNA杂交的条件下不可与靶mRNA杂交的5′部分的有尾引物。
122.权利要求89至92中任意一项所述的方法,其中使用了多种不同的复合引物与靶RNA杂交。
123.权利要求89至92中任意一项所述的方法,其中第二引物为随机引物。
124.权利要求89至92中任意一项所述的方法,其中第二引物为包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5′部分的有尾引物。
125.权利要求89至92中任意一项所述的方法,其中在步骤(c)的反应混合物中从RNA/DNA杂合体上切割RNA的酶为RNaseH。
126.权利要求89至92中任意一项所述的方法,其中RNA依赖的DNA聚合酶和DNA依赖的DNA聚合酶为同一种酶。
127.权利要求89至92中任意一项所述的方法,其中RNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶为同一种酶。
128.权利要求89至92中任意一项所述的方法,其中DNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶为同一种酶。
129.权利要求89至92中任意一项所述的方法,其中DNA依赖的DNA聚合酶、RNA依赖的DNA聚合酶和从RNA/DNA杂合体上切割RNA的酶为同一种酶。
130.权利要求89至92中任意一项所述的方法,其中步骤(c)的反应混合物还包含经标记的dNTP,由此产生标记的产物。
131.权利要求89至92中任意一项所述的方法,其中第一引物和扩增引物相同。
132.权利要求89至92中任意一项所述的方法,其中第一引物和扩增引物不相同。
133.权利要求89至92中任意一项所述的方法,其中所述方法包括产生多拷贝的与两种或多种不同目的序列互补的多核苷酸序列。
134.权利要求133的方法,其中所述方法包含至少两种不同的第一引物。
135.权利要求134的方法,其中第一引物包含多聚dT部分。
136.权利要求135的方法,其中第一引物包含随机引物序列。
137.权利要求94的方法,其中第一引物的RNA部分包含至少约5个核苷酸,且第一引物的DNA部分包含至少约5个核苷酸。
138.权利要求137的方法,其中第一引物的RNA部分由约5至约50个核苷酸组成,且第一引物的DNA部分由约5至约20个核苷酸组成。
139.权利要求89至92中任意一项所述的方法,其中复合引物的RNA部分包含下列核苷酸序列:5′-GACGGAUGCGGUCU-3′(SEQ ID NO:25)。
140.权利要求89至92中任意一项所述的方法,其中不同的酶包含RNA依赖的DNA聚合酶活性和DNA依赖的DNA聚合酶活性。
141.权利要求89至92中任意一项所述的方法,其中不同的酶包含RNA依赖的DNA聚合酶活性和从RNA/DNA杂合体上切割RNA。
142.权利要求89至92中任意一项所述的方法,其中不同的酶包含DNA依赖的DNA聚合酶活性和从RNA/DNA杂合体上切割RNA。
143.权利要求89至92中任意一项所述的方法,其中不同的酶包含DNA依赖的DNA聚合酶活性、RNA依赖的DNA聚合酶活性和从RNA/DNA杂合体上切割RNA。
144.产生多拷贝与目的RNA序列互补的多核苷酸序列的方法,所述方法包括下列步骤:
(a)用从RNA/DNA杂合体上切割RNA的酶切割第一和第二引物延伸产物复合体中的RNA,其中第一引物延伸产物通过用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物而产生,其中第一引物为包含RNA部分和3′DNA部分的复合引物,且其中第二引物延伸产物通过延抻与第一引物延伸产物杂交的第二引物而产生;
(b)将复合扩增引物与第二引物延伸产物杂交,并用DNA依赖的DNA聚合酶延伸该扩增引物,其中所述复合扩增引物为包含RNA部分和3′DNA部分的复合引物;
由此所述第一引物延伸产物被置换,RNA从复合扩增引物上被切割下来,且另一复合扩增引物杂交,由此重复引物延伸和链置换;并由此多拷贝的与目的RNA序列互补的多核苷酸序列得以产生。
145.产生多拷贝的与目的RNA序列互补的多核苷酸序列的方法,所述方法包括:延伸复合体中复合扩增引物的步骤,所述复合体包含:
(i)第一和第二引物延伸产物复合体,其中第一引物延伸产物通过用RNA依赖的DNA聚合酶延伸与靶RNA杂交的第一引物而产生,其中第一引物为包含RNA部分和3’DNA部分的复合引物,其中第二引物延伸产物通过延伸与第一引物延伸产物杂交的第二引物而产生,且其中第一和第二引物延伸产物复合体中的RNA被从RNA/DNA杂合体上切割RNA的酶切割;和
(ii)复合扩增引物,所述复合扩增引物包含RNA部分和3′DNA部分,其中复合扩增引物杂交至第二引物延伸产物;
由此所述第一引物延伸产物被置换,RNA从复合扩增引物上被切割下来,且另一复合扩增引物杂交,由此重复引物延伸和链置换;并由此多拷贝的与目的RNA序列互补的多核苷酸序列得以产生。
146.权利要求144或145的方法,其中第二引物包含DNA。
147.权利要求144或145的方法,其中第一引物的RNA部分相对于该第一引物的3′DNA部分而言为5′。
148.权利要求147的方法,其中第一引物的5′RNA部分与该第一引物的3′DNA部分毗邻。
149.权利要求148的方法,其中第一引物的RNA部分包含至少约5个核苷酸,且该第一引物的DNA部分包含至少约5个核苷酸。
150.权利要求149的方法,其中第一引物的RNA部分由约5至约50个核苷酸组成,且该第一引物的DNA部分由约5至约20个核苷酸组成。
151.权利要求145的方法,其中复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
152.权利要求151的方法,其中复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
153.权利要求152的方法,其中复合扩增引物的RNA部分包含至少约5个核苷酸,且该复合扩增引物的DNA部分包含至少1个核苷酸。
154.权利要求153的方法,其中复合扩增引物的RNA部分由约5至约50个核苷酸组成,且该复合扩增引物的DNA部分由约1至约20个核苷酸组成。
155.权利要求144或145的方法,其中第一引物的RNA部分相对于该第一引物的3’DNA部分而言为5’,且该复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
156.权利要求155的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
157.权利要求155的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分。
158.权利要求155的方法,其中第一引物包含随机引物序列。
159.权利要求155的方法,其中第一引物包含多聚dT序列。
160.权利要求155的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含随机引物序列。
161.权利要求155的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列。
162.权利要求155的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列,且其中第一引物在3’端还包含至少1个随机核苷酸。
163.权利要求155的方法,其中第二引物为包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5’部分的有尾引物。
164.权利要求157的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
165.权利要求158的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
166.权利要求159的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
167.权利要求160的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
168.权利要求161的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
169.权利要求162的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
170.权利要求163的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
171.权利要求145的方法,其中第一引物为包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分的有尾引物。
172.权利要求145的方法,其中第一引物包含多聚dT序列。
173.权利要求172的方法,其中第一引物在3’端包含至少1个随机核苷酸。
174.权利要求172的方法,其中靶RNA为mRNA。
175.权利要求144或145的方法,其中靶RNA为mRNA。
176.产生多拷贝的与RNA序列互补的多核苷酸序列的方法,所述方法包括以下步骤:
(a)通过延伸与靶RNA杂交的第一引物合成多核苷酸链,其中第一引物为包含RNA部分和3’DNA部分的复合引物,且由此产生包含第一多核苷酸链和靶RNA的复合体;
(b)合成与第一多核苷酸链互补的第二多核苷酸链,由此第二多核苷酸链与第一多核苷酸链形成复合体;
(c)从第一多核苷酸链和第二多核苷酸链的复合体中切割下第一复合引物的RNA,由此复合扩增引物杂交至第二多核苷酸链,其中所述复合扩增引物包含RNA部分和3′DNA部分;
(d)延伸与第二多核苷酸链杂交的复合扩增引物,由此所述第一多核苷酸链被置换,RNA从复合扩增引物上被切割下来,且另一复合扩增引物杂交,由此重复引物延伸和链置换,且由此产生多拷贝的与靶RNA互补的多核苷酸序列。
177.权利要求176的方法,其中第二多核苷酸链的合成由第二引物引发,所述第二引物包含与第一多核苷酸产物杂交的靶RNA的片段,所述片段通过用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体中的靶RNA而产生。
178.权利要求177的方法,其中所述从RNA/DNA杂合体上切割RNA的酶为RNase H。
179.权利要求176的方法,其中第一引物的RNA部分相对于3’DNA部分而言为5’。
180.权利要求179的方法,其中第一引物的5’RNA部分与3’DNA部分毗邻。
181.权利要求176、179或180的方法,其中第一引物为有尾引物,其包含在该复合第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分。
182.权利要求180的方法,其中复合扩增引物的RNA部分相对于3’DNA部分而言为5’。
183.权利要求182的方法,其中复合扩增引物的RNA部分与其3’DNA部分毗邻。
184.权利要求176、179或180的方法,其中复合扩增引物的RNA部分相对于其3’DNA部分而言为5’。
185.权利要求184的方法,其中复合扩增引物的RNA部分与其3’DNA部分毗邻。
186.权利要求185的方法,其中第一引物包含多聚dT序列。
187.权利要求185或186的方法,其中靶RNA为mRNA。
188.权利要求176的方法,其中第一引物的3’DNA部分包含随机引物序列。
189.权利要求176的方法,其中合成第二多核苷酸链的步骤中使用了这样的酶,其包含DNA依赖的DNA聚合酶活性和RNA依赖的DNA聚合酶活性。
190.权利要求176的方法,其中合成第二多核苷酸链的步骤中使用了这样的酶,其包含DNA依赖的DNA聚合酶活性、RNA依赖的DNA聚合酶活性和从RNA/DNA杂合体上切割RNA的活性。
191.权利要求176的方法,其中从第一多核苷酸链和第二多核苷酸链的复合体中切割下第一复合引物的RNA的步骤中使用了包含从RNA/DNA杂合体上切割RNA这一活性的酶。
192.权利要求176的方法,其中引物延伸是在存在至少一种经标记的dNTP时实施的,由此产生标记的产物。
193.权利要求176的方法,其中所述方法包括使用两种或多种不同的目的靶RNA序列,并产生与两种或多种不同的目的靶RNA序列互补的多拷贝多核苷酸序列。
194.权利要求193的方法,其中所述方法包含至少两种不同的与靶RNA杂交的复合第一引物,其中每一引物包含含有随机引物序列的3′部分。
195.权利要求193的方法,其中所述方法包含至少两种不同的与靶RNA杂交的复合第一引物,其中每一引物包含含有多聚dT序列的3′DNA部分。
196.权利要求176的方法,其中第一引物的RNA部分相对于该第一引物的3’DNA部分而言为5’,且复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
197.权利要求196的方法,其中第一引物的5’RNA部分与该第一引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
198.权利要求196或197的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分。
199.权利要求196或197的方法,其中第一引物包含随机引物序列。
200.权利要求196或197的方法,其中第一引物包含多聚dT序列。
201.权利要求196或197的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含随机引物序列。
202.权利要求196或197的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列。
203.权利要求196或197的方法,其中第一引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5’部分,且其中第一引物还包含多聚dT序列,且其中第一引物在3’端还包含至少1个随机核苷酸。
204.权利要求196或197的方法,其中第二引物为包含在该第二引物与第一引物延伸产物杂交的条件下不可与第一引物延伸产物杂交的5’部分的有尾引物。
205.测定目的RNA序列的方法,所述方法包括分析扩增产物以确定序列,所述扩增产物为在dNTP和dNTP类似物的混合物存在下通过权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法产生的,这样在掺入dNTP类似物后引物延伸终止。
206.测定目的RNA序列的方法,所述方法包括分析扩增产物以确定序列,所述扩增产物为在rNTP和rNTP类似物的混合物存在下通过权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中所述的任一方法产生的,这样在掺入rNTP类似物后引物延伸终止。
207.通过单链构象多态性检测靶RNA中突变的方法,其包括分析扩增产物的单链构象,其中与参照单链多核苷酸相比较构象的差异显示出靶多核苷酸上的突变,所述扩增产物通过权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法产生。
208.确定靶RNA中目的序列存在与否的方法,所述方法包括(i)扩增靶RNA,所述扩增包括延伸与由靶RNA产生的多核苷酸复合体杂交的复合扩增引物,其中所述多核苷酸复合体包含对应于目的序列的3’单链区,其中复合扩增引物的RNA部分已知与包含目的序列的参考序列杂交,且其中所述多核苷酸复合体通过以下方法产生:
(a)延伸与靶RNA杂交的第一引物,其中第一引物为包含RNA部分和3’DNA部分的复合引物,由此产生包含第一引物延伸产物和靶RNA的复合体;
(b)延伸与第一引物延伸产物杂交的第二引物,由此产生第二引物延伸产物,以形成第一和第二引物延伸产物的复合体;以及
(c)切割第一和第二引物延伸产物复合体中的RNA,由此产生包含3’单链区的多核苷酸复合体;以及
(ii)将步骤(i)的扩增产物与产生自参考模板的多核苷酸复合体的扩增产物量进行比较,其中所述产生自参考模板的多核苷酸复合体包含含有参考序列的3’单链区,其中所述参考模板的多核苷酸复合体的3’单链区对应于目的序列,其中从靶RNA产生的多核苷酸复合体的可检测出的扩增产物量少于从参考模板产生的多核苷酸复合体的扩增产物量,说明靶RNA中不存在目的序列,且靶RNA可包含相对于可与复合扩增引物RNA部分杂交的序列而言的序列变体。
209.产生固定于基片上的核酸的方法,其包括将扩增产物固定于基片上,其中所述扩增产物通过权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法产生。
210.权利要求209的方法,其中基片为微阵列。
211.鉴定目的RNA序列的方法,其包括分析DNA扩增产物,其中扩增产物使用权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法通过扩增靶RNA而产生。
212.权利要求211的方法,其中DNA产物被标记。
213.权利要求211或212的方法,其中分析DNA扩增产物包括确定所述产物的量,由此定量存在于样品中的目的RNA序列的量。
214.权利要求211或212的方法,其中分析DNA扩增产物包括将DNA产物与至少一种探针接触。
215.权利要求214的方法,其中DNA扩增产物被标记,且其中至少一种探针是以微阵列形式提供的。
216.权利要求215的方法,其中微阵列包含至少一种固定于基片上的探针,上述基片由选自纸、玻璃、陶瓷、塑料、聚丙烯、聚苯乙烯、尼龙、聚丙烯酰胺、硝化纤维、硅和光纤的材料制备。
217.权利要求216的方法,其中探针固定在二维结构或三维结构的基片上,其中二维或三维结构包括针、棒、纤维、带、细线、珠、颗粒、微量滴定孔、毛细管和圆柱体。
218.鉴定目的RNA序列的方法,其包括分析RNA扩增产物,所述RNA扩增产物使用权利要求2或60的方法产生。
219.权利要求218的方法,其中RNA产物被标记。
220.权利要求218或219的方法,其中分析RNA扩增产物包括确定所述产物的量,由此定量存在于样品中的目的RNA序列的量。
221.权利要求218或219的方法,其中分析RNA扩增产物包括将标记的RNA产物与至少一种探针接触。
222.权利要求221的方法,其中RNA扩增产物被标记,且其中至少一种探针是以微阵列形式提供的。
223.权利要求222的方法,其中微阵列包含至少一种固定于基片上的探针,上述基片由选自纸、玻璃、陶瓷、塑料、聚丙烯、聚苯乙烯、尼龙、聚丙烯酰胺、硝化纤维、硅和光纤的材料制备。
224.权利要求223的方法,其中探针固定在二维结构或三维结构的基片上,其中二维或三维结构包括针、棒、纤维、带、细线、珠、颗粒、微量滴定孔、毛细管和圆柱体。
225.确定样品中基因表达谱的方法,所述方法包括确定至少一种目的RNA序列的扩增产物量,其中所述扩增产物通过权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法扩增样本中至少一个目的RNA序列产生,其中每一所述量显示出样品中每一目的RNA序列的量,由此确定样品的基因表达谱。
226.权利要求225的方法,其中每一靶RNA为mRNA。
227.制备文库的方法,所述方法包括:使用权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法扩增多种目的RNA序列。
228.权利要求227的方法,其中第一引物包含随机引物序列。
229.权利要求227的方法,其中与靶RNA杂交的第一引物包含多聚dT序列。
230.制备消减杂交探针的方法,所述方法包括使用权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法产生与第一RNA群体中至少一种目的RNA序列互补的多种DNA拷贝。
231.进行消减杂交的方法,其中比较了至少第一和第二靶RNA群体,所述方法包括:(a)使用权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法将与来自第一RNA群体的至少一种目的RNA序列互补的多种多核苷酸拷贝杂交;以及(b)将所述多拷贝与第二RNA群体杂交,由此第二群体的亚群体与多核苷酸拷贝形成复合体。
232.对不与至少一种目的RNA序列杂交的RNA差异扩增的方法,所述方法包括:
(a)将使用权利要求1、2、43、44、45、59、60、73、74、75、89、99、100、101、144、145、155、156、157、176、196、197或198中任意一项所述的方法制备的与至少一种目的RNA序列互补的多种多核苷酸拷贝与RNA群体杂交,由此所述RNA群体的亚群体与多核苷酸拷贝杂交形成复合体;
(b)用从RNA/DNA杂合体上切割RNA的酶切割步骤(a)复合体中的RNA;以及
(c)扩增RNA群体中的未杂交亚群体,由此多拷贝的与所述RNA群体的未杂交亚群体互补的单链DNA得以产生。
233.制备文库的方法,所述方法包括:制备根据权利要求232制备的RNA群体的未杂交亚群体的多种互补拷贝。
234.包含第一复合引物和复合扩增引物的组合物,其中所述第一复合引物包含RNA部分和3’DNA部分,其中所述复合扩增引物包含RNA部分和3’DNA部分,且其中所述复合扩增引物包含可与这样的多核苷酸杂交的序列,所述多核苷酸包含第一复合引物的互补序列。
235.根据权利要求234的组合物,其中第一复合引物的RNA部分相对于该第一复合引物的3’DNA部分而言为5’,且复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
236.根据权利要求235的组合物,其中第一复合引物的5’RNA部分与所述第一复合引物的3′DNA部分毗邻,且复合扩增引物的5’RNA部分与所述复合扩增引物的3′DNA部分毗邻。
237.根据权利要求236的组合物,其中第一复合引物由5’RNA部分和3’DNA部分组成,且复合扩增引物由5’RNA部分和3’DNA部分组成。
238.根据权利要求234-237中任意一项所述的组合物,其中第一复合引物为有尾引物,其包含在该第一复合引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分。
239.根据权利要求234-237中任意一项所述的组合物,其中第一复合引物的3’DNA部分包含随机引物序列。
240.根据权利要求234-237中任意一项所述的组合物,其中第一复合引物的3’DNA部分包含多聚dT序列。
241.根据权利要求240的组合物,其中第一复合引物在3′端包含至少1个随机核苷酸。
242.根据权利要求234-237中任意一项所述的组合物,其中第一复合引物的RNA部分包含至少约5个核苷酸,且该第一复合引物的3’DNA部分包含至少约5个核苷酸,其中复合扩增引物的RNA部分包含至少约5个核苷酸,且该复合扩增引物的3’DNA部分包含至少1个核苷酸。
243.根据权利要求242的组合物,其中第一复合引物的RNA部分由约5个至约50个核苷酸组成,且该第一复合引物的3’DNA部分由约5个至约20个核苷酸组成,其中复合扩增引物的RNA部分由约5个至约50个核苷酸组成,且该复合扩增引物的3’DNA部分由约1个至约20个核苷酸组成。
244.组合物,其包含:
(a)包含第一引物延伸产物和第二引物延伸产物的复合体,其中第一引物延伸产物通过使用至少一种包含RNA依赖的DNA聚合酶活性的酶延伸与靶RNA杂交的第一引物而产生,其中第一引物为包含RNA部分和3’DNA部分的复合引物,且其中第二引物延伸产物通过延伸与第一引物延伸产物杂交的第二引物而产生;以及
(b)复合扩增引物,其中复合扩增引物包含RNA部分和3’DNA部分,且其中复合扩增引物包含可与含有第一引物互补序列的多核苷酸杂交的序列。
245.根据权利要求244的组合物,其中第一复合引物的RNA部分相对于该第一复合引物的3’DNA部分而言为5’,且复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
246.根据权利要求245的组合物,其中第一复合引物的5’RNA部分与该第一复合引物的3’DNA部分毗邻,且复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
247.根据权利要求246的组合物,其中第一复合引物由5’RNA部分和3’DNA部分组成,且复合扩增引物由5’RNA部分和3’DNA部分组成。
248.根据权利要求244-247中任意一项所述的组合物,其中第一复合引物为有尾引物,其包含在该第一复合引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分。
249.根据权利要求244-247中任意一项所述的组合物,其中第一复合引物的3’DNA部分包含随机引物序列。
250.根据权利要求244-247中任意一项所述的组合物,其中第一复合引物的3’DNA部分包含多聚dT序列。
251.根据权利要求250的组合物,其中第一复合引物的3’DNA部分在3’端包含至少1个随机核苷酸。
252.根据权利要求244-247中任意一项所述的组合物,其中第一复合引物的RNA部分包含至少约5个核苷酸,且该第一复合引物的3’DNA部分包含至少约5个核苷酸,其中复合扩增引物的RNA部分包含至少约5个核苷酸,且该复合扩增引物的3’DNA部分包含至少1个核苷酸。
253.根据权利要求252的组合物,其中第一复合引物的RNA部分由约5个至约50个核苷酸组成,且该第一复合引物的3’DNA部分由约5个至约20个核苷酸组成,其中复合扩增引物的RNA部分由约5个至约50个核苷酸组成,且该复合扩增引物的3’DNA部分由约1个至约20个核苷酸组成。
254.根据权利要求244-247中任意一项所述的组合物,其中复合扩增引物与第二引物延伸产物杂交。
255.根据权利要求244-247中任意一项所述的组合物,其中第二引物包含与第一引物延伸产物杂交的靶RNA的片段。
256.扩增靶RNA的试剂盒,其包含第一复合引物和复合扩增引物,其中第一复合引物包含RNA部分和3’DNA部分,其中复合扩增引物包含RNA部分和3’DNA部分,且其中该复合扩增引物包含可与含有第一复合引物互补序列的多核苷酸杂交的序列。
257.权利要求256的试剂盒,其中第一复合引物的RNA部分相对于该第一复合引物的3′DNA部分而言为5′,且复合扩增引物的RNA部分相对于该复合扩增引物的3’DNA部分而言为5’。
258.权利要求257的试剂盒,其中第一复合引物的5’RNA部分与该第一复合引物的3’DNA部分毗邻,复合扩增引物的5’RNA部分与该复合扩增引物的3’DNA部分毗邻。
259.根据权利要求258的试剂盒,其中第一复合引物由5’RNA部分和3’DNA部分组成,且复合扩增引物由5’RNA部分和3’DNA部分组成。
260.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分。
261.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物的3′DNA部分包含随机引物序列。
262.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物的3′DNA部分包含多聚dT序列。
263.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物的3′DNA部分包含多聚dT序列,且其中第一复合引物的3’DNA部分在3’端包含至少1个随机核苷酸。
264.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物为有尾引物,其包含在该第一引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分,且其中该第一复合引物还包含随机引物序列。
265.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物为有尾引物,其包含在该第一复合引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分,且其中该第一复合引物还包含多聚dT序列。
266.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物为有尾引物,其包含在该第一复合引物与靶RNA杂交的条件下不可与靶RNA杂交的5′部分,且其中该第一复合引物还包含多聚dT序列,且其中该第一复合引物在3’端还包含至少1个随机核苷酸。
267.权利要求256-259中任意一项所述的试剂盒,其中第一复合引物的RNA部分包含至少约5个核苷酸,且该第一复合引物的DNA部分包含至少约5个核苷酸。
268.权利要求256-259中任意一项所述的试剂盒,其中其中第一复合引物的RNA部分由约5个至约50个核苷酸组成,且该第一复合引物的3’DNA部分由约5个至约20个核苷酸组成。
269.权利要求256-259中任意一项所述的试剂盒,其中复合扩增引物的RNA部分包含至少约5个核苷酸,且该复合扩增引物的DNA部分包含至少1个核苷酸。
270.权利要求256-259中任意一项所述的试剂盒,其中复合扩增引物的RNA部分由约5个至约50个核苷酸组成,且该复合扩增引物的3’DNA部分由约1个至约20个核苷酸组成。
271.权利要求256-259中任意一项所述的试剂盒,其还包含从RNA/DNA杂合体切割RNA的酶。
272.权利要求271的试剂盒,其中从RNA/DNA杂合体上切割RNA的酶为RNaseH。
273.权利要求256-259中任意一项所述的试剂盒,其还包含RNA依赖的DNA聚合酶。
274.权利要求256-259中任意一项所述的试剂盒,其还包含经标记的dNTP。
275.权利要求256-259中任意一项所述的试剂盒,其还包含一套实施以下方法的说明书,所述方法包括以下步骤:
(a)通过用至少一种包含RNA依赖的DNA聚合酶活性的酶延伸与靶RNA杂交的第一复合引物产生第一引物延伸产物;
(b)通过延伸与第一引物延伸产物杂交的第二引物产生第二引物延伸产物;
(c)用至少一种从RNA/DNA杂合体切割RNA的酶从第一和第二引物延伸产物的复合体切割RNA;以及
(d)将复合扩增引物杂交至第二引物延伸产物,并用至少一种包含DNA依赖的DNA聚合酶活性的酶延伸复合扩增引物,
由此所述第一引物延伸产物被置换,RNA从复合扩增引物上被切割下来,且另一复合扩增引物杂交,由此重复引物延伸和链置换;且由此产生多拷贝的与目的RNA序列互补的多核苷酸序列。
276.权利要求256-259中任意一项所述的试剂盒,其还包含第三引物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US27455001P | 2001-03-09 | 2001-03-09 | |
| US60/274,550 | 2001-03-09 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1473202A CN1473202A (zh) | 2004-02-04 |
| CN1289690C true CN1289690C (zh) | 2006-12-13 |
Family
ID=23048664
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB028028279A Expired - Fee Related CN1289690C (zh) | 2001-03-09 | 2002-03-11 | Rna序列扩增的方法和组合物 |
Country Status (17)
| Country | Link |
|---|---|
| US (7) | US6946251B2 (zh) |
| EP (1) | EP1366197B1 (zh) |
| JP (3) | JP4542312B2 (zh) |
| KR (1) | KR20030082535A (zh) |
| CN (1) | CN1289690C (zh) |
| AT (1) | ATE361996T1 (zh) |
| AU (1) | AU2002252279B2 (zh) |
| BR (1) | BR0205268A (zh) |
| CA (1) | CA2416963C (zh) |
| DE (1) | DE60220025T2 (zh) |
| HK (1) | HK1059097A1 (zh) |
| IL (1) | IL153504A0 (zh) |
| MX (1) | MXPA02012739A (zh) |
| NO (1) | NO20030557D0 (zh) |
| NZ (1) | NZ523167A (zh) |
| WO (1) | WO2002072772A2 (zh) |
| ZA (1) | ZA200210369B (zh) |
Families Citing this family (149)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6692918B2 (en) * | 1999-09-13 | 2004-02-17 | Nugen Technologies, Inc. | Methods and compositions for linear isothermal amplification of polynucleotide sequences |
| EP1356094B1 (en) * | 2000-06-26 | 2010-01-13 | Nugen Technologies, Inc. | Methods and compositions for transcription-based nucleic acid amplification |
| US7846733B2 (en) | 2000-06-26 | 2010-12-07 | Nugen Technologies, Inc. | Methods and compositions for transcription-based nucleic acid amplification |
| CA2430329A1 (en) * | 2000-12-13 | 2002-06-20 | Nugen Technologies, Inc. | Methods and compositions for generation of multiple copies of nucleic acid sequences and methods of detection thereof |
| ATE361996T1 (de) | 2001-03-09 | 2007-06-15 | Nugen Technologies Inc | Methoden und zusammensetzungen zur vervielfältigung von rna sequenzen |
| EP1390537B1 (en) * | 2001-03-09 | 2013-11-13 | Nugen Technologies, Inc. | Methods and compositions for amplification of rna sequences |
| ES2305289T3 (es) | 2001-04-20 | 2008-11-01 | The Penn State Research Foundation | Metodo de manipulacion de acidos nucleicos. |
| DE60323067D1 (de) | 2002-03-11 | 2008-10-02 | Nugen Technologies Inc | Verfahren zur erzeugung doppelsträngiger dna mit einem 3'-einzelstranganteil und verwendungen dieser komplexe zur rekombination |
| EP1490514A4 (en) * | 2002-03-29 | 2008-12-17 | Nugen Technologies Inc | THROUGH ISOTHERME SINGLE PRIMER NUCLEIC ACID AMPLIFICATION IMPROVED DETECTION AND QUANTIFICATION OF ANALYTES |
| CA2486283A1 (en) * | 2002-05-17 | 2004-02-05 | Nugen Technologies, Inc. | Methods for fragmentation, labeling and immobilization of nucleic acids |
| EP1567675A4 (en) | 2002-11-21 | 2006-05-10 | Epict Technologies | METHODS OF USING PRIMERS THAT CODE A STRAND OF A BICATENARY PROMOTER |
| US8206913B1 (en) | 2003-03-07 | 2012-06-26 | Rubicon Genomics, Inc. | Amplification and analysis of whole genome and whole transcriptome libraries generated by a DNA polymerization process |
| DE602004029560D1 (de) | 2003-03-07 | 2010-11-25 | Rubicon Genomics Inc | Amplifikation und analyse von gesamtgenom- und gesamttranskriptom- bibliotheken, die durch ein dns-polymerisierungsverfahren produziert wurden |
| CA2521084A1 (en) | 2003-04-14 | 2004-10-28 | Nugen Technologies, Inc. | Global amplification using a randomly primed composite primer |
| WO2005065321A2 (en) | 2003-12-29 | 2005-07-21 | Nugen Technologies, Inc. | Methods for analysis of nucleic acid methylation status and methods for fragmentation, labeling and immobilization of nucleic acids |
| US20080026950A1 (en) * | 2004-02-24 | 2008-01-31 | Mitsubishi Rayon Co., Ltd. | Gene Relating to Estimation of Postoperative Prognosis for Breast Cancer |
| CA2559209C (en) | 2004-03-08 | 2016-06-07 | Rubicon Genomics, Inc. | Methods and compositions for generating and amplifying dna libraries for sensitive detection and analysis of dna methylation |
| US7758896B2 (en) * | 2004-04-16 | 2010-07-20 | University Of Massachusetts | Porous calcium phosphate networks for synthetic bone material |
| US7713697B2 (en) * | 2004-08-27 | 2010-05-11 | Gen-Probe Incorporated | Methods and kits for amplifying DNA |
| DE602005026730D1 (de) * | 2004-08-27 | 2011-04-14 | Gen Probe Inc | Einfach-Primernukleinsäuren-Erweiterungsverfahren |
| WO2006033487A1 (en) * | 2004-09-21 | 2006-03-30 | Genomictree Inc. | Method for linear amplification of rna using high-heel primer |
| WO2006086668A2 (en) * | 2005-02-09 | 2006-08-17 | Epicentre Technologies | Compositions and methods employing 5'-phosphate-dependent nucleic acid exonucleases |
| JP2008544214A (ja) | 2005-05-09 | 2008-12-04 | セラノス, インコーポレイテッド | ポイントオブケア流体システムおよびその使用 |
| US20090317798A1 (en) | 2005-06-02 | 2009-12-24 | Heid Christian A | Analysis using microfluidic partitioning devices |
| ATE510930T1 (de) | 2005-08-02 | 2011-06-15 | Rubicon Genomics Inc | Zusammensetzungen und verfahren zur bearbeitung und amplifikation von dna mit verwendung mehrerer enzyme in einer einzigen reaktion |
| EP1924705A1 (en) | 2005-08-02 | 2008-05-28 | Rubicon Genomics, Inc. | Isolation of cpg islands by thermal segregation and enzymatic selection-amplification method |
| US20070048741A1 (en) * | 2005-08-24 | 2007-03-01 | Getts Robert C | Methods and kits for sense RNA synthesis |
| WO2007030759A2 (en) * | 2005-09-07 | 2007-03-15 | Nugen Technologies, Inc. | Improved nucleic acid amplification procedure |
| US8979770B2 (en) * | 2006-02-24 | 2015-03-17 | Merck Sharp & Dohme Corp. | Extraction and diagnostic fluid devices, systems and methods of use |
| US8741230B2 (en) | 2006-03-24 | 2014-06-03 | Theranos, Inc. | Systems and methods of sample processing and fluid control in a fluidic system |
| US11287421B2 (en) | 2006-03-24 | 2022-03-29 | Labrador Diagnostics Llc | Systems and methods of sample processing and fluid control in a fluidic system |
| WO2007136717A1 (en) * | 2006-05-16 | 2007-11-29 | Nugen Technologies, Inc. | Nucleic acid separation and purification method based on reversible charge interactions |
| US11001881B2 (en) | 2006-08-24 | 2021-05-11 | California Institute Of Technology | Methods for detecting analytes |
| US7833716B2 (en) | 2006-06-06 | 2010-11-16 | Gen-Probe Incorporated | Tagged oligonucleotides and their use in nucleic acid amplification methods |
| WO2008005459A2 (en) * | 2006-06-30 | 2008-01-10 | Nugen Technologies, Inc. | Methods for fragmentation and labeling of nucleic acids |
| US11525156B2 (en) | 2006-07-28 | 2022-12-13 | California Institute Of Technology | Multiplex Q-PCR arrays |
| WO2008014485A2 (en) | 2006-07-28 | 2008-01-31 | California Institute Of Technology | Multiplex q-pcr arrays |
| WO2008105814A2 (en) * | 2006-08-22 | 2008-09-04 | Los Alamos National Security, Llc | Miniturized lateral flow device for rapid and sensitive detection of proteins or nucleic acids |
| US8980561B1 (en) | 2006-08-22 | 2015-03-17 | Los Alamos National Security, Llc. | Nucleic acid detection system and method for detecting influenza |
| US11560588B2 (en) | 2006-08-24 | 2023-01-24 | California Institute Of Technology | Multiplex Q-PCR arrays |
| US8183359B2 (en) * | 2007-03-01 | 2012-05-22 | Gen-Probe Incorporated | Kits for amplifying DNA |
| CA3138078C (en) | 2007-10-02 | 2024-02-13 | Labrador Diagnostics Llc | Modular point-of-care devices and uses thereof |
| EP2209912A1 (en) * | 2007-10-26 | 2010-07-28 | Rosetta Inpharmatics LLC | Cdna synthesis using non-random primers |
| US8034568B2 (en) * | 2008-02-12 | 2011-10-11 | Nugen Technologies, Inc. | Isothermal nucleic acid amplification methods and compositions |
| WO2009102896A2 (en) * | 2008-02-12 | 2009-08-20 | Nugen Technologies, Inc. | Isothermal nucleic acid amplification methods and compositions |
| US20090215050A1 (en) * | 2008-02-22 | 2009-08-27 | Robert Delmar Jenison | Systems and methods for point-of-care amplification and detection of polynucleotides |
| WO2009117698A2 (en) * | 2008-03-21 | 2009-09-24 | Nugen Technologies, Inc. | Methods of rna amplification in the presence of dna |
| US20110118125A1 (en) * | 2008-05-03 | 2011-05-19 | Tufts Medical Center, Inc. | Neonatal salivary genomics |
| CN102084238B (zh) | 2008-05-05 | 2016-06-01 | 洛斯阿拉莫斯国家安全有限责任公司 | 基于高度简化的侧向流动的核酸样品制备和被动流体流动控制 |
| WO2010126913A1 (en) | 2009-04-27 | 2010-11-04 | Gen-Probe Incorporated | Methods and kits for use in the selective amplification of target sequences |
| US9309557B2 (en) | 2010-12-17 | 2016-04-12 | Life Technologies Corporation | Nucleic acid amplification |
| US9334531B2 (en) | 2010-12-17 | 2016-05-10 | Life Technologies Corporation | Nucleic acid amplification |
| US9309566B2 (en) | 2010-12-17 | 2016-04-12 | Life Technologies Corporation | Methods, compositions, systems, apparatuses and kits for nucleic acid amplification |
| EP2475777A4 (en) * | 2009-09-11 | 2013-03-06 | Nugen Technologies Inc | COMPOSITIONS AND METHODS FOR COMPLETE TRANSCRIPTOMAL ANALYSIS |
| WO2011055737A1 (ja) * | 2009-11-06 | 2011-05-12 | 株式会社ニッポンジーン | 耐熱性鎖置換型dnaポリメラーゼ及び該dnaポリメラーゼの生産方法 |
| US8835358B2 (en) | 2009-12-15 | 2014-09-16 | Cellular Research, Inc. | Digital counting of individual molecules by stochastic attachment of diverse labels |
| CN101935697B (zh) * | 2010-04-16 | 2015-11-25 | 中生方政生物技术有限公司 | 用于核酸序列检测的方法和试剂盒 |
| CN110079588B (zh) * | 2010-12-17 | 2024-03-15 | 生命技术公司 | 用于核酸扩增的方法、组合物、系统、仪器和试剂盒 |
| CN106290160A (zh) | 2011-01-21 | 2017-01-04 | 提拉诺斯公司 | 样品使用最大化的系统和方法 |
| US8759036B2 (en) | 2011-03-21 | 2014-06-24 | Affymetrix, Inc. | Methods for synthesizing pools of probes |
| KR20140044323A (ko) | 2011-04-20 | 2014-04-14 | 메사 테크 인터내셔널, 인코포레이티드 | 핵산의 왕복 증폭 반응 |
| US8840838B2 (en) | 2011-09-25 | 2014-09-23 | Theranos, Inc. | Centrifuge configurations |
| US9632102B2 (en) | 2011-09-25 | 2017-04-25 | Theranos, Inc. | Systems and methods for multi-purpose analysis |
| US8380541B1 (en) | 2011-09-25 | 2013-02-19 | Theranos, Inc. | Systems and methods for collecting and transmitting assay results |
| US9268915B2 (en) | 2011-09-25 | 2016-02-23 | Theranos, Inc. | Systems and methods for diagnosis or treatment |
| US20140170735A1 (en) | 2011-09-25 | 2014-06-19 | Elizabeth A. Holmes | Systems and methods for multi-analysis |
| US9619627B2 (en) | 2011-09-25 | 2017-04-11 | Theranos, Inc. | Systems and methods for collecting and transmitting assay results |
| US9664702B2 (en) | 2011-09-25 | 2017-05-30 | Theranos, Inc. | Fluid handling apparatus and configurations |
| US8435738B2 (en) | 2011-09-25 | 2013-05-07 | Theranos, Inc. | Systems and methods for multi-analysis |
| US8475739B2 (en) | 2011-09-25 | 2013-07-02 | Theranos, Inc. | Systems and methods for fluid handling |
| US10012664B2 (en) | 2011-09-25 | 2018-07-03 | Theranos Ip Company, Llc | Systems and methods for fluid and component handling |
| RU2627927C2 (ru) | 2011-09-25 | 2017-08-14 | Теранос, Инк. | Системы и способы многостороннего анализа |
| US9250229B2 (en) | 2011-09-25 | 2016-02-02 | Theranos, Inc. | Systems and methods for multi-analysis |
| US9810704B2 (en) | 2013-02-18 | 2017-11-07 | Theranos, Inc. | Systems and methods for multi-analysis |
| GB2497838A (en) | 2011-10-19 | 2013-06-26 | Nugen Technologies Inc | Compositions and methods for directional nucleic acid amplification and sequencing |
| GB201121869D0 (en) * | 2011-11-17 | 2012-02-01 | Clarient Inc | Method of allele-specific amplification |
| EP2798089B1 (en) | 2011-12-30 | 2018-05-23 | Bio-rad Laboratories, Inc. | Methods and compositions for performing nucleic acid amplification reactions |
| EP4372084A3 (en) | 2012-01-26 | 2024-08-14 | Tecan Genomics, Inc. | Compositions and methods for targeted nucleic acid sequence enrichment and high efficiency library generation |
| CN104364392B (zh) | 2012-02-27 | 2018-05-25 | 赛卢拉研究公司 | 用于分子计数的组合物和试剂盒 |
| EP4026912A1 (en) | 2012-05-10 | 2022-07-13 | The General Hospital Corporation | Methods for determining a nucleotide sequence |
| KR101184566B1 (ko) | 2012-05-11 | 2012-09-20 | 케이맥(주) | 실시간 중합효소 연쇄반응과 dna 칩이 통합된 검사 시스템 및 이를 이용한 통합 분석방법 |
| CN104619894B (zh) | 2012-06-18 | 2017-06-06 | 纽亘技术公司 | 用于非期望核酸序列的阴性选择的组合物和方法 |
| US20150011396A1 (en) | 2012-07-09 | 2015-01-08 | Benjamin G. Schroeder | Methods for creating directional bisulfite-converted nucleic acid libraries for next generation sequencing |
| US20140081665A1 (en) | 2012-09-11 | 2014-03-20 | Theranos, Inc. | Information management systems and methods using a biological signature |
| CN102962015B (zh) * | 2012-11-20 | 2014-04-23 | 北京大学 | 以固定的纳米材料微球作基底的dna或rna合成装置 |
| MX354033B (es) | 2013-02-18 | 2018-02-09 | Theranos Ip Co Llc | Sistemas y métodos para recolectar y transmitir resultados de ensayos. |
| WO2014138688A1 (en) * | 2013-03-07 | 2014-09-12 | Bio-Rad Laboratories, Inc. | Repetitive reverse transcription partition assay |
| US20140274738A1 (en) | 2013-03-15 | 2014-09-18 | Nugen Technologies, Inc. | Sequential sequencing |
| US9428747B2 (en) * | 2013-03-15 | 2016-08-30 | Lyle J. Arnold | Methods for amplification of nucleic acids utilizing hairpin loop or duplex primers |
| GB2546833B (en) | 2013-08-28 | 2018-04-18 | Cellular Res Inc | Microwell for single cell analysis comprising single cell and single bead oligonucleotide capture labels |
| US9907867B2 (en) | 2013-09-26 | 2018-03-06 | General Electric Company | Systems, methods and apparatus for manufacturing radioisotopes |
| CA2929596C (en) | 2013-11-13 | 2022-07-05 | Nugen Technologies, Inc. | Compositions and methods for identification of a duplicate sequencing read |
| US10767222B2 (en) | 2013-12-11 | 2020-09-08 | Accuragen Holdings Limited | Compositions and methods for detecting rare sequence variants |
| US11859246B2 (en) | 2013-12-11 | 2024-01-02 | Accuragen Holdings Limited | Methods and compositions for enrichment of amplification products |
| US11286519B2 (en) | 2013-12-11 | 2022-03-29 | Accuragen Holdings Limited | Methods and compositions for enrichment of amplification products |
| CA2938080A1 (en) | 2014-01-27 | 2015-07-30 | The General Hospital Corporation | Methods of preparing nucleic acids for sequencing |
| WO2015131107A1 (en) | 2014-02-28 | 2015-09-03 | Nugen Technologies, Inc. | Reduced representation bisulfite sequencing with diversity adaptors |
| JP6803327B2 (ja) | 2014-08-06 | 2020-12-23 | ニューゲン テクノロジーズ, インコーポレイテッド | 標的化されたシークエンシングからのデジタル測定値 |
| DE112016000293T5 (de) * | 2015-02-26 | 2017-09-21 | Hitachi High-Technologies Corporation | Verfahren zum konstruieren eines nucleinsäure-moleküls |
| EP3262192B1 (en) | 2015-02-27 | 2020-09-16 | Becton, Dickinson and Company | Spatially addressable molecular barcoding |
| CN104673786A (zh) * | 2015-03-09 | 2015-06-03 | 武汉格蓝丽富科技有限公司 | 一种选择性扩增rna的方法 |
| US9708647B2 (en) | 2015-03-23 | 2017-07-18 | Insilixa, Inc. | Multiplexed analysis of nucleic acid hybridization thermodynamics using integrated arrays |
| JP7508191B2 (ja) | 2015-03-30 | 2024-07-01 | ベクトン・ディキンソン・アンド・カンパニー | コンビナトリアルバーコーディングのための方法および組成物 |
| US11390914B2 (en) | 2015-04-23 | 2022-07-19 | Becton, Dickinson And Company | Methods and compositions for whole transcriptome amplification |
| CN118788410A (zh) | 2015-04-24 | 2024-10-18 | 美飒生物技术公司 | 流体检测盒 |
| US9499861B1 (en) | 2015-09-10 | 2016-11-22 | Insilixa, Inc. | Methods and systems for multiplex quantitative nucleic acid amplification |
| ES2745694T3 (es) | 2015-09-11 | 2020-03-03 | Cellular Res Inc | Métodos y composiciones para normalización de biblioteca de ácido nucleico |
| CN114807323A (zh) | 2015-10-09 | 2022-07-29 | 安可济控股有限公司 | 用于富集扩增产物的方法及组合物 |
| CN108699505A (zh) | 2015-12-03 | 2018-10-23 | 安可济控股有限公司 | 用于形成连接产物的方法和组合物 |
| WO2017155858A1 (en) | 2016-03-07 | 2017-09-14 | Insilixa, Inc. | Nucleic acid sequence identification using solid-phase cyclic single base extension |
| US9617587B1 (en) | 2016-04-04 | 2017-04-11 | Nat Diagnostics, Inc. | Isothermal amplification components and processes |
| US11299777B2 (en) | 2016-04-04 | 2022-04-12 | Nat Diagnostics, Inc. | Isothermal amplification components and processes |
| EP3458586B1 (en) | 2016-05-16 | 2022-12-28 | Accuragen Holdings Limited | Method of improved sequencing by strand identification |
| US10301677B2 (en) | 2016-05-25 | 2019-05-28 | Cellular Research, Inc. | Normalization of nucleic acid libraries |
| US10640763B2 (en) | 2016-05-31 | 2020-05-05 | Cellular Research, Inc. | Molecular indexing of internal sequences |
| US10202641B2 (en) | 2016-05-31 | 2019-02-12 | Cellular Research, Inc. | Error correction in amplification of samples |
| CN107541508A (zh) * | 2016-06-24 | 2018-01-05 | 广州康昕瑞基因健康科技有限公司 | 模板‑引物核酸分子、聚合酶活性测定方法及试剂盒 |
| WO2018035170A1 (en) | 2016-08-15 | 2018-02-22 | Accuragen Holdings Limited | Compositions and methods for detecting rare sequence variants |
| AU2017328953B2 (en) | 2016-09-15 | 2023-09-14 | Archerdx, Llc | Methods of nucleic acid sample preparation for analysis of cell-free DNA |
| EP3933039A1 (en) | 2016-09-15 | 2022-01-05 | ArcherDX, LLC | Methods of nucleic acid sample preparation |
| KR102363716B1 (ko) | 2016-09-26 | 2022-02-18 | 셀룰러 리서치, 인크. | 바코딩된 올리고뉴클레오티드 서열을 갖는 시약을 이용한 단백질 발현의 측정 |
| CN109923203A (zh) | 2016-09-30 | 2019-06-21 | 多伦多大学管理委员会 | 用于鉴定和靶向异质群体中的个体细胞以选择性提取细胞内容物的系统 |
| WO2018144240A1 (en) | 2017-02-01 | 2018-08-09 | Cellular Research, Inc. | Selective amplification using blocking oligonucleotides |
| JP7056012B2 (ja) * | 2017-05-19 | 2022-04-19 | トヨタ自動車株式会社 | ランダムプライマーセット、及びこれを用いたdnaライブラリーの作製方法 |
| EP3635135A1 (en) | 2017-06-05 | 2020-04-15 | Becton, Dickinson and Company | Sample indexing for single cells |
| CN107287320A (zh) * | 2017-07-12 | 2017-10-24 | 曹国君 | Gapdh基因的lamp检测用引物组合及试剂盒 |
| US11099202B2 (en) | 2017-10-20 | 2021-08-24 | Tecan Genomics, Inc. | Reagent delivery system |
| US11203782B2 (en) | 2018-03-29 | 2021-12-21 | Accuragen Holdings Limited | Compositions and methods comprising asymmetric barcoding |
| US11365409B2 (en) | 2018-05-03 | 2022-06-21 | Becton, Dickinson And Company | Molecular barcoding on opposite transcript ends |
| CA3097976A1 (en) | 2018-05-03 | 2019-11-07 | Becton, Dickinson And Company | High throughput multiomics sample analysis |
| JP7537748B2 (ja) | 2018-06-06 | 2024-08-21 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 核酸ライブラリを生成する方法ならびにそれを実施するための組成物およびキット |
| US12049665B2 (en) | 2018-06-12 | 2024-07-30 | Accuragen Holdings Limited | Methods and compositions for forming ligation products |
| JP2022511398A (ja) | 2018-10-01 | 2022-01-31 | ベクトン・ディキンソン・アンド・カンパニー | 5’転写物配列の決定 |
| JP2022506546A (ja) | 2018-11-08 | 2022-01-17 | ベクトン・ディキンソン・アンド・カンパニー | ランダムプライミングを使用した単一細胞の全トランスクリプトーム解析 |
| CN113195717A (zh) | 2018-12-13 | 2021-07-30 | 贝克顿迪金森公司 | 单细胞全转录组分析中的选择性延伸 |
| CN113574178A (zh) | 2019-01-23 | 2021-10-29 | 贝克顿迪金森公司 | 与抗体关联的寡核苷酸 |
| EP3924506A1 (en) | 2019-02-14 | 2021-12-22 | Becton Dickinson and Company | Hybrid targeted and whole transcriptome amplification |
| EP3937780A4 (en) | 2019-03-14 | 2022-12-07 | InSilixa, Inc. | METHODS AND SYSTEMS FOR TIMED FLUORESCENCE-BASED DETECTION |
| CA3134617A1 (en) * | 2019-03-25 | 2020-10-01 | The Board Of Trustees Of The Leland Stanford Junior University | Signature for diagnosis of bacterial vs viral infections |
| KR102249111B1 (ko) * | 2019-04-22 | 2021-05-07 | 포항공과대학교 산학협력단 | 신규한 등온 단일 반응용 프로브 세트 및 이의 용도 |
| CN110241178B (zh) * | 2019-06-25 | 2023-03-31 | 北京博奥晶方生物科技有限公司 | 一种单细胞转录组测序高通量快速文库制备方法及检测试剂盒 |
| US11939622B2 (en) | 2019-07-22 | 2024-03-26 | Becton, Dickinson And Company | Single cell chromatin immunoprecipitation sequencing assay |
| WO2021092386A1 (en) | 2019-11-08 | 2021-05-14 | Becton Dickinson And Company | Using random priming to obtain full-length v(d)j information for immune repertoire sequencing |
| EP4090763A1 (en) | 2020-01-13 | 2022-11-23 | Becton Dickinson and Company | Methods and compositions for quantitation of proteins and rna |
| US12059674B2 (en) | 2020-02-03 | 2024-08-13 | Tecan Genomics, Inc. | Reagent storage system |
| WO2021231779A1 (en) | 2020-05-14 | 2021-11-18 | Becton, Dickinson And Company | Primers for immune repertoire profiling |
| US11932901B2 (en) | 2020-07-13 | 2024-03-19 | Becton, Dickinson And Company | Target enrichment using nucleic acid probes for scRNAseq |
| WO2022109343A1 (en) | 2020-11-20 | 2022-05-27 | Becton, Dickinson And Company | Profiling of highly expressed and lowly expressed proteins |
| CN114410778B (zh) * | 2021-12-29 | 2024-03-19 | 中南大学湘雅医院 | Pf543在制备pd-l1/pd-1单抗肿瘤免疫治疗药物中的应用 |
Family Cites Families (246)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3996345A (en) | 1974-08-12 | 1976-12-07 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US4174384A (en) | 1975-06-30 | 1979-11-13 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US3999345A (en) | 1975-11-10 | 1976-12-28 | Shatterproof Glass Corporation | Spandrel units |
| US4261968A (en) * | 1979-05-10 | 1981-04-14 | Syva Company | Fluorescence quenching with immunological pairs in immunoassays |
| US4458066A (en) * | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| JPS57501692A (zh) | 1980-09-24 | 1982-09-16 | ||
| US4362867A (en) | 1980-12-10 | 1982-12-07 | Research Corporation | Recombinant cDNA construction method and hybrid nucleotides useful in cloning |
| US4582788A (en) | 1982-01-22 | 1986-04-15 | Cetus Corporation | HLA typing method and cDNA probes used therein |
| DE3381518D1 (de) | 1982-01-22 | 1990-06-07 | Cetus Corp | Verfahren zur charakterisierung von hla und die darin benutzten cdns-testmittel. |
| US4786600A (en) | 1984-05-25 | 1988-11-22 | The Trustees Of Columbia University In The City Of New York | Autocatalytic replication of recombinant RNA |
| US4683194A (en) | 1984-05-29 | 1987-07-28 | Cetus Corporation | Method for detection of polymorphic restriction sites and nucleic acid sequences |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US5011769A (en) | 1985-12-05 | 1991-04-30 | Meiogenics U.S. Limited Partnership | Methods for detecting nucleic acid sequences |
| US4876187A (en) | 1985-12-05 | 1989-10-24 | Meiogenics, Inc. | Nucleic acid compositions with scissile linkage useful for detecting nucleic acid sequences |
| US4996143A (en) * | 1985-12-23 | 1991-02-26 | Syngene, Inc. | Fluorescent stokes shift probes for polynucleotide hybridization |
| US5721098A (en) | 1986-01-16 | 1998-02-24 | The Regents Of The University Of California | Comparative genomic hybridization |
| CA1284931C (en) | 1986-03-13 | 1991-06-18 | Henry A. Erlich | Process for detecting specific nucleotide variations and genetic polymorphisms present in nucleic acids |
| US5849478A (en) | 1986-08-14 | 1998-12-15 | Cashman; Daniel P. | Blocked-polymerase polynucleotide immunoassay method and kit |
| CA1338457C (en) | 1986-08-22 | 1996-07-16 | Henry A. Erlich | Purified thermostable enzyme |
| DE3634356A1 (de) | 1986-10-08 | 1988-04-21 | Epis Sa | Arzneimittel enthaltend alpha-halogenierte dicarbonsaeuren |
| US6270961B1 (en) | 1987-04-01 | 2001-08-07 | Hyseq, Inc. | Methods and apparatus for DNA sequencing and DNA identification |
| IL86724A (en) | 1987-06-19 | 1995-01-24 | Siska Diagnostics Inc | Methods and kits for amplification and testing of nucleic acid sequences |
| CA1340843C (en) | 1987-07-31 | 1999-12-07 | J. Lawrence Burg | Selective amplification of target polynucleotide sequences |
| US6090591A (en) * | 1987-07-31 | 2000-07-18 | The Board Of Trustees Of The Leland Stanford Junior University | Selective amplification of target polynucleotide sequences |
| US6004745A (en) * | 1987-09-21 | 1999-12-21 | Gen-Probe Incorporated | Hybridization protection assay |
| US5403711A (en) * | 1987-11-30 | 1995-04-04 | University Of Iowa Research Foundation | Nucleic acid hybridization and amplification method for detection of specific sequences in which a complementary labeled nucleic acid probe is cleaved |
| CA1323293C (en) | 1987-12-11 | 1993-10-19 | Keith C. Backman | Assay using template-dependent nucleic acid probe reorganization |
| JP2846018B2 (ja) | 1988-01-21 | 1999-01-13 | ジェネンテク,インコーポレイテッド | 核酸配列の増幅および検出 |
| CA1340807C (en) | 1988-02-24 | 1999-11-02 | Lawrence T. Malek | Nucleic acid amplification process |
| JP2650159B2 (ja) | 1988-02-24 | 1997-09-03 | アクゾ・ノベル・エヌ・ベー | 核酸増幅方法 |
| DE68911648T2 (de) | 1988-03-24 | 1994-06-23 | Univ Iowa Res Found | Katalytische hybridisierungs-systeme zum nachweis von nukleinsäuresequenzen, die auf deren aktivität als kofaktoren in katalytischen reaktionen basieren in denen eine komplementäre, markierte nukleinsäureprobe gespalten wird. |
| US5130238A (en) | 1988-06-24 | 1992-07-14 | Cangene Corporation | Enhanced nucleic acid amplification process |
| EP0425563B1 (en) | 1988-07-20 | 1996-05-15 | David Segev | Process for amplifying and detecting nucleic acid sequences |
| US5185243A (en) | 1988-08-25 | 1993-02-09 | Syntex (U.S.A.) Inc. | Method for detection of specific nucleic acid sequences |
| US5508178A (en) | 1989-01-19 | 1996-04-16 | Rose; Samuel | Nucleic acid amplification using single primer |
| US5708154A (en) * | 1989-02-24 | 1998-01-13 | City Of Hope | RNA-DNA hybrid molecules of nucleic acid |
| US5043272A (en) | 1989-04-27 | 1991-08-27 | Life Technologies, Incorporated | Amplification of nucleic acid sequences using oligonucleotides of random sequence as primers |
| US5106727A (en) * | 1989-04-27 | 1992-04-21 | Life Technologies, Inc. | Amplification of nucleic acid sequences using oligonucleotides of random sequences as primers |
| US6040138A (en) * | 1995-09-15 | 2000-03-21 | Affymetrix, Inc. | Expression monitoring by hybridization to high density oligonucleotide arrays |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| CA2020958C (en) * | 1989-07-11 | 2005-01-11 | Daniel L. Kacian | Nucleic acid sequence amplification methods |
| US5766849A (en) * | 1989-07-11 | 1998-06-16 | Gen-Probe Incorporated | Methods of amplifying nucleic acids using promoter-containing primer sequence |
| ATE282716T1 (de) | 1989-07-11 | 2004-12-15 | Gen Probe Inc | Verfahren zur amplifikation von nukleinsäuresequenzen |
| US5545522A (en) | 1989-09-22 | 1996-08-13 | Van Gelder; Russell N. | Process for amplifying a target polynucleotide sequence using a single primer-promoter complex |
| US5427930A (en) * | 1990-01-26 | 1995-06-27 | Abbott Laboratories | Amplification of target nucleic acids using gap filling ligase chain reaction |
| US6013431A (en) | 1990-02-16 | 2000-01-11 | Molecular Tool, Inc. | Method for determining specific nucleotide variations by primer extension in the presence of mixture of labeled nucleotides and terminators |
| CA2037349C (en) | 1990-03-26 | 2008-06-17 | James G. Wetmur | Branch migration of nucleotides |
| HU218095B (hu) | 1990-05-01 | 2000-05-28 | Amgen Inc. | Eljárás átvitt szennyeződések csökkentésére, amplifikációs eljárásokban |
| US5427911A (en) | 1990-05-01 | 1995-06-27 | Yale University | Coupled amplification and sequencing of DNA |
| US5194370A (en) | 1990-05-16 | 1993-03-16 | Life Technologies, Inc. | Promoter ligation activated transcription amplification of nucleic acid sequences |
| US5693502A (en) | 1990-06-11 | 1997-12-02 | Nexstar Pharmaceuticals, Inc. | Nucleic acid ligand inhibitors to DNA polymerases |
| US5595891A (en) | 1990-07-19 | 1997-01-21 | Behringwerke Ag | Method for producing a polynucleotide for use in single primer amplification |
| US5527872A (en) | 1990-09-14 | 1996-06-18 | At&T Global Information Solutions Company | Electronic device with a spin-on glass dielectric layer |
| US6083689A (en) * | 1990-10-16 | 2000-07-04 | Bayer Corporation | Sensitive immunoassays utilizing antibody conjugates with replicable DNA templates |
| US5846710A (en) | 1990-11-02 | 1998-12-08 | St. Louis University | Method for the detection of genetic diseases and gene sequence variations by single nucleotide primer extension |
| US5175243A (en) | 1990-11-14 | 1992-12-29 | Phillips Petroleum Company | Process for preparing arylene sulfide polymers with halo benzene containing deactivating group |
| AU8997991A (en) | 1991-01-31 | 1992-08-06 | Becton Dickinson & Company | Exonuclease mediated strand displacement amplification |
| KR930009227B1 (ko) | 1991-01-31 | 1993-09-24 | 삼성전자 주식회사 | 테이프 레코더의 브레이크 구동장치 |
| US5455166A (en) * | 1991-01-31 | 1995-10-03 | Becton, Dickinson And Company | Strand displacement amplification |
| US6004744A (en) | 1991-03-05 | 1999-12-21 | Molecular Tool, Inc. | Method for determining nucleotide identity through extension of immobilized primer |
| US5888819A (en) * | 1991-03-05 | 1999-03-30 | Molecular Tool, Inc. | Method for determining nucleotide identity through primer extension |
| US5090591A (en) * | 1991-03-18 | 1992-02-25 | Longford Equipment International Limited | Article dispenser for use with continuous strip of articles |
| WO1992018521A1 (en) | 1991-04-10 | 1992-10-29 | Life Technologies, Inc. | Method for amplifying and altering an rna sequence |
| US5340716A (en) | 1991-06-20 | 1994-08-23 | Snytex (U.S.A.) Inc. | Assay method utilizing photoactivated chemiluminescent label |
| US5169766A (en) | 1991-06-14 | 1992-12-08 | Life Technologies, Inc. | Amplification of nucleic acid molecules |
| US5328985A (en) * | 1991-07-12 | 1994-07-12 | The Regents Of The University Of California | Recombinant streptavidin-protein chimeras useful for conjugation of molecules in the immune system |
| US5665539A (en) | 1991-07-12 | 1997-09-09 | The Regents Of The University Of California | Immuno-polymerase chain reaction system for antigen detection |
| DE69231853T2 (de) | 1991-11-07 | 2001-09-13 | Nanotronics, Inc. | Hybridisierung von mit chromophoren und fluorophoren konjugierten polynukleotiden zur erzeugung eines donor-zu-donor energietransfersystems |
| US5270184A (en) | 1991-11-19 | 1993-12-14 | Becton, Dickinson And Company | Nucleic acid target generation |
| EP0625211B1 (en) | 1992-02-04 | 1999-10-06 | NEN Life Science Products, Inc. | Amplification of assay reporters by nucleic acid replication |
| US5262311A (en) | 1992-03-11 | 1993-11-16 | Dana-Farber Cancer Institute, Inc. | Methods to clone polyA mRNA |
| ATE231920T1 (de) | 1992-03-11 | 2003-02-15 | Dana Farber Cancer Inst Inc | Methode um mrna zu klonieren |
| WO1993022461A1 (en) | 1992-05-06 | 1993-11-11 | Gen-Probe Incorporated | Nucleic acid sequence amplification method, composition and kit |
| EP1262560A2 (en) | 1992-05-29 | 2002-12-04 | Abbott Laboratories | Method of forming cDNA from an RNA target sequence present in a sample |
| US5710028A (en) * | 1992-07-02 | 1998-01-20 | Eyal; Nurit | Method of quick screening and identification of specific DNA sequences by single nucleotide primer extension and kits therefor |
| US5766846A (en) * | 1992-07-10 | 1998-06-16 | Athena Neurosciences | Methods of screening for compounds which inhibit soluble β-amyloid peptide production |
| EP0653066B1 (en) * | 1992-07-31 | 1998-01-28 | BEHRINGWERKE Aktiengesellschaft | Photoactivatable chemiluminescent matrices |
| JPH07509365A (ja) * | 1992-07-31 | 1995-10-19 | デイド・ベーリング・マルブルク・ゲゼルシヤフト・ミツト・ベシユレンクテル・ハフツング | ポリヌクレオチド類の3’末端に特定配列を導入する方法 |
| ZA936016B (en) | 1992-08-24 | 1994-03-10 | Akzo Nv | Method for nucleic acid amplification |
| RU2048522C1 (ru) * | 1992-10-14 | 1995-11-20 | Институт белка РАН | Способ размножения нуклеиновых кислот, способ их экспрессии и среда для их осуществления |
| US5445935A (en) | 1992-11-23 | 1995-08-29 | Royer; Catherine A. | Quantitative detection of macromolecules with fluorescent oligonucleotides |
| US5571669A (en) | 1993-01-14 | 1996-11-05 | The University Of Pennsylvania | Transcription and nucleic acid sequence determination with short primer DNA/RNA molecules and RNA polymerase |
| US5985548A (en) | 1993-02-04 | 1999-11-16 | E. I. Du Pont De Nemours And Company | Amplification of assay reporters by nucleic acid replication |
| US5591575A (en) | 1993-04-07 | 1997-01-07 | Amersham International Plc | Subtraction hybridization employing aziridinylbenoquinone cross-linking agents |
| US5714320A (en) | 1993-04-15 | 1998-02-03 | University Of Rochester | Rolling circle synthesis of oligonucleotides and amplification of select randomized circular oligonucleotides |
| US6096715A (en) * | 1993-05-07 | 2000-08-01 | City Of Hope | Chimeric DNA-RNA catalytic sequences |
| JPH06327500A (ja) * | 1993-05-20 | 1994-11-29 | Toyobo Co Ltd | 核酸配列の増幅方法および検出方法 |
| US5837832A (en) | 1993-06-25 | 1998-11-17 | Affymetrix, Inc. | Arrays of nucleic acid probes on biological chips |
| JPH0723799A (ja) | 1993-07-13 | 1995-01-27 | Hitachi Ltd | ポリヌクレオチドの検出方法 |
| US5731171A (en) * | 1993-07-23 | 1998-03-24 | Arch Development Corp. | Sequence independent amplification of DNA |
| US6027923A (en) | 1993-07-23 | 2000-02-22 | Bio-Rad Laboratories, Inc. | Linked linear amplification of nucleic acids |
| FR2708288B1 (fr) | 1993-07-26 | 1995-09-01 | Bio Merieux | Procédé d'amplification d'acides nucléiques par transcription utilisant le déplacement, réactifs et nécessaire pour la mise en Óoeuvre de ce procédé. |
| EP0716713A1 (en) * | 1993-08-18 | 1996-06-19 | Id Biomedical Corporation | Compositions and methods for detecting target nucleic acid sequences utilizing adjacent sequence-enzyme molecules |
| US5925517A (en) * | 1993-11-12 | 1999-07-20 | The Public Health Research Institute Of The City Of New York, Inc. | Detectably labeled dual conformation oligonucleotide probes, assays and kits |
| WO1995014106A2 (en) * | 1993-11-17 | 1995-05-26 | Id Biomedical Corporation | Cycling probe cleavage detection of nucleic acid sequences |
| EP0765401B1 (en) | 1993-11-17 | 2001-02-21 | Amersham Pharmacia Biotech UK Limited | Primer extension mass spectroscopy nucleic acid sequencing method |
| CA2140081C (en) | 1994-01-13 | 2008-04-01 | Dean L. Engelhardt | Process, construct and conjugate for producing multiple nucleic acid copies |
| US5654419A (en) | 1994-02-01 | 1997-08-05 | The Regents Of The University Of California | Fluorescent labels and their use in separations |
| CA2182517C (en) | 1994-02-07 | 2001-08-21 | Theo Nikiforov | Ligase/polymerase-mediated primer extension of single nucleotide polymorphisms and its use in genetic analysis |
| US5578832A (en) | 1994-09-02 | 1996-11-26 | Affymetrix, Inc. | Method and apparatus for imaging a sample on a device |
| US5605793A (en) | 1994-02-17 | 1997-02-25 | Affymax Technologies N.V. | Methods for in vitro recombination |
| US6117679A (en) * | 1994-02-17 | 2000-09-12 | Maxygen, Inc. | Methods for generating polynucleotides having desired characteristics by iterative selection and recombination |
| US6335160B1 (en) * | 1995-02-17 | 2002-01-01 | Maxygen, Inc. | Methods and compositions for polypeptide engineering |
| US5648211A (en) | 1994-04-18 | 1997-07-15 | Becton, Dickinson And Company | Strand displacement amplification using thermophilic enzymes |
| US5705332A (en) | 1994-04-25 | 1998-01-06 | University Of Hawaii | Detection and identification of Salmonella and Shigella |
| US6060288A (en) * | 1994-08-03 | 2000-05-09 | Mosaic Technologies | Method for performing amplification of nucleic acid on supports |
| US5641658A (en) * | 1994-08-03 | 1997-06-24 | Mosaic Technologies, Inc. | Method for performing amplification of nucleic acid with two primers bound to a single solid support |
| US5491063A (en) * | 1994-09-01 | 1996-02-13 | Hoffmann-La Roche Inc. | Methods for in-solution quenching of fluorescently labeled oligonucleotide probes |
| FR2724934B1 (fr) * | 1994-09-26 | 1997-01-24 | Bio Merieux | Oligonucleotide chimere et son utilisation dans l'obtention de transcrits d'un acide nucleique |
| US6280935B1 (en) | 1994-10-13 | 2001-08-28 | Lynx Therapeutics, Inc. | Method of detecting the presence or absence of a plurality of target sequences using oligonucleotide tags |
| US5556752A (en) | 1994-10-24 | 1996-09-17 | Affymetrix, Inc. | Surface-bound, unimolecular, double-stranded DNA |
| US6309843B1 (en) | 1994-10-25 | 2001-10-30 | The Curators Of The University Of Missouri | Glycoprotein for use in determining endometrial receptivity |
| US5665545A (en) * | 1994-11-28 | 1997-09-09 | Akzo Nobel N.V. | Terminal repeat amplification method |
| US5556771A (en) | 1995-02-10 | 1996-09-17 | Gen-Probe Incorporated | Stabilized compositions of reverse transcriptase and RNA polymerase for nucleic acid amplification |
| US5700642A (en) * | 1995-05-22 | 1997-12-23 | Sri International | Oligonucleotide sizing using immobilized cleavable primers |
| US5830655A (en) * | 1995-05-22 | 1998-11-03 | Sri International | Oligonucleotide sizing using cleavable primers |
| US5916777A (en) * | 1995-06-07 | 1999-06-29 | Gen-Probe Incorporated | Enzymatic synthesis of oligonucleotides using 3'-ribonucleotide primers |
| US5882867A (en) * | 1995-06-07 | 1999-03-16 | Dade Behring Marburg Gmbh | Detection of nucleic acids by formation of template-dependent product |
| US5763178A (en) * | 1995-06-07 | 1998-06-09 | Trevigen, Inc. | Oscillating signal amplifier for nucleic acid detection |
| US5932450A (en) * | 1995-06-07 | 1999-08-03 | Gen-Probe Incorporated | Enzymatic synthesis of oligonucleotides using digestible templates |
| JPH0920263A (ja) * | 1995-07-06 | 1997-01-21 | Jidosha Kiki Co Ltd | 電動ポンプ式動力舵取装置 |
| US5989813A (en) | 1995-07-13 | 1999-11-23 | Molecular Innovations, Inc. | Detection of amplified nucleic acid sequences using bifunctional haptenization and dyed microparticles |
| WO1997004123A1 (en) | 1995-07-19 | 1997-02-06 | Gel Tech Group Inc. | Collagen compound production in plants |
| FR2737223B1 (fr) * | 1995-07-24 | 1997-09-12 | Bio Merieux | Procede d'amplification de sequences d'acide nucleique par deplacement, a l'aide d'amorces chimeres |
| US5652356A (en) * | 1995-08-17 | 1997-07-29 | Hybridon, Inc. | Inverted chimeric and hybrid oligonucleotides |
| US6068829A (en) | 1995-09-11 | 2000-05-30 | The Burnham Institute | Method of identifying molecules that home to a selected organ in vivo |
| US5916779A (en) | 1995-09-21 | 1999-06-29 | Becton, Dickinson And Company | Strand displacement amplification of RNA targets |
| US5747255A (en) * | 1995-09-29 | 1998-05-05 | Lynx Therapeutics, Inc. | Polynucleotide detection by isothermal amplification using cleavable oligonucleotides |
| US5871697A (en) | 1995-10-24 | 1999-02-16 | Curagen Corporation | Method and apparatus for identifying, classifying, or quantifying DNA sequences in a sample without sequencing |
| AU714486B2 (en) * | 1995-11-21 | 2000-01-06 | Yale University | Unimolecular segment amplification and detection |
| US5854033A (en) * | 1995-11-21 | 1998-12-29 | Yale University | Rolling circle replication reporter systems |
| DE69613856T2 (de) * | 1995-12-15 | 2002-04-04 | Amersham Pharmacia Biotech Inc., Piscataway | Thermostabile dna polymerase aus thermoanaerobacter thermohydrosulfuricus und davon abgeleitete mutierte enzyme mit entfernter exonukleaseaktivität |
| US5962271A (en) * | 1996-01-03 | 1999-10-05 | Cloutech Laboratories, Inc. | Methods and compositions for generating full-length cDNA having arbitrary nucleotide sequence at the 3'-end |
| US5932449A (en) | 1996-02-01 | 1999-08-03 | The United States Of America As Represented By The Secretary Of The Army | Detection of botulinum toxin |
| GB9604267D0 (en) | 1996-02-29 | 1996-05-01 | Royal Infirmary Of Edinburgh N | Mutation assay |
| US5712127A (en) * | 1996-04-29 | 1998-01-27 | Genescape Inc. | Subtractive amplification |
| CA2255774C (en) * | 1996-05-29 | 2008-03-18 | Cornell Research Foundation, Inc. | Detection of nucleic acid sequence differences using coupled ligase detection and polymerase chain reactions |
| BR9612660A (pt) | 1996-07-08 | 1999-12-28 | Bar Cochva Mardix | Processo de produção de palmilha personalisada e palmilha personolisada. |
| US6218105B1 (en) * | 1996-07-19 | 2001-04-17 | Kathleen S. Hall | High throughput papilloma virus in vitro infectivity assay |
| US5858665A (en) * | 1996-07-25 | 1999-01-12 | Navix, Inc. | Homogeneous diagnostic assay method utilizing simultaneous target and signal amplification |
| US5853990A (en) * | 1996-07-26 | 1998-12-29 | Edward E. Winger | Real time homogeneous nucleotide assay |
| EP0923557A4 (en) | 1996-08-09 | 1999-12-08 | Merck & Co Inc | STEREOSELECTIVE DEOXY GENERATION REACTION |
| WO1998006736A1 (en) | 1996-08-14 | 1998-02-19 | Life Technologies, Inc. | Stable compositions for nucleic acid amplification and sequencing |
| US6255060B1 (en) * | 1996-11-21 | 2001-07-03 | Trustees Of The University Of Pennsylvania | Method of detecting protein by immuno RNA |
| US5958703A (en) | 1996-12-03 | 1999-09-28 | Glaxo Group Limited | Use of modified tethers in screening compound libraries |
| DE19653439A1 (de) | 1996-12-20 | 1998-07-02 | Svante Dr Paeaebo | Verfahren zur direkten, exponentiellen Amplifikation und Sequenzierung von DNA Molekülen und dessen Anwendung |
| US6482590B1 (en) | 1996-12-20 | 2002-11-19 | Aventis Behring Gmbh | Method for polynucleotide amplification |
| AU6846698A (en) | 1997-04-01 | 1998-10-22 | Glaxo Group Limited | Method of nucleic acid amplification |
| AU745126B2 (en) | 1997-04-16 | 2002-03-14 | Applied Biosystems, Llc | Nucleic acid archiving |
| US6566101B1 (en) | 1997-06-16 | 2003-05-20 | Anthony P. Shuber | Primer extension methods for detecting nucleic acids |
| AU8162498A (en) | 1997-06-25 | 1999-01-04 | Orchid Biosciences, Inc. | Methods for the detection of multiple single nucleotide polymorphisms in a single reaction |
| US6136533A (en) * | 1997-07-03 | 2000-10-24 | Id Biomedical | Additives for use in cycling probe reactions |
| US6140086A (en) | 1997-08-15 | 2000-10-31 | Fox; Donna K. | Methods and compositions for cloning nucleic acid molecules |
| US6124120A (en) | 1997-10-08 | 2000-09-26 | Yale University | Multiple displacement amplification |
| US6485944B1 (en) | 1997-10-10 | 2002-11-26 | President And Fellows Of Harvard College | Replica amplification of nucleic acid arrays |
| AU753505B2 (en) | 1997-10-30 | 2002-10-17 | Cold Spring Harbor Laboratory | Probe arrays and methods of using probe arrays for distinguishing DNA |
| US5932451A (en) | 1997-11-19 | 1999-08-03 | Incyte Pharmaceuticals, Inc. | Method for unbiased mRNA amplification |
| US6345481B1 (en) | 1997-11-25 | 2002-02-12 | Premark Rwp Holdings, Inc. | Article with interlocking edges and covering product prepared therefrom |
| WO1999029901A1 (en) | 1997-12-11 | 1999-06-17 | The General Hospital Corporation | Broad range pcr amplification techniques |
| JP4317953B2 (ja) | 1998-01-22 | 2009-08-19 | 独立行政法人理化学研究所 | Dnaの塩基配列決定方法 |
| US20010000077A1 (en) | 1998-02-03 | 2001-03-29 | Engelhardt Dean L. | Novel process, construct and conjugate for producing multiple nucleic acid copies |
| AU2520799A (en) | 1998-02-05 | 1999-08-23 | Bavarian Nordic Research Institute A/S | Quantification by inhibition of amplification |
| US6365346B1 (en) | 1998-02-18 | 2002-04-02 | Dade Behring Inc. | Quantitative determination of nucleic acid amplification products |
| US6087103A (en) * | 1998-03-04 | 2000-07-11 | Lifespan Biosciences, Inc. | Tagged ligand arrays for identifying target-ligand interactions |
| DE19813317A1 (de) * | 1998-03-26 | 1999-09-30 | Roche Diagnostics Gmbh | Verbessertes Verfahren zur Primer Extension Präamplifikations-PCR |
| US20020064837A1 (en) * | 1998-05-08 | 2002-05-30 | Thuan Quoc Trinh | Method for synthesizing a nucleic acid molecule using a ribonuclease |
| US6297170B1 (en) * | 1998-06-23 | 2001-10-02 | Vlsi Technology, Inc. | Sacrificial multilayer anti-reflective coating for mos gate formation |
| US6743605B1 (en) | 1998-06-24 | 2004-06-01 | Enzo Life Sciences, Inc. | Linear amplification of specific nucleic acid sequences |
| WO2000004193A1 (en) | 1998-07-20 | 2000-01-27 | Yale University | Method for detecting nucleic acids using target-mediated ligation of bipartite primers |
| GB9817055D0 (en) | 1998-08-05 | 1998-09-30 | Medical Res Council | Reverse transcription and amplification processes and primers therefore |
| CA2245039A1 (en) | 1998-08-13 | 2000-02-13 | Vito Scalia | Primer-specific and mispair extension assay for identifying gene variation |
| EP1873260B1 (en) * | 1998-11-09 | 2009-03-18 | Eiken Kagaku Kabushiki Kaisha | Process for synthesizing nucleic acid |
| US20030049657A1 (en) | 1998-11-13 | 2003-03-13 | Cherry Joshua L. | Use of primers containing non-replicatable residues for improved cycle-sequencing of nucleic acids |
| US6927024B2 (en) | 1998-11-30 | 2005-08-09 | Genentech, Inc. | PCR assay |
| EP1141275B1 (en) | 1999-01-05 | 2009-08-12 | Trustees Of Boston University | Improved nucleic acid cloning |
| US6358712B1 (en) | 1999-01-05 | 2002-03-19 | Trustee Of Boston University | Ordered gene assembly |
| US6376246B1 (en) | 1999-02-05 | 2002-04-23 | Maxygen, Inc. | Oligonucleotide mediated nucleic acid recombination |
| US7074556B2 (en) | 1999-03-02 | 2006-07-11 | Invitrogen Corporation | cDNA synthesis improvements |
| US6951722B2 (en) | 1999-03-19 | 2005-10-04 | Takara Bio Inc. | Method for amplifying nucleic acid sequence |
| WO2000056925A2 (en) | 1999-03-19 | 2000-09-28 | Aclara Biosciences, Inc. | Methods for single nucleotide polymorphism detection |
| WO2000056877A1 (fr) * | 1999-03-19 | 2000-09-28 | Takara Shuzo Co., Ltd. | Procede d'amplification d'une sequence d'acide nucleique |
| US6355431B1 (en) * | 1999-04-20 | 2002-03-12 | Illumina, Inc. | Detection of nucleic acid amplification reactions using bead arrays |
| WO2000070095A2 (en) | 1999-05-17 | 2000-11-23 | Dade Behring Inc. | Homogeneous isothermal amplification and detection of nucleic acids using a template switch oligonucleotide |
| US6132997A (en) * | 1999-05-28 | 2000-10-17 | Agilent Technologies | Method for linear mRNA amplification |
| US6692918B2 (en) * | 1999-09-13 | 2004-02-17 | Nugen Technologies, Inc. | Methods and compositions for linear isothermal amplification of polynucleotide sequences |
| BR0014182A (pt) * | 1999-09-13 | 2002-05-21 | Nugen Technologies Inc | Processos e composições para amplificação isotérmica linear de sequências polinucleotìdicas |
| US6107061A (en) | 1999-09-18 | 2000-08-22 | The Perkin-Elmer Corporation | Modified primer extension reactions for polynucleotide sequence detection |
| US6617442B1 (en) | 1999-09-30 | 2003-09-09 | Isis Pharmaceuticals, Inc. | Human Rnase H1 and oligonucleotide compositions thereof |
| US6300073B1 (en) | 1999-10-01 | 2001-10-09 | Clontech Laboratories, Inc. | One step RT-PCR methods, enzyme mixes and kits for use in practicing the same |
| US6271002B1 (en) | 1999-10-04 | 2001-08-07 | Rosetta Inpharmatics, Inc. | RNA amplification method |
| US6794138B1 (en) | 1999-12-16 | 2004-09-21 | Affymetrix, Inc. | Methods of small sample amplification |
| US7205129B1 (en) | 2000-02-28 | 2007-04-17 | Qiagen Gmbh | Method for reducing artifacts in nucleic acid amplification |
| US6376191B1 (en) | 2000-03-22 | 2002-04-23 | Mergen, Ltd. | Microarray-based analysis of polynucleotide sequence variations |
| AU2001251069A1 (en) | 2000-03-28 | 2001-10-08 | The Government of the United States of America, as represented by the Secretary, Department of Health and Human Services, The NationalInstitutes Of Health | Gene profiling arrays |
| EP1356094B1 (en) * | 2000-06-26 | 2010-01-13 | Nugen Technologies, Inc. | Methods and compositions for transcription-based nucleic acid amplification |
| US7846733B2 (en) * | 2000-06-26 | 2010-12-07 | Nugen Technologies, Inc. | Methods and compositions for transcription-based nucleic acid amplification |
| US6596490B2 (en) * | 2000-07-14 | 2003-07-22 | Applied Gene Technologies, Inc. | Nucleic acid hairpin probes and uses thereof |
| US6379932B1 (en) | 2000-07-17 | 2002-04-30 | Incyte Genomics, Inc. | Single primer PCR amplification of RNA |
| EA005739B1 (ru) | 2000-08-23 | 2005-06-30 | Такара Био Инк. | Способ амплификации нуклеиновых кислот |
| CA2356123A1 (en) | 2000-08-25 | 2002-02-25 | Riken | Method of preparing normalized and/or subtracted cdna |
| US20040166499A1 (en) | 2000-10-05 | 2004-08-26 | Yoshihide Hayashizaki | Oligonucleotide linkers comprising a variable cohesive portion and method for the praparation of polynucleotide libraries by using said linkers |
| CA2423729A1 (en) | 2000-10-06 | 2002-04-11 | Nugen Technologies, Inc. | Methods and probes for detection and/or quantification of nucleic acid sequences |
| US6673549B1 (en) * | 2000-10-12 | 2004-01-06 | Incyte Corporation | Genes expressed in C3A liver cell cultures treated with steroids |
| US20020127575A1 (en) * | 2000-10-30 | 2002-09-12 | Glenn Hoke | Partially double-stranded nucleic acids, methods of making, and use thereof |
| AR031640A1 (es) | 2000-12-08 | 2003-09-24 | Applied Research Systems | Amplificacion isotermica de acidos nucleicos en un soporte solido |
| CA2430329A1 (en) * | 2000-12-13 | 2002-06-20 | Nugen Technologies, Inc. | Methods and compositions for generation of multiple copies of nucleic acid sequences and methods of detection thereof |
| GB0101397D0 (en) | 2001-01-19 | 2001-03-07 | Amersham Pharm Biotech Uk Ltd | Suppression of non-specific nucleic acid amplication |
| EP1390537B1 (en) | 2001-03-09 | 2013-11-13 | Nugen Technologies, Inc. | Methods and compositions for amplification of rna sequences |
| ATE361996T1 (de) | 2001-03-09 | 2007-06-15 | Nugen Technologies Inc | Methoden und zusammensetzungen zur vervielfältigung von rna sequenzen |
| US20040161741A1 (en) | 2001-06-30 | 2004-08-19 | Elazar Rabani | Novel compositions and processes for analyte detection, quantification and amplification |
| CN100487116C (zh) | 2001-07-09 | 2009-05-13 | 旭化成株式会社 | 应用非织造织物纯化和检测核酸的方法 |
| EP1281757A1 (en) | 2001-07-31 | 2003-02-05 | Direvo Biotech AG | Method for the production of nucleic acids consisting of stochastically combined parts of source nucleic acids |
| GB0118758D0 (en) | 2001-08-01 | 2001-09-26 | Sybesma Wilbert F H | Chimeric primed based real time rt-pcr for qualification of rna or dna templates in a crude sample |
| KR20040028991A (ko) | 2001-08-20 | 2004-04-03 | 다카라 바이오 가부시키가이샤 | 핵산 증폭 방법 |
| US6617137B2 (en) | 2001-10-15 | 2003-09-09 | Molecular Staging Inc. | Method of amplifying whole genomes without subjecting the genome to denaturing conditions |
| JP2005509871A (ja) | 2001-11-20 | 2005-04-14 | エグザクト サイエンシーズ コーポレイション | 自動化サンプル調製方法および装置 |
| DE60323067D1 (de) * | 2002-03-11 | 2008-10-02 | Nugen Technologies Inc | Verfahren zur erzeugung doppelsträngiger dna mit einem 3'-einzelstranganteil und verwendungen dieser komplexe zur rekombination |
| AU2003220249A1 (en) | 2002-03-15 | 2003-09-29 | Arcturus Bioscience, Inc. | Improved nucleic acid amplification |
| EP1490514A4 (en) * | 2002-03-29 | 2008-12-17 | Nugen Technologies Inc | THROUGH ISOTHERME SINGLE PRIMER NUCLEIC ACID AMPLIFICATION IMPROVED DETECTION AND QUANTIFICATION OF ANALYTES |
| CA2486283A1 (en) * | 2002-05-17 | 2004-02-05 | Nugen Technologies, Inc. | Methods for fragmentation, labeling and immobilization of nucleic acids |
| US7205128B2 (en) * | 2002-08-16 | 2007-04-17 | Agilent Technologies, Inc. | Method for synthesis of the second strand of cDNA |
| EP2159285B1 (en) | 2003-01-29 | 2012-09-26 | 454 Life Sciences Corporation | Methods of amplifying and sequencing nucleic acids |
| US20060183132A1 (en) | 2005-02-14 | 2006-08-17 | Perlegen Sciences, Inc. | Selection probe amplification |
| WO2004092330A2 (en) | 2003-04-11 | 2004-10-28 | Applera Corporation | Method of generating long nucleic acid molecules of defined sequence |
| CA2521084A1 (en) | 2003-04-14 | 2004-10-28 | Nugen Technologies, Inc. | Global amplification using a randomly primed composite primer |
| GB0318110D0 (en) | 2003-08-01 | 2003-09-03 | Isaeo Ltd | Methods and kits for detecting an enzyme capable of modifying a nucleic acid |
| WO2005065321A2 (en) | 2003-12-29 | 2005-07-21 | Nugen Technologies, Inc. | Methods for analysis of nucleic acid methylation status and methods for fragmentation, labeling and immobilization of nucleic acids |
| US7622281B2 (en) * | 2004-05-20 | 2009-11-24 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and compositions for clonal amplification of nucleic acid |
| EP1866434B1 (en) | 2005-02-19 | 2013-06-05 | Avacta Group plc | Isothermal nucleic acid amplification |
| US20060269934A1 (en) | 2005-03-16 | 2006-11-30 | Applera Corporation | Compositions and methods for clonal amplification and analysis of polynucleotides |
| US7709197B2 (en) | 2005-06-15 | 2010-05-04 | Callida Genomics, Inc. | Nucleic acid analysis by random mixtures of non-overlapping fragments |
| ATE550441T1 (de) | 2005-09-06 | 2012-04-15 | Gen Probe Inc | Verfahren, zusammensetzungen und kits zur isothermischen amplifikation von nukleinsäuren |
| WO2007030759A2 (en) | 2005-09-07 | 2007-03-15 | Nugen Technologies, Inc. | Improved nucleic acid amplification procedure |
| JP5438320B2 (ja) | 2005-10-03 | 2014-03-12 | アプライド バイオシステムズ リミテッド ライアビリティー カンパニー | 核酸を増幅するための組成物、方法およびキット |
| WO2007136717A1 (en) | 2006-05-16 | 2007-11-29 | Nugen Technologies, Inc. | Nucleic acid separation and purification method based on reversible charge interactions |
| US7833716B2 (en) | 2006-06-06 | 2010-11-16 | Gen-Probe Incorporated | Tagged oligonucleotides and their use in nucleic acid amplification methods |
| WO2008005459A2 (en) | 2006-06-30 | 2008-01-10 | Nugen Technologies, Inc. | Methods for fragmentation and labeling of nucleic acids |
| US9388457B2 (en) | 2007-09-14 | 2016-07-12 | Affymetrix, Inc. | Locus specific amplification using array probes |
| US8034568B2 (en) | 2008-02-12 | 2011-10-11 | Nugen Technologies, Inc. | Isothermal nucleic acid amplification methods and compositions |
| WO2009117698A2 (en) | 2008-03-21 | 2009-09-24 | Nugen Technologies, Inc. | Methods of rna amplification in the presence of dna |
| WO2011019964A1 (en) | 2009-08-12 | 2011-02-17 | Nugen Technologies, Inc. | Methods, compositions, and kits for generating nucleic acid products substantially free of template nucleic acid |
| EP2475777A4 (en) | 2009-09-11 | 2013-03-06 | Nugen Technologies Inc | COMPOSITIONS AND METHODS FOR COMPLETE TRANSCRIPTOMAL ANALYSIS |
| GB2487341A (en) | 2009-11-02 | 2012-07-18 | Nugen Technologies Inc | Compositions and methods for targeted nucleic acid sequence selection and amplification |
| WO2012103154A1 (en) | 2011-01-24 | 2012-08-02 | Nugen Technologies, Inc. | Stem-loop composite rna-dna adaptor-primers: compositions and methods for library generation, amplification and other downstream manipulations |
| GB2497838A (en) | 2011-10-19 | 2013-06-26 | Nugen Technologies Inc | Compositions and methods for directional nucleic acid amplification and sequencing |
| EP4372084A3 (en) | 2012-01-26 | 2024-08-14 | Tecan Genomics, Inc. | Compositions and methods for targeted nucleic acid sequence enrichment and high efficiency library generation |
-
2002
- 2002-03-11 AT AT02721342T patent/ATE361996T1/de not_active IP Right Cessation
- 2002-03-11 WO PCT/US2002/007306 patent/WO2002072772A2/en active IP Right Grant
- 2002-03-11 DE DE60220025T patent/DE60220025T2/de not_active Expired - Lifetime
- 2002-03-11 ZA ZA200210369A patent/ZA200210369B/en unknown
- 2002-03-11 CN CNB028028279A patent/CN1289690C/zh not_active Expired - Fee Related
- 2002-03-11 KR KR10-2003-7000702A patent/KR20030082535A/ko not_active Application Discontinuation
- 2002-03-11 CA CA2416963A patent/CA2416963C/en not_active Expired - Fee Related
- 2002-03-11 EP EP02721342A patent/EP1366197B1/en not_active Expired - Lifetime
- 2002-03-11 BR BR0205268-7A patent/BR0205268A/pt not_active IP Right Cessation
- 2002-03-11 AU AU2002252279A patent/AU2002252279B2/en not_active Ceased
- 2002-03-11 NZ NZ523167A patent/NZ523167A/en not_active IP Right Cessation
- 2002-03-11 US US10/100,321 patent/US6946251B2/en not_active Expired - Lifetime
- 2002-03-11 MX MXPA02012739A patent/MXPA02012739A/es active IP Right Grant
- 2002-03-11 JP JP2002571828A patent/JP4542312B2/ja not_active Expired - Fee Related
- 2002-03-11 IL IL15350402A patent/IL153504A0/xx unknown
-
2003
- 2003-02-04 NO NO20030557A patent/NO20030557D0/no not_active Application Discontinuation
- 2003-10-14 JP JP2003354377A patent/JP2004267201A/ja not_active Withdrawn
-
2004
- 2004-03-16 HK HK04101908A patent/HK1059097A1/xx not_active IP Right Cessation
- 2004-08-05 US US10/913,246 patent/US20050003441A1/en not_active Abandoned
- 2004-09-03 US US10/934,890 patent/US7354717B2/en not_active Expired - Lifetime
-
2007
- 2007-10-03 JP JP2007260418A patent/JP2008067709A/ja active Pending
-
2008
- 2008-01-25 US US12/020,434 patent/US7771946B2/en not_active Expired - Fee Related
-
2009
- 2009-11-10 US US12/615,958 patent/US8071311B2/en not_active Expired - Fee Related
-
2011
- 2011-10-27 US US13/282,732 patent/US8492095B2/en not_active Expired - Fee Related
-
2013
- 2013-06-19 US US13/922,146 patent/US9181582B2/en not_active Expired - Fee Related
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1289690C (zh) | Rna序列扩增的方法和组合物 | |
| CN1498274A (zh) | 基于转录的核酸扩增方法和组合物 | |
| CN1227357C (zh) | 用于扩增核酸序列的方法 | |
| CN1154733C (zh) | 改进的热稳定dna聚合酶 | |
| CN1185347C (zh) | 用于改进体外核酸合成和扩增的提升热稳定dna聚合酶保真性的热稳定酶 | |
| CN1273611C (zh) | 使用突变dna聚合酶的高温逆转录 | |
| CN1198943C (zh) | 通过裂解脱碱基位点的核酸产生可延伸的上游dna片段而鉴定核酸分子的方法 | |
| CN1118581C (zh) | 对dna的特性分析 | |
| CN1195872C (zh) | 通过连接经编码的衔接子进行测序 | |
| CN1608137A (zh) | 通过同时探查和酶介导检测的多态性基因座多重分析 | |
| CN1373812A (zh) | 用于多核苷酸序列线性等温扩增的方法及组合物 | |
| CN1876843A (zh) | 检测突变和/或多态性的方法 | |
| CN1950519A (zh) | 聚合酶群落荧光原位测序珠子 | |
| CN1415020A (zh) | 检测突变和/或多态性的方法 | |
| CN1059562A (zh) | 减少扩增过程中载带污染的方法 | |
| CN1723217A (zh) | 使用单核苷酸多态性组分析受损样品的方法和组合物 | |
| CN1071955A (zh) | 分支杆菌引物及探针 | |
| CN1602361A (zh) | 杂交部分控制寡核苷酸及其应用 | |
| CN1863927A (zh) | 核酸检测分析 | |
| CN100351393C (zh) | 核苷酸多态性的检测方法 | |
| CN1451050A (zh) | 控制水相介质的微生物质量的方法及其试剂盒 | |
| CN1806051A (zh) | 通过(例如)t细胞受体v/d/j基因中的重复鉴定克隆性细胞 | |
| CN1876844A (zh) | 在阵列上对遗传修饰植物特异的核苷酸序列元件的鉴定和/或定量 | |
| CN1500144A (zh) | 扩增的核酸及其固定化制品 | |
| CN1665938A (zh) | 检测序列差异的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1059097 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20061213 Termination date: 20170311 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |