CN100351393C - 核苷酸多态性的检测方法 - Google Patents
核苷酸多态性的检测方法 Download PDFInfo
- Publication number
- CN100351393C CN100351393C CNB028079310A CN02807931A CN100351393C CN 100351393 C CN100351393 C CN 100351393C CN B028079310 A CNB028079310 A CN B028079310A CN 02807931 A CN02807931 A CN 02807931A CN 100351393 C CN100351393 C CN 100351393C
- Authority
- CN
- China
- Prior art keywords
- nucleotide
- nucleic acid
- base
- target nucleic
- nucleotides
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6827—Hybridisation assays for detection of mutation or polymorphism
- C12Q1/683—Hybridisation assays for detection of mutation or polymorphism involving restriction enzymes, e.g. restriction fragment length polymorphism [RFLP]
Abstract
本发明提供一种可用于检测基因上核苷酸多态性的核苷酸;一种使用该核苷酸检测碱基上核苷酸多态性的方法;以及用于所述方法的试剂盒。
Description
技术领域
本发明涉及可用于检测基因中碱基置换的核苷酸(供本发明方法用的寡核苷酸)、使用所述核苷酸检测基因中碱基置换的方法、以及用于所述方法的试剂盒。
背景技术
已知属于同一物种的生物个体基因组中所含的遗传密码相互并不相同,在碱基序列中存在差异,被称为多态性。其中一个至数十个碱基缺失或插入的碱基序列、其中特定碱基序列被复制的碱基序列等都被称为多态性。其中一个碱基被另一碱基取代的碱基序列被称为单核苷酸多态性(SNP)。
据说单核苷酸多态性以约1/100-1/1000碱基的速率存在。因此,人类基因组上存在的SNP数目估计是3-10×106。注意到SNP作为用于搜索与疾病相关的基因的指标,或者作为用于获得有关对疾病的感病性或对药物的敏感性(作用或副作用)方面差异的信息的指标。用于检测SNP的方法正在研究之中。
用于检测SNP的常规方法一般分为基于杂交的方法、基于引物延伸的方法和应用酶的底物专一性的方法。
在杂交方法中,通过探针与核酸样品的杂交来检测碱基置换的存在。按照所述方法,必需确定探针和杂交条件,以便使杂交可受仅一个碱基差别的影响。因此,难以建立高度可再现的检测系统。
例举应用如美国专利第5,660,988号中所述的循环探针反应来检测突变的方法。在所述方法中,将具有可容易切割的键合的核酸探针与目标核酸分子杂交。如果目标核酸分子没有碱基置换,则探针被切割,反之,如果所述核酸分子有碱基置换,则探针不被切割。碱基置换则通过检测从被切割探针释放的片段的产生程度并对其进行定量来检测。然而,如果依照此方法检测痕量的靶核酸,则可能需要相当长的时间来达到所述方法可以检测到来自探针的切割产物的水平,因为切割产物的量很少。
应用如美国专利第5,210,015号和第5,487,972号中所述的TaqMan方法来检测突变的方法是另一方法的例子。在该方法中使用与荧光染料和猝灭剂连接的TaqMan探针。使用两种探针(一种含有碱基置换,而另一种不含碱基置换)作为TaqMan探针。所述探针与目标核酸分子杂交,并且引物从上游开始延伸。只有当目标核酸分子不含碱基置换时,所述探针才由于DNA聚合酶的5’→3’外切核酸酶活性而被切割。碱基置换则通过检测发射的荧光来检测。然而,所述方法有问题,因为所述方法需要具有5’→3’外切核酸酶活性的聚合酶、使用3’末端被封闭的标记核苷酸以及严格的温度调节的PCR,因而检测需要的时间长。
其中使用酶的方法包括其中使用DNA聚合酶的方法。这样的方法还分为如下三组:(1)其中使用3’末端退火至待检测碱基置换的碱基部分的引物,基于引物延伸反应的存在检测碱基置换的方法,如美国专利第5,137,806号中所述;(2)其中使用其中待检测的碱基置换位点位于从3’末端起第二个核苷酸上的引物,基于引物延伸反应的存在检测碱基置换的方法,如WO 01/42498中所述;和(3)其中使用3’末端退火至邻近待检测碱基置换的碱基的3’碱基上的引物,通过鉴别掺入到引物中的碱基,测定在目标位点上存在突变和所述位点上的碱基的方法。
其中使用DNA连接酶的方法是已知的,按照所述方法,碱基置换基于探针与相邻探针连接的存在进行检测。所述探针的末端部分对应于待检测碱基置换的碱基部分。
其中使用DNA聚合酶或DNA连接酶的方法可能不能够精确检测出由于碱基置换引起的引物(或探针)和靶核酸之间的错配。具体地说,即使引物或探针有错配,这样的酶也可以起始酶促反应,从而提供错误结果。
因为由于靶核酸和引物之间的错误退火引起的可能的假阳性或者由于所使用的连接酶或聚合酶造成的错误,所以必需非常严格地控制反应条件(特别是反应温度)等,因而有涉及可再现性的问题。
最后,包括其中使用具有识别和切割双链核酸中特定结构的活性的酶的方法,例如在美国专利第5,846,717号中所述的侵入者(invader)方法。切割酶已知是这样的酶。通过检查探针的切割来检测碱基置换是可行的。设计所述探针使其形成为所述酶所识别的结构,如果碱基置换存在(或不存在)的话。然而,其中使用具有识别和切割双链核酸中特定结构的活性的酶的方法就其灵敏度而论有问题。具体地说,按照所述方法,由于从一种靶核酸分子产生一种信号,所以不可能从痕量的核酸样品中获得足以检测出碱基置换的信号。自然,有可能通过重复探针切割反应来增强所述信号,虽然必需预先扩增靶核酸,以便获得强的信号。因此,如果依照此方法检测痕量的靶核酸,则可能需要相当长的时间来达到可以检测到来自探针的切割产物的水平,因为切割产物的量很少。
由于所述方法有如上所述的几个问题,因此一直需要可以用来精确检测碱基置换的方法。
发明目的
本发明的主要目的是解决上述问题,并且提供即使使用痕量的核酸样品也能精确而极好再现性地检测碱基置换(例如SNP)的方法。
发明概述
为了解决如上所述的问题,需要可以用来精确检测碱基置换并且获得作为强信号的结果的方法。
本发明人制备了一种核苷酸。所述核苷酸能够退火至待检测碱基置换的靶核酸上。通过DNA聚合酶从其3’末端的DNA延伸反应当所述核苷酸处于完整状态时则不被起始。核酸酶对所述核苷酸的切割受退火的模板链的碱基序列的影响。此外,本发明人建立了使用所述核苷酸可以用来精确而高灵敏度地检测靶核酸中碱基置换的方法。因而完成了本发明。
本发明概述如下。本发明的第一个方面涉及一种用于检测靶核酸中特定碱基上存在碱基置换的方法,所述方法包括:
(1)将含有靶核酸的样品与一种核苷酸混合,其中所述核苷酸
(A)在3’末端被修饰,致使不发生由DNA聚合酶从所述末端开始的延伸;
(B)具有能够退火至所述靶核酸中含有特定碱基的区上的碱基序列;和
(C)含有这样的序列:其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基和在所述核苷酸中对应于所述特定碱基的碱基之间有错配,则所述核苷酸不被核酸酶切割,而如果在所述特定碱基和在所述核苷酸中对应于所述特定碱基的碱基之间没有错配,则所述核苷酸被核酸酶切割,产生一个新的3’末端;
(2)用所述核酸酶和所述DNA聚合酶处理所述混合物;且
(3)检测所述核酸酶有无切割所述核苷酸。
以下方法作为第一方面的用来检测碱基置换的方法的例子;其中所述核酸酶为核糖核酸酶H,并且所述核苷酸在含对应于所述特定碱基的碱基的区中含有一个核糖核苷酸的方法;以及其中所述核酸酶为限制性酶,并且所述核苷酸在含对应于所述特定碱基的碱基的区中含有一个限制性酶的识别序列的方法。
本发明的第二个方面涉及一种用于检测靶核酸中碱基置换的方法,所述方法包括:
(1)将含有靶核酸的样品与一种核苷酸混合,其中所述核苷酸
(A)在3’末端被修饰,致使不发生由DNA聚合酶从所述末端开始的延伸;
(B)具有能够退火至所述靶核酸中含有特定碱基的区上的碱基序列;和
(C)含有这样的序列:其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间没有错配,则所述核苷酸不被核酸酶切割,而如果在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间有错配,则所述核苷酸被核酸酶切割,产生一个新的3’末端;
(2)用所述核酸酶和所述DNA聚合酶处理所述混合物;且
(3)检测所述核酸酶有无切割所述核苷酸。
其中所述核酸酶是一种错配特异性核酸酶的方法为第二个方面的检测方法的例子。
在第一个或第二个方面的检测方法中所使用的所述核苷酸可以具有这样的序列:其中如果在所述靶核酸中没有碱基置换,则在由所述核苷酸和所述靶核酸构成的复合物中不产生错配,或者它可以具有这样的序列:其中如果在所述靶核酸中有碱基置换,则在由所述核苷酸和所述靶核酸构成的复合物中不产生错配。
以下方法例证了第一个或第二个方面的实施方案:其中碱基置换的存在基于通过所述DNA聚合酶的作用产生的延伸产物的存在来测定的方法;和其中碱基置换的存在基于通过所述核酸酶的作用产生的从所述核苷酸释放的3’部分的片段的存在来测定的方法。此外,延伸产物或所述核苷酸3’部分的片段可以利用与所述核苷酸连接的标记来检测。可以用荧光物质作为标记。此外,可以使用与荧光物质和能够猝灭荧光的物质连接的核苷酸,其中当核酸酶进行切割或切割后DNA延伸时发射荧光。在其中使用荧光标记的核苷酸的实施方案中,可以使用荧光偏振法进行检测。
就在第一个或第二个方面用于检测碱基置换的方法中所使用的所述核苷酸而论,在3’端对所述核苷酸进行修饰的例子为修饰核糖3-位上的羟基。在本发明用于检测碱基置换的方法中所使用的所述核苷酸可以含有核苷酸类似物和/或经修饰的核苷酸。虽然并不打算限制本发明,但是例如可以优选使用脱氧核糖肌苷核苷酸、脱氧核糖尿嘧啶核苷酸等作为核苷酸类似物,而可以优选使用(α-S)核糖核苷酸作为经修饰的核糖核苷酸。此外,第一个或第二个方面的方法还可以包括一个核酸扩增步骤,其中用通过所述DNA聚合酶的作用产生的延伸产物作为模板。
本发明的第三个方面涉及一种用于分析等位基因的基因型的方法,所述方法包括按照第一个或第二个方面的方法检测碱基置换。
本发明的第四个方面涉及一种用于检测靶核酸中特定碱基上碱基置换的核苷酸,所述核苷酸
(A)在3’末端被修饰,致使不发生由DNA聚合酶从所述末端开始的延伸;
(B)具有能够退火至所述靶核酸中含有特定碱基的区上的碱基序列;和
(C)含有这样的序列:其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间有错配,则所述核苷酸不被核酸酶切割,而如果在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间没有错配,则所述核苷酸被核酸酶切割,产生一个新的3’末端。
以下核苷酸为第四个方面的核苷酸的例子:在所述靶核酸中含有对应于所述特定碱基的碱基的区中含有核糖核苷酸的核苷酸,其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间没有错配,则所述核苷酸被核糖核酸酶H切割;以及在所述靶核酸中含对应于所述特定碱基的碱基的区中含有限制性酶识别序列的核苷酸,其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间没有错配,则所述核苷酸被所述限制性酶切割。
本发明的第五个方面涉及一种用于检测靶核酸中特定碱基上碱基置换的核苷酸,所述核苷酸
(A)在3’末端被修饰,致使不发生由DNA聚合酶从所述末端开始的延伸;
(B)具有能够退火至所述靶核酸中含有特定碱基的区上的碱基序列;和
(C)含有这样的序列:其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间没有错配,则所述核苷酸不被核酸酶切割,而如果在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间有错配,则所述核苷酸被核酸酶切割,产生一个新的3’末端。
其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述核苷酸和所述靶核酸之间有错配、则所述核苷酸被错配特异性核酸酶切割的核苷酸是第五个方面的核苷酸的例子。
第四个或第五个方面的核苷酸可以具有这样的序列:其中如果在所述靶核酸中没有碱基置换,则在由所述核苷酸和所述靶核酸构成的复合物中不产生错配;或者它可以具有这样的序列:其中如果在所述靶核酸中有碱基置换,则在由所述核苷酸和所述靶核酸构成的复合物中不产生错配。
第四个或第五个方面的核苷酸可以具有连接的标记化合物。其位置可以位于所述核酸酶切割位点3’或5’的部分。例如,可以使用荧光物质作为标记化合物。通过进一步连接能够猝灭荧光的物质,可以制备当所述核酸酶进行切割或者所述切割后DNA延伸时发射荧光的核苷酸。
就第四个或第五个方面的核苷酸而论,在3’端对所述核苷酸进行修饰的例子为修饰核糖3-位上的羟基。本发明的核苷酸可以含有核苷酸类似物和/或经修饰的核苷酸。虽然并不打算限制本发明,但是例如可以优选使用脱氧核糖肌苷核苷酸、脱氧核糖尿嘧啶核苷酸等作为核苷酸类似物,而可以优选使用(α-S)核糖核苷酸作为经修饰的核糖核苷酸。
本发明的第六个方面涉及一种用于检测靶核酸中碱基置换的试剂盒,所述试剂盒含有第四个或第五个方面的所述核苷酸。
以下试剂盒是第六个方面的试剂盒的例子:含有核酸酶和/或DNA聚合酶的试剂盒;还含有用于检测DNA延伸物存在的试剂的试剂盒;和还含有用于实施核酸扩增法的试剂的试剂盒。
附图简述
图1图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
图2图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
图3图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
图4图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
图5是一幅曲线图,图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
图6图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
图7图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
图8图示说明依照本发明用于检测碱基置换的方法来检测人类基因中碱基置换的结果。
发明详述
此中所用的“碱基置换”是指核酸中特定位点上的碱基被另一碱基取代。碱基置换导致在生物个体中遗传信息方面的差别。遗传信息方面的差别被称为多态性或变异。此中所用的碱基置换包括多态性和变异方面的碱基置换。所述碱基置换也包括人工引入核酸中的碱基置换。
对于所述碱基置换中被置换碱基的数目并无具体限制。可以有一个或多个置换。
本发明特别适用于检测基因组多态性或变异,尤其是基因中的单核苷酸多态性(SNP)。
在下文,将详细描述本发明。
(1)本发明的核苷酸
本发明的核苷酸具有能够退火至靶核酸中含有待检测碱基置换的位点的区上的碱基序列。所述核苷酸如果它处于完整状态则不充当通过DNA聚合酶延伸DNA的引物,而只有当它被核酸酶切割时它才可以充当引物。对于所述核苷酸的长度并无具体限制,只要它具有如上所述的特性。按照本发明既可以使用寡核苷酸,也可以使用多核苷酸。使用通常8-50个碱基、优选10-40个碱基、更优选12-30个碱基的寡核苷酸作为本发明的核苷酸。
通常,本发明的核苷酸是一种含有脱氧核糖核苷酸的寡核苷酸。任选的是,它可以含有核糖核苷酸、或者核苷酸的类似物或衍生物(修饰物)。例如,具有诸如肌苷或7-脱氮鸟嘌呤的碱基作为其碱基部分的核苷酸类似物或者具有核糖衍生物的核苷酸类似物可以用作核苷酸类似物。经修饰的核苷酸的实例包括其中与磷酸基团连接的氧原子被硫原子取代的(α-S)核苷酸以及连接了标记化合物的核苷酸。此外,本发明的核苷酸可以含有如PNA;Nature,365:566-568(1993)中所述的肽核酸。虽然并不打算限制本发明,但是所述核苷酸类似物或衍生物优选掺入在所述掺入并不影响所用核酸酶作用的位点上。将核苷酸类似物掺入到本发明的核苷酸中对于抑制所述核苷酸自身高级结构的形成以及所述核苷酸退火至靶核酸上的稳定性是有效的。因此,所述核苷酸可以含有核苷酸类似物和/或经修饰的核苷酸,只要在本发明用于检测碱基置换的方法中可以使用的核苷酸的功能得以保留。
按照本发明使用的所述核苷酸具有供检测靶核酸中特定碱基上的碱基置换用的以下特性:
(A)在3’末端被修饰,致使不发生由DNA聚合酶从所述末端开始的延伸;
(B)具有能够退火至所述靶核酸中含有特定碱基的区上的碱基序列;和
(C)含有这样的序列:其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基与所述核苷酸中对应于所述特定碱基(即在所述特定碱基之间形成氢键)的碱基之间有错配(或者如果没有错配的话),则所述核苷酸不被核酸酶切割,而如果在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间没有错配(或者如果有错配的话),则所述核苷酸被核酸酶切割,产生一个新的3’末端。
所述核苷酸被核酸酶切割后的5’部分的片段仍可以退火至靶核酸上。由于在所述核苷酸5’部分的片段的3’末端上的核糖或脱氧核糖的3-位上存在一个羟基,因此DNA可以由DNA聚合酶从所述末端开始延伸。因而,所述核苷酸如果具有可被核酸酶切割的碱基序列,则充当引物的前体。
如上所述,本发明的核苷酸在3’末端被修饰,致使它不能用于通过DNA聚合酶的DNA延伸反应中。对于修饰方法并无具体限制,只要可以达到上述目的。其实例包括在双脱氧核苷酸的3’末端添加一个在核糖3-位上的羟基上修饰的核苷酸或者添加一个具有由于空间位阻而干扰DNA聚合酶延伸的修饰的核苷酸。可以使用烷基化或其它已知的修饰方法作为修饰核苷酸的核糖3-位上的羟基的方法。例如,DNA延伸反应可以为氨基烷基化所阻止。
本发明的核苷酸具有能够在所用条件下退火至靶核酸中待检测碱基置换的区的碱基序列。所述核苷酸具有与靶核酸基本互补的序列,并且不必具有与所述靶核酸完全互补的碱基序列,只要对目标碱基上置换的检测不受干扰。
当本发明的核苷酸退火至靶核酸上并且在合适的核酸酶和合适的DNA聚合酶的存在下保温时,所述核苷酸的切割受到靶核酸中存在碱基置换即在于由所述核苷酸退火至靶核酸上所形成的双链核酸中存在错配的位点的影响。用所述靶核酸作为模板的DNA延伸仅当所述核苷酸被切割而产生一个新的3’末端时才发生。因此,人们可以根据DNA延伸的存在而获得有关存在错配或者存在碱基置换的信息。
按照本发明,制备所述核苷酸致使如果存在待检测的碱基置换则产生错配是可能的,并且制备所述核苷酸致使如果存在碱基置换则不产生错配也是可能的。此外,人们可以如下获得有关存在碱基置换的信息,并且同时获得置换碱基类型的信息:制备四种类型的核苷酸,它们分别具有置于对应于目标碱基的位置上的四种类型碱基的其中一种;然后检查导致延伸的引物中所含的碱基的类型。
如上所述,本发明的核苷酸由于被核酸酶切割而转变成能够进行DNA延伸的引物。所述核苷酸中位于所述核酸酶切割位点5’的部分充当进行DNA延伸的引物。对于所述核酸酶并无具有限制,只要它根据在由于所述核苷酸退火至靶核酸上而形成的双链核酸中存在错配而切割(或者不切割)所述核苷酸。其实例包括核糖核酸酶H、限制性酶和错配特异性核酸酶。
核糖核酸酶H(RNA酶H)是一种识别由DNA和RNA组成的双链核酸并且选择性地切割RNA链的酶。通过将核糖核苷酸置于核苷酸中对应于待检测置换的碱基的位点上,可以制备仅当没有错配时才被核糖核酸酶H切割的核苷酸。
关于按照本发明使用的核糖核酸酶并无具体限制,只要它具有识别由含核糖核苷酸的本发明核苷酸和与其互补的DNA组成的双链核酸并且在核糖核苷酸部分选择性地切割的活性。例如,来自大肠杆菌(Escherichia coli)的核糖核酸酶H或者来自属于芽孢杆菌属(Bacillus)嗜热菌、属于栖热菌属(Thermus)细菌、属于热球菌属(Pyrococcus)细菌、属于栖热袍菌属(Thermotoga)细菌或属于古生球菌属(Archaeoglobus)细菌的核糖核酸酶H优选作为这样的酶使用。虽然并不打算限制本发明,但是所述核糖核酸酶H优选在与同时使用的DNA聚合酶的相同反应条件下表现出高活性。如果本发明的核苷酸与核酸扩增反应联合使用,则优选使用在进行所述反应的条件下表现出其活性的核糖核酸酶H。例如,如果使用包括在高温下反应或处理的核酸扩增反应(例如PCR),则最好使用耐热性核糖核酸酶H。例如,来自热坚芽孢杆菌(Bacillus caldotenax)、激烈热球菌(Prococcusfuriosus)、Pyrococcus horikoshii、Thermococcus lioralis、海栖热袍菌(Thermotoga maritima)、闪烁古生球菌(Archaeoglobus fulgidus)或詹氏甲烷球菌(Methanococcus jannashi)的核糖核酸酶H可以作为耐热性核糖核酸酶H使用。
限制性酶是一种识别DNA中特定碱基序列(4-8个碱基)并且在所述序列内或其周围的位置进行切割的酶。如果待检测置换的碱基部分与限制性酶的识别序列重叠,则制备用以包括所述序列的核苷酸可以用来检测碱基置换。如果在核苷酸和靶核酸之间产生错配,则不发生限制性酶的切割。人们可以根据所述结果获得有关存在碱基置换的信息。如果使用这样的核苷酸,则必需制备对所述限制性酶的切割不敏感的靶核酸。例如,通过使用对应于所用限制性酶的修饰性甲基化酶,使所述特定碱基甲基化,而特异性地给靶核酸赋予对限制性酶的抗性是可行的。
可以使用识别靶核酸和核苷酸之间的错配并且进行切割、并且与上述两种类型的核酸酶不同的酶。Mut H或类似的酶可以作为这样的酶使用。
本发明的核苷酸被所述核酸酸酶切割,产生一个新的3’末端,然后从所述末端起始DNA延伸。对于该步骤中所使用的DNA聚合酶并无具体限制,只要它能够根据作为模板的DNA的序列,从引物的3’末端进行DNA延伸。其实例包括大肠杆菌DNA聚合酶I、Klenow片段、T7DNA聚合酶、来自属于芽孢杆菌属嗜热菌的DNA聚合酶(BstDNA聚合酶、Bca DNA聚合酶)、来自栖热菌属细菌的DNA聚合酶(TaqDNA聚合酶等)和来自嗜热古细菌的α-型DNA聚合酶(Pfu DNA聚合酶等)。
如果本发明的核苷酸与基因扩增反应结合使用,则选择适合于基因扩增反应的DNA聚合酶来使用。
由于被核酸酶切割而产生的本发明核苷酸3’部分的片段仍可以退火至靶核酸上(如果它足够长的话),虽然它可以从所述靶核酸中释放出来(如果它短的话)。如果使用具有链置换活性的DNA聚合酶,则所述片段当通过所述DNA聚合酶进行DNA延伸时与所述靶核酸解离。如果使用具有5’→3’外切核酸酶活性的DNA聚合酶,则所述片段被所述DNA聚合酶降解。
虽然并不打算限制本发明,但是例如在使用核糖核酸酶H作为核酸酶的情况下,具有由以下通式表示的结构的寡核苷酸可以用作本发明的核苷酸:
通式:5’-dNa-Nb-dNc-N’-3’
(a:11或11以上的整数;b:1或1以上的整数;c:0或者1或1以上的整数;dN:脱氧核糖核苷酸;N:核糖核苷酸;N’:经修饰致使不发生由DNA聚合酶进行延伸的核苷酸)。
在所述通式中由Nb表示的部分含有与作为置换检测研究对象的碱基相对应的碱基。此外,所述核苷酸可以含有核苷酸类似物或衍生物(经修饰的核苷酸),只要不消除所述核苷酸的功能。
实例为作为由所述通式表示的嵌合寡核苷酸的核苷酸,其中N’是经修饰的脱氧核糖核苷酸,a是11或11以上的整数,b=1-3,c=0-2。对于与作为碱基置换检测对象的碱基相对应的碱基并无具体限制,只要它位于由Nb表示的部分中。在本发明的一个实施方案中,例如,可以优选使用一种这样的核苷酸:其中由(dNc-N’)表示的部分的长度为3个碱基,而与待检测碱基置换的碱基相对应的碱基位于由Nb表示的部分的3’末端。这样的核苷酸在检测碱基置换方面表现出良好的特异性。
可以促进通过用核酸酶进行切割从本发明的核苷酸释放的或者通过切割后DNA延伸反应时产生的产物(延伸产物)释放的3’部分的片段的检测,并且碱基置换的存在可以方便地通过适当标记所述核苷酸加以证实。
对于标记核苷酸的方法并无具体限制。例如,可以使用放射性同位素(32P等)、染料、荧光物质、发光物质、各种配体(生物素、洋地黄毒苷等)和酶。来源于标记核苷酸的产物的存在可以用适用于该标记的检测方法加以证实。不能直接检测的配体,可以与具有可检测标记的配体结合物质结合使用。例如,通过联合使用来自配体标记的核苷酸的产物和酶标记的抗配体抗体并且扩增该信号,可以高灵敏度地检测靶核酸。
荧光标记的核苷酸的实施方案的实例包括用荧光物质和具有适当间隔的猝灭所述荧光物质所发射荧光的作用的物质标记的核苷酸。这样的引物如果它处于完整状态则不发射荧光。然而,如果它被核酸酶切割并且使荧光物质和猝灭物质相距一定距离,则它发射荧光。由于这样的核苷酸在与DNA延伸反应起始的同时发射荧光,因此人们可以通过直接观察反应期间的反应混合物而获得有关存在碱基置换的信息。
(2)本发明用于检测碱基置换的方法
将如以上(1)中所述的本发明核苷酸用于本发明用于检测碱基置换的方法中,所述方法包括:
(1)将含有靶核酸的样品与所述核苷酸混合;
(2)用核酸酶和DNA聚合酶处理所述混合物;且
(3)检测所述核酸酶有无切割所述核苷酸。按照如以上(1)中所述的本发明核苷酸的特征,根据核苷酸被核酸酶切割的存在,确定碱基置换的存在。
在本发明用于检测碱基置换的方法中,可以使用单链或双链核酸(DNA或RNA)作为靶核酸。根据所使用的核酸酶,可能难以使用RNA作为靶核酸。在这种情况下,可以通过用RNA作为模板制备cDNA并且使用cDNA作为靶核酸,检测所述RNA中的碱基置换。
按照本发明,可以使用含有靶核酸的样品进行检测反应。
可以使用可能含有核酸的任何样品或生物体,例如不但限于细胞、组织(活检样品等)、全血、血清、脑脊髓液、精液、唾液、痰、尿液、粪便、毛发和细胞培养物。虽然并不打算限制本发明,但是可以对试样实施本发明的方法,优选在将其适当加工后,例如在将其转化为人们可以使用DNA聚合酶进行反应的形式之后。这样的加工包括裂解细胞以及从样品中提取并纯化核酸。
依照本发明用于检测碱基置换的方法,根据待用核苷酸被切割的存在及切割后DNA延伸反应的存在,测定碱基置换的存在。对于所述测定方法并无具体限制,可以使用分析核酸的已知方法。用于测定DNA延伸反应存在的方法的实例包括以下方法:其中分离所产生的延伸产物以通过凝胶电泳(琼脂糖凝胶、聚丙烯酰胺凝胶等)或毛细管电泳加以证实的方法;和其中通过质谱法测量延伸产物的长度增加的方法。在另一个实施方案中,例子为其中测定将核苷酸掺入延伸产物中的方法。在该方法中,人们可以获得作为在大分子延伸产物中掺入的合适标记的三磷酸核苷酸的量的、有关已合成延伸产物的量的信息。可以测定所产生的延伸产物的量,例如,在通过酸沉淀或凝胶电泳从未反应的核苷酸中分离所述产物之后测定。此外,可以使用其中通过酶促方法检测DNA延伸反应时产生的焦磷酸的方法。
按照本发明的检测方法,可以采用已知的核酸扩增反应,进一步扩增所述延伸产物。鉴于高灵敏度地检测碱基置换,这样的实施方案是有用的。
可以使用其中用具有与作为模板的核酸互补的序列的引物的各种核酸扩增法作为核酸扩增反应,但不限于此。例如,可以使用已知的扩增法,例如聚合酶链式反应(PCR,美国专利第4,683,195号、第4,683,202号和第4,800,159号)、链置换扩增(SDA,JP-B 7-114718)、自动维持序列扩增(3SR)、基于核酸序列的扩增(NASBA,日本专利第2650159号)、转录介导扩增(TMA)以及核酸的等温嵌合引物起始的扩增(ICAN,WO 00/56877)。在这样的方法中,可以通过用本发明的核苷酸作为引物来合成与作为模板的DNA链互补的DNA,检测靶核酸中的碱基置换。
如果采用上述核酸扩增法来实施本发明用于检测碱基置换的方法,则使用本发明的核苷酸作为在所述方法中所使用的引物中的至少一种,在所述反应系统中包括适用于所述核苷酸的核酸酶。
按照采用如上所述的核酸扩增反应来检测碱基置换,可以根据通过所述反应的特异性扩增产物的产生,测定碱基置换的存在。虽然并不打算限制本发明,但是对于所产生的扩增产物,可以使用例如凝胶电泳、使用具有与扩增产物互补的序列的探针的杂交、使用荧光标记核苷酸的荧光偏振法、TaqMan法等。另外,也可以使用适用于相应基因扩增法的检测反应。
当使用本发明的检测方法在基因组水平上分析碱基置换时,可以使得反应系统的体积更小且可以结合使用提高集成程度的装置,以便分析大量的碱基序列。其中通过使用最近的超精细加工技术集成了本发明的检测方法或分析方法的基本过程(例如从细胞提取DNA、核酸扩增反应、目标DNA的检测等)的几平方厘米至指尖大小的微芯片可以结合使用作为这样的装置。任选的是,可以结合凝胶电泳或毛细管电泳及与检测探针的杂交的过程。这样一种系统被称为微芯片—毛细管电泳(CE)微芯片或纳米芯片。
任何核酸扩增反应都可以用于这样的系统,只要目标DNA片段使用所述反应来扩增。虽然并不打算限制本发明,但是例如可以优选使用可以用来在等温条件下扩增核酸的方法,例如ICAN法。由于联合使用这样一种方法可以简化所述系统,因而所述方法非常优选用于如上所述的集成系统。此外,利用按照本发明的技术,可以构建更高度集成的系统。
通过在本发明的核苷酸中包括经修饰的核苷酸和/或通过在本发明的方法中适当调节反应温度,可以改进检测碱基置换的特异性。
具有标记的如以上(1)中所述的本发明核苷酸可以促进证实DNA延伸反应的存在,并且可用于本发明用于检测碱基置换的方法中。在这种情况下,延伸反应的存在通过适用于标记的如上所述的方法检测来源于所述核苷酸的标记物质加以证实。
例如,如果使用连接了荧光物质的本发明核苷酸并且如果将所述标记与用作引物的部分连接,则可以利用荧光检测延伸产物。如果将标记连接于位于核苷酸中的核酸酶切割位点3’的部分,则由于DNA聚合酶或类似酶的5’→3’外切核酸酶活性,而将所述片段转变为更小的分子等,根据3’片段与靶核酸的解离,可以检测延伸反应的存在。对于涉及荧光标记核苷酸分子量变化的这样的实施方案,优选使用荧光偏振法。
如果使用通过连接荧光物质和具有猝灭来自荧光物质发射的荧光的作用致使不发射荧光的物质而标记本发明的核苷酸,则在延伸反应起始的同时发射荧光。因此,可以非常容易地检测碱基置换。
在上述相应的实施方案中,通过利用在对应于待检测碱基置换的位点的位置上分别具有腺嘌呤(A)、胞嘧啶(C)、鸟嘌呤(G)、胸腺嘧啶(T)或尿嘧啶(U)以及可辨别的不同标记的核苷酸,人们可以获得有关存在碱基置换的信息,并且同时获得置换碱基类型的信息。
本发明的核苷酸可以用于PCR中,以检测碱基置换。在这种情况下,用本发明的核苷酸取代PCR引物的其中一种,还将适用于所述核苷酸的核酸酶加入到正常反应混合物中,供PCR用。通过选择在所述条件下不失活的核酸酶进行PCR,可以高灵敏度地检测碱基置换。
包括人在内的高等动物的细胞通常都是具有一对染色体的二倍体。因此,当染色体上的特定碱基可能存在碱基置换时,则有如下的三种可能的情况:纯合子(纯合型),其中细胞的两条染色体均没有碱基置换;纯合子(纯合型),其中两条染色体上均存在碱基置换;和杂合子(杂合型),其中仅一条染色体具有碱基置换。
通过将本发明用于检测碱基置换的方法用于从二倍体细胞制备的核酸样品,检查所述二倍体细胞或具有所述细胞的个体的基因型对于基因中的特定碱基是纯合型还是杂合型是可能的。虽然并不打算限制本发明,但是例如当用对应于四种类型的碱基并且如果没有错配则被切割的核苷酸实施本发明的方法时,对于来源于基因型为杂合型的细胞的核酸样品,核苷酸由于核苷酸被切割而检测到两种核苷酸的信号。另一方面,对于来源于基因型为纯合型的细胞的核酸样品,仅检测到一种核苷酸的信号。另外,同时测定所述纯合型有无碱基置换是可能的。如上所述,本发明的方法可用来检测等位基因中的碱基置换。
(3)本发明用于检测碱基置换的试剂盒
本发明提供用于如上所述按照本发明检测碱基置换的试剂盒。在一个实施方案中,所述试剂盒含有本发明的核苷酸。它可以含有一组分别含有四种类型的碱基之一的核苷酸,所述核苷酸可以用来测定碱基置换的存在,并且同时测定被置换碱基的类型。此外,所述试剂盒可以含有适用于所述核苷酸的核酸酶、DNA聚合酶、DNA聚合酶的底物(dNTP)、适用于反应的缓冲液等。或者,所述试剂盒可以含有用于检测引物-延伸产物的试剂。优选含有用于制备核酸扩增法中所使用的反应混合物的试剂的试剂盒,作为用于结合核酸扩增法检测碱基置换的试剂盒。
实施例
以下实施例更详细地说明本发明,但不应解释为限制本发明的范围。
参比实施例1:激烈热球菌(pyrococcus furiosus)RNA酶HII基因的克隆
(1)从激烈热球菌制备基因组DNA
将含有1%胰蛋白胨(Difco Laboratories)、0.5%酵母膏(DifcoLaboratories)、1%可溶性淀粉(Nacalai Tesque)、3.5%Jamarine S Solid(Jamarine Laboratory)、0.5%Jamarine S Liquid(Jamarine Laboratory)、0.003%MgSO4、0.001%NaCl、0.0001%FeSO4·7H2O、0.0001%CoSO4、0.0001%CaCl2·7H2O、0.0001%ZnSO4、0.1ppm CuSO4·5H2O、0.1ppmKAl(SO4)2、0.1ppm H3BO4、0.1ppm Na2MoO4·2H2O和0.25ppmNiCl2·6H2O的2L培养基置于2L培养瓶中,于120℃灭菌20分钟,通入氮气,以除去溶解氧。然后在培养基中接种激烈热球菌(从德意志微生物保藏中心(Deutsche Sammlung von Microorganismen)购买;DSM3638),于95℃不振荡培养16小时。培养后,通过离心收集细胞。
然后将所得细胞悬浮于4ml25%蔗糖、50mM Tris-HCl(pH 8.0)中。向其中加入0.4ml 10mg/ml氯化溶菌酶(lysozyme chloride)(NacalaiTesque)的水溶液。让混合物于20℃反应1小时。反应后,向反应混合物中加入含有150mM NaCl、1mM EDTA和20mM Tris-HCl(pH 8.0)的24ml混合物、0.2ml 20mg/ml蛋白酶K(Takara Shuzo)和2ml 10%十二烷基硫酸钠水溶液。将混合物于37℃温育1小时。
反应后,混合物经过苯酚-氯仿抽提,然后乙醇沉淀,制备约1mg基因组DNA。
(2)RNA酶HII基因的克隆
Pyrococcus horikoshii的完整基因组序列已经发表[DNA Research,5:55-76(1998)]。已知在基因组中存在一个编码RNA酶HII同源物的基因(PH1650)(SEQ ID NO:1,National Institute of Technology andEvaluation:http://www/nite.go.jp/的主页)。
搜索了PH1650基因(SEQ ID NO:1)和激烈热球菌的部分发表的基因组序列(University of Utah,Utah Genome Center:http://www.genome.utah.edu/sequence.html的主页)之间的同源性。结果,发现一个高度同源的序列。
根据所述同源序列,合成引物1650Nde(SEQ ID NO:2)和1650Bam(SEQ ID NO:3)。
用参比实施例1-(1)中获得的200ng激烈热球菌DNA作为模板,用20pmol 1650Nde和20pmol 1650Bam作为引物,在100μl体积中进行PCR。用TaKaRa Ex Taq(Takara Shuzo)作为DNA聚合酶,按照所附的方案进行PCR。如下进行PCR:94℃30秒、55℃30秒和72℃1分钟,进行30个循环。约0.7kb的扩增DNA片段用NdeI和BamHI(都得自Takara Shuzo)消化。将所得的DNA片段插入到质粒载体pET3a(Novagen)的NdeI位点和BamHI位点之间,制备质粒pPFU220。
(3)含RNA酶HII基因的DNA片段的碱基序列的测定
按照双脱氧法,测定在参比实施例1-(2)中获得的插入到pPFU220中的所述DNA片段的碱基序列。
所测定的碱基序列的分析表明,存在一个推定编码RNA酶HII的可读框。所述可读框的碱基序列示于SEQ ID NO:4中。从所述碱基序列导出的RNA酶HII的氨基酸序列示于SEQ ID NO:5中。
用质粒pPFU220转化的大肠杆菌JM109被命名和指定为大肠杆菌JM109/pPFU220,并且于2000年9月5日保藏于独立行政法人产业技术综合研究所特许生物寄托中心(International Patent OrganismDepositorv,National Institute of Advanced Industrial Science andTechnology),AIST Tsukuba Central 6,1-1,Higashi 1-Chome,Tsukuba-shi,Ibaraki-ken 305-8566,Japan,保藏号为FERM P-18020以及以保藏号FERM BP-7654保藏于独立行政法人产业技术综合研究所特许生物寄托中心,(转至国际保藏机构的日期:2001年7月9日)。
(4)经纯化的RNA酶HII制剂的制备
用参比实施例1-(2)中获得的pPFU220转化大肠杆菌HMS174(DE3)(Novagen)。将所得的带有pPFU220的大肠杆菌HMS174(DE3)接种到含有100μg/ml氨苄青霉素的2L LB培养基中,于37℃振荡培养16小时。培养后,将经离心收集的细胞悬浮于66.0ml超声处理缓冲液[50mM Tris-HCl(pH 8.0)、1mM EDTA、2mM苯基甲磺酰氟]中,进行超声处理。将通过超声处理悬浮液以12,000rpm离心10分钟而获得的上清液于60℃加热15分钟。然后再次以12,000rpm离心10分钟,以收集上清液。从而获得61.5ml热处理上清液。
将所述热处理上清液经过用缓冲液A[50mM Tris-HCl(pH 8.0)、1mM EDTA]平衡的RESOURSE Q柱(Amersham Pharmacia Biotech),用FPLC系统(Amersham Pharmacia Biotech)进行色谱分离。结果,RNA酶HII流过RESOURSE Q柱。
将60.0ml所述流通RNA酶HII流分经过用缓冲液A平衡的RESOURSE S柱(Amersham Pharmacia Biotech),用FPLC系统,以0-500mM NaCl线性梯度洗脱。获得用约150mM NaCl洗脱出的含RNA酶HII的流分。
用Centricon-10(Amicon),通过超滤浓缩2.0ml所述RNA酶HII流分。将250μl所述浓缩液经过用含有100mM NaCl和0.1mM EDTA的50mM Tris-HCl(pH 8.0)平衡的Superdex 200凝胶过滤柱(AmershamPharmacia Biotech),用同一种缓冲液洗脱。结果,RNA酶HII在相当于17千道尔顿分子量的位置洗脱出来。这一分子量对应于单体形式的RNA酶HII的分子量。
将洗脱出的RNA酶HII用作Pfu RNA酶HII制剂。如下测定如此获得的Pfu RNA酶HII制剂的RNA酶H活性。
将10mM Tris-HCl(pH 8.0)、1mM二硫苏糖醇(Nacalai Tesque)、0.003%牛血清白蛋白(fraction V,Sigma)、4%甘油、20μg/ml poly(dT)(Amersham Pharmacia Biotech)和30μg/ml poly(rA)(AmershamPharmacia Biotech)混合在一起。让混合物于37℃保温10分钟,用作供测量RNA酶H活性用的底物溶液。
加入1μl 1M MnCl2至100μl底物溶液中。让混合物于40℃保温。加入适当稀释的Pfu RNA酶HII制剂至所述混合物中,以起始反应。于40℃反应30分钟后,加入10μl 0.5M EDTA以终止反应。然后测量260nm的吸光度。
结果,加入Pfu RNA酶HII制剂的反应混合物的260nm的吸光度值,高于在加入Pfu RNA酶HII制剂之前加入10μl 0.5M EDTA的反应混合物的吸光度值。因此,表明该制剂具有RNA酶H活性。
(5)经纯化的RNA酶H活性的测量
(a)所用试剂溶液的制备
供测定活性用的反应混合物:在无菌水中含有指定终浓度的以下物质:40mM Tris-HCl(pH 7.7,37℃)、4mM氯化镁、1mM DTT、0.003%BSA、4%甘油和24μM poly(dT)。
Poly[8-3H]腺苷酸溶液:将370kBq Poly[8-3H]腺苷酸溶液溶于200μl无菌水中。
聚腺苷酸溶液:用无菌超纯水将聚腺苷酸稀释至3mM的浓度。
酶稀释液:在无菌水中含有指定终浓度的以下物质:25mMTris-HCl(pH 7.5,37℃)、5mM 2-巯基乙醇、0.5mM EDTA(pH 7.5,37℃)、30mM氯化钠和50%甘油。
热变性小牛胸腺DNA的制备:将200mg小牛胸腺DNA悬浮于100ml TE缓冲液中并让其溶胀。基于在UV 260nm下测量的吸光度,用无菌超纯水将溶液稀释至1mg/ml的浓度。将所述稀释液于100℃加热10分钟,然后在冰浴中快速冷却。
(b)用于测量活性的方法
加入7μl Poly[8-3H]腺苷酸溶液至以上(a)中制备的测定活性用的985μl反应混合物中。让混合物于37℃保温10分钟。加入8μl聚腺苷酸至混合物中,使终浓度为24μM。再让混合物于37℃保温5分钟。如此制备了1000μl Poly[8-3H]rA-poly-dT反应混合物。然后将200μl反应混合物于30℃保温5分钟。向其中加入1μl酶溶液的适当连续稀释液。在规定时间内从反应混合物中取出每种样品50μl,用于随后的测量。将按分钟计从加入酶至取样的时间定义为Y。加入1μl所述酶稀释液以取代酶溶液,制备总CPM或空白的50μl反应混合物。向样品中加入100μl 100mM焦磷酸钠、50μl热变性小牛胸腺DNA溶液和300μl 10%三氯乙酸(对于测量总CPM,300μl超纯水)。让混合物于0℃保温5分钟,然后以10000rpm离心10分钟。离心后,将250μl所得上清液置于小瓶中。向其中加入10ml Aqausol-2(NEN Life ScienceProducts)。在液体闪烁计数器中测量CPM。
(c)单位的计算
按照以下公式计算每种酶的单位值:单位/ml={(测量的CPM-空白CPM)×1.2*×20×1000×稀释率}200(μl)/(总CPM×Y(min)×50(μl)×9**)
1.2*:每50μl总CPM中所含有的Poly[8-3H]rA-poly-dT量(nmol)
9**:校正系数。
参比实施例2:得自闪烁古生球菌(Archaeoglobus fulgidus)的RNA酶HII基因的克隆
(1)从闪烁古生球菌制备基因组DNA
将从8ml培养物收集的闪烁古生球菌(从德意志微生物和细胞保藏中心购买;DSM4139)细胞悬浮于100μl 25%蔗糖、50mM Tris-HCl(pH 8.0)中。加入20μl 0.5M EDTA和10μl 10mg/ml氯化溶菌酶(Nacalai Tesque)的水溶液。让混合物于20℃反应1小时。反应后,向反应混合物中加入含有150mM NaCl、1mM EDTA和20mM Tris-HCl(pH 8.0)的800μl混合物、10μl 20mg/ml蛋白酶K(Takara Shuzo)和50μl 10%十二烷基硫酸钠水溶液。将混合物于37℃温育1小时。反应后,混合物经过苯酚-氯仿抽提,然后乙醇沉淀并风干,然后溶于50μl TE中,获得基因组DNA溶液。
(2)RNA酶HII基因的克隆
闪烁古生球菌的完整基因组序列已经发表[Klenk,H.P.等,Nature,390:364-370(1997)]。已知存在一个编码RNA酶HII同源物的基因(AF0621)(SEQ ID NO:13,http://www.tigr.org/tdb/CMR/btm/htmls/SplashPage.htlm)。
根据AF0621基因(SEQ ID NO:13)的序列,合成引物AfuNde(SEQID NO:14)和AfuBam(SEQ ID NO:15)。
用参比实施例2-(1)中制备的30ng闪烁古生球菌基因组DNA作为模板,用AfuNde和AfuBam各20pmol作为引物,在100μl体积中进行PCR。用Pyrobest DNA聚合酶(Takara Shuzo)作为DNA聚合酶,按照所附的方案进行PCR。如下进行PCR:94℃30秒、55℃30秒和72℃1分钟,进行40个循环。约0.6kb扩增DNA片段用NdeI和BamHI(都得自Takara Shuzo)消化。然后将所得的DNA片段插入到质粒载体pTV119Nd(一种其中pTV119N的NcoI位点被转变为NdeI位点的质粒)的NdeI位点和BamHI位点之间,构建质粒pAFU204。
(3)含RNA酶HII基因的DNA片段的碱基序列的测定
按照双脱氧法,测定在参比实施例2-(2)中获得的插入到pAFU204中的所述DNA片段的碱基序列。
所测定的碱基序列的分析揭示出一个推定编码RNA酶HII的可读框。所述可读框的碱基序列示于SEQ ID NO:16中。从所述碱基序列导出的RNA酶HII的氨基酸序列示于SEQ ID NO:17中。
用质粒pAFU204转化的大肠杆菌JM109被命名和指定为大肠杆菌JM109/pAFU204,并且于2001年2月22日保藏于独立行政法人产业技术综合研究所特许生物寄托中心,AIST Tsukuba Central 6,1-1,Higashi 1-chome,Tsukuba-shi,Ibaraki-ken 305-8566,Japan,保藏号为FERM P-18221以及以保藏号FERM BP-7691保藏于独立行政法人产业技术综合研究所特许生物寄托中心(转至国际保藏机构的日期:2001年8月2日)。
(4)经纯化的RNA酶HII制剂的制备
用参比实施例2-(2)中获得的pAFU204转化大肠杆菌JM109。将所得的带有pAFU204的大肠杆菌JM109接种到含有100μg/ml氨苄青霉素的2L LB培养基中,于37℃振荡培养16小时。培养后,将经离心收集的细胞悬浮于37.1ml超声处理缓冲液[50mM Tris-HCl(pH8.0)、1mM EDTA、2mM苯基甲磺酰氟]中,进行超声处理。将通过超声处理悬浮液以12,000rpm离心10分钟而获得的上清液于70℃加热15分钟。然后再次以12,000rpm离心10分钟,以收集上清液。从而获得40.3ml热处理上清液。
将所述热处理上清液经过用缓冲液A[50mM Tris-HCl(pH 8.0)、1mM EDTA]平衡的RESOURSE Q柱(Amersham Pharmacia Biotech),用FPLC系统(Amersham Pharmacia Biotech)进行色谱分离。结果,RNA酶HII流过RESOURSE Q柱。
所述流通RNA酶HII流分经过用缓冲液A平衡的RESOURSE S柱(Amersham Pharmacia Biotech),用FPLC系统(Amersham PharmaciaBiotech)进行色谱分离。结果,RNA酶HII流过所述RESOURSE S柱。
将40.0ml所述流通RNA酶HII流分用2L含有50mM NaCl的缓冲液B[50mM Tris-HCl(pH 7.0)、1mM EDTA]透析3次,每次透析2小时。将40.2ml透析过的酶溶液经过用含有50mM NaCl的缓冲液B平衡的HiTrap-肝素柱(Amersham Pharmacia Biotech),用FPLC系统,以50-550mM NaCl线性梯度洗脱。结果,获得用约240mM NaCl洗脱出的含RNA酶HII的流分。
用Centricon-10(Amicon),通过超滤浓缩7.8ml所述RNA酶HII流分。将从约600μl所述浓缩液分离出的4个部分分别经过用含有100mM NaCl和0.1mM EDTA的50mM Tris-HCl(pH 7.0)平衡的Superose6凝胶过滤柱(Amersham Pharmacia Biotech),用同一种缓冲液洗脱。结果,RNA酶HII在相当于30.0千道尔顿分子量的位置洗脱出来。这一分子量对应于单体形式的RNA酶HII的分子量。
将如上所述洗脱出的RNA酶HII用作Afu RNA酶HII制剂。
按照参比实施例1-(5)中所述的方法,用如此获得的Afu RNA酶HII制剂测定酶活性。结果,观察到所述Afu RNA酶HII制剂的RNA酶H活性。
如下计算以下实施例中耐热性RNA酶H的单位值。
将1mg poly(rA)或poly(dT)(都得自Amersham Pharmacia Biotech)溶于含有1mM EDTA的1ml 40mM Tris-HCl(pH 7.7)中,制备poly(rA)溶液和poly(dT)溶液。
然后加入poly(rA)溶液(至终浓度为20μg/rml)和poly(dT)溶液(至终浓度为30μg/ml)至含有4mM MgCl2、1mM DTT、0.003%BSA和4%甘油的40mM Tris-HCl(pH 7.7)中。让混合物于37℃反应10分钟,然后冷却至4℃,制备poly(rA)-poly(dT)溶液。加入1μl适当稀释的酶溶液至100μl所述poly(rA)-poly(dT)溶液中。让混合物于40℃反应10分钟。向其中加入10μl 0.5M EDTA,以终止反应。然后测量260nm的吸光度。作为对照,加入10μl 0.5M EDTA至反应混合物中,让所得混合物于40℃反应10分钟,然后测量吸光度。通过从无EDTA时反应物的吸光度中减去对照的吸光度,获得一个数值(吸光度之差)。因此,基于所述吸光度之差,测量由于所述酶促反应从poly(rA)-poly(dT)杂合体中释放的核苷酸的浓度。一个单位的RNA酶H定义为按照以下公式计算、增加相当于在10分钟内释放1nmol核糖核苷酸的A260的酶量:
单位=[吸光度之差×反应体积(ml)/0.0152×(110/100)×稀释率]
实施例1:人c-Ki-ras基因中碱基置换的检测
(1)模板的制备
制备分别具有人c-Ki-ras外显子1中12号密码子的序列GGT(Gly)、CGT(Arg)、TGT(Cys)或AGT(Ser)的DNA片段。简而言之,将使用对应于ras Mutant Set c-Ki-ras 12号密码子(Takara Shuzo)和rasGene Primer Set c-Ki-ras/12(Takara Shuzo)中的上述密码子的模板DNA通过PCR获得的扩增产物,克隆到载体pT7-Blue(Novagen)中。用如此获得的重组质粒作为模板,使用M13引物M4和RV(都得自TakaraShuzo),进行PCR。回收所得的扩增片段,分别命名为模板12G、12R、12C和12S。
(2)碱基置换的检测
基于人c-Ki-ras外显子1的碱基序列,合成了具有SEQ ID NO:7-9的碱基序列、作为正向核苷酸供特异性地检测模板12G用的三种嵌合寡核苷酸。每种嵌合寡核苷酸3’端核苷酸的核糖部分3-位上的羟基用氨基己基修饰。每种所述核苷酸都具有与人c-Ki-ras外显子1的碱基序列互补的序列,其中12号密码子编码Gly。合成了具有SEQ IDNO:6的碱基序列的寡核苷酸作为反义引物,供核酸扩增用。
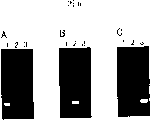
制备含有正向核苷酸和反义引物各50pmol、1μl 0.25%丙二胺水溶液和1pg模板12G、12C、12R和12S之一作为模板的5μl总体积的反应混合物。通过在Thermal Cycler Personal (Takara Shuzo)中于98℃加热2分钟,然后于53℃加热,使正向核苷酸和反义引物退火至所述模板上。向所述热处理混合物中加入20μl含有0.625mM dNTP混合物、40mM Hepes-KOH缓冲液(pH 7.8)、125mM乙酸钾、5mM乙酸镁、0.0125%牛血清白蛋白、1.25%二甲基亚砜、16U在参比实施例1中描述的Pfu RNA酶HII、5.5U BcaBest DNA聚合酶(Takara Shuzo)和无菌水的混合物,使终体积为25μl。让反应混合物于53℃保温1小时。反应后,将每种反应混合物5μl在3.0%琼脂糖凝胶上进行电泳。结果示于图1中。如图1-1、图1-2和图1-3所示,将使用模板12G、12C、12R和12S的反应混合物分别上样至所述琼脂糖凝胶中的第1-4泳道。图1-1、图1-2和图1-3分别显示在反应中使用SEQ ID NO:7、8和9的核苷酸的反应结果。
如图1所示,使用SEQ ID NO:7-9的核苷酸,仅当使用模板12G时才观察到扩增产物,换句话说,当靶核酸的12号密码子编码Gly时才观察到扩增产物。这些结果表明,通过使用本发明的核苷酸,可以鉴别靶核酸中的碱基置换。此外,证明特异性扩增可以通过使用含有肌甘的核苷酸得到改进。
实施例2:c-Ki-ras 12号密码子的其它等位基因的检测
根据实施例1的结果,合成了具有SEQ ID NO:10-12的碱基序列的嵌合寡核苷酸,作为能够特异性地鉴别实施例1-(1)中制备的12R、12C和12S中12号密码子的碱基的核苷酸。SEQ ID NO:10、11和12分别显示对应于其中12号密码子编码Cys、Arg和Ser的等位基因的碱基序列。每种核苷酸3’端核苷酸的核糖部分3-位上的羟基用氨基己基修饰。使用这些核苷酸和SEQ ID NO:6的反义引物,在实施例1-(2)中描述的反应条件下进行反应。反应后,将每种反应混合物5μl在3.0%琼脂糖凝胶上进行电泳。结果示于图2中。如图2-1、图2-2和图2-3所示,将使用模板12G、12C、12R和12S的反应混合物分别上样至所述琼脂糖凝胶中的第1-4泳道。图2-1、图2-2和图2-3分别显示在反应中使用SEQ ID NO:10、11和12的核苷酸的反应结果。
如图2所示,分别仅当结合使用SEQ ID NO:10、11和12的核苷酸和模板12C、12R和12S时才观察到特异性扩增产物。因而,本发明的核苷酸可以精确鉴别目标碱基。此外,证明特异性扩增可以通过使用含有肌甘的寡核苷酸得到改进。
实施例3:基因组DNA的等位基因特异性DNA扩增
在如以上(2)中描述的条件下进行反应。在反应中,使用150ng或30ng人类基因组DNA(Clontech)(对其已经证实c-Ki-ras外显子1中的12号密码子编码Gly(GGT))、SEQ ID NO:7、10、11和12的核苷酸(分别对应于12号密码子的Gly、Cys、Arg和Ser)(在实施例1和实施例2中,已经证明所述核苷酸能够特异性地检测12号密码子的四个等位基因)以及SEQ ID NO:6的反义引物。反应后,将每种反应混合物5μl在3.0%琼脂糖凝胶上进行电泳。结果示于图3中。
如图3-1、图3-2和图3-3所示,将使用SEQ ID NO:7、10、11和12的核苷酸的反应混合物,分别上样至所述琼脂糖凝胶中的第1-4泳道。图3-1和图3-2分别显示在反应中使用150ng和30ng人类基因组DNA的反应结果。
如图3所示,仅当使用SEQ ID NO:7的核苷酸时才观察到DNA片段的扩增,与人类基因组DNA的量无关,而使用其它核苷酸没有观察到DNA片段的扩增。这些结果证明,本发明用于检测碱基置换的方法可以用于检测基因组DNA中的特定等位基因。
实施例4:使用不同RNA酶H的检测
检查在如实施例1中描述的检测碱基置换中使用不同RNA酶H。
具体地说,使用如参比实施例2中描述的Afu RNA酶HII或MjaRNA酶HII取代Pfu RNA酶HII,Mja RNA酶HII得自詹氏甲烷球菌(Methanococcus jannashi),如Structure,8:897-904中所述的方法制备。使用SEQ ID NO:7的核苷酸作为正向核苷酸,用SEQ ID NO:6的寡核苷酸作为反义引物,在如实施例1中描述的条件下进行反应。反应后,将每种反应混合物5μl在3.0%琼脂糖凝胶上进行电泳。结果示于图4中。如图4-1和图4-2所示,将使用模板12G、12C、12R和12S的反应混合物分别上样至所述琼脂糖凝胶中的第1-4泳道。图4-1和图4-2分别显示在反应中使用Afu RNA酶HII和Mja RNA酶HII的反应结果。
如图4所示,使用Afu RNA酶HII和Mja RNA酶HII,仅当使用模板12G时才观察到扩增产物,换句话说,当所述靶核酸的12号密码子编码Gly时才观察到扩增产物。这些结果表明,靶核酸中的碱基置换可以用这些RNA酶H来鉴别。
实施例5:用需要变性步骤的DNA扩增反应系统(PCR)检测SNP
用需要变性步骤的DNA扩增反应系统检查本发明的方法。基于人c-Ki-ras外显子1的碱基序列,合成了SEQ ID NO:25的嵌合寡核苷酸作为有义核苷酸,供特异性地检测模板12G用。所述核苷酸3’端核苷酸的核糖部分3-位上的羟基用氨基己基修饰。也合成了具有SEQ IDNO:18的碱基序列的引物作为反义引物。制备含有所述合成核苷酸和引物(有义核苷酸和反义引物)各50pmol、2.5μl Ex Taq缓冲液(TakaraShuzo)、2μl 2.5mM dNTP混合物、50U Afu RNA酶HII和0.625U ExTaq DNA聚合酶(Takara Shuzo)的24μl总体积的反应混合物。向反应混合物中加入实施例1中制备的1μl 10ng/μl模板12G、12C、12R或12S的溶液。采用Thermal Cycler(Takara Shuzo),如下进行PCR:94℃5秒、59℃2分钟和72℃5秒,进行25个或30个循环。在反应后,采用Agilent 2100 Bioanalyzer(Hewlett-Packard),分析1μl每种反应混合物。结果示于图5中。图5是一幅曲线图,图示说明相应模板的目标扩增产物的量。纵轴代表目标扩增产物的量,横轴代表PCR循环数。如图5所示,仅当使用等位基因与检测用引物相符的模板12G时才观察到目标DNA的特异性扩增。因而,证明本发明的方法对于需要使作为模板的核酸变性的步骤的DNA扩增反应系统而言也是有效的。
实施例6:K-ras 61号密码子的等位基因特异性检测
检查另一碱基置换的检测。具体地说,将分别具有使用SEQ IDNO:19和20的DNA引物通过PCR扩增的人c-Ki-ras外显子2中61号密码子的序列CAA(Glu)、AAA(Lys)或GAA(Gln)的DNA片段克隆到载体pT7-Blue中。按照常规方法纯化克隆了DNA片段的载体,分别命名为61Q、61K和61E。根据实施例1-(2)的结果,基于人c-Ki-ras外显子2的碱基序列,合成了SEQ ID NO:21、22和23的嵌合寡核苷酸,作为供特异性地检测相应载体61Q、61K和61E用的核苷酸。每种核苷酸3’端核苷酸的核糖部分3-位上的羟基都用氨基己基修饰。用所述核苷酸作为有义引物,用SEQ ID NO:24的引物作为反义引物,进行以下的反应。制备含有所述合成寡核苷酸引物(有义引物和反义引物)各50pmol、1μl 0.05%丙二胺水溶液和10pg模板DNA 61Q、61K和61E之一的5μl总体积的反应混合物。通过在Thermal Cycler Personal(Takara Shuzo)中于98℃加热2分钟,然后于53℃加热,使所述引物退火至所述模板上。向所述热处理混合物中加入20μl含有0.625mMdNTP混合物、40mM Hepes-KOH缓冲液(pH 7.8)、125mM乙酸钾、5mM乙酸镁、0.0125%牛血清白蛋白、1.25%二甲基亚砜、11U Afu RNA酶HII(Takara Shuzo)、5.5U BcaBest DNA聚合酶(Takara Shuzo)和无菌水的混合物,使终体积为25μl。让反应混合物于58℃保温1小时。反应后,将每种反应混合物5μl在3.0%琼脂糖凝胶上进行电泳。结果示于图6中。图6A是一幅电泳谱图,代表用SEQ ID NO:21的检测61Q用引物进行检测的结果。第1、2和3泳道分别代表用模板61Q、61K和61E作为模板获得的结果。图6B是一幅电泳谱图,代表用SEQ IDNO:22的检测61K用引物进行检测的结果。第1、2和3泳道分别代表使用模板61Q、61K和61E获得的结果。图6C是一幅电泳谱图,代表用SEQ ID NO:23的引物检测61E的检测结果。第1、2和3泳道分别代表用模板61Q、61K和61E获得的结果。
如图6A、图6B和图6C所示,证明使用SEQ ID NO:21、22和23,以等位基因特异性方式,通过ICAN反应获得目标DNA扩增产物。因而,证明本发明的方法当改变目的碱基置换时也是有效的。
实施例7:CYP2C19(636)的等位基因特异性检测
(1)检查区分基因纯合型和杂合型的检测方法。选择人CYP2C19中第636号碱基的等位基因作为研究对象。首先,将使用SEQ ID NO:26和27的DNA引物通过PCR扩增的、人CYP2C19中第636号碱基为G或A的DNA片段克隆到载体pT7-Blue中。按照常规方法纯化克隆这些DNA片段的质粒,命名为636G和636A。
用质粒636G和636A以及通过将质粒636G和636A以1∶1混合而制备的质粒636G/A作为模板。质粒636G和636A用作基因纯合型的模型,而质粒636G/A用作基因杂合型的模型。接着,合成了SEQ IDNO:28和29的核苷酸,分别作为供特异性地检测636G和636A用的核苷酸。用所述核苷酸作为有义引物,用SEQ ID NO:30的引物作为反义引物,进行以下的反应。制备含有所述合成寡核苷酸引物(有义引物和反义引物)各50pmol、1μl 0.05%丙二胺水溶液和1pg质粒636G、636A和636G/A之一作为模板DNA的5μl总体积的反应混合物。通过在Thermal Cycler Personal(Takara Shuzo)中于98℃加热2分钟,然后于53℃加热,使所述引物退火至所述模板上。向所述热处理混合物中加入20μl含有0.625mM dNTP混合物、40mM Hepes-KOH缓冲液(pH 7.8)、125mM乙酸钾、5mM乙酸镁、0.0125%牛血清白蛋白、1.25%二甲基亚砜、11U Afu RNA酶HII、5.5U BcaBest DNA聚合酶和无菌水的混合物,使终体积为25μl。让反应混合物于53℃保温1小时。反应后,将每种反应混合物5μl在3.0%琼脂糖凝胶上进行电泳。结果示于图7A和7B中。图7A是一幅电泳谱图,代表使用核苷酸636G进行检测的结果。第1、2和3泳道分别代表用质粒636G、636A和636G/A作为模板获得的结果。
图7B是一幅电泳谱图,代表使用核苷酸636A进行检测的结果。第1、2和3泳道分别代表用质粒636G、636A和636G/A作为模板获得的结果。如图7A和图7B所示,证明可以使用所述核苷酸以等位基因特异性方式进行检测。
(2)在与PCR-RFLP进行比较时用人类基因组DNA作为模板以进行分析。用150ng人类基因组DNA(Clontech)作为模板,如以上(1)中所述的方法进行SNP分型。结果示于图7C中。图7C是一幅电泳谱图,代表人类基因组DNA SNP分型的结果。第1和2泳道分别代表使用核苷酸636G和636A获得的结果。
如图7C所示,仅当使用核苷酸636G时才检测到扩增的目标DNA。所述基因组DNA的CYP2C19中第636号碱基的等位基因被确定是纯合型(636G/G)。
另一方面,使用人类基因组DNA,通过PCR-RFLP进行分型。使用150ng所述基因组DNA以及SEQ ID NO:26和27的引物进行PCR。所得PCR扩增产物用BamHI处理,将反应混合物在3.0%琼脂糖凝胶上进行电泳。结果示于图7D中。图7D是一幅电泳谱图,代表用人类基因组DNA作为模板通过PCR-RFLP分型的结果。第1和2泳道分别代表PCR扩增产物和用BamHI消化的PCR扩增产物的结果。
如图7D所示,PCR扩增产物被BamHI完全消化。因而,所述基因组DNA的CYP2C19中第636号碱基的等位基因,根据PCR-RFLP也被确定是纯合型(636G/G)。证明采用本发明用于检测碱基置换的方法获得的结果,与采用常规的通过PCR-RFLP进行SNP分型获得的结果相一致。
(3)使用以上(1)中制备的质粒636G、636A和636G/A,检查假定同源染色体基因型的检测方法。如下进行反应。首先,合成了在5’末端上连接了可相互鉴别的荧光标记Rox(ABI)和Fam(ABI)的核苷酸636G和636A。使用含有等量的所述荧光标记核苷酸的混合物。如以上(1)中所述的方法进行检测。反应后,将每种反应混合物的一部分在3.0%琼脂糖凝胶上进行电泳,使扩增产物和未反应的荧光标记核苷酸完全分离。电泳后,用FM-BIO II Multi-View(Takara Shuzo)对所述琼脂糖凝胶进行分析。结果,当用质粒636G作为模板时,仅观察到来自荧光标记Rox的荧光信号。当用质粒636A作为模板时,仅观察到来自荧光标记Fam的荧光信号。此外,当用质粒636G/A作为模板时,观察到来自Rox和Fam两者的荧光信号。根据这些结果,证明本发明的方法可用作可以用来分析同源染色体上基因型(纯合型或杂合型)的方法。
实施例8:用从全血提取的基因组DNA进行分型
在征得同意后从健康个体收集的全血样品1-6号各200μl,用Dr.GenTLETM(Takara Shuzo)制备基因组DNA。用160ng所制备的基因组DNA作为模板以及用SEQ ID NO:28和29的核苷酸作为引物,如实施例7-(1)中所述的方法进行SNP分型,以特异性地检测等位基因636G和636A。结果示于图8A-F中。图8A-F是电泳谱图,代表使用从血样1-6号中提取的基因组DNA作为模板如实施例7-(1)中所述的方法进行分型的结果。第1和2泳道分别代表用SEQ ID NO:28的核苷酸(用于检测636G)和SEQ ID NO:29的核苷酸(用于检测636G)获得的结果。基于如图8A-F所示的扩增产物的谱图,对于CYP2C19中第636号碱基而言,相应血样的等位基因分型如下(1:G/A,2:G/G,3:G/A,4:G/G,5:G/G,6:G/G)。另一方面,用同一基因组DNA作为模板,如实施例7-(2)中所述的方法通过PCR-RFLP进行分型。结果示于图8G中。图8G是一幅电泳谱图,代表使用从血样1-6号中制备的基因组DNA作为模板通过PCR-RFLP进行分型的结果。第1-6泳道分别代表用从血样1-6号中提取的基因组DNA作为模板获得的结果。图8G显示用相应的人血样制备的DNA作为模板获得的PCR扩增产物的切割谱图,基于如图8G所示的电泳结果,CYP2C19中第636号碱基的等位基因分型如下(1:G/A,2:G/G,3:G/A,4:G/G,5:G/G,6:G/G),所述结果与上述结果相一致。
如上所述,证明本发明的方法当使用实际临床试样时也是有效的。
工业应用性
如上所述,本发明的核苷酸和使用所述核苷酸检测碱基置换的方法可用于检测天然存在的或人工引入的碱基置换。
按照本发明,可以便捷而可再现地检测靶核酸中碱基置换的存在。本发明的方法可以容易地与已知的核酸扩增法结合使用,并且可以用来高灵敏度地检测碱基置换。此外,通过结合使用具有合适序列的核苷酸,有可能获得有关存在碱基置换的信息,并且同时获得有关被置换碱基类型的信息。
本发明可用来检测或鉴定生物体基因组DNA中所产生的碱基置换(例如SNP),例如多态性或变异。因而,本发明可用于基因组药物开发领域和基因组医学领域,以搜索人类的疾病基因,分析药物抗性等。
序列表的独立文本
SEQ ID NO:1:编码得自Pyrococcus horikoshii、具有RNA酶HII活性的多肽的基因。
SEQ ID NO:2:PCR引物1650Nde,用于从激烈热球菌克隆编码具有RNA酶HII活性的多肽的基因。
SEQ ID NO:3:PCR引物1650Bam,用于从激烈热球菌克隆编码具有RNA酶HII活性的多肽的基因。
SEQ ID NO:6:嵌合寡核苷酸引物,用于扩增人c-Ki-ras基因的一部分的DNA。“核苷酸18-20为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸”
SEQ ID NO:7:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:8:嵌合寡核苷酸引物前体,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸12-15为核糖核苷酸,核苷酸17为肌苷,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:9:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸14和15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:10:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:11:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:12:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,核苷酸17为肌苷,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:13:得自闪烁古生球菌的AF0621基因的碱基序列。
SEQ ID NO:14:PCR引物AfuNde,用于从闪烁古生球菌克隆编码具有RNA酶HII活性的多肽的基因。
SEQ ID NO:15:PCR引物AfuBam,用于从闪烁古生球菌克隆编码具有RNA酶HII活性的多肽的基因。
SEQ ID NO:16:得自闪烁古生球菌的RNA酶HII中ORF的碱基序列。
SEQ ID NO:17:得自闪烁古生球菌的RNA酶HII的氨基酸序列。
SEQ ID NO:18:设计的PCR引物,用于扩增c-Ki-ras癌基因外显子1的一部分。
SEQ ID NO:19:设计的PCR引物,用于扩增人c-Ki-ras癌基因外显子2的一部分。
SEQ ID NO:20:设计的PCR引物,用于扩增人c-Ki-ras癌基因外显子2的一部分。
SEQ ID NO:21:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:22:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:23:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:24:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸17-19为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸”
SEQ ID NO:25:嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸16-18为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:26:设计的PCR引物,用于扩增人CYP2C19基因的一部分。
SEQ ID NO:27:设计的PCR引物,用于扩增人CYP2C19基因的一部分。
SEQ ID NO:28:嵌合寡核苷酸,用于检测人CYP2C19基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:29:嵌合寡核苷酸,用于检测人CYP2C19基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
SEQ ID NO:30:嵌合寡核苷酸引物,用于扩增人CYP2C19基因上的一部分。“核苷酸19-21为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸”
序列表
<110>宝酒造株式会社(Takara Shuzo Co.,Ltd.)
<120>核苷酸取代的检测方法
<130>663051
<150>JP 2001-39268
<151>2001-02-15
<150>JP 2001-40721
<151>2001-02-16
<150>JP 2001-101055
<151>2001-03-30
<150>JP 2001-177381
<151>2001-06-12
<150>JP 2001-290384
<151>2001-09-25
<150>JP 2001-338440
<151>2001-11-02
<150>JP 2001-368929
<151>2001-12-03
<160>30
<210>1
<211>663
<212>DNA
<213>Pyrococcus horikoshii
<400>1
atgaaggttg ctggagttga tgaagcgggg agggggccgg taattggccc gttagtaatt 60
ggagtagccg ttatagatga gaaaaatatt gagaggttac gtgacattgg ggttaaagac 120
tccaaacaat taactcctgg gcaacgtgaa aaactattta gcaaattaat agatatccta 180
gacgattatt atgttcttct cgttaccccc aaggaaatag atgagaggca tcattctatg 240
aatgaactag aagctgagaa attcgttgta gccttgaatt ctttaaggat caagccgcag 300
aagatatatg tggactctgc cgatgtagat cctaagaggt ttgctagtct aataaaggct 360
gggttgaaat atgaagccac ggttatcgcc gagcataaag ccgatgcaaa gtatgagata 420
gtatcggcag catcaataat tgcaaaggtc actagggata gagagataga gaagctaaag 480
caaaagtatg gggaatttgg ttctggctat ccgagtgatc cgagaactaa ggagtggctt 540
gaagaatatt acaaacaata tggtgacttt cctccaatag ttaggagaac ttgggaaacc 600
gctaggaaga tagaggaaag gtttagaaaa aatcagctaa cgcttgataa attccttaag 660
tga
663
<210>2
<211>33
<212>DNA
<213>人工序列
<220>
<223>PCR引物1650Nde,用于从激烈热球菌(Pyrococcus furiosus)克隆编码具有RNA酶HII活性的多肽的基因
<400>2
caggaggaga gacatatgaa aataggggga att 33
<210>3
<211>33
<212>DNA
<213>人工序列
<220>
<223>PCR引物1650Bam,用于从激烈热球菌(Pyrococcus furiosus)克隆编码具有RNA酶HII活性的多肽的基因
<400>3
gaaggttgtg gatccacttt ctaaggtttc tta 33
<210>4
<211>672
<212>DNA
<213>激烈热球菌(Pyrococcus furiosus)
<400>4
atgaaaatag ggggaattga cgaagcagga agaggaccag cgatagggcc attagtagta 60
gctactgtcg tcgttgatga gaaaaacatt gagaagctca gaaacattgg agtaaaagac 120
tccaaacaac taacacccca tgaaaggaag aatttatttt cccagataac ctcaatagcg 180
gatgattaca aaatagtgat agtatcccca gaagaaatcg acaatagatc aggaacaatg 240
aacgagttag aggtagagaa gtttgctctc gccttaaatt cgcttcagat aaaaccagct 300
cttatatacg ctgatgcagc ggatgtagat gccaatagat ttgcaagctt gatagagaga 360
agactcaatt ataaggcgaa gattattgcc gaacacaagg ccgatgcaaa gtatccagta 420
gtttcagcag cttcaatact tgcaaaggtt gttagggatg aggaaattga aaaattaaaa 480
aagcaatatg gagactttgg ctctgggtat ccaagtgatc caaaaaccaa gaaatggctt 540
gaagagtact acaaaaaaca caactctttc cctccaatag tcagacgaac ctgggaaact 600
gtaagaaaaa tagaggaaag cattaaagcc aaaaaatccc agctaacgct tgataaattc 660
tttaagaaac ct 672
<210>5
<211>224
<212>PRT
<213>激烈热球菌(Pyrococcus furiosus)
<400>5
Met Lys Ile Gly Gly Ile Asp Glu Ala Gly Arg Gly Pro Ala Ile
1 5 10 15
Gly Pro Leu Val Val Ala Thr Val Val Val Asp Glu Lys Asn Ile
20 25 30
Glu Lys Leu Arg Asn Ile Gly Val Lys Asp Ser Lys Gln Leu Thr
35 40 45
Pro His Glu Arg Lys Asn Leu Phe Ser Gln Ile Thr Ser Ile Ala
50 55 60
Asp Asp Tyr Lys Ile Val Ile Val Ser Pro Glu Glu Ile Asp Asn
65 70 75
Arg Ser Gly Thr Met Asn Glu Leu Glu Val Glu Lys Phe Ala Leu
80 85 90
Ala Leu Asn Ser Leu Gln Ile Lys Pro Ala Leu Ile Tyr Ala Asp
95 100 105
Ala Ala Asp Val Asp Ala Asn Arg Phe Ala Ser Leu Ile Glu Arg
110 115 120
Arg Leu Asn Tyr Lys Ala Lys Ile Ile Ala Glu His Lys Ala Asp
125 130 135
Ala Lys Tyr Pro Val Val Ser Ala Ala Ser Ile Leu Ala Lys Val
140 145 150
Val Arg Asp Glu Glu Ile Glu Lys Leu Lys Lys Gln Tyr Gly Asp
155 160 165
Phe Gly Ser Gly Tyr Pro Ser Asp Pro Lys Thr Lys Lys Trp Leu
170 175 180
Glu Glu Tyr Tyr Lys Lys His Asn Ser Phe Pro Pro Ile Val Arg
185 190 195
Arg Thr Trp Glu Thr Val Arg Lys Ile Glu Glu Ser Ile Lys Ala
200 205 210
Lys Lys Ser Gln Leu Thr Leu Asp Lys Phe Phe Lys Lys Pro
215 220
<210>6
<211>20
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸引物,用于扩增人c-Ki-ras基因的一部分的DNA。“核苷酸18-20为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸”
<400>6
ctattgttgg atcatatucg 20
<210>7
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-
15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>7
tggtagttgg agcuggtg 18
<210>8
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸12-15为核糖核苷酸,核苷酸17为肌苷,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>8
tggtagttgg agcuggng 18
<210>9
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸14和15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>9
tggtagttgg agcuggtg 18
<210>10
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>10
tggtagttgg agcuugtg 18
<210>11
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>11
tggtagttgg agcucgtg 18
<210>12
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,核苷酸17为肌苷,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>12
tggtagttgg agcuagng 18
<210>13
<211>626
<212>DNA
<213>闪烁古生球菌(Archaeoglobus fulgidus)
<400>13
atgaaggcag gcatcgatga ggctggaaag ggctgcgtca tcggcccact ggttgttgca 60
ggagtggctt gcagcgatga ggataggctg agaaagcttg gtgtgaaaga ctccaaaaag 120
ctaagtcagg ggaggagaga ggaactagcc gaggaaataa ggaaaatctg cagaacggag 180
gttttgaaag tttctcccga aaatctcgac gaaaggatgg ctgctaaaac cataaacgag 240
attttgaagg agtgctacgc tgaaataatt ctcaggctga agccggaaat tgcttatgtt 300
gacagtcctg atgtgattcc cgagagactt tcgagggagc ttgaggagat tacggggttg 360
agagttgtgg ccgagcacaa ggcggacgag aagtatcccc tggtagctgc ggcttcaatc 420
atcgcaaagg tggaaaggga gcgggagatt gagaggctga aagaaaaatt cggggatttc 480
ggcagcggct atgcgagcga tccgaggaca agagaagtgc tgaaggagtg gatagcttca 540
ggcagaattc cgagctgcgt gagaatgcgc tggaagacgg tgtcaaatct gaggcagaag 600
acgcttgacg atttctaaac gaaacc 626
<210>14
<211>30
<212>DNA
<213>人工序列
<220>
<223>PCR引物AfuNde,用于从闪烁古生球菌(Archaeoglobus fulgidus)克隆编码具有RNA酶HII活性的多肽的基因
<400>14
aagctgggtt tcatatgaag gcaggcatcg 30
<210>15
<211>30
<212>DNA
<213>人工序列
<220>
<223>PCR引物AfuBam,用于从闪烁古生球菌(Archaeoglobus fulgidus)克隆编码具有RNA酶HII活性的多肽的基因
<400>15
tggtaataac ggatccgttt agaaatcgtc 30
<210>16
<211>638
<212>DNA
<213>闪烁古生球菌(Archaeoglobus fulgidus)
<400>16
catatgaagg caggcatcga tgaggctgga aagggctgcg tcatcggccc actggttgtt 60
gcaggagtgg cttgcagcga tgaggatagg ctgagaaagc ttggtgtgaa agactccaaa 120
aagctaagtc aggggaggag agaggaacta gccgaggaaa taaggaaaat ctgcagaacg 180
gaggttttga aagtttctcc cgaaaatctc gacgaaagga tggctgctaa aaccataaac 240
gagattttga aggagtgcta cgctgaaata attctcaggc tgaagccgga aattgcttat 300
gttgacagtc ctgatgtgat tcccgagaga ctttcgaggg agcttgagga gattacgggg 360
ttgagagttg tggccgagca caaggcggac gagaagtatc ccctggtagc tgcggcttca 420
atcatcgcaa aggtggaaag ggagcgggag attgagaggc tgaaagaaaa attcggggat 480
ttcggcagcg gctatgcgag cgatccgagg acaagagaag tgctgaagga gtggatagct 540
tcaggcagaa ttccgagctg cgtgagaatg cgctggaaga cggtgtcaaa tctgaggcag 600
aagacgcttg acgatttcta aacggatccc cgggtacc 638
<210>17
<211>205
<212>PRT
<213>闪烁古生球菌(Archaeoglobus fulgidus)
<400>17
Met Lys Ala Gly Ile Asp Glu Ala Gly Lys Gly Cys Val Ile Gly
1 5 10 15
Pro Leu Val Val Ala Gly Val Ala Cys Ser Asp Glu Asp Arg Leu
20 25 30
Arg Lys Leu Gly Val Lys Asp Ser Lys Lys Leu Ser Gln Gly Arg
35 40 45
Arg Glu Glu Leu Ala Glu Glu Ile Arg Lys Ile Cys Arg Thr Glu
50 55 60
Val Leu Lys Val Ser Pro Glu Asn Leu Asp Glu Arg Met Ala Ala
65 70 75
Lys Thr Ile Asn Glu Ile Leu Lys Glu Cys Tyr Ala Glu Ile Ile
80 85 90
Leu Arg Leu Lys Pro Glu Ile Ala Tyr Val Asp Ser Pro Asp Val
95 100 105
Ile Pro Glu Arg Leu Ser Arg Glu Leu Glu Glu Ile Thr Gly Leu
110 115 120
Arg Val Val Ala Glu His Lys Ala Asp Glu Lys Tyr Pro Leu Val
125 130 135
Ala Ala Ala Ser Ile Ile Ala Lys Val Glu Arg Glu Arg Glu Ile
140 145 150
Glu Arg Leu Lys Glu Lys Phe Gly Asp Phe Gly Ser Gly Tyr Ala
155 160 165
Ser Asp Pro Arg Thr Arg Glu Val Leu Lys Glu Trp Ile Ala Ser
170 175 180
Gly Arg Ile Pro Ser Cys Val Arg Met Arg Trp Lys Thr Val Ser
185 190 195
Asn Leu Arg Gln Lys Thr Leu Asp Asp Phe
200 205
<210>18
<211>20
<212>DNA
<213>人工序列
<220>
<223>设计的PCR引物,用于扩增c-ki-ras癌基因外显子1的一部分
<400>18
ctattgttgg atcatattcg 20
<210>19
<211>19
<212>DNA
<213>人工序列
<220>
<223>设计的PCR引物,用于扩增人c-ki-ras癌基因外显子2的一部分
<400>19
ttcctacgga agcaagtag 19
<210>20
<211>20
<212>DNA
<213>人工序列
<220>
<223>设计的PCR引物,用于扩增人c-ki-ras癌基因外显子2的一部分
<400>20
cacaaagaaa gccctcccca 20
<210>21
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>21
tcgacacagc aggucaag 18
<210>22
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>22
tcgacacagc agguaaag 18
<210>23
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>23
tcgacacagc aggugaag 18
<210>24
<211>19
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸17-19为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸”
<400>24
acaaagaaag ccctcccca 19
<210>25
<211>21
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人c-Ki-ras基因上的核苷酸取代。“核苷酸16-18为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>25
ttgtggtagt tggagcuggt g 21
<210>26
<211>22
<212>DNA
<213>人工序列
<220>
<223>设计的PCR引物,用于扩增人CYP2C19基因的一部分
<400>26
tattatctgt taactaatat ga 22
<210>27
<211>20
<212>DNA
<213>人工序列
<220>
<223>设计的PCR引物,用于扩增人CYP2C19基因的一部分
<400>27
acttcagggc ttggtcaata 20
<210>28
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人CYP2C19基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>28
gtaagcaccc ccuggatc 18
<210>29
<211>18
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸,用于检测人CYP2C19基因上的核苷酸取代。“核苷酸13-15为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸,并且3’端核苷酸的3’-OH基团用氨基己基保护”
<400>29
gtaagcaccc ccugaatc 18
<210>30
<211>21
<212>DNA
<213>人工序列
<220>
<223>嵌合寡核苷酸引物,用于扩增人CYP2C19基因的一部分。“核苷酸19-21为核糖核苷酸,而其它核苷酸为脱氧核糖核苷酸”
<400>30
ttggtcaata tagaatttug g 21
Claims (9)
1.一种用于检测靶核酸中特定碱基上存在碱基置换的方法,所述方法包括:
(1)将含有靶核酸的样品与一种核苷酸和引物混合,以使所述核苷酸和引物退火至靶核酸上,其中所述核苷酸
(A)在3’末端被修饰,致使不发生由DNA聚合酶从所述末端开始的延伸;
(B)具有能够退火至所述靶核酸中含有特定碱基的区上的碱基序列;和
(C)含有这样的序列:其中如果在由所述核苷酸和所述靶核酸构成的复合物中在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间有错配,则所述核苷酸不被核酸酶切割,而如果在所述特定碱基与所述核苷酸中对应于所述特定碱基的碱基之间没有错配,则所述核苷酸被核酸酶切割,产生一个新的3’末端;
(2)用所述核酸酶和所述DNA聚合酶处理所述混合物,以从通过核酸酶切割所述核苷酸产生的新的3’末端,在DNA聚合酶的作用下产生一种延伸产物,并使用作为模板的所述延伸产物、切割的核苷酸和所述引物扩增核酸;且
(3)检测扩增产物是否存在。
2.权利要求1的方法,其中所述核酸酶是一种核糖核酸酶H,并且所述核苷酸在含有对应于所述特定碱基的碱基的区中含有核糖核苷酸。
3.权利要求1的方法,其中所述核酸酶是一种限制性酶,并且所述核苷酸在含有对应于所述特定碱基的碱基的区中含有所述限制性酶的识别序列。
4.权利要求1的方法,其中所述核苷酸具有这样的序列:其中如果在所述靶核酸中没有碱基置换,则在由所述核苷酸和所述靶核酸构成的复合物中不产生错配。
5.权利要求1的方法,其中所述核苷酸具有这样的序列:其中如果在所述靶核酸中有碱基置换,则在由所述核苷酸和所述靶核酸构成的复合物中不产生错配。
6.权利要求1的方法,其中所述核苷酸在3’末端的修饰是修饰核糖3-位上的羟基。
7.权利要求1的方法,其中所述核苷酸含有核苷酸类似物和/或经修饰的核苷酸。
8.权利要求7的方法,其中所述核苷酸类似物是脱氧核糖肌苷核苷酸或脱氧核糖尿嘧啶核苷酸,而所述经修饰的核糖核苷酸是(α-S)核糖核苷酸。
9.一种用于分析等位基因的基因型的方法,所述方法包括按照权利要求1所限定的方法来检测靶核酸中特定碱基上碱基置换的存在。
Applications Claiming Priority (14)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2001039268 | 2001-02-15 | ||
| JP39268/2001 | 2001-02-15 | ||
| JP40721/2001 | 2001-02-16 | ||
| JP2001040721 | 2001-02-16 | ||
| JP101055/2001 | 2001-03-30 | ||
| JP2001101055 | 2001-03-30 | ||
| JP177381/2001 | 2001-06-12 | ||
| JP2001177381 | 2001-06-12 | ||
| JP2001290384 | 2001-09-25 | ||
| JP290384/2001 | 2001-09-25 | ||
| JP2001338440 | 2001-11-02 | ||
| JP338440/2001 | 2001-11-02 | ||
| JP2001368929 | 2001-12-03 | ||
| JP368929/2001 | 2001-12-03 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1524127A CN1524127A (zh) | 2004-08-25 |
| CN100351393C true CN100351393C (zh) | 2007-11-28 |
Family
ID=27567022
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB028079310A Expired - Fee Related CN100351393C (zh) | 2001-02-15 | 2002-02-14 | 核苷酸多态性的检测方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US7135291B2 (zh) |
| EP (1) | EP1367136A4 (zh) |
| JP (3) | JP3681729B2 (zh) |
| KR (1) | KR100809949B1 (zh) |
| CN (1) | CN100351393C (zh) |
| AU (1) | AU2002232177B2 (zh) |
| CA (1) | CA2438574C (zh) |
| EA (1) | EA005141B1 (zh) |
| WO (1) | WO2002064833A1 (zh) |
Families Citing this family (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW200404889A (en) * | 2002-05-31 | 2004-04-01 | Takara Bio Inc | Method of typing gene polymorphisms |
| ATE557105T1 (de) * | 2005-06-23 | 2012-05-15 | Keygene Nv | Strategien für eine hohe durchsatzidentifikation und erkennung von polymorphismen |
| US8911948B2 (en) | 2008-04-30 | 2014-12-16 | Integrated Dna Technologies, Inc. | RNase H-based assays utilizing modified RNA monomers |
| US20090325169A1 (en) | 2008-04-30 | 2009-12-31 | Integrated Dna Technologies, Inc. | Rnase h-based assays utilizing modified rna monomers |
| US10227641B2 (en) | 2008-04-30 | 2019-03-12 | Integrated Dna Technologies, Inc. | RNase H-based assays utilizing modified RNA monomers |
| US10760074B2 (en) * | 2008-09-03 | 2020-09-01 | Takara Bio Inc. | Composition for detection of RNA |
| ES2527653T3 (es) * | 2008-10-20 | 2015-01-28 | F. Hoffmann-La Roche Ag | Amplificación específica de alelo usando un cebador con un nucleótido modificado |
| US20110117559A1 (en) * | 2009-11-13 | 2011-05-19 | Integrated Dna Technologies, Inc. | Small rna detection assays |
| US9238832B2 (en) | 2009-12-11 | 2016-01-19 | Roche Molecular Systems, Inc. | Allele-specific amplification of nucleic acids |
| US8614071B2 (en) | 2009-12-11 | 2013-12-24 | Roche Molecular Systems, Inc. | Preferential amplification of mRNA over DNA using chemically modified primers |
| WO2012135053A2 (en) | 2011-03-25 | 2012-10-04 | Integrated Dna Technologies, Inc. | Rnase h-based assays utilizing modified rna monomers |
| CA2881200A1 (en) | 2012-02-14 | 2013-08-22 | Great Basin Scientific | Methods of isothermal amplification using blocked primers |
| JP6009649B2 (ja) | 2013-03-14 | 2016-10-19 | タカラバイオ株式会社 | 耐熱性のミスマッチエンドヌクレアーゼの利用方法 |
| EP2971072A1 (en) * | 2013-03-15 | 2016-01-20 | Integrated DNA Technologies Inc. | Rnase h-based assays utilizing modified rna monomers |
| CA2930595C (en) | 2013-11-14 | 2023-09-19 | Integrated Dna Technologies, Inc. | Dna polymerase mutants having enhanced template discrimination activity |
| AU2015277059B2 (en) | 2014-06-18 | 2021-06-17 | Clear Gene, Inc. | Methods, compositions, and devices for rapid analysis of biological markers |
| JP6550649B2 (ja) | 2014-09-11 | 2019-07-31 | タカラバイオ株式会社 | 耐熱性のミスマッチエンドヌクレアーゼの利用方法 |
| US9909169B2 (en) | 2014-12-17 | 2018-03-06 | Roche Molecular Systems, Inc. | Allele-specific amplification of nucleic acids using blocking oligonucleotides for wild type suppression |
| CN107614681A (zh) * | 2015-03-20 | 2018-01-19 | 宝生物工程株式会社 | 用于检测靶核酸的高灵敏度方法 |
| WO2017106790A1 (en) | 2015-12-18 | 2017-06-22 | Clear Gene, Inc. | Methods, compositions, kits and devices for rapid analysis of biological markers |
| CN108148895A (zh) * | 2017-12-29 | 2018-06-12 | 星阵(广州)基因科技有限公司 | 用于检测突变的人akt1基因的引物、试剂盒及方法 |
| CN113215163B (zh) * | 2021-05-12 | 2023-05-12 | 苏州海苗生物科技有限公司 | 一种特异性扩增目的基因的分子锁及应用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1992002638A1 (en) * | 1990-08-06 | 1992-02-20 | F. Hoffmann-La Roche Ag | Homogeneous assay system |
| EP0705905A2 (de) * | 1994-07-16 | 1996-04-10 | Roche Diagnostics GmbH | Verfahren zum sensitiven Nachweis von Nukleinsäuren |
| US5660988A (en) * | 1993-11-17 | 1997-08-26 | Id Biomedical Corporation | Cycling probe cleavage detection of nucleic acid sequences |
| JP2001136965A (ja) * | 1999-11-12 | 2001-05-22 | Takara Shuzo Co Ltd | 核酸配列の増幅方法 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4521509A (en) * | 1982-11-24 | 1985-06-04 | Research Corporation | Method for degrading DNA |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4876187A (en) | 1985-12-05 | 1989-10-24 | Meiogenics, Inc. | Nucleic acid compositions with scissile linkage useful for detecting nucleic acid sequences |
| US5011769A (en) | 1985-12-05 | 1991-04-30 | Meiogenics U.S. Limited Partnership | Methods for detecting nucleic acid sequences |
| US4800159A (en) | 1986-02-07 | 1989-01-24 | Cetus Corporation | Process for amplifying, detecting, and/or cloning nucleic acid sequences |
| CA1340807C (en) | 1988-02-24 | 1999-11-02 | Lawrence T. Malek | Nucleic acid amplification process |
| JP2650159B2 (ja) | 1988-02-24 | 1997-09-03 | アクゾ・ノベル・エヌ・ベー | 核酸増幅方法 |
| US5639611A (en) * | 1988-12-12 | 1997-06-17 | City Of Hope | Allele specific polymerase chain reaction |
| US5137806A (en) * | 1989-12-11 | 1992-08-11 | Board Of Regents, The University Of Texas System | Methods and compositions for the detection of sequences in selected DNA molecules |
| US5455166A (en) | 1991-01-31 | 1995-10-03 | Becton, Dickinson And Company | Strand displacement amplification |
| US5846717A (en) | 1996-01-24 | 1998-12-08 | Third Wave Technologies, Inc. | Detection of nucleic acid sequences by invader-directed cleavage |
| EP1634890B1 (en) * | 1996-01-24 | 2008-11-19 | Third Wave Technologies, Inc. | Invasive cleavage of nucleic acids |
| NL1002427C2 (nl) * | 1996-02-23 | 1997-08-26 | Akzo Nobel Nv | Bekledingssamenstelling omvattende een bicyclo- of spiroorthoester functionele verbinding. |
| US5808108A (en) * | 1997-01-15 | 1998-09-15 | Chappelow; Cecil C. | Polymeric compositions and composites prepared from spiroorthocarbonates and epoxy monomers |
| DE19733619C1 (de) | 1997-08-04 | 2000-02-24 | Markus Schuermann | CASE-PCR, ein hochselektives Verfahren zum Nachweis von Onkogenmutationen und Allelvarianten |
| WO2000056877A1 (fr) * | 1999-03-19 | 2000-09-28 | Takara Shuzo Co., Ltd. | Procede d'amplification d'une sequence d'acide nucleique |
| GB9915200D0 (en) * | 1999-06-29 | 1999-09-01 | Janssen Pharmaceutica Nv | Neurotrophic factor receptor |
| JP2003504018A (ja) | 1999-07-02 | 2003-02-04 | インビトロゲン・コーポレーション | 核酸合成の感度および特異性の増大のための組成物および方法 |
| GB9918150D0 (en) | 1999-08-03 | 1999-10-06 | Univ Sheffield | Nuclease variant |
| US6274353B1 (en) * | 1999-09-22 | 2001-08-14 | Genecopoeia, Inc. | Method and compositions for improved polynucleotide synthesis |
| JP3937136B2 (ja) | 1999-12-10 | 2007-06-27 | 東洋紡績株式会社 | 塩基多型の検出方法 |
| JP2004513617A (ja) | 2000-06-26 | 2004-05-13 | ニューゲン テクノロジーズ, インコーポレイテッド | 転写に基づく核酸増幅のための方法および組成物 |
| US6773885B1 (en) * | 2000-09-29 | 2004-08-10 | Integrated Dna Technologies, Inc. | Compositions and methods for visual ribonuclease detection assays |
| WO2002063049A2 (en) * | 2001-02-02 | 2002-08-15 | Genome Therapeutics Corporation | Methods for determining a nucleotide at a specific location within a nucleic acid molecule |
| EP1456409B1 (en) * | 2001-11-28 | 2010-02-24 | Bio-Rad Laboratories, Inc. | Parallel polymorphism scoring by amplification and error correction |
-
2002
- 2002-02-14 EP EP02712338A patent/EP1367136A4/en not_active Withdrawn
- 2002-02-14 CN CNB028079310A patent/CN100351393C/zh not_active Expired - Fee Related
- 2002-02-14 KR KR1020037010391A patent/KR100809949B1/ko not_active IP Right Cessation
- 2002-02-14 EA EA200300880A patent/EA005141B1/ru not_active IP Right Cessation
- 2002-02-14 WO PCT/JP2002/001222 patent/WO2002064833A1/ja active Application Filing
- 2002-02-14 CA CA002438574A patent/CA2438574C/en not_active Expired - Fee Related
- 2002-02-14 US US10/468,128 patent/US7135291B2/en not_active Expired - Fee Related
- 2002-02-14 AU AU2002232177A patent/AU2002232177B2/en not_active Ceased
- 2002-02-14 JP JP2002565143A patent/JP3681729B2/ja not_active Expired - Fee Related
-
2004
- 2004-07-29 JP JP2004221749A patent/JP2004298200A/ja active Pending
-
2005
- 2005-05-17 JP JP2005144399A patent/JP2005245465A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1992002638A1 (en) * | 1990-08-06 | 1992-02-20 | F. Hoffmann-La Roche Ag | Homogeneous assay system |
| US5660988A (en) * | 1993-11-17 | 1997-08-26 | Id Biomedical Corporation | Cycling probe cleavage detection of nucleic acid sequences |
| EP0705905A2 (de) * | 1994-07-16 | 1996-04-10 | Roche Diagnostics GmbH | Verfahren zum sensitiven Nachweis von Nukleinsäuren |
| JP2001136965A (ja) * | 1999-11-12 | 2001-05-22 | Takara Shuzo Co Ltd | 核酸配列の増幅方法 |
Non-Patent Citations (2)
| Title |
|---|
| Invader分析——一种新的核酸检测技术 张宁等.国外医学.临床生物化学与检验学分册,第22卷第6期 2001 * |
| 单核苷酸多态性的研究技术 罗怀容等.遗传,第23卷第5期 2001 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EA005141B1 (ru) | 2004-12-30 |
| JP2004298200A (ja) | 2004-10-28 |
| JPWO2002064833A1 (ja) | 2004-06-17 |
| JP2005245465A (ja) | 2005-09-15 |
| CA2438574C (en) | 2009-08-11 |
| US7135291B2 (en) | 2006-11-14 |
| KR20030074797A (ko) | 2003-09-19 |
| WO2002064833A1 (fr) | 2002-08-22 |
| KR100809949B1 (ko) | 2008-03-06 |
| CA2438574A1 (en) | 2002-08-22 |
| JP3681729B2 (ja) | 2005-08-10 |
| AU2002232177B2 (en) | 2006-11-09 |
| EP1367136A1 (en) | 2003-12-03 |
| US20040137451A1 (en) | 2004-07-15 |
| CN1524127A (zh) | 2004-08-25 |
| EA200300880A1 (ru) | 2004-02-26 |
| EP1367136A4 (en) | 2005-01-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN100351393C (zh) | 核苷酸多态性的检测方法 | |
| CN1198943C (zh) | 通过裂解脱碱基位点的核酸产生可延伸的上游dna片段而鉴定核酸分子的方法 | |
| CN1185347C (zh) | 用于改进体外核酸合成和扩增的提升热稳定dna聚合酶保真性的热稳定酶 | |
| CN1227357C (zh) | 用于扩增核酸序列的方法 | |
| CN1197962C (zh) | 用于测序的改变的热稳定dna聚合酶 | |
| CN1154733C (zh) | 改进的热稳定dna聚合酶 | |
| CN1273611C (zh) | 使用突变dna聚合酶的高温逆转录 | |
| CN1034673C (zh) | 检测核苷酸顺序的方法 | |
| CN1254548C (zh) | 核酸扩增方法 | |
| CN100335621C (zh) | 用于dna测序的具有修饰的核苷酸结合位点的dna聚合酶 | |
| CN1633505A (zh) | 核酸扩增方法 | |
| CN1876843A (zh) | 检测突变和/或多态性的方法 | |
| CN1415020A (zh) | 检测突变和/或多态性的方法 | |
| CN1491285A (zh) | 致病微生物的检测方法 | |
| CN101031659A (zh) | 基因组分析 | |
| CN1578841A (zh) | 退火控制引物及该退火控制引物的使用 | |
| CN1500144A (zh) | 扩增的核酸及其固定化制品 | |
| CN1590543A (zh) | 热稳定的Taq聚合酶片断 | |
| CN101074450A (zh) | 诊断探针检测系统 | |
| CN1167794C (zh) | Dna的合成方法 | |
| CN1541267A (zh) | 核酸扩增或检测用试剂的稳定化方法和保存方法 | |
| CN1496410A (zh) | 方法 | |
| CN1890368A (zh) | 扩增核酸的方法 | |
| CN1675373A (zh) | 用于鉴别水稻品种的方法 | |
| CN1993468A (zh) | 具有dna聚合酶活性的多肽 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20071128 Termination date: 20100214 |