JP2019523301A - キメラ抗原受容体とpd−1阻害薬との併用療法 - Google Patents
キメラ抗原受容体とpd−1阻害薬との併用療法 Download PDFInfo
- Publication number
- JP2019523301A JP2019523301A JP2019526201A JP2019526201A JP2019523301A JP 2019523301 A JP2019523301 A JP 2019523301A JP 2019526201 A JP2019526201 A JP 2019526201A JP 2019526201 A JP2019526201 A JP 2019526201A JP 2019523301 A JP2019523301 A JP 2019523301A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- amino acid
- acid sequence
- car
- car therapy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 title claims abstract description 659
- 239000012270 PD-1 inhibitor Substances 0.000 title claims description 263
- 239000012668 PD-1-inhibitor Substances 0.000 title claims description 263
- 229940121655 pd-1 inhibitor Drugs 0.000 title claims description 263
- 238000002648 combination therapy Methods 0.000 title description 12
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 174
- 238000000034 method Methods 0.000 claims abstract description 162
- 239000000427 antigen Substances 0.000 claims abstract description 157
- 108091007433 antigens Proteins 0.000 claims abstract description 156
- 102000036639 antigens Human genes 0.000 claims abstract description 156
- 201000011510 cancer Diseases 0.000 claims abstract description 125
- 230000014509 gene expression Effects 0.000 claims abstract description 53
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 claims abstract description 42
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 claims abstract description 42
- 239000000203 mixture Substances 0.000 claims abstract description 27
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 461
- 210000004027 cell Anatomy 0.000 claims description 410
- 238000002560 therapeutic procedure Methods 0.000 claims description 242
- 230000027455 binding Effects 0.000 claims description 179
- 238000011282 treatment Methods 0.000 claims description 132
- 230000004068 intracellular signaling Effects 0.000 claims description 81
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 78
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 77
- 102100040678 Programmed cell death protein 1 Human genes 0.000 claims description 70
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 70
- 230000004048 modification Effects 0.000 claims description 70
- 238000012986 modification Methods 0.000 claims description 70
- 230000011664 signaling Effects 0.000 claims description 69
- 108090000623 proteins and genes Proteins 0.000 claims description 65
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 61
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 57
- 230000004044 response Effects 0.000 claims description 55
- 150000007523 nucleic acids Chemical class 0.000 claims description 54
- 229920001184 polypeptide Polymers 0.000 claims description 53
- 150000001413 amino acids Chemical class 0.000 claims description 49
- 230000000139 costimulatory effect Effects 0.000 claims description 49
- 239000012642 immune effector Substances 0.000 claims description 44
- 229940121354 immunomodulator Drugs 0.000 claims description 44
- 102000004169 proteins and genes Human genes 0.000 claims description 44
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 claims description 37
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 claims description 37
- 102000039446 nucleic acids Human genes 0.000 claims description 33
- 108020004707 nucleic acids Proteins 0.000 claims description 33
- -1 CD86 Proteins 0.000 claims description 28
- 229960002621 pembrolizumab Drugs 0.000 claims description 28
- 208000025324 B-cell acute lymphoblastic leukemia Diseases 0.000 claims description 25
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 claims description 25
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 claims description 25
- 206010052015 cytokine release syndrome Diseases 0.000 claims description 22
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 21
- 230000036961 partial effect Effects 0.000 claims description 19
- 230000000694 effects Effects 0.000 claims description 18
- 238000001802 infusion Methods 0.000 claims description 18
- 239000013598 vector Substances 0.000 claims description 18
- 206010025323 Lymphomas Diseases 0.000 claims description 17
- 239000003446 ligand Substances 0.000 claims description 16
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 15
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 14
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 14
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 claims description 14
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 claims description 14
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 14
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 claims description 14
- 238000013518 transcription Methods 0.000 claims description 14
- 230000035897 transcription Effects 0.000 claims description 14
- 102100027207 CD27 antigen Human genes 0.000 claims description 13
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 13
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 13
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 13
- 230000002062 proliferating effect Effects 0.000 claims description 13
- 208000017604 Hodgkin disease Diseases 0.000 claims description 12
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 12
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 12
- 108020001507 fusion proteins Proteins 0.000 claims description 12
- 102000037865 fusion proteins Human genes 0.000 claims description 12
- 238000000338 in vitro Methods 0.000 claims description 12
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 11
- 108091008874 T cell receptors Proteins 0.000 claims description 11
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims description 11
- 230000002489 hematologic effect Effects 0.000 claims description 11
- 210000004698 lymphocyte Anatomy 0.000 claims description 11
- 210000000822 natural killer cell Anatomy 0.000 claims description 10
- 229960003301 nivolumab Drugs 0.000 claims description 10
- 101000994375 Homo sapiens Integrin alpha-4 Proteins 0.000 claims description 9
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 claims description 9
- 101000633786 Homo sapiens SLAM family member 6 Proteins 0.000 claims description 9
- 102100032818 Integrin alpha-4 Human genes 0.000 claims description 9
- 102100032816 Integrin alpha-6 Human genes 0.000 claims description 9
- 102100025390 Integrin beta-2 Human genes 0.000 claims description 9
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 claims description 9
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 claims description 9
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 9
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 9
- 102100029197 SLAM family member 6 Human genes 0.000 claims description 9
- 201000003444 follicular lymphoma Diseases 0.000 claims description 9
- 230000002401 inhibitory effect Effects 0.000 claims description 9
- 208000032839 leukemia Diseases 0.000 claims description 9
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 8
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims description 8
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 8
- 208000029052 T-cell acute lymphoblastic leukemia Diseases 0.000 claims description 8
- 208000035269 cancer or benign tumor Diseases 0.000 claims description 8
- 210000005134 plasmacytoid dendritic cell Anatomy 0.000 claims description 8
- 238000011084 recovery Methods 0.000 claims description 8
- 229950007213 spartalizumab Drugs 0.000 claims description 8
- 101000633784 Homo sapiens SLAM family member 7 Proteins 0.000 claims description 7
- 102100029198 SLAM family member 7 Human genes 0.000 claims description 7
- 102100029215 Signaling lymphocytic activation molecule Human genes 0.000 claims description 7
- 230000004913 activation Effects 0.000 claims description 7
- 150000003384 small molecules Chemical class 0.000 claims description 7
- 238000013519 translation Methods 0.000 claims description 7
- 102100038080 B-cell receptor CD22 Human genes 0.000 claims description 6
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 claims description 6
- 101001078158 Homo sapiens Integrin alpha-1 Proteins 0.000 claims description 6
- 101000994365 Homo sapiens Integrin alpha-6 Proteins 0.000 claims description 6
- 101001035237 Homo sapiens Integrin alpha-D Proteins 0.000 claims description 6
- 101001046687 Homo sapiens Integrin alpha-E Proteins 0.000 claims description 6
- 101000971538 Homo sapiens Killer cell lectin-like receptor subfamily F member 1 Proteins 0.000 claims description 6
- 102100025323 Integrin alpha-1 Human genes 0.000 claims description 6
- 102100039904 Integrin alpha-D Human genes 0.000 claims description 6
- 102100022341 Integrin alpha-E Human genes 0.000 claims description 6
- 102100022339 Integrin alpha-L Human genes 0.000 claims description 6
- 102100022338 Integrin alpha-M Human genes 0.000 claims description 6
- 102100022297 Integrin alpha-X Human genes 0.000 claims description 6
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 claims description 6
- 102100021458 Killer cell lectin-like receptor subfamily F member 1 Human genes 0.000 claims description 6
- 102000017578 LAG3 Human genes 0.000 claims description 6
- 102100038082 Natural killer cell receptor 2B4 Human genes 0.000 claims description 6
- 102000014128 RANK Ligand Human genes 0.000 claims description 6
- 108010025832 RANK Ligand Proteins 0.000 claims description 6
- 206010038111 Recurrent cancer Diseases 0.000 claims description 6
- 102100027744 Semaphorin-4D Human genes 0.000 claims description 6
- 108010074687 Signaling Lymphocytic Activation Molecule Family Member 1 Proteins 0.000 claims description 6
- 208000011691 Burkitt lymphomas Diseases 0.000 claims description 5
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 claims description 5
- 241000124008 Mammalia Species 0.000 claims description 5
- 108020004459 Small interfering RNA Proteins 0.000 claims description 5
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 claims description 5
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims description 5
- 230000000735 allogeneic effect Effects 0.000 claims description 5
- 230000003211 malignant effect Effects 0.000 claims description 5
- 102000003298 tumor necrosis factor receptor Human genes 0.000 claims description 5
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 claims description 4
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 4
- 102100024263 CD160 antigen Human genes 0.000 claims description 4
- 102100038077 CD226 antigen Human genes 0.000 claims description 4
- 102100038078 CD276 antigen Human genes 0.000 claims description 4
- 206010061850 Extranodal marginal zone B-cell lymphoma (MALT type) Diseases 0.000 claims description 4
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 claims description 4
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 claims description 4
- 101000761938 Homo sapiens CD160 antigen Proteins 0.000 claims description 4
- 101000884298 Homo sapiens CD226 antigen Proteins 0.000 claims description 4
- 101000935043 Homo sapiens Integrin beta-1 Proteins 0.000 claims description 4
- 101000873418 Homo sapiens P-selectin glycoprotein ligand 1 Proteins 0.000 claims description 4
- 101000633780 Homo sapiens Signaling lymphocytic activation molecule Proteins 0.000 claims description 4
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 claims description 4
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 claims description 4
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 claims description 4
- 102100025304 Integrin beta-1 Human genes 0.000 claims description 4
- 201000003791 MALT lymphoma Diseases 0.000 claims description 4
- 208000034578 Multiple myelomas Diseases 0.000 claims description 4
- 102100034925 P-selectin glycoprotein ligand 1 Human genes 0.000 claims description 4
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 4
- 108091027967 Small hairpin RNA Proteins 0.000 claims description 4
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 claims description 4
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 claims description 4
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 claims description 4
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 claims description 4
- 239000002246 antineoplastic agent Substances 0.000 claims description 4
- 201000009277 hairy cell leukemia Diseases 0.000 claims description 4
- 238000001990 intravenous administration Methods 0.000 claims description 4
- 201000007924 marginal zone B-cell lymphoma Diseases 0.000 claims description 4
- 208000021937 marginal zone lymphoma Diseases 0.000 claims description 4
- 208000007525 plasmablastic lymphoma Diseases 0.000 claims description 4
- 239000004055 small Interfering RNA Substances 0.000 claims description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 3
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 claims description 3
- 208000032568 B-cell prolymphocytic leukaemia Diseases 0.000 claims description 3
- 108010056102 CD100 antigen Proteins 0.000 claims description 3
- 108010017009 CD11b Antigen Proteins 0.000 claims description 3
- 101710185679 CD276 antigen Proteins 0.000 claims description 3
- 101150013553 CD40 gene Proteins 0.000 claims description 3
- 108010062802 CD66 antigens Proteins 0.000 claims description 3
- 102100027217 CD82 antigen Human genes 0.000 claims description 3
- 101710139831 CD82 antigen Proteins 0.000 claims description 3
- 102100035793 CD83 antigen Human genes 0.000 claims description 3
- 102100024533 Carcinoembryonic antigen-related cell adhesion molecule 1 Human genes 0.000 claims description 3
- 102100027816 Cytotoxic and regulatory T-cell molecule Human genes 0.000 claims description 3
- 102100025137 Early activation antigen CD69 Human genes 0.000 claims description 3
- 101000585551 Equus caballus Pregnancy-associated glycoprotein Proteins 0.000 claims description 3
- 102100022086 GRB2-related adapter protein 2 Human genes 0.000 claims description 3
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 claims description 3
- 101000946856 Homo sapiens CD83 antigen Proteins 0.000 claims description 3
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 claims description 3
- 101000900690 Homo sapiens GRB2-related adapter protein 2 Proteins 0.000 claims description 3
- 101001046683 Homo sapiens Integrin alpha-L Proteins 0.000 claims description 3
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 claims description 3
- 101001046668 Homo sapiens Integrin alpha-X Proteins 0.000 claims description 3
- 101001015037 Homo sapiens Integrin beta-7 Proteins 0.000 claims description 3
- 101001047640 Homo sapiens Linker for activation of T-cells family member 1 Proteins 0.000 claims description 3
- 101001090688 Homo sapiens Lymphocyte cytosolic protein 2 Proteins 0.000 claims description 3
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 claims description 3
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 claims description 3
- 101000589305 Homo sapiens Natural cytotoxicity triggering receptor 2 Proteins 0.000 claims description 3
- 101001124867 Homo sapiens Peroxiredoxin-1 Proteins 0.000 claims description 3
- 101000692259 Homo sapiens Phosphoprotein associated with glycosphingolipid-enriched microdomains 1 Proteins 0.000 claims description 3
- 101000702132 Homo sapiens Protein spinster homolog 1 Proteins 0.000 claims description 3
- 101000633778 Homo sapiens SLAM family member 5 Proteins 0.000 claims description 3
- 101000914496 Homo sapiens T-cell antigen CD7 Proteins 0.000 claims description 3
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 claims description 3
- 101000596234 Homo sapiens T-cell surface protein tactile Proteins 0.000 claims description 3
- 101000795169 Homo sapiens Tumor necrosis factor receptor superfamily member 13C Proteins 0.000 claims description 3
- 101000679857 Homo sapiens Tumor necrosis factor receptor superfamily member 3 Proteins 0.000 claims description 3
- 108010041100 Integrin alpha6 Proteins 0.000 claims description 3
- 108010030465 Integrin alpha6beta1 Proteins 0.000 claims description 3
- 102100033016 Integrin beta-7 Human genes 0.000 claims description 3
- 102100024032 Linker for activation of T-cells family member 1 Human genes 0.000 claims description 3
- 102100034709 Lymphocyte cytosolic protein 2 Human genes 0.000 claims description 3
- 208000028018 Lymphocytic leukaemia Diseases 0.000 claims description 3
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 claims description 3
- 101100236305 Mus musculus Ly9 gene Proteins 0.000 claims description 3
- 108091008877 NK cell receptors Proteins 0.000 claims description 3
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 claims description 3
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 claims description 3
- 108010004217 Natural Cytotoxicity Triggering Receptor 1 Proteins 0.000 claims description 3
- 108010004222 Natural Cytotoxicity Triggering Receptor 3 Proteins 0.000 claims description 3
- 102100032870 Natural cytotoxicity triggering receptor 1 Human genes 0.000 claims description 3
- 102100032851 Natural cytotoxicity triggering receptor 2 Human genes 0.000 claims description 3
- 102100032852 Natural cytotoxicity triggering receptor 3 Human genes 0.000 claims description 3
- 101710141230 Natural killer cell receptor 2B4 Proteins 0.000 claims description 3
- 102100026066 Phosphoprotein associated with glycosphingolipid-enriched microdomains 1 Human genes 0.000 claims description 3
- 208000035416 Prolymphocytic B-Cell Leukemia Diseases 0.000 claims description 3
- 102100029216 SLAM family member 5 Human genes 0.000 claims description 3
- 102000008115 Signaling Lymphocytic Activation Molecule Family Member 1 Human genes 0.000 claims description 3
- 102100027208 T-cell antigen CD7 Human genes 0.000 claims description 3
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 claims description 3
- 102100035268 T-cell surface protein tactile Human genes 0.000 claims description 3
- 102100029690 Tumor necrosis factor receptor superfamily member 13C Human genes 0.000 claims description 3
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 claims description 3
- 102100033733 Tumor necrosis factor receptor superfamily member 1B Human genes 0.000 claims description 3
- 101710187830 Tumor necrosis factor receptor superfamily member 1B Proteins 0.000 claims description 3
- 102100022156 Tumor necrosis factor receptor superfamily member 3 Human genes 0.000 claims description 3
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims description 3
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 claims description 3
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 claims description 3
- 101001038499 Yarrowia lipolytica (strain CLIB 122 / E 150) Lysine acetyltransferase Proteins 0.000 claims description 3
- 108010072917 class-I restricted T cell-associated molecule Proteins 0.000 claims description 3
- 102000003675 cytokine receptors Human genes 0.000 claims description 3
- 108010057085 cytokine receptors Proteins 0.000 claims description 3
- 238000004520 electroporation Methods 0.000 claims description 3
- 102000006495 integrins Human genes 0.000 claims description 3
- 108010044426 integrins Proteins 0.000 claims description 3
- 208000003747 lymphoid leukemia Diseases 0.000 claims description 3
- 238000010361 transduction Methods 0.000 claims description 3
- 230000026683 transduction Effects 0.000 claims description 3
- 102100032937 CD40 ligand Human genes 0.000 claims description 2
- 102100037904 CD9 antigen Human genes 0.000 claims description 2
- 102100028976 HLA class I histocompatibility antigen, B alpha chain Human genes 0.000 claims description 2
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 claims description 2
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 claims description 2
- 101000738354 Homo sapiens CD9 antigen Proteins 0.000 claims description 2
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 claims description 2
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 claims description 2
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 claims description 2
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 claims description 2
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 claims description 2
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 claims description 2
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 claims description 2
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 claims description 2
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 claims description 2
- 208000016025 Waldenstroem macroglobulinemia Diseases 0.000 claims description 2
- 208000003606 Congenital Rubella Syndrome Diseases 0.000 claims 9
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 claims 7
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 claims 5
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 claims 5
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 claims 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims 4
- 101150030213 Lag3 gene Proteins 0.000 claims 3
- 208000025321 B-lymphoblastic leukemia/lymphoma Diseases 0.000 claims 1
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 claims 1
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 claims 1
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 claims 1
- 102100021462 Natural killer cells antigen CD94 Human genes 0.000 claims 1
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 claims 1
- 239000002552 dosage form Substances 0.000 claims 1
- 208000017426 precursor B-cell acute lymphoblastic leukemia Diseases 0.000 claims 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 65
- 201000010099 disease Diseases 0.000 abstract description 53
- 239000003112 inhibitor Substances 0.000 abstract description 8
- 239000002773 nucleotide Substances 0.000 description 61
- 125000003729 nucleotide group Chemical group 0.000 description 61
- 235000001014 amino acid Nutrition 0.000 description 54
- 229940024606 amino acid Drugs 0.000 description 49
- 235000018102 proteins Nutrition 0.000 description 40
- 108091028043 Nucleic acid sequence Proteins 0.000 description 37
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 32
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 32
- 239000012634 fragment Substances 0.000 description 22
- 238000006467 substitution reaction Methods 0.000 description 21
- 108060003951 Immunoglobulin Proteins 0.000 description 20
- 102000018358 immunoglobulin Human genes 0.000 description 20
- 108020004999 messenger RNA Proteins 0.000 description 20
- 125000000539 amino acid group Chemical group 0.000 description 17
- 230000006870 function Effects 0.000 description 17
- 229920002477 rna polymer Polymers 0.000 description 17
- 101000998120 Homo sapiens Interleukin-3 receptor subunit alpha Proteins 0.000 description 16
- 102100033493 Interleukin-3 receptor subunit alpha Human genes 0.000 description 16
- 230000003834 intracellular effect Effects 0.000 description 16
- 230000004936 stimulating effect Effects 0.000 description 16
- 241000699666 Mus <mouse, genus> Species 0.000 description 15
- 230000001965 increasing effect Effects 0.000 description 14
- 230000001086 cytosolic effect Effects 0.000 description 13
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 12
- 102100026094 C-type lectin domain family 12 member A Human genes 0.000 description 12
- 102100035932 Cocaine- and amphetamine-regulated transcript protein Human genes 0.000 description 12
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 12
- 101000715592 Homo sapiens Cocaine- and amphetamine-regulated transcript protein Proteins 0.000 description 12
- 208000035475 disorder Diseases 0.000 description 12
- 230000005764 inhibitory process Effects 0.000 description 12
- 210000005259 peripheral blood Anatomy 0.000 description 12
- 239000011886 peripheral blood Substances 0.000 description 12
- 230000002688 persistence Effects 0.000 description 12
- 102000040430 polynucleotide Human genes 0.000 description 12
- 108091033319 polynucleotide Proteins 0.000 description 12
- 239000002157 polynucleotide Substances 0.000 description 12
- 230000009467 reduction Effects 0.000 description 12
- 238000006471 dimerization reaction Methods 0.000 description 11
- 108010087914 epidermal growth factor receptor VIII Proteins 0.000 description 11
- 239000000463 material Substances 0.000 description 11
- 102000003735 Mesothelin Human genes 0.000 description 10
- 108090000015 Mesothelin Proteins 0.000 description 10
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 9
- 102000053602 DNA Human genes 0.000 description 9
- 108020004414 DNA Proteins 0.000 description 9
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 9
- 241000283984 Rodentia Species 0.000 description 9
- 210000001185 bone marrow Anatomy 0.000 description 9
- 150000001875 compounds Chemical class 0.000 description 9
- 230000028993 immune response Effects 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 229940090044 injection Drugs 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 229940124302 mTOR inhibitor Drugs 0.000 description 9
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 9
- 101100445364 Mus musculus Eomes gene Proteins 0.000 description 8
- 101100445365 Xenopus laevis eomes gene Proteins 0.000 description 8
- 238000002512 chemotherapy Methods 0.000 description 8
- 230000001976 improved effect Effects 0.000 description 8
- 208000024891 symptom Diseases 0.000 description 8
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 7
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 7
- 241000282693 Cercopithecidae Species 0.000 description 7
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 7
- 230000000259 anti-tumor effect Effects 0.000 description 7
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 7
- 230000000875 corresponding effect Effects 0.000 description 7
- 238000012217 deletion Methods 0.000 description 7
- 230000037430 deletion Effects 0.000 description 7
- 239000003814 drug Substances 0.000 description 7
- 230000006872 improvement Effects 0.000 description 7
- 230000035772 mutation Effects 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 230000000638 stimulation Effects 0.000 description 7
- 229940124597 therapeutic agent Drugs 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 7
- 101100279855 Arabidopsis thaliana EPFL5 gene Proteins 0.000 description 6
- 101710188619 C-type lectin domain family 12 member A Proteins 0.000 description 6
- 101150031358 COLEC10 gene Proteins 0.000 description 6
- 108091007741 Chimeric antigen receptor T cells Proteins 0.000 description 6
- 101100496086 Homo sapiens CLEC12A gene Proteins 0.000 description 6
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 6
- 238000001994 activation Methods 0.000 description 6
- 239000012636 effector Substances 0.000 description 6
- 210000001165 lymph node Anatomy 0.000 description 6
- 230000001105 regulatory effect Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 239000004471 Glycine Substances 0.000 description 5
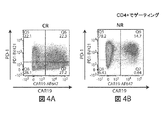
- 101100383038 Homo sapiens CD19 gene Proteins 0.000 description 5
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 5
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 5
- 241000713666 Lentivirus Species 0.000 description 5
- 208000009052 Precursor T-Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 5
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 210000003071 memory t lymphocyte Anatomy 0.000 description 5
- JMANVNJQNLATNU-UHFFFAOYSA-N oxalonitrile Chemical compound N#CC#N JMANVNJQNLATNU-UHFFFAOYSA-N 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 230000008488 polyadenylation Effects 0.000 description 5
- 208000037821 progressive disease Diseases 0.000 description 5
- 230000035755 proliferation Effects 0.000 description 5
- 208000016691 refractory malignant neoplasm Diseases 0.000 description 5
- 241000894007 species Species 0.000 description 5
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 5
- 108010013238 70-kDa Ribosomal Protein S6 Kinases Proteins 0.000 description 4
- 108010005327 CD19-specific chimeric antigen receptor Proteins 0.000 description 4
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 4
- 102000001398 Granzyme Human genes 0.000 description 4
- 108060005986 Granzyme Proteins 0.000 description 4
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 4
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 4
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 4
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 4
- 206010061309 Neoplasm progression Diseases 0.000 description 4
- 206010070308 Refractory cancer Diseases 0.000 description 4
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 4
- 239000004473 Threonine Substances 0.000 description 4
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 4
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 235000018417 cysteine Nutrition 0.000 description 4
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 4
- 229960005167 everolimus Drugs 0.000 description 4
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 4
- 210000002865 immune cell Anatomy 0.000 description 4
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 4
- 229960000310 isoleucine Drugs 0.000 description 4
- 230000003902 lesion Effects 0.000 description 4
- 230000007774 longterm Effects 0.000 description 4
- 230000036210 malignancy Effects 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 201000001441 melanoma Diseases 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 210000004379 membrane Anatomy 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 229960004799 tryptophan Drugs 0.000 description 4
- 230000005751 tumor progression Effects 0.000 description 4
- 239000004474 valine Substances 0.000 description 4
- 230000003612 virological effect Effects 0.000 description 4
- 101710145634 Antigen 1 Proteins 0.000 description 3
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 102000001301 EGF receptor Human genes 0.000 description 3
- 108060006698 EGF receptor Proteins 0.000 description 3
- 102100038083 Endosialin Human genes 0.000 description 3
- 241001272567 Hominoidea Species 0.000 description 3
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 3
- 101000878602 Homo sapiens Immunoglobulin alpha Fc receptor Proteins 0.000 description 3
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 description 3
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 3
- 102100038005 Immunoglobulin alpha Fc receptor Human genes 0.000 description 3
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 108091036407 Polyadenylation Proteins 0.000 description 3
- 206010060862 Prostate cancer Diseases 0.000 description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 3
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 206010039491 Sarcoma Diseases 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 230000000996 additive effect Effects 0.000 description 3
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 210000000612 antigen-presenting cell Anatomy 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 230000005754 cellular signaling Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 229960004397 cyclophosphamide Drugs 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 230000002708 enhancing effect Effects 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 102000048362 human PDCD1 Human genes 0.000 description 3
- 210000000265 leukocyte Anatomy 0.000 description 3
- 201000005202 lung cancer Diseases 0.000 description 3
- 208000020816 lung neoplasm Diseases 0.000 description 3
- 229920002521 macromolecule Polymers 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 238000001959 radiotherapy Methods 0.000 description 3
- 231100000628 reference dose Toxicity 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 210000004881 tumor cell Anatomy 0.000 description 3
- RJBDSRWGVYNDHL-XNJNKMBASA-N (2S,4R,5S,6S)-2-[(2S,3R,4R,5S,6R)-5-[(2S,3R,4R,5R,6R)-3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-2-[(2R,3S,4R,5R,6R)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(E,2R,3S)-3-hydroxy-2-(octadecanoylamino)octadec-4-enoxy]oxan-3-yl]oxy-3-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-5-amino-6-[(1S,2R)-2-[(2S,4R,5S,6S)-5-amino-2-carboxy-4-hydroxy-6-[(1R,2R)-1,2,3-trihydroxypropyl]oxan-2-yl]oxy-1,3-dihydroxypropyl]-4-hydroxyoxane-2-carboxylic acid Chemical compound CCCCCCCCCCCCCCCCCC(=O)N[C@H](CO[C@@H]1O[C@H](CO)[C@@H](O[C@@H]2O[C@H](CO)[C@H](O[C@@H]3O[C@H](CO)[C@H](O)[C@H](O)[C@H]3NC(C)=O)[C@H](O[C@@]3(C[C@@H](O)[C@H](N)[C@H](O3)[C@H](O)[C@@H](CO)O[C@@]3(C[C@@H](O)[C@H](N)[C@H](O3)[C@H](O)[C@H](O)CO)C(O)=O)C(O)=O)[C@H]2O)[C@H](O)[C@H]1O)[C@@H](O)\C=C\CCCCCCCCCCCCC RJBDSRWGVYNDHL-XNJNKMBASA-N 0.000 description 2
- LTHJXDSHSVNJKG-UHFFFAOYSA-N 2-[2-[2-[2-(2-methylprop-2-enoyloxy)ethoxy]ethoxy]ethoxy]ethyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCOCCOCCOCCOC(=O)C(C)=C LTHJXDSHSVNJKG-UHFFFAOYSA-N 0.000 description 2
- 101710109924 A-kinase anchor protein 4 Proteins 0.000 description 2
- 102100033793 ALK tyrosine kinase receptor Human genes 0.000 description 2
- 101710168331 ALK tyrosine kinase receptor Proteins 0.000 description 2
- 206010000830 Acute leukaemia Diseases 0.000 description 2
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 2
- 102100026402 Adhesion G protein-coupled receptor E2 Human genes 0.000 description 2
- 102100037982 Alpha-1,6-mannosylglycoprotein 6-beta-N-acetylglucosaminyltransferase A Human genes 0.000 description 2
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 2
- 239000004475 Arginine Substances 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 2
- 108091012583 BCL2 Proteins 0.000 description 2
- 108010051118 Bone Marrow Stromal Antigen 2 Proteins 0.000 description 2
- 102100037086 Bone marrow stromal antigen 2 Human genes 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- 108700012439 CA9 Proteins 0.000 description 2
- 102100029390 CMRF35-like molecule 1 Human genes 0.000 description 2
- 101100228196 Caenorhabditis elegans gly-4 gene Proteins 0.000 description 2
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 description 2
- 102100039510 Cancer/testis antigen 2 Human genes 0.000 description 2
- 102100024423 Carbonic anhydrase 9 Human genes 0.000 description 2
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 description 2
- 102100025466 Carcinoembryonic antigen-related cell adhesion molecule 3 Human genes 0.000 description 2
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- 102100038449 Claudin-6 Human genes 0.000 description 2
- 108090000229 Claudin-6 Proteins 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 108091033380 Coding strand Proteins 0.000 description 2
- 102000012466 Cytochrome P450 1B1 Human genes 0.000 description 2
- 108050002014 Cytochrome P450 1B1 Proteins 0.000 description 2
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 2
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 206010058314 Dysplasia Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 description 2
- 101710116743 Ephrin type-A receptor 2 Proteins 0.000 description 2
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 2
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 108010021468 Fc gamma receptor IIA Proteins 0.000 description 2
- 102100031507 Fc receptor-like protein 5 Human genes 0.000 description 2
- 102100037362 Fibronectin Human genes 0.000 description 2
- 108010067306 Fibronectins Proteins 0.000 description 2
- 102100036939 G-protein coupled receptor 20 Human genes 0.000 description 2
- 101710108873 G-protein coupled receptor 20 Proteins 0.000 description 2
- 102100039554 Galectin-8 Human genes 0.000 description 2
- 102000050627 Glucocorticoid-Induced TNFR-Related Human genes 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 102000010956 Glypican Human genes 0.000 description 2
- 108050001154 Glypican Proteins 0.000 description 2
- 108050007237 Glypican-3 Proteins 0.000 description 2
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 2
- 102100029360 Hematopoietic cell signal transducer Human genes 0.000 description 2
- 102100022132 High affinity immunoglobulin epsilon receptor subunit gamma Human genes 0.000 description 2
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 2
- 101000990055 Homo sapiens CMRF35-like molecule 1 Proteins 0.000 description 2
- 101000914337 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 3 Proteins 0.000 description 2
- 101000884275 Homo sapiens Endosialin Proteins 0.000 description 2
- 101000846908 Homo sapiens Fc receptor-like protein 5 Proteins 0.000 description 2
- 101000608769 Homo sapiens Galectin-8 Proteins 0.000 description 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 2
- 101000990188 Homo sapiens Hematopoietic cell signal transducer Proteins 0.000 description 2
- 101000824104 Homo sapiens High affinity immunoglobulin epsilon receptor subunit gamma Proteins 0.000 description 2
- 101000971533 Homo sapiens Killer cell lectin-like receptor subfamily G member 1 Proteins 0.000 description 2
- 101001018097 Homo sapiens L-selectin Proteins 0.000 description 2
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 description 2
- 101001136981 Homo sapiens Proteasome subunit beta type-9 Proteins 0.000 description 2
- 101000824971 Homo sapiens Sperm surface protein Sp17 Proteins 0.000 description 2
- 101000716124 Homo sapiens T-cell surface glycoprotein CD1c Proteins 0.000 description 2
- 101000809875 Homo sapiens TYRO protein tyrosine kinase-binding protein Proteins 0.000 description 2
- 101000655352 Homo sapiens Telomerase reverse transcriptase Proteins 0.000 description 2
- 101001047681 Homo sapiens Tyrosine-protein kinase Lck Proteins 0.000 description 2
- 101000814512 Homo sapiens X antigen family member 1 Proteins 0.000 description 2
- 241000701806 Human papillomavirus Species 0.000 description 2
- 108010073816 IgE Receptors Proteins 0.000 description 2
- 102000009438 IgE Receptors Human genes 0.000 description 2
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 2
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- 102100029616 Immunoglobulin lambda-like polypeptide 1 Human genes 0.000 description 2
- 101710107067 Immunoglobulin lambda-like polypeptide 1 Proteins 0.000 description 2
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 108091092195 Intron Proteins 0.000 description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 description 2
- 102100021457 Killer cell lectin-like receptor subfamily G member 1 Human genes 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- 102100031413 L-dopachrome tautomerase Human genes 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- 102100033467 L-selectin Human genes 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 2
- 102100033486 Lymphocyte antigen 75 Human genes 0.000 description 2
- 101710157884 Lymphocyte antigen 75 Proteins 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 108091054437 MHC class I family Proteins 0.000 description 2
- 102100034256 Mucin-1 Human genes 0.000 description 2
- 101100519207 Mus musculus Pdcd1 gene Proteins 0.000 description 2
- 102000010648 Natural Killer Cell Receptors Human genes 0.000 description 2
- 102100021852 Neuronal cell adhesion molecule Human genes 0.000 description 2
- 101710130688 Neuronal cell adhesion molecule Proteins 0.000 description 2
- 102100025128 Olfactory receptor 51E2 Human genes 0.000 description 2
- 101710187841 Olfactory receptor 51E2 Proteins 0.000 description 2
- 108010038807 Oligopeptides Proteins 0.000 description 2
- 102000015636 Oligopeptides Human genes 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 102100032364 Pannexin-3 Human genes 0.000 description 2
- 101710165197 Pannexin-3 Proteins 0.000 description 2
- 102100026181 Placenta-specific protein 1 Human genes 0.000 description 2
- 108050005093 Placenta-specific protein 1 Proteins 0.000 description 2
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 2
- 208000006994 Precancerous Conditions Diseases 0.000 description 2
- 208000007541 Preleukemia Diseases 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 102100023832 Prolyl endopeptidase FAP Human genes 0.000 description 2
- 101710120463 Prostate stem cell antigen Proteins 0.000 description 2
- 102100036735 Prostate stem cell antigen Human genes 0.000 description 2
- 102100035703 Prostatic acid phosphatase Human genes 0.000 description 2
- 102100035764 Proteasome subunit beta type-9 Human genes 0.000 description 2
- 102100037686 Protein SSX2 Human genes 0.000 description 2
- 101710149284 Protein SSX2 Proteins 0.000 description 2
- 102100038098 Protein-glutamine gamma-glutamyltransferase 5 Human genes 0.000 description 2
- 108010024221 Proto-Oncogene Proteins c-bcr Proteins 0.000 description 2
- 102000015690 Proto-Oncogene Proteins c-bcr Human genes 0.000 description 2
- 108091034057 RNA (poly(A)) Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 208000007660 Residual Neoplasm Diseases 0.000 description 2
- 102100027610 Rho-related GTP-binding protein RhoC Human genes 0.000 description 2
- 101800001271 Surface protein Proteins 0.000 description 2
- 102100024219 T-cell surface glycoprotein CD1a Human genes 0.000 description 2
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 2
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 2
- 102100038717 TYRO protein tyrosine kinase-binding protein Human genes 0.000 description 2
- 102100036494 Testisin Human genes 0.000 description 2
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 2
- 108090000253 Thyrotropin Receptors Proteins 0.000 description 2
- 102100029337 Thyrotropin receptor Human genes 0.000 description 2
- 102100021393 Transcriptional repressor CTCFL Human genes 0.000 description 2
- 101710187882 Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 2
- 102100024036 Tyrosine-protein kinase Lck Human genes 0.000 description 2
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 2
- 102000013532 Uroplakin II Human genes 0.000 description 2
- 108010065940 Uroplakin II Proteins 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 2
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 2
- 102100022748 Wilms tumor protein Human genes 0.000 description 2
- 101710127857 Wilms tumor protein Proteins 0.000 description 2
- 102100039490 X antigen family member 1 Human genes 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 238000007792 addition Methods 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 108010034034 alpha-1,6-mannosylglycoprotein beta 1,6-N-acetylglucosaminyltransferase Proteins 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 230000005975 antitumor immune response Effects 0.000 description 2
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 210000001772 blood platelet Anatomy 0.000 description 2
- 230000009702 cancer cell proliferation Effects 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 208000024207 chronic leukemia Diseases 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 230000001461 cytolytic effect Effects 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 230000000779 depleting effect Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 108010051081 dopachrome isomerase Proteins 0.000 description 2
- 230000003828 downregulation Effects 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 108010072257 fibroblast activation protein alpha Proteins 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 108010003374 fms-Like Tyrosine Kinase 3 Proteins 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 230000007274 generation of a signal involved in cell-cell signaling Effects 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 230000008004 immune attack Effects 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 230000009545 invasion Effects 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 239000013610 patient sample Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 108010043671 prostatic acid phosphatase Proteins 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 108010073531 rhoC GTP-Binding Protein Proteins 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- 210000000130 stem cell Anatomy 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 108010058721 transglutaminase 5 Proteins 0.000 description 2
- 230000005945 translocation Effects 0.000 description 2
- 238000011269 treatment regimen Methods 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 description 1
- FSPQCTGGIANIJZ-UHFFFAOYSA-N 2-[[(3,4-dimethoxyphenyl)-oxomethyl]amino]-4,5,6,7-tetrahydro-1-benzothiophene-3-carboxamide Chemical compound C1=C(OC)C(OC)=CC=C1C(=O)NC1=C(C(N)=O)C(CCCC2)=C2S1 FSPQCTGGIANIJZ-UHFFFAOYSA-N 0.000 description 1
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 1
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 1
- 108060003355 ADRB3 Proteins 0.000 description 1
- 102000017918 ADRB3 Human genes 0.000 description 1
- 102100022907 Acrosin-binding protein Human genes 0.000 description 1
- 101710107749 Acrosin-binding protein Proteins 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- 101710096292 Adhesion G protein-coupled receptor E2 Proteins 0.000 description 1
- 102100026423 Adhesion G protein-coupled receptor E5 Human genes 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 206010073478 Anaplastic large-cell lymphoma Diseases 0.000 description 1
- 102100032187 Androgen receptor Human genes 0.000 description 1
- 102000009840 Angiopoietins Human genes 0.000 description 1
- 108010009906 Angiopoietins Proteins 0.000 description 1
- 102100023003 Ankyrin repeat domain-containing protein 30A Human genes 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 229940088872 Apoptosis inhibitor Drugs 0.000 description 1
- 102000030431 Asparaginyl endopeptidase Human genes 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 102100025218 B-cell differentiation antigen CD72 Human genes 0.000 description 1
- 102000008096 B7-H1 Antigen Human genes 0.000 description 1
- 102100027522 Baculoviral IAP repeat-containing protein 7 Human genes 0.000 description 1
- 102100034159 Beta-3 adrenergic receptor Human genes 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 102000007645 CD24 Antigen Human genes 0.000 description 1
- 108010071965 CD24 Antigen Proteins 0.000 description 1
- 108010058905 CD44v6 antigen Proteins 0.000 description 1
- 201000004085 CLL/SLL Diseases 0.000 description 1
- 101100518995 Caenorhabditis elegans pax-3 gene Proteins 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 101710120600 Cancer/testis antigen 1 Proteins 0.000 description 1
- 101710120595 Cancer/testis antigen 2 Proteins 0.000 description 1
- 102100024633 Carbonic anhydrase 2 Human genes 0.000 description 1
- 102000013392 Carboxylesterase Human genes 0.000 description 1
- 108010051152 Carboxylesterase Proteins 0.000 description 1
- 101710181340 Chaperone protein DnaK2 Proteins 0.000 description 1
- 108091062157 Cis-regulatory element Proteins 0.000 description 1
- 102100035167 Coiled-coil domain-containing protein 54 Human genes 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 1
- 108010060385 Cyclin B1 Proteins 0.000 description 1
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 1
- 101100481408 Danio rerio tie2 gene Proteins 0.000 description 1
- 206010011968 Decreased immune responsiveness Diseases 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- 102100031334 Elongation factor 2 Human genes 0.000 description 1
- 102100031780 Endonuclease Human genes 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 101710144543 Endosialin Proteins 0.000 description 1
- 102100023721 Ephrin-B2 Human genes 0.000 description 1
- 108010044090 Ephrin-B2 Proteins 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- 102000002090 Fibronectin type III Human genes 0.000 description 1
- 108050009401 Fibronectin type III Proteins 0.000 description 1
- 102100026121 Flap endonuclease 1 Human genes 0.000 description 1
- 102000010451 Folate receptor alpha Human genes 0.000 description 1
- 108050001931 Folate receptor alpha Proteins 0.000 description 1
- 102000010449 Folate receptor beta Human genes 0.000 description 1
- 108050001930 Folate receptor beta Proteins 0.000 description 1
- 108090000123 Fos-related antigen 1 Proteins 0.000 description 1
- 102100023372 Fos-related antigen 1 Human genes 0.000 description 1
- 108010084795 Fusion Oncogene Proteins Proteins 0.000 description 1
- 102000005668 Fusion Oncogene Proteins Human genes 0.000 description 1
- 102100021197 G-protein coupled receptor family C group 5 member D Human genes 0.000 description 1
- 102100032340 G2/mitotic-specific cyclin-B1 Human genes 0.000 description 1
- 102000027583 GPCRs class C Human genes 0.000 description 1
- 108091008882 GPCRs class C Proteins 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- BCCRXDTUTZHDEU-VKHMYHEASA-N Gly-Ser Chemical compound NCC(=O)N[C@@H](CO)C(O)=O BCCRXDTUTZHDEU-VKHMYHEASA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102100031547 HLA class II histocompatibility antigen, DO alpha chain Human genes 0.000 description 1
- 102000025850 HLA-A2 Antigen Human genes 0.000 description 1
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 1
- 206010066476 Haematological malignancy Diseases 0.000 description 1
- 101710178419 Heat shock protein 70 2 Proteins 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 241000709721 Hepatovirus A Species 0.000 description 1
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 1
- 101000718211 Homo sapiens Adhesion G protein-coupled receptor E2 Proteins 0.000 description 1
- 101000718243 Homo sapiens Adhesion G protein-coupled receptor E5 Proteins 0.000 description 1
- 101000757191 Homo sapiens Ankyrin repeat domain-containing protein 30A Proteins 0.000 description 1
- 101000934359 Homo sapiens B-cell differentiation antigen CD72 Proteins 0.000 description 1
- 101000936083 Homo sapiens Baculoviral IAP repeat-containing protein 7 Proteins 0.000 description 1
- 101000780539 Homo sapiens Beta-3 adrenergic receptor Proteins 0.000 description 1
- 101000884279 Homo sapiens CD276 antigen Proteins 0.000 description 1
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 description 1
- 101000889345 Homo sapiens Cancer/testis antigen 2 Proteins 0.000 description 1
- 101000760643 Homo sapiens Carbonic anhydrase 2 Proteins 0.000 description 1
- 101000737052 Homo sapiens Coiled-coil domain-containing protein 54 Proteins 0.000 description 1
- 101000913035 Homo sapiens Flap endonuclease 1 Proteins 0.000 description 1
- 101001040713 Homo sapiens G-protein coupled receptor family C group 5 member D Proteins 0.000 description 1
- 101000866278 Homo sapiens HLA class II histocompatibility antigen, DO alpha chain Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101001014223 Homo sapiens MAPK/MAK/MRK overlapping kinase Proteins 0.000 description 1
- 101001057249 Homo sapiens Mastermind-like domain-containing protein 1 Proteins 0.000 description 1
- 101000578784 Homo sapiens Melanoma antigen recognized by T-cells 1 Proteins 0.000 description 1
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 1
- 101001094545 Homo sapiens Retrotransposon-like protein 1 Proteins 0.000 description 1
- 101000714168 Homo sapiens Testisin Proteins 0.000 description 1
- 101000725972 Homo sapiens Transcriptional repressor CTCF Proteins 0.000 description 1
- 101000638154 Homo sapiens Transmembrane protease serine 2 Proteins 0.000 description 1
- 101000662009 Homo sapiens UDP-N-acetylglucosamine pyrophosphorylase Proteins 0.000 description 1
- 241000725303 Human immunodeficiency virus Species 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 108010031794 IGF Type 1 Receptor Proteins 0.000 description 1
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 1
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 1
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 102100039615 Inactive tyrosine-protein kinase transmembrane receptor ROR1 Human genes 0.000 description 1
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 description 1
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 description 1
- 101710184277 Insulin-like growth factor 1 receptor Proteins 0.000 description 1
- 102000015271 Intercellular Adhesion Molecule-1 Human genes 0.000 description 1
- 102000004553 Interleukin-11 Receptors Human genes 0.000 description 1
- 108010017521 Interleukin-11 Receptors Proteins 0.000 description 1
- 102100020793 Interleukin-13 receptor subunit alpha-2 Human genes 0.000 description 1
- 101710112634 Interleukin-13 receptor subunit alpha-2 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 102100034872 Kallikrein-4 Human genes 0.000 description 1
- 208000032004 Large-Cell Anaplastic Lymphoma Diseases 0.000 description 1
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 1
- 102100032129 Lymphocyte antigen 6K Human genes 0.000 description 1
- 102100031520 MAPK/MAK/MRK overlapping kinase Human genes 0.000 description 1
- 102000043129 MHC class I family Human genes 0.000 description 1
- 108700012912 MYCN Proteins 0.000 description 1
- 101150022024 MYCN gene Proteins 0.000 description 1
- 101001059732 Malassezia furfur Putative peroxiredoxin Proteins 0.000 description 1
- 102100027235 Mastermind-like domain-containing protein 1 Human genes 0.000 description 1
- 102100028389 Melanoma antigen recognized by T-cells 1 Human genes 0.000 description 1
- 102000000440 Melanoma-associated antigen Human genes 0.000 description 1
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 1
- 102000008840 Melanoma-associated antigen 1 Human genes 0.000 description 1
- 108050000731 Melanoma-associated antigen 1 Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- 241001024304 Mino Species 0.000 description 1
- 101150097381 Mtor gene Proteins 0.000 description 1
- 101000858032 Mus musculus Coxsackievirus and adenovirus receptor homolog Proteins 0.000 description 1
- 101001124276 Mus musculus Nuclear receptor subfamily 1 group I member 3 Proteins 0.000 description 1
- 101100518997 Mus musculus Pax3 gene Proteins 0.000 description 1
- 101100351020 Mus musculus Pax5 gene Proteins 0.000 description 1
- 101100481410 Mus musculus Tek gene Proteins 0.000 description 1
- 108700026495 N-Myc Proto-Oncogene Proteins 0.000 description 1
- 102100030124 N-myc proto-oncogene protein Human genes 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 102000003729 Neprilysin Human genes 0.000 description 1
- 108090000028 Neprilysin Proteins 0.000 description 1
- 102100024964 Neural cell adhesion molecule L1 Human genes 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- KUIFHYPNNRVEKZ-VIJRYAKMSA-N O-(N-acetyl-alpha-D-galactosaminyl)-L-threonine Chemical compound OC(=O)[C@@H](N)[C@@H](C)O[C@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1NC(C)=O KUIFHYPNNRVEKZ-VIJRYAKMSA-N 0.000 description 1
- 102220487048 Olfactory receptor 8H1_G2S_mutation Human genes 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 102100040891 Paired box protein Pax-3 Human genes 0.000 description 1
- 101710149060 Paired box protein Pax-3 Proteins 0.000 description 1
- 102100037504 Paired box protein Pax-5 Human genes 0.000 description 1
- 101710149067 Paired box protein Pax-5 Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 108010077519 Peptide Elongation Factor 2 Proteins 0.000 description 1
- 108010051742 Platelet-Derived Growth Factor beta Receptor Proteins 0.000 description 1
- 101710164680 Platelet-derived growth factor receptor beta Proteins 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 102000015623 Polynucleotide Adenylyltransferase Human genes 0.000 description 1
- 108010024055 Polynucleotide adenylyltransferase Proteins 0.000 description 1
- 206010036524 Precursor B-lymphoblastic lymphomas Diseases 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108020005161 RNA Caps Proteins 0.000 description 1
- 108010006700 Receptor Tyrosine Kinase-like Orphan Receptors Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 101710100968 Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101710151245 Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 241000712907 Retroviridae Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 102100022441 Sperm surface protein Sp17 Human genes 0.000 description 1
- 206010041660 Splenomegaly Diseases 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 208000020982 T-lymphoblastic lymphoma Diseases 0.000 description 1
- 210000000662 T-lymphocyte subset Anatomy 0.000 description 1
- 102000018679 Tacrolimus Binding Proteins Human genes 0.000 description 1
- 108010027179 Tacrolimus Binding Proteins Proteins 0.000 description 1
- 108010017842 Telomerase Proteins 0.000 description 1
- 206010058901 Testicular mass Diseases 0.000 description 1
- 108050003829 Testisin Proteins 0.000 description 1
- 102100027671 Transcriptional repressor CTCF Human genes 0.000 description 1
- 101710128101 Transcriptional repressor CTCFL Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- 102100031989 Transmembrane protease serine 2 Human genes 0.000 description 1
- 102100034392 Trypsin-2 Human genes 0.000 description 1
- 101710119666 Trypsin-2 Proteins 0.000 description 1
- 102100033254 Tumor suppressor ARF Human genes 0.000 description 1
- 101710102803 Tumor suppressor ARF Proteins 0.000 description 1
- 102000003425 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- 102100037921 UDP-N-acetylglucosamine pyrophosphorylase Human genes 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 101710101493 Viral myc transforming protein Proteins 0.000 description 1
- 210000001766 X chromosome Anatomy 0.000 description 1
- 101100351021 Xenopus laevis pax5 gene Proteins 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 229950006790 adenosine phosphate Drugs 0.000 description 1
- 150000003838 adenosines Chemical class 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- 230000003281 allosteric effect Effects 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 108010080146 androgen receptors Proteins 0.000 description 1
- 239000000158 apoptosis inhibitor Substances 0.000 description 1
- 108010055066 asparaginylendopeptidase Proteins 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 1
- 229960002707 bendamustine Drugs 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 238000005842 biochemical reaction Methods 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 238000010322 bone marrow transplantation Methods 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000011748 cell maturation Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 208000018805 childhood acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000011654 childhood malignant neoplasm Diseases 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 208000023738 chronic lymphocytic leukemia/small lymphocytic lymphoma Diseases 0.000 description 1
- 230000007012 clinical effect Effects 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 230000004940 costimulation Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 230000003436 cytoskeletal effect Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 230000003203 everyday effect Effects 0.000 description 1
- 230000003090 exacerbative effect Effects 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 125000002446 fucosyl group Chemical group C1([C@@H](O)[C@H](O)[C@H](O)[C@@H](O1)C)* 0.000 description 1
- 238000002825 functional assay Methods 0.000 description 1
- PFJKOHUKELZMLE-VEUXDRLPSA-N ganglioside GM3 Chemical compound O[C@@H]1[C@@H](O)[C@H](OC[C@@H]([C@H](O)/C=C/CCCCCCCCCCCCC)NC(=O)CCCCCCCCCCCCC\C=C/CCCCCCCC)O[C@H](CO)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@]2(O[C@H]([C@H](NC(C)=O)[C@@H](O)C2)[C@H](O)[C@H](O)CO)C(O)=O)[C@@H](O)[C@@H](CO)O1 PFJKOHUKELZMLE-VEUXDRLPSA-N 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000036252 glycation Effects 0.000 description 1
- 150000002333 glycines Chemical group 0.000 description 1
- 108010033706 glycylserine Proteins 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical class O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 1
- 229940029575 guanosine Drugs 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 102000027596 immune receptors Human genes 0.000 description 1
- 108091008915 immune receptors Proteins 0.000 description 1
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 108010023260 immunoglobulin Fv Proteins 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 230000002434 immunopotentiative effect Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 108010024383 kallikrein 4 Proteins 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 230000001589 lymphoproliferative effect Effects 0.000 description 1
- 201000000564 macroglobulinemia Diseases 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 210000001167 myeloblast Anatomy 0.000 description 1
- 210000003887 myelocyte Anatomy 0.000 description 1
- 125000001419 myristoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 208000037916 non-allergic rhinitis Diseases 0.000 description 1
- 230000030147 nuclear export Effects 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 231100000590 oncogenic Toxicity 0.000 description 1
- 230000002246 oncogenic effect Effects 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 101710135378 pH 6 antigen Proteins 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 229940114393 pembrolizumab injection Drugs 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 210000001539 phagocyte Anatomy 0.000 description 1
- 239000002831 pharmacologic agent Substances 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 229950010773 pidilizumab Drugs 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000002250 progressing effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 238000002818 protein evolution Methods 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 230000007420 reactivation Effects 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 201000006845 reticulosarcoma Diseases 0.000 description 1
- 208000029922 reticulum cell sarcoma Diseases 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 102220191892 rs199825512 Human genes 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 125000005630 sialyl group Chemical group 0.000 description 1
- 230000008054 signal transmission Effects 0.000 description 1
- 230000007781 signaling event Effects 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 108010088201 squamous cell carcinoma-related antigen Proteins 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000011301 standard therapy Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 208000008732 thymoma Diseases 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000004222 uncontrolled growth Effects 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 1
- 229940045145 uridine Drugs 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001111—Immunoglobulin superfamily
- A61K39/001112—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/46—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the cancer treated
- A61K2239/48—Blood cells, e.g. leukemia or lymphoma
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/463—Cellular immunotherapy characterised by recombinant expression
- A61K39/4631—Chimeric Antigen Receptors [CAR]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464411—Immunoglobulin superfamily
- A61K39/464412—CD19 or B4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57426—Specifically defined cancers leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/55—Medicinal preparations containing antigens or antibodies characterised by the host/recipient, e.g. newborn with maternal antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Molecular Biology (AREA)
- Cell Biology (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Mycology (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Urology & Nephrology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Biotechnology (AREA)
- Hospice & Palliative Care (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Virology (AREA)
Abstract
Description
本願は、ASCII形式で電子的に提出された配列表を含み、この配列表は、全体として参照により本明細書に援用される。2017年7月27日に作成された前記ASCII複製物は、N2067−7109WO_SL.txtという名称であり、サイズが907,582バイトである。
(i)CARを含む、例えば発現する免疫エフェクター細胞の集団を含むCAR療法であって、CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を対象に投与することを含む。
(i)CARを含む、例えば発現する免疫エフェクター細胞の集団を含むCAR療法であって、CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を対象に投与することを含む。
(i)CARを含む、例えば発現する免疫エフェクター細胞の集団を含むCAR療法であって、CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を対象に投与することを含む。
(a)CAR療法に対する部分奏効又は検出可能な奏効なし、
(b)CAR療法後の再発癌、
(c)CAR療法に不応性の癌、
(d)CAR療法後の進行型の癌、又は
(e)CAR療法後、例えば3ヵ月未満のB細胞回復
の1つ以上を有するか、又は有すると同定された後に開始される。
(i)キメラ抗原受容体(CAR)を含む、例えば発現する免疫エフェクター細胞の集団を含むCAR療法であって、CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を対象に投与することを含む。
(a)CAR療法に対する部分奏効又は検出可能な奏効なし、
(b)CAR療法後の再発癌、
(c)CAR療法に不応性の癌、
(d)進行型の癌、又は
(e)CAR療法後、例えば3ヵ月未満のB細胞回復
の1つ以上を有しないか、又は有すると同定されていない。
(i)配列番号503のVHCDR1アミノ酸配列、配列番号504のVHCDR2アミノ酸配列、及び配列番号505のVHCDR3アミノ酸配列を含む重鎖可変(VH)領域、及び
(ii)配列番号500のVLCDR1アミノ酸配列、配列番号501のVLCDR2アミノ酸配列、及び配列番号502のVLCDR3アミノ酸配列を含む軽鎖可変(VL)領域、又は
少なくとも85%、90%、95%又はそれを超えて同一の高いアミノ酸配列
を含む。
本明細書では、本明細書に記載される方法又は組成物のいずれかにおける使用のためのPD−1阻害薬が提供される。本明細書に記載される任意の方法又は組成物において、PD−1阻害薬は、抗体分子、小分子、ポリペプチド、例えば融合タンパク質、又は阻害核酸、例えばsiRNA若しくはshRNAを含む。
i)配列番号144のアミノ酸配列を含む重鎖及び配列番号152のアミノ酸配列を含む軽鎖、
ii)配列番号156又は160のアミノ酸配列を含む重鎖及び配列番号164のアミノ酸配列を含む軽鎖、
iii)配列番号156又は160のアミノ酸配列を含む重鎖及び配列番号170のアミノ酸配列を含む軽鎖
iv)配列番号174のアミノ酸配列を含む重鎖及び配列番号178のアミノ酸配列を含む軽鎖、
v)配列番号174のアミノ酸配列を含む重鎖及び配列番号182のアミノ酸配列を含む軽鎖、
vi)配列番号186のアミノ酸配列を含む重鎖及び配列番号182のアミノ酸配列を含む軽鎖、
vii)配列番号186のアミノ酸配列を含む重鎖及び配列番号190のアミノ酸配列を含む軽鎖、
viii)配列番号174のアミノ酸配列を含む重鎖及び配列番号190のアミノ酸配列を含む軽鎖、
ix)配列番号174のアミノ酸配列を含む重鎖及び配列番号194のアミノ酸配列を含む軽鎖、
x)配列番号174のアミノ酸配列を含む重鎖及び配列番号198のアミノ酸配列を含む軽鎖、
xi)配列番号186のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xii)配列番号174のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xiii)配列番号186のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、
xiv)配列番号174のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、
xv)配列番号174のアミノ酸配列を含む重鎖及び配列番号210のアミノ酸配列を含む軽鎖、
xvi)配列番号174のアミノ酸配列を含む重鎖及び配列番号214のアミノ酸配列を含む軽鎖、
xvii)配列番号218のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、
xviii)配列番号218のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xix)配列番号222のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xx)配列番号225のアミノ酸配列を含む重鎖及び配列番号178のアミノ酸配列を含む軽鎖、
xxi)配列番号225のアミノ酸配列を含む重鎖及び配列番号190のアミノ酸配列を含む軽鎖、
xxii)配列番号225のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xxiii)配列番号236のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、又は
xxiv)配列番号225のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖
を含む。
i)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
ii)配列番号142又は144のアミノ酸配列を含む重鎖可変ドメイン及び配列番号152のアミノ酸配列を含む軽鎖可変ドメイン、
iii)配列番号154又は158のアミノ酸配列を含む重鎖可変ドメイン及び配列番号162のアミノ酸配列を含む軽鎖可変ドメイン、
iv)配列番号154又は158のアミノ酸配列を含む重鎖可変ドメイン及び配列番号168のアミノ酸配列を含む軽鎖可変ドメイン、
v)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号176のアミノ酸配列を含む軽鎖可変ドメイン、
vi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号180のアミノ酸配列を含む軽鎖可変ドメイン、
vii)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号180のアミノ酸配列を含む軽鎖可変ドメイン、
viii)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号188のアミノ酸配列を含む軽鎖可変ドメイン、
ix)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号188のアミノ酸配列を含む軽鎖可変ドメイン、
x)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号192のアミノ酸配列を含む軽鎖可変ドメイン、
xi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号196のアミノ酸配列を含む軽鎖可変ドメイン、
xii)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xiii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xiv)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
xv)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
xvi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号208のアミノ酸配列を含む軽鎖可変ドメイン、
xvii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号212のアミノ酸配列を含む軽鎖可変ドメイン、
xviii)配列番号216のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
xix)配列番号216のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xx)配列番号220のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xxi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号176のアミノ酸配列を含む軽鎖可変ドメイン、
xxii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号188のアミノ酸配列を含む軽鎖可変ドメイン、
xxiii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、又は
xxiv)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン
を含む。
(a)配列番号140のVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含む重鎖可変領域(VH)、並びに配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含む軽鎖可変領域(VL)(それぞれ米国特許出願公開第2015/0210769号明細書の表1、又は本明細書の表6に開示される)、
(b)配列番号137から選択されるVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含むVL(それぞれ米国特許出願公開第2015/0210769号明細書の表1、又は本明細書の表6に開示される)、
(c)配列番号286のVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含むVL(それぞれ米国特許出願公開第2015/0210769号明細書の表1、又は本明細書の表6に開示される)、又は
(d)配列番号286のVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含むVL(それぞれ米国特許出願公開第2015/0210769号明細書の表1、又は本明細書の表6に開示される)
を含む。
(i)配列番号503のVHCDR1アミノ酸配列、配列番号504のVHCDR2アミノ酸配列、及び配列番号505のVHCDR3アミノ酸配列を含む重鎖可変(VH)領域、及び
(ii)配列番号500のVLCDR1アミノ酸配列、配列番号501のVLCDR2アミノ酸配列、及び配列番号502のVLCDR3アミノ酸配列を含む軽鎖可変(VL)領域、又は
少なくとも85%、90%、95%又はそれを超えて同一の高いアミノ酸配列
を含む。
本明細書には、本明細書に記載される方法又は組成物のいずれかにおける使用のための、抗原(例えば、CD19)を標的とする、例えばそれに特異的に結合するキメラ抗原受容体(CAR)を発現する細胞、例えば免疫エフェクター細胞が提供される。抗原Xに特異的に結合するCARは、本明細書では「X CAR」とも称される。例えば、CD19に特異的に結合するCARは、本明細書では「CD19 CAR」とも称される。本明細書に記載されるCAR発現細胞(例えば、CD19 CAR発現細胞)によって発現されるCAR(例えば、CD19 CAR)は、抗原結合ドメイン(例えば、CD19結合ドメイン)と、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む。一実施形態において、細胞内シグナル伝達ドメインは、共刺激ドメイン及び/又は一次シグナル伝達ドメインを含む。
一実施形態において、CD19結合ドメインは、表2又は表3に挙げられる任意のCD19重鎖結合ドメインアミノ酸配列の重鎖相補性決定領域1(HC CDR1)、重鎖相補性決定領域2(HC CDR2)、及び重鎖相補性決定領域3(HC CDR3)、並びに表2又は表3に挙げられる任意のCD19軽鎖結合ドメインアミノ酸配列の軽鎖相補性決定領域1(LC CDR1)、軽鎖相補性決定領域2(LC CDR2)、及び軽鎖相補性決定領域3(LC CDR3)を含む。一実施形態において、CD19結合ドメインは、表4のHC CDRアミノ酸配列に係るHC CDR1、HC CDR2、及びHC CDR3、並びに表5のLC CDRアミノ酸配列に係るLC CDR1、LC CDR2、及びLC CDR3を含む。
一実施形態において、CAR、例えばCD19 CARは、例えば、T細胞受容体のα、β又はζ鎖、CD28、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、及びCD154からなる群から選択されるタンパク質、例えば本明細書に記載されるタンパク質の膜貫通ドメインを含む膜貫通ドメインを含む。一実施形態において、膜貫通ドメインは、配列番号6の配列を含む。一実施形態において、膜貫通ドメインは、配列番号6のアミノ酸配列の少なくとも1、2、又は3つの改変であるが、20、10、又は5つ以下の改変を含むアミノ酸配列、又は配列番号6のアミノ酸配列と95〜99%の同一性を有する配列を含む。一実施形態において、膜貫通ドメインをコードする核酸配列は、配列番号17のヌクレオチド配列又はそれと少なくとも95%同一の(例えば、95〜99%の同一性を有する)配列を含む。
一実施形態において、CD19 CARは、配列番号108、配列番号93、配列番号94、配列番号95、配列番号96、配列番号97、配列番号98、配列番号99、配列番号100、配列番号101、配列番号102、配列番号103、配列番号104、配列番号111、配列番号114、又は配列番号116のいずれかのアミノ酸配列を含む。一実施形態において、CD19 CARは、配列番号108、配列番号93、配列番号94、配列番号95、配列番号96、配列番号97、配列番号98、配列番号99、配列番号100、配列番号101、配列番号102、配列番号103、配列番号104、配列番号111、配列番号114、又は配列番号116のいずれかに対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列を含む。一実施形態において、CD19 CARは、配列番号108、配列番号93、配列番号94、配列番号95、配列番号96、配列番号97、配列番号98、配列番号99、配列番号100、配列番号101、配列番号102、配列番号103、配列番号104、配列番号111、配列番号114、又は配列番号116のいずれかと少なくとも95%同一の(例えば、95〜99%の同一性を有する)アミノ酸配列を含む。
一実施形態において、対象、例えば免疫細胞を取得する対象及び/又は治療する対象は、ヒト、例えば癌患者である。特定の実施形態において、対象は、18歳以下(例えば、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、1歳又はそれ未満(例えば、12ヵ月、6ヵ月、3ヵ月又はそれ未満))である。一実施形態において、対象は、小児癌患者である。
特に定義されない限り、本明細書で使用される全ての科学技術用語は、本発明が関係する技術分野の当業者が一般に理解するのと同じ意味を有する。
例えば、メモリーT細胞上、例えばメモリーT細胞前駆体上の、以下のマーカー:CD62Lhigh、CD127high、CD27+、及びBCL2の1つ以上の発現の増加、
例えば、メモリーT細胞上、例えばメモリーT細胞前駆体上の、KLRG1の発現の減少、及び
メモリーT細胞前駆体、例えば以下の特性:CD62Lhighの増加、CD127highの増加、CD27+の増加、KLRG1の減少、及びBCL2の増加のいずれか1つ又は組み合わせを有する細胞の数の増加。
ここで、上記に記載される変化のいずれも、例えば未治療対象と比較したとき、例えば少なくとも一過性に起こる。
本明細書には、PD−1阻害薬と併用して、抗原、例えば本明細書に記載される抗原、例えばCD19を標的とするキメラ抗原受容体、例えばCD19 CARを含む細胞を投与することにより、癌などの疾患を治療するための組成物及び方法が提供される。CAR分子、例えばCD19 CAR及びCAR発現細胞(例えば、CD19 CAR発現細胞)を作成するための例示的構成要素は、本明細書に開示される。例示的PD−1阻害薬も本明細書に記載される。
本開示は、抗原、例えば本明細書に記載される抗原、例えばCD19を標的とする、例えばそれに特異的に結合するCAR分子(CAR、例えばCD19 CAR)を含む免疫エフェクター細胞(例えば、T細胞又はNK細胞)を包含する。一実施形態において、免疫エフェクター細胞は、CAR、例えばCD19 CARを発現するように操作される。一実施形態において、免疫エフェクター細胞は、CAR、例えばCD19 CARをコードする核酸配列を含む組換え核酸コンストラクトを含む。
一態様において、本開示のCARは、別様には抗原結合ドメインと称される標的特異的結合エレメントを含む。一実施形態において、CARのうちの抗原結合ドメインを含む部分は、抗原、例えば本明細書に記載される抗原、例えばCD19を標的とする、例えばそれに特異的に結合する抗原結合ドメインを含む。一実施形態において、抗原結合ドメインは、ヒトCD19を標的とし、例えばそれに特異的に結合する。
本明細書に開示される例示的CD19 CARコンストラクトは、任意選択で任意選択のリーダー配列(例えば、それぞれ例示的リーダーアミノ酸及びヌクレオチド配列について配列番号1及び配列番号12)が先行する、本明細書の表2又は表3に開示されるとおりのscFv(例えば、ヒトscFv)を含む。scFv断片の配列(配列番号45〜56、69〜80、106、109、110、112、又は115のアミノ酸配列)は、本明細書の表2又は表3に提供される。CD19 CAR構築物は、任意選択によるヒンジドメイン、例えばCD8ヒンジドメイン(例えば、配列番号2又は配列番号13の核酸配列によりコードされたアミノ酸配列を含む);膜貫通ドメイン、例えばCD8膜貫通ドメイン(例えば、配列番号6又は配列番号17のヌクレオチド配列によりコードされたアミノ酸配列を含む);細胞内ドメイン、例えば4−1BB細胞内ドメイン(例えば、配列番号7又は配列番号18のヌクレオチド配列によりコードされたアミノ酸配列を含み、及び機能的シグナル伝達ドメイン、例えばCD3ζドメイン(例えば、配列番号9若しくは10又は配列番号20若しくは21のヌクレオチド配列によりコードされたアミノ酸配列を含む)を更に含む。一実施形態において、ドメインは、単一融合タンパク質を形成するように同じリーディングフレームに隣接するか又はその中にある。他の実施形態において、ドメインは、例えば、本明細書に記載のようなRCAR分子におけるような別々のポリペプチドにある。
マウスCD19抗体のヒト化は、CART19処置、即ちCAR19構築物が形質導入されたT細胞での処置を受けている患者において、マウス特異的な残基がヒト抗マウス抗原(HAMA)応答を誘導することが可能な臨床条件にとって望ましい。ヒト化CD19 CAR配列の産生、特徴付け及び効能は、実施例1〜5(115〜159頁)、例えば表3、4及び5(125〜147頁)を含めて、その全体が参照により本明細書に組み入れられる国際公開第2014/153270号パンフレットにおいて説明されている。
国際公開第2014/153270号パンフレットに記載のCD19 CAR構築物の特定の配列を本明細書において再現する。
実施形態において、BCMA CARは、抗BCMA結合ドメイン(例えば、ヒト又はヒト化抗BCMA結合ドメイン)と、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含み、ここで、前記抗BCMA結合ドメインは、表7又は表8に挙げられる任意の抗BMCA重鎖結合ドメインアミノ酸配列の重鎖相補性決定領域1(HC CDR1)、重鎖相補性決定領域2(HC CDR2)、及び重鎖相補性決定領域3(HC CDR3)を含む。
一実施形態において、多特異性抗体分子は、二特異性抗体分子である。二特異性抗体は、2以下の抗原に特異性を有する。二特異性抗体分子は、第1エピトープに対する結合特異性を有する第1免疫グロブリン可変ドメイン配列及び第2エピトープに対する結合特異性を有する第2免疫グロブリン可変ドメイン配列により特徴付けられる。一実施形態において、第1及び第2エピトープは、同じ抗原、例えば同じタンパク質(又は多量体タンパク質のサブユニット)である。一実施形態において、第1及び第2エピトープは、重複する。一実施形態において、第1及び第2エピトープは、重複しない。一実施形態において、第1及び第2エピトープは、異なる抗原、例えば異なるタンパク質(又は多量体タンパク質の異なるサブユニット)にある。ある実施形態において、二重特異性抗体分子は、第1のエピトープに対して結合特異性を有する重鎖可変ドメイン配列及び軽鎖可変ドメイン配列と、第2のエピトープに対して結合特異性を有する重鎖可変ドメイン配列及び軽鎖可変ドメイン配列とを含む。一実施形態において、二特異性抗体分子は、第1エピトープに結合特異性を有する半抗体及び第2エピトープに結合特異性を有する半抗体を含む。一実施形態において、二特異性抗体分子は、第1エピトープに結合特異性を有する半抗体又はそのフラグメント及び第2エピトープに結合特異性を有する半抗体又はそのフラグメントを含む。一実施形態において、二特異性抗体分子は、第1エピトープに結合特異性を有するscFv又はそのフラグメント及び第2エピトープに結合特異性を有するscFv又はそのフラグメントを含む。
一態様において、本発明のCD19抗原及び抗原フラグメント(例えば、表2又は3に開示されるもの)を、CD19に特異的に結合するキメラTCRを作るために、T細胞受容体(「TCR」)鎖の1つ以上の定常ドメイン、例えばTCRα又はTCRβ鎖に移植できる。理論に拘束されないが、キメラTCRは、抗原結合によりTCR複合体を経てシグナル伝達すると考えられる。例えば、本明細書に記載するようなCD19 scFvを、TCR鎖、例えばTCRα鎖及び/又はTCRβ鎖の定常ドメイン、例えば少なくとも細胞外定常ドメイン、膜貫通ドメイン及び細胞質ドメインの部分に移植できる。別の例として、CD19抗体フラグメント、例えば本明細書に記載のようなVLドメインを、TCRα鎖の定常ドメインに移植でき、CD19抗体フラグメント、例えば本明細書に記載のようなVHドメインを、TCRβ鎖の定常ドメインに移植できる(又は代替的にVLドメインをTCRβ鎖の定常ドメインに移植し得、VHドメインをTCRα鎖に移植し得る)。別の例として、CD19抗体又は抗体フラグメントのCDR、例えば表4又は5に記載のCD19抗体又は抗体フラグメントのCDRをTCRα及び/又はβ鎖に移植して、CD19に特異的に結合するキメラTCRを生成し得る。例えば、本明細書に記載のLCDRをTCRα鎖の可変ドメインに移植し得、本明細書に記載のHCDRをTCRβ鎖の可変ドメインに移植し得、又はその逆も可能である。このようなキメラTCRは、当技術分野で知られる方法により産生し得る(例えば、Willemsen RA et al,Gene Therapy 2000;7:1369−1377;Zhang T et al,Cancer Gene Ther 2004;11:487−496;Aggen et al,Gene Ther.2012 Apr;19(4):365−74)。
膜貫通ドメインに関して、種々の実施形態において、CARは、CARの細胞外ドメインに結合する膜貫通ドメインを含むように設計できる。膜貫通ドメインは、膜貫通領域に隣接した1つ以上の更なるアミノ酸、例えば膜貫通が由来するタンパク質の細胞外領域と関係する1つ以上のアミノ酸(例えば、細胞外領域の1、2、3、4、5、6、7、8、9、10〜最大15アミノ酸)及び/又は膜貫通タンパク質が由来するタンパク質の細胞内領域と関係する1つ以上の更なるアミノ酸(例えば、細胞内領域の1、2、3、4、5、6、7、8、9、10〜最大15アミノ酸)を含み得る。一態様において、膜貫通ドメインは、CARの他のドメインの1つに関連するものであり、使用され、例えば、一実施形態において、膜貫通ドメインは、シグナル伝達ドメイン、共刺激ドメイン又はヒンジドメインが由来するのと同じタンパク質からのものであり得る。別の態様において、膜貫通ドメインは、CARの任意の他のドメインが由来するのと同じタンパク質に由来しない。ある例において、膜貫通ドメインは、このようなドメインが、同一又は異なる表面膜タンパク質の膜貫通ドメインと結合するのを避けるように、例えば受容体複合体の他のメンバーとの相互作用を最小化するように選択され又はアミノ酸置換による改変ができる。一態様において、膜貫通ドメインは、CAR発現細胞の細胞表面上の別のCARとホモ二量体化できる。異なる態様において、膜貫通ドメインのアミノ酸配列は、同じCAR発現細胞に存在する天然結合パートナーの結合ドメインとの相互作用を最小化するように改変又は置換され得る。
CARの細胞質ドメイン又は領域は、細胞内シグナル伝達ドメインを含む。細胞内シグナル伝達ドメインは、概して、CARが導入された免疫細胞の正常エフェクター機能の少なくとも1つの活性化に関与する。用語「エフェクター機能」は、細胞の特殊化した機能を指す。例えば、T細胞のエフェクター機能は、細胞溶解活性又はサイトカインの分泌を含めたヘルパー活性であり得る。従って、用語「細胞内シグナル伝達ドメイン」は、エフェクター機能シグナルを伝達し、且つ細胞が特殊化した機能を果たすように仕向けるタンパク質の一部分を指す。通常、細胞内シグナル伝達ドメイン全体を利用し得るが、多くの場合、必ずしも鎖全体を使用する必要はない。細胞内シグナル伝達ドメインのトランケート部分が使用される範囲において、それがエフェクター機能シグナルを伝達する限り、インタクトな鎖の代わりにかかるトランケート部分が使用され得る。従って、用語の細胞内シグナル伝達ドメインは、エフェクター機能シグナルを伝達するのに十分な細胞内シグナル伝達ドメインの任意のトランケート部分を含むことが意味される。
ある実施形態において、本明細書に記載されるCAR分子は、ナチュラルキラー細胞受容体(NKR)の1つ以上の成分を含み、それによりNKR−CARを形成する。NKR成分は、以下のナチュラルキラー細胞受容体:キラー細胞免疫グロブリン様受容体(KIR)、例えばKIR2DL1、KIR2DL2/L3、KIR2DL4、KIR2DL5A、KIR2DL5B、KIR2DS1、KIR2DS2、KIR2DS3、KIR2DS4、DIR2DS5、KIR3DL1/S1、KIR3DL2、KIR3DL3、KIR2DP1、及びKIR3DP1;自然細胞傷害性受容体(NCR)、例えばNKp30、NKp44、NKp46;免疫細胞受容体のシグナル伝達リンパ球活性化分子(SLAM)ファミリー、例えばCD48、CD229、2B4、CD84、NTB−A、CRACC、BLAME、及びCD2F−10;Fc受容体(FcR)、例えばCD16、及びCD64;及びLy49受容体、例えばLY49A、LY49Cのいずれかからの膜貫通ドメイン、ヒンジドメイン、又は細胞質ドメインであり得る。本明細書に記載されるNKR−CAR分子は、アダプター分子又は細胞内シグナル伝達ドメイン、例えばDAP12と相互作用し得る。NKR成分を含むCAR分子の例示的構成及び配列は、国際公開第2014/145252号パンフレット(この内容は、参照により本明細書に援用される)に記載されている。
一部の実施形態において、本明細書に記載されるCAR発現細胞は、スプリットCARを使用する。スプリットCAR手法については、国際公開第2014/055442号パンフレット及び同第2014/055657号パンフレット(参照により本明細書に援用される)に更に詳細に記載される。簡潔に言えば、スプリットCARシステムは、第1の抗原結合ドメイン及び共刺激ドメイン(例えば、4−1BB)を有する第1のCARを発現する細胞を含み、この細胞は、第2の抗原結合ドメイン及び細胞内シグナル伝達ドメイン(例えば、CD3ζ)を有する第2のCARも発現する。細胞が第1の抗原に遭遇すると、共刺激ドメインが活性化され、細胞が増殖する。細胞が第2の抗原に遭遇すると、細胞内シグナル伝達ドメインが活性化され、細胞死滅活性が始まる。従って、このCAR発現細胞は、両方の抗原の存在下に限り完全に活性化される。実施形態では、第1の抗原結合ドメインは、本明細書に記載される腫瘍抗原又はB細胞抗原を認識し、例えば本明細書に記載される抗原結合ドメインを含み、且つ第2の抗原結合ドメインは、第2の抗原、例えば本明細書に記載される第2の腫瘍抗原又は第2のB細胞抗原を認識する。
第2のCARの共発現
一態様において、本明細書に記載されるCAR発現細胞は、例えば、同じ標的(CD19)又は異なる標的(例えば、CD19以外の標的、例えばCD19以外のB細胞抗原、例えばCD10、CD20、CD22、CD34、CD123、FLT−3、ROR1、CD79b、CD179b、又はCD79a)に対する第2のCAR、例えば異なる抗原結合ドメインを含む第2のCARを更に含み得る。一実施形態において、CAR発現細胞は、第1の抗原を標的とし、共刺激性シグナル伝達ドメインを有するが、一次シグナル伝達ドメインを有しない細胞内シグナル伝達ドメインを含む第1のCAR、及び第2の異なる抗原を標的とし、一次シグナル伝達ドメインを有するが、共刺激性シグナル伝達ドメインを有しない細胞内シグナル伝達ドメインを含む第2のCARを含む。第1のCARへの共刺激性シグナル伝達ドメイン、例えば4−1BB、CD28、CD27、OX−40又はICOS及び一次シグナル伝達ドメイン、例えばCD3ζの第2のCARへの配置は、両標的が発現される細胞に対してCAR活性を制限する。一実施形態において、CAR発現細胞は、CD19結合ドメインと、膜貫通ドメインと、共刺激ドメインとを含む第1のCD19 CARと、CD19以外の抗原(例えば、CD19以外の標的、例えばCD19以外のB細胞抗原、例えばCD10、CD20、CD22、CD34、CD123、FLT−3、ROR1、CD79b、CD179b、又はCD79a)を標的とする第2のCARであって、抗原結合ドメインと、膜貫通ドメインと、一次シグナル伝達ドメインとを含む第2のCARとを含む。別の実施形態において、CAR発現細胞は、CD19結合ドメインと、膜貫通ドメインと、一次シグナル伝達ドメインとを含む第1のCD19 CARと、CD19以外の抗原(例えば、CD19以外の標的、例えばCD19以外のB細胞抗原、例えばCD10、CD20、CD22、CD34、CD123、FLT−3、ROR1、CD79b、CD179b、又はCD79a)を標的とする第2のCARであって、その抗原に対する抗原結合ドメインと、膜貫通ドメインと、共刺激シグナル伝達ドメインとを含む第2のCARとを含む。
別の態様において、本明細書に記載されるCAR発現細胞は、別の薬剤、例えばCAR発現細胞の活性又は適合性を増強する薬剤を更に発現することができる。
実施形態において、本明細書に記載のCAR発現細胞、例えばCD19 CAR発現細胞は、ケモカイン受容体分子を更に含む。T細胞におけるケモカイン受容体CCR2b又はCXCR2のトランスジェニック発現は、黒色腫及び神経芽腫を含むCCL2−又はCXCL1分泌固形腫瘍への輸送を促進する(Craddock et al.,J Immunother.2010 Oct;33(8):780−8及びKershaw et al.,Hum Gene Ther.2002 Nov 1;13(16):1971−80)。そのため、理論に拘束されることを望まないが、腫瘍、例えば固形腫瘍により分泌されるケモカインを認識するCAR発現細胞で発現されるケモカイン受容体は、CAR発現細胞の腫瘍への帰巣を改善し、CAR発現細胞の腫瘍への浸潤を促進し、CAR発現細胞の抗腫瘍効果を増強すると考えられる。ケモカイン受容体分子は、天然に存在する又は組み換えケモカイン受容体又はそのケモカイン結合フラグメントを含む。本明細書に記載のCAR発現細胞(例えば、CAR−Tx)における発現に適するケモカイン受容体分子は、CXCケモカイン受容体(例えば、CXCR1、CXCR2、CXCR3、CXCR4、CXCR5、CXCR6又はCXCR7)、CCケモカイン受容体(例えば、CCR1、CCR2、CCR3、CCR4、CCR5、CCR6、CCR7、CCR8、CCR9、CCR10又はCCR11)、CX3Cケモカイン受容体(例えば、CX3CR1)、XCケモカイン受容体(例えば、XCR1)又はそのケモカイン結合フラグメントを含む。一実施形態において、本明細書に記載のCARと共に発現するケモカイン受容体分子は、腫瘍により発現されるケモカインに基づいて選択する。一実施形態において、本明細書に記載のCAR発現細胞は、CCR2b受容体又はCXCR2受容体を更に含み、例えば発現する。一実施形態において、本明細書に記載のCAR及びケモカイン受容体分子は、同じベクターにあるか又は2つの異なるベクターにある。本明細書に記載のCAR及びケモカイン受容体分子が同じベクターにある実施形態において、CAR及びケモカイン受容体分子は、それぞれ2つの異なるプロモーターの制御下にあるか又は同じプロモーターの制御下にある。
本発明は、本発明の1つ以上のCARコンストラクトをコードする核酸配列を含むCARトランス遺伝子を提供する。一態様において、CARトランス遺伝子は、メッセンジャーRNA転写物として提供される。一態様において、CARトランス遺伝子は、DNAコンストラクトとして提供される。
本発明は、本発明のDNAが挿入されているベクターも提供する。レンチウイルスなどのレトロウイルス由来のベクターは、それらが導入遺伝子の長期の安定した組込み及び娘細胞への伝播を可能にするため、長期遺伝子導入を達成するのに適するツールである。レンチウイルスベクターは、肝細胞などの非増殖細胞を形質導入できる点で、マウス白血病ウイルスなどのオンコ−レトロウイルス由来のベクターを超える更なる利点を有する。更に低免疫原性であるという付加的利点も有する。
本明細書には、インビトロ転写RNA CARの作製方法が開示される。本発明は、細胞に直接トランスフェクトすることのできるCARコードRNAコンストラクトも含む。トランスフェクションに使用するためのmRNAの作成方法は、特別に設計されたプライマーによる鋳型のインビトロ転写(IVT)と、続くポリA付加とを伴うこともあり、3’及び5’非翻訳配列(「UTR」)、5’キャップ及び/又は配列内リボソーム進入部位(IRES)、発現させる核酸、及びポリAテール、典型的には50〜2000塩基長(配列番号35)を含むコンストラクトが作製される。このように作製されたRNAは、様々な種類の細胞を効率的にトランスフェクトすることができる。一態様において、鋳型は、CARの配列を含む。
一部の態様において、本明細書に記載されるCARをコードする核酸を細胞、又は組織、又は対象に送達するために非ウイルス方法を用いることができる。一部の実施形態において、非ウイルス方法は、トランスポゾン(転移因子とも称される)の使用を含む。一部の実施形態において、トランスポゾンは、それ自体をゲノム内の位置に挿入することのできるDNAの断片、例えば自己複製し且つそのコピーをゲノムに挿入する能力を有するDNAの断片、又はより長い核酸からスプライスアウトされ、且つゲノム内の別の場所に挿入され得るDNAの断片である。追加の例示的なトランスポゾン及び非ウイルス送達方法は、2016年4月8日に出願された国際公開第2016/164731号パンフレット(その全体が参照により援用される)の196〜198頁に記載されている。
拡大培養及び例えば本明細書に記載されるCARを発現させるための遺伝子改変に先立ち、細胞、例えばT細胞又はNK細胞の供給源を対象から入手することができる。用語「対象」は、免疫応答が惹起できる生存生物(例えば、哺乳動物)を含むことを意図する。対象の例は、ヒト、イヌ、ネコ、マウス、ラット及びそれらのトランスジェニック種を含む。
本明細書に記載の実施形態において、免疫エフェクター細胞は、同種免疫エフェクター細胞、例えばT細胞又はNK細胞であり得る。例えば、細胞は、同種T細胞、例えば機能的T細胞受容体(TCR)及び/又はヒト白血球抗原(HLA)、例えばHLAクラスI及び/又はHLAクラスIIの発現を欠く同種T細胞である。
一実施形態において、TCR発現及び/又はHLA発現を、細胞、例えばT細胞におけるTCR、及び/又はHLA、及び/又は本明細書に記載の阻害分子(例えば、PD1、PD−L1、PD−L2、CTLA4、TIM3、CEACAM(例えば、CEACAM−1、CEACAM−3及び/又はCEACAM−5)、LAG3、VISTA、BTLA、TIGIT、LAIR1、CD160、2B4、CD80、CD86、B7−H3(CD276)、B7−H4(VTCN1)、HVEM(TNFRSF14又はCD270)、KIR、A2aR、MHCクラスI、MHCクラスII、GAL9、アデノシン及びTGFβ)をコードする核酸を標的とするsiRNA又はshRNAを使用して阻害できる。
本明細書で使用する「CRISPR」、又は「TCR及び/又はHLAに対するCRISPR」、又は「TCR及び/又はHLAを阻害するためのCRISPR」は、一連の群生性等間隔短回文反復配列又はこのような一連の反復を含む系を指す。本明細書で使用する「Cas」は、CRISPR関連タンパク質を指す。
「TALEN」、又は「HLA及び/又はTCRに対するTALEN」、又は「HLA及び/又はTCRを阻害するTALEN」は、細胞、例えばT細胞内でのHLA及び/又はTCR遺伝子、及び/又は本明細書に記載される阻害性分子(例えば、PD1、PD−L1、PD−L2、CTLA4、TIM3、CEACAM(例えば、CEACAM−1、CEACAM−3及び/又はCEACAM−5)、LAG3、VISTA、BTLA、TIGIT、LAIR1、CD160、2B4、CD80、CD86、B7−H3(CD276)、B7−H4(VTCN1)、HVEM(TNFRSF14又はCD270)、KIR、A2aR、MHCクラスI、MHCクラスII、GAL9、アデノシン、及びTGFβ)の編集に使用し得る人工ヌクレアーゼである転写活性化因子様エフェクターヌクレアーゼを指す。
「ZFN」、又は「ジンクフィンガーヌクレアーゼ」、又は「HLA及び/又はTCRに対するZFN」、又は「HLA及び/又はTCRを阻害するZFN」は、細胞、例えばT細胞内でのHLA及び/又はTCR遺伝子、及び/又は本明細書に記載される阻害性分子(例えば、PD1、PD−L1、PD−L2、CTLA4、TIM3、CEACAM(例えば、CEACAM−1、CEACAM−3及び/又はCEACAM−5)、LAG3、VISTA、BTLA、TIGIT、LAIR1、CD160、2B4、CD80、CD86、B7−H3(CD276)、B7−H4(VTCN1)、HVEM(TNFRSF14又はCD270)、KIR、A2aR、MHCクラスI、MHCクラスII、GAL9、アデノシン、及びTGFβ)の編集に使用し得る人工ヌクレアーゼであるジンクフィンガーヌクレアーゼを指す。
何らかの特定の理論に拘束されることを望まないが、一実施形態において、治療的T細胞は、T細胞における短縮されたテロメアのために患者における残留性が短く、従って、テロメラーゼ遺伝子を用いるトランスフェクションは、T細胞のテロメアを延長し、患者におけるT細胞の残留性を改善し得る。Carl June,“Adoptive T cell therapy for cancer in the clinic”,Journal of Clinical Investigation,117:1466−1476(2007)を参照されたい。そのため、一実施形態において、免疫エフェクター細胞、例えばT細胞、異所性にテロメラーゼサブユニット、例えばテロメラーゼの触媒的サブユニット、例えばTERT、例えばhTERTを発現する。いくつかの態様において、本開示は、細胞をテロメラーゼサブユニット、例えばテロメラーゼの触媒的サブユニット、例えばTERT、例えばhTERTをコードする核酸と接触させることを含む、CAR発現細胞を産生する方法を提供する。細胞を、CARをコードする構築物と接触させる前に、同時に又は後に核酸と接触させ得る。
T細胞などの免疫エフェクター細胞は、概して、例えば米国特許第6,352,694号明細書、同第6,534,055号明細書、同第6,905,680号明細書、同第6,692,964号明細書、同第5,858,358号明細書、同第6,887,466号明細書、同第6,905,681号明細書、同第7,144,575号明細書、同第7,067,318号明細書、同第7,172,869号明細書、同第7,232,566号明細書、同第7,175,843号明細書、同第5,883,223号明細書、同第6,905,874号明細書、同第6,797,514号明細書、同第6,867,041号明細書、及び米国特許出願公開第20060121005号明細書に記載されるとおりの方法を用いて活性化し、拡大培養することができる。
別の態様において、本発明は、CAR発現細胞の集団、例えばCD19 CAR発現細胞の集団を提供する。一部の実施形態において、CAR発現細胞の集団は、異なるCARを発現する細胞の混合物を含む。
免疫系は、腫瘍細胞を認識し、それを除去する能力を有する。しかしながら、腫瘍は、複数の戦略を用いて免疫を逃れることができる。免疫チェックポイントの遮断は、治療的抗腫瘍免疫を活性化又は再活性化する手法である。PD−1は、例示的な免疫チェックポイント分子である。
一実施形態において、PD−1阻害薬は、「Antibody Molecules to PD−1 and Uses Thereof」という名称の2015年7月30日に公開された米国特許出願公開第2015/0210769号明細書(全体として参照により援用される)に記載されるとおりの抗PD−1抗体分子である。
(i)PD−1、例えばヒトPD−1に高親和性、例えば少なくとも約107M−1、典型的には約108M−1、及びより典型的には約109M−1〜1010M−1又はそれより強い親和性定数で結合する、
(ii)CD28、CTLA−4、ICOS又はBTLAに実質的に結合しない、
(iii)PD−1によるPD−1リガンド、例えばPD−L1又はPD−L2、又は両方への結合を阻害するか又は低下させる、
(iv)PD−1上のエピトープ、例えばマウスモノクローナル抗体BAP049又はキメラ抗体BAP049、例えばBAP049−chi又はBAP049−chi−Yによって認識されるエピトープと同じ又は同様のエピトープに特異的に結合する、
(v)BAP049−hum01、BAP049−hum02、BAP049−hum03、BAP049−hum04、BAP049−hum05、BAP049−hum06、BAP049−hum07、BAP049−hum08、BAP049−hum09、BAP049−hum10、BAP049−hum11、BAP049−hum12、BAP049−hum13、BAP049−hum14、BAP049−hum15、BAP049−hum16、BAP049−クローン−A、BAP049−クローン−B、BAP049−クローン−C、BAP049−クローン−D、又はBAP049−クローン−Eのいずれかと同じ又は同様の結合親和性若しくは特異性又は両方を示す、
(vi)表6に記載される抗体分子(例えば、重鎖可変領域及び軽鎖可変領域)と同じ又は同様の結合親和性若しくは特異性又は両方を示す、
(vii)表6に示されるアミノ酸配列を有する抗体分子(例えば、重鎖可変領域及び軽鎖可変領域)と同じ又は同様の結合親和性若しくは特異性又は両方を示す、
(viii)表6に示されるヌクレオチド配列によってコードされる抗体分子(例えば、重鎖可変領域及び軽鎖可変領域)と同じ又は同様の結合親和性若しくは特異性又は両方を示す、
(ix)第2の抗体分子によるPD−1への結合を阻害する、例えば競合的に阻害し、ここで、第2の抗体分子は、本明細書に記載される抗体分子、例えばBAP049−hum01、BAP049−hum02、BAP049−hum03、BAP049−hum04、BAP049−hum05、BAP049−hum06、BAP049−hum07、BAP049−hum08、BAP049−hum09、BAP049−hum10、BAP049−hum11、BAP049−hum12、BAP049−hum13、BAP049−hum14、BAP049−hum15、BAP049−hum16、BAP049−クローン−A、BAP049−クローン−B、BAP049−クローン−C、BAP049−クローン−D、又はBAP049−クローン−Eのいずれかから例えば選択される抗体分子である、
(x)PD−1に対する第2の抗体分子と同じ又は重複するエピトープに結合し、ここで、第2の抗体分子は、本明細書に記載される抗体分子、例えばBAP049−hum01、BAP049−hum02、BAP049−hum03、BAP049−hum04、BAP049−hum05、BAP049−hum06、BAP049−hum07、BAP049−hum08、BAP049−hum09、BAP049−hum10、BAP049−hum11、BAP049−hum12、BAP049−hum13、BAP049−hum14、BAP049−hum15、BAP049−hum16、BAP049−クローン−A、BAP049−クローン−B、BAP049−クローン−C、BAP049−クローン−D、又はBAP049−クローン−Eのいずれかから例えば選択される抗体分子である、
(xi)PD−1に対する第2の抗体分子と結合に関して競合し、及び/又はそれと同じエピトープに結合し、ここで、第2の抗体分子は、本明細書に記載される抗体分子、例えばBAP049−hum01、BAP049−hum02、BAP049−hum03、BAP049−hum04、BAP049−hum05、BAP049−hum06、BAP049−hum07、BAP049−hum08、BAP049−hum09、BAP049−hum10、BAP049−hum11、BAP049−hum12、BAP049−hum13、BAP049−hum14、BAP049−hum15、BAP049−hum16、BAP049−クローン−A、BAP049−クローン−B、BAP049−クローン−C、BAP049−クローン−D、又はBAP049−クローン−Eのいずれかから例えば選択される抗体分子である、
(xii)本明細書に記載される抗体分子、例えばBAP049−hum01、BAP049−hum02、BAP049−hum03、BAP049−hum04、BAP049−hum05、BAP049−hum06、BAP049−hum07、BAP049−hum08、BAP049−hum09、BAP049−hum10、BAP049−hum11、BAP049−hum12、BAP049−hum13、BAP049−hum14、BAP049−hum15、BAP049−hum16、BAP049−クローン−A、BAP049−クローン−B、BAP049−クローン−C、BAP049−クローン−D、又はBAP049−クローン−Eのいずれかから例えば選択される抗体分子の1つ以上の生物学的特性を有する、
(xiii)本明細書に記載される抗体分子、例えばBAP049−hum01、BAP049−hum02、BAP049−hum03、BAP049−hum04、BAP049−hum05、BAP049−hum06、BAP049−hum07、BAP049−hum08、BAP049−hum09、BAP049−hum10、BAP049−hum11、BAP049−hum12、BAP049−hum13、BAP049−hum14、BAP049−hum15、BAP049−hum16、BAP049−クローン−A、BAP049−クローン−B、BAP049−クローン−C、BAP049−クローン−D、又はBAP049−クローン−Eのいずれかから例えば選択される抗体分子の1つ以上の薬物動態特性を有する、
(xiv)PD−1の1つ以上の活性を阻害する、例えば腫瘍浸潤リンパ球の増加、T細胞受容体媒介性増殖の増加、又は癌性細胞による免疫回避の低下の1つ以上をもたらす、
(xv)ヒトPD−1に結合し、及びカニクイザルPD−1と交差反応性を有する、
(xvi)PD−1のC鎖、CC’ループ、C’鎖、若しくはFGループ、又はPD−1のC鎖、CC’ループ、C’鎖若しくはFGループの組み合わせの2、3つ又は全ての範囲内にある1つ以上の残基に結合し、例えば、ここで、結合は、ELISA又はBiacoreを用いてアッセイされる、又は
(xvii)VH領域よりも多くPD−1への結合に寄与するVL領域を有する。
(a)配列番号140のVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含む重鎖可変領域(VH)、並びに配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含む軽鎖可変領域(VL)、
(b)配列番号137から選択されるVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含むVL、
(c)配列番号286のVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含むVL、又は
(d)配列番号286のVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含むVL
を含む。
(i)配列番号137、配列番号140又は配列番号286から選択されるVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含む重鎖可変領域(VH)、及び
(ii)配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含む軽鎖可変領域(VL)
を含む。
(i)配列番号137、配列番号140又は配列番号286から選択されるVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含む重鎖可変領域(VH)、及び
(ii)配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含む軽鎖可変領域(VL)
を含む。
(a)配列番号140のVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含む重鎖可変領域(VH)、並びに配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含む軽鎖可変領域(VL)、
(b)配列番号137から選択されるVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含むVL、
(c)配列番号286のVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含むVL、又は
(d)配列番号286のVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含むVH、並びに配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含むVL
を含む。
(i)配列番号137、配列番号140又は配列番号286から選択されるVHCDR1アミノ酸配列、配列番号138のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含む重鎖可変領域(VH)、及び
(ii)配列番号146のVLCDR1アミノ酸配列、配列番号147のVLCDR2アミノ酸配列、及び配列番号166のVLCDR3アミノ酸配列を含む軽鎖可変領域(VL)
を含む。
(i)配列番号137、配列番号140又は配列番号286から選択されるVHCDR1アミノ酸配列、配列番号141のVHCDR2アミノ酸配列、及び配列番号139のVHCDR3アミノ酸配列を含む重鎖可変領域(VH)、及び
(ii)配列番号149のVLCDR1アミノ酸配列、配列番号150のVLCDR2アミノ酸配列、及び配列番号167のVLCDR3アミノ酸配列を含む軽鎖可変領域(VL)
を含む。
一実施形態では、PD−1の阻害剤は、例えば、米国特許第8,354,509号明細書及び国際公開第2009/114335号パンフレットに開示されており、且つ本明細書に開示される配列(又はそれと実質的に同一若しくは類似の配列、例えば指定される配列と少なくとも85%、90%、95%若しくはそれを超えて同一の配列)を有するペンブロリズマブである。一実施形態では、抗PD−1抗体分子は、ペンブロリズマブのCDR配列(若しくは集合的にCDR配列の全部)、重鎖若しくは軽鎖可変領域配列、又は重鎖若しくは軽鎖配列の1つ以上を含む。
(i)配列番号530のVHCDR1アミノ酸配列、配列番号531のVHCDR2アミノ酸配列、及び配列番号532のVHCDR3アミノ酸配列を含む重鎖可変(VH)領域、及び
(ii)配列番号527のVLCDR1アミノ酸配列、配列番号528のVLCDR2アミノ酸配列、及び配列番号529のVLCDR3アミノ酸配列を含む軽鎖可変(VL)領域、又は
それらと類似の配列、例えば少なくとも85%、90%、95%若しくはそれを超えて同一の配列
を含む。
軽鎖CDR2:LASYLES(配列番号528)
軽鎖CDR3:QHSRDLPLT(配列番号529)
重鎖CDR1:NYYMY(配列番号530)
重鎖CDR2:GINPSNGGTNFNEKFKN(配列番号531)
重鎖CDR3:RDYRFDMGFDY(配列番号532)
抗原(例えばCD19)関連疾患及び/又は障害
本開示は、例えば、抗原、例えばCD19の発現に関連する疾患及び障害(例えば、癌)を治療するための組成物及び方法を提供する。一態様では、本発明は、疾患を治療する方法を提供し、ここで、癌の一部は、抗原、例えばCD19について陰性であり、癌の一部は、抗原、例えばCD19について陽性である。
血液癌状態は、白血病、リンパ腫、並びに血液、骨髄及びリンパ系に影響する悪性リンパ増殖状態などの癌の種類である。
本明細書に記載する方法のいずれかを他の既知薬剤及び療法と組み合わせて使用し得る。
B群腫瘍溶解性アデノウイルス(ColoAd1)(PsiOxus Therapeutics Ltd.)(例えば、Clinical Trial Identifier:NCT02053220を参照されたい)、
顆粒球−マクロファージコロニー刺激因子(GM−CSF)を含むアデノウイルスであるONCOS−102(以前はCGTG−102と呼ばれた)(Oncos Therapeutics)(例えば、Clinical Trial Identifier:NCT01598129を参照されたい)、
ヒトPH20ヒアルロニダーゼをコードする遺伝的に改変された腫瘍溶解性ヒトアデノウイルスであるVCN−01(VCN Biosciences,S.L.)(例えば、Clinical Trial Identifiers:NCT02045602及びNCT02045589を参照されたい)、
網膜芽細胞腫/E2F経路の脱制御を伴い癌細胞で選択的に複製するように改変されている野生型ヒトアデノウイルス血清型5(Had5)由来のウイルスである条件的複製アデノウイルスICOVIR−5(Institut Catala d’Oncologia)(例えば、Clinical Trial Identifier:NCT01864759を参照されたい)、
ICOVIR5、腫瘍溶解性アデノウイルスで感染させた骨髄由来自己間葉性幹細胞(MSC)を含むCelyvir(Hospital Infantil Universitario Nino Jesus,Madrid,Spain/Ramon Alemany)(例えば、Clinical Trial Identifier:NCT01844661を参照されたい)、
ヒトE2F−1プロモーターが必須E1aウイルス遺伝子の発現を駆動し、それによりRb経路欠損腫瘍細胞に対するウイルス複製及び細胞毒性を制限する、条件複製腫瘍溶解性血清型5アデノウイルス(Ad5)であるCG0070(Cold Genesys,Inc.)(例えば、Clinical Trial Identifier:NCT02143804を参照されたい)、又は
網膜芽細胞腫(Rb)経路欠損細胞で選択的に複製し、ある種のRGD結合インテグリンをより効率的に発現する細胞に感染するように操作されているアデノウイルスであるDNX−2401(以前はデルタ−24−RGDと称された)(Clinica Universidad de Navarra,Universidad de Navarra/DNAtrix,Inc.)(例えば、Clinical Trial Identifier:NCT01956734を参照されたい)。
R1は、水素、任意選択によりヒドロキシで置換され得るC1−C6アルキルであり、
R2は、水素又はハロゲンであり、
R3は、水素又はハロゲンであり、
R4は、水素であり、
R5は、水素又はハロゲンであり、又は
R4とR5とは、互いに結合し、結合、−CH2−、−CH2−CH2−、−CH=CH−、−CH=CH−CH2−、−CH2−CH=CH−、又は−CH2−CH2−CH2−を意味し、
R6及びR7は、互いに独立してH、任意選択によりヒドロキシで置換され得るC1−C6アルキル、任意選択によりハロゲン又はヒドロキシ又はハロゲンで置換され得るC3−C6シクロアルキルであり、
R8、R9、R、R’、R10及びR11は、互いに独立してH又は任意選択によりC1−C6アルコキシで置換され得るC1−C6アルキルであり、又はR8、R9、R、R’、R10及びR11の任意の2個は、それらが結合している炭素原子と一体となって3〜6員飽和炭素環式環を形成し得、
R12は、水素又は任意選択によりハロゲン若しくはC1−C6アルコキシで置換され得るC1−C6アルキルであり、又は
R12及びR8、R9、R、R’、R10又はR11のいずれか1つは、それらが結合している原子と一体となって、4員、5員、6員又は7員アザシクロ環を形成し得、その環は、任意選択によりハロゲン、シアノ、ヒドロキシル、C1−C6アルキル又はC1−C6アルコキシで置換され得、
nは、0又は1であり、
R13は、任意選択によりC1−C6アルキルで置換され得るC2−C6アルケニル、C1−C6アルコキシ又は任意選択によりC1−C6アルキル若しくはC1−C6アルコキシで置換され得るN,N−ジ−C1−C6アルキルアミノC2−C6アルキニル、又は任意選択によりC1−C6アルキルで置換され得るC2−C6アルキレニルオキシドである。
一実施形態において、T細胞機能を調節又は制御、例えば阻害する薬剤は、阻害分子に結合する抗体又は抗体フラグメントであり得る。例えば、薬剤は、PD1、PD−L1、PD−L2又はCTLA4に結合する抗体又は抗体フラグメント(例えば、イピリムマブ(MDX−010及びMDX−101とも呼ばれ、Yervoy(登録商標)として市販されている;Bistol−Myers Squibb;トレメリムマブ(Pfizerから市販されているIgG2モノクローナル抗体、旧名チシリムマブ、CP−675,206)であり得る。一実施形態において、薬剤は、TIM3に結合する抗体又は抗体フラグメントである。一実施形態において、薬剤は、LAG3に結合する抗体又は抗体フラグメントである。一実施形態において、薬剤は、PD−L1に結合する抗体又は抗体フラグメントである。
一実施形態では、本明細書に記載の併用療法、例えばCAR発現細胞(例えば、CD19 CAR発現細胞)及びPD−1阻害剤を低い免疫増強用量のmTOR阻害剤と組み合わせて投与する。
サイトカイン放出症候群(CRS)は、癌免疫療法、例えば癌抗体療法又はT細胞免疫療法(例えば、CAR T細胞)の結果として起こり得る潜在的に生命を脅かすサイトカイン関連毒性である。CRSは、多数のリンパ球及び/又は骨髄細胞が、活性化時に炎症性サイトカインを放出する際の高レベルの免疫活性化に起因する。CRSの重症度及び症状開始のタイミングは、対象における免疫細胞活性化の規模、投与される治療法の種類、及び/又は腫瘍負荷の程度に応じて変動し得る。癌のためのT細胞療法の場合、症状の開始は、インビボでのT細胞増殖のピークがある場合、典型的には、T細胞療法の投与後の数日〜数週間である。例えば、Lee et al.Blood.124.2(2014):188−95を参照されたい。
一部の実施形態において、CRSを以下のような1〜5の重症度にグレード付けすることができる。グレード1〜3は、重症CRS未満である。グレード4〜5は、重症CRSである。グレード1のCRSについては、対症処置のみが必要であり(例えば、悪心、発熱、疲労、筋肉痛、不快感、頭痛)、症状は、生命を脅かすものではない。グレード2のCRSについては、症状は適度の介入を必要とし、一般的に適度の介入に応答する。グレード2のCRSを有する対象は、液体若しくは1種の低用量昇圧剤に応答する低血圧を発症するか、又は対象は、グレード2の臓器毒性若しくは低流量の酸素(40%未満の酸素)に応答する軽度の呼吸器症状を発症する。グレード3のCRS対象では、低血圧は、一般的に、液体療法又は1回の低用量昇圧剤によって逆転させることができない。これらの対象は、一般的に、低流量酸素より多くのものを必要とし、グレード3の臓器毒性(例えば、腎若しくは心機能障害又は血液凝固障害)及び/又はグレード4の高トランスアミナーゼ血症を有する。グレード3のCRS対象は、より積極的な介入、例えば40%以上の酸素、高用量昇圧剤、及び/又は複数の昇圧剤を必要とする。グレード4のCRS対象は、グレード4の臓器毒性又は機械的人工換気の必要性を含む、直ちに生命を脅かす症状に罹患する。グレード4のCRS対象は、一般的に、高トランスアミナーゼ血症を有さない。グレード5のCRS対象では、毒性は、死亡の原因となる。例えば、CRSをグレード付けするための基準は、表Aとして本明細書に提供される。特に指定がない限り、本明細書で使用されるCRSは、表Aの基準によるCRSを指す。
CRSのための療法としては、IL−6阻害剤又はIL−6受容体(IL−6R)阻害剤(例えば、トシリズマブ又はシルツキシマブ)、sgp130遮断剤、血管作動性薬剤、コルチコステロイド、免疫抑制剤、及び機械的人工換気が挙げられる。CRSのための例示的療法は、国際公開第2014011984号パンフレットに記載され、これは、参照により本明細書に援用される。
本発明の医薬組成物は、本明細書に記載のように、CAR発現細胞、例えば複数のCAR発現細胞を1つ以上の薬学的に又は生理学的に許容される担体、希釈剤又は添加物と組み合わせて含む。このような組成物は、中性緩衝化食塩水、リン酸緩衝化食塩水などの緩衝液;グルコース、マンノース、スクロース又はデキストラン、マンニトールなどの炭水化物;タンパク質;グリシンなどのポリペプチド又はアミノ酸;抗酸化剤;EDTA又はグルタチオンなどのキレート剤;アジュバント(例えば、水酸化アルミニウム);及び防腐剤を含み得る。本発明の組成物は、1つの態様において静脈内投与用に製剤される。
「免疫学的に有効量」、「有効用量」、「抗腫瘍有効量」、「腫瘍阻害有効量」、又は「治療量」が示されるとき、本発明の組成物の投与すべき正確な量は、患者(対象)の年齢、体重、腫瘍サイズ、感染又は転移の程度、及び状態の個体差を考慮して医師が決定することができる。
a)第1の用量で投与されるCAR発現生存細胞の数は、第2の用量で投与されるCAR発現生存細胞の数の1/3以下である、
b)第1の用量で投与されるCAR発現生存細胞の数は、投与されるCAR発現生存細胞の総数の1/X以下であり、ここで、Xは、2、3、4、5、6、7、8、9、10、15、20、30、40、又は50である、
c)第1の用量で投与されるCAR発現生存細胞の数は、1×107、2×107、3×107、4×107、5×107、6×107、7×107、8×107、9×107、1×108、2×108、3×108、4×108、又は5×108以下のCAR発現生存細胞であり、第2の用量は、第1の用量より大きい、
d)第2の用量で投与されるCAR発現生存細胞の数は、第3の用量で投与されるCAR発現生存細胞の数の1/2以下である、
e)第2の用量で投与されるCAR発現生存細胞の数は、投与されるCAR発現生存細胞の総数の1/Y以下であり、ここで、Yは、2、3、4、5、6、7、8、9、10、15、20、30、40、又は50である、
f)第2の用量で投与されるCAR発現生存細胞の数は、1×107、2×107、3×107、4×107、5×107、6×107、7×107、8×107、9×107、1×108、2×108、3×108、4×108、又は5×108以下のCAR発現生存細胞であり、第3の用量は、第2の用量より大きい、
h)第1の用量、第2の用量、及び任意選択的に第3の用量の投与の用量及び期間は、対象が4、3、2又は1以下のレベルのCRSを経験するように選択される。
「ダブルヒット」DLBCLに変化した濾胞性リンパ腫を有する34歳の女性を、PD−1アンタゴニストと組み合わせたCD19 CART細胞注入により処置した。女性は、同種骨髄移植を含む11種の選択化学療法及び免疫療法を以前に受けていたが、これまでの治療法に対して非応答性であった。女性は、CD19 CART細胞(CTL019)の投与前に、リンパ球枯渇化学療法(例えば、カルボプラチン及びゲムシタビン)を受けた。CTL019を女性に投与し、続く放射線療法の後、PD−1アンタゴニスト、ペンブロリズマブ(ヒト化IgG4抗PD−1モノクローナル抗体)を投与した。CTL019の投与と放射線療法との間に生検を採取し、フローサイトメトリー、免疫組織化学(IHC)、及び蛍光インサイチューハイブリダイゼーション(FISH)により生検を分析した。フローサイトメトリーにより、試料は、κ軽鎖、CD10、及びCD19について陽性であった。IHCにより、試料は、大きいPAX5+B細胞を有し、PDL1+であった。FISHにより、試料は、再編集c−MYC及びBCL−2を有した。ペンブロリズマブ処置後に第2の生検を採取した。第2の生検には広範な壊死が観察され、腫瘍は一切検出されなかった。従って、データは、CD19 CART細胞とPD−1アンタゴニストとの組み合わせがヒトの腫瘍負荷を低減する上で有効であったことを証明している。
PDR−001は、ヒトPD−1に対して指向されるヒト化モノクローナル抗体である。PDR−001は、分子解離及びハーフ抗体の形成を防止するための安定化ヒンジ突然変異を有する。PDR−001は、IgG4/κアイソタイプサブクラスに属する。
進行した悪性疾患を有する患者のPDR−001について臨床試験を実施した。1、3、及び10mg/kgのQ2W、並びに3及び5mg/kgのQ4Wの用量レベルで患者を処置した。用量制限毒性を呈示した患者はおらず、毒性プロフィールは、市販のPD−1阻害剤の毒性プロフィールと類似していることがわかった。用量漸増及び曝露データのモデル化から得られた薬物動態学的データは、4週間毎に投与される400mgのPDR−001の固定用量の使用を支持するものであった。トラフ濃度(Cthrough)は、数種の癌で実質的な効果を有することが立証されたペンブロリズマブについて観察された定常状態平均トラフ濃度と合致した。これらのデータも、例えば併用療法レジメンにおいて、代替用量レジメンとしての300mgのQ3Wの使用を支持するものであった。
試験の対象は、CD19+と識別されたびまん性大細胞型B細胞リンパ腫(DLBCL)を有する。対象は、次の特徴の1つ以上を有する:(i)一次治療後の残存病変、従って自己幹細胞移植に不適格である、(ii)以前の自己幹細胞移植後、再発若しくは持続疾患、(iii)再発若しくは持続疾患について最初の完全奏効(CR)を過ぎており、且つ従来の同種又は自己幹細胞移植に不適格若しくは不適性である、及び/又は(iv)濾胞性リンパ腫若しくはCLL/SLLの既往歴。
インビトロでのCAR T細胞増殖に対する低用量RAD001の作用は、例えば、米国特許出願公開第2016/0096892A1号明細書の実施例8に記載されており、同出願の全体が参照により本明細書で援用される。
インビボでのCART細胞増殖に対する低用量RAD001の作用は、例えば、米国特許出願公開第2016/0096892A1号明細書の実施例9に記載されており、同出願の全体が参照により本明細書で援用される。
T細胞に対するプログラム死1受容体(PD−1)を遮断する抗体は、PD−L1/PD−1免疫阻害軸を破壊することにより、複数の癌で腫瘍退縮を引き起こす。例えば、Topalian et al.N.Engl J Med 2012;366:2443−54;Brahmer et al.N Engl J Med 2012;366:2455−65;Hamid,et al.N Engl J Med 2013;369:134−44;Wolchok,et al.N Engl J Med 2013;369:122−33;及びTopalian,et al.J Clin Oncol 2014;32:1020−30を参照されたい。癌免疫療法に対するこの手法は、キメラ抗原受容体(CAR)修飾T細胞療法にとって優れたパートナーとなり得るが、その組み合わせは、依然として試験されていない。この実施例は、PD−1遮断抗体を難治性びまん性大細胞型B細胞リンパ腫(DLBCL)及び進行性リンパ腫を有する患者に、CD19(CART19)に対して指向されるCAR修飾T細胞による療法後に投与した実験を説明する。PD−1遮断後、患者は、頑健な抗腫瘍応答、CART19細胞の拡大を有すると共に、CART19細胞によりPD−1及びエオメス(Eomes)の同時発現が低減した。これらの結果は、抗PD−1が、CAR修飾T細胞療法に応答しない癌に対して高度に有効となり得ることを示唆している。これは、PD−1経路が、CAR修飾T細胞療法に対する応答を決定する上で重要となり得ることも示唆している。
免疫組織化学により、リンパ腫からの試料中に免疫チェックポイント分子(PD−L1、PD1、LAG3、及びTIM3)を検出した。また、陽性及び陰性対照組織及び細胞株も実施した。免疫チェックポイント発現分析は、腫瘍細胞と、免疫細胞などの非腫瘍細胞を含み得る目的の領域に対する定量的画像分析を用いて実施した。組織、リンパ節、又は骨髄から試料を採取した。
この試験では、34人のCLL患者由来の治験製剤からのCART19細胞をPD−1、LAG3、及びTIM3などの免疫チェックポイント阻害剤分子の発現について評価した。このコホートのCART19に対する応答はわかっていたため、応答とバイオマーカー発現パターンとの相関を評価することができた。
近年、キメラ抗原受容体(CAR)修飾T細胞及びチェックポイント阻害剤の形態で癌免疫療法空間において強力な進歩が達成されているが、それらの組み合わせの治療メカニズムを探究するための高度なツールは、広く入手可能ではない。この高まる要求に対処する目的で、チェックポイント阻害剤発現を評価し、CAR T細胞を計数し、新規の同時局在化アルゴリズムにより腫瘍細胞と免疫細胞との相互作用を決定するために、多重AQUA(自動定量解析)技術を用いた頑健な定量蛍光免疫組織化学プラットフォームが開発された。この方法の有用性は、臨床前及び臨床モデル系の両方で特性決定された。B細胞リンパ腫の免疫欠損マウスモデルで一次リンパ器官中の悪性B細胞へのCAR T細胞のホーミングを評価した。CD4、CD8、PD1及びFOXP3発現の多重分析によるCAR T細胞の表現型及び機能状態を決定した。更に、びまん性大細胞型B細胞リンパ腫(DLBCL)状況における併用免疫療法を可能にするために、免疫及び腫瘍細胞コンパートメントにおけるPD1及びPD−L1発現の形態の適応免疫耐性の出現率を、DLBCL患者(n=63)からの一次及び二次生検の両方における細胞質及び核染色により作製したランドマークによって調べた。CAR T試験の患者の選択を支持するために、従来の方法によって再現可能にスコアリングできない関連腫瘍抗原の発現及び出現率を定量して、客観的なカットポイントを取得した。患者の最適な選択のためのこれらの定量的多重化IHC法は、次の新しい併用免疫療法試験に使用することができる。
試料調製。ホルマリン固定パラフィン包埋(FFPE)組織試料を脱パラフィン処理した。次に、スライドを一連のキシレンからアルコール洗浄剤で再水和した後、蒸留水中でインキュベートした。次に、高圧及び高温条件を用いて、熱誘導による抗原回収を実施し、冷却させた後、Tris緩衝食塩水に移した。続いて、染色を実施したが、その際、次の工程を実施した。最初に、内在性ペルオキシダーゼを遮断した後、非特異的抗体染色を低減するためにタンパク質遮断溶液と一緒にインキュベートした。次に、スライドをウサギ抗PDL1一次抗体で染色した。その後、スライドを洗浄してから、抗ウサギHRP二次抗体と一緒にインキュベートした。スライドを洗浄した後、TSA+Cy(登録商標)3(Perkin Elmer)を用いてPDL1染色を検出した。次に、マイクロ波により一次及び二次抗体試薬を除去した。スライドを再度洗浄してから、マウス抗CD19一次抗体で染色した。スライドを洗浄した後、抗マウスHRP二次抗体と4’,6−ジアミジノ−2−フェニルインドール(DAPI)のカクテルとを一緒にインキュベートした。スライドを洗浄した後、TSA−Cy(登録商標)5(Perkin Elmer)を用いてCD19染色を検出した。スライドを最後に洗浄した後、封入剤と一緒にカバーガラスを載せて室温で一晩乾燥させた。
注記:別に記載されない限り、この実施例で使用されるペンブロリズマブの用量は、200mgの用量に達するまで患者の体重に基づいて2mg/kgであり、200mgの用量に達した時点から200mgの固定用量を投与した。
注記:別に記載されない限り、この実施例で使用されるペンブロリズマブの用量は、200mgの用量に達するまで患者の体重に基づいて2mg/kgであり、200mgの用量に達した時点から200mgの固定用量を投与した。
CAR T細胞の低持続性を示したCD19 CAR発現T細胞で先に処置した再発性難治性ALL患者は、ペンブロリズマブを含むか又は含まないCAR T細胞の反復注入を受けるのに適格であった。R/R ALL患者は、臨床試験に登録した(NCT02374333)。患者は、最初のCAR T細胞の注入前に化学療法及びリンパ球枯渇を受けた。1日目にベースライン評価を実施した後、ヒト化CD19 CAR T細胞(CTL119)の最初の注入を実施した。28日目に応答について患者を評価し、経過観察評価を3、6、9及び12ヶ月目に実施した。微小残存病変(MRD)、B細胞形成不全及びCTL119持続性について患者をモニタリングした。CTL119持続性の状態に基づいて患者にCTL119を再注入した。一部の患者は、再注入、又はCRSからの回復から少なくとも2週間後にペンブロリズマブでも処置した。図10は、試験設計を示す。
症例1:部分奏効のためのペンブロリズマブ
症例1は、先のCD19 CAR療法に対して応答なし(NR)のR/R ALLを有する患者を表す。huCART19の増殖がこの患者に観察され、28日目に患者は、1.2%CD19+MRDの完全奏効(CR)として認定された。注入から7週間後、患者は、CD19+疾患を再発し、huCART19は、低レベルであった。続いて、52日目にペンブロリズマブを患者に投与した。huCART19の控え目な増加が観察され、末梢血芽球の一過性クリアランスに続いて疾患の進行が起こった。
症例2は、先のCD19 CAR療法から12ヶ月後にCD19+再発を伴うR/R ALLを有する患者を表す。この患者ではhuCART19の良好な増殖が観察された。28日目に、患者は、CD19+再発と共にNRとして認定された。6週間後、この患者にhuCART19を注入し、再注入から14日後にペンブロリズマブでの処置を行った。細胞の持続性延長と共に、huCART19の良好な増殖が観察された。再注入後28日目の評価で、患者は、変動性のCD19発現を伴う持続性の疾患を示した。
症例3、4及び5は、先のhuCART19の注入を受けたが、CAR T細胞の低持続性を示したR/R ALLを有する患者を表す。これらの患者は、良好な初期huCART19増殖を有した。3人の患者全員にhuCART19の再注入を行い、その14日後に1用量のペンブロリズマブを投与した。
症例6は、骨髄中のM3期のR/R ALLと共に、広範囲のリンパ腫様疾患(LAD)を有する患者を表す。この患者は、CART19の注入を受け、細胞は良好に増殖した。28日目の評価は、骨髄中にCRを示したが、PET分析は、リンパ節中への広範囲の取り込みを示した。患者には注入後32日目にペンブロリズマブを投与し、2〜3週間毎に1回投与した。図13に示すように、ペンブロリズマブ処置は、CART19細胞のパーセンテージを増加した。ペンブロリズマブによる処置後、PETavid病変の減少も認められた(図14)。
研究実施の根拠
CD19標的化CART療法(CTL019)は、36〜45%の患者のr/rDLBCLにおいて潜在的に治療性である。しかし、PD−L1は、DLBCLで高度に発現されるため、形質導入T細胞、例えばCTL019細胞上でのPD−1の活性化を引き起こす。CTL019細胞上でPD−1の活性化は、CTL019療法の機能を損なう。抗PD−1による処置は、PD−1/PD−L1相互作用を遮断し、DLBCLを有する患者からのCTL019細胞を再活性化して、奏効率を改善することができる。
r/r(JULIET)DLBCL患者集団におけるCTL019とペンブロリズマブとの同時投与の第I/II相試験を実施する。単一アーム試験には20〜25人の患者が登録される予定であり、用量タイミング設定の導入期(run−in)を含む。移植に適格ではないr/rDLBCL患者がこの試験に参加する予定である。治療法の開始5週間前(−5週目)に自己CTL019細胞を作製し、凍結保存する。この期間にサルベージ療法を開始し、CTL019注入の1週間前(−1週目)に疾患の病期決定を実施する。次に、CTL019を患者に注入する。ペンブロリズマブ療法をCTL019注入から少なくとも5日後に投与する。3週間毎に1回300mgの用量で6回のペンブロリズマブ投与を行う。注入から最初の6ヶ月間では毎月、7〜24ヶ月目では3ヶ月毎、その後では6ヶ月毎に患者を評価する。患者は、遺伝子移入プロトコルのFDA規定に従って15年間経過観察する。
CTL019注入後に増悪が記録されたr/rDLBCL患者において、ペンブロリズマブを用いた臨床試験を開始した。増悪が観察及び記録された直後に1回目用量のペンブロリズマブを投与した。ペンブロリズマブは、2年にわたって3週間毎に1回投与する。患者は、CTL019注入から約28日後にペンブロリズマブを受けた。
背景
抗CD19自己キメラ抗原受容体T(CART19)細胞を用いた細胞療法は、B細胞由来のいくつかの血液系悪性疾患において有望な転帰を示したが、この療法は、ホジキンリンパ腫(HL)患者で研究されていない。腫瘍性HL Reed−Sternberg(HRS)細胞は、CD19陰性であると考えられるが、循環CD19陽性クローンHRS細胞前駆体、及びHRS腫瘍微小環境内のCD19陽性反応性細胞は、HLにおけるCART19の潜在的治療標的となる。
他の治療的処置オプションがなく、2つ以上の標準的サルベージ選択療法に対して非応答性であるか、又は非耐性である再発性/難治性HL患者におけるRNA CART19細胞注入の実現可能性、安全性及び効果を評価するために、非盲検予備試験を設計した。これらの患者には、一過性CD19標的化を可能にし、且つ短期及び長期毒性に関するウィンドウを制限するために、レンチウイルス導入で操作したより持続性の細胞ではなく、キメラ抗CD19免疫受容体scFv(RNA CART19細胞)をエレクトロポレーションした自己T細胞を使用した。フェレーシス及びRNA CART19細胞の製造後、患者は、体重80kg未満の患者の場合、8×105〜1.5×106RNA CART19細胞/kg/用量、体重80kgを超える患者の場合、1×108RNA CART19細胞/kg/用量(±20%)の最大6回の静脈内(IV)注入を受ける。生着を促進するために、1回目及び4回目のRNA CART19細胞用量前に静脈内シクロホスファミド(30mg/kg)を投与した。試験全体を通して、所定の時点において、Cheson 2007基準を用いた安全性及び応答評価を測定した。主要な目的は、再発性HLにおけるRNA CART19細胞の製造実現可能性、安全性及び生着を記述することであった。副次目的は、総合奏効率(ORR)により効果、及びまた全身可溶性免疫因子に対するRNA CART19細胞の作用を推定することであった。
5人の患者が登録され、RNA CART19が製造され、4人の患者が注入されて、応答及び/又は毒性について評価された。登録時の5人の患者の特徴は以下を含む:i)年齢中央値は、24歳であり、その範囲は、21〜42歳である、ii)4人の患者は、IV期/節外病変を有する、iii)以前の治療法の数の中央値は、5であり、その範囲は、0〜8療法であった、iv)4人の患者は、幹細胞移植を有した(そのうちの3人の患者は、自己幹細胞移植を有し、1人は、自己及び同種幹細胞移植の両方を有した)。RNA CART19細胞で処置した患者のうち、3人の患者(60%)は、以前PD−1阻害剤を受けて増悪した。フェレーシス時の絶対リンパ球数中央値は、1,030mmol/μL(範囲:830〜2,650)であった。患者全員についてRNA CART19の製造が成功した。2人の患者は、架橋化学療法を必要とし、そのうちの1人の患者は、ブレンツキシマブを受け、もう1人の患者は、ベンダムスチンとペンブロリズマブとを受けた。4人の処置患者全員がプロトコルに従ってシクロホスファミドと一緒にリンパ球枯渇処置を受けた。CART19細胞/kg/用量の数の中央値は、1.5×106(範囲:7.3×105〜1.52×106)であった。各患者は、2週間の期間にわたってRNA CART19細胞の6回の個別用量又は注入を受けた。qRT−PCRを用いて、80%の注入後直ちに抹消血試料中にRNA CART19を一過性検出した(図14)。試験に関係する死亡又はグレード3〜4の非血液系毒性はなかった。最も一般的なグレード1〜2毒性は、3人の患者に認められた一過性の頭痛、及び2人の患者に認められた不眠症を含んだ。サイトカイン放出症候群のエビデンスはなかった。注入から1ヶ月後の総合奏効率(ORR)は、50%であり、1人の完全奏効(CR)と1人の部分奏効(PR)とが観察された。もう1人の患者は、安定疾患(SD)を有した。CR患者は、3ヶ月後に増悪し、PR患者は、他の治療法を受けるために試験から外れた。SDを有する患者は、3ヶ月後に増悪した。現在、2人の患者がPD−1阻害剤でCRである。1人の患者は、レナリドミドでPRであり、1人は進行性疾患のために死亡した。明らかな長期の毒性は見られなかった。
これらのデータは、非ウイルス性、RNA再指向CART19細胞を用いた細胞療法が再発性/難治性HL患者において実現可能且つ安全であることを示唆している。
本明細書に引用するそれぞれの及び全ての特許、特許出願及び刊行物の開示は、その全体が参照により本明細書に援用される。本発明は、具体的態様を参照して開示しているが、本発明の他の態様及び変形形態は、本発明の真の趣旨及び範囲から逸脱することなく他の当業者によって考案され得ることが明らかである。下記の特許請求の範囲は、全てのこのような態様及び均等な変形形態を含むと解釈されることを意図する。
Claims (108)
- PD−1阻害薬との併用での使用のための、キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含み、前記PD−1阻害薬、例えば抗PD−1抗体分子の用量は、例えば、2週間、3週間、4週間、又は5週間毎に投与される約200mg〜約450mg、例えば約300mg〜約400mgである、CAR療法。
- 癌を有する対象を治療する方法であって、
(i)キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を前記対象に投与することを含み、前記PD−1阻害薬、例えば抗PD−1抗体分子の用量は、例えば、2週間、3週間、4週間、又は5週間毎に投与される約200mg〜約450mg、例えば約300mg〜約400mgである、方法。 - PD−1阻害薬との併用での使用のための、キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含み、前記PD−1阻害薬の投与は、前記CAR療法の投与後20日以内に開始される、CAR療法。
- 癌を有する対象を治療する方法であって、
(i)キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を前記対象に投与することを含み、前記PD−1阻害薬の投与は、前記CAR療法の投与後20日以内に開始される、方法。 - 前記PD−1阻害薬の投与は、前記CAR療法の投与後16日以内、15日以内、14日以内、13日以内、12日以内、11日以内、10日以内、9日以内、8日以内、7日以内、6日以内、5日以内、4日以内、3日以内、又は2日以内に開始される、請求項3又は4に記載の使用のためのCAR療法又は方法。
- PD−1阻害薬との併用での使用のための、キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含み、前記PD−1阻害薬の投与は、前記対象が以下:
(a)前記CAR療法に対する部分奏効又は検出可能な奏効なし、
(b)前記CAR療法後の再発癌、
(c)前記CAR療法に不応性の癌、
(d)前記CAR療法後の進行型の前記癌、又は
(e)前記CAR療法後、例えば3ヵ月未満のB細胞回復
の1つ以上を有するか、又は有すると同定された後に開始される、CAR療法。 - 癌を有する対象を治療する方法であって、
(i)キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を前記対象に投与することを含み、前記PD−1阻害薬の投与は、前記対象が以下:
(a)前記CAR療法に対する部分奏効又は検出可能な奏効なし、
(b)前記CAR療法後の再発癌、
(c)前記CAR療法に不応性の癌、又は
(d)前記CAR療法後の進行型の前記癌、又は
(e)前記CAR療法後、例えば3ヵ月未満のB細胞回復
の1つ以上を有するか、又は有すると同定された後に開始される、方法。 - PD−1阻害薬との併用での使用のための、キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含み、前記PD−1阻害薬の投与は、前記CAR療法の投与後に開始され、及び前記対象は、以下:
(a)前記CAR療法に対する部分奏効又は検出可能な奏効なし、
(b)前記CAR療法後の再発癌、
(c)前記CAR療法に不応性の癌、
(d)進行型の前記癌、又は
(e)前記CAR療法後、例えば3ヵ月未満のB細胞回復
の1つ以上を有しないか、又は有すると同定されていない、CAR療法。 - 癌を有する対象を治療する方法であって、
(i)キメラ抗原受容体(CAR)を発現する免疫エフェクター細胞の集団を含むCAR療法であって、前記CARは、抗原(例えば、CD19)結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、CAR療法、及び
(ii)PD−1阻害薬
を前記対象に投与することを含み、前記PD−1阻害薬の投与は、前記CAR療法の投与後に開始され、及び前記対象は、以下:
(a)CAR療法に対する部分奏効又は検出可能な奏効なし、
(b)CAR療法後の再発癌、
(c)CAR療法に不応性の癌、
(d)進行型の前記癌、又は
(e)CAR療法後、例えば3ヵ月未満のB細胞回復
の1つ以上を有しないか、又は有すると同定されていない、方法。 - 1用量以上、例えば1、2、3、4若しくは5用量又はそれを超える後続用量の前記PD−1阻害薬を投与することを更に含む、請求項1〜9のいずれか一項に記載の使用のためのCAR療法又は方法。
- 最大6用量の前記PD−1阻害薬は、投与される、請求項10に記載の使用のためのCAR療法又は方法。
- 前記方法は、前記対象におけるCRSの存在又は非存在を評価することを更に含む、請求項1〜11のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記対象は、前記CAR療法後にCRS、例えば重症CRS(例えば、CRSグレード3又はグレード4)を有しないか、又は有しないと同定される、請求項1〜12のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の投与は、前記対象が前記CAR療法後にCRS、例えば重症CRS(例えば、CRSグレード3又はグレード4)を有しないと同定された後に開始される、請求項12又は13に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の投与は、前記CAR療法後のCRSの治療後、例えばCRS消散後に開始される、請求項12〜14のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CAR療法及び前記PD−1阻害薬は、治療インターバルにわたって投与され、前記治療インターバルは、単回用量の前記PD−1阻害薬及び単回用量の前記CAR発現細胞を含む、請求項1〜15のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記治療インターバルは、前記CAR療法の前記用量の投与で開始され、且つ前記PD−1阻害薬の前記用量の投与で完了される、請求項16に記載の使用のためのCAR療法又は方法。
- 前記治療インターバルは、1用量以上、例えば1、2、3、4若しくは5用量又はそれを超える後続用量の前記PD−1阻害薬を投与することを更に含む、請求項16又は17に記載の使用のためのCAR療法又は方法。
- 最大6用量の前記PD−1阻害薬は、前記治療インターバル中に投与される、請求項18に記載の使用のためのCAR療法又は方法。
- 前記CAR療法の前記用量は、PD−1阻害薬の前記用量が投与される少なくとも2日、少なくとも3日、少なくとも4日、少なくとも5日、少なくとも6日、少なくとも7日、少なくとも8日、少なくとも9日、少なくとも10日、少なくとも11日、少なくとも12、少なくとも13、少なくとも14日、少なくとも15日、少なくとも16日、少なくとも17日、少なくとも18日、少なくとも19日、又は少なくとも20日前に投与される、請求項1若しくは2又は6〜19のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CAR療法の前記用量は、前記PD−1阻害薬の前記用量が投与される25〜40日前(例えば、約25〜30、30〜35、又は35〜40日、例えば約35日前)に投与される、請求項20に記載の使用のためのCAR療法又は方法。
- 前記CAR療法及び前記PD−1阻害薬は、治療インターバルにわたって投与され、前記治療インターバルは、第1及び第2の用量の前記PD−1阻害薬と、ある用量の前記CAR療法とを含み、前記CAR療法の前記用量は、前記PD−1阻害薬の前記第1の用量の投与後であるが、前記PD−1阻害薬の前記第2の用量の投与前に投与される、請求項1若しくは2又は12〜15のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記治療インターバルは、前記PD−1阻害薬の前記第1の用量の投与で開始され、且つ前記PD−1阻害薬の前記第2の用量の投与で完了される、請求項22に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記第2の用量は、前記PD−1阻害薬の前記第1の用量の投与の少なくとも5日、7日、1週間、2週間、又は3週間後に投与される、請求項22又は23に記載の使用のためのCAR療法又は方法。
- 前記CAR療法の前記用量は、前記PD−1阻害薬の前記第1の用量の投与の少なくとも2日、3日、4日、5日、6日、7日、又は2週間後に投与される、請求項22〜24のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記第2の用量は、前記CAR療法の前記用量の投与の少なくとも2日、3日、4日、5日、6日、7日、又は2週間後に投与される、請求項22〜25のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記治療インターバルは、例えば、1回以上、例えば1、2、3、4、又は5回の更なる回数だけ繰り返される、請求項16〜26のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記治療インターバル後、1回以上、例えば1、2、3、4、又は5回の後続の治療インターバルが続く、請求項16〜27のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記1回以上の後続の治療インターバルは、初回又は前回の治療インターバルと異なる、請求項28に記載の使用のためのCAR療法又は方法。
- 前記1回以上の後続の治療インターバルは、前記初回又は前回の治療インターバルの完了から少なくとも1日後、例えば少なくとも1日、少なくとも2日、少なくとも3日、少なくとも4日、少なくとも5日、少なくとも6日、少なくとも7日、少なくとも2週間、少なくとも1ヵ月、少なくとも3ヵ月、少なくとも6ヵ月、又は少なくとも1年後に投与される、請求項28又は29に記載の使用のためのCAR療法又は方法。
- 1用量以上の後続用量、例えば1、2、3、4若しくは5用量又はそれを超える前記PD−1阻害薬は、1回以上の治療インターバルの完了後に投与される、請求項16〜30のいずれか一項に記載の使用のためのCAR療法又は方法。
- ある用量の前記PD−1阻害薬は、1回以上の治療インターバルの完了後、5日、6日、7日、10日、2週間、3週間、又は4週間毎に投与される、請求項16〜31のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記治療インターバルは、前記PD〜1阻害薬の前記用量が投与される2〜20日、5〜17日、7〜16日、8〜16日、10〜15日、14〜21日、又は2〜3週間前に投与されるある用量のCAR療法を含み、前記治療インターバルは、0〜52回だけ繰り返され、前記治療インターバルは、前記前回の治療インターバルの完了から少なくとも1日、少なくとも2日、少なくとも3日、少なくとも4日、少なくとも5日、少なくとも6日、少なくとも7日、少なくとも2週間、少なくとも1ヵ月、少なくとも3ヵ月、少なくとも6ヵ月、又は少なくとも1年後に開始される、請求項16〜32のいずれか一項に記載の使用のためのCAR療法又は方法。
- 1用量以上の後続用量の前記PD−1阻害薬は、2回目の治療インターバル後、5日、7日、2週間、3週間、又は4週間毎に投与される、請求項33に記載の使用のためのCAR療法又は方法。
- 前記対象は、単回用量のCAR発現細胞及び単回用量のPD−1阻害薬を投与される、請求項1〜15のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CAR発現細胞の前記単回用量は、前記PD−1阻害薬の前記単回用量の投与の少なくとも2日前、例えば2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、又は20日前に投与される、請求項35に記載の使用のためのCAR療法又は方法。
- 前記CAR療法は、RNA CAR分子、例えばインビトロ転写(IVT)RNAを含み、1用量以上、例えば1、2、3、4、又は5用量の後続用量のCAR療法は、前記CAR療法の初回用量後に前記対象に投与される、請求項35又は36に記載の使用のためのCAR療法又は方法。
- 前記CAR発現細胞の前記1用量以上の後続用量は、前記CAR発現細胞の前回用量の少なくとも2日後、例えば2、3、4、5、6、7日、2週間、又は3週間後に投与される、請求項37に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記単回用量の投与後に1用量以上、例えば1、2、3、4若しくは5用量又はそれを超える後続用量のPD−1阻害薬は、投与される、請求項27〜38のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記1用量以上の後続用量は、PD−1阻害薬の前記前回用量の少なくとも5日、7日、2週間、3週間、又は4週間後に投与される、請求項39に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記1用量以上の後続用量は、前記CAR療法の用量、例えば前記CAR療法の前記初回用量の少なくとも1、2、3、4、5、6若しくは7日後又は2週間若しくは3週間後に投与される、請求項39又は40に記載の使用のためのCAR療法又は方法。
- 前記CAR発現細胞の前記1用量以上及びPD−1阻害薬の前記1用量以上の投与は、繰り返される、請求項27〜41のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CAR療法は、約104〜約109細胞/kg、例えば約104〜約105細胞/kg、約105〜約106細胞/kg、約106〜約107細胞/kg、約107〜約108細胞/kg、約108〜約109細胞/kg、又は約1〜5×107細胞/kg〜約1〜5×108細胞/kgを含むCAR発現細胞の用量を含む、請求項1〜42のいずれか一項に記載の使用のためのCAR療法又は方法。
- CAR発現細胞の前記用量は、約1〜5×107細胞/kgである、請求項43に記載の使用のためのCAR療法又は方法。
- CAR発現細胞の前記用量は、約1〜5×108細胞/kgである、請求項43に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記用量は、1〜30mg/kg、例えば約1〜25mg/kg、約2〜20mg/kg、約2〜5mg/kg、又は約2mg/kg、約3mg/kg、約4mg/kg若しくは約5mg/kgである、請求項3〜45のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記用量は、例えば、2週間、3週間、4週間、又は5週間毎に投与される約1〜20mg/kg又は約2〜5mg/kgである、請求項46に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬、例えば抗PD−1抗体分子の前記用量は、例えば、2週間、3週間、4週間、又は5週間毎に投与される約200mg〜約450mg、例えば約200mg〜約400mgである、請求項1〜45のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記用量は、例えば、3週間毎に例えば静脈内注入によって投与される約200mg又は約300mgである、請求項1〜48のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬の前記用量は、例えば、4週間毎に例えば静脈内注入によって投与される約400mgである、請求項1〜48のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬は、PD−1抗体分子であり、且つ約300mgの用量で2週間、3週間、又は4週間毎に投与され、及び前記CAR療法は、1〜5×108細胞の用量で投与される、請求項1〜48のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬は、抗体分子、小分子、ポリペプチド、例えば融合タンパク質、又は阻害性核酸、例えばsiRNA若しくはshRNAを含む、請求項1〜51のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬は、以下:
a.PD−1発現、例えばPD−1の転写又は翻訳を阻害するか又は低下させること、
b.PD−1活性を阻害するか又は低下させる、例えばPD−1のそのコグネイトリガンド、例えばPD−L1又はPD−L2への結合を阻害するか又は低下させること、又は
c.PD−1又はそのリガンド、例えばPD−L1又はPD−L2に結合すること
の1つ以上によって特徴付けられる、請求項1〜52のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記PD−1阻害薬は、抗体分子である、請求項1〜53のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬は、ニボルマブ、ペンブロリズマブ、PDR001、ピジリズマブ、AMP 514、AMP−224、及び表6に提供される任意の抗PD−1抗体分子からなる群から選択される、請求項1〜54のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記PD−1阻害薬は、
a.表6に挙げられる任意のPD−1抗体分子アミノ酸配列の重鎖相補性決定領域1(HC CDR1)、重鎖相補性決定領域2(HC CDR2)、及び重鎖相補性決定領域3(HC CDR3)、及び
b.表6に挙げられる任意のPD−1抗体分子アミノ酸配列の軽鎖相補性決定領域1(LC CDR1)、軽鎖相補性決定領域2(LC CDR2)、及び軽鎖相補性決定領域3(LC CDR3)
を含む抗PD−1抗体分子を含む、請求項1〜55のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記その抗PD−1抗体分子は、
a)配列番号137又は140から選択されるHC CDR1アミノ酸配列、配列番号138又は141のHC CDR2アミノ酸配列、及び配列番号139のHC CDR3アミノ酸配列、及び
b)配列番号146又は149のLC CDR1アミノ酸配列、配列番号147又は150のLC CDR2アミノ酸配列、及び配列番号148、151、166、又は167のLC CDR3アミノ酸配列(例えば、配列番号166又は167のLC CDR3アミノ酸配列)
を含む、請求項56に記載の使用のためのCAR療法又は方法。 - 前記抗PD−1抗体分子は、
i)表6に挙げられる任意の重鎖可変領域のアミノ酸配列、例えば配列番号142、144、154、158、172、184、216、又は220、
ii)表6に提供される任意の重鎖可変領域のアミノ酸配列、例えば配列番号142、144、154、158、172、184、216、又は220に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
iii)表6に提供される任意の重鎖可変領域のアミノ酸配列、例えば配列番号142、144、154、158、172、184、216、又は220と95〜99%の同一性を有するアミノ酸配列
を含む重鎖可変領域を含む、請求項56又は57に記載の使用のためのCAR療法又は方法。 - 前記抗PD−1抗体分子は、
i)表6に挙げられる任意の重鎖のアミノ酸配列、例えば配列番号156、160、174、186、218、222、225、又は236、
ii)表6に挙げられる任意の重鎖、例えば配列番号156、160、174、186、218、222、225、又は236に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
iii)表6に挙げられる任意の重鎖のアミノ酸配列、例えば配列番号156、160、174、186、218、222、225、又は236と95〜99%の同一性を有するアミノ酸配列
を含む重鎖を含む、請求項56〜58のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記抗PD−1抗体分子は、
i)表6に挙げられる任意の軽鎖可変領域のアミノ酸配列、例えば配列番号152、162、168、176、180、188、192、196、200、204、208、又は212、
ii)表6に提供される任意の軽鎖可変領域のアミノ酸配列、例えば配列番号152、162、168、176、180、188、192、196、200、204、208、又は212に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
iii)表6に提供される任意の軽鎖可変領域のアミノ酸配列、例えば配列番号152、162、168、176、180、188、192、196、200、204、208、又は212と95〜99%の同一性を有するアミノ酸配列
を含む軽鎖可変領域を含む、請求項56〜59のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記抗PD−1抗体分子は、
i)表6に挙げられる任意の軽鎖のアミノ酸配列、例えば配列番号164、170、178、182、190、194、198、202、206、210、又は214、
ii)表6に挙げられる任意の軽鎖、例えば配列番号164、170、178、182、190、194、198、202、206、210、又は214に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
iii)表6に挙げられる任意の軽鎖に対するアミノ酸配列、例えば配列番号164、170、178、182、190、194、198、202、206、210、又は214と95〜99%の同一性を有するアミノ酸配列
を含む軽鎖を含む、請求項56〜60のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記抗PD−1抗体分子は、
i)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
ii)配列番号142又は144のアミノ酸配列を含む重鎖可変ドメイン及び配列番号152のアミノ酸配列を含む軽鎖可変ドメイン、
iii)配列番号154又は158のアミノ酸配列を含む重鎖可変ドメイン及び配列番号162のアミノ酸配列を含む軽鎖可変ドメイン、
iv)配列番号154又は158のアミノ酸配列を含む重鎖可変ドメイン及び配列番号168のアミノ酸配列を含む軽鎖可変ドメイン、
v)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号176のアミノ酸配列を含む軽鎖可変ドメイン、
vi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号180のアミノ酸配列を含む軽鎖可変ドメイン、
vii)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号180のアミノ酸配列を含む軽鎖可変ドメイン、
viii)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号188のアミノ酸配列を含む軽鎖可変ドメイン、
ix)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号188のアミノ酸配列を含む軽鎖可変ドメイン、
x)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号192のアミノ酸配列を含む軽鎖可変ドメイン、
xi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号196のアミノ酸配列を含む軽鎖可変ドメイン、
xii)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xiii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xiv)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
xv)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
xvi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号208のアミノ酸配列を含む軽鎖可変ドメイン、
xvii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号212のアミノ酸配列を含む軽鎖可変ドメイン、
xviii)配列番号216のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン、
xix)配列番号216のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xx)配列番号220のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、
xxi)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号176のアミノ酸配列を含む軽鎖可変ドメイン、
xxii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号188のアミノ酸配列を含む軽鎖可変ドメイン、
xxiii)配列番号172のアミノ酸配列を含む重鎖可変ドメイン及び配列番号200のアミノ酸配列を含む軽鎖可変ドメイン、又は
xxiv)配列番号184のアミノ酸配列を含む重鎖可変ドメイン及び配列番号204のアミノ酸配列を含む軽鎖可変ドメイン
を含む、請求項56〜61のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記抗PD−1抗体分子は、
i)配列番号225のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、
ii)配列番号144のアミノ酸配列を含む重鎖及び配列番号152のアミノ酸配列を含む軽鎖、
iii)配列番号156又は160のアミノ酸配列を含む重鎖及び配列番号164のアミノ酸配列を含む軽鎖、
iv)配列番号156又は160のアミノ酸配列を含む重鎖及び配列番号170のアミノ酸配列を含む軽鎖、
v)配列番号174のアミノ酸配列を含む重鎖及び配列番号178のアミノ酸配列を含む軽鎖、
vi)配列番号174のアミノ酸配列を含む重鎖及び配列番号182のアミノ酸配列を含む軽鎖、
vii)配列番号186のアミノ酸配列を含む重鎖及び配列番号182のアミノ酸配列を含む軽鎖、
viii)配列番号186のアミノ酸配列を含む重鎖及び配列番号190のアミノ酸配列を含む軽鎖、
ix)配列番号174のアミノ酸配列を含む重鎖及び配列番号190のアミノ酸配列を含む軽鎖、
x)配列番号174のアミノ酸配列を含む重鎖及び配列番号194のアミノ酸配列を含む軽鎖、
xi)配列番号174のアミノ酸配列を含む重鎖及び配列番号198のアミノ酸配列を含む軽鎖、
xii)配列番号186のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xiii)配列番号174のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xiv)配列番号186のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、
xv)配列番号174のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、
xvi)配列番号174のアミノ酸配列を含む重鎖及び配列番号210のアミノ酸配列を含む軽鎖、
xvii)配列番号174のアミノ酸配列を含む重鎖及び配列番号214のアミノ酸配列を含む軽鎖、
xviii)配列番号218のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖、
xix)配列番号218のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xx)配列番号222のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、
xxi)配列番号225のアミノ酸配列を含む重鎖及び配列番号178のアミノ酸配列を含む軽鎖、
xxii)配列番号225のアミノ酸配列を含む重鎖及び配列番号190のアミノ酸配列を含む軽鎖、
xxiii)配列番号225のアミノ酸配列を含む重鎖及び配列番号202のアミノ酸配列を含む軽鎖、又は
xxiv)配列番号236のアミノ酸配列を含む重鎖及び配列番号206のアミノ酸配列を含む軽鎖
を含む、請求項56〜62のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記PD−1阻害薬は、配列番号172のアミノ酸配列を含む重鎖可変ドメインと配列番号204のアミノ酸配列を含む軽鎖可変ドメインとを含む抗PD−1抗体分子を含む、請求項56〜63のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記抗PD1抗体分子は、
(i)配列番号503のVHCDR1アミノ酸配列、配列番号504のVHCDR2アミノ酸配列、及び配列番号505のVHCDR3アミノ酸配列を含む重鎖可変(VH)領域、及び
(ii)配列番号500のVLCDR1アミノ酸配列、配列番号501のVLCDR2アミノ酸配列、及び配列番号502のVLCDR3アミノ酸配列を含む軽鎖可変(VL)領域、又は
少なくとも85%、90%、95%又はそれを超えて同一のアミノ酸配列
を含む、請求項64に記載の使用のためのCAR療法又は方法。 - 前記CD19結合ドメインは、表2又は表3に挙げられる任意のCD19重鎖結合ドメインアミノ酸配列の重鎖相補性決定領域1(HC CDR1)、重鎖相補性決定領域2(HC CDR2)、及び重鎖相補性決定領域3(HC CDR3)、並びに表2又は表3に挙げられる任意のCD19軽鎖結合ドメインアミノ酸配列の軽鎖相補性決定領域1(LC CDR1)、軽鎖相補性決定領域2(LC CDR2)、及び軽鎖相補性決定領域3(LC CDR3)を含む、請求項1〜65のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CD19結合ドメインは、表4のHC CDRアミノ酸配列に係るHC CDR1、HC CDR2、及びHC CDR3、並びに表5のLC CDRアミノ酸配列に係るLC CDR1、LC CDR2、及びLC CDR3を含む、請求項66に記載の使用のためのCAR療法又は方法。
- 前記CD19結合ドメインは、
a.表2又は表3に挙げられるCD19結合ドメインの任意の重鎖可変領域のアミノ酸配列、
b.表2又は表3に提供されるCD19結合ドメインの任意の重鎖可変領域のアミノ酸配列に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
c.表2又は表3に提供されるCD19結合ドメインの任意の重鎖可変領域のアミノ酸配列と少なくとも95%同一である、例えば95〜99%の同一性を有するアミノ酸配列
を含む、請求項1〜67のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記CD19結合ドメインは、
a.表2又は表3に提供されるCD19結合ドメインの任意の重鎖のアミノ酸配列、
b.表2又は表3に提供されるCD19結合ドメインの任意の重鎖に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
c.表2又は表3に提供されるCD19結合ドメインの任意の重鎖に対するアミノ酸配列と少なくとも95%同一である、例えば95〜99%の同一性を有するアミノ酸配列
を含む、請求項1〜68のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記CD19結合ドメインは、
a.表2又は表3に提供されるCD19結合ドメインの任意の軽鎖可変領域のアミノ酸配列、
b.表2又は表3に提供されるCD19結合ドメインの任意の軽鎖可変領域のアミノ酸配列に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
c.表2又は表3に提供されるCD19結合ドメインの任意の軽鎖可変領域のアミノ酸配列と少なくとも95%同一である、例えば95〜99%の同一性を有するアミノ酸配列
を含む、請求項1〜69のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記CD19結合ドメインは、
a.表2又は表3に提供されるCD19結合ドメインの任意の軽鎖のアミノ酸配列、
b.表2又は表3に提供されるCD19結合ドメインの任意の軽鎖に対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
c.表2又は表3に提供されるCD19結合ドメインの任意の軽鎖に対するアミノ酸配列と少なくとも95%同一である、例えば95〜99%の同一性を有するアミノ酸配列
を含む、請求項1〜70のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記CD19結合ドメインは、表2又は表3に挙げられる任意の重鎖可変領域のアミノ酸配列と、表2又は表3に挙げられる任意の軽鎖可変領域のアミノ酸配列とを含む、請求項1〜71のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CD19結合ドメインは、
a.配列番号109、配列番号45、配列番号46、配列番号47、配列番号48、配列番号49、配列番号50、配列番号51、配列番号52、配列番号53、配列番号54、配列番号55、配列番号56、配列番号110、配列番号112、又は配列番号115からなる群から選択されるアミノ酸配列、
b.配列番号109、配列番号45、配列番号46、配列番号47、配列番号48、配列番号49、配列番号50、配列番号51、配列番号52、配列番号53、配列番号54、配列番号55、配列番号56、配列番号110、配列番号112、又は配列番号115のいずれかに対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
c.配列番号109、配列番号45、配列番号46、配列番号47、配列番号48、配列番号49、配列番号50、配列番号51、配列番号52、配列番号53、配列番号54、配列番号55、配列番号56、配列番号110、配列番号112、又は配列番号115のいずれかに対するアミノ酸配列と少なくとも95%同一である、例えば95〜99%の同一性を有するアミノ酸配列
を含む、請求項1〜72のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記膜貫通ドメインは、T細胞受容体のα、β又はζ鎖、CD28、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、及びCD154からなる群から選択されるタンパク質からの膜貫通ドメインを含む、請求項1〜73のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記膜貫通ドメインは、
(i)配列番号6のアミノ酸配列、
(ii)配列番号6のアミノ酸配列の少なくとも1、2、又は3つの改変であるが、20、10、又は5つ以下の改変を含むアミノ酸配列、又は
(iii)配列番号6のアミノ酸配列と少なくとも95%同一である、例えば95〜99%の同一性を有する配列
を含む、請求項1〜74のいずれか一項に記載の使用のためのCAR療法又は方法。 - 前記CD19結合ドメインは、ヒンジ領域によって前記膜貫通ドメインに結合される、請求項1〜75のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記ヒンジ領域は、配列番号2又はそれと少なくとも95%同一である、例えば95〜99%の同一性を有する配列を含む、請求項1〜76のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記細胞内シグナル伝達ドメインは、MHCクラスI分子、TNF受容体タンパク質、免疫グロブリン様タンパク質、サイトカイン受容体、インテグリン、シグナル伝達リンパ球活性化分子(SLAMタンパク質)、活性化NK細胞受容体、BTLA、Tollリガンド受容体、OX40、CD2、CD7、CD27、CD28、CD30、CD40、CDS、ICAM−1、LFA−1(CD11a/CD18)、4−1BB(CD137)、B7−H3、CDS、ICAM−1、ICOS(CD278)、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL2Rβ、IL2Rγ、IL7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA−6、CD49f、ITGAD、CD11d、ITGAE、CD103、ITGAL、CD11a、LFA−1、ITGAM、CD11b、ITGAX、CD11c、ITGB1、CD29、ITGB2、CD18、LFA−1、ITGB7、NKG2D、NKG2C、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRTAM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB−A、Ly108)、SLAM(SLAMF1、CD150、IPO−3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP−76、PAG/Cbp、CD19a、及びCD83に特異的に結合するリガンドからなる群から選択されるタンパク質から得られる機能性シグナル伝達ドメインを含む共刺激シグナル伝達ドメインを含む、請求項1〜77のいずれか一項に記載の使用のためのCAR療法又は方法。
- 共刺激ドメインは、配列番号7のアミノ酸配列、又は配列番号7のアミノ酸配列の少なくとも1、2、又は3つの改変であるが、20、10、又は5つ以下の改変を有するアミノ酸配列、又は配列番号7のアミノ酸配列と少なくとも95%同一のアミノ酸配列を含む、請求項59に記載の使用のためのCAR療法又は方法。
- 前記細胞内シグナル伝達ドメインは、4−1BBの機能性シグナル伝達ドメイン及び/又はCD3ζの機能性シグナル伝達ドメインを含む、請求項1〜79のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記細胞内シグナル伝達ドメインは、配列番号7のアミノ酸配列及び/又は配列番号9若しくは配列番号10のアミノ酸配列、或いは配列番号7のアミノ酸配列及び/又は配列番号9若しくは配列番号10のアミノ酸配列の少なくとも1つ、2つ、又は3つの改変であるが、20、10、又は5つ以下の改変を有するアミノ酸配列、或いは配列番号7のアミノ酸配列及び/又は配列番号9若しくは配列番号10のアミノ酸配列と少なくとも95%同一のアミノ酸配列を含む、請求項1〜80のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記細胞内シグナル伝達ドメインは、配列番号7のアミノ酸配列及び配列番号9又は配列番号10のアミノ酸配列を含み、前記細胞内シグナル伝達ドメインを含むアミノ酸配列は、同じフレームにおいて且つ単一のポリペプチド鎖として発現される、請求項1〜81のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CARは、配列番号1のアミノ酸配列を含むリーダー配列を更に含む、請求項1〜82のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CARは、
(i)配列番号108、配列番号93、配列番号94、配列番号95、配列番号96、配列番号97、配列番号98、配列番号99、配列番号100、配列番号101、配列番号102、配列番号103、配列番号104、配列番号111、配列番号114、又は配列番号116のいずれかのアミノ酸配列、
(ii)配列番号108、配列番号93、配列番号94、配列番号95、配列番号96、配列番号97、配列番号98、配列番号99、配列番号100、配列番号101、配列番号102、配列番号103、配列番号104、配列番号111、配列番号114、又は配列番号116のいずれかに対して少なくとも1、2、又は3つの改変であるが、30、20、又は10以下の改変を有するアミノ酸配列、又は
(iii)配列番号108、配列番号93、配列番号94、配列番号95、配列番号96、配列番号97、配列番号98、配列番号99、配列番号100、配列番号101、配列番号102、配列番号103、配列番号104、配列番号111、配列番号114、又は配列番号116のいずれかと少なくとも95同一のアミノ酸配列
を含む、請求項1〜83のいずれか一項に記載の使用のためのCAR療法又は方法。 - CARを含む前記細胞は、前記CARをコードする核酸を含む、請求項1〜84のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CARをコードする前記核酸は、レンチウイルスベクターである、請求項85に記載の使用のためのCAR療法又は方法。
- 前記CARをコードする前記核酸は、レンチウイルス形質導入によって前記細胞に導入される、請求項85又は86に記載の使用のためのCAR療法又は方法。
- 前記CARをコードする前記核酸は、RNA、例えばインビトロ転写RNAである、請求項85〜87のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記CARをコードする前記核酸は、電気穿孔によって前記細胞に導入される、請求項88に記載の使用のためのCAR療法又は方法。
- 前記細胞は、T細胞又はNK細胞である、請求項1〜89のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記T細胞は、自己又は同種異系T細胞である、請求項90に記載の使用のためのCAR療法又は方法。
- 追加の抗癌剤を投与することを更に含む、請求項1〜91のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記癌は、血液癌である、請求項1〜92のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記癌は、リンパ腫又は白血病である、請求項1〜93のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記癌は、B細胞急性リンパ性白血病(BALL)、T細胞急性リンパ性白血病(TALL)、小リンパ球性白血病(SLL)、急性リンパ性白血病(ALL)、慢性骨髄球性白血病(CML)、慢性リンパ球性白血病(CLL)、マントル細胞リンパ腫(MCL)、B細胞前リンパ球性白血病、芽球性形質細胞様樹状細胞新生物、バーキットリンパ腫、びまん性大細胞型B細胞リンパ腫(DLBCL)、濾胞性リンパ腫、ヘアリー細胞白血病、小細胞型又は大細胞型濾胞性リンパ腫、悪性リンパ球増殖病態、MALTリンパ腫、辺縁帯リンパ腫、多発性骨髄腫、骨髄形成異常及び骨髄異形成症候群、非ホジキンリンパ腫、ホジキンリンパ腫、形質芽球性リンパ腫、形質細胞様樹状細胞新生物、又はワルデンシュトレームマクログロブリン血症の1つ以上から選択される、請求項93に記載の使用のためのCAR療法又は方法。
- 前記癌は、急性リンパ性白血病(ALL)、例えば小児B−ALL、又はB細胞リンパ腫、例えば小児B細胞リンパ腫である、請求項93に記載の使用のためのCAR療法又は方法。
- 前記癌は、びまん性大細胞型B細胞リンパ腫(DLBCL)、例えば再発性又は不応性DLBCLである、請求項93に記載の使用のためのCAR療法又は方法。
- 前記対象は、哺乳類、例えばヒトである、請求項1〜97のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記対象は、PD−1、PD−L1、及び/又はPD−L2を発現する、請求項1〜98のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記対象における癌細胞又は癌細胞に近接した細胞は、PD−1、PD−L1、及び/又はPD−L2を発現する、請求項99に記載の使用のためのCAR療法又は方法。
- 前記癌細胞は、DLBCL試料からのもの、例えば再発性又は不応性DLBCL試料からのものである、請求項99又は100に記載の使用のためのCAR療法又は方法。
- CARを発現する前記細胞は、PD−1、PD−L1、及び/又はPD−L2を発現する、請求項1〜101のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記対象は、基準値、例えば前記CAR療法に対する完全奏効者と比較してより多数又はより高い割合の、PD−1、LAG−3、又はTIM−3の1、2、3つ、又は全てを発現する免疫エフェクター細胞、例えばCD4+及び/又はCD8+T細胞を有するか、又は有すると同定される、請求項1〜102のいずれか一項に記載の使用のためのCAR療法又は方法。
- 前記対象は、多数の、PD−1を発現する免疫エフェクター細胞、例えばCD4+及び/若しくはCD8+T細胞、PD−1及びLAG−3を発現する免疫エフェクター細胞、例えばCD4+及び/若しくはCD8+T細胞、PD−1及びTIM−3を発現する免疫エフェクター細胞、例えばCD4+及び/若しくはCD8+T細胞、又はPD−1、TIM−3及びLAG−3を発現する免疫エフェクター細胞、例えばCD4+及び/若しくはCD8+T細胞を有するか、又は有すると同定される、請求項103に記載の使用のためのCAR療法又は方法。
- 前記免疫エフェクター細胞、例えばCD4+及び/又はCD8+T細胞は、CAR、例えばCD19 CARを共発現する、請求項103又は104に記載の使用のためのCAR療法又は方法。
- 対象の癌の治療における使用のための、
CARを含む細胞、例えば免疫エフェクター細胞の集団であって、前記CARは、抗原結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、細胞、及び
ペンブロリズマブ、ニボルマブ、又は例えば配列番号204及び配列番号172の可変軽鎖及び可変重鎖アミノ酸配列を含む、表6からの抗体分子のいずれかから選択されるPD−1阻害薬
を含む併用。 - CARを含む細胞、例えば免疫エフェクター細胞の集団であって、前記CARは、抗原結合ドメインと、膜貫通ドメインと、細胞内シグナル伝達ドメインとを含む、細胞、及び
例えば、配列番号204及び配列番号172の可変軽鎖及び可変重鎖アミノ酸配列を含む、表6から選択されるPD−1阻害薬
を含む組成物(例えば、1つ以上の組成物又は剤形)。 - 前記CD19結合ドメインは、配列番号109のアミノ酸配列であるか、又は前記CARは、配列番号108のアミノ酸配列を含む、請求項1〜107のいずれか一項に記載の方法、併用、又は組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022036315A JP2022088432A (ja) | 2016-07-28 | 2022-03-09 | キメラ抗原受容体とpd-1阻害薬との併用療法 |
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662368100P | 2016-07-28 | 2016-07-28 | |
| US62/368,100 | 2016-07-28 | ||
| US201762455547P | 2017-02-06 | 2017-02-06 | |
| US62/455,547 | 2017-02-06 | ||
| US201762482846P | 2017-04-07 | 2017-04-07 | |
| US62/482,846 | 2017-04-07 | ||
| US201762514542P | 2017-06-02 | 2017-06-02 | |
| US62/514,542 | 2017-06-02 | ||
| PCT/US2017/044425 WO2018023025A1 (en) | 2016-07-28 | 2017-07-28 | Combination therapies of chimeric antigen receptors adn pd-1 inhibitors |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022036315A Division JP2022088432A (ja) | 2016-07-28 | 2022-03-09 | キメラ抗原受容体とpd-1阻害薬との併用療法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019523301A true JP2019523301A (ja) | 2019-08-22 |
| JP2019523301A5 JP2019523301A5 (ja) | 2020-09-10 |
Family
ID=59700172
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019526201A Withdrawn JP2019523301A (ja) | 2016-07-28 | 2017-07-28 | キメラ抗原受容体とpd−1阻害薬との併用療法 |
| JP2022036315A Pending JP2022088432A (ja) | 2016-07-28 | 2022-03-09 | キメラ抗原受容体とpd-1阻害薬との併用療法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022036315A Pending JP2022088432A (ja) | 2016-07-28 | 2022-03-09 | キメラ抗原受容体とpd-1阻害薬との併用療法 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20190151365A1 (ja) |
| EP (1) | EP3491016A1 (ja) |
| JP (2) | JP2019523301A (ja) |
| KR (2) | KR20190034588A (ja) |
| CN (3) | CN118021943A (ja) |
| AU (2) | AU2017302668B9 (ja) |
| BR (1) | BR112019001570A2 (ja) |
| CA (1) | CA3032054A1 (ja) |
| IL (1) | IL264486A (ja) |
| SG (1) | SG11201900677SA (ja) |
| TW (1) | TW201806619A (ja) |
| WO (1) | WO2018023025A1 (ja) |
Families Citing this family (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2708032C2 (ru) | 2013-02-20 | 2019-12-03 | Новартис Аг | ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII |
| EP2958942B1 (en) | 2013-02-20 | 2020-06-03 | Novartis AG | Effective targeting of primary human leukemia using anti-cd123 chimeric antigen receptor engineered t cells |
| WO2014145252A2 (en) | 2013-03-15 | 2014-09-18 | Milone Michael C | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| TWI654206B (zh) | 2013-03-16 | 2019-03-21 | 諾華公司 | 使用人類化抗-cd19嵌合抗原受體治療癌症 |
| EP3087101B1 (en) | 2013-12-20 | 2024-06-05 | Novartis AG | Regulatable chimeric antigen receptor |
| US11028143B2 (en) | 2014-01-21 | 2021-06-08 | Novartis Ag | Enhanced antigen presenting ability of RNA CAR T cells by co-introduction of costimulatory molecules |
| JOP20200094A1 (ar) | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| CU24481B1 (es) * | 2014-03-14 | 2020-03-04 | Immutep Sas | Moléculas de anticuerpo que se unen a lag-3 |
| US11542488B2 (en) | 2014-07-21 | 2023-01-03 | Novartis Ag | Sortase synthesized chimeric antigen receptors |
| BR112017000939A2 (pt) | 2014-07-21 | 2017-11-14 | Novartis Ag | tratamento de câncer usando um receptor antigênico quimérico de cll-1 |
| WO2016014576A1 (en) | 2014-07-21 | 2016-01-28 | Novartis Ag | Treatment of cancer using a cd33 chimeric antigen receptor |
| MY181834A (en) | 2014-07-21 | 2021-01-08 | Novartis Ag | Treatment of cancer using humanized anti-bcma chimeric antigen receptor |
| RU2724999C2 (ru) | 2014-08-19 | 2020-06-29 | Новартис Аг | Химерный антигенный рецептор (car) против cd123 для использования в лечении злокачественных опухолей |
| WO2016044605A1 (en) | 2014-09-17 | 2016-03-24 | Beatty, Gregory | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| WO2016057705A1 (en) | 2014-10-08 | 2016-04-14 | Novartis Ag | Biomarkers predictive of therapeutic responsiveness to chimeric antigen receptor therapy and uses thereof |
| US11459390B2 (en) | 2015-01-16 | 2022-10-04 | Novartis Ag | Phosphoglycerate kinase 1 (PGK) promoters and methods of use for expressing chimeric antigen receptor |
| US11161907B2 (en) | 2015-02-02 | 2021-11-02 | Novartis Ag | Car-expressing cells against multiple tumor antigens and uses thereof |
| DK3280729T3 (da) | 2015-04-08 | 2022-07-25 | Novartis Ag | Cd20-behandlinger, cd22-behandlinger og kombinationsbehandlinger med en cd19-kimær antigenreceptor (car)-udtrykkende celle |
| AU2016249005B2 (en) | 2015-04-17 | 2022-06-16 | Novartis Ag | Methods for improving the efficacy and expansion of chimeric antigen receptor-expressing cells |
| CN109476722A (zh) | 2015-07-21 | 2019-03-15 | 诺华股份有限公司 | 用于改善免疫细胞的功效和扩张的方法 |
| WO2017027392A1 (en) | 2015-08-07 | 2017-02-16 | Novartis Ag | Treatment of cancer using chimeric cd3 receptor proteins |
| US11747346B2 (en) | 2015-09-03 | 2023-09-05 | Novartis Ag | Biomarkers predictive of cytokine release syndrome |
| SG10202109655VA (en) | 2015-12-04 | 2021-10-28 | Novartis Ag | Compositions and methods for immunooncology |
| EP3432924A1 (en) | 2016-03-23 | 2019-01-30 | Novartis AG | Cell secreted minibodies and uses thereof |
| US11446398B2 (en) | 2016-04-11 | 2022-09-20 | Obsidian Therapeutics, Inc. | Regulated biocircuit systems |
| KR20190058509A (ko) | 2016-10-07 | 2019-05-29 | 티씨알2 테라퓨틱스 인크. | 융합 단백질을 이용하는 t-세포 수용체 리프로그래밍을 위한 조성물 및 방법 |
| TW202340473A (zh) | 2016-10-07 | 2023-10-16 | 瑞士商諾華公司 | 利用嵌合抗原受體之癌症治療 |
| ES2939646T3 (es) | 2016-10-13 | 2023-04-25 | Juno Therapeutics Inc | Métodos y composiciones de inmunoterapia que comprenden moduladores de la vía metabólica del triptófano |
| ES2912408T3 (es) | 2017-01-26 | 2022-05-25 | Novartis Ag | Composiciones de CD28 y métodos para terapia con receptores quiméricos para antígenos |
| US11629340B2 (en) | 2017-03-03 | 2023-04-18 | Obsidian Therapeutics, Inc. | DHFR tunable protein regulation |
| AU2018227583B2 (en) * | 2017-03-03 | 2023-06-01 | Obsidian Therapeutics, Inc. | CD19 compositions and methods for immunotherapy |
| MX2019011272A (es) | 2017-03-22 | 2019-10-24 | Novartis Ag | Composiciones y metodos para inmunooncologia. |
| TW202428622A (zh) | 2017-10-18 | 2024-07-16 | 瑞士商諾華公司 | 用於選擇性蛋白質降解的組合物及方法 |
| JP7517983B2 (ja) * | 2017-11-20 | 2024-07-17 | ユリウス-マクシミリアン-ウニヴェルシテート・ヴュルツブルク | 非常に低レベルのcd19を発現する骨髄腫細胞を除去するcd19cart細胞 |
| RU2020124143A (ru) * | 2017-12-22 | 2022-01-24 | Кодадженикс Инк. | Рекомбинантный вирус с областью деоптимизированной пары кодонов и его применение для лечения рака |
| WO2019143272A1 (en) | 2018-01-16 | 2019-07-25 | Cls Therapeutics Limited | Treatment of diseases by liver expression of an enzyme which has a deoxyribonuclease (dnase) activity |
| CN108424927A (zh) * | 2018-02-10 | 2018-08-21 | 武汉波睿达生物科技有限公司 | 一种能同时表达cd19 car和敲低t细胞表面pd-1表达的质粒结构及其构建方法 |
| US12097257B2 (en) | 2018-03-05 | 2024-09-24 | New York University | Induction and enhancement of antitumor immunity involving Sindbis virus vectors expressing immune checkpoint proteins |
| TW202016139A (zh) | 2018-06-13 | 2020-05-01 | 瑞士商諾華公司 | Bcma 嵌合抗原受體及其用途 |
| KR20210065962A (ko) * | 2018-09-25 | 2021-06-04 | 셀라토 파마슈티칼즈, 인코포레이티드 | 혈액학적 장애의 저강도 치료 |
| US20220088075A1 (en) * | 2019-02-22 | 2022-03-24 | The Trustees Of The University Of Pennsylvania | Combination therapies of egfrviii chimeric antigen receptors and pd-1 inhibitors |
| WO2020180882A1 (en) | 2019-03-05 | 2020-09-10 | Nkarta, Inc. | Cd19-directed chimeric antigen receptors and uses thereof in immunotherapy |
| CN114206357A (zh) * | 2019-03-22 | 2022-03-18 | T细胞受体治疗公司 | 使用融合蛋白进行tcr重编程的组合物和方法 |
| CN111743923A (zh) * | 2019-03-27 | 2020-10-09 | 北京康万达医药科技有限公司 | 包含分离的重组溶瘤腺病毒和免疫细胞的治疗剂及其应用 |
| CN110408698B (zh) * | 2019-06-17 | 2023-05-30 | 重庆医科大学附属第二医院 | 肝癌的新诊治标志物lncRNA-LALR1及应用 |
| JP2022537066A (ja) * | 2019-06-21 | 2022-08-23 | シャタック ラボ,インコーポレイテッド | キメラタンパク質を発現するt細胞 |
| US20220275104A1 (en) * | 2019-08-01 | 2022-09-01 | Mie University | Gd2 binding molecule |
| US20220332780A1 (en) | 2019-09-10 | 2022-10-20 | Obsidian Therapeutics, Inc. | Ca2-il15 fusion proteins for tunable regulation |
| CN110592140A (zh) * | 2019-09-30 | 2019-12-20 | 王清路 | Pd-1基因缺陷型pd-1-cart细胞制剂的制法 |
| BR112022009679A2 (pt) | 2019-11-26 | 2022-08-09 | Novartis Ag | Receptores de antígeno quimérico cd19 e cd22 e usos dos mesmos |
| WO2021127428A1 (en) * | 2019-12-18 | 2021-06-24 | Albert Einstein College Of Medicine | Chimeric antigen receptors targeting b7-h3 (cd276) and associated methods |
| CN113150167A (zh) * | 2020-01-22 | 2021-07-23 | 中国人民解放军总医院第五医学中心 | 一种能够反转pd-1免疫抑制信号的car t细胞结构em1设计 |
| WO2022150609A1 (en) * | 2021-01-08 | 2022-07-14 | Cls Therapeutics Limited | Combination of deoxyribonuclease enzyme and cell therapies for treatment of cancer |
| US20240181052A1 (en) * | 2021-03-29 | 2024-06-06 | Juno Therapeutics, Inc. | Methods for dosing and treatment with a combination of a checkpoint inhibitor therapy and a car t cell therapy |
| CN117693519A (zh) | 2021-05-25 | 2024-03-12 | 瓦克斯细胞生物 | 基于单体拟抗体的嵌合抗原受体和包含其的免疫细胞 |
| EP4384621A1 (en) * | 2021-08-09 | 2024-06-19 | The Trustees of The University of Pennsylvania | Optimizing t cell differentiation state with micrornas |
| TW202332456A (zh) * | 2021-10-06 | 2023-08-16 | 美商步行魚醫療公司 | 以經修飾之b細胞來增強t細胞活性之方法及組成物 |
| WO2023076811A1 (en) * | 2021-10-26 | 2023-05-04 | Seattle Children's Hospital (dba Seattle Children's Research Institute) | Combination therapies with chimeric antigen receptors |
| AU2023229697A1 (en) | 2022-03-08 | 2024-09-19 | Vaxcell-Bio Co., Ltd. | Pd-l1-specific chimeric antigen receptor and immune cell comprising same |
| CN117999344A (zh) * | 2022-07-14 | 2024-05-07 | 达仁生物科技有限公司 | Nkg2d嵌合抗原受体和pd1抑制剂联合治疗癌症的方法和药物 |
| WO2024102954A1 (en) | 2022-11-10 | 2024-05-16 | Massachusetts Institute Of Technology | Activation induced clipping system (aics) |
Family Cites Families (164)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4433059A (en) | 1981-09-08 | 1984-02-21 | Ortho Diagnostic Systems Inc. | Double antibody conjugate |
| US4444878A (en) | 1981-12-21 | 1984-04-24 | Boston Biomedical Research Institute, Inc. | Bispecific antibody determinants |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US5869620A (en) | 1986-09-02 | 1999-02-09 | Enzon, Inc. | Multivalent antigen-binding proteins |
| JPH021556A (ja) | 1988-06-09 | 1990-01-05 | Snow Brand Milk Prod Co Ltd | ハイブリッド抗体及びその作製方法 |
| US6352694B1 (en) | 1994-06-03 | 2002-03-05 | Genetics Institute, Inc. | Methods for inducing a population of T cells to proliferate using agents which recognize TCR/CD3 and ligands which stimulate an accessory molecule on the surface of the T cells |
| US6905680B2 (en) | 1988-11-23 | 2005-06-14 | Genetics Institute, Inc. | Methods of treating HIV infected subjects |
| US6534055B1 (en) | 1988-11-23 | 2003-03-18 | Genetics Institute, Inc. | Methods for selectively stimulating proliferation of T cells |
| US5858358A (en) | 1992-04-07 | 1999-01-12 | The United States Of America As Represented By The Secretary Of The Navy | Methods for selectively stimulating proliferation of T cells |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5399346A (en) | 1989-06-14 | 1995-03-21 | The United States Of America As Represented By The Department Of Health And Human Services | Gene therapy |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| AU6290090A (en) | 1989-08-29 | 1991-04-08 | University Of Southampton | Bi-or trispecific (fab)3 or (fab)4 conjugates |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5273743A (en) | 1990-03-09 | 1993-12-28 | Hybritech Incorporated | Trifunctional antibody-like compounds as a combined diagnostic and therapeutic agent |
| GB9012995D0 (en) | 1990-06-11 | 1990-08-01 | Celltech Ltd | Multivalent antigen-binding proteins |
| US5582996A (en) | 1990-12-04 | 1996-12-10 | The Wistar Institute Of Anatomy & Biology | Bifunctional antibodies and method of preparing same |
| DE69233482T2 (de) | 1991-05-17 | 2006-01-12 | Merck & Co., Inc. | Verfahren zur Verminderung der Immunogenität der variablen Antikörperdomänen |
| DE4118120A1 (de) | 1991-06-03 | 1992-12-10 | Behringwerke Ag | Tetravalente bispezifische rezeptoren, ihre herstellung und verwendung |
| US6511663B1 (en) | 1991-06-11 | 2003-01-28 | Celltech R&D Limited | Tri- and tetra-valent monospecific antigen-binding proteins |
| WO1992022653A1 (en) | 1991-06-14 | 1992-12-23 | Genentech, Inc. | Method for making humanized antibodies |
| US5637481A (en) | 1993-02-01 | 1997-06-10 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| US5932448A (en) | 1991-11-29 | 1999-08-03 | Protein Design Labs., Inc. | Bispecific antibody heterodimers |
| CA2103887C (en) | 1991-12-13 | 2005-08-30 | Gary M. Studnicka | Methods and materials for preparation of modified antibody variable domains and therapeutic uses thereof |
| US5910573A (en) | 1992-01-23 | 1999-06-08 | Merck Patent Gesellschaft Mit Beschrankter Haftung | Monomeric and dimeric antibody-fragment fusion proteins |
| CA2372813A1 (en) | 1992-02-06 | 1993-08-19 | L.L. Houston | Biosynthetic binding protein for cancer marker |
| GB9203459D0 (en) | 1992-02-19 | 1992-04-08 | Scotgen Ltd | Antibodies with germ-line variable regions |
| EP0640130B1 (en) | 1992-05-08 | 1998-04-15 | Creative Biomolecules, Inc. | Chimeric multivalent protein analogues and methods of use thereof |
| WO1994004678A1 (en) | 1992-08-21 | 1994-03-03 | Casterman Cecile | Immunoglobulins devoid of light chains |
| US6005079A (en) | 1992-08-21 | 1999-12-21 | Vrije Universiteit Brussels | Immunoglobulins devoid of light chains |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| EP1550729B1 (en) | 1992-09-25 | 2009-05-27 | Avipep Pty Limited | Target binding polypeptide comprising an IG-like VL domain linked to an IG-like VH domain |
| GB9221657D0 (en) | 1992-10-15 | 1992-11-25 | Scotgen Ltd | Recombinant bispecific antibodies |
| EP0627932B1 (en) | 1992-11-04 | 2002-05-08 | City Of Hope | Antibody construct |
| GB9323648D0 (en) | 1992-11-23 | 1994-01-05 | Zeneca Ltd | Proteins |
| WO1994013804A1 (en) | 1992-12-04 | 1994-06-23 | Medical Research Council | Multivalent and multispecific binding proteins, their manufacture and use |
| US6476198B1 (en) | 1993-07-13 | 2002-11-05 | The Scripps Research Institute | Multispecific and multivalent antigen-binding polypeptide molecules |
| US5635602A (en) | 1993-08-13 | 1997-06-03 | The Regents Of The University Of California | Design and synthesis of bispecific DNA-antibody conjugates |
| WO1995009917A1 (en) | 1993-10-07 | 1995-04-13 | The Regents Of The University Of California | Genetically engineered bispecific tetravalent antibodies |
| US7175843B2 (en) | 1994-06-03 | 2007-02-13 | Genetics Institute, Llc | Methods for selectively stimulating proliferation of T cells |
| JP3659261B2 (ja) | 1994-10-20 | 2005-06-15 | モルフォシス・アクチェンゲゼルシャフト | 組換体タンパク質の多機能性複合体への標的化ヘテロ結合 |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US6692964B1 (en) | 1995-05-04 | 2004-02-17 | The United States Of America As Represented By The Secretary Of The Navy | Methods for transfecting T cells |
| US7067318B2 (en) | 1995-06-07 | 2006-06-27 | The Regents Of The University Of Michigan | Methods for transfecting T cells |
| JPH11508126A (ja) | 1995-05-23 | 1999-07-21 | モルフォシス ゲゼルシャフト ファー プロテインオプティマイルング エムベーハー | 多量体タンパク質 |
| US5989830A (en) | 1995-10-16 | 1999-11-23 | Unilever Patent Holdings Bv | Bifunctional or bivalent antibody fragment analogue |
| ES2225961T3 (es) | 1996-04-04 | 2005-03-16 | Unilever N.V. | Proteina de union a antigeno multivalente y multiespecifica. |
| EP0979102A4 (en) | 1997-04-30 | 2005-11-23 | Enzon Inc | DETAILED POLYPEPTIDE MODIFIED BY POLYALKYLENE OXIDE |
| US20020062010A1 (en) | 1997-05-02 | 2002-05-23 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| US20030207346A1 (en) | 1997-05-02 | 2003-11-06 | William R. Arathoon | Method for making multispecific antibodies having heteromultimeric and common components |
| CA2304254C (en) | 1997-06-11 | 2012-05-22 | Hans Christian Thogersen | Trimerising module |
| CA2293632C (en) | 1997-06-12 | 2011-11-29 | Research Corporation Technologies, Inc. | Artificial antibody polypeptides |
| AU2152299A (en) | 1997-10-27 | 1999-05-24 | Unilever Plc | Multivalent antigen-binding proteins |
| DE69922159T2 (de) | 1998-01-23 | 2005-12-01 | Vlaams Interuniversitair Instituut Voor Biotechnologie | Mehrzweck-antikörperderivate |
| CZ121599A3 (cs) | 1998-04-09 | 1999-10-13 | Aventis Pharma Deutschland Gmbh | Jednořetězcová molekula vázající několik antigenů, způsob její přípravy a léčivo obsahující tuto molekulu |
| DE19819846B4 (de) | 1998-05-05 | 2016-11-24 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Multivalente Antikörper-Konstrukte |
| GB9812545D0 (en) | 1998-06-10 | 1998-08-05 | Celltech Therapeutics Ltd | Biological products |
| JP2002521053A (ja) | 1998-07-28 | 2002-07-16 | マイクロメット アーゲー | ヘテロミニ体 |
| US6333396B1 (en) | 1998-10-20 | 2001-12-25 | Enzon, Inc. | Method for targeted delivery of nucleic acids |
| US7534866B2 (en) | 2005-10-19 | 2009-05-19 | Ibc Pharmaceuticals, Inc. | Methods and compositions for generating bioactive assemblies of increased complexity and uses |
| US7527787B2 (en) | 2005-10-19 | 2009-05-05 | Ibc Pharmaceuticals, Inc. | Multivalent immunoglobulin-based bioactive assemblies |
| WO2001029058A1 (en) | 1999-10-15 | 2001-04-26 | University Of Massachusetts | Rna interference pathway genes as tools for targeted genetic interference |
| US6326193B1 (en) | 1999-11-05 | 2001-12-04 | Cambria Biosciences, Llc | Insect control agent |
| US6797514B2 (en) | 2000-02-24 | 2004-09-28 | Xcyte Therapies, Inc. | Simultaneous stimulation and concentration of cells |
| US7572631B2 (en) | 2000-02-24 | 2009-08-11 | Invitrogen Corporation | Activation and expansion of T cells |
| US6867041B2 (en) | 2000-02-24 | 2005-03-15 | Xcyte Therapies, Inc. | Simultaneous stimulation and concentration of cells |
| IL151287A0 (en) | 2000-02-24 | 2003-04-10 | Xcyte Therapies Inc | A method for stimulation and concentrating cells |
| EP1272647B1 (en) | 2000-04-11 | 2014-11-12 | Genentech, Inc. | Multivalent antibodies and uses therefor |
| US20020103345A1 (en) | 2000-05-24 | 2002-08-01 | Zhenping Zhu | Bispecific immunoglobulin-like antigen binding proteins and method of production |
| WO2001096584A2 (en) | 2000-06-12 | 2001-12-20 | Akkadix Corporation | Materials and methods for the control of nematodes |
| WO2002002781A1 (en) | 2000-06-30 | 2002-01-10 | Vlaams Interuniversitair Instituut Voor Biotechnologie Vzw | Heterodimeric fusion proteins |
| AU2001283496A1 (en) | 2000-07-25 | 2002-02-05 | Immunomedics, Inc. | Multivalent target binding protein |
| US20040242847A1 (en) | 2000-10-20 | 2004-12-02 | Naoshi Fukushima | Degraded agonist antibody |
| US7829084B2 (en) | 2001-01-17 | 2010-11-09 | Trubion Pharmaceuticals, Inc. | Binding constructs and methods for use thereof |
| AU2002247826A1 (en) | 2001-03-13 | 2002-09-24 | University College London | Specific binding members |
| CN1294148C (zh) | 2001-04-11 | 2007-01-10 | 中国科学院遗传与发育生物学研究所 | 环状单链三特异抗体 |
| DE60237282D1 (de) | 2001-06-28 | 2010-09-23 | Domantis Ltd | Doppelspezifischer ligand und dessen verwendung |
| US6833441B2 (en) | 2001-08-01 | 2004-12-21 | Abmaxis, Inc. | Compositions and methods for generating chimeric heteromultimers |
| JP5133494B2 (ja) | 2001-08-10 | 2013-01-30 | アバディーン ユニバーシティ | 抗原結合ドメイン |
| ATE346866T1 (de) | 2001-09-14 | 2006-12-15 | Affimed Therapeutics Ag | Multimerische, einzelkettige, tandem-fv- antikörper |
| US20030211078A1 (en) | 2001-12-07 | 2003-11-13 | Heavner George A. | Pseudo-antibody constructs |
| US7745140B2 (en) | 2002-01-03 | 2010-06-29 | The Trustees Of The University Of Pennsylvania | Activation and expansion of T-cells using an engineered multivalent signaling platform as a research tool |
| AU2003209446B2 (en) | 2002-03-01 | 2008-09-25 | Immunomedics, Inc. | Bispecific antibody point mutations for enhancing rate of clearance |
| AU2003227504A1 (en) | 2002-04-15 | 2003-10-27 | Chugai Seiyaku Kabushiki Kaisha | METHOD OF CONSTRUCTING scDb LIBRARY |
| US7446190B2 (en) | 2002-05-28 | 2008-11-04 | Sloan-Kettering Institute For Cancer Research | Nucleic acids encoding chimeric T cell receptors |
| ATE514713T1 (de) | 2002-12-23 | 2011-07-15 | Wyeth Llc | Antikörper gegen pd-1 und ihre verwendung |
| GB0230203D0 (en) | 2002-12-27 | 2003-02-05 | Domantis Ltd | Fc fusion |
| GB0305702D0 (en) | 2003-03-12 | 2003-04-16 | Univ Birmingham | Bispecific antibodies |
| US20050003403A1 (en) | 2003-04-22 | 2005-01-06 | Rossi Edmund A. | Polyvalent protein complex |
| WO2005000898A2 (en) | 2003-06-27 | 2005-01-06 | Biogen Idec Ma Inc. | Use of hydrophobic-interaction-chromatography or hinge-region modifications for the production of homogeneous antibody-solutions |
| AU2004255216B2 (en) | 2003-07-01 | 2010-08-19 | Immunomedics, Inc. | Multivalent carriers of bi-specific antibodies |
| US7696322B2 (en) | 2003-07-28 | 2010-04-13 | Catalent Pharma Solutions, Inc. | Fusion antibodies |
| WO2005042743A2 (en) | 2003-08-18 | 2005-05-12 | Medimmune, Inc. | Humanization of antibodies |
| WO2005035575A2 (en) | 2003-08-22 | 2005-04-21 | Medimmune, Inc. | Humanization of antibodies |
| EP1688439A4 (en) | 2003-10-08 | 2007-12-19 | Kyowa Hakko Kogyo Kk | HYBRID PROTEIN COMPOSITION |
| US7435596B2 (en) | 2004-11-04 | 2008-10-14 | St. Jude Children's Research Hospital, Inc. | Modified cell line and method for expansion of NK cell |
| US20050136051A1 (en) | 2003-12-22 | 2005-06-23 | Bernard Scallon | Methods for generating multimeric molecules |
| GB0329825D0 (en) | 2003-12-23 | 2004-01-28 | Celltech R&D Ltd | Biological products |
| US20050266425A1 (en) | 2003-12-31 | 2005-12-01 | Vaccinex, Inc. | Methods for producing and identifying multispecific antibodies |
| US8383575B2 (en) | 2004-01-30 | 2013-02-26 | Paul Scherrer Institut | (DI)barnase-barstar complexes |
| WO2005118788A2 (en) | 2004-05-27 | 2005-12-15 | The Trustees Of The University Of Pennsylvania | Novel artificial antigen presenting cells and uses therefor |
| JP2008512352A (ja) | 2004-07-17 | 2008-04-24 | イムクローン システムズ インコーポレイティド | 新規な四価の二重特異性抗体 |
| MX2007002856A (es) | 2004-09-02 | 2007-09-25 | Genentech Inc | Metodos para el uso de ligandos receptores de muerte y anticuerpos c20. |
| EP3050963B1 (en) | 2005-03-31 | 2019-09-18 | Chugai Seiyaku Kabushiki Kaisha | Process for production of polypeptide by regulation of assembly |
| JP5011277B2 (ja) | 2005-04-06 | 2012-08-29 | アイビーシー・ファーマシューティカルズ・インコーポレーテッド | ホモダイマー、ホモテトラマーまたはダイマーのダイマーのからなる安定に連結された複合体を発生させるための方法および使用 |
| ES2707152T3 (es) | 2005-04-15 | 2019-04-02 | Macrogenics Inc | Diacuerpos covalentes y usos de los mismos |
| US20060263367A1 (en) | 2005-05-23 | 2006-11-23 | Fey Georg H | Bispecific antibody devoid of Fc region and method of treatment using same |
| US7612181B2 (en) | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| MY169746A (en) | 2005-08-19 | 2019-05-14 | Abbvie Inc | Dual variable domain immunoglobulin and uses thereof |
| ATE452913T1 (de) | 2005-08-26 | 2010-01-15 | Pls Design Gmbh | Bivalente igy antikörperkonstrukte für diagnostische und therapeutische anwendungen |
| WO2007044887A2 (en) | 2005-10-11 | 2007-04-19 | Transtarget, Inc. | Method for producing a population of homogenous tetravalent bispecific antibodies |
| EP1962961B1 (en) | 2005-11-29 | 2013-01-09 | The University Of Sydney | Demibodies: dimerisation-activated therapeutic agents |
| MX2008010561A (es) | 2006-02-15 | 2009-03-02 | Imclone Systems Inc | Anticuerpos funcionales. |
| JP5374359B2 (ja) | 2006-03-17 | 2013-12-25 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 安定化されたポリペプチド化合物 |
| JP5474531B2 (ja) | 2006-03-24 | 2014-04-16 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 操作されたヘテロ二量体タンパク質ドメイン |
| WO2007112362A2 (en) | 2006-03-24 | 2007-10-04 | The Regents Of The University Of California | Construction of a multivalent scfv through alkyne-azide 1,3-dipolar cycloaddition |
| ES2654040T3 (es) | 2006-03-31 | 2018-02-12 | Chugai Seiyaku Kabushiki Kaisha | Método de modificación de anticuerpos para la purificación de anticuerpos biespecíficos |
| JP5189082B2 (ja) | 2006-05-25 | 2013-04-24 | バイエル・ファルマ・アクチェンゲゼルシャフト | 二量体分子複合体 |
| US20070274985A1 (en) | 2006-05-26 | 2007-11-29 | Stefan Dubel | Antibody |
| CA2654317A1 (en) | 2006-06-12 | 2007-12-21 | Trubion Pharmaceuticals, Inc. | Single-chain multivalent binding proteins with effector function |
| US8759297B2 (en) | 2006-08-18 | 2014-06-24 | Armagen Technologies, Inc. | Genetically encoded multifunctional compositions bidirectionally transported between peripheral blood and the cns |
| WO2008027236A2 (en) | 2006-08-30 | 2008-03-06 | Genentech, Inc. | Multispecific antibodies |
| WO2008140477A2 (en) | 2006-11-02 | 2008-11-20 | Capon Daniel J | Hybrid immunoglobulins with moving parts |
| EP2626372B1 (en) | 2007-03-29 | 2018-03-21 | Genmab A/S | Bispecific antibodies and methods for production thereof |
| EP2144930A1 (en) | 2007-04-18 | 2010-01-20 | ZymoGenetics, Inc. | Single chain fc, methods of making and methods of treatment |
| WO2009018386A1 (en) | 2007-07-31 | 2009-02-05 | Medimmune, Llc | Multispecific epitope binding proteins and uses thereof |
| JP5485152B2 (ja) | 2007-08-15 | 2014-05-07 | バイエル・インテレクチュアル・プロパティ・ゲゼルシャフト・ミット・ベシュレンクテル・ハフツング | 単一特異性および多特異性抗体ならびに使用方法 |
| JP2011504740A (ja) | 2007-11-27 | 2011-02-17 | アブリンクス エン.ヴェー. | ヘテロ二量体サイトカイン及び/又はこれらの受容体に指向性を有するアミノ酸配列、並びにこれを含むポリペプチド |
| TW200944231A (en) | 2007-11-30 | 2009-11-01 | Glaxo Group Ltd | Antigen-binding constructs |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| US8242247B2 (en) | 2007-12-21 | 2012-08-14 | Hoffmann-La Roche Inc. | Bivalent, bispecific antibodies |
| US9266967B2 (en) | 2007-12-21 | 2016-02-23 | Hoffmann-La Roche, Inc. | Bivalent, bispecific antibodies |
| US8227577B2 (en) | 2007-12-21 | 2012-07-24 | Hoffman-La Roche Inc. | Bivalent, bispecific antibodies |
| HUE028536T2 (en) | 2008-01-07 | 2016-12-28 | Amgen Inc | Method for producing antibody to FC heterodimer molecules using electrostatic control effects |
| SI2350129T1 (sl) | 2008-08-25 | 2015-11-30 | Amplimmune, Inc. | Sestavki PD-1 antagonistov in postopek njihove uporabe |
| EP2424567B1 (en) | 2009-04-27 | 2018-11-21 | OncoMed Pharmaceuticals, Inc. | Method for making heteromultimeric molecules |
| PT2560993T (pt) | 2010-04-20 | 2024-09-16 | Genmab As | Proteínas contendo anticorpo heterodimérico fc e métodos para a produção das mesmas |
| SG190997A1 (en) | 2010-12-09 | 2013-07-31 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| JP6076963B2 (ja) | 2011-04-08 | 2017-02-15 | アメリカ合衆国 | 抗上皮成長因子受容体変異体iiiキメラ抗原受容体及び癌の治療のためのその使用 |
| EP3674320A3 (en) | 2011-10-27 | 2020-08-12 | Genmab A/S | Production of heterodimeric proteins |
| MX2014010183A (es) | 2012-02-22 | 2015-03-20 | Univ Pennsylvania | Composiciones y metodos para generar una poblacion persistente de celulas t utiles para el tratamiento de cancer. |
| US9365641B2 (en) | 2012-10-01 | 2016-06-14 | The Trustees Of The University Of Pennsylvania | Compositions and methods for targeting stromal cells for the treatment of cancer |
| WO2014055657A1 (en) | 2012-10-05 | 2014-04-10 | The Trustees Of The University Of Pennsylvania | Use of a trans-signaling approach in chimeric antigen receptors |
| EP2958942B1 (en) | 2013-02-20 | 2020-06-03 | Novartis AG | Effective targeting of primary human leukemia using anti-cd123 chimeric antigen receptor engineered t cells |
| RU2708032C2 (ru) | 2013-02-20 | 2019-12-03 | Новартис Аг | ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII |
| WO2014145252A2 (en) | 2013-03-15 | 2014-09-18 | Milone Michael C | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| TWI654206B (zh) | 2013-03-16 | 2019-03-21 | 諾華公司 | 使用人類化抗-cd19嵌合抗原受體治療癌症 |
| ES2831315T3 (es) | 2013-04-03 | 2021-06-08 | Memorial Sloan Kettering Cancer Center | Generación efectiva de células T dirigidas al tumor derivadas de células madre pluripotentes |
| CN116478927A (zh) | 2013-12-19 | 2023-07-25 | 诺华股份有限公司 | 人间皮素嵌合抗原受体及其用途 |
| JOP20200094A1 (ar) * | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| EP3593812A3 (en) | 2014-03-15 | 2020-05-27 | Novartis AG | Treatment of cancer using chimeric antigen receptor |
| SG10202109752XA (en) * | 2014-04-07 | 2021-10-28 | Novartis Ag | Treatment of cancer using anti-cd19 chimeric antigen receptor |
| BR112017000939A2 (pt) | 2014-07-21 | 2017-11-14 | Novartis Ag | tratamento de câncer usando um receptor antigênico quimérico de cll-1 |
| WO2016014576A1 (en) | 2014-07-21 | 2016-01-28 | Novartis Ag | Treatment of cancer using a cd33 chimeric antigen receptor |
| MY181834A (en) | 2014-07-21 | 2021-01-08 | Novartis Ag | Treatment of cancer using humanized anti-bcma chimeric antigen receptor |
| EP4205749A1 (en) * | 2014-07-31 | 2023-07-05 | Novartis AG | Subset-optimized chimeric antigen receptor-containing cells |
| JP6919118B2 (ja) | 2014-08-14 | 2021-08-18 | ノバルティス アーゲー | GFRα−4キメラ抗原受容体を用いる癌の治療 |
| RU2724999C2 (ru) | 2014-08-19 | 2020-06-29 | Новартис Аг | Химерный антигенный рецептор (car) против cd123 для использования в лечении злокачественных опухолей |
| WO2016057705A1 (en) * | 2014-10-08 | 2016-04-14 | Novartis Ag | Biomarkers predictive of therapeutic responsiveness to chimeric antigen receptor therapy and uses thereof |
| SG11201703203RA (en) * | 2014-10-20 | 2017-05-30 | Juno Therapeutics Inc | Methods and compositions for dosing in adoptive cell therapy |
| DK3280729T3 (da) | 2015-04-08 | 2022-07-25 | Novartis Ag | Cd20-behandlinger, cd22-behandlinger og kombinationsbehandlinger med en cd19-kimær antigenreceptor (car)-udtrykkende celle |
-
2017
- 2017-07-28 CN CN202410141903.5A patent/CN118021943A/zh active Pending
- 2017-07-28 EP EP17757594.1A patent/EP3491016A1/en active Pending
- 2017-07-28 CA CA3032054A patent/CA3032054A1/en active Pending
- 2017-07-28 US US16/321,322 patent/US20190151365A1/en active Pending
- 2017-07-28 KR KR1020197005490A patent/KR20190034588A/ko not_active IP Right Cessation
- 2017-07-28 AU AU2017302668A patent/AU2017302668B9/en active Active
- 2017-07-28 BR BR112019001570A patent/BR112019001570A2/pt unknown
- 2017-07-28 KR KR1020237020747A patent/KR20230100748A/ko not_active Application Discontinuation
- 2017-07-28 WO PCT/US2017/044425 patent/WO2018023025A1/en unknown
- 2017-07-28 CN CN202410141560.2A patent/CN117959417A/zh active Pending
- 2017-07-28 CN CN201780059525.4A patent/CN110214150A/zh active Pending
- 2017-07-28 SG SG11201900677SA patent/SG11201900677SA/en unknown
- 2017-07-28 JP JP2019526201A patent/JP2019523301A/ja not_active Withdrawn
- 2017-07-28 TW TW106125631A patent/TW201806619A/zh unknown
-
2019
- 2019-01-27 IL IL264486A patent/IL264486A/en unknown
-
2022
- 2022-03-09 JP JP2022036315A patent/JP2022088432A/ja active Pending
-
2023
- 2023-12-18 AU AU2023284778A patent/AU2023284778A1/en active Pending
Non-Patent Citations (5)
| Title |
|---|
| BLOOD, vol. 126(23), JPN6021027075, 2015, pages 834, ISSN: 0004770657 * |
| BLOOD, vol. 126(23), JPN6021027077, 2015, pages 5430, ISSN: 0004770655 * |
| CLINICAL CANSER RESEARCH, vol. 19(20), JPN6021027078, 2013, pages 5636 - 5646, ISSN: 0004770654 * |
| JOURNAL OF CLINICAL INVESTIGATION, vol. 126(8), JPN6021027079, 25 July 2016 (2016-07-25), pages 3130 - 3144, ISSN: 0004770653 * |
| 日本臨床免疫学会会誌, vol. 39(3), JPN6021027076, 17 June 2016 (2016-06-17), pages 164 - 171, ISSN: 0004770656 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN117959417A (zh) | 2024-05-03 |
| BR112019001570A2 (pt) | 2019-07-09 |
| RU2019105559A (ru) | 2020-08-28 |
| EP3491016A1 (en) | 2019-06-05 |
| CA3032054A1 (en) | 2018-02-01 |
| US20190151365A1 (en) | 2019-05-23 |
| JP2022088432A (ja) | 2022-06-14 |
| CN118021943A (zh) | 2024-05-14 |
| KR20190034588A (ko) | 2019-04-02 |
| SG11201900677SA (en) | 2019-02-27 |
| RU2019105559A3 (ja) | 2021-04-27 |
| AU2017302668A1 (en) | 2019-02-14 |
| CN110214150A (zh) | 2019-09-06 |
| AU2017302668B2 (en) | 2023-06-08 |
| AU2023284778A1 (en) | 2024-02-22 |
| KR20230100748A (ko) | 2023-07-05 |
| WO2018023025A1 (en) | 2018-02-01 |
| TW201806619A (zh) | 2018-03-01 |
| WO2018023025A8 (en) | 2019-06-06 |
| IL264486A (en) | 2019-02-28 |
| AU2017302668B9 (en) | 2023-06-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20240139244A1 (en) | Cells expressing multiple chimeric antigen receptor (car) molecules and uses therefore | |
| JP7524249B2 (ja) | 抗癌治療における組み合わせ使用のためのメソテリンキメラ抗原受容体(car)およびpd-l1阻害剤に対する抗体 | |
| AU2017302668B2 (en) | Combination therapies of chimeric antigen receptors and PD-1 inhibitors | |
| JP7219376B2 (ja) | キメラ抗原受容体をキナーゼ阻害薬と併用して使用したサイトカイン放出症候群の治療及び予防 | |
| US20200339651A1 (en) | Methods for b cell preconditioning in car therapy | |
| US20200085869A1 (en) | Therapeutic regimens for chimeric antigen receptor therapies | |
| US20210213063A1 (en) | Combination therapy with chimeric antigen receptor (car) therapies | |
| JP2019206538A (ja) | キメラ抗原受容体を使用する癌の処置 | |
| WO2016126608A1 (en) | Car-expressing cells against multiple tumor antigens and uses thereof | |
| JP2017534261A (ja) | 養子免疫療法のためのキメラ受容体での細胞毒性細胞のターゲティング | |
| US20180092968A1 (en) | Compositions to disrupt protein kinase a anchoring and uses thereof | |
| US20210179709A1 (en) | Anti-car compositions and methods | |
| US20200390811A1 (en) | Compositions to disrupt protein kinase a anchoring and uses thereof | |
| BR122024008851A2 (pt) | Terapia de receptores de antígeno quiméricos, e uso de população de células que expressam receptores de antígeno quiméricos em combinação com inibidores de pd-1 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200727 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200727 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210713 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211013 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20211109 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220309 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20220309 |
|
| C11 | Written invitation by the commissioner to file amendments |
Free format text: JAPANESE INTERMEDIATE CODE: C11 Effective date: 20220322 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20220421 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20220426 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20220513 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20220517 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20230113 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231225 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20240830 |