WO2005014689A2 - Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung - Google Patents
Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung Download PDFInfo
- Publication number
- WO2005014689A2 WO2005014689A2 PCT/EP2004/009019 EP2004009019W WO2005014689A2 WO 2005014689 A2 WO2005014689 A2 WO 2005014689A2 EP 2004009019 W EP2004009019 W EP 2004009019W WO 2005014689 A2 WO2005014689 A2 WO 2005014689A2
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- formula
- derivatives
- units
- polymers
- atoms
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
- PHCCTARIZGWEAG-UHFFFAOYSA-N Cc1ccc(-c(cc2)c3nccnc3c2-c2ccc[s]2)[s]1 Chemical compound Cc1ccc(-c(cc2)c3nccnc3c2-c2ccc[s]2)[s]1 PHCCTARIZGWEAG-UHFFFAOYSA-N 0.000 description 1
- KIOQIOMNVDJSFS-UHFFFAOYSA-N Cc1ccc(-c2ccc(-c3ccc(-c4cccc5n[s]nc45)[s]3)[s]2)c2n[s]nc12 Chemical compound Cc1ccc(-c2ccc(-c3ccc(-c4cccc5n[s]nc45)[s]3)[s]2)c2n[s]nc12 KIOQIOMNVDJSFS-UHFFFAOYSA-N 0.000 description 1
- DTNXKWSNCVWRSH-UHFFFAOYSA-N Cc1ccc(-c2nc(-c3ncccc3)c[o]2)nc1 Chemical compound Cc1ccc(-c2nc(-c3ncccc3)c[o]2)nc1 DTNXKWSNCVWRSH-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N c1cncnc1 Chemical compound c1cncnc1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N c1cnncc1 Chemical compound c1cnncc1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
- H10K85/113—Heteroaromatic compounds comprising sulfur or selene, e.g. polythiophene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/02—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/12—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule
- C08G61/122—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from five- or six-membered heterocyclic compounds, other than imides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G63/00—Macromolecular compounds obtained by reactions forming a carboxylic ester link in the main chain of the macromolecule
- C08G63/02—Polyesters derived from hydroxycarboxylic acids or from polycarboxylic acids and polyhydroxy compounds
- C08G63/12—Polyesters derived from hydroxycarboxylic acids or from polycarboxylic acids and polyhydroxy compounds derived from polycarboxylic acids and polyhydroxy compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L65/00—Compositions of macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain; Compositions of derivatives of such polymers
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/105—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing a methine or polymethine dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/109—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing other specific dyes
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K10/00—Organic devices specially adapted for rectifying, amplifying, oscillating or switching; Organic capacitors or resistors having potential barriers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/151—Copolymers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Definitions
- ladder PPPs LPPP
- poly-tetrahydropyrenes e.g. according to EP 699699
- PPPs containing Ansa structures e.g according to EP 690086
- the single-color displays can possibly be produced by simple coating technologies (such as squeegees, spin-coating), the use of printing processes (e.g. ink-jet printing, off-set printing, gravure printing processes) is necessary for multi-color or full-color display elements , Screen printing process) is very likely. All of these processes require soluble polymers.
- Unsubstituted poly (dihydrophenanthrene) are already in JP 04288322 and by T. Yamamoto et al. (Macromolecules 1992, 25, 1214-1223). Due to the lack of substitution both at the 9,10-position and at the aromatics, these polymers do not represent an alternative to the polymers according to the invention, since the unsubstituted polymers are insoluble and therefore cannot be processed from solution.
- F. Uckert (dissertation, University of Mainz 1998) also describes the synthesis of oligo (9,9,10,10-tetramethyl-9,10-dihydrophenanthrene).
- EP 1074600 describes alternating poly (arylene vinylene) compounds, one arylene unit being a 9,10-dialkyl-9,10-dihydrophenanthrene and the other being a substituted phenylene. Properties of this polymer, in particular in electroluminescence, are not described, so that this example does not show what special advantages this polymer should have.
- the invention relates to polymers containing at least 1 mol%, preferably at least 10 mol%, particularly preferably at least 40 mol%
- X is the same or different on each occurrence C (R3) (R4) or N (R3);
- Z is the same or different on each occurrence C (R5) or N;
- R1, R2, R3, R4 is the same or different H, fluorine, chlorine, bromine, iodine, CN, N (R6) 2 , Si (R6) 3 or B (R6) 2 , a straight-chain, branched or cyclic alkyl or alkoxy chain having 1 to 22 carbon atoms, may be replaced in the well 'one or more non-adjacent C atoms by NR6, O, S, O-CO-O, CONR6, Si (R6) 2 and one or more H atoms can be replaced by fluorine, an aryl, heteroaryl or aryloxy group with 5 to 40 C atoms, in which one or more C atoms can be replaced by O, S or N and which ones by one or more non-aromatic radicals R1 can be substituted, with two or more of the radicals R1 to R4 also being a ring system with one another can form; with the proviso that two substituents on one carbon atom (ie R1 and
- X C (R3) (R4), as shown in formula (Ia): R2 R3
- the polymers can be conjugated, partially conjugated, or non-conjugated. In a preferred embodiment of the invention, the polymers are conjugated or partially conjugated; In a particularly preferred embodiment of the invention, the polymers are conjugated.
- conjugated polymers are polymers which contain mainly sp 2 -hybridized carbon atoms in the main chain, which can also be replaced by corresponding heteroatoms. In the simplest case, this means alternating double and single bonds in the main chain. Mainly means that naturally occurring defects that lead to interruptions in conjugation do not invalidate the term "conjugated polymers".
- this application text also refers to conjugate if, for example, arylamine units and / or certain heterocycles (ie conjugation via N, O or S atoms) and / or organometallic complexes (ie conjugation via the metal atom) are present in the main chain
- partially conjugated polymers are polymers which either contain longer conjugated sections in the main chain, which are interrupted by non-conjugated sections, or which contain longer conjugated sections in the side chains of a polymer which is non-conjugated in the main chain.
- units such as simple (thio) ether bridges, alkyl chains,
- the polymers according to the invention can also contain further structural elements. These are u. a. such as those in the above.
- Group 1 units which significantly increase the hole injection and / or transport properties of the polymers
- Group 2 units which significantly increase the electron injection and / or transport properties of the polymers
- Group 3 units which have combinations of individual units of group 1 and group 2
- Group 4 units which change the emission characteristics to the extent that phosphorescence can be obtained instead of fluorescence
- Group 5 units which facilitate the transition from the so-called singlet to triplet state
- Group 6 units which influence the morphology or the emission color of the resulting polymers
- Group 7 units that are typically used as a backbone.
- Preferred polymers according to the invention are those in which at least one
- Structural element has charge transport properties, ie contain the units from groups 1 and / or 2.
- charge transport properties ie contain the units from groups 1 and / or 2.
- such structural elements should be understood to mean the following: If homopolymers or oligomers were to be produced from these structural elements, these would have - at least for one charge carrier, ie either electrons or holes - a higher charge carrier mobility than that of a polymer which consists exclusively of Structural elements according to formula (I) exists, the case is.
- the charge carrier mobility (measured in cm 2 / (V * s)) is preferably greater by at least a factor of 10, particularly preferably at least by a factor of 50.
- HOMO highest-lying occupied mole
- Preferred units of group 1 are units according to formulas (II) to (XX), A --- Ar 3-N— (Ar *) - N— Ar * --- * ,. , / - N ⁇ ⁇ 3 - I -Ar 3 / ⁇ Ar 3 - Ar 1 Ar 1 Formula (II) Formula (III)
- substituents R1 to R6 the above.
- substituents R1 and R6 the above.
- the different formulas at the free positions can be substituted by substituents R1 and the symbols and indices mean the following: n is the same or different at each occurrence 0, 1 or 2; P is the same or different on each occurrence 0, 1 or 2, preferably 0 or 1; o is the same or different at each occurrence 1, 2 or 3, preferably 1 or 2;
- Ar 1 , Ar 3 are identical or different in each occurrence to an aromatic or heteroaromatic ring system with 2 to 40 C atoms, which can be substituted or unsubstituted; the possible substituents R1 can potentially be in any free position;
- Ar 2 , Ar 4 are the same or different at each occurrence Ar 1 , Ar 3 or a substituted or unsubstituted stilbenylene or tolanylene unit;
- Ar ü is the same or different with each occurrence of either a system according to Ar 1 or an aromatic or heteroaromatic ring system with 9 to 40 aromatic atoms (C or heteroatoms), which can be substituted or unsubstituted and which consists of at least two condensed rings; the possible substituents R1 can potentially be located in any free position.
- LUMO lowest unoccupied molecular orbital
- Preferred units of group 2 are units according to formulas (XXI) to (XXXII),
- the polymers according to the invention contain units from group 3 in which units which increase the hole mobility and which increase the electron mobility are bonded directly to one another.
- units which increase the hole mobility and which increase the electron mobility are bonded directly to one another.
- These are below other units according to formulas (XXXIII) to (XXXXVII), or somewhat more generally according to formula (XXXXVIII), which have both one or more structures according to formulas (II) to (XX), as well as one or more structures according to formulas ( XXI) to (XXXII), where the various formulas at the free positions can be substituted by substituents R1 and the symbols R1, R2, R3, R4, R5, Ar 1 and indices n, p and o have the meaning given above and Y is the same or different on each occurrence O, S, Se, N, P, Si or Ge.
- Structural units according to group 4 are those which enable a transfer of so-called singlet excitons to triplet excitons and which can emit light from the triplet state with high efficiency even at room temperature, i.e. show electrophosphorescence instead of electrofluorescence, which often results in an increase in energy efficiency.
- the use of such metal complexes in low molecular weight OLEDs is described, for example, in MA Baldo, S. Lamansky, PE Burrows, ME Thompson, SR Forrest, Appl. Phys. Lett. 1999, 75, 4-6. • Compounds containing heavy atoms, ie atoms from the periodic table of the elements with an atomic number of more than 36, are initially suitable for this.
- Preferred units of group 4 are units of the formulas (XXXXIX) to (LVI),
- Structural elements of group 5 are those which facilitate the transition from the so-called singlet to triplet state, which can be used to support the structural elements of group 4 and which thus improve the phosphorescence properties of the structural elements of group 4.
- carbazole units particularly preferably bridged carbazole dimer units, are suitable for this, as are described in the not disclosed applications DE 10304819.7 and DE 10328627.6.
- aromatic structures which have 6 to 40 carbon atoms or stilbene, bisstyrylarylene or tolane derivatives, which can each be substituted with one or more non-aromatic radicals R1.
- R1 non-aromatic radicals
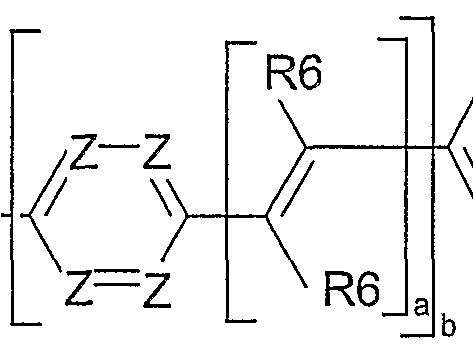
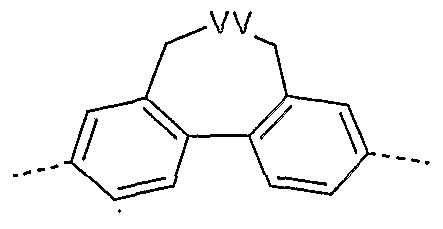
- Group 7 structural elements are units which contain aromatic structures with 6 to 40 C atoms, which are typically used as a polymer backbone. These would be, for example, 4,5-dihydropyrene derivatives, 4,5,9,10-tetrahydropyrene derivatives, fluorene derivatives, spirobifluorene derivatives, 5,7-dihydrodibenzooxepine derivatives and ice and trans indenofluorene derivatives.
- Preferred units of group 7 are units according to the formulas (LXIX) to (LXXVIII), where the various positions can be substituted by substituents R1, corresponds to YY Si or Ge and
- VV O, S, Se corresponds.
- the polymers according to the invention generally have 10 to 10,000, preferably 50 to 5000, particularly preferably 50 to 2000 repeating units.
- the necessary solubility of the polymers is v. a. guaranteed by the substituents R1 to R4, both on units of the formula (I) and on other repeating units. If substituents R5 and R6 are present, these also contribute to solubility.
- At least 2 non-aromatic carbon atoms are present in the substituents per repeating unit. At least 4, particularly preferably at least 8, carbon atoms are preferred. Some of these C atoms can also be replaced by O or S. However, this can mean that a certain proportion of repeat units, both according to formulas (I) to (LXXVIII) and other structure types, does not carry any further non-aromatic substituents.
- non-aromatic C atoms are in corresponding straight-chain, branched or cyclic
- the proportion of units of the formula (I) in the polymer is preferably at least 10 mol%, particularly preferably at least 40 mol%. This applies in particular if these units are used as a polymer backbone. If these units are used as emitting units, their proportion is preferably in the order of 5 to 20 mol%.
- Units of the formula (I) which are suitable as emitting units are in particular those in which at least one symbol a stands for 1 and the corresponding symbol b stands for 1 or 2.
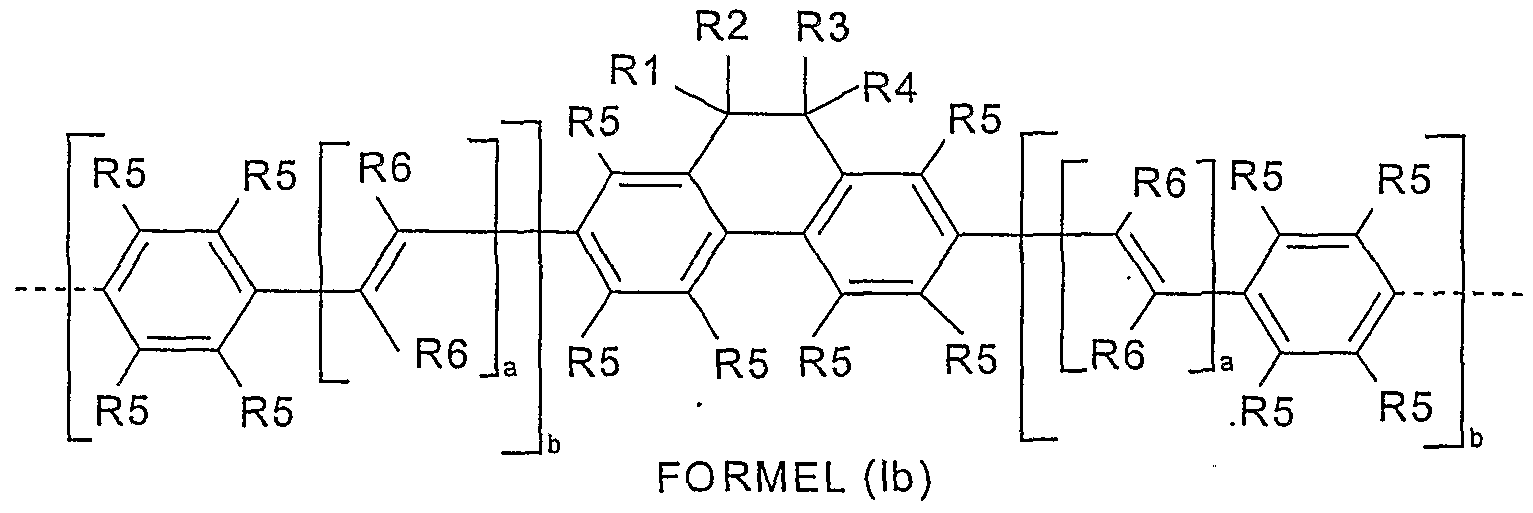
- X is the same or different in each occurrence C (R3) (R4); With each occurrence, R1-R4 is the same or different, a straight-chain, branched or cyclic alkyl or alkoxy chain with 1 to 10 C atoms, whereby one or more H atoms can also be replaced by fluorine, an aryl, heteroaryl or aryloxy group with 5 to 14 carbon atoms, in which one or more carbon atoms can be replaced by N, S or O and which are also substituted by one or more non-aromatic radicals R5; the other symbols are as defined above under formula (I).
- X is the same or different in each occurrence C (R3) (R4); Z is the same or different on each occurrence C (R5);
- R1-R4 is the same or different, a straight-chain or branched alkyl or alkoxy chain with 1 to 8 C atoms or an aryl or aryloxy group with 5 to 14 C atoms, in which one or more C atoms are also represented by N.
- S or O can be replaced and which are also substituted by one or more non-aromatic radicals R5; b is the same or different at each occurrence 0 or 1; the other symbols are as defined above under formula (I).
- polymers according to the invention are very particularly preferred in which the following applies to units of the formula (I): X is the same or different in each occurrence C (R3) (R4); Z is the same or different CH on each occurrence; R1, R3 are the same or different in each occurrence, a straight-chain or branched alkyl chain with 1 to 8 carbon atoms or an aryl group with 5 to 10 carbon atoms, in which one or more carbon atoms are also substituted by N, S or O.
- R5 can and which can also be substituted by one or more non-aromatic radicals R5; R2, R4 are identical or different in each occurrence a straight-chain or branched alkoxy chain with 1 to 8 carbon atoms; a is 1 at each occurrence if the units of the formula (I) are used as emitters; b is 1 on each occurrence if the units of the formula (I) are used as emitters; otherwise b is 0 on each occurrence; the other symbols are as defined above under formula (I).
- Examples of particularly preferred structures according to formula (I) are structures according to formulas (LXXIX) to (CVI), the linkage in the polymer taking place in each case via the 2,7 positions of the dihydrophenanthrene units, as indicated by the dashed bonds, and R for one straight-chain or branched alkyl chain with 1 to 8 carbon atoms:
- the polymers according to the invention are either homopolymers or copolymers.
- copolymers according to the invention can potentially have one or more further structures, for example of the formulas (II) to (LXXVI).
- copolymers according to the invention can have statistical, alternating or block-like structures or alternatively have several of these structures. How copolymers with block-like structures can be obtained and which other structural elements are particularly preferred for this purpose is described in detail, for example, in the unpublished application DE 10337077.3. This is part of the present application via quotation. By using several different structural elements, properties such as solubility, solid phase morphology, color, charge injection and transport properties, temperature stability, electro-optical characteristics, etc. can be set. Polymers according to the invention are preferred which, in addition to structural units of the formula (I), also have at least one structural unit of the formulas (II) to
- the proportion of these structural elements is at least 1 mol%, preferably at least 5 mol%.
- the maximum proportion of these structural elements is preferably at most 90 mol%, particularly preferably at most 60 mol%.
- These structural units can also be incorporated randomly, alternately or in blocks in the polymer. 0
- the polymers according to the invention have a comparison with the poly-spirobifluorenes and polyfluorenes described in WO 03/020790, described in WO 02/077060, which are hereby cited as the closest prior art. the following advantages: (1) It was surprisingly found that the polymers according to the invention (with 5 otherwise the same or similar structure) have higher luminous efficiencies in use.
- the polymers according to the invention are equivalent to the known polymers or have e.g. T. better solubility in a wider range of solvents.
- the accessibility and the attainability of colors is equivalent to the prior art for the polymers according to the invention. Although this is not an immediate advantage, it means that the 5 monomers according to the invention can be taken over in the polymerization without changing further process parameters, which is by no means as expected and therefore surprising.
- the type of installation of the structures according to formulas (II) to (LXXVIII) is already specified for a number (see e.g. formulas (II) to (VI) and formulas (XIV) to (XX)).
- Monomers which lead to structural units of the formula (I) in polymers according to the invention are dihydrophenanthrenes or corresponding nitrogen-containing derivatives which are appropriately substituted at the 9,10-position and have suitable functionalities at the 2,7-position which allow it to incorporate these monomer units into the polymer.
- Pinacolen leads. Such pinacols are also obtainable by reacting twice with a Grignard reagent, a lithium organic compound or a zinc organic compound on phenanthrenequinone. It may be preferred to carry out the reaction with the organometallic Mg, Li or Zn reagent first on the phenanthrenequinone and only at the end to introduce functionalities which allow the polymerization, such as bromine functionalities. It may also be preferred to first functionalize the phenanthrenequinone, for example by bromination, and then to carry out the reaction with the organometallic Mg, Li or Zn reagent.
- a dibromo derivative can be generated by bromination, for example with elemental bromine or NBS, which can either be used directly as a monomer in the polymerization or by methods which are known to the person skilled in the art, for example in boronic acid derivatives or stannates, which can then be converted can also be used in the polymerization.
- bromination for example with elemental bromine or NBS, which can either be used directly as a monomer in the polymerization or by methods which are known to the person skilled in the art, for example in boronic acid derivatives or stannates, which can then be converted can also be used in the polymerization.
- the invention therefore furthermore relates to bifunctional monomeric compounds of the formula (CVII), R2
- FORMULA (CVII) characterized in that the two functional groups AA, identical or different, copolymerize under the conditions of the CC linkages; the other symbols have the same meaning as in formula (I) with the proviso that not all of the radicals R1 to R4 may simultaneously be fluorine or chlorine.
- AA is preferably selected from the groups Cl, Br, I, O-tosylate, O-triflate, 0-S0 2 R5, B (OH) 2> B (OR5) 2 and Sn (R5) 3 .
- the CC links are preferably selected from the groups of the SUZUKI clutch, the YAMAMOTO clutch and the STILLE clutch. Particularly preferred here are monomeric compounds of the formula (CVII) which, after reaction in the polymer, lead to structural units of the formula (LXXIX) to (CVI).
- the invention further relates to a method according to formula (CVIII) for the preparation of symmetrical, monomeric bifunctional compounds according to formula (CVII), or a method according to formula (CIX) for the preparation of asymmetrical, monomeric bifunctional compounds according to formula (CVII), wherein X represents C (R3) (R4) and Z represents C (R5), R1 and R3 also represent an alkyl or aryl group and R2 and R4 represent an alkoxy group, characterized in that a phenanthrenequinone is reacted with an organic magnesium or Organic lithium or organic zinc compound, followed by reaction with an alkylating reagent R-LG under basic conditions:
- BB is the same or different H on each occurrence or has the same meaning as described for AA above;
- R-LG is the same or different alkylation reagent, where R stands for an alkyl group, preferably a linear or branched alkyl chain with 1 to 8 C atoms, and LG is a group which reacts under the conditions of nucleophilic aliphatic substitution as a leaving group , preferably Cl, Br, I, O-tosylate or O-trifiate; R1, R3 represents an alkyl, aryl or heteroaryl group;
- R2, R4 represents an alkoxy group O-R, where R has the same meaning as described above;
- organometallic Mg, Li or Zn reagent is carried out twice in succession for the synthesis of the asymmetrical monomeric compound.
- Lithium-organic compounds are understood to mean compounds which have at least one Li-C bond, in the simplest case R-Li, e.g. As phenyllithium, butyllithium, methyl lithium, covalent multicenter bonds are expressly permitted.
- metal hydrides such as. As sodium hydride, metal carbonates, such as. As sodium carbonate or potassium carbonate, or metal alcoholates, such as. B. sodium methoxide, sodium ethoxide or potassium tert-butoxide.
- a Grignard compound is used as the organometallic reagent.
- the polymers according to the invention are generally prepared by polymerizing one or more types of monomers, at least one of which is described by the formula (I) and, if present, further by the formulas (II) to (LXXVIII). There are in principle many corresponding polymerization reactions. However, some types have proven particularly useful here, all of which lead to C-C linkages:
- the polymer according to the invention can also be preferred not to use the polymer according to the invention as a pure substance, but as a mixture (blend) together with any other polymeric, oligomeric, dendritic or low molecular weight substances. These can, for example, improve the electronic properties, influence the transfer from the singlet to the triplet state or emit themselves. But electronically inactive substances can also be useful to influence, for example, the morphology of the polymer film formed or the viscosity of polymer solutions. Such blends are therefore also part of the present invention.
- the invention further relates to solutions and formulations of one or more polymers or blends according to the invention in one or more solvents. How polymer solutions can be prepared is described, for example, in WO 02/072714, in WO 03/019694 and in the literature cited therein. These solutions can then be used to produce thin polymer layers, for example by surface coating processes (for example spin coating) or by printing processes (for example inkjet printing).
- surface coating processes for example spin coating
- printing processes for example inkjet printing
- the polymers according to the invention are particularly suitable as electroluminescent materials in the PLEDs or displays produced in this way.
- electroluminescent materials are materials which can be used as an active layer in a PLED.
- Active layer means that the layer is capable of emitting light when an electric field is applied (light-emitting layer) and / or that it improves the injection and / or the transport of the positive and / or negative charges (charge injection or charge transport layer).
- the invention therefore also relates to the use of a polymer according to the invention in a PLED, in particular as an electroluminescent material.
- the invention thus also relates to a PLED with one or more active layers, at least one of these active layers containing one or more polymers according to the invention.
- the active layer can be, for example, a light-emitting layer and / or a charge transport layer and / or a charge injection layer.
- the aim is to use polymers or blends according to the invention in relation to PLEDs and the corresponding displays.
- devices for. B. for organic integrated circuits (O-ICs), in organic field-effect transistors (OFETs), in organic thin-film transistors (OTFTs), for organic solar cells (O-SCs), for organic photoreceptors or organic laser diodes (O-lasers ) to name just a few applications.
- O-ICs organic integrated circuits
- OFETs organic field-effect transistors
- OTFTs organic thin-film transistors
- O-SCs organic solar cells
- O-lasers organic laser diodes
- THF was added dropwise at an internal temperature of 10 ° C., 300 ml of a 2.0 M solution of n-butylmagnesium chloride (0.6 mol) within 1.5 h and then stirred at RT for 6 h. After hydrolysis with 125 mL sat. The precipitate was filtered off with NHCl solution, washed with ethyl acetate, the filtrate was extracted twice with water and the organic phase was dried over Na 2 SO 4 . The after
- Foam was suspended in 100 mL toluene and, after adding 4 mL ethylene glycol (71.2 mmol), heated to boiling until water was constantly released. The solvent was then distilled off and the remaining solid was recrystallized four times from ethyl acetate. 17 g (74%) of the bisboronic acid ester were obtained as colorless crystals with a purity of> 99.90% (RP-
- THF prepared the Grignard reagent and then added dropwise to the solution of 2,7-dibromo-10,10-dimethyl-10H-phenanthren-9-one (54.8 g, 144.2 mmol) in 220 mL THF at RT. The mixture was refluxed for 4 hours. For working up, the mixture was stirred into 50 ml of HCl in 500 ml of ice water, extracted with ethyl acetate, dried over Na 2 S0 and freed from the solvent in vacuo.
- Part B Synthesis of polymers containing dihydrophenanthrene units
- Manganese (0.1 1 g, 2 mmol) was mixed with NiBr 2 (200 mg, 0.9 mmol) dissolved in 5 mL DMF at room temperature.
- the ligand solution consisting of 150 mg (0.96 mmol) bipyridine and 0.12 mL (1.0 mmol) COD dissolved in 15 mL toluene was slowly added. After 5-10 minutes the solution became deep purple. The mixture was stirred vigorously at room temperature for 12 h.
- Comparative polymers (hereinafter referred to as V) were also synthesized, which instead of units according to formula (I) contain spirobifluorene units. All of these polymers have also been studied for use in PLEDs. These PLEDs were each two-layer systems, i.e. H.
- PEDOT is a polythiophene derivative (from H.C. Stark, Goslar). Ba / Ag was used as the cathode in all cases. How PLEDs can be represented has already been described in detail in WO 04/037887 and the literature cited therein. The most important device properties of the polymers according to the invention (color,
- Table 1 Properties of poly (dihydrophenanthrenes) and their comparison with poly (spirofluorene); all polymers were made by Suzuki polymerization. * GPC measurements: THF; 1 mL / min, Plgel 10 ⁇ m Mixed-B 2 x 300 x 7.5 mm 2 , 35 ° C, Rl detection was calibrated against polystyrene.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Electroluminescent Light Sources (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
Abstract
Description
Claims
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006522983A JP4824558B2 (ja) | 2003-08-12 | 2004-08-12 | ジヒドロフェナントレン単位を含む共役ポリマーとその使用 |
| DE502004011045T DE502004011045D1 (de) | 2003-08-12 | 2004-08-12 | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung |
| CN2004800231570A CN1835986B (zh) | 2003-08-12 | 2004-08-12 | 含有二氢菲单元的共轭聚合物及其用途 |
| US10/568,167 US7723455B2 (en) | 2003-08-12 | 2004-08-12 | Conjugated polymers containing dihydrophenanthrene units and use thereof |
| EP04764023A EP1656408B1 (de) | 2003-08-12 | 2004-08-12 | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10337346.2 | 2003-08-12 | ||
| DE10337346A DE10337346A1 (de) | 2003-08-12 | 2003-08-12 | Konjugierte Polymere enthaltend Dihydrophenanthren-Einheiten und deren Verwendung |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| WO2005014689A2 true WO2005014689A2 (de) | 2005-02-17 |
| WO2005014689A3 WO2005014689A3 (de) | 2005-03-31 |
Family
ID=34129580
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2004/009019 Ceased WO2005014689A2 (de) | 2003-08-12 | 2004-08-12 | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US7723455B2 (de) |
| EP (1) | EP1656408B1 (de) |
| JP (1) | JP4824558B2 (de) |
| KR (1) | KR20060118403A (de) |
| CN (1) | CN1835986B (de) |
| DE (2) | DE10337346A1 (de) |
| WO (1) | WO2005014689A2 (de) |
Cited By (297)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006097419A1 (en) * | 2005-03-14 | 2006-09-21 | Ciba Specialty Chemicals Holding Inc. | Novel polymers |
| WO2007017066A1 (de) * | 2005-08-10 | 2007-02-15 | Merck Patent Gmbh | Elektrolumineszierende polymere und ihre verwendung |
| WO2007022845A1 (de) | 2005-08-26 | 2007-03-01 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2007068325A1 (de) | 2005-12-17 | 2007-06-21 | Merck Patent Gmbh | Konjugierte polymere enthaltend triarylamin-arylvinylen-einheiten, deren darstellung und verwendung |
| WO2007090773A1 (en) * | 2006-02-10 | 2007-08-16 | Ciba Holding Inc. | Novel polymers |
| WO2007101820A1 (en) * | 2006-03-08 | 2007-09-13 | Ciba Holding Inc. | Palladium catalyzed polymerization reaction |
| EP1717258A4 (de) * | 2004-02-18 | 2007-11-07 | Tokyo Inst Tech | Dihalogenid, polymerverbindung und herstellungsverfahren dafür |
| WO2008006743A1 (en) * | 2006-07-14 | 2008-01-17 | Ciba Holding Inc | Novel electroluminescent polymers for electronic applications |
| WO2008019744A1 (de) * | 2006-08-17 | 2008-02-21 | Merck Patent Gmbh | Konjugierte polymere, verfahren zu deren herstellung sowie deren verwendung |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2009053088A1 (de) | 2007-10-24 | 2009-04-30 | Merck Patent Gmbh | Optoelektronische vorrichtung |
| WO2009053089A1 (de) | 2007-10-24 | 2009-04-30 | Merck Patent Gmbh | Optoelektronische vorrichtung |
| US7592622B2 (en) | 2004-08-11 | 2009-09-22 | Merck Patent Gmbh | Polymers for use in organic electroluminescent devices |
| DE102008015526A1 (de) | 2008-03-25 | 2009-10-01 | Merck Patent Gmbh | Metallkomplexe |
| DE102008017591A1 (de) | 2008-04-07 | 2009-10-08 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008027005A1 (de) | 2008-06-05 | 2009-12-10 | Merck Patent Gmbh | Organische elektronische Vorrichtung enthaltend Metallkomplexe |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2010506416A (ja) * | 2006-10-10 | 2010-02-25 | シーディーティー オックスフォード リミテッド | 発光素子 |
| DE102008045662A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Optoelektronische Vorrichtung |
| DE102008045664A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Optoelektronische Vorrichtung |
| DE102008044868A1 (de) | 2008-08-29 | 2010-03-04 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| DE102008045663A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Fluorverbrückte Assoziate für optoelektronische Anwendungen |
| DE102008050841A1 (de) | 2008-10-08 | 2010-04-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008049037A1 (de) | 2008-09-25 | 2010-04-22 | Merck Patent Gmbh | Neue Polymere mit niedriger Polydispersität |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057050A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057051A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005289A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005746A1 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010086089A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| DE102009009277A1 (de) | 2009-02-17 | 2010-08-19 | Merck Patent Gmbh | Organische elektronische Vorrichtung |
| WO2010097156A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Vernetzbare und vernetzte polymere, verfahren zu deren herstellung sowie deren verwendung |
| DE102009010713A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Polymer mit Aldehydgruppen, Umsetzung sowie Vernetzung dieses Polymers, vernetztes Polymer sowie Elektrolumineszenzvorrichtung enthaltend dieses Polymer |
| WO2010097155A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Polymer mit aldehydgruppen, umsetzung sowie vernetzung dieses polymers, vernetztes polymer sowie elektrolumineszenzvorrichtung enthaltend dieses polymer |
| WO2010099852A1 (de) | 2009-03-02 | 2010-09-10 | Merck Patent Gmbh | Metallkomplexe mit azaborol-liganden und elektronische vorrichtung damit |
| DE102009013041A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US7816531B2 (en) | 2004-07-16 | 2010-10-19 | Merck Patent Gmbh | Metal complexes |
| US7820305B2 (en) | 2004-07-06 | 2010-10-26 | Merck Patent Gmbh | Electroluminescent polymers |
| US7825249B2 (en) | 2004-05-19 | 2010-11-02 | Merck Patent Gmbh | Metal complexes |
| EP2248869A2 (de) | 2005-09-12 | 2010-11-10 | Merck Patent GmbH | Verbindungen für organische elektronische Vorrichtungen |
| DE102009023156A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Polymere, die substituierte Indenofluorenderivate als Struktureinheit enthalten, Verfahren zu deren Herstellung sowie deren Verwendung |
| WO2010149259A2 (en) | 2009-06-22 | 2010-12-29 | Merck Patent Gmbh | Conducting formulation |
| DE102009030847A1 (de) | 2009-06-26 | 2010-12-30 | Merck Patent Gmbh | Polymere enthaltend substituierte Anthracenyleinheiten, Blends enthaltend diese Polymere sowie Vorrichtungen enthaltend diese Polymere oder Blends |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009034194A1 (de) | 2009-07-22 | 2011-01-27 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009034625A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009030848A1 (de) | 2009-06-26 | 2011-02-03 | Merck Patent Gmbh | Polymere enthaltend Struktureinheiten, die Alkylalkoxygruppen aufweisen, Blends enthaltend diese Polymere sowie optoelektronische Vorrichtungen enthaltend diese Polymere und Blends |
| WO2011015265A2 (en) | 2009-08-04 | 2011-02-10 | Merck Patent Gmbh | Electronic devices comprising multi cyclic hydrocarbons |
| WO2011032686A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Formulierungen zur herstellung von elektronischen vorrichtungen |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011042107A2 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011054442A2 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| DE102009053382A1 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US7947382B2 (en) | 2004-04-26 | 2011-05-24 | Merck Patent Gmbh | Electroluminescent polymers and the use thereof |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009023154A1 (de) | 2009-05-29 | 2011-06-16 | Merck Patent Gmbh | Zusammensetzung, enthaltend mindestens eine Emitterverbindung und mindestens ein Polymer mit konjugationsunterbrechenden Einheiten |
| WO2011076324A1 (en) | 2009-12-23 | 2011-06-30 | Merck Patent Gmbh | Compositions comprising organic semiconducting compounds |
| WO2011076314A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent formulations |
| WO2011076326A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent functional surfactants |
| WO2011076323A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Formulations comprising phase-separated functional materials |
| DE102009059985A1 (de) | 2009-12-22 | 2011-07-07 | Merck Patent GmbH, 64293 | Polymer mit Aldehydgruppen, Umsetzung sowie Vernetzung dieses Polymers, vernetztes Polymer sowie Elektrolumineszenzvorrichtung enthaltend dieses Polymer |
| WO2011085781A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102010005697A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent GmbH, 64293 | Verbindungen für elektronische Vorrichtungen |
| WO2011091838A1 (de) | 2010-01-29 | 2011-08-04 | Merck Patent Gmbh | Styrolbasierte copolymere, insbesondere für die anwendung in optoelektronischen bauteilen |
| WO2011098205A1 (de) | 2010-02-12 | 2011-08-18 | Merck Patent Gmbh | Elektrolumineszierende polymere, verfahren zu ihrer herstellung sowie ihre verwendung |
| DE102010009193A1 (de) | 2010-02-24 | 2011-08-25 | Merck Patent GmbH, 64293 | Fluor-Fluor Assoziate |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2011110277A1 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Fibers in therapy and cosmetics |
| WO2011110275A2 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Radiative fibers |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011116857A1 (en) | 2010-03-23 | 2011-09-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2011128017A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Überbrückte triarylamine und -phosphine als materialien für elektronische vorrichtungen |
| WO2011128035A1 (en) | 2010-04-12 | 2011-10-20 | Merck Patent Gmbh | Composition and method for preparation of organic electronic devices |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| DE102010019306A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| US8058790B2 (en) | 2004-05-11 | 2011-11-15 | Merck Patent Gmbh | Material mixtures for use in electroluminescence |
| WO2011147521A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Down conversion |
| WO2011147523A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Formulation and method for preparation of organic electronic devices |
| WO2011147522A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Compositions comprising quantum dots |
| DE102009022858A1 (de) | 2009-05-27 | 2011-12-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011160758A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012007102A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Polymere materialien für organische elektrolumineszenzvorrichtungen |
| DE102010027316A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010032737A1 (de) | 2010-07-29 | 2012-02-02 | Merck Patent Gmbh | Polymere enthaltend substituierte Benzodithiopheneinheiten, Blends enthaltend diese Polymere sowie Vorrichtungen enthaltend diese Polymere oder Blends |
| DE102010033080A1 (de) | 2010-08-02 | 2012-02-02 | Merck Patent Gmbh | Polymere mit Struktureinheiten, die Elektronen-Transport-Eigenschaften aufweisen |
| WO2012016630A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US8129037B2 (en) | 2004-10-11 | 2012-03-06 | Merck Patent Gmbh | Phenanthrene derivative |
| DE102010045369A1 (de) | 2010-09-14 | 2012-03-15 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010048498A1 (de) | 2010-10-14 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012048780A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010056151A1 (de) | 2010-12-28 | 2012-06-28 | Merck Patent Gmbh | Materiallen für organische Elektrolumineszenzvorrichtungen |
| WO2012084114A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| WO2012095143A1 (de) | 2011-01-13 | 2012-07-19 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2482159A2 (de) | 2011-01-28 | 2012-08-01 | Honeywell International, Inc. | Verfahren und umkonfigurierbare System zur Optimierung der Leistung eines zustandsabhängigen Wartungssystems |
| WO2012107158A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | 1,3 - dioxan-5-on-verbindungen |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US8293380B2 (en) * | 2004-12-27 | 2012-10-23 | Sumitomo Chemical Company, Limited | Polymer compound and polymer light emitting device using the same |
| EP2514736A1 (de) | 2006-07-28 | 2012-10-24 | Basf Se | Zwischenprodukte für Polymere |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012150001A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| DE102011104745A1 (de) | 2011-06-17 | 2012-12-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2013013754A1 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Copolymers with functionalized side chains |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| WO2013060418A1 (en) | 2011-10-27 | 2013-05-02 | Merck Patent Gmbh | Materials for electronic devices |
| WO2013060411A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte polymere, verfahren zu deren herstellung sowie deren verwendung in elektronischen vorrichtungen |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| DE102011121022A1 (de) | 2011-12-13 | 2013-06-13 | Merck Patent Gmbh | Organische Sensibilisatoren für Up- Conversion |
| WO2013087142A1 (de) | 2011-12-12 | 2013-06-20 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| WO2013124029A2 (de) | 2012-02-22 | 2013-08-29 | Merck Patent Gmbh | Polymere enthaltend dibenzocycloheptan-struktureinheiten |
| WO2013139431A1 (de) | 2012-03-23 | 2013-09-26 | Merck Patent Gmbh | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen |
| US8558223B2 (en) | 2008-09-26 | 2013-10-15 | Osram Opto Semiconductors Gmbh | Organic electronic component and method for the production thereof |
| WO2013156130A1 (de) | 2012-04-17 | 2013-10-24 | Merck Patent Gmbh | Polymere enthaltend substituierte triarylamin-einheiten sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| WO2013182263A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Phenanthrenverbindungen für organische elektronische vorrichtungen |
| WO2014000860A1 (de) | 2012-06-29 | 2014-01-03 | Merck Patent Gmbh | Polymere enthaltend 2,7-pyren-struktureinheiten |
| WO2014008982A1 (de) | 2012-07-13 | 2014-01-16 | Merck Patent Gmbh | Metallkomplexe |
| WO2014015935A2 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektronische vorrichtungen |
| WO2014015938A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Derivate von 2-diarylaminofluoren und diese enthaltnde organische elektronische verbindungen |
| WO2014015937A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektrolumineszierende vorrichtungen |
| WO2014023377A2 (de) | 2012-08-07 | 2014-02-13 | Merck Patent Gmbh | Metallkomplexe |
| US8679644B2 (en) | 2004-04-26 | 2014-03-25 | Merck Patent Gmbh | Electroluminescent polymers containing planar arylamine units, the preparation and use thereof |
| US8679645B2 (en) | 2005-06-09 | 2014-03-25 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014101981A1 (en) | 2012-12-28 | 2014-07-03 | Merck Patent Gmbh | Composition comprising polymeric organic semiconducting compounds |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US8865321B2 (en) | 2008-11-11 | 2014-10-21 | Merck Patent Gmbh | Organic electroluminescent devices |
| WO2015014429A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elekrolumineszenzvorrichtung |
| WO2015014427A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elektrooptische vorrichtung und deren verwendung |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015090504A2 (de) | 2013-12-19 | 2015-06-25 | Merck Patent Gmbh | Heterocyclische spiroverbindungen |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016074755A1 (de) | 2014-11-11 | 2016-05-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016120007A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Formulations with a low particle content |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016124304A1 (de) | 2015-02-03 | 2016-08-11 | Merck Patent Gmbh | Metallkomplexe |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| WO2016198144A1 (en) | 2015-06-10 | 2016-12-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017008883A1 (en) | 2015-07-15 | 2017-01-19 | Merck Patent Gmbh | Composition comprising organic semiconducting compounds |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| WO2017012687A1 (en) | 2015-07-22 | 2017-01-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017157983A1 (de) | 2016-03-17 | 2017-09-21 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2017157783A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine formulierung enthaltend mindestens einen organischen halbleiter |
| WO2017178311A1 (de) | 2016-04-11 | 2017-10-19 | Merck Patent Gmbh | Heterocyclische verbindungen mit dibenzofuran- und/oder dibenzothiophen-strukturen |
| WO2017207596A1 (en) | 2016-06-03 | 2017-12-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001990A1 (de) | 2016-06-30 | 2018-01-04 | Merck Patent Gmbh | Verfahren zur auftrennung von enantiomerenmischungen von metallkomplexen |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018011186A1 (de) | 2016-07-14 | 2018-01-18 | Merck Patent Gmbh | Metallkomplexe |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018050583A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit carbazol-strukturen |
| WO2018050584A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2018060307A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Verbindungen mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018060218A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Carbazole mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2018087346A1 (de) | 2016-11-14 | 2018-05-17 | Merck Patent Gmbh | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018095888A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused 2,8-diaminoindeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095940A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused indeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| WO2018099847A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Polymere mit asymmetrischen wiederholungseinheiten |
| WO2018099846A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Verbindungen mit valerolaktam-strukturen |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| WO2018104195A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| EP3345984A1 (de) | 2013-12-06 | 2018-07-11 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| WO2018134392A1 (en) | 2017-01-23 | 2018-07-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018138039A1 (de) | 2017-01-25 | 2018-08-02 | Merck Patent Gmbh | Carbazolderivate |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018166932A1 (de) | 2017-03-13 | 2018-09-20 | Merck Patent Gmbh | Verbindungen mit arylamin-strukturen |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018197447A1 (de) | 2017-04-25 | 2018-11-01 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018215318A1 (de) | 2017-05-22 | 2018-11-29 | Merck Patent Gmbh | Hexazyklische heteroaromatische verbindungen für elektronische vorrichtungen |
| WO2018234220A1 (de) | 2017-06-21 | 2018-12-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| WO2019007823A1 (en) | 2017-07-03 | 2019-01-10 | Merck Patent Gmbh | LOW-PHENOL IMPURITY FORMULATIONS |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| WO2019121458A1 (de) | 2017-12-19 | 2019-06-27 | Merck Patent Gmbh | Heterocyclische verbindung zur verwendung in electronischen vorrichtungen |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2020064662A2 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020094537A1 (de) | 2018-11-07 | 2020-05-14 | Merck Patent Gmbh | Polymere mit amingruppenhaltigen wiederholungseinheiten |
| WO2020094539A1 (de) | 2018-11-05 | 2020-05-14 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| EP3670609A1 (de) * | 2018-12-14 | 2020-06-24 | Beckman Coulter, Inc. | Polymerfarbstoffmodifizierung und anwendungen |
| WO2020212295A1 (en) | 2019-04-16 | 2020-10-22 | Merck Patent Gmbh | Formulation containing a crosslinkable polymer |
| US10862038B2 (en) | 2014-12-30 | 2020-12-08 | Merck Patent Gmbh | Compositions comprising at least one polymer and at least one salt, and electroluminescent devices containing said compositions |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021078710A1 (en) | 2019-10-22 | 2021-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021122538A1 (de) | 2019-12-18 | 2021-06-24 | Merck Patent Gmbh | Aromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021122740A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| WO2021170522A1 (de) | 2020-02-25 | 2021-09-02 | Merck Patent Gmbh | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| WO2021185712A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021185829A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021191183A1 (de) | 2020-03-26 | 2021-09-30 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021204646A1 (de) | 2020-04-06 | 2021-10-14 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021213917A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Emulsions comprising organic functional materials |
| EP3904361A2 (de) | 2013-10-02 | 2021-11-03 | Merck Patent GmbH | Borenthaltende verbindungen |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| US11208527B2 (en) | 2016-04-15 | 2021-12-28 | Beckman Coulter, Inc. | Photoactive macromolecules and uses thereof |
| WO2022002772A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022002771A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022069422A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Verbindungen zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen |
| WO2022069421A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen einsetzbare verbindungen |
| WO2022079067A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Verbindungen mit heteroatomen für organische elektrolumineszenzvorrichtungen |
| WO2022079068A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023012084A1 (en) | 2021-08-02 | 2023-02-09 | Merck Patent Gmbh | A printing method by combining inks |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| EP4236652A2 (de) | 2015-07-29 | 2023-08-30 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213759A1 (de) | 2022-05-04 | 2023-11-09 | Merck Patent Gmbh | Polymere enthaltend speziell substituierte triarylamin-einheiten sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023237458A1 (en) | 2022-06-07 | 2023-12-14 | Merck Patent Gmbh | Method of printing a functional layer of an electronic device by combining inks |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024094592A2 (de) | 2022-11-01 | 2024-05-10 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024115426A1 (de) | 2022-12-01 | 2024-06-06 | Merck Patent Gmbh | Polymere enthaltend spirotruxenderivate als wiederholungseinheit sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| WO2024126635A1 (en) | 2022-12-16 | 2024-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2024149694A1 (de) | 2023-01-10 | 2024-07-18 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024153568A1 (de) | 2023-01-17 | 2024-07-25 | Merck Patent Gmbh | Heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024184050A1 (de) | 2023-03-07 | 2024-09-12 | Merck Patent Gmbh | Cyclische stickstoffverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025003084A1 (de) | 2023-06-28 | 2025-01-02 | Merck Patent Gmbh | Dicyanoarylverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025032039A1 (en) | 2023-08-07 | 2025-02-13 | Merck Patent Gmbh | Process for the preparation of an electronic device |
| WO2025045935A1 (de) | 2023-08-31 | 2025-03-06 | Merck Patent Gmbh | Cyanogruppen-enthaltende aromaten für organische elektrolumineszenzvorrichtungen |
| WO2025109056A1 (de) | 2023-11-24 | 2025-05-30 | Merck Patent Gmbh | Sauerstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025181044A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025181124A1 (de) | 2024-03-01 | 2025-09-04 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2025181097A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2026008710A1 (de) | 2024-07-05 | 2026-01-08 | Merck Patent Gmbh | Cyclische siliciumverbindungen für organische elektrolumineszenzvorrichtungen |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8012603B2 (en) * | 2002-10-30 | 2011-09-06 | Sumitomo Chemical Company, Limited | Polymer compound and polymer light-emitting device using the same |
| EP1668058B1 (de) | 2003-09-20 | 2012-10-24 | Merck Patent GmbH | Konjugierte polymere, deren darstellung und verwendung |
| DE10343606A1 (de) | 2003-09-20 | 2005-04-14 | Covion Organic Semiconductors Gmbh | Weiß emittierende Copolymere, deren Darstellung und Verwendung |
| KR100773522B1 (ko) * | 2003-10-02 | 2007-11-07 | 삼성에스디아이 주식회사 | 사이클로펜타페난트렌계 화합물 및 이를 이용한 유기 전계발광 소자 |
| EP2366752B1 (de) | 2003-10-22 | 2016-07-20 | Merck Patent GmbH | Neue materialien für die elektrolumineszenz und deren verwendung |
| DE10350722A1 (de) | 2003-10-30 | 2005-05-25 | Covion Organic Semiconductors Gmbh | Metallkomplexe |
| DE10356099A1 (de) | 2003-11-27 | 2005-07-07 | Covion Organic Semiconductors Gmbh | Organisches Elektrolumineszenzelement |
| JP4724404B2 (ja) * | 2004-10-05 | 2011-07-13 | 国立大学法人東京工業大学 | 高分子組成物および高分子発光素子 |
| DE102006006412A1 (de) * | 2006-02-13 | 2007-08-16 | Merck Patent Gmbh | Elektronisches Bauteil, Verfahren zu dessen Herstellung und dessen Verwendung |
| DE102006031991A1 (de) | 2006-07-11 | 2008-01-17 | Merck Patent Gmbh | Elektrolumineszierende Polymere und ihre Verwendung |
| US20100276637A1 (en) * | 2007-11-14 | 2010-11-04 | Konica Minolta Holdings, Inc. | Organic electroluminescent element material, organic electroluminescent element, method of manufacturing organic electroluminescent element, display device, and illuminating device |
| CN102047475B (zh) * | 2008-03-28 | 2013-12-04 | 松下电器产业株式会社 | 蓄电装置用电极活性物质、蓄电装置以及电子设备和运输设备 |
| WO2009155595A2 (en) * | 2008-06-20 | 2009-12-23 | Tempur-Pedic Management, Inc. | Inflatable mattress and method of operating same |
| JP2010031248A (ja) * | 2008-06-23 | 2010-02-12 | Sumitomo Chemical Co Ltd | 組成物及び該組成物を用いてなる発光素子 |
| JP2010034528A (ja) * | 2008-06-23 | 2010-02-12 | Sumitomo Chemical Co Ltd | 組成物及び該組成物を用いてなる発光素子 |
| CN102276799B (zh) * | 2010-06-09 | 2014-05-28 | 海洋王照明科技股份有限公司 | 含喹喔啉单元芴类共聚物及其制备方法和应用 |
| CN103270078B (zh) | 2010-12-21 | 2015-12-16 | 住友化学株式会社 | 高分子化合物及使用其的发光元件 |
| GB201122316D0 (en) * | 2011-12-23 | 2012-02-01 | Cambridge Display Tech Ltd | Polymer, polymer composition and organic light-emitting device |
| CN103563113A (zh) | 2011-06-01 | 2014-02-05 | 默克专利股份有限公司 | 混杂双极性tft |
| JP6031030B2 (ja) * | 2011-06-27 | 2016-11-24 | 新日鉄住金化学株式会社 | 有機電界発光素子用重合体及びそれを用いた有機電界発光素子 |
| WO2013113349A1 (en) | 2012-01-30 | 2013-08-08 | Merck Patent Gmbh | Nanocrystals on fibers |
| JP6046389B2 (ja) * | 2012-06-20 | 2016-12-14 | 住友化学株式会社 | 有機エレクトロルミネッセンス素子 |
| KR102133241B1 (ko) * | 2013-04-11 | 2020-07-13 | 닛테츠 케미컬 앤드 머티리얼 가부시키가이샤 | 유기 전계 발광 소자용 아다만탄 화합물 및 유기 전계 발광 소자 |
| CN103254044B (zh) * | 2013-05-22 | 2015-08-26 | 河南省科学院化学研究所有限公司 | 2,7-二溴-9,10取代-菲衍生物 |
Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1074600A2 (de) | 1999-08-03 | 2001-02-07 | Sumitomo Chemical Company, Limited | Polymerische fluoreszente Substanz und organische elektrolumineszente Vorrichtungen |
| WO2002077060A1 (de) | 2001-03-24 | 2002-10-03 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend spirobifluoren-einheiten und fluoren-einheiten und deren verwendung |
| WO2003020790A2 (de) | 2001-09-04 | 2003-03-13 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend spirobifluoren-einheiten und deren verwendung |
| WO2003048225A2 (de) | 2001-12-06 | 2003-06-12 | Covion Organic Semiconductors Gmbh | Prozess zur herstellung von aryl-aryl gekoppelten verbindungen |
| WO2004022626A1 (de) | 2002-09-06 | 2004-03-18 | Covion Organic Semiconductors Gmbh | Prozess zur herstellung von aryl-aryl gekoppelten verbindungen |
| WO2004037887A2 (de) | 2002-10-25 | 2004-05-06 | Covion Organic Semiconductors Gmbh | Arylamin-einheiten enthaltende konjugierte polymere, deren darstellung und verwendung |
| WO2004041901A1 (en) | 2002-11-08 | 2004-05-21 | Covion Organic Semiconductors Gmbh | Aryl-substituted polyindenofluorenes for use in organic electroluminiscent devices |
| DE10304819A1 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte Polymere und Blends, deren Darstellung und Verwendung |
| DE10328627A1 (de) | 2003-06-26 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Neue Materialien für die Elektrolumineszenz |
| DE10337077A1 (de) | 2003-08-12 | 2005-03-10 | Covion Organic Semiconductors | Konjugierte Copolymere, deren Darstellung und Verwendung |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4013713A (en) * | 1971-12-30 | 1977-03-22 | Ciba-Geigy Corporation | Diarylvinyl-dihydrophenanthrene compounds |
| DE3131625A1 (de) * | 1980-09-16 | 1982-06-09 | VEB Werk für Fernsehelektronik im VEB Kombinat Mikroelektronik, DDR 1160 Berlin | Kristallin-fluessige substanzen des dihydrophenanthrens |
| PT80975B (pt) * | 1984-08-17 | 1987-11-11 | Shinetsu Chemical Co | Processo para a preparacao de um polimero de vinilo |
| FR2656606B1 (fr) * | 1989-12-28 | 1993-06-25 | Roussel Uclaf | Utilisation de derives du 9,10-dihydrophenanthrene pour la preparation d'un medicament anti-tumoral, application a titre de medicaments de derives du 9,10-dihydrophenanthrene et produits derives de cette structure. |
| JP2857223B2 (ja) * | 1990-05-02 | 1999-02-17 | キヤノン株式会社 | 液晶性化合物、それを含有する液晶組成物およびそれを使用した液晶素子 |
| JPH04288322A (ja) * | 1991-03-15 | 1992-10-13 | General Sekiyu Kk | ポリ(9,10−ジヒドロフェナンスレン−2,7−ジイル)重合体、その製法および用途 |
| JPH04286805A (ja) * | 1991-03-15 | 1992-10-12 | General Sekiyu Kk | ポリ(9,10−ジヒドロフェナンスレン−2,7−ジイル)重合体膜状物およびその製法 |
| US5648021A (en) * | 1994-01-17 | 1997-07-15 | Hoechst Aktiengesellschaft | Phenanthrene derivatives and their use in liquid-crystalline mixtures |
| US5401794A (en) * | 1994-06-03 | 1995-03-28 | Shell Oil Company | Stabilized polyketone polymer compositions |
| DE4431039A1 (de) * | 1994-09-01 | 1996-03-07 | Hoechst Ag | Poly(4,5,9,10-tetrahydropyren-2,7-diyl)-Derivate und ihre Verwendung als Elektrolumineszenzmaterialien |
| US5997874A (en) * | 1996-06-12 | 1999-12-07 | Nomura Co., Ltd. | Dihydrophenanthrene |
| DE19653008A1 (de) * | 1996-12-19 | 1998-06-25 | Hoechst Ag | Fluorierte Phenanthren-Derivate und ihre Verwendung in flüssigkristallinen Mischungen |
| US6124421A (en) * | 1997-12-12 | 2000-09-26 | Alliedsignal Inc. | Poly(arylene ether) compositions and methods of manufacture thereof |
| US6303250B1 (en) * | 1999-04-09 | 2001-10-16 | Matsushita Electric Industrial Co., Ltd. | Secondary battery including an electrolytic solution with an organic additive |
| US6414104B1 (en) * | 1999-07-20 | 2002-07-02 | Sri International | Arylamine-substituted poly (arylene vinylenes) and associated methods of preparation and use |
| HK1046128B (en) * | 1999-08-03 | 2006-08-11 | 大日本油墨化学工业株式会社 | Fused ring compound |
| DE10002186B4 (de) * | 2000-01-19 | 2018-01-18 | Merck Patent Gmbh | Disubstituierte Phenanthrene und ihre Verwendung in Flüssigkristallmischungen |
| DE60134366D1 (de) * | 2000-06-21 | 2008-07-24 | Canon Kk | Elektrophotographisches photoempfindliches Element, Prozesskartusche und elektrophotographischer Apparat |
| US6621099B2 (en) | 2002-01-11 | 2003-09-16 | Xerox Corporation | Polythiophenes and devices thereof |
| US6716955B2 (en) * | 2002-01-14 | 2004-04-06 | Air Products And Chemicals, Inc. | Poly(arylene ether) polymer with low temperature crosslinking grafts and adhesive comprising the same |
| US7094902B2 (en) * | 2002-09-25 | 2006-08-22 | 3M Innovative Properties Company | Electroactive polymers |
| DE102004004228A1 (de) * | 2003-02-25 | 2004-09-02 | Merck Patent Gmbh | Benzochromenderivate |
| US7271406B2 (en) * | 2003-04-15 | 2007-09-18 | 3M Innovative Properties Company | Electron transport agents for organic electronic devices |
| US6967255B2 (en) * | 2004-02-06 | 2005-11-22 | Industrial Technology Research Institute | Phenanthrene compounds |
-
2003
- 2003-08-12 DE DE10337346A patent/DE10337346A1/de not_active Withdrawn
-
2004
- 2004-08-12 CN CN2004800231570A patent/CN1835986B/zh not_active Expired - Fee Related
- 2004-08-12 JP JP2006522983A patent/JP4824558B2/ja not_active Expired - Lifetime
- 2004-08-12 KR KR1020067002902A patent/KR20060118403A/ko not_active Ceased
- 2004-08-12 WO PCT/EP2004/009019 patent/WO2005014689A2/de not_active Ceased
- 2004-08-12 US US10/568,167 patent/US7723455B2/en not_active Expired - Lifetime
- 2004-08-12 EP EP04764023A patent/EP1656408B1/de not_active Expired - Lifetime
- 2004-08-12 DE DE502004011045T patent/DE502004011045D1/de not_active Expired - Lifetime
Patent Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1074600A2 (de) | 1999-08-03 | 2001-02-07 | Sumitomo Chemical Company, Limited | Polymerische fluoreszente Substanz und organische elektrolumineszente Vorrichtungen |
| WO2002077060A1 (de) | 2001-03-24 | 2002-10-03 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend spirobifluoren-einheiten und fluoren-einheiten und deren verwendung |
| WO2003020790A2 (de) | 2001-09-04 | 2003-03-13 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend spirobifluoren-einheiten und deren verwendung |
| WO2003048225A2 (de) | 2001-12-06 | 2003-06-12 | Covion Organic Semiconductors Gmbh | Prozess zur herstellung von aryl-aryl gekoppelten verbindungen |
| WO2004022626A1 (de) | 2002-09-06 | 2004-03-18 | Covion Organic Semiconductors Gmbh | Prozess zur herstellung von aryl-aryl gekoppelten verbindungen |
| WO2004037887A2 (de) | 2002-10-25 | 2004-05-06 | Covion Organic Semiconductors Gmbh | Arylamin-einheiten enthaltende konjugierte polymere, deren darstellung und verwendung |
| WO2004041901A1 (en) | 2002-11-08 | 2004-05-21 | Covion Organic Semiconductors Gmbh | Aryl-substituted polyindenofluorenes for use in organic electroluminiscent devices |
| DE10304819A1 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte Polymere und Blends, deren Darstellung und Verwendung |
| DE10328627A1 (de) | 2003-06-26 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Neue Materialien für die Elektrolumineszenz |
| DE10337077A1 (de) | 2003-08-12 | 2005-03-10 | Covion Organic Semiconductors | Konjugierte Copolymere, deren Darstellung und Verwendung |
Non-Patent Citations (4)
| Title |
|---|
| BALLWEG ET AL., SILICON CHEMISTRY, vol. 1, 2002, pages 57 - 60 |
| LAARHOVEN ET AL., J. CHEM. SOC. PERKIN TRANS., vol. 2, 1978, pages 915 - 922 |
| SCHERF ET AL., J. ORG. CHEM., vol. 64, 1999, pages 655 - 658 |
| WILLIAMS ET AL., J. CHEM. SOC., CHEM. COMMUN., 1996, pages 2259 - 2260 |
Cited By (417)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7462683B2 (en) | 2004-02-18 | 2008-12-09 | Tokyo Institute Of Technology | Dihalide, polymer compound and method for producing the same |
| EP1717258A4 (de) * | 2004-02-18 | 2007-11-07 | Tokyo Inst Tech | Dihalogenid, polymerverbindung und herstellungsverfahren dafür |
| US7947382B2 (en) | 2004-04-26 | 2011-05-24 | Merck Patent Gmbh | Electroluminescent polymers and the use thereof |
| US8679644B2 (en) | 2004-04-26 | 2014-03-25 | Merck Patent Gmbh | Electroluminescent polymers containing planar arylamine units, the preparation and use thereof |
| US8058790B2 (en) | 2004-05-11 | 2011-11-15 | Merck Patent Gmbh | Material mixtures for use in electroluminescence |
| US7825249B2 (en) | 2004-05-19 | 2010-11-02 | Merck Patent Gmbh | Metal complexes |
| US7820305B2 (en) | 2004-07-06 | 2010-10-26 | Merck Patent Gmbh | Electroluminescent polymers |
| US7816531B2 (en) | 2004-07-16 | 2010-10-19 | Merck Patent Gmbh | Metal complexes |
| US7592622B2 (en) | 2004-08-11 | 2009-09-22 | Merck Patent Gmbh | Polymers for use in organic electroluminescent devices |
| EP3287506A1 (de) | 2004-10-11 | 2018-02-28 | Merck Patent GmbH | Phenanthren-derivate |
| US8129037B2 (en) | 2004-10-11 | 2012-03-06 | Merck Patent Gmbh | Phenanthrene derivative |
| US8293380B2 (en) * | 2004-12-27 | 2012-10-23 | Sumitomo Chemical Company, Limited | Polymer compound and polymer light emitting device using the same |
| WO2006097419A1 (en) * | 2005-03-14 | 2006-09-21 | Ciba Specialty Chemicals Holding Inc. | Novel polymers |
| JP2008538221A (ja) * | 2005-03-14 | 2008-10-16 | チバ ホールディング インコーポレーテッド | 新規ポリマー |
| US8445630B2 (en) | 2005-03-14 | 2013-05-21 | Basf Se | Polymers |
| KR101248047B1 (ko) * | 2005-03-14 | 2013-03-27 | 시바 홀딩 인크 | 신규한 중합체 |
| US8679645B2 (en) | 2005-06-09 | 2014-03-25 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| US9893292B2 (en) | 2005-06-09 | 2018-02-13 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| JP2009504811A (ja) * | 2005-08-10 | 2009-02-05 | メルク パテント ゲーエムベーハー | エレクトロルミネセントポリマー及びそれの使用 |
| CN101238756B (zh) * | 2005-08-10 | 2010-10-06 | 默克专利有限公司 | 电致发光聚合物和其用途 |
| WO2007017066A1 (de) * | 2005-08-10 | 2007-02-15 | Merck Patent Gmbh | Elektrolumineszierende polymere und ihre verwendung |
| EP3211058A1 (de) | 2005-08-26 | 2017-08-30 | Merck Patent GmbH | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2007022845A1 (de) | 2005-08-26 | 2007-03-01 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| EP2248869A2 (de) | 2005-09-12 | 2010-11-10 | Merck Patent GmbH | Verbindungen für organische elektronische Vorrichtungen |
| WO2007068325A1 (de) | 2005-12-17 | 2007-06-21 | Merck Patent Gmbh | Konjugierte polymere enthaltend triarylamin-arylvinylen-einheiten, deren darstellung und verwendung |
| EP2273512A2 (de) | 2005-12-17 | 2011-01-12 | Merck Patent GmbH | Konjugierte Polymere enthaltend Triarylamin-arylvinylen-einheiten, deren Darstellung und Verwendung |
| US7799875B2 (en) | 2005-12-17 | 2010-09-21 | Merck Patent Gmbh | Triarylamine-arylvinylene moiety-containing conjugated polymers, their production and use |
| JP2009526111A (ja) * | 2006-02-10 | 2009-07-16 | チバ ホールディング インコーポレーテッド | 新規ポリマー |
| WO2007090773A1 (en) * | 2006-02-10 | 2007-08-16 | Ciba Holding Inc. | Novel polymers |
| US8138303B2 (en) | 2006-02-10 | 2012-03-20 | Basf Se | Polymers |
| WO2007101820A1 (en) * | 2006-03-08 | 2007-09-13 | Ciba Holding Inc. | Palladium catalyzed polymerization reaction |
| WO2008006743A1 (en) * | 2006-07-14 | 2008-01-17 | Ciba Holding Inc | Novel electroluminescent polymers for electronic applications |
| US8221906B2 (en) | 2006-07-14 | 2012-07-17 | Basf Se | Electroluminescent polymers for electronic applications |
| CN101490125B (zh) * | 2006-07-14 | 2012-11-14 | 西巴控股有限公司 | 用于电子应用的新型电致发光聚合物 |
| EP2514736A1 (de) | 2006-07-28 | 2012-10-24 | Basf Se | Zwischenprodukte für Polymere |
| WO2008019744A1 (de) * | 2006-08-17 | 2008-02-21 | Merck Patent Gmbh | Konjugierte polymere, verfahren zu deren herstellung sowie deren verwendung |
| JP2010506416A (ja) * | 2006-10-10 | 2010-02-25 | シーディーティー オックスフォード リミテッド | 発光素子 |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2009053089A1 (de) | 2007-10-24 | 2009-04-30 | Merck Patent Gmbh | Optoelektronische vorrichtung |
| WO2009053088A1 (de) | 2007-10-24 | 2009-04-30 | Merck Patent Gmbh | Optoelektronische vorrichtung |
| US8637853B2 (en) | 2007-10-24 | 2014-01-28 | Merck Patent Gmbh | Optoelectronic device |
| DE102008015526A1 (de) | 2008-03-25 | 2009-10-01 | Merck Patent Gmbh | Metallkomplexe |
| DE102008017591A1 (de) | 2008-04-07 | 2009-10-08 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US9481826B2 (en) | 2008-06-05 | 2016-11-01 | Merck Patent Gmbh | Electronic device comprising metal complexes |
| US10538698B2 (en) | 2008-06-05 | 2020-01-21 | Merck Patent Gmbh | Electronic device comprising metal complexes |
| DE102008027005A1 (de) | 2008-06-05 | 2009-12-10 | Merck Patent Gmbh | Organische elektronische Vorrichtung enthaltend Metallkomplexe |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US8580395B2 (en) | 2008-08-29 | 2013-11-12 | Merck Patent Gmbh | Electroluminescent polymers, method for the production thereof, and use thereof |
| DE102008044868A1 (de) | 2008-08-29 | 2010-03-04 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| DE102008045662A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Optoelektronische Vorrichtung |
| DE102008045664A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Optoelektronische Vorrichtung |
| DE102008045663A1 (de) | 2008-09-03 | 2010-03-04 | Merck Patent Gmbh | Fluorverbrückte Assoziate für optoelektronische Anwendungen |
| DE102008049037A1 (de) | 2008-09-25 | 2010-04-22 | Merck Patent Gmbh | Neue Polymere mit niedriger Polydispersität |
| US8558223B2 (en) | 2008-09-26 | 2013-10-15 | Osram Opto Semiconductors Gmbh | Organic electronic component and method for the production thereof |
| DE102008050841B4 (de) | 2008-10-08 | 2019-08-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US8637168B2 (en) | 2008-10-08 | 2014-01-28 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| DE102008050841A1 (de) | 2008-10-08 | 2010-04-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8865321B2 (en) | 2008-11-11 | 2014-10-21 | Merck Patent Gmbh | Organic electroluminescent devices |
| DE102008057050A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057051A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8597798B2 (en) | 2008-11-13 | 2013-12-03 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102009005289B4 (de) | 2009-01-20 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung und elektronische Vorrichtungen, enthaltend diese |
| US9475792B2 (en) | 2009-01-20 | 2016-10-25 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| DE102009005289A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010083872A2 (de) | 2009-01-20 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010083873A1 (de) | 2009-01-20 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US9006503B2 (en) | 2009-01-23 | 2015-04-14 | Merck Patent Gmbh | Organic electroluminescence devices containing substituted benzo[C]phenanthrenes |
| US8710284B2 (en) | 2009-01-23 | 2014-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices containing substituted 10-benzo[c]phenanthrenes |
| DE102009005746A1 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010083869A2 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010086089A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| US9169282B2 (en) | 2009-02-02 | 2015-10-27 | Merck Patent Gmbh | Metal complexes |
| DE102009007038A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| US9066410B2 (en) | 2009-02-17 | 2015-06-23 | Merck Patent Gmbh | Organic electronic device |
| WO2010094378A1 (de) | 2009-02-17 | 2010-08-26 | Merck Patent Gmbh | Organische elektronische vorrichtung |
| DE102009009277A1 (de) | 2009-02-17 | 2010-08-19 | Merck Patent Gmbh | Organische elektronische Vorrichtung |
| DE102009009277B4 (de) | 2009-02-17 | 2023-12-07 | Merck Patent Gmbh | Organische elektronische Vorrichtung, Verfahren zu deren Herstellung und Verwendung von Verbindungen |
| US9156939B2 (en) | 2009-02-27 | 2015-10-13 | Merck Patent Gmbh | Polymer containing aldehyde groups, reaction and crosslinking of this polymer, crosslinked polymer, and electroluminescent device comprising this polymer |
| DE102009010713A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Polymer mit Aldehydgruppen, Umsetzung sowie Vernetzung dieses Polymers, vernetztes Polymer sowie Elektrolumineszenzvorrichtung enthaltend dieses Polymer |
| WO2010097155A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Polymer mit aldehydgruppen, umsetzung sowie vernetzung dieses polymers, vernetztes polymer sowie elektrolumineszenzvorrichtung enthaltend dieses polymer |
| WO2010097156A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Vernetzbare und vernetzte polymere, verfahren zu deren herstellung sowie deren verwendung |
| US9728724B2 (en) | 2009-02-27 | 2017-08-08 | Merck Patent Gmbh | Polymer containing aldehyde groups, reaction and crosslinking of this polymer, crosslinked polymer, and electroluminescent device comprising this polymer |
| US9315617B2 (en) | 2009-02-27 | 2016-04-19 | Merck Patent Gmbh | Crosslinkable and crosslinked polymers, method for the production thereof, and use thereof |
| DE102009010714A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Vernetzbare und vernetzte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung |
| DE102009011223A1 (de) | 2009-03-02 | 2010-09-23 | Merck Patent Gmbh | Metallkomplexe |
| WO2010099852A1 (de) | 2009-03-02 | 2010-09-10 | Merck Patent Gmbh | Metallkomplexe mit azaborol-liganden und elektronische vorrichtung damit |
| US9074128B2 (en) | 2009-03-02 | 2015-07-07 | Merck Patent Gmbh | Metal complexes having azaborol ligands and electronic device having the same |
| US9085579B2 (en) | 2009-03-13 | 2015-07-21 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2010102709A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009013041A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009022858A1 (de) | 2009-05-27 | 2011-12-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2010136110A2 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Polymere, die substituierte indenofluorenderivate als struktureinheit enthalten, verfahren zu deren herstellung sowie deren verwendung |
| DE102009023156A1 (de) | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Polymere, die substituierte Indenofluorenderivate als Struktureinheit enthalten, Verfahren zu deren Herstellung sowie deren Verwendung |
| DE102009023154A1 (de) | 2009-05-29 | 2011-06-16 | Merck Patent Gmbh | Zusammensetzung, enthaltend mindestens eine Emitterverbindung und mindestens ein Polymer mit konjugationsunterbrechenden Einheiten |
| WO2010149259A2 (en) | 2009-06-22 | 2010-12-29 | Merck Patent Gmbh | Conducting formulation |
| DE102009030847A1 (de) | 2009-06-26 | 2010-12-30 | Merck Patent Gmbh | Polymere enthaltend substituierte Anthracenyleinheiten, Blends enthaltend diese Polymere sowie Vorrichtungen enthaltend diese Polymere oder Blends |
| US8557953B2 (en) | 2009-06-26 | 2013-10-15 | Merck Patent Gmbh | Polymers comprising substituted anthracenyl units, blends comprising these polymers, and devices comprising these polymers or blends |
| DE102009030848A1 (de) | 2009-06-26 | 2011-02-03 | Merck Patent Gmbh | Polymere enthaltend Struktureinheiten, die Alkylalkoxygruppen aufweisen, Blends enthaltend diese Polymere sowie optoelektronische Vorrichtungen enthaltend diese Polymere und Blends |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011000455A1 (de) | 2009-06-30 | 2011-01-06 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011009522A2 (de) | 2009-07-22 | 2011-01-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009034194A1 (de) | 2009-07-22 | 2011-01-27 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011012212A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| DE102009034625A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011015265A2 (en) | 2009-08-04 | 2011-02-10 | Merck Patent Gmbh | Electronic devices comprising multi cyclic hydrocarbons |
| WO2011032686A1 (de) | 2009-09-16 | 2011-03-24 | Merck Patent Gmbh | Formulierungen zur herstellung von elektronischen vorrichtungen |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011035836A1 (de) | 2009-09-23 | 2011-03-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011042107A2 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| WO2011044988A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| WO2011054442A2 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009053191A1 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011057701A1 (de) | 2009-11-10 | 2011-05-19 | Merck Patent Gmbh | Organische verbindungen für elektroluminiszenz vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| WO2011057706A2 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009053382A1 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011060859A1 (de) | 2009-11-17 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011060867A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Stickstoffhaltige kondensierte heterozyklen für oleds |
| WO2011076314A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent formulations |
| WO2011076326A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent functional surfactants |
| WO2011076323A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Formulations comprising phase-separated functional materials |
| DE102009059985A1 (de) | 2009-12-22 | 2011-07-07 | Merck Patent GmbH, 64293 | Polymer mit Aldehydgruppen, Umsetzung sowie Vernetzung dieses Polymers, vernetztes Polymer sowie Elektrolumineszenzvorrichtung enthaltend dieses Polymer |
| WO2011076324A1 (en) | 2009-12-23 | 2011-06-30 | Merck Patent Gmbh | Compositions comprising organic semiconducting compounds |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011085781A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2011088877A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010005697A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent GmbH, 64293 | Verbindungen für elektronische Vorrichtungen |
| WO2011091838A1 (de) | 2010-01-29 | 2011-08-04 | Merck Patent Gmbh | Styrolbasierte copolymere, insbesondere für die anwendung in optoelektronischen bauteilen |
| DE102010006377A1 (de) | 2010-01-29 | 2011-08-04 | Merck Patent GmbH, 64293 | Styrolbasierte Copolymere, insbesondere für die Anwendung in optoelektronischen Bauteilen |
| DE102010007938A1 (de) | 2010-02-12 | 2011-10-06 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| WO2011098205A1 (de) | 2010-02-12 | 2011-08-18 | Merck Patent Gmbh | Elektrolumineszierende polymere, verfahren zu ihrer herstellung sowie ihre verwendung |
| DE102010009193B4 (de) | 2010-02-24 | 2022-05-19 | MERCK Patent Gesellschaft mit beschränkter Haftung | Zusammensetzung enthaltend Fluor-Fluor Assoziate, Verfahren zu deren Herstellung, deren Verwendung sowie organische elektronische Vorrichtung diese enthaltend |
| DE102010009193A1 (de) | 2010-02-24 | 2011-08-25 | Merck Patent GmbH, 64293 | Fluor-Fluor Assoziate |
| WO2011103953A1 (de) | 2010-02-24 | 2011-09-01 | Merck Patent Gmbh | Fluor-fluor assoziate |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2011107186A2 (de) | 2010-03-02 | 2011-09-09 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2011110277A1 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Fibers in therapy and cosmetics |
| WO2011110275A2 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Radiative fibers |
| WO2011116857A1 (en) | 2010-03-23 | 2011-09-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011116865A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2011128035A1 (en) | 2010-04-12 | 2011-10-20 | Merck Patent Gmbh | Composition and method for preparation of organic electronic devices |
| WO2011128017A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Überbrückte triarylamine und -phosphine als materialien für elektronische vorrichtungen |
| DE102010014933A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011137922A1 (de) | 2010-05-03 | 2011-11-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2011137951A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| DE102010019306A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2011147521A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Down conversion |
| EP3309236A1 (de) | 2010-05-27 | 2018-04-18 | Merck Patent GmbH | Zusammensetzungen mit quantenpunkten |
| WO2011147522A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Compositions comprising quantum dots |
| WO2011147523A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Formulation and method for preparation of organic electronic devices |
| WO2011157346A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011160757A1 (de) | 2010-06-22 | 2011-12-29 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2011160758A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012007102A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Polymere materialien für organische elektrolumineszenzvorrichtungen |
| WO2012007087A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| DE102010027320A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Polymere Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010027316A1 (de) | 2010-07-16 | 2012-01-19 | Merck Patent Gmbh | Metallkomplexe |
| WO2012013310A1 (de) | 2010-07-29 | 2012-02-02 | Merck Patent Gmbh | Polymere enthaltend substituierte benzodithiopheneinheiten, blends enthaltend diese polymere sowie vorrichtungen enthaltend diese polymere oder blends |
| DE102010032737A1 (de) | 2010-07-29 | 2012-02-02 | Merck Patent Gmbh | Polymere enthaltend substituierte Benzodithiopheneinheiten, Blends enthaltend diese Polymere sowie Vorrichtungen enthaltend diese Polymere oder Blends |
| EP2889320A2 (de) | 2010-08-02 | 2015-07-01 | Merck Patent GmbH | Polymers mit Struktureinheiten, die Elektronen-Transport-Eigenschaften aufweisen |
| DE102010033080A1 (de) | 2010-08-02 | 2012-02-02 | Merck Patent Gmbh | Polymere mit Struktureinheiten, die Elektronen-Transport-Eigenschaften aufweisen |
| WO2012016627A2 (de) | 2010-08-02 | 2012-02-09 | Merck Patent Gmbh | Polymere mit struktureinheiten, die elektronen-transport-eigenschaften aufweisen |
| WO2012016630A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2012034626A1 (de) | 2010-09-14 | 2012-03-22 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102010045369A1 (de) | 2010-09-14 | 2012-03-15 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012048778A1 (de) | 2010-10-14 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012048900A1 (de) | 2010-10-14 | 2012-04-19 | Fraunhofer-Gesellschaft Zur Förderung Der Angewandten Forschung E.V. . | Materialien für organische elektrolumineszenzvorrichtungen |
| EP2787053A1 (de) | 2010-10-14 | 2014-10-08 | Merck Patent GmbH | Polymere Materialien |
| DE102010048498A1 (de) | 2010-10-14 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012048781A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien auf basis von triphenylen für organische elektrolumineszenzvorrichtungen |
| DE102010048607A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012048780A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012084114A1 (de) | 2010-12-23 | 2012-06-28 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtung |
| DE102010056151A1 (de) | 2010-12-28 | 2012-06-28 | Merck Patent Gmbh | Materiallen für organische Elektrolumineszenzvorrichtungen |
| WO2012089294A1 (de) | 2010-12-28 | 2012-07-05 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2012095143A1 (de) | 2011-01-13 | 2012-07-19 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2482159A2 (de) | 2011-01-28 | 2012-08-01 | Honeywell International, Inc. | Verfahren und umkonfigurierbare System zur Optimierung der Leistung eines zustandsabhängigen Wartungssystems |
| DE102011010841A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | (1,3)-Dioxan-5-on-Verbindungen |
| WO2012107158A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | 1,3 - dioxan-5-on-verbindungen |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012110182A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149992A1 (de) | 2011-05-04 | 2012-11-08 | Merck Patent Gmbh | Vorrichtung zur aufbewahrung von frischwaren |
| WO2012150001A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102011104745A1 (de) | 2011-06-17 | 2012-12-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012171609A1 (de) | 2011-06-17 | 2012-12-20 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2013013754A1 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Copolymers with functionalized side chains |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| EP3439065A1 (de) | 2011-08-03 | 2019-02-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| WO2013060418A1 (en) | 2011-10-27 | 2013-05-02 | Merck Patent Gmbh | Materials for electronic devices |
| WO2013060411A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte polymere, verfahren zu deren herstellung sowie deren verwendung in elektronischen vorrichtungen |
| DE102011117422A1 (de) | 2011-10-28 | 2013-05-02 | Merck Patent Gmbh | Hyperverzweigte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung in elektronischen Vorrichtungen |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| WO2013087142A1 (de) | 2011-12-12 | 2013-06-20 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102011121022A1 (de) | 2011-12-13 | 2013-06-13 | Merck Patent Gmbh | Organische Sensibilisatoren für Up- Conversion |
| WO2013087162A1 (de) | 2011-12-13 | 2013-06-20 | Merck Patent Gmbh | Organische sensibilisatoren für die aufwärtskonvers ion (up-conversion) |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| EP3101088A1 (de) | 2012-02-14 | 2016-12-07 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3235892A1 (de) | 2012-02-14 | 2017-10-25 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2013124029A2 (de) | 2012-02-22 | 2013-08-29 | Merck Patent Gmbh | Polymere enthaltend dibenzocycloheptan-struktureinheiten |
| WO2013139431A1 (de) | 2012-03-23 | 2013-09-26 | Merck Patent Gmbh | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen |
| WO2013156130A1 (de) | 2012-04-17 | 2013-10-24 | Merck Patent Gmbh | Polymere enthaltend substituierte triarylamin-einheiten sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| WO2013156129A1 (de) | 2012-04-17 | 2013-10-24 | Merck Patent Gmbh | Polymere enthaltend substituierte oligo-triarylamin-einheiten sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| WO2013182263A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Phenanthrenverbindungen für organische elektronische vorrichtungen |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| WO2014000860A1 (de) | 2012-06-29 | 2014-01-03 | Merck Patent Gmbh | Polymere enthaltend 2,7-pyren-struktureinheiten |
| WO2014008982A1 (de) | 2012-07-13 | 2014-01-16 | Merck Patent Gmbh | Metallkomplexe |
| EP3424907A2 (de) | 2012-07-23 | 2019-01-09 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| WO2014015935A2 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektronische vorrichtungen |
| DE202013012401U1 (de) | 2012-07-23 | 2016-10-12 | Merck Patent Gmbh | Verbindungen und Organische Elektronische Vorrichtungen |
| WO2014015938A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Derivate von 2-diarylaminofluoren und diese enthaltnde organische elektronische verbindungen |
| WO2014015937A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektrolumineszierende vorrichtungen |
| EP3424936A1 (de) | 2012-08-07 | 2019-01-09 | Merck Patent GmbH | Metallkomplexe |
| WO2014023377A2 (de) | 2012-08-07 | 2014-02-13 | Merck Patent Gmbh | Metallkomplexe |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014101981A1 (en) | 2012-12-28 | 2014-07-03 | Merck Patent Gmbh | Composition comprising polymeric organic semiconducting compounds |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015014427A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elektrooptische vorrichtung und deren verwendung |
| WO2015014429A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elekrolumineszenzvorrichtung |
| EP3904361A2 (de) | 2013-10-02 | 2021-11-03 | Merck Patent GmbH | Borenthaltende verbindungen |
| EP3693437A1 (de) | 2013-12-06 | 2020-08-12 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| EP3345984A1 (de) | 2013-12-06 | 2018-07-11 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP3708634A1 (de) | 2013-12-19 | 2020-09-16 | Merck Patent GmbH | Heterocyclische spiroverbindungen |
| WO2015090504A2 (de) | 2013-12-19 | 2015-06-25 | Merck Patent Gmbh | Heterocyclische spiroverbindungen |
| EP4438693A2 (de) | 2013-12-19 | 2024-10-02 | Merck Patent GmbH | Heterocyclische spiroverbindungen |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016074755A1 (de) | 2014-11-11 | 2016-05-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| US10862038B2 (en) | 2014-12-30 | 2020-12-08 | Merck Patent Gmbh | Compositions comprising at least one polymer and at least one salt, and electroluminescent devices containing said compositions |
| WO2016120007A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Formulations with a low particle content |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016124304A1 (de) | 2015-02-03 | 2016-08-11 | Merck Patent Gmbh | Metallkomplexe |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| WO2016198144A1 (en) | 2015-06-10 | 2016-12-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| EP3581633A1 (de) | 2015-06-12 | 2019-12-18 | Merck Patent GmbH | Ester mit nichtaromatischen zyklen als lösungsmittel für oled-formulierungen |
| WO2017008883A1 (en) | 2015-07-15 | 2017-01-19 | Merck Patent Gmbh | Composition comprising organic semiconducting compounds |
| WO2017012687A1 (en) | 2015-07-22 | 2017-01-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| EP4236652A2 (de) | 2015-07-29 | 2023-08-30 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP4301110A2 (de) | 2015-07-30 | 2024-01-03 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| EP4084109A1 (de) | 2015-12-15 | 2022-11-02 | Merck Patent GmbH | Ester mit aromatischen gruppen als lösungsmittel für organische elektronische formulierungen |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| WO2017157783A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine formulierung enthaltend mindestens einen organischen halbleiter |
| WO2017157983A1 (de) | 2016-03-17 | 2017-09-21 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2017178311A1 (de) | 2016-04-11 | 2017-10-19 | Merck Patent Gmbh | Heterocyclische verbindungen mit dibenzofuran- und/oder dibenzothiophen-strukturen |
| US12312437B2 (en) | 2016-04-15 | 2025-05-27 | Beckman Coulter, Inc. | Photoactive macromolecules and uses thereof |
| US11834551B2 (en) | 2016-04-15 | 2023-12-05 | Beckman Coulter, Inc. | Photoactive macromolecules and uses thereof |
| US11208527B2 (en) | 2016-04-15 | 2021-12-28 | Beckman Coulter, Inc. | Photoactive macromolecules and uses thereof |
| EP3978477A2 (de) | 2016-06-03 | 2022-04-06 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2017207596A1 (en) | 2016-06-03 | 2017-12-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001990A1 (de) | 2016-06-30 | 2018-01-04 | Merck Patent Gmbh | Verfahren zur auftrennung von enantiomerenmischungen von metallkomplexen |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| EP3792235A1 (de) | 2016-07-08 | 2021-03-17 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2018011186A1 (de) | 2016-07-14 | 2018-01-18 | Merck Patent Gmbh | Metallkomplexe |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018050584A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2018050583A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit carbazol-strukturen |
| WO2018060307A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Verbindungen mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018060218A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Carbazole mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| EP4255151A2 (de) | 2016-10-10 | 2023-10-04 | Merck Patent GmbH | Spiro[fluoren-9,9'-(thio)xanthen] verbindungen |
| EP4113643A1 (de) | 2016-10-10 | 2023-01-04 | Merck Patent GmbH | Elektronische vorrichtung |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| EP4271163A2 (de) | 2016-11-14 | 2023-11-01 | Merck Patent GmbH | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018087346A1 (de) | 2016-11-14 | 2018-05-17 | Merck Patent Gmbh | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| WO2018095888A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused 2,8-diaminoindeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095940A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused indeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018099847A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Polymere mit asymmetrischen wiederholungseinheiten |
| WO2018099846A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Verbindungen mit valerolaktam-strukturen |
| EP3978491A1 (de) | 2016-12-05 | 2022-04-06 | Merck Patent GmbH | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018104195A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| WO2018134392A1 (en) | 2017-01-23 | 2018-07-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018138039A1 (de) | 2017-01-25 | 2018-08-02 | Merck Patent Gmbh | Carbazolderivate |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018166932A1 (de) | 2017-03-13 | 2018-09-20 | Merck Patent Gmbh | Verbindungen mit arylamin-strukturen |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018197447A1 (de) | 2017-04-25 | 2018-11-01 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018215318A1 (de) | 2017-05-22 | 2018-11-29 | Merck Patent Gmbh | Hexazyklische heteroaromatische verbindungen für elektronische vorrichtungen |
| WO2018234220A1 (de) | 2017-06-21 | 2018-12-27 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| WO2019007823A1 (en) | 2017-07-03 | 2019-01-10 | Merck Patent Gmbh | LOW-PHENOL IMPURITY FORMULATIONS |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| EP4603562A2 (de) | 2017-07-28 | 2025-08-20 | Merck Patent GmbH | Spirobifluorenderivate zur verwendung in elektronischen vorrichtungen |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP4242286A2 (de) | 2017-11-23 | 2023-09-13 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019121458A1 (de) | 2017-12-19 | 2019-06-27 | Merck Patent Gmbh | Heterocyclische verbindung zur verwendung in electronischen vorrichtungen |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| EP4451832A2 (de) | 2017-12-20 | 2024-10-23 | Merck Patent GmbH | Heteroaromatische verbindungen |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| EP4190880A1 (de) | 2018-09-27 | 2023-06-07 | Merck Patent GmbH | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| EP4601449A2 (de) | 2018-09-27 | 2025-08-13 | Merck Patent GmbH | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020064662A2 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| WO2020094539A1 (de) | 2018-11-05 | 2020-05-14 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2020094537A1 (de) | 2018-11-07 | 2020-05-14 | Merck Patent Gmbh | Polymere mit amingruppenhaltigen wiederholungseinheiten |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| US12018117B2 (en) | 2018-12-14 | 2024-06-25 | Beckman Coulter, Inc. | Polymer dye modification and applications |
| AU2019280076B2 (en) * | 2018-12-14 | 2022-06-09 | Beckman Coulter, Inc. | Polymer dye modification and applications |
| US11584825B2 (en) | 2018-12-14 | 2023-02-21 | Beckman Coulter, Inc. | Polymer dye modification and applications |
| EP3670609A1 (de) * | 2018-12-14 | 2020-06-24 | Beckman Coulter, Inc. | Polymerfarbstoffmodifizierung und anwendungen |
| WO2020212295A1 (en) | 2019-04-16 | 2020-10-22 | Merck Patent Gmbh | Formulation containing a crosslinkable polymer |
| WO2021078710A1 (en) | 2019-10-22 | 2021-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021122538A1 (de) | 2019-12-18 | 2021-06-24 | Merck Patent Gmbh | Aromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021122740A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| WO2021170522A1 (de) | 2020-02-25 | 2021-09-02 | Merck Patent Gmbh | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| WO2021185712A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021185829A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021191183A1 (de) | 2020-03-26 | 2021-09-30 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021204646A1 (de) | 2020-04-06 | 2021-10-14 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021213917A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Emulsions comprising organic functional materials |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| WO2022002771A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022002772A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022069422A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Verbindungen zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen |
| WO2022069421A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen einsetzbare verbindungen |
| WO2022079067A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Verbindungen mit heteroatomen für organische elektrolumineszenzvorrichtungen |
| WO2022079068A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| EP4676208A2 (de) | 2020-12-18 | 2026-01-07 | Merck Patent GmbH | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023012084A1 (en) | 2021-08-02 | 2023-02-09 | Merck Patent Gmbh | A printing method by combining inks |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213759A1 (de) | 2022-05-04 | 2023-11-09 | Merck Patent Gmbh | Polymere enthaltend speziell substituierte triarylamin-einheiten sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023237458A1 (en) | 2022-06-07 | 2023-12-14 | Merck Patent Gmbh | Method of printing a functional layer of an electronic device by combining inks |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024094592A2 (de) | 2022-11-01 | 2024-05-10 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024115426A1 (de) | 2022-12-01 | 2024-06-06 | Merck Patent Gmbh | Polymere enthaltend spirotruxenderivate als wiederholungseinheit sowie elektrolumineszenzvorrichtungen enthaltend diese polymere |
| WO2024126635A1 (en) | 2022-12-16 | 2024-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2024149694A1 (de) | 2023-01-10 | 2024-07-18 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024153568A1 (de) | 2023-01-17 | 2024-07-25 | Merck Patent Gmbh | Heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2024184050A1 (de) | 2023-03-07 | 2024-09-12 | Merck Patent Gmbh | Cyclische stickstoffverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025003084A1 (de) | 2023-06-28 | 2025-01-02 | Merck Patent Gmbh | Dicyanoarylverbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025032039A1 (en) | 2023-08-07 | 2025-02-13 | Merck Patent Gmbh | Process for the preparation of an electronic device |
| WO2025045935A1 (de) | 2023-08-31 | 2025-03-06 | Merck Patent Gmbh | Cyanogruppen-enthaltende aromaten für organische elektrolumineszenzvorrichtungen |
| WO2025109056A1 (de) | 2023-11-24 | 2025-05-30 | Merck Patent Gmbh | Sauerstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025181044A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2025181097A1 (de) | 2024-02-29 | 2025-09-04 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2025181124A1 (de) | 2024-03-01 | 2025-09-04 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2026008710A1 (de) | 2024-07-05 | 2026-01-08 | Merck Patent Gmbh | Cyclische siliciumverbindungen für organische elektrolumineszenzvorrichtungen |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2005014689A3 (de) | 2005-03-31 |
| DE502004011045D1 (de) | 2010-05-27 |
| DE10337346A1 (de) | 2005-03-31 |
| CN1835986B (zh) | 2010-05-26 |
| CN1835986A (zh) | 2006-09-20 |
| US20070060736A1 (en) | 2007-03-15 |
| KR20060118403A (ko) | 2006-11-23 |
| EP1656408A2 (de) | 2006-05-17 |
| JP4824558B2 (ja) | 2011-11-30 |
| EP1656408B1 (de) | 2010-04-14 |
| JP2007501884A (ja) | 2007-02-01 |
| US7723455B2 (en) | 2010-05-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1656408B1 (de) | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung | |
| DE102005037734B4 (de) | Elektrolumineszierende Polymere, ihre Verwendung und bifunktionelle monomere Verbindungen | |
| EP1641894B1 (de) | Neue materialien für die elektrolumineszenz | |
| EP1656407B1 (de) | Konjugierte copolymere, deren darstellung und verwendung | |
| EP1381639B1 (de) | Konjugierte polymere enthaltend spirobifluoren-einheiten und fluoren-einheiten und deren verwendung | |
| EP1558662B1 (de) | Arylamin-einheiten enthaltende konjugierte polymere, deren darstellung und verwendung | |
| EP1592729B1 (de) | Carbazol-enthaltende konjugierte polymere und blends, deren darstellung und verwendung | |
| EP2038241B1 (de) | Elektrolumineszierende polymere und ihre verwendung | |
| EP1427768B1 (de) | Konjugierte polymere enthaltend spirobifluoren-einheiten und deren verwendung | |
| DE102004020298A1 (de) | Elektrolumineszierende Polymere und deren Verwendung | |
| EP1709699B1 (de) | Konjugierte polymere, deren darstellung und verwendung | |
| DE102004020299A1 (de) | Konjugierte Polymere, deren Darstellung und Verwendung | |
| EP1668058A1 (de) | Konjugierte polymere, deren darstellung und verwendung | |
| WO1996017036A1 (de) | Konjugierte polymere mit hetero-spiroatomen und ihre verwendung als elektrolumineszenzmaterialien | |
| DE10357317A1 (de) | Konjugierte Polymere, deren Darstellung und Verwendung |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 200480023157.0 Country of ref document: CN |
|
| AK | Designated states |
Kind code of ref document: A2 Designated state(s): AE AG AL AM AT AU AZ BA BB BG BR BW BY BZ CA CH CN CO CR CU CZ DE DK DM DZ EC EE EG ES FI GB GD GE GH GM HR HU ID IL IN IS JP KE KG KP KR KZ LC LK LR LS LT LU LV MA MD MG MK MN MW MX MZ NA NI NO NZ OM PG PH PL PT RO RU SC SD SE SG SK SL SY TJ TM TN TR TT TZ UA UG US UZ VC VN YU ZA ZM ZW |
|
| AL | Designated countries for regional patents |
Kind code of ref document: A2 Designated state(s): BW GH GM KE LS MW MZ NA SD SL SZ TZ UG ZM ZW AM AZ BY KG KZ MD RU TJ TM AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IT LU MC NL PL PT RO SE SI SK TR BF BJ CF CG CI CM GA GN GQ GW ML MR NE SN TD TG |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | ||
| WWE | Wipo information: entry into national phase |
Ref document number: 1020067002902 Country of ref document: KR |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2006522983 Country of ref document: JP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2004764023 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2007060736 Country of ref document: US Ref document number: 10568167 Country of ref document: US |
|
| WWP | Wipo information: published in national office |
Ref document number: 2004764023 Country of ref document: EP |
|
| WWP | Wipo information: published in national office |
Ref document number: 1020067002902 Country of ref document: KR |
|
| WWP | Wipo information: published in national office |
Ref document number: 10568167 Country of ref document: US |