KR20160081898A - 면역조절제로서 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 유도체 - Google Patents
면역조절제로서 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 유도체 Download PDFInfo
- Publication number
- KR20160081898A KR20160081898A KR1020167009155A KR20167009155A KR20160081898A KR 20160081898 A KR20160081898 A KR 20160081898A KR 1020167009155 A KR1020167009155 A KR 1020167009155A KR 20167009155 A KR20167009155 A KR 20167009155A KR 20160081898 A KR20160081898 A KR 20160081898A
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- compound
- ser
- asn
- amino acid
- Prior art date
Links
- 0 CC(*)[C@](C(*)=O)N Chemical compound CC(*)[C@](C(*)=O)N 0.000 description 4
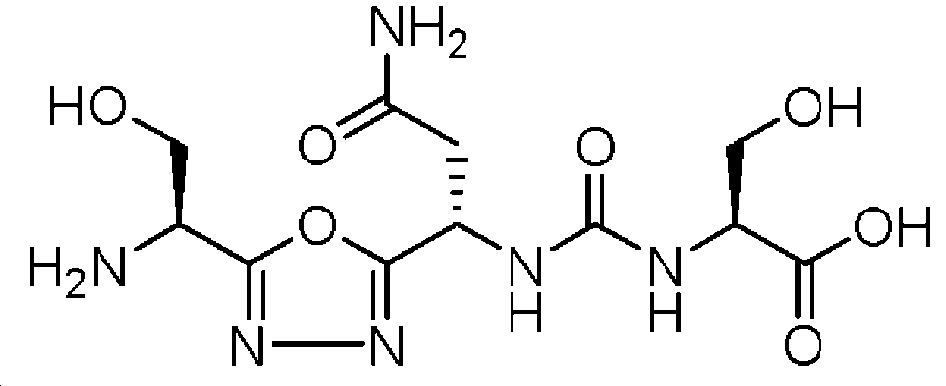
- GDITTYZMNKGASY-ZLUOBGJFSA-N N[C@@H](CO)c1nnc([C@H](CC(N)=O)NC(N[C@@H](CO)C(O)=O)=O)[o]1 Chemical compound N[C@@H](CO)c1nnc([C@H](CC(N)=O)NC(N[C@@H](CO)C(O)=O)=O)[o]1 GDITTYZMNKGASY-ZLUOBGJFSA-N 0.000 description 1
- NXLNNXIXOYSCMB-UHFFFAOYSA-N [O-][N+](c(cc1)ccc1OC(Cl)=O)=O Chemical compound [O-][N+](c(cc1)ccc1OC(Cl)=O)=O NXLNNXIXOYSCMB-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D271/00—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms
- C07D271/02—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms not condensed with other rings
- C07D271/10—1,3,4-Oxadiazoles; Hydrogenated 1,3,4-oxadiazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D285/00—Heterocyclic compounds containing rings having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by groups C07D275/00 - C07D283/00
- C07D285/01—Five-membered rings
- C07D285/02—Thiadiazoles; Hydrogenated thiadiazoles
- C07D285/04—Thiadiazoles; Hydrogenated thiadiazoles not condensed with other rings
- C07D285/12—1,3,4-Thiadiazoles; Hydrogenated 1,3,4-thiadiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4245—Oxadiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/433—Thidiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Abstract
본 발명은 예정 세포사 1(PD1) 신호전달 경로를 억제할 수 있는 치료제로서 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물에 관한 것이다. 본 발명은 또한 치료제의 유도체에 관한 것이다. 본 발명은 또한 PD-1, PD-L1, 또는 PD-L2로 인해 유도된 면역억제 신호의 억제를 포함하는 면역증강을 통해 장애를 치료하기 위한 상기 치료제의 용도 및 이들을 사용한 치료요법을 포함한다.
Description
본 출원은 2013년 9월 6일자로 출원된, 인도 가 특허원 제4012/CHE/2013호의 이익을 청구하며, 이는 본원에 참고로 포함된다.
기술 분야
본 발명은 면역조절제로서 치료학적으로 유용한 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물에 관한 것이다. 본 발명은 또한 치료제로서 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물을 포함하는 약제학적 조성물에 관한 것이다.
발명의 배경
예정 세포사-1(programmed cell death-1: PD-1)은 이의 2개의 리간드, PD-L1 또는 PD-L2와의 상호작용시 부정적인 신호를 전달하는 CD28 상과(superfamily)의 구성원이다. PD-1 및 이의 리간드는 T 세포 활성화시 광범위한 면역조절 역할 및 다른 CD28 구성원과 비교한 내성을 광범위하게 발현하고 발휘한다. PD-1 및 이의 리간드는 감염성 면역성 및 종양 면역성을 약화시키고, 만성 감염 및 종양 진행을 촉진하는데 관여한다. PD-1 및 이의 리간드의 생물학적 유의성은 다양한 사람 질환에 대한 PD-1 경로의 조작의 치료학적 효능을 제안한다(참고: Ariel Pedoeem et al., Curr Top Microbiol Immunol. (2011); 350:17-37).
T-세포 활성화 및 기능장애는 직접적인 및 조절된 수용체에 의존한다. 이들의 기능적 결과를 기본으로 하여, 보조-신호전달 분자(co-signaling molecule)는 보조-조절인자 및 보조-억제제로서 나누어질 수 있으며, 이는 T-세포 반응의 프라이밍(priming), 성장, 분화 및 기능적 성숙을 긍정적으로 및 부정적으로 조절한다(참조: Li Shi, et al., Journal of Hematology & Oncology 2013, 6:74).
예정 세포사 단백질-1(PD-1) 면역 체크포인트 경로를 차단하는 치료학적 항체는 T-세포 하향 조절을 방지하고 암에 대한 면역 반응을 촉진한다. 수개의 PD-1 경로 억제제는 진행중인 임상 시험의 다양한 상에서 강건한 활성을 나타내어 왔다(참고: RD Harvey, Clinical Pharmacology & Therapeutics (2014); 96 2, 214-223).
예정 세포사-1(PD-1)는 T 세포에 의해 주로 발현되는 보조-수용체이다. 이의 리간드, PD-L1 또는 PD-L2에 대한 PD-1의 결합은 면역계의 생리학적 조절에 매우 중요하다. PD-1 신호전달 경로의 주요 기능적 역할은 자가-반응성 T 세포의 억제이며, 이는 자가면역 질환에 대해 보호하기 위해 제공된다. 따라서, PD-1 경로의 제거는 병원성 자가면역성의 발달을 궁극적으로 초래할 수 있는 면역 내성의 파괴를 초래할 수 있다. 역으로, 종양 세포는 PD-1 경로를 때때로 선임하여 면역감시 메카니즘으로부터 도피할 수 있다. 따라서, PD-1 경로의 봉쇄는 암 치료요법의 매력적인 표적이 되어 왔다. 현재의 시도는 PD-1 및 PD-L1 표적화된 중화 항체 또는 융합 단백질인 6개의 제제를 포함한다. 40개 이상의 임상 시험이 다양한 종양 유형에서 PD-1 봉쇄의 역할을 보다 잘 규정하기 위해 진행중에 있다(참고: Hyun-Tak Jin et al., Clinical Immunology (Amsterdam, Netherlands) (2014), 153(1), 145-152).
국제 출원 WO 01/14557, WO 02/079499, WO 2002/086083, WO 03/042402, WO 2004/004771, WO 2004/056875, WO2006121168, WO2008156712, WO2010077634, WO2011066389, WO2014055897, WO2014059173, WO2014100079 및 미국 특허 US08735553은 PD-1 또는 PD-L1 억제 항체 또는 융합 단백질을 보고하고 있다.
또한, 국제 출원, WO2011161699, WO2012/168944, WO2013144704 및 WO2013132317은 예정 세포사 1(PD1) 신호전달 경로를 제어하고/하거나 억제할 수 있는 펩타이드 또는 펩티도미메틱 화합물을 보고하고 있다.
여전히, PD-1 경로의 보다 강력하고/하거나, 보다 우수하고/하거나 선택적인 면역 조절인자에 대한 요구가 있다. 본 발명은 예정 세포사 1(PD1) 신호전달 경로를 제어하고/하거나 억제할 수 있는 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물을 제공한다.
발명의 요약
본 발명에 따라서, 예정 세포사 1(PD1) 신호전달 경로를 제어하고/하거나 억제할 수 있는, 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체가 제공된다.
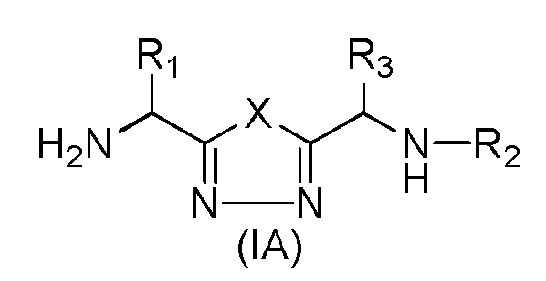
일 측면에서, 본 발명은 화학식 I의 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체가 제공된다:
[화학식 I]
상기 화학식 I에서,
R1은 Ser, Thr, Phe, Ala 또는 Asn으로부터 선택된 아미노산의 측쇄이고;
X는 S 또는 O이며;
R2는 수소 또는 -CO-Aaa이고;
Aaa는 Ser, Asn 또는 Thr로부터 선택된 아미노산 잔기이고, 여기서 이의 C-말단은 유리 말단이거나, 아미드화되어 있거나, 에스테르화되어 있으며;
R3은 Ser, Ala, Glu, Gln, Asn 또는 Asp로부터 선택된 아미노산의 측쇄이고;
-----는 임의 결합이며;
R4 및 R5는 독립적으로 수소이거나 부재한다.
본 발명의 추가의 측면에서, 이는 화학식 I의 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 포함하는 약제학적 조성물 및 이의 제조 방법에 관한 것이다.
본 발명의 여전히 다른 측면에서, 이는 예정 세포사 1(PD1) 신호전달 경로를 제어하고/하거나 억제할 수 있는, 화학식 I의 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체의 용도를 제공한다.
발명의 상세한 설명
본 발명은 PD-1, PD-L1, 또는 PD-L2로 인해 유도된 면역제어 신호의 억제를 포함하는 면역효능화를 통해 장애의 치료에 유용한 치료제로서 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 화합물 및 이를 사용한 치료요법을 제공한다.
각각의 구현예는 본 발명의 설명으로 제공되며, 본 발명의 제한으로 제공되지는 않는다. 실제로, 당해 분야의 숙련가에게는, 다양한 변형 및 변화가 본 발명의 영역 또는 취지로부터 벗어남이 없이 본 발명내에서 이루어질 수 있음이 명백할 것이다. 예를 들면, 일 구현예의 일부로서 예증되거나 설명된 특징은 여전히 추가의 구현예를 수득하기 위해서 다른 구현예에서 사용될 수 있다. 따라서, 본 발명은 첨부된 청구범위 및 이들의 등가물의 범위내에 있는 것으로서 이러한 변형 및 변화를 포함하는 것으로 의도된다. 본 발명의 다른 목적, 특징, 및 측면이 다음의 상세한 설명에 기재되어 있거나 이로부터 명백하다. 당해 분야의 통상의 기술자에게는, 본 발명이 예시적인 구현예를 설명하는 것 뿐이며 본 발명의 보다 광범위한 측면을 제한하는 것으로 해석되지 않아야 함이 이해되어야 한다.
일 구현예에서, 본 발명은 화학식 I의 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체에 관한 것이다.
[화학식 I]
상기 화학식 I에서,
R1은 Ser, Thr, Phe, Ala 또는 Asn으로부터 선택된 아미노산의 측쇄이고;
X는 S 또는 O이며;
R2는 수소 또는 -CO-Aaa이고;
Aaa는 Ser, Asn 또는 Thr로부터 선택된 아미노산 잔기이고, 여기서 이의 C-말단은 유리 말단이거나, 아미드화되어 있거나, 에스테르화되어 있으며;
R3은 Ser, Ala, Glu, Gln, Asn 또는 Asp로부터 선택된 아미노산의 측쇄이고;
-----는 임의의 결합이며;
R4 및 R5는 독립적으로 수소이거나 부재한다.
여전히 다른 구현예에서, 본 발명은 화학식 IA의 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 제공한다:
[화학식 IA]
상기 화학식 IA에서,
R1은 Ser, Thr, Phe, Ala 또는 Asn으로부터 선택된 아미노산의 측쇄이고;
X는 S 또는 O이며;
R2는 수소 또는 -CO-Aaa이고;
R3은 Ser, Ala, Glu, Gln, Asn 또는 Asp로부터 선택된 아미노산의 측쇄이며;
Aaa는 Ser, Asn 또는 Thr로부터 선택된 아미노산 잔기이고, 여기서 이의 C-말단은 유리 말단이거나, 아미드화되어 있거나, 에스테르화되어 있다.
여전히 다른 구현예에서, 본 발명은 화학식 IB의 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 제공한다:
[화학식 IB]
상기 화학식 IB에서,
R1은 Ser, Thr, Phe, Ala 또는 Asn으로부터 선택된 아미노산의 측쇄이고;
R3은 Ser, Ala, Glu, Gln, Asn 또는 Asp로부터 선택된 아미노산의 측쇄이며;
Aaa는 Ser, Asn 또는 Thr로부터 선택된 아미노산 잔기이고, 여기서 이의 C-말단은 유리 말단이거나, 아미드화되어 있거나, 에스테르화되어 있다.
여전히 추가의 구현예에서, 본 발명은 화학식 IC의 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체를 제공한다:
[화학식 IC]
상기 화학식 IC에서,
R1은 Ser, Thr, Phe, Ala 또는 Asn으로부터 선택된 아미노산의 측쇄이고;
R3은 Ser, Ala, Glu, Gln, Asn 또는 Asp로부터 선택된 아미노산의 측쇄이며;
Aaa는 Ser, Asn 또는 Thr로부터 선택된 아미노산 잔기이고, 여기서 이의 C-말단은 유리 말단이거나, 아미드화되어 있거나, 에스테르화되어 있다.
여전히 추가의 구현예에서, 본 발명은
R1이 Ser 또는 Thr의 측쇄이고;
R2가 -CO-Aaa이며;
Aaa가 아미노산 잔기 Ser 또는 Thr이고, 여기서 C-말단은 유리되어 있고;
R3은 Asn, Gln, Glu 또는 Asp의 측쇄인 화학식 I의 화합물을 제공한다.
하기 구현예는 본 발명의 예증이며 청구범위를 예시된 구체적인 구현예로 한정하는 것으로 의도되지 않는다.
일 구현예에 따라서, X가 O인 화학식 I 및 화학식 IA의 화합물이 구체적으로 제공된다.
일 구현예에 따라서, X가 S인 화학식 I 및 화학식 IA의 화합물이 구체적으로 제공된다.
일 구현예에 따라서, R2가 수소인 화학식 I 및 화학식 IA의 화합물이 구체적으로 제공된다.
일 구현예에 따라서, R4 및 R5가 수소인 화학식 I의 화합물이 구체적으로 제공된다.
일 구현예에 따라서, R4 및 R5가 부재한 화학식 I의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R2가 -CO-Ser인 화학식 I의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R2가 -CO-Thr인 화학식 I의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R1이 Ser의 측쇄인 화학식 I, 화학식 IA, 화학식 IB 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R1이 Thr의 측쇄인 화학식 I, 화학식 IA, 화학식 IB 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R1이 Phe, Ala 또는 Asn의 측쇄인 화학식 I, 화학식 IA, 화학식 IB 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R3이 Asn의 측쇄인 화학식 I, 화학식 IA, 화학식 IB 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R3이 Ser의 측쇄인 화학식 I, 화학식 IA 및 화학식 IB의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R3이 Gln의 측쇄인 화학식 I, 화학식 IA 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R3이 Glu의 측쇄인 화학식 I, 화학식 IA 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, R3이 Ala 또는 Asp의 측쇄인 화학식 I, 화학식 IA 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, Aaa가 Ser인 화학식 IB 및 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, Aaa가 Thr인 화학식 IC의 화합물이 구체적으로 제공된다.
여전히 다른 구현예에 따라서, 하나, 하나 이상 또는 모든 아미노산(들)이 D 아미노산(들)인 화학식 I, 화학식 IA 및 화학식 IB의 화합물이 구체적으로 제공된다.
일 구현예에서, 어떠한 제한없이 화학식 I의 구체적인 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체는 표 1에 열거된다:
본 발명에 개시된 바와 같은 화합물은 약제 투여를 위해 제형화된다.
일 구현예에서, 본 발명은 개시된 화합물, 및 약제학적으로 허용되는 담체 또는 희석제를 포함하는 약제학적 조성물을 제공한다.
다른 구현예에서, 상기 약제학적 조성물은 항암제, 화학치료제, 또는 항증식 화합물 중의 하나 이상을 추가로 포함한다.
일 구현예에서, 본 발명은 의약으로서 사용하기 위한 본 발명에 개시된 화합물을 제공한다.
다른 구현예에서, 본 발명은 암 또는 감염성 질환의 치료를 위한 의약으로서 사용하기 위한 본 발명에 개시된 바와 같은 화합물을 제공한다.
다른 구현예에서, 본 발명은 골암, 두부 또는 경부의 암, 췌장암, 피부암, 피하 또는 안구내 악성 흑색종, 자궁암, 난소암, 직장암, 항문 부위의 암, 위암, 고환암, 자궁암, 나팔관의 암종, 자궁내막의 암종, 자궁경부의 암종, 질의 암종, 외음의 암종, 호지킨 질환(Hodgkin's Disease), 비-호지킨 림프종(non-Hodgkin's lymphoma), 식도암, 소장암, 내분비계의 암, 갑상선의 암, 부갑상선의 암, 부신의 암, 연 조직의 육종, 요도의 암, 음경의 암, 급성 골수 백혈병, 만성 골수 백혈병, 급성 림프구성 백혈병, 만성 림프구성 백혈병을 포함하는 만성 또는 급성 백혈병, 유년기 고형 종양, 림프구성 림프종, 방광의 암, 신장 또는 자궁의 암, 신우의 암종, 중추신경계(CNS)의 신생물, 원발성 CNS 림프종, 종양 혈관형성, 척추 종양, 뇌간 신경교종, 뇌하수체 선종, 카포시 육종, 유표피암, 평편세포암, T-세포 림프종, 석면에 의해 유발된 것들을 포함하는 환경 유발암, 및 상기 암의 조합의 치료용 의약으로서 사용하기 위한 본 발명에 개시된 바와 같은 화합물을 제공된다.
다른 구현예에서, 본 발명은 암의 치료에 사용하기 위한 본 발명에 개시된 화합물을 제공한다.
다른 구현예에서, 본 발명은 감염성 질환의 치료에 사용하기 위한 본 발명에 개시된 화합물을 제공한다.
일 구현예에서, 본 발명은 세균 감염성 질환, 바이러스 감염성 질환 또는 진균 감염성 질환의 치료용 의약으로서 사용하기 위한 본 발명에 개시된 바와 같은 화합물을 제공한다.
일 구현예에서, 본 발명은 암의 치료 방법을 제공하며, 여기서 당해 방법은 이를 필요로 하는 대상체에게 유효량의 본 발명의 화합물의 투여를 포함한다.
다른 구현예에서, 본 발명은 대상체에게 치료학적 유효량의 본 발명의 화합물을 투여함으로써 대상체에서 면역 반응이 조절되도록 함을 포함하여, 대상체에서 PD-1 신호전달 경로에 의해 매개되는 면역 반응을 조절하는 방법을 제공한다.
여전히 다른 구현예에서, 본 발명은 대상체에게 예정 세포사 1(PD-1) 신호전달 경로를 억제할 수 있는 치료학적 유효량의 본 발명의 화합물을 투여함을 포함하여, 대상체에서 종양 세포의 성장 및/또는 전이를 억제하는 방법을 제공한다.
상기 종양 세포는 골암, 두부 또는 경부의 암, 췌장암, 피부암, 피하 또는 안구내 악성 흑색종, 자궁암, 난소암, 직장암, 항문 부위의 암, 위암, 고환암, 자궁암, 나팔관의 암종, 자궁내막의 암종, 자궁경부의 암종, 질의 암종, 외음의 암종, 호지킨 질환, 비-호지킨 림프종, 식도암, 소장암, 내분비계의 암, 갑상샘의 암, 부갑상선의 암, 부신의 암, 연 조직의 육종, 요도의 암, 음경의 암, 급성 골수 백혈병, 만성 골수 백혈병, 급성 림프구성 백혈병, 만성 림프구성 백혈병을 포함하는 만성 또는 급성 백혈병, 유년기 고형 종양, 림프구성 림프종, 방광의 암, 신장 또는 자궁의 암, 신우의 암종, 중추신경계(CNS)의 신생물, 원발성 CNS 림프종, 종양 혈관형성, 척추 종양, 뇌간 신경교종, 뇌하수체 선종, 카포시 육종, 유표피암, 평편세포암, T-세포 림프종, 석면에 의해 유발된 것들을 포함하는 환경 유발암, 및 상기 암의 조합과 같은 암을 포함하나, 이에 한정되지 않는다.
여전히 다른 추가의 구현예에서, 본 발명은 예정 세포사 1(PD1) 신호전달 경로를 억제할 수 있는 치료학적 유효량의 본 발명의 화합물을 대상체에게 투여함으로써 상기 대상체가 감염성 질환을 치료함을 포함하여, 대상체에서 감염성 질환을 치료하는 방법을 제공한다.
본 발명의 여전히 다른 추가의 구현예는 대상체에게 예정 세포사 1(PD1) 신호전달 경로를 억제할 수 있는 치료학적 유효량의 본 발명의 화합물을 투여함으로써 상기 대상체가 세균, 바이러스 및 진균 감염을 치료하도록 함을 포함하여, 상기 대상체에서 세균, 바이러스 및 진균 감염을 치료하는 방법을 제공한다.
감염성 질환은 HIV, 인플루엔자, 헤르페스, 기아르디아(Giardia), 말라리아, 레슈마니아(Leishmania), 감염 바이러스(A, B, 및 C)에 의한 병원성 감염, 헤르페스 바이러스(예를 들면, VZV, HSV-I, HAV-6, HSV-II, 및 CMV, 엡슈타인 바르 바이러스(Epstein Barr virus)), 아데노바이러스, 인플루엔자 바이러스, 플라비바이러스(flavivirus), 에코바이러스(echovirus), 리노바이러스, 콕사키에 바이러스(coxsackie virus), 코르노바이러스, 호흡기 합포체 바이러스, 볼거리 바이러스, 로타 바이러스, 홍역 바이러스, 루벨라 바이러스(rubella virus), 파르보바이러스(parvovirus), 박시니아 바이러스(vaccinia virus), HTLV 바이러스, 뎅구열 바이러스(dengue virus), 파필로마바이러스, 몰루스쿰 바이러스(molluscum virus), 폴리오바이러스, 라비스 바이러스, JC 바이러스 및 아르보바이러스성 뇌염 바이러스, 세균 클라미디아(chlamydia), 리켓챠(rickettsial) 세균, 마이코박테리아(mycobacteria), 스타필로코쿠스(staphylococci), 스트렙토코쿠스, 뉴모노코쿠스(pneumonococci), 메닝고코쿠스(meningococci) 및 코노코쿠스(conococci), 클렙시엘라(klebsiella), 프로테우스(proteus), 세라티아(serratia), 슈도모나스(pseudomonas), 이. 콜라이(E. coli), 레지오넬라(legionella), 디프테리아(diphtheria), 살모넬라(salmonella), 바실러스(bacilli), 콜레라(cholera), 테타누스(tetanus), 보툴리즘(botulism), 안트락스(anthrax), 플라그(plague), 렙토스피로시스(leptospirosis), 및 라임 질환(Lyme's disease) 세균에 의한 병원성 감염, 진균 칸디다(Candida)(알비칸스(albicans), 크루세이(krusei), 글라바타(glabrata), 트로피칼리스(tropicalis), 등), 크립토코쿠스 네오포르만스(Cryptococcus neoformans), 아스퍼길러스(Aspergillus)(푸미가투스(fumigatus), 나이거(niger) 등), 무코랄레스 (Mucorales) 속(무코르(mucor), 압시디아(absidia), 리조푸스(rhizophus)), 스포로트릭스 스켄키이(Sporothrix schenkii), 블라스토마이세스 더마티티디스(Blastomyces dermatitidis), 파라코키디오이데스 브라실리엔시스(Paracoccidioides brasiliensis), 콕시디오이데스 임미티스(Coccidioides immitis) 및 히스토플라스마 캡슐라툼(Histoplasma capsulatum)에 의한 병원성 감염, 및 기생충 엔타모에바 히스톨리티카(Entamoeba histolytica), 발란티디움 콜리(Balantidium coli), 나에글레리아포울레리(Naegleriafowleri), 아칸토모에바 종(Acanthamoeba sp.), 기아르디아 램비아(Giardia lambia), 크립토스포리디움 종(Cryptosporidium sp.), 뉴모시스티스 카리니이(Pneumocystis carinii), 플라스모디움 비박스(Plasmodium vivax), 바베시아 미크로티(Babesia microti), 트리파노소마 브루세이(Trypanosoma brucei), 트리파노소마 크루지(Trypanosoma cruzi), 레이슈마니아 도노바니(Leishmania donovani), 톡소플라스마 곤디(Toxoplasma gondi), 니포스트론길루스 브라실리엔시스(Nippostrongylus brasiliensis)에 의해 유발된 병원성 감염을 포함하나, 이에 한정되지 않는다.
본 발명의 화합물은, 단일 약물로서 또는 당해 화합물이 다양한 약리학적으로 허용되는 물질과 혼합된 약제학적 조성물로서 사용될 수 있다.
약제학적 조성물은 일반적으로 경구 또는 흡입 경로에 의해 투여되나, 비경구 투여 경로에 의해서 투여될 수 있다. 본 발명의 실시에서, 조성물은 예를 들면, 경구적으로, 정맥내 주입에 의해, 국소적으로, 복강내, 방광내 또는 척추강내에 의해 투여될 수 있다. 비경구 투여의 예는 관절내(관절들내), 정맥내, 근육내, 피내, 복강내, 및 피하 경로를 포함하나 이에 한정되지 않으며, 항산화제, 완충제, 세균정지제, 및 제형이 의도된 수용체의 혈액과 등장성이 되도록 하는 용질을 함유할 수 있는 수성 및 비수성의 등장성 멸균 주사 용액, 및 현탁화제, 가용화제, 증점제, 안정화제, 및 보존제를 포함할 수 있는 수성 및 비-수성 멸균 현탁제를 포함한다. 경구 투여, 비경구 투여, 피하 투여 및 정맥내 투여가 바람직한 투여 방법이다.
본 발명의 화합물의 용량은 연령, 체중, 증상, 치료 효능, 투여 요법 및/또는 치료 시간에 따라 변한다. 일반적으로, 이들은 경구 또는 흡입 경로에 의해, 횟수당 1mg 내지 100mg의 양으로, 성인의 경우 3일에 1회, 2일에 1회, 1일 1회 내지 1일 2회, 또는 경구 또는 흡입 경로에 의해 1일에 1 내지 24시간에 걸쳐 연속 투여될 수 있다. 용량은 다양한 조건에 의해 영향받으므로, 상기 용량 미만의 양이 때때로 매우 충분하거나, 일부 경우에 보다 많은 용량이 요구될 수 있다.
본 발명의 화합물은 (1) 본 발명의 예방적 및/또는 치료학적 약물의 예방 및/또는 치료학적 효능의 보충 및/또는 향상, (2) 본 발명의 예방적 및/또는 치료학적 약물의 역학, 흡수 증진, 용량 감소, 및/또는 (3) 본 발명의 예방적 및/또는 치료학적 약물의 부작용의 감소를 위해 다른 약물과 함께 투여될 수 있다.
본 발명의 화합물을 포함하는 수반되는 의약 및 다른 약물은, 성분 둘 다가 단일 제형 속에 함유되거나 별개의 제형으로 투여되는 조합 제제로서 투여될 수 있다. 별도의 제형에 의한 투여는 동시 투여 및 일부 시간 간격으로의 투여를 포함한다. 일부 시간 간격을 사용한 투여의 경우, 본 발명의 화합물은 우선 투여한 후 다른 약물을 투여할 수 있거나 다른 약물을 먼저 투여한 후 본 발명의 화합물을 투여할 수 있다. 각각의 약물의 투여 방법은 동일하거나 상이할 수 있다.
다른 약물의 용량은 임상적으로 사용된 용량을 기준으로 하여, 적절하게 선택될 수 있다. 본 발명의 화합물 및 다른 약물의 화합 비는 투여될 대상체의 연령 및 체중, 투여 방법, 투여 시간, 치료될 장애, 증상 및 이의 조합에 따라 적절히 선택될 수 있다. 예를 들면, 다른 약물을 본 발명의 화합물의 1 질량부(part by mass)를 기준으로 하여, 0.01 내지 100질량부의 양으로 사용될 수 있다. 다른 약물은 2개 이상의 종류의 임의의 약물과의 적절한 비율의 조합물일 수 있다. 본 발명의 화합물의 예방적 및/또는 치료학적 효능을 보충하고/하거나 향상시키는 다른 약물은 상기 메카니즘을 기준으로 하여, 이미 발견된 것들 뿐만 아니라, 앞으로 발견될 것들을 포함한다.
당해 수반된 사용이 예방적 및/또는 치료학적 효과를 발휘하는 질병은 특별히 제한되지 않는다. 수반된 의약은, 이것이 본 발명의 화합물의 예방적 및/또는 치료학적 효능을 보충하고/하거나 향상시키는 한, 어떠한 질환에 대해서도 사용될 수 있다.
본 발명의 화합물(들)은 존재하는 화학치료제와 함께 동시에 또는 혼합물 형태로 사용될 수 있다. 화학치료제의 예는 알킬화제, 니트로소우레아제, 항대사체, 항암 항생물제, 야채-기원 알칼로이드, 토포이소머라제 억제제, 호르몬 약물, 호르몬 길항제, 아로마타제 억제제, P-당단백질 억제제, 백금 복합체 유도체, 다른 면역치료 약물 및 다른 항암 약물을 포함한다. 또한, 이는 백혈구감소증(호중구감소증) 치료 약물, 혈소판감소증 치료 약물, 구토방지제 및 암 통증 조정 약물과 같은 암 치료 보조제와 함께 동시에 또는 혼합물 형태로 사용될 수 있다.
일 구현예에서, 본 발명의 화합물(들)은 다른 면역조절제 및/또는 효능화제와 함께 동시에 또는 혼합물 형태로 사용될 수 있다. 면역조절제의 예는 다양한 사이토킨, 백신 및 보조제를 포함한다. 면역 반응을 자극하는 이들 사이토킨, 백신 및 보조제의 예는 GM-CSF, M-CSF, G-CSF, 인터페론-α, -β, 또는 γ, IL-1, IL-2, IL-3 , IL-12, 폴리(I:C) 및 CpG를 포함하나, 이에 한정되지 않는다.
다른 구현예에서, 강화제는 사이클로포스파미드 및 사이클로포스마미드의 유사체, 항-TGFβ 및 이마티니브(글리벡), 파클리탁셀, 수니티니브(수텐트) 또는 다른 항혈관형성제와 같은 유사분열 억제제, 레트로졸과 같은 아로마타제 억제제, A2a 아데노신 수용체(A2AR) 길항제, 혈관형성 억제제, 안트라사이클린, 옥살리플라틴, 독소루비신, TLR4 길항제, 및 IL-18 길항제를 포함한다.
달리 정의하지 않는 한, 본원에 사용된 모든 기술 및 과학 용어는, 본원의 주요 물질이 속하는 당해 분야의 숙련가가 일반적으로 이해하는 바와 동일한 의미를 갖는다. 본원에 사용된 것으로서, 다음의 정의는 본 발명의 이해를 촉진하기 위하여 적용된다.
본원에 사용된 것으로서, 용어 '화합물(들)'은 본 발명에 기술된 화합물을 말한다.
본원에 사용된 것으로서, 용어 "포함하다" 또는 "포함하는"은 일반적으로 하나 이상의 특징 또는 성분의 존재를 허용함을 말하는 것을 포함하는 의미로 일반적으로 사용된다.
본원에 사용된 것으로서, 용어 "포함하는" 및 또한 "포함하다(include, includes 및 included)"는 제한되지 않는다.
본원에 사용된 것으로서, 용어 "아미노"는 -NH2 그룹을 말한다. 달리 나타내거나 열거되지 않는 한, 본원에 기술되거나 청구된 모든 아미노 그룹은 치환되거나 비치환될 수 있다.
본원에 사용된 것으로서, 용어 "아미노산"은 알파 탄소에서 L 또는 D 입체화학을 갖는 아미노산을 말한다.
"약제학적으로 허용되는 염"은, 특히 당해 염이 활성 성분의 유리 형태 또는 앞서 사용된 활성 성분의 어떠한 다른 염 형태와 비교하여 활성 성분에서 개선된 약동학적 특성을 부여하는 경우, 이의 염들 중의 하나의 형태의 화학식 I의 화합물을 포함한다. 활성 성분의 약제학적으로 허용되는 염 형태는 또한 앞서 가지지 않았고 심지어 신체내에서 이의 치료학적 효능과 관련하여 당해 활성 성분의 약동학에 있어서 긍정적인 영향까지도 가질 수 있는 바람직한 약동학적 특성을 당해 활성 성분에 처음으로 제공할 수 있다.
"약제학적으로 허용되는"은 일반적으로 안전하고, 무-독성이며, 생물학적으로 또는 달리는 바람직하지 않은 약제학적 조성물을 제조하는데 유용한 것을 의미하며, 수의학 및 또한 사람 약제학적 용도에 허용될 수 있는 것을 포함한다.
용어 "입체이성체"는, 이들이 키랄임에 상관없이 또는 이들이 하나 이상의 이중 결합을 지닌 경우, 화학식 I의 화합물의 어떠한 거울상이성체, 부분입체이성체, 또는 기하학적 이성체를 말한다. 화학식 I의 화합물 및 관련된 화학식이 키랄인 경우, 이들은 라세미체 또는 광학적으로 활성인 형태로 존재할 수 있다. 본 발명에 따른 화합물의 라세미체 또는 입체이성체의 약제학적 활성은 상이할 수 있으므로, 거울상이성체를 사용하는 것이 바람직할 수 있다. 이들 경우에, 말단 생성물 또는 심지어 중간체는 당해 분야의 숙련가에게 공지되거나 심지어 합성시 이와 같이 사용된 화학적 또는 물리적 척도에 의해 거울상이성체 화합물로 분리될 수 있다. 라세미성 아민의 경우에, 부분입체이성체는 광학적으로 활성인 용해제와의 반응에 의해 혼합물로부터 형성된다. 적합한 분해제의 예는 타르타르산, 디아세틸타르타르산, 디벤조일타르타르산, 만델산, 말산, 락트산, 적합한 N-보호된 아미노산(예를 들면, N-벤조일프롤린 또는 N-벤젠설포닐프롤린)의 R 및 S 형태와 같은 광학적 활성 산, 또는 다양한 광학적으로 활성인 캄포르설폰산과 같은 광학적으로 활성인 산이다. 또한 광학적으로 활성인 분해제(예를 들면, 디니트로벤조일페닐글리신, 셀룰로즈 트리아세테이트 또는 탄수화물의 다른 유도체 또는 실리카 겔에 고정된 키랄성 유도체화된 메타크릴레이트 중합체)를 사용한 크로마토그래프성 거울상이성체 분해가 유리하다.
용어 "대상체"는 포유류(특히 사람) 및 가정용 동물(예를 들면, 고양이 및 개를 포함하는 가정용 애완동물) 및 비-가정용 동물(예를 들면, 야생동물)과 같은 다른 동물을 포함한다.
"치료학적 유효량" 또는 "유효량"은 (i) 특수한 질환, 장애 또는 증상을 치료하거나 예방하고 (ii) 특수한 질환, 장애 또는 증상의 하나 이상의 증상을 약화시키거나, 완화시키거나 제거하거나 (iii) 본원에 기술된 특수한 질환, 장애 또는 증상의 하나 이상의 증상들의 발병을 예방하거나 지연시키는 본 발명의 화합물(들)의 충분한 양을 말한다. 암의 경우에, 약물의 치료학적 유효량은 암 세포의 수를 감소시킬 수 있고/있거나; 암 크기를 감소시킬 수 있고/있거나; 말초 기관내로 암 세포 침윤을 억제(즉, 일정 정도로 늦추고 달리는 정지)하고/하거나; 종양 전이를 제어(즉, 일정 정도로 늦추고 달리는 정지)하고/하거나; 종양 성장을 일부 정도로 억제하고/하거나 암과 관련된 하나 이상의 증상을 일정 정도로 완화시킬 수 있다. 감염성 질병 상태의 경우에, 치료학적 유효량은 감염성 질환, 세균, 바이러스 및 진균에 의해 유발된 감염의 증상을 감소시키거나 완화시키는데 충분한 양이다.
천연적으로 존재하는 아미노산은 하기 표 2에 나타낸 통상의 3-문자 약어에 의해 명세서 전체에서 확인된다:
| 아미노산 코드 | |||
| 명칭 | 3-문자 코드 | 명칭 | 3-문자 코드 |
| 아스파라긴 | Asn | 글루타민 | Gln |
| 아스파르트산 | Asp | 페닐알라닌 | Phe |
| 알라닌 | Ala | 세린 | Ser |
| 글루탐산 | Glu | 트레오닌 | Thr |
명세서 전체에서 사용된 약어는 이들의 특수한 의미와 함께 본원의 하기에 요약될 수 있다.
℃(섭씨 도); δ(델타); %(퍼센트); 염수(NaCl 용액); CH2Cl2/DCM(디클로로메탄); br s(광역 단일선); Cs2CO3(탄산세슘); d(이중선); DMF(디메틸 포름아미드); DMSO(디메틸 설폭사이드); DMSO-d6(중수소화된 DMSO); EDC.HCl/EDCI(1-(3-디메틸 아미노프로필)-3-카보디이미드 하이드로클로라이드); Et2NH(디에틸아민); Fmoc(플루오레닐메틸옥시카보닐 클로라이드); g 또는 gr(그램); H 또는 H2(수소); H2O(물); HOBt/HOBT(1-하이드록시 벤조트리아졸); HCl(염산); h 또는 hr(시간); Hz(헤르츠); HPLC(고-성능 액체 크로마토그래피); I2(요오드); K2CO3(탄산칼륨); LCMS(액체 크로마토그래피 질량 분광기); MeOH(메탄올); mmol(밀리몰); M(몰); μl(마이크로 리터); mL(밀리리터); mg(밀리그램); m(다중선); MHz(메가헤르츠); MS(ES)(질량 분광기-전자 스프레이); min.(분); Na(나트륨); NaHCO3(중탄산나트륨); NH2NH2·N2O(하이드라진 수화물); NMM(N-메틸 모르폴린); Na2SO4 (황산나트륨); N2(질소); NMR(핵 자기 공명 분광기); PD-L1(예정 세포사-리간드 1); PD-L2(예정 세포사 1 리간드 2); 예비-HPLC/제조적 HPLC(제조적 고-성능 액체 크로마토그래피); S(단일선); tBu(3급 부틸); TEA/Et3N(트리에틸 아민); TLC(박층 크로마토그래피); THF(테트라하이드로푸란); TIPS(트리이소프로필실란); TFA/CF3COOH(트리플루오로아세트산); t(삼중선); tR = (보유 시간); TPP(트리페닐 메탄); 등
실험
본 발명의 구현예는 적절한 물질을 사용한, 다음의 실시예의 과정에 따른 화학식 I의 화합물의 제조를 제공한다. 당해 분야의 숙련가는 다음의 제조 과정의 조건 및 공정의 공지된 변형을 사용하여 이들 화합물을 제조할 수 있음을 이해할 것이다. 또한, 상세히 기술된 과정을 이용함으로써, 당해 분야의 통상의 기술자는 본 발명의 추가의 화합물을 제조할 수 있다.
출발 물질은 일반적으로 미국 또는 독일의 Sigma-Aldrich; 미국의 Chem-Impex; 중국의 G.L. Biochem 및 인도의 Spectrochem과 같은 시판 공급원으로부터 일반적으로 입수가능하다.
화합물의 정제 및 특성화
분석적 HPLC 분석 방법: 분석적 HPLC를 ZIC HILIC 200 Å 컬럼(4.6 mm x 250 mm, 5 μm), 유동 속도: 1.0 mL/분을 사용하여 수행하였다. 사용된 용출 조건은 완충액 A: 5mmol 아세트산암모늄, 완충액 B: 아세토니트릴, 90% 완충액 B를 사용한 컬럼의 평형 및 30분 동안의 90% 내지 40% 완충액 B의 구배에 의한 용출.
제조적 HPLC 방법: 제조적 HPLC를 SeQuant ZIC HILIC 200 Å 컬럼(10mm x 250mm, 5μm), 유동 속도: 5.0mL/분을 사용하여 수행하였다. 사용된 용출 조건은 다음과 같다: 완충액 A: 5mmol 아세트산암모늄(아세트산으로 pH-4로 조절), 완충액 B: 아세토니트릴, 90% 완충액 B를 사용한 컬럼의 평형 및 20분 동안 90% 내지 40% 완충액 B의 구배에 의한 용출.
LCMS를 G1315 B DAD를 지닌 아질런트(Agilent) 1100 시리즈 HPLC로 AP1 2000 LC/MS/MS 3중 쿼드(triple quad)(제조원: Applied bio systems) 상에서, 수은 MS 컬럼을 사용하거나 G1315 B DAD를 지닌 아질런트 1100 시리즈 HPLC로 아질런트 LC/MSD VL 단일 쿼드 상에서, 수은 MS 컬럼을 사용하거나 SPD-20 A DAD를 지닌 프로미넌스(Prominence) UFLC 시스템으로 시마즈(Shimadzu) LCMS 2020 단일 쿼드를 사용하여 수행하였다.
실시예 1: 화합물 (1)의 합성
단계 1a:
탄산칼륨(7.9g, 57.39mmol) 및 요오드화메틸(1.3mL, 21.04mmol)을 DMF(35mL) 중의 화합물(1a)(5.0g, 19.13mmol)의 용액에 가하고 실온에서 2h 동안 교반하였다. 반응의 완성도(completeness)를 TLC 분석으로 확인하였다. 반응 혼합물을 물과 에틸 아세테이트 사이에 분배하였다. 유기 층을 물, 염수로 세척하고, Na2SO4 위에서 건조시키고 감압하에 증발시켜 5.0g의 화합물(1b)을 수득하였다(수율: 96.1%). LCMS: 176.1 (M-Boc)+.
단계 1b:
하이드라진 수화물(7.2mL)을 메탄올(30mL) 중의 화합물(1b)(5.0g, 18.16mmol)의 용액에 가하고 실온에서 2시간 동안 교반하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응 혼합물을 감압하에 증발시키고, 수득된 잔사를 물과 에틸 아세테이트 사이에 분배하였다. 유기 층을 물, 염수로 세척하고, Na2SO4 위에서 건조시키고 감압하에 증발시켜 4.0g의 화합물(1c)을 수득하였다(수율: 80.0%). LCMS: 276.3(M+H)+.
단계 1c:
NMM(0.67ml, 6.52mmol)을 DMF(15mL) 중의 화합물(1c)(1.2g, 4.35mmol), 화합물(1d)(1.43g, 4.35mmol), HOBt(0.7g, 5.22mmol) 및 EDC.HCl(0.99g, 5.22mmol)의 교반 용액에 0℃에서 서서히 가하였다. 반응 혼합물을 실온에서 12h 동안 교반하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응물을 얼음으로 퀀칭(quenching)시키고 침전된 고체를 여과하고 진공 하에 건조시켜 2.0g의 순수한 생성물(1e)을 수득하였다(수율: 83.3%). LCMS: 591.5 (M+Na)+.
단계 1d:
무수 THF(15.0mL) 및 DMF(5.0mL) 중의 화합물(1e)(1.5g, 2.63mmol)의 교반 용액에 트리페닐포스핀(1.38g, 5.27mmol) 및 요오드(1.33g, 5.27mmol)를 0℃에서 가하였다. 요오드가 완전히 용해된 후, Et3N(1.52mL, 10.54mmol)을 당해 반응 혼합물에 빙냉 온도에서 가하였다. 반응 혼합물을 실온에 도달하도록 하고 4시간 동안 교반하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응물을 빙수로 퀀칭시키고 에틸 아세테이트로 추출하였다. 유기 층을 포화된 티오황산나트륨 및 염수 용액으로 세척하였다. 분리된 유기 층을 Na2SO4 위에서 건조시키고 감압하에 증발시켜 잔사를 수득하고, 이를 실리카 겔 크로마토그래피(용출제: 헥산 중의 30% 에틸 아세테이트)로 정제하여 0.8g의 화합물(1f)를 수득하였다(수율: 55%). LCMS: 551.3 (M+H)+.
단계 1e:
Fmoc 그룹을, 디에틸아민(20.0mL)을 CH2Cl2(20.0mL) 중의 화합물(1f)(0.8g, 1.45mmol)의 용액에 0℃에서 가하여 탈보호시켰다. 반응물을 실온에서 2시간 동안 교반하였다. 수득되는 용액을 진공하에 농축시켜 진한 점착성 잔사(thick gummy residue)를 수득하였다. 조 화합물을 중성 알루미나 컬럼 크로마토그래피(용출제: 클로로포름 중의 2% 메탄올)로 정제하여 0.38g의 화합물(1g)를 수득하였다(수율: 80.0%): LCMS: 329.4 (M+H)+.
단계 1f:
DMF(10mL) 중에 용해된 화합물(1g)(0.38g, 1.16mmol), TEA(0.33mL, 2.32mmol)을 화합물(1h)(0.55g, 1.39mmol)의 용액에 0℃에서 우레아 결합 형성을 위해 적가하고 혼합물을 실온에서 2시간 동안 교반하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응물을 빙수로 퀀칭시키고, 침전된 고체를 여과하고 진공 하에 건조시켜 조 화합물을 수득하고, 이를 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 35% 에틸 아세테이트)로 추가로 정제하여 0.4g의 생성물(1i)을 수득하였다(수율: 59.7%). LCMS: 586.4(M+H)+.
단계 1g:
CH2Cl2(5mL) 중의 화합물(1i)(0.4g, 0.68mmol)의 용액에, 트리플루오로아세트산 (5mL) 및 촉매량의 트리이소프로필실란을 가하고 실온에서 3시간 동안 교반하여 산 민감성 보호 그룹을 제거하였다. 수득되는 용액을 질소 하에 농축시키고 고체 물질을 실험 조건 하에 기술된 바와 같은 제조적 HPLC 방법으로 정제하였다(수율: 0.05 g). LCMS: 318.0 (M+H)+; HPLC: tR= 10.96분.
화합물(1h)(NO
2
-C
6
H
4
-OCO-Thr(tBu)- O
t
Bu)의 합성:
DCM(25.0mL) 중의 4-니트로페닐클로로포르메이트(4.79g, 23.77mmol)의 용액에 CH2Cl2(25mL) 중의 H-Thr(tBu)-OtBu(5.0g, 21.61mmol) TEA(6.2mL, 43.22mmol)의 용액을 0℃에서 서서히 가하고 30분 동안 교반되도록 하였다. 반응의 완료를 TLC 분석으로 확인하였다. 반응의 완료 후 이를 DCM로 희석하고 1.0M의 시트르산에 이어서 1.0M 탄산나트륨 용액으로 세척하였다. 유기 층을 Na2SO4 위에서 건조시키고 감압하에 증발시켜 조 화합물(1h)을 수득하고, 이를 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 5% 에틸 아세테이트)로 추가로 정제하여 3.0g의 생성물(1h)를 수득하였다. 1H NMR (CDCl3, 400 MHz): δ 1.17 (s, 9H), 1.28 (d, 3H), 1.50 (s, 9H), 4.11 (m, 1H), 4.28 (m, 1H), 5.89 (d, 1H), 7.37 (d, 2H), 8.26 (d, 2H).
실시예 2: 화합물(2)의 합성
단계 2a:
NMM(1.8mL, 18.15mmol)을 DMF(15mL) 중의 화합물(1c)(2.0g, 7.26mmol), 화합물(2d)(4.3g, 7.26mmol), HOBt(1.17g, 8.7mmol) 및 EDC.HCl(1.66g, 8.7mmol)의 교반 용액에 0℃에서 서서히 교반하였다. 반응 혼합물을 실온에서 12시간 동안 교반하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응물을 얼음으로 퀀칭시키고, 침전된 고체를 여과하고 진공 하에 건조시켜 3.7g의 순수한 생성물(2e)을 수득하였다(수율: 59.6%). LCMS: 854.4 (M+H)+.
단계 2b:
무수 THF(25.0mL) 및 DMF(10.0mL) 중의 화합물(2e)(3.7g, 4.33mmol)의 교반된 용액에, 트리페닐포스핀(2.28g, 8.66mmol) 및 요오드(2.2g, 8.66mmol)를 0℃에서 가하였다. 요오드를 완전히 용해시킨 후, Et3N(2.5mL, 17.32mmol)을 동일한 온도에서 가하였다. 반응 혼합물을 실온에서 4시간 동안 교반하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응물을 빙수로 퀀칭시키고 에틸 아세테이트로 추출하였다. 유기 층을 포화된 티오황산나트륨 및 염수 용액으로 세척하였다. 분리된 유기 층을 Na2SO4 위에서 건조시키고 감압하에 증발시키고, 이를 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 30% 에틸 아세테이트)로 추가로 정제하여 2.0g의 화합물(2f)(수율: 55%)를 수득하였다. LCMS: 858.4 (M+Na)+.
단계 2c:
디에틸아민(30.0mL)을 CH2Cl2(30.0mL) 중의 화합물(2f)(2.0g, 1.17mmol)의 용액에 0℃에서 가하였다. 반응 혼합물을 실온에서 1시간 동안 교반하였다. 수득되는 용액을 진공 속에서 농축시켜 진한 점착성 잔사를 수득하였다. 조 화합물을 중성 알루미나 컬럼 크로마토그래피(용출제: 클로로포름 중의 2% 메탄올)로 정제하여 1.0g의 화합물(2g)을 수득하였다(수율: 71.4%). LCMS: 614.5 (M+H)+.
단계 2d:
DMF(10mL) 중에 용해된 화합물(2g)(1.0g, 1.63mmol) 및 TEA(0.47mL, 3.2mmol)를 화합물(1h)(0.7g, 1.79mmol)의 용액에 0℃에서 적가하였다. 이후에, 반응 혼합물을 실온에 도달하도록 하고 2시간 동안 교반을 지속하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응물을 빙수로 퀀칭시키고, 침전된 고체를 여과하고 진공하에 건조시켰다. 수득된 조 화합물을 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 30% 에틸 아세테이트)로 추가로 정제하여 0.8g의 생성물(2i)를 수득하였다(수율: 57.1%). LCMS: 871.6 (M+H)+.
단계 2e:
CH2Cl2(6mL) 중의 화합물(2i)(0.8g, 0.92mmol)의 용액에, 트리플루오로아세트산 (6mL) 및 촉매량의 트리이소프로필실란을 가하고 실온에서 3시간 동안 교반하였다. 수득되는 용액을 질소하에 농축시키고 고체 물질을 실험 조건 하에 기술된 제조적 HPLC 방법으로 정제하였다(수율: 0.065 g). HPLC: tR = 12.01분; LCMS: 361.34 (M+H)+.
실시예 3: 화합물(3)의 합성
단계 3a:
라우슨 시약(Lawesson's reagent)(2.85g, 7.03mmol)을 THF(40mL) 중의 화합물(2e)(4g, 4.68mmol)의 용액에 가하고 75℃에서 4시간 동안 교반하였다. 반응의 완성도를 TLC 분석으로 확인하였다. 반응 혼합물을 감암하에 증발시키고 수득된 잔사를 빙수와 에틸 아세테이트 사이에 분배하였다. 유기 층을 NaHCO3 용액에 이어서 염수 용액으로 세척하였다. 유기 층을 Na2SO4 위에서 건조시키고, 여과하고 감압하에 증발시켜 잔사를 수득하고 이를 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 5% 에틸 아세테이트)로 추가로 정제하여 2.7g의 화합물(3a)를 수득하였다(수율: 67.66%). LCMS: 852.3 (M+H)+,
단계 3b:
화합물(3a) 상의 Fmoc 그룹은 디에틸아민(3.8mL)을 CH2Cl2(3.8mL) 중의 화합물(3a)(1g, 1.17mmol)의 용액에 가하여 탈보호하였다. 반응 혼합물을 실온에서 30분 동안 교반하였다. 수득되는 용액을 진공하에 농축시켜 진한 점성 잔사를 수득하였다. 조 화합물을 중성 알루미나 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 50% 에틸 아세테이트에 이어서 클로로포름 중의 0 내지 5% 메탄올)로 정제하여 0.62g의 화합물(3b)를 수득하였다. LCMS: 630.5 (M+H)+.
단계 3c:
CH2Cl2(7.5mL) 중의 화합물(3b)(0.6 g)의 용액에, 트리플루오로아세트산(2.5mL) 및 촉매량의 트리이소프로필실란을 가하고 실온에서 3시간 동안 교반하였다. 수득되는 용액을 진공하에 농축시켜 0.13g의 화합물(3)을 수득하고 이를 실험 조건 하에서 제조적 HPLC 방법으로 정제하였다. LCMS: 232.3 (M+H)+.
실시예 4: 화합물(4)의 합성
단계 4a:
우레아 결합은 THF(10mL) 중의 화합물(3b)(0.5g, 7.9mmol)를 실온에서 화합물(4e)(0.34g, 7.9mmol)와 커플링시켜 수행하였다. 커플링은 THF(10mL) 중의 TEA(0.16g, 15.8mmol)를 첨가하여 개시하고 수득되는 혼합물을 실온에서 교반하였다. 12 시간 후에, THF를 반응 덩어리로부터 증발시키고, 물과 에틸 아세테이트 사이에 분배하였다. 유기 층을 물, 염수로 세척하고, Na2SO4 위에서 건조시키고 감압하에 증발시켜 화합물(4a)를 수득하고, 이를 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 50% 에틸 아세테이트)로 정제하여 0.45g의 생성물(4a)를 수득하였다(수율: 61.64%). LCMS: 921.8 (M+H)+.
단계 4b:
메탄올(20mL) 중의 화합물(4a)(0.55g)의 용액에 10% Pd-C(0.15g)를 불활성 대기하에서 가하였다. 혼합물을 1시간 동안 H2 대기하에서 교반하였다. 반응의 완료를 TLC 분석으로 확인하였다. 이후에, Pd-C 촉매를 Celite® 패드를 통한 여과로 제거하고 20mL의 메탄올로 세척하였다. 감압하에 증발하여 합한 유기 여과액을 생성물(4b)의 분리로 생성시켰다(수율: 0.42g, 85.71%). LCMS: 831.5 (M+H)+.
단계 4c:
CH2Cl2(5mL) 중의 화합물(4b)(0.2g, 0.3mmol)의 용액에, 트리플루오로아세트산(5mL) 및 촉매량의 트리이소프로필실란을 가하고 실온에서 3시간 동안 교반하였다. 수득되는 용액을 진공 하에 농축시키고 고체 물질을 실험 조건 하에서 기술된 제조적 HPLC 방법으로 정제하였다(수율: 0.065 g). HPLC: tR = 14.1 min.; LCMS: 377.3 (M+H)+.
화합물(4e), (NO
2
-C
6
H
4
-OCO-Thr(O
t
Bu)-Bzl,)의 합성:
100mL의 DMF 중의 화합물 Fmoc-Thr(tBu)-OH(15g, 37.73mmol)의 용액에, Cs2CO3 (14.75g, 45.2mmol)를 가하고 수득되는 혼합물을 0℃로 냉각시켰다. 냉각된 반응 혼합물에 벤질 브로마이드(7.74g, 45.2mmol)를 가하고 용액을 빙냉 온도에서 30분 동안 교반한 후 실온에서 12시간 동안 교반하였다. 반응 혼합물을 감압하에 농축시키고 에틸 아세테이트로 희석시켰다. 유기 층을 물에 이어 염수 용액으로 세척하고 Na2SO4 위에서 건조시켰다. 여과된 용액을 농축시키고 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 30% 에틸 아세테이트)로 정제하여 18g의 화합물(4c)를 백색 고체로서 수득하였다. LCMS: 433.1 (M-OtBu)+, 397.2 (M-OBzl)+.
화합물(4c)(25g, 51.3mmol) 상의 Fmoc 그룹은 디에틸아민(100mL)을 CH2Cl2(100mL) 중의 화합물(4d)(25g, 51.3mmol)에 1시간 동안 실온에서 교반하면서 가하여 탈보호하였다. 수득되는 용액을 진공 하에 농축시키고 진한 잔사를 중성 알루미나 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 50% 에틸 아세테이트에 이어서 클로로포름 중의 0 내지 5% 메탄올)로 정제하여 10.6g의 화합물(4d)를 수득하였다. LCMS: 266.5 (M+H)+.
CH2Cl2(25mL) 중의 화합물(4d)(1.5g, 5.65mmol)의 용액에 TEA(1.14g, 11.3mmol)를 가하고 당해 용액을 실온에서 5 내지 10분 동안 교반하였다. 당해 혼합물에 CH2Cl2(10mL) 중의 4-니트로페닐 클로로포르메이트(1.4g, 6.78mmol)의 용액을 가하고 수득되는 혼합물을 실온에서 12시간 동안 교반하였다. 반응의 완료를 TLC 분석으로 확인하였다. 반응의 완료 후 이를 DCM으로 희석시키고 1.0M 중황산나트륨 용액에 이어서 1.0M 탄산나트륨 용액으로 세척하였다. 유기 층을 Na2SO4 위에서 건조시키고, 여과하고 감압하에 증발시켜 조 화합물(4e)를 수득하고, 이를 실리카 겔 컬럼 크로마토그래피(용출제: 헥산 중의 0 내지 20% 에틸 아세테이트)로 추가로 정제하여 0.7g의 생성물(4e)를 수득하였다. 1H NMR (DMSO-d 6, 300 MHz): d 1.04 (s, 9H), 1.16 (d, 3H), 4.11 (m, 1H), 5.11 (m, 3H), 6.91 (d, 2H), 7.40 (m, 5H), 8.10 (d, 2H), 8.26 (br s, 1H).
하기 표 3의 화합물을 위에서 기술된 실험 과정을 기본으로 하여 제조하였다.
당해 분야의 통상의 기술자에게 공지된 적합한 변형을 사용하여 위에서 기술된 바와 유사한 과정에 따라 제조할 수 있는, 하기 표 4에 나타낸 화합물이 또한 본 출원의 영역에 포함된다.
재조합체 PD-L1/PD-L2의 존재하에서 마우스 비장세포 증식의 구조(rescue):
재조합체 마우스 PD-L1(rm-PDL-1, 제품 번호: 1019-B7-100 및 R&D Systems)을 PD-L1의 공급원으로서 사용하였다.
요건:
마우스 비장세포를 6 내지 8주령 C57 BL6 마우스로부터 수거하였다; RPMI 1640 (GIBCO, 제품 번호 11875); 고 글루코즈가 들어있는 DMEM(GIBCO, 제품 번호D6429); 태아 소 혈청[Hyclone, 제품 번호 SH30071.03]; 페니실린(10000단위/ml)-스트렙토마이신(10,000μg/ml) 액체(GIBCO, 제품 번호15140-122); MEM 피루브산나트륨 용액 100mM(100x), 액체(GIBCO, 제품 번호 11360); 비필수 아미노산(GIBCO, 제품 번호 11140); L-글루타민(GIBCO, 제품 번호 25030); 항-CD3 항체 (eBiosciences - 16-0032); 항-CD28 항체(eBiosciences - 16-0281); ACK 분해 완충액(1mL)(GIBCO, 제품 번호-A10492); 히스토파크(밀도-1.083gm/mL)(SIGMA 10831); 트립판 블루 용액(SIGMA-T8154); 2mL의 노른 젝트 루어 록 주사기(Norm Ject Luer Lock syringe)-(Sigma 2014-12); 40μM 나일론 세포 여과기(BD FALCON 35230); 혈구계산기(Bright line-SIGMA Z359629); FACS 완충액(PBS/0.1% BSA): 0.1% 소 혈청 알부민(BSA) 및 나트륨 아지드(SIGMA 08591)가 들어있는 인산염 완충된 염수(PBS) pH 7.2(HiMedia TS1006)(SIGMA A7050); CFSE의 5mM 스톡 용액: CFSE 스톡 용액은 동결건조된 CFSE를 180μL의 디메틸 설폭사이드(DMSO C2H6SO, SIGMA-D-5879)로 희석시켜 제조하고 추가의 사용을 위해 튜브 내로 분취하였다. 작업 농도를 10μM로부터 1μM로 적정하였다. (eBioscience-650850-85); 0.05% 트립신 및 0.02% EDTA(SIGMA 59417C); 96-웰 방식 ELISA 플레이트(Corning CLS3390); BD FACS 구경(E6016); 재조합체 마우스 B7-H1/PDL1 Fc 키메라, (rm-PD-L1 cat no: 1019-B7-100).
프로토콜
비장세포 제조 및 배양:
마우스 비장을 40μm 세포 여과기로 으깨어 50mL 팔콘 튜브(falcon tube) 속에 수거한 비장세포를 1mL의 ACK 분해 완충액으로 5분 동안 실온에서 추가로 처리하였다. 9mL의 RPMI 완전 배지로 세척한 후, 세포를 15mL 튜브 속에서 3mL의 1xPBS 속에 재-현탁시켰다. 3mL의 히스토파크(Histopaque)를 덮여진 비장세포 현탁액을 교란시키지 않고 튜브의 바닥에 조심스럽게 가하였다. 800xg에서 20분 동안 실온으로 원심분리한 후, 비장세포의 불투명한 층을 층의 교란/혼합없이 조심스럽게 수집하였다. 비장 세포를 냉 1xPBS로 세척한 후 트립판 블루 배제 방법을 사용한 총 세포 계수 후 세포계 검정에 추가로 사용하였다.
비장 세포를 RPMI 완전 배지(RPMI + 10% 태아 소 혈청 + 1mM 피루브산나트륨 + 10,000단위/mL의 페니실린 및 10,000μg/mL의 스트렙토마이신) 속에 배양하고 CO2 항온처리기 속에 5% CO2와 함께 37℃에서 유지시켰다.
CFSE 증식 검정:
CFSE는 세포내로 수동적으로 확산하여 세포내 단백질에 결합하는 염료이다. 1x106개의 세포/mL의 수거된 비장세포를 예비-가온된 1xPBS/0.1% BSA 용액 중의 5μM의 CFSE 용액으로 37℃에서 처리하였다. 과량의 CFSE를 세포에 대하여 5 용적의 빙냉 배양 배지를 사용하여 퀀칭시키고 빙상에서 5분 동안 항온처리하였다. CFSE 표지된 비장세포를 빙냉 완전 RPMI 배지를 사용하여 추가로 3회 제공하였다. CFSE 표지된 1x105개의 비장세포를 MDA-MB231 세포(고 글루코즈 DMEM 배지 속에 배양된 1x105 세포) 또는 재조합체 사람 PDL-1(100ng/mL) 및 시험 화합물을 함유하는 웰(well)에 가하였다. 비장세포를 항-마우스 CD3 및 항-마우스 CD28 항체(각각 1μg/mL)로 자극하고, 배양물을 72h 동안 37℃에서 5% CO2와 함께 추가로 항온처리하였다. 세포를 수거하고 빙냉 FACS 완충액으로 3회 세척하고 증식 %를 488nm 여기 및 521nm 방사 여과기를 사용하는 유동 세포분석법으로 분석하였다.
데이타 편집, 프로세싱 및 추론:
비장세포 증식 퍼센트를 세포 퀘스트(cell quest) FACS 프로그램을 사용하여 분석하고 화합물에 의한 비장세포 증식의 구조 퍼센트를 배경 증식값 %를 추론하고 100%로서 자극된 비장세포 증식(양성 대조군) %에 대해 표준화하여 분석하였다.
자극된 비장세포: 비장세포 + 항-CD3/CD28 자극
배경 증식: 비장세포 + 항-CD3/CD28 + PD-L1
화합물 증식: 비장세포 + 항-CD3/CD28 + PD-L1 + 화합물
화합물 효과를 리간드(PDL-1)의 존재하에서 화합물의 요구되는 농도를 항-CD3/CD28 자극된 비장세포에 가하여 실험하였다.
Claims (21)
- 화학식 I의 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체:
[화학식 I]
상기 화학식 I에서,
R1은 Ser, Thr, Phe, Ala 또는 Asn으로부터 선택된 아미노산의 측쇄이고;
X는 S 또는 O이며;
R2는 수소 또는 -CO-Aaa이고;
Aaa는 Ser, Asn 또는 Thr로부터 선택된 아미노산 잔기이고, 여기서 이의 C-말단은 유리 말단이거나, 아미드화되어 있거나, 에스테르화되어 있으며;
R3은 Ser, Ala, Glu, Gln, Asn 또는 Asp로부터 선택된 아미노산의 측쇄이고;
-----는 임의 결합이며;
R4 및 R5는 독립적으로 수소이거나 부재한다. - 제1항 또는 제2항에 있어서, X가 O인 화합물.
- 제1항 또는 제2항에 있어서, X가 S인 화합물.
- 제1항에 있어서,
R1이 Ser 또는 Thr의 측쇄이고;
R2가 -CO-Aaa이며;
Aaa가 아미노산 잔기 Ser 또는 Thr이고, 여기서 C-말단은 유리되어 있고;
R3이 Asn, Gln, Glu 또는 Asp의 측쇄인 화합물. - 제1항 또는 제2항에 있어서, R2가 수소인 화합물.
- 제1항 내지 제9항 중의 어느 한 항에 따른 적어도 하나의 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체, 및 약제학적으로 허용되는 담체 또는 부형제를 포함하는 약제학적 조성물.
- 제10항에 있어서, 적어도 하나의 추가의 약제학적 제제를 포함하고, 여기서 상기 추가의 약제학적 제제가 항암제, 화학치료제, 또는 항증식성 화합물인 약제학적 조성물.
- 의약으로서 사용하기 위한, 제1항 내지 제9항 중의 어느 한 항에 따른 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체.
- 암 또는 감염성 질병의 치료용 의약으로서 사용하기 위한, 제1항 내지 제9항 중의 어느 한 항에 따른 화합물 또는 이의 약제학적으로 허용되는 염 또는 입체이성체.
- 제13항에 있어서, 암이 골암, 두부 또는 경부의 암, 췌장암, 피부암, 피하 또는 안구내 악성 흑색종, 자궁암, 난소암, 직장암, 항문 부위의 암, 위암, 고환암, 자궁암, 나팔관의 암종, 자궁내막의 암종, 자궁경부의 암종, 질의 암종, 외음의 암종, 호지킨 질환(Hodgkin's Disease), 비-호지킨 림프종(non-Hodgkin's lymphoma), 식도암, 소장암, 내분비계의 암, 갑상선의 암, 부갑상선의 암, 부신의 암, 연 조직의 육종, 요도의 암, 음경의 암, 급성 골수 백혈병, 만성 골수 백혈병, 급성 림프구성 백혈병, 만성 림프구성 백혈병을 포함하는 만성 또는 급성 백혈병, 유년기 고형 종양, 림프구성 림프종, 방광의 암, 신장 또는 자궁의 암, 신우의 암종, 중추신경계(CNS)의 신생물, 원발성 CNS 림프종, 종양 혈관형성, 척추 종양, 뇌간 신경교종, 뇌하수체 선종, 카포시 육종, 유표피암, 평편세포암, T-세포 림프종, 석면에 의해 유발된 것들을 포함하는 환경 유발암, 및 상기 암의 조합으로 이루어진 그룹으로부터 선택된 화합물.
- 제13항에 있어서, 상기 감염성 질환이 세균 감염성 질환, 바이러스 감염성 질환 또는 진균 감염성 질환인 화합물.
- 대상체에게 치료학적 유효량의 제1항 내지 제9항 중의 어느 한 항에 따른 화합물을 투여함을 포함하여, 상기 대상체에서 PD-1 신호전달 경로에 의해 매개되는 면역 반응을 조절하는 방법.
- 대상체에게 치료학적 유효량의 제1항 내지 제9항 중의 어느 한 항에 따른 화합물을 투여함을 포함하여, 대상체에서 종양 세포의 성장 및/또는 전이를 억제하는 방법.
- 제15항에 있어서, 종양 세포가 유방암, 결장암, 폐암, 흑색종, 전립선암 및 신장암으로 이루어진 그룹으로부터 선택된 암의 세포인 방법.
- 제15항에 있어서, 종양 세포가 골암, 두부 또는 경부의 암, 췌장암, 피부암, 피하 또는 안구내 악성 흑색종, 자궁암, 난소암, 직장암, 항문 부위의 암, 위암, 고환암, 자궁암, 나팔관의 암종, 자궁내막의 암종, 자궁경부의 암종, 질의 암종, 외음의 암종, 호지킨 질환(Hodgkin's Disease), 비-호지킨 림프종(non-Hodgkin's lymphoma), 식도암, 소장암, 내분비계의 암, 갑상선의 암, 부갑상선의 암, 부신의 암, 연 조직의 육종, 요도의 암, 음경의 암, 급성 골수 백혈병, 만성 골수 백혈병, 급성 림프구성 백혈병, 만성 림프구성 백혈병을 포함하는 만성 또는 급성 백혈병, 유년기 고형 종양, 림프구성 림프종, 방광의 암, 신장 또는 자궁의 암, 신우의 암종, 중추신경계(CNS)의 신생물, 원발성 CNS 림프종, 종양 혈관형성, 척추 종양, 뇌간 신경교종, 뇌하수체 선종, 카포시 육종, 유표피암, 평편세포암, T-세포 림프종, 석면에 의해 유발된 것들을 포함하는 환경 유발암, 및 상기 암의 조합으로 이루어진 목록으로부터 선택된 암의 세포인 방법.
- 대상체에게 치료학적 유효량의 제1항 내지 제9항 중의 어느 한 항에 따른 화합물을 투여함을 포함하여, 상기 대상체에서 감염성 질환을 치료하는 방법.
- 대상체에게 치료학적 유효량의 제1항 내지 제9항 중의 어느 한 항에 따른 화합물을 투여함을 포함하여, 대상체에서 세균성, 바이러스성 및 진균성 감염을 치료하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IN4012/CHE/2013 | 2013-09-06 | ||
| IN4012CH2013 | 2013-09-06 | ||
| PCT/IB2014/064281 WO2015033301A1 (en) | 2013-09-06 | 2014-09-05 | 1,3,4-oxadiazole and 1,3,4-thiadiazole derivatives as immunomodulators |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160081898A true KR20160081898A (ko) | 2016-07-08 |
Family
ID=52627870
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167009155A KR20160081898A (ko) | 2013-09-06 | 2014-09-05 | 면역조절제로서 1,3,4-옥사디아졸 및 1,3,4-티아디아졸 유도체 |
Country Status (25)
| Country | Link |
|---|---|
| US (3) | US20160194295A1 (ko) |
| EP (2) | EP3041828B1 (ko) |
| JP (1) | JP2016532711A (ko) |
| KR (1) | KR20160081898A (ko) |
| CN (1) | CN105849092A (ko) |
| AU (1) | AU2014316684A1 (ko) |
| CA (1) | CA2922655A1 (ko) |
| CU (1) | CU24345B1 (ko) |
| CY (1) | CY1120769T1 (ko) |
| DK (1) | DK3041828T3 (ko) |
| EA (1) | EA029661B1 (ko) |
| ES (1) | ES2682040T3 (ko) |
| HR (1) | HRP20181251T1 (ko) |
| HU (1) | HUE039014T2 (ko) |
| IL (1) | IL244313A0 (ko) |
| LT (1) | LT3041828T (ko) |
| MX (1) | MX2016002971A (ko) |
| PH (1) | PH12016500405B1 (ko) |
| PL (1) | PL3041828T3 (ko) |
| PT (1) | PT3041828T (ko) |
| RS (1) | RS57559B1 (ko) |
| SG (2) | SG10201800508SA (ko) |
| SI (1) | SI3041828T1 (ko) |
| TR (1) | TR201811077T4 (ko) |
| WO (1) | WO2015033301A1 (ko) |
Families Citing this family (168)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2015007051A (es) | 2012-12-07 | 2016-01-12 | Chemocentryx Inc | Diazol lactamas. |
| PL3363790T3 (pl) | 2013-09-06 | 2020-07-27 | Aurigene Discovery Technologies Limited | Pochodne 1,2,4-oksadiazolu jako immunomodulatory |
| EA029661B1 (ru) | 2013-09-06 | 2018-04-30 | Ауриген Дискавери Текнолоджиз Лимитед | Производные 1,3,4-оксадиазола и 1,3,4-тиадиазола в качестве иммуномодуляторов |
| SG10202108921VA (en) | 2015-03-10 | 2021-09-29 | Aurigene Discovery Tech Ltd | 1,2,4-oxadiazole and thiadiazole compounds as immunomodulators |
| BR112017019306A2 (pt) * | 2015-03-10 | 2018-05-08 | Aurigene Discovery Technologies Limited | compostos de 1,3,4-oxadiazol e tiadiazol como imunomoduladores |
| CA2979163A1 (en) * | 2015-03-10 | 2016-09-15 | Aurigene Discovery Technologies Limited | 3-substituted 1,3,4-oxadiazole and thiadiazole compounds as immunomodulators |
| MY197262A (en) | 2015-07-27 | 2023-06-08 | Chong Kun Dang Pharmaceutical Corp | 1,3,4-oxadiazole sulfonamide derivative compounds as histone deacetylase 6 inhibitor, and the pharmaceutical composition comprising the same |
| JP6538266B2 (ja) | 2015-07-27 | 2019-07-03 | チョン クン ダン ファーマシューティカル コーポレーション | ヒストン脱アセチル化酵素6阻害剤としての1,3,4−オキサジアゾールスルファミド誘導体化合物及びこれを含有する薬剤学的組成物(1,3,4−Oxadiazole Sulfamide Derivative Compounds as Histone Deacetylase 6 Inhibitor, and the Pharmaceutical Composition Comprising the same) |
| KR101799009B1 (ko) | 2015-07-27 | 2017-11-17 | 주식회사 종근당 | 히스톤 탈아세틸화효소 6 억제제로서의 1,3,4-옥사다이아졸 아마이드 유도체 화합물 및 이를 포함하는 약제학적 조성물 |
| BR112018002304B1 (pt) | 2015-08-04 | 2023-12-19 | Chong Kun Dang Pharmaceutical Corp | Compostos de derivado de 1,3,4-oxadiazol como inibidor de histona desacetilase 6 e a composição farmacêutica que compreende os mesmos |
| MA44909A (fr) | 2015-09-15 | 2018-07-25 | Acerta Pharma Bv | Association thérapeutique d'un inhibiteur du cd19 et d'un inhibiteur de la btk |
| NZ740809A (en) | 2015-10-12 | 2019-04-26 | Chong Kun Dang Pharmaceutical Corp | Oxadiazole amine derivative compounds as histone deacetylase 6 inhibitor, and the pharmaceutical composition comprising the same |
| US20170107216A1 (en) | 2015-10-19 | 2017-04-20 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| PL3377488T3 (pl) | 2015-11-19 | 2022-12-19 | Incyte Corporation | Związki heterocykliczne jako immunomodulatory |
| MD3394033T2 (ro) | 2015-12-22 | 2021-04-30 | Incyte Corp | Compuși heterociclici ca imunomodulatori |
| PL3402503T3 (pl) | 2016-01-13 | 2021-04-19 | Acerta Pharma B.V. | Kombinacje terapeutyczne antyfolianu oraz inhibitora btk |
| IL261998B2 (en) | 2016-04-07 | 2023-03-01 | Chemocentryx Inc | Reducing your burden by giving ccr1 antagonists in combination with pd-1 inhibitors or pd-l1 inhibitors |
| US20170320875A1 (en) | 2016-05-06 | 2017-11-09 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2017205464A1 (en) | 2016-05-26 | 2017-11-30 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| MY197280A (en) | 2016-06-20 | 2023-06-09 | Incyte Corp | Heterocyclic compounds as immunomodulators |
| KR102401963B1 (ko) | 2016-06-27 | 2022-05-25 | 케모센트릭스, 인크. | 면역조절제 화합물 |
| CN107573332B (zh) | 2016-07-05 | 2022-04-19 | 广州再极医药科技有限公司 | 芳香乙炔或芳香乙烯类化合物、其中间体、制备方法、药物组合物及应用 |
| EP3484866B1 (en) | 2016-07-14 | 2022-09-07 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2018044783A1 (en) | 2016-08-29 | 2018-03-08 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2018047143A1 (en) * | 2016-09-12 | 2018-03-15 | Aurigene Discovery Technologies Limited | Vista signaling pathway inhibitory compounds useful as immunomodulators |
| WO2018047139A1 (en) * | 2016-09-12 | 2018-03-15 | Aurigene Discovery Technologies Limited | Compounds as modulators of tigit signalling pathway |
| WO2018051255A1 (en) * | 2016-09-14 | 2018-03-22 | Aurigene Discovery Technologies Limited | Cyclic substituted-1,3,4-oxadiazole and thiadiazole compounds as immunomodulators |
| EP3515453A1 (en) | 2016-09-22 | 2019-07-31 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for reprograming immune environment in a subject in need thereof |
| AU2017342536A1 (en) | 2016-10-14 | 2019-05-02 | Precision Biosciences, Inc. | Engineered meganucleases specific for recognition sequences in the Hepatitis B virus genome |
| TWI788307B (zh) | 2016-10-31 | 2023-01-01 | 美商艾歐凡斯生物治療公司 | 用於擴增腫瘤浸潤性淋巴細胞之工程化人造抗原呈現細胞 |
| WO2018098352A2 (en) | 2016-11-22 | 2018-05-31 | Jun Oishi | Targeting kras induced immune checkpoint expression |
| KR20190111025A (ko) | 2016-12-22 | 2019-10-01 | 인사이트 코포레이션 | 면역조절제로서의 벤조옥사졸 유도체 |
| WO2018119236A1 (en) | 2016-12-22 | 2018-06-28 | Incyte Corporation | Triazolo[1,5-a]pyridine derivatives as immunomodulators |
| MD3558990T2 (ro) | 2016-12-22 | 2023-02-28 | Incyte Corp | Derivați tetrahidro imidazo[4,5-c]piridină ca inductori de internalizare a PD-L1 |
| ES2899402T3 (es) | 2016-12-22 | 2022-03-11 | Incyte Corp | Derivados de piridina como inmunomoduladores |
| WO2018129533A1 (en) | 2017-01-09 | 2018-07-12 | Shuttle Pharmaceuticals, Llc | Selective histone deacetylase inhibitors for the treatment of human disease |
| MA47215A (fr) | 2017-01-09 | 2019-11-13 | Bioxcel Therapeutics Inc | Procédés prédictifs et diagnostiques pour le cancer de la prostate |
| US11584733B2 (en) | 2017-01-09 | 2023-02-21 | Shuttle Pharmaceuticals, Inc. | Selective histone deacetylase inhibitors for the treatment of human disease |
| CN108395443B (zh) * | 2017-02-04 | 2021-05-04 | 广州丹康医药生物有限公司 | 抑制程序性死亡受体配体1的环状化合物及其用途 |
| TW201841896A (zh) * | 2017-04-26 | 2018-12-01 | 大陸商南京聖和藥業股份有限公司 | 作為pd—l1抑制劑的雜環類化合物 |
| CN108863963B (zh) * | 2017-05-08 | 2022-05-27 | 南京圣和药物研发有限公司 | 作为pd-l1抑制剂的杂环类化合物 |
| CN109096219B (zh) * | 2017-06-20 | 2023-03-21 | 广州丹康医药生物有限公司 | 一种新型抗pd-l1化合物、其应用及含其的组合物 |
| EP3658173A1 (en) | 2017-07-25 | 2020-06-03 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for modulating monocytopoiesis |
| IL272258B (en) | 2017-07-28 | 2022-08-01 | Chemocentryx Inc | Immunomodulator compounds |
| CN111225665B (zh) | 2017-08-08 | 2023-12-08 | 凯莫森特里克斯股份有限公司 | 大环免疫调节剂 |
| WO2019061324A1 (en) | 2017-09-29 | 2019-04-04 | Curis Inc. | CRYSTALLINE FORMS OF IMMUNOMODULATORS |
| SG11202003081WA (en) | 2017-10-11 | 2020-05-28 | Aurigene Discovery Tech Ltd | Crystalline forms of 3-substituted 1,2,4-oxadiazole |
| CN109678796B (zh) * | 2017-10-19 | 2023-01-10 | 上海长森药业有限公司 | Pd-1/pd-l1小分子抑制剂及其制备方法和用途 |
| CN111655260A (zh) | 2017-10-26 | 2020-09-11 | 南方研究院 | 作为TGF-β抑制剂的噁二唑和噻二唑 |
| CN111372584A (zh) | 2017-11-03 | 2020-07-03 | 奥瑞基尼探索技术有限公司 | Tim-3和pd-1途径的双重抑制剂 |
| CA3081675A1 (en) | 2017-11-06 | 2019-05-09 | Aurigene Discovery Technologies Limited | Conjoint therapies for immunomodulation |
| JP2021502066A (ja) | 2017-11-06 | 2021-01-28 | ジェネンテック, インコーポレイテッド | がんの診断及び療法 |
| KR102492187B1 (ko) | 2017-12-20 | 2023-01-27 | 인스티튜트 오브 오가닉 케미스트리 앤드 바이오케미스트리 에이에스 씨알 브이.브이.아이. | Sting 어댑터 단백질을 활성화하는 포스포네이트 결합을 가진 3'3' 사이클릭 다이뉴클레오티드 |
| AU2018392212B9 (en) | 2017-12-20 | 2021-03-18 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3' cyclic dinucleotides with phosphonate bond activating the STING adaptor protein |
| SG11202005962YA (en) | 2017-12-29 | 2020-07-29 | Guangzhou Maxinovel Pharmaceuticals Co Ltd | Aromatic vinyl or aromatic ethyl derivative, preparation method therefor, intermediate, pharmaceutical composition, and application |
| US11407723B2 (en) | 2018-01-09 | 2022-08-09 | Shuttle Pharmaceuticals, Inc. | Selective histone deacetylase inhibitors for the treatment of human disease |
| EP3755311A4 (en) | 2018-02-22 | 2021-11-10 | ChemoCentryx, Inc. | USEFUL INDANE-AMINES AS AN AGONISTS OF PD-L1 |
| CN111788204B (zh) | 2018-02-26 | 2023-05-05 | 吉利德科学公司 | 作为hbv复制抑制剂的取代吡咯嗪化合物 |
| US20210030703A1 (en) | 2018-03-12 | 2021-02-04 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of caloric restriction mimetics for potentiating chemo-immunotherapy for the treatment of cancers |
| PE20211911A1 (es) | 2018-03-30 | 2021-09-28 | Incyte Corp | Compuestos heterociclicos como inmunomoduladores |
| WO2019195181A1 (en) | 2018-04-05 | 2019-10-10 | Gilead Sciences, Inc. | Antibodies and fragments thereof that bind hepatitis b virus protein x |
| TWI818007B (zh) | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| KR20200140867A (ko) | 2018-04-06 | 2020-12-16 | 인스티튜트 오브 오가닉 케미스트리 앤드 바이오케미스트리 에이에스 씨알 브이.브이.아이. | 3'3'-사이클릭 다이뉴클레오티드 |
| TW201945388A (zh) | 2018-04-12 | 2019-12-01 | 美商精密生物科學公司 | 對b型肝炎病毒基因體中之識別序列具有特異性之最佳化之經工程化巨核酸酶 |
| US20190359645A1 (en) | 2018-05-03 | 2019-11-28 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotides comprising carbocyclic nucleotide |
| JOP20200288A1 (ar) | 2018-05-11 | 2020-11-11 | Incyte Corp | مشتقات تترا هيدرو – إيميدازو[4، 5-c]بيريدين كمعدِّلات مناعية pd-l1 |
| WO2019232319A1 (en) | 2018-05-31 | 2019-12-05 | Peloton Therapeutics, Inc. | Compositions and methods for inhibiting cd73 |
| SG11202012446UA (en) | 2018-06-23 | 2021-01-28 | Genentech Inc | Methods of treating lung cancer with a pd-1 axis binding antagonist, a platinum agent, and a topoisomerase ii inhibitor |
| TW202011991A (zh) | 2018-07-18 | 2020-04-01 | 美商建南德克公司 | 用pd-1軸結合拮抗劑、抗代謝劑及鉑劑治療肺癌之方法 |
| KR102316234B1 (ko) | 2018-07-26 | 2021-10-22 | 주식회사 종근당 | 히스톤 탈아세틸화효소 6 억제제로서의 1,3,4-옥사다이아졸 유도체 화합물 및 이를 포함하는 약제학적 조성물 |
| WO2020028097A1 (en) | 2018-08-01 | 2020-02-06 | Gilead Sciences, Inc. | Solid forms of (r)-11-(methoxymethyl)-12-(3-methoxypropoxy)-3,3-dimethyl-8-0x0-2,3,8,13b-tetrahydro-1h-pyrido[2,1-a]pyrrolo[1,2-c] phthalazine-7-c arboxylic acid |
| TW202031273A (zh) | 2018-08-31 | 2020-09-01 | 美商艾歐凡斯生物治療公司 | 抗pd-1抗體難治療性之非小細胞肺癌(nsclc)病患的治療 |
| EP3847154A1 (en) | 2018-09-03 | 2021-07-14 | F. Hoffmann-La Roche AG | Carboxamide and sulfonamide derivatives useful as tead modulators |
| WO2020048942A1 (en) | 2018-09-04 | 2020-03-12 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for enhancing cytotoxic t lymphocyte-dependent immune responses |
| WO2020058372A1 (en) | 2018-09-19 | 2020-03-26 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical composition for the treatment of cancers resistant to immune checkpoint therapy |
| CN112930114B (zh) | 2018-09-20 | 2023-10-03 | 艾欧凡斯生物治疗公司 | 由冷冻保存的肿瘤样品扩增til |
| WO2020070053A1 (en) | 2018-10-01 | 2020-04-09 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of inhibitors of stress granule formation for targeting the regulation of immune responses |
| CN111057069B (zh) * | 2018-10-16 | 2024-01-26 | 武汉光谷通用名药物研究院有限公司 | 一种环状化合物、其应用及组合物 |
| CN111100086B (zh) * | 2018-10-25 | 2022-07-01 | 南京圣和药业股份有限公司 | 1,3,4-噁二唑-2-环丁基类化合物及其制备方法 |
| TW202024042A (zh) * | 2018-10-25 | 2020-07-01 | 大陸商南京聖和藥業股份有限公司 | 1,3,4-噁二唑-2-環丁基類化合物及其製備方法和應用 |
| WO2020092528A1 (en) | 2018-10-31 | 2020-05-07 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds having hpk1 inhibitory activity |
| MX2021005047A (es) | 2018-10-31 | 2021-09-08 | Gilead Sciences Inc | Compuestos de 6-azabenzimidazol sustituidos como inhibidores de hpk1. |
| JP2022513592A (ja) | 2018-11-02 | 2022-02-09 | シャンハイ マキシノベル ファーマシューティカルズ カンパニー リミテッド | ビフェニル系化合物、その中間体、製造方法、医薬組成物及び使用 |
| WO2020109355A1 (en) | 2018-11-28 | 2020-06-04 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and kit for assaying lytic potential of immune effector cells |
| US20220018835A1 (en) | 2018-12-07 | 2022-01-20 | INSERM (Institut National de la Santé et de la Recherche Médicale | Use of cd26 and cd39 as new phenotypic markers for assessing maturation of foxp3+ t cells and uses thereof for diagnostic purposes |
| US20220047556A1 (en) | 2018-12-17 | 2022-02-17 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of sulconazole as a furin inhibitor |
| BR112021013157A8 (pt) | 2019-01-03 | 2022-12-06 | Inst Nat Sante Rech Med | Usos de um inibidor de nrp-1, uso de uma combinação, uso de um anticorpo multiespecífico, método ex vivo para predizer, uso de um inibidor, anticorpo multiespecífico, população de células modificadas, método ex vivo de produção e uso de uma população de células t |
| JP2022518399A (ja) | 2019-01-14 | 2022-03-15 | ジェネンテック, インコーポレイテッド | Pd-1軸結合アンタゴニスト及びrnaワクチンを用いてがんを処置する方法 |
| SG11202107606VA (en) | 2019-01-15 | 2021-08-30 | Inst Nat Sante Rech Med | Mutated interleukin-34 (il-34) polypeptides and uses thereof in therapy |
| WO2020169472A2 (en) | 2019-02-18 | 2020-08-27 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods of inducing phenotypic changes in macrophages |
| CN113543851A (zh) | 2019-03-07 | 2021-10-22 | 捷克共和国有机化学与生物化学研究所 | 2’3’-环二核苷酸及其前药 |
| EP3935066A1 (en) | 2019-03-07 | 2022-01-12 | Institute of Organic Chemistry and Biochemistry ASCR, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| US11766447B2 (en) | 2019-03-07 | 2023-09-26 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3′3′-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| CN109824621A (zh) * | 2019-03-28 | 2019-05-31 | 中国药科大学 | 噁二唑类和噻二唑类化合物及其制备方法和用途 |
| WO2020201362A2 (en) | 2019-04-02 | 2020-10-08 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods of predicting and preventing cancer in patients having premalignant lesions |
| US20220160692A1 (en) | 2019-04-09 | 2022-05-26 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of sk2 inhibitors in combination with immune checkpoint blockade therapy for the treatment of cancer |
| WO2020212484A1 (en) | 2019-04-17 | 2020-10-22 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and compositions for treatment of nlrp3 inflammasome mediated il-1beta dependent disorders |
| TW202210480A (zh) | 2019-04-17 | 2022-03-16 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TWI751517B (zh) | 2019-04-17 | 2022-01-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| KR20220002967A (ko) | 2019-04-19 | 2022-01-07 | 제넨테크, 인크. | 항 mertk 항체 및 이의 사용 방법 |
| KR20220009420A (ko) | 2019-05-15 | 2022-01-24 | 케모센트릭스, 인크. | Pd-l1 질환의 치료를 위한 트리아릴 화합물 |
| EP3972695A1 (en) | 2019-05-23 | 2022-03-30 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| CA3141531A1 (en) | 2019-05-24 | 2020-12-03 | Pfizer Inc. | Combination therapies using cdk inhibitors |
| CA3143104A1 (en) | 2019-06-12 | 2020-12-17 | Technical University Of Denmark | Dissacharide formulations for controlled drug release |
| AU2020294781A1 (en) | 2019-06-20 | 2021-12-23 | Chemocentryx, Inc. | Compounds for treatment of PD-L1 diseases |
| CN114206338A (zh) | 2019-07-10 | 2022-03-18 | 凯莫森特里克斯股份有限公司 | 作为pd-l1抑制剂的二氢化茚类 |
| AR119624A1 (es) | 2019-08-09 | 2021-12-29 | Incyte Corp | Sales de un inhibidor de pd-1 / pd-l1 |
| EP4017476A1 (en) | 2019-08-19 | 2022-06-29 | Gilead Sciences, Inc. | Pharmaceutical formulations of tenofovir alafenamide |
| EP4037773A1 (en) | 2019-09-30 | 2022-08-10 | Incyte Corporation | Pyrido[3,2-d]pyrimidine compounds as immunomodulators |
| WO2021067181A1 (en) | 2019-09-30 | 2021-04-08 | Gilead Sciences, Inc. | Hbv vaccines and methods treating hbv |
| CA3151322A1 (en) | 2019-10-01 | 2021-04-08 | Silverback Therapeutics, Inc. | Combination therapy with immune stimulatory conjugates |
| EP3800201A1 (en) | 2019-10-01 | 2021-04-07 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Cd28h stimulation enhances nk cell killing activities |
| US20220363776A1 (en) | 2019-10-04 | 2022-11-17 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical composition for the treatment of ovarian cancer, breast cancer or pancreatic cancer |
| PE20221764A1 (es) | 2019-10-16 | 2022-11-11 | Chemocentryx Inc | Aminas de heteroaril-bifenilo para el tratamiento de enfermedades pd-l1 |
| CA3152329A1 (en) | 2019-10-16 | 2021-04-22 | Pingchen Fan | Heteroaryl-biphenyl amides for the treatment of pd-l1 diseases |
| KR20220101664A (ko) | 2019-11-11 | 2022-07-19 | 인사이트 코포레이션 | Pd-1/pd-l1 억제제의 염 및 결정질 형태 |
| TW202130618A (zh) | 2019-11-13 | 2021-08-16 | 美商建南德克公司 | 治療性化合物及使用方法 |
| US20230031465A1 (en) | 2019-12-06 | 2023-02-02 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| KR20220125278A (ko) | 2020-01-03 | 2022-09-14 | 상하이 한서 바이오메디컬 컴퍼니 리미티드 | 비페닐 유도체 억제제, 이의 제조 방법 및 용도 |
| BR112022012918A2 (pt) | 2020-01-07 | 2022-09-06 | Univ Texas | Variantes de enzima de exaustão de metiltioadenosina/adenosina humana melhorada para terapia do câncer |
| JP2023512654A (ja) | 2020-01-31 | 2023-03-28 | ジェネンテック, インコーポレイテッド | Pd-1軸結合アンタゴニストおよびrnaワクチンを用いてネオエピトープ特異的t細胞を誘導する方法 |
| JP2023518433A (ja) | 2020-03-20 | 2023-05-01 | ギリアード サイエンシーズ, インコーポレイテッド | 4’-c-置換-2-ハロ-2’-デオキシアデノシンヌクレオシドのプロドラッグ並びにその製造法及び使用法 |
| WO2021216920A1 (en) | 2020-04-22 | 2021-10-28 | Iovance Biotherapeutics, Inc. | Systems and methods for coordinating manufacturing of cells for patient-specific immunotherapy |
| KR20230042222A (ko) | 2020-05-26 | 2023-03-28 | 인쎄름 (엥스띠뛰 나씨오날 드 라 쌍떼 에 드 라 흐쉐르슈 메디깔) | 중증 급성 호흡기 증후군 코로나바이러스 2(sars-cov-2) 폴리펩티드 및 백신 목적을 위한 이의 용도 |
| US11787775B2 (en) | 2020-07-24 | 2023-10-17 | Genentech, Inc. | Therapeutic compounds and methods of use |
| WO2022052926A1 (zh) | 2020-09-09 | 2022-03-17 | 广州再极医药科技有限公司 | 芳香乙烯类化合物、其制备方法、中间体、药物组合物及其应用 |
| TW202233671A (zh) | 2020-10-20 | 2022-09-01 | 美商建南德克公司 | Peg結合抗mertk抗體及其使用方法 |
| AU2021369590A1 (en) | 2020-10-28 | 2023-06-22 | Ikena Oncology, Inc. | Combination of an ahr inhibitor with a pdx inhibitor or doxorubicine |
| WO2022093981A1 (en) | 2020-10-28 | 2022-05-05 | Genentech, Inc. | Combination therapy comprising ptpn22 inhibitors and pd-l1 binding antagonists |
| CA3195572A1 (en) | 2020-11-04 | 2022-05-12 | Heidelberg Pharma Research Gmbh | Composition comprising a combination of immune checkpoint inhibitor and antibody-amatoxin conjugate for use in cancer therapy |
| US11780836B2 (en) | 2020-11-06 | 2023-10-10 | Incyte Corporation | Process of preparing a PD-1/PD-L1 inhibitor |
| PE20231438A1 (es) | 2020-11-06 | 2023-09-14 | Incyte Corp | Proceso para hacer un inhibidor de pd-1/pd-l1 y sales y formas cristalinas del mismo |
| WO2022099075A1 (en) | 2020-11-06 | 2022-05-12 | Incyte Corporation | Crystalline form of a pd-1/pd-l1 inhibitor |
| WO2022101302A1 (en) | 2020-11-12 | 2022-05-19 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Antibodies conjugated or fused to the receptor-binding domain of the sars-cov-2 spike protein and uses thereof for vaccine purposes |
| WO2022101463A1 (en) | 2020-11-16 | 2022-05-19 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Use of the last c-terminal residues m31/41 of zikv m ectodomain for triggering apoptotic cell death |
| US20220168293A1 (en) | 2020-12-02 | 2022-06-02 | Pfizer Inc. | Time to resolution of axitinib-related adverse events |
| WO2022119830A1 (en) | 2020-12-02 | 2022-06-09 | Genentech, Inc. | Methods and compositions for neoadjuvant and adjuvant urothelial carcinoma therapy |
| KR20230159480A (ko) | 2021-03-19 | 2023-11-21 | 하이델베르크 파마 리서치 게엠베하 | B-림프구 특이적 아마톡신 항체 접합체 |
| EP4322938A1 (en) | 2021-04-14 | 2024-02-21 | Institut National de la Santé et de la Recherche Médicale (INSERM) | New method to improve nk cells cytotoxicity |
| JP2024516230A (ja) | 2021-04-30 | 2024-04-12 | ジェネンテック, インコーポレイテッド | がんのための治療及び診断方法並びに組成物 |
| WO2022241134A1 (en) | 2021-05-13 | 2022-11-17 | Gilead Sciences, Inc. | COMBINATION OF A TLR8 MODULATING COMPOUND AND ANTI-HBV siRNA THERAPEUTICS |
| EP4351564A1 (en) | 2021-06-11 | 2024-04-17 | Gilead Sciences, Inc. | Combination mcl-1 inhibitors with anti-cancer agents |
| AU2022290855A1 (en) | 2021-06-11 | 2023-12-07 | Gilead Sciences, Inc. | Combination mcl-1 inhibitors with anti-body drug conjugates |
| EP4359411A1 (en) | 2021-06-23 | 2024-05-01 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| IL309378A (en) | 2021-06-23 | 2024-02-01 | Gilead Sciences Inc | DIACYLGLYERCOL KINASE MODULATING COMPOUNDS |
| WO2022271684A1 (en) | 2021-06-23 | 2022-12-29 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| CN117396478A (zh) | 2021-06-23 | 2024-01-12 | 吉利德科学公司 | 二酰基甘油激酶调节化合物 |
| AU2022302170A1 (en) | 2021-07-02 | 2023-12-21 | F. Hoffmann-La Roche Ag | Methods and compositions for treating cancer |
| WO2023280790A1 (en) | 2021-07-05 | 2023-01-12 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Gene signatures for predicting survival time in patients suffering from renal cell carcinoma |
| WO2023010094A2 (en) | 2021-07-28 | 2023-02-02 | Genentech, Inc. | Methods and compositions for treating cancer |
| CA3224180A1 (en) | 2021-07-28 | 2023-02-02 | F. Hoffmann-La Roche Ag | Methods and compositions for treating cancer |
| TW202321308A (zh) | 2021-09-30 | 2023-06-01 | 美商建南德克公司 | 使用抗tigit抗體、抗cd38抗體及pd—1軸結合拮抗劑治療血液癌症的方法 |
| WO2023080900A1 (en) | 2021-11-05 | 2023-05-11 | Genentech, Inc. | Methods and compositions for classifying and treating kidney cancer |
| WO2023088968A1 (en) | 2021-11-17 | 2023-05-25 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Universal sarbecovirus vaccines |
| TW202332429A (zh) | 2021-11-24 | 2023-08-16 | 美商建南德克公司 | 治療性化合物及其使用方法 |
| WO2023097194A2 (en) | 2021-11-24 | 2023-06-01 | Genentech, Inc. | Therapeutic compounds and methods of use |
| WO2023191816A1 (en) | 2022-04-01 | 2023-10-05 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| WO2023219613A1 (en) | 2022-05-11 | 2023-11-16 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| EP4282435A1 (en) | 2022-05-23 | 2023-11-29 | Danmarks Tekniske Universitet | Formulations of active pharmaceutical ingredients and excipients in icells via hydrophobic ion pairing |
| EP4282448A1 (en) | 2022-05-23 | 2023-11-29 | Danmarks Tekniske Universitet | Porous expanding biocompatible scaffolds |
| WO2023240058A2 (en) | 2022-06-07 | 2023-12-14 | Genentech, Inc. | Prognostic and therapeutic methods for cancer |
| WO2024015897A1 (en) | 2022-07-13 | 2024-01-18 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| WO2024020432A1 (en) | 2022-07-19 | 2024-01-25 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| WO2024049949A1 (en) | 2022-09-01 | 2024-03-07 | Genentech, Inc. | Therapeutic and diagnostic methods for bladder cancer |
| WO2024052356A1 (en) | 2022-09-06 | 2024-03-14 | Institut National de la Santé et de la Recherche Médicale | Inhibitors of the ceramide metabolic pathway for overcoming immunotherapy resistance in cancer |
| WO2024077095A1 (en) | 2022-10-05 | 2024-04-11 | Genentech, Inc. | Methods and compositions for classifying and treating bladder cancer |
| WO2024077166A1 (en) | 2022-10-05 | 2024-04-11 | Genentech, Inc. | Methods and compositions for classifying and treating lung cancer |
Family Cites Families (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001014557A1 (en) | 1999-08-23 | 2001-03-01 | Dana-Farber Cancer Institute, Inc. | Pd-1, a receptor for b7-4, and uses therefor |
| EP2388590A1 (en) | 2001-04-02 | 2011-11-23 | Dana Farber Cancer Institute | PD-1, a receptor for B7-4, and uses thereof |
| AU2002258941A1 (en) | 2001-04-20 | 2002-11-05 | Mayo Foundation For Medical Education And Research | Methods of enhancing cell responsiveness |
| AU2002348394A1 (en) | 2001-10-25 | 2003-05-06 | Merck And Co., Inc. | Tyrosine kinase inhibitors |
| WO2003042402A2 (en) | 2001-11-13 | 2003-05-22 | Dana-Farber Cancer Institute, Inc. | Agents that modulate immune cell activation and methods of use thereof |
| DE10161767T1 (de) | 2002-07-03 | 2018-06-07 | Honjo Tasuku | Immunopotenzierende Zusammensetzungen, die einen Anti-PD-L1 Antikörper enthalten |
| US7521051B2 (en) | 2002-12-23 | 2009-04-21 | Medimmune Limited | Methods of upmodulating adaptive immune response using anti-PD-1 antibodies |
| AU2006244885B2 (en) | 2005-05-09 | 2011-03-31 | E. R. Squibb & Sons, L.L.C. | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| US20080021217A1 (en) | 2006-07-20 | 2008-01-24 | Allen Borchardt | Heterocyclic inhibitors of rho kinase |
| US20080242694A1 (en) | 2006-09-18 | 2008-10-02 | D Sidocky Neil R | Amino-substituted heterocycles, compositions thereof, and methods of treatment therewith |
| SI2170959T1 (sl) | 2007-06-18 | 2014-04-30 | Merck Sharp & Dohme B.V. | Protitelesa proti receptorjem pd-1 za humano programirano smrt |
| US20090264315A1 (en) * | 2007-07-26 | 2009-10-22 | Texas A&M University System | Dipeptide mimics, libraries combining two dipeptide mimics with a third group, and methods for production thereof |
| TW200940537A (en) | 2008-02-26 | 2009-10-01 | Astrazeneca Ab | Heterocyclic urea derivatives and methods of use thereof |
| US20130225527A1 (en) | 2008-05-21 | 2013-08-29 | Ariad Pharmaceuticals, Inc. | Phosphorus Derivatives as Kinase Inhibitors |
| CN114835812A (zh) | 2008-12-09 | 2022-08-02 | 霍夫曼-拉罗奇有限公司 | 抗-pd-l1抗体及它们用于增强t细胞功能的用途 |
| HUE037159T2 (hu) | 2009-11-24 | 2018-08-28 | Medimmune Ltd | Targetált kötõdõ ágensek B7-H1 ellen |
| US8907053B2 (en) * | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| CN103732238A (zh) * | 2011-06-08 | 2014-04-16 | 奥瑞基尼探索技术有限公司 | 用于免疫调节的治疗性化合物 |
| US9006230B2 (en) | 2011-08-30 | 2015-04-14 | Wockhardt Ltd. | 1,6-diazabicyclo [3,2,1] octan-7-one derivatives and their use in the treatment of bacterial infections |
| JP2015505850A (ja) | 2011-12-14 | 2015-02-26 | シアトル ジェネティックス, インコーポレイテッド | 新規な抗体薬物コンジュゲート(adc)およびそれらの使用 |
| US20140343017A1 (en) | 2012-01-25 | 2014-11-20 | Kabushiki Kaisha Yakult Honsha | Pyrrole compound |
| WO2013131018A1 (en) | 2012-03-02 | 2013-09-06 | Zalicus Pharmaceuticals Ltd. | Biaryl inhibitors of the sodium channel |
| EP2822957A1 (en) | 2012-03-07 | 2015-01-14 | Aurigene Discovery Technologies Limited | Peptidomimetic compounds as immunomodulators |
| JP2015512910A (ja) | 2012-03-29 | 2015-04-30 | オーリジーン ディスカバリー テクノロジーズ リミテッドAurigene Discovery Technologies Limited | ヒトpd1のbcループに由来する免疫調節性環状化合物 |
| EA201590197A1 (ru) | 2012-08-23 | 2015-07-30 | Алиос Биофарма, Инк. | Соединения для лечения парамиксовирусных вирусных инфекций |
| CN107892719B (zh) | 2012-10-04 | 2022-01-14 | 达纳-法伯癌症研究所公司 | 人单克隆抗-pd-l1抗体和使用方法 |
| EP2906684B8 (en) | 2012-10-10 | 2020-09-02 | Sangamo Therapeutics, Inc. | T cell modifying compounds and uses thereof |
| AR093984A1 (es) | 2012-12-21 | 2015-07-01 | Merck Sharp & Dohme | Anticuerpos que se unen a ligando 1 de muerte programada (pd-l1) humano |
| AU2014229283B2 (en) | 2013-03-14 | 2016-07-28 | Novartis Ag | 3-pyrimidin-4-yl-oxazolidin-2-ones as inhibitors of mutant IDH |
| EA029661B1 (ru) | 2013-09-06 | 2018-04-30 | Ауриген Дискавери Текнолоджиз Лимитед | Производные 1,3,4-оксадиазола и 1,3,4-тиадиазола в качестве иммуномодуляторов |
| PL3363790T3 (pl) * | 2013-09-06 | 2020-07-27 | Aurigene Discovery Technologies Limited | Pochodne 1,2,4-oksadiazolu jako immunomodulatory |
| CN112552401B (zh) | 2013-09-13 | 2023-08-25 | 广州百济神州生物制药有限公司 | 抗pd1抗体及其作为治疗剂与诊断剂的用途 |
| CA2979163A1 (en) | 2015-03-10 | 2016-09-15 | Aurigene Discovery Technologies Limited | 3-substituted 1,3,4-oxadiazole and thiadiazole compounds as immunomodulators |
| BR112017019306A2 (pt) | 2015-03-10 | 2018-05-08 | Aurigene Discovery Technologies Limited | compostos de 1,3,4-oxadiazol e tiadiazol como imunomoduladores |
| WO2016149160A1 (en) | 2015-03-15 | 2016-09-22 | Sunshine Lake Pharma Co., Ltd. | Substituted aminopyrimidine compounds and methods of use |
| WO2018051255A1 (en) | 2016-09-14 | 2018-03-22 | Aurigene Discovery Technologies Limited | Cyclic substituted-1,3,4-oxadiazole and thiadiazole compounds as immunomodulators |
-
2014
- 2014-09-05 EA EA201600234A patent/EA029661B1/ru not_active IP Right Cessation
- 2014-09-05 SG SG10201800508SA patent/SG10201800508SA/en unknown
- 2014-09-05 TR TR2018/11077T patent/TR201811077T4/tr unknown
- 2014-09-05 LT LTEP14842822.0T patent/LT3041828T/lt unknown
- 2014-09-05 EP EP14842822.0A patent/EP3041828B1/en active Active
- 2014-09-05 AU AU2014316684A patent/AU2014316684A1/en not_active Abandoned
- 2014-09-05 EP EP18173376.7A patent/EP3385257A1/en not_active Withdrawn
- 2014-09-05 SI SI201430833T patent/SI3041828T1/sl unknown
- 2014-09-05 PL PL14842822T patent/PL3041828T3/pl unknown
- 2014-09-05 US US14/916,290 patent/US20160194295A1/en not_active Abandoned
- 2014-09-05 KR KR1020167009155A patent/KR20160081898A/ko not_active Application Discontinuation
- 2014-09-05 CN CN201480057737.5A patent/CN105849092A/zh active Pending
- 2014-09-05 CA CA2922655A patent/CA2922655A1/en not_active Abandoned
- 2014-09-05 MX MX2016002971A patent/MX2016002971A/es unknown
- 2014-09-05 RS RS20180936A patent/RS57559B1/sr unknown
- 2014-09-05 HU HUE14842822A patent/HUE039014T2/hu unknown
- 2014-09-05 CU CUP2016000028A patent/CU24345B1/xx unknown
- 2014-09-05 ES ES14842822.0T patent/ES2682040T3/es active Active
- 2014-09-05 DK DK14842822.0T patent/DK3041828T3/en active
- 2014-09-05 PT PT14842822T patent/PT3041828T/pt unknown
- 2014-09-05 JP JP2016539663A patent/JP2016532711A/ja not_active Ceased
- 2014-09-05 WO PCT/IB2014/064281 patent/WO2015033301A1/en active Application Filing
- 2014-09-05 SG SG11201601679TA patent/SG11201601679TA/en unknown
-
2016
- 2016-02-28 IL IL244313A patent/IL244313A0/en unknown
- 2016-03-01 PH PH12016500405A patent/PH12016500405B1/en unknown
- 2016-10-18 US US15/296,292 patent/US9776978B2/en not_active Expired - Fee Related
-
2017
- 2017-10-02 US US15/722,194 patent/US10160736B2/en not_active Expired - Fee Related
-
2018
- 2018-08-02 HR HRP20181251TT patent/HRP20181251T1/hr unknown
- 2018-08-10 CY CY181100849T patent/CY1120769T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10160736B2 (en) | 1,3,4-oxadiazole and 1,3,4-thiadiazole derivatives as immunomodulators | |
| US11512060B2 (en) | 1,2,4-oxadiazole derivatives as immunomodulators | |
| US10106581B2 (en) | Cyclic peptidomimetic compounds as immunomodulators | |
| NZ718711B2 (en) | 1,2,4-oxadiazole derivatives as immunomodulators |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |