JP7220080B2 - ハンチントン病治療組成物及び方法 - Google Patents
ハンチントン病治療組成物及び方法 Download PDFInfo
- Publication number
- JP7220080B2 JP7220080B2 JP2018560628A JP2018560628A JP7220080B2 JP 7220080 B2 JP7220080 B2 JP 7220080B2 JP 2018560628 A JP2018560628 A JP 2018560628A JP 2018560628 A JP2018560628 A JP 2018560628A JP 7220080 B2 JP7220080 B2 JP 7220080B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- aav
- htt
- limiting example
- expression
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 208000023105 Huntington disease Diseases 0.000 title claims description 100
- 239000000203 mixture Substances 0.000 title claims description 100
- 238000000034 method Methods 0.000 title description 119
- 230000014509 gene expression Effects 0.000 claims description 365
- 108020004459 Small interfering RNA Proteins 0.000 claims description 305
- 108090000623 proteins and genes Proteins 0.000 claims description 303
- 102000004169 proteins and genes Human genes 0.000 claims description 273
- 108020004999 messenger RNA Proteins 0.000 claims description 263
- 150000007523 nucleic acids Chemical group 0.000 claims description 255
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 208
- 210000004027 cell Anatomy 0.000 claims description 198
- 125000003729 nucleotide group Chemical group 0.000 claims description 192
- 239000002773 nucleotide Substances 0.000 claims description 179
- 239000013598 vector Substances 0.000 claims description 166
- 102000040430 polynucleotide Human genes 0.000 claims description 114
- 108091033319 polynucleotide Proteins 0.000 claims description 114
- 239000002157 polynucleotide Substances 0.000 claims description 114
- 230000001105 regulatory effect Effects 0.000 claims description 106
- 101150043003 Htt gene Proteins 0.000 claims description 98
- 230000000692 anti-sense effect Effects 0.000 claims description 92
- 239000002245 particle Substances 0.000 claims description 80
- 230000003612 virological effect Effects 0.000 claims description 73
- 108091081021 Sense strand Proteins 0.000 claims description 49
- 210000002637 putamen Anatomy 0.000 claims description 42
- 210000000234 capsid Anatomy 0.000 claims description 39
- 210000002569 neuron Anatomy 0.000 claims description 39
- 210000003169 central nervous system Anatomy 0.000 claims description 38
- 230000002123 temporal effect Effects 0.000 claims description 32
- 210000001130 astrocyte Anatomy 0.000 claims description 30
- 239000007924 injection Substances 0.000 claims description 30
- 238000002347 injection Methods 0.000 claims description 30
- 239000008194 pharmaceutical composition Substances 0.000 claims description 29
- 239000002679 microRNA Substances 0.000 claims description 26
- 238000004519 manufacturing process Methods 0.000 claims description 25
- 241001655883 Adeno-associated virus - 1 Species 0.000 claims description 23
- 239000003795 chemical substances by application Substances 0.000 claims description 23
- 210000003618 cortical neuron Anatomy 0.000 claims description 19
- 102000039446 nucleic acids Human genes 0.000 claims description 19
- 108020004707 nucleic acids Proteins 0.000 claims description 19
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 17
- 230000002401 inhibitory effect Effects 0.000 claims description 14
- 241001634120 Adeno-associated virus - 5 Species 0.000 claims description 13
- 210000004962 mammalian cell Anatomy 0.000 claims description 13
- 239000003623 enhancer Substances 0.000 claims description 12
- 230000035772 mutation Effects 0.000 claims description 12
- 241000702421 Dependoparvovirus Species 0.000 claims description 11
- 230000004770 neurodegeneration Effects 0.000 claims description 10
- 108091007428 primary miRNA Proteins 0.000 claims description 10
- 210000004129 prosencephalon Anatomy 0.000 claims description 10
- 239000003814 drug Substances 0.000 claims description 9
- 208000024891 symptom Diseases 0.000 claims description 9
- 102100026031 Beta-glucuronidase Human genes 0.000 claims description 8
- 101000933465 Homo sapiens Beta-glucuronidase Proteins 0.000 claims description 8
- 210000003710 cerebral cortex Anatomy 0.000 claims description 8
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 8
- 238000011282 treatment Methods 0.000 claims description 8
- 101710193519 Glial fibrillary acidic protein Proteins 0.000 claims description 7
- 210000005046 glial fibrillary acidic protein Anatomy 0.000 claims description 7
- 108090000565 Capsid Proteins Proteins 0.000 claims description 6
- 230000003247 decreasing effect Effects 0.000 claims description 6
- 238000001990 intravenous administration Methods 0.000 claims description 6
- 102100023321 Ceruloplasmin Human genes 0.000 claims description 5
- 108010072388 Methyl-CpG-Binding Protein 2 Proteins 0.000 claims description 5
- 102000001435 Synapsin Human genes 0.000 claims description 5
- 108050009621 Synapsin Proteins 0.000 claims description 5
- 210000001259 mesencephalon Anatomy 0.000 claims description 5
- 208000010877 cognitive disease Diseases 0.000 claims description 4
- 210000001103 thalamus Anatomy 0.000 claims description 4
- 229940124597 therapeutic agent Drugs 0.000 claims description 4
- 206010022998 Irritability Diseases 0.000 claims description 3
- 239000004090 neuroprotective agent Substances 0.000 claims description 3
- 206010003591 Ataxia Diseases 0.000 claims description 2
- 206010006100 Bradykinesia Diseases 0.000 claims description 2
- 206010010947 Coordination abnormal Diseases 0.000 claims description 2
- 208000014094 Dystonic disease Diseases 0.000 claims description 2
- 208000006083 Hypokinesia Diseases 0.000 claims description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 claims description 2
- 230000007850 degeneration Effects 0.000 claims description 2
- 208000010118 dystonia Diseases 0.000 claims description 2
- 208000016290 incoordination Diseases 0.000 claims description 2
- 229910052744 lithium Inorganic materials 0.000 claims description 2
- 230000004580 weight loss Effects 0.000 claims description 2
- CVSVTCORWBXHQV-UHFFFAOYSA-N creatine Chemical compound NC(=[NH2+])N(C)CC([O-])=O CVSVTCORWBXHQV-UHFFFAOYSA-N 0.000 claims 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 claims 2
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 claims 2
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 claims 2
- 239000012896 selective serotonin reuptake inhibitor Substances 0.000 claims 2
- AHOUBRCZNHFOSL-YOEHRIQHSA-N (+)-Casbol Chemical compound C1=CC(F)=CC=C1[C@H]1[C@H](COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-YOEHRIQHSA-N 0.000 claims 1
- WSEQXVZVJXJVFP-HXUWFJFHSA-N (R)-citalopram Chemical compound C1([C@@]2(C3=CC=C(C=C3CO2)C#N)CCCN(C)C)=CC=C(F)C=C1 WSEQXVZVJXJVFP-HXUWFJFHSA-N 0.000 claims 1
- RTHCYVBBDHJXIQ-MRXNPFEDSA-N (R)-fluoxetine Chemical compound O([C@H](CCNC)C=1C=CC=CC=1)C1=CC=C(C(F)(F)F)C=C1 RTHCYVBBDHJXIQ-MRXNPFEDSA-N 0.000 claims 1
- BGRJTUBHPOOWDU-NSHDSACASA-N (S)-(-)-sulpiride Chemical compound CCN1CCC[C@H]1CNC(=O)C1=CC(S(N)(=O)=O)=CC=C1OC BGRJTUBHPOOWDU-NSHDSACASA-N 0.000 claims 1
- 208000019901 Anxiety disease Diseases 0.000 claims 1
- 206010002942 Apathy Diseases 0.000 claims 1
- CEUORZQYGODEFX-UHFFFAOYSA-N Aripirazole Chemical compound ClC1=CC=CC(N2CCN(CCCCOC=3C=C4NC(=O)CCC4=CC=3)CC2)=C1Cl CEUORZQYGODEFX-UHFFFAOYSA-N 0.000 claims 1
- KPYSYYIEGFHWSV-UHFFFAOYSA-N Baclofen Chemical compound OC(=O)CC(CN)C1=CC=C(Cl)C=C1 KPYSYYIEGFHWSV-UHFFFAOYSA-N 0.000 claims 1
- 108030001720 Bontoxilysin Proteins 0.000 claims 1
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 claims 1
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 claims 1
- 208000028698 Cognitive impairment Diseases 0.000 claims 1
- 208000019505 Deglutition disease Diseases 0.000 claims 1
- 206010012239 Delusion Diseases 0.000 claims 1
- 206010013142 Disinhibition Diseases 0.000 claims 1
- 206010013887 Dysarthria Diseases 0.000 claims 1
- 208000012661 Dyskinesia Diseases 0.000 claims 1
- 241001539473 Euphoria Species 0.000 claims 1
- 206010015535 Euphoric mood Diseases 0.000 claims 1
- 206010017577 Gait disturbance Diseases 0.000 claims 1
- 108091010837 Glial cell line-derived neurotrophic factor Proteins 0.000 claims 1
- 102000034615 Glial cell line-derived neurotrophic factor Human genes 0.000 claims 1
- 102100039289 Glial fibrillary acidic protein Human genes 0.000 claims 1
- 208000004547 Hallucinations Diseases 0.000 claims 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 claims 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 claims 1
- 208000015592 Involuntary movements Diseases 0.000 claims 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 claims 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 claims 1
- XNSAINXGIQZQOO-UHFFFAOYSA-N L-pyroglutamyl-L-histidyl-L-proline amide Natural products NC(=O)C1CCCN1C(=O)C(NC(=O)C1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-UHFFFAOYSA-N 0.000 claims 1
- 102000006890 Methyl-CpG-Binding Protein 2 Human genes 0.000 claims 1
- 208000011644 Neurologic Gait disease Diseases 0.000 claims 1
- AHOUBRCZNHFOSL-UHFFFAOYSA-N Paroxetine hydrochloride Natural products C1=CC(F)=CC=C1C1C(COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-UHFFFAOYSA-N 0.000 claims 1
- 102100032251 Pro-thyrotropin-releasing hormone Human genes 0.000 claims 1
- 206010065954 Stubbornness Diseases 0.000 claims 1
- 206010042458 Suicidal ideation Diseases 0.000 claims 1
- 239000000627 Thyrotropin-Releasing Hormone Substances 0.000 claims 1
- 101800004623 Thyrotropin-releasing hormone Proteins 0.000 claims 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 claims 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 claims 1
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 claims 1
- 229960004373 acetylcholine Drugs 0.000 claims 1
- 230000016571 aggressive behavior Effects 0.000 claims 1
- 229940125681 anticonvulsant agent Drugs 0.000 claims 1
- 239000001961 anticonvulsive agent Substances 0.000 claims 1
- 230000036506 anxiety Effects 0.000 claims 1
- 229960004372 aripiprazole Drugs 0.000 claims 1
- 239000003693 atypical antipsychotic agent Substances 0.000 claims 1
- 229960000794 baclofen Drugs 0.000 claims 1
- 229940049706 benzodiazepine Drugs 0.000 claims 1
- 150000001557 benzodiazepines Chemical class 0.000 claims 1
- 229940053031 botulinum toxin Drugs 0.000 claims 1
- 229960001653 citalopram Drugs 0.000 claims 1
- DGBIGWXXNGSACT-UHFFFAOYSA-N clonazepam Chemical compound C12=CC([N+](=O)[O-])=CC=C2NC(=O)CN=C1C1=CC=CC=C1Cl DGBIGWXXNGSACT-UHFFFAOYSA-N 0.000 claims 1
- 229960003120 clonazepam Drugs 0.000 claims 1
- 229960004170 clozapine Drugs 0.000 claims 1
- QZUDBNBUXVUHMW-UHFFFAOYSA-N clozapine Chemical compound C1CN(C)CCN1C1=NC2=CC(Cl)=CC=C2NC2=CC=CC=C12 QZUDBNBUXVUHMW-UHFFFAOYSA-N 0.000 claims 1
- 229960003624 creatine Drugs 0.000 claims 1
- 239000006046 creatine Substances 0.000 claims 1
- 231100000868 delusion Toxicity 0.000 claims 1
- 230000000779 depleting effect Effects 0.000 claims 1
- NIJJYAXOARWZEE-UHFFFAOYSA-N di-n-propyl-acetic acid Natural products CCCC(C(O)=O)CCC NIJJYAXOARWZEE-UHFFFAOYSA-N 0.000 claims 1
- 229960003638 dopamine Drugs 0.000 claims 1
- 229960002464 fluoxetine Drugs 0.000 claims 1
- 229960003878 haloperidol Drugs 0.000 claims 1
- 208000013403 hyperactivity Diseases 0.000 claims 1
- 239000003112 inhibitor Substances 0.000 claims 1
- 229960004002 levetiracetam Drugs 0.000 claims 1
- HPHUVLMMVZITSG-ZCFIWIBFSA-N levetiracetam Chemical compound CC[C@H](C(N)=O)N1CCCC1=O HPHUVLMMVZITSG-ZCFIWIBFSA-N 0.000 claims 1
- 229960004502 levodopa Drugs 0.000 claims 1
- 229960001078 lithium Drugs 0.000 claims 1
- 229960001785 mirtazapine Drugs 0.000 claims 1
- RONZAEMNMFQXRA-UHFFFAOYSA-N mirtazapine Chemical compound C1C2=CC=CN=C2N2CCN(C)CC2C2=CC=CC=C21 RONZAEMNMFQXRA-UHFFFAOYSA-N 0.000 claims 1
- 239000004050 mood stabilizer Substances 0.000 claims 1
- 229940127237 mood stabilizer Drugs 0.000 claims 1
- 230000017311 musculoskeletal movement, spinal reflex action Effects 0.000 claims 1
- 239000003158 myorelaxant agent Substances 0.000 claims 1
- 210000000715 neuromuscular junction Anatomy 0.000 claims 1
- 229960005017 olanzapine Drugs 0.000 claims 1
- KVWDHTXUZHCGIO-UHFFFAOYSA-N olanzapine Chemical compound C1CN(C)CCN1C1=NC2=CC=CC=C2NC2=C1C=C(C)S2 KVWDHTXUZHCGIO-UHFFFAOYSA-N 0.000 claims 1
- 229960002296 paroxetine Drugs 0.000 claims 1
- 230000002265 prevention Effects 0.000 claims 1
- XNSAINXGIQZQOO-SRVKXCTJSA-N protirelin Chemical compound NC(=O)[C@@H]1CCCN1C(=O)[C@@H](NC(=O)[C@H]1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-SRVKXCTJSA-N 0.000 claims 1
- 229960004431 quetiapine Drugs 0.000 claims 1
- URKOMYMAXPYINW-UHFFFAOYSA-N quetiapine Chemical compound C1CN(CCOCCO)CCN1C1=NC2=CC=CC=C2SC2=CC=CC=C12 URKOMYMAXPYINW-UHFFFAOYSA-N 0.000 claims 1
- 229960001534 risperidone Drugs 0.000 claims 1
- RAPZEAPATHNIPO-UHFFFAOYSA-N risperidone Chemical compound FC1=CC=C2C(C3CCN(CC3)CCC=3C(=O)N4CCCCC4=NC=3C)=NOC2=C1 RAPZEAPATHNIPO-UHFFFAOYSA-N 0.000 claims 1
- 229960002073 sertraline Drugs 0.000 claims 1
- VGKDLMBJGBXTGI-SJCJKPOMSA-N sertraline Chemical compound C1([C@@H]2CC[C@@H](C3=CC=CC=C32)NC)=CC=C(Cl)C(Cl)=C1 VGKDLMBJGBXTGI-SJCJKPOMSA-N 0.000 claims 1
- 229940125706 skeletal muscle relaxant agent Drugs 0.000 claims 1
- 208000026473 slurred speech Diseases 0.000 claims 1
- 229940084026 sodium valproate Drugs 0.000 claims 1
- AEQFSUDEHCCHBT-UHFFFAOYSA-M sodium valproate Chemical compound [Na+].CCCC(C([O-])=O)CCC AEQFSUDEHCCHBT-UHFFFAOYSA-M 0.000 claims 1
- 230000003238 somatosensory effect Effects 0.000 claims 1
- 229960004940 sulpiride Drugs 0.000 claims 1
- 229940034199 thyrotropin-releasing hormone Drugs 0.000 claims 1
- 229960000488 tizanidine Drugs 0.000 claims 1
- XFYDIVBRZNQMJC-UHFFFAOYSA-N tizanidine Chemical compound ClC=1C=CC2=NSN=C2C=1NC1=NCCN1 XFYDIVBRZNQMJC-UHFFFAOYSA-N 0.000 claims 1
- 208000016261 weight loss Diseases 0.000 claims 1
- WJJYZXPHLSLMGE-UHFFFAOYSA-N xaliproden Chemical compound FC(F)(F)C1=CC=CC(C=2CCN(CCC=3C=C4C=CC=CC4=CC=3)CC=2)=C1 WJJYZXPHLSLMGE-UHFFFAOYSA-N 0.000 claims 1
- 229960004664 xaliproden Drugs 0.000 claims 1
- 229960001475 zolpidem Drugs 0.000 claims 1
- ZAFYATHCZYHLPB-UHFFFAOYSA-N zolpidem Chemical compound N1=C2C=CC(C)=CN2C(CC(=O)N(C)C)=C1C1=CC=C(C)C=C1 ZAFYATHCZYHLPB-UHFFFAOYSA-N 0.000 claims 1
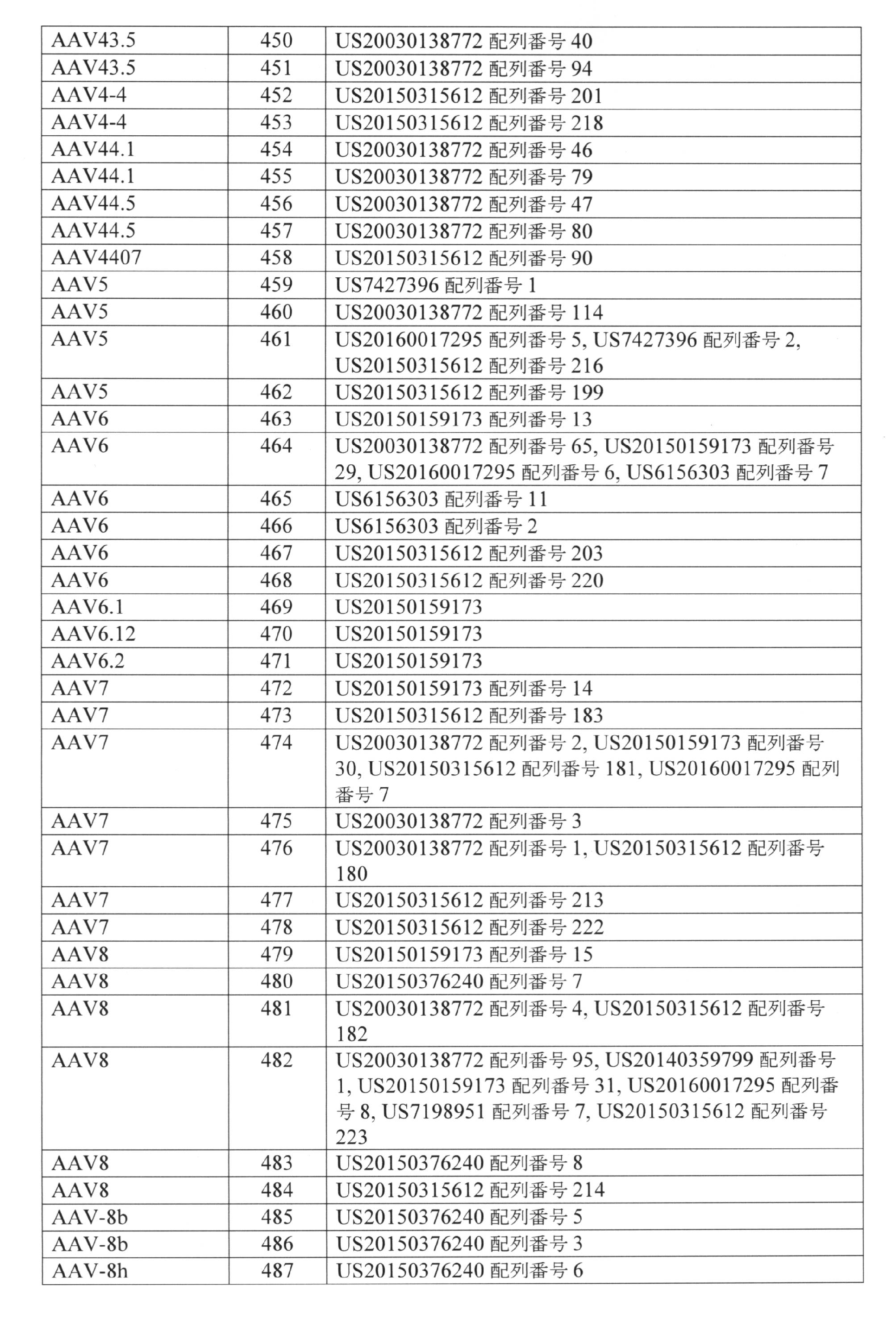
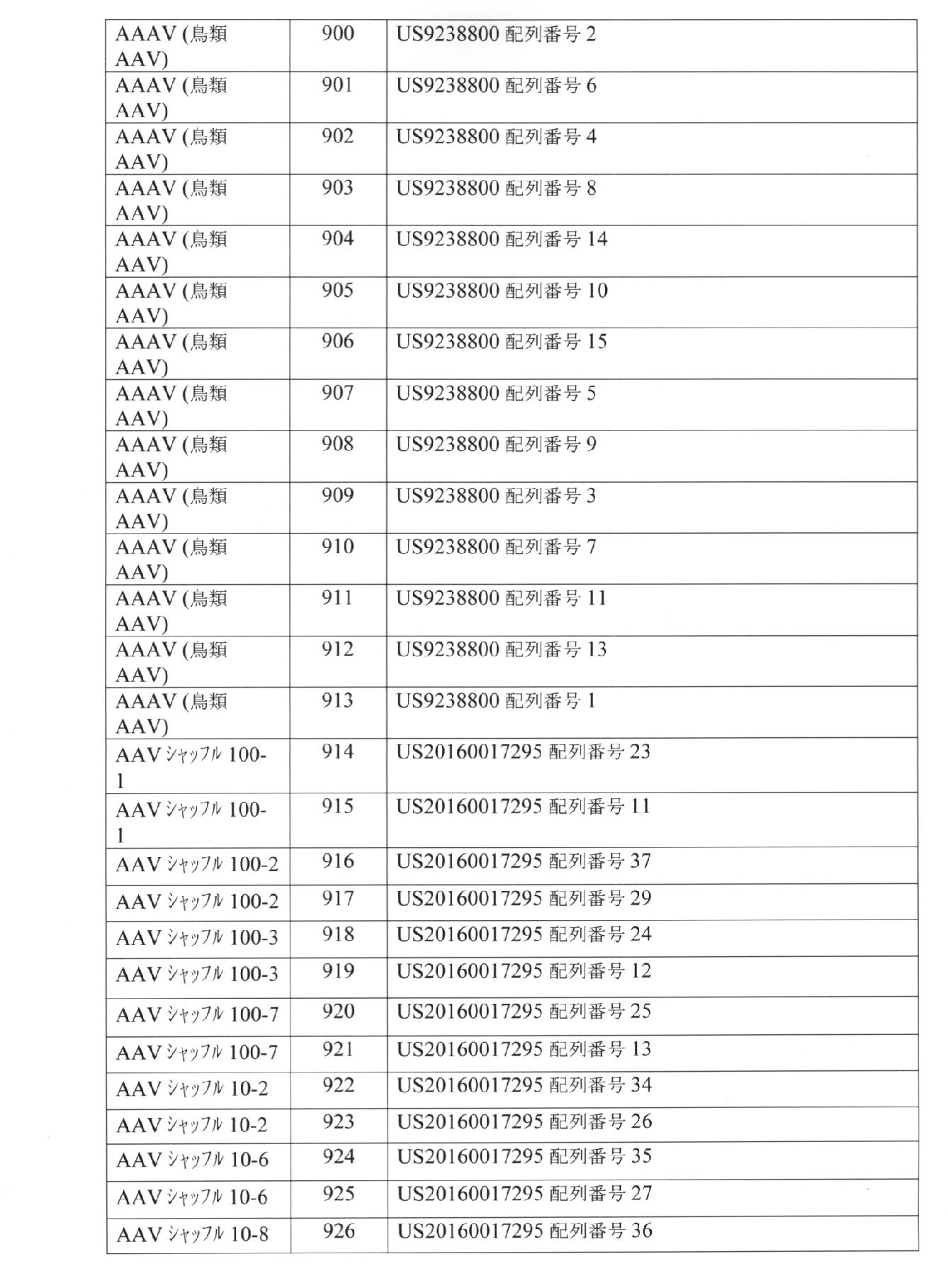
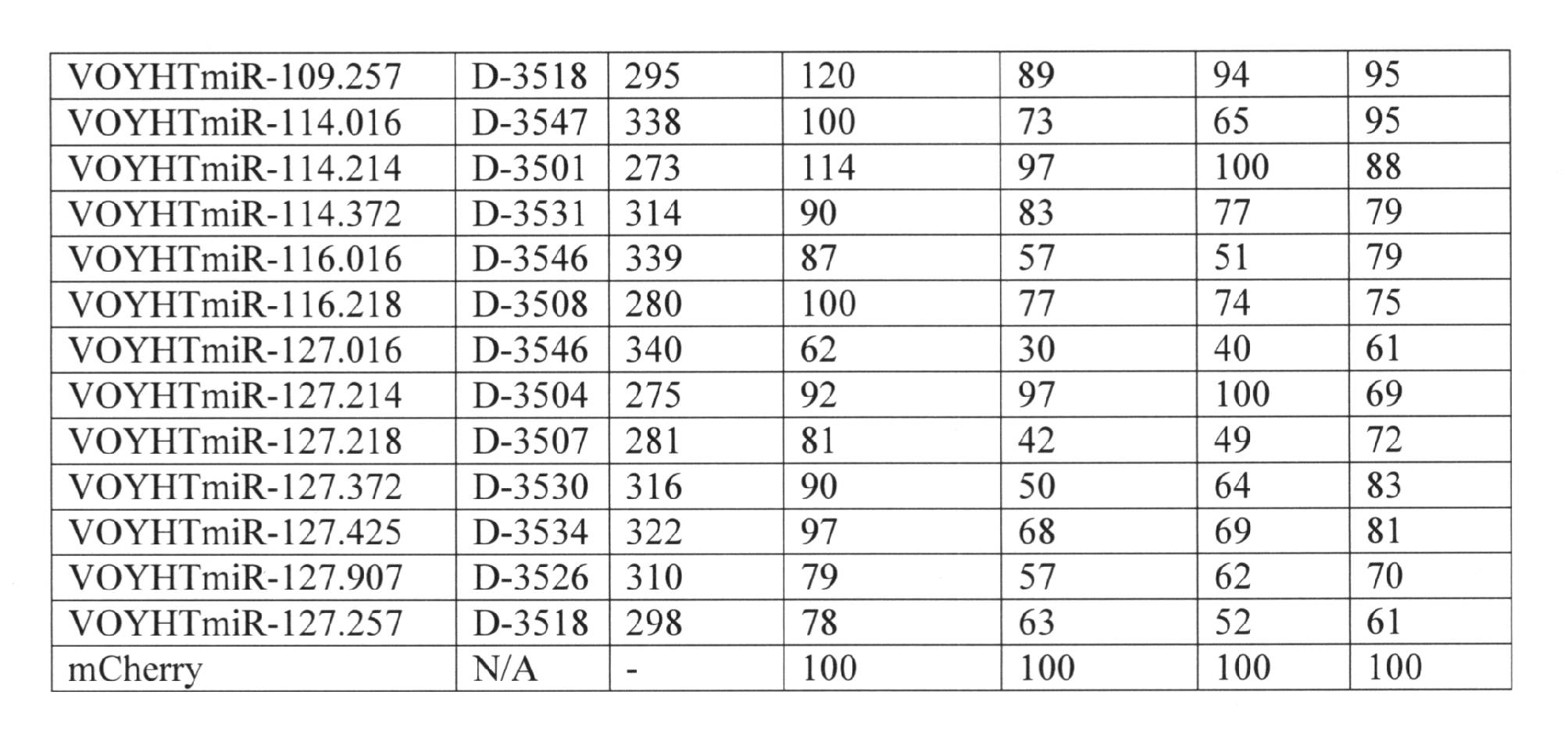
- 230000000670 limiting effect Effects 0.000 description 361
- 239000004055 small Interfering RNA Substances 0.000 description 300
- 230000002829 reductive effect Effects 0.000 description 216
- 239000013607 AAV vector Substances 0.000 description 135
- 239000002062 molecular scaffold Substances 0.000 description 116
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 88
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 66
- 210000001577 neostriatum Anatomy 0.000 description 51
- 230000008685 targeting Effects 0.000 description 48
- 108020005029 5' Flanking Region Proteins 0.000 description 45
- 239000013604 expression vector Substances 0.000 description 45
- 230000008488 polyadenylation Effects 0.000 description 36
- 241000700605 Viruses Species 0.000 description 31
- 210000000337 motor cortex Anatomy 0.000 description 31
- 210000004092 somatosensory cortex Anatomy 0.000 description 31
- 230000009089 cytolysis Effects 0.000 description 29
- 230000000694 effects Effects 0.000 description 29
- 230000005764 inhibitory process Effects 0.000 description 29
- 239000013603 viral vector Substances 0.000 description 29
- 108020005065 3' Flanking Region Proteins 0.000 description 28
- 150000001413 amino acids Chemical group 0.000 description 28
- 238000003197 gene knockdown Methods 0.000 description 28
- 238000000338 in vitro Methods 0.000 description 28
- 241000701022 Cytomegalovirus Species 0.000 description 27
- -1 e.g. Proteins 0.000 description 25
- 239000002609 medium Substances 0.000 description 24
- 229940024606 amino acid Drugs 0.000 description 23
- 239000000243 solution Substances 0.000 description 23
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 21
- 238000009472 formulation Methods 0.000 description 21
- 238000001727 in vivo Methods 0.000 description 21
- 210000001519 tissue Anatomy 0.000 description 21
- 230000000295 complement effect Effects 0.000 description 20
- 241000701447 unidentified baculovirus Species 0.000 description 18
- 241000282414 Homo sapiens Species 0.000 description 17
- 239000013592 cell lysate Substances 0.000 description 17
- 201000010099 disease Diseases 0.000 description 17
- 150000003839 salts Chemical class 0.000 description 17
- 150000001875 compounds Chemical class 0.000 description 16
- 230000009467 reduction Effects 0.000 description 16
- 241001164825 Adeno-associated virus - 8 Species 0.000 description 15
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 15
- 238000005352 clarification Methods 0.000 description 15
- 241000972680 Adeno-associated virus - 6 Species 0.000 description 14
- 239000002585 base Substances 0.000 description 14
- 210000004556 brain Anatomy 0.000 description 14
- 238000004113 cell culture Methods 0.000 description 14
- 230000006037 cell lysis Effects 0.000 description 14
- 230000030279 gene silencing Effects 0.000 description 14
- 230000009368 gene silencing by RNA Effects 0.000 description 14
- 230000004048 modification Effects 0.000 description 14
- 238000012986 modification Methods 0.000 description 14
- 238000012545 processing Methods 0.000 description 14
- 239000002904 solvent Substances 0.000 description 14
- 238000011144 upstream manufacturing Methods 0.000 description 14
- 241000580270 Adeno-associated virus - 4 Species 0.000 description 13
- 239000004480 active ingredient Substances 0.000 description 13
- 230000001965 increasing effect Effects 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- 235000000346 sugar Nutrition 0.000 description 13
- 241000649045 Adeno-associated virus 10 Species 0.000 description 12
- 102100037935 Polyubiquitin-C Human genes 0.000 description 12
- 108010056354 Ubiquitin C Proteins 0.000 description 12
- 238000001415 gene therapy Methods 0.000 description 12
- 108020004414 DNA Proteins 0.000 description 11
- 108700011259 MicroRNAs Proteins 0.000 description 11
- 102000012288 Phosphopyruvate Hydratase Human genes 0.000 description 11
- 108010022181 Phosphopyruvate Hydratase Proteins 0.000 description 11
- 239000012634 fragment Substances 0.000 description 11
- 108091070501 miRNA Proteins 0.000 description 11
- 230000008569 process Effects 0.000 description 11
- 108090000765 processed proteins & peptides Proteins 0.000 description 11
- 241001164823 Adeno-associated virus - 7 Species 0.000 description 10
- 239000004475 Arginine Substances 0.000 description 10
- 241000238631 Hexapoda Species 0.000 description 10
- 210000001744 T-lymphocyte Anatomy 0.000 description 10
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 10
- 238000001914 filtration Methods 0.000 description 10
- 208000015181 infectious disease Diseases 0.000 description 10
- 102000004196 processed proteins & peptides Human genes 0.000 description 10
- 230000010076 replication Effects 0.000 description 10
- 125000006850 spacer group Chemical group 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- 230000014616 translation Effects 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 241000202702 Adeno-associated virus - 3 Species 0.000 description 9
- 230000001413 cellular effect Effects 0.000 description 9
- 238000009826 distribution Methods 0.000 description 9
- 238000007913 intrathecal administration Methods 0.000 description 9
- 239000000463 material Substances 0.000 description 9
- 238000001890 transfection Methods 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- 241000649046 Adeno-associated virus 11 Species 0.000 description 8
- 241000649047 Adeno-associated virus 12 Species 0.000 description 8
- 101001111338 Homo sapiens Neurofilament heavy polypeptide Proteins 0.000 description 8
- 102100024007 Neurofilament heavy polypeptide Human genes 0.000 description 8
- 108700019146 Transgenes Proteins 0.000 description 8
- 238000004587 chromatography analysis Methods 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 241000894007 species Species 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- 108700028369 Alleles Proteins 0.000 description 7
- 108091092195 Intron Proteins 0.000 description 7
- 102100023057 Neurofilament light polypeptide Human genes 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 238000004115 adherent culture Methods 0.000 description 7
- 238000003776 cleavage reaction Methods 0.000 description 7
- 238000013461 design Methods 0.000 description 7
- 230000002934 lysing effect Effects 0.000 description 7
- 230000001404 mediated effect Effects 0.000 description 7
- 108010040003 polyglutamine Proteins 0.000 description 7
- 230000003362 replicative effect Effects 0.000 description 7
- 230000007017 scission Effects 0.000 description 7
- 238000001542 size-exclusion chromatography Methods 0.000 description 7
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical group C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- 108700024394 Exon Proteins 0.000 description 6
- 102000053171 Glial Fibrillary Acidic Human genes 0.000 description 6
- 241000282412 Homo Species 0.000 description 6
- 101000979333 Homo sapiens Neurofilament light polypeptide Proteins 0.000 description 6
- 102100037850 Interferon gamma Human genes 0.000 description 6
- 108010074328 Interferon-gamma Proteins 0.000 description 6
- 206010029350 Neurotoxicity Diseases 0.000 description 6
- 206010044221 Toxic encephalopathy Diseases 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- 125000002091 cationic group Chemical group 0.000 description 6
- 150000001768 cations Chemical class 0.000 description 6
- 210000000170 cell membrane Anatomy 0.000 description 6
- 238000005119 centrifugation Methods 0.000 description 6
- 230000001054 cortical effect Effects 0.000 description 6
- 239000002577 cryoprotective agent Substances 0.000 description 6
- 239000006166 lysate Substances 0.000 description 6
- 239000002105 nanoparticle Substances 0.000 description 6
- 230000007135 neurotoxicity Effects 0.000 description 6
- 231100000228 neurotoxicity Toxicity 0.000 description 6
- 238000004806 packaging method and process Methods 0.000 description 6
- 229920000155 polyglutamine Polymers 0.000 description 6
- 239000011148 porous material Substances 0.000 description 6
- 210000004988 splenocyte Anatomy 0.000 description 6
- 108020003589 5' Untranslated Regions Proteins 0.000 description 5
- 241000125945 Protoparvovirus Species 0.000 description 5
- 102000000574 RNA-Induced Silencing Complex Human genes 0.000 description 5
- 108010016790 RNA-Induced Silencing Complex Proteins 0.000 description 5
- 230000001464 adherent effect Effects 0.000 description 5
- 210000001508 eye Anatomy 0.000 description 5
- 239000004615 ingredient Substances 0.000 description 5
- 230000000977 initiatory effect Effects 0.000 description 5
- 238000000185 intracerebroventricular administration Methods 0.000 description 5
- 239000002563 ionic surfactant Substances 0.000 description 5
- 238000010172 mouse model Methods 0.000 description 5
- 230000001537 neural effect Effects 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 238000011084 recovery Methods 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 210000000278 spinal cord Anatomy 0.000 description 5
- 239000004094 surface-active agent Substances 0.000 description 5
- 230000004083 survival effect Effects 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 238000010257 thawing Methods 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- 231100000331 toxic Toxicity 0.000 description 5
- 230000002588 toxic effect Effects 0.000 description 5
- 238000010361 transduction Methods 0.000 description 5
- 230000026683 transduction Effects 0.000 description 5
- 230000010415 tropism Effects 0.000 description 5
- 101710132601 Capsid protein Proteins 0.000 description 4
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 4
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 4
- 102100039124 Methyl-CpG-binding protein 2 Human genes 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 4
- 229920002873 Polyethylenimine Polymers 0.000 description 4
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 4
- 239000004473 Threonine Substances 0.000 description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000001506 calcium phosphate Substances 0.000 description 4
- 230000015556 catabolic process Effects 0.000 description 4
- 238000002648 combination therapy Methods 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- 238000006731 degradation reaction Methods 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 238000012226 gene silencing method Methods 0.000 description 4
- 102000018146 globin Human genes 0.000 description 4
- 108060003196 globin Proteins 0.000 description 4
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 4
- 239000005414 inactive ingredient Substances 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 238000004255 ion exchange chromatography Methods 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- 230000002101 lytic effect Effects 0.000 description 4
- 229910052751 metal Inorganic materials 0.000 description 4
- 239000002184 metal Substances 0.000 description 4
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 4
- 230000009437 off-target effect Effects 0.000 description 4
- 210000004248 oligodendroglia Anatomy 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- 230000002459 sustained effect Effects 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- 238000003151 transfection method Methods 0.000 description 4
- 241000701161 unidentified adenovirus Species 0.000 description 4
- 230000029812 viral genome replication Effects 0.000 description 4
- 210000002845 virion Anatomy 0.000 description 4
- 241000958487 Adeno-associated virus 3B Species 0.000 description 3
- 241000271566 Aves Species 0.000 description 3
- 241000283707 Capra Species 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- 206010008748 Chorea Diseases 0.000 description 3
- 102100023387 Endoribonuclease Dicer Human genes 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102100021519 Hemoglobin subunit beta Human genes 0.000 description 3
- 108091005904 Hemoglobin subunit beta Proteins 0.000 description 3
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 3
- 101000907904 Homo sapiens Endoribonuclease Dicer Proteins 0.000 description 3
- 101150090950 Hsc70-1 gene Proteins 0.000 description 3
- 102000016252 Huntingtin Human genes 0.000 description 3
- 108050004784 Huntingtin Proteins 0.000 description 3
- 108060001084 Luciferase Proteins 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 108091033773 MiR-155 Proteins 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 101100150366 Schizosaccharomyces pombe (strain 972 / ATCC 24843) sks2 gene Proteins 0.000 description 3
- 108091027967 Small hairpin RNA Proteins 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 230000002159 abnormal effect Effects 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 230000008335 axon cargo transport Effects 0.000 description 3
- 230000008499 blood brain barrier function Effects 0.000 description 3
- 210000001218 blood-brain barrier Anatomy 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 229910000389 calcium phosphate Inorganic materials 0.000 description 3
- 235000011010 calcium phosphates Nutrition 0.000 description 3
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 3
- 208000012601 choreatic disease Diseases 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 239000002532 enzyme inhibitor Substances 0.000 description 3
- 210000002950 fibroblast Anatomy 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 3
- 229960002897 heparin Drugs 0.000 description 3
- 229920000669 heparin Polymers 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000006193 liquid solution Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 239000002736 nonionic surfactant Substances 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 3
- 239000013600 plasmid vector Substances 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 238000005215 recombination Methods 0.000 description 3
- 230000001177 retroviral effect Effects 0.000 description 3
- 239000012453 solvate Substances 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- 210000004885 white matter Anatomy 0.000 description 3
- CYSGHNMQYZDMIA-UHFFFAOYSA-N 1,3-Dimethyl-2-imidazolidinon Chemical compound CN1CCN(C)C1=O CYSGHNMQYZDMIA-UHFFFAOYSA-N 0.000 description 2
- UMCMPZBLKLEWAF-BCTGSCMUSA-N 3-[(3-cholamidopropyl)dimethylammonio]propane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CCCS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 UMCMPZBLKLEWAF-BCTGSCMUSA-N 0.000 description 2
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 206010001541 Akinesia Diseases 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 2
- 241000272517 Anseriformes Species 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 206010003497 Asphyxia Diseases 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 108091032955 Bacterial small RNA Proteins 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 208000024806 Brain atrophy Diseases 0.000 description 2
- 101100495845 Caenorhabditis elegans cht-1 gene Proteins 0.000 description 2
- 101100495842 Caenorhabditis elegans cht-3 gene Proteins 0.000 description 2
- 101100441244 Caenorhabditis elegans csp-1 gene Proteins 0.000 description 2
- 101100222092 Caenorhabditis elegans csp-3 gene Proteins 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 2
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 102100035426 DnaJ homolog subfamily B member 7 Human genes 0.000 description 2
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 2
- 101100178718 Drosophila melanogaster Hsc70-4 gene Proteins 0.000 description 2
- 101100178723 Drosophila melanogaster Hsc70-5 gene Proteins 0.000 description 2
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 2
- 102100031562 Excitatory amino acid transporter 2 Human genes 0.000 description 2
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 108091022930 Glutamate decarboxylase Proteins 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 2
- 101000804114 Homo sapiens DnaJ homolog subfamily B member 7 Proteins 0.000 description 2
- 101000866287 Homo sapiens Excitatory amino acid transporter 2 Proteins 0.000 description 2
- 229920001612 Hydroxyethyl starch Polymers 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 206010061533 Myotonia Diseases 0.000 description 2
- BVIAOQMSVZHOJM-UHFFFAOYSA-N N(6),N(6)-dimethyladenine Chemical compound CN(C)C1=NC=NC2=C1N=CN2 BVIAOQMSVZHOJM-UHFFFAOYSA-N 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- 239000002033 PVDF binder Substances 0.000 description 2
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 2
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 241000710179 Potato virus S Species 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 2
- 241000256251 Spodoptera frugiperda Species 0.000 description 2
- 101710172711 Structural protein Proteins 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 2
- 108091093126 WHP Posttrascriptional Response Element Proteins 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 239000003513 alkali Substances 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 210000004102 animal cell Anatomy 0.000 description 2
- 238000005571 anion exchange chromatography Methods 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 108010068380 arginylarginine Proteins 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 210000004227 basal ganglia Anatomy 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 229940077388 benzenesulfonate Drugs 0.000 description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- 238000007622 bioinformatic analysis Methods 0.000 description 2
- 102220408030 c.1336T>C Human genes 0.000 description 2
- 102200042638 c.1358G>A Human genes 0.000 description 2
- 102220360166 c.1445C>T Human genes 0.000 description 2
- 102220346620 c.1720A>T Human genes 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000005277 cation exchange chromatography Methods 0.000 description 2
- 230000022131 cell cycle Effects 0.000 description 2
- 230000004700 cellular uptake Effects 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical group C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 210000003703 cisterna magna Anatomy 0.000 description 2
- 210000000795 conjunctiva Anatomy 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000002716 delivery method Methods 0.000 description 2
- 239000000412 dendrimer Substances 0.000 description 2
- 229920000736 dendritic polymer Polymers 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- GUVUOGQBMYCBQP-UHFFFAOYSA-N dmpu Chemical compound CN1CCCN(C)C1=O GUVUOGQBMYCBQP-UHFFFAOYSA-N 0.000 description 2
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 2
- 229940043264 dodecyl sulfate Drugs 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 102000054767 gene variant Human genes 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000000122 growth hormone Substances 0.000 description 2
- 210000002216 heart Anatomy 0.000 description 2
- 210000003494 hepatocyte Anatomy 0.000 description 2
- 239000012510 hollow fiber Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 229940050526 hydroxyethylstarch Drugs 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 2
- 229960000367 inositol Drugs 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 238000007917 intracranial administration Methods 0.000 description 2
- 210000001739 intranuclear inclusion body Anatomy 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 230000000366 juvenile effect Effects 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 238000011031 large-scale manufacturing process Methods 0.000 description 2
- 210000000867 larynx Anatomy 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000006194 liquid suspension Substances 0.000 description 2
- 239000012139 lysis buffer Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 230000004898 mitochondrial function Effects 0.000 description 2
- 238000009126 molecular therapy Methods 0.000 description 2
- 210000004898 n-terminal fragment Anatomy 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 210000004498 neuroglial cell Anatomy 0.000 description 2
- 230000000324 neuroprotective effect Effects 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 230000010412 perfusion Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 2
- 230000032361 posttranscriptional gene silencing Effects 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 235000013772 propylene glycol Nutrition 0.000 description 2
- 102220214569 rs1060502907 Human genes 0.000 description 2
- 102220231840 rs1064797305 Human genes 0.000 description 2
- 102220236111 rs1131691934 Human genes 0.000 description 2
- 102200119083 rs118204039 Human genes 0.000 description 2
- 102200119884 rs119103214 Human genes 0.000 description 2
- 102200062143 rs132630330 Human genes 0.000 description 2
- 102220279424 rs1373614735 Human genes 0.000 description 2
- 102220003569 rs137852596 Human genes 0.000 description 2
- 102200154191 rs137853843 Human genes 0.000 description 2
- 102220040801 rs140919432 Human genes 0.000 description 2
- 102220282247 rs1555516544 Human genes 0.000 description 2
- 102220071628 rs199472937 Human genes 0.000 description 2
- 102220201261 rs201339004 Human genes 0.000 description 2
- 102220056826 rs368482358 Human genes 0.000 description 2
- 102220135453 rs369488860 Human genes 0.000 description 2
- 102220014665 rs397517216 Human genes 0.000 description 2
- 102200100757 rs62637007 Human genes 0.000 description 2
- 102220215441 rs756472919 Human genes 0.000 description 2
- 102220333114 rs764023352 Human genes 0.000 description 2
- 102220101445 rs878853486 Human genes 0.000 description 2
- 102200010124 rs878854402 Human genes 0.000 description 2
- 102220158313 rs886063623 Human genes 0.000 description 2
- 238000007790 scraping Methods 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 2
- 238000009097 single-agent therapy Methods 0.000 description 2
- 210000002027 skeletal muscle Anatomy 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 235000010356 sorbitol Nutrition 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 230000007100 striatal neurodegeneration Effects 0.000 description 2
- 210000001977 striatum neuron Anatomy 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 230000003319 supportive effect Effects 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 210000002435 tendon Anatomy 0.000 description 2
- 210000000515 tooth Anatomy 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 230000008733 trauma Effects 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 241001529453 unidentified herpesvirus Species 0.000 description 2
- 210000000626 ureter Anatomy 0.000 description 2
- 210000003708 urethra Anatomy 0.000 description 2
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical compound C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 1
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- LKUDPHPHKOZXCD-UHFFFAOYSA-N 1,3,5-trimethoxybenzene Chemical compound COC1=CC(OC)=CC(OC)=C1 LKUDPHPHKOZXCD-UHFFFAOYSA-N 0.000 description 1
- YPFDHNVEDLHUCE-UHFFFAOYSA-N 1,3-propanediol Substances OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 1
- UTQUILVPBZEHTK-ZOQUXTDFSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3-methylpyrimidine-2,4-dione Chemical compound O=C1N(C)C(=O)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 UTQUILVPBZEHTK-ZOQUXTDFSA-N 0.000 description 1
- NEOJKYRRLHDYII-TURQNECASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-(2-oxopropyl)pyrimidine-2,4-dione Chemical compound O=C1NC(=O)C(CC(=O)C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NEOJKYRRLHDYII-TURQNECASA-N 0.000 description 1
- WZIZREBAUZZJOS-TURQNECASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-[2-(methylamino)ethyl]pyrimidine-2,4-dione Chemical compound O=C1NC(=O)C(CCNC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 WZIZREBAUZZJOS-TURQNECASA-N 0.000 description 1
- QLOCVMVCRJOTTM-TURQNECASA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-prop-1-ynylpyrimidine-2,4-dione Chemical compound O=C1NC(=O)C(C#CC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 QLOCVMVCRJOTTM-TURQNECASA-N 0.000 description 1
- SGKGZYGMLGVQHP-ZOQUXTDFSA-N 1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-6-methylpyrimidine-2,4-dione Chemical compound CC1=CC(=O)NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 SGKGZYGMLGVQHP-ZOQUXTDFSA-N 0.000 description 1
- RYCNUMLMNKHWPZ-SNVBAGLBSA-N 1-acetyl-sn-glycero-3-phosphocholine Chemical compound CC(=O)OC[C@@H](O)COP([O-])(=O)OCC[N+](C)(C)C RYCNUMLMNKHWPZ-SNVBAGLBSA-N 0.000 description 1
- GFYLSDSUCHVORB-IOSLPCCCSA-N 1-methyladenosine Chemical compound C1=NC=2C(=N)N(C)C=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O GFYLSDSUCHVORB-IOSLPCCCSA-N 0.000 description 1
- WJNGQIYEQLPJMN-IOSLPCCCSA-N 1-methylinosine Chemical compound C1=NC=2C(=O)N(C)C=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O WJNGQIYEQLPJMN-IOSLPCCCSA-N 0.000 description 1
- IQZWKGWOBPJWMX-UHFFFAOYSA-N 2-Methyladenosine Natural products C12=NC(C)=NC(N)=C2N=CN1C1OC(CO)C(O)C1O IQZWKGWOBPJWMX-UHFFFAOYSA-N 0.000 description 1
- KISWVXRQTGLFGD-UHFFFAOYSA-N 2-[[2-[[6-amino-2-[[2-[[2-[[5-amino-2-[[2-[[1-[2-[[6-amino-2-[(2,5-diamino-5-oxopentanoyl)amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-(diaminomethylideneamino)p Chemical compound C1CCN(C(=O)C(CCCN=C(N)N)NC(=O)C(CCCCN)NC(=O)C(N)CCC(N)=O)C1C(=O)NC(CO)C(=O)NC(CCC(N)=O)C(=O)NC(CCCN=C(N)N)C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 KISWVXRQTGLFGD-UHFFFAOYSA-N 0.000 description 1
- HTOVHZGIBCAAJU-UHFFFAOYSA-N 2-amino-2-propyl-1h-purin-6-one Chemical compound CCCC1(N)NC(=O)C2=NC=NC2=N1 HTOVHZGIBCAAJU-UHFFFAOYSA-N 0.000 description 1
- CDAWCLOXVUBKRW-UHFFFAOYSA-N 2-aminophenol Chemical group NC1=CC=CC=C1O CDAWCLOXVUBKRW-UHFFFAOYSA-N 0.000 description 1
- ASJSAQIRZKANQN-CRCLSJGQSA-N 2-deoxy-D-ribose Chemical compound OC[C@@H](O)[C@@H](O)CC=O ASJSAQIRZKANQN-CRCLSJGQSA-N 0.000 description 1
- IQZWKGWOBPJWMX-IOSLPCCCSA-N 2-methyladenosine Chemical compound C12=NC(C)=NC(N)=C2N=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O IQZWKGWOBPJWMX-IOSLPCCCSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M 2-methylbenzenesulfonate Chemical compound CC1=CC=CC=C1S([O-])(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 229940080296 2-naphthalenesulfonate Drugs 0.000 description 1
- USCCECGPGBGFOM-UHFFFAOYSA-N 2-propyl-7h-purin-6-amine Chemical compound CCCC1=NC(N)=C2NC=NC2=N1 USCCECGPGBGFOM-UHFFFAOYSA-N 0.000 description 1
- RHFUOMFWUGWKKO-XVFCMESISA-N 2-thiocytidine Chemical compound S=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RHFUOMFWUGWKKO-XVFCMESISA-N 0.000 description 1
- GJTBSTBJLVYKAU-XVFCMESISA-N 2-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=S)NC(=O)C=C1 GJTBSTBJLVYKAU-XVFCMESISA-N 0.000 description 1
- 108020005345 3' Untranslated Regions Proteins 0.000 description 1
- RDPUKVRQKWBSPK-UHFFFAOYSA-N 3-Methylcytidine Natural products O=C1N(C)C(=N)C=CN1C1C(O)C(O)C(CO)O1 RDPUKVRQKWBSPK-UHFFFAOYSA-N 0.000 description 1
- UTQUILVPBZEHTK-UHFFFAOYSA-N 3-Methyluridine Natural products O=C1N(C)C(=O)C=CN1C1C(O)C(O)C(CO)O1 UTQUILVPBZEHTK-UHFFFAOYSA-N 0.000 description 1
- RMTFNDVZYPHUEF-XZBKPIIZSA-N 3-O-methyl-D-glucose Chemical compound O=C[C@H](O)[C@@H](OC)[C@H](O)[C@H](O)CO RMTFNDVZYPHUEF-XZBKPIIZSA-N 0.000 description 1
- ZRPLANDPDWYOMZ-UHFFFAOYSA-N 3-cyclopentylpropionic acid Chemical compound OC(=O)CCC1CCCC1 ZRPLANDPDWYOMZ-UHFFFAOYSA-N 0.000 description 1
- RDPUKVRQKWBSPK-ZOQUXTDFSA-N 3-methylcytidine Chemical compound O=C1N(C)C(=N)C=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 RDPUKVRQKWBSPK-ZOQUXTDFSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-M 3-phenylpropionate Chemical compound [O-]C(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-M 0.000 description 1
- ZLOIGESWDJYCTF-UHFFFAOYSA-N 4-Thiouridine Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-UHFFFAOYSA-N 0.000 description 1
- BCZUPRDAAVVBSO-MJXNYTJMSA-N 4-acetylcytidine Chemical compound C1=CC(C(=O)C)(N)NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 BCZUPRDAAVVBSO-MJXNYTJMSA-N 0.000 description 1
- XXSIICQLPUAUDF-TURQNECASA-N 4-amino-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-5-prop-1-ynylpyrimidin-2-one Chemical compound O=C1N=C(N)C(C#CC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 XXSIICQLPUAUDF-TURQNECASA-N 0.000 description 1
- GCNTZFIIOFTKIY-UHFFFAOYSA-N 4-hydroxypyridine Chemical compound OC1=CC=NC=C1 GCNTZFIIOFTKIY-UHFFFAOYSA-N 0.000 description 1
- ZLOIGESWDJYCTF-XVFCMESISA-N 4-thiouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=S)C=C1 ZLOIGESWDJYCTF-XVFCMESISA-N 0.000 description 1
- SIBMIRVJDKGAIZ-CWUIGSMPSA-N 5-(2-aminopropyl)-1-[(2r,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidine-2,4-dione Chemical compound O=C1NC(=O)C(CC(N)C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 SIBMIRVJDKGAIZ-CWUIGSMPSA-N 0.000 description 1
- ZAYHVCMSTBRABG-UHFFFAOYSA-N 5-Methylcytidine Natural products O=C1N=C(N)C(C)=CN1C1C(O)C(O)C(CO)O1 ZAYHVCMSTBRABG-UHFFFAOYSA-N 0.000 description 1
- ZXIATBNUWJBBGT-JXOAFFINSA-N 5-methoxyuridine Chemical compound O=C1NC(=O)C(OC)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ZXIATBNUWJBBGT-JXOAFFINSA-N 0.000 description 1
- SNNBPMAXGYBMHM-JXOAFFINSA-N 5-methyl-2-thiouridine Chemical compound S=C1NC(=O)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 SNNBPMAXGYBMHM-JXOAFFINSA-N 0.000 description 1
- ZAYHVCMSTBRABG-JXOAFFINSA-N 5-methylcytidine Chemical compound O=C1N=C(N)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 ZAYHVCMSTBRABG-JXOAFFINSA-N 0.000 description 1
- CKOMXBHMKXXTNW-UHFFFAOYSA-N 6-methyladenine Chemical compound CNC1=NC=NC2=C1N=CN2 CKOMXBHMKXXTNW-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- OGHAROSJZRTIOK-KQYNXXCUSA-O 7-methylguanosine Chemical compound C1=2N=C(N)NC(=O)C=2[N+](C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OGHAROSJZRTIOK-KQYNXXCUSA-O 0.000 description 1
- MSSXOMSJDRHRMC-UHFFFAOYSA-N 9H-purine-2,6-diamine Chemical compound NC1=NC(N)=C2NC=NC2=N1 MSSXOMSJDRHRMC-UHFFFAOYSA-N 0.000 description 1
- HDZZVAMISRMYHH-UHFFFAOYSA-N 9beta-Ribofuranosyl-7-deazaadenin Natural products C1=CC=2C(N)=NC=NC=2N1C1OC(CO)C(O)C1O HDZZVAMISRMYHH-UHFFFAOYSA-N 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 241000425548 Adeno-associated virus 3A Species 0.000 description 1
- 241000256173 Aedes albopictus Species 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 241000702419 Ambidensovirus Species 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- PEMQXWCOMFJRLS-UHFFFAOYSA-N Archaeosine Natural products C1=2NC(N)=NC(=O)C=2C(C(=N)N)=CN1C1OC(CO)C(O)C1O PEMQXWCOMFJRLS-UHFFFAOYSA-N 0.000 description 1
- 102220603295 Arf-GAP with GTPase, ANK repeat and PH domain-containing protein 3_S414N_mutation Human genes 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- 241000244203 Caenorhabditis elegans Species 0.000 description 1
- 101100441252 Caenorhabditis elegans csp-2 gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 102000004657 Calcium-Calmodulin-Dependent Protein Kinase Type 2 Human genes 0.000 description 1
- 108010003721 Calcium-Calmodulin-Dependent Protein Kinase Type 2 Proteins 0.000 description 1
- 101150044789 Cap gene Proteins 0.000 description 1
- 102000011727 Caspases Human genes 0.000 description 1
- 108010076667 Caspases Proteins 0.000 description 1
- 102000005600 Cathepsins Human genes 0.000 description 1
- 108010084457 Cathepsins Proteins 0.000 description 1
- PTHCMJGKKRQCBF-UHFFFAOYSA-N Cellulose, microcrystalline Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC)C(CO)O1 PTHCMJGKKRQCBF-UHFFFAOYSA-N 0.000 description 1
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 1
- 102000012286 Chitinases Human genes 0.000 description 1
- 108010022172 Chitinases Proteins 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108020004394 Complementary RNA Proteins 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 241000450599 DNA viruses Species 0.000 description 1
- 102100036912 Desmin Human genes 0.000 description 1
- 108010044052 Desmin Proteins 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- QRLVDLBMBULFAL-UHFFFAOYSA-N Digitonin Natural products CC1CCC2(OC1)OC3C(O)C4C5CCC6CC(OC7OC(CO)C(OC8OC(CO)C(O)C(OC9OCC(O)C(O)C9OC%10OC(CO)C(O)C(OC%11OC(CO)C(O)C(O)C%11O)C%10O)C8O)C(O)C7O)C(O)CC6(C)C5CCC4(C)C3C2C QRLVDLBMBULFAL-UHFFFAOYSA-N 0.000 description 1
- 241000255925 Diptera Species 0.000 description 1
- 101100285903 Drosophila melanogaster Hsc70-2 gene Proteins 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 101000834253 Gallus gallus Actin, cytoplasmic 1 Proteins 0.000 description 1
- 208000003098 Ganglion Cysts Diseases 0.000 description 1
- 102000053187 Glucuronidase Human genes 0.000 description 1
- 108010060309 Glucuronidase Proteins 0.000 description 1
- 102000008214 Glutamate decarboxylase Human genes 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 101000744174 Homo sapiens DNA-3-methyladenine glycosylase Proteins 0.000 description 1
- 101001092197 Homo sapiens RNA binding protein fox-1 homolog 3 Proteins 0.000 description 1
- 101001046426 Homo sapiens cGMP-dependent protein kinase 1 Proteins 0.000 description 1
- 102220471194 Huntingtin_Y2309H_mutation Human genes 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 229930010555 Inosine Natural products 0.000 description 1
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 239000000232 Lipid Bilayer Substances 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102100036837 Metabotropic glutamate receptor 2 Human genes 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 206010028289 Muscle atrophy Diseases 0.000 description 1
- RSPURTUNRHNVGF-IOSLPCCCSA-N N(2),N(2)-dimethylguanosine Chemical compound C1=NC=2C(=O)NC(N(C)C)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O RSPURTUNRHNVGF-IOSLPCCCSA-N 0.000 description 1
- SLEHROROQDYRAW-KQYNXXCUSA-N N(2)-methylguanosine Chemical compound C1=NC=2C(=O)NC(NC)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O SLEHROROQDYRAW-KQYNXXCUSA-N 0.000 description 1
- VQAYFKKCNSOZKM-IOSLPCCCSA-N N(6)-methyladenosine Chemical compound C1=NC=2C(NC)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O VQAYFKKCNSOZKM-IOSLPCCCSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- VQAYFKKCNSOZKM-UHFFFAOYSA-N NSC 29409 Natural products C1=NC=2C(NC)=NC=NC=2N1C1OC(CO)C(O)C1O VQAYFKKCNSOZKM-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- MHABMANUFPZXEB-UHFFFAOYSA-N O-demethyl-aloesaponarin I Natural products O=C1C2=CC=CC(O)=C2C(=O)C2=C1C=C(O)C(C(O)=O)=C2C MHABMANUFPZXEB-UHFFFAOYSA-N 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229920002230 Pectic acid Polymers 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 1
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 1
- 102000002508 Peptide Elongation Factors Human genes 0.000 description 1
- 108010068204 Peptide Elongation Factors Proteins 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 241000286209 Phasianidae Species 0.000 description 1
- 102100040990 Platelet-derived growth factor subunit B Human genes 0.000 description 1
- 101710103494 Platelet-derived growth factor subunit B Proteins 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 229930185560 Pseudouridine Natural products 0.000 description 1
- PTJWIQPHWPFNBW-UHFFFAOYSA-N Pseudouridine C Natural products OC1C(O)C(CO)OC1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-UHFFFAOYSA-N 0.000 description 1
- 102100035530 RNA binding protein fox-1 homolog 3 Human genes 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 101150020107 SCN8A gene Proteins 0.000 description 1
- 235000012377 Salvia columbariae var. columbariae Nutrition 0.000 description 1
- 240000005481 Salvia hispanica Species 0.000 description 1
- 235000001498 Salvia hispanica Nutrition 0.000 description 1
- 101001000154 Schistosoma mansoni Phosphoglycerate kinase Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 208000005400 Synovial Cyst Diseases 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 101710138874 Viral cathepsin Proteins 0.000 description 1
- 206010052428 Wound Diseases 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 102000015296 acetylcholine-gated cation-selective channel activity proteins Human genes 0.000 description 1
- 108040006409 acetylcholine-gated cation-selective channel activity proteins Proteins 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-BKBMJHBISA-N alpha-D-galacturonic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-BKBMJHBISA-N 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- MQXQVCLAUDMCEF-CWLIKTDRSA-N amoxicillin trihydrate Chemical compound O.O.O.C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=C(O)C=C1 MQXQVCLAUDMCEF-CWLIKTDRSA-N 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- PEMQXWCOMFJRLS-RPKMEZRRSA-N archaeosine Chemical compound C1=2NC(N)=NC(=O)C=2C(C(=N)N)=CN1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O PEMQXWCOMFJRLS-RPKMEZRRSA-N 0.000 description 1
- 210000002565 arteriole Anatomy 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000002567 autonomic effect Effects 0.000 description 1
- 230000003376 axonal effect Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- WGDUUQDYDIIBKT-UHFFFAOYSA-N beta-Pseudouridine Natural products OC1OC(CN2C=CC(=O)NC2=O)C(O)C1O WGDUUQDYDIIBKT-UHFFFAOYSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N beta-phenylpropanoic acid Natural products OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000000621 bronchi Anatomy 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 210000005252 bulbus oculi Anatomy 0.000 description 1
- OWBTYPJTUOEWEK-UHFFFAOYSA-N butane-2,3-diol Chemical compound CC(O)C(C)O OWBTYPJTUOEWEK-UHFFFAOYSA-N 0.000 description 1
- 102220418807 c.1335C>T Human genes 0.000 description 1
- 102220354899 c.1441G>C Human genes 0.000 description 1
- 102220419728 c.1500A>T Human genes 0.000 description 1
- 102220419205 c.1712C>T Human genes 0.000 description 1
- 102220360931 c.3691A>G Human genes 0.000 description 1
- 102100022422 cGMP-dependent protein kinase 1 Human genes 0.000 description 1
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- FATUQANACHZLRT-KMRXSBRUSA-L calcium glucoheptonate Chemical compound [Ca+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O FATUQANACHZLRT-KMRXSBRUSA-L 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 229940077731 carbohydrate nutrients Drugs 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000002041 carbon nanotube Substances 0.000 description 1
- 229910021393 carbon nanotube Inorganic materials 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 210000001159 caudate nucleus Anatomy 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 210000003850 cellular structure Anatomy 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 210000004289 cerebral ventricle Anatomy 0.000 description 1
- 210000004720 cerebrum Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 235000014167 chia Nutrition 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 229940099352 cholate Drugs 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 208000035850 clinical syndrome Diseases 0.000 description 1
- 231100000876 cognitive deterioration Toxicity 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 239000011258 core-shell material Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 210000004087 cornea Anatomy 0.000 description 1
- 210000004351 coronary vessel Anatomy 0.000 description 1
- 238000009295 crossflow filtration Methods 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 229940009976 deoxycholate Drugs 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- 210000005045 desmin Anatomy 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 235000019700 dicalcium phosphate Nutrition 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- UVYVLBIGDKGWPX-KUAJCENISA-N digitonin Chemical compound O([C@@H]1[C@@H]([C@]2(CC[C@@H]3[C@@]4(C)C[C@@H](O)[C@H](O[C@H]5[C@@H]([C@@H](O)[C@@H](O[C@H]6[C@@H]([C@@H](O[C@H]7[C@@H]([C@@H](O)[C@H](O)CO7)O)[C@H](O)[C@@H](CO)O6)O[C@H]6[C@@H]([C@@H](O[C@H]7[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O7)O)[C@@H](O)[C@@H](CO)O6)O)[C@@H](CO)O5)O)C[C@@H]4CC[C@H]3[C@@H]2[C@@H]1O)C)[C@@H]1C)[C@]11CC[C@@H](C)CO1 UVYVLBIGDKGWPX-KUAJCENISA-N 0.000 description 1
- UVYVLBIGDKGWPX-UHFFFAOYSA-N digitonine Natural products CC1C(C2(CCC3C4(C)CC(O)C(OC5C(C(O)C(OC6C(C(OC7C(C(O)C(O)CO7)O)C(O)C(CO)O6)OC6C(C(OC7C(C(O)C(O)C(CO)O7)O)C(O)C(CO)O6)O)C(CO)O5)O)CC4CCC3C2C2O)C)C2OC11CCC(C)CO1 UVYVLBIGDKGWPX-UHFFFAOYSA-N 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- ZPTBLXKRQACLCR-XVFCMESISA-N dihydrouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)CC1 ZPTBLXKRQACLCR-XVFCMESISA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000002612 dispersion medium Substances 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-M dodecanoate Chemical compound CCCCCCCCCCCC([O-])=O POULHZVOKOAJMA-UHFFFAOYSA-M 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 238000009513 drug distribution Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 210000001951 dura mater Anatomy 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 239000003221 ear drop Substances 0.000 description 1
- 229940047652 ear drops Drugs 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 238000005370 electroosmosis Methods 0.000 description 1
- 210000001671 embryonic stem cell Anatomy 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 229940095399 enema Drugs 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 210000003238 esophagus Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 235000019439 ethyl acetate Nutrition 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 210000003722 extracellular fluid Anatomy 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008717 functional decline Effects 0.000 description 1
- 229960003082 galactose Drugs 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000010363 gene targeting Methods 0.000 description 1
- 238000012252 genetic analysis Methods 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 210000004195 gingiva Anatomy 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960001031 glucose Drugs 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 238000001631 haemodialysis Methods 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000000322 hemodialysis Effects 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 210000004295 hippocampal neuron Anatomy 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 210000003000 inclusion body Anatomy 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 229960003786 inosine Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 210000001153 interneuron Anatomy 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 239000007926 intracavernous injection Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- NBQNWMBBSKPBAY-UHFFFAOYSA-N iodixanol Chemical compound IC=1C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C(I)C=1N(C(=O)C)CC(O)CN(C(C)=O)C1=C(I)C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C1I NBQNWMBBSKPBAY-UHFFFAOYSA-N 0.000 description 1
- 229960004359 iodixanol Drugs 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 230000002262 irrigation Effects 0.000 description 1
- 238000003973 irrigation Methods 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229940099584 lactobionate Drugs 0.000 description 1
- JYTUSYBCFIZPBE-AMTLMPIISA-N lactobionic acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O JYTUSYBCFIZPBE-AMTLMPIISA-N 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- 229940070765 laurate Drugs 0.000 description 1
- IZWSFJTYBVKZNK-UHFFFAOYSA-N lauryl sulfobetaine Chemical compound CCCCCCCCCCCC[N+](C)(C)CCCS([O-])(=O)=O IZWSFJTYBVKZNK-UHFFFAOYSA-N 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 230000021633 leukocyte mediated immunity Effects 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000002418 meninge Anatomy 0.000 description 1
- 230000003818 metabolic dysfunction Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 108010038421 metabotropic glutamate receptor 2 Proteins 0.000 description 1
- 239000007769 metal material Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 210000000274 microglia Anatomy 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 231100000324 minimal toxicity Toxicity 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 230000009456 molecular mechanism Effects 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 210000002161 motor neuron Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 210000000663 muscle cell Anatomy 0.000 description 1
- 201000000585 muscular atrophy Diseases 0.000 description 1
- 210000003098 myoblast Anatomy 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-M naphthalene-2-sulfonate Chemical compound C1=CC=CC2=CC(S(=O)(=O)[O-])=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-M 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 210000000653 nervous system Anatomy 0.000 description 1
- 210000005155 neural progenitor cell Anatomy 0.000 description 1
- 210000001178 neural stem cell Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- HEGSGKPQLMEBJL-RKQHYHRCSA-N octyl beta-D-glucopyranoside Chemical compound CCCCCCCCO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HEGSGKPQLMEBJL-RKQHYHRCSA-N 0.000 description 1
- 229940049964 oleate Drugs 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 210000003300 oropharynx Anatomy 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000011860 particles by size Substances 0.000 description 1
- 239000013618 particulate matter Substances 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 108010043655 penetratin Proteins 0.000 description 1
- MCYTYTUNNNZWOK-LCLOTLQISA-N penetratin Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=CC=C1 MCYTYTUNNNZWOK-LCLOTLQISA-N 0.000 description 1
- 210000003899 penis Anatomy 0.000 description 1
- 210000003516 pericardium Anatomy 0.000 description 1
- 230000003239 periodontal effect Effects 0.000 description 1
- 210000004303 peritoneum Anatomy 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 210000003800 pharynx Anatomy 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 150000004713 phosphodiesters Chemical class 0.000 description 1
- 230000037081 physical activity Effects 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 229940075930 picrate Drugs 0.000 description 1
- OXNIZHLAWKMVMX-UHFFFAOYSA-M picrate anion Chemical compound [O-]C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O OXNIZHLAWKMVMX-UHFFFAOYSA-M 0.000 description 1
- 229950010765 pivalate Drugs 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 210000002826 placenta Anatomy 0.000 description 1
- 210000004224 pleura Anatomy 0.000 description 1
- 238000005498 polishing Methods 0.000 description 1
- 229920002492 poly(sulfone) Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920006393 polyether sulfone Polymers 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 235000013594 poultry meat Nutrition 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 210000002243 primary neuron Anatomy 0.000 description 1
- 230000000272 proprioceptive effect Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 230000004845 protein aggregation Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- PTJWIQPHWPFNBW-GBNDHIKLSA-N pseudouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1C1=CNC(=O)NC1=O PTJWIQPHWPFNBW-GBNDHIKLSA-N 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 210000000449 purkinje cell Anatomy 0.000 description 1
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical compound OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 1
- 150000003230 pyrimidines Chemical class 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- QQXQGKSPIMGUIZ-AEZJAUAXSA-N queuosine Chemical compound C1=2C(=O)NC(N)=NC=2N([C@H]2[C@@H]([C@H](O)[C@@H](CO)O2)O)C=C1CN[C@H]1C=C[C@H](O)[C@@H]1O QQXQGKSPIMGUIZ-AEZJAUAXSA-N 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 238000011552 rat model Methods 0.000 description 1
- 239000003642 reactive oxygen metabolite Substances 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 238000009877 rendering Methods 0.000 description 1
- 101150066583 rep gene Proteins 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- DWRXFEITVBNRMK-JXOAFFINSA-N ribothymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 DWRXFEITVBNRMK-JXOAFFINSA-N 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 102220033742 rs104886487 Human genes 0.000 description 1
- 102220217136 rs1060503142 Human genes 0.000 description 1
- 102220234408 rs1114167611 Human genes 0.000 description 1
- 102200132001 rs1135402744 Human genes 0.000 description 1
- 102200120522 rs121912519 Human genes 0.000 description 1
- 102220082115 rs141585847 Human genes 0.000 description 1
- 102220237864 rs142410102 Human genes 0.000 description 1
- 102220079302 rs147748659 Human genes 0.000 description 1
- 102220277289 rs1553412768 Human genes 0.000 description 1
- 102220277580 rs1553662861 Human genes 0.000 description 1
- 102220300987 rs1554081754 Human genes 0.000 description 1
- 102220327838 rs1555591722 Human genes 0.000 description 1
- 102200038664 rs199472801 Human genes 0.000 description 1
- 102220094018 rs201798163 Human genes 0.000 description 1
- 102200019566 rs281875320 Human genes 0.000 description 1
- 102210054132 rs362307 Human genes 0.000 description 1
- 102220129048 rs376402047 Human genes 0.000 description 1
- 102220035394 rs483352828 Human genes 0.000 description 1
- 102220179730 rs553562104 Human genes 0.000 description 1
- 102220041311 rs587778722 Human genes 0.000 description 1
- 102220036621 rs587779914 Human genes 0.000 description 1
- 102220039319 rs587780542 Human genes 0.000 description 1
- 102220201815 rs587780589 Human genes 0.000 description 1
- 102220026213 rs63749971 Human genes 0.000 description 1
- 102220052360 rs71530906 Human genes 0.000 description 1
- 102220056437 rs730880130 Human genes 0.000 description 1
- 102220110490 rs753339980 Human genes 0.000 description 1
- 102220100312 rs755193751 Human genes 0.000 description 1
- 102220219522 rs756197350 Human genes 0.000 description 1
- 102220059095 rs762396230 Human genes 0.000 description 1
- 102220279291 rs764616982 Human genes 0.000 description 1
- 102220086638 rs766438395 Human genes 0.000 description 1
- 102220322048 rs766438395 Human genes 0.000 description 1
- 102220278637 rs770181766 Human genes 0.000 description 1
- 102220095438 rs876658180 Human genes 0.000 description 1
- 102220096219 rs876659201 Human genes 0.000 description 1
- 102220122123 rs886043008 Human genes 0.000 description 1
- RHFUOMFWUGWKKO-UHFFFAOYSA-N s2C Natural products S=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 RHFUOMFWUGWKKO-UHFFFAOYSA-N 0.000 description 1
- 239000013609 scAAV vector Substances 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 238000011218 seed culture Methods 0.000 description 1
- 210000001044 sensory neuron Anatomy 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 230000006807 siRNA silencing Effects 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- AWUCVROLDVIAJX-GSVOUGTGSA-N sn-glycerol 3-phosphate Chemical compound OC[C@@H](O)COP(O)(O)=O AWUCVROLDVIAJX-GSVOUGTGSA-N 0.000 description 1
- 238000002791 soaking Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000017550 sodium carbonate Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 235000011008 sodium phosphates Nutrition 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 230000002739 subcortical effect Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 238000004114 suspension culture Methods 0.000 description 1
- 230000009747 swallowing Effects 0.000 description 1
- 210000001171 synovial bursa Anatomy 0.000 description 1
- 210000000538 tail Anatomy 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- CBXCPBUEXACCNR-UHFFFAOYSA-N tetraethylammonium Chemical compound CC[N+](CC)(CC)CC CBXCPBUEXACCNR-UHFFFAOYSA-N 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical compound C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical group [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000009752 translational inhibition Effects 0.000 description 1
- 230000001296 transplacental effect Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- PBKWZFANFUTEPS-CWUSWOHSSA-N transportan Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(N)=O)[C@@H](C)CC)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)CN)[C@@H](C)O)C1=CC=C(O)C=C1 PBKWZFANFUTEPS-CWUSWOHSSA-N 0.000 description 1
- 108010062760 transportan Proteins 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 150000004684 trihydrates Chemical class 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- HDZZVAMISRMYHH-KCGFPETGSA-N tubercidin Chemical compound C1=CC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O HDZZVAMISRMYHH-KCGFPETGSA-N 0.000 description 1
- 210000005239 tubule Anatomy 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- ZDPHROOEEOARMN-UHFFFAOYSA-N undecanoic acid Chemical compound CCCCCCCCCCC(O)=O ZDPHROOEEOARMN-UHFFFAOYSA-N 0.000 description 1
- 229940035893 uracil Drugs 0.000 description 1
- RVCNQQGZJWVLIP-VPCXQMTMSA-N uridin-5-yloxyacetic acid Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(OCC(O)=O)=C1 RVCNQQGZJWVLIP-VPCXQMTMSA-N 0.000 description 1
- 238000003828 vacuum filtration Methods 0.000 description 1
- 229940070710 valerate Drugs 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 210000000264 venule Anatomy 0.000 description 1
- 230000028973 vesicle-mediated transport Effects 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H21/00—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids
- C07H21/02—Compounds containing two or more mononucleotide units having separate phosphate or polyphosphate groups linked by saccharide radicals of nucleoside groups, e.g. nucleic acids with ribosyl as saccharide radical
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering nucleic acids [NA]
- C12N2310/141—MicroRNAs, miRNAs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2330/00—Production
- C12N2330/50—Biochemical production, i.e. in a transformed host cell
- C12N2330/51—Specially adapted vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biochemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Psychology (AREA)
- Virology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicinal Preparation (AREA)
Description
一実施形態において、siRNA又はdsRNAは、互いに相補的な少なくとも2つの配列を含む。dsRNAは、第1の配列を有するセンス鎖と、第2の配列を有するアンチセンス鎖とを含む。アンチセンス鎖は、HTTタンパク質をコードするmRNAの少なくとも一部と実質的に相補的なヌクレオチド配列を含み、相補性領域は30ヌクレオチド以下、及び少なくとも15ヌクレオチド長である。概して、dsRNAは19~24、例えば19~21ヌクレオチド長である。一部の実施形態においてdsRNAは約15~約25ヌクレオチド長であり、他の実施形態においてdsRNAは約25~約30ヌクレオチド長である。
一実施形態において、siRNA又はdsRNAは、互いに相補的な少なくとも2つの配列を含む。dsRNAは、第1の配列を有するセンス鎖と、第2の配列を有するアンチセンス鎖とを含む。アンチセンス鎖は、HTTをコードするmRNAの少なくとも一部と実質的に相補的なヌクレオチド配列を含み、相補性領域は30ヌクレオチド以下、及び少なくとも15ヌクレオチド長である。概して、dsRNAは19~25、19~24又は19~21ヌクレオチド長である。一部の実施形態においてdsRNAは約15~約25ヌクレオチド長であり、他の実施形態においてdsRNAは約25~約30ヌクレオチド長である。
一部の実施形態において、siRNA分子又はかかるsiRNA分子を含むAAVベクターは、対象の中枢神経系に直接、例えば対象の視床への注入によって導入されてもよい。理論によって拘束されることを望むものではないが、視床はハンチントン病の対象において比較的保たれている脳領域であり、これはAAVベクターの軸索輸送を通じたより広範な皮質形質導入が可能となり得ることを意味する。
一部の実施形態において、siRNA分子又はかかるsiRNA分子を含むAAVベクターは、対象の中枢神経系に直接、例えば対象の白質への注入によって導入されてもよい。理論によって拘束されることを望むものではないが、白質への直接注入による分布は、ハンチントン病の対象において損なわれていることもある軸索輸送機構と独立している可能性があり、これは白質注入が一層のAAVベクター輸送を実現し得ることを意味する。
ハンチントン病(HD)
ハンチントン病(HD)は、進行性の舞踏運動、精神神経及び認知機能障害によって特徴付けられる単一遺伝子性の致死性神経変性疾患である。ハンチントン病は、ハンチンチン(HTT)遺伝子(そのN末端にポリグルタミンストレッチを有するHTTタンパク質をコードする)における常染色体優性トリプレット(CAG)リピート伸長によって引き起こされることが知られている。このリピート伸長がHTTの毒性の機能獲得をもたらし、最終的に線条体神経変性につながり、それが広汎性脳萎縮へと進行する。HDでは線条体の中型有棘ニューロンが特に脆弱であるものと見られ、最大95%が消失する一方、介在ニューロンはほぼ保たれている。
本明細書に記載されるsiRNA及びベクターと共に使用し得るハンチントン病の研究用モデルシステムとしては、限定はされないが、細胞モデル(例えば、初代ニューロン及び人工多能性幹細胞)、無脊椎動物モデル(例えば、ショウジョウバエ属(Drosophila)又はカエノラブディティス・エレガンス(Caenorhabditis elegans))、マウスモデル(例えば、YAC128マウスモデル;R6/2マウスモデル;BAC、YAC及びノックインマウスモデル)、ラットモデル(例えば、BAC)及び大型哺乳類モデル(例えば、ブタ、ヒツジ又はサル)が挙げられる。
一実施形態では、調節性ポリヌクレオチド、例えばRNA又はDNA分子が、神経変性疾患、詳細にはハンチントン病(HD)の治療に用いられ得る。本明細書で使用されるとき、「調節性ポリヌクレオチド」は、標的遺伝子のレベル又は量、例えばmRNA又はタンパク質レベルを調節する(増加させるか又は減少させるかのいずれか)働きをする任意の核酸配列である。
本発明は、神経変性障害を治療するためのRNA干渉(RNAi)誘導性の遺伝子発現阻害に関する。本明細書には、HTT遺伝子を標的とするsiRNA二重鎖又はコード化dsRNA(本明細書では、まとめて「siRNA分子」と称される)が提供される。かかるsiRNA二重鎖又はコード化dsRNAは、細胞、例えば、中型有棘ニューロン、皮質ニューロン及び/又はアストロサイトにおけるHTT遺伝子発現を軽減又はサイレンシングして、それによりハンチントン病(HD)の症状を改善することができる。
HTT遺伝子を標的とするsiRNA二重鎖の設計及び配列
当該技術分野では、siRNAの設計に関して幾つかの指針が提案されている。これらの指針は、概して、その遺伝子においてサイレンシングしようとする領域を標的とする19ヌクレオチド二重鎖形成領域、対称2~3ヌクレオチド3’オーバハング、5’-リン酸基及び3’-ヒドロキシル基を作成することを推奨している。siRNA配列の好ましさを左右し得る他の規則としては、限定はされないが、(i)アンチセンス鎖の5’末端におけるA/U;(ii)センス鎖の5’末端におけるG/C;(iii)アンチセンス鎖の5’端側3分の1にある少なくとも5個のA/U残基;及び(iv)9ヌクレオチド長より長いいかなるGCストレッチも存在しないことが挙げられる。標的遺伝子の具体的な配列と合わせて、かかる考慮点に従い、哺乳類標的遺伝子発現の抑制に不可欠な極めて有効なsiRNA分子を容易に設計し得る。
42、6343、6344、6345、6600、6601、6602、6603、6604、6605、6606、6607、6608、6609、6610、6611、6612、6613、6614、6615、6725、6726、6727、6728、6729、6730、6731、6732、6733、6734、6735、6736、6737、6738、6739、6740、6741、6742、6743、6744、6745、6746、6747、6748、6749、6750、6751、6752、6753、6754、6755、6756、6757、6758、6759、6760、6761、6762、6763、6764、6765、6766、6767、6768、6769、6770、6771、6772、6773、6774、6775、7655、7656、7657、7658、7659、7660、7661、7662、7663、7664、7665、7666、7667、7668、7669、7670、7671、7672、8510、8511、8512、8513、8514、8515、8516、8715、8716、8717、8718、8719、8720、8721、8722、8723、8724、8725、8726、8727、8728、8729、8730、8731、8732、8733、8734、8735、8736、8737、8738、8739、8740、8741、8742、8743、8744、8745、9250、9251、9252、9253、9254、9255、9256、9257、9258、9259、9260、9261、9262、9263、9264、9265、9266、9267、9268、9269、9270、9480、9481、9482、9483、9484、9485、9486、9487、9488、9489、9490、9491、9492、9493、9494、9495、9496、9497、9498、9499、9500、9575、9576、9577、9578、9579、9580、9581、9582、9583、9584、9585、9586、9587、9588、9589、9590、10525、10526、10527、10528、10529、10530、10531、10532、10533、10534、10535、10536、10537、10538、10539、10540、11545、11546、11547、11548、11549、11550、11551、11552、11553、11554、11555、11556、11557、11558、11559、11560、11875、11876、11877、11878、11879、11880、11881、11882、11883、11884、11885、11886、11887、11888、11889、11890、11891、11892、11893、11894、11895、11896、11897、11898、11899、11900、11915、11916、11917、11918、11919、11920、11921、11922、11923、11924、11925、11926、11927、11928、11929、11930、11931、11932、11933、11934、11935、11936、11937、11938、11939、11940、13375、13376、13377、13378、13379、13380、13381、13382、13383、13384、13385、13386、13387、13388、13389及び13390であってもよい。
他の実施形態において、アンチセンス鎖と標的mRNA配列とは少なくとも1つのミスマッチを含む。非限定的な例として、アンチセンス鎖と標的mRNA配列とは、少なくとも30%、40%、50%、60%、70%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%又は99%又は少なくとも20~30%、20~40%、20~50%、20~60%、20~70%、20~80%、20~90%、20~95%、20~99%、30~40%、30~50%、30~60%、30~70%、30~80%、30~90%、30~95%、30~99%、40~50%、40~60%、40~70%、40~80%、40~90%、40~95%、40~99%、50~60%、50~70%、50~80%、50~90%、50~95%、50~99%、60~70%、60~80%、60~90%、60~95%、60~99%、70~80%、70~90%、70~95%、70~99%、80~90%、80~95%、80~99%、90~95%、90~99%又は95~99%の相補性を有する。
一実施形態において、最も近いオフターゲットに対するガイド鎖のIC50は、標的に対するガイド鎖のIC50の100倍よりも高い。非限定的な例として、最も近いオフターゲットに対するガイド鎖のIC50が標的に対するガイド鎖のIC50の100倍よりも高い場合、そのsiRNA分子は、インビトロでのHttの阻害に高いガイド鎖選択性を有すると言われる。
一実施形態において、ガイド鎖対パッセンジャー鎖(G:P)(アンチセンス鎖対センス鎖とも称される)の発現比は2より大きい。
一実施形態において、ガイド鎖対パッセンジャー鎖(G:P)(アンチセンス鎖対センス鎖とも称される)の発現比は10より大きい。
一実施形態において、ガイド鎖対パッセンジャー鎖(G:P)(アンチセンス鎖対センス鎖とも称される)の発現比は50より大きい。
一実施形態において、ガイド鎖対パッセンジャー鎖(G:P)(アンチセンス鎖対センス鎖とも称される)の発現比は少なくとも5:1である。
一実施形態において、ガイド鎖対パッセンジャー鎖(G:P)(アンチセンス鎖対センス鎖とも称される)の発現比は少なくとも20:1である。
一実施形態において、パッセンジャー鎖対ガイド鎖(P:G)(センス鎖対アンチセンス鎖とも称される)の発現比は、インビトロ又はインビボで1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1;1、2:10、2:9、2:8、2:7、2:6、2:5、2:4、2:3、2:2、2:1、3:10、3:9、3:8、3:7、3:6、3:5、3:4、3:3、3:2、3:1、4:10、4:9、4:8、4:7、4:6、4:5、4:4、4:3、4:2、4:1、5:10、5:9、5:8、5:7、5:6、5:5、5:4、5:3、5:2、5:1、6:10、6:9、6:8、6:7、6:6、6:5、6:4、6:3、6:2、6:1、7:10、7:9、7:8、7:7、7:6、7:5、7:4、7:3、7:2、7:1、8:10、8:9、8:8、8:7、8:6、8:5、8:4、8:3、8:2、8:1、9:10、9:9、9:8、9:7、9:6、9:5、9:4、9:3、9:2、9:1、10:10、10:9、10:8、10:7、10:6、10:5、10:4、10:3、10:2、10:1、1:99、5:95、10:90、15:85、20:80、25:75、30:70、35:65、40:60、45:55、50:50、55:45、60:40、65:35、70:30、75:25、80:20、85:15、90:10、95:5、又は99:1である。パッセンジャー対ガイド比とは、ガイド鎖切断後のパッセンジャー鎖対ガイド鎖の比を指す。例えば、80:20のパッセンジャー対ガイド比であれば、前駆体からプロセシングされるガイド鎖2つにつき8つのパッセンジャー鎖を有し得る。非限定的な例として、パッセンジャー鎖対ガイド鎖比はインビトロで80:20である。非限定的な例として、パッセンジャー鎖対ガイド鎖比はインビボで80:20である。非限定的な例として、パッセンジャー鎖対ガイド鎖比はインビトロで8:2である。非限定的な例として、パッセンジャー鎖対ガイド鎖比はインビボで8:2である。非限定的な例として、パッセンジャー鎖対ガイド鎖比はインビトロで9:1である。非限定的な例として、パッセンジャー鎖対ガイド鎖比はインビボで9:1である。
一実施形態において、パッセンジャー鎖対ガイド鎖(P:G)(センス鎖対アンチセンス鎖とも称される)の発現比は2より大きい。
一実施形態において、パッセンジャー鎖対ガイド鎖(P:G)(センス鎖対アンチセンス鎖とも称される)の発現比は10より大きい。
一実施形態において、パッセンジャー鎖対ガイド鎖(P:G)(センス鎖対アンチセンス鎖とも称される)の発現比は50より大きい。
一実施形態において、パッセンジャー鎖対ガイド鎖(P:G)(センス鎖対アンチセンス鎖とも称される)の発現比は少なくとも5:1である。
一実施形態において、パッセンジャー鎖対ガイド鎖(P:G)(センス鎖対アンチセンス鎖とも称される)の発現比は少なくとも20:1である。
一実施形態において、パッセンジャー鎖-ガイド鎖二重鎖は、プリマイクロ又はプレマイクロRNAが、しかし当該技術分野において公知の及び本明細書に記載される方法、プロセシングを測定したとき2倍より高いガイド鎖対パッセンジャー鎖比を示す場合に有効と見なされる。非限定的な例として、プリマイクロ又はプレマイクロRNAは、プロセシングを測定したとき、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍、15倍より高い、又は2~5倍、2~10倍、2~15倍、3~5倍、3~10倍、3~15倍、4~5倍、4~10倍、4~15倍、5~10倍、5~15倍、6~10倍、6~15倍、7~10倍、7~15倍、8~10倍、8~15倍、9~10倍、9~15倍、10~15倍、11~15倍、12~15倍、13~15倍、又は14~15倍のガイド鎖対パッセンジャー鎖比を示す。
一部の実施形態において、本発明のsiRNA分子は、前駆体又はDNAとして送達されるのでない場合、限定はされないがインビボでのsiRNAの安定性の増加など、RNA分子の幾つかの特徴を調節するように化学的に修飾されてもよい。化学的に修飾されたsiRNA分子はヒトの治療適用において使用することができ、siRNA分子のRNAi活性を損なうことなく改良される。非限定的な例として、センス鎖及びアンチセンス鎖の両方の3’末端及び5’末端の両方で修飾されたsiRNA分子。
一実施形態において、修飾ヌクレオチドは骨格修飾ヌクレオチドであってもよい。一部の実施形態において、本発明のsiRNA二重鎖は骨格に他の修飾を更に含み得る。通常の「骨格」は、本明細書で使用されるとき、DNA又はRNA分子における交互に繰り返す糖-リン酸配列を指す。デオキシリボース/リボース糖が3’-ヒドロキシル基及び5’-ヒドロキシル基の両方においてエステル結合でリン酸基につなぎ合わされ、これは「リン酸ジエステル」結合/リンカーとしても知られる(PO連結)。PO骨格は「ホスホロチオエート骨格」として修飾されてもよい(PS連結)。ある場合には、天然のリン酸ジエステル結合がアミド結合によって置き換えられてもよく、但し2つの糖単位間の4つの原子は保たれる。かかるアミド修飾は、オリゴヌクレオチドの固相合成を促進し、siRNA相補体と形成された二重鎖の熱力学的安定性を増加させることができる。例えばメスマエカー(Mesmaeker)ら著、ピュア・アンド・アプライド・ケミストリー(Pure & Appl.Chem.)、1997年、第3巻、p.437~440を参照のこと;この内容は全体として参照により本明細書に援用される。
別の実施形態において、修飾ヌクレオチドはアンチセンス鎖上にだけあってもよい。
一部の実施形態において、修飾ヌクレオチドはセンス鎖及びアンチセンス鎖の両方にあってもよい。
分子足場
一実施形態において、siRNA分子は、分子足場もまた含む調節性ポリヌクレオチドにコードされてもよい。本明細書で使用されるとき「分子足場」は、それに対して後続の分子を設計又は作製する配列又は構造基盤を形成するフレームワーク又は出発分子である。
一実施形態において、分子足場は、5’フランキング領域、ループモチーフ領域及び/又は3’フランキング領域を含む。
一実施形態において、調節性ポリヌクレオチドのステムループ構造のセンス配列とアンチセンス配列とをループ配列(ループモチーフ、リンカー又はリンカーモチーフとしても知られる)が分離している。ループ配列は、任意の長さ、4~30ヌクレオチド、4~20ヌクレオチド、4~15ヌクレオチド、5~15ヌクレオチド、6~12ヌクレオチド、6ヌクレオチド、7ヌクレオチド、8ヌクレオチド、9ヌクレオチド、10ヌクレオチド、11ヌクレオチド、12ヌクレオチド、13ヌクレオチド、14ヌクレオチド、及び/又は15ヌクレオチドであってもよい。
一実施形態において、分子足場は、少なくとも1つの5F2フランキング領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、少なくとも1つの5F4フランキング領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、少なくとも1つの5F6フランキング領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、表7に挙げられる少なくとも1つのループモチーフ領域をコードする少なくとも1つの核酸配列を含み得る。非限定的な例として、ループモチーフ領域は、L1、L2、L3、L4、L5、L6、L7、又はL8であってもよい。
一実施形態において、分子足場は、少なくとも1つのL2ループモチーフ領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、少なくとも1つのL4ループモチーフ領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、少なくとも1つのL6ループモチーフ領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、少なくとも1つのL8ループモチーフ領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、少なくとも1つの3F2フランキング領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、少なくとも1つの3F4フランキング領域をコードする少なくとも1つの核酸配列を含み得る。
一実施形態において、分子足場は、表6及び表7に記載されるとおりの少なくとも1つの5’フランキング領域及び少なくとも1つのループモチーフ領域をコードする少なくとも1つの核酸配列を含み得る。非限定的な例として、5’フランキング領域及びループモチーフ領域は、5F1及びL1、5F1及びL2、5F1及びL3、5F1及びL4、5F1及びL5、5F1及びL6、5F1及びL7、5F1及びL8、5F2及びL1、5F2及びL2、5F2及びL3、5F2及びL4、5F2及びL5、5F2及びL6、5F2及びL7、5F2及びL8、5F3及びL1、5F3及びL2、5F3及びL3、5F3及びL4、5F3及びL5、5F3及びL6、5F3及びL7、5F3及びL8、5F4及びL1、5F4及びL2、5F4及びL3、5F4及びL4、5F4及びL5、5F4及びL6、5F4及びL7、5F4及びL8、5F5及びL1、5F5及びL2、5F5及びL3、5F5及びL4、5F5及びL5、5F5及びL6、5F5及びL7、5F5及びL8、5F6及びL1、5F6及びL2、5F6及びL3、5F6及びL4、5F6及びL5、5F6及びL6、5F6及びL7、5F6及びL8、5F7及びL1、5F7及びL2、5F7及びL3、5F7及びL4、5F7及びL5、5F7及びL6、5F7及びL7、並びに5F7及びL8であってもよい。
一実施形態において、分子足場は当該技術分野において公知の1つ以上のリンカーを含み得る。リンカーは、領域間を、又は1つの分子足場を別の分子足場と分離し得る。非限定的な例として、分子足場はポリシストロン性であってもよい。
一実施形態において、分子足場は、CMVプロモータ、その断片又は変異体の下流に位置してもよい。
一実施形態において、分子足場は、CMVプロモータの下流に位置する天然pri-miRNA足場であってもよい。非限定的な例として、天然pri-miRNA足場はヒトmiR155足場に由来する。
一実施形態において、分子足場及び調節性ポリヌクレオチドの選択は、pri-miRNA内での調節性ポリヌクレオチドを比較する方法によって決定される(例えば、ミニアリコバ(Miniarikova)ら著、「ハンチントン病に対する遺伝子療法を開発するためのハンチンチンを標的とする治療用miRNAの設計、特徴付け、及びリード選択(Design,Characterization,and Lead Selection of Therapeutic miRNAs Targeting Huntingtin for Development of Gene Therapy for Huntington’s Disease)」、モレキュラー・セラピー-ヌクレイック・アシッド(Molecular Therapy-Nucleic Acids)、2016年、第5巻、p.e297及び国際公開第2016102664号パンフレット(これらの各々の内容は本明細書において全体として参照により援用される)により記載される方法を参照のこと)。調節性ポリヌクレオチドは、限定はされないが、エクソン1、CAGリピート、エクソン50のSNP rs362331及び/又はエクソン67のSNP rs362307を標的とし得る。調節性ポリヌクレオチドの活性を評価するため、使用し得る使用される分子足場は、ヒトpri-miRNA足場(例えば、miR155足場)であり、プロモータはCMVであってもよい。活性はインビトロでHEK293T細胞及びレポータ(例えばルシフェラーゼ)を用いて決定されてもよい。エクソン1のターゲティングについては、ノックダウンが80%以上である場合に、その調節性ポリヌクレオチドはHTTノックダウンに有効であると決定される。CAGのターゲティングについては、ノックダウンが少なくとも60%である場合に、その調節性ポリヌクレオチドはHTTノックダウンに有効であると決定される。SNPのターゲティングについては、ノックダウンが少なくとも60%である場合に、その調節性ポリヌクレオチドはHTTノックダウンに有効であると決定される。CAGリピート又はSNPターゲティングに関する対立遺伝子選択性のため、調節性ポリヌクレオチドは、対立遺伝子選択性を改善するため少なくとも1つの置換を含み得る。非限定的な例として、置換は、G又はCをT又は対応するUに置き換えるもの、及びA又はT/UをCによって置き換えるものであり得る。
一部の実施形態において、本明細書に記載されるsiRNA分子はプラスミド又はウイルスベクターなどのベクターによってコードされ得る。一実施形態において、siRNA分子はウイルスベクターによってコードされる。ウイルスベクターは、限定はされないが、ヘルペスウイルス(HSV)ベクター、レトロウイルスベクター、アデノウイルスベクター、アデノ随伴ウイルスベクター、レンチウイルスベクターなどであってもよい。一部の具体的な実施形態において、ウイルスベクターはAAVベクターである。
一部の実施形態において、HTT遺伝子を標的とするsiRNA二重鎖はレトロウイルスベクターによってコードされてもよい(例えば、米国特許第5,399,346号明細書;同第5,124,263号明細書;同第4,650,764号明細書及び同第4,980,289号明細書を参照のこと;これらの各々の内容は全体として参照により本明細書に援用される)。
アデノウイルスは、インビボで核酸が種々の細胞型に効率的に送達されるように修飾することのできる真核生物DNAウイルスであり、神経細胞への遺伝子のターゲティングを含め、遺伝子療法プロトコルにおいて広範に用いられている。核酸療法薬向けに様々な複製欠損アデノウイルス及び最小アデノウイルスベクターが記載されている(例えば、国際公開第199426914号パンフレット、同第199502697号パンフレット、同第199428152号パンフレット、同第199412649号パンフレット、同第199502697号パンフレット及び同第199622378号パンフレットを参照のこと;これらの各々の内容は全体として参照により援用される)。かかるアデノウイルスベクターはまた、細胞への本発明のsiRNA分子の送達にも使用することができる。
アデノ随伴ウイルス(AAV)は、(他のパルボウイルスと同様に)依存性パルボウイルスであって、約5000ヌクレオチド長のゲノムを有する一本鎖非エンベロープDNAウイルスであり、且つ複製に関与するタンパク質(Rep)及びカプシドの構造タンパク質(Cap)をコードする2つのオープンリーディングフレームを含むものである。これらのオープンリーディングフレームには、ウイルスゲノムの複製起点として働く2つの末端逆位配列(ITR)配列が隣接する。更に、AAVゲノムはパッケージング配列を含み、ウイルスゲノムをAAVカプシドにパッケージングすることが可能である。AAVベクターは、感染細胞において増殖性感染を起こすのにコヘルパー(例えばアデノウイルス)を必要とする。かかるヘルパー機能がないとき、AAVビリオンは本質的に宿主細胞に侵入するものの、細胞のゲノムに組み込まれない。
AAVベクターは、送達効率が増強されるように修飾されてもよい。本発明のsiRNA分子をコードする核酸配列を含むかかる修飾AAVベクターは、効率的にパッケージングされることができ、及び標的細胞を高頻度且つ最小限の毒性で首尾よく感染させるために使用することができる。
一実施形態において、本発明に使用されるAAVベクターは一本鎖ベクター(ssAAV)である。
AAVベクターを作製及び/又は修飾する方法は、シュードタイプAAVベクターなど、当該技術分野において開示されている(国際公開第200028004号パンフレット;同第200123001号パンフレット;同第2004112727号パンフレット;同第2005005610号パンフレット及び同第2005072364号パンフレット、これらの各々の内容は全体として参照により本明細書に援用される)。
本発明のAAV粒子は任意の天然又は組換えAAV血清型を含んでもよく、又はそれに由来してもよい。本発明によれば、AAV粒子は以下のいずれか、AAV1、AAV2、AAV2G9、AAV3、AAV3a、AAV3b、AAV3-3、AAV4、AAV4-4、AAV5、AAV6、AAV6.1、AAV6.2、AAV6.1.2、AAV7、AAV7.2、AAV8、AAV9、AAV9.11、AAV9.13、AAV9.16、AAV9.24、AAV9.45、AAV9.47、AAV9.61、AAV9.68、AAV9.84、AAV9.9、AAV10、AAV11、AAV12、AAV16.3、AAV24.1、AAV27.3、AAV42.12、AAV42-1b、AAV42-2、AAV42-3a、AAV42-3b、AAV42-4、AAV42-5a、AAV42-5b、AAV42-6b、AAV42-8、AAV42-10、AAV42-11、AAV42-12、AAV42-13、AAV42-15、AAV42-aa、AAV43-1、AAV43-12、AAV43-20、AAV43-21、AAV43-23、AAV43-25、AAV43-5、AAV44.1、AAV44.2、AAV44.5、AAV223.1、AAV223.2、AAV223.4、AAV223.5、AAV223.6、AAV223.7、AAV1-7/rh.48、AAV1-8/rh.49、AAV2-15/rh.62、AAV2-3/rh.61、AAV2-4/rh.50、AAV2-5/rh.51、AAV3.1/hu.6、AAV3.1/hu.9、AAV3-9/rh.52、AAV3-11/rh.53、AAV4-8/r11.64、AAV4-9/rh.54、AAV4-19/rh.55、AAV5-3/rh.57、AAV5-22/rh.58、AAV7.3/hu.7、AAV16.8/hu.10、AAV16.12/hu.11、AAV29.3/bb.1、AAV29.5/bb.2、AAV106.1/hu.37、AAV114.3/hu.40、AAV127.2/hu.41、AAV127.5/hu.42、AAV128.3/hu.44、AAV130.4/hu.48、AAV145.1/hu.53、AAV145.5/hu.54、AAV145.6/hu.55、AAV161.10/hu.60、AAV161.6/hu.61、AAV33.12/hu.17、AAV33.4/hu.15、AAV33.8/hu.16、AAV52/hu.19、AAV52.1/hu.20、AAV58.2/hu.25、AAVA3.3、AAVA3.4、AAVA3.5、AAVA3.7、AAVC1、AAVC2、AAVC5、AAV-DJ、AAV-DJ8、AAVF3、AAVF5、AAVH2、AAVrh.72、AAVhu.8、AAVrh.68、AAVrh.70、AAVpi.1、AAVpi.3、AAVpi.2、AAVrh.60、AAVrh.44、AAVrh.65、AAVrh.55、AAVrh.47、AAVrh.69、AAVrh.45、AAVrh.59、AAVhu.12、AAVH6、AAVLK03、AAVH-1/hu.1、AAVH-5/hu.3、AAVLG-10/rh.40、AAVLG-4/rh.38、AAVLG-9/hu.39、AAVN721-8/rh.43、AAVCh.5、AAVCh.5R1、AAVcy.2、AAVcy.3、AAVcy.4、AAVcy.5、AAVCy.5R1、AAVCy.5R2、AAVCy.5R3、AAVCy.5R4、AAVcy.6、AAVhu.1、AAVhu.2、AAVhu.3、AAVhu.4、AAVhu.5、AAVhu.6、AAVhu.7、AAVhu.9、AAVhu.10、AAVhu.11、AAVhu.13、AAVhu.15、AAVhu.16、AAVhu.17、AAVhu.18、AAVhu.20、AAVhu.21、AAVhu.22、AAVhu.23.2、AAVhu.24、AAVhu.25、AAVhu.27、AAVhu.28、AAVhu.29、AAVhu.29R、AAVhu.31、AAVhu.32、AAVhu.34、AAVhu.35、AAVhu.37、AAVhu.39、AAVhu.40、AAVhu.41、AAVhu.42、AAVhu.43、AAVhu.44、AAVhu.44R1、AAVhu.44R2、AAVhu.44R3、AAVhu.45、AAVhu.46、AAVhu.47、AAVhu.48、AAVhu.48R1、AAVhu.48R2、AAVhu.48R3、AAVhu.49、AAVhu.51、AAVhu.52、AAVhu.54、AAVhu.55、AAVhu.56、AAVhu.57、AAVhu.58、AAVhu.60、AAVhu.61、AAVhu.63、AAVhu.64、AAVhu.66、AAVhu.67、AAVhu.14/9、AAVhu.t 19、AAVrh.2、AAVrh.2R、AAVrh.8、AAVrh.8R、AAVrh.10、AAVrh.12、AAVrh.13、AAVrh.13R、AAVrh.14、AAVrh.17、AAVrh.18、AAVrh.19、AAVrh.20、AAVrh.21、AAVrh.22、AAVrh.23、AAVrh.24、AAVrh.25、AAVrh.31、AAVrh.32、AAVrh.33、AAVrh.34、AAVrh.35、AAVrh.36、AAVrh.37、AAVrh.37R2、AAVrh.38、AAVrh.39、AAVrh.40、AAVrh.46、AAVrh.48、AAVrh.48.1、AAVrh.48.1.2、AAVrh.48.2、AAVrh.49、AAVrh.51、AAVrh.52、AAVrh.53、AAVrh.54、AAVrh.56、AAVrh.57、AAVrh.58、AAVrh.61、AAVrh.64、AAVrh.64R1、AAVrh.64R2、AAVrh.67、AAVrh.73、AAVrh.74、AAVrh8R、AAVrh8R A586R突然変異体、AAVrh8R R533A突然変異体、AAAV、BAAV、ヤギAAV、ウシAAV、AAVhE1.1、AAVhEr1.5、AAVhER1.14、AAVhEr1.8、AAVhEr1.16、AAVhEr1.18、AAVhEr1.35、AAVhEr1.7、AAVhEr1.36、AAVhEr2.29、AAVhEr2.4、AAVhEr2.16、AAVhEr2.30、AAVhEr2.31、AAVhEr2.36、AAVhER1.23、AAVhEr3.1、AAV2.5T、AAV-PAEC、AAV-LK01、AAV-LK02、AAV-LK03、AAV-LK04、AAV-LK05、AAV-LK06、AAV-LK07、AAV-LK08、AAV-LK09、AAV-LK10、AAV-LK11、AAV-LK12、AAV-LK13、AAV-LK14、AAV-LK15、AAV-LK16、AAV-LK17、AAV-LK18、AAV-LK19、AAV-PAEC2、AAV-PAEC4、AAV-PAEC6、AAV-PAEC7、AAV-PAEC8、AAV-PAEC11、AAV-PAEC12、AAV-2-pre-miRNA-101、AAV-8h、AAV-8b、AAV-h、AAV-b、AAV SM 10-2、AAVシャッフル100-1、AAVシャッフル100-3、AAVシャッフル100-7、AAVシャッフル10-2、AAVシャッフル10-6、AAVシャッフル10-8、AAVシャッフル100-2、AAV SM 10-1、AAV SM 10-8、AAV SM 100-3、AAV SM 100-10、BNP61 AAV、BNP62 AAV、BNP63 AAV、AAVrh.50、AAVrh.43、AAVrh.62、AAVrh.48、AAVhu.19、AAVhu.11、AAVhu.53、AAV4-8/rh.64、AAVLG-9/hu.39、AAV54.5/hu.23、AAV54.2/hu.22、AAV54.7/hu.24、AAV54.1/hu.21、AAV54.4R/hu.27、AAV46.2/hu.28、AAV46.6/hu.29、AAV128.1/hu.43、トゥルータイプAAV(ttAAV)、UPENN AAV10、ジャパニーズAAV10血清型、AAV CBr-7.1、AAV CBr-7.10、AAV CBr-7.2、AAV CBr-7.3、AAV CBr-7.4、AAV CBr-7.5、AAV CBr-7.7、AAV CBr-7.8、AAV CBr-B7.3、AAV CBr-B7.4、AAV CBr-E1、AAV CBr-E2、AAV CBr-E3、AAV CBr-E4、AAV CBr-E5、AAV CBr-e5、AAV CBr-E6、AAV CBr-E7、AAV CBr-E8、AAV CHt-1、AAV CHt-2、AAV CHt-3、AAV CHt-6.1、AAV CHt-6.10、AAV CHt-6.5、AAV CHt-6.6、AAV CHt-6.7、AAV CHt-6.8、AAV CHt-P1、AAV CHt-P2、AAV CHt-P5、AAV CHt-P6、AAV CHt-P8、AAV CHt-P9、AAV CKd-1、AAV CKd-10、AAV CKd-2、AAV CKd-3、AAV CKd-4、AAV CKd-6、AAV CKd-7、AAV CKd-8、AAV CKd-B1、AAV CKd-B2、AAV CKd-B3、AAV CKd-B4、AAV CKd-B5、AAV CKd-B6、AAV CKd-B7、AAV CKd-B8、AAV CKd-H1、AAV CKd-H2、AAV CKd-H3、AAV CKd-H4、AAV CKd-H5、AAV CKd-H6、AAV CKd-N3、AAV CKd-N4、AAV CKd-N9、AAV CLg-F1、AAV CLg-F2、AAV CLg-F3、AAV CLg-F4、AAV CLg-F5、AAV CLg-F6、AAV CLg-F7、AAV CLg-F8、AAV CLv-1、AAV CLv1-1、AAV Clv1-10、AAV CLv1-2、AAV CLv-12、AAV CLv1-3、AAV CLv-13、AAV CLv1-4、AAV Clv1-7、AAV Clv1-8、AAV Clv1-9、AAV CLv-2、AAV CLv-3、AAV CLv-4、AAV CLv-6、AAV CLv-8、AAV CLv-D1、AAV CLv-D2、AAV CLv-D3、AAV CLv-D4、AAV CLv-D5、AAV CLv-D6、AAV CLv-D7、AAV CLv-D8、AAV CLv-E1、AAV CLv-K1、AAV CLv-K3、AAV CLv-K6、AAV CLv-L4、AAV CLv-L5、AAV CLv-L6、AAV CLv-M1、AAV CLv-M11、AAV CLv-M2、AAV CLv-M5、AAV CLv-M6、AAV CLv-M7、AAV CLv-M8、AAV CLv-M9、AAV CLv-R1、AAV CLv-R2、AAV CLv-R3、AAV CLv-R4、AAV CLv-R5、AAV CLv-R6、AAV CLv-R7、AAV CLv-R8、AAV CLv-R9、AAV CSp-1、AAV CSp-10、AAV CSp-11、AAV CSp-2、AAV CSp-3、AAV CSp-4、AAV CSp-6、AAV CSp-7、AAV CSp-8、AAV CSp-8.10、AAV CSp-8.2、AAV CSp-8.4、AAV CSp-8.5、AAV CSp-8.6、AAV CSp-8.7、AAV CSp-8.8、AAV CSp-8.9、AAV CSp-9、AAV.hu.48R3、AAV.VR-355、AAV3B、AAV4、AAV5、AAVF1/HSC1、AAVF11/HSC11、AAVF12/HSC12、AAVF13/HSC13、AAVF14/HSC14、AAVF15/HSC15、AAVF16/HSC1
6、AAVF17/HSC17、AAVF2/HSC2、AAVF3/HSC3、AAVF4/HSC4、AAVF5/HSC5、AAVF6/HSC6、AAVF7/HSC7、AAVF8/HSC8、AAVF9/HSC9、AAV-PHP.B(PHP.B)、AAV-PHP.A(PHP.A)、G2B-26、G2B-13、TH1.1-32及び/又はTH1.1-35、及びこれらのバリアントから選択される血清型を利用してもよく、又はそれをベースとしてもよい。非限定的な例として、組換えAAVウイルスのカプシドはAAV1である。非限定的な例として、組換えAAVウイルスのカプシドはAAV2である。非限定的な例として、組換えAAVウイルスのカプシドはAAVrh10である。非限定的な例として、組換えAAVウイルスのカプシドはAAV9(hu14)である。非限定的な例として、組換えAAVウイルスのカプシドはAAV-DJである。非限定的な例として、組換えAAVウイルスのカプシドはAAV9.47である。非限定的な例として、組換えAAVウイルスのカプシドはAAV-DJ8である。非限定的な例として、組換えAAVウイルスのカプシドはAAV-PHP.Bである。非限定的な例として、組換えAAVウイルスのカプシドはAAV-PHP.Aである。
際公開第2005033321号パンフレットの配列番号97)、AAVrh.55(国際公開第2005033321号パンフレット配列番号37)、AAVrh.56(国際公開第2005033321号パンフレットの配列番号152)、AAVrh.57(国際公開第2005033321号パンフレットの配列番号105)、AAVrh.58(国際公開第2005033321号パンフレットの配列番号106)、AAVrh.59(国際公開第2005033321号パンフレット配列番号42)、AAVrh.60(国際公開第2005033321号パンフレット配列番号31)、AAVrh.61(国際公開第2005033321号パンフレットの配列番号107)、AAVrh.62(国際公開第2005033321号パンフレットの配列番号114)、AAVrh.64(国際公開第2005033321号パンフレットの配列番号99)、AAVrh.65(国際公開第2005033321号パンフレット配列番号35)、AAVrh.68(国際公開第2005033321号パンフレット配列番号16)、AAVrh.69(国際公開第2005033321号パンフレット配列番号39)、AAVrh.70(国際公開第2005033321号パンフレット配列番号20)、AAVrh.72(国際公開第2005033321号パンフレット配列番号9)、又はこれらのバリアントなど、限定はされないが、AAVcy.2、AAVcy.3、AAVcy.4、AAVcy.5、AAVcy.6、AAVrh.12、AAVrh.17、AAVrh.18、AAVrh.19、AAVrh.21、AAVrh.22、AAVrh.23、AAVrh.24、AAVrh.25、AAVrh.25/42 15、AAVrh.31、AAVrh.32、AAVrh.33、AAVrh.34、AAVrh.35、AAVrh.36、AAVrh.37、AAVrh14を含め、国際公開第2005033321号パンフレット(この内容は本明細書において全体として参照により援用される)に記載されるとおりの配列であってもよく、又はそれを有してもよい。バリアントの非限定的な例としては、国際公開第2005033321号パンフレット(この内容は本明細書において全体として参照により援用される)の配列番号13、15、17、19、24、36、40、45、47、48、51~54、60~62、64~77、79、80、82、89、90、93~95、98、100、101、109~113、118~120、124、126、131、139、142、151、154、158、161、162、165~183、202、204~212、215、219、224~236が挙げられる。
一実施形態において、AAVは、表11にある配列の配列、その断片又は変異体を含んでもよい。
本発明のAAV粒子は、少なくとも1つのITR領域とペイロード領域とを有するウイルスゲノムを含む。一実施形態において、ウイルスゲノムは2つのITRを有する。これらの2つのITRは5’末端及び3’末端でペイロード領域に隣接する。ITRは、複製のための認識部位を含む複製起点として働く。ITRは、相補的で且つ対称に配置され得る配列領域を含む。本発明のウイルスゲノムに組み込まれるITRは、天然に存在するポリヌクレオチド配列又は組換え的に誘導されたポリヌクレオチド配列を含み得る。
当業者は、標的細胞が、限定はされないが、種特異的、誘導性、組織特異的、又は細胞周期特異的であるプロモータを含め、特異的プロモータを必要とし得ることを認識し得る(パー(Parr)ら著、ネイチャー・メディシン(Nat.Med.)、第3巻、p.1145~9、1997年;これらの内容は本明細書において全体として参照により援用される)。
一実施形態において、プロモータは、標的とする細胞に向性を有するプロモータである。
一実施形態において、ベクターゲノムはP1プロモータを含む。
一実施形態において、ベクターゲノムはFXNプロモータを含む。
一実施形態において、ベクターゲノムはCBAプロモータを含む。
一実施形態において、ベクターゲノムはCMVプロモータを含む。
一実施形態において、ベクターゲノムはU6プロモータを含む。
一実施形態において、ベクターゲノムは肝又は骨格筋プロモータを含む。肝プロモータの非限定的な例としては、hAAT及びTBGが挙げられる。骨格筋プロモータの非限定的な例としては、デスミン、MCK及びC5-12が挙げられる。
ウイルスゲノム成分:イントロン
一実施形態において、ベクターゲノムは、イントロンなど、トランス遺伝子標的特異性及び発現を増強する少なくとも1つのエレメントを含む(例えば、パウエル(Powell)ら著、「遺伝子療法におけるトランス遺伝子標的特異性及び発現を増強するウイルス発現カセットエレメント(Viral Expression Cassette Elements to Enhance Transgene Target Specificity and Expression in Gene Therapy)」、2015年を参照のこと;この内容は本明細書において全体として参照により援用される)。イントロンの非限定的な例としては、MVM(67~97bps)、F.IXトランケート型イントロン1(300bp)、β-グロビンSD/免疫グロブリン重鎖スプライスアクセプター(250bp)、アデノウイルススプライスドナー/イムノグロビンスプライスアクセプター(500bp)、SV40後期スプライスドナー/スプライスアクセプター(19S/16S)(180bp)及びハイブリッドアデノウイルススプライスドナー/IgGスプライスアクセプター(230bp)が挙げられる。
一実施形態において、AAVベクターはU6プロモータを含み得る。
一実施形態において、AAVベクターはCMV及びU6プロモータを含み得る。
一実施形態において、AAVベクターはCBAプロモータを含み得る。
一実施形態において、コード化siRNA分子は、限定はされないが、CMV、U6、H1、CBA、又はSV40、βグロビン若しくは当該技術分野において公知の他のものなどのイントロンを伴うCBAプロモータなど、発現ベクターにおいてプロモータの下流に位置してもよい。更に、コード化siRNA分子はまた、発現ベクターにおいてポリアデニル化配列の上流に位置してもよい。非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流に1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30ヌクレオチド又は30ヌクレオチド超以内に位置してもよい。別の非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流に1~5、1~10、1~15、1~20、1~25、1~30、5~10、5~15、5~20、5~25、5~30、10~15、10~20、10~25、10~30、15~20、15~25、15~30、20~25、20~30又は25~30ヌクレオチド以内に位置してもよい。非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流にあるヌクレオチドの最初の1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%又は25%超以内に位置してもよい。別の非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流に最初の1~5%、1~10%、1~15%、1~20%、1~25%、5~10%、5~15%、5~20%、5~25%、10~15%、10~20%、10~25%、15~20%、15~25%、又は20~25%で位置してもよい。
一実施形態において、本発明のAAV粒子のウイルスゲノムは少なくとも1つのポリアデニル化配列を含む。AAV粒子のウイルスゲノムは、ペイロードコード配列の3’末端と3’ITRの5’末端との間にポリアデニル化配列を含み得る。
一実施形態において、ポリアデニル化配列は50~150ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は50~160ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は60~100ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は60~150ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は60~200ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は70~100ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は70~160ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は70~200ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は80~150ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は80~160ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は90~100ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は90~150ヌクレオチド長である。
一実施形態において、ポリアデニル化配列は90~200ヌクレオチド長である。
一実施形態において、コード化siRNA分子は発現ベクターにおいてポリアデニル化配列の上流に位置してもよい。更に、コード化siRNA分子は、限定はされないが、CMV、U6、H1、CBA、又はSV40若しくはβグロビンイントロンを伴うCBAプロモータなど、発現ベクターにおいてプロモータの下流に位置してもよい。非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流に1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30ヌクレオチド又は30ヌクレオチド超以内に位置してもよい。別の非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流に1~5、1~10、1~15、1~20、1~25、1~30、5~10、5~15、5~20、5~25、5~30、10~15、10~20、10~25、10~30、15~20、15~25、15~30、20~25、20~30又は25~30ヌクレオチド以内に位置してもよい。非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流にあるヌクレオチドの最初の1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%又は25%超以内に位置してもよい。別の非限定的な例として、コード化siRNA分子は、発現ベクターにおいてプロモータから下流及び/又はポリアデニル化配列の上流に最初の1~5%、1~10%、1~15%、1~20%、1~25%、5~10%、5~15%、5~20%、5~25%、10~15%、10~20%、10~25%、15~20%、15~25%、又は20~25%で位置してもよい。
一実施形態において、発現ベクター(例えばAAVベクター)は、本明細書に記載されるsiRNA配列又は二重鎖のうちの少なくとも1つをコードする調節性ポリヌクレオチドの少なくとも1つを含み得る。
一実施形態において、本明細書に記載される調節性ポリヌクレオチドをコードする核酸配列を含むベクターゲノムは、一本鎖又は二本鎖ベクターゲノムであってもよい。ベクターゲノムのサイズは、小型、中型、大型又は最大サイズであってもよい。加えて、ベクターゲノムはプロモータ及びポリAテールを含み得る。
本開示は、ウイルス複製細胞をAAVポリヌクレオチド又はAAVゲノムに接触させることを含む、ウイルス複製細胞におけるウイルスゲノム複製によるパルボウイルス粒子、例えばAAV粒子の作成方法を提供する。
本開示は、AAVポリヌクレオチド及び/又はAAVゲノムを含む細胞を提供する。
本明細書に開示されるウイルス作製は、ペイロード分子をコードするポリヌクレオチド配列を含むペイロードコンストラクト、例えば組換えウイルスコンストラクトを送達するため標的細胞に接触するAAV粒子の作製プロセス及び方法を記載する。
培養下の昆虫細胞の成長条件、及び培養下の昆虫細胞における異種産物の産生は当該技術分野において周知であり、米国特許第6,204,059号明細書(この内容は本明細書において全体として参照により援用される)を参照されたい。
本明細書に開示されるウイルス作製は、ペイロードをコードするポリヌクレオチド配列を含むペイロード、例えば組換えウイルスコンストラクトを送達するため標的細胞に接触するAAV粒子の作製プロセス及び方法を記載する。
組換えAAV粒子の作製に一般的に使用されるウイルス複製細胞としては、限定はされないが、米国特許第6,156,303号明細書、同第5,387,484号明細書、同第5,741,683号明細書、同第5,691,176号明細書、及び同第5,688,676号明細書;米国特許出願公開第2002/0081721号明細書、及び国際公開第00/47757号パンフレット、同第00/24916号パンフレット、及び同第96/17947号パンフレット(これらの各々の内容は本明細書において全体として参照により援用される)に記載されるとおりの、293細胞、COS細胞、HeLa細胞、KB細胞、及び他の哺乳類細胞株が挙げられる。
本明細書に開示される粒子作製は、ペイロードをコードするポリヌクレオチド配列を含むペイロードコンストラクトを送達するため標的細胞に接触するAAV粒子の作製プロセス及び方法を記載する。
一部の実施形態において、AAV粒子作製は、作製規模を増加させるように改良されてもよい。本開示に係る大規模ウイルス作製方法には、米国特許第5,756,283号明細書、同第6,258,595号明細書、同第6,261,551号明細書、同第6,270,996号明細書、同第6,281,010号明細書、同第6,365,394号明細書、同第6,475,769号明細書、同第6,482,634号明細書、同第6,485,966号明細書、同第6,943,019号明細書、同第6,953,690号明細書、同第7,022,519号明細書、同第7,238,526号明細書、同第7,291,498号明細書及び同第7,491,508号明細書又は国際公開第1996039530号パンフレット、同第1998010088号パンフレット、同第1999014354号パンフレット、同第1999015685号パンフレット、同第1999047691号パンフレット、同第2000055342号パンフレット、同第2000075353号パンフレット及び同第2001023597号パンフレット(これらの各々の内容は本明細書において全体として参照により援用される)に教示されるもののいずれかが含まれてもよい。ウイルス粒子作製規模を増加させる方法は、典型的には、ウイルス複製細胞の数を増加させることを含む。一部の実施形態において、ウイルス複製細胞は接着細胞を含む。接着ウイルス複製細胞によるウイルス粒子作製規模の増加には、より大きい細胞培養表面が必要である。ある場合には、大規模作製方法は、細胞培養表面を増加させるためのローラボトルの使用を含む。表面積が増加した他の細胞培養基材が当該技術分野において公知である。表面積が増加した更なる接着細胞培養製品の例としては、限定はされないが、セルスタック(登録商標)(CELLSTACK(登録商標))、セルキューブ(登録商標)(CELLCUBE(登録商標))(コーニング社(Corning Corp.)、ニューヨーク州コーニング(Corning))及びヌンク(商標)(NUNC(商標))セル・ファクトリー(商標)(CELL FACTORY(商標))(サーモ・サイエンティフィック(Thermo Scientific)、マサチューセッツ州ウォルサム(Waltham))が挙げられる。ある場合には、大規模接着細胞表面は約1,000cm2~約100,000cm2を含み得る。ある場合には、大規模接着細胞培養物は、約107~約109細胞、約108~約1010細胞、約109~約1012細胞又は少なくとも1012細胞を含み得る。ある場合には、大規模接着培養物は、約109~約1012、約1010~約1013、約1011~約1014、約1012~約1015又は少なくとも1015ウイルス粒子を作製し得る。
一部の実施形態において、大規模ウイルス作製には細胞培養バイオリアクターが用いられ得る。ある場合には、バイオリアクターは撹拌槽型リアクターを含む。かかるリアクターは、概して、典型的には円筒形状の、撹拌機(例えばインペラ)を備えたベッセルを含む。一部の実施形態において、かかるバイオリアクターベッセルは、ベッセル温度を制御し、及び/又は周囲温度の変化による影響を最小限に抑えるため、ウォータジャケット内に置かれ得る。バイオリアクターベッセル容積は、サイズが約500ml~約2L、約1L~約5L、約2.5L~約20L、約10L~約50L、約25L~約100L、約75L~約500L、約250L~約2,000L、約1,000L~約10,000L、約5,000L~約50,000L又は少なくとも50,000Lの範囲であり得る。ベッセルの底は丸底又は平底であり得る。ある場合には、動物細胞培養物が丸底ベッセルのバイオリアクターに維持され得る。
本発明の細胞は、限定はされないがウイルス作製細胞を含め、当該技術分野において公知の任意の方法により細胞溶解に供されてもよい。細胞溶解は、本発明の任意の細胞内に存在する1つ以上の薬剤(例えばウイルス粒子)を入手するために行われ得る。一部の実施形態において、細胞溶解は、米国特許第7,326,555号明細書、同第7,579,181号明細書、同第7,048,920号明細書、同第6,410,300号明細書、同第6,436,394号明細書、同第7,732,129号明細書、同第7,510,875号明細書、同第7,445,930号明細書、同第6,726,907号明細書、同第6,194,191号明細書、同第7,125,706号明細書、同第6,995,006号明細書、同第6,676,935号明細書、同第7,968,333号明細書、同第5,756,283号明細書、同第6,258,595号明細書、同第6,261,551号明細書、同第6,270,996号明細書、同第6,281,010号明細書、同第6,365,394号明細書、同第6,475,769号明細書、同第6,482,634号明細書、同第6,485,966号明細書、同第6,943,019号明細書、同第6,953,690号明細書、同第7,022,519号明細書、同第7,238,526号明細書、同第7,291,498号明細書及び同第7,491,508号明細書又は国際公開第1996039530号パンフレット、同第1998010088号パンフレット、同第1999014354号パンフレット、同第1999015685号パンフレット、同第1999047691号パンフレット、同第2000055342号パンフレット、同第2000075353号パンフレット及び同第2001023597号パンフレット(これらの各々の内容は本明細書において全体として参照により援用される)に挙げられる方法のいずれかにより行われてもよい。細胞溶解方法は化学的又は機械的であってもよい。化学的細胞溶解は、典型的には、1つ以上の細胞を1つ以上の溶解剤と接触させることを含む。機械的溶解は、典型的には、1つ以上の細胞を1つ以上の溶解条件及び/又は1つ以上の溶解力に供することを含む。
ウイルス粒子を含む細胞ライセートは清澄化に供され得る。清澄化とは、細胞ライセートからのウイルス粒子の精製において行われる最初のステップを指す。清澄化は、より大きい不溶性のデブリを除去することにより更なる精製にかけるためのライセートを調製する働きをする。清澄化ステップとしては、限定はされないが、遠心及びろ過を挙げることができる。清澄化において、遠心は、より大きいデブリのみを除去するため低速で行われてもよい。同様に、ろ過は、より大きいデブリのみが除去されるように、より大きい孔径のフィルタを使用して行われてもよい。ある場合には、清澄化の間にタンジェンシャルフローろ過が用いられてもよい。ウイルス清澄化の目的には、細胞ライセートのハイスループット処理及び最終的なウイルス回収率の最適化が含まれる。清澄化ステップを含める利点には、更に大容積のライセートを処理するため規模を調整可能であることが含まれる。一部の実施形態において、清澄化は、米国特許第8,524,446号明細書、同第5,756,283号明細書、同第6,258,595号明細書、同第6,261,551号明細書、同第6,270,996号明細書、同第6,281,010号明細書、同第6,365,394号明細書、同第6,475,769号明細書、同第6,482,634号明細書、同第6,485,966号明細書、同第6,943,019号明細書、同第6,953,690号明細書、同第7,022,519号明細書、同第7,238,526号明細書、同第7,291,498号明細書、同第7,491,508号明細書、米国特許出願公開第2013/0045186号明細書、同第2011/0263027号明細書、同第2011/0151434号明細書、同第2003/0138772号明細書、及び国際公開第2002012455号パンフレット、同第1996039530号パンフレット、同第1998010088号パンフレット、同第1999014354号パンフレット、同第1999015685号パンフレット、同第1999047691号パンフレット、同第2000055342号パンフレット、同第2000075353号パンフレット及び同第2001023597号パンフレット(これらの各々の内容は本明細書において全体として参照により援用される)に提示される方法のいずれかにより行われてもよい。
ある場合には、AAV粒子は、清澄化細胞ライセートから1つ以上のクロマトグラフィー方法によって精製されてもよい。クロマトグラフィーとは、混合物から1つ以上の要素を取り分けるための当該技術分野において公知のあらゆる方法を指す。かかる方法としては、限定はされないが、イオン交換クロマトグラフィー(例えば陽イオン交換クロマトグラフィー及び陰イオン交換クロマトグラフィー)、イムノアフィニティークロマトグラフィー及びサイズ排除クロマトグラフィーを挙げることができる。一部の実施形態において、ウイルスクロマトグラフィー方法としては、米国特許第5,756,283号明細書、同第6,258,595号明細書、同第6,261,551号明細書、同第6,270,996号明細書、同第6,281,010号明細書、同第6,365,394号明細書、同第6,475,769号明細書、同第6,482,634号明細書、同第6,485,966号明細書、同第6,943,019号明細書、同第6,953,690号明細書、同第7,022,519号明細書、同第7,238,526号明細書、同第7,291,498号明細書及び同第7,491,508号明細書又は国際公開第1996039530号パンフレット、同第1998010088号パンフレット、同第1999014354号パンフレット、同第1999015685号パンフレット、同第1999047691号パンフレット、同第2000055342号パンフレット、同第2000075353号パンフレット及び同第2001023597号パンフレット(これらの各々の内容は本明細書において全体として参照により援用される)に教示されるもののいずれかを挙げることができる。
医薬組成物及び製剤
医薬組成物(siRNA分子をコードする核酸配列を含むベクター、例えばAAVベクター)に加えて、本明細書にはヒトへの投与に好適な医薬組成物が提供され、当業者は、かかる組成物が概して任意の他の動物、例えば非ヒト動物、例えば非ヒト哺乳類への投与に好適であることを理解するであろう。組成物を種々の動物への投与に好適にするための、ヒトへの投与に好適な医薬組成物の修飾については十分に理解されており、獣医薬理学の当業者は、あったとしても通常どおりに過ぎない実験をもって、かかる修飾を設計及び/又は実施することができる。医薬組成物の投与が企図される対象としては、限定はされないが、ヒト及び/又は他の霊長類;ウシ、ブタ、ウマ、ヒツジ、ネコ、イヌ、マウス、及び/又はラットなど、商業的に関連性のある哺乳類を含めた哺乳類;及び/又は、家禽、ニワトリ、アヒル、ガチョウ、及び/又はシチメンチョウなど、商業的に関連性のある鳥類を含めた鳥類が挙げられる。
一部の実施形態において、製剤は、非活性成分である少なくとも1つの賦形剤を含み得る。本明細書で使用されるとき、用語「非活性成分」は、製剤中に含まれる1つ以上の非活性薬剤を指す。一部の実施形態において、本開示の製剤に使用し得る非活性成分は、全てが米国食品医薬品局(FDA)によって承認されているか、いずれも承認されていないか、又は一部が承認されているものであり得る。
一実施形態において、本明細書に記載されるウイルスベクターを含む組成物は、欧州特許出願第1857552号明細書(この内容は本明細書において全体として参照により援用される)に記載されるAAVビリオンの送達方法を用いて投与又は送達されてもよい。
本開示は、上述のAAVポリヌクレオチド又はAAVゲノムのいずれかを細胞又は組織に送達する方法であって、前記AAVポリヌクレオチド又はAAVゲノムと細胞又は組織を接触させること又は前記AAVポリヌクレオチド又はAAVゲノムを含む粒子と細胞又は組織を接触させること、又は医薬組成物を含めた記載される組成物のいずれかと細胞又は組織を接触させることを含む方法を提供する。AAVポリヌクレオチド又はAAVゲノムを細胞又は組織に送達する方法は、インビトロ、エキソビボ、又はインビボで達成することができる。
siRNA分子(例えば、siRNA二重鎖及びdsRNA)の化学的及び生物学的安定性を確保するためには、siRNA分子を標的細胞の内部に送達することが重要である。一部の実施形態において、細胞としては、限定はされないが、哺乳類起源の細胞、ヒト起源の細胞、胚性幹細胞、人工多能性幹細胞、神経幹細胞、及び神経前駆細胞を挙げることができる。
本発明のsiRNA分子(例えばsiRNA二重鎖)は、限定はされないがウイルスベクター(例えばAAVベクター)など、種々の手法のいずれを用いて細胞に導入されてもよい。これらのウイルスベクターは、トランスフェクションに容易には適さない細胞へのsiRNA分子の侵入を促進するように操作及び最適化される。また、幾つかの合成ウイルスベクターはshRNAを細胞ゲノムに組み込む能力を有し、それにより安定したsiRNA発現及び標的遺伝子の長期ノックダウンがもたらされる。このように、ウイルスベクターは、野生型ウイルスに見られる有害な複製及び/又は組込み特徴を欠きながらも、特異的送達媒体として操作される。
別の実施形態において、ベクター、例えばAAVベクターは、標的配列の内因性発現レベルが低い細胞に導入されてもよい。
対象への送達
本開示は更に、上述のAAVポリヌクレオチド又はAAVゲノムのいずれかを哺乳類対象を含めた対象に送達する方法であって、前記AAVポリヌクレオチド又はAAVゲノムを対象に投与すること、又は前記AAVポリヌクレオチド又はAAVゲノムを含む粒子を対象に投与すること、又は医薬組成物を含めた記載される組成物のいずれかを対象に投与することを含む方法を提供する。
III.投与及び用量設定
投与
本発明のsiRNA分子をコードする核酸配列を含むベクター、例えばAAVベクターは、治療上有効な結果をもたらす任意の経路によって投与されてもよい。それらとしては、限定はされないが、臓器の実質の範囲内、例えば、限定はされないが、脳(例えば実質内)、線条体(線条体内)、経腸(腸の中)、胃腸、硬膜上、経口(口を介して)、経皮、硬膜外、大脳内(大脳の中)、脳室内(脳室の中)、皮膚上(皮膚への塗布)、皮内(皮膚それ自体の中)、皮下(皮膚の下)、鼻腔投与(鼻を通じて)、静脈内(静脈の中)、静脈内ボーラス、静脈内点滴、動脈内(動脈の中)、筋肉内(筋肉の中)、心臓内(心臓の中)、骨内注入(骨髄の中)、髄腔内(脊柱管の中)、軟膜下(軟膜と下層組織との間)、神経節内(神経節の中)、腹腔内(腹膜への注入又は注射)、膀胱内注入、硝子体内(眼を通じて)、海綿体内注射(病的腔の中)、腔内(陰茎の基部の中)、腟内投与、子宮内、羊膜外投与、経皮(全身分布のためのインタクトな皮膚を通じた拡散)、経粘膜(粘膜を通じた拡散)、経腟、インサフレーション(鼻から吸い込む)、舌下、唇下、浣腸、点眼薬(結膜上)、点耳薬で、耳介(耳内又は耳を介して)、頬側(頬の方に向けて)、結膜、皮膚、歯(1本又は複数の歯に対して)、電気浸透、子宮頚管内、副鼻腔内、気管内、体外、血液透析、浸潤、間質内、腹腔内、羊膜内、関節内、胆管内、気管支内、嚢内、軟骨内(軟骨の範囲内)、仙骨内(馬尾(cauda equine)の範囲内)、大槽内(大槽小脳延髄槽の範囲内)、角膜内(角膜の範囲内)、歯冠内、冠内(冠動脈の範囲内)、海綿体内(intracorporus cavernosum)(陰茎海綿体(corporus cavernosa)の可膨張性腔の範囲内)、椎間板内(椎間板の範囲内)、管内(腺管の範囲内)、十二指腸内(十二指腸の範囲内)、硬膜内(硬膜の範囲内又は真下)、表皮内(表皮に対して)、食道内(食道に対して)、胃内(胃の範囲内)、歯肉内(歯肉の範囲内)、回腸内(小腸の遠位部分の範囲内)、病巣内(局所病変の範囲内、又はそこに直接導入される)、管腔内(管の管腔の範囲内)、リンパ内(リンパの範囲内)、髄内(骨の髄腔の範囲内)、髄膜内(髄膜の範囲内)、眼内(眼の範囲内)、卵巣内(卵巣の範囲内)、心膜内(心膜の範囲内)、胸膜内(胸膜の範囲内)、前立腺内(前立腺の範囲内)、肺内(肺、又はその気管支の範囲内)、洞内(鼻洞又は眼窩周囲洞の範囲内)、脊髄内(脊柱の範囲内)、滑液嚢内(関節の滑膜腔の範囲内)、腱内(腱の範囲内)、精巣内(精巣の範囲内)、髄腔内(脳脊髄軸の任意のレベルにおける脳脊髄液の範囲内)、胸腔内(胸郭の範囲内)、細管内(臓器の細管の範囲内)、腫瘍内(腫瘍の範囲内)、鼓室内(中耳(aurus media)の範囲内)、血管内(1つ又は複数の血管の範囲内)、脳室内(脳室の範囲内)、イオントフォレシス(電流を用いるもので、可溶性塩のイオンが体の組織に移動する)、潅注(開放創又は体腔を浸す又はフラッシュする)、喉頭(喉頭に対して直接)、経鼻胃(鼻を通じて胃の中に)、密封包帯療法(局所経路投与、これは次に包帯で覆われ、包帯がその範囲を閉塞する)、眼(外眼部に対して)、中咽頭(口及び咽頭に対して直接)、非経口、経皮、関節周囲、硬膜外、神経周囲、歯周、直腸、呼吸器(局所又は全身作用のため経口的又は鼻腔的に吸入することにより気道の範囲内に)、球後(橋の後ろ又は眼球の後ろ)、軟部組織、くも膜下、結膜下、粘膜下、局所、経胎盤(胎盤を通じて又は越えて)、経気管(気管の壁を通じて)、経鼓室(鼓室を越えて又は通じて)、尿管(尿管に対して)、尿道(尿道に対して)、腟、仙骨ブロック、診断的、神経ブロック、胆管灌流、心灌流、フォトフェレーシス又は脊髄が挙げられる。
一実施形態において、本発明のsiRNA分子をコードする核酸配列を含むベクター、例えばAAVベクターは、実質内注射によって投与されてもよい。
一実施形態において、本発明のsiRNA分子をコードする核酸配列を含むベクター、例えばAAVベクターは、線条体内注射によって投与されてもよい。
一実施形態において、調節性ポリヌクレオチドを含むベクター、例えばAAVベクターは多部位投与経路によって対象に送達されてもよい。対象には、調節性ポリヌクレオチドを含むベクター、例えばAAVベクターが2、3、4、5又は5より多い部位に投与されてもよい。
一実施形態において、対象には、本明細書に記載される調節性ポリヌクレオチドを含むベクター、例えばAAVベクターが、数分間、数時間又は数日間の時間をかけた徐放送達を用いて投与されてもよい。注入速度は、対象、分布、製剤又は別の送達パラメータに応じて変更されてもよい。
本発明の医薬組成物は、HTT関連障害(例えば、ハンチントン病(HD))を軽減、予防及び/又は治療するのに有効な任意の量を用いて対象に投与されてもよい。必要となる正確な量は、対象の種、年齢、及び全身状態、疾患の重症度、詳細な組成物、その投与様式、その活性様式などに応じて対象毎に異なることになる。
一実施形態において、本発明に係る組成物の細胞への送達は、[VG/時間=mL/時間×VG/mL](式中、VGはウイルスゲノムであり、VG/mLは組成物濃度であり、及びmL/時間は持続送達速度である)によって定義される送達速度を含む。
一実施形態において、本発明に係る組成物の細胞への送達は、約1×106VG/mL~約1×1016VG/mLの総濃度を含み得る。一部の実施形態において、送達は、約1×106、2×106、3×106、4×106、5×106、6×106、7×106、8×106、9×106、1×107、2×107、3×107、4×107、5×107、6×107、7×107、8×107、9×107、1×108、2×108、3×108、4×108、5×108、6×108、7×108、8×108、9×108、1×109、2×109、3×109、4×109、5×109、6×109、7×109、8×109、9×109、1×1010、2×1010、3×1010、4×1010、5×1010、6×1010、7×1010、8×1010、9×1010、1×1011、1.1×1011、1.2×1011、1.3×1011、1.4×1011、1.5×1011、1.6×1011、1.7×1011、1.8×1011、1.9×1011、2×1011、3×1011、4×1011、5×1011、6×1011、7×1011、8×1011、9×1011、1×1012、1.1×1012、1.2×1012、1.3×1012、1.4×1012、1.5×1012、1.6×1012、1.7×1012、1.8×1012、1.9×1012、2×1012、2.1×1012、2.2×1012、2.3×1012、2.4×1012、2.5×1012、2.6×1012、2.7×1012、2.8×1012、2.9×1012、3×1012、3.1×1012、3.2×1012、3.3×1012、3.4×1012、3.5×1012、3.6×1012、3.7×1012、3.8×1012、3.9×1012、4×1012、4.1×1012、4.2×1012、4.3×1012、4.4×1012、4.5×1012、4.6×1012、4.7×1012、4.8×1012、4.9×1012、5×1012、6×1012、6.1×1012、6.2×1012、6.3×1012、6.4×1012、6.5×1012、6.6×1012、6.7×1012、6.8×1012、6.9×1012、7×1012、8×1012、9×1012、1×1013、1.1×1013、1.2×1013、1.3×1013、1.4×1013、1.5×1013、1.6×1013、1.7×1013、1.8×1013、1.9×1013、2×1013、3×1013、4×1013、5×1013、6×1013、6.7×1013、7×1013、8×1013、9×1013、1×1014、2×1014、3×1014、4×1014、5×1014、6×1014、7×1014、8×1014、9×1014、1×1015、2×1015、3×1015、4×1015、5×1015、6×1015、7×1015、8×1015、9×1015、又は1×1016VG/mLの組成物濃度を含み得る。
ハンチントン病の治療方法
本発明には、本発明のsiRNA分子をコードする核酸配列を含むベクター、例えばAAVベクターを細胞に導入する方法であって、標的HTT mRNAの分解が起こるのに十分な量でベクターのいずれかを前記細胞に導入し、それにより細胞において標的特異的RNAiを活性化させることを含む方法が提供される。一部の態様において、細胞は、幹細胞、中型有棘又は皮質ニューロンなどのニューロン、筋細胞及びアストロサイトなどのグリア細胞であってもよい。
一部の実施形態において、本発明のsiRNA分子をコードする核酸配列を含むベクター、例えばAAVベクターを使用して、線条体及び/又は皮質のニューロン及び/又はアストロサイトにおけるHTTタンパク質を抑制してもよい。非限定的な例として、HTTタンパク質の抑制は、線条体の中型有棘ニューロン及び/又は皮質のニューロンにおける抑制である。
HTT遺伝子を標的とするsiRNA二重鎖をコードするベクター、例えばAAVベクターは、1つ以上の他の治療用薬剤と併用して使用されてもよい。「~と併用して」とは、その薬剤が同じ時点で投与されなければならない、及び/又は一緒に送達されるように製剤化されなければならないことを含意するよう意図するものではなく、しかしながらこれらの送達方法は本開示の範囲内にある。組成物は、1つ以上の他の所望の治療薬又は医療手技と同時に、その前に、又はその後に投与することができる。一般に、各薬剤は、当該の薬剤について決定された用量及び/又はタイムスケジュールで投与されることになる。
特定の態様において、HDの症状としては、限定はされないが、無関心又は自発性の欠如、不機嫌、易怒、激越又は不安、自己管理不足、判断力低下、強情、脱抑制、抑欝、自殺念慮、多幸症、攻撃性、妄想、強迫、性欲亢進、幻覚、発話能力低下、不明瞭発語、嚥下困難、体重減少、実行機能(例えば、整理する、計画する、調べる又は代替案を取る、及び新規運動技能の獲得の遅れ)を損なう認知機能障害、不安定歩行及び不随意運動(舞踏運動)など、行動上の困難及び症状が挙げられる。他の態様において、本発明の組成物は脳及び脊髄の一方又は両方に適用される。一実施形態において、本明細書に記載されるHDの症状のいずれかを治療することにより、対象の生存が延びる。
一実施形態において、ベクター、例えばAAVベクターを使用して、HTT遺伝子が41回以上のCAGリピート(例えば、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90回又は90回超のCAGリピート)を有する完全浸透HDを有するHD対象が治療されてもよい。
特に明記しない限り、以下の用語及び語句は以下に説明する意味を有する。これらの定義は、本質的に限定するよう意図するものでなく、本発明の特定の態様のより明確な理解を提供するために供される。
用語「遺伝子発現」は、核酸配列が首尾よく転写及びほとんどの場合に翻訳を受けてタンパク質又はペプチドを産生する過程を指す。明確にするため、「遺伝子発現」の測定に言及するとき、それは、測定が核酸転写産物、例えばRNA若しくはmRNAの測定又はアミノ酸翻訳産物、例えばポリペプチド若しくはペプチドの測定であり得ることを意味するものと理解されなければならない。RNA、mRNA、ポリペプチド及びペプチドの量又はレベルの測定方法は当該技術分野において周知である。
本明細書で使用されるとき、用語「修飾された」は、本発明の分子の変化した状態又は構造を指す。分子は、化学的、構造的、及び機能的に修飾することを含め、多くの方法で修飾し得る。
本明細書で使用されるとき、語句「薬学的に許容可能」は、本明細書では、妥当な医学的判断の範囲内で、過度の毒性、刺激作用、アレルギー反応、又は他の問題若しくは合併症のない、妥当なリスク対効果比に相応の、ヒト及び動物の組織との接触における使用に好適な化合物、材料、組成物、及び/又は剤形を指して用いられる。
本明細書で使用されるとき、用語「神経変性」は、神経細胞死をもたらす病的状態を指す。多数の神経障害が共通の病的状態として神経変性を共有する。例えば、アルツハイマー病、パーキンソン病、ハンチントン病、及び筋萎縮性側索硬化症(ALS)は、いずれも慢性神経変性を引き起こし、慢性神経変性は数年の期間にわたる緩慢な進行性の神経細胞死によって特徴付けられる一方、急性神経変性は、脳卒中などの虚血、又は外傷性脳傷害などの外傷の結果としての、又は例えば脊髄損傷若しくは多発性硬化症によって引き起こされる脱髄又は外傷による軸索切断の結果としての、神経細胞死の突発的な発生によって特徴付けられる。一部の神経障害では、例えば初期HDにおける中型有棘ニューロン変性など、主に1つのタイプの神経細胞が変性する。
当業者は、本明細書に記載される本発明に係る具体的な実施形態の多くの均等物を認識し、又はルーチンに過ぎない実験を用いて確かめることが可能であろう。本発明の範囲が上記の説明に限定されることは意図されず、それはむしろ添付の特許請求の範囲に示されるとおりである。
VII.実施例
実施例1.HEK293T及びHeLa細胞におけるコンストラクトの活性
A.トランスフェクション
AAV-miRNA発現ベクターをHEK293T及びHeLa細胞にトランスフェクトした。mCherry処理細胞及び未処理細胞もまた評価した。48時間後、相対HTT mRNA発現を決定した。相対HTT mRNA発現は、qRT-PCRにより決定して、HTT mRNAレベルをハウスキーピング遺伝子mRNAレベルに対して正規化することにより得て;次にこの正規化HTT mRNAレベルをmCherry処理及び/又は未処理細胞における正規化HTT mRNAレベルと比べて表した。結果は表12~表14に示す。
HEK293T及びHeLa細胞の感染用に、AAV-miRNA発現ベクターをAAV2にパッケージングし(AAV2-miRNA発現ベクターと称される)、又はmCherryベクターをAAV2にパッケージングした。未処理細胞もまた評価した。AAV2粒子を使用してHEK293T細胞を1E4又は1E5vg/細胞のMOIで、及びHeLa細胞を1E5vg/細胞のMOIで感染させた。
AAV-miRNA発現ベクターをAAV2にパッケージングし、ヒト正常初代アストロサイトNHA(ロンザ(Lonza))(AGM(商標)アストロサイト成長培地、ロンザ(Lonza)カタログ番号CC-3186において培養した)、ヒトアストロサイト細胞株U251MG(シグマ(Sigma)カタログ番号09063001-1VL)(2mM グルアマックス(商標)(GLUAMAX(商標))添加剤、1×MEM非必須アミノ酸溶液、10mM HEPES及び10%FBS、2ng/mlヒトFGF-2及び5ug/mlヒトインスリンを含有するDMEM/F-12において培養した。試薬は全てライフテクノロジーズ(Life Technologies)による)、神経分化SH-SY5Y細胞(シグマ(Sigma)カタログ番号94030304)(2mM グルアマックス(商標)(GLUAMAX(商標))添加剤、1×MEM非必須アミノ酸溶液、10mM HEPES及び10%FBS、2ng/mlヒトFGF-2及び5ug/mlヒトインスリンを含有するDMEM/F-12において培養した。試薬は全てライフテクノロジーズ(Life Technologies)による)及び/又はヒトHD初代線維芽細胞(コリエル研究所(Coriell Institute)カタログ番号GM21756)(2mM グルアマックス(商標)(GLUAMAX(商標))添加剤、1×MEM非必須アミノ酸溶液、10mM HEPES及び10%FBS、2ng/mlヒトFGF-2及び5ug/mlヒトインスリンを含有するDMEM/F-12において培養した。試薬は全てライフテクノロジーズ(Life Technologies)による)に感染させた。mCherryの対照もまた評価した。NHA、線維芽細胞及びU251MGについては、細胞を96ウェルプレートにプレーティングし(200ul細胞培養培地中1~2E4細胞/ウェル)、AAV2にパッケージングしたAAV-miRNA発現ベクター又は対照mCherryベクターにトリプリケートで感染させた。0.1ug/mlポリ-D-リジン及び15ug/mlラミニンで二重コーティングした96ウェルプレートにSH-SY5Y細胞をプレーティングし(200ul細胞培養培地中1E4細胞/ウェル)、分化培地中で4日間にわたって神経細胞分化を誘導し、次にAAV2-miRNA発現ベクターにトリプリケートで感染させた。AAV2-miRNA発現ベクターは1E5又は1E6vg/細胞のMOIで感染させた。感染後24~48時間で細胞を回収し、直ちに細胞溶解及びqRT-PCRを行った。
正常ヒト初代アストロサイト、ヒトアストロサイト細胞株U251MG、SH-SY5Y分化ニューロン、及びヒトHD初代線維芽細胞について、1E5vg/細胞のMOIでの感染後24時間におけるHTT mRNAの相対発現をqRT-PCRにより決定した。相対HTT mRNA発現は、qRT-PCRにより決定して、HTT mRNAレベルをハウスキーピング遺伝子mRNAレベルに対して正規化することにより得て;次にこの正規化HTT mRNAレベルをmCherry処理細胞における正規化HTT mRNAレベルと比べて表した。結果を表19に示す。
ヒトアストロサイト細胞株U251MG及び神経分化SH-SY5Y細胞について、1E6のMOIでの感染後24時間におけるHTT mRNAの相対発現をqRT-PCRにより決定した。相対HTT mRNA発現は、qRT-PCRにより決定して、HTT mRNAレベルをハウスキーピング遺伝子mRNAレベルに対して正規化することにより得て;次にこの正規化HTT mRNAレベルをmCherry処理細胞における正規化HTT mRNAレベルと比べて表した。結果を表20に示す。
感染後36時間で、1E5vg/細胞のMOIでのヒトアストロサイト細胞株U251MG、及び神経分化SH-SY5Y細胞についてHTT mRNAの相対発現をqRT-PCRにより決定した。相対HTT mRNA発現は、HTT mRNAをハウスキーピングmRNAに対して正規化し、更にmCherry処理細胞に対して正規化することにより決定した;結果を表21に示す。
感染後36時間で、1E6vg/細胞のMOIでの神経分化SH-SY5Y細胞におけるHTT mRNAの相対発現をqRT-PCRにより決定した。相対HTT mRNA発現は、HTT mRNAをハウスキーピングmRNAに対して正規化し、更にmCherry処理細胞に対して正規化することにより決定した;結果を表22に示す。
感染後40時間で、1E6vg/細胞のMOIでのヒトアストロサイト細胞株U251MG、及び神経分化SH-SY5Y細胞におけるHTT mRNAの相対発現をqRT-PCRにより決定した。相対HTT mRNA発現は、HTT mRNAをハウスキーピングmRNAに対して正規化し、更にmCherry処理細胞に対して正規化することにより決定した;結果を表23に示す。
プラスミドトランスフェクション及びAAVにパッケージングされたAAV-miRNA発現ベクターの感染によるHTTのインビトロ抑制に基づき、選択されたAAV-miRNA発現ベクターをAAV1にパッケージングし、YAC128マウスにおいてインビボで評価することにより、HTT mRNA抑制を定量化し、ガイド対パッセンジャー比及び5’末端プロセシング精度をディープシーケンシングによって評価した。AAV-miRNAトランス遺伝子ゲノムをCBAプロモータでAAV1にパッケージングし(AAV1.CBA.iHtt)、次にHEK293又はHEK293T細胞におけるトリプルトランスフェクションによってベクターを作製し、精製して、0.001%F-68含有リン酸緩衝生理食塩水(PBS)中に製剤化した。7~12週齢のYAC128マウスにベクターを半球当たり5uL中約1E10~3E10vgの用量で10分かけて両側性線条体内注入によって投与した。対照群は媒体(0.001%F-68含有PBS)で処置した。各群に4匹の雌及び4匹の雄が含まれた。被験物質投与後約28日で線条体組織パンチを収集し、後の分析のためスナップ凍結した。
ヒトHTT遺伝子に対するアンチセンス鎖の予測される選択性に基づき、表3に挙げられるHTT siRNAの二重鎖のガイド鎖及びパッセンジャー鎖の一部をAAV-miRNA発現ベクターとなるように操作し、中枢神経系の細胞、神経細胞株又は非神経細胞株にトランスフェクトする。siRNAノックダウン試験に利用されるオーバハングがsiRNAのカノニカルなdTdTであったとしても、コンストラクトにおけるオーバハングは任意のジヌクレオチドオーバハングを含んでもよい。
次にHTTノックダウンを測定し、ディープシーケンシングを実施して、発現ベクターで投与される各コンストラクトからプロセシングされる正確なパッセンジャー鎖及びガイド鎖を定量化する。
ガイド鎖の5’末端をシーケンシングして切断精度を決定し、及び正確な切断によって生じるパーセント予想ガイド鎖を決定する。
実施例6.HTTを標的にするガイド配列とパッセンジャー配列とを含むPri-miRNAカセット
本発明により、pri-miRNAカセット及びHTT siRNAを含むコンストラクトを設計した。これらは表27に示す。表中にはパッセンジャー鎖及びガイド鎖並びに5’及び3’フランキング領域及びループ領域(リンカー領域とも称される)を記載する。表27において、配列名の「miR」成分は必ずしもmiRNA遺伝子の配列の付番に対応するわけではない(例えば、VOYHTmiR-102が配列名であるが、必ずしもmiR-102がその配列の一部であることを意味するわけではない)。
HTTを標的にするガイド鎖とパッセンジャー鎖とを含むpri-miRNAカセットを含むコンストラクトをAAV-miRNA発現ベクター(ss又はscのいずれか)となるように操作した。AAV-miRNA発現ベクターコンストラクトは、ITRからITRまで、5’から3’に挙げて、突然変異又は野生型ITR、プロモータ(CMV(SV40イントロンを含む)、U6、H1、CBA(CMVieエンハンサー、CBプロモータ及びSV40イントロンを含む)、HTTを標的にするガイド配列とパッセンジャー配列とを含むpri-miRNAカセット(表3から)、ウサギグロビンポリA及び野生型ITRを含む。インビトロ及びインビボ試験を実施してAAV-miRNA発現ベクターの薬理活性を判定する。
A.有効性のインビボ試験
YAC128マウスにおけるHTT抑制、ガイド対パッセンジャー比、及び5’末端プロセシング精度に基づき、選択されたAAV-miRNA発現ベクターをAAV1(ss又はscのいずれかとしての)にCBAプロモータと共にパッケージングし(AAV1.CBA.iHtt)、0.001%F-68含有リン酸緩衝生理食塩水(PBS)中に製剤化し、YAC128マウスに投与して、有効性を評価する。AAV1ベクターは7~12週齢のYAC128マウスに半球当たり5uL中約1E10~3E10vgの用量で10分かけて両側性線条体内注入によって投与する。対照群は媒体(0.001%F-68含有PBS)で処置する。被験物質投与後、ロータロッド及びポーソルト(Porsolt)水泳試験を含む行動試験を所定の時間間隔で実施して、有効性を評価する。投与後所定の日数で動物を安楽死させ、線条体組織パンチを収集し、スナップ凍結する。組織試料をホモジナイズし、全RNAを精製する。HTTの相対発現をqRT-PCRによって決定する。正規化用のハウスキーピング遺伝子にはマウスXPNPEP1が含まれた。HTTはハウスキーピング遺伝子発現に対して正規化し、次に媒体群に対して更に正規化する。試料はまた、HTTタンパク質の定量化にも使用する。
YAC128マウスにおけるHTT抑制、ガイド対パッセンジャー比、及び5’末端プロセシング精度に基づき、選択されたAAV-miRNA発現ベクターをCBAプロモータと共にAAV1にパッケージングし(AAV1.CBA.iHtt)、0.001%F-68含有リン酸緩衝生理食塩水(PBS)中に製剤化して、非ヒト霊長類に実質内脳注入によって投与する。対照群は媒体(0.001%F-68含有PBS)で処置する。投与後所定の時間で様々な組織試料においてHTT mRNAの相対発現、ガイド対パッセンジャー比、及び5’末端プロセシング精度を決定する。
(付記)
好ましい実施形態として、上記実施形態から把握できる技術的思想について、以下に記載する。
[項目1]
2つの末端逆位配列(ITR)間に位置する核酸配列を含むアデノ随伴ウイルス(AAV)ベクターであって、前記核酸が、発現すると細胞におけるHTT発現を阻害又は抑制し、前記核酸配列がセンス鎖配列とアンチセンス鎖配列とを含み、前記センス鎖配列が、表3、表4、又は表5に挙げられる配列のヌクレオチド配列と3ヌクレオチド以下しか異ならない少なくとも15連続ヌクレオチドを含み、及び前記アンチセンス鎖配列が、表3、表4、又は表5に挙げられる配列のヌクレオチド配列と3ヌクレオチド以下しか異ならない少なくとも15連続ヌクレオチドを含み、及び前記センス鎖配列とアンチセンス鎖配列とが少なくとも4ヌクレオチド長の相補性領域を共有する、AAVベクター。
[項目2]
前記核酸配列が、siRNA二重鎖のセンス鎖配列及びアンチセンス鎖配列を含む、項目1に記載のAAVベクター。
[項目3]
前記siRNA二重鎖が、siRNA二重鎖ID番号D-3566~二重鎖ID D-3570、及び二重鎖ID D-3500~ID番号二重鎖ID D-3565からなる群から選択される、項目2に記載のAAVベクター。
[項目4]
前記siRNA二重鎖がD-3546である、項目3に記載のAAVベクター。
[項目5]
前記siRNA二重鎖がD-3518である、項目3に記載のAAVベクター。
[項目6]
前記siRNA二重鎖がD-3548である、項目3に記載のAAVベクター。
[項目7]
前記siRNA二重鎖がD-3566である、項目3に記載のAAVベクター。
[項目8]
前記siRNA二重鎖がD-3570である、項目3に記載のAAVベクター。
[項目9]
前記siRNA二重鎖がD-3545である、項目3に記載のAAVベクター。
[項目10]
前記相補性領域が少なくとも17ヌクレオチド長である、項目1に記載のAAVベクター。
[項目11]
前記相補性領域が19~21ヌクレオチド長である、項目10に記載のAAVベクター。
[項目12]
前記相補性領域が19ヌクレオチド長である、項目11に記載のAAVベクター。
[項目13]
前記センス鎖配列及び前記アンチセンス鎖配列が、独立に、30ヌクレオチド以下である、項目1に記載のAAVベクター。
[項目14]
前記センス鎖配列及び前記アンチセンス鎖配列の少なくとも一方が少なくとも1ヌクレオチドの3’オーバハングを含む、項目1に記載のAAVベクター。
[項目15]
前記センス鎖配列及び前記アンチセンス鎖配列の少なくとも一方が少なくとも2ヌクレオチドの3’オーバハングを含む、項目14に記載のAAVベクター。
[項目16]
前記AAVベクターが、AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9、AAV9.47、AAV9(hu14)、AAV10、AAV11、AAV12、AAVrh8、AAVrh10、AAV-DJ8、AAV-DJ、AAV-PHP.A(PHP.A)、及びAAV-PHP.B(PHP.B)、及びこれらのバリアントからなる群から選択されるカプシド血清型を含む、項目1に記載のAAVベクター。
[項目17]
前記アンチセンス鎖がHTT発現を阻害又は抑制する、項目1に記載のAAVベクター。
[項目18]
前記アンチセンス鎖及び前記センス鎖が二重機能ターゲティング調節性ポリヌクレオチドである、項目17に記載のAAVベクター。
[項目19]
前記センス鎖がHTT発現を阻害又は抑制する、項目18に記載のAAVベクター。
[項目20]
2つの末端逆位配列(ITR)間に位置する核酸配列を含むアデノ随伴ウイルス(AAV)ベクターであって、前記核酸配列が、
(a)ステム-ループ構造を形成するステム及びループであって、前記ステム-ループ構造の配列が、5’から3’に、
i.前記ステム-ループ構造の5’ステムの塩基又はその近傍におけるUGモチーフ;
ii.センス鎖と任意選択の5’スペーサ領域とを含む5’ステムアームであって、存在する場合には前記5’スペーサ領域が前記UGモチーフと前記センス鎖との間に位置する、5’ステムアーム;
iii.その5’末端にUGUGモチーフを含むループ領域;
iv.アンチセンス鎖と任意選択で3’スペーサ領域とを含む3’ステムアームであって前記アンチセンス鎖の5’末端にウリジンが存在し、及び存在する場合には前記3’スペーサ領域が1ヘリカルターンを形成するのに十分な長さを有する、3’ステムアームを含む、ステム及びループ;
(b)前記ステム-ループ構造の5’側に位置する第1のフランキング領域;及び
(c)前記ステム-ループ構造の3’側に位置する第2のフランキング領域であって、CNNCモチーフを含む第2の領域を含み、
前記アンチセンス鎖及び前記センス鎖が、発現すると細胞におけるHTT発現を阻害又は抑制するsiRNA二重鎖を形成し、前記センス鎖配列が、表3、表4、又は表5に挙げられる配列のヌクレオチド配列と3ヌクレオチド以下しか異ならない少なくとも15連続ヌクレオチドを含み、及び前記アンチセンス鎖配列が、表3、表4、又は表5に挙げられる配列のヌクレオチド配列と3ヌクレオチド以下しか異ならない少なくとも15連続ヌクレオチドを含み、及び前記センス鎖配列とアンチセンス鎖配列とが少なくとも4ヌクレオチド長の相補性領域を共有する、AAVベクター。
[項目21]
前記siRNA二重鎖が、siRNA二重鎖ID番号D-3566~二重鎖ID D-3570、及び二重鎖ID D-3500~ID番号二重鎖ID D-3565からなる群から選択される、項目20に記載のAAVベクター。
[項目22]
前記siRNA二重鎖がD-3546である、項目21に記載のAAVベクター。
[項目23]
前記siRNA二重鎖がD-3518である、項目21に記載のAAVベクター。
[項目24]
前記siRNA二重鎖がD-3548である、項目21に記載のAAVベクター。
[項目25]
前記siRNA二重鎖がD-3566である、項目21に記載のAAVベクター。
[項目26]
前記siRNA二重鎖がD-3570である、項目21に記載のAAVベクター。
[項目27]
前記siRNA二重鎖がD-3545である、項目21に記載のAAVベクター。
[項目28]
前記相補性領域が少なくとも17ヌクレオチド長である、項目20に記載のAAVベクター。
[項目29]
前記相補性領域が19~21ヌクレオチド長である、項目28に記載のAAVベクター。
[項目30]
前記相補性領域が19ヌクレオチド長である、項目29に記載のAAVベクター。
[項目31]
前記センス鎖配列及び前記アンチセンス鎖配列が、独立に、30ヌクレオチド以下である、項目20に記載のAAVベクター。
[項目32]
前記センス鎖配列及び前記アンチセンス鎖配列の少なくとも一方が少なくとも1ヌクレオチドの3’オーバハングを含む、項目20に記載のAAVベクター。
[項目33]
前記センス鎖配列及び前記アンチセンス鎖配列の少なくとも一方が少なくとも2ヌクレオチドの3’オーバハングを含む、項目32に記載のAAVベクター。
[項目34]
前記AAVベクターが、AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9、AAV9.47、AAV9(hu14)、AAV10、AAV11、AAV12、AAVrh8、AAVrh10、AAV-DJ8、AAV-DJ、AAV-PHP.A(PHP.A)、及びAAV-PHP.B(PHP.B)及びこれらのバリアントからなる群から選択されるカプシド血清型を含む、項目20に記載のAAVベクター。
[項目35]
前記アンチセンス鎖がHTT発現を阻害又は抑制する、項目20に記載のAAVベクター。
[項目36]
前記アンチセンス鎖及び前記センス鎖が二重機能ターゲティング調節性ポリヌクレオチドである、項目35に記載のAAVベクター。
[項目37]
前記センス鎖がHTT発現を阻害又は抑制する、項目36に記載のAAVベクター。
[項目38]
前記核酸配列が配列番号270~368からなる群から選択される、項目20に記載のAAVベクター。
[項目39]
前記核酸配列が配列番号340である、項目38に記載のAAVベクター。
[項目40]
前記核酸配列が配列番号298である、項目38に記載のAAVベクター。
[項目41]
前記核酸配列が配列番号346である、項目38に記載のAAVベクター。
[項目42]
前記核酸配列が配列番号349である、項目38に記載のAAVベクター。
[項目43]
前記核酸配列が配列番号368である、項目38に記載のAAVベクター。
[項目44]
前記核酸配列が配列番号336である、項目38に記載のAAVベクター。
[項目45]
前記核酸配列が配列番号337である、項目38に記載のAAVベクター。
[項目46]
細胞におけるHTT遺伝子の発現を阻害する方法であって、項目1~45のいずれか一項に記載のAAVベクターを含む組成物を前記細胞に投与することを含む方法。
[項目47]
前記細胞が哺乳類細胞である、項目46に記載の方法。
[項目48]
前記哺乳類細胞が中型有棘ニューロンである、項目47に記載の方法。
[項目49]
前記哺乳類細胞が皮質ニューロンである、項目47に記載の方法。
[項目50]
前記哺乳類細胞がアストロサイトである、項目47に記載の方法。
[項目51]
前記組成物が1より大きいアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目52]
前記組成物が2より大きいアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目53]
前記組成物が5より大きいアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目54]
前記組成物が10より大きいアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目55]
前記組成物が20より大きいアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目56]
前記組成物が50より大きいアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目57]
前記組成物が少なくとも3:1のアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目58]
前記組成物が少なくとも5:1のアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目59]
前記組成物が少なくとも10:1のアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目60]
前記組成物が少なくとも20:1のアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目61]
前記組成物が少なくとも50:1のアンチセンス鎖対センス鎖比を含む、項目46に記載の方法。
[項目62]
治療を必要としている対象のハンチントン病(HD)を治療する方法であって、項目1~45のいずれか一項に記載のAAVベクターを含む組成物の治療有効量を対象に投与することを含む方法。
[項目63]
HTT発現が阻害又は抑制される、項目62に記載の方法。
[項目64]
HTT発現が約30%~約70%阻害又は抑制される、項目63に記載の方法。
[項目65]
HTT発現が約50%~約90%阻害又は抑制される、項目63に記載の方法。
[項目66]
前記組成物が1より大きいアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目67]
前記組成物が2より大きいアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目68]
前記組成物が5より大きいアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目69]
前記組成物が10より大きいアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目70]
前記組成物が20より大きいアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目71]
前記組成物が50より大きいアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目72]
前記組成物が少なくとも3:1のアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目73]
前記組成物が少なくとも5:1のアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目74]
前記組成物が少なくとも10:1のアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目75]
前記組成物が少なくとも20:1のアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目76]
前記組成物が少なくとも50:1のアンチセンス鎖対センス鎖比を含む、項目62に記載の方法。
[項目77]
細胞におけるHTT遺伝子の発現を阻害する方法であって、前記HTT遺伝子は前記細胞の内部で機能獲得効果を引き起こすものであり、項目1~45のいずれか一項に記載のAAVベクターを含む組成物を前記細胞に投与することを含む方法。
[項目78]
前記細胞が哺乳類細胞である、項目77に記載の方法。
[項目79]
前記哺乳類細胞が中型有棘ニューロンである、項目78に記載の方法。
[項目80]
前記哺乳類細胞が皮質ニューロンである、項目77に記載の方法。
[項目81]
前記哺乳類細胞がアストロサイトである、項目77に記載の方法。
[項目82]
前記組成物が1より大きいアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目83]
前記組成物が2より大きいアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目84]
前記組成物が5より大きいアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目85]
前記組成物が10より大きいアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目86]
前記組成物が20より大きいアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目87]
前記組成物が50より大きいアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目88]
前記組成物が少なくとも3:1のアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目89]
前記組成物が少なくとも5:1のアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目90]
前記組成物が少なくとも10:1のアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目91]
前記組成物が少なくとも20:1のアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目92]
前記組成物が少なくとも50:1のアンチセンス鎖対センス鎖比を含む、項目77に記載の方法。
[項目93]
対象の中枢神経系領域におけるHTT遺伝子の発現を阻害する方法であって、2つの末端逆位配列(ITR)間に位置する核酸配列を含む少なくとも1つのアデノ随伴ウイルス(AAV)ベクターを含む組成物を前記対象に投与することを含み、前記核酸配列がアンチセンス鎖とセンス鎖とを含み、前記アンチセンス鎖及び前記センス鎖が、発現すると前記対象のHTT発現を阻害又は抑制するsiRNA二重鎖を形成する、方法。
[項目94]
前記領域が前脳である、項目93に記載の方法。
[項目95]
前記発現が前脳の被殻において低下する、項目94に記載の方法。
[項目96]
被殻におけるHTT発現が40~70%低下する、項目95に記載の方法。
[項目97]
被殻におけるHTT発現が40~60%低下する、項目96に記載の方法。
[項目98]
被殻におけるHTT発現が50~70%低下する、項目95に記載の方法。
[項目99]
被殻におけるHTT発現が50~60%低下する、項目98に記載の方法。
[項目100]
被殻におけるHTT発現が50%低下する、項目95に記載の方法。
[項目101]
被殻におけるHTT発現が51%低下する、項目95に記載の方法。
[項目102]
被殻におけるHTT発現が52%低下する、項目95に記載の方法。
[項目103]
被殻におけるHTT発現が53%低下する、項目95に記載の方法。
[項目104]
被殻におけるHTT発現が54%低下する、項目95に記載の方法。
[項目105]
被殻におけるHTT発現が55%低下する、項目95に記載の方法。
[項目106]
被殻におけるHTT発現が56%低下する、項目95に記載の方法。
[項目107]
被殻におけるHTT発現が57%低下する、項目95に記載の方法。
[項目108]
被殻におけるHTT発現が58%低下する、項目95に記載の方法。
[項目109]
被殻におけるHTT発現が59%低下する、項目95に記載の方法。
[項目110]
被殻におけるHTT発現が60%低下する、項目95に記載の方法。
[項目111]
治療を必要としている対象のハンチントン病(HD)を治療する方法であって、前記方法が、対象の中枢神経系領域におけるHTT遺伝子の発現を阻害し、2つの末端逆位配列(ITR)間に位置する核酸配列を含む少なくとも1つのアデノ随伴ウイルス(AAV)ベクターを含む組成物を前記対象に投与することを含み、前記核酸配列がアンチセンス鎖とセンス鎖とを含み、前記アンチセンス鎖及び前記センス鎖が、発現すると前記対象のHTT発現を阻害又は抑制するsiRNA二重鎖を形成する、方法。
[項目112]
前記領域が前脳である、項目111に記載の方法。
[項目113]
前記発現が前脳の被殻において低下する、項目112に記載の方法。
[項目114]
被殻におけるHTT発現が40~70%低下する、項目113に記載の方法。
[項目115]
被殻におけるHTT発現が40~60%低下する、項目113に記載の方法。
[項目116]
被殻におけるHTT発現が50~70%低下する、項目113に記載の方法。
[項目117]
被殻におけるHTT発現が50~60%低下する、項目113に記載の方法。
[項目118]
被殻におけるHTT発現が50%低下する、項目113に記載の方法。
[項目119]
被殻におけるHTT発現が51%低下する、項目113に記載の方法。
[項目120]
被殻におけるHTT発現が52%低下する、項目113に記載の方法。
[項目121]
被殻におけるHTT発現が53%低下する、項目113に記載の方法。
[項目122]
被殻におけるHTT発現が54%低下する、項目113に記載の方法。
[項目123]
被殻におけるHTT発現が55%低下する、項目113に記載の方法。
[項目124]
被殻におけるHTT発現が56%低下する、項目113に記載の方法。
[項目125]
被殻におけるHTT発現が57%低下する、項目113に記載の方法。
[項目126]
被殻におけるHTT発現が58%低下する、項目113に記載の方法。
[項目127]
被殻におけるHTT発現が59%低下する、項目113に記載の方法。
[項目128]
被殻におけるHTT発現が60%低下する、項目113に記載の方法。
Claims (40)
- siRNA二重鎖を含む、ハンチンチン(HTT)遺伝子の発現を減少させるための調節性ポリヌクレオチドであって、
前記siRNA二重鎖がセンス鎖配列及びアンチセンス鎖配列を含んでおり、
前記センス鎖配列が、配列番号168又は171のヌクレオチド配列を含み、
前記アンチセンス鎖配列が、配列番号7のヌクレオチド配列を含み、
前記調節性ポリヌクレオチドが、
(i)配列番号252のヌクレオチド配列を含む第1フランキング領域、配列番号261のヌクレオチド配列を含むループ配列、及び配列番号265のヌクレオチド配列を含む第2フランキング領域;又は、
(ii)配列番号256のヌクレオチド配列を含む第1フランキング領域、配列番号264のヌクレオチド配列を含むループ配列、及び配列番号269のヌクレオチド配列を含む第2フランキング領域、
を含む、調節性ポリヌクレオチド。 - 配列番号168のセンス鎖配列と配列番号7のアンチセンス鎖配列とを含む、請求項1に記載の調節性ポリヌクレオチド。
- 配列番号171のセンス鎖配列と配列番号7のアンチセンス鎖配列とを含む、請求項1に記載の調節性ポリヌクレオチド。
- 前記センス鎖配列及び前記アンチセンス鎖配列が、それぞれ、少なくとも21、22、又は23ヌクレオチド長である、請求項1~3のいずれか一項に記載の調節性ポリヌクレオチド。
- 前記センス鎖配列及び/又はアンチセンス鎖配列が、少なくとも1又は2ヌクレオチドの3’オーバハングを含む、請求項1~4のいずれか一項に記載の調節性ポリヌクレオチド。
- 前記アンチセンス鎖配列が、標的mRNA配列に対して少なくとも1つのミスマッチを含む、請求項1~5のいずれか一項に記載の調節性ポリヌクレオチド。
- 前記センス鎖配列および前記アンチセンス鎖配列が、少なくとも17ヌクレオチドの相補性領域を含む、請求項1~6のいずれか一項に記載の調節性ポリヌクレオチド。
- 前記第1フランキング領域が、配列番号252のヌクレオチド配列を含み;前記ループ配列が、配列番号261のヌクレオチド配列を含み;かつ前記第2フランキング領域が、配列番号265のヌクレオチド配列を含む、請求項1~7のいずれか一項に記載の調節性ポリヌクレオチド。
- 前記第1フランキング領域が、配列番号256のヌクレオチド配列を含み;前記ループ配列が、配列番号264のヌクレオチド配列を含み;かつ前記第2フランキング領域が、配列番号269のヌクレオチド配列を含む、請求項1~7のいずれか一項に記載の調節性ポリヌクレオチド。
- 前記調節性ポリヌクレオチドが、配列番号168のセンス鎖配列と配列番号7のアンチセンス鎖配列とを含み、
(i)前記第1フランキング領域が、配列番号252のヌクレオチド配列を含み;
(ii)前記ループ配列が、配列番号261のヌクレオチド配列を含み;かつ
(iii)前記第2フランキング領域が、配列番号265のヌクレオチド配列を含む、請求項1,2,及び4~8のいずれか一項に記載の調節性ポリヌクレオチド。 - 前記調節性ポリヌクレオチドが、配列番号171のセンス鎖配列と配列番号7のアンチセンス鎖配列とを含み、
(i)前記第1フランキング領域が、配列番号256のヌクレオチド配列を含み;
(ii)前記ループ配列が、配列番号264のヌクレオチド配列を含み;かつ
(iii)前記第2フランキング領域が、配列番号269のヌクレオチド配列を含む、請求項1,3~7,及び9のいずれか一項に記載の調節性ポリヌクレオチド。 - 配列番号349又は368のヌクレオチド配列を含む、請求項1~11のいずれか一項に記載の調節性ポリヌクレオチド。
- 配列番号349の配列を含む、HTT遺伝子の発現を減少させるための調節性ポリヌクレオチド。
- 配列番号368の配列を含む、HTT遺伝子の発現を減少させるための調節性ポリヌクレオチド。
- 配列番号349又は368の配列からなる、HTT遺伝子の発現を減少させるための調節性ポリヌクレオチド。
- pri-miRNAである、請求項1~15のいずれか一項に記載の調節性ポリヌクレオチド。
- 2つの末端逆位配列(ITR)間に位置する核酸配列を含むアデノ随伴ウイルス(AAV)ウイルスゲノムであって、前記核酸配列が、請求項1~16のいずれか一項に記載の調節性ポリヌクレオチドをコードする、アデノ随伴ウイルス(AAV)ウイルスゲノム。
- (i)前記調節性ポリヌクレオチドをコードする前記核酸配列に作動可能に連結されたプロモータ;
(ii)エンハンサー;
(iii)イントロン領域;及び/又は
(iv)ポリAシグナル領域、
をさらに含む、請求項17に記載のAAVウイルスゲノム。 - (i)前記プロモータがCBAプロモータ、CMVプロモータ、PGKプロモータ、H1プロモータ、UBCプロモータ、GUSBプロモータ、NSEプロモータ、シナプシンプロモータ、MeCP2プロモータ、又はGFAPプロモータ、を含み;
(ii)前記エンハンサーがCMVエンハンサーを含み;及び/又は
(iii)前記イントロンがSV40イントロンを含む、請求項18に記載のAAVウイルスゲノム。 - 請求項17~19のいずれか一項に記載のAAVウイルスゲノムと、AAVカプシドとを含む、組換えアデノ随伴ウイルス(rAAV)粒子。
- 前記AAVカプシドがAAV1カプシドもしくはそのバリアント、AAV5カプシドもしくはそのバリアント、またはAAV9もしくはそのバリアントである、請求項20に記載のrAAV粒子。
- 請求項1~16のいずれか一項に記載の調節性ポリヌクレオチド、又は請求項17~19のいずれか一項に記載のAAVウイルスゲノムを含む、ベクター。
- 請求項1~16のいずれか一項に記載の調節性ポリヌクレオチド、請求項17~19のいずれか一項に記載のAAVウイルスゲノム、又は請求項20もしくは21に記載のrAAV粒子を含む、細胞。
- 哺乳類細胞、中型有棘ニューロン、皮質ニューロン、又はアストロサイトである、請求項23に記載の細胞。
- 請求項1~16のいずれか一項に記載の調節性ポリヌクレオチド、請求項17~19のいずれか一項に記載のAAVウイルスゲノム、又は請求項20もしくは21に記載のrAAV粒子と、薬学的に許容可能な賦形剤とを含む、医薬組成物。
- 対象の神経変性疾患の治療に使用するための組成物であって、請求項1~16のいずれか一項に記載の調節性ポリヌクレオチド、請求項17~19のいずれか一項に記載のAAVウイルスゲノム、請求項20もしくは21に記載のrAAV粒子、又は請求項25に記載の医薬組成物を含む、組成物。
- 細胞におけるHTT遺伝子の発現の阻害に使用するための組成物であって、請求項1~16のいずれか一項に記載の調節性ポリヌクレオチド、請求項17~19のいずれか一項に記載のAAVウイルスゲノム、請求項20もしくは21に記載のrAAV粒子、又は請求項25に記載の医薬組成物を含む、組成物。
- (i)前記細胞が、哺乳類細胞、中型有棘ニューロン、皮質ニューロン、又はアストロサイトである;及び/又は
(ii)前記細胞が、対象内にある、請求項27に記載の組成物。 - 前記対象が、ハンチントン病(HD)を有する、請求項28に記載の組成物。
- HTT mRNAの発現が、少なくとも45%、50%、55%、60%、65%、70%、75%又は80%阻害される、請求項27~29のいずれか一項に記載の組成物。
- 対象のハンチントン病(HD)の治療に使用するための組成物であって、請求項1~16のいずれか一項に記載の調節性ポリヌクレオチド、請求項17~19のいずれか一項に記載のAAVウイルスゲノム、請求項20もしくは21に記載のrAAV粒子、又は請求項25に記載の医薬組成物を含む、組成物。
- HTT遺伝子、mRNA、及び/又はタンパク質の発現が、中枢神経系(CNS)の細胞又はCNSの領域において阻害される、請求項26又は31に記載の組成物。
- (i)前記CNSの細胞が、ニューロン、中型有棘ニューロン、アストロサイト、又はこれらの組合せを含む;
(ii)前記CNSの領域が、前脳領域、中脳領域、被殻領域、線条体領域、皮質領域、運動皮質領域、体性感覚皮質領域、側頭皮質領域、又はこれらの組合せである;又は
(iii)前記CNSの領域が、被殻領域である、請求項32に記載の組成物。 - 前記HTT遺伝子が、野生型のHTT遺伝子、mRNA、及び/又はタンパク質;少なくとも1つの突然変異を含むHTT遺伝子、mRNA、及び/又はタンパク質;CAGリピートを含むHTT遺伝子;又は、これらの組合せを含む、請求項27又は32に記載の組成物。
- CAGリピートを含む前記HTT遺伝子が、36~40回のCAGリピートを含むCAG伸長HTTである、請求項34に記載の組成物。
- 前記HDが、
(i)若年性型HD;
(ii)初期段階HD;
(iii)後期段階HD;
(iv)前記HTT遺伝子が41回以上のCAGリピートを含む完全浸透HD;
(v)前記HTT遺伝子が36~40回のCAGリピートを含む不完全浸透HD;又は
(vi)無症候HDである、請求項29又は31に記載の組成物。 - 前記使用が、前記対象におけるHDの症状の改善を含み、
前記症状が、無関心又は自発性の欠如、不機嫌、易怒、激越又は不安、自己管理不足、判断力低下、強情、脱抑制、抑欝、自殺念慮、多幸症、攻撃性、妄想、強迫、性欲亢進、幻覚、ジストニア、発話能力低下、不明瞭発語、嚥下困難、体重減少、動作緩慢、協調運動障害、認知機能障害、不安定歩行及び不随意運動、又はCNS変性に起因する特徴を含む、請求項31~36のいずれか一項に記載の組成物。 - 前記組成物が、
(i)被殻、視床、又はこれらの両方に;
(ii)被殻内投与、視床内投与、又はこれらの両方を介して;
(iii)実質内注射を介して、及び/又は
(iv)静脈内投与を介して、
投与される、請求項26及び31~37のいずれか一項に記載の組成物。 - 前記組成物が、HDの治療又は予防に好適な追加の治療剤と併用して前記対象に投与されるものであり、
前記追加の治療剤が、神経保護剤、ドーパミン枯渇剤、テトラベナジン、ベンゾジアゼピン、クロナゼパム、抗痙攣薬、バルプロ酸ナトリウム、レベチラセタム、レボドパ、骨格筋弛緩薬、バクロフェン、チザニジン、神経筋接合部におけるアセチルコリン放出に対する阻害薬、ボツリヌス毒素、非定型神経遮断薬、オランザピン、クエチアピン、リスペリドン、スルピリド、ハロペリドール、クロザピン、アリピプラゾール、クレアチン、選択的セロトニン再取り込み阻害薬(SSRI)、シタロプラム、フルオキセチン、パロキセチン、セルトラリン、ミルタザピン、ベンラファキシン、ゾピクロン(xopiclone)、ゾルピデム、気分安定剤、リチウム、IGF-I、GDNF、BDNF、CTNF、VEGF、コリベリン、キサリプロデン、甲状腺刺激ホルモン放出ホルモン、ADNF、又はこれらの組合せを含む、請求項26,29,及び31~36のいずれか一項に記載の組成物。 - 請求項20又は21に記載のrAAV粒子の作製方法であって、
(i)前記AAVウイルスゲノムと、前記カプシドタンパク質をコードする核酸とを含む細胞を提供すること;及び
(ii)前記細胞由来のrAAV粒子を精製すること、
を含み、これにより、前記rAAV粒子を作製する、方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662338113P | 2016-05-18 | 2016-05-18 | |
| US62/338,113 | 2016-05-18 | ||
| US201762485049P | 2017-04-13 | 2017-04-13 | |
| US62/485,049 | 2017-04-13 | ||
| PCT/US2017/033281 WO2017201258A1 (en) | 2016-05-18 | 2017-05-18 | Compositions and methods of treating huntington's disease |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019519219A JP2019519219A (ja) | 2019-07-11 |
| JP2019519219A5 JP2019519219A5 (ja) | 2020-06-25 |
| JP7220080B2 true JP7220080B2 (ja) | 2023-02-09 |
Family
ID=60325655
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018560628A Active JP7220080B2 (ja) | 2016-05-18 | 2017-05-18 | ハンチントン病治療組成物及び方法 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US11951121B2 (ja) |
| EP (1) | EP3458589A4 (ja) |
| JP (1) | JP7220080B2 (ja) |
| KR (2) | KR20220108216A (ja) |
| CN (1) | CN109831916B (ja) |
| AU (1) | AU2017268382B2 (ja) |
| BR (1) | BR112018073472A2 (ja) |
| CA (1) | CA3024449A1 (ja) |
| IL (2) | IL297576B2 (ja) |
| MX (1) | MX2018014152A (ja) |
| RU (1) | RU2764587C2 (ja) |
| SG (1) | SG11201809643UA (ja) |
| WO (1) | WO2017201258A1 (ja) |
Families Citing this family (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2017006216A (es) | 2014-11-14 | 2018-08-29 | Voyager Therapeutics Inc | Composiciones y métodos para tratar la esclerosis lateral amiotrófica (ela). |
| IL284949B2 (en) | 2014-11-14 | 2024-06-01 | Voyager Therapeutics Inc | Modulatory polynucleotides |
| EP3458588B1 (en) | 2016-05-18 | 2025-10-29 | Voyager Therapeutics, Inc. | Modulatory polynucleotides |
| CN111108198A (zh) * | 2017-05-05 | 2020-05-05 | 沃雅戈治疗公司 | 治疗亨廷顿病的组合物和方法 |
| EP3618839A4 (en) | 2017-05-05 | 2021-06-09 | Voyager Therapeutics, Inc. | Compositions and methods of treating amyotrophic lateral sclerosis (als) |
| WO2019060649A1 (en) * | 2017-09-22 | 2019-03-28 | Voyager Therapeutics, Inc. | COMPOSITIONS AND METHODS FOR TREATING HUNTINGTON'S DISEASE |
| AR113134A1 (es) * | 2017-09-22 | 2020-01-29 | Genzyme Corp | Arni variante |
| CN111479924B (zh) | 2017-10-16 | 2024-06-14 | 沃雅戈治疗公司 | 肌萎缩性侧索硬化症(als)的治疗 |
| WO2019213183A1 (en) * | 2018-04-30 | 2019-11-07 | The Trustees Of The University Of Pennsylvania | In utero crispr-mediated therapeutic editing of genes |
| WO2019222444A2 (en) * | 2018-05-16 | 2019-11-21 | Voyager Therapeutics, Inc. | Directed evolution |
| WO2019241486A1 (en) | 2018-06-13 | 2019-12-19 | Voyager Therapeutics, Inc. | Engineered 5' untranslated regions (5' utr) for aav production |
| CA3103963A1 (en) * | 2018-07-02 | 2020-01-09 | Voyager Therapeutics, Inc. | Treatment of amyotrophic lateral sclerosis and disorders associated with the spinal cord |
| JP2021530548A (ja) * | 2018-07-24 | 2021-11-11 | ボイジャー セラピューティクス インコーポレイテッドVoyager Therapeutics, Inc. | 遺伝子治療製剤を生産するための系および方法 |
| EP3861113A1 (en) | 2018-10-04 | 2021-08-11 | Voyager Therapeutics, Inc. | Methods for measuring the titer and potency of viral vector particles |
| CA3115248A1 (en) | 2018-10-05 | 2020-04-09 | Voyager Therapeutics, Inc. | Engineered nucleic acid constructs encoding aav production proteins |
| EA202190688A1 (ru) | 2018-10-09 | 2021-06-07 | Дзе Юниверсити Оф Бритиш Коламбиа | Композиции и системы, содержащие трансфекционно-компетентные везикулы, не содержащие органических растворителей и детергентов, и связанные с ними способы |
| TW202028468A (zh) | 2018-10-15 | 2020-08-01 | 美商航海家醫療公司 | 用於桿狀病毒/Sf9系統中rAAV之大規模生產的表現載體 |
| WO2020104469A1 (en) * | 2018-11-19 | 2020-05-28 | Uniqure Ip B.V. | Method and means to deliver mirna to target cells |
| SG11202107645RA (en) | 2019-01-18 | 2021-08-30 | Voyager Therapeutics Inc | Methods and systems for producing aav particles |
| AU2020225632A1 (en) * | 2019-02-22 | 2021-09-02 | Life Technologies Corporation | Suspension system for adeno associated virus production |
| WO2020223274A1 (en) | 2019-04-29 | 2020-11-05 | Voyager Therapeutics, Inc. | SYSTEMS AND METHODS FOR PRODUCING BACULOVIRAL INFECTED INSECT CELLS (BIICs) IN BIOREACTORS |
| WO2021030125A1 (en) | 2019-08-09 | 2021-02-18 | Voyager Therapeutics, Inc. | Cell culture medium for use in producing gene therapy products in bioreactors |
| WO2021041485A1 (en) | 2019-08-26 | 2021-03-04 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| WO2021053018A1 (en) * | 2019-09-16 | 2021-03-25 | Uniqure Ip B.V. | Targeting misspliced transcripts in genetic disorders |
| WO2021072129A2 (en) | 2019-10-08 | 2021-04-15 | Trustees Of Boston College | Proteins containing multiple, different unnatural amino acids and methods of making and using such proteins |
| CN112980837B (zh) * | 2019-12-13 | 2023-07-04 | 深圳艾码生物科技有限公司 | 一种抑制HTT基因表达的siRNA及其前体和应用 |
| JP2023517011A (ja) | 2020-03-05 | 2023-04-21 | ネオティーエックス セラピューティクス リミテッド | 免疫細胞を用いて癌を治療するための方法および組成物 |
| CA3181623A1 (en) | 2020-04-29 | 2021-11-04 | The Broad Institute, Inc. | Machine learning accelerated protein engineering through fitness prediction |
| AU2021314809A1 (en) | 2020-07-27 | 2023-02-23 | Anjarium Biosciences Ag | Compositions of DNA molecules, methods of making therefor, and methods of use thereof |
| EP4192514A1 (en) | 2020-08-06 | 2023-06-14 | Voyager Therapeutics, Inc. | Cell culture medium for use in producing gene therapy products in bioreactors |
| EP4196494A1 (en) | 2020-08-17 | 2023-06-21 | Massachusetts Institute of Technology | Shank3 gene therapy approaches |
| US20240141378A1 (en) | 2021-03-03 | 2024-05-02 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| EP4301768A2 (en) | 2021-03-03 | 2024-01-10 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| EP4396201A1 (en) * | 2021-09-03 | 2024-07-10 | BioMarin Pharmaceutical Inc. | Aav capsid compositions and methods for delivery |
| CA3234664A1 (en) | 2021-10-08 | 2023-04-13 | Dyno Therapeutics, Inc. | Capsid variants and methods of using the same |
| EP4469156A2 (en) * | 2022-01-27 | 2024-12-04 | Asklepios Biopharmaceutical, Inc. | Compositions for treating neurological disease |
| WO2023164545A1 (en) | 2022-02-23 | 2023-08-31 | Massachusetts Institute Of Technology | Methods for upregulating shank3 expression |
| WO2024054983A1 (en) | 2022-09-08 | 2024-03-14 | Voyager Therapeutics, Inc. | Controlled expression of viral proteins |
| WO2024129992A1 (en) * | 2022-12-15 | 2024-06-20 | President And Fellows Of Harvard College | Enhancers driving expression in motor neurons |
| WO2024137931A1 (en) * | 2022-12-21 | 2024-06-27 | Icahn School Of Medicine At Mount Sinai | Inhibition of zbtb7a |
| IL320511A (en) | 2022-12-29 | 2025-06-01 | Voyager Therapeutics Inc | Compositions and methods for regulating MAPT |
| WO2024226761A2 (en) | 2023-04-26 | 2024-10-31 | Voyager Therapeutics, Inc. | Compositions and methods for treating amyotrophic lateral sclerosis |
| WO2024233422A1 (en) | 2023-05-05 | 2024-11-14 | Massachusetts Institute Of Technology | Shank3 gene therapy approaches |
| WO2025122644A1 (en) | 2023-12-05 | 2025-06-12 | Voyager Therapeutics, Inc. | Compositions and methods for regulating mapt |
| WO2025160434A1 (en) * | 2024-01-26 | 2025-07-31 | Genzyme Corporation | Artificial micrornas targeting huntington's disease |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008503590A (ja) | 2004-06-21 | 2008-02-07 | メドトロニック・インコーポレーテッド | 組成物を細胞にデリバリーするための医学用システム及び方法 |
| JP2009513144A (ja) | 2005-10-28 | 2009-04-02 | アルナイラム ファーマシューティカルズ インコーポレイテッド | ハンチンチン遺伝子の発現を抑制するための組成物および方法 |
| WO2015143078A1 (en) | 2014-03-18 | 2015-09-24 | University Of Massachusetts | Raav-based compositions and methods for treating amyotrophic lateral sclerosis |
| WO2015168666A2 (en) | 2014-05-02 | 2015-11-05 | Genzyme Corporation | Aav vectors for retinal and cns gene therapy |
Family Cites Families (429)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2640638B1 (fr) | 1988-12-20 | 1991-02-15 | Commissariat Energie Atomique | Bioreacteur et dispositif pour la culture de cellules animales |
| WO1991018088A1 (en) | 1990-05-23 | 1991-11-28 | The United States Of America, Represented By The Secretary, United States Department Of Commerce | Adeno-associated virus (aav)-based eucaryotic vectors |
| US5173414A (en) | 1990-10-30 | 1992-12-22 | Applied Immune Sciences, Inc. | Production of recombinant adeno-associated virus vectors |
| US5252479A (en) | 1991-11-08 | 1993-10-12 | Research Corporation Technologies, Inc. | Safe vector for gene therapy |
| US5587308A (en) | 1992-06-02 | 1996-12-24 | The United States Of America As Represented By The Department Of Health & Human Services | Modified adeno-associated virus vector capable of expression from a novel promoter |
| US6268213B1 (en) | 1992-06-03 | 2001-07-31 | Richard Jude Samulski | Adeno-associated virus vector and cis-acting regulatory and promoter elements capable of expressing at least one gene and method of using same for gene therapy |
| US5693531A (en) | 1993-11-24 | 1997-12-02 | The United States Of America As Represented By The Department Of Health And Human Services | Vector systems for the generation of adeno-associated virus particles |
| ATE386131T1 (de) | 1994-04-13 | 2008-03-15 | Univ Rockefeller | Aav-vermittelte überbringung von dna in zellen des nervensystems |
| US20020159979A1 (en) | 1994-06-06 | 2002-10-31 | Children's Hospital, Inc. | Adeno-associated virus materials and methods |
| US5658785A (en) | 1994-06-06 | 1997-08-19 | Children's Hospital, Inc. | Adeno-associated virus materials and methods |
| US6204059B1 (en) | 1994-06-30 | 2001-03-20 | University Of Pittsburgh | AAV capsid vehicles for molecular transfer |
| US5856152A (en) | 1994-10-28 | 1999-01-05 | The Trustees Of The University Of Pennsylvania | Hybrid adenovirus-AAV vector and methods of use therefor |
| US5625048A (en) | 1994-11-10 | 1997-04-29 | The Regents Of The University Of California | Modified green fluorescent proteins |
| WO1996017947A1 (en) | 1994-12-06 | 1996-06-13 | Targeted Genetics Corporation | Packaging cell lines for generation of high titers of recombinant aav vectors |
| US5652224A (en) | 1995-02-24 | 1997-07-29 | The Trustees Of The University Of Pennsylvania | Methods and compositions for gene therapy for the treatment of defects in lipoprotein metabolism |
| US5741657A (en) | 1995-03-20 | 1998-04-21 | The Regents Of The University Of California | Fluorogenic substrates for β-lactamase and methods of use |
| US5756283A (en) | 1995-06-05 | 1998-05-26 | The Trustees Of The University Of Pennsylvania | Method for improved production of recombinant adeno-associated viruses for gene therapy |
| US6281010B1 (en) | 1995-06-05 | 2001-08-28 | The Trustees Of The University Of Pennsylvania | Adenovirus gene therapy vehicle and cell line |
| US5688676A (en) | 1995-06-07 | 1997-11-18 | Research Foundation Of State University Of New York | In vitro packaging of adeno-associated virus DNA |
| US5741683A (en) | 1995-06-07 | 1998-04-21 | The Research Foundation Of State University Of New York | In vitro packaging of adeno-associated virus DNA |
| US6197293B1 (en) | 1997-03-03 | 2001-03-06 | Calydon, Inc. | Adenovirus vectors specific for cells expressing androgen receptor and methods of use thereof |
| US6676935B2 (en) | 1995-06-27 | 2004-01-13 | Cell Genesys, Inc. | Tissue specific adenoviral vectors |
| JPH11511326A (ja) | 1995-08-30 | 1999-10-05 | ジエンザイム コーポレイション | アデノウィルスおよびaavの精製 |
| US6265389B1 (en) | 1995-08-31 | 2001-07-24 | Alkermes Controlled Therapeutics, Inc. | Microencapsulation and sustained release of oligonucleotides |
| US5858351A (en) | 1996-01-18 | 1999-01-12 | Avigen, Inc. | Methods for delivering DNA to muscle cells using recombinant adeno-associated virus vectors |
| US5846528A (en) | 1996-01-18 | 1998-12-08 | Avigen, Inc. | Treating anemia using recombinant adeno-associated virus virions comprising an EPO DNA sequence |
| US5962313A (en) | 1996-01-18 | 1999-10-05 | Avigen, Inc. | Adeno-associated virus vectors comprising a gene encoding a lyosomal enzyme |
| US5952221A (en) | 1996-03-06 | 1999-09-14 | Avigen, Inc. | Adeno-associated virus vectors comprising a first and second nucleic acid sequence |
| US7026468B2 (en) | 1996-07-19 | 2006-04-11 | Valentis, Inc. | Process and equipment for plasmid purification |
| US6083716A (en) | 1996-09-06 | 2000-07-04 | The Trustees Of The University Of Pennsylvania | Chimpanzee adenovirus vectors |
| AU722375B2 (en) | 1996-09-06 | 2000-08-03 | Trustees Of The University Of Pennsylvania, The | Methods using cre-lox for production of recombinant adeno-associated viruses |
| US5866552A (en) | 1996-09-06 | 1999-02-02 | The Trustees Of The University Of Pennsylvania | Method for expressing a gene in the absence of an immune response |
| AU722624B2 (en) | 1996-09-06 | 2000-08-10 | Trustees Of The University Of Pennsylvania, The | An inducible method for production of recombinant adeno-associated viruses utilizing T7 polymerase |
| US20020037867A1 (en) | 1999-02-26 | 2002-03-28 | James M. Wilson | Method for recombinant adeno-associated virus-directed gene therapy |
| DE69738351T2 (de) | 1996-09-06 | 2008-11-13 | The Trustees Of The University Of Pennsylvania | Verfaheren zur durch rekombinante adeno-assoziierte virus-gerichtete gentherapie |
| CA2265460A1 (en) | 1996-09-11 | 1998-03-19 | The Government Of The United States Of America, Represented By The Secre Tary, Department Of Health And Human Services | Aav4 vector and uses thereof |
| US7732129B1 (en) | 1998-12-01 | 2010-06-08 | Crucell Holland B.V. | Method for the production and purification of adenoviral vectors |
| WO1998022588A2 (en) | 1996-11-20 | 1998-05-28 | Introgen Therapeutics, Inc. | An improved method for the production and purification of adenoviral vectors |
| AU741605B2 (en) | 1996-12-18 | 2001-12-06 | Targeted Genetics Corporation | AAV split-packaging genes and cell lines comprising such genes for use in the production of recombinant AAV vectors |
| US6156303A (en) | 1997-06-11 | 2000-12-05 | University Of Washington | Adeno-associated virus (AAV) isolates and AAV vectors derived therefrom |
| US6710036B2 (en) | 1997-07-25 | 2004-03-23 | Avigen, Inc. | Induction of immune response to antigens expressed by recombinant adeno-associated virus |
| US6251677B1 (en) | 1997-08-25 | 2001-06-26 | The Trustees Of The University Of Pennsylvania | Hybrid adenovirus-AAV virus and methods of use thereof |
| US6995006B2 (en) | 1997-09-05 | 2006-02-07 | Targeted Genetics Corporation | Methods for generating high titer helper-free preparations of released recombinant AAV vectors |
| US6566118B1 (en) | 1997-09-05 | 2003-05-20 | Targeted Genetics Corporation | Methods for generating high titer helper-free preparations of released recombinant AAV vectors |
| JP2001517454A (ja) | 1997-09-19 | 2001-10-09 | ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア | 組換えアデノ随伴ウイルスの産生に有用な方法および細胞株 |
| CA2304131A1 (en) | 1997-09-19 | 1999-04-01 | James M. Wilson | Method for gene transfer using bcl2 and compositions useful therein |
| WO1999014354A1 (en) | 1997-09-19 | 1999-03-25 | The Trustees Of The University Of The Pennsylvania | Methods and vector constructs useful for production of recombinant aav |
| US6642051B1 (en) | 1997-10-21 | 2003-11-04 | Targeted Genetics Corporation | Amplifiable adeno-associated virus(AAV) packaging cassettes for the production of recombinant AAV vectors |
| IT1297074B1 (it) | 1997-11-21 | 1999-08-03 | Angeletti P Ist Richerche Bio | Forme ormone-dipendenti delle proteine rep del virus adeno-associato (aav-2), sequenze di dna codificanti per esse, vettori che le |
| JP2001526900A (ja) | 1997-12-23 | 2001-12-25 | イントロヘーネ ベスローテン フェンノートシャップ | 標的細胞の染色体dnaへの外来遺伝子情報の組み込みに有用な、アデノ随伴ウイルスおよびアデノウイルスのキメラ組換えウイルス |
| US6410300B1 (en) | 1998-01-12 | 2002-06-25 | The University Of North Carolina At Chapel Hill | Methods and formulations for mediating adeno-associated virus (AAV) attachment and infection and methods for purifying AAV |
| AU2882899A (en) | 1998-02-26 | 1999-09-15 | Trustees Of The University Of Pennsylvania, The | Stable protection from dystrophic sarcolemmal degeneration and restoration of the sarcoglycan complex |
| US6953690B1 (en) | 1998-03-20 | 2005-10-11 | The Trustees Of The University Of Pennsylvania | Compositions and methods for helper-free production of recombinant adeno-associated viruses |
| US6521426B1 (en) | 1998-04-08 | 2003-02-18 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti S.P.A. | Preparation of recombinant adenovirus carrying a rep gene of adeno-associated virus |
| FR2778413B1 (fr) | 1998-05-07 | 2000-08-04 | Immunotech Sa | Nouveaux reactifs et methode de lyse des erythrocytes |
| EP1078096A1 (en) | 1998-05-11 | 2001-02-28 | Ariad Gene Therapeutics, Inc. | Multiviral compositions and uses thereof |
| US6436392B1 (en) | 1998-05-20 | 2002-08-20 | University Of Iowa Research Foundation | Adeno-associated virus vectors |
| EP1849872A1 (en) | 1998-05-20 | 2007-10-31 | University Of Iowa Research Foundation | Adeno-associated virus vectors and uses thereof |
| WO1999061643A1 (en) | 1998-05-27 | 1999-12-02 | University Of Florida | Method of preparing recombinant adeno-associated virus compositions by using an iodixananol gradient |
| EP1082445A2 (en) | 1998-05-27 | 2001-03-14 | Cell Genesys, Inc. | Adeno-associated viral vector-mediated expression of factor viii activity |
| US6984517B1 (en) | 1998-05-28 | 2006-01-10 | The United States Of America As Represented By The Department Of Health And Human Services | AAV5 vector and uses thereof |
| ATE402254T1 (de) | 1998-05-28 | 2008-08-15 | Us Gov Health & Human Serv | Aav5 vektoren und deren verwendung |
| GB2338236B (en) | 1998-06-13 | 2003-04-09 | Aea Technology Plc | Microbiological cell processing |
| US6900049B2 (en) | 1998-09-10 | 2005-05-31 | Cell Genesys, Inc. | Adenovirus vectors containing cell status-specific response elements and methods of use thereof |
| WO2000022152A1 (en) | 1998-10-13 | 2000-04-20 | Avigen, Inc. | Compositions and methods for producing recombinant adeno-associated virus |
| US6200560B1 (en) | 1998-10-20 | 2001-03-13 | Avigen, Inc. | Adeno-associated virus vectors for expression of factor VIII by target cells |
| AU764130B2 (en) | 1998-10-27 | 2003-08-14 | Crucell Holland B.V. | Improved AAV vector production |
| US6759237B1 (en) | 1998-11-05 | 2004-07-06 | The Trustees Of The University Of Pennsylvania | Adeno-associated virus serotype 1 nucleic acid sequences, vectors and host cells containing same |
| US6689600B1 (en) | 1998-11-16 | 2004-02-10 | Introgen Therapeutics, Inc. | Formulation of adenovirus for gene therapy |
| US6759050B1 (en) | 1998-12-03 | 2004-07-06 | Avigen, Inc. | Excipients for use in adeno-associated virus pharmaceutical formulations, and pharmaceutical formulations made therewith |
| US6225113B1 (en) | 1998-12-04 | 2001-05-01 | Genvec, Inc. | Use of trans-activation and cis-activation to modulate the persistence of expression of a transgene in an at least E4-deficient adenovirus |
| US6387368B1 (en) | 1999-02-08 | 2002-05-14 | The Trustees Of The University Of Pennsylvania | Hybrid adenovirus-AAV virus and methods of use thereof |
| DE19905501B4 (de) | 1999-02-10 | 2005-05-19 | MediGene AG, Gesellschaft für molekularbiologische Kardiologie und Onkologie | Verfahren zur Herstellung eines rekombinanten Adeno-assoziierten Virus, geeignete Mittel hierzu sowie Verwendung zur Herstellung eines Arzneimittels |
| US6509150B1 (en) | 1999-03-05 | 2003-01-21 | Universite De Nantes | Compositions and methods for recombinant Adeno-Associated Virus production |
| JP4693244B2 (ja) | 1999-03-18 | 2011-06-01 | ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア | 組換えアデノ随伴ウイルスのヘルパー無しの生産のための組成物および方法 |
| US6258595B1 (en) | 1999-03-18 | 2001-07-10 | The Trustees Of The University Of Pennsylvania | Compositions and methods for helper-free production of recombinant adeno-associated viruses |
| WO2000066780A2 (en) | 1999-04-30 | 2000-11-09 | University Of Florida | Adeno-associated virus-delivered ribozyme compositions and methods of use |
| EP1183380A1 (en) | 1999-06-02 | 2002-03-06 | The Trustees Of The University Of Pennsylvania | Compositions and methods useful for production of recombinant viruses which require helper viruses |
| JP4969002B2 (ja) | 1999-06-08 | 2012-07-04 | ユニバーシテイ・オブ・アイオワ・リサーチ・フアウンデーシヨン | rAAV形質導入を増加するための化合物および方法 |
| CA2382483A1 (en) | 1999-08-20 | 2001-03-01 | Johns Hopkins University School Of Medicine | Methods and compositions for the construction and use of fusion libraries |
| CA2384814A1 (en) | 1999-09-29 | 2001-04-05 | The Trustees Of The University Of Pennsylvania | Methods for rapid peg-modification of viral vectors, compositions for enhanced gene transduction, compositions with enhanced physical stability, and uses therefor |
| US6365394B1 (en) | 1999-09-29 | 2002-04-02 | The Trustees Of The University Of Pennsylvania | Cell lines and constructs useful in production of E1-deleted adenoviruses in absence of replication competent adenovirus |
| US7241447B1 (en) | 1999-10-07 | 2007-07-10 | University Of Iowa Research Foundation | Adeno-associated virus vectors and uses thereof |
| WO2001025465A1 (en) | 1999-10-07 | 2001-04-12 | University Of Iowa Research Foundation | Adeno-associated viruses and uses thereof |
| AU1436401A (en) | 1999-10-21 | 2001-05-14 | Board Of Trustees Of The University Of Arkansas, The | RepO-associated virus AAV REP78 major regulatory protein, mutants thereof and uses thereof |
| WO2001036623A2 (en) | 1999-11-05 | 2001-05-25 | Avigen, Inc. | Ecdysone-inducible adeno-associated virus expression vectors |
| WO2001036603A2 (en) | 1999-11-17 | 2001-05-25 | Avigen, Inc. | Recombinant adeno-associated virus virions for the treatment of lysosomal disorders |
| US20010049144A1 (en) | 1999-12-10 | 2001-12-06 | Victor Rivera | Methods for high level expression of genes in primates |
| US7638120B2 (en) | 2000-03-14 | 2009-12-29 | Thomas Jefferson University | High transgene expression of a pseudotyped adeno-associated virus type |
| WO2001068888A2 (en) | 2000-03-14 | 2001-09-20 | Neurologix, Inc. | Production of chimeric capsid vectors |
| US6855314B1 (en) | 2000-03-22 | 2005-02-15 | The United States Of America As Represented By The Department Of Health And Human Services | AAV5 vector for transducing brain cells and lung cells |
| US6468524B1 (en) | 2000-03-22 | 2002-10-22 | The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services | AAV4 vector and uses thereof |
| US7048920B2 (en) | 2000-03-24 | 2006-05-23 | Cell Genesys, Inc. | Recombinant oncolytic adenovirus for human melanoma |
| KR20080023768A (ko) | 2000-03-30 | 2008-03-14 | 화이트헤드 인스티튜트 포 바이오메디칼 리서치 | Rna 간섭의 rna 서열 특이적인 매개체 |
| GB0009887D0 (en) | 2000-04-20 | 2000-06-07 | Btg Int Ltd | Cytotoxic agents |
| CA2406743A1 (en) | 2000-04-28 | 2001-11-08 | The Trustees Of The University Of Pennsylvania | Recombinant aav vectors with aav5 capsids and aav5 vectors pseudotyped in heterologous capsids |
| US20030013189A1 (en) | 2000-04-28 | 2003-01-16 | Wilson James M. | Compositions and methods useful for non-invasive delivery of therapeutic molecules to the bloodstream |
| US7125705B2 (en) | 2000-04-28 | 2006-10-24 | Genzyme Corporation | Polynucleotides for use in recombinant adeno-associated virus virion production |
| AU2001268373A1 (en) | 2000-06-13 | 2001-12-24 | The Children's Hospital Of Philadelphia | Methods for administering recombinant adeno-associated virus virions to humans previously exposed to adeno-associated virus |
| WO2002006483A1 (fr) | 2000-07-18 | 2002-01-24 | Takeda Chemical Industries, Ltd. | Nouveau peptide actif sur le plan physiologique et utilisation associee |
| US6329181B1 (en) | 2000-08-07 | 2001-12-11 | Neurologix, Inc. | Helper functions for recombinant vector production |
| US6593123B1 (en) | 2000-08-07 | 2003-07-15 | Avigen, Inc. | Large-scale recombinant adeno-associated virus (rAAV) production and purification |
| US20020111324A1 (en) | 2000-08-17 | 2002-08-15 | Keiya Ozawa | Adeno-associated virus-mediated delivery of angiogenic factors |
| DE10044384A1 (de) | 2000-09-08 | 2002-04-18 | Medigene Ag | Wirtszellen zur Verpackung von rekombinantem Adeno-assoziiertem Virus (rAAV), Verfahren zu ihrer Herstellung und deren Verwendung |
| FR2813891B1 (fr) | 2000-09-14 | 2005-01-14 | Immunotech Sa | Reactif multifonctionnel pour erythrocytes mettant en jeu des carbamates et applications |
| JP2002153278A (ja) | 2000-11-22 | 2002-05-28 | Hisamitsu Pharmaceut Co Inc | ウイルスベクターの製造に用いられる細胞、その製法およびその細胞を用いたウイルスベクターの製造方法 |
| WO2002070719A2 (en) | 2001-01-19 | 2002-09-12 | Trustees Of The University Of Pennsylvania | Regulatable gene expression system |
| FR2821624B1 (fr) | 2001-03-01 | 2004-01-02 | Sod Conseils Rech Applic | Nouveau polynucleotide utilisable pour moduler la proliferation des cellules cancereuses |
| JP2004532822A (ja) | 2001-03-14 | 2004-10-28 | アビジェン, インコーポレイテッド | ビリオンの管逆行感染による組換えアデノ随伴ウイルス媒介遺伝子移入 |
| US20060217331A1 (en) * | 2001-05-18 | 2006-09-28 | Sirna Therapeutics, Inc. | Chemically modified double stranded nucleic acid molecules that mediate RNA interference |
| US20040136963A1 (en) | 2001-06-22 | 2004-07-15 | The Trustees Of The University Of Pennsylvania | Simian adenovirus vectors and methods of use |
| ES2375557T3 (es) | 2001-06-22 | 2012-03-02 | The Trustees Of The University Of Pennsylvania | Adenovirus recombinantes que comprenden prote�?nas de adenovirus de simios y usos de los mismos. |
| CA2921821A1 (en) | 2001-07-12 | 2003-01-23 | University Of Massachusetts | In vivo production of small interfering rnas that mediate gene silencing |
| EP1900815B1 (en) | 2001-07-12 | 2016-09-07 | University of Massachusetts | In vivo production of small interfering RNAs that mediate gene silencing |
| US8241622B2 (en) | 2001-07-13 | 2012-08-14 | University Of Iowa Research Foundation | Adeno-associated virus vectors with intravector heterologous terminal palindromic sequences |
| EP1279740A1 (en) | 2001-07-26 | 2003-01-29 | Vrije Universiteit Brussel | Recombinant vector derived from adeno-associated virus for gene therapy |
| EP1427835B1 (en) | 2001-08-08 | 2016-01-20 | The Trustees of the University of Pennsylvania | Method for purification of viral vectors having proteins which bind sialic acid |
| US20030092161A1 (en) | 2001-09-19 | 2003-05-15 | The Trustees Of The University Of Pennsylvania | Compositions and methods for production of recombinant viruses, and uses therefor |
| EP2385123B1 (en) | 2001-09-28 | 2018-04-25 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Microrna molecules |
| US6723551B2 (en) | 2001-11-09 | 2004-04-20 | The United States Of America As Represented By The Department Of Health And Human Services | Production of adeno-associated virus in insect cells |
| EP1572893B1 (en) | 2001-11-09 | 2009-01-07 | THE GOVERNMENT OF THE UNITED STATES OF AMERICA as represented by THE SECRETARY of the DEPARTMENT OF HEALTH AND HUMAN SERVICES | Production of adeno-associated virus in insect cells |
| IL161827A0 (en) | 2001-11-13 | 2005-11-20 | Univ Pennsylvania | A method of detecting and/or identifying adeno-associated virus (aav) sequences and isolating novelsequences identified thereby |
| SG165153A1 (en) | 2001-11-21 | 2010-10-28 | Univ Pennsylvania | Simian adenovirus nucleic acid and amino acid sequences, vectors containing same, and methods of use |
| EP1944043A1 (en) | 2001-11-21 | 2008-07-16 | The Trustees of the University of Pennsylvania | Simian adenovirus nucleic acid and amino acid sequences, vectors containing same, and methods of use |
| CA2469491A1 (en) | 2001-12-12 | 2003-06-19 | Kerrie Setiawan | Composition for viral preservation |
| EP1463805B1 (en) | 2001-12-17 | 2014-10-22 | The Trustees of The University of Pennsylvania | Adeno-associated virus (aav) serotype 9 sequences, vectors containing same, and uses therefor |
| CA2469785C (en) | 2001-12-17 | 2014-04-22 | The Trustees Of The University Of Pennsylvania | Adeno-associated virus (aav) serotype 8 sequences, vectors containing same, and uses therefor |
| CA2469658A1 (en) | 2001-12-19 | 2003-07-03 | Lijun Wang | Adeno-associated virus-mediated delivery of gdnf to skeletal muscles |
| CA2473376A1 (en) | 2002-01-16 | 2003-07-31 | Dynal Biotech Asa | Method for isolating nucleic acids and protein from a single sample |
| GB0208390D0 (en) | 2002-04-11 | 2002-05-22 | Univ London | Adeno-associated virus producer system |
| US20030198620A1 (en) | 2002-04-16 | 2003-10-23 | Keiya Ozawa | Method of treating amino acid metabolic disorders using recombinant adeno-associated virus virions |
| ES2280694T3 (es) | 2002-04-29 | 2007-09-16 | The Trustees Of The University Of Pennsylvania | Metodo para la extraccion directa y la amplificacion de virus integrados del adn celular de tejidos. |
| CA2482512C (en) | 2002-04-30 | 2011-09-20 | Oncolytics Biotech Inc. | Improved viral purification methods |
| ATE405295T1 (de) | 2002-05-01 | 2008-09-15 | Univ Florida | Verbesserte raav-expressionssysteme für die genetische modifikation spezifischer capsidproteine |
| AU2003265978A1 (en) | 2002-05-03 | 2003-11-17 | Duke University | A method of regulating gene expression |
| ATE494362T1 (de) | 2002-05-14 | 2011-01-15 | Merck Sharp & Dohme | Verfahren zur reinigung von adenovirus |
| US7419817B2 (en) | 2002-05-17 | 2008-09-02 | The United States Of America As Represented By The Secretary Department Of Health And Human Services, Nih. | Scalable purification of AAV2, AAV4 or AAV5 using ion-exchange chromatography |
| WO2003104413A2 (en) | 2002-06-05 | 2003-12-18 | University Of Florida | Production of pseudotyped recombinant aav virions |
| US20050255086A1 (en) | 2002-08-05 | 2005-11-17 | Davidson Beverly L | Nucleic acid silencing of Huntington's Disease gene |
| US20040241854A1 (en) | 2002-08-05 | 2004-12-02 | Davidson Beverly L. | siRNA-mediated gene silencing |
| US20080274989A1 (en) | 2002-08-05 | 2008-11-06 | University Of Iowa Research Foundation | Rna Interference Suppression of Neurodegenerative Diseases and Methods of Use Thereof |
| AU2003273336A1 (en) | 2002-09-18 | 2004-04-08 | Isis Pharmaceuticals, Inc. | Efficient reduction of target rna's by single- and double-stranded oligomeric compounds |
| EP1418185A1 (en) | 2002-11-11 | 2004-05-12 | Aventis Pharma Deutschland GmbH | Use of EDG2 receptor in an animal model of heart failure |
| US7169612B2 (en) | 2002-11-11 | 2007-01-30 | Sanofi-Aventis Deutschland Gmbh | Use of EDG2 receptor in an animal model of heart failure |
| US7618948B2 (en) | 2002-11-26 | 2009-11-17 | Medtronic, Inc. | Devices, systems and methods for improving and/or cognitive function through brain delivery of siRNA |
| US20060269530A1 (en) | 2003-02-21 | 2006-11-30 | The Penn State Research Foundation | RNA interference compositions and methods |
| US7510872B2 (en) | 2003-02-26 | 2009-03-31 | Nationwide Children's Hospital | Recombinant adeno-associated virus production |
| WO2004083441A2 (en) | 2003-03-19 | 2004-09-30 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Random peptide library displayed on aav vectors |
| WO2004108922A2 (en) | 2003-04-25 | 2004-12-16 | The Trustees Of The University Of Pennsylvania | Use of aav comprising a capsid protein from aav7 or aav8 for the delivery of genes encoding apoprotein a or e genes to the liver |
| AU2004239114B2 (en) | 2003-05-14 | 2008-03-13 | Japan Science And Technology Agency | Inhibition of the expression of huntingtin gene |
| WO2005017101A2 (en) | 2003-05-19 | 2005-02-24 | THE GOVERNMENT OF THE UNITED STATES OF AMERICA, as represented by THE SECRETARY, DEPARTMENT OF HEALTH & HUMAN SERVICES, NATIONAL INSTITUTES OF HEALTH | Avian adenoassociated virus (aaav) and uses thereof |
| EP2277996B1 (en) | 2003-05-21 | 2014-09-03 | Genzyme Corporation | Methods for producing preparations of recombinant AAV virions substantially free of empty capsids |
| EP1633890B2 (en) * | 2003-06-02 | 2020-11-18 | University of Massachusetts | METHODS AND COMPOSITIONS FOR ENHANCING THE EFFICACY AND SPECIFICITY OF FNAi |
| EP1486567A1 (en) | 2003-06-11 | 2004-12-15 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Improved adeno-associated virus (AAV) vector for gene therapy |
| JP4888876B2 (ja) | 2003-06-13 | 2012-02-29 | 田平 武 | アルツハイマー病の治療のための組換えアデノ随伴ウィルスベクター |
| DK2657247T3 (en) | 2003-06-19 | 2017-07-10 | Genzyme Corp | AAV virions with reduced immunoreactivity and applications thereof |
| US7291498B2 (en) | 2003-06-20 | 2007-11-06 | The Trustees Of The University Of Pennsylvania | Methods of generating chimeric adenoviruses and uses for such chimeric adenoviruses |
| CA2528511C (en) | 2003-06-20 | 2015-11-03 | The Trustees Of The University Of Pennsylvania | Methods of generating chimeric adenoviruses and uses for such chimeric adenoviruses |
| US9441244B2 (en) | 2003-06-30 | 2016-09-13 | The Regents Of The University Of California | Mutant adeno-associated virus virions and methods of use thereof |
| WO2005012537A2 (en) | 2003-07-25 | 2005-02-10 | Genvec, Inc. | Adenoviral vector-based vaccines |
| WO2005013901A2 (en) | 2003-07-31 | 2005-02-17 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding rnas |
| EP3760234B1 (en) | 2003-09-12 | 2023-11-01 | University of Massachusetts | Rna interference for the treatment of gain-of-function disorders |
| EP3211085B1 (en) | 2003-09-30 | 2021-03-31 | The Trustees of The University of Pennsylvania | Adeno-associated virus (aav) clades, sequences, vectors containing same, and uses therefor |
| EP1692262B1 (en) | 2003-10-27 | 2018-08-15 | Merck Sharp & Dohme Corp. | Method of designing sirnas for gene silencing |
| WO2006078279A2 (en) | 2004-04-28 | 2006-07-27 | The Trustees Of The University Of Pennsylvania | Sequential delivery of immunogenic molecules via adenovirus and adeno-associated virus-mediated administrations |
| HUE035418T2 (en) | 2004-06-01 | 2018-05-02 | Genzyme Corp | Preparations and methods for preventing aggregation of the AAV vector |
| EP2572661B1 (en) | 2004-10-05 | 2019-11-20 | Genzyme Corporation | Stepped cannula |
| JPWO2006043354A1 (ja) | 2004-10-20 | 2008-05-22 | 独立行政法人放射線医学総合研究所 | 組込型の低線量放射線誘導性ベクター |
| US7901921B2 (en) | 2004-10-22 | 2011-03-08 | Oncolytics Biotech Inc. | Viral purification methods |
| EP1814899A4 (en) | 2004-11-18 | 2008-09-03 | Univ Illinois | MULTICISTRONIC INTERFERING RNA CONSTRUCTS FOR INHIBITING TUMORS |
| CN1286981C (zh) | 2004-11-30 | 2006-11-29 | 华中科技大学同济医学院附属同济医院 | 表达人类cyp2j2反义基因的重组腺相关病毒及其制备方法 |
| CA2596588C (en) * | 2005-01-31 | 2017-06-27 | University Of Iowa Research Foundation | Nucleic acid silencing of huntington's disease gene |
| WO2006084209A2 (en) | 2005-02-03 | 2006-08-10 | Benitec, Inc. | Rnai expression constructs |
| US8614101B2 (en) | 2008-05-20 | 2013-12-24 | Rapid Pathogen Screening, Inc. | In situ lysis of cells in lateral flow immunoassays |
| US7625570B1 (en) | 2005-03-10 | 2009-12-01 | The Regents Of The University Of California | Methods for purifying adeno-associated virus |
| WO2006102072A2 (en) | 2005-03-23 | 2006-09-28 | The Trustees Of The University Of Pennsylvania | Use of a pa131 polypeptide in treatment of atherosclerosis |
| CN104293835B (zh) | 2005-04-07 | 2017-07-04 | 宾夕法尼亚大学托管会 | 增强腺相关病毒载体功能的方法 |
| WO2006119432A2 (en) | 2005-04-29 | 2006-11-09 | The Government Of The U.S.A., As Rep. By The Sec., Dept. Of Health & Human Services | Isolation, cloning and characterization of new adeno-associated virus (aav) serotypes |
| CA2607173C (en) | 2005-05-02 | 2018-04-24 | Genzyme Corporation | Composition comprising an adeno-associated virus vector having a serotype 1 capsid for use in treating lysosomal storage diseases or alzheimer's disease |
| AU2006279280A1 (en) | 2005-08-18 | 2007-02-22 | Alnylam Pharmaceuticals, Inc. | Methods and compositions for treating neurological disease |
| EP1928557B1 (en) | 2005-08-23 | 2018-06-06 | The Regents of The University of California | Reflux resistant cannula and system for chronic delivery of therapeutic agents using convection-enhanced delivery |
| EP1857552A1 (en) | 2006-05-20 | 2007-11-21 | Cargill Incorporated | Thermostable xylose isomerase enzyme |
| WO2007046703A2 (en) | 2005-10-20 | 2007-04-26 | Amsterdam Molecular Therapeutics B.V. | Improved aav vectors produced in insect cells |
| WO2007120542A2 (en) | 2006-03-30 | 2007-10-25 | The Board Of Trustees Of The Leland Stanford Junior University | Aav capsid library and aav capsid proteins |
| KR101407707B1 (ko) | 2006-04-03 | 2014-06-19 | 산타리스 팔마 에이/에스 | Anti-mirna 안티센스 올리고뉴클레오타이드를 함유하는 약학적 조성물 |
| WO2007127264A2 (en) | 2006-04-28 | 2007-11-08 | The Trustees Of The University Of Pennsylvania | Scalable production method for aav |
| WO2008027084A2 (en) | 2006-04-28 | 2008-03-06 | The Trustees Of The University Of Pennsylvania | Modified aav vectors having reduced capsid immunogenicity and use thereof |
| PL2012822T3 (pl) | 2006-04-28 | 2010-06-30 | Univ Pennsylvania | Zmodyfikowane białko heksonu adenowirusa i jego zastosowania |
| US20080003565A1 (en) | 2006-05-02 | 2008-01-03 | Government Of The Us, As Represented By The Secretary, Department Of Health And Human Services | Viral nucleic acid microarray and method of use |
| EP2447279B1 (en) | 2006-05-25 | 2014-04-09 | Sangamo BioSciences, Inc. | Methods and compositions for gene inactivation |
| WO2007148971A2 (en) | 2006-06-21 | 2007-12-27 | Amsterdam Molecular Therapeutics B.V. | Vectors with modified initiation codon for the translation of aav-rep78 useful for production of aav in insect cells |
| BRPI0714495B8 (pt) | 2006-07-21 | 2021-05-25 | California Inst Of Techn | lentivírus deficiente para replicação recombinante pseudotipado |
| CN101501193B (zh) * | 2006-08-11 | 2013-07-03 | 普罗森那技术公司 | 用于治疗与dna重复不稳定性相关的遗传病的方法和手段 |
| ES2385679T3 (es) | 2006-08-24 | 2012-07-30 | Virovek, Inc. | Expresión de células de insecto de genes con marcos de lectura abiertos superpuestos, métodos y composiciones de éstos |
| CA2670967C (en) | 2006-11-29 | 2016-05-10 | University Of Iowa Research Foundation | Alternative export pathways for vector expressed rna interference |
| ES2569365T3 (es) | 2006-11-29 | 2016-05-10 | Nationwide Children's Hospital | Inhibición de miostatina para la potenciación de músculo y/o la mejora de la función muscular |
| US9611302B2 (en) | 2007-04-09 | 2017-04-04 | University Of Florida Research Foundation, Inc. | High-transduction-efficiency RAAV vectors, compositions, and methods of use |
| DK2191001T3 (en) | 2007-04-09 | 2016-09-19 | Univ Florida | RAAV VECTOR COMPOSITIONS WITH TYROSIN MODIFIED CAPSIDE PROTEINS AND PROCEDURES FOR USE THEREOF |
| US9725485B2 (en) | 2012-05-15 | 2017-08-08 | University Of Florida Research Foundation, Inc. | AAV vectors with high transduction efficiency and uses thereof for gene therapy |
| WO2008128251A1 (en) | 2007-04-17 | 2008-10-23 | The Children's Hospital Of Philadelphia | Humanized viral vectors and methods of use thereof |
| WO2008134646A2 (en) | 2007-04-26 | 2008-11-06 | University Of Iowa Research Foundation | Rna interference suppression of neurodegenerative diseases and methods of use thereof |
| EP2158211B1 (en) | 2007-05-31 | 2016-08-10 | Medigene AG | Mutated structural protein of a parvovirus |
| EP2012122A1 (en) | 2007-07-06 | 2009-01-07 | Medigene AG | Mutated parvovirus structural proteins as vaccines |
| AU2008260103B2 (en) | 2007-05-31 | 2014-04-03 | University Of Iowa Research Foundation | Reduction of off-target RNA interference toxicity |
| US8841437B2 (en) | 2008-06-20 | 2014-09-23 | The Board Of Trustees Of The Leland Stanford Junior University | Precursor miRNA loop-modulated target regulation |
| AU2008271658B8 (en) | 2007-06-29 | 2013-07-04 | F. Hoffmann-La Roche Ag | Promoter |
| EP3121190A1 (en) | 2007-07-14 | 2017-01-25 | University of Iowa Research Foundation | Methods and compositions for treating brain diseases |
| EP2019143A1 (en) | 2007-07-23 | 2009-01-28 | Genethon | CNS gene delivery using peripheral administration of AAV vectors |
| MX2010000944A (es) | 2007-07-26 | 2010-08-31 | Amsterdam Molecular Therapeutics Bv | Vectores baculovirales que comprenden secuencias de codificacion repetida con deformaciones diferenciales en codones. |
| CA2735166C (en) | 2007-08-27 | 2020-12-01 | Boston Biomedical, Inc. | Compositions of asymmetric interfering rna and uses thereof |
| WO2009030025A1 (en) | 2007-09-04 | 2009-03-12 | Her Majesty The Queen In Right Of Canada As Represented By The Minister Of Health | Porcine adeno-associated viruses |
| JP2010538675A (ja) | 2007-09-19 | 2010-12-16 | アムステルダム モレキュラー セラピューティクス ビー.ブイ. | タンパク質産生の改善のためのaav複製機構の使用 |
| SG10201603993TA (en) | 2007-11-28 | 2016-07-28 | Univ Pennsylvania | SIMIAN SUBFAMILY B ADENOVIRUS SAdV-28, -27, -29, -32, -33 AND -35 AND USES THEREOF |
| CA2707029A1 (en) | 2007-11-28 | 2009-08-27 | Soumitra Roy | Simian subfamily c adenoviruses sadv-40, -31, and -34 and uses thereof |
| MX347246B (es) | 2007-11-28 | 2017-04-19 | Univ Pennsylvania | Adenovirus e simianos sadv-39, sadv-25.2, sadv-26, sadv-30, sadv-37 y sadv-38. |
| ES2751999T3 (es) | 2008-01-29 | 2020-04-02 | Applied Genetic Tech Corporation | Producción recombinante de virus adeno-asociados usando células BHK en suspensión |
| EA020969B1 (ru) | 2008-02-19 | 2015-03-31 | ЮНИКЬЮРЕ АйПи Б.В. | ОПТИМИЗАЦИЯ ЭКСПРЕССИИ ПАРВОВИРУСНЫХ БЕЛКОВ Rep И Cap В КЛЕТКАХ НАСЕКОМЫХ |
| EP2325298B1 (en) | 2008-03-04 | 2016-10-05 | The Trustees Of The University Of Pennsylvania | SIMIAN ADENOVIRUSES SAdV-36, -42.1, -42.2, AND -44 AND USES THEREOF |
| WO2009134681A2 (en) | 2008-04-30 | 2009-11-05 | The Trustees Of The University Of Pennsylvania | Aav7 viral vectors for targeted delivery of rpe cells |
| US8632764B2 (en) | 2008-04-30 | 2014-01-21 | University Of North Carolina At Chapel Hill | Directed evolution and in vivo panning of virus vectors |
| EP2291191A4 (en) * | 2008-05-09 | 2014-01-22 | Sinai School Medicine | METHODS FOR PREVENTING AND TREATING NEURODEGENERATIVE DISEASES |
| CN102159713A (zh) | 2008-05-20 | 2011-08-17 | Eos神经科学公司 | 用于递送光敏蛋白的载体和使用方法 |
| US9217155B2 (en) | 2008-05-28 | 2015-12-22 | University Of Massachusetts | Isolation of novel AAV'S and uses thereof |
| EP2297185A1 (en) | 2008-06-17 | 2011-03-23 | Amsterdam Molecular Therapeutics (AMT) B.V. | Parvoviral capsid with incorporated gly-ala repeat region |
| US8945885B2 (en) | 2008-07-03 | 2015-02-03 | The Board Of Trustees Of The Leland Stanford Junior University | Minicircle DNA vector preparations and methods of making and using the same |
| US8212019B2 (en) | 2008-07-30 | 2012-07-03 | University Of Massachusetts | Nucleic acid silencing sequences |
| WO2010036118A1 (en) | 2008-09-29 | 2010-04-01 | Amsterdam Molecular Therapeutics (Amt) B.V. | Porphobilinogen deaminase gene therapy |
| BRPI0919564A2 (pt) | 2008-10-22 | 2019-09-24 | Genentech Inc | modulação da degeneração do axônio |
| US8940290B2 (en) | 2008-10-31 | 2015-01-27 | The Trustees Of The University Of Pennsylvania | Simian adenoviruses SAdV-43, -45, -46, -47, -48, -49, and -50 and uses thereof |
| US9415121B2 (en) | 2008-12-19 | 2016-08-16 | Nationwide Children's Hospital | Delivery of MECP2 polynucleotide using recombinant AAV9 |
| WO2010093784A2 (en) | 2009-02-11 | 2010-08-19 | The University Of North Carolina At Chapel Hill | Modified virus vectors and methods of making and using the same |
| ES2742180T3 (es) | 2009-03-04 | 2020-02-13 | Deutsches Krebsforsch | Proteína activadora del ensamblaje (AAP) y su uso para la fabricación de partículas de parvovirus que consisten esencialmente en VP3 |
| US20120093775A1 (en) | 2009-03-27 | 2012-04-19 | Proyecto De Biomedicina Cima, S.L. | Methods and compositions for the treatment of cirrhosis and liver fibrosis |
| HUE044522T2 (hu) | 2009-04-30 | 2019-10-28 | Univ Pennsylvania | Adeno-asszociált vírus konstrukciókat tartalmazó légúti vezetõ sejtek célzására szolgáló kompozíciók |
| US8476418B2 (en) | 2009-05-28 | 2013-07-02 | Deutsches Krebsforschungszentrum | Modified AAV capsid polypeptides |
| US8734809B2 (en) | 2009-05-28 | 2014-05-27 | University Of Massachusetts | AAV's and uses thereof |
| CN102575232B (zh) | 2009-05-29 | 2015-07-22 | 宾夕法尼亚大学托管会 | 猿腺病毒41及其应用 |
| HUE028341T2 (en) | 2009-06-16 | 2016-12-28 | Genzyme Corp | Improved methods for purification of recombinant aav vectors |
| CA2767231A1 (en) * | 2009-07-06 | 2011-01-13 | Alnylam Pharmaceuticals, Inc. | Cell-based bioprocessing |
| US20140099666A1 (en) | 2009-07-06 | 2014-04-10 | Alnylam Pharmaceuticals, Inc. | Compositions and methods for enhancing production of a biological product |
| RU2015133046A (ru) | 2009-07-15 | 2018-12-24 | Кэлиммьюн Инк. | Двойной вектор для подавления вируса иммунодефицита человека |
| EP2292781A1 (en) | 2009-08-17 | 2011-03-09 | Genethon | Baculovirus-based production of biopharmaceuticals free of contaminating baculoviral virions |
| WO2011038187A1 (en) | 2009-09-25 | 2011-03-31 | The Trustees Of The University Of Pennsylvania | Controlled adeno-associated virus (aav) diversification and libraries prepared therefrom |
| CN102695526A (zh) | 2009-11-09 | 2012-09-26 | 吉恩波多治疗股份公司 | 用于神经元特异性的体内连续dopa合成的新型病毒载体构建体 |
| US9493776B2 (en) | 2009-11-19 | 2016-11-15 | National University Corporation Okayama University | System for increasing gene expression and vector comprising the system |
| WO2011069529A1 (en) | 2009-12-09 | 2011-06-16 | Curevac Gmbh | Mannose-containing solution for lyophilization, transfection and/or injection of nucleic acids |
| WO2011088081A1 (en) | 2010-01-12 | 2011-07-21 | The University Of North Carolina At Chapel Hill | Restrictive inverted terminal repeats for viral vectors |
| JP6141021B2 (ja) | 2010-02-05 | 2017-06-07 | ザ・ユニヴァーシティ・オヴ・ノース・キャロライナ・アト・チャペル・ヒル | パルボウイルスの形質導入を増強するための組成物および方法 |
| US9228174B2 (en) | 2010-03-11 | 2016-01-05 | Uniqure Ip B.V. | Mutated rep encoding sequences for use in AAV production |
| WO2011117258A2 (en) | 2010-03-22 | 2011-09-29 | Association Institut De Myologie | Methods of increasing efficiency of vector penetration of target tissue |
| US9315825B2 (en) | 2010-03-29 | 2016-04-19 | The Trustees Of The University Of Pennsylvania | Pharmacologically induced transgene ablation system |
| MX342858B (es) | 2010-03-29 | 2016-10-13 | The Trustees Of The Univ Of Pennsylvania * | Sistema de ablacion transgenica inducida farmacologicamente. |
| WO2011122950A1 (en) | 2010-04-01 | 2011-10-06 | Amsterdam Molecular Therapeutics (Amt) Ip B.V. | Monomeric duplex aav vectors |
| ES2605305T3 (es) | 2010-04-23 | 2017-03-13 | University Of Massachusetts | Vectores de AAV que se dirigen al SNC y métodos de uso de los mismos |
| CA2833912C (en) | 2010-04-23 | 2021-09-21 | University Of Massachusetts | Aav-based treatment of cholesterol-related disorders |
| CA3050894C (en) | 2010-04-23 | 2022-10-18 | University Of Massachusetts | Multicistronic expression constructs |
| US8927514B2 (en) | 2010-04-30 | 2015-01-06 | City Of Hope | Recombinant adeno-associated vectors for targeted treatment |
| US9839696B2 (en) | 2010-04-30 | 2017-12-12 | City Of Hope | Recombinant adeno-associated vectors for targeted treatment |
| US8808684B2 (en) | 2010-09-10 | 2014-08-19 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Epidermal growth factor receptor (EGFR) and methods of use in adenoviral-associated virus type 6 (AAV6) transduction |
| KR101362111B1 (ko) | 2010-10-05 | 2014-02-12 | 다카라 바이오 가부시키가이샤 | 바이러스 벡터의 제조방법 |
| US8663624B2 (en) | 2010-10-06 | 2014-03-04 | The Regents Of The University Of California | Adeno-associated virus virions with variant capsid and methods of use thereof |
| WO2012057363A1 (ja) | 2010-10-27 | 2012-05-03 | 学校法人自治医科大学 | 神経系細胞への遺伝子導入のためのアデノ随伴ウイルスビリオン |
| EP2637702A4 (en) | 2010-11-11 | 2014-11-26 | Univ Miami | METHODS, COMPOSITIONS, CELLS AND KITS FOR TREATING ISCHEMIC INJURIES |
| WO2012071318A2 (en) | 2010-11-23 | 2012-05-31 | The Trustees Of The University Of Pennsylvania | Subfamily e simian adenoviruses a1321, a1325, a1295, a1309, a1316 and a1322 and uses thereof |
| US9181544B2 (en) | 2011-02-12 | 2015-11-10 | University Of Iowa Research Foundation | Therapeutic compounds |
| JP6224459B2 (ja) | 2011-02-17 | 2017-11-01 | ザ・トラステイーズ・オブ・ザ・ユニバーシテイ・オブ・ペンシルベニア | 組織特異性を改変し、aav9媒介遺伝子導入を改善するための組成物および方法 |
| GB201103062D0 (en) | 2011-02-22 | 2011-04-06 | Isis Innovation | Method |
| EP2500434A1 (en) | 2011-03-12 | 2012-09-19 | Association Institut de Myologie | Capsid-free AAV vectors, compositions, and methods for vector production and gene delivery |
| JP6007463B2 (ja) | 2011-04-18 | 2016-10-12 | 国立研究開発法人国立精神・神経医療研究センター | 薬剤送達粒子及びその製造方法 |
| EP2699688A1 (en) | 2011-04-20 | 2014-02-26 | The Trustees Of The University Of Pennsylvania | Regimens and compositions for aav-mediated passive immunization of airborne pathogens |
| CN105755044A (zh) | 2011-04-22 | 2016-07-13 | 加利福尼亚大学董事会 | 具有变异衣壳的腺相关病毒病毒体及其使用方法 |
| WO2012149646A1 (en) | 2011-05-05 | 2012-11-08 | Sunnybrook Research Institute | Mirna inhibitors and their uses |
| WO2012158757A1 (en) | 2011-05-16 | 2012-11-22 | The Trustees Of The University Of Pennsylvania | Proviral plasmids for production of recombinant adeno-associated virus |
| US9598468B2 (en) | 2011-05-18 | 2017-03-21 | University Of Florida Research Foundation, Incorporated | Polypeptides and vectors for targeting HER2/neu expressing cells and uses thereof |
| CN103518132B (zh) | 2011-06-06 | 2015-11-25 | 拜奥卡蒂斯股份有限公司 | 通过离子型表面活性剂选择性裂解细胞 |
| US20140275211A1 (en) * | 2011-06-21 | 2014-09-18 | Alnylam Pharmaceuticals, Inc. | Assays and methods for determining activity of a therapeutic agent in a subject |
| DK2737071T3 (en) | 2011-07-27 | 2017-05-08 | Genethon | IMPROVED BACULOVIRUS EXPRESSION SYSTEMS |
| EA027511B1 (ru) | 2011-09-08 | 2017-08-31 | ЮНИКЬЮРЕ АйПи Б.В. | Способ отделения популяции парвовирусных вирионов от популяции бакуловирусных вирионов |
| WO2013036889A1 (en) | 2011-09-09 | 2013-03-14 | University Of Washington | Retrograde transport peptide and use of same for delivery to central nervous system |
| EP2771455B1 (en) | 2011-10-28 | 2016-10-05 | The University of North Carolina At Chapel Hill | Cell line for production of adeno-associated virus |
| US10640785B2 (en) | 2011-11-22 | 2020-05-05 | The Children's Hospital Of Philadelphia | Virus vectors for highly efficient transgene delivery |
| WO2013078199A2 (en) | 2011-11-23 | 2013-05-30 | Children's Medical Center Corporation | Methods for enhanced in vivo delivery of synthetic, modified rnas |
| HUE036640T2 (hu) | 2012-02-14 | 2018-07-30 | Univ California | Parakrin gének szisztémás bejuttatása és szabályozott expressziója szív és érrendszeri betegségekre és egyéb állapotokra |
| KR102057540B1 (ko) | 2012-02-17 | 2019-12-19 | 더 칠드런스 호스피탈 오브 필라델피아 | 세포, 기관 및 조직으로의 유전자 전이를 위한 aav 벡터 조성물 및 방법 |
| MX374399B (es) | 2012-02-29 | 2025-03-06 | Sangamo Biosciences Inc | Composiciones y sus usos para tratar y prevenir la enfermedad de huntington. |
| SG11201406776TA (en) | 2012-04-18 | 2015-03-30 | Philadelphia Children Hospital | Composition and methods for highly efficient gene transfer using aav capsid variants |
| EP2660325A3 (en) | 2012-05-02 | 2014-02-12 | Christian Medical College | AAV vectors and corresponding nucleotide sequences and methods |
| US9163259B2 (en) | 2012-05-04 | 2015-10-20 | Novartis Ag | Viral vectors for the treatment of retinal dystrophy |
| CN104395323B (zh) | 2012-05-08 | 2017-08-01 | 默沙东公司 | 可透过性糖苷酶抑制剂及其用途 |
| EP2847337A4 (en) | 2012-05-09 | 2016-04-27 | Univ Oregon Health & Science | ADENO ASSOCIATED VIRUS PLASMIDS AND VECTORS |
| TWI702955B (zh) | 2012-05-15 | 2020-09-01 | 澳大利亞商艾佛蘭屈澳洲私營有限公司 | 使用腺相關病毒(aav)sflt-1治療老年性黃斑部退化(amd) |
| SG11201407343XA (en) | 2012-05-18 | 2014-12-30 | Univ Pennsylvania | Subfamily e simian adenoviruses a1302, a1320, a1331 and a1337 and uses thereof |
| CN104619832B (zh) | 2012-07-06 | 2021-03-16 | 衣阿华大学研究基金会 | 经修饰的腺伴随病毒载体组合物 |
| CN104603272B (zh) | 2012-07-06 | 2017-11-07 | 宝生物工程株式会社 | 能够产生腺伴随病毒载体的细胞 |
| EP2875133B1 (en) | 2012-07-17 | 2018-01-10 | Université de Genève | Nucleic acids for down-regulation of gene expression |
| EP3415167B1 (en) | 2012-08-01 | 2024-05-29 | Nationwide Children's Hospital | Intrathecal delivery of recombinant adeno-associated virus 9 |
| EP3738974A1 (en) | 2012-09-28 | 2020-11-18 | The University of North Carolina at Chapel Hill | Aav vectors targeted to oligodendrocytes |
| WO2014103957A1 (ja) | 2012-12-25 | 2014-07-03 | タカラバイオ株式会社 | Aav変異体 |
| JP2016507514A (ja) | 2013-01-08 | 2016-03-10 | ベニテック バイオファーマ リミテッド | 加齢黄斑変性の処置 |
| US9567376B2 (en) | 2013-02-08 | 2017-02-14 | The Trustees Of The University Of Pennsylvania | Enhanced AAV-mediated gene transfer for retinal therapies |
| CA2905952A1 (en) | 2013-03-13 | 2014-10-02 | The Children's Hospital Of Philadelphia | Adeno-associated virus vectors and methods of use thereof |
| WO2014143932A1 (en) | 2013-03-15 | 2014-09-18 | The University Of North Carolina At Chapel Hill | Synthetic adeno-associated virus inverted terminal repeats |
| WO2014144486A2 (en) | 2013-03-15 | 2014-09-18 | The Children's Hospital Of Philadelphia | Vectors comprising stuffer/filler polynucleotide sequences and methods of use |
| WO2014144844A1 (en) | 2013-03-15 | 2014-09-18 | The Board Of Trustees Of The Leland Stanford Junior University | tRNA DERIVED SMALL RNAs (tsRNAs) INVOLVED IN CELL VIABILITY |
| EP2983707B1 (en) | 2013-04-08 | 2019-06-12 | University of Iowa Research Foundation | Chimeric adeno-associated virus/ bocavirus parvovirus vector |
| EP2792742A1 (en) | 2013-04-17 | 2014-10-22 | Universitätsklinikum Hamburg-Eppendorf (UKE) | Gene-therapy vectors for treating cardiomyopathy |
| AU2014255665B2 (en) | 2013-04-18 | 2018-08-02 | Fondazione Telethon | Effective delivery of large genes by dual AAV vectors |
| EP3461838A1 (en) | 2013-04-20 | 2019-04-03 | Research Institute at Nationwide Children's Hospital | Recombinant adeno-associated virus delivery of exon 2-targeted u7snrna polynucleotide constructs |
| US9719106B2 (en) | 2013-04-29 | 2017-08-01 | The Trustees Of The University Of Pennsylvania | Tissue preferential codon modified expression cassettes, vectors containing same, and uses thereof |
| CN105377039A (zh) | 2013-05-15 | 2016-03-02 | 明尼苏达大学董事会 | 腺相关病毒介导的基因向中枢神经系统转移 |
| US10006049B2 (en) | 2013-05-16 | 2018-06-26 | University Of Florida Research Foundation, Incorporated | Hairpin mRNA elements and methods for the regulation of protein translation |
| CN105247044B (zh) | 2013-05-31 | 2021-05-07 | 加利福尼亚大学董事会 | 腺相关病毒变体及其使用方法 |
| WO2014201308A1 (en) | 2013-06-12 | 2014-12-18 | Washington University | Endothelial-targeted adenoviral vectors, methods and uses therefor |
| WO2014201252A2 (en) | 2013-06-13 | 2014-12-18 | Shire Human Genetic Therapies, Inc. | Messenger rna based viral production |
| HUE047996T2 (hu) | 2013-07-22 | 2020-05-28 | Childrens Hospital Philadelphia | AAV variáns és készítmények, eljárások és alkalmazások sejtekbe, szervekbe és szövetekbe történõ géntranszferhez |
| DK3024497T3 (da) | 2013-07-26 | 2021-04-12 | Univ Iowa Res Found | Fremgangsmåder og præparater til behandling af hjernesygdomme |
| ITTO20130669A1 (it) | 2013-08-05 | 2015-02-06 | Consiglio Nazionale Ricerche | Vettore adeno-associato ricombinante muscolo-specifico e suo impiego nel trattamento di patologie muscolari |
| EP3039129B1 (en) | 2013-08-30 | 2018-06-27 | Amgen Inc. | High titer recombinant aav vector production in adherent and suspension cells |
| WO2015038958A1 (en) | 2013-09-13 | 2015-03-19 | California Institute Of Technology | Selective recovery |
| EP3049527A4 (en) | 2013-09-26 | 2017-08-16 | University of Florida Research Foundation, Inc. | Synthetic combinatorial aav capsid library for targeted gene therapy |
| EP3068889B1 (en) | 2013-09-26 | 2019-04-17 | Universitat Autònoma De Barcelona | Gene therapy compositions for use in the prevention and/or treatment of non-alcoholic fatty liver disease |
| EP3459965B1 (en) | 2013-10-11 | 2020-12-02 | Massachusetts Eye & Ear Infirmary | Methods of predicting ancestral virus sequences and uses thereof |
| EP3060669B1 (en) | 2013-10-24 | 2024-12-11 | uniQure IP B.V. | Aav-5 pseudotyped vector for gene therapy for neurological diseases |
| EP3066195A4 (en) | 2013-11-08 | 2017-06-28 | The Board of Trustees of the University of Arkansas | Adeno-associated virus "x" oncogene |
| US10369201B2 (en) | 2013-11-11 | 2019-08-06 | Sangamo Therapeutics, Inc. | Methods and compositions for treating Huntington's disease |
| EP3415620B1 (en) | 2013-11-26 | 2021-03-31 | The United States of America, as represented by The Secretary, Department of Health and Human Services | Adeno-associated virus vectors for treatment of glycogen storage disease |
| CN105765066B (zh) | 2013-11-29 | 2018-12-14 | 宝生物工程株式会社 | 用于定量腺伴随病毒的方法 |
| US20170002350A1 (en) | 2013-12-03 | 2017-01-05 | Agency For Science, Technology And Research | Tailed mirtron effectors for rnai-mediated gene silencing |
| GB201322798D0 (en) | 2013-12-20 | 2014-02-05 | Oxford Biomedica Ltd | Production system |
| WO2015106273A2 (en) | 2014-01-13 | 2015-07-16 | Trustees Of Boston University | Methods and assays relating to huntingtons disease and parkinson's disease |
| GB201401707D0 (en) | 2014-01-31 | 2014-03-19 | Sec Dep For Health The | Adeno-associated viral vectors |
| GB201403684D0 (en) | 2014-03-03 | 2014-04-16 | King S College London | Vector |
| WO2015124546A1 (en) | 2014-02-19 | 2015-08-27 | Fundación Centro Nacional De Investigaciones Cardiovasculares Carlos Iii- Cnic | Aav vectors for the treatment of ischemic and non-ischemic heart disease |
| US10072251B2 (en) | 2014-02-19 | 2018-09-11 | University Of Massachusetts | Recombinant AAVS having useful transcytosis properties |
| WO2015126972A1 (en) | 2014-02-21 | 2015-08-27 | University Of Florida Research Foundation, Inc. | Methods and compositions for gene delivery to on bipolar cells |
| US10272117B2 (en) | 2014-02-24 | 2019-04-30 | Celgene Corporation | Methods of using an activator of cereblon for neural cell expansion and the treatment of central nervous system disorders |
| EP3113787B1 (en) | 2014-03-04 | 2019-12-04 | University of Florida Research Foundation, Inc. | Improved raav vectors and methods for transduction of photoreceptors and rpe cells |
| WO2015137802A1 (en) | 2014-03-10 | 2015-09-17 | Uniqure Ip B.V. | Further improved aav vectors produced in insect cells |
| EP2933335A1 (en) | 2014-04-18 | 2015-10-21 | Genethon | A method of treating peripheral neuropathies and motor neuron diseases |
| WO2015164786A1 (en) | 2014-04-25 | 2015-10-29 | University Of Massachusetts | Recombinant aav vectors useful for reducing immunity against transgene products |
| BR112016024379A2 (pt) | 2014-04-25 | 2017-10-10 | Univ Pennsylvania | variantes ldlr e seu uso em composições para reduzir os níveis de colesterol |
| CA2947035A1 (en) | 2014-05-08 | 2015-11-12 | Sangamo Biosciences, Inc. | Methods and compositions for treating huntington's disease |
| US20170088819A1 (en) | 2014-05-16 | 2017-03-30 | Vrije Universiteit Brussel | Genetic correction of myotonic dystrophy type 1 |
| RU2711147C2 (ru) | 2014-05-20 | 2020-01-15 | Юниверсити Оф Айова Рисерч Фаундейшн | Терапевтические соединения для лечения болезни хантингтона |
| WO2015183667A1 (en) | 2014-05-28 | 2015-12-03 | The Regents Of The University Of California | HYBRID tRNA/pre-miRNA MOLECULES AND METHODS OF USE |
| EP3151866B1 (en) * | 2014-06-09 | 2023-03-08 | Voyager Therapeutics, Inc. | Chimeric capsids |
| EP3154560B1 (en) | 2014-06-13 | 2019-03-13 | University of Pittsburgh - Of the Commonwealth System of Higher Education | Methods and materials for increasing viral vector infectivity |
| US10781459B2 (en) | 2014-06-20 | 2020-09-22 | University Of Florida Research Foundation, Incorporated | Methods of packaging multiple adeno-associated virus vectors |
| US10526583B2 (en) | 2014-07-02 | 2020-01-07 | University Of Florida Research Foundation, Incorporated | Compositions and methods for purifying recombinant adeno-associated virus |
| US10023846B2 (en) | 2014-07-10 | 2018-07-17 | Takara Bio Inc. | Production method for non-enveloped virus particles |
| US10392622B2 (en) | 2014-08-01 | 2019-08-27 | The Trustees Of The University Of Pennsylvania | Compositions and methods for self-regulated inducible gene expression |
| US10711270B2 (en) | 2014-10-03 | 2020-07-14 | University Of Massachusetts | High efficiency library-identified AAV vectors |
| US10370432B2 (en) | 2014-10-03 | 2019-08-06 | University Of Massachusetts | Heterologous targeting peptide grafted AAVS |
| CN107073051B (zh) | 2014-10-21 | 2021-08-24 | 马萨诸塞大学 | 重组aav变体及其用途 |
| SG10202007103TA (en) | 2014-11-05 | 2020-09-29 | Voyager Therapeutics Inc | Aadc polynucleotides for the treatment of parkinson's disease |
| IL284949B2 (en) | 2014-11-14 | 2024-06-01 | Voyager Therapeutics Inc | Modulatory polynucleotides |
| MX2017006216A (es) | 2014-11-14 | 2018-08-29 | Voyager Therapeutics Inc | Composiciones y métodos para tratar la esclerosis lateral amiotrófica (ela). |
| WO2016081927A2 (en) | 2014-11-21 | 2016-05-26 | University Of Florida Research Foundation, Inc. | Genome-modified recombinant adeno-associated virus vectors |
| EP4344741A3 (en) | 2014-11-21 | 2024-08-28 | The University of North Carolina at Chapel Hill | Aav vectors targeted to the central nervous system |
| HRP20190992T1 (hr) | 2014-12-24 | 2019-09-20 | Uniqure Ip B.V. | Suprimiranje gena za huntingtin inducirano s rnai |
| KR102618947B1 (ko) | 2014-12-30 | 2023-12-27 | 유니버시티 오브 아이오와 리써치 파운데이션 | 뇌 질환을 치료하기 위한 방법 및 조성물 |
| EP3245220B1 (en) | 2015-01-14 | 2023-09-20 | The University of North Carolina at Chapel Hill | Methods and compositions for targeted gene transfer |
| EP3245221A4 (en) | 2015-01-16 | 2018-06-13 | Voyager Therapeutics, Inc. | Central nervous system targeting polynucleotides |
| JP2018506530A (ja) | 2015-01-30 | 2018-03-08 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 脊柱軟膜下遺伝子送達システム |
| WO2016126857A1 (en) | 2015-02-03 | 2016-08-11 | University Of Florida Research Foundation, Inc. | Recombinant aav1, aav5, and aav6 capsid mutants and uses thereof |
| JP2018506304A (ja) | 2015-02-10 | 2018-03-08 | ジェンザイム・コーポレーション | バリアントRNAi |
| WO2016130591A2 (en) | 2015-02-10 | 2016-08-18 | Genzyme Corporation | Enhanced delivery of viral particles to the striatum and cortex |
| US20180245073A1 (en) | 2015-02-23 | 2018-08-30 | Voyager Therapeutics, Inc. | Regulatable expression using adeno-associated virus (aav) |
| US20180094280A1 (en) | 2015-03-20 | 2018-04-05 | Bluebird Bio, Inc. | Vector formulations |
| EP3277819B1 (en) | 2015-03-24 | 2021-03-03 | The Regents of The University of California | Adeno-associated virus variants and methods of use thereof |
| LT3277814T (lt) * | 2015-04-03 | 2020-10-26 | University Of Massachusetts | Oligonukleotidų junginiai, skirti nukreipimui į hantingtino mrnr |
| EP3929293A3 (en) | 2015-04-03 | 2022-03-16 | University Of Massachusetts | Fully stabilized asymmetric sirna |
| US10081659B2 (en) | 2015-04-06 | 2018-09-25 | The United States Of America, As Represented By The Secretary, Dept. Of Health And Human Services | Adeno-associated vectors for enhanced transduction and reduced immunogenicity |
| TWI707951B (zh) | 2015-04-08 | 2020-10-21 | 美商健臻公司 | 過大腺相關載體之製造 |
| US10058624B2 (en) | 2015-04-16 | 2018-08-28 | Emory University | Recombinant promoters and vectors for protein expression in liver and use thereof |
| WO2016172155A1 (en) | 2015-04-23 | 2016-10-27 | University Of Massachusetts | Modulation of aav vector transgene expression |
| US11046955B2 (en) | 2015-04-24 | 2021-06-29 | University Of Massachusetts | Modified AAV constructs and uses thereof |
| WO2016179496A1 (en) | 2015-05-07 | 2016-11-10 | Massachusetts Eye And Ear Infirmary | Methods of delivering an agent to the eye |
| JP6993234B2 (ja) | 2015-05-11 | 2022-01-13 | アルキオーネ・ライフサイエンシズ・インコーポレイテッド | 薬物送達システムおよび方法 |
| EP3294894B8 (en) | 2015-05-12 | 2019-09-25 | The U.S.A. as represented by the Secretary, Department of Health and Human Services | Aav isolate and fusion protein comprising nerve growth factor signal peptide and parathyroid hormone |
| US20170067028A1 (en) | 2015-05-15 | 2017-03-09 | Douglas J. Ballon | Radiolabeling of adeno associated virus |
| WO2016191418A1 (en) | 2015-05-26 | 2016-12-01 | Salk Institute For Biological Studies | Motor neuron-specific expression vectors |
| WO2016196507A1 (en) | 2015-05-29 | 2016-12-08 | University Of Iowa Research Foundation | Methods of delivery of transgenes for treating brain diseases |
| US11266748B2 (en) | 2015-07-02 | 2022-03-08 | University Of Florida Research Foundation, Incorporated | Recombinant adeno-associated virus vectors to target medullary thyroid carcinoma |
| US10801040B2 (en) | 2015-07-07 | 2020-10-13 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for expressing a polynucleotide of interest in the peripheral nervous system of a subject |
| US20170007669A1 (en) | 2015-07-07 | 2017-01-12 | Mayo Foundation For Medical Education And Research | Peptide-mediated delivery of active agents across the blood-brain barrier |
| US20180216133A1 (en) | 2015-07-17 | 2018-08-02 | The Trustees Of The University Of Pennsylvania | Compositions and methods for achieving high levels of transduction in human liver cells |
| WO2017019876A1 (en) | 2015-07-28 | 2017-02-02 | University Of Massachusetts | Transgenic expression of dnase i in vivo delivered by an adeno-associated virus vector |
| WO2017019994A2 (en) | 2015-07-30 | 2017-02-02 | Massachusetts Eye And Ear Infirmary | Ancestral virus sequences and uses thereof |
| US20180201937A1 (en) | 2015-08-04 | 2018-07-19 | The University Of Chicago | Inhibitors of cacna1a/alpha1a subunit internal ribosomal entry site (ires) and methods of treating spinocerebellar ataxia type 6 |
| SI3352776T1 (sl) | 2015-09-23 | 2025-08-29 | Sangamo Therapeutics, Inc. | Represorji Htt in njihove uporabe |
| AU2016332821B2 (en) | 2015-09-28 | 2022-02-17 | The University Of North Carolina At Chapel Hill | Methods and compositions for antibody-evading virus vectors |
| HUE071193T2 (hu) | 2015-10-09 | 2025-08-28 | Genzyme Corp | Sejtek transzfekció utáni korai izolálása (EPIC) biologikumok elõállításához |
| EP3359662A4 (en) | 2015-10-09 | 2019-06-19 | The Children's Hospital of Philadelphia | COMPOSITIONS AND METHODS OF TREATING HUNTINGTON DISEASE AND RELATED DISEASES |
| US10123969B2 (en) | 2015-10-15 | 2018-11-13 | Wisconsin Alumni Research Foundation | Osmotic enhancement of drug/therapeutic delivery to the brain following infusion or injection into the cerebrospinal fluid |
| WO2017070476A2 (en) | 2015-10-22 | 2017-04-27 | University Of Florida Research Foundation, Inc. | Synthetic combinatorial aav3 capsid library |
| WO2017070516A1 (en) | 2015-10-22 | 2017-04-27 | University Of Massachusetts | Prostate-targeting adeno-associated virus serotype vectors |
| EP3364997B1 (en) | 2015-10-22 | 2024-01-17 | University of Massachusetts | Aspartoacylase gene therapy in the treatment of canavan disease |
| CN116650668A (zh) | 2015-10-23 | 2023-08-29 | 衣阿华大学研究基金会 | 使用基因疗法以推迟疾病发生和发展同时提供认知保护来治疗神经变性疾病的方法 |
| EP3368054A4 (en) | 2015-10-28 | 2019-07-03 | Voyager Therapeutics, Inc. | REGULATORY EXPRESSION USING THE ADENO-ASSOCIATED VIRUS (AAV) |
| CA3003435A1 (en) | 2015-10-28 | 2017-05-04 | The Trustees Of The University Of Pennsylvania | Intrathecal administration of adeno-associated-viral vectors for gene therapy |
| US10633662B2 (en) | 2015-11-10 | 2020-04-28 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and compositions for modulating AAV infection |
| IL259595B2 (en) | 2015-12-01 | 2024-01-01 | Spark Therapeutics Inc | Gradual methods for the production of a recombinant adenovirus (AAV) vector in a serum-free suspension cell culture system suitable for clinical use |
| US20170151416A1 (en) | 2015-12-01 | 2017-06-01 | Invivo Therapeutics Corporation | Methods and Systems for Delivery of a Trail of a Therapeutic Substance into an Anatomical Space |
| EP3384034B1 (en) | 2015-12-02 | 2020-07-08 | The Board of Trustees of the Leland Stanford Junior University | Novel recombinant adeno-associated virus capsids with enhanced human skeletal muscle tropism |
| US10406244B2 (en) | 2015-12-02 | 2019-09-10 | The Board Of Trustees Of The Leland Stanford Junior University | AAV vectors with expanded packaging capacity |
| JP7350485B2 (ja) | 2015-12-03 | 2023-09-26 | ジェネトン | ウイルスベクター効率を改善するための組成物及び方法 |
| WO2017100704A1 (en) | 2015-12-11 | 2017-06-15 | The Trustees Of The University Of Pennsylvania | Scalable purification method for aavrh10 |
| WO2017100674A1 (en) | 2015-12-11 | 2017-06-15 | The Trustees Of The University Of Pennsylvania | Scalable purification method for aav1 |
| WO2017100671A1 (en) | 2015-12-11 | 2017-06-15 | California Institute Of Technology | TARGETING PEPTIDES FOR DIRECTING ADENO-ASSOCIATED VIRUSES (AAVs) |
| EP3387117B1 (en) | 2015-12-11 | 2022-11-23 | The Trustees Of The University Of Pennsylvania | Scalable purification method for aav8 |
| AU2016371779C1 (en) | 2015-12-14 | 2022-10-13 | The University Of North Carolina At Chapel Hill | Modified capsid proteins for enhanced delivery of parvovirus vectors |
| WO2017136536A1 (en) | 2016-02-02 | 2017-08-10 | University Of Massachusetts | Method to enhance the efficiency of systemic aav gene delivery to the central nervous system |
| AU2017229347A1 (en) | 2016-03-07 | 2018-11-01 | University Of Iowa Research Foundation | AAV-mediated expression using a synthetic promoter and enhancer |
| CA3018076A1 (en) | 2016-03-18 | 2017-09-21 | The Children's Hospital Of Philadelphia | Therapeutic for treatment of diseases including the central nervous system |
| EP3235516B1 (en) | 2016-04-22 | 2019-06-26 | Georg-August-Universität Göttingen Stiftung Öffentlichen Rechts Universitätsmedizin | Regulatable adeno-associated virus (aav) vector |
| WO2017189963A1 (en) | 2016-04-29 | 2017-11-02 | Voyager Therapeutics, Inc. | Compositions for the treatment of disease |
| AU2017261249B2 (en) | 2016-05-03 | 2021-05-06 | Children's Medical Research Institute | Adeno-associated virus polynucleotides, polypeptides and virions |
| US11866462B2 (en) | 2016-05-04 | 2024-01-09 | Oregon Health & Science University | Recombinant adeno-associated viral vectors |
| EP3458588B1 (en) | 2016-05-18 | 2025-10-29 | Voyager Therapeutics, Inc. | Modulatory polynucleotides |
| US10457940B2 (en) | 2016-09-22 | 2019-10-29 | University Of Massachusetts | AAV treatment of Huntington's disease |
| CN111108198A (zh) | 2017-05-05 | 2020-05-05 | 沃雅戈治疗公司 | 治疗亨廷顿病的组合物和方法 |
| CN118910166A (zh) | 2017-05-05 | 2024-11-08 | 沃雅戈治疗公司 | 调节性多核苷酸 |
| CN118581154A (zh) | 2017-06-02 | 2024-09-03 | 国家健康与医学研究院 | 用于遗传障碍的基因疗法的基因组编辑手段和结合病毒载体的基因疗法 |
| GB201714027D0 (en) | 2017-09-01 | 2017-10-18 | Proqr Therapeutics Ii Bv | Antisense oligonucleotides for the treatment of huntington's disease |
| AR113134A1 (es) | 2017-09-22 | 2020-01-29 | Genzyme Corp | Arni variante |
| CN111479924B (zh) | 2017-10-16 | 2024-06-14 | 沃雅戈治疗公司 | 肌萎缩性侧索硬化症(als)的治疗 |
| JP2021530548A (ja) | 2018-07-24 | 2021-11-11 | ボイジャー セラピューティクス インコーポレイテッドVoyager Therapeutics, Inc. | 遺伝子治療製剤を生産するための系および方法 |
| WO2021016505A1 (en) | 2019-07-24 | 2021-01-28 | Voyager Therapeutics, Inc. | Compositions and methods for treating huntington's disease |
-
2017
- 2017-05-18 AU AU2017268382A patent/AU2017268382B2/en not_active Ceased
- 2017-05-18 IL IL297576A patent/IL297576B2/en unknown
- 2017-05-18 KR KR1020227025973A patent/KR20220108216A/ko not_active Ceased
- 2017-05-18 BR BR112018073472-1A patent/BR112018073472A2/pt not_active Application Discontinuation
- 2017-05-18 CN CN201780043501.XA patent/CN109831916B/zh active Active
- 2017-05-18 EP EP17800155.8A patent/EP3458589A4/en active Pending
- 2017-05-18 WO PCT/US2017/033281 patent/WO2017201258A1/en not_active Ceased
- 2017-05-18 RU RU2018140499A patent/RU2764587C2/ru active
- 2017-05-18 US US16/302,140 patent/US11951121B2/en active Active
- 2017-05-18 CA CA3024449A patent/CA3024449A1/en active Pending
- 2017-05-18 SG SG11201809643UA patent/SG11201809643UA/en unknown
- 2017-05-18 KR KR1020187033504A patent/KR102427379B1/ko active Active
- 2017-05-18 JP JP2018560628A patent/JP7220080B2/ja active Active
- 2017-05-18 MX MX2018014152A patent/MX2018014152A/es unknown
-
2018
- 2018-11-04 IL IL262763A patent/IL262763A/en unknown
-
2024
- 2024-02-29 US US18/591,756 patent/US20240415868A1/en active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008503590A (ja) | 2004-06-21 | 2008-02-07 | メドトロニック・インコーポレーテッド | 組成物を細胞にデリバリーするための医学用システム及び方法 |
| JP2009513144A (ja) | 2005-10-28 | 2009-04-02 | アルナイラム ファーマシューティカルズ インコーポレイテッド | ハンチンチン遺伝子の発現を抑制するための組成物および方法 |
| WO2015143078A1 (en) | 2014-03-18 | 2015-09-24 | University Of Massachusetts | Raav-based compositions and methods for treating amyotrophic lateral sclerosis |
| WO2015168666A2 (en) | 2014-05-02 | 2015-11-05 | Genzyme Corporation | Aav vectors for retinal and cns gene therapy |
Also Published As
| Publication number | Publication date |
|---|---|
| US20190160091A1 (en) | 2019-05-30 |
| IL262763A (en) | 2018-12-31 |
| SG11201809643UA (en) | 2018-12-28 |
| KR20190005887A (ko) | 2019-01-16 |
| RU2018140499A3 (ja) | 2021-01-25 |
| AU2017268382A1 (en) | 2018-11-29 |
| CA3024449A1 (en) | 2017-11-23 |
| RU2018140499A (ru) | 2020-06-18 |
| MX2018014152A (es) | 2019-03-28 |
| IL297576B2 (en) | 2024-02-01 |
| KR102427379B1 (ko) | 2022-08-02 |
| CN109831916B (zh) | 2023-07-21 |
| KR20220108216A (ko) | 2022-08-02 |
| US11951121B2 (en) | 2024-04-09 |
| EP3458589A4 (en) | 2020-01-01 |
| CN109831916A (zh) | 2019-05-31 |
| EP3458589A1 (en) | 2019-03-27 |
| US20240415868A1 (en) | 2024-12-19 |
| JP2019519219A (ja) | 2019-07-11 |
| AU2017268382B2 (en) | 2023-09-28 |
| RU2764587C2 (ru) | 2022-01-18 |
| IL297576B1 (en) | 2023-10-01 |
| IL297576A (en) | 2022-12-01 |
| WO2017201258A1 (en) | 2017-11-23 |
| BR112018073472A2 (pt) | 2019-08-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7220080B2 (ja) | ハンチントン病治療組成物及び方法 | |
| JP7768928B2 (ja) | 調節性ポリヌクレオチド | |
| US20240226203A9 (en) | Compositions and methods of treating huntington's disease | |
| US20230295663A1 (en) | Compositions and methods of treating amyotrophic lateral sclerosis (als) | |
| JP7502991B2 (ja) | 筋萎縮性側索硬化症(als)の治療 | |
| JP7565218B2 (ja) | 筋萎縮性側索硬化症および脊髄に関連する障害の治療 | |
| CA3024448A1 (en) | Modulatory polynucleotides | |
| US20230399642A1 (en) | Compositions and methods of treating huntington's disease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190206 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200513 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200513 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210427 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210727 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210830 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220104 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220401 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220506 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220816 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221024 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230110 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230130 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7220080 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |