我々は、ISFETの大きなアレイを特に構成し、それを使用して、DNA合成を含めた化学的プロセスの変化のモニタリングに基づいてDNA配列決定技術を促進することができるのを認識し、認めた。より一般的には、出願人らは、化学的に感受性のFET(すなわち、chemFET)の大きなアレイを使用して、価値ある情報をそのような分析物測定に基づいて得ることができる、化学的および/または生物学的プロセス(例えば、生物学的または化学的反応、細胞または組織の培養、またはモニタリング、神経活性、核酸配列決定等)の宿主において、種々の分析物(例えば、水素イオン、他のイオン、非イオン性分子または化合物等)の静的および/または動的濃度/レベルを検出し、測定することができるのを認識し、認めた。
従って、本開示の種々の実施形態は、一般に、1以上の分析物を測定するための大規模なFETアレイに関する発明的方法および装置に向けられる。本明細書中に開示される種々の実施形態において、FETアレイは、化学センサーとして作用する多数のchemFETを含む。先に議論したISFETは、イオン検出のために構成されたchemFET、および本明細書中に開示される種々の実施形態で使用することができるISFETの特別なタイプである。本開示によって考えられるchemFETの他のタイプは、酵素を使用して分析物を検出する酵素FET(EnFET)を含む。しかしながら、本開示はISFETおよびEnFETに限定されず、より一般的には、化学的感度のいくつかのタイプについて構成されるいずれのFETにも関することを認識されたい。本明細書中で用いるように、化学的感度は、広く、限定されるものではないが、有機、無機、天然に生じる、天然に生じない、および合成の、イオン、小分子のような化学的および生物学的化合物、核酸、蛋白質、ペプチド、多糖等のようなポリマーを含めた、注目するいずれの分子に対する感度も含む。
なお他の実施形態によると、本開示は、一般に、化学的または生物学的試料の分析における前記した大規模なchemFETアレイの使用に関する発明的方法および装置に向けられる。これらの試料は、分析物(例えば、イオンまたは他の成分)の存在、分析物に関する濃度または他の測定の高速の高密度決定を容易とするために、典型的には液体であり(または液体に溶解させ)および小さな容量のものである。
例えば、いくつかの実施形態は、「非常に大規模な」二次元のchemFETセンサーアレイ(例えば、256を超えるセンサー)に向けられ、ここに、そのようなアレイのセンサーを構成する1以上のchemFET−含有エレメントまたは「画素」は、アレイの画素に近接して起こる、1以上の独立した生物学的または化学的反応または事象をモニターするように構成される。いくつかの例示的な実施において、アレイは、アレイの個々のセンサーまたはセンサーのグループ上に1以上の反応チャンバー、または「ウェル」または「マイクロウェル」を形成する1以上のミクロ流体構造、および分析物試料(すなわち、分析物溶液)をウェルに送達し、それらを、測定の間にウェルから除去する装置にカップリングされていてよい。例えマイクロウェルが使用されない場合であっても、センサーアレイは、1以上の分析物の画素への送達のための、および測定の間における分析物の除去のための1以上のミクロ流体構造にカップリングされていてよい。従って、以下により詳細に議論されるように、保護するのが望まれる本開示の発明的態様は、分析物および、適切には、例えば、分析物の検出および測定で有用な他の試薬をウェルまたは画素へ、およびウェルまたは画素から流動させるのに使用することができる種々のミクロ流体構造、ウェルのアレイの製造方法、アレイ化されたウェルをアレイ化された画素とカップリングさせるための方法および構造、および例えば、装置をDNA配列決定または関連分析に用いる場合に、ウェルにDNA担持ビーズを負荷(loading)することを含めた、ウェルに分析すべき試料を負荷するための方法および装置を含む。
ミクロ流体に関しては、ユニークな参照電極およびフローセルへのそれらのカップリングも示される。
本発明の種々の態様において、特に注目する分析物は核酸合成の副産物である。そのような副産物は配列決定×合成方法の読出としてモニターすることができる。1つの特に重要な副産物は、(本明細書中においては、dNTPとも言われる)デオキシヌクレオチド三リン酸の、(配列決定プライマーのような)核酸の3’末端への負荷(または取込み)に際して放出される無機ピロホスフェート(PPi)である。PPiは水の存在下で(所望により、かつピロホスファターゼの存在下においてはかなりより迅速に)、オルトホスフェート(Pi)および遊離水素イオン(H+)に加水分解され得る。その結果、ヌクレオチドの取込み、またかくして、配列決定×合成反応を、PPi、Piおよび/またはH+を検出することによってモニターすることができる。慣用的にはPPiはchemFETによって検出されたり測定されたりしなかった。光学的ベースの配列決定×合成方法は、アデノシン三リン酸(ATP)へのそのスルフリラーゼ媒介変換、次いで、光の同時放出を伴う、従前に生じたATPの存在下でのルシフェリンのオキシルシフェリンへのルシフェラーゼ−媒介変換を介して、PPiを検出してきた。そのような検出は、本明細書中においては、PPiの「酵素的」検出という。本発明は、非酵素的方法を用いてPPiを検出する方法を提供する。本明細書中で用いる場合、PPiの非酵素的検出は、第一の場合においてPPiを生じさせ、または放出するのに必要ないずれかの酵素(例えば、ポリメラーゼ)以外の酵素を必要としないPPiの検出である。PPiの非酵素的検出の一例は、PPiのATPへの変換を必要としない検出方法である。
H+は、標準pHメーターを用い、あるいはいくつかの場合においては、ISFETを用いてpH変化を測定することによって検出されてきた。重要な事には、ISFETを用いてヌクレオチド取込を検出する全てではないが多くの先行する試みはpH変化のみに焦点を当てており、放出されたPPiの検出または測定には焦点を当てていなかった。
本発明では、PPi(またはPi)特異的受容体、取り込まれていないdNTP、またはそのいくつかの組合せの不存在下または存在下でH+(またはpHの変化)、PPi(またはPi)を検出することによって、核酸配列決定反応をモニタリングし、かくして、核酸のヌクレオチド配列を決定するための方法が考えられ、かくして、それを提供する。従って、いくつかの態様はpHモニタリングを狙っており、他方、他の態様は、FET表面と接触した溶液中のイオン種の変化から得られるそのような表面におけるイオンパルスをモニタリングし(および検出する)ことを狙っている。
かくして、本発明の種々の態様は、ヌクレオチドの核酸への取込みのインジケーターとして放出されたPPiを直接的に検出するための方法および装置を提供する。本発明は、本明細書中に記載されたchemFETアレイの使用を介してそれを行う。いくつかの実施形態において、核酸合成反応は、chemFETと接触している溶液中で行われ、放出されたPPiはchemFET表面によって検出され(または検知される)。重要な事には、PPiを直接的に検出する本発明のchemFETの能力を仮定すれば、そのような合成および/または配列決定反応を行うことができ、いくつかの例においては、実質的にpH感受性である環境(すなわち、pHの変化が、例えば、環境の強力な緩衝能力のため検出されない環境)において好ましくは行われる。
他の実施形態において、注目する分析物は水素イオンであって、本開示による大規模なISFETアレイは、具体的にはH+濃度の変化(すなわち、pHの変化)を測定するように構成される。
他の実施形態において、他の生物学的または化学的反応をモニターすることができ、chemFETアレイは、具体的には、水素イオンおよび/または注目する特定の生物学的または化学的プロセスの出現および/または進行に関連する重要な情報を提供する1以上の他の分析物を測定するように構成することができる。
種々の態様において、chemFETアレイは慣用的なCMOS(またはbiCMOSまたは他の適当な)加工技術を用いて製造することができ、特に、(対応する画素出力シグナルを得るために画素の全てをスキャニングする)全アレイからのデータの迅速な獲得を容易とするように構成される。
分析物の検出および測定に関しては、以下により詳細に議論される種々の実施形態において、本開示に従ったchemFETアレイによって測定された1以上の分析物は、生物学的または化学的プロセスに関する関連情報(例えば、核酸の相互に対するハイブリダイゼーション、抗原−抗体結合、受容体−リガンド結合、酵素−阻害剤結合、酵素−基板結合等のような結合事象)を供する種々の生物学的または化学的物質のいずれかを含むことができるのを認めるべきである。いくつかの態様において、分析物の存在または不存在を単に決定することに加えて、1以上の分析物の絶対的または相対的ならびに静的および/または動的レベルおよび/または濃度を測定する能力は、生物学的および化学的プロセスに関連する価値ある情報を提供する。他の態様において、注目する分析物または複数分析物の存在または不存在の単なる決定は、十分であり得る価値ある情報を提供することができる。
本開示の種々の発明的実施形態によるchemFETアレイは、種々の分析物のいずれかの1以上に対する感度のために構成することができる。1つの実施形態において、アレイの1以上のchemFETは、1以上の分析物に対する感度のために特に構成することができ、他の実施形態においては、所与のアレイの異なるchemFETは異なる分析物に対する感度のために構成することができる。例えば、1つの実施形態において、アレイの1以上のセンサー(画素)は、第1の分析物に対して感受性であるように構成された第1のタイプのchemFETを含むことができ、およびアレイの1以上の他のセンサーは、第1の分析物とは異なる第2の分析物に対して感受性であるように構成されたchemFETの第2のタイプを含むことができる。1つの実施形態において、第1および第2の分析物は相互に関連していてもよい。例として、第1および第2の分析物は、同一の生物学的または化学的反応/プロセスの副産物であってよく、従って、それらは同時に検出して、反応の出現(またはその欠如)を確認することができる。そのような冗長性は、好ましくは、いくつかの分析物検出方法にある。もちろん、chemFETの2を超える異なるタイプを、いずれかの所与のアレイで使用して、分析物の異なるタイプを検出し、および/または測定し、および所望により、結合事象のような生物学的または化学的プロセスをモニターすることができるのは認識すべきである。一般に、所与のセンサーアレイは「均一」であり、従って、同一分析物(例えば、pHまたは他のイオン濃度)を検出するおよび/または測定する実質的に同様または同一のタイプのchemFETよりなることができ、あるいはセンサーアレイは「不均一」であり、異なる分析物を検出し、および/または測定するための異なるタイプのchemFETを含むのは、本明細書中で議論したセンサーアレイの実施形態にいずれにおいても認識されるべきである。もう1つの実施形態において、アレイ中のセンサーは、検出されたおよび/または測定されたそのタイプ(またはクラス)の種がセンサーの間で異なってもよいが、分析物の単一タイプ(またはクラス)を検出しおよび/または測定するように構成することができる。例として、アレイ中の全てのセンサーは、核酸を検出し、および/または測定するように構成することができるが、各センサーは異なる核酸を検出し、および/または測定する。
なお他の態様において、出願人等は、図1〜7との関連において先に議論したMilgrew et al.のISFETアレイ設計、ならびに他の慣用的なISFETアレイ設計を特異的に改良して、画素のサイズを有意に低下させ、それにより、所与の半導体ダイサイズに対するchemFETアレイの画素の数を増加させた(すなわち、画素密度を増加させた)。種々の実施形態において、画素の密度のこの増加は、同時に、モニターされた生物学的および化学的プロセスに対応する出力シグナルのシグナル-対-ノイズ比率(SNR)、およびそのような出力シグナルをアレイから読むことができるスピードを増加させつつ達成される。特に、出願人らは、chemFET直線性についての要件を緩和し、1以上の限定された測定出力シグナル範囲(例えば、1〜14よりはむしろほぼ7〜9以下のpH範囲に対応する出力シグナル、ならびにpHに必ずしも有意に関連しない出力シグナル)に焦点を当てることによって、個々の画素の複雑性およびサイズを有意に低下させ、それにより、非常に大規模な密なchemFETアレイの実現を促進することができるのを認識し、認めた。また、出願人らは、chemFETアレイにおける画素選択に対する別のより複雑でないアプローチ(例えば、その複雑性はアレイのサイズと共に倍率変更する、図7に示された、Milgrew et al.の設計で使用される行および列デコーダーアプローチに対する代替法)、ならびにISFET応答モデリングおよびそのようなモデリングに基づくデータ外挿を含む種々のデータ処理技術は、有意に大きくかつ密なアレイからのデータの迅速な獲得を促進することも認識し、認めた。
chemFETアレイ製造に関しては、出願人らは、さらに、慣用的CMOS製造プロセスで使用される種々の技術、ならびに種々のポスト製造処理工程(ウエハ−の取扱い、洗浄、ダイシング、パッケージング等)は、いくつかの例においては得られたchemFETアレイの性能に悪影響し得るのを認識し、認めた。例えば、再度、図1を参照し、1つの潜在的問題点は、フローティングゲート構造70に関連する金属のエッチングの間にゲート酸化物65において誘導できるトラップされた電荷、およびどのようにしてそのようにトラップされた電荷がchemFET閾値電圧VTHに影響し得るかに関する。もう1つの潜在的問題点は、アルミニウム金属ベースのCMOS製造で通常使用される低温材料蒸着プロセスに由来する、chemFET不動態化層の密度/多孔度に関する(例えば、図1におけるISFET不動態化層72参照)。そのような低温プロセスは、一般に、慣用的なCMOSデバイスのための適切な不動態化層を供するが、その結果、分析物溶液と接触したchemFETについては潜在的に問題であり得る幾分低密度かつ多孔性の不動態化層をもたらしかねず;特に、低密度多孔性不動態化層は、経時的に、溶液中の分析物または他の物質を吸収しかねず、かつそれに飽和しかねず、これは、今度は、chemFET閾値電圧VTHにおいて望ましくない時間変化ドリフトを引き起こしかねない。この現象は、今度は、注目する1以上の特定の分析物の正確な測定を妨げるであろう。これまでの事を考慮すると、本明細書中で開示された他の発明的実施形態は、chemFETアレイの製造および製造後処理/取扱の種々の態様から生起し得るchemFETの性能に対する潜在的に有害な効果を緩和する方法および装置に関する。
従って、本発明の1つの実施形態は、CMOS製造されたセンサーのアレイを含む装置に向けられ、各センサーは1つの化学的に感受性の電界効果トランジスタ(chemFET)を含み、10μm2以下のアレイの表面の面積を占有する。
もう1つの実施形態は、エレクトロニクスセンサーの少なくとも512の行および少なくとも512の列を含めたエレクトロニクスセンサーの二次元アレイを含むセンサーアレイに向けられ、各センサーは、二次元アレイの表面に近接する分析物の存在および/または濃度を表す少なくとも1つの出力シグナルを供するように構成された1つの化学的に感受性の電界効果トランジスタ(chemFET)を含む。
もう1つの実施形態は、CMOS製造されたセンサーのアレイを含む装置に向けられ、各センサーは1つの化学的に感受性の電界効果トランジスタ(chemFET)を含む。CMOS−製造センサーのアレイは、256を超えるセンサーを含み、および該アレイの全てのchemFETからのchemFET出力シグナルのコレクションはデータのフレームを構成する。該装置は、さらに、該アレイにカップリングされ、かつ少なくとも1つのアレイ出力シグナルを生じさせて、秒当たり少なくとも1つのフレームのフレーム速度にて該アレイからのデータの多数のフレームを提供するように構成された制御回路を含む。1つの態様において、フレーム速度は秒当たり少なくとも10のフレームであってよい。もう1つの態様において、フレーム速度は秒当たり少なくとも20のフレームであってよい。なお他の態様において、フレーム速度は秒当たり少なくとも30、40、50、70フレーム、または100フレームまでであってよい。
もう1つの実施形態は、CMOS製造されたセンサーのアレイを含む装置に向けられ、各センサーは化学的に感受性の電界効果トランジスタ(chemFET)を含む。chemFETはフローティングゲート構造、および第1の半導体タイプを有し、かつ第2の半導体タイプを有する領域に製造されたソースおよびドレインを含み、ここに、第2の半導体タイプを有する領域をソースまたはドレインいずれかに電気的に結合させる導電体はない。
もう1つの実施形態は、エレクトロニクスセンサーのアレイを含む装置に向けられ、各センサーは、1つの化学的に感受性の電界効果トランジスタ(chemFET)を含めた3つの電界効果トランジスタ(FET)よりなる。
もう1つの実施形態は、エレクトロニクスセンサーのアレイを含む装置に向けられ、各センサーは3以下の電界効果トランジスタ(FET)を含み、ここに、3以下のFETは1つの化学的に感受性の電界効果トランジスタ(chemFET)を含む。
もう1つの実施形態はエレクトロニクスセンサーのアレイを含む装置に向けられ、各センサーは、1つの化学的に感受性の電界効果トランジスタ(chemFET)を含めた複数の電界効果トランジスタ(FET)、および該複数のFETに電気的に結合した複数の導電体を含み、ここに、該複数のFETは、該複数の導電体が、アレイの各センサーおよび相互結合する多数のセンサーによって占められるエリアを移動する4以下の導電体を含むように構成される。
もう1つの実施形態はCMOS製造されたセンサーのアレイを含む装置に向けられ、各センサーは1つの化学的に感受性の電界効果トランジスタ(chemFET)を含めた複数の電界効果トランジスタ(FET)を含み、ここに、各センサーにおけるFETの全ては同一のチャネルタイプのものであって、アレイ基板の単一半導体領域で実施される。
もう1つの実施形態は、複数の行および複数の列に配置された複数のエレクトロニクスセンサーを含むセンサーアレイに向けられる。各センサーは、アレイの表面に近接する分析物の存在および/または濃度を表す少なくとも1つ、ある場合には、少なくとも2つの出力シグナルを供するように構成された1つの化学的に感受性の電界効果トランジスタ(chemFET)を含む。複数の列の各列については、アレイは、さらに、列における各chemFETに対する一定のドレイン電流および一定のドレイン-対-ソース電圧を供するように構成された列回路を含み、該列回路は、2つの操作増幅器および各chemFETを持つケルビンブリッジ構成に配置されたダイオード−連結FETを含んで、一定のドレイン−対−ソース電圧を供す。
もう1つの実施形態は、複数の行および複数の列に配置された複数のエレクトロニクスセンサーを含むセンサーアレイに向けられる。各センサーは、アレイの表面に近接した溶液中のイオンの濃度を表す少なくとも1つの出力シグナル、ある例においては、少なくとも2つの出力シグナルを供するように構成された1つの化学的に感受性の電界効果トランジスタ(chemFET)を含む。アレイは、さらに、複数の行の各行を可能とするための少なくとも1つの行選択シフトレジスタ、および複数の列の各列からのchemFET出力シグナルを獲得するための少なくとも1つの列選択シフトレジスタを含む。
もう1つの実施形態は、CMOS製造されたセンサーのアレイを含む装置に向けられ、各センサーは化学的に感受性の電界効果トランジスタ(chemFET)を含む。chemFETはフローティングゲート構造、および第1の半導体タイプを有し、かつ第2の半導体タイプを有する領域に製造されたソースおよびドレインを含み、ここに、第2の半導体タイプを有する領域をソースまたはドレインいずれかに電気的に結合させる導電体はない。アレイは、CMOS−製造センサーの少なくとも512の行および少なくとも512の列の2次元アレイを含む。各センサーは、chemFETを含めた3つの電界効果トランジスタ(FET)よりなり、各センサーは3つのFETに電気的に結合した複数の導電体を含む。3つのFETは、複数の導電体が、各センサーによって占有されるエリアを移動し、およびアレイの多数のセンサーを相互に連結する4以下の導電体を含むように配置される。各センサー中のFETの全ては同一のチャネルタイプのものであって、アレイ基板の単一の半導体領域で実施される。アレイの全てのchemFETからのchemFET出力シグナルのコレクションは、データのフレームを構成する。該装置は、さらに、アレイにカップリングされ、かつ少なくとも1つのアレイ出力シグナルを生じさせて、秒当たり少なくとも20フレームのフレーム速度にてアレイからのデータの多数のフレームを供するように構成された制御回路を含む。
もう1つの実施形態は、CMOS製造されたセンサーのアレイを製造する方法に向けられ、各センサーは化学的に感受性の電界効果トランジスタ(chemFET)を含む。該方法は:a)アレイを含めた半導体ウェハーをダイシングして、該アレイを含めた少なくとも1つのダイシングされた部分を形成し;およびb)該少なくとも1つのダイシングされた部分で気体アニール形成を行うことを含む。A)アレイを含めた半導体ウェハーをダイシングして、アレイを含めた少なくとも1つのダイシングされた部分を形成し;次いでB)該少なくとも1つのダイシングされた部分に形成性ガスアニールの形成を行う。
もう1つの実施形態は、chemFETのアレイを製造する方法に向けられる。該方法は:a)アレイを含めた半導体ウェハーをダイシングして、該アレイを含めた少なくとも1つのダイシングされた部分を形成し;およびb)該少なくとも1つのダイシングされた部分で気体アニール形成を行うことを含む。chemFETのアレイを製造し;誘電性材料を該アレイ上に蒸着させ;形成性ガスアニールを、ダイシング工程前に該アレイに適用し;該アレイをダイシングし;次いで、該ダイシング工程後に形成性ガスアニールを適用する。該方法は、さらに、1以上の蒸着工程の間に半導体ウェハーを試験することを含むことができる。
もう1つの実施形態は、CMOS−製造センサーのアレイを加工する方法に向けられる。各センサーは、プラズマ増強化学気相蒸着(PECVD)を介して蒸着された窒化ケイ素および/またはオキシ窒化ケイ素の化学的に感受性の不動態化層を有する化学的に感受性の電界効果トランジスタ(chemFET)を含む。該方法は、不動態化層の多孔度を低下させ、および/または密度を増大させるように、化学的に感受性の不動態化層上に少なくとも1つのさらなる不動態化材料を蒸着することを含む。
本発明の他の態様は、限定されるものではないが、合成方法による配列決定に一体化されるものを含めた核酸合成反応をモニターする方法に関する。かくして、本発明の種々の態様は、核酸合成反応をモニターする方法、核酸へのヌクレオチドの取込を決定し、またはモニターする方法、ヌクレオチド取込の存在または不存在を決定する方法、取り込まれたヌクレオチドの数を決定する方法を提供する。
1つのそのような態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置し(例えば、入れるまたは位置させ)、ここに、該複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、ここに、該鋳型核酸の各々は配列決定プライマーにハイブリダイズし(それにより、鋳型/プライマーハイブリッドを形成し)、およびポリメラーゼに結合され、(本明細書中においては上位概念的にdNTPともいう)1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し(または配列決定プライマーを延長(extending)させ)、次いで、該少なくとも1つのchemFETの電圧および/または電流の変化によって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。chemFETの、(およびかくして複数のchemFET)のアレイは少なくとも2、少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも8、少なくとも9、少なくとも10、少なくとも100、少なくとも200、少なくとも300、少なくとも400、少なくとも500、少なくとも1000、少なくとも104、少なくとも105、少なくとも106、少なくとも107、またはそれ以上のchemFET(当該用語は本明細書中においては相互交換可能に用いられるので、またはchemFETセンサー、または複数センサー)を含むことができる。同様に、複数の反応チャンバーは、少なくとも2、少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも8、少なくとも9、少なくとも10、少なくとも100、少なくとも200、少なくとも300、少なくとも400、少なくとも500、少なくとも1000、少なくとも104、少なくとも105、少なくとも106、少なくとも107、またはそれ以上の反応チャンバーであってよい。
もう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置し、ここに、該複数の反応チャンバーはchemFETアレイと接触しており、ここに、少なくとも1つのchemFETは各反応チャンバーと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズされ(それにより、鋳型/プライマーハイブリッドを形成し)、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって、新しい核酸ストランドを合成し(または配列決定プライマーを延長し)、次いで、少なくとも1つのchemFETにおける電圧および/または電流の変化によって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供し、ここに、該chemFETアレイはこれまでのアレイのいずれかである。
もう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置させ、ここに、該複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズされ、(それにより、鋳型/プライマーハイブリッドを形成させ)、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって(配列決定プライマーを延長させることによって)新しい核酸ストランドを合成し、次いで、アレイ内の少なくとも1つのchemFETにおける電圧および/または電流の変化によって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供し、ここに、隣接する反応チャンバー間の中心間距離(または「ピッチ」)は1〜10μmである。
もう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置し、ここに、該複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、該鋳型核酸の各々は配列決定プライマーにハイブリダイズし(それにより鋳型/プライマーハイブリッドを形成し)、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって(配列決定プライマーを延長することにより)新しい核酸ストランドを合成し、次いで、配列決定反応の副産物の生成によって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供し、ここに、(a)該chemFETアレイは256を超えるセンサーを含み、あるいは(b)隣接する反応チャンバー間の中心間距離は1〜10μmである。重要な実施形態において、配列決定反応副産物はPPiである。
なおもう1つの態様において、本発明は、標的核酸を断片化して(あるいは、例えば、豊富化されたエクソン単離との関係では単離して)、複数の断片化された(または単離された)核酸を生成させ、該複数の断片化された(または単離された)核酸の各々を個々のビーズに付着させて、各々が単一の断片化された(または単離された)核酸に付着された複数のビーズを生成させ、各ビーズ上で断片化された(または単離された)核酸の数を増幅させ、増幅された断片化された(単離された)核酸に付着された複数のビーズを、アレイ中の各センサーについての別々の反応チャンバーを有するchemFETアレイに送達し、ここに、唯1つのビーズが各反応チャンバーに位置しており、次いで、複数の反応チャンバーにおいて同時配列決定反応を行うことを含み、核酸を配列決定する方法を提供する。
本明細書中においてより詳細に記載されるように、配列決定すべき核酸は、次いで、引き続いて断片化される(すなわち、より短い核酸に変換される)より長い核酸から由来することができるか、あるいはそれらは本明細書中で考えられる反応にとって適した長さで単離することができ、かくして、短くする(または断片化する)必要はないであろうことは理解されるべきである。従って、標的核酸を断片化するプロセスというあらゆる態様および本明細書中で議論する限定については、該方法は、断片化の不存在下において標的核酸を単離することによって行うこともできるのは理解されるべきである。
なおもう1つの実施形態において、本発明は、標的核酸を断片化して、複数の断片化された核酸を生成させ、ビーズの存在下で各断片化された核酸を別々に増幅し、断片化された核酸の増幅されたコピーをビーズに結合させ、それにより、各々が複数の同一の断片化された核酸に付着された複数のビーズを生じさせ、各々が複数の同一の断片化された核酸に付着された複数のビーズを、アレイ中の各chemFETセンサーについての別々の反応チャンバーを有するchemFETアレイに送達し、ここに、唯1つのビーズが各反応チャンバー中に位置し、次いで、複数の反応チャンバーにおいて同時配列決定反応を行うことを含む、核酸を配列決定する方法を提供する。
もう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置し、ここに、該複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズされ(それにより、鋳型/プライマーハイブリッドを形成し)、およびポリメラーゼに結合されており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって(配列決定プライマーを延長することにより)新しい核酸ストランドを合成し、次いで、1以上の既知のヌクレオチド三リン酸の取込みのインジケーターとして配列決定副産物レベルの変化を検出することを含む、核酸を配列決定する方法を提供する。
レベルの変化は、1以上の既知のヌクレオチド三リン酸の取込みに先立ってのレベルに対するレベルの増加または減少であってよい。レベルの変化は、chemFETセンサーにおける電圧および/または電流の変化、またはpHの変化として読むことができるが、それに限定されるものではない。
もう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置し、ここに、該複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込、1以上の既知のヌクレオチド三リン酸の取込みのインジケーターとしてPPiの放出を直接的に検出することを含む、核酸を配列決定する方法を提供する。
もう1つの態様において、本発明は、鋳型核酸を断片化して、複数の断片化された核酸を生成し、該複数の断片化された核酸の各々からの1つのストランドを、個々に、ビーズに付着させて、各々が、それに付着した一本鎖の断片化された核酸を有する複数のビーズを生成させて、それに付着された一本鎖の断片化された核酸を有する複数のビーズを、エリア中の各センサー用の別々の反応チャンバーを有するchemFETアレイに送達し、ここに、唯1つのビーズが各反応チャンバー中に位置し、次いで、複数のチャンバー中で同時配列決定反応を行うことを含む、核酸を配列決定する方法を提供する。
1つの態様において、本発明は、反応チャンバーおよびchemFETのそのようなアセンブリの少なくとも3(および数百万まで)を含むアレイ中にて、chemFETと接触した反応チャンバー中の複数の同一鋳型核酸を配列決定することを含む、核酸を配列決定する方法を提供する。
もう1つの態様において、本発明は、少なくとも3つもchemFETを含むchemFETアレイのchemFETと接触した反応チャンバー中の鋳型核酸にハイブリダイズした配列決定プライマーの3’末端への、1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
1つの態様において、本発明は、標的核酸を断片化して、複数の断片化された核酸を生成し、複数の断片化された核酸の1以上を個々に増幅し、次いで、chemFETアレイを用いて個々に増幅された断片化された核酸を配列決定することを含む、核酸を配列決定する方法を提供する。1つの実施形態において、chemFETアレイは少なくとも3つのchemFETを含む。いくつかの実施形態において、chemFETアレイは少なくとも500のchemFET、または少なくとも100,000のchemFETを含む。いくつかの実施形態において、複数の断片化された核酸は、油中水型エマルジョン増幅方法を用いて個々に増幅される。
もう1つの実施形態において、本発明は、標的核酸を断片化して、複数の断片化された核酸を生成させ、複数の断片化された核酸の各々を個々のビーズに付着させて、各々が、単一の断片化された核酸に付着した複数のビーズを生成させ、各ビーズ上の複数の同一の断片化された核酸をもたらす各ビーズ上の断片化された核酸を増幅し、断片化された核酸に付着された複数のビーズを、アレイ中の各センサー用の別々の反応チャンバーを有するchemFETに送達し、ここに、唯1つのビーズが各反応チャンバーに位置しており、次いで、複数の反応チャンバー中で配列決定反応を同時に行うことを含む、核酸を配列決定する方法を提供する。
もう1つの態様において、本発明は、標的核酸を断片化して、複数の断片化された核酸を生成させ、該複数の断片化された核酸の内1以上を個々に増幅させ、次いで、chemFETアレイを用いて、約1〜10μmの中心間距離を有する複数の反応チャンバーにおいて増幅された断片化された核酸を個々に配列決定することを含む、核酸を配列決定する方法を提供する。種々の実施形態において、中心間距離は約9μm、約5μm、または約2μmである。
もう1つの態様において、本発明は複数の鋳型核酸を複数の反応チャンバー中に配置し、ここに、該複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し、次いで、検出可能なpH変化の不存在下において、アレイ内の少なくとも1つのchemFETにおける電圧の変化により1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
もう1つの態様において、本発明は、複数の鋳型核酸を反応チャンバー中に配置し、ここに、複数の鋳型核酸は単一のビーズに付着され、鋳型核酸の各々は配列決定プライマーにハイブリダイズされており、およびポリメラーゼに結合しており、および反応チャンバーはchemFETと接触しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し、次いで、chemFETにおける第一および第二の電圧パルスの検出により1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
なおもう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置し、ここに、複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズされており、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことにより新しい核酸ストランドを合成し、次いで、放出された無機ピロホスフェートを非酵素的に検出することにより1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。1つの実施形態において、検出工程は検出可能なpH変化の不存在下において行われる。
さらにもう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置し、ここに、複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し、次いで、放出された無機ピロホスフェートおよび取り込まれていないヌクレオチド三リン酸を検出することによって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
1つの実施形態において、放出された無機ピロホスフェートはt0において検出され、および取り込まれていないヌクレオチド三リン酸は時間t1において検出される。関連する実施形態において、t1−t0の時間差は取り込まれた既知のヌクレオチド三リン酸の数を示す。
もう1つの態様において、本発明は、鋳型核酸を配列決定プライマーおよびポリメラーゼと、鋳型核酸が、鋳型/プライマーハイブリットを形成するために配列決定プライマーに結合するのを可能とし、かつポリメラーゼが鋳型/プライマーハイブリットに結合するのを可能とするのに十分な時間および条件で接触させ、ヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し、次いで、放出された無機ピロホスフェートおよび取り込まれていないヌクレオチド三リン酸を検出することによって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
1つの実施形態において、放出された無機ピロホスフェートはt0において検出され、および取り込まれていないヌクレオチド三リン酸は時間t1において検出される。関連する実施形態において、t1およびt0の間の時間差(すなわち、t1−t0)は、取り込まれた既知のヌクレオチド三リン酸の数を示す。
更にもう1つの態様において、本発明は、鋳型核酸を配列決定プライマーおよびポリメラーゼと、鋳型核酸が、鋳型/プライマーハイブリッドを形成するために配列決定プライマーに結合するのを可能とし、かつポリメラーゼが鋳型/プライマーハイブリッドに結合するのを可能とするのに十分な時間および条件で接触させ、1以上の既知のヌクレオチド三リン酸を、順次に、低イオン強度環境において配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し(または配列決定プライマーを延長し)、次いで、chemFETにおける1以上の電圧パルスの検出によって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
実施形態に依存して、低イオン強度環境は1mM未満のMgCl2、0.5mM未満のMgCl2、100μM未満のMgCl2、または50μM未満のMgCl2を含むこともできる。他の実施形態において、低イオン強度環境は1mM未満のMnCl2、0.5mM未満のMnCl2、100μM未満のMnCl2、または50μM未満のMnCl2を含むこともできる。更に他の実施形態において、塩はもう1つのMg2+またはMn2+含有塩であってよく、あるいはそれはCa2+またはCo2+含有塩であってよく、またはそれは1以上のそのような塩の組合せであってよい。
もう1つの態様において、本発明は、chemFETと接触した溶液中で、ヌクレオチド三リン酸、鋳型/プライマーハイブリッド、およびポリメラーゼを合わせ、次いで、chemFETにおいて電圧パルスを検出することを含む、新しく合成された核酸への(または配列決定プライマーのようなプライマー上への)ヌクレオチド三リン酸の取込みを決定する方法を提供し、ここに、第一および第二の電圧パルスの検出はヌクレオチド三リン酸の取込みを示し、およびここに、第二の電圧パルスではなく第一の電圧パルスの検出はヌクレオチド三リン酸の取込みの欠如を示す。
1つの実施形態において、電圧パルスは、chemFETの不動態化層における結合事象から独立したchemFETにおいて検出される。
もう1つの態様において、本発明は、chemFETと接触した溶液中で、ヌクレオチド三リン酸、鋳型/プライマーハイブリッド、およびポリメラーゼを合わせ、次いで、chemFETの不動態化層における結合事象とは独立してchemFETにおける電圧パルスを検出することを含む、ヌクレオチド三リン酸の新しく合成された核酸への(または配列決定プライマーのようなプライマーの上への)取込みを決定する方法を提供し、ここに、第一および第二の電圧パルスの検出は少なくとも1つのヌクレオチド三リン酸の取込みを示す。
これまでのいくつかの態様の種々の実施形態において、第一の電圧パルスは時間t0で起こり、第二の電圧パルスは時間t1で起こり、t1−t0は取り込まれたヌクレオチド三リン酸の数を示す。種々の実施形態において、取り込まれたヌクレオチド三リン酸は既知である。種々の実施形態において、ヌクレオチド三リン酸は複数の同一のヌクレオチド三リン酸であり、鋳型/プライマーハイブリッドは複数の同一の鋳型/プライマーハイブリッドであって、ポリメラーゼは複数の同一のポリメラーゼである。別法として、ポリメラーゼは、同一でなく、むしろ2、3、またはそれを超えるタイプのポリメラーゼよりなることができる複数のポリメラーゼであってよい。いくつかの例において、2つのポリメラーゼの混合物を、適当な加工性を有する一方のもの、および取込みの適当な速度を有する他方のものと共に用いることができる。異なるポリメラーゼの比率は変化させることができ、本発明はこの点において限定されるものではない。同様に、鋳型/プライマーハイブリッドは、相互に同一でなくてもよい複数の鋳型/プライマーハイブリッドでよく、但し、単一の反応チャンバー中の、または単一のビーズに付着されたいずれかの鋳型/プライマーハイブリッドは相互に同一であるものとする。
更にもう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置させ(例えば、入れるかまたは位置させ)、ここに、複数の反応チャンバーは各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し(または配列決定プライマーを延長し)、次いで、少なくとも1つのchemFETにおいて、高さh0を有する時間t0における第一の電圧パルスおよび高さh1を有する時間t1における第二のパルスを検出することによって、1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供し、ここに、h0およびh1は、各々、ベースラインを少なくとも約5mV超えておりおよびt1−t0は少なくとも1ミリ秒である。いくつかの実施形態において、t1−t0は少なくとも5ミリ秒、少なくとも10ミリ秒、少なくとも20ミリ秒、少なくとも30ミリ秒、少なくとも40ミリ秒、または少なくとも50ミリ秒である。
もう1つの態様において、本発明は、複数のビーズを複数の反応チャンバー中に配置し、ここに、各反応チャンバーは単一のビーズを含み、各ビーズは複数の同一の鋳型核酸に付着しており、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、およびここに、複数の反応チャンバーは各反応チャンバー用の少なくとも1つのchemFETを含むchemFETアレイと接触しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し(または配列決定プライマーを延長し)、次いで、第一および第二の電圧パルスをアレイ内で少なくとも1つのchemFETにおいて検出することによって、1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供し、ここに、chemFETアレイは少なくとも3つのchemFETを含む。
もう1つの態様において、本発明は、複数のビーズを複数の反応チャンバー中に配置し、ここに、各反応チャンバーは単一のビーズを含み、各ビーズは複数の同一の鋳型核酸に付着しており、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、およびここに、複数の反応チャンバーは、各反応チャンバー用の少なくとも1つのchemFETを含む化学的に感受性の電界効果トランジスタ(chemFET)アレイと接触しており、複数の既知の同一のヌクレオチド三リン酸を各反応チャンバーに導入することによって新しい核酸ストランドの合成(または配列決定プライマーの延長)を開始し、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し、次いで、アレイ内の少なくとも1つのchemFETにおいて第一および第二の電圧パルスを検出することによって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
1つの実施形態において、各反応チャンバーは、複数の既知の三リン酸を各反応チャンバーに導入するに先立ってアデノシン三リン酸を含む。
もう1つの態様において、本発明は、(a)複数のビーズを複数の反応チャンバーに配置し、各反応チャンバーは単一のビーズを含み、各ビーズは複数の同一の鋳型核酸に付着しており、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、および各反応チャンバーは少なくとも1つのchemFETと接触しており、(b)複数の既知の同一のヌクレオチド三リン酸を核反応チャンバーに導入し、(c)もし鋳型核酸中の対応するヌクレオチドに対して相補的であれば、1以上のヌクレオチド三リン酸の配列決定プライマーの3’末端における順次の取込みを検出し、(d)反応チャンバーからの取り込まれていないヌクレオチド三リン酸を洗浄し、次いで、(e)異なる複数の既知のヌクレオチド三リン酸を用いて同一反応チャンバーにおいて工程(b)〜(d)を反復することを含む、核酸を配列決定する方法を提供する。
1つの実施形態において、1以上のヌクレオチド三リン酸の順次の取込みが、chemFETにおいて第一および第二の電圧パルスによって検出される。いくつかの実施形態において、工程(e)は、各異なる複数の既知のヌクレオチド三リン酸を各反応チャンバーに別々に導入することによって工程(b)〜(d)を反復することを含む。
もう1つの態様において、本発明は、複数のビーズを複数の反応チャンバー中に配置し、ここに、各反応チャンバーは単一のビーズを含み、各ビーズは複数の同一の鋳型核酸に付着しており、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、およびここに、複数の反応チャンバーの各々はchemFETアレイ中の少なくとも1つのchemFETと接触しており、二価カチオンを各反応チャンバーに導入することによって新しい核酸ストランドの合成を開始し、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込むことによって新しい核酸ストランドを合成し、次いで、アレイ内の少なくとも1つのchemFETにおいて第一および第二の電圧パルスを検出することによって1以上の既知のヌクレオチド三リン酸の取込みを検出することを含む、核酸を配列決定する方法を提供する。
1つの実施形態において、二価カチオンはMg2+である。もう1つの実施形態において、二価カチオンはMn2+である。なお更なる実施形態において、二価カチオンはMg2+およびMn2+の混合物である。実施形態に依存して、二価カチオンは1mM未満、または100μm未満または50μmの濃度におけるものである。
なおもう1つの態様において、本発明は、複数の同一の鋳型核酸を反応チャンバー中に配置し、ここに、反応チャンバーはchemFETと接触しており、およびここに、鋳型核酸の各々は配列決定プライマーにハイブリダイズしており、およびポリメラーゼに結合しており、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込み、次いで、chemFETにおいて電圧パルスによって1以上の既知のヌクレオチド三リン酸の取り込みを検出することを含む、核酸を配列決定する方法を提供し、ここに、10〜1000ヌクレオチド三リン酸の取込みが検出される。
種々の実施形態は、本発明の種々のこれまでの態様に含まれ得るが、これらは便宜および簡略化のために以下において一旦引用される。
本発明の種々のこれまでの態様および実施形態は鋳型への配列決定プライマーのハイブリダイゼーション(または結合)を引用するが、本発明では、それ自体に(すなわち、分子内に)ハイブリダイズし、それにより、ヌクレオチド三リン酸が取り込まれ得る遊離3’末端を生起する配列決定プライマーおよび/または鋳型核酸の使用も考えられることを理解されたい。自己起点鋳型と本明細書中で呼ばれるそのような鋳型はこれまでの方法のいずれにおいても用いることができる。
同様に、本発明では、DNAニッカーゼのようなニッキング酵素が作用することができるそれらの遊離末端において特定の配列を有するように作成された二本鎖鋳型の使用が同等に考えられる。このようにして、ポリメラーゼはヌクレオチド三リン酸をニックされた部位において取り込む。これらの例において、別々の配列決定プライマーに対する要件はない。
いくつかの実施形態において、少なくとも10、少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも60、少なくとも70、少なくとも80、少なくとも90、または少なくとも100のヌクレオチド三リン酸の取込みが検出される。他の実施形態において、100〜1000ヌクレオチド三リン酸の取込みが検出される。なお他のいくつかの実施形態において、250〜750ヌクレオチド三リン酸の取込みが検出される。
いくつかの実施形態において、反応チャンバーは複数のパッキングビーズを含む。いくつかの実施形態において、検出工程は複数のパッキングビーズの存在下で起こる。
いくつかの実施形態において、反応チャンバーは可溶性非核酸ポリマーを含む。いくつかの実施形態において、検出工程は可溶性非核酸ポリマーの存在下で起こる。いくつかの実施形態において、可溶性非核酸ポリマーはポリエチレングリコール、またはPEA、またはデキストラン、またはアクリルアミド、またはセルロース(例えば、エチルセルロース)である。いくつかの実施形態において、ポリエチレングリコースのような非核酸ポリマーは単一のビーズに付着されている。いくつかの実施形態において、いくつかの例では、FET表面である反応チャンバーの底部を除いて、非核酸ポリマーは反応チャンバーの1以上の(または全ての)側に付着している。いくつかの実施形態において、非核酸ポリマーは、限定されるものではないが、ビオチニル化ポリエチレングリコールのようにビオチニル化されている。
いくつかの実施形態において、該方法は約7〜9、または約8.5〜9.5、または約9のpHで行われる。
いくつかの実施形態において、合成および/または検出工程は弱い緩衝液中で行われる。いくつかの実施形態において、弱い緩衝液は、緩衝剤としての、Tris−HCl、ホウ酸またはボレート緩衝液、アセテート、モルホリン、クエン酸、カルボン酸、またはリン酸を含む。
いくつかの実施形態において、合成および/または検出工程は約1mM Tris−HCl中で行われる。いくつかの実施形態において、合成および/または検出工程は1mM未満のTris−HCl中で行われる。いくつかの実施形態において、合成および/または検出工程は約0.9mM Tris−HCl、約0.8mM Tris−HCl、約0.7mM Tris−HCl、約0.6mM Tris−HCl、約0.5mM Tris−HCl、約0.4mM Tris−HCl、約0.3mM Tris−HCl、または約0.2mM Tris−HCl中で行われる。
いくつかの実施形態において、合成および/または検出工程は約1mMボレート緩衝液中で行われる。いくつかの実施形態において、合成および/または検出工程は約1mM未満のボレート緩衝液中で行われる。いくつかの実施形態において、合成および/または検出工程は約0.9mMボレート緩衝液、約0.8mMボレート緩衝液、約0.7mMボレート緩衝液、約0.6mMボレート緩衝液、約0.5mMボレート緩衝液、約0.4mMボレート緩衝液、約0.3mMボレート緩衝液、または約0.2mMボレート緩衝液中で行われる。
いくつかの実施形態において、検出工程は検出可能なpH変化の不存在下で行われる。いくつかの実施形態において、検出工程は一定のpHの環境で行われる。いくつかの実施形態において、chemFETは比較的pH非感受性である。いくつかの実施形態において、合成および/または検出工程は約0.5mM Tris−HCl中で行われる。
いくつかの実施形態において、合成および/または検出工程は低イオン強度環境で行われる。いくつかの実施形態において、合成および/または検出工程は、1mM未満のMgCl2またはMnCl2、0.5mM未満のMgCl2またはMnCl2、100μM未満のMgCl2またはMnCl2を含む低イオン強度環境で行われる。いくつかの実施形態において、合成および/または検出工程は、約100μm MgCl2またはMnCl2、約75μm MgCl2またはMnCl2、50μm MgCl2またはMnCl2、約40μm MgCl2またはMnCl2、約30μm MgCl2またはMnCl2、約20μm MgCl2またはMnCl2、約10μm MgCl2またはMnCl2を含む低イオン強度環境で行う。本発明では、同様に、他の二価カチオンの量が考えられ、従って、それはMgCl2、またはMnCl2のみに限定されないのは理解されるべきである。同様に、本発明では、2以上の二価カチオン(および/またはそれらの対応する塩)の使用が考えられることが理解されるべきであり、但し、合計イオン濃度は前記したレベルにおけるものであるものとする。
いくつかの実施形態において、合成および/または検出工程は約0.5mM TRISおよび約50μM MgCl2またはMnCl2中で行われる。
種々の実施形態において、ヌクレオチド三リン酸はブロックされていない。本明細書中で用いる場合、ブロックされていないヌクレオチド三リン酸は、(その3’末端において)核酸に取り込むことができる未修飾末端を持つヌクレオチド三リン酸であり、一旦それが取り込まれると、取り込むべき以下のヌクレオチド三リン酸に付着させることができる。ブロックされたdNTPは、対照的に、核酸に加えることができないか、あるいは核酸へのそれらの取込みはいずれかの更なるヌクレオチドの取込みを妨げる。種々の実施形態において、ヌクレオチド三リン酸はデオキシヌクレオチド三リン酸(dNTP)である。
種々の実施形態において、chemFETは窒化ケイ素不動態化層を含む。いくつかの実施形態において、chemFETは、無機ピロフォスフェート(PPi)受容体に付着された不動態化層を含む。いくつかの実施形態において、chemFETは、核酸に結合していない不動態化層を含む。
いくつかの実施形態において、各反応チャンバーは単一のchemFETと接触している。
いくつかの実施形態において、反応チャンバーは、0.5pL未満、0.1pL未満、0.05pL未満、0.01pL未満、0.005pL未満を含めた、約1ピコリットル(pL)と等しい、またはそれ未満の容量を有する。いくつかの実施形態において、反応チャンバーは1〜10μmの中心間間隔によって分離されている。いくつかの実施形態において、反応チャンバーは、約9μm、約5ミクロン、または約2ミクロンの中心間間隔によって分離されている。反応チャンバーは、例えば、それらのベースまたは底部において四角形の断面を有することができる。その例は8μm×8μmの断面、4μm×4μmの断面、または1.5μm×1.5μmの断面を含む。別法として、それらは、例えば、それらのベースまたは底部において三角形の断面を有することができる。その例は8μm×12μmの断面、4μm×6μmの断面、または1.5μm×2.25μmの断面を含む。
いくつかの実施形態において、ヌクレオチド三リン酸は(例えば、MgCl2の存在下で)Mg2+に、または(例えば、MnCl2の存在下で)Mn2+に予め浸漬させる。いくつかの実施形態において、ポリメラーゼは(例えば、MgCl2の存在下で)Mg2+または(例えば、MnCl2の存在下で)Mn2+に予め浸漬させる。
いくつかの実施形態において、該方法は単一の捕獲ビーズを含む反応チャンバーにおいて行われ、ここに、単一の捕獲ビーズ直径に対する反応チャンバー幅の比率は少なくとも0.7、少なくとも0.8、または少なくとも0.9である。
いくつかの実施形態において、ポリメラーゼは溶液中で遊離している。いくつかの実施形態において、ポリメラーゼはビーズに固定化されている。いくつかの実施形態において、ポリメラーゼは捕獲ビーズに固定化されている。いくつかの実施形態において、鋳型核酸は捕獲ビーズに付着されている。
いくつかの実施形態において、ヌクレオチド取込みを検出するに先立って、無機ピロホスフェート(PPi)は有意に加水分解されていない。いくつかの実施形態において、第1の電圧パルスを検出するに先立って、無機ピロホスフェート(PPi)は有意に加水分解されていない。
1つの態様において、本発明は、各々がその表面に配置されたPPi受容体を有する複数のchemFETセンサーを含むchemFETアレイを含む装置を提供し、ここに、該アレイは少なくとも3つのchemFETセンサーを含む。
1つの態様において、本発明は、各々がその表面に配置されたPPi受容体を有する複数のchemFETセンサーを含むchemFETアレイを含む装置を提供し、ここに、該アレイ中の隣接するchemFETセンサーは、約10μm未満の中心間距離だけ分離されている(例えば、.18μm CMOS製造を用い、ピッチは約2.8μmとすることができる)。
もう1つの態様において、本発明は、その表面にPPi選択的受容体が配置された化学的に感受性の電界効果トランジスタ(chemFET)を含む装置を提供する。PPi受容体はchemFET表面に固定化することができる。
なおもう1つの態様において、本発明は、各々がその表面に配置されたPPi受容体を有する複数のchemFETセンサーを含む化学的に感受性の電界効果トランジスタ(chemFET)アレイを含む装置を提供し、ここに、該複数はアレイ中のchemFETセンサーのサブ組である。関連する実施形態において、アレイは少なくとも3つのchemFETセンサーを含む。該サブ組はアレイ中のセンサーの10%、25%、33%、50%、75%以上を表すことができる。PPi選択的受容体は各chemFETの表面に固定化することができる。
いつくかの実施形態において、隣接する反応チャンバーの間の中心間距離は約1〜9μm、または約2〜9μm、約1μm、約2μm、約3μm、約4μm、約5μm、約6μm、約7μm、約8μm、または約9μmである。いくつかの実施形態において、chemFETアレイは256を超えるセンサー(および、所望により、256を超える対応する反応チャンバー(またはウエル))、300を超えるセンサー(および、所望により、300を超える対応する反応チャンバー)、400を超えるセンサー(および、所望により400を超える対応する反応チャンバー)、500を超えるセンサー(および、所望により500を超える対応する反応チャンバー)、600を超えるセンサー(および、所望により600を超える対応する反応チャンバー)、700を超えるセンサー(および、所望により700を超える対応する反応チャンバー)、800を超えるセンサー(および、所望により800を超える対応する反応チャンバー)、900を超えるセンサー(および、所望により900を超える対応する反応チャンバー)、103を超えるセンサー(および、所望により103を超える対応する反応チャンバー)、104を超えるセンサー(および、所望により104を超える対応する反応チャンバー)、105を超えるセンサー(および、所望により105を超える対応する反応チャンバー)、または106を超えるセンサー(および、所望により106を超える対応する反応チャンバー)を含む。いくつかの実施形態において、chemFETアレイはセンサーの少なくとも512の行および少なくとも512の列を含む。
いくつかの実施形態において、配列決定副産物はPPiである。いくつかの実施形態において、PPiは直接的に測定される。関連する実施形態において、PPiは、chemFETセンサーの表面に固定化されたPPi選択的受容体へのその結合によって検出される。もう1つの実施形態において、PPiは、PPi選択的受容体の不存在下で検出される。他の実施形態において、PPiはpH非依存性または非感受性環境で検出される。
いくつかの実施形態において、配列決定反応の副産物は水素イオンである。いくつかの実施形態において、配列決定反応副産物はPiである。なお他の実施形態において、chemFETは、本明細書中に記載したように、他のパラメーターと所望により組合せて、副産物のいずれかの組合せの変化を検出する。
いくつかの実施形態において、PPi選択的受容体は、図11Bに示された化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9または化合物10である。いくつかの実施形態において、chemFETは、その各々がその表面に固定化されたPPi選択的受容体を含めて配置されたchemFETのアレイに存在する。いくつかの実施形態において、同一のPPi選択的受容体はアレイの各chemFETに配置されている。いくつかの実施形態において、アレイは256を超えるセンサーを含む。いくつかの実施形態において、アレイはセンサーの少なくとも512の行および少なくとも512の列を含む。いくつかの実施形態において、chemFETは反応チャンバーの底部に位置する。
もう1つの態様において、本発明は、その表面に配置された生物学的アレイまたは化学的アレイを有するchemFETアレイを含む装置を提供する。
生物学的アレイは核酸アレイ、限定されるものではないが、酵素アレイ、抗体アレイおよび抗体断片アレイを含めた蛋白質アレイ、細胞アレイなどであってよい。化学的アレイは有機小分子アレイ、または無機分子アレイであってよいが、それに限定されるものではない。chemFETアレイは少なくとも5、少なくとも10、少なくとも102、少なくとも103、少なくとも104、少なくとも105、少なくとも106、またはそれ以上のセンサーを含んでもよい。生物学的または化学的アレイは、複数の「セル」、または空間的に定義された領域に配置してもよく、およびこれらの領域の各々は、いくつかの実施形態においては、chemFETアレイ中の異なるセンサー上に位置させる。
なおもう1つの態様において、本発明は、chemFETアレイ上に配置された核酸アレイを試料と接触させ、次いで、該試料からの核酸の、核酸アレイ上の1以上の領域への結合を検出することを含む、核酸を検出する方法を提供する。
もう1つの態様において、本発明は、chemFETアレイ上に配置された蛋白質アレイを試料と接触させ、次いで、該試料からの蛋白質の、蛋白質アレイ上の1以上の領域への結合を検出することを含む、蛋白質を検出する方法を提供する。
尚もう1つの態様において、本発明は、chemFETアレイ上に配置された蛋白質アレイを試料と接触させ、次いで、該試料からの核酸の、蛋白質アレイ上の1以上の領域への結合を検出することを含む、核酸を検出する方法を提供する。
もう1つの態様において、本発明は、chemFETアレイ上に配置された抗体アレイを試料と接触させ、次いで、該試料からの抗原の、抗体アレイ上の1以上の領域への結合を検出することを含む、抗原を検出する方法を提供する。
もう1つの態様において、本発明は、chemFETアレイ上に配置された酵素アレイを試料と接触させ、次いで、該試料からの物質の、酵素アレイ上の1以上の領域への結合を検出することを含む、酵素基質または阻害剤を検出する方法を提供する。
これまでの概念、および以下により詳細に議論する更なる概念(但し、その様な概念は相互に矛盾しないものとする)の全ての組合せは、本明細書中で開示された発明的主題の一部であると考えられるのは認められるべきである。特に、本開示の最後に現れる特許請求される主題全ての組合せは、本明細書中で開示される発明的主題の一部であると考えられる。また、引用により一体化されるいずれかの開示において、やはり現れるであろう、本明細書中で明示的に使用される用語は、本明細書中に開示された特定の概念と最も合致する意味に従うべきであると認識されるべきである。
以下に示すのは、分析物の検出および/または測定のための大規模なchemFETアレイに関する本発明の方法および装置に関する種々の概念、およびその実施形態のより詳細な記載である。開示された概念は実施のいずれかの特定の様式に限定されないので、上記で導入され、および以下でより詳細に議論される種々の概念は、多数の方法のいずれかで実施できるのは認められるべきである。具体的な実施および適用の例は、主として、説明目的で供される。
本開示に従った種々の発明的実施形態は、少なくとも部分的には、マイクロエレクトロニクスのパワーをミクロ流体系の生体適合性と組み合わせる半導体ベースの/ミクロ流体ハイブリッド系に向けられる。以下のいくつかの例において、ハイブリッド系のマイクロエレクトロニクス部分は、説明の目的で、CMOS技術で実施される。しかしながら、他の半導体ベースの技術を利用して、本明細書中で議論される系のマイクロエレクトロニクス部分の種々の態様を実施できるので、該開示はこの点について限定的であることを意図しないことは認められるべきである。
本明細書中に開示される1つの実施形態は、化学的に感受性の電界効果トランジスタ(chemFET)の大きなセンサーアレイ(例えば、二次元アレイ)に向けられ、ここに、個々のchemFETセンサーエレメントまたはアレイの「画素」は、操作されていない試料中におけるあるいはアレイに近接して起こる化学的および/または生物学的プロセス(化学反応、細胞培養、神経活性、核酸配列決定プロセスなど)の結果としての、分析物の存在(または不存在)、分析物のレベル(または量)および/または分析物の濃度を検出するように構成されている。以下により詳細に議論する種々の実施形態において考えられるchemFETの例は、限定されるものではないが、イオン感受性電界効果トランジスタ(ISFET)および酵素感受性電界効果トランジスタ(ENFET)を含む。1つの例示的な実施において、1以上のミクロ流体構造はchemFETセンサーアレイ上方で製造されて、当てはまるように、注目する分析物を生産し、または消費することができる生物学的または化学的反応の含有および/または封じ込めを提供する。例えば、1つの実施においては、その上に所与のウェルが設けられた1以上のセンサーが、該所与のウェル中の分析物の存在、レベル、および/または濃度を検出し、測定するように、ミクロ流体構造は、アレイの1以上のセンサーの上方に配置された1以上の「ウェル」(例えば、小さな反応チャンバーまたは「反応ウェル」)として構成することができる。
もう1つの例示的実施において、本発明は、反応チャンバーの少なくとも1つの二次元アレイを含む高スループット配列決定のための系を含み、ここに、各反応チャンバーは化学的に感受性の電界効果トランジスタ(「chemFET」)にカップリングされており、各反応チャンバーは容量が10μm3(すなわち、1pL)以下である。好ましくは、各反応チャンバーは容量が.34pL以下、より好ましくは.096pL以下、.012pLさえである。反応チャンバーは、所望により、頂部における断面面積が22、32、42、52、62、72、82、92または102平方ミクロンとすることができる。好ましくは、アレイは少なくとも100、1,000、10,000、100,000または1,000,000の反応チャンバーを有する。反応チャンバーは、chemFETに容量的にカップリングさせることができ、好ましくは、chemFETに容量的にカップリングさせる。
いくつかの実施形態において、そのようなchemFETアレイ/マイクロ流体ハイブリッド構造を用いて、核酸を含有する注目する溶液/材料を分析することができる。例えば、そのような構造を使用して、核酸の配列決定をモニターすることができる。核酸の配列決定を行って、核酸の部分的または完全なヌクレオチド配列を決定し、核酸における単一ヌクレオチド多形の存在、いくつかの例においては、性質を検出し、いずれの治療方法が、対象の遺伝子メーキャップによって決定できるように、特定の疾患を有する対象を処置するのに最も有効であるかを決定し、2以上の状態の核酸発現プロフィールを決定し、比較し、(例えば、病気のおよび正常な組織の発現プロフィールの比較、あるいは未処理組織、および薬物、酵素、放射線または化学的処置で処理された組織の発現プロフィールの比較)、試料をハプロタイプ分析し(例えば、ヒト対象に存在する2つの対立遺伝子の各々についての遺伝子または遺伝子における変異の比較)、試料を核型分析し(例えば、肉眼での染色体または他のゲノムの異常を検出するための、胚のような細胞または組織の染色体メーキャップの分析)、および遺伝子型分析する(例えば、例えばキャリアの状態および/または種−族関係を決定するために1以上の遺伝子座の分析)ことができる。
本明細書中に記載された系を利用して、全ゲノムまたはそのいずれかの部分の核酸を配列決定することができる。配列決定することができるゲノムは哺乳動物ゲノム、好ましくはヒトゲノムを含む。かくして、1つの例示的な実施形態において、本発明は:ゲノムまたはその部分からの断片化された核酸を、反応チャンバーの少なくとも1つの二次元アレイを含む高スループット配列決定のための系に送達し、ここに、各反応チャンバーは化学的に感受性の電界効果トランジスタ(「chemFET」)にカップリングされており、および各反応チャンバーは容量が1pL以下であり、次いで、反応チャンバーのchemFETからのシグナルを介して反応チャンバーの少なくとも1つにおいて配列決定反応を検出することを含む、ゲノムまたはその部分を配列決定する方法を含む。
別法の例示的実施形態において、該方法は:ゲノムまたはその部分からの断片化された核酸を、反応チャンバーの二次元アレイを含む配列決定装置に送達し、ここに、反応チャンバーの各々は、関連するchemFETとの検知関係において配置され;次いで、関連するchemFETからのシグナルを介して反応チャンバーの少なくとも1つにおける配列決定反応を検出することを含む。
好ましくは、配列決定反応は、第一のデオキシリボヌクレオチド三リン酸(「dNTP」)を、反応チャンバーの各々に送達することによって行われる。好ましくは、送達工程は、第一のdNTPを実質的に同時に反応チャンバーの各々に送達することを含む。一旦、第一のdNTPが反応チャンバーに送達されれば、酵素は、典型的には、反応チャンバーに送達されて、いずれの使用されていないdNTPも分解し、続いて、洗浄して、反応チャンバーからの酵素の実質的に全てを除去する。好ましくは、該酵素はPPiも分解する。洗浄はいずれの分解されたdNTPまたは分解されたPPiも除去することもできる。
配列決定すべき核酸は、天然に生じるまたは天然に生じない核酸とすることができ、好ましくは、天然に生じる核酸である。核酸は、限定されるものではないが、デオキシリボ核酸(「DNA」)(例えば、メッセンジャーDNA、相補的DNA、または核DNA)、リボ核酸(「RNA」)(例えば、ミクロRNA、トランスファーRNA、メッセンジャーRNA、または小干渉性RNA)、またはペプチドを含めたいくつかの源のいずれから得ることもできる。該源がDNAである場合、該DNAは、限定されるものではないが、血液、唾液、脳脊髄液(「CSF」)、皮膚、毛髪、尿、糞、および粘膜を含めた、DNAを含有するいずれの体液または組織からも得ることができる。配列決定すべき核酸の出発量は、最小の試料の要件を決定する。単一のストランドにおける450塩基の平均を持ち、塩基当り325g/モルの平均分子量を持つ以下のビーズのサイズを考慮し、我々は以下の:
アレイで用いるのが考えられるビーズおよびマイクロウェルの数が与えられれば、かくして、試験すべき対象から採取された試料は3μgのオーダーであることのみが必要であるのは明らかであろう。
好ましくは、前記した方法を用い、少なくとも106の塩基対が1時間当たりに配列決定され、より好ましくは、少なくとも107塩基対が1時間当たりに配列決定され、なおより好ましくは、少なくとも108の塩基対が1時間当たりに配列決定され、なおより好ましくは、少なくとも109の塩基対が1時間当たりに配列決定され、最も好ましくは少なくとも1010の塩基対が1時間当たりに配列決定される。かくして、該方法を用いて、約24時間以内に、より好ましくは約20時間以内に、なおより好ましくは約15時間以内に、なおより好ましくは約10時間以内に、なおより好ましくは約5時間以内に、最も好ましくは、約1時間以内に全ヒトゲノムを配列決定することができる。
本明細書中に記載された系を利用して、約3μg以下のDNAから生物の全ゲノムを配列決定することができる。1つの実施形態において、本発明は、生物からの約3μg以下のDNAを化学的に感受性の電界効果トランジスタのアレイに送達し、次いで、ゲノムの配列を決定することを含む、生物の全ゲノムを配列決定する方法を含む。もう1つの実施形態において、本発明は、オプティックスまたは標識を使用することなく約1ng以下のDNAから完全なヒトゲノムを配列決定するのに適合したデバイスを含む。典型的には、該デバイスはchemFETアレイおよび/またはミクロ流体反応チャンバーのアレイおよび/または誘電性材料にカップリングされた半導体材料を含む。
前記した配列決定は、500μm、400μm、または300μmまでのイオン強度を有する反応混合物中で行うことができる。溶液のイオン強度Iは、溶液に存在する全てのイオンの濃度の関数である。
ここに、c
BはイオンBのモル濃度(モルdm
−3)であり、z
Bはそのイオンの電荷数であって、合計は溶液中の全てのイオンにわたって取られる。Mg
+2またはMn
2+濃度は1000μM、500μM、200μM、100μM、50μM、10μM、5μMまたは1μMであってさえよい。
前記した方法は、配列決定反応がロボティックスを介して行われるように自動化してもよい、加えて、反応チャンバーのchemFETからのシグナルを介して得られた配列決定情報は、ユーザーが配列決定反応の進行を遠隔的にモニターできるように、パーソナルコンピュータ、パーソナルデジタルアシスタント、携帯電話、ビデオゲームシステム、またはテレビに供することができる。このプロセスは、例えば、図71に示される。
また、本明細書中に記載された系を用いて、病気の同定および治療を助けることもできる。例えば、該系は、特定の病気に関連した配列を同定するために、または特定の有効成分に対する陽性の応答に関連する配列を同定するために用いることができる。
1つの実施形態において、本発明は、疾患を有する複数の対象からの核酸を、反応チャンバーの二次元アレイを含む配列決定装置に送達し、ここに、反応チャンバーの各々がchemFETに容量的にカップリングされており;該chemFETからのシグナルから核酸の配列を決定し;次いで、複数の対象からのDNA間の共通の配列を同定することを含む、疾患に関連する配列を同定する方法を含む。好ましくは、対象は哺乳動物、より好ましくはヒトである。好ましくは、疾患は癌、免疫抑制疾患、神経学的疾患、またはウイルス感染である。
もう1つの実施形態において、本発明は、1以上の配列決定装置を用い、活性剤に対して、陽性応答を呈した複数の対象からの、および陰性応答を有する複数の対象からのDNAを配列決定し、ここに、各配列決定装置はchemFETのアレイを含み;次いで、陽性応答を呈した複数の対象における、あるいは他の複数の対象には存在しない陰性応答を呈した対象からの共通のDNA配列を決定することを含む、特定の活性剤に対する陽性応答に関連する配列を同定する方法を含む。好ましくは、対象は哺乳動物、より好ましくはヒトである。
しかしながら、本明細書中に開示された概念のいくつかの説明的例は核酸プロセッシングに対して焦点を当てているが、本発明では、これらの概念のより広い適用が考えられ、これらの例に限定される意図はないことは認められるべきである。
図8は、一般に、本開示の1つの発明的実施形態に従った、大規模なchemFETアレイを含む核酸プロセッシング系1000を説明する。核酸プロセッシング系の例は核酸配列決定系である。以下の議論においては、アレイのchemFETセンサーは、限定されるものではないが、水素イオン濃度および/または核酸プロセッシングに関与する他のイオン種の濃度を含めた、静的および/または動的イオン濃度に対する感度について構成されたISFETとしての説明目的で記載される。しかしながら、本開示はこの点について限定されず、および説明的例としてISFETが使用される本明細書中で議論した実施形態のいずれにおいても、以下でさらに詳細に議論するように、chemFETの他のタイプを代替実施形態で同様に使用できることは認められるべきである。同様に、本発明の種々の態様および実施形態はセンサーとしてISFETを使用できるが、水素イオンではない1以上のイオン性種を検出できるのは認められるべきである。
系1000は、ISFETセンサーアレイ100およびミクロ流体フローセル200を含む半導体/ミクロ流体ハイブリッド構造300を含む。1つの態様において、フローセル200は、ISFETアレイ100の対応するセンサー上方に配置された(図8には示されない)多数のウェルを含むことができる。もう1つの態様において、フローセル200は、多数の配列決定試薬272(例えば、本明細書中においては上位概念的にはdNTPという塩基、dATP、dCTP、dGTP、dTTP、限定されるものではないが、Mg2+のような二価カチオン、洗浄溶液等)のフローセルに対する制御されかつ順序立てた許可(または導入)を介してフローセルに配置された1以上の同一の鋳型核酸の配列決定を容易とするように構成される。
図8に示されるように、配列決定試薬のフローセル200への許可は、コンピュータ260によって制御される1以上のバルブ270および1以上のポンプ274を介して達成することができる。多数の技術を用いて、種々のプロセッシング材料(例えば、溶液、試料、反応試薬、洗浄溶液等)をそのようなフローセルのウェルに対して許可する(すなわち、導入する)ことができる。図8に示されるように、塩基を含めた試薬は、それらがそこからウェルに拡散するフローセルへ(例えば、コンピュータ制御バルブ270およびポンプ274を介して)許可され得、あるいは試薬はインクジェットのような他の手段によってフローセルに加えることができる。なおもう1つの例において、フローセル200はいずれのウェルも含有できず、試薬の拡散特性を探索して、ISFETアレイ100の各センサーの間のクロス−トークを制限することができる。
本明細書中でより詳細に議論するように、本発明に従って提供される配列決定方法の種々の実施形態は、鋳型核酸の多数の同一コピーがそれらの表面に付着されたビーズを用いる。そのようなビーズは、一般に、本明細書中においては、核酸が「負荷された」という。好ましくは、各反応ウェルは単一のビーズのみを含む。それらの内には数十、数百、数千以上があり得る核酸が負荷されたビーズは、まず、フローセルに入り、次いで、個々のビーズが個々のウェルに入る。ビーズは受動的にまたはその他の方法でウェルに入ることができる。例えば、ビーズは、いずれかの適用された外力なくして重力を通じてウェルに入ることができる。ビーズは、限定されるものではないが、磁力または遠心力を含めた適用された外力を通じてウェルに入ることができる。いくつかの実施形態において、もし外力が適用されたならば、それは、ウェルの高さ/深さに対して横方向よりもむしろ、ウェルの高さ/深さに対して平行である方向に適用され、目的はできる限り多くのビーズを「捕獲する」ことである。好ましくは、ウェル(またはウェルアレイ)は攪拌されないというのは、例えば、ウェルの高さ/深さに対して垂直である適用された外力を通じて起こり得るからである。さらに、一旦ウェルがそのように負荷されたならば、それらは、ウェルからビーズを除去し得るいずれの他の力にも付されない。
さらに、本明細書中で議論されるように、核酸負荷ビーズに加えて、各ウェルは、本明細書中においては「パッキングビーズ」といわれる複数のより小さいビーズを含むこともできる。パッキングビーズは、ウェルに存在する分析物、試薬、反応パラメータ等と相互作用または干渉しないいずれかの不活性な材料で構成され得る。パッキングビーズはchemFET表面および核酸負荷ビーズの間に位置させることができ、その場合、それらは核酸負荷ビーズ前にウェルに導入してもよい。別法として、それらは、全て、核酸負荷ビーズの周りに位置させてもよく、その場合、それらは、核酸負荷ビーズの前に、その間におよび/または後にウェルに加えてもよい。なお他の実施形態において、パッキングビーズの大部分は核酸負荷ビーズの頂部に位置させてもよく、その場合、それらは核酸負荷ビーズ後にウェルに加えてもよい。
パッキングビーズは1以上の種々の機能を発揮することができる。例えば、パッキングビーズは、特に、もしそれらのいくらかの分率が核酸負荷ビーズの頂部に位置するならば、ウェルからの核酸負荷ビーズの除去を最小化し、または一緒に妨げるように作用することができる。パッキングビーズは、限定されるものではないが、PPiおよび取り込まれていないヌクレオチドを含めた、ウェルにおける溶液中の1以上の成分の拡散速度を減少させるように働くことができる。いくつかの実施形態において、パッキングビーズは、常磁性ビーズである。パッキングビーズは、Bangs Labratoriesのような源から商業的に入手可能である。
拡散は、反応チャンバーに増粘剤を含めることによってインパクトすることができる。そのような剤の一例は、核酸でないポリマー(すなわち、非核酸ポリマーである)。該ポリマーは天然に生じるものであっても、または天然に生ないものであってもよく、PPi、取り込まれていないヌクレオチド、および/または他の反応副産物または試薬の反応チャンバー底部に向けての拡散を減速させる以外は、それはいずれの性質であってもよく、但し、それはヌクレオチドの取込みおよび検出に干渉しないものとする。適当なポリマーの一例はポリエチレングリコール(PEG)である。他の例はPEA、デキストラン、アクリルアミド、セルロース(例えば、メチルセルロース)等を含む。該ポリマーは溶液中で遊離していてもよく、またそれは反応チャンバーの1以上の側に、捕獲ビーズに、および/または存在し得るいずれかのパッキングビーズに(共有結合により、または非共有結合により)固定化されていてもよい。非共有結合付着はビオチン−アビジン相互作用を介して達成することができる。
なお他の配列決定実施形態において、捕獲ビーズを使用する代わりに、ウェルを例えば、プライマー核酸の対を含めた1以上の核酸でコーティングすることができ、およびプライマーヌクレオチド配列に相補的なアダプターヌクレオチド配列を有する鋳型核酸をウェルに導入することができる。分析物または鋳型核酸を固定化することにおいて有用なこれらおよび他の剤をセンサーアレイ100に、チップパッキングの一部としての個々のダイに、またはウェルに、試料の処理直前に供することができる。ゾルゲルに関連する他の方法を用いて、ISFETアレイ100の表面近くに核酸のような剤を固定化することができる。
本明細書中でより詳細に議論するように、本発明において考えられる配列決定方法のいくつかの態様において鋳型核酸をウェルへの設置に先立って、またはその後に増幅してもよい。種々の方法が核酸を増幅するのに存在する。かくして、1つの態様において、一旦鋳型核酸がフローセル200のウェルに負荷されたならば、増幅をウェルにおいて実行し、得られた増幅された産物を変性し、および配列決定×合成し、または次いで実施してもよい。増幅方法は、限定されるものではないが、ブリッジ増幅、ローリングサークル増幅、あるいは等温または非−等温増幅技術を用いる他の戦略を含む。
まとめると、図8の系におけるフローセル200は、種々の様式で構成して、ISFETアレイ100に近接して1以上の分析物(または1以上の反応溶液)を供することができる。例えば、鋳型核酸を適当に近接させて、センサーアレイ100の1以上の画素に、あるいはセンサーアレイ上方に位置した支持体材料(例えば、1以上の「ビーズ」)上に直接的に付着させ、または適用してもよい。プロセッシング試薬(例えば、ポリメラーゼのような酵素)を、直接センサー上に、あるいはセンサーに近接した1以上の固体支持体上に置くこともできる。該デバイスは、少なくとも1つのセンサー−検出可能生成物(例えば、イオン濃度の変化)の検出および/または測定を含む多数のバイオセンサー適用のためにウェルまたはビーズ無くして用いることができるのは理解されるべきである。
図8の系1000においては、1つの実施形態によると、ISFETセンサーアレイ100はイオン種、特に、イオン種のレベル/量および/または濃度の変化をモニターする。重要な実施形態において、種は、核酸合成または配列決定反応から得られたものである。1つの特に重要なイオン種は、ヌクレオチド取込の結果として放出されるPPiである。一旦合成または配列決定反応が完了したならば、もう1つの重要な種は反応チャンバーに加えられた、および反応チャンバーに残る過剰のヌクレオチドである。そのようなヌクレオチドは、本明細書中においては、「取り込まれていないヌクレオチド」という。
本明細書中においてより詳細に議論されるように、本発明の種々の実施形態は、ISFETの静的および/または動的応答を含むモニタリング/測定技術に関することができる。核酸合成または配列決定反応の間におけるヌクレオチド取込の検出に関連する1つの実施形態において、検出/測定技術は、特に、図2Aに関連して先に議論したように、核酸合成または配列決定反応に関連する種々のイオン種の濃度変化を検出するために、ISFETの一過的または動的応答(イオン−段階的応答、または「イオンパルス」出力)に依拠している。核酸合成または配列決定反応の特定の例を供して、ISFETの一過的または動的応答を説明するが、他の実施形態によると、以下に議論されるISFETの一過的または動的応答は、核酸合成または配列決定反応の具体的例を超えた化学的および/または生物学的活性の他のタイプをモニターし/検知するために開発することができるのは認められるべきである。
1つの例示的実施において、従前の研究努力によって考えられた分析物溶液中の段階的または実質的に瞬間的なpH変化を超えて、本発明のいくつかの実施形態に従ったISFETの動的応答に依拠する検出/測定技術は、少なくとも部分的には、(例えば、ISFET上の反応ウェルの底部における)分析物/ISFETの不動態化層界面に近接する種々のイオン性種の異なる拡散に基づく。特に、出願人らは、もし分析物/不動態化層界面に近接したイオン強度の変化によって構成される与えられた刺激が、注目する各種の適当な拡散のため、不動態化層の能力よりも有意に速い速度で起こって、濃度変化の刺激に応答してその表面電荷密度を調整するならば(例えば、不動態化層表面に関連する特徴的な応答時定数τよりも速い)、イオン強度の段階的または実質的に瞬時の変化は、ISFETからのイオンパルス出力を観察するのに必ずしも必要とされないのを認識し、認めた。この原理は、DNA配列決定の例に対してのみならず、同様に、化学物質の他のタイプおよび化学反応検知に適用可能である。
本開示の目的では、十分に速いタイムスケールで起こる分析物溶液中のイオン強度のいずれかの有意な変化によって構成された刺激に対するISFETのパルス応答を「イオンパルス」といい、ここに、該パルスの振幅は方程式(17)によって記載されて、ここに、パルスの幅および形状(経時的なパルスの上昇および崩壊)は、イオン種に関連する拡散パラメーターに関し、(方程式(18)に関連して先に議論したように、1以上の特徴的な時定数τに反映されたように)分析物/不動態化層界面において、イオン強度の変化および平衡反応キネティックスを生起させる。(18)).本明細書中で議論された種々の実施形態において、分析物/不動態化層表面に近接するイオン種の濃度変化による1以上のパルスが、もしそのような濃度変化が、濃度変化の刺激に応答してその表面電荷密度を調整する不動態化層の能力よりも速い速度で起こるならば、ISFET出力シグナルで観察できる(例えば、イオン強度の変化は時間t<<τ以内に起こる)。再度、これまでから、イオン強度の段階的または瞬時の変化(例えば、ISFET不動態化層表面に対して鉛直な方向の高い流速)は、ISFETからのイオンパルス出力を観察するのに必要とされないのは認識されるべきである。
より具体的には、(相対的により低いイオン強度、例えば、<1モル/リットルの領域におけるデバイ理論の適用性を仮定して)方程式(10)および(11)を再度参照し、ISFETがイオン強度の変化の後に同一表面ポテンシャルに再度平衡化することを考慮されたい。これは、もしデバイスクリーニング長さがλ’に変化すれば、表面電荷密度は対向量だけ変化して、表面ポテンシャル定数を保つことを示唆する、すなわち:
方程式(18)に関連して先に議論したように、表面電荷密度σは、時定数τでの時間の指数関数として近似して記載することができる。従って、もし、分析物溶液中の時間変化イオン強度I(t)のため時間−変化デバイスクリーニング長さλ(t)があれば(方程式(12)および(13)参照)、表面電荷密度は微分方程式:
に従い、表面電荷密度は、連続して、デバイスクリーニング長さが時間と共に変化するにつれて初期表面ポテンシャルを与える値まで戻ろうとするのが観察できる。
方程式(15)から、298ケルビン度の温度Tにおいては、59.2mV/pHの理論的最大pH感度はα=1で達成できるのは認識されるであろう。時間の関数としての表面ポテンシャルは、以下の
のように、方程式(10)および(11)から、デバイスクリーニング長さの項において表わすことができる。
σ(t)を含む新しい変数g(t)を導入し、かつ方程式(12)を参照し、方程式(22)は、以下の
のように、時間変化イオン強度I(t)の項において書き換えることができ、それから以下の
が得られる:
方程式(23)および(24)は、ISFET出力シグナルにおけるイオンパルスの発生および総じてのプロフィールが、共に、分析物/不動態化層界面の表面キネティックスに関連する時定数τ、および時間I(t)の関数としてのイオン強度に依存し、これは、反応ウェルにおける各イオン種の濃度によって与えられ、というのは、それらは反応および拡散のため経時的に変化するからであることを示す。前記したように、これまでのことから、出願人らは、I(t)が、(時定数τによって特徴付けられるように)再度平衡化する表面電荷密度の能力よりも速い速度で変化する限り、イオンパルス出力が観察できることを認識し、認めており、ここに、パルスの開始のプロフィールは主としてI(t)によって決定され、パルスの崩壊プロフィールは主として時定数τによって決定される。再度、これまでの分析は、一般に分析物溶液に存在する実質的にいずれのイオン種にも適用され、従って、ISFETの一過的または動的応答を開発して、種々の化学的/または生物学的活性をモニターすることができる。
核酸合成または配列決定反応の具体的例に関しては、1つの実施形態において、アレイ100の例示的ISFETを使用して、合成または配列決定試薬の、ISFETに関連する、かつ従前に負荷された鋳型を含有する対応する反応ウェルへの添加に応答する、1以上のパルスを含む出力シグナルを供することができる。図8Aおよび8Bを参照し、この実施形態に従った例示的方法において、既知のヌクレオチド(すなわち、dNTP、ここに、NはA、C、GまたはTの1つをいう)が(以下にさらに議論する)適当な拡散パラメータにて反応ウェルに導入され、合成または配列決定反応を開始させ、ISFET出力シグナルにおいて検出された、(もし多数のパルスが発生するならば)イオンパルスの数、および順次のパルスの間の時間間隔はヌクレオチド取込みについて価値ある情報を提供する。
より具体的には、ヌクレオチド取込みを検出するための1つの実施形態に従った方法において、もし反応ウェルに導入された1以上のヌクレオチドがそれらの導入に際して取り込まれれば、PPiが発生する。図8Aは、1つの例示的実施における核酸合成または配列決定反応の間における、ISFET分析物/不動態化層界面に近接する分析物における時間の関数としての種々のイオン種の(μMで表わした)濃度を示すグラフである。図8Aに示された特別な例において、プロット41は時間の関数としてのPPiの濃度を示し、およびプロット43は(秒で表わした)時間の関数としてのdNTP濃度を示す。PPiの最初の濃度増加に実質的に対応する時間t=0秒および注目する種に対する特定の拡散パラメータにて、ほぼ15秒<t<17.5秒において、PPiの濃度は突然減少し、dNTPの濃度の対応する増加があることが観察することができる。本論議の目的では、反応ウェルへの許可に際しての所与のヌクレオチドタイプdNTPの各取込みは、「取込み事象」という。図8Aの例においては、以下でさらに議論するように、多数の取込み事象が期間0<t<17.5の間に起こり、そこでは、PPi濃度は上昇する。
図8Bは、図8Aにてプロフィールを示したものと同様な例示的核酸配列決定/合成反応についての時間の関数としてのISFET出力電圧の多数のプロットを示すグラフである。前記表1および方程式(3)、(4)、(5)および(16)を参照し、二酸化ケイ素または窒化ケイ素いずれかの不動態化層および、例えば、ほぼ8〜9の分析物pHに基づき、ほぼ−200mVのオーダーの「ベースライン」ISFET出力電圧が、図8Bに示されるように予測されるはずであることを認識し得る。関連するイオン種の適当な拡散パラメータを仮定すれば、ISFETの分析物/不動態化層界面に近接するPPiの初期の発生は、1以上の取込み事象のため、十分に速いイオン強度変化刺激I(t)を構成し、それにより、前記方程式(23)に従った表面ポテンシャルΨ0の変化、および前記方程式(3)、(4)および(5)によって与えられるISFET出力シグナルの対応する変化を引き起こし、その結果、ISFET出力シグナルにおいてイオンパルスをもたらす。別の言い方をすれば、1以上の取込み事象によるPPi発生の持続に拘わらず、十分に速い刺激を構成する初期のPPi発生に続き、分析物/不動態化層界面はいくらかの定常状態平衡に戻り、それにより、初期刺激に対する一過性の応答を完成させ、ISFETシグナルにおいてパルスを生起させ、その例は図8Bに示される。一般に、図8Bから、1つの例示的実施において、与えられたイオンパルスについての崩壊プロフィールに対する時定数τは、ほぼ2〜2.5秒のオーダーとなり得ることが観察できる。しかしながら、(例えば、方程式(19)に関連して先に議論したように)本発明の種々の実施形態はこの説明的例に限定されず、というのは、時定数τは、少なくとも部分的に、所与の不動態化層の材料依存性特性、ならびに分析物溶液のバルクpHに依存し得るからであることは認識されるべきである。
図8Bにおいては、時間の関数としてのISFET出力シグナルに対する多数の異なるプロットが示され、脚注は、示された出力シグナルを生起させる取込み事象の数を示すために注意書きNpoly=x(X=0,1,2,7)を使用する。…1以上の取込み事象(Npoly≠0)に対応する出力シグナルのプロットの全ては、その各ピークがいくらかの時間間隔によって分離される2つのパルスを含む。例えば、時間間隔47によって分離されたパルス45および49を含めた出力シグナルのプロットは、図8Aに示された濃度変化に対応し、脚注注意書きNpoly=7で標識され、これは、本例示的実施における時間間隔47が7つの取込み事象を表すことを示す。
より具体的には、ヌクレオチド取込みを検出するための例示的方法において、もしPPiが1以上の取込み事象に従って発生すれば、いくつかの点取込み中断において、プロット43により図8Aに示されるように、PPiはもはや発生せず、および取り込まれていないヌクレオチド(dNTP)の濃度は増大する。もし、拡散パラメータが、dNTPの増大した濃度が、PPiによるイオンパルスの完了の後に(すなわち、分析物/不動態化層界面が最初のPPi刺激に続いて定常状態に到達した後に)起こるようなものであれば、取り込まれていないヌクレオチドのこの増大した濃度が、ISFET出力シグナルにおける第二のイオンパルスを発生する第二のイオン刺激を構成し;再度、7つの取込み事象に対応する図8Aに示された濃度変化の説明的例を用い、その各ピークが時間間隔47によって分離される、取込み事象が一旦終了すれば、図8B中のプロットNpoly=7は、初期PPi発生に対応する第一のイオンパルス45、およびdNTPの増大した濃度に対応する第二のパルス49を含む。
より一般的には、出願人らは、いくらかの時間間隔によって分離された多数のパルスを含めた図8B中のISFET出力シグナルのいずれかについて、PPi発生による第一のイオンパルスおよび取り込まれていないヌクレオチドの増大した濃度による第二のイオンパルスの間の時間の間隔は、少なくとも部分的には、取込み事象の数に関連することを認識し、認めた。更に以下に議論するように、この時間間隔は、少なくとも部分的には、限定されるものではないが、反応ウェルの寸法、ウェル内のパッキング密度、ヌクレオチド配列決定または合成反応のキネティックス、関連する種の拡散係数、ヌクレオチド濃度、およびDNAの初期の量を含めた他のパラメータに関連することができる。図8Bにおける脚注Npoly=7に関連する出力シグナルに加えて、さらなる説明の目的で、多数の他のパルスが図8Bにおいて標識されており;特に、パルス53はNpoly=3と標識された出力シグナルにおいて2つのパルスの秒を構成し(すなわち、パルス45およびパルス53の間の時間間隔は3つの取込み事象に対応し)、およびパルス55はNpoly=5と標識された出力シグナルにおいて2つのパルスの秒を構成する(すなわち、パルス45およびパルス55の間の時間間隔は5つの取込み事象に対応する)。
ヌクレオチド取込みを検出するためのこれまでの方法のもう1つの態様において、もし所与のヌクレオチドdNTPのウェルへの導入に際してヌクレオチドが取り込まれなければ、PPiは発生せず、ウェルに関連するISFETに対する第一および唯一のイオン刺激は、それがウェルに対して許容されているので、dNTPの濃度の上昇である。その結果、単一のイオンパルスのみが発生し、再度、dNTPに対する適当な拡散パラメータを仮定する。この状況が、出力シグナルにおいて単一パルス51のみを含む、図8B中のNpoly=0として標識された出力シグナルによって示される。
従って、前記した方法は、以下のように、核酸合成または配列決定反応の有意な特徴付けを供する:
1)もし単一のイオンパルスのみがISFET出力シグナルに存在するならば、反応ウェルに導入されたヌクレオチドの取込みは無い(すなわち、dNTP刺激のみ);
2)もし2つの連続したイオンパルスがISFET出力シグナルに存在するならば、反応ウェルに導入されたヌクレオチドの取込みがある、(すなわちPPi刺激、続いてのdNTP刺激);および
3)2つの連続的イオンパルスの間の時間間隔は、取込み事象の数の関数である。
ヌクレオチド取込み検出について直ぐ上で議論した種々の概念に従った方法の種々の例示的実施において、ISFET出力シグナルに1または2のパルスが存在するか否かを単に決定するのは、ヌクレオチド取込みに対して有用な情報を提供することは認識されるべきである。よって、本発明に従った全ての方法が、もし存在すれば、多数のパルスの間の時間間隔をやはり分析するのに必要であるというのではない。しかしながら、再度、いくつかの例においては、1以上のイオンパルスを生起させる各種に関連する種々の拡散パラメータを考慮し、この時間間隔は取込み事象の数に関連するさらなる有用な情報を提供し、事実、いくらかの例示的実施はISFET出力シグナルに存在するパルスの数のみならず、パルスの間のタイミングを分析する。
先に議論したヌクレオチド取込み検出のための方法に関し、かつ方程式(17)を再度参照し、出願人らは、核酸合成または配列決定反応の種々のパラメータが改善され、および/または最適化されて、ISFET出力シグナルにおける所与のイオンパルスに関連するシグナル対ノイズ比(SNR)を増加させることができる(例えば、イオンパルスの振幅ΔΨ0を増大させることができる)ことを認識し、認めてきた。
まず、方程式(17)から、より高い初期平衡表面ポテンシャルΨ1(すなわち、所与のヌクレオチドdNPTの反応ウェルへの導入前の洗浄緩衝液の存在下における定常状態表面ポテンシャル)は、一般に、イオンパルスについてのより高い振幅ΔΨ0をもたらすことが認められる。1つの態様において、方程式(16)を再度参照し、出願人らは、より高いΨ1は、ISFETの不動態化層のpHpzc(すなわち、不動態化層表面においてゼロ電荷密度をもたらすバルク分析物pH)とは有意に異なるpHを有する洗浄緩衝液の選択によって促進されることを認めた。よって、種々の実施において、洗浄緩衝液は、不動態化層で使用される材料のタイプに基づいて適切に選択することができる。
方程式(15)から、298ケルビン度の温度Tにおいては、59.2mV/pHの理論的最大pH感度はα=1で達成できるのは認識されるであろう。方程式(15)から、出願人らは、ISFETの比較的高いpH感度(ΔΨ0/ΔpH)はより高いΨ1に寄与することもでき;このようにして、方程式(15)に関連して先に議論したように、大きな固有の緩衝能力βintを持つ不動態化層材料が望ましく、これは、方程式(15)に与えられた無次元感度因子αは大きなβintによって増加するからであることも認めた。また、しかしながら、この点に関しては、pHに対する高い感度は先に記載した特異的実施形態に従ったヌクレオチド取込み検出方法において必ずしも要件ではなく、これは、該方法は、主として、PPiおよびdNTP濃度変化の検出を前提としており、水素イオン濃度それ自体の測定を前提とするものではないからであることも認められるべきである。この状況は、(例えば、MOSFET本体効果を考慮して)より限定されたpH測定範囲および低下した直線性の要件の考慮に基づき、本明細書中で議論された種々のISFETアレイ最適化技術の前記した方法への適用性を強調する。もちろん、事実、本明細書中で議論された本発明の他の実施形態に従った方法は、反応インジケーターとしての水素イオン濃度および濃度変化に依拠することができる。いずれの場合においても、前記したように、出願人らは、有意に制限されたpH範囲にわたってさえ、ISFETの比較的高いpH感度は、いくつかの例においては、イオンパルスについての増大した振幅ΔΨ0および、よって、ISFET出力シグナルの増大したSNRを促進することができるのを認めた。
加えて、出願人らは、方程式(17)から、(dNTPの導入に先立って洗浄緩衝液から生じる)分析物溶液中の初期イオン強度による初期二重層キャパシタンスCdl,1の低下または最小化、および/または濃度変化刺激(すなわち、PPiの発生またはdNTPの増加)から生じる引き続いての二重層キャパシタンスCdl,2の増加または最大化もまたイオンパルスに対するより高い振幅ΔΨ0をもたらすことを認めた。従って、種々の実施において、低イオン強度緩衝液を適切に選択して、イオンパルスに対する増大した振幅ΔΨ0および、よって、ISFET出力シグナルの増大したSNRを促進することができる。
時間分解能に関して、先に示唆したように、パルス形状、ならびにいずれかの2つのパルスの間の時間間隔のいくつかの態様は、時間、および注目する種々のイオン種がISFETの分析物/不動態化層界面に近接して発生する速度の関数である。これらの点における重要なパラメータの例は、限定されるものではないが、分析物溶液の種々の構成要素(例えば、種々の試薬)が反応ウェルに受け入れられる流速、種々の種の各濃度および/または集合的濃度、ウェルに存在する鋳型材料の量、ウェルで起こり得る核酸配列決定または合成反応のキネティックス、および反応ウェルにおける種の拡散に影響する種々の因子(例えば、種々の種の拡散係数、反応ウェルの幾何学/寸法、パッキングビーズの存在およびサイズ、密度に影響する分析物溶液に対する添加剤)を含む。一般に、ISFET出力シグナルにおける1以上のイオンパルスの時間分解能に関連するパラメータは以下により詳細に議論する。
前記したように、いくつかの実施形態においては、pHの変化は、新しく合成された核酸ストランドに取り込まれたヌクレオチドの数に比例するので、ISFETを使用して、定常状態pH値を測定することができる。以下でより詳細に議論される他の実施形態において、FETセンサーアレイは、特に、注目する化学反応についての関連情報を供することができる他の分析物に対する感度に対して構成することができる。そのような修飾または構成の例は、本明細書中においてより詳細に議論するように、注目する分析物に結合するための分析物−特異的受容体の使用である。
(やはりコンピュータ260操作下にある)アレイコントローラ250を介して、ISFETアレイは、分析物の検出および/または測定に関連するデータ(例えば、アレイの各ISFETの出力シグナル)を獲得するように制御することができ、収集されたデータはコンピュータ260によって処理されて、鋳型核酸の(配列決定を含めた)プロセッシングに関する有意義な情報を得ることができる。
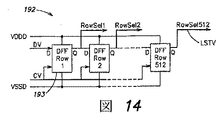
図8に示された系1000のISFETアレイ100に関しては、1つの実施形態において、1以上の分析物および/または反応をモニターし/測定するのに必要な全てのセンサーおよびエレクトロニクスを含む、標準CMOSプロセス(例えば、0.35マイクロメートルプロセス、0.18マイクロメートルプロセス)を用いて設計され、製造された集積回路としてアレイ100は実施される。再度、図1を参照し、ISFETアレイ100に関連して使用されるべき1以上の参照電極76を(例えば、フローセルの「使用されない」ウェルに配置された)フローセル200に入れることができ、そうでなければ、参照(例えば、配列決定試薬172の1以上)に暴露して、それに対してアレイ100の各ISFETに近接する分析物濃度の変化が比較されるベースラインを確立することができる。参照電極76はアレイ100、アレイコントローラ250、または直接的にコンピュータ260に電気的にカップリングさせて、アレイ100から得られた電圧シグナルに基づいて分析物測定を容易とすることができ;いくつかの実施においては、参照電極は電気的アースまたは他の所定のポテンシャルにカップリングさせることができるか、あるいは参照電極電圧をアースに関して測定して、以下にさらに議論するように、ISFET出力シグナル測定のための電気的参照を確立することができる。
ISFETアレイ100は、限定されるものではないが、2〜256のようにできるだけ少ない画素(例えば、二次元実施における16×16画素)を含めた一次元または二次元アレイとして、または54メガのようにできるだけ多い画素(例えば、二次元実施において7400×7400画素)として、任意の特定のサイズに限定されない。あるいは本明細書中に開示された概念に従った種々の化学的/生物学的分析目的で、より大きなものさえ製造し、使用することができる。図8に示された例示的系の1つの実施形態において、アレイの個々のISFETセンサーは、PPi、取り組まれていないヌクレオチド、水素イオン等に対する感度のために構成することができ;しかしながら、ISFETセンサーアレイの個々のセンサーは、種々の適用(例えば、ナトリウム、銀、鉄、臭素、ヨウ素、カルシウム、および硝酸塩のような他のイオンに対して感受性の材料は知られている)のためのイオン濃度の他のタイプに対する感度について特に構成することができるので、本開示はこの点において限定されないことも認められるべきである。
より一般的には、本開示の種々の実施形態に従ったchemFETアレイは、種々の分析物のいずれか1以上に対する感度について構成することができる。1つの実施形態において、アレイの1以上のchemFETは、1以上の分析物および/または1以上の結合事象に対する感度について特に構成することができ、他の実施形態においては、所与のアレイの異なるchemFETを、異なる分析物に対する感度について構成することができる。例えば、1つの実施形態において、アレイの1以上のセンサー(画素)は、第1の分析物に対して感受性であるように構成された第1のタイプのchemFETを含むことができ、およびアレイの1以上の他のセンサーは、第1の分析物とは異なる第2の分析物に対して感受性であるように構成されたchemFETの第2のタイプを含むことができる。1つの例示的な実施において、第1および第2の双方の分析物は、例えば、合成方法による配列決定におけるヌクレオチド取込のような特定の反応を示すことができる。もちろん、chemFETの2を超える異なるタイプをいずれかの所与のアレイで使用して、分析物および/または他の反応の異なるタイプを検出し、および/または測定することができることも認められるべきである。一般に、本明細書中で議論されたセンサーアレイの実施形態のいずれにおいても、所与のセンサーアレイは「均一」であってよく、実質的に同様なまたは同一のタイプのchemFETを含んで、分析物の同一タイプ(例えば、pHまたは他のイオン濃度)を検出し、および/または測定することができ、あるいはセンサーアレイは「不均一」であってよく、異なるタイプのchemFETを含んで、異なる分析物を検出し、および/または測定することができる。議論を簡単にするために、再度、ISFETの例をセンサーアレイの種々の実施形態において以下に議論するが、本開示はこの点において限定されず、分析物感度についての数個の他のオプションを(例えば、図11Aに関して)以下にさらに詳細に議論する。
種々の分析物のいずれか1以上に対する感度について構成されたchemFETアレイはエレクトロニクスチップに配置することができ、各チップは1以上の異なる生物学的反応を行うように構成することができる。ピンが、アレイの特徴、および/またはいずれの種類の生物学的反応が特定のチップで行われるべきかに関して、情報を系に運ぶような方法で暗号化されたピンによってアレイ出力を読む前記系の部分に、エレクトロニクスチップを結合させることができる。
1つの実施形態において、本発明は、チップおよび/またはチップで行うべき反応のタイプの特徴を同定する回路に情報を送達するための1以上のピンを含む、生物学的反応をそこで行うために構成されたエレクトロニクスチップを含む。そのようなtは限定されるものではないが、短ヌクレオチド多形検出、短タンデムリピート検出、または配列決定を含むことができる。
もう1つの実施形態において、本発明は:チップを受領するのに適合させたチップ受領モジュール;およびエレクトロニクスチップからの情報を検出するためのレシーバーを含む、1を超える生物学的反応をチップ上で実行するのに適合させた系を含み、ここに、情報はチップで行うべき生物学的反応を決定する。典型的には、該系は、さらに、選択された生物学的反応を行うための1以上の試薬を含む。
もう1つの実施形態において、本発明は:反応チャンバーの空間的位置、空間的位置に加えられたモノマーのタイプ、複数のモノマーを含む試薬と延長ポリマーとの完全な反応に要する時間についての情報をリレーするように構成された少なくとも1つの集積回路を含む、ポリマー鋳型を配列決定する装置を含む。
0.35マイクロメートルCMOSプロセッシング技術(またはより小さな特徴サイズが可能なCMOSプロセッシング技術)に基づく例示的な実施において、ISFETアレイ100の各画素は、ISFETおよび伴う可能化/選択成分を含むことができ、ほぼ10マイクロメートル×10マイクロメートル(すなわち、100マイクロメートル2)以下のアレイの表面に面積を占有することができ;別の言い方をすれば、10マイクロメートル以下のオーダーのピッチ(画素間隔の画素−対−中心の中心)を有するアレイを実現することができる。0.35マイクロメートルCMOSプロセッシング技術を用いる10マイクロメートル以下のオーダーのアレイピッチは、ISFETアレイを製造する従前の試みに対するサイズ低下の点での有意な改良を構成し、その結果、少なくとも12マイクロメートル以上のオーダーの画素サイズがもたらされた。
より具体的には、本明細書中で開示された発明的概念に基づいて以下にさらに議論するいくつかの実施形態において、ほぼ9マイクロメートルのアレイピッチは、関連行および列選択およびバイアス/読み出しエレクトロニクスと共に、256,000を超える画素を含めたISFETアレイ(例えば、512×512アレイ)が、7ミリメートル×7ミリメートル半導体ダイ上に製造されることを可能とし、および400万を超える画素含めた同様なセンサーアレイ(例えば、4メガを超える画素を生じる2048×2048アレイ)が、21ミリメートル×21ミリメートルダイ上で製造されるのを可能とする。他の例において、ほぼ5マイクロメートルのアレイピッチは、ほぼ1.55メガ−画素を含めたISFETアレイ(例えば、1348×1152アレイ)および関連エレクトロニクスが、9ミリメートル×9ミリメートルダイ上で製造され、および14メガを超える画素を含めたISFETセンサーアレイおよび関連エレクトロニクスが22ミリメートル×20ミリメートルダイ上で製造されるのを可能とする。なお他の実施において、0.35マイクロメートル未満の特徴サイズが可能である(例えば、0.18マイクロメートルCMOSプロセッシング技術)CMOS製造プロセスを用い、5マイクロメートルよりもかなり小さなピッチを持つISFETセンサーアレイを製造することができ(例えば、2.6マイクロメートルのアレイピッチ、または8または9マイクロメートル2未満の画素面積)、有意に密なISFETアレイを提供する。もちろん、(例えば、ほぼ20、50、100マイクロメートル以上のオーダーの)10マイクロメートルを超える画素サイズを、やはり本開示に従って、chemFETアレイの種々の実施形態で実施することができるのは認められるべきである。
当業者によって理解されるように、配列決定反応をミニチュア化する能力は、(ヒトゲノムのような)大きなゲノムの配列決定に関与する時間、コストおよび労力を低下させる。
図8に示される系の他の態様において、1以上のアレイコントローラ250を使用して、ISFETアレイ100を操作することができる(例えば、分析物測定を表す出力シグナルを得るためのアレイの各画素の選択/可能化)。種々の実施において、1以上のアレイコントローラを構成する1以上の構成要素を、ICチップの異なる部分におけるのを除いてアレイと同一の集積回路(IC)チップ、またはオフ−チップ上で、アレイそれ自体の画素エレメントと共に実施することができる。アレイ制御に関しては、ISFET出力シグナルのアナログ−デジタル変換はセンサーアレイ領域の外側に位置することを除いて、ISFETアレイと同一の集積回路チップ上で実施される回路によって行うことができる(センサーアレイ領域の外側にアナログ−デジタル変換回路を位置させるのは、より小さなピッチおよび、よって、より大きな数のセンサー、ならびに低下したノイズを可能とする)。以下にさらに議論される種々の例示的な実施において、アナログ−デジタル変換は、必要とされるシグナルの動的レンジに依存して、4−ビット、8−ビット、12−ビット、16−ビットまたは他のビット分解能であり得る。
本明細書中で用いるように、アレイはセンサーまたはウェルのようなエレメントの平面上配置である。該アレイは一次元または二次元であってよい。一次元アレイは、第1の次元においてエレメントの1つの列(または行)、および第2の次元において複数の列(または行)を有するアレイである。一次元アレイの例は1×5アレイである。二次元アレイは、第1および第2の次元双方において複数の列(または行)を有するアレイである。第1および第2の次元における列(または行)の数は同一であっても同一でなくてもよい。二次元アレイの例は5×10アレイである。
1以上の分析物を測定するための例示的系1000におけるchemFET(例えば、ISFET)アレイ100の役割の一般的概観を提供してきたが、以下に、種々の適用で使用することができる本開示の種々の発明的実施形態に従った例示的chemFETアレイのより詳細な記載を掲げる。再度、説明の目的で、本開示に従ったchemFETアレイを、ISFETアレイの特定の例を用いて以下に議論するが、chemFETの他のタイプを代替実施形態で使用してもよい。また、再度、説明の目的で、核酸配列決定適用の関連においてchemFETアレイを議論するが、本発明はそれに限定されるものではなく、むしろ、本明細書中に記載されたchemFETアレイについての種々の適用が考えられる。
先に述べたように、本明細書中で開示された種々の発明的実施形態は、図1〜7に関連して先に議論されたMilgrew et al.のISFETアレイ設計、ならびに他の従前のISFETアレイ設計を具体的に改良して、画素のサイズおよびアレイのピッチを有意に低下させ、それにより、所与の半導体ダイのサイズについてのISFETアレイの画素の数を増加させる(すなわち、画素密度を増加させる)。いくつかの実施において、画素密度の増加は、同時に、1以上の分析物に関する各測定に対応する出力シグナルのシグナル−対−ノイズ比率(SNR)、およびそのような出力シグナルをアレイから読むことができるスピードを増加させつつ達成される。特に、出願人らは、ISFET直線性に対する要件を緩和し、より制限されたシグナル出力/測定レンジ(例えば、1〜14よりむしろ、ほぼ7〜9以下のpH範囲に対応するシグナル出力、ならびに試料中のpH変化に有意に必ずしも関連しない出力シグナル)に焦点を当てることによって、個々の画素の複雑性およびサイズを有意に低下させることができ、それにより、非常に大規模な密なISFETアレイの実現を促進させることができることを認識し、認めてきた。
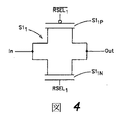
この目的で、図9は本開示の1つの発明的実施形態に従ったISFETアレイ100の1つの列102jを示し、ここに、ISFET画素設計は認識可能に単純化されて、小さな画素サイズを容易とする。列102jはnの画素を含み、その最初および最後を画素1051および105nとして図9に示す。図13に関連してさらに以下で議論するように、図9に示された列設計に基づく完全な二次元ISFETアレイ100は、一般に並んで配置される画素の連続的列を伴うmのそのような列102j(j=1、2、3、・・・m)を含む。もちろん、ISFETは、ハニカムパターンにおけるように、行−列グリッド以外にアレイ化してもよい。
図9に示された実施形態の1つの態様において、列102
jの各画素105
1〜105
nは、3つの構成要素のみ、すなわち、(Q1とも標識される)ISFET150、および2つのMOSFETスイッチQ2およびQ3を含む。MOSFETスイッチQ2およびQ3は、共に、nの行選択シグナル(
から
ロジック低活性)の内の1つに対して反応性であって、列102
jの所与の画素を可能とし、またはそれを選択する。列の全ての画素に適用される例として画素105
1を用い、トランジスタスイッチQ3は、ライン118
1を介する対応する行選択シグナルの受領に際して、ライン112
1を介して制御可能な電流ソース106
jをISFET150のソースにカップリングさせる。トランジスタスイッチQ2は、対応する行選択シグナルの受領に際して、ライン114
1を介して、ISFET150のソースを列バイアス/読出回路110
jにカップリングさせる。ISFET150のドレインは、ライン116
1を介して、バイアス/読み出し回路110
jに直接的にカップリングされる。かくして、画素当たり4つのシグナルラインのみ、すなわち、ライン112
1、114
1、116
1および118
1が、画素105
1の3つの構成要素を操作するのに必要とされる。mの列のアレイにおいて、所与の行選択シグナルが(例えば、各列における同一位置において)各列の1つの画素に同時に適用される。
図9において説明されるように、1つの実施形態に従った列102jについての設計は、図3に示されたMilgrew et al.の列設計に関連して先に議論したものと同様な一般的原理に基づく。特に、各画素のISFETは、可能とされると、一定のドレイン電流IDjおよび一定のドレイン−対−ソース電圧VDSjとで構成されて、前記方程式(3)に従って、可能とされた画素からの出力シグナルVSjを得る。この目的で、列102jは、列の全ての画素によって共有されて、可能とされた画素のISFETに一定のドレイン電流IDjを供する、アナログ回路陽性供給電圧VDDAにカップリングされ、かつバイアス電圧VB1に応答性である、制御可能な電流ソース106jを含む。1つの態様において、電流ソース106jは、2つの長−チャネルの長さおよび高い出力インピーダンスMOSFETを含めた電流ミラーとして実施される。また、該列は、やはり該列の全ての画素によって供給されて、可能とされた画素のISFETへ一定のドレイン−対−ソース電圧を供給するバイアス/読出回路110jも含む。バイアス/読出回路110jはケルビンブリッジ構成に基づき、バッファ増幅器として構成され、かつアナログ回路陽性供給電圧VDDAおよびアナログ供給電圧アースVSSAにカップリングされた、2つの操作増幅器107A(A1)および107B(A2)を含む。バイアス/読出回路は、アナログアースVSSAにカップリングされ、かつバイアス電圧VB2に対して応答性である、(電流ソース106jと同様な)制御可能な電流シンク108j、およびダイオード−連結MOSFET Q6も含む。バイアス電圧VB1およびVB2はタンデムに設定/制御されて、相補的なソースおよびシンク電流を供する。電流シンク108jによって引かれた電流の結果としてのダイオード−結合MOSFET Q6を横切って発生した電圧は操作増幅器によって強制されて、一定のドレイン−ソース電圧VDSjとして、可能とされた画素のISFETのドレインおよびソースを横切って出現する。
図3に説明されたMilgrew et al.の設計において示されたレジスタRSDjよりはむしろ、図9のバイアス/読出回路110jにおいてダイオード−連結MOSFET Q6を使用することによって、かなりの利点がCMOS製造プロセスにおいて提供され;具体的には、マッチングレジスタは、一般に±20%のオーダーの誤差許容でもって製造することができ、他方、CMOS製造プロセスにおけるMOSFETマッチングは±1%以上のオーダーである。一定のISFETドレイン−対−ソース電圧VDSjを供することを担う構成要素を列から列へマッチさせることができる程度は、列から列への測定精度(例えば、食い違い)に有意に影響する。かくして、レジスタよりはむしろMOSFET Q6を使用することは、列から列への測定食い違いを認識可能に緩和する。さらに、レジスタおよびISFETの熱的ドリフト特徴は認識可能に異なり得るが、MOSFETおよびISFETの熱的ドリフト特徴は、もし実質的に同一でなければ、実質的に同様であり;よって、MOSFE Q6におけるいずれの熱的ドリフトも、ISFET Q1からのいずれの熱的ドリフトも実質的にキャンセルし、その結果、アレイ温度の変化に伴ってより大きな測定安定性がもたらされる。
図9において、列バイアス/読出回路110jは、列からの出力シグナルVCOLjを供するための試料/ホールドおよびバッファ回路も含む。特に、画素1051〜105nのうちの1つを各画素においてトランジスタQ2およびQ3を介して可能とし、または選択した後に、増幅器107A(A1)の出力、すなわち、緩衝化VSjは、列試料およびホールドシグナルCOL SHに対して応答性であるスイッチ(例えば、伝達ゲート)の操作を介して、列試料およびホールドキャパシタCshに貯蔵される。試料およびホールドキャパシタのための適当なキャパシタンスの例は、限定されるものではないが、ほぼ500fF〜2pFの範囲を含む。サンプリングされた電圧は列出力バッファ増幅器111j(BUF)を介して緩衝化され、列出力シグナルVCOLjとして供される。図9にやはり示されるように、参照電圧VREFは、制御シグナルCALに対して応答性のスイッチを介して、バッファ増幅器111jに適応して、バッファ増幅器111jによる列間の非均一性の特徴付けを容易とし、かくして、読出後データ修正を可能とする。
図9Aは、バイアス/読出回路110jの増幅器107Aの1つについての例示的な回路ダイアグラムを示し(増幅器107Bは同一に実施され)、および図9Bは、増幅器107Aおよび107Bについての増幅器バイアスvs.バンド幅のグラフである。図9Aに示されるように、増幅器107Aは9つのMOSFET(M1〜M9)に基づいて多数の電流ミラーの配置を使用し、単位利得バッファとして構成され、そこでは、増幅器の入力および出力は、各々、IN+およびVOUTとして一般性について標識される。(対応するバイアス電流を表す)バイアス電圧VB4は増幅器のトランスインピーダンスを制御し、バンド幅の対照(すなわち、増大した電流を伴う増大したバンド幅)として働く。図9を再度参照し、試料およびホールドキャパシタCshのため、増幅器107Aの出力は、試料およびホールドスイッチが閉じられると、フィルタを実質的に駆動する。従って、認識可能に高いデータ速度を達成するには、バイアス電圧VB4を調整して、より高いバイアス電流および増大した増幅器バンド幅を供することができる。図9Bから、いくつかの例示的実施においては、少なくとも40MHzおよび有意にそれよりも大きな増幅器バンド幅が実現することができるのが観察できる。いくつかの実施において、100MHzと高い増幅器バンド幅は適切であって、高いデータ獲得率および(例えば、10〜20マイクロ秒のオーダーの)比較的より低い画素試料または「滞留」時間を容易とすることができる。
図9に示された実施形態のもう1つの態様において、図3に示されたMilgrew et al.の画素設計とは異なり、画素1051〜105nは、いずれかの伝達ゲート、またはn−チャネルおよびp−チャネル双方のFET構成要素を必要とする他のデバイスを含まず;特に、この実施形態の画素1051〜105nは同一タイプのFETデバイスのみを含む(すなわち、n−チャネルのみまたはp−チャネルのみ)。説明の目的で、図9に示された画素1051および105nは、p−チャネル構成要素のみ、すなわち、2つのp−チャネルMOSFET Q2およびQ3およびp−チャネルISFET 150を含むものとして示される。ISFETのソースをバイアス/読出回路110jにカップリングさせるために伝達ゲートを使用しないことによって、ISFET出力シグナル(すなわち、ISFETソース電圧VS)についてのいくらかの動的レンジを犠牲にすることができる。しかしながら、出願人らは、潜在的にいくらかの出力シグナル動的レンジに先行し(それにより、pHまたは他のイオン種の濃度変化のような所与の静的および/または動的化学的特性についての測定範囲を潜在的に制限する)ことによって、各画素における異なるタイプのFETデバイス(n−チャネルおよびp−チャネル双方)の要件を排除することができ、画素構成要素のカウントを低下させることができるのを認識し、認めてきた。図10〜12に関連してさらに以下で議論するように、これは、画素サイズの低下を有意に促進する。かくして、1つの態様において、低下した動的レンジおよびより小さな画素サイズの間で有益なトレードオフがある。
図9に示された実施形態のなおもう1つの態様において、Milgrew et al.の画素設計とは異なり、各画素1051〜105nのISFET 150はそのソースにつながれたその本体結合を有しない(すなわち、本体結合およびISFETのソースが操作の間に強制的に同一の電気ポテンシャルとなるような、それらをカップリングさせる導電体は無い)。むしろ、アレイの全てのISFETの本体結合は相互に結ばれ、本体バイアス電圧VBODYにつながれる。図9において明示的には示されてないが、MOSFET Q2およびQ3についての本体結合は、同様に、それらの各ソースにつながれていないが、むしろ本体バイアス電圧VBODYにつながれている。全てのp−チャネル構成要素を有する画素に基づく1つの例示的実施において、本体バイアス電圧VBODYは、図17との関係で以下にさらに議論するように、アレイ(例えば、VDDA)に利用可能な最高の電圧ポテンシャルにカップリングされている。
各ISFETのそのソースへの本体結合を試みないことによって、いくらかの非−ゼロのソース−対−本体電圧VSBの可能性は、図1に関連して先に議論したように、「本体効果」を生起させることができ、これは非線形関係に従ってISFETの閾値電圧VTHに影響する(かくして、方程式(3)、(4)および(5)によると、分析物活性の検出および/または測定に影響しかねず、分析物/不動態化層界面において表面ポテンシャルの変化を生起させる)。しかしながら、出願人らは、低下したISFET出力シグナル動的レンジに焦点を当てることによって、非−ゼロのソース−対−本体電圧からISFETにおいて生じるであろういずれの本体効果も相対的に最小であろうことを認識し、認めてきた。かくして、低下した動的レンジにわたって得られるであろういずれの測定非直線性も、(例えば、図17に関連して以下でさらに議論するように、アレイキャリブレーションおよびデータプロセッシング技術を介して)有意でないとして無視するか、あるいは考慮し、補償することができる。また、出願人は、その本体結合に対する各ISFETソースを試みないことによって、画素を構成するFETの全ては共通の本体結合を共有することができ、それにより、図10〜12に関連して以下でさらに議論するように、画素サイズの低下をさらに容易とすることができる。従って、もう1つの態様において、低下した直線性およびより小さな画素サイズの間に有益なトレードオフがある。
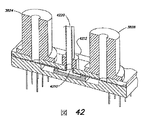
図10は、本開示の1つの発明的実施形態に従った、図9に示された画素1051についてのチップレイアウト設計の頂面図を示す。図11Aは、画素製造の層×層図を示す、線II――IIおよびIII――IIIの間の図10の右半分におけるさらなるエレメントを含めた、図10に示された画素の線I――Iに沿った複合断面図を示し、および図12A〜12Lは図11Aに示された製造層の各々の頂面図を供する(図12A〜12Lの各像はもう1つの頂部に重ねられて、図10に示された画素チップレイアウト設計を生じる)。1つの例示的な実施において、図10〜12に示された画素設計は、標準4−金属、2−ポリ、0.35マイクロメートルCMOSプロセスを用いて実現して、ほぼ9マイクロメートルの図10に示された寸法「e」、およびほぼ7マイクロメートルのISFET感受性エリアに対応する寸法「f」を有する幾何学的に四角形の画素を供することができる。
図10の頂面図において、(図10においてQ1と標識された)ISFET150は、一般に、画素説明の右側中心部分を占有し、およびISFETのゲート、ソースおよびドレインの各位置はQ1G、Q1SおよびQ1Dとして示される。MOSFET Q2およびQ3は、一般に、画素説明の左側中心部分を占有し;MOSFET Q2のゲートおよびソースはQ2GおよびQ2Sとして示され、およびMOSFET Q3のゲートおよびソースはQ3GおよびQ3Sとして示される。図10に示されるレイアウトの1つの態様において、MOSFET Q2およびQ3は、Q2/3Dとして示されたドレインを共有する。もう1つの態様において、一般に、ISFETは、そのチャネルが画素の第1の軸に沿って(例えば、線I――Iと平行に)存在するように形成され、他方、MOSFET Q2およびQ3は、それらのチャネルが第1の軸に対して垂直な第2の軸に沿って存在するのは、図10の頂面図から観察できる。また、図10は、画素を操作するのに必要な4つのライン、すなわち、Q3のソースにカップリングされたライン1121、Q2のソースにカップリングされたライン1141、ISFETのドレインにカップリングされたライン1161、およびQ2およびQ3のゲートにカップリングされた行選択ライン1181を示す。図9を参照し、所与の列における全ての画素は(例えば、図10中の画素を垂直方向に横切って走る)ライン112、114および116を共有し、所与の行における全ての画素は(例えば、図10中の画素を水平方向に横切って走る)ライン118を共有することは認めることができる;かくして、図9の画素設計および図10に示されたレイアウトに基づき、4つの金属線のみが各画素を移動するのに必要である。
ここで、図11Aの断面図を参照し、n−ウェル154中の(図10中の線I――Iに沿って存在する)高度にドープされたp−タイプの領域156および158は、ISFET多結晶シリコンゲート164およびゲート酸化物165下方にISFET p−チャネルが形成されるn−ウェルの領域160がその間に存在する、ISFETのソース(S)およびドレイン(D)を構成する。図10および11に示された発明的実施形態の1つの態様に従い、画素1051のFET構成要素の全ては、p−タイプの半導体基板152に形成された単一のn−タイプウェル154においてp−チャネルFETとして製造される。Milgrew et al.の設計とは異なり、1)画素における伝達ゲートについて要件はなく;および2)ISFETソースはnーウェルの本体結合に結び付けられていないゆえに、これは可能である。より具体的には、高度にドープされたn−タイプ領域162はn−ウェル154に対する本体結合(B)を供し、図10に示されるように、本体結合Bは、画素1051の周辺の周りの金属導電体322にカップリングされている。しかしながら、本体結合はISFETのソース領域156に直接的に電気的にカップリングされておらず(すなわち、本体連結およびソースを、それらが強制的に操作の間に同一電気ポテンシャルにあるようにそれらをカップリングする導電体はない)、また、画素中のいずれかの構成要素のゲート、ソースまたはドレインに直接的に電気的にカップリングした本体結合はない。かくして、画素の他のp−チャネルFET構成要素、すなわち、Q2およびQ3は同一のn−ウェル154において製造することができる。
図11Aの複合断面図において、MOSFET Q2およびQ3の共有されたドレイン(D)に対応する、高度にドープされたp−タイプの領域159も目に見える(図10において線I――Iに沿って存在する)。説明の目的で、MOSFET Q3の多結晶シリコンゲート166もまた図11A中に見えるが、このゲートは、図10中の線I――Iに沿って存在せず、むしろ、線I――Iに沿った断面の「面の背後に」存在する。しかしながら、簡単のために、図10に示されたMOSFET Q2およびQ3の各ソース、ならびにQ2のゲートは図11Aでは見えない。というのは、それらは共有されたドレインと同一の軸に沿って(すなわち、図の面に対して垂直に)存在するからである(もし図11Aに示されるならば、これらのエレメントは図11Aの複合断面図を不当に複雑とするであろう)。
図11Aに示された基板、ゲート酸化物、および多結晶シリコン層の上方に、多数のさらなる層が設けられて、それを通って導電性通路が形成される交互の金属層および酸化物層を含めた、種々の画素構成要素に対する電気的結合を確立する。4−金属CMOSプロセスの例に従い、これらの層は図11Aにおいて「接触」、「金属1」、「通路1」、「金属2」、「通路2」、「金属3」、「通路3」、および「金属4」として標識される。(より多いまたはより少ない金属層を使用してもよいことに留意されたい)。特に、ISFET電気的連結の理解を容易とするために、図11Aの複合断面図は、線II――IIおよびIII――IIIの間の、図10の頂面図の右側に、画素製造のさらなるエレメントを示す。ISFET電気的結合に関しては、最も頂部の金属層304は、その上方に、分析物―感受性不動態化層172が配置された、ISFET感受性エリア178に対応する。ISFET多結晶シリコンゲート164、および介在導電体306、308、312、316、320、326および338と共に、最も頂部の金属層304は、図1に示された慣用的ISFET設計と関連して先に議論されたのと同様な方法で、ISFET「フローティングゲート」構造170を形成する。ISFETドレインに対する電気的結合は、ライン1161にカップリングされた導電体340、328、318、314および310によって供される。ISFETソースは、導電体334および336および(図10中の線I−Iに沿って存在する)導電体324を介してMOSFET Q2およびQ3の共有されたドレインにカップリングされている。n−ウェル154に対する本体結合162は、導電体330および332を介して、「金属1」層上の画素の周辺の周りの金属導電体322に電気的にカップリングされている。
先に示したように、図12A〜12Lは、図11Aに示された製造層の各々の頂面図を供する(図12A〜12Lの各像はもう1つのものの頂部に重ねられて、図10に示された画素チップレイアウト設計を作り出す)。図12において、各層の文字を入れた頂面図、および図11Aの断面図の間の対応は以下の通りである;A)n−タイプのウェル154;B)インプラント;C)拡散;D)多結晶シリコンゲート164(ISFET)および166(MOSFET Q2およびQ3);E)接触;F)金属1;G)通路1;H)金属2;I)通路2;J)金属3;K)通路3;L)金属4(ISFETゲートに接触する頂部電極)。図12A〜12Lに示された種々の参照数字は、図11Aの複合断面図に存在する同一の特徴に対応する。
出願人らは、少なくともいくつかの適用においては、画素キャパシタンスは分析物測定のいくつかのタイプについてサイレントパラメータであってよいことを認識し、認めてきた。従って、画素レイアウトおよび設計に関連するもう1つの実施形態において、種々の通路および金属層は、寄生キャパシタンスについてのポテンシャルを少なくとも部分的に緩和して、画素操作の間に生起するように再度構成することができる。例えば、1つのそのような実施形態において、シグナルライン1121、1141、1161および1181、およびフローティングゲート構造170を構成する最も頂部の金属層304の間により大きな垂直方向の距離があるように画素は設計される。
直前に記載した実施形態において、再度図11Aを参照し、最も頂部の金属層304は金属4層中に形成され(また、図12L参照)、シグナルライン1121、1141、および1161は金属3層中に形成される(また、図12J参照)のは容易に観察できるであろう。また、図11Aの図においては見えないが、シグナルライン1181は金属2層中に形成されるのは図12Hから観察できる。これらのシグナルの1以上はアレイ操作の間に時々アースすることができるので、寄生キャパシタンスは、これらのシグナルラインのいずれかの1以上、および金属層304の間で生起することができる。これらのシグナルラインおよび金属層304の間の距離を増加させることによって、それらの寄生キャパシタンスは低下させることができる。
この目的で、もう1つの実施形態においては、いくつかの通路および金属層は、シグナルライン1121、1141、1161および1181が金属1および金属2層において実施され、金属3層が、フローティングゲート構造170の金属2層構成要素、および最も頂部の金属層304の間のジャンパーとしてのみ用いられ、それにより、シグナルラインおよび金属層304の間のより大きな距離を確実とするように再構成される。図10−1は、図9に示されたchemFETアレイの4つの隣接する画素のクラスターについてのそのようなチップレイアウト設計の正面図を示し、1つの特定の画素1051が同定され、標識されている。図11A−1は、画素製造の層×層図を示す、線II――IIの間の更なるエレメントを含めた図10―1に示された画素1051の線I――Iに沿った、隣接する画素の複合断面図を示し、図12―1A〜図12−1Lは、図11A−1に示された製造層の各々の頂面図を供する(図12−1A〜12−1Lの各像はもう1つのものの頂部に重ねられて、図10−1に示された画素チップレイアウト設計を作り出す)。
図10−1においては、画素頂面図レイアウトは、一般に、図10に示されたものと同様であることが観察できる。例えば、頂面図においては、ISFET 150は、一般に、各画素の右側中心部分を占有し、およびMOSFET Q2およびQ3は、一般に、画素説明の左側中心部分を占有する。図10に含まれた構成要素標識の多くは明瞭性のために図10−1から省略されているが、ISFET多結晶シリコンゲート164は、向きのために画素1051に示される。図10−1は、画素を操作するのに必要な4つのライン(1121、1141、1161および1181)も示す。図10および図10−1の間の1つの注目される差は、本体領域162に対する電気的結合を提供する(金属1層上に位置する)金属導電体322に関し;すなわち、図10においては、導電体322は画素の周辺を囲い、他方、図10−1においては、導電体322は画素の周辺を完全には囲わないが、不連続727を含む。これらの不連続727は、ライン1181が、金属1層上で製造され、画素を通って、行の隣接する画素に結合するのも可能とする。
ここで、図11A−1の断面図を参照し、3つの隣接する画素が断面に示され、中央画素は議論の目的で図10−1中の画素1051に対応する。図11Aの実施形態におけるように、画素1051のFET構成要素の全ては、単一のn−タイプのウェル154においてp−チャネルFETとして製造される。加えて、図11Aにおけるように、図11A−1の複合断面図においては、MOSFET Q2およびQ3の共有されたドレイン(D)に対応して、高度にドープされたp−タイプの領域159も目に見える(図10−1中の線I――Iに沿って存在する)。説明の目的で、MOSFET Q3の多結晶シリコンゲート166もまた図11A−1において見えるが、このゲートは図10−1中の線I−Iに沿って存在せず、むしろ線I――Iに沿った断面の「面の背後に」存在する。しかしながら、簡単のために、図10−1に示されたMOSFET Q2およびQ3の各ソース、ならびにQ2のゲートは図11A−1においては見えない。というのは、それらは共有されたドレインと同一の軸に沿って(すなわち、図面の面に垂直に)存在するからである。さらに、ISFETフローティングゲート電気的結合の理解を容易とするために、図11A−1の複合断面図は、図10−1の線II――IIの間の画素製造のさらなるエレメントを示す。
より具体的には、図11−Aの実施形態におけるように、最も頂部の金属層304は、その上方に、分析物−感受性不動態化層172が配置されたISFEF感受性エリア178に対応する。ISFET多結晶シリコンゲート164および介入導電体306、308、312、316、320、326および338と共に、最も頂部の金属層304は、ISFETフローティングゲート構造170を形成する。しかしながら、図11Aの実施形態とは異なり、ISFETドレインへの電気的結合は、金属3層よりはむしろ金属2層に形成されたライン1161にカップリングされた導電体340、328、および318によって供される。加えて、ライン1121および1141もまた、金属3層よりはむしろ金属2層に形成されたものとして図11A−1に示される。これらのライン、ならびにライン1181の構成は、図12−1A〜12−1Lの各像からさらに認識でき(ここに、各層の文字を付した頂面図、および図11A-1の断面図の間の対応は図12A−12Lとの関係で記載されたものと同一である);特に、金属導電体322と共にライン1181は金属1層において形成されるのは図12−1Fにおいて観察することができ、およびライン1121、1141および1161は金属2層に形成され、フローティングゲート構造170のジャンパー308のみを図12−1Jに示される金属3層に残すのが観察できる。
従って、シグナルライン1121、1141、1161および1181を金属1および金属2層に統合し、それにより、これらのシグナルライン、および金属4層におけるフローティングゲート構造170の最も頂部の層304の間の距離を増加させることによって、ISFETにおける寄生キャパシタンスを少なくとも部分的に緩和することができる。(例えば、シグナルラインおよびフローティングゲート構造の最も頂部の層の間の1以上の介入金属層を含めた)この一般的概念は、より大きな数の金属層を含む他の製造プロセスで実施することができるのは認められるべきである。例えば、画素シグナルラインおよび最も頂部の金属層の間の距離は、最も頂部の金属層に対するジャンパーのみがさらなる金属層において形成されたさらなる金属層(合計4を超える金属層)を加えることによって増加させることができる。特に、6―金属−層製造プロセスを使用することができ、そこでは、シグナルラインが金属1および金属2層を用いて製造され、フローティングゲート構造の最も頂部の金属層が金属6層で形成され、および最も頂部の金属層へのジャンパーが、(金属層の間の関連通路と共に)、各々、金属3、金属4および金属5層に形成される。6―金属―層製造プロセスに基づくもう1つの例示的な実施において、図10、11A、および12A〜12Lで示された一般的画素構成を使用することができ(金属2および金属3層上のシグナルライン)、そこでは、最も頂部の金属層は金属6層に形成され、およびジャンパーは、各々、金属4および金属5層に形成させる。
低下したキャパシタンスに関連するなおもう1つの態様において、最も頂部の金属層304(および、かくして、ISFET感受性エリア178)の寸法「f」を低下させて、隣接する画素の間の交差−キャパシタンスを低下させることができる。図11A-1で観察でき(および、ISFETアレイ上方でのウェル製造に向けられた他の実施形態に関連して以下でさらに議論されるように)、ウェル725は、ウェルの頂部における寸法「g」が画素ピッチ「e」よりも小さいが、ウェルの底部における寸法「f」よりはなお大きいように、テーパーが付された形状を有するように製造することができる。そのようなテーパリングに基づき、最も頂部の金属層304もまた、寸法「g」よりはむしろ寸法「f」にて設計して、隣接する画素の頂部金属層の間のさらなる空間を供することができる。いくつかの説明的非限定的実施において、9マイクロメートルのオーダーの寸法「e」を有する画素については、寸法「f」は(先に議論したように7マイクロメートルとは反対に)6マイクロメートルのオーダーとすることができる。5マイクロメートルのオーダーの寸法「e」を有する画素では、寸法「f」は3.5マイクロメートルのオーダーとすることができる。
かくして、各々、図10、11A、および12A〜12L、および図10−1、11A−1、および12−1A〜12−1Lで示された画素チップレイアウト設計は、種々の実施形態に従って、同一タイプのFETデバイスを画素の全ての構成要素のために使用でき、および全ての構成要素は単一のウェルにおいて実施できることを示す。これは、画素で必要な面積を劇的に低下させ、それにより、所与の面積における増大した画素密度を容易とする。
1つの例示的な実施において、ISFETのためのゲート酸化物165は、ほぼ75オングストロームのオーダーの厚みを有し、4.5fF/μm2の単位面積Cox当たりのゲート酸化物キャパシタンスを生起させるように製造することができる。加えて、多結晶シリコンゲート164は、1.2μmのチャネル幅Wおよび0.35〜0.6μmのチャネル長さL(すなわち、ほぼ2〜3.5の範囲のW/L)に対応する寸法にて製造でき、領域160のドーピングは、p−チャネルについてのキャリア移動度が190cm2/Vキs(すなわち1.9E10μm2/Vキs)となるように選択することができる。方程式(15)から、298ケルビン度の温度Tにおいては、59.2mV/pHの理論的最大pH感度はα=1で達成できるのは認識されるであろう。前記方程式(2)から、ほぼ170〜300μA/V2のオーダーのISFETトランスコンダクタンスパラメーターβがもたらされる。この例示的実施の他の態様において、アナログ供給電圧VDDAは3.3ボルトであって、VB1およびVB2は、5μAのオーダーの一定ISFETドレイン電流IDjを供るようにバイアスがかけられる(いくつかの実施において、VB1およびVB2はほぼ1μA〜20μAのドレイン電流を供するように調整することができる)。加えて、MOSFET Q6(図9中のバイアス/読出回路110j参照)は、Q6を横切った電圧が、5μAのIDjを仮定すると、800mVとなるような(すなわち、VDSj=800mV)、チャネルの長さに対する幅の比率を有するようなサイズとされる(例えば、ほぼ50のW/L)。方程式(15)から、298ケルビン度の温度Tにおいては、59.2mV/pHの理論的最大pH感度はα=1で達成できるのは認識されるであろう。前記方程式(3)から、これらの例示的パラメータに基づき、これは、ほぼ0〜2ボルトの範囲にわたってISFET閾値電圧変化についてほぼ0.5〜2.5ボルトの範囲にわたって画素出力電圧VSjを供する。
図11Aに示された分析物−感受性不動態化層172に関しては、例示的CMOS実施において、不動態化層は、水素を含めた種々のイオン種の濃度に対して有意に感受性とすることができ、窒化ケイ素(Si3N4)および/またはオキシ窒化ケイ素(Si2N2O)を含むことができる。慣用的なCMOSプロセスにおいて、不動態化層はこれらの材料の1以上の連続的動着によって形成することができ、これを使用して、一般的に、デバイスを処理し、またはコーティングして汚染に対して保護し、電気的安定性を増加させる。窒化ケイ素およびオキシ窒化ケイ素の材料の特性は、これらの材料を含む不動態化層がスクラッチ保護を供し、デバイス金属化を腐食させ、および/またはデバイス操作を不安定としかねない、水およびナトリウムの拡散に対する有利なバリアとして働くようなものである。窒化ケイ素および/またはオキシ窒化ケイ素を含めた不動態化層は、不動態化層がそれらが接触する分析物溶液からのプロトンを供与し、または受け取ることができる表面基を含有し、それにより、図1および2Aとの関係で先に議論したように、表面ポテンシャルおよびデバイス閾値電圧VTHを改変する点で、ISFETデバイスにおいてイオン−感受性も提供する。
(ほぼ650度摂氏の融点を有する)金属としてのアルミニウムを含むCMOSプロセスでは、窒化ケイ素および/またはオキシ窒化ケイ素不動態化層は、一般には、250〜350度摂氏のグロー放電が窒化ケイ素またはオキシ窒化ケイ素を形成する構成ガスをイオン化し、ウエハー表面で反応する活性種を作り出して、各材料の積層体を形成する、プラズマ−増強化学的気相蒸着法(PECVD)を介して形成される。1つの例示的プロセスにおいて、ほぼ1.0〜1.5μmのオーダーの厚みを有する不動態化層は、(0.2〜0.4μmのオーダーの)オキシ窒化ケイ素の薄層の初期蒸着、続いて、(0.5μmのオーダーの)オキシ窒化ケイ素のわずかにより厚い蒸着、および(0.5μmのオーダーの)窒化ケイ素の最終蒸着によって形成することができる。PECVDプロセスに関与する低い蒸着温度のため、アルミニウム金属化は有害に影響されない。
しかしながら、出願人らは、低温PECVDプロセスが慣用的CMOSデバイスに対して適切な不動態化を提供するが、低温プロセスの結果、一般には低密度かつ幾分多孔性の不動態化層をもたらし、これは、いくつかの場合において、ISFET閾値電圧安定性に悪影響しかねないことを認識し、認めてきた。特に、ISFETデバイス操作の間に、低密度多孔性不動態化層は、経時的に、溶液からのイオンを吸収でき、該イオンで飽和でき、これは、今度は、ISFET閾値電圧VTHにおいて望ましくない時間−変化ドリフトを引き起こしかねず、正確な測定を挑戦的なものとする。
これまでのことを考慮すると、1つの実施形態において、アルミニウムの代わりにタングステン金属を用いるCMOSプロセスを使用して、本発明の開示に従い、ISFETアレイを製造することができる。(3400度摂氏を超える)タングステンの高い融解温度は、窒化ケイ素またはオキシ窒化ケイ素不動態化層のための、より高い温度の低圧化学的気相蒸着(LPCVD)プロセス(例えば、ほぼ700〜800度摂氏)の使用を可能とする。LPCVDプロセスは、典型的には、不動態化層についての有意により密なかつ多孔性の低いフィルムをもたらし、それにより、ISFET閾値電圧のドリフトに導く、分析物溶液からのイオン吸収の潜在的な悪影響を緩和する。
アルミニウムベースのCMOSプロセスを使用して、本開示に従ってISFETアレイを製造するなおもう1つの実施形態において、図11Aに示された不動態化層172は、慣用的なCMOSプロセスで典型的に使用されたものを超えたさらなる蒸着および/または材料を含むことができる。例えば、不動態化層172は、先に議論した窒化ケイ素および/またはオキシ窒化ケイ素の初期低温プラズマ−援助蒸着(PECVD)を含むことができ;本議論の目的では、これらの慣用的蒸着は、不動態化層172の最初の部分172Aとして図11Aに示される。1つの実施形態において、最初の部分172Aに続いて、1以上のさらなる不動態化材料を配置して、少なくとも第2の部分172Bを形成して、密度を増大させ、総じての不動態化層172の多孔度(およびそれによる吸収)を低下させる。1つのさらなる部分172Bが、主として、図11Aでの説明の目的で、該開示はこの点において限定されない、というのは、総じての不動態化層172は2以上の構成部分を含むことができるからであり、そこでは、各部分は同一または異なる材料の1以上の層/蒸着を含むことができ、および各部分は同様にまたは異なって構成することができるのは認められるべきである。
不動態化層172の第2の部分172B(または他のさらなる部分)に適した材料の例は、限定されるものではないが、窒化ケイ素、オキシ窒化ケイ素、酸化アルミニウム(Al2O3)、酸化タンタル(Ta3O5)、酸化スズ(SnO2)および二酸化ケイ素(SiO2)を含む。1つの態様において、第2の部分172B(または他のさらなる部分)は、限定されるものではないが、RFスパッタリング、DCマグネトロンスパッタリング、熱または電子線蒸着、およびイオン−援助蒸着を含めた、種々の比較的低温のプロセスを介して蒸着することができる、もう1つの態様において、プレ−スパッタリングエッチングプロセスを、第2の部分172Bの蒸着に先立って使用し、第1の部分172Aに存在するいずれの天然酸化物も除去することができる(別法として、上昇した温度の水素雰囲気のような還元性雰囲気を使用して、第1の部分172Aに存在する天然酸化物を除去することができる)。なおもう1つの態様において、第2の部分172Bの厚みはほぼ0.04μm〜0.06μm(400〜600オングストローム)のオーダーとすることができ、第1の部分の厚みは、先に議論したように、1.0〜1.5μmのオーダーとすることができる。いくつかの例示的な実施において、第1の部分172Aは、1.0〜1.5μmの組合せ厚みを有するオキシ窒化ケイ素および窒化ケイ素の多数の層を含むことができ、第2の部分172Bは、ほぼ400〜600オングストロームの厚みを有する酸化アルミニウムまたは酸化タンタルいずれかの単一の層を含むことができる。再度、これまでの例示的厚みは、主として、説明目的で供されるものであり、開示はこれらの点において制限されないことが認められるべきである。
本発明に従い、水素イオン感受性不動態化層は、限定されるものではないが、PPiおよび取り込まれていないヌクレオチド三リン酸を含めた他の分析物に対しての感受性であることが判明した。例として、窒化ケイ素不動態化層は、PPiおよびヌクレオチド三リン酸の濃度の変化を検出することができる。同一のchemFETを用いてこれらの分析物の濃度変化を測定する能力は、単一アレイを用いて核酸を配列決定し、それにより、配列決定方法を単純化する能力を大いに促進する。
かくして、本明細書に記載されたchemFETアレイを用いて、種々の分析物を検出し、および/または測定することができ、そうすることによって、種々の反応および/または相互作用をモニターすることができるのは理解されるべきである。また、(pH変化の形態である)水素イオン検出に関するここでの議論は、便宜および簡潔性のためのものであり、および(他のイオンを含めた)他の分析物の静的または動的レベル/濃度を、これらの記載における水素に代えて置き換えることができるのも理解されるべきである。特に、分析物に存在する種々のイオン種のいずれか1以上の十分に速い濃度変化は、図2Aに関連して先に議論したように、chemFETの一過的または動的応答を介して検出することができる。また、分析物/不動態化層界面についての部位−解離(または部位−結合)モデルに関連して先に議論したように、分析物/不動態化層界面における平衡反応に関連する種々のパラメータ(例えば、順方向および逆方向平衡反応についての速度定数、不動態化層表面の単位面積当たりのプロトンドナー/アクセプター部位の合計数、固有の緩衝能力、ゼロ電荷の点におけるpH)は、材料依存性特性であって、かくして、不動態化層で使用される材料の選択によって影響されるのは認められるべきである。
本明細書中に記載されたISFETを含めたchemFETは、接触した場合に電場の変化をそれ自体が誘導することができるいずれの分析物も検出することができるか、あるいはそうでなければ、chemFET表面によって検知され、または検出される。分析物は、センサーによって検出されるためには荷電されている必要はない。例えば、実施形態に依存して、分析物は正に荷電され(すなわち、カチオン)、負に荷電され(すなわち、アニオン)、両性イオンであり、(すなわち、2つの等しいおよび反対の電荷を有することができるが、総じて中性である)、および極性であるが中性であってもよい。このリストは限定的な事を意図しない。というのは他の分析物クラスならびに各クラス内の種は、本明細書中に提供された開示に基づいて当業者によって容易に考えられるからである。
本発明の最も広い意味において、不動態化層はコーティングされていてもいなくてもよく、分析物は不動態化層と直接的に相互作用してもしなくてもよい。例として、不動態化層は窒化ケイ素を含むものでよく、分析物は水素イオン以外の何かであってもよい。具体的な例として、不動態化層は窒化ケイ素を含んでも良く、分析物はPPiであってよい。これらの例において、(すなわち、直接的にまたは間接的にのいずれかで不動態化層に付着されたPPi受容体の不存在下において)PPiは直接的に検出される。
もし検出されるべき分析物が水素(または別法として水酸化物)であれば、いずれかのイオン種の変化が不動態化層で検出できるように、弱い緩衝液を用いるのが好ましい。もし検出されるべき分析物が水素(または水酸化物)以外の何かであるが、反応または検出工程の間に溶液中のpH変化のいくらかの可能性があれば、pHの変化が分析物の検出に干渉しない場合、強い緩衝液を用いるのが好ましい。緩衝液は、pHの種々の程度の変化に対して抵抗するイオン性分子(またはイオン性分子を含む溶液)である。いくつかの緩衝液は、溶液中に加えられた、または溶液中で生じた酸または塩基を中和することができ、その結果、溶液中の有効なpH変化はない。いずれの緩衝液も適当であるが、それが所望の範囲においてpKaを有するこを条件とするのは理解されるべきである。いくつかの実施形態においては、適当な緩衝液は、6〜9、より好ましくは6.5〜8.5のpH範囲当たりで機能するものである。他の実施形態において、適当な緩衝液は、8.5〜9.5を含めた、7〜10のpH範囲当たりで機能するものである。
緩衝液の強度は相対的項である。というのは、それが注目する溶液に加えられた、または溶液中で生じた酸または塩基の性質、強度および濃度に依存するからである。弱い緩衝液は約少なくとも+/−0.005、約少なくとも+/−0.01、約少なくとも+/−0.015、約少なくとも+/−0.02、約少なくとも+/−0.03、約少なくとも+/−0.04、約少なくとも+/−0.05、約少なくとも+/−0.10、約少なくとも+/−0.15、約少なくとも+/−0.20、約少なくとも+/−0.25、約少なくとも+/−0.30、約少なくとも+/−0.35。約少なくとも+/−0.45、約少なくとも+/−0.50以上のpH変化の検出を可能とする緩衝液である(従って、そうでなければ制御することができない)。いくつかの実施形態において、pH変化は(例えば、ヌクレオチド取込み当たり)約0.005のオーダーであり、好ましくは、pHの増加である。強い緩衝液は、約少なくとも+/−0.005、約少なくとも+/-0.01、約少なくとも+/−0.015、約少なくとも+/−0.02、約少なくとも+/−0.03、約少なくとも+/−0.04、約少なくとも+/−0.05、約少なくとも+/−0.10、約少なくとも+/−0.15、約少なくとも+/−0.20、約少なくとも+/−0.25、約少なくとも+/−0.30、約少なくとも+/−0.35、約少なくとも+/−0.45、約少なくとも+/−0.50以上のpH変化を制御する緩衝液である。緩衝液の強度は、緩衝液種それ自体の濃度を変化させることによって変化させることができる。かくして、低濃度の緩衝液は低強度緩衝液であり得る。例は、1mM未満の(例えば、50〜100μM)緩衝液種を有するものを含む。pHの変化が読出である、本明細書中に記載された配列決定反応に適した弱い緩衝液の非限定的例は、0.1mM TrisまたはTricineである。適当な弱い緩衝液の例は実施例に供されており、また当該分野で公知でもある。より高い濃度の緩衝液はより強い緩衝液であり得る。その例は、1〜25mM緩衝液種を有するものを含む。PPiおよび/またはヌクレオチド三リン酸が直接的に読まれる、本明細書中に記載された配列決定反応に適した強い緩衝液の非限定的例は1、5または25mM(またはそれ以上の)TrisまたはTricineである。当業者であれば、本発明に含まれる反応および検出方法で用いられる最適な緩衝液を決定することができるであろう。
いくつかの実施形態において、不動態化層および/または複数層および/またはその上にコーティングされた分子は、アレイ読出の分析物特異性を指令する。
(pHの形態の)水素イオン、および本発明によって決定される他の分析物の検出は、窒化ケイ素(Si3N4)、オキシ窒化ケイ素(Si2N2O)、酸化ケイ素(SiO2)、酸化アルミニウム(Al2O3)、五酸化タンタル(Ta2O5)、酸化スズまたは酸化第二スズ(SnO2)等で作成された不動態化層を用いて行うことができる。
不動態化層は、限定されるものではないが、カルシウム、カリウム、ナトリウム、ヨウ素、マグネシウム、塩化物、リチウム、鉛、銀、カドミウム、ニトレート、フォスフェート、二水素フォスフェートなどを含めた他のイオン種を直接的に検出することもできる。
いくつかの実施形態において、不動態化層は注目する分析物に対する受容体でコーティングされる。好ましくは、受容体は注目する分析物、またはいくつかの例においては、分析物が属する剤のクラスに選択的に結合する。本明細書中で用いるように、分析物に選択的に結合する受容体は、その分析物に優先的に結合する分子である(すなわち、その分析物に対するその結合親和性は、いずれかの他の分析物に対するその結合親和性よりも大きい)。注目する分析物に対するその結合親和性は、いずれかの他の分析物に対するその結合親和性よりも2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、40倍、50倍、100倍またはそれ以上であり得る。その相対的結合親和性に加えて、受容体は、注目する分析物に有効に結合するのに十分高い絶対結合親和性も有しなければならない(すなわち、それは十分な感度を有しなければならない)。ピコモル〜マイクロモル範囲に結合親和性を有する受容体も適当である。好ましくは、そのような相互作用は可逆的である。
受容体はいずれの性質のものであってもよい(例えば、化学物質、核酸、ペプチド、脂質、その組合せ等)。そのような実施形態において、分析物もまたいずれの性質のものであってもよいが、それに選択的に、いくつかの例においては、特異的に結合する受容体が存在するものとする。しかしながら、本発明はさらに、受容体の不存在下での分析物の検出が考えられるのは理解されるべきである。この例は、PPiまたはPi受容体の不存在下における不動態化層によるPPiおよびPiの検出である。
1つの態様において、本発明では、イオノフォアである受容体が考えられる。本明細書中で用いるように、イオノフォアは、アニオンまたはカチオンを問わず、イオン種に選択的に結合する分子である。本発明の関係では、イオノフォアは受容体であって、それが結合するイオンは分析物である。本発明のイオノフォアは微生物に由来する当該分野で認められたキャリアイオノフォア(すなわち、特定のイオンに結合する小さな脂質−可溶性分子)を含む。種々のイオノフォアがCalbiochemのような源から商業的に入手可能である。
いくつかのイオンの検出は、不動態化層それ自体の使用を通じて、または不動態化層上にコーティングされた受容体の使用を通じて達成することができる。例えば、カリウムは、ポリシロキサン、バリノマイシンまたはサリノマイシンを用いて選択的に検出することができ;ナトリウムはモネンシン、ナイスタチン、またはSQI-Prを用いて選択的に検出することができ;カルシウムはイオノマイシン、カルシマイシン(A23187)、またはCA1001(ETH 1001)を用いて選択的に検出することができる。
1を超えるイオンに結合することができる受容体もまたいくつかの例で用いることができる。例えば、ボベリシンを用いてカルシウムおよび/またはバリウムイオンを検出することができ、ニゲリシンを用いてカリウム、水素および/または鉛イオンを検出することができ、グラミシジンを用いて水素、ナトリウムおよび/またはカリウムイオンを検出することができる。当業者であれば、これらの化合物を、単一のイオン特異性が要求されない、あるいは化合物が結合する他のイオンが存在したり生じたりしないような(または不可能な)適用で用いることができる。同様に、特定の属の多数の種に結合する受容体もまた、該属内のただ1つの種が存在し、あるいは当該方法が種の間の区別を必要としないものを含めた、いくつかの実施形態でやはり有用であり得る。
もう1つの例として、ニューロトキシンに対する受容体は、Simonian Electroanalysis 2004, 16:1896−1906に記載されている。1896-1906.
限定されるものではないが、核酸配列決定適用を含めた他の実施形態において、PPiに選択的に結合する受容体を用いることができる。PPi受容体の例は図11B(1)〜(3)に示された化合物(化合物1〜10)を含む。化合物1はAngew,Chem Int(Ed 2004)43:4777−4780およびUS 2005/0119497 A1に記載されており、p−ナフチル−ビス[(ビス)2−ピリジルメチル]アミノ)メチル]フェノールという。化合物2はJ Am Chem Soc 2003 125:7752−7753およびUS 2005/0119497 A1に記載されており、p−(p−ニトロフェニルアゾ)−ビス[(ビス(2−ピリジルメチルー1)アミノ)メチル]フェノール(またはその二核Zn錯体)という。化合物1および2についての合成スキームはUS 2005/0119497 A1に供されている。化合物3はLee et al.Organic Letters 2007 9(2):243−246,およびSensors and Actuators B 1995 29:324−327に記載されている。化合物4は、Angew, Chem Int(Ed 2002)41(20):3811−3814に記載されている。化合物7、8および9についての例示的合成は図11C(1)〜(3)に示されている。化合物5はWO2007/002204に記載されており、ビス−Zn2+−ジピコリルアミン(Zn2+−DPA)とそこではいわれる。化合物6は、PPiに結合した11B(3)に示されている。(McDonough et al. Chem. Commun. 2006 2971−2973)化合物7の金属酸化物表面への結合は図11Eに示されている。
受容体は、共有結合により、または非-共有結合により、不動態化層に結合させることができる。受容体の不動態化層への共有結合は直接的または(例えば、リンカーを通じて)間接的であってよい。図11D(1)および(2)は、不動態化層へ受容体を共有結合により結合させるためのシラノール化学の使用を説明する。受容体は、例えば、脂肪族第一級アミン(底部左側パネル)またはアリールイソチオシアネート(底部右側パネル)を用いて不動態化層に固定化することができる。これらおよび他の実施形態において、それ自体が窒化ケイ素、酸化アルミニウム、酸化ケイ素、五酸化タンタルなどよりなることができる不動態化層を、その反応性表面基を介してシラネーション層に結合させる。FET表面への共有結合についてのシラノール化学に関するより詳細については、少なくとも以下の刊行物を参照することができる:窒化ケイ素については、Sensors and Actuators B 1995 29:324−327, Jpn J Appl Phys 1999 38:3912−3917およびLangmuir 2005 21:395−402参照;酸化ケイ素については、Protein Sci 1995 4:2532−2544およびAm Biotechnol Lab 2002 20(7):16−18参照;および酸化アルミニウムについては、Colloids and Surfaces 1992 63:1−9, Sensors and Actuators B 2003 89:40−47,およびBioconjugate Chem 1997 8:424−433参照。次いで、受容体をシラネーション層反応性基にコンジュゲートさせる。この後者の結合は、図11D(1)および(2)に説明されるように、二官能性リンカーの使用を通じて直接的にまたは間接的に起こり得る。
二官能性リンカーは、それに2つの物質が結合し得る少なくとも2つの反応性基を有する化合物である。いくつかの例において、反応性基はリンカーの反対末端に位置させる。いくつかの実施形態において、二官能性リンカーは、図11D(1)および(2)に示されたもののような普遍的二官能性リンカーである。普遍的リンカーは、種々の物質に連結させるのに用いることができるリンカーである。図11D(1)および(2)に示された化学は説明的であって限定的ではないことが理解されるべきである。
二官能性リンカーは、コンジュゲートさせるべき分子の性質に依存して、ホモ−二官能性リンカーまたはヘテロ−二官能性リンカーであってよい。ホモ−二官能性リンカーは2つの同一性反応基を有する。ヘテロ−二官能性リンカーは2つの異なる反応性基を有する。商業的に入手可能なリンカーの種々のタイプは以下の基の1以上と反応性である:第一級アミン、第二級アミン、スルフヒドリル、カルボキシル、カルボニルおよび炭水化物。アミン−特異的リンカーの例はビス(スルフォスクシンイミジル)スベレート、ビス[2−(スクシンイミドオキシカルボニルオキシ)エチル]スルホン、ジスクシンイミジルスベレート、ジスクシンイミジルタルタレート、ジメチルアジピメートキ2HCl、ジメチルピメリミデートキ2HCl、ジメチルスベリミデートキ2HCl、およびエチレングリコビス-[スクシンイミジル-[スクシネート]]である。スルフヒドリル基と反応性であるリンカーはビスマレイミドヘキサン、1,4-ジ−[3’-(2’−ピリジルジチオ)−プロピオンアミド]ブタン、1−[p−アジドサリチルアミド]−4−[ヨードアセタミド]ブタン、およびN−[4−(p−アジドサリチルアミド)ブチル]−3’−[2’−ピリジルジチオ]プロピオンアミドを含む。炭水化物と優先的に反応性のリンカーはアジドベンゾイルヒドラジンを含む。カルボキシル基と優先的に反応性のリンカーは4−[p−アジドサリチルアミド]ブチルアミンを含む。
アミンおよびスルフヒドリルと反応するヘテロ二感応性リンカーはN−スクシンイミジル−3−[2−ピリジルジチオ]プロピオネート、スクシンイミジル[4−ヨードアセチル]アミノベンゾエート、スクシンイミジル4−[N−マレイミドメチル]シクロヘキサン−1−カルボキシレート、m−マレイミドベンゾイル−N−ヒドロキシスクシンアミドエステル、スルホスクシンイミジル6−[3−[2−ピリジルジチオ]プロピオンアミド]ヘキサノエート、およびスルホスクシンイミジル4−[N−マレイミドメチル]シクロヘキサン−1−カルボキシレートを含む。カルボキシルおよびアミン基と反応するヘテロ二感応性リンカーは1−エチル−3−[3−ジメチルアミノプロピル]−カルボジイミド塩酸塩を含む。炭水化物およびスルフヒドリルと反応するヘテロ二感応性リンカーは、4−[N−マレイミドメチル]−シクロヘキサン−1−カルボキシルヒドラジド・2HCl、4−(4−N−マレイミドフェニル)−酪酸ヒドラジド・2HCl、および3−[2−ピリジルジチオ]プロイオニルヒドラジドを含む。
別法として受容体は不動態化層上に非共有結合的にコーティングすることができる。不動態化層上への受容体の非−共有結合蒸着はポリマーマトリックスの使用を含むことができる。ポリマーは天然に生じるものであっても、または天然に生じないものであってもよく、限定されるものでないが、核酸(例えば、DNA、RNA、PNA、LNA等、あるいはそのミミック、誘導体、または組合せ)、アミノ酸(例えば、ペプチド、蛋白質(天然または非天然)等、またはそのミミック、誘導体、または組合せ)、脂質、多糖、および感応性化ブロックコポリマーを含めたいずれのタイプのものであってもよい。受容体はポリマーマトリックス上に吸着されおよび/またはポリマーマトリックス内に捕獲されていてもよい。ポリマーの性質は、用いられるべき受容体、および/または検出されるべき分析物の性質に依存するであろう。
別法として、受容体はポリマーに共有結合によりコンジュゲートされ、または架橋されていてもよい(例えば、それは感応性化ポリマー上に「グラフト化」されていてもよい)。
適当なペプチドポリマーの例はポリ−リシン(例えば、ポリ−L−リシン)である。他のポリマーの例は、ポリエチレングリコール(PEG)、ポリアミド、ポリカーボネート、ポリアルキレン、ポリアルキレングリコール、ポリアルキレンオキサイド、ポリアルキレンテレフタレート、ポリビニルアルコール、ポリビニルエーテル、ポリビニルエステル、ポリビニルハライド、ポリビニルピロリドン、ポリグリコリド、ポリシロキサン、ポリウレタン、アルキルセルロース、ヒドロキシアルキルセルロース、セルロースエーテル、セルロースエステル、ニトロセルロースを含むブロックコポリマー、アクリル酸およびメタクリル酸エステルのポリマー、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシブチルメチルセルロース、酢酸セルロース、プロピオン酸セルロース、酢酸酪酸セルロース、酢酸フタル酸セルロース、カルボキシルエチルセルロース、三酢酸セルロース、硫酸セルロースナトリウム塩ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート)、ポリ(ラウリルメタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)、ポリ(オクタデシルアクリレート)、ポリエチレン、ポリプロピレン、ポリ(エチレングリコール)、ポリ(エチレンオキサイド)、ポリ(エチレンテレフタレート)、ポリ(ビニルアルコール)、ポリ酢酸ビニル、ポリ塩化ビニル、ポリスチレン、ポリヒアルロン酸、カゼイン、ゼラチン、グルチン、ポリアンヒドリド、ポリアクリル酸、アルジネート、キトサン、ポリ(メチルメタクリレート)、ポリ(エチルメタクリレート)、ポリ(ブチルメタクリレート)、ポリ(イソブチルメタクリレート)、ポリ(ヘキシルメタクリレート)、ポリ(イソデシルメタクリレート)、ポリ(ラウリルメタクリレート)、ポリ(フェニルメタクリレート)、ポリ(メチルアクリレート)、ポリ(イソプロピルアクリレート)、ポリ(イソブチルアクリレート)、およびポリ(オクタデシルアクリレート)、ポリ(ラクチド−グリコリド)、コポリオキサレート、ポリカプロラクトン、ポリエステルアミド、ポリオルトエステル、ポリヒドロキシ酪酸、ポリアンヒドリド、ポリ(スチレン−b−イソブチレン−b−スチレン)(SIBS)ブロックコポリマー、エチレンビニルアセテート、ポリ(メタアクリル酸)、乳酸およびグリコール酸のポリマー、ポリアンヒドリド、ポリ(オルト)エステル、ポリウレタン、ポリ(酪酸)、ポリ(吉草酸)、およびポリ(ラクチド−コカプロラクトン)、アルジネート、およびデキストランおよびセルロースを含めた他の多糖コラーゲン、アルブミン、および他の親水性蛋白質ゼインおよび他のプロルアミンおよび疎水性蛋白質のような天然ポリマー、そのコポリマーおよび混合物、ならびに化学基、例えば、アルキル、アルキレンの置換および/または付加、ヒドロキシル化、酸化、および当業者によってルーチン的に成される他の修飾を含めたその化学的誘導体を含む。
ISFET閾値電圧の安定性および/または予測性に関するもう1つの論点は、アレイ製造の間における、またはアレイ製造に続いての種々の加工活動(例えば、プラズマ金属エッチング、ウエハー洗浄、ダイシング、パッケージング、取扱等のようなラインのバックエンド処理)の結果としての、CMOS−製造デバイスの金属層に(特に)蓄積しかねないトラップされた電荷を含む。特に図11Aを参照し、トラップされた電荷はいくつかの例においては、ISFETフローティングゲート構造170を構成する種々の導電体304、306、308、312,316、320、326、338、および164の1以上に蓄積しかねない。この現象は、関連文献においては、「アンテナ効果」とも言われる。
トラップされた電荷が蓄積する1つの機会は、最も頂部の金属層304のプラズマエッチングを含む。出願人らは、フローティングゲート構造の1以上の導電体、またはFETの他の部分に電荷が蓄積する他の機会は、その間にウェハーを通ってのダイシング鋸切断の研磨剤プロセスが静電気を生じるウェハーダイシングおよび/または、いくつかの例においてはウエハーを取り扱い/輸送する自動機械が、フローティングゲート構造の導電体への静電気放電(ESD)の源となり得る。ダイ−対−パッケージワイヤー結合のような種々の処理後ウェハーは取扱/パッケージング工程を含む。もし電気的経路を供して、そのような電荷蓄積を減らすためのシリコン基板(または他の半導体基板)への結合がなければ、ゲート酸化物165に対して望ましくない変化または損傷(例えば、酸化物への電荷の噴射、または下にある基板への低レベルの酸化物分解)を引き起こす点まで電荷は形成され得る。ゲート酸化物中の、またはゲート酸化物−半導体界面におけるトラップされた電荷は、今度は閾値電圧における変動のような、ISFET操作および性能における望ましくないおよび/または予測できないムラを引き起こしかねない。
これまでのことを考慮すると、本開示の他の発明的実施形態はトラップされた電荷を低下させ、またはアンテナ効果を緩和することによって、ISFET性能を改良する方法および装置に向けられる。1つの実施形態において、センサーアレイが製造された後にトラップされた電荷は低下させることができ、他方、他の実施形態において、製造プロセスそれ自体を修飾していくつかの慣用的なプロセス工程によって誘導され得るであろう、トラップされた電荷を低化させることができる。なお、他の実施形態において、「製造の間」および「製造後」の双方の技術を組み合わせて、トラップされた電荷を低下させ、それにより、ISFET性能を改良することができる。
トラップされた電荷を低下させるための製造プロセスそれ自体に対する改変に関しては、1つの実施形態において、図11Aに示されたゲート酸化物165の厚みは、基板に対する蓄積された電荷の滲出を容易とするように特に選択することができ;特により薄いゲート酸化物は、十分な量の形成された電荷が、ゲート酸化物を通って、トラップされるようになることなく、下方の基板まで通過することを可能とすることができる。この概念に基づくもう1つの実施形態において、画素は、さらなる「犠牲」デバイス、すなわち、ISFETのゲート酸化物165よりも薄いゲート酸化物を有するもう1つのトランジスタを含むように設計することができる。次いで、ISFETのフローティングゲート構造を、それが「電荷滲出トランジスタ」として働くように犠牲デバイスのゲートにカップリングさせることができる。勿論、そのような犠牲デバイスを含めたいくらかのトレードオフは、画素のサイズおよび複雑性の増加を含むのは認められるべきである。
もう1つの実施形態において、図11Aに示されたISFETフローティングゲート構造170の最も頂部の金属層304は、プラズマエッチングに先立って誘電体でキャップして、トラップされた電荷を軽減することができる。先に議論したように、フローティングゲート構造に蓄積した電荷は、いくつかの場合において、金属エッチングで用いられるプラズマからカップリングすることができる。典型的には、フォトレジストをエッチングすべき金属上に適用し、次いで、下に存在する金属のための所望の幾何学に基づいてパターニングする。1つの例示的な実施において、キャッピング誘電層(例えば、酸化物)をフォトレジストの適用に先立ってエッチングすべき金属上に蒸着させ、プラズマエッチングプロセスからの電荷に対する金属表面にさらなるバリアを供することができる。1つの態様において、キャッピング誘導層は背後に残り、不動態化層172の一部を形成することができる。
なお、もう1つの実施形態において、最も頂部の金属層304のための金属エッチングプロセスを、プラズマエッチングよりはむしろ湿式化学またはイオン−ビームミリングを含むように修飾することができる。例えば、下に存在する誘電体に対して選択性の水性化学を用いて、金属層304をエッチングすることができよう(例えば、ここに引用して援用する、アルミニウムに関するTranseneについてのウェブサイト参照)。もう1つの代替アプローチは金属層304のためのプラズマエッチングよりはむしろイオン−ミリングを使用する。イオン−ミリングは、通常、慣用的プラズマまたは湿式化学を用いて容易に除去することができる材料をエッチングするのに用いられる。イオン−ミリングプロセスは、電荷形成が金属層において起こらないように、プラズマがそうであるように、振動電場を使用しない。なお、もう1つの金属エッチング代替法は、エッチング速度を低下させるためのプラズマ条件を最適化することを含む(すなわち、より低いパワー密度)。
なお、もう1つの実施形態において、アーキテクチャー変化を金属層に対して行って、フローティングゲートの定義の間に完全な電気的単離を容易とすることができる。1つの態様において、大面積ISFETフローティングゲートがその最終規定の間に何かに結合しないような金属スタック−アップの設計は、トランジスタのフローティングゲートに対する電気的結合を実現するための「ジャンパー」として働く引き続いての金属層を必要とするであろう。この「ジャンパー」結合スキームは大きなフローティングゲートからトランジスタへの電荷のフローを妨げる。この方法は以下のように実施することができる(M=金属層):i)Polyゲート電極に接触するM1;ii)M1に接触するM2;iii)M3はフローティングゲートを規定し、別々に、単離されたアイランドでM2に結合し;iv)単離されたアイランド上でエッチングされるべき非常に小さなエリアおよびフローティングゲートM3への結合を有するM4ジャンパーは、トランジスタ活性エリアの直ぐ上のPolyゲートに結合されたM1/M2/M3スタックにM3フローティングゲートを結合させ;およびv)M3〜M4層間誘電体はフローティングゲート上のみで除去して、裸のM3フローティングゲートを露出させる。直前に概説した方法において、工程v)は成される必要がない。と言うのは、先に議論したいくつかの実施形態に従ったISFETアーキテクチャーは、M4不動態化をM4フローティングゲート上の所定の場所に残すからである。1つの態様において、除去は、それにもかかわらず、他の方法でISFET性能(すなわち、感度)を改良することができる。いずれの場合においても最終の感受性不動化層は、薄いスパッタリング蒸着されたイオン−感受性金属酸化物層であってよい。先に議論した上層のジャンパードアーキテクチャーは、標準CMOS製造フローで実施して、最初の3つの金属層のいずれかがフローティングゲートとして用いられるのを可能とするのは認められるべきである(すなわち、M1、M2またはM3)。
トラップされた電荷を低下させるための製造後プロセスに関しては1つの実施形態において、「ガスアニール形成」を製造後プロセスとして使用して、トラップされた電荷の潜在的に有害な効果を緩和することができる。ガスアニールの形成においては、CMOS製造ISFETデバイスを水素および窒素ガス混合物中で加熱する。混合物中の水素ガスはゲート酸化物165へ拡散し、トラップされた電荷のある形態を中和する。1つの態様において、ガスアニール形成はトラップされた電荷に由来し得る全てのゲート酸化物の損傷を必ずしも除去する必要はなく、むしろいくつかの場合においては、いくらかのトラップされた電荷の部分的中和は、ISFET性能を有意に改良するのに十分である。本開示に従った例示的アニーリングプロセスにおいて、ISFETを10〜15%水素を含む水素/窒素混合物中でほぼ400〜425度摂氏でほぼ30〜60分間加熱することができる。1つの特別な実施において、10%水素を含む水素/窒素混合物における425度摂氏での30分間のアニーリングは、ISFET性能を改良するにおいて特に有効であると観察される。アルミニウムCMOSプロセスでは、アニーリングの温度は450度摂氏、またはそれ未満に保ってアルミニウム冶金の損傷を回避すべきである。本開示に従ったアニーリングプロセスのもう1つの態様において、ガスアニーリング形成は、製造されたISFETアレイのウエハーがダイシングされた後に行って、ダイシングプロセスそれ自体、および/または他のプレ−ダイシング処理工程(例えば、金属のプラズマエッチング)によって誘導されたトラップされた電荷による損傷が効果的に軽減できるのを確実とする。なお、もう1つの態様において、ガスアニーリング形成は、ダイ−対−パッケージワイヤーボンディング後に行って、同様に、トラップされた電荷による損傷を軽減することができる。アセンブリプロセスにおいてこの時点で、ダイシングされたアレイチップは、典型的には、加熱され、化学的抵抗性のセラミックパッケージ、および低許容ワイヤーボンディング手法ならびに耐熱性ダイ−対−パッケージ接着剤を使用してアニーリング手法に耐えることができる。かくして、1つの例示的な実施において、本発明は:共通の半導体基板において複数のFETを製造し、その複数の内の各々はフローティングゲートにカップリングされており;ダイシング工程に先立ってガスアニーリング形成を半導体に適用し;半導体をダイシングし;次いで、ダイシング工程後にガスアニーリング形成を半導体に適用することを含む、各々がゼロまたは実質的にゼロのトラップされた電荷を有するフローティングゲートを有するか、またはカップリングされた、FETのアレイを製造する方法を含む。好ましくは、半導体基板は少なくとも100,000のFETを含む。好ましくは、複数のFETはchemFETである。該方法は、さらに、不動態化層を半導体上に蒸着させ、高分子ガラスイオン−反応的にエッチング可能であるか、または感光性材料層を不動態化層上に蒸着し、次いで、高分子ガラスのイオン−反応的にエッチング可能であるかまたは感光性材料をエッチングして、ガラス層において反応チャンバーのアレイを形成することを含むことができる。
本開示の実施形態に従った、トラップされた電荷の潜在的に有害な効果を緩和するなお他のプロセスにおいて、種々のウェハー製造後の取扱い/パッキング工程のいずれかの間に、種々の「静電気放電(ESD)−感受性プロトコル」を採用することができる。例えば、1つの例示的なプロセスにおいて、静電防止ダイシングテープを使用して、(例えば、ダイシングプロセスの間)ウェハー基板を所定の場所に保つことができる。また、高−抵抗率(例えば、10MΩ)脱イオン水は、本開示の1つの実施形態に従って、慣用的にダイシング鋸の冷却の関係で使用されれば、この目的で抵抗率がより低く/より導電性の水を使用して、水を介しての電荷伝達を容易とすることができ;例えば、脱イオン水を二酸化炭素でより低い抵抗率まで処理し、ダイシングプロセスから生起する電荷の伝達を改良することができる。さらに、種々のウェハーダイシング/取扱/パッケージング工程の間に、導電性およびアースされたダイ−噴出ツールを用いて、再度、これらの工程のいずれかの間に発生した電荷のための効果的な導電経路を供し、それにより、アレイの各ISFETのフローティングゲート構造の1以上の導電体上に電荷が蓄積する機会を低下させることができる。
トラップされた電荷を低下させるための製造後プロセスを含むさらにもう1つの実施形態において、ISFETのゲート酸化物領域にUV放射線を照射することができる。図11Aを再度参照し、本実施形態に基づく、1つの例示的な実施形態において、ISFETフローティングゲート構造に近接したアレイの各画素の頂部金属層304におけるISFETアレイの製造の間に、任意の穴またはウインドウ302を含める。このウインドウは、生じた場合、UV放射線をISFETゲート領域に侵入させることを意図し、特に、画素1051の種々の層は、図11および12A〜Lに示すようにウインドウ302に進入するUV放射線が、多結晶シリコンゲート164およびゲート酸化物165に近接するエリアに実質的に邪魔されない方法で作用させることができるように構成される。
トラップされた電荷を低下させるUV照射プロセスを容易とするために出願人らは、窒化ケイ素およびオキシ窒化ケイ素以外の材料が、図11Aに示される不動態化層172で一般に使用される必要があるのを認識し、認めてきたが、というのは窒化ケイ素およびオキシ窒化ケイ素はUV放射線を有意に吸収するからである。これまでを考慮し、これらの材料はその例が、限定されるものではないが、フォスオシリケート(phososilicate)ガラス(PSG)およびホウ素をドープしたフォスオシリケートガラス(BPSG)を含む、UV放射線に対して、認識可能に透明な他のもので置換される必要がある。しかしながら、PSGおよびBPSGは水素およびヒドロキシイオンに対して不浸透性ではなく;従って、pH感度のために設計されたISFETの不動態化層で使用されるためには、PSGおよびBPSGは、酸化アルミニウム(Al2O3)のような、UV放射線に対してやはり有意に透明であるイオン−不浸透性材料と共に用いて、不動態化層を形成することができる。例えば、再度図11Aを参照し、PSGまたはBPSGは、不動態化層172の最初の部分172Aにおける窒化ケイ素またはオキシ窒化ケイ素に対する代替物として使用することができ、酸化アルミニウムの薄い層(例えば、400〜600オングストローム)を不動態化層172の第二の部分172Bで使用することができる(例えば、酸化アルミニウムはポスト−CMOSリフトオフリソグラフィープロセスを用いて蒸着することができる)。
UV照射を含む実施形態のもう1つの態様において、センサーアレイの各ISFETはUV照射プロセスの間に適切にバイアスされて、トラップされた電荷の低下を容易にすることができる。特に、ISFET導電性チャネルが形成されるバルクシリコン領域160に作用する、UV照射からの高エネルギーフォトンは電子−ホール対を生じさせ、これは、ISFET導電性チャネルを通じて電流が流れるにつれ、ゲート酸化物中のトラップされた電荷の中和を容易とする。この目的で、図17に関連して、以下でさらに議論するアレイコントローラはUV照射プロセスの間にアレイのISFETをバイアスするための適当なシグナルを生じる。特に、図9を再度参照し、シグナル
から
の各々は、同時にセンサーアレイの全ての行を可能とし/選択し(すなわち、スイッチを入れ)、それにより、アレイのISFETの全てを各列における各制御可能な電流ソース106
jにカップリングさせるように生成させる。同時に選択された各列の全ての画素に関し、所与の列の電流ソース106
jからの電流は、列の全ての画素によって共有される。列増幅器107Aおよび107Bは、バイアス電圧VB4を除去することによって、無能とされ、同時に、所与の列における各ISFETのドレインに結合された増幅器107Bの出力は、対照シグナル「UV」に応答性のスイッチを介してアースされる。また、アレイの全てのISFETについての共通の本体電圧V
BODYは、電気的アースにカップリングされる(すなわち、V
BODY=0ボルト)(先に議論したように、アレイの通常の操作の間に、本体バイアス電圧V
BODYはアレイに対して利用可能な最高の電圧ポテンシャル、例えば、VDDAにカップリングされる)。1つの例示的な手法において、制御可能な電流ソース106
jの全てについてのバイアス電圧VB1は、各画素のISFETがほぼ1μAの電流を伝達するように設定される。ISFETアレイがかくしてバイアスされた状態で、次いで、アレイにUV放射線の十分な線量を(例えば、アレイからほぼ1インチの距離においてほぼ20ミリワット/cm
2の放射線を生じるEPROMイレーザーから、ほぼ1時間)照射する。照射の後、アレイを放置し、イオン濃度のような化学的特性の測定で用いる前に、数時間にわたって安定化することができる。
トラップされた電荷を低下させるための前記した技術の少なくとも1つを利用し、我々は、ゼロまたは実質的にゼロのトラップされた電荷を有するFETフローティングゲートを製造することができた。かくして、いくつかの実施形態において、本発明の態様は、ベースライン閾値電圧および、好ましくは、ゼロまたは実質的にゼロのトラップされた電荷を有する約4μm2〜約50μm2の表面積を有するフローティングゲートを含む。好ましくは、FETはchemFETである。トラップされた電荷は、アレイを横切って、FETからFETへの認識可能な変動を引き起こさないレベルまで維持すべきである。というのは、それはデバイスの動的レンジ、測定の一致を制限し、そうでなければ性能に悪影響するからである。
図13は、本開示の1つの実施形態に従った、図9〜12との関係で先に議論した列および画素設計に基づく、ISFETセンサーアレイ100の例示的なCMOS ICチップ実施のブロックダイアグラムを示す。この実施形態の1つの態様において、アレイ100は、対応する列バイアス/読出回路1101〜110512(図9に示すように、各列につき1つ)と共に、512の列1021〜102512を含み、ここに、各列は、各々がほぼ9マイクロメートル×9マイクロメートルのサイズを有する512の幾何学的に四角の画素1051〜105512を含む(すなわち、アレイは512列×512行である)。もう1つの態様において、(関連する行および列選択回路および列バイアス/読出回路と共に画素を含めた)全アレイを、ほぼ7ミリメートル×7ミリメートルの寸法を有する適用特異的集積回路(ASIC)として半導体ダイ上に製造することができる。512×512画素のアレイは図13の実施形態に示されるが、アレイは、図19〜23との関係で以下にさらに議論するように、他の実施形態に従った、異なる数の行および列ならびに異なる画素サイズで実施することができるのは認められるべきである。
また、先に議論したように、本発明の種々の実施形態に従ったアレイは、慣用的なCMOS製造技術、(例えば、不動態化材料のさらなる蒸着、トラップされた電荷を緩和するためのプロセス工程等のような、本明細書中で議論されたchemFETアレイの種々の機能的態様の実現を容易とするための)修飾されたCMOS製造技術、およびCMOS製造で慣用的に使用されるものを超えた他の半導体製造技術に従って製造することができるのは認められるべきである。加えて、種々のリソグラフィー技術を、アレイ製造プロセスの一部として使用することができる。例えば、1つの例示的な実施において、リソグラフィー技術を使用することができ、そこでは、工程および反復リソグラフィー暴露のエッジを、ほぼ0.2マイクロメートルだけ、ウエハ−基板上に重ねることによって、適当に設計されたブロックが一緒に「スティッチされる」。単一の暴露において、最大ダイサイズは、典型的には、ほぼ21ミリメートル×21ミリメートルである。異なるブロック(側、頂部&底部、コア等)を選択的に暴露することによって、非常に大きなチップを、(極端には、通常「ウェハ−スケール取込」というウェハ−当たり1つのチップの最大まで)ウェハ−に規定することができる。
図13に示されるアレイ100の1つの態様において、第1および最後の2つの列1021、1022、102511および102512、ならびに列1023〜102510の各々の最初の2つの画素1051および1052および最後の2つの画素105511および105512(例えば、アレイの周辺の周りの画素の2つの行および列)は、「参照」または「ダミー」画素103として構成することができる。図11Aを参照し、アレイのダミー画素では、(ISFET多結晶シリコンゲート164に最終的にはカップリングされた)各ダミー画素のISFETの最も頂部の金属層304は、他のダミー画素の同一金属層に結び付けられており、今度は、参照電圧VREFにカップリングすることができるチップの末端として接近可能とされる。図9との関係で先に議論したように、参照電圧VREFもまた、アレイの各列のバイアス/読出回路に適用することができる。以下にさらに議論されるいくつかの例示的実施において、オフセット決定(例えば、画素間および列間変動)およびアレイキャリブレーションを容易とするために、予備的試験/評価データは、参照電圧VREFの適用、およびダミー画素の選択および読出、および/または(例えば、CALシグナルを介する)各列緩衝液へのVREFの直接的適用に基づく列の読出に基づいて、アレイから獲得することができる。
図13に示されたのと同様なアレイのなおもう1つの実施において、512の列の最初および最後の2つの列、および参照画素としての512の画素の各列の最初および最後の2つの画素を維持するよりはむしろ、アレイは、アレイの合計サイズが、現実の画素の点において、516×516画素であるように、活性画素の512×512領域の周辺を囲う参照画素のさらなる2つの行/列を含むように製造することができる。種々のサイズおよび構成のアレイが本開示によって考えられるので、これまでの概念は本明細書中で議論された他のアレイ実施形態のいずれにも適用できるのは認められるべきである。図13に示された例示的アレイ100に関して以下で直ちに議論する目的で、512×512画素のアレイについての合計画素カウントを考慮する。
図13において、(図9との関係で先に議論したように)アレイ操作に必要な種々の電力供給およびバイアス電圧が、電気的結合(例えば、ピン、金属パッド)を介してアレイに供され、「供給およびバイアス結合」とブロック195において単純性のために標識される。図13のアレイ100は、行選択シフトレジスター192、2つの組の列選択シフトレジスター1941,2および2つの出力ドライバー1981および1982をやはり含んで、センサー測定(すなわち、アレイの各ISFETによって生じた個々の出力シグナルのコレクション)を表す2つの平行アレイ出力シグナルVout1およびVout2を供する。図13に示される、種々の電源およびバイアス電圧、行および列シフトレジスターのための制御シグナル、および列バイアス/読出回路のための制御シグナルは、アレイ100からアレイ出力シグナルVout1およびVout2(および他の任意の状態/診断シグナル)をやはり読む、図17との関係で以下にさらに議論される、アレイコントローラによって供される。図13に示されるアレイ実施形態のもう1つの態様において、アレイの多数の領域(例えば、多数の列)が多数の平行アレイ出力シグナル(例えば、Vout1およびVout2)を介して同時に読み出すことができるようにアレイを構成することは、図17および18との関係で以下にさらに議論するように、増大したデータ獲得速度を促進する。図13は1度に2つの列から同時にデータを獲得するための2つの列選択レジスタおよび平行アレイ出力シグナルVout1およびVout2を有するアレイを説明するが、他の実施形態においては、本開示に従ったアレイは、ただ1つの測定シグナル出力、または2を超える測定シグナル出力を有するように構成することができ;特に、図19〜23との関係で以下にさらに議論するように、他の発明的実施形態に従ったより密なアレイは、4以上の平行測定シグナル出力を有し、アレイの異なる領域を同時に可能として、4以上の出力を介してデータを供するように構成することができるのは認められるべきである。
図14は行選択シフトレジスタ192を示し、図15は列選択シフトレジスタ194
2の1つを示し、および図16は、1つの例示的実施に従った、図13に示されるアレイ100の出力ドライバー198
2の1つを示す。図14および15に示されるように、行および列選択シフトレジスタは、デジタル回路陽性供給電圧VDDDおよびデジタル供給アースVSSDにカップリングされたD−タイプのフリップ−フロップのシリーズとして実施される。行および列シフトレジスタにおいて、データシグナルは各シリーズにおいて第1のフリップ−フロップのD−入力に適用され、クロックシグナルは、同時に、シリーズ中のフリップ−フロップの全てのクロック入力に適用される。各フリップ−フロップについては、「Q」出力は、クロックシグナルの変換(例えば、フォーリングエッジ)に際してD−入力の状態を再度生じる。図14を参照し、行選択シフトレジスタ192は512のD−タイプのフリップ−フロップを含み、ここに、第1のフリップ−フロップ193は垂直データシグナルDVを受領し、および全てのフリップ−フロップは垂直クロックシグナルCVを受領する。第1のフリップ−フロップ193の「Q」出力は、第1の行選択シグナルRowSel
1を供し、シリーズ中の次のフリップ−フロップのD−入力にカップリングされる。連続的フリップ−フロップのQ出力はシリーズ中の次のフリップ−フロップのD−入力にカップリングされ、図18との関連で以下にさらに議論するように、垂直クロックシグナルCVの連続的フォーリングエッジ変換と共に、行選択シグナルRowSel
2〜RowSel
512を供する。最後の行選択シグナルRowSel
512もまた、アレイの最後の列が選択されている(例えば、診断目的での)表示を供するシグナルLSTV(最終段階垂直)として、アレイ100の任意の出力として採ることができる。図14には明示的に示されていないが、核行選択シグナルRowSel
1〜RowSel
512は、その出力を用いて、(シグナル
から
によって図9で説明されるように)各列における所与の画素を可能とする、対応するインバーターに適用される。
列選択シフトレジスタ1941および1942に関して、これらは行選択シフトレジスタのそれと同様な方法で実施され、各列選択シフトレジスターは256のシリーズ―結合フリップ−フロップを含み、アレイの奇数列またはアレイの偶数列のいずれかからの読出を可能とすることを担う。例えば、図15は列選択シフトレジスタ1942を説明し、これは、列選択シグナルColSel2、ColSel4、....ColSel512を介して連続的なアレイの偶数の番号の列の全てからの読出を可能とするように構成され、他方、もう1つの列選択シフトレジスタ1941は、(列選択シグナルColSel1、ColSel3、....ColSel511を介して)連続的なアレイの奇数番号の列の全てからの読出を可能とするように構成される。双方の列選択シフトレジスタは、水平方向データシグナルDHおよび水平方向クロックシグナルCHによって同時に制御されて、図18との関係で以下にさらに議論されるように、各列選択シグナルを供する。図15に示されるように、最後の列選択シグナルColSel512もまた、アレイの最後の列が選択されている(例えば、診断目的の)表示を供する、シグナルLSTH(最終段階水平)としてアレイ100の任意の出力として採ることができる。
図7に対する態様について再度参照し、出願人らは、図13〜15に関連して先に議論したように、シフトレジスタに基づくアレイ行および列選択についての実施は、図7に示されたMilgrew et al.の設計を含めた、種々の先行技術ISFETアレイ設計で使用される行および列デコーダアプローチに対する有意な改良であることは認識し、認めてきた。特に、図7に示される行デコーダ92および列デコーダ94に関しては、集積回路アレイ設計においてこれらの構成要素を実施する複雑性は、双方のデコーダに対する新たな入力が必要なので、アレイのサイズが増大するにつれて劇的に増大する。例えば、図13との関連で先に議論した512の行および列を有するアレイがもしそのようなスキームが行および列選択で使用されるならば、行および列デコーダ当たり9つの入力を必要とし(29=512);同様に、7400の行および7400の列を有するアレイは、他の実施形態の関連で以下に議論するように、行および列デコーダ当たり13の入力を必要とするであろう(213=8192)。対照的に、図14および15で示された行および列選択シフトレジスタは、さらなる入力シグナルを必要としない。というのは、アレイサイズは増大するが、むしろさらなるD−タイプは急変するからである(これは、CMOSプロセスにおいてルーチン的に実施されている)。かくして、図14および15に示されたシフトレジスタ実施は、アレイの行および列選択に対して容易に拡張可能な解決を供する。
図13の実施形態において、「奇数の」列選択シフトレジスタ1941は「奇数の」出力ドライバ1981に対して奇数の列選択シグナルを供し、偶数の列選択シフトレジスタ1942は、「偶数の」出力ドライバ1982に偶数の列選択シグナルを供する。双方の出力ドライバは同様に構成され、偶数の出力ドライバ1982の例を図16に示す。特に、図16は、各偶数列出力シグナルVCOL2、VCOL4、...VCOL512(一般的な列シグナル出力VCOLjについては図9参照)が、列選択レジスタ1942によって供される偶数の列選択シグナルColSel2、ColSel4、...ColSel512に応答して、対応するスイッチ1912、1914、....191512に適用されて、バス175を介して、偶数の列出力シグナルをバッファー増幅器199(BUF)の入力に連続的にカップリングさせることを示す。図16において、バッファー増幅器199は、出力バッファー陽性供給電圧VDDOおよび出力バッファー供給アースVSSOからのパワーを受領し、出力バッファーバイアス電圧VBOOに応答して、バッファー出力のための対応するバイアス電流を設定する。バッファー増幅器199の高インピーダンス入力を仮定すれば、バイアス電圧VB3に応答性の電流シンク197はバス175にカップリングされて、選択された列の列出力バッファー(図9のバッファー増幅器111j参照)の出力のために、(例えば、ほぼ100μAのオーダーの)適当な駆動電流を供する。バッファー増幅器199は、アレイの選択された偶数列に基づいて出力シグナルVout2供し;同時に、図13を参照し、「奇数の」出力ドライバ1981の対応するバッファー増幅器は、アレイの選択された奇数の列に基づいて出力シグナルVout1を供する。
1つの例示的な実施において、偶数および奇数の双方の出力ドライバ1981および1982のスイッチ(例えば、図16に示されたスイッチ1912、1914、....191512)は、(n−チャネルMOSFETおよびp−チャネルMOSFETを含む;図4参照)CMOS-対伝達ゲートとして実施することができ、およびインバーターは、各列選択シグナルおよびその相補体が所与の伝達ゲートスイッチ191に適用され、スイッチングを可能とできるように使用することができる。各スイッチ191は、可能とされるか、あるいは「オン」されて、対応する列出力シグナルをバス175にカップリングした場合に、一連の抵抗を有し;同様に、各スイッチは、スイッチがオフとされた場合に、キャパシタンスをバス175に加える。より大きなスイッチは一連の抵抗を低下させ、バス175のためのより高い駆動電流を可能とし、これは、一般に、バス175がより迅速に定着するのを可能とし;他方、より大きなスイッチは、スイッチがオフとされると、バス175のキャパシタンスを増大させ、これは、今度は、バス175の定着時間を増加させる。よって、スイッチのサイズに関連して、スイッチシリーズの抵抗およびキャパシタンスの間にはトレードオフがある。
連続的スイッチを可能とした後に迅速に定着するバス175の能力は、今度は、アレイからの迅速なデータ獲得を容易とする。この目的で、いくつかの実施形態において、出力ドライバ1981および1982のスイッチ191は、特に、バス175の定着時間を有意に低下させるように構成される。所与のスイッチのn−チャネルおよびp−チャネルMOSFETの双方はバス175のキャパシタンスに加わり;しかしながら、n−チャネルMOSFETは、一般に、それらのp−チャネルのカウンターパートよりも良好な周波数応答および電流駆動能力を有する。これまでを考慮し、出願人らは、n−チャネルのMOSFETの優れた特徴のいくつかを開発して、「非対称」スイッチを行うことによってバス175の定着時間を改良することができることを認識し、認めてきたが、ここに、所与のスイッチのn−チャネルMOSFETおよびp−チャネルMOSFETの各サイズは異なっている。
例えば、1つの実施形態において、図16を参照し、電流シンク197は、全てのスイッチ1912、1914、....191512が開かれるか、またはオフとされた場合(導電性でない)、バス175が正常に「引き下げられる」ように構成することができる。ISFET測定に基づく列出力シグナルについての幾分限定された予測されたシグナル動的レンジを仮定すれば、所与のスイッチが可能とされ、またはオン(導電性)とされれば、多くの例において、導電のほとんどがスイッチを構成するCMOS−対のn−チャネルMOSFETによってなされる。従って、この実施形態の1つの態様において、各スイッチ191のn−チャネルMOSFETおよびp−チャネルMOSFETは異なったサイズである;すなわち、1つの例示的な実施において、n−チャネルMOSFETはp−チャネルMOSFETよりも有意に大きなサイズとされる。より具体的には、等しいサイズのn−チャネルおよびp−チャネルMOSFETを参照の点として考え、1つの実施において、n−チャネルMOSFETがp−チャネルMOSFETよりもほぼ20倍大きくなるように、n−チャネルMOSFETを約2〜2.5倍大きくまで増加させることができ、およびp−チャネルを約8〜10倍小さくなるようにサイズを減少させることができる。p−チャネルMOSFETのサイズの有意な減少およびn−チャネルMOSFETのサイズの比較的中程度の増加のため、オフ状態におけるスイッチの総じてのキャパシタンスは顕著に低下し、バス175についてのキャパシタンスの対応する顕著な低下があり;同時に、より大きなn−チャネルMOSFETのため、スイッチの電流駆動能力、周波数応答およびトランスコンダクタンスの有意な増加があり、これは、今度は、バス175の定着時間の有意な低下をもたらす。
前記例は、n−チャネルMOSFETがp−チャネルMOSFETよりも大きな出力ドライバ1981および1982についての非対称スイッチ191を記載するが、もう1つの実施形態において、逆を実施することができ、すなわち、p−チャネルMOSFETがn−チャネルMOSFETよりも大きな非対称スイッチである。この実施形態の1つの態様において、図16を再度参照し、電流シンク197を別法として電流のソースとして働かせて、選択された列の列出力バッファー(図9のバッファー増幅器111j参照)の出力を適切に駆動させることができ、全てのスイッチ1912、1914、....191512が開いているか、またはオフ(導電しない)であれば、バス175が正常に「引き上げられる」ように構成することができる。この状況において、スイッチ導電のほとんどは、スイッチを構成するCMOSの対のp−チャネルMOSFETによって達成することができる、低下したスイッチキャパシタンス(および、よって、低下したバスキャパシタンス)の利点はこの実施形態で実現することができるが、バス175についての低下した定着時間の総じての有益な効果は、n−チャネルMOSFETと比較してp−チャネルMOSFETのより低い周波数応答のため、従前に記載されたものよりも幾分低いであろう。それにもかかわらず、より大きなp−チャネルMOSFETに基づく非対称スイッチは、依然として、バス定着時間の顕著な低下を容易とすることができ、また、回路実施も提供することができ、そこでは、列出力バッファー増幅器(図9の111j)は、認識可能な増大した利得でもって、本体に結び付けられたソースフォロワであり得る。
図16に示されたバス175の迅速な定着の促進に向けられたなおもう1つの実施形態において、バス175にカップリングされたより少ないスイッチ191の結果、より小さなバスキャパシタンスがもたらされることが認められるべきである。これを念頭に置き、再度図13を参照し、なおもう1つの実施形態において、2を超える出力ドライバ1981および1982は、各出力ドライバがアレイのより少数の列を取り扱うように、ISFETアレイ100で使用することができる。例えば、1つのドライバによって取り扱われる全ての偶数の列、およびもう1つのドライバによって取り扱われる全ての偶数列を有するよりはむしろ、アレイは、各出力ドライバーが列の1/2よりはむしろアレイの1/4の合計列を取り扱うように、4つの列選択レジスタ1941,2,3,4および4つの対応する出力ドライバ1981,2,3,4を含むことができる。そのような実施において、各出力ドライバは、従って、図16に関連して先に議論された実施形態と比較して半分の数のスイッチ191を有し、各出力ドライバのバス175は対応するより低いキャパシタンスを有し、それにより、バス定着時間を改良する。4つの出力ドライバがこの実施例での説明目的で議論されたが、本開示はこの点において限定されず、2よりも大きな実質的に任意の数の出力ドライバを用いて、先に記載されたシナリオにおいてバス定着時間を改良することもできる。2を超える出力ドライバを使用して、アレイからの迅速なデータ獲得を容易とする他のアレイ実施形態を、(例えば、図19〜23との関連で)以下に詳細に議論する。
説明の目的で、バス175は、直前で議論した実施形態(例えば対称スイッチ、非対称スイッチ、より大きな数の出力ドライバ等)のいずれかにおいてほぼ5pF〜20pFの範囲のキャパシタンスを有することができる。もちろん、バス175のキャパシタンスはこれらの例示的な値に制限されず、他のキャパシタンス値が本開示に従ったアレイの異なる実施で可能であることは認められるべきである。
図13〜16との関連で先に議論したアレイ設計の1つの態様において、別々のアナログ供給電圧連結(VDDA、VSSAのため)、デジタル供給電圧結合(VDDD、VSSDのため)、および出力バッファー供給電圧結合(VDDD、VSSOのため)がアレイ上に供給されて、ノイズ単離を促進し、種々のアレイ構成要素の中でシグナルクロス−トークを低下させ、それにより、出力シグナルVout1およびVout2のシグナル−対−ノイズ比率(SNR)を増加させる。1つの例示的な実施において、陽性供給電圧VDDA、VDDDおよびVDDOは、各々、ほぼ3.3ボルトとすることができる。もう1つの態様において、これらの電圧は、各々、図17との関連で以下にさらに議論するように、1以上のプログラム可能な電圧ソースによって「オフチップ」にて供することができる。
図17は、本開示の1つの発明的実施形態に従った、アレイコントローラ250にカップリングされた図13のセンサーアレイ100のブロックダイアグラムを示す。種々の例示的な実施において、アレイコントローラ250は「独立型」コントローラとして、あるいは図8の関連で先に議論したように、コンピュータ260の一部を形成する1以上のコンピューター適合性「カード」として製造することができる。1つの態様において、アレイコントローラ−250の機能は、図17に示されたように、界面ブロック252(例えば、USBポートまたはPCIバスを介するシリーズ界面、Ethernet(登録商標)結合等)を通じてコンピュータ260によって制御することができる。1つの実施形態において、アレイコントローラ250の全てまたは一部は1以上のプリント基板として製造され、アレイ100は、慣用的なICチップと同様に、プリント基板の1つへのプラグに構成される(例えば、アレイ100は、プリント基板のゼロ−挿入−力または「ZIF」ソケットのようなチップソケットに差し込まれるASICとして構成される)。そのような実施形態の1つの態様において、ASICとして構成されたアレイ100は、アレイコントローラ250によってアクセスでき/読むことができ、および/またはコンピュータ260へ通過させることができる図17においては「ID」として示された、同定暗号を供するのに専念する1以上のピン/端子結合を含むことができる。そのような同定暗号はアレイ100の種々の属性(例えば、画素のサイズ、数、出力シグナルの数、供給および/またはバイアス電流などのような種々の操作パラメータ)を表すことができ、これを処理して、アレイコントローラ250によって供された対応する操作モード、パラメータおよびまたはシグナルを決定して、アレイ100の多数の異なるタイプのいずれかでの適当な操作を確実とすることができる。1つの例示的な実施において、ASICとして構成されたアレイ100に同定暗号に専念させた3つのピンを設けることができ、製造プロセスの間に、ASICを暗号化して、アレイコントローラ250によって読まれるべきこれらの3つのピンの各々においての3つの可能な電圧状態(すなわち、トリ−状態ピン暗号化スキーム)の1つを供し、それにより、27のユニークなアレイ同定暗号を供することができる。この実施形態のもう1つの態様において、アレイコントローラ250の全てまたは一部を、以下でさらに詳細に記載する種々のアレイコントローラ機能を実施するように構成された場プログラム可能ゲートアレイ(FPGA)として実施することができる。
一般に、アレイコントローラ250は種々の供給電圧およびバイアス電圧をアレイ100に供し、ならびに、行および列選択、画素出力サンプリングおよびデータ獲得に関する種々のシグナルを供する。特に、アレイコントローラ250は、アレイ100からの多重化各画素電圧シグナルを含めた、1以上のアナログ出力シグナル(例えば、Vout1およびVout2)を読み、次いで、これらの各画素シグナルをデジタル化して、コンピュータ260へ測定データを供し、コンピュータは、今度は、データを貯蔵しおよび/または処理することができる。いくつかの実施において、アレイコントローラ250は、図11Aとの関連で先に議論したように、種々のアレイキャリブレーションおよび診断機能、および任意のアレイUV照射治療を行い、またはそれを促進するように構成することができる。
図17に示されたように、アレイコントローラ250は、一般に、アレイ100に、アナログ供給電圧およびアース(VDDA、VSSA)、デジタル供給電圧およびアース(VDDD、VSSD)、およびバッファー出力供給電圧およびアース(VDDO、VSSO)を供する。1つの例示的な実施において、供給電圧VDDA、VDDDおよびVDDOの各々はほぼ3.3ボルトである。もう1つの実施において、供給電圧VDDA、VDDDおよびVDDOはほぼ1.8ボルトのように低くてもよい。先に議論したように、1つの態様において、これらの電力供給電圧の各々は、別々の導電経路を介してアレイ100に供されて、ノイズ単離を促進する。もう1つの態様において、これらの供給電圧は、各電力供給/レギュレータに由来することができ、あるいはこれらの供給電圧の1以上はアレイコントローラ250の電力供給258における共通の源に由来することができる。電力供給258は、アレイ操作に必要な種々のバイアス電圧(例えば、VB1、VB2、VB3、VB4、VBOO、VBODY)およびアレイ診断およびキャリブレーションで用いる参照電圧VREFを供することもできる。
もう1つの態様において、電力供給258は、コンピュータ260によって制御され、バイアス電圧、参照電圧および供給電圧いずれかまたは全てがソフトウエア制御(すなわち、プログラム可能なバイアス設定)下で変化されるのを可能とすることができる1以上のデジタル−対−アナログコンバーター(DAC)を含む。例えば、(例えば、ソフトウエア実行を介して)コンピュータ制御に応答性の電力供給258は、供給電圧の1以上の調整(例えば、同定暗号によって表わされるチップタイプに依存する3.3ボルトおよび1.8ボルトの間のスイッチング)およびまたは画素ドレイン電流のためのバイアス電圧VB1およびVB2、列バス駆動のためのVB3、列増幅器バンド幅のためのVB4、および列出力バッファー電流駆動のためのVBOOの1以上の調整を促進することができる。いくつかの態様において、1以上のバイアス電圧を調整して、可能とされた画素からのシグナルの定着時間を最適化することができる。加えて、アレイの全てのISFETについての共通の本体電圧VBODYは、所望の製造後UV照射処理の間にアースして、トラップされた電荷を低下させ、次に、診断分析、キャリブレーション、および測定/データ獲得のためのアレイの通常の操作の間により高い電圧(例えば、VDDA)にカップリングさせることができる。同様に、参照電圧VREFを変化させ、種々の診断およびキャリブレーション機能を促進させることができる。
また図17に示すように、典型的には、分析物溶液との関連で使用して、(図1との関連で先に議論したように)アレイ100によって測定される参照電極76を電力供給258にカップリングして、画素出力電圧のための参照ポテンシャルを供することができる。例えば、1つの実施において、参照電極76を供給アース(例えば、アナログアースVSSA)にカップリングして、前記の方程式(3)に基づいて画素出力電圧のための参照を供することができる。他の例示的な実施において、参照電極電圧は、既知のpHレベルを有する注目する溶液/試料をセンサーアレイ100に近接して置き、次いでアレイ出力シグナルVout1およびVout2が、それから画素電圧の引き続いての変化が既知の参照pHレベルに関してpHの局所的変化を反映する、所望の参照レベルにおける画素電圧を供するまで参照電極電圧を調整することによって設定することができる。一般に、参照電極76に関連する電圧は、(種々のアレイ診断およびキャリブレーション機能で使用することができる)先に議論した参照電圧VREFと必ずしも同一である必要はないが、いくつかの実施においては、電力供給258によって供される参照電圧VREFを用いて、参照電極76の電圧を設定することができるのは認められるべきである。
アレイ100からのデータ獲得に関しては、1つの実施形態において、図17のアレイコントローラ250は1以上のプレ増幅器253を含んで、センサーアレイからの1以上の出力シグナル(例えば、Vout1およびVout2)をさらに緩衝し、選択可能利得を供することができる。1つの態様において、アレイコントローラ250は、各出力シグナルのための1つのプレ増幅器(例えば、2つのアナログ出力シグナルのための2つのプレ増幅器)を含むことができる。他の態様において、プレ増幅器は、0.0〜1.8ボルト、または0.0〜3.3ボルトの入力電圧を許容するように構成することができ、プログラム可能な/コンピュータ選択可能利得(例えば、1、2、5、10および20)および低いノイズ出力(例えば、<10nV/sqrtHz)を有することができ、および低いパスフィルタリング(例えば、5MHzおよび25MHzのバンド幅)を供することができる。ノイズの低下およびノイズに関するシグナルの比率の増加に関しては、アレイ100がアレイコントローラ−250の全てまたは一部を含有するプリント基板のチップソケットに入れられたASICとして構成される1つの実施において、フィルタリングキャパシタをチップソケットに近接して(例えば、ZIFソケットの下面)使用して、ノイズの低下を促進することができる。なおもう1つの態様において、プレ増幅器は入力および/または出力電圧シグナルのためのプログラム可能/コンピュータ選択可能オフセットを有して、いずれかの所望の範囲までのための公称レベルを設定することができる。
図17のアレイコントローラ250は、コンピュータ260にデータを供するために、センサーアレイ出力シグナルVout1およびVout2をデジタル出力(例えば、10−ビットまたは12−ビット)に変換するための1以上のアナログ-対-デジタルコンバータ254(ADC)も含む。1つの態様において、1つのADCをセンサーアレイの各アナログ出力のために使用することができ、および各ADCを(もしプレ増幅器が所与の実施で使用されるならば)対応するプレ増幅器の出力にカップリングすることができる。もう1つの態様において、ADCはコンピュータ−選択可能入力レンジ(例えば、50mV、200mV、500mV、1V)を有して、アレイ出力シグナルの異なる範囲および/またはプレ増幅器パラメータとの適合性を促進することができる。なお他の態様においては、ADCのバンド幅は60MHzよりも大きくすることができ、データ獲得/変換率は25MHzよりも大きく(例えば100MHz以上と高く)することができる。
図17の実施形態において、ADC獲得タイミングおよびアレイの行および列選択はタイミングジェネレータ256によって制御することができる。特に、図9との関連で先に議論したように、該タイミングジェネレータはデジタル垂直データおよびクロックシグナル(DV,CV)を供して、行選択を制御し、デジタル垂直データおよびクロックシグナル(DH,CH)を供して、列選択を制御し、列試料およびホールドシグナルCOL SHを供して、可能となる行についての画素電圧をサンプリングする。図18との関連で以下にさらに議論するように、また、該タイミングジェネレータ256は、サンプリングクロックシグナルCSをADC 254に供して、所与のアレイアナログ出力シグナル(例えば、Vout1およびVout2)のデータストリームにおいて連続的画素値を適当にサンプリングし、デジタル化する。いくつかの実施において、該タイミングジェネレータ256は、マイクロプロセッサ実施暗号によって実施することができ、およびマルチ−チャネルデジタルパターンジェネレータとして構成して、適切なタイミングの制御シグナルを供することができる。1つの例示的な実施において、該タイミングジェネレータ256は、場−プログラム可能ゲートアレイ(FPGA)として実施することができる。
図18は、センサーアレイ100からの画素データを獲得するための、タイミングジェネレータ256によって供されるような、種々のアレイ制御シグナルのための例示的なタイミングダイアグラムを示す。以下の議論の目的で、「フレーム」は、アレイにおける各画素についての値(例えば、画素出力シグナルまたは電圧VS)を含むデータ組と定義され、および「フレーム速度」は、連続的フレームがアレイから獲得できる速度と定義される。かくして、フレーム速度は、いずれかの所与の画素からのデータは該フレーム速度で得られるので、アレイの各画素についての「画素サンプリング速度」に実質的に対応する。
図18の例において、20フレーム/秒の例示的フレーム速度は、アレイの操作(すなわち、行および列選択およびシグナル獲得)を説明するために選択され;しかしながら、本開示に従ったアレイおよびアレイコントローラはこの点で制限されず、これはより低いフレーム速度(例えば、1〜10フレーム/秒)またはより高いフレーム速度(例えば、25、30、40、50、60、70〜100フレーム/秒等)を含めた異なるフレーム速度が可能であるからであることは認識されるべきであり、アレイは同一またはより多くの画素を有する。いくつかの例示的な適用において、数秒を超える多くのフレームを含んで、所与の分析物または複数分析物についての実験を行うデータ組を獲得することができる。いくつかのそのような実験は、連続的に、いくつかの場合においては、間に休みを入れて行って、データ移動/処理および/またはセンサーアレイASICの洗浄、および引き続いての実験のための試薬の調製を可能とすることができる。
例えば、ISFET上方の反応ウェルにおける核酸合成または配列決定反応の間にアレイの所与のISFET画素の出力シグナルにおいて、1以上のイオンパルスが発生する、図8、8Aおよび8Bに関連して先に議論したヌクレオチド取込みを検出する方法に関して、適当なフレーム速度を選択して、ISFETの出力シグナルを十分にサンプリングして、1以上のパルス存在、およびパルスの間の時間間隔を有効に検出することができる。いくつかの例示的な実施において、ヌクレオチド取込事象の数に依存して、ほぼ1秒〜ほぼ2.5秒のオーダーの半−最大における全幅(FWHM)、およびほぼ1〜20秒のオーダーの(もし多数のパルスが生じれば)連続的パルスピークの間の時間間隔を有する1以上のイオンパルスを生じさせることができる。これらの例示的な値を仮定すれば、20Hzのフレーム速度(または画素サンプリング速度)は、所与の画素の出力シグナルにおいて1以上のパルスを信頼性よく分解するのに十分である。再度、この例において与えられたパルスの特徴およびフレーム速度は、主として、説明の目的で供するものであり、および異なるパルス特徴およびフレーム速度が他の実施に関与してもよい。
1つの実施において、アレイコントローラ250はアレイ100を制御して、一度に1つを、連続的に、行を可能とする。例えば、態様のために再度図9を参照し、画素の最初の行を、行選択シグナル
を介して可能とする。可能とされた画素をいくらかな時間の間定着させ、その後、COL SHシグナルを簡単に活性として、各列において試料/ホールドスイッチを閉じ、列における最初の画素によって、列の試料/ホールドキャパシタC
shに電圧値出力を貯蔵する。次いで、この電圧は、2つの(奇数および偶数列)アレイ出力ドライバ198
1および198
2の内の1つに印加された列出力電圧V
COLjとして利用可能である(例えば、図16参照)。次いで、COL SHシグナルを活性でなくし、それにより各列において試料/ホールドスイッチを開き、列増幅器107Aおよび107Bからの列出力バッファー111jを脱カップリングする。その後まもなく、画素の第2の行を、行選択シグナル
を介して可能とする。画素の第二の行を定着させる時間の間において、列選択シグナルを一度に2つ発生させて(1つの奇数および1つの偶数;奇数列選択シグナルは、連続的に、奇数出力ドライバに適用され、偶数列選択シグナルは、連続的に、偶数出力ドライバに適用される)、第1の行に関連する列出力電圧を読む。かくして、アレイ中の所与の行が可能とされ、定着している間、従前の行は一度に2つの列だけ読み出されている。(例えば、異なる垂直および平行クロックシグナルおよび列試料/ホールドを介して)行選択およびサンプリング/読出をスタガーさせ、次いで、所与の行について一度に多数の列を読むことによって、データのフレームを、有意にストリームライン化された様式でアレイから獲得することができる。
図18は、20フレーム/秒の例示的なフレーム速度についてのこれまでのプロセスのタイミング詳細を示す。アレイにおけるこのフレーム速度および512行を仮定すれば、図18において垂直描写によって示されるように、各行はほぼ98マイクロ秒以内に読み出されなければならない。従って、垂直クロックシグナルCVは98マイクロ秒の期間を有し(すなわち、10kHzを超えるクロック周波数)、新しい行はCVシグナルのトレイリングエッジ(陰性変換)に可能とされる。図18の左側は新しいフレームサイクルの開始を反映し、その時点において、垂直データシグナルDVはCVシグナルの最初のトレイリングエッジ前で活性とされ、CVシグナルの次のトレイリングエッジの前に脱活性される(連続的フレームからのデータ獲得のためには、垂直データシグナルが、再度、行512が可能とされる後にのみ再度活性とされる)。また、CVシグナル(すなわち、可能とされる新しい行)の、各トレイリングエッジの直前に、COL SHシグナルは2マイクロ秒の間活性とされ、CVシグナルのトレイリングエッジのほぼ50ナノ秒前に去る。
図18において、COL SHシグナルの最初の出現は、アレイの行512の画素値を現実にサンプリングしている。かくして、CVシグナルの最初のトレイリングエッジに際して、最初の行は可能とされ、COL SHシグナルの第2の出現まで(ほぼ96マイクロ秒の間)定着される。最初の行についてのこの定着時間の間に、行512の画素値が列選択シグナルを介して読み出される。2つの列選択シグナルが同時に生じて、512の列を読むゆえに、水平クロックシグナルCHはこの期間内に256サイクルを生じさせなければならず、CHシグナルの各トレイリングエッジは1つの奇数および1つの偶数列選択シグナルを生じさせる。図18に示されたように、所与の行におけるCHシグナルの最初のトレイリングエッジは、(COL SHシグナルの脱活性化後に)行の選択から2マイクロ秒後に起こるようなタイミングとされ、試料/ホールドキャパシタCshに貯蔵され、かつ列出力バッファーによって供される電圧値を可能とする。しかしながら、(例えば、図18Aとの関連で以下に議論するように)他の実施において、CHシグナルの最初のトレイリングエッジおよびCOL SHシグナルのトレイリングエッジ(すなわち、脱活性化)の間の期間は2マイクロ秒よりも有意に短くてもよく、いくつかの場合においては、ちょうど50ナノ秒を超えるくらい小さくてもよいことが認められるべきである。また、各行については、CHシグナルの最初のトレイリングエッジ前に垂直データシグナルDHは活性とされ、CHシグナルの次のトレイリングエッジ前に脱活性される。最後の2つの列(例えば、511および512)は、先に議論したように、次の行が可能とされるほぼ2マイクロ秒前に起こるCOL SHシグナルの出現前に選択される。かくして、512列はほぼ94マイクロ秒の時間内に一度に2つ読まれる(すなわち、行当たり98マイクロ秒、それから各行の始まりおよび最後において2マイクロ秒は引かれる)。この結果、ほぼ2.7MHzのアレイ出力シグナルVout1およびVout2の各々についてのデータ速度がもたらされる。
図18Aは、図18のタイミングダイアグラムからわずかに修飾されたアレイ100からのデータ獲得プロセスのもう1つのタイミングダイアグラムを示す。図13に関連して先に議論したように、いくつかの実施においては、図13に示されたの同様なアレイは、参照画素(すなわち、アレイの最初および最後の2つの行および列)の周辺によって囲まれた512×512「活性」画素の領域を含むように構成することができ、その結果、516×516画素の合計画素カウントを有するアレイがもたらされる。従って、20フレーム/秒の例示的なフレーム速度およびアレイにおける516行を仮定すれば、図18Aにおける垂直描写によって示されるように、各行はほぼ97マイクロ秒以内に読み出されなければならない。従って、垂直クロックシグナルCVは、97マイクロ秒のわずかにより短い期間を有する。2つの列選択シグナルが同時に生じて、516列を読むゆえに、水平クロックシグナルCHは、図18との関係で参照した256サイクルとは対照的に、この期間内に258サイクルを生じさせなければならない。従って、図18Aに示された1つの態様において、所与の行におけるCHシグナルの最初のトレイリングエッジは、COL SHシグナルのトレイリングエッジ(例えば、非活性化)から丁度50ナノ秒を超えて起こるようなタイミングとされ、さらなる水平クロックサイクルを、垂直クロックシグナルCVの僅かにより短い期間に「絞る」。図18におけるように、水平データシグナルDHは、CHシグナルの第1のトレイリングエッジ前に活性とされ、それ自体、図18と比較して、図18Aのタイミングダイアグラムにおいてもわずかに早く起こる。最後の2つの列(すなわち、図18Aにおいては「Ref3、4と標識される列515および516)は、先に議論されたように、次の行が可能とされるほぼ2マイクロ秒前に起こるCOLSHシグナル出現前に選択される。かくして、516列はほぼ95マイクロ秒の期間内に1度に2つ読まれる(すなわち、行当たり97マイクロ秒から、各行の端における2マイクロ秒を差し引く、および各行の最初におけるのは無視できる時間)。この結果、図18のタイミングダイアグラム、すなわち、ほぼ2.7MHzによって供されたアレイ出力シグナルVout1およびVout2各々について実質的に同一のデータ速度をもたらす。
図17との関連で先に議論したように、タイミングジェネレータ256もまた、ADC 254へとサンプリングクロックシグナルCSを生じさせ、所与のアレイ出力シグナルのデータストリームにおける連続的画素値を適当にサンプリングし、デジタル化する。1つの態様において、サンプリングクロックシグナルCSは、少なくとも1回、データストリームにおける所与の画素値のサンプリングを供する。サンプリングクロックシグナルCSは図18および18Aのタイミングダイアグラムにおいては示されてないが、例示的実施においては、シグナルCSは水平クロックシグナルCHのタイミングを実質的に追跡することができ;特に、サンプリングクロックシグナルCSは水平クロックシグナルCHと連携して、CHによって可能とされるべきデータストリームにおける次の画素値に直ぐに先立ってADCが画素値をサンプリングするのを可能とし、それにより、所与の画素値をサンプリングするに先立ってできるだけ多くのシグナル定着時間を可能とすることは認めることができる。例えば、ADCはCSの陽性変換に際して入力画素値をサンプリングするように構成することができ、CSの各陽性変換は、タイミングジェネレータ256によって、CHの各陰性変換に直ぐに先立って、またはいくつかの場合においては、それと実質的に同時に起こるようなタイミングとされ、可能とされるべきデータストリームにおける次の画素に丁度先立って所与の画素をサンプリングすることができる。もう1つの例示的実施において、ADC 254はサンプリングクロックシグナルCSを介してタイミングジェネレータ256によって制御されて、有意に高い速度にて出力シグナルVout1およびVout2をサンプリングして、各画素測定について多数のデジタル化された試料を供することができ、これは、次いで、平均化することができる(例えば、ADCデータ獲得速度はほぼ100MHzとすることができて、2.7MHzアレイ出力シグナルをサンプリングし、それにより画素測定当たりほぼ35〜40試料と多くを供することができる)。
1つの実施形態において、一旦画素値がADC 254によってサンプリングされ、デジタル化されたならば、コンピュータ260は、アレイ100およびアレイコントローラ250から得られた画素データを処理するようにプログラムされて、ある場合においては、所与のアレイ出力シグナルにおいて表わされた画素電圧においての十分な定着時間を超えることができる高いデータ獲得速度を促進することができる。高い獲得速度で獲得されたアレイの処理および修正のためにコンピュータ260によって実施することができる本発明の1つの実施形態に従った例示的な方法を説明するフローチャートは図18Bに示される。本実施形態の種々の説明において、コンピュータ260は、アレイに対する参照または「ドライ」入力を用い(例えば、分析物は存在しない)、所与のアレイ出力シグナルにおける画素電圧についての十分な定着時間、ならびに認識可能に高い操作周波数においてのアレイ応答を最初に特徴付けるようにプログラムされる。この特徴付けは、高い操作周波数において、かつ測定されるべき分析物の存在下で、アレイから得られたデータに引き続いて適用される修正因子を駆動するための基礎を形成する。
画素定着時間に関しては、再度、図16を参照し、先に議論したように、所与のアレイ出力シグナル(例えば、図16におけるVout2)は、列選択スイッチ191の順次の操作から由来する一連の画素電圧値を含んで、バス175を介して各列電圧V
COLjをバッファー増幅器199に適用する(各列電圧V
COLjは、今度は、ISFETソース電圧V
Sjの緩衝化されたバージョンを表す)。いくつかの実施において、2つの連続する画素の読みの間のアレイ出力シグナルにおける電圧変化ΔV
PIXは、(PP)によって与えられた指数プロセスとして特徴付けられるのが観察され、
ここに、Aは2つの画素電圧値の間の差(V
COLj−V
COLj−1)であって、kはバス175のキャパシタンスに関連する時定数である。図18Cおよび18Dは、例示的サンプリングクロックシグナルCSに対してプロットされた時間の関数としての出力シグナルにおける画素間変換を示す、所与のアレイ出力シグナルVout(例えば、Vout1およびVout2のうちの1つ)における例示的な画素電圧を示す。図18Cにおいて、サンプリングクロックシグナルCSは期間524、およびCS試料によって制御されるADC、CSの陽性変換に際しての画素電圧を有する(先に議論したように、1つの実施形態においては、CSおよびCHは実質的に同一の期間を有する)。図18Cは、その間において、電圧の差Aとの間の、ΔV
PIX(t)に対応する指数的電圧変換522が容易に観察することができる、2つの試料525Aおよび525Bを示す。
本議論の目的では、画素「定着時間」t
settleは、ΔV
PIX(t)が、アレイ出力シグナルのピークノイズレベルと等しい量だけ、その最終値とは異なる値を獲得する時間tと定義される。もしアレイ出力シグナルのピークノイズレベルがn
pと示されるならば、定着時間t
settleにおける電圧はΔV
PIX (t
settle=A[1−(n
p/A)]によって与えられる。方程式(PP)に代入し、t
settleについて解き、(QQ)が得られる。
図18Dは、全定着を可能とするために十分に長い期間を有するサンプリングクロックシグナルCSを用い、差Aを有する2つの画素電圧の間における単一電圧変換522についての画素定着時間t
settle(参照番号526)を概念的に示す。説明の目的でいくつかの例示的なパラメータを供すると、1つの実施においては、画素電圧変換についての最大範囲を表すAについての最大値(例えば、最小および最大値における連続画素)はほぼ250mVのオーダーにある。加えて、アレイ出力シグナルのピークノイズレベルn
pはほぼ100μVとして取られ、および時定数kは5ナノ秒としてとられる。これらの値は、ほぼ40ナノ秒の例示的な定着時間t
settleを提供する。もしアレイ出力シグナルの最大データ速度が定着時間t
settleの逆数としてとられるならば、40ナノ秒の定着時間は25MHzの最大データ速度に対応する。他の実施において、Aは20mVのオーダーであってよく、および時定数kは15ナノ秒のオーダーであってよく、その結果ほぼ80ナノ秒の定着時間t
settleおよび12.5MHzの最大データ速度がもたらされる。先に示したkの値は、一般に、ほぼ5pF〜20pFの範囲においてバス175についてのキャパシタンスに対応する。これまでの値は主として説明の目的で供されたものであり、本発明の種々の実施形態はこれらの例示的な値に制限されず;特に、本発明の種々の実施形態に従ったアレイは、異なる画素定着時間t
settle(例えば、いくつかの場合には、40ナノ秒未満)を有しても良いのは認められるべきである。
先に示したように、1つの実施形態においては、画素データは、画素定着時間によって指令されるものを超えたデータ速度にてアレイから獲得することができる。図18Bは、本開示の1つの発明的実施形態に従ったそのような方法についてのフローチャートを示す。図18Bの方法において、十分に遅いクロック周波数が、アレイ出力シグナル当たりの得られたデータ速度が画素定着時間tsettleの逆数に等しいか、またはそれよりも低いように、シグナルCV、CHおよびCSについて選択されて、所与の出力シグナルにおいて画素間の十分に定着された画素電圧値を可能とする。図18Bのブロック502において示されるように、これらのクロック周波数に関し、次いで、定着された画素電圧値が、分析物の不存在において(または参照分析物の存在下にて)全アレイについて獲得されて、該アレイについての第一の「ドライ」または参照データイメージを供する。図18Bのブロック504において、最初のデータイメージを構成する各画素電圧については、画素の最後の電圧および対応する出力シグナルデータストリームにおける直ぐに先行する画素の最終電圧の間の転移値(すなわち、電圧差A)が収集され、貯蔵される。アレイの全ての画素についてのこれらの転移値のコレクションは、最初の転移値データ組を供する。
引き続いて、図18Bのブロック506においては、シグナルCV、CHおよびCSについてのクロック周波数は、アレイ出力シグナル当たりの得られたデータ速度が、画素電圧値が十分に定着される速度(すなわち、定着時間tsettleの逆数よりも高いデータ速度)を超えるように増大させる。本議論の目的では、シグナルCV、CHおよびCSについてのそのような増大したクロック周波数のコレクションから得られたアレイ出力シグナルでのデータ速度は「過剰スピードデータ速度」と言われる。過剰スピードデータ速度に対応するクロック周波数を用いて、画素電圧値が、再度、分析物の不存在下において(または同一参照分析物の存在下において)全アレイについて得られて、該アレイについても第二の「ドライ」または参照データイメージを供する。図18Bのブロック508において、過剰スピードデータ速度で得られた第二のデータイメージに基づく第二の転移値データ組が計算され、第一のデータイメージについて前記したように貯蔵される。
図18Bのブロック510において、アレイの各画素についての修正因子は、第一および第二の転移値データ組に貯蔵された値に基づいて計算される。例えば、各画素についての修正因子は、最初の転移値データからのその転移値、および第二の転移値データ組からのその対応する転移値の比率として計算されて、(例えば、第一のデータ組からの転移値を第二のデータ組からの転移値で割ることができ、またはその逆もできる)、修正因子データ組が供され、次いで、これが貯蔵され得る。図18Bのブロック512および514に示されるように、次いで、この修正因子データ組を使用して、測定すべき現実の分析物の存在下で、過剰スピードデータ速度に対応するクロック周波数で操作されるアレイから得られた画素データを処理することができ;特に、分析物の存在下で過剰スピードデータ速度にてアレイから得られたデータを、修正因子データ組によって適切には乗じ、または割って(例えば、対応する修正因子によって乗じ、または割られた各画素)、測定すべき所望の分析物特性(例えば、イオン濃度)の修正されたデータ代表を得ることができる。一旦、修正因子データ組が計算され、貯蔵されると、それを反復して用いて、過剰スピードデータ速度においてアレイから獲得されたデータの多数のフレームを修正することができるのは認められるべきである。
センサーアレイおよびADCを制御することに加えて、タイミングジェネレータ256は、種々のアレイキャリブレーションおよび診断機能、ならびに任意のUV照射処理を容易とするように構成することができる。この目的で、タイミングジェネレータは、アレイの最後の行およびシグナルLSTHの選択を示すシグナルLSTVを利用して、アレイの最後の列の選択を示すことができる。タイミングジェネレータ256は、参照電圧VREFを列バッファー増幅器に適用するCALシグナルを生じさせ、およびUV照射プロセスの間にアレイにおけるすべてのISFETのドレインをアースするUVシグナルを生じさせることを担うこともできる(図9参照)。タイミングジェネレータは、種々のキャリブレーションおよび診断機能、またはUV照射の間に電力供給258上にいくらかの制御機能を供して、供給またはバイアス電圧を適切に制御することもでき、例えばUV照射の間に、タイミングジェネレータは電力供給を制御し、UVシグナルが活性化されてISFETドレインをアースしつつ、本体電圧VBODYをアースにカップリングさせることができる。アレイキャリブレーションおよび診断、ならびにUV照射に関しては、いくつかの実施において、タイミングジェネレータは、コンピュータ260からの特殊化されたプログラムを受領して、適当な制御シグナルを供することができる。1つの態様において、コンピュータ260は、アレイの参照および/またはダミー画素、ならびにCALシグナルおよび参照電圧VREFの適用に基づく列情報から得られた種々のデータを用いて、所与のアレイに関連する種々のキャリブレーションパラメータを決定しおよび/またはキャリブレーションおよび診断機能のための特殊化されたプログラムを生じさせることができる。
アレイコントローラ250のコンピュータインターフェイス252に関して、1つの例示的な実施において、該インターフェイスは、コンピュータ260に対するほぼ200MB/秒のデータ速度を容易とするように構成され、および400MB以上までの局所的貯蔵を含むことができる。コンピュータ260は、200MB/秒の速度でデータを受領し、データを処理して、(例えば、モニター上の偽−色にて表示され得る)画素のイメージを再構築するように構成される。例えば、コンピュータは、C++またはビジュアルベーシック(Visual Basic)で書かれたルーチンについての一般的なプログラムを実施して、データを操作するように構成することができ、ディスプレイは所望のようにする。
本明細書中に記載されたシステムは、配列決定で用いる場合、典型的には、chemFETアレイ支持反応チャンバーを含み、該chemFETは、該chemFETからのシグナルを配列決定情報に変換するロジックを実施することができるインターフェイスにカップリングされている。
いくつかの実施形態において、本発明は、PPiまたはdNTPまたは双方とのイオン相互作用に関連するイオンパルスを決定するためのロジックを含む、ポリマー配列決定のロジック(好ましくはコンピュータ実行可能ロジック)を含む。典型的には、ロジックは、イオンパルスの特徴をポリマー配列決定情報に変換する。
いくつかの実施形態において、本発明は、イオンパルス間の時間、または単一イオンパルスの特徴に基づいて核酸鋳型の配列を決定するためのロジックを含むロジック(好ましくは、コンピュータ実行可能ロジック)を含む。該ロジックは、所望により、さらに、chemFETのアレイ上のイオンパルスの空間的位置を決定するためのロジックを含むことができる。
いくつかの実施形態において、本発明は、配列決定反応で利用されるべき特定のdNTPでかかる時間の持続に基づき、核酸鋳型の配列を決定するためのロジックを含むロジック(好ましくは、コンピュータ実行可能ロジック)を含む。典型的には、該ロジックは1以上のchemFETからのシグナルを受け取る。好ましくは、該配列は実質的にリアルタイムで表示される。
いくつかの実施形態において、本発明は、chemFETのアレイからのイオンパルスを処理して、注目するポリマーの配列を決定するためのロジック(好ましくは、コンピュータ実行可能ロジック)を含む。該ロジックは、所望により、さらに、ファイル管理、ファイル貯蔵、および可視化のためのロジックを含んでもよい。また、該ロジックは、所望により、さらに、イオンパルスをヌクレオチド配列に変換するためのロジックを含んでもよい。好ましくは、該配列は実質的にリアルタイムで表示される。好ましくは、該配列は実質的にリアルタイムで表示される。
システムから得られた配列決定情報は、パーソナルデジタルアシスタントのようなコンパクトな計算デバイスに送達することができる。かくして、1つの実施形態において、本発明は、コンパクトな計算デバイス上で生物の完全なゲノムを表示するためのロジックを含む。また、本発明は、chemFETアレイからのデータをコンパクトな計算デバイスに送るのに適合したロジックも含む。そのようなロジックのいずれもコンピュータで実施できる。
本開示に従った例示的なISFETアレイおよびアレイコントローラのいくつかの態様を議論してきたが、図19〜23は、なお他の発明的実施形態に従った、より多数の画素を有するISFETセンサーアレイの代替CMOS ICチップ実施のブロックダイアグラムを示す。1つの態様において、図19〜23に関連して以下にさらに議論するISFETアレイの各々は、図17で示されたのと同様な、いくつかの場合には、より多数の画素を収容するために些細な修飾(例えば、さらなるプレ増幅器253およびアナログ−対−デジタルコンバータ254)を施した、アレイコントローラによって制御することができる。
図19は、1つの発明的実施形態に従った、図9〜12に関連して先に議論した列および画素の設計に基づくISFETセンサーアレイ100A、および0.35マイクロメートルCMOS製造プロセスのブロックダイアグラムを示す。アレイ100Aは2048の列1021〜1022048を含み、ここに、各列は、各々がほぼ9マイクロメートル×9マイクロメートルのサイズを有する、2048の幾何学的に四角形の画素1051〜1052048を含む。かくして、アレイは、400万画素以上(>4メガ画素)を含み1つの例示的な実施においては、完全なアレイ(ISFET画素および関連回路)は、ほぼ20.5ミリメートル×20.5ミリメートルの寸法を有する集積回路チップとして製造することができる。
図19に示された実施形態の1つの態様において、アレイ100Aは、少なくとも部分的には各々制御できる画素の多数のグループとして構成することができる。例えば、画素の各列は頂部および底部半体に分割することができ、列の各頂部半体における画素のコレクションは行の第一のグループ4001(例えば、頂部グループ、行1〜1024)を形成し、列の各底部半体における画素のコレクションは行の第二のグループ4002(例えば、底部グループ、行1025〜2048)を形成する。今度は、行の第一および第二(例えば、頂部および底部)のグループの各々は、対応する行選択レジスタ、列バイアス/読出回路、列選択レジスタ、および出力ドライバに関連する。このようにして、行4001および4002の第一および第二のグループの各々からの画素選択およびデータ獲得は、図13に示された全アレイ100からの画素選択およびデータ獲得と実質的に同様であり;異なって述べれば、1つの態様において、図19のアレイ100Aは、異なる画素グループの2つの同時に制御された「サブ−アレイ」を実質的に含んで、より多数の画素からの有意にストリームライン化されたデータ獲得を供する。
特に、図19は、行の第一のグループ400
1の行選択が、第1の行選択レジスタ192
1によって制御することができ、および行の第二のグループ400
2の行選択は、第二の行選択レジスタ192
2によって制御することができるのを示す。1つの態様において、行選択レジスタ192
1および192
2の各々は、図14との関連で先に議論したように構成して、垂直クロック(CV)および垂直データ(DV)シグナルを受領し、応答において行選択シグナルを生じるように構成することができ;例えば、第一の行選択レジスタ129
1は、シグナル
から
を生じさせることができ、および第二の行選択レジスタ192
2は、シグナル
から
を生じさせることができる。もう1つの態様において、行選択レジスタ192
1および192
2の双方は、アレイの2つの行が所与の時間において、頂部グループから1つ、底部グループからもう1つ、可能とされるように、共通の垂直クロックおよびデータシグナルを同時に受領することができる。
行の第一および第二のグループの各々について、図19のアレイ100Aは、さらに、各列が図9に示されるバイアス/読出回路110jの2つの例を含むように、(第一の行グループ4001のための)列バイアス/読出回路1101T〜1102048T、および(第二の行グループ4002のための)1101B〜1102048Bを含む。アレイ100Aは、第二の行グループ4002のための2つの列選択レジスタ1921,2(奇数および偶数)および2つの出力ドライバ1981,2(奇数および偶数)、および第一の行グループ4001のための2つの列選択レジスタ1923,4(奇数および偶数)および2つの出力ドライバー1983,4(奇数および偶数)を含む(すなわち、4つの列選択レジスタおよび4つの出力ドライバの合計)。列選択レジスタは、水平クロックシグナル(各々、第一の行グループおよび第二の行グループについてのCHTおよびCHB、および水平データシグナル(各々、第1の行グループおよび第2の行グループのためのDHTおよびDHB)を受領して、奇数および偶数の列選択を制御する。1つの実施において、CHTおよびCHBシグナルは共通のシグナルとして供することができ、およびDHTおよびDHBは共通のシグナルとして供することができて、アレイからの1度に4つの列を同時に読出ことができ(すなわち、各行グループからの1つの奇数および1つの偶数列);特に、図13〜18との関連で先に議論したように、2つの列を、各可能にされた行、および2つの出力シグナルとして供された対応する画素電圧について同時に読出すことができる。かくして、いずれかの所与の時間における2つの行の実施化、およびいずれかの所与の時間における行当たり2つの列の読みを介して、アレイ100Aは、4つの同時出力シグナルVout1、Vout2、Vout3およびVout4を供することができる、
完全なデータフレーム(第一および第二の行グループ4001および4002双方からの全ての画素)が20フレーム/秒のフレーム速度で獲得される、図19のアレイ100Aの1つの例示的な実施において、行1024対は、各々、ほぼ49マイクロ秒の期間にて連続的に可能とされる。各可能とされた行については、ほぼ45マイクロ秒の間に各列選択レジスタ/出力ドライバによって1024画素が読まれて、(図18との関連で先に議論されたように、各行の始めおよび終わりにおいて2マイクロ秒を可能とする)。かくして、この例においては、アレイ出力シグナルVout1、Vout2、Vout3およびVout4の各々は、ほぼ23MHzのデータ速度を有する。かくして、この例においては、アレイ出力シグナルVout1、Vout2、Vout3およびVout4の各々は、ほぼ23MHzのデータ速度を有する。再度、他の実施においては、データは、20フレーム/秒以外のフレーム速度(例えば、50〜100フレーム/秒)にて図19のアレイ100Aから獲得することができる。
図13のアレイ100と同様に、なお他の態様において、図19のアレイ100Aは、アレイの周辺の周りにダミーまたは参照画素103の多数の行および列を含んで、予備的な試験/評価データ、オフセット決定および/またはアレイキャリブレーションを促進することができる。加えて、(図9との関連で先に議論されたように)アレイ操作で必要な種々の電力供給およびバイアス電圧が、図13との関連で先に議論したのと同様な方法で、ブロック195におけるアレイ100Aに対して供される。
図20は、なおもう1つの発明的実施形態に従った、0.35マイクロメートルCMOS製造プロセスに基づく、かつ図19において先に議論したアレイ100Aと実質的に同様な構成を有するISFETセンサーアレイ100Bのブロックダイアグラムを示す。アレイ100Bもまた、図9〜12に関連して、先に議論された列および画素設計に一般的には基づき、アレイ100Bにおける画素のサイズ/ピッチは図10に示された画素のそれよりも小さい。特に、図10および11を再度参照し、図10に示された寸法「e」は、ほぼ9マイクロメートルからほぼ5マイクロメートルに、画素の中心領域に配置された活性画素構成要素の一体性に影響することなく、図20の実施形態において、実質的に低下しており;同様に、図10に示された寸法「f」は、ほぼ7マイクロメートルからほぼ4マイクロメートルに低下している。異なって述べれば、活性構成要素を囲う画素の周辺エリアのいくつかは、図10および11に示された画素の活性構成要素の頂面図および断面レイアウトおよび設計を阻害することなく、図10との関連で与えられた寸法に対して実質的に低下している。そのような画素105Aの頂面図は図20Aに示され、そこでは、寸法「e」は5.1マイクロメートルであって、寸法「f」は4.1マイクロメートルである。この画素設計の1つの態様において、サイズの低下を容易とするためには、画素の全周囲の周りに数個の本体結合Bを含む、図10に示された画素と比較して、より少ない本体結合Bを画素105Aに含める(例えば、画素の各コーナーにおいて1つ)。
図20に示されたように、アレイ100Bは1348の列1021〜1021348を含み、ここに、各列は1152の幾何学的に四角形の画素105A1〜105A1152を含み、各々は、ほぼ5マイクロメートル×5マイクロメートルのサイズを有する。かくして、アレイは150万を超える画素(>1.5メガ画素)を含み、1つの例示的な実施において、完全なアレイ(ISFET画素および関連回路)は、ほぼ9ミリメートル×9ミリメートルの寸法を有する集積回路チップとして製造することができる。図19のアレイ100Aと同様に、1つの態様において、図20のアレイ100Bは、図19との関連で先に議論したように、行4001および4002の2つのグループに分割される。1つの例示的な実施において、完全なデータフレーム(第一および第二の行グループ4001および4002双方からの全ての画素)は50フレーム/秒のフレーム速度で獲得され、それにより、行の576対が、各々、ほぼ35マイクロ秒の期間で連続的に可能とされることを要求する。各可能とされた行については、ほぼ31マイクロ秒の間に各列選択レジスタ/出力ドライバによって674画素が読まれて、(図18との関連で先に議論されたように、各行の始めおよび終わりにおいて2マイクロ秒を可能とする)。かくして、この例においては、アレイ出力シグナルVout1、Vout2、Vout3およびVout4の各々は、ほぼ23MHzのデータ速度を有する。かくして、この例においては、アレイ出力シグナルVout1、Vout2、Vout3およびVout4の各々は、ほぼ23MHzのデータ速度を有する。再度、他の実施においては、データは、50フレーム/秒以外のフレーム速度にて図20のアレイ100Bから獲得できるのは認められるべきである。
図21は、なおもう1つの実施形態に従った、0.35マイクロメートルCMOS製造プロセスに基づいた、かつ図20および20Aとの関連で先に議論したより小さな画素サイズ(5.1マイクロメートルの四角形画素)を取り込むISFETセンサーアレイ100Cのブロックダイアグラムを示す。図21に示すように、アレイ100Cは4000の列1021〜1024000を含み、ここに、各列は、各々がほぼ5マイクロメートル×5マイクロメートルのサイズを有する、3600の幾何学的に四角形の画素105A1〜105A3600を含む。かくして、アレイは1400万を超える画素(>14メガ画素)を含み、1つの例示的な実施においては、完全なアレイ(ISFET画素および関連回路)は、ほぼ22ミリメートル×22ミリメートルの寸法を有する集積回路チップとして製造することができる。図19および20のアレイ100Aおよび100Bと同様に、1つの態様において、図21のアレイ100Cは行4001および4002の2つのグループに分割される。しかしながら、アレイ100Aおよび100Bとは異なり、各行グループでは、アレイ100Cは、16の列選択レジスタおよび16の出力ドライバを含んで、32の出力シグナルVout1〜Vout32がアレイ100Cから供され得るように、可能とされた行において1度に16の画素を同時に読む。1つの例示的な実施において、完全なデータフレーム(第一および第二の行グループ4001および4002双方からの全ての画素)は50フレーム/秒のフレーム速度で獲得することができ、それにより、行の1800対が、各々、ほぼ11マイクロ秒の期間に連続的に可能とされるのを要求する。各可能とされた行では、ほぼ7マイクロ秒の間に各列選択レジスタ/出力ドライバによって250の画素(4000/16)が読まれ、(各行の最初および最後において2マイクロ秒を可能とする)。かくして、この例においては、アレイ読出シグナルVout1〜Vout32の各々はほぼ35MHzのデータ速度を有する。従前の実施形態に関しては、他の実施においては、データは50フレーム/秒以外のフレーム速度にてアレイ100Cから獲得することができるのは認められるべきである。
図13〜21との関連で先に議論された例示的アレイは0.35マイクロメートルの慣用的CMOS製造プロセスに基づくが、0.35マイクロメートル未満の特徴サイズを有するCMOS製造プロセスを使用して(例えば、0.18マイクロメートルCMOS加工技術)そのようなアレイを製造できるので、本開示に従ったアレイはこの点において制限されないことが認められるべきである。従って、5マイクロメートルよりも有意に小さい画素サイズ/ピッチを持つISFETセンサーアレイを製造することができ、有意に密なISFETアレイを供する。例えば、図22および23は、2.6マイクロメートルの画素サイズが達成される、0.18マイクロメートルCMOS製造プロセスに基づくなお他の実施形態に従ったISFETセンサーアレイ100Dおよび100Eの各ブロックダイアグラムを示す。画素の設計それ自体は、0.18マイクロメートルCMOSプロセスによるより小さなスケールに拘わらず、図20Aに示された画素105Aに実質的には基づく。
図22のアレイ100Dは2800の列1021〜1022800を含み、ここに、各列は、各々がほぼ2.6マイクロメートル×2.6マイクロメートルのサイズを有する、2400の幾何学的に四角形の画素を含む。かくして、アレイは650万を超える画素(>6.5メガ画素)を含み、1つの例示的な実施において、完全なアレイ(ISFET画素および関連回路)は、ほぼ9ミリメートル×9ミリメートルの寸法を有する集積回路チップとして製造することができる。図19〜21のアレイ100A、100Bおよび100Cと同様に、1つの態様において、図22のアレイ100Dは行4001および4002の2つのグループに分割される。しかしながら、アレイ100A、100B、および100Cとは異なり、各行グループでは、アレイ100Dは8つの列選択レジスタおよび8つの出力ドライバを含んで、16の出力シグナルVout1〜Vout16がアレイ100Dから供され得るように、可能とされた行において1度に8つの画素を同時に読む。1つの例示的な実施において、完全なデータフレーム(第一および第二の行グループ4001および4002双方からの全ての画素)は50フレーム/秒のフレーム速度で獲得することができ、それにより行の1200対が、各々、ほぼ16〜17マイクロ秒の期間で連続的に可能とされることを要求する。各可能とされた行では、ほぼ14マイクロ秒の間に各列選択レジスタ/出力ドライバによって350画素(2800/8)が読み出され、(各行の初めおよび最後において1〜2マイクロ秒を可能とする)。かくして、この例においては、アレイ出力シグナルVout1〜Vout16の各々はほぼ約25MHzのデータ速度を有する。従前の実施形態に関しては、他の実施においては、データは、50フレーム/秒以外のフレーム速度にてアレイ100Dから獲得することができるのは認められるべきである。
図23のアレイ100Eは7400の列1021〜1027400を含み、ここに、各列は、各々がほぼ2.6マイクロメートル×2.6マイクロメートルのサイズを有する、7400の幾何学的に四角形の画素を含む。かくして、アレイは5400万を超える画素(>54メガ画素)を含み、1つの例示的な実施において、完全なアレイ(ISFET画素および関連回路)は、ほぼ21ミリメートル×21ミリメートルの寸法を有する集積回路チップとして製造することができる。図19〜22のアレイ100A〜100Dと同様に、1つの態様において、図23のアレイ100Eは行4001および4002の2つのグループに分割される。しかしながら、アレイ100A〜100Dとは異なり、各行グループでは、アレイ100Eは32の列選択レジスタおよび32の出力ドライバを含んで、64の出力シグナルVout1〜Vout64がアレイ100Eから供され得るように、可能とされた行において1度に32の画素を同時に読む。1つの例示的な実施において、完全なデータフレーム(第一および第二の行グループ4001および4002双方からの全ての画素)は100フレーム/秒のフレーム速度で獲得することができ、それにより、行の3700対が、各々、ほぼ3マイクロ秒の期間に連続的に可能とされるのを要求する。各可能とされた行では、ほぼ700ナノ秒の間に各列選択レジスタ/出力ドライバによって230の画素(7400/32)が読み出される。かくして、この例においては、アレイ出力シグナルVout1〜Vout64の各々はほぼ328MHzのデータ速度を有する。従前の実施形態に関しては、他の実施においては、データは、100フレーム/秒以外のフレーム速度にてアレイ100Dから獲得することができるのは認められるべきである。従前の実施形態に関しては、他の実施においては、データは、100フレーム/秒以外のフレーム速度にてアレイ100Dから獲得することができるのは認められるべきである。
かくして、本明細書中に開示された発明的概念に基づくISFETアレイの種々の例において、ほぼ9マイクロメートルのアレイピッチ(例えば、10マイクロメートル×10マイクロメートル未満のセンサー表面エリア)は、関連行および列選択およびバイアス/読出エレクトロニクスと共に、256,000を超える画素を含めたISFETアレイ(すなわち、512×512アレイ)が、7ミリメートル×7ミリメートル半導体ダイ上に製造され、および400万を超える画素を含めた同様なセンサーアレイ(すなわち、2048×2048アレイ、4メガを超える画素)が、21ミリメートル×21ミリメートルダイ上に製造させることを可能とする。他の例において、ほぼ5マイクロメートルのアレイピッチは、ほぼ1.55メガの画素を含めたISFETアレイ(すなわち、1348×1152アレイ)および関連エレクトロニクスが、9マイクロメートル×9マイクロメートルのダイ上に製造され、および14メガを超える画素を含めたISFETセンサーアレイ、および関連エレクトロニクスが22ミリメートル×22ミリメートルのダイ上で製造されることを可能とする。なお他の実施において、0.35マイクロメートル未満の特徴サイズの可能なCMOS製造プロセス(例えば、0.18マイクロメートルCMOS加工技術)を用い、5マイクロメートルよりも有意に小さな画素サイズ/ピッチを持つISFETセンサーアレイを製造することができ(例えば、2.6マイクロメートルのアレイピッチ、あるいは8または9マイクロメートル2未満の画素/センサーエリア)、有意に密なISFETアレイを供する。
先に議論したISFETアレイの実施形態において、図9との関連で先に議論したように、アレイ画素はp−チャネルISFETを使用する。しかしながら、本開示に従ったISFETアレイはこの点において制限されず、および他の実施形態においては、ISFETアレイについての画素設計はn−チャネルISFETに基づくことができるのは認められるべきである。特に、図13および19〜23との関連で先に議論したアレイのいずれも、n−チャネルISFETに基づく画素で実施することができる。
例えば、図24は、本開示のもう1つの発明的実施形態に従った、n−チャネルISFETおよび伴うn−チャネルMOSFETで実施される図9の画素設計を示す。より具体的には、図24は、ISFET 150(Q1)がn−チャネルISFETである、列バイアス/読出回路110jと共に、アレイ列の1つの例示的画素1051(すなわち、列の最初の画素)を示す。図9の画素設計と同様に、図24の画素設計は3つの構成要素、すなわち、nの行選択シグナル(RowSel1〜RowSeln、ロジック高活性の内の1つに応答する、ISFET 150および2つのn−チャネルMOSFETスイッチQ2およびQ3を含む。図24の画素においては伝達ゲートは必要とされず、および画素の全てのデバイスは「同一タイプ」、すなわち、n−チャネルデバイスのものである。また、図9の画素設計と同様に、画素当たり4のみのシグナルライン、すなわち、ライン1121、1141、1161および1181が、図24に示された画素1051の3つの構成要素を操作するのに必要とされる。他の点においては、図9および図24の画素設計は、それらが共に、一定のドレイン電流IDjおよび一定のドレイン−対−ソース電圧VDSjにて構成されて、可能とされた画素から出力シグナルVSjを得る点で同様である。
図24のn−チャネルISFET画素設計および図9のp−チャネルISFET設計の間の主な差の1つは、画素を通っての電流の流れの反対方向である。この目的で、図24においては、エレメント106jは、アナログ回路供給電圧アースVSSAにカップリングされた制御可能な電流シンクであって、バイアス/読出回路110jのエレメント108jは、アナログ正供給電圧VDDAにカップリングされた制御可能な電流ソースである。加えて、ISFET 150の本体結合はそのソースに対してではなく、今度は、図24に示されるようにアナログアースVSSAにカップリングされた、アレイの他のISFETの本体結合にむしろ結びついている。
(一定のISFETドレイン電流および一定のISFETドレイン-ソース電圧に基づく)図9および24に示された画素設計に加えて、図25〜27に示された、本開示のなお他の発明的実施形態に従った、p−チャネルISFETおよびn−チャネルISFET双方に基づく、代替画素設計がISFETアレイについて考えられる。以下に議論するように、いくつかの代替画素設計は、アレイコントローラ250からのさらなるおよび/または修飾されたシグナルがデータ獲得を容易とすることを必要とするであろう。特に、図25〜27に示された画素設計の共通の特徴は、アレイの各列についての試料およびホールドキャパシタに加えて、各画素それ自体内に試料およびホールドキャパシタを含む。図25〜27の代替画素設計は、一般に、図9および24の画素設計よりも多数の構成要素を含むが、画素試料およびホールドキャパシタの特徴はアレイの「スナップショップ」のタイプを可能とし、ここに、アレイの全ての画素は同時に可能とされて、完全なフレームをサンプリングし、およびアレイの各ISFETに近接する1以上の分析物の測定を代表するシグナルを獲得することができる。いくつかの適用において、これは、より大きなデータ獲得スピードおよび/または改良されたシグナル感度(例えば、より高いシグナル対ノイズ比)を供することができる、
図25は、単一画素105Cおよび関連列回路110jについての1つのそのような代替設計を示す。画素105Cはn−チャネルISFETを使用し、一般に、フィードバック増幅器に基づくISFET Q1を横切る一定電圧を供するという前提に基づく(Q4、Q5およびQ6)。特に、トランジスタQ4はフィードバック増幅器負荷を構成し、および増幅器電流は、(アレイコントローラによって供される)バイアス電圧VB1によって設定される。トランジスタQ5は共通のゲート増幅器であって、トランジスタQ6は共通のソース増幅器である。再度、フィードバック増幅器の目的は、トランジスタQ3によって供給される電流を調整することによって、ISFET Q1定数を横切って電圧を保つことである。トランジスタQ2は、(例えば、画素の非常に大きなアレイを過熱することからのダメージを防止するために)、ISFET Q1が描くことができる最大電流を制限する。この最大電流は、(アレイコントローラによってやはり供される)バイアス電圧VB2によって設定される。図25に示された画素設計の1つの態様においては、バイアス電圧VB2を0ボルトに、およびバイアス電圧VB1を3.3ボルトに設定することによって、画素105Cへの電力はスイッチが切られ得る。このようにして、そのような画素の大きなアレイに供給される電力は変調され(短時間の間スイッチが入れられ、次いで、アレイコントローラによってスイッチが切られて)、同時に、アレイの総じての電力消費を低下しつつ、イオン濃度測定を得ることができる。画素に対する電力の変調は、アレイの熱の消散、および分析物溶液の潜在的加熱も低下させ、それにより、また、試料加熱からのいずれの潜在的に有害な効果も低下させる。
図25においてフィートバック増幅器(トランジスタQ3のゲート)の出力は、MOSスイッチQ7によってサンプリングされ、画素試料、および画素それ自体内のホールドキャパシタCshに貯蔵される。スイッチQ7は画素試料およびホールドシグナルpSH(アレイコントローラによってアレイチップに供される)によって制御され、これは、同時にアレイの全ての画素に適用されて、全ての画素の読みをそれらの各試料およびホールドキャパシタに同時に貯蔵する。このようにして、図25の画素設計に基づくアレイは、アレイの連続的行をサンプリングするよりはむしろ、データの全フレームがいずれかの所与の時間にサンプリングされる点で「スナップショット」アレイと考えることもできる。各画素値が対応する画素試料およびホールドキャパシタCshの上に貯蔵された後、各画素105C(ISFETおよびフィードバック増幅器)は、自由に、もう1つのpHの読みを獲得し、あるいはそれのスイッチを切って、電力を保存することができる。
図25において、画素試料およびホールドキャパシタCshの全てに貯蔵された画素値は、行選択シグナル(例えば、RowSel1)に応答してトランジスタQ9を介して可能とされる、ソースフォロアQ8を通じて、一度に1行、列回路110jに適用される。特に、行が選択され、定着された後に、次いで、今度は、画素試料およびホールドキャパシタに貯蔵された値は、列試料およびホールドシグナルCOL SHによって可能とされ、かつ列出力シグナルVCOLjとして供されるように、列試料およびホールドキャパシタCsh2に貯蔵される。
図26は、本開示の1つの実施形態に従った単一画素105Dおよび関連列回路110jについてのもう1つの代替設計を示す。この実施形態において、ISFETはp−チャネルデバイスとして示される。データ獲得サイクルの出発において、シグナルpSH(画素試料/ホールド)およびpRST(画素リセット)によって制御されたCMOSスイッチは閉じられる(これらのシグナルはアレイコントローラによって供給される)。これはISFET(Q1)のソースを電圧VRSTまで引く。引き続いて、シグナルpRSTによって制御されるスイッチが開かれ、ISFET Q1のソースは画素試料およびホールドキャパシタCshを、pHによって設定されるレベル未満の閾値まで引く。次いで、シグナルpSHによって制御されたスイッチは開かれ、行選択シグナルRowSel1に対して応答性のスイッチの操作を介して、画素出力値は列回路110jにカップリングされて、列出力シグナルVCOLjを供する。図25に示された実施形態における画素設計と同様に、画素105Dに基づくアレイは、アレイの全ての画素が同時に操作できる点で、「スナップショット」タイプのアレイである。1つの態様において、この設計は、全ての画素についての長い同時組込み時間、続いてのデータの全フレームの高速読出を可能とする。
図27は、本開示の1つの実施形態に従った、単一の画素105Eおよび関連列回路110jについてのなおもう1つの代替設計を示す。この実施形態において、再度、ISFETはp−チャネルデバイスとして示される。データ獲得サイクルの出発において、制御シグナルp1およびpRSTによって操作されるスイッチは簡単に閉じられる。これは、サンプリングキャパシタCshに貯蔵された値を明らかとし、電荷がISFET(Q1)に貯蔵されるのを可能とする。引き続いて、シグナルpSHによって制御されたスイッチが閉じられ、ISFET Q1に貯蔵された電荷が、画素試料およびホールドキャパシタCshに貯蔵されることを可能とする。次いで、シグナルpSHによって制御されたスイッチは開かれ、行選択シグナルRowSel1に対して応答性のスイッチの操作を介して、画素出力値は列回路110jにカップリングされて、列出力シグナルVCOLjを供する。次いで、シグナルpSHによって制御されたスイッチは開かれ、行選択シグナルRowSel1に対して応答性のスイッチの操作を介して、画素出力値は列回路110jにカップリングされて、列出力シグナルVCOLjを供する。利得は、Cshキャップに対するISFETキャパシタンスの比率を介して、すなわち、利得=CQ1/Csh、あるいは画素を多数回可能とし(すなわち、分析物測定の多数の試料を採取し)、次いで、キャパシタを再度設定することなく、ISFET出力を画素試料およびホールドキャパシタCshに蓄積することによって(すなわち、利得は蓄積の数の関数である)、画素105Eに供することができる。図25および26の実施形態と同様に、画素105Dに基づくアレイは、アレイの全ての画素を同時に操作することができる点で、「スナップショット」タイプのアレイである。
センサーの議論から転じ、ここで、我々は、ISFETアレイと、マイクロウェルアレイおよび付随する流体との組合せに取り組む。マイクロウェルアレイ構造の図面のほとんどは、断面のみで、あるいは単純化されたダイアグラム中のブロックのみとしてのアレイを示して表示されるので、図28Aおよび28Bは、三次元で得られた装置を可視化するために最初に読み手を援助するために掲げる。図28Aはアレイに配置された丸い円筒形ウェル2810のグループを示し、他方、図28Bは、アレイに配置された矩形円筒形ウェル2830のグループを示す。ウェルは、ウェル壁を形成する材料2840によって相互から分離され(隔てられ)ていることが見られるであろう。他の断面のウェルを製造するのは確かに可能であるが、いくつかの実施形態においては、そうするのは有利でないであろう。マイクルウェルのそのようなアレイは、ウェル当たり1以上のISFETを伴って、先に議論したISFETアレイの上に存在する。引き続いての図面においては、マイクロウェルアレイが同定されると、これらのアレイの1つを描くことができる。
多くの使用では、先に説明した高密度エレクトロニクスアレイを用いて化学反応または化学剤を検知するための系を完成するために、検知用の化学または生化学成分を含有する流体を(「画素」と呼ばれる)アレイエレメントに送達するための技術および装置が必要とされる。このセクションにおいては、望ましい特徴を伴う、そのような目的に有用な例示的技術および方法を説明する。
系の高スピードの操作が望まれるのであろうから、流体送達系は、可能な限り、全系の操作のスピードを制限しないのが好ましい。
従って、イオン濃度または他の化学的属性、または化学的属性の変化に感受性であるISFETまたは他のエレメントの高スピードの高密度アレイに対するのみならず、アレイエレメントに、評価すべき試料を、十分に小さな反応容量で供給して、検知すべき変数の検出のスピードおよび質を実質的に高めるための関連メカニズムおよび技術に対して要望が存在する。
対象化学試料のアレイエレメント:(1)試薬および洗浄流体の供給、および適当なバルビングおよび補助的装置のマクロ流体系、(2)フローセルおよび(3)多くの適用においては、マイクロウェルアレイへの送達に関与する、2つの、時々は、3つの構成要素またはサブ系、および関連方法がある。これらのサブ系の各々は、逆の方向であるが、議論する。
他の個所で議論するように、DNA配列決定におけるような多くの使用では、半導体センサーのアレイ上に、各マイクロウェルが、アレイ中の下にある画素が対応する出力シグナルを供する関係で、好ましくは唯1つのDNA−負荷ビーズを受け取るのに十分小さい、マイクロウェルの対応するアレイを設けるのが望ましい。
そのようなマイクロウェルアレイの使用は、その各々を別々に議論する、製造および調製の3つの段階を含む:(1)マイクロウェルアレイ層を含むコーティングを有するチップをもたらすマイクロウェルのアレイの創成;(2)流体界面への、およびDNA配列決定の場合におけるコーティングされたチップの設置、(3)DNA−負荷ビーズまたは複数ビーズのウェルへの負荷。もちろん、他の適用においては、ビーズは必要ないか、または異なる特徴を有するビーズを使用することができることが理解されるだろう。
本明細書中に記載された系は、chemFETのアレイを含む半導体と一体化されたミクロ流体反応チャンバーのアレイを含むことができる。いくつかの実施形態においては、本発明は、そのようなアレイを含む。反応チャンバーは、例えば、ガラス、誘電性の、感光性またはエッチング可能な材料に形成することができる。ガラス材料は二酸化ケイ素であってよい。
好ましくは、アレイは少なくとも100,000チャンバーを含む。好ましくは、各反応チャンバーは、約1:1以下のアスペクト比を有する水平方向幅および垂直方向深さを有する。好ましくは、反応チャンバーの間のピッチは、約10ミクロン以下である。
前記したアレイは、配列決定のためのキットに設けることもできる。かくして、いくつかの実施形態において、本発明は、chemFETのアレイと一体化されたミクロ流体反応チャンバーのアレイ、および1以上の増幅試薬を含むキットを含む。
いくつかの実施形態において、本発明は、chemFETの上にある誘電体層を含む配列決定装置を含み、該誘電体層は、chemFETの頂部を横方向の中心とする窪みを有する。好ましくは、該誘電体層は二酸化ケイ素で形成される。
マイクロウェル製造は、多数の方法で達成することができる。製造の現実の詳細はいくつかの実験を必要とし、利用可能な加工能力と共に変化し得る。
一般に、マイクロウェルの高密度アレイの製造は、フォトレジスト(有機または無機)、誘電体のような材料の層または複数層上に、エッチングプロセスを用いて、ウェルアレイ形状をフォトリソグラフィーによりパターニングすることを含む。パターニングは、センサーアレイ上で該材料でなすことができるか、またはそれは別々に行い、次いで、2つのいくつかの組合せの、センサーアレイチップ上に移動することができる。しかしながら、フォトリソグラフィー以外の技術は、もしそれらが許容できる結果を供するならば排除されるべきではない。
ここで、マイクロウェルアレイを形成する方法の1つの例を、図29を参照して出発し、議論する。その図面は、CMOSダイ2914上の個々のISFETセンサー2912のアレイ2910を示すチップのレイアウトの1つのコーナー(すなわち、下方左側コーナー)の頂面図を模式的に描く。シグナルライン2916および2918を、アレイにアドレスし、およびその出力を読むために用いる。ブロック2920は、先に議論したように、アレイのためのエレクトロニクスのいくつかを表し、層2922は、以下により十分に説明するように、ミクロ流体構造、フローセルの一部となる壁の部分を表し;該フローセルは、もしマイクロウェル構造がなければ、マイクロウェルアレイ上に、または直接的にセンサー表面上に流体の流動を供するその構造である。該ダイの表面には、図29の底部左側におけるパターン2922のようなパターンが、半導体加工の間に形成されて、誘電体がダイの表面をカバーする場合に、センサー画素上にウェルを位置させるための整列マークとして用いられる、ISFETおよび関連回路を形成することができる。
示されるように、半導体構造が形成された後、マイクロウェル構造がダイに適用される。すなわち、マイクロウェル構造はダイ上の右側に形成することができるか、あるいはそれは別々に形成し、次いで、ダイの上に設けることができ、いずれかのアプローチが許容できる。ダイ上にマイクロウェル構造を形成するためには、種々のプロセスを用いることができる。例えば、全ダイは、例えば、MicrochemのSU−8 2015のようなネガティブフォトレジスト、またはHD Microsystems HD8820のようなポジティブレジスト/ポリイミドで、マイクロウェルの所望の高さまでスピンコーティングすることができる。フォトレジスト層中のウェルの所望の高さ(例えば、一般的事項として制限されるものではないが、ウェル当たり1画素の例においては約4〜12μm)は、1以上の層において、(文献および製造業者の仕様を参照して、または経験的に見出すことができる)所定の速度で適当なレジストをスピニングすることによって達成することができる。(ウェルの高さは、典型的には、センサー画素の横方向寸法との対応性にて、好ましくは公称1:1〜1.5:1の縦横比、高さ:幅または直径について選択することができる。ノイズに対するシグナルの考慮に基づき、性能の所望のレベルを達成するための、寸法および必要なデータサンプリング速度の間に関係がある。かくして、所与の適応のための最適なパラメータの選択に行ける多数の因子がある。)別法として、異なるフォトレジストの多数の層を適用することができるか、あるいは誘電体材料のもう1つの形態を蒸着することができる。化学気相蒸着の種々のタイプを用いて、その中でのマイクロウェル形成に適した材料の層を形成することができる。
一旦フォトレジスト層(単数形の「層」は、同様に、集合体における多数の層を含むように用いられる)が所定の場所にあると、(典型的には、ウェル当たり4つのISFETセンサーのいずれか1つを有するようにマッピングされた)個々のウェルは、(例えば、クロムの)マスクをレジストがコーティングされたダイの上に置き、該レジストを架橋(典型的には、UV)放射線に暴露することによって生じさせることができる。放射線に暴露された全てのレジスト(すなわち、ここで、マスクは放射線をブロックしない)は架橋された状態となり、その結果、チップ(ダイ)の表面に結合された永久的プラスチック層を形成する。未反応のレジスト(すなわち、光がレジストに到達するのをブロックし、架橋を妨げるマスクのため、暴露されないエリアにおけるレジスト)は、ポリエチレングリコールメチルエチルアセテート(PGMEA)または他の適当な溶媒のような適当な溶媒(すなわち、展開液)中でチップを洗浄することによって除去される。得られた構造は、マイクロウェルのアレイの壁を規定する。
図30は、図29に示されたダイの一部に対応する、ウェル当たり1センサーの実施形態のためのクロムマスク3010の一部についてのレイアウトの例を示す。灰色のエリア3012、3014はUV放射線をブロックするものである。灰色のエリア3012内の、図30の底部左側4分の1の白色部分3016中の整列マークは、ウェルのレイアウトを、チップ表面のISFETセンサーと整列させるために用いられる。マスクの上方右側4分の1における円形3014のアレイは、放射線がウェルエリアに到達するのをブロックして、溶解することができる未反応レジストをウェルの形成に残す。
図31は、ウェル当たり4センサーの実施形態のためのマスク3020についての対応するレイアウトを示す。整列パターン3016は依然として用いられ、およびアレイ2910中の個々のウェル−マスキング円形3014Aは、今や、ウェル当たり1センサーの代わりにウェル当たり4センサーを収容するための、図30中のウェル3014として2倍の直径を有することに留意されたい。
UV放射線へのダイ/レジストの暴露の後に、レジストの第二の層をチップの表面にコーティングしてもよい。レジストのこの層は、典型的には、約400〜450μm厚みのように比較的厚くてもよい。クロムのものであってもよい第二のマスク3210(図32)を用いて、図33に示すように、基板3312上のセンサーの活性アレイを囲うレジストのカラーまたは壁(地質学的意味のその用語を用い、、盆地)3310を形成するために、アレイを囲うエリア3320をマスクする。記載される特別な例において、カラーは、x方向にてアレイの各側でセンサーアレイよりも150μm広く、y方向にて、センサーアレイよりも各側で9μm広い。(ほとんど示されない)マスク3210上の整列マークは、第一の層およびCMOSチップそれ自体上の整列マークとマッチする。
他のフォトリソグラフィーアプローチが、もちろん、マイクロウェルアレイの形成で用いることができ、これまでのは1つの例に過ぎない。
例えば、種々のエッチャントおよび展開液での種々の分解能の接触リソグラフィーを使用することができる。有機および無機の双方の材料を、マイクロウェルが形成される層で用いることができる。層は、不動態化層のようなセンサーアレイ中の画素構造上に誘電体層を有するチップ上にエッチングすることができるか、層は別々に形成し、次いで、センサーアレイ上に適用することができる。具体的な選択またはプロセスは、アレイサイズ、ウェルサイズ、利用可能な製造施設、許容されるコスト等のような因子に依存する。
マイクロウェル層を形成するためにいくつかの実施形態に用いることができる種々の有機材料の中には、ネガティブ−作用性フォトレジストの前記したSU−8タイプ、慣用的なポジティブ−作用性フォトレジスト、およびポジティブ−作用性感光性ポリイミドがある。各々は、フォトリソグラフィー分野に精通した者によく知られたその利点およびその欠点を有する。
当然、生産環境において、改変が適切であろう。
接触リソグラフィーはその制限を有し、それはウェルの最高密度を生じさせる選択された生産方法ではなく、すなわち、それは横方向の制限を所望の最小ピッチよりも高く課すことができる。深UV工程および反復プロセスのような他の技術はより高い分解能のリソグラフィーを供することができ、それを用いて、小さなピッチおよび恐らくはより小さなウェル直径を生じさせることができる。もちろん、異なる所望の仕様(例えば、センサーの数およびチップ当たりのウェル)では、異なる技術は最適であることが証明されよう。そして、製造業者に利用可能な製造プロセスのような実用的な因子は、特異的製造の方法の使用を動機付けることができる。新規な方法を議論するが、本発明の種々の態様はこれらの新規な方法の使用に制限される。
好ましくは、ISFETアレイを伴うCMOSウェハーは、最終金属化プロセス後に平面化される。窒化ケイ素不動態化に先立った化学機械的誘電性平面化が適当である。これは、引き続いてのリソグラフィー工程が、裏側端部CMOSトポグラフィーが関連しない非常に平坦な表面で行われるのを可能とするであろう。
深−UV工程および反復リソグラフィー系を利用することによって、優れた分解能、登録、および反復可能性にて小さな特徴を分解するのが可能である。しかしながら、これらの系の高い分解能および大きな開口数(NA)は、それらが大きな深さの焦点を有するのを排除する。それ自体、そのような製造系を用いる場合、より薄いフォト規定可能スピン−オン層(すなわち、接触リソグラフィーで用いるより厚い層よりはむしろ1〜2μmのオーダーのレジスト)を用いて、下にある層または複数層に対してマイクロウェルの特徴をパターン移動し、次いで、エッチングする必要があろう。次いで、高分解能リソグラフィーを用いて、マイクロウェルの特徴をパターニングし、慣用的SiO2エッチ化学を用いることができ−選択的エッチストップを有する、ボンドパッドエリアおよび、次いで、マイクロウェルエリアについて各々1つ;次いで、エッチストップは、各々、アルミニウムボンドパットおよび窒化ケイ素不動態化(等)上とすることができる。別法として、他の適当な代替パターン移動およびエッチプロセスを使用して、無機材料のマイクロウェルを供することができる。
もう1つのアプローチは、有機材料においてマイクロウェル構造を形成することである。例えばデュアル−レジスト「ソフト−マスク」プロセスを使用することができ、それにより、薄い高−分解能の深−UVレジストを、より厚い有機材料(例えば、硬化されたポリイミドまたは反対−作用性レジスト)の頂部で用いる。頂部レジスト層をパターニングする。酸素プラズマ反応性イオンエッチプロセスを用い、パターンを移動させることができる。このプロセスの配列は、時々、「ポータブル的合成マスク」(PCM)技術と言われる。B.J. Lin et al.,「Practicing the Novolac deep−UV portable conformable masking technique」,Journal of Vacuum Science and Technology 19,No.4,1313−1319(1981);およびA.Cooper et al,「Optimization of a photosensitive spin−on dielectric process for copper inductor coil and interconnect protection in RF SoC devices」参照。
別法として、「ドリル−フォーカシング」技術を使用することができ、それにより、数回の順次の工程−および−反復暴露を異なる焦点深さで行って、厚いレジスト層をパターニングする場合に、高−分解能ステッパーの焦点の制限された深さ(DOF)を補償する。この技術は、ステッパーNAおよびDOFならびにレジスト材料のコントラスト特性に依存する。
Edwards et al.による米国特許出願公開第2006/0073422号に示されたようなもう1つのPCM技術をこれらの目的に適合させることができる。これは3−層PCMプロセスであって、これを図33Aに示す。そこに示されるように、基本的には、マイクロウェルアレイを製造するのに6つの主な工程が必要とされ、結果は、接触リソグラフィーが生じるであろうものとかなり同様である。
最初の工程3320において、タイプShipley InterVia Photodielectric Material 8021 (IV8021) 3322のような高コントラストネガティブ−作用性フォトレジストの層を、我々が(センサーアレイが製造される)図33の基板3312を供するウェハーであると推定する、ウェハーの表面にスピンされ、ソフトベイク操作を行う。次に、工程3324において、ブロッキング抗−反射コーティング(BARC)層3326を適用し、ソフトベイキングを行う。この構造の頂部に、薄いレジスト層3328をスピンし、ソフトベイキングを行い、工程3330、レジストの薄い層は微細な特徴規定に適している。次いで、レジスト層3328をパターニングし、暴露し、展開し、レジスト3328によってもはや保護されない暴露された領域3329中のBARCを除去する、工程3332。これは、領域3329を未硬化IV8021層へと下方に開く。BARC層は、今や、コンフォーマル接触マスクのように作用することができる。フラッディング暴露ツールでのブランケット暴露、工程3334、暴露されたIV8021を架橋し、今や、これは3322における未硬化IV8021から区別されて示される。次いで、1以上の展開液工程3338が行われて、領域3336中の架橋されたIV8021を除いて全てのものを除去する。領域3336は、今や、マイクロウェルの壁を構成する。
先に示されたように、ウェルはISFETの頂部不動態化層上にボトムアウト(すなわち、終了)されるが、(すなわち、シグナル対ノイズ比のような)ISFETセンサー性能の改良が、もし活性ビーズがISFET不動態化層からわずかに上昇して維持されるならば、得ることができる。それを行う1つの方法は、スペーサー「バンプ」を画素マイクロウェルの境界内に置くことである。これがどのようにして行われるかの例は、別々の層を蒸着し、リソグラフィーにより規定し、エッチングして「バンプ」を形成することによって、一旦マイクロウェルが完了すれば、バンプのための永久的フォト−規定可能材料を用いることによって、またはマイクロウェルを形成するのに先立ってバンプを形成することによって、マイクロウェル構造を形成するのに層−または−複数の層の一部をエッチングにより除去するのではない(すなわち、マイクロウェルを形成するための2つのリソグラフィー工程−1つの1部をエッチングするためのものであり、他方はバンプをパターニングし、該エッチを仕上げてボトムアウトするためのもの)。バンプ特徴は図33B中に3350として示される。別法としての(またはさらなる)非−一体化アプローチは、ウェルに、DNA−担持ビーズを負荷する前に層または非常に小さなパッキングビーズ2つを負荷するものである。
マイクロウェル形成のためのSiO2−様層としてのテトラ−メチルーオルト−シリケート(TEOS)の6μm(ミクロン)の厚みの層を用い、図33B−1は、本明細書中に教示されるアレイアーキテクチャーの部分3300Aの断面の走査型電子顕微鏡(SEM)像を示す。マイクロウェル3302Aは、TEOS層3304Aに形成される。ウェルは、約4umだけ6um厚みの層内に延びる。典型的には、例えば、酸化物、有機材料、またはエッチ−ストッピング使用のための半導体加工で知られた他の適当な材料であってよいエッチ−ストップ材料の底に突き当たる。エッチストップ材料の薄い層は、ウェル底部、および延長されたゲート電極3008Aがアレイ中の各下にあるISFETについて形成されるチップのMetal4(M4)層の間に約2umのエッチストップ+ポリイミドがあるように、ポリイミドのより厚い層または他の適当な誘電体の頂部に形成することができる。側面に標識されるように、より低いレベルの相互結合および構造を形成するCMOS金属化層M3、M2およびM1が示され、ISFETチャネルは矢印3310Aによって示されるエリアに形成される。
(頂部から下を見る)直交断面図において、ウェルは丸いまたは四角い形状いずれかで形成することができる。丸いウェルはビーズ捕獲を改良することができ、ウェルの底部または頂部においてビーズをパッキングする必要性を解消することができる。
マイクロウェルの側面に対するテーパーを付した傾きを用いて、有利とすることもできる。図33B−2を参照し、もしビーズ3320Aがウェルを横切った底部スパンよりも大きな直径を有するが、ウェルのマウスに嵌合するのに十分小さいならば、ビーズは、幾何学的拘束のためウェルの底部から空間的に離されるであろう。例えば、図33B−2は、3.8um直径のビーズ3320Aが負荷された側面4umにて、頂部から見た断面が四角形であるマイクロウェルの例を示す。実験的に、かついくらか計算すると、適当なビーズのサイズおよびウェル寸法の組合せを決定することができる。図33B−3は、明らかに、相対的に小さく、かつウェルの底までずっと下る、2.8um直径のビーズ3322A;ウェルの側壁テーパーによって底部に到達することが停止された4.0um直径のビーズ3324A;およびビーズ3328Aをパッキングすることによってウェル底部から間隔が設けられた3.6um直径の中間サイズのビーズ3326Aが負荷された1つの4umウェルの一部を示す。明らかに、ビーズのサイズは、マイクロウェルのエッチテーパーに注意深くマッチさせなければならない。
かくして、マイクロウェルは、必要な厚み、(例えば、4〜10um)を供することができるいずれかの高縦横比のフォト−規定可能なまたはエッチング可能な薄い−フィルムプロセスによって製造することができる。適当であると考えられる材料の中には、感光性ポリマー、蒸着された二酸化ケイ素、例えば、プラズマエッチングプロセスなどを用いてエッチングすることができる非−感光性ポリマーがある。二酸化ケイ素ファミリーにおいては、TEOSおよびシラン一酸化窒素(SILOX)は適当なように見える。最終の構造は、標的生物学または化学を異なって反応させることができる表面組成が異なって存在する種々の材料を除いて同様である。
マイクロウェル層が形成されると、エッチングプロセスが望むよりもさらに進まないように、エッチストップ層を設けることが必要であろう。例えば、低−K誘電体のような、維持されるべき下の層があってよい。エッチストップ材料は、適用に従って選択されるべきである。SiCおよびSiN材料は適当であってよいが、それは、代わりに、他の材料を使用することができないことを示すことは意味しない。これらのエッチ−ストップ材料は、ゼロ電荷の適当な点(PZC)を有するようにエッチ-ストップ材料を選択することによりISFETセンサー感受性を駆動する表面化学をまた強調する役目を果たす。種々の金属酸化物は、二酸化ケイ素および窒化ケイ素に加えて適当であろう。
種々の金属酸化物のためのPZCは、J.Fierroによる「Metal Oxides−Chemstry and Applications」のような種々のテキスト中で見出すことができる。我々がAl2O3のPZCが用いられるpH(すなわち、約8,8)において右であって、よって、ゼロ電荷の点において右であるゆえに、Ta2O5はAl2O3よりもエッチストップとして好ましいであろうことを学習した。加えて、Ta2O5は、センサー性能においてもう1つの重要な因子であるpHに対するより高い感度(すなわち、mV/pH)を有する。これらのパラメータの最適化は、不動態化表面材料の思慮深い選択を必要とするであろう。
この目的での(すなわち、エッチストップ層としての)薄い金属酸化物の材料の使用は、それらがかなり薄く蒸着される(典型的には、200〜500A)という事実のため困難である。ポスト−マイクロウェル製造金属酸化物蒸着技術は、適当なPZC金属酸化物フィルムを、高い縦横比のマイクロウェルの底部に置くことを可能とし得る。
(a)反応スパッタリングされた酸化タンタル、(b)非−反応性化学量論的酸化タンタル、(c)酸化タングステン、または(d)酸化バナジウムの電子線蒸着は、蒸着プロセスの優れた方向性のため、優れた「ダウン−イン−ウェル」被覆を有することが判明するであろう。
アレイは、典型的には、その各々が1以上のchemFETセンサーにカップリングされた少なくとも100のミクロ流体ウェルを含む。好ましくは、ウェルは、ガラス(例えば、SiO2)、ポリマー材料、感光性材料または反応性イオンエッチング可能の薄いフィルム材料の少なくとも1つに形成される。好ましくは、ウェルは、1:1未満の高さに対する幅の比率を有する。好ましくは、センサーは電界効果トランジスタ、より好ましくはchemFETである。chemFETは、所望により、PPi受容体にカップリングしていてもよい。好ましくは、chemFETの各々は、102ミクロン以下のアレイのエリアを占める。
いくつかの実施形態において、本発明は、そこで反応チャンバーが形成される、ガラス(例えば、SiO2)、高分子の感光性または反応性イオンエッチング可能材料のような誘電体層にカップリングされた半導体ウエハーデバイスを含む配列決定デバイスを含む。典型的には、該ガラス、誘電体、高分子の感光性または反応性のイオンエッチング可能材料は、半導体ウェハー層と一体化される。いくつかの例において、該ガラス、高分子の感光性または反応性エッチング可能層は非−結晶性である。いくつかの場合において、ガラスはSiO2であってよい。デバイスは、所望により、さらに、ポリマー材料、好ましくは、射出成形材料のような適当な材料の流体送達モジュールを含むことができる。より好ましくは、ポリマー層は、ポリカーボネートである。
いくつかの実施形態において、本発明は:フォトリソグラフィーを用い、トランジスタのアレイの頂部にガラス、誘電体、感光性または反応性イオンエッチング可能材料中にウェルを生成させることを含む、配列決定デバイスを製造する方法を含む。
試料中のDNAを配列決定するためのマイクロウェルのアレイと組合せたチップ上のセンサーのアレイのアセンブリを用いるプロセスを、「実験」という。実験の実行は、ウェルにDNA−結合ビーズを負荷すること、およびウェルを横切ってのいくつかの異なる流体溶液(すなわち、試薬および洗浄液)の流動を必要とする。流体界面とカップリグされた流体送達系(例えば、バルブ、導管、圧力源など)が必要であり、これは、供用可能に小さなデッドボリューム、および順次の溶液の間の小さな交差汚染を伴う、制御された均一な流れ中のウェルを横切って種々の溶液を流す。理想的には、(時々、「フローセル」といわれる)チップへの流体界面は、流体を同時に全てのマイクロウェルに到達させるであろう。アレイスピードを最大化するためには、アレイ出力は可能な限り同一時間近くに利用可能であることが必要である。理想は明らかに可能でないが、種々のウェルにおいて導入された流体の到着回数の差またはスキューを最小化して、アレイからの全てのシグナルの総じての獲得スピードを最大化するのが望ましい。
多くの構成のフローセル設計が可能であり;かくして、本明細書中で提供する系および方法は、特異的フローセル構成の使用に依存し〜かしながら、適当なフローセルが目的の以下の組に実質的に適合するのが望ましい:例えば、適当なサイズのチューブを介して、流体送達系と相互結合するのに適した結合を有すること;ウェル上方に適当なヘッドスペースを有すること;流体が遭遇するデッドボリュームを最小化すること;流体と接触しているが、フローセルを通っての洗浄流体の流動によって迅速には奇麗に掃除されない小さな空間を最小化して(交差汚染を最小化すること);アレイ上の流動の均一な通過時間を達成されるように構成されていること;ウェル上の流動中に最小の泡を発生させまたは増やすこと;流動チャンバーの内側、またはそれにできるだけ近い除去可能な参照電極の設置に適合すること;ビーズの容易な負荷を促進すること;許容できるコストで製造可能なこと;および容易に組み立てられ、チップパッケージに付着されること。
これらの基準の満足は、可能な限り、積極的に系の性能に貢献するであろう。例えば、泡の最小化は、アレイからのシグナルが、誤ったノイズであるよりもむしろウェル中の反応を真に示すように重要である。
いくつかの例の設計の各々を議論し、これらの基準を異なった方法かつ程度で満足させる。各場合においては、典型的には、2つの方法:フローセルをフレームに付着させ、フレームをチップに接着させる(またはそうでなければそれを付着させる)ことによって、あるいはフレームをフローセルの構造に一体化させ、この統合されたアセンブリをチップに付着させることによって;の内の1つで設計を選択して実施することができる。さらに、設計は、参照電極を配置に一体化させることによって、カテゴリー化することができる。設計に依存して、参照電極はフローセルに一体化させ(例えば、流動チャンバーの天井の一部を形成し)、または(典型的には、センサーアレイ後に、出口に、または流路の下流側へ)流路中に入れることができる。
そのような流体界面を一体化させる適当な実験装置3410の最初の例は、図34〜37に示され、その製造および構築は以下により詳細に議論されるであろう。
装置は、ウェルおよびセンサーのアレイが形成される(隠れているが、一般的には示される)半導体チップ3412およびチップの頂部の、読むために試料をチップに送達する流体アセンブリ3414を含む。流体アセンブリは試料を含有する流体を導入するための部分3416、流体がパイプを通って外に出ることを可能とするための部分3418、および流体が入口から出口へ、ウェル中の材料と相互作用する道に沿って流動させるための流動チャンバー部分3420を含む。それらの3つの部分は、ガラススライド3422を含むインターフェイスによって統合されている(例えば、Erie Scientific Company, Portsmouth, NHからのErieマイクロアレイカタログ番号C22−5128−M20,3分の1に切断、各々はサイズが約25mm×25mm)。
ガラススライドの頂部面には、Oak Harbor,WAのUpchurch Scientificからのナノポートフィッティング部品番号N−333のような2つのフィッティング3424および3426が設置されている。1つのポート(例えば、3424)は、以下に記載されるがここでは示されていないポンピング/バルビング系からの液体を送達する入口として働く。第2のポート(例えば、3426)は、液体をパイプで送って廃棄する出口である。各ポートは、適当な内径のフレキシブルなチューブのような導管3428、3432に連結される。ナノポートは、チューブがガラススライド中の対応する穴を貫くことができるように設置される。チューブ開口はスライドの底部表面と同一平面とすべきである。
ガラススライドの底部上では、流動チャンバー3420は、マイクロウェルアレイを横切っての層流を実質的に促進するための種々の構造を含むことができる。例えば、入口パイプから流動チャンバーのエッジにかけて広がる一連のミクロ流体チャネルは、Newton,MAのMicroChem Corp.からのSU−8フォトレジストのようなポジティブフォトレジストを用いる接触リソグラフィーによってパターニングすることができる。他の構造は以下に議論する。
チップ3412は、今度は、パッキング、およびコネクターピン3432への結合のために、キャリア3430に対して設置される。
記載の容易性のために、図38で出発する製造を議論するために、今や、我々は、それが図34〜37中に有する向きに対してひっくり返されるべきガラススライド3422を考慮する。
フォトレジスト3810の層はスライドの「頂部」に適応され(それは、スライドおよびそのさらなる層が回転され、ISFETアレイとその上のマイクロウェルアレイとのセンサーアセンブリに対して設置される場合に、「底部」側となる)。層3810は、この例においては約150μmの厚みとすることができ、それは、ナノポート中のチューブの端部から、センサーアレイチップのエッジまで層を運ぶ主な流体を形成するであろう。層3810は、図39のマスク3910のようなマスクを用いてパターニングされる(「パターン化された」は、放射線源を用いて、マスクを通じてレジストを露出させ、次いで、非−可塑化レジストを除去することを意味する)。マスク3910は、白色として示される放射線−透明領域、および放射線−ブロッキング領域3920を有し、それらは陰影をつけて示される。放射線−ブロッキング領域は3922〜3928におけるものである。領域3926は、センサーアセンブリの周りにチャネルを形成し;それはマスク3920の外側境界から約0.5mm内側に形成されて、典型的なエッジビーズを回避する。領域3922および3924は、レジストの対応する部分が示されたような形状のボイドを形成するために除去されるように、放射線をブロックするであろう。領域3922、3924の各々は、対応するナノポート3424、3426を通過するチューブ3428、3432の対応する1つの端部を受け取るような寸法の丸い端部を有する。丸い端部から、領域3922、3924は、センサーアレイの方向に広がって、アレイを横切っての流動が実質的に層流となるように、液体を広がらせることができる。領域3928は単純に整列パターンであって、いずれかの適当な整列パターンであってもよく、あるいは適当な代替整列メカニズムによって置き換えられていてもよい。図38のダッシュ線は、マスク領域3922および3924下でのボイド3822および3824の形成を示すために設けられている。
フォトレジストの第二の層が、レジスト3810またはスライド3422の上ではなく、かなり別々に形成される。好ましくは、それは(図示しない)平坦なフレキシブルな表面に形成されて、剥離式のパターニングされたプラスチック層を作り出す。図40に示されるように、フォトレジストのこの第二の層はマスク4010のようなマスクを用いて形成することができ、これは、パターニング後に、フレキシブルな基板の上に、その使用は以下に議論される、領域4012下の境界、領域4014、4016下の2つのスリット、およびパターニングされた領域4018および4022によって生じた整列マークを残す。次いで、例を挙げるならば、これらの層の整列のために、パターン4018によって生じた、1つの整列マークまたは整列マークの組を用い、フォトレジストの第二の層がフォトレジストの第一の層に適用される。次いで、第二の層がそのフレキシブルな基板から剥離され、後者は除去される。
パターン4022によって生じた他の整列マークまたはマークの組は、議論すべき引き続いての層との整列のために用いられる。
第二の層は好ましくは約150μmの深さであって、スリット−形成領域4014および4016下の、センサーアレイチップの各エッジにおけるスリット約150μm長を例外として、それは流体を運ぶチャネルをカバーする。
一旦、フォトレジストの第二の層が第一の層の上に設けられれば、フォトレジストの第三のパターニングされた層は、図41に示されるマスク4110のようなマスクを用いて第二の層の上に形成される。第3の層は、センサーチップアレイ上のカラー3310と同程度の幅である(図33参照)が、約300μmより狭い領域4112下にバッフル部材を供して、第一の層の流体を運ぶチャネルとの重複を可能とする。第三の層は約150μmの厚さとすることができ、それは、150μmだけ、それにより形成された盆地のフロアに向けてチップカラー3310を貫通するであろう。この構成は、センサーアレイチップ上のウェルの上方に約300μmのヘッドスペースを残すであろう。流体は、4014、4016下の150μmスリットを通るセンサーアレイの全幅に沿ってウェルを横切って流動する。
図36は、流体流路をより見えるようにするために拡大された、図34および35においての描かれた、ミクロ流体およびセンサーアセンブリの前記例の実施形態の、斜視図における、部分的断面図を示す。(流路の半分のさらなる拡大模式図を図37に示す)。ここに、流体は入口パイプ3428を介して入口ポート3424に進入するのが分かるであろう。パイプ3428の底部において、流体は、マスクエリア3922によって形成された流動拡大チャンバー3610を通って流動し、流体はカラー3310上を流れ、次いで、盆地の底部3320に向けて下方に、およびそのマイクロウェルアレイと共にダイ3412を横切って流れる。アレイ上を通過した後、次いで、流体はカラー3310の遠い壁において垂直に回転し、マスクエリア3924によって形成された流動濃度チャンバー3612への、およびそれを横切って、カラーの頂部上を流れ、出口ポート3426中の出口パイプ3432を介して出る。アレイの中央から出口にかけての、この流動の一部は、図37の拡大模式図においても見ることができ、ここに、矢印は流体の流れを示す。
流体アセンブリは、整列において、接着剤を、それらの2つのアセンブリの表面に接合する部品に適応し、次いで、それを一緒にプレスすることによって、センサーアレイチップアセンブリに固定することができる。
図34〜36に示されていないが、参照電極は、流動チャンバーの天井において、図37に示されるように、金属化3710であると理解することができる。
参照電極を導入するもう1つの方法は図42に示される。そこでは、穴4210は流動チャンバーの天井に設けられ、(例えば、シリコーンの)グロメット4212がその穴に嵌合され、それを通って参照電極4220を挿入することができる中央通路または穴を供する。(図42には示されていないが、図42Aとの関連で後に議論される)バッフルまたは他のミクロ特徴は流動チャネルにパターニングされて、マイクロウェルアレイ上での層流を促進することができる。
均一な流れの先頭を達成し、問題の流路エリアを排除するのは、多数の理由で望ましい。1つの理由は、系のフローセル内の流体界面の非常に速い転移が多くの適用、特に遺伝子配列決定で望まれることである。換言すれば、入ってくる流体は、短時間で従前の流体を完全に置き換えなければならない。不均一な流体速度およびフローセル内の拡散、ならびに問題の流路はこの要求に競合し得る。三角形断面の導管を通っての単純な流動は、側壁に隣接するものに対して流動容量の中心近くの領域からの流体速度のかなりの不均衡を呈しかねず、1つの側壁はマイクロウェル層の頂部表面であり、流体はウェル中にある。そのような不均衡は、2つの移動する流体の間の空間的かつ時間的に大きな濃度勾配に導く。さらに、泡は、フローセル内部の鋭いコーナーと同様に淀みエリアに捕獲され、またはそこで生じるようである。(表面エネルギー(親水性vs.疎水性)は泡の滞留に有意に影響し得る。もし、成形された表面が余りにも疎水性であれば、加工の間の表面汚染の回避、およびより親水性の表面を作り出すための表面処理の使用が考えられる。)もちろん、流動チャンバーの物理的配置は、恐らくは、流れの先頭で達成可能な均一性の程度に最も影響する因子である。
1つのアプローチは、フローチャンバーの流動断面を、通過回数がアレイを横切って均一となるように、アレイ幅を横切って変化する流動速度を達成するように構成することである。例えば、ディフューザー(すなわち、流動拡大チャンバー)セクション3416、3610の断面は、4204Aにおけるように、単純に矩形である代わりに、図42A中の4204Aに示されるように作成することができる。すなわち、それは曲った(例えば、凹)壁を有することができる。ディフューザーの非−平坦壁4206Aは頂部または底部となることができる。もう1つのアプローチは、アレイ上の入口から出口までの全路長が実質的に同一となるように、アレイへの有効な路長を構成することである。これは、例えば、流動方向に対して垂直向きのシリンダーまたは他の構造のような流動−破壊特徴を流動の通路に入れることによって達成することができる。もし流動チャンバーがフロアとしてのマイクロウェルアレイの頂部、および天井としての対向壁を有するならば、これらの流動−破壊構造を、マイクロウェル層の頂部に、または天井壁上(または中)のいずれかに設けることができる。構造は、所望の効果を有するように、流れに十分に突出していなければならないが、小さな流れの乱れさえかなりのインパクトを有し得る。図42B〜42Fに転じ、そのような構造の模式的ないくつかの例が示される。図42Bにおいて、マイクロウェル層4210Bの表面に、流動チャンバー天井壁4212Bに向かって垂直に延び、および矢印Aの方向に移動する流体についての層流を乱すように働く一連の円筒形流動ディスラプタ4214Bが形成される。図42Cは、流動ディスラプタ4216Cが円い頂部を有し、バンプ、恐らくは、半球または球形頂部を持つ円筒により似て見えることを除いて、同様な配置を描く。対照的に、図42Dにおいては、流動ディスラプタ4218Dは、流動チャンバーの天井壁4212Bから突出しているか、または垂れ下がっている。流動ディスラプタのただ1つの列が示されるが、複数のより多い、またはより少ない平行列が典型的には要求されるのは認められるであろう。例えば、図42Eは、(天井壁4212Bから外方に突き出しているそのような流動ディスラプタのいくつかの列4202Eを示す(が、向きは図42B〜42Dに対して上下逆である)。複数のディスラプタおよびそれらの高さの間の間隔は、それにわたって、通過時間が平衡するように、流動プロフィールが放物線状になる距離に影響するように選択することができる。
図42Fおよび42F1に示されるもう1つの構成は、ディスラプタとしての固体のビーム−様突出またはバッフル4220Fの使用を含む。この概念を用いて、流動チャンバーのための天井部材を形成することができる。そのような配置はより均一な流体流動を刺激し、ディスラプタ構造が無い単純な矩形断面として比較して、流動置換回数を有意に低下させる。さらに、1つのエッジに沿って起こるアレイへの流体の進入の代わりに、流体を小さなポートを通って1つのコーナー4242Fにおいて導入してもよく、およびそのコーナーエリアと流体連通したポートを介して、反対コーナー4244Fから出てもよい。該一連の平行バッフル4220Fは、一連のチャネルへの入口および出口コーナーの間で流動容量を分離する。最低の流体抵抗路は、バッフルに対して垂直な、チップのエッジに沿っている。入ってくる流体がこのチャネルを満たすにつれ、次いで、流体はバッフルの間でチップの反対側に向けられる。各バッフル対の間のチャネル深さは、好ましくは、流動が最も遠いチャネルを通って出口ポートに向けて移動するように刺激され、それにより、バッフルの間の流動先頭を均一とするように、チップを横切って段階的とされる。バッフルはほとんどチップ(すなわち、マイクロウェル層)表面まで下方に延びるが、それらはかなり薄いゆえに、流体はそれらの下で迅速に拡散し、アレイアセンブリの関連エリアを露出させることができる。
図42F2−42F8は、バッフル4220F、流動チャンバーに対する天井、流体入口および出口ポートおよび参照電極さえを設けるのに用いることができる(好ましくは、ポリカーボネートの)単一ピースの射出成形されたフローセル部材42F200の例を示す。図42F7は、部材42F200の底部のバッフルの拡大図を示し、バッフルは図42F6中の部材42F200の下面の一部として示される。射出成形によって小さな寸法で矩形特徴を形成するのは困難であるので、4220F’として示されたこれらのバッフルの特別な例は断面で示した三角形である。
図42F2においては、それらの間に形成されたシール42F202、およびセンサーアレイチップのパッケージから垂れ下がった接触ピン42F204と共に、センサーアレイパッケージ42F300上に設置された部材42F200の頂面等尺図がある。図42F3および42F4は、各々、図42F5のセクション線H−HおよびI−Iを通るセクションを示し、それは、関係において、センサーアレイチップ42F250、バッフル4220F’および入口42F260および出口42F270ポートを介する流体流路を見ることができる。
金属化を部材42F200の底部42F280に適用することによって、参照電極を形成することができる。
種々の他の位置およびアプローチを、流体流動を流動チャンバーに導入するために、同様に用いることができる。例えば、図57〜58に示されるように、流体をチップアセンブリ42F1のエッジの幅を横切って導入することができる実施形態に加えて、あるいは流体を、図42F1におけると同様に、チップアセンブリの1つのコーナーにおいて導入することができる。例えば、流体を、4254Gにおけるように、入口導管4252Gを通って流動させて、隣接して、かつチップの中央に向けて排出させ、導入点から径方向外側に流動される図42Gおよび42Hにおけるように、流体を導入することもできる。
図42Iおよび42Jは、図42Gおよび42Hとの関連で、そのような構造およびその操作の例を断面にて描く。より以前の例とは対照的に、この実施形態はさらなるエレメント、ダイヤフラムバルブ4260Iを含有する。最初に、図42Hに示すように、該バルブ4260Iが開き、(図示しない)廃棄レソルボアへの導管4262Iを介する通路を供する。開いた弁は、廃棄レソルボアまたは出口への低いインピーダンス流動を供する。次いで、図42Jにおけるように、空気圧力をダイヤフラムバルブに適用し、低インピーダンス通路を閉じ、流体流動を、流動チャンバーの天井を形成する部材4266J中の中央穴4264Jを通って下方に、かつチップ(センサー)アセンブリを横切って継続させる。該流動は前記したようにセンサーのエッジにてチャネルによって収集され、導管4268Jを介して廃棄出口に向けて出る。
このアイディアについてのバリエーションは図42K〜42Mに描かれており、これはチップアセンブリの中央ではなく、その代わり、1つのコーナー4272Kにおいて導入される流体を示す。それはライン4274Kによって記号的に示されるように、チップ3412を横切って流動し、対角線方向に対向するコーナー4276Kにおいて除去される。この概念の利点は、全てではないが、それはいずれの淀み点も排除するものである。それは、流動が底部において導入され、頂部において除去されて、泡の一掃を助けるように、センサーアレイは垂直に位置させることができるという利点も有する。このタイプの実施形態は、ところで、アレイの中心に導入された流動についての実施形態の4分の1として考えることができる。閉じた、かつ流動を廃棄出口またはレソルボアに押しやるバルブ4278Lでの実施の例を図42Lに示す。図42Iおよび42Jの実施形態に関する主な差は、流体流動がその中心におけるよりはむしろアレイのコーナーにおいて導入されることである。
全ての場合において、試薬サイクルの間に、マイクロウェルに沿って、全流動チャンバーの徹底的な洗浄を確保するのに注意を向けるべきである。流動の乱れは、流動チャンバーを十分に洗浄する挑戦を悪化しかねない。
また、流動の乱れは流体中の泡を誘導し、または増加させかねない。泡は流体がマイクロウェルに到達するのを妨げ、あるいはマイクロウェルへのその導入を遅延させかねず、マイクロウェルの読みに誤差を導入し、またはそのマイクロウェルからの出力を、アレイからの出力の処理において無益なものとする。かくして、これらの潜在的有害因子を管理するために、流動ディスラプタについての構成および寸法を選択するにおいて注意を払うべきである。例えば、ディスラプタエレメントの高さ、および望まれる速度プロフィール変化の間でトレードオフをなすことができる。
図43〜44は、もう1つの別法フローセルの設計4310を示す。この設計は、フローセルを完成させるための、チップに付着させるべき単一のプラスチックピースまたは部材4320の成形に依拠する。流体系への結合は、4330および4340におけるプラスチックピース中の適当な穴に軽く打ちこまれた螺合結合を介してなされる。あるいは、もし部材4320がポリジメチルシロキサン(PDMS)のような材料で作成されているならば、結合は、単に、部材4320中の適当なサイズの穴にチューブを挿入することによってなすことができる。この設計の垂直断面を図43〜44に示す。この設計は、(示された固体壁、または下方に延びるフェンス−様壁を形成する一連の吊り下がっている間隔を設けられた脚であってよい)張り出したプラスチックカラー4350を用いて、チップパッケージを包み、プラスチックピースをチップパッケージまたは他の適当な構造と整列させ、それにより、チップフレームをフローセル形成部材4320と整列させることができる。液体は、開口4330、4340のうちの1つを介してフローセルに、よって、流動チャンバーに向けて下方に向けられる。
示された実施形態において、参照電極は、部材4320中の穴4325を介して流動チャンバーの頂部に導入される。除去可能な参照電極の設置は、シリコーンスリーブ4360およびエポキシストップリング4370によって促進される(図44の拡大参照)。該シリコーンスリーブは密なシールを提供し、エポキシストップリングは電極がフローセルへ余りにも遠く挿入されるのを妨げる。もちろん、他のメカニズムを同一目的で使用することができ、電極を停止させるための構造を使用する必要はないであろう。そして、もしPDMSのような材料を部材4320のために用いるならば、該部材それ自体は、電極が挿入されると、水密シールを形成し、シリコーンスリーブの必要性を解消する。
図45および46は、部材4510が参照電極を受け取るための穴を欠如する以外は同様な配置を示す。その代わり、参照電極4515が中央部分4520の底部に形成されるか、またはそれに付着され、流動チャンバーの天井の少なくとも一部を形成する。例えば、部材4510をチップパッケージに設置した後に、金属化層を、中央部分4520の底部に適用することができる。
図47〜48は図43〜44に示された実施形態の変形であるもう1つの例を示すが、ここに、フレームはフローセルの一部として製造され、むしろ、チップ表面に従前に付着されたフレームに流動ポート構造を付着させる。このタイプの設計においては、アセンブリは幾分よりデリケートである。というのは、チップに対するワイヤボンドはチップをカプセル化するエポキシによって保護されていないからである。この設計の成功は、正確な設置、および一体化された「フレーム」のチップの表面への確実な接着に依存する。流動チャンバーの天井にある参照電極4910を備え、およびフローセルの一部として製造されたフレームを備えた、図45〜46のそれに対するカウンターパート実施形態は図49〜50に示される。
図51〜52に示される流体アセンブリに対するなおもう1つの別法は、チップパッケージ5130の頂部からスタンド−オフ5120上に約5.5mmだけ隆起した流体部材5110を有する。これは、オペレータが、プラスチックピース5140およびチップ表面の間の結合の質を目で精査し、もし必要であれば、結合を外から補強するのを可能とする。
これまでの別法実施形態のいくつかは、ハイブリッドプラスチック/PDMS構成において実施することもできる。例えば、図53〜54に示されるように、プラスチック部分5310は、PDMS「ベース」部分5320に存在する、フレームおよび流動チャンバーを作成することができる。プラスチック部分5310は、入口ポートからの流体の流動の拡大のためのアレイに対する領域5330を供することもでき;従って、PDMS部分は、それを通って、液体がPDMS部分から、以下の流動チャンバーへ、および流動チャンバーから通過する連通スリット5410、5412を含むことができる。
流体構造は、フォト−規定可能(PD)ガラスのような、先に議論したガラスから作成することもできる。そのようなガラスは、一旦UV光に選択的に暴露されると、フッ化水素酸中での高められたエッチング速度を有することができ、特徴は、それにより、頂部側および裏面側にマイクロマシーン処理することができ、これは、一緒に接着されると、三次元の低縦横比流体セルを形成することができる。
例は図55に示される。第1のガラス層またはシート5510は、頂部側にナノポート流体穴5522および5524を、および裏側に流体拡大チャネル5526および5528を作り出すようにパターニングされ、エッチングされている。第二のガラス層またはシート5530は、約300μmの高さ(層の厚み)の、下向き流体入力/出力チャネル5532および5534を供するようにパターニングされ、エッチングされている。層5530の底部表面は、チャネル5532および5534の外側に向けて薄くされていて、層5530がチップフレーム上に存在し、および突出エリア5542が適当な高さとなって、流動チャネルの頂部を形成するのを可能とする。2つのガラス層、またはウェハーおよび4つのリソグラフィー工程が必要とされる。双方のウェハーは、下向き流体入力/出力ポートが、流体拡大チャネルと適切に整列するように、整列され、(例えば、図示されない適切な接着剤で)結合されているべきである。整列標的はガラスにエッチングされて、整列プロセスを促進することができる。
ナノポートはナノポート流体穴上に固定されて、入力および出力チューブの結合を容易とすることができる。
中央穴5550は、参照電極5560を受け取るためのガラス層を通ってエッチングすることができる。電極を固定し、シリコーンカラー5570または同様な構造で所定の場所にシールすることができ;あるいは電極は同一目的を行うための適当なワッシャを一体的に備えることができる。
2−層流体セルのためにガラス材料を用いることによって、参照電極は、導電性層であるか、または(図示しない)第二のガラス層の底部表面に蒸着されたパターンであってもよい。あるいは、図56に示したように、突出領域をエッチングして、その頂部が銀(または他の材料)の薄い−フィルム5620をコーティングして、一体化された参照電極を形成する該頂部に、浸透性ガラス膜5610を形成することができる。穴5630を、電極を評価するために上層にエッチングすることができ、もしその穴が十分大きければ、それは塩化銀溶液のためのレソルボアとして働くこともできる。薄い−フィルムの銀電極への電気的結合は、チップ−オンプッシュピンコネクタを用いることによるような、いずれかの適当な方法で作成することができ、あるいは別法として、セラミックISFETパッケージにワイヤー結合してもよい。
もう1つの代替法は、流動チャンバーの天井の−すなわち、流体セルの天井を形成する部材の下面の金属化表面を用いることによって、参照電極を配列決定チップ/流動セルに一体化させることである。金属化表面への電気的結合は、限定されるものではないが、今度は、セラミック基板中の通路を通って、チップパッケージの底部にあるスペアピンに電気的に結合することができるセラミックパッケージシールリングに導電性エポキシを適用することによるのを含めた、種々の方法のいずれかで作成することができる。これを行うと、チップソケットマウントを通ったチップの制御エレクトロニクスへの入力によって、流体セルにおける参照ポテンシャルの系−レベル制御を可能とするであろう。
対照的に、外部から挿入された電極は、入口ポートへの過剰な流体管を必要とし、これは、サイクルの間のさらなる流体流動を必要とする。
セラミックピングリッドアレイ(PGA)パッキングをISFETアレイで用いることができ、これは、裏面のピンとで、先端面の種々の表面の間の特別あつらえの電気的結合を可能とする。
フローセルは、ISFETチップおよびそのPGAに対する「蓋」と考えられることができる。フローセルは、他の個所で述べたように、多くの異なる材料で製造することができる。射出成形されたポリカーボネートはかなり適切であるように見える。導電性金属(例えば、金)は、接着層(例えば、クロム)を用いてグローセル屋根の下面(流動チャンバーの天井)に蒸着することができる。適当な低温薄−フィルム蒸着技術は、好ましくは、材料(例えば、ポリカーボネート)による金属参照電極の蒸着、および流体セルの底部−側(すなわち、ISFETアレイのフレーム囲い)における大きな段階被覆トポグラフィーで使用される。1つの可能なアプローチは、遊星系において電子線蒸発を用いるであろう。
活性電極エリアは、ISFETアレイのフレーム囲い内側の中心流動チャンバーに封じ込まれている。というのは、それは、配列決定の間にイオン性流体と接触するであろう唯一の金属化表面だからである。
一旦、アセンブリが完了したならば−導電性エポキシ(例えば、Epo−Tek H2OEまたは同様なもの)を、フローセルを整列させてシールリング上に分注し、設置し、プレスし、次いで硬化させることができ−ISFETフローセルは、パッケージの割り当てられたピンに適用される参照ポテンシャルでの操作で直ぐに使える。
かくして、ISFETデバイスへの得られた流体系の結合は、短縮された入力および出力の流体ラインを組み込み、これは望ましい。
流体アセンブリのためのなおもう1つの例実施形態は図57〜58に示される。この設計は、フレームを組み込み、直接的にチップ表面に付着されたプラスチックピース5710、および流体系からの管を結合させるのに用いられる第二のピース5720および、同様に、先に議論したPDMSピースに制限され、液体を小さな穴管から広い平面スリットに分配する。2つのピースを一緒に接着させ、多数の(例えば、3つの)整列マーカー(図示せず)を用いて、接着プロセスの間に2つのピースを正確に整列させることができる。穴を底部プレートに設けることができ、該穴は、(例えば)エポキシでキャビティを満たして、チップへのワイヤボンドを保護し、フレーム/チップ接触においていずれの潜在的ギャップも満たすように用いられる。示された例において、参照電極は、フローセルに対して外側である(出口ポートを通る排気ストリームにおいて下流−以下を参照)が、参照電極の他の構成をもちろん用いることができる。
フローセル構造のなお更なる例は図59〜60に示される。図59Aは、フローセル流体界面についての、射出成形された底部層、またはプレート5910の8つの図(A〜H)を含み、他方、図59Bは、接合性射出成形頂部プレート、または層5950の7つの図(A〜G)を含む。プレート5910の底部は、センサーチップを包むように構成され配置された下方に吊りり下がったリム5912、およびその外側エッジに沿って頂部プレート5610と接合させるための上方に延びるリム5914を有する。2つの流体チャンバー(入口チャンバーおよび出口チャンバー)をそれらの間に形成するため。頂部プレート5950の段付の下方に吊り下がった部分5960は、入力チャンバーを出力チャンバーから分離する。入口管5970および出口管5980は、頂部プレート5950の残りと一体的に成形されている。プレート5910の頂部における窪み5920によって形成された入口チャンバーの小さな端部が空である入口管5970から、入口チャンバーの出口エッジは、扇形に広がって、全アレイを横切って流体を方向付ける。
ガラスまたはプラスチックまたは他の材料を用いてフローセルを形成するかを問わず、特に、より大きなアレイでは、丁度徐々に拡大する(扇形に広がる)空間ではなく、適切に層流であるアレイを横切っての流動を容易とする何らかの構造を、アレイの入口導管および先端エッジの間の、フローセルの入口チャンバーに含めるのが望ましいであろう。例として射出成形されたフローセルの底部層5990を用い、図59Cに示された、この目的のための構造の1つの例であるタイプは、フローセルの入口位置からマイクロウェルアレイまたはセンサーアレイの先端エッジへのチャネルのツリー構造5992であり、これは、5994において該構造の出口側下にあると理解されるべきである。
配列決定のための前記した系は、典型的には、層流流体流動系を利用して、生物学的ポリマーを配列決定する。部分的には、流体流動系は、好ましくは、センサーチップおよび単一のピースによって形成された流動チャンバー、入口および出口ポートを含み、かつ流動チャンバーを確立するためのチップ上に設置可能な射出成形部材を含む。該チャンバー内部のそのような部材の表面が好ましくは形成されて、本明細書中に記載される、所望の便宜な流体流動を促進する。
いくつかの実施形態において、本発明は、層流流体流動系を含むイオンパルスの検出のための装置を含む。好ましくは、該装置は、複数の核酸鋳型を配列決定するために用いられ、ここに、該核酸鋳型は、所望により、アレイ上に蒸着される。
該装置は、典型的には、流体が同時にまたは実質的に同時にミクロ流体反応チャンバーの全てに到達するように、流体を少なくとも100K、500K、または1Mミクロ流体反応チャンバーのアレイに流動するよう非−機械的に方向付けるための1以上の開口を含む部材を含む流体アセンブリを含む。典型的には、流体の流動はセンサー表面に対して平行である。典型的には、アセンブリは1000、500、200、100、50、20、または10未満のレイノルズ数を有する。好ましくは、該部材は、さらに、センサーアレイに向けて流体を方向付けるための第一の開口、およびセンサーアレイからの離れるように流体を方向付けるための第二の開口を含む。
いくつかの実施形態において、本発明は、流体ソースをセンサーアレイに流体的にカップリングさせる開口を含む流体アセンブリを供し;次いで、センサーアレイに流体を非−機械的に方向付けることを含む、流体をセンサーアレイに方向付ける方法を含む。「非−機械的に」とは、流体が、圧力下で、機械的ポンプとは反対に、ガス状圧力ソースから移動することを意味する。
いくつかの実施形態において、本発明は、その各々が、入口ポートおよび出口ポートを有する蓋への、および該入口および出口ポートから非−機械的に流体を送達し、除去するための流体送達系にカップリングされたウェルのアレイを含む。
いくつかの実施形態において、本発明は:モノマーを含む流体を反応チャンバーのアレイに方向付けることを含む、前記した装置を利用して生物学的ポリマーを配列決定する方法を含み、ここに、該流体はせいぜい2000、1000、200、100、50、または20の流体流動レイノルズ数を有する。該方法は、所望により、さらに、各該反応チャンバーからイオンパルスを検出することを含んでもよい。イオンパルスは、典型的には、センサー表面へのイオン拡散によって検出される。マイクロウェルおよびセンサーアレイアセンブリを横切って適当な流体流動を送達するための流体アセンブリを提供する種々の他の方法があり、これまでの例は、かくして、包括的な事を意図しない。
塩化銀プロトン−浸透性電極のような商業的なフロータイプの流体電極は、直列に流体ラインに挿入することができ、種々の電気化学的目的で、流体ラインに沿った安定な電気ポテンシャルを供するように一般的には設計される。しかしながら、前記した系においては、そのようなポテンシャルは、マイクロウェルISFETチップと接触した流体容量において維持されなければならない。慣用的な塩化銀電極では、(フローセル中の小さなチャネルを通った)チップ表面および電極の間の電気的に長い流体通路のため、安定なポテンシャルを達成するのは困難であることが判明している。これは、チップのエレクトロニクスにおけるノイズの受領に導いた。加えて、電極の流動キャビティ内の大きな容量は、流体への電気的結合を劣化させた気泡をトラップし、蓄積する傾向があった。図60を参照し、この問題に対する解決は、直接的に、シールドされたケーブル6030を通って、チップのフローセル出口ポート6020に結合し、かつ(図示されていない)電圧ソースに結合された、ステンレス鋼毛細管電極6010の使用において見出されている。金属毛細管6010は、認識可能な程度までガスをトラップしない(例えば、0.01”のオーダーの)小さな内径を有し、他のミクロ流体チューブのように流体およびガスを有効に輸送する。また、毛細管はフローセルのポート6020に直接的に挿入することができる故に、それがチップ表面に近く、流体を通っての可能な電気的な喪失を低下させる。毛細管(典型的には、約2”長)の大きな内部表面積もまたその高い性能に貢献することができる。ステンレス層の構成は高度に化学的抵抗性であって、系における非常に低い電流の使用(<1μA)のため、電気化学的効果に従うべきではない。流体フィッティング6040は、流体送達および除去サブ系に対する管への結合のため、フローセルポート中にはない毛細端部に付着されている。
センサーアレイを用いるための完全な系は、適用に依存して、適当な流体ソース、バルビング、およびマイクロアレイまたはセンサーアレイ上の試薬および洗浄を減らすようにバルビングを操作するためのコントローラを含むであろう。これらのエレメントはオフ−ザ−シェルフ構成要素から容易に組み立てられ、コントローラは所望の実験を行うために容易にプログラムすることができる。
chemFETにおける読出は電流または電圧(またはその変化)とすることができ、およびいずれかの読出に対するいずれかの特定の参照は単純性を意図したものであり、他の読出を排除するものではないことが理解されるべきである。従って、chemFETにおける電流または電圧いずれかの検出への以下の明細書中でのいずれの参照も考えられ、同様に、他の読出に等しく適用されるのは理解されるべきである。重要な実施形態において、読出は、分析物の濃度の迅速な一過性変化を反映する。1を超える分析物の濃度は種々の時点において検出することができる。そのような測定は、定常状態の濃度測定に焦点を当てる先行技術の方法と対照すべきである。
既に議論したように、本発明の装置および系を用いて種々の物質の間の相互作用を検出し、および/またはモニターすることができる。これらの相互作用は生物学的および化学的反応を含み、限定されるものではないが、結合事象のような、酵素的反応および/または非−酵素的相互作用を含むことができる。例として、本発明では、基板および/または試薬が消費される酵素反応をモニターすることが考えられ、および/または反応中間体、副産物および/または産物が生成する。本発明に従ってモニターできる反応の例は、核酸配列に関する情報を提供するもののような核酸合成方法である。この反応は本明細書中においてかなり詳細に議論する。
配列決定反応に関して、本明細書中で提供された装置および系は、chemFET電流および/または電圧の変化に基づいてヌクレオチド取込みを検出することができ、というのは、それらの後者のパラメータは相互に関係するからである。電流の変化は、その単一またはいくつかの組合せでの以下の事象の1以上の結果であろう:PPiの生成、(例えば、ピロホスファターゼの存在下における)Piの生成、水素の生成(および、例えば、低強度緩衝液の存在下におけるpHの同時変化)、chemFET表面における取り込まれていないdNPTの低下した濃度、chemFETの表面における取り込まれていないdNTPの遅延された到着など。本明細書中に記載された方法は、chemFET表面における分析物濃度の変化を検出することができ、そのような変化は、前記事象の1以上に由来することができる。本発明では、たとえ読出がpHより独立している(またはpHに非感受性である)としても、本明細書中に記載された配列決定方法におけるISFETのようなchemFETの使用が考えられる。換言すれば、本発明ではPPiおよび取り込まれていないヌクレオチドのような分析物の検出のためのISFETの使用が考えられる。配列決定に関しては、本発明は、Pourmand et al.PNAS 2006 103(17):6466−6470を含めた文献中のものと対照することができる。本明細書中で議論したように、本発明では、核酸のヌクレオチド配列(すなわち、「配列」)を決定する方法が考えられる。そのような方法は、鋳型核酸の配列に基づいて、(当業者によって認識されるように、予め存在する核酸が起点となった)新しい核酸の合成を含む。すなわち、新しく合成された核酸の配列は、鋳型核酸に対して相補的であって、従って、新しく合成された核酸の配列の知識は、鋳型核酸の配列についての情報を生じる。新しく合成された核酸の配列の知識は、既知のヌクレオチドが新しく合成された核酸に取り込まれているか否かを決定することによって導かれ、もしそうであれば、どれくらい多くのそのような既知のヌクレオチドが取り込まれたかを決定することによって導かれる。ヌクレオチド取込みは、PPi、Piおよび/またはH+のような産物の生産を含めた、多数の方法でモニターすることができる。
図61は、新しく合成された核酸ストランドにおけるヌクレオチドの取込みから得られたPPiの生成/発生を示す。核酸ストランドにおけるヌクレオチドの取込みの反応副産物として発生したPPiは、(図11B1〜3に提供されたもののような)PPi受容体の不存在下において、および(例えば、本明細書中において定義された強力な緩衝液の存在下において起こり得るように)検出可能なpH変化の不存在下において、直接的に検出することができる。PPiの単純な存在は、いくつかの例において、chemFET表面において電気的変化を引き起こし、それにより、電流の変化がもたらされるのに十分である。電流の変化は、単独、あるいは先に記載したもののような他の事象と組合せたPPi発生に由来し得る。
図8Aは、ヌクレオチドの取込み反応の基質および生成物の計算された濃度を示す。それらの計算は、複数の核酸が、本明細書中に記載されたように、ウェル中に位置するビーズに結合した複数の同一鋳型核酸から同調して合成されるモデルに基づく。該モデルは、ウェルが、ヌクレオチドを除いて、プライマー核酸、ポリメラーゼ、ヌクレオチド取込みに必要な補因子にハイブリダイズドされた鋳型核酸を含有すると仮定している。取込み反応は、既知の同一のヌクレオチド三リン酸の集団を(流動を通じて)ウェルに導入することによって開始される。該モデルは、chemFET表面によって検出される第一の分析物が新しく発生したPPiであって、いくつかの時点において、その後、取り込まれていないヌクレオチド三リン酸が発生することを示す。これらの分析物集団の各々は、chemFETにおける電流読出を生起させる。図8Bは、PPiおよび取り込まれていないヌクレオチドの濃度の変化に対応する(本明細書中においては相互交換可能に言及される)電圧パルスおよび/またはピークを示す。第一の観察可能なパルスの時間を本明細書中においてはt0といい、第二の観察可能なパルスの時間を本明細書中においてはt1という。種々の重複した痕跡は、所与の反応における0の、1またはそれを超える同一のヌクレオチドの取込みを反映する。図8Bにおいて理解できるように、t1およびt0の間の時間の差(すなわち、t1−t0)は、ヌクレオチド取込みの増加に従って増加する。その結果、PPiパスルおよび取り込まれていないヌクレオチド三リン酸パルスの間の時間差は、どれくらい多くのヌクレオチド三リン酸がいずれかの所与の工程において取り込まれたかの尺度として用いることができる。これは、典型的には、どれくらい多くのdNTPの既知の単一タイプが取り込まれたかを決定するのに用いられる。しかしながら、それを用いて、本発明の他の態様に従って、dNTPの同一性に拘わらず取り込まれたdNTPの数を決定することもできる。
かくして、いくつかの実施形態において、本発明では、鋳型核酸上で配列決定されるべき次の位置に対して相補的なヌクレオチドの導入に際して、そのようなヌクレオチドは効果的に消費されて、PPiが生じ、これは、次いで、chemFETにおいて検出されることが考慮される。一旦、合成反応が完了すれば(すなわち、ヌクレオチドの適当な数が、全て、新しく合成された核酸に取り込まれると)、取り込まれていないヌクレオチドの集団はchemFET表面まで拡散し、該表面によって検出することができる。取り込まれていないヌクレオチドの検出における遅延は、どれくらい多くのそのようなヌクレオチドが取り込まれたかを示す。これらの遅延は図8Bにおいてモデル化される。もしウェルに導入されたヌクレオチドが、鋳型核酸上で配列決定されるべき次の位置に対して相補的でないならば、取込みは起こらない。従って、chemFETの表面において検出された最初の分析物は、PPiは生じないであろうから、取り込まれていないヌクレオチドの集団であろう。かくして、(単一の電圧パルスに翻訳される)chemFETによる単一イオンパルスの検出は、ヌクレオチドの取込みが起こっていないことを示し、(2つの電圧パルスに翻訳される)2つの時間的に分離されたイオンパルスの検出はヌクレオチド取込みが起こったことを示し、および後者の2つのパルスの間の時間の差は、取り込まれたヌクレオチドの数を示す。
dNTPの核酸ストランドへの取込みはPPiを放出させ、これは、次いで、2つのオルトホスフェート(Pi)および2つの水素イオンまで加水分解できる。従って、水素イオンの発生は、ヌクレオチド取込みのインジケータとして検出することができる。別法として、Piは直接的または間接的に検出することができる。これらの事象のいずれかおよび全て(および本明細書中に記載されるそれ以上)はchemFETにおいて検出することができ、それにより、ヌクレオチド取込みに相関する電流変化を引き起こす。
このデュアルパルス検出の限界は、2つのパルスを時間内に分解することができない(すなわち、2つのピークが1つに合され得る、ここに、t0およびt1ピークは区別できない)場合に起こる。この限界は、Npoly=0 vs Npoly=1の場合に、以下によって与えられる:幅=W0および標準偏差σW0を有する第一のピークNpoly=0、および幅=W1および標準偏差σW1..を有する第二のピークNpoly=1を考慮する。.1%のPeでは[ここに、Pe = erfc(SNR/2*(sqr(2)))]、シグナル対ノイズ比(SNR)=5.15。従って、検出の限界はピーク幅の差ΔWであり、ΔW=(W1−W0)>5.15*σW0.によって与えられる。
同様な計算を他のSNRでなすことができる。
ある実施形態において、chemFET(またはISFET)読出はPiおよび/またはH+の濃度の変化から独立している(または該変化に非感受性である)。これらの実施形態において、H+の同時放出を伴うPiへのPPi加水分解の速度は、時々は有意に低下する、。PPiおよびPi変換は、ピロホスファターゼのような酵素によって、および/またはある種のイオンによって触媒され得る。酵素および特定のイオンの双方(いくつかの場合には、いずれか)の不存在下において変換の速度は無視できるほど十分に遅い。(例えば、酵素、および約103秒−1のオーダーとすべきMg2+の存在下での速度を報告するBiochemistry,2002,41:12025と比較した、酵素、または約3−1年−1のオーダーとすべきイオンの不存在下における変換についての速度定数を報告するJ. Chem, Soc. Farady Trans.2007,93:4295参照)。pH感受性環境は、水素の放出から得られたpHのいずれの変化を観察するのに十分に緩衝化されているものであってもよい。反応は、たとえあったとしてもごく僅かの水素イオンが反応の結果として放出された結果として、pH非感受性または非依存性であってよい。
配列決定される核酸は、本明細書中においては、標的核酸という。標的核酸は、限定されるものではないが、ゲノムDNA、ミトコンドリアDNA,cDNA等のようなDNA、および限定されるものではないが、mRNA、miRNA等のようなRNAを含むが、それらに限定されない。核酸は、天然に生じる源または合成源を含めたいずれの源からのものであってもよい。核酸は、PCR産物、コスミド、プラスミド、天然に生じるまたは合成のライブラリーなどであってよい。本発明は、この点に関して制限されることを意図しない。本明細書中で提供される方法を用いて、いずれの長さの核酸も配列決定することができる。明瞭にするために、実施例は、既知の配列の4つの鋳型の配列決定の原理を示す証拠を提供する。この人工的モデルは、本明細書中に記載された装置および系の実施形態が、鋳型の既知の配列に相関するヌクレオチド取込みを読み出すことができるのを示す意図である。これは、場における方法または系の典型的な使用を表す意図ではない。以下に示すのは、これらの方法の簡単な記載である。
標的核酸は当該分野で公知のいずれの方法を用いても調製される。例として、ゲノムDNAは当該分野で公知の技術に従って試料から収穫することことができる(例えば、Sambrook et al.「Maniatis」参照)。収穫の後、DNAを断片化して、より小さな長さの核酸を得ることができる。得られた断片は、長さは、数百、数千、数万ヌクレオチドのオーダーであってもよい。いくつかの実施形態において、断片はサイズが200〜1000塩基対、またはサイズが300〜800塩基対、約200、約300、約400、約500、約600、約700、約800、約900、または約1000塩基対であるが、それらはそのように限定されるものではない。核酸は、限定されるものではないが、機械的、酵素的または化学的手段を含めたいずれかの手段によっても断片化することができる。例は剪断、音波処理、噴霧化、エンドヌクレアーゼ(例えば、DNase I)消化、PCR増幅のような増幅、あるいは好ましくは所望の長さの核酸断片を生じさせるための当該分野で知られたいずれかの他の技術を含む。本明細書中で用いるように、断片化は、標的核酸のより小さなサイズの断片の集団を生じさせるための増幅の使用も含む。すなわち、標的核酸を融解させ、次いで、2(好ましくは、それよりも大)の増幅プライマーにアニールし、次いで、例えば、(Taqのような)熱安定性ポリメラーゼを用いて増幅することができる。例は、絶対的な平行PCR-ベースの増幅である。断片化に続いて、特定の長さまたはサイズの断片を豊富化し、または単離するためのサイズ選択技術を行うことができる。そのような技術は当該分野でやはり知られており、限定されるものではないが、ゲル電気泳動またはSPRIを含む。
別法として、既に十分小さなサイズ(または長さ)である標的核酸を用いることができる。そのような標的核酸は、エクソン豊富化プロセスに由来するものを含む。かくして、より長い標的核酸を(ランダムにまたは非-ランダムに)断片化するよりもむしろ、標的は、天然に存在するか、または(前記したような)mRNA、cDNA、エクソン、PCR産物等のようなより短い使用可能な長さに単離することができる核酸であってよい。配列決定に先立ってエクソンのような配列を単離し、および/または豊富化する方法については、Albert et al Nature Methods 2007 4(11):903−905(エクソンおよび遺伝子座−特異的領域のマイクロアレイハイブリダイゼーション)、Porreca et al.Nature Methods 2007 4(11):931−936、およびOkou et al.Nature Methods 2007 4(11):907−909参照。
いくつかの実施形態において、サイズが選択された標的核酸を、5および3鋳末端の双方のアダプター配列に連結する。これらのアダプター配列は標的核酸を増幅するのに用いられる、増幅プライマー配列に相補的な配列を含む。1つのアダプター配列は、配列決定プライマーに対して相補的な配列も含むことができる。反対アダプター配列は、限定されるものではないが、ビーズのような固体支持体への核酸の結合を容易とする部位を含むことができる。そのような部位の例はビオチン分子(またはDiehl et al.Nature Methods, 2006,3(7):551−559によって記載された二重ビオチン部位)であり、そのような標識された核酸は、従って、アビジンまたはストレプトアビジン基を有する固体支持体に結合させることができる。用いることができるもう1つの部位は、NHS−エステルおよびアミン親和性対である。本発明は、この点に関して限定されず、当業者であればこれらの親和性対を他の結合対で置き換えることができることが理解されるべきである。得られた核酸は、本明細書中においては、鋳型核酸という。鋳型核酸は少なくとも標的核酸を含み、通常、5’および3’両末端の標的に加えて、ヌクレオチド配列を含む。
いくつかの実施形態において、鋳型核酸は自己アニールが可能であり、それにより、ヌクレオチド三リン酸を取り込むべき3’末端を作り出す。そのような場合、鋳型は鋳型およびプライマー双方として作用するので、別々の配列決定プライマーに対する必要性は無い。ピロ配列決定反応における自己−アニーリング鋳型の使用の議論については、Eriksson et al.Electrophoresis 2004 25:20−27参照。
なお他の実施形態において、鋳型は、それから(ビーズ結合鋳型の遊離末端において)好ましくはアダプター配列内でニックされる、二本鎖(または部分的に二本鎖)で用いられる。二本鎖鋳型における開きは、DNAポリメラーゼのようなポリメラーゼがニックされた部位で進入し、ヌクレオチド取込みを始めるのを可能とする。これらの開きは、制御された様式で鋳型に導入することができる。特に、DNAニッカーゼ(すなわち、この場合にはニッキング酵素)が作用する配列は既知である(すなわち、5’GAGTC3’)からである。これらのコンセンサスニッキング標的配列の議論については、Zyrina et al.参照。
いくつかの例においては、スペーサーを用いて、ビーズのような固体支持体から鋳型核酸(特に、その中に含まれる標的核酸配列)を遠ざける。これは、例えば、ビーズに最も近い標的の末端の配列決定を容易とする。適当なリンカーの例は当該分野で知られており(Diehl et al.Nature Methods,2006,3(7):551−559参照)、限定されるものではないが、iSp18のような炭素−炭素リンカーを含むが、それに限定されない。
鋳型核酸が結合される固体支持体は、本明細書中においては、「捕獲固体支持体」という。もし固体支持体がビーズであれば、そのようなビーズは本明細書中については「捕獲ビーズ」という。ビーズは、限定されるものではないが、セルロース、セルロース誘導体、ゼラチン、アクリル樹脂、ガラス、シリカゲル、ポリビニルピロリドン(PVP)、ビニルおよびアクリルアミドのコポリマー、ポリスチレン、ジビニルベンゼン等で架橋されたポリスチレン(Merrifield Biochemistry 1964,3,1385−1390参照)、ポリアクリルアミド、ラテックスゲル、デキストラン、架橋されたデキストラン(例えば、SephadexTM)、ゴム、シリコン、プラスチック、ニトロセルロース、天然スポンジ、金属、アガロースゲル(SepharoseTM)を含めたいずれかの材料で作成することができる。1つの実施形態において、ビーズはストレプトアビジンでコーティングされたビーズである。ビーズの直径は、より小さなビーズを必要とするより大きなアレイ(および、かくして、より小さなサイズのウェル)と共に用いられるchemFETおよびマイクロウェルアレイの密度に依存するであろう。一般に、ビーズのサイズは約1〜10μM、より好ましくは2〜6μMである。いくつかの実施形態において、ビーズは約5.91μMであり、他方、他の実施形態において、ビーズは約2.8μMである。なお他の実施形態において、ビーズは直径が約1.5μm、または約1μmである。ビーズは形状が完全な球形であってもなくてもよいのは理解されるべきである。また、他のビーズを用いることができ、核酸をビーズに付着させるための他のメカニズムを用いることができるのも理解されるべきである。いくつかの例において、捕獲ビーズ(すなわち、配列決定反応がその上で起こるビーズ)は、増幅ビーズを含めた鋳型調製ビーズと同一である。
本発明の重要な態様では、複数の異なる鋳型核酸を同時に配列決定することが考えられる。これは、本明細書中で記載されたセンサーアレイを用いて達成することができる。1つの実施形態において、センサーアレイはマイクロウェルのアレイ(またはそれらの用語は本明細書中においては相互交換可能に用いられるので、反応チャンバーまたはウェル)に重ねられ、(および/またはそれと一体化され)、但し、マイクロウェル当たり少なくとも1つのセンサーがあるものとする。複数のマイクロウェルには、鋳型核酸の同一コピーの集団が存在する。いずれかの2つのマイクロウェルが同一の鋳型核酸を運ぶ要件はないが、いくつかの例においては、そのような鋳型は重複配列を共有することができる。かくして、各マイクロウェルは鋳型核酸の複数の同一コピーを含み、マイクロウェル間の鋳型が異なっていてもよい。
マイクロウェルは、アレイの間でサイズが変化してもよい。マイクロウェルのサイズは断面で記載してもよい。断面はウェルの深さ(または高さ)に平行な「スライス」をいうことができる、あるいはそれはウェルの深さ(または高さ)に垂直なスライスであってよい。
これらのマイクロウェルのサイズは、高さに対する幅(または直径)の比率の換算で記載してもよい。いくつかの実施形態においては、この比率は1:1〜1:1.5である。ウェルサイズに対するビーズ(例えば、ウェルの幅、直径または高さに対するビーズの直径)は0.6〜0.8の範囲にあるのが好ましい。
マイクロウェルは断面が四角形でもよいが、それはそのように限定されるものではない。(ウェルの深さに垂直な断面における)マイクロウェルの底部における寸法は1.5μm×1.5μmであってよく、あるいはそれは1.5μm×2μmであってよい。種々の直径が実施例によって示されており、限定されるものではないが、100μm、95μm、90μm、85μm、80μm、75μm、70μm、65μm、60μm、55μm、50μm、45μm、40μm、35μm、30μm、25μm、20μm、15μm、10μm、9μm、8μm、7μm、6μm、5μm、4μm、3μm、2μm、1μmまたはそれ未満、またはおよそ、それらの直径を含む。いくつかの特別な実施形態において、直径は44μm、32μm、8μm、4μmまたは1,5μmまたはおよそ、それらであってよい。種々の高さが実施例に示されており、限定されるものではないが、100μm、95μm、90μm、85μm、80μm、75μm、70μm、65μm、60μm、55μm、50μm、45μm、40μm、35μm、30μm、25μm、20μm、15μm、10μm、9μm、8μm、7μm、6μm、5μm、4μm、3μm、2μm、1μmまたはそれ未満、またはおよそそれらの高さを含む。いくつかの特別な実施形態において、高さは55μm、48μm、32μm、12μm、8μm 6μm、4μm、2.25μm、1.5μm、またはそれ未満、またはおよそそれらであってよい。本発明の種々の実施形態では、これらの直径のいずれかとこれらの高さのいずれかとの組合せが考えられる。なお他の実施形態において、反応ウェルの寸法は(μmで表わした直径×μmで表わした高さが)44×55、32×32、32×48、8×8、8×12、4×4、4×6、1.5×1.5または1.5×2.25であってよい。
反応ウェルの容量は、ウェル寸法に基づいて(アレイの間の、好ましくは、単一のアレイ内ではない)範囲とすることができる。この容量は100ピコリットル(pL)、90、80、70、60、50、40、30、20、10またはそれ未満のpL、またはおよそそれらであってよい。重要な実施形態において、ウェルの容量は、0.5pLと等しいか、またはそれ未満、0.1pLと等しいかまたはそれ未満、0.05pLと等しいか、またはそれ未満、0.01pLと等しいか、またはそれ未満、0.005pLと等しいか、またはそれ未満、または0.001pLと等しいか、またはそれ未満を含めた、1pL未満である。容量は0.001〜0.9pL、0.001〜0.5pL、0.001〜0.1pL、0.001〜0.05pL、または0.005〜0.05pLであってよい。特定の実施形態において、ウェルの容量は75pL、34pL、23pL、0.54pL、0.36pL、0.07pL、0.045pL、0,0024pL、または0.004pLである。各マイクロウェル中の複数の鋳型は(例えば、核酸が負荷されたビーズを介して)マイクロウェルに導入してもよく、あるいはそれはマイクロウェルそれ自体中で生じさせてもよい。複数とは、本明細書中においては、少なくとも2つと定義され、マイクロウェル中の、または核酸負荷ビーズ上の鋳型核酸の関係では、数十、数百、数千、数万、数十万、数百万、またはそれを超える鋳型核酸のコピーを含む。コピーの数についての制限は、(例えば、ビーズ上の、またはマイクロウェルの壁上の)鋳型核酸についての結合部位の数、ビーズのサイズ、鋳型核酸の長さ、該複数を生じさせるのに用いられる増幅反応の程度等に依存するであろう。一般に、シグナル対ノイズ比をできる限り多く増大させるためには、ウェル当たりの所与の鋳型の多くのコピーを有するのが好ましい。増幅、およびビーズのような固体支持体への核酸のコンジュゲーションは、限定されるものではないが、Margulies at al. Nature 2005 437(15):376−380および付随する補足的資料によって記載されたエマルジョンPCR(すなわち、油中水型エマルジョン増幅)を含めた多数の方法で達成することができる。いくつかの実施形態において、該増幅は代表的増幅である。代表的な増幅は、いずれの核酸種の相対的表示も変更しない増幅である。ウェルは、一般には、合成反応に必要な、配列決定プライマー、ポリメラーゼおよび他の基質または触媒を含む。
配列決定すべき鋳型核酸でのいずれかの捕獲(すなわち、配列決定)ビーズの飽和の程度は100%でなくてもよい。いくつかの実施形態において、10%〜100%の飽和レベルが存在する。本明細書中で用いるように、鋳型での捕獲ビーズの飽和の程度とは、鋳型にコンジュゲートしたビーズ上の部位の割合をいう。いくつかの例において、これは少なくとも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、であってよく、あるいはそれは100%であってもよい。
配列決定プライマーおよびポリメラーゼの量は飽和レベルを超えた飽和性であってよく、あるいはいくつかの例においては、飽和レベル未満であってよいのは理解されるであろう。本明細書中で用いるように、配列決定プライマーまたはポリメラーゼの飽和レベルは、各々、あらゆる鋳型核酸が配列決定プライマーにハイブリダイズするか、あるいはポリメラーゼによって結合されるレベルである。かくして、飽和量は、単一ビーズ上の鋳型の数に等しいポリメラーゼまたはプライマーの数である。.いくつかの実施形態において、該レベルは、鋳型核酸のレベルの少なくとも2倍、3倍、4倍、5倍、10倍またはそれよりも大を含めたこれを超えるレベルである。他の実施形態において、ポリメラーゼおよび/またはプライマーの数は、単一ウェル中の単一ビーズ上の鋳型の数の10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%までであってよい。
かくして、例えば、ウェル中にある前、またはウェル中にある間、鋳型核酸を、(増幅プライマー配列中の、または標的核酸の30末端に連結されたもう1つのアダプター配列における)鋳型核酸の30末端に位置するその相補的配列に結合する配列決定プライマーと共に、およびその相補的配列へのプライマーのハイブリダイゼーションを促進するおよび鋳型核酸へのポリメラーゼの結合を促進する時間および条件下でのポリメラーゼと共にインキュベートされる。プライマーは実質的にいずれの配列のものとすることもでき、但し、それはユニークであるのに十分長いものとする。ハイブリダイゼーション条件は、プライマーが、鋳型の3’末端のその真の相補体のみにハイブリダイズするようなものである。適当な条件はMargulies et al. Nature 2005 437(15):376−380および付随する補足的資料に開示されている。
本明細書中に記載されるように、鋳型核酸は、異なる鋳型が同一の5末端および同一の3鋳末端を有するように作成することができる。しかしながら、いくつかの実施形態においては、本発明では複数の鋳型集団の使用が考えられ、ここに、所与の複数の各部材は同一の3’末端を共に有するが、異なる鋳型集団はそれらの3’末端配列に基づいて相互に異なる。例として、本発明では、いくつかの例において、1を超える対象または源からの核酸の配列決定が考えられる。第一の源からの核酸は第一の3’配列を有することができ、第二の源からの核酸は第二の3’配列を有することができ、等であり、但し、第一および第二の3’配列は異なるものとする。この点に関し、典型的にはユニークな配列である3’末端をバーコードまたは識別子として用いて、所与のウェル中の特定の核酸の源を標識(または同定)することができる。バーコードでの核酸の標識、続いての配列決定の議論については、Meyer et al.Nucleic Acid Research 2007 35(15):e97を参照することができる。いくつかの例において、(もし用いるならば)配列決定プライマーを、ビーズをウェルに負荷(または導入する)に先立って、または負荷の後に、鋳型にハイブリダイズすることができる(またはアニールすることができる;というのは該用語が本明細書中のおいては相互交換可能に用いられるべきである)。
しかしながら、あらゆる個々の鋳型上の50および30末端は、好ましくは、配列が異なる。特に、鋳型は同一のプライマー結合配列を共に有する。これは、マイクロウェルを横切っての同一のプライマーの使用を促進し、また、同様な(または同一)程度のプライマーハイブリダイゼーションがマイクロウェルを横切って起こるのを確実とする。一旦、配列決定プライマーのような相補的なプライマーにアニールすれば、鋳型は、複合体においては、本明細書中では、鋳型/プライマーハイブリッドという。このハイブリッドにおいては、鋳型の1つの領域は二本鎖であり(すなわち、そこでは、それはその相補的プライマーに結合しており)、および1つの領域は一本鎖である。ヌクレオチドの、プライマーの末端への取込みのための鋳型として作用するのはこの一本鎖領域であり、かくして、本発明に従って最終的に配列決定されるのはやはりこの一本鎖領域である。
適当なポリメラーゼは、限定されるものではないが、DNAポリメラーゼ、RNAポリメラーゼ、またはそのサブユニットを含み、但し、それは、鋳型に基づき、ハイブリダイズしたプライマーから出発して、新しい核酸ストランドを合成できるものとする。適当なポリメラーゼサブユニットの一例は、3’〜5’エキソヌクレアーゼ活性を欠如するE.coli DNAポリメラーゼIのクレノウ断片のエキソバージョンである。他のポリメラーゼは、T4 exo−、Therminator、およびBstポリメラーゼを含む。ポリメラーゼは溶液中で遊離していてもよく(および洗浄およびdNTP溶液中に存在してもよく)、あるいはそれは、例えば、ビーズ(または対応する固体支持体)に、またはchemFETの壁に結合していてもよいが、好ましくは、ISFET表面それ自体には結合していない。もう1つの態様において、本発明は、複数の鋳型核酸を複数の反応チャンバー中に配置することを含む、核酸を配列決定する方法を提供し、各反応チャンバーはchemFETと接触している。配列決定は、1以上の既知のヌクレオチド三リン酸を、順次、配列決定プライマーの3’末端に取り込み、次いで、1以上の既知のヌクレオチド三リン酸の取込みを検出することによって、新しい核酸ストランドを合成することを含む。取込みは、DNAポリメラーゼによって行われる。いくつかの実施形態において、ポリメラーゼは鋳型に対して高い親和性を有し、100bp、250bp、500bp、750bpまたは1000bpさえの加工性を有する。いくつかの実施形態において、ポリメラーゼは高pH条件において高い活性および高い触媒速度を有する。いくつかの実施形態において、反応混合物のpHは約7〜10、好ましくは約9である。いくつかの実施形態において、酵素はdNTPの低い濃度において、高い活性および高い触媒速度を有する。いくつかの実施形態において、dNTPの濃度は50μM、40μM、30μM、20μM、10μM、5μM、好ましくは20μM以下である。いくつかの実施形態において、酵素は、反応混合物が低いイオン強度のものである場合、高い活性、触媒速度を有する。いくつかの実施形態において、MgCl2またはMnCl2の濃度は100μM以下である。いくつかの実施形態において、Trisの濃度は0.5mM以下である。
本発明の種々の態様は、低イオン強度溶液または環境の存在下で、(例えば、配列決定プライマーのような)予め存在する核酸へのヌクレオチドの取込みに関する。本明細書中で用いる場合、低イオン強度溶液は、3mMに等しいか、またはそれ未満の合計イオン濃度であるイオン濃度を有する溶液である。.低イオン強度溶液の一例は、100μM未満のMgCl2を有する0.5mM Tris−HCl溶液である。MgCl2濃度は90μMと等しいか、またはそれ未満、80μMと等しいか、またはそれ未満、70μMと等しいか、またはそれ未満、60μMと等しいか、またはそれ未満、50μMと等しいか、またはそれ未満、40μMと等しいか、またはそれ未満、30μMと等しいか、またはそれ未満、20μMと等しいか、またはそれ未満、10μMと等しいか、またはそれ未満であってよい。従って、いくつかの実施形態において、ポリメラーゼは低いイオン強度において機能できなければならない。実施例において記載されたように、ポリメラーゼは好ましくは、低いイオン強度条件において、プライマー/鋳型ハイブリッドを認識し、それに結合し、例えば、ポリメラーゼの増大した加工性をもたらすハイブリッドに対する十分な親和性を有し、プライマーを延長できる。実施例2はT4 exo−、Therminator、Bst、およびクレノウexo−ポリメラーゼに対するこれらの種々の特性を示す。該実施例は、さらに、これらのポリメラーゼは、chemFETと接触したシリコンウェルとの関係で、ヌクレオチドをプライマーに取り込み、それにより、プライマーを延長できる。
いくつかの実施形態において、ポリメラーゼは、dNTPの低い濃度において、ヌクレオチドを取り込むこともできなければならない。いくつかの実施形態において、dNTPの低い濃度は、20μM未満の合計dNTPである濃度である。dNTPの反応ウェルへの同時導入よりはむしろ順次の導入が考えられる実施形態において、この濃度は、反応ウェルに加えられた各dNTPの濃度に関することは当業者によって理解されるであろう。他の実施形態において、(dNTP当たり、あるいはいくつかの例においては、反応の間のいずれかの時間に反応ウェルに存在する合計dNTP当たりのいずれかの)dNTP濃度は19μMと等しいか、またはそれ未満、18μMと等しいか、またはそれ未満、17μMと等しいか、またはそれ未満、16μMと等しいか、またはそれ未満、15μMと等しいか、またはそれ未満、14μMと等しいか、またはそれ未満、13μMと等しいか、またはそれ未満、12μMと等しいか、またはそれ未満、11μMと等しいか、またはそれ未満、10μMと等しいか、またはそれ未満、9μMと等しいか、またはそれ未満、8μMと等しいか、またはそれ未満、7μMと等しいか、またはそれ未満、6μMと等しいか、またはそれ未満、5μMと等しいか、またはそれ未満、4μMと等しいか、またはそれ未満、3μMと等しいか、またはそれ未満、2μMと等しいか、またはそれ未満、1μMと等しいか、またはそれ未満である。いくつかの実施形態において、dNTP濃度は0〜20μMの間、1〜19μMの間、または5〜15μMの間である。
本発明のいくつかの実施形態は、ポリメラーゼが十分な加工性を有することを必要とする。本明細書中で用いる場合、加工性は、単一のプライマー/鋳型ハイブリッドに結合したままであるポリメラーゼの能力である。本明細書中で用いる場合、それは、プライマー/鋳型ハイブリッドからのポリメラーゼの解離に先立って、ポリメラーゼが(配列決定プライマーのような)核酸に取り込まれるヌクレオチドの数によって測定される。いくつかの実施形態において、ポリメラーゼは少なくとも100ヌクレオチドの加工性を有するが、他の実施形態においては、それは少なくとも200ヌクレオチド、少なくとも300ヌクレオチド、少なくとも400ヌクレオチド、または少なくとも500ヌクレオチドの加工性を有する。ポリメラーゼの加工性がより高くなれば、解離に先立って取り込むことができるヌクレオチドは多くなり、従って、配列決定することができる核酸はより長くなるのは当業者によって理解されるであろう。換言すれば、低い加工性を有するポリメラーゼ(例えば、5つの取込み後にハイブリッドから解離するポリメラーゼ)は、本発明のいくつかの態様によると、長さが5ヌクレオチドの配列を供するに過ぎないであろう。
本発明のなお他の態様および実施形態では、高いpH(すなわち、7を超えるpH)においてヌクレオチド取込みを行うことが考えられる。かくして、いくつかの反応は、7.5と等しいかまたはそれよりも大きな、8と等しいかまたはそれよりも大きな、8.5と等しいかまたはそれよりも大きな、9と等しいかまたはそれよりも大きな、9.5と等しいかまたはそれよりも大きな、10と等しいかまたはそれよりも大きな、11と等しいかまたはそれよりも大きなpHで行われる。ポリメラーゼは、7〜11、7.5〜10.5、8〜10、8.5〜9.5、または9のpHにおいて、(配列決定プライマーのような)核酸にヌクレオチドを取り込むものであってよい。
本明細書中における教示に基づき、本発明のいくつかの態様および実施形態は、低いイオン強度の溶液、および/または低いdNTP濃度、および/または高いpHにおいて高い活性を示すポリメラーゼを使用するであろうことは理解されるであろう。取込みの適当な速度は実施形態に依存して変化するであろう。いくつかの実施形態においては、ヌクレオチド取込みは、反応チャンバー内の試薬の拡散よりも速い速度で起こる。例えば、1つの実施形態において、ヌクレオチド取込みは、反応ウェル中のdNTPの、好ましくは、底部または反応ウェルに向けての(すなわち、センサーへの)dNTPの拡散の速度を超える速度で起こる。これらの例において、新しく導入されたdNTPは、取込み反応が完了するまで、センサーに向けて拡散しない。その時点において、残存するdNTP(すなわち、取り込まれていないdNTP)はハイブリッド(当てはまる場合にはビーズ)を通過し、センサー底部に向けて拡散する。これらの例において、取込み反応が完了するまで、ビーズおよびウェル底部の方向に拡散するdNTPは、ウェル底部に到達さえする前まで用いられる。
一般には、取込みのより早い速度が好ましいが、ポリメラーゼがヌクレオチドを取り込む速度は特定の適用に依存して変化するであろう。(配列決定プライマーのような)単一の核酸への単一のポリメラーゼの取込み速度は、いくつかの例においては、ウェルにおける取り込まれていないヌクレオチド三リン酸の拡散、特に、ウェルの底部に向けてのそれらの拡散の速度よりも速い。「配列決定」の速度は、チップ上のアレイの数、ウェルのサイズ、反応が行われる温度および条件等に依存するであろう。本明細書中において他の個所で議論されるように、拡散速度は、取り込まれていないヌクレオチド三リン酸の移動を効果的に妨げることによって操作することもできる。これは、例えば、反応チャンバー中の粘度を増大させることによって成すことができる。これは、反応チャンバーに、限定されるものではないが、ポリエチレングリコール(PEG)またはPEAのような増粘剤を加えることによって達成することができる。また、核酸は、反応ウェル中でのパッキングビーズの使用によって遅延させることもできる。本発明のいくつかの実施形態において、4ヌクレオチドサイクルための時間は50〜100秒、60〜90秒、または約70秒であってよい。他の実施形態において、このサイクル時間は、60秒と等しい、またはそれ未満、50秒と等しい、またはそれ未満、40秒と等しい、またはそれ未満、または30秒と等しい、またはそれ未満、を含めた70秒と等しい、またはそれ未満とすることができる。約400塩基の読みの長さは、30分、60分、1.5時間、2時間、2.5時間、3時間、3.5時間、4時間、4.5時間、またはいくつかの例においては、5時間以上のオーダーを取ることができる。これらの時間は数メガ塩基、より好ましくは数ギガ塩基の配列の配列決定に十分であり、より大きな量の配列はより密なアレイ(すなわち、より大きな数の反応ウェルおよびFETを持つアレイ)の使用、および/または多数のアレイの同時使用を介して達成することができる。
表2は、本明細書中で考えられる種々のアレイ、チップおよび系の構成に基づいて配列決定する速度についての見積もりを提供する。本発明では、表2に示されたものよりも密なアレイさえ考えられるのは理解されるべきである。これらのより密なアレイは、0.7μmビーズで用いることができる1.4μmのピッチおよび1μmのウェルサイズを持つ90nm CMOS、または0.3μmビーズで用いることができる1μmのピッチおよび0.5μmのウェルサイズを持つ65nm CMOS、または0.2μmビーズで用いることができる0.7μmのピッチおよび0.3μmのウェルサイズを持つ45μm CMOSとして特徴付けることができる。
鋳型核酸は、限定されるものではないが、緩衝液、洗剤、ジチオスレイトール(DTT,Clelandの試薬)のような還元剤、一本鎖結合蛋白質等を含めた他の試薬および/または補因子と、ウェルの前でおよび/またはウェル中でやはり接触している。1つの実施形態において、ポリメラーゼは1以上の一本鎖結合蛋白質を含む(例えば、ポリメラーゼは、1以上の一本鎖結合蛋白質を含むように作成されたものであってよい)。1つの実施形態において、鋳型核酸は、流動チャンパーおよびそのウェルへのその導入に先立ってプライマーおよびポリメラーゼと接触される。
1つの実施形態において、核酸負荷ビーズは流動チャンバーおよび、最終的には、chemFETアレイ上方に位置したウェルに導入される。該方法は、流動チャンバー中の各ウェルが唯一の核酸負荷ビーズを含有することを必要とし、これは、ウェル当たり2つのビーズの存在が、2つの異なる鋳型核酸に由来する使用不可能な配列決定情報を生じさせるからである。実施例は、磁性ビーズとの関係で例示的ビーズ負荷プロトコルの簡単な記載を供する。同様なアプローチを用いて、他のビーズタイプを負荷することができようことは理解されるべきである。該プロトコルは流動チャンバーのウェル中でのトラップされた空気の尤度および発生率を低下させ、流動チャンバーの全ウェル中に核酸負荷ビーズを均一に分配し、および流動チャンバー中での過剰のビーズの存在および/または蓄積を回避することが示されている。いくつかの実施形態において、マイクロウェルアレイは、マイクロウェルへのビーズの負荷の程度を決定し、いくつかの例においては、ビーズを有するマイクロウェルおよびビーズを欠如するマイクロウェルを同定するように分析できる。いずれのマイクロウェルがビーズを欠如するかを知る能力は、配列決定反応のためのもう1つの内部対照を供する。ウェル中のビーズの存在または不存在は、標準的な顕微鏡観察によって、あるいはセンサーそれ自体によって決定することができる。図61AおよびBは、マイクロウェルアレイの光学顕微鏡観察(A)から、およびマイクロウェルアレイの下にあるセンサーアレイ(B)から捕獲されたイメージである。双方のイメージ中の白色スポットは、各々、ウェル中のビーズを表す。そのようなマイクロウェルの観察は、通常、実行当たり1回なされるに過ぎない。というのは、特に、一旦マイクロウェル中に配置されたビーズはもう1つのウェルまで移動することは考えにくいからである。
ウェルアレイ中の専有されたウェルのパーセンテージは、実行されるべき方法に依存して変化し得る。もし該方法が可能な最短時間で最大配列データを抽出することを狙っているならば、より高い専有が望ましい。もしスピードおよびスループット(throughout)が臨界的でないならば、より低い専有が許容できる。従って、実施形態に依存して、適当な専有パーセンテージは、ウェルの少なくとも10%、少なくとも20%、少なくとも30%、少なくとも40%、少なくとも50%、少なくとも60%、少なくとも70%、少なくとも80%、少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%であってよい。本明細書中で用いる場合、専有とは、ウェル中での1つの核酸が負荷されたビーズの存在をいい、パーセンテージ専有とは、単一のビーズによって占有されたアレイ中の合計ウェルの割合をいう。1を超えるビーズによって専有されたウェルは、本発明で考えられる分析で用いることができない。
最終的には、鋳型核酸の均一な集団を複数のウェルの各々に入れ、各ウェルは少なくとも1つのセンサー上に位置し、かくして、少なくとも1つのセンサーに対応している。先に議論したように、好ましくは、ウェルは、同一の鋳型核酸の少なくとも10、少なくとも100、少なくとも1000、少なくとも104、少なくとも105、少なくとも106、またはそれを超えるコピーを含有する。同一の鋳型核酸は、鋳型が、配列の点で同一であることを意味する。最も好ましくは、ウェル内の全ての鋳型核酸はプライマーに均一にハイブリダイズさせる。鋳型核酸のプライマーへの均一なハイブリダイゼーションは、ウェル中のあらゆる他の鋳型/プライマーハイブリッドと同じ位置における鋳型にプライマーがハイブリダイズすることを意味する(すなわち、プライマーに相補的な鋳型に沿った配列)。あらゆる鋳型上へのプライマーの均一な位置付けは、ウェル内での全ての新しい核酸ストランドの協調された合成を可能とし、それにより、より大きなシグナル対ノイズ比がもたらされる。
いくつかの実施形態において、次いで、順次の順番にて、流動で、またはいずれかの他の適当な方法によって流動チャンバーおよび、かくして、ウェルに加える。ヌクレオチドはいずれの順序でも加えることができ、但し、それが既知のものであって、実行の全体を通じて一定に保たれた単純性のためのものであるとする。
本明細書中で言及されたように、いくつかの実施形態においては、該方法はPPiおよび取り込まれていないヌクレオチドの検出に依拠する。他の実施形態において、取り込まれていないヌクレオチドは検出されない。これは、例えば、ウェルに流入するdNTPがウェルからのATPを置き換えるように、ATPを洗浄緩衝液に加えることによって達成することができる。ATPは、ウェルに入るdNTPのイオン強度にマッチし、それは、dNTPと同様な拡散プロフィールも有する。このようにして、配列決定反応の間におけるdNTPの流入および流出はchemFETにおいて測定に干渉しない。用いるATPの濃度は、用いるdNTPの濃度のオーダーである。
いくつかの実施形態、特に、低いイオン強度の環境を用いる実施形態においては、dNTPおよび/またはポリメラーゼは、限定されるものではないが、(例えば、MgCl2の形態の)Mg2+または(例えば、MnCl2の形態の)Mn2+のような二価カチオンと予めインキュベートされるであろう。限定されるものではないが、Ca2+、Co2+を含めた他の二価カチオンを用いることができる。このプレインキュベーション(および、かくして、dNTPおよび/またはポリメラーゼの「プレ負荷」)は、もしそれが低いイオン強度の環境に存在さえすれば、ポリメラーゼは、適当なかつ必要な機能のために十分な量の二価カチオンに暴露されることを確実とすることができる。プレインキュベーションは、実施形態に依存して、1〜60分、5〜45分、または10〜30分の間起こり得るが、本発明はこれらの時間範囲に限定されない。
従って、配列決定サイクルは、以下のように進行する;(所望により、ATPを含有してもよい)洗浄緩衝液での流動チャンバー(およびウェル)の洗浄、流動チャンバー(およびウェル)への第一のdNTP種(例えば、dATP)の取込み、PPiおよび、次いで、(もし取込みが起こったならば)取り込まれていないヌクレオチドの放出および検出、または(本明細書中に記載されたメカニズムのいずれかによる)(もし取込みが起こらなかったら)取り込まれていないヌクレオチドのみの検出、洗浄緩衝液での流動チャンバー(およびウェル)の洗浄、(次のdNTPのフロースルーに先立ってできる限り多くの取り込まれていないヌクレオチドを除去するための)アピラーゼを含有する洗浄緩衝液での流動チャンバー(およびウェル)の洗浄、洗浄緩衝液での流動チャンバー(およびウェル)の洗浄、および第二のdNTP種の導入。このプロセスは、全ての4つのdNTP(すなわち、dATP、dCTP、dGTPおよびdTTP)がチャンバーを通って流動し、新しく合成されたストランドに取り込まれるまで継続する。この4−ヌクレオチドサイクルは、限定されるものではないが、10、25、50、100、200またはそれを超える回数を含めたいずれかの数の回数だけ反復することができる。サイクルの数は、配列決定されるべき鋳型の長さ、および反応試薬、特に、dNTPストックおよび洗浄緩衝液を補充する必要性によって支配されるであろう。
配列決定反応の一部として、dNTPは、もしその相補的なヌクレオチドが、鋳型核酸上のその同一位置に存在するならば、新しく合成されたストランドの3’(または第一の取り込まれたdNTPの場合における配列決定プライマー3’末端)に連結される(または本明細書中で用いられるように「取り込まれる」)。従って、導入されたdNTPの取込み(およびPPiの同時放出)は、鋳型核酸における対応するヌクレオチドの同一性を示す。もしdNTPが取り込まれなかったならば、chemFETの表面における取り込まれていないヌクレオチドに対応して、単一のイオンパルスのみが検出される。従って、相補的なヌクレオチドはその位置において鋳型に存在しなかったと結論することができる。もし導入されたdNTPが新しく合成されたストランドに取り込まれているならば、chemFETは、PPiに対応する第一のイオンパルス、および取り込まれていないヌクレオチドに対応する第二のパルスを検出するであろう。さらに、例えば、第一の(PPi)イオンパルス(すなわち、t0)および第二の(取り込まれていないヌクレオチド)イオンパルス(すなわち、t1)についての時間の間の時間差を測定することにより、取り込まれたdNTPの数を定量することが可能である。時間差がより大きくなれば、取り込まれたヌクレオチドの数はより大きくなる。結果は、鋳型中のホモポリマーストレッチ(例えば、ポリA、ポリT、ポリC、またはポリG)の配列決定を通じて配列情報は失われないことになる。
アピラーゼは、残存する取り込まれていないヌクレオチドを分解し、それを一リン酸に変換し、無機ホスフェートをプロセス中に放出する酵素である。取り込まれていない、および/または過剰に存在するdNTPを分解するのにそれは有用である。過剰のおよび/または取り込まれていないdNTPは、測定が完了した後に、かつ引き続いてのdNTPの導入前に全てのウェルから洗浄除去されるのが重要である。従って、異なるdNTPの導入の間におけるアピラーゼの添加は、そうでなければ配列決定データを曖昧にするであろう取り込まれていないdNTPを除去するのに有用である。
前記したもののようなさらなる配列決定反応試薬は反応を通じて導入することができるが、いくつかの場合には、これは必要ないであろう。例えば、さらなるポリメラーゼ、DTT、SBB等はもし必要であれば加えてもよい。
従って、本発明では、複数の異なる配列決定反応を同時に行うことが考えられる。複数の同一配列決定反応は、各専有されたウェルにおいて同時に起こっている。シグナル対ノイズ比を増大させるのは、各ウェル内でのdNTPのこの同時かつ同一取込みである。複数のウェル中で配列決定反応を同時に行うことによって、複数の異なる核酸は同時に配列決定される。
該方法は、いずれかの所与のdNTPに対する全てのマイクロウェルを横切っての完全な取込みを最大化し、シグナル検出が完了した後に、ウェルに残る取り込まれていないdNTPの数を低下または減少させ、およびできる限り高いシグナル対ノイズ比を達成することを狙っている。
配列決定反応は、ある範囲の温度で実行することができる。典型的には、反応は30〜60℃、35〜55℃、または40〜45℃の範囲で実行される。核酸における二次構造の形成を妨げる温度で反応を実行するのが好ましい。しかしながら、これは、プライマー(および新しく合成されたストランド)の、より高温における、鋳型核酸への結合、およびアピラーゼの低下した半減期とバランスしていなければならない。適当な温度は約41℃である。洗浄緩衝液およびdNTP溶液を含めた溶液は、一般に、ウェル中の温度を変化させないために、これらの温度まで温められる。しかしながら、アピラーゼを含有する洗浄緩衝液は、好ましくは、酵素の半減期を延長するために、より低温に維持される、。典型的には、この溶液は約4〜15℃、より好ましくは4〜10℃に維持される。低いイオン濃度での配列決定は配列決定プライマーのTmを、恐らくは、ポリメラーゼに対して最適なそれ未満まで降下させることができると認められるであろう。従って、本発明では、配列決定プライマーは修飾された塩基、連結された核酸(LNA)モノマー、ペプチド核酸(PNA)モノマーのようなヌクレオチド修飾を含んでもよく、あるいは別法として、プライマーのTmを適当な範囲まで上昇させるのに副溝バインダーを用いることができようと考えられる。ヌクレオチド取込み反応は、非常に迅速に起こり得る。その結果、いくつかの例においては、反応の間における最大データ捕獲を確保するために、反応を遅らせ、あるいはウェル中での分析物の拡散を遅らせるのが望ましいであろう。試薬および/または副産物の拡散は、限定されるものではないが、パッキングビーズのウェル中への添加、および/またはウェル中でのポリエチレングリコール(例えば、捕獲ビーズおよび/またはパッキングビーズへ付着したPEG)のようなポリマーの使用を含めた多数の方法で遅くすることができる。また、パッキングビーズは、chemFET表面における試薬および/または副産物の濃度を増大させ、それにより、シグナルについてのポテンシャルを増加させる傾向がある。パッキングビーズの存在は、一般に、試料に対してより大きな倍数(例えば、2倍または4倍)を可能とする。
データ捕獲速度は変化することができ、例えば、秒当たり10〜100のフレームのいずれかの所とすることができ、用いるべきいずれかの速度の選択は、少なくとも部分的には、ウェルのサイズ、およびパッキングビーズの存在、または他の拡散制限技術によって指令されるであろう。より小さなウェルのサイズは、一般に、より早いデータ捕獲速度を必要とする。
流動ベースの、かつウェルの頂部面が開いており、かつチップの全体にわたって流体と連通している本発明のいくつかの態様において、ウェルから外へのその拡散に先立って、放出されたPPiまたは他の副産物(例えば、H+)を検出するのが重要である。ウェルから外への反応副産物の拡散は(副産物はそのウェルにおいて検出されないゆえに)偽陰性、および(副産物を検出することができる)隣接または下流ウェルにおける潜在的偽陽性に導き、かくして、回避すべきである。PEGのようなパッキングビーズおよび/またはポリマーは、ウェル間の拡散および/またはクロス−トークの程度を低下させるのを助けることもできる。
かくして、いくつかの実施形態において、核酸負荷ビーズに加えて、パッキングビーズを用いる。パッキングビーズは(超常磁性を含めて)磁性であってよいが、それらはそれに限定されるものではない。いくつかの実施形態において、パッキングビーズおよび捕獲ビーズは同一の材料で作成され(例えば、双方が磁性であり、双方がポリスチレン等)、他方、他の実施形態において、それらは異なる材料で作成される(例えば、パッキングビーズはポリスチレンであって、捕獲ビーズは磁性である)。パッキングビーズは、一般に、捕獲ビーズよりも小さい。サイズの差は変化することができ、5倍、10倍、15倍、20倍以上であってよい。一例として、0.35μm直径のパッキングビーズを、5.91μmの捕獲ビーズと共に用いることができる。そのようなパッキングビーズはBang Labsのような源から商業的に入手可能である。捕獲ビーズに対するパッキングビーズの設置は変化し得る。例えば、パッキングビーズは捕獲ビーズを囲むことができ、それにより、捕獲ビーズがchemFET表面と接触するのを妨げることができる。もう1つの例として、パッキングビーズを捕獲ビーズに続いてウェルに負荷することができ、その場合、捕獲ビーズはchemFET表面に接触している。捕獲ビーズおよびchemFET表面の間のパッキングビーズの存在は、PPiのような配列決定副産物の拡散を遅らせ、それにより、データ捕獲を容易とする。
本発明では、さらに、chemFET表面の、捕獲ビーズに結合した鋳型核酸との接触、かくして、干渉を妨げるための、パッキングビーズ、または(本明細書中に記載された)chemFET表面への修飾の使用が考えられる。深さまたは高さが0.1〜0.5μmであるパッキングビーズの層はこの相互作用を排除するであろう。
配列決定反応には、アレイの分析を先行させて、ビーズの位置を決定することができる。流動の非存在下においては、バックグラウンドシグナル(すなわち、ノイズ)は約0.25mV未満であるか、またはそれと等しいが、DNA負荷捕獲ビーズの存在下では、そのシグナルは約1.0mV=/−0.5mVまで増加することが判明した。この増加は、ウェルをビーズで決定するのを可能とするのに十分である。
本発明では、さらに、本明細書中に記載された方法に従って、配列決定反応を実行するのに必要な種々の試薬および使用指示書を含むキットが考えられる。
1つの好ましいキットは洗浄緩衝液を収容する1以上の容器、各々が以下の試薬:dATP緩衝液、dCTP緩衝液、dGTP緩衝液またはdTTP緩衝液、dATP、dCTP、dGTPおよびdTTPストック、アピラーゼ、SSB、ポリメラーゼ、パッキングビーズおよび、所望により、ピロホスファターゼのうちの1つを含有する1以上の容器を含む。重要なことには、キットは天然に生じるdNTPのみを含むことができる。キットは、実施例に記載された成分を含む1以上の洗浄緩衝液も含むが、それに限定されない。キットは、本発明の方法を示す図解を含めた、使用のための指示書も含むことができる。
受容体およびリガンドの間の、あるいは結合対の2つの部材の間のまたは分子複合体の構成要素の間の相互作用はchemFETアレイを用いて検出することもできることが理解されるべきである。そのような相互作用の例は、核酸の相互に対するハイブリダイゼーション、蛋白質-核酸結合、蛋白質-蛋白質結合、酵素−基板結合、酵素−阻害剤結合、抗原−抗体結合などを含む。FETインターフェースにおいて半導体電荷密度の変化を引き起こし、かくして、本明細書中に記載されたセンサーのソースからドレインへ流れる電流を変化させるいずれの結合またはハイブリダイゼーション事象も、本発明に従って検出することができる。
これらの実施形態において、不動態化層(または恐らくは不動態化層上にコーティングされた中間層)は核酸(例えば、DNA、RNA、miRNA、cDNA等)、(いずれの性質のものでもあり得る)抗原、蛋白質(例えば、酵素、補因子、抗体、抗体断片等)等で機能性化されている。これらの物質の不動態化層へのコンジュゲーションは、(例えば、不動態化層の反応性基および結合すべき物質双方に結合する二感応性リンカーを用いて)直接的または間接的であり得る。
例として、アミンまたはチオール基のような反応基を合成の間にいずれかのヌクレオチドにおいて核酸に加えて、二感応性リンカーのための付着点を供することができる。もう1つの例として、核酸は、Uni−Link AminoModifier、3−DMT−C6−Amine−ON_CPG、AminoModifier II、N−TFA−C6−AminoModifier、C6−ThiolModifier、C6−DisulfidePhosphoramiditeand C6−Disulfide CPG(Clontech,PaloAlto,CA)のようなコンジュゲーション−成分試薬を取り込むことによって合成することができる。核酸を付着させるための他の方法は以下に議論する。
本発明の1つの態様において、chemFETアレイは、核酸アレイと組合せて提供される。短い核酸(例えば、オリゴヌクレオチド)またはより長い核酸(例えば、全長cDNA)の形態の核酸を本明細書中で記載されたアレイのchemFET表面に供することができる。核酸アレイは一般に、その各々が、その1以上、好ましくはそれを超える核酸にコンジュゲートされている平面上の表面上の複数の物理的に規定された領域(例えば、「スポット」)を含む。核酸は、通常、一本鎖である。所与のスポットにコンジュゲートされた核酸は通常は同一である。オリゴヌクレオチドアレイとの関係では、これらの核酸は、(長さが約10、20、25、30、40、50、60、70、80、90または100ヌクレオチドを含めた)長さが100ヌクレオチド未満のオーダーであってよい。もしアレイを用いて、(そのような遺伝子における突然変異またはそのような遺伝子の発現レベルを含めた)ある種の遺伝子を検出すれば、アレイは、その各々が、遺伝子を規定され、かつ潜在的に異なる配列にわたるオリゴヌクレオチドを含有する多数のスポットを含むことができる。次いで、これらのスポットを平面上の表面を横切って位置させて、アレイのハイブリダイゼーションおよび読出手段における位置関連効果を排除する。
アレイはテストされるべき試料と接触させる。試料は、細胞、組織または塊(例えば、腫瘍)、アレイ、潜在的には下にあるセンサーアレイ等に対応する2次元アレイ上で成長させる細胞の集団からのゲノムDNA試料、cDNA試料であってよい。従って、そのようなアレイは、特定の遺伝子の、またはその発現の存在および/またはレベルを決定し、(限定されるものではないが、単一ヌクレオチド多形を含めた欠失、負荷、置換のような)特定の遺伝子内の突然変異を検出する等に有用である。
試料核酸および固定化核酸の結合またはハイブリダイゼーションは、一般に、その用語は当該分野で理解されているように、ストリンジェントなハイブリダイゼーション条件下で行われる(例えば、Sambrook et el.「Maniatis」参照)。関連条件の例は(増大するストリンジェンシーの順番で):25℃、37℃、50℃および68℃のインキュベーション温度;他の緩衝液系を用いる10× SSC、6× SSC、4× SSC、1× SSC、0.1X SSC(ここに、SSCは0.15M NaClおよび15mMクエン酸塩緩衝液)およびそれらの同等体の緩衝液濃度;0%、25%、50%、および75%のホルムアミド濃度;5分〜24時間のインキュベーション時間;1、2、またはそれを超える洗浄工程;1、2、または15分の洗浄インキュベーション時間;6× SSC、1× SSC、0.1× SSCまたは脱イオン水の洗浄溶液を含む。例として、ハイブリダイゼーションは50%ホルムアミドおよび4× SSCで行い、続いて、50℃にておよび1× SSCと共に2× SSC/ホルムアミドの洗浄を行うことができる。
核酸アレイは、cDNAのような既に形成された核酸を特異的位置にてアレイ上に蒸着する(または、「スポットする」)ものを含む。核酸は、圧電沈着、限定されるものではないが、ポリ−L−リシンまたはポリピロールのようなポリマー層への核酸のUV架橋、公開された米国特許出願第2003/0186262号に記載されたシリコン被覆SiO2への直接的コンジュゲーション、シラン化chemFET表面への直接的コンジュゲーションによって表面にスポットすることができる(例えば、Uslu et al.によって記載された3−アミノプロピルトリエトキシシラン(APTES)で処理された表面)。
核酸アレイは、(既知の配列のオリゴヌクレオチドのような)核酸がアレイ上に直接的に合成されたものも含む。核酸は、限定されるものではないが、微細なとがったピンでのガラススライドへの印刷、予め作成されたマスクを用いるフォトリソグラフィー、(DLPミラーのような)動的マイクロミラーデバイスを用いるフォトリソグラフィー、インク−ジェット印刷、またはミクロ電極アレイ上の電気化学のような当該分野で認められた技術を用いてアレイ上に合成することができる。また、Nuwaysir et al.2002「Gene expression analysis using oligonucleotide arrays produced by maskless photolithography」Genome Res12:1749−1755を参照することもできる。1749-1755.アレイのこの後者のタイプの商業的源はAgilent,AffymetrixおよびNimbleGenを含む。
かくして、chemFET不動態化層はそれに対して核酸が結合し、および/またはそれからそれらが合成される反応性分子(および、従って、反応性基)の中間体層でコーティングすることができる。
本発明では、そのような核酸アレイをchemFETアレイと、特に、本明細書中に記載された「大規模な」chemFETアレイと組み合わせることが考えられる。chemFET/核酸アレイは種々の適用で用いることができ、そのうちいくつかはウェル(またはマイクロウェルまたは反応チャンバー;と言うのは、それらは本明細書中において相互交換可能に言うからである)を必要としない。分析は「閉じた」系(すなわち、ここに、試薬および洗浄溶液の流動などが自動化されている)を含めた流動に依然として運ばれているだろうから前記位置の、アレイと接触した1以上の流動チャンバーがあろう。多数の流動チャンバーの使用は多数の試料(または核酸ライブラリー)が同時に分析されるのを可能とする。2、3、4、5、6、7、8、9、10またはそれを超える流動チャンバーがあり得る。この構成は、蛋白質アレイ、抗体アレイ、酵素アレイ、化学アレイ等のような、本明細書中で議論されたものを含めた他の生物学的アレイに等しく適用される。
結合パートナーの間の、または複合体の成分の間の結合事象は下に存在するFETを介してエレクトロニクス的に検出されるので、そのようなアレイは、アッセイすべき試料を操作する(例えば、外因的に標識する)必要性無くして行うことができる。そのような操作は、試料の喪失を普変的にもたらし、一般的には、増大した時間および仕事を必要とするので、これは有利である。加えて、本発明の方法は、結合相互作用がリアルタイムで研究されるのを可能とする。
本発明のchemFETアレイと組合せて用いられる蛋白質アレイも考えられる。蛋白質アレイは、組織化されたかつ所定の様式にて、平面上表面に結合した生物学的部位を含む蛋白質またはペプチドまたは他のアミノ酸を含む。そのような蛋白質は、限定されるものではないが、酵素、抗体および抗体断片または抗体ミミック(例えば、単一鎖抗体)を含む。
1つの実施形態において、蛋白質アレイは、複数の異なる蛋白質(または生物学的部位を含有する他のアミノ酸)を含むことができる。各蛋白質、好ましくは複数の蛋白質はアレイの所定の領域または「セル」に存在する。領域(またはセル)は、各領域(またはセル)に対して1つのセンサーとなるように、センサーアレイ中のセンサーと整列している。単一の領域((またはセル)中の複数の蛋白質は、蛋白質のサイズまたは領域(またはセル)のサイズに依存して変化することができ、限定されるものではないが、少なくとも10、50、100、500、103、104またはそれよりも大であってよい。アレイそれ自体は、限定されるものではないが、少なくとも、10、102、103、104、105、106、107、またはそれよりも大を含めたいずれの数のセルも有することができる。1つの適用において、アレイは、蛋白質に結合する分析物を含有することが知られた、または含有することが疑われる試料に暴露される。もし蛋白質が酵素であれば、分析物は基質または阻害剤であってよい。分析物はもう1つの蛋白質を含めた蛋白質、核酸、(合成または天然を問わず)化学的種等に結合するいずれの分子であってもよい。
本明細書中で考えられる核酸アレイと同様に、蛋白質アレイからの読出はchemFETを通じての電流の変化であり、かくして、標識および/または標識検出のさらなる工程はこれらのアレイでは必要でないことが理解されるべきである。
もう1つの実施形態において、蛋白質アレイは、複数の同一の蛋白質(または生物的部位を含有する他のアミノ酸)を含むことができる。同一の蛋白質を平面上の表面に均一に分布させることができるか、あるいはそれらはその表面の区別される領域(またはセル)に組織化させることができる。これらの後者の実施形態においては、領域(またはセル)は、各領域(またはセル)に対して1つのセンサーになるように、センサーアレイ中のセンサーと整列している。
蛋白質はオフチップ合成し、次いで、精製し、アレイに付着させることができる。別法として、それらは、先に議論した核酸と同様に、オンチップ合成することができる。無細胞DNA発現または化学的合成を用いる蛋白質の合成は、オン−チップ合成に使用可能である。無細胞DNA発現を用い、一旦合成されると、蛋白質は固体支持体に付着される。別法として、蛋白質は、固相ペプチド合成を用いて固体支持体上に化学的に合成することができる。選択的脱保護は、リソグラフィー方法を介して、またはSPOT−合成によって行われる。少なくとも、MacBeath and Schreiber, Science, 2000, 289:1760−1763,またはJones et al. Nature,2006,439:168−174を参照することができる。また、Fodor et al.に対する米国特許第6919211号を参照することもできる。
chemFETアレイと組合せた化学的化合物マイクロアレイも考えられる。化学的化合物マイクロアレイは、多様な連結技術(文献中では、「小分子マイクロアレイ」ともいうことができる)で化合物(例えば、有機化合物)を固体表面に共有結合により固定化し、化合物(例えば、有機化合物)を固定化無しで固体表面にスポットし、乾燥することによって(文献においては、「ミクロアレイ化化合物スクリーニング(μARCS)」ということができる)、あるいは固定化および(Reaction Biology CorporationによってDiscoveryDotTM技術として商業化された)乾燥効果無しに均一溶液中に有機化合物をスポットすることによって、作成することができる。
chemFETアレイと組合せた組織マイクロアレイが、さらに、本発明では考えられる。組織マイクロアレイは、Battifora Lab Invest 1986,55:244−248;Battifora and Mehta Lab Invest 1990,63:722−724;およびKononen et al. Nat Med 1998,4:844−847においてより詳細に議論されている。
chemFETアレイおよび生物学的または化学的アレイの構成は、各場合において、同様であり、一つの組合せアレイの議論は本明細書中に記載されまたはそうでなければ、当該分野で知られた他のものに適用されるであろう。
なおもう1つの態様において、本発明では、細胞培養(例えば、二次元細胞培養)(例えば、Baumann et al. Sensors and Actuators B 55 1999 77:89参照)、およびchemFETアレイと接触して入れられた組織セクションの分析が考えられる。例として、脳セクションを本発明のchemFETアレイと接触させて入れることができ、セクションの変化は、限定されるものではないが、ニューロトキシン等のような刺激の存在下または不存在下のいずれかで検出することができる。神経プロセスの伝達および/または刺激はそれにより分析される。これらの実施形態において、chemFETは、不動態化層それ自体を介して、または不動態化層にコーティングされたこれらのイオンに対する受容体を介して、カルシウムおよび/またはカリウムフラックスを検出することによって働くことができる。
なおもう1つの態様において、本発明では、イン・ビボで用いるための、本明細書中で記載されたように、またはもう1つの様式で機能性化されたchemFETアレイの使用が考えられる。そのようなアレイを(例えば、脳、またはイオンフラックスに従う他の領域において)対象に導入し、次いで、対象の状態に基づいて変化について分析することができる。
特にアレイとの関連で核酸、蛋白質、分子等を固体支持体に付着させるための方法は当該分野で記載されている。例えば、Lipshutz et al.Nat.Genet.(supplement)1999 21:20−24;Li et al.Proc.Natl.Acad.Sci.,2001,98:31−36;Lockhart et al.Nat.Biotechnol.199614:−675−1680;Wodicka et al.Nat.Biotechnol.199715:1359−1367:Chenet al.Journal of Biomedical Optics 1997 2:364;Duggan et al.NatGenet 199121(1 Suppl):10−4;Martonet al.Nat Med.19984(11):1293−301;Kononen et al.Nat Med 1998 4(7):844−847;MacBeathet al.,Science 2000289(5485):1760−1763;Haab et al.GenomeBiology 2001 2(2);Pollack et al.NatGenet199923(1):41−6;WangDGet al.Science1998280(5366):1077−82;Fodoret al.Science1991251:767-773;Fodoret al.Nature1993364:555-556;Peaseet al.Proc.NatlAcad.Sci.USA199491:5022-5026;FodorScience1997277:393-395;Southernet al.Genomics199213:1008-1017;Schenaet al.Science1995270(5235):467−70;Shalonet al.GenomeRes19966(7):639−45;JongsmaProteomics2006,6:2650−2655;Sakata,BiosensorsandBioelectronics2007,22:1311−1316参照。1311-1316.
本明細書中に記載された系は、光学的検出なくして、未標識生物学的ポリマーを配列決定するために用いることができる。
いくつかの実施形態において、本発明では、光学的検出無くして、未標識生物学的ポリマーを配列決定するのに適合し、かつ少なくとも100の反応チャンバーのアレイを含む配列決定装置を含む。
典型的には、各反応チャンバーはchemFETに容量的にカップリングされている。
好ましくは、各反応チャンバーは容量が約.39pL以下、約49μm2の表面開口であり、より好ましくは、約16μm2以下の開口および約.064pL以下の容量を有する。好ましくは、アレイは少なくとも1.000、10.000、100.000、または1.000.000の反応チャンバーを有する。
典型的には、反応チャンバーはミクロ流体ウェルを含む。
好ましくは、装置は時間当たり少なくとも106塩基対、より好ましくは時間当たり少なくとも107塩基対、最も好ましくは時間当たり少なくとも108塩基対を配列決定するのに適合している。
もう1つの実施形態において、本発明は、個々のモノマーの伸長ポリマーへの取込みの時間を測定することを含む、生物学的ポリマーを前記装置で配列決定する方法を含む。
典型的には、生物学的ポリマーは核酸鋳型であって、モノマーはヌクレオチドである。好ましくは、核酸鋳型は200〜700塩基対を有する。好ましくは、核酸鋳型は配列を決定するに先立って増幅される。
典型的には、測定は拡散制限条件下で行われる。測定は、電気的変化を検出し、イオンパルスを検出するか、あるいは無機ピロホスフェート(「PPi」)の放出を検出することを含むことができる。好ましくは、取込みは400μM以下のイオン強度にて起こり、ここに、Mg2+またはMn2+または他の二価カチオンの濃度は100μM以下である。好ましくは、前記した方法を用い、少なくとも106の塩基対を時間当たりに配列決定し、より好ましくは少なくとも107塩基対を時間当たりに配列決定し、最も好ましくは少なくとも108塩基対を時間当たりに配列決定する。好ましくは、検出は、前記したchemFETのアレイによって達成される。
いくつかの実施形態において、本発明では:少なくとも100の配列決定反応を同時に行い;次いで、標識の使用無くして、および光学的検出の使用無くして配列を決定することを含む、核酸配列を決定する方法を含む。
本発明のこのおよび他の方法で用いる核酸鋳型は、全て、当業者に知られた、種々の方法によって種々の源に由来することができる。鋳型は、限定されるものではないが、変化する複雑性の全ゲノムcDNA、mRNAまたはsiRNA試料に由来することができるか、あるいは種々の環境およびメタビオメ配列決定プロジェクトにおけるように、全集団を表してもよい。鋳型核酸は、限定されるものではないが、PCR産物、注目する特異的エクソン領域、または16Sまたは他の診断剤または同定性ゲノム領域を含めた、核酸集団の特異的サブ組から生じさせることもできる。
典型的には、配列決定に必要な出発材料は3μg未満の核酸である。好ましくは、配列決定に先立って、鋳型核酸を増幅する。鋳型核酸は、所望により、配列決定に先立って1以上のビーズに結合させることができる。
典型的には、決定工程は、1以上の第一のモノマーが伸長する配列に取り込まれるのに必要な時間の量を測定することを含む。典型的には、モノマーの取込みは拡散制限条件下で測定される。測定は、電気的変化を検出し、イオンパルスを検出するか、あるいは無機ピロホスフェート(「PPi」)の放出を検出することを含むことができる。
好ましくは、前記した方法を用い、少なくとも106の塩基対を時間当たりに配列決定し、より好ましくは少なくとも107塩基対を時間当たりに配列決定し、最も好ましくは少なくとも108塩基対を時間当たりに配列決定する。かくして、該方法を用いて、約24時間以内に、より好ましくは約20時間以内に、なおより好ましくは約15時間以内に、なおより好ましくは約10時間以内に、なおより好ましくは約5時間以内に、最も好ましくは、約1時間以内に全ヒトゲノムを配列決定することができる。これらの速度は本明細書中に示された多数のISFETアレイを用い、かつそれらの出力を並行して処理して達成することができる。
以下の実施例は説明の目的に含め、本発明の範囲を制限する意図はない。
実施例
実施例1ビーズの調製
一本鎖オリゴヌクレオチドのストレプトアビジンをコーティングした磁性ビーズへの結合。(HPLC精製した)5’Dual Biotin(デュアルビオチン)タグを備えた一本鎖DNAオリゴヌクレオチド鋳型、および20塩基ユニバーサルプライマーをIDT(Integrated DNA Technologies, Coralville, IN)から注文した。鋳型は長さが60塩基であって、20塩基プライマーに相補的な3’末端に20塩基を含むように設計した(表3,イタリック体)。凍結乾燥されビオチニル化された鋳型およびプライマーを、各々、40μMストック溶液として、および400μMストック溶液としてTE緩衝液(10mM Tris−HCl,1mM EDTA,pH8)に再度懸濁させ、使用するまで−20℃で貯蔵した。
各鋳型については、4℃の、水性緩衝化懸濁液(8.57×104ビーズ/μL)として貯蔵された、60μlの磁性5.91μm(Bangs Laboratories,Inc. Fishers,IN)のストレプトアビジンでコーティングされたビーズを、120μlビーズ洗浄緩衝液で3回洗浄し、次いで、各々、5’末端にビオチンを備えた鋳型1、2、3および4(T1,T2,T3,T4:表3)と共にインキュベートすることによって調製した。
ビオチンに対するストレプトアビジンの強い共有結合親和性(Kd約10〜15)のため、これらの磁性ビーズを用いて、後に記載するように、鋳型を固体支持体に固定化する。遊離ビオチンのためのこれらのビーズの報告された結合能力は、0.650ピコモル/μLのビーズストック溶液である。小さな(<100塩基)ビオチニル化ssDNA鋳型では、9.1×105鋳型がビーズ当たり結合することができると保存的に計算される。ビーズは、Dynal Magnetic Particle ConcentratorまたはMPC−s(Invitrogen,Carlsbad,CA)に関するように、単純な磁石を用いて容易に濃縮される。MPC−sを記載された実験で用いた。
MPC−sを用いて、各洗浄の間に1分間ビーズを濃縮し、次いで、緩衝液を加え、ビーズを再懸濁させた。第三の洗浄に続いて、ビーズを、120μLのビーズ洗浄緩衝液+1μlの各鋳型(40μM)に再懸濁させた。ビーズを回転させつつ30分間インキュベートした(Labquake Tube Rotator,Barnstead,Dubuque,IA)。インキュベーションに続き、次いで、ビーズを120μLのアニーリング緩衝液(20mM Tris−HCl、5mM酢酸マグネシウム、pH7.5)中で3回洗浄し、60μLの同一緩衝液中に再度懸濁させた。
配列決定プライマーのアニーリング次いで、5.91μmの磁性ビーズに対して5’末端において結合した固定化鋳型を、該鋳型の3’末端に対して相補的な20塩基プライマーにアニーリングする(表3)。次いで、固定化された鋳型に対して20倍過剰なプライマーを表す、400μMのプライマーストック溶液の1.0μLのアリコットを加え、次いで、ビーズと鋳型とをプライマーと共に95℃にて15分間インキュベートし、次いで、温度をゆっくりと室温まで降下させた。次いで、MPC−sを用いて前記したように、ビーズを120μLの25mMトリシン緩衝液(25mMトリシン、0.4mg/ml PVP、0.1% Tween 20、8.8mM酢酸マグネシウム;pH7.8)中で3回洗浄した。ビーズを25mMトリシン緩衝液中に再懸濁させた。
DNAポリメラーゼと、ハイブリダイズされた鋳型/プライマーとのインキュベーション。鋳型およびプライマーハイブリッドを、Margulies et al.によって実質的に記載されているようにポリメラーゼと共にインキュベートする。
調製された試験試料のISFETセンサーアレイ上への負荷。ISFETアレイ、およびその上に位置させたミクロ流体の寸法および密度は適用に依存して変化し得ることができる。非限定的例は512×512アレイである。(そのうち262144がある)そのようなアレイの各グリッドは単一のISFETを有する。各グリッドはその上に位置したウェル(あるいは、それらは本明細書中においては相互交換的に「マイクロウェル」と言うことができる)をやはり有する。ウェル(またはマイクロウェル)は、柱状、円錐状、四角形、三角形等を含めたいずれの形状を有してもよい。1つの例示的な形状において、ウェルは7×7×10μmの寸法を有する四角形ウェルである。ウェルの間の中心間距離は、本明細書中においては、「ピッチ」と言う。ピッチはいずれの距離であってもよいが、可能な限り大きなアレイを収容するためにはより短いピッチを有するのが好ましい。ピッチは50μm未満、40μm未満、30μm未満、20μm未満、または10μm未満であってよい。1つの実施形態において、ピッチは約9μmである。(その中にウェルが位置する)アレイ上方の全チャンバーは、約30μLと等しいか、またはそれ未満、約20μLと等しいか、またはそれ未満、約15μLと等しいか、またはそれ未満、約10μLと等しいか、またはそれ未満の容量を有することができる。従って、これらの容量は、同様に、チャンバー内の溶液の容量に対応する。
「開いた」系へのビーズの負荷。鋳型1〜4を備えたビーズをチップ上に負荷した(10μLの各鋳型)。簡単に述べれば、各鋳型のアリコットを、エッペンドルフピペットを用いてチップ上に加えた。次いで、磁石を用いて、ビーズをウェルの方に引いた。
「閉じた」系へのビーズの負荷。捕獲ビーズおよびパッキングビーズの双方は流動を用いて負荷する。ビーズ溶液の容量のマイクロリットル精度、ならびに流体結合を通じてのビーズ溶液のポジショニングは、主たるレゼルボア(容量がほぼ1mL)、従たるレゼルボア(容量がほぼ10μL)、および小さな容量のビーズ溶液を取り扱うためのミクロ流体チャネルを含む、ビーズ負荷フィッティングを用いて図62〜70に示されたように達成される。この方法もまた、精度ピペットによって可能とされた流体適用のマイクロリットル精度を活用する。
ISFETアレイおよびフローセルを含むチップは、負荷備品のZIF(ゼロ挿入力)ソケットに存在し、次いで、ステンレス鋼毛細管をフローセルの一方のポート、および他方のポート上の可撓性ナイロンチューブに付着させる。「双方の材料はミクロ流体−タイプの流路である(例えば、<0.01’’内径のオーダー)」。主たるおよび従たるレゼルボアよりなるビーズ負荷フィッティングは、それを、毛細管の端部に付着させた。共通のプラスチックシリンジを緩衝液溶液で満たし、次いで、ナイロンチューブの遊離末端に結合する。チップの底部から突出する電気的リードを、(図示しない)備品ユニットの頂部のソケットに挿入する。
ISFETアレイおよびフローセルを含むチップは、負荷備品のZIF(ゼロ挿入力)ソケットのようなソケットに存在し、次いで、ステンレス鋼毛細管をフローセルの一方のポート、および他方のポートの可撓性ナイロンチューブに付着させることができる。「双方の材料はミクロ流体−タイプの流路である(例えば、<0.01’’内径のオーダー)」。主たるおよび従たるレゼルボアよりなるビーズ負荷フィッティングは、それを、毛細管の端部に付着させた。共通のプラスチックシリンジを緩衝液溶液で満たし、次いで、ナイロンチューブの遊離末端に結合する。チップの底部から突出する電気的リードを、(図示しない)備品ユニットの頂部のソケットに挿入する。
遠心力および重力を含めた、ビーズを流動チャンバーのウェルに吸い込む他の方法があるのは認められるであろう。本発明はこの点に関して制限されない。
開いた系におけるISFETセンサーアレイを用いるDNA配列決定。説明的配列決定反応は「開いた」系で行うことができる(すなわち、ISFETチップをISFET装置のプラットフォーム上に置き、次いで、各ヌクレオチド(各々6.5μMにて得られた5μL)は、所与のヌクレオチドをチップの表面に既にある液体にピペットで与え、次いで、2.5mHzの速度でチップからデータを収集することによって、以下の順序:dATP、dCTP、dGTPおよびdTT(100mMストック溶液,Pierce,Milwaukee,WI)で手動により加える。これは、ほぼ18フレーム/秒にて7.5秒間にわたってデータの収集をもたらすことができる。データは、次いで、LabViewを用いて分析することができる。
鋳型の配列が与えられれば、dATPの付加の結果、鋳型4について4塩基延長がもたらされるであろう。dCTPの付加の結果、鋳型1において4塩基延長がもたらされるであろう。dGTPの付加は鋳型1、2および4を表4に示されたように延長させ、dTTPの付加の結果、ランオフ(示されたような全ての鋳型の延長)がもたらされるであろう。
好ましくは、該方法が非自動で(すなわち、自動化された流動および試薬導入の不存在下で)行われると、各ウェルはアピラーゼを含有して、取り込まれていないdNTPを分解させ、あるいは別法として、各dNTP(例えば、dATP)の付加および取込みに続いて、かつもう1つのdNTP(例えば、dTTP)の付加に先立って、アピラーゼが各ウェルに加えられる。アピラーゼは、この実施形態において、または本明細書中で議論されたいずれかの他の実施形態においては、dNTPを分解することができるもう1つの化合物(または酵素)で置き換えることができるのは理解されるべきである。
センサーチップ上のミクロ流体を用いるDNA配列決定。流動様式における配列決定は、DNAへの取込み用のヌクレオチド試薬の開いた適用の延長である。試薬をISFETチップ上のバルク溶液に加えるよりはむしろ、試薬は、チップ表面を横切って順次に流動させ、一度に単一DNA塩基を延長させる。dNTPは順次に流動させ、dTTP、次いで、dATP、dCTP、およびdGTPで開始する。チップにわたる流体運動の層流性質のため、マイクロウェルへの、および最終的には核酸負荷ビーズの周りへのヌクレオチドの拡散は、送達のための主なメカニズムである。流動様式は、ほとんど大部分のヌクレオチド溶液が適用の間に洗浄除去されるのも確実とする。これは、あらゆるヌクレオチド流動に続いて、チップを緩衝液溶液およびアピラーゼ溶液ですすぐことを含む。ヌクレオチドおよび洗浄溶液は系中の化学瓶中に貯蔵され、流体管および自動バルブの系を用いてチップ上を流動される。ISFETチップは、ヌクレオチド流動の間にDNA延長の化学的産物を検知するために活性化される。
実施例2ポリメラーゼ活性に対する低イオン強度の効果
実験を行って、特に、低イオン強度ヌクレオチド取込み反応を含めた、本明細書中に議論された配列決定の態様および実施形態に関連したある種の機能について種々のポリメラーゼを試験した。これらの機能は、低イオン強度において配列決定プライマーを延長するためのポリメラーゼの能力、低イオン強度におけるプライマー/鋳型核酸ハイブリッドに対するポリメラーゼの親和性、プライマー延長の速度、およびchemFETセンサー上方に位置したウェルとの関係でプライマーを延長するポリメラーゼの能力を含む。これらの機能の各々を以下に議論する。
低イオン強度におけるポリメラーゼの活性。ポリメラーゼ活性は、ポリメラーゼが鋳型に沿って延長される程度を決定することによって測定することができる。蛍光レポーターアッセイを工夫して、ポリメラーゼ活性を測定した(図72A)。簡単に述べれば、(本実施例との関係では鋳型と言われる)蛍光標識したDNAオリゴヌクレオチドを、ストレプトアビジン−ビオチン相互作用を介して超常磁性ビーズに付着させる。鋳型の5’末端をビオチンで標識し、3’末端を、例えば、6−FAMで標識する。ビーズをストレプトアビジンで標識する。鋳型の3’末端に対して相補的なDNAオリゴヌクレオチドプライマーを鋳型にアニールし、ビーズを、緩衝液、塩およびdNTPを含有する延長溶液中のポリメラーゼで、鋳型配列に基づくプライマーの延長のために十分な時間の間インキュベートする。インキュベーションの後、ポリメラーゼおよび他の反応成分を、ビーズの連続洗浄によって除去する。もしプライマーが所定の制限酵素認識部位を通って延長すれば、蛍光標識二本鎖DNAは、適切なエンドヌクレアーゼ(例えば、HindIII)と共にインキュベートすると放出されるであろう。制限消化からの上清を、次いで、蛍光定量に付す。放出された蛍光の大きさは、ポリメラーゼ活性に比例する、ビーズ上に存在する二本鎖DNAの量に比例する、制限エンドヌクレアーゼ活性によって放出されたDNAの量に比例する。
特に、図72Bおよび72Cに示されるデータは、ポリメラーゼを、dNTPの不存在下においてビーズ固定されたプライマー/鋳型ハイブリッドに結合させることによって生じさせた。未結合ポリメラーゼおよび結合性溶液成分を洗浄除去した後、dNTPで補足された示された延長ミックス(例えば、標準または低イオン強度)をビーズに加え、40℃において10分間インキュベートした。活性アッセイを前記したように引き続いて完了して、示されたポリメラーゼの活性を測定し、バックグラウンドを差し引いた蛍光をプロットする。図72Cにおいて、「Therminator(+)」は延長溶液中へのdNTPの添加を示し、および「Therminator(−)」は、延長溶液中でのdNTPの不存在、すなわち、各々、陽性および陰性対照を示す。
このアッセイを用い、ポリメラーゼ活性が標準および低イオン強度反応条件双方において測定されている。多数のポリメラーゼは、標準条件と比較した場合、低イオン強度条件において比較的活性である(図72Bおよび72C)。
低イオン強度におけるポリメラーゼ親和性鋳型/プライマーハイブリッドに対するポリメラーゼの親和性は、我々の標準アッセイで間接的に測定することができる(図72A)。3つの異なるDNAポリメラーゼ(T4exo−、Therminator、クレノウexo−)を、dNTPを含まない標準延長溶液中で、室温にて15分間、プライマー活性化されたビーズ固定化鋳型に結合させた(図72A、工程1)。次いで、ビーズを洗浄して、未結合ポリメラーゼおよび他の成分を除去し、次いで、40℃にて、低イオン強度溶液(例えば、25℃の0.5mM Tris、100μM MgCl2、pH9.0)中に再懸濁し、そこでインキュベートした。図73に示した時間の後、ビーズを、20μMの各dNTPを補足した低イオン強度溶液(例えば、Therminatorおよびクレノウexo−のためには25℃の0.5mM Tris、100μM MgCl2、pH9.0、あるいはT4 exo−のためには25℃の0.5mM Tris、80μM MgCl2、pH9.0)中で洗浄し、そこに再懸濁させた。もしポリメラーゼが鋳型/プライマーハイブリッドに対して低い親和性を有するならば、それは離れ落ち、洗浄除去されると予測され、その結果、プライマーの延長は無いであろう。しかしながら、もしポリメラーゼが鋳型/プライマーハイブリッドに対して高い親和性を有するならば、それは結合したままであり、dNTPと共にインキュベートした場合に鋳型を延長できよう。延長したプライマーの量は我々の標準アッセイを用いて測定され(図72A)、図73にプロットする。プライマー延長は全ての時点において同等であり、全ての3つのポリメラーゼは、40℃にてインキュベートすると、40分間で、プライマー活性化鋳型にしっかりと結合することを示唆する。(「(+)dNTP」として示された)陽性対照として、プライマー活性化鋳型にポリメラーゼを予備結合させることなく、プライマー延長を測定し、もしdNTPを延長溶液に加えなければ、(「(−)dNTP」として示された)陰性対照として、蛍光を測定した。T4 exo−ポリメラーゼ(3’〜5’エキソヌクレアーゼ欠乏)、Therminator、およびクレノウexo−は、低イオン強度溶液中で40分間のインキュベーションの後にプライマーを延長させ、これは、全ての3つのポリメラーゼが低イオン強度において鋳型/プライマーハイブリッドに対する高い親和性を有することを示唆する(図73)。
ポリメラーゼの速度。鋳型に沿ってポリメラーゼがプライマーを延長することができる速度は、単位時間当たりに延長された鋳型の分率を測定することによって標準アッセイで測定することができる。T4 exo−ポリメラーゼ(3’〜5’エキソヌクレアーゼ欠乏)は、異なる速度を除いては、双方の標準反応条件(STD;25℃の10mM Tris−HCl、50mM NaCl、10mM MgCl2、1mMジチオスレイトール、20μMの各dNTP、pH7.9)において、および低イオン強度条件(LS;25℃の0.5mM Tris、80μM MgCl2、20μMの各dNTP、pH9.0)においてプライマーを延長する。T4の従前の研究は、T4が、標準反応溶液中で(すなわち、標準イオン強度で)秒当たり4ヌクレオチドの最大定常状態速度にて鋳型に沿ってプライマーを延長させることができるのを示す。この速度にて、標準反応溶液中の延長は8.75秒以内に完了すると予測され、事実、延長は実験的には約10秒で完了する(図74A、T4−STD)。低イオン強度反応溶液中では、T4は20秒以内に延長を完了させ、これは2倍の減少を示唆する。さらに、該反応溶液が0.5mM Tris、20μM MgCl2および5μMの各dNTPである場合、T4の速度は80μM MgCl2および各dNTPについての20μMに対して約2倍だけ(すなわち、図74Aの低イオン強度溶液、図74B参照)、10mM MgCl2および各dNTPについての20μMに対して4倍だけ(すなわち、図74Aの標準溶液、データは示さず)減少する。T4は、重合(または取込み)の最初のバースト、続いてのより遅い重合速度を含めた二相キネティックスで重合すると報告されている。重合のこの最初のバーストは、低イオン濃度で観察されるわずかに低下した速度を補償することができる。(Capson et al. Biochemistry 1992 31:10984−10994.)
TherminatorおよびBstポリメラーゼは、双方の標準反応条件(STD;25℃の20mM Tris−HCl、10mM(NH2)2SO4、10mM KCl、2mM MgSO4、0.1%Triton X−100、pH8.8)において、および低イオン強度条件(LS;25℃の0.5mM Tris、100μM MgCl2、20μMの各dNTP、pH9.0)において、プライマーを延長することができる。低イオン強度条件における定常状態速度は、標準イオン強度条件におけるこれらのポリメラーゼによる延長よりも遅く、それは、低イオン強度延長溶液におけるT4プライマー延長の定常状態速度よりも遅い。
センサーのウェルにおけるプライマー延長標準活性アッセイと同様なアッセイを用い(図72A)、プライマー延長をchemFETセンサーのシリコンウェルで試験して、センサーウェルの壁材料がポリメラーゼを阻害するか否かを決定した。このアッセイは、鋳型を6−FAMで標識しなかった点のみで、前記したものとは異なる。ポリメラーゼ結合プライマー活性化鋳型を備えたビーズを(図75Aに示すように)シリコン色素上にピペットで入れ、40℃にて1分間インキュベートし、続いて、低塩緩衝液中でdNTPを加えた。インキュベーションの後、ビーズをチップから回収し、標準制限消化に付す。プライマー延長は、BioAnalyzerを用いてDNA断片分離によって測定した。dNTPの添加の結果、断片が得られ、他方、dNTP無しの反応はそうでなく、これは、センサーウェルの壁材料がプライマーのポリメラーゼ延長を阻害しないことを示唆する(図75B)。
実施例3増大するスピードおよびスループット
ISFET/chemFETチップで用いたアレイアーキテクチャの1つの利点は、全てのマイクロウェルが並行して化学材料を受け取り、それを処理し、FETの出力を並行して分析することである。単一のチップはNのウェルに限定され、および数Nは半導体プロセスがデバイスをより小さく収縮させるにつれ経時的に増大するが、どれくらい多くのFETおよび(反応チャンバーとしても知られた)ウェルが単一のチップの上にあったとしても、系は、並行に操作される、同一マシーン中の2以上のチップで容易に形成され得;あるいは多数のマシーンは並行に操作でき、それらのFETが出力を供するにつれ、それらの出力は並行して処理されて、ゲノムを配列決定し、またはもう1つの分析を行うのに必要な時間を低下させる。並行した計算は良く知られており、コンピューター科学者が、数個のチップの出力の処理を構成して、所望の出力の計算を便宜にする多数の知られた方法がある。よって、各々が、256k以上のマイクロウェルを有する多数のチップでは、1時間、または僅か数時間のスパンにおいて試料からヒトゲノムを抽出するのは容易に達成できる。チップのスピードが増大し、デバイスのサイズが収縮するにつれ、これらの時間が単一のチップで達成することができる。
前記したイオンパルス検出アプローチの理論および目的を説明してきたが、幾人かにとっては、いくつかの環境において、DNA配列決定反応の検出を達成するために、シミュレーションに基づいて、有用であると思われる条件の基本的例を供するのは有用であろう。
溶液中のイオンイオン強度は、イオンパルス応答を決定するのに関与する因子である。反応緩衝液中のイオンを制限するのは有用であろう。0.5mM Tris、および電荷をバランスさせるためのCl
−の使用を仮定すると、以下のように決定することができる:
Trisの他の濃度(例えば、5〜20mM)は前記濃度を倍率変更させることによって与えられるので、0.5mM Trisの場合を考える。pHは8.8において一定であると仮定する。溶液中の他の種は反応体および生成物を含む:
これは、0.5mM Tris−HClに倍率変更した、反応緩衝液についての状況である。全てのMg
++は予め浸漬することによって酵素に複合体化されると仮定する。反応の溶液および配列決定反応に対する拡散方程式から、イオン強度は計算され、
、センサーダイナミックスは先に設定された関係によって与えられる。
濃度変化は小さいので、濃度変化のイオン強度の拡大を行うのが可能である:
I={119.227+6.67[PPi]+2.78[Pi]+0.79[放出されたH+]−9.52(6.5μM−[dNTP])}x10
−6 (5)
pHは8.80である
イオンおよび硫酸を含有する、0.5mM TrisにおけるBST反応緩衝液については:
I={1452.46+6.5[PPi]+2.87[Pi]+0.98[放出されたH+]−9.98(6.5μM−[dNTP])}x10
−6 (5’)
5mM Tris緩衝液については、イオン強度は以下によって与えられる。
I={555.803+7.43[PPi]+2.92[Pi]+0.98[放出されたH+]−9.90(6.5μM−[dNTP])}x10
−6 (5’’)
pHは9.03である
0.5mM Tris+1mM MgCl
2については、イオン強度は以下によって与えられる。
I={3119.86+6.94[PPi]+2.78[Pi]+0.91[放出されたH+]−9.49(6.5μM−[dNTP])}x10
−6 (5’’’)
pHは8.81.03である
5mM Tris+1mM MgCl
2については、イオン強度は以下によって与えられる。
I={3556.67+7.71[PPi]+2.93[Pi]+0.98[放出されたH+]−9.89(6.5μM−[dNTP])}x10
−6 (5’’’’)
pHは9.04.03である
0.5mM Trisについては、イオン強度は、I={250.699+6.44[PPi]+2.83[Pi]+0.96[放出されたH+]−9.67(20μM−[dNTP])}x10
−6によって与えられる。
pHは、dNTPが存在すれば8.53、存在しなければ8.97である。
0.5mM Tris+50μM MgCl
2については、イオン強度は以下によって与えられる。
I={400.759+6.46[PPi]+2.84[Pi]+0.96[放出されたH+]−9.66(20μM−[dNTP])}x10
−6 (5’’’’’’)
pHは、dNTPが存在すれば8.53、存在しなければ8.97である。
最後に、dNTPの不存在下における、pH=9およびイオン強度=300mMでのカノニカル緩衝液を考える。方程式は以下のようになろう。
I={493.20+6.46[PPi]+2.84[Pi]+0.96[放出されたH+]−9.66(20μM−[dNTP])}x10
−6 (5’’’’’’’)
シグナルはI−1/2に比例し、従って、反応緩衝溶液のイオン強度はできるだけ低く保つのが望ましいことを注記する。(I
0+dI)
−1/2=I
0 −1/2−1/2(dI/I
0)I0
−1/2であることを注記する。かくして、シグナルに対する相対的変化は−1/2(dI/I
0)である。方程式5−5’’’’’’’を比較することによって、dIは緩衝液イオン強度からおおよそ独立していることが分かる。かくして、もし初期のイオン強度であるI
0がより低いならば、相対的シグナル変化はより大きい。
反応/拡散計算
起こる反応は以下のものである。
d[DNA]/dt=−k
bst[dNTP][DNA]
d[PPi]/dt=k
bst[dNTP][DNA]
d[dNTP]/dt=k
bst[dNTP][DNA]
反応PPi+H
2O→2Piの酵素が存在すれば、この反応は瞬時に起こると推定される。これらの種の全ては、DNAを除いて、個々の拡散係数に従って拡散する。しかしながら、DNAのもう1つの塩基を加えることによって放出されたH
+は拡散する。
有限要素法を用いて、これらの種の反応および拡散を計算することができる.該方法は、好ましくは、円筒座標にコードされる。反応速度に対するMg
++の効果について以下に注意して、各要素における反応は前記スキームに従う。加えてMg
++の拡散も追跡される。しかしながら、電流の計算についてはMg
++は一定であると仮定するのを想起されたい。
数字コードは、直径Dおよび深さHの円筒への拡散に対する分析的解に対するチェックであった:
もしr方向において(D/2)/100の点、およびz方向のH/100の点のグリッドを用いるならば、結果は0.1%の精度に合致した。
パラメータk
bstを決定するには、Rothberg et alのNatureの論文からの結果を用いた。その論文は関連拡散の単純化された質量移動計算を表し(resented)、それから関連反応は以下のようになる。
d[DNA]/dt=−k
bst[dNTP][DNA]
d[PPi]/dt=k
bst[dNTP][DNA]−k
c([PPi])
d[dNTP]/dt=k
bst[dNTP][DNA]+k
c([dNTP]
0−[dNTP])
最後の2つの反応を合わせると、以下が見出される。
d([PPi]+[dNTP])/dt=−k
bst[dNTP][DNA]−k
c([dNTP]
0−[PPi]−[dNTP])
これらの方程式を数値的に解いて、k
bstおよびk
cの値を決定することができ、30℃におけるk
bst=2.38(μMs)
−1およびk
c=0.2 s
−1を得る。
PPi→Pi酵素
反応PPi+H
2O→2Piは有限の速度で起こる。酵素およびMg
++の存在下における速度定数は約10
3s
−1である(Biochemistry 41(2002)12025)。従って、この反応は1ms以内に終了する。かくして、この変換は瞬時であるということができる。しかしながら、いずれかの酵素またはイオン触媒の不存在下においては、速度定数は約3
−1年
−1である(J. Chem.Soc. Farady Trans,93(1007)4295)。この場合、反応は全く進行し〜かしながら、多くのイオンはこの反応をある程度触媒する。かくして、もしこの反応が進行しないのが望まれるならば、反応を触媒するイオンが存在しないように溶液を選択するよう注意しなければならない。
拡散係数
配列決定反応からのpH変化によるシグナルは、関連種の拡散係数に依存する。文献(Biophys.J 78(2000)1657)は、Pi、PPi、およびdNTPについての値を与える:
文献(BBA 1291(1996)115)は、温度範囲にわたってのATPに対しての値を与える。37℃において、該値は4.5×10
−6cm
2/sであり、これを本明細書中において用いる。PiおよびPPiについての値は、因子D
ATP(T)/D
ATP(37℃)だけ前記値を倍率変更させることによって温度Tにおいて計算される。25℃におけるイオンの拡散係数(J. Chem. Phys. 119(2003)11342)は、以下の通りである。Mg++ 1.25(J. Amer. Chem. Soc. 77(1955)265)、Na+ 1.33(J. Chem. Phys. 119(2003)11342)である。
H
+の拡散係数はNa
+のそれと同等であると推定され、なぜならば、電荷中性によって、H
+は対としての負のイオンでの拡散でなければならず、あるいはH
+はもう1つの正のイオンと交換しなければならず、そのうちN
+は最も迅速に拡散するからである。
1つの好ましい実施は、全ての種の拡散係数を減少させるための小さな球(例えば、0.1μm)の使用を含む。これは、おおよそ拡散係数が低下する比率だけ、pH曲線をより大きな時間にシフトさせる。拡散係数の低下についてのテキストブックの式は、D
eff/D
0=2(1−φ)/(2+φ)であり、ここに、φは該球によって専有される容積の分率である。
小さな球の半径はこの表現に直接的には入らない。球無しについては、φ=0である。ランダムにパッキングした球では、φ≒0.6であり、密なパッキングをした球では、φ=0.74である。
もう1つのアプローチが、H
+、Pi、PPi、およびdNTPの拡散係数を低下させるために他の方法を用いることである。例えば、溶液の粘度は増大させることができる。
配列決定反応
次に、Mg
++の拡散して入る効果を考える。どのように酵素反応速度が[Mg
++]に依存するかは正確に知られてい〜かしながら、二価金属イオンが酵素活性に必要である。該速度は、1mMのMg++における最大速度まで直線状に比例すると推定される。かくして、反応速度定数はk
bst min(1,[Mg
++]/1mM)と等しいと推定される。
Mg
++についての1.25×10
−5cm
2/2の拡散係数を用いることができる。モデル2については、t=0では、濃度[Mg
++]
0=1mMにおいて、z=0においてのみMg
++が存在する。t>0では、それは拡散して入り、方程式(8)によると反応速度に影響する(8).モデル1では、Mg
++の濃度はウェルにおいて全ての時間に1mMである。別法として、溶液中の遊離Mg
++濃度がゼロとなるように、酵素はMg
++と共に予め浸漬されると仮定することができる。
7〜9のpHの範囲においては、反応は、おおよそ以下のように、H
+を放出する。
DNA
n n
DNA
n+1 n+1
dNTP 4
PPi 3
2Pi 4
これは、溶液のpHよりも低いpKa値を持つ全てのH
+が良好な近似にて生じるからである。もし溶液がpH7〜9であれば、これらの種の全てはpHを低下させる。従って、反応dNTP+DNA
n→PPi+DNA
n+1の正味の効果は、pHを変化させないことである。
反応PPi+H
2O→2Piの正味の効果は、1つの正味のH
+の放出によってpHを変化させることである。
ビーズ表面のDNAによって放出されたH
+はDNAを越えて外まで拡散し、pHはDNAのpKaよりもかなり高いので、これらのH
+イオンは、平衡時間t<0の間にウェルから外へ拡散するであろう。(全てのこれらのH
+は拡散して離れる)。すなわち、もしビーズ上のDNAが、dNTPが加えられる前に平衡とされると、溶液は、丁度、(ビーズ近くに少し過剰のNa
+が存在して、デバイ長さ内で、DNA上の負の電荷をバランスさせた)通常の緩衝溶液のはずである。DNAの過剰の塩基が加えられると、H
+のパルスが生じ−−−拡散係数はNa+のようなものである。
ウェルのサイズ
シミュレーション実行は小さなウェルについて行った:
D=1.5μmでは、h=0.2μm(ビーズの1層)である。D=4μmについては、h=1.1μmである。そうでなければh=1.5μmである。加えて、1つの実行は、半径3.6μmのより大きなビーズにて4μm×6μmウェルについて行った。
デバイス流動におけるdNTP先端厚み
dNTPは、計算において、t=0においてウェル上方で0から6.5μMへ瞬時に変化すると推定される。もしdNTPがウェルを通って十分迅速に流動するならば、この条件はほぼ真実である。定義
V=ウェル上方の流体の流動の速度
L=デバイスの長さ
D=dNTPの拡散性=3.91×10
−6cm
2/s
d=ウェルのサイズ
t=デバイスを通っての流動を一掃するための時間
t
0=「瞬時の変化」のためのカットオフ時間
W
d=デバイスの端部における拡散による先端の幅=(2Dt)
1/2
W
m=混合による先端の幅≒フラッシュ容量領域の長さ
U=フラッシュ容量=15μl(現在52μl)
U=流速=50μl/s
フローセルの幾何学は、313および314と命名された2つのモデルについて以下の通りである:
L=5mm、d=4μmを取り、t=1/6.69sを仮定する。Q=50μl/s。従って、W
d=10.8μmである。また、V=L/t=3.3cm/sである。φ=0.6では、D
eff=D
0 2(1−φ)/(2+φ)=1.20x10
−6cm
2/sである。t
0の値はウェルのサイズに依存する。それは、dNTPがN
poly=0につきウェルの底部まで拡散する時間よりもかなり短い(すなわち、このイオンパルス応答が起こる時間よりもかなり短い)はずであり、いってみれば、その値の10%である。4×6μmウェルについては、拡散に対する障害無しを仮定して、dNTPがウェルの底部まで拡散する時間は、H
2/(2D)であり、従って、t
0=10%×H
2/(2D)=0.015sである。シミュレーションは、その上のDNAを備えた球が拡散を遅延させ、従って、恐らくはt0=10%*0.2s=0.02sであることを明らかにする。D=max(W
d,W
m)と定義する。先端の前方端がデバイスを横切る時間はd/Vである。全先端(前方+後方端)がウェルを横切るのに要する時間は(W+d)/Vである。dNTP濃度の「瞬時の」上昇の条件は(W+d)/V<<t
0である。(W+d)/V≒U/u。U/u=0.3sであって、t
0=0.02sであるので、この条件は前記仮定によって満足されない。10のファクターだけ、Uはより小さくされなければならないか、またはuはより大きくされなければならないか、あるいはその双方であるか、のいずれかである。W
mがフラッシュ領域の長さによって与えられる条件は少し余りにも厳格であろう:混合領域の幅は、全フラッシュ領域の長さよりも実質的により小さくてもよい。これは保存的条件である。しかしながら、W
d/V<<t
0であり、従って、先端の拡散的広がりは無視できる。
次に、異なる計算である。チャネルの壁におけるdNTPの濃度は、t
0未満において、0から6.5μmまで上昇するのが望ましい。t=0における濃度C(x,y,z)は、t=0においてc
0=6.5μmであると仮定することができる。0<x<L、−B<y<B、0<z<Wを取る。0<x<Lのいずれかの値については、y=Bにおける濃度を知るのが望まれる。厳格に述べれば、壁における濃度は0にとどまり、というのは、拡散を考慮しない限り、そこでの速度は0だからである。従ってx方向の対流およびz方向の拡散を考慮する必要がある。対流[6]の計算。
v=[(p
0−p
L)B
2/(2μL)][1−(y/B)
2] (10)
流速はQ=(2/3)(p
0−p
L) B
3 W/(μ L)である。デバイスの末端における平均流動が0.95 c
0となるのに必要な時間を計算する。まず、拡散がなければ、濃度は以下によって与えられることに注意されたい。
c(x,y,z) 0, t<t*
c
0, t>t*
t*=x/v(y) (11)
流動はt’=L/v(0.95B)の最大濃度の95%となる。1つの容量をクリアするための時間はt’’=容量/Qであり、ここに、容量=2B WLである。t’=2/3/0.0975t’’=6.87t’’であることが判明し得る。かくして、平均濃度を最終値(3ではない)の95%に持ってゆくのに7デバイス容量を要する。関心事の中には、デバイス壁の濃度の値がある。濃度は、対流によって支配されるy方向の拡散を無視し、方程式
∂c/∂t+v(y) ∂c/∂x=D ∂
2c/∂y
2 (12)
c(x,y,0)=0
c(0,y,t)=c
0
∂c(x,±B,t)/∂y=0
に従う。次に、濃度は、より小さなx−δxおよびy=y−δyにおいて存在した濃度プロフィールからの拡散を除いて、時間δtにおける拡散によって壁に到達するというのは、対流はこの時間δtの間に起こるからである。(δy)
2=2Dtに注意されたい。前記より、濃度は、時間t’’=1/6.69sの間の拡散によってδy=10μmのオーダーで拡散することができることが分かる。それは時間t
0=0.02sの間に拡散するのが望まれ、それは、3.95μmの拡散距離を意味する。従って、保存的計算として、方程式(11)t*=L/v(B−3.95μm)から計算することができよう。時間t*+t
0までに、壁における濃度は、拡散および対流の組合せを通じてほぼc
0であろう。かくして、v=(3/4)(1/B W)Q[1−(y/B)^2]である。
これを用い、t*=L/v(B−3.95 μm)=1.84sである。後の値t
0において、壁における濃度はほぼ最大まで上昇する。残念なことに、この計算は、1.84sの間に、yの小さな値からの速度プロフィールからの材料もまた壁まで拡散するチャンスを有したことを無視する。また、それは、xのより小さな値について開始する拡散は、yがより大きくなるにつれ、より低い速度にて右側に進行することを無視している。
かくして、境界層をわたっての拡散は対流よりも速いのはいつであるかと尋ねることができる。拡散によってはδ/t=2D/δである。対流によってはδ/t=v(B−δ)である。これらの2つはδ=.001mm=1.0μmについて等しい。従って、先端がδ=L/v(B−δ)=6.78sのこの値に到達すると、壁への材料の進行は拡散によって完全に支配されている。そして、濃度は、時間δ
2/(2D)=0.01sの間にほぼc
0まで上昇するであろう。従って、δ<1.0μmについては、対流はx方向の拡散よりも重要である。
方程式(12)の数値的解は、前記近似的計算をチェックするために必要である。有限要素法を用いて。数値的に方程式(12)を解くことができる。我々は、前記デバイスについては、壁における濃度はx=0.5mmにおいては約0.15s内に、およびx=5.0mmにおいては約0.5s内に上昇することを見出す。これは余りにも遅い。レイノルズ数はRe=1g/cm3*0.5cm/(1/6.69s)*0.0293cm/0.01cp=9.8である。もし高さが0.1mmであると設定すれば、壁における濃度はx=0.5mmにおいては約0.04s内に、およびx5.0mmにおいては約0.15s内に上昇することが見出される。これはおそらくは余りにも遅い。Re=9.8。もし別法としてQ=240μl/sと設定すれば、壁における濃度はx=0.5mmにおいては約0.05s内に、およびx=5.0mmにおいては約0.2s内に上昇する。これは恐らくは余りにも遅い。Re=47。高さが0.1mmおよびQ=240μl/sの双方を設定すれば、壁における濃度はx=0.5mmにおいて約0.013s内に、およびx=5.0mmにおいて約0.07s内に上昇する。これは恐らくは十分速い。Re=47。全ての場合における流動は層流とすべきである。
前記したことは、最大のシグナルがdNTPのブレークスルーから来るものであり、およびこのブレークスルーはかなりシャープである点で少し余りにも厳格であろう。ウェルの頂部におけるdNTP上昇は0.02s内に完了する必要はない可能性がある。恐らく、該上昇は、ウェルの底部におけるdNTPブレークスルーのかなり前に完了しさえすればよい。そして、これは数秒のオーダーである。従って、ウェルの頂部において上昇しているdNTP濃度に関して反応/拡散方程式を解く必要がある。それを0およびtの間で0から6.5μMまで直線状に上昇させ、ここに、tは、デバイスの末端における上昇時間についての従前のパラグラフで特定された値である。
これらの数値的シミュレーションから、ウェルの表面におけるdNTPの有限上昇時間は、イオンパルスデバイスの効率をわずかに低下させるに過ぎないことが判明するであろう。6μm×8μmデバイスでは、0.2sの有限上昇時間は、観察されたセンサー応答曲線にわずかに影響するに過ぎない。0.5sの有限上昇時間は最初のピークをより長い時間にシフトさせ、ならびにN
polyの全ての値のピークの高さを低下させることによって観察されたセンサー応答曲線に影響する。より遅い応答時間を持つ表面は、この有限なdNTP上昇時間によって余り影響されない。4μm×6μmについてはわずかにより劇的であれば、効果は同様である。というのは、このデバイスについての特徴的な拡散時間はより小さく、従って、有限上昇時間は、ウェルの表面における瞬時のdNTP上昇の理想化された場合に対するより大きな相対的摂動だからである。
結果のパラメータ感度
実験的変数に対するイオンパルス応答の感度を決定するために、4μm×6μm系を参照として採用した。この検出方法は拡散に依拠しているので、ウェルの幾何学はプロットされるいずれのN
poly曲線の分解能に対しても有意なインパクトを有する。
dNTP濃度は半分とされて3.25μMとなり、2倍とされて13μMとなった。ビーズ表面のDNAを3のファクターだけ増大させた。実行は、より大きな3.6μmビーズで行った。ビーズ表面のDNAおよびdNTPの双方は3のファクターだけ増加させた。酵素の反応速度kは半分とし、および2倍とした。5μM Tris、遊離Mg
++無しについてのセンサー応答曲線を、前記の全てについて作成した。
酵素の反応速度定数の2倍は、ピークを非常にわずかにより高くする。
1つの可能性は、ビーズ上のDNA濃度が余りにも高くて反応は有効に拡散制限され、従って、酵素速度定数は濃度曲線に影響する主な因子ではないということである。同様に、1/2だけ酵素反応速度を低下させるのは、センサー曲線に対してほとんど効果を有しない。それは、それらを時間内に非常にわずかに広げるにすぎない。
大きなビーズは非常によく働く。ビーズ上のDNAのより多くの塊があるので、それを消費するのはより長い時間がかかる。加えて、ビーズは容量がより大きな空間を取り、従ってウェル底部までの拡散は少し長い時間を要する。ピークはより大きな時間まで広がる。
ビーズ上のDNAのより大きな濃度は時間内にピークを広げる。これは、DNAのより大きな濃度は、ビーズ上のDNAのより大きな塊を意味するからである。DNAのこのより大きな塊は、反応までにより長い時間を要する。かくして、dNTPの最終ブレークスルーはより長い時間を用する。
溶液dNTP濃度を3.25μMまで降下させるのは、ピークを時間内に広げるが、また、ピークの高さを低下させる。2つの効果が、恐らくは、異なるN
poly曲線を区別することに関してほぼ相殺される。逆に、dNTP濃度の13μMまでの増大は、ピークをより小さな時間へシフトさせる。ピークはより高いが、それらは、また、時間が実質的により近い。該曲線はそのようにより短い時間におけるものであるので、それらはセンサーの応答時間へ移動している。13μM曲線は6.5μMの場合よりも余り区別ができないであろう。
ビーズ上のDNAの濃度を3倍増加させ、および溶液中のdNTP濃度を13μMまで増加させるのは、ピークを約3倍高くするが、それらを時間内に広げない。タイムスケールは比較的変化しない。なぜならば、ビーズ上のDNAの量はより大きいが、反応速度もまた、より高いdNTP濃度のためより大きいからである。同一時間に放出されるより大きな塊があるゆえに、ピークはより高い。
パッキングビーズ−φ(ファイ)
(全ての種の拡散を遅らせるための)パッキングビーズに対する所望性は、同様なウェル寸法の間で、および4×6ミクロン(幅×高さ)および6×8ミクロンウェルの間で、イオンパルス応答を比較することによって見られる。N
poly曲線は、ウェルの増大した深さおよびパッキングビーズで分解される(φ=0.6)。
φの効果を見るための式は、効果的な拡散係数である。
D
eff=D
0*2(1−φ)/(2+φ)
φ=0.6についてはD
0/D
eff=3.25、例えば、ビーズのため3.25×減速である。
φ=0.9についてはD
0/D
eff=14.5、例えば、このため14.5×減速である。
必要な他の式はウェルにおける特徴的時間である。
H
2=2 D
eff t
従って、φ=0.6における6umウェルについては、t=6
2/(2/3.25*D
0)=58.5/D
0である。
φ=0.9における2.25ウェルは、t=2.25
2/(2/14.5*D
0)=36.7/D
0を生じる。
従って、φ=0.9における2.25umウェルは、全ての時間に、φ=0.6における6umウェルよりも小さな約36.7/58.5=0.63を有するであろう。より小さなウェルは、依然として、僅かにより速いであろう。φ=0.936を有すれば(ウェルの直径およびDNAビーズがウェル高さと同様に倍率変更されることを仮定し)、より小さなウェルは丁度より大きなウェルとしてほぼ正確に作動するであろう。
シグナル対ノイズ
シグナル対ノイズ比は、N
polyおよびN
poly+1シグナルの間のmVで表わした差に、また、mV曲線が異なる間の時間の長さの平方根に比例する。σをセンサーのノイズと定義し、fを秒当たりのフレームの数と定義する。0<t<t
maxの間におけるシグナル1およびシグナル2の間の絶対値の平均的差をΔと定義し、すなわち、Δ=∫
0 tmax|v
1−v
2|/t
maxである。
曲線の間の差は双方の兆候を有することができる故に、絶対値を取る。かくして、条件はΔ>σ[2/(ft
max)]
1/2である。
一例として、D=4μM、H=6μMウェル、φ=0、dNTP=20μM、10×DNAの場合について考える。f=20Hz、およびt
max=2sを取る。Δの値は0.6861である。かくして、v=(3/4)(1/B W)Q[1−(y/B)^2]である。
0.6861>0.22σ
従って、σ=0.25mVの値を用い、このデバイスは作動するであろう(1−P=10
−35)。もう1つの例として、D=4μM、H=6μMウェル、φ=0、dNTP=6.5μM、10×DNAの場合について考える。f=20Hz、およびt
max=4sを取る。Δの値は0.1862である。かくして、v=(3/4)(1/B W)Q[1−(y/B)^2]である。
0.1862>0.1581σ
従って、σ=0.25mVの値を用い、このデバイスは恐らくは作動するであろう(1−P=2.4×10
−6)。
t
maxの最適な値:余りにも小さな値があり、十分なシグナル;余りにも大きな値を有するものではなく、かなりのノイズを見ていることに注意されたい。t
maxの値はここではおおまかなものに過ぎない。
同等物
いくつかの発明的実施形態を記載し、ここに説明してきたが、当業者であれば、機能を実施し、および/または結果および/または本明細書中で記載された利点の1以上を得るために、種々の他の手段および/または構造を容易に考え付き、そのような変形および/または修飾の各々は、本明細書中で記載された発明的実施形態の範囲内にあるとみなされる。より一般的には、当業者であれば、本明細書中で記載された全てのパラメータ、寸法、材料、および構成は、例示的であることを意図し、および現実のパラメータ、寸法、材料、および/または構成は、具体的な適用、または発明の教示が用いられる適用に依存するであろうことは容易に認識するであろう。当業者であれば、ルーチン的実験を超えないものを用いて、本明細書中で記載された具体的な発明的実施形態に対する多くの同等物を認識し、またはそれを確認することができよう。従って、これまでの実施形態は例のみによって提示され、添付の特許請求の範囲およびその同等物内で、発明的実施形態は、具体的に記載され、および特許請求されるものとは異なるように実施することができると理解されるべきである。本開示の発明的実施形態は、本明細書中で記載された各個々の特徴、系、製品、材料、キットおよび/または方法に向けられる。加えて、2以上のそのような特徴、系、製品、材料、キット、および/または方法のいずれの組合せも、もしそのような特徴、系、製品、材料、キット、および/または方法が相互に矛盾しないならば、本開示の発明的範囲内に含まれる。
全ての定義は、本明細書中で定義されかつ用いられるように、辞書的定義、引用により援用された書類中の定義、および/または定義された用語の通常の意味を支配すると理解されるべきである。
本明細書中で開示された全ての文献、特許および特許出願は、各々が引用され、いくつかの場合には書類の全体を含むことができる、主題に関連して、引用して援用する。
不定冠詞「a」および「an」は、明細書および特許請求の範囲において、ここに用いられるように、明瞭に反対のことが示されるのでなければ、「少なくとも1つ」を意味すると理解されるべきである。
フレーズ「および/または」、明細書および特許請求の範囲において、ここに用いるように、そのように連結されたエレメント、すなわち、いくつかの場合には同時に存在し、および他の場合には同時でなく存在するエレメントの「いずれかまたは双方」を意味すると理解されるべきである。「および/または」でリストされた多数のエレメントは同じように、すなわち、そのように連結されたエレメントの「1以上」と解釈されるべきである。他のエレメントは、所望により、具体的に特定されたそれらのエレメントに関連するか関連しないかを問わず「および/または」節によって具体的に同定されたエレメント以外で存在してもよい。かくして、非限定的例として、「Aおよび/またはB」の言及は、「含む」のようなオープン−エンデット言語と組合わせて用いた場合、1つの実施形態においては、(所望により、B以外のエレメントを含めた)Aのみをいうことができ;もう1つの実施形態においては、(所望により、A以外のエレメントを含めた)Bのみをいうことができ;なおもう1つの実施形態においては(所望においては、他のエレメントを含めた)AおよびB双方をいうことができ;等々である。
明細書および特許請求の範囲において、ここに用いるように「または」は先に定義された「および/または」と同一の意味を有すると理解されるべきである。例えば、リスト中で項目を分離する場合、「または」または「および/または」は、包括的である、すなわち、エレメントの数またはリストおよび、所望により、さらなるリストされていない項目の、少なくとも1、また1を超えたものを含めると解釈されるべきである。「の1つのみ」、「の正確に1つ」または特許請求の範囲で用いる場合には「よりなる」のような、明瞭に反対のことが記された用語のみがエレメントの数またはリストの正確に1つのエレメントを含めるという。一般に、用語「または」は、本明細書中で用いるように、「いずれか」、「の1つ」、「の1つのみ」または「の正確に1つ」のような排他性の用語が先行する場合、排他的代替物(すなわち、「1つ、またはもう一方、しかし双方ではない」)を示すように単に解釈されるべきである。「より実質的になる」は、特許請求の範囲で用いられた場合には、特許法の分野で用いられるその通常の意味を有する。
明細書および特許請求の範囲においてここに用いられるように、フレーズ「少なくとも1つ」は1以上のエレメントのリストへの参照において、エレメントのリスト中のいずれかの1以上のエレメントから選択される少なくとも1つを意味すると理解されるべきであるが、エレメントのリスト内に具体的にリストされた各およびあらゆるエレメントの少なくとも1つを必ずしも含まず、かつエレメントのリスト中のエレメントのいずれかの組合せを排除しない。この定義は、具体的に確認されたエレメントに関連するかまたは関連しないかを問わず、フレーズ「少なくとも1つ」が言及するエレメントのリスト内で具体的に確認されるエレメント以外で、エレメントが所望により存在してもよいことを許容する。かくして、非限定的例として、「AおよびBの内少なくとも1つ」(または、同等に、「AまたはBの少なくとも1つ」、または同等に、「Aおよび/またはBの少なくとも1つ」)は、1つの実施形態において、所望により1を超えるを含めた少なくとも1つのAをいい、Bは存在せず(所望により、B以外のエレメントを含んでもよい);もう1つの実施形態において、所望により1を超えるを含めた少なくとも1つのBをいい、Aは存在せず(所望により、A以外のエレメントを含んでもよい);なおもう1つの実施形態において、所望により1を超えてもよい少なくとも1つのA、および所望により1を超えてもよいを含めた少なくとも1つのBをいう(所望により、他のエレメントを含んでもよい);等々。
また、明瞭に反対のことが示されているのでなければ、1を超える工程または行為を含む本明細書中において特許請求されたいずれの方法においても、該方法の工程または行為の順番は、該方法の工程または行為が引用される順番に必ずしも限定されないのも理解されるべきである。
特許請求の範囲、ならびに前記明細書中において「含む」、「含めた」、「運ぶ」、「有する」、「含有する」、「関係する」、「維持する」、「から構成された」等のような全ての移行フレーズは、オープン−エンデッドである、すなわち、限定されるものではないが含めることを意味すると理解されるべきである。移行フレーズ「よりなる」および「実質的によりなる」のみが、各々、米国特許庁の特許審査手順のマニュアル、第2111.03条に記載されているように、閉じているか、または半分とじた移行フレーズである。