JP5111421B2 - リチウム二次電池用正極材料,リチウム二次電池及びそれを用いた二次電池モジュール - Google Patents
リチウム二次電池用正極材料,リチウム二次電池及びそれを用いた二次電池モジュール Download PDFInfo
- Publication number
- JP5111421B2 JP5111421B2 JP2009078004A JP2009078004A JP5111421B2 JP 5111421 B2 JP5111421 B2 JP 5111421B2 JP 2009078004 A JP2009078004 A JP 2009078004A JP 2009078004 A JP2009078004 A JP 2009078004A JP 5111421 B2 JP5111421 B2 JP 5111421B2
- Authority
- JP
- Japan
- Prior art keywords
- positive electrode
- lithium
- electrode material
- secondary battery
- composite oxide
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/50—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese
- H01M4/505—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese of mixed oxides or hydroxides containing manganese for inserting or intercalating light metals, e.g. LiMn2O4 or LiMn2OxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/42—Methods or arrangements for servicing or maintenance of secondary cells or secondary half-cells
- H01M10/4235—Safety or regulating additives or arrangements in electrodes, separators or electrolyte
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/362—Composites
- H01M4/366—Composites as layered products
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/58—Selection of substances as active materials, active masses, active liquids of inorganic compounds other than oxides or hydroxides, e.g. sulfides, selenides, tellurides, halogenides or LiCoFy; of polyanionic structures, e.g. phosphates, silicates or borates
- H01M4/5825—Oxygenated metallic salts or polyanionic structures, e.g. borates, phosphates, silicates, olivines
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/62—Selection of inactive substances as ingredients for active masses, e.g. binders, fillers
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Description
作製した正極材料の結晶構造は、自動X線回折装置(リガク社製 RINT−UltimaIII 以下、XRDと略す)を用い、線源CuKαで回折プロファイルを測定した。得られた回折プロファイルのピーク角度から結晶構造を確認した。
正極材料の平均粒径は、レーザー回折/散乱式粒子径分布測定装置(LA−920 堀場製作所社製)を用いて、レーザー回折/散乱法により以下のように測定した。まず、分散剤として純水に0.2重量%のヘキサメタリン酸ナトリウムを混合したものを使用し、材料を投入した。材料の凝集を抑制するため、5分間超音波をかけた後、メディアン径(相対粒子量が50%である粒子の粒子径)を測定して平均粒径とした。
表面処理に用いた金属元素の重量比及び、電解液中に溶解したMnの重量比は、高周波誘導結合プラズマ発光分光(以下ICPと略す)分析装置(日立製作所製 P−4000)を用いて測定した。まず、ビーカーに入れた45mlのイオン交換水に5gの正極材料と2mlの硝酸、または5mlの電解液を投入し、スターラーで30分間攪拌した。5分間放置後、濾紙で濾過した炉液をアルゴンガスと共に高周波雰囲気中に噴霧し、励起された各元素特有の光の強度を測定して元素の重量比を算出した。
表面被覆化合物の結合状態は、X線光電子分光(以下XPSと略す)装置(島津/KRATOS社製 AXIS−HS)を用い、線源AlKαで各元素のスペクトルを測定した。被覆化合物に関しては、化合物中に含まれる金属元素のスペクトルを測定し、ピーク位置をNISTのStandard Reference Database 20 Version3.5と比較して化合物種を決定した。
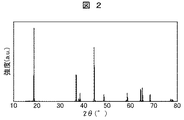
実施例1では、正極材料作製の原料として炭酸リチウム,四三酸化マンガン,二酸化コバルト,酸化ニッケルを使用し、原料比でLi:Mn:Co:Niが、1.02:0.34:0.5:0.14となるように秤量し、粉砕機で湿式粉砕混合した。粉末は乾燥した後、高純度アルミナ容器に入れ、焼結性を高めるため大気中600℃で12時間の仮焼成を行った。次に、再び高純度アルミナ容器に入れ、大気中900℃,12時間保持の条件で本焼成し、空冷後、解砕分級した。得られた正極材料のX線回折プロファイルを図2に示す。得られたピークをInternational Centre for Diffraction Dataカード(PDF−2)と照合し、六方晶の層状構造であることを確認した。よって、正極材料の組成はLiMn0.34(Li0.02Co0.5Ni0.14)O2である。また、正極材料の粒度分布を測定したところ、平均粒径は6μmであった。
得られた正極材料を用いて正極電極を作製した。正極材料,炭素系導電材料及び、あらかじめ溶媒のN−メチル−2−ピロジノン(NMP)に溶解させた結着剤を質量パーセントで表してそれぞれ85:10:5の割合で混合し、均一に混合されたスラリーを厚み20μmのアルミ集電体箔上に塗布した。その後120℃で乾燥し、プレスにて電極密度が2.7g/cm3になるよう圧縮成形した。圧縮成形後、直径15mmの円盤状に打ち抜き金具を用いて打ち抜き、正極電極を作製した。
上記正極電極を用い、金属リチウムを負極、1.0モルのLiPF6を電解質としたエチルカーボネートとジメチルカーボネートの混合溶媒を電解液として試験電池を作製した。
本比較例では、実施例1と比較して、原料として四酸化三コバルトを除き、原料比でLi:Mn:Ni=1.02:0.8:0.18となるよう秤量し、実施例1と同様に正極材料を作製した。本実施例の結晶構造は六方晶の層状構造で、組成はLiMn0.8(Li0.02Ni0.18)O2である。
本比較例では、実施例1と同様に正極材料を作製した。
本比較例では、実施例2と同様に正極材料を作製した。
本比較例では、実施例2と同様に正極材料を作製した。
本比較例では、実施例1と同様に正極材料を作製した。
本比較例では、実施例2と同様に正極材料を作製した。
本比較例では、実施例2と同様に正極材料を作製した。
本比較例では、実施例8と同様に正極材料を作製した。
本比較例では、原料として炭酸リチウム、四三酸化マンガン、酸化マグネシウム、酸化マグネシウムを使用し、原料比でLi:Mn:Mgが、1.02:1.96:0.02となるように秤量し、実施例1と同様に正極材料を作製した。本実施例の結晶構造は立方晶のスピネル構造で、組成はLiMn1.96(Li0.02Mg0.02)O4である。
2 負極
3 セパレータ
4 電池缶
5 負極リード
6 蓋部
7 正極リード
8 パッキン
9 絶縁板
10 リチウム二次電池
11 セルコントローラ
12 バッテリーコントローラ
13 信号線
111 入力部
112 出力部
Claims (5)
- 遷移金属として少なくともMnを含むリチウム遷移金属複合酸化物の表面に、金属フッ化物とリン酸リチウム化合物を有し、
前記金属フッ化物が、AlF3,NiF2,MgF2からなる群より選択される一つ以上であり、
前記リン酸リチウム化合物が、Li3PO4,Li4P2O7,LiPO3からなる群より選択される一つ以上であり、
前記リチウム遷移金属複合酸化物が、六方晶の層状構造を有し、組成式LiMnxM1−xO2(但し、0.3≦x≦0.6。MはLi,B,Mg,Al,Co,Niからなる群より選択される一つ以上の元素である)で表わされるリチウム遷移金属複合酸化物、或いは、立方晶のスピネル構造を有し、組成式LiMnyN2−yO4(但し、1.5≦y≦1.9。NはLi,Mg,Al,Niからなる群より選択される一つ以上の元素である)で表わされるリチウム遷移金属複合酸化物であり、
前記金属フッ化物の含有率が、前記リチウム遷移金属複合酸化物に対して0.1重量%以上3.0重量%以下であり、
前記リン酸リチウム化合物の含有率が、前記リチウム遷移金属複合酸化物に対して0.1重量%以上3.0重量%以下であり、
前記リチウム遷移金属複合酸化物の表面には、50%以上99%以下を覆う形で金属フッ化物が配置されており、
前記リン酸リチウム化合物は、少なくとも半分以上が、前記金属フッ化物上か、金属フッ化物が被覆されていない前記リチウム遷移金属複合酸化物の表面に存在しており、
平均二次粒子径が3μm以上30μm以下であることを特徴とするリチウム二次電池用正極材料。 - 請求項1において、前記金属フッ化物の被膜の厚さが、5nm以上50nm以下であることを特徴とするリチウム二次電池用正極材料。
- 請求項1において、前記リチウム遷移金属複合酸化物に、金属フッ化物を被覆した後、リン酸リチウム化合物を被覆し、熱処理して形成されることを特徴とするリチウム二次電池用正極材料。
- リチウムを吸蔵放出可能な正極と、リチウムを吸蔵放出可能な負極と、が電解質を介して形成されるリチウム二次電池において、
前記正極に、請求項1に記載のリチウム二次電池用正極材料を用いることを特徴とするリチウム二次電池。 - 電気的に接続された複数の電池と、前記複数の電池の状態を管理及び制御する制御装置と、を有する二次電池モジュールであって、
前記制御装置は、前記複数の電池の端子間電圧を検知し、
前記複数の電池は、電池缶に、正極,負極及び電解質を有する積層体を構成してなり、
前記正極に、請求項1に記載のリチウム二次電池用正極材料を用いることを特徴とする二次電池モジュール。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009078004A JP5111421B2 (ja) | 2009-03-27 | 2009-03-27 | リチウム二次電池用正極材料,リチウム二次電池及びそれを用いた二次電池モジュール |
| US12/695,879 US20100247986A1 (en) | 2009-03-27 | 2010-01-28 | Positive electrode material for lithium secondary battery, lithium secondary battery, and secondary battery module using lithium secondary battery |
| EP10001839.9A EP2237348B1 (en) | 2009-03-27 | 2010-02-23 | Positive electrode material for lithium secondary battery, lithium secondary battery, and secondary battery module using lithium secondary battery |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009078004A JP5111421B2 (ja) | 2009-03-27 | 2009-03-27 | リチウム二次電池用正極材料,リチウム二次電池及びそれを用いた二次電池モジュール |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010232001A JP2010232001A (ja) | 2010-10-14 |
| JP2010232001A5 JP2010232001A5 (ja) | 2011-03-10 |
| JP5111421B2 true JP5111421B2 (ja) | 2013-01-09 |
Family
ID=42244358
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009078004A Expired - Fee Related JP5111421B2 (ja) | 2009-03-27 | 2009-03-27 | リチウム二次電池用正極材料,リチウム二次電池及びそれを用いた二次電池モジュール |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US20100247986A1 (ja) |
| EP (1) | EP2237348B1 (ja) |
| JP (1) | JP5111421B2 (ja) |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007024556A2 (en) * | 2005-08-19 | 2007-03-01 | Houghton Metal Finishing Company | Methods and compositions for acid treatment of a metal surface |
| JP5526636B2 (ja) * | 2009-07-24 | 2014-06-18 | ソニー株式会社 | 非水電解質二次電池の正極活物質、非水電解質二次電池の正極および非水電解質二次電池 |
| JP5791877B2 (ja) * | 2009-09-30 | 2015-10-07 | 三洋電機株式会社 | 正極活物質、この正極活物質の製造方法、及び、正極活物質を用いた非水電解質二次電池 |
| JP5149927B2 (ja) * | 2010-03-05 | 2013-02-20 | 株式会社日立製作所 | リチウム二次電池用正極材料、リチウム二次電池及びそれを用いた二次電池モジュール |
| WO2012038270A2 (de) * | 2010-09-21 | 2012-03-29 | Basf Se | Verfahren zur herstellung von modifizierten übergangsmetallmischoxiden |
| JP5601157B2 (ja) * | 2010-11-01 | 2014-10-08 | トヨタ自動車株式会社 | 正極活物質材料、正極活物質層、全固体電池および正極活物質材料の製造方法 |
| ES2605782T3 (es) | 2011-03-30 | 2017-03-16 | Toda Kogyo Corporation | Polvo granular de material activo de electrodo positivo y método de producción del mismo, y batería secundaria de electrolito no acuoso |
| JP2013084547A (ja) * | 2011-09-28 | 2013-05-09 | Sanyo Electric Co Ltd | 非水電解質二次電池 |
| JP5958926B2 (ja) * | 2011-11-08 | 2016-08-02 | 国立研究開発法人産業技術総合研究所 | リチウムマンガン系複合酸化物およびその製造方法 |
| KR101375701B1 (ko) * | 2011-11-11 | 2014-03-20 | 에스케이씨 주식회사 | 플루오르화 포스페이트 함유 리튬이차전지용 양극활물질 및 이의 제조방법 |
| RU2483401C1 (ru) * | 2011-12-02 | 2013-05-27 | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Московский государственный университет путей сообщения" (МИИТ) | Способ циклирования щелочных аккумуляторных батарей и устройство для его реализации |
| US8999009B2 (en) * | 2012-03-07 | 2015-04-07 | A123 Systems Llc | Surface modification of battery materials and method for making a battery |
| CN104221190B (zh) * | 2012-03-29 | 2018-03-13 | 三洋电机株式会社 | 非水电解质二次电池 |
| US9240595B2 (en) * | 2012-08-24 | 2016-01-19 | Mitsui Mining & Smelting Co., Ltd. | Spinel type lithium-manganese-nickel-containing composite oxide |
| KR101975394B1 (ko) | 2012-09-12 | 2019-05-07 | 삼성에스디아이 주식회사 | 복합양극활물질, 이를 채용한 양극과 리튬전지 및 그 제조방법 |
| KR101658503B1 (ko) | 2012-11-06 | 2016-09-21 | 주식회사 엘지화학 | 이차전지용 양극 활물질 및 이를 포함하는 이차전지 |
| KR101400593B1 (ko) * | 2012-12-06 | 2014-05-27 | 삼성정밀화학 주식회사 | 양극 활물질, 이의 제조방법 및 이를 포함하는 리튬 이차 전지 |
| JP5920629B2 (ja) * | 2012-12-28 | 2016-05-18 | トヨタ自動車株式会社 | 非水電解質二次電池およびその製造方法 |
| US20150357638A1 (en) * | 2013-01-31 | 2015-12-10 | Iucf-Hyu(Industry-University Cooperation Foundation Hanyang University) | Cathode active material for lithium secondary battery, method for manufacturing the same, and lithium secondary battery using the same |
| KR101667968B1 (ko) * | 2013-06-18 | 2016-10-20 | 주식회사 엘지화학 | 리튬이차전지용 양극 활물질 및 그의 제조방법 |
| WO2015001631A1 (ja) * | 2013-07-03 | 2015-01-08 | 株式会社日立製作所 | リチウムイオン二次電池用正極活物質、リチウムイオン二次電池用正極、リチウムイオン二次電池及びこれらの製造方法 |
| CN103413931B (zh) * | 2013-08-08 | 2016-01-20 | 北京大学 | 硼掺杂的锂离子电池富锂正极材料及其制备方法 |
| KR101646729B1 (ko) * | 2013-10-11 | 2016-08-08 | 주식회사 엘 앤 에프 | 리튬 이차 전지용 양극 활물질, 이의 제조방법 및 이를 포함하는 리튬 이차 전지 |
| WO2015053586A1 (ko) * | 2013-10-11 | 2015-04-16 | 주식회사 엘앤에프신소재 | 리튬 이차 전지용 양극 활물질, 이의 제조방법 및 이를 포함하는 리튬 이차 전지 |
| JP6020490B2 (ja) * | 2014-03-03 | 2016-11-02 | トヨタ自動車株式会社 | リチウムイオン二次電池の正極、及びリチウムイオン二次電池の製造方法 |
| CN104332630B (zh) * | 2014-10-22 | 2018-03-30 | 深圳市贝特瑞新能源材料股份有限公司 | 一种表面包覆的石墨负极材料及其制备方法及包含其的锂离子电池 |
| KR102307907B1 (ko) * | 2014-11-04 | 2021-10-01 | 삼성에스디아이 주식회사 | 양극 활물질, 이를 채용한 양극과 리튬 전지 및 이의 제조 방법 |
| US10355269B2 (en) * | 2015-01-14 | 2019-07-16 | Toyota Jidosha Kabushiki Kaisha | Lithium ion secondary battery having positive electrode active material particle with fluorine and phosphorous containing film, and method of manufacturing the same |
| JP6202038B2 (ja) * | 2015-01-14 | 2017-09-27 | トヨタ自動車株式会社 | リチウムイオン二次電池及びリチウムイオン二次電池の製造方法 |
| CN107251303A (zh) * | 2015-02-27 | 2017-10-13 | 三洋电机株式会社 | 非水电解质二次电池 |
| JP6304198B2 (ja) * | 2015-11-04 | 2018-04-04 | トヨタ自動車株式会社 | 非水電解液二次電池および非水電解液二次電池の製造方法 |
| US10833369B2 (en) | 2015-12-02 | 2020-11-10 | Nec Corporation | Positive electrode active substance for lithium secondary battery, positive electrode for lithium secondary battery and lithium secondary battery, and methods for producing these |
| CN108475769A (zh) * | 2015-12-11 | 2018-08-31 | 株式会社杰士汤浅国际 | 非水电解质蓄电元件及其制造方法 |
| JP6655819B2 (ja) * | 2016-02-29 | 2020-02-26 | パナソニックIpマネジメント株式会社 | 非水電解質二次電池 |
| DE112017002507T5 (de) | 2016-07-05 | 2019-03-07 | Semiconductor Energy Laboratory Co., Ltd. | Positivelektrodenaktivmaterial, Verfahren zum Herstellen des Positivelektrodenaktivmaterials undSekundärbatterie |
| JP6837780B2 (ja) * | 2016-08-31 | 2021-03-03 | 積水化学工業株式会社 | 活物質−炭素材料複合体、非水電解質二次電池用正極、非水電解質二次電池及び炭素材料 |
| KR20230101939A (ko) | 2016-10-12 | 2023-07-06 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 양극 활물질 입자 및 양극 활물질 입자의 제작 방법 |
| CN115966674A (zh) * | 2016-11-24 | 2023-04-14 | 株式会社半导体能源研究所 | 正极活性物质粒子及正极活性物质粒子的制造方法 |
| JP6901310B2 (ja) * | 2017-04-25 | 2021-07-14 | トヨタ自動車株式会社 | 複合粒子 |
| US11489151B2 (en) | 2017-05-12 | 2022-11-01 | Semiconductor Energy Laboratory Co., Ltd. | Positive electrode active material particle |
| CN110574193B (zh) | 2017-05-19 | 2023-08-29 | 株式会社半导体能源研究所 | 正极活性物质、正极活性物质的制造方法以及二次电池 |
| KR102588500B1 (ko) * | 2017-06-26 | 2023-10-11 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 양극 활물질의 제작 방법 및 이차 전지 |
| JP7052799B2 (ja) * | 2017-08-30 | 2022-04-12 | 株式会社村田製作所 | 正極活物質、正極、電池、電池パック、電子機器、電動車両、蓄電装置および電力システム |
| US20190115591A1 (en) * | 2017-10-16 | 2019-04-18 | Nanotek Instruments, Inc. | Surface-Stabilized Cathode Active Material Particles, Lithium Secondary Batteries Containing Same, and Method of Manufacturing |
| JP7096008B2 (ja) * | 2018-02-19 | 2022-07-05 | 旭化成株式会社 | 非水系リチウム型蓄電素子の容量劣化率推定方法および容量劣化率推定装置、システム |
| CN108448109B (zh) * | 2018-03-23 | 2021-07-02 | 中南大学 | 一种层状富锂锰基正极材料及其制备方法 |
| JP7071697B2 (ja) * | 2018-06-01 | 2022-05-19 | トヨタ自動車株式会社 | 非水電解液二次電池 |
| KR20210066723A (ko) | 2019-11-28 | 2021-06-07 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 양극 활물질, 이차 전지, 전자 기기 |
| CN112018378B (zh) * | 2020-05-26 | 2023-03-21 | 宜宾锂宝新材料有限公司 | 一种减小高电压三元正极材料金属溶出的包覆改性方法 |
| JP7320012B2 (ja) * | 2021-03-15 | 2023-08-02 | プライムプラネットエナジー&ソリューションズ株式会社 | 正極および当該正極を備える非水電解質二次電池 |
| WO2023031729A1 (ja) * | 2021-09-02 | 2023-03-09 | 株式会社半導体エネルギー研究所 | 正極および正極の作製方法 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL8803047A (nl) * | 1988-12-13 | 1990-07-02 | Philips Nv | Oxydekathode. |
| JP3157413B2 (ja) * | 1995-03-27 | 2001-04-16 | 三洋電機株式会社 | リチウム二次電池 |
| JP3142522B2 (ja) * | 1998-07-13 | 2001-03-07 | 日本碍子株式会社 | リチウム二次電池 |
| JP3031546B1 (ja) * | 1998-11-13 | 2000-04-10 | 宇部興産株式会社 | リチウム遷移金属系ハロゲン化酸化物とその製造方法及びその用途 |
| EP1020944B1 (en) * | 1999-01-14 | 2011-12-07 | Hitachi Chemical Company, Ltd. | Lithium secondary battery, and process for producing the same |
| JP3944899B2 (ja) | 2001-12-27 | 2007-07-18 | 株式会社ジーエス・ユアサコーポレーション | 非水系二次電池 |
| EP1786052B1 (en) * | 2004-08-18 | 2012-09-19 | Central Research Institute of Electric Power Industry | Organic electrolyte battery, and process for producing positive electrode sheet for use therein |
| JP4923397B2 (ja) * | 2004-09-06 | 2012-04-25 | 日産自動車株式会社 | 非水電解質リチウムイオン二次電池用正極材料およびその製造方法 |
| KR100822013B1 (ko) * | 2005-04-15 | 2008-04-14 | 주식회사 에너세라믹 | 불소화합물코팅 리튬이차전지 양극 활물질 및 그 제조방법 |
| JP5070686B2 (ja) * | 2005-08-08 | 2012-11-14 | 日産自動車株式会社 | 非水電解質リチウムイオン電池用正極材料およびこれを用いた電池 |
| JP5092224B2 (ja) * | 2005-10-05 | 2012-12-05 | パナソニック株式会社 | 非水電解液二次電池とその電池パックおよび電子機器 |
| US10665892B2 (en) * | 2007-01-10 | 2020-05-26 | Eocell Limited | Lithium batteries with nano-composite positive electrode material |
| JP5189384B2 (ja) * | 2008-02-29 | 2013-04-24 | 株式会社日立製作所 | リチウム二次電池 |
-
2009
- 2009-03-27 JP JP2009078004A patent/JP5111421B2/ja not_active Expired - Fee Related
-
2010
- 2010-01-28 US US12/695,879 patent/US20100247986A1/en not_active Abandoned
- 2010-02-23 EP EP10001839.9A patent/EP2237348B1/en not_active Not-in-force
Also Published As
| Publication number | Publication date |
|---|---|
| JP2010232001A (ja) | 2010-10-14 |
| US20100247986A1 (en) | 2010-09-30 |
| EP2237348A1 (en) | 2010-10-06 |
| EP2237348B1 (en) | 2013-09-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5111421B2 (ja) | リチウム二次電池用正極材料,リチウム二次電池及びそれを用いた二次電池モジュール | |
| JP5205424B2 (ja) | リチウム二次電池用正極材料,リチウム二次電池及びそれを用いた二次電池モジュール | |
| JP5199844B2 (ja) | リチウム二次電池 | |
| JP5149927B2 (ja) | リチウム二次電池用正極材料、リチウム二次電池及びそれを用いた二次電池モジュール | |
| JP5189384B2 (ja) | リチウム二次電池 | |
| JP6015591B2 (ja) | 非水電解液二次電池 | |
| KR101965016B1 (ko) | 블렌딩된 캐소드 물질 | |
| JP6236197B2 (ja) | リチウム電池用正極及びリチウム電池 | |
| JP2008277152A (ja) | 活物質、電極、電池、及び活物質の製造方法 | |
| JP4706090B2 (ja) | リチウム二次電池用正極材料及び正極、並びにリチウム二次電池 | |
| JP2005317512A (ja) | 非水電解質電池 | |
| JP2011082133A (ja) | 正極活物質、正極、非水電解質電池および正極活物質の製造方法 | |
| CN104703921A (zh) | Li-Ni复合氧化物颗粒粉末和非水电解质二次电池 | |
| JP5621869B2 (ja) | リチウムイオン二次電池 | |
| JP5610014B2 (ja) | リチウムイオン二次電池 | |
| JP2012160345A (ja) | 非水電解質二次電池 | |
| JP2013187032A (ja) | リチウム二次電池用正極材料及びリチウム二次電池 | |
| JP5262318B2 (ja) | リチウム二次電池用正極活物質およびリチウム二次電池。 | |
| JP2006286208A (ja) | リチウムイオン二次電池及び正極活物質 | |
| JP5017010B2 (ja) | リチウム二次電池 | |
| JP2013114809A (ja) | 非水電解質二次電池およびその製造方法 | |
| JP5195854B2 (ja) | リチウムイオン二次電池 | |
| KR101675480B1 (ko) | 리튬 이차 전지용 양극 활물질, 이의 제조방법 및 이를 포함하는 리튬 이차 전지 | |
| JP2023101247A (ja) | チタン酸リチウム粉末、それを用いた電極、及び蓄電デバイス | |
| JP2010027603A (ja) | リチウム二次電池用正極活物質およびリチウム二次電池 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110120 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110120 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20110714 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110726 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110920 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120612 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120810 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120911 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20121009 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20151019 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20151019 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |