JP4184433B2 - 免疫調節のための医薬組成物 - Google Patents
免疫調節のための医薬組成物 Download PDFInfo
- Publication number
- JP4184433B2 JP4184433B2 JP52980697A JP52980697A JP4184433B2 JP 4184433 B2 JP4184433 B2 JP 4184433B2 JP 52980697 A JP52980697 A JP 52980697A JP 52980697 A JP52980697 A JP 52980697A JP 4184433 B2 JP4184433 B2 JP 4184433B2
- Authority
- JP
- Japan
- Prior art keywords
- peptide
- pharmaceutical composition
- composition according
- cells
- tumor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000008194 pharmaceutical composition Substances 0.000 title claims description 39
- 230000002519 immonomodulatory effect Effects 0.000 title claims description 14
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 398
- 210000004027 cell Anatomy 0.000 claims description 146
- 206010028980 Neoplasm Diseases 0.000 claims description 121
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 97
- 239000002671 adjuvant Substances 0.000 claims description 75
- 239000000427 antigen Substances 0.000 claims description 74
- 108091007433 antigens Proteins 0.000 claims description 74
- 102000036639 antigens Human genes 0.000 claims description 74
- 239000000203 mixture Substances 0.000 claims description 73
- 108090000623 proteins and genes Proteins 0.000 claims description 69
- 102000004169 proteins and genes Human genes 0.000 claims description 65
- 210000000612 antigen-presenting cell Anatomy 0.000 claims description 28
- 239000003446 ligand Substances 0.000 claims description 26
- 230000024932 T cell mediated immunity Effects 0.000 claims description 19
- 238000011282 treatment Methods 0.000 claims description 18
- 102000000588 Interleukin-2 Human genes 0.000 claims description 12
- 108010002350 Interleukin-2 Proteins 0.000 claims description 12
- 201000001441 melanoma Diseases 0.000 claims description 12
- 244000052769 pathogen Species 0.000 claims description 12
- 102000004127 Cytokines Human genes 0.000 claims description 10
- 108090000695 Cytokines Proteins 0.000 claims description 10
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 claims description 10
- 230000001965 increasing effect Effects 0.000 claims description 10
- 102100037850 Interferon gamma Human genes 0.000 claims description 8
- 108010074328 Interferon-gamma Proteins 0.000 claims description 8
- 239000005557 antagonist Substances 0.000 claims description 7
- 230000002163 immunogen Effects 0.000 claims description 7
- 208000023275 Autoimmune disease Diseases 0.000 claims description 6
- 239000000017 hydrogel Substances 0.000 claims description 5
- 230000001717 pathogenic effect Effects 0.000 claims description 5
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims description 4
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 claims description 4
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 claims description 4
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 claims description 4
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 4
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims description 4
- 239000007857 degradation product Substances 0.000 claims description 4
- 230000000699 topical effect Effects 0.000 claims description 4
- 239000004475 Arginine Substances 0.000 claims description 3
- -1 IFN-ω Proteins 0.000 claims description 3
- 102000004338 Transferrin Human genes 0.000 claims description 3
- 108090000901 Transferrin Proteins 0.000 claims description 3
- 108010067390 Viral Proteins Proteins 0.000 claims description 3
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 3
- 239000003814 drug Substances 0.000 claims description 3
- 239000012581 transferrin Substances 0.000 claims description 3
- 108010077805 Bacterial Proteins Proteins 0.000 claims description 2
- 102100026720 Interferon beta Human genes 0.000 claims description 2
- 108010047761 Interferon-alpha Proteins 0.000 claims description 2
- 102000006992 Interferon-alpha Human genes 0.000 claims description 2
- 108090000467 Interferon-beta Proteins 0.000 claims description 2
- 102000013462 Interleukin-12 Human genes 0.000 claims description 2
- 108010065805 Interleukin-12 Proteins 0.000 claims description 2
- 102000004388 Interleukin-4 Human genes 0.000 claims description 2
- 108090000978 Interleukin-4 Proteins 0.000 claims description 2
- 150000001720 carbohydrates Chemical group 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 claims description 2
- 238000007911 parenteral administration Methods 0.000 claims description 2
- 239000000725 suspension Substances 0.000 claims description 2
- 102000004457 Granulocyte-Macrophage Colony-Stimulating Factor Human genes 0.000 claims 1
- 229920000656 polylysine Polymers 0.000 description 85
- 108010039918 Polylysine Proteins 0.000 description 78
- 229960005486 vaccine Drugs 0.000 description 77
- 241001465754 Metazoa Species 0.000 description 49
- 210000004881 tumor cell Anatomy 0.000 description 38
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 37
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 37
- 238000012360 testing method Methods 0.000 description 27
- 229920000724 poly(L-arginine) polymer Polymers 0.000 description 26
- 241000699670 Mus sp. Species 0.000 description 25
- 238000000034 method Methods 0.000 description 25
- 108010011110 polyarginine Proteins 0.000 description 25
- 150000001413 amino acids Chemical class 0.000 description 20
- 239000012634 fragment Substances 0.000 description 20
- 238000002255 vaccination Methods 0.000 description 18
- 238000002474 experimental method Methods 0.000 description 17
- 230000000694 effects Effects 0.000 description 16
- 238000011534 incubation Methods 0.000 description 16
- 239000007924 injection Substances 0.000 description 16
- 238000002347 injection Methods 0.000 description 16
- 210000001744 T-lymphocyte Anatomy 0.000 description 14
- 230000028993 immune response Effects 0.000 description 14
- 210000000987 immune system Anatomy 0.000 description 14
- 230000032258 transport Effects 0.000 description 14
- 201000011510 cancer Diseases 0.000 description 12
- 229940030156 cell vaccine Drugs 0.000 description 12
- 230000001413 cellular effect Effects 0.000 description 12
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 12
- 239000002609 medium Substances 0.000 description 12
- 229920001308 poly(aminoacid) Polymers 0.000 description 12
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 230000005847 immunogenicity Effects 0.000 description 11
- 238000011068 loading method Methods 0.000 description 11
- 229940023041 peptide vaccine Drugs 0.000 description 11
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 9
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 9
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 9
- 206010027476 Metastases Diseases 0.000 description 9
- 201000006512 mast cell neoplasm Diseases 0.000 description 9
- 208000006971 mastocytoma Diseases 0.000 description 9
- 230000001681 protective effect Effects 0.000 description 9
- 238000000684 flow cytometry Methods 0.000 description 8
- 210000002540 macrophage Anatomy 0.000 description 8
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 7
- 102000003425 Tyrosinase Human genes 0.000 description 7
- 108060008724 Tyrosinase Proteins 0.000 description 7
- 210000000170 cell membrane Anatomy 0.000 description 7
- 102000054766 genetic haplotypes Human genes 0.000 description 7
- 230000036039 immunity Effects 0.000 description 7
- 238000011081 inoculation Methods 0.000 description 7
- 230000003248 secreting effect Effects 0.000 description 7
- 210000004989 spleen cell Anatomy 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 229930191564 Monensin Natural products 0.000 description 6
- GAOZTHIDHYLHMS-UHFFFAOYSA-N Monensin A Natural products O1C(CC)(C2C(CC(O2)C2C(CC(C)C(O)(CO)O2)C)C)CCC1C(O1)(C)CCC21CC(O)C(C)C(C(C)C(OC)C(C)C(O)=O)O2 GAOZTHIDHYLHMS-UHFFFAOYSA-N 0.000 description 6
- 230000000259 anti-tumor effect Effects 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 238000009169 immunotherapy Methods 0.000 description 6
- 230000009401 metastasis Effects 0.000 description 6
- 229960005358 monensin Drugs 0.000 description 6
- GAOZTHIDHYLHMS-KEOBGNEYSA-N monensin A Chemical compound C([C@@](O1)(C)[C@H]2CC[C@@](O2)(CC)[C@H]2[C@H](C[C@@H](O2)[C@@H]2[C@H](C[C@@H](C)[C@](O)(CO)O2)C)C)C[C@@]21C[C@H](O)[C@@H](C)[C@@H]([C@@H](C)[C@@H](OC)[C@H](C)C(O)=O)O2 GAOZTHIDHYLHMS-KEOBGNEYSA-N 0.000 description 6
- 239000013641 positive control Substances 0.000 description 6
- 230000001225 therapeutic effect Effects 0.000 description 6
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 5
- 108010033040 Histones Proteins 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- 210000004443 dendritic cell Anatomy 0.000 description 5
- 239000008103 glucose Substances 0.000 description 5
- 230000028996 humoral immune response Effects 0.000 description 5
- 230000006698 induction Effects 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 238000012552 review Methods 0.000 description 5
- 206010057249 Phagocytosis Diseases 0.000 description 4
- 206010070834 Sensitisation Diseases 0.000 description 4
- 230000001464 adherent effect Effects 0.000 description 4
- 210000003719 b-lymphocyte Anatomy 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 210000001163 endosome Anatomy 0.000 description 4
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 210000002865 immune cell Anatomy 0.000 description 4
- 230000003053 immunization Effects 0.000 description 4
- 238000002649 immunization Methods 0.000 description 4
- 238000000338 in vitro Methods 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 230000007246 mechanism Effects 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 230000008823 permeabilization Effects 0.000 description 4
- 230000008782 phagocytosis Effects 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 230000008313 sensitization Effects 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 208000027930 type IV hypersensitivity disease Diseases 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- WEEGYLXZBRQIMU-UHFFFAOYSA-N 1,8-cineole Natural products C1CC2CCC1(C)OC2(C)C WEEGYLXZBRQIMU-UHFFFAOYSA-N 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 3
- 229930182566 Gentamicin Natural products 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 3
- 229930182816 L-glutamine Natural products 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 101150003479 Parg gene Proteins 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 230000006044 T cell activation Effects 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 230000006023 anti-tumor response Effects 0.000 description 3
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 3
- 239000008365 aqueous carrier Substances 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- 230000001804 emulsifying effect Effects 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 230000002708 enhancing effect Effects 0.000 description 3
- 210000002950 fibroblast Anatomy 0.000 description 3
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 3
- 229960002518 gentamicin Drugs 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 206010022000 influenza Diseases 0.000 description 3
- 210000001821 langerhans cell Anatomy 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000010172 mouse model Methods 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 108010055896 polyornithine Proteins 0.000 description 3
- 229920002714 polyornithine Polymers 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 210000003491 skin Anatomy 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 230000008961 swelling Effects 0.000 description 3
- 230000009885 systemic effect Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000005945 translocation Effects 0.000 description 3
- 230000004614 tumor growth Effects 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- XMGQYMWWDOXHJM-JTQLQIEISA-N (+)-α-limonene Chemical compound CC(=C)[C@@H]1CCC(C)=CC1 XMGQYMWWDOXHJM-JTQLQIEISA-N 0.000 description 2
- GWEHVDNNLFDJLR-UHFFFAOYSA-N 1,3-diphenylurea Chemical compound C=1C=CC=CC=1NC(=O)NC1=CC=CC=C1 GWEHVDNNLFDJLR-UHFFFAOYSA-N 0.000 description 2
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 description 2
- SNPLKNRPJHDVJA-ZETCQYMHSA-N D-panthenol Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCCO SNPLKNRPJHDVJA-ZETCQYMHSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102400001368 Epidermal growth factor Human genes 0.000 description 2
- 101800003838 Epidermal growth factor Proteins 0.000 description 2
- 229910052693 Europium Inorganic materials 0.000 description 2
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101000914324 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 5 Proteins 0.000 description 2
- 101000914321 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 7 Proteins 0.000 description 2
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 description 2
- 101000617725 Homo sapiens Pregnancy-specific beta-1-glycoprotein 2 Proteins 0.000 description 2
- 102000007330 LDL Lipoproteins Human genes 0.000 description 2
- 108010007622 LDL Lipoproteins Proteins 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 102100034256 Mucin-1 Human genes 0.000 description 2
- 241001467552 Mycobacterium bovis BCG Species 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- 108090001074 Nucleocapsid Proteins Proteins 0.000 description 2
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 2
- 206010053613 Type IV hypersensitivity reaction Diseases 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 230000000840 anti-viral effect Effects 0.000 description 2
- 229960000190 bacillus calmette–guérin vaccine Drugs 0.000 description 2
- 238000001815 biotherapy Methods 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 210000002798 bone marrow cell Anatomy 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- XXJWXESWEXIICW-UHFFFAOYSA-N diethylene glycol monoethyl ether Chemical compound CCOCCOCCO XXJWXESWEXIICW-UHFFFAOYSA-N 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000009881 electrostatic interaction Effects 0.000 description 2
- 229940116977 epidermal growth factor Drugs 0.000 description 2
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 2
- 230000000763 evoking effect Effects 0.000 description 2
- 239000007850 fluorescent dye Substances 0.000 description 2
- 230000002998 immunogenetic effect Effects 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000008595 infiltration Effects 0.000 description 2
- 238000001764 infiltration Methods 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 210000002510 keratinocyte Anatomy 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 238000006116 polymerization reaction Methods 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- QEVHRUUCFGRFIF-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C(C5=CC=C(OC)C=C5N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 QEVHRUUCFGRFIF-MDEJGZGSSA-N 0.000 description 2
- 238000003757 reverse transcription PCR Methods 0.000 description 2
- 239000011435 rock Substances 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 229940021747 therapeutic vaccine Drugs 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000005740 tumor formation Effects 0.000 description 2
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 2
- 230000005951 type IV hypersensitivity Effects 0.000 description 2
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 2
- NFLGAXVYCFJBMK-RKDXNWHRSA-N (+)-isomenthone Natural products CC(C)[C@H]1CC[C@@H](C)CC1=O NFLGAXVYCFJBMK-RKDXNWHRSA-N 0.000 description 1
- LZOIGVDSAMDBIO-LXWJMTKESA-N (2S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S,3S)-2-[[(2S)-4-amino-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-4-methylsulfanylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-phenylpropanoyl]amino]-3-methylpentanoyl]amino]-4-oxobutanoyl]amino]-3-methylpentanoyl]amino]-4-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]-4-methylpentanoic acid Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O)[C@@H](C)CC)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@@H](N)CCSC)C1=CC=CC=C1 LZOIGVDSAMDBIO-LXWJMTKESA-N 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- VZQHRKZCAZCACO-PYJNHQTQSA-N (2s)-2-[[(2s)-2-[2-[[(2s)-2-[[(2s)-2-amino-5-(diaminomethylideneamino)pentanoyl]amino]propanoyl]amino]prop-2-enoylamino]-3-methylbutanoyl]amino]propanoic acid Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](C(C)C)NC(=O)C(=C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCNC(N)=N VZQHRKZCAZCACO-PYJNHQTQSA-N 0.000 description 1
- CCEFMUBVSUDRLG-KXUCPTDWSA-N (4R)-limonene 1,2-epoxide Natural products C1[C@H](C(=C)C)CC[C@@]2(C)O[C@H]21 CCEFMUBVSUDRLG-KXUCPTDWSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- YLOGJPLTYYDQCN-UHFFFAOYSA-N 1,3-didodecylurea Chemical compound CCCCCCCCCCCCNC(=O)NCCCCCCCCCCCC YLOGJPLTYYDQCN-UHFFFAOYSA-N 0.000 description 1
- WDQFELCEOPFLCZ-UHFFFAOYSA-N 1-(2-hydroxyethyl)pyrrolidin-2-one Chemical compound OCCN1CCCC1=O WDQFELCEOPFLCZ-UHFFFAOYSA-N 0.000 description 1
- NZJXADCEESMBPW-UHFFFAOYSA-N 1-methylsulfinyldecane Chemical compound CCCCCCCCCCS(C)=O NZJXADCEESMBPW-UHFFFAOYSA-N 0.000 description 1
- KISWVXRQTGLFGD-UHFFFAOYSA-N 2-[[2-[[6-amino-2-[[2-[[2-[[5-amino-2-[[2-[[1-[2-[[6-amino-2-[(2,5-diamino-5-oxopentanoyl)amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-(diaminomethylideneamino)p Chemical compound C1CCN(C(=O)C(CCCN=C(N)N)NC(=O)C(CCCCN)NC(=O)C(N)CCC(N)=O)C1C(=O)NC(CO)C(=O)NC(CCC(N)=O)C(=O)NC(CCCN=C(N)N)C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 KISWVXRQTGLFGD-UHFFFAOYSA-N 0.000 description 1
- BUOYTFVLNZIELF-UHFFFAOYSA-N 2-phenyl-1h-indole-4,6-dicarboximidamide Chemical compound N1C2=CC(C(=N)N)=CC(C(N)=N)=C2C=C1C1=CC=CC=C1 BUOYTFVLNZIELF-UHFFFAOYSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-UHFFFAOYSA-N 5-oxoproline Chemical compound OC(=O)C1CCC(=O)N1 ODHCTXKNWHHXJC-UHFFFAOYSA-N 0.000 description 1
- DLQPMEMYCIGJIM-UHFFFAOYSA-N Adjuvant peptide Natural products CC(NC(=O)CCOC1C(O)C(CO)OC(O)C1NC(=O)C)C(=O)NC(CCC(=O)O)C(=O)N DLQPMEMYCIGJIM-UHFFFAOYSA-N 0.000 description 1
- CKLDHDOIYBVUNP-KBIXCLLPSA-N Ala-Ile-Glu Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(O)=O CKLDHDOIYBVUNP-KBIXCLLPSA-N 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- OBMZMSLWNNWEJA-XNCRXQDQSA-N C1=CC=2C(C[C@@H]3NC(=O)[C@@H](NC(=O)[C@H](NC(=O)N(CC#CCN(CCCC[C@H](NC(=O)[C@@H](CC4=CC=CC=C4)NC3=O)C(=O)N)CC=C)NC(=O)[C@@H](N)C)CC3=CNC4=C3C=CC=C4)C)=CNC=2C=C1 Chemical compound C1=CC=2C(C[C@@H]3NC(=O)[C@@H](NC(=O)[C@H](NC(=O)N(CC#CCN(CCCC[C@H](NC(=O)[C@@H](CC4=CC=CC=C4)NC3=O)C(=O)N)CC=C)NC(=O)[C@@H](N)C)CC3=CNC4=C3C=CC=C4)C)=CNC=2C=C1 OBMZMSLWNNWEJA-XNCRXQDQSA-N 0.000 description 1
- 210000003359 CD4-positive helper T lymphocyte Anatomy 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- AUTNXSQEVVHSJK-YVNDNENWSA-N Glu-Glu-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O AUTNXSQEVVHSJK-YVNDNENWSA-N 0.000 description 1
- VSVZIEVNUYDAFR-YUMQZZPRSA-N Gly-Ala-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)CN VSVZIEVNUYDAFR-YUMQZZPRSA-N 0.000 description 1
- IBYOLNARKHMLBG-WHOFXGATSA-N Gly-Phe-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CC=CC=C1 IBYOLNARKHMLBG-WHOFXGATSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 206010018691 Granuloma Diseases 0.000 description 1
- 108010075704 HLA-A Antigens Proteins 0.000 description 1
- 102000011786 HLA-A Antigens Human genes 0.000 description 1
- 108010035452 HLA-A1 Antigen Proteins 0.000 description 1
- 108010074032 HLA-A2 Antigen Proteins 0.000 description 1
- 206010018910 Haemolysis Diseases 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 241000711549 Hepacivirus C Species 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 description 1
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 description 1
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 1
- 108010027412 Histocompatibility Antigens Class II Proteins 0.000 description 1
- 102000006947 Histones Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 241000701806 Human papillomavirus Species 0.000 description 1
- 241000341655 Human papillomavirus type 16 Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 241001289721 Lethe Species 0.000 description 1
- AIRUUHAOKGVJAD-JYJNAYRXSA-N Leu-Phe-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CCC(O)=O)C(O)=O AIRUUHAOKGVJAD-JYJNAYRXSA-N 0.000 description 1
- CCEFMUBVSUDRLG-XNWIYYODSA-N Limonene-1,2-epoxide Chemical compound C1[C@H](C(=C)C)CCC2(C)OC21 CCEFMUBVSUDRLG-XNWIYYODSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 108010066345 MHC binding peptide Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- NFLGAXVYCFJBMK-UHFFFAOYSA-N Menthone Chemical compound CC(C)C1CCC(C)CC1=O NFLGAXVYCFJBMK-UHFFFAOYSA-N 0.000 description 1
- 101000773004 Mus musculus 5,6-dihydroxyindole-2-carboxylic acid oxidase Proteins 0.000 description 1
- 101000746372 Mus musculus Granulocyte-macrophage colony-stimulating factor Proteins 0.000 description 1
- 101000608782 Mus musculus Tyrosinase Proteins 0.000 description 1
- 241000204031 Mycoplasma Species 0.000 description 1
- 102000047918 Myelin Basic Human genes 0.000 description 1
- 101710107068 Myelin basic protein Proteins 0.000 description 1
- 208000003788 Neoplasm Micrometastasis Diseases 0.000 description 1
- 102000011931 Nucleoproteins Human genes 0.000 description 1
- 108010061100 Nucleoproteins Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 101710176384 Peptide 1 Proteins 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 108010067902 Peptide Library Proteins 0.000 description 1
- FENSZYFJQOFSQR-FIRPJDEBSA-N Phe-Phe-Ile Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(O)=O)NC(=O)[C@@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FENSZYFJQOFSQR-FIRPJDEBSA-N 0.000 description 1
- 241000224016 Plasmodium Species 0.000 description 1
- 229920002535 Polyethylene Glycol 1500 Polymers 0.000 description 1
- 229920002556 Polyethylene Glycol 300 Polymers 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 108010009736 Protein Hydrolysates Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 108010092262 T-Cell Antigen Receptors Proteins 0.000 description 1
- 101710090322 Truncated surface protein Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 229940022399 cancer vaccine Drugs 0.000 description 1
- 238000009566 cancer vaccine Methods 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000006800 cellular catabolic process Effects 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 238000003501 co-culture Methods 0.000 description 1
- 238000003271 compound fluorescence assay Methods 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 229940097362 cyclodextrins Drugs 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 229940075557 diethylene glycol monoethyl ether Drugs 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- WRNOAELBRPKVHC-UHFFFAOYSA-N dodecylurea Chemical compound CCCCCCCCCCCCNC(N)=O WRNOAELBRPKVHC-UHFFFAOYSA-N 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 238000007824 enzymatic assay Methods 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 238000002073 fluorescence micrograph Methods 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 238000005227 gel permeation chromatography Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 230000009395 genetic defect Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 108010000434 glycyl-alanyl-leucine Proteins 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 244000144993 groups of animals Species 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- BCQZXOMGPXTTIC-UHFFFAOYSA-N halothane Chemical compound FC(F)(F)C(Cl)Br BCQZXOMGPXTTIC-UHFFFAOYSA-N 0.000 description 1
- 229960003132 halothane Drugs 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 230000008588 hemolysis Effects 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 239000012642 immune effector Substances 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 239000013546 insoluble monolayer Substances 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 229940115256 melanoma vaccine Drugs 0.000 description 1
- 229930007503 menthone Natural products 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 238000009126 molecular therapy Methods 0.000 description 1
- BSOQXXWZTUDTEL-QAQREVAFSA-N muramyl dipeptide Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)OC(O)[C@@H]1NC(C)=O BSOQXXWZTUDTEL-QAQREVAFSA-N 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 102000014187 peptide receptors Human genes 0.000 description 1
- 108010011903 peptide receptors Proteins 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000003752 polymerase chain reaction Methods 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 229940021993 prophylactic vaccine Drugs 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 239000003531 protein hydrolysate Substances 0.000 description 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 1
- 150000004040 pyrrolidinones Chemical class 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 210000004927 skin cell Anatomy 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 230000000475 sunscreen effect Effects 0.000 description 1
- 239000000516 sunscreening agent Substances 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 150000003505 terpenes Chemical class 0.000 description 1
- 235000007586 terpenes Nutrition 0.000 description 1
- VUYXVWGKCKTUMF-UHFFFAOYSA-N tetratriacontaethylene glycol monomethyl ether Chemical compound COCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO VUYXVWGKCKTUMF-UHFFFAOYSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 239000003860 topical agent Substances 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000007723 transport mechanism Effects 0.000 description 1
- AVBGNFCMKJOFIN-UHFFFAOYSA-N triethylammonium acetate Chemical compound CC(O)=O.CCN(CC)CC AVBGNFCMKJOFIN-UHFFFAOYSA-N 0.000 description 1
- 108010060175 trypsinogen activation peptide Proteins 0.000 description 1
- 230000005851 tumor immunogenicity Effects 0.000 description 1
- 230000037455 tumor specific immune response Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 239000013598 vector Substances 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/145—Orthomyxoviridae, e.g. influenza virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/02—Peptides of undefined number of amino acids; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5154—Antigen presenting cells [APCs], e.g. dendritic cells or macrophages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5156—Animal cells expressing foreign proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55516—Proteins; Peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55522—Cytokines; Lymphokines; Interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/70—Multivalent vaccine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Virology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Pulmonology (AREA)
- Communicable Diseases (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本発明は、以下の前提に本質的に依存する、腫瘍細胞を基礎とする治療ワクチンの開発である。すなわち、腫瘍細胞と正常細胞の間には質的または量的な違いがあること、免疫系はその違いを根本的に認識でき、免疫系はワクチンによる能動的、特異的な感作によって刺激され、腫瘍細胞をそれらの違いによって認識し、腫瘍細胞を排除することができる、ということである。
抗腫瘍応答を起こすためには、少なくとも2つの条件が満足されなければならない。第1に、腫瘍細胞が正常細胞には出現しない抗原か、又は、正常細胞と腫瘍細胞とをもっぱら質的に区別できる程度の抗原を発現していなければならない。第2に、それらによって免疫系がそれらの抗原と反応すべく活性化されなければならない。腫瘍の免疫療法における重大な障害は、腫瘍の免疫原性が、特にヒトでは弱いことである。
近年、このようなネオ・エピトープを構成し、従って当然に免疫系の攻撃目標を構成し得る筈の腫瘍関連および腫瘍特異的抗原が発見されてきている。それにもかかわらず免疫系がこれらのネオ・エピトープを発現している腫瘍を排除することができないという事実は、明らかにネオ・エピトープが存在しないためでなく、これらのネオ・エピトープに対する免疫応答が不十分であるという事実によるものである。
細胞を基礎とする癌の免疫療法のために、2つの一般的な戦略が開発されてきた。一方は、腫瘍反応性Tリンパ球をin vitroで拡大させ患者に再移入する養子免疫療法であり、もう一方は、腫瘍抗原に対して新しい又はより強い免疫応答を引き起こし、全身性の腫瘍応答を導くことを期待して腫瘍細胞を使用する能動免疫療法である。
能動免疫療法を基礎とする腫瘍ワクチンは種々の方法により調製されてきた。1例として、腫瘍抗原に対する免疫応答を呼び起こすためのコリネバクテリウム・パルバム(Corynebacterium parvum)やカルメット・ゲラン杵菌(Bacillus Calmette Guerin)(BCG)のような免疫刺激アジュバントと混合した放射線照射腫瘍細胞が挙られる(Oettgen and Old,1991)
近年、特に遺伝的に改変された腫瘍細胞が癌に対する能動免疫療法に用いられている。種々の遺伝子を取り込ませることによってより強い免疫原性について腫瘍細胞を異質化(alienise)するこれらの種々のアプローチの概説はZatloukalら(1993)によって提供されている。これまで使われてきた戦略の一つでは、サイトカインを産生するように遺伝的に改変された腫瘍細胞を用いる。
腫瘍抗原および腫瘍関連抗原(TAs)またはそれらに由来するペプチドを同定し単離することは、(例えば、
1994 a)および1994 b)、Carrelら、(1993)、Lehmannら(1989)、Tibbetsら(1993)、または公開国際出願WO 92/20356、WO 94/05304、WO94/23031、WO 95/00159に記載されているように)タンパク質の形態およびペプチドの形態のどちらの形態にしろ腫瘍ワクチンの免疫原として腫瘍抗原を使用する他の戦略の必要条件である。Boonら(1992)、Boonら(1994)、Boonら(1995)、van Peelら(1995)、van der Eynde(1995)の研究により悪性メラノーマがMHC-Iとの関係において腫瘍抗原由来ペプチドを提示していることが分かった。しかし、そのような腫瘍抗原の形態での腫瘍ワクチンは腫瘍抗原を保持する腫瘍細胞を排除するに必要であろう細胞性免疫応答を誘発するために充分な免疫原性がない(Marchandら、1995)。抗原提示細胞(APC)が特定のペプチド抗原をその表面に提示することを保証するため、そのペプチドを「パルス」することが提案されたが、これは細胞にそのペプチドを負わせるのには不充分であった(Tykocinskiら、1996)。また、アジュバントを共投与しても免疫応答を増強するにはあまり成功しないことが示された(OettgenとOld、1991)。
腫瘍ワクチンの効力を高めるための能動免疫療法の3番目の戦略は、自家腫瘍細胞の異種化(xenogenised)(異質化)に基づくものである。この考えは、免疫系は外来性のタンパク質を発現している腫瘍細胞に反応し、この反応の過程で、ワクチンの腫瘍細胞によって提示されている腫瘍抗原に対しての免疫応答も呼び起こされるという仮定に基づいている。
特異的な免疫応答の制御における中心的役割は、T細胞抗原レセプター、MHC(主要組織適合複合体)分子およびタンパク質由来のペプチド断片であるそのリガンドを構成成分とする3分子複合体によって演じられる。
MHC分子(または対応するヒトの分子であるHLA)は多くの異なったリガンドを結合しうるペプチドレセプターであり、厳密な特異性を有している。この必要条件は以下の特異性基準を有するアレル特異的なペプチドモチーフによって与えられる。すなわち、ペプチドがMHCハプロタイプに依存する特定の長さを有することであり、この長さは通常MCH-Iハプロタイプ中の8から10のアミノ酸群である。典型的にはアミノ酸位置のうちの2か所がいわゆる「アンカー」であり1つのアミノ酸または密接に関連する側鎖を持つアミノ酸群によってのみ占められる。ペプチド中のアンカーアミノ酸の正確な位置およびその性質に要求されることはMHCハプロタイプによって変動する。このペプチドリガンドのC末はしばしば脂肪族または電荷を持つ基である。このようなMCH-I−ペプチド−リガンドモチーフがこれまで知られており、特に、H−2Kd,Kb、Kk、Kkm1、Db、HLA-A*0201、A*0205およびB*2705ハプロタイプについて知られている。
細胞内のタンパク質変換の範囲内で、通常の、変性したおよび外来性の遺伝子産物、例えばウイルスタンパク質または腫瘍抗原は小さなペプチドに壊され、それらのいくつかはMHC分子のリガンドとなりうるものを構成する。このことは、MHC分子によるそれらの提示、その結果として細胞性免疫応答を引き起こすための必要条件を提供する。但し、細胞内でこのペプチドがMHCリガンドとしてどのように作り出されるかは未だに明確には説明されていない。外来性の又は異質化されたタンパク質及びその断片は液性免疫応答を構成する免疫グロブリンにも認識され、結合され、除去されるかもしれない。これは全ての腫瘍抗原についてあてはまる。腫瘍関連抗原MUC1、CEAおよびHER2/neuという例を用いて、これらのタンパク質に対して特異性を有する免疫グロブリンはこのタンパク質を保持する細胞を認識し、殺すことができることが示されている。従って、腫瘍抗原特異的液性免疫応答を引き起こすため、MUC1およびCEAの種々の形態のものが免疫原として(たとえば、組換えポックスベクター中で;Bronteら、J.Immunol.154:5282、1995)動物モデルおよび予備的な臨床試験において試されている。
本発明の範囲内で、細胞腫瘍ワクチン開発から生じたいくつかの着想を実行した。非悪性の正常体細胞は免疫系により寛容化されているが、この細胞が身体にとって外来性のタンパク質、例えば、ウイルス感染の結果として外来性タンパク質を合成していると身体は免疫応答によって正常細胞に反応する。この理由はMHC分子が外来性タンパク質に由来する外来性ペプチドを提示するからである。従って、免疫系はこの細胞に望ましくない異質な何かが起こったことを記録する。APC(これにはマクロファージ、樹状細胞、ランゲルハンス細胞、B細胞、が含まれ、かつ、最近発見されたB細胞とマクロファージの両方の性質を有する複表現形(biphenotypic)細胞(Tykocinskiら、1996)がおそらく含まれる)が活性化され、新たな特異的免疫が生成されこの細胞は除去される。
腫瘍細胞は確かに問題の腫瘍特異的腫瘍抗原を含んでいるが、その免疫原性が低い結果として免疫システムに無視されるためそれ自体は効果的なワクチンでない。腫瘍細胞がもし外来性タンパク質でなく外来性ペプチドを装填(charge)させられたならば、この外来ペプチドに加えてその細胞自身の腫瘍抗原がその細胞によって外来性であると認識されるであろう。ペプチドによる異質化の意図は、外来性ペプチドによって引き起こされる腫瘍抗原に対する細胞免疫応答を指令するものである。
腫瘍細胞の免疫原性が低い原因は質的な問題ではなく、量的な問題であろう。このことは、腫瘍抗原由来のペプチドについては、ペプチドは確かにMHC分子によって提示されているが、細胞性腫瘍特異的免疫応答を引き起こすにはその濃度が低すぎることを意味する。腫瘍細胞上の腫瘍特異的ペプチドの数が増加すると、その腫瘍細胞の異質化も生じさせ、その結果細胞性免疫応答を引き起こすはずである。腫瘍抗原またはそれに由来するペプチドを、その問題としているタンパク質またはペプチドをコードするDNAをトランスフェクションすることにより細胞表面上に提示させることが、国際出願WO 92/20356、WO 94/05304、WO 94/23031およびWO 95/00159に記載されているように、提案されてきた。
ドイツ国特許出願P 195 43 649.0は活性な構成成分として1以上のペプチドを装填された腫瘍細胞を含み、その腫瘍細胞がペプチドとの関連において患者の免疫系に外来性であると認識され、細胞性免疫応答を引き起こすような細胞性ワクチンを開示する。このペプチドの本質的特徴は、それらが患者のMHC-ハプロタイプのリガンドであることである。従って、このペプチドは一方では「外来性ペプチド」または「異種ペプチド」、すなわち患者の腫瘍細胞が発現しているタンパク質由来のペプチドとは異なるかもしれないので、患者の免疫系に外来性であると認識される。他のカテゴリーのペプチドは患者の細胞が発現している腫瘍細胞に由来するものである。これらのペプチドは、患者の腫瘍細胞上の同じペプチドの濃度よりも大きな濃度でワクチンの腫瘍細胞上に存在するという事実により免疫原性の増加をもたらす。
本発明の目的は免疫調節活性を有する新規な医薬組成物、特にワクチンを提供することである。
ドイツ国特許出願P 195 43 649.0に開示された細胞性ワクチンの考え方を進めて、本発明の範囲内の医薬組成物が開発されている。それには、病原体に対する細胞性及び/又は液性の、好ましくは全身性の免疫応答又は抗腫瘍応答を誘発し又は増強し、または自己免疫活性のあるタンパク質に対するトレランスをもたらすために、細胞との関係においてだけではなく、アジュバントと合わせた関係において免疫調節的効果を有するペプチドが含まれる。
驚くべきことに、ある種のアジュバント、例えばポリカチオンがタンパク質の細胞内への移行を増加させ得ることは1965年に最初に示されたが(Ryserら、1965;Ryserら、1978;Shenら、1981)、それらがペプチドの免疫原性を高めることが分かってきた。
本発明は、アジュバントと共に、免疫調節効果を有する1以上のペプチド、タンパク質またはタンパク質断片を含む医薬組成物に関する。本組成物は、このアジュバントが、治療される個体の細胞に対するペプチド又はタンパク質又はタンパク質断片の結合を増強することができ、または、このペプチドの細胞内への移行を促進することができ、このペプチド又はタンパク質又はタンパク質断片の免疫調節効果の増大をもたらすことを特徴とする。
簡略化のため、一般に上述した免疫調節効果のあるペプチド、タンパク質またはタンパク質断片の例を以後「ペプチド」と称することにする。「ペプチド」の語は、特にリガンドを言うのでない場合は、そのペプチドが由来する、より大きなタンパク質断片またはタンパク質、または細胞の分解産物をもいうことがある。
「免疫調節効果」の語は、一方では、細胞性及び/又は液性の、好ましくは全身性の免疫反応の誘発又は増強を意味する。この実施態様では、本発明の医薬組成物はワクチンとして機能する。
好ましい実施態様では、このペプチドは治療される個体が発現している少なくとも1つのMHC分子のリガンドである。
ヒトのMHC分子は、以後国際的慣習に従いHLA(ヒト白血球抗原(Human Leucocyte Antigen)ともいう。
「細胞性免疫応答」の語は、特に細胞障害性CD8陽性T細胞およびCD4陽性ヘルパーT細胞の生成の結果として腫瘍細胞の破壊または病原体に冒された細胞の破壊をもたらす、細胞障害性T細胞免疫を言う。
「液性免疫応答」という表現は、腫瘍細胞または病原体に由来する構造を選択的に認識し、続いて、他のシステム、例えば補体、ADCC(抗体依存性細胞障害)または食作用のようなシステムと一緒に、これらの腫瘍細胞または病原性媒介物に冒された細胞の破壊をもたらす免疫グロブリンの産生を言う。
ワクチンに含まれるペプチドは抗原に由来し、またはタンパク質の場合はそれに対して細胞性および/または液性免疫応答が誘発される抗原である。このことは、この抗原および/または抗体を有する病原体または腫瘍細胞を認識するT細胞または他の細胞障害性エフェクター細胞の生成を保証するものである。
バクテリア、ウイルスおよび寄生虫などの疾病の病原体に対する感作のために、その問題の病原体タンパク質を構成する、またはそれらに由来するタンパク質またはペプチドが用いられる。特に適切なものは、これらの病原体の、一般に高い変異率に影響を受けないタンパク質である。公表されている例としては、HPV16/17(ヒト・パピローマウイルス;Feltkampら、1995)、B型肝炎ウイルスコア抗原(Vitielloら、1995)、プラスモディウム・ベルゲイィ(Plasmodium bergheii)(Widmannら、1992)、インフルエンザウイルス核タンパク質およびC型肝炎ウイルスが挙られる。
本発明の一つの実施態様では、抗腫瘍応答を誘発することを意図して、このタンパク質は腫瘍抗原であり、またはペプチドは腫瘍抗原に由来し、医薬組成物は腫瘍ワクチンとして用いられる。この場合、ワクチンが治療に用いられる際には、このペプチドは患者の腫瘍細胞が発現している腫瘍抗原に由来する。これらの腫瘍抗原は、例えば、患者が発現している抗原の濃度が低すぎて、その腫瘍細胞が外来性であると認識されないような抗原である。
患者の腫瘍抗原は、患者の診断と治療計画を立てる過程で通常の方法に従って決定することができる:腫瘍抗原は抗体を用いた免疫組織化学によって容易に検出できる。腫瘍抗原が酵素、例えばチロシナーゼ、である場合は酵素アッセイによって検出できる。既知の配列の腫瘍抗原の場合は、RT-PCR法を用いることができる(Boonら、1994;Coulie,PG.ら、1994、Weynants.P.ら、1994)。検出の他の方法は、検出すべき腫瘍抗原に対して特異性のあるCTLに基づくアッセイである。これらのアッセイは、例えば、
Coulieら(1993)、Coxら(1994)、Rivoltiniら(1995)、Kawakamiら(1995)に記載されており、WO 94/14459に記載されている。これらの文献は本発明の範囲内の、適切な種々の腫瘍抗原およびそれに由来するペプチドエピトープも開示している。適切な腫瘍抗原の例は最近発刊されたRosenberg(1996)およびHendersonとFinn(1996)の総説記事中でも与えられている。利用可能な腫瘍抗原に関しては、本発明はいかなる制限も受けない。
腫瘍抗原または腫瘍抗原に由来するペプチドを含む腫瘍ワクチンは治療的にだけでなく予防的に用いてもよい。予防的使用の場合は、通常生じる腫瘍抗原の代表的なものに由来するペプチドの混合物を使用するのが好ましい。本発明による腫瘍ワクチンが治療的に用いられる場合は、患者の腫瘍抗原に含まれていると期待される1以上のペプチドが用いられる。
本発明による腫瘍ワクチンは、疾病のかなり初期の段階(ステージIおよびII)にあって細胞ワクチンを作るに充分な腫瘍細胞を持たない患者に対してさえ治療的に有用であるという点で、自家腫瘍細胞に基づく細胞ワクチンに対して有利である。
本発明の好ましい実施態様において、ペプチドは、細胞性免疫応答を誘発するために、ワクチン接種される患者のMCH-IまたはMHC-IIサブタイプと一致する。従って、このペプチドはMHC分子に結合することが保証される配列であるかまたはその配列を含む。
他の実施態様では、腫瘍ワクチンの形での医薬組成物はまた免疫刺激効果のあるポリペプチド、特にサイトカインをも含む。本発明の好ましい実施態様において使用されるサイトカインは、インターロイキン2(IL-2)またはGM-CSFであり、例えば約1000ユニットの投与量で用いる。他のサイトカインの例としては、IL-4、IL-12、IFN-α、IFN-β、IFN-γ、IFN-ω、TNF-αおよびそれらの組み合わせ、例えばIL-2+IFN-γ、IL-2+IL-4、IL-2+TNF-αまたはTNF-α+IFN-γが挙られる。
本発明の一つの実施態様では、本医薬組成物は自己免疫性疾患を誘発するタンパク質またはその断片に対するトレランスを与えるのに役立ち、すなわち自己免疫疾患の治療に役立つ。この実施態様で用いられるペプチドは自己免疫疾患の原因となるタンパク質に由来するものである。
腫瘍ワクチンまたは病原体に対するワクチンとして本発明が適用される場合には、本ペプチドが「原抗原」として認識される程度に元のタンパク質(腫瘍抗原または病原体のタンパク質)の一部と本質的に一致しているのに対して、本発明が自己免疫疾患の治療に応用されるときには、いくつかの重要な点で特に元のタンパク質のアミノ酸配列と異なるペプチドが用いられる。これらのペプチドは、アンカー位置がある結果としてMHC分子に確かに結合するが、その配列中に活性化された特異的T細胞を再びスイッチ・オフするアンタゴニストとして働かせる変異を持つ(KershとAllen,1996)。
ウイルスで発見された「天然」アンタゴニスト(Bertolettiら、1994)も系統的な探索、例えばペプチドライブラリーのスクリーニングなどによって発見されるアンタゴニストも共に適切なペプチドアンタゴニストである。ペプチドアンタゴニストの例としては、ミエリン塩基性タンパク質に特異的なT細胞をスイッチ・オフすることのできるペプチドが挙られる。これらは動物実験でその有効性をテストされた(Brockeら、1996)。
細胞性免疫応答を誘発すると考えられているペプチドはMHC分子に結合できなくてはならない。患者の中で免疫応答が誘発されるために、治療される個体はそのレパートリーの中に対応するHLA分子を有していなければならない。従って患者のHLAサブタイプの決定は、細胞性免疫応答を得るという点に関して、患者にこのペプチドを効果的に投与するための最も重要な前提条件のひとつを構成する。
患者のHLAサブタイプはマイクロ細胞障害性試験(micro Iymphotoxicity test)などの標準的な方法を用いて検出できる(Practical Immunol.,1989)。この試験は、まず患者の血液から単離したリンパ球をウサギ補体(C)の存在下で特定のHLA分子に対する抗血清またはモノクローナル抗体と混合するという原理に基づいている。陽性の細胞は溶解し指示染色剤を吸収するが、損傷を受けない細胞は未染色のままである。
RT-PCRも患者のHLA-IまたはHLA-IIハプロタイプ決定に用いることができる(Curr.Prot.Mol.Biol第2および第15章)。このために患者から血液を採取し、それからRNAを単離する。このRNAをまず逆転写にかけ、患者からのcDNAを形成させる。このcDNAは、一定のHLAハプロタイプを示すDNA断片の特異的な増幅をもたらすプライマー対を用いたポリメラーゼ連鎖反応のための基質として利用される。アガロースゲル電気泳動の後、DNAバンドが現れれば、その患者は対応するHLA分子を発現している。バンドが現れなければ、それに対してその患者は陰性である。
HLA分子を使って本発明によって使用されるペプチドを同定すると、そのアンカーアミノ酸および長さに関する特徴が明らかにされる。明らかにされたアンカー位置と長さはこのペプチドが問題にしているHLA分子のペプチド結合フォークに適合することを保証する。このことは、もし腫瘍抗原に由来するペプチドが使用されると、免疫系が刺激され患者の腫瘍細胞に対する細胞性免疫反応が呼び起こされるであろうことを意味する。
本発明の目的に適したペプチドは広く入手可能である。それらの配列は天然に存在する免疫原タンパク質またはその細胞分解産物、例えばウイルス又はバクテリアのペプチドに由来してもよく、または、腫瘍抗原に由来してもよく、または自己免疫疾患を引き起こすタンパク質に由来するペプチドのアンタゴニストであってもよい。
適切なペプチドは、例えば文献により知られているペプチド配列に基づいて選んでもよい。
細胞性免疫応答を誘発するために、例えば種々のHLAモチーフに対する、Rammenseeら(1993)、Rammenseeら(1995)、Falkら(1991)によって記載されたペプチド、種々の起源の免疫原性タンパク質に由来するペプチドによって、種々のHLAサブタイプ分子の結合フォークに適合するペプチドが同定されるかもしれない。免疫原性作用のあるタンパク質の部分配列を有するペプチドについては、すでに知られた、または確定されるはずのポリペプチドを用いてHLA特異的要求性を考慮しつつ配列を比較することによって、どのペプチドが適切な候補であるかを確証することができる。適切なペプチドは、例えばRammenseeら(1993)、Falkら(1991)およびRammenseeら(1995)およびWO 91/09869(HIVペプチド)に見ることができ、特に、腫瘍抗原に由来するペプチドは公開国際特許出願WO 95/00159およびWO 94/05304に見られる。ペプチドについて、これらの文献および引用した論文の開示は本明細書で参照するものとする。好ましい候補は、その免疫原性が既に証明されているペプチド、すなわち、ウイルスまたはバクテリアのタンパク質のような既知の免疫原に由来するペプチドである。
MHC-IまたはMHC-II分子の結合フォークに適合する元のペプチド、すなわち、天然のタンパク質に由来する未改変のペプチドを用いる代わりに、もとのペプチド配列に基づいて特定されるアンカー位置と長さに関する最小限の必要条件を用い、望みの変異をいれることが可能である。ただし、これらの変異が、MHC分子への結合アフィニティーとT細胞レセプターを刺激する能力によるこのペプチドの効果的な免疫原性を損なわないだけでなく、好ましくは増強する限りにおいてである。従って、この場合、MHC-I分子への結合に関する必要条件に従って設計される合成ペプチドが本発明によって使用される。従って、例えばH2-KdリガンドLeu Phe Glu Ala Ile Glu Gly Phe Ile(LFEAIEGFI)から始めて、Phe Phe Ile Gly Ala Leu Glu Glu Ile(FFIGALEEI)というペプチド配列を得るようなやり方で、アンカーアミノ酸でないアミノ酸を変化させることができる。さらにアンカーアミノ酸である位置9のアミノ酸IleはLeuに置換することができる。MHC-IまたはMHC-IIリガンドまたはその変異体のエピトープの決定は、例えばRammenseeら(1995)によって記載された原理を用いて行なわれるだろう。そのペプチドの長さは好ましくは、必要なアンカーアミノ酸を一緒に含む、MHC-I分子に結合するために必要な8から10アミノ酸という最少配列に一致する。9アミノ酸以上にわたるMHC-II結合モチーフはアンカー位置についてより高度な縮退を有している。MHC-II分子のX線構造解析を初めとして、MHC-II結合モチーフおよび、それらを基礎として、ペプチド配列における変異の正確な解析を可能とする方法が近年開発されている(Rammenseeら、1995、およびその中で引用されている原文献)。
所望であれば、ペプチドはC末及び/またはN末を長くしてもよいが、長くすることがMHC分子への結合能に干渉しない、すなわち、伸びたペプチドが細胞レベルで最少配列にプロセッシングされ得ることが条件である。
本発明のひとつの実施態様では、ペプチドは負に帯電している。この実施態様では、ポリリジンのようなポリカチオン性アジュバントに対するペプチドの静電的結合を達成するために、ペプチドは負に帯電したアミノ酸によって延長されてもよく、または、負に帯電したアミノ酸がペプチド中に取り込まれてもよく、その位置は特異的CTLによる認識またはアンカーアミノ酸として必須でないことが好ましい。
本発明のひとつの実施態様では、抗原はペプチドの形ではなく、タンパク質またはタンパク質断片またはタンパク質もしくはタンパク質断片の混合物として用いられる。
本発明の範囲で、患者のAPCが作用してMHC分子に適合するペプチドへプロセッシングされることが保証されている、より大きなタンパク質断片またはタンパク質全体は適切である。
このタンパク質は、プロセッシング後に得られる断片が由来する抗原または腫瘍抗原である。この実施態様では、細胞、特に樹状細胞やマクロファージのようなAPCに腫瘍抗原または断片を装填(「移行装填(transloading)」)することができる、または増強するようにアジュバントは働く。このように吸収されたタンパク質またはタンパク質断片は細胞によってプロセッシングされMHCとの関連において免疫エフェクター細胞に対して提示され得るものであり、免疫応答を誘発または増強する(BracialeとBraciale,1991;Kovacsovics BankowskiとRock,1995;YorkとRock,1996)。
タンパク質またはより大きなタンパク質断片が抗原として用いられる本発明の実施態様では、そのタンパク質は複数の断片にプロセッシングされ、その結果ペプチドの「適合形態」に関してより大きな変異性があるため、患者のHLAタイプへの依存性が少ないという点で有利である。
タンパク質またはタンパク質断片が投与されると、プロセッシングされた最終産物の特徴(identity)は化学的分析(プロセッシングされた断片のエドマン分解またはマススペクトロメトリー;Rammenseeら、1995年の総説およびそこで引用されている原論文を参照せよ)または生物学的分析(プロセッシングされた断片に特異的なT細胞を刺激するAPCの能力)によって示すことができる。
原則として細胞性免疫応答を生み出すために適切なペプチド候補はいくつかの段階で選択される。通常、これらの候補は先ず、MHC分子への結合能についてのペプチド結合テストでテストされ、複数のテストによるのが好ましい。
研究のための適切な方法の一つは、例えばStuberら(1994)およびMclntyreら(1996)に記載されているように、ペプチドが空のMHC分子を安定化できることに基づいている。ペプチドを、問題としているMHC分子を発現できるが遺伝的欠損のためにMHCとの関連においていかなる内在性ペプチドも結合しない細胞に加える。このタイプの適切な細胞株はRMA-S(マウス)およびT2(ヒト)およびそのトランスフェクションされた変異体である。従って、問題としているペプチドによって安定化されたMHC分子のみが検出可能であり、これはフローサイトメトリーに基づくFACS解析によるのが好ましい(Flow Cytometry,1989;FACS Vantage TM User’s Guide,1994;CELL QuestTM User’s Guide,1994)。安定なMHC分子は適切な抗MHC抗体および、例えばFITC(フルオレセインイソチオシアネート)のような蛍光色素で印をつけた2次(例えば、ポリクローナル)抗体によって検出される。フロー中、個々の細胞は特定の波長のレーザーで励起される。放射される蛍光が測定され、蛍光はその細胞に結合したペプチドの量に依存する。
結合したペプチドの量を測定する他の方法は、Setteら(1994)に記載されているようにスキャッチャードブロットである。例えば、I125でラベルしたペプチドがこのために用いられ、そのペプチドの種々の一定濃度のものが、単離したまたは組換えで作られたMHC分子と4℃で一晩インキュベーションされる。ペプチドの非特異的な相互作用を測定するために、サンプルのいくつかには過剰の未ラベルペプチドを加え、ラベルしたペプチドの非特異的な相互作用を阻止する。次に、非特異的に結合したペプチドは、例えばゲルクロマトグラフィーによって除去される。次に、結合したペプチドの量は放出される放射能を利用してシンチレーションカウンターで測定される。このようにして得られたデータは標準的な方法で評価される。
MHC/ペプチド相互作用の特徴を明らかにする方法の概略、すなわち本発明の範囲内で用いてもよいMHCリガンドの解析およびペプチド結合アッセイはRammenseeら(1995)によって提供されている。
第2段階では、優れた結合特性を有するペプチド候補がその免疫原性についてテストされる。
細胞性免疫応答の誘発は、例えばCurrent Protocols in Immunology第3章またはBlombergら(1993)にあるように、ペプチド特異的CTLを検出することによって確かめられる。細胞性免疫応答が存在することのもう一つの指標が、T細胞の非存在下、実験動物において免疫応答がない場合に提供される(これはその動物をCD4細胞またはCD8細胞を消滅させる抗体で処理することにより達成される)(Current Protocols in Immunology第3章)。
細胞性免疫応答はまた感作された動物における「遅延型過敏」(DTH)反応を検出することによっても証明される。この目的のためには、ペプチドはマウスの足の裏に注射され注射部位の腫れが測定される(Grohmanら1995;Puccettiら,1994)。
治療される生体に対して外来性の抗原または生体によって低濃度で発現されている抗原であるペプチドによる液性免疫応答の誘導は、血清中の特異的な抗体の検出によって測定できる。血清中の抗体レベルを検出する適切な方法は酵素結合免疫測定法(ELISA)である。特異的な抗体は、感作に用いたペプチドに結合後、染色反応によって検出される。もう一つの方法はウエスタンブロットである。これによれば、特異的な血清抗体は膜上に固定化されたペプチドに結合する。結合した抗体はここでも最終的には染色反応で検出される(両方法に関する参照文献:Current Protocols in Immunology.編集者:Coliganら、1991)
特に、外来性抗原、例えばウイルス起源の外来抗原でワクチン接種すると、抗体の形成が期待される。しかしながら、特異的抗体が細胞性の腫瘍抗原に由来する変異した又は過剰に発現したペプチドに対して形成されるかもしれないことを排除することができない。そのような抗体による腫瘍の破壊は抗体が腫瘍細胞に結合した後、例えば、補体、抗体依存性細胞障害(ADCC)またはマクロファージによる食作用のような、免疫系の他の構成要素によって引き起こされるだろう(Roitt I.M.,Brostoff J.,Male D.K.Immunology,Churchill Livingstone)。
例えばRvoltiniら(1995)またはKawakamiら(1994a)に記載されたように、免疫原性が不明のタンパク質に由来するペプチドによる細胞性免疫応答をテストしてもよい。このためには、求めるペプチドがMHC分子によって提示されたときにこれを認識できるT細胞が必要である。腫瘍細胞に由来するペプチドの場合は、Kawakamiら(1994b)に記載されているように、対応するT細胞は腫瘍浸潤性リンパ球(TIL)から得られる。外来性ペプチドの場合は、この種のT細胞は末梢血から同様にして得られる。T細胞は問題としているペプチドと混合されていたT2(Alexanderら、1989)またはRMA-S
のような細胞株と一緒にインキュベーションされ、もしそれが免疫原性ペプチドであればT細胞はそれらを破壊する。
MHC結合ペプチド候補をその免疫原性についてテストする他の可能な方法は、そのペプチドのT2細胞への結合を調べることにある。こうしたテストの一つは、TAPペプチド輸送機構を欠損しておりMHCとの関係において提示されるペプチドが与えられたときにのみ安定なMHC分子を提示するというT2細胞(Alexanderら、1989)またはRMA-S細胞
の特殊な性質に基づいている。T2細胞またはRMA-S細胞はHLA遺伝子、例えば、HLA-A1および/またはHLA-A2遺伝子で安定にトランスフェクションされ、このテストに用いられる。この細胞がHLAの良いリガンドであるペプチドと混合されると、免疫系に外来性であると認識されるような形でHLAとの関係において提示される事により、これらのペプチドはHLA分子を細胞表面にかなりの量で出現させる。例えばモノクローナル抗体により細胞表面上のHLAを検出することにより適切なペプチドを同定することが可能となる(Malnatiら、1995;Sykulevら、1994)。ここでもまた、よいHLA結合能を有することが知られている標準的なペプチドは使用に適当である。
本発明による医薬組成物の可能な最も広範囲な応用のためには、いくつかのペプチドの混合物を用いるのが好ましく、その各々は別のMHC分子、好ましくは最も一般的に生じるMHCサブタイプの2,3の一つに結合するのが好ましい。それらのハプロタイプに結合できるペプチド混合物に基づくワクチンは広範囲の患者をカバーするのに用いることができる。
本発明の一つの実施態様では、ワクチンは異なる配列の多数のペプチドを含んでいてもよい。この場合、使用されるペプチドは一方では異なるHLAサブタイプに結合するという点で互いに異なっていてもよい。この方法で、一人の患者の、または患者のより大きな集団のいくつかの、又は全てのHLAサブタイプを検出することが可能である。
使用されるペプチドに関する可能な付加的な他の可変性は、特定のHLAサブタイプに結合するペプチドはHLA結合に重要でない配列に相違があり、例えば同じ病原体又は異なる病原体に由来する異なるタンパク質に由来するという事実にあるかもしれない。この種の可変性は免疫応答に対する刺激を増強するかまたは種々の病原体に対する免疫を与えることが期待され得る。
本発明による組成物中の効果的なペプチドの量は広い範囲で変り得る。ペプチドの量は、とりわけ、投与方法と使用する特定の製剤形に依存する。投与するペプチドの量は1回の投与量あたり約1.0μgから約5000μgであってよく、通常1.0μgから約1000μgであり、特に約10μgから約500μgである。1回または数回投与されてもよく、数回投与される場合は、少なくとも3回が好ましい。特に治療用途には、このペプチドは患者の特定の免疫状態や病気の進行によって定める必要な期間にわたって、間隔をおいて(例えば、週に1回から月に1回)投与してもよい。
本発明による医薬組成物はex vivoで用いてもよい。可能なex vivo投与の原理はAPC、例えば樹状細胞をex vivoで培養し、その培養細胞を本発明による組成物と共にインキュベーションし、ペプチドをMHCとの関連で提示するようになったAPCを治療される個体に投与することにある。文献的に知られた方法を、例えば、PorgadorとGilboa(1995);YoungとInabe(1996)に記載されているように、このタイプの応用例に用いてもよい。
本発明による組成物に含まれるアジュバントは、細胞内へのペプチドの移入を助け、または患者の細胞へペプチドを結合させ、かつそのペプチドの免疫原性を高めるという性質を有する。このアジュバントは、例えば、ペプチドが貫通するはずの標的細胞の膜を、ペプチドがそこを通って細胞内に移送されるように少なくとも短期間の間、透過性にするかもしれない。ペプチドがアジュバントに結合すること、例えば負に帯電したペプチドとポリカチオン性アジュバントの間の静電的相互作用により結合することは有利であろうが、絶対に必要なわけではない。ペプチドの細胞内への移行はまた、ペプチドが、空間的に細胞膜に接近しているために、アジュバントが細胞膜を透過性にすると直に細胞膜を通過することができるという事実により達成されうる。アジュバントの効果は、細胞内への吸収に重要な、細胞表面におけるペプチドの濃度を増加させるという事実、またはアジュバントが食作用または細胞内へのペプチドの液体移送(飲作用)を引き起こすという事実によるものかもしれない。
驚いたことに、アジュバントの存在は細胞内へのペプチドの取り込みを増加させるだけでなく、ペプチドの免疫調節効果の賦活化も生じさせる。これはペプチドのMHC分子による正確な提示によるものであろう。
一つの実施態様では、アジュバントは、とりわけ理論的には全て核酸を細胞内に輸送するために用いられる膜透過性化(membrane-permeabilising)物質である。これについては、そのような物質について述べているWO 93/19768を参照のこと。
本発明の好ましい実施態様では、アジュバントは塩基性ポリアミノ酸または塩基性ポリアミノ酸の混合物である。
ポリアミノ酸の重合度は広い範囲にわたってよい。その範囲は約5から約1000、より具体的には約15から500であろう。
好ましくは、本発明の範囲内でアジュバントとしてポリアルギニンが用いられる。
本発明の目的のための他の好ましいアジュバントはポリリジンである。
他の適切な、特にポリカチオン性の有機化合物(塩基性アミノ酸)の例として、ポリオルニチン、ヒストン、プロタミン、ポリエチレンイミンまたはそれらの混合物が挙られる。
アジュバントは任意的に細胞リガンドと結合されてもよい。例えば、トランスフェリン、gp120、LDL(低密度リポタンパク質)、α-フェチュイン、EGF(上皮成長因子)ペプチドと結合されてもよく、または、レセプター介在エンドサイトーシスによるDNAの輸送に関するとしてWO 93/07283に記載されている他の細胞リガンドの代表的なもの、マンノースまたはフコース(マクロファージのリガンド)のような炭水化物残基または細胞表面タンパク質に対する抗体若しくは抗体断片と結合されてもよい。
ポリアルギニンまたはポリリジンのようなポリカチオン性アジュバントは、細胞リガンドと結合していてもよいが、DNAとの複合体要素、例えばプラスミドDNAの形で存在してもよい。このDNAは機能のあるペプチドをコードする配列を含まなくてよく、この場合DNAは空のプラスミドである。
本発明の一つの実施態様では、このDNAは免疫調節タンパク質、特にIL-2、インターフェロンおよびGM-CSFのようなサイトカインをコードしている。
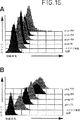
塩基性ポリアミノ酸によって媒介されるペプチド輸送の機構を調べるために、本発明の範囲において乳酸デヒドロゲナーゼ(LDH)の放出を測定した。ポリアルギニン処理したサンプルでは放出されるLDHの量はほとんど検出できないが、ポリリジンとインキュベーションの後に高いLDH濃度が細胞上清に検出された。これらの結果により、ポリリジンの効果は細胞膜の透過性化によるものであると結論することができる。
理論に拘束されるつもりはないが、本発明による医薬組成物の効果は、ペプチドがアジュバントの助けを借りて標的細胞中に浸透するか、または細胞に結合すること、これは皮膚の内皮領域で生じるが、この事実によるものであるように考えられる。標的細胞には、例えば、ペプチドを、場合によってはプロセッシング後、B細胞および/またはT細胞に提示する抗原提示細胞が含まれる。標的細胞の例としては、マクロファージ、繊維芽細胞、ケラチン細胞、ランゲルハンス細胞、樹状細胞またはB細胞が挙られる。
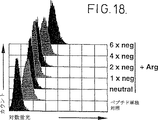
本発明の範囲内であるが、小さなペプチドが、塩基性ポリアミノ酸またはポリカチオンのグリコシル化型の存在下でマクロファージ様抗原提示細胞(APC)に強く吸収されるかどうか明らかにするための研究を行った。使用する糖残基については、レセプター媒介エンドサイトーシスを利用してマクロファージに吸収されることが知られている。(APCについては、in vivoではそれらはペプチドを吸収して他の免疫細胞に提示するタイプの細胞を構成すると考えられている。テストしたアジュバントの存在下でAPCエンドサイトーシスがペプチド抗原の量を増加させることを示すin vitroテストの結果は、これらのアジュバントがin vivoで細胞障害性エフェクター細胞に対するペプチドの提示を増強し、エフェクター細胞を活性化するのにも適切であり、ワクチンに含まれる標的に対して全体として、より強い免疫応答を起こすことを示すものである。
上述したアジュバントに加えて、任意であるが、使用するアジュバントは粒子形成分であってもよい。この粒子は理論的にはペプチド合成用のカラム材料を作るためにも用いられるどんな物質であってもよく、例えばシリカゲル又は合成樹脂であってよいが、但し、生理学的に許容できるものであり、それから作られる粒子が細胞内に入るほど充分に小さいことが条件である。粒子形態のアジュバントを用いると、局所的にペプチド濃度を高くすることができ、細胞内に吸収し易くすることができる。
使用するアジュバントのタイプ、細胞リガンドまたはDNAの添加による改変の適切性およびペプチドに対するアジュバントの必要量は経験的に決定されるであろう。例えば、選択したアジュバントに対する具体的なペプチドの比は、理論的には広範囲に変動しうるが、タイトレーションによって決定し得る。
アジュバントは理論上はペプチドと同じ方法で、任意的な多数のステップでテストできるであろう。
APCへのペプチドの結合及び/または内部移行を増強させるアジュバントの能力を測定してもよく、例えば、最初の段階としてAPCを蛍光ラベルペプチドとアジュバントと共にインキュベーションしてもよい。アジュバントによってもたらされる取込み又は結合の増加はスルーフローサイトメトリーによってペプチド単独と混合した細胞と比較することによって測定できる。
第2段階で、テストすべきアジュバントは、その存在によってペプチドがAPCに提示されるかどうか、かつどの程度提示されるかをin vitroで調べることができ、上述のペプチドをテストするために用いた方法を細胞上のMHC濃度を測定するために用いてもよい。
アジュバントの有効性をテストするための他の可能な方法はin vitroモデル系を使用することである。ここでは、APCはアジュバント及びペプチドと一緒にインキュベーションされ、使用したペプチドを特異的に認識するT細胞クローンの相対的活性化が測定される(Coliganら,1991;Lopezら、1993)。
この配合物の有効性は、感作された動物において遅延型過敏(DTH)反応が示されることによる、細胞性免疫応答によって明らかにすることもできるかもしれない。
最後に、この配合物の免疫調節効果は動物実験で測定される。確立された腫瘍モデルが、免疫細胞に認識されるペプチド配列と共に用いられてもよい。アジュバントおよび全体量に対するペプチドの量について種々の割合のペプチドとアジュバントを含むワクチンが投与される。腫瘍増殖からの保護は腫瘍ワクチンの有効性の測定値となる。
本医薬組成物は、非経口的に、局所的に、経口的にまたは部分的に投与されてよい。好ましくは非経口的に、例えば皮下、皮内または筋肉内経路で与えられ、標的細胞として、皮膚細胞(ケラチン細胞、繊維芽細胞)、特に樹状細胞、ランゲルハンス細胞またはマクロファージに達するように、皮下又は皮内経路によるのが好ましい。腫瘍治療の範囲として腫瘍ワクチンは腫瘍内経路によって投与されてもよい。
非経口的投与のための本発明による組成物は通常はペプチドとアジュバントの、製薬的に許容できる担体、好ましくは水性担体中の溶液又は懸濁液の形態である。使用してもよい水性担体の例には、水、緩衝化された水、生理食塩水(0.4%)、グリシン溶液(0.3%)、ヒアルロン酸および類似の既知の担体が含まれる。水性担体とは別に、ジメチルスルホキシド、プロピレングリコール、ジメチルホルムアミドおよびそれらの混合物のような溶媒も使用することができる。本組成物は、正常な浸透圧及び/又は効率的な凍結乾燥化のために、緩衝剤および無機塩類のような製薬上許容できる賦形剤を含んでもよい。そのような添加剤の例としては、ナトリウム塩およびカリウム塩、例えば塩化物およびリン酸塩、スクロース、グルコース、タンパク質加水分解物、デキストラン、ポリビニルピロリドンまたはポリエチレングリコールが挙られる。本組成物は通常の方法、例えば濾過滅菌によって滅菌されてよい。本組成物はこの形態で直接移されてもよく、凍結乾燥されて使用前に滅菌溶液と混合されてもよい。
一つの実施態様では、本発明による医薬組成物は局所製剤の形、例えば、皮膚または経皮的適用のための形態である。本医薬組成物は、例えば、ポリアクリル酸又はポリアクリルアミドを基礎とするヒドロゲルの形(Dolobene▲R▼、Merckleのように)をとってもよく、その形態は例えば、標準的な軟膏DAB 8(50% PEG 300、50% PEG 1500)のようにポリエチレングリコール(PEG)を担体とする軟膏として、又は、乳剤、特に油中水滴または水中油滴に基づく、リポソームが添加されていてもよいマイクロ乳剤でよい。適切な透過促進剤(同調剤)には、ジメチルスルホキシド(DMSO)やデシルメチルスルホキシド(デシル-DMSO)のようなスルホキシド誘導体およびトランスクトール(transcutol)(ジエチレングリコールモノエチルエーテル)またはシクロデキストリン、およびピロリドン類、例えば2-ピロリドン、N-メチル-2-ピロリドン、2-ピロリドン-5-カルボン酸または生分解性のN-(2-ヒドロキシエチル)-2-ピロリドンおよびその脂肪酸エステル、ドデシル尿素、1,3-ジドデシル尿素および1,3-ジフェニル尿素のような尿素誘導体、テルペン類、例えばD-リモネン、メントン、a-テルピノール、カルボール、リモネンオキシドまたは1,8-シネオールが含まれる。
他の製剤形は、例えば鼻内噴霧または吸入剤として投与するためのエーロゾルである。
本発明による組成物は、乳剤、フォーム、ミセル、不溶性単分子層、リン脂質分散体、ラメラ層その他の形をとってもよいリポソームによって投与されるかもしれない。これらはペプチドを特定の組織の標的、例えばリンパ組織または腫瘍組織へ移送するため、又はペプチドの半減期を伸ばすための担体として働く。
本発明による組成物が局所性剤の形態であるときには、例えばその製剤がメラノーマに対して予防的に用いられるならば、例えば日焼け止めクリームとして作用させるためにUV吸収剤を含んでもよい。
当業者はRemington’s Pharmaceutical Sciences(1990)のような通常水準の研究の中に適切な製剤形及びアジュバントを見いだすであろう。
図面の概要
図1:DBA/2マウスへの、肥満細胞腫P815に対するペプチドKYQAVTTTLによるワクチン接種。
図2:DBA/2マウスへの、肥満細胞腫P815に対するペプチドSYFPEITHIによるワクチン接種。
図3:DBA/2マウスへの、肥満細胞腫P815に対するペプチドSYFPEITHIによるワクチン接種。
図4:DBA/2マウスへの、メラノーマM-3に対するペプチド混合物によるワクチン接種。
図5:DBA/2マウスへの、メラノーマM-3に対する局所的塗布によるワクチン接種。
図6:DBA/2マウスへの、メラノーマM-3転移に対するワクチン接種。
図7:ペプチド混合物によるワクチン接種後のマウスにおけるM-3微小転移の治癒。
図8:細胞のポリリジン媒介チロシナーゼ装填。
図9:治療モデルにおける、ワクチン接種後のT細胞活性化(ワクチン接種動物の、M-3細胞に対する反応としての脾臓細胞からのIFN-γ放出)。
図10:インフルエンザヌクレオキャプシドペプチドASNENMETMおよびアジュバントとしてフコシル化ポリリジンによる抗ウイルス免疫の誘導(CTL活性化)。
図11:塩基性ポリアミノ酸による、APCへのペプチドの結合促進。
図12:塩基性ポリアミノ酸による、細胞膜の透過性化(細胞のポリリジン又はポリアルギニン処理後のLDH放出)。
図13:ポリアルギニンによるペプチドの内部移行。
図14:抗原提示骨髄細胞へのペプチドの輸送。
図15:ポリカチオン性のポリアミノ酸及びヒストンによる、抗原提示細胞内へのペプチド輸送の増加。
図16:塩基性アミノ酸の重合度の関数としての輸送効率。
図17:低分子量ポリアルギニンによるペプチド輸送。
図18:ペプチド装填の関数としての輸送効率への影響。
以下の実施例では、ことわりのない限り、以下の材料と方法を用いた。
A)細胞
a)細胞株
マウスメラノーマ細胞株Cloudman S91(クローンM-3;ATCC No.CCL 53.1)、肥満腫瘍細胞株P815(ATCC No.TIB 64)および単球マクロファージ細胞株P388D1(ATCC TIB 63)はATCCより入手した。細胞は、10%FCS、2mM L-グルタミンおよび20μg/mlのゲンタマイシンを添加した高濃度グルコースのDMEM培地(High glucose DMEM,Life Techonologies)で培養した。細胞は通常通りマイコプラズマ汚染が無いことをテストした(PCR-Mycoplasma Detection Kit、Stratagene)。
マウス細胞株RMA/S(マウスリンパ腫)は
ら(1986)およびLjunggrenら(1990)に記載されている。
b)骨髄の抗原提示細胞
まず、DBA/2マウスの大腿骨をリンスした。骨髄細胞を、10%FCS、5%ウマ血清、2mM L-グルタミンおよび20μg/mlゲンタマイシンを含む高グルコースDMEM培地で200ユニット/mlのマウスGM-CSF存在下で培養した(Liら、1989;Genzyme,Cambridge,MA,USA)。最初の5日間は24時間毎に培地の2/3を交換し、非接着性の顆粒球とB細胞を除去した(Inabaら、1992)。8日と10日めの間で、PBS/5mM EDTAとインキュベーションすることによって、接着している、および緩く接着している細胞の両方を集め、1ウェルあたり3x104細胞の密度で8穴スライドガラス上に播いた(Nunc,Roskilde,Denmark)。90%以上の細胞が抗体F4/80と陽性反応を示した(Endogen,Cambridge,MA,USA)。
B)ペプチド合成
ペプチドはTentaGel S PHB
を固相として、Fmoc法(HBTU活性化、Fastmoc、スケール0:25 mmol)を用いてペプチド合成機(フィードバックモニターの付いたモデル433A、Applied Biosystems,Foster City,Canada)で合成した。ペプチドは1M TEAA pH7.3に溶解し、Vydac C 18カラムの逆相クロマトグラフィーで精製した。配列はMAT Lasermat(Finnigan,San Jose,Canada)による飛行時間型(flight time)質量分析法によって確かめた。
c)使用したペプチドのリスト
ペプチド混合物:
M-3メラノーマワクチン用のペプチド混合物I:
kpep143、kpep145、kpep146、kpep150。
肥満細胞腫P815ワクチン用のペプチド混合物III:
kpep117、kpep188、Kpep162、Kpep163、Kpep164。
D)ワクチンの調製
D1)個々のペプチドワクチン
a)アジュバント無しの個々のペプチド対照ワクチンはペプチドを1mg/mlの濃度でPBSに溶解することで調製した。注射までの時間は室温で4時間とした。
b)ポリリジンをアジュバントとして含む個々のペプチドワクチンは(特にことわらなければ200の鎖長のポリリジンを用いた)特定の量のペプチドとポリリジンをHBS中で混合して調製した。注射までの時間は室温で4時間とした。
i)16μgの有効なペプチドを含むワクチンを得るために、11.8μgのポリリジンを160μgのペプチドkpep117と全量1mlのHBS中で混合した。
ii)100μgの有効なペプチドを含むワクチンを得るため74μgのポリリジンを1mgのペプチドkpep117と全量1mlのHBS中で混合した。
c)不完全フロイントアジュバント(IFA)を含む個々のペプチド対照ワクチンは特定の量のペプチドとIFAを乳化することによって調製した。注射までのインキュベーション時間は室温で30分とした。
i)16μgの活性なペプチドを含む対照ワクチンのために、600μlのHBSに溶解した192μgのペプチドkpep117を600μlのIFAと共に乳化した。
ii)100μgの有効なペプチドを含む対照ワクチンのために、600μlのHBSに溶解した1.2mgのペプチドkpep117を600μlのIFAと乳化した。
D2)ワクチンとしてのペプチド混合物
a)アジュバントを含まない対照ワクチンとしてのペプチド混合物Iには、kpep143、kpep145、kpep146、およびkpep150のペプチドを全量1mlのPBS中に各々250μg含めた。
b)アジュバントを含まない対照ワクチンとしてのペプチド混合物IIIには、kpep117、kpep118、Kpep162、Kpep163およびKpep164のペプチドを全量1mlのPBS中に各々250μg含めた。
c)ポリリジンをアジュバントとして含むワクチンとしてのペプチド混合物Iは1mgのペプチド混合物I(各ペプチドを250μg含む)をHBS中で74μgのポリリジンと混合することによって調製した。注射までのインキュベーション時間は室温で4時間とした。
d)ポリリジンをアジュバントとして含むワクチンとしてのペプチド混合物IIIは1.25mgのペプチド混合物III(250μgの各ペプチドを含む)をHBS中で93μgのポリリジンと混合することによって調製した。注射までのインキュベーション時間は室温で4時間とした。
e)不完全フロイントアジュバントを含む対照ワクチンとしてのペプチド混合物Iは600μlのHBSに溶解した1.2mgのペプチド混合物I(300μgの各ペプチドを含む)を600μlのIFAと乳化することによって調製した。注射までのインキュベーション時間は室温で30分とした。
f)不完全フロイントアジュバントを含む対照ワクチンとしてのペプチド混合物IIIは、600μlのHBSに溶解した1.5mgのペプチド混合物III(300μgの各ペプチドを含む)を600μlのIFAと乳化することによって調製した。注射までのインキュベーション時間は室温で30分とした。
g)ポリリジンをアジュバントとする局所的な適用のために、1mgのペプチド混合物I(250μgの各ペプチドを含む)を全量400μlのHBS中で74μgのポリリジンと4時間インキュベーションした。得られた混合物を1.6gのヒドロゲルDOLOBENE(Merckle)中に加えて撹拌した。
h)アジュバントを含まない対照ワクチンの局所的投与のために、全量200μlのHBSに溶解した1mgのペプチド混合物I(250μgの各ペプチドを含む)を1.8gのヒドロゲルDOLOBENE(Merckle)中に加えて撹拌した。
i)フコース結合ポリリジン(鎖長240)の調製は、MacBroomら(1992)に記載された方法を用いて行ない、約40%の置換を達成した(出発物質のβ-L-フコピラノシルフェニル-イソチオシアネートおよびポリリジンはSigmaから入手した)。
j)トランスフェリン/ポリリジンコンジュゲート(WO 93/07283に記載されたように調製した)が用いられる場合は、ポリリジンの絶対量が1mgのペプチドあたり75μgであるように量を調整した。プラスミドDNA(空のプラスミドpSP65、LPS-フリー、Boehringer Mannheim)を複合体に含めるときは、その比は37.5μgのDNA/75μgのポリリジン/1mgのペプチドとした。1mgのペプチドの代わりに160μgが用いるときは、他の構成成分は同じ係数(6.25)で減少させた。
E)ワクチンの注射
皮下注射の前に、マウスを8体までの動物のグループにして、別々のエアーチャンバー内で麻酔した。3.5分間のハロタン処理(O2中4%、流速4)を行なうと、マウスは約1分間麻酔された。この時間の間にワクチンを皮下注射した。
腹腔内注射は事前の麻酔をせずに行なった。注射量は各ワクチンについて動物1体あたり100μlとしたが、これは動物1体あたり個々のペプチドまたはペプチド混合物Iの100μgに相当する。ペプチド混合物IIIの場合は、各マウスに投与するペプチドの全量を125μgとした。
F)ワクチンの局所的適用
各マウスに対して、100μgのペプチドまたはペプチド混合物Iまたは125μgのペプチド混合物Iを毛をそった動物の、背中全体および耳にこすり付けた。正確な量は秤で測定した。
G)マウスモデルにおける腫瘍増殖に対するワクチンの使用
予防又は治療マウスモデルにおける癌ワクチンの効力のテストは、特に述べない限り、マウスモデルとしてDBA/2モデルを用い、WO 94/21808に記載された原理に従った。
実施例1
肥満細胞腫P815に対するDBA/2マウスのワクチン接種
Letheら(1992)によって記載されている腫瘍抗原P815に由来する配列KYQAVTTTL(kpep118)のペプチド、これはH2-Kdのリガンドであるが、この160μgを11.8μgのポリリジン300と500μlのHBS中で混合し室温で4時間インキュベーションした。次に500μlのEBSS(アールの緩衝化生理食塩水)を加えた。生じた混合物の100μl分を1週間の間隔をおいて8体のマウスに皮下投与した。この予備免疫の後、更に一週間後、100μlのEBSS中の5x104個の肥満細胞腫細胞株P815(ATCC No.TIB 64;この細胞はペプチドP815が由来する腫瘍抗原を発現している)を個々のマウスに対側性注射することにより、腫瘍を接種した。これらのテストの結果は図1に示した(黒塗りの四角)。
並行実験において、200μgのペプチドを500μlのHBSと混合し次に500μlのフロイントのアジュバントと乳化した。生じた乳剤の100μlで8体のマウスを予備免疫し、上述のようにP815細胞で腫瘍を植えつけた(図1:黒丸)。
並行した別の実験のために、細胞腫瘍ワクチンを以下のように調製した。
160μgのペプチドkpep118を3μgのトランスフェリン-ポリリジン(TfpL)、10μgのpLおよび6μgのプラスミドpsp65(LPSフリー)を500μlのHBSバッファー中で混合した。室温で30分後、上記溶液を20mlのDMEM培地(10%FCS、20mMグルコース)中にアロジェニックな線維芽細胞株NIH3T3(ATCC No.CRL 1658)細胞を1.5x106個含むT75培養フラスコに加え、37℃でインキュベーションした。3時間後細胞を15mlの新しい培地と混合し37℃、5%CO2で一晩インキュベーションした。投与する4時間前に、細胞を20Gyで放射線照射した。ワクチンはWO 94/21808に記載されたように調製した。このワクチンによる予備免疫を105個の細胞で1週間の間隔で行なった。さらに1週間後、腫瘍細胞を上述したように植えつけた(図1:黒三角)。ポリリジンと組み合わせた、ペプチドを含むワクチンは腫瘍形成に対して最もよくマウスを防御することが分かった。
実施例2
DBA/2マウスの単一ペプチドワクチンによる肥満細胞腫P815に対するワクチン接種
a)PBSに溶解したペプチドkpep117単独(図2a)、IFA中で乳化したペプチドkpep117(図2b)、ポリリジン(鎖長:240)をアジュバントとするペプチドkepe117(図2c)のいずれかを含む単一ペプチドワクチンを、P815腫瘍攻撃に対する防御効果についてテストした。ワクチンは上述のD節に記載したように調製した。注射用量は各場合に100μlとし、注射は皮下(sc)または腹腔内(ip)にした。ナイーブ(naive)マウスを負対照として使用し、GM-CSF分泌P815細胞からなる全細胞ワクチンを正の対照とした(P815-GM-CSF;100μl中の105個の細胞を各動物に皮下注射した)。各実験群は8体の動物からなり、3回のワクチン接種(SC)を7日間の間隔をおいて行なった。最後のワクチン接種から1週間後、動物に5x104個のP815細胞を対側性に接種した。動物を毎日観察し、1週間ごとにあらゆる腫瘍の出現を記録した。
ポリリジンをアジュバントとするペプチドkpep117は各動物に100μg皮下注射したときに最もよい抗腫瘍効果を表した(8体の動物のうち、3体は防御された)。この効果は、全細胞ワクチンで達成される効果(8体中4体の動物が防御された)とほぼ同程度に優れている。ポリリジンと一緒にした1体あたり16μgのペプチドは効果が劣っていたが(2体が防御された)、PBSに溶かした100μgのペプチド(図2a、防御効果なし)よりも有意に優れていた。また、IFA中で乳化しても、このペプチドはポリリジンと一緒にしたときに達する活性に達しなかった(図2c)。
b)P815肥満細胞腫モデルに関する他の実験において、2種類の異なる鎖長の未修飾ポリリジン、短い方はわずか16個のリジン残基しか含まず(pL16)長い方は240残基を含む(pL240)が、これらを相互に比較した。対照群の動物にPBSに溶解した、またはIFA中で乳化した、いずれかのペプチドkpep117を100μg注射した。2種類のGM-CSF分泌細胞対照ワクチンを正の対照として用いた(a)を参照)。1つのワクチンは、、安定にトランスフェクションされたP815から得たものであり、2番目のワクチンはWagnerら(1992)によって記載された方法を用いて一過性トランスフェクションによって(AVET)得られたものである。この2種の全細胞ワクチンは全体で8体の動物のうち4から5体を防御した。ペプチド単独またはIFA中に乳化したペプチドからなるペプチドベースのワクチンは防御効果を示さなかった。腫瘍接種のあと、全ての動物で腫瘍は急速に増殖した。しかしながら、ペプチドをポリリジンと一緒に投与すると、ペプチドワクチンは動物を腫瘍攻撃から防御した。長いポリリジン(pL240)を用いた場合は8体の動物のうち2体が防御され、短いポリリジンの場合には8体のうち4体であった。これらの結果は図3に示したが、これは単一ペプチドをアジュバントとしてポリリジンと共に投与すると、抗腫瘍ワクチン接種の標準として文献に記載されている(Dranoffら、1993;Schmidtら、1995)、最も効果的なサイトカイン分泌全細胞ワクチンの効果に匹敵する効果的な抗腫瘍防御を与えることを証明するものである。
実施例3
P815肥満細胞腫に対する、P815単一ペプチドまたはP815ペプチド混合物を含む腫瘍ワクチンのDBA/2マウスへの接種
ワクチンを調製するために以下のペプチドを用いた:
kpep118(注射あたり100μg)
ペプチド混合物III(kpep117、kpep118、kpep162、kpep163、kpep164):このペプチド混合物はこれまで知られているP815の全てのペプチドを含んでおり、25μgの各ペプチドを各注射で投与した。
GM-CSF分泌P815細胞を正の対照として使用した。
予備的テストでは、kpep117はポリリジンと一緒に100μgのペプチドを用いると(標準割合に対応して7.5gのポリリジン/100μgのペプチド;ポリリジン:鎖長=200)P815腫瘍接種に対して最も優れた防御効果を示すペプチドであることが分かった。より少ない量の(16μg)kpep117は効果が少なかった。この例では、各動物に100μgのkpep118を、一つの場合はポリリジンのみと(グループB)、トランスフェリン-ポリリジン(グループC)およびさらにトランスフェリン-ポリリジン/DNA(グループD)と一緒に注射した。IFAと一緒にしたkpep118を対照として用いた。この実験では、kpep118単独では腫瘍接種に対して全く防御効果を示さなかった。
実施例4において行った実験では、メラノーマペプチドのペプチド混合物を含むワクチンはメラノーマに対して防御効果を示した。従って、この実施例をペプチド混合物という考え方がP815細胞にも適切であるかをテストするために利用した。
ペプチド混合物IIIを、ポリリジンのみと共に一度(Eグループ)、トランスフェリン-ポリリジンと共に一度(Fグループ)、トランスフェリン-ポリリジン/DNAと共に一度(Gグループ)投与した。IFA中のペプチド混合物IIIを対照として用いた。ナイーブマウスを負対照として用い、GM-CSFトランスフェクションされたP815細胞を正の対照として(マウスあたり105個の細胞)用いた。
本実施例でおこなった実験は他の実験に比べて典型的でないことが分かった:正の対照群(GM-CSF分泌細胞)において、接種後の短期間全ての動物で腫瘍が増殖し、その腫瘍の大部分は形成されたのと同じくらい急速に消失した。このことの可能な説明一つは、腫瘍は破壊される前に暫く増殖したということである。2つめの可能な説明は、腫瘍と診断された腫脹は腫瘍増殖に起因するものでなく、免疫細胞の激しい浸潤(肉芽腫)であったということである。動物を解剖しなかったので、この理由は完全に明確にはできなかった。いずれにしろ、生じた腫瘍は最終的には破壊された。他の興味深い結果が、ペプチド混合物IIIとポリリジンの組み合わせで動物が処理されているグループGにおいて得られた。すべての動物において腫瘍が増殖したが、動物のうち2体において腫瘍(または免疫細胞の浸潤)の腫脹の大きさはかなり小さく、大きくならず、マウスは健康でないように見えなかった。この2体の動物は殺さずに観察下においた。驚くべきことに、腫瘍接種から9週間後に腫瘍は検出できなくなったが、これはそれまで見られなかった結果である。最後に、8体の動物のうち2体が腫瘍を破壊した。腫瘍の破壊はペプチド混合物中の内容物であるkpep117のためのようであり、実施例2と同じように、16μgのkpep117で8体の動物のうち2体が防御され、100μgのkpep117で8体の動物のうち3体が防御された。しかしながら、防御効果は混合物中の1以上のペプチドによって生じているかもしれない。
実施例4
ペプチド混合物を含む腫瘍ワクチンで予備免疫することによる、DBA/2マウスのメラノーマM-3からの防御
メラノーマペプチド混合物(ペプチド混合物I、D2節)を含む予防ワクチンを用いた。
このワクチンによる予備免疫と腫瘍の植え付け方法は実施例2に記載した方法と同じであるが、腫瘍の接種はM3細胞で行なった(1体あたり105個の細胞)。使用する対照ワクチンは、最適量のIL-2(105個の細胞あたり1000-2000ユニット)を分泌する、Schmidtら(1995)に記載されたように調製したM-3細胞の全細胞ワクチンとした。用いたテスト条件下では、このワクチンは100%の防御を達成した(図4)。実験動物の4つのグループにペプチド混合物のワクチンを投与した。2つのグループにはIFAに乳化したペプチドをs.c.またはi.p.で与えた。他の2つのグループにはペプチドをポリリジン(pL240)と共にs.c.またはi.p.のいずれかにより与えた。
図4は、ポリリジン(pL240)をアジュバントとするペプチドワクチンの防御効果を示すものである。処置したマウスの50%がM-3腫瘍攻撃から防御され、これに対して未処理の動物は固形腫瘍が急速に増殖した。この効果は、ペプチド-ポリリジンワクチンを皮下注射したとき又はヒドロゲルとして皮膚に塗布したときに達成することができた(図5)。ペプチド/ポリリジンワクチンi.p.またはIFA中のペプチドで処理された、他の3つの対照群においては、ワクチンは実質的に効果がなかった。ここでは接種された腫瘍は拒絶されず、未処理の対照動物に比較して少し遅れるだけで腫瘍は増殖した。これらの結果はペプチド混合物を含むワクチンは、ポリリジンを含むときに抗腫瘍性防御効果を達成することを示すものである。選択したテスト条件下で、このペプチドワクチンは、最近なされた報告(Zatloukao,1993,Zatloukao,1995)によれば105個の生きたM3細胞による腫瘍攻撃に対して動物を100%に達するまで防御したという細胞性IL-2ワクチンの半分程度の効果しかなかった。
実施例5
DBA/2マウスのM-3転移に対する防御
a)メラノーマペプチドの混合物(D2節に記載したペプチド混合物1)を含む治療ワクチンを使用した。3回のワクチン接種(sc)を1週間の間隔で行なった。最初のワクチン接種は転移の開始(setting)から5日後に行ない、従ってワクチン接種は5日後転移に対して行なわれた。WO 94/21808およびSchmidtら(1996)に記載された方法を用いて、1.2x104個のM-3細胞を転移開始のために注射した。
使用したワクチンはペプチド混合物Iであって、アジュバント無し(pepmix1 PBS)、アジュバントとしてIFA(IFA pepmix1)またはフコース修飾ポリリジン(fpL pepmix1)とした。対照群はワクチンを投与せず(ナイーブ)または実施例4で述べたIL-2産生M-3全細胞ワクチンを投与した。図6は、最良の防御は、アジュバントとしてフコース修飾ポリリジンと一緒にしたペプチド混合物Iで処理した群において得られたことを示す(図6a)。この処置は50%のマウス(4/8)が転移を拒絶することができた。この処置は33%のマウス(3/9)しか防御しなかった全細胞ワクチン処置よりも効果的であった。IFAを含む、またはアジュバントを含まないペプチドワクチンは転移したものが腫瘍へと増殖するのを遅らせるだけであった(図6b)。
b)他の実験では、ペプチド混合物Iを含み、皮下投与したワクチンの防御効果を、治療モデルにおいてテストした。対照群にはPBS(アジュバント無し)に溶解したまたはIFAを含むペプチド混合物を投与した。未修飾のポリリジン240をアジュバントとして使用した。加えて、フコース-修飾ポリリジン200(fpL 200)をアジュバントとして使用した。対照はIL-2発現細胞ワクチンを投与された動物の群からなる。図7aに示されたように、ペプチド/ポリリジンワクチンはM3-転移の治療において効果的であった。この実験において有意な治癒率はフコース-修飾ポリリジンについてのみ達成された。この処置により、動物の50%は転移を拒絶したが、これはこのケースで70%の動物を治癒したIL-2ワクチンと比較して良好な結果である。
c)他の実験では、抗腫瘍活性に対するポリカチオンの変化と修飾の効果を治療モデルでテストした。未修飾の、およびフコース修飾ポリリジン200に加えて、短い未修飾ポリリジンpL16、長いポリリジンpL450および他のポリカチオン、すなわちポリアルギニン(pArg720)をテストした。GM-CSFの最適量(105個の細胞あたり ≧10ng)を分泌する細胞性M3ワクチンを正の対照としてテストした(Schmidt,1995)。この実験でもまた、対照群にはIFA中の、またはいかなるアジュバントも含まないペプチド混合物を投与した。実施例5b)のように、フコース-ポリリジンをアジュバントとして用いたときに最も優れた効果が達成された(図7b)。この群では、40%の動物が転移を拒絶し、これに対して短いポリリジンpL16では30%であった。ポリアルギニンと一緒にペプチドを投与されてきた群を別にして、ペプチドワクチンを投与されていた他の群の動物は腫瘍形成までに少しの遅延を示しただけである。未修飾のポリアルギニンはこのテストにおいてはフコース-修飾ポリリジンと同程度に効果的であり、10体の動物の4体において腫瘍の拒絶を起こさせた。
図7cは独立の実験においてポリアルギニンにより達成されるこの効果の再現性を示すものである。ここでもまた、ポリアルギニンと一緒にしたペプチド混合物のワクチン接種は、処置した8体の動物のうち4体において抗腫瘍活性を示した。
実施例6
ポリリジンをアジュバントとして用いた、細胞のチロシナーゼ移行装填
この実施例は、M-3細胞を細胞の例として用いて、ポリリジンがより大きなタンパク質断片又はタンパク質全体を細胞に装填するためのアジュバントとして適切であることを示すための実験である。
細胞に装填するため、まず160μgのFITCラベルしたチロシナーゼ(EC 1.14.18.1;Sigma)を3μgのポリリジン(pL240)と混合し室温で3時間インキュベーションした。次に、得られた溶液を2x106個のM-3細胞と共にT75細胞培養フラスコに入れ37℃でインキュベーションした。次に細胞をPBSで2回洗浄し、PBS/2mM EDTAで剥がし、FACS解析のため1mlのPBS/5%FCSに溶かした。図8はチロシナーゼによるM-3細胞の装填を示すものである(左側のカーブは対照を示し、右側のカーブはチロシナーゼの装填を示すものである)。
実施例7
治療モデルにおける、感作後のT細胞活性化の測定
ペプチド/ポリカチオンワクチンがマウス治療モデルではっきりと効果を示したので(実施例5を参照)、この処置がT細胞の活性化も引き起こすか否かを調べるために研究を行なった。このため、マーカーとして機能する親のM3細胞と、ワクチン接種した動物からの脾臓細胞とを一緒にインキュベーションした後のサイトカイン分泌を用いた(Kawakamiら、1994b)。
脾臓単一細胞懸濁液をワクチン接種した、および未処置の動物から調製し、次に低張バッファー(0.15 NH4Cl、1mM KHCO3、0.1mM EDTA、pH7.4)により赤血球溶血を起こさせた。接着細胞を、1mlのDMEM培地(10%FCS)あたり3x106個の脾臓細胞をいれたシャーレで37℃、90分インキュベーションすることによって除去した。非接着細胞を注意深くピペッティングし1x103個の親細胞と種々の割合で共培養した。細胞を200μlのDMEM培地(10%FCS)、2mM L-グルタミンおよび20μg/mlのゲンタマイシンをいれた96穴平底組織培養プレート中で培養した。9日目に、100μlの上清を集めIFN-γ含量を、商業的に入手可能なELISAキット(Endogen,Cambridge,MA,USA)を用いて取扱説明書に従って測定した。9日間のインキューベーション後、ワクチン接種した動物の脾臓細胞のみが培地中に多量のIFN-γを分泌し、未処置の動物の脾臓細胞とM3細胞の共培養中にはほとんどIFN-γは検出できなかった。これらの実験の結果は図9に示した。
実施例8
インフルエンザヌクレオキャプシドペプチドASNENMETMおよびアジュバントとしてフコシル化ポリリジンによる抗ウイルス免疫の誘導
1mgのペプチドASNENMETMあたり75μgのfpLysを含むワクチンを使用した。このワクチンは、方法の節のところで述べたように1回の注射で投与し、1体の動物あたり100μgのペプチド/7.5μgのfpLysを注射した。対照として、100μgのペプチドを単独(PBS)で注射するか、または全く注射しなかった(ナイーブ対照)。
RMA-Sマウスリンパ腫細胞を無血清培地で10μg/mlのペプチドASNENMETMとともに一晩26℃でインキュベーションした。
ワクチン接種の10日後、脾臓細胞をワクチン接種した動物から単離し、ペプチド装填RMA-S細胞と5:1の比で混合しさらに5日間培養した(Stuberら、1994)。種々の培養において生き残るエフェクター脾臓細胞の数を測定し、次に、標準的な4hユーロピウム放出アッセイ(Blombergら、1993)によってCTL活性を測定するために、この細胞を予めペプチドASNENMETMおよびユーロピウムキレートと一緒にしておいたRMA-S細胞といろいろな割合で混合した。図10に示したように、このテストにおいて、ペプチドとfpLysでワクチン接種したときにのみ特異的な免疫が得られ、ペプチド単独で投与したときは得られなかった。
実施例9
種々の塩基性ポリアミノ酸の、APCへのペプチドの内部移行及び/または結合を促進する能力のテスト
これらのテストのために蛍光アッセイを用いた:配列LFEAIEGFI(MHC Kd拘束)のモデルペプチド抗原を蛍光色素フルオレセインイソチオシアネート(FITC)で取扱説明書に従ってラベルした(Molecular Probes)。FITCラベルした(「パルス」された)ペプチド単独または塩基性アミノ酸の種々の濃度のもの(16から490の鎖長のポリリジン、鎖長15から720のポリアルギニン)と一緒にしたFITCラベルペプチドの、MHC Kd拘束単球マクロファージ細胞株P388D1による取込み又は結合を、スルーフローサイトメトリーで測定した。これを行なうために1x106個のP388D1細胞を、遠心試験管の中で、5μgのFITC-ラベルペプチド単独またはペプチドとポリアミノ酸の混合物と共に最終体積1mlの培地(DMEM/10% FCS)中で37℃、30分間インキュベーションし、その後いかなる遊離のペプチドも除去するために徹底的に洗浄した。ポリアミノ酸は1mlの培地あたり50、25、12、6および3μgの濃度で加え、FITCラベルしたペプチドを5μg入れた。ペプチドの取込み及び/または結合の効率を評価するために種々のサンプルの相対蛍光強度を比較した。これらのテストの結果は図11に示した。このテストはそれぞれ25μgのpL450およびpArg450を用いて行なった。使用した条件下では、ポリアルギニンはポリリジンより約5倍効果的であることが分かった。
実施例10
ペプチドがAPCに吸収されるメカニズムの研究
ペプチドはマクロ飲作用またはレセプター媒介エンドサイトーシスのような特異的なメカニズムによって吸収されうる(Lanzavecchia,1996)。もう一つのメカニズムは、ポリアミノ酸が細胞膜を透過性にし、ペプチドが膜を通って培地から細胞質へ拡散することができることにあるかもしれない。
a)商業的に入手可能なキット(Cytotox 96,Promega,Madison,Wisconsin,USA)を用い、取扱説明書に従い、P388D1細胞をポリアミノ酸(ポリリジンまたはポリアルギニン)と共に等張条件下でインキュベーション後に細胞質性酵素の乳酸デヒドロゲナーゼ(LDH)の放出を測定することにより、細胞膜の透過性化の可能性をテストした。図12aの結果を基にすると、pLysの効果は細胞膜を透過性にすること、これは等張条件下での高濃度の細胞質性酵素の放出によって示されるが、そこにあるとすることができる。これに対してpArg処理の後では(図12b)、LDHはほとんど検出されなかった。ポリアミノ酸単独で処理したサンプルを比較すると、ポリリジン又はポリアルギニンとペプチドの混合物による処理とLDHの放出に関して差異はみられなかった。ペプチド単独とのインキュベーション後は、測定可能なLHD活性は検出できなかった。
b)塩基性ポリアミノ酸の存在下又は非存在下におけるFITCラベルしたペプチドの内部移行の可能性をMidouxら(1993)によって公表された原理に基づいて調べた。細胞によって内部移行される粒子はエンドソーム中で輸送される。中性pH値を有する細胞質または細胞培養培地に比較して、pHが約5であるこれらのオルガネラは酸性である。FITCにより放出される蛍光は強いpH依存性である。エンドソームに見られるようなpH条件の環境では、蛍光は抑えられている。従って、細胞によってエンドソームへ吸収されたFITCラベルペプチド蛍光の減少を示す。モネンシンを加えると、エンドソームの低いpHは中和され、内部移行したFITCラベルペプチドの、測定可能な強い蛍光が生じる。
細胞をポリアルギニン(平均分子量範囲100,000、鎖長490)と蛍光ラベルペプチドとを一緒に4℃または37℃でインキュベーションした。37℃でインキュベーションしたサンプルの一部をとっておき、スルーフローサイトメトリーによる解析をする前に4℃で50μMのモネンシンで処理した。
APCをポリリジン(pLys)およびポリアルギニン(pArg)のような特定の塩基性ポリアミノ酸と共にインキュベーションするとAPCへのペプチドの取込み又は結合を増強することが見いだされた。
図13から明らかなように、単独のペプチド及びモネンシンで処理した細胞では僅かな蛍光の増加が見られただけであった。これに対して、モネンシンとポリアルギニン及びペプチドの混合物とで処理したサンプルでは蛍光シグナルは大きく増大した。サンプルを4℃でインキュベーションした場合は取込みは全く見られなかった。モネンシン処理後の蛍光の有意な増大は、pArgによってもたらされるペプチドの装填により、そのペプチドが細胞内の小胞へ蓄積することを示すものである(Midouxら、1993、図13)。予想したたように、ポリリジンを装填したサンプルをモネンシン処理しても、わずかな蛍光の増加が見られただけであった。4℃でポリリジンを装填させると測定可能な程度に蛍光が増加したが、これはポリリジンの効果は主として細胞膜の透過性化によって起こることを更に示すものである(図12b)。
実施例11
APCによる短いペプチド装填の研究
骨髄からGM-CSFによって得られたAPCを蛍光ラベルペプチドとポリリジン(pL200;Sigma)の組み合わせ、またはペプチド単独を用いて蛍光顕微鏡によって調べた。ペプチド取込みの顕微鏡検出のために、APCをスライド上に播き、40μgのフルオレセインラベルペプチドLFEAIEGFI単独または50μg/mlのポリリジン(pL200)と40μg/mlペプチドLFEAIEGFIの混合物と共に37℃、30分間インキュベーションした。徹底洗浄後、細胞を4%のパラホルムアルデヒドで固定し、アンチフェイデント(anti-Fadent)(Dako,Glostrup,Denmark)で覆い、蛍光顕微鏡(Zeiss)観察下においた。核は4,6-ジアミジノ-2-フェニルインドール(DAPI;Sigma)でカウンター染色した。図14の蛍光顕微鏡写真に示されているように、ペプチドとポリリジンと共にインキュベーションした細胞(A)は、ペプチド単独で処理した細胞(B)よりもペプチド取込みの有意な増加を示した。蛍光はペプチド単独で処理(「パルス」)された細胞内ではまばらにしか存在せず、かつ粒子形態でしか存在しないが、ポリリジン存在下でペプチドを装填させた細胞の強い蛍光は局在しておらず、全体として一般に細胞全体に、より均一に分布していた。
実施例12
スルーフローサイトメトリーによる、細胞のペプチド装填の定量的測定(移行装填アッセイ)
a)実施例11において行なったテストによりAPCは小さなペプチドを装填するための優れた標的細胞であることが分かったので、ペプチドワクチンに適切なアジュバントを明らかにするためにin vitroでFACSアッセイを行なった。このアッセイにより蛍光ラベルペプチドを迅速に定量的にテストをすることができる。配列LFEAIEGFIのペプチドをモデルペプチドとして使用した。これらのテストでは、マウス細胞株P388D1をAPCとして使用した。1x106個の細胞を、最終体積1mlの10%FCS高グルコースDMEM培地中、最終的なフルオレセイン濃度5nmol/mlで5μgのペプチドとともに37℃、30分間インキュベーションした。細胞は、図15に示したように細胞をペプチド単独または、ペプチドとポリカチオンの組み合わせ、または、ペプチドとヒストンの組み合わせのいずれかにより、これらの濃度を増加させて(3から50μg/ml)各濃度で処理した。以下の化合物を用いた:A:ポリオルニチン(平均分子量範囲110,000、鎖長580);B:アルギニン-リッチヒストン;C:リジン-リッチヒストン;D:ポリアルギニン(平均分子量範囲100,000、鎖長490);E:ポリリジン(平均分子量範囲94,000、鎖長450)。予備テストにおいては、30分間のインキュベーションで最大のペプチド取込みがあることが分かった。これより長い処理(4または8時間)は蛍光シグナルの有意な増加を全く示さなかった。解析の前に細胞を0.2%BSAを含む多量のPBSで5回洗浄した。細胞を1mlの氷冷却PBS/0.2BSAに溶かし、スルーフローサイトメトリー(FACScan;Becton Dickinson,San Jose,CA,USA)で調べた。
ポリアルギニンおよびポリリジンは最も効果的なアジュバントであることが分かった。ポリオルニチンは選択した条件下で細胞障害性効果を示した。ポリアルギニンおよびポリリジンによるペプチド取込みの増加は濃度と相関しており(図15d,e)、取込みは鎖長と共に増加する(図16)
ポリアルギニンは、対照に比べて103の増加が見られ、最大102に満たない増加しか示さなかったポリリジンよりも適切な濃度範囲が広いことが観察され、使用した全ての鎖長においてポリリジンよりもタンパク質輸送についてより効果的であることが観察された(図16):ポリアルギニンは3μg/mlという低濃度で効率的な輸送を可能とするが、ポリリジンについては蛍光の有意な増加を得るためには25μg/mlより大きな濃度が必要とされた(図15d,e)。
b)ペプチド輸送について鎖長の下限があるかどうかを明確にするために、異なる鎖長のポリアルギニン(10〜30残基)を合成し、このポリカチオンが高濃度においてペプチド輸送を増加させ得るかをテストした(図17)。これらの実験にはペプチドLFEAIEGFIを用い、テストしたポリアルギニンポリマーは100μg/mlの濃度で使用した。
テストしたポリアルギニンの最も短いものでも、僅かではあったが、ペプチド輸送の増加が見られた。
c)塩基性アミノ酸は正に帯電した分子である。従って、負に帯電したペプチドは静電的相互作用によってこれらのポリカチオンに結合することができると仮定することができ、これによってペプチド取込みが増加する可能性があるかもしれない。この仮説をテストするため、陽イオン性ポリアミノ酸の、その電荷の作用としてP388D1細胞に短いペプチドを吸収させる能力を比較した。以下の表は、使用した、MHC-I結合に要求される全ての条件(Rammenseeら、1995)を満足する、負に帯電したペプチドを列挙したものである。ペプチド1はマウスTRP(チロシン関連タンパク質(tyrosine related protein))に由来し,ペプチド2はインフルエンザ赤血球凝集素(Schmidtら、1996)に由来し、ペプチド3はマウスチロシナーゼに由来し、ペプチド4はP198腫瘍抗原に由来し、ペプチド5はベータガラクトシダーゼ(Gavinら、1993)に由来する。(「Mr」は分子量範囲を表し、「蛍光」はフルオレセインを表す。)
フルオレセインでペプチドをラベルするために使用した方法のために、2個の負電荷が導入された。ポリアルギニンとともにインキュベーションすると、負電荷数の最も多いペプチド(各サンプル5nmol)がP388D1細胞に最も効率よく輸送されることが分かり、これはペプチドとポリカチオン間のイオン性相互作用がペプチドの細胞内への輸送を更に促進することを示すものである(図18)。しかしながら、ペプチド単独で処理した細胞と比較して、中性ペプチドについて、ポリカチオンの存在下で、より多くの量が吸収された。ペプチド単独での処理は、テストした全てのペプチドについてほとんど同じ蛍光シグナルを生じた。代表的例を示すため、ペプチドLFEAIEGFIで得られた蛍光シグナルを代表として「ペプチド単独」と図18に示した。
参考文献
Alexander,J.et al.,1989,Immunogenetics 29,380
Allred,D.C.et al.,1992,J.Clin.Oncol.10(4),599-605
Avrameas,A.et al.,1996,Eur.J.Immunol.26,394-400
Behr,J.P.,1994,Bioconjug-Chem.,Sept-Oct,5(5),382-9
Bertoletti,A.et al.,1994,Nature 369,407-410
Biologic Therapy of Cancer,Editors:DeVita,V.T.Jr.,Hellman,S.,Rosenberg,S.A.,Verlag J.B.Lippincott Company,Philadelphia,New York,London,Hagerstown
Blomberg,K.und Ulfstedt,A.C.,1993,J.Immunol.Methods 160:27-34
Boon,T.,1992,Adv Cancer Res 58,177-210
Boon,T.,1993,Spektrum der Wissenschaft(Mai),58-66
Boon,T.et al.,1994,Annu.Rev.Immunol.12,337-65
Boon,T.und van der Bruggen,P.,1996,J Exp Med 183,725-729
Braciale,T.J.und Braciale,V.L.,1991,Immunol.Today 12,124-129
Brocke,S.et al.,1996,Nature 379(6563),343-346
Bronte,et al.,1995,J.Immunol.154,5282
Carrel,S.und Johnson,J.P.,1993,Current Opinion in Oncology 5,383-389
Coligan,J.E.,et al.,1991,Nature 351,290-296
Coligan,J.E.,et al.,1991,Current Prot.in Immunol.,Wiley,New York
Coulie,P.G.et al.,1992,Int.J.Cancer,50,289-297
Coulie,P.G.et al.,1995,Proc Natl Acad Sci U S A 92,7976-80
Coulie,P.G.et al.,1994,J.Exp.Med.180,35-42
Cox,A.L.et al.,1994,Science 264,5159,716-9
Current Protocols im Molecular Biology,1995,Herausgeber:Ausubel F.M.,et al.,John Wiley & Sons,Inc.
Dranoff,G.et al.,1993,Proc.Natl.Acad.Sci.USA 90,3539-3543
Dranoff,G.und Mulligan,R.C.,1995,Advances in Immunology 58,417
Falk,K.et al.,1991.,Nature 351,290-296
Felgner,J.H.et al.,1994,J.Biol.Chem.269,2550-2561
Feltkamp,M.C.et al.,1995,Eur.J.Immunol.25(9),2638-2642
Fenton,R.G.et al.,1993,J.Natl.Cancer Inst.85,16,1294-302
Fisk,B.et al.,1995,J.Exp.Med.1881,2109-2117
Flow Cytometry,Acad.Press,Methods in Cell Biology,1989,Vol.33,Herausgeber:Darzynkiewicz,Z.und Crissman,H.A.
Gedde Dahl,T,et al.,1992,Hum Immunol.33,4,266-74
Grohmann,U.et al.,1995,Eur.J.Immunol.25,2797-2802
Guarini,A.et al.,1995,Cytokines and Molecular Therapy 1,57-64
Han,X.K.et al.,1995,PNAS 92,9747-9751
Handbuch:FACS Vantage TM User’s Guide,April 1994,Becton Dickinson
Handbuch:CELL Quest TM Software User’s Guide,June 1994,Becton Dickinson
Henderson,R.A.,und Finn,O.J..1996,Advances in Immunology 62,217-256
Hock,H.et al.,1993,Cancer Research 53,714-716
Houbiers,J.G.,et al.,1993;Eur J Immunol 23,2072-7.
Huang,A.Y.C.,und Pardoll,D.M.(1996).Proc Natl Acad Sci U S A 93,9730-5
Inaba,K.,et al.,1992,J Exp Med 176,1693-1702
Jung,S.et al.,1991,J,Exp.Med.173,1,273-6
Kawakami,Y.et al.,1994,Proc.Natl.Acad.Sci.USA 91,6458-62
Kawakami,Y.et al.,1994a,Proc.Natl.Acad.Sci.USA 91,9,3515-9
Kawakami,Y.et al.,1994b,J.Exp.Med.180,1,347-52
Kawakami,Y.et al.,1995,The Journal of Immunol.154,3961-3968
Kersh,G.J.et al.,1996,Nature 380(6574),495-498
Kovacsovics Bankowski,M.und Rock,K.L.,1995,Science 267,243-246
Lanzavecchia,A.,1996,Curr.Opin.Immunol.8,348-354
Lehmann,J.M.et al.,1989,Proc.Natl.Acad.Sci.USA86,9891-9895
Lethe,B.et al.,1992,Eur.J.Immunol.22,2283-2288
Li,H,et al.,1989,J Exp Med 169,973-986
Lill,N.L.,Tevethia,M.J.,Hendrickson,W.G.,und Tevethia,S.S.(1992).J Exp Med 176,449-57
Ljunggren,H.G.,et al.,1990,Nature 346:476-480
Loeffler,J.-P.et al.,1993,Methods Enzymol.217,599-618
Lopez,J.A,et al.,1993,Eur.J.Immunol.23,217-223
MacBroom,C.R.et al.,1972,Meth.Enzymol.28,212-219
Mackiewicz,A.et al.,1995,Human Gene Therapy 6,805-811
Malnati,M.S.et al.,1995,Science 267,1016-1018
Mandelboim,O.et al.,1994,Nature 369,5.May,67-71
Mandelboim,O.et al.,1995,Nature Medicine 1,11,1179-1183
Marchand,M.,et al.,1995,Int J of Cancer 63,883-5
Mclntyre,C.A.,et al.,1996 Cancer Immunol.Immunother.42:246-250.
Midoux,P.,et al.,1993,NATO ASI Series H67,49-64
Morishita,R.et al.,1993,J.Clin.Invest.91,6,2580-5
Nabel,G.J.et al.,1993,Proc.Natl.Acad.Sci.USA 90,11307-11311
Noguchi,Y.et al.,1994.Proc Natl Acad Sci U S A91,3171-3175
Oettgen,H.F.und Old,L.J.,1991,Biologic Therapy of Cancer,Editors:DeVita,V.T.Jr.,Hellman,S.,Rosenberg,S.A.,Verlag J.B.Lippincott Company,Philadelphia,New York,London,Hagerstown,87-119
Ostrand-Rosenberg,S.,1994,Current Opinion in Immunology 6,722-727
Pardoll,D.M.,1993,Immunology Today 14,6,310
Practical Immunology,Editors:Leslie Hudson and Frank C.Hay,Blackwell Scientific Publications,Oxford,London,Edinburgh,Boston,Melbourne Peace,D.J.et al.,1991,J.Immunol.146,6,2059-65
Peoples,G.E.et al.,1994,J.Immunol.152,10,4993-9
Plautz,G.E.et al.,1993,Proc.Natl.Acad.Sci.USA 90,4645-4649
Porgador,A.,Gilboa,E.,1995,J.Exp.Med.182,255-260
Puccetti,P.et al.,1995,Eur.J.Immunol.24,1446-1452
Rammensee,H.G.,et al.,1993,Annu Rev Immunol 11,213-44
Rammensee,H.G.et al.,1993,Current Opinion in Immunology 5,35-44
Rammensee,H.G.,et al.,1995,Current Biology 7,85-96
Rammensee,H.G.,1995,Current Opinion in Immunology 7,85-96
Rammensee,H.G.,et al.,1995,Immunogenetics 41,178-228
Remington’s Pharmaceutical Sciences,18.Auflage 1990,Mack Publishing Company,Easton,Penn.1990
Remy,J.S.et al.,1994,Bioconjug-Chem.,Nov-Dec,5(6),647-54
Rennie,J.und Rusting,R.,1996,Scientific American September,28-30
Rivoltini,L.et al.,1995,The Journal of Immunology 154,5 2257-2265
Robbins,P.F.,et al.,1994,Cancer Res 54,3124-6
Robbins,P.F.,et al.,1995,J Immunol 154,5944-50
Robbins,P.F.und Rosenberg,S.A.,1996,Journ.Exp.Med.183,1185-92.
Robbins,P.F.und Kawakami,Y.,1996,Curr Opin Immunol 8,628-636
Roitt I.M.,Brostoff J.,Male D.K.Immunology,Churchill Livingstone
Rosenberg,S.A.,1996,Annual Reviews of Medicine,47,481-491
Ryser,H.J.und Hancock,R.,1965,Science 150,501-503
Ryser,H.J.und Shen,W.C.,1978,Proc Natl Acad Sci USA 75,3867-3870
Schmidt,W.,et al.,May 1995,Proc.Natl.Acad.Sci.USA,92,4711-4714
Schmidt,W.,et al.,1996,Proc Natl Acad Sci USA,93,9759-63
Sette,A.et al.,1994,Mol.Immunol.31(11):813-822,.
Shen,W.C.und Ryser,H.J.,1978,Proc.Natl.Acad.Sci.USA,75,1872-1876
Shen,W.C.und Ryser,H.J.,1979,Mol.Pharmacol.16,614-622
Shen,W.C.und Ryser,H.J.,1981,Proc.Natl.Acad.Sci.USA,78,7589-7593
Skipper,J.,und Stauss,H.J.,1993,J.Exp.Med.177,5,1493-8
Slingluff,C.L.et al.,1994,Current Opinion in Immunology 6,733-740
Stein,D.et al.,1994,EMBO Journal,13,6,1331-40
Stuber,G.et al.,1994,Eur.J.Immunol 24,765-768
Sykulev,Y.et al.,1994,Immunity 1,15-22
Theobald,M.,Levine,A.J.,und Sherman,L.A.(1995)PNAS 92,11993-7
Tibbets,L.M.et al.,1993,Cancer,Jan.15.,Vol.71,2,315-321
Tykocinski,M.L.et al.,1996,Am.J.Pathol.148,1-16
van der Bruggen,P.et al.,1994,Eur.J.Immunol.24,9,2134-40 Issn:0014-2980
Van der Eynde,B.und Brichard,V.G.,1995,Current Opinion Immunol.7,674-81
Van Pel,A.und Boon,T.,1982,Proc.Natl.Acad.Sci.USA 79,4718-4722
Van Pel,A.,et al.,1995,Immunological Reviews 145,229-250
Vitiello,A.et al,1995,J.Clin.Inv.95,1,341-349
Wagner,E.,et al.,1990,Proc Natl Acad Sci USA 87,3410-4
Wagner,E.,et al.,1992,Proc Natl Acad Sci USA 89,6099-103
Wang,R.F.,et al.,1995,J Exp Med 181,799-804
Weynants,P.et al.,1994,Int.J.Cancer 56,826-829
Widmann,C.et al.,1992,J.Immunol.Methods 155(1),95-99
York,I.A.und Rock,K.L.,1996,Ann.Rev.Immunol.14,369-396
Yoshino,I.et al.,1994 a),J.Immunol.152,5,2393-400
Yoshino,I.et al.,1994 b),Cancer Res.,54,13,3387-90
Young,J.W.,Inaba,K.,1996,J.Exp.Med.,183,7-11
Zatloukal,K.et al.,1993,Gene 135,199-20
Zatloukal,K.et al.,1995,J.Immun.154,3406-3419
Claims (25)
- 細胞性免疫応答に対して免疫調節活性を有するペプチドの前記免疫調節活性を増大させるための医薬組成物であって、細胞性免疫応答に対して免疫調節活性を有する少なくとも1つのペプチドをアジュバントと共に含み、前記アジュバントが、治療される個体の抗原提示細胞への前記ペプチドの結合を増大させることができ、または、抗原提示細胞への前記ペプチドの取込みを増加させることができ、かつ、前記アジュバントがポリアルギニンであることを特徴とする医薬組成物。
- ペプチドが、治療される個体が発現している少なくとも1つのMHC分子のリガンドであることを特徴とする、請求項1に記載の医薬組成物。
- ペプチドがMHC-I分子のリガンドであることを特徴とする、請求項2に記載の医薬組成物。
- ペプチドがMHC-II分子のリガンドであることを特徴とする、請求項2に記載の医薬組成物。
- 病原体のタンパク質に由来するペプチドを含むことを特徴とする、請求項1〜4のいずれか1項に記載の医薬組成物。
- ペプチドがバクテリアのタンパク質に由来することを特徴とする、請求項5に記載の医薬組成物。
- ペプチドがウイルスタンパク質に由来することを特徴とする、請求項5に記載の医薬組成物。
- ペプチドが腫瘍抗原に由来することを特徴とする、腫瘍ワクチンとしての請求項1〜4のいずれか1項に記載の医薬組成物。
- 腫瘍抗原が、治療される個体が発現している腫瘍抗原に由来することを特徴とする、治療に使用される請求項8に記載の医薬組成物。
- 腫瘍抗原が一般に生ずる腫瘍抗原の代表的なものに由来することを特徴とする、予防的に使用される請求項8に記載の医薬組成物。
- 腫瘍抗原がメラノーマ抗原であることを特徴とする、請求項8〜10のいずれか1項に記載の医薬組成物。
- サイトカインをも含むことを特徴とする、請求項8〜11のいずれか1項に記載の医薬組成物。
- サイトカインが、IL-2、IL-4、IL-12、IFN-α、IFN-β、IFN-γ、IFN-ω、TNF-α、GM-CSFまたはそれらの混合物からなる群より選ばれることを特徴とする、請求項12に記載の医薬組成物。
- 治療される個体の異なるMHCサブタイプに結合するという点で異なる複数のペプチドを含むことを特徴とする請求項2〜11のいずれか1項に記載の医薬組成物。
- 天然に生ずる免疫原性タンパク質または腫瘍抗原またはそれらの細胞分解物に由来する1またはそれ以上のペプチドを含むことを特徴とする、請求項2〜14のいずれか1項に記載の医薬組成物。
- 天然に生ずる免疫原性タンパク質または腫瘍抗原またはそれらの細胞分解物に由来するペプチドと異なる1またはそれ以上のペプチドを含むことを特徴とする、請求項2〜14のいずれか1項に記載の医薬組成物。
- ペプチドが、自己免疫疾患の原因となるタンパク質に由来するペプチドのアンタゴニストである、請求項1に記載の医薬組成物。
- アジュバントが細胞リガンドと結合していることを特徴とする請求項1〜17のいずれか1項に記載の医薬組成物。
- リガンドが炭水化物残基であることを特徴とする、請求項18に記載の医薬組成物。
- リガンドがフコースであることを特徴とする、請求項19に記載の医薬組成物。
- リガンドがトランスフェリンであることを特徴とする、請求項18に記載の医薬組成物。
- 非経口的投与のための、請求項1〜21のいずれか1項に記載の医薬組成物。
- 製薬的に許容できる担体中の、ペプチドおよびアジュバントの溶液または懸濁液の形態であることを特徴とする、請求項22に記載の医薬組成物。
- 局所的な適用のための、請求項1〜21のいずれか1項に記載の医薬組成物。
- ヒドロゲルの形態である、請求項24に記載の医薬組成物。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19607044A DE19607044A1 (de) | 1996-02-24 | 1996-02-24 | Tumorvakzine und Verfahren zu ihrer Herstellung |
| DE19607044.9 | 1996-02-24 | ||
| DE19638313.7 | 1996-09-19 | ||
| DE19638313A DE19638313C2 (de) | 1996-09-19 | 1996-09-19 | Pharmazeutische Zusammensetzung für die Immunmodulation |
| DE19648687A DE19648687A1 (de) | 1996-11-25 | 1996-11-25 | Pharmazeutische Zusammensetzung für die Immunmodulation |
| DE19648687.4 | 1996-11-25 | ||
| PCT/EP1997/000828 WO1997030721A1 (de) | 1996-02-24 | 1997-02-21 | Pharmazeutische zusammensetzung für die immunmodulation beruhend auf peptiden und adjuvantien |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2000506125A JP2000506125A (ja) | 2000-05-23 |
| JP2000506125A5 JP2000506125A5 (ja) | 2004-11-25 |
| JP4184433B2 true JP4184433B2 (ja) | 2008-11-19 |
Family
ID=27215945
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP52980697A Expired - Fee Related JP4184433B2 (ja) | 1996-02-24 | 1997-02-21 | 免疫調節のための医薬組成物 |
Country Status (35)
| Country | Link |
|---|---|
| US (1) | US7105162B1 (ja) |
| EP (1) | EP0881906B2 (ja) |
| JP (1) | JP4184433B2 (ja) |
| KR (1) | KR100457647B1 (ja) |
| CN (1) | CN1177610C (ja) |
| AR (1) | AR005945A1 (ja) |
| AT (1) | ATE274350T1 (ja) |
| AU (1) | AU722264B2 (ja) |
| BG (1) | BG63682B1 (ja) |
| BR (1) | BR9707694A (ja) |
| CA (1) | CA2243559C (ja) |
| CO (1) | CO4600681A1 (ja) |
| CZ (1) | CZ295396B6 (ja) |
| DE (1) | DE59711873D1 (ja) |
| DK (1) | DK0881906T4 (ja) |
| EE (1) | EE04481B1 (ja) |
| ES (1) | ES2225951T5 (ja) |
| HK (1) | HK1017257A1 (ja) |
| HR (1) | HRP970100B1 (ja) |
| HU (1) | HU224410B1 (ja) |
| ID (1) | ID16038A (ja) |
| IL (1) | IL125361A (ja) |
| MY (1) | MY119276A (ja) |
| NO (1) | NO983850L (ja) |
| NZ (1) | NZ332020A (ja) |
| PE (1) | PE55398A1 (ja) |
| PL (1) | PL189413B1 (ja) |
| PT (1) | PT881906E (ja) |
| RO (1) | RO119344B1 (ja) |
| RS (1) | RS50101B (ja) |
| SI (1) | SI0881906T2 (ja) |
| SK (1) | SK284582B6 (ja) |
| TR (1) | TR199801649T2 (ja) |
| TW (1) | TW585774B (ja) |
| WO (1) | WO1997030721A1 (ja) |
Families Citing this family (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RS50101B (sr) | 1996-02-24 | 2009-01-22 | Boehringer Ingelheim International Gmbh., | Farmaceutski preparati za imunomodulaciju |
| DE19803453A1 (de) | 1998-01-30 | 1999-08-12 | Boehringer Ingelheim Int | Vakzine |
| JP4875799B2 (ja) * | 1998-02-25 | 2012-02-15 | アメリカ合衆国 | Adp−リボシル化外毒素により誘引される経皮免疫応答を促進するための皮膚浸透性エンハンサーおよびバリア崩壊剤の使用 |
| WO1999053912A1 (en) * | 1998-04-20 | 1999-10-28 | Torrey Pines Institute For Molecular Studies | Topical immunostimulation to induce langerhans cell migration |
| EP2204186B1 (en) * | 1999-02-17 | 2016-04-06 | CSL Limited | Immunogenic complexes and methods relating thereto |
| DE19909503A1 (de) * | 1999-03-04 | 2000-09-07 | Boehringer Ingelheim Int | Tumorassoziiertes Antigen |
| US6809179B1 (en) | 1999-08-04 | 2004-10-26 | Boehringer Ingelheim International Gmbh | Tumor-associated antigen (R11) |
| US20070031446A1 (en) | 2003-07-11 | 2007-02-08 | Intercell Ag | Hcv vaccines |
| AT408721B (de) | 1999-10-01 | 2002-02-25 | Cistem Biotechnologies Gmbh | Pharmazeutische zusammensetzung enthaltend ein antigen |
| AT409085B (de) * | 2000-01-28 | 2002-05-27 | Cistem Biotechnologies Gmbh | Pharmazeutische zusammensetzung zur immunmodulation und herstellung von vakzinen |
| US20020009491A1 (en) * | 2000-02-14 | 2002-01-24 | Rothbard Jonathan B. | Compositions and methods for enhancing drug delivery across biological membranes and tissues |
| AT409762B (de) * | 2000-04-13 | 2002-11-25 | Cistem Biotechnologies Gmbh | Verfahren zur identifizierung von zytokin sekretierenden zellen |
| AT410173B (de) | 2000-06-08 | 2003-02-25 | Cistem Biotechnologies Gmbh | Antigene zusammensetzung |
| KR20020014459A (ko) * | 2000-08-18 | 2002-02-25 | 서진호 | 양이온성 아미노산이 부가된 융합단백질 및 이를 이용한생물공정의 개선방법 |
| EP1347775B1 (en) * | 2001-01-05 | 2016-11-30 | Valneva Austria GmbH | Uses for polycationic compounds as vaccine adjuvants |
| WO2002053185A2 (en) * | 2001-01-05 | 2002-07-11 | Intercell Ag | Anti-inflammatory use of polycationic compounds |
| US7244438B2 (en) | 2001-01-05 | 2007-07-17 | Intercell Ag | Uses for polycationic compounds |
| AT410798B (de) | 2001-01-26 | 2003-07-25 | Cistem Biotechnologies Gmbh | Verfahren zur identifizierung, isolierung und herstellung von antigenen gegen ein spezifisches pathogen |
| FR2824326B1 (fr) * | 2001-05-04 | 2004-03-19 | Commissariat Energie Atomique | Melange de peptides issus des proteines e6 et/ou e7 de papillomavirus et leurs applications |
| AU2002358616A1 (en) * | 2001-12-07 | 2003-06-17 | Intercell Ag | Immunostimulatory oligodeoxynucleotides |
| US20050221350A1 (en) * | 2002-05-29 | 2005-10-06 | Toni Weinschenk | Method for identifying immunoreactive peptides |
| CN1650012A (zh) | 2002-07-24 | 2005-08-03 | 英特塞尔股份公司 | 来自致病病毒的备选阅读框所编码的抗原 |
| JP2006504687A (ja) | 2002-09-13 | 2006-02-09 | インターツェル・アクチェンゲゼルシャフト | C型肝炎ウイルスペプチドの単離方法 |
| WO2004035618A2 (en) | 2002-10-15 | 2004-04-29 | Intercell Ag | Nucleic acids coding for adhesion factor of group b streptococcus, adhesion factors of group b streptococcus and further uses thereof |
| JP2006520202A (ja) | 2003-03-04 | 2006-09-07 | インターツェル・アクチェンゲゼルシャフト | ストレプトコッカス・ピオゲネス抗原 |
| WO2004084938A1 (en) | 2003-03-24 | 2004-10-07 | Intercell Ag | Improved vaccines |
| ATE449177T1 (de) | 2003-03-31 | 2009-12-15 | Intercell Ag | Staphylococcus epidermidis antigene |
| WO2004092209A2 (en) | 2003-04-15 | 2004-10-28 | Intercell Ag | S. pneumoniae antigens |
| CN101864432A (zh) | 2003-05-07 | 2010-10-20 | 英特塞尔股份公司 | 无乳链球菌抗原ⅰ和ⅱ |
| CA2525540A1 (en) | 2003-05-30 | 2004-12-09 | Intercell Ag | Enterococcus antigens |
| EP1722819B1 (en) | 2004-03-12 | 2007-12-26 | Intercell AG | Method for solubilising peptide mixtures |
| DE102004038134B4 (de) | 2004-08-05 | 2013-07-25 | Johann Wolfgang Goethe-Universität Frankfurt am Main | Multivalente Chelatoren zum Modifizieren und Organisieren von Zielmolekülen, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| US9573979B2 (en) | 2004-09-24 | 2017-02-21 | Susanne Modrow | Modified VP1-capsid protein of parvovirus B19 |
| CN101048172A (zh) * | 2004-10-29 | 2007-10-03 | 英特塞尔股份公司 | 用于慢性hcv患者的hcv疫苗 |
| ES2396240T3 (es) | 2005-04-20 | 2013-02-20 | Mitsuru Akashi | Poliaminoácido para usar como adyuvante |
| EP1887084A1 (en) * | 2006-08-10 | 2008-02-13 | International Investment and Patents SA | Plasmids with immunological action |
| CN101516905A (zh) | 2006-09-15 | 2009-08-26 | 英特塞尔股份公司 | 疏螺旋体属抗原 |
| JP2008174490A (ja) * | 2007-01-18 | 2008-07-31 | Nitto Denko Corp | 抗原性ペプチドを主成分とする薬剤 |
| CA2685805A1 (en) | 2007-05-02 | 2008-11-13 | Intercell Ag | Klebsiella antigens |
| KR100748265B1 (ko) * | 2007-06-15 | 2007-08-10 | (주)성문엔지니어링 | 공동주택에 배선된 전선의 합선방지구조 |
| CN101883782A (zh) | 2007-06-18 | 2010-11-10 | 英特塞尔股份公司 | 衣原体抗原 |
| MX2010001284A (es) | 2007-08-02 | 2010-08-31 | Biondvax Pharmaceuticals Ltd | Vacunas contra la influenza con multiepitope multimerico. |
| WO2009120378A2 (en) * | 2008-03-27 | 2009-10-01 | Nestec S.A. | Methods for increasing absorption of peptides, peptidomimetics, and other gastrointestinal transport protein substrates |
| KR20110091560A (ko) | 2008-12-03 | 2011-08-11 | 프로테아 벡신 테크놀로지스 엘티디. | 글루타밀 tRNA 합성효소(GtS) 단편들 |
| WO2010092176A2 (en) | 2009-02-13 | 2010-08-19 | Intercell Ag | Nontypable haemophilus influenzae antigens |
| AU2010288239B2 (en) * | 2009-08-27 | 2014-01-16 | Novartis Ag | Adjuvant comprising aluminium, oligonucleotide and polycation |
| WO2011057131A1 (en) | 2009-11-09 | 2011-05-12 | Spotlight Technology Partners Llc | Polysaccharide based hydrogels |
| US8795727B2 (en) | 2009-11-09 | 2014-08-05 | Spotlight Technology Partners Llc | Fragmented hydrogels |
| WO2011067758A2 (en) | 2009-12-02 | 2011-06-09 | Protea Vaccine Technologies Ltd. | Immunogenic fragments and multimers from streptococcus pneumoniae proteins |
| US8765148B2 (en) | 2010-02-19 | 2014-07-01 | Valneva Austria Gmbh | 1C31 nanoparticles |
| US9303070B2 (en) | 2011-02-22 | 2016-04-05 | Biondvax Pharmaceuticals Ltd. | Multimeric multiepitope polypeptides in improved seasonal and pandemic influenza vaccines |
| RU2478399C2 (ru) * | 2011-06-16 | 2013-04-10 | Государственное научное учреждение Всероссийский научно-исследовательский институт бруцеллеза и туберкулеза животных Российской академии сельскохозяйственных наук (ГНУ ВНИИБТЖ Россельхозакадемии) | Способ получения специфического иммуномодулятора |
| US20140271723A1 (en) * | 2013-03-15 | 2014-09-18 | Saint Louis University | Adjuvant compositions and methods of using thereof |
| MX2017014532A (es) | 2015-05-13 | 2018-02-21 | Agenus Inc | Vacunas para el tratamiento y prevencion del cancer. |
| WO2017159686A1 (ja) * | 2016-03-15 | 2017-09-21 | Repertoire Genesis株式会社 | 免疫療法のためのモニタリングまたは診断ならびに治療剤の設計 |
| EP3735984A1 (en) * | 2016-05-27 | 2020-11-11 | Etubics Corporation | Neoepitope vaccine compositions and methods of use thereof |
| US11291718B2 (en) | 2016-10-11 | 2022-04-05 | Cytlimic Inc. | Method for treating cancer by administering a toll-like receptor agonist and LAG-3 IgG fusion protein |
| CN107469067B (zh) * | 2017-09-05 | 2018-06-19 | 浙江大学 | 一种多肽及其改造体在制备免疫调节药物中的应用 |
| TW202012430A (zh) | 2018-04-26 | 2020-04-01 | 美商艾吉納斯公司 | 熱休克蛋白質-結合之胜肽組成物及其使用方法 |
| CN110870912A (zh) * | 2018-08-31 | 2020-03-10 | 成都夸常奥普医疗科技有限公司 | 亚甲蓝类染料作为疫苗佐剂的应用、包含该佐剂的疫苗及其应用 |
| CN110870913A (zh) * | 2018-08-31 | 2020-03-10 | 成都夸常奥普医疗科技有限公司 | 氨基酸类营养素作为疫苗佐剂的应用以及包含氨基酸营养素作为佐剂的疫苗 |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1290141A (ja) | 1968-05-31 | 1972-09-20 | ||
| US4847240A (en) * | 1978-01-16 | 1989-07-11 | The Trustees Of Boston University | Method of effecting cellular uptake of molecules |
| US4728639A (en) * | 1982-07-27 | 1988-03-01 | University Of Tennessee Research Corporation | Type-specific opsonic antibodies evoked with a synthetic peptide of streptococcal M protein conjugated to polylysine without adjuvant |
| US6022544A (en) * | 1983-01-24 | 2000-02-08 | The John Hopkins University | Therapeutic suppression of specific immune responses by administration of oligomeric forms of antigen of controlled chemistry |
| US4956273A (en) * | 1985-10-24 | 1990-09-11 | Southwest Foundation For Biomedical Research | Synthetic peptides and method of use for diagnosis and vaccination for AIDS and ARC |
| BE1000587A4 (fr) | 1986-06-13 | 1989-02-14 | Oncogen | Coordinats et procedes en vue d'augmenter la proliferation des lymphocytes b. |
| GB2220939B (en) * | 1988-06-10 | 1992-02-26 | Medical Res Council | Peptide fragments of hiv and their use in vaccines and diagnosis |
| ATE147633T1 (de) * | 1988-10-27 | 1997-02-15 | Univ Minnesota | Immunhilfsmittel aus liposome enthaltend lymphokin il -2 |
| WO1991009869A1 (en) | 1990-01-05 | 1991-07-11 | Medical Research Council | Hiv-1 core protein fragments |
| US5342774A (en) | 1991-05-23 | 1994-08-30 | Ludwig Institute For Cancer Research | Nucleotide sequence encoding the tumor rejection antigen precursor, MAGE-1 |
| US6235525B1 (en) | 1991-05-23 | 2001-05-22 | Ludwig Institute For Cancer Research | Isolated nucleic acid molecules coding for tumor rejection antigen precursor MAGE-3 and uses thereof |
| CA2133323C (en) | 1992-04-03 | 2010-10-26 | Francis C. Szoka, Jr. | Self-assembling polynucleotide delivery system |
| JP3608788B2 (ja) | 1992-08-31 | 2005-01-12 | ルドヴィグ・インスティテュート・フォー・キャンサー・リサーチ | Mage−3遺伝子から誘導されてhla−a1により提示される単離されたノナペプチドおよびそれらの用途 |
| US5571711A (en) | 1993-06-17 | 1996-11-05 | Ludwig Institute For Cancer Research | Isolated nucleic acid molecules coding for BAGE tumor rejection antigen precursors |
| US5409703A (en) * | 1993-06-24 | 1995-04-25 | Carrington Laboratories, Inc. | Dried hydrogel from hydrophilic-hygroscopic polymer |
| CZ281462B6 (cs) | 1993-07-12 | 1996-10-16 | Aliatros Medical, A.S. | Farmaceutický prostředek pro imunomodulační a adjuvantní léčbu |
| JP2828391B2 (ja) * | 1993-10-29 | 1998-11-25 | 東燃株式会社 | オリゴ糖を表面に有するリポソーム |
| US6660276B1 (en) * | 1994-02-16 | 2003-12-09 | The University Of Virginia Patent Foundation | Peptides recognized by melanoma-specific cytotoxic lymphocytes, and uses therefor |
| US6001809A (en) * | 1994-07-11 | 1999-12-14 | Elan Pharmaceuticals, Inc. | Inhibitors of leukocyte adhesion |
| UY24367A1 (es) † | 1995-11-23 | 2000-10-31 | Boehringer Ingelheim Int | Vacunas contra tumores y procedimiento para su produccion |
| RS50101B (sr) | 1996-02-24 | 2009-01-22 | Boehringer Ingelheim International Gmbh., | Farmaceutski preparati za imunomodulaciju |
-
1997
- 1997-02-20 RS YUP-62/97A patent/RS50101B/sr unknown
- 1997-02-20 CO CO97009092A patent/CO4600681A1/es unknown
- 1997-02-21 CN CNB971925186A patent/CN1177610C/zh not_active Expired - Fee Related
- 1997-02-21 AT AT97905068T patent/ATE274350T1/de active
- 1997-02-21 DE DE59711873T patent/DE59711873D1/de not_active Expired - Lifetime
- 1997-02-21 US US09/125,672 patent/US7105162B1/en not_active Expired - Fee Related
- 1997-02-21 BR BR9707694A patent/BR9707694A/pt not_active IP Right Cessation
- 1997-02-21 PL PL97328455A patent/PL189413B1/pl unknown
- 1997-02-21 KR KR10-1998-0706339A patent/KR100457647B1/ko not_active IP Right Cessation
- 1997-02-21 PT PT97905068T patent/PT881906E/pt unknown
- 1997-02-21 CA CA2243559A patent/CA2243559C/en not_active Expired - Fee Related
- 1997-02-21 ES ES97905068T patent/ES2225951T5/es not_active Expired - Lifetime
- 1997-02-21 EE EE9800255A patent/EE04481B1/xx unknown
- 1997-02-21 SI SI9730672T patent/SI0881906T2/sl unknown
- 1997-02-21 SK SK1145-98A patent/SK284582B6/sk not_active IP Right Cessation
- 1997-02-21 DK DK97905068T patent/DK0881906T4/da active
- 1997-02-21 EP EP97905068A patent/EP0881906B2/de not_active Expired - Lifetime
- 1997-02-21 CZ CZ19982689A patent/CZ295396B6/cs not_active IP Right Cessation
- 1997-02-21 NZ NZ332020A patent/NZ332020A/en not_active IP Right Cessation
- 1997-02-21 MY MYPI97000683A patent/MY119276A/en unknown
- 1997-02-21 WO PCT/EP1997/000828 patent/WO1997030721A1/de active IP Right Grant
- 1997-02-21 HR HR970100A patent/HRP970100B1/xx not_active IP Right Cessation
- 1997-02-21 TR TR1998/01649T patent/TR199801649T2/xx unknown
- 1997-02-21 HU HU9901186A patent/HU224410B1/hu not_active IP Right Cessation
- 1997-02-21 AR ARP970100701A patent/AR005945A1/es active IP Right Grant
- 1997-02-21 AU AU18759/97A patent/AU722264B2/en not_active Ceased
- 1997-02-21 JP JP52980697A patent/JP4184433B2/ja not_active Expired - Fee Related
- 1997-02-21 RO RO98-01305A patent/RO119344B1/ro unknown
- 1997-02-21 IL IL12536197A patent/IL125361A/en not_active IP Right Cessation
- 1997-02-24 PE PE1997000130A patent/PE55398A1/es not_active IP Right Cessation
- 1997-02-24 ID IDP970541A patent/ID16038A/id unknown
- 1997-02-24 TW TW086102221A patent/TW585774B/zh not_active IP Right Cessation
-
1998
- 1998-08-21 BG BG102714A patent/BG63682B1/bg active Active
- 1998-08-21 NO NO983850A patent/NO983850L/no not_active Application Discontinuation
-
1999
- 1999-05-25 HK HK99102360A patent/HK1017257A1/xx not_active IP Right Cessation
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4184433B2 (ja) | 免疫調節のための医薬組成物 | |
| CA2756996C (en) | Vaccine compositions and methods of use thereof | |
| AU720131B2 (en) | Tumour vaccine and processes for preparing it | |
| Andrieu et al. | Endocytosis of an HIV‐derived lipopeptide into human dendritic cells followed by class I‐restricted CD8+ T lymphocyte activation | |
| US10688165B2 (en) | Medicament for use in a method of inducing or extending a cellular cytotoxic immune response | |
| JP2020509067A (ja) | 糖尿病の治療のためのペプチド及び方法 | |
| CN102172397A (zh) | 树突细胞的体内靶向 | |
| Rice et al. | DNA fusion gene vaccination mobilizes effective anti‐leukemic cytotoxic T lymphocytes from a tolerized repertoire | |
| Babon et al. | Cross-presentation of a CMV pp65 epitope by human dendritic cells using bee venom PLA2 as a membrane-binding vector | |
| DE19638313C2 (de) | Pharmazeutische Zusammensetzung für die Immunmodulation | |
| MXPA98003930A (en) | Vaccines against tumors and procedure for your producc | |
| DE19648687A1 (de) | Pharmazeutische Zusammensetzung für die Immunmodulation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20040223 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20040223 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070213 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070510 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20070625 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070809 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20080129 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080425 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20080612 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080825 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080904 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110912 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110912 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120912 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120912 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130912 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |