JP2005515260A - 複分解に使用される金属錯体 - Google Patents
複分解に使用される金属錯体 Download PDFInfo
- Publication number
- JP2005515260A JP2005515260A JP2003562130A JP2003562130A JP2005515260A JP 2005515260 A JP2005515260 A JP 2005515260A JP 2003562130 A JP2003562130 A JP 2003562130A JP 2003562130 A JP2003562130 A JP 2003562130A JP 2005515260 A JP2005515260 A JP 2005515260A
- Authority
- JP
- Japan
- Prior art keywords
- group
- metal
- alkyl
- chain
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 229910052751 metal Inorganic materials 0.000 title claims abstract description 211
- 239000002184 metal Substances 0.000 title claims abstract description 211
- 238000005649 metathesis reaction Methods 0.000 title 1
- 239000003054 catalyst Substances 0.000 claims abstract description 156
- 238000000034 method Methods 0.000 claims abstract description 94
- 150000001336 alkenes Chemical class 0.000 claims abstract description 82
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 claims abstract description 77
- 239000000463 material Substances 0.000 claims abstract description 67
- 238000006116 polymerization reaction Methods 0.000 claims abstract description 63
- 229920000642 polymer Polymers 0.000 claims abstract description 53
- 238000012546 transfer Methods 0.000 claims abstract description 47
- 238000006276 transfer reaction Methods 0.000 claims abstract description 38
- 239000011541 reaction mixture Substances 0.000 claims abstract description 36
- 150000001993 dienes Chemical class 0.000 claims abstract description 30
- 230000015572 biosynthetic process Effects 0.000 claims abstract description 26
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims abstract description 14
- 238000003786 synthesis reaction Methods 0.000 claims abstract description 14
- 238000006886 vinylation reaction Methods 0.000 claims abstract description 14
- 239000000412 dendrimer Substances 0.000 claims abstract description 12
- 229920000736 dendritic polymer Polymers 0.000 claims abstract description 12
- 238000004519 manufacturing process Methods 0.000 claims abstract description 12
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims abstract description 10
- 239000004711 α-olefin Substances 0.000 claims abstract description 9
- 238000000108 ultra-filtration Methods 0.000 claims abstract description 5
- 238000007259 addition reaction Methods 0.000 claims abstract description 3
- -1 tetrafluoroborate Chemical compound 0.000 claims description 192
- 239000003446 ligand Substances 0.000 claims description 141
- 150000001875 compounds Chemical class 0.000 claims description 107
- 125000000217 alkyl group Chemical group 0.000 claims description 66
- 238000006243 chemical reaction Methods 0.000 claims description 65
- 125000003118 aryl group Chemical group 0.000 claims description 63
- 239000000178 monomer Substances 0.000 claims description 58
- 239000002904 solvent Substances 0.000 claims description 57
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 claims description 54
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 44
- 239000000203 mixture Substances 0.000 claims description 43
- 239000001257 hydrogen Substances 0.000 claims description 35
- 229910052739 hydrogen Inorganic materials 0.000 claims description 35
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 claims description 35
- 125000003545 alkoxy group Chemical group 0.000 claims description 33
- 239000003505 polymerization initiator Substances 0.000 claims description 33
- 125000004432 carbon atom Chemical group C* 0.000 claims description 32
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 29
- 239000000047 product Substances 0.000 claims description 29
- 229910052707 ruthenium Inorganic materials 0.000 claims description 28
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 27
- 125000000129 anionic group Chemical group 0.000 claims description 27
- 125000004429 atom Chemical group 0.000 claims description 27
- 125000001424 substituent group Chemical group 0.000 claims description 26
- 229910052736 halogen Inorganic materials 0.000 claims description 24
- 150000002367 halogens Chemical class 0.000 claims description 24
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 22
- 229910052723 transition metal Inorganic materials 0.000 claims description 21
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 21
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 claims description 20
- 125000001072 heteroaryl group Chemical group 0.000 claims description 20
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 19
- 150000003839 salts Chemical class 0.000 claims description 18
- 150000003624 transition metals Chemical class 0.000 claims description 18
- 150000008052 alkyl sulfonates Chemical class 0.000 claims description 17
- 125000002993 cycloalkylene group Chemical group 0.000 claims description 17
- 229910052757 nitrogen Inorganic materials 0.000 claims description 17
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 17
- 230000008569 process Effects 0.000 claims description 17
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 claims description 16
- 239000000543 intermediate Substances 0.000 claims description 16
- 229910052762 osmium Inorganic materials 0.000 claims description 16
- 125000005210 alkyl ammonium group Chemical group 0.000 claims description 15
- 125000005228 aryl sulfonate group Chemical group 0.000 claims description 15
- 230000000737 periodic effect Effects 0.000 claims description 15
- 239000000126 substance Substances 0.000 claims description 15
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 claims description 14
- 125000005600 alkyl phosphonate group Chemical group 0.000 claims description 14
- 125000004104 aryloxy group Chemical group 0.000 claims description 14
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 14
- 229910052760 oxygen Inorganic materials 0.000 claims description 14
- 239000001301 oxygen Substances 0.000 claims description 14
- 229910052719 titanium Inorganic materials 0.000 claims description 14
- 239000010936 titanium Substances 0.000 claims description 14
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 13
- 125000004414 alkyl thio group Chemical group 0.000 claims description 13
- 125000005843 halogen group Chemical group 0.000 claims description 13
- 239000002808 molecular sieve Substances 0.000 claims description 13
- SYQBFIAQOQZEGI-UHFFFAOYSA-N osmium atom Chemical compound [Os] SYQBFIAQOQZEGI-UHFFFAOYSA-N 0.000 claims description 13
- 238000010526 radical polymerization reaction Methods 0.000 claims description 13
- 239000000376 reactant Substances 0.000 claims description 13
- 238000007142 ring opening reaction Methods 0.000 claims description 13
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 claims description 13
- 229910052717 sulfur Inorganic materials 0.000 claims description 13
- 239000011593 sulfur Substances 0.000 claims description 13
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 claims description 12
- 125000003358 C2-C20 alkenyl group Chemical group 0.000 claims description 12
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 12
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 claims description 12
- 229910052799 carbon Inorganic materials 0.000 claims description 12
- 150000007942 carboxylates Chemical class 0.000 claims description 12
- 229910052742 iron Inorganic materials 0.000 claims description 12
- 229910052750 molybdenum Inorganic materials 0.000 claims description 12
- 239000011733 molybdenum Substances 0.000 claims description 12
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 claims description 12
- 229910052721 tungsten Inorganic materials 0.000 claims description 12
- 239000010937 tungsten Substances 0.000 claims description 12
- 125000005842 heteroatom Chemical group 0.000 claims description 11
- 230000007935 neutral effect Effects 0.000 claims description 11
- 239000010948 rhodium Substances 0.000 claims description 11
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 claims description 11
- 125000006850 spacer group Chemical group 0.000 claims description 11
- 239000004094 surface-active agent Substances 0.000 claims description 11
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 10
- 125000006649 (C2-C20) alkynyl group Chemical group 0.000 claims description 10
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 claims description 10
- 125000003302 alkenyloxy group Chemical group 0.000 claims description 10
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 10
- 125000005133 alkynyloxy group Chemical group 0.000 claims description 10
- 229910052802 copper Inorganic materials 0.000 claims description 10
- 239000010949 copper Substances 0.000 claims description 10
- 150000002148 esters Chemical class 0.000 claims description 10
- 125000000524 functional group Chemical group 0.000 claims description 10
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 10
- 229910052759 nickel Inorganic materials 0.000 claims description 10
- 229910052703 rhodium Inorganic materials 0.000 claims description 10
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 claims description 9
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 claims description 9
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 claims description 9
- 125000002091 cationic group Chemical group 0.000 claims description 9
- 229910052804 chromium Inorganic materials 0.000 claims description 9
- 239000011651 chromium Substances 0.000 claims description 9
- 229910017052 cobalt Inorganic materials 0.000 claims description 9
- 239000010941 cobalt Substances 0.000 claims description 9
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 claims description 9
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims description 9
- 229910052737 gold Inorganic materials 0.000 claims description 9
- 239000010931 gold Substances 0.000 claims description 9
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 claims description 9
- 150000005673 monoalkenes Chemical class 0.000 claims description 9
- 229910052702 rhenium Inorganic materials 0.000 claims description 9
- WUAPFZMCVAUBPE-UHFFFAOYSA-N rhenium atom Chemical compound [Re] WUAPFZMCVAUBPE-UHFFFAOYSA-N 0.000 claims description 9
- 229910052709 silver Inorganic materials 0.000 claims description 9
- 239000004332 silver Substances 0.000 claims description 9
- 239000012453 solvate Substances 0.000 claims description 9
- 230000007704 transition Effects 0.000 claims description 9
- 229910052720 vanadium Inorganic materials 0.000 claims description 9
- GPPXJZIENCGNKB-UHFFFAOYSA-N vanadium Chemical compound [V]#[V] GPPXJZIENCGNKB-UHFFFAOYSA-N 0.000 claims description 9
- 229910052725 zinc Inorganic materials 0.000 claims description 9
- 239000011701 zinc Substances 0.000 claims description 9
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 claims description 8
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 8
- 150000001335 aliphatic alkanes Chemical class 0.000 claims description 8
- 229910052782 aluminium Inorganic materials 0.000 claims description 8
- 125000000732 arylene group Chemical group 0.000 claims description 8
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 8
- 150000008049 diazo compounds Chemical class 0.000 claims description 8
- 150000002430 hydrocarbons Chemical group 0.000 claims description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 8
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 7
- 125000004644 alkyl sulfinyl group Chemical group 0.000 claims description 7
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 7
- 125000002947 alkylene group Chemical group 0.000 claims description 7
- 125000000860 allenylidene group Chemical group [*]=C=C=C([H])[H] 0.000 claims description 7
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims description 7
- 150000001450 anions Chemical class 0.000 claims description 7
- 150000002466 imines Chemical class 0.000 claims description 7
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 claims description 6
- MCMNRKCIXSYSNV-UHFFFAOYSA-N Zirconium dioxide Chemical compound O=[Zr]=O MCMNRKCIXSYSNV-UHFFFAOYSA-N 0.000 claims description 6
- 238000012644 addition polymerization Methods 0.000 claims description 6
- 125000001931 aliphatic group Chemical group 0.000 claims description 6
- 125000005370 alkoxysilyl group Chemical group 0.000 claims description 6
- 150000001408 amides Chemical class 0.000 claims description 6
- 150000001412 amines Chemical class 0.000 claims description 6
- 150000004945 aromatic hydrocarbons Chemical class 0.000 claims description 6
- 150000001721 carbon Chemical group 0.000 claims description 6
- 238000006555 catalytic reaction Methods 0.000 claims description 6
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 6
- HNPSIPDUKPIQMN-UHFFFAOYSA-N dioxosilane;oxo(oxoalumanyloxy)alumane Chemical class O=[Si]=O.O=[Al]O[Al]=O HNPSIPDUKPIQMN-UHFFFAOYSA-N 0.000 claims description 6
- 150000002170 ethers Chemical class 0.000 claims description 6
- 150000002576 ketones Chemical class 0.000 claims description 6
- 150000002739 metals Chemical class 0.000 claims description 6
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 6
- 239000002243 precursor Substances 0.000 claims description 6
- 239000003586 protic polar solvent Substances 0.000 claims description 6
- 229910052711 selenium Inorganic materials 0.000 claims description 6
- 239000011669 selenium Substances 0.000 claims description 6
- 239000000377 silicon dioxide Substances 0.000 claims description 6
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 5
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 claims description 5
- 125000002723 alicyclic group Chemical group 0.000 claims description 5
- 125000005549 heteroarylene group Chemical group 0.000 claims description 5
- 229910052809 inorganic oxide Inorganic materials 0.000 claims description 5
- 229910003480 inorganic solid Inorganic materials 0.000 claims description 5
- 150000002500 ions Chemical class 0.000 claims description 5
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 claims description 5
- 239000012454 non-polar solvent Substances 0.000 claims description 5
- 239000003016 pheromone Substances 0.000 claims description 5
- 239000003880 polar aprotic solvent Substances 0.000 claims description 5
- 125000003396 thiol group Chemical class [H]S* 0.000 claims description 5
- 150000003623 transition metal compounds Chemical class 0.000 claims description 5
- ADLVDYMTBOSDFE-UHFFFAOYSA-N 5-chloro-6-nitroisoindole-1,3-dione Chemical compound C1=C(Cl)C([N+](=O)[O-])=CC2=C1C(=O)NC2=O ADLVDYMTBOSDFE-UHFFFAOYSA-N 0.000 claims description 4
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 claims description 4
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 4
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 claims description 4
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 claims description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 4
- 150000001298 alcohols Chemical class 0.000 claims description 4
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 claims description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-O ammonium group Chemical group [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 claims description 4
- 230000000975 bioactive effect Effects 0.000 claims description 4
- 229910052796 boron Inorganic materials 0.000 claims description 4
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 4
- 229910052794 bromium Inorganic materials 0.000 claims description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 4
- 239000007795 chemical reaction product Substances 0.000 claims description 4
- 150000008280 chlorinated hydrocarbons Chemical class 0.000 claims description 4
- 125000000392 cycloalkenyl group Chemical group 0.000 claims description 4
- 239000003205 fragrance Substances 0.000 claims description 4
- 230000000977 initiatory effect Effects 0.000 claims description 4
- 239000002917 insecticide Substances 0.000 claims description 4
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 4
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 4
- 229920000620 organic polymer Polymers 0.000 claims description 4
- 229910052763 palladium Inorganic materials 0.000 claims description 4
- 229910052698 phosphorus Inorganic materials 0.000 claims description 4
- 239000011574 phosphorus Chemical group 0.000 claims description 4
- 238000007348 radical reaction Methods 0.000 claims description 4
- 229910052710 silicon Inorganic materials 0.000 claims description 4
- 239000010703 silicon Substances 0.000 claims description 4
- 125000004665 trialkylsilyl group Chemical group 0.000 claims description 4
- NQBHLERNEITUTI-WGDLNXRISA-N CCCC\C=C\CC\C=C\CCC=C Chemical compound CCCC\C=C\CC\C=C\CCC=C NQBHLERNEITUTI-WGDLNXRISA-N 0.000 claims description 3
- 239000002841 Lewis acid Substances 0.000 claims description 3
- 150000005674 acyclic monoalkenes Chemical class 0.000 claims description 3
- 125000003342 alkenyl group Chemical group 0.000 claims description 3
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 claims description 3
- 125000000304 alkynyl group Chemical group 0.000 claims description 3
- 229910052787 antimony Chemical group 0.000 claims description 3
- WATWJIUSRGPENY-UHFFFAOYSA-N antimony atom Chemical group [Sb] WATWJIUSRGPENY-UHFFFAOYSA-N 0.000 claims description 3
- 229910052785 arsenic Inorganic materials 0.000 claims description 3
- RQNWIZPPADIBDY-UHFFFAOYSA-N arsenic atom Chemical group [As] RQNWIZPPADIBDY-UHFFFAOYSA-N 0.000 claims description 3
- 239000011203 carbon fibre reinforced carbon Substances 0.000 claims description 3
- 150000005675 cyclic monoalkenes Chemical class 0.000 claims description 3
- VRNCRGHDRGGBLW-UHFFFAOYSA-N cyclopenta-1,2-diene Chemical class C1CC=C=C1 VRNCRGHDRGGBLW-UHFFFAOYSA-N 0.000 claims description 3
- 125000002485 formyl group Chemical class [H]C(*)=O 0.000 claims description 3
- 125000000623 heterocyclic group Chemical group 0.000 claims description 3
- BXJHOKLLMOYSRQ-UHFFFAOYSA-N hexadeca-7,11-dienyl acetate Chemical compound CCCCC=CCCC=CCCCCCCOC(C)=O BXJHOKLLMOYSRQ-UHFFFAOYSA-N 0.000 claims description 3
- 150000007517 lewis acids Chemical class 0.000 claims description 3
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 claims description 3
- 229910052697 platinum Inorganic materials 0.000 claims description 3
- 239000002952 polymeric resin Substances 0.000 claims description 3
- 229920005990 polystyrene resin Polymers 0.000 claims description 3
- 239000004032 superbase Substances 0.000 claims description 3
- 150000007525 superbases Chemical class 0.000 claims description 3
- LWNGJAHMBMVCJR-UHFFFAOYSA-N (2,3,4,5,6-pentafluorophenoxy)boronic acid Chemical compound OB(O)OC1=C(F)C(F)=C(F)C(F)=C1F LWNGJAHMBMVCJR-UHFFFAOYSA-N 0.000 claims description 2
- CSWBSLXBXRFNST-MQQKCMAXSA-N (8e,10e)-dodeca-8,10-dien-1-ol Chemical compound C\C=C\C=C\CCCCCCCO CSWBSLXBXRFNST-MQQKCMAXSA-N 0.000 claims description 2
- 125000003837 (C1-C20) alkyl group Chemical group 0.000 claims description 2
- RTCAJAHYBVGCHJ-AATRIKPKSA-N (e)-1-chlorodec-5-ene Chemical compound CCCC\C=C\CCCCCl RTCAJAHYBVGCHJ-AATRIKPKSA-N 0.000 claims description 2
- YJINQJFQLQIYHX-SNAWJCMRSA-N 11E-Tetradecenyl acetate Chemical compound CC\C=C\CCCCCCCCCCOC(C)=O YJINQJFQLQIYHX-SNAWJCMRSA-N 0.000 claims description 2
- RGICCULPCWNRAB-UHFFFAOYSA-N 2-[2-(2-hexoxyethoxy)ethoxy]ethanol Chemical compound CCCCCCOCCOCCOCCO RGICCULPCWNRAB-UHFFFAOYSA-N 0.000 claims description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 claims description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 claims description 2
- 239000004593 Epoxy Substances 0.000 claims description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 claims description 2
- 125000006241 alcohol protecting group Chemical group 0.000 claims description 2
- 125000005134 alkynylsulfinyl group Chemical group 0.000 claims description 2
- 125000000707 boryl group Chemical group B* 0.000 claims description 2
- 229910052793 cadmium Inorganic materials 0.000 claims description 2
- BDOSMKKIYDKNTQ-UHFFFAOYSA-N cadmium atom Chemical compound [Cd] BDOSMKKIYDKNTQ-UHFFFAOYSA-N 0.000 claims description 2
- 150000001718 carbodiimides Chemical class 0.000 claims description 2
- 125000001651 cyanato group Chemical group [*]OC#N 0.000 claims description 2
- VTUFOIHYMMMNOM-UHFFFAOYSA-N dec-5-enyl acetate Chemical compound CCCCC=CCCCCOC(C)=O VTUFOIHYMMMNOM-UHFFFAOYSA-N 0.000 claims description 2
- 125000005448 ethoxyethyl group Chemical group [H]C([H])([H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 claims description 2
- 239000012948 isocyanate Substances 0.000 claims description 2
- 150000002513 isocyanates Chemical class 0.000 claims description 2
- NONOKGVFTBWRLD-UHFFFAOYSA-N isocyanatosulfanylimino(oxo)methane Chemical compound O=C=NSN=C=O NONOKGVFTBWRLD-UHFFFAOYSA-N 0.000 claims description 2
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 claims description 2
- 229910052753 mercury Inorganic materials 0.000 claims description 2
- 150000007522 mineralic acids Chemical class 0.000 claims description 2
- 125000000018 nitroso group Chemical group N(=O)* 0.000 claims description 2
- 150000007524 organic acids Chemical class 0.000 claims description 2
- 239000012450 pharmaceutical intermediate Substances 0.000 claims description 2
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 claims description 2
- 229910000073 phosphorus hydride Inorganic materials 0.000 claims description 2
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical group [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 claims description 2
- MHHMZAHLXURERJ-UHFFFAOYSA-N pyrrol-1-ylmethylphosphonic acid Chemical compound OP(O)(=O)CN1C=CC=C1 MHHMZAHLXURERJ-UHFFFAOYSA-N 0.000 claims description 2
- 125000003638 stannyl group Chemical group [H][Sn]([H])([H])* 0.000 claims description 2
- 229940124530 sulfonamide Drugs 0.000 claims description 2
- 150000003456 sulfonamides Chemical class 0.000 claims description 2
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 claims description 2
- 125000001412 tetrahydropyranyl group Chemical group 0.000 claims description 2
- 150000007970 thio esters Chemical class 0.000 claims description 2
- 125000005309 thioalkoxy group Chemical group 0.000 claims description 2
- 125000005296 thioaryloxy group Chemical group 0.000 claims description 2
- 150000003568 thioethers Chemical class 0.000 claims description 2
- 229930192474 thiophene Natural products 0.000 claims description 2
- YJINQJFQLQIYHX-UHFFFAOYSA-N trans-11-tetradecenyl acetate Natural products CCC=CCCCCCCCCCCOC(C)=O YJINQJFQLQIYHX-UHFFFAOYSA-N 0.000 claims description 2
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 2
- 239000002131 composite material Substances 0.000 claims 3
- 238000006462 rearrangement reaction Methods 0.000 claims 3
- 125000005139 alkynylsulfonyl group Chemical group 0.000 claims 1
- 125000005621 boronate group Chemical group 0.000 claims 1
- 125000000837 carbohydrate group Chemical group 0.000 claims 1
- AASDCUKBIIEHFJ-UHFFFAOYSA-N dodeca-3,8,10-trien-1-ol Chemical compound CC=CC=CCCCC=CCCO AASDCUKBIIEHFJ-UHFFFAOYSA-N 0.000 claims 1
- 239000004615 ingredient Substances 0.000 claims 1
- SNOOUWRIMMFWNE-UHFFFAOYSA-M sodium;6-[(3,4,5-trimethoxybenzoyl)amino]hexanoate Chemical compound [Na+].COC1=CC(C(=O)NCCCCCC([O-])=O)=CC(OC)=C1OC SNOOUWRIMMFWNE-UHFFFAOYSA-M 0.000 claims 1
- 125000001273 sulfonato group Chemical class [O-]S(*)(=O)=O 0.000 claims 1
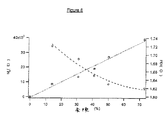
- 230000000694 effects Effects 0.000 abstract description 12
- 238000009826 distribution Methods 0.000 abstract description 7
- PYGSKMBEVAICCR-UHFFFAOYSA-N hexa-1,5-diene Chemical group C=CCCC=C PYGSKMBEVAICCR-UHFFFAOYSA-N 0.000 abstract description 6
- 238000010550 living polymerization reaction Methods 0.000 abstract description 6
- 238000007210 heterogeneous catalysis Methods 0.000 abstract description 3
- 150000003577 thiophenes Chemical class 0.000 abstract description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 113
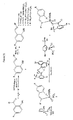
- 239000002262 Schiff base Substances 0.000 description 58
- 239000000243 solution Substances 0.000 description 55
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 54
- 150000004753 Schiff bases Chemical class 0.000 description 46
- 239000007787 solid Substances 0.000 description 46
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 35
- 238000010560 atom transfer radical polymerization reaction Methods 0.000 description 32
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 30
- 239000002638 heterogeneous catalyst Substances 0.000 description 29
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- 150000003254 radicals Chemical class 0.000 description 25
- 229920001577 copolymer Polymers 0.000 description 24
- 101710141544 Allatotropin-related peptide Proteins 0.000 description 23
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 23
- 238000002360 preparation method Methods 0.000 description 22
- 238000003756 stirring Methods 0.000 description 22
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 21
- 239000011148 porous material Substances 0.000 description 20
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 16
- 229920002554 vinyl polymer Polymers 0.000 description 16
- 230000003197 catalytic effect Effects 0.000 description 15
- 239000000460 chlorine Substances 0.000 description 15
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 14
- 238000001228 spectrum Methods 0.000 description 14
- 238000001704 evaporation Methods 0.000 description 13
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 13
- 238000001914 filtration Methods 0.000 description 11
- 239000011572 manganese Substances 0.000 description 11
- 241000894007 species Species 0.000 description 11
- 238000010183 spectrum analysis Methods 0.000 description 11
- 238000002441 X-ray diffraction Methods 0.000 description 10
- 239000002609 medium Substances 0.000 description 10
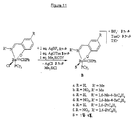
- SMQUZDBALVYZAC-UHFFFAOYSA-N salicylaldehyde Chemical compound OC1=CC=CC=C1C=O SMQUZDBALVYZAC-UHFFFAOYSA-N 0.000 description 10
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 9
- 238000005481 NMR spectroscopy Methods 0.000 description 9
- 239000004793 Polystyrene Substances 0.000 description 9
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 9
- 238000000921 elemental analysis Methods 0.000 description 9
- 238000002474 experimental method Methods 0.000 description 9
- 230000006870 function Effects 0.000 description 9
- 229920002223 polystyrene Polymers 0.000 description 9
- 238000004458 analytical method Methods 0.000 description 8
- 230000008020 evaporation Effects 0.000 description 8
- 239000000843 powder Substances 0.000 description 8
- 239000000725 suspension Substances 0.000 description 8
- 150000001768 cations Chemical class 0.000 description 7
- 239000000839 emulsion Substances 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 239000002245 particle Substances 0.000 description 7
- UEXCJVNBTNXOEH-UHFFFAOYSA-N phenyl acethylene Natural products C#CC1=CC=CC=C1 UEXCJVNBTNXOEH-UHFFFAOYSA-N 0.000 description 7
- 239000002994 raw material Substances 0.000 description 7
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 7
- 238000005160 1H NMR spectroscopy Methods 0.000 description 6
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 6
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 6
- 238000001069 Raman spectroscopy Methods 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 239000012298 atmosphere Substances 0.000 description 6
- UHOVQNZJYSORNB-MZWXYZOWSA-N benzene-d6 Chemical compound [2H]C1=C([2H])C([2H])=C([2H])C([2H])=C1[2H] UHOVQNZJYSORNB-MZWXYZOWSA-N 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- FJKIXWOMBXYWOQ-UHFFFAOYSA-N ethenoxyethane Chemical compound CCOC=C FJKIXWOMBXYWOQ-UHFFFAOYSA-N 0.000 description 6
- 238000004817 gas chromatography Methods 0.000 description 6
- JFNLZVQOOSMTJK-KNVOCYPGSA-N norbornene Chemical compound C1[C@@H]2CC[C@H]1C=C2 JFNLZVQOOSMTJK-KNVOCYPGSA-N 0.000 description 6
- 230000035484 reaction time Effects 0.000 description 6
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 5
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 5
- 239000002253 acid Substances 0.000 description 5
- 239000012300 argon atmosphere Substances 0.000 description 5
- 239000006227 byproduct Substances 0.000 description 5
- 229910052801 chlorine Inorganic materials 0.000 description 5
- 239000013078 crystal Substances 0.000 description 5
- 239000002815 homogeneous catalyst Substances 0.000 description 5
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 5
- 239000003960 organic solvent Substances 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- BPELEZSCHIEMAE-UHFFFAOYSA-N salicylaldehyde imine Chemical compound OC1=CC=CC=C1C=N BPELEZSCHIEMAE-UHFFFAOYSA-N 0.000 description 5
- 238000001179 sorption measurement Methods 0.000 description 5
- GBECUEIQVRDUKB-UHFFFAOYSA-M thallium monochloride Chemical compound [Tl]Cl GBECUEIQVRDUKB-UHFFFAOYSA-M 0.000 description 5
- WYTZZXDRDKSJID-UHFFFAOYSA-N (3-aminopropyl)triethoxysilane Chemical compound CCO[Si](OCC)(OCC)CCCN WYTZZXDRDKSJID-UHFFFAOYSA-N 0.000 description 4
- XWJBRBSPAODJER-UHFFFAOYSA-N 1,7-octadiene Chemical compound C=CCCCCC=C XWJBRBSPAODJER-UHFFFAOYSA-N 0.000 description 4
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 4
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 4
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical group CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 4
- 238000001237 Raman spectrum Methods 0.000 description 4
- 125000001118 alkylidene group Chemical group 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 4
- DZFYOYRNBGNPJW-UHFFFAOYSA-N ethoxythallium Chemical compound [Tl+].CC[O-] DZFYOYRNBGNPJW-UHFFFAOYSA-N 0.000 description 4
- 239000010410 layer Substances 0.000 description 4
- 230000031700 light absorption Effects 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- DSOJWVLXZNRKCS-UHFFFAOYSA-N octa-1,7-diyne Chemical compound C#CCCCCC#C DSOJWVLXZNRKCS-UHFFFAOYSA-N 0.000 description 4
- 239000012044 organic layer Substances 0.000 description 4
- 125000004430 oxygen atom Chemical group O* 0.000 description 4
- 238000001556 precipitation Methods 0.000 description 4
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 4
- 238000007342 radical addition reaction Methods 0.000 description 4
- 230000009257 reactivity Effects 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 230000002441 reversible effect Effects 0.000 description 4
- 238000007363 ring formation reaction Methods 0.000 description 4
- 238000007152 ring opening metathesis polymerisation reaction Methods 0.000 description 4
- 150000004760 silicates Chemical class 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 230000008961 swelling Effects 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 4
- CURPNKKOBDCLOS-UHFFFAOYSA-N 2-[bis(prop-2-enyl)azaniumyl]acetate Chemical class OC(=O)CN(CC=C)CC=C CURPNKKOBDCLOS-UHFFFAOYSA-N 0.000 description 3
- KGIGUEBEKRSTEW-UHFFFAOYSA-N 2-vinylpyridine Chemical compound C=CC1=CC=CC=N1 KGIGUEBEKRSTEW-UHFFFAOYSA-N 0.000 description 3
- JMFBXUMHVSZUKY-UHFFFAOYSA-N 3-bromopropyl(triethoxy)silane Chemical compound CCO[Si](OCC)(OCC)CCCBr JMFBXUMHVSZUKY-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 239000005977 Ethylene Substances 0.000 description 3
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 150000001299 aldehydes Chemical class 0.000 description 3
- 150000001345 alkine derivatives Chemical class 0.000 description 3
- 229910052786 argon Inorganic materials 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 229920001400 block copolymer Polymers 0.000 description 3
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 3
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 3
- 239000003093 cationic surfactant Substances 0.000 description 3
- 239000012986 chain transfer agent Substances 0.000 description 3
- 238000004440 column chromatography Methods 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 125000001945 cyclooctatrienyl group Chemical group C1(=CC=CC=CCC1)* 0.000 description 3
- 125000000058 cyclopentadienyl group Chemical group C1(=CC=CC1)* 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- ZSWFCLXCOIISFI-UHFFFAOYSA-N endo-cyclopentadiene Natural products C1C=CC=C1 ZSWFCLXCOIISFI-UHFFFAOYSA-N 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- 238000005227 gel permeation chromatography Methods 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 150000008282 halocarbons Chemical class 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 229920002521 macromolecule Polymers 0.000 description 3
- 150000002736 metal compounds Chemical class 0.000 description 3
- HJDDLKXKJBTCFS-UHFFFAOYSA-N n-(diethoxyphosphorylmethyl)-n-prop-2-enylprop-2-en-1-amine Chemical compound CCOP(=O)(OCC)CN(CC=C)CC=C HJDDLKXKJBTCFS-UHFFFAOYSA-N 0.000 description 3
- VPCDQGACGWYTMC-UHFFFAOYSA-N nitrosyl chloride Chemical compound ClN=O VPCDQGACGWYTMC-UHFFFAOYSA-N 0.000 description 3
- 239000002736 nonionic surfactant Substances 0.000 description 3
- 125000002872 norbornadienyl group Chemical group C12=C(C=C(CC1)C2)* 0.000 description 3
- 230000003647 oxidation Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 3
- 239000002685 polymerization catalyst Substances 0.000 description 3
- 239000004926 polymethyl methacrylate Substances 0.000 description 3
- 238000010107 reaction injection moulding Methods 0.000 description 3
- 229910001494 silver tetrafluoroborate Inorganic materials 0.000 description 3
- 229920006250 telechelic polymer Polymers 0.000 description 3
- 150000003475 thallium Chemical class 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- 239000010457 zeolite Substances 0.000 description 3
- RRKODOZNUZCUBN-CCAGOZQPSA-N (1z,3z)-cycloocta-1,3-diene Chemical compound C1CC\C=C/C=C\C1 RRKODOZNUZCUBN-CCAGOZQPSA-N 0.000 description 2
- CRRUGYDDEMGVDY-UHFFFAOYSA-N 1-bromoethylbenzene Chemical compound CC(Br)C1=CC=CC=C1 CRRUGYDDEMGVDY-UHFFFAOYSA-N 0.000 description 2
- LIKMAJRDDDTEIG-UHFFFAOYSA-N 1-hexene Chemical compound CCCCC=C LIKMAJRDDDTEIG-UHFFFAOYSA-N 0.000 description 2
- JKTCBAGSMQIFNL-UHFFFAOYSA-N 2,3-dihydrofuran Chemical compound C1CC=CO1 JKTCBAGSMQIFNL-UHFFFAOYSA-N 0.000 description 2
- MZNSQRLUUXWLSB-UHFFFAOYSA-N 2-ethenyl-1h-pyrrole Chemical compound C=CC1=CC=CN1 MZNSQRLUUXWLSB-UHFFFAOYSA-N 0.000 description 2
- KANZWHBYRHQMKZ-UHFFFAOYSA-N 2-ethenylpyrazine Chemical compound C=CC1=CN=CC=N1 KANZWHBYRHQMKZ-UHFFFAOYSA-N 0.000 description 2
- 125000006040 2-hexenyl group Chemical group 0.000 description 2
- RSEBUVRVKCANEP-UHFFFAOYSA-N 2-pyrroline Chemical compound C1CC=CN1 RSEBUVRVKCANEP-UHFFFAOYSA-N 0.000 description 2
- 238000004400 29Si cross polarisation magic angle spinning Methods 0.000 description 2
- DTYXUWCJYMNDQD-UHFFFAOYSA-N 3-ethenylpyridazine Chemical compound C=CC1=CC=CN=N1 DTYXUWCJYMNDQD-UHFFFAOYSA-N 0.000 description 2
- 125000006041 3-hexenyl group Chemical group 0.000 description 2
- BWRRWBIBNBVHQF-UHFFFAOYSA-N 4-(3-pyridin-2-yl-1,2,4-oxadiazol-5-yl)butanoic acid Chemical compound O1C(CCCC(=O)O)=NC(C=2N=CC=CC=2)=N1 BWRRWBIBNBVHQF-UHFFFAOYSA-N 0.000 description 2
- UMKWZZPKADNTRP-UHFFFAOYSA-N 4-ethenylpyrimidine Chemical compound C=CC1=CC=NC=N1 UMKWZZPKADNTRP-UHFFFAOYSA-N 0.000 description 2
- XCENPWBBAXQVCG-UHFFFAOYSA-N 4-phenylpiperidine-4-carbaldehyde Chemical compound C=1C=CC=CC=1C1(C=O)CCNCC1 XCENPWBBAXQVCG-UHFFFAOYSA-N 0.000 description 2
- YPIINMAYDTYYSQ-UHFFFAOYSA-N 5-ethenyl-1h-pyrazole Chemical compound C=CC=1C=CNN=1 YPIINMAYDTYYSQ-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical group CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 2
- 229910021536 Zeolite Inorganic materials 0.000 description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 229910052783 alkali metal Inorganic materials 0.000 description 2
- 150000001340 alkali metals Chemical class 0.000 description 2
- 150000004703 alkoxides Chemical class 0.000 description 2
- BHELZAPQIKSEDF-UHFFFAOYSA-N allyl bromide Chemical compound BrCC=C BHELZAPQIKSEDF-UHFFFAOYSA-N 0.000 description 2
- ZSIQJIWKELUFRJ-UHFFFAOYSA-N azepane Chemical compound C1CCCNCC1 ZSIQJIWKELUFRJ-UHFFFAOYSA-N 0.000 description 2
- HUMNYLRZRPPJDN-UHFFFAOYSA-N benzaldehyde Chemical compound O=CC1=CC=CC=C1 HUMNYLRZRPPJDN-UHFFFAOYSA-N 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- WTEOIRVLGSZEPR-UHFFFAOYSA-N boron trifluoride Chemical compound FB(F)F WTEOIRVLGSZEPR-UHFFFAOYSA-N 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 238000001875 carbon-13 cross-polarisation magic angle spinning nuclear magnetic resonance spectrum Methods 0.000 description 2
- 150000001735 carboxylic acids Chemical class 0.000 description 2
- 238000005266 casting Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 239000007859 condensation product Substances 0.000 description 2
- 238000007334 copolymerization reaction Methods 0.000 description 2
- RWGFKTVRMDUZSP-UHFFFAOYSA-N cumene Chemical compound CC(C)C1=CC=CC=C1 RWGFKTVRMDUZSP-UHFFFAOYSA-N 0.000 description 2
- 150000004292 cyclic ethers Chemical class 0.000 description 2
- 150000001924 cycloalkanes Chemical class 0.000 description 2
- DMEGYFMYUHOHGS-UHFFFAOYSA-N cycloheptane Chemical compound C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 2
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 239000000806 elastomer Substances 0.000 description 2
- 238000004945 emulsification Methods 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 229920001519 homopolymer Polymers 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- 150000008040 ionic compounds Chemical class 0.000 description 2
- 239000004816 latex Substances 0.000 description 2
- 229920000126 latex Polymers 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- IVSZLXZYQVIEFR-UHFFFAOYSA-N m-xylene Chemical group CC1=CC=CC(C)=C1 IVSZLXZYQVIEFR-UHFFFAOYSA-N 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 238000000465 moulding Methods 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- 238000004172 nitrogen cycle Methods 0.000 description 2
- 150000002848 norbornenes Chemical class 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 2
- 150000003003 phosphines Chemical class 0.000 description 2
- 229920000058 polyacrylate Polymers 0.000 description 2
- 229920013639 polyalphaolefin Polymers 0.000 description 2
- 230000000379 polymerizing effect Effects 0.000 description 2
- 229920000098 polyolefin Polymers 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 2
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 238000006479 redox reaction Methods 0.000 description 2
- 238000006798 ring closing metathesis reaction Methods 0.000 description 2
- 150000003304 ruthenium compounds Chemical class 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 238000000371 solid-state nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- 238000004611 spectroscopical analysis Methods 0.000 description 2
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 2
- 102000055501 telomere Human genes 0.000 description 2
- 108091035539 telomere Proteins 0.000 description 2
- 210000003411 telomere Anatomy 0.000 description 2
- HJUGFYREWKUQJT-UHFFFAOYSA-N tetrabromomethane Chemical compound BrC(Br)(Br)Br HJUGFYREWKUQJT-UHFFFAOYSA-N 0.000 description 2
- 229920002725 thermoplastic elastomer Polymers 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 229920000428 triblock copolymer Polymers 0.000 description 2
- SQBBHCOIQXKPHL-UHFFFAOYSA-N tributylalumane Chemical compound CCCC[Al](CCCC)CCCC SQBBHCOIQXKPHL-UHFFFAOYSA-N 0.000 description 2
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 238000005303 weighing Methods 0.000 description 2
- DBZZJLFTGQBESX-UHFFFAOYSA-N (2-methylpyrrol-1-yl) acetate Chemical compound CC(=O)ON1C=CC=C1C DBZZJLFTGQBESX-UHFFFAOYSA-N 0.000 description 1
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 description 1
- 125000006586 (C3-C10) cycloalkylene group Chemical group 0.000 description 1
- XEMRAKSQROQPBR-UHFFFAOYSA-N (trichloromethyl)benzene Chemical compound ClC(Cl)(Cl)C1=CC=CC=C1 XEMRAKSQROQPBR-UHFFFAOYSA-N 0.000 description 1
- FFJCNSLCJOQHKM-CLFAGFIQSA-N (z)-1-[(z)-octadec-9-enoxy]octadec-9-ene Chemical compound CCCCCCCC\C=C/CCCCCCCCOCCCCCCCC\C=C/CCCCCCCC FFJCNSLCJOQHKM-CLFAGFIQSA-N 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- OLYMKHFFLBFZGU-UHFFFAOYSA-N 1,2-dimethoxyethane;1-methoxy-2-(2-methoxyethoxy)ethane Chemical compound COCCOC.COCCOCCOC OLYMKHFFLBFZGU-UHFFFAOYSA-N 0.000 description 1
- OYSVBCSOQFXYHK-UHFFFAOYSA-N 1,3-dibromo-2,2-bis(bromomethyl)propane Chemical compound BrCC(CBr)(CBr)CBr OYSVBCSOQFXYHK-UHFFFAOYSA-N 0.000 description 1
- KPZGRMZPZLOPBS-UHFFFAOYSA-N 1,3-dichloro-2,2-bis(chloromethyl)propane Chemical compound ClCC(CCl)(CCl)CCl KPZGRMZPZLOPBS-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- OCJBOOLMMGQPQU-UHFFFAOYSA-N 1,4-dichlorobenzene Chemical compound ClC1=CC=C(Cl)C=C1 OCJBOOLMMGQPQU-UHFFFAOYSA-N 0.000 description 1
- VYXHVRARDIDEHS-UHFFFAOYSA-N 1,5-cyclooctadiene Chemical compound C1CC=CCCC=C1 VYXHVRARDIDEHS-UHFFFAOYSA-N 0.000 description 1
- 239000004912 1,5-cyclooctadiene Substances 0.000 description 1
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 1
- GTLWADFFABIGAE-UHFFFAOYSA-N 1-chloroethylbenzene Chemical compound CC(Cl)C1=CC=CC=C1 GTLWADFFABIGAE-UHFFFAOYSA-N 0.000 description 1
- NVJUHMXYKCUMQA-UHFFFAOYSA-N 1-ethoxypropane Chemical compound CCCOCC NVJUHMXYKCUMQA-UHFFFAOYSA-N 0.000 description 1
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- HECLRDQVFMWTQS-RGOKHQFPSA-N 1755-01-7 Chemical compound C1[C@H]2[C@@H]3CC=C[C@@H]3[C@@H]1C=C2 HECLRDQVFMWTQS-RGOKHQFPSA-N 0.000 description 1
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Natural products C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 1
- OXBLVCZKDOZZOJ-UHFFFAOYSA-N 2,3-Dihydrothiophene Chemical class C1CC=CS1 OXBLVCZKDOZZOJ-UHFFFAOYSA-N 0.000 description 1
- CDAWCLOXVUBKRW-UHFFFAOYSA-N 2-aminophenol Chemical compound NC1=CC=CC=C1O CDAWCLOXVUBKRW-UHFFFAOYSA-N 0.000 description 1
- XXSPGBOGLXKMDU-UHFFFAOYSA-N 2-bromo-2-methylpropanoic acid Chemical compound CC(C)(Br)C(O)=O XXSPGBOGLXKMDU-UHFFFAOYSA-N 0.000 description 1
- PYNYHMRMZOGVML-UHFFFAOYSA-N 2-bromopropanenitrile Chemical compound CC(Br)C#N PYNYHMRMZOGVML-UHFFFAOYSA-N 0.000 description 1
- MONMFXREYOKQTI-UHFFFAOYSA-N 2-bromopropanoic acid Chemical compound CC(Br)C(O)=O MONMFXREYOKQTI-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- MYCXCBCDXVFXNE-UHFFFAOYSA-N 2-chloro-2-methylpropanoic acid Chemical compound CC(C)(Cl)C(O)=O MYCXCBCDXVFXNE-UHFFFAOYSA-N 0.000 description 1
- JNAYPRPPXRWGQO-UHFFFAOYSA-N 2-chloropropanenitrile Chemical compound CC(Cl)C#N JNAYPRPPXRWGQO-UHFFFAOYSA-N 0.000 description 1
- GAWAYYRQGQZKCR-UHFFFAOYSA-N 2-chloropropionic acid Chemical compound CC(Cl)C(O)=O GAWAYYRQGQZKCR-UHFFFAOYSA-N 0.000 description 1
- PGMMQIGGQSIEGH-UHFFFAOYSA-N 2-ethenyl-1,3-oxazole Chemical compound C=CC1=NC=CO1 PGMMQIGGQSIEGH-UHFFFAOYSA-N 0.000 description 1
- MLMGJTAJUDSUKA-UHFFFAOYSA-N 2-ethenyl-1h-imidazole Chemical compound C=CC1=NC=CN1 MLMGJTAJUDSUKA-UHFFFAOYSA-N 0.000 description 1
- ZDHWTWWXCXEGIC-UHFFFAOYSA-N 2-ethenylpyrimidine Chemical compound C=CC1=NC=CC=N1 ZDHWTWWXCXEGIC-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M 2-methylbenzenesulfonate Chemical compound CC1=CC=CC=C1S([O-])(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- 125000005916 2-methylpentyl group Chemical group 0.000 description 1
- 125000006024 2-pentenyl group Chemical group 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- GLISZRPOUBOZDL-UHFFFAOYSA-N 3-bromopropyl(trimethoxy)silane Chemical compound CO[Si](OC)(OC)CCCBr GLISZRPOUBOZDL-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- WHALRBQHHBHKEO-UHFFFAOYSA-N 3-ethenyl-1,2-oxazole Chemical compound C=CC=1C=CON=1 WHALRBQHHBHKEO-UHFFFAOYSA-N 0.000 description 1
- DRIPCNMXVSPFBC-UHFFFAOYSA-N 3-ethenyl-1,2-thiazole Chemical compound C=CC=1C=CSN=1 DRIPCNMXVSPFBC-UHFFFAOYSA-N 0.000 description 1
- 125000005917 3-methylpentyl group Chemical group 0.000 description 1
- ATVJXMYDOSMEPO-UHFFFAOYSA-N 3-prop-2-enoxyprop-1-ene Chemical compound C=CCOCC=C ATVJXMYDOSMEPO-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- QGLAYJCJLHNIGJ-UHFFFAOYSA-N 4-bromo-2,6-dimethylaniline Chemical compound CC1=CC(Br)=CC(C)=C1N QGLAYJCJLHNIGJ-UHFFFAOYSA-N 0.000 description 1
- CDHFJMAKBNRMFE-UHFFFAOYSA-N 5-ethenyl-1,3-oxazole Chemical compound C=CC1=CN=CO1 CDHFJMAKBNRMFE-UHFFFAOYSA-N 0.000 description 1
- SZMYFESRCUFULU-UHFFFAOYSA-N 5-ethenyl-1,3-thiazole Chemical compound C=CC1=CN=CS1 SZMYFESRCUFULU-UHFFFAOYSA-N 0.000 description 1
- MHQZDNQHLGFBRN-UHFFFAOYSA-N 5-ethenyl-1h-imidazole Chemical compound C=CC1=CNC=N1 MHQZDNQHLGFBRN-UHFFFAOYSA-N 0.000 description 1
- YKCNBNDWSATCJL-UHFFFAOYSA-N 7-oxabicyclo[2.2.1]hepta-2,5-diene Chemical compound C1=CC2C=CC1O2 YKCNBNDWSATCJL-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 230000035495 ADMET Effects 0.000 description 1
- ORILYTVJVMAKLC-UHFFFAOYSA-N Adamantane Natural products C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 1
- 229910015900 BF3 Inorganic materials 0.000 description 1
- IUJPNYGCCVWRGL-UHFFFAOYSA-N C(=C)=[Ru].ClC1(CCC(CC1)PC1CCCCC1)Cl Chemical group C(=C)=[Ru].ClC1(CCC(CC1)PC1CCCCC1)Cl IUJPNYGCCVWRGL-UHFFFAOYSA-N 0.000 description 1
- PBEYBPHEGHUSAX-UHFFFAOYSA-L C1CCC(CC1)P(C=C=[Ru](Cl)Cl)C2CCCCC2 Chemical group C1CCC(CC1)P(C=C=[Ru](Cl)Cl)C2CCCCC2 PBEYBPHEGHUSAX-UHFFFAOYSA-L 0.000 description 1
- ZPNQIJNBECXHDX-UHFFFAOYSA-N C=C=[Ru] Chemical group C=C=[Ru] ZPNQIJNBECXHDX-UHFFFAOYSA-N 0.000 description 1
- 0 CCC1C(C(C)O2)OC2=C*1 Chemical compound CCC1C(C(C)O2)OC2=C*1 0.000 description 1
- CXJSBFUGEDXLPB-SNUJAXHWSA-N CCCCCC\C=C\C=C\C=C\O Chemical compound CCCCCC\C=C\C=C\C=C\O CXJSBFUGEDXLPB-SNUJAXHWSA-N 0.000 description 1
- 229910021581 Cobalt(III) chloride Inorganic materials 0.000 description 1
- 229920001651 Cyanoacrylate Polymers 0.000 description 1
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 1
- LYUUVYQGUMRKOV-UHFFFAOYSA-N Diethyl diallylmalonate Chemical compound CCOC(=O)C(CC=C)(CC=C)C(=O)OCC LYUUVYQGUMRKOV-UHFFFAOYSA-N 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- MWCLLHOVUTZFKS-UHFFFAOYSA-N Methyl cyanoacrylate Chemical compound COC(=O)C(=C)C#N MWCLLHOVUTZFKS-UHFFFAOYSA-N 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- 101000860173 Myxococcus xanthus C-factor Proteins 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- XOJVVFBFDXDTEG-UHFFFAOYSA-N Norphytane Natural products CC(C)CCCC(C)CCCC(C)CCCC(C)C XOJVVFBFDXDTEG-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- GMPDOIGGGXSAPL-UHFFFAOYSA-N Phenyl vinyl sulfide Natural products C=CSC1=CC=CC=C1 GMPDOIGGGXSAPL-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-L Phosphate ion(2-) Chemical compound OP([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-L 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000005062 Polybutadiene Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 229910021604 Rhodium(III) chloride Inorganic materials 0.000 description 1
- 229910008051 Si-OH Inorganic materials 0.000 description 1
- 229910004283 SiO 4 Inorganic materials 0.000 description 1
- 229910021607 Silver chloride Inorganic materials 0.000 description 1
- 229910006358 Si—OH Inorganic materials 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- 239000002174 Styrene-butadiene Substances 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical group [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 229910021551 Vanadium(III) chloride Inorganic materials 0.000 description 1
- 241000607479 Yersinia pestis Species 0.000 description 1
- QCWXUUIWCKQGHC-UHFFFAOYSA-N Zirconium Chemical compound [Zr] QCWXUUIWCKQGHC-UHFFFAOYSA-N 0.000 description 1
- VZUAUHWZIKOMFC-ARJAWSKDSA-N [(z)-4-acetyloxybut-2-enyl] acetate Chemical compound CC(=O)OC\C=C/COC(C)=O VZUAUHWZIKOMFC-ARJAWSKDSA-N 0.000 description 1
- SBBIQGKTWQQQQB-UHFFFAOYSA-N [SbH2]N Chemical compound [SbH2]N SBBIQGKTWQQQQB-UHFFFAOYSA-N 0.000 description 1
- 238000010669 acid-base reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 229920006397 acrylic thermoplastic Polymers 0.000 description 1
- 238000010535 acyclic diene metathesis reaction Methods 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 239000002318 adhesion promoter Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000002159 adsorption--desorption isotherm Methods 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 150000004705 aldimines Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000005250 alkyl acrylate group Chemical group 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 150000001361 allenes Chemical class 0.000 description 1
- 125000000746 allylic group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 229910000323 aluminium silicate Inorganic materials 0.000 description 1
- 150000001414 amino alcohols Chemical class 0.000 description 1
- IVYZFLBDJCMVRZ-UHFFFAOYSA-N aminoarsenic Chemical compound [As]N IVYZFLBDJCMVRZ-UHFFFAOYSA-N 0.000 description 1
- XQJHRCVXRAJIDY-UHFFFAOYSA-N aminophosphine Chemical compound PN XQJHRCVXRAJIDY-UHFFFAOYSA-N 0.000 description 1
- 238000004873 anchoring Methods 0.000 description 1
- 238000010539 anionic addition polymerization reaction Methods 0.000 description 1
- 239000003945 anionic surfactant Substances 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000002216 antistatic agent Substances 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- RBFQJDQYXXHULB-UHFFFAOYSA-N arsane Chemical compound [AsH3] RBFQJDQYXXHULB-UHFFFAOYSA-N 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 125000005135 aryl sulfinyl group Chemical group 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 230000037429 base substitution Effects 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 125000000649 benzylidene group Chemical group [H]C(=[*])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- UORVGPXVDQYIDP-BJUDXGSMSA-N borane Chemical class [10BH3] UORVGPXVDQYIDP-BJUDXGSMSA-N 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- LLCSWKVOHICRDD-UHFFFAOYSA-N buta-1,3-diyne Chemical compound C#CC#C LLCSWKVOHICRDD-UHFFFAOYSA-N 0.000 description 1
- MTAZNLWOLGHBHU-UHFFFAOYSA-N butadiene-styrene rubber Chemical compound C=CC=C.C=CC1=CC=CC=C1 MTAZNLWOLGHBHU-UHFFFAOYSA-N 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 125000003739 carbamimidoyl group Chemical group C(N)(=N)* 0.000 description 1
- 125000004623 carbolinyl group Chemical group 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 125000005626 carbonium group Chemical group 0.000 description 1
- 238000003763 carbonization Methods 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 238000010538 cationic polymerization reaction Methods 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 238000012668 chain scission Methods 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- WBLIXGSTEMXDSM-UHFFFAOYSA-N chloromethane Chemical compound Cl[CH2] WBLIXGSTEMXDSM-UHFFFAOYSA-N 0.000 description 1
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000002676 chrysenyl group Chemical group C1(=CC=CC=2C3=CC=C4C=CC=CC4=C3C=CC12)* 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 239000004927 clay Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000010924 continuous production Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 238000006880 cross-coupling reaction Methods 0.000 description 1
- 229920005565 cyclic polymer Polymers 0.000 description 1
- CFBGXYDUODCMNS-UHFFFAOYSA-N cyclobutene Chemical compound C1CC=C1 CFBGXYDUODCMNS-UHFFFAOYSA-N 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- HYPABJGVBDSCIT-UPHRSURJSA-N cyclododecene Chemical compound C1CCCCC\C=C/CCCC1 HYPABJGVBDSCIT-UPHRSURJSA-N 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- WJTCGQSWYFHTAC-UHFFFAOYSA-N cyclooctane Chemical compound C1CCCCCCC1 WJTCGQSWYFHTAC-UHFFFAOYSA-N 0.000 description 1
- 239000004914 cyclooctane Substances 0.000 description 1
- URYYVOIYTNXXBN-UPHRSURJSA-N cyclooctene Chemical compound C1CCC\C=C/CC1 URYYVOIYTNXXBN-UPHRSURJSA-N 0.000 description 1
- 239000004913 cyclooctene Substances 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- BOXSCYUXSBYGRD-UHFFFAOYSA-N cyclopenta-1,3-diene;iron(3+) Chemical compound [Fe+3].C=1C=C[CH-]C=1.C=1C=C[CH-]C=1 BOXSCYUXSBYGRD-UHFFFAOYSA-N 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000007872 degassing Methods 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- AQEFLFZSWDEAIP-UHFFFAOYSA-N di-tert-butyl ether Chemical compound CC(C)(C)OC(C)(C)C AQEFLFZSWDEAIP-UHFFFAOYSA-N 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 229940117389 dichlorobenzene Drugs 0.000 description 1
- HDULBKVLSJEMGN-UHFFFAOYSA-N dicyclohexylphosphane Chemical compound C1CCCCC1PC1CCCCC1 HDULBKVLSJEMGN-UHFFFAOYSA-N 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- POLCUAVZOMRGSN-UHFFFAOYSA-N dipropyl ether Chemical compound CCCOCCC POLCUAVZOMRGSN-UHFFFAOYSA-N 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- XJWSAJYUBXQQDR-UHFFFAOYSA-M dodecyltrimethylammonium bromide Chemical group [Br-].CCCCCCCCCCCC[N+](C)(C)C XJWSAJYUBXQQDR-UHFFFAOYSA-M 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000002003 electron diffraction Methods 0.000 description 1
- 238000007720 emulsion polymerization reaction Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 description 1
- IOLQWGVDEFWYNP-UHFFFAOYSA-N ethyl 2-bromo-2-methylpropanoate Chemical compound CCOC(=O)C(C)(C)Br IOLQWGVDEFWYNP-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000000219 ethylidene group Chemical group [H]C(=[*])C([H])([H])[H] 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 125000003914 fluoranthenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC=C4C1=C23)* 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 125000003055 glycidyl group Chemical group C(C1CO1)* 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 229910052735 hafnium Inorganic materials 0.000 description 1
- VBJZVLUMGGDVMO-UHFFFAOYSA-N hafnium atom Chemical compound [Hf] VBJZVLUMGGDVMO-UHFFFAOYSA-N 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 125000004970 halomethyl group Chemical group 0.000 description 1
- GEAWFZNTIFJMHR-UHFFFAOYSA-N hepta-1,6-diene Chemical class C=CCCCC=C GEAWFZNTIFJMHR-UHFFFAOYSA-N 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005553 heteroaryloxy group Chemical group 0.000 description 1
- 229920006158 high molecular weight polymer Polymers 0.000 description 1
- 150000004678 hydrides Chemical class 0.000 description 1
- COQRGFWWJBEXRC-UHFFFAOYSA-N hydron;methyl 2-aminoacetate;chloride Chemical compound Cl.COC(=O)CN COQRGFWWJBEXRC-UHFFFAOYSA-N 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 238000001746 injection moulding Methods 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 239000011229 interlayer Substances 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- 125000000654 isopropylidene group Chemical group C(C)(C)=* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 150000002690 malonic acid derivatives Chemical class 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000013011 mating Effects 0.000 description 1
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000013335 mesoporous material Substances 0.000 description 1
- 150000002734 metacrylic acid derivatives Chemical class 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-M methacrylate group Chemical group C(C(=C)C)(=O)[O-] CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- ACEONLNNWKIPTM-UHFFFAOYSA-N methyl 2-bromopropanoate Chemical compound COC(=O)C(C)Br ACEONLNNWKIPTM-UHFFFAOYSA-N 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 239000012778 molding material Substances 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 229920006030 multiblock copolymer Polymers 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- DYUWTXWIYMHBQS-UHFFFAOYSA-N n-prop-2-enylprop-2-en-1-amine Chemical compound C=CCNCC=C DYUWTXWIYMHBQS-UHFFFAOYSA-N 0.000 description 1
- 125000004626 naphthothienyl group Chemical group C1(=CSC2=C1C1=CC=CC=C1C=C2)* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 238000002429 nitrogen sorption measurement Methods 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- SJYNFBVQFBRSIB-UHFFFAOYSA-N norbornadiene Chemical compound C1=CC2C=CC1C2 SJYNFBVQFBRSIB-UHFFFAOYSA-N 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 229940078552 o-xylene Drugs 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005447 octyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 238000011017 operating method Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 125000005375 organosiloxane group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-O oxonium Chemical compound [OH3+] XLYOFNOQVPJJNP-UHFFFAOYSA-O 0.000 description 1
- QNGNSVIICDLXHT-UHFFFAOYSA-N para-ethylbenzaldehyde Natural products CCC1=CC=C(C=O)C=C1 QNGNSVIICDLXHT-UHFFFAOYSA-N 0.000 description 1
- UCUUFSAXZMGPGH-UHFFFAOYSA-N penta-1,4-dien-3-one Chemical compound C=CC(=O)C=C UCUUFSAXZMGPGH-UHFFFAOYSA-N 0.000 description 1
- RGSFGYAAUTVSQA-UHFFFAOYSA-N pentamethylene Natural products C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 1
- 125000005327 perimidinyl group Chemical group N1C(=NC2=CC=CC3=CC=CC1=C23)* 0.000 description 1
- 238000005504 petroleum refining Methods 0.000 description 1
- 125000004625 phenanthrolinyl group Chemical group N1=C(C=CC2=CC=C3C=CC=NC3=C12)* 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 125000005954 phenoxathiinyl group Chemical group 0.000 description 1
- QMVQPDHYQQDAJA-UHFFFAOYSA-N phosphane;ruthenium Chemical compound P.P.[Ru] QMVQPDHYQQDAJA-UHFFFAOYSA-N 0.000 description 1
- FVZVCSNXTFCBQU-UHFFFAOYSA-N phosphanyl Chemical group [PH2] FVZVCSNXTFCBQU-UHFFFAOYSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- XYFCBTPGUUZFHI-UHFFFAOYSA-O phosphonium Chemical compound [PH4+] XYFCBTPGUUZFHI-UHFFFAOYSA-O 0.000 description 1
- DHRLEVQXOMLTIM-UHFFFAOYSA-N phosphoric acid;trioxomolybdenum Chemical compound O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.O=[Mo](=O)=O.OP(O)(O)=O DHRLEVQXOMLTIM-UHFFFAOYSA-N 0.000 description 1
- 238000000722 phosphorus-31 cross-polarisation magic angle spinning nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000005498 phthalate group Chemical class 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 125000001388 picenyl group Chemical group C1(=CC=CC2=CC=C3C4=CC=C5C=CC=CC5=C4C=CC3=C21)* 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920000636 poly(norbornene) polymer Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920002857 polybutadiene Polymers 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920002959 polymer blend Polymers 0.000 description 1
- 230000037048 polymerization activity Effects 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 238000011417 postcuring Methods 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 125000001844 prenyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003139 primary aliphatic amines Chemical class 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- HJWLCRVIBGQPNF-UHFFFAOYSA-N prop-2-enylbenzene Chemical compound C=CCC1=CC=CC=C1 HJWLCRVIBGQPNF-UHFFFAOYSA-N 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 238000005086 pumping Methods 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 150000003233 pyrroles Chemical class 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 229920005604 random copolymer Polymers 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 239000012783 reinforcing fiber Substances 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000007151 ring opening polymerisation reaction Methods 0.000 description 1
- 150000003303 ruthenium Chemical class 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 125000005372 silanol group Chemical group 0.000 description 1
- HKZLPVFGJNLROG-UHFFFAOYSA-M silver monochloride Chemical compound [Cl-].[Ag+] HKZLPVFGJNLROG-UHFFFAOYSA-M 0.000 description 1
- JUDUFOKGIZUSFP-UHFFFAOYSA-M silver;4-methylbenzenesulfonate Chemical compound [Ag+].CC1=CC=C(S([O-])(=O)=O)C=C1 JUDUFOKGIZUSFP-UHFFFAOYSA-M 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000006104 solid solution Substances 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- 239000011115 styrene butadiene Substances 0.000 description 1
- 229920003048 styrene butadiene rubber Polymers 0.000 description 1
- 125000003011 styrenyl group Chemical group [H]\C(*)=C(/[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 230000003075 superhydrophobic effect Effects 0.000 description 1
- 238000010557 suspension polymerization reaction Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- PQEXLIRUMIRSAL-UHFFFAOYSA-N tert-butyl 4-(2-ethoxy-2-oxoethyl)piperidine-1-carboxylate Chemical compound CCOC(=O)CC1CCN(C(=O)OC(C)(C)C)CC1 PQEXLIRUMIRSAL-UHFFFAOYSA-N 0.000 description 1
- 229910052716 thallium Inorganic materials 0.000 description 1
- BKVIYDNLLOSFOA-UHFFFAOYSA-N thallium Chemical compound [Tl] BKVIYDNLLOSFOA-UHFFFAOYSA-N 0.000 description 1
- 238000007725 thermal activation Methods 0.000 description 1
- 230000000930 thermomechanical effect Effects 0.000 description 1
- 229920001187 thermosetting polymer Polymers 0.000 description 1
- 239000004634 thermosetting polymer Substances 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- XJDNKRIXUMDJCW-UHFFFAOYSA-J titanium tetrachloride Chemical compound Cl[Ti](Cl)(Cl)Cl XJDNKRIXUMDJCW-UHFFFAOYSA-J 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-M toluene-4-sulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-M 0.000 description 1
- 238000004627 transmission electron microscopy Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- IEKWPPTXWFKANS-UHFFFAOYSA-K trichlorocobalt Chemical compound Cl[Co](Cl)Cl IEKWPPTXWFKANS-UHFFFAOYSA-K 0.000 description 1
- DHWBYAACHDUFAT-UHFFFAOYSA-N tricyclopentylphosphane Chemical compound C1CCCC1P(C1CCCC1)C1CCCC1 DHWBYAACHDUFAT-UHFFFAOYSA-N 0.000 description 1
- QQQSFSZALRVCSZ-UHFFFAOYSA-N triethoxysilane Chemical compound CCO[SiH](OCC)OCC QQQSFSZALRVCSZ-UHFFFAOYSA-N 0.000 description 1
- VOITXYVAKOUIBA-UHFFFAOYSA-N triethylaluminium Chemical compound CC[Al](CC)CC VOITXYVAKOUIBA-UHFFFAOYSA-N 0.000 description 1
- 125000004205 trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- ORYGRKHDLWYTKX-UHFFFAOYSA-N trihexylalumane Chemical compound CCCCCC[Al](CCCCCC)CCCCCC ORYGRKHDLWYTKX-UHFFFAOYSA-N 0.000 description 1
- IGNTWNVBGLNYDV-UHFFFAOYSA-N triisopropylphosphine Chemical compound CC(C)P(C(C)C)C(C)C IGNTWNVBGLNYDV-UHFFFAOYSA-N 0.000 description 1
- FTVLMFQEYACZNP-UHFFFAOYSA-N trimethylsilyl trifluoromethanesulfonate Chemical compound C[Si](C)(C)OS(=O)(=O)C(F)(F)F FTVLMFQEYACZNP-UHFFFAOYSA-N 0.000 description 1
- LFXVBWRMVZPLFK-UHFFFAOYSA-N trioctylalumane Chemical compound CCCCCCCC[Al](CCCCCCCC)CCCCCCCC LFXVBWRMVZPLFK-UHFFFAOYSA-N 0.000 description 1
- JOJQVUCWSDRWJE-UHFFFAOYSA-N tripentylalumane Chemical compound CCCCC[Al](CCCCC)CCCCC JOJQVUCWSDRWJE-UHFFFAOYSA-N 0.000 description 1
- CNWZYDSEVLFSMS-UHFFFAOYSA-N tripropylalumane Chemical compound CCC[Al](CCC)CCC CNWZYDSEVLFSMS-UHFFFAOYSA-N 0.000 description 1
- USJZIJNMRRNDPO-UHFFFAOYSA-N tris-decylalumane Chemical compound CCCCCCCCCC[Al](CCCCCCCCCC)CCCCCCCCCC USJZIJNMRRNDPO-UHFFFAOYSA-N 0.000 description 1
- 229930195735 unsaturated hydrocarbon Natural products 0.000 description 1
- 238000005292 vacuum distillation Methods 0.000 description 1
- 238000003828 vacuum filtration Methods 0.000 description 1
- LSGOVYNHVSXFFJ-UHFFFAOYSA-N vanadate(3-) Chemical compound [O-][V]([O-])([O-])=O LSGOVYNHVSXFFJ-UHFFFAOYSA-N 0.000 description 1
- HQYCOEXWFMFWLR-UHFFFAOYSA-K vanadium(iii) chloride Chemical compound [Cl-].[Cl-].[Cl-].[V+3] HQYCOEXWFMFWLR-UHFFFAOYSA-K 0.000 description 1
- 239000011800 void material Substances 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 238000004876 x-ray fluorescence Methods 0.000 description 1
- 238000009681 x-ray fluorescence measurement Methods 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- 229910052726 zirconium Inorganic materials 0.000 description 1
- DUNKXUFBGCUVQW-UHFFFAOYSA-J zirconium tetrachloride Chemical compound Cl[Zr](Cl)(Cl)Cl DUNKXUFBGCUVQW-UHFFFAOYSA-J 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/0046—Ruthenium compounds
- C07F15/0053—Ruthenium compounds without a metal-carbon linkage
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/1616—Coordination complexes, e.g. organometallic complexes, immobilised on an inorganic support, e.g. ship-in-a-bottle type catalysts
- B01J31/1625—Coordination complexes, e.g. organometallic complexes, immobilised on an inorganic support, e.g. ship-in-a-bottle type catalysts immobilised by covalent linkages, i.e. pendant complexes with optional linking groups
- B01J31/1633—Coordination complexes, e.g. organometallic complexes, immobilised on an inorganic support, e.g. ship-in-a-bottle type catalysts immobilised by covalent linkages, i.e. pendant complexes with optional linking groups covalent linkages via silicon containing groups
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/22—Organic complexes
- B01J31/2204—Organic complexes the ligands containing oxygen or sulfur as complexing atoms
- B01J31/2208—Oxygen, e.g. acetylacetonates
- B01J31/2226—Anionic ligands, i.e. the overall ligand carries at least one formal negative charge
- B01J31/2243—At least one oxygen and one nitrogen atom present as complexing atoms in an at least bidentate or bridging ligand
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/22—Organic complexes
- B01J31/2265—Carbenes or carbynes, i.e.(image)
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/24—Phosphines, i.e. phosphorus bonded to only carbon atoms, or to both carbon and hydrogen atoms, including e.g. sp2-hybridised phosphorus compounds such as phosphabenzene, phosphole or anionic phospholide ligands
- B01J31/2404—Cyclic ligands, including e.g. non-condensed polycyclic ligands, the phosphine-P atom being a ring member or a substituent on the ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F1/00—Compounds containing elements of Groups 1 or 11 of the Periodic Table
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F1/00—Compounds containing elements of Groups 1 or 11 of the Periodic Table
- C07F1/08—Copper compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F11/00—Compounds containing elements of Groups 6 or 16 of the Periodic Table
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F13/00—Compounds containing elements of Groups 7 or 17 of the Periodic Table
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/002—Osmium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/0046—Ruthenium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/0006—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table compounds of the platinum group
- C07F15/0073—Rhodium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/02—Iron compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/04—Nickel compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F15/00—Compounds containing elements of Groups 8, 9, 10 or 18 of the Periodic Table
- C07F15/06—Cobalt compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F7/00—Compounds containing elements of Groups 4 or 14 of the Periodic Table
- C07F7/28—Titanium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F12/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and at least one being terminated by an aromatic carbocyclic ring
- C08F12/02—Monomers containing only one unsaturated aliphatic radical
- C08F12/04—Monomers containing only one unsaturated aliphatic radical containing one ring
- C08F12/06—Hydrocarbons
- C08F12/08—Styrene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F4/00—Polymerisation catalysts
- C08F4/42—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors
- C08F4/44—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides
- C08F4/60—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides together with refractory metals, iron group metals, platinum group metals, manganese, rhenium technetium or compounds thereof
- C08F4/70—Iron group metals, platinum group metals or compounds thereof
- C08F4/7001—Iron group metals, platinum group metals or compounds thereof the metallic compound containing a multidentate ligand, i.e. a ligand capable of donating two or more pairs of electrons to form a coordinate or ionic bond
- C08F4/7003—Bidentate ligand
- C08F4/7019—Monoanionic ligand
- C08F4/7022—NO
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/02—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes
- C08G61/04—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes only aliphatic carbon atoms
- C08G61/06—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes only aliphatic carbon atoms prepared by ring-opening of carbocyclic compounds
- C08G61/08—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes only aliphatic carbon atoms prepared by ring-opening of carbocyclic compounds of carbocyclic compounds containing one or more carbon-to-carbon double bonds in the ring
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/10—Polymerisation reactions involving at least dual use catalysts, e.g. for both oligomerisation and polymerisation
- B01J2231/12—Olefin polymerisation or copolymerisation
- B01J2231/125—Radical (co)polymerisation, e.g. mediators therefor
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/50—Redistribution or isomerisation reactions of C-C, C=C or C-C triple bonds
- B01J2231/54—Metathesis reactions, e.g. olefin metathesis
- B01J2231/543—Metathesis reactions, e.g. olefin metathesis alkene metathesis
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/02—Compositional aspects of complexes used, e.g. polynuclearity
- B01J2531/0286—Complexes comprising ligands or other components characterized by their function
- B01J2531/0288—Sterically demanding or shielding ligands
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/80—Complexes comprising metals of Group VIII as the central metal
- B01J2531/82—Metals of the platinum group
- B01J2531/821—Ruthenium
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/11—Compounds covalently bound to a solid support
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F220/00—Copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride ester, amide, imide or nitrile thereof
- C08F220/02—Monocarboxylic acids having less than ten carbon atoms; Derivatives thereof
- C08F220/10—Esters
- C08F220/12—Esters of monohydric alcohols or phenols
- C08F220/16—Esters of monohydric alcohols or phenols of phenols or of alcohols containing two or more carbon atoms
- C08F220/18—Esters of monohydric alcohols or phenols of phenols or of alcohols containing two or more carbon atoms with acrylic or methacrylic acids
- C08F220/1804—C4-(meth)acrylate, e.g. butyl (meth)acrylate, isobutyl (meth)acrylate or tert-butyl (meth)acrylate
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2438/00—Living radical polymerisation
- C08F2438/01—Atom Transfer Radical Polymerization [ATRP] or reverse ATRP
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/30—Monomer units or repeat units incorporating structural elements in the main chain
- C08G2261/33—Monomer units or repeat units incorporating structural elements in the main chain incorporating non-aromatic structural elements in the main chain
- C08G2261/332—Monomer units or repeat units incorporating structural elements in the main chain incorporating non-aromatic structural elements in the main chain containing only carbon atoms
- C08G2261/3322—Monomer units or repeat units incorporating structural elements in the main chain incorporating non-aromatic structural elements in the main chain containing only carbon atoms derived from cyclooctene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/30—Monomer units or repeat units incorporating structural elements in the main chain
- C08G2261/33—Monomer units or repeat units incorporating structural elements in the main chain incorporating non-aromatic structural elements in the main chain
- C08G2261/332—Monomer units or repeat units incorporating structural elements in the main chain incorporating non-aromatic structural elements in the main chain containing only carbon atoms
- C08G2261/3324—Monomer units or repeat units incorporating structural elements in the main chain incorporating non-aromatic structural elements in the main chain containing only carbon atoms derived from norbornene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/40—Polymerisation processes
- C08G2261/41—Organometallic coupling reactions
- C08G2261/418—Ring opening metathesis polymerisation [ROMP]
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G2261/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G2261/40—Polymerisation processes
- C08G2261/41—Organometallic coupling reactions
- C08G2261/419—Acyclic diene metathesis [ADMET]
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Inorganic Chemistry (AREA)
- Polymers & Plastics (AREA)
- Medicinal Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Catalysts (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Polyoxymethylene Polymers And Polymers With Carbon-To-Carbon Bonds (AREA)
- Polymerization Catalysts (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Heterocyclic Compounds That Contain Two Or More Ring Oxygen Atoms (AREA)
- Pyrrole Compounds (AREA)
Abstract
Description
ジカル重合を組み合わせることは、極めて好都合なことであり、(1)原子または基の転移経路、および(2)ラジカル中間体の関与する米国特許第5,763,548号の原子(または基)転移ラジカル重合法(以後ATRPと称する)により達成されている。この種のリビング重合では転移および停止等の鎖切断反応が実質的に存在せず、分子量、分子量分布および末端官能基等の大分子構造の種々のパラメーターの制御が可能である。これはまた種々の共重合体、例えばブロックおよび星型共重合体の調製も可能とする。リビング/制御ラジカル重合は種々の不活性の種との平衡状態においてラジカルの低い定常状態濃度を要する。これは種々の遷移金属家具物と重合開始剤、例えばアルキルハライドまたはハロアルキルエステルとの間の酸化還元反応において成長中のラジカルの可逆的形成に基づいた新しい重合開始系を使用することができる。ATRPは不活性種中の炭素とハロゲンの共有結合の可逆的な遷移金属触媒性の切断を介して樹立された、増幅中のラジカルと不活性種との間の動的な平衡に基づいている。この概念を利用した重合系は、必要な平衡を樹立するために、例えば銅、ルテニウム、ニッケル、パラジウム、ロジウムおよび鉄の鎖体を用いて開発されている。
産性を改善するために、触媒量当たりのポリオレフィンの収量の増大および連続製造の期間に渡る触媒活性の維持も重要な要件である。WO02/02649号は(A)イミン構造部分を含む2座配位子を有する好ましくは遷移金属がチタン、ジルコニウムまたハフニウムである遷移金属化合物、(B−1)化合物(A)と反応して該イミン構造部分を金属アミン構造に変換できる還元能を有する化合物、および、(B−2)化合物(A)と反応してイオン対を形成する化合物を含むオレフィン重合触媒系を開示している。しかしながら、WO02/02649号は金属がカルベン配位子に対して配位している遷移金属化合物を記載していない。WO02/02649号の記載について、オレフィン重合活性とその維持を改善する必要性がなお当該分野に存在する。
本明細書においては鎖体または配位化合物という用語は、金属(アクセプター)と、それぞれが非金属の原子またはイオンを含む、配位子と呼ばれる数種の中性分子またはイオン化合物(ドナー)との間のドナー−アクセプター機序またはルイス酸−塩基反応の結果
物を指す。孤立電子対を有する原子1個以上を有する配位子を多座配位子と呼ぶ。
その最も広範な解釈において、本発明は、カルベン配位子、多座配位子および他の配位子1個以上を含み、該他の配位子の少なくとも1個がpKaが少なくとも15である制限立体障害配位子である5配位金属鎖体、その塩、その溶媒和物またはそのエナンチオマー
に関する。この5配位金属鎖体は1金属鎖体でまたは2金属鎖体であって、中性の配位子1個以上およびアニオン性の配位子1個以上に対して一方の金属が5配位であり、もう一方が4配位であるものであってよい。後者の場合には金属2個は同じかまたは異なっていてよい。多座配位子は2座配位子であってよく、その場合は本発明の金属鎖体は他の配位子2個を含み、または3座配位子であってよく、その場合は金属鎖体は他の配位子1個を含む。
本発明の5配位金属鎖体のカルベン配位子はアレニリデン配位子、クムレニリデン配位子、例えばブタン−1,2,3−トリエニリデン、ペンタ−1,2,3,4−テトラニリデン等である。
− (i)多座配位子、および、pKaが少なくとも15である制限立体障害配位子以外であり、カルベン配位子以外である他の配位子1個以上を含む4配位金属鎖体を、(ii)アルキニル化合物、ジアゾ化合物およびジアルキニル化合物からなる群より選択される反応体、ただし該反応体は金属に対するカルベン配位子を与えることができるもの、と反応させることにより5配位1金属鎖体を製造する第1の工程、および、次に、
− 第1の工程で得られた5配位1金属鎖体を、pKaが少なくとも15である制限立体障害基を含む種と、pKaが少なくとも15である該制限立体障害基を含む種がカルベン配位子以外の他の配位子の1個の変わりに金属に対して配位できるような条件下で、反応させる第2の工程、
を包含する。
− Mは周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される遷移金属、好ましくはルテニウム、オスミウム、鉄、モリブデン、タングステン、チタン、レニウム、銅、クロム、マンガン、ロジウム、バナジウム、亜鉛、金、銀、ニッケルおよびコバルトから選択される金属であり;
− Zは酸素、イオウ、セレン、NR’’’’、PR’’’’、AsR’’’’およびSbR’’’’からなる群より選択され;
− R’’、R’’’およびR’’’’は各々、水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルキル−C1-6アルコキシシリル、C1-6アルキル−アリールオキシシリル、C1-6アルキル−C3-10シクロアルコキシシリル、アリールおよびヘテロアリールか
らなる群より選択されるか、または、R’’およびR’’’は一緒になってアリールまたはヘテロアリール基を形成し、該基各々(水素でない場合)は、場合により、ハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、C1-6アルキル−C1-6アルコキシシリル、C1-6アルキル−アリールオキシシリル、C1-6アルキル−C3-10シクロアルキルシリル、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R51個以上、好ましくは1〜3個で置換されており;
− R’は一般式(IA)を有する化合物中に含まれる場合はR’’、R’’’およびR’’’’と同様に定義され、または、一般式(IB)を有する化合物中に含まれる場合はC1-6アルキレンおよびC3-8シクロアルキレンからなる群より選択され、該アルキレンまたはシクロアルキレン基は場合により置換基R51個以上で置換されており;
− R1はpKaが少なくとも15である制限立体障害基であり;
− R2はアニオン性配位子であり;
− R3はおよびR4は各々、水素またはC1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、アリール、アリールオキシ、C1-20アルコキシカルボニル、C1-8アルキルチオ、C1-20アルキルスルホニル、C1-20アルキルスルフィニルC1-20アルキルスルホネート、アリールスルホネート、C1-20アルキルホスホネート、アリールホスホネート、C1-20アルキルアンモニウムおよびアリールアンモニウムからなる群より選択される基であり;
− R’およびR3およびR4の一方は相互に結合して2座の配位子を形成し;
−R’’’およびR’’’’は相互に結合して窒素、リン、砒素およびアンチモンからなる群より選択されるヘテロ原子を含む脂肪族の環系を形成し;
− R3およびR4は一緒になって縮合芳香族環系を形成し、そして、
− yはMとR3およびR4を担持した炭素原子との間のsp2炭素原子の数を示し、そして0〜3の整数であるもの、その塩、溶媒和物およびエナンチオマーを提供する。
− イミダゾール−2−イリデン(pKa=24)、
− ジヒドロイミダゾール−2−イリデン(pKaは24より高値)、
− オキサゾール−2−イリデン、
− チアゾール−5−イリデン、
− チアゾール−2−イリデン、
− ピロリリデン(pKa=17.5)、
− ピラゾリリデン、
− ジヒドロピロリリデン、
− ピロリリジニリデン(pKa=44)、
− ビス(イミダゾリン−2−イリデン)およびビス(イミダゾリジン−2−イリデン)、
− インドリリデン等のベンゾ縮合誘導体(pKa=16)、および、
− 非イオン性プロホスファトランスーパー塩基、例えば米国特許第5,698,737号に記載のもの、好ましくは、Verkadeスーパー塩基として知られているトリメチリトリアザプロホスファトランP(CH3NCH2CH2)3N。
ば2,4,6−トリメチルフェニル(メシル)、2,6−ジメチルフェニル、2,4,6−トリイソプロピルフェニルまたは2,6−ジイソプロピルフェニル)またはC1-6アルキル置換基1個以上を有するヘテロアリール基(例えばピリジニル)である。
− 式R3R4R7CO≡CHを有するアルキニル化合物、ただしR3およびR4は一般式(IA)および(IB)について上記した通り定義され、そしてR7は水素、ヒドロキシルおよびR3からなる群より選択されるもの(y=2の場合)、
− 式N2CR3R4を有するジアゾ化合物、ただしただしR3およびR4は前述の通り定義されるもの(yが0である場合)、
− 式R3C≡CHを有するアルキニル化合物、ただしR3は前述の通り定義されるもの(yが1の場合)、および、
− 式R21C≡C−C≡CR22を有するジアルキニル化合物、ただしR21およびR22は各々独立して水素およびトリアルキルシリルから選択されるもの(yが3の場合)、
からなる群より選択される反応体と反応させること、を含む方法を提供する。
− 式R3R4R7CO≡CHを有するアルキニル化合物、ただしR3およびR4は式(IA)および(IB)に関して上記した通り定義され、そしてR7は水素、ヒドロキシルおよびR3からなる群より選択されるもの(y=2の場合)、
− 式N2CR3R4を有するジアゾ化合物、ただしただしR3およびR4は上記した通り定義されるもの(yが0である場合)、
− 式R3C≡CHを有するアルキニル化合物、ただしR3は上記した通り定義されるもの(yが1の場合)、および、
− 式R21C≡C−C≡CR22を有するジアルキニル化合物、ただしR21およびR22は各々独立して水素およびトリアルキルシリルから選択されるもの(yが3の場合)、
からなる群より選択される反応体と反応させること、
および、第2の工程において更に、第1の工程の反応生成物を、式R1Yを有する化合物、ただし式中R1は上記した通り定義され、Yは脱離基であるものと反応させること、を包含する上記方法を提供する。この第2の方法において、脱離基Yの適当な例は第1の方法について開示したとおりである。
− Mは周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される遷移金属、好ましくはルテニウム、オスミウム、鉄、モリブデン、タングステン、チタン、レニウム、銅、クロム、マンガン、ロジウム、バナジウム、亜鉛、金、銀、コバルトおよびニッケルから選択される金属であり;
− Zは酸素、イオウ、セレン、NR’’’’、PR’’’’、AsR’’’’およびSbR’’’’からなる群より選択され;
− R’’、R’’’およびR’’’’は各々、水素、C1-6アルキル、C3-8シクロアルキル、アリールおよびヘテロアリールからなる群より選択されるか、または、R’’およびR’’’は一緒になってアリールまたはヘテロアリール基を形成し、該基各々は場合により、ハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネー
ト、アリールスルホネート、アルキルホスホネート、アリールホスホネート、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R51個以上、好ましくは1〜3個で置換されており;
− R’は一般式(IIIA)を有する化合物中に含まれる場合はR’’、R’’’およびR’’’’と同様に定義され、または、一般式(IIIB)を有する化合物中に含まれる場合はC1-6アルキレンおよびC3-8シクロアルキレンからなる群より選択され、該アルキレンまたはシクロアルキレン基は場合により置換基R51個以上で置換されており;
− R1はpKaが少なくとも15である制限立体障害基であり;
− R2はアニオン性配位子である、上記鎖体、その塩、溶媒和物およびエナンチオマーを提供する。
− Mは周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される遷移金属、好ましくはルテニウム、オスミウム、鉄、モリブデン、タングステン、チタン、レニウム、銅、クロム、マンガン、ロジウム、バナジウム、亜鉛、金、銀、コバルトおよびニッケルから選択される金属であり;
− Zは酸素、イオウ、セレン、NR’’’’、PR’’’’、AsR’’’’およびSbR’’’’からなる群より選択され;
− R’’、R’’’およびR’’’’は各々、水素、C1-6アルキル、C3-8シクロアルキル、アリールおよびヘテロアリールからなる群より選択されるか、またはR’’およびR’’’は一緒になってアリールまたはヘテロアリール基を形成し、各該基は場合によりハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R51個以上、好ましくは1〜3個で置換されているか、または、R’’およびR’’’は一緒になってアリールまたはヘテロアリール基を形成し、該基は、臭素、ヨウ素、C2-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、アルキルアンモニウムおよびアリールアンモニウムからなる群より選択される置換基R51個、または、ハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、C1-6アルキル−C1-6アルコキシシリル、C1-6アルキル−アリールオキシシリル、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R52個以上で置換されており;
− R’は一般式(IIA)を有する化合物中に含まれる場合はR’’、R’’’およびR’’’’と同様に定義され、または、一般式(IIB)を有する化合物中に含まれる場合はC1-6アルキレンおよびC3-8シクロアルキレンからなる群より選択され、該アルキレンまたはシクロアルキレン基は場合により置換基R51個以上で置換されており;
− R2はアニオン性配位子であり;
− R6は芳香族および不飽和の脂環族、好ましくはアリールおよびC4-20シクロアルケニル(例えばシクロオクタジエニル、ノルボルナジエニル、シクロペンタジエニルおよびシクロオクタトリエニル)基であって、該基はC1-6アルキル基1個以上で場合により置換されたものである、上記鎖体、その塩、その溶媒和物およびそのエナンチオマーを提供する。
R’’’C(OH)=C(R’’)CHO
を有するヒドロキシアルデヒド、例えばサリチルアルデヒド(Zが酸素の場合)または相当するチオアルデヒド(Zがイオウの場合)、アミノアルデヒド(ZがNR’’’’の場合)、ホスフィノアルデヒド(ZがPR’’’’の場合)、アルシノアルデヒド(ZがAsR’’’’の場合)またはスチビノアルデヒド(ZがSbR’’’’の場合)、ただしヒドロキシ、チオ、アミノ、ホスフィノ、アルシノまたはスチビノ基がアルデヒド基に対してβ位にあるものを、第1脂肪族または芳香族のアミンと縮合すること、次いで、得られたアルジミンを、例えば周期律表のIA、IIAまたはIIIA族の何れかの金属(例えばナトリウム、カリウム、マグネシウムまたはタリウム)のアルコキシドとの反応によりその炎に変換すること、次いで、該塩を例えば[RuCl2(p−クメン)]2等の不安定な配位子(例えばハロゲン)を有する金属鎖体と反応させることを包含するよく知られた方法と類似の方法で調製してよい。式(IIB)を有する中間体の第2のクラスは、所望の5員のキレート配位子を得るためには、まずベンズアルデヒド等のアルデヒドを、o−ヒドロキシアニリン(Zが酸素の場合(、アミノチオール(Zがイオウの場合)、ジアミン(ZがNR’’’’の場合)、アミノホスフィン(ZがPR’’’’の場合)、アミノアルシン(ZがAsR’’’’の場合)またはアミノスチビン(ZがSbR’’’’の場合)、ただしヒドロキシ、チオ、第2アミノ、ホスフィノ、アルシノまたはスチビノ基が第1アミノ基に対してβ位にあるもののようなアミノアルコールと縮合させること、次に得られたアミジノをその塩に変換すること、そして次に該塩を上記化合物(IA)に関して示したものと同様の方法で不安定な配位子を有する金属鎖体と反応させることにより調製してよい。
(a)前記のとおり定義される触媒活性5配位金属鎖体、および、
(b)該触媒活性5配位金属鎖体(a)を支持するのに適する担体の支持量、
を含む不均一触媒反応において使用するための支持された触媒を提供する。
晶質シリカの100〜250オングストロームの粒子よりなり(Kirk−Othmer
Encyclopedia of Chemical Technology,3rd.ed.,vol.20,766−781(1982))、多孔性は粒子間の空隙より生じるものである。
能する有機化合物の反応混合物からのその合成を記載している。別の構造要素を有する同様の組成物が欧州特許出願第293,032号に記載されている。ヘキサメチレンイミンはまた米国特許第4,954,325号において結晶性モレキュラーシーブMCM−22;米国特許第4,981,663号においてMCM−35;米国特許第5,236,575号においてMCM−49;そして米国特許第5,021,141号においてZSM−12の合成における使用について説明されている。モレキュラーシーブ組成物SSZ−25は米国特許第4,826,667号および欧州特許出願第231,860号に記載されており、該ゼオライトはアダマンタン第4アンモニウムイオンを含む反応混合物から合成されている。ゼオライト、REY、USY、REUSY、脱アルミニウム化Y、超疎水性Y、ケイ素高含有脱アルミニウム化Y、ZSM−20、Beta、L、シリコアルミオホスフェートSAPO−5、SAPO−37、SAPO−40、MCM−9、メタロアルミノホスフェートMAPO−36、アルミノホスフェートVPI−5およびメソポーラス結晶MCM−41からなる群より選択されるモレキュラーシーブ物質が本発明の支持された触媒内に含まれるのに適している。
する。本発明の金属カルベン化合物の高水準の転移活性はこれらの化合物を配意させ、そして、全種類のオレフィンの間の転移反応を触媒する。本発明の金属カルベン化合物により可能となる反応の例は、例えば、環状オレフィンの開環転移重合、非環状ジエンの閉環転移、非環状または環状のオレフィン少なくとも1種の関与する交差転移反応、および、オレフィン重合体の脱重合である。特に本発明の触媒は少なくとも3原子の環サイズの環状オレフィンを触媒することができる。このような転移反応において使用してよい環状オレフィンの例はノルボルネンおよびその機能的誘導体(例えば後述する実施例において説明するもの)、シクロブテン、ノルボルナジエン、シクロペンテン、ジシクロペンタジエン、シクロヘプタン、シクロオクタン、7−オキサノルボルネン、7−オキサノルボルナジエン、シクロオクタジエンおよびシクロドデセンを包含する。
れかであってよい。
上記式中、
aは0〜2の整数であり、
bは1および2から選択され、
cは0および1から選択され、
mおよびpは式(V)の炭化水素鎖が炭素原子10〜18個を含むようにするものであり、
rおよびtは式(IV)の2種の同じでないオレフィンの炭化水素鎖中の炭素原子の合計が12〜40となるようにするものであり、
X、X’およびX’’は水素、ハロゲン、メチル、アセチル、−CHOおよび−OR12から独立して選択され、ここでR12は水素およびテトラヒドロピラニル、テトラヒドロフラニル、t−ブチル、トリチル、エトキシエチルおよびSiR13R14R15からなる群より選択されるアルコール保護基から選択され、ここで、R13、R14およびR15は各々独立してC1-6アルキル基およびアリール基から選択される。
。この種の問題は、液体オレフィン単量体および触媒を混合し、金型内に注入、キャスティングまたは射出し、そして重合完了(即ち製品の硬化)時に成型された部分を金型から取り出した後、反応射出成型(RIM)法の場合のように必要であれば後硬化工程を行う熱硬化性重合体の成型時に起こる可能性が高い。反応速度、即ち反応混合物のポットライフを制御できる能力はより大型の部品の鋳造においてより重要となる。本発明の触媒を用いること、ポットライフを延長すること、および/または転移重合反応の速度を制御することは、種々の方法、例えば触媒/オレフィンの比率の増大、および/または重合遅延剤の反応混合物への添加等において、行ってよい。更に、これはまた下記:
(a)前述した転移触媒(場合により支持されている)をオレフィンと、反応器中、該転移触媒が実質的に非反応性(不活性)である第1の温度において接触させる第1の工程、および、
(b)反応器の温度を、該触媒が活性となる、第1の温度を超えた第2の温度とする(例えば該反応器を過熱する)第1の工程、
を包含する進歩した実施形態により達成することができる。
ニオン性配位子を抽出して得られるもの)を場合により担体の支持量と組み合わせたもの、ただしここで:
− M、Z、R’、R’’、R’’’、R’’’’、R2、R3、R4およびyは式(IA)および(IB)に関して前述のとおり定義したものであり、
− R16は中性の電子供与体であるもの、
の使用に関する。
は式R31R32C=CR33R34のものを含み、式中、
− R31およびR32は相互に独立して水素、ハロゲン、CN、CF3、C1-20アルキル(好ましくはC1-6アルキル)、α,β−不飽和C2-20アルキル(好ましくはアセチレニル)、α,β−不飽和C2-20アルケニル(好ましくはビニル)、ただし場合により(好ましくはα位において)ハロゲン、C3-8シクロアルキル、フェニルただし場合により置換基1〜5個を担持しているもの、で置換されたもの、からなる群より選択され;
− R33およびR34は独立して水素、ハロゲン(好ましくはフッ素または塩素)、C1-6アルキルおよびCOOR35(式中R35は水素、アルカリ金属またはC1-6アルキルから選択される)からなる群より選択され;そして、
− R31、R32、R33およびR34の少なくとも2つは水素またはハロゲンである。
− C1-20アルコールの(メタ)アクリル酸エステル、
− アクリロニトリル、
− C1-20アルコールのシアノアクリル酸エステル、
− C1-6アルコールのジデヒドロマトネートジエステル、
− アルキル基のα炭素原子が水素原子を担持していないビニルケトン、および、
− 場合によりビニル部分(好ましくはα炭素原子)にC1-6アルキル基およびフェニル環上に置換基1〜5個を担持したスチレン、ただし該置換基はC1-6アルキル、C1-6アルケニル(好ましくはビニル)、C1-6アルキニル(好ましくはアセチレニル)、C1-6アルコキシ、ハロゲン、ニトロ、カルボキシ、C1-6アルコキシカルボニル、C1-6アシルで保護されたヒドロキシ、シアノおよびフェニルからなる群より選択されるもの、
を包含する。
− X1はハロゲン、OR38(R38はC1-20アルキル、ポリハロC1-20アルキル、C2-20アルキニル(好ましくはアセチレニル)、C2-20アルケニル(好ましくはビニル)、場合により1〜5個のハロゲン原子またはC1-6アルキル基で置換されたフェニル、および、フェニル置換C1-6アルキルから選択される)、SR39、OC(=O)R39、OP(=O)R39、OP(=O)(OR39)2、OP(=O)OR39、O−N(R39)2およびS−C(=S)N(R39)2からなる群より選択され、ここでR39はアリールまたはC1-20アルキルであるか、または、N(R39)2基が存在する場合は、2個のR39基が一緒になって5、6または7員の複素環を形成し(上記ヘテロアリールの定義に従う)、そして、
− R35、R36およびR37は各々独立して水素、ハロゲン、C1-20アルキル(好ましくはC1-6アルキル)、C3-8シクロアルキル、C(=O)R40(ただしR40はC1-20アルキル、C1-20アルコキシ、アリールオキシまたはヘテロアリールオキシからなる群より選択さ
れる)、C(=O)NR41R42(式中R41およびR42は相互に独立して水素およびC1-20アルキルからなる群より選択されるか、または、R41とR42は一緒になって炭素原子2〜5個のアルキレン基を形成する)、COCl、OH、CN、C2-20アルケニル(好ましくはビニル)、C2-20アルキニル、オキシラニル、グリシジル、アリール、ヘテロアリール、アリールアルキルおよびアリール置換C2-20アルケニルからなる群より選択される。
懸濁法、乳化法、または沈殿法に従って実施しても良い。適当なエーテルにはジエチルエーテル、エチルプロピルエーテル、ジプロピルエーテル、メチルt−ブチルエーテル、ジ−t−ブチルエーテル、グライム(ジメトキシエタン)ジグライム(ジエチレングリコールジメチルエーテル)等が包含される。適当な環状エーテルにはテトラヒドロフランおよびジオキサンが包含される。適当なアルカンにはペンタン、ヘキサン、シクロヘキサン、オクタンおよびドデカンが包含される。適当な芳香族炭化水素にはベンゼン、トルエン、o−キシレン、m−キシレン、p−キシレンおよびクメンが包含される。選択されたハロゲン化炭化水素は反応条件下において重合開始剤として機能しないことを確認しておく必要があるが、適当なハロゲン化炭化水素には、ジクロロメタン、1,2−ジクロロエタンおよびフッ素原子/塩素原子1〜6個で置換されたベンゼンが包含される。
チレートの使用により明らかにされるとおり重合開始剤にとって要件とはならない。重合開始剤および他の反応成分の転換順序はいずれでもよいが、阻害剤を乳化前の反応混合物に添加する場合は、通常は安定なラテックスが得られる。適当な重合開始剤はATRP工程における溶媒の実施形態において前述したとおりである。重合開始剤はまたラジカル転移可能な原子または基を含む巨大分子であることができる。このような巨大分子の典型的な種類は水溶性またはむしろ両親媒性であってよく、そして、反応開始後は、重合体粒子内に取り込まれて良く、そして巨大重合開始剤の親水性セグメントにより成長中の粒子を安定させて良い。
ことによりマルチブロック共重合体を調製することができる。更にまた、ATRPはラジカル重合であるため、これらのブロックは本質的にどのような順序で調製することもできる。
(A)一般式(IB)を有する鎖体、
(B)化合物(A)と反応することによりそのイミン部分を金属アミン構造に変換する能力を有する化合物、および、
(C)化合物(A)と反応することによりイオン対を形成する能力を有する化合物、
を含む上記触媒系において使用される。
することが望ましい場合がある。
− R20はC1-6アルキレン、アリーレン、ヘテロアリーレンおよびC3-8シクロアルキレンからなる群より選択される基であり、該基は場合により、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C2-20アルキルチオ、アリールオキシおよびアリールからなる群より各々が独立して選択される置換基R241個以上で置換されており;
− Dは酸素、イオウ、ケイ素、アリーレン、メチレン、CHR24、C(R24)2、NH、NR24およびPR24からなる群より選択される2価の原子または基であり;
− R21、R22およびR23は各々独立して水素、ハロゲンおよびR24からなる群より選択され;
− nは1〜20の整数であるが;
ただし、R21、R22およびR23の少なくとも1個はC1-20アルコキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C2-20アルコキシカルボニル、C1-20アルキルスルホニル、C1-20アルキニルスルフィニル、C1-20アルキルチオおよびアリールオキシからなる群より選択される)を有する基で置き換えられるか置換されている上記誘導体に関する。
物質を提供する。
− アリール、ポリアリール、C1-20アルキル、シクロアルキルおよび複素環シクロアルキル基、および、
− 式A(R20)nX3-n、ただしここでR20はC1-6アルキレン、アリーレン、ヘテロアリーレンおよびC3-8シクロアルキレンからなる群より選択される基であり、該基は場合により、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C2-20アルコキシカルボニル、C1-20アルキスルホニル、C1-20アルキスルフィニル、C1-20アルキルチオ、アリールオキシおよびアリールからなる群より各々が独立して選択される置換基R241個以上で置換されており;Aは周期律表のIIIA族の元素(好ましくはホウ素またはアルミニウム)または窒素であるもの、または式G(R20)nX4-n、ただしGがIVA族の元素(好ましくは炭素、ケイ素またはスズ)であるもの、または、式J(R20)nX5-n、ただしJが窒素以外のVA族の元素(即ち好ましくはリン、砒素またはアンチモン)であるもの;または式E(R20)nX2-n、ただしEがVIA族の元素(好ましくは酸素またはイオウ)であるもの;ただし、該式においてXは水素またはハロゲンであるもの、を有する基、および、
− 周期律表のIIB、IIIB、IVB、VB、VIB、VIIBおよびVIIIB族の何れかの金属の遷移金族化合物、例えば4塩化チタン、3塩化バナジウム、4塩化ジルコニウム、C1-6アルキルチタネート、バナデート、ジルコネート等、
からなる群より選択される。
R’’’C(OH)=C(R’’)CHO
を有するアルデヒド、好ましくはサリチルアルデヒドを、式H2NR’を有する第1アミンと、還流温度で、有機溶媒(例えばテトラヒドロフラン)中で縮合させることにより、当該分野で知られた方法を用いて調製し、精製する。冷却後、粘稠な黄色の油状の縮合生成物をシリカゲルクロマトグラフィーで精製し、これにより式(I)の所望のサリチルアルジミン配位子を得る。第2工程においては、上記式(IIA)および(IIB)と混同してはならない式(II)を有するシッフ塩基置換ルテニウム鎖体を、金属アルコキシド、好ましくはタリウムエトキシドを式(I)の配位子の有機溶液に添加し、次に得られた固体を不活性雰囲気下に濾過し、該当するタリウム塩を定量的に得ることにより、当該分野で知られた方法を用いて調製し、精製する。次に該塩の有機溶液を室温で[RuCl2(p−クメン)]2の有機溶液と反応させた。塩化タリウム副生成物を濾過し、溶媒を蒸発させた後、残存物を結晶化し、洗浄し、乾燥し、赤茶色固体の外観を有する式(II)のシッフ塩基ルテニウム鎖体を得た。
II)を有するシッフ塩基置換ルテニウム鎖体は、まず式(III)を有するt−ブトキシル化化合物の有機溶液を式(VI)を有するシッフ塩基置換インデニリデン鎖体の有機溶液に添加し、そして混合物を1時間70〜80℃で攪拌することにより調製する。溶媒を除去した後、固体残存物を洗浄し、再結晶し、その後真空下に乾燥することにより、赤茶色の微結晶性固体として式(VII)を有する純粋な化合物を得る。
RおよびR’が添付の図の下端に示す意味を有し、MeがメチルでありiPrがイソプロピルである式(I.a)〜(I.f)を有するシッフ塩基リガンドを以下の通り調製し、精製した。第1脂肪族アミン(即ちR’が脂肪族または脂環族の基である)とのサリチルアルデヒドの縮合は、2時間還流温度でテトラヒドロフラン(以後THFと記載する)中攪拌することにより行った。室温に冷却後、粘稠な黄色の油状の縮合産物をシリカゲルクロマトグラフィーで精製し、式(I.a)〜(I.f)を有する所望のサリチルアルジミン配位子をそれぞれ95%および93%の収率で得た。芳香族第1アミンとのサリチルアルデヒドの縮合は同様に、2時間80℃でエタノール中攪拌することにより行った。0℃に冷却することにより黄色固体が反応混合物から析出した。この固体を濾過し、冷エタノールで洗浄し、次に真空下に乾燥し、式(I.a)〜(I.f)を有する所望のサリチルアルジミン配位子を90%〜93%の収率で得た。これらの配位子は物理化学的変化を起こすことなくデシケーター中数ヶ月保存できる。
添付の図に示す式(II.a)〜(II.f)を有するシッフ塩基置換ルテニウム鎖体を2工程で調製し、以下の通り精製した。第1の工程において、実施例1に従って調製した式(I.a)〜(I.f)の適切なシッフ塩基のTHF(10ml)中の溶液に、THF(5ml)中のタリウムエトキシドの溶液を室温で滴加した。添加直後、淡黄色の固体が形成し、そして反応混合物を20℃で2時間攪拌した。固体をアルゴン雰囲気下に濾過することにより、定量的収率で該当するサリチルアルジミンタリウム塩が得られ、これは更に精製することなく次の工程において即座に使用した。
THF(5ml)中のカリウムt−ブトキシドの溶液1当量をTHF(10ml)中の
1,3−ビス(2,4,6−トリメチルフェニル)−4,5−ジヒドロイミダゾリウムテトラフルオロボレートの溶液に添加し、反応混合物を室温(20℃)で5分間攪拌した後、カリウムテトラフルオロボレート副生成物を不活性雰囲気下に濾去し、式(III)を有するt−ブトキシル化化合物が定量的収率で形成した。溶媒を蒸発させた後、化合物(III)をトルエン(10ml)に溶解し、更に精製することなく次の工程において即座に使用した。トルエン(10ml)中の実施例2に従って調製した式(II.a)〜(II.f)の1つを有する適切なシッフ塩基置換ルテニウム鎖体の溶液1当量を添加した後、激しく攪拌しながら1時間反応混合物を70〜80℃に加熱した。溶媒を蒸発させた後、固体の残存物をヘキサン(3x10ml)で洗浄し、トルエン/ペンタン混合物から0℃で再結晶させた。その後真空下に乾燥して90%〜95%の範囲の収率で茶色の微結晶性固体として式(IV.a)〜(IV.f)の純粋なシッフ塩基置換ルテニウム鎖体を形成した。
式(V.a)〜(V.f)を有するシッフ塩基置換アレニリデン化合物はトルエン(15ml)中の実施例3に従って調製した式(IV.a)〜(IV.f)の1つを有する適切なシッフ塩基置換ルテニウム鎖体の溶液をトルエン(5ml)中の市販のジフェニルプロパルギルアルコールの溶液の1.2当量に添加し、次に室温(20℃)で17時間反応混合物を攪拌することにより得た。トルエンを真空下に蒸発させ、残存する固体残存物をジクロロメタン/ヘキサン混合物から再結晶し、ヘキサン(3x10ml)で洗浄して80〜90%の範囲の収率で暗茶色の微結晶性固体として所望の化合物を得た。
式(VI.a)〜(VI.f)のシッフ塩基置換インデニリデン化合物はトルエン(15ml)中の実施例2に従って調製した式(II.a)〜(II.f)の1つを有する適切なシッフ塩基置換ルテニウム鎖体の溶液をトルエン(5ml)中の市販のジフェニルプロパルギルアルコールの溶液の1.2当量に添加し、次に室温(20℃)で17時間反応混合物を攪拌することにより得た。トルエンを真空下に蒸発させ、残存する固体残存物をジクロロメタン/ヘキサン混合物から再結晶し、ヘキサン(3x10ml)で洗浄して70%より高い収率で赤茶色の微結晶性固体として所望の化合物を得た。
トルエン(10ml)中の実施例5に従って調製した式(VI.a)〜(VI.f)の1つを有する適切なシッフ塩基置換ルテニウム鎖体の溶液に、トルエン(10ml)中の実施例3の通り調製した式(III)を有するt−ブトキシル化化合物の溶液の1当量を添加した。次に70〜80℃で1時間、反応混合物を激しく攪拌した。溶媒を蒸発させた後、固体の残存物をヘキサン(3x10ml)で洗浄し、ジクロロメタン/ヘキサン混合物から再結晶した。その後真空下に乾燥し、定量的収率で赤茶色の微結晶性固体として式(VII.a)〜(VII.f)の純粋な化合物を得た。
種々の環状オレフィンの開環転移重合を溶媒としてトルエン1ml中において実施し、その際触媒としては実施例4で調製した式(V.a)を有するシッフ塩基置換アレニリデン化合物0.005モルを用いた。以下の表1はオレフィン単量体の名称、オレフィン/触媒のモル比、重合温度T(℃表示)および重合時間t(分表示)を示すものであり、そして更に時間tにおける重合収率を示している。
種々のジエンの閉環転移反応は溶媒として重水素化ベンゼン1ml中で行い(ただし塩酸ジアリルアミンの場合のみ溶媒として重水素化メタノールを使用)、その際、下記を使用した。
− 触媒として実施例4で調製した式(V.a)を有するシッフ塩基置換アレニリデン化合物0.005ミリモル、および、
− ジエン/触媒のモル比100.
以下の表2に使用したジエンの名称、反応温度T(℃表示)、反応時間t(分表示)を示し、また時間tにおける反応収率(%表示)および得られた生成物の名称も示した。
種々のオレフィンの原子転移ラジカル重合を下記に示す温度(℃表示)において下記を使用しながら8時間トルエン1ml中で行った。
− 触媒として、実施例4で調製した式(V.a)を有するシッフ塩基置換アレニリデン室温に有無鎖体0.0116モル、
− 重合開始剤として、エチル−2−メチル−2−ブロモピロピオネート(単量体がメタクリレートの場合)、メチル−2−ブロモプロピオネート(単量体がアクリレートの場合)、1−ブロモシアノエタン(単量体がアクリロニトリルの場合)または(1−ブロモエチル)ベンゼン(単量体がスチレンの場合)、
− [触媒]/[重合開始剤]/[単量体]のモル比1:2:800.
以下の表3は使用したオレフィンの名称、重合温度および重合収率(%表示)を示す。
種々のオレフィンの原子転移ラジカル重合を溶媒として水中において、下記:
− 触媒として、テトラフルオロホウ酸銀1当量であらかじめ処理しておいた実施例4において調製した式(V.a)を有するシッフ塩基置換アレニリデン化合物0.0116モル(より詳細には、化合物(V.a)の上記した量をトルエン1mlおよびトルエン中0.2MのAgBF4溶液56μlに添加し、次にAgClの濁度が観察されるまで20分間攪拌し、これによりクロリドの配位子が抽出されトルエンにより置き換えられているカチオン性ルテニウム鎖体とした)、および、
− 実施例9において既に記載したものと同様の重合開始剤、および、
− [触媒]/[重合開始剤]/[単量体]のモル比1:2:800、
を使用しながら、以下の表に示す温度で、8時間、行った。触媒および重合開始剤をトルエン中に溶解し、トルエン:水の容量比を1:1とした。以下の表4は使用したオレフィンの名称、重合温度および重合収率(%表示)を示す。
種々のビニル単量体の原子転移ラジカル重合および共重合を以下を用いて行った。
− 実施例9において使用したものと同様の重合開始剤、および、
− 触媒として、以前にChang等、Organometallics(1998)17:3460によりオレフィン転移触媒として開示されており、そして、下記式:
アルゴン雰囲気下に行った。触媒0.0117ミリモルを磁気攪拌子の入った3方向ストップコックでキャップされたガラス試験管(真空−窒素サイクル3回により脱気)に入れた。次に単量体および重合開始剤を添加することにより[触媒]/[重合開始剤]/[単量体]のモル比を1/2/800とした。全液体をアルゴン雰囲気下で乾燥シリンジを用いて取り扱った。次に反応混合物を85℃((メタ)アクリレートの場合)または110℃(スチレンの場合)の反応温度で17時間過熱した。冷却後、これをTHF中に希釈し、激しく攪拌しながらn−ヘプタン((メタ)アクリレートの場合)50mlまたはメタノール(スチレンの場合)50mlに注ぎ込んだ。次に沈殿した重合体を濾過し、一夜真空下に乾燥した。
種々のビニル単量体の原子転移ラジカル重合および共重合を溶媒S中で下記を用いて実施した。
− 実施例9において使用したものと同様の重合開始剤、および、
− 触媒として、Tosがトシレート(p−トルエンスルホネート)の略号であり、Tfがトリフレート(トリフルオロメタンスルホネート)の略号である後述するスキームに従
って溶媒Sの存在下において塩で適切な式(A.a)〜(A.f)を有する実施例11のルテニウムカルベン複合体を処理することにより図11に示したスキームに従って得られるカチオン性ルテニウムカルベン鎖体(B.a)〜(B.f)。
種々のビニルオレフィンのへの4塩化炭素の原子転移ラジカル付加を有機溶媒中、触媒として実施例4において調製した式(V.a)を有するシッフ塩基置換アレニリデン化合物を用いながら実施した。該触媒(0.03ミリモル)をトルエン(1ml)に溶解し、その後セプタムを通してトルエン(3ml)中のビニル単量体(9ミリモル)および4塩化炭素(13ミリモル)の卒に添加した。次に反応混合物を17時間65℃に加熱した。以下の表9は試験したビニル単量体の名称および得られた塩素化飽和付加生成物の収率(%表示)を示す。
トルエン(17ml)中の[RuCl2(p−クメン)]2(306mg、0.5ミリモル)の懸濁液に、それぞれ、トリシクロヘキシルホスフィン(0.617g、2.2ミリモル)およびフェニルアセチレンC6H5C≡CH(0.102g、1ミリモル)を添加した。混合物をゆっくり70℃に加熱し、24時間攪拌した。揮発性物質をポンピングすることにより約4mlまで混合物を濃縮した。アセトン10mlを添加し、−78℃まで冷却することにより析出した暗茶色の微結晶性固体を濾過し、真空乾燥した。収率85%で得られたこの固体はプロトンNMRスペクトル分析(CDCl3上30℃で実施)によりCl2Ru{=C=CHC6H5}(PCy3)2であることが特性化され、以下のデータが得られた。
THF(5ml)中の実施例14において得られたジクロロジシクロヘキシルホスフィンビニリデンルテニウム鎖体(3ミリモル)の溶液に実施例2の第1工程の終了時に得られたサチチルアルジミンタリウム塩のTHF(10ml)中の溶液を添加した。反応混合物を4時間20℃で攪拌し、形成した塩化タリウムを濾過して分離した。固体の残存物を−70℃でペンタンから再結晶し、式(IC)を有するシッフ塩基ビニリデンルテニウム鎖体を得た。
後に記載するスキームの6〜17の式および参照番号により識別される環状オレフィンの開環転移重合を以下の操作法に従って実施した。
種々のジエンの閉環転移反応を以下の操作法に従って実施した。10mlのSchlenck試験管中、ジエン0.095ミリモル、メシチレン13.2μl(0.095ミリモル)および実施例15に従って調製したシッフ塩基ビニリデンルテニウム鎖体50μlを重水素化ベンゼン1mlに添加し、そして、70または85℃に攪拌しながら加熱した(以下の表11に記載するとおり)。形成したエチレンを10分間間隔で真空下に除去した。2時間後、溶液を20℃に冷却し、NMR試験管内に注ぎ込んだ。生成物の収率はア
リル性プロトンの組み込みにより1H−NMRで測定する。環状異性体、オリゴマーまたはテロメアの形成は反応混合物のGC−MS分析により区別した。シリカゲルカラム上のフラッシュカラムクロマトグラフィーにより濃縮した反応混合物の精製により反応性生物を同定した(ヘキサン/酢酸エチル=6:1、Rf=0.3)。
体が係留している触媒の調製
全ての反応および操作は従来のSchlenck試験管法を用いることによりアルゴン雰囲気下で行った。アルゴンガスはP2O5(Aldrich、97%)を通して乾燥した。1H−NMRスペクトル(500MHz)はBrukerAM分光分析器上に記録した。化学シフトはppmで表示し、TMSを比較対照化合物として使用した。固相NMRスペクトルはBrukerDSX−300分光光度計を1H−NMRの場合は300.18MHz、13C−NMRの場合は75.49MHz、31P−NMRの場合は121.51MHzおよび29Si−NMRの場合は59.595MHzで操作することにより獲得した。スペクトルは12KHzまでのスピン周波数を与える慣用的な4mmのプローブヘッドを用いてMAS条件下において記録した。均一な触媒の係留はFRA106モジュールを有するラマン分光光度計Bruker Equinox 55により確認した。不均一ハイブリッド触媒の負荷はVarian Liberty ICP/MS分光光度計およびARL9400SequentialXRF分光光度計により測定した。XRDスペクトルはSiemens回折光度計D5000で記録した。元素分析はCarloErbaEA1110装置で実施した。BET分析はFlow prep060脱気装置を有するGeminiマイクロメトリック2360表面積分析器で行った。試料を423°Kで一夜乾燥し、室温に冷却してから吸着させた。空気酸化の可能性のため官能性付与された物質による特別の留意が必要であり、従って、天秤への移動および系の脱気は迅速に行った。窒素等温曲線は77℃で記録した。比表面積をBETプロットの直線部分から求めた。
XRF測定によれば、0.1069ミリモルRu鎖体/g不均一触媒5および0.054ミリモルRu鎖体/g不均一触媒11の負荷が明らかにされる。
実施例18の不均一触媒5および11の両方を使用して溶媒中の種々のオレフィンの開環転移重合を行った。市黒億点およびノルボルネン誘導体をAldrichより購入し、窒素下CaH2から蒸留した後に使用した。市販品等級の溶媒を乾燥し、窒素雰囲気下適切な乾燥剤上で24時間脱酸素処理し、蒸留した後に使用した。典型的なROMP実験において、トルエン中の触媒の懸濁液0.005ミリモルを15ml容の容器に移し、その後トルエン/ジクロロメタン中の単量体を添加した(ノルボルネンは2000当量、シクロオクテンは200当量およびノルボルネン誘導体は800当量)。反応混合物を6時間35℃で攪拌し続けた。触媒を不活性化するため、エチルビニルエーテル/2,6−ジ−t−ブチル−メチルフェノール(BHT)溶液2.5mlを添加し、完全な不活性化が起こるまで溶液を攪拌した。溶液をメタノール50ml(0.1%BHT含有)に注ぎ込み、重合体を析出させ、濾過した。重合体をCHCl3に溶解することにより触媒を濾過した。次に高粘度となるまでCHCl3を真空下に重合体溶液から除去し、その後メタノール100mlを添加することにより重合体を析出させた。次に白色の重合体を濾過紙、一夜真空下に乾燥した。重合体の数および重量平均分子量(MnおよびMw)および多分散性(Mw/Mn)をポリスチレン標準物質を用いたゲル透過クロマトグラフィー(CHCl3、25℃)により測定した。使用したGPC機材はPLゲルカラムを装着したWatersのMaxima820システムである。DSC測定はサーモメカニカル分析器(TMA2940)を使用しながらTA機器DSC−TGA(SDT2960)により行った。形成された重合体の収率[%]を以下の表12に示す。
乾燥した10ml容の容器内に触媒5モル%を計り込み、固体をベンゼン2ml中に懸濁することにより空気中のベンチトップ上で反応を行った。ベンゼン(2ml)中の適切
なジエン基質(0.1ミリモル)の溶液を内標準のドデカンとともに添加した。反応混合物を以下の表14に示す適切な温度で適切な時間攪拌した。生成物の形成およびジエンの消失はガスクロマトグラフィー(GC)でモニタリングし、アリル性メチレンのピークを積分を介して1H−NMRスペクトル分析により再現性試験において確認した(溶媒は重水素化ベンゼンであり内標準は1,3,5−メシチレンとした)。反応混合物のGC分析はまたシクロ異性体、オリゴマーまたはテロメアの形成を区別した。
従来の方法により、全試薬および溶媒を乾燥し、蒸留し、−20℃で窒素下に保存した。典型的なATRP実験においては、実施例18において製造した不均一触媒11の0.0117ミリモルを磁気攪拌子の入った3方向ストップコックでキャップしたガラス管(3回の真空−窒素サイクルにより脱気しておく)内に入れた。次にモル比[触媒]/[重合開始剤]/[単量体]が1:2:800となるようにスチレン(単量体として)および1−ブロモメチルベンゼン(重合開始剤として)を添加した。全液体を乾燥シリンジを用いながらアルゴン下に取り扱った。反応混合物を110℃で17時間加熱し、冷却した後
、THF中に希釈し、激しく攪拌しながらメタノール50ml中に注ぎ込み、その後析出したポリスチレンを吸引濾過した。最後に重合体をCHCl3に溶解することにより触媒を濾別した。次に高粘度となるまでCHCl3を重合体溶液から真空下に除去し、次にメタノール100mlを添加することにより重合体を析出させ、濾別し、15分間真空下に乾燥して分析した。重合体の収率は73%、分子量(Mn)は39,000、そして多分散性指数(Mw/Mn)は1.62であった。
従来の方法により、全試薬および溶媒を乾燥し、蒸留し、−20℃で窒素下に保存した。反応は実施例18の触媒5または11の0.01ミリモルを乾燥した10ml容の容器に計り込み、固体をトルエン2mlで懸濁することにより空気中ベンチトップ上で行った。次にトルエン(1ml)中のアルケン(3ミリモル)、CCl4(4.33ミリモル)およびドデカン(0.083ml)の溶液を添加し、反応混合物を表15に示す適切な反応温度において17時間加熱した。得られた生成物の収率は内標準としてドデカンを用いた反応混合物のGC分析により求め、以下の表5に示した。
典型的なビニル化実験において、カルボン酸(ギ酸または酢酸)4.4ミリモル、アルキン(フェニルアセチレンまたは1,7−オクタジイン)4.4ミリモルおよび実施例18の触媒5または110.04ミリモルをトルエン3mlの入った15ml容のガラス容器に移した。次に反応混合物を不活性雰囲気下100℃で4時間加熱した。総収率はフェニルアセチレンまたは1,7−オクタジインのVC≡Cの強度低下を追跡し、検量線を用いながら、ラマン分光分析により測定した。得られた生成物の立体配座は単量体の種々のフラグメント化を用いながらGC/MSにより測定した。GC/MS測定により以下に報告するもの以外の生成物の形成を区別した。
)。1,7−オクタジインを基質として使用した場合は、両方のカルボン酸の添加により、使用した触媒系にかかわらず三重結合への酸のレジオ選択的および立体選択的なアンチMarkovnikov付加に相当する(E)−アルカン−1−エニルエステルの選択的形成が起こった。しかしながら総収率は使用した触媒およびカルボン酸の種類に依存している。(E)−アルカン−1−エニルエステルの形成のほかに、低い比率の(Z)−アルカン−1−エニルエステル、Markovnikov付加産物およびジ置換エノールエステルも得られた。アルキンとしてフェニルアセチレンを使用した場合、総収率は1,7−オクタジインよりも明らかに高値となった。後者はビニル化過程において完全に異なる選択性を誘導し、即ち、不均一触媒はMarkovnikov付加産物の形成のために高い水準の反応性をもたらした。
本合成は図10に示すスキームに従って進行させた。式(2.a−f)を有するシッフ塩基置換ルテニウム鎖体を以下のとおり2工程において調製し、精製した。第1の工程においては、実施例1に従って調製した式(2.a−f)の適切なシッフ塩基のTHF(10ml)中の溶液にTHF(5ml)中のタリウムエトキシドの溶液を室温で滴加した。添加終了直後、淡黄色固体が形成し、反応混合物を20℃で2時間攪拌した。アルゴン雰囲気下に固体を濾過し、定量的収率で得られた該当するサリシルアルジミンタリウム塩を更に精製することなく即座に次の工程において使用した。
a−fを得た。該鎖体を更に核磁気共鳴(NMR)および赤外スペクトル分析(IR)で特性化し、その分析結果は以下のとおりとなった。
H5.21、N1.72;測定値:C53.23、H5.24、N1.74。
ジエチルアリルアミノエチルホスホネート0.60g(2.9ミリモル)を乾燥ジエチルエーテル50mlに溶解し、そしてトリエチルアミン1.17g(11.6ミリモル)を添加した。室温で15分間攪拌した後、アリルブロミド1.40gを滴加した。混合物を4日間還流した。水50mlを混合物に添加し、その後CH2Cl250mlで3回益した。有機層を合わせMgSO4上に乾燥した。MgSO4を濾過し、溶媒を蒸発させ、得られた生成物を高真空蒸留により更に精製し、0.1mbarの低圧力下において65℃の沸点を有するジエチルジアリルアミノメチルホスホネート0.6g(2.4ミリモル、84%収率)を得た。この生成物は以下のスペクトルにより更に特性化された。
− 質量スペクトル分析:247(M+,3)、232(M+−15.7)、206(30)、110(M+−PO(OEt)2、100)、81(14)、68(21)および41(26)。
実施例25において調製したジエチルジアリルアミノメチルホスホネート0.1g(0.41ミリモル)をクロロベンゼン2mlに溶解し、次に実施例24において調製した2
金属ルテニウム鎖体3.e0.014g(0.02ミリモル)を添加し、そして混合物を60℃で16時間攪拌した。カラムクロマトグラフィーによりクロロベンゼン蒸発後に触媒を除去し、ジエチル1H−ピロール−1−イルメチルホスホネート0.04g(0.18ミリモル、収率45%)を得た。この生成物は以下のスペクトルにより更に特性化された。
− 質量スペクトル分析:217(M+,57)、202(M+−15.17)、174(13)、107(29)、80(M+−PO(OEt)2、100)および53(14)。
塩酸グリシンメチルエステル1.5g(11.9ミリモル)を乾燥THF100mlに添加し、その後トリエチルアミン3.61g(35.8ミリモル)を添加した。室温で15分間攪拌した後、アリルブロミド4.33g(35.8ミリモル)を滴加し、そして混合物を16時間還流した。2N塩酸100mlを添加し、次にジエチルエーテル100mlで益した。水相を酸抽出後にK2CO3でアルカリ化し、そしてCH2Cl2(100ml3回)で抽出した。有機層をMgSO4上に乾燥し溶媒を蒸発させた後、生成物を更にカラムクロマトグラフィーで精製し、100%の選択性で0.78g(5.75ミリモル、収率49%)のジアリルグリシンメチルエステルを得た。この生成物は以下のスペクトルにより更に特性化された。
− 質量スペクトル分析:169(M+,−41.25)、110(M+−COOMe、100)および41(CH2=CH−CH2+、28)。
実施例27で調製したジアリルグリシンメチルエステル0.22g(1.3ミリモル)をクロロベンゼン3mlに溶解し、その後実施例24で調製した2金属ルテニウム鎖体3.e0.046g(0.064ミリモル)を添加した。混合物を65℃で16時間攪拌した。クロロベンゼン蒸発後に触媒をカラムクロマトグラフィーにより除去し、100%の選択性でメチル1H−ピロール−1−イルアセテート0.05g(0.36ミリモル、収
率28%)を得た。この生成物は以下のスペクトルにより更に特性化された。
− 質量スペクトル分析:139(M+,63)および80(M+−PO(OEt)2、100)。
Claims (90)
- カルベン配位子、多座配位子および他の配位子1個以上を含み、前記他の配位子の少なくとも1個がpKaが少なくとも15である制限(コンストレイント)立体障害配位子である5配位金属鎖体、その塩、その溶媒和物またはそのエナンチオマー。
- 1金属鎖体である、請求項1に記載の5配位金属鎖体。
- 2金属鎖体であって、中性の配位子1個以上およびアニオン性の配位子1個以上に対して一方の金属が5配位であり、他方が4配位である、請求項1に記載の5配位金属鎖体。
- 金属2個が同じである、請求項3に記載の5配位金属鎖体。
- 金属2個が異なる、請求項3に記載の5配位金属鎖体。
- 多座配位子が2座配位子であり、金属鎖体が他の配位子2個を含む、請求項1または2に記載の5配位金属鎖体。
- 多座配位子が3座配位子であり、金属鎖体が他の配位子1個を含む、請求項1または2に記載の5配位金属鎖体。
- 金属が周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される遷移金属である、請求項1〜7の何れかに記載の5配位金属鎖体。
- 金属がルテニウム、オスミウム、鉄、モリブデン、タングステン、チタン、レニウム、銅、クロム、マンガン、パラジウム、白金、ロジウム、バナジウム、亜鉛、カドミウム、水銀、金、銀、ニッケルおよびコバルトからなる群より選択される請求項1〜8の何れかに記載の5配位金属鎖体。
- 多座配位子が金属の配位に使用されるヘテロ原子少なくとも2個を含む、請求項1〜9の何れかに記載の5配位金属鎖体。
- ヘテロ原子2個のうちの少なくとも1個が窒素原子である、請求項10に記載の5配位金属鎖体。
- カルベン配位子がアレニリデン配位子である、請求項1〜11の何れかに記載の5配位金属鎖体。
- カルベン配位子がクムレニリデン配位子である、請求項1〜11の何れかに記載の5配位金属鎖体。
- 前記他の配位子の1個がアニオン性配位子である、請求項1〜6の何れかに記載の5配位金属鎖体。
- 前記他の配位子の1個が溶媒であり、鎖体がアニオンと会合したカチオン性核種である、請求項2に記載の5配位金属鎖体。
- 前記アニオンがテトラフルオロボレート、テトラ(ペンタフルオロフェニル)ボレート、アルキル基がハロゲン原子1個以上で置換されていて良いアルキスルホネートおよびアリールスルホネートからなる群より選択される、請求項15に記載の5配位金属鎖体。
- 前記溶媒Sがプロトン性溶媒、極性非プロトン性溶媒および非極性溶媒、例えば芳香族炭化水素、塩素化炭化水素、エーテル、脂肪族炭化水素、アルコール、エステル、ケトン、アミド、水またはこれらの混合物からなる群より選択される、請求項15または16に記載の5配位金属鎖体。
- pKaが少なくとも15である前記制限立体障害配位子が誘導体であり、水素原子の1個以上が非イオン性プロホスファトランスーパー塩基またはイミダゾール−2−イリデン、ジヒドロイミダゾール−2−イリデン、オキサゾール−2−イリデン、チアゾール−5−イリデン、チアゾール−2−イリデン、ビス(イミダゾリン−2−イリデン)、ビス(イミダゾリジン−2−イリデン)、ピロリリデン、ピラゾリリデン、ジヒドロピロリリデン、ピロリリジニリデンおよびこれらのベンゾ縮合誘導体からなる群より選択されるN−複素環カルベンの制限立体障害を与える基により置換されている、請求項1〜17の何れかに記載の5配位金属鎖体。
- (i)多座配位子および他の配位子1個以上を含み、前記他の配位子の少なくとも1個はpKaが少なくとも15である制限立体障害配位子である4配位金属鎖体を、(ii)アルキニル化合物、ジアゾ化合物およびジアルキニル化合物からなる群より選択される反応体、ただし前記反応体は金属に対するカルベン配位子を与えることができるもの、と反応させることにより5配位1金属鎖体を製造する工程を含む、請求項1〜18の何れかに記載の5配位金属鎖体の製造方法。
- 請求項1〜18の何れかに記載の5配位金属鎖体の製造方法であって、下記工程:
− (i)多座配位子、および、pKaが少なくとも15である制限立体障害配位子以外であり、カルベン配位子以外である他の配位子1個以上を含む4配位金属鎖体を、(ii)アルキニル化合物、ジアゾ化合物およびジアルキニル化合物からなる群より選択される反応体、ただし前記反応体は金属に対するカルベン配位子を与えることができるもの、と反応させることにより5配位1金属鎖体を製造する第1の工程、および、次に、
− 第1の工程で得られた5配位1金属鎖体を、pKaが少なくとも15である制限立体障害基を含む核種と、前記15のpKaを有する制限立体障害基を含む核種がカルベン配位子以外の他の配位子の1個の変わりに金属に対して配位できるような条件下で、反応させる第2の工程、
を含む、方法。 - 前記5配位金属鎖体が、一方の金属が5配位であり、そして他方の金属が4配位である2金属鎖体であり、前記5配位1金属鎖体を、各金属が4配位である2金属鎖体と反応させる工程を更に含む、請求項19または20に記載の方法。
- 各金属が4配位である前記2金属鎖体の金属が前記5配位1金属鎖体の金属とは異なる、請求項21に記載の方法。
- 各金属が独立して、周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される、請求項19〜22の何れかに記載の方法。
- 第1の工程の4配位1金属鎖体がアニオン性配位子1個を含むことによりアニオン性配位子1個を含む5配位1金属鎖体を与え、前記方法が、前記5配位1金属鎖体を塩と溶媒の存在下に反応させることにより前記5配位1金属鎖体から前記アニオン性配位子を抽出する工程を更に含み、これによりアニオンと会合したカチオン性核種である5配位1金属鎖体を形成し、その際金属が溶媒に対して配位する、請求項19または20に記載の方法。
- 多座配位子配位子および他の配位子1個以上を含む4配位1金属鎖体であって、前記他の配位子の少なくとも1個は、pKaが少なくとも15である制限立体障害配位子である、鎖体。
- 触媒成分を製造するための中間体としての、請求項25に記載の4配位1金属鎖体の使用。
- 図3に示す一般式(IA)および(IB)の1つを有する金属鎖体から選択される、請求項1または2に記載の5配位金属鎖体であって、前記式中、
− Mは周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される遷移金属であり;
− Zは酸素、イオウ、セレン、NR’’’’、PR’’’’、AsR’’’’およびSbR’’’’からなる群より選択され;
− R’’、R’’’およびR’’’’は各々、水素、C1-6アルキル、C3-10シクロアルキル、C1-6アルキル−C1-6アルコキシシリル、C1-6アルキル−アリールオキシシリル、C1-6アルキル−C3-10シクロアルコキシシリル、アリールおよびヘテロアリールからなる群より選択されるか、または、R’’およびR’’’は一緒になってアリールまたはヘテロアリール基を形成し、前記基各々は場合により、ハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、C1-6アルキル−C1-6アルコキシシリル、C1-6アルキル−アリールオキシシリル、C1-6アルキル−C3-10シクロアルキルシリル、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R51個以上、好ましくは1〜3個で置換されており;
− R’は一般式(IA)を有する化合物中に含まれる場合はR’’、R’’’およびR’’’’と同様に定義され、または、一般式(IB)を有する化合物中に含まれる場合はC1-6アルキレンおよびC3-8シクロアルキレンからなる群より選択され、前記アルキレンまたはシクロアルキレン基は場合により置換基R51個以上で置換されており;
− R1はpKaが少なくとも15である制限立体障害基であり;
− R2はアニオン性配位子であり;
− R3およびR4は各々、水素またはC1-20アルキル、C1-20アルケニル、C1-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C1-20アルケニルオキシ、C1-20アルキニルオキシ、アリール、アリールオキシ、C1-20アルコキシカルボニル、C1-8アルキルチオ、C1-20アルキルスルホニル、C1-20アルキルスルフィニルC1-20アルキルスルホネート、アリールスルホネート、C1-20アルキルホスホネート、アリールホスホネート、C1-20アルキルアンモニウムおよびアリールアンモニウムからなる群より選択される炭水化物基であり;
− R’およびR3およびR4の一方は相互に結合して2座の配位子を形成し;
−R’’’およびR’’’’は相互に結合して窒素、リン、砒素およびアンチモンからなる群より選択されるヘテロ原子を含む脂肪族の環系を形成し;
− R3およびR4は一緒になって縮合芳香族環系を形成し、そして、
− yはMとR3およびR4を担持した炭素原子との間のsp2炭素原子の数を示し、0〜3の整数である、鎖体、その塩、その溶媒和物およびそのエナンチオマー。 - R1が誘導体であり、水素原子の1個以上がイミダゾール−2−イリデン、ジヒドロイミダゾール−2−イリデン、オキサゾール−2−イリデン、チアゾール−5−イリデン、チアゾール−2−イリデン、ビス(イミダゾリン−2−イリデン)、ビス(イミダゾリジン−2−イリデン)、ピロリリデン、ピラゾリリデン、ジヒドロピロリリデン、ピロリリジニリデンおよびこれらのベンゾ縮合誘導体からなる群より選択されるN−複素環カルベンまたは非イオン性プロホスファトランスーパー塩基の制限立体障害を与える基により置
換されている、請求項27に記載の5配位金属鎖体。 - R2がC1-20アルキル、C1-20アルケニル、C1-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C1-20アルケニルオキシ、C1-20アルキニルオキシ、アリール、アリールオキシ、C1-20アルコキシカルボニル、C1-8アルキルチオ、C1-20アルキルスルホニル、C1-20アルキルスルフィニル、C1-20アルキルスルホネート、アリールスルホネート、C1-20アルキルホスホネート、アリールホスホネート、C1-20アルキルアンモニウム、アリールアンモニウム、ハロゲン原子およびシアノからなる群より選択される、請求項27または28に記載の5配位金属鎖体。
- R3およびR4の各々がフェニル基である、請求項27〜29の何れかに記載の5配位金属鎖体。
- y=1である、請求項27〜30の何れかに記載の5配位金属鎖体。
- y=2である、請求項27〜30の何れかに記載の5配位金属鎖体。
- R3およびR4が一緒になって図3に示す式(vi)を有する縮合芳香族環系を形成する、請求項27〜32の何れかに記載の5配位金属鎖体。
- R’がメチルである、請求項27〜33の何れかに記載の5配位金属鎖体。
- 請求項27に記載の5配位金属鎖体の製造方法であって、図4に示す一般式(IIA)または(IIB)の一方を有する4配位金属鎖体、ただし式中M、Z、R、R’、R’’、R’’’、R’’’’およびR2は請求項27の通り定義され、そしてR6は脱離基であるものを、式R1Yを有する化合物、ただし式中R1は請求項27の通り定義され、そしてYは脱離基であるものと反応させることにより、図4の一般式(IIIA)または(IIIB)の一方をそれぞれ有する中間体を形成すること、および、更に前記中間体を下記物質:
− 式R3R4R7CO≡CHを有するアルキニル化合物、ただしR3およびR4は請求項27の通り定義され、そしてR7は水素、ヒドロキシルおよびR3からなる群より選択されるもの(y=2の場合)、
− 式N2CR3R4を有するジアゾ化合物、ただしR3およびR4は請求項27の通り定義されるもの(yが0である場合)、
− 式R3C≡CHを有するアルキニル化合物、ただしR3は請求項27の通り定義されるもの(yが1の場合)、および、
− 式R21C≡C−C≡CR22を有するジアルキニル化合物、ただしR21およびR22は各々独立して水素およびトリアルキルシリルから選択されるもの(yが3の場合)、
からなる群より選択される反応体と反応させること、を含む、方法。 - Yが水素、C1-6アルコキシ、PR3およびNR3からなる群より選択される、請求項35に記載の方法。
- 請求項27に記載の5配位金属鎖体の製造方法であって、第1の工程において、図4に示す一般式(IIA)または(IIB)の一方を有する化合物、ただし式中M、Z、R、R’、R’’、R’’’、R’’’’およびR2は請求項27の通り定義され、そしてR6は脱離基であるものを、下記物質:
− 式R3R4R7CO≡CHを有するアルキニル化合物、ただしR3およびR4は請求項27の通り定義され、そしてR7は水素、ヒドロキシルおよびR3からなる群より選択されるもの(y=2の場合)、
− 式N2CR3R4を有するジアゾ化合物、ただしただしR3およびR4は請求項27の通り定義されるもの(yが0である場合)、
− 式R3C≡CHを有するアルキニル化合物、ただしR3は請求項27の通り定義されるもの(yが1の場合)、および、
− 式R21C≡C−C≡CR22を有するジアルキニル化合物、ただしR21およびR22は各々独立して水素およびトリアルキルシリルから選択されるもの(yが3の場合)、
からなる群より選択される反応体と反応させること、
および、第2の工程において更に、第1の工程の反応生成物を、式R1Yを有する化合物、ただし式中R1は請求項27の通り定義されるものと反応させること、を含む、方法。 - R6が芳香族および不飽和の脂環族基、好ましくはアリールおよびC4-20シクロアルケニル基であって、C1-6アルキル基1個以上で場合により置換されたものである、請求項35〜37の何れかに記載の方法。
- 図4に示す一般式(IIIA)または(IIIB)の一方を有する4配位金属鎖体、ただし、
− Mは周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される遷移金属であり;
− Zは酸素、イオウ、セレン、NR’’’’、PR’’’’、AsR’’’’およびSbR’’’’からなる群より選択され;
− R’’、R’’’およびR’’’’は各々、水素、C1-6アルキル、C3-8シクロアルキル、アリールおよびヘテロアリールからなる群より選択されるか、または、R’’およびR’’’は一緒になってアリールまたはヘテロアリール基を形成し、前記基各々は場合により、ハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R51個以上、好ましくは1〜3個で置換されており;
− R’は一般式(IIIA)を有する化合物中に含まれる場合はR’’、R’’’およびR’’’’と同様に定義され、または、一般式(IIIB)を有する化合物中に含まれる場合はC1-6アルキレンおよびC3-8シクロアルキレンからなる群より選択され、前記アルキレンまたはシクロアルキレン基は場合により置換基R51個以上で置換されており;
− R1はpKaが少なくとも15である制限立体障害基であり;
− R2はアニオン性配位子である、鎖体、その塩、その溶媒和物およびそのエナンチオマー。 - 図4に示す一般式(IIA)または(IIB)の一方を有する4配位金属鎖体、ただし、
− Mは周期律表の4、5、6、7、8、9、10、11および12族からなる群より選択される遷移金属であり;
− Zは酸素、イオウ、セレン、NR’’’’、PR’’’’、AsR’’’’およびSbR’’’’からなる群より選択され;
− R’’、R’’’およびR’’’’は各々、水素、C1-6アルキル、C3-8シクロアルキル、アリールおよびヘテロアリールからなる群より選択され、各前記基は場合によりハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R51個以上、好ましくは1〜3個で置換されているか、または、R’’およびR’’’は一緒になってアリールまたはヘテロアリール基を形成し、前記基は、臭素、C2-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、アルキルアンモニウムおよびアリールアンモニウムからなる群より選択
される置換基R51個、または、ハロゲン原子、C1-6アルキル、C1-6アルコキシ、アリール、アルキルスルホネート、アリールスルホネート、アルキルホスホネート、アリールホスホネート、C1-6アルキル−C1-6アルコキシシリル、C1-6アルキル−アリールオキシシリル、アルキルアンモニウムおよびアリールアンモニウムからなる群より各々独立して選択される置換基R52個以上で置換されており;
− R’は一般式(IIA)を有する化合物中に含まれる場合はR’’、R’’’およびR’’’’と同様に定義され、または、一般式(IIB)を有する化合物中に含まれる場合はC1-6アルキレンおよびC3-8シクロアルキレンからなる群より選択され、前記アルキレンまたはシクロアルキレン基は場合により置換基R51個以上で置換されており;
− R2はアニオン性配位子であり;
− R6は芳香族および不飽和の脂環族基、好ましくはアリールおよびC4-20シクロアルケニル基であって、前記基はC1-6アルキル基1個以上で場合により置換されたものである、鎖体、その塩、その溶媒和物およびそのエナンチオマー。 - 請求項27に記載の5配位金属鎖体を製造するための中間体としての、請求項39または40記載の4配位金属鎖体の使用。
- 下記成分:
(a)請求項1〜18および27〜34の何れかに記載の触媒活性5配位金属鎖体、および、
(b)前記触媒活性5配位金属鎖体(a)を支持するのに適する担体の支持量、
を含む不均一触媒反応において使用するための支持された触媒。 - 前記担体が多孔性無機固体、例えば不定形または擬似結晶性の物質、結晶性モレキュラーシーブおよび変性層状物質、例えば無機酸化物1種以上および有機重合体樹脂からなる群より選択される、請求項42に記載の支持された触媒。
- 転移反応、原子転移ラジカル反応、付加重合反応およびビニル化反応からなる群より選択される反応における触媒成分としての、請求項1〜18および27〜34の何れかに記載の5配位金属鎖体または請求項42または43に記載の支持された触媒の使用。
- 前記反応が第1のオレフィンを第2のオレフィン少なくとも1種に、または、直鎖オレフィンオリゴマーまたは重合体または環状オレフィンに変換するための転移反応である、請求項44に記載の使用。
- 第1のオレフィン性化合物少なくとも1種を請求項1〜18および27〜34の何れかに記載の5配位金属鎖体または請求項42または43に記載の支持された触媒と接触させることを含む、転移反応を行う方法。
- 前記第1のオレフィン性化合物が1個以上の官能性原子、または、ヒドロキシル、チオール(メルカプト)、ケトン、アルデヒド、エステル(カルボキシレート)、チオエステル、シアノ、シアナト、エポキシ、シリル、シリルオキシ、シラニル、シロキサザニル、ボロナト、ボリル、スタニル、ジスルフィド、カーボネート、イミン、カルボキシル、アミン、アミド、カルボキシル、イソシアネート、チオイソシアネート、カルボジイミド、エーテル(好ましくはC1-20アルコキシまたはアリールオキシ)、チオエーテル(好ましくはC1-20チオアルコキシまたはチオアリールオキシ)、ニトロ、ニトロソ、ハロゲン、アンモニウム、ホスホネート、ホスホリル、ホスフィノ、ホスファニル、C1-20アルキルスルファニル、アリールスルフィニル、スルホンアミドおよびスルホネートからなる群より選択される基を含む、請求項46に記載の方法。
- 前記第1のオレフィン性化合物の官能性の原子または基が第1のオレフィンの置換している基の部分である、請求項46に記載の方法。
- 前記第1のオレフィン性化合物の官能性の基が第1のオレフィンの炭素鎖の部分である、請求項46に記載の方法。
- 前記第1のオレフィン性化合物が非環状のモノオレフィンである、請求項46に記載の方法。
- 前記転移反応が、式R8CH=CHR10を有するモノオレフィンおよび式R9CH=CHR11を有するモノオレフィンの混合物、ただしR8、R9、R10およびR11は独立して官能性の原子または基1個以上を場合により担持したC1-20アルキル基から選択されるもの、を式R8CH=CHR9有するモノオレフィンおよび式R10CH=CHR11を有するモノオレフィンの混合物に変換する、請求項46〜49の何れかに記載の方法。
- 前記第1のオレフィンがジオレフィンまたは炭素原子少なくとも3個の環の大きさを有する環状モノオレフィンである、請求項46〜49の何れかに記載の方法。
- 前記転移反応が前記ジオレフィンまたは環状オレフィンから直鎖オレフィンのオリゴマーまたは重合体への変換のために適する条件下で行われる、請求項52に記載の方法。
- 前記第1のオレフィンがジオレフィンであり、そして前記転移反応が前記ジオレフィンを環状オレフィンと脂肪族アルファオレフィンとの混合物に変換するために適する条件下で行われる、請求項52に記載の方法。
- 前記転移反応が、2種の同じでないオレフィンの混合物、yただし少なくとも一方が(i)炭素原子5〜12個を含むシクロジエン、および、(ii)下記式:
aは0〜2の整数であり、
bは1および2から選択され、
cは0および1から選択され、
mおよびpは式(V)の炭化水素鎖が炭素原子10〜18個を含むようにするものであり、
rおよびtは式(IV)の2種の同じでないオレフィンの炭化水素鎖中の炭素原子の合計が12〜40となるようにするものであり、
X、X’およびX’’は水素、ハロゲン、メチル、アセチル、−CHOおよび−OR12から独立して選択され、ここでR12は水素およびテトラヒドロピラニル、テトラヒドロフラニル、t−ブチル、トリチル、エトキシエチルおよびSiR13R14R15からなる群より選択されるアルコール保護基から選択され、ここで、R13、R14およびR15は各々独立してC1-6アルキル基およびアリール基から選択される、方法。 - 前記不飽和の生物学的活性化合物がフェロモンまたはフェロモン前駆体、殺虫剤または殺虫剤前駆体、医薬化合物または医薬中間体、芳香剤または芳香剤前駆体である、請求項55に記載の方法。
- 前記不飽和の生物学的活性化合物が7,11−ヘキサデカジエニルアセテート、1−クロロ−5−デセン、トランス、トランス−8,10−ドデカ−ジエノール、3,8,10−ドデカトリエノール、5−デセニルアセテート、11−テトラデセニルアセテートおよび1,5,9−テトラデカトリエンからなる群より選択される、請求項55または56に記載の方法。
- 前記第1のオレフィン性化合物が炭素−炭素二重結合および炭素−炭素3重結合を含む、請求項46に記載の方法。
- 前記転移反応が前記第1のオレフィン性化合物をビニルシクロアルカンに変換する、請求項58に記載の方法。
- 前記方法を、溶媒を使用せずに行う、請求項46〜59の何れかに記載の方法。
- 前記方法がプロトン性溶媒、極性非プロトン性溶媒および非極性溶媒からなる群より選択される溶媒中で行われる、請求項46〜59の何れかに記載の方法。
- 前記第1のオレフィンを有機または無機の酸または好ましくはアルミニウム、チタンまたはホウ素系のルイス酸に接触させることを更に含む、請求項46〜61の何れかに記載の方法。
- 環状オレフィンの開環転移重合の開始を制御するための、請求項1〜18および27〜34の何れかに記載の5配位金属鎖体または請求項42または43に記載の支持された触媒の使用。
- 重合開始の制御が、下記:
(a)第1に、前記複合体または支持された触媒を、前記環状モノオレフィンと、反応器中、前記複合体または支持された触媒が実質的に不活性である第1の温度において接触させること、および、
(b)第2の工程において反応器の温度を、前記複合体または支持された触媒が活性となる第2の温度とすること、
により行われる、請求項63に記載の使用。 - 前記反応がポリハロゲン化アルカンのオレフィン上への付加反応である、請求項44に記載の使用。
- ラジカル(共)重合性の単量体の原子または基転移ラジカル重合のための触媒系の触媒成分としての下記:
− 請求項1〜18および27〜34の何れかに記載の5配位金属鎖体または請求項42または43に記載の支持された触媒、または、
− 図4に示す一般式(IC)および(ID)の一方を有する5配位金属鎖体またはそのカチオン性核種を場合により担体の支持量と組み合わせたもの、ただしここで:
− M、Z、R’、R’’、R’’’、R’’’’、R2、R3、R4およびyは請求項27において定義したものであり、
− R16は中性の電子供与体であるもの、
から選択される化合物の使用。 - R16が式PR17R18R19のホスフィンであり、ここで、R17、R18およびR19は各々独立してC1-20アルキル、C3-10シクロアルキル、ヘテロアリールおよびアリールからなる群より選択される、請求項66に記載の使用。
- ラジカル転移可能な原子または基を有する重合開始剤と組み合わせた、請求項66または67に記載の使用。
- 界面活性剤と組み合わせた、請求項66〜68の何れかに記載の使用。
- 前記反応が、場合により炭素原子4〜20個を有するジエン1種以上と組み合わせた炭素原子2〜12個を有するα−オレフィン1種以上の付加重合である、請求項44に記載の使用。
- 触媒活性5配位金属鎖体が請求項27に記載の一般式(IB)を有する鎖体である、請求項70に記載の使用。
- 場合により炭素原子4〜20個を有するジエン1種以上と組み合わせた炭素原子2〜12個を有するα−オレフィン1種以上の付加重合のための触媒系であって、下記要素:
(A)請求項27に記載の一般式(IB)を有する鎖体、
(B)化合物(A)と反応することによりそのイミン部分を金属アミン構造に変換する能力を有する化合物、および、
(C)化合物(A)と反応することによりイオン対を形成する能力を有する化合物、
を含む、触媒系。 - 請求項27記載の5配位金属鎖体の担体への共有結合に適する誘導体であって、R’および/またはR’’が下記式:
− R20はC1-6アルキレン、アリーレン、ヘテロアリーレンおよびC3-8シクロアルキレンからなる群より選択される基であり、前記基は場合により、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C2-20アルコキシカルボニル、C1-20アルチルスルホニル、C1-20アルキニルスルホニル、C1-20アルキルチオ、アリールオキシおよびアリールからなる群より各々が独立して選択される置換基R241個以上で置換されており;
− Dは酸素、イオウ、ケイ素、アリーレン、メチレン、CHR24、C(R24)2、NH、NR24およびPR24からなる群より選択される二価の原子または基であり;
− R21、R22およびR23は各々独立して水素、ハロゲンおよびR24からなる群より選択され;
− nは1〜20の整数であるが;
ただし、R21、R22およびR23の少なくとも1個はC1-20アルコキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C2-20アルコキシカルボニル、C1-20アルキルスルホニル、C1-20アルキニルスルフィニル、C1-20アルキルチオおよびアリールオキシからなる群より選択される)
を有する基で置き換えられるか置換されている、誘導体。 - R’が3−(トリエトキシシリル)プロピル基で置き換えられるか置換されている、請求項73に記載の誘導体。
- 下記要素:
(a)請求項73または74に記載の誘導体、および、
(b)担体、
の共有結合の生成物を含む不均一触媒反応において使用するための、支持された触媒。 - 前記担体が無機の酸化物1種以上を含む、請求項75に記載の支持された触媒。
- 前記担体がシリカ、ジルコニア、アルミノシリカ、天然および合成のゼオライト、およびこれらの混合物からなる群より選択される、請求項76または76に記載の支持された触媒。
- 前記担体が有機重合性物質である、請求項75に記載の支持された触媒。
- 前記担体が、芳香族環がC1-6アルキル、C3-10シクロアルキル、アリールおよびヘテロアリールから選択される基1個以上で置換されているポリスチレン樹脂またはその誘導体である、請求項78に記載の支持された触媒。
- 直接または間接的にスペーサー分子を介して、そのNおよび/またはZ原子により、および/または、R’、R’’またはR’’’が官能基を担持している場合は前記官能基により、コア分子に各々結合している、請求項27〜34、39および40の何れかに記載の化合物2種以上を含む、デンドリマー物質。
- 請求項80に記載のデンドリマー物質であって、コア分子が下記要素:
− アリール、ポリアリール、C1-20アルキル、シクロアルキルおよび複素環シクロアルキル基、および、
− 式A(R20)nX3-n、ただしここでR20はC1-6アルキレン、アリーレン、ヘテロアリーレンおよびC3-8シクロアルキレンからなる群より選択される基であり、前記基は場合により、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C2-20アルコキシカルボニル、C1-20アルキスルホニル、C1-20アルキスルフィニル、C1-20アルキルチオ、アリールオキシおよびアリールからなる群より各々が独立して選択される置換基R241個以上で置換されており;Aは周期律表のIIIA族の元素または窒素であるもの、または式G(R20)nX4-n、ただしGがIVA族の元素であるもの、または、式J(R20)nX5-n、ただしJが窒素以外のVA族の元素であるもの、ただし、前記式においてXは水素またはハロゲンであるもの;または式E(R20)nX2-n、ただしEがVIA族の元素であるもの、を有する基、および、
− 周期律表のIIB、IIIB、IVB、VB、VIB、VIIBおよびVIIIB族の何れかの金属の遷移金族化合物、
からなる群より選択される、物質。 - 請求項80または81に記載のデンドリマー物質であって、スペーサー分子が一般式R20−(CH2)−Dを有し、ここでR20はC1-6アルキレン、アリーレン、ヘテロアリーレンおよびC3-8シクロアルキレンからなる群より選択される基であり、前記基は場合により、C1-20アルキル、C2-20アルケニル、C2-20アルキニル、C1-20カルボキシレート、C1-20アルコキシ、C2-20アルケニルオキシ、C2-20アルキニルオキシ、C2-20アルコキシカルボニル、C1-20アルキスルホニル、C1-20アルキスルフィニル、C1-20アルキルチ
オ、アリールオキシおよびアリールからなる群より各々が独立して選択される置換基R241個以上で置換されており;そしてDは酸素、イオウ、ケイ素、アリーレン、メチレン、CHR24、C(R24)2、NH、NR24およびPR24からなる群より選択されるにかの原子または基である、物質。 - 第1のオレフィンを少なくとも1種の第2のオレフィンに、または、直鎖オレフィンのオリゴマーまたは重合体に転移させるための触媒としての請求項80〜82の何れかに記載のデンドリマー物質の使用であって、前記触媒が限外濾過による反応混合物からの除去に適するものである、使用。
- 図4に示す一般式(IC)および(ID)の一方を有する5配位金属鎖体であって、式中、
− M、Z、R’、R’’、R’’’、R’’’’、R2、R3、R4は請求項27において定義したものであり、
− yは1〜3のであり、そして、
− R16は中性の電子供与体である、鎖体。 - 図4に示す一般式(IC)および(ID)の一方を有する5配位金属鎖体であって、式中、
− Z、R’、R’’、R’’’、R’’’’、R2、R3、R4は請求項27において定義したものであり、
− Mは鉄、モリブデン、タングステン、チタン、レニウム、銅、クロム、マンガン、ロジウム、バナジウム、亜鉛、金、銀、コバルト、パラジウム、白金およびニッケルからなる群より選択される金属であり、
− yは0であり、そして、
− R16は中性の電子供与体である、鎖体。 - ヘテロジアリル化合物からの1−ヘテロ−2,4−シクロペンタジエン化合物の合成のための、1工程方法。
- 前記ヘテロジアリル化合物を、一方の金属はカルベン配位子、多座配位子および他の配位子1個以上に対して5配位であり、他方の金属は中性の配位子1個以上およびアニオン性配位子1個以上に対して4配位である2金属鎖体以上と接触させる、請求項86に記載の金属。
- 前記1−ヘテロ−2,4−シクロペンタジエン化合物がピロール、フラン、チオフェンおよび誘導体からなる群より選択される、請求項86または87に記載の方法。
- アルキル基が炭素原子1〜4個を有する、ジアルキルジアリルアミノメチルホスホネート。
- アルキル基が炭素原子1〜4個を有する、ジアルキル1H−ピロール−1−イルメチルホスホネート。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP02075250A EP1329455A1 (en) | 2002-01-22 | 2002-01-22 | Metal carbene complexes, methods and intermediates for making them and their use in metathesis reactions |
| US34995602P | 2002-02-01 | 2002-02-01 | |
| PCT/BE2003/000008 WO2003062253A1 (en) | 2002-01-22 | 2003-01-22 | Metal complexes for use in metathesis |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009218735A Division JP5100728B2 (ja) | 2002-01-22 | 2009-09-24 | メタセシスに使用される金属錯体 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2005515260A true JP2005515260A (ja) | 2005-05-26 |
| JP2005515260A5 JP2005515260A5 (ja) | 2006-01-12 |
| JP4477879B2 JP4477879B2 (ja) | 2010-06-09 |
Family
ID=27614617
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003562130A Expired - Fee Related JP4477879B2 (ja) | 2002-01-22 | 2003-01-22 | 複分解に使用される金属錯体 |
| JP2009218735A Expired - Fee Related JP5100728B2 (ja) | 2002-01-22 | 2009-09-24 | メタセシスに使用される金属錯体 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009218735A Expired - Fee Related JP5100728B2 (ja) | 2002-01-22 | 2009-09-24 | メタセシスに使用される金属錯体 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US7687635B2 (ja) |
| EP (2) | EP1468004B1 (ja) |
| JP (2) | JP4477879B2 (ja) |
| AT (2) | ATE348835T1 (ja) |
| AU (1) | AU2003236511B2 (ja) |
| CA (1) | CA2473029A1 (ja) |
| DE (2) | DE60327378D1 (ja) |
| DK (2) | DK1468004T3 (ja) |
| ES (2) | ES2323803T3 (ja) |
| WO (1) | WO2003062253A1 (ja) |
| ZA (1) | ZA200405685B (ja) |
Cited By (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006016606A (ja) * | 2004-05-31 | 2006-01-19 | Nippon Zeon Co Ltd | 環状オレフィンの付加重合用触媒、およびこれを用いた環状オレフィン付加重合体の製造方法 |
| JP2009504401A (ja) * | 2005-08-22 | 2009-02-05 | テレーヌ ソシエテ パル アクシオン サンプリフィエー | 転換反応に使用する多座配位金属錯体 |
| JP2009523605A (ja) * | 2006-01-19 | 2009-06-25 | エージェンシー フォー サイエンス,テクノロジー アンド リサーチ | 不均一キラル触媒 |
| JP2009533215A (ja) * | 2006-04-11 | 2009-09-17 | エージェンシー フォー サイエンス, テクノロジー アンド リサーチ | 閉環メタセシスのための触媒 |
| JP2010522079A (ja) * | 2007-03-22 | 2010-07-01 | エージェンシー フォー サイエンス,テクノロジー アンド リサーチ | シリカ系メソセル発泡体へのクリックケミストリーによる触媒の固定 |
| JP2012077284A (ja) * | 2010-09-10 | 2012-04-19 | Showa Denko Kk | ノルボルネン系モノマー重合用触媒及びノルボルネン系重合体の製造方法 |
| JP2012533591A (ja) * | 2009-07-21 | 2012-12-27 | テレーヌ ソシエテ パル アクシオン サンプリフィエー | オレフィンメタセシス反応用触媒錯体、その製造方法及びその使用 |
| US8592336B2 (en) | 2006-04-11 | 2013-11-26 | Agency For Science, Technology And Research | Catalysts for ring-closing metathesis |
| WO2014050890A1 (ja) | 2012-09-26 | 2014-04-03 | Rimtec株式会社 | 重合性組成物および樹脂成形体の製造方法 |
| WO2015046028A1 (ja) | 2013-09-27 | 2015-04-02 | Rimtec株式会社 | ノルボルネン系架橋重合体およびその製造方法 |
| WO2015098636A1 (ja) | 2013-12-26 | 2015-07-02 | Rimtec株式会社 | 複合成形体の製造方法 |
| WO2016013629A1 (ja) * | 2014-07-24 | 2016-01-28 | 日本ポリエチレン株式会社 | オレフィン重合触媒及びオレフィン重合体の製造方法 |
| WO2017138304A1 (ja) | 2016-02-10 | 2017-08-17 | Rimtec株式会社 | 重合性組成物及び複合材料 |
| WO2017204051A1 (ja) | 2016-05-27 | 2017-11-30 | Rimtec株式会社 | 複合材料成形体の製造方法 |
| WO2018207861A1 (ja) | 2017-05-11 | 2018-11-15 | 公益財団法人鉄道総合技術研究所 | 超電導コイル装置及びその製造方法 |
| WO2019235538A1 (ja) | 2018-06-07 | 2019-12-12 | Rimtec株式会社 | 複合材料および複合材料成形体 |
| WO2020218242A1 (ja) | 2019-04-23 | 2020-10-29 | Rimtec株式会社 | シクロオレフィン樹脂加飾成形品の製造方法 |
| WO2021024956A1 (ja) | 2019-08-06 | 2021-02-11 | Rimtec株式会社 | 重合性組成物、シクロオレフィン系重合体および金属樹脂複合体 |
| WO2021215533A1 (ja) | 2020-04-24 | 2021-10-28 | Rimtec株式会社 | 重合反応性配合液の製造方法 |
| WO2022030310A1 (ja) | 2020-08-03 | 2022-02-10 | Rimtec株式会社 | シクロオレフィン系樹脂硬化物 |
| WO2022045204A1 (ja) | 2020-08-28 | 2022-03-03 | Rimtec株式会社 | 酸素バリア性シクロオレフィン系樹脂硬化物 |
| WO2022118614A1 (ja) | 2020-12-03 | 2022-06-09 | Rimtec株式会社 | 重合性組成物及び樹脂含浸超電導コイル |
| WO2022230803A1 (ja) | 2021-04-30 | 2022-11-03 | Rimtec株式会社 | 金属樹脂積層体及び金属樹脂積層体の製造方法 |
| WO2025013577A1 (ja) | 2023-07-10 | 2025-01-16 | Rimtec株式会社 | 重合性組成物及び樹脂含浸超電導コイル |
Families Citing this family (81)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2473029A1 (en) * | 2002-01-22 | 2003-07-31 | Universiteit Gent | Ruthenium and osmium carbene complexes for use in metathesis |
| WO2005035121A2 (en) * | 2003-10-16 | 2005-04-21 | Universiteit Gent | Schiff base metal complexes for use as catalysts in organic synthesis |
| DE102004002178A1 (de) * | 2004-01-15 | 2005-08-11 | Ivoclar Vivadent Ag | Dentalmeterialien auf der Basis von RÖMP-Kompositen |
| EP1577282B1 (en) | 2004-02-26 | 2011-06-15 | Telene SAS | Metal complexes for use in olefin metathesis and atom or group transfer reactions |
| US20070185343A1 (en) * | 2004-02-26 | 2007-08-09 | Universiteit Gent | Metal complexes for use in olefin metathesis and atom group transfer reactions |
| DE102004039277A1 (de) * | 2004-08-13 | 2006-02-23 | Merck Patent Gmbh | Am Zentralatom substituierte, immoblisierbare Ruthenium(II)-Katalysatoren, Verfahren zu deren Herstellung und Verwendung |
| GB0517137D0 (en) | 2005-08-22 | 2005-09-28 | Viacatt N V | Multicoordinated metal complexes for use in metalthesis reactions |
| CN100465195C (zh) * | 2006-04-29 | 2009-03-04 | 中国科学院长春应用化学研究所 | 一种β-羟基丙烯亚胺钒烯烃聚合催化剂及制备方法和应用 |
| CN100424100C (zh) * | 2006-05-25 | 2008-10-08 | 中国科学院长春应用化学研究所 | 一种β-酮亚胺钒烯烃聚合催化剂及制备方法和应用 |
| WO2008064223A1 (en) * | 2006-11-21 | 2008-05-29 | California Institute Of Technology | Olefin metathesis initiators bearing thiazol-2-ylidene ligands |
| WO2008067443A1 (en) * | 2006-11-29 | 2008-06-05 | Board Of Governors For Higher Education, | Aerobic oxidative coupling for the formation biaryls |
| KR101015435B1 (ko) * | 2006-12-05 | 2011-02-22 | 주식회사 엘지화학 | 중합체 제조방법 |
| FR2910004A1 (fr) * | 2006-12-14 | 2008-06-20 | Rhodia Recherches & Tech | Procede d'oligomerisation et/ou polymerisation du composes insatures |
| WO2008156451A1 (en) * | 2007-06-20 | 2008-12-24 | Agency For Science, Technology And Research | N-heterocyclic carbene metallacycle catalysts and methods |
| EP2170923B1 (en) | 2007-06-25 | 2015-10-14 | Sun Chemical Corporation | Process for preparation of oligomeric or polymeric compounds using selective michael addition |
| WO2009009597A1 (en) * | 2007-07-09 | 2009-01-15 | The Regents Of The University Of California | Water soluble olefin metathesis |
| US8263712B2 (en) | 2007-09-04 | 2012-09-11 | Exxonmobil Research And Engineering Company | Production of elastomeric functionalized olefin polymers |
| EP2042537B1 (en) * | 2007-09-28 | 2014-05-14 | Rimtec Corporation | Polycycloolefin (PCO) thermoset assembly and process for its preparation |
| WO2009085040A1 (en) * | 2007-12-27 | 2009-07-09 | Dcb-Usa Llc | Protein kinase inhibitors |
| US8080681B2 (en) | 2007-12-28 | 2011-12-20 | Chevron Phillips Chemical Company Lp | Nano-linked metallocene catalyst compositions and their polymer products |
| US8012900B2 (en) | 2007-12-28 | 2011-09-06 | Chevron Phillips Chemical Company, L.P. | Nano-linked metallocene catalyst compositions and their polymer products |
| US7863210B2 (en) | 2007-12-28 | 2011-01-04 | Chevron Phillips Chemical Company Lp | Nano-linked metallocene catalyst compositions and their polymer products |
| DE102009017498A1 (de) | 2009-04-16 | 2010-10-28 | Süd-Chemie AG | Verwendung einer Katalysatorzusammensetzung zur Olefinmetathese in der Gasphase und Verfahren zur Olefinmetathese in der Gasphase |
| US20120035331A1 (en) * | 2009-04-28 | 2012-02-09 | Korea Institute Of Science And Technology | Polyalkylthiophene block copolymer and a method of preparing the same through a ring-opening metathesis polymerization reaction |
| US7919639B2 (en) | 2009-06-23 | 2011-04-05 | Chevron Phillips Chemical Company Lp | Nano-linked heteronuclear metallocene catalyst compositions and their polymer products |
| GB2479830A (en) * | 2010-04-23 | 2011-10-26 | Helvetica Ind | Phosphine oxide and phosphonate pyrrole derivatives |
| ES2948064T3 (es) | 2010-08-23 | 2023-08-30 | Materia Inc | Modificaciones de flujo de VARTM para sistemas de resina de viscosidad baja |
| EP2620483B1 (en) | 2010-09-22 | 2016-02-10 | Zeon Corporation | Adhesive film for organic electrolyte accumulator devices |
| US8937207B2 (en) * | 2010-12-22 | 2015-01-20 | Richard Dehn | Use of supported ruthenium-carbene complexes in continuously operated reactors |
| US20120289617A1 (en) * | 2011-05-10 | 2012-11-15 | Saudi Arabian Oil Company | Hybrid Catalyst for Olefin Metathesis |
| SG10201601566TA (en) | 2011-06-17 | 2016-03-30 | Materia Inc | Adhesion Promoters And Gel-Modifiers For Olefin Metathesis Compositions |
| US8993819B2 (en) | 2011-07-12 | 2015-03-31 | Basf Se | Process for preparing cycloheptene |
| EP2731923B1 (de) | 2011-07-12 | 2015-09-09 | Basf Se | Verfahren zur herstellung von cyclohepten |
| EP2753655B1 (en) | 2011-09-07 | 2019-12-04 | Dow Silicones Corporation | Titanium containing complex and condensation reaction catalysts, methods for preparing the catalysts, and compositions containing the catalysts |
| EP2753663B1 (en) | 2011-09-07 | 2020-01-08 | Dow Silicones Corporation | Zirconium containing complex and condensation reaction catalysts, methods for preparing the catalysts, and compositions containing the catalysts |
| US9139699B2 (en) * | 2012-10-04 | 2015-09-22 | Dow Corning Corporation | Metal containing condensation reaction catalysts, methods for preparing the catalysts, and compositions containing the catalysts |
| US9328205B2 (en) | 2011-10-04 | 2016-05-03 | Dow Corning Corporation | Iron(III) containing complex and condensation reaction catalysts, methods for preparing the catalysts, and compositions containing the catalysts |
| CN103827126B (zh) * | 2011-11-18 | 2017-05-17 | 株式会社艾迪科 | 新型化合物和担载该新型化合物的担载体 |
| GB201204715D0 (en) | 2012-03-18 | 2012-05-02 | Croda Int Plc | Metathesis of olefins using ruthenium-based catalytic complexes |
| MX356142B (es) | 2012-06-13 | 2018-05-16 | Basf Se | Metodo para producir cetonas macrociclicas. |
| SG11201408648YA (en) | 2012-06-29 | 2015-01-29 | Apeiron Synthesis Sa | Metal complexes, their application and methods of carrying out of metathesis reaction |
| EP2695901B1 (de) | 2012-08-10 | 2016-09-14 | Basf Se | Aliphatische langkettige Polykondensate |
| TWI485145B (zh) | 2012-10-26 | 2015-05-21 | Ind Tech Res Inst | P型有機半導體材料與光電元件 |
| US9527982B2 (en) | 2012-12-19 | 2016-12-27 | Materia, Inc. | Storage stable adhesion promoter compositions for cyclic olefin resin compositions |
| US9598531B2 (en) | 2013-02-27 | 2017-03-21 | Materia, Inc. | Olefin metathesis catalyst compositions comprising at least two metal carbene olefin metathesis catalysts |
| CA2902451C (en) * | 2013-02-27 | 2021-05-25 | Materia, Inc. | Metal carbene olefin metathesis two catalyst composition |
| EP2970522B1 (en) | 2013-03-15 | 2025-05-21 | Materia, Inc. | In-mold coating of romp polymers |
| US9663440B2 (en) | 2013-04-09 | 2017-05-30 | Materia, Inc. | Cross metathesis of poly-branched poly-olefins |
| EP3013886B1 (en) | 2013-06-24 | 2025-03-26 | Materia, Inc. | Thermal insulation |
| US9751975B2 (en) | 2013-07-03 | 2017-09-05 | Materia, Inc. | Liquid molding compositions |
| US9890239B2 (en) | 2013-09-04 | 2018-02-13 | California Institute Of Technology | Functionalized linear and cyclic polyolefins |
| EP3092204A4 (en) | 2014-01-10 | 2017-12-20 | Materia, Inc. | Method and composition for improving adhesion of metathesis compositions to substrates |
| WO2015130802A1 (en) | 2014-02-27 | 2015-09-03 | Materia, Inc. | Adhesion promoter compositions for cyclic olefin resin compositions |
| WO2016000242A1 (en) | 2014-07-03 | 2016-01-07 | Guang Ming Innovation Company (Wuhan) | Group 8 transition metal catalysts and method for making same and process for use of same in metathesis reaction |
| PL2982709T3 (pl) | 2014-08-07 | 2017-12-29 | Telene Sas | Kompozycja utwardzalna i wytwór formowany zawierający kompozycję |
| US9856352B2 (en) | 2014-08-07 | 2018-01-02 | Ppg Industries Ohio, Inc. | Glass fiber sizing compositions, sized glass fibers, and polyolefin composites |
| TWI688609B (zh) | 2014-11-13 | 2020-03-21 | 美商道康寧公司 | 含硫聚有機矽氧烷組成物及相關態樣 |
| WO2016130743A1 (en) | 2015-02-12 | 2016-08-18 | Materia, Inc. | Cyclic olefin resin compositions comprising functional elastomers |
| US10344118B2 (en) | 2015-02-14 | 2019-07-09 | Materia, Inc. | Romp polymers having improved resistance to hydrocarbon fluids |
| EP3153227A1 (de) * | 2015-10-07 | 2017-04-12 | Evonik Degussa GmbH | Verfahren zur herstellung von polyalkenameren für verpackungsanwendungen |
| EP3202813A1 (en) | 2016-02-05 | 2017-08-09 | Telene SAS | Curable composition and molded article comprising the composition |
| US11179879B2 (en) | 2016-02-07 | 2021-11-23 | Stratasys Ltd. | Three-dimensional printing combining ring-opening metathesis polymerization and free radical polymerization |
| US11118004B2 (en) | 2016-04-26 | 2021-09-14 | Stratasys Ltd. | Three-dimensional inkjet printing using ring-opening metathesis polymerization |
| EP3515885B1 (en) | 2016-09-23 | 2023-12-13 | Umicore Ag & Co. Kg | Preparation of amino acids and amino acid derivatives |
| JP7153937B2 (ja) | 2017-02-17 | 2022-10-17 | プロビビ インコーポレイテッド | オレフィンメタセシスによるフェロモンおよび関連材料の合成方法 |
| US10245583B1 (en) * | 2017-09-12 | 2019-04-02 | Chevron Phillips Chemical Company, Lp | Use of charge-containing molecules linked with covalent bonds to enhance acetylene hydrogenation catalysts |
| CN112004598B (zh) | 2018-04-20 | 2024-07-19 | 阿朗新科德国有限责任公司 | 氢化催化剂组合物及其用于氢化丁腈橡胶的用途 |
| CN108559083B (zh) * | 2018-04-26 | 2020-07-14 | 大连理工大学 | 一种结晶性聚单硫代碳酸酯的制备方法 |
| CN109046463B (zh) * | 2018-08-16 | 2021-05-04 | 中山大学 | 双齿氮杂卡宾锰催化剂及其制备方法和烷基化合成应用 |
| CN111068774B (zh) * | 2018-10-18 | 2022-11-04 | 中国石油化工股份有限公司 | 2,6-萘二甲酸合成所用催化剂和其应用 |
| CN112250843B (zh) * | 2020-10-16 | 2023-05-30 | 湘潭大学 | 四种D-A’-(π-A)2型聚合烷基化水杨醛席夫碱衍生物合金属配合物及其制备方法与用途 |
| CN115518689B (zh) * | 2021-06-24 | 2023-10-31 | 中国石油化工股份有限公司 | 一种环氧烷烃水合制二醇催化剂及其制备方法和应用 |
| US11780864B2 (en) * | 2021-07-07 | 2023-10-10 | The Hong Kong University Of Science And Technology | Rhenium(V) alkylidyne complexes and methods of use and preparation thereof |
| CN113666956B (zh) * | 2021-08-25 | 2023-04-25 | 上海橡实化学有限公司 | 一种水杨醛亚胺硅烷偶联剂及其制备方法和应用 |
| WO2023220706A2 (en) * | 2022-05-12 | 2023-11-16 | Yale University | Catalyst, system and method for mineralization of organic pollutants |
| CN115463655B (zh) * | 2022-06-23 | 2024-05-14 | 浙江恒逸石化研究院有限公司 | 一种可一步法制备高顺反比2,2,4,4-四甲基-1,3-环丁二醇的催化剂及其应用 |
| CN116351472B (zh) * | 2023-02-22 | 2024-06-25 | 万华化学集团股份有限公司 | 一种催化精馏生产异氰酸酯的制备方法和系统 |
| CN116970148A (zh) * | 2023-06-15 | 2023-10-31 | 天津大学 | 一种高性能宽加工窗口的环烯烃共聚物及其制备方法 |
| CN116693812A (zh) * | 2023-06-16 | 2023-09-05 | 北京大学 | 含有离去基团的烯丙基化合物作为封端剂的应用 |
| CN121135989A (zh) * | 2025-11-18 | 2025-12-16 | 湖南工程学院 | 共价有机框架材料及其制备方法和应用 |
| CN121182370A (zh) * | 2025-11-24 | 2025-12-23 | 合肥绿拓新材料科技有限公司 | 一种金属螯合成膜剂及其制备方法、应用 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4035032C1 (ja) | 1990-11-03 | 1992-04-30 | Degussa Ag, 6000 Frankfurt, De | |
| EP0563730A3 (en) * | 1992-03-28 | 1994-07-27 | Hoechst Ag | Alkenylaminoalkylene phosphonic acid esters and process for the preparation of copolymers comprising alkenylaminoalkylene phosphonates and ethylenic unsaturated compounds |
| US6541580B1 (en) | 1995-03-31 | 2003-04-01 | Carnegie Mellon University | Atom or group transfer radical polymerization |
| US5763548A (en) | 1995-03-31 | 1998-06-09 | Carnegie-Mellon University | (Co)polymers and a novel polymerization process based on atom (or group) transfer radical polymerization |
| US6410664B1 (en) * | 1997-03-24 | 2002-06-25 | Cryovac, Inc. | Catalyst compositions and processes for olefin polymers and copolymers |
| US6284852B1 (en) | 1997-10-30 | 2001-09-04 | California Institute Of Technology | Acid activation of ruthenium metathesis catalysts and living ROMP metathesis polymerization in water |
| DE19748468A1 (de) | 1997-11-03 | 1999-05-06 | Hoechst Ag | Beschichtete Gestricke als katalytische Füllungen für Destillationskolonnen |
| US5977393A (en) * | 1997-11-21 | 1999-11-02 | California Institute Of Technology | Schiff base derivatives of ruthenium and osmium olefin metathesis catalysts |
| US6696597B2 (en) | 1998-09-01 | 2004-02-24 | Tilliechem, Inc. | Metathesis syntheses of pheromones or their components |
| JP2002020417A (ja) | 2000-07-04 | 2002-01-23 | Mitsui Chemicals Inc | オレフィンの重合方法 |
| CA2473029A1 (en) * | 2002-01-22 | 2003-07-31 | Universiteit Gent | Ruthenium and osmium carbene complexes for use in metathesis |
| WO2005035121A2 (en) | 2003-10-16 | 2005-04-21 | Universiteit Gent | Schiff base metal complexes for use as catalysts in organic synthesis |
| EP1577282B1 (en) | 2004-02-26 | 2011-06-15 | Telene SAS | Metal complexes for use in olefin metathesis and atom or group transfer reactions |
| US20070185343A1 (en) | 2004-02-26 | 2007-08-09 | Universiteit Gent | Metal complexes for use in olefin metathesis and atom group transfer reactions |
| GB0517137D0 (en) | 2005-08-22 | 2005-09-28 | Viacatt N V | Multicoordinated metal complexes for use in metalthesis reactions |
-
2003
- 2003-01-22 CA CA002473029A patent/CA2473029A1/en not_active Abandoned
- 2003-01-22 DE DE60327378T patent/DE60327378D1/de not_active Expired - Lifetime
- 2003-01-22 JP JP2003562130A patent/JP4477879B2/ja not_active Expired - Fee Related
- 2003-01-22 ES ES06020387T patent/ES2323803T3/es not_active Expired - Lifetime
- 2003-01-22 DE DE60310521T patent/DE60310521T2/de not_active Expired - Lifetime
- 2003-01-22 AU AU2003236511A patent/AU2003236511B2/en not_active Ceased
- 2003-01-22 AT AT03731638T patent/ATE348835T1/de active
- 2003-01-22 ES ES03731638T patent/ES2279117T3/es not_active Expired - Lifetime
- 2003-01-22 AT AT06020387T patent/ATE429437T1/de active
- 2003-01-22 EP EP03731638A patent/EP1468004B1/en not_active Expired - Lifetime
- 2003-01-22 EP EP06020387A patent/EP1743899B1/en not_active Expired - Lifetime
- 2003-01-22 DK DK03731638T patent/DK1468004T3/da active
- 2003-01-22 WO PCT/BE2003/000008 patent/WO2003062253A1/en not_active Ceased
- 2003-01-22 DK DK06020387T patent/DK1743899T3/da active
-
2004
- 2004-07-16 ZA ZA2004/05685A patent/ZA200405685B/en unknown
- 2004-07-19 US US10/894,308 patent/US7687635B2/en not_active Expired - Fee Related
-
2009
- 2009-09-24 JP JP2009218735A patent/JP5100728B2/ja not_active Expired - Fee Related
Cited By (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006016606A (ja) * | 2004-05-31 | 2006-01-19 | Nippon Zeon Co Ltd | 環状オレフィンの付加重合用触媒、およびこれを用いた環状オレフィン付加重合体の製造方法 |
| JP2009504401A (ja) * | 2005-08-22 | 2009-02-05 | テレーヌ ソシエテ パル アクシオン サンプリフィエー | 転換反応に使用する多座配位金属錯体 |
| JP2009523605A (ja) * | 2006-01-19 | 2009-06-25 | エージェンシー フォー サイエンス,テクノロジー アンド リサーチ | 不均一キラル触媒 |
| JP2009533215A (ja) * | 2006-04-11 | 2009-09-17 | エージェンシー フォー サイエンス, テクノロジー アンド リサーチ | 閉環メタセシスのための触媒 |
| US8592336B2 (en) | 2006-04-11 | 2013-11-26 | Agency For Science, Technology And Research | Catalysts for ring-closing metathesis |
| US8648003B2 (en) | 2006-04-11 | 2014-02-11 | Agency For Science, Technology And Research | Catalysts for ring-closing metathesis |
| JP2015037785A (ja) * | 2006-04-11 | 2015-02-26 | エージェンシー フォー サイエンス, テクノロジー アンド リサーチ | 閉環メタセシスのための触媒 |
| JP2010522079A (ja) * | 2007-03-22 | 2010-07-01 | エージェンシー フォー サイエンス,テクノロジー アンド リサーチ | シリカ系メソセル発泡体へのクリックケミストリーによる触媒の固定 |
| JP2012533591A (ja) * | 2009-07-21 | 2012-12-27 | テレーヌ ソシエテ パル アクシオン サンプリフィエー | オレフィンメタセシス反応用触媒錯体、その製造方法及びその使用 |
| JP2012077284A (ja) * | 2010-09-10 | 2012-04-19 | Showa Denko Kk | ノルボルネン系モノマー重合用触媒及びノルボルネン系重合体の製造方法 |
| WO2014050890A1 (ja) | 2012-09-26 | 2014-04-03 | Rimtec株式会社 | 重合性組成物および樹脂成形体の製造方法 |
| WO2015046028A1 (ja) | 2013-09-27 | 2015-04-02 | Rimtec株式会社 | ノルボルネン系架橋重合体およびその製造方法 |
| WO2015098636A1 (ja) | 2013-12-26 | 2015-07-02 | Rimtec株式会社 | 複合成形体の製造方法 |
| WO2016013629A1 (ja) * | 2014-07-24 | 2016-01-28 | 日本ポリエチレン株式会社 | オレフィン重合触媒及びオレフィン重合体の製造方法 |
| WO2017138304A1 (ja) | 2016-02-10 | 2017-08-17 | Rimtec株式会社 | 重合性組成物及び複合材料 |
| WO2017204051A1 (ja) | 2016-05-27 | 2017-11-30 | Rimtec株式会社 | 複合材料成形体の製造方法 |
| WO2018207861A1 (ja) | 2017-05-11 | 2018-11-15 | 公益財団法人鉄道総合技術研究所 | 超電導コイル装置及びその製造方法 |
| WO2019235538A1 (ja) | 2018-06-07 | 2019-12-12 | Rimtec株式会社 | 複合材料および複合材料成形体 |
| WO2020218242A1 (ja) | 2019-04-23 | 2020-10-29 | Rimtec株式会社 | シクロオレフィン樹脂加飾成形品の製造方法 |
| WO2021024956A1 (ja) | 2019-08-06 | 2021-02-11 | Rimtec株式会社 | 重合性組成物、シクロオレフィン系重合体および金属樹脂複合体 |
| WO2021215533A1 (ja) | 2020-04-24 | 2021-10-28 | Rimtec株式会社 | 重合反応性配合液の製造方法 |
| WO2022030310A1 (ja) | 2020-08-03 | 2022-02-10 | Rimtec株式会社 | シクロオレフィン系樹脂硬化物 |
| WO2022045204A1 (ja) | 2020-08-28 | 2022-03-03 | Rimtec株式会社 | 酸素バリア性シクロオレフィン系樹脂硬化物 |
| WO2022118614A1 (ja) | 2020-12-03 | 2022-06-09 | Rimtec株式会社 | 重合性組成物及び樹脂含浸超電導コイル |
| WO2022230803A1 (ja) | 2021-04-30 | 2022-11-03 | Rimtec株式会社 | 金属樹脂積層体及び金属樹脂積層体の製造方法 |
| WO2025013577A1 (ja) | 2023-07-10 | 2025-01-16 | Rimtec株式会社 | 重合性組成物及び樹脂含浸超電導コイル |
Also Published As
| Publication number | Publication date |
|---|---|
| ATE348835T1 (de) | 2007-01-15 |
| EP1743899A1 (en) | 2007-01-17 |
| EP1468004B1 (en) | 2006-12-20 |
| WO2003062253A1 (en) | 2003-07-31 |
| ES2323803T3 (es) | 2009-07-24 |
| US7687635B2 (en) | 2010-03-30 |
| JP2010077128A (ja) | 2010-04-08 |
| JP4477879B2 (ja) | 2010-06-09 |
| EP1743899B1 (en) | 2009-04-22 |
| DK1468004T3 (da) | 2007-04-30 |
| DE60327378D1 (de) | 2009-06-04 |
| US20050043541A1 (en) | 2005-02-24 |
| AU2003236511B2 (en) | 2009-04-09 |
| ZA200405685B (en) | 2005-10-26 |
| ES2279117T3 (es) | 2007-08-16 |
| CA2473029A1 (en) | 2003-07-31 |
| EP1468004A1 (en) | 2004-10-20 |
| DE60310521D1 (de) | 2007-02-01 |
| ATE429437T1 (de) | 2009-05-15 |
| JP5100728B2 (ja) | 2012-12-19 |
| DK1743899T3 (da) | 2009-06-22 |
| DE60310521T2 (de) | 2007-11-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4477879B2 (ja) | 複分解に使用される金属錯体 | |
| AU2003236511A1 (en) | Metal complexes for use in metathesis | |
| KR100333761B1 (ko) | 고복분해활성루테늄및오스뮴금속카르벤착화합물의이용방법 | |
| JP4997096B2 (ja) | オレフィンメタセシスおよび原子またはグループ移動反応に使用するための金属錯体 | |
| EP3164409B1 (en) | Group 8 transition metal catalysts and method for making same and process for use of same in metathesis reaction | |
| US20070185343A1 (en) | Metal complexes for use in olefin metathesis and atom group transfer reactions | |
| CN104936995B (zh) | 制备含极性基团烯烃的聚合物的方法 | |
| WO2005035121A2 (en) | Schiff base metal complexes for use as catalysts in organic synthesis | |
| JP2005501936A (ja) | 2個以上のヘテロ原子を含有する架橋された二環式および多環式のオレフィンの開環メタセシス重合 | |
| EP1937731B1 (en) | Polymerization methods using the catalysts | |
| JP2009511731A (ja) | 環状オレフィン重合体の製造方法 | |
| CN114106057B (zh) | Ru亚烷基络合物的合成与表征 | |
| KR100828728B1 (ko) | 고리형 올레핀 중합체 제조용 촉매 | |
| Krause | Development of new Ruthenium Catalysts for homogeneous and heterogeneous Olefin-Metathesis | |
| DE CLERCQ et al. | Ghent University, Krijgslaan 281 (S3), 9000 Ghent, BELGIUM. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20051011 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20051011 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20080722 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20080722 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090127 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090417 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090526 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090924 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20091005 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20091007 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20091007 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091104 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100202 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100303 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100312 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130319 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130319 Year of fee payment: 3 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130319 Year of fee payment: 3 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130319 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140319 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |