JP6854340B2 - デノボ合成された核酸ライブラリ - Google Patents
デノボ合成された核酸ライブラリ Download PDFInfo
- Publication number
- JP6854340B2 JP6854340B2 JP2019510673A JP2019510673A JP6854340B2 JP 6854340 B2 JP6854340 B2 JP 6854340B2 JP 2019510673 A JP2019510673 A JP 2019510673A JP 2019510673 A JP2019510673 A JP 2019510673A JP 6854340 B2 JP6854340 B2 JP 6854340B2
- Authority
- JP
- Japan
- Prior art keywords
- nucleic acid
- library
- examples
- grna
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 150000007523 nucleic acids Chemical class 0.000 title claims description 305
- 102000039446 nucleic acids Human genes 0.000 title claims description 219
- 108020004707 nucleic acids Proteins 0.000 title claims description 219
- 108020005004 Guide RNA Proteins 0.000 claims description 240
- 108020004414 DNA Proteins 0.000 claims description 217
- 108090000623 proteins and genes Proteins 0.000 claims description 204
- 102000053602 DNA Human genes 0.000 claims description 32
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims description 31
- 238000003199 nucleic acid amplification method Methods 0.000 claims description 30
- 230000003321 amplification Effects 0.000 claims description 29
- 108091027544 Subgenomic mRNA Proteins 0.000 claims description 25
- 108091093088 Amplicon Proteins 0.000 claims description 17
- 230000000295 complement effect Effects 0.000 claims description 12
- 230000008236 biological pathway Effects 0.000 claims description 6
- 241000206602 Eukaryota Species 0.000 claims description 3
- 238000010363 gene targeting Methods 0.000 claims description 3
- 239000002253 acid Substances 0.000 description 294
- 239000000758 substrate Substances 0.000 description 120
- 238000000034 method Methods 0.000 description 118
- 150000007513 acids Chemical class 0.000 description 108
- 230000015572 biosynthetic process Effects 0.000 description 96
- 238000003786 synthesis reaction Methods 0.000 description 94
- 210000004027 cell Anatomy 0.000 description 91
- 108091028043 Nucleic acid sequence Proteins 0.000 description 65
- 101710163270 Nuclease Proteins 0.000 description 62
- 108091033409 CRISPR Proteins 0.000 description 61
- 230000000694 effects Effects 0.000 description 52
- 230000027455 binding Effects 0.000 description 42
- 230000002194 synthesizing effect Effects 0.000 description 38
- 239000012634 fragment Substances 0.000 description 30
- 102000004190 Enzymes Human genes 0.000 description 29
- 108090000790 Enzymes Proteins 0.000 description 29
- 238000006243 chemical reaction Methods 0.000 description 29
- 230000008569 process Effects 0.000 description 29
- 238000013461 design Methods 0.000 description 28
- -1 target sequence Proteins 0.000 description 28
- 230000004568 DNA-binding Effects 0.000 description 25
- 108010073062 Transcription Activator-Like Effectors Proteins 0.000 description 25
- 239000002773 nucleotide Substances 0.000 description 25
- 125000003729 nucleotide group Chemical group 0.000 description 25
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 23
- 239000000203 mixture Substances 0.000 description 23
- 239000013604 expression vector Substances 0.000 description 22
- 239000010703 silicon Substances 0.000 description 22
- 229910052710 silicon Inorganic materials 0.000 description 22
- 239000003153 chemical reaction reagent Substances 0.000 description 21
- 230000035772 mutation Effects 0.000 description 21
- 102000004169 proteins and genes Human genes 0.000 description 21
- 102000003960 Ligases Human genes 0.000 description 20
- 108090000364 Ligases Proteins 0.000 description 20
- 230000014509 gene expression Effects 0.000 description 20
- 239000013598 vector Substances 0.000 description 19
- 230000037361 pathway Effects 0.000 description 18
- 230000008685 targeting Effects 0.000 description 18
- 238000013518 transcription Methods 0.000 description 18
- 230000035897 transcription Effects 0.000 description 18
- 108010017070 Zinc Finger Nucleases Proteins 0.000 description 17
- 239000000463 material Substances 0.000 description 17
- 239000000126 substance Substances 0.000 description 17
- 150000008300 phosphoramidites Chemical class 0.000 description 16
- 238000003776 cleavage reaction Methods 0.000 description 15
- 239000002777 nucleoside Substances 0.000 description 15
- 230000007017 scission Effects 0.000 description 15
- 108010008532 Deoxyribonuclease I Proteins 0.000 description 14
- 102000007260 Deoxyribonuclease I Human genes 0.000 description 14
- 238000010459 TALEN Methods 0.000 description 14
- 108010043645 Transcription Activator-Like Effector Nucleases Proteins 0.000 description 14
- 230000003647 oxidation Effects 0.000 description 14
- 238000007254 oxidation reaction Methods 0.000 description 14
- 239000000047 product Substances 0.000 description 14
- 238000012216 screening Methods 0.000 description 14
- 238000012163 sequencing technique Methods 0.000 description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 14
- 238000010354 CRISPR gene editing Methods 0.000 description 13
- 238000010586 diagram Methods 0.000 description 13
- 102000008158 DNA Ligase ATP Human genes 0.000 description 12
- 108010060248 DNA Ligase ATP Proteins 0.000 description 12
- 238000009826 distribution Methods 0.000 description 12
- 238000004458 analytical method Methods 0.000 description 11
- 230000006870 function Effects 0.000 description 11
- 238000012545 processing Methods 0.000 description 11
- 238000000338 in vitro Methods 0.000 description 10
- 230000004048 modification Effects 0.000 description 10
- 238000012986 modification Methods 0.000 description 10
- 238000003860 storage Methods 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 108020004705 Codon Proteins 0.000 description 9
- 241000588724 Escherichia coli Species 0.000 description 9
- 238000003780 insertion Methods 0.000 description 9
- 230000037431 insertion Effects 0.000 description 9
- 229910000077 silane Inorganic materials 0.000 description 9
- 125000006850 spacer group Chemical group 0.000 description 9
- 241000700159 Rattus Species 0.000 description 8
- 108091028113 Trans-activating crRNA Proteins 0.000 description 8
- 238000012217 deletion Methods 0.000 description 8
- 230000037430 deletion Effects 0.000 description 8
- 238000002372 labelling Methods 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 150000003833 nucleoside derivatives Chemical class 0.000 description 8
- 102000008682 Argonaute Proteins Human genes 0.000 description 7
- 108010088141 Argonaute Proteins Proteins 0.000 description 7
- 241000252212 Danio rerio Species 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- 241000282414 Homo sapiens Species 0.000 description 7
- 241000699670 Mus sp. Species 0.000 description 7
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 7
- 150000001413 amino acids Chemical class 0.000 description 7
- 238000000137 annealing Methods 0.000 description 7
- 239000010410 layer Substances 0.000 description 7
- 229920002401 polyacrylamide Polymers 0.000 description 7
- 230000002103 transcriptional effect Effects 0.000 description 7
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- 102100035102 E3 ubiquitin-protein ligase MYCBP2 Human genes 0.000 description 6
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 6
- 108700007698 Genetic Terminator Regions Proteins 0.000 description 6
- 229910019142 PO4 Inorganic materials 0.000 description 6
- 238000003491 array Methods 0.000 description 6
- 238000004891 communication Methods 0.000 description 6
- 230000004927 fusion Effects 0.000 description 6
- 238000010362 genome editing Methods 0.000 description 6
- 238000002156 mixing Methods 0.000 description 6
- 238000007481 next generation sequencing Methods 0.000 description 6
- 230000002093 peripheral effect Effects 0.000 description 6
- 235000021317 phosphate Nutrition 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 238000001308 synthesis method Methods 0.000 description 6
- 238000013519 translation Methods 0.000 description 6
- 241000196324 Embryophyta Species 0.000 description 5
- 241000699666 Mus <mouse, genus> Species 0.000 description 5
- 241000283973 Oryctolagus cuniculus Species 0.000 description 5
- 108091081548 Palindromic sequence Proteins 0.000 description 5
- 108091000080 Phosphotransferase Proteins 0.000 description 5
- 101710137500 T7 RNA polymerase Proteins 0.000 description 5
- 230000005782 double-strand break Effects 0.000 description 5
- 230000037433 frameshift Effects 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 239000010452 phosphate Substances 0.000 description 5
- 102000020233 phosphotransferase Human genes 0.000 description 5
- 238000005987 sulfurization reaction Methods 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- 238000011144 upstream manufacturing Methods 0.000 description 5
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- 241000238631 Hexapoda Species 0.000 description 4
- 238000012408 PCR amplification Methods 0.000 description 4
- 239000004743 Polypropylene Substances 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 4
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 238000004140 cleaning Methods 0.000 description 4
- 238000013500 data storage Methods 0.000 description 4
- 238000000151 deposition Methods 0.000 description 4
- 239000012636 effector Substances 0.000 description 4
- 210000003527 eukaryotic cell Anatomy 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 238000007306 functionalization reaction Methods 0.000 description 4
- 210000004962 mammalian cell Anatomy 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 229920001155 polypropylene Polymers 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 229910052725 zinc Inorganic materials 0.000 description 4
- 239000011701 zinc Substances 0.000 description 4
- KTFLAZUEXFFCFI-UHFFFAOYSA-N 4-(3-triethoxysilylpropylamino)butan-1-ol Chemical compound CCO[Si](OCC)(OCC)CCCNCCCCO KTFLAZUEXFFCFI-UHFFFAOYSA-N 0.000 description 3
- 241000157882 Acrasida Species 0.000 description 3
- 241000219195 Arabidopsis thaliana Species 0.000 description 3
- 241000282465 Canis Species 0.000 description 3
- 241000195585 Chlamydomonas Species 0.000 description 3
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 3
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 3
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 3
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 241000255601 Drosophila melanogaster Species 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 241000270322 Lepidosauria Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000244206 Nematoda Species 0.000 description 3
- 239000004677 Nylon Substances 0.000 description 3
- 241000777895 Opitutus Species 0.000 description 3
- 239000004793 Polystyrene Substances 0.000 description 3
- 241000288906 Primates Species 0.000 description 3
- 241000235343 Saccharomycetales Species 0.000 description 3
- 241000193996 Streptococcus pyogenes Species 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000012190 activator Substances 0.000 description 3
- 230000003044 adaptive effect Effects 0.000 description 3
- 230000002860 competitive effect Effects 0.000 description 3
- DMSZORWOGDLWGN-UHFFFAOYSA-N ctk1a3526 Chemical compound NP(N)(N)=O DMSZORWOGDLWGN-UHFFFAOYSA-N 0.000 description 3
- 150000002009 diols Chemical class 0.000 description 3
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 3
- 230000011559 double-strand break repair via nonhomologous end joining Effects 0.000 description 3
- 230000009977 dual effect Effects 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 150000002739 metals Chemical class 0.000 description 3
- 238000013508 migration Methods 0.000 description 3
- 230000005012 migration Effects 0.000 description 3
- 229920001778 nylon Polymers 0.000 description 3
- 230000036961 partial effect Effects 0.000 description 3
- 239000004417 polycarbonate Substances 0.000 description 3
- 229920000515 polycarbonate Polymers 0.000 description 3
- 229920002223 polystyrene Polymers 0.000 description 3
- 239000004810 polytetrafluoroethylene Substances 0.000 description 3
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 3
- 210000001236 prokaryotic cell Anatomy 0.000 description 3
- 108020001580 protein domains Proteins 0.000 description 3
- 238000011084 recovery Methods 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 235000012239 silicon dioxide Nutrition 0.000 description 3
- MCTWTZJPVLRJOU-UHFFFAOYSA-N 1-methyl-1H-imidazole Chemical compound CN1C=CN=C1 MCTWTZJPVLRJOU-UHFFFAOYSA-N 0.000 description 2
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Chemical compound C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 2
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 description 2
- SJECZPVISLOESU-UHFFFAOYSA-N 3-trimethoxysilylpropan-1-amine Chemical compound CO[Si](OC)(OC)CCCN SJECZPVISLOESU-UHFFFAOYSA-N 0.000 description 2
- 241000589941 Azospirillum Species 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 238000010356 CRISPR-Cas9 genome editing Methods 0.000 description 2
- 108050006400 Cyclin Proteins 0.000 description 2
- 102100026846 Cytidine deaminase Human genes 0.000 description 2
- 108010031325 Cytidine deaminase Proteins 0.000 description 2
- 108700039887 Essential Genes Proteins 0.000 description 2
- 108010067218 Guanine Nucleotide Exchange Factors Proteins 0.000 description 2
- 102000016285 Guanine Nucleotide Exchange Factors Human genes 0.000 description 2
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical group C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 2
- 101001105486 Homo sapiens Proteasome subunit alpha type-7 Proteins 0.000 description 2
- 101000616172 Homo sapiens Splicing factor 3B subunit 3 Proteins 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 102000004157 Hydrolases Human genes 0.000 description 2
- 108090000604 Hydrolases Proteins 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- 108060004795 Methyltransferase Proteins 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 2
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 2
- 241000605894 Porphyromonas Species 0.000 description 2
- 102100036691 Proliferating cell nuclear antigen Human genes 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 102100021201 Proteasome subunit alpha type-7 Human genes 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- 101710205896 Ribonuclease P protein component 4 Proteins 0.000 description 2
- 102100024753 Ribonuclease P protein subunit p21 Human genes 0.000 description 2
- 229910052581 Si3N4 Inorganic materials 0.000 description 2
- 102100021816 Splicing factor 3B subunit 3 Human genes 0.000 description 2
- DRTQHJPVMGBUCF-XVFCMESISA-N Uridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-XVFCMESISA-N 0.000 description 2
- 239000002318 adhesion promoter Substances 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 210000004102 animal cell Anatomy 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 230000030833 cell death Effects 0.000 description 2
- 230000005754 cellular signaling Effects 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- 230000009615 deamination Effects 0.000 description 2
- 238000006481 deamination reaction Methods 0.000 description 2
- 230000006837 decompression Effects 0.000 description 2
- BAAAEEDPKUHLID-UHFFFAOYSA-N decyl(triethoxy)silane Chemical compound CCCCCCCCCC[Si](OCC)(OCC)OCC BAAAEEDPKUHLID-UHFFFAOYSA-N 0.000 description 2
- 230000017858 demethylation Effects 0.000 description 2
- 238000010520 demethylation reaction Methods 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 230000008021 deposition Effects 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 230000027832 depurination Effects 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 239000004205 dimethyl polysiloxane Substances 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 108091008053 gene clusters Proteins 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 230000006801 homologous recombination Effects 0.000 description 2
- 238000002744 homologous recombination Methods 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 230000011987 methylation Effects 0.000 description 2
- 238000007069 methylation reaction Methods 0.000 description 2
- 230000009437 off-target effect Effects 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 238000000059 patterning Methods 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 229920001296 polysiloxane Polymers 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 2
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 2
- 230000008439 repair process Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 150000004756 silanes Chemical class 0.000 description 2
- HQVNEWCFYHHQES-UHFFFAOYSA-N silicon nitride Chemical compound N12[Si]34N5[Si]62N3[Si]51N64 HQVNEWCFYHHQES-UHFFFAOYSA-N 0.000 description 2
- 230000005783 single-strand break Effects 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 108091006106 transcriptional activators Proteins 0.000 description 2
- 108091006107 transcriptional repressors Proteins 0.000 description 2
- 238000010361 transduction Methods 0.000 description 2
- 230000026683 transduction Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 241001515965 unidentified phage Species 0.000 description 2
- 238000010200 validation analysis Methods 0.000 description 2
- 108700026220 vif Genes Proteins 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- RQHMQURGSQBBJY-UHFFFAOYSA-N (2,2-dichloroacetyl) 2,2-dichloroacetate Chemical compound ClC(Cl)C(=O)OC(=O)C(Cl)Cl RQHMQURGSQBBJY-UHFFFAOYSA-N 0.000 description 1
- WYTZZXDRDKSJID-UHFFFAOYSA-N (3-aminopropyl)triethoxysilane Chemical compound CCO[Si](OCC)(OCC)CCCN WYTZZXDRDKSJID-UHFFFAOYSA-N 0.000 description 1
- GBBJBUGPGFNISJ-YDQXZVTASA-N (4as,7r,8as)-9,9-dimethyltetrahydro-4h-4a,7-methanobenzo[c][1,2]oxazireno[2,3-b]isothiazole 3,3-dioxide Chemical compound C1S(=O)(=O)N2O[C@@]32C[C@@H]2C(C)(C)[C@]13CC2 GBBJBUGPGFNISJ-YDQXZVTASA-N 0.000 description 1
- JUDOLRSMWHVKGX-UHFFFAOYSA-N 1,1-dioxo-1$l^{6},2-benzodithiol-3-one Chemical compound C1=CC=C2C(=O)SS(=O)(=O)C2=C1 JUDOLRSMWHVKGX-UHFFFAOYSA-N 0.000 description 1
- WUHZCNHGBOHDKN-UHFFFAOYSA-N 11-triethoxysilylundecyl acetate Chemical compound CCO[Si](OCC)(OCC)CCCCCCCCCCCOC(C)=O WUHZCNHGBOHDKN-UHFFFAOYSA-N 0.000 description 1
- GVZJRBAUSGYWJI-UHFFFAOYSA-N 2,5-bis(3-dodecylthiophen-2-yl)thiophene Chemical compound C1=CSC(C=2SC(=CC=2)C2=C(C=CS2)CCCCCCCCCCCC)=C1CCCCCCCCCCCC GVZJRBAUSGYWJI-UHFFFAOYSA-N 0.000 description 1
- FOYWCEUVVIHJKD-UHFFFAOYSA-N 2-methyl-5-(1h-pyrazol-5-yl)pyridine Chemical compound C1=NC(C)=CC=C1C1=CC=NN1 FOYWCEUVVIHJKD-UHFFFAOYSA-N 0.000 description 1
- HXLAEGYMDGUSBD-UHFFFAOYSA-N 3-[diethoxy(methyl)silyl]propan-1-amine Chemical compound CCO[Si](C)(OCC)CCCN HXLAEGYMDGUSBD-UHFFFAOYSA-N 0.000 description 1
- IKYAJDOSWUATPI-UHFFFAOYSA-N 3-[dimethoxy(methyl)silyl]propane-1-thiol Chemical compound CO[Si](C)(OC)CCCS IKYAJDOSWUATPI-UHFFFAOYSA-N 0.000 description 1
- GLISOBUNKGBQCL-UHFFFAOYSA-N 3-[ethoxy(dimethyl)silyl]propan-1-amine Chemical compound CCO[Si](C)(C)CCCN GLISOBUNKGBQCL-UHFFFAOYSA-N 0.000 description 1
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 description 1
- TZZGHGKTHXIOMN-UHFFFAOYSA-N 3-trimethoxysilyl-n-(3-trimethoxysilylpropyl)propan-1-amine Chemical compound CO[Si](OC)(OC)CCCNCCC[Si](OC)(OC)OC TZZGHGKTHXIOMN-UHFFFAOYSA-N 0.000 description 1
- UUEWCQRISZBELL-UHFFFAOYSA-N 3-trimethoxysilylpropane-1-thiol Chemical compound CO[Si](OC)(OC)CCCS UUEWCQRISZBELL-UHFFFAOYSA-N 0.000 description 1
- 125000002103 4,4'-dimethoxytriphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)(C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H])C1=C([H])C([H])=C(OC([H])([H])[H])C([H])=C1[H] 0.000 description 1
- PTIOHXNQUJSMNL-UHFFFAOYSA-N 4-[3-aminopropyl(diethoxy)silyl]oxypentan-1-amine Chemical compound NCCCC(C)O[Si](OCC)(OCC)CCCN PTIOHXNQUJSMNL-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- BLFRQYKZFKYQLO-UHFFFAOYSA-N 4-aminobutan-1-ol Chemical compound NCCCCO BLFRQYKZFKYQLO-UHFFFAOYSA-N 0.000 description 1
- TXLINXBIWJYFNR-UHFFFAOYSA-N 4-phenylpyridine-2-carbonitrile Chemical compound C1=NC(C#N)=CC(C=2C=CC=CC=2)=C1 TXLINXBIWJYFNR-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 241000604451 Acidaminococcus Species 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 241001147780 Alicyclobacillus Species 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 108091032955 Bacterial small RNA Proteins 0.000 description 1
- 241000555281 Brevibacillus Species 0.000 description 1
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N Butyraldehyde Chemical compound CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 description 1
- 238000010446 CRISPR interference Methods 0.000 description 1
- 101150018129 CSF2 gene Proteins 0.000 description 1
- 101150069031 CSN2 gene Proteins 0.000 description 1
- 241000206594 Carnobacterium Species 0.000 description 1
- 241000252506 Characiformes Species 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 108020004394 Complementary RNA Proteins 0.000 description 1
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 1
- 101150074775 Csf1 gene Proteins 0.000 description 1
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 1
- 125000000824 D-ribofuranosyl group Chemical group [H]OC([H])([H])[C@@]1([H])OC([H])(*)[C@]([H])(O[H])[C@]1([H])O[H] 0.000 description 1
- 108050009160 DNA polymerase 1 Proteins 0.000 description 1
- 230000007018 DNA scission Effects 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 241000936939 Desulfonatronum Species 0.000 description 1
- 241000205236 Desulfurococcus Species 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 101000889905 Enterobacteria phage RB3 Intron-associated endonuclease 3 Proteins 0.000 description 1
- 101000889904 Enterobacteria phage T4 Defective intron-associated endonuclease 3 Proteins 0.000 description 1
- 101000889899 Enterobacteria phage T4 Intron-associated endonuclease 2 Proteins 0.000 description 1
- 241000709744 Enterobacterio phage MS2 Species 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 108060002716 Exonuclease Proteins 0.000 description 1
- 241000589565 Flavobacterium Species 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 101150106478 GPS1 gene Proteins 0.000 description 1
- 102000018638 GTP binding domains Human genes 0.000 description 1
- 108050007795 GTP binding domains Proteins 0.000 description 1
- 102000018898 GTPase-Activating Proteins Human genes 0.000 description 1
- 108091006094 GTPase-accelerating proteins Proteins 0.000 description 1
- 241000032681 Gluconacetobacter Species 0.000 description 1
- 101000615488 Homo sapiens Methyl-CpG-binding domain protein 2 Proteins 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 108010061833 Integrases Proteins 0.000 description 1
- 102000004195 Isomerases Human genes 0.000 description 1
- 108090000769 Isomerases Proteins 0.000 description 1
- 241000186781 Listeria Species 0.000 description 1
- 102000004317 Lyases Human genes 0.000 description 1
- 108090000856 Lyases Proteins 0.000 description 1
- 244000261422 Lysimachia clethroides Species 0.000 description 1
- 102100025169 Max-binding protein MNT Human genes 0.000 description 1
- 102100021299 Methyl-CpG-binding domain protein 2 Human genes 0.000 description 1
- 102000016397 Methyltransferase Human genes 0.000 description 1
- 101100219625 Mus musculus Casd1 gene Proteins 0.000 description 1
- 101100385413 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) csm-3 gene Proteins 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- NWSOKOJWKWNSAF-UHFFFAOYSA-N O=C(Sc1nnn[nH]1)c1ccccc1 Chemical compound O=C(Sc1nnn[nH]1)c1ccccc1 NWSOKOJWKWNSAF-UHFFFAOYSA-N 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 241001386753 Parvibaculum Species 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 108700019535 Phosphoprotein Phosphatases Proteins 0.000 description 1
- 102000045595 Phosphoprotein Phosphatases Human genes 0.000 description 1
- 235000014676 Phragmites communis Nutrition 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920002873 Polyethylenimine Polymers 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 229920002396 Polyurea Polymers 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 108010026552 Proteome Proteins 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 108091093078 Pyrimidine dimer Proteins 0.000 description 1
- 241000205160 Pyrococcus Species 0.000 description 1
- 101100047461 Rattus norvegicus Trpm8 gene Proteins 0.000 description 1
- 102000018120 Recombinases Human genes 0.000 description 1
- 108010091086 Recombinases Proteins 0.000 description 1
- 241000191025 Rhodobacter Species 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 241000589596 Thermus Species 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102000004357 Transferases Human genes 0.000 description 1
- 108090000992 Transferases Proteins 0.000 description 1
- 102000008579 Transposases Human genes 0.000 description 1
- 108010020764 Transposases Proteins 0.000 description 1
- 108090000848 Ubiquitin Proteins 0.000 description 1
- 102000044159 Ubiquitin Human genes 0.000 description 1
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 description 1
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 102000005421 acetyltransferase Human genes 0.000 description 1
- 108020002494 acetyltransferase Proteins 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 230000006154 adenylylation Effects 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000000429 assembly Methods 0.000 description 1
- 230000000712 assembly Effects 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 108010028263 bacteriophage T3 RNA polymerase Proteins 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- DRTQHJPVMGBUCF-PSQAKQOGSA-N beta-L-uridine Natural products O[C@H]1[C@@H](O)[C@H](CO)O[C@@H]1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-PSQAKQOGSA-N 0.000 description 1
- 238000005842 biochemical reaction Methods 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 101150055766 cat gene Proteins 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 230000006369 cell cycle progression Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000007265 chloromethylation reaction Methods 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 239000004020 conductor Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 101150055601 cops2 gene Proteins 0.000 description 1
- 238000005336 cracking Methods 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000013499 data model Methods 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000006114 demyristoylation Effects 0.000 description 1
- 125000004990 dihydroxyalkyl group Chemical group 0.000 description 1
- HPYNZHMRTTWQTB-UHFFFAOYSA-N dimethylpyridine Natural products CC1=CC=CN=C1C HPYNZHMRTTWQTB-UHFFFAOYSA-N 0.000 description 1
- 230000034431 double-strand break repair via homologous recombination Effects 0.000 description 1
- 230000005014 ectopic expression Effects 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 230000001973 epigenetic effect Effects 0.000 description 1
- 238000005530 etching Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 102000013165 exonuclease Human genes 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 239000005350 fused silica glass Substances 0.000 description 1
- 238000012224 gene deletion Methods 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 229940029575 guanosine Drugs 0.000 description 1
- 229920000140 heteropolymer Polymers 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 230000005931 immune cell recruitment Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000013178 mathematical model Methods 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 238000001668 nucleic acid synthesis Methods 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- NWLSIXHRLQYIAE-UHFFFAOYSA-N oxiran-2-ylmethoxysilicon Chemical compound [Si]OCC1CO1 NWLSIXHRLQYIAE-UHFFFAOYSA-N 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 238000000206 photolithography Methods 0.000 description 1
- 229920002120 photoresistant polymer Polymers 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000412 polyarylene Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920003053 polystyrene-divinylbenzene Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000009465 prokaryotic expression Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000018883 protein targeting Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000012521 purified sample Substances 0.000 description 1
- 239000013635 pyrimidine dimer Substances 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000033458 reproduction Effects 0.000 description 1
- 230000011506 response to oxidative stress Effects 0.000 description 1
- 230000003938 response to stress Effects 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 238000007480 sanger sequencing Methods 0.000 description 1
- 238000001338 self-assembly Methods 0.000 description 1
- 230000003007 single stranded DNA break Effects 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- TXDNPSYEJHXKMK-UHFFFAOYSA-N sulfanylsilane Chemical compound S[SiH3] TXDNPSYEJHXKMK-UHFFFAOYSA-N 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 239000002344 surface layer Substances 0.000 description 1
- 230000003746 surface roughness Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 150000003568 thioethers Chemical class 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- AVXLXFZNRNUCRP-UHFFFAOYSA-N trichloro(1,1,2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-heptadecafluorooctyl)silane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)[Si](Cl)(Cl)Cl AVXLXFZNRNUCRP-UHFFFAOYSA-N 0.000 description 1
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 1
- 239000005052 trichlorosilane Substances 0.000 description 1
- SEAZOECJMOZWTD-UHFFFAOYSA-N trimethoxy(oxiran-2-ylmethyl)silane Chemical compound CO[Si](OC)(OC)CC1CO1 SEAZOECJMOZWTD-UHFFFAOYSA-N 0.000 description 1
- DQZNLOXENNXVAD-UHFFFAOYSA-N trimethoxy-[2-(7-oxabicyclo[4.1.0]heptan-4-yl)ethyl]silane Chemical compound C1C(CC[Si](OC)(OC)OC)CCC2OC21 DQZNLOXENNXVAD-UHFFFAOYSA-N 0.000 description 1
- YUYCVXFAYWRXLS-UHFFFAOYSA-N trimethoxysilane Chemical compound CO[SiH](OC)OC YUYCVXFAYWRXLS-UHFFFAOYSA-N 0.000 description 1
- XFVUECRWXACELC-UHFFFAOYSA-N trimethyl oxiran-2-ylmethyl silicate Chemical compound CO[Si](OC)(OC)OCC1CO1 XFVUECRWXACELC-UHFFFAOYSA-N 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- 235000011178 triphosphate Nutrition 0.000 description 1
- 125000002264 triphosphate group Chemical class [H]OP(=O)(O[H])OP(=O)(O[H])OP(=O)(O[H])O* 0.000 description 1
- DRTQHJPVMGBUCF-UHFFFAOYSA-N uracil arabinoside Natural products OC1C(O)C(CO)OC1N1C(=O)NC(=O)C=C1 DRTQHJPVMGBUCF-UHFFFAOYSA-N 0.000 description 1
- 229940045145 uridine Drugs 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- 239000006200 vaporizer Substances 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1034—Isolating an individual clone by screening libraries
- C12N15/1068—Template (nucleic acid) mediated chemical library synthesis, e.g. chemical and enzymatical DNA-templated organic molecule synthesis, libraries prepared by non ribosomal polypeptide synthesis [NRPS], DNA/RNA-polymerase mediated polypeptide synthesis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/10—Processes for the isolation, preparation or purification of DNA or RNA
- C12N15/1034—Isolating an individual clone by screening libraries
- C12N15/1093—General methods of preparing gene libraries, not provided for in other subgroups
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6806—Preparing nucleic acids for analysis, e.g. for polymerase chain reaction [PCR] assay
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
-
- C—CHEMISTRY; METALLURGY
- C40—COMBINATORIAL TECHNOLOGY
- C40B—COMBINATORIAL CHEMISTRY; LIBRARIES, e.g. CHEMICAL LIBRARIES
- C40B40/00—Libraries per se, e.g. arrays, mixtures
- C40B40/04—Libraries containing only organic compounds
- C40B40/06—Libraries containing nucleotides or polynucleotides, or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C04—CEMENTS; CONCRETE; ARTIFICIAL STONE; CERAMICS; REFRACTORIES
- C04B—LIME, MAGNESIA; SLAG; CEMENTS; COMPOSITIONS THEREOF, e.g. MORTARS, CONCRETE OR LIKE BUILDING MATERIALS; ARTIFICIAL STONE; CERAMICS; REFRACTORIES; TREATMENT OF NATURAL STONE
- C04B40/00—Processes, in general, for influencing or modifying the properties of mortars, concrete or artificial stone compositions, e.g. their setting or hardening ability
- C04B40/06—Inhibiting the setting, e.g. mortars of the deferred action type containing water in breakable containers ; Inhibiting the action of active ingredients
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/20—Type of nucleic acid involving clustered regularly interspaced short palindromic repeats [CRISPRs]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2330/00—Production
- C12N2330/30—Production chemically synthesised
- C12N2330/31—Libraries, arrays
-
- C—CHEMISTRY; METALLURGY
- C40—COMBINATORIAL TECHNOLOGY
- C40B—COMBINATORIAL CHEMISTRY; LIBRARIES, e.g. CHEMICAL LIBRARIES
- C40B50/00—Methods of creating libraries, e.g. combinatorial synthesis
- C40B50/14—Solid phase synthesis, i.e. wherein one or more library building blocks are bound to a solid support during library creation; Particular methods of cleavage from the solid support
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Organic Chemistry (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Plant Pathology (AREA)
- Analytical Chemistry (AREA)
- Bioinformatics & Computational Biology (AREA)
- Crystallography & Structural Chemistry (AREA)
- Immunology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Ceramic Engineering (AREA)
- Enzymes And Modification Thereof (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Materials Engineering (AREA)
- Structural Engineering (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
Description
本明細書で言及される全ての刊行物、特許、および特許出願は、あたかも個々の刊行物、特許、または特許出願が参照により組み込まれるように具体的かつ個々に指示される程度に、参照により本明細書に組み込まれる。
本開示の全体にわたって、様々な実施形態は範囲形式で提示される。範囲形式での記載は単に利便性と簡潔さのためのものに過ぎず、任意の実施形態の範囲に対する確固たる限定として解釈されてはならないということを理解されたい。これに応じて、範囲の記載は、文脈で別段の定めのない限り、すべての可能性のある下位範囲と、下限の単位の小数第2位までのその範囲内の個々の数値を具体的に開示したと考えられなければならない。例えば、1乃至6などの範囲の記載は、1乃至3、1乃至4、1乃至5、2乃至4、2乃至6、3乃至6などの下位範囲と、例えば、1.1、2、2.3、5、および5.9のその範囲内の個々の数値を具体的に開示したと考えられなければならない。これは、範囲の広さにかかわらず適用される。これらの介入する範囲の上限および下限は、より小さな範囲内に独立して含まれてもよく、また、定められた範囲内のあらゆる具体的に除外された限度に従って、本発明内に包含される。定められた範囲が上限および下限の1つ又はその両方を含む場合、これらの含まれた上限および下限のいずれかまたは両方を除く範囲もまた、文脈が明らかに他に指示しない限り、本発明内に包含される。
本明細書で提供されるのは、クラスタ化して規則的な配置の短い回文配列リピート(CRISPR)−酵素複合体中での取り込みのための、非常に正確なgRNAライブラリを設計、構築、およびスクリーニングするための方法である。例えば、図1A−ABを参照する。本明細書に記載された方法を用いて生成されたgRNAライブラリは、sgRNAライブラリおよびdgRNAライブラリの両方を含む。本明細書で提供されるのは、結果としてもたらされるライブラリで、予め決められたgRNAの高度な表示をもたらす非常に均一な合成のための方法である。設計段階では、gRNAが設計される。図2を参照する。設計戦略は、遺伝子に及ぶgRNAの設計が挙げられるが、これに限定されない。所望のワークフローに応じて、デノボ合成された核酸はDNAまたはRNA塩基である。
本明細書で提供されるのは、特定の核酸配列の転写活性化因子様エフェクターヌクレアーゼ(TALEN)標的化のための核酸を含む、核酸ライブラリを合成する方法である。TALENは、特定の標的配列で二本鎖切断を誘発するために使用することができる、操作された配列の特異的なヌクレアーゼの類である。TALENは、ヌクレアーゼの触媒ドメインに、 転写活性化因子様(TAL)エフェクターDNA結合ドメイン、またはそれらの機能部分を融合させることによって生成され得る。TALエフェクターDNA結合ドメインは、一連のTAL反復を含み、それは、各々がRVD(repeat variable diresidue)として知られる非常に可変的な12番目と13番目のアミノ酸を含む一般的に高度に保存された33または34のアミノ酸配列セグメントである。各RVDは、特異的なヌクレオチドを認識し、それに結合することができる。したがって、TALエフェクター結合ドメインは、適切なRVDを含むTAL反復を組み合わせることによってヌクレオチドの特異的なシーケンスを認識するように操作され得る。
変異核酸ライブラリ生成のための例示的なプロセスにおいて、Cas9切断および相同組換えが、標的DNAライブラリ内に変型を生成するために組込まれる。まず、(RNAのデノボ合成またはDNAのデノボ合成のいずれか、その後(インビボまたはインビトロの)転写をしてgRNAを生成することによって)gRNAライブラリが合成され、ここで、ライブラリは、遺伝子あたり複数のgRNA分子を含む。例えば、gRNAライブラリは、遺伝子あたり、1、2、3、4、5、6、7、8、9、10、またはそれより多くのgRNAを含み得る。gRNAライブラリは、Cas9酵素および標的DNAライブラリと混合され、ここで、標的DNAライブラリは少なくとも1つの遺伝子断片または少なくとも1つの遺伝子をコードする核酸配列を含む。例えば、標的DNAライブラリは1、2、3、4、5、6、7、8、9、10、またはそれより多くの遺伝子または遺伝子断片を含み得る。いくつかの例では、標的DNAライブラリは、経路内の同義遺伝子からの配列または生物体内の全遺伝子からの配列を含む。さらに、変異が標的DNA鎖に導入されるように、相性配列および変異核酸配列を含む置換配列が混合物に加えられる。結果として生じる標的DNAライブラリは、複数の変異DNA配列を含むだろう。いくつかの例では、変異は、欠失、フレームシフト、または標的DNA配列への挿入を導入する。いくつかの例では、変異DNA配列は、遺伝子または遺伝子の断片あたり、少なくとも1のコドンについての変異を結果としてもたらす。いくつかの例では、遺伝子の一部が標的DNAに挿入され、あるいは、標的DNA配列の一部(つまり、遺伝子の断片または全遺伝子)は、標的DNAから取り除かれる。いくつかの例では、変異DNA配列は、遺伝子または遺伝子の断片と関連付けられる少なくとも1つの転写調節配列、例えば、プロモーター、UTR、あるいはターミネーター配列についての変異を結果としてもたらす。
幾つかの方法において、オリゴ核酸のライブラリは、クラスタの複数の遺伝子座において合成される。
98C、30秒
98C、10秒;63℃、10秒;72℃、10秒;12のサイクルを繰り返す
72℃、2分
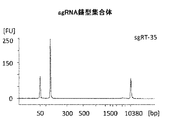
図6A−図6Bを参照。T7プロモーター領域を加えて、T7ポリメラーゼを有するsgRNAのインビトロの産生を可能にした。
精製されたサンプルからの結果を表21に要約する。
合成されたオリゴ核酸をPCR増幅し、消化し、ベクターへとクローン化し、スクリーニング及び分析を含む下流の適用のための使用のために細胞へと転移させた。
Claims (20)
- 核酸ライブラリであって、該核酸ライブラリは、少なくとも500の非同一のDNA分子を含み、各非同一のDNA分子は異なるgRNA配列をコードし、各gRNA配列は哺乳類遺伝子に相補的な標的ドメインを含み、および、少なくとも500の非同一のDNA分子の少なくとも80%が、核酸ライブラリ中の非同一のDNA分子の各々について平均頻度の2倍以内の量で核酸ライブラリにそれぞれ存在する、核酸ライブラリ。
- 各非同一のDNA分子は、20%〜85%のGC塩基含有量を有する、請求項1に記載の核酸ライブラリ。
- 各非同一のDNA分子は、30%〜70%のGC塩基含有量を有する、請求項1に記載の核酸ライブラリ。
- 少なくとも500の非同一のDNA分子の少なくとも90%は、核酸ライブラリ中の非同一のDNA分子の各々について平均頻度の2倍以内の量で核酸ライブラリにそれぞれ存在する、請求項1に記載の核酸ライブラリ。
- 少なくとも500の非同一のDNA分子は、少なくとも2000の非同一のDNA分子を含む、請求項1に記載の核酸ライブラリ。
- 少なくとも500の非同一のDNA分子は、少なくとも3500の非同一のDNA分子を含む、請求項1に記載の核酸ライブラリ。
- 各非同一のDNA分子は、最大200の塩基の長さを含む、請求項1に記載の核酸ライブラリ。
- 少なくとも500の非同一のDNA分子は、生物学的経路において、遺伝子を標的とするgRNA配列をコードする非同一のDNA分子を含む、請求項1に記載の核酸ライブラリ。
- 少なくとも500の非同一のDNA分子は、全ゲノムにおいて、遺伝子を標的とするgRNA配列をコードする非同一のDNA分子を含む、請求項1に記載の核酸ライブラリ。
- gRNAは単一のgRNAまたは二重のgRNAである、請求項1に記載の核酸ライブラリ。
- 核酸ライブラリであって、該核酸ライブラリは少なくとも2000の非同一の核酸を含み、各非同一の核酸は異なるsgRNA配列をコードし、各sgRNA配列は真核生物の遺伝子に相補的な標的ドメインを含み、および、少なくとも2000の非同一の核酸の少なくとも80%は、核酸ライブラリ中の非同一の核酸の各々について平均頻度の2倍以内の量で核酸ライブラリに存在する、核酸ライブラリ。
- 各非同一の核酸は、20%〜85%のGC塩基含有量を有する、請求項11に記載の核酸ライブラリ。
- 少なくとも2000の非同一の核酸の少なくとも90%は、核酸ライブラリ中の非同一の核酸の各々について平均頻度の2倍以内の量で核酸ライブラリ中にそれぞれ存在する、請求項11に記載の核酸ライブラリ。
- 各非同一の核酸は最大で200の塩基の長さを含む、請求項11に記載の核酸ライブラリ。
- 少なくとも2000の非同一の核酸が、生物学的経路において、遺伝子を標的とするsgRNA配列をコードする非同一の核酸を含む、請求項11に記載の核酸ライブラリ。
- 少なくとも2000の非同一の核酸が、全ゲノムにおいて、遺伝子を標的とするsgRNA配列をコードする非同一の核酸を含む、請求項11に記載の核酸ライブラリ。
- 各非同一の核酸はDNA分子またはRNA分子を含む、請求項11に記載の核酸ライブラリ。
- アンプリコンライブラリであって、該アンプリコンライブラリは複数の非同一のDNA分子含み、各非同一のDNA分子は増幅産物の集団中に存在し、各非同一のDNA分子は異なるgRNA配列をコードし、各gRNA配列は真核生物の遺伝子に相補的な標的ドメインを含み、および複数の非同一のDNA分子の少なくとも80%は、アンプリコンライブラリ中の非同一のDNA分子の各々について平均頻度の2倍以内の量でアンプリコンライブラリにそれぞれ存在する、アンプリコンライブラリ。
- 各非同一のDNA分子は、30%〜70%のGC塩基含有量を有する、請求項18
に記載のアンプリコンライブラリ。 - gRNAは単一のgRNAまたは二重のgRNAである、請求項18に記載のアンプリ
コンライブラリ。
Applications Claiming Priority (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662378134P | 2016-08-22 | 2016-08-22 | |
| US62/378,134 | 2016-08-22 | ||
| US201662382191P | 2016-08-31 | 2016-08-31 | |
| US62/382,191 | 2016-08-31 | ||
| US201662393948P | 2016-09-13 | 2016-09-13 | |
| US62/393,948 | 2016-09-13 | ||
| US201662411388P | 2016-10-21 | 2016-10-21 | |
| US62/411,388 | 2016-10-21 | ||
| US201662419881P | 2016-11-09 | 2016-11-09 | |
| US62/419,881 | 2016-11-09 | ||
| PCT/US2017/026232 WO2018038772A1 (en) | 2016-08-22 | 2017-04-05 | De novo synthesized nucleic acid libraries |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019528070A JP2019528070A (ja) | 2019-10-10 |
| JP2019528070A5 JP2019528070A5 (ja) | 2020-05-28 |
| JP6854340B2 true JP6854340B2 (ja) | 2021-04-07 |
Family
ID=61191281
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019510673A Active JP6854340B2 (ja) | 2016-08-22 | 2017-04-05 | デノボ合成された核酸ライブラリ |
Country Status (11)
| Country | Link |
|---|---|
| US (3) | US10053688B2 (ja) |
| EP (1) | EP3500672A4 (ja) |
| JP (1) | JP6854340B2 (ja) |
| KR (1) | KR102212257B1 (ja) |
| CN (1) | CN109996876A (ja) |
| AU (2) | AU2017315294B2 (ja) |
| CA (1) | CA3034769A1 (ja) |
| GB (1) | GB2568444A (ja) |
| IL (1) | IL264966B (ja) |
| SG (1) | SG11201901563UA (ja) |
| WO (1) | WO2018038772A1 (ja) |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9409139B2 (en) | 2013-08-05 | 2016-08-09 | Twist Bioscience Corporation | De novo synthesized gene libraries |
| US10669304B2 (en) | 2015-02-04 | 2020-06-02 | Twist Bioscience Corporation | Methods and devices for de novo oligonucleic acid assembly |
| WO2016172377A1 (en) | 2015-04-21 | 2016-10-27 | Twist Bioscience Corporation | Devices and methods for oligonucleic acid library synthesis |
| JP6982362B2 (ja) | 2015-09-18 | 2021-12-17 | ツイスト バイオサイエンス コーポレーション | オリゴ核酸変異体ライブラリーとその合成 |
| CN108698012A (zh) | 2015-09-22 | 2018-10-23 | 特韦斯特生物科学公司 | 用于核酸合成的柔性基底 |
| CA3006867A1 (en) | 2015-12-01 | 2017-06-08 | Twist Bioscience Corporation | Functionalized surfaces and preparation thereof |
| CA3034769A1 (en) | 2016-08-22 | 2018-03-01 | Twist Bioscience Corporation | De novo synthesized nucleic acid libraries |
| JP6871364B2 (ja) | 2016-09-21 | 2021-05-12 | ツイスト バイオサイエンス コーポレーション | 核酸に基づくデータ保存 |
| KR102514213B1 (ko) | 2016-12-16 | 2023-03-27 | 트위스트 바이오사이언스 코포레이션 | 면역 시냅스의 변이체 라이브러리 및 그의 합성 |
| KR102723464B1 (ko) | 2017-02-22 | 2024-10-28 | 트위스트 바이오사이언스 코포레이션 | 핵산 기반 데이터 저장 |
| EP3595674A4 (en) | 2017-03-15 | 2020-12-16 | Twist Bioscience Corporation | BANKS OF VARIANTS OF IMMUNOLOGICAL SYNAPSE AND THEIR SYNTHESIS |
| US11499151B2 (en) | 2017-04-28 | 2022-11-15 | Editas Medicine, Inc. | Methods and systems for analyzing guide RNA molecules |
| WO2018231864A1 (en) | 2017-06-12 | 2018-12-20 | Twist Bioscience Corporation | Methods for seamless nucleic acid assembly |
| CN111566209B (zh) | 2017-06-12 | 2024-08-30 | 特韦斯特生物科学公司 | 无缝核酸装配方法 |
| CN111566125A (zh) | 2017-09-11 | 2020-08-21 | 特韦斯特生物科学公司 | Gpcr结合蛋白及其合成 |
| JP7066840B2 (ja) | 2017-10-20 | 2022-05-13 | ツイスト バイオサイエンス コーポレーション | ポリヌクレオチド合成のための加熱されたナノウェル |
| IL312616A (en) | 2018-01-04 | 2024-07-01 | Twist Bioscience Corp | Digital information storage based on DNA |
| SG11202011467RA (en) | 2018-05-18 | 2020-12-30 | Twist Bioscience Corp | Polynucleotides, reagents, and methods for nucleic acid hybridization |
| US20200063119A1 (en) * | 2018-08-22 | 2020-02-27 | Massachusetts Institute Of Technology | In vitro dna writing for information storage |
| CN113692409A (zh) * | 2018-12-26 | 2021-11-23 | 特韦斯特生物科学公司 | 高度准确的从头多核苷酸合成 |
| EP3924476A4 (en) * | 2019-02-12 | 2022-11-23 | Jumpcode Genomics, Inc. | METHODS FOR TARGETED NUCLEIC ACID DEPLETION |
| US11492727B2 (en) | 2019-02-26 | 2022-11-08 | Twist Bioscience Corporation | Variant nucleic acid libraries for GLP1 receptor |
| KR20210144698A (ko) | 2019-02-26 | 2021-11-30 | 트위스트 바이오사이언스 코포레이션 | 항체 최적화를 위한 변이 핵산 라이브러리 |
| EP3987019A4 (en) * | 2019-06-21 | 2023-04-19 | Twist Bioscience Corporation | BARCODE-BASED NUCLEIC ACID SEQUENCE ARRANGEMENT |
| EP4034566A4 (en) | 2019-09-23 | 2024-01-24 | Twist Bioscience Corporation | VARIANT NUCLEIC ACID LIBRARIES FOR CRTH2 |
| WO2021222316A2 (en) | 2020-04-27 | 2021-11-04 | Twist Bioscience Corporation | Variant nucleic acid libraries for coronavirus |
| WO2022086866A1 (en) | 2020-10-19 | 2022-04-28 | Twist Bioscience Corporation | Methods of synthesizing oligonucleotides using tethered nucleotides |
| US12134656B2 (en) | 2021-11-18 | 2024-11-05 | Twist Bioscience Corporation | Dickkopf-1 variant antibodies and methods of use |
| US20230407290A1 (en) * | 2022-03-07 | 2023-12-21 | Twist Bioscience Corporation | Methylation-mediated adapter removal on nucleic acid sequences |
| WO2024072006A1 (ko) * | 2022-09-28 | 2024-04-04 | 포항공과대학교 산학협력단 | 효소 반응을 통한 총 mrna 기반 무작위 sgrna 라이브러리 생성 방법 |
Family Cites Families (834)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3549368A (en) | 1968-07-02 | 1970-12-22 | Ibm | Process for improving photoresist adhesion |
| US3920714A (en) | 1972-11-16 | 1975-11-18 | Weber Heinrich | Process for the production of polymeric hydrocarbons with reactive silyl side groups |
| GB1550867A (en) | 1975-08-04 | 1979-08-22 | Hughes Aircraft Co | Positioning method and apparatus for fabricating microcircuit devices |
| US4415732A (en) | 1981-03-27 | 1983-11-15 | University Patents, Inc. | Phosphoramidite compounds and processes |
| EP0090789A1 (en) | 1982-03-26 | 1983-10-05 | Monsanto Company | Chemical DNA synthesis |
| US4994373A (en) | 1983-01-27 | 1991-02-19 | Enzo Biochem, Inc. | Method and structures employing chemically-labelled polynucleotide probes |
| JPS59224123A (ja) | 1983-05-20 | 1984-12-17 | Oki Electric Ind Co Ltd | ウエハアライメントマ−ク |
| US5118605A (en) | 1984-10-16 | 1992-06-02 | Chiron Corporation | Polynucleotide determination with selectable cleavage sites |
| JPS61141761A (ja) | 1984-12-12 | 1986-06-28 | Kanegafuchi Chem Ind Co Ltd | 硬化性組成物 |
| US5242794A (en) | 1984-12-13 | 1993-09-07 | Applied Biosystems, Inc. | Detection of specific sequences in nucleic acids |
| US6492107B1 (en) | 1986-11-20 | 2002-12-10 | Stuart Kauffman | Process for obtaining DNA, RNA, peptides, polypeptides, or protein, by recombinant DNA technique |
| US4613398A (en) | 1985-06-06 | 1986-09-23 | International Business Machines Corporation | Formation of etch-resistant resists through preferential permeation |
| US4981797A (en) | 1985-08-08 | 1991-01-01 | Life Technologies, Inc. | Process of producing highly transformable cells and cells produced thereby |
| US4726877A (en) | 1986-01-22 | 1988-02-23 | E. I. Du Pont De Nemours And Company | Methods of using photosensitive compositions containing microgels |
| US4808511A (en) | 1987-05-19 | 1989-02-28 | International Business Machines Corporation | Vapor phase photoresist silylation process |
| JPH07113774B2 (ja) | 1987-05-29 | 1995-12-06 | 株式会社日立製作所 | パタ−ンの形成方法 |
| US4988617A (en) | 1988-03-25 | 1991-01-29 | California Institute Of Technology | Method of detecting a nucleotide change in nucleic acids |
| US5700637A (en) | 1988-05-03 | 1997-12-23 | Isis Innovation Limited | Apparatus and method for analyzing polynucleotide sequences and method of generating oligonucleotide arrays |
| ATE143696T1 (de) | 1989-02-28 | 1996-10-15 | Canon Kk | Partiell doppelsträngiges oligonukleotid und verfahren zu seiner bildung |
| US6008031A (en) | 1989-05-12 | 1999-12-28 | Duke University | Method of analysis and manipulation of DNA utilizing mismatch repair systems |
| US5556750A (en) | 1989-05-12 | 1996-09-17 | Duke University | Methods and kits for fractionating a population of DNA molecules based on the presence or absence of a base-pair mismatch utilizing mismatch repair systems |
| US5459039A (en) | 1989-05-12 | 1995-10-17 | Duke University | Methods for mapping genetic mutations |
| US5102797A (en) | 1989-05-26 | 1992-04-07 | Dna Plant Technology Corporation | Introduction of heterologous genes into bacteria using transposon flanked expression cassette and a binary vector system |
| US6040138A (en) | 1995-09-15 | 2000-03-21 | Affymetrix, Inc. | Expression monitoring by hybridization to high density oligonucleotide arrays |
| US5527681A (en) | 1989-06-07 | 1996-06-18 | Affymax Technologies N.V. | Immobilized molecular synthesis of systematically substituted compounds |
| US5242974A (en) | 1991-11-22 | 1993-09-07 | Affymax Technologies N.V. | Polymer reversal on solid surfaces |
| US6309822B1 (en) | 1989-06-07 | 2001-10-30 | Affymetrix, Inc. | Method for comparing copy number of nucleic acid sequences |
| US5744101A (en) | 1989-06-07 | 1998-04-28 | Affymax Technologies N.V. | Photolabile nucleoside protecting groups |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| CA2036946C (en) | 1990-04-06 | 2001-10-16 | Kenneth V. Deugau | Indexing linkers |
| US5494810A (en) | 1990-05-03 | 1996-02-27 | Cornell Research Foundation, Inc. | Thermostable ligase-mediated DNA amplifications system for the detection of genetic disease |
| US6087482A (en) | 1990-07-27 | 2000-07-11 | Isis Pharmaceuticals, Inc. | Heteroatomic oligonucleoside linkages |
| FI87886C (fi) | 1990-09-06 | 1993-03-10 | Instrumentarium Oy | Faestorgan |
| WO1992006189A1 (en) | 1990-09-27 | 1992-04-16 | Invitrogen Corporation | Direct cloning of pcr amplified nucleic acids |
| GB9025236D0 (en) | 1990-11-20 | 1991-01-02 | Secr Defence | Silicon-on porous-silicon;method of production |
| ES2155822T3 (es) | 1990-12-06 | 2001-06-01 | Affymetrix Inc | Compuestos y su utilizacion en una estrategia de sintesis binaria. |
| US6582908B2 (en) | 1990-12-06 | 2003-06-24 | Affymetrix, Inc. | Oligonucleotides |
| AU1248292A (en) | 1990-12-06 | 1992-07-08 | Affymax Technologies N.V. | Sequencing by hybridization of a target nucleic acid to a matrix of defined oligonucleotides |
| US5455166A (en) | 1991-01-31 | 1995-10-03 | Becton, Dickinson And Company | Strand displacement amplification |
| US5137814A (en) | 1991-06-14 | 1992-08-11 | Life Technologies, Inc. | Use of exo-sample nucleotides in gene cloning |
| US5449754A (en) | 1991-08-07 | 1995-09-12 | H & N Instruments, Inc. | Generation of combinatorial libraries |
| US5474796A (en) | 1991-09-04 | 1995-12-12 | Protogene Laboratories, Inc. | Method and apparatus for conducting an array of chemical reactions on a support surface |
| US5846717A (en) | 1996-01-24 | 1998-12-08 | Third Wave Technologies, Inc. | Detection of nucleic acid sequences by invader-directed cleavage |
| US7150982B2 (en) | 1991-09-09 | 2006-12-19 | Third Wave Technologies, Inc. | RNA detection assays |
| US6759226B1 (en) | 2000-05-24 | 2004-07-06 | Third Wave Technologies, Inc. | Enzymes for the detection of specific nucleic acid sequences |
| US7045289B2 (en) | 1991-09-09 | 2006-05-16 | Third Wave Technologies, Inc. | Detection of RNA Sequences |
| US5994069A (en) | 1996-01-24 | 1999-11-30 | Third Wave Technologies, Inc. | Detection of nucleic acids by multiple sequential invasive cleavages |
| US5384261A (en) | 1991-11-22 | 1995-01-24 | Affymax Technologies N.V. | Very large scale immobilized polymer synthesis using mechanically directed flow paths |
| CA2124087C (en) | 1991-11-22 | 2002-10-01 | James L. Winkler | Combinatorial strategies for polymer synthesis |
| EP0636186B1 (en) | 1992-04-03 | 1998-11-25 | The Perkin-Elmer Corporation | Probe composition and method |
| JP2553322Y2 (ja) | 1992-05-11 | 1997-11-05 | サンデン株式会社 | 飲料抽出装置のフィルタ送り機構 |
| WO1994003637A1 (en) | 1992-07-31 | 1994-02-17 | Syntex (Usa) Inc. | Method for introducing defined sequences at the 3' end of polynucleotides |
| US5288514A (en) | 1992-09-14 | 1994-02-22 | The Regents Of The University Of California | Solid phase and combinatorial synthesis of benzodiazepine compounds on a solid support |
| JP3176444B2 (ja) | 1992-10-01 | 2001-06-18 | 株式会社リコー | 水性インク及びこれを用いた記録方法 |
| DE4241045C1 (de) | 1992-12-05 | 1994-05-26 | Bosch Gmbh Robert | Verfahren zum anisotropen Ätzen von Silicium |
| US5395753A (en) | 1993-02-19 | 1995-03-07 | Theratech, Inc. | Method for diagnosing rheumatoid arthritis |
| ATE246702T1 (de) | 1993-04-12 | 2003-08-15 | Univ Northwestern | Verfahren zur darstellung von oligonukleotiden |
| US7135312B2 (en) | 1993-04-15 | 2006-11-14 | University Of Rochester | Circular DNA vectors for synthesis of RNA and DNA |
| US5482845A (en) * | 1993-09-24 | 1996-01-09 | The Trustees Of Columbia University In The City Of New York | Method for construction of normalized cDNA libraries |
| CN1039623C (zh) | 1993-10-22 | 1998-09-02 | 中国人民解放军军事医学科学院毒物药物研究所 | 一种防治运动病综合征的药物组合物及其制备方法 |
| US6893816B1 (en) | 1993-10-28 | 2005-05-17 | Houston Advanced Research Center | Microfabricated, flowthrough porous apparatus for discrete detection of binding reactions |
| DE69430207T2 (de) | 1993-10-28 | 2002-09-19 | Houston Advanced Research Center, Woodlands | Mikrofabriziertes poröses durchflussgerät |
| US6027877A (en) | 1993-11-04 | 2000-02-22 | Gene Check, Inc. | Use of immobilized mismatch binding protein for detection of mutations and polymorphisms, purification of amplified DNA samples and allele identification |
| US5834252A (en) | 1995-04-18 | 1998-11-10 | Glaxo Group Limited | End-complementary polymerase reaction |
| US6015880A (en) | 1994-03-16 | 2000-01-18 | California Institute Of Technology | Method and substrate for performing multiple sequential reactions on a matrix |
| KR970702363A (ko) | 1994-03-29 | 1997-05-13 | 안네 제케르 | 알칼리성 Bacillus 아밀라제(Alkaline Bacillus Amylase) |
| US5514789A (en) | 1994-04-21 | 1996-05-07 | Barrskogen, Inc. | Recovery of oligonucleotides by gas phase cleavage |
| SE512382C2 (sv) | 1994-04-26 | 2000-03-06 | Ericsson Telefon Ab L M | Anordning och förfarande för att placera långsträckta element mot eller invid en yta |
| DE69519783T2 (de) | 1994-04-29 | 2001-06-07 | Perkin-Elmer Corp., Foster City | Verfahren und vorrichtung zur echtzeiterfassung der produkte von nukleinsäureamplifikation |
| US6287850B1 (en) | 1995-06-07 | 2001-09-11 | Affymetrix, Inc. | Bioarray chip reaction apparatus and its manufacture |
| WO1996000378A1 (en) | 1994-06-23 | 1996-01-04 | Affymax Technologies N.V. | Photolabile compounds and methods for their use |
| US5641658A (en) | 1994-08-03 | 1997-06-24 | Mosaic Technologies, Inc. | Method for performing amplification of nucleic acid with two primers bound to a single solid support |
| US5530516A (en) | 1994-10-04 | 1996-06-25 | Tamarack Scientific Co., Inc. | Large-area projection exposure system |
| US6635226B1 (en) | 1994-10-19 | 2003-10-21 | Agilent Technologies, Inc. | Microanalytical device and use thereof for conducting chemical processes |
| US6613560B1 (en) | 1994-10-19 | 2003-09-02 | Agilent Technologies, Inc. | PCR microreactor for amplifying DNA using microquantities of sample fluid |
| US5556752A (en) | 1994-10-24 | 1996-09-17 | Affymetrix, Inc. | Surface-bound, unimolecular, double-stranded DNA |
| AU4283196A (en) | 1994-11-22 | 1996-06-17 | Complex Fluid Systems, Inc. | Non-aminic photoresist adhesion promoters for microelectronic applications |
| US5688642A (en) | 1994-12-01 | 1997-11-18 | The United States Of America As Represented By The Secretary Of The Navy | Selective attachment of nucleic acid molecules to patterned self-assembled surfaces |
| US6017434A (en) | 1995-05-09 | 2000-01-25 | Curagen Corporation | Apparatus and method for the generation, separation, detection, and recognition of biopolymer fragments |
| US5830655A (en) | 1995-05-22 | 1998-11-03 | Sri International | Oligonucleotide sizing using cleavable primers |
| US5700642A (en) | 1995-05-22 | 1997-12-23 | Sri International | Oligonucleotide sizing using immobilized cleavable primers |
| US6446682B1 (en) | 1995-06-06 | 2002-09-10 | James P. Viken | Auto-loading fluid exchanger and method of use |
| US5877280A (en) | 1995-06-06 | 1999-03-02 | The Mount Sinai School Of Medicine Of The City University Of New York | Thermostable muts proteins |
| US5707806A (en) | 1995-06-07 | 1998-01-13 | Genzyme Corporation | Direct sequence identification of mutations by cleavage- and ligation-associated mutation-specific sequencing |
| US5780613A (en) | 1995-08-01 | 1998-07-14 | Northwestern University | Covalent lock for self-assembled oligonucleotide constructs |
| US5854033A (en) | 1995-11-21 | 1998-12-29 | Yale University | Rolling circle replication reporter systems |
| JP2000501615A (ja) | 1995-12-15 | 2000-02-15 | アマーシャム・ライフ・サイエンス・インコーポレーテッド | 酵素増幅中に生じる変異配列の検出および除去のためのミスマッチ修復系を用いる方法 |
| US5962271A (en) | 1996-01-03 | 1999-10-05 | Cloutech Laboratories, Inc. | Methods and compositions for generating full-length cDNA having arbitrary nucleotide sequence at the 3'-end |
| US5976846A (en) | 1996-01-13 | 1999-11-02 | Passmore; Steven E. | Method for multifragment in vivo cloning and mutation mapping |
| US7122364B1 (en) | 1998-03-24 | 2006-10-17 | Third Wave Technologies, Inc. | FEN endonucleases |
| US7432048B2 (en) | 1996-11-29 | 2008-10-07 | Third Wave Technologies, Inc. | Reactions on a solid surface |
| US5985557A (en) | 1996-01-24 | 1999-11-16 | Third Wave Technologies, Inc. | Invasive cleavage of nucleic acids |
| US6090606A (en) | 1996-01-24 | 2000-07-18 | Third Wave Technologies, Inc. | Cleavage agents |
| US6706471B1 (en) | 1996-01-24 | 2004-03-16 | Third Wave Technologies, Inc. | Detection of nucleic acid sequences by invader-directed cleavage |
| US7527928B2 (en) | 1996-11-29 | 2009-05-05 | Third Wave Technologies, Inc. | Reactions on a solid surface |
| US6274369B1 (en) | 1996-02-02 | 2001-08-14 | Invitrogen Corporation | Method capable of increasing competency of bacterial cell transformation |
| US6013440A (en) | 1996-03-11 | 2000-01-11 | Affymetrix, Inc. | Nucleic acid affinity columns |
| US6020481A (en) | 1996-04-01 | 2000-02-01 | The Perkin-Elmer Corporation | Asymmetric benzoxanthene dyes |
| US6706875B1 (en) | 1996-04-17 | 2004-03-16 | Affyemtrix, Inc. | Substrate preparation process |
| US5869245A (en) | 1996-06-05 | 1999-02-09 | Fox Chase Cancer Center | Mismatch endonuclease and its use in identifying mutations in targeted polynucleotide strands |
| US5863801A (en) | 1996-06-14 | 1999-01-26 | Sarnoff Corporation | Automated nucleic acid isolation |
| US6780982B2 (en) | 1996-07-12 | 2004-08-24 | Third Wave Technologies, Inc. | Charge tags and the separation of nucleic acid molecules |
| US5853993A (en) | 1996-10-21 | 1998-12-29 | Hewlett-Packard Company | Signal enhancement method and kit |
| WO1998022541A2 (en) | 1996-11-08 | 1998-05-28 | Ikonos Corporation | Method for coating substrates |
| US5750672A (en) | 1996-11-22 | 1998-05-12 | Barrskogen, Inc. | Anhydrous amine cleavage of oligonucleotides |
| DK0966542T3 (da) | 1996-11-29 | 2009-03-23 | Third Wave Tech Inc | FEN-1 endonukleaser, blandinger og spaltningsmethoder |
| EP2295988A2 (en) | 1996-12-31 | 2011-03-16 | High Throughput Genomics, Inc. | Multiplexed molecular analysis apparatus and its fabrication method |
| ES2241120T3 (es) | 1997-02-12 | 2005-10-16 | Invitrogen Corporation | Metodos para liofilizar celulas competentes. |
| US5882496A (en) | 1997-02-27 | 1999-03-16 | The Regents Of The University Of California | Porous silicon structures with high surface area/specific pore size |
| US6770748B2 (en) | 1997-03-07 | 2004-08-03 | Takeshi Imanishi | Bicyclonucleoside and oligonucleotide analogue |
| US6419883B1 (en) | 1998-01-16 | 2002-07-16 | University Of Washington | Chemical synthesis using solvent microdroplets |
| AU751956B2 (en) | 1997-03-20 | 2002-09-05 | University Of Washington | Solvent for biopolymer synthesis, solvent microdroplets and methods of use |
| US6028189A (en) | 1997-03-20 | 2000-02-22 | University Of Washington | Solvent for oligonucleotide synthesis and methods of use |
| CA2283635A1 (en) | 1997-03-21 | 1998-10-01 | Stratagene | Polymerase enhancing factor (pef) extracts, pef protein complexes, isolated pef protein, and methods for purifying and identifying |
| US6969488B2 (en) | 1998-05-22 | 2005-11-29 | Solexa, Inc. | System and apparatus for sequential processing of analytes |
| US5922593A (en) | 1997-05-23 | 1999-07-13 | Becton, Dickinson And Company | Microbiological test panel and method therefor |
| EP0991930B1 (en) | 1997-06-26 | 2004-06-16 | Perseptive Biosystems, Inc. | High density sample holder for analysis of biological samples |
| GB9714716D0 (en) | 1997-07-11 | 1997-09-17 | Brax Genomics Ltd | Characterising nucleic acids |
| US5989872A (en) | 1997-08-12 | 1999-11-23 | Clontech Laboratories, Inc. | Methods and compositions for transferring DNA sequence information among vectors |
| US6027898A (en) | 1997-08-18 | 2000-02-22 | Transgenomic, Inc. | Chromatographic method for mutation detection using mutation site specifically acting enzymes and chemicals |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| US6136568A (en) | 1997-09-15 | 2000-10-24 | Hiatt; Andrew C. | De novo polynucleotide synthesis using rolling templates |
| DK1538206T3 (da) | 1997-09-16 | 2010-07-12 | Centocor Ortho Biotech Inc | Fremgangsmåde til fuldstændig kemisk syntese og samling af gener og genomer |
| US6670127B2 (en) | 1997-09-16 | 2003-12-30 | Egea Biosciences, Inc. | Method for assembly of a polynucleotide encoding a target polypeptide |
| US5976842A (en) | 1997-10-30 | 1999-11-02 | Clontech Laboratories, Inc. | Methods and compositions for use in high fidelity polymerase chain reaction |
| US8182991B1 (en) | 1997-11-26 | 2012-05-22 | Third Wave Technologies, Inc. | FEN-1 endonucleases, mixtures and cleavage methods |
| US6408308B1 (en) | 1998-01-29 | 2002-06-18 | Incyte Pharmaceuticals, Inc. | System and method for generating, analyzing and storing normalized expression datasets from raw expression datasets derived from microarray includes nucleic acid probe sequences |
| US6287776B1 (en) | 1998-02-02 | 2001-09-11 | Signature Bioscience, Inc. | Method for detecting and classifying nucleic acid hybridization |
| US6251588B1 (en) | 1998-02-10 | 2001-06-26 | Agilent Technologies, Inc. | Method for evaluating oligonucleotide probe sequences |
| EP1054726B1 (en) | 1998-02-11 | 2003-07-30 | University of Houston, Office of Technology Transfer | Apparatus for chemical and biochemical reactions using photo-generated reagents |
| EP1066506B1 (en) | 1998-02-23 | 2010-04-21 | Wisconsin Alumni Research Foundation | Method and apparatus for synthesis of arrays of dna probes |
| JP4493844B2 (ja) | 1998-03-25 | 2010-06-30 | ランデグレン、ウルフ | 錠型(padlock)プローブのローリングサークル複製 |
| US6284497B1 (en) | 1998-04-09 | 2001-09-04 | Trustees Of Boston University | Nucleic acid arrays and methods of synthesis |
| US6376285B1 (en) | 1998-05-28 | 2002-04-23 | Texas Instruments Incorporated | Annealed porous silicon with epitaxial layer for SOI |
| US6274725B1 (en) | 1998-06-02 | 2001-08-14 | Isis Pharmaceuticals, Inc. | Activators for oligonucleotide synthesis |
| US6130045A (en) | 1998-06-11 | 2000-10-10 | Clontech Laboratories, Inc. | Thermostable polymerase |
| US6251595B1 (en) | 1998-06-18 | 2001-06-26 | Agilent Technologies, Inc. | Methods and devices for carrying out chemical reactions |
| DE69928995T2 (de) | 1998-06-22 | 2006-09-07 | Affymetrix, Inc., Santa Clara | Reagenz und Verfahren zu fester Phase Synthese |
| US7399844B2 (en) | 1998-07-09 | 2008-07-15 | Agilent Technologies, Inc. | Method and reagents for analyzing the nucleotide sequence of nucleic acids |
| US6218118B1 (en) | 1998-07-09 | 2001-04-17 | Agilent Technologies, Inc. | Method and mixture reagents for analyzing the nucleotide sequence of nucleic acids by mass spectrometry |
| US6787308B2 (en) | 1998-07-30 | 2004-09-07 | Solexa Ltd. | Arrayed biomolecules and their use in sequencing |
| US20030022207A1 (en) | 1998-10-16 | 2003-01-30 | Solexa, Ltd. | Arrayed polynucleotides and their use in genome analysis |
| US6222030B1 (en) | 1998-08-03 | 2001-04-24 | Agilent Technologies, Inc. | Solid phase synthesis of oligonucleotides using carbonate protecting groups and alpha-effect nucleophile deprotection |
| US6951719B1 (en) | 1999-08-11 | 2005-10-04 | Proteus S.A. | Process for obtaining recombined nucleotide sequences in vitro, libraries of sequences and sequences thus obtained |
| US6991922B2 (en) | 1998-08-12 | 2006-01-31 | Proteus S.A. | Process for in vitro creation of recombinant polynucleotide sequences by oriented ligation |
| US6107038A (en) | 1998-08-14 | 2000-08-22 | Agilent Technologies Inc. | Method of binding a plurality of chemicals on a substrate by electrophoretic self-assembly |
| CA2341896A1 (en) | 1998-08-28 | 2000-03-09 | Febit Ferrarius Biotechnology Gmbh | Support for a method for determining an analyte and a method for producing the support |
| US6258454B1 (en) | 1998-09-01 | 2001-07-10 | Agilent Technologies Inc. | Functionalization of substrate surfaces with silane mixtures |
| US6461812B2 (en) | 1998-09-09 | 2002-10-08 | Agilent Technologies, Inc. | Method and multiple reservoir apparatus for fabrication of biomolecular arrays |
| US6458583B1 (en) | 1998-09-09 | 2002-10-01 | Agilent Technologies, Inc. | Method and apparatus for making nucleic acid arrays |
| WO2000015779A2 (en) | 1998-09-15 | 2000-03-23 | Yale University | Molecular cloning using rolling circle amplification |
| AR021833A1 (es) | 1998-09-30 | 2002-08-07 | Applied Research Systems | Metodos de amplificacion y secuenciacion de acido nucleico |
| US6399516B1 (en) | 1998-10-30 | 2002-06-04 | Massachusetts Institute Of Technology | Plasma etch techniques for fabricating silicon structures from a substrate |
| US6309828B1 (en) | 1998-11-18 | 2001-10-30 | Agilent Technologies, Inc. | Method and apparatus for fabricating replicate arrays of nucleic acid molecules |
| GB9900298D0 (en) | 1999-01-07 | 1999-02-24 | Medical Res Council | Optical sorting method |
| US6376246B1 (en) | 1999-02-05 | 2002-04-23 | Maxygen, Inc. | Oligonucleotide mediated nucleic acid recombination |
| AU2415200A (en) | 1999-01-18 | 2000-08-01 | Maxygen, Inc. | Methods of populating data structures for use in evolutionary simulations |
| EP1108783A3 (en) | 1999-01-19 | 2001-09-05 | Maxygen, Inc. | Oligonucleotide-mediated nucleic acid recombination |
| US20070065838A1 (en) | 1999-01-19 | 2007-03-22 | Maxygen, Inc. | Oligonucleotide mediated nucleic acid recombination |
| US6251685B1 (en) | 1999-02-18 | 2001-06-26 | Agilent Technologies, Inc. | Readout method for molecular biological electronically addressable arrays |
| AU767606B2 (en) | 1999-02-19 | 2003-11-20 | Synthetic Genomics, Inc. | Method for producing polymers |
| EP2177627B1 (en) | 1999-02-23 | 2012-05-02 | Caliper Life Sciences, Inc. | Manipulation of microparticles in microfluidic systems |
| US20030186226A1 (en) | 1999-03-08 | 2003-10-02 | Brennan Thomas M. | Methods and compositions for economically synthesizing and assembling long DNA sequences |
| US6824866B1 (en) | 1999-04-08 | 2004-11-30 | Affymetrix, Inc. | Porous silica substrates for polymer synthesis and assays |
| US6284465B1 (en) | 1999-04-15 | 2001-09-04 | Agilent Technologies, Inc. | Apparatus, systems and method for locating nucleic acids bound to surfaces |
| US6469156B1 (en) | 1999-04-20 | 2002-10-22 | The United States Of America As Represented By The Department Of Health And Human Services | Rapid and sensitive method for detecting histoplasma capsulatum |
| US6518056B2 (en) | 1999-04-27 | 2003-02-11 | Agilent Technologies Inc. | Apparatus, systems and method for assaying biological materials using an annular format |
| US6773676B2 (en) | 1999-04-27 | 2004-08-10 | Agilent Technologies, Inc. | Devices for performing array hybridization assays and methods of using the same |
| US6221653B1 (en) | 1999-04-27 | 2001-04-24 | Agilent Technologies, Inc. | Method of performing array-based hybridization assays using thermal inkjet deposition of sample fluids |
| US6300137B1 (en) | 1999-04-28 | 2001-10-09 | Agilent Technologies Inc. | Method for synthesizing a specific, surface-bound polymer uniformly over an element of a molecular array |
| US6242266B1 (en) | 1999-04-30 | 2001-06-05 | Agilent Technologies Inc. | Preparation of biopolymer arrays |
| US6323043B1 (en) | 1999-04-30 | 2001-11-27 | Agilent Technologies, Inc. | Fabricating biopolymer arrays |
| US7276336B1 (en) | 1999-07-22 | 2007-10-02 | Agilent Technologies, Inc. | Methods of fabricating an addressable array of biopolymer probes |
| WO2000066190A1 (en) | 1999-05-01 | 2000-11-09 | Qinetiq Limited | Derivatized porous silicon |
| CA2395874C (en) | 1999-05-06 | 2011-09-20 | Frank Carter Bancroft | Dna-based steganography |
| US7056661B2 (en) | 1999-05-19 | 2006-06-06 | Cornell Research Foundation, Inc. | Method for sequencing nucleic acid molecules |
| WO2000071559A1 (en) | 1999-05-24 | 2000-11-30 | Invitrogen Corporation | Method for deblocking of labeled oligonucleotides |
| US6472147B1 (en) | 1999-05-25 | 2002-10-29 | The Scripps Research Institute | Methods for display of heterodimeric proteins on filamentous phage using pVII and pIX, compositions, vectors and combinatorial libraries |
| US6132997A (en) | 1999-05-28 | 2000-10-17 | Agilent Technologies | Method for linear mRNA amplification |
| US6815218B1 (en) | 1999-06-09 | 2004-11-09 | Massachusetts Institute Of Technology | Methods for manufacturing bioelectronic devices |
| US6709852B1 (en) | 1999-06-22 | 2004-03-23 | Invitrogen Corporation | Rapid growing microorganisms for biotechnology applications |
| DE19928410C2 (de) | 1999-06-22 | 2002-11-28 | Agilent Technologies Inc | Gerätegehäuse mit einer Einrichtung zum Betrieb eines Labor-Mikrochips |
| AU5882000A (en) | 1999-06-22 | 2001-01-09 | Invitrogen Corporation | Improved primers and methods for the detection and discrimination of nucleic acids |
| US6399394B1 (en) | 1999-06-30 | 2002-06-04 | Agilent Technologies, Inc. | Testing multiple fluid samples with multiple biopolymer arrays |
| US6465183B2 (en) | 1999-07-01 | 2002-10-15 | Agilent Technologies, Inc. | Multidentate arrays |
| US6461816B1 (en) | 1999-07-09 | 2002-10-08 | Agilent Technologies, Inc. | Methods for controlling cross-hybridization in analysis of nucleic acid sequences |
| US7504213B2 (en) | 1999-07-09 | 2009-03-17 | Agilent Technologies, Inc. | Methods and apparatus for preparing arrays comprising features having degenerate biopolymers |
| US6306599B1 (en) | 1999-07-16 | 2001-10-23 | Agilent Technologies Inc. | Biopolymer arrays and their fabrication |
| US6346423B1 (en) | 1999-07-16 | 2002-02-12 | Agilent Technologies, Inc. | Methods and compositions for producing biopolymeric arrays |
| US6180351B1 (en) | 1999-07-22 | 2001-01-30 | Agilent Technologies Inc. | Chemical array fabrication with identifier |
| US6201112B1 (en) | 1999-07-22 | 2001-03-13 | Agilent Technologies Inc. | Method for 3′ end-labeling ribonucleic acids |
| WO2001012862A2 (en) | 1999-08-18 | 2001-02-22 | Illumina, Inc. | Compositions and methods for preparing oligonucleotide solutions |
| US6262490B1 (en) | 1999-11-05 | 2001-07-17 | Advanced Semiconductor Engineering, Inc. | Substrate strip for use in packaging semiconductor chips |
| US7211390B2 (en) | 1999-09-16 | 2007-05-01 | 454 Life Sciences Corporation | Method of sequencing a nucleic acid |
| US7244559B2 (en) | 1999-09-16 | 2007-07-17 | 454 Life Sciences Corporation | Method of sequencing a nucleic acid |
| US6319674B1 (en) | 1999-09-16 | 2001-11-20 | Agilent Technologies, Inc. | Methods for attaching substances to surfaces |
| US6743585B2 (en) | 1999-09-16 | 2004-06-01 | Agilent Technologies, Inc. | Methods for preparing conjugates |
| US7078167B2 (en) | 1999-09-17 | 2006-07-18 | Agilent Technologies, Inc. | Arrays having background features and methods for using the same |
| US7122303B2 (en) | 1999-09-17 | 2006-10-17 | Agilent Technologies, Inc. | Arrays comprising background features that provide for a measure of a non-specific binding and methods for using the same |
| AU7537200A (en) | 1999-09-29 | 2001-04-30 | Solexa Ltd. | Polynucleotide sequencing |
| DE19947495C2 (de) | 1999-10-01 | 2003-05-28 | Agilent Technologies Inc | Mikrofluidischer Mikrochip |
| EP1235932A2 (en) | 1999-10-08 | 2002-09-04 | Protogene Laboratories, Inc. | Method and apparatus for performing large numbers of reactions using array assembly |
| US6232072B1 (en) | 1999-10-15 | 2001-05-15 | Agilent Technologies, Inc. | Biopolymer array inspection |
| US6451998B1 (en) | 1999-10-18 | 2002-09-17 | Agilent Technologies, Inc. | Capping and de-capping during oligonucleotide synthesis |
| US6171797B1 (en) | 1999-10-20 | 2001-01-09 | Agilent Technologies Inc. | Methods of making polymeric arrays |
| US7115423B1 (en) | 1999-10-22 | 2006-10-03 | Agilent Technologies, Inc. | Fluidic structures within an array package |
| US6387636B1 (en) | 1999-10-22 | 2002-05-14 | Agilent Technologies, Inc. | Method of shielding biosynthesis reactions from the ambient environment on an array |
| US6077674A (en) | 1999-10-27 | 2000-06-20 | Agilent Technologies Inc. | Method of producing oligonucleotide arrays with features of high purity |
| US8268605B2 (en) | 1999-10-29 | 2012-09-18 | Agilent Technologies, Inc. | Compositions and methods utilizing DNA polymerases |
| US6689319B1 (en) | 1999-10-29 | 2004-02-10 | Agilent Technologies, Ind. | Apparatus for deposition and inspection of chemical and biological fluids |
| US6406849B1 (en) | 1999-10-29 | 2002-06-18 | Agilent Technologies, Inc. | Interrogating multi-featured arrays |
| US20010055761A1 (en) | 1999-10-29 | 2001-12-27 | Agilent Technologies | Small scale dna synthesis using polymeric solid support with functionalized regions |
| US6329210B1 (en) | 1999-10-29 | 2001-12-11 | Agilent Technologies, Inc. | Method and apparatus for high volume polymer synthesis |
| US6428957B1 (en) | 1999-11-08 | 2002-08-06 | Agilent Technologies, Inc. | Systems tools and methods of assaying biological materials using spatially-addressable arrays |
| US6440669B1 (en) | 1999-11-10 | 2002-08-27 | Agilent Technologies, Inc. | Methods for applying small volumes of reagents |
| US7041445B2 (en) | 1999-11-15 | 2006-05-09 | Clontech Laboratories, Inc. | Long oligonucleotide arrays |
| US6446642B1 (en) | 1999-11-22 | 2002-09-10 | Agilent Technologies, Inc. | Method and apparatus to clean an inkjet reagent deposition device |
| US6582938B1 (en) | 2001-05-11 | 2003-06-24 | Affymetrix, Inc. | Amplification of nucleic acids |
| US6800439B1 (en) | 2000-01-06 | 2004-10-05 | Affymetrix, Inc. | Methods for improved array preparation |
| AU2788101A (en) | 2000-01-11 | 2001-07-24 | Maxygen, Inc. | Integrated systems and methods for diversity generation and screening |
| EP1118661A1 (en) | 2000-01-13 | 2001-07-25 | Het Nederlands Kanker Instituut | T cell receptor libraries |
| EP1252513A4 (en) | 2000-01-25 | 2007-07-18 | Affymetrix Inc | METHOD, SYSTEM AND SOFTWARE FOR OFFERING A GENOMIC WEB PORTAL |
| US6587579B1 (en) | 2000-01-26 | 2003-07-01 | Agilent Technologies Inc. | Feature quality in array fabrication |
| US6458526B1 (en) | 2000-01-28 | 2002-10-01 | Agilent Technologies, Inc. | Method and apparatus to inhibit bubble formation in a fluid |
| US7198939B2 (en) | 2000-01-28 | 2007-04-03 | Agilent Technologies, Inc. | Apparatus for interrogating an addressable array |
| US6406851B1 (en) | 2000-01-28 | 2002-06-18 | Agilent Technologies, Inc. | Method for coating a substrate quickly and uniformly with a small volume of fluid |
| US6235483B1 (en) | 2000-01-31 | 2001-05-22 | Agilent Technologies, Inc. | Methods and kits for indirect labeling of nucleic acids |
| GB0002389D0 (en) | 2000-02-02 | 2000-03-22 | Solexa Ltd | Molecular arrays |
| US6403314B1 (en) | 2000-02-04 | 2002-06-11 | Agilent Technologies, Inc. | Computational method and system for predicting fragmented hybridization and for identifying potential cross-hybridization |
| US6833450B1 (en) | 2000-03-17 | 2004-12-21 | Affymetrix, Inc. | Phosphite ester oxidation in nucleic acid array preparation |
| US6365355B1 (en) | 2000-03-28 | 2002-04-02 | The Regents Of The University Of California | Chimeric proteins for detection and quantitation of DNA mutations, DNA sequence variations, DNA damage and DNA mismatches |
| US20020025561A1 (en) | 2000-04-17 | 2002-02-28 | Hodgson Clague Pitman | Vectors for gene-self-assembly |
| US7776021B2 (en) | 2000-04-28 | 2010-08-17 | The Charles Stark Draper Laboratory | Micromachined bilayer unit for filtration of small molecules |
| US6716634B1 (en) | 2000-05-31 | 2004-04-06 | Agilent Technologies, Inc. | Increasing ionization efficiency in mass spectrometry |
| US7163660B2 (en) | 2000-05-31 | 2007-01-16 | Infineon Technologies Ag | Arrangement for taking up liquid analytes |
| EP1287010A1 (en) | 2000-06-02 | 2003-03-05 | Blue Heron Biotechnology, Inc. | Methods for improving the sequence fidelity of synthetic double-stranded oligonucleotides |
| US7399599B2 (en) | 2000-07-10 | 2008-07-15 | Vertex Pharmaceuticals (San Diego) Llc | Ion channel assay methods |
| CA2416952A1 (en) | 2000-07-27 | 2002-02-07 | The Australian National University | Combinatorial probes and uses therefor |
| US7135565B2 (en) | 2000-07-28 | 2006-11-14 | Agilent Technologies, Inc. | Synthesis of polynucleotides using combined oxidation/deprotection chemistry |
| US7205400B2 (en) | 2000-07-31 | 2007-04-17 | Agilent Technologies, Inc. | Array fabrication |
| US6613893B1 (en) | 2000-07-31 | 2003-09-02 | Agilent Technologies Inc. | Array fabrication |
| EP1180548B1 (en) | 2000-07-31 | 2005-11-02 | Agilent Technologies, Inc. (a Delaware corporation) | Array based methods for synthesizing nucleic acid mixtures |
| US6599693B1 (en) | 2000-07-31 | 2003-07-29 | Agilent Technologies Inc. | Array fabrication |
| US6890760B1 (en) | 2000-07-31 | 2005-05-10 | Agilent Technologies, Inc. | Array fabrication |
| GB0018876D0 (en) | 2000-08-01 | 2000-09-20 | Applied Research Systems | Method of producing polypeptides |
| CN1468313A (zh) | 2000-08-24 | 2004-01-14 | �����ɷ� | 新颖的构建物及其在代谢途径工程中的用途 |
| AU2001291540A1 (en) | 2000-09-08 | 2002-03-22 | University Technologies International, Inc. | Linker phosphoramidites for oligonucleotide synthesis |
| US6966945B1 (en) | 2000-09-20 | 2005-11-22 | Goodrich Corporation | Inorganic matrix compositions, composites and process of making the same |
| US6897023B2 (en) | 2000-09-27 | 2005-05-24 | The Molecular Sciences Institute, Inc. | Method for determining relative abundance of nucleic acid sequences |
| NO20004869D0 (no) | 2000-09-28 | 2000-09-28 | Torbjoern Rognes | Metode for hurtig optimal lokal sekvensjustering ved bruk av parallell prosessering |
| US7097809B2 (en) | 2000-10-03 | 2006-08-29 | California Institute Of Technology | Combinatorial synthesis system |
| JP4361271B2 (ja) | 2000-10-10 | 2009-11-11 | バイオトローブ・インコーポレイテツド | アッセイ、合成、および保存用の器具、ならびに、その作製、使用、および操作の方法 |
| DE10051396A1 (de) | 2000-10-17 | 2002-04-18 | Febit Ferrarius Biotech Gmbh | Verfahren und Vorrichtung zur integrierten Synthese und Analytbestimmung an einem Träger |
| AU7680200A (en) | 2000-10-18 | 2002-04-29 | Ultra Proizv Elektronskih Napr | System for payment data exchange and payment terminal device used therein |
| DE60125312T2 (de) | 2000-10-26 | 2007-06-06 | Agilent Technologies, Inc. (n.d. Ges. d. Staates Delaware), Santa Clara | Mikroarray |
| US6905816B2 (en) | 2000-11-27 | 2005-06-14 | Intelligent Medical Devices, Inc. | Clinically intelligent diagnostic devices and methods |
| US20020155439A1 (en) | 2000-12-04 | 2002-10-24 | Ana Rodriguez | Method for generating a library of mutant oligonucleotides using the linear cyclic amplification reaction |
| CA2437040C (en) | 2000-12-05 | 2011-01-25 | Avecia Limited | Process for the preparation of phosphorothioate oligonucleotides |
| DE10060433B4 (de) | 2000-12-05 | 2006-05-11 | Hahn-Schickard-Gesellschaft für angewandte Forschung e.V. | Verfahren zur Herstellung eines Fluidbauelements, Fluidbauelement und Analysevorrichtung |
| US6768005B2 (en) | 2000-12-20 | 2004-07-27 | Avecia Limited | Process |
| US6660475B2 (en) | 2000-12-15 | 2003-12-09 | New England Biolabs, Inc. | Use of site-specific nicking endonucleases to create single-stranded regions and applications thereof |
| AUPR259301A0 (en) | 2001-01-18 | 2001-02-15 | Polymerat Pty Ltd | Polymers having co-continuous architecture |
| DK1385950T3 (da) | 2001-01-19 | 2008-11-03 | Centocor Inc | Computerstyret samling af et polynucleotid, som koder for et målpolypeptid |
| US6958217B2 (en) | 2001-01-24 | 2005-10-25 | Genomic Expression Aps | Single-stranded polynucleotide tags |
| US7166258B2 (en) | 2001-01-31 | 2007-01-23 | Agilent Technologies, Inc. | Automation-optimized microarray package |
| US7027930B2 (en) | 2001-01-31 | 2006-04-11 | Agilent Technologies, Inc. | Reading chemical arrays |
| US6879915B2 (en) | 2001-01-31 | 2005-04-12 | Agilent Technologies, Inc. | Chemical array fabrication and use |
| US20020164824A1 (en) | 2001-02-16 | 2002-11-07 | Jianming Xiao | Method and apparatus based on bundled capillaries for high throughput screening |
| US6660338B1 (en) | 2001-03-08 | 2003-12-09 | Agilent Technologies, Inc. | Functionalization of substrate surfaces with silane mixtures |
| US7211654B2 (en) | 2001-03-14 | 2007-05-01 | Regents Of The University Of Michigan | Linkers and co-coupling agents for optimization of oligonucleotide synthesis and purification on solid supports |
| ATE549415T1 (de) | 2001-03-16 | 2012-03-15 | Kalim Mir | Arrays und verfahren zur deren verwendung |
| US6610978B2 (en) | 2001-03-27 | 2003-08-26 | Agilent Technologies, Inc. | Integrated sample preparation, separation and introduction microdevice for inductively coupled plasma mass spectrometry |
| EP1392504A4 (en) | 2001-04-02 | 2008-03-05 | Agilent Technologies Inc | SENSOR SURFACES FOR DETECTING ANALYTES |
| US20030022240A1 (en) | 2001-04-17 | 2003-01-30 | Peizhi Luo | Generation and affinity maturation of antibody library in silico |
| US6943036B2 (en) | 2001-04-30 | 2005-09-13 | Agilent Technologies, Inc. | Error detection in chemical array fabrication |
| AU2002340641A1 (en) | 2001-05-03 | 2002-11-18 | Sigma-Genosys, Ltd. | Methods for assembling protein microarrays |
| WO2002095073A1 (en) | 2001-05-18 | 2002-11-28 | Wisconsin Alumni Research Foundation | Method for the synthesis of dna sequences |
| US20040175710A1 (en) | 2001-05-22 | 2004-09-09 | Haushalter Robert C. | Method for in situ, on-chip chemical synthesis |
| US6880576B2 (en) | 2001-06-07 | 2005-04-19 | Nanostream, Inc. | Microfluidic devices for methods development |
| US6613523B2 (en) | 2001-06-29 | 2003-09-02 | Agilent Technologies, Inc. | Method of DNA sequencing using cleavable tags |
| US6649348B2 (en) | 2001-06-29 | 2003-11-18 | Agilent Technologies Inc. | Methods for manufacturing arrays |
| US20040161741A1 (en) | 2001-06-30 | 2004-08-19 | Elazar Rabani | Novel compositions and processes for analyte detection, quantification and amplification |
| US6989267B2 (en) | 2001-07-02 | 2006-01-24 | Agilent Technologies, Inc. | Methods of making microarrays with substrate surfaces having covalently bound polyelectrolyte films |
| US6753145B2 (en) | 2001-07-05 | 2004-06-22 | Agilent Technologies, Inc. | Buffer composition and method for hybridization of microarrays on adsorbed polymer siliceous surfaces |
| US7314599B2 (en) | 2001-07-17 | 2008-01-01 | Agilent Technologies, Inc. | Paek embossing and adhesion for microfluidic devices |
| US7128876B2 (en) | 2001-07-17 | 2006-10-31 | Agilent Technologies, Inc. | Microdevice and method for component separation in a fluid |
| US6702256B2 (en) | 2001-07-17 | 2004-03-09 | Agilent Technologies, Inc. | Flow-switching microdevice |
| US20030108903A1 (en) | 2001-07-19 | 2003-06-12 | Liman Wang | Multiple word DNA computing on surfaces |
| WO2003025118A2 (en) | 2001-07-26 | 2003-03-27 | Stratagene | Multi-site mutagenesis |
| US7371580B2 (en) | 2001-08-24 | 2008-05-13 | Agilent Technologies, Inc. | Use of unstructured nucleic acids in assaying nucleic acid molecules |
| US6682702B2 (en) | 2001-08-24 | 2004-01-27 | Agilent Technologies, Inc. | Apparatus and method for simultaneously conducting multiple chemical reactions |
| JP2003101204A (ja) | 2001-09-25 | 2003-04-04 | Nec Kansai Ltd | 配線基板及び配線基板の製造方法並びに電子部品 |
| US20050124022A1 (en) | 2001-10-30 | 2005-06-09 | Maithreyan Srinivasan | Novel sulfurylase-luciferase fusion proteins and thermostable sulfurylase |
| US6902921B2 (en) | 2001-10-30 | 2005-06-07 | 454 Corporation | Sulfurylase-luciferase fusion proteins and thermostable sulfurylase |
| US6852850B2 (en) | 2001-10-31 | 2005-02-08 | Agilent Technologies, Inc. | Use of ionic liquids for fabrication of polynucleotide arrays |
| US7524950B2 (en) | 2001-10-31 | 2009-04-28 | Agilent Technologies, Inc. | Uses of cationic salts for polynucleotide synthesis |
| US6858720B2 (en) | 2001-10-31 | 2005-02-22 | Agilent Technologies, Inc. | Method of synthesizing polynucleotides using ionic liquids |
| US20030087298A1 (en) | 2001-11-02 | 2003-05-08 | Roland Green | Detection of hybridization on oligonucleotide microarray through covalently labeling microarray probe |
| US7482118B2 (en) | 2001-11-15 | 2009-01-27 | Third Wave Technologies, Inc. | Endonuclease-substrate complexes |
| DE50114507D1 (de) | 2001-11-22 | 2009-01-02 | Sloning Biotechnology Gmbh | Nukleinsäure-Linker und deren Verwendung in der Gensynthese |
| US20030099952A1 (en) | 2001-11-26 | 2003-05-29 | Roland Green | Microarrays with visible pattern detection |
| US20030143605A1 (en) | 2001-12-03 | 2003-07-31 | Si Lok | Methods for the selection and cloning of nucleic acid molecules free of unwanted nucleotide sequence alterations |
| US6927029B2 (en) | 2001-12-03 | 2005-08-09 | Agilent Technologies, Inc. | Surface with tethered polymeric species for binding biomolecules |
| US6838888B2 (en) | 2001-12-13 | 2005-01-04 | Agilent Technologies, Inc. | Flow cell humidity sensor system |
| AU2002357249A1 (en) | 2001-12-13 | 2003-07-09 | Blue Heron Biotechnology, Inc. | Methods for removal of double-stranded oligonucleotides containing sequence errors using mismatch recognition proteins |
| US7932070B2 (en) | 2001-12-21 | 2011-04-26 | Agilent Technologies, Inc. | High fidelity DNA polymerase compositions and uses therefor |
| US6790620B2 (en) | 2001-12-24 | 2004-09-14 | Agilent Technologies, Inc. | Small volume chambers |
| US7282183B2 (en) | 2001-12-24 | 2007-10-16 | Agilent Technologies, Inc. | Atmospheric control in reaction chambers |
| US6846454B2 (en) | 2001-12-24 | 2005-01-25 | Agilent Technologies, Inc. | Fluid exit in reaction chambers |
| AU2003207448A1 (en) | 2002-01-04 | 2003-07-24 | Board Of Regents, The University Of Texas System | Proofreading, error deletion, and ligation method for synthesis of high-fidelity polynucleotide sequences |
| US7025324B1 (en) | 2002-01-04 | 2006-04-11 | Massachusetts Institute Of Technology | Gating apparatus and method of manufacture |
| US6673552B2 (en) | 2002-01-14 | 2004-01-06 | Diversa Corporation | Methods for purifying annealed double-stranded oligonucleotides lacking base pair mismatches or nucleotide gaps |
| US20040009498A1 (en) | 2002-01-14 | 2004-01-15 | Diversa Corporation | Chimeric antigen binding molecules and methods for making and using them |
| US7141368B2 (en) | 2002-01-30 | 2006-11-28 | Agilent Technologies, Inc. | Multi-directional deposition in array fabrication |
| US7422851B2 (en) | 2002-01-31 | 2008-09-09 | Nimblegen Systems, Inc. | Correction for illumination non-uniformity during the synthesis of arrays of oligomers |
| US20040126757A1 (en) | 2002-01-31 | 2004-07-01 | Francesco Cerrina | Method and apparatus for synthesis of arrays of DNA probes |
| US7157229B2 (en) | 2002-01-31 | 2007-01-02 | Nimblegen Systems, Inc. | Prepatterned substrate for optical synthesis of DNA probes |
| US7037659B2 (en) | 2002-01-31 | 2006-05-02 | Nimblegen Systems Inc. | Apparatus for constructing DNA probes having a prismatic and kaleidoscopic light homogenizer |
| US7083975B2 (en) | 2002-02-01 | 2006-08-01 | Roland Green | Microarray synthesis instrument and method |
| US20030148291A1 (en) | 2002-02-05 | 2003-08-07 | Karla Robotti | Method of immobilizing biologically active molecules for assay purposes in a microfluidic format |
| US6728129B2 (en) | 2002-02-19 | 2004-04-27 | The Regents Of The University Of California | Multistate triple-decker dyads in three distinct architectures for information storage applications |
| US6958119B2 (en) | 2002-02-26 | 2005-10-25 | Agilent Technologies, Inc. | Mobile phase gradient generation microfluidic device |
| US6770892B2 (en) | 2002-02-28 | 2004-08-03 | Agilent Technologies, Inc. | Method and system for automated focus-distance determination for molecular array scanners |
| US6914229B2 (en) | 2002-02-28 | 2005-07-05 | Agilent Technologies, Inc. | Signal offset for prevention of data clipping in a molecular array scanner |
| US6929951B2 (en) | 2002-02-28 | 2005-08-16 | Agilent Technologies, Inc. | Method and system for molecular array scanner calibration |
| US20050084907A1 (en) | 2002-03-01 | 2005-04-21 | Maxygen, Inc. | Methods, systems, and software for identifying functional biomolecules |
| US6919181B2 (en) | 2002-03-25 | 2005-07-19 | Agilent Technologies, Inc. | Methods for generating ligand arrays |
| JP2005521419A (ja) | 2002-04-01 | 2005-07-21 | ブルー ヘロン バイオテクノロジー インコーポレイテッド | ポリヌクレオチド作製のための固相方法 |
| EP1350853A1 (en) | 2002-04-05 | 2003-10-08 | ID-Lelystad, Instituut voor Dierhouderij en Diergezondheid B.V. | Detection of polymorphisms |
| US6773888B2 (en) | 2002-04-08 | 2004-08-10 | Affymetrix, Inc. | Photoactivatable silane compounds and methods for their synthesis and use |
| ATE401422T1 (de) | 2002-04-22 | 2008-08-15 | Genencor Int | Verfahren zur erzeugung einer bibliothek aus bakterienklonen mit unterschiedlichen genexpressionsniveaus |
| GB0209539D0 (en) | 2002-04-26 | 2002-06-05 | Avecia Ltd | Monomer Polymer and process |
| US7125523B2 (en) | 2002-04-29 | 2006-10-24 | Agilent Technologies, Inc. | Holders for arrays |
| US6946285B2 (en) | 2002-04-29 | 2005-09-20 | Agilent Technologies, Inc. | Arrays with elongated features |
| US6621076B1 (en) | 2002-04-30 | 2003-09-16 | Agilent Technologies, Inc. | Flexible assembly for transporting sample fluids into a mass spectrometer |
| US7094537B2 (en) | 2002-04-30 | 2006-08-22 | Agilent Technologies, Inc. | Micro arrays with structured and unstructured probes |
| WO2003093504A1 (de) | 2002-05-06 | 2003-11-13 | Noxxon Pharma Ag | Verfahren zur amplifikation von nukleinsäuren |
| US20030211478A1 (en) | 2002-05-08 | 2003-11-13 | Gentel Corporation | Transcription factor profiling on a solid surface |
| US7221785B2 (en) | 2002-05-21 | 2007-05-22 | Agilent Technologies, Inc. | Method and system for measuring a molecular array background signal from a continuous background region of specified size |
| US7273730B2 (en) | 2002-05-24 | 2007-09-25 | Invitrogen Corporation | Nested PCR employing degradable primers |
| EP1546378B1 (en) | 2002-05-24 | 2011-06-22 | Roche NimbleGen, Inc. | Microarrays and method for running hybridization reaction for multiple samples on a single microarray |
| US6789965B2 (en) | 2002-05-31 | 2004-09-14 | Agilent Technologies, Inc. | Dot printer with off-axis loading |
| US7537936B2 (en) | 2002-05-31 | 2009-05-26 | Agilent Technologies, Inc. | Method of testing multiple fluid samples with multiple biopolymer arrays |
| US7078505B2 (en) | 2002-06-06 | 2006-07-18 | Agilent Technologies, Inc. | Manufacture of arrays with varying deposition parameters |
| US6939673B2 (en) | 2002-06-14 | 2005-09-06 | Agilent Technologies, Inc. | Manufacture of arrays with reduced error impact |
| US7371348B2 (en) | 2002-06-14 | 2008-05-13 | Agilent Technologies | Multiple array format |
| US7919308B2 (en) | 2002-06-14 | 2011-04-05 | Agilent Technologies, Inc. | Form in place gaskets for assays |
| US7351379B2 (en) | 2002-06-14 | 2008-04-01 | Agilent Technologies, Inc. | Fluid containment structure |
| US7220573B2 (en) | 2002-06-21 | 2007-05-22 | Agilent Technologies, Inc. | Array assay devices and methods of using the same |
| US6713262B2 (en) | 2002-06-25 | 2004-03-30 | Agilent Technologies, Inc. | Methods and compositions for high throughput identification of protein/nucleic acid binding pairs |
| US7894998B2 (en) | 2002-06-26 | 2011-02-22 | Agilent Technologies, Inc. | Method for identifying suitable nucleic acid probe sequences for use in nucleic acid arrays |
| US7202358B2 (en) | 2002-07-25 | 2007-04-10 | Agilent Technologies, Inc. | Methods for producing ligand arrays |
| US7452712B2 (en) | 2002-07-30 | 2008-11-18 | Applied Biosystems Inc. | Sample block apparatus and method of maintaining a microcard on a sample block |
| US7101508B2 (en) | 2002-07-31 | 2006-09-05 | Agilent Technologies, Inc. | Chemical array fabrication errors |
| US6835938B2 (en) | 2002-07-31 | 2004-12-28 | Agilent Technologies, Inc. | Biopolymer array substrate thickness dependent automated focus-distance determination method for biopolymer array scanners |
| US7153689B2 (en) | 2002-08-01 | 2006-12-26 | Agilent Technologies, Inc. | Apparatus and methods for cleaning and priming droplet dispensing devices |
| US7205128B2 (en) | 2002-08-16 | 2007-04-17 | Agilent Technologies, Inc. | Method for synthesis of the second strand of cDNA |
| US7563600B2 (en) | 2002-09-12 | 2009-07-21 | Combimatrix Corporation | Microarray synthesis and assembly of gene-length polynucleotides |
| US20040166567A1 (en) | 2002-09-26 | 2004-08-26 | Santi Daniel V | Synthetic genes |
| WO2004029586A1 (en) | 2002-09-27 | 2004-04-08 | Nimblegen Systems, Inc. | Microarray with hydrophobic barriers |
| AU2003282885A1 (en) | 2002-09-30 | 2004-04-23 | Nimblegen Systems, Inc. | Parallel loading of arrays |
| GB2409454B (en) | 2002-10-01 | 2007-05-23 | Nimblegen Systems Inc | Microarrays having multiple oligonucleotides in single array features |
| US7129075B2 (en) | 2002-10-18 | 2006-10-31 | Transgenomic, Inc. | Isolated CEL II endonuclease |
| US8283148B2 (en) | 2002-10-25 | 2012-10-09 | Agilent Technologies, Inc. | DNA polymerase compositions for quantitative PCR and methods thereof |
| JP2006503586A (ja) | 2002-10-28 | 2006-02-02 | ゼオトロン コーポレイション | アレイオリゴマー合成および使用 |
| US7422911B2 (en) | 2002-10-31 | 2008-09-09 | Agilent Technologies, Inc. | Composite flexible array substrate having flexible support |
| US7402279B2 (en) | 2002-10-31 | 2008-07-22 | Agilent Technologies, Inc. | Device with integrated microfluidic and electronic components |
| US6976384B2 (en) | 2002-10-31 | 2005-12-20 | Nanostream, Inc. | Parallel detection chromatography systems |
| US7390457B2 (en) | 2002-10-31 | 2008-06-24 | Agilent Technologies, Inc. | Integrated microfluidic array device |
| US7364896B2 (en) | 2002-10-31 | 2008-04-29 | Agilent Technologies, Inc. | Test strips including flexible array substrates and method of hybridization |
| US7629120B2 (en) | 2002-10-31 | 2009-12-08 | Rice University | Method for assembling PCR fragments of DNA |
| US20040086892A1 (en) | 2002-11-06 | 2004-05-06 | Crothers Donald M. | Universal tag assay |
| US7029854B2 (en) | 2002-11-22 | 2006-04-18 | Agilent Technologies, Inc. | Methods designing multiple mRNA transcript nucleic acid probe sequences for use in nucleic acid arrays |
| US7062385B2 (en) | 2002-11-25 | 2006-06-13 | Tufts University | Intelligent electro-optical nucleic acid-based sensor array and method for detecting volatile compounds in ambient air |
| US20040110133A1 (en) | 2002-12-06 | 2004-06-10 | Affymetrix, Inc. | Functionated photoacid generator for biological microarray synthesis |
| US7932025B2 (en) | 2002-12-10 | 2011-04-26 | Massachusetts Institute Of Technology | Methods for high fidelity production of long nucleic acid molecules with error control |
| US7879580B2 (en) | 2002-12-10 | 2011-02-01 | Massachusetts Institute Of Technology | Methods for high fidelity production of long nucleic acid molecules |
| US20060076482A1 (en) | 2002-12-13 | 2006-04-13 | Hobbs Steven E | High throughput systems and methods for parallel sample analysis |
| US6987263B2 (en) | 2002-12-13 | 2006-01-17 | Nanostream, Inc. | High throughput systems and methods for parallel sample analysis |
| US7247337B1 (en) | 2002-12-16 | 2007-07-24 | Agilent Technologies, Inc. | Method and apparatus for microarray fabrication |
| US20040191810A1 (en) | 2002-12-17 | 2004-09-30 | Affymetrix, Inc. | Immersed microarrays in conical wells |
| GB0229443D0 (en) | 2002-12-18 | 2003-01-22 | Avecia Ltd | Process |
| US7960157B2 (en) | 2002-12-20 | 2011-06-14 | Agilent Technologies, Inc. | DNA polymerase blends and uses thereof |
| ES2246748T1 (es) | 2002-12-23 | 2006-03-01 | Agilent Technologies, Inc. | Ensayos de hibridacion genomica comparativos que utilizan caracteristicas oligonucleotidicas inmovilizadas y composiciones para ponerlos en practica. |
| CA2508660C (en) | 2002-12-23 | 2013-08-20 | Wyeth | Antibodies against pd-1 and uses therefor |
| WO2004058391A2 (de) | 2002-12-23 | 2004-07-15 | Febit Biotech Gmbh | Photoaktivierbare zweistufige schutzgruppen für die synthese von biopolymeren |
| DE10260805A1 (de) | 2002-12-23 | 2004-07-22 | Geneart Gmbh | Verfahren und Vorrichtung zum Optimieren einer Nucleotidsequenz zur Expression eines Proteins |
| US7372982B2 (en) | 2003-01-14 | 2008-05-13 | Agilent Technologies, Inc. | User interface for molecular array feature analysis |
| US6809277B2 (en) | 2003-01-22 | 2004-10-26 | Agilent Technologies, Inc. | Method for registering a deposited material with channel plate channels, and switch produced using same |
| ES2330339T3 (es) | 2003-01-29 | 2009-12-09 | 454 Life Sciences Corporation | Procedimientos para amplificar y secuenciar acidos nucleicos. |
| US7202264B2 (en) | 2003-01-31 | 2007-04-10 | Isis Pharmaceuticals, Inc. | Supports for oligomer synthesis |
| US8073626B2 (en) | 2003-01-31 | 2011-12-06 | Agilent Technologies, Inc. | Biopolymer array reading |
| US6950756B2 (en) | 2003-02-05 | 2005-09-27 | Agilent Technologies, Inc. | Rearrangement of microarray scan images to form virtual arrays |
| GB2398383B (en) | 2003-02-12 | 2005-03-09 | Global Genomics Ab | Method and means for nucleic acid sequencing |
| US7413709B2 (en) | 2003-02-12 | 2008-08-19 | Agilent Technologies, Inc. | PAEK-based microfluidic device with integrated electrospray emitter |
| US7244513B2 (en) | 2003-02-21 | 2007-07-17 | Nano-Proprietary, Inc. | Stain-etched silicon powder |
| US7070932B2 (en) | 2003-02-25 | 2006-07-04 | Agilent Technologies, Inc. | Methods and devices for detecting printhead misalignment of an in situ polymeric array synthesis device |
| US7252938B2 (en) | 2003-02-25 | 2007-08-07 | Agilent Technologies, Inc. | Methods and devices for producing a polymer at a location of a substrate |
| US6977223B2 (en) | 2003-03-07 | 2005-12-20 | Massachusetts Institute Of Technology | Three dimensional microfabrication |
| US20050053968A1 (en) | 2003-03-31 | 2005-03-10 | Council Of Scientific And Industrial Research | Method for storing information in DNA |
| WO2004090170A1 (en) | 2003-04-02 | 2004-10-21 | Blue Heron Biotechnology, Inc. | Error reduction in automated gene synthesis |
| US7534561B2 (en) | 2003-04-02 | 2009-05-19 | Agilent Technologies, Inc. | Nucleic acid array in situ fabrication methods and arrays produced using the same |
| US20040219663A1 (en) | 2003-04-30 | 2004-11-04 | Page Robert D. | Biopolymer array fabrication using different drop deposition heads |
| US7206439B2 (en) | 2003-04-30 | 2007-04-17 | Agilent Technologies, Inc. | Feature locations in array reading |
| US7269518B2 (en) | 2003-04-30 | 2007-09-11 | Agilent Technologies, Inc. | Chemical array reading |
| US6916113B2 (en) | 2003-05-16 | 2005-07-12 | Agilent Technologies, Inc. | Devices and methods for fluid mixing |
| US7695683B2 (en) | 2003-05-20 | 2010-04-13 | Fluidigm Corporation | Method and system for microfluidic device and imaging thereof |
| CA2531197A1 (en) | 2003-05-30 | 2005-01-06 | The Board Of Trustees Of The University Of Illinois | Gene expression profiles that identify genetically elite ungulate mammals |
| CA2540692C (en) | 2003-06-02 | 2013-05-28 | Isis Pharmaceuticals, Inc. | Oligonucleotide synthesis with alternative solvents |
| US8133670B2 (en) | 2003-06-13 | 2012-03-13 | Cold Spring Harbor Laboratory | Method for making populations of defined nucleic acid molecules |
| US6938476B2 (en) | 2003-06-25 | 2005-09-06 | Agilent Technologies, Inc. | Apparatus and methods for sensing fluid levels |
| US7534563B2 (en) | 2003-06-30 | 2009-05-19 | Agilent Technologies, Inc. | Methods for producing ligand arrays |
| US20050016851A1 (en) | 2003-07-24 | 2005-01-27 | Jensen Klavs F. | Microchemical method and apparatus for synthesis and coating of colloidal nanoparticles |
| US6843281B1 (en) | 2003-07-30 | 2005-01-18 | Agilent Techinologies, Inc. | Methods and apparatus for introducing liquids into microfluidic chambers |
| US7353116B2 (en) | 2003-07-31 | 2008-04-01 | Agilent Technologies, Inc. | Chemical array with test dependent signal reading or processing |
| US7939310B2 (en) | 2003-08-06 | 2011-05-10 | University Of Massachusetts | Systems and methods for analyzing nucleic acid sequences |
| US7028536B2 (en) | 2004-06-29 | 2006-04-18 | Nanostream, Inc. | Sealing interface for microfluidic device |
| US7348144B2 (en) | 2003-08-13 | 2008-03-25 | Agilent Technologies, Inc. | Methods and system for multi-drug treatment discovery |
| US7229497B2 (en) | 2003-08-26 | 2007-06-12 | Massachusetts Institute Of Technology | Method of preparing nanocrystals |
| US7427679B2 (en) | 2003-08-30 | 2008-09-23 | Agilent Technologies, Inc. | Precursors for two-step polynucleotide synthesis |
| US7385050B2 (en) | 2003-08-30 | 2008-06-10 | Agilent Technologies, Inc. | Cleavable linker for polynucleotide synthesis |
| US7417139B2 (en) | 2003-08-30 | 2008-08-26 | Agilent Technologies, Inc. | Method for polynucleotide synthesis |
| US7585970B2 (en) | 2003-08-30 | 2009-09-08 | Agilent Technologies, Inc. | Method of polynucleotide synthesis using modified support |
| US7193077B2 (en) | 2003-08-30 | 2007-03-20 | Agilent Technologies, Inc. | Exocyclic amine triaryl methyl protecting groups in two-step polynucleotide synthesis |
| US20050049796A1 (en) | 2003-09-03 | 2005-03-03 | Webb Peter G. | Methods for encoding non-biological information on microarrays |
| EP2824190A1 (en) | 2003-09-09 | 2015-01-14 | Integrigen, Inc. | Methods and compositions for generation of germline human antibody genes |
| JP2007506429A (ja) | 2003-09-23 | 2007-03-22 | アトム・サイエンシズ・インコーポレーテッド | ポリマー核酸のハイブリダイゼーションプローブ |
| US7488607B2 (en) | 2003-09-30 | 2009-02-10 | Agilent Technologies, Inc. | Electronically readable microarray with electronic addressing function |
| US7147362B2 (en) | 2003-10-15 | 2006-12-12 | Agilent Technologies, Inc. | Method of mixing by intermittent centrifugal force |
| US7075161B2 (en) | 2003-10-23 | 2006-07-11 | Agilent Technologies, Inc. | Apparatus and method for making a low capacitance artificial nanopore |
| WO2005043154A2 (en) | 2003-10-27 | 2005-05-12 | Massachusetts Institute Of Technology | High density reaction chambers and methods of use |
| US7169560B2 (en) | 2003-11-12 | 2007-01-30 | Helicos Biosciences Corporation | Short cycle methods for sequencing polynucleotides |
| US7276338B2 (en) | 2003-11-17 | 2007-10-02 | Jacobson Joseph M | Nucleotide sequencing via repetitive single molecule hybridization |
| DE10353887A1 (de) | 2003-11-18 | 2005-06-16 | Febit Ag | Hochparalleler DNA-Synthesizer auf Matrizenbasis |
| US7851192B2 (en) | 2004-11-22 | 2010-12-14 | New England Biolabs, Inc. | Modified DNA cleavage enzymes and methods for use |
| US7282705B2 (en) | 2003-12-19 | 2007-10-16 | Agilent Technologies, Inc. | Microdevice having an annular lining for producing an electrospray emitter |
| US20110059865A1 (en) | 2004-01-07 | 2011-03-10 | Mark Edward Brennan Smith | Modified Molecular Arrays |
| US7084180B2 (en) | 2004-01-28 | 2006-08-01 | Velocys, Inc. | Fischer-tropsch synthesis using microchannel technology and novel catalyst and microchannel reactor |
| CA2553833C (en) | 2004-01-28 | 2012-10-02 | 454 Corporation | Nucleic acid amplification with continuous flow emulsion |
| JP2007521833A (ja) | 2004-02-12 | 2007-08-09 | コンパス ジェネティクス エルエルシー | 配列特異的分類による遺伝的分析 |
| US7125488B2 (en) | 2004-02-12 | 2006-10-24 | Varian, Inc. | Polar-modified bonded phase materials for chromatographic separations |
| AU2005222788A1 (en) | 2004-02-27 | 2005-09-29 | President And Fellows Of Harvard College | Polynucleotide synthesis |
| US7875463B2 (en) | 2004-03-26 | 2011-01-25 | Agilent Technologies, Inc. | Generalized pulse jet ejection head control model |
| US20050214779A1 (en) | 2004-03-29 | 2005-09-29 | Peck Bill J | Methods for in situ generation of nucleic acid arrays |
| US8825411B2 (en) | 2004-05-04 | 2014-09-02 | Dna Twopointo, Inc. | Design, synthesis and assembly of synthetic nucleic acids |
| AU2005243187A1 (en) | 2004-05-11 | 2005-11-24 | Wyeth | Oligonucleotide arrays to monitor gene expression and methods for making and using same |
| ES2459367T3 (es) | 2004-05-19 | 2014-05-09 | Massachusetts Institute Of Technology | Modelos tridimensionales de enfermedades de células/tejidos perfundidos |
| US7302348B2 (en) | 2004-06-02 | 2007-11-27 | Agilent Technologies, Inc. | Method and system for quantifying and removing spatial-intensity trends in microarray data |
| US20060024711A1 (en) | 2004-07-02 | 2006-02-02 | Helicos Biosciences Corporation | Methods for nucleic acid amplification and sequence determination |
| BRPI0513155B1 (pt) | 2004-07-06 | 2021-07-20 | Bioren, Inc. | Método de distinguir um ou mais resíduos de aminoácido funcionais dos resíduos de aminoácido não-funcionais em uma região definida dentro de um polipeptídeo, método de gerar uma biblioteca de análogos de polipeptídeo e método de identificar um subconjunto de análogos de polipeptídeo tendo uma propriedade desejada |
| US7811753B2 (en) | 2004-07-14 | 2010-10-12 | Ibis Biosciences, Inc. | Methods for repairing degraded DNA |
| US20060012793A1 (en) | 2004-07-19 | 2006-01-19 | Helicos Biosciences Corporation | Apparatus and methods for analyzing samples |
| US7276720B2 (en) | 2004-07-19 | 2007-10-02 | Helicos Biosciences Corporation | Apparatus and methods for analyzing samples |
| US20060019084A1 (en) | 2004-07-23 | 2006-01-26 | Pearson Laurence T | Monolithic composition and method |
| US20060024678A1 (en) | 2004-07-28 | 2006-02-02 | Helicos Biosciences Corporation | Use of single-stranded nucleic acid binding proteins in sequencing |
| MX2007001292A (es) | 2004-08-03 | 2007-07-04 | Geneart Ag | Metodo para modular la expresion genica al alterar el contendido de cpg. |
| WO2006073504A2 (en) | 2004-08-04 | 2006-07-13 | President And Fellows Of Harvard College | Wobble sequencing |
| WO2006018044A1 (en) | 2004-08-18 | 2006-02-23 | Agilent Technologies, Inc. | Microfluidic assembly with coupled microfluidic devices |
| US7034290B2 (en) | 2004-09-24 | 2006-04-25 | Agilent Technologies, Inc. | Target support with pattern recognition sites |
| US7943046B2 (en) | 2004-10-01 | 2011-05-17 | Agilent Technologies, Inc | Methods and systems for on-column protein delipidation |
| CA2584984A1 (en) | 2004-10-18 | 2006-04-27 | Codon Devices, Inc. | Methods for assembly of high fidelity synthetic polynucleotides |
| US20070122817A1 (en) | 2005-02-28 | 2007-05-31 | George Church | Methods for assembly of high fidelity synthetic polynucleotides |
| US7141807B2 (en) | 2004-10-22 | 2006-11-28 | Agilent Technologies, Inc. | Nanowire capillaries for mass spectrometry |
| US20060110744A1 (en) | 2004-11-23 | 2006-05-25 | Sampas Nicolas M | Probe design methods and microarrays for comparative genomic hybridization and location analysis |
| US8380441B2 (en) | 2004-11-30 | 2013-02-19 | Agilent Technologies, Inc. | Systems for producing chemical array layouts |
| US7977119B2 (en) | 2004-12-08 | 2011-07-12 | Agilent Technologies, Inc. | Chemical arrays and methods of using the same |
| US7439272B2 (en) | 2004-12-20 | 2008-10-21 | Varian, Inc. | Ultraporous sol gel monoliths |
| EP1841788A4 (en) | 2004-12-22 | 2009-01-21 | Univ Singapore | NEW TOXIN FROM A SERPENT |
| CA2594832A1 (en) | 2005-01-13 | 2006-07-20 | Codon Devices, Inc. | Compositions and methods for protein design |
| US20060171855A1 (en) | 2005-02-03 | 2006-08-03 | Hongfeng Yin | Devices,systems and methods for multi-dimensional separation |
| WO2006086391A2 (en) | 2005-02-07 | 2006-08-17 | Massachusetts Institute Of Technology | Electrochemically-degradable layer-by-layer thin films |
| US7393665B2 (en) | 2005-02-10 | 2008-07-01 | Population Genetics Technologies Ltd | Methods and compositions for tagging and identifying polynucleotides |
| US20060203236A1 (en) | 2005-03-08 | 2006-09-14 | Zhenghua Ji | Sample cell |
| EP1623763A1 (en) | 2005-03-11 | 2006-02-08 | Agilent Technologies, Inc. | Chip with cleaning cavity |
| US7618777B2 (en) | 2005-03-16 | 2009-11-17 | Agilent Technologies, Inc. | Composition and method for array hybridization |
| US20060219637A1 (en) | 2005-03-29 | 2006-10-05 | Killeen Kevin P | Devices, systems and methods for liquid chromatography |
| WO2006116476A1 (en) | 2005-04-27 | 2006-11-02 | Sigma-Aldrich Co. | Activators for oligonucleotide and phosphoramidite synthesis |
| DE602006015633D1 (de) | 2005-04-29 | 2010-09-02 | Synthetic Genomics Inc | Amplifikation und klonierung einzelner dna-moleküle mittels rolling-circle-amplifikation |
| US7572907B2 (en) | 2005-04-29 | 2009-08-11 | Agilent Technologies, Inc. | Methods and compounds for polynucleotide synthesis |
| US7396676B2 (en) | 2005-05-31 | 2008-07-08 | Agilent Technologies, Inc. | Evanescent wave sensor with attached ligand |
| EP1907583B2 (en) | 2005-06-15 | 2019-10-23 | Complete Genomics Inc. | Single molecule arrays for genetic and chemical analysis |
| US7919239B2 (en) | 2005-07-01 | 2011-04-05 | Agilent Technologies, Inc. | Increasing hybridization efficiencies |
| US8076064B2 (en) | 2005-07-09 | 2011-12-13 | Agilent Technologies, Inc. | Method of treatment of RNA sample |
| US7718365B2 (en) | 2005-07-09 | 2010-05-18 | Agilent Technologies, Inc. | Microarray analysis of RNA |
| EP1924704B1 (en) | 2005-08-02 | 2011-05-25 | Rubicon Genomics, Inc. | Compositions and methods for processing and amplification of dna, including using multiple enzymes in a single reaction |
| DE102005037351B3 (de) | 2005-08-08 | 2007-01-11 | Geneart Ag | Verfahren für die kontinuierliche zielgerichtete Evolution von Proteinen in vitro |
| US9404882B2 (en) | 2005-08-11 | 2016-08-02 | New Mexico Tech Research Foundation | Method of producing a multi-microchannel, flow-through element and device using same |
| CA2618665C (en) | 2005-08-11 | 2012-11-13 | J. Craig Venter Institute | Method for in vitro recombination |
| US7749701B2 (en) | 2005-08-11 | 2010-07-06 | Agilent Technologies, Inc. | Controlling use of oligonucleotide sequences released from arrays |
| US7723077B2 (en) | 2005-08-11 | 2010-05-25 | Synthetic Genomics, Inc. | In vitro recombination method |
| US7805252B2 (en) | 2005-08-16 | 2010-09-28 | Dna Twopointo, Inc. | Systems and methods for designing and ordering polynucleotides |
| US20070054127A1 (en) | 2005-08-26 | 2007-03-08 | Hergenrother Robert W | Silane coating compositions, coating systems, and methods |
| US20100233429A1 (en) | 2005-09-16 | 2010-09-16 | Yamatake Corporation | Substrate for Biochip, Biochip, Method for Manufacturing Substrate for Biochip and Method for Manufacturing Biochip |
| US20080308884A1 (en) | 2005-10-13 | 2008-12-18 | Silex Microsystems Ab | Fabrication of Inlet and Outlet Connections for Microfluidic Chips |
| US7368550B2 (en) | 2005-10-31 | 2008-05-06 | Agilent Technologies, Inc. | Phosphorus protecting groups |
| US7759471B2 (en) | 2005-10-31 | 2010-07-20 | Agilent Technologies, Inc. | Monomer compositions for the synthesis of RNA, methods of synthesis, and methods of deprotection |
| US8552174B2 (en) | 2005-10-31 | 2013-10-08 | Agilent Technologies, Inc. | Solutions, methods, and processes for deprotection of polynucleotides |
| US8202985B2 (en) | 2005-10-31 | 2012-06-19 | Agilent Technologies, Inc. | Monomer compositions for the synthesis of polynucleotides, methods of synthesis, and methods of deprotection |
| GB0522310D0 (en) | 2005-11-01 | 2005-12-07 | Solexa Ltd | Methods of preparing libraries of template polynucleotides |
| US7291471B2 (en) | 2005-11-21 | 2007-11-06 | Agilent Technologies, Inc. | Cleavable oligonucleotide arrays |
| GB0524069D0 (en) | 2005-11-25 | 2006-01-04 | Solexa Ltd | Preparation of templates for solid phase amplification |
| US8137936B2 (en) | 2005-11-29 | 2012-03-20 | Macevicz Stephen C | Selected amplification of polynucleotides |
| JP5106416B2 (ja) | 2006-01-06 | 2012-12-26 | アジレント・テクノロジーズ・インク | 濃縮(packed)DNAポリメラーゼを含む核酸複製のための反応緩衝液組成物 |
| EP1987162A4 (en) | 2006-01-23 | 2009-11-25 | Population Genetics Technologi | NUCLEIC ACID ANALYSIS ABOUT SEQUENCE TOKENS |
| WO2007087377A2 (en) | 2006-01-25 | 2007-08-02 | Massachusetts Institute Of Technology | Photoelectrochemical synthesis of high density combinatorial polymer arrays |
| WO2008057127A2 (en) | 2006-02-06 | 2008-05-15 | Massachusetts Institute Of Technology | Self-assembly of macromolecules on multilayered polymer surfaces |
| US8809876B2 (en) | 2006-02-14 | 2014-08-19 | Massachusetts Institute Of Technology | Absorbing film |
| US7807356B2 (en) | 2006-03-09 | 2010-10-05 | Agilent Technologies, Inc. | Labeled nucleotide composition |
| TW200806317A (en) | 2006-03-20 | 2008-02-01 | Wyeth Corp | Methods for reducing protein aggregation |
| US7572908B2 (en) | 2006-03-23 | 2009-08-11 | Agilent Technologies, Inc. | Cleavable linkers for polynucleotides |
| US7855281B2 (en) | 2006-03-23 | 2010-12-21 | Agilent Technologies, Inc. | Cleavable thiocarbonate linkers for polynucleotide synthesis |
| US20070231800A1 (en) | 2006-03-28 | 2007-10-04 | Agilent Technologies, Inc. | Determination of methylated DNA |
| US20070238106A1 (en) | 2006-04-07 | 2007-10-11 | Agilent Technologies, Inc. | Systems and methods of determining alleles and/or copy numbers |
| US20070238104A1 (en) | 2006-04-07 | 2007-10-11 | Agilent Technologies, Inc. | Competitive oligonucleotides |
| US20070238108A1 (en) | 2006-04-07 | 2007-10-11 | Agilent Technologies, Inc. | Validation of comparative genomic hybridization |
| US8058055B2 (en) | 2006-04-07 | 2011-11-15 | Agilent Technologies, Inc. | High resolution chromosomal mapping |
| WO2007120627A2 (en) | 2006-04-11 | 2007-10-25 | New England Biolabs, Inc. | Repair of nucleic acids for improved amplification |
| US20090062129A1 (en) | 2006-04-19 | 2009-03-05 | Agencourt Personal Genomics, Inc. | Reagents, methods, and libraries for gel-free bead-based sequencing |
| US8383338B2 (en) | 2006-04-24 | 2013-02-26 | Roche Nimblegen, Inc. | Methods and systems for uniform enrichment of genomic regions |
| US20070259344A1 (en) | 2006-05-03 | 2007-11-08 | Agilent Technologies, Inc. | Compound probes and methods of increasing the effective probe densities of arrays |
| US20070259347A1 (en) | 2006-05-03 | 2007-11-08 | Agilent Technologies, Inc. | Methods of increasing the effective probe densities of arrays |
| US20070259346A1 (en) | 2006-05-03 | 2007-11-08 | Agilent Technologies, Inc. | Analysis of arrays |
| US20070259345A1 (en) | 2006-05-03 | 2007-11-08 | Agilent Technologies, Inc. | Target determination using compound probes |
| WO2007137242A2 (en) | 2006-05-19 | 2007-11-29 | Massachusetts Institute Of Technology | Microfluidic-based gene synthesis |
| WO2007136834A2 (en) | 2006-05-19 | 2007-11-29 | Codon Devices, Inc. | Combined extension and ligation for nucleic acid assembly |
| WO2008054543A2 (en) | 2006-05-20 | 2008-05-08 | Codon Devices, Inc. | Oligonucleotides for multiplex nucleic acid assembly |
| WO2007148337A2 (en) | 2006-06-19 | 2007-12-27 | Yeda Research And Development Co. Ltd. | Programmable iterated elongation: a method for manufacturing synthetic genes and combinatorial dna and protein libraries |
| AT503861B1 (de) | 2006-07-05 | 2008-06-15 | F Star Biotech Forsch & Entw | Verfahren zur manipulation von t-zell-rezeptoren |
| AT503902B1 (de) | 2006-07-05 | 2008-06-15 | F Star Biotech Forsch & Entw | Verfahren zur manipulation von immunglobulinen |
| US20080193772A1 (en) | 2006-07-07 | 2008-08-14 | Bio-Rad Laboratories, Inc | Mass spectrometry probes having hydrophobic coatiings |
| US7524942B2 (en) | 2006-07-31 | 2009-04-28 | Agilent Technologies, Inc. | Labeled nucleotide composition |
| US7572585B2 (en) | 2006-07-31 | 2009-08-11 | Agilent Technologies, Inc. | Enzymatic labeling of RNA |
| EP2049682A2 (en) | 2006-07-31 | 2009-04-22 | Illumina Cambridge Limited | Method of library preparation avoiding the formation of adaptor dimers |
| AU2007283022B2 (en) | 2006-08-08 | 2011-07-28 | Rheinische Friedrich-Wilhelms-Universitat Bonn | Structure and use of 5' phosphate oligonucleotides |
| DE102006039479A1 (de) | 2006-08-23 | 2008-03-06 | Febit Biotech Gmbh | Programmierbare Oligonukleotidsynthese |
| WO2008023179A2 (en) | 2006-08-24 | 2008-02-28 | Solexa Limited | Method for retaining even coverage of short insert libraries |
| US8053191B2 (en) | 2006-08-31 | 2011-11-08 | Westend Asset Clearinghouse Company, Llc | Iterative nucleic acid assembly using activation of vector-encoded traits |
| US8415138B2 (en) | 2006-08-31 | 2013-04-09 | Agilent Technologies, Inc. | Apparatuses and methods for oligonucleotide preparation |
| US8097711B2 (en) | 2006-09-02 | 2012-01-17 | Agilent Technologies, Inc. | Thioether substituted aryl carbonate protecting groups |
| US20080311628A1 (en) | 2006-10-03 | 2008-12-18 | Ghc Technologies, Inc. | Methods and compositions for rapid amplification and capture of nucleic acid sequences |
| US20080287320A1 (en) | 2006-10-04 | 2008-11-20 | Codon Devices | Libraries and their design and assembly |
| US20080085511A1 (en) | 2006-10-05 | 2008-04-10 | Peck Bill J | Preparation of biopolymer arrays |
| US20080085514A1 (en) | 2006-10-10 | 2008-04-10 | Peck Bill J | Methods and devices for array synthesis |
| US7867782B2 (en) | 2006-10-19 | 2011-01-11 | Agilent Technologies, Inc. | Nanoscale moiety placement methods |
| US7999087B2 (en) | 2006-11-15 | 2011-08-16 | Agilent Technologies, Inc. | 2′-silyl containing thiocarbonate protecting groups for RNA synthesis |
| WO2008063134A1 (en) | 2006-11-24 | 2008-05-29 | Agency For Science, Technology And Research | Method of producing a pattern of discriminative wettability |
| WO2008063135A1 (en) | 2006-11-24 | 2008-05-29 | Agency For Science, Technology And Research | Apparatus for processing a sample in a liquid droplet and method of using the same |
| US8242258B2 (en) | 2006-12-03 | 2012-08-14 | Agilent Technologies, Inc. | Protecting groups for RNA synthesis |
| US7989396B2 (en) | 2006-12-05 | 2011-08-02 | The Board Of Trustees Of The Leland Stanford Junior University | Biomolecule immobilization on biosensors |
| US7862999B2 (en) | 2007-01-17 | 2011-01-04 | Affymetrix, Inc. | Multiplex targeted amplification using flap nuclease |
| US8314220B2 (en) | 2007-01-26 | 2012-11-20 | Agilent Technologies, Inc. | Methods compositions, and kits for detection of microRNA |
| US20080182296A1 (en) | 2007-01-31 | 2008-07-31 | Chanda Pranab K | Pcr-directed gene synthesis from large number of overlapping oligodeoxyribonucleotides |
| JP2008218579A (ja) | 2007-03-01 | 2008-09-18 | Denki Kagaku Kogyo Kk | 金属ベース回路基板 |
| WO2008109176A2 (en) | 2007-03-07 | 2008-09-12 | President And Fellows Of Harvard College | Assays and other reactions involving droplets |
| US7651762B2 (en) | 2007-03-13 | 2010-01-26 | Varian, Inc. | Methods and devices using a shrinkable support for porous monolithic materials |
| CN101680873B (zh) | 2007-04-04 | 2015-11-25 | 加利福尼亚大学董事会 | 使用纳米孔的组合物、设备、系统和方法 |
| EP2160396B1 (en) | 2007-05-10 | 2018-11-21 | Agilent Technologies, Inc. | Thiocarbon-protecting groups for rna synthesis |
| EP2160472A1 (en) | 2007-06-04 | 2010-03-10 | IN Situ RCP A/S | Enzyme activity assay using rolling circle amplification |
| US20080318334A1 (en) | 2007-06-20 | 2008-12-25 | Robotti Karla M | Microfluidic devices comprising fluid flow paths having a monolithic chromatographic material |
| US20090023190A1 (en) | 2007-06-20 | 2009-01-22 | Kai Qin Lao | Sequence amplification with loopable primers |
| US8194244B2 (en) | 2007-06-29 | 2012-06-05 | Intel Corporation | Solution sample plate with wells designed for improved Raman scattering signal detection efficiency |
| US7659069B2 (en) | 2007-08-31 | 2010-02-09 | Agilent Technologies, Inc. | Binary signaling assay using a split-polymerase |
| US7979215B2 (en) | 2007-07-30 | 2011-07-12 | Agilent Technologies, Inc. | Methods and systems for evaluating CGH candidate probe nucleic acid sequences |
| US8685642B2 (en) | 2007-07-30 | 2014-04-01 | Agilent Technologies, Inc. | Allele-specific copy number measurement using single nucleotide polymorphism and DNA arrays |
| US20090036664A1 (en) | 2007-07-31 | 2009-02-05 | Brian Jon Peter | Complex oligonucleotide primer mix |
| WO2009020435A1 (en) | 2007-08-07 | 2009-02-12 | Agency For Science, Technology And Research | Integrated microfluidic device for gene synthesis |
| CA2696372C (en) | 2007-08-14 | 2016-09-13 | Arcxis Biotechnologies, Inc. | Polymer microfluidic biochip fabrication |
| WO2009023257A1 (en) | 2007-08-15 | 2009-02-19 | Massachusetts Institute Of Technology | Microstructures for fluidic ballasting and flow control |
| US9598737B2 (en) | 2012-05-09 | 2017-03-21 | Longhorn Vaccines And Diagnostics, Llc | Next generation genomic sequencing methods |
| US20090053704A1 (en) | 2007-08-24 | 2009-02-26 | Natalia Novoradovskaya | Stabilization of nucleic acids on solid supports |
| US8877688B2 (en) | 2007-09-14 | 2014-11-04 | Adimab, Llc | Rationally designed, synthetic antibody libraries and uses therefor |
| US20100256017A1 (en) | 2007-09-17 | 2010-10-07 | Harry Benjamin Larman | Supramolecular nanostamping printing device |
| US7790387B2 (en) | 2007-09-24 | 2010-09-07 | Agilent Technologies, Inc. | Thiocarbonate linkers for polynucleotides |
| US8003330B2 (en) | 2007-09-28 | 2011-08-23 | Pacific Biosciences Of California, Inc. | Error-free amplification of DNA for clonal sequencing |
| EP2053132A1 (en) | 2007-10-23 | 2009-04-29 | Roche Diagnostics GmbH | Enrichment and sequence analysis of geomic regions |
| US8617811B2 (en) | 2008-01-28 | 2013-12-31 | Complete Genomics, Inc. | Methods and compositions for efficient base calling in sequencing reactions |
| WO2009070665A1 (en) | 2007-11-27 | 2009-06-04 | Massachusetts Institute Of Technology | Near field detector for integrated surface plasmon resonance biosensor applications |
| EP2247708A4 (en) | 2007-12-17 | 2013-02-27 | Yeda Res & Dev | SYSTEM AND METHOD FOR PROCESSING AND MANIPULATING DNA |
| WO2012044847A1 (en) | 2010-10-01 | 2012-04-05 | Life Technologies Corporation | Nucleic acid adaptors and uses thereof |
| WO2009089384A1 (en) | 2008-01-09 | 2009-07-16 | Life Technologies | Method of making a paired tag library for nucleic acid sequencing |
| US7682809B2 (en) | 2008-01-11 | 2010-03-23 | Agilent Technologies, Inc. | Direct ATP release sequencing |
| WO2009092564A2 (en) | 2008-01-23 | 2009-07-30 | Roche Diagnostics Gmbh | Integrated instrument performing synthesis and amplification |
| US8304273B2 (en) | 2008-01-24 | 2012-11-06 | Massachusetts Institute Of Technology | Insulated nanogap devices and methods of use thereof |
| US20090194483A1 (en) | 2008-01-31 | 2009-08-06 | Robotti Karla M | Microfluidic device having monolithic separation medium and method of use |
| CN107384910A (zh) | 2008-02-15 | 2017-11-24 | 合成基因组公司 | 体外连接和组合装配核酸分子的方法 |
| WO2009113709A1 (ja) | 2008-03-11 | 2009-09-17 | 国立大学法人東京大学 | 粘着末端を有するdna断片の調製方法 |
| US20090230044A1 (en) | 2008-03-13 | 2009-09-17 | Agilent Technologies, Inc. | Microfluid Chip Cleaning |
| US20090238722A1 (en) | 2008-03-18 | 2009-09-24 | Agilent Technologies, Inc. | Pressure-Reinforced Fluidic Chip |
| WO2009145818A1 (en) | 2008-03-31 | 2009-12-03 | Pacific Biosciences Of California, Inc | Single molecule loading methods and compositions |
| US20090246788A1 (en) | 2008-04-01 | 2009-10-01 | Roche Nimblegen, Inc. | Methods and Assays for Capture of Nucleic Acids |
| US8911948B2 (en) | 2008-04-30 | 2014-12-16 | Integrated Dna Technologies, Inc. | RNase H-based assays utilizing modified RNA monomers |
| JP4582224B2 (ja) | 2008-05-02 | 2010-11-17 | ソニー株式会社 | マイクロビーズ作製方法及びマイクロビーズ |
| JP4667490B2 (ja) | 2008-07-09 | 2011-04-13 | 三菱電機株式会社 | 加熱調理器 |
| WO2010014903A1 (en) | 2008-07-31 | 2010-02-04 | Massachusetts Institute Of Technology | Multiplexed olfactory receptor-based microsurface plasmon polariton detector |
| US20100069250A1 (en) | 2008-08-16 | 2010-03-18 | The Board Of Trustees Of The Leland Stanford Junior University | Digital PCR Calibration for High Throughput Sequencing |
| EP2313515B1 (en) | 2008-08-22 | 2015-03-04 | Sangamo BioSciences, Inc. | Methods and compositions for targeted single-stranded cleavage and targeted integration |
| US8808986B2 (en) | 2008-08-27 | 2014-08-19 | Gen9, Inc. | Methods and devices for high fidelity polynucleotide synthesis |
| US8034917B2 (en) | 2008-08-28 | 2011-10-11 | Agilent Technologies, Inc. | Primer-directed chromosome painting |
| JP2012501658A (ja) | 2008-09-05 | 2012-01-26 | ライフ テクノロジーズ コーポレーション | 核酸配列決定の検証、較正、および標準化のための方法およびシステム |
| CA2772434C (en) | 2008-09-05 | 2017-11-21 | Masad Damha | Rna monomers containing o-acetal levulinyl ester groups and their use in rna microarrays |
| US8586310B2 (en) | 2008-09-05 | 2013-11-19 | Washington University | Method for multiplexed nucleic acid patch polymerase chain reaction |
| KR101718406B1 (ko) | 2008-09-06 | 2017-03-21 | 켐진스 코포레이션 | 역방향 합성 rna용 rna 합성-포스포라미디트, 및 리간드, 크로모포어의 용이한 도입, 및 합성 rna 3´-말단에서의 변형에서의 적용 |
| US8541569B2 (en) | 2008-09-06 | 2013-09-24 | Chemgenes Corporation | Phosphoramidites for synthetic RNA in the reverse direction, efficient RNA synthesis and convenient introduction of 3'-end ligands, chromophores and modifications of synthetic RNA |
| US20100062495A1 (en) | 2008-09-10 | 2010-03-11 | Genscript Corporation | Homologous recombination-based DNA cloning methods and compositions |
| US20100076183A1 (en) | 2008-09-22 | 2010-03-25 | Dellinger Douglas J | Protected monomer and method of final deprotection for rna synthesis |
| US8213015B2 (en) | 2008-09-25 | 2012-07-03 | Agilent Technologies, Inc. | Integrated flow cell with semiconductor oxide tubing |
| US8404445B2 (en) | 2008-09-30 | 2013-03-26 | Abbvie Inc. | Antibody libraries |
| US20100090341A1 (en) | 2008-10-14 | 2010-04-15 | Molecular Imprints, Inc. | Nano-patterned active layers formed by nano-imprint lithography |
| US20100301398A1 (en) | 2009-05-29 | 2010-12-02 | Ion Torrent Systems Incorporated | Methods and apparatus for measuring analytes |
| US9080211B2 (en) | 2008-10-24 | 2015-07-14 | Epicentre Technologies Corporation | Transposon end compositions and methods for modifying nucleic acids |
| US8357489B2 (en) | 2008-11-13 | 2013-01-22 | The Board Of Trustees Of The Leland Stanford Junior University | Methods for detecting hepatocellular carcinoma |
| EP2370451B1 (en) | 2008-12-02 | 2016-11-16 | Wave Life Sciences Japan, Inc. | Method for the synthesis of phosphorus atom modified nucleic acids |
| US8963262B2 (en) | 2009-08-07 | 2015-02-24 | Massachusettes Institute Of Technology | Method and apparatus for forming MEMS device |
| TW201104253A (en) | 2008-12-31 | 2011-02-01 | Nat Health Research Institutes | Microarray chip and method of fabricating for the same |
| EP2393833A1 (en) | 2009-02-09 | 2011-12-14 | Helmholtz Zentrum München Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH) | Repertoire of allo-restricted peptide-specific t cell receptor sequences and use thereof |
| US8569046B2 (en) | 2009-02-20 | 2013-10-29 | Massachusetts Institute Of Technology | Microarray with microchannels |
| WO2010094772A1 (en) | 2009-02-20 | 2010-08-26 | Febit Holding Gmbh | Synthesis of sequence-verified nucleic acids |
| AU2010222818B2 (en) | 2009-03-09 | 2015-05-14 | Bioatla, Llc | Mirac proteins |
| WO2010115122A2 (en) | 2009-04-03 | 2010-10-07 | Illumina, Inc. | Generation of uniform fragments of nucleic acids using patterned substrates |
| US7862716B2 (en) | 2009-04-13 | 2011-01-04 | Sielc Technologies Corporation | HPLC schematic with integrated sample cleaning system |
| CN102802798B (zh) | 2009-04-29 | 2015-04-08 | 锡克拜控股有限公司 | 用于将生物液体淀积在基板上的方法和仪器 |
| WO2010127186A1 (en) | 2009-04-30 | 2010-11-04 | Prognosys Biosciences, Inc. | Nucleic acid constructs and methods of use |
| EP2248914A1 (en) | 2009-05-05 | 2010-11-10 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | The use of class IIB restriction endonucleases in 2nd generation sequencing applications |
| US9309557B2 (en) | 2010-12-17 | 2016-04-12 | Life Technologies Corporation | Nucleic acid amplification |
| US20100292102A1 (en) | 2009-05-14 | 2010-11-18 | Ali Nouri | System and Method For Preventing Synthesis of Dangerous Biological Sequences |
| US20100300882A1 (en) | 2009-05-26 | 2010-12-02 | General Electric Company | Devices and methods for in-line sample preparation of materials |
| US9493846B2 (en) | 2009-06-02 | 2016-11-15 | The Regents Of The University Of California | Virus discovery by sequencing and assembly of virus-derived siRNAS, miRNAs, piRNAs |
| US8309710B2 (en) | 2009-06-29 | 2012-11-13 | Agilent Technologies, Inc. | Use of N-alkyl imidazole for sulfurization of oligonucleotides with an acetyl disulfide |
| US8642755B2 (en) | 2009-06-30 | 2014-02-04 | Agilent Technologies, Inc. | Use of thioacetic acid derivatives in the sulfurization of oligonucleotides with phenylacetyl disulfide |
| GB0912909D0 (en) | 2009-07-23 | 2009-08-26 | Olink Genomics Ab | Probes for specific analysis of nucleic acids |
| US8329208B2 (en) | 2009-07-28 | 2012-12-11 | Methylation Sciences International Srl | Pharmacokinetics of S-adenosylmethionine formulations |
| JP6013912B2 (ja) | 2009-07-30 | 2016-10-25 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | オリゴヌクレオチドプローブのセットならびにそれに関連する方法および使用 |
| WO2011021102A2 (en) | 2009-08-20 | 2011-02-24 | Population Genetics Technologies Ltd | Compositions and methods for intramolecular nucleic acid rearrangement |
| US8476598B1 (en) | 2009-08-31 | 2013-07-02 | Sionyx, Inc. | Electromagnetic radiation imaging devices and associated methods |
| US20110082055A1 (en) | 2009-09-18 | 2011-04-07 | Codexis, Inc. | Reduced codon mutagenesis |
| US20120184724A1 (en) | 2009-09-22 | 2012-07-19 | Agilent Technologies, Inc. | Protected monomers and methods of deprotection for rna synthesis |
| US20130053252A1 (en) | 2009-09-25 | 2013-02-28 | President & Fellows Of Harvard College | Nucleic acid amplification and sequencing by synthesis with fluorogenic nucleotides |
| US8975019B2 (en) | 2009-10-19 | 2015-03-10 | University Of Massachusetts | Deducing exon connectivity by RNA-templated DNA ligation/sequencing |
| JP5774595B2 (ja) | 2009-10-28 | 2015-09-09 | ヤンセン バイオテツク,インコーポレーテツド | 抗glp−1r抗体及びそれらの使用 |
| WO2011053957A2 (en) | 2009-11-02 | 2011-05-05 | Gen9, Inc. | Compositions and methods for the regulation of multiple genes of interest in a cell |
| WO2011056872A2 (en) | 2009-11-03 | 2011-05-12 | Gen9, Inc. | Methods and microfluidic devices for the manipulation of droplets in high fidelity polynucleotide assembly |
| US20110114549A1 (en) | 2009-11-13 | 2011-05-19 | Agilent Technolgies, Inc. | Microfluidic device comprising separation columns |
| WO2011066185A1 (en) | 2009-11-25 | 2011-06-03 | Gen9, Inc. | Microfluidic devices and methods for gene synthesis |
| EP3597771A1 (en) | 2009-11-25 | 2020-01-22 | Gen9, Inc. | Methods and apparatuses for chip-based dna error reduction |
| US8500979B2 (en) | 2009-12-31 | 2013-08-06 | Intel Corporation | Nanogap chemical and biochemical sensors |
| WO2011085075A2 (en) | 2010-01-07 | 2011-07-14 | Gen9, Inc. | Assembly of high fidelity polynucleotides |
| US9758817B2 (en) | 2010-01-13 | 2017-09-12 | Agilent Technologies, Inc. | Method for identifying a nucleic acid in a sample |
| KR101230350B1 (ko) | 2010-01-27 | 2013-02-06 | 주식회사 엘지화학 | 구조적 안정성이 우수한 전지팩 |
| US20120027786A1 (en) | 2010-02-23 | 2012-02-02 | Massachusetts Institute Of Technology | Genetically programmable pathogen sense and destroy |
| GB201003036D0 (en) | 2010-02-23 | 2010-04-07 | Fermentas Uab | Restriction endonucleases and their applications |
| US8716467B2 (en) | 2010-03-03 | 2014-05-06 | Gen9, Inc. | Methods and devices for nucleic acid synthesis |
| JP2013520989A (ja) | 2010-03-05 | 2013-06-10 | シンセティック ジェノミクス インコーポレーテッド | ゲノムのクローニングおよび操作のための方法 |
| CA2792676A1 (en) | 2010-03-09 | 2011-09-15 | Toxcure, Inc. | Microneedle nasal delivery device |
| US10240194B2 (en) | 2010-05-13 | 2019-03-26 | Gen9, Inc. | Methods for nucleotide sequencing and high fidelity polynucleotide synthesis |
| US9187777B2 (en) | 2010-05-28 | 2015-11-17 | Gen9, Inc. | Methods and devices for in situ nucleic acid synthesis |
| GB2481425A (en) | 2010-06-23 | 2011-12-28 | Iti Scotland Ltd | Method and device for assembling polynucleic acid sequences |
| EP2598528A1 (en) | 2010-07-28 | 2013-06-05 | Immunocore Ltd. | T cell receptors |
| CN103154273A (zh) | 2010-09-21 | 2013-06-12 | 群体遗传学科技有限公司 | 通过分子计数提高等位基因调用的置信度 |
| US8715933B2 (en) | 2010-09-27 | 2014-05-06 | Nabsys, Inc. | Assay methods using nicking endonucleases |
| WO2012051327A2 (en) | 2010-10-12 | 2012-04-19 | Cornell University | Method of dual-adapter recombination for efficient concatenation of multiple dna fragments in shuffled or specified arrangements |
| US20140045728A1 (en) | 2010-10-22 | 2014-02-13 | President And Fellows Of Harvard College | Orthogonal Amplification and Assembly of Nucleic Acid Sequences |
| CA2821299C (en) | 2010-11-05 | 2019-02-12 | Frank J. Steemers | Linking sequence reads using paired code tags |
| WO2012078312A2 (en) | 2010-11-12 | 2012-06-14 | Gen9, Inc. | Methods and devices for nucleic acids synthesis |
| WO2012064975A1 (en) | 2010-11-12 | 2012-05-18 | Gen9, Inc. | Protein arrays and methods of using and making the same |
| CN118086471A (zh) | 2010-12-17 | 2024-05-28 | 生命技术公司 | 用于核酸扩增的方法、组合物、系统、仪器和试剂盒 |
| US20120164633A1 (en) | 2010-12-27 | 2012-06-28 | Ibis Biosciences, Inc. | Digital droplet sequencing |
| US9487807B2 (en) | 2010-12-27 | 2016-11-08 | Ibis Biosciences, Inc. | Compositions and methods for producing single-stranded circular DNA |
| CA2823044C (en) | 2010-12-31 | 2022-08-16 | Jay M. Short | Express humanization of antibodies |
| CN104673670A (zh) | 2011-03-30 | 2015-06-03 | 独立行政法人国立长寿医疗研究中心 | 膜分选培养器、膜分选培养试剂盒、和使用其的干细胞分选方法、以及分离膜 |
| US10131903B2 (en) | 2011-04-01 | 2018-11-20 | The Regents Of The University Of California | Microfluidic platform for synthetic biology applications |
| US9384920B1 (en) | 2011-04-04 | 2016-07-05 | Eric J. Bakulich | Locking knob |
| US20140357497A1 (en) | 2011-04-27 | 2014-12-04 | Kun Zhang | Designing padlock probes for targeted genomic sequencing |
| US8722585B2 (en) | 2011-05-08 | 2014-05-13 | Yan Wang | Methods of making di-tagged DNA libraries from DNA or RNA using double-tagged oligonucleotides |
| US9074204B2 (en) | 2011-05-20 | 2015-07-07 | Fluidigm Corporation | Nucleic acid encoding reactions |
| US9752176B2 (en) | 2011-06-15 | 2017-09-05 | Ginkgo Bioworks, Inc. | Methods for preparative in vitro cloning |
| JP6164535B2 (ja) | 2011-06-21 | 2017-07-19 | フエー・イー・ベー・フエー・ゼツト・ウエー | Gpcr:gタンパク質複合体に対して作製された結合ドメインおよびそれに由来する使用 |
| US9487824B2 (en) | 2011-06-28 | 2016-11-08 | Igor Kutyavin | Methods and compositions for enrichment of nucleic acids in mixtures of highly homologous sequences |
| US20130045483A1 (en) | 2011-07-01 | 2013-02-21 | Whitehead Institute For Biomedical Research | Yeast cells expressing amyloid beta and uses therefor |
| US9139874B2 (en) | 2011-07-07 | 2015-09-22 | Life Technologies Corporation | Bi-directional sequencing compositions and methods |
| US20130017978A1 (en) | 2011-07-11 | 2013-01-17 | Finnzymes Oy | Methods and transposon nucleic acids for generating a dna library |
| US20150203839A1 (en) | 2011-08-26 | 2015-07-23 | Gen9, Inc. | Compositions and Methods for High Fidelity Assembly of Nucleic Acids |
| IL280334B2 (en) | 2011-08-26 | 2023-09-01 | Gen9 Inc | Preparations and methods for high-fidelity assembly of nucleic acids |
| EP2751729B1 (en) | 2011-09-01 | 2020-10-21 | Genome Compiler Corporation | System for polynucleotide construct design, visualization and transactions to manufacture the same |
| WO2013036668A1 (en) | 2011-09-06 | 2013-03-14 | Gen-Probe Incorporated | Circularized templates for sequencing |
| US8840981B2 (en) | 2011-09-09 | 2014-09-23 | Eastman Kodak Company | Microfluidic device with multilayer coating |
| US20130109596A1 (en) | 2011-09-26 | 2013-05-02 | Life Technologies Corporation | High efficiency, small volume nucleic acid synthesis |
| EP2766838A2 (en) | 2011-10-11 | 2014-08-20 | Life Technologies Corporation | Systems and methods for analysis and interpretation of nucleic acid sequence data |
| CA2852949A1 (en) | 2011-10-19 | 2013-04-25 | Nugen Technologies, Inc. | Compositions and methods for directional nucleic acid amplification and sequencing |
| US8987174B2 (en) | 2011-10-28 | 2015-03-24 | Prognosys Biosciences, Inc. | Methods for manufacturing molecular arrays |
| US8815782B2 (en) | 2011-11-11 | 2014-08-26 | Agilent Technologies, Inc. | Use of DNAzymes for analysis of an RNA sample |
| US8450107B1 (en) | 2011-11-30 | 2013-05-28 | The Broad Institute Inc. | Nucleotide-specific recognition sequences for designer TAL effectors |
| EP2599785A1 (en) | 2011-11-30 | 2013-06-05 | Agilent Technologies, Inc. | Novel methods for the synthesis and purification of oligomers |
| US20130137173A1 (en) | 2011-11-30 | 2013-05-30 | Feng Zhang | Nucleotide-specific recognition sequences for designer tal effectors |
| WO2013093693A1 (en) | 2011-12-22 | 2013-06-27 | Rinat Neuroscience Corp. | Staphylococcus aureus specific antibodies and uses thereof |
| US9593375B2 (en) | 2011-12-30 | 2017-03-14 | Quest Diagnostics Investments Incorporated | Nucleic acid analysis using emulsion PCR |
| SG10201606285YA (en) | 2012-02-01 | 2016-09-29 | Synthetic Genomics Inc | Materials and methods for the synthesis of error-minimized nucleic acid molecules |
| ES2776673T3 (es) | 2012-02-27 | 2020-07-31 | Univ North Carolina Chapel Hill | Métodos y usos para etiquetas moleculares |
| ES2741099T3 (es) | 2012-02-28 | 2020-02-10 | Agilent Technologies Inc | Método de fijación de una secuencia de recuento para una muestra de ácido nucleico |
| US9150853B2 (en) | 2012-03-21 | 2015-10-06 | Gen9, Inc. | Methods for screening proteins using DNA encoded chemical libraries as templates for enzyme catalysis |
| WO2013149078A1 (en) | 2012-03-28 | 2013-10-03 | Kci Licensing, Inc. | Reduced-pressure systems, dressings, and methods facilitating separation of electronic and clinical component parts |
| CA2868928A1 (en) | 2012-04-10 | 2013-10-17 | The Trustees Of Princeton University | Ultra-sensitive sensor |
| US20150353921A9 (en) | 2012-04-16 | 2015-12-10 | Jingdong Tian | Method of on-chip nucleic acid molecule synthesis |
| US20130281308A1 (en) | 2012-04-24 | 2013-10-24 | Gen9, Inc. | Methods for sorting nucleic acids and preparative in vitro cloning |
| CA2871505C (en) | 2012-04-24 | 2021-10-12 | Gen9, Inc. | Methods for sorting nucleic acids and multiplexed preparative in vitro cloning |
| EP3514243B1 (en) | 2012-05-21 | 2022-08-17 | The Scripps Research Institute | Methods of sample preparation |
| US10308979B2 (en) | 2012-06-01 | 2019-06-04 | Agilent Technologies, Inc. | Target enrichment and labeling for multi-kilobase DNA |
| CN107055468A (zh) | 2012-06-01 | 2017-08-18 | 欧洲分子生物学实验室 | Dna中数字信息的高容量存储 |
| WO2013188037A2 (en) | 2012-06-11 | 2013-12-19 | Agilent Technologies, Inc | Method of adaptor-dimer subtraction using a crispr cas6 protein |
| WO2014004393A1 (en) | 2012-06-25 | 2014-01-03 | Gen9, Inc. | Methods for nucleic acid assembly and high throughput sequencing |
| SG10201610861XA (en) | 2012-07-03 | 2017-02-27 | Integrated Dna Tech Inc | Tm-enhanced blocking oligonucleotides and baits for improved target enrichment and reduced off-target selection |
| US9255245B2 (en) | 2012-07-03 | 2016-02-09 | Agilent Technologies, Inc. | Sample probes and methods for sampling intracellular material |
| WO2014011800A1 (en) | 2012-07-10 | 2014-01-16 | Pivot Bio, Inc. | Methods for multipart, modular and scarless assembly of dna molecules |
| WO2014012071A1 (en) | 2012-07-12 | 2014-01-16 | Massachusetts Institute Of Technology | Methods and apparatus for assembly |
| JP6239813B2 (ja) | 2012-07-18 | 2017-11-29 | 株式会社Screenセミコンダクターソリューションズ | 基板処理装置および基板処理方法 |
| US9384320B2 (en) | 2012-07-19 | 2016-07-05 | President And Fellows Of Harvard College | Methods of storing information using nucleic acids |
| RU2015106749A (ru) | 2012-07-27 | 2016-09-20 | Дзе Борд Оф Трастиз Оф Дзе Юниверсити Оф Иллинойс | Конструирование т-клеточных рецепторов |
| WO2014021938A1 (en) | 2012-08-02 | 2014-02-06 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and apparatus for nucleic acid synthesis using oligo-templated polymerization |
| CN102797044B (zh) * | 2012-08-16 | 2017-11-03 | 北京诺兰信生化科技有限责任公司 | 一种快速高效的均一化全长cDNA文库构建方法 |
| EP4219706A1 (en) | 2012-08-16 | 2023-08-02 | Synthetic Genomics, Inc. | Automated dsdna synthesis using a digital to biological converter |
| AU2013309272B2 (en) | 2012-08-31 | 2017-03-09 | Richard A. Lerner | Methods and compositions related to modulators of eukaryotic cells |
| WO2014039587A1 (en) | 2012-09-05 | 2014-03-13 | Bio-Rad Laboratories, Inc. | Systems and methods for stabilizing droplets |
| CN107541546B (zh) | 2012-10-15 | 2021-06-15 | 生命技术公司 | 用于标靶核酸富集的组合物、方法、系统和试剂盒 |
| KR20140048733A (ko) | 2012-10-16 | 2014-04-24 | 삼성전자주식회사 | 다중 웰 플레이트 및 상기 다중 웰 플레이트를 이용한 표적 물질 분석 방법 |
| US9410173B2 (en) | 2012-10-24 | 2016-08-09 | Clontech Laboratories, Inc. | Template switch-based methods for producing a product nucleic acid |
| US11439594B2 (en) | 2012-12-04 | 2022-09-13 | Phosphorex, Inc. | Microparticles and nanoparticles having negative surface charges |
| EP2929027B1 (en) | 2012-12-06 | 2018-02-21 | Agilent Technologies, Inc. | Molecular fabrication |
| CN104854246B (zh) | 2012-12-06 | 2018-05-01 | 安捷伦科技有限公司 | 无限制酶的靶标富集 |
| US9976162B2 (en) | 2012-12-10 | 2018-05-22 | Agilent Technologies, Inc. | Pairing code directed assembly |
| SG10201704633UA (en) | 2012-12-10 | 2017-07-28 | Resolution Bioscience Inc | Methods for targeted genomic analysis |
| WO2014093694A1 (en) | 2012-12-12 | 2014-06-19 | The Broad Institute, Inc. | Crispr-cas nickase systems, methods and compositions for sequence manipulation in eukaryotes |
| EP2962110A4 (en) | 2013-02-28 | 2016-11-02 | Univ Nanyang Tech | METHOD FOR MANUFACTURING DEVICE FOR SUPPORTING CULTURE OF BIOLOGICAL SUBSTANCE AND DEVICE THEREOF |
| US9580746B2 (en) | 2013-03-05 | 2017-02-28 | Agilent Technologies, Inc. | Synthesis of long fish probes |
| EP2964778B1 (en) | 2013-03-05 | 2019-10-09 | Agilent Technologies, Inc. | Detection of genomic rearrangements by sequence capture |
| WO2014160004A1 (en) | 2013-03-13 | 2014-10-02 | Gen9, Inc. | Compositions, methods and apparatus for oligonucleotides synthesis |
| WO2014160059A1 (en) | 2013-03-13 | 2014-10-02 | Gen9, Inc. | Compositions and methods for synthesis of high fidelity oligonucleotides |
| US20140274729A1 (en) | 2013-03-15 | 2014-09-18 | Nugen Technologies, Inc. | Methods, compositions and kits for generation of stranded rna or dna libraries |
| AU2014237003B2 (en) | 2013-03-15 | 2018-11-15 | Gen9, Inc. | Compositions and methods for multiplex nucleic acids synthesis |
| WO2014151117A1 (en) | 2013-03-15 | 2014-09-25 | The Board Of Trustees Of The Leland Stanford Junior University | Identification and use of circulating nucleic acid tumor markers |
| US20140274741A1 (en) | 2013-03-15 | 2014-09-18 | The Translational Genomics Research Institute | Methods to capture and sequence large fragments of dna and diagnostic methods for neuromuscular disease |
| US9279149B2 (en) | 2013-04-02 | 2016-03-08 | Molecular Assemblies, Inc. | Methods and apparatus for synthesizing nucleic acids |
| US10683536B2 (en) | 2013-04-02 | 2020-06-16 | Molecular Assemblies, Inc. | Reusable initiators for synthesizing nucleic acids |
| US9771613B2 (en) | 2013-04-02 | 2017-09-26 | Molecular Assemblies, Inc. | Methods and apparatus for synthesizing nucleic acid |
| US20150293102A1 (en) | 2013-04-13 | 2015-10-15 | Jung-Uk Shim | Detecting low-abundant analyte in microfluidic droplets |
| ITRM20130278A1 (it) | 2013-05-10 | 2014-11-11 | Consiglio Nazionale Ricerche | Procedimento di fabbricazione di film autoassemblati di copolimeri a blocchi |
| CA2916960C (en) | 2013-06-26 | 2022-12-06 | Guangzhou Xiangxue Pharmaceutical Co. Ltd | High-stability t-cell receptor and preparation method and application thereof |
| US20150010953A1 (en) | 2013-07-03 | 2015-01-08 | Agilent Technologies, Inc. | Method for producing a population of oligonucleotides that has reduced synthesis errors |
| KR20150005062A (ko) | 2013-07-04 | 2015-01-14 | 삼성전자주식회사 | 미니-코어를 사용하는 프로세서 |
| US10421957B2 (en) | 2013-07-29 | 2019-09-24 | Agilent Technologies, Inc. | DNA assembly using an RNA-programmable nickase |
| US20160168564A1 (en) | 2013-07-30 | 2016-06-16 | Gen9, Inc. | Methods for the Production of Long Length Clonal Sequence Verified Nucleic Acid Constructs |
| US9409139B2 (en) | 2013-08-05 | 2016-08-09 | Twist Bioscience Corporation | De novo synthesized gene libraries |
| US9595180B2 (en) | 2013-08-07 | 2017-03-14 | Nike, Inc. | Activity recognition with activity reminders |
| CN104371019B (zh) | 2013-08-13 | 2019-09-10 | 鸿运华宁(杭州)生物医药有限公司 | 一种能与glp-1r特异性结合的抗体及其与glp-1的融合蛋白质 |
| GB201314721D0 (en) | 2013-08-16 | 2013-10-02 | Almagen Ltd | A method of selectively masking one or more sites on a surface and a method of synthesising an array of molecules |
| EP3039161B1 (en) | 2013-08-30 | 2021-10-06 | Personalis, Inc. | Methods and systems for genomic analysis |
| JP6571663B2 (ja) | 2013-09-14 | 2019-09-04 | ケムジーンズ コーポレーション | 逆方向アプローチを使用した長いrnaの非常に効果的な合成 |
| WO2015040075A1 (en) * | 2013-09-18 | 2015-03-26 | Genome Research Limited | Genomic screening methods using rna-guided endonucleases |
| US9422325B2 (en) | 2013-10-04 | 2016-08-23 | Trustees Of Tufts College | Glycosylation reactions using phenyl(trifluoroethyl)iodonium salts |
| US9582877B2 (en) | 2013-10-07 | 2017-02-28 | Cellular Research, Inc. | Methods and systems for digitally counting features on arrays |
| CA2929108A1 (en) | 2013-10-29 | 2015-05-07 | Longhorn Vaccines And Diagnostics, Llc | Next generation genomic sequencing methods |
| EP3073967A1 (en) | 2013-11-26 | 2016-10-05 | Xenco Medical, LLC | Lock and release implant delivery system |
| EP3074554B1 (en) | 2013-11-27 | 2021-05-19 | Gen9, Inc. | Libraries of nucleic acids and methods for making the same |
| CN105980557B (zh) | 2013-12-04 | 2020-04-07 | 中外制药株式会社 | 抗原结合能力根据化合物的浓度而变化的抗原结合分子及其文库 |
| WO2015089053A1 (en) | 2013-12-09 | 2015-06-18 | Integrated Dna Technologies, Inc. | Long nucleic acid sequences containing variable regions |
| MX2016007887A (es) | 2013-12-17 | 2016-10-28 | Genentech Inc | Metodos de tratamiento de canceres positivos a her2 usando antagonistas de union del eje de pd-1 y anticuerpos anti-her2. |
| GB2521387B (en) | 2013-12-18 | 2020-05-27 | Ge Healthcare Uk Ltd | Oligonucleotide data storage on solid supports |
| WO2015103225A1 (en) | 2013-12-31 | 2015-07-09 | Illumina, Inc. | Addressable flow cell using patterned electrodes |
| US9587268B2 (en) | 2014-01-29 | 2017-03-07 | Agilent Technologies Inc. | Fast hybridization for next generation sequencing target enrichment |
| US10287627B2 (en) | 2014-02-08 | 2019-05-14 | The Regents Of The University Of Colorado, A Body Corporate | Multiplexed linking PCR |
| US10208338B2 (en) | 2014-03-03 | 2019-02-19 | Swift Biosciences, Inc. | Enhanced adaptor ligation |
| EP3116901B1 (en) | 2014-03-14 | 2019-06-12 | Immunocore Limited | Tcr libraries |
| US10675618B2 (en) | 2014-03-27 | 2020-06-09 | University Of Maryland, College Park | Integration of ex situ fabricated porous polymer monoliths into fluidic chips |
| US20170037790A1 (en) | 2014-04-15 | 2017-02-09 | Volvo Construction Equipment Ab | Device for controlling engine and hydraulic pump of construction equipment and control method therefor |
| GB201407852D0 (en) | 2014-05-02 | 2014-06-18 | Iontas Ltd | Preparation of libraries od protein variants expressed in eukaryotic cells and use for selecting binding molecules |
| CN106536734B (zh) | 2014-05-16 | 2020-12-22 | Illumina公司 | 核酸合成技术 |
| US20150361422A1 (en) | 2014-06-16 | 2015-12-17 | Agilent Technologies, Inc. | High throughput gene assembly in droplets |
| US20150361423A1 (en) | 2014-06-16 | 2015-12-17 | Agilent Technologies, Inc. | High throughput gene assembly in droplets |
| US10472620B2 (en) | 2014-07-01 | 2019-11-12 | General Electric Company | Method, substrate and device for separating nucleic acids |
| US10870845B2 (en) | 2014-07-01 | 2020-12-22 | Global Life Sciences Solutions Operations UK Ltd | Methods for capturing nucleic acids |
| US20170198268A1 (en) | 2014-07-09 | 2017-07-13 | Gen9, Inc. | Compositions and Methods for Site-Directed DNA Nicking and Cleaving |
| US11254933B2 (en) * | 2014-07-14 | 2022-02-22 | The Regents Of The University Of California | CRISPR/Cas transcriptional modulation |
| US20160017394A1 (en) | 2014-07-15 | 2016-01-21 | Life Technologies Corporation | Compositions and methods for nucleic acid assembly |
| WO2016022557A1 (en) | 2014-08-05 | 2016-02-11 | Twist Bioscience Corporation | Cell free cloning of nucleic acids |
| CN107278234A (zh) | 2014-10-03 | 2017-10-20 | 生命科技公司 | 基因序列校验组合物、方法和试剂盒 |
| WO2016057951A2 (en) * | 2014-10-09 | 2016-04-14 | Life Technologies Corporation | Crispr oligonucleotides and gene editing |
| US10648103B2 (en) | 2014-10-10 | 2020-05-12 | Invitae Corporation | Universal blocking oligo system and improved hybridization capture methods for multiplexed capture reactions |
| US20170249345A1 (en) | 2014-10-18 | 2017-08-31 | Girik Malik | A biomolecule based data storage system |
| WO2016065056A1 (en) | 2014-10-22 | 2016-04-28 | The Regents Of The University Of California | High definition microdroplet printer |
| US9890417B2 (en) | 2014-11-03 | 2018-02-13 | Agilent Technologies, Inc. | Signal amplification of fluorescence in situ hybridization |
| US10233490B2 (en) | 2014-11-21 | 2019-03-19 | Metabiotech Corporation | Methods for assembling and reading nucleic acid sequences from mixed populations |
| CN104562213A (zh) * | 2014-12-26 | 2015-04-29 | 北京诺禾致源生物信息科技有限公司 | 扩增子文库及其构建方法 |
| US10669304B2 (en) | 2015-02-04 | 2020-06-02 | Twist Bioscience Corporation | Methods and devices for de novo oligonucleic acid assembly |
| WO2016126987A1 (en) | 2015-02-04 | 2016-08-11 | Twist Bioscience Corporation | Compositions and methods for synthetic gene assembly |
| US9834774B2 (en) | 2015-02-11 | 2017-12-05 | Agilent Technologies, Inc. | Methods and compositions for rapid seamless DNA assembly |
| WO2016130868A2 (en) * | 2015-02-13 | 2016-08-18 | Vaccine Research Institute Of San Diego | Materials and methods to analyze rna isoforms in transcriptomes |
| CN104734848A (zh) | 2015-03-02 | 2015-06-24 | 郑州轻工业学院 | 基于重组dna技术对信息进行加密与隐藏的方法及应用 |
| JP2018511329A (ja) | 2015-04-01 | 2018-04-26 | ザ スクリプス リサーチ インスティテュート | Gpcrアゴニストポリペプチドに関連する方法および組成物 |
| WO2016162127A1 (en) | 2015-04-08 | 2016-10-13 | Polyphor Ag | Backbone-cyclized peptidomimetics |
| US11164661B2 (en) | 2015-04-10 | 2021-11-02 | University Of Washington | Integrated system for nucleic acid-based storage and retrieval of digital data using keys |
| WO2016168755A1 (en) | 2015-04-17 | 2016-10-20 | Distributed Bio, Inc. | Method for mass humanization of non-human antibodies |
| WO2016172377A1 (en) | 2015-04-21 | 2016-10-27 | Twist Bioscience Corporation | Devices and methods for oligonucleic acid library synthesis |
| CA2988001C (en) | 2015-04-30 | 2023-09-26 | Abcheck S.R.O. | Method for mass humanization of rabbit antibodies |
| US20160333340A1 (en) | 2015-05-11 | 2016-11-17 | Twist Bioscience Corporation | Compositions and methods for nucleic acid amplification |
| WO2017011492A1 (en) | 2015-07-13 | 2017-01-19 | President And Fellows Of Harvard College | Methods for retrievable information storage using nucleic acids |
| GB201513113D0 (en) | 2015-07-24 | 2015-09-09 | Genome Res Ltd | Nasal sampling methods |
| JP6982362B2 (ja) * | 2015-09-18 | 2021-12-17 | ツイスト バイオサイエンス コーポレーション | オリゴ核酸変異体ライブラリーとその合成 |
| CN108698012A (zh) | 2015-09-22 | 2018-10-23 | 特韦斯特生物科学公司 | 用于核酸合成的柔性基底 |
| US20180320166A1 (en) | 2015-10-01 | 2018-11-08 | University Of Washington | Multiplex pairwise assembly of dna oligonucleotides |
| US20170141793A1 (en) | 2015-11-13 | 2017-05-18 | Microsoft Technology Licensing, Llc | Error correction for nucleotide data stores |
| CA3006867A1 (en) | 2015-12-01 | 2017-06-08 | Twist Bioscience Corporation | Functionalized surfaces and preparation thereof |
| CA3006792A1 (en) | 2015-12-08 | 2017-06-15 | Twinstrand Biosciences, Inc. | Improved adapters, methods, and compositions for duplex sequencing |
| CN108473987B (zh) | 2016-01-08 | 2024-01-02 | 马可讯治疗有限公司 | 具有改变的多样性支架结构域的结合成员 |
| GB201604492D0 (en) | 2016-03-16 | 2016-04-27 | Immatics Biotechnologies Gmbh | Transfected t-cells and t-cell receptors for use in immunotherapy against cancers |
| WO2017214557A1 (en) | 2016-06-10 | 2017-12-14 | Counsyl, Inc. | Nucleic acid sequencing adapters and uses thereof |
| JP2019523940A (ja) | 2016-06-10 | 2019-08-29 | ツイスト バイオサイエンス コーポレーション | 生物学的配列の自動アノテーションとスクリーニングのためのシステムおよび方法 |
| CN110088281A (zh) | 2016-08-03 | 2019-08-02 | 特韦斯特生物科学公司 | 用于多核苷酸合成的纹理化表面 |
| CA3034769A1 (en) | 2016-08-22 | 2018-03-01 | Twist Bioscience Corporation | De novo synthesized nucleic acid libraries |
| JP6871364B2 (ja) | 2016-09-21 | 2021-05-12 | ツイスト バイオサイエンス コーポレーション | 核酸に基づくデータ保存 |
| US20180142289A1 (en) | 2016-11-18 | 2018-05-24 | Twist Bioscience Corporation | Polynucleotide libraries having controlled stoichiometry and synthesis thereof |
| KR102514213B1 (ko) | 2016-12-16 | 2023-03-27 | 트위스트 바이오사이언스 코포레이션 | 면역 시냅스의 변이체 라이브러리 및 그의 합성 |
| KR102723464B1 (ko) | 2017-02-22 | 2024-10-28 | 트위스트 바이오사이언스 코포레이션 | 핵산 기반 데이터 저장 |
| CA3056386A1 (en) | 2017-03-15 | 2018-09-20 | Twist Bioscience Corporation | De novo synthesized combinatorial nucleic acid libraries |
| EP3595674A4 (en) | 2017-03-15 | 2020-12-16 | Twist Bioscience Corporation | BANKS OF VARIANTS OF IMMUNOLOGICAL SYNAPSE AND THEIR SYNTHESIS |
| DK3615690T3 (da) | 2017-04-23 | 2021-11-15 | Illumina Cambridge Ltd | Sammensætninger og fremgangsmåder til forbedring af prøveidentificering i indekserede nukleinsyrebiblioteker |
| WO2018231864A1 (en) | 2017-06-12 | 2018-12-20 | Twist Bioscience Corporation | Methods for seamless nucleic acid assembly |
| CN111566209B (zh) | 2017-06-12 | 2024-08-30 | 特韦斯特生物科学公司 | 无缝核酸装配方法 |
| CN111566125A (zh) | 2017-09-11 | 2020-08-21 | 特韦斯特生物科学公司 | Gpcr结合蛋白及其合成 |
| JP7066840B2 (ja) | 2017-10-20 | 2022-05-13 | ツイスト バイオサイエンス コーポレーション | ポリヌクレオチド合成のための加熱されたナノウェル |
| WO2019084500A1 (en) | 2017-10-27 | 2019-05-02 | Twist Bioscience Corporation | SYSTEMS AND METHODS FOR CLASSIFYING POLYNUCLEOTIDES |
| IL312616A (en) | 2018-01-04 | 2024-07-01 | Twist Bioscience Corp | Digital information storage based on DNA |
| SG11202011467RA (en) | 2018-05-18 | 2020-12-30 | Twist Bioscience Corp | Polynucleotides, reagents, and methods for nucleic acid hybridization |
| CN113692409A (zh) | 2018-12-26 | 2021-11-23 | 特韦斯特生物科学公司 | 高度准确的从头多核苷酸合成 |
| JP2022521766A (ja) | 2019-02-25 | 2022-04-12 | ツイスト バイオサイエンス コーポレーション | 次世代シーケンシングのための組成物および方法 |
| US11492727B2 (en) | 2019-02-26 | 2022-11-08 | Twist Bioscience Corporation | Variant nucleic acid libraries for GLP1 receptor |
| KR20210144698A (ko) | 2019-02-26 | 2021-11-30 | 트위스트 바이오사이언스 코포레이션 | 항체 최적화를 위한 변이 핵산 라이브러리 |
-
2017
- 2017-04-05 CA CA3034769A patent/CA3034769A1/en active Pending
- 2017-04-05 WO PCT/US2017/026232 patent/WO2018038772A1/en unknown
- 2017-04-05 KR KR1020197008458A patent/KR102212257B1/ko active IP Right Grant
- 2017-04-05 EP EP17844060.8A patent/EP3500672A4/en active Pending
- 2017-04-05 GB GB1903914.8A patent/GB2568444A/en not_active Withdrawn
- 2017-04-05 SG SG11201901563UA patent/SG11201901563UA/en unknown
- 2017-04-05 CN CN201780065373.9A patent/CN109996876A/zh active Pending
- 2017-04-05 JP JP2019510673A patent/JP6854340B2/ja active Active
- 2017-04-05 AU AU2017315294A patent/AU2017315294B2/en active Active
- 2017-08-21 US US15/682,100 patent/US10053688B2/en active Active
-
2018
- 2018-07-10 US US16/031,784 patent/US10975372B2/en active Active
-
2019
- 2019-02-21 IL IL264966A patent/IL264966B/en unknown
-
2021
- 2021-02-23 US US17/183,038 patent/US20210180046A1/en active Pending
-
2024
- 2024-01-18 AU AU2024200331A patent/AU2024200331A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| KR20190041000A (ko) | 2019-04-19 |
| EP3500672A4 (en) | 2020-05-20 |
| US20180312834A1 (en) | 2018-11-01 |
| AU2017315294B2 (en) | 2023-12-21 |
| US10975372B2 (en) | 2021-04-13 |
| US10053688B2 (en) | 2018-08-21 |
| GB201903914D0 (en) | 2019-05-08 |
| CA3034769A1 (en) | 2018-03-01 |
| WO2018038772A1 (en) | 2018-03-01 |
| SG11201901563UA (en) | 2019-03-28 |
| KR102212257B1 (ko) | 2021-02-04 |
| GB2568444A (en) | 2019-05-15 |
| EP3500672A1 (en) | 2019-06-26 |
| US20180051278A1 (en) | 2018-02-22 |
| IL264966B (en) | 2021-10-31 |
| CN109996876A (zh) | 2019-07-09 |
| AU2017315294A1 (en) | 2019-03-21 |
| AU2024200331A1 (en) | 2024-03-14 |
| JP2019528070A (ja) | 2019-10-10 |
| US20210180046A1 (en) | 2021-06-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6854340B2 (ja) | デノボ合成された核酸ライブラリ | |
| US20220315971A1 (en) | Methods for seamless nucleic acid assembly | |
| KR102628876B1 (ko) | 심리스 핵산 어셈블리를 위한 방법 | |
| JP7239465B2 (ja) | 蛍光in situ配列決定による検出のための核酸配列ライブラリの作製法 | |
| US20220106590A1 (en) | Hybridization methods and reagents | |
| ES2888976T3 (es) | Identificación no sesgada pangenómica de DSBs evaluada por secuenciación (GUIDE-Seq.) | |
| JP2021526366A (ja) | 核酸ハイブリダイゼーションのためのポリヌクレオチド、試薬、および方法 | |
| CN111201329A (zh) | 具有减少的扩增偏倚的高通量单细胞测序 | |
| WO2016022557A1 (en) | Cell free cloning of nucleic acids | |
| JP2023519782A (ja) | 標的化された配列決定の方法 | |
| Kropocheva et al. | Prokaryotic Argonaute proteins as a tool for biotechnology | |
| Gozukirmizi et al. | Transposon activity in plant genomes | |
| JP2023538537A (ja) | 核酸の標的化除去のための方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190617 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200403 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200403 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20200408 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20200529 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20200608 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201109 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210129 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210217 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210315 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6854340 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |