JP4919529B2 - Escherichiacoilの新規株、その調製方法、およびL―トレオニン産生のための発酵プロセスにおけるその使用 - Google Patents
Escherichiacoilの新規株、その調製方法、およびL―トレオニン産生のための発酵プロセスにおけるその使用 Download PDFInfo
- Publication number
- JP4919529B2 JP4919529B2 JP50911198A JP50911198A JP4919529B2 JP 4919529 B2 JP4919529 B2 JP 4919529B2 JP 50911198 A JP50911198 A JP 50911198A JP 50911198 A JP50911198 A JP 50911198A JP 4919529 B2 JP4919529 B2 JP 4919529B2
- Authority
- JP
- Japan
- Prior art keywords
- threonine
- gene
- strain
- coli
- plasmid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000004473 Threonine Substances 0.000 title claims abstract description 150
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 title claims description 212
- 229960002898 threonine Drugs 0.000 title claims description 149
- 238000000034 method Methods 0.000 title abstract description 31
- 238000000855 fermentation Methods 0.000 title abstract description 29
- 230000004151 fermentation Effects 0.000 title abstract description 29
- 238000004519 manufacturing process Methods 0.000 title abstract description 25
- 238000002360 preparation method Methods 0.000 title description 4
- 230000008569 process Effects 0.000 title description 4
- 241000588722 Escherichia Species 0.000 title 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 claims abstract description 123
- 241000588724 Escherichia coli Species 0.000 claims abstract description 64
- 244000005700 microbiome Species 0.000 claims abstract description 18
- 239000013612 plasmid Substances 0.000 claims description 65
- 108090000623 proteins and genes Proteins 0.000 claims description 57
- 102000004190 Enzymes Human genes 0.000 claims description 39
- 108090000790 Enzymes Proteins 0.000 claims description 39
- OJCKRNPLOZHAOU-RSXXJMTFSA-N (1r,2r)-2-[(2s,4e,6e,8r,9s,11r,13s,15s,16s)-7-cyano-8,16-dihydroxy-9,11,13,15-tetramethyl-18-oxo-1-oxacyclooctadeca-4,6-dien-2-yl]cyclopentane-1-carboxylic acid Chemical compound O1C(=O)C[C@H](O)[C@@H](C)C[C@@H](C)C[C@@H](C)C[C@H](C)[C@@H](O)\C(C#N)=C\C=C\C[C@H]1[C@H]1[C@H](C(O)=O)CCC1 OJCKRNPLOZHAOU-RSXXJMTFSA-N 0.000 claims description 31
- OJCKRNPLOZHAOU-BNXNOGCYSA-N Borrelidin Natural products CC1CC(C)CC(C)C(O)C(=C/C=C/CC(OC(=O)CC(O)C(C)C1)C2CCCC2C(=O)O)C#N OJCKRNPLOZHAOU-BNXNOGCYSA-N 0.000 claims description 31
- 230000001851 biosynthetic effect Effects 0.000 claims description 27
- 210000000349 chromosome Anatomy 0.000 claims description 26
- 101150014006 thrA gene Proteins 0.000 claims description 22
- 230000002950 deficient Effects 0.000 claims description 14
- 108010043075 L-threonine 3-dehydrogenase Proteins 0.000 claims description 12
- 101150063051 hom gene Proteins 0.000 claims description 11
- 101150000850 thrC gene Proteins 0.000 claims description 10
- 108010022394 Threonine synthase Proteins 0.000 claims description 8
- 101150072448 thrB gene Proteins 0.000 claims description 8
- 108010071598 homoserine kinase Proteins 0.000 claims description 7
- 108010055400 Aspartate kinase Proteins 0.000 claims description 5
- 101710088194 Dehydrogenase Proteins 0.000 claims description 4
- 102100033451 Thyroid hormone receptor beta Human genes 0.000 claims description 4
- 101150017040 I gene Proteins 0.000 claims description 3
- 238000003780 insertion Methods 0.000 claims description 3
- 230000037431 insertion Effects 0.000 claims description 3
- 229940024606 amino acid Drugs 0.000 abstract description 27
- 150000001413 amino acids Chemical class 0.000 abstract description 27
- 238000012262 fermentative production Methods 0.000 abstract description 6
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 abstract description 5
- 229940009098 aspartate Drugs 0.000 abstract description 3
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 32
- 229960000310 isoleucine Drugs 0.000 description 31
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 27
- 235000001014 amino acid Nutrition 0.000 description 24
- 230000015572 biosynthetic process Effects 0.000 description 24
- 230000001580 bacterial effect Effects 0.000 description 23
- 239000002609 medium Substances 0.000 description 21
- 239000012634 fragment Substances 0.000 description 20
- 210000004027 cell Anatomy 0.000 description 18
- 230000000694 effects Effects 0.000 description 17
- 230000014509 gene expression Effects 0.000 description 13
- 108020004414 DNA Proteins 0.000 description 11
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 10
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 9
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 9
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- 229930027917 kanamycin Natural products 0.000 description 9
- 229960000318 kanamycin Drugs 0.000 description 9
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 9
- 229930182823 kanamycin A Natural products 0.000 description 9
- 101150058720 tdh gene Proteins 0.000 description 9
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 8
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 8
- 239000006166 lysate Substances 0.000 description 8
- 229960004452 methionine Drugs 0.000 description 8
- 238000011144 upstream manufacturing Methods 0.000 description 8
- 230000012010 growth Effects 0.000 description 7
- 239000003550 marker Substances 0.000 description 7
- 229930182817 methionine Natural products 0.000 description 7
- 108091008146 restriction endonucleases Proteins 0.000 description 7
- 238000010361 transduction Methods 0.000 description 7
- 230000026683 transduction Effects 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 6
- 239000004472 Lysine Substances 0.000 description 6
- 235000018977 lysine Nutrition 0.000 description 6
- 238000003786 synthesis reaction Methods 0.000 description 6
- 108010064711 Homoserine dehydrogenase Proteins 0.000 description 5
- 229940041514 candida albicans extract Drugs 0.000 description 5
- 239000008121 dextrose Substances 0.000 description 5
- 230000002255 enzymatic effect Effects 0.000 description 5
- 230000006801 homologous recombination Effects 0.000 description 5
- 238000002744 homologous recombination Methods 0.000 description 5
- 101150095957 ilvA gene Proteins 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 238000002703 mutagenesis Methods 0.000 description 5
- 231100000350 mutagenesis Toxicity 0.000 description 5
- 230000001105 regulatory effect Effects 0.000 description 5
- 239000012138 yeast extract Substances 0.000 description 5
- 229920001817 Agar Polymers 0.000 description 4
- 229930182844 L-isoleucine Natural products 0.000 description 4
- 108091028043 Nucleic acid sequence Proteins 0.000 description 4
- 108010076504 Protein Sorting Signals Proteins 0.000 description 4
- 102000006843 Threonine synthase Human genes 0.000 description 4
- 108010029287 Threonine-tRNA ligase Proteins 0.000 description 4
- 102100028196 Threonine-tRNA ligase 2, cytoplasmic Human genes 0.000 description 4
- 239000008272 agar Substances 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 230000003115 biocidal effect Effects 0.000 description 4
- 238000010276 construction Methods 0.000 description 4
- 230000002068 genetic effect Effects 0.000 description 4
- 239000008103 glucose Substances 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- -1 threonine Chemical class 0.000 description 4
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 108020004652 Aspartate-Semialdehyde Dehydrogenase Proteins 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 108010035563 Chloramphenicol O-acetyltransferase Proteins 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 102000004594 DNA Polymerase I Human genes 0.000 description 3
- 108010017826 DNA Polymerase I Proteins 0.000 description 3
- 101100322888 Escherichia coli (strain K12) metL gene Proteins 0.000 description 3
- 241000282326 Felis catus Species 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 3
- 239000004098 Tetracycline Substances 0.000 description 3
- 229910021529 ammonia Inorganic materials 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 230000010354 integration Effects 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 229960002180 tetracycline Drugs 0.000 description 3
- 229930101283 tetracycline Natural products 0.000 description 3
- 235000019364 tetracycline Nutrition 0.000 description 3
- 150000003522 tetracyclines Chemical class 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 241000702191 Escherichia virus P1 Species 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- ZRALSGWEFCBTJO-UHFFFAOYSA-N Guanidine Chemical compound NC(N)=N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- VZUNGTLZRAYYDE-UHFFFAOYSA-N N-methyl-N'-nitro-N-nitrosoguanidine Chemical compound O=NN(C)C(=N)N[N+]([O-])=O VZUNGTLZRAYYDE-UHFFFAOYSA-N 0.000 description 2
- FXDNYOANAXWZHG-VKHMYHEASA-N O-phospho-L-homoserine Chemical compound OC(=O)[C@@H](N)CCOP(O)(O)=O FXDNYOANAXWZHG-VKHMYHEASA-N 0.000 description 2
- 241000364057 Peoria Species 0.000 description 2
- 108010009736 Protein Hydrolysates Proteins 0.000 description 2
- 241000607715 Serratia marcescens Species 0.000 description 2
- 108010006873 Threonine Dehydratase Proteins 0.000 description 2
- 108700009124 Transcription Initiation Site Proteins 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 2
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 2
- 229940088710 antibiotic agent Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 235000005822 corn Nutrition 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 239000002054 inoculum Substances 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 101150109249 lacI gene Proteins 0.000 description 2
- 101150035025 lysC gene Proteins 0.000 description 2
- 229960003646 lysine Drugs 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 101150011956 recD gene Proteins 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 229960003495 thiamine Drugs 0.000 description 2
- KYMBYSLLVAOCFI-UHFFFAOYSA-N thiamine Chemical compound CC1=C(CCO)SCN1CC1=CN=C(C)N=C1N KYMBYSLLVAOCFI-UHFFFAOYSA-N 0.000 description 2
- 230000001131 transforming effect Effects 0.000 description 2
- 241001515965 unidentified phage Species 0.000 description 2
- HOZBSSWDEKVXNO-BXRBKJIMSA-N (2s)-2-azanylbutanedioic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O.OC(=O)[C@@H](N)CC(O)=O HOZBSSWDEKVXNO-BXRBKJIMSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- WQNHWIYLCRZRLR-UHFFFAOYSA-N 2-(3-hydroxy-2,5-dioxooxolan-3-yl)acetic acid Chemical compound OC(=O)CC1(O)CC(=O)OC1=O WQNHWIYLCRZRLR-UHFFFAOYSA-N 0.000 description 1
- PKAUICCNAWQPAU-UHFFFAOYSA-N 2-(4-chloro-2-methylphenoxy)acetic acid;n-methylmethanamine Chemical compound CNC.CC1=CC(Cl)=CC=C1OCC(O)=O PKAUICCNAWQPAU-UHFFFAOYSA-N 0.000 description 1
- LGVJIYCMHMKTPB-UHFFFAOYSA-N 3-hydroxynorvaline Chemical compound CCC(O)C(N)C(O)=O LGVJIYCMHMKTPB-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- 101710092702 47 kDa protein Proteins 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- 239000004254 Ammonium phosphate Substances 0.000 description 1
- 101100130094 Bacillus subtilis (strain 168) metK gene Proteins 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 241000186146 Brevibacterium Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 108010076010 Cystathionine beta-lyase Proteins 0.000 description 1
- 102000012410 DNA Ligases Human genes 0.000 description 1
- 108010061982 DNA Ligases Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 241000238557 Decapoda Species 0.000 description 1
- 101100465553 Dictyostelium discoideum psmB6 gene Proteins 0.000 description 1
- 241001646716 Escherichia coli K-12 Species 0.000 description 1
- 241001302584 Escherichia coli str. K-12 substr. W3110 Species 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 108010046914 Exodeoxyribonuclease V Proteins 0.000 description 1
- 102000019236 Exonuclease V Human genes 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 108010016979 Homoserine O-succinyltransferase Proteins 0.000 description 1
- SAUCHDKDCUROAO-VKHMYHEASA-N L-2-amino-3-oxobutanoic acid Chemical compound CC(=O)[C@H](N)C(O)=O SAUCHDKDCUROAO-VKHMYHEASA-N 0.000 description 1
- FFEARJCKVFRZRR-UHFFFAOYSA-N L-Methionine Natural products CSCCC(N)C(O)=O FFEARJCKVFRZRR-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- 229930195722 L-methionine Natural products 0.000 description 1
- 108010054278 Lac Repressors Proteins 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 239000006142 Luria-Bertani Agar Substances 0.000 description 1
- CHJJGSNFBQVOTG-UHFFFAOYSA-N N-methyl-guanidine Natural products CNC(N)=N CHJJGSNFBQVOTG-UHFFFAOYSA-N 0.000 description 1
- 108010061618 O-succinylhomoserine (thiol)-lyase Proteins 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 101100169519 Pyrococcus abyssi (strain GE5 / Orsay) dapAL gene Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 101150067147 TDC gene Proteins 0.000 description 1
- JZRWCGZRTZMZEH-UHFFFAOYSA-N Thiamine Natural products CC1=C(CCO)SC=[N+]1CC1=CN=C(C)N=C1N JZRWCGZRTZMZEH-UHFFFAOYSA-N 0.000 description 1
- 229930003451 Vitamin B1 Chemical class 0.000 description 1
- 241000319304 [Brevibacterium] flavum Species 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 229910000148 ammonium phosphate Inorganic materials 0.000 description 1
- 235000019289 ammonium phosphates Nutrition 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 101150072344 argA gene Proteins 0.000 description 1
- 101150107204 asd gene Proteins 0.000 description 1
- JGGLZQUGOKVDGS-VYTIMWRQSA-N aspartate semialdehyde Chemical compound O[C@@H]1[C@@H](NC(=O)C)CO[C@H](CO)[C@H]1O[C@@H]1[C@@H](NC(C)=O)[C@H](O)[C@H](O[C@@H]2[C@H]([C@@H](O[C@@H]3[C@@H]([C@H](O)[C@@H](O)[C@H](CO)O3)O[C@@H]3[C@@H]([C@H](O)[C@@H](O)[C@H](CO)O3)O[C@@H]3[C@H]([C@H](O)[C@@H](O)[C@H](CO)O3)O)[C@@H](O)[C@H](CO[C@@H]3[C@H]([C@H](O[C@@H]4[C@H]([C@H](O)[C@@H](O)[C@H](CO)O4)O)[C@@H](O)[C@H](CO)O3)O)O2)O)[C@H](CO)O1 JGGLZQUGOKVDGS-VYTIMWRQSA-N 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 239000003729 cation exchange resin Substances 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000002962 chemical mutagen Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 101150011371 dapA gene Proteins 0.000 description 1
- MNNHAPBLZZVQHP-UHFFFAOYSA-N diammonium hydrogen phosphate Chemical compound [NH4+].[NH4+].OP([O-])([O-])=O MNNHAPBLZZVQHP-UHFFFAOYSA-N 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- SWSQBOPZIKWTGO-UHFFFAOYSA-N dimethylaminoamidine Natural products CN(C)C(N)=N SWSQBOPZIKWTGO-UHFFFAOYSA-N 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 230000004034 genetic regulation Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229910052500 inorganic mineral Chemical class 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 230000037041 intracellular level Effects 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical class ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 101150060102 metA gene Proteins 0.000 description 1
- 101150003180 metB gene Proteins 0.000 description 1
- 101150117293 metC gene Proteins 0.000 description 1
- 101150108178 metE gene Proteins 0.000 description 1
- 101150042623 metH gene Proteins 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- MBABOKRGFJTBAE-UHFFFAOYSA-N methyl methanesulfonate Chemical compound COS(C)(=O)=O MBABOKRGFJTBAE-UHFFFAOYSA-N 0.000 description 1
- 101150031330 metl gene Proteins 0.000 description 1
- 239000011707 mineral Chemical class 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 235000013379 molasses Nutrition 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 238000007747 plating Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 229960002429 proline Drugs 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 101150033993 recR gene Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- WPLOVIFNBMNBPD-ATHMIXSHSA-N subtilin Chemical compound CC1SCC(NC2=O)C(=O)NC(CC(N)=O)C(=O)NC(C(=O)NC(CCCCN)C(=O)NC(C(C)CC)C(=O)NC(=C)C(=O)NC(CCCCN)C(O)=O)CSC(C)C2NC(=O)C(CC(C)C)NC(=O)C1NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C1NC(=O)C(=C/C)/NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)CNC(=O)C(NC(=O)C(NC(=O)C2NC(=O)CNC(=O)C3CCCN3C(=O)C(NC(=O)C3NC(=O)C(CC(C)C)NC(=O)C(=C)NC(=O)C(CCC(O)=O)NC(=O)C(NC(=O)C(CCCCN)NC(=O)C(N)CC=4C5=CC=CC=C5NC=4)CSC3)C(C)SC2)C(C)C)C(C)SC1)CC1=CC=CC=C1 WPLOVIFNBMNBPD-ATHMIXSHSA-N 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000009469 supplementation Effects 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 235000019157 thiamine Nutrition 0.000 description 1
- 239000011721 thiamine Substances 0.000 description 1
- 101150046628 thrS gene Proteins 0.000 description 1
- 101150031421 thrS-cat gene Proteins 0.000 description 1
- 229910021654 trace metal Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 239000012137 tryptone Substances 0.000 description 1
- 239000011691 vitamin B1 Chemical class 0.000 description 1
- 235000010374 vitamin B1 Nutrition 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P13/00—Preparation of nitrogen-containing organic compounds
- C12P13/04—Alpha- or beta- amino acids
- C12P13/08—Lysine; Diaminopimelic acid; Threonine; Valine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/20—Bacteria; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y101/00—Oxidoreductases acting on the CH-OH group of donors (1.1)
- C12Y101/01—Oxidoreductases acting on the CH-OH group of donors (1.1) with NAD+ or NADP+ as acceptor (1.1.1)
- C12Y101/01003—Homoserine dehydrogenase (1.1.1.3)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/01—Phosphotransferases with an alcohol group as acceptor (2.7.1)
- C12Y207/01039—Homoserine kinase (2.7.1.39)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y207/00—Transferases transferring phosphorus-containing groups (2.7)
- C12Y207/02—Phosphotransferases with a carboxy group as acceptor (2.7.2)
- C12Y207/02004—Aspartate kinase (2.7.2.4)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y402/00—Carbon-oxygen lyases (4.2)
- C12Y402/03—Carbon-oxygen lyases (4.2) acting on phosphates (4.2.3)
- C12Y402/03001—Threonine synthase (4.2.3.1)
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Plant Pathology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
本発明は、Escherichia coliの新規株、およびこれらの微生物を含む発酵プロセスに関する。より詳細には、本発明は、遺伝子改変したEscherichia coli株、およびアミノ酸、特にトレオニンのようなアスパラギン酸ファミリーのメンバーのアミノ酸の産生のためのその使用に関する。本発明はまた、アミノ酸の発酵産生における使用のためにE. coli株を調製する方法に関する。
発明の背景
Escherichia coliにおいて、アミノ酸L-トレオニン、L-イソロイシン、L-リジン、およびL-メチオニンは、以下の通常の生合成経路によって、すべてまたは一部の炭素原子をアスパラギン酸塩(アスパラギン酸)から誘導する(G.N. Cohen,「The common pathway to lysine, methionine and threonine」147-171頁,Amino Acids: Biosynthesis and Genetic Regulation, K.M. HerrmannおよびR.L. Somerville編,Addison-Welesley Publishing Co., Inc., Reading, Mass.(1983)):
この通常の経路の第1の反応は、3つの異なるアスパラギン酸キナーゼ(AK I、II、またはIII)の1つによって触媒され、そのそれぞれは別々の遺伝子によってコードされ、そしてその活性および合成が調節されるように他のものとは異なる。例えば、アスパラギン酸キナーゼIは、thrAによってコードされ、その活性はトレオニンによって阻害され、そしてその合成はトレオニンとイソロイシンの組み合わせによって抑制される。しかし、AK IIは、metLによってコードされ、そしてその合成はメチオニンによって抑制される(しかし、その活性は、メチオニンによって、またはメチオニン、リジン、トレオニン、およびイソロイシンの2つの組み合わせによって抑制されない(F.Falcoz-Kellyら,Eur. J. Biochem. 8:146-152(1969);J.C.Patteら,Biochim. Biophys. Acta 136:245-257(1967)))。AK IIIはlysCによってコードされ、そしてその活性および合成は、リジンによって、それぞれ阻害および抑制される。
2つのAK、IおよびIIは、異なるタンパク質ではなく、むしろそれぞれホモセリンデヒドロゲナーゼIまたはIIを含む複合タンパク質のドメインであり、そのそれぞれは、アスパラギン酸セミアルデヒドのホモセリンへの還元を触媒する(P. Truffa-Bachiら,Eur. J. Biochem.5:73-80(12968))。従って、ホモセリンデヒドロゲナーゼIはまた、thrAによってコードされ、その合成はトレオニンおよびイソロイシンによって抑制され、そしてその活性はトレオニンによって阻害される。HD IIは同様にmetLによってコードされ、そしてその合成はメチオニンによって抑制される。
トレオニン生合成は、以下のさらなる反応を包含する:ホモセリン→ホモセリンホスフェート→トレオニン。ホモセリンのリン酸化は、thrBによってコードされる2つの同一の29kDaサブユニットからなるタンパク質であるホモセリンキナーゼによって触媒され、そしてその活性はトレオニンによって阻害される(B. Burrら,J. Biochem. 62:519-526(1976))。最終工程の、ホモセリンホスフェートのL-トレオニンへの複合変換は、thrCによってコードされる47kDaタンパク質であるトレオニンシンターゼによって触媒される(C. Parsotら,Nucleic Acids Res. 11:7331-7345(1983))。
thrA、thrB、およびthrC遺伝子はすべてE. coliの遺伝子マップの0分に位置する単一オペロンであるthrオペロンに属する
これらの遺伝子は、それぞれ、アスパラギン酸キナーゼI−ホモセリンデヒドロゲナーゼI、ホモセリンキナーゼ、およびトレオニンシンターゼをコードする。これらの酵素の生合成は、トレオニンおよびイソロイシンによる多価抑制を受ける(M. Freundlich, Biochem.Biophys. Res. Commun. 10:277-282(1963))。
調節領域は、thrオペロンの第1の構造遺伝子の上流に見られ、そしてその配列は決定されている(J.F. Gardner, Proc. Natl. Acad. Sci. USA 76:1706-1710(1979))。転写開始部位の下流のthrアテニュエーターは、リーダーペプチドをコードする配列を含み;この配列は、8つのトレオニンコドンおよび4つのイソロイシンコドンを含む。thrアテニュエーターはまた、古典的に相互排他的な二次構造を含み、これは荷電したトレオニル-およびイソロイシル-tRNAのレベルに依存して、thrオペロン中の構造遺伝子のRNAポリメラーゼ転写を可能にするかまたは防止する。
天然の生合成による高レベルのアミノ酸産生を得ることに関する問題のため(例えば、所望の産物によるthrオペロンの抑制)、フィードバック耐性酵素をコードするthrA遺伝子とともにthrオペロンを含むプラスミドを有する細菌株が産生されている。このようなプラスミドを用いて、L-トレオニンは、Brevibacterium flavum、Serratia marcescens、およびEscherichia coliのような広範な種々の微生物を用いる発酵プロセスによって工業的な規模で産生されている。
例えば、E. coli BKIIM B-3996株(Debabovら,米国特許第5,175,107号)はプラスミドpVIC40を含み、36時間で約85g/Lを生成する。宿主は欠損トレオニンシンターゼのためにトレオニン要求株である。BKIIM B-3996では、トレオニン生合成に必要とされる重要な酵素的活性、すなわち、フィードバック耐性AK I-HD I、ホモセリンキナーゼ、およびトレオニンシンターゼを提供する組換えプラスミドpVIC40である。このプラスミドはまた、宿主のトレオニン栄養要求性を補完する。
E. coli 29-4株(E. Shimizuら,Biosci. Biotech. Biochem. 59:1095-1098(1995))は、組換えE. coliトレオニンプロデューサーの別の例である。29-4株を、トレオニン-過剰産生変異株、E. coli K-12(βIM-4)(E. coli株ATCC 21277に由来する)のthrオペロンを、プラスミドpBR322にクローニングすることによって構築し、次いで、これを親株に導入した(K. Wiwaら,Agric. Biol. Chem. 47:2329-2334(1983))。29-4株は、72時間で約65g/LのL-トレオニンを産生する。
同様に構築された組換え株は、他の生物を使用して作成されている。例えば、S. marcescens T2000株は、フィードバック耐性thrA遺伝子産物をコードするthrオペロンを有するプラスミドを含み、そして96時間で約100g/Lのトレオニンを産生する(M. Masudaら,Applied Biochemistry and Biotechnology 37:255-262(1992))。これらの株はすべて、トレオニン生合成酵素をコードする遺伝子の複数コピーを有するプラスミドを含み、これはこれらの酵素の過剰発現を可能にする。トレオニン生合成酵素をコードするプラスミド産生遺伝子、特にフィードバック耐性AK I-HD IをコードするthrA遺伝子の過剰発現は、これらの株が大量のトレオニンを産生することを可能にする。プラスミド含有微生物の他の例は、例えば、米国特許第4,321,325号;第4,347,318号;第4,371,615号;第4,601,983号;第4,757,009号;第4,945,058号;第4,946,781号;第4,980,285号;第5,153,123号;および第5,236,831号に記載される。
しかし、これらのようなプラスミド含有株は、それらのアミノ酸の商業的発酵産生のための有用性を限定するという問題を有する。例えば、これらの株での重要な問題は、プラスミド含有株の統合性が、細胞増殖および分裂の間のプラスミドの潜在的喪失のために、発酵プロセスを通して維持されることを確実にする。この問題を避けるために、例えば、プラスミドにおける抗生物質耐性遺伝子を用いることによって、培養中のプラスミドを含まない細胞を選択的に排除することが必要である。しかし、この溶液は、発酵培地に1つ以上の抗生物質の添加を必要とし、これは大規模発酵のためには商業的に実際的ではない。
プラスミド含有株での別の重要な問題は、プラスミド安定性である。遺伝子がプラスミド上にコードされる酵素の高発現は、商業的に実際的な発酵プロセスに必要であり、しばしばプラスミド不安定性を引き起こす(E. Shimizuら,Biosci. Biotech. Biochem. 59:1095-1098(1995))。プラスミド安定性はまた、培養温度および培養培地中の溶存酸素のレベルのような因子に依存する。例えば、プラスミド含有29-4株は、より低い培養温度(30℃対37℃)およびより高いレベルの溶存酸素でより安定であった(E. Shimizuら,Biosci. Biotech. Biochem. 59:1095-1098(1995))。
上記の微生物より効果が少ないが、非プラスミド含有微生物はまた、トレオニンプロデューサーとして使用されている。H-8460のようなE. coliの株は、一連の従来の変異誘発およびいくつかの代謝アナログに対する耐性についての選択によって得られ、70時間で約75g/LのL-トレオニンを生成する(Kinoら,米国特許第5,474,918号)。H-8460株は、組換えプラスミドを有さず、そして染色体上のトレオニン生合成遺伝子の1つのコピーを有する。これらの非プラスミド含有株がトレオニン生合成遺伝子の単一コピーのみを有するので、BKIIM B-3996のようなプラスミドを産生する株と比較して、この株のより低い生産性は、より低い酵素活性(特にthrオペロンによってコードされるもの)によると考えられる。適切な非プラスミド含有微生物の他の例は、例えば、米国特許第5,376,538号;第5,342,766号;第5,264,353号:第5,217,883号;第5,188,949号;第5,164,307号;第5,098,835号;第5,087,566号;第5,077,207号;第5,019,503号;第5,017,483号;第4,996,147号;第4,463,094号;第4,452,890号;第3,732,144号;第3,711,375号;第3,684,654号;第3,684,653号;第3,647,628号;第3,622,453号;第3,582,471号;第3,580,810号;第3,984,830号;および第3,375,173号に記載される。
E. coliの非プラスミド含有およびプラスミド含有株の両方で、thrオペロンは、特定の株のそれぞれの天然トレオニンプロモーターによって制御される。上記のように、天然プロモーターの発現は、リーダーペプチドをコードし、そして多くのトレオニンおよびイソロイシンコドンを含むDNAの領域によって制御されるアテニュエーション機構によって調製される。この領域は、トレオニニル-tRNAおよびイソロイシニル-tRNAのレベルを感知するリボソームによって翻訳される。これらのレベルがリーダーペプチドが翻訳されるために十分である場合、転写は早めに終結されるが、レベルがリーダーペプチドが翻訳されるために不十分である場合、転写は終結されず、そしてオペロン全体が転写され、これは翻訳後、トレオニン生合成酵素の産生の増加を生じる。従って、トレオニル-tRNAおよび/またはイソロイシニル-tRNAレベルが低い場合、thrオペロンが最大に転写され、そしてトレオニン生合成酵素が最大に生成される。
E. coliトレオニン産生株BKIIM B-3996では、プラスミド中のトレオニンオペロンは、その天然プロモーターによって制御される。結果として、株がトレオニンおよび/またはイソロイシンを枯渇される場合にのみ、thrオペロンは最大で発現される。トレオニンの枯渇がトレオニン産生株で可能ではないので、これらの株は、より高いレベルの酵素的活性を得るために、イソロイシンの栄養要求性である。
アテニュエーション制御を克服する別の方法は、細胞中のトレオニル-tRNAおよび/またはイソロイシニル-tRNAのレベルを低下させることである。例えば、トレオニンに対して200倍減少した見かけの親和性を示すトレオニル-tRNAシンターゼを有するthrS変異体は、おそらく低レベルのトレオニル-tRNAにより、thrオペロンの過剰発現を生じる(E.J. Johnsonら,J. Bacteriol. 129:66-70(1977))。
しかし、これらの株を使用する発酵プロセスにおいて、細胞は、その欠失したイソロイシン生合成のために、増殖期でイソロイシンを補充されなければならない。続いて、産生段階では、細胞は、トレオニン生合成酵素の発現を誘導するためにイソロイシンを取り除かれる。従って、トレオニン生合成酵素の発現を制御するために天然トレオニンプロモーターを使用することの主な欠点は、細胞がイソロイシンで補充されなければならないことである。
抗生物質ボレリジンはまた、トレオニルtRNA-シンセターゼの酵素的活性を減少させ、そしてそれによってE. coliの増殖を阻害することが公知である(G. Nassら,Biochem. Biophys. Res. Commun. 34:84(1969))。この減少した活性を考慮して、E. coliの特定のボレリジン感受性株は、高レベルのトレオニンを産生するために用いられている(日本国特許出願公開第6752/76号;米国特許第5,264,353号)。培養物へのボレリジンの添加は、L-トレオニンの収量を増加することが見出された。BrevibacteriumおよびCorynebacteriumのボレリジン感受性株もまた、高レベルのトレオニンを産生するために使用されている(日本国特許第53-101591号)。
E. coliのボレリジン耐性変異体は、トレオニルtRNA-シンセターゼ活性の変化を同様に示す。より詳細には、ボレリジン耐性E. coliは、以下の特徴の1つを示すことが示されている:(i)構成的に増加したレベルの野生型トレオニルtRNA-シンセターゼ;(ii)構造的に変化されたトレオニルtRNA-シンセターゼ;または(iii)おそらく膜変化による、いくつかの未知の細胞変化(G. NassおよびJ. Thomale, FEBS Lett. 39:182-186(1974))。しかし、これらの変異体株のいずれもが、L-トレオニンの発酵産生のためには使用されていない。
上記の議論を考慮すると、トレオニンのようなアミノ酸を効率的に産生する微生物株について当該技術分野での必要性が残ったままであるが、最先端に関連する問題はない。
発明の要旨
従って、本発明の目的は、高収量でL-トレオニンを効率的に産生するが、トレオニン生合成酵素をコードする遺伝子を含む任意の組換えプラスミドを必要とせずそして好ましくはアミノ酸栄養要求性を有さない微生物を提供することである。本発明の他の目的、特徴、および利点は、以下の好ましい実施態様の詳細な説明に記載され、そして一部はその記載から明らかでありまたは本発明の実施によって学び得る。本発明のこれらの目的および利点は、本明細書の記載された説明および請求の範囲で特に指摘された方法によって理解され達成される。
これらおよび他の目的は本発明の方法によって達成され、これは、第1の実施態様では、L-トレオニンのようなアミノ酸を産生するためのプロセスに関し、これは、培地中でE. coliの株を培養する工程、および培地からアミノ酸を回収する工程を包含する。このプロセスで使用されるE. coliの株は、以下の特徴を有する:(i)非天然プロモーターの制御下の染色体上に、トレオニンオペロン(これはトレオニン生合成酵素をコードする)のようなアミノ酸生合成の遺伝子決定基を含む;および(ii)トレオニンを産生するためのトレオニン生合成酵素をコードする遺伝子を含むいかなる組換えプラスミドも必要としない。
本発明の別の実施態様は、上記の特徴を有するE. coliの株の生物学的に純粋な培養物に関する。
本発明のさらなる実施態様は、L-トレオニンのようなアミノ酸を産生するプロセスに関し、これは、培地中でE. coliの株を培養する工程、および培地からアミノ酸を回収する工程を包含し、ここでE. coliの株はボレリジンに耐性である。
本発明のさらなる実施態様は、トレオニンのようなアミノ酸の発酵産生に有用なE. coliの株を産生する方法に関し、これは、(a)E. coli原栄養性になるようにE. coli栄養要求性の染色体中にアミノ酸産生微生物からの遺伝物質を導入する工程;(b)その発現を制御するためにアミノ酸生合成遺伝子の染色体位置の前の染色体に非天然プロモーターを挿入する工程;および、必要に応じて、(c)染色体からアミノ酸生合成のためのアミノ酸栄養要求性を除去する工程および/または染色体からのアミノ酸生合成に対する妨害を調節する工程、を包含する。
上記の一般的説明および以下の詳細な説明の両方が例示的および説明的のみであり、そして請求の範囲として発明のさらなる説明を提供することが意図されることが、理解されるべきである。
【図面の簡単な説明】
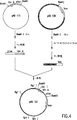
図1は、Koharaのλ676およびプラスミドpUC19からのプラスミドpAD103の構築を示す。
図2は、プラスミドpAD103およびプラスミドpUC4kからのプラスミドpAD106の構築を示す。
図3は、プラスミドpAD103およびプラスミドpkk223-3からのプラスミドpAD115の構築を示す。
図4は、プラスミドpAD115およびプラスミドpAD106からのプラスミドpAD123の構築を示す。
図5は、E. coliの染色体中へのプラスミドpAD123からのプロモーター領域の組込みを示す。
発明の好ましい実施態様の詳細な説明
第1の実施態様では、本発明は、アミノ酸の産生のための発酵プロセスで使用され得る新規細菌株に関する。本発明の新規細菌株は以下の特徴を有する:
(i)細胞は、非天然プロモーターの制御下で、染色体上に少なくとも1つのthrオペロン(すなわち、トレオニン生合成酵素をコードする少なくとも1セットの遺伝子)を含む;および
(ii)細胞は、トレオニンを産生するために、トレオニン生合成酵素をコードする任意の組換えプラスミドを必要としない。
好ましくは、本発明の株は、約30時間で少なくとも約50g/LのL-トレオニン、より好ましくは約30時間で少なくとも約70g/L、さらにより好ましくは約30時間で少なくとも約80g/L、および最も好ましくは約30時間で少なくとも約90g/Lを産生し得る。好ましくは、本発明の株は、約48時間で少なくとも約90g/L、より好ましくは約48時間で少なくとも約100g/L、および最も好ましくは約48時間で少なくとも約110g/Lのトレオニンを産生し得る。
好ましくは、本発明の株は、少なくとも約2g/L/時間、より好ましくは少なくとも約2.5g/L/時間、さらにより好ましくは少なくとも約3g/L/時間、および最も好ましくは少なくとも約3.6g/L/時間の速度でL-トレオニンを産生し得る。
特に好ましい実施態様では、新規細菌株はまた、トレオニンの発酵産生のためのアミノ酸栄養要求性を有さない。すなわち、細胞は、増殖およびトレオニン産生にアミノ酸補充を必要としない。
本発明に従って、本発明の細菌株は、トレオニン産生のためのトレオニン生合成酵素をコードする1つ以上の遺伝子を含む任意の組換えプラスミドを必要としない。すなわち、この株は、組換えプラスミドに含まれる遺伝子によってコードされる1つ以上のトレオニン生合成酵素を必要とせずにトレオニンを産生し得る。もちろん、本発明の株は、必要に応じて、所望の1つ以上の組換えプラスミドを含み得る。例えば、このようなプラスミドはトレオニン産生に必要とされないが、それにもかかわらず、本発明の株は、トレオニン産生を増加するために、トレオニン生合成酵素をコードする組換えプラスミドを含み得る。本発明の株は、アスパラギン酸セミアルデヒドデヒドロゲナーゼ(asd)のような、トレオニン生合成に関連する他の酵素をコードする組換えプラスミドを同様に含み得る。
好ましくは、本発明の細菌株は、Escherichia coliの株である。より好ましくは、本発明の細菌株は、マクロライド抗生物質ボレリジンに対する耐性を示すE. coliの株である。本発明の細菌株の特に好ましい例は、E. coli kat-13株であり、これは、Agricultural Research Service Culture Collection(NRRL), 1815 North University Street, Peoria, Illinois 61604, USAに1996年6月28日に寄託され、そして受託番号NRRL B-21593を与えられた。
本発明の細菌株の細胞の染色体上のトレオニン(thr)オペロンは、トレオニン生合成に必要な酵素をコードする。好ましくは、トレオニンオペロンは、AK-HD遺伝子(thrAまたはmetL)、ホモセリンキナーゼ遺伝子(thrβ)、およびトレオニンシンターゼ遺伝子(thrC)からなる。より好ましくは、thrオペロンは、thrA(AK I-HD I遺伝子)、thrB、およびthrCからなる。適切なthrオペロンは、例えば、E. coli ATCC 21277株およびATCC 21530株から得られ得る。ATCC 21277株からのthrオペロンが特に好ましい。複数のコピーのthrオペロンが、染色体上に存在し得る。
好ましくは、thrオペロンは、少なくとも1つのアテニュエートされない遺伝子を含む。すなわち、遺伝子の発現は、1つ以上のトレオニン生合成酵素および/またはその産物(例えば、トレオニンおよびイソロイシン)のレベル(細胞外および/または細胞内)によって抑制されない。本発明の株はまた、欠損thrアテニュエーターを含むthrオペロン(転写開始部位の下流および第1の構造遺伝子の上流の調節領域)またはthrアテニュエーターを全く欠くthrオペロンを含み得る。
本発明の特に好ましい実施態様では、thrオペロンは、1つ以上のフィードバック耐性トレオニン生合成酵素をコードする。すなわち、酵素の活性は、トレオニン生合成の中間体および産物の細胞外および/または細胞内レベルによって阻害されない。最も好ましくは、thrオペロンは、フィードバック耐性AK I-HD Iのような、フィードバック耐性AK-HDをコードする遺伝子を含む。フィードバック耐性AK-HDの使用は、産生されているL-トレオニンの存在下でさえも、トレオニン生合成のためにより高いレベルの酵素的活性を提供する。
本発明の株における1つまたは複数のトレオニンオペロンの発現は、非天然プロモーター、すなわち、天然で通常見られるE. coli細菌株においてthrオペロンの発現を制御しないプロモーターによって制御される。トレオニン生合成酵素の天然プロモーターを、thrオペロンの発現を制御するために強力な非天然プロモーターに置換することは、thrオペロンの単一のゲノムコピーのみを用いても、より高いトレオニン産生を生じる。さらに、非天然プロモーターがトレオニンオペロンの発現を制御するために使用されるので、このより高いトレオニン産生を達成するためにイソロイシンについて細菌株を栄養要求性にする必要がない。適切なプロモーターの例示的な例として、lacプロモーター;trpプロモーター;λバクテリオファージのPLプロモーター;PRプロモーター;lppプロモーター;およびtacプロモーターが挙げられるが、これらに限定されない。本発明の細菌株における使用に特に好ましいものは、tacプロモーターである。
トレオニンオペロンに加えて、本発明の細菌株の細胞中の染色体はまた、好ましくはアスパラギン酸セミアルデヒドデヒドロゲナーゼ(asd)をコードする少なくとも1つの遺伝子を含む。最も好ましくは、本発明の細胞中の染色体は、少なくとも1つのasd遺伝子、少なくとも1つのthrA遺伝子、少なくとも1つのthrB遺伝子、および少なくとも1つのthrC遺伝子を含む。染色体は、もちろん、1つ以上のこれらの遺伝子の複数のコピーを含み得る。
トレオニンデヒドロゲナーゼ(tdh)は、L-トレオニンのα-アミノ-β-ケトブチレートへの酸化を触媒する。従って、特に好ましい実施態様では、本発明の細胞の染色体は、少なくとも1つの欠損トレオニンデヒドロゲナーゼ(tdh-)遺伝子をさらに含む。欠損tdh遺伝子は、トレオニンデヒドロゲナーゼの減少した発現レベルを有する遺伝子、または天然トレオニンデヒドロゲナーゼの活性と比較して減少した酵素的活性を有するトレオニンデヒドロゲナーゼ変異体をコードする遺伝子であり得る。好ましくは、本発明の株で用いられる欠損tdh遺伝子は、トレオニンデヒドロゲナーゼを発現しない。トレオニンデヒドロゲナーゼを発現しない適切なtdh-遺伝子の例示的な例として、米国特許第5,175,107号に記載のように、それに挿入されたクロラムフェニコールアセチルトランスフェラーゼ(cat)遺伝子を有するtdh遺伝子またはそれに挿入されたトランスポゾンTn5を有するtdh遺伝子が挙げられる。
本発明の細菌株は、当業者に公知および利用可能な方法および技術のいずれかによって調製され得る。本発明の細菌株を構築するために適切な方法の例示的な例として、NTGのような適切な薬剤を使用する変異誘発;直鎖状DNAフラグメントを形質転換することおよび相同組換えによって媒介される、遺伝子組込み技術;およびバクテリオファージP1によって媒介される形質導入が挙げられる。これらの方法は、当該技術分野で周知であり、そして、例えば、J.H. Miller, Experiments in Molecular Genetics, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York(1972);J.H. Miller, A Short Course in Bacterial Genetics, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York(1992);M. SingerおよびP. Berg, Genes & Genomes, University Science Books, Mill Valley, California(1991);J. Sambrook, E.F. FritschおよびT. Maniatis, Molecular Cloning: A Laboratory Manual, 第2版,Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York(1989);P.B. Kaufmanら,Handbook of Molecular and Cellular Methods in Biology and Medicine, CRC Press, Boca Raton, Florida(1995);Methods in Plant Molecular Biology and Biotechnology, B.R. GlickおよびJ.E. Thompson編,CRC Press, Boca Raton, Florida(1993);およびP.F. Smith-Keary, Molecular Genetics of Escherichia coli, The Guilford Press, New York, NY(1989)に記載される。
本発明の特に好ましい実施態様では、増殖のためにトレオニンを必要とするE. coli 472T23株は、E. coli ATCC 21277株(アメリカンタイプカルチャーコレクション、12301 Parklawn Drive, Rockville, Maryland 20852, USAから得られ得る)のトレオニンオペロンを導入するためにP1-媒介形質導入を使用してトレオニンプロデューサーに変換され得る。このthrオペロンは、フィードバック耐性アスパラギン酸キナーゼ−ホモセリンデヒドロゲナーゼ遺伝子(thrA)、ホモセリンキナーゼ遺伝子(thrB)、およびトレオニンシンターゼ遺伝子(thrC)からなる。
本発明の株におけるトレオニン産生を改良するために、E. coli CGSC6945株(関連遺伝子型:tdh-1::cat1212;E. coli Genetic Stock Center, 355 Osborne Memorial Laboratory, Department of Biology, Yale University, New Haven, Connecticut 06520-8104, USAから得られた)からの欠損トレオニンデヒドロゲナーゼ遺伝子は、P1形質導入によって導入され得る。得られるトレオニンプロデューサーは、NTGで変異誘発することおよび/またはボレリジン耐性について選択することによってさらに改良され得る。
kan(カナマイシン耐性をコードする)のような抗生物質耐性マーカー遺伝子、およびPLまたはtacのような強力なプロモーター(好ましくは、thrAおよび野生型thrA遺伝子の数百塩基対(すなわち、thrA遺伝子全体ではない)の上流のDNAに隣接する)を有するプラスミドが構築され、そして染色体に所望のDNAフラグメントを送達するためにビヒクルとして使用され得る。プラスミド上のフラグメントは、適切な制限酵素での消化によって単離され、そして精製され、次いで形質転換またはエレクトロポレーションによって株に導入され、トレオニンオペロンの制御領域を除去して所望のフラグメント(すなわち、抗生物質耐性マーカー遺伝子およびthrA遺伝子の始まりでの強力なプロモーター)での相同組換えによって置換され得る。次いで、このフラグメントは、P1形質導入によってボレリジン耐性株に移入され得る。
好ましい宿主の株(472T23)のイソロイシン要求性は、例えば、P1形質導入を介してマーカーの野生型対立遺伝子を導入することによって、排除され得る。他の宿主の望ましくない栄養要求性は、類似の方法でまたは当業者に公知および利用可能な他の方法に従って除去され得る。
本発明の第2の実施態様は、アスパラギン酸ファミリーのアミノ酸の産生のための発酵プロセスにおける上記の細菌株の使用に関する。例えば、L-トレオニンは、少なくとも1つの炭素供給源、少なくとも1つの窒素供給源、および適宜、無機塩、増殖因子などを含む合成または天然の培地中で、本発明の細菌株を培養することによって得られる。
適切な炭素供給源の例示的な例として、炭水化物(例えば、グルコース、フルクトース、スクロース、スターチ加水分解物、セルロース加水分解物、および糖蜜);有機酸(例えば、酢酸、プロピオン酸、ギ酸、リンゴ酸、クエン酸、およびフマル酸);およびアルコール(例えば、グリセロール)が挙げられるが、これらに限定されない。
適切な窒素源の例示的な例として、アンモニア(アンモニアガスおよびアンモニア水溶液を含む);無機または有機酸のアンモニウム塩(例えば、塩化アンモニウム、リン酸アンモニウム、硫酸アンモニウム、および酢酸アンモニウム);および他の窒素含有物(肉エキス、ペプトン、コーン浸出液、カゼイン加水分解物、ダイズケーキ加水分解物、および酵母エキスを含む)が挙げられるが、これらに限定されない。
培養後、培養ブロス中に蓄積されたL-トレオニンは、公知の方法のいずれかに従って、例えば、米国特許第5,342,766号に記載されるようなイオン交換樹脂の使用によって、分離され得る。この方法は、最初に遠心分離によって培養ブロスから微生物を除去する工程、および次に塩酸を使用してブロスのpHを約2に調節する工程を包含する。酸性化した溶液を、続いて強い酸性カチオン交換樹脂に通し、そして吸着剤を希釈アンモニア水溶液を使用して溶出する。アンモニアを、真空下でのエバポレーションによって除去し、そして得られる溶液を濃縮する。アルコールの添加およびその後の冷却によってL-トレオニンの結晶を得る。
アスパラギン酸ファミリーの他のアミノ酸は、上の詳細に記載された方法と類似の方法によって産生され得る。例えば、イソロイシンは、染色体上またはプラスミド上に、増幅されたilvA遺伝子またはtdc遺伝子(その両方とも、トレオニンのイソロイシンへの生物変換に関連する最初の酵素であるトレオニンデアミナーゼをコードする)を含む本発明の細菌株から調製され得る。例えば、フィードバック耐性酵素をコードするilvA遺伝子の使用によるこの遺伝子の増幅は、イソロイシンの生合成を増加させる。
同様に、メチオニンは、染色体上に少なくとも1つのmetオペロン(すなわち、metL遺伝子(AK II-HD IIをコードする)、metA遺伝子(ホモセリンスクシニルトランスフェラーゼ)、metB遺伝子(シスタチオニンγ-シンターゼ)、metC遺伝子(シスタチオニンβ-リアーゼ)、ならびにmetEおよびmetH遺伝子(ホモシステインメチラーゼ))を含むE. coliのような微生物によって調製され得る。これらの遺伝子(そのフィードバック耐性改変体を含む)および必要に応じて非天然プロモーターは、上記のおよび/または当業者に公知の1つ以上の一般的な方法に従って宿主微生物の染色体に導入され得る。同様に、リジンは、リジン生合成酵素(好ましくは、lysCおよび/またはdapAによってコードされるフィードバック耐性リジン生合成酵素)、および必要に応じて非天然プロモーターをコードする遺伝子を含む微生物によって調製され得る。
本発明の第3の実施態様は、L-トレオニンの産生のための発酵プロセスにおけるボレリジン耐性細菌株の使用に関する。好ましくは、ボレリジン耐性株は、E. coli株の変異体である。このような変異体の特に好ましい実施態様は、E. coli kat-13株であり、これはAgricultural Research Service Culture Collection(NRRL), 1815 North University Street, Peoria, Illinois 61604, USAに1996年6月28日に寄託され、そして受託番号NRRL B-21593が与えられた。
ボレリジン耐性は、当業者に公知の任意の利用可能な方法によって決定され得る。例えば、ボレリジン耐性株は、G. NassおよびJ. Thomale, FEBS Lett. 39:182-186(1974)に記載のように、約139μMボレリジンを含む最少培地に候補株をプレーティングすることによって単離され得る。さらに、ある株におけるボレリジン耐性は、細胞の1つ以上の表現型特徴の変化として現れる。例えば、E. coli株6-8およびその誘導体のボレリジン耐性変異体は、桿状よりもむしろ円形のようである。このような場合では、表現型特徴の変化の証拠は、ボレリジン耐性株を適切に同定するために十分であり得る。
本発明のこの実施態様に有用なボレリジン耐性変異体は、トレオニンを産生し得る。トレオニン生合成酵素をコードする遺伝子は、染色体上に存在し得るかまたはプラスミドもしくはその混合物に含まれ得る。これらの遺伝子の複数コピーもまた存在し得る。好ましくは、トレオニン生合成酵素をコードする遺伝子は、アテニュエーション制御に耐性であり、および/またはフィードバック耐性酵素をコードする。
上記のように、本発明のボレリジン耐性株は、所望のように1つ以上の組換えプラスミドを含み得る。例えば、本発明の微生物は、トレオニン生合成酵素をコードする組換えプラスミドを含み得る。本発明の細菌株は、同様に、アスパラギン酸セミアルデヒドデヒドロゲナーゼ(asd)または増殖を増大させるための酵素のような、トレオニン生合成に関連する他の酵素をコードする組換えプラスミドを含み得る。
さらに、当業者に公知および利用可能な任意の方法および技術を使用して、例えば、トレオニン産生を増加させる、栄養要求性を除去するなどのために、ボレリジン耐性株は所望のように改変され得る。ボレリジン耐性E. coli変異体および改変体を改変するために適切な方法の例示的な例として:紫外線もしくはX線での照射による、またはニトロソグアニジン(N-メチル-N’-ニトロ-N-ニトロソグアニジン)、メチルメタンスルホネート、ナイトロジェンマスタードなどのような化学的変異原での処理による変異誘発;直鎖状DNAフラグメントおよび相同組換えを形質転換することによって媒介されるような遺伝子組込み技術;およびP1のようなバクテリオファージによって媒介される形質導入が挙げられるが、これらに限定されない。これらの方法は、当該技術分野で周知であり、そして、例えば、J.H. Miller, Experiments in Molecular Genetics, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York(1972);J.H. Miller, A Short Course in Bacterial Genetics, Cold Spring Harbor Laboratory Press,Cold Spring Harbor, New York(1992);M. SingerおよびP. Berg, Genes & Genomes, University Science Books, Mill Valley, California(1991);J. Sambrook, E.F. FritschおよびT. Maniatis, Molecular Cloning: A Laboratory Manual,第2版, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York(1989);P.B. Kaufmanら,Handbook of Molecular and Cellular Methods in Biology and Medicine, CRC Press, Baca Raton, Florida(1995);Methods in Plant Molecular Biology and Biotechnology, B.R. GlickおよびJ.E. Thompson編,CRC Press, Boca Raton, Florida(1993);およびP.F. Smith-Keary, Molecular Genetics of Escherichia coli, The Guilford Press, New York, NY(1989)に記載される。
好ましくは、本発明のボレリジン耐性変異体は、これらの遺伝子が染色体上にあるかおよび/またはプラスミドに含まれるかどうかにかかわりなく、トレオニン生合成酵素をコードする1つ以上の遺伝子の上流に、およびその遺伝子への作動可能な連結で、非天然プロモーターを含むように改変される。
本発明のこの実施態様の特に好ましい態様に従って、L-トレオニンは、上記のように、少なくとも1つの炭素供給源、少なくとも1つの窒素供給源、および適宜、無機塩、増殖因子などを含む合成または天然の培地中で、少なくとも1つのボレリジン耐性細菌株を培養することによって得られる。蓄積されたトレオニンは、当業者に公知の任意の方法によって回収され得る。
以下の実施例は、例示するのみであって、添付の請求の範囲に定義されるように本発明の範囲を限定することを意図しない。種々の改変および変更が、本発明の精神および範囲から逸脱することなく本発明の方法で作成され得ることは、当業者に明らかである。従って、本発明が、添付の請求の範囲およびその等価物の範囲内であるならば、本発明の改変および変更を網羅することが意図される。
本明細書中で言及されるすべての特許および刊行物は、特に、参考として援用される。
実施例1:E. coli kat-13株の調製
A.E. coli 472T23株の染色体へのE. coli ATCC 21277株のトレオニンオペロンの転移
アメリカンタイプカルチャーコレクション、12301 Parklawn Drive, Rockville, Maryland 20852, USAから入手可能なE. coli ATCC 21277株(米国特許第3,580,810号)は、アミノ-β-ヒドロキシ吉草酸(AHV)耐性であるが、最少培地中で増殖するためにプロリン、チアミン、イソロイシン、メチオニンを必要とする。ATCC 21277は、発酵プロセスにおいて6.20g/Lのトレオニンを蓄積すると報告されている。ATCC 21277のトレオニンオペロンは、フィードバック耐性酵素をコードするアスパラギン酸キナーゼI−ホモセリンデヒドロゲナーゼI遺伝子(thrA)、ホモセリンキナーゼ遺伝子(thrB)、およびトレオニンシンターゼ遺伝子(thrC)からなる。
登録番号BKIIM B-2307としてUSSR Antibiotics Research InstituteでのUSSR Collection of Commercial Microorganismsに寄託される、E. coli 472T23株は、グルコース、アンモニア、ビタミンB1、およびミネラル塩を含む最少培地中で増殖するためにトレオニンおよびイソロイシンを必要とすると報告される。この株は、トレオニン生合成に必須な遺伝子である欠損thrC遺伝子を有するので、トレオニンを産生し得ない。472T23株はまた、イソロイシン生合成における最初の酵素をコードする欠損トレオニンデアミナーゼ遺伝子ilvAを有する。
バクテリオファージP1溶解物を、ATCC 21277でファージを増殖することによって調製した。次いで、472T23株を、その中に少数のファージ粒子がATCC 21277のトレオニンオペロンを有するこのP1溶解物で感染させた。感染後、トレオニンを合成する細菌を、0.25g/Lのイソロイシンを補充した最少培地E[グルコース0.05g/L;MgSO4・7H2O 0.2g/L;クエン酸・H2O 2.0g/L;K2HPO4 10.0g/L;NaHNH4PO4・4H2O 3.5g/L;寒天15.0g/L]寒天プレート上に播種することによって選択した。ATCC 21277のトレオニンオペロンを有するいくつかのトレオニン原栄養性形質導入体は、現在、イソロイシンのみを補充した最少プレート中で増殖し得た。
これらの形質導入体を、以下の実施例2に記載されるように、トレオニン産生のために振盪フラスコ発酵によってスクリーニングした。トレオニンを産生するこれらの1つであるG9を、さらなる株の開発のために選択した。
B.E. coli G9株の染色体へのクロラムフェニコールアセチルトランスフェラーゼ(cat)遺伝子とともに挿入された欠損トレオニンデヒドロゲナーゼ(tdh-)遺伝子の導入
欠損トレオニンデヒドロゲナーゼ遺伝子(tdh-)を有するCGSC6945株を、E. coli Genetic Stock Center, 355 Osborne Memorial Laboratory, Department of Biology, Yale University, New Haven, Connecticut 06520-8104, USAから得た。トレオニンデヒドロゲナーゼ遺伝子は、クロラムフェニコールアセチルトランスフェラーゼ(cat)遺伝子がこれに挿入されるので、欠損性である。この欠損遺伝子をG9に転移するために、P1ファージをCSCG6945で増殖し、そして溶解物をG9を感染させるために使用した。G9のいくつかのクロラムフェニコール耐性形質導入体を選択し、そして以下の実施例2に記載されるように振盪フラスコ発酵でトレオニン産生について選択およびスクリーニングした。G9よりも高いトレオニン力価を有するこれらの1つであるG909を、さらなる開発のために選択した。
C.E. coli G909株の染色体への非天然プロモーターの挿入
G909の染色体へtacプロモーターを送達するために、線状DNAフラグメントとエキソヌクレアーゼVマイナス株(recD)の染色体との間の相同組換えを用いた。
線状DNAフラグメントは、トレオニンオペロンの上流(5’末端)の1.5kbの配列、カナマイシン耐性マーカー、tacプロモーター配列、および約480bpのthrA遺伝子を含んだ。それぞれ、5’末端相同性、選択マーカー(カナマイシン耐性)、トレオニンオペロン(tac)への強力および制御可能なプロモーター、ならびに3’末端相同性を提供するこのフラグメントを、以下のように生成した。
野生型E. coli W3110のトレオニンオペロンを、Dr. Yuju Kohara, Department of Molecular Biology, School of Science, Nagoya University, Chikusa-ku, Nagoya, Japanからのλクローン676のDNAを使用することによって、プラスミドpUC19の制限酵素SphI部位へクローニングした。次いで、λクローン676およびpUC19のDNAを、SphIで消化した。続いて、pUC19フラグメントを、エビアルカリホスファターゼ(SAP)で脱リン酸化し、そしてアガロースゲル精製した。λクローンからのトレオニンオペロンの6.9kbフラグメントもまた精製した。続いて、これらの2つのフラグメントを、T4 DNAリガーゼによって連結し、プラスミドpAD103を生成した。
次いで、相同組換えおよびカナマイシン耐性マーカーについての上流隣接領域を構築した。pAD103を、制限酵素BstEII、XbaIで消化し、クレノウフラグメント処理で平滑末端にした。トレオニンオペロンの5’末端(上流)のみ(しかしthrオペロン自体でもその制御領域でもない)を含む1.5kbフラグメントを単離し、そしてpUC4K(Pharmacia)からのカナマイシン耐性遺伝子のフラグメントに連結し、これを、制限酵素SalIで消化し、そして3’突出を満たすようにクレノウフラグメント処理し、中間体プラスミドpAD106を生成した。
pAD103もまた制限酵素TaqIで消化し、そしてクレノウフラグメント処理で平滑末端にした。天然リボソーム結合部位およびthrA遺伝子の約480bpのコード配列を含むフラグメントを単離し、次いでpKK233-3(Pharmacia)のフラグメントに連結した。これは、プラスミドpAD115を得るために制限酵素SmaIで消化およびSAPで脱リン酸化され、tacプロモーターのDNA配列、リボソーム結合部位、および数百塩基のthrA遺伝子を含んでいる。
続いて、pAD115を制限酵素BamHiで消化し、そして所望のDNA配列を含む0.75kbのDNAフラグメントを単離した。pAD106もまたBamHIで消化し、次いでSAPで脱リン酸化した。次いで、2つのフラグメントを連結してプラスミドpAD123を提供した。これは、トレオニンオペロンの上流のDNA配列、カナマイシン耐性マーカー遺伝子、tacプロモーター、およびthrA遺伝子の始めの約480bpを含んだ。
次いで、pAD123をSpeI、BglIで消化し、そして所望のDNA配列を含むフラグメントを単離した。
エキソヌクレアーゼVマイナス株(recD)を、argA中の同時形質導入可能なトランスポゾンTn10挿入とともにrecD遺伝子を含むE. coli KW251株(関連遺伝子型:argA81::Tn10,recD1014;Pharmaciaから得られた)でP1ファージを増殖することによって調製した。次いで、ファージから調製された溶解物を使用して、G9株を感染させ、そしてテトラサイクリン耐性形質導入体G9T7を単離した。
プラスミドpAD123からのDNAフラグメントを、エレクトロポレーションによってE. coli G9T7株へ送達した。G9T7のカナマイシン耐性株を単離し、そしてP1ファージ溶解物を、この株でファージを増殖することによって作成した。次いで、P1ファージ溶解物を使用して、G909を形質導入した。G909のカナマイシン耐性形質導入体の1つであるtac3は、振盪フラスコ研究においてIPTGの存在下でより高いトレオニン力価を示し、これを単離した。
続いて、P1ファージ溶解物をtac3株で調製し、次いで6-8株を感染させるために使用した(以下に記載される)。カナマイシン耐性形質導入体を選択し、そしてそれらの1つである6-8tac3株(これは、振盪フラスコ研究でtac3よりもさらに高い力価を生じた)を単離した。
D.E. coli G909株および6-8からのNTG変異誘発ならびにボレリジン耐性変異体の単離
G909株の細胞を、従来の方法を使用してN-メチル-N’-ニトロ-N-ニトロソグアニジン(NTG)処理(50mg/L、30分、36℃)によって変異誘発した。次いで、得られる細胞を、0.25g/LのL-イソロイシンおよび0.1%v/vのボレリジンを含む最少培地E寒天プレート上に播種した。36℃にて3〜5日間のインキュベーション後、6-8株を含む、プレート上に形成した大きなコロニーを、ボレリジン耐性およびL-トレオニン産生の試験のために選択した。
ボレリジン耐性について試験するために、各株を、20mlの種培地SM[32.5g/Lグルコース;1g/L MgSO4・7H2O;24.36g/L K2HPO4;9.52g/L KH2PO4;5g/L(NH4)2SO4;15g/L酵母エキス;pH7.2]中で36℃にて17時間振盪しながら培養した。細胞を回収し、そして最少培地Eで洗浄した。次いで、細胞懸濁液を、3mlの最少培地Eおよび0、0.1、0.5、または1mMボレリジンを含む滅菌管に接種した。振盪しながら36℃にて24時間の培養後、増殖を660nmでの吸光度を測定することによって決定した。結果を、ボレリジンの非存在下での増殖と比較して以下に示す。
E.イソロイシン要求性およびラクトースリプレッサー遺伝子(lacI)の除去
非天然tacプロモーターおよびフィードバック耐性thrA遺伝子を導入することによって、thrオペロン(thrA、thrB、thrC)の発現は、もはやアテニュエーション機構によって制御されない。結果として、イソロイシンの枯渇および/またはilvA-栄養要求性マーカーの存在は、もはやトレオニン産生を必要としない。
従って、野生型ilvAマーカーを、株のイソロイシン要求性を固定するために、すなわち、細胞増殖のためのイソロイシン補充培地の必要性を排除するために、6-8tac3への形質導入によって導入した。CGSC7334(関連遺伝子型:lacI42::Tn10, lacZU118;E. coli Genetic Stock Center, 355 Osborne Memorial Laboratory, Department of Biology, Yale University, New Haven, Connecticut 06520-8104, USAから得られた)から作成されたP1ファージ溶解物を使用して6-8tac3を感染させ、そしてイソロイシン生合成にポジティブな形質導入体を選択した。これらの形質導入体は、振盪フラスコ研究で、6-8tac3株とほぼ同じ量のL-トレオニンを産生した。これらの形質導入体の1つである6-8tac3ile+を、さらなる開発のために選択した。
6-8tac3ileのトレオニンオペロンがtacプロモーターの制御下にあるので、イソプロピル-β-D-チオガラクトシド(IPTG)は、thrオペロンを完全に発現するために細胞を誘導することが必要であった。しかし、thrオペロンの発現を誘導するためのIPTGの使用は、本発明の方法ではあまり好ましくない。
従って、この不必要な調節障害を排除するために、欠損lacリプレッサー(lacI)遺伝子を、CGSC7334から作成したP1ファージでの6-8tac3ile+の感染によって導入する。得られた形質導入体(6-8tac3lacI-)を、テトラサイクリンに対する耐性について試験し、そしてテトラサイクリン耐性コロニーを選択した。
実施例2:トレオニン産生の振盪フラスコ発酵研究
種々のE. coli株間のトレオニン産生の比較を、振盪フラスコ発酵におけるそれらの性能によって決定した。試験した株をLB寒天培地[10g/Lのトリプトン、5g/Lのエキス、15g/L寒天]上で増殖した。1〜2日の増殖後、細胞をpH7.2での5mlの種培地[デキストロース32.5g/L;K2HPO4 24.35g/L;KH2PO4 9.5g/L;酵母エキス15g/L;(NH4)2SO4 5g/L;MgSO4・7H2O 1g/L]に懸濁した。種を、37℃にて250rpmの撹拌速度で24時間増殖した。次いで、15mlの発酵培地[デキストロース 40g/L;酵母エキス2g/L;クエン酸2g/L;(NH4)2SO4 25g/L;MgSO4・7H2O 2.8g/L;CaCO3 20g/L;微量金属溶液2mL]をpH7.2で種に添加し、そして発酵プロセスを250rpmの撹拌速度で37℃にて行った。培養後、培養ブロス中に蓄積したL-トレオニンの量をHPLC(ISCO Model 2353ポンプ、Rainin Model RI-1屈折インデックス検出器、およびaminex Hp87-CAカラム)によって分析した。
試験した株のそれぞれによって産生されたL-トレオニンの量を以下に示す。
実施例3:発酵研究
本発明のE. coli株およびその前駆体株を、発酵によるL-トレオニン産生について試験した。
G909を、以下の条件下で試験した。2Lの遮断振盪フラスコ中の30g/Lのトリプシン処理ダイズブロスおよび5g/Lの酵母エキスを含む0.5Lの水性培養培地を1.5mLのG909で接種し、そして35℃および200rpmにて8.5時間振盪器でインキュベートした。0.9mL(0.03%)の成熟接種物を、3.0Lの種発酵培地[10g/Ld.s.のコーン浸出液、0.4g/LのL-イソロイシン、2.5g/LのKH2PO4、2.0g/LのMgSO4・7H2O、0.5g/Lの(NH4)2SO4、0.192g/Lの無水クエン酸、0.03g/LのFeSO4・7H2O、0.021g/LのMnSO4・H2O、および80g/Lのデキストロース]を含むガラス発酵槽に添加した。インキュベーションを、以下の条件下で行った:最初の18時間は39℃、次いで継続中は37℃の温度;6.9のpH(NH4OHの添加によって維持した);3.5LPMの空気流;最初に500rpmの撹拌、次いでこれを20%でDOを維持するように増加した;ならびに1〜2psiの逆圧。種発酵段階の完了を、デキストロースの枯渇によって決定した。種発酵槽からの315mL(15%)の成熟接種物を、以下を除く上述と同じ培地(主発酵培地)を含むガラス発酵槽に添加した:容量は2.1Lでありそして0.34g/LのL-イソロイシンを添加した。インキュベーションを、以下の条件下で48時間行った:37℃の温度;6.9のpH(NH4OHで維持した);20時間まで3.5LPMの空気流、次いで4.0LPMまで増加した;最初に500rpmの撹拌、次いでこれを20%でDOを維持するように増加した;1〜2psiの逆圧;ならびに10g/Lのデキストロースレベル(50%w/wデキストロース溶液を供給することによって維持した)。発酵を48時間後に終了した。G909は以下の結果を生じた:274gの総生産性および23.2%の収率での62.3g/Lのトレオニンの最終力価。
tac3を、以下を除く上記のG909と同じ条件下で試験した:1mg/LのIPTGを主発酵段階の開始で添加した。IPTGの添加で、tac3は、355gの総生産性および28.8%の収率での85.7g/Lのトレオニンの最終力価を生じた。
6-8を、上記のG909と同じ条件下で試験した。6-8は以下の結果を生じた:290gの総生産性および28.3%の収率での74.1g/Lのトレオニンの最終力価。
6-8tac3を、IPTGの添加を含む、上記のtac3と同じ条件下で試験した。6-8tac3は以下の結果を生じた:421gの総生産性および35.1%の収率での99.3g/Lのトレオニンの最終力価。
6-8tac3ile+を、以下を除く上記の6-8tac3と同じ条件下で試験した:種発酵段階または主発酵段階のいずれかでL-イソロイシンを必要としなかった。22.5時間では撹拌不足のため、22時間での力価のみを記録した(62g/Lトレオニン)。
kat-13を、以下を除く上記の6-8tac3と同じ条件下で試験した:IPTGを添加しなかった。これらの条件下で、kat-13は、445gの総生産性および33.1%の収率での102g/Lのトレオニンの最終力価を生じた。
構築された株の関連遺伝子型、トレオニンの発酵的産生に必要とされる補充物、および記録された力価を、以下の表に示す:
(Escherichia coli株kat-13)
(シンガポール)
出願人はここにおいて、微生物サンプルの供与が専門家に対してのみ利用可能にされる旨を請求する。この旨の請求は、出願の国際公表のための規則上の準備が完了する前に、出願人により国際事務局に対してなされなければならない。
(ノルウェー)
出願人はここにおいて、出願が(ノルウェー特許庁により)公開に付されるかあるいは公開を経ずにノルウェー特許庁による決定を受けるまでは、サンプルの供与は当該技術の専門家に対してのみ行われる旨を、請求する。この旨の請求は、ノルウェー特許法第22条および第33条(3)に基づき出願が公に利用可能にされる時点以前に、出願人によりノルウェー特許庁に対してなされるものとする。そのような請求が出願人によりなされた場合は、第三者によるサンプルの供与のいかなる請求においても、利用される専門家を表示するものとする。専門家は、ノルウェー特許庁により作成された公認専門家のリスト(list of recognized experts)に記載された任意の者か、あるいは、個々の場合において出願人により承認された任意の者であり得る。
(オーストラリア)
出願人はここにおいて、微生物のサンプルの供与は、特許の付与前において、あるいは出願の放棄(lapsing)、拒絶あるいは取り下げ前において、発明に対し利害関係を有さない当業者である対象者(skilled addressee)に対してのみ行われる旨を、告知するものである(オーストラリア国特許法第3.25(3)号規定)。
(フィンランド)
出願人はここにおいて、出願が(特許および統制委員会(National Board of Patents and Regulations)により)公開に付されるかあるいは公開を経ずに国立特許および法規委員会による決定を受けるまでは、サンプルの供与は当該技術の専門家に対してのみ行われる旨を、請求する。
(アイスランド)
出願人はここにおいて、出願が(アイスランド特許庁により)公開に付されるかあるいは公開を経ずにアイスランド特許庁による決定を受けるまでは、サンプルの供与は当該技術の専門家に対してのみ行われる旨を、請求する。
(デンマーク)
出願人はここにおいて、出願が(デンマーク特許庁により)公開に付されるかあるいは公開を経ずにデンマーク特許庁による決定を受けるまでは、サンプルの供与は当該技術の専門家に対してのみ行われる旨を、請求する。この旨の請求は、デンマーク特許法第22条および第33条(3)に基づき出願が公に利用可能にされる時点以前に、出願人によりデンマーク特許庁に対してなされるものとする。そのような請求が出願人によりなされた場合は、第三者によるサンプルの供与のいかなる請求においても、利用される専門家を表示するものとする。専門家は、デンマーク特許庁により作成された公認専門家のリスト(list of recognized experts)に記載された任意の者か、あるいは、個々の場合において出願人により承認された任意の者であり得る。
(スウェーデン)
出願人はここにおいて、出願が(スウェーデン特許庁により)公開に付されるかあるいは公開を経ずにスウェーデン特許庁による決定を受けるまでは、サンプルの供与は当該技術の専門家に対してのみ行われる旨を、請求する。この旨の請求は、優先日から16ヶ月が経過するよりも前に、出願人により国際事務局に対してなされるものとする(好ましくはPCT Applicant’s GuideのVolume Iのannex Zに記載された書式PCT/RO/134による)。そのような請求が出願人によりなされた場合は、第三者によるサンプルの供与のいかなる請求においても、利用される専門家を表示するものとする。専門家は、スウェーデン特許庁により作成された公認専門家のリスト(list of recognized experts)に記載された任意の者か、あるいは、個々の場合において出願人により承認された任意の者であり得る。
(英国)
出願人はここにおいて、微生物のサンプルの供与は専門家に対してのみ利用可能にされる旨を、請求する。この旨の請求は、出願の国際公表のための規則上の準備が完了する前に、出願人により国際事務局に対してなされなければならない。
(オランダ)
出願人はここにおいて、オランダ特許の発行日まで、あるいは出願が拒絶、取り下げあるいは放棄(lapsed)される日までは、特許法31F(1)の規定に基づき、微生物は専門家へのサンプル供与の形でのみ行われる旨を、請求する。この旨の請求は、オランダ王国特許法の第22C条または第25条に基づき出願が公に利用可能にされる日のうちいずれか早い方の日付よりも前に、出願人によりオランダ工業所有権局に対して提出されるものとする。
Claims (3)
- 以下の特徴:
(i)その染色体が、該染色体への挿入を介して、その天然プロモーターに代わる少なくとも1つの非天然プロモーターと作動可能に連結される少なくとも1つのトレオニン(thr)オペロンを含み;
(ii)トレオニンを産生するために、1つ以上のトレオニン生合成酵素をコードする1つ以上の遺伝子を含む任意の組換えプラスミドを必要とせず;そして
(iii)L−トレオニンを産生する、
を有する微生物E.coliの株であって、
該非天然プロモーターがtacプロモーターであり、
該E.coliがボレリジン耐性であり、
ここで、該トレオニンオペロンが、フィードバック耐性アスパラギン酸キナーゼI−ホモセリンデヒドロゲナーゼI遺伝子(thrA)、ホモセリンキナーゼ(thrB)遺伝子、トレオニンシンターゼ遺伝子(thrC)からなり、
該E.coliが、該染色体上に欠損トレオニンデヒドロゲナーゼ遺伝子を含む、
株。 - 前記E.coliが受託番号NRRL B−21593の株である、請求項1に記載の株。
- 前記E.coliが、約30時間で少なくとも約50g/LのL−トレオニンを産生し得る、請求項1に記載の株。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US2240796P | 1996-07-30 | 1996-07-30 | |
| US60/022,407 | 1996-07-30 | ||
| PCT/US1997/013359 WO1998004715A1 (en) | 1996-07-30 | 1997-07-30 | Novel strains of escherichia coli, methods of preparing the same and use thereof in fermentation processes for l-threonine production |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011262728A Division JP2012070752A (ja) | 1996-07-30 | 2011-11-30 | Escherichiacoliの新規株、その調製方法、およびL−トレオニン産生のための発酵プロセスにおけるその使用 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2000515763A JP2000515763A (ja) | 2000-11-28 |
| JP2000515763A5 JP2000515763A5 (ja) | 2005-04-07 |
| JP4919529B2 true JP4919529B2 (ja) | 2012-04-18 |
Family
ID=21809430
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP50911198A Expired - Lifetime JP4919529B2 (ja) | 1996-07-30 | 1997-07-30 | Escherichiacoilの新規株、その調製方法、およびL―トレオニン産生のための発酵プロセスにおけるその使用 |
| JP2011262728A Pending JP2012070752A (ja) | 1996-07-30 | 2011-11-30 | Escherichiacoliの新規株、その調製方法、およびL−トレオニン産生のための発酵プロセスにおけるその使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011262728A Pending JP2012070752A (ja) | 1996-07-30 | 2011-11-30 | Escherichiacoliの新規株、その調製方法、およびL−トレオニン産生のための発酵プロセスにおけるその使用 |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US5939307A (ja) |
| EP (1) | EP0917578B1 (ja) |
| JP (2) | JP4919529B2 (ja) |
| KR (1) | KR20000029691A (ja) |
| CN (1) | CN1261576C (ja) |
| AT (1) | ATE421587T1 (ja) |
| AU (1) | AU730102B2 (ja) |
| BR (1) | BR9710503A (ja) |
| CA (1) | CA2262813C (ja) |
| DE (1) | DE69739234D1 (ja) |
| HU (1) | HUP9903856A2 (ja) |
| ID (1) | ID19402A (ja) |
| IL (3) | IL128293A (ja) |
| NO (1) | NO320044B1 (ja) |
| NZ (1) | NZ334032A (ja) |
| PL (1) | PL191395B1 (ja) |
| RU (1) | RU2212448C2 (ja) |
| TR (1) | TR199900213T2 (ja) |
| WO (1) | WO1998004715A1 (ja) |
| ZA (1) | ZA976803B (ja) |
Families Citing this family (114)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI9813021B1 (pt) * | 1997-10-04 | 2016-04-05 | Degussa | processo para a preparação microbiana de aminoácidos de l-lisina, l-treonina, l-homosserina e glutamato, vetor, e célula transformada |
| MXPA01010151A (es) * | 1999-04-09 | 2002-06-21 | Ajinomoto Kk | Bacterianas que producen l-aminoacido y procedimiento para producir l-aminoacido. |
| US6984512B1 (en) * | 1999-08-02 | 2006-01-10 | Archer-Daniels-Midland Company | Bacterial strains, methods of preparing the same and use thereof in fermentation processes for L-lysine production |
| CN100443592C (zh) * | 2000-05-27 | 2008-12-17 | 德古萨股份公司 | 发酵制备l-苏氨酸的方法 |
| WO2002006459A1 (en) * | 2000-07-18 | 2002-01-24 | Degussa Ag | Process for the fermentative preparation of l-threonine |
| US6562601B2 (en) * | 2000-08-31 | 2003-05-13 | Degussa Ag | Fermentation process for the preparation of L-threonine |
| US20030190712A1 (en) * | 2000-08-31 | 2003-10-09 | Degussa Ag | Fermentation process for the preparation of L-threonine |
| EP1313838A2 (en) * | 2000-08-31 | 2003-05-28 | Degussa AG | Fermentation process for the preparation of l-threonine |
| US7220571B2 (en) * | 2000-09-28 | 2007-05-22 | Archer-Daniels-Midland Company | Escherichia coli strains which over-produce L-threonine and processes for the production of L-threonine by fermentation |
| KR100427480B1 (ko) * | 2001-01-16 | 2004-04-27 | 씨제이 주식회사 | L-쓰레오닌의 제조방법 |
| KR100397423B1 (ko) * | 2001-02-13 | 2003-09-13 | 씨제이 주식회사 | L-쓰레오닌의 제조방법 |
| US7368266B2 (en) * | 2001-02-13 | 2008-05-06 | Cj Corporation | Method for L-threonine production |
| JP2005510999A (ja) | 2001-04-04 | 2005-04-28 | ジェネンコー・インターナショナル・インク | 宿主細胞における生成物の生産方法 |
| US7241587B2 (en) | 2001-04-04 | 2007-07-10 | Genencor International, Inc. | Method of uncoupling the catabolic pathway of glycolysis from the oxidative membrane bound pathway of glucose conversion |
| KR100426807B1 (ko) * | 2001-06-19 | 2004-04-13 | 씨제이 주식회사 | 엘-쓰레오닌 생산 미생물 및 이를 이용한 엘-쓰레오닌 제조방법 |
| KR100426808B1 (ko) * | 2001-06-19 | 2004-04-13 | 씨제이 주식회사 | 엘-쓰레오닌 생산 미생물 및 이를 이용한 엘-쓰레오닌 제조방법 |
| DE10132945A1 (de) * | 2001-07-06 | 2003-01-16 | Degussa | Verfahren zur fermentativen Herstellung von L-Aminosäuren unter Verwendung von Stämmen der Familie Enterobacteriaceae |
| US20040241813A1 (en) * | 2001-07-06 | 2004-12-02 | Mechthild Rieping | Procsess for the preration of l-amino acids using strains of the enterobacteriaceae family |
| EP1686184B1 (en) * | 2001-07-11 | 2008-08-27 | Evonik Degussa GmbH | Process for the preparation of L-threonine using strains of the enterobacteriaceae family |
| ES2269712T3 (es) * | 2001-07-11 | 2007-04-01 | Degussa Gmbh | Proceso para la preparacion de l-aminoacidos que utiliza cepas de la familia enterobacteriaceas. |
| WO2003008613A2 (en) * | 2001-07-18 | 2003-01-30 | Degussa Ag | Process for the preparation of l-amino acids using strains of the enterobacteriaceae family which contain an enhanced soda gene |
| KR100547882B1 (ko) | 2002-02-26 | 2006-02-01 | 삼성전자주식회사 | 안테나 선택 다이버시티를 지원하는 이동통신시스템에서순방향 채널 상태 정보를 송수신하는 방법 및 장치 |
| RU2244007C2 (ru) * | 2002-02-27 | 2005-01-10 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" | Способ получения l-треонина, штамм escherichia coli - продуцент треонина (варианты) |
| DE10210960A1 (de) | 2002-03-13 | 2003-09-25 | Degussa | Verfahren zur fermentativen Hestellung von L-Aminosäuren unter Verwendung von Stämmen der Familie Enterobacteriaceae |
| KR100451299B1 (ko) * | 2002-03-21 | 2004-10-06 | 씨제이 주식회사 | L―쓰레오닌의 제조방법 |
| US7378267B1 (en) | 2002-05-16 | 2008-05-27 | Cheil Jedang Corporation | Method for L-threonine production |
| WO2004033471A2 (en) | 2002-10-04 | 2004-04-22 | Genencor International, Inc. | Glucose transport mutants for production of biomaterial |
| KR100478468B1 (ko) * | 2003-09-06 | 2005-03-23 | 씨제이 주식회사 | L―쓰레오닌의 제조방법 |
| JP4380305B2 (ja) * | 2003-11-21 | 2009-12-09 | 味の素株式会社 | 発酵法によるl−アミノ酸の製造法 |
| RU2275424C2 (ru) * | 2003-12-05 | 2006-04-27 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО АГРИ) | Способ получения l-треонина с использованием бактерий, принадлежащих к роду escherichia |
| PL1664318T3 (pl) * | 2004-01-30 | 2010-03-31 | Ajinomoto Kk | Mikroorganizm wytwarzający L-aminokwas i sposób wytwarzania L-aminokwasu |
| US20050181488A1 (en) * | 2004-02-12 | 2005-08-18 | Akhverdian Valery Z. | Method for producing L-threonine using bacteria belonging to the genus Escherichia |
| RU2288264C2 (ru) * | 2004-02-12 | 2006-11-27 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО АГРИ) | Бактерия, принадлежащая к роду escherichia - продуцент l-треонина и способ получения l-треонина |
| US7915018B2 (en) * | 2004-10-22 | 2011-03-29 | Ajinomoto Co., Inc. | Method for producing L-amino acids using bacteria of the Enterobacteriaceae family |
| US20070212764A1 (en) * | 2005-01-19 | 2007-09-13 | Ptitsyn Leonid R | Method for producing l-amino acids using bacterium of the enterobacteriaceae family |
| US7723097B2 (en) * | 2005-03-11 | 2010-05-25 | Archer-Daniels-Midland Company | Escherichia coli strains that over-produce L-threonine and processes for their production |
| DE102005018835A1 (de) | 2005-04-22 | 2006-11-02 | Degussa Ag | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung verbesserter Stämme der Familie Enterobacteriaceae |
| US8187842B2 (en) * | 2005-06-20 | 2012-05-29 | Archer Daniels Midland Company | Altered glyoxylate shunt for improved production of aspartate-derived amino acids and chemicals |
| JP2009095237A (ja) * | 2006-02-02 | 2009-05-07 | Ajinomoto Co Inc | L−アミノ酸の製造法 |
| JP2009118740A (ja) * | 2006-03-03 | 2009-06-04 | Ajinomoto Co Inc | L−アミノ酸の製造法 |
| WO2007119574A2 (en) | 2006-03-23 | 2007-10-25 | Ajinomoto Co., Inc. | A method for producing an l-amino acid using bacterium of the enterobacteriaceae family with attenuated expression of a gene coding for small rna |
| JP2009165355A (ja) | 2006-04-28 | 2009-07-30 | Ajinomoto Co Inc | L−アミノ酸を生産する微生物及びl−アミノ酸の製造法 |
| WO2007136133A1 (en) | 2006-05-23 | 2007-11-29 | Ajinomoto Co., Inc. | A method for producing an l-amino acid using a bacterium of the enterobacteriaceae family |
| RU2006143864A (ru) | 2006-12-12 | 2008-06-20 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО АГРИ) (RU) | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE, В КОТОРОЙ ОСЛАБЛЕНА ЭКСПРЕССИЯ ГЕНОВ cynT, cynS, cynX, ИЛИ cynR, ИЛИ ИХ КОМБИНАЦИИ |
| JP2010041920A (ja) | 2006-12-19 | 2010-02-25 | Ajinomoto Co Inc | L−アミノ酸の製造法 |
| CN101627110B (zh) | 2007-01-22 | 2014-08-13 | 味之素株式会社 | 生产l-氨基酸的微生物和l-氨基酸的生产方法 |
| JP2010110216A (ja) | 2007-02-20 | 2010-05-20 | Ajinomoto Co Inc | L−アミノ酸または核酸の製造方法 |
| JP2010110217A (ja) | 2007-02-22 | 2010-05-20 | Ajinomoto Co Inc | L−アミノ酸生産菌及びl−アミノ酸の製造法 |
| DE102007051024A1 (de) | 2007-03-05 | 2008-09-11 | Evonik Degussa Gmbh | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von Stämmen der Familie Enterobacteriaceae |
| KR100858913B1 (ko) | 2007-03-09 | 2008-09-17 | 한국과학기술원 | 부위특이적 변이에 의해 제조된 고수율의 l-쓰레오닌생산균주 및 이를 이용한 l-쓰레오닌의 제조방법 |
| EP1975241A1 (de) | 2007-03-29 | 2008-10-01 | Evonik Degussa GmbH | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| EP2149608A4 (en) | 2007-04-16 | 2013-02-20 | Ajinomoto Kk | PROCESS FOR PRODUCING AN ORGANIC ACID |
| CN101939412B (zh) | 2007-09-04 | 2016-01-20 | 味之素株式会社 | 生产氨基酸的微生物以及氨基酸的生产方法 |
| DE102007044134A1 (de) | 2007-09-15 | 2009-03-19 | Evonik Degussa Gmbh | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| DE102007052270A1 (de) | 2007-11-02 | 2009-05-07 | Evonik Degussa Gmbh | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| EP2060636A1 (de) | 2007-11-14 | 2009-05-20 | Evonik Degussa GmbH | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| WO2009072562A1 (ja) | 2007-12-06 | 2009-06-11 | Ajinomoto Co., Inc. | 有機酸の製造方法 |
| KR20090075549A (ko) * | 2008-01-04 | 2009-07-08 | 씨제이제일제당 (주) | 향상된 l-쓰레오닌 생산능을 갖는 대장균 및 이를 이용한l-쓰레오닌의 생산 방법 |
| KR100966324B1 (ko) * | 2008-01-08 | 2010-06-28 | 씨제이제일제당 (주) | 향상된 l-쓰레오닌 생산능을 갖는 대장균 및 이를 이용한l-쓰레오닌의 생산 방법 |
| JP2011067095A (ja) | 2008-01-10 | 2011-04-07 | Ajinomoto Co Inc | 発酵法による目的物質の製造法 |
| EP2248906A4 (en) | 2008-01-23 | 2012-07-11 | Ajinomoto Kk | PROCESS FOR THE PREPARATION OF L-AMINO ACID |
| RU2008105793A (ru) | 2008-02-19 | 2009-08-27 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО АГРИ) (RU) | Способ конструирования оперонов, содержащих трансляционно сопряженные гены, бактерия, содержащая такой оперон, способ продукции полезного метаболита и способ мониторинга экспрессии гена |
| EP2098597A1 (de) | 2008-03-04 | 2009-09-09 | Evonik Degussa GmbH | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| DE102008002309A1 (de) | 2008-06-09 | 2009-12-10 | Evonik Degussa Gmbh | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| DE102008040352A1 (de) | 2008-07-11 | 2010-01-14 | Evonik Degussa Gmbh | Verfahren zur Herstellung von L-Tryptophan unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| DE102008044768A1 (de) | 2008-08-28 | 2010-03-04 | Evonik Degussa Gmbh | Verfahren zur Herstellung von organisch-chemischen Verbindungen unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| EP2343371B1 (en) | 2008-09-05 | 2015-10-21 | Ajinomoto Co., Inc. | Method for producing l-amino acid |
| EP2336347B1 (en) | 2008-09-08 | 2017-03-15 | Ajinomoto Co., Inc. | An l-amino acid-producing microorganism and a method for producing an l-amino acid |
| JP2012029565A (ja) | 2008-11-27 | 2012-02-16 | Ajinomoto Co Inc | L−アミノ酸の製造法 |
| BRPI1007069A2 (pt) | 2009-01-23 | 2015-08-25 | Ajinomoto Kk | Método para produzir um l-aminoácido. |
| EP2267145A1 (de) | 2009-06-24 | 2010-12-29 | Evonik Degussa GmbH | Verfahren zur Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| JPWO2011013707A1 (ja) | 2009-07-29 | 2013-01-10 | 味の素株式会社 | L−アミノ酸の製造法 |
| JP2012196144A (ja) | 2009-08-03 | 2012-10-18 | Ajinomoto Co Inc | ビブリオ属細菌を用いたl−リジンの製造法 |
| JP2012223092A (ja) | 2009-08-28 | 2012-11-15 | Ajinomoto Co Inc | L−アミノ酸の製造法 |
| JP2013013329A (ja) | 2009-11-06 | 2013-01-24 | Ajinomoto Co Inc | L−アミノ酸の製造法 |
| RU2460793C2 (ru) | 2010-01-15 | 2012-09-10 | Закрытое акционерное общество "Научно-исследовательский институт "Аджиномото-Генетика" (ЗАО АГРИ) | Способ получения l-аминокислот с использованием бактерий семейства enterobacteriaceae |
| JP2013074795A (ja) | 2010-02-08 | 2013-04-25 | Ajinomoto Co Inc | 変異型rpsA遺伝子及びL−アミノ酸の製造法 |
| RU2471868C2 (ru) | 2010-02-18 | 2013-01-10 | Закрытое акционерное общество "Научно-исследовательский институт "Аджиномото-Генетика" (ЗАО АГРИ) | Мутантная аденилатциклаза, днк, кодирующая ее, бактерия семейства enterobacteriaceae, содержащая указанную днк, и способ получения l-аминокислот |
| RU2482188C2 (ru) | 2010-07-21 | 2013-05-20 | Закрытое акционерное общество "Научно-исследовательский институт "Аджиномото-Генетика" (ЗАО АГРИ) | СПОСОБ ПОЛУЧЕНИЯ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ РОДА Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН astCADBE |
| RU2501858C2 (ru) | 2010-07-21 | 2013-12-20 | Закрытое акционерное общество "Научно-исследовательский институт "Аджиномото-Генетика" (ЗАО АГРИ) | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae |
| JP2014036576A (ja) | 2010-12-10 | 2014-02-27 | Ajinomoto Co Inc | L−アミノ酸の製造法 |
| EP2479279A1 (de) | 2011-01-20 | 2012-07-25 | Evonik Degussa GmbH | Verfahren zur fermentativen Herstellung schwefelhaltiger Aminosäuren |
| CN102181502B (zh) * | 2011-05-17 | 2014-03-19 | 内蒙古阜丰生物科技有限公司 | 一种提高发酵生产l-苏氨酸产率的方法 |
| JPWO2012157699A1 (ja) | 2011-05-18 | 2014-07-31 | 味の素株式会社 | 動物用免疫賦活剤、それを含む飼料及びその製造方法 |
| RU2011134436A (ru) | 2011-08-18 | 2013-10-27 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО "АГРИ") | Способ получения l-аминокислоты с использованием бактерии семейства enterobacteriaceae, обладающей повышенной экспрессией генов каскада образования флагелл и клеточной подвижности |
| EP2628792A1 (de) | 2012-02-17 | 2013-08-21 | Evonik Industries AG | Zelle mit verringerter ppGppase-Aktivität |
| JP2015515866A (ja) * | 2012-05-11 | 2015-06-04 | リージェンツ オブ ザ ユニバーシティ オブ ミネソタ | 生合成経路、組換え細胞及び方法 |
| EP2700715B1 (de) | 2012-08-20 | 2018-07-25 | Evonik Degussa GmbH | Verfahren zur fermentativen Herstellung von L-Aminosäuren unter Verwendung von verbesserten Stämmen der Familie Enterobacteriaceae |
| EP2762571A1 (de) | 2013-01-30 | 2014-08-06 | Evonik Industries AG | Mikroorganismus und Verfahren zur fermentativen Herstellung von Aminosäuren |
| RU2013118637A (ru) | 2013-04-23 | 2014-10-27 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО "АГРИ") | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE, В КОТОРОЙ РАЗРЕГУЛИРОВАН ГЕН yjjK |
| PE20150681A1 (es) | 2013-05-13 | 2015-05-15 | Ajinomoto Kk | Metodo para producir l-aminoacidos |
| RU2013140115A (ru) | 2013-08-30 | 2015-03-10 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО "АГРИ") | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae, В КОТОРОЙ НАРУШЕНА ЭКСПРЕССИЯ КЛАСТЕРА ГЕНОВ znuACB |
| JP2016192903A (ja) | 2013-09-17 | 2016-11-17 | 味の素株式会社 | 海藻由来バイオマスからのl−アミノ酸の製造方法 |
| JP5958653B2 (ja) | 2013-10-02 | 2016-08-02 | 味の素株式会社 | アンモニア制御装置およびアンモニア制御方法 |
| RU2013144250A (ru) | 2013-10-02 | 2015-04-10 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" (ЗАО "АГРИ") | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae, В КОТОРОЙ ОСЛАБЛЕНА ЭКСПРЕССИЯ ГЕНА, КОДИРУЮЩЕГО ФОСФАТНЫЙ ТРАНСПОРТЕР |
| JP6459962B2 (ja) | 2013-10-21 | 2019-01-30 | 味の素株式会社 | L−アミノ酸の製造法 |
| JP6519476B2 (ja) | 2013-10-23 | 2019-05-29 | 味の素株式会社 | 目的物質の製造法 |
| RU2014105547A (ru) | 2014-02-14 | 2015-08-20 | Адзиномото Ко., Инк. | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE, ИМЕЮЩЕЙ СВЕРХЭКСПРЕССИРУЕМЫЙ ГЕН yajL |
| RU2015120052A (ru) | 2015-05-28 | 2016-12-20 | Аджиномото Ко., Инк. | Способ получения L-аминокислоты с использованием бактерии семейства Enterobacteriaceae, в которой ослаблена экспрессия гена gshA |
| BR112018017227A2 (pt) | 2016-02-25 | 2019-02-05 | Ajinomoto Kk | método para produzir um l-aminoácido |
| WO2017151059A1 (en) * | 2016-02-29 | 2017-09-08 | Agency For Science, Technology And Research | Multiplexable activation of silent biosynthetic clusters in native actinomycete hosts for natural product discovery |
| JP7066977B2 (ja) | 2017-04-03 | 2022-05-16 | 味の素株式会社 | L-アミノ酸の製造法 |
| US11053526B2 (en) | 2018-08-09 | 2021-07-06 | Evonik Operations Gmbh | Process for preparing L amino acids using improved strains of the enterobacteriaceae family |
| EP3608409A1 (en) | 2018-08-09 | 2020-02-12 | Evonik Operations GmbH | Process for preparing l amino acids using improved strains of the enterobacteriaceae family |
| RU2697219C1 (ru) * | 2018-09-28 | 2019-08-13 | Федеральное государственное бюджетное учреждение "Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра "Курчатовский институт" (НИЦ "Курчатовский институт" - ГосНИИгенетика) | Рекомбинантный штамм бактерии Escherichia coli - продуцент L-треонина |
| WO2020071538A1 (en) | 2018-10-05 | 2020-04-09 | Ajinomoto Co., Inc. | Method for producing target substance by bacterial fermentation |
| CN109554322B (zh) * | 2018-12-03 | 2020-08-04 | 江南大学 | 一种高产l-苏氨酸的重组大肠杆菌及其构建方法 |
| BR112021014194A2 (pt) | 2019-02-22 | 2021-12-28 | Ajinomoto Kk | Método para a produção de um l-aminoácido |
| BR112021017870A2 (pt) | 2019-04-05 | 2021-12-07 | Ajinomoto Kk | Método para produzir um l-aminoácido |
| EP4034668B1 (en) | 2019-09-25 | 2024-04-17 | Ajinomoto Co., Inc. | Method for producing 2-methyl-butyric acid by bacterial fermentation |
| JP2022550084A (ja) | 2019-09-25 | 2022-11-30 | 味の素株式会社 | 細菌の発酵によるl-アミノ酸の製造方法 |
| RU2748676C1 (ru) * | 2020-10-05 | 2021-05-28 | Федеральное государственное бюджетное учреждение "Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра "Курчатовский институт" (НИЦ "Курчатовский институт" - ГосНИИгенетика) | Штамм Escherichia coli с инактивированным геном ydgI - продуцент L-треонина |
| KR20230170961A (ko) | 2021-04-16 | 2023-12-19 | 인바이오스 엔.브이. | 시알릴화 이당 및/또는 올리고당의 세포 생산 |
| EP4323507A2 (en) | 2021-04-16 | 2024-02-21 | Inbiose N.V. | Fermentative production |
Family Cites Families (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1097908A (en) * | 1964-07-01 | 1968-01-03 | Chugai Pharmaceutical Co Ltd | A fermentation process for the production of l-threonine |
| GB1122508A (en) * | 1965-07-16 | 1968-08-07 | Kyowa Hakko Kogyo Kk | Process for producing l-threonine |
| GB1176125A (en) * | 1967-01-21 | 1970-01-01 | Kyowa Hakko Kogyo Kk | Process for Producing L-Threonine. |
| US3582471A (en) * | 1967-07-03 | 1971-06-01 | Ajinomoto Kk | Method of producing threonine by fermentation |
| FR1580549A (ja) * | 1967-07-28 | 1969-09-05 | ||
| GB1185130A (en) * | 1967-09-12 | 1970-03-18 | Kyowa Hakko Kogyo Kk | Process for producing L-Threonine |
| US3684654A (en) * | 1968-06-17 | 1972-08-15 | Kyowa Hakko Kogyo Kk | Process for producing l-threonine |
| JPS4825515B1 (ja) * | 1968-08-17 | 1973-07-30 | ||
| GB1342308A (en) * | 1970-01-22 | 1974-01-03 | Kyowa Hakko Kogyo Kk | Production of threonine and lysine by fermentation |
| JPS53101591A (en) * | 1977-02-15 | 1978-09-05 | Ajinomoto Co Inc | Preparation of l-threonine by fermentation |
| SU943282A1 (ru) * | 1979-07-13 | 1982-07-15 | Всесоюзный научно-исследовательский институт генетики и селекции промышленных микроорганизмов | Способ получени L-треонина |
| JPS55131397A (en) * | 1979-04-02 | 1980-10-13 | Ajinomoto Co Inc | Preparation of l-threonine by fermentation |
| JPS55156591A (en) * | 1979-05-23 | 1980-12-05 | Ajinomoto Co Inc | Method for stabilizing property of bacteria containing plasmid |
| JPS56134993A (en) * | 1980-03-21 | 1981-10-22 | Tanabe Seiyaku Co Ltd | Preparation of l-threonine by fermentation method |
| JPS57186496A (en) * | 1981-05-11 | 1982-11-16 | Ajinomoto Co Inc | Preparation of l-threonine by fermentation |
| US5236831A (en) * | 1981-12-29 | 1993-08-17 | Kiowa Hakko Kogyo Co., Ltd. | Amino acid synthesis in corynebacteria using E. coli genes |
| US4601983A (en) * | 1983-06-15 | 1986-07-22 | Ajinomoto Co., Inc. | Coryneform bacteria carrying recombinant plasmids and their use in the fermentative production of L-threonine and L-isoleucine |
| JPH0783714B2 (ja) * | 1983-08-29 | 1995-09-13 | 味の素株式会社 | 発酵法によるl―アミノ酸の製造法 |
| JPS6062982A (ja) * | 1983-09-14 | 1985-04-11 | Ajinomoto Co Inc | 組換えdνa,該組換えdνaを有する細菌及び該細菌を用いるl−スレオニン又はl−イソロイシンの製造法 |
| JPH0746994B2 (ja) * | 1984-10-04 | 1995-05-24 | 味の素株式会社 | 発酵法によるl−アミノ酸の製造法 |
| DE3682709D1 (de) * | 1985-05-13 | 1992-01-16 | Toray Industries | Verfahren zur herstellung von l-threonin durch fermentation. |
| US5264353A (en) * | 1985-08-23 | 1993-11-23 | Toray Industries, Inc. | Process for producing L-threonine by fermentation |
| US5342766A (en) * | 1985-08-26 | 1994-08-30 | Toray Industries, Inc. | Process for producing L-threonine by fermentation with P. rettgeri. |
| DE3689437T2 (de) * | 1985-10-18 | 1994-04-14 | Toray Industries | Plasmid mit breitem Wirtspektrum. |
| US5017483A (en) * | 1986-02-20 | 1991-05-21 | Kyowa Hakko Kogyo Co., Ltd. | Process for producing L-threonine |
| JP2516625B2 (ja) * | 1986-06-02 | 1996-07-24 | 三菱化学株式会社 | L−スレオニンの製造法 |
| US5188949A (en) * | 1986-09-29 | 1993-02-23 | Ajinomoto Co., Inc. | Method for producing L-threonine by fermentation |
| US5164307A (en) * | 1987-01-23 | 1992-11-17 | Ajinomoto Co., Inc. | Process for producing L-amino acids by fermentation |
| JPS6437295A (en) * | 1987-07-31 | 1989-02-07 | Kyowa Hakko Kogyo Kk | Production of l-threonine by fermentation |
| EP0312089B1 (en) * | 1987-10-15 | 1994-03-02 | Mitsubishi Petrochemical Co., Ltd. | Method for producing L-threonine |
| JP2600750B2 (ja) * | 1988-01-21 | 1997-04-16 | 味の素株式会社 | 発酵法によるl―スレオニンの製造法 |
| US5705371A (en) * | 1990-06-12 | 1998-01-06 | Ajinomoto Co., Inc. | Bacterial strain of escherichia coli BKIIM B-3996 as the producer of L-threonine |
| WO1990004636A1 (en) * | 1988-10-25 | 1990-05-03 | Vsesojuzny Nauchno-Issledovatelsky Institut Genetiki I Selektsii Promyshlennykh Mikroorganizmov (Vniigenetika) | Strain of bacteria escherichia coli, producer of l-threonine |
| JP2578492B2 (ja) * | 1988-11-10 | 1997-02-05 | 協和醗酵工業株式会社 | 発酵法によるl−スレオニンの製造法 |
| JP3046332B2 (ja) * | 1990-08-02 | 2000-05-29 | 協和醗酵工業株式会社 | 発酵法によるアミノ酸の製造法 |
| JP3006926B2 (ja) * | 1991-09-04 | 2000-02-07 | 協和醗酵工業株式会社 | 発酵法によるl−スレオニンの製造法 |
| JP3151073B2 (ja) * | 1992-02-25 | 2001-04-03 | 協和醗酵工業株式会社 | 発酵法によるアミノ酸の製造法 |
| TW258753B (en) * | 1992-06-30 | 1995-10-01 | Dev Center Biotechnology | Direct fermentation of L-tryptophan by a recombinant microbe |
| DE69219775T3 (de) * | 1992-10-14 | 2004-08-05 | Ajinomoto Co., Inc. | Neuartiges L-threoninproduzierendes Mikrobakterium und eine Herstellungsmethode für L-Threonin |
| US5998178A (en) * | 1994-05-30 | 1999-12-07 | Ajinomoto Co., Ltd. | L-isoleucine-producing bacterium and method for preparing L-isoleucine through fermentation |
-
1997
- 1997-07-29 US US08/902,336 patent/US5939307A/en not_active Expired - Lifetime
- 1997-07-30 IL IL128293A patent/IL128293A/en not_active IP Right Cessation
- 1997-07-30 WO PCT/US1997/013359 patent/WO1998004715A1/en not_active Application Discontinuation
- 1997-07-30 CA CA2262813A patent/CA2262813C/en not_active Expired - Lifetime
- 1997-07-30 KR KR1019997000770A patent/KR20000029691A/ko not_active Application Discontinuation
- 1997-07-30 RU RU99104488/13A patent/RU2212448C2/ru active
- 1997-07-30 AU AU38994/97A patent/AU730102B2/en not_active Expired
- 1997-07-30 JP JP50911198A patent/JP4919529B2/ja not_active Expired - Lifetime
- 1997-07-30 TR TR1999/00213T patent/TR199900213T2/xx unknown
- 1997-07-30 BR BR9710503-1A patent/BR9710503A/pt not_active Application Discontinuation
- 1997-07-30 AT AT97936291T patent/ATE421587T1/de not_active IP Right Cessation
- 1997-07-30 ID IDP972641A patent/ID19402A/id unknown
- 1997-07-30 EP EP97936291A patent/EP0917578B1/en not_active Expired - Lifetime
- 1997-07-30 NZ NZ334032A patent/NZ334032A/xx not_active IP Right Cessation
- 1997-07-30 DE DE69739234T patent/DE69739234D1/de not_active Expired - Lifetime
- 1997-07-30 ZA ZA9706803A patent/ZA976803B/xx unknown
- 1997-07-30 HU HU9903856A patent/HUP9903856A2/hu unknown
- 1997-07-30 CN CNB971968977A patent/CN1261576C/zh not_active Expired - Lifetime
- 1997-07-30 PL PL331351A patent/PL191395B1/pl unknown
-
1999
- 1999-01-26 NO NO19990362A patent/NO320044B1/no not_active IP Right Cessation
-
2005
- 2005-01-04 IL IL166145A patent/IL166145A/en not_active IP Right Cessation
- 2005-01-04 IL IL166146A patent/IL166146A/en not_active IP Right Cessation
-
2011
- 2011-11-30 JP JP2011262728A patent/JP2012070752A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CA2262813A1 (en) | 1998-02-05 |
| IL128293A0 (en) | 1999-11-30 |
| AU3899497A (en) | 1998-02-20 |
| US5939307A (en) | 1999-08-17 |
| ZA976803B (en) | 1998-02-19 |
| CN1261576C (zh) | 2006-06-28 |
| IL166146A (en) | 2006-12-31 |
| IL166146A0 (en) | 2006-01-15 |
| NZ334032A (en) | 2000-09-29 |
| IL128293A (en) | 2006-12-31 |
| PL331351A1 (en) | 1999-07-05 |
| KR20000029691A (ko) | 2000-05-25 |
| ID19402A (id) | 1998-07-09 |
| NO320044B1 (no) | 2005-10-17 |
| PL191395B1 (pl) | 2006-05-31 |
| RU2212448C2 (ru) | 2003-09-20 |
| EP0917578B1 (en) | 2009-01-21 |
| CN1226931A (zh) | 1999-08-25 |
| AU730102B2 (en) | 2001-02-22 |
| WO1998004715A1 (en) | 1998-02-05 |
| JP2000515763A (ja) | 2000-11-28 |
| JP2012070752A (ja) | 2012-04-12 |
| NO990362L (no) | 1999-01-26 |
| EP0917578A1 (en) | 1999-05-26 |
| IL166145A (en) | 2006-12-31 |
| TR199900213T2 (xx) | 1999-04-21 |
| HUP9903856A2 (hu) | 2000-03-28 |
| ATE421587T1 (de) | 2009-02-15 |
| CA2262813C (en) | 2011-09-13 |
| DE69739234D1 (de) | 2009-03-12 |
| NO990362D0 (no) | 1999-01-26 |
| IL166145A0 (en) | 2006-01-15 |
| BR9710503A (pt) | 2000-01-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4919529B2 (ja) | Escherichiacoilの新規株、その調製方法、およびL―トレオニン産生のための発酵プロセスにおけるその使用 | |
| US7767431B2 (en) | Escherichia coli strains which over-produce L-threonine and processes for the production of L-threonine by fermentation | |
| WO1998004715A9 (en) | Novel strains of escherichia coli, methods of preparing the same and use thereof in fermentation processes for l-threonine production | |
| JP4380305B2 (ja) | 発酵法によるl−アミノ酸の製造法 | |
| AU2001296415A1 (en) | Escherichia coli strains which over-produce L-threonine and processes for the production of L-threonine by fermentation | |
| US8455237B2 (en) | Escherichia coli strain with phosphoenolpyruvate carboxylase promoter replaced with cysteine synthase promoter and method of enhanced production of L-threonine using the same | |
| JP2002136286A (ja) | L−グルタミン酸、l−プロリン又はl−アルギニンの生産能を有する細菌及びl−グルタミン酸、l−プロリン又はl−アルギニンの製造法 | |
| EP1360312A1 (en) | Method for l-threonine production | |
| JP2005520548A (ja) | L−スレオニンの製造方法 | |
| US20040241831A1 (en) | tdcBC/pckA gene-inactivated microorganism and method of producing L-threonine using the same | |
| MXPA99000962A (en) | Novel strains of escherichia coli | |
| US7368266B2 (en) | Method for L-threonine production |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20040726 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20040726 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20061121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070220 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070605 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070831 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20071005 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20071003 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20080819 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081117 |
|
| A72 | Notification of change in name of applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A721 Effective date: 20081117 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20090129 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20090305 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110225 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110302 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110330 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110404 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20111026 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20111031 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111130 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120131 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150210 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150210 Year of fee payment: 3 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: R3D02 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150210 Year of fee payment: 3 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: R3D04 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |