JP4034366B2 - 薬理学的作用を有する1 − フエニル−3− ジメチルアミノ− プロパン化合物 - Google Patents
薬理学的作用を有する1 − フエニル−3− ジメチルアミノ− プロパン化合物 Download PDFInfo
- Publication number
- JP4034366B2 JP4034366B2 JP18603195A JP18603195A JP4034366B2 JP 4034366 B2 JP4034366 B2 JP 4034366B2 JP 18603195 A JP18603195 A JP 18603195A JP 18603195 A JP18603195 A JP 18603195A JP 4034366 B2 JP4034366 B2 JP 4034366B2
- Authority
- JP
- Japan
- Prior art keywords
- meta
- phenyl
- isolated
- alkyl
- para
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 0 CC[C@@]([C@](C)CN(C)C)c1cc(OC(*c2ccc(C(C)C)cc2)=O)ccc1 Chemical compound CC[C@@]([C@](C)CN(C)C)c1cc(OC(*c2ccc(C(C)C)cc2)=O)ccc1 0.000 description 3
- DSYYVFJOQLAICR-IUODEOHRSA-N CC[C@@]([C@H](C)CN(C)C)(c1cccc(SC)c1)O Chemical compound CC[C@@]([C@H](C)CN(C)C)(c1cccc(SC)c1)O DSYYVFJOQLAICR-IUODEOHRSA-N 0.000 description 1
- UMTBGMDYYBKESP-ZWNOBZJWSA-N C[C@H](CN(C)C)[C@](C)(c1cccc(O)c1)O Chemical compound C[C@H](CN(C)C)[C@](C)(c1cccc(O)c1)O UMTBGMDYYBKESP-ZWNOBZJWSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/78—Benzo [b] furans; Hydrogenated benzo [b] furans
- C07D307/79—Benzo [b] furans; Hydrogenated benzo [b] furans with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the hetero ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
- A61P29/02—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID] without antiinflammatory effect
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/02—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C215/22—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being unsaturated
- C07C215/28—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being unsaturated and containing six-membered aromatic rings
- C07C215/30—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being unsaturated and containing six-membered aromatic rings containing hydroxy groups and carbon atoms of six-membered aromatic rings bound to the same carbon atom of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/46—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C215/48—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains not further substituted by hydroxy groups
- C07C215/54—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains not further substituted by hydroxy groups linked by carbon chains having at least three carbon atoms between the amino groups and the six-membered aromatic ring or the condensed ring system containing that ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/46—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C215/56—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains further substituted by hydroxy groups
- C07C215/58—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains further substituted by hydroxy groups with hydroxy groups and the six-membered aromatic ring, or the condensed ring system containing that ring, bound to the same carbon atom of the carbon chain
- C07C215/62—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains further substituted by hydroxy groups with hydroxy groups and the six-membered aromatic ring, or the condensed ring system containing that ring, bound to the same carbon atom of the carbon chain the chain having at least three carbon atoms between the amino groups and the six-membered aromatic ring or the condensed ring system containing that ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C217/00—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton
- C07C217/54—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C217/56—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains not further substituted by singly-bound oxygen atoms
- C07C217/62—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains not further substituted by singly-bound oxygen atoms linked by carbon chains having at least three carbon atoms between the amino groups and the six-membered aromatic ring or the condensed ring system containing that ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C217/00—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton
- C07C217/54—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C217/64—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains further substituted by singly-bound oxygen atoms
- C07C217/66—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains further substituted by singly-bound oxygen atoms with singly-bound oxygen atoms and six-membered aromatic rings bound to the same carbon atom of the carbon chain
- C07C217/72—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups linked to the six-membered aromatic ring, or to the condensed ring system containing that ring, by carbon chains further substituted by singly-bound oxygen atoms with singly-bound oxygen atoms and six-membered aromatic rings bound to the same carbon atom of the carbon chain linked by carbon chains having at least three carbon atoms between the amino groups and the six-membered aromatic ring or the condensed ring system containing that ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C217/00—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton
- C07C217/54—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C217/74—Compounds containing amino and etherified hydroxy groups bound to the same carbon skeleton having etherified hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with rings other than six-membered aromatic rings being part of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C219/00—Compounds containing amino and esterified hydroxy groups bound to the same carbon skeleton
- C07C219/02—Compounds containing amino and esterified hydroxy groups bound to the same carbon skeleton having esterified hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton
- C07C219/20—Compounds containing amino and esterified hydroxy groups bound to the same carbon skeleton having esterified hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being unsaturated
- C07C219/22—Compounds containing amino and esterified hydroxy groups bound to the same carbon skeleton having esterified hydroxy groups and amino groups bound to acyclic carbon atoms of the same carbon skeleton the carbon skeleton being unsaturated and containing six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C225/00—Compounds containing amino groups and doubly—bound oxygen atoms bound to the same carbon skeleton, at least one of the doubly—bound oxygen atoms not being part of a —CHO group, e.g. amino ketones
- C07C225/02—Compounds containing amino groups and doubly—bound oxygen atoms bound to the same carbon skeleton, at least one of the doubly—bound oxygen atoms not being part of a —CHO group, e.g. amino ketones having amino groups bound to acyclic carbon atoms of the carbon skeleton
- C07C225/04—Compounds containing amino groups and doubly—bound oxygen atoms bound to the same carbon skeleton, at least one of the doubly—bound oxygen atoms not being part of a —CHO group, e.g. amino ketones having amino groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being saturated
- C07C225/08—Compounds containing amino groups and doubly—bound oxygen atoms bound to the same carbon skeleton, at least one of the doubly—bound oxygen atoms not being part of a —CHO group, e.g. amino ketones having amino groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being saturated and containing rings
- C07C225/10—Compounds containing amino groups and doubly—bound oxygen atoms bound to the same carbon skeleton, at least one of the doubly—bound oxygen atoms not being part of a —CHO group, e.g. amino ketones having amino groups bound to acyclic carbon atoms of the carbon skeleton the carbon skeleton being saturated and containing rings with doubly-bound oxygen atoms bound to carbon atoms not being part of rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C271/00—Derivatives of carbamic acids, i.e. compounds containing any of the groups, the nitrogen atom not being part of nitro or nitroso groups
- C07C271/06—Esters of carbamic acids
- C07C271/40—Esters of carbamic acids having oxygen atoms of carbamate groups bound to carbon atoms of six-membered aromatic rings
- C07C271/58—Esters of carbamic acids having oxygen atoms of carbamate groups bound to carbon atoms of six-membered aromatic rings with the nitrogen atom of at least one of the carbamate groups bound to a carbon atom of a six-membered aromatic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C323/00—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups
- C07C323/23—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton
- C07C323/31—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton
- C07C323/33—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton having at least one of the nitrogen atoms bound to a carbon atom of the same non-condensed six-membered aromatic ring
- C07C323/35—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton having at least one of the nitrogen atoms bound to a carbon atom of the same non-condensed six-membered aromatic ring the thio group being a sulfide group
- C07C323/36—Thiols, sulfides, hydropolysulfides or polysulfides substituted by halogen, oxygen or nitrogen atoms, or by sulfur atoms not being part of thio groups containing thio groups and nitrogen atoms, not being part of nitro or nitroso groups, bound to the same carbon skeleton having the sulfur atom of at least one of the thio groups bound to a carbon atom of a six-membered aromatic ring of the carbon skeleton having at least one of the nitrogen atoms bound to a carbon atom of the same non-condensed six-membered aromatic ring the thio group being a sulfide group the sulfur atom of the sulfide group being further bound to an acyclic carbon atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/14—The ring being saturated
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pain & Pain Management (AREA)
- Public Health (AREA)
- Rheumatology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Furan Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Adhesive Tapes (AREA)
- Steroid Compounds (AREA)
Description
【発明の属する技術分野】
本発明は、1- フエニル -3- ジメチルアミノ- プロパン化合物、その製造方法並びにこの物質を医薬有効物質として使用する方法に関する。
【0002】
【従来の技術】
慢性及び非慢性苦痛症状の処置は、医療に於て極めて重要である。これは多くの文献中に開示されている。ヨーロッパ特許第176049号明細書から、たとえば鎮痛- 麻酔作用を有する1- ナフチル -3- アミノ- プロパン -1- オールが知られている。γ- 位のアミノ基を有する第二及び第三アルコールは、 J. Pharm. Sci.59,1038(1970)und J. Prakt. Chem. 323,793(1981)中にパラ置換されたフエニル基を有するフエニル- ジメチルアミノ- プロパノールは、Chem. Abstr.54,20963c(1960)und Chem. Abstr.63,6912e(1965)中に記載されている。この化合物も鎮痛性質を有する。これに対してドイツ特許第3242922号明細書中に記載された、2個のフエニル基を有する3- ジメチルアミノ- プロパン -1- オールは、抗うつ的に作用する。J. Pharm. Sci.57,1487(1968)中に記載された1- フエニル- プロパン -1- オールは、γ- 位のアザ環に依存して種々の薬理学的作用を有する。
【0003】
オピオイドは、一連の副作用、たとえば習慣性及び依存性、呼吸抑圧、胃腸阻害作用及び便秘を引き起こすにもかかわらず、これは数年来苦痛治療のための鎮痛剤として使用される。したがってこれは特別の予防措置、たとえば特別な処方箋下にしか比較的長い期間にわたって又は比較的高い投薬量で投与することができない(グッドマン(Goodmam) 、ギルマン(Gilman)、“The Pharmacological Basis of Therapeutics", Pergaman Press, New York(1990).
トラマドールハイドロクロライド──(1RS,2RS)-2- 〔(ジメチルアミノ)メチル〕 -1-(3- メトキシフエニル)シクロヘキサノール、ハイドロクロライド──は、中枢性鎮痛剤の中で特殊な立場をとる。というのはこの有効物質がオピオイドに対する公知の副作用を有せずに著しい苦痛阻害を引き起こすからである。(J. Pharmacol. Exptl. Ther.267,331(1993))。トラマドールはラセミ体であり、(+)-及び(−)-対掌体の同一量からなる。生体内で有効物質は、代謝物、o- デスメチル- トラマドールを生じる。このトラマドールも同様に対掌体混合物として存在する。試験から、トラマドールの対掌体及びトラマドール代謝物の対掌体は鎮痛作用に関与することが明らかである (J. Pharmacol.Exp. Ther.260,275(1992))。
【0004】
【発明を解決しようとする課題】
本発明による課題は、鎮痛に有効な物質の開発にあり、この物質はオピオイドに典型的な副作用を生じない強い苦痛の治療に適することである。更に開発すべき物質は、トラマドールでの治療の間多くの場合生じる副作用、たとえば悪心及び嘔土を有しない。
【0005】
本発明者は、開発すべき物質にある多くの要求が特定の1- フエニル -3- ジメチルアミノ- プロパン化合物によって満足されることを見い出した。この物質は、トラマドールに比して明らかに強い際立った鎮痛作用の点で優れている。
【0006】
【課題を解決するための手段】
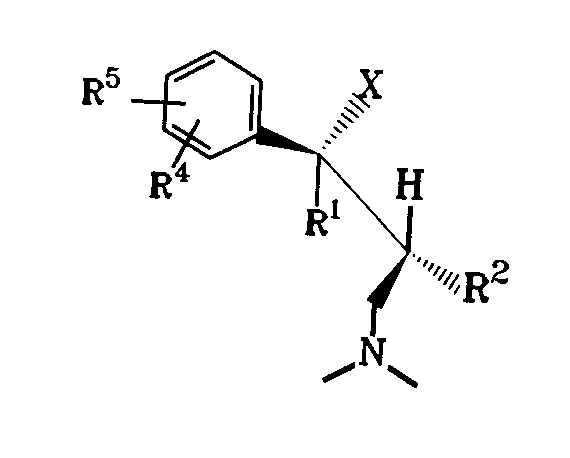
したがって本発明の対象は、ジアステレオマー又は対掌体としてその塩基又はその生理学的な相容な酸の塩の形で式I
【0007】
【化5】
【0008】
{式中、
XはOH、F、Cl、H又はOCOR6 基(R6 はC1-3 アルキル基を示す。)を示し、
R1 はC1-C4-アルキル基、R 2 はH又はC 1-4 - アルキル基、R3 はH又は直鎖状C1-4-アルキル基を示すか又はR2 及びR3 と一緒になってC4-7-シクロアルキル基を形成する、
R5 がHである場合、R4 はメタ -O- Z〔ZはH、C1-3-アルキル基、PO(O- C1-4-アルキル)2 、CO(OC1-5-アルキル)、CONH- C6 H4-(C1-3-アルキル)又はCO- C6 H4-R7 を示し、この際R7 はオルト- OCOC1-3-アルキル基又はメタ- 又はパラ- CH2 N(R8)2(R8 はC1-4-アルキル基又は4- モルホリノ基である。)を示す。〕
を示すか又はR4 はメタ- S- C1-3-アルキル基、メタ- Cl、メタ- F、メタ- CR9 R10R11(R9,R10及びR11はH又はF、オルト- OH、オルト- O- C2-3-アルキル基、パラ- F又はパラ- CR9 R10R11を示す)を示す、あるいはR5 はパラ- 位のCl、F、OH又はO- C1-3-アルキルを示す場合、R4 はメタ- 位のCl、F、OH又はO- C1-3-アルキル基を示す、あるいはR4 及びR5 は一緒になって3,4- OCH=CH- 又は3,4- OCH=CHO- を示す。}
の1- フエニル -3- ジメチルアミノ- プロパン化合物である。
【0009】
式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(式中XはOH、F、Cl又はHであり、R1 はC1-4-アルキル基、R2 はH又はCH3 、R3 はH又はCH3 を示す、R5 がHである場合、R4 はメタ- O- C1-3 -アルキル基、メタ- OH、メタ- S- C1-3-アルキル、メタ- F、メタ- Cl、メタ- CH3 、メタ- CF2 H又はメタ- CF3 、又はパラ- CF3 を示すか又はR5 がパラ位のCl又はFである場合、R4 はメタ- 位のCl又はFを示すか、又はR4 及びR5 は一緒になって3,4- OCH=CH- を示し。)が好ましい。
【0010】
式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(式中R2 及びR3 は種々の意味を有する。)は、立体配置Ia
【0011】
【化6】
【0012】
を有するそのジアステレオマーの形で存在するのが特に好ましい。
更に本発明の対象は、式II
【0013】
【化7】
【0014】
のβ- ジメチルアミノケトンと式III
【0015】
【化8】
【0016】
(式中ZはMgCl、MgBr、MgI又はLiを示す。)
の金属有機化合物とを反応させて、式Iで表わされる化合物(X=OH)とする、式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(X=OH)を製造する方法である。
β- ジメチルアミノケトンと式IIIのグリニヤール化合物(式中ZはMgCl、MgBr又はMgIを示す。)と又は式IIIのリチウム有機化合物との反応を、脂肪族エーテル、たとえばジエチルエーテル及び(又は)テトラヒドロフラン中で、−70 〜+60 の温度で実施することができる。式IIIのリチウム有機化合物を式IIIの化合物(ZはCl、Br又はIを示す。)とたとえばn- ブチルリチウム/ヘキサン- 溶液との反応によりハロゲン- リチウム- 置換によって得ることができる。式IIのβ- ジメチルアミノケトンを、式IV
【0017】
【化9】
【0018】
のケトンからジメチルアミンハイドロクロライド及びホルムアルデヒドを氷酢酸中で又はC1-4-アルキルアルコール中で反応させることによって又はジメチルアンモニウムメチレンクロライドとアセトニトリル中でアセチルクロライド- 触媒作用下に反応させることによって得ることができる(Synthesis 1973,703)。
【0019】
式IIのβ- ジメチルアミノケトン(式中、R2 及びR3 は種々の意味を有する。)と式IIIの金属有機化合物との反応に於て、式Ia
【0020】
【化10】
【0021】
の相対配置を有する、式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物が得られ、X及びジメチルアミノメチル基はスレオ形で互いに配置される。これに対してドイツ民主共和国特許第124521号明細書中に開示された1- フエニル -1- ヒドロキシ -3- アミノプロパンの製造方法に従って反応を実施した場合、すなわち式V
【0022】
【化11】
【0023】
のβ- アミノケトンとアルキルグリニヤール化合物R1 MgHalとを反応させた場合、相対配置Ib
【0024】
【化12】
【0025】
を有する化合物が得られ、OH- 基及びジメチルアミノメチル基がエリスロの形で互いに配置される。
式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(式中R4 及び(又は)R5 はOH- 基である。)を対応する1-(4(5)-メトキシフエニル)-3- ジメチルアミノ- プロパン化合物からジイソブチルアルミニウムヒドリドを用いて芳香族炭化水素、たとえばトルエン中で、60〜130℃の温度で選択的エーテル分解することによって製造することができる(合成1975,67)。
【0026】
更なる本発明の対象は、式Iの化合物(X=Cl)と水素化ホウ素亜鉛、水素化シアノホウ素亜鉛及び(又は)水素化シアノホウ素錫とを反応させることを特徴とする、式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(X=H)を製造する方法である。
通常、反応を溶剤、たとえばジエチルエーテル及び(又は)テトラヒドロフラン中で0〜30℃の温度で実施する。
【0027】
式Iの化合物(X=H及びR4 及び(又は)R5 =OH- 基)を、対応するメトキシフエニル- 化合物から濃い臭化水素酸と共に数時間加熱して得ることができる(Chem. Rev.54,615(1954);J. Am. Chem. Soc. 74,1316(1952)).
更に本発明の対象は、式Iの化合物(X=OH)とジメチルアミノ- 三フッ化イオウとを溶剤中で反応させることを特徴とする、式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(X=F)を製造する方法である。
【0028】
溶剤としてジクロロメタン、1,1,2- トリクロロエタン及び(又は)トルエンが適する。常に反応を−50℃〜+30℃の温度で実施する(Org. React.35,513(1988)).式Iの化合物(X=OH、R4 及び(又は)R5 =OH- 基)を使用する場合、このOH- 基をフッ素化合物との反応の前に、たとえばベンゾイルクロライドとの反応によって保護しなければならない。
【0029】
更に、本発明の対象は、式Iの化合物(X=OH)とチオニルクロライドを反応させることを特徴とする式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(X=Cl)を製造する方法である。
一般に反応を溶剤の不在下0〜20℃の温度で実施する。OH/Cl- 置換は、立体配置の維持下に行われる。
【0030】
更に、本発明の対象は、式Iの化合物(X=OH)と酸クロライド(Cl- COOR6 )とを反応させることを特徴とする、式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物〔X=OCR6 (式中R6 はC1-C3 アルキル基を示す。)〕を製造する方法である。
反応を、溶剤、たとえばジクロロメタン、トルエン及び(又は)テトラヒドロフラン中で10℃〜+30℃の温度で実施するのが好ましい。
【0031】
式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物(式中R5 はH、R4 はメタ- 位のホスフアート- 、カルボナート- 、カルバマート- 又はカルボキシラート基である。)が対応する式Iの1-(3- ヒドロキシフエニル)-3- ジメチルアミノ- プロパン化合物をそのアルカリ塩の形でジアルキルクロロホスフアートと、アルキルクロロホルミアートと、アリールイソシアナートと又はカルボン酸クロライドとの反応によって得られる。この反応を常法で溶剤、たとえばトルエン、ジクロロメタン、ジエチルエーテル及び(又は)テトラヒドロフラン中で−15℃〜+110℃の温度で実施する(Drugs of the Future 16,443(1991);J. Med. Chem. 30,2008(1987)及び32,2503(1989);J. Org. Chem. 43,4797(1978);Tetrahedron Lett. 1977,1571;J. Pharm. Sci.57,774(1968)).
式Iの化合物を生理学的に許容性な酸、たとえば塩酸、臭化水素酸、硫酸、メタンスルホン酸、ギ酸、酢酸、シュウ酸、コハク酸、酒石酸、マンデル酸、フマール酸、乳酸、クエン酸、グルタミン酸及び(又は)アスパラギン酸を用いて公知方法でその塩に変えることができる。塩形成を溶剤、たとえばジエチルエーテル、ジイソプロピルエーテル、酢酸アルキルエステル、アセトン及び(又は)2- ブタノン中で実施するのが好ましい。更に塩酸塩の製造に水性溶液の形でトリメチルクロロシランが適する。
【0032】
式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物は毒物学上危険がないので、薬剤中の医薬有効物質として適する。
したがって更なる本発明の対象は、式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物を医薬有効物質として使用する方法である。
式Iの化合物を苦痛の治療に使用するのが好ましい。
【0033】
本発明の鎮痛剤は、少なくとも1個の1- フエニル -3- ジメチルアミノ- プロパン化合物と共に、賦形剤、増量剤、溶剤、希釈剤、染料及び(又は)結合剤を含有する。助剤の選択及びその使用量は、薬剤が経口、静脈内、腹腔内、皮下、筋肉内、鼻腔内又は局所に、たとえば皮膚、粘膜及び眼の感染に投与しなければならないかによる。経口投与に、錠剤、糖衣丸、カプセル、顆粒、滴剤、液剤及びシロップの形の腸管外、外用及び吸入投与に、溶液、懸濁液、容易に再構成される乾燥製剤及びスプレーの形の製剤が適する。デポー製剤の形で溶解された形で又は場合により主な浸透を促進する剤の添加下に硬膏剤の形での式Iの本発明による化合物は、適する経皮適用製剤である。経口又は経皮適用の製剤形態は、式Iの本発明の化合物を徐々に遊離することができる。
【0034】
患者に投与すべき有効量は、患者の体重、投与の種類、病気の徴候及び重さの度合に従って変化する。一般に少なくとも1種の式Iの1- フエニル -3- ジメチルアミノ- プロパン化合物50〜500mg/kgを投与する。
【0035】
【実施例】
製造された化合物の収量は、最善のものではない。
すべての温度は未修正である。
他に明記しない限り、沸騰範囲50〜70℃を有する石油エーテルを使用する。エーテルの記載は、ジエチルエーテルを示す。
【0036】
カラムクロマトグラフィーの固定相としてイー.メルク社(グルムシュタット)のシリカゲル60(0.040〜0.063mm)を使用する。
薄層- クロマトグラフィー試験をHPTLC- 既製プレート、シリカゲル60F254、イー.メルク社(ダルムシュタット)を用いて実施する。
ラセミ体分離をキラセルODカラムで実施する。
【0037】
すべてのクロマトグラフィー試験に対する展開剤の混合割合を容量/容量で記載する。
RTは室温である。
〔例1〕
【0038】
【化13】
【0039】
(2RS,3RS)-1- ジメチルアミノ -3-(3- メトキシ- フエニル)-2- メチル- ペンタン -3- オール、ハイドロクロライド(1)
乾燥テトラヒドロフラン150ml中のマグネシウムチップ26.99g(1.11モル)に、乾燥テトラヒドロフラン400ml中に溶解された3- ブロモアニソール207.63g(1.11モル)を、反応混合物が容易に沸騰する様に滴加する。3- ブロムアニソールの添加が終了した後、1時間還流加熱し、その後5〜10℃に冷却する。この温度でテトラヒドロフラン400ml中に溶解された1- ジメチルアミノ -2- メチル- ペンタン -3- オン128.30g(0.89モル)を加える。反応混合物を一晩放置し、次いで新たに5〜10℃に冷却する。20%塩化アンモニウム溶液300mlの添加によって、グリニヤール溶液を分解する。反応混合物をエーテル400mlで希釈し、有機相を分離し、水性相を2回エーテル250mlで抽出する。一緒にされた有機相を硫酸ナトリウムを介して乾燥する。溶液の蒸留による除去後、残留物(212g)を2- ブタノン3200ml中に取り、トリメチルクロルシラン120.60g(1.11モル)及び水20mlを加える。4〜5℃で融点198〜199℃のハイドロクロライド(1)121.5g(理論値の38%)が晶出する。
〔例2〕
【0040】
【化14】
【0041】
(1)の対掌体:
(−)-(2S,3S)-1- ジメチルアミノ -3-(3- メトキシ- フエニル)-2- メチル- ペンタン -3- オール、ハイドロクロライド(−1)
及び
(+)-(2R,3R)-1- ジメチルアミノ -3-(3- メトキシ- フエニル)-2- メチル- ペンタン -3- オール、ハイドロクロライド(+1)
(1)からジクロロメタン/苛性ソーダで塩基を遊離する。溶液の乾燥後、ジクロロメタンを減圧蒸留する。次いでラセミ体をキラルHPLC- カラム上で分離する。得られた対掌体から、2- ブタノン中でのトリメチルクロロシラン/水との反応によって融点150〜151℃を有するハイドロクロライドを製造する。
【0042】
〔例3〕
【0043】
【化15】
【0044】
(2RS,3RS)-3-(3,4- ジクロロフエニル)-1- ジメチルアミノ -2- メチル- ペンタン -3- オール、ハイドロクロライド(2)
例1と同様に、1- ジメチルアミノ -2- メチル- ペンタン -3- オン15g(105mmol)、4- ブロモ -1,2- ジクロロベンゼン35.5g(157mmol)及びマグネシウムチップ3.8g(157mmol)から粗混合物39gを製造する。これをシリカゲルで充填された7×40cmカラム上に加え、酢酸エチルエステル/メタノール4:1で溶離する。塩基14.9gが得られ、これから2- ブタノン/ジイソプロピルエーテル中でトリメチルクロロシラン/水を用いて融点183〜184℃を有するハイドロクロライド(2)11.2g(理論値の31%)が得られる。
〔例4〕
【0045】
【化16】
【0046】
(2RS,3RS)-3-(3- イソプロポキシ- フエニル)-1- ジメチルアミノ -2- メチル- ペンタン -3- オール、ハイドロクロライド(3)
例1に対応して、1- ジメチルアミノ -2- メチル- ペンタン -3- オン14.3g(100mmol)、1- ブロモ -3- イソプロポキシ- ベンゼン20.0g(157mmol)及びマグネシウムチップ2.79g(115mmol)から、粗混合物25gを製造する。これをシリカゲルで充填された7×40cmカラム上に加え、酢酸エチルエステル/メタノール15:1を溶離する。塩基9.0gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点133〜134℃を有するハイドロクロライド(3)8.3g(理論値の26%)が得られる。
〔例5〕
【0047】
【化17】
【0048】
(2RS,3RS)-3-(3- クロロ- フエニル)-1- ジメチルアミノ -2- メチル- ペンタン -3- オール、ハイドロクロライド(4)
例1に記載された条件で、1- ジメチルアミノ -2- メチル- ペンタン -3- オン38.0g(270mmol)、1- ブロモ -3- クロロベンゼン74.7g(390mmol)及びマグネシウムチップ9.50g(390mmol)から、粗混合物63gが得られる。これをシリカゲルで充填された7×45cmカラム上に加え、ジイソロピルエーテル/メタノール7:1で溶離する。塩基12.8gが得られ、これから2- ブタノン/エーテル中でトリメチルクロロシラン/水を用いて、融点160〜162℃を有するハイドロクロライド(4)10.8g(理論値の14%)が得られる。
〔例6〕
【0049】
【化18】
【0050】
(2RS,3RS)-1- ジメチルアミノ -2- メチル -3-(3- トリルオロメチル- フェニル)-ペンタン -3- オール、ハイドロクロライド(5)
例1に記載された条件下で1- ジメチルアミノ -2- メチル- ペンタン -3- オン14.3g(100mmol)、1- ブロモ -3- トリフルオロメチル- ベンゼン29.3g(130mmol)及びマグネシウムチップ3.2g(130mmol)から、粗混合物21.2gが得られる。これをシリカゲルで充填された6×40cmカラム上に加え、ジイソプロピルエーテル/メタノール10:1で溶離する。塩基9.1gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点189〜190℃を有するハイドロクロライド(5)7.8g(理論値の18.5%)が得られる。
〔例7〕
【0051】
【化19】
【0052】
(2RS,3RS)-1- ジメチルアミノ -2- メチル -3-(m- トリル)-ペンタン -3- オール、ハイドロクロライド(6)
例1に従って、1- ジメチルアミノ -2- メチル- ペンタン -3- オン47.3g(330mmol)、3- ブロモ- トルエン64.6g(400mmol)及びマグネシウムチップ9.72g(400mmol)から、粗混合物75gが得られる。これをシリカゲルで充填された7×50cmカラム上に加え、ジイソプロピルエーテル/メタノール7:1で溶離する。塩基24.3gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点154〜155℃を有するハイドロクロライド(6)21.5g(理論値の24%)が得られる。
〔例8〕
【0053】
【化20】
【0054】
(2RS,3RS)-1- ジメチルアミノ -3-(3- フルオロ- フエニル)-2- メチル- ペンタン -3- オール、ハイドロクロライド(7)
例1に記載された条件下で、1- ジメチルアミノ -2- メチル -ペンタン -3- オン54.0g(380mmol)、1- ブロモ -3- フルオロベンゼン82.5g(470mmol)及びマグネシウムチップ9.23g(470mmol)から、粗混合物70gが得られる。これをシリカゲルで充填された7×50cmカラム上に加え、酢酸エチルエステル/メタノール1:1で溶離する。塩基13.0gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点145〜146℃を有するハイドロクロライド(7)11.2g(理論値の11.5%)が得られる。
〔例9〕
【0055】
【化21】
【0056】
(2RS,3RS)-3-(3- ジフルオロメチル- フエニル)-1- ジメチルアミノ -2- メチル- ペンタン -3- オール、ハイドロクロライド(8)
Org. React. 35,513(1988)に従ってジクロロメタン中で3- ブロモベンズアルデヒド及びジエチルアミノ三フッ化イオウから製造された1- ブロモ -3- ジフルオロメチル- ベンゼン7.0g(34mmol)を、乾燥テトラヒドロフラン110ml中に溶解し、−75℃に冷却する。ヘキサン中の1.6モルn- ブチルリチウム溶液21.12ml(34mmol)の添加後、一時間−75℃で撹拌する。次いで乾燥テトラヒドロフラン15ml中に溶解された1- ジメチルアミノ -2- メチル- ペンタン -3- オン4.8g(34mmol)を滴下する。2.5時間以内に、反応混合物を室温に加熱する。
【0057】
後処理のために、氷浴冷却下に5%塩酸を滴下するが、内部温度は15℃を越えない。相分離後、有機相を5%塩酸40mlで抽出する。一緒にされた水性相を2回エーテル50mlで洗滌する。塩基の遊離後、濃苛性ソーダ溶液を加え、ジクロロメタンで抽出する。この方法で、粗生成物7.8gが得られ、これをシリカゲルで充填された7×40cmカラム上に加える。酢酸エチルエステル/メタノール1:1での溶離は、塩基4.89gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点194〜195℃を有するハイドロクロライド(8)4.6g(理論値の44%)が得られる。
〔例10〕
【0058】
【化22】
【0059】
(2RS,3RS)-1- ジメチルアミノ -2- メチル -3-(3- メチルスルフアニル- フエニル)-ペンタン -3- オール、ハイドロクロライド(9)
例1に記載した条件下で、1- ジメチルアミノ -2- メチル -ペンタン -3- オン17.6g(123mmol)、1- ブロモ -3- メチルスルフアニル- ベンゼン25.0g(123mmol)及びマグネシウムチップ3.0g(123mmol)から、粗混合物38gが得られる。これをシリカゲルで充填された7×40cmカラム上に加え、酢酸エチルエステル/メタノール10:1で溶離する。塩基8.35gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点159〜160℃を有するハイドロクロライド(9)7.2g(理論値の19%)が得られる。
〔例11〕
【0060】
【化23】
【0061】
(2RS,3RS)-3- ベンゾフラン -6- イル -1- ジメチルアミノ -2- メチル- ペンタン -3- オール、ハイドロクロライド(10)
乾燥エ−テル30ml中にマグネシウムチップ2.12g(87mmol)に、乾燥エーテル60ml中に溶解された6- ブロモベンゾフラン(ヨーロッパ特許第355827号明細書に従って製造される)3.45g(18mmol)及び1,2- ジブロモ- エタン6mlを、1.5時間以内に滴下し、添加後30分還流加熱する。その後氷浴冷却下に内部温度5〜10℃でエーテル7.5ml中に溶解された1- ジメチルアミノ -2- メチル- ペンタン -3- オン2.5g(18mmol)を滴下する。反応混合物を室温で一晩放置し、次いで新たに5〜10℃に冷却し、20%水性塩化アンモニウム溶液35mlを添加する。相分離後、水性相を2回エーテル50mlで抽出する。一緒にされた有機相を硫酸ナトリウムを介して乾燥する。溶剤の蒸留による除去後、残留物(3.9g)をシリカゲルで充填された5×16cmカラム上に加える。ジイソプロピルエーテル/メタノール7:1での溶離によって、塩基0.95gが得られ、これから酢酸エチルエステル/2- ブタノン中でトリメチルクロロシラン/水を用いて融点162℃を有するハイドロクロライド(10)0.82g(理論値の15.5%)が得られる。
〔例12〕
【0062】
【化24】
【0063】
(2RS,3RS)-1- ジメチルアミノ -2- メチル -3-(4- トリフルオロメチル- フエニル)-ペンタン -3- オール、ハイドロクロライド(11)
例1に従って、1- ジメチルアミノ -2- メチル- ペンタン -3- オン20g(140mmol)、1- ブロモ -4- トリフルオロメチル- ベンゼン31.5g(140mmol)、マグネシウムチップ16.5g(680mmol)及び1,2- ジブロモ- エタン47mlから、粗混合物44gが得られる。これをシリカゲルで充填された7×50cmカラム上に加え、酢酸エチルエステル/メタノール5:1で溶離する。塩基16.4gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点170〜171℃を有するハイドロクロライド(11)12.3g(理論値の27%)が得られる。
〔例13〕
(3RS)-1- ジメチルアミノ -3-(3- メトキシ- フエニル)-ヘキサン -3- オール、ハイドロクロライド(12)
例1に従って、1- ジメチルアミノ -ヘキサン -3- オン10g(70mmol)、1- ブロモ -3- メトキシ- ベンゼン18.7g(100mmol)及びマグネシウムチップ2.3g(100mmol)から、粗混合物18.5gが得られる。これをシリカゲルで充填された6×50cmカラム上に加え、酢酸エチルエステル/メタノール1:1で溶離する。塩基6.84gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点179〜180℃を有するハイドロクロライド(12)6.15g(理論値の32%)が得られる。
〔例14〕
(3RS)-1- ジメチルアミノ -3-(3- メトキシ- フエニル)-ヘプタン -3- オール、ハイドロクロライド(13)
例1に従って、1- ジメチルアミノ - ヘプタン - 3 - オン10g(64mmol)、1- ブロモ -3- メトキシ- ベンゼン15.9g(157mmol)及びマグネシウムチップ2.06g(85mmol)から、粗混合物17.3gが得られる。これをシリカゲルで充填された6×40cmカラム上に加え、酢酸エチルエステルで溶離する。塩基5.4gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点150℃を有するハイドロクロライド(13)4.1g(理論値の21%)が得られる。
〔例15〕
(3RS)-1- ジメチルアミノ -3-(3- メトキシ- フエニル)-4,4- ジメチル- ペンタン -3- オール、ハイドロクロライド(14)
例1に従って、1- ジメチルアミノ -4,4- ジメチル- ペンタン -3- オン18.6g(118mmol)、1- ブロモ -3- メトキシ- ベンゼン28.4g(152mmol)及びマグネシウムチップ3.7g(152mmol)から、粗混合物37gを製造する。これをシリカゲルで充填された7×40cmカラム上に加え、酢酸エチルエステル/メタノール5:1で溶離する。塩基2.2gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点213℃を有するハイドロクロライド(14)1.8g(理論値の5%)が得られる。
〔例16〕
【0064】
【化25】
【0065】
(2RS,3RS)-4- ジメチルアミノ -2-(3- メトキシ- フエニル)-3- メチル- ブタン -2- オール、ハイドロクロライド(15)
例1に従って、4- ジメチルアミノ -3- メチル- ブタン -2- オン5.3g(41mmol)、1- ブロモ -3- メトキシ- ベンゼン23.0g(123mmol)及びマグネシウムチップ3.0g(123mmol)から、粗混合物21gが得られる。これをシリカゲルで充填された4.5×27cmカラム上に加え、酢酸エチルエステル/メタノール4:1で溶離する。塩基4.0gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点124℃を有するハイドロクロライド(15)3.6g(理論値の32%)が得られる。〔例17〕
【0066】
【化26】
【0067】
(15)の対掌体:
(−)-(2S,3S)-4- ジメチルアミノ -2-(3- メトキシ- フエニル)-3- メチル- ブタン -2- オール、ハイドロクロライド(−15)
及び
(+)-(2R,3R)-4- ジメチルアミノ -2-(3- メトキシ- フエニル)-3- メチル- ブタン -2- オール、ハイドロクロライド(+15)
例16に従って製造されたハイドロクロライド(15)から、ジクロロメタン/苛性ソーダ溶液を用いて塩基を遊離させる。乾燥し、次いでジクロロメタンを蒸留により除去した後、ラセミ体をキラルHPLC- カラム上で対掌体の形に分離する。これから2- ブタノン中のトリメチルクロロシラン/水を用いてハイドロクロライドが得られる。
(−15):収率:理論値の41%
融点:117〜118℃
〔α〕D RT=−38.6°(c=1.05;メタノール)
(+15):収率:理論値の41%
融点:118〜119℃
〔α〕D RT=+41.0°(c=1.01;メタノール)
〔例18〕
【0068】
【化27】
【0069】
(2RS,3RS)-3-(3- ジメチルアミノ -1- エチル -1- ヒドロキシ -2- メチル- プロピル)-フエノール、ハイドロクロライド(16)
例1に従って得られた化合物(1)から、ジクロロメタン/苛性ソーダ溶液を用いて塩基を遊離し、溶液の乾燥後ジクロロメタンを蒸留により除去する。塩基4.3g(17mmol)を乾燥トルエン25ml中に溶解し、徐々に1.2モルのトルエン性ジイソブチルアルミニウムヒドリド- 溶液71ml(85mmol)に滴下する。添加の終了後、8時間還流下に加熱し、次いで室温に冷却する。反応混合物をトルエン25mlで希釈する。氷浴冷却下にエタノ−ル9.4mlついで水9.4mlを滴下する。氷浴冷却下に1時間の撹拌後、反応混合物からアルミニウム塩を濾過によって除去する。この際、残留物を3回夫々トルエン50mlで洗滌する。その後一緒にされた有機相を乾燥し、トルエンを蒸留により除去する。塩基からアセトン中で、アセトン中の水性塩酸溶液を用いて融点213〜214℃を有するハイドロクロライド(16)3.95g(理論値の85%)が得られる。
〔例19〕
【0070】
【化28】
【0071】
(16)の対掌体:
(−)-(1S,2S)-3-(3- ジメチルアミノ -1- エチル -2- ヒドロキシ -2- メチル- プロピル)-フエノール、ハイドロクロライド(−16)
及び
(+)(1R,2R)-3-(3- ジメチルアミノ -1- エチル -1- ヒドロキシ -2- メチル- プロピル)-フエノール、ハイドロクロライド(+16)
対掌体(−16)及び(+16)を例2に記載した条件下で製造する。
(−16):収率:理論値の85%
融点:208−209℃
〔α〕D RT=−34.6°(c=0.98;メタノール)
(+16):収率:理論値の85%
融点:206〜207℃
〔α〕D RT=+34.4°(c=1.06;メタノール)
〔例20〕
【0072】
【化29】
【0073】
(1RS,2RS)-3-(3- ジメチルアミノ -1- ヒドロキシ -1,2- ジメチル- プロピル)-フエノール、ハイドロクロライド(17)
例18に記載された条件下で、例16に従って得られたメトキシ化合物(15)から出発して、化合物(17)を製造する。
収率:理論値の85%
融点:232℃
〔例21〕
【0074】
【化30】
【0075】
(17)の対掌体:
(−)-(1S,2S)-3-(3- ジメチルアミノ -1- ヒドロキシ -1,2- ジメチル- プロピル)-フエノール、ハイドロクロライド(−17)
及び
(+)-(1R,2R)-3-(3- ジメチルアミノ -1- ヒドロキシ -1,2- ジメチル- プロピル)-フエノール、ハイドロクロライド(+17)
対掌体(−17)及び(+17)を例2に記載された条件下で製造する。
〔例22〕
【0076】
【化31】
【0077】
(+)-(1R,2R)-3-(3- ジメチルアミノ -1- エチル -1- フルオロ -2- メチル- プロピル)-フエノール、ハイドロクロライド(+18)
第一段階:
【0078】
【化32】
【0079】
(+)-(1R,2R)-3-(3- ベンジルオキシ- フエニル)-1- ジメチルアミノ -2- メチル- ペンタン -3- オール(+19)
例19に従って得られた対掌体(+16)から、ジクロロメタン/苛性ソーダ溶液を用いて塩基を遊離し、溶液の乾燥後ジクロロメタンを蒸留により除去する。塩基5.3g(22mmol)を乾燥ジメチルホルムアミド27ml中に溶解し、50%水素化ナトリウム1.2gを数回に分けて加える。添加の終了後、3時間70℃で加熱する。次いで室温に冷却し、反応混合物を氷水上に注ぐ。この際3回夫々エーテル70mlで抽出する。その後一緒にされた有機相を硫酸ナトリウムを介して乾燥し、溶剤を蒸留し、残留物をシリカゲルで充填された4.5×30cmカラム上に加える。ジイソプロピルエーテル/メタノールで溶離して、塩基(19)6.8g(理論値の92%)が淡黄色の高粘性油状物として得られる。
第二段階:
【0080】
【化33】
【0081】
(+)-(2R,3R)-〔3-(3- ベンジルオキシ- フエニル)-3- フルオロ -2- メチル- ペンチル〕- ジメチルアミン(+20)
乾燥ジクロロメタン30ml中にジエチルアミノ- 三フッ化イオウ3.7g(23mmol)を有する溶液に、ジクロロメタン80ml中に溶解された(+19)6.8g(21mmol)を−20℃で滴下する。添加の終了後、30分この温度で撹拌し、次いで室温に加熱する。室温で更に1時間撹拌後、0〜5℃に冷却し、水50mlで加水分解する。相分離後、水性相を2回ジクロロメタン50mlで抽出する。一緒にされた有機相を乾燥し、減圧蒸留によって溶剤を除去する。得られた反応混合物(8.04g)を、シリカゲルで充填された6×50cmカラム上に加え、酢酸エチルエステル/メタノール1:1で溶離する。塩基(+20)3.04g(理論値の40%)が淡黄色の粘性油状物として得られる。
第三段階:
(+)-(1R,2R)-3-(3- ジメチルアミノ -1- エチル -1- フルオロ -2- メチル- プロピル)-フエノール、ハイドロクロライド(+18)
(+20)3.0g(91mmol)を、乾燥メタノール15ml中に溶解し、水素添加装置中で活性炭(10%Pd)に担持されたパラジウム0.44gを加える。室温で3時間撹拌後、水素215mlを消費する。触媒を濾過し、次いでメタノールを蒸留により除去する。塩基2.22gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いてハイドロクロライド(+18)2.0g(理論値の79%)が得られる。
融点:174〜176℃
〔α〕D RT=+29.5°(c=1.08;メタノール)
〔例23〕
【0082】
【化34】
【0083】
(−)-(1S,2S)-3-(3- ジメチルアミノ -1- エチル -1- フルオロ -2- メチル- プロピル)-フエノール、ハイドロクロライド(−18)
例19に従って得られた対掌体(−16)から出発して、例22に記載された条件下で対掌体(−18)が、理論値の29%の収率で得られる。
融点:170−172℃
〔α〕D RT=−28.4o (c=1.03;メタノール)
〔例24〕
【0084】
【化35】
【0085】
(+)-(1S,2S)-3-(3- ジメチルアミノ -1- エチル -2- メチル- プロピル)-フエノール、ハイドロクロライド(+21)
第一段階:
【0086】
【化36】
【0087】
(+)-(2R,3R)-〔3- クロロ -3-(3- メトキシ- フエニル)-2- メチル- ペンチル〕- ジメチルアミン、ハイドロクロライド(+22)
例2に従って製造された(+1)10g(35mmol)に、室温でチオニルクロライド10mlを加える。次いで過剰のチオニルクロライドを除去するために、2時間窒素を反応混合物に添加する。2.5時間以内で過剰のチオニルクロライドを窒素流によって新たに除去する前にチオニルクロライド10mlを新たに加えた後、反応混合物を12時間放置する。乾燥後、残留物を氷冷された2- ブタノン1010ml中に溶解し、撹拌下でエーテル200ml、次いでジイソプロピルエーテル140mlを加える。そのままの状態の溶剤相をデカンテーションし、残存する油状物を新たに2- ブタノン10ml中に取る。結晶種の添加後、ジイソプロピルエーテル300mlを、3時間以内激しい撹拌下に滴下し、この際ハイドロクロライドが晶出する。(22)9.8g(理論値の91%)が得られる。
融点:120℃(分解)
〔α〕D RT=+24.7o (c=1.01;メタノール)
第二段階:
【0088】
【化37】
【0089】
(+)-(2S,3S)-〔3-(3- メトキシ- フエニル)-2- メチル- ペンチル〕- ジメチル- アミン、ハイドロクロライド(+23)
乾燥塩化亜鉛46gを、乾燥エーテル580ml中に溶解し、次いでエーテル1800ml中に水素化ホウ素ナトリウム31gを有する懸濁液に滴下する。12時間の撹拌後、得られた水素ホウ素亜鉛懸濁液から500mlをデカンテーションし、乾燥エーテル200ml中に(+22)9.8g(32mmol)に滴加する。反応混合物を72時間室温で撹拌し、次いで氷浴冷却下に飽和塩化アンモニウム溶液40mlを滴下する。相分離後、エーテル相を2回飽和食塩溶液で洗滌し、硫酸ナトリウムを介して乾燥後、溶剤を減圧蒸留する。アミン- ホウ素- 錯体7.3gが得られ、これを遊離塩基の単離のために乾燥メタノール100ml中に溶解する。トリフエニルホスフィン7.5gの添加後、18時間還流加熱する。溶剤の蒸留除去後、残留物に5%塩酸100mlを加える。次いで塩酸相を更に2回エーテル50mlで洗滌する。その後塩酸相を濃苛性ソーダ溶液で氷浴冷却下にアルカリ性にし、2回ジクロロメタン50mlで振出する。一緒にされた有機相を硫酸ナトリウムを介して乾燥した後、溶剤を減圧蒸留し、残存する残留物(5.2g)を2- ブタノン中に取る。トリメチルクロロシラン/水の添加後、ハイドロクロライド(+23)4.3g(理論値の50%)が晶出する。
融点:163〜164℃
〔α〕D RT=+25.2°(c=0.95;メタノール)
第三段階:
(+)-(1S,2S)-3-(3- ジメチルアミノ -1- エチル -2- メチル- プロピル)-フエノール、ハイドロクロライド(+21)
第二段階から得られた(+23)4.3g(15mmol)に、濃臭化水素酸100mlを加える。次いで2時間還流加熱する。室温に冷却後反応混合物を水流ポンプ減圧で蒸発する。残留物に濃炭酸水素ナトリウム溶液を加えてアルカリ性反応を生じさせる。各々ジクロロメタン50mlを用いて2回抽出した後、一緒にされた有機相を硫酸ナトリウムを介して乾燥する。次いでジクロロメタンを減圧蒸留し、残留物(4g)を2- ブタノン中に取る。トリメチルクロロシラン/水の添加後ハイドロクロライド(+21)3.8g(理論値の98%)が晶出する。
融点:194−196℃
〔α〕D RT=+24.5° (c=1.10;メタノール)
〔例25〕
【0090】
【化38】
【0091】
(−)-(1R,2R)-3-(3- ジメチルアミノ -1- エチル -2- メチル- プロピル)-フエノール、ハイドロクロライド(−21)
例2に従って製造された(−1)から出発して、対掌体(−21)が例24に記載された条件下で45%収率で得られる。
融点:168−170℃
〔α〕D RT=−27.5°(c=0.97;メタノール)
〔例26〕
【0092】
【化39】
【0093】
(+)-(1R,2R)-酢酸 -3- ジメチルアミノ -1- エチル -1-(3- メトキシ- フエニル)-2- メチル- プロピルエステル、ハイドロクライド(+24)
例2に従って製造された対掌体(+1)から、ジクロロメタン/苛性ソーダ溶液を用いて塩基を遊離する。溶液の乾燥後、ジクロロメタンを蒸留により除去する。得られた塩基10g(35mmol)──これを乾燥ジクロロメタン150ml中に取る──に、氷浴冷却下でアセチルクロライド3.0g(39mmol)を滴下する。アセチルクロライドの添加が終了した後、反応混合物を室温に加熱し、2時間攪拌後、飽和炭酸水素ナトリウム溶液100mlを加える。有機相を水性相から分離し、水性相を2回ジクロロメタン50mlで抽出する。有機相を一緒にして、硫酸ナトリウムを介して乾燥する。溶剤の蒸留除去後、粗混合物13.4gが得られ、これから2- ブタノン/酢酸エチル中でトリメチルクロロシラン/水を用いてハイドロクロライド(+24)10.7g(理論値の93%)が得られる。
融点:153℃
〔α〕D RT=+17.3o (c=1.04;メタノール)
〔例27〕
【0094】
【化40】
【0095】
(1RS)-1-(1- ジメチルアミノメチル- シクロヘキシル)-1-(3- メトキシ- フエニル)-プロパンン -1- オール、ハイドロクロライド(25)
第一段階:
【0096】
【化41】
【0097】
(1RS)-( 1 - ジメチルアミノメチル- シクロヘキシル)-(3- メトキシ- フエニル)-メタノール、ハイドロクロライド(26)
例1に記載された条件下で、1- ジメチルアミノメチル- シクロヘキサン- カルボアルデヒド25g(150mmol)、1- ブロモ -3- メトキシ- ベンゼセン32.9g(180mmol)及びマグネシウムチップ4.3g(180mmol)から、粗混合物44gが得られる。これをシリカゲルで充填された7×40cmカラム上に加え、ジイソプロピルエーテル/メタノール4:1で溶離する。塩基38gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点235℃を有するハイドロクロライド(26)40g(理論値の85%)が得られる。
第二段階:
【0098】
【化42】
【0099】
(1RS)-(1- ジメチルアミノメチル- シクロヘキシル)-(3- メトキシ- フエニル)-メタノン、ハイドロクロライド(27)
(26)からジクロロメタン/苛性ソーダ溶液を用いて塩基を遊離し、溶液の乾燥後、ジクロロメタンを蒸留により除去する。塩基8.3g(30mmol)をn- ヘキサン30ml中に溶解し、中性酸化アルミニウム上に吸収されたピリジニウムクロロクロマート95g(Synthesis 1980,223に従って製造される)から成る懸濁液に滴下する。室温で72時間撹拌後、反応混合物にジクロロメタン120mlを加え、更に2時間撹拌し、次いで酸化アルミルウム30gを介して濾過する。フィルター残留物を3回夫々ジクロロメタン及びエーテル50mlでデカンテーションにより洗滌する。濾液と一緒にされた有機相から溶剤を蒸留により除去し、得られた残留物を2N苛性ソーダ溶液60ml中に取り、4回夫々酢酸エチル20mgで抽出する。一緒にされた有機相を乾燥した後、溶剤を蒸留により除去する。粗混合物4.8gが得られ、これをシリカゲルで充填された6×30cmカラム上に加え、先ず酢酸エチルで、次いで酢酸エチル/メタノール9:1次いで酢酸エチル/メタノール4:1で溶離する。塩基3.8gが得られ、これから2- ブタノン中でトリメチルクロロシラン/水を用いて融点174℃を有するハイドロクロライド(27)3.1g(理論値の33%)が得られる。
第三段階:
(1RS)-1-(1- ジメチルアミノメチル- シクロヘキシル)-1-(3- メトキシ- フエニル)-プロハン -1- オール、ハイドロクロライド(25)
例1に記載された条件下で、塩基の形で(27)2.8g(10mmol)、ブロモエタン1.4g(13mmol)及びマグネシウムチップ 0 .32g(13mmol)から溶剤としてエーテルの使用下に粗混合物3.0gが得られる。これをシリカゲルで充填された3×20cmカラム上に加え、ジイソプロピルエーテル/メタノール19:1で溶離する。塩基2.1gが得られ、これから2- ブタノン/酢酸エチル中でトリメチルクロロシラン/水を用いて融点230℃を有するハイドロクロライド(25)1.9g(理論値の55%)が得られる。
〔例28〕
【0100】
【化43】
【0101】
(−)-(2R,3S)-{3〔3-(p- イソプロピル- フエニル- カルバモイル)-オキシ- フエニル〕 -2- メチル- ペンチル}- ジメチルアミン、ハイドロクロライド(−28)
例24に従って製造された対掌体(+21)から、ジクロロメタンン/苛性ソーダ溶液を用いて塩基を遊離し、溶液の乾燥後、ジクロロメタンを蒸留により除去する。得られた塩基2.2g(10mmol)を乾燥トルエン20ml中に溶解し、4- イソプロピルエニルイソシアナート1.8g(11mmol)を加える。室温で20時間撹拌した後、トルエンを蒸留により除去する。残留物をn- プロピルアセタート中のトリメチルクロロシラン/水と反応ささせ、ハイドロクロライド(−28)3.2g(理論値の76%)が得られる。
融点:151〜152℃
〔α〕D RT=−5.2o (c=1.11;メタノール)
【0102】
【薬理学的試験】
マウスでのライジング(Writhing)テスト
本発明による化合物の鎮痛作用をフエニルキノン- 誘発されたライジング- テスト──これはI.C.ヘンダーショット(Hendershot)、J.フォーサイス(Forsaith) 、J. Pharmacol. Exptl. Ther.125,237(1959)に従って変えられている──でマウスで試験する。体重25〜30gを有する雄性NMRI- マウスを使用する。物質投薬量につき各10匹の動物は、本発明による化合物の経口投与30分後にマウス1匹につき0.02%水性フエニルキノン- 溶液0.3ml(フエニルベンゾキノン、シグマ社、ダイスホ−フエン;5%エタノールの添加下に溶液を製造し、45℃で水浴中で保存する)を腹腔内投与して保つ。その後動物を個々に観察かご中に入れる。押ボタン係数器を用いてフエニルキノン投与5〜20分後、苦痛誘発された伸展運動(ライジング- 反応=後足の伸展と共に体をまっすぐ伸ばす)を数える。フエニルキノンのみが投与された比較試験マウスに比してライジング- 反応の投薬量に依存する減少を退行分析(評価プログラムマルテンスEDV- サービス、エッケンタル)を用いてED50- 値(ライスング反応の50%阻害を有する有効量)を95%信頼範囲で算出する。すべてのテストされた本発明による化合物は、際立った鎮痛作用を示す。結果を次表にまとめて示す。
Claims (78)
- 式 Ia
X はOH, F, Cl, H 又はOCOR6 基(式中、R6 は C1-3 -アルキル基である。)を示し、
R1 はC1-4 -アルキル基であり、
R2 は C1-4 -アルキル基を示し、そして
R5 はHを示し, そして
R4はメタ-O-Z
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3アルキル) 又は-CH 2 C 6H5 である。]
を示すか、
又は R4 はメタ-S-C1-3 -アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, 又は パラ-CR9R10R11(式中、R9, R10及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F又はパラ-OH を示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5 は一緒になって3,4-OCH=CH- を示す。}
に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩。 - 式 Ia’ 及びIc’
X はOH, F, Cl, H 又はOCOR6 基(式中、 R6 はC1-3-アルキル基である。)を示し、
R1 は C1-4-アルキル基であり、
R2 はCn-アルキル基(式中、 n = 1〜4)を示し、
R3 はR2と異なり、H 又は 直鎖状 Cm-アルキル基(式中、0 < m < n)を示し、そして
R5 は Hを示し、そしてR4はメタ-O-Z
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3 - アルキル) 又は-CH 2 C 6H5 である。]
を示すか、
又は R4 はメタ-S-C1-3-アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, オルト-O-C2-3- アルキル, 又は パラ-CR9R10R11(式中、R9, R10 及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F, パラ-OH 又は パラ-O-C1-3 - アルキルを示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5は一緒になって3,4-OCH=CH- を示す。}
のうちの少なくとも1種に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩。 - 式 Ia’
X はOH, F, Cl, H 又はOCOR6基(式中、R6 は C1-3 -アルキル基である。)を示し、
R1 はC1-4-アルキル基であり、
R2 は C1-4-アルキル基を示し、そして
R3 はR2と異なり、H又は直鎖状C1-3-アルキル基を示し、これによってX及びジメチルアミノ基は互いに対してスレオに配置され、そして
R5 は Hを示し、そしてR4はメタ-O-Z
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3 - アルキル) 又は-CH 2 C 6H5 である。]
を示すか、又は
R4 はメタ-S-C1-3-アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, 又は パラ-CR9R10R11(式中、R9, R10 及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F, パラ-OH 又は パラ-O-C1-3 - アルキルを示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5は一緒になって3,4-OCH=CH- を示す。}
に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩。 - R5 がHであり, そしてR4 がメタ-OCH3である、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5がHであり, そしてR4 がメタ-OHである、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体 。
- X がOH, F, Cl, 又は Hを示し、
R1 がC1-4-アルキル基であり、
R2 が CH3を示し、
R3 がHであり、そして
R5 がHを示し、そして R4がメタ-O-C1-3-アルキル, メタ-OH, メタ-S- C1-3-アルキル, メタ-F, メタ-Cl, メタ-CH3, メタ- CF2H, メタ-CF3, 又は パラ-CF3を示すか、 又は
R5 がパラ-Cl, 又は パラ-Fを示し、そしてR4がメタ-Cl, 又は メタ-Fを示すか, 又は
R4 及びR5 が一緒になって 3,4-OCH=CH-を示す、
請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体 。 - X が OH, F, Cl, 又はOCOR6基(式中、 R6 がC1-3-アルキル基である。)を示す、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R2 がCH3, そしてR3 がHである、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R9, R10 及び R11 が Fを示す、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOHを示す、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが F, Cl, H又はOCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5がHであり、そして R4 がメタ-OCH3である、請求項1記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5がHであり、そして R4 がメタ-OHである、請求項1記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOH, F, Cl又は OCOR6基(式中、R6 がC1-3-アルキル基である。)を示す、請求項1記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R9, R10 及びR11 がFを示す、請求項1記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOHを示す、請求項1記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが F, Cl, H又はOCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項1記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 式Ia’及びIc’
X がOH, F, Cl, H又はOCOR6基(式中、R6 がC1-3-アルキル基である。)を示し、
R1 がC1-4-アルキル基であり、
R2 がC1-4-アルキル基を示し、そして
R3 はR2 と異なり、H又は直鎖状C1-3-アルキル基を示し、これによってX及びジメチルアミノ基は互いに対してスレオに配置され、そして
R5 は Hを示し、そしてR4はメタ-O-Z
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3 - アルキル) 又は-CH 2 C 6H5 である。]
を示すか、
又は R4 はメタ-S-C1-3 -アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, 又は パラ-CR9R10R11(式中、R9, R10及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F又はパラ-OH を示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5 は一緒になって3,4-OCH=CH- を示す。}
のうちの少なくとも1種に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩。 - XがOH, F, Cl 又はHを示し、
R1 が C1-4-アルキル基を示し、
R2 がCH3を示し、
R3 がHであり、そして
R5 がHを示し、そしてR4 がメタ-OC1-3-アルキル, メタ-OH, メタ-S-C1-3-アルキル, メタ-F, メタ-Cl, メタ-CH3, メタ-CF2H, メタ-CF3 又はパラ-CF3を示すか、又は
R5 がパラ-Cl 又はパラ-Fを示し、そしてR4 がメタ-Cl又はメタ-Fを示すか、又は
R4 及びR5 が一緒になって3,4-OCH=CH-を示す、
請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。 - R5がHであり、そして R4がメタ-OCH3である、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5がHであり、そして R4がメタ-OHである、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOH, F, Cl又は OCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R2 がCH3 であり及びR 3がHである、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R9, R10 及びR11 がFを示す、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOHを示す、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが F, Cl, H又はOCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 式Ia 及びIc
X がOH, F, Cl, H又はOCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、
R1 がC1-4-アルキル基を示し、
R2 が C1-4-アルキル基を示し、そして
R5 は Hを示し、そしてR4はメタ-O-Z
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3 - アルキル) 又は-CH 2 C 6H5 である。]
を示すか、又は
R4 はメタ-S-C1-3 -アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, 又は パラ-CR9R10R11(式中、R9, R10及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F又はパラ-OH を示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5 は一緒になって3,4-OCH=CH- を示す。}
のうちの少なくとも1種に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩。 - R5 がHであり、そして R4 がメタ-OCH3である、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5 がHであり、そして R4 がメタ-OHである、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。.
- XがOH, F, Cl又は OCOR6基(式中、R6 がC1-3-アルキル基である。)を示す、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R9, R10 及びR11 がFを示す、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOHを示す、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが F, Cl, H又はOCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 式 Ic’
X はOH, F, Cl, H 又はOCOR6 基(式中、R6 は C1-3 -アルキル基である。)を示し、
R1 はC1-4 -アルキル基であり、
R2 は C1-4 -アルキル基を示し、そして
R3 はR2 と異なり、H又は直鎖状C1-3-アルキル基を示し、これによってX及びジメチルアミノ基は互いに対してスレオに配置され、そして
R5 は Hを示し、そしてR4はメタ-O-Z
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3 - アルキル) 又は-CH 2 C 6H5 である。]
を示すか、又は
R4 はメタ-S-C1-3 -アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, 又は パラ-CR9R10R11(式中、R9, R10及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F又はパラ-OH を示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5 は一緒になって3,4-OCH=CH- を示す。}
に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩。 - XがOH, F, Cl 又はHを示し、;
R1 が C1-4-アルキル基を示し、;
R2 がCH3を示し、
R3 がHであり、そして
R5 がHを示し、そしてR4 がメタ-OC1-3-アルキル, メタ-OH,
メタ-S-C1-3-アルキル, メタ-F, メタ-Cl, メタ-CH3, メタ-CF2H, メタ-CF3 又は パラ-CF3を示すか、又は
R5 がパラ-Cl 又はパラ-Fを示し、そしてR4 がメタ-Cl又はメタ-Fを示すか、又は
R4 及びR5 が一緒になって3,4-OCH=CH-を示す、
請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。 - R5がHであり、そして R4がメタ-OCH3を示す、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5がHであり、そして R4 がメタ-OHである、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOH, F, Cl又は OCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R2 がCH3であり、そしてR3 がHである、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R9, R10 及びR11がFを示す、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOHを示す、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが F, Cl, H又はOCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 式 Ic
X はOH, F, Cl, H 又はOCOR6 基(式中、R6 は C1-3 -アルキル基である。)を示し、
R1 はC1-4 -アルキル基であり、
R2 は C1-4 -アルキル基を示し、そして
R5 は Hを示し、そしてR4はメタ-O-Z
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3 - アルキル) 又は-CH 2 C 6H5 である。]
を示すか、又は
R4 はメタ-S-C1-3 -アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, 又は パラ-CR9R10R11(式中、R9, R10及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F又はパラ-OH を示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5 は一緒になって3,4-OCH=CH- を示す。}
に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩。 - R5 がHであり、そして R4 がメタ-OCH3である、請求項43記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5 がHであり、そして R4 がメタ-OHである、請求項43記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOH, F, Cl又は OCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項43記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R9, R10 及びR11 がFを示す、請求項43記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがOHを示す、請求項43記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが F, Cl, H又はOCOR6 基(式中、R6 がC1-3-アルキル基である。)を示す、請求項43記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 化合物が、
(2S, 3S)-1-ジメチルアミノ-3-(3-メトキシフェニル)-2-メチルペンタン-3-オール塩酸塩 (-1),
(+)-(2R, 3R)-1-ジメチルアミノ-3-(3-メトキシフェニル)-2-メチルペンタン-3-オール塩酸塩 (+1),
(±)-(2RS, 3RS)-1-ジメチルアミノ-3-(3-メトキシフェニル)-2-メチルペンタン-3-オール塩酸塩 (±1),
(+)-(2S,3S)-[3-(3-メトキシフェニル)-2-メチルペンチル]-ジメチルアミン塩酸塩 (+23),
(-)-(2R,3R)-[3-(3-メトキシフェニル)-2-メチルペンチル]-ジメチルアミン塩酸塩 (-23)及び
(±)-(2RS, 3RS)-[3-(3-メトキシフェニル)-2-メチルペンチル]-ジメチルアミン塩酸塩 (±23)
より成る群から選ばれる、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。 - 化合物が、(+)-(1S,2S)-3-(3-ジメチルアミノ-1-エチル-2-メトキシプロピル)-フェノール塩酸塩(+21)である、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 化合物が、(-)-(1R,2R)-3-(3-ジメチルアミノ-1-エチル-2-メトキシプロピル)-フェノール塩酸塩(-21)である、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 化合物が(±)-(1RS,2RS)-3-(3-ジメチルアミノ-1-エチル-2-メトキシプロピル)-フェノール塩酸塩 (±21)である、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- 式Ia及びIc
X がOH, F, Cl 又は Hを示す、
R1 がC1-4-アルキル基を示し、
R2 が C1-4-アルキル基を示し、そして
R5 は Hを示し、そしてR4はメタ-O-Z [式中、 Z はH,又は C1-3 -アルキルである。]を示すか、又は
R4 はメタ-S-C1-3 -アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11又はパラ-CR9R10R11(式中、R9, R10及びR11 は独立して H 又は Fを示す。)を示すか、 又は
R5 はパラ-Cl, パラ-F 又はパラ-OH を示し、そして R4 はメタ-Cl, メタ-F, 又はメタ-OH を示すか, 又は
R4 及び R5 は一緒になって3,4-OCH=CH--を示す。}
のうちの少なくとも1種に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体又はこれと生理学的に許容し得る酸との塩、及び少なくとも1種の薬学的キャリヤー又は佐剤を含む鎮痛剤。 - R5 がHであり、そして R4 がメタ-OCH3である、請求項54記載の鎮痛剤。
- R5がHであり、そして R4がメタ-OHである、請求項54記載の鎮痛剤。
- XがOH, F,又はClを示す、請求項54記載の鎮痛剤。
- R9, R10 及びR11 がFを示す、請求項54記載の鎮痛剤。
- XがOHを示す、請求項54記載の鎮痛剤。
- Xが F, Cl又は Hを示す、請求項54記載の鎮痛剤。
- 1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体が、式 Iaに相当する立体配置を有する、請求項54記載の鎮痛剤。
- 1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体が、式 Icに相当する立体配置を有する、 請求項54記載の鎮痛剤。
- Xが Hである、請求項1記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが Hである、請求項3記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが Hである、請求項18記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが Hである、請求項27記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが Hである、請求項34記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- Xが Hである、請求項43記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- XがHである、請求項54記載の鎮痛剤。
- XがHである、請求項61載の鎮痛剤。
- XがHである、請求項62記載の鎮痛剤。
- 式 I
Xは Hを示し、
R1 はC1-4-アルキル基を示し、,
R2 は C1-4-アルキル基を示し、,
R3 はR2と異なり、そして H 又は 直鎖状 C1-3-アルキル基を示し、そして
R5 はHを示し、そしてR4がメタ-O-Z,
[式中、 Z はH, C1-3-アルキル, CONH-C 6H4 -(C1-3 - アルキル) 又は-CH 2 C 6H5 である。]
を示すか、又は
R4 はメタ-S-C1-3 -アルキル, メタ-Cl, メタ-F, メタ-CR9R10R11, 又は パラ-CR9R10R11(式中、R9, R10及びR11 は独立して H 又は Fを示す。)を示すか、又は
R5 はパラ-Cl, パラ-F, 又はパラ-OH を示し、そして R4 はメタ-Cl, メタ-F又はメタ-OH を示すか, 又は
R4 及び R5 は一緒になって3,4-OCH=CH- を示す。}
に相当する立体配置を有する、単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体 [但し、1及び2位の炭素原子は双方とも不斉炭素であり、そしてそのジアステレオマーは(1R, 2R) 又は (1S, 2S) 立体配置を有する] 又はこれと生理学的に許容し得る酸との塩。 - R5 がHであり、そしてR4がメタ-OCH3である、請求項72記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R5 がHであり、そしてR4 がメタ-OHである、請求項72記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R2 がCH3を示し、
R3 がHであり、そして
R5 がHを示し、そしてR4がメタ-O-C1-3-アルキル, メタ-OH, メタ-S- C1-3-アルキル, メタ-F, メタ-Cl, メタ-CH3, メタ- CF2H, メタ-CF3, 又は パラ-CF3を示すか、又は
R5 がパラ-Cl, 又はパラ-Fを示し、そしてR4がメタ-Cl, 又は メタ -Fを示すか、又は
R4及びR5が一緒になって3,4-OCH=CH-を示す、
請求項72記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。 - R2がCH3であり、そしてR3がHである、請求項72記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- R9, R10 及びR11 がFを示す、請求項72記載の単離された1-フェニル-3-ジメチルアミノプロパンジアステレオ異性体。
- (-)-(1R,2R)-3-(3-ジメチルアミノ-1-エチル-2-メトキシプロピル)-フェノールの薬学的に許容し得る塩。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE4426245A DE4426245A1 (de) | 1994-07-23 | 1994-07-23 | 1-Phenyl-3-dimethylamino-propanverbindungen mit pharmakologischer Wirkung |
| DE4426245:0 | 1994-07-23 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006342354A Division JP4846552B2 (ja) | 1994-07-23 | 2006-12-20 | 1−フエニル−3−ジメチルアミノ−プロパン化合物の製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH0899939A JPH0899939A (ja) | 1996-04-16 |
| JP4034366B2 true JP4034366B2 (ja) | 2008-01-16 |
Family
ID=6524045
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP18603195A Expired - Lifetime JP4034366B2 (ja) | 1994-07-23 | 1995-07-21 | 薬理学的作用を有する1 − フエニル−3− ジメチルアミノ− プロパン化合物 |
| JP2006342354A Expired - Lifetime JP4846552B2 (ja) | 1994-07-23 | 2006-12-20 | 1−フエニル−3−ジメチルアミノ−プロパン化合物の製造方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006342354A Expired - Lifetime JP4846552B2 (ja) | 1994-07-23 | 2006-12-20 | 1−フエニル−3−ジメチルアミノ−プロパン化合物の製造方法 |
Country Status (31)
| Country | Link |
|---|---|
| US (3) | US6248737B1 (ja) |
| EP (1) | EP0693475B1 (ja) |
| JP (2) | JP4034366B2 (ja) |
| KR (1) | KR100364465B1 (ja) |
| CN (1) | CN1077566C (ja) |
| AT (1) | ATE163176T1 (ja) |
| AU (1) | AU685644B2 (ja) |
| BR (1) | BR9502390A (ja) |
| CA (1) | CA2154424C (ja) |
| CO (1) | CO4410179A1 (ja) |
| CZ (1) | CZ286441B6 (ja) |
| DE (3) | DE4426245A1 (ja) |
| DK (1) | DK0693475T3 (ja) |
| ES (1) | ES2115298T3 (ja) |
| FI (1) | FI114704B (ja) |
| FR (1) | FR12C0016I2 (ja) |
| GR (1) | GR3026326T3 (ja) |
| HK (1) | HK1005062A1 (ja) |
| HU (1) | HU218481B (ja) |
| IL (1) | IL113901A (ja) |
| LT (1) | LTPA2011007I1 (ja) |
| LU (1) | LU91793I2 (ja) |
| MY (1) | MY114889A (ja) |
| NZ (1) | NZ272623A (ja) |
| PE (1) | PE34896A1 (ja) |
| PL (1) | PL181169B1 (ja) |
| RU (1) | RU2150465C1 (ja) |
| SI (1) | SI0693475T1 (ja) |
| UA (1) | UA41345C2 (ja) |
| UY (1) | UY23992A1 (ja) |
| ZA (1) | ZA956118B (ja) |
Families Citing this family (174)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1088585C (zh) * | 1994-02-08 | 2002-08-07 | Nps药物有限公司 | 在受体操纵性钙通道上的新位点具有活性的可用于治疗神经障碍和其他疾病的化合物 |
| JP2000506157A (ja) * | 1996-03-08 | 2000-05-23 | サンテラボ | (2―アミノエチル)ベンゾフラン誘導体、その製造およびその治療的使用 |
| FR2745815B1 (fr) * | 1996-03-08 | 1998-06-26 | Synthelabo | Derives de benzofurane, leur preparations et compositions pharmaceutiques les comprenant |
| DE19609847A1 (de) * | 1996-03-13 | 1997-09-18 | Gruenenthal Gmbh | Dimethyl-(3-aryl-but-3-enyl)-aminverbindungen als pharmazeutische Wirkstoffe |
| DE19732928C2 (de) * | 1997-07-31 | 2000-05-18 | Gruenenthal Gmbh | Verwendung substituierter Imidazolidin-2,4-dion-Verbindungen als Schmerzmittel |
| DE19933421A1 (de) | 1999-07-16 | 2001-01-25 | Gruenenthal Gmbh | 2-Benzyl-3-dimethylamino-1-phenyl-propanderi- vate |
| PE20010623A1 (es) * | 1999-10-05 | 2001-07-07 | Gruenenthal Chemie | Uso de (+)-tramadol y/o o-demetiltramadol para tratamiento de urgencia urinaria incrementada y/o incontinencia urinaria |
| DE10000312A1 (de) * | 2000-01-05 | 2001-07-12 | Gruenenthal Gmbh | Substituierte Aminomethyl-Phenyl-Cyclohexanderivate |
| DE10059412A1 (de) | 2000-11-30 | 2002-06-13 | Gruenenthal Gmbh | Verwendung von 1-Phenyl-3-dimethylamino-propanverbindungen zur Therapie der Harninkontinenz |
| US20050176790A1 (en) * | 2001-02-28 | 2005-08-11 | Johannes Bartholomaus | Pharmaceutical salts |
| DE10109763A1 (de) * | 2001-02-28 | 2002-09-05 | Gruenenthal Gmbh | Pharmazeutische Salze |
| DE10146275A1 (de) * | 2001-09-18 | 2003-04-24 | Gruenenthal Gmbh | Kombination ausgewählter Opioide mit Muscarin-Antagonisten zur Therapie der Harninkontinenz |
| DE10152469A1 (de) * | 2001-10-24 | 2003-06-26 | Gruenenthal Gmbh | 3-(3-Dimethylamino-1-ethyl-2-methyl-propyl)phenol enthaltendes Arzneimittel mit verzögerter Wirkstofffreisetzung |
| PE20030527A1 (es) * | 2001-10-24 | 2003-07-26 | Gruenenthal Chemie | Formulacion farmaceutica con liberacion retardada que contiene 3-(3-dimetilamino-1-etil-2-metil-propil) fenol o una sal farmaceuticamente aceptable del mismo y tabletas para administracion oral que la contienen |
| US20080057011A1 (en) * | 2001-12-12 | 2008-03-06 | L'oreal S.A., | Composition structured with a polymer containing a heteroatom and an Organogelator |
| DE10161809A1 (de) * | 2001-12-14 | 2003-06-26 | Gruenenthal Gmbh | Arzneimittel enthaltend N,N'-disubstituierte Piperazin-Verbindungen |
| DE10161644A1 (de) * | 2001-12-14 | 2003-06-26 | Gruenenthal Gmbh | N,N'-disubstituierte Piperazin-Verbindungen |
| DE10163421A1 (de) * | 2001-12-21 | 2003-07-31 | Gruenenthal Gmbh | Verwendung von (+)-(1S,2S)-3-(3-Dimethylamino-1-ethyl-2-methyl-propyl)phenol als Antiemetikum |
| US20050137194A1 (en) * | 2002-05-29 | 2005-06-23 | Gruenenthal Gmbh | Combination of selected opioids with other active compounds for treatment of urinary incontinence |
| US7410965B2 (en) * | 2002-05-29 | 2008-08-12 | Gruenenthal Gmbh | Delayed release pharmaceutical composition containing 1-dimethyl-amino-3-(3-methoxyphenyl)-2-methyl-pentan-3-ol |
| DE10224108A1 (de) * | 2002-05-29 | 2004-01-29 | Grünenthal GmbH | 1-Dimethylamino-3-(3-methoxy-phenyl)-2-methyl-pentan-3-ol enthaltendes Arzneimiitel mit verzögerter Wirkstofffreisetzung |
| DE10224624A1 (de) * | 2002-05-30 | 2003-12-11 | Gruenenthal Gmbh | Metabolite und Prodrugs von 1-Dimethylamino-3-(3-methoxy-phenyl)-2-methyl-pentan-3-ol |
| US20050137145A1 (en) * | 2002-05-30 | 2005-06-23 | Gruenenthal Gmbh | Metabolites of 1-dimethylamino-3-(3-methoxy-phenyl)-2-methyl-pentan-3-ol and their use in the treatment of urinary incontinence |
| DE10224556A1 (de) * | 2002-05-31 | 2004-01-08 | Grünenthal GmbH | 1-Dimethylamino- 3-(3-methoxy-phenyl)2-methyl-pentan-3-ol entaltendes Arzneimittel in verschiedenen Formulierungen |
| DE10225315A1 (de) * | 2002-06-06 | 2003-12-24 | Gruenenthal Gmbh | Wirkstoffsalze und Ester von 1-Dimethylamino-3-(3-methoxy-phenyl)-2-methyl- pentan-3-ol und 3-(3-Dimethylamino-1-ethyl-1-hydroxy-2-methyl- propyl)-phenol |
| US7550624B2 (en) * | 2002-06-06 | 2009-06-23 | Gruenenthal Gmbh | Pharmaceutically active salts and esters of 1-dimethylamino-3-(3-methoxyphenyl)-2-methylpentan-3-ol and 3- (3-dimethylamino-1-ethyl-1-hydroxy-2-methylpropyl)-phenol and methods of using same |
| US7776314B2 (en) | 2002-06-17 | 2010-08-17 | Grunenthal Gmbh | Abuse-proofed dosage system |
| DE10228192A1 (de) * | 2002-06-24 | 2004-01-15 | Grünenthal GmbH | Darreichungsform zur oralen Verabreichung von Wirkstoffen, Vitaminen und/oder Nährstoffen |
| CA2492468A1 (en) * | 2002-09-24 | 2004-04-08 | Virginia Commonwealth University | .beta.-hydroxyphenylalkylamines and their use for treating glaucoma |
| DK1562567T3 (en) | 2002-11-22 | 2017-07-17 | Gruenenthal Gmbh | Combination of selected analgesics with COX II inhibitors |
| DE10326097A1 (de) * | 2003-06-06 | 2005-01-05 | Grünenthal GmbH | Verfahren zur Herstellung von Dimethyl-(3-aryl-butyl)-aminverbindungen |
| DE10328316A1 (de) | 2003-06-23 | 2005-01-20 | Grünenthal GmbH | Verfahren zur Herstellung von Dimethyl-(3-aryl-buthyl)-aminverbindungen als pharmazeutische Wirkstoffe |
| DE102005005446A1 (de) | 2005-02-04 | 2006-08-10 | Grünenthal GmbH | Bruchfeste Darreichungsformen mit retardierter Freisetzung |
| US20070048228A1 (en) * | 2003-08-06 | 2007-03-01 | Elisabeth Arkenau-Maric | Abuse-proofed dosage form |
| DE10336400A1 (de) * | 2003-08-06 | 2005-03-24 | Grünenthal GmbH | Gegen Missbrauch gesicherte Darreichungsform |
| DE102004032051A1 (de) * | 2004-07-01 | 2006-01-19 | Grünenthal GmbH | Verfahren zur Herstellung einer gegen Missbrauch gesicherten, festen Darreichungsform |
| DE10361596A1 (de) | 2003-12-24 | 2005-09-29 | Grünenthal GmbH | Verfahren zur Herstellung einer gegen Missbrauch gesicherten Darreichungsform |
| US8075872B2 (en) * | 2003-08-06 | 2011-12-13 | Gruenenthal Gmbh | Abuse-proofed dosage form |
| DE102004020220A1 (de) * | 2004-04-22 | 2005-11-10 | Grünenthal GmbH | Verfahren zur Herstellung einer gegen Missbrauch gesicherten, festen Darreichungsform |
| DE102004019916A1 (de) * | 2004-04-21 | 2005-11-17 | Grünenthal GmbH | Gegen Missbrauch gesichertes wirkstoffhaltiges Pflaster |
| CN1984879B (zh) * | 2004-05-14 | 2011-07-27 | 詹森药业有限公司 | 甲酰胺基阿片样化合物 |
| PT1612203E (pt) * | 2004-06-28 | 2007-08-20 | Gruenenthal Gmbh | ''formas cristalinas de cloridrato de (-) - (1r,2r) - 3 -(3-dimetilamino-l-etil - 2 - metilpropil) fenol'' |
| DE102004032049A1 (de) * | 2004-07-01 | 2006-01-19 | Grünenthal GmbH | Gegen Missbrauch gesicherte, orale Darreichungsform |
| US20060160905A1 (en) * | 2005-01-18 | 2006-07-20 | Bergeron Raymond J Jr | Compositions and methods for inhibiting pain |
| CA2595184A1 (en) * | 2005-01-18 | 2006-07-27 | University Of Florida | Compositions and methods for inhibiting pain |
| DE102005005449A1 (de) * | 2005-02-04 | 2006-08-10 | Grünenthal GmbH | Verfahren zur Herstellung einer gegen Missbrauch gesicherten Darreichungsform |
| DE102005033732B4 (de) * | 2005-05-27 | 2014-02-13 | Grünenthal GmbH | Trennung stereoisomerer N,N-Dialkylamino-2-alkyl-3-hydroxy-3-phenyl-alkane |
| DE202005014347U1 (de) * | 2005-09-09 | 2007-01-18 | Grünenthal GmbH | Applikationssystem für ein wirkstoffhaltiges Pflaster und Wirkstoffabgaberegulierungsmittel |
| US20090104266A1 (en) * | 2005-09-15 | 2009-04-23 | Tobias Jung | 3-(2-dimethylaminomethylcy clohexyl)phenol retard formulation |
| DE102005052588A1 (de) * | 2005-11-02 | 2007-05-10 | Grünenthal GmbH | Verfahren zur Herstellung substituierter Dimethyl-(3-aryl-butyl)-amin-Verbindungen mittels homogener Katalyse |
| AU2007247481B2 (en) * | 2006-04-28 | 2013-02-14 | Grunenthal Gmbh | Pharmaceutical combination comprising 3- ( 3-Dimethylamino-1-ethyl-2-methyl-propyl) -phenol and paracetamol |
| US20070254960A1 (en) * | 2006-04-28 | 2007-11-01 | Gruenenthal Gmbh | Pharmaceutical combination |
| SI2012763T1 (sl) * | 2006-04-28 | 2011-06-30 | Gruenenthal Gmbh | Farmacevtska kombinacija, ki obsega 3-(3-dimetilamino-1-etil-2-metil- propil)-fenol in NSAID |
| MX2009000911A (es) | 2006-07-24 | 2009-02-04 | Janssen Pharmaceutica Nv | Preparacion de (2r,3r)-3-(3-metoxifenil)-n,n,2-trimetilpentanamina . |
| TWI448447B (zh) * | 2006-07-24 | 2014-08-11 | Gruenenthal Chemie | 製備(1r,2r)-3-(3-二甲胺基-1-乙基-2-甲基-丙基)-酚之方法 |
| TWI401237B (zh) * | 2006-07-24 | 2013-07-11 | 3-〔(1r,2r)-3-(二甲基氨基)-1-乙基-2-甲基丙基〕酚之製備 | |
| SA07280459B1 (ar) | 2006-08-25 | 2011-07-20 | بيورديو فارما إل. بي. | أشكال جرعة صيدلانية للتناول عن طريق الفم مقاومة للعبث تشتمل على مسكن شبه أفيوني |
| DE102007011485A1 (de) | 2007-03-07 | 2008-09-11 | Grünenthal GmbH | Darreichungsform mit erschwertem Missbrauch |
| DE102007012165A1 (de) * | 2007-03-12 | 2008-09-18 | Grünenthal GmbH | Verwendung von 1-Phenyl-3-dimethylamino-propanverbindungen zur Therapie des Neuropathieschmerzes |
| DE102007019417A1 (de) | 2007-04-23 | 2008-11-13 | Grünenthal GmbH | Tapentadol zur Schmerzbehandlung bei Arthrose |
| EP1985292A1 (en) * | 2007-04-23 | 2008-10-29 | Grünenthal GmbH | Titration of tapentadol |
| US20090076164A1 (en) * | 2007-09-15 | 2009-03-19 | Protia, Llc | Deuterium-enriched tapentadol |
| KR101784777B1 (ko) | 2007-11-23 | 2017-11-06 | 그뤼넨탈 게엠베하 | 타펜타돌 조성물 |
| SI2240431T1 (sl) * | 2007-12-07 | 2017-05-31 | Gruenenthal Gmbh | Kristalinične modifikacije (1R,2R)-3-(3-dimetilamino-1-etil-2-metil-propil)-fenola |
| CA2713128C (en) | 2008-01-25 | 2016-04-05 | Gruenenthal Gmbh | Pharmaceutical dosage form |
| FR2927076B1 (fr) * | 2008-01-31 | 2010-03-26 | Oroxcell | Derives de 2-amino-2-phenyl-alkanol, leur preparation et les compositions pharmaceutiques qui les contiennent |
| PT2273983T (pt) | 2008-05-09 | 2016-10-28 | Gruenenthal Gmbh | Processo para a preparação de uma formulação em pó intermediária e uma forma de dosagem sólida final sob utilização de uma etapa de congelamento por atomização |
| US20100190752A1 (en) | 2008-09-05 | 2010-07-29 | Gruenenthal Gmbh | Pharmaceutical Combination |
| KR101730924B1 (ko) | 2008-09-05 | 2017-04-27 | 그뤼넨탈 게엠베하 | 3-(3-디메틸아미노-1-에틸-2-메틸-프로필)-페놀과 항간질제의 약제학적 병용물 |
| EP2352494B1 (en) | 2008-10-30 | 2019-10-09 | Grünenthal GmbH | Novel and potent tapentadol dosage forms |
| US20100272815A1 (en) * | 2009-04-28 | 2010-10-28 | Actavis Group Ptc Ehf | Amorphous form of tapentadol hydrochloride |
| JP5993303B2 (ja) | 2009-04-30 | 2016-09-14 | グリュネンタール・ゲゼルシャフト・ミト・ベシュレンクテル・ハフツング | リウマチ性痛を治療するための1−フェニル−3−ジメチルアミノプロパン化合物の使用 |
| BR112012001547A2 (pt) | 2009-07-22 | 2016-03-08 | Gruenenthal Gmbh | forma de dosagem farmacêutica extrusada por fusão a quente |
| PE20120572A1 (es) | 2009-07-22 | 2012-06-06 | Gruenenthal Chemie | Forma de dosificacion de oxidacion estabilizada resistente a la manipulacion |
| CN102002065B (zh) * | 2009-09-02 | 2014-09-10 | 上海特化医药科技有限公司 | 他喷他多的制备方法及其中间体 |
| US8288592B2 (en) * | 2009-09-22 | 2012-10-16 | Actavis Group Ptc Ehf | Solid state forms of tapentadol salts |
| IT1397189B1 (it) * | 2009-12-01 | 2013-01-04 | Archimica Srl | Nuovo processo per la preparazione di tapentadol e suoi intermedi. |
| CN102711461A (zh) * | 2009-12-29 | 2012-10-03 | Mapi医药公司 | 用于制备他喷他多及相关化合物的中间体化合物和方法 |
| WO2011080756A1 (en) * | 2009-12-29 | 2011-07-07 | Ind-Swift Laboratories Limited | Process for the preparation of 1-phenyl-3-dimethylaminopropane derivatives |
| WO2011092719A2 (en) * | 2010-02-01 | 2011-08-04 | Ind-Swift Laboratories Limited | Process for the preparation of l-phenyl-3-dimethylaminopropane derivatives |
| EP2531176B1 (en) | 2010-02-03 | 2016-09-07 | Grünenthal GmbH | Preparation of a powdery pharmaceutical composition by means of an extruder |
| WO2011107876A2 (en) | 2010-03-05 | 2011-09-09 | Actavis Group Ptc Ehf | Improved resolution methods for isolating desired enantiomers of tapentadol intermediates and use thereof for the preparation of tapentadol |
| CA2793948A1 (en) | 2010-04-05 | 2011-10-20 | Actavis Group Ptc Ehf | Novel process for preparing highly pure tapentadol or a pharmaceutically acceptable salt thereof |
| AU2011236548A1 (en) | 2010-04-07 | 2012-11-01 | Lupin Limited | Controlled release pharmaceutical compositions of tapentadol |
| EP2383255A1 (en) | 2010-04-28 | 2011-11-02 | Lacer, S.A. | New compounds, synthesis and use thereof in the treatment of pain |
| EP2566461A2 (de) | 2010-05-05 | 2013-03-13 | Ratiopharm GmbH | Festes tapentadol in nicht-kristalliner form |
| ITMI20100924A1 (it) * | 2010-05-21 | 2011-11-22 | Fidia Farmaceutici | Nuovo metodo di sintesi delle due forme enantiomeriche del tapentadol |
| BR112012031836A2 (pt) * | 2010-06-15 | 2016-11-08 | Gruenenthal Gmbh | combinação farmacêutica para o tratamento da dor |
| WO2011157390A2 (en) | 2010-06-15 | 2011-12-22 | Grünenthal GmbH | Process for the preparation of substituted 3-(1-amino-2-methylpentane-3-yl)phenyl compounds |
| AU2011273907B2 (en) | 2010-06-30 | 2015-03-19 | Grunenthal Gmbh | Tapentadol for use in the treatment of Irritable Bowel Syndrome |
| IT1401109B1 (it) | 2010-07-02 | 2013-07-12 | Archimica Srl | Nuovo processo per la preparazione di tapentadol e suoi intermedi. |
| EP3650439B1 (en) * | 2010-07-23 | 2021-02-24 | Grünenthal GmbH | Salts or co-crystals of 3-(3-dimethylamino-1-ethyl-2-methyl-propyl)-phenol |
| WO2012023147A1 (en) | 2010-08-16 | 2012-02-23 | Indoco Remedies Limited | Process for the preparation of tapentadol |
| AU2011297892B2 (en) | 2010-09-02 | 2014-05-29 | Grunenthal Gmbh | Tamper resistant dosage form comprising an anionic polymer |
| MX2013002377A (es) | 2010-09-02 | 2013-04-29 | Gruenenthal Gmbh | Forma de dosificacion resistente a manipulacion que comprende una sal inorganica. |
| CN101948397A (zh) * | 2010-09-07 | 2011-01-19 | 天津泰普药品科技发展有限公司 | 镇痛药他喷他多重要中间体的制备方法 |
| EP2619174A4 (en) | 2010-09-20 | 2014-05-14 | Ind Swift Lab Ltd | PROCESS FOR THE PREPARATION OF L-PHENYL-3-DIMETHYLAMINOPROPANE DERIVATIVES |
| WO2012051246A1 (en) | 2010-10-12 | 2012-04-19 | Ratiopharm Gmbh | Tapentadol hydrobromide and crystalline forms thereof |
| CZ302992B6 (cs) * | 2010-12-30 | 2012-02-08 | Zentiva, K.S. | Zpusob výroby (2R,3R)-N,N-dimethyl-3-(3-hydroxyfenyl)-2-methylpentylaminu (tapentadolu) |
| CZ303115B6 (cs) * | 2010-12-30 | 2012-04-11 | Zentiva, K.S. | Zpusob výroby (2R,3R)-N,N-dimethyl-3-(3-hydroxyfenyl)-2-methylpentylaminu |
| EP2545028A4 (en) | 2011-01-27 | 2013-07-03 | Symed Labs Ltd | STEREOSPECIFIC SYNTHESIS OF (-) (2S, 3S) -1-DIMETHYLAMINO-3- (3-METHOXYPHENYL) -2-METHYLPENTAN-3-OLE |
| CN102617501A (zh) | 2011-01-31 | 2012-08-01 | 中国科学院上海药物研究所 | 取代正戊酰胺类化合物、其制备方法及用途 |
| CN103501775A (zh) | 2011-03-04 | 2014-01-08 | 格吕伦塔尔有限公司 | 他喷他多的胃肠外给药 |
| SI3287123T1 (sl) | 2011-03-04 | 2020-07-31 | Gruenenthal Gmbh | Vodna farmacevtska formulacija tapentadola za peroralno uporabo |
| PL2680834T3 (pl) | 2011-03-04 | 2018-03-30 | Grünenthal GmbH | Półstała wodna kompozycja farmaceutyczna zawierająca tapentadol |
| EP3449917A3 (en) | 2011-04-05 | 2019-06-05 | Grünenthal GmbH | Tapentadol for preventing chronification of pain |
| PL2694050T3 (pl) | 2011-04-05 | 2020-03-31 | Grünenthal GmbH | Tapentadol do stosowania w leczeniu bólu związanego z nerwobólami nerwu trójdzielnego |
| CN102206164A (zh) * | 2011-04-11 | 2011-10-05 | 中国药科大学 | 一种他喷他多中间体的制备方法 |
| WO2012146978A2 (en) | 2011-04-28 | 2012-11-01 | Actavis Group Ptc Ehf | A novel process for the preparation of tapentadol or a pharmaceutically acceptable salt thereof |
| HRP20171570T1 (hr) | 2011-04-29 | 2017-11-17 | Grünenthal GmbH | Tapentadol za sprječavanje i liječenje depresije i tjeskobe |
| EP2530072A1 (en) | 2011-06-03 | 2012-12-05 | Lacer, S.A. | New compounds, synthesis and use thereof in the treatment of pain |
| US11413239B2 (en) | 2011-07-20 | 2022-08-16 | Torrent Pharmaceuticals Ltd. | Pharmaceutical composition of tapentadol for nasal administration |
| ES2663403T3 (es) | 2011-07-29 | 2018-04-12 | Grünenthal GmbH | Administración intratecal o epidural de 3-[(1S,2S)-3-(dimetilamino)-1-etil-2-metilpropil]fenol |
| NO2736495T3 (ja) | 2011-07-29 | 2018-01-20 | ||
| MX348054B (es) | 2011-07-29 | 2017-05-25 | Gruenenthal Gmbh | Tableta a prueba de alteracion que proporciona liberacion inmediata del farmaco. |
| EP2617706B1 (en) | 2011-07-29 | 2017-09-06 | Anhui New Star Pharmaceutical Development Co., Ltd | Novel intermediate used for preparing tapentadol or analogues thereof |
| WO2013105109A1 (en) | 2011-11-09 | 2013-07-18 | Indoco Remedies Limited | Process for the preparation of tapentadol |
| WO2013090161A1 (en) | 2011-12-12 | 2013-06-20 | Boehringer Ingelheim International Gmbh | Stereoselective synthesis of tapentadol and its salts |
| CN102557851B (zh) * | 2011-12-13 | 2014-03-26 | 安徽省新星药物开发有限责任公司 | 一种盐酸他喷他多及其类似物的合成方法 |
| WO2013111161A2 (en) * | 2012-01-10 | 2013-08-01 | Msn Laboratories Limited | Process for the preparation of 3-aryl-2-methyl-propanamine derivatives and polymorphs thereof |
| WO2013120466A1 (en) | 2012-02-17 | 2013-08-22 | Zentiva, K.S. | A new solid form of tapentadol and a method of its preparation |
| CA2864949A1 (en) | 2012-02-28 | 2013-09-06 | Grunenthal Gmbh | Tamper-resistant dosage form comprising pharmacologically active compound and anionic polymer |
| PT2838512T (pt) | 2012-04-18 | 2018-11-09 | Gruenenthal Gmbh | Forma farmacêutica resistente à adulteração e resistente à libertação inesperada de alta quantidade (dose-dumping) |
| US10064945B2 (en) | 2012-05-11 | 2018-09-04 | Gruenenthal Gmbh | Thermoformed, tamper-resistant pharmaceutical dosage form containing zinc |
| EP2674414A1 (en) | 2012-06-15 | 2013-12-18 | Siegfried AG | Method for the preparation of 1-aryl-1-alkyl-3-dialkylaminopropane compounds |
| CN103159633B (zh) * | 2012-07-06 | 2015-08-12 | 江苏恩华药业股份有限公司 | 他喷他多的制备方法及用于制备他喷他多的化合物 |
| EP2872126B1 (en) | 2012-07-16 | 2017-12-06 | Grünenthal GmbH | Pharmaceutical patch for transdermal administration of tapentadol |
| CZ304576B6 (cs) * | 2012-07-24 | 2014-07-16 | Zentiva, K.S. | Oxalát TAPENTADOLU a způsob jeho přípravy |
| EP2914243A1 (en) | 2012-11-01 | 2015-09-09 | Torrent Pharmaceuticals Limited | Pharmaceutical composition of tapentadol for parenteral administration |
| US9090539B2 (en) | 2013-05-24 | 2015-07-28 | Ampac Fine Chemicals Llc | Compounds and methods for preparing substituted 3-(1-amino-2-methylpentane-3-yl)phenyl compounds |
| JP6466417B2 (ja) | 2013-05-29 | 2019-02-06 | グリュネンタール・ゲゼルシャフト・ミト・ベシュレンクテル・ハフツング | 二峰性放出プロファイルを有する改変防止(tamper−resistant)剤形 |
| WO2014191397A1 (en) | 2013-05-29 | 2014-12-04 | Grünenthal GmbH | Tamper-resistant dosage form containing one or more particles |
| EP2808319A1 (en) | 2013-05-31 | 2014-12-03 | Arevipharma GmbH | 3-[3-(Dimethylamino)-1-ethyl-2-methylpropyl]phenol resin complex |
| BR112016000194A8 (pt) | 2013-07-12 | 2019-12-31 | Gruenenthal Gmbh | forma de dosagem resistente à violação contendo o polímero de acetato de etileno-vinila |
| EP2845625A1 (en) | 2013-09-04 | 2015-03-11 | Grünenthal GmbH | Tapentadol for use in the treatment of fibromyalgia and chronic fatigue syndrome |
| US9663456B2 (en) | 2013-11-01 | 2017-05-30 | Sun Pharma Advanced Research Company | Intermediate of tapentadol |
| WO2015071248A1 (en) | 2013-11-15 | 2015-05-21 | Synthon B.V. | Abuse-proofed extended release pharmaceutical composition comprising tapentadol |
| WO2015075678A1 (en) | 2013-11-21 | 2015-05-28 | Unimark Remedies Ltd. | A novel process for the preparation of 1-phenyl-3-aminopropane derivatives |
| MX371372B (es) | 2013-11-26 | 2020-01-28 | Gruenenthal Gmbh | Preparacion de una composicion farmaceutica en polvo por medio de criomolienda. |
| SI3083551T1 (en) | 2013-12-16 | 2018-04-30 | Farma Grs, D.O.O. | CRYSTAL FORM INTERMEDIATE TAPENTADOL |
| CN104803861B (zh) * | 2014-01-27 | 2017-05-24 | 上海博邦医药科技有限公司 | 一种合成盐酸他喷他多的方法 |
| CZ307492B6 (cs) | 2014-02-04 | 2018-10-17 | Zentiva, K.S. | Pevná forma maleátu tapentadolu a způsob její přípravy |
| GB2523089A (en) * | 2014-02-12 | 2015-08-19 | Azad Pharmaceutical Ingredients Ag | Stable polymorph form B of tapentadol hydrochloride |
| EP2942054A1 (en) | 2014-05-09 | 2015-11-11 | G.L. Pharma GmbH | Slow-release pharmaceutical formulation |
| CN106572980A (zh) | 2014-05-12 | 2017-04-19 | 格吕伦塔尔有限公司 | 包含他喷他多的防篡改即释胶囊制剂 |
| MX2016015417A (es) | 2014-05-26 | 2017-02-22 | Gruenenthal Gmbh | Multiparticulas protegidas contra vertido de dosis etanolico. |
| US9556108B2 (en) | 2014-07-10 | 2017-01-31 | Mallinckrodt Llc | Process for preparing substituted phenylalkanes |
| PE20171651A1 (es) | 2015-03-27 | 2017-11-13 | Gruenenthal Chemie | Formulacion estable para administracion parenteral de tapentadol |
| AU2016251854A1 (en) | 2015-04-24 | 2017-10-19 | Grunenthal Gmbh | Tamper-resistant dosage form with immediate release and resistance against solvent extraction |
| US10421050B2 (en) * | 2015-05-22 | 2019-09-24 | Digi-Star, Llc | Utilization of a mobile agricultural weighing system to monitor and store ancillary operational data for diagnostic purposes on trailed and truck-mounted equipment |
| WO2016190766A1 (en) | 2015-05-26 | 2016-12-01 | Technophage, Investigação E Desenvolvimento Em Biotecnologia, Sa | Compositions for use in treating parkinson's disease and related disorders |
| CA2991421C (en) | 2015-07-10 | 2019-04-30 | Mallinckrodt Llc | A two-step process for preparing 3-substituted phenylalkylamines |
| JP2018526414A (ja) | 2015-09-10 | 2018-09-13 | グリュネンタール・ゲゼルシャフト・ミト・ベシュレンクテル・ハフツング | 乱用抑止性の即放性製剤を用いた経口過剰摂取に対する保護 |
| HUE054338T2 (hu) | 2015-11-17 | 2021-08-30 | Msn Laboratories Private Ltd | Tapentadol sók kristályos formái és eljárás azok elõállítására |
| PL3653599T3 (pl) | 2016-04-19 | 2023-03-20 | Ratiopharm Gmbh | Krystaliczny fosforan tapentadolu |
| BR112019005439A2 (pt) | 2016-09-23 | 2019-06-18 | Gruenenthal Gmbh | formulação estável para administração parenteral de tapentadol |
| SI3568126T1 (sl) | 2017-01-11 | 2024-03-29 | Torrent Pharmaceuticals Limited | Tapentadolni nazalni sestavek |
| US10292948B2 (en) | 2017-01-11 | 2019-05-21 | Torrent Pharmaceuticals Limited | Tapentadol nasal composition |
| WO2019195775A1 (en) * | 2018-04-06 | 2019-10-10 | Flex Pharma, Inc. | Tolperisone analogs and methods of use |
| CN112262121A (zh) | 2018-06-15 | 2021-01-22 | 法尔玛赞公司 | 用于制备他喷他多的新方法 |
| GR1009751B (el) | 2019-03-22 | 2020-05-29 | "Φαρματεν Α.Β.Ε.Ε." | Σκευασμα παρατεταμενης αποδεσμευσης που περιλαμβανει οξαλικη ταπενταδολη και μεθοδος παρασκευης αυτου |
| GR1009791B (el) | 2019-03-26 | 2020-08-03 | Φαρματεν Α.Β.Ε.Ε. | Σκευασμα παρατεταμενης αποδεσμευσης που περιλαμβανει ταπενταδολη και μεθοδος παρασκευης αυτου |
| AU2020245333A1 (en) | 2019-03-28 | 2021-10-28 | Council Of Scientific And Industrial Research | Process for the preparation of tapentadol and analogs thereof |
| KR102297806B1 (ko) * | 2019-11-11 | 2021-09-03 | 한국생산기술연구원 | 탄탈륨-구리 합금의 제조방법 및 이로부터 제조된 탄탈륨-구리 합금 |
| CN111056961A (zh) * | 2019-11-13 | 2020-04-24 | 李晓强 | 3-((1s,2s)-3-二甲氨基-1-乙基-2-甲基丙基)苯酚盐酸盐的制备方法 |
| MX2022010780A (es) | 2020-03-02 | 2022-09-26 | Gruenenthal Gmbh | Forma de dosificacion que proporciona liberacion prolongada de sal de acido fosforico de tapentadol. |
| HRP20240081T1 (hr) | 2020-03-02 | 2024-05-24 | Grünenthal GmbH | Oblik doziranja koji pruža produljeno oslobađanje soli tapentadol-fosforne kiseline |
| EP3875080B1 (en) | 2020-03-02 | 2025-12-31 | Grünenthal GmbH | EXTENDED-RELEASE DOSAGE FORM OF PHOSPHORIC ACID SALT OF TAPENTADOL |
| DE202020104285U1 (de) | 2020-07-24 | 2020-12-18 | Grünenthal GmbH | Ethylcellulose-beschichtete Partikel enthaltend ein Salz aus Tapentadol und Phosphorsäure |
| MX2023005472A (es) | 2020-11-10 | 2023-05-22 | Gruenenthal Gmbh | Formas de dosificacion de liberacion sostenida de una sal de tapentadol con acido l-(+)-tartarico. |
| ES2927147T3 (es) | 2020-11-10 | 2022-11-02 | Gruenenthal Gmbh | Forma de dosificación que proporciona liberación prolongada de una sal de Tapentadol con ácido L-(+)-tartárico |
| DE202020005470U1 (de) | 2020-11-10 | 2022-01-25 | Grünenthal GmbH | Darreichungsformen mit verlängerter Freisetzung eines Salzes von Tapentadol mit L-(+)-Weinsäure |
| EP4011369A1 (en) | 2020-12-14 | 2022-06-15 | G.L. Pharma GmbH | Aqueous pharmaceutical composition comprising tapentadol tartrate |
| EP4269384A1 (en) | 2022-04-26 | 2023-11-01 | KRKA, d.d., Novo mesto | Method for crystallizing tapentadol intermediate, tapentadol intermediate of high purity, method of making tapentadol and tapentadol of high purity |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE124521C (ja) | ||||
| US2662886A (en) | 1949-01-28 | 1953-12-15 | Winthrop Stearns Inc | Substituted phenylpropylamines |
| DE1051281B (de) * | 1955-07-05 | 1959-02-26 | Bayer Ag | Verfahren zur Herstellung von Derivaten der 1-Aryl-3-aminopropan-1-ole |
| US3328249A (en) | 1965-06-21 | 1967-06-27 | Sterling Drug Inc | Process for counteracting depressive states |
| NL7403348A (ja) * | 1973-03-19 | 1974-09-23 | ||
| DD124521A1 (ja) | 1976-03-16 | 1977-03-02 | ||
| US4608391A (en) | 1977-07-05 | 1986-08-26 | Cornell Research Foundation Inc. | Catecholamine derivatives, a process for their preparation and pharmaceutical compositions thereof |
| DE2732750A1 (de) * | 1977-07-20 | 1979-02-08 | Merck Patent Gmbh | Basische thioaether und verfahren zu ihrer herstellung |
| US4404222A (en) | 1980-08-25 | 1983-09-13 | American Cyanamid Company | Phenylethanolamine derivatives and acid addition salts thereof for enhancing the growth rate of meat-producing animals and improving the efficiency of feed utilization thereby |
| US4336269A (en) | 1979-12-10 | 1982-06-22 | Eli Lilly And Company | Para-nitrophenylalkylamines |
| DE3242922A1 (de) | 1982-11-20 | 1984-05-24 | Basf Ag, 6700 Ludwigshafen | Phenylpropanolamine, ihre herstellung und verwendung |
| IT1213219B (it) | 1984-09-28 | 1989-12-14 | Consiglio Nazionale Ricerche | Derivati amminoalchilnaftalenici ad attivita' farmacologica. |
| US4843160A (en) | 1984-10-01 | 1989-06-27 | The Dow Chemical Company | Preparation of alpha-aminoalkylphenols |
| US5169633A (en) | 1985-07-29 | 1992-12-08 | American Cyanamid Company | Continuous release phenylethanolamine derivative compositions |
| US5059422A (en) | 1985-07-29 | 1991-10-22 | American Cyanamid Company | Continuous release phenylethanolamine derivative compositions |
| EP0296264A1 (de) * | 1987-06-23 | 1988-12-28 | Helopharm W. Petrik GmbH & Co.KG. | Aminopropanolderivate von 3-(2-Hydroxyphenyl)-1-propanonderivaten, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel |
| US4857553A (en) | 1987-08-06 | 1989-08-15 | A. H. Robins Company, Incorporated | Method of treating nausea and vomiting with certain substituted-phenylalkylamino (and aminoacid) derivatives and other serotonin depleting agents |
| SE8800207D0 (sv) * | 1988-01-22 | 1988-01-22 | Kabivitrum Ab | Nya aminer, deras anvendning och framstellning |
| US5135955A (en) | 1988-04-25 | 1992-08-04 | Eli Lilly And Company | Propanamine derivatives |
| FI902028A0 (fi) | 1988-08-24 | 1990-04-23 | Mochida Pharm Co Ltd | Hydantoinderivat. |
| DK258389D0 (da) * | 1989-05-26 | 1989-05-26 | Ferrosan As | Aryloxyphenylpropylaminer, deres fremstilling og anvendelse |
| AU658134B2 (en) | 1989-12-28 | 1995-04-06 | Virginia Commonwealth University | Sigma receptor ligands and the use thereof |
| GB9017390D0 (en) * | 1990-08-08 | 1990-09-19 | Norgine Ltd | Improvements in or relating to propylamine derivatives |
| CA2049481A1 (en) | 1990-08-27 | 1992-02-28 | Jill Ann Panetta | Method of treating inflammatory bowel disease |
| US5281623A (en) | 1990-08-27 | 1994-01-25 | Eli Lilly And Company | Method for treating inflammation |
| US5280046A (en) | 1991-02-22 | 1994-01-18 | The University Of Colorado Foundation, Inc. | Method of treating type I diabetes |
| GB9108222D0 (en) * | 1991-04-17 | 1991-06-05 | Ici Plc | Composition and method |
| US6011068A (en) * | 1991-08-23 | 2000-01-04 | Nps Pharmaceuticals, Inc. | Calcium receptor-active molecules |
| US6031003A (en) * | 1991-08-23 | 2000-02-29 | Nps Pharmaceuticals, Inc. | Calcium receptor-active molecules |
| US6001884A (en) * | 1991-08-23 | 1999-12-14 | Nps Pharmaceuticals, Inc. | Calcium receptor-active molecules |
| US5419993A (en) | 1991-11-01 | 1995-05-30 | Canon Kabushiki Kaisha | Polyamide, electrophotographic photosensitive member employing the polyamide, and electrophotographic apparatus, device unit and facsimile machine employing the member |
| US5322859A (en) | 1993-02-08 | 1994-06-21 | University Of Iowa Research Foundation | Antiglaucoma drug composition and method |
| US6017965A (en) * | 1993-02-08 | 2000-01-25 | Nps Pharmaceuticals, Inc. | Compounds active at a novel site on receptor-operated calcium channels useful for treatment of neurological disorders and diseases |
| US6071970A (en) * | 1993-02-08 | 2000-06-06 | Nps Pharmaceuticals, Inc. | Compounds active at a novel site on receptor-operated calcium channels useful for treatment of neurological disorders and diseases |
| US5387614A (en) | 1993-07-27 | 1995-02-07 | University Of Iowa Research Foundation | Use of sigma receptor ligands as salivary gland stimulants |
| CN1088585C (zh) * | 1994-02-08 | 2002-08-07 | Nps药物有限公司 | 在受体操纵性钙通道上的新位点具有活性的可用于治疗神经障碍和其他疾病的化合物 |
| DK0762877T3 (da) | 1994-06-03 | 2001-07-16 | Thejmde Trust | Meta-substituerede arylalkylaminer og terapeutiske og diagnostiske anvendelser deraf |
| UA55374C2 (uk) | 1994-10-21 | 2003-04-15 | Нпс Фармасьютікалз, Інк | Сполуки, що мають активність по відношенню до рецепторів кальцію |
| DE19525137C2 (de) | 1995-07-11 | 2003-02-27 | Gruenenthal Gmbh | 6-Dimethylaminomethyl-1-phenyl-cyclohexanverbin -dungen als Zwischenprodukte zur Herstellung pharmazeutischer Wirkstoffe |
| US5648541A (en) | 1995-09-28 | 1997-07-15 | Nps Pharmaceuticals, Inc. | Chiral reductions of imines leading to the syntheses of optically active amines |
| US5830509A (en) | 1996-02-07 | 1998-11-03 | West; Daniel David | Microparticle complexes with 2-amino-1-phenylpropanol materials |
| DE19609847A1 (de) * | 1996-03-13 | 1997-09-18 | Gruenenthal Gmbh | Dimethyl-(3-aryl-but-3-enyl)-aminverbindungen als pharmazeutische Wirkstoffe |
| WO1997037967A1 (en) * | 1996-04-09 | 1997-10-16 | Nps Pharmaceuticals, Inc. | Calcilytic compounds |
| EP0907631B1 (en) * | 1996-05-01 | 2003-06-18 | Nps Pharmaceuticals, Inc. | Inorganic ion receptor-active compounds |
| US6052610A (en) * | 1998-01-09 | 2000-04-18 | International Business Machines Corporation | Magnetic catheter tracker and method therefor |
| US6011066A (en) | 1998-02-02 | 2000-01-04 | Veterans General Hospital-Taipei | Method for treating septic shock |
| DE19915601A1 (de) | 1999-04-07 | 2000-10-19 | Gruenenthal Gmbh | 3-Amino-3-arylpropan-1-ol-Derivate, deren Herstellung und Verwendung |
| TWI291871B (en) | 2000-11-01 | 2008-01-01 | Cognition Pharmaceuticals Llc | Pharmaceutical compositions and use of amphetamine compounds for improving memory and learning |
-
1994
- 1994-07-23 DE DE4426245A patent/DE4426245A1/de not_active Withdrawn
-
1995
- 1995-05-29 IL IL11390195A patent/IL113901A/xx active Protection Beyond IP Right Term
- 1995-06-06 US US08/466,911 patent/US6248737B1/en not_active Ceased
- 1995-07-06 UY UY23992A patent/UY23992A1/es not_active IP Right Cessation
- 1995-07-12 DE DE122011000007C patent/DE122011000007I1/de active Pending
- 1995-07-12 AT AT95110864T patent/ATE163176T1/de active
- 1995-07-12 SI SI9530043T patent/SI0693475T1/xx unknown
- 1995-07-12 DE DE59501431T patent/DE59501431D1/de not_active Expired - Lifetime
- 1995-07-12 EP EP95110864A patent/EP0693475B1/de not_active Expired - Lifetime
- 1995-07-12 ES ES95110864T patent/ES2115298T3/es not_active Expired - Lifetime
- 1995-07-12 DK DK95110864T patent/DK0693475T3/da active
- 1995-07-14 UA UA95073330A patent/UA41345C2/uk unknown
- 1995-07-17 HU HU9502146A patent/HU218481B/hu active Protection Beyond IP Right Term
- 1995-07-19 RU RU95113154/04A patent/RU2150465C1/ru active
- 1995-07-19 PE PE1995274181A patent/PE34896A1/es not_active IP Right Cessation
- 1995-07-20 NZ NZ272623A patent/NZ272623A/en not_active IP Right Cessation
- 1995-07-20 MY MYPI95002089A patent/MY114889A/en unknown
- 1995-07-21 CZ CZ19951904A patent/CZ286441B6/cs not_active IP Right Cessation
- 1995-07-21 CO CO95032376A patent/CO4410179A1/es unknown
- 1995-07-21 FI FI953523A patent/FI114704B/fi not_active IP Right Cessation
- 1995-07-21 AU AU27138/95A patent/AU685644B2/en not_active Expired
- 1995-07-21 CN CN95108919A patent/CN1077566C/zh not_active Expired - Lifetime
- 1995-07-21 JP JP18603195A patent/JP4034366B2/ja not_active Expired - Lifetime
- 1995-07-21 ZA ZA956118A patent/ZA956118B/xx unknown
- 1995-07-21 CA CA002154424A patent/CA2154424C/en not_active Expired - Lifetime
- 1995-07-21 PL PL95309734A patent/PL181169B1/pl unknown
- 1995-07-21 BR BR9502390A patent/BR9502390A/pt not_active IP Right Cessation
- 1995-07-22 KR KR1019950021738A patent/KR100364465B1/ko not_active Expired - Lifetime
-
1998
- 1998-03-11 GR GR980400517T patent/GR3026326T3/el unknown
- 1998-05-15 HK HK98104213A patent/HK1005062A1/xx not_active IP Right Cessation
-
2001
- 2001-04-20 US US09/838,192 patent/US6344558B1/en not_active Expired - Lifetime
-
2003
- 2003-06-17 US US10/462,844 patent/USRE39593E1/en not_active Expired - Lifetime
-
2006
- 2006-12-20 JP JP2006342354A patent/JP4846552B2/ja not_active Expired - Lifetime
-
2011
- 2011-03-01 LU LU91793C patent/LU91793I2/fr unknown
- 2011-07-14 LT LTPA2011007C patent/LTPA2011007I1/lt unknown
-
2012
- 2012-03-02 FR FR12C0016C patent/FR12C0016I2/fr active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4034366B2 (ja) | 薬理学的作用を有する1 − フエニル−3− ジメチルアミノ− プロパン化合物 | |
| JP3982853B2 (ja) | 医薬有効物質としての6− ジメチルアミノメチル− 1− フエニル− シクロヘキサン化合物 | |
| JP4846750B2 (ja) | 医薬有効物質としてのジメチル−(3−アリール−ブト−3−エニル)−アミノ化合物 | |
| CA2333004C (en) | Formoterol polymorphs | |
| JP3987598B2 (ja) | 医薬有効物質としての1− フエニル− 2− ジメチルアミノメチル− シクロヘキサン− 1− オール− 化合物 | |
| HK1005062B (en) | 1-phenyl-3-dimethylamino-propane derivatives having pharmacological activity | |
| CA2380857C (en) | Substituted 2-dialkylaminoalkylbiphenyl derivatives | |
| AU2006322057A1 (en) | Process for selective synthesis of enantiomers of substituted 1-(2-amino-1-phenyl-ethyl)-cyclohexanols | |
| HK1026197B (en) | Pharmaceutically-active dimethyl-(3-aryl-but-3-enyl)-amine compounds | |
| MXPA97001865A (en) | Compounds of dimethyl- (3-aril-but-3-enil) -amino as active ingredients farmaceuti |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060620 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20060825 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20060831 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20061220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20061220 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070313 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070514 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20070517 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070829 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20071016 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20071025 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101102 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 4034366 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111102 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121102 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121102 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131102 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |