発明の詳細な説明
〔技術分野〕
本発明は、天然にコードされていないアミノ酸を少なくとも1つ用いて修飾されている、ネコ、イヌおよびウマのエリスロポエチンポリペプチドに関する。
〔背景技術〕
成長ホルモン(GH)スーパージーンファミリー(Bazan, F. Immunology Today 11: 350-354 (1991); Mott, H. R. and Campbell, I. D. Current Opinion in Structural Biology 5: 114-121 (1995); Silvennoinen, O. and Ihle, J. N. (1996) SIGNALING BY THE HEMATOPOIETIC CYTOKINE RECEPTORS)は、類似の構造的な特徴を有している一連のタンパク質を表している。さらに同定されるべき当該ファミリーの多くのメンバーがあり、当該ファミリーのいくつかのメンバーとしては、成長ホルモン、プロラクチン、胎盤性ラクトゲン、エリスロポエチン(EPO)、トロンボポエチン(TPO)、インターロイキン−2(IL−2)、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12(p35サブユニット)、IL−13、IL−15、オンコスタチンM、毛様体神経栄養因子、白血病抑制因子、αインターフェロン、βインターフェロン、γインターフェロン、ωインターフェロン、τインターフェロン、顆粒球コロニー刺激因子(G−CSF)、顆粒球−マクロファージコロニー刺激因子(GM−CSF)、マクロファージコロニー刺激因子(M−CSF)、カルディオトロフィン(CT−1)(“GHスーパージーンファミリー”)が挙げられる。GHスーパージーンファミリーのメンバーは、アミノ酸配列またはDNA配列のわずかな同一性を一般的に有しているに過ぎないにもかかわらず、類似の二次構造および三次構造を有している。
GHスーパージーンファミリーの1つのメンバーはネコエリスロポエチン(fEPO)である。天然に存在しているエリスロポエチン(EPO)は、哺乳類の腎臓および肝臓において産生される分子量34キロダルトン(kDa)の糖タンパク質ホルモンである。EPOは、赤血球新生(赤血球細胞の前駆体の増殖および分化が挙げられる)における重要な要素である。また、EPO活性は、赤血球特異的な多くの遺伝子(グロビンおよび炭酸脱水酵素が挙げられる)の活性化と関連している。例えば、Bondurant et al., Mol. Cell Biol. 5:675-683 (1985); Koury et al., J. Cell. Physiol. 126: 259-265 (1986)を参照すればよい。
エリスロポエチン受容体(EpoR)は、造血性/サイトカイン/成長因子受容体ファミリー(種々の他の成長因子受容体(例えば、インターロイキン(IL)−3、−4および−6の受容体、顆粒球マクロファージコロニー刺激因子(GM−CSF)の受容体ならびにプロラクチンおよび成長ホルモンの受容体)が挙げられる)のメンバーである。Bazan, Proc. Natl. Acad. Sci USA 87: 6934-6938 (1990)を参照すればよい。サイトカイン受容体ファミリーのメンバーは、保存されている4つのシステイン残基および膜貫通領域のすぐ外側に位置しているトリプトファン−セリン−X−トリプトファン−セリンのモチーフを含んでいる。保存されている配列はタンパク質−タンパク質の相互作用に関与していると考えられている。例えば、Chiba et al., Biochim. Biophys. Res. Comm. 184: 485-490 (1992)を参照すればよい。
米国特許第5,441,868号;米国特許第5,547,933号;米国特許第5,618,698号;および米国特許第5,621,080号には、ヒトEPOをコードしているDNA配列、ならびに一次構造の立体配置および天然に存在しているEPOの生物学的な特性の一部もしくはすべてを有している、精製されておりかつ単離されているポリペプチドについて開示されている。
EPOの生物学的な作用は特異的な細胞性の受容体との相互作用に由来する。EPOおよびその受容体(EPObp)の細胞外ドメインの間の相互作用はよく知られている。EPOが2つの受容体結合部位を有しており、その分子上の異なる部位を用いて順に2つの受容体分子と結合することは、高解像度のx線結晶解析データによって示されている。2つの受容体結合部位はSiteIおよびSiteIIと呼ばれている。SiteIはヘリックスDのカルボキシ末端ならびにヘリックスAおよびA−Bループの一部を含んでおり、一方で、SiteIIはヘリックスAのカルボキシ末端およびヘリックスCの部分を含んでいる。その受容体に対するEPOの結合はまずSiteIとから順に生じる。それからSiteIIが第2のEPO受容体をはめ込み、受容体の二量体化および細胞内シグナル伝達経路の活性化を生じて、ホルモンに対する細胞内応答を導く。
組換えヒトEPOは治療薬として使用されており、ヒトの対象の処置に関して認可されている。EPOの欠乏症は、例えばホルモンの外因性の投与によって首尾よく処置される貧血症を導く。
貧血症は2つの分類:再生性および非再生性に大きく分けられる。再生性の貧血症は、失血によって引き起こされるか、または免疫系による赤血球細胞の破壊の結果として引き起こされる傾向にある。一方で、非再生性の貧血症は、骨髄が貧血に応答しないか、または応答できない貧血症である。貧血症の通常の原因は慢性の腎不全(CRF)であり、残りのほとんどの場合がネコ白血病ウイルス(FeLV)による感染症に起因している。これらの2つの疾患は、愛玩動物であるネコの死因の第1位(Felv)および第2位(CRF)である。hEPOはネコの貧血症の処置に使用されている。残念ながら、ネコの貧血症の処置にhEPOを用いた場合の免疫原性に関連しており、hEPOを用いて処置されたネコの約25%〜33%が赤血球形成不全(RCA)にかかった。組換えhEPOを用いて処置されたCRFにかかっている11匹のネコおよび6匹のイヌの試験を含む研究がなされており、赤血球細胞(RBC)および網状赤血球カウントの増加能がいくらか証明されているが、5/11のネコが抗r−hEPO抗体を生じた(LD Cowgill, et al., J Am Vet Med Assoc. 1998 Feb 15;212(4):521-8)。組換えネコエリスロポエチン(rfEPO)の安全性および有効性の試験が、試験対象の26匹のネコを用いて実施され、当該試験によって、この場合もやはりRBCおよび網状赤血球カウントが上昇するが、26匹のネコのうち8匹(すなわち30%を超える)が抗r−fEPO抗体を生じることが見出された(JE Randolph, et al., Am J Vet Res. 2004 Oct;65(10):1355-66)。他の研究において、ネコエリスロポエチンのcDNAを含んでいる組換えアデノ随伴ウイルスの血清型2型(rAAV2)ベクターが10匹のネコの試験群に投与され、rAAV2抗体がベクター処理されたネコのすべてに検出され、1匹のネコが真正のRBC形成不全にかかり、より少量を用いて処理されたネコが何ら影響を示さなかった(MC Walker, et al., Am J Vet Res. 2005 Mar;66(3):450-6)。
PEGと略書される親水性重合体ポリ(エチレングリコール)の共有結合性の付加は、多くの生物学的に活性な分子(タンパク質、ペプチドおよび特に疎水性の分子が挙げられる)の水溶性の向上、生体適合性の向上、血中半減期の延長、治療半減期の延長、免疫原性の調節、生物学的活性の調節、または循環時間の延長の一方法である。PEGは、生物適合性、毒性がないこと、および免疫原性がないことが重要である場合に、製薬、人工的な移植物および他の用途に広く使用されている。PEGの特性を最大化するために、生物学的に活性な分子に結合される(複数の)PEG重合体の総分子量および水和部位は、PEG重合体の結合と代表的に関連する有利な特徴(例えば、水溶性および循環半減期の増大)を与えるほどに、親分子の生物活性に逆の作用を与えないほどに、十分に高くなければならない。
PEG誘導体は、反応性の化学官能基(例えばリジン残基、システイン残基、ヒスチジン残基、N末端部分およびカルボキシル末端部分)を介して生物学的に活性な分子と、しばしば結合されている。タンパク質および他の分子は、しばしば重合体の付加に利用可能な反応性部位を限られた数しか有していない。重合体結合を介した修飾に最も好適な部位は、しばしば受容体結合に重要な役割を果たしており、分子の生物学的な活性の維持に必須である。結果として、生物学的に活性な分子上のそのような反応性部位に対する重合体鎖の無差別な付加は、重合体によって修飾されている分子の生物学的な活性の有意な低下または完全な消失さえしばしば引き起こす(R. Clark et al., (1996), J. Biol. Chem., 271:21969-21977)。所望の利点を標的分子に与えるために十分な分子量を有している抱合体を形成するために、従来技術の手法は、多数の重合体の腕の、分子に対する無作為な結合を典型的に含んでおり、これによって親分子の生物活性の低下または完全な消失という危険性が高まる。
タンパク質に対するPEG誘導体の結合部位を形成する反応性部位は、タンパク質の構造によって決定される。タンパク質(酵素が挙げられる)は一般構造H2N−−CHR−−COOHを有しているαアミノ酸の種々の配列から構築されている。アミノ酸のαアミノ部分(H2N−−)は、隣接するアミノ酸のカルボキシ部分(−−COOH)と結合して、−−(NH−−CHR−−CO)n−−と表され得るアミド結合を形成する。ここで、下付文字の“n”は数百または数千であり得る。Rによって表される部分は、タンパク質の生物学的な活性およびPEG誘導体の結合のための反応性の部位を含み得る。
例えばアミノ酸リジンの場合、ε位およびα位に−−NH2部分が存在している。ε位の−−NH2は塩基性のpH条件における反応にとって自由である。PEGを用いたタンパク質の誘導体化の分野における技術のほとんどが、タンパク質に存在しているリジン残基のε位の−−NH2部分に対する結合のためのPEG誘導体の開発に関する(“Polyethylene Glycol and Derivatives for Advanced PEGylation”, Nektar Molecular Engineering Catalog, 2003, pp. 1-17)。しかし、これらのPEG誘導体のすべては、タンパク質の表面に存在している多くの場合に多数のリジン残基のなかから選択的に導入し得ないという一般的な制限を有している。これは、リジン残基がタンパク質の活性に重要である(酵素活性部位に存在している)場合、または例えば、受容体結合部位の場合のように、リジン残基が他の生物学的分子とのタンパク質の相互作用を媒介する役割を果たしている場合、実際に重大な制限であり得る。
タンパク質にPEGを付加する既存の方法の等しく重要な他の複雑さは、PEG誘導体が所望される残基以外の残基と所望されない副反応を受け得ることである。ヒスチジンは、−−N(H)−−と構造的に表される反応性部分を含んでいるが、ε位の−−NH2と反応する多くの誘導体はまた、−−N(H)−−と反応し得る。同様に、アミノ酸システインの側鎖は、−−SHと構造的に表される自由なスルフィドリル基を有している。いくつかの場合に、リジンのε位の−−NH2基に関するPEG誘導体はまた、システイン、ヒスチジンまたは他の残基と反応する。これは、PEG誘導体化されている生物学的に活性な分子の複合的な異種混合物を生成し得、標的の生物学的に活性な分子の活性を破壊する危険性がある。タンパク質内の単一の部位に化学官能基が導入され得、それから明確かつ予測可能なタンパク質表面の特定の部位において生物学的に活性な分子に対する1つ以上のPEG重合体が選択的に結合可能なPEG誘導体の開発が望まれている。
リジン残基に加えて、当該分野における多くの試みは、他のアミノ酸側鎖(システイン、ヒスチジンおよびN末端が挙げられる)を標的とする活性化されているPEG試薬の開発に関する。例えば、米国特許第号6,610,281号および“Polyethylene Glycol and Derivatives for Advanced PEGylation”, Nektar Molecular Engineering Catalog, 2003, pp. 1-17を参照すればよい。システイン残基は、部位特異的変異生成および当該分野に公知の他の技術を用いてタンパク質の構造へ部位特異的に導入され得、生じた自由なスルフィドリル部分がチオール反応性の官能基を有しているPEG誘導体と反応され得る。しかし、この手法は、自由なスルフィドリル基が存在しているアミノ酸の発現、フォールディングおよび安定性を悪化させ得る点において複雑である。したがって、1つ以上のPEG重合体の、タンパク質に対する選択的な結合を可能にすると同時に、スルフィドリルおよびタンパク質に典型的に見られる他の化学官能基と適合する(すなわち、これらと所望されない側鎖反応を起こさない)生物学的に活性な分子に化学官能基を導入する手法を有していることが所望される。
従来技術の抽出からわかるように、タンパク質の側鎖(特にリジンのアミノ酸側鎖にある−−NH2部分およびシステインの側鎖にある−−SH部分)に対する結合のために開発されているこれらの誘導体は、合成および使用において問題があると証明されている。いくつかは、加水分解を受け、したがって変性するか、分解されるか、または水性環境(例えば血流)において不安定であるタンパク質との不安定な結合を形成する。いくつかはより安定な結合を形成するが、結合が形成される前に加水分解され、つまりPEG誘導体上の反応性基がタンパク質と結合し得る前に不活性化され得る。いくつかは、若干の毒性を示し、したがってインビボにおける使用にとってあまり好適ではない。いくつかは実際に有用である反応の進行が遅すぎる。いくつかは、タンパク質の活性を担っている部位に結合することによってタンパク質の活性の消失を起こす。いくつかは、それらが結合する部位に特異的ではなく、所望の活性の消失および再現性のない結果を生じ得る。ポリ(エチレングリコール)を用いたタンパク質の修飾と関連する問題点を克服するために、より安定なPEG誘導体(例えば米国特許第6,602,498号)、または分子上および表面上のチオール部分と選択的に反応するPEG誘導体(例えば米国特許第6,610,281号)が開発されている。安定な化学結合を形成するために選択的に反応させることを所望するまで、生理学的環境において化学的に不活性なPEG誘導体に対する当該分野における明らかな必要性がある。
最近、タンパク質の部位特異的修飾に関連する多くの制限の克服を可能にする、タンパク質科学における全く新たな技術が報告されている。具体的には、新たな構成要素が、原核生物の大腸菌(Escherichia coli)(E. coli)(例えば、L. Wang, et al., (2001), Science 292:498-500)、および真核生物の酵母(Sacchromyces cerevisiae)(S. cerevisiae)(例えば、J. Chin et al., Science 301:964-7 (2003))のタンパク質生合成機構に対して加えられている。これらの構成要素は、インビボにおけるタンパク質に対する遺伝的にコードされないアミノ酸の組込みを可能にしている。新規な化学的、物理的または生物学的特性を有する多くの新たなアミノ酸(光親和性標識されたアミノ酸、光異性化可能なアミノ酸、光架橋アミノ酸(例えばChin, J. W., et al. (2002) Proc. Natl. Acad. Sci. U. S. A. 99:11020-11024; and, Chin, J. W., et al., (2002) J. Am. Chem. Soc. 124:9026-9027を参照すればよい)、ケトアミノ酸、および糖鎖付加アミノ酸が挙げられる)が、この方法論を用いて、アンバーコドンTAGに応じてE. coliおよび酵母内にて、タンパク質に対して効率的かつ高い忠実度を有して組み込まれている。例えば、J. W. Chin et al., (2002), Journal of the American Chemical Society 124:9026-9027; J. W. Chin, & P. G. Schultz, (2002), ChemBioChem 3(11):1135-1137を参照すればよい。これらの研究は、遺伝的にコードされる通常の20のアミノ酸に見出される官能基のすべてに対して化学的に不活性であり、効率的にかつ選択的に反応して安定な共有結合を形成するために使用され得る、タンパク質に見出されない化学官能基(例えば、アルキン基およびアジド部分)を、選択的かつ日常的に導入することが可能であることを証明している。
遺伝的にコードされていないアミノ酸をタンパク質に組み込むことができれば、天然に存在する官能基(例えば、リジンのε位の−NH2、システインのスルフィドリル−SH、ヒスチジンのイミノ基など)に代わる有益な化学官能基の導入が可能である。ある種の化学官能基は、一般的な20個の遺伝的にコードされるアミノ酸に見出される官能基に対して不活性であるが、安定な結合を形成するために容易かつ効率的に反応することが知られている。例えば、アジド基およびアセチレン基は、触媒量の銅が存在する水性条件においてヒュイゲン(Huisgen)[3+2]付加環化反応を受けることが当該技術において知られている。例えば、Tornoe, et al., (2002) Org. Chem. 67:3057-3064;およびRostovtsev, et al., (2002) Angew. Chem. Int. Ed. 41 :2596-2599を参照すればよい。例えば、タンパク質構造にアジド部分を導入することによって、タンパク質に見られるアミン基、スルフィドリル基、カルボン酸基、およびヒドロキシル基に対して化学的に不活性であるが、アセチレン部分と速やかにかつ効率的に反応して付加環化生成物を形成する官能基を組み込むことができる。重要なことに、アジドは、アセチレン部分が存在していないと、他のタンパク質の側鎖が存在したり、生理学的条件下であったりしても、化学的に不活性のままであり、非反応性を維持する。
本発明は、EPOの活性および生成と関連する問題を解決するものであり、生物学的または薬理学的な特性(例えば、向上した治療半減期)を有しているhEPOの生成に関する。
〔発明の概要〕
本発明は天然にコードされていないアミノ酸を含んでいるfEPOを提供する。
いくつかの実施形態において、上記fEPOは第2のfEPOポリペプチドと連結されている。
いくつかの実施形態において、上記天然にコードされていないアミノ酸は水溶性重合体と連結されている。いくつかの実施形態において、上記水溶性重合体はポリ(エチレングリコール)部分を含んでいる。いくつかの実施形態において、上記ポリ(エチレングリコール)分子は二機能性重合体である。いくつかの実施形態において、上記二機能性重合体は第2のポリペプチドと連結されている。いくつかの実施形態において、上記第2のポリペプチドはfEPOポリペプチドである。
いくつかの実施形態において、fEPOポリペプチドは、ポリ(エチレングリコール)部分を含んでいる水溶性重合体と連結されている少なくとも2つのアミノ酸を含んでいる。いくつかの実施形態において、少なくとも1つのアミノ酸は天然にコードされていないアミノ酸である。
いくつかの実施形態において、1つ以上の上記天然にコードされていないアミノ酸は、fEPOにおける二次構造に対応する以下の領域:1〜7(N−末端)、8〜26(Aヘリックス)、27〜54(AヘリックスおよびBヘリックスの間にある領域)、55〜83(Bヘリックス)、84〜89(BヘリックスおよびCヘリックスの間にある領域)、90〜112(Cヘリックス)、113〜137(CヘリックスおよびDヘリックスの間にある領域)、138〜161(C−末端)、39〜41(ベータシート2)、47〜52(ミニBループ)、114〜121(ミニCループ)、34〜38(Aヘリックスおよび非平行ベータシートの間にあるループ)、51〜57(B’ヘリックスのC−末端、B’ヘリックスおよびBヘリックスの間にあるループ、ならびにBヘリックスのN−末端)、82〜92(BヘリックスおよびCヘリックスの間にある領域)、120〜133(C’ヘリックスおよび非平行ベータシート2の間にある領域)の任意の位置に組み込まれている。いくつかの実施形態において、1つ以上の上記天然にコードされていないアミノ酸は、fEPOにおける以下の位置:1位、2位、3位、4位、5位、6位、7位、8位、9位、10位、11位、12位、13位、14位、15位、16位、17位、18位、19位、20位、21位、22位、23位、24位、25位、26位、27位、28位、29位、30位、31位、32位、33位、34位、35位、36位、37位、38位、39位、40位、41位、42位、43位、44位、45位、46位、47位、48位、49位、50位、51位、52位、53位、54位、55位、56位、57位、58位、59位、60位、61位、62位、63位、64位、65位、66位、67位、68位、69位、70位、71位、72位、73位、74位、75位、76位、77位、78位、79位、80位、81位、82位、83位、84位、85位、86位、87位、88位、89位、90位、91位、92位、93位、94位、95位、96位、97位、98位、99位、100位、101位、102位、103位、104位、105位、106位、107位、108位、109位、110位、111位、112位、113位、114位、115位、116位、117位、118位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、133位、134位、135位、136位、137位、138位、139位、140位、141位、142位、143位、144位、145位、146位、147位、148位、149位、150位、151位、152位、153位、154位、155位、156位、157位、158位、159位、160位、161位、162位、163位、164位、165位および166位の1つに組み込まれている。いくつかの実施形態において、1つ以上の上記天然にコードされていないアミノ酸は、fEPOにおける以下の位置:1位、2位、3位、4位、5位、6位、7位、8位、9位、10位、11位、12位、13位、14位、15位、16位、17位、19位、20位、21位、22位、23位、24位、25位、26位、27位、28位、29位、30位、31位、32位、33位、34位、35位、36位、37位、38位、39位、40位、41位、42位、43位、44位、45位、46位、47位、48位、49位、50位、51位、52位、53位、54位、55位、56位、57位、58位、59位、60位、61位、62位、63位、64位、65位、66位、67位、68位、69位、70位、71位、72位、73位、74位、75位、76位、77位、78位、79位、80位、81位、82位、83位、84位、85位、86位、87位、88位、89位、90位、91位、92位、93位、94位、95位、96位、97位、98位、99位、100位、101位、102位、103位、104位、105位、106位、107位、108位、109位、110位、111位、112位、113位、114位、115位、116位、117位、118位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、133位、134位、135位、136位、137位、138位、139位、140位、141位、142位、143位、144位、145位、146位、147位、148位、149位、150位、151位、152位、153位、154位、155位、156位、157位、158位、159位、160位、161位、162位、163位、164位、165位および166位の1つに組み込まれている。いくつかの実施形態において、1つ以上の上記天然にコードされていないアミノ酸は、fEPOにおける以下の位置:1位、2位、3位、4位、5位、6位、17,21位、24位、27位、28位、 30位、31位、32位、34位、35位、36位、37位、38位、40位、50位、51位、52位、53位、54位、55位、56位、57位、58位、68位、72位、76位、80位、82位、83位、84位、85位、86位、87位、88位、89位、90位、91位、92位、113位、116位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、133位、134位、136位、162位、163位、164位、165位および166位の1つに組み込まれている。いくつかの実施形態において、1つ以上の上記天然にコードされていないアミノ酸は、fEPOにおける以下の位置:1位、2位、3位、4位、5位、6位、17位、18位、21位、24位、27位、28位、30位、31位、32位、34位、35位、36位、37位、38位、40位、50位、51位、52位、53位、54位、55位、56位、57位、58位、68位、72位、76位、80位、82位、83位、84位、85位、86位、87位、88位、89位、90位、91位、92位、113位、116位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、133位、134,136位、162位、163位、164位、165位および166位の1つに組み込まれている。いくつかの実施形態において、本発明のfEPOは、以下の位置:21位、24位、27位、28位、30位、31位、34位、36位、37位、38位、40位、55位、68位、72位、76位、83位、85位、86位、87位、89位、113位、116位、119位、120位、121位、123位、124位、125位、126位、127位、128位、129位、130位、136位および162位の1つ以上に、非天然に存在しているアミノ酸を1つ以上含んでいる。いくつかの実施形態において、これらの位置(21位、24位、38位、83位、85位、116位および119位が挙げられるが、これらに限定されない)または他の位置における非天然に存在しているアミノ酸は、水溶性重合体と連結されている。いくつかの実施形態において、本発明のfEPOは、以下の位置:18位、53位、58位、116位、121位、89位、94位、72位、77位、86位、91位、31位、36位、132位、137位、163位、168位、120位、125位、55位および60位の1つ以上に、非天然に存在しているアミノ酸を1つ以上含んでいる。いくつかの実施形態において、本発明のfEPOは、以下の位置:53位、58位、116位、121位、89位、94位、72位、77位、86位、91位、31位、36位、132位、137位、163位、168位、120位、125位、55位および60位の1つ以上に、非天然に存在しているアミノ酸を1つ以上含んでいる。いくつかの実施形態において、本発明のfEPOは、以下の位置:18位、53位、58位、116位、121位、89位、94位、72位、77位、86位、91位、31位、36位、132位、137位、163位、168位、120位、125位、55位および60位の1つ以上に、非天然に存在しているアミノ酸を1つ以上含んでいる。いくつかの実施形態において、これらの位置(53位、58位、116位、121位、89位、94位、72位、77位、86位、91位、31位、36位、132位、137位、163位、168位、120位、125位、55位および60位が挙げられるが、これらに限定されない)または他の位置における非天然に存在しているアミノ酸は、水溶性重合体と連結されている。いくつかの実施形態において、本発明のfEPOは、以下の位置:123位、124位、125位、126位、127位、128位、129位および130位の1つ以上に、非天然に存在しているアミノ酸を1つ以上含んでいる。いくつかの実施形態において、これらの位置(123位、124位、125位、126位、127位、128位、129位および130位が挙げられるが、これらに限定されない)または他の位置における非天然に存在しているアミノ酸は、水溶性重合体と連結されている。
いくつかの実施形態において、上記fEPOポリペプチドは、エリスロポエチン受容体に対する当該fEPOポリペプチドの親和性を向上させる置換、付加または欠失を含んでいる。いくつかの実施形態において、上記fEPOポリペプチドは、当該fEPOポリペプチドの安定性を向上させる置換、付加または欠失を含んでいる。いくつかの実施形態において、上記fEPOポリペプチドは、当該fEPOポリペプチドの水溶性を向上させる置換、付加または欠失を含んでいる。いくつかの実施形態において、上記fEPOポリペプチドは、宿主細胞において生成される当該fEPOポリペプチドの可溶性を向上させる置換、付加または欠失を含んでいる。いくつかの実施形態において、上記fEPOポリペプチドは、これらに限定されないが、配列番号2におけるN24、N36、N38、Q58、Q65、N83、Q86、G113、Q115およびS126ならびにこれらの組合せからなる群から選択されるアミノ酸の置換を含んでいる。いくつかの実施形態において、上記fEPOポリペプチドは、これらに限定されないが、配列番号4におけるN24、N36、N38、Q58、Q65、N83、Q86、G113、Q115およびS126ならびにこれらの組合せからなる群から選択されるアミノ酸の置換を含んでいる。
いくつかの実施形態において、上記fEPOポリペプチドにおける上記アミノ酸置換は、少なくとも1つの置換が天然にコードされていないアミノ酸を用いてなされていることを条件に、天然または非天然に存在しているアミノ酸を用いてなされ得る。
いくつかの実施形態において、上記天然にコードされていないアミノ酸は、カルボニル基、アセチル基、アミノオキシ基、ヒドラジン基、ヒドラジド基、セミカルバジド基、アジド基またはアルキン基を含んでいる。
いくつかの実施形態において、上記天然にコードされていないアミノ酸はカルボニル基を含んでいる。いくつかの実施形態において、上記天然にコードされていないアミノ酸は以下の構造:
(ここで、nは1〜10であり、R1はアルキル、アリール、置換されているアルキルまたは置換されているアリールであり、R2は、H、アルキル、アリール、置換されているアルキルまたは置換されているアリールであり、R3は、H、アミノ酸、ポリペプチドまたはアミノ末端修飾基であり、R4は、H、アミノ酸、ポリペプチドまたはカルボニル末端修飾基である)
を有している。
いくつかの実施形態において、上記天然にコードされていないアミノ酸はアミノオキシ基を含んでいる。いくつかの実施形態において、上記天然にコードされていないアミノ酸はヒドラジド基を含んでいる。いくつかの実施形態において、上記天然にコードされていないアミノ酸はヒドラジン基を含んでいる。いくつかの実施形態において、上記天然にコードされていないアミノ酸はセミカルバジド基を含んでいる。
いくつかの実施形態において、上記天然にコードされていないアミノ酸はアジド基を含んでいる。いくつかの実施形態において、上記天然にコードされていないアミノ酸は以下の構造:
(ここで、nは0〜10であり、R1はアルキル、アリール、置換されているアルキルもしくは置換されているアリールであるか、または存在せず、Xは、O、NもしくはSであるか、または存在せず、mは0〜10であり、R2は、H、アミノ酸、ポリペプチドまたはアミノ末端修飾基であり、R3は、H、アミノ酸、ポリペプチドまたはカルボニル末端修飾基である)
を有している。
いくつかの実施形態において、上記天然にコードされていないアミノ酸はアルキン基を含んでいる。いくつかの実施形態において、上記天然にコードされていないアミノ酸は以下の構造:
(ここで、nは0〜10であり、R1はアルキル、アリール、置換されているアルキルまたは置換されているアリールであり、Xは、O、NもしくはSであるか、または存在せず、mは0〜10であり、R2は、H、アミノ酸、ポリペプチドまたはアミノ末端修飾基であり、R3は、H、アミノ酸、ポリペプチドまたはカルボニル末端修飾基である)
を有している。
いくつかの実施形態において、上記ポリペプチドは、エリスロポエチンのアゴニスト、部分アゴニスト、アンタゴニスト、部分アンタゴニストまたは逆アゴニストである。いくつかの実施形態において、エリスロポエチンの上記アゴニスト、部分アゴニスト、アンタゴニスト、部分アンタゴニストまたは逆アゴニストは、水溶性重合体と連結されている天然にコードされていないアミノ酸を含んでいる。いくつかの実施形態において、上記水溶性重合体はポリ(エチレングリコール)部分を含んでいる。いくつかの実施形態において、水溶性重合体と連結されている上記天然にコードされていないアミノ酸は、fEPOのSite2領域(ACヘリックスバンドルの表面を包含しているタンパク質の領域)に存在している。いくつかの実施形態において、水溶性重合体と連結されている天然にコードされていないアミノ酸を含んでいる上記fEPOポリペプチドは、fEPOアンタゴニストが第2のfEPO受容体分子に対する結合を妨げることによって、fEPO受容体の二量体化を妨げる。いくつかの実施形態において、ロイシン以外のアミノ酸が配列番号2におけるL108と置換されている。いくつかの実施形態において、アルギニンまたはリジンが配列番号2におけるL108と置換されている。いくつかの実施形態において、天然にコードされていないアミノ酸が配列番号2におけるL108と置換されている。
また、本発明は、ストリンジェントな条件において配列番号24、配列番号25、配列番号26または配列番号27とハイブリダイズするポリヌクレオチドを含んでいる単離されている核酸を提供する。ここで、当該ポリヌクレオチドは少なくとも1つセレクターコドンを含んでいる。いくつかの実施形態において、上記セレクターコドンは、アンバーコドン、オーカーコドン、オパールコドン、ユニークコドン、レアコドンおよび4塩基コドンからなる群から選択される。
また、本発明は、水溶性重合体と連結されているfEPOポリペプチドの製造方法を提供する。いくつかの実施形態において、当該方法は、天然にコードされていないアミノ酸を含んでいる単離されているfEPOポリペプチドを、当該天然にコードされていないアミノ酸と反応する部分を含んでいる水溶性重合体と接触させることを包含している。いくつかの実施形態において、fEPOに組み込まれている上記天然にコードされていないアミノ酸は水溶性重合体に対して反応性であり、一般的な任意の20のアミノ酸に対して非反応性である。
いくつかの実施形態において、上記水溶性重合体と連結されている上記fEPOポリペプチドは、カルボニル含有アミノ酸を含んでいるfEPOポリペプチドを、アミノオキシ基、ヒドロキシルアミン基、ヒドラジン基、ヒドラジド基またはセミカルバジド基を含んでいるポリ(エチレングリコール)と反応させることによって製造されている。いくつかの実施形態において、上記アミノオキシ基、ヒドロキシルアミン基、ヒドラジン基、ヒドラジド基またはセミカルバジド基は、アミド結合を介して上記ポリ(エチレングリコール)分子と連結されている。
いくつかの実施形態において、上記水溶性重合体と連結されている上記fEPOポリペプチドは、カルボニル基を含んでいるポリ(エチレングリコール)分子を、ヒドロキシルアミン基、ヒドラジド基またはセミカルバジド基を含んでいる天然にコードされていないアミノ酸を含んでいるポリペプチドと反応させることによって製造されている。
いくつかの実施形態において、上記水溶性重合体と連結されているfEPOポリペプチドは、アルキン含有アミノ酸を含んでいるfEPOポリペプチドを、アジド部分を含んでいるポリ(エチレングリコール)分子と反応させることによって製造されている。いくつかの実施形態において、上記アジド基またはアルキン基はアミド結合を介して上記ポリ(エチレングリコール)分子と連結されている。
いくつかの実施形態において、上記水溶性重合体と連結されているfEPOポリペプチドは、アジド含有アミノ酸を含んでいるfEPOポリペプチドを、アルキン部分を含んでいるポリ(エチレングリコール)分子と反応させることによって製造されている。いくつかの実施形態において、上記アジド基またはアルキン基はアミド結合を介して上記ポリ(エチレングリコール)分子と連結されている。
いくつかの実施形態において、上記ポリ(エチレングリコール)分子は約1〜約100kDaの分子量を有している。いくつかの実施形態において、上記ポリ(エチレングリコール)分子は約1kDa〜約50kDaの分子量を有している。
いくつかの実施形態において、上記ポリ(エチレングリコール)分子は分枝鎖状の重合体である。いくつかの実施形態において、分枝鎖状の重合体である上記ポリ(エチレングリコール)の分枝鎖のそれぞれは、1kDa〜100kDaまたは1kDa〜50kDaの分子量を有している。
いくつかの実施形態において、fEPOポリペプチドと連結されている上記水溶性重合体はポリアルキレングリコール部分を含んでいる。いくつかの実施形態において、fEPOポリペプチドに組み込まれている上記天然にコードされていないアミノ酸残基は、カルボニル基、アセチル基、アミノオキシ基、ヒドラジド基、セミカルバジド基、アジド基またはアルキン基を含んでいる。いくつかの実施形態において、fEPOに組み込まれいている天然にコードされていないアミノ酸残基はカルボニル部分を含んでおり、上記水溶性重合体が、アミノオキシ基、ヒドロキシルアミン基ヒドラジド基またはセミカルバジド基を含んでいる。いくつかの実施形態において、fEPOに組み込まれている上記天然にコードされていないアミノ酸残基がアルキン部分を含んでおり、上記水溶性重合体がアジド部分を含んでいる。いくつかの実施形態において、fEPOに組み込まれている上記天然にコードされていないアミノ酸はアジド部分を含んでおり、上記水溶性重合体がアルキン部分を含んでいる。
また、本発明は、天然にコードされていないアミノ酸を含んでいるfEPOポリペプチド、および薬学的に受容可能な担体を含んでいる組成物を提供する。いくつかの実施形態において、上記天然にコードされていないアミノ酸は水溶性重合体と連結されている。
また、本発明は、上記fEPOポリペプチドをコードしておりかつセレクターコドンを含んでいるポリヌクレオチドを含んでいる細胞を提供する。いくつかの実施形態において、上記細胞は上記fEPO内に上記天然にコードされていないアミノ酸を置換するための直交性の(orthogonal)RNA合成酵素および/または直交性のtRNAを含んでいる。
また、本発明は、天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドの製造方法を提供する。いくつかの実施形態において、当該方法は、fEPOポリペプチド、直交性のRNA合成酵素および直交性のtRNAをコードしている1つ以上のポリヌクレオチドを含んでいる細胞を、当該fEPOを発現可能な条件において培養すること;ならびに当該細胞および/または培養培地から上記fEPOを精製することを包含している。
また、本発明はfEPOの治療半減期、血中半減期または循環時間を増大させる方法を提供する。いくつかの実施形態において、当該方法は、天然に存在しているfEPOにおける1つ以上の任意のアミノ酸を天然にコードされていないアミノ酸に置換すること、および/または当該fEPOポリペプチドを水溶性重合体と連結することを包含している。
また、本発明は、本発明のfEPO分子の治療有効量を用いた処置を必要としている患者を処置する方法を提供する。いくつかの実施形態において、当該方法は、天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドおよび薬学的に受容可能な担体を含んでいる薬学的組成物の治療有効量を上記患者に投与することを包含している。いくつかの実施形態において、上記天然にコードされていないアミノ酸は水溶性重合体と連結されている。
また、本発明は、少なくとも1つのアミノ酸が天然にコードされていないアミノ酸によって置換されている点を除いて、配列番号1、配列番号2、配列番号3または配列番号4に示されている配列を含んでいるfEPOポリペプチドを提供する。いくつかの実施形態において、上記天然にコードされていないアミノ酸は水溶性重合体と連結されている。いくつかの実施形態において、上記水溶性重合体はポリ(エチレングリコール)部分を含んでいる。いくつかの実施形態において、上記天然にコードされていないアミノ酸は、配列番号2、配列番号4、または配列番号1もしくは配列番号3の対応するアミノ酸位置に由来する1位〜6位、21位〜40位、68位〜89位、116位〜136位、162位〜166位の残基(これらが挙げられるが、限定されない)からなる群から選択される位置に置換されている。いくつかの実施形態において、上記天然にコードされていないアミノ酸は、カルボニル基、アミノオキシ基、ヒドラジド基、ヒドラジン基、セミカルバジド基、アジド基またはアルキン基を含んでいる。
また、本発明は、配列番号1、配列番号2、配列番号3もしくは配列番号4に示されている配列を含んでいるfEPOポリペプチド、ならびに薬学的に受容可能な担体を含んでいる薬学的組成物を提供する。ここで、少なくとも1つのアミノ酸が天然にコードされていないアミノ酸によって置換されている。また、本発明は、配列番号2もしくは配列番号4に示されている配列を含んでいるfEPOポリペプチド、ならびに薬学的に受容可能な担体を含んでいる薬学的組成物を提供する。ここで、少なくとも1つのアミノ酸が天然にコードされていないアミノ酸によって置換されている。いくつかの実施形態において、上記天然にコードされていないアミノ酸は糖部分を含んでいる。いくつかの実施形態において、水溶性重合体が糖部分を介して上記ポリペプチドと連結されている。
〔図面の簡単な説明〕
図1−ヒトおよびネコのエリスロポエチンの配列整列化の図。
図2−ジーンバンクに寄託されている2つの配列(ジーンバンクアクセッション番号:U00685およびジーンバンク受入れ番号:L10606)の間における差異、共通配列を強調している図。
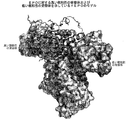
図3−4ヘリックスバンドルタンパク質のエリスロポエチン(EPO)に関する一般的な構造の図が、高親和性および低親和性の受容体とともに示されている。
図4−4ヘリックスバンドルタンパク質のエリスロポエチン(EPO)に関する一般的な構造の別の視点からの図が、高親和性および低親和性の受容体とともに示されている。
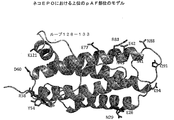
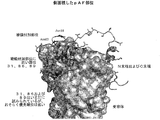
図5−天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位が示されている図。
図6−天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位を上面視している図。
図7−天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位を側面視している図。
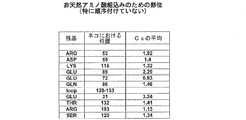
図8−天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位、配列番号2および配列番号4に由来する天然に存在しているアミノ酸およびそのアミノ酸位置、ならびにこれらの部位に関するCxの平均値の表。
図9−天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位、配列番号2および配列番号4に由来する天然に存在しているアミノ酸およびそのアミノ酸位置、ならびにこれらの部位に関するCxの平均値の表。
図10a−調合緩衝液に対してグラフ化されている450nmにおける吸光度。
図10b−エンドトキシンに対してグラフ化されている450nmにおける吸光度。
図11−TF−1増殖アッセイの図。
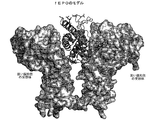
図12−リガンド結合によるfEPO受容体の二量体化の図。
図13−鐘形の用量応答曲線を示している、fEPOの濃度の増加に対してプロットされた450nmにおける吸光度。
図14−TF−1細胞の異なる播種密度を示している。このグラフは、例えば、JAK−STATシグナル伝達経路にfEPOに応じた最適な活性を与えるfEPOおよびfEPO受容体の間の比率が1:2であることを示している。
図15−細胞のスタベーションが細胞分裂を同期化し、より大きなダイナミックレンジを生じるか否かを決定する実験結果のグラフ−その結果は、これが特に有利ではないことを示した。
図16−20000の播種密度、72時間のインキュベーション時間、500ng/mlのfEPOの開始濃度および2.5倍希釈を用いたTF−1アッセイのために使用された条件のグラフ。
図17−細胞の継代数、EC50、吸光度およびダイナミックレンジに関するデータを提供している、アッセイの信頼性を測定する表。
図18−野生型のfEPOおよび調合緩衝液を用いたTF−1の成績の表およびグラフ。
図19−ヒトおよびネコの野生型のEPOの間におけるアッセイの成績を比較するグラフ。
図20−対照として野生型のfEPOを用いた調整済および未調整のCHO培地の濃度変化に対して測定された吸光度のグラフ。
図21−低下する濃度および測定された吸光度に関する、野生型のfEPO、CHO/PEI+1.25mg/mLのfEPOおよびCHO/PEI単独を比較するグラフ。
図22−野生型のfEPOと比較したときの、組み込まれている非天然アミノ酸pAFを有しているfEPOバリアントの相対活性の表およびグラフ。
図23−組み込まれている非天然アミノ酸pAFを有している種々のfEPOバリアント、およびそれぞれのED50 ng/mLの測定の棒グラフ。
図24−野生型のfEPOと比較したときの、4℃および−80℃において5週間以上にわたって保存されたE72 fEPOバリアント、およびそれらの吸光度のグラフ。
図25−Lucy Fベクター、ならびにtRNA、所望の転写エレメントの遺伝子およびtRNA合成酵素の位置の模式図。
図26−Irwinベクター、ならびにtRNA、所望の転写エレメントの遺伝子およびtRNA合成酵素の位置の模式図。
図27−ネコエリスロポエチンのためのLucy Fにおける抑制発現コンストラクトL BB−Opti FEPOの模式図。
図28−ネコエリスロポエチンのためのIrwinにおける抑制発現コンストラクトL BB−Opti FEPOの模式図。
図29−軽鎖遺伝子および重鎖遺伝子を有している、ジェネリック抗体をコードしている本発明に係る抑制発現コンストラクトを示す模式図。
図30−ELISAによって測定された、pAF存在下におけるfEPOの抑制レベル(OD−50)を示している棒グラフ。
図31−SDS−PAGEによるPEG付加fEPOの移動度を示している。レーン1〜3:20kDa PEGがfEPOのR53 pAFバリアントと反応している。レーン1:R53、8μgのfEPO添加、PEGなし。レーン2:R53 PEG付加、2μgのfEPO添加。レーン3:R53 PEG付加、8μgのfEPO添加。レーン4〜6:30kDaのPEGがfEPOのP129 pAFバリアントと反応している。レーン4:P129、8μgのfEPO添加、PEGなし。レーン5:P129 PEG付加、2μgのfEPO添加。レーン6:P129 PEG付加、8μgのfEPO添加。レーン7〜9:40kDaのPEGがfEPOのY49 pAFバリアントと反応している。レーン7:Y49、8μgのfEPO添加、PEGなし。レーン9:Y49 PEG付加、8μgのfEPO添加。38kDaにおける横向きの矢印はPEG付加なしのfEPOの移動度を支援している。矩形の囲みはPEG付加fEPOの移動度の領域を示している。
図32−fEPOのD55およびP129 pAFバリアントに関するPEG付加反応(30kDa)、これらのPEG付加バリアントを示しているSDS−PAGEゲル。レーン1:D55、PEGなし。レーン2:D55 PEG付加。レーン3:野生型のfEPO、インキュベーションなし。レーン4:P129、8μgのfEPO、PEGなし。レーン5:P129 PEG付加、2μgのfEPO添加。レーン6:P129 PEG付加、8μgのfEPO添加。38kDaにおける横向きの矢印はPEGなしのfEPOの移動度を示している。矩形の囲みはPEG付加fEPOの移動度の領域を示している。
図33−fEPO A1 pAFバリアントに対するPEG付加反応(30kDa)の成功を示すSDS−PAGEゲル。
図34−2者の間に94%の相同性があるcEPO(配列番号31)およびfEPO(配列番号4)のアミノ酸配列の比較。
図35−2者の間に94%の相同性があるeEPO(配列番号33)およびfEPO(配列番号4)のアミノ酸配列の比較。
図36−実施例32において実施された実験からの、ヘマトクリットおよび赤血球(RBC)に対するバリアント処理の影響を示しているグラフ。
〔定義〕
本発明は本明細書に記載されている特定の方法論、手順、細胞株、コンストラクトおよび試薬に制限されず、よって変更可能であることが理解されるべきである。また、本明細書において使用される専門用語は、特定の実施形態のみを説明することを目的としており、添付の特許請求の範囲によってのみ制限される本発明の範囲を制限することを意図されていないことが理解されるべきである。
本明細書および添付の特許請求の範囲において使用されるときに、単数形“a”、“an”、および“the”は、前後関係から1つのものを明確に示している場合を除いて、複数を指すことを包含している。したがって例えば、“fEPO”に対する言及は、1つ以上のそのようなタンパク質を指し、当業者にとって公知のこれらの等価物などを包含している。
他に明示されていない限り、本明細書において使用される技術用語および科学用語は、本発明が属する技術分野の当業者に通常に理解されるような、同じ意味を有している。任意の方法、装置および物質、本明細書に記載されているそれらの類似物または等価物が本発明の実施または試験に使用され得るが、好ましい方法、装置および材料は、これから説明される。
本明細書に述べられている公報および特許は、例えば、現在、説明されている本発明と関連して使用され得る公報に説明されているコンストラクトおよび方法論を説明し、開示することを目的として、参照によって本明細書に援用される。本明細書において議論される公報において、本願の出願日の前における開示内容が単に規定される。本明細書において、先の発明によって当該開示に先立つために、または任意の他の理由によって、発明者に権利が与えられないことの承認として解釈されるべきではない。
“実質的に精製された”という用語は、天然に存在する環境(すなわち、天然の細胞またはfEPOポリペプチドが組換え的に産生される場合における宿主細胞)に見られるような、fEPOタンパク質と付随するか、または相互作用する化合物を実質的にか、またはほとんど含み得ない、fEPOポリペプチドを指す。細胞性物質を実質的に含み得ないfEPOポリペプチドとしては、混入しているタンパク質が、(乾燥重量として)約30%未満、約25%未満、約20%未満、約15%未満、約10%未満、約5%未満、約4%未満、約3%未満、約2%未満、または約1%未満である、タンパク質の調製物が挙げられる。fEPOポリペプチドまたはこれらのバリアントが、宿主細胞において組換え的に産生される場合に、タンパク質は、細胞の乾燥重量の約30%、約25%、約20%、約15%、約10%、約5%、約4%、約3%、約2%、または約1%もしくはそれ未満において存在し得る。fEPOポリペプチドまたはこれらのバリアントが、宿主細胞において組換え的に産生される場合に、タンパク質は、細胞の乾燥重量の約5g/l、約4g/l、約3g/l、約2g/l、約1g/l、約750mg/l、約500mg/l、約250mg/l、約100mg/l、約50mg/l、約10mg/l、または約1mg/lもしくはそれ未満において培養培地に存在し得る。したがって、本発明の方法によって産生される“実質的に精製された”fEPOポリペプチドは、適切な方法(例えば、SDS/PAGE分析、RP−HPLC、SEC、およびキャピラリー電気泳動)によって決定されるときに、少なくとも約30%、少なくとも35約%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%の純度、詳細には少なくとも約75%、80%、85%の純度、そしてより詳細には少なくとも約90%の純度、少なくとも約95%の純度、少なくとも約99%またはそれ以上の純度を有している。
“組換え宿主細胞”または“宿主細胞”は、挿入に使用される方法(例えば、直接的な取り込み、形質導入、f−交配(f-mating)、または組換え宿主細胞を作り出すために使用される他の公知の方法)にかかわらず、外来性のポリヌクレオチドを含んでいる細胞を指す。外来性のポリヌクレオチドは、宿主のゲノムに組み込まれないベクター(例えばプラスミド)として維持され得るか、または宿主のゲノムに組み込まれ得る。
本明細書において使用されるとき、“培地”または“培養液”という用語は、任意の宿主細胞(細菌宿主細胞、酵母宿主細胞、昆虫宿主細胞、植物宿主細胞、真核生物宿主細胞、哺乳類宿主細胞、CHO細胞またはE. coliが挙げられる)、および細胞内容物を保持し得るか、または含有し得る任意の培養培地、溶液、固体、半固体、または固定担体を包含している。したがって、当該用語は、宿主細胞が培養されている培地(例えば、fEPOポリペプチドが分泌されている培地(増殖段階の前または後のいずれかにおける培地))を包含し得る。また、当該用語は、“fEPO”ポリペプチドが細胞内において産生され、宿主細胞が溶解されるか、または崩壊させられてfEPOポリペプチドを放出する場合に、宿主細胞溶解液を含有している緩衝液または試薬を包含し得る。
本明細書において用いられるとき、“IRES”、すなわち内部リボソーム進入部位は当業者に知られている。IRESは核酸分子(例えば、mRNA分子)の領域である。当該領域は、キャップ非依存性の翻訳のためのアッセイ(米国特許第6,715,821号明細書に記載される二シストロン性の受容体アッセイなど)において、翻訳を開始させるために十分な内部リボソームの進入/結合を可能にする。mRNA分子内におけるIRESの存在によって、結合タンパク質をコードする配列(IRESが存在しなければ翻訳されない配列)のキャップ非依存性の翻訳が可能である。IRESの領域はピコナウイルスにおいて最初に同定され、当該領域はキャップ非依存性の翻訳にとっての典型とみなされている。すべてのピコナウイルスの5’UTRSは長く、リボソームの直接的な供給および結合によって翻訳開始を媒介し、それにより、キャップ結合の最初の段階を回避する。
IRES因子はウイルス性のmRNASにしばしば見られ、非ウイルス性のmRNAにおいてまれに見られる。これまでに、非ウイルス性のmRNAがそれらの各5’UTRSに機能性のIRES因子を含んでいることが知られている。この機能性のIRES因子としては、免疫グロブリン重鎖結合タンパク質(BIP)(Macejak, D. J. et al., Nature 353:90-94 (1991));Drosophilaのアンテナペディア(Antennapedia)(Oh, S. K. et al., Genes Dev. 6:1643-53 (1992));Drosophilaのウルトラビソラン(Ultrabithoran)(Ye, X. et al., Mol. Cell. Biol. 17:1714-21 (1997 ));線維芽細胞増殖因子2(Vagner et al., Mol. Cell. Biol. 15:35-47 (1915);開始因子(Gan et al., J. Biol. Chem. 273:5006-12 (1992));タンパク質癌遺伝子c−myc(Nambru et al., J. Biol. Chem. 272:32061-6 (1995)); Stonely M. Oncogene 16:423-8 (1998));血管内皮増殖因子(VEGF)(Stein J. et al., Mol. Cell. Biol. 18:3112-9 (1998))が挙げられる。細胞性IRES因子は、IRES配列に対してか、または互いに、明らかな配列または構造的な類似性を有しておらず、したがって細胞性IRES因子は翻訳アッセイを用いて同定される。他の公知のIRESは、参照によって本明細書に援用される米国特許出願第6,171,821号明細書に開示されているXIAP IRESである。
タンパク質のフォールディングに関して本明細書に使用されるとき、“還元剤”は、還元状態においてスルフィドリル基を維持し、分子内または分子間のジスルフィド結合を還元する、任意の化合物または物質と定義づけられる。好適な還元剤としては、ジチオスレイトール(DTT)、2−メルカプトエタノール、ジチオエリスリトール、システイン、システアミン(2−アミノエタンチオール)および還元グルタチオンが挙げられるが、これらに限定されない。広範な還元剤が本発明の方法および組成物における使用に好適であることは、当業者にとって直ちに明らかになる。
タンパク質のフォールディングに関して本明細書に使用されるとき、“酸化剤”は、酸化される化合物から電子を除去できる任意の化合物または物質と定義づけられる。好適な酸化剤としては、酸化グルタチオン、シスチン、シスタミン、酸化ジチオスレイトール、酸化エリスレイトールおよび酸素が挙げられるが、これらに限定されない。広範な酸化剤が本発明の方法における使用に好適であることは、当業者にとって直ちに明らかになる。
本明細書に使用されるとき、“変性剤(denaturing agent)”“変性剤(denaturant)”は、タンパク質の可逆的な変性を引き起こす任意の化合物または物質と定義づけられる。変性剤または変性剤の強さは、特定の変性剤または変性剤の性質および濃度の両方によって決定される。好適な変性剤または変性剤は、カオトロープ、界面活性剤、有機溶媒、水混和性溶媒、リン脂質または当該試薬の2つ以上の組合せであり得る。好適なカオトロープとしては、尿素、グアジニンおよびチオシアン酸ナトリウムが挙げられるが、これらに限定されない。有用な界面活性剤としては、ドデシル硫酸ナトリウム、またはポリオキシエチレンエーテル(例えば、TweenまたはTriton界面活性剤)といった強力な界面活性剤、サルコシル(Sarkosyl)、穏やかな非イオン性界面活性剤(例えば、ジギトニン)、N−>2,3−(ジオレイオキシ)−プロピル−N,N,N−トリメチルアンモニウムといった穏やかなカチオン性界面活性剤、穏やかなイオン性界面活性剤(例えば、コール酸ナトリウムまたはデオキシコール酸ナトリウム)または両性イオン性界面活性(これらに限定されないが、スルホベタイン(ツヴァイッタージェント)、3−(3−クロルアミドプロピル)ジメチルアンモニオ−1−プロパン硫酸塩(CHAPS)、3−(3−クロルアミドプロピル)ジメチルアンモニオ−2−ヒドロキシ−1−プロパンスルホン酸塩(CHAPSO)が挙げられる)が挙げられ得るが、これらに限定されない。アセトニトリル、低級アルカノール(特にエタノールまたはイソプロパノールといったC2−C4アルカノール)、または低級アルカンジオール(特にエチレングリコールといったC2−C4アルカンジオール)といった水混和性の有機溶媒が、変性剤として使用され得る。本発明において有用なリン脂質は、天然に存在するリン脂質(例えばホスファチジルエタノールアミン、ホスファチジルコリン、ホスファチジルセリンおよびホスファチジルイノシトール)であり得るか、または合成リン脂質の誘導体(例えばジヘキサノイルホスファチジルコリンまたはジヘプタノイルホスファチジルコリン)もしくはバリアントであり得る。
本明細書に使用されるとき、“リフォールディング”は、ジスルフィド結合を含んでいるポリペプチドを、不適切に折りたたまれた状態または変性された状態から、ジスルフィド結合に関して本来の立体構造または適切に折りたたまれた立体構造に変形させる任意の過程、反応または方法を説明する。
本明細書に使用されるときに、“コフォールディング(cofolding)”は、互いに相互作用する少なくとも2つのポリペプチドを用いて、変性されたポリペプチドまたは不適切に折りたたまれたポリペプチドを本来の適切に折りたたまれたポリペプチドに変形させるリフォールディングの過程、反応または方法を特に指す。
本明細書に使用されるとき、“エリスロポエチン”または“EPO”は、ネコエリスロポエチン(fEPO)の生物学的な活性の少なくとも1つを有しているポリペプチドおよびタンパク質、ならびにその生物学的な活性、およびさらにそれらの合成方法もしくは作製方法(組換え法(cDNAまたはゲノムDNAのいずれかから生成される)、合成法、遺伝子導入法および遺伝子活性化法が挙げられるが、これらに限定されない)にかかわらず、エリスロポエチン類似物、エリスロポエチンのアイソフォーム(例えば、参照によって本明細書に援用される米国特許第5,856,298号に記載のもの)、エリスロポエチン模倣物(例えば、参照によって本明細書に援用される米国特許第6,310,078号に記載のもの)、エリスロポエチン断片、ハイブリッドエリスロポエチンタンパク質、融合タンパク質のオリゴマーおよび多量体、相同物、糖鎖付加型のバリアントおよび変異体を包含している。エリスロポエチンの特定の例としては、エポエチンアルファ(例えば、参照によって本明細書に援用される米国特許第4,667,016号;米国特許第4,703,008号;米国特許第5,441,868号;米国特許第5,547,933号;米国特許第5,618,698号;米国特許第5,621,080号;米国特許第5,756,349号;および米国特許第5,955,422号に記載のもの)、ダルベポエチンアルファ(例えば、欧州特許出願第640619号に記載のもの)、DYNEPO(登録商標)(エポエチンデルタ)、ヒトエリスロポエチン類似物(例えば、参照によって本明細書に援用される国際公開第9966054号、米国特許第6,548,653号および米国特許第5,888,772号に記載のヒト血清アルブミンの融合タンパク質)、エリスロポエチン変異体(例えば、参照によって本明細書に援用される国際公開第9938890号、米国特許第6,489,293号、米国特許第5,888,772号、米国特許第5,614,184号および米国特許第5,457,089号に記載のもの)、エリスロポエチンオメガ(参照によって本明細書に援用される米国特許第5,688,679号;米国特許第6,099,830号;米国特許第6,316,254号;および米国特許第6,682,910号に記載のヒトエリスロポエチンのApaI制限酵素断片から生成され得る)、改変されている糖鎖付加型のヒトエリスロポエチン(例えば、国際公開第9911781号およびEP1064951に記載のもの)、およびPEGが抱合されているエリスロポエチン類似物(例えば、参照によって本明細書に援用される国際公開第9805363号、米国特許第5,643,575号;米国特許第6,583,272号;米国特許第6,340,742号;および米国特許第6,586,398号に記載のもの)が挙げられるが、これらに限定されない。内因性のヒトエリスロポエチンの発現のために改変されている細胞株の特定の例が、参照によって本明細書に援用される国際公開第9905268号、国際公開第9412650号および米国特許第6,376,218号に記載されている。
“ネコエリスロポエチン(fEPO)”または“fEPOポリペプチド”という用語は、上述のエリスロポエチンまたはEPO、ならびに天然に存在しているfEPOの生物学的な活性の少なくとも1つを保持しているポリペプチドを指す。fEPOポリペプチドは、天然に存在しているネコエリスロポエチンの薬学的に受容可能な塩およびプロドラッグ、および当該塩のプロドラッグ、多形体、水和物、溶媒和物、生物学的に活性な断片、生物学的に活性なバリアントおよび立体異性体、このほかに天然に存在しているヒトエリスロポエチンのアゴニスト、模倣物およびアンタゴニストならびにこれらのポリペプチド融合物を包含している。fEPOポリペプチドおよび模倣物の例としては、参照によって本明細書に援用される米国特許第6,310,078号;米国特許第5,106,954号;米国特許第6,703,480号;米国特許第6,642,353号;米国特許第5,986,047号;および米国特許第5,712,370号に記載のものが挙げられる。アミノ末端、カルボキシ末端、またはその両方にさらなるアミノ酸を含んでいる融合物が“fEPOポリペプチド”という用語に包含される。例示的な融合物としては、fEPOのN末端にメチオニンが結合しているメチオニルエリスロポエチン、精製のための融合物(ポリヒスチジンまたは親和性エピトープに対する融合物が挙げられるが、これらに限定されない)、血清アルブミン結合ペプチドとの融合物、および血清タンパク質(例えば血清アルブミン)との融合物が挙げられるが、これらに限定されない。天然に存在しているfEPOの完全なアミノ酸配列および天然に存在している成熟fEPOのアミノ酸配列については、それぞれ配列番号1および配列番号2を参照すればよい。fEPOの完全なアミノ酸配列および成熟fEPOのアミノ酸配列の共通配列については、配列番号3および配列番号4を参照すればよい。いくつかの実施形態において、本発明のfEPOポリペプチドは、配列番号1、配列番号2、配列番号3または配列番号4と実質的に同一である。fEPO変異体および変異体fEPOポリペプチドをコードしている核酸分子は周知である。fEPO変異体の例としては、参照によって本明細書に援用される米国特許第6,489,293号;米国特許第6,153,407号;米国特許第6,048,971号;米国特許第5,614,184号;および米国特許第5,457,089号が挙げられる。
エリスロポエチンまたはfEPOは、種々の生物学的活性(受容体の二量体化を引き起こすその受容体に対する結合、赤血球細胞産生の刺激および細胞増殖の刺激が挙げられるが、これらに限定されない)を有している。エリスロポエチンおよびhEPOの生物学的な活性のいくつかの例が、参照によって本明細書に援用される米国特許第6,676,947号;米国特許第6,579,525号;米国特許第6,531,121号;米国特許第6,521,245号;米国特許第6,489,293号;米国特許第6,368,854号;米国特許第6,316,254号;米国特許第6,268,336号;米国特許第6,239,109号;米国特許第6,165,283号;米国特許第5,986,047号;米国特許第5,830,851号;および米国特許第5,773,569号に記載されている。
fEPOの生物学的に活性な断片/バリアントは、最初の26アミノ酸が分泌中に切断され、最後の4アミノ酸の1つ以上が除去されてエリスロポエチンの成熟形態を形成する(配列番号1および配列番号2)192アミノ酸を含んでいる遺伝子産物を包含している。また、“fEPOポリペプチド”という用語は、24位、38位および83位にN型糖鎖付加部位を有しており、126位にO型糖鎖付加部位を有している糖鎖付加形態(Takeuchi et al. (1988) JBC 263: 3657-3663; Saski et al. (1988) Biochemistry 27: 8618-8626)を包含している。また、単一のヌクレオチド変更を含んでいるバリアント(すなわちS104NおよびL105F、P122Q、E13Q、Q58−>QQ、G113R)は、生物学的に活性なfEPOのバリアントと見なされる(Jacobs et al., (1985) Nature 313: 806-810; Funakoshi et al., (1993) Biochem.Biophys.Res.Comm. 195: 717-722)。また、“fEPOポリペプチド”という用語は、fEPOのヘテロ二量体、ホモ二量体、ヘテロ多量体もしくはホモ多量体、または化学的手法によって連結されているか、または融合タンパク質として発現されている任意の他のポリペプチド、タンパク質、炭化水素、重合体、小分子、リガンド、もしくは任意の他の種類の活性な分子(参照によって本明細書に援用されるSytkowski et al., (1998) Proc.Natl.Acad.Sci.USA 95(3):1184-8;およびSytkowski et al. (1999) J.Biol.Chem. 274(35):24773-8、ならびに米国特許第6,187,564号;米国特許第6,703,480号;米国特許第5,767,078号)、ならびに特定の欠失を含んでおり、生物学的な活性を維持しているポリペプチド類似物(Boissel et al., (1993) JBC 268: 15983-15993;Wen et al., (1994) JBC 269: 22839-22846;Bittorf et al., (1993) FEBS 336: 133-136;および参照によって本明細書に援用される米国特許第6,153,407号)を包含している。
本明細書に記載されているfEPOにおけるアミノ酸位置に対するすべての言及は、特に指定が(すなわち比較が配列番号3に基づいていると述べられている場合では)ない限り、配列番号2における位置に基づいている。当業者は、配列番号2における位置に対応するアミノ酸位置がfEPOの融合物、バリアント、断片などにおいて容易に同定され得ることを理解する。例えば、配列整列化プログラム(例えばBLAST)を使用して、配列番号2に対応するタンパク質における特定の位置が整列化され、同定され得る。配列番号2を参照して本明細書に記載されているアミノ酸の置換、欠失または付加は、本明細書に記載されているか、または当該分野に公知のfEPOの融合物、バリアント、断片などにおける対応する位置の置換、欠失または付加をも指すことが意図されており、本発明によって明らかに包含されている。
“fEPO”という用語は、1つ以上のアミノ酸の置換、付加または欠失を含んでいるfEPOポリペプチドを包含している。天然に存在しているfEPOにおける広範なアミノ酸位置における例示的な置換が説明されており、当該置換としては、アゴニスト活性を向上させる置換、ポリペプチドの可溶性を増大させる置換、ポリペプチドをアンタゴニストに変換する置換などが挙げられるが、これらに限定されない。当該置換は“fEPOポリペプチド”という用語によって包含されている。
ネコEPOアンタゴニストとしては、低い親和性の受容体結合部位(Site2)に見られるV11、R14、Y15、D96、K97、S100、R103、S104、T107、L108およびR110に置換を有しているもの(V11S、R14Q、Y15I、S100E、R103A、S104IおよびL108Kが挙げられるが、これらに限定されない(Elliot et al. 1993を参照))が挙げられるが、これらに限定されない。いくつかの実施形態において、fEPOアンタゴニストは、fEPOをアンタゴニストとして作用させる10〜15位または100〜108位の領域に少なくとも1つの置換を含んでいる。Elliot et al. 1993 and Cheetham et al. 1998を参照すればよい。いくつかの実施形態において、fEPOアンタゴニストは、水溶性重合体に連結されている天然にコードされていないアミノ酸を含んでいる。当該アミノ酸は、hEPO分子のSite2結合領域に存在している。いくつかの実施形態において、fEPOポリペプチドは、以下の置換:V11S、R14Q、Y15I、S100E、R103A、S104IおよびL108Kを含むことによってさらに修飾されている。
いくつかの実施形態において、fEPOの生物学的な活性を調節する付加、置換または欠失をさらに含んでいる。例えば、上記付加、置換または欠失は、fEPO受容体に対する親和性を調節し得るか、受容体の二量体化を調節(増大または低下が挙げられるが、これらに限定されない)し得るか、受容体の二量体を安定化し得るか、循環半減期を調節し得るか、治療半減期を調節し得るか、ポリペプチドの安定性を調節し得るか、用量を調節し得るか、放出もしくは生体安定性を調節し得るか、精製を容易にし得るか、または投与の特定の経路を改良し得るか、もしくは変更し得る。同様に、fEPOポリペプチドは、プロテアーゼ切断配列、反応性基、抗体結合ドメイン(FLAGまたはポリHisが挙げられるが、これらに限定されない)もしくは他の親和性に基づく配列(FLAG、ポリHis、GSTなど)、または検出(GFPが挙げられるが、これらに限定されない)、精製もしくはポリペプチド他の性質を向上させる連結されている分子(ビオチンが挙げられるが、これらに限定されない)を含み得る。
また、“fEPOポリペプチド”という用語は、同じかもしくは異なる天然にコードされていないアミノ酸側鎖のいずれかに対して天然にコードされていないアミノ酸を介して直接的にか、またはリンカーを介して間接的に連結されているfEPOのホモ二量体、ヘテロ二量体、ホモ多量体またはヘテロ多量体を包含している。例示的なリンカーとしては、水溶性重合体(例えば、ポリ(エチレングリコール)、ポリデキストランまたはポリペプチド)が挙げられるが、これらに限定されない。
“天然にコードされていないアミノ酸”は、通常の20のアミノ酸の1つ、ピロールリジンまたはセレノシステインではないアミノ酸を指す。“天然にコードされていないアミノ酸”という用語は、“天然にコードされるアミノ酸(通常の20のアミノ酸、ピロールリジンまたはセレノシステインが挙げられるが、これらに限定されない)の修飾(例えば翻訳後修飾)によって天然に生じるが、翻訳複合体によって伸張されるポリペプチド鎖に天然には組み込まれないアミノ酸を包含しているが、これらに限定されない。当該天然に生じるアミノ酸(天然にコードされていない)の例としては、N−アセチルグルコサミニル−L−セリン、N−アセチルグルコサミニル−L−スレオニンおよびO−ホスホチロシンが挙げられるが、これらに限定されない。
“アミノ末端修飾基”は、ポリペプチドのアミノ末端に結合され得る任意の分子を指す。同様に、“カルボキシル末端修飾基”は、ポリペプチドのカルボキシル末端に結合され得る任意の分子を指す。末端修飾基としては、種々の水溶性重合体、ペプチドまたはタンパク質(例えば、血清アルブミン、またはペプチドの血中半減期を増加させる他の分子)が挙げられるが、これらに限定されない。
“官能基”、“活性部分”、“活性化基”、“切断基”、“反応性部分”、“化学反応性基”および“化学反応性部分”という用語は、当該技術において用いられており、本明細書においてある分子における明確に識別可能な部分または単位を指す。当該用語は、化学の分野において幾分同義語であり、本明細書においていくつかの機能もしくは活性を担い、他の分子と反応性を示す分子の部分を指すために用いられる。
本明細書に使用されるとき、“連結”または“リンカー”という用語は、通常、化学反応の結果として形成される原子団または結合を指し、典型的には共有結合を指す。加水分解に安定な結合とは、長期間(おそらく永久にでさえ)にわたって、生理学的環境において当該結合が水において実質的に安定であり、有用なpH値において水と反応しないことを意味する。加水分解に不安定な結合または分解可能な結合とは、当該結合が水または水性溶液(例えば血液が挙げられる)において分解可能であることを意味する。酵素的に不安定な結合または分解可能な結合とは、当該結合が1つ以上の酵素によって分解され得る結合であることを意味する。PEGおよび関連する重合体が、重合体骨格、または重合体骨格と重合体分子の1つ以上の末端官能基との間のリンカー基における分解可能な結合を含み得ることは、当該技術分野において理解されている。例えば、PEGカルボキシル酸または活性化されたPEGカルボキシル酸と、生物学的に活性な作用物におけるアルコール基との反応によって形成されるエステル結合は、一般に、当該作用物を放出するための生物学的環境において加水分解する。他の加水分解可能な結合としては、これらに限定されないが、炭酸結合;アミンとアルデヒドとの反応から生じるイミン結合;アルコールとリン酸基との反応によって形成されるリン酸エステル結合;ヒドラジドおよびアルデヒドの反応産物であるヒドラゾン結合;アルデヒドとアルコールとの反応産物であるアセタール結合;ギ酸とアルコールとの反応産物であるオルトエステル結合;アミン基によって形成されるペプチド結合(PEGといった重合体の末端における結合が挙げられるが、これらに限定されない);およびホスホラミダイト基におって形成されるオリゴヌクレオチド結合(オリゴヌクレオチドの5’ヒドロキシル基が挙げられるが、これに限定されない)が挙げられる。
本明細書に使用されるとき、“生物学的に活性な分子”、“生物学的に活性な部分”または“生物学的に活性な作用物”という用語は、生物学的な生物(ウイルス、細菌、菌類、植物、動物およびヒトが挙げられるが、これらに限定されない)の物理的または生化学的な任意の特性に影響を及ぼし得る任意の物質を意味する。特に、本明細書に使用されるときの生物学的に活性な分子としては、ヒトもしくは他の動物における疾患の診断、治療、鎮静、処置もしくは予防、またはそうでなければヒトまたは他の動物の肉体的もしくは精神的な健康を増進することを対象にした任意の物質が挙げられるが、これらに限定されない。生物学的に活性な分子の例としては、ペプチド、タンパク質、酵素、小分子薬、色素、脂質、ヌクレオシド、オリゴヌクレオチド、細胞、ウイルス、リポソーム、微小粒子およびミセル体が挙げられるが、これらに限定されない。本発明をともなった使用に好適な生物学的に活性な作用物の分類としては、抗生物質、殺真菌剤、抗ウイルス薬、抗炎症誘発因子、抗腫瘍薬、心血管作動薬、抗不安薬、ホルモン、成長因子およびステロイド剤などが挙げられるが、これらに限定されない。
“二官能性重合体”は、他の部分と特異的に反応して、共有的または非共有的な結合を形成可能な2つの別個の官能基を含んでいる重合体を指す。当該部分としては、アミノ酸側鎖基が挙げられるが、これに限定されない。二官能性リンカーは、特定の生物学的に活性な成分における官能基との反応性を示す1つの官能基、および第2の生物学的成分における官能基と反応性を示す他の官能基を有している。よって、当該二官能性リンカーは、第1の生物活性成分、二官能性リンカーおよび第2の生物活性成分を含んでいる抱合物の形成に使用され得る。種々の化合物をペプチドに結合させる多くの手法およびリンカー分子が知られている。例えば、参照によって本明細書に援用される、欧州特許出願公開第188,256号;米国特許第4,671,958号、米国特許第4,659,839号、米国特許第4,414,148号、米国特許第4,699,784号;米国特許第4,680,338号;米国特許第4,569,789号;および米国特許第4,589,071号を参照すればよい。“多官能性重合体”は、他の部分と特異的に反応して、共有的または非共有的な結合を形成可能な2つ以上の別個の官能基を備える重合体を指す。当該部分としては、アミノ酸側鎖基が挙げられるが、これに限定されない。
置換基が左から右に書かれる従来の化学式によって特定される場合に、それらは、右から左に構造を記載することによって生じる化学的に同一な置換基を等しく包含している(例えば、−CH2O−は−OCH2−と等価である)。
“置換基”という用語は、“非干渉性の置換基”を包含するが、これに限定されない。“非干渉性の置換基”は安定な化合物を生じるこれらの基である。安定な非干渉性の置換基またはラジカルとしては、ハロ、C1−C10アルキル、C2−10アルケニル、C2−10アルキニル、C1−C10アルコキシ、C1−C12アラルキル、C1−C12アルカリル、C3−C12シクロアルキル、C3−C12シクロアルケニル、フェニル、置換フェニル、トルオイル、キシレニル、ビフェニル、C2−C12アルコキシアルキル、C2−C12アルコキシアリール、C7−C12アリールオキシアルキル、C7−C12オキシアリール、C1−C6アルキルスルフィニル、C1−C10アルキルスルフォニル、−−(CH2)m−−O−−(C1−C10アルキル)(ここで、mは1から8である)、アリール、置換アリール、置換アルコキシ、フルオロアルキル、ヘテロ環ラジカル、置換ヘテロ環ラジカル、ニトロアルキル、−−NO2、−−CN、−−NRC(O)−−(C1−C10アルキル)、−−C(O)−−(C1−C10アルキル)、C2−C10アルキルチオアルキル、−−C(O)O−−(C1−C10アルキル)、−−OH、−−SO2、=S、−−COOH、−−NR2、カルボニル、−−C(O)−−(C1−C10アルキル)−CF3、−−C(O)−CF3、−−C(O)NR2、−−(C1−C10アリール)−S−−(C6−C10アリール)、−−C(O)−−(C1−C10アリール)、−−(CH2)m−−O−−(−−(CH2)m−−O−−(C1−C10アルキル)(ここで、mのそれぞれは1から8までである)、−−C(O)NR2、−−C(S)NR2、−−SO2NR2、−−NRC(O)NR2、−−NRC(S)NR2、これらの塩などが挙げられるが、これらに限定されない。本明細書に使用されるとき、Rのそれぞれは、H、アルキルもしくは置換アルキル、アリールもしくは置換アリール、アラルキル、またはアルカリルである。
“ハロゲン”という用語は、フッ素、塩素、ヨウ素、および臭素を包含している。
それ自身によってか、または他の置換基の一部として“アルキル”という用語は、特に断りがない限り、完全に飽和され得るか、一価不飽和され得るか、または多価不飽和され得る、直鎖状もしくは分枝鎖状の鎖、または環状炭化水素ラジカル、またはこれらの組合せを意味しており、所望の炭素原子数(すなわち、C1−C10は1から10の炭素を意味する)を有している二価または多価のラジカルを含み得る。飽和炭化水素ラジカルの例としては、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、t−ブチル、イソブチル、sec−ブチル、シクロヘキシル、(シクロヘキシル)メチル、シクロプロピルメチル、類似物および異性体(例えばn−ペンチル、n−ヘキシル、n−ヘプチルおよびn−オクチルなどの類似物および異性体)といった基が挙げられるが、これらに限定されない。不飽和アルキル基は1つ以上の2重結合または3重結合を有しているアルキル基である。不飽和アルキル基の例としては、ビニル、2−プロペニル、クロチル、2−イソペンテニル、2−(ブタジエニル)、2,4−ペンタジエニル、3−(1,4−ペンタジエニル)、エチニル、1−および3−プロピニル、3−ブチニルならびにより高級な類似物および異性体が挙げられるが、これらに限定されない。また、“アルキル”という用語は、特に断りがない限り、“ヘテロアルキル”といった以下においてより詳細に定義づけされるアルキルの誘導体を含むことが意図されている。炭化水素基に限定されるアルキル基は“ホモアルキル”と称される。
それ自身によってか、または他の置換基の一部として“アルキレン”という用語は、構造−CH2CH2−および−CH2CH2CH2CH2−によって例示されるような、アルカンから得られる二価のラジカルを意味し、“ヘテロアルキレン”として以下に記載されているこれらの基をさらに包含するが、これらに限定されない。典型的に、アルキル(またはアルキレン)基は1から24の炭素原子を有しており、これらの基は本発明において好ましい10以下の炭素原子を有する基である。“低級アルキル”または“低級アルキレン”は、8以下の炭素原子を一般的に有している、より短い鎖状のアルキル基またはアルキレン基である。
“アルコキシ”、“アルキルアミノ”および“アルキルチオ”(またはチオアルコキシ)という用語は、それらの従来の意味において使用され、酸素原子、アミノ基、または硫黄原子をそれぞれ介して分子の残余部分に対して連結されているこれらのアルキル基を指す。
それ自身によってか、または他の用語との組合せにおいて、“ヘテロアルキル”という用語は、特に断りがない限り、一定の数の炭素原子、ならびにO、N、SiおよびSからなる群から選択される少なくとも1つの異種原子(ここで、窒素原子および硫黄原子は任意に酸化され、窒素異種原子は任意に四級化される)から構成される安定な直鎖状、分枝鎖状、または環状の炭化水素ラジカルを意味する。(複数の)異種原子であるO、NおよびSおよびSiは、ヘテロアルキル基の任意の内部位置、またはアルキル基が分子の残余部に対して連結される位置に配置され得る。例としては、−CH2−CH2−O−CH3、−CH2−CH2−NH−CH3、−CH2−CH2−N(CH3−)CH3、−CH2−S−CH2−CH3、−CH2−CH2−S(O)−CH3、−CH2−CH2−S(O)2−CH3、−CH=CH−O−CH3、−Si(CH3)3、−CH2−CH=N−OCH3および−CH=CH−N(CH3)−CH3が挙げられるが、これらに限定されない。最大で2つの異種原子が、例えば−CH2−NH−OCH3および−CH2−O−Si(CH3)3といったように連続し得る。同様に、それ自身によってか、または他の置換基の一部として、“ヘテロアルキレン”という用語は、−CH2−CH2−S−CH2−CH2−および−CH2−S−CH2−CH2−NH−CH2−に例示されるような、ヘテロアルキルから得られる二価のラジカルを意味するが、これらに限定されない。また、ヘテロアルキレン基に関して、同じかまたは異なる異種原子は、鎖の末端のいずれかまたは両方を占有し得る(アルキレンオキシ、アルキレンジオキシ、アルキレンアミノ、アルキレンジアミノおよびアミノオキシアルキレンなどが挙げられるが、これらに限定されない)。また、アルキレン連結基およびへテロアルキレン連結基に関して、連結基の方向は連結基の式が書かれている方向によって意味されない。例えば、式−C(O)2R’は、−C(O)2R’およびR’C(O)2−の両方を意味する。
それら自身によってか、または他の用語との組合せにおいて、“シクロアルキル”および“ヘテロシクロアルキル”という用語は、特に断りがない限り、“アルキル”および“ヘテロアルキル”のぞれぞれの環状の型を表す。したがって、シクロアルキルまたはヘテロシクロアルキルは飽和環結合および不飽和の環結合を含んでいる。さらに、ヘテロシクロアルキルに関して、異種原子は複素環が分子の残余部に対して連結されている位置を占有し得る。シクロアルキルの例としては、シクロペンチル、シクロヘキシル、1−シクロヘキセニル、3−シクロヘキセニル、およびシクロヘプチルなどが挙げられるが、これらに限定されない。ヘテロシクロアルキルの例としては、1−(1,2,5,6−テトラヒドロピリジル)、1−ピペリジニル、2−ピペリジニル、3−ピペリジニル、4−モルホリニル、3−モルホリニル、テトラヒドロフラン−2−イル、テトラヒドロフラン−3−イル、テトラヒドロチエン−2−イル、テトラヒドロチエン−3−イル、1−ピペラジニル、および2−ピペラジニルなどが挙げられるが、これらに限定されない。
本明細書に使用されるとき、“水溶性重合体”という用語は水性溶媒に可溶性を示す任意の重合体を指す。fEPOポリペプチドに対する水溶性重合体の連結は、変化(非修飾形態と比べて増強されたかもしくは調節された血中半減期または増強されたかもしくは調節された治療半減期、調節された免疫原性、調節された物理的な会合特性(例えば、凝集および多量体形成)、変更された受容体結合、ならびに変更された二量体化もしくは多量体化が挙げられるが、これらに限定されない)を生じ得る。水溶性重合体は、特有の生物活性を有し得るか、または有し得ない。好適な重合体としては、ポリエチレングリコール、ポリエチレングリコールプロピオンアルデヒド、モノC1−C10アルコキシ誘導体もしくはモノC1−C10アリールオキシ誘導体(参照によって本明細書に援用される米国特許第5,252,714号に記載されている)、モノメトキシポリエチレングリコール、ポリビニルピロリドン、ポリビニルアルコール、ポリアミノ酸、ジビニルエーテルマレイン酸無水物、N−(2−ヒドロキシプロピル)−メタクリルアミド、デキストラン、デキストラン誘導体(硫化デキストランが挙げられる)、ポリプロピレングリコール、ポリプロピレンオキシド/エチレンオキシド共重合体、ポリオキシエチル化ポリオール、ヘパリン、ヘパリン断片、多糖、オリゴ糖、グリカン、セルロースおよびセルロース誘導体(メチルセルロースおよびカルボキシメチルセルロースが挙げられるが、これらに限定されない)、スターチおよびスターチ誘導体、ポリペプチド、ポリアルキレングリコールおよびこれらの誘導体、ポリアルキレングリコールおよびこれらの誘導体、ポリビニルエチルエーテル、ならびにアルファ−ベータ−ポリ[(2−ヒドロキシエチル)−DL−アスパルトアミドなどの共重合体、あるいはこれらの混合物が挙げられるが、これらに限定されない。当該水溶性重合体の例としては、ポリエチレングリコールおよび血清アルブミンが挙げられるが、これらに限定されない。
本明細書に使用されるとき、“ポリアルキレングリコール”という用語は、ポリエチレングリコール、ポリプロピレングリコール、ポリブチレングリコールおよびこれらの誘導体を指す。“ポリアルキレングリコール”という用語は、0.1kDaから100kDaの間の平均分子量を有している、直鎖状および分枝鎖状の重合体の両方を包含する。他の例示的な実施形態は、例えば、株式会社シェアーウォーター(Shearwater)のカタログ“Polyethylene Glycol and Derivatives for Biomedical Applications”(2001)といった商業的な供給業者のカタログに挙げられている。
“アリール”という用語は、特に断りがない限り、ともに融合されるか、または共有的に結合される単環または多環(好ましくは、1から3つの環)であり得る、多価不飽和の芳香族炭化水素置換基を意味する。“ヘテロアリール”という用語は、N、OおよびSから選択される1から4つの異種原子を含んでいるアリール基(または環)を指す。ここで、窒素原子および硫黄原子は任意に酸化され、(複数の)窒素原子は任意に四級化されている。ヘテロアリール基は、異種原子を介して分子の残余部に対して連結され得る。アリール基またはヘテロアリール基の非限定的な例としては、フェニル、1−ナフチル、2−ナフチル、4−ビフェニル、1−ピロリル、2−ピロリル、3−ピロリル、3−ピラゾリル、2−イミダゾリル、4−イミダゾリル、ピラジニル、2−オキサゾリル、4−オキサゾリル、2−フェニル−4−オキサゾリル、5−オキサゾリル、3−イソキサゾリル、4−イソキサゾリル、5−イソキサゾリル、2−チアゾリル、4−チアゾリル、5−チアゾリル、2−フリル、3−フリル、2−チエニル、3−チエニル、2−ピリジル、3−ピリジル、4−ピリジル、2−ピリミジル、4−ピリミジル、5−ベンゾチアゾリル、プリニル、2−ベンズイミダゾリル、5−インドリル、1−イソキノリル、5−イソキノリル、2−キノキサリニル、5−キノキサリニル、3−キノリルおよび6−キノリルが挙げられる。上述のアリール環系およびヘテロアリール環系のそれぞれに関する置換基は、以下に記載される受容可能な置換基の群から選択される。
簡潔に言うと、他の用語との組合せにおいて使用される場合の、“アリール”という用語(アリールオキシ、アリールチオキシ、アリールアルキルが挙げられるが、これらに限定されない)は、上記定義づけのようなアリール環およびヘテロアリール環の両方を包含している。したがって、“アリールアルキル”という用語は、アリール基がアルキル基に対して連結されているこれらのラジカル(ベンジル、フェネチル、およびピリジルメチルなどが挙げられるが、これらに限定されない)であって、当該アルキル基が、炭素原子が例えば酸素原子によって置換されているこれらのアルキル基(メチレン基が挙げられるが、これに限定されない)を包含しているこれらのラジカル(フェノキシメチル、2−ピリジルオキシメチル、および3−(1−ナフチルオキシ)プロピルなどが挙げられるが、これらに限定されない)を包含することが意図されている。
上述の用語のそれぞれ(“アルキル”、“ヘテロアルキル”、“アリール”および“ヘテロアリール”が挙げられるが、これらに限定されない)は、示されているラジカルの置換形態および非置換形態の両方を包含することを意図されている。それぞれの種類のラジカルにとっての例示的な置換基が以下に規定されている。
アルキルラジカルおよびへテロアルキルラジカル(アルキレン、アルケニル、ヘテロアルキレン、ヘテロアルケニル、アルキニル、シクロアルキル、ヘテロシクロアルキル、シクロアルケニルおよびへテロシクロアルケニルとしばしば呼ばれるこれらの基が挙げられる)にとっての置換基は、0から(2m’+1)の範囲の数における(ここで、m’は当該ラジカルにおける炭素原子の総数である)、−OR’、=O、=NR’、=N−OR’、−NR’R’’、−SR’、−ハロゲン、−SiR’R’’R’’’、−OC(O)R’、−C(O)R’、−CO2R’、−CONR’R’’、−OC(O)NR’R’’、−NR’’C(O)R’、−NR’−C(O)NR’’R’’’、−NR’’C(O)2R’、−NR−C(NR’R’’R’’’)=NR’’’’、−NR−C(NR’R’’)=NR’’’、−S(O)R’、−S(O)2R’、−S(O)2NR’R’’、−NRSO2R’、−CNおよび−NO2から選択される多様な群の1つ以上であり得るが、これらに限定されない。R’、R’’、R’’’およびR’’’’はそれぞれ独立して、水素、置換もしくは非置換のヘテロアルキル、置換もしくは非置換のアリール(1−3のハロゲンに置換されたアリールが挙げられるが、これに限定されない)、置換もしくは非置換のアルキル、アルコキシもしくはチオアルコキシ基、またはアリールアルキル基を指す。本発明の化合物が1つ以上のR基を含む場合に、例えばR基はそれぞれ独立して、1つ以上のこれらの基が存在する場合にR’、R’’、R’’’およびR’’’’基のそれぞれであるように選択される。R’およびR’’が、同じ窒素原子に連結される場合に、それらは、5−、6−、7−員環を形成するために窒素原子と組み合せられ得る。例えば、−NR’R’’は、1−ピロリジニルおよび4−モルホリニルを含むことを意図されているが、これらに限定されない。置換基の上述の議論から、当業者は、“アルキル”という用語が、水素基以外の基(例えば、ハロアルキル基(−CF3および−CH2CF3が挙げられるが、これらに限定されない)およびアシル(−C(O)CH3、−C(O)CF3、および−C(O)CH2OCH3などが挙げられるが、これらに限定されない))に対して結合される炭素原子を含むことを意図されていることを理解する。
アルキルラジカルに関して記載される置換基と同様に、アリール基およびへテロアリール基にとっての置換基は、変更され、0から芳香族環系における空いている原子価の総数の範囲の数において、ハロゲン、−OR’、=O、=NR’、=N−OR’、−NR’R’’、−SR’、−ハロゲン、−SiR’R’’R’’’、−OC(O)R’、−C(O)R’、−CO2R’、−CONR’R’’、−OC(O)NR’R’’、−NR’’C(O)R’、−NR’−C(O)NR’’R’’’、−NR’’C(O)2R’、−NR−C(NR’R’’R’’’)=NR’’’’、−NR−C(NR’R’’)=NR’’’、−S(O)R’、−S(O)2R’、−S(O)2NR’R’’、−NRSO2R’、−CNおよび−NO2、−R’、−N3、−CH(Ph)2、フルオロ(C1−C4)アルコキシ、ならびにフルオロ(C1−C4)アルキルから選択されるが、これらに限定されない。ここで、R’、R’’、R’’’およびR’’’’が独立して、水素、アルキル、ヘテロアルキル、アリールおよびヘテロアリールから選択される。本発明の化合物が、1つ以上のR基を含む場合に、例えば、R基のそれぞれは独立して、1つ以上のこれらの基が存在する場合に、R’、R’’、R’’’およびR’’’’のそれぞれであるように、選択される。
本明細書に使用されるとき、“調節された血中半減期”という用語は、その非修飾形態に比べて、修飾された生物学的に活性な分子の循環半減期における正または負の変化を意味する。血中半減期は、生物学的に活性な分子の投与後における種々の時点において血液試料を採取すること、および試料のそれぞれにおける分子の濃度を決定することによって測定される。時間と血清濃度との相関関係によって、血中半減期の算出が可能になる。増強された血中半減期は、少なくとも約2倍を好ましく有しているが、例えば、十分な投与計画を可能にするか、または毒作用を避ける場合には、より小さな増強が有用であり得る。いくつかの実施形態において、増強は少なくとも約3倍、少なくとも約5倍または少なくとも約10倍である。
本明細書に使用されるとき、“調節された治療半減期”という用語は、その非修飾形態に比べて、治療有効量の修飾された生物学的に活性な分子の半減期における正または負の変化を意味する。治療半減期は、投与後における種々の時点において分子の薬物動態特性および/または薬理学的特性を測定することによって測定される。増強された治療半減期は、特に利益をもたらす投与計画または特に利益をもたらす総投与量を好ましく可能にするか、または好ましくない影響を好ましく回避する。いくつかの実施形態において、増強された治療半減期は、増強された有効性、修飾された分子のその標的に対する増強されたかもしくは低減された結合、または非修飾分子の作用の他の要素もしくは機序の増強もしくは減弱を生じる。
核酸またはタンパク質に適用されるとき“単離された”という用語は、核酸またはタンパク質が、天然の状態において会合される他の細胞性構成要素から十分に遊離していることを表す。それは均質な状態にあり得る。単離された物質は、乾燥状態もしくは半乾燥状態、または溶液(水性溶液が挙げられるが、これに限定されない)内のいずれかにあり得る。純度および均質性は、ポリアクリルアミドゲル電気泳動または高速液体クロマトグラフィーといった分析化学的技術を用いて、典型的に決定される。調製物に存在する優勢種であるタンパク質は、実質的に精製されている。特に、単離された遺伝子は、遺伝子に隣接し、所定の遺伝子以外のタンパク質をコードするオープンリーディングフレームから分離されている。“精製されている”という用語は、核酸またはタンパク質が電気泳動ゲルにおいて実質的に1つのバンドを生じることを表す。特に、それは、核酸またはタンパク質が少なくとも85%の純度、少なくとも90%の純度、少なくとも95%の純度、少なくとも99%かそれ以上の純度であることを意味し得る。
“核酸”という用語は、一本鎖の形態または二本鎖の形態のいずれかとしての、デオキシリボヌクレオチド、またはリボヌクレオチド、ならびにこれらの重合体を指す。特に断りがない限り、当該用語は、基準の核酸と同様の結合特性を有しており、天然に存在しているヌクレオチドと同様の様式において代謝される天然ヌクレオチドの公知の類似物を含んでいる核酸を包含する。また、特に断りがない限り、特定の核酸配列は、これらの保存的に修飾されたバリアント(変性コドン置換が挙げられるが、これに限定されない)および相補的な配列、これらと同様に明確に示されている配列を暗に包含する。特に、変性コドン置換は、1つ以上の選択された(またはすべての)コドンの3番目の位置が混合塩基および/またはデオキシイノシン残基に置換される配列を生成することによって達成され得る(Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985) ;Cassol et al. (1992) ;Rossolini et al., Mol. Cell. Probes 8:91-98 (1994))。
“ポリペプチド”、“ペプチド”および“タンパク質”という用語は、本明細書において交換可能に使用されて、アミノ酸残基の重合体を指す。すなわち、ポリペプチドを対象とする記載は、ペプチドの記載およびタンパク質の記載に等しく適用され、逆の場合も同様である。当該用語は、天然に存在するアミノ酸重合体および1つ以上の残基が天然にコードされていないアミノ酸であるアミノ酸重合体に適用される。本明細書に使用されるとき、当該用語は任意の長さ(全長のタンパク質(例えば抗原)が挙げられる)のアミノ酸鎖を包含し、ここでアミノ酸残基は共有的なペプチド結合によって連結されている。
抗体は、特異的な抗原に対して結合特異性を示すタンパク質である。天然の抗体は、通常、約150,000ダルトンのヘテロ四量体の糖タンパク質であり、2つの同一の軽(L)鎖および2つの同一の重(H)鎖からなる。軽鎖のそれぞれは1つの共有的なジスルフィド結合によって重鎖と結合しており、同時に、ジスルフィド結合の数は異なる免疫グロブリンのイソタイプの重鎖の間において変わる。また、重鎖および軽鎖のそれぞれは、規則正しく間隔があけられている鎖内のジスルフィド架橋を有している。重鎖のそれぞれは、一方の末端に可変ドメイン(VH)を有しており、その後に多くの定常ドメインが続いている。軽鎖のそれぞれは、一方の末端に可変ドメイン(VL)を有しており、もう一方の端部に定常ドメインを有している。軽鎖の定常ドメインは重鎖の第1の定常ドメインと並んでおり、軽鎖の可変ドメインは重鎖の可変ドメインと並んでいる。特定のアミノ酸残基は、軽鎖の可変ドメインと重鎖の可変ドメインとの間に接合点を形成すると考えられている。
“可変”という用語は、可変ドメインの特定の部分が抗体間の配列において広範囲にわたって異なっており、その特定の抗原に対する各特定の抗体の結合特異性を担っているという事実を指す。しかし、可変性は抗体の可変ドメインの全体にわたって均等に分布していない。それは、軽鎖および重鎖の両方の可変領域における相補性決定領域(CDR)と呼ばれる3つの部分に集中している。可変ドメインの最も高度に保存されている部分はフレームワーク領域(FR)と呼ばれている。天然の重鎖および軽鎖の可変ドメインのそれぞれは、3または4つのCDRによって接続されており、βシート構造を主に取っている4つのFR領域を含んでいる。CDRは、βシート構造に接続しており、ある場合にβシート構造の一部を形成しているループを形成している。各鎖におけるCDRは、FR領域によって他の鎖に由来するCDRと非常に近傍に保持されており、抗体の抗原結合部位の形成に寄与している(Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)を参照すればよい)。
定常ドメインは、抗原に対する抗体の結合には直接的に関与しないが、種々のエフェクター機能を示す。重鎖の定常ドメインのアミノ酸配列に依存して、抗体または免疫グロブリンは異なるクラスに割り当てられ得る。免疫グロブリンには5つの主なクラス:IgA、IgD、IgF、IgGおよびIgMがあり、それらのいくつかはサブクラス(アイソタイプ)(例えば、IgG1、IgG2、IgG3およびIgG4;IgA1およびIgA2)にさらに分けられ得る。免疫グロブリンの異なるクラスに対応する重鎖の定常領域はそれぞれ、α、δ、ε、γおよびμと呼ばれる。種々のヒト免疫グロブリンのクラスのうち、ヒトのIgG1、IgG2、IgG3およびIgMのみが活性な構成要素であると知られている。
インビボにおいて、抗体の成熟は、体細胞性の超変異生成によって主になされるより高い親和性の抗体バリアントの抗原選択によって促進される。また、二次応答または三次応答の優勢生殖遺伝子が一次応答ならびに二次応答の優勢生殖遺伝子と異なると理解されている“レパートリーシフト”がしばしば起こる。
免疫系の親和性成熟の過程は、インビトロにおける抗体遺伝子に変異を導入すること、および親和性選択を利用して向上した親和性を有している変異体を分離することによって再現され得る。そのような変異体抗体は、糸状菌または微生物(例えば酵母)の表面に提示され得、抗体は、抗原に対するそれらの親和性または抗原からの解離(オフレート)の反応速度論によって選択され得る(Hawkins et al. J. Mol. Biol. 226:889-896 (1992))。CDRウォーキング変異生成は、ヒト免疫不全ウイルス1型(HIV−1)のヒトエンベロープ糖タンパク質gp120に結合するヒト抗体(Barbas III et al. PNAS (USA) 91: 3809-3813 (1994);およびYang et al. J. Mol. Biol. 254:392-403 (1995))、および抗c−erbB−2の単鎖Fv断片(Schier et al. J. Mol. Biol. 263:551567 (1996))を親和性成熟させるために採用されている。抗体鎖シャッフリングおよびCDR変異生成は、HIVの3番目の超可変ループに対して親和性の高いヒト抗体の親和性成熟に使用された(Thompson et al. J. Mol. Biol. 256:77-88 (1996))。Balint and Larrick Gene 137:109-118 (1993)には、コンピュータを利用したオリゴリボヌクレオチドの定方向変異生成について記載されている。ここで、可変領域遺伝子のすべてのCDRが良好なバリアントに関して同時かつ全体的に検索されている。αvβ3−特異的なヒト化抗体は、6つのCDRのすべてのあらゆる位置が変異を受け、最も高い親和性の変異体を含んでいる組合せライブラリの発現およびスクリーニングを行う初期の限られた変異生成方法を用いて親和性成熟された(Wu et al. PNAS (USA) 95: 6037-6-42 (1998))。ファージディスプレイされた抗体について、Chiswell and McCafferty TIBTECH 10:80-84 (1992);およびRader and Barbas III Current Opinion in Biotech. 8:503-508 (1997)に記載されている。親抗体と比べて向上した親和性を有している変異体抗体が上記の文献に報告されているそれぞれの場合において、変異体抗体はCDRにアミノ酸置換を有している。
本明細書において“親和性変異”によって、その抗原に対する抗体の親和性を増強させる処理が意図されている。親和性変異のための方法としては、コンピュータを利用したスクリーニング法および実験的な方法が挙げられるが、これらに限定されない。
本明細書において“抗体”によって、抗体遺伝子のすべてまたは一部によって実質的にコードされている1つ以上のポリペプチドからなるタンパク質が意図されている。免疫グロブリン遺伝子としては、κ、λ、α、γ(IgG1、IgG2、IgG3およびIgG4)、δ、εおよびμの定常領域遺伝子、ならびに無数の免疫グロブリンの可変領域遺伝子が挙げられるが、これらに限定されない。本明細書において抗体は、全長の抗体および抗体断片、ならび任意の生物に天然に存在しているか、または改変さている(例えばバリアント)に抗体を含んでいることが意図されている。
“抗体断片”によって、全長の形態以外の抗体の任意の形態が意図されている。本明細書における抗体断片としては、全長の抗体に存在しているより小さい構成要素である抗体、および改変されている抗体が挙げられる。抗体断片としては、Fv、Fc、Fabおよび(Fab’)2、単鎖Fv(scFv)、ダイアボディ、トリアボディ、テトラボディ、二機能性ハイブリッド抗体、CDR1、CDR2、CDR3、CDRの組合せ、可変領域、フレームワーク領域ならびに定常領域などが挙げられるが、これらに限定されない(Maynard & Georgiou, 2000, Annu. Rev. Biomed. Eng. 2:339-76; Hudson, 1998, Curr. Opin. Biotechnol. 9:395-402)。
“アミノ酸”という用語は、天然に存在するアミノ酸および天然に存在していないアミノ酸、ならびに天然に存在するアミノ酸と類似の様式に機能するアミノ酸類似物およびアミノ酸模倣物を指す。天然にコードされるアミノ酸は、通常の20のアミノ酸(アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン、グルタミン酸、グリシン、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、スレオニン、トリプトファン、チロシン、およびバリン)、ピロールリジンおよびセレノシステインである。アミノ酸類似物は、天然に存在するアミノ酸と同じ基本の化学構造を有する化合物(すなわち、水素、カルボキシル基、アミノ基、およびR基(例えば、ホモセリン、ノルロイシン、メチオニンスルフォキシド、メチオニンメチルスルフォニウム)に対して結合されているα炭素)を指す。当該類似物は、修飾されたR基(例えば、ノルロイシン)または修飾されたペプチド骨格を有しているが、天然に存在するアミノ酸と同じ基本の化学構造を維持している。
アミノ酸は、本明細書において、国際純正および応用化学連合−国際生化学連合生化学命名委員会によって推奨されている、一般的に知られる3文字表記、または1文字表記のいずれかによって示される。同様に、ヌクレオチドは一般的に受け容れられているそれらの1文字符号によって示される。
“保存的に修飾されたバリアント”は、アミノ酸配列および核酸配列の両方に適用される。特定の核酸配列に関して、“保存的に修飾されたバリアント”は、同一もしくは本質的に同一なアミノ酸配列をコードしているか、または核酸がアミノ酸配列をコードしていない場合に実質的に同一な、それらの核酸を指す。遺伝暗号の縮重のために、非常に多数の機能的に同一な核酸が所定のタンパク質のいずれかをコードしている。実際に、コドンGCA、GCC、GCGおよびGCUのすべては、アミノ酸のアラニンをコードする。したがって、アラニンがコドンによって特定されるすべての位置において、コドンは、コードされるポリペプチドを変更せずに、記載されている対応するコドンのうちいずれかのコドンに変更され得る。このような核酸の変異は、保存的に修飾される変異の1種である“サイレント変異である”。また、ポリペプチドをコードする本明細書におけるすべての核酸配列は、核酸のすべての見込みのあるサイレント変異について説明している。当業者は、核酸におけるコドンのそれぞれ(通常、メチオニンに対する唯一のコドンであるAUG、および通常、トリプトファンに対する唯一のコドンであるTGGを除いて)が修飾されて、機能的に同一な分子を生成し得ることを認識している。したがって、ポリペプチドをコードする核酸のサイレント変異のそれぞれは、記載されている配列のそれぞれにおいて暗に示されている。
アミノ酸配列については、当業者は、コードされるアミノ酸における単一のアミノ酸または低い割合のアミノ酸を変更するか、付加するかもしくは欠失する核酸配列、ペプチド配列、ポリペプチド配列またはタンパク質配列に対する個々の置換、欠失または付加が、変更が化学的に類似のアミノ酸とのアミノ酸の置換を結果として生じる場合に、“保存的に修飾されているバリアント”であることを認識する。機能的に類似のアミノ酸を規定する保存的な置換の表は、当業者に公知である。当該保存的に修飾されたバリアントは、加えて、本発明の多形バリアント、種間相同物、および対立因子を除外しない。
以下の8つの群のそれぞれ:
(1)アラニン(A)、グリシン(G);
(2)アスパラギン酸(D)、グルタミン酸(E);
(3)アスパラギン(N)、グルタミン(Q);
(4)アルギニン(R)、リジン(K);
(5)イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V);
(6)フェニルアラニン(P)、チロシン(Y)、トリプトファン(W);
(7)セリン(S)、スレオニン(T);および
(8)システイン(C)、メチオニン(M)
は、他の1つのアミノ酸に対して保存的な置換であるアミノ酸を含んでいる(例えば、Creighton, Proteins: Structures and Molecular Properties (W H Freeman & Co.; 2nd edition (December 1993)を参照すればよい)。
2つ以上の核酸配列またはポリペプチド配列において、“同一の”または“同一性の”割合は、同じである2つ以上の配列または部分配列を指す。配列は、以下の配列比較演算手順の1つを用いてか、もしくは手動の整列化および目視検査によって測定されるような比較領域または所望の領域の全体にわたって最大の一致に関して比較され、整列される場合に同じである割合(すなわち、特定の領域の全体にわたって、約60%の同一性、任意により、約65%、約70%、約75%、約80%、約85%、約90%、または約95%の同一性)であって、それらがアミノ酸残基またはヌクレオチドの当該割合を有する場合に、“実質的に同一”である。また、この定義は、試験配列の相補性を指す。同一性は、少なくとも約50のアミノ酸もしくはヌクレオチドの長さである領域の全体にわたってか、または75−100のアミノ酸もしくはヌクレオチドの長さである領域の全体にわたってか、または特に特定されないが、ポリヌクレオチドもしくはポリペプチドの全体の配列にわたって存在し得る。
配列比較に関して、1つの配列は、比較される試験配列に対する基準配列としての役目を典型的に果たす。配列比較演算手順を用いる場合に、試験配列および基準配列はコンピュータに入力され、配列座標が指定され、必要に応じて配列演算手順のプログラム変数が指定される。初期設定のプログラム変数が使用され得るか、または代替の変数が指示され得る。それから、配列比較演算手順は、プログラム変数に基づいて基準配列と比較した、試験配列に関する配列同一性の割合を算出する。
本明細書に使用されるとき、“比較領域”は、2つの配列が最適に整列化された後に、配列が連続する位置の同じ数の基準領域に対して比較され得る20から600、一般的に約50から約200、より一般的に約100から約150からなる群から選択される多くの連続する位置のいずれか1つの区分に対する基準を包含している。比較に関する配列の整列化の方法は当業者にとって公知である。比較に関する配列の最適な整列化は、これらに限定されないが、Smith and Waterman (1970) Adv. Appl. Math. 2:482cの局部的な相同性演算手順、Needleman and Wunsch (1970) J. Mol. Biol. 48:443の相同性整列化演算手順、Pearson and Lipman (1988) Proc. Nat’l. Acad. Sci. USA 85:2444の類似性に関する検索方法、これらの演算手順のコンピュータ化された実施(the Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WIにおけるGAP、BESTFIT、FASTA、およびTFASTA)、または手動の整列化および目視検査(例えば、Ausubel et al., Current Protocols in Molecular Biology (1995 supplement) を参照すればよい)が挙げられる演算方法によって、実施され得る。
配列同一性および配列類似性の割合の決定に好適な演算手順の一例はBLASTおよびBLAST2.0演算手順である(それぞれ、Altschul et al. (1977) Nuc. Acids Res. 25:3389-3402、およびAltschul et al. (1990) J. Mol. Biol. 215:403-410に記載されている)。BLAST分析を実施するソフトウェアは、全米バイオテクノロジー情報センターを通して一般に利用可能である。BLAST演算手順の変数W、TおよびXは整列化の感度および速度を決定する。BLASTNプログラム(ヌクレオチド用)には、11のワード長(W)、期待値(E)または10、M=5、N=−4を初期設定として、両方の鎖の比較を使用する。アミノ酸配列に関して、BLASTPプログラムは、3のワード長、および10の期待値(E)を初期設定として、BLOSUM62 採点マトリクス(Henikoff and Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915を参照すればよい)50の位置合わせ(B)、10の期待値(E)、M=5、N=−4および両方の鎖の比較を使用する。BLAST演算手順は、無効にされる“低い複雑性”のフィルタを用いて典型的に実施される。
また、BLAST演算手順は、2つの配列間の類似性の統計的な分析を実施する(例えば、Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5787を参照すればよい)。BLAST演算手順によって与えられる類似性の指標の1つは、2つのヌクレオチド配列またはアミノ酸配列の間の適合が偶然に生じる確率の指標を提供する、最小の総和確率(P(N))である。例えば、核酸は、基準核酸に対する試験核酸の比較において最小の総和確率が約0.2未満、より好ましくは約0.01未満、および最も好ましくは約0.001未満である場合に、基準配列に対して類似であると見做される。
“〜に対して選択的に(または特異的に)ハイブリダイズする”という表現は、配列が複合混合物(全体の細胞またはライブラリのDNAまたはRNAが挙げられるが、これらに限定されない)内に存在する場合に、ストリンジェントなハイブリダイゼーション条件において、特定のヌクレオチド配列に対してのみ結合すること、2重鎖化すること、またはハイブリダイズすることを指す。
“ストリンジェントなハイブリダイゼーション条件”という表現は、当該技術において知られるように、低いイオン強度および高い温度の条件を指す。典型的に、ストリンジェントな条件において、プローブは、核酸の複合混合物(全体の細胞またはライブラリのDNAまたはRNAが挙げられるが、これらに限定されない)においてその標的配列とハイブリダイズするが、複合混合物における他の配列とはハイブリダイズしない。ストリンジェントな条件は、配列依存的であり、異なる環境において異なる。より長い配列は、より高い温度において特異的にハイブリダイズする。核酸のハイブリダイゼーションに対する広範にわたる指針は、Tijssen, Techniques in Biochemistry and Molecular Biology--Hybridization with Nucleic Probes, “Overview of principles of hybridization and the strategy of nucleic acid assays” (1993)に見られる。一般的に、ストリンジェントな条件は規定のイオン強度 pHにおける、特定の配列に関する熱溶融点(Tm)よりも約5−10℃低く選択される。Tmは、標的に対して相補的なプローブの50%が平衡状態において標的配列とハイブリダイズする(標的配列がTmにおいて過剰に存在し、プローブの50%が平衡状態にあるような)、温度である(規定のイオン強度、pH、および核酸の濃度の条件下)。ストリンジェントな条件は、塩濃度がpH7.0から8.3において約1.0M未満のナトリウムイオン濃度、典型的に約0.01から1.0Mのナトリウムイオン濃度(または他の塩)であり、短いプローブ(10から50のヌクレオチドが挙げられるが、これらに限定されない)に関して温度が少なくとも約30℃、および長いプローブ(50を超えるヌクレオチドが挙げられるが、これらに限定されない)に関して少なくとも約60℃である条件であり得る。また、ストリンジェントな条件はホルムアミドといった不安定化剤の添加を伴って達成され得る。選択的または特異的なハイブリダイゼーションに関して、正のシグナルは、バックグラウンドの少なくとも2倍の、状況に応じてバックグラウンドの10倍のハイブリダイゼーションであり得る。例示的なストリンジェントなハイブリダイゼーション条件は、以下のとおり:65℃において0.2×SSC、および0.1%のSDSにおける洗浄を伴う、42℃においてインキュベートする50%のホルムアミド、5×SSC、および1%のSDSか、または65℃においてインキュベートする5×SSC、1%SDSであり得る。当該洗浄は、5、15、30、60、120分、またはそれ以上にわたって実施され得る。
本明細書に使用されるとき、“真核生物”という用語は、動物(哺乳類、昆虫、爬虫類、鳥類などが挙げられるが、これらに限定されない)、繊毛虫類、植物(単子葉植物、双子葉植物、藻類などが挙げられるが、これらに限定されない)、菌類、酵母、鞭毛虫、微胞子虫、原生生物といった、真核生物界の系統学的な領域に属する生体を指す。
“真核細胞”および“複数の真核細胞”の一例としては、CHO、骨髄腫、BHKなどの哺乳類細胞、免疫細胞、昆虫細胞、鳥類細胞、両生類細胞(例えば、カエル卵母細胞)、菌類細胞および酵母細胞が挙げられる。酵母としては、Saccharomyces、Schizosaccharomyces、Hansenula、Candida、Torulopsis、Yarrowia、Pichiaなどが挙げられる。発現にとって特に好ましい酵母としては、メチロトローフ酵母菌株(例えば、Pichia pastoris、Hansenula、polymorpha、Pichia guillermordii、Pichia methanolica、Pichia inositoveraなど)が挙げられる(例えば、すべての目的について参照によって本明細書に援用される米国特許第4,812,405号明細書、米国特許第4,818,700号明細書、米国特許第4,929,555号明細書、米国特許第5,736,383号明細書、米国特許第5,955,349号明細書、米国特許第5,888,768号明細書および米国特許第6,258,559号明細書を参照すればよい)。これらおよび他の特許には、プロモータ、ターミネータ、エンハンサ、シグナル配列、および酵母における非相同遺伝子発現を促進するために有用な他の調節配列(本発明において見られるようなタンパク質の遺伝子)がさらに記載されている。
本明細書に使用されるとき、“形質転換”という用語は、遺伝形質を変化させ、結果として受容細胞における変化を生じさせる、受容宿主細胞へのDNAの任意の導入を指すために広い意味において使用される。
本明細書に使用されるとき、“非真核生物”という用語は非真核生物の生体を指す。例えば、非真核生物の生体は、系統学的な領域の真正細菌(Escherichia coli、Thermus thermophilus、Bacillus stearothermophilus、などが挙げられるが、これらに限定されない)、または系統学的な領域の古細菌(Methanococcus jannaschii、Methanobacterium thermoautotrophicum、Halobacterium(例えば、Haloferax volcaniiおよびHalobacterium種のNRC−1)、Archaeoglobus fulgidus、Pyrococcus furiosus、Pyrococcus horikoshii、Aeuropyrum pernixなどが挙げられるが、これらに限定されない)に属することができる。
本明細書に使用されるとき、“対象”という用語は、処置、観察または実験の対象である動物、好ましくは哺乳類、最も好ましくはヒトを指す。
〔詳細な説明〕
当業者は、(1)ネコエリスロポエチンの組成物および関連する方法にとっての、(2)イヌエリスロポエチン(cEPO)(配列番号31 成熟アミノ酸配列、配列番号30 全長アミノ酸配列)およびウマエリスロポエチン(eEPO)(配列番号33 成熟アミノ酸配列、配列番号32 全長アミノ酸配列)に関連する組成物および関連する方法にとっての、(3)cEPOポリペプチドおよびeEPOポリペプチドに組み込まれている非天然の(unnatural)アミノ酸、非天然の(non-natural)アミノ酸および/または天然にコードされていないアミノ酸を有しているcEPOおよびeEPOにとっての、以下に示されている同じ方法を構築可能であり、使用可能である。また、これらのポリペプチドは、本明細書に開示されているように、処置を必要としているネコまたは他の動物の処置に使用され得るか、または当該ポリペプチドはイヌまたはウマの処置に使用され得る。図34および35には、本明細書においてより詳細に述べられているfEPO(166アミノ酸)に対する、cEPOおよびeEPOに関する166アミノ酸の配列のそれぞれとの比較について示されているが、本開示事項はまた、天然にコードされていないアミノ酸の配列番号31および33(それぞれcEPOおよびeEPO)に対する置換、付加または欠失に対する裏づけを与えている。
I.導入
非天然アミノ酸を少なくとも1つ含んでいるネコEPO分子が、本発明において提供される。本発明のある実施形態において、非天然アミノ酸を少なくとも1つ有しているEPOポリペプチドは、少なくとも1つの翻訳後修飾を含んでいる。一実施形態において、少なくとも1つの翻訳後修飾は、分子(色素、重合体(ポリエチレングリコールの誘導体が挙げられるがこれに限定されない)、光架橋剤、細胞毒性化合物、親和性標識、ビオチンの誘導体、樹脂、第2のタンパク質もしくはポリペプチド、抗体もしくは抗体断片、金属キレート剤、補助因子、脂肪酸、含水炭素、ポリヌクレオチド(DNA、RNAが挙げられるがこれらに限定されない)などが挙げられるが、これらに限定されない)の連結を含んでいる。当該分子は、特定の反応性基にとって好適であることが当業者に知られている化学方法論に利用される第1の反応性基を含んでいる少なくとも1つの非天然アミノ酸に対して反応性を示す第2の基を含んでいる。例えば、第1の反応性基が、アルキニル部分(非天然アミノ酸p−プロパルギルオキシフェニルアラニン(ここで、プロパルギル基は、ときにアセチレン部分とも呼ばれる)における、が挙げられるが、これに限定されない)であり、第2の反応性基がアジド部分であり、[3+2]付加環化の化学方法論が利用される。他の例において、第1の反応性基が、アジド部分(非天然アミノ酸p−アジド−L−フェニルアラニンが挙げられるが、これに限定されない)であり、第2の反応性基がアルキニル部分である。本発明の修飾されたfEPOポリペプチドのある特定の実施形態において、少なくとも1つの翻訳後修飾を含んでいる少なくとも1つの非天然アミノ酸(ケト官能基を含有する非天然アミノ酸が挙げられるが、これに限定されない)が、使用される(ここで、少なくとも1つの翻訳語後修飾が糖鎖部分を含んでいる)。ある特定の実施形態において、翻訳後修飾は真核細胞または非真核細胞のインビボにおいてなされる。
ある特定の実施形態において、タンパク質は1つの宿主細胞によってインビボにおいてなされる少なくとも1つの翻訳後修飾を含んでおり、ここで、当該翻訳後修飾は他の宿主によって通常はなされない。ある特定の実施形態において、タンパク質は真核細胞によってインビボにおいてなされる少なくとも1つの翻訳修飾を含んでおり、ここで、当該翻訳後修飾は非真核細胞によって通常はなされない。翻訳後修飾の例としては、アセチル化、アシル化、脂質修飾、パルミトイル化、パルミチン酸付加、リン酸化および糖脂質結合修飾などが挙げられるが、これらに限定されない。ある実施形態において、翻訳後修飾は、GlcNAc−アスパラギン酸結合によるアスパラギン酸に対するオリゴ糖(オリゴ糖が(GlcNAc−Man)2−Man−GlcNAc−GlcNAcなどを包含する場合が挙げられるが、これに限定されない)の連結を含んでいる。他の実施形態において、翻訳後修飾は、GalNAc−セリン、GalNAc−スレオニン、GlcNAc−セリン、またはGlcNAc−スレオニン結合による、セリンまたはスレオニンに対するオリゴ糖(Gal−GalNAc、Gal−GlcNAcなどが挙げられるが、これらに限定されない)の連結を含んでいる。ある特定の実施形態において、本発明のタンパク質またはポリペプチドは、分泌シグナル配列もしくは局在配列、エピトープタグ、FLAGタグ、ポリヒスチジンタグ、および/またはGST融合などを含み得る。
所定のタンパク質またはポリペプチドは、少なくとも1つの、少なくとも2つの、少なくとも3つの、少なくとも4つの、少なくとも5つの、少なくとも6つの、少なくとも7つの、少なくとも8つの、少なくとも9つの、または10もしくはそれ以上の非天然アミノ酸を含有し得る。非天然アミノ酸は、同じであるか、または異なり得る(例えば、1、2、3、4、5、6、7、8、9、10またはそれ以上の異なる非天然アミノ酸を含んでいるタンパク質における1、2、3、4、5、6、7、8、9、10またはそれ以上の異なる部位にあり得る)。ある特定の実施形態において、タンパク質の天然に存在する型に存在する特定のアミノ酸のすべてではないが、少なくとも1つが非天然アミノ酸に置換されている。
本発明は、天然にコードされていないアミノ酸を少なくとも1つ含んでいるGHスーパージーンファミリーのメンバー(特にfEPO)を用いた方法および組成物を提供する。GHスーパージーンファミリー(例えば、fEPO)に対する天然にコードされていないアミノ酸の少なくとも1つの導入は、通常に存在する20のアミノ酸と反応しないが、1つ以上の天然にコードされていないアミノ酸と反応する(これが挙げられるが、限定されない)、特定の化学反応を含む抱合化学的性質の適用を可能にする。いくつかの実施形態において、天然にコードされていないアミノ酸を含んでいるGHスーパージーンファミリー(例えばfEPO)は、ポリエチレングリコール(PEG)といった水溶性重合体に対して、天然にコードされていないアミノ酸の側鎖を介して連結される。本発明はPEG誘導体を用いてタンパク質を選択的に修飾する高効率な方法を提供する。当該方法は、遺伝的にコードされないアミノ酸のセレクターコドンに応じたタンパク質への効率的な組込み、および好適な反応性のPEG誘導体を用いたこれらのアミノ酸の一連の修飾に関する。ここで、遺伝的にコードされないアミノ酸としては、天然に組み込まれる20のアミノ酸に見られない官能基または置換基(アジドまたはアセチレン部分が挙げられるが、これらに限定されない)が挙げられるが、これらに限定されない。組み込まれると、それから、アミノ酸側鎖は、天然にコードされたアミノ酸に存在する特定の官能基または置換基にとって好適であると当業者に知られる、化学方法論を利用することによって修飾され得る。多種多様な公知の化学方法論が、水溶性重合体をタンパク質に組み込むために、本発明における使用にとって好適である。当該方法論としては、ヒュイゲン[3+2]付加環化反応(アセチレン誘導体またはアジド誘導体のそれぞれとのヒュイゲン[3+2]付加環化反応が挙げられるが、これらに限定されない)が挙げられるが、これらに限定されない(例えば、Padwa, A. in Comprehensive Organic Synthesis, Vol. 4, (1991) Ed. Trost, B. M., Pergamon, Oxford, p. 1069-1109;およびHuisgen, R. in 1,3-Dipolar Cycloaddition Chemistry, (1984) Ed. Padwa, A., Wiley, New York, p. 1-176を参照すればよい)。
ヒュイゲン[3+2]付加環化法は求核置換反応よりむしろ付加環化に関するので、タンパク質は非常に高い選択性をともなって修飾され得る。反応は、室温および水性条件において、非常に良好な位置選択性(1,4>1,5)をともなって、反応混合物に触媒量のCu(I)塩を添加することによって実施され得る。例えば、Tornoe, et al., (2002) Org. Chem. 67:3057-3064; and, Rostovtsev, et al., (2002) Angew. Chem. Int. Ed. 41:2596-2599および国際公開第03/101972号を参照すればよい。[3+2]付加環化を介して本発明のタンパク質に加えられ得る分子としては、好適な官能基または置換基(アジド誘導体またはアセチレン誘導体が挙げられる)を有している実質的に任意の分子が挙げられるが、これらに限定されない。これらの分子は、アセチレン基またはアジド基を有している非天然アミノ酸のそれぞれに対して付加され得る。アセチレン基を有している非天然アミノ酸としては、p−プロパルギルオキシフェニルアラニンが挙げられるが、これに限定されない。アジド基を有する非天然アミノ酸としては、p−アジド−フェニルアラニンが挙げられるが、これに限定されない。
ヒュイゲン[3+2]付加環化から生じる5員環は、還元性環境において一般的に不可逆的であり、水性環境において長期間にわたって加水分解に対して安定である。結果として、多種多様な物質の物理的および化学的な特性が本発明の活性PEG誘導体をともなう厳しい水性条件において修飾され得る。さらに重要なことに、アジド部分およびアセチレン部分が互いに特異的である(そして、例えば遺伝的にコードされる通常の20のアミノ酸のいずれとも反応しない)ので、タンパク質は非常に高い選択性をともなって1つ以上の特定の部位において修飾され得る。
また、本発明は、PEG誘導体の加水分解に対して安定な水溶性の誘導体を提供し、1つ以上のアセチレン部分またはアジド部分を有している親水性重合体に関する。アセチレン部分を含有しているPEG重合体誘導体は、セレクターコドンに応じてタンパク質に選択的に導入されているアジド部分と結合する高い選択性を有している。同様に、アジド部分を含有するPEG重合体誘導体は、セレクターコドンに応じてタンパク質に選択的に導入されているアセチレン部分と結合する高い選択性を有している。
より詳細には、アジド部分は、アルキルアジド、アリールアジドおよびこれらのアジドの誘導体を包含しているが、これらに限定されない。アルキルアジドおよびアリールアジドの誘導体は、アセチレン特異的な反応性が維持される限り、他の置換基を含み得る。アセチレン部分は、アルキルアセチレン、アリールアセチレンおよびそれぞれの誘導体を包含しているが、これらに限定されない。アルキルアセチレンおよびアリールアセチレンの誘導体は、アジド特異的な反応性が維持される限り、他の置換基を含み得る。
本発明は、他の物質(水溶性重合体(例えば、PEG);薬物;小分子;生体材料;または他に所望される任意の化合物もしくは物質が挙げられるが、これらに限定されない)との、多種多様な官能基、置換基または部分を有している物質の抱合物を提供する。また、本発明は、対応するアセチレンまたはアジド部分を有しているPEG重合体誘導体との、アジドまたはアセチレン部分を有している物質の抱合物を包含している。例えば、アジド部分を含んでいるPEG重合体は、アセチレン官能性基を有している遺伝的にコードされないアミノ酸を含んでいるタンパク質における位置において、生物学的に活性な分子に連結され得る。PEGおよび生物学的に活性な分子が連結される結合としては、ヒュイゲン[3+2]付加環化産物が挙げられるが、これに限定されない。
PEGを用いて生体材料の表面を修飾し得ることは、当該技術において十分に確立されている。例えば、参照によって本明細書に援用される、米国特許第6,610,281号;Mehvar, R., J. Pharmaceut. ScL, 3(1):125-136 (2000)を参照すればよい。また、本発明は、1つ以上のアジド反応性部位もしくはアセチレン反応性部位を有している表面、およびヒュイゲン[3+2]付加環化結合を介して当該表面に結合されている本発明のアジドもしくはアセチレン含有重合体を含んでいる生体材料を包含している。また、生体材料および他の物質は、アジド結合またはアセチレン結合以外の結合を介してアジドまたはアセチレン活性化重合体に対して結合され得る。当該結合は、例えば、後の反応に利用可能なアジド部分またはアセチレン部分を残しておくための、カルボン酸、アミン、アルコールまたはチオール部分を含んでいる結合である。
本発明は、本発明のアジド含有重合体およびアセチレン含有重合体を合成する方法を包含している。アジド含有PEG誘導体の場合には、アジドは、重合体の炭素原子に対して直接に結合され得る。他の方法として、アジド含有PEG誘導体は、生成される重合体がその末端にアジド部分を有するように、1つの末端にアジド部分を有している連結剤を従来の活性化重合体に連結させることによって調製され得る。アセチレン含有PEG誘導体の場合には、アセチレンは、重合体の炭素原子に対して直接に結合され得る。他の方法として、アセチレン含有PEG誘導体は、生成される重合体がその末端にアセチレン部分を有するように、1つの末端にアセチレン部分を有している連結剤を従来の活性化重合体に連結させることによって調製され得る。
より詳細には、アジド含有PEG誘導体の場合には、少なくとも1つの活性ヒドロキシ部分を有する水溶性重合体は、より反応性の高い部分を有している置換重合体を生成するための反応を受ける。より反応性の高い部分は、例えば、水溶性重合体上にあるメシレート基、トレシレート基、トシレート基またはハロゲン離脱基である。ハロゲン化スルフォニル酸、ハロゲンおよび他の離脱基を含んでいるPEG誘導体の調製および使用は、当業者にとって公知である。それから、生成される置換重合体は、重合体の末端においてアジド部分をより反応性の高い部分に置換するための反応を受ける。他の方法としては、少なくとも1つの活性な求核部分または求電子部分を有している水溶性重合体は、1つの末端にアジド部分を有している連結剤との反応を受ける。当該連結剤は、1つの末端にアジド部分を有しているので、PEG重合体と連結剤との間に共有結合が形成され、アジド部分が重合体の末端に配置される。求核部分および求電子部分は当業者に公知であり、これらとしては、アミン、チオール、ヒドラジド、ヒドラジン、アルコール、カルボン酸塩、アルデヒド、ケトンおよびチオエステルなどが挙げられる。
より詳細には、アセチレン含有PEG誘導体の場合には、少なくとも1つの活性なヒドロキシ部分を有している水溶性重合体は、アセチレン部分を含んでいる前駆体からハロゲンまたは活性な離脱基を置換するための反応を受ける。他の方法としては、少なくとも1つの活性な求核部分または求電子部分を有している水溶性重合体は、1つの末端にアセチレン部分を有している連結剤との反応を受ける。当該連結剤は、1つの末端にアセチレン部分を有しているので、PEG重合体と連結剤との間に共有結合が形成され、アセチレン部分が重合体の末端に配置されることを可能にする。PEG誘導体の有機合成、調製および使用に関する、ハロゲン部分、活性化脱離基、求核部分および求電子部分の使用は、当該分野において十分に確立されている。
また、本発明は、修飾されているタンパク質に他の物質を加えるために、タンパク質を選択的に修飾する方法を提供する。他の物質としては、水溶性重合体(例えば、アジド部分もしくはアセチレン部分を含有するPEGおよびPEG誘導体)が挙げられるが、これらに限定されない。アジド含有PEG誘導体およびアセチレン含有PEG誘導体を使用して、表面を修飾し得、分子の特性を調節し得る。ここで、当該特性としては、生体利用効率、安定性、溶解性および欠失した免疫原性が重要である。同時に、タンパク質に対してPEG誘導体をより選択的に連結させる手段は、当該技術において以前から公知であった。
II.成長ホルモンスーパージーンファミリー
成長ホルモン(GH)スーパージーンファミリーの遺伝子によってコードされているタンパク質としては、以下のタンパク質:成長ホルモン、プロラクチン、胎盤性ラクトゲン、エリスロポエチン(EPO)、トロンボポエチン(TPO)、インターロイキン−2(IL−2)、IL−3、IL−4、IL−5、IL−6、IL−7、IL−9、IL−10、IL−11、IL−12(p35サブユニット)、IL−13、IL−15、オンコスタチンM、毛様体神経栄養因子、白血病抑制因子、αインターフェロン、βインターフェロン、γインターフェロン、ωインターフェロン、τインターフェロン、顆粒球コロニー刺激因子(G−CSF)、顆粒球マクロファージコロニー刺激因子(GM−CSF)、マクロファージコロニー刺激因子(M−CSF)およびカルディオトロフィン−1(CT−1)(“GHスーパージーンファミリー”)が挙げられる(Bazan, F., Immunology Today 11: 350-354 (1991); Bazan, J. F. Science 257: 410-411 (1992); Mott, H. R. and Campbell, I. D., Current Opinion in Structural Biology 5: 114-121 (1995); Silvennoinen, O. and Ihle, J. N., SIGNALLING BY THE HEMATOPOIETIC CYTOKINE RECEPTORS (1996))。このスーパージーンファミリーのさらなるメンバーは遺伝子のクローニングおよび配列決定を介して将来的に同定されることが予想される。GHスーパージーンファミリーのメンバーは、それらが限られたアミノ酸配列またはDNA配列の同一性しか有していないという事実にもかかわらず、類似の二次構造および三次構造を有している。共有されている構造上の特徴によって、当該遺伝子ファミリーの新たなメンバーの容易な同定が可能である。GHスーパージーンファミリーのメンバーの間に構造的な相同性の程度が示されているので、天然にコードされていないアミノ酸は、GHスーパージーンファミリーの任意のメンバーに、本発明を用いて組み込まれ得る。
サイトカインのメンバーの構造は、X線回折およびNMR試験によって決定されており、有意な一次配列の相同性を欠いているにもかかわらず、GHの構造とともに著しい保存を示している。サイトカインとしては、G−CSF(Hill, C. P., Proc. Natl. Acad. Sci. USA 90:5167-5171 (1993))、GM−CSF(Diederichs, K., et al. Science 154: 1779-1782 (1991); Walter et al., J. Mol. Biol. 224:1075-1085 (1992))、IL−2(Bazan, J. F. Science 257: 410-411 (1992); McKay, D. B. Science 257: 412 (1992))、IL−4(Redfield et al., Biochemistry 30: 11029-11035 (1991); Powers et al., Science 256:1673-1677 (1992))、およびIL−5(Milburn et al., Nature 363: 172-176 (1993))が挙げられる。EPOはモデリングおよび変異生成の研究に基づいてこのファミリーのメンバーであると見なされている(Boissel et al., J. Biol. Chem. 268: 15983-15993 (1993); Wen et al., J. Biol. Chem. 269: 22839-22846 (1994))。さらなる多くのサイトカインおよび成長因子がこのファミリーに属しており、その例としては、毛様体神経栄養因子(CNFT)、白血病抑制因子(LIF)、トロンボポエチン(TPO)、オンコスタチンM、マクロファージコロニー刺激因子(M−CSF)、IL−3、IL−6、IL−7、IL−9、IL−12、IL−13、IL−15、ならびにα、β、ω、τおよびγ インターフェロンが挙げられる(Mott and Campbell, Current Opinion in Structural Biology 5: 114-121 (1995); Silvennoinen and Ihle (1996) SIGNALLING BY THE HEMATOPOIETIC CYTOKINE RECEPTORSに概説されている)。現在、上述のサイトカインおよび成長因子のすべては1つの大きな遺伝子ファミリーを構成していると考えられている。
共有している類似の二次構造および三次構造に加えて、このファミリーのメンバーは、細胞内シグナル経路を活性化するために細胞表面受容体をオリゴマー化する必要があるという特性を共有している。GHファミリーのいくつかのメンバー(GHおよびEPOが挙げられるが、これらに限定されない)は、単一の種類の受容体と結合し、その受容体のホモ二量体の形成を引き起こす。ファミリーの他のメンバー(IL−2、IL−4およびIL−6が挙げられるが、これらに限定されない)は、1つ以上の種類の受容体と結合し、ヘテロ二量体またはより高次の凝集物の形成を引き起こす(Davis et al., (1993) Science 260: 1805-1808; Paonessa et al., (1995) EMBO J. 14: 1942-1951; Mott and Campbell, Current Opinion in Structural Biology 5: 114-121 (1995))。GHと同様にこれらの他のサイトカインおよび成長因子が複数(典型的に2つ)の受容体結合部位を含んでおり、それらの同種の受容体と次々に結合することが、変異生成の研究によって示されている。GHと同様に、ファミリーのこれらの他のメンバーは、4つのαヘリックスおよびA−Bループを主に生じる。受容体結合に関与するヘリックスバンドルにおけるアミノ酸は、ファミリーのメンバーの間において異なっている。GHスーパージーンファミリーのメンバーと相互作用する細胞表面受容体のほとんどは、構造的に関連性を有しており、第2の大きなマルチ遺伝子ファミリーを構成している。米国特許第6,608,183号を参照すればよい。
GHスーパージーンファミリーの種々のメンバーの変異の研究から達せられた一般的な結論は、αヘリックスに接続しているループが一般的に受容体結合に関与しない傾向にあることである。特に、短いB−Cループはすべてではないがほとんどのファミリーのメンバーにおいて受容体結合に非必須であると思われる。このため、B−Cループは、GHスーパージーンファミリーのメンバーにおいて、本明細書に記載の天然にコードされていないアミノ酸を用いて置換され得る。また、A−Bループ、C−Dループ(およびGHスーパーファミリーのインターフェロン/IL−10様のメンバーのD−Eループ)は、非天然に存在しているアミノ酸を用いて置換され得る。また、ヘリックスAに近く、最後のヘリックスから遠いアミノ酸は受容体結合に関与しない傾向があり、非天然に存在しているアミノ酸を導入する部位であり得る。いくつかの実施形態において、天然にコードされていないアミノ酸は、ループ領域内の任意の位置(A−B、B−C、C−DまたはD−Eループの最初の1、2、3、4、5、6、7またはそれ以上のアミノ酸が挙げられるが、これらに限定されない)に置換されている。いくつかの実施形態において、天然にコードされていないアミノ酸は、A−B、B−C、C−DまたはD−Eループの最後の1、2、3、4、5、6、7またはそれ以上のアミノ酸に置換されている。
GHファミリーの特定のメンバー(EPO、IL−2、IL−4、IL−6、G−CSF、GM−CSF、TPO、IL−10、IL−12 p35、IL−13、IL−15およびβインターフェロンが挙げられるが、これらに限定されない)は、N結合型およびO結合型の糖を含んでいる。タンパク質における糖鎖付加部位のほとんどはループ領域以外に存在しており、αヘリックスバンドルには存在していない。ループ領域が受容体結合に一般的に関与しておらず、糖鎖の共有結合部位であるので、それらは天然にコードされていないアミノ酸をタンパク質に組み込むための有用な部位であり得る。タンパク質においてN結合型およびO結合型の糖鎖付加部位を構成しているアミノ酸は、これらのアミノ酸が表面露出しているので、非天然に存在しているアミノ酸置換のための部位であり得る。したがって、天然のタンパク質は、これらの部位におけるタンパク質に対する巨大な糖鎖の結合を許容し得、糖鎖付加部位は受容体結合部位から離れて位置している傾向にある。
GH遺伝子ファミリーのさらなるメンバーは将来的に発見されると思われる。GHスーパージーンファミリーの新たなメンバーは、予想されるタンパク質配列のコンピュータを利用した二次構造および三次構造の解析を通して同定され得る。GHスーパージーンファミリーのメンバーは、非ヘリックス性のアミノ酸によってつながれている4または5つの両親媒性のらせん(ループ領域)を典型的に有している。タンパク質は細胞からの分泌を促進するためのそのN末端に疎水性シグナル配列を含み得る。また、GHスーパーファミリーの今後発見されるそのようなメンバーが本発明の範囲に包含される。
本願におけるfEPOポリペプチドに対する言及は、GHスーパージーンファミリーの一例としてfEPOを使用することを意図されている。したがって、fEPOを参照して本明細書に記載されている修飾および化学的性質は、GHスーパージーンファミリーの任意の他のメンバー(本明細書に特に挙げられているメンバーが挙げられる)に対して適用され得る。
III.所望の単一または複数の遺伝子産物を単一の発現コンストラクトから生成する、本発明とともに使用される発現系
本明細書に記載されているのは、単一または複数の発現コンストラクトから所望の単一または複数の遺伝子産物を生成する新規な発現系である。一実施形態において、本発明は、人工アミノ酸を含めるための抑制に必要なすべての要素をコードしている単一のベクターから、抑制されている所望のタンパク質の遺伝子が転写される真核生物の抑制発現系を含んでいる。特に発現系は、人工アミノ酸を含んでいる(複数の)タンパク質を真核生物の宿主細胞において発現可能なベクターを含んでいる。発現系は、非天然アミノ酸(non-natural amino acid)または非天然アミノ酸(unnatural amino acid)を含んでいる(複数の)タンパク質を原核生物の宿主細胞において発現可能なベクターを含んでいる。発現系は、天然にコードされていないアミノ酸(例えば、p−アセチルフェニルアラニン(pAF)が挙げられるが、これらに限定されない)を含んでいる(複数の)タンパク質を真核生物の宿主細胞において発現可能なベクターを含んでいる。発現ベクターは、作動可能に連結されている以下の要素:単コピーまたは多コピーの抑制tRNA配列(真核細胞において作動可能なプロモータおよび転写終結因子が挙げられる);発現(抑制)される所望の任意の遺伝子をコードしているDNA配列と連結されているプロモータ;および哺乳類の機能的なtRNA合成酵素のコーディング領域と連結されているプロモータを含み得る。本発明の一実施形態は、抑制発現ベクターを含んでいる哺乳類細胞、および抑制発現ベクターを用いてトランスフェクトされている哺乳類細胞において機能的に抑制されているタンパク質を生成する方法である。
また、本発明は、真核生物の宿主細胞における発現系を介した、十分な発現レベルにおける機能的なタンパク質の抑制発現に関する。一実施形態において、本発明は、真核細胞、好ましくは哺乳類細胞、真菌細胞または酵母細胞、より好ましくはCHO(チャイニーズハムスターの卵巣)細胞における、抑制発現系を用いた機能的なタンパク質の抑制発現に関する。
より詳細には、本発明の一実施形態は、真核細胞(例えば、哺乳類細胞、真菌細胞または酵母細胞)における、抑制発現系を用いた機能的なタンパク質の抑制発現に関し、ここで、すべての抑制要素が単一のベクターに含まれている。本発明の一実施形態は、CHO(チャイニーズハムスターの卵巣)細胞(ATCCに寄託されている細胞、ならびに公知のバリアント、およびCHO細胞の代わりに使用され得ることが当業者にとって公知の細胞および/または細胞株)における、抑制発現系を用いた機能的なタンパク質の抑制発現に関し、ここで、すべての抑制要素が単一のベクターに含まれている。本発明のこの実施形態の一局面において、哺乳類細胞における機能的なタンパク質の抑制発現は、所望のtRNA、tRNA合成酵素およびタンパク質の転写/翻訳エレメントを含んでいる抑制発現系を用いることを包含している。
本発明の他の実施形態は、細胞内の発現レベルを効率的に調節するために、転写方向に依存しない単一または複数のtRNA要素を含んでいる選択肢を提供する。他の実施形態において、本発明は、人工アミノ酸が導入される所望の単一のタンパク質をコードしている単一の転写ユニットを含んでいる選択肢を提供する。本発明の他の実施形態は、所望の複数のタンパク質またはそれらにおけるサブユニット(例えば、抗体の軽鎖および重鎖)をコードしている複数の転写ユニットを含んでいる選択肢を提供する。ここで、人工アミノ酸が当該タンパク質の一方または両方に導入されている。
本発明の他の実施形態は、抑制されているタンパク質を分泌する真核生物の細胞株(例えば、CHO細胞株)であり、ここで、当該タンパク質の発現は本明細書に記載の抑制発現系を介している。いくつかの実施形態において、真核生物の細胞はCHO細胞または酵母細胞(例えばPichia)である。本発明の他の実施形態は、機能的に抑制されているタンパク質を生成可能な抑制発現系を含んでいる哺乳類細胞または酵母細胞の培養物である。本発明に係る発現抑制配列を含んでいるベクターは哺乳類細胞または酵母細胞に導入され得る。細胞培養の間に、外来性のDNA配列がランダムにか、または相同性組換えを介して哺乳類細胞または酵母細胞のゲノムに挿入されるように、外来性の所望のDNA配列が標的の哺乳類細胞または酵母細胞に導入され得る。使用される配列に依存して、機能的に抑制されているタンパク質は細胞培養物の生物資源または細胞培養の培地から回収され得る。
本発明のさらなる他の実施形態は、抗体の軽鎖および重鎖の配列を発現する抑制発現系を含んでいる真核細胞、好ましくは哺乳類細胞または酵母細胞を培養すること、ならびに細胞培養物から機能的な抗体を回収することを包含している機能的に抑制されているタンパク質を生成する方法である。機能的な抗体は、工業的な最大の生産量のために最適化されている条件において治療用途に好適なレベルに、流加回分細胞培養において生成され得る。例えば、グルコースレベルが継続的に制御されている流加回分培養において培養されたCHO細胞は、少なくとも12日間以上にわたって組換えタンパク質を生成し得る。例えば、流加回分培養において培養されている細胞による組換えタンパク質の生産量に関する考察について、米国特許第6,180,401号を参照すればよい。
異なる種類の様々なタンパク質が本発明にしたがって発現され得る。タンパク質の種類としては、単一のポリペプチドまたは複数が集合したポリペプチド(例えばこれに限定されないが、抗体)が挙げられる。本発明の目的のために、多くの発現抑制ベクター系が使用され得る。例えば、発現抑制ベクターは、細菌(例えばこれらに限定されないが、E. coli、Bacillus、Salmonella);動物ウイルス(例えば、ウシパピローマウイルス、ポリオーマウイルス、ワクシニアウイルス、バキュロウイルス、レトロウイルス(RSV、MMTVまたはMOMLV)、SV40ウイルス)に由来するDNAエレメントを含み得る。さらに、発現抑制コンストラクトのDNAがそれらの染色体に統合されている細胞は、形質転換されている宿主細胞の選択を可能にする1つ以上のマーカーの導入によって選択され得る。マーカーは、選択について当業者に公知の任意の手段(栄養要求性の宿主に対する原栄養性、殺生剤耐性(例えば抗生物質)または重金属(例えば銅)に対する耐性が挙げられるが、これらに限定されない)を提供する。選択可能なマーカー遺伝子は、発現される遺伝子配列と直接に連結され得るか、または同時形質導入によって同じ細胞に導入され得る。mRNAの合成の最適化に使用され得るさらなる要素としては、スプライスシグナル、ならびに転写プロモータ、エンハンサ、および終結シグナルが挙げられる。
より一般的に、タンパク質サブユニットをコードしているベクターまたはDNA配列がいったん調製されると、発現ベクターは適切な宿主細胞に導入され得る。つまり宿主細胞は形質転換され得る。宿主細胞へのプラスミドの導入は当業者に公知の種々の手法によって実施され得る。これらとしては、トランスフェクション(電気泳動および電気穿孔法が挙げられる)、原形質融合、リン酸カルシウム沈降、外皮に包まれたDNAを用いた細胞融合、微量注入、PEIおよび完全なウイルスを用いた感染が挙げられるが、これらに限定されない。Ridgway, A. A. G. "Mammalian Expression Vectors" Chapter 24.2, pp. 470-472 Vectors, Rodriguez and Denhardt, Eds. (Butterworths, Boston, Mass. 1988)を参照すればよい。最も好ましくは、安定に統合されているベクターに関して、宿主細胞へのプラスミドの導入は電気穿孔法を介している。形質転換されている細胞は、タンパク質の生成にとって適切な条件において培養され、タンパク質合成についてアッセイされる。所望の遺伝子産物を同定し、定量化する例示的なアッセイの手法としては、酵素結合免疫吸着アッセイ(ELISA)、放射免疫アッセイ(RIA)もしくは蛍光標示式細胞分取アッセイ、免疫組織化学などが挙げられる。
本発明の一実施形態において、タンパク質発現に使用される宿主細胞は哺乳類由来である。当業者は所望の遺伝子産物の発現に適合している宿主細胞または細胞株を容易に決定し得る。例示的な宿主細胞としては、DG44およびDUXB11(チャイニーズハムスターの卵巣株、DHFR−)、CHO−K1派生物、CHO−S、HELA(ヒトの子宮頸がん)、CVI(サルの腎株)、COS(SV40のT抗原を有しているCVIの派生物)、R1610(チャイニーズハムスターの繊維芽細胞)、BALBC/3T3(マウスの繊維芽細胞)、HAK(ハムスターの腎株)、SP2/O(マウスの骨髄腫)、P3x63−AG3.653(マウスの骨髄腫)、BFA−1c1BPT(ウシの内皮細胞)、RAJI(ヒトのリンパ球)、および293(ヒトの腎)が挙げられるが、これらに限定されない。CHO細胞が特に好ましい。宿主細胞または細胞株は、商業的な事業体のアメリカンティシューカルチャーコレクション、または公知の文献から典型的に入手可能である。
インビトロ生成は、抑制発現系を用いて生成される所望のポリペプチドを大量に生じさせる大規模化を可能にする。組織培養条件における真核生物(例えば哺乳類細胞および酵母細胞)の培養は当該分野において公知であり、当該培養としては、均質な懸濁培養(例えば、エアリフト反応器または連続攪拌反応器における)、または固定化細胞培養もしくは捕捉細胞培養(例えば、中空糸、微小カプセル、アガロース微小ビーズ、またはセラミックカートリッジにおける)が挙げられる。抗体の単離および回収について、培養懸濁物における免疫グロブリンがまず、例えば硫酸アンモニウムを用いた沈殿、吸湿性の材料(例えばPEG)に対する透析、または選択膜を介したろ過によって、濃縮され得る。必要に応じてか、および/または所望される場合に、多価抗体の濃縮溶液は、通常のクロマトグラフィー法(例えば、ゲルろ過、イオン交換クロマトグラフィー、DEAEセルロースに通すクロマトグラフィー、または(免疫)親和性クロマトグラフィー)によって精製される。
本発明のいくつかの実施形態において、発現に使用される真核細胞は哺乳類細胞または酵母細胞である。本発明の他の実施形態において、発現に使用される真核細胞はCHO細胞である。本発明のさらなる実施形態において、発現に使用される真核細胞は高レベルのタンパク質生成のために効率的に培養される他の細胞である。上述のように、本発明に係る抑制発現系に組み込むためのタンパク質遺伝子の入手またはクローニングは当業者の範疇にある。上述のように、そのようなタンパク質遺伝子は、成熟遺伝子、全長タンパク質をコードし得るか、または当該タンパク質遺伝子は、例えばキメラ化、ヒト化、ドメイン欠失もしくは部位特異的変異生成によって修飾され得る。本発明の系によって生成されるタンパク質としては、全長タンパク質、成熟タンパク質、切断されているタンパク質、切断されていないタンパク質、本明細書に開示されているタンパク質、抗体、抗体断片(Fv、Fc、Fabおよび(Fab’)2、単鎖Fv(scFv)、ダイアボディ、トリアボディ、テトラボディ、二機能性のハイブリッド抗体、CDR1、CDR2、CDR3、CDRの組合せ、可変領域、フレームワーク領域、定常領域などが挙げられるが、これらに限定されない)が挙げられる。
本発明の一実施形態において、発現系は、真核生物の細胞(非限定的な例:哺乳類細胞(例えば、チャイニーズハムスターの卵巣(CHO)細胞、新生児ハムスターの腎(BHK)細胞、繊維が細胞株および骨髄腫細胞))においてタンパク質を生成する。一実施形態において、CHO細胞は、シストロンを含んでいる抑制発現系にとっての宿主として使用される。当該シストロンは、以下の配列:tRNA配列遺伝子、発現に使用される特定の真核生物の細胞において機能的な真核生物のプロモータ配列(例えば、CMV、SV40の初期、またはアクチンのプロモータ配列、好ましくはCMV);所望のタンパク質をコードしているDNA配列、好ましくは5’末端における真核生物の分泌リーダー配列;ならびに5’開始コドンおよび3’終止コドンによって挟まれている配列、およびその3’末端におけるポリA配列を含んでいる。
本発明にしたがって抑制されており、発現されているタンパク質は、抱合されている形態(すなわち免疫抱合物)または抱合されていない形態の多くのうちのいずれか1つにおいて一般的に使用され得る。特に本発明のタンパク質は、細胞毒素(例えば放射性同位元素、治療薬、細胞分裂抑制剤、生物学的な毒素またはプロドラッグ)と抱合され得る。特に好ましい実施形態において、本発明の発現系にしたがって生成されるタンパク質は、例えば放射性同位元素または生物活性ペプチドとの抱合によって、修飾され得る。多くの公知のキレート剤または直接標識のうちのいずれかを用いる本発明にしたがって有用な放射性同位元素の例としては、90Y、125I、131I、123I、111In、105Rh、153Sm、67Cu、67Ga、166Ho、177Lu、186Reおよび188Reが挙げられる。一実施形態において、抱合されているタンパク質および抱合されていないタンパク質は、例えば特定の非ホジキンリンパ腫の処置に対するZevalinを使用する現在認可されている治療法に使用されるように、同じ治療法においてともに使用され得る。
他の実施形態において、本発明のタンパク質は、薬剤、プロドラッグまたは生物学的な応答の調節物(例えば、メトトレキセート、アドリアマイシンおよびリンフォカイン(例えばサイトカイン))と結合されている修飾されているタンパク質を含んでいる組成物に含められ得る。本発明のさらなる他の実施形態は、特定の生物毒素(例えばリシンまたはジフテリア毒素)と抱合されている修飾されているタンパク質の使用を包含している。さらなる他の実施形態において、修飾されているタンパク質は免疫学的に活性な他のリガンド(例えば抗体またはそれらの断片)と複合体化され得、ここで、生じる分子は、新生細胞および必要に応じて効果細胞(例えばT細胞)と結合する。さらなる他の実施形態において、修飾されているタンパク質は免疫学的に活性な他のリガンド(例えば抗体またはそれらの断片)と複合体化され得、ここで、生じる分子は、新生細胞および効果細胞(例えばT細胞)と結合する。抱合されているか、および/または抱合されていない修飾されているタンパク質の、使用するための選択は、がんの種類および段階、付加的な処置(例えば、化学療法または外部放射線)、および患者の状態に依存している。当業者が本明細書の教示に鑑みてそのような選択を容易になし得ることが十分に理解される。
本発明は、非限定的な実施例2、3および4によってさらに例証されている。
IV.本発明とともに使用するための一般的な組換え核酸法
本発明の多くの実施形態において、所定のfEPOポリペプチドをコードする核酸は、単離され、クローン化され、しばしば組換え法を用いて変更される。当該実施形態は、これらに限定されないが、fEPOポリペプチドから得られるバリアント、誘導体、発現カセットまたは他の配列の、タンパク質発現または生成の間を含めて使用される。いくつかの実施形態において、本発明のポリペプチドをコードする配列は、異種のプロモータに対して作動可能に連結されている。hEPOの単離について、例えば、米国特許第5,441,868号;米国特許第5,547,933号;米国特許第5,618,698号;米国特許第5,621,080号;および米国特許第6,544,748号に記載されており、また、ヒト細胞におけるEPOの産生について、国際公開第93/09222号パンフレットに記載されている(各明細書は、参照によって本明細書に援用される)。これらの技術は単離およびfEPOの産生において当業者によって用いられ得る。
天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドをコードするヌクレオチド配列は、親ポリペプチドのアミノ酸配列に基づいて合成され得る(配列番号2(または配列番号4、または必要に応じてそれに代わる公知の配列またはSNPs)に示されるアミノ酸配列を有し、それから関連する(複数の)アミノ酸残基の導入(すなわち組み込みまたは置換)または除去(すなわち欠失または置換)をもたらすようにヌクレオチド配列を変えている、が挙げられるが、これらに限定されない)。ヌクレオチド配列は、従来の方法にしたがった部位特異的な変異生成によって簡便に修飾され得る。代替可能に、ヌクレオチド配列は、化学合成(オリゴヌクレオチド合成機を用いること、および好ましくは組換えポリペプチドが産生される宿主細胞に好まれるこれらのコドンを選択することが挙げられるが、これらに限定されない)によって調製され得る(ここで、オリゴヌクレオチドは、所望のポリペプチドのアミノ酸配列に基づいて設計される)。例えば、所望のポリペプチドの部分をコードする種々の小さなオリゴヌクレオチドが合成され、PCR、ライゲーションまたはライゲーション連鎖反応によって組み立てられ得る。例えば、参照によって本明細書に援用される、Barany, et al., Proc. Natl. Acad. Sci. 88: 189-193 (1991) ;米国特許第6,521,427号を参照すればよい。
本発明は、組換え遺伝学の分野における通常の技術を利用している。本発明に使用する一般的な方法を開示する基本的な教科書としては、Sambrook et al., Molecular Cloning, A Laboratory Manual (3rd ed. 2001);Kriegler, Gene Transfer and Expression: A Laboratory Manual (1990);およびCurrent Protocols in Molecular Biology (Ausubel et al., eds., 1994))が挙げられる。
分子生物学的な技術について記載している一般的な教科書としては、Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, CA (Berger);Sambrook et al., Molecular Cloning - A Laboratory Manual (2nd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989 (“Sambrook”)およびCurrent Protocols in Molecular Biology, F.M. Ausubel et al., eds., Current Protocols, a joint venture beTween Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., (supplemented through 1999) (“Ausubel”))が挙げられる。これらの教科書には、変異生成、ベクター、プロモータおよび他の関連性のある多くの原理(非天然アミノ酸、直交性のtRNA、直交性の合成酵素、およびこれらの対を含んでいるタンパク質産生用のセレクターコドンを含んでいる、遺伝子の生成と関連性のあるものが挙げられるが、これらに限定されない)の利用について記載されている。
多様な種類の変異生成が本発明において種々の目的に使用される。当該目的としては、tRNAのライブラリを産生すること、合成酵素のライブラリを産生すること、セレクターコドンを産生すること、所定のタンパク質またはポリペプチドにおける非天然アミノ酸をコードするセレクターコドンを挿入することが挙げられるが、これらに限定されない。変異生成としては、部位特異的変異生成、無作為点変異生成、相同性組換え、DNAシャッフリングもしくは他の反復的な変異生成法、キメラ構築、鋳型を含有するウラシルを用いた変異生成、オリゴヌクレオチド特異的変異生成、ホスホロチオネート修飾DNA変異生成、もしくはギャップ2本鎖DNAを用いた変異生成など、またはこれらの任意の組合わせが挙げられるが、これらに限定されない。付加的な好適な方法としては、点不一致対、修復欠失宿主株を用いた変異生成、制限選択および制限精製、欠失変異生成、全体の遺伝子合成による変異生成、ならびに2本鎖切断修復などが挙げられるが、これらに限定されない。また、キメラ構築に関する変異生成が本発明に包含されるが、これに限定されない。一実施形態において、変異生成は、天然に存在する分子、または変更されるかもしくは変異された天然に存在する分子の公知の情報(配列、配列比較、物理的性質、または結晶構造などが挙げられるが、これらに限定されない)よって導かれ得る。
本明細書に見られる教科書および例は、これらの手法について記載している。付加的な情報は、以下の公刊物および引用文献:Ling et al., Approaches to DNA mutagenesis: an overview, Anal Biochem. 254(2): 157-178 (1997);Dale et al., Oligonucleotide-directed random mutagenesis using the phosphorothioate method, Methods Mol. Biol. 57:369-374 (1996) ;Smith, In vitro mutagenesis, Ann. Rev. Genet. 19:423-462 (1985);Botstein & Shortle, Strategies and applications of in vitro mutagenesis, Science 229:1193-1201 (1985);Carter, Site-directed mutagenesis, Biochem. J. 237:1-7 (1986) ;Kunkel, The efficiency of oligonucleotide directed mutagenesis, in Nucleic Acids & Molecular Biology (Eckstein, F. and Lilley, D.M.J. eds., Springer Verlag, Berlin) (1987);Kunkel, Rapid and efficient site-specific mutagenesis without phenotypic selection, Proc. Natl. Acad. Sci. USA 82:488-492 (1985);Kunkel et al., Rapid and efficient site-specific mutagenesis without phenotypic selection, Methods in Enzymol. 154, 367-382 (1987);Bass et al., Mutant Trp repressors with new DNA-binding specificities, Science 242:240-245 (1988); Methods in Enzymol. 100: 468-500 (1983); Methods in Enzymol. 154: 329-350 (1987);Zollcr & Smith, Oligonucleotide-directed mutagenesis using M13-derived vectors: an efficient and general procedure for the production of point mutations in any DNA fragment, Nucleic Acids Res. 10:6487-6500 (1982); Zoller & Smith, Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors, Methods in Enzymol. 100:468-500 (1983); Zollcr & Smith, Oligonucleotide-directed mutagenesis: a simple method using two oligonucleotide primers and a single-stranded DNA template, Methods in Enzymol. 154:329- 350 (1987);Taylor et al., The use of phosphorothioate-modified DNA in restriction enzyme reactions to prepare nicked DNA, Nucl. Acids Res. 13: 8749-8764 (1985) ;Taylor et al., The rapid generation of oligonucleotide-directed mutations at high frequency using phosphorothioate-modified DNA, Nucl. Acids Res. 13: 8765-8787 (1985) ;Nakamaye & Eckstein, Inhibition of restriction endonuclease Nci I cleavage by phosphorothioate groups and its application to oligonucleotide-directed mutagenesis, Nucl. Acids Res. 14: 9679-9698 (1986) ;Sayers et al, Y-T Exonucleases in phosphorothioaie-based oligonucleotide-directed mutagenesis, Nucl. Acids Res, 16:791-802 (1988);Sayers et al., Strand specific cleavage of phosphorothioate-containing DNA by reaction with restriction endonucleases in the presence of ethidium bromide, (1988) Nucl. Acids Res. 16: 803-814;Kramer et al., The gapped duplex DNA approach to oligonucleotide-directed mutation construction, Nucl. Acids Res. 12: 9441-9456 (1984) ;Kramer & Fritz Oligonucleotide-directed construction of mutations via gapped duplex DNA, Methods in Enzymol. 154:350-367 (1987);Kramer et al., Improved enzymatic in vitro reactions in the gapped duplex DNA approach to oligonucleotide-directed construction of mutations, Nucl. Acids Res. 16: 7207 (1988) ;Fritz et al., Oligonucleotide-directed construction of mutations: a gapped duplex DNA procedure without enzymatic reactions in vitro, Nucl. Acids Res. 16: 6987-6999 (1988) ;Kramer et al., Point Mismatch Repair, Cell 38:879-887 (1984); Carter et al., Improved oligonucleotide site-directed mutagenesis using M13 vectors, Nucl. Acids Res. 13: 4431 -4443 (1985);Carter, Improved oligonucleotide-directed mutagenesis using M13 vectors, Methods in Enzymol. 154: 382-403 (1987);Eghtedarzadeh & Henikoff, Use of oligonucleotides to generate large deletions, Nucl. Acids Res. 14: 5115 (1986) ;Wells et al., Importance of hydrogen-bond formation in stabilizing the transition state of subtilisin, Phil. Trans. R. Soc. Lond. A 317: 415-423 (1986);Nambiar et al., Total synthesis and cloning of a gene coding for the ribonuclease S protein, Science 223: 1299-1301 (1984);Sakamar and Khorana, Total synthesis and expression of a gene for the a-subunit of bovine rod outer segment guanine nucleotide-binding protein (transducin), Nucl. Acids Res. 14: 6361-6372 (1988) ;Wells et al., Cassette mutagenesis: an efficient method for generation of multiple mutations at defined sites, Gene 34:315-323 (1985) ;Grundstrom et al., Oligonucleotide-directed mutagenesis by microscale 'shot-gun' gene synthesis, Nucl. Acids Res. 13: 3305-3316 (1985) ;Mandecki, Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis, Proc. Natl. Acad. Sci. USA, 83:7177-7181 (1986) ;Arnold, Protein engineering for unusual environments, Current Opinion in Biotechnology 4:450-455 (1993) ;Sieber, et al., Nature Biotechnology, 19:456-460 (2001) ;W. P. C. Stemmer, Nature 370, 389-91 (1994) ;およびI. A. Lorimer, I. Pastan, Nucleic Acids Res. 23, 3067-8 (1995) に見出される。上述の方法に関する付加的な詳細は、種々の変異生成方法に伴う問題を解決する有用な管理についても記載しているMethods in Enzymology Volume 154に見出され得る。
また、本発明は、直交性のtRNA/RS対を介した非天然アミノ酸のインビボにおける組み込み用の、真核生物宿主細胞、非真核生物宿主細胞および生体に関する。宿主細胞は、本発明のポリヌクレオチドまたは本発明のポリヌクレオチドを含んでいるコンストラクト(クローニングベクターまたは発現ベクターであり得る本発明のベクターが挙げられるが、これらに限定されない)を用いて、遺伝的に改変される(形質転換されるか、形質導入されるか、またはトランスフェクトされる、が挙げられるが、これらに限定されない)。ベクターは例えば、プラスミド、細菌、ウイルス、裸のポリヌクレオチドまたは抱合されたポリヌクレオチドの形態であり得る。ベクターは、標準的な方法(エレクトロポレーション(From et al., Proc. Natl. Acad. Sci. USA 82, 5824 (1985) )、ウイルスベクターによる感染、小さなビーズもしくは粒子のマトリクスの内部、または表面のいずれかに核酸を有する小粒子による高速弾丸侵入(high velocity ballistic penetration)(Klein et al., Nature 327, 70-73 (1987) )などが挙げられる)によって細胞および/または微生物に導入される。
改変された宿主細胞は、例えば、スクリーニング段階、プロモータの活性化または形質転換体の選択といった活性に適するように改変された、従来の培養液において培養され得る。これらの細胞は遺伝子導入生体において任意に培養され得る。他の有用な参考文献(細胞の単離および培養にとって(例えば、続く核酸の単離にとって)の、が挙げられるが、これらに限定されない)としては、Freshney (1994) Culture of Animal Cells, a Manual of Basic Technique, third edition, Wiley- Liss, New York およびこれに引用されている参考文献;Payne et al. (1992) Plant Cell and Tissue Culture in Liquid Systems John Wiley & Sons, Inc. New York, NY;Gamborg and Phillips (eds.) (1995) Plant Cell, Tissue and Organ Culture;Fundamental Methods Springer Lab Manual, Springer-Verlag (Berlin Heidelberg New York)、ならびにAtlas and Parks (eds.) The Handbook of Microbiological Media (1993) CRC Press, Boca Raton, FLが挙げられる。
標的の核酸を細胞に導入する種々のよく知られる方法が、本発明に使用される任意の方法に利用可能である。これらとしては、DNAを含有する細菌の原形質体との受容細胞の融合、エレクトロポレーション、粒子衝撃法(projectile bombardment)、およびウイルスベクターを用いた感染(以下にさらに論じられている)などが挙げられる。細菌細胞は本発明のDNAコンストラクトを含有するプラスミドの数を増幅するために使用され得る。細菌は、対数期まで増殖され、細菌内におけるプラスミドは、当該技術において公知の種々の方法(例えば、実際には、Sambrookを参照すればよい)によって単離され得る。さらに、細菌からのプラスミドの精製にとっての大量のキットは、市販されている(例えば、いずれもPharmacia Biotechから得られるEasyPrep(商標)、FlexiPrep(商標);Stratageneから得られるStrataClean(商標);およびQiagenから得られるQIAprep(商標))。それから、単離され、精製されたプラスミドは、さらに操作されて他のプラスミドを産生するか、細胞のトランスフェクトに使用されるか、または関連するベクターに組み込まれて生体に感染させられる。典型的なベクターは、特定の標的核酸の発現の制御に有用な、転写ターミネータおよび翻訳ターミネータ、転写開始配列および翻訳開始配列、ならびにプロモータを含んでいる。ベクターは、少なくとも1つの独立したターミネータ配列を含んでいる遺伝的な発現カセット、真核生物もしくは原核生物もしくはこの両方におけるカセットの複製を可能にする配列(シャトルベクターが挙げられるが、これに限定されない)、および原核生物系もしくは真核生物系の両方にとっての選択マーカーを任意に含んでいる。ベクターは、原核生物、真核生物または好ましくは両方における複製および組み込みに好適である。例えば、Giliman & Smith, Gene 8:81 (1979);Roberts, et al., Nature, 328:731 (1987); Schneider, B., et al., Protein Expr. Purif. 6435:10 (1995);Ausubel, Sambrook, Berger (すべて上述されている)を参照すればよい。クローニングに有用な細菌およびバクテリオファージのカタログは、例えば、ATCCによって提供される(例えば、ATCCによって公開されるThe ATCC Catalogue of Bacteria and Bacteriophage (1992) Gherna et al. (eds))。また、配列決定、クローニング、および分子生物の他の局面に関する付加的な基本的な手法ならびに基礎になる論理的な考察は、Watson et al. (1992) Recombinant DNA Second Edition Scientific American Books, NYに見出される。さらに、実質的に任意の核酸(および、らせん構造であるか否かにかかわらず、実質的に任意の標識核酸)は、任意の多様な販売元(例えば、the Midland Certified Reagent Company(Midland、TX mcrc.com)、The Great American Gene Company(Ramona)、CA、ワールドワイドウェブのgenco.comにおいて利用可能である)、ExpressGen Inc.(Chicago、IL)、ワールドワイドウェブのexpressgen.comにおいて利用可能である)、Operon Technologies Inc.(Alameda)、CA)および多くの他社)から、特別または通常に注文して提供され得る。
(セレクターコドン)
本発明のセレクターコドンは、タンパク質の生合成機構の遺伝学的なコドンの枠組みを拡張する。例えば、セレクターコドンとしては、固有の3塩基コドン、ナンセンスコドン(例えば、ストップコドン(アンバーコドン(UAG)、またはオパールコドン(UGA)が挙げられるが、これらに限定されない))、非天然コドン、4塩基以上のコドン、またはレアコドン(rare codon)などが挙げられるが、これらに限定されない。所望の遺伝子に導入され得るセレクターコドンの数は広範囲に及ぶ(少なくともfEPOの一部を少なくともコードする単一のポリヌクレオチドにおける1以上、2以上、3以上、4、5、6、7、8、9、10以上が挙げられるが、これらに限定されない)ことは、当業者にとって直ちに明らかになる。
一実施形態において、方法は、真核細胞のインビボにおける1つ以上の非天然アミノ酸の組込み用のストップコドンである、セレクターコドンの使用に関する。例えば、ストップコドン(UAGが挙げられるが、これに限定されない)を認識するO−tRNAが産生され、O−RSによって所望の非天然アミノ酸とアミノアシル化される。このO−tRNAは、天然に存在する宿主のアミノアシルtRNA合成酵素によって認識されない。従来の部位特異的な突然変異生成は、所定のポリペプチドにおける所定の部位に対するストップコドン(TAGが挙げられるが、これに限定されない)の導入に使用され得る。例えば、Sayers, J.R.,ら (1988), 5'-3' Exonuclease in phosphorothioate-based oligonucleotide-directed mutagenesis. Nucleic Acids Res. 791-802を参照すればよい。O−RS、O−tRNAおよび所定のポリペプチドをコードする核酸がインビボにおいて組み合せられると、非天然アミノ酸がUAGコドンに応じて組み込まれて、特定の位置に非天然アミノ酸を含んでいるポリペプチドを生じさせる。
非天然アミノ酸のインビボにおける組込みは、宿主細胞を大きく乱すことなくなされ得る。例えば、UAGコドンの抑制効率が、O−tRNA(アンバーサプレッサtRNAが挙げられるが、これらに限定されない)と、(ストップコドンに対して結合し、リボソームからの成長しつつあるペプチドの放出を開始する)真核細胞放出因子(eRFが挙げられるが、これに限定されない)との間の競合に依存するので、抑制効率は、O−tRNAおよび/またはサプレッサtRNAの発現レベルを増強することによって調節され得るが、これらに限定されない。
また、セレクターコドンは、拡張されたコドン(4以上の塩基コドン(例えば、4、5、6以上の塩基コドン)が挙げられるが、これらに限定されない)を包含する。4塩基コドンの例としては、AGGA、CUAG、UAGA、およびCCCUなどが挙げられるが、これらに限定されない。5塩基コドンの例としては、AGGAC、CCCCU、CCCUC、CUAGA、CUACU、およびUAGGCなどが挙げられるが、これらに限定されない。本発明の特徴は、フレームシフト抑圧に基づいて延長されたコドンの使用を包含する。4以上の塩基コドンは、同じタンパク質に1つまたは複数の非天然アミノ酸(例として挙げられるが、これらに限定されない)を挿入可能である。例えば、突然変異されたO−tRNA(特別なフレームシフトサプレッサtRNAが挙げられるが、これに限定されない)の存在下において、アンチコドンループ(少なくとも8−10ntのアンチコドンループが挙げられるが、これらに限定されない)を用いて、4以上の塩基コドンが単一のアミノ酸として解読される。他の実施形態において、アンチコドンループは、少なくとも4塩基コドン、少なくとも5塩基コドン、または少なくとも6塩基コドン(例として挙げられるが、これらに限定されない)を翻訳可能である。見込みのある4塩基コドンが256あるので、複数の非天然アミノ酸は、4以上の塩基コドンを用いて同じ細胞においてコードされ得る。Anderson et al, (2002) Exploring the Limits of Codon and Anticodon Size, Chemistry and Biology. 9:237-244;Magliery, (2001) Expanding the Genetic Code: Selection of Efficient Suppressors of Four-base Codons and Identification of "Shifty" Four-base Codons with a Library Approach in Escherichia coli, J. MoI. Biol. 307: 755-769を参照すればよい。
例えば、4塩基コドンは、インビトロ生合成方法を用いたタンパク質への非天然アミノ酸の組込みに使用されている。例えば、Ma et al, (1993) Biochemistry. 32:7939、およびHohsaka et al, (1999) L Am. Chem. Soc. 121: 34を参照すればよい。CGGGおよびAGGUは、化学的にアシル化された2つのフレームシフトサプレッサtRNAを用いて、ストレプトアビジンに2−ナフチルアラニンおよびリジンNBD誘導体をインビトロにおいて同時に組み込むために使用された。例えば、Hohsaka et al, (1999) J. Am. Chem. Soc. 121: 12194を参照すればよい。インビボにおける研究において、Moore et alは、NCUAアンチコドンを有しているtRNALeu誘導体のUAGNコドン(NはU、A、GまたはCであり得る)を抑圧する能力を試験し、クワドラプレットUAGAが、0または−1フレームの状態に少なく翻訳して、13から26%の効率において、UCUAアンチコドンを有するtRNALeuによって翻訳され得ることを見出した。例えば、Moore et al, (2000) J. MoI. Biol., 298:195を参照すればよい。一実施形態において、レアコドンまたはナンセンスコドンに基づいて延長されたコドンは、読み過ごしのミスセンス、および他の不要な部位におけるフレームシフト抑圧を低減し得る本発明に使用され得る。
また、所定の系に関して、内因性の系が天然塩基コドンを使用しない(またはまれにしか使用しない)場合に、セレクターコドンは天然の3塩基コドンの1つを包含し得る。この例としては、天然の3塩基コドンを認識するtRNAを欠損している系、および/または3塩基コドンがレアコドンである系が挙げられる。
セレクターコドンは非天然の塩基対を任意に包含する。これらの非天然塩基対は存在する遺伝子アルファベットをさらに拡張する。1つの追加塩基対は、64から125までトリプレットの数を増加させる。第3の塩基対の性質としては、安定かつ選択的な塩基対形成、ポリメラーゼによる高い正確さにおけるDNAへの効率的な酵素的組み込み、および新生の非天然塩基対の合成後における効率的な連続するプライマー伸張が挙げられる。方法および組成物に適合し得る非天然塩基対の記述の例としては、例えばHirao et al, (2002) An unnatural base pair for incorporating amino acid analogues into protein, Nature Biotechnology, 20:177-182が挙げられる。他の関連する刊行物は以下に挙げられている。
インビボにおける使用法に関して、非天然ヌクレオシドは、膜透過性であり、リン酸化されて対応する3リン酸塩を形成する。その上に、増加した遺伝情報は、安定であり、細胞性の酵素によって破壊されない。Bennerおよびその他によるこれまでの試みは、もっとも注目すべき例であるイソ−C:イソ−G対という、基準のWatson-Crick対における水素結合様式とは異なる水素結合様式を巧く活用した。例えば、Switzer et al, (1989) J. Am. Chem. Soc, 111 :8322;およびPiccirilli et al, (1990) Nature, 343:33;Kool, (2000) Curr. Opin. Chem. Biol., 4:602を参照すればよい。これらの塩基は、通常、ある程度まで天然塩基と誤対合し、酵素的に修復され得ない。Koolおよび共同研究者らは、塩基間の疎水性パッキング相互作用(hydrophobic packing interactions)が水素結合と入れ替わって、塩基対の形成を生じることができることを証明した。例えば、Kool, (2000) Curr. Opin. Chem. Biol., 4:602、およびGuckian and Kool, (1998) Angew. Chem. Int. Ed. Engl., 36, 2825を参照すればよい。上述した条件のすべてを満たす非天然塩基対を開発する試みにおいて、Schultz、Romesbergおよび共同研究者らは、一連の非天然疎水性塩基を体系的に合成し、研究している。PICS:PICS自己対は、天然塩基対より安定であることが見出されており、Escherichia coliのDNAポリメラーゼ Iのクレノー断片(KF)によって、DNAに効率的に組み込まれ得る。例えば、McMinn et al, (1999) J. Am. Chem. Soc. 121: 11586;およびOgawa et al, (2000) J. Am. Chem. Soc. 122:3274;を参照すればよい。3MN:3MN自己対は、生物学的機能に対して十分な効率性および選択性を伴って、KFによって合成され得る。例えば、Ogawa et al, (2000) J. Am. Chem. Soc, 122:8803を参照すればよい。しかし、両方の塩基は、さらなる複製に対して連鎖ターミネータとして作用する。近年、突然変異体DNAポリメラーゼは、PICS自己対の複製に使用され得るように、開発されている。さらに、7AI自己対は複製され得る。例えば、Tae et al, (2001) J. Am. Chem. Soc. 123:7439を参照すればよい。また、Cu(II)との結合によって安定な対を形成する新規な金属塩基対であるDipic:Pyが開発されている。例えば、Meggers et al, (2000) J. Am. Chem. Soc 122:10714を参照すればよい。拡張されたコドンおよび非天然コドンが、天然コドンに対して本来的に直交性であるので、本発明の方法は、この性質を活かして非天然アミノ酸用の直交性のtRNAを生成し得る。
また、翻訳回避系(translational bypassing system)が、所望のポリペプチドにおける非天然アミノ酸の組み込みに使用され得る。翻訳回避系において、大きな配列が遺伝子に組み込まれるが、タンパク質に翻訳されない。当該配列は、リボソームに当該配列を跳び越えさせ、挿入の下流にある翻訳を再開させる合図としての機能を果たす構造を含んでいる。
ある種の実施形態において、本発明の方法および/または組成物における所定のタンパク質またはポリペプチド(またはこれらの一部)は、核酸によってコードされている。典型的に、核酸は、少なくとも1つのセレクターコドン、少なくともつ2のセレクターコドン、少なくとも3つのセレクターコドン、少なくとも4つのセレクターコドン、少なくとも5つのセレクターコドン、少なくとも6つのセレクターコドン、少なくとも7つのセレクターコドン、少なくとも8つのセレクターコドン、少なくとも9つのセレクターコドン、少なくとも10またはそれ以上のセレクターコドンを含んでいる。
所定のタンパク質またはポリペプチドをコードする遺伝子は、例えば、非天然アミノ酸を組込むための1つ以上のセレクターコドンを含めるために、当業者に公知の方法、ならびに変異生成および分子生物学技術に基づいて本明細書に記載されている方法を用いて、突然変異生成され得る。例えば、所定のあるタンパク質に関する核酸は、1つ以上の非天然アミノ酸の組込みを提供する1つ以上のセレクターコドンを含めるために、突然変異される。本発明は、そのようなバリアント(例えば非天然アミノ酸を少なくとも1つ含んでいる突然変異体、任意のタンパク質の型が挙げられるが、これらに限定されない)のいずれかを包含する。また同様に、本発明は、対応する核酸(すなわち、1つ以上の非天然アミノ酸をコードする1つ以上のセレクターコドンを有する任意の核酸)を包含する。
所定のタンパク質(例えばfEPOポリペプチド)をコードする核酸分子によって、ポリペプチドの所望される任意の位置にシステインを導入する突然変異が容易になされ得る。システインは、反応性分子、水溶性重合体、タンパク質、または多種多様な他の分子を所定のタンパク質に導入するために広く使用されている。fEPOポリペプチドの所望の位置へのシステインの組み込みに好適な方法は、当業者に公知であり(例えば、引用によって本明細書に援用される米国特許第6,608,183号に記載の方法)、標準的な技術である。
V.天然にコードされていないアミノ酸
非常に広範囲に及ぶ天然にコードされていないアミノ酸が本発明における使用に好適である。任意の多様な天然にコードされていないアミノ酸がfEPOポリペプチドに導入され得る。一般的に、導入された天然にコードされていないアミノ酸は、一般的な20の遺伝的にコードされるアミノ酸(すなわち、アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン、グルタミン酸、グリシン、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、スレオニン、トリプトファン、チロシン、およびバリン)に対して化学的に、実質的に不活性である。いくつかの実施形態において、天然にコードされていないアミノ酸は、通常の20のアミノ酸に見られない官能基と効率的かつ選択的に反応して安定な抱合物を形成する側鎖官能基(アジド、ケトン、アルデヒドおよびアミノオキシ基が挙げられるが、これらに限定されない)を含んでいる。例えば、アジド官能基を含んでいる天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドは、重合体(ポリ(エチレングリコール)が挙げられるが、これに限定されない)と反応してか、または代替可能に、アルキン部分を含有する第2のポリペプチドと反応して、ヒュイゲン[3+2]付加環化産物を形成するためのアジドおよびアルキン官能基の選択的な反応によって生じる安定な抱合物を形成し得る。
α−アミノ酸の一般的な構造は、以下:
のように示される。
天然にコードされていないアミノ酸は、典型的に、上述の式を有する構造のいずれかであり(ここで、R基は20の天然アミノ酸に用いられている官能基以外の任意の置換基である)、本発明における利用に好適であり得る。本発明の天然にコードされていないアミノ酸が、側鎖の構造においてのみ天然アミノ酸と典型的に異なるので、天然にコードされていないアミノ酸は、それらが天然に存在するポリペプチドにおいて形成される同じ様式において、他のアミノ酸(天然または天然にコードされていないアミノ酸が挙げられるが、これらに限定されない)とアミド結合を形成する。しかし、天然にコードされていないアミノ酸はこれらを天然のアミノ酸と区別する側鎖基を有している。例えば、Rは、アルキル−、アリール−、アシル−、ケト−、アジド−、ヒドロキシル−、ヒドラジン、シアノ−、ハロ−、ヒドラジド、アルケニル、アルキル、エーテル、チオール、セレノ−、スルフォニル−、ボレート、ボロネート、ホスホ、ホスホノ、ホスフィン、ヘテロ環、エノン、イミン、アルデヒド、エステル、チオ酸、ヒドロキシルアミン、もしくはアミノ基、またはこれらの組合わせを任意に包含している。本発明における使用に好適であり得る他の所定の天然に存在していないアミノ酸としては、光活性化架橋を含んでいるアミノ酸、スピン標識されたアミノ酸、蛍光性のアミノ酸、金属が結合しているアミノ酸、金属を含有しているアミノ酸、放射性のアミノ酸、新規な官能基を有するアミノ酸、他の分子と共有的または非共有的に相互作用するアミノ酸、光ケージドおよび/または光異性体化アミノ酸、ビオチンまたはビオチン類似体を含んでいるアミノ酸、糖鎖付加されたアミノ酸(例えば糖置換化セリン)、他の炭水化物によって修飾されたアミノ酸、ケト含有アミノ酸、ポリエチレングリコールまたはポリエーテルを含んでいるアミノ酸、重元素によって置換されたアミノ酸、化学的に切断可能および/または光によって切断可能なアミノ酸、天然アミノ酸と比べて延長された側鎖(ポリエーテルまたは長鎖炭化水素(約5または約10を超える炭素が挙げられるが、これらに限定されない)が挙げられるが、これらに限定されない)を有しているアミノ酸、炭素結合型の糖を含有しているアミノ酸、酸化還元活性のアミノ酸、アミノチオ酸含有アミノ酸、ならびに1つ以上の毒性部分を含んでいるアミノ酸が挙げられる。
本発明における使用に好適であり得、水溶性重合体との反応に有用である例示的な天然にコードされていないアミノ酸としては、カルボニル反応性基、アミノオキシ反応性基、ヒドロキシルアミン反応性基、ヒドラジド反応性基、セミカルバジド反応性基、アジド反応性基およびアルキン反応性基を有するアミノ酸が挙げられるが、これらに限定されない。いくつかの実施形態において、天然にコードされていないアミノ酸は、糖鎖部分を含んでいる。そのようなアミノ酸の例としては、N−アセチル−L−グルコサミニル−L−セリン、N−アセチル−L−ガラクトサミニル−L−セリン、N−アセチル−L−グルコサミニル−L−スレオニン、N−アセチル−L−グルコサミニル−L−アスパラギンおよびO−マンノサミニル−L−セリンが挙げられるが、これらに限定されない。また、そのようなアミノ酸の例としては、アミノ酸と糖鎖との間に天然に存在するN型またはO型の結合が、自然には通常は見られない共有結合(アルケン、オキシム、チオエーテルおよびアミドなどが挙げられるが、これらに限定されない)によって置換されている場合の例が挙げられる。また、そのようなアミノ酸の例としては、2−デオキシ−グルコース、および2−デオキシガラクトースといった、天然に存在するタンパク質に通常は見られない糖鎖が挙げられる。
本明細書に規定される天然にコードされていないアミノ酸の多くは、市販されている(例えば、シグマアルドリッチ(Sigma-Aldrich)(St.Louis、MO、USA)、Novabiochem(EMD Biosciences部門、Darmstadt、ドイツ)、またはPeptech(Burlington、MA、USA)から得られる)。市販されていない天然にコードされていないアミノ酸は、本明細書に規定されているようにか、または当業者にとって公知の標準的な方法を用いて任意に合成される。有機合成技術に関しては、例えば、Organic Chemistry by Fessendon and Fessendon, (1982, Second Edition, Willard Grant Press, Boston Mass.);Advanced Organic Chemistry by March (Third Edition, 1985, Wiley and Sons, New York);およびAdvanced Organic Chemistry by Carey and Sundberg (Third Edition, Parts A and B, 1990, Plenum Press, New York)を参照すればよい。また、参照によって本明細書に援用される、米国特許出願公開第2003/0082575号明細書および第2003/0108885号明細書を参照すればよい。また、新規な側鎖を含有する非天然アミノ酸に加えて、本発明における使用に好適であり得る非天然アミノ酸は、これらに限定されないが、式IIおよびIII:
(ここで、Zは、OH、NH2、SH、NH−R’、またはS−R’を典型的に含んでおり;同じかまたは異なり得るXおよびYは、SまたはOを典型的に含んでおり、任意に同じであるか、または異なるRおよびR’は、水素だけでなく式Iを有する非天然アミノ酸に関して上述したR基にとっての置換基の同じ一覧から任意に選択される)の構造が挙げられる修飾された骨格構造を任意に含んでいる。例えば、本発明の非天然アミノ酸は、式IIおよびIIIによって示されるようなアミノ基またはカルボキシル基において置換基を任意に含んでいる。この種の非天然アミノ酸としては、通常の20の天然アミノ酸または非天然アミノ酸に対応する側鎖を有している(限定されないが、これらが挙げられる)、α−ヒドロキシ酸、α−チオ酸、α−アミノチオカルボキシレートが挙げられるが、これらに限定されない。さらに、α−炭素における置換基としては、L、D、またはα−α−2置換アミノ酸(例えば、D−グルタメート、D−アラニン、D−メチル−O−チロシン、およびアミノブチル酸など)が任意に挙げられるが、これらに限定されない。他の構造的な代替物としては、環状アミノ酸(例えば、プロリン類似物ならびに3、4、5、6、7、8および9員環のプロリン類似物など)、ならびにβおよびγアミノ酸(例えば、置換β−アラニンおよびγ−アミノブチル酸など)が挙げられる。
多くの非天然アミノ酸は、チロシン、グルタミンおよびフェニルアラニンといった天然アミノ酸に基づいており、本発明における使用に好適である。チロシン類似物としては、置換チロシンが、ケト基(アセチル基が挙げられるが、これに限定されない)、ベンゾイル基、アミノ基、ヒドラジン基、ヒドロキシアミン基、チオール基、カルボキシ基、イソプロピル基、メチル基、C6−C20の直鎖状または分枝鎖状の炭化水素、飽和もしくは不飽和の炭化水素、O−メチル基、ポリエーテル基、ニトロ基、またはアルキニル基など(限定されないが、これらが挙げられる)を含んでいる場合の、パラ位置換チロシン、オルト位置換チロシン、およびメタ位置換チロシンが挙げられるが、これらに限定されない。さらにまた、多置換アリール環が意図される。本発明における利用に好適なグルタミン類似物としては、α−ヒドロキシ誘導体、γ−置換誘導体、環状誘導体、およびアミド置換グルタミン誘導体が挙げられるが、これらに限定されない。本発明における利用に好適なフェニルアラニン類似物の例としては、置換基が、ヒドロキシ基、メトキシ基、メチル基、アリル基、アルデヒド、アジド、ヨード、ブロモ、ケト基(アセチル基が挙げられるが、これに限定されない)、ベンゾイル、またはアルキニル基など(限定されないが、これらが挙げられる)を含んでいる場合の、パラ位置換フェニルアラニン、オルト位置換フェニルアラニン、およびメタ位置換フェニルアラニンが挙げられるが、これらに限定されない。本発明における利用に好適な非天然アミノ酸の特定の例としては、p−アセチル−L−フェニルアラニン、p−プロパルギルオキシフェニルアラニン、O−メチル−L−チロシン、L−3−(2−ナフチル)アラニン、3−メチル−フェニルアラニン、O−4−アリル−L−チロシン、4−プロピル−L−チロシン、トリ−O−アセチル−GlcNAcβ−セリン、L−ドーパ、フッ化フェニルアラニン、イソプロピル−L−フェニルアラニン、p−アジド−L−フェニルアラニン、p−アシル−L−フェニルアラニン、p−ベンゾイル−L−フェニルアラニン、L−ホスホセリン、ホスホノセリン、ホスホノチロシン、p−ヨード−フェニルアラニン、p−ブロモフェニルアラニン、p−アミノ−L−フェニルアラニン、およびイソプロピル−L−フェニルアラニン、およびp−プロパルギルオキシ−フェニルアラニンなどが挙げられるが、これらに限定されない。本発明における使用に好適な非天然アミノ酸の変形の構造の例は、例えば、国際公開第2002/085923号(発明の名称:“In vivo incorporation of unnatural amino acids”)に規定されている。また、さらなるメチオニン類似物に関しては、Kiick et al., (2002) Incorporation of azides into recombinant proteins for chemoselective modification by the Staudinger ligation, PNAS 99:19-24を参照すればよい。
一実施形態において、非天然アミノ酸(例えばp−(プロパルギルオキシ)−フェニルアラニン)を含んでいるfEPOポリペプチドの組成物が提供される。また、p−(プロパルギルオキシ)−フェニルアラニンを含んでいる種々の組成物(タンパク質および/または細胞が挙げられるが、これらに限定されない)が、提供される。1つの局面において、p−(プロパルギルオキシ)−フェニルアラニン非天然アミノ酸を含んでいる組成物は、直交性のtRNAをさらに含んでいる。非天然アミノ酸は、直交性のtRNAに対して共有結合的に(限定されないが、これが挙げられる)結合され得る(アミノアシル結合を介して直交性のtRNAに対して共有結合的に結合される、直交性のtRNAの末端リボース糖の3’OHまたは2’OHに対して共有結合的に結合されるなど、が挙げられるが、これらに限定されない)。
タンパク質に組み込まれ得る非天然アミノ酸を介する化学部分は、タンパク質の種々の利点および操作を提供する。例えば、ケト官能基の固有の反応性は、多くのヒドラジン含有試薬またはヒドロキシアミン含有試薬のいずれかを用いた、インビボおよびインビトロにおけるタンパク質の選択的な修飾を可能にする。重原子非天然アミノ酸は、例えば、X線構造データの位相合わせに有用であり得る。また、非天然アミノ酸を用いた重原子の部位特異的な導入は、重原子のための位置の選択に選択性および自由度を提供する。光反応性非天然アミノ酸(ベンゾフェノンおよびアリールアジド(フェニルアジドが挙げられるが、これらに限定されない)側鎖を有するアミノ酸が挙げられるが、これらに限定されない)は、例えば、タンパク質のインビボおよびインビトロにおける効率的な光架橋を可能にする。光反応性アミノ酸の例としては、p−アジド−フェニルアラニンおよびp−ベンゾイル−フェニルアラニンが挙げられるが、これらに限定されない。光反応性アミノ酸を有するタンパク質は、その結果、光反応性基を供給する一時的な制御の励起によって自在に光架橋され得る。1つの例において、非天然アミノ酸のメチル基は、核磁気共鳴および振動顕微鏡の利用を伴う(限定されないが、これらが挙げられる)、局所的な構造および動態のプローブとして、放射線標識されたメチル基(限定されないが、これが挙げられる)に置換され得る。アルキニル官能基またはアジド官能基は、例えば、[3+2]付加環化反応を介したタンパク質の選択的な修飾を可能にする。
(非天然アミノ酸の化学合成)
本発明における使用に好適な非天然アミノ酸の多くは、例えば、Sigma(USA)またはAldrich(Milwaukee、WI、USA)から市販されている。市販されていない非天然アミノ酸は、本明細書に規定されているように、または各種の刊行物に規定されているように、または当業者に公知の標準的な方法を用いて、任意に合成される。有機合成技術に関しては、例えば、Organic Chemistry by Fessendon and Fessendon, (1982, Second Edition, Willard Grant Press, Boston Mass.);Advanced Organic Chemistry by March (Third Edition, 1985, Wiley and Sons, New York);およびAdvanced Organic Chemistry by Carey and Sundberg (Third Edition, Parts A and B, 1990, Plenum Press, New York)を参照すればよい。非天然アミノ酸の合成について記載しているさらなる刊行物としては、例えば、国際公開第2002/085923号(発明の名称:“In vivo incorporation of Unnatural Amino Acids”);Matsoukas et al, (1995) J. Med. Chem., 38, 4660-4669;King, F.E. & Kidd, D.A.A. (1949) A New Synthesis of Glutamine and of γ- Dipeptides of Glutamic Acid from Phthylated Intermediates. J. Chem. Soc. 3315-3319;Friedman, O.M. & Chatterrji, R. (1959) Synthesis of Derivatives of Glutamine as Model Substrates for Anti- Tumor Agents. J. Am. Chem. Soc. 81, 3750-3752;Craig, J.C. et al. (1988) Absolute Configuration of the Enantiomers of 7-Chloro-4 [[4-(diethylamino)-l-methylbutyl]amino]quinolim (Chloroquine). J. Org. Chem. 53, 1167-1170;Azoulay, M., Vilmont, M. & Frappier, F. (1991) Glutamine analogues as Potential Antimalarials, Eur. J. Med. Chem. 26, 201-5;Koskinen, A.M.P. & Rapoport, H. (1989) Synthesis of 4-Substituted Prolines as Conformationally Constrained Amino Acid Analogues. J. Org. Chem. 54, 1859-1866;Christie, B.D. & Rapoport, H. (1985) Synthesis of Optically Pure Pipecolates from L-Asparagine. Application to the Total Synthesis of (+)-Apovincamine through Amino Acid Decarbonylation and Iminium Ion Cyclization. J. Org. Chem. 1989:1859-1866;Barton et al, (1987) Synthesis of Novel a-Amino-Acids and Derivatives Using Radical Chemistry: Synthesis of L- and D-a-Amino-Adipic Acids, L-a- aminopimelic Acid and Appropriate Unsaturated Derivatives. Tetrahedron Lett. 43:4297-4308;およびSubasinghe et al, (1992) Quisqualic acid analogues: synthesis of beta-heterocyclic 2- aminopropanoic acid derivatives and their activity at a novel quisqualate-sensitized site. J. Med. Chem. 35:4602-7が挙げられる。また、“Protein Arrays”と題された特許文献(代理人整理番号P1001US00、2002年12月22出願)を参照すればよい。
A.カルボニル反応性基
カルボニル反応性基を有しているアミノ酸は、求核性の付加を介して分子(PEGまたは他の水溶性分子が挙げられるが、これらに限定されない)を連結するための種々の反応、または特にアルドール縮合反応を可能にする。
例示的なカルボニル含有アミノ酸は、以下のように表され得る:
(ここで、nは0−10であり;R1は、アルキル、アリール、置換アルキル、または置換アリールであり;R2は、H、アルキル、アリール、置換アルキル、および置換アリールであり;R3は、H、アミノ酸、ポリペプチド、またはアミノ末端修飾基であり、R4は、H、アミノ酸、ポリペプチド、またはカルボキシ末端修飾基である)。いくつかの実施形態において、nは1であり、R1はフェニルであり、R2は単純アルキル(すなわち、メチル、エチルまたはプロピル)であり、ケトン部分はアルキル側鎖に対してパラ位に位置している。いくつかの実施形態において、nは1であり、R1はフェニルであり、R2は単純アルキル(すなわち、メチル、エチルまたはプロピル)であり、ケトン部分はアルキル側鎖に対してメタ位に位置している。
p−アセチル−(+/−)−フェニルアラニンおよびm−アセチル−(+/−)−フェニルアラニンの合成は、参照によって援用されるZhang, Z.et al, Biochemistry 42: 6735-6746 (2003)に記載されている。他のカルボニル含有アミノ酸は当業者によって同様に調製され得る。
いくつかの実施形態において、天然にコードされていないアミノ酸を含んでいるポリペプチドは、化学的に修飾されて反応性のカルボニル官能基を生成する。例えば、抱合反応に有用なアルデヒド官能性基は、隣接するアミノ基とヒドロキシル基とを有している官能性基から生成され得る。生物学的に活性な分子がポリペプチドである場合に、例えば、N末端のセリンまたはスレオニン(通常に存在し得るか、または化学的もしくは酵素的な消化を介して露出され得る)は、過ヨウ素酸塩を用いた穏やかな酸化切断条件においてアルデヒド官能性基を生成するために使用され得る。例えば、Gaertner, et ah, Bioconjug. Chem. 3: 262-268 (1992) ;Geoghegan, K. & Stroh, J., Bioconjug. Chem. 3:138-146 (1992) ;Gaertner et al, J. Biol. Chem. 269:7224-7230 (1994) を参照すればよい。しかし、当該技術において公知の方法はペプチドまたはタンパク質のN末端におけるアミノ酸に制限される。
本発明において、隣接するヒドロキシル基とアミノ基とを有する天然にコードされていないアミノ酸アミノ酸は、“マスクされた”アルデヒド官能性基としてポリペプチドに組み込まれ得る。例えば、5−ヒドロキシリジンはイプシロンアミンと隣接するヒドロキシル基を有している。アルデヒドを生成する反応条件は、典型的に、ポリペプチド内の他の部位における酸化を回避するための穏やかな反応条件における、過剰なモル濃度のメタ過ヨウ素酸ナトリウムの添加に関する。酸化反応のpHは、典型的に約7.0である。典型的な反応は、ポリペプチド緩衝化溶液に対する、1.5モル濃度を超えるメタ過ヨウ素酸ナトリウムの添加に続いて、暗所における約10分間のインキュベーションを含んでいる。例えば、参照によって本明細書に援用される米国特許第6,423,685号を参照すればよい。
カルボニル官能性基は、水性溶液における穏やかな条件の下に、ヒドラジン含有試薬、ヒドラジド含有試薬、ヒドロキシルアミン含有試薬、またはセミカルバジド含有試薬と選択的に反応して、生理学的条件においてそれぞれに対して安定な対応するヒドラゾン、オキシム、またはセミカルバゾン連結を形成し得る。例えば、Jencks, W. P., J. Am. Chem. Soc. 81, 475-481 (1959) ;Shao, J. and Tam, J. P., J. Am. Chem. Soc. 117:3893-3899 (1995) を参照すればよい。さらに、カルボニル基の固有な反応性は、他のアミノ酸側鎖の存在下において選択的な修飾を可能にする。例えば、Cornish, V. W., et al, J. Am. Chem. Soc. 118:8150-8151 (1996) ;Geoghegan, K. F. & Stroh, J. G., Bioconjug. Chem. 3:138-146 (1992) ;Mahal, L. K., et al, Science 276:1125-1128 (1997) を参照すればよい。
B.ヒドラジン反応性基、ヒドラジド反応性基またはセミカルバジド反応性基
求核性基(例えば、ヒドラジン、ヒドラジドまたはセミカルバジド)を含んでいる天然にコードされていないアミノ酸は、PEGまたは他の水溶性重合体(限定されないが、これらが挙げられる)との抱合物を形成するための多様な求電子基との反応を可能にする。
例示的なヒドラジン含有アミノ酸、ヒドラジド含有アミノ酸、またはセミカルバジド含有アミノ酸は、以下のように表され得る:
(ここで、nは0−10であり;R1は、アルキル、アリール、置換アルキル、または置換アリールであるか、または存在しないかであり;Xは、O、NまたはSであるか、または存在しないかであり;R2は、H、アミノ酸、ポリペプチド、またはアミノ末端修飾基であり、R3は、H、アミノ酸、ポリペプチド、またはカルボキシ末端修飾基である)。
いくつかの実施形態において、nは4であり、R1は存在せず、XはNである。いくつかの実施形態において、nは2であり、R1は存在せず、Xは存在しない。いくつかの実施形態において、nは1であり、R1はフェニルであり、XはOであり、酸素原子は、アリール環上における脂肪族基に対してパラ位に位置している。
ヒドラジド含有アミノ酸、ヒドラジン含有アミノ酸、またはセミカルバジド含有アミノ酸は、市販の供給元から入手可能である。例えば、L−グルタミン酸−γ−ヒドラジドは、Sigma Chemical(St. Louis、MO)から入手可能である。市販されていない他のアミノ酸は当業者によって調製され得る。例えば米国特許第6,281,211号を参照すればよい。
ヒドラジド、ヒドラジンまたはセミカルバジド反応性基を有している天然にコードされていないアミノ酸を含んでいるポリペプチドは、アルデヒドまたは類似の化学反応性を有する他の官能基を含んでいる種々の分子と効率的かつ選択的に反応し得る。例えばShao, J. and Tam, J., J. Am. Chem. Soc. 117:3893-3899 (1995)を参照すればよい。ヒドラジド、ヒドラジンおよびセミカルバジド官能基の固有な反応性は、通常の20のアミノ酸に存在する求核性基(セリンもしくはスレオニンのヒドロキシ基、またはリジンおよびN末端のアミノ基が挙げられるが、これらに限定されない)と比較して、アルデヒド、ケトンおよび他の求電子性基に対してより著しい反応を起こさせる。
C.アミノオキシ含有アミノ酸
アミノオキシ(ヒドロキシアミンとも呼ばれる)基を含んでいる天然にコードされていないアミノ酸は、PEGまたは他の水溶性重合体(限定されないが、これらが挙げられる)との抱合物を形成するための求電子性基との反応を可能にする。ヒドラジン、ヒドラジドおよびセミカルバジドと同様に、アミノオキシ基の増強された求核性は、アミノオキシ基がアルデヒドまたは類似の化学反応性を有している他の官能基と効率的かつ選択的に反応することを可能にする。例えば、Shao, J. and Tam, J., J. Am. Chem. Soc. 117:3893-3899 (1995);H. Hang and C. Bertozzi, Acc. Chem. Res. 34: 727-736 (2001) を参照すればよい。ヒドラジン基との反応の結果として生じるのは、対応するヒドラゾンであるが、これに対してオキシムは一般的にカルボニル含有基(例えばケトン)とアミノオキシ基の反応から生じる。
例示的なアミノオキシ基を含むアミノ酸は以下のように表され得る:
(ここで、nは0〜10であり、R1は、アルキル、アリール、置換アルキルまたは置換アリールであるか、または存在せず;Xは、O、NまたはSであるか、または存在せず;mは0〜10であり;YはC(O)であるか、または存在せず;R2は、H、アミノ酸、ポリペプチドまたはアミノ末端修飾基であり、R3は、H、アミノ酸、ポリペプチドまたはカルボキシ末端修飾基である)。いくつかの実施形態において、nは1であり、R1はフェニルであり、XはOであり、mは1であり、Yは存在する。いくつかの実施形態において、nは2であり、R1およびXは存在せず、mは0であり、Yは存在しない)。
アミノオキシ含有アミノ酸は、容易に入手可能なアミノ酸前駆体(ホモセリン、セリンおよびスレオニン)から調製され得る。例えば、M. Carrasco and R. Brown, J. Org. Chem. 68: 8853-8858 (2003) を参照すればよい。ある種のアミノオキシ含有アミノ酸(例えば、L−2−アミノ−4−(アミノオキシ)ブチル酸)は、天然の供給源から単離されている(Rosenthal, G, et al., Life Sci. 60: 1635-1641 (1997))。他のアミノオキシ含有アミノ酸は当業者によって調製され得る。
D.アジド反応性基およびアルキン反応性基
アジド官能基およびアルキン官能基の固有な反応性は、ポリペプチドおよび他の生体分子の選択的な修飾にとって、それらを極めて有効にさせる。有機アジド、特にアルファティック(alphatic)アジド、およびアルキンは、通常の反応性の化学的条件に対して一般的に安定である。特に、アジド官能基およびアルキン官能基の両方は、天然に存在するポリペプチドに見られる通常の20のアミノ酸の側鎖(すなわちR基)に対して不活性である。しかし、非常に近づくと、アジド基およびアルキン基の“ばね荷重”性質が現れ、それらは、ヒュイゲン(Huisgen)[3+2]付加環化反応を介して選択的かつ効率的に反応して対応するトリアゾールを生成する。例えば、Chin J., et al, Science 301 :964-7 (2003);Wang, Q,, et al, J. Am. Chem. Soc. 125, 3192-3193 (2003) ;Chin, J. W., et al, J. Am. Chem. Soc. 124:9026-9027 (2002) を参照すればよい。
ヒュイゲン付加環化反応が、求核置換よりむしろ選択的な付加環化反応に関与するので(例えば、Padwa, A., in COMPREHENSIVE ORGANIC SYNTHESIS, Vol. 4, (ed. Trost, B. M., 1991), p. 1069-1109;Huisgen, R. in 1,3-DIPOLAR CYCLOADDITION CHEMISTRY, (ed. Padwa, A., 1984), p. 1-176を参照すればよい)、アジド含有側鎖およびアルキン含有側鎖を有している天然にコードされていないアミノ酸の組込みによって、生じるポリペプチドが、天然にコードされていないアミノ酸の位置において選択的に修飾されることが可能になる。アジド含有bG−CSFポリペプチドまたはアルキン含有bG−CSFポリペプチドに関する付加環化反応は、室温における水性条件の下に、Cu(II)(触媒量のCuSO4の形態が挙げられるが、これに限定されない)の付加によって、インシチュ(in situ)においてCu(II)をCu(I)に還元する触媒量の還元物質の存在下において、達成され得る。例えば、Wang, Q., et al, J. Am. Chem. Soc. 125, 3192-3193 (2003) ;Tornoe, C. W., et al, J. Org. Chem. 67:3057-3064 (2002) ;Rostovtsev, et al, Angew. Chem. Int. Ed. 41:2596-2599 (2002) を参照すればよい。例示的な還元物質としては、アスコルビン酸塩、金属銅、キニーネ、ヒドロキノン、ビタミンK、グルタチオン、システイン、Fe2+、Co2+および印加された電位が挙げられるが、これらに限定されない。
いくつかの場合に、アジドとアルキンとの間におけるヒュイゲン[3+2]付加環化反応が所望される場合に、fEPOポリペプチドは、アルキン部分を含んでいる天然にコードされていないアミノ酸を含んでおり、当該アミノ酸に連結されるべき水溶性重合体はアジド部分を含んでいる。また代替可能に、逆反応(すなわち、アミノ酸上におけるアジド部分および水溶性重合体上に存在するアルキン部分を用いる)が達成され得る。
また、アジド官能基は、アリールエステルを含んでいる水溶性重合体と選択的に反応し、アリールホスフィン部分を用いて適切に機能付与されて、アミド連結を生成する。アリールホスフィン基はインシチュにおいてアジドを還元し、それから生じたアミンは、近接するエステル結合と効率的に反応して対応するアミドを生成する。例えばE. Saxon and C. Bertozzi, Science 287, 2007-2010 (2000) を参照すればよい。アジド含有アミノ酸は、アルキルアジド(2−アミノ−6−アジド−1−ヘキサン酸が挙げられるが、これに限定されない)またはアリールアジド(p−アジド−フェニルアラニン)のいずれかであり得る。
アリールエステルおよびホスフィン部分を含んでいる例示的な水溶性重合体は、以下のように表され得る:
(ここで、Xは、O、NまたはSであり得るか、または存在しない場合があり得、Phはフェニルであり、Wは水溶性重合体であり、Rは、H、アルキル基、アリール基、置換アルキル基および置換アリール基であり得る)。例示的なR基としては、−CH2、−C(CH3)3、−OR’、−NR’R’’、−SR’、−ハロゲン、−C(O)R’、−CONR’R’’、−S(O)2R’、−S(O)2NR’R’’、−CNおよび−NO2が挙げられるが、これらに限定されない。R’、R’’、R’’’およびR’’’’のそれぞれは独立して、水素基、置換もしくは非置換のヘテロアルキル基、置換もしくは非置換のアリール基(1−3のハロゲンと置換されたアリールが挙げられるが、これに限定されない)、置換もしくは非置換のアルキル基、アルコキシ基もしくはチオアルコキシ基、またはアリールアルキル基を指す。本発明の化合物が2つ以上のR基を含む場合に、例えば2つ以上のこれらの基が存在する場合に、R基のそれぞれは、R’、R’’、R’’’およびR’’’’のそれぞれであるように、独立して選択される。R’およびR’’が同じ窒素原子に結び付けられている場合に、それらは窒素原子と組み合わさって、5員環、6員環または7員環を形成し得る。例えば、−NR’R’’は、1−ピロリジニルおよび4−モルホリニルが挙げられるが、これらに限定されないことが意図される。置換体の上述の議論から、当業者は、“アルキル”という用語が、水素基以外の基(例えば、ハロアルキル(−CF3および−CH2OCH3が挙げられるが、これらに限定されない)およびアシル(−C(O)CH3、−C(O)CF3、および−C(O)CH2OCH3などが挙げられるが、これらに限定されない))と結合された炭素原子を含むことを意図されることを理解する。
また、アジド官能基は、チオエステルを含む水溶性重合体と選択的に反応し、アリールホスフィン部分を用いて適切に機能付与されてアミド結合を生成し得る。アリールホスフィン基は、インシチュにおいてアジドを還元し、それから生じるアミンは、チオエステル結合と効率的に反応して対応するアミドを生成する。チオエステル部分およびホスフィン部分を含んでいる例示的な水溶性重合体は、以下のように表され得る:
(ここで、nは1〜10であり、XはO、NまたはSであり得るか、または存在しない場合があり得、Phはフェニルであり、Wは水溶性重合体である)。
例示的なアルキン含有アミノ酸は、以下のように表され得る:
(ここで、nは0〜10であり;R1は、アルキル、アリール、置換アルキルまたは置換アリールであるか、または存在せず;Xは、O、NまたはSであるか、存在せず;mは0〜10であり、R2は、H、アミノ酸、ポリペプチドまたはアミノ末端修飾基であり、R3は、H、アミノ酸、ポリペプチドまたはカルボキシ末端修飾基である)。いくつかの実施形態において、nは1であり、R1はフェニルであり、Xは存在せず、mは0であり、アセチレン部分はアルキル側鎖に対してパラ位に位置している。いくつかの実施形態において、nは1であり、R1はフェニルであり、XはOであり、mは1であり、プロパルギルオキシ基はアルキル側鎖に対してパラ位に位置している(すなわち、O−プロパルギル−チロシン)。いくつかの実施形態において、nは1であり、R1およびXは存在せず、mは0である(すなわち、プロパリルグリシン)。
アルキン含有アミノ酸は市販されている。例えばプロパルギルグリシンはPeptech(Burlington、MA)から市販されている。代替可能に、アルキン含有アミノ酸は標準的な方法にしたがって調製され得る。例えば、p−プロパルギルオキシフェニルアラニンは、例えば、Deiters, A.et al, J. Am. Chem. Soc. 125: 11782-11783 (2003) に記載されているように合成され得、4−アルキニル−L−フェニルアラニンは、Kayser, B., et al, Tetrahedron 53(7): 2475-2484 (1997) に記載されているように、合成され得る。他のアルキン含有アミノ酸は当業者によって調製され得る。
例示的なアジド含有アミノ酸は以下のように表され得る:
(ここで、nは0〜10であり;R1は、アルキル、アリール、置換アルキルまたは置換アリールであるか、または存在せず;Xは、O、NまたはSであるか、または存在せず;mは0〜10であり;R2は、H、アミノ酸、ポリペプチドまたはアミノ末端修飾基であり、R3は、H、アミノ酸、ポリペプチドまたはカルボキシ末端修飾基である)。いくつかの実施形態において、nは1であり、R1はフェニルであり、Xは存在せず、mは0であり、アジド部分はアルキル側鎖に対してパラに位置している。いくつかの実施形態において、nは0−4であり、R1およびXは存在せず、m=0である。いくつかの実施形態において、nは1であり、R1はフェニルであり、XはOであり、mは2であり、β−アジドエトキシ部分はアルキル側鎖に対してパラ位に位置している。
アジド含有アミノ酸は商業的な供給元から入手可能である。例えば、4−アジドフェニルアラニンは、Chem-Impex International(Wood Dale、IL)から入手され得る。市販されていないこれらのアジド含有アミノ酸に関して、アジド基は、適切な脱離基(ハロゲン化物、メシラート、トシレートが挙げられるが、これらに限定されない)の排除を介した、または適切に保護されたラクトンの開環を介した(限定されないが、これらが挙げられる)、当業者に公知の標準的な方法を用いて、比較的容易に調製され得る。例えば、Advanced Organic Chemistry by March (Third Edition, 1985, Wiley and Sons, New York)を参照すればよい。
E.アミノチオール反応性基
ベータ置換アミノチオール官能基の固有な反応性は、チアゾリジンの形成を介した、アルデヒド基を含んでいるポリペプチドおよび他の生体分子の選択的な修飾にとって、それらを極めて有効にする。例えばJ.Shao and J. Tam, J. Am. Chem. Soc. 1995, 117 (14) 3893-3899を参照すればよい。いくつかの実施形態において、ベータ置換アミノチオールアミノ酸は、fEPOポリペプチドに組み込まれ得、それからアルデヒド官能性基を含んでいる水溶性重合体と反応し得る。いくつかの実施形態において、水溶性重合体、薬剤抱合物または他のペイロード(payload)は、チアゾリジンの形成を介したベータ置換アミノチオールアミノ酸を含んでいるfEPOポリペプチドに連結され得る。
(非天然アミノ酸の細胞の取込み)
真核細胞による非天然アミノ酸の取込みは、タンパク質への組込みを目的として(限定されないが、これが挙げられる)、非天然アミノ酸を設計および選択するときに典型的に考慮される1つの課題である。例えば、α−アミノ酸の高い電荷密度はこれらの化合物が細胞透過性ではあり得ないことを意味する。天然アミノ酸はタンパク質に基づく輸送系の収集を介して真核細胞に取り込まれる。非天然アミノ酸が少しでも細胞によって取り込まれるならば、これを評価する急速なふるいが行われ得る。例えば、“Protein Arrays”と題された特許文献(代理人整理番号P1001US00、2002年12月22出願);ならびにLiu, D.R. & Schultz, P.G. (1999) Progress toward the evolution of an organism with an expanded genetic code. PNAS United States 96:4780-4785 における、例えば、毒性アッセイを参照すればよい。取込みは、多様なアッセイを用いて容易に分析されるが、細胞性の取込み経路に受け容れられる非天然アミノ酸の設計ための代替案は、インビボにおいてアミノ酸を作り出す生合成経路を提供することである。
(非天然アミノ酸の生合成)
多くの生合成経路が、アミノ酸および他の化合物を産生するために細胞にすでに存在している。特定の非天然アミノ酸のための生合成方法が、天然(真核細胞内が挙げられるが、これに限定されない)には存在し得ない一方で、本発明はそのような方法を提供する。例えば、非天然アミノ酸のための生合成経路は、新しい酵素の添加、または存在する宿主細胞経路の改変によって宿主細胞において生成され得る。追加の新しい酵素は、必要に応じて、天然に存在する酵素または人工的に開発された酵素である。例えば、p−アミノフェニルアラニンの生合成(国際公開第2002/085923号(発明の名称:“In vivo incorporation of unnatural amino acids”)における一例に示されるように)は、他の生物に由来する公知の酵素の組合わせの追加を基にしている。これらの酵素に関する遺伝子は、当該遺伝子を備えるプラスミドを用いた真核細胞の形質転換によって、当該細胞に導入され得る。細胞において発現される場合に、当該遺伝子は所望の化合物を合成する酵素経路を提供する。任意に添加されるこの種の酵素の例は、以下の実施例に示されている。追加の酵素の配列は、例えばジーンバンクに見出される。また、人工的に開発した酵素は同様の方法において細胞の中に加えられ得る。この方法において、細胞性機構および細胞資源は非天然アミノ酸を産生するために操作される。
種々の方法が、生合成経路に使用するための新規な酵素の産生、または存在する経路の発展に利用可能である。例えばMaxygen(maxigen.comにおけるワールドワイドウェブ上において利用可能である)によって開発されたような(限定されないが、これが挙げられる)、反復的な組換えは、新規の酵素および経路の開発に使用され得る。例えば、Stemmer (1994), Rapid evolution of a protein in vitro by DNA shuffling, Nature 370(4):389- 391、およびStemmer, (1994), DNA shuffling by random fragmentation and reassembly: In vitro recombination for molecular evolution, Proc. Natl. Acad. Sci. USA., 91:10747-10751を参照すればよい。同様に、Genencor(genencor.comにおけるワールドワイドウェブ上において利用可能である)によって開発されたDesignPath(商標)は、代謝経路操作(細胞においてO−メチリル−L−チロシンを作り出す経路の操作が挙げられるが、これに限定されない)に任意に使用される。この技術は、新しい遺伝子(機能的なゲノミクスを介して同定された遺伝子が挙げられるが、これに限定されない)、ならびに分子進化および設計の組合わせを用いて、宿主生物に存在する経路を再構築する。また、Diversa Corporation(diversa.comにおけるワールドワイドウェブ上において利用可能である)は、新しい経路を作り出すための(限定されないが、これが挙げられる)、遺伝子および遺伝子経路のライブラリを迅速にスクリーニングする技術を提供している。
典型的に、本発明の設計された生合成経路を用いて産生された非天然アミノ酸は、タンパク質の効率的な生合成に十分な濃度(天然の細胞における量が挙げられるが、これに限定されない)に産生されるが、他のアミノ酸の濃度に影響するか、または細胞性の資源を使い果たす程ではない。この方法においてインビボにおいて生成される典型的な濃度は、約10mMから0.05mMである。ひとたび、特定の経路に関して所望される酵素の生成に使用される遺伝子を含んでいるプラスミドを用いて、細胞が形質転換され、非天然アミノ酸が生成されると、リボソームタンパク質の合成および細胞増殖の両方に対して、非天然アミノ酸の産生をさらに最適化するために、必要に応じてインビボセレクションが使用される。
(非天然アミノ酸を有しているポリペプチド)
非天然アミノ酸の組込みは、種々の目的(タンパク質構造および/または機能の変化の修正、大きさの変更、酸性度の変更、求核性の変更、水素結合の変更、疎水性の変更、プロテアーゼ標的部位の接触性の変更、部分に対する標的化の変更(タンパク質アレイ用が挙げられるが、これらに限定されない)などが挙げられるが、これらに限定されない)のためになされ得る。非天然アミノ酸を含んでいるタンパク質は、増強されたかもしくはまったく新しい触媒的、または生物学的な性質を有し得る。例えば、以下の性質:毒性、体内分布、構造的性質、分光性質、化学的および/または光化学的な性質、触媒能、半減期(血中半減期が挙げられるが、これに限定されない)、ならびに他の分子との共有結合的または非共有結合的な(限定されないが、これらが挙げられる)反応能などは、タンパク質への非天然アミノ酸の含有によって任意に調節される。少なくとも1つの非天然アミノ酸を含んでいるタンパク質を含有している組成物は、新規の治療、診断、触媒酵素、産業的な酵素、結合タンパク質(抗体が挙げられるが、これに限定されない)、ならびにタンパク質の構造および機能に関する研究(限定されないが、これらが挙げられる)に有用である。例えば、Dougherty, (2000) Unnatural Amino Acids as Probes of Protein Structure and Function, Current Opinion in Chemical Biology, 4:645-652を参照すればよい。
本発明の1つの局面において、組成物は、少なくとも1(少なくとも2、少なくとも3、少なくとも4、少なくとも5、少なくとも6、少なくとも7、少なくとも8、少なくとも9、または少なくとも10以上が挙げられるが、これらに限定されない)の非天然アミノ酸を有している少なくとも1つのタンパク質を含んでいる。非天然アミノ酸は、同じであり得るか、または異なり得る(1、2、3、4、5、6、7、8、9、10もしくはそれ以上の異なる、または同じ非天然アミノ酸を含んでいるポリペプチドにおける、1、2、3、4、5、6、7、8、9、10もしくはそれ以上の異なる部位があり得ることが挙げられるが、これらに限定されない)。他の局面において、タンパク質に存在する特定のアミノ酸のすべてではないが、少なくとも1つが非天然アミノ酸と置換されているタンパク質を含んでいる。2つ以上の非天然アミノ酸を有している所定のタンパク質に関して、当該非天然アミノ酸は、同一であり得るか、または異なり得る(タンパク質が2つ以上の異なる種類の非天然アミノ酸を含み得るか、または2つの同じ非天然アミノ酸を含み得ることが挙げられるが、これらに限定されない)。3つ以上の非天然アミノ酸を有している所定のタンパク質に関して、当該非天然アミノ酸は、同じであり得るか、異なり得るか、または少なくとも1つの非天然アミノ酸と複数の同種の非天然アミノ酸との組合せであり得る。
少なくとも1つの非天然アミノ酸を有する所定のタンパク質またはポリペプチドは本発明の特徴である。また、本発明は、本発明の組成物および方法を用いて産生された少なくとも1つの非天然アミノ酸を有しているポリペプチドまたはタンパク質を包含しいている。また、賦形剤(薬学的に受容可能な賦形剤が挙げられるが、これに限定されない)はタンパク質と共に存在し得る。
少なくとも1つの非天然アミノ酸を有している所定のタンパク質またはポリペプチドを真核細胞において産生することによって、タンパク質またはポリペプチドは、真核細胞の翻訳後修飾を典型的に含んでいる。ある特定の実施形態において、タンパク質は、少なくとも1つの非天然アミノ酸、および真核細胞によってインビボにおいてなされた少なくとも1つの翻訳後修飾を含んでおり、ここで、当該翻訳後修飾は原核細胞によってなされない。例えば、翻訳後修飾としては、アセチル化、アシル化、脂質修飾、パルミトイル化、パルミチン酸付加、リン酸化、糖脂質結合修飾、および糖鎖形成などが挙げられるが、これらに限定されない。1つの局面において、翻訳後修飾としては、GlcNAc−アスパラギン連結による、アスパラギンに対するオリゴ糖((GlcNAc−Man)2−Man−GlcNAc−GlcNAcが挙げられるが、これに限定されない)の付加が挙げられる。また、真核細胞タンパク質のN結合型オリゴ糖のいくつかの例を挙げている表1を参照すればよい(付加的な残基が存在し得るが、示されていない)。他の局面において、翻訳後修飾としては、GalNAc−セリン連結もしくはGalNAc−スレオニン連結、またはGlcNAc−セリン連結もしくはGlcNAcスレオニン連結による、セリンまたはスレオニンに対するオリゴ糖(Gal−GalNAc、Gal−GlcNAcなどが挙げられるが、これらに限定されない)の付加が挙げられる。
さらなるもう1つの局面において、翻訳後修飾としては、前駆体(カルシトニン前駆体、カルシトニン遺伝子関連ペプチド前駆体、プレプロ副甲状腺ホルモン(preproparathyriod hormone)、プレプロインシュリン、プロインシュリン、プレプロオピオメラノコルチン、およびプロオピオメラノコルチンなどが挙げられるが、これらに限定されない)のタンパク質分解性のプロセシング、多サブユニットタンパク質への集合もしくは巨大分子への集合、細胞における他の部位への移動(細胞小器官(例えば、小胞体、ゴルジ装置、核、リソソーム、ペルオキシソーム、ミトコンドリア、葉緑体、液胞など)または分泌経路の通過が挙げられるが、これらに限定されない)が挙げられる。ある特定の実施形態において、ポリペプチドは、分泌配列または局在化配列であるエピトープタグ、FLAGタグ、ポリヒスチジンタグ、またはGST融合などを含んでいる。
非天然アミノ酸の利点の1つは、非天然アミノ酸が付加的な分子の付加に使用され得る付加的な化学部分を与えるということである。これらの修飾は、真核細胞もしくは原核細胞のインビボまたはインビトロにおいてなされ得る。したがって、ある特定の実施形態において、翻訳後修飾は非天然アミノ酸を介する。例えば、翻訳後修飾は求核−求電子反応を介し得る。タンパク質の選択的な修飾に現在、使用されるほとんどの反応は、求核反応パートナーと求電子反応パートナーとの間における共有結合(α−ハロケトンのヒスチジン側鎖またはシステイン側鎖との反応が挙げられるが、これらに限定されない)の形成に関する。これらの場合における選択性はタンパク質における求核性残基の数および接触性によって決定される。本発明のポリペプチドにおいて、より選択的な他の反応は、例えば、インビボおよびインビトロにおける、ヒドラジドまたはアミノオキシ化合物との非天然ケトアミノ酸の反応に使用され得る。例えば、すべてが参照によって本明細書に援用される、Cornish et al, (1996) Am. Chem. Soc. 118:8150-8151;Mahal et al, (1997) Science. 276:1125-1128;Wang et al, (2001) Science 292:498-500;Chin et al, (2002) Am. Chem. Soc. 124:9026-9027;Chin et al, (2002) Proc. Natl. Acad. Sci., 99: 11020-11024;Wang et al, (2003) Proc. Natl. Acad. Sci 100:56-61;Zhang et al, (2003) Biochemistry. 42:6735-6746;およびChin et al, (2003) Science,(近刊の) を参照すればよい。これは、多くの試薬(蛍光団、架橋剤、糖誘導体および細胞毒性分子が挙げられるが、これらに限定されない)を用いた実質的に任意のタンパク質の選択的な標識を可能にする。また、参照によって本明細書に援用される米国特許公開第10/686,944号(発明の名称:“Glycoprotein synthesis”、2003年1月16日出願)を参照すればよい。また、アジドアミノ酸を介した(限定されないが、これが挙げられる)翻訳後修飾は、トリアリールホスフィン試薬を用いた(限定されないが、これが挙げられる)シュタウディンガー連結を介してなされ得る。例えば、Kiick et al, (2002) Incorporation of azides into recombinant proteins for chemoselective modification by the Staudinger ligation, PNAS 99: 19-24を参照すればよい。
本発明は、タンパク質にアジド部分またはアルキニル部分(限定されないが、これらが挙げられる)を含んでいる非天然アミノ酸の、セレクターコドンに応じた遺伝的組込みに関する、タンパク質の選択的な修飾のための他の高効率な方法を提供する。それから、これらのアミノ酸側鎖は、アジド誘導体またはアルキニル誘導体(限定されないが、これらが挙げられる)を別々に用いて、ヒュイゲン[3+2]付加環化反応(限定されないが、これが挙げられる)(例えば、Padwa, A. in Comprehensive Organic Synthesis. Vol. 4. (1991) Ed. Trost, B. M., Pergamon, Oxford, p. 1069-1109;およびHuisgen, R. in 1 ,3-Dipolar Cycloaddition Chemistry. (1984) Ed. Padwa, A., Wiley, New York, p. 1-176を参照すればよい)によって修飾され得る。この方法は、求核性置換よりむしろ付加環化に関するので、タンパク質は極めて高い選択性を有して修飾され得る。この反応は、反応混合物に対する触媒量のCu(I)塩の添加によって、室温の水性条件下において、優れた位置選択性(1,4>1,5)を有して達成され得る。例えば、Tornoe et al, (2002) Org. Chem. 67:3057-3064;およびRostovtsev et al, (2002) Angew. Chem. Int. Ed. 41: 2596-2599を参照すればよい。使用され得る他の方法は、テトラシステインモチーフを有しているビス砒素化合物におけるリガンド交換である(例えば、Griffin et al, (1998) Science 281 :269-272を参照すればよい)。
[3+2]付加環化を介して本発明のポリペプチドに加えられ得る分子としては、アジド誘導体またはアルキニル誘導体を有する実質的に任意の分子が挙げられる。分子としては、色素、蛍光団、架橋剤、糖誘導体、重合体(ポリエチレングリコールの誘導体が挙げられるが、これに限定されない)、光架橋剤、細胞毒性化合物、親和性標識、ビオチンの誘導体、樹脂、ビーズ、第2のタンパク質もしくはポリペプチド(もしくはそれ以上)、ポリヌクレオチド(DNA、RNAなどが挙げられるが、これらに限定されない)、金属キレート剤、補助因子、脂肪酸、および炭水化物などが挙げられるが、これらに限定されない。これらの分子は、アルキニル基(p−プロパルギルオキシフェニルアラニンが挙げられるが、これに限定されない)またはアジド基(p−アジド−フェニルアラニンが挙げられるが、これに限定されない)を別々に有している非天然アミノ酸に加えられ得る。
VI.遺伝的にコードされていないアミノ酸を含んでいるfEPOポリペプチドのインビボ生成
本発明のfEPOポリペプチドは、天然に存在する系にコードされないアミノ酸を加えるか、または置換するために、修飾されたtRNAおよびtRNA合成酵素を用いてインビボにおいて生成され得る。
天然に存在する系にコードされていないアミノ酸を使用するtRNAおよびtRNA合成酵素を生成する方法は、参照によって本明細書に援用される、米国特許公開第2003/0082575号(出願番号10/126,927)および米国特許公開第2003/0108885号(出願番号10/126,931)に記載されている。これらの方法は、翻訳系に対して内在性の合成酵素およびtRNAと独立して機能する(そして、このためにときに“直交性の(orthogonal)”と呼ばれる)、翻訳機構の生成に関与する。典型的に、当該翻訳系は、直交性のtRNA(O−tRNA)および直交性のアミノアシルtRNA合成酵素(O−RS)を含んでいる。典型的に、O−RSは、翻訳系における少なくとも1つの天然に存在していないアミノ酸を用いてO−tRNAを好ましくアミノアシル化し、O−tRNAは、当該系における他のtRNAによって認識されない少なくとも1つのセレクターコドンを認識する。したがって、当該翻訳系は、コードされたセレクターコドンに応じて、当該系において産生されるタンパク質に天然にコードされていないアミノ酸を挿入して、これによってコードされたポリペプチドにおける所定の位置にアミノ酸を“置換する”。
広範な直交性のtRNAおよびアミノアシルtRNA合成酵素は、ポリペプチドに特定の合成アミノ酸を挿入する当該技術において説明されており、本発明における使用にとって一般的に好適である。例えば、ケト特異的O−tRNA/アミノアシルtRNA合成酵素は、Wang, L.et al, Proc. Natl. Acad. Sci. USA 100:56-61 (2003)、およびZhang, Z.et al, Biochem. 42(22):6735-6746 (2003)に記載されている。例示的なO−RSまたはこれらの一部は、米国特許公開第2003/0082575号(出願番号10/126,927)および米国特許公開第2003/0108885号(出願番号10/126,931)(それぞれ、参照によって本明細書に援用される)に開示されている、ポリヌクレオチド配列にコードされ、アミノ酸配列を含んでいる。また、O−RSと共に使用するための対応するO−tRNA分子は、参照によって本明細書に援用される、米国特許公開第2003/0082575号(出願番号10/126,927)および米国特許公開第2003/0108885号(出願番号10/126,931)に記載されている。
アジド特異的なO−tRNA/アミノアシルtRNA合成酵素の系の例が、Chin, J. W., et al, J. Am. Chem. Soc. 124:9026-9027 (2002) に記載されている。p−アジド−L−Phe用の例示的なO−RS配列としては、参照によって本明細書に援用される米国特許公開第2003/0108885号(出願番号10/126,931)に記載されているように、配列番号14−16および29−32のヌクレオチド配列、ならびに配列番号46−48および61−64のアミノ酸配列が挙げられるが、これらに限定されない。本発明の使用に好適な例示的なO−tRNA配列としては、参照によって本明細書に援用される米国特許公開第2003/0082575号(出願番号10/126,927)に開示されているように、配列番号1−3のヌクレオチド配列が挙げられるが、これらに限定されない。特定の天然にコードされていないアミノ酸に対して特異的なO−tRNA/アミノアシルtRNA合成酵素の他の例が、参照によって本明細書に援用される米国特許公開第2003/0082575号(出願番号10/126,927)に記載されている。S.セレビジアエにおいてケト含有アミノ酸およびアジド含有アミノ酸の両方を組み込む、O−RSおよびO−tRNAについて、Chin, J. W.et al, Science 301 :964-967 (2003). に記載されている。
O−tRNA/アミノアシルtRNA合成酵素の使用は、天然にコードされていないアミノ酸をコードする特異的なコドンの選択に関与する。任意のコドンが使用され得るが、一般的にO−tRNA/アミノアシルtRNA合成酵素が発現されている細胞において、まれにしか使用されないか、または決して使用されないコドンを選択することが好ましい。例えば、例示的なコドンとしては、ナンセンスコドン(例えば、ストップコドン(アンバー、オーカー、およびオパール))、4以上の塩基コドン、ならびにまれにしか使用されない、または使用されない他の天然の3塩基コドンが挙げられる。
特異的なセレクターコドンは、当該技術において公知の突然変異生成方法(部位特異的突然変異生成法、カセット突然変異生成法、制限選択突然変異生成法などが挙げられるが、これらに限定されない)を用いて、fEPOポリヌクレオチドのコード配列における適切な位置に導入され得る。
タンパク質の生合成機構の構成要素(例えば、非天然アミノ酸を組み込むために使用され得るO−RS、O−tRNAおよび直交性のO−tRNA/O−RS対)を生成する方法は、Wang, L., et al Science 292: 498-500 (2001);Chin, J. W.et al, J. Am. Chem. Soc. 124:9026-9027 (2002) ;Zhang, Z.et al, Biochemistry 42: 6735-6746 (2003) に記載されている。天然にコードされていないアミノ酸のインビボにおける組込みのための方法および組成物は、参照によって本明細書に援用される米国特許公開第2003/0082575号(出願番号10/126,927)に記載されている。また、生体のインビボにおける翻訳系に使用する、直交性のtRNA−tRNA合成酵素対を選択する方法は、参照によって本明細書に援用される、米国特許公開第2003/0082575号(出願番号10/126,927)および米国特許公開第2003/0108885号(出願番号10/126,931)に記載されている。
少なくとも1つの直交性の組換えアミノアシルtRNA合成酵素(O−RS)を産生する方法は:(a)第1の生物(原核生物(例えば、Methanococcus jannaschii, Methanobacterium thermoautotrophicum, Halobacterium, Escherichia coli, A. fulgidus, P. furiosus, P. horikoshii, A. pernixまたはT. thermophilusなど)または真核生物が挙げられるが、これらに限定されない)から、少なくとも1つのアミノアシルtRNA合成酵素から誘導体化された(任意に突然変異した)RSのライブラリを生成すること;(b)非天然アミノ酸および天然アミノ酸の存在下において直交性のtRNA(O−tRNA)をアミノアシル化する構成要素のためのRS(任意に突然変異したRS)のライブラリを選択(および/またはスクリーニング)し、これによって活性な(任意に突然変異した)RSのプールを提供すること;および/または(c)非天然アミノ酸の非存在下においてO−tRNAを好ましくアミノアシル化する活性なRS(突然変異体RSが挙げられるが、これに限定されない)のプールを、(任意にネガティブ選択を介して)選択し、これによって少なくとも1つの組換えO−RSを提供することを包含し;ここで、少なくとも1つの当該組換えO−RSは、非天然アミノ酸を用いて当該O−tRNAを好ましくアミノアシル化する。
一実施形態において、RSは不活性RSである。不活性RSは、活性なRSを突然変異させることによって生成され得る。例えば、不活性RSは、異なるアミノ酸(アラニンが挙げられるが、これに限定されない)に対して、少なくとも約1つ、少なくとも約2つ、少なくとも約3つ、少なくとも約4つ、少なくとも約5つ、少なくとも約6つ、または少なくとも約10以上のアミノ酸を突然変異させることによって生成され得る。
突然変異体RSのライブラリは、当該分野において公知の多様な技術(三次元のRS構造に基づいた合理的な設計、または無作為のもしくは合理的な技術におけるRSヌクレオチドの突然変異生成法が挙げられるが、これらに限定されない)を用いて生成され得る。例えば、突然変異体RSは、部位特異的突然変異生成法、無作為の突然変異生成法、多様性生成組換え突然変異、キメラ構築、合理的な設計、ならびに本明細書に記載されているか、もしくは当該技術において公知の他の方法によって、生成され得る。
一実施形態において、活性な構成要素(非天然アミノ酸および天然アミノ酸の存在下において直交性のtRNA(O−tRNA)をアミノアシル化する構成要素が挙げられるが、これに限定されない)のためのRS(任意に突然変異したRS)のライブラリを選択(および/またはスクリーニング)することは:ポジティブ選択またはスクリーニングマーカー(抗生物質耐性遺伝子などが挙げられるが、これに限定されない)、および(任意に突然変異した)RSのライブラリを、複数の細胞に導入すること(ここで、ポジティブ選択マーカーおよび/またはスクリーニングマーカーは、少なくとも1つのセレクターコドン(アンバーコドン、オーカーコドン、オパールコドンが挙げられるが、これらに限定されない)を含んでいる);選択薬剤の存在下において複数の細胞を成長させること;ポジティブ選択マーカーまたはスクリーニングマーカーにおける少なくとも1つのセレクターコドンを抑圧することによって、選択薬剤および/またはスクリーニング薬剤の存在下において、生存する(または特異的な反応を示す)細胞を同定し、これによって活性な(任意に突然変異した)RSのプールを含んでいるポジティブに選択された細胞の一部を提供することを包含している。選択薬剤および/またはスクリーニング薬剤の濃度は任意に変更され得る。
1つの局面において、ポジティブ選択マーカーは、クロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子であり、セレクターコドンは、CAT遺伝子におけるアンバーストップコドンである。任意に、ポジティブ選択マーカーはβ−ラクタマーゼ遺伝子であり、セレクターコドンはβ−ラクタマーゼ遺伝子におけるアンバーストップコドンである。他の局面において、ポジティブ選択マーカーは、蛍光もしくは発光のスクリーニングマーカー、または親和性に基づくスクリーニングマーカー(細胞表面マーカーが挙げられるが、これに限定されない)を含んでいる。
一実施形態において、非天然アミノ酸の非存在下においてO−tRNAを好ましくアミノアシル化する活性なRS(任意に突然変異した)に関するプールの、ネガティブ選択またはネガティブスクリーニングは:ポジティブ選択またはスクリーニングマーカーからの活性な(任意に突然変異した)RSのプールと共に、ネガティブ選択マーカー、またはネガティブスクリーニングマーカーを、第2の生物の複数の細胞に導入すること(ここで、ネガティブ選択マーカー、またはネガティブスクリーニングマーカーは、少なくとも1つのセレクターコドン(抗生物質耐性遺伝子(クロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子が挙げられるが、これに限定されない)が挙げられるが、これに限定されない)を含んでいる);ならびに非天然アミノ酸、およびスクリーニング薬剤もしくは選択薬剤を補った第1の培地において生存するか、または特異的なスクリーニング反応を示すが、非天然アミノ酸およびスクリーニング薬剤もしくは選択薬剤を補っていない第2の培地において生存できないか、または特異的なスクリーニング反応を示さない細胞を同定し、これによって少なくとも1つの組換えO−RSを有する生存細胞または選別された細胞を提供することを包含している。例えば、CAT同定手順は、適切なO−RS組換え体の決定において、ポジティブ選択および/またはネガティブ選択として任意に役割を果たす。例えば、クローンのプールは、1つ以上の非天然アミノ酸を有しているか、または有していないCAT(少なくとも1つのセレクターコドンを含んでいる)を含んでいる成長プレート上において、任意に複製される。したがって、非天然アミノ酸を含んでいるプレート上において排他的に成長するコロニーは、組換えO−RSを含んでいるとみなされる。1つの局面において、選択(および/またはスクリーニング)薬剤の濃度は変更される。いくつかの実施形態において第1および第2の生物は異なる。したがって、第1および/または第2の生物は、原核生物、真核生物、哺乳類、Escherichia coli、菌類、酵母、古細菌、真正細菌、植物、昆虫、原生生物などを任意に包含する。他の実施形態において、スクリーニングマーカーは、蛍光もしくは発光のスクリーニングマーカー、または親和性に基づくスクリーニングマーカーを含んでいる。
他の実施形態において、活性な(任意に突然変異した)RSに関するプールのスクリーニングまたは選択(ネガティブ選択が挙げられるが、これに限定されない)は:ポジティブ選択の段階(b)から活性な突然変異体RSのプールを単離することと;ネガティブ選択マーカー、またはネガティブスクリーニングマーカー(ここで、ネガティブ選択マーカー、またはネガティブスクリーニングマーカーは、少なくとも1つのセレクターコドン(少なくとも1つのセレクターコドンを含んでいる毒性マーカー遺伝子(リボヌクレアーゼバルナーゼ(barnase)遺伝子が挙げられるが、これに限定されない)が挙げられるが、これに限定されない)を含んでいる)、ならびに活性な(任意に突然変異した)RSのプールを、第2の生物の複数の細胞に導入することと;非天然アミノ酸を補っていない第1の培地において生存するか、または特異的なスクリーニング反応を示すが、非天然アミノ酸を補った第2の培地において生存できないか、または特異的なスクリーニング反応を示さない細胞を同定し、これによって少なくとも1つの組換えO−RSを有する生存細胞、または選別細胞を提供することとを包含しており、ここで、少なくとも1つの組換えO−RSは天然にコードされていないアミノ酸に特異的である。1つの局面において、少なくとも1つのセレクターコドンは約2つ以上のセレクターコドンを含んでいる。そのような実施形態は、少なくとも1つのセレクターコドンが2つ以上のセレクターコドンを含んでいる場合、ならびに第1および第2の生物が異なる場合(それぞれの生物が、任意に原核生物、真核生物、哺乳類、Escherichia coli、菌類、酵母、古細菌、真正細菌、植物、昆虫、原生生物など(限定されないが、これらが挙げられる)である場合が挙げられるが、これらに限定されない)を任意に含み得る。また、いくつかの局面は、ネガティブ選択マーカーが、リボヌクレアーゼバルナーゼ遺伝子(少なくとも1つのセレクターコドンを含んでいる)を含んでいる場合を包含している。他の局面は、スクリーニングマーカーが蛍光もしくは発光のスクリーニングマーカー、または親和性に基づくスクリーニングマーカーを任意に含んでいる場合を包含している。本明細書における実施形態において、スクリーニングおよび/または選択は、スクリーニングおよび/または選択のストリンジェンシー(stringency)の変更を任意に包含している。
一実施形態において、直交性の組換えアミノアシルtRNA合成酵素(O−RS)を少なくとも1つを産生する方法は:(d)少なくとも1つの組換えO−RSを単離すること;(e)少なくとも1つの組換えO−RSから誘導体化されたO−RS(任意に突然変異した)の第2のセットを生成すること;ならびに(f)O−tRNAを好ましくアミノアシル化する能力を備える突然変異したO−RSが得られるまで、段階(b)および(c)を繰り返すことをさらに包含している。段階(d)−(f)は、任意に繰り返される(少なくとも2回が挙げられるが、これに限定されない)。1つの局面において、少なくとも1つの組換えO−RSから誘導体化された突然変異したO−RSの第2のセットは、突然変異生成法(無作為の突然変異生成法、部位特異的突然変異生成法、組換え、またはこれらの組合せが挙げられるが、これらに限定されない)によって生成され得る。
選択/スクリーニングの段階(上述した方法における、ポジティブ選択/スクリーニングの段階(b)か、ネガティブ選択/スクリーニングの段階(c)か、ポジティブおよびネガティブ選択/スクリーニングの段階(b)および(c)の両方かのいずれかが挙げられるが、これらに限定されない)のストリンジェンシーは、選択/スクリーニングのストリンジェンシーの変更を任意に包含している。他の実施形態において、ポジティブ選択/スクリーニングの段階(b)か、ネガティブ選択/スクリーニングの段階(c)か、ポジティブおよびネガティブ選択/スクリーニングの段階(b)および(c)の両方かのいずれかは、蛍光標示式細胞分取器(FACS)によって検出されるか、または発光によって検出されるレポーターを使用することを包含している。レポーターは、細胞表面、またはファージディスプレイなどに並び、非天然アミノ酸または類似体に関する親和性、または触媒活性に基づいて選択される。一実施形態において、突然変異した合成酵素は、細胞表面またはファージディスプレイなどに提示される。
組換え直交性のtRNA(O−tRNA)を産生する方法は:(a)第1の生物に由来する少なくとも1つのtRNA(サプレッサtRNAが挙げられるが、これに限定されない)から誘導体化された突然変異体tRNAのライブラリを生成すること;(b)第1の生物に由来するRSの非存在下において、第2の生物に由来するアミノアシルtRNA合成酵素(RS)によってアミノアシル化される(任意に突然変異した)tRNAに関するライブラリを選択(ネガティブ選択が挙げられるが、これに限定されない)、またはスクリーニングし、これによってtRNA(任意に突然変異した)のプールを提供すること;ならびに(c)導入された直交性のRS(O−RS)によってアミノアシル化される構成要素に関するtRNA(任意に突然変異した)のプールを選択またはスクリーニングし、これによって少なくとも1つの組換えO−tRNAを提供することを包含しており;ここで、少なくとも1つの組換えO−tRNAは、セレクターコドンを認識し、第2の生物に由来するRSによって効率的に認識されず、O−RSによって好ましくアミノアシル化される。いくつかの実施形態において、少なくとも1つのtRNAは、サプレッサtRNAであり、および/または、天然および/または非天然の塩基の固有な3塩基コドンを含んでいるか、ナンセンスコドン、レアコドン、非天然コドン、少なくとも4塩基を含んでいるコドン、アンバーコドン、オーカーコドン、もしくはオパールストップコドンである。一実施形態において組換えO−tRNAは向上した直交性を有している。いくつかの実施形態において、O−tRNAが修飾を必要とせずに、第2の生物から第1の生物に任意に取り込まれることが理解される。多様な実施形態において、第1および第2の生物は、同じであるか、または異なり、原核生物(Methanococcus jannaschii、Methanobacterium thermoautotrophicum、Escherichia coli、Halobacteriumなどが挙げられるが、これらに限定されない)、真核生物、哺乳類、菌類、酵母、古細菌、真正細菌、植物、昆虫、原生生物など(限定されないが、これらが挙げられる)から任意に選択される。付加的に、組換えtRNAは、遺伝子操作を介してインビボにおいてか、または天然に生合成される非天然アミノ酸によって、任意にアミノアシル化される。非天然アミノ酸は少なくとも第1または第2の生物に使われる成長培地に任意に加えられる。
1つの局面において、アミノアシルtRNA合成酵素によってアミノアシル化される(突然変異されている場合がある)tRNAに関するライブラリの選択(ネガティブ選択が挙げられるが、これに限定されない)またはスクリーニング(段階(b))は:毒性マーカー遺伝子(ここで、毒性マーカー遺伝子が、少なくとも1つのセレクターコドンを含んでいる(または少なくとも1つのセレクターコドンを含んでいる毒性マーカー遺伝子が、毒性薬剤もしくは静止薬剤の産生を導く遺伝子か、生物に必須の遺伝子を含んでいる))、および(任意に突然変異した)tRNAのライブラリを、第2の生物に由来する複数の細胞に導入すること;ならびに生存細胞を選択すること(ここで、生存細胞は、少なくとも1つの直交性のtRNAまたは非機能的tRNAを有している(任意に突然変異した)tRNAのプールを含んでいる)を包含する。例えば、生存細胞は比較比率細胞密度アッセイ(comparison ratio cell density assay)を用いることによって選択され得る。
他の局面において、毒性マーカー遺伝子は、2つ以上のセレクターコドンを含み得る。当該方法の他の実施形態において、毒性マーカー遺伝子は少なくとも1つのアンバーコドンを含んでいるリボヌクレアーゼバルナーゼ遺伝子である。リボヌクレアーゼバルナーゼ遺伝子は2つ以上のアンバーコドンを任意に含み得る。
一実施形態において、導入された直交性のRS(O−RS)によってアミノアシル化される構成要素に関する(任意に突然変異した)tRNAのプールの選択またはスクリーニングは:ポジティブ選択マーカー遺伝子またはポジティブスクリーニングマーカー遺伝子(ここで、ポジティブマーカー遺伝子は、薬剤耐性遺伝子(少なくとも1つのセレクターコドン(例えば、少なくとも1つのアンバーストップコドン)を含んでいるβ−ラクタマーゼ遺伝子が挙げられるが、これに限定されない)、または生物に必須の遺伝子、またはO−RSと共に毒性薬剤の無毒化を導く遺伝子を含んでいる)、および(任意に突然変異した)tRNAのプールを、第2の生物に由来する複数の細胞に導入すること;ならびに選択薬剤またはスクリーニング薬剤(抗生物質が挙げられるが、これに限定されない)の存在下において成長された、生存細胞または選択細胞を同定し、これによって少なくとも1つの組換えtRNAを含んでいる細胞のプールを提供すること(ここで、少なくとも組換えtRNAは、O−RSによってアミノアシル化され、少なくともセレクターコドンに応じて、ポジティブマーカー遺伝子によってコードされる転写産物にアミノ酸を挿入する)を包含し得る。他の実施形態において、選択薬剤および/またはスクリーニング薬剤の濃度は変更される。
特定のO−tRNA/O−RS対を生成する方法が提供される。当該方法は:(a)第1の生物に由来する少なくとも1つのtRNAから得られた突然変異体tRNAのライブラリを生成すること;(b)第2の生物に由来するアミノアシルtRNA合成酵素(RS)によってアミノアシル化される(任意に突然変異した)tRNAに関するライブラリを、第1の生物に由来するRSの非存在下において、ネガティブ選択またはネガティブスクリーニングし、これによって(任意に突然変異した)tRNAのプールを提供すること;(c)導入された直交性のRS(O−RS)によってアミノアシル化される構成要素に関する(任意に突然変異した)tRNAのプールを選択またはスクリーニングし、これによって少なくとも1つの組換えO−tRNAを提供することを包含している。少なくとも1つの組換えO−tRNAは、セレクターコドンを認識し、第2の生物に由来するRSによって効率的に認識されず、O−RSによって好ましくアミノアシル化される。また、当該方法は、(d)第3の生物に由来する少なくとも1つのアミノアシルtRNA合成酵素(RS)から誘導体化された(任意に突然変異した)RSのライブラリを生成すること;(e)少なくとも1つの組換えO−tRNAを好ましくアミノアシル化する構成要素に関する突然変異体RSのライブラリを、天然にコードされていないアミノ酸および天然アミノ酸の存在下において選択またはスクリーニングし、これによって活性な(任意に突然変異した)RSのプールを提供すること;ならびに(f)少なくとも1つの組換えO−tRNAを好ましくアミノアシル化する活性な(任意に突然変異した)RSに関するプールを、天然にコードされていないアミノ酸の非存在下において、ネガティブ選択またはネガティブスクリーニングし、これによって少なくとも1つの特異的なO−tRNA/O−RS対を提供すること(ここで、少なくとも1つの特異的なO−tRNA/O−RS対は、天然にコードされていないアミノ酸および少なくとも1つの組換えO−tRNAに対して特異的な、少なくとも1つの組換えO−RSを含んでいる)を包含している。当該方法によって産生される特異的なO−tRNA/O−RS対が包含される。例えば、特異的なO−tRNA/O−RS対としては、mutRNATyr−mutTyrRS対(例えば、mutRNATyr−SS12TyrRS対)、mutRNALeu−mutLeuRS対、mutRNAThr−mutThrRS対、またはmutRNAGlu−mutGluRS対などが挙げることができるが、これらに限定されない。付加的に、そのような方法は、第1および第3の生物が同じ生物(Methanococcus jannaschiiが挙げられるが、これに限定されない)である場合を包含している。
また、第2の生物のインビボにおける翻訳系に使用するための直交性のtRNA−tRNA合成酵素対を選択する方法が、本発明に包含される。当該方法は:マーカー遺伝子、第1の生物から単離されたか、得られたtRNAおよびアミノアシルtRNA合成酵素(RS)を、第2の生物に由来する第1の細胞のセットに導入すること;第2の生物に由来する対をなす細胞のセットにマーカー遺伝子およびtRNAを導入すること;ならびに対をなす細胞のセットにおいて生存することができない第1のセットにおける生存細胞を選択すること、または対をなす細胞のセットにおいて特異的なスクリーニング反応を示すことができないそのような反応を示す細胞を選択すること(ここで、第1のセットおよび対をなす細胞のセットは、選択薬剤またはスクリーニング薬剤の存在下において成長され、ここで、生存細胞または選択細胞は、第2の生物のインビボにおける翻訳系に使用するための直交性のtRNA−tRNA合成酵素対を含んでいる)を含んでいる。一実施形態において、比較、および選択もしくはスクリーニングは、インビボ相補的アッセイを包含する。選択薬剤またはスクリーニング薬剤の濃度は変更され得る。
本発明の生物は、種々の生物および種々の組合せを包含している。例えば、本発明の方法の第1および第2の生物は、同じであり得るか、または異なり得る。一実施形態において、生物は、任意に原核生物(Methanococcus jannaschii、Methanobacterium thermoautotrophicum、Halobacterium、Escherichia coli、A. fulgidus、P. furiosus、P. horikoshii、A. pernix、T. thermophilusなどが挙げられるが、これらに限定されない)である。代替可能に、生物は、任意に真核生物(植物(複合体植物(例えば、単子葉植物または双子葉植物)が挙げられるが、これらに限定されない)、藻類、原生生物、菌類(酵母が挙げられるが、これに限定されない)、または動物(哺乳類、昆虫、節足動物などが挙げられるが、これらに限定されない)が挙げられるが、これらに限定されない)などである。他の実施形態において、第2の生物は、原核生物(Methanococcus jannaschii、Methanobacterium thermoautotrophicum、Halobacterium、Escherichia coli、A. fulgidus、Halobacterium、P. furiosus、P. horikoshii、A. pernix、T. thermophilusなどが挙げられるが、これらに限定されない)である。代替可能に、第2の生物は、真核生物(酵母、動物細胞、植物細胞、菌類、または哺乳類細胞などが挙げられるが、これらに限定されない)であり得る。種々の実施形態において、第1および第2の生物は異なる。
VII.非天然に存在しているアミノ酸のfEPOにおける位置
本発明は、非天然に存在している1つ以上のアミノ酸のfEPOに対する組込みを意図している。非天然に存在している1つ以上のアミノ酸はポリペプチドの活性を破壊しない特定の位置に組み込まれ得る。これは、“保存的な”置換(疎水性アミノ酸を用いた疎水性アミノ酸の置換、かさ高いアミノ酸のかさ高いアミノ酸への置換、親水性アミノ酸の親水性アミノ酸への置換が挙げられるが、これらに限定されない)、および/または活性に必要のない位置における非天然に存在しているアミノ酸の挿入の生成によって実現され得る。
fEPOの領域は、fEPOにおけるアミノ酸位置が中段に示されている、以下のように例示され得る。
種々の生化学的手法および構造的手法が、fEPO内における非天然に存在しているアミノ酸を用いた置換に所望される部位を選択するために使用され得る。ポリペプチド鎖の任意の位置が非天然に存在しているアミノ酸を組み込むための選択に好適であり、選択が合理的な設計、または任意の目的もしくは特に所望されていない目的のための任意の選択に基づき得ることは、当業者にとって容易に明らかになる。所望の部位の選択は所望される任意の特性もしくは活性を有しているfEPO分子(アゴニスト、スーパーアンタゴニスト、逆アゴニスト、アンタゴニスト、受容体結合分子、受容体活性調節物質が挙げられるが、これらに限定されない)の生成、未処理の分子と比べて変化のない活性もしくは特性を有しているfEPO分子の生成、またはポリペプチドの物理的な任意の特性もしくは化学的な任意の特性(例えば可溶性、凝集または安定性)の操作のためであり得る。例えば、fEPOの生物学的な活性に必要な、ポリペプチドにおける位置は、当該分野において公知のアラニンスキャニング法または相同性スキャニング法を用いて同定され得る。例えば、Bittorf, T. et al. FEBS, 336:133-136 (1993)(fEPOの活性に重要な残基の同定)、Wen, D., et al.JBC, 269:22839-22846 (1994)(hEPOの機能的に重要なドメインの同定に採用されているアラニンスキャニング変異生成)、およびElliot, S. et al. Blood, 89:493-502 (1997)(hEPOおよびヒトEPO受容体の間における重要な静電的な相互作用の同定)を参照すればよい。アラニンスキャニング変異生成または相同性スキャニング変異生成によって生物学的な活性にとって重要であると同定された残基以外の残基は、ポリペプチドに求められている所望の活性に応じた、天然にコードされていないアミノ酸を用いた置換にとって良好な候補であり得る。また代替的に、生物学的な活性にとって重要であると同定された部位は、ポリペプチドに求められている所望の活性に応じた、天然にコードされていないアミノ酸を用いた置換にとって良好な候補であり得る。他の代替法は、天然にコードされていないアミノ酸を用いたポリペプチド上の各位置における一連の置換を単に生成すること、およびポリペプチドの活性に対する影響を観察することである。任意のポリペプチドに対する非天然アミノ酸を用いた置換のための部位を選択する任意の手法、技術または方法が本発明における使用にとって好適であることは、当業者にとって容易に明らかになる。
また、天然に存在しており、欠失を含んでいるfEPO変異体の構造および活性が試験されて、天然にコードされていないアミノ酸を用いた置換を許容すると思われるタンパク質の領域を決定し得る。例えば、Bittorf et al., FEBS, 336:133 (1993); Wen et al, JBC, 269:22839 (1994)を参照すればよい。天然にコードされていないアミノ酸を用いた置換を許容できないと思われる他の残基が排除されていると、残りの位置のそれぞれにおける提案されている置換の影響がfEPOおよびその結合タンパク質の三次元構造から試験され得る。Syed et al., Nature, 395: 511 (1998) and Cheetham et al., Nature Structural Biology, 5:861 (1998)を参照すればよく;fEPOのx線結晶構造およびNMR構造がProtein Data Bank(PDB、PDBのID:1CN4、1EERおよび1BUYを有しているwww.rcsb.org)において利用可能である。したがって、hEPOに関する公知の情報を用いることによって、当業者は、天然にコードされていないアミノ酸を用いて置換され得る、fEPOにおけるアミノ酸位置(図1を参照)を容易に同定し得る。
いくつかの実施形態において、本発明のfEPOポリペプチドは、EPOのらせんまたはベータシートの二次構造を破壊しないタンパク質の領域に配置されている非天然に存在しているアミノ酸を1つ以上含んでいる。いくつかの実施形態において、天然にコードされていないアミノ酸の1つ以上は、EPOにおける二次構造に対応する以下の領域:1〜7位(N末端)、8〜26位(Aヘリックス)、27〜38位(AヘリックスおよびBヘリックスの間の領域)、39〜41位(ベータシート1)、42〜46位(ベータシート1およびミニヘリックスB’の間の領域)、47〜52(ミニB’ヘリックス)、53〜54位(ミニB’ヘリックスおよびBヘリックスの間の領域)、55〜83(Bヘリックス)、84〜89位(BヘリックスおよびCヘリックスの間の領域)、90〜113位(Cヘリックス)、114〜121位(ミニC’ヘリックス)、122〜132位(身にC’ヘリックスおよびベータシート2の間の領域)、133〜135位(ベータシート2)、136〜137位(ベータシート2およびDヘリックスの間の領域)、138〜161位(Dヘリックス)、162〜166位(C末端)の1つ以上に組み込まれているか、または置換されている。いくつかの実施形態において、天然にコードされていないアミノ酸の1つ以上は、fEPOにおける以下の位置:1位、2位、3位、4位、5位、6位、8位、9位、17位、21位、24位、25位、26位、27位、28位、30位、31位、32位、34位、35位、36位、37位、38位、39位、40位、43位、45位、47位、50位、51位、52位、53位、54位、55位、56位、57位、58位、68位、72位、76位、77位、78位、79位、80位、82位、83位、84位、85位、86位、87位、88位、89位、90位、91位、92位、107位、110位、111位、113位、114位、115位、116位、117位、118位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、133位、134,136位、154位、157位、158位、159位、160位、162位、163位、164位、165位および166位の1つに組み込まれている。いくつかの実施形態において、本発明のfEPOポリペプチドは、非天然に存在しているアミノ酸の1つ以上を、以下の位置:21位、24位、27位、28位、30位、31位、36位、37位、38位、55位、72位、83位、85位、86位、87位、89位、113位、116位、119位、120位、121位、123位、124位、125位、126位、127位、128位、129位、130位および162位の1つ以上に含んでいる。いくつかの実施形態において、これらまたは他の位置(21位、24位、38位、83位、85位、86位、89位、116位、119位、121位、124位、125位、126位、127位および128位が挙げられるが、これらに限定されない)における非天然に存在しているアミノ酸は、水溶性重合体と連結されている。
天然にコードされていないアミノ酸の組込みの例示的な部位としては、SiteIおよびSiteIIに含まれていない部位、完全にかまたは部分的に溶媒にさらされ得る部位、近傍の残基と最小の水素結合相互作用を示すか、もしくは水素結合相互作用を示さない部位、ならびにその受容体をともなうhEPOの三次元結晶構造によって予想されるような選択の余地の大きい領域(C−Dループが挙げられるが、こらに限定されない)もしくは構造的に堅固な領域(Bヘリックスが挙げられるが、これに限定されない)が挙げられるが、これらに限定されない。
広範な天然にコードされていないアミノ酸が、fEPOにおける所定の位置に置換され得るか、または組み込まれ得る。一般的に、特定の天然にコードされていないアミノ酸は、その受容体をともなったfEPOの三次元結晶構造の試験に基づく組込み、保存的な置換(すなわちアリールを有している天然にコードされていないアミノ酸の、Phe、TyrまたはTrpに対する置換)にとっての好ましさ、およびfEPOへの導入を所望される特定の抱合の化学的性質(アルキン部分を有している水溶性重合体とのヒュイゲン[3+2]環付加、またはアリールエステル(すなわちホスフィン部分を組み込む)を有している水溶性重合体とのアミド結合の形成をもたらすことが所望される場合における4−アジドフェニルアラニンの導入が挙げられるが、これらに限定されない)のために選択される。
一実施形態において、上記方法は、第1の反応性基を含んでいる非天然アミノ酸をタンパク質に組み込むこと;およびタンパク質を第2の反応性基を含んでいる分子と接触させることを包含している。当該分子としては、色素、重合体(ポリエチレングリコールの誘導体が挙げられるが、これに限定されない)、光架橋リンカー、細胞毒性化合物、親和性標識、ビオチンの誘導体、樹脂、他のポリペプチドまたはタンパク質、金属キレート剤、補足因子、脂肪酸、含水炭素、ポリヌクレオチド(DNA、RNAなどが挙げられるが、これらに限定されない)などが挙げられるが、これらに限定されない。上記第1の反応性基は、上記第2の反応性基と反応して、[3+2]環付加を介して非天然アミノ酸に上記分子を結合させる。一実施形態において、上記第1の反応性基はアルキン部分またはアジド部分であり、上記第2の反応性基はアジド部分またはアルキン部分である。例えば、上記第1の反応性基はアルキン部分(非天然アミノ酸p−プロパルギルフェニルアラニンにおけるアルキン部分が挙げられるが、これに限定されない)であり、上記第2の反応性基はアジド部分である。他の例において、上記第1の反応性基はアジド部分(非天然アミノ酸p−アジド−L−フェニルアラニンにおけるアジド部分が挙げられるが、これに限定されない)であり、上記第2の反応性基はアルキン部分である。
天然にコードされていないアミノ酸の組込みのための例示的な部位の部分集合としては、1位、2位、4位、17位、21位、24位、27位、28位、30位、31位、32位、34位、36位、37位、38位、40位、50位、53位、55位、58位、65位、68位、72位、76位、80位、82位、83位、85位、86位、87位、89位、113位、115位、116位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、134位、136位および162位が挙げられるが、これらに限定されない。hEPOの結晶構造およびhEPO受容体とのその相互作用の試験、および現時点で出願されているfEPOの出願にともなって与えられている分子モデリングによって、これらのアミノ酸残基の側鎖が溶媒に対して完全または部分的に接触化能であり。天然にコードされていないアミノ酸の側鎖がタンパク質の表面の外側および溶媒の中に向いていることが示されている。
天然にコードされていないアミノ酸のfEPOに対する組込みのための例示的な部位としては、21位、24位、28位、30位、31位、36位、37位、38位、55位、72位、 83位、85位、86位、87位、89位、113位、116位、119位、120位、121位、123位、124位、125位、126位、127位、128位、129位、130位および162位が挙げられる。fEPOの結晶構造およびhEPO受容体との相互作用の試験によって、これらのアミノ酸残基が完全に溶媒にさらされており、元の残基の側鎖が溶媒内に向いていることが示されている。
いくつかの場合において、天然にコードされていないアミノ酸の(複数の)置換または(複数の)組込みは、fEPOの生物学的な他の性質にfEPOポリペプチド内の他の付加、置換または欠失と組み合わせられる。いくつかの場合において、上記他の付加、置換または欠失はfEPOポリペプチドの安定性(タンパク質分解性の分解に対する耐性が挙げられるが、これに限定されない)を増大させ得るか、またはエリスロポエチン受容体に対するfEPOポリペプチドの親和性を増大させ得る。いくつかの場合において、上記他の付加、置換または欠失は、fEPOポリペプチドの可溶性(E. coliまたは他の宿主細胞において発現される場合の可溶性が挙げられるが、これらに限定されない)を増大させ得る。いくつかの実施形態において、E. coli組換え宿主細胞における発現後のfEPOの可溶性を増大させるための、天然にコードされていないアミノ酸の組込みにとっての他の部位に加えて、部位は天然にコードされているアミノ酸または天然にコードされていないアミノ酸を用いた置換のために選択される。可溶性を増大させるためのアミノ酸置換に関するfEPOにおける当該部位の例は、Lys、Arg、Gluまたは電荷を有している任意の他の天然にコードされているアミノ酸もしくは天然にコードされていないアミノ酸を用いて置換され得るN36、Q86、G113および/またはQ115である。いくつかの実施形態において、fEPOポリペプチドは、fEPO受容体に対する親和性を調節するか、受容体の二量体化を調節する(増強させるか、または低減させるが挙げられるが、これらに限定されない)か、受容体の二量体を安定化させるか、循環半減期を調節するか、遊離もしくは生体利用効率を調節するか、精製を容易にするか、または特定の投与経路を改善するか、もしくは変更させる他の付加、置換または欠失を含んでいる。同様に、fEPOポリペプチドは、プロテアーゼ切断配列、反応性基、抗体結合ドメイン(FLAGまたはポリHisが挙げられるが、これらに限定されない)、またはポリペプチドの検出(GFPが挙げられるが、これに限定されない)、精製もしくは他の性質を改善させる他の親和性に基づく配列(FLAG、ポリHis、GSTなどが挙げられるが、これらに限定されない)もしくは結合されている分子(ビオチンが挙げられるが、これに限定されない)を含み得る。
例えば、本明細書にすでに述べられているような天然にコードされていないアミノ酸の1つ以上の導入に加えて、以下の置換:その受容体に対するfEPOの親和性を増強させるためのS9A、F48S、Y49S、A50S、Q59A、A73G、G101A、T106A、L108A、T12A、R139A、K140A、R143A、S146A、N147A、R150AおよびK154Aの1つ以上が導入される(Wen et al., (1994) JBC 269:22839-22846)。
いくつかの実施形態において、天然にコードされていないアミノ酸の置換は、fEPOアンタゴニストを生成する。天然にコードされていないアミノ酸の組込みのための例示的な部位の部分集合としては、10位、11位、14位、15位、96位、97位、100位、103位、104位、107位、110位が挙げられる(Elliot et al. (1997) Blood 89: 493-502;およびCheetham et al. (1998) Nature Structural Biology 5: 861-866)。他の実施形態において、天然にコードされていないアミノ酸の組込みの例示的な部位としては、ヘリックスAのアミノ末端領域、およびヘリックスCの部分の内部における残基が挙げられる。他の実施形態において、天然にコードされていないアミノ酸(例えばp−アジド−L−フェニルアラニンまたはO−プロパルギル−L−チロシン)を用いたL108の置換。他の実施形態において、上述の置換はfEPOポリペプチドをfEPOアンタゴニストにする付加的な置換と組み合わせられる。例えば、天然にコードされていないアミノ酸は、本明細書に特定されている位置の1つにおいて置換されており、同時の置換がL108に導入されている(L108K、L108R、L108H、L108DまたはL108Eが挙げられるが、これらに限定されない)。
いくつかの場合において、1、2、3、4、5、6、7、8、9または10以上のアミノ酸が天然にコードされていないアミノ酸を用いて置換されている。いくつかの場合において、fEPOポリペプチドは、天然に存在しているアミノ酸に対する天然にコードされていないアミノ酸の、1、2、3、4、5、6、7、8、9または10以上の置換をさらに含んでいる。例えば、いくつかの実施形態において、fEPOの以下の領域:1〜7位(N末端)、8〜26位(Aヘリックス)、27〜38位(AヘリックスおよびBヘリックスの間の領域)、39〜41位(ベータシート1)、42〜46位(ベータシート1およびミニヘリックスB’の間の領域)、47〜52(ミニB’ヘリックス)、53〜54位(ミニB’ヘリックスおよびBヘリックスの間の領域)、55〜83(Bヘリックス)、84〜89位(BヘリックスおよびCヘリックスの間の領域)、90〜113位(Cヘリックス)、114〜121位(ミニC’ヘリックス)、122〜132位(身にC’ヘリックスおよびベータシート2の間の領域)、133〜135位(ベータシート2)、136〜137位(ベータシート2およびDヘリックスの間の領域)、138〜161位(Dヘリックス)、162〜166位(C末端)における少なくとも2つの残基が天然にコードされていないアミノ酸を用いて置換されている。いくつかの場合において、天然にコードされていない残基の2つ以上が、1つ以上の低分子量の直鎖状または分枝鎖状のPEG(およそ5〜20kDa未満の質量)と連結されており、より高分子の単一のPEGと結合している種に対して、増大している結合親和性および血中半減期を示す。
いくつかの実施形態において、以下の残基:1位、2位、4位、17位、21位、24位、27位、28位、30位、31位、32位、34位、36位、37位、38位、40位、50位、53位、55位、58位、65位、68位、72位、76位、80位、82位、83位、85位、86位、87位、89位、113位、115位、116位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、134位、136位および162位の2つ以下が、天然にコードされていないアミノ酸を用いて置換されている。したがって、いくつかの場合において、以下の置換の組合せ:N24X*およびG113X*;N38X*およびQ115X*;N36X*およびS85X*;N36X*およびA125X*;N36X*およびA128X*;Q86X*およびS126X*のいずれかがもたらされている。ここで、X*は天然にコードされていないアミノ酸を表している。天然にコードされていないアミノ酸の2つ以上の置換のための好ましい部位としては、以下の残基:21位、24位、28位、30位、31位、36位、37位、38位、55位、72位、83位、85位、86位、87位、89位、113位、116位、119位、120位、121位、123位、124位、125位、126位、127位、128位、129位、130位および162位の組合せが挙げられる。天然にコードされていないアミノ酸の2つ以上の置換のための特に好ましい部位としては、以下の残基:21位、24位、38位、83位、86位、89位、116位、119位、124位、125位、126位、127位、128位、129位、130位および162位の組合せが挙げられる。
VIII.非真核生物および真核生物における発現
クローン化されたfEPOポリヌクレオチドを高レベルに発現させるために、直接転写にとって強力なプロモータ、転写/翻訳ターミネータ、および(タンパク質をコードする核酸用の場合に)翻訳開始用のリボソーム結合部位を含んでいる発現ベクターに対して、本発明のfEPOポリペプチドをコードするポリヌクレオチドを一般的にサブクローニングする。適切な細菌プロモータは、当業者に周知であり、Sambrook et alおよびAusubel et alにて説明されている。
本発明のfEPOポリペプチドの発現を目的とした細菌発現系は、例えばE. coli、Bacillus spおよびSalmonellaにおいて利用可能であるが、これらに限定されない(Palva et al., Gene 22:229-235 (1983); Mosbach et al., Nature 302:543-545 (1983))。そのような発現系用のキットは市販されている。また、哺乳動物細胞、酵母および昆虫細胞にとっての真核発現系は、当業者に周知であり、市販もされている。直交性のtRNAおよびアミノアシル化tRNA合成酵素(上述されている)を使用して、本発明のfEPOポリペプチドを発現する場合、発現用の宿主細胞は、直交性の構成要素を使用する該宿主細胞の能力に基づいて選択される。例示的な宿主細胞としては、グラム陽性細菌(B. brevisまたはB. subtilis、PseudomonasまたはStreptomycesが挙げられるが、これらに限定されない)、およびグラム陰性細菌(E. coli)だけでなく、酵母および他の真核細胞が挙げられる。O−tRNA/O−RSの対を含んでいる細胞は、本明細書に記載されているように使用され得る。
本発明の真核生物の宿主細胞、または非真核生物の宿主細胞は、非常に有用な量の非天然アミノ酸を含んでいるタンパク質を合成する能力を有している。1つの局面において、組成物は、必要に応じて、少なくとも10マイクログラム、少なくとも50マイクログラム、少なくとも75マイクログラム、少なくとも100マイクログラム、少なくとも200マイクログラム、少なくとも250マイクログラム、少なくとも500マイクログラム、少なくとも1ミリグラム、少なくとも10ミリグラム、少なくとも100ミリグラム、少なくとも1グラム、もしくはそれ以上(これらに限定されない)の、非天然アミノ酸を含んでいるタンパク質を含んでいるか、またはインビボにおけるタンパク質の製造方法(組換えタンパク質の製造および精製についての詳細が本明細書に与えられている)を用いて達成され得る量のタンパク質を含んでいる。他の局面において、タンパク質は、(これに限定されないが、1nL〜100Lなどの任意の量の)細胞溶解液、緩衝液、薬学的緩衝液または他の液体懸濁液の中に、1リットルごとに少なくとも10マイクログラムのタンパク質、1リットルごとに少なくとも50マイクログラムのタンパク質、1リットルごとに少なくとも75マイクログラムのタンパク質、1リットルごとに少なくとも100マイクログラムのタンパク質、1リットルごとに少なくとも200マイクログラムのタンパク質、1リットルごとに少なくとも250マイクログラムのタンパク質、1リットルごとに少なくとも500マイクログラムのタンパク質、1リットルごとに少なくとも1ミリグラムのタンパク質、1リットルごとに少なくとも10ミリグラムのタンパク質、またはそれ以上の濃度(これらに限定されない)において、組成物中に必要に応じて存在する。少なくとも1つの非天然アミノ酸を含んでいるタンパク質の真核細胞での大量生産(典型的に限定されないが、インビボにおける翻訳を含む他の方法を用いて可能な量よりも多い量が挙げられるが、これに限定されない)は、本発明の1つの特徴である。
本発明の真核生物の宿主細胞、または非真核生物の宿主細胞は、非天然アミノ酸を含んでいるタンパク質を非常に有用な量で生合成する能力を備えている。例えば、非天然アミノ酸を含んでいるタンパク質は、細胞抽出物、細胞溶解液、培地、および/または緩衝液などの中に、例えば、少なくとも10μg/リットル、少なくとも50μg/リットル、少なくとも75μg/リットル、少なくとも100μg/リットル、少なくとも200μg/リットル、少なくとも250μg/リットル、少なくとも500μg/リットル、少なくとも1mg/リットル、少なくとも2mg/リットル、少なくとも3mg/リットル、少なくとも4mg/リットル、少なくとも5mg/リットル、少なくとも6mg/リットル、少なくとも7mg/リットル、少なくとも8mg/リットル、少なくとも9mg/リットル、少なくとも10mg/リットル、少なくとも20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900mg/リットル、1g/リットル、5g/リットル、10g/リットル、またはそれ以上の濃度において、製造され得る。
発現系、培養および単離
任意の数の適切な発現系において、fEPOを発現させ得る。当該発現系としては、例えば、酵母、昆虫細胞、哺乳動物細胞および細菌が挙げられる。典型的な発現系の例を以下に示す。
(酵母)
本明細書で用いられる場合、“酵母”という用語は、fEPOをコードする遺伝子を発現可能な、種々の酵母のいずれかを包含する。そのような酵母としては、限定されないが、子嚢胞子を生じる(ascosporogenous)酵母(Endomycetales)、担子胞子を生じる(basidiosporogenous)酵母、および不完全真菌(Blastomycetes)の群に属する酵母などが挙げられるが、これらに限定されない。子嚢胞子を生じる酵母は、2のファミリー(SpermophthoraceaeおよびSaccharomycetaceae)に分けられる。後者は、4のサブファミリー(Schizosaccharomycoideae(Schizosaccharomyces属など)、Nadsonioideae、Lipomycoideae、およびSaccharomycoideae(Pichia属、Kluyveromyces属およびSaccharomyces属など))から構成されている。担子胞子を生じる酵母としては、Leucosporidium属、Rhodosporidium属、Sporidiobolus属、Filobasidium属およびgenus Filobasidiella属が挙げられる。不完全真菌(Blastomycetes)の群に属する酵母は、2のファミリー(Sporobolomycetaceae(Sporobolomyces属およびBullera属など)およびCryptococcaceae(Candida属など))に分けられる。
本発明と一緒に使用するための特に所定のものとして、Pichia属、Kluyveromyces属、Saccharomyces属、Schizosaccharomyces属、Hansenula属、Torulopsis属およびCandida属に含まれる種であり、P. pastoris、P. guillerimondii、S. cerevisiae、S. carlsbergensis、S. diastaticus、S. douglasii、S. kluyveri、S. norbensis、S. oviformis、K. lactis、K. fragilis、C. albicans、C. maltosa、およびH. polymorphaが挙げられるが、これらに限定されない。
fEPOの発現に好適な酵母の選択は当業者の技術範囲にある。発現用の酵母宿主の選択において、好適な宿主としては、例えば良好な分泌能、低いタンパク質分解活性、および総合的な強健さを有していることが示されている酵母が挙げられ得る。酵母は、一般的に種々の供給源から入手でき、カリフォルニア大学生物物理学および医学物理学分野(Department of Biophysics and Medical Physics, University of California)のYeast Genetic Stock Center (Berkeley、CA)、およびthe American Type Culture Collection(“ATCC”)(Manassas、VA)などから入手できるが、これらに限定されない。
“酵母宿主”または“酵母宿主細胞”という用語は、組換えベクターまたは他のトランスファーDNAの受容物として使用し得るか、または使用されている酵母を包含している。この用語は、組換えベクターまたは他のトランスファーDNAを受け容れている元々の酵母宿主細胞の子孫を包含している。1つの親細胞の子孫は、形態において、またはゲノムDNAもしくは全DNAの補体(complement)において、偶発的な突然変異、もしくは計画的な突然変異に起因して、元々の親細胞と必ずしも完全に一致しなくてもよいことが理解される。関連する性質(例えば、fEPOをコードするヌクレオチド配列の存在)により特徴付けられる親細胞と十分に類似する親細胞の子孫は、この定義によって意図される子孫に包含される。
発現ベクターおよび形質転換ベクター(染色体外レプリコンまたは組込みベクターが挙げられる)は、多くの酵母宿主を形質転換するために開発されている。例えば、S. cerevisiae(Sikorski et al, GENETICS (1998) 112:19、Ito et al, J. BACTERIOL. (1983) 153:163、Hinnen et al, PROC. NATL. ACAD. SCI. USA (1978) 75:1929)、C. albicans(Kurtz et al, MOL. CELL. BIOL. (1986) 6:142)、C. albicans(Kunze et al, J. BASIC MICROBIOL. (1985) 25:141)、H. polymorpha(Gleeson et al, J. GEN. MICROBIOL. (1986) 132:3459、Roggenkamp et al, MOL. GEN. GENET. (1986) 202:302)、K. fragilis(Das et al, J. BACTERIOL. (1984) 158:1165)、K. lactis(De Louvencourt et al, J. BACTERIOL. (1983) 154:737、Van den Berg et al, BIO/TECHNOLOGY (1990) 8:135)、P. guillerimondii(Kunze et al, J. BASIC MICROBIOL. (1985) 25:141)、P. pastoris(米国特許第5,324,639号、米国特許第4,929,555号、および米国特許第4,837,148号、Cregg et al, MOL. CELL. BIOL. (1985) 5:3376、Schizosaccharomyces pombe(Beach and Nurse, NATURE (1981) 300:706)、およびY. lipolytica(Davidow et al., Curr. Genet. (1985) 10:380 (1985); Gaillardin et al., Curr. Genet. (1985) 10:49)、A. nidulans(Balance et al, BIOCHEM. BIOPHYS. RES. COMMUN. (1983) 112:284-89、Tilburn et al, GENE (1983) 26:205-221、およびYelton et al, PROC. NATL. ACAD. SCI. USA (1984) 81:1470-74)、A. niger(Kelly and Hynes, EMBO J. (1985) 4:475479)、T. reesia(欧州特許出願公開第0244234号)、および糸状菌(例えば、Neurospora、Penicillium、Tolypocladium(国際公開第91/00357号)など)のための発現ベクターが開発されている。
酵母ベクター用の制御配列は、当業者に周知であり、アルコールデヒドロゲナーゼ(ADH)(欧州特許出願公開第0284044号)、エノラーゼ、グルコキナーゼ、グルコース−6リン酸イソメラーゼ、グリセルアルデヒド−3−リン酸−デヒドロゲナーゼ(GAPまたはGAPDH)、ヘキソキナーゼ、ホスホフルクトキナーゼ、3−ホスホグリセリン酸ムターゼ、およびピルビン酸キナーゼ(PyK)(欧州特許出願公開第0329203号)といった遺伝子に由来するプロモータ領域などが挙げられるが、これらに限定されない。また、酸性ホスファターゼをコードしている酵母のPHO5遺伝子は、有用なプロモータ配列を提供し得る(Myanohara et al, PROC. NATL. ACAD. SCI. USA (1983) 80:1)。酵母宿主との使用に適切な他のプロモータ配列としては、3−ホスホグリセリン酸キナーゼ(Hitzeman et al, J. BIOL. CHEM. (1980) 255:2073)、および他の解糖系の酵素(例えば、ピルビン酸デカルボキシラーゼ、トリオースリン酸イソメラーゼ、およびホスホグルコースイソメラーゼ(例えば、Holland et al, BIOCHEMISTRY (1978) 17:4900、Hess et al, J. ADV. ENZYME REG. (1968) 7:149)が挙げられ得る。増殖条件によって制御される転写のさらなる利点を有している、酵母の誘導性プロモータとしては、アルコールデヒドロゲナーゼ2、イソチトクロームC、酸性ホスファターゼ、メタロチオネイン、グリセルアルデヒド−3−リン酸デヒドロゲナーゼ、窒素代謝に関連する分解酵素、ならびにマルトースおよびガラクトースの利用を担っている酵素にとってのプロモータ領域が挙げられ得る。酵母発現における使用に適切なベクターおよびプロモータが、欧州特許出願公開第0073657号に、さらに記載されている。
また、酵母エンハンサーを、酵母プロモータと共に用いてもよい。さらに、合成プロモータもまた、酵母プロモータとして機能し得る。例えば、酵母プロモータの上流活性化配列(UAS)を別の酵母プロモータの転写活性化領域につないで、合成混成プロモータを作製し得る。混成プロモータとしては、例えばGAPの転写活性化領域に連結されたADH調節配列が挙げられる。米国特許第4,880,734号、および米国特許第4,876,197号を参照すればよい。混成プロモータの他の例としては、解糖系酵素の遺伝子(例えば、GAPまたはPyK)の転写活性化領域と組み合せたADH2、GAL4、GAL10、またはPHO5の遺伝子の調節配列からなるプロモータが挙げられる。欧州特許出願公開0164556号を参照すればよい。さらに、酵母プロモータとしては、酵母のRNAポリメラーゼとの結合能および転写開始能を有している、非酵母由来の天然に存在するプロモータが挙げられ得る。
酵母発現ベクターの一部を構成し得る他の制御要素としては、例えば、GAPDHまたはエノラーゼ遺伝子に由来するターミネータ(Holland et al, J. BlOL. CHEM. (1981) 256:1385)が挙げられる。さらに、2μプラスミドの起点に由来する複製開始点は、酵母にとって適切である。酵母に使用するための適切な選択遺伝子は、酵母プラスミドに存在するtrp1遺伝子である。Tschemper et al, GENE (1980) 10:157、Kingsman et al, GENE (1979) 7:141を参照すればよい。trp1遺伝子は、トリプトファン存在下において増殖能を欠如している酵母の突然変異株に対する選択マーカーを提供する。同様にLeu2欠損酵母株(ATCC 20,622または38,626)は、Leu2遺伝子を有する公知のプラスミドによって補完される。
外因性DNAを酵母宿主に導入する方法は、当業者に周知の技術であり、通常、アルカリ性陽イオンを用いて処理された天然の酵母宿主細胞またはスフェロプラストのいずれかの形質転換が挙げられるが、これらに限定されない。例えば、酵母の形質転換は、Hsiao et al, PROC. NATL. ACAD. SCI. USA (1979) 76:3829およびVan Solingen et al, J. BACT. (1977) 130:946に記載の方法にしたがって、実施され得る。しかし、また、例えば、核注入、エレクトロポレーションまたは原形質融合によってDNAを細胞に導入する他の方法も、SAMBROOK et al, MOLECULAR CLONING: A LAB. MANUAL (2001)に通常に記載されているように使用され得る。次いで、酵母宿主細胞を当業者に公知の標準技術を用いて培養してもよい。
酵母宿主細胞において異種タンパク質を発現させる他の方法は、当業者に公知の技術である。一般的に、米国特許出願公開第2002/0055169号、米国特許第6,361,969号、米国特許第6,312,923号、米国特許第6,183,985号、米国特許第6,083,723号、米国特許第6,017,731号、米国特許第5,674,706号、米国特許第5,629,203号、米国特許第5,602,034号、および米国特許第5,089,398号、米国再発行特許発明第RE37,343号、および米国再発行特許発明第RE35,749号、国際公開第99/078621号、国際公開第98/37208号、および国際公開第98/26080号、欧州特許出願公開第0946736号、欧州特許出願公開第0732403号、欧州特許出願公開第0480480号、欧州特許出願公開第0460071号、欧州特許出願公開第0340986号、欧州特許出願公開第0329203号、欧州特許出願公開第0324274号、および欧州特許出願公開第0164556明細書を参照すればよい。また、Gellissen et al, ANTONIE VAN LEEUWENHOEK (1992) 62(1-2):79-93、Romanos et al, YEAST (1992) 8(6):423-488、Goeddel, METHODS IN ENZYMOLOGY (1990) 185:3-7を参照すればよい。
酵母宿主株は、当業者に周知である標準の給飼バッチ発酵方法(feed batch fermentation method)を用いて、増幅段階の間に発酵槽において増殖されてもよい。上記発酵方法は、特定の酵母宿主の炭素利用経路、または発現制御の様式の差異に起因して適合され得る。例えば、サッカロミセス酵母宿主の発酵は、1つのグルコース飼料、複合的な窒素源(カゼイン加水分解物など)、および複数のビタミン補助物を必要とし得る。これに対して、メチロトローフ酵母であるP. pastorisは、グリセロール、メタノール、および微量の無機化合物飼料を必要とし得、最適な増殖および発現については単純なアンモニウム(窒素)塩だけを必要とする。例えば、米国特許第5,324,639号、Elliott et al, J. PROTEIN CHEM. (1990) 9:95、およびFieschko et al, BIOTECH. BIOENG. (1987) 29:1113を参照すればよい。
しかし、上記発酵方法は、用いられる酵母宿主株とは無関係な特定の共通の特徴を有し得る。例えば、成長限界栄養素(通常は炭素)を発酵槽に増幅段階の間に添加して、最大限の成長を可能にし得る。さらに、発酵方法は、一般的に、十分な量の炭素、窒素、基本塩、リンおよび他の微量栄養素(ビタミン、微量無機物、および塩など)を含むように調製された発酵培地を用い得る。Pichiaを用いた使用に適切な発酵培地の例が、米国特許第5,324,639号、および米国特許第5,231,178号に記載されている。
(バキュロウイルス感染昆虫細胞)
“昆虫宿主”または“昆虫宿主細胞”という用語は、組換えベクターまたは他のトランスファーDNAの受容物として使用し得るか、または使用されている昆虫を指す。この用語は、トランスフェクトされた元々の昆虫宿主細胞の子孫を包含している。1つの親細胞の子孫が、形態において、またはゲノムDNAもしくは全DNAの補体において、偶発的な突然変異、もしくは計画的な突然変異に起因して、元々の親細胞と必ずしも完全に一致していなくてもよいことは理解される。関連する性質により特徴付けられる親細胞と十分に類似する親細胞の子孫は、この定義によって意図される子孫に含まれる。ここで、関連する性質は、例えば、fEPOポリペプチドをコードしているヌクレオチド配列の存在である。
fEPOの発現に好適な昆虫細胞の選択は当業者に周知である。いくつかの昆虫種は、当該分野において十分に説明されており、例えば、市販されているAedes aegypti、Bombyx mori、Drosophila melanogaster、Spodoptera frugiperda、およびTrichoplusia niが挙げられる。発現用の昆虫宿主の選択において、適切な宿主としては、特に、良好な分泌能、低いタンパク質分解活性、および総合的な強健さを有していることが示されている宿主が挙げられ得る。昆虫は、Insect Genetic Stock Center, Department of Biophysics and Medical Physics, University of California (Berkeley、CA)、およびthe American Type Culture Collection (“ATCC”) (Manassas、VA)を含む、種々の供給源から通常に入手することができるが、これらに限定されない。
一般的に、バキュロウイルス−感染昆虫の発現系の構成要素は、バキュロウイルスのゲノム断片、および発現される異種遺伝子の挿入に便利な制限酵素認識部位の両方を含んでいるトランスファーベクター(普通は細菌のプラスミド);当該トランスファーベクターにおけるバキュロウイルスに特異的な断片に対して、相同な配列を有している(これにより、バキュロウイルスゲノムに対する異種遺伝子の相同組換えが可能になる)野生型バキュロウイルス;ならびに適切な昆虫宿主細胞および増殖培地を含んでいる。ベクターの構築、細胞のトランスフェクション、プラークの選択、または培養における細胞の増殖などに用いられる材料、方法および技術は公知であり、これらの技術が記載されている手引書が利用可能である。
異種遺伝子をトランスファーベクターに挿入した後に、このベクターおよび野生型ウイルスゲノムを、ベクターとウイルスゲノムとが組換えを起こす昆虫宿主細胞にトランスフェクションする。パッケージングされた組換えウイルスが発現され、組換え体のプラークが同定および精製される。バキュロウイルス/昆虫細胞発現系にとっての材料および方法は、例えば、Invitrogen Corp(Carlsbad、CA)が提供している、キットの様式において市販されている。これらの技術は、一般的に当業者に公知であり、SUMMERS AND SMITH, TEXAS AGRICULTURAL EXPERIMENT STATION BULLETIN NO. 1555 (1987)に十分に記載されている。なお、この文献は、参照によって本明細書に援用される。また、RICHARDSON, 39 METHODS IN MOLECULAR BIOLOGY: BACULOVIRUS EXPRESSION PROTOCOLS (1995); AUSUBEL ET AL., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY 16.9-16.11 (1994); KING AND POSSEE, THE BACULOVIRUS SYSTEM: A LABORATORY GUIDE (1992); および O’REILLY ET AL., BACULOVIRUS EXPRESSION VECTORS: A LABORATORY MANUAL (1992)を参照すればよい。
バキュロウイルス/昆虫細胞発現系を用いた、種々の異種タンパク質の製造は、当業者にとって周知である。例えば、米国特許出願第6,368,825号、米国特許出願第6,342,216号、米国特許出願第6,338,846号、米国特許出願第6,261,805号、米国特許出願第6,245,528号、米国特許出願第6,225,060号、米国特許出願第6,183,987号、米国特許出願第6,168,932号、米国特許出願第6,126,944号、米国特許出願第6,096,304号、米国特許出願第6,013,433号、米国特許出願第5,965,393号、米国特許出願第5,939,285号、米国特許出願第5,891,676号、米国特許出願第5,871,986号、米国特許出願第5,861,279号、米国特許出願第5,858,368号、米国特許出願第5,843,733号、米国特許出願第5,762,939号、米国特許出願第5,753,220号、米国特許出願第5,605,827号、米国特許出願第5,583,023号、米国特許出願第5,571,709号、米国特許出願第5,516,657号、米国特許出願第5,290,686号、国際公開第02/06305号、国際公開第01/90390号、国際公開第01/27301号、国際公開第01/05956号、国際公開第00/55345号、国際公開第00/20032号、国際公開第99/51721号、国際公開第99/45130号、国際公開第99/31257号、国際公開第99/10515号、国際公開第99/09193号、国際公開第97/26332号、国際公開第96/29400号、国際公開第96/25496号、国際公開第96/06161号、国際公開第95/20672号、国際公開第93/03173号、国際公開第92/16619号、国際公開第92/03628号、国際公開第92/01801号、国際公開第90/14428号、国際公開第90/10078号、国際公開第90/02566号、国際公開第90/02186号、国際公開第90/01556号、国際公開第89/01038号、国際公開第89/01037号、国際公開第88/07082号を参照すればよい。
バキュロウイルス/昆虫細胞の発現系に有用なベクターは公知であり、例えば、バキュロウイルスのAutographacalifornica核多角体ウイルス(AcNPV)に由来する、ヘルパー非依存性のウイルス発現ベクターである昆虫の発現およびトランスファーベクターを包含する。この系に由来するウイルス発現ベクターは、一般的に、異種遺伝子の発現を誘導するために、ウイルスの強力なポリヘドリン遺伝子プロモータを使用する。一般的には、Reilly ET AL., BACULOVIRUS EXPRESSION VECTORS:A LABORATORY MANUAL(1992)を参照すればよい。
外来の遺伝子をバキュロウイルスのゲノムに挿入する前に、上記構成要素(プロモータ、リーダー(必要に応じて)、目的のコード配列、および転写終結配列を含んでいる)は、集合して中間トランス配置コンストラクト(intermediate transplacement construct)(トランスファーベクター)を構築する。中間トランス配列コンストラクトはレプリコンにしばしば維持される。このレプリコンは、例えば、細菌などの宿主において安定な維持が可能な染色体外エレメント(例えば、プラスミド)といったものである。レプリコンは複製系を有しており、このため、クローニングおよび増幅に適切な宿主における当該レプリコンの維持を可能にする。より具体的には、プラスミドは、ポリヘドリンポリアデニル化シグナル(Miller et al., ANN. REV. MICROBIOL. (1988) 42:177)およびE. coliにおける選択および増殖に関する、原核生物のアンピシリン耐性(amp)遺伝子と複製開始点とを含み得る。
AcNPVへ外来遺伝子を導入するために一般的に使用されるトランスファーベクターの1つは、pAc373である。当業者に公知である他の多くのベクターもまた設計されており、例えば、これらとしてはpVL985が挙げられる。このベクターでは、ポリヘドリン開始コドンがATGからATTに変えられ、ATTの下流の32塩基対にBamHIクローニング部位が導入されている(Luckow and Summers, 17 VIROLOGY 31 (1989)を参照すればよい)。他の市販されているベクターとしては、例えば、PBlueBac4.5/V5−His、pBlueBacHis2、pMelBac、pBlueBac4.5(Invitrogen Corp、Carlsbad、CA)が挙げられる。
異種遺伝子を挿入した後に、トランスファーベクターおよび野生型バキュロウイルスのゲノムを、昆虫細胞宿主に同時トランスフェクションする。異種DNAをバキュロウイルスの所望の部位に導入するための方法は公知である。SUMMERS AND SMITH, TEXAS AGRICULTURAL EXPERIMENT STATION BULLETIN NO. 1555 (1987); Smith et al., MOL. CELL. BIOL. (1983) 3:2156; Luckow and Summers, VIROLOGY (1989) 17:31を参照すればよい。例えば、二重交差型相同組換えによって、ポリへドリン遺伝子などの遺伝子に挿入し得る。また、所望のバキュロウイルス遺伝子中に設けられた、制限酵素認識部位に挿入してもよい。Miller et al., BIOESSAYS (1989) 4:91を参照すればよい。
トランスフェクションを、エレクトロポレーションによって実現し得る。TROTTER AND WOOD, 39 METHODS IN MOLECULAR BIOLOGY (1995)、Mann and King, J. GEN. VIROL. (1989) 70:3501を参照すればよい。代替可能に、リポソームを使用して、組換え発現ベクターとバキュロウイルスとを用いて昆虫細胞をトランスフェクションし得る。例えば、Liebman et al., BIOTECHNIQUES (1999) 26(1):36、Graves et al, BIOCHEMISTRY (1998) 37:6050、Nomura et al, J. BIOL. CHEM. (1998) 273(22): 13570、Schmidt et al, PROTEIN EXPRESSION AND PURIFICATION (1998) 12:323、Siffert et al, NATURE GENETICS (1998) 18:45、TILKINS et al, CELL BIOLOGY: A LABORATORY HANDBOOK 145-154 (1998) 、Cai et al, PROTEIN EXPRESSION AND PURIFICATION (1997) 10:263、Dolphin et al, NATURE GENETICS (1997) 17:491、Kost et al, GENE (1997) 190:139、Jakobsson et al, J. BlOL. CHEM. (1996) 271:22203、Rowles et al, J. BIOL. CHEM. (1996) 271(37): 22376、Reversey et al, J. BIOL. CHEM. (1996) 271(39) :23607- 10、Stanley et al, J. BlOL. CHEM. (1995) 270:4121、Sisk et al, J. VlROL. (1994) 68(2):766、およびPeng et al, BIOTECHNIQUES (1993) 14.2:274を参照すればよい。市販されているリポソームとしては、例えば、Cellfectin(登録商標)、およびLipofectin(登録商標)(Invitrogen Corp、Carlsbad、CA)が挙げられる。また、リン酸カルシウムトランスフェクションを用いてもよい。TROTTER AND WOOD, 39 METHODS IN MOLECULAR BIOLOGY (1995)、Kitts, NAR (1990) 18(19):5667、およびMann and King, J. GEN. VIROL. (1989) 70:3501を参照すればよい。
バキュロウイルス発現ベクターは、バキュロウイルスプロモータを一般的に含んでいる。バキュロウイルスプロモータは、バキュロウイルスのRNAポリメラーゼが結合でき、mRNAにおけるコード配列(例えば、構造遺伝子)の下流(3’)への転写開始する任意のDNA配列である。プロモータは、コード配列の5’末端近傍に配置される転写開始領域を一般的に有している。この転写開始領域は、RNAポリメラーゼ結合部位および転写開始部位を一般的に含んでいる。また、バキュロウイルスのプロモータは、エンハンサーと呼ばれる2次ドメインを有し得る。この2次ドメインは、存在する場合、構造遺伝子から遠位に存在し得る。また、発現は、調節され得るか、または恒常的であり得る。
感染サイクルの後期に多量に転写される構造遺伝子は、特に有用なプロモータ配列を提供する。有用なプロモータ配列の例としては、ウイルスポリヘドリンタンパク質をコードする遺伝子由来の配列(FRIESEN ET AL., The Regulation of Baculovirus Gene Expression in THE MOLECULAR BIOLOGY OF BACULOVIRUSES (1986)、欧州特許出願公開第0127839号、および欧州特許出願公開第0155476号)、およびp10タンパク質をコードする遺伝子由来の配列(Vlak et al., J. GEN. VIROL. (1988) 69:765)が挙げられる。
新しく形成されたバキュロウイルス発現ベクターは、感染性の組換えバキュロウイルスにパッケージングされる。その後、成長したプラークは当業者に公知の方法により精製され得る。Miller et al, BIOESSAYS (1989) 4:91、SUMMERS AND SMITH, TEXAS AGRICULTURAL EXPERIMENT STATION BULLETIN NO. 1555 (1987)を参照すればよい。
組換えバキュロウイルス発現ベクターは、いくつかの昆虫細胞へ感染させるために開発されている。例えば、とりわけAedea aegypti(ATCC番号CCL−125)、Bombyx mori(ATCC番号CRL−8910)、Drosophila melanogaster(ATCC番号1963)、Spodoptera frugiperdaおよびTrichoplusia niのための組換えバキュロウイルスが開発されている。国際公開第89/046,699号、Wright, NATURE (1986) 321:718、Carbonell et al, J. VlROL. (1985) 56:153、Smith et al, MOL. CELL. BIOL. (1983) 3:2156を参照すればよい。一般的には、Fraser et al, IN VITRO CELL. DEV. BIOL (1989) 25:225を参照すればよい。より具体的には、バキュロウイルス発現ベクターの系に用いられる細胞株としては、通常、Sf9(Spodoptera frugiperda(ATCC番号CRL−1711)、Sf21(Spodoptera frugiperda)(Invitrogen Corp、カタログ番号11497−013(Carlsbad、CA))、Tri−368(Trichoplusia ni)、およびHigh-Five(登録商標)、BTI−TN−5B1−4(Trichoplusia ni)が挙げられるが、これらに限定されない。
バキュロウイルス/発現における異種ポリペプチドの直接発現および融合発現の両方にとっての細胞および培地は、市販されている。また、細胞培養技術は当業者に公知である。
(E. Coli)
細菌における発現技術は当業者に周知である。多種多様なベクターが細菌宿主における使用に利用可能である。これらのベクターは、1コピーベクター、またはコピー数が少ない多コピー型ベクター(low multicopy vectors)もしくはコピー数が多い多コピー型ベクター(high multicopy vectors)であり得る。ベクターはクローニングおよび/または発現に役立ち得る。ベクターに関する豊富な文献、多くの市販のベクター、ならびにベクター、その制限酵素地図およびその特徴について記載している手引書を考慮すれば、本明細書ではこれ以上論じる必要がない。よく知られているように、ベクターは、通常は選択を可能にするマーカーを含んでいる。このマーカーは、細胞毒性剤への耐性、原栄養性、または免疫を提供し得るものである。しばしば、異なる特徴を提供する複数のマーカーが存在する。
細菌プロモータは、細菌のRNAポリメラーゼと結合可能であり、mRNAのコード配列(例えば、構造遺伝子)を下流(3”)へ転写開始できる任意のDNA配列である。プロモータは、コード配列の5’末端近傍に通常、配置される転写開始領域を有している。この転写開始領域は、RNAポリメラーゼ結合部位および転写開始部位を典型的に含んでいる。また、細菌プロモータは、オペレータと呼ばれる2次ドメインを有し得る。この2次ドメインは、RNA合成が始まる隣接したRNAポリメラーゼ結合部位と重複し得る。遺伝子リプレッサータンパク質がオペレータに結合することによって、特定の遺伝子の転写を阻害し得るように、オペレータは負に調節される(誘導性の)転写を可能にする。恒常的発現は、負の調節エレメント(オペレータなど)がないときに起こり得る。さらに、正の調節が、遺伝子アクチベータタンパク質の結合配列によってもたらされ得る。該結合配列は、存在する場合、通常、RNAポリメラーゼ結合配列よりも遠位(5’)に存在する。遺伝子アクチベータタンパク質としては、例えば、カタボライト活性化タンパク質(CAP)が挙げられる。このCAPは、Escherichia coli(E. coli)のlacオペロンの転写開始を助ける(Raibaud et al, ANNU. REV. GENET. (1984) 18:173)。したがって、調節された発現は、正または負のいずれかであり得、これによって転写を増強または低減させ得る。
代謝経路の酵素をコードしている配列は、特に有用なプロモータ配列を提供する。このプロモータ配列としては、例えば、ガラクトース、ラクトース(lac)(Chang et al, NATURE (1977) 198:1056)、およびマルトースなどの糖代謝酵素に由来するプロモータ配列が挙げられる。さらなる例としては、トリプトファン(trp)などの生合成酵素に由来するプロモータ配列が挙げられる(Goeddel et al, Nuc. ACIDS RES. (1980) 8:4057、Yelverton et al, NUCL. ACIDS RES. (1981) 9:731、米国特許第4,738,921号、欧州公開第036776号、欧州公開第121775号)。また、β−ガラクトシダーゼ(bla)のプロモータ系(Weissmann (1981) “The cloning of interferon and other mistakes.” In Interferon 3 (Ed. I. Gresser))、バクテリオファージ ラムダのPL(Shimatake et al, NATURE (1981) 292:128)、およびT5(米国特許第4,689,406号)のプロモータ系も、有用なプロモータ配列を提供する。本発明の好ましい方法は、fEPOを高レベルに誘導するためのT7プロモータなどの強力なプロモータを利用する。そのようなベクターの例は、当業者に周知であり、pET29のシリーズ(Novagen)、および国際公開第99/05297号に記載のpPOPベクターなどが挙げられる。そのような発現系は、宿主細胞の生存能力または増殖パラメータに支障をきたすことなく、宿主において、fEPOを高レベルに産生する。
また、天然に存在しない合成プロモータも、細菌プロモータとして機能する。例えば、ある細菌またはバクテリオファージのプロモータの転写活性化配列を、別の細菌またはバクテリオファージのプロモータのオペロン配列に結合して、合成混成プロモータを作製し得る(米国特許第4,551,433号)。例えば、tacプロモータは、trpプロモータ配列、およびlacリプレッサーによって調節されるlacオペロン配列を含んでいる混成のtrp−lacプロモータである(Amann et al, GENE (1983) 25:167、de Boer et al, PROC. NATL. ACAD. SCI. (1983) 80:21)。さらに、細菌プロモータは、細菌のRNAポリメラーゼとの結合能、および転写開始能を有している非細菌起源の天然に存在しているプロモータを含み得る。また、非細菌起源の天然に存在しているプロモータを、適合するRNAポリメラーゼに結合させることによって、原核生物においていくつかの遺伝子を高レベルに発現させ得る。バクテリオファージのT7RNAポリメラーゼ/プロモータ系は、共役型プロモータ系の例である(Studier et al, J. MOL. BIOL. (1986) 189:113、Tabor et al, Proc Natl. Acad. Sci. (1985) 82:1074)。さらに、混成プロモータは、バクテリオファージプロモータ、およびE. coliのオペレータ領域を含み得る(欧州公開第267851号)。
また、機能性プロモータ配列に加えて、効率的なリボソーム結合部位が、外来遺伝子を原核細胞において発現させるために有効である。E. coliにおいて、リボソーム結合部位は、シャイン−ダルガルノ(SD)配列と呼ばれ、開始コドン(ATG)、および該開始コドンから3〜11ヌクレオチド上流に位置している3〜9の長さのヌクレオチドの配列を含んでいる(Shine et al, NATURE (1975) 254:34)。SD配列は、SD配列とE. coliの16S rRNAの3’との間において塩基対を形成することによって、mRNAとリボソームとの結合を促進すると考えられている(Steitz et al “Genetic signals and nucleotide sequences in messenger RNA”, In Biological Regulation and Development: Gene Expression (Ed. R. F. Goldberger, 1979))。真核生物の遺伝子および原核生物の遺伝子を、弱いリボソーム結合部位によって発現すること(Sambrook et al Expression of cloned genes in Escherichia coli, Molecular Cloning: A Laboratory Manual, 1989)。
“細菌宿主”または“細菌宿主細胞”という用語は、組換えベクターまたは他のトランスファーDNAにとっての受容物として使用され得るか、または使用されている細菌のことを指す。この用語は、トランスフェクションされている元々の細菌宿主細胞の子孫を包含している。1つの親細胞の子孫が、形態、ゲノムDNAまたは全DNAの補体において、偶発的な突然変異、または計画的な突然変異に起因して、元々の親細胞と必ずしも完全に一致していなくてもよいことは理解される。関連する性質(例えば、fEPOをコードするヌクレオチド配列の存在)により特徴付けられる親細胞と十分に類似する親細胞の子孫は、この定義によって意図される子孫に含まれる。
fEPOの発現に適切な細菌宿主の選択は当業者に周知である。発現のための細菌宿主の選択において、適切な宿主としては、とりわけ良好な封入体形成能、低いタンパク質分解活性、および全体的に強健さを有していることが示されている宿主が挙げられ得る。細菌宿主は、一般的に種々の供給源から入手することができ、例えば、Bacterial Genetic Stock Center, Department of Biophysics and Medical Physics, University of California (Berkeley、CA)、およびthe American Type Culture Collection (“ATCC”) (Manassas、VA)から入手することができるが、これらに限定されない。K株に由来する細菌(W3110など)、またはB株に由来する細菌(BL21など)が、一般的に産業的/製薬的な発酵に用いられる。これらの株は、増殖パラメータが極めてよく知られており、強健であるから特に有用である。さらに、これらの株は非病原性であり、このことは安全性および環境的理由にとって工業的に重要である。本発明の方法の一実施形態においてE. coli宿主はBL21株である。本発明の方法の別の一実施形態において、E. coli宿主は、プロテアーゼが欠失した株(OMP−、およびLON−が挙げられるが、これらに限定されない)である。
組換え宿主細胞株が、確立されれば(すなわち、発現コンストラクトが、宿主細胞に導入され、適切な発現コンストラクトを有する宿主細胞が単離されれば)、当該組換え宿主細胞株がfEPOの産生に適切な条件下において培養される。当業者にとって明らかなように、組換え宿主細胞株の培養方法は、利用される発現コンストラクトの性質、および宿主細胞の個性に依存する。組換え宿主株は、一般に、当業者に周知の方法を用いて培養される。組換え宿主細胞は、通常、炭素、窒素および無機塩の吸収可能な供給源を含んでおり、任意にビタミン、アミノ酸、増殖因子、および当業者にとって周知の他のタンパク質性の培養補助物を含んでいる液体培養基において一般的に培養される。また、宿主細胞を培養するための液体培養基は、所望されない微生物および/または化合物の増殖を阻害するための抗生物質、または抗真菌剤(発現ベクターを含んでいる宿主細胞を選択するための抗生物質が挙げられるが、これに限定されない)を任意に含み得る。
組換え宿主細胞は、バッチ式もしくは連続式のいずれかにおいて、細胞の回収(fEPOが細胞内に蓄積する場合に)、または培養上清の回収のいずれかを伴う、バッチ式または連続式において培養され得る。原核生物の宿主細胞における産生にとって、バッチ式培養および細胞収集が好ましい。
本発明のfEPOは、組換え系における発現の後に、普通、精製される。fEPOは、当該技術分野において公知の種々の方法によって宿主細胞から精製され得る。通常、細菌宿主細胞において産生されたfEPOは、(封入体の形態において)溶解性に乏しいか、または不溶性であり得る。本発明の一実施形態では、当該技術において公知の方法だけでなく、本明細書に記載された方法を利用して、組換えによって産生されるタンパク質の溶解性の向上を目的として選択されたアミノ酸の置換が、fEPOポリペプチドにおいて容易に行われ得る。不溶性のタンパク質の場合、このタンパク質は、宿主細胞溶解液から遠心分離によって回収され得、次いで細胞のホモジナイゼーション(homogenization)がさらに行われ得る。溶解性に乏しいタンパク質の場合、化合物(ポリエチレンイミン(PEI)が挙げられるが、これに限定されない)が、部分的に可溶性のタンパク質の沈殿を引き起こすために加えられ得る。その後、沈殿したタンパク質は、遠心分離によって首尾よく回収され得る。当業者にとって周知の種々の方法により、組換え宿主細胞が破壊またはホモジナイズされて、当該細胞内から封入体が放出され得る。宿主細胞の破壊またはホモジナイゼーションは周知の技術(酵素的な細胞の破壊、超音波処理、ダウンス型ホモジナイゼーション(dounce homogenization)、または高圧放出破壊が挙げられるが、これらに限定されない)を用いて実施され得る。本発明の方法の一実施形態では、高圧放出技術をE. coli宿主細胞の破壊に使用することによって、fEPOの封入体を放出させる。E. Coli宿主細胞をホモジナイザー内に一回だけ通過させることによって、封入体の形態内における不溶性のfEPOの収量を増加させ得ることが分かっている。fEPOの封入体を取り扱うときに、繰り返しのホモジナイゼーション時間を最小化することが好都合であり得る。これによって、可溶化、器械的なせん断またはタンパク質分解などの要因による損失を無くし、封入体の収量が最大になる。
次いで、不溶性のfEPOまたは沈殿したfEPOは、当該技術にとって公知の適切な多くの可溶化試薬のいずれかを用いて可溶化され得る。fEPOは尿素またはグアジニン塩酸塩を用いて好ましく可溶化され得る。バッチの大きさが都合よく扱いやすいものを用いて、大規模なバッチが産生され得るように、可溶化されたfEPO−BPの容積は最小化されるべきである。組換え宿主細胞が数千リットルの容積であるバッチにおいて増殖され得るとき、この要因は大規模な工業的設定において重要であり得る。また、特にヒトへの薬学的な使用のために大規模な工業的設定においてfEPOを製造するとき、機械および容器、またはタンパク質産物自体のいずれかを損傷するおそれのある過酷な化学物質の回避は、可能であれば、避けられるべきである。過酷な変性試薬であるグアニジン塩酸塩の代わりに、穏やかな変性試薬である尿素をfEPOの封入体の可溶化に使用し得ることが、本発明の方法に示されている。尿素の使用は、fEPOの製造過程および精製過程に利用されるステンレス鋼の設備に対する損傷の危険度を顕著に低減すると同時に、fEPOの封入体を効率的に可溶化する。
fEPOが融合タンパク質として産生されるとき、融合配列は除去することが好ましい。融合配列の除去は、酵素的切断または化学的切断によって、好ましくは酵素的切断によって果たされ得る。融合配列の酵素的除去は当業者に周知の方法を用いて果たされ得る。当業者にとって明らかなように、融合配列を除去するための酵素の選択は融合の個性によって決定され、反応条件は酵素の選択によって特定される。化学的切断は、当業者に公知の試薬(臭化シアン、TEVプロテアーゼ、および他の試薬が挙げられるが、これらに限定されない)によって果たされ得る。切断されたfEPOは、当業者に周知の方法によって、切断された融合配列から精製されることが好ましい。そのような方法は、当業者にとって明らかなように、融合配列およびfEPOの個性および性質によって決定される。精製方法としては、サイズ排除クロマトグラフィー、疎水性相互作用クロマトグラフィー、イオン交換クロマトグラフィー、もしくは透析、またはこれらの任意の組合せが挙げられ得るが、これらに限定されない。
また、fEPOは、タンパク質の溶液からDNAを除去するために、精製されることが好ましい。DNAは、当業者に公知の任意の適切な方法(例えば、沈殿またはイオン交換クロマトグラフィー)によって除去され得るが、核酸沈殿試薬(例えば、硫酸プロタミンが挙げられるが、これに限定されない)を用いた沈殿によって除去することが好ましい。fEPOは、標準的な周知の方法(遠心分離またはろ過が挙げられるが、これらに限定されない)を用いて、沈殿されたDNAから分離され得る。fEPOがヒトの治療に用いられる設定、および本発明の方法が薬学的に許容可能なレベルまで宿主細胞のDNAを低減する設定において、宿主核酸分子の除去は重要な要因である。
また、小規模または大規模な発酵方法は、タンパク質の発現(発酵槽、振とうフラスコ、流動床バイオリアクター、中空糸バイオリアクター、ローラーボトル培養系、および攪拌タンクバイオリアクター系が挙げられるが、これらに限定されない)に使用され得る。これらの方法のそれぞれは、バッチ処理、給飼バッチ処理、連続様式処理において実施され得る。
本発明のネコ科のEPOポリペプチドは、通常、当該分野における標準的な方法を用いて回収され得る。例えば、培地または細胞溶解液は、細胞破片を除去するために遠心分離またはろ過され得る。上清は、濃縮され得るか、所望の容積に希釈され得るか、またはさらなる精製のために調製物の状態を整える適切な緩衝液へ透析され得る。本発明のfEPOのさらなる精製としては、脱アミド化され、短縮された形態のfEPOバリアントを、損なわれていない形態(intact form)のfEPOから分離することが挙げられる。
以下の例示的な手法のいずれかが、本発明のfEPOポリペプチドの精製に採用され得る。当該手法は、アフィニティークロマトグラフィー;陰イオン交換クロマトグラフィーもしくは陽イオン交換クロマトグラフィー(DEAE SEPHAROSEを用いたものが挙げられるが、これに限定されない);シリカ上におけるクロマトグラフィー;逆相HPLC;ゲルろ過(SEPHADEX G-75を用いたものが挙げられるが、これに限定されない);疎水性相互作用クロマトグラフィー;サイズ排除クロマトグラフィー;金属キレートクロマトグラフィー;限外ろ過/ダイアフィルトレーション;エタノール沈殿;硫酸アンモニウム沈殿;等電点電気泳動(chromatofocusing);置換クロマトグラフィー;電気泳動的手法(分離用の等電点電気泳動(preparative isoelectric focusing)が挙げられるが、これに限定されない)、差別的溶解性(differential solubility)(硫酸アンモニウム沈殿が挙げられるが、これに限定されない)、SDS−PAGEまたは抽出である。
本発明のタンパク質(非天然アミノ酸を含んでいるタンパク質、非天然アミノ酸を含んでいるタンパク質に対する抗体、非天然アミノ酸を含んでいるタンパク質に対する結合パートナーなどが挙げられるが、これらに限定されない)は、当業者が知っており、使用する標準的な手法にしたがって、部分的または実質的に均質に精製される。したがって、本発明のポリペプチドは、当業者に周知の任意の多くの方法(硫酸アンモニウム沈殿もしくはエタノール沈殿、酸抽出もしくは塩基抽出、カラムクロマトグラフィー、アフィニティーカラムクロマトグラフィー、陰イオン交換クロマトグラフィーもしくは陽イオン交換クロマトグラフィー、ホスホセルロースクロマトグラフィー、疎水性相互作用クロマトグラフィー、ヒドロキシルアパタイトクロマトグラフィー、レクチンクロマトグラフィー、およびゲル電気泳動などが挙げられるが、これらに限定されない)によって、回収および精製され得る。タンパク質をリフォールディング(refolding)する工程は、必要に応じて、正確に折りたたまれた成熟タンパク質を作製するときに使用され得る。高速液体クロマトグラフィー(HPLC)、アフィニティークロマトグラフィー、または他の適切な方法は、高い純度が所望される場合に、最終的な精製工程において採用され得る。一実施形態において、非天然アミノ酸(または非天然アミノ酸を含んでいるタンパク質)に対して作製された抗体は、1つ以上の非天然アミノ酸を含んでいるタンパク質の親和性に基づく精製などのための精製試薬として使用され得るが、これに限定されない。必要に応じて、部分的にまたは均質にまで精製されると、ポリペプチドは、多種多様な有用物(例えば、アッセイの構成要素、治療学、予防法、診断学、研究試薬として、および/または抗体生成用の抗原としてであるが、これらに限定されない)に関して、任意に使用される。
本明細書に言及されている他の参考文献に加えて、種々の精製/タンパク質フォールディング方法が、当業者に周知である(R. Scopes, Protein Purification, Springer-Verlag, N.Y. (1982); Deutscher, Methods in Enzymology Vol. 182: Guide to Protein Purification, Academic Press, Inc. N.Y. (1990); Sandana, (1997) Bioseparation of Proteins, Academic Press, Inc.; Bollag et al. (1996) Protein Methods, 2nd Edition Wiley-Liss, NY; Walker, (1996) The Protein Protocols Handbook Humana Press, NJ, Harris and Angal, (1990) Protein Purification Applications: A Practical Approach IRL Press at Oxford, Oxford, England; Harris and Angal, Protein Purification Methods: A Practical Approach IRL Press at Oxford, Oxford, England; Scopes, (1993) Protein Purification: Principles and Practice 3rd Edition Springer Verlag, NY; Janson and Ryden, (1998) Protein Purification: Principles, High Resolution Methods and Applications, Second Edition Wiley-VCH, NY; and Walker (1998), Protein Protocols on CD-ROM Humana Press, NJならびにこれらに引用されている参考文献に記載されている方法が挙げられるが、これらに限定されない)。
真核生物の宿主細胞または非真核生物の宿主細胞において、非天然アミノ酸を用いて目的のタンパク質またはポリペプチドを産生することの1つの利点は、通常、当該タンパク質またはポリペプチドが、それらの本来の立体構造に折りたたまれることである。しかし、本発明のある特定の実施形態において、当業者は、合成、発現および/または精製の後に、タンパク質が、関連するポリペプチドの所望の立体構造とは異なる立体構造を有することが可能であることを認識している。本発明の1つの局面において、発現されたタンパク質は、任意に変性され、次いで復元される。これは、当該分野において公知の方法を利用して(目的のタンパク質またはポリペプチドに対するシャペロニンの添加によってか、カオトロピック剤(例えば、グアニジンHCl)にタンパク質を可溶化することによってか、またはプロテインジスルフィドイソメラーゼを用いてなどが挙げられるが、これらに限定されない)なされ得る。
一般的には、発現したポリペプチドを変性または還元して、その後に当該ポリペプチドを好ましい立体構造へとリフォールディングさせることが望ましいことがある。例えば、グアニジン、尿素、DTT、DTEおよび/またはシャペロニンは、目的の転写産物に加えられ得る。タンパク質の還元、変性および復元の方法は、当業者に周知である(上記参考文献、Debinski,et al, (1993) J. Biol. Chem., 268: 14065- 14070)、Kreitman and Pastan (1993) Bioconiug. Chem.. 4: 581-585、およびBuchner,et al, (1992) Anal. Biochem., 205: 263-270を参照すればよい)。Debinski, et alには、例えばグアニジン−DTEにおける封入体タンパク質の変性および還元が記載されている。タンパク質は、レドックス緩衝剤(これらに限定されないが、酸化型グルタチオンおよびL−アルギニンなどを含有している)においてリフォールディングされ得る。リフォールディング剤は、流されるか、またはそうでなければ、移動されて、1つ以上のポリペプチドもしくは他の発現産物と接触させられ得る。また、その逆もあり得る。
fEPOを原核生物において産生する場合、そのように産生されるfEPOは、誤って折りたたまれることがある。このため、ポリペプチドの生物活性が欠如または低下していることがあり得る。タンパク質の生物活性は“リフォールディング”によって回復され得る。一般に、誤って折りたたまれたfEPOは、例えば、1つ以上のカオトロピック剤(例えば、尿素および/またはグアニジン)およびジスルフィド結合を還元可能な還元剤(例えば、ジチオスレイトール(DTT)、または2メルカプトエタノール(2−ME))を用いて、(fEPOも不溶性である場合に)ポリペプチド鎖を可溶化し、アンフォールディング(unfolding)し、そして還元することによってリフォールディングされ得る。次いで、穏やかな濃度のカオトロープ(chaotorope)において、ジスルフィド結合の再形成を可能にする酸化剤(例えば、酸素、シスチンまたはシスタミン)が添加される。fEPOは、当該分野において公知の標準的な方法(例えば、米国特許第4,511,502号、米国特許第4,511,503号、および米国特許第4,512,922号に記載の方法)を用いてリフォールディングされ得る。また、fEPOは、他のタンパク質とコフォールディングされて、異種二量体または異種多量体を形成し得る。リフォールディングまたはコフォールディングの後に、fEPOがさらに精製されることが好ましい。
(一般的な精製方法)
種々の単離工程のいずれか1つが、fEPOを含んでいる細胞溶解物、または任意の単離工程から生じた任意のfEPOの混合物に対して実施され得る。このような単離工程としては、アフィニティークロマトグラフィー、イオン交換クロマトグラフィー、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、高速液体クロマトグラフィー(“HPLC”)、逆相HPLC(“PR−HPLC”)、発泡床吸着(expanded bed adsorption)、あるいはそれらの任意の組合せおよび/または繰り返し、ならびに任意の適切な順序でのそれらの任意の組合せおよび/または繰り返しが挙げられるが、これらに限定されない。
本明細書に記載されている技術の実施に使用される設備、および他の必要な材料は、市販されている。ポンプ、フラクションコレクター、モニター、記録器、および全体のシステムは、例えば、Applied Biosystems(Foster City、CA)、BioRad Laboratories, Inc.(Hercules、CA)、およびAmersham Biosciences Inc.(Piscataway、NJ)から入手することができる。また、クロマトグラフィーの材料(交換基質材料、溶剤および緩衝液が挙げられるが、これらに限定されない)も、そのような企業から入手可能である。
本明細書に記載のカラムクロマトグラフィー手法における平衡および他の工程(例えば洗浄および溶出)は、特殊な設備(例えばポンプ)を用いてより迅速に実施され得る。市販のポンプとしては、HILOAD(登録商標) Pump P-50、ペリスタルティックポンプ(Peristaltic Pump)、ポンプP−901、およびポンプP−903(Amersham Biosciences Inc.、Piscataway、NJ)が挙げられるが、これらに限定されない。
フラクションコレクターの例としては、REDIFRACフラクションコレクターFraction Collector、FRAC−100およびFRAC−200フラクションコレクター、ならびにSUPERFRAC(登録商標)フラクションコレクター(Amersham Biosciences Inc.、Piscataway、NJ)が挙げられるが、これらに限定されない。また、混合器は、pH勾配および直線的な濃度勾配の形成に利用可能である。市販の混合器としては、グラジエントミキサー(Gradient Mixer)GM−1およびイン−ラインミキサーズ(In-Line Mixers)(Amersham Biosciences Inc.、Piscataway、NJ)が挙げられる。
クロマトグラフィー過程は、任意の市販のモニターを用いて観察され得る。そのようなモニターは、UV、pHおよび導電率のような情報の収集に使用され得る。検出器の例としては、モニター(Monitor)UV−1、UVICORD(登録商標)SII、モニターUV−MII、モニターUV−900、モニターUPC−900、モニターpH/C−900、およびコンダクティヴィティーモニター(Conductivity Monitor)(Amersham Biosciences、Piscataway、NJ)が挙げられる。実際に、全体のシステムは、市販されている(例えば、Amersham Biosciences Inc.(Piscataway、NJ))から提供されているAKTA(登録商標)システムズが挙げられる)。
本発明の一実施形態において、例えば、fEPOは、得られた精製されたfEPOを、尿素を用いてまず変性によって還元し変性して、続いて適切なpHにおいて還元剤(例えばDTT)を含んでいる緩衝液に希釈され得る。他の実施形態において、fEPOは、約2M〜約9Mの濃度の尿素によって変性され、続いて約5.0〜約8.0のpHのTRIS緩衝液に希釈される。次いで、この実施形態のリフォールディング混合物はインキュベートされ得る。一実施形態において、リフォールディング混合物は、室温において4〜24時間にわたってインキュベートされる。還元されかつ変性されたfEPO混合物は、それからさらに単離され得るか、または精製され得る。本明細書に述べられているように、第1のfEPO混合物のpHは、その後の任意の単離工程を実施する前に調整され得る。また、第1のfEPO混合物、またはその後に生じた任意の混合物は、当該分野において公知の技術を用いて濃縮され得る。さらに、第1のfEPO混合物、またはその後に生じた任意の混合物のいずれかを含む溶出緩衝液は、当業者に周知の技術を用いて、次の単離工程に好適な緩衝液に交換され得る。
(イオン交換クロマトグラフィー)
一実施形態において、そして必要に応じてさらなる工程として、イオン交換クロマトグラフィーが、第1のfEPO混合物に対して実施され得る。一般的に、ION EXCHANGE CHROMATOGRAPHY: PRINCIPLES AND METHODS(カタログ番号18−1114−21、Amersham Biosciences Inc.(Piscataway、NJ))を参照すればよい。市販のイオン交換カラムとしては、HITRAP(登録商標)カラム、HIPREP(登録商標)カラム、およびHILOAD(登録商標)カラム(Amersham Biosciences Inc.、Piscataway、NJ)が挙げられる。そのようなカラムは、強い陰イオン交換体(例えば、Q SEPHAROSE(登録商標) Fast Flow)、Q SEPHAROSE(登録商標) High Performance、およびQ SEPHAROSE(登録商標)XL);強い陽イオン交換体(例えば、SP SEPHAROSE(登録商標) High Performance、SP SEPHAROSE(登録商標) Fast Flow、およびSP SEPHAROSE(登録商標)XL);弱い陰イオン交換体(例えば、DEAE SEPHAROSE(登録商標) Fast Flow);および弱い陽イオン交換体(例えば、CM SEPHAROSE(登録商標) Fast Flow)(Amersham Biosciences Inc.、Piscataway、NJ)を利用している。陽イオン交換カラムクロマトグラフィーは、実質的に精製されたfEPOを単離するために、精製過程の任意の工程において、fEPOに対して実施され得る。陽イオン交換クロマトグラフィー工程は、任意の適切な陽イオン交換基質を用いて実施され得る。有用な陽イオン交換基質としては、繊維状の陽イオン交換基質材料、多孔質の陽イオン交換基質材料、非多孔質の陽イオン交換基質材料、微粒子状の陽イオン交換基質材料、ビーズ状の陽イオン交換基質材料、または架橋された陽イオン交換基質材料が挙げられるが、これらに限定されない。このような陽イオン交換基質材料としては、セルロース、アガロース、デキストラン、ポリアクリレート、ポリビニル、ポリスチレン、シリカ、ポリエーテル、または上述のものの何れかの混合材料が挙げられるが、これらに限定されない。陽イオン交換基質へのfEPOの吸着に続いて、十分に精製したfEPOは、十分に低いpHまたはイオン強度を有する緩衝液と当該基質を接触させることによって溶出されて、基質からfEPOを除去し得る。十分に精製されたfEPOの高pHの溶出に使用するために好適な緩衝液としては、少なくとも約5mMから少なくとも約100mMの濃度範囲にあるクエン酸塩、リン酸塩、蟻酸塩、酢酸塩、HEPES、およびMESの緩衝液が挙げられるが、これらに限定されない。
(逆相クロマトグラフィー)
RP−HPLCは、当業者に公知の適切なプロトコールにしたがって、タンパク質を精製するために実施され得る。例えば、Pearson et al, ANAL BIOCHEM. (1982) 124:217-230 (1982)、Rivier et al, J. CHROM. (1983) 268:112-119、Kunitani et al, J. CHROM. (1986) 359:391-402を参照すればよい。RP−HPLCをfEPOに対して実施して、実質的に精製されたfEPOを単離し得る。この点に関して、多種多様な長さ(少なくともC3〜少なくともC30、少なくともC3〜少なくともC20、または少なくともC3〜少なくともC18の長さが挙げられるが、これらに限定されない)を有しているアルキル官能基を用いた、シリカ誘導体化樹脂が使用され得る。代替可能に、重合体化樹脂が使用され得る。例えば、スチレン重合体樹脂である、トソハースアンバークローム(TosoHaas Amberchrome)CG1000sd樹脂が使用され得る。また、多種多様な長さのアルキル鎖を有するシアノ樹脂または重合体樹脂が使用され得る。さらに、RP−HPLCカラムは、溶媒(例えば、エタノール)を用いて洗浄され得る。イオン対を形成する剤および有機修飾因子(例えば、メタノール、イソプロパノール、テトラヒドロフラン、アセトニトリル、またはエタノール)を含んでいる適切な溶出緩衝液が、fEPOをPR−HPLCカラムから溶出するために使用され得る。最も一般的に使用されるイオン対を形成する剤としては、酢酸、蟻酸、過塩素酸、リン酸、トリフルオロ酢酸、ヘプタフルオロブチル酸、トリエチルアミン、テトラメチルアンモニウム、テトラブチルアンモニウム、酢酸トリエチルアンモニウムが挙げられるが、これらに限定されない。溶出は、分離時間の短縮、およびピーク幅の縮小に好ましい勾配条件を有している、1つ以上の勾配条件または定組成条件(isocratic condition)を用いて実施され得る。他の方法は、異なる溶媒濃度範囲を有する2つの勾配を使用することを包含している。本明細書における使用に適した溶出緩衝液の例としては、酢酸アンモニウム溶液およびアセトニトリル溶液が挙げられるが、これらに限定されない。
(疎水性相互作用クロマトグラフィー精製技術)
疎水性相互作用クロマトグラフィー(HIC)が、fEPOに対して実施されてもよい。一般的に、HYDROPHOBIC INTERACTION CHROMATOGRAPHY HANDBOOK: PRINCIPLES AND METHODS(カタログ番号18−1020−90、Amersham Biosciences Inc.(Piscataway、NJ))を参照すればよく、これは参照によって本明細書に援用される。適切なHIC基質としては、アルキルによって置換された基質もしくはアリールによって置換された基質(例えば、ブチルによって置換された基質、ヘキシルによって置換された基質、オクチルによって置換された基質、またはフェニルによって置換された基質(アガロース基質、架橋されたアガロース基質、セファロース基質、セルロース基質、シリカ基質、デキストラン基質、ポリスチレン基質、ポリ(メタクリレート)基質が挙げられる))、および混合された形式の基質(ポリエチレンアミン樹脂基質、またはブチルもしくはフェニルで置換されたポリ(メタクリレート)基質が挙げられるが、これらに限定されない)が挙げられるが、これらに限定されない。疎水性相互作用クロマトグラフィーに関する市販の原料としては、HITRAP(登録商標)カラム、HIPREP(登録商標)カラム、およびHILOAD(登録商標)カラム(Amersham Biosciences Inc.、Piscataway、NJ)が挙げられるが、これらに限定されない。簡単に説明すると、装填の前に、HICカラムは、当業者に公知の標準的な緩衝液(例えば、酢酸溶液/塩化ナトリウム溶液、または硫酸アンモニウムを含んでいるHEPES)を用いて、平衡化され得る。次いで、fEPOを装填した後に、カラムは、不要な物質を取り除くための標準的な緩衝液と条件とを用いて洗浄され得るが、fEPOはHICカラムに保持されている。fEPOは、カラム容積の約3倍〜約10倍の標準的な緩衝液(例えば、とりわけ、EDTAと平衡化緩衝液よりも低濃度の硫酸アンモニウムとを含むHEPES緩衝液、または酢酸/塩化ナトリウム緩衝液)を用いて溶出され得る。また、例えば、リン酸カルシウムの勾配を用いた塩が減少する直線勾配を用いて、fEPO分子を溶出し得る。次いで、この溶出物は、例えば、ダイアフィルトレーション、または限外ろ過といったろ過によって濃縮され得る。ダイアフィルトレーションは、fEPOの溶出に使用される塩を除くために利用され得る。
(他の精製技術)
例えば、ゲルろ過(参照によって本明細書に援用されるGEL FILTRATION: PRINCIPLES AND METHODS(カタログ番号18−1022−18、アマシャムバイオサイエンス(ピスカタウェイ、NJ)))、HPLC、発泡床吸着、限外ろ過、ダイアフィルトレーション、および凍結乾燥などを用いたさらに他の単離工程を第1のfEPO混合物または該混合物のその後に生じた任意の混合物に対して行い、任意の過剰な塩を除去したり、緩衝液を、次の単離工程または最終的な製剤の処方にさえも好適な緩衝液と交換したりし得る。fEPO(実質的に精製されたfEPOを含んでいる)の収率は、当業者に公知の技術を用いて、本明細書に記載の各工程においてモニターされ得る。また、そのような技術は、最後の単離工程の後に、実質的に精製されたfEPOの収率を評価するために使用され得る。例えば、fEPOの収率は、陽イオン交換クロマトグラフィーおよびゲルろ過だけでなく、種々のアルキル鎖長を有するいくつかの逆相高圧液体クロマトグラフィーのいずれか(例えば、シアノPR−HPLC、C18RP−HPLC;同様に、陽イオン交換HPLCおよびゲルろ過HPLC)を用いてモニターされ得る。
精製は、標準的な技術(例えば、SDS−PAGE)を用いることによって、またはウエスタンブロットおよびELISAアッセイを用いてfEPOを測定することによって、決定され得る。例えば、ポリクローナル抗体は、陰性対照の酵母を発酵させ、陽イオン交換によって回収することによって単離されたタンパク質に対して生成され得る。また、抗体は、宿主細胞のタンパク質の夾雑物の存在を探索するために使用され得る。
純度は、標準的な技術(例えばSDS−PAGE)を用いてか、またはウエスタンブロットおよびELISAアッセイを用いたfEPOの測定によって決定され得る。例えば、ポリクロナル抗体が、陰性対照の酵母発酵およびカチオン交換回収から単離されたタンパク質に対して生成され得る。また、抗体が使用されて、混入している宿主細胞のタンパク質の存在について調べ得る。
さらなる精製手段としては、米国特許第4,612,367号に記載されている手段が挙げられ、(1)約7〜約9のpHにおいて逆相マクロ細孔アクリルエステル共重合体樹脂の担体に、fEPOポリペプチドを含んでいる混合物を加えること、ならびに(2)約20容量%〜約80容量%の有機希釈剤を含んでおり、約7〜約9のpHを有している水溶性溶出液を用いて、この担体からfEPOポリペプチドを溶出ことが挙げられるが、これに限定されない。当該有機希釈剤は、アセトン、アセトニトリル、ならびにアセトンおよびアセトニトリルの組合せからなる群から選択される。
EPOタンパク質の精製のための典型的な方法は、1996年11月14日に公開されているBurgの国際公開第96/35718号に開示されており、以下に記載されている。ブルーセファロース(Pharmacia)は、表面にシバクロンブルー色素(Cibacron blue dye)が共有結合されているセファロースビーズからなる。EPOは、非タンパク質性の夾雑物、いくつかのタンパク質性の不純物およびPVAの大部分と比べてブルーセファロースにより強く結合するので、この工程においてEPOを濃縮し得る。ブルーセファロースカラムの溶出は、塩濃度およびpHを増加させることによって実施される。カラムは、80〜100lのブルーセファロースを用いて満たされ、NaOHを用いて再生され、平衡化緩衝液(塩化ナトリウム/塩化カルシウムおよび酢酸ナトリウム)を用いて平衡化される。酸性化され、ろ過された培養上清を装填する。装填の完了後に、平衡化緩衝液と同様の緩衝液(より高濃度の塩化ナトリウムを含んでいる)を用いてカラムを洗浄し、続いてTRISベースの緩衝液を用いて洗浄する。基本の溶出プロファイルにしたがって、TRISベースの緩衝液を用いて生成物を溶出し、単一の画分に回収する。
ブチルトヨパール650C(Toso Haas)は、脂肪族ブチルの残部が共有結合したポリスチレンにもとづく基材である。EPOは、不純物およびPVAの大部分と比べて、このゲルにより強く結合するので、イソプロパノールを含んでいる緩衝液を用いて溶出される必要がある。カラムは、30〜40lのブチルトヨパール650Cを用いて充填され、NaOHを用いて再生され、TRISベースの緩衝液を用いて洗浄され、イソプロパノールを含んでいるTRISベースの緩衝液を用いて平衡化される。ブルーセッファロースの溶出液は、カラム平衡化緩衝液におけるイソプロパノール濃度に調整され、カラムに装填される。それからイソプロパノール濃度を増加させた平衡化緩衝液を用いてカラムを洗浄する。基本の溶出プロファイルにしたがって、溶出緩衝液(高い含有量のイソプロパノールを有しているTRISベースの緩衝液)を用いて生成物を溶出し、単一の画分に回収する。
ヒドロキシアパタイトウルトロゲル(Hydroxyapatite Ultrogel)(Biosepra)は、機械的性質を向上させるためにアガロース基材に組み込まれているヒドロキシアパタイトによって構成されている。EPOは、ヒドロキシアパタイトに対する弱い親和性を有しているため、タンパク質の不純物よりも低いリン酸濃度において溶出され得る。カラムは、30〜40lのヒドロキシアパタイトウルトロゲルを用いて満たされ、リン酸カリウム/塩化カルシウムの緩衝液およびNaOH、続いてTRISベースの緩衝液を用いて再生される。それから、低量のイソプロパノールおよび塩化ナトリウムを含んでいるTRISベースの緩衝液を用いてカラムを平衡化する。ブチルトヨパールクロマトグラフィーの、EPOを含んでいる溶出液を、カラムに装填する。続いて、カラムを、イソプロパノールおよび塩化ナトリウムを含んでいな平衡化緩衝液およびTRISベースの緩衝液を用いて洗浄する。基本の溶出プロファイルにしたがって、低濃度のリン酸カリウムを含んでいるTRISベースの緩衝液を用いて生成物を溶出し、単一の画分に回収する。
RP−HPLC材料であるVydac C4(Vydac)は、シリカゲル粒子からなり、シリカゲル粒子の表面にC4−アルキル鎖が保持されている。タンパク質性の不純物からのEPOの分離は、疎水性相互作用の強度の差に基づく。アセトニトリル勾配の希釈されたトリフルオロ酢酸を用いて溶出を行う。ステンレス鋼カラム(2.8〜3.2リットルのVydac C4シリカゲルが充填されている)を用いて、調製用HPLCを行う。ヒドロキシアパタイトウルトロゲルの溶出物を、トリフルオロ酢酸を加えることによって酸性化し、そして、Vydac C4カラム上に添加する。洗浄および溶出のために、アセトニトリル勾配の希釈されたトリフルオロ酢酸を使用する。画分を収集し、ただちにリン酸緩衝液を用いて中性化する。IPC限界内にあるEPOの画分をプールする。
デアエセファロース(Pharmacia)材料は、セファロースビーズの表面と共有結合されるジエチルアミノエチル(DEAE)基からなる。DEAE基に対するEPOの結合はイオン性相互作用によって媒介される。アセトニトリルおよびトリフルオロ酢酸は、保持されることなくカラムを通過する。これらの物質が洗い流された後に、低pHの酢酸緩衝液を用いてカラムを洗浄することによって微量の不純物を除去する。次いで、カラムを中性のリン酸緩衝液を用いて洗浄する。そして、イオン強度が増加した緩衝液を用いてEPOを溶出する。カラムに、デアエセファロースファストフロウを充填する。3〜10mgのEPO/1mlのゲルの範囲において、EPOを添加することを保障するように、カラム容積を調整する。水および平衡化緩衝液(リン酸ナトリウム/カリウム)を用いてカラムを洗浄する。HPLC溶出物のプールされた画分を添加し、平衡化緩衝液を用いてカラムを洗浄する。次いで、洗浄緩衝液(酢酸ナトリウム緩衝液)を用いてカラムを洗浄し、その後、平衡化緩衝液を用いてカラムを洗浄する。続いて、溶出緩衝液(塩化ナトリウム、リン酸ナトリウム/カリウム)を用いてEPOをカラムから溶出し、基本の溶出プロファイルにしたがって、単一の画分に収集する。デアエセファロースカラムの溶出物を、特定の伝導性に調整する。結果として生じる製剤原料を、テフロン(Teflon)(登録商標)ボトルの中に無菌的にろ過し、−70℃にて保存する。
多種多様な方法および手法が、天然にコードされていないアミノ酸を1つ以上含んでいるfEPOタンパク質の収率および純度を評価するために使用され得る。このような方法および手法としては、ブラッドフォードアッセイ、SDS−PAGE、銀染色されるSDS−PAGE、クーマシーブルー染色されるSDS−PAGE、質量分析(MALDI−TOFが挙げられるが、これに限定されない)、および当業者に公知のタンパク質の性質を決定するための他の方法が挙げられるが、これらに限定されない。
IX.代替系における発現
種々の戦略が、非組換え宿主細胞、変異された宿主細胞、または無細胞系においてタンパク質に非天然アミノ酸を導入するために使用されている。また、これらの系は本発明のfEPOポリペプチドの作製における使用に好適である。Lys、CysおよびTyrといった反応性の側鎖を有するアミノ酸を誘導体化することによって、リジンをN2−アセチル−リジンに転換させる。また、化学合成は非天然アミノ酸を組み込むための簡便な方法を提供する。ペプチドの断片の酵素的ライゲーションおよびネイティブな化学的ライゲーションの最近の発展に伴って、巨大タンパク質の作製が可能である。例えば、P. E. Dawson and S. B. H. Kent, Annu. Rev. Biochem, 69:923 (2000)を参照すればよい。所望の非天然アミノ酸によって化学的にアシル化されたサプレッサtRNAが、タンパク質生合成を支持し得るインビトロ抽出物に添加される、通常のインビトロ生合成方法は、実質的に任意の大きさを有する種々のタンパク質に100を超える非天然アミノ酸を部位特異的に組み込むために、使用されている。例えば、V. W. Cornish, D. Mendel and P. G. Schultz, Angew. Chem. Int. Ed. Engl., 1995, 34:621 (1995); C.J. Noren, S.J. Anthony-Cahill, M.C. Griffith, P.G. Schultz, A general method for site-specific incorporation of unnatural amino acids into proteins, Science 244:182-188 (1989);およびJ.D. Bain, C.G. Glabe, T.A. Dix, A.R. Chamberlin, E.S. Diala, Biosynthetic site-specific incorporation of a non-natural amino acid into a polypeptide, J. Am. Chem. Soc. 111:8013-8014 (1989)を参照すればよい。広範な官能基が、タンパク質の安定性、タンパク質のフォールディング、酵素機序およびシグナル伝達を研究するために、タンパク質に組み込まれている。
選択圧(selective pressure)組込みと呼ばれるインビボの方法が、野生型合成酵素の無差別さを活用するために開発された。例えば、N. Budisa, C. Minks, S. Alefelder, W. Wenger, F. M. Dong, L. Moroder and R. Huber, FASEB J., 13:41 (1999)を参照すればよい。特定の天然アミノ酸を細胞に供給する関連代謝経路が断たれている栄養要求株は、制限された濃度の天然アミノ酸を含有している最小培地において増殖する一方で、標的遺伝子の転写が抑制されている。増殖の定常期に入ると、天然アミノ酸が枯渇して、非天然アミノ酸類似物と置き換えられる。組換えタンパク質の発現の誘導は、非天然の類似物を含んでいるタンパク質の蓄積を生じる。例えば、この戦略を用いて、o、mおよびp−フルオロフェニルアラニンが、タンパク質に組み込まれており、容易に同定され得るUVスペクトルにおける2つの特徴的な肩を示し(例えば、C. Minks, R. Huber, L. Moroder and N. Budisa, Anal. Biochem., 284:29 (2000)を参照すればよい);トリフルオロメチオニンが、19F NMRによってチトオリゴ糖のリガンドとの相互作用を研究するために、バクテリオファージのT4ライソザイム内のメチオニンを置換するために使用されており(例えば、H. Duewel, E. Daub, V. Robinson and J. F. Honek, Biochemistry, 36:3404 (1997)を参照すればよい);トリフルオロロイシンがロイシンの代わりに組み込まれて、ロイシンジッパータンパク質の増強された熱的および化学的な安定性をもたらしている。例えば、Y. Tang, G. Ghirlanda, W. A. Petka, T. Nakajima, W. F. DeGrado and D. A. Tirrell, Angew. Chem. Int. Ed. Engl., 40:1494 (2001)を参照すればよい。さらに、セレノメチオニンおよびテルルメチオニンが、種々の組換えタンパク質に組み込まれて、X線結晶解析における位相の解像を容易にしている。例えば、W. A. Hendrickson, J. R. Horton and D. M. Lemaster, EMBO J., 9:1665 (1990);J. O. Boles, K. Lewinski, M. Kunkle, J. D. Odom, B. Dunlap, L. Lebioda and M. Hatada, Nat. Struct. Biol., 1:283 (1994);N. Budisa, B. Steipe, P. Demange, C. Eckerskorn, J. Kellermann and R. Huber, Eur. J. Biochem., 230:788 (1995);およびN. Budisa, W. Karnbrock, S. Steinbacher, A. Humm, L. Prade, T. Neuefeind, L. Moroder and R. Huber, J. Mol. Biol., 270:616 (1997)を参照すればよい。また、アルケンまたはアルキンの官能基を有しているメチオニン類似物が効率的に組み込まれて、化学的手段によるタンパク質のさらなる修飾を可能にしている。例えば、J. C. M. van Hest and D. A. Tirrell, FEBS Lett., 428:68 (1998);J. C. M. van Hest, K. L. Kiick and D. A. Tirrell, J. Am. Chem. Soc., 122:1282 (2000);およびK. L. Kiick and D. A. Tirrell, Tetrahedron, 56:9487 (2000);米国特許第6,586,207号;米国特許出願公開第2002/0042097号を参照すればよい(なお、これらの文献は参照によって本明細書に援用される)。
この方法の成功は、タンパク質翻訳の忠実度を保証するために高い選択性を一般的に必要とする、アミノアシルtRNAによる非天然アミノ酸類似物の認識に依存する。この方法の有効範囲を拡張するための1つの方法は、アミノアシルtRNAの基質特異性を緩和することであるが、この緩和は限られた事例にしか達成されていない。例えば、Escherichia coliのフェニルアラニル合成酵素(PheRS)内のAla294のGlyによる置換は、基質結合ポケットの大きさを増加させ、p−Cl−フェニルアラニン(p−Cl−Phe)によってtRNAPheがアシル化されることをもたらす。M. Ibba, P. Kast and H. Hennecke, Biochemistry, 33:7107 (1994)を参照すればよい。この変異PheRSを内部に有しているEscherichia coli株は、フェニルアラニンの代わりに、p−Cl−フェニルアラニンまたはp−Br−フェニルアラニンの組込みを可能にする。例えば、M. Ibba and H. Hennecke, FEBS Lett., 364:272 (1995);およびN. Sharma, R. Furter, P. Kast and D. A. Tirrell, FEBS Lett., 467:37 (2000)を参照すればよい。同様に、Escherichia coliのチロシル−tRNA合成酵素のアミノ酸結合部位の近傍の点変異Phe130Serによって、アザチロシンがチロシンよりも効率的に組み込まれることが可能になることが、示されている。F. Hamano-Takaku, T. Iwama, S. Saito-Yano, K. Takaku, Y. Monden, M. Kitabatake, D. Soll and S. Nishimura, J. Biol. Chem., 275:40324 (2000)を参照すればよい。
インビボにおいて非天然アミノ酸をタンパク質に組み込む他の戦略は、校正機序を有している合成酵素を修飾することである。これらの合成酵素は、同種の天然アミノ酸と構造的に類似するアミノ酸を区別できず、それゆえ当該類似するアミノ酸を活性化する。この誤りは別の部位において訂正されて、誤ってチャージしたアミノ酸をtRNAから脱アシル化し、タンパク質翻訳の正確さを維持する。合成酵素の校正活性が無効にされると、誤って活性化される構造的類似物が、編集機能を免れて組み込まれることがある。この方法は、近年、バリル−tRNA合成酵素(ValRS)を用いて証明されている。V. Doring, H. D. Mootz, L. A. Nangle, T. L. Hendrickson, V. de Crecy-Lagard, P. Schimmel and P. Marliere, Science, 292:501 (2001)を参照すればよい。ValRSは、Cys、Thr、アミノブチレート(Abu)によってtRNAValを誤ってアシル化でき;その後にこれらの非同種のアミノ酸が編集ドメインによって加水分解される。Escherichia coliの染色体の無作為変異生成の後に、ValRSの編集部位に変異を有している変異体Escherichia coli株が選択された。この編集を欠損したValRSは、Cysを用いてtRNAValを不正確にチャージする。また、AbuがCysと立体的に類似している(Cysの−SH基がAbuにおいて−CH3に置換されている)ので、変異体ValRSは、この変異体Escherichia coli株がAbuの存在下において増殖されると、タンパク質にAbuを組み込む。質量分析に基づく解析は、本来のタンパク質におけるバリンの位置のそれぞれにおいて、バリンの約24%がAbuに置換されることを示している。
また、固相合成法および固相半合成法は、新規のアミノ酸を含んでいる多くのタンパク質の合成を可能にしている。例えば、以下の刊行物および引用される参考文献を参照すればよい:Crick, F.J.C., Barrett, L. Brenner, S. Watts-Tobin, R. General nature of the genetic code for proteins. Nature, 1227-1232 (1961); Hofmann, K., Bohn, H. Studies on polypeptides. XXXVI. The effect of pyrazole-imidazole replacements on the S-protein activating potency of an S-peptide fragment, J. Am Chem, 5914-5919 (1966); Kaiser, E.T. Synthetic approaches to biologically active peptides and proteins including enyzmes, Acc Chem Res, 47-54 (1989); Nakatsuka, T., Sasaki, T., Kaiser, E.T. Peptide segment coupling catalyzed by the semisynthetic enzyme thiosubtilisin, J Am Chem Soc, 3808-3810 (1987); Schnolzer, M., Kent, S B H. Constructing proteins by dovetailing unprotected synthetic peptides: backbone-engineered HIV protease, Science, 221-225 (1992); Chaiken, I.M. Semisynthetic peptides and proteins, CRC Crit Rev Biochem, 255-301 (1981); Offord, R.E. Protein engineering by chemical means? Protein Eng., 151-157 (1987); and, Jackson, D.Y., Burnier, J., Quan, C., Stanley, M., Tom, J., Wells, J.A. A Designed Peptide Ligase for Total Synthesis of Ribonuclease A with Unnatural Catalytic Residues, Science, 243 (1994)。
化学的修飾は、インビトロにおいてタンパク質に種々の非天然な側鎖(補助因子、スピン標識およびオリゴヌクレオチドが挙げられる)を導入するために、使用されている。例えば、Corey, D.R., Schultz, P.G. Generation of a hybrid sequence-specific single-stranded deoxyribonuclease, Science, 1401-1403 (1987); Kaiser, E.T., Lawrence D.S., Rokita, S.E. The chemical modification of enzymatic specificity, Rev Biochem, 565-595 (1985); Kaiser, E.T., Lawrence, D.S. Chemical mutation of enyzme active sites, Science, 505-511 (1984); Neet, K.E., Nanci A, Koshland, D.E. Properties of thiol-subtilisin, J Biol. Chem, 6392-6401 (1968); Polgar, L.B., M.L. A new enzyme containing a synthetically formed active site. Thiol-subtilisin. J. Am Chem Soc, 3153-3154 (1966); and, Pollack, S.J., Nakayama, G. Schultz, P.G. Introduction of nucleophiles and spectroscopic probes into antibody combining sites, Science, 1038-1040 (1988)を参照すればよい。
代替可能に、化学的に修飾されたアミノアシル−tRNAを採用する生合成方法は、インビトロにおいて合成されるタンパク質に種々の生物物理的なプローブを組み込むために使用されている。以下の刊行物および引用される参考文献:Brunner, J. New Photolabeling and crosslinking methods, Annu. Rev Biochem, 483-514 (1993); and, Krieg, U.C., Walter, P., Hohnson, A.E. Photocrosslinking of the signal sequence of nascent preprolactin of the 54-kilodalton polypeptide of the signal recognition particle, Proc. Natl. Acad. Sci, 8604-8608 (1986)を参照すればよい。
これまでに、所望のアンバーナンセンス変異を含んでいる遺伝子を用いて計画されたタンパク質合成反応に対して、化学的にアミノアシル化されたサプレッサtRNAを加えることによって、非天然アミノ酸がインビトロにおいて部位特異的に組み込まれ得ることが示されている。これらの方法を用いて、特定のアミノ酸に対して栄養要求性の株を用いて通常の20のアミノ酸の多くを構造的に近い相同物(例えば、フェニルアラニンに対するフルオロフェニルアラニン)に置換し得る。例えば、Noren, C.J., Anthony-Cahill, Griffith, M.C., Schultz, P.G. A general method for site-specific incorporation of unnatural amino acids into proteins, Science, 244: 182-188 (1989); M.W. Nowak, et al., Science 268:439-42 (1995); Bain, J.D., Glabe, C.G., Dix, T.A., Chamberlin, A.R., Diala, E.S. Biosynthetic site-specific Incorporation of a non-natural amino acid into a polypeptide, J. Am Chem Soc, 111:8013-8014 (1989); N. Budisa et al., FASEB J. 13:41-51 (1999); Ellman, J.A., Mendel, D., Anthony-Cahill, S., Noren, C.J., Schultz, P.G. Biosynthetic method for introducing unnatural amino acids site-specifically into proteins, Methods in Enz., 301-336 (1992); and, Mendel, D., Cornish, V.W. & Schultz, P.G. Site-Directed Mutagenesis with an Expanded Genetic Code, Annu Rev Biophys. Biomol Struct. 24, 435-62 (1995)を参照すればよい。
例えば、UAGストップコドンを認識するサプレッサtRNAが調製され、非天然アミノ酸によって化学的にアミノアシル化された。従来の部位特異的変異生成が、タンパク質遺伝子における目的の部位に、ストップコドンTAGを導入するために使用された。例えば、Sayers, J.R., Schmidt, W. Eckstein, F. 5’, 3’ Exonucleases in phosphorothioate-based olignoucleotide-directed mutagensis, Nucleic Acids Res, 791-802 (1988)を参照すればよい。アミノアシル化サプレッサtRNAおよび変異体遺伝子が、インビトロの転写/翻訳系において組み合せられる場合、非天然アミノ酸がUAGコドンに応じて組み込まれ、特定の位置においてアミノ酸を含んでいるタンパク質が生じる。[3H]−Pheを用いた実験およびα−ヒドロキシ酸を用いた実験によって、所望のアミノ酸のみがUAGコドンによって特定される位置に組み込まれ、このアミノ酸がタンパク質における任意の他の部位に組み込まれないことが証明された。例えば、Noren, et al, supra; Kobayashi et al., (2003) Nature Structural Biology 10(6):425-432;およびEllman, J.A., Mendel, D., Schultz, P.G. Site-specific incorporation of novel backbone structures into proteins, Science, 197-200 (1992)を参照すればよい。
また、微量注入技術はタンパク質への非天然アミノ酸の組込みに使用されている。例えば、M. W. Nowak, P. C. Kearney, J. R. Sampson, M. E. Saks, C. G. Labarca, S. K. Silverman, W. G. Zhong, J. Thorson, J. N. Abelson, N. Davidson, P. G. Schultz, D. A. Dougherty and H. A. Lester, Science, 268:439 (1995) ;およびD. A. Dougherty, Curr. Opin. Chem. Biol., 4:645 (2000)を参照すればよい。アフリカツメガエルの卵母細胞は、インビトロにおいて作製された2つのRNA種:所定のアミノ酸位置にUAGストップコドンを有している標的タンパク質をコードするmRNA、および所望の非天然アミノ酸と共にアミノアシル化されたアンバーサプレッサtRNAを用いて共注入された。それから、卵母細胞の翻訳機構はUAGによって特定される位置に非天然アミノ酸を挿入する。この方法は、一般的にインビトロの系に受け容れられない内在性膜タンパク質(integral membrane protein)の構造−機能研究を可能にしている。例としては、蛍光共鳴エネルギー転移によって距離を測定するための、タキキニン ニューロキニン−2受容体への蛍光アミノ酸の組込み(例えば、G. Turcatti, K. Nemeth, M. D. Edgerton, U. Meseth, F. Talabot, M. Peitsch, J. Knowles, H. Vogel and A. Chollet, J. Biol. Chem., 271:19991 (1996)を参照すればよい);イオンチャネルにおける表面露出残基を同定するための、ビオチン化アミノ酸の組込み(例えば、J. P. Gallivan, H. A. Lester and D. A. Dougherty, Chem. Biol., 4:739 (1997)を参照すればよい);実時間におけるイオンチャネルの立体配置の変化を観察するための、ケージ化チロシン類似物の使用(例えば、J. C. Miller, S. K. Silverman, P. M. England, D. A. Dougherty and H. A. Lester, Neuron, 20:619 (1998)を参照すればよい);およびそれらのゲート機構を調べるためにイオンチャネル骨格を変更するための、αヒドロキシアミノ酸の使用が挙げられる。例えば、P. M. England, Y. Zhang, D. A. Dougherty and H. A. Lester, Cell, 96:89 (1999);およびT. Lu, A. Y. Ting, J. Mainland, L. Y. Jan, P. G. Schultz and J. Yang, Nat. Neurosci., 4:239 (2001)を参照すればよい。
インビボにおいてタンパク質に非天然アミノ酸を組み込む能力は、利点(変異タンパク質の高い収率、技術的な容易さ、細胞もしくはおそらくは生体における変異タンパク質を研究する見込み、および治療的な処置におけるこれらのタンパク質の利用が挙げられる)を提供する。種々の大きさ、酸性度、求核性、疎水性および他の特性を有している非天然アミノ酸をタンパク質に含める能力は、タンパク質の機能を調べること、および新規の性質を有する新たなタンパク質もしくは生体を作り出すことの両方を目的として、タンパク質の構造を合理的かつ体系的に操作するわれわれの能力を非常に拡張し得る。しかし、タンパク質翻訳においては、tRNA合成酵素の相互作用に高度な正確さが要求され、複雑な性質を有しているため、この方法は困難である。
パラ−F−Pheを部位特異的に組み込むための1つの試みにおいて、酵母アンバーサプレッサtRNAPheCUA/フェニルアラニル−tRNA対が、p−F−Phe耐性の、Phe要求性のEscherichia coli株に使用された。例えば、R. Furter, Protein Sci., 7:419 (1998) を参照すればよい。
また、無細胞(インビトロ)翻訳系を用いて、本発明のfEPOポリヌクレオチドを発現させ得る。鋳型としてmRNA(インビトロ翻訳)または鋳型としてDNA(インビトロ転写および翻訳の組合せ)のいずれかを含み得るこれらの系において、インビトロ合成は、リボソームによって導かれる。無細胞タンパク質発現系の開発に多大な努力が注がれている。例えば、参照によって本明細書に援用されるKim, D.M. and J.R. Swartz, Biotechnology and Bioengineering, 74 :309-316 (2001);Kim, D.M. and J.R. Swartz, Biotechnology Letters, 22, 1537-1542, (2000);Kim, D.M., and J.R. Swartz, Biotechnology Progress, 16, 385-390, (2000);Kim, D.M., and J.R. Swartz, Biotechnology and Bioengineering, 66, 180-188, (1999);およびPatnaik, R. and J.R. Swartz, Biotechniques 24, 862-868, (1998);米国特許第6,337,191号;米国特許出願公開第2002/0081660号;国際公開第00/55353号国際公開第90/05785号を参照すればよい。天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドの発現に適用され得る他の方法としては、mRNA−ペプチド融合技術が挙げられる。例えば、R. Roberts and J. Szostak, Proc. Natl Acad. Sci. (USA) 94:12297-12302 (1997) ;A. Frankel, et al., Chemistry & Biology 10:1043-1050 (2003)を参照すればよい。この方法において、ピューロマイシンと連結されたmRNAの鋳型はリボソーム上において翻訳される。1つ以上のtRNA分子が修飾されると、非天然アミノ酸が同様にペプチドに組み込まれ得る。最後のmRNAコドンが読まれた後に、ピューロマイシンはペプチドのC末端を捕捉する。生じたmRNA−ペプチド抱合物がインビトロアッセイにおいて興味深い性質を有することを見出されている場合に、その同一性はmRNA配列から容易に明らかにされ得る。この方法において、所望の性質を有するポリペプチドを同定するために、天然にコードされていないアミノ酸を1つ以上含んでいるfEPOポリペプチドのライブラリをスクリーニングし得る。より最近に、精製成分を用いたインビトロリボソーム翻訳は、天然にコードされていないアミノ酸に置換されたペプチドの合成を可能にすることが、報告されている。例えば、A. Forster et al., Proc. Natl Acad. Sci. (USA) 100:6353 (2003)を参照すればよい。
X.fEPOに結合されている巨大分子重合体
広範な巨大分子重合体および他の分子は、fEPOポリペプチドの生物学的な性質を調節するためか、および/またはfEPO分子に対して新たな生物学的な性質を与えるために、本発明のfEPOに対して連結され得る。これらの巨大分子重合体は、天然にコードされるアミノ酸を介してか、天然にコードされていないアミノ酸、または天然アミノ酸もしくは非天然アミノ酸の任意の置換基、または天然アミノ酸もしくは非天然アミノ酸に対して加えられる任意の置換基もしくは官能基を介して、fEPOに対して連結され得る。
本発明は、重合体:タンパク質の抱合物の実質的に均質な調製物を提供する。本明細書に使用されるとき、“実質的に均質な”は、重合体:ポリペプチドの抱合物がタンパク質の総量の半分より多く観察されることを意味する。重合体:タンパク質の抱合物は、生物活性を有し、かつ本明細書において規定される“実質的に同質な”PEG付加fEPO調製物は、均質な調製物の利点(例えば、1組の薬物動態に対する1組の予想における臨床的な適用における容易さ)を示すために十分に均質であるそれらである。
また、重合体:タンパク質の抱合物分子の混合物を調製するために選択し得、かつ本明細書に規定されている利点は、混合物に含まれるモノ−重合体:タンパク質の抱合物の比率を選択し得ることである。したがって、必要に応じて、種々の数(すなわち、ジ−、トリ−、テトラ−など)の重合体部分と連結した状態の様々なタンパク質の混合物を調製し得、かつ本発明の方法を用いて調製されたモノ−重合体:タンパク質の抱合物と上記抱合物を組み合せ得、かつ所定の割合のモノ−重合体:タンパク質の抱合物を有している混合物を有し得る。
選択される重合体は、重合体が連結されるタンパク質が水性環境(例えば、生理学的環境)において沈殿しないように、水溶性重合体であり得る。重合体は、分枝鎖状であり得るか、または非分枝鎖状であり得る。最終産物の調製物の治療的利用に関して、重合体は薬学的に受容可能であることが好ましい。
タンパク質分子に対するポリエチレングリコールの比率は、反応混合物におけるそれらの濃度にしたがって変化する。一般的に、最適な比率(余剰の未反応のタンパク質または重合体が最小である反応の効率に関する)は、選択されるポリエチレングリコールの分子量によって、かつ有用な反応性基の利用可能な数に基づいて決定され得る。分子量に関連するときに、タンパク質に対して連結されるのは、典型的により分子量の高い重合体、より少ない数の重合体分子である。同様に、重合体の分枝は、これらの要素を最適化する場合に、計算に入れられるべきである。一般的に、分子量が高いほど(分枝が多いほど)、重合体:タンパク質の割合が高くなる。
本明細書に使用されるとき、およびPEG:fEPOの抱合物について検討される場合に、“治療有効量”は、ヘマトクリットを増加させ、患者に利益を与える量を指す。当該量は、個体間において変わり、かつ要素(患者の全体的な体調および処置される貧血の原因が挙げられる)の数に依存する。例えば、慢性腎不全を患う患者に対するfEPOの治療有効量は、週に3回にわたる50〜150ユニット/kgである。治療のために使用されるfEPOの量は、ヘマトクリットの増加に関し受容可能な変化率を生じ、ヘマクリットを有益なレベルに維持する(通常、少なくとも約30%であり、典型的に30%〜36%の範囲内である)。本発明の組成物の治療有効量は、一般に利用可能な材料および手法を用いて当業者によって容易に確認され得る。
水溶性重合体は、任意の構造的な形態(直鎖、分岐鎖または分枝鎖が挙げられるが、これらに限定されない)であり得る。水溶性重合体は、典型的にポリ(エチレングリコール)(PEG)といったポリ(アルキレングリコール)であるが、他の水溶性重合体もまた採用され得る。ほんの一例として、PEGは、本発明のある特定の実施形態を説明するために使用される。
PEGは、市販されているか、または当業者に公知の方法(Sandler and Karo, Polymer Synthesis, Academic Press, New York, Vol. 3, pages 138-161)にしたがってエチレングリコールの開環重合によって調製され得る、よく知られている水溶性重合体である。“PEG”という用語は、PEGの大きさまたは末端における修飾に関係なく、任意のポリエチレングリコール分子を包含するために広く使用され、かつfEPOに対して連結されるときに、式:
XO-(CH2CH2O)n-CH2CH2-Y
(ここで、nは2から10000であり、Xは、Hまたは末端修飾(C1−4アルキルが挙げられるが、これらに限定されない)である)
によって表され得る。
いくつかの場合において、本発明において使用されるPEGは、ヒドロキシまたはメトキシを有している末端が終端になる(すなわち、XはHまたはCH3(“メトキシPEG”)である)。代替可能に、PEGは、これによって二官能性重合体を形成する反応性基が終端になる。典型的な反応性基としては、一般的に見られる20のアミノ酸における官能基と反応するために通常に使用されるこれらの反応性基(マレイミド基、活性化カルボン酸塩(p−ニトロフェニルエステルが挙げられるが、これに限定されない)、活性化エステル(N−ヒドロキシスクシニミド、p−ニトロフェニルエステルが挙げられるが、これらに限定されない)、およびアルデヒドが挙げられるが、これらに限定されない)だけでなく、通常の20のアミノ酸に対して不活性であるが、天然にコードされていないアミノ酸に存在する補完的な官能基と特に反応する官能基(アジド基、アルキン基が挙げられるが、これらに限定されない)が挙げられ得る。ここで留意すべきは、上記式においてYによって示されているPEGの他の末端が、天然に存在するアミノ酸または天然にコードされていないアミノ酸を介してfEPOポリペプチドに対して直接的または間接的に連結していることである。実際に、Yは、ポリペプチドのアミン基(リジンまたはN末端のイプシロンアミンが挙げられるが、これらに限定されない)に対する、アミド結合、カルバメート結合または尿素結合であり得る。代替可能に、Yは、チオール基(システインのチオール基が挙げられるが、これに限定されない)に対するマレイミド結合であり得る。代替可能に、Yは、通常の20のアミノ酸を介して通常には接近できない残基に対する結合であり得る。例えば、PEGにおけるアジド基は、fEPOポリペプチドにおけるアルキン基と反応して、ヒュイゲン[3+2]環付加産物を形成し得る。代替可能に、PEGにおけるアルキン基は、天然にコードされていないアミノ酸に存在するアジド基と反応して、同様の産物を形成し得る。いくつかの実施形態において、強い求核基(ヒドラジン、ヒドラジド、ヒドロキシアミン、セミカルバジドが挙げられるが、これらに限定されない)は、天然にコードされていないアミノ酸に存在するアルデヒド基またはケトン基と反応して、必要に応じていくつかの場合に適切な還元剤を用いた処理によってさらに還元されるヒドラゾン、オキシムまたはセミカルバゾンを形成し得る。代替可能に、強い求核基は、天然にコードされていないアミノ酸を介してfEPOポリペプチドに組み込まれ得、水溶性重合体に存在するケトン基またはアルデヒド基と好適に反応するために使用され得る。
PEGに関する任意の分子量が、実際に所望されるように、約1000ダルトン(Da)から100000Daまたは必要に応じてそれ以上(1〜50kDaまたは10〜40kDaが挙げられるが、これらに限定されない)まで(これらが挙げられるが、限定されない)使用され得る。また、分枝鎖状のPEG(10〜40kDa(5〜20kDaが挙げられるが、これらに限定されない)の範囲にあるMWを有しているそれぞれの鎖を含んでいるPEG分子が挙げられるが、これらに限定されない)が使用され得る。広範なPEG分子が参照によって本明細書に援用されるShearwater Polymers, Inc. catalog, Nektar Therapeutics catalog(これが挙げられるが、限定されない)に記載されている。
一般的に、PEGの少なくとも1つの末端は、天然にコードされていないアミノ酸との反応に利用可能である。例えば、アミノ酸側鎖との反応のためのアルキン部分およびアジド部分は、本明細書に記載されるような天然にコードされていないアミノ酸に対してPEGを連結させるために使用され得る。天然にコードされていないアミノ酸がアジドを含んでいる場合に、そのときPEGは、ヒュイゲン[3+2]環付加産物の形成をもたらすためのアルキン部分、またはアミド結合の形成をもたらすための活性化PEG種(すなわち、エステル、カルボン酸塩)のいずれかを典型的に含んでいる。代替可能に、天然にコードされていないアミノ酸がアルキンを含んでいる場合に、そのときPEGは、[3+2]ヒュイゲン環付加産物の形成をもたらすためのアジド部分を典型的に含んでいる。天然にコードされていないアミノ酸がカルボニル基を含んでいる場合に、PEGは、対応するヒドラゾン、ヒドロキシアミン、またはセミカルバゾン結合のそれぞれをもたらすために、強力な求核基(ヒドラジド、ヒドラジン、ヒドロキシアミンまたはセミカルバジド基能性基が挙げられるが、これらに限定されない)を典型的に含んでいる。他の代替物において、上記において説明される反応性基の逆の方向性が使用され得る(すなわち、天然にコードされていないアミノ酸におけるアジド基がアルキンを含有するPEG誘導体と反応され得る)。
いくつかの実施形態において、PEG誘導体を有しているfEPOバリアントは、天然にコードされていないアミノ酸の側鎖に存在する化学的な官能性基と反応性である化学的な官能性基を含んでいる。
本発明は、いくつかの実施形態において、約800Daから約100000Daまでの平均分子量を有している水溶性重合体骨格を含んでいるアジド含有重合体およびアセチレン含有重合体を提供する。水溶性重合体の重合体骨格は、ポリ(エチレングリコール)であり得る。しかし、広範な水溶性重合体(ポリ(エチレン)グリコールおよび他の関連する重合体(ポリ(デキストラン)およびポリ(プロピレングリコール))が挙げられるが、これらに限定されない)がまた、本発明の実践における使用に好適であること、PEGまたはポリ(エチレングリコール)という用語が、そのような分子のすべてを包含し、含むことを意図されることは、理解されるべきである。PEGという用語としては、その形態のいずれか(二官能性のPEG、マルチアームのPEG、誘導体化PEG、分岐状のPEG、分枝鎖状のPEG、ぶら下がりのPEG(すなわち、重合体骨格に対してぶら下がっている1つ以上の官能基を有しているPEGまたは関連重合体)、またはこれらに分解可能な結合を有しているPEGが挙げられるが、これらに限定されない)であるポリ(エチレングリコール)が挙げられるが、これに限定されない。
PEGは、典型的に透明であり、無色であり、無臭であり、水溶性であり、熱に安定であり、多くの化学物質に対して不活性であり、加水分解されないか、または劣化されず、かつ一般的に無毒である。ポリ(エチレングリコール)は、生体適合性である(PEGが、損傷の原因になることなく、生きている組織または生体と共存可能であることを意味する)と見做される。より詳細には、PEGは実質的に非免疫原性である(PEGが身体に免疫応答を生じさせる傾向を示さないことを意味する)。身体においていくつかの所望の機能を有している分子(例えば生物学的に活性な分子)に連結される場合に、PEGは、物質をマスクする傾向にあり、生体が物質の存在に寛容であり得るように任意の免疫応答を低減可能か、または排除できる。PEG抱合物は、実質的な免疫応答を生じないか、または凝固もしくは他の好ましくない影響の原因にならない傾向を示す。式−CH2CH2O−(CH2CH2O)n−CH2CH2−(ここでnは約3から4000、典型的に約20から約2000である)を有しているPEGは、本発明における使用に好適である。約800Daから約100000Daまでの分子量を有しているPEGは、本発明のいくつかの実施形態において重合体骨格として特に有用である。
重合体骨格は直鎖状または分枝鎖状であり得る。分枝鎖状の重合体骨格は一般的に当該技術において公知である。典型的に、分枝鎖状の重合体は、中心の分枝核部分および中心の分枝核に連結された複数の直鎖状の重合体鎖を有している。PEGは、種々のポリオール(例えば、グリセロール、グリセロールオリゴマー、ペンタエリスリトールおよびソルビトール)に対するエチレンオキシドの付加によって調製され得る、分枝鎖状の形態において通常に使用される。また、中心の分枝核部分はリジンといった種々のアミノ酸から誘導体化され得る。分枝鎖状のポリ(エチレングリコール)は、R(−PEG−OH)m(Rは、グリセロール、グリセロールオリゴマー、またはペンタエリスリトールといった核部分から誘導体化され、mは腕の数を表す)として通常の形態において表され得る。また、マルチアームのPEG分子(例えば、参照によってその全体が本明細書に援用される米国特許第5,932,462号;米国特許第5,643,575号;米国特許第5,229,490号;米国特許第4,289,872号;米国特許出願公開第2003/0143596号;国際公開第96/21469号;および国際公開第93/21259号に記載のそれら)は、重合体骨格として使用され得る。
また、分枝鎖状のPEGは、PEG(−YCHZ2)n(ここで、Yは結合基であり、Zは所定の長さの原子の鎖によってCHに対して連結される活性化末端基である)によって表される分岐状のPEGの形態であり得る。
まださらなる分枝鎖状の形態、ぶら下がりのPEGは、PEG鎖の末端ではなくPEG骨格に沿ってあるカルボキシルといった反応性基を有している。
またPEGのこれらの形態に加えて、重合体は、骨格において弱い結合または分解可能な結合を有して調製され得る。例えば、PEGは、重合体骨格に加水分解を受けやすいエステル結合を有して調製され得る。以下に示すように:
-PEG-CO2-PEG-+H2O → PEG-CO2H+HO-PEG-
この加水分解は、重合体のより低い分子量の断片への切断を結果として生じる。ポリ(エチレングリコール)またはPEGという用語が、当該技術において公知の形態のすべて(本明細書に開示されるそれらが挙げられるが、これらに限定されない)を表すか、または含むことは、当業者によって理解される。
また、他の重合体は本発明における使用にとって好適である。いくつかの実施形態において、2から約300の末端を有しており、水溶性重合体である重合体骨格は、本発明において特に有用である。好適な重合体の例としては、ポリ(プロピレングリコール)(“PPG”)、これらの共重合体(エチレングリコールおよびプロピレングリコールの共重合体が挙げられるが、これに限定されない)、これらの三元重合体、およびこれらの混合物などといった、他のポリ(アルキレングリコール)が挙げられるが、これらに限定されない。重合体骨格のそれぞれの鎖の分子量は、変更可能であるが、典型的に約800Daから約100000Daまで、しばしば約6000Daから約80000Daまでの範囲である。
当業者は、水溶性重合体に関して上記に挙げたものが、決して網羅的なものではなく、単に例示であること、および上述のような品質を有している重合体材料のすべてが、本発明における使用に好適であると考えら得ることを認識する。
本発明のいくつかの実施形態において、重合体誘導体は、重合体骨格が官能基を用いて官能性化されたか、または活性化された少なくとも2つの末端、おそらく約300もの末端を有することを意味する、“多官能性”である。多官能性重合体誘導体としては、2つの末端(末端のそれぞれが、同じであり得るか、または異なり得る官能基に対して結合されている)を有する直鎖状の重合体が挙げられるが、これに限定されない。
一実施形態において、重合体誘導体は、構造:
X-A-POLY-B-N=N=N
(ここで、
N=N=Nはアジド部分であり;
Bは、存在し得るか、または存在しない場合があり得る連結部分であり;
POLYは、水溶性の非抗原性の重合体であり;
Aは、存在し得るか、または存在し得ず、Bと同じであり得るか、または異なり得る連結部分であり;
Xは第2の官能基である)を有している。
AおよびBに関する連結部分の例は、18まで含有する多重官能性化アルキル基を含んでおり、より好ましくは1〜10の間の炭素原子を含有しているが、これらに限定されない。窒素、酸素または硫黄といった異種原子は、アルキル鎖に含まれ得る。また、アルキル鎖は異種原子において枝分かれし得る。AおよびBに関する結合部分の他の例は、10まで含有する多重官能性化アリール基を含んでおり、より好ましくは5〜6の間の炭素原子を含有するが、これに限定されない。アリール基は、1つ以上の炭素原子、窒素原子、酸素原子または硫黄原子を用いて置換され得る。好適な連結基の他の例としては、参照によって本明細書にその全体が援用される米国特許第5,932,462号;米国特許第5,643,575号;および米国特許出願公開第2003/0143596号に記載されているこれらの連結基が挙げられるが、これらに限定されない。当業者は、連結部分に関して上記に挙げたものが、決して網羅的ではなく、かつ単に例示であること、および上述の品質を有する結合部分のすべてが、本発明における使用に好適であると考えらえることを認識する。
Xとしての使用に好適な官能基の例としては、ヒドロキシル、保護されたヒドロキシル、アルコキシル、活性化エステル(例えば、N−ヒドロキシスクシニミジルエステルおよび1−ベンゾトリアゾリルエステル)、活性化カルボネート(例えば、N−ヒドロキシスクシニミジルカルボネートおよび1−ベンゾトリアゾリルカルボネート)、アセタール、アルデヒド、アルデヒド水和物、アルケニル、アクリレート、メタクリレート、アクリルアミド、活性化スルホン、アミン、アミノオキシ、保護されたアミン、ヒドラジド、保護されたヒドラジド、保護されたチオール、カルボキシル酸、保護されたカルボキシル酸、イソシアネート、イソチオシアネート、マレイミド、ビニルスルホン、ジチオピリジン、ビニルピリジン、ヨードアセトアミド、エポキシド、グリオキサール、ジオン、メシレート、トシレート、トレシレート、アルケン、ケトンおよびアジドなどが挙げられるが、これらに限定されない。当業者によって理解されるように、選択されるX部分は、アジド基との反応が生じないように、アジド基とコンパティブル(compatible)であるべきである。アジド含有重合体誘導体は、第2の官能基(すなわち、X)がまたアジド部分であることを意味する同種の二官能性であり得るか、または第2の官能基が異なる官能基であることを意味する異種二官能性であり得る。
“保護された”という用語は、特定の反応条件下における化学的に反応性の官能基の反応を妨げる保護基または保護部分の存在を指す。保護基は、保護される化学的に反応性の基の種類に依存して変わる。例えば、化学的に反応性の基がアミンまたはヒドラジドである場合に、保護基は、tert−ブチルオキシカルボニル(t−Boc)および9−フルオレニルメトキシカルボニル(Fmoc)の群から選択され得る。化学的に反応性の基がチオールである場合に、保護基は、オルトピリジルジスルフィドであり得る。化学的に反応性の基がカルボキシル酸(例えば、ブタン酸またはプロピオン酸)またはヒドロキシル基である場合に、保護基は、ベンジル基またはメチル、エチルもしくはtert−ブチルといったアルキル基であり得る。また、当該技術において公知の他の保護基は、本発明に使用され得る。
文献における特定の末端官能基の例としては、N−スクシニミジルカルボネート(例えば、米国特許第5,281,698号、米国特許第5,468,478号を参照すればよい)、アミン(例えば、Buckmann et al. Makromol. Chem. 182:1379 (1981), Zaplipsky et al. Eur. Polym. J. 19:1177 (1983)を参照すればよい)、ヒドラジド(例えば、Andresz et al. Makromol. Chem. 179:301 (1978)を参照すればよい)、スクシニミジルプロピオネートおよびスクシニミジルブタノエート(例えば、Olson et al. in Poly(ethylene glycol) Chemistry & Biological Applications, pp 170-181, Harris & Zaplipsky Eds., ACS, Washington, D.C., 1997を参照すればよく;また、米国特許第5,672,662号を参照すればよい)、スクシニミジルスクシネート(例えば、Abuchowski et al. Cancer Biochem. Biophys. 7:175 (1984)およびJoppich et al. Macrolol. Chem. 180:1381 (1979)を参照すればよい)、スクシニミジルエステル(例えば、米国特許第4,670,417号を参照すればよい)、ベンゾトリアゾールカルボネート(例えば、米国特許第5,650,234号を参照すればよい)、グリシジルエステル(例えば、Pitha et al. Eur. J Biochem. 94:11 (1979)、Elling et al., Biotech. Appl. Biochem. 13:354 (1991)を参照すればよい)、オキシカルボニルイミダゾール(例えば、Beauchamp, et al., Anal. Biochem. 131:25 (1983), Tondelli et al. J. Controlled Release 1:251 (1985)を参照すればよい)、p−ニトロフェニルカルボネート(例えば、Veronese, et al., Appl. Biochem. Biotech., 11: 141 (1985);およびSartore et al., Appl. Biochem. Biotech., 27:45 (1991)を参照すればよい)、アルデヒド(例えば、Harris et al. J. Polym. Sci. Chem. Ed. 22:341 (1984)、米国特許第5,824,784号、米国特許第5,252,714号を参照すればよい)、マレイミド(例えば、Goodson et al. Bio/Technology 8:343 (1990)、Romani et al. in Chemistry of Peptides and Proteins 2:29 (1984)を参照すればよい)、オルトピリジル−ジスルフィド(例えば、Woghiren, et al. Bioconj. Chem. 4:314(1993)を参照すればよい)、アクリロール(例えば、Sawhney et al., Macromolecules, 26:581 (1993)を参照すればよい)、ビニルスルホン(例えば、米国特許第5,900,461号を参照すればよい)が挙げられるが、これらに限定されない。上述の参考文献および特許文献のすべては、参照によって本明細書に援用される。
本発明のある特定の実施形態において、本発明の重合体誘導体は、構造:
X-CH2CH2O-(CH2CH2O)n-CH2CH2-N=N=N
(ここで、
Xは、上述のような官能基であり;
nは、約20から約4000までである)
を有している重合体骨格を含んでいる。
他の実施形態において、本発明の重合体誘導体は、構造:
X-CH2CH2O-(CH2CH2O)n-CH2CH2-O-(CH2)m-W-N=N=N
(ここで、
Wは、1−10の炭素原子を備える脂肪族または芳香族の連結部分であり;
nは、約20から約4000までであり;
Xは、上述のような官能基である)
を有している重合体骨格を含んでいる。
本発明のアジド含有PEG誘導体は、当該技術において公知の種々の方法および/または本明細書に開示されている種々の方法によって調製され得る。以下に示されている1つの方法において、約800Daから約100000Daまでの平均分子量を有している水溶性重合体骨格であり、第1の官能基に対して結合される第1の末端および好適な脱離基に対して結合される第2の末端を有する重合体骨格は、アジドアニオン(好適な対イオン(ナトリウム、カリウム、およびtertブチルアンモニウムなどが挙げられる)と一対にされ得る)と反応させられる。脱離基は、求核置換を受け、かつアジド部分によって置換され、所望のアジド含有PEG重合体を生じる。
X-PEG-L+N3 - → X-PEG-N3
に示されているように、本発明における使用に好適な重合体骨格は、式X−PEG−L(ここで、PEGはポリ(エチレングリコール)であり、Xはアジド基と反応しない官能基であり、Lは好適な脱離基である)を有している。好適な官能基の例としては、ヒドロキシル、保護されたヒドロキシル、アセタール、アルケニル、アミン、アミノオキシ、保護されたアミン、保護されたヒドラジド、保護されたチオール、カルボキシル酸、保護されたカルボキシル酸、マレイミド、ジチオピリジン、およびビニルピリジン、およびケトンが挙げられるが、これらに限定されない。好適な脱離基の例としては、塩化物、臭化物、ヨウ化物、メシレート、トレシレート、およびトシレートが挙げられるが、これらに限定されない。
本発明のアジド含有重合体の誘導体を調製する他の方法において、アジド官能性基を有する結合剤は、約800Daから約100000Daまでの平均分子量を有している水溶性の重合体骨格と接触させられ、ここで、上記結合剤は、PEG重合体における化学的な官能性基と選択的に反応してアジド含有重合体誘導体産物を形成する化学的な官能性基を有しており、ここで、アジドは、結合剤よって重合体骨格から離されている。
例示的な反応手順が、以下に示される:
X-PEG-M+N-リンカー-N=N=N → PG-X-PEG-リンカー-N=N=N
(ここで、
PEGは、ポリ(エチレングリコール)であり、Xは、アルコキシまたは上述のような官能基といったキャップ形成基であり;
Mは、アジド官能性基と反応しないが、Nの官能基と効率的かつ選択的に反応する官能基である)。
好適な官能基の例としては、Nがアミンである場合にカルボキシル酸、カルボネートまたは活性エステルであるM;Nがヒドラジドまたはアミノオキシ部分である場合にケトンであるM;Nが求核基である場合に脱離基であるMが挙げられるが、これらに限定されない。
粗製産物の精製は、公知の方法(必要に応じてクロマトグラフィーに続く産物の沈殿が挙げられるが、これに限定されない)によって達成され得る。
より詳細な例は、アミンの1つがtert−ブチル−Bocといった保護基部分によって保護され、結果として生じる1保護されたPEGジアミンがアジド官能性基を有している連結部分と反応される、PEGジアミンの場合に関して、以下に示される:
BocHN-PEG-NH2+HO2C-(CH2)3-N=N=N。
この場合には、アミン基は、チオニル塩化物もしくはカルボジイミド試薬、およびN−ヒドロキシスクシニミドもしくはN−ヒドロキシベンゾトリアゾールといった種々の活性剤を用いて、カルボキシル酸基に対して結合されて、モノアミンPEG誘導体とアジド担持連結部分との間にアミド結合を作り出し得る。アミド結合の形成が成功した後に生じる、N−tert−ブチル−Boc−保護されたアジドを含んでいる誘導体は、生体活性分子を修飾するために直接に使用され得るか、または他の有用な官能基を組み込むために、さらに合成され得る。例えば、N−t−Boc基は、強酸を用いた処理によって加水分解されて、ω−アミノ−PEG−アジドを生成する。生じるアミンは、合成の手がかりとして使用されて、有益な異種の二官能性試薬にとっての、マレイミド基、活性化ジスルフィド、および活性化エステルなどといった他の有用な官能性基を組み込み得る。
異種の二官能性誘導体は、重合体の末端のそれぞれに対して異なる分子を連結させることが所望される場合に特に有用である。例えば、ω−N−アミノ−N−アジドPEGは、活性化された求核基(例えば、アルデヒド、ケトン、および活性化カルボネートなど)を有している分子の、PEGの1つの末端に対する連結、およびアセチレン基を有している分子の、PEGの他の末端に対する連結を可能にする。
本発明の他の実施形態において、重合体誘導体は、構造:
X-A-POLY-B-C≡C-R
(ここで、
Rは、Hもしくはアルキル、アルキレン、アルコキシ、またはアリールもしくは置換アリールであり得;
Bは、存在し得るか、または存在しない場合があり得る連結部分であり;
POLYは、水溶性の非抗原性重合体であり;
Aは、存在し得るか、または存在しない場合があり得、かつBと同じであり得るか、または異なり得る連結部分であり;
Xは、第2の官能基である)
を有している。
AおよびBに関する連結部分の例は、18まで含有する多機能化アルキル基を含んでおり、より好ましくは1〜10の間の炭素原子を含有しているが、これらに限定されない。窒素、酸素または硫黄といった異種原子は、アルキル鎖と共に含まれ得る。また、アルキル鎖は異種原子において分岐され得る。AおよびBに関する連結部分の例は、10まで含有する多機能化アルキル基を含んでおり、より好ましくは5−6の間の炭素原子を含有しているが、これらに限定されない。アリール基は、1つ以上の炭素原子、窒素原子、酸素原子または硫黄原子を用いて置換され得る。好適な連結基の他の例としては、参照によって本明細書にその全体が援用される米国特許第5,932,462号、米国特許第5,643,575号および米国特許出願公開第2003/0143596号に記載されている連結基が挙げられる。当業者は、連結部分に関して上記に挙げたものが、決して網羅的なものではなく、かつ単に例示であること、および上述のような品質を有する連結部材料のすべてが、本発明における使用に好適であると考えらえることを認識する。
Xとしての利用に好適な官能基の例としては、ヒドロキシル、保護されたヒドロキシル、アルコキシル、活性化エステル(例えば、N−ヒドロキシスクシニミジルエステルおよび1−ベンゾトリアゾリルエステル)、活性なカルボネート(例えば、N−ヒドロキシスクシニミジルカルボネートおよび1−ベンゾトリアゾリルカルボネート)、アセタール、アルデヒド、アルデヒド水和物、アルケニル、アクリレート、メタクリレート、アクリルアミド、活性化スルホン、アミン、アミノオキシ、保護されたアミン、ヒドラジド、保護されたヒドラジド、保護されたチオール、カルボキシル酸、保護されたカルボキシル酸、イソシアネート、イソチオシアネート、マレイミド、ビニルスルホン、ジチオピリジン、ビニルピリジン、ヨードアセトアミド、エポキシド、グリオキサール、ジオン、メシレート、トシレート、およびトレシレート、アルケン、ケトン、およびアセチレンが挙げられる。理解されるように、選択されるX部分は、アセチレン基との反応が生じないように、アセチレン基とコンパティブルであるべきである。アセチレン含有重合体誘導体は、第2の官能基(すなわちX)がまた、アセチレン部分であることを意味する同種の二官能性であり得るか、または第2の官能基が異なる官能基であることを意味する異種の二官能性であり得る。
本発明の他の実施形態において、重合体誘導体は、構造:
X-CH2CH2O-(CH2CH2O)n-CH2CH2-O-(CH2)m-C≡CH
(ここで、
Xは、上述のような官能基であり;
nは、約20から約4000であり;
mは、1から10の間である)
を有している重合体骨格を含んでいる。異種二官能性PEG重合体のそれぞれの詳細な例が以下に示される。
本発明のアセチレン含有PEG誘導体は、当業者に公知の方法および/または本明細書に開示されている方法を用いて調製され得る。1つの方法において、約800Daから約100000Daまでの平均分子量を有している水溶性重合体骨格であり、第1の官能基に対して結合される第1の末端および好適な求核基に対して結合される第2の末端を有する重合体骨格は、PEGにおける求核基との反応に好適であるアセチレン基および脱離基の両方を有している化合物と反応される。求核部分を有するPEG重合体および脱離基を有している分子が組み合せられると、脱離基は、求核置換を受け、かつ求核部分によって置換され、所望のアセチレン含有重合体を生じる。
X-PEG-Nu+L-A-C → X-PEG-Nu-A-C≡CR’
に示されるように、反応における使用に好ましい重合体骨格は、式X−PEG−Nu(ここで、PEGはポリ(エチレングリコール)であり、Nuは求核部分であり、かつXはNu、Lまたはアセチレン官能性基と反応しない官能基である)を有している。
Nuの例としては、SN2−型機序を介して主に反応するアミン、アルコキシ、アリールオキシ、スルフィドリル、イミノ、カルボキシレート、ヒドラジド、アミノオキシ基が挙げられるが、これらに限定されない。Nuの付加的な例としては、求核付加反応を介して主に反応するこれらの官能基が挙げられる。L基の例としては、塩化物、臭化物、ヨウ化物、メシレート、トレシレート、およびトシレートおよび求核置換を受けると予想される他の基、これらと同様にケトン、アルデヒド、チオエステル、オレフィン、α−β不飽和カルボニル基、カルボネートおよび求核基によって付加を受けると予想される他の求核性基が挙げられる。
本発明の他の実施形態において、Aは、1〜10の間の炭素原子の脂肪酸リンカー、または6〜14の間の炭素原子の置換アリール環である。Xはアジド基と反応しない官能基であり、Lは好適な脱離基である。
本発明のアセチレン含有重合体の誘導体を調製する他の方法において、約800Daから約100000Daまでの平均分子量を有しており、1つの末端に保護された官能基もしくはキャップ形成剤のいずれかを有しており、もう一方の末端に好適な脱離基を有するPEG重合体は、アセチレンアニオンによって接触される。
例示的な反応手順は、以下に示される:
X-PEG-L+-C≡CR’ → X-PEG-C≡CR’
(ここで、
PEGはポリ(エチレングリコール)であり、Xはキャップ形成基(例えば、アルコキシまたは上述のような官能基)であり;
R’はH、アルキル、アルコキシ、アリールもしくはアリールオキシ基、または置換アルキル、置換アルコキシル、置換アリールもしくは置換アリールオキシ基のいずれかである)。
上述の例において、脱離基Lは、十分な濃度のアセチレンアニオンと接触される場合に、SN2−型置換を受けるために十分に反応性でなければならない。アセチレンアニオンによる脱離基のSN2置換の達成に要求される反応条件は、当業者に公知である。
粗製産物の精製は、当該分野に公知の方法(必要に応じて、クロマトグラフィーに続く沈殿が挙げられる)によって通常に達成され得るが、これに限定されない。
水溶性重合体は本発明のfEPOポリペプチドに対して連結され得る。水溶性重合体は、(1)天然にコードされていないアミノ酸もしくは天然にコードされるアミノ酸の任意の官能基もしくは置換基、またはfEPOポリペプチドに組み込まれている天然にコードされていないアミノ酸、または(2)天然にコードされるアミノ酸に付加された任意の官能基もしくは置換基を介して連結され得る。代替可能に、水溶性重合体は、天然に存在するアミノ酸(システイン、リジンまたはN末端残基のアミノ酸が挙げられるが、これらに限定されない)を介して、天然にコードされていないアミノ酸を組み込んでいるfEPOポリペプチドに連結され得る。いくつかの場合において、本発明のfEPOポリペプチドは、1、2、3、4、5、6、7、8、9、10の非天然アミノ酸を含んでおり、ここで、天然にコードされていないアミノ酸の1つ以上は、(複数の)水溶性重合体(PEGおよび/またはオリゴ糖が挙げられるが、これらに限定されない)に連結される。いくつかの場合において、本発明のfEPOポリペプチドは、水溶性重合体に連結された1、2、3、4、5、6、7、8、9、10またはそれ以上の天然にコードされていないアミノ酸をさらに含んでいる。いくつかの場合において、本発明のfEPOポリペプチドは、水溶性重合体に連結された天然にコードされていないアミノ酸の1つ以上、および水溶性重合体に連結された天然に存在するアミノ酸の1つ以上を含んでいる。いくつかの場合において、本発明に使用される水溶性重合体は、その非抱合形態と比べて、fEPOポリペプチドの半減期を延長させる。
本発明のfEPOポリペプチドに対して連結される水溶性重合体の数(すなわちPEG付加または糖鎖付加の程度)は、変更された(増強されたか、または低減されたが挙げられるが、これらに限定されない)薬理的特性、薬物動態的特性、または薬力学特性(例えばインビボにおける半減期)を与えるために調節され得る。いくつかの実施形態において、fEPOの半減期は、少なくとも約10、20、30、40、50、60、70、80、90パーセント、2倍、5倍、10倍、50倍、または少なくとも約100倍に、非修飾のポリペプチドを超えて延長される。
(強い求核性基(すなわちヒドラジド、ヒドラジン、ヒドロキシアミンまたはセミカルバジド)を含んでいるPEG誘導体)
本発明の一実施形態において、カルボニルを含有する天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドは、PEG骨格に対して直接に連結されている末端のヒドラジン、ヒドロキシアミン、ヒドラジドまたはセミカルバジド部分を含んでいるPEG誘導体を用いて修飾されている。
いくつかの実施形態において、ヒドロキシルアミン末端PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)m-O-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは、100〜1000である(すなわち、平均分子量は5−40kDaの間である))
を有している。
いくつかの実施形態において、ヒドラジン含有PEG誘導体またはヒドラジド含有PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)m-X-NH-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000であり、Xは任意に、存在し得るか、または存在しない場合があり得るカルボニル基(C=O)である)
を有している。
いくつかの実施形態において、セミカルバジド含有PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)m-NH-C(O)-NH-NH2
(ここで、Rは、単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000である)
を有している。
本発明の他の実施形態において、カルボニル含有アミノ酸を含んでいるfEPOポリペプチドは、アミド結合を用いてPEG骨格に連結されている末端のヒドロキシアミン、ヒドラジド、ヒドラジン、またはセミカルバジド部分を含んでいるPEG誘導体を用いて修飾されている。
いくつかの実施形態において、ヒドロキシアミン末端PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)(CH2)m-O-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000である(すなわち、平均分子量は5−40kDaの間である))
を有している。
いくつかの実施形態において、ヒドラジン含有PEG誘導体またはヒドラジド含有PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)(CH2)m-X-NH-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000であり、かつXは任意に、存在し得るかまたは存在しない場合があり得るカルボニル基(C=O)である)
を有している。
いくつかの実施形態において、セミカルバジド含有PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)(CH2)m-NH-C(O)-NH-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000である)
を有している。
本発明の他の実施形態において、カルボニル含有アミノ酸を含んでいるfEPOポリペプチドは、末端のヒドラジン、ヒドロキシアミン、ヒドラジドまたはセミカルバジド部分を含んでいる分枝鎖状のPEG(10〜40kDa(より好ましくは、5〜20kDaである)の範囲にある分子量を有する分枝鎖状のPEGのそれぞれの鎖を伴う)を用いて修飾されている。
本発明の他の実施形態において、天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドは、分枝鎖状構造を有しているPEG誘導体を用いて修飾されている。例えば、いくつかの実施形態において、ヒドラジン末端PEG誘導体またはヒドラジド末端PEG誘導体は、以下の構造:
[RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)]2CH(CH2)m-X-NH-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000であり、Xは任意に、存在し得るか、または存在しない場合があり得るカルボニル基(C=O)である)
を有している。
いくつかの実施形態において、セミカルバジド基を含有するPEG誘導体は、構造:
[RO-(CH2CH2O)n-O-(CH2)2-C(O)-NH-CH2-CH2]2CH-X-(CH2)m-NH-C(O)-NH-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、Xは任意にNH、O、S、C(O)であるか、または存在せず、mは2〜10であり、nは100〜1000である)
を有している。
いくつかの実施形態において、ヒドロキシアミン基を含有するPEG誘導体は、構造:
[RO-(CH2CH2O)n-O-(CH2)2-C(O)-NH-CH2-CH2]2CH-X-(CH2)m-O-NH2
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、Xは任意にNH、O、S、C(O)であるか、または存在せず、mは2〜10であり、nは100〜1000である)
を有している。
水溶性重合体がfEPOに対して連結される程度および部位は、fEPO受容体のSite1に対するfEPOの結合を調節し得る。いくつかの実施形態において、連結は、fEPOポリペプチドが、fEPO受容体のSite1に、平衡化結合アッセイ(例えば、hGHについてSpencer et al., J. Biol. Chem., 263:7862-7867 (1988) に記載の通りである)によって測定されるときに約400nM以下のKdを有して、150nM以下のKdを有して、そしていくつかの場合において100nM以下のKdを有して、結合するように配置される。
重合体の活性化およびペプチドの抱合に関する方法および化学反応は、文献に記載され、かつ当該技術において公知である。重合体の活性化に通常に使用される方法としては、シアン、臭化物、過ヨウ素酸塩、グルタルアルデヒド、ビエポキシド、エピクロロヒドリン、ジビニルスルホン、カルボジイミド、ハロゲン化スルホニル、トリクロロトリアジンなどを有する官能基の活性化が挙げられるが、これらに限定されない(R. F. Taylor, (1991), PROTEIN IMMOBILISATION. FUNDAMENTAL AND APPLICATIONS, Marcel Dekker, N.Y.; S. S. Wong, (1992), CHEMISTRY OF PROTEIN CONJUGATION AND CROSSLINKING, CRC Press, Boca Raton; G. T. Hermanson et al., (1993), IMMOBILIZED AFFINITY LIGAND TECHNIQUES, Academic Press, N.Y.; Dunn, R.L., et al., Eds. POLYMERIC DRUGS AND DRUG DELIVERY SYSTEMS, ACS Symposium Series Vol. 469, American Chemical Society, Washington, D.C. 1991を参照すればよい)。
PEGの官能性化および抱合に関する種々の概説および研究論文が利用可能である。例えば、Harris, Macronol. Chem. Phys. C25: 325-373 (1985); Scouten, Methods in Enzymology 135: 30-65 (1987); Wong et al., Enzyme Microb. Technol. 14: 866-874 (1992); Delgado et al., Critical Reviews in Therapeutic Drug Carrier Systems 9: 249-304 (1992); Zalipsky, Bioconjugate Chem. 6: 150-165 (1995)を参照すればよい。
また、重合体を活性化する方法は、国際公開第94/17039号、米国特許第5,324,844号、国際公開第94/18247号、国際公開第94/04193号、米国特許第5,219,564号、米国特許第5,122,614号、国際公開第90/13540号、米国特許第5,281,698号、およびさらに国際公開第93/15189号に見出され得、かつ活性化重合体と酵素(凝結因子VIII(国際公開第94/15625号)、ヘモグロビン(国際公開第94/09027号)、酸素運搬タンパク質(米国特許第4,412,989号)、リボヌクレアーゼおよび超酸化物不均化酵素(Veronese at al., App. Biochem. Biotech. 11: 141-45 (1985))が挙げられるが、これらに限定されない)との間における抱合に関して見出され得る。
天然にコードされていないアミノ酸(例えば、p−アジド−L−フェニルアラニン)を含んでいるfEPOポリペプチドのPEG付加(すなわち、任意の水溶性重合体の付加)は、任意の従来の方法によって実施される。例えば、fEPOポリペプチドはアルキン末端化mPEG誘導体を用いて修飾される。簡単に言うと、過剰のmPEG(5000)−O−CH2−C≡CHが、室温において攪拌しながらp−アジド−L−Phe含有fEPOの水性溶液に対して加えられる。典型的に、水性溶液は、反応が実施されるべきpH(一般的に約pH4〜10)に近いpKaを有する緩衝液を用いて緩衝化される。pH7.5におけるPEG付加に好適な緩衝液の例としては、例えば、HEPES、リン酸塩、ホウ酸塩、TRIS−HCl、EPPS、およびTESが挙げられるが、これらに限定されない。pHは、継続的に観察され、必要に応じて調節される。反応は放置されて、典型的に1〜48時間にわたって継続される。
反応産物は、続いて疎水性相互作用クロマトグラフィーにかけられて、遊離mPEG(5000)−O−CH2−C≡CH、ならびにブロックされていないPEGが分子の両方の末端において活性化される場合に形成し、これによってfEPOバリアント分子を架橋し得るPEG化fEPOポリペプチドの任意の高分子量複合体から、PEG付加fEPOバリアントを分離する。疎水性相互作用クロマトグラフィーの条件は、遊離mPEG(5000)−O−CH2−C≡CHがカラムを通り抜ける一方で、PEG付加fEPOバリアント複合体が、1つ以上のPEG基に抱合された1つのfEPOバリアント分子を含んでいる所望の形態の後に溶出するような条件である。好適な条件は、所望の抱合物に対する架橋化複合体の相対的な大きさに依存して変わり、当業者によって容易に決定される。所望の抱合物を含んでいる溶出物は、限外ろ過によって濃縮され、ダイアフィルトレーションによって脱塩化される。
必要に応じて、疎水性相互作用クロマトグラフィーから得られたPEG付加fEPOは、当業者に公知の1つ以上の手法(アフィニティークロマトグラフィー;アニオンまたはカチオン交換クロマトグラフィー(DEAE SEPHAROSEを用いる、が挙げられるが、これに限定されない);シリカ上におけるクロマトグラフィー;逆相HPLC;ゲルろ過(SEPHADEX G-75を用いる、が挙げられるが、これらに限定されない);疎水性相互作用クロマトグラフィー;サイズ排除クロマトグラフィー、金属キレートクロマトグラフィー;限外ろ過/ダイアフィルトレーション;エタノール沈殿;硫酸アンモニウム沈殿;等電点電気泳動;置換クロマトグラフィー;電気泳動手法(分離用の等電点電気泳動が挙げられるが、これに限定されない)、差異的可溶性(硫酸アンモニウム沈殿が挙げられるが、これに限定されない)、または抽出が挙げられるが、これらに限定されない)によってさらに精製され得る。見かけの分子量は、球状タンパク質標準との比較によるGPCによって、見積もられ得る(Preneta, AZ in PROTEIN PURIFICATION METHODS, A PRACTICAL APPROACH (Harris & Angal, Eds.) IRL Press 1989, 293-306)。fEPO−PEG抱合物は、タンパク質分解(トリプシン切断が挙げられるが、これに限定されない)に続く質量分析によって評価され得る。Pepinsky B., et al., J. Pharmcol. & Exp. Ther. 297(3):1059-66 (2001)。
本発明のfEPOポリペプチドのアミノ酸に連結された水溶性重合体は、制限されることなく、さらに誘導体化され得るか、または置換され得る。
(アジド含有PEG誘導体)
本発明の他の実施形態において、fEPOポリペプチドは、天然にコードされていないアミノ酸の側鎖に存在するアルキン部分と反応するアジド部分を含んでいるPEG誘導体を用いて、修飾されている。一般的に、PEG誘導体は、1−100kDaを有しており、いくつかの実施形態において10−40kDaの範囲にある平均分子量を有している。
いくつかの実施形態において、アジド末端PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)m-N3
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000である(すなわち、平均分子量は5〜40kDaの間である))
を有している。
他の実施形態において、アジド末端PEG誘導体は、構造:
RO-(CH2CH2O)n-O-(CH2)m-NH-C(O)-(CH2)p-N3
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、pは2〜10であり、nは100〜1000である(すなわち、平均分子量は5〜40kDaの間である))
を有している。
本発明の他の実施形態において、アルキン含有アミノ酸を含んでいるfEPOポリペプチドは、末端アジド部分を含んでいる分枝鎖状のPEG誘導体(10〜40kDa、およびより好ましくは5〜20kDaの範囲にある分子量を有する分枝鎖状のPEGのそれぞれの鎖を伴う)を用いて修飾されている。例えば、いくつかの実施形態において、アジド末端PEG誘導体は、以下の構造:
[RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)]2CH(CH2)m-X-(CH2)pN3
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、pは2〜10であり、nは100〜1000であり、かつXは任意に、いずれの場合においても存在し得るか、または存在し得ない、O、N、Sまたはカルボニル基(C=O)である)
を有している。
(アルキン含有PEG誘導体)
本発明の他の実施形態において、fEPOポリペプチドは、天然にコードされていないアミノ酸の側鎖に存在しているアジド部分と反応するアルキン部分を含んでいる、PEG誘導体を用いて修飾されている。
いくつかの実施形態において、アルキン末端PEG誘導体は、以下の構造:
RO-(CH2CH2O)n-O-(CH2)m-C≡CH
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、nは100〜1000である(すなわち、平均分子量は5〜40kDaの間である))
を有している。
本発明の他の実施形態において、アルキンを含んでいり天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドは、アミド結合を用いてPEGに対して連結される末端のアジドまたは末端のアルキン部分を含んでいるPEG誘導体を用いて、修飾されている。
いくつかの実施形態において、アルキン末端PEG誘導体は、以下の構造:
RO-(CH2CH2O)n-O-(CH2)m-NH-C(O)-(CH2)p-C≡CH
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、pは2〜10であり、nは100〜1000である)
を有している。
本発明の他の実施形態において、アジド含有アミノ酸を含んでいるfEPOポリペプチドは、末端のアルキン部分を含んでいる分枝鎖状のPEG誘導体(10〜40kDa、およびより好ましくは5〜20kDaの範囲にある分子量を有している分枝鎖状のPEGのそれぞれの鎖を伴う)を用いて修飾されている。例えば、いくつかの実施形態において、アルキン末端PEG誘導体は、以下の構造:
[RO-(CH2CH2O)n-O-(CH2)2-NH-C(O)]2CH(CH2)m-X-(CH2)pC≡CH
(ここで、Rは単純なアルキル(メチル、エチル、プロピルなど)であり、mは2〜10であり、pは2〜10であり、nは100〜1000であり、かつXはO、N、Sまたはカルボニル基(C=O)であるか、または存在しない)
を有している。
(ホスフィン含有PEG誘導体)
本発明の他の実施形態において、fEPOポリペプチドは、活性化官能基(エステル、カルボネートが挙げられるが、これらに限定されない)を含有しており、天然にコードされていないアミノ酸の側鎖に存在しているアジド部分と反応するアリールホスフィン基をさらに含んでいるPEG誘導体を用いて、修飾されている。一般的に、PEG誘導体は、1〜100kDa、そしていくつかの実施形態において10〜40kDaの範囲の平均分子量を有している。
いくつかの実施形態において、PEG誘導体は、構造:
(ここで、nは1〜10であり、XはO、NまたはSであり得るか、または存在しない場合があり得、Phはフェニルであり、かつWは水溶性重合体である)
を有している。
いくつかの実施形態において、PEG誘導体は、構造:
(ここで、Xは、O、NまたはSであるか、または存在せず、Phはフェニルであり、Wは水溶性重合体であり、RはH、アルキル、アリール、置換アルキルおよび置換アリール基であり得る)。例示的なR基としては、−CH2、−C(CH3)3、−OR’,−NR’R’’、−SR’、−ハロゲン、−C(O)R’、−CONR’R’’、−S(O)2R’、−S(O)2NR’R’’、−CNおよび−NO2が挙げられるが、これらに限定されない。R’、R’’、R’’’およびR’’’’は互いに独立して、水素、置換もしくは非置換のヘテロアルキル、置換もしくは非置換のアリール(1−3のハロゲンを用いて置換されているアリールが挙げられるが、これらに限定されない)、置換もしくは非置換のアルキル、アルコキシもしくはチオアルコキシ、またはアルキルアリール基を指す。本発明の化合物が1つ以上のR基を含んでいる場合に、例えば、R基のそれぞれは独立して、2つ以上のこれらの基が存在する場合に、R’、R’’、R’’’およびR’’’’のそれぞれであるように選択される。R’およびR’’が同じ窒素原子に連結される場合に、それらは、窒素原子と組み合わさって、5−、6−または7−員環を形成し得る。例えば、−NR’R’’は、1−ピロリジニルおよび4−モルホリニルを包含することを意図されているが、これらに限定されない。置換基の上述の議論から、当業者は、“アルキル”という用語が、水素基以外の基(例えば、ハロアルキル(−CF3および−CH2CF3が挙げられるが、これらに限定されない)およびアシル(−C(O)CH3、−C(O)CF3、および−C(O)CH2OCH3などが挙げられるが、これらに限定されない))に結合される炭素原子を含めた基を包含することを意図している。
(他のPEG誘導体および一般的なPEG付加技術)
fEPOポリペプチドに連結され得る他の例示的なPEG分子だけでなく、PEG付加方法としては、例えば、参照によって本明細書に援用される米国特許出願公開第2004/0001838号;米国特許出願公開第2002/0052009号;米国特許出願公開第2003/0162949号;米国特許出願公開第2004/0013637号;米国特許出願公開第2003/0228274号;米国特許出願公開第2003/0220447号;米国特許出願公開第2003/0158333号;米国特許出願公開第2003/0143596号;米国特許出願公開第2003/0114647号;米国特許出願公開第2003/0105275号;米国特許出願公開第2003/0105224号;米国特許出願公開第2003/0023023号;米国特許出願公開第2002/0156047号;米国特許出願公開第2002/0099133号;米国特許出願公開第2002/0086939号;米国特許出願公開第2002/0082345号;米国特許出願公開第2002/0072573号;米国特許出願公開第2002/0052430号;米国特許出願公開第2002/0040076号;米国特許出願公開第2002/0037949号;米国特許出願公開第2002/0002250号;米国特許出願公開第2001/0056171号;米国特許出願公開第2001/0044526号;米国特許出願公開第2001/0027217;米国特許出願公開第2001/0021763号;米国特許第6,646,110号;米国特許第5,824,778号;米国特許第5,476,653号;米国特許第5,219,564号;米国特許第5,629,384号;米国特許第5,736,625号;米国特許第4,902,502号;米国特許第5,281,698号;米国特許第5,122,614号;米国特許第5,473,034号;米国特許第5,516,673号;米国特許第5,382,657号;米国特許第6,552,167号;米国特許第6,610,281号;米国特許第6,515,100号;米国特許第6,461,603号;米国特許第6,436,386号;米国特許第6,214,966号;米国特許第5,990,237号;米国特許第5,900,461号;米国特許第5,739,208号;米国特許第5,672,662号;米国特許第5,446,090号;米国特許第5,808,096号;米国特許第5,612,460号;米国特許第5,324,844号;米国特許第5,252,714号;米国特許第6,420,339号;米国特許第6,201,072号;米国特許第6,451,346号;米国特許第6,306,821号;米国特許第5,559,213号;米国特許第5,612,460号;米国特許第5,747,646号;米国特許第5,834,594号;米国特許第5,849,860号;米国特許第5,980,948号;米国特許第6,004,573号;米国特許第6,129,912号;国際公開第97/32607号、欧州特許出願公開第229,108号、欧州特許出願公開第402,378号、国際公開第92/16555号、国際公開第94/04193号、国際公開第94/14758号、国際公開第94/17039号、国際公開第94/18247号、国際公開第94/28024号、国際公開第95/00162号、国際公開第95/11924, WO95/13090号、国際公開第95/33490号、国際公開第96/00080号、国際公開第97/18832号、国際公開第98/41562号、国際公開第98/48837号、国際公開第99/32134号、国際公開第99/32139号、国際公開第99/32140号、国際公開第96/40791号、国際公開第98/32466号、国際公開第95/06058号、欧州特許出願公開第439 508号、国際公開第97/03106号、国際公開第96/21469号、国際公開第95/13312号、欧州特許出願公開第921 131号、国際公開第98/05363号、欧州特許出願公開第809 996号、国際公開第96/41813号、国際公開第96/07670号、欧州特許出願公開第605 963号、欧州特許出願公開第510 356号、欧州特許出願公開第400 472号、欧州特許出願公開第183 503号および欧州特許出願公開第154 316号に記載されているそれらが挙げられる。本明細書に記載されているPEG分子のいずれもが、任意の形態(単鎖、分枝状鎖、マルチアーム鎖、単官能性、二官能性、多官能性、またはこれらの組合せが挙げられるが、これらに限定されない)において使用され得る。
(血清アルブミンに対する親和性の増強)
また、種々の分子が本発明のfEPOポリペプチドと融合されて、血清中のfEPOの半減期を調節し得る。いくつかの実施形態において、分子が本発明のfEPOポリペプチドに対して連結されるか、または融合されて、動物における内因性の血清アルブミンに対する親和性を増強し得る。
例えば、いくつかの場合において、fEPOポリペプチドおよびアルブミン結合配列の組換え融合体が作製される。例示的なアルブミン結合配列としては、ストレプトコッカスのタンパク質Gから得られるアルブミン結合ドメイン(例えば、Makrides et al., J. Pharmacol. Exp. Ther. 277:534-542 (1996)およびSjolander et al., J, Immunol. Methods 201:115-123 (1997)を参照すればよい)、または例えば、Dennis, et al., J. Biol. Chem. 277:35035-35043 (2002)に記載されているペプチドといったアルブミン結合ペプチドが挙げられるが、これらに限定されない。
他の実施形態において、本発明のfEPOポリペプチドは、脂肪酸を用いてアシル化される。いくつかの場合において、脂肪酸は血清アルブミンに対する結合を促進する。例えばKurtzhals, et al., Biochem. J. 312:725-731 (1995)を参照すればよい。
他の実施形態において、本発明のfEPOポリペプチドは、血清アルブミン(ヒトアルブミンが挙げられるが、これに限定されない)と直接に融合される。例えば、参照によって本明細書に援用される米国特許第6,548,653号を参照すればよい。
当業者であれば、広範な生物学的に活性な分子がまた、本発明におけるfEPOに対して連結されて、血清アルブミンまたは他の血清成分との結合を調節し得ることを認識する。
XI.fEPOの糖鎖付加
本発明は、糖付加残基を有する天然にコードされていないアミノ酸を1つ以上組み込んでいる、fEPOポリペプチドを包含する。糖付加残基は、天然(N−アセチルグルコサミンが挙げられるが、これに限定されない)、または非天然(3−フルオロガラクトースが挙げられるが、これに限定されない)であり得る。糖は、N型もしくはO型の糖鎖結合(N−アセチルガラクトース−L−セリンが挙げられるが、これに限定されない)、または非天然の結合(オキシムまたは対応するC型−またはS型のグリコシドが挙げられるが、これらに限定されない)のいずれかによって、天然にコードされていないアミノ酸に連結され得る。
糖(グリコシルが挙げられるが、これに限定されない)部分は、インビボまたはインビトロにおいてfEPOポリペプチドに付加され得る。本発明のいくつかの実施形態において、カルボニルを含んでいる天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドは、オキシム結合を介して対応する糖鎖付加ポリペプチドを生成するためのアミノオキシ基を有している糖誘導体を用いて修飾される。天然にコードされていないアミノ酸に連結されると、糖は、fEPOポリペプチドに結合されるオリゴ糖を生成するための糖転移酵素および他の酵素を用いた処理によって、さらに合成され得る。例えば、H. Liu, et al. J. Am. Chem. Soc. 125: 1702-1703 (2003)を参照すればよい。
本発明のいくつかの実施形態において、カルボニルを含んでいる天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドは、アミノオキシ誘導体として調製される所定の構造を有しているグリカンを用いて、直接に修飾される。当業者は、他の官能性基(アジド、ヒドラジド、ヒドラジン、およびセミカルバジドが挙げられるが、これらに限定されない)が、天然にコードされていないアミノ酸に対する糖の連結に対して使用され得ることを認識する。
本発明のいくつかの実施形態において、アジドまたはアルキニルを含んでいる天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドは、それから、アルキニルまたはアジド誘導体のそれぞれ(限定されないが、これら挙げられる)を用いた、ヒュイゲン[3+2]環付加反応によって(限定されないが、これが挙げられる)、修飾される。この方法は、タンパク質が非常に高い選択性を有して修飾されることを可能にする。
XII.GHスーパージーンファミリーの二量体および多量体
また、本発明は、GHスーパージーンファミリーのメンバーの組合せ(EPOが挙げられるが、これらに限定されない)のホモ二量体、ヘテロ二量体、ホモ多量体またはヘテロ多量体(すなわち三量体、四量体など)を提供する。ここで、GHスーパージーンファミリーのメンバーのポリペプチド(例えば、1つ以上の天然にコードされていないアミノ酸を含んでいるfEPO)は、GHスーパージーンファミリーのメンバーもしくはそれらのバリアント、またはGHスーパージーンファミリーのメンバーではない任意の他のポリペプチドと、ポリペプチド骨格に対して直接にか、またはリンカーを介して結合されている。単量体と比べて増加しているその分子量に起因して、GHスーパージーンファミリーのメンバー(例えばfEPO)の二量体または多量体の抱合物は、単量体のGHスーパージーンファミリーのメンバーに対して、新たな特性または所望の特性(異なる薬理作用、異なる薬物動態、異なる薬力学、調節されている治療半減期、または修飾されている血漿半減期が挙げられるが、これらに限定されない)を示し得る。いくつかの実施形態において、本発明のGHスーパージーンファミリーのメンバー(例えばfEPO)の二量体は、GHスーパージーンファミリーのメンバーの受容体の二量体化を調節する。他の実施形態において、本発明のGHスーパージーンファミリーのメンバーの二量体または多量体は、GHスーパージーンファミリーのメンバーの受容体のアンタゴニスト、アゴニストまたは調節因子として作用する。
いくつかの実施形態において、二量体または多量体を含んでいるfEPOに存在している1つ以上のfEPO分子は、SiteII結合領域内に存在しており、かつ水溶性重合体と連結されている天然にコードされていないアミノ酸を含んでいる。したがって、二量体または多量体のfEPO分子のそれぞれは、SiteIの接合点を介してfEPO受容体との結合に利用可能であるが、SiteIIの接合点を介してfEPO受容体との結合に利用可能ではない。このようにして、fEPOの二量体または多量体は、2つの異なるfEPO受容体のそれぞれとのSiteI部位における結合を可能にするが、fEPO分子がSiteIIに存在している遺伝的にコードされていないアミノ酸と連結されている水溶性重合体を有しているので、fEPO受容体はfEPOリガンドのSiteII領域に結合できず、当該二量体または多量体は、fEPOアンタゴニストの機能を果たす。いくつかの実施形態において、二量体または多量体を含んでいるfEPOに存在しているfEPO分子の1つ以上は、SiteI結合領域に存在しており、かつ水溶性重合体と連結されている天然にコードされていないアミノ酸を含んでおり、SiteII領域との結合が可能である。代替的に、いくつかの実施形態において、二量体または多量体を含んでいるfEPOに存在するfEPO分子の1つ以上は、SiteIおよびSiteIIにおける結合が可能であるように、SiteIまたはSiteIIの結合領域内ではない部位に存在しており、かつ水溶性重合体と連結されている天然にコードされていないアミノ酸を含んでいる。いくつかの実施形態において、結合に利用可能なSiteI、SiteIIまたはその両方を有しているfEPO分子の組合せが使用される。結合に利用可能な少なくとも1つのSiteIを有しており、かつ結合に利用可能な少なくとも1つのSiteIIを有しているfEPO分子の組合せは、所望の活性または特性を有している分子を提供し得る。さらに、結合に利用可能なSiteIおよびSiteIIを有しているfEPO分子の組合せは、スーパーアゴニストfEPO分子を提供し得る。
いくつかの実施形態において、GHスーパージーンファミリーのメンバーの複数のポリペプチドは、直接に(Asn−Lysのアミド結合またはCys−Cysのジスルフィド結合を介してが挙げられるが、これらに限定されない)連結されている。いくつかの実施形態において、連結されているGHスーパージーンファミリーのメンバーのポリペプチドおよび/または連結されているGHスーパージーンファミリーのメンバーではないポリペプチドは、二量体化を容易にする異なる天然にコードされていないアミノ酸を含んでいる。この例としては、第1のfEPOポリペプチドの天然にコードされていないアミノ酸の1つにおけるアルキンおよび第2のGHスーパージーンファミリーのメンバーのポリペプチドの天然にコードされていないアミノ酸の1つにおけるアジドがヒュイゲン[3+2]環付加を介して抱合されていることが挙げられるが、これらに限定されない。代替的に、ケトンを含有している天然にコードされていないアミノ酸を含んでいる第1の、GHスーパージーンファミリーのメンバーのポリペプチドおよび/または連結されているGHスーパージーンファミリーのメンバーでなはいポリペプチドは、ヒドロキシアミンを含有している天然にコードされていないアミノ酸を含んでいる第2のGHスーパージーンファミリーのメンバーのポリペプチドと抱合され得、これらのポリペプチドは対応するオキシムの形成を介して反応する。
代替的に、2つのGHスーパージーンファミリーのメンバーのポリペプチド、および/または連結されているGHスーパージーンファミリーのメンバーではないポリペプチドは、リンカーを介して連結されている。任意のヘテロ−またはホモ−二機能性リンカーを使用して、同じか、または異なる一次配列を有している、2つのGHスーパージーンファミリーのメンバーのポリペプチドおよび/または連結されているGHスーパージーンファミリーのメンバーではないポリペプチドを連結し得る。いくつかの実施形態において、GHスーパージーンファミリーのメンバーのポリペプチドおよび/または連結されているGHスーパージーンファミリーのメンバーではないポリペプチドとともに使用されるリンカーは、二機能性のPEG試薬であり得る。
いくつかの実施形態において、本発明は、ダンベル構造を有している二機能性の水溶性リンカーを提供する。当該ダンベル構造は、a)重合体骨格の少なくとも第1の末端におけるアジド含有部分、アルキン含有部分、ヒドラジン含有部分、ヒドラジド含有部分、ヒドロキシアミン含有部分、またはカルボニル含有部分、ならびにb)重合体骨格の第2の末端における少なくとも第2の官能基を含んでいる。第2の官能基は、第1の官能基と同じであり得るか、または異なり得る。いくつかの実施形態において、第2の官能基は第1の官能基と反応性ではない。本発明は、いくつかの実施形態において、分枝鎖状の分子構造の少なくとも1つのアームを含んでいる水溶性化合物を提供する。例えば、分枝鎖状の分子構造は樹状であり得る。
いくつかの実施形態において、本発明は、以下の構造:
R-(CH2CH2O)n-O-(CH2)m-X
(ここで、nは5〜3000であり、mは2〜10であり、Xは、アジド含有部分、アルキン含有部分、ヒドラジン含有部分、ヒドラジド含有部分、アミノオキシ含有部分、ヒドロキシアミン含有部分、アセチル含有部分、またはカルボニル含有部分であり得、Rは、Xと同じであり得るか、または異なり得るキャップ基、官能基または脱離基である)
を有している活性化されている水溶性重合体との反応によって形成されている、GHスーパージーンファミリーのメンバー(例えばfEPO)を1つ以上含んでいる多量体を提供する。Rは、例えばヒドロキシル、保護されているヒドロキシル、アルコキシル、N−ヒドロキシスクシニミジルエステル、1−ベンゾトリアゾールエステル、N−ヒドロキシスクシニミジルカルボネート、1−ベンゾトリアゾイルカルボネート、アセタール、アルデヒド、アルデヒドハイドレート、アルケニル、アクリレート、メタクリレート、アクリルアミド、活性なスルホン、アミン、アミノオキシ、保護されているアミン、ヒドラジド、保護されているヒドラジド、保護されているチオール、カルボン酸、保護されているカルボン酸、イソシアネート、マレイミド、ビニルスルホン、ジチオピリジン、ビニルピリジン、ヨードアセトアミド、グリオキサール、ジオン、メシレート、トシレートおよびトレシレート、アルケン、およびケトンからなる群から選択される官能基であり得る。
XIII.fEPOの活性およびfEPO受容体に対するfEPOの親和性の測定
fEPO受容体は、参照によって本明細書に援用される米国特許第5,387,808号;米国特許第5,292,654号;米国特許第5,278,065号に記載のように、調製され得る。fEPOポリペプチドの活性はインビボまたはインビトロにおける標準的なアッセイを用いて決定され得る。例えば、fEPOの存在下において増殖する細胞株(UT−7細胞、TF−1細胞、FDCP−1/mEPORまたはすい臓細胞が挙げられるが、これらに限定されない)が使用されて、fEPO受容体の結合を観察し得る。例えば、参照によって本明細書に援用されるWrighton et al., (1997) Nature Biotechnology 15:1261-1265;米国特許第5,773,569号;および米国特許第5,830,851号を参照すればよい。非天然アミノ酸を含んでいる非PEG付加またはPEG付加のfEPOポリペプチドについて、その受容体に対するホルモンの親和性は、BIAcore(商標)バイオセンサ(Pharmacia)を用いて測定され得る。fEPOの活性を試験するためのインビボの動物モデル(例えばマウスなど)およびネコの治験は公知であり、これらとしては、参照によって本明細書に援用される米国特許第6,696,056号;Cotes et al., (1961) Nature 191:1065-1067;米国特許出願公開第2003/0198691号;Pharm Europa Spec. Issue Erythropoietin BRPBio 1997(2)に記載のものが挙げられる。天然にコードされていないアミノ酸を1つ以上含んでいるfEPOポリペプチドの二量体化能についてのアッセイは、参照によって本明細書に援用される米国特許第6,221,608号に記載されているように実施され得る。
XIV.有効性、機能的なインビボ半減期および薬物動態パラメータ
天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドの有効性および機能的なインビボ半減期は、参照によって本明細書に援用される米国特許第6,586,398号;米国特許第5,583,272号;および米国特許出願公開第2003/0198691号に記載の手順にしたがって決定され得る。
天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドについての薬物動態パラメータは、健常なオスのスピローグ/ダウリーラット(処置群につきN=5の動物)において評価され得る。動物は25ug/ラットの静脈内への単回投与または50ug/ラットの皮下への単回投与のいずれかを受け、およそ5〜7の血液サンプルがあらかじめ規定された時間経過にしたがって採取される。当該時間経過は、天然にコードされていないアミノ酸を含んでいる、水溶性重合体と抱合されていないfEPOポリペプチドに対して約6時間、および天然にコードされていないアミノ酸を含んでいる、水溶性重合体と抱合されているfEPOポリペプチドに対して約4日間に一般的に及ぶ。fEPOについての薬物動態のデータは、様々な種において十分に研究されており、天然にコードされていないアミノ酸を含んでいるfEPOについて得られたデータと直接的に比較され得る。Mordenti J., et al., Pharm. Res. 8(11):1351-59 (1991)を参照すればよい。
本発明にしたがうfEPOの特定の活性は当該技術において公知の種々のアッセイによって決定され得る。精製されている本発明のfEPOタンパク質の生物学的な活性は、ヒトの患者に対する注入によるfEPOタンパク質の投与が、被験体の注入されていない群または対照群と比べて網状赤血球および赤血球の産生を増大している骨髄細胞を生じることである。本発明にしたがって得られ、かつ精製されているfEPO変異体またはこれらの断片の生物学的な活性は、Pharm. Europa Spec. Issue Erythropoietin BRPBio 1997(2)に基づく方法によって試験され得る。fEPOの活性を決定する他の生物学的なアッセイは、正赤血球性貧血(normocythaemic)マウスアッセイ(Pharm. Europa Spec. Issue Erythropoietin BRP Bio 1997(2)である。
本発明のポリペプチドまたはタンパク質(bG−CSF、合成酵素、1つ以上の非天然アミノ酸を含んでいるタンパク質などが挙げられるが、これらに限定されない)は、好適な薬学的担体と組み合せて(限定されないが、これが挙げられる)、治療用途に任意に採用される。当該組成物は、例えば、治療有効量の化合物、および薬学的に受容可能な担体もしくは賦形剤を含んでいる。当該担体または賦形剤としては、生理食塩水、緩衝化生理食塩水、デキストロース、水、グリセロール、エタノール、および/またはこれらの組合せが挙げられるが、これらに限定されない。調合物は投与形態に合わせて作製される。一般的に、タンパク質を投与する方法は、当該分野においてよく知られており、かつ本発明のポリペプチドの投与に適用され得る。
本発明の1つ以上のポリペプチドを含んでいる治療組成物は、当業者に公知の方法にしたがって有効性を確認し、用量を評価するために、疾患の1つ以上のインビトロおよび/またはインビボにおける動物モデルにおいて任意に試験され得る。特に、用量は、天然アミノ酸の相同物に対する本明細書における非天然アミノ酸の活性、安定性または他の好適な測定(1つ以上の非天然アミノ酸を含めるために修飾されたbG−CSFポリペプチドの、天然アミノ酸のbG−CSFポリペプチドに対する比較が挙げられるが、これらに限定されない)(すなわち、比較アッセイ)によって最初に決定され得る。
投与は、血液または組織細胞と最終的に接触する分子の導入に通常に使用される任意の経路による。本発明の非天然アミノ酸含有ポリペプチドは、1つ以上の薬学的に受容可能な担体を任意に伴って、任意の好適な様式において投与される。本発明に関する当該ポリペプチドの、患者に対する投与の好適な方法が利用可能であり、そして、2つ以上の経路が特定の組成物を投与するために使用されるが、特定の経路は、他の経路よりも即時のかつ効果的な作用または反応をしばしば提供し得る。
薬学的に受容可能な担体は、投与される特定の組成物よって、これと同様に組成物を投与するために使用される方法によって、部分的に決定される。したがって、本発明の薬学的組成物の広範な好適な調合物がある。
ポリペプチド組成物は、多くの経路(経口、静脈内、腹腔内、筋肉内、経皮、皮下、局所、舌下または直腸の手段が挙げられるが、これらに限定されない)によって投与され得る。非天然アミノ酸ポリペプチドはリポソームを介して投与され得る。そのような投与経路および適切な調合物は当業者にとって公知である。
また、単独の、または他の好適な組成物との組合せの、非天然アミノ酸ポリペプチドは、吸入を介して投与されるためのエアロゾル調合物(すなわち、それらは“霧状化”され得る)に作製され得る。エアロゾル調合物は、圧縮化可能な噴霧剤(例えば、ジクロロジフルオロメタン、プロパンおよび窒素など)に配合され得る。
例えば、関節内(関節における)、静脈内、筋肉内、皮内、腹腔内および皮下の経路といった、非経口投与に好適な調合物としては、抗酸化剤、緩衝液、静菌剤および意図される受容物の血液と等張な調合物にさせる溶液を含有できる水性および非水性の等張無菌注入溶液剤、ならびに懸濁剤、可溶化剤、増粘剤、安定化剤、および防腐剤を含むことができる水性および非水性の無菌懸濁剤が挙げられる。パッケージされている核酸の調合物は、容器(例えば、アンプルおよびバイアル)に密封された単回用量または多回用量において提供され得る。
非経口投与および静脈内投与は投与の好ましい方法である。特に、天然アミノ酸相同物治療に関してすでに使用中の投与の経路(EPO、GCSF、GMCFS、IFN、インターロイキン、抗体および/または任意の他の薬学的に送達されるタンパク質にとって使用される経路が挙げられるが、これらに限定されない)が、現在使用中の調合物と共に、本発明のポリペプチドにとっての投与および調合物の好適な経路を提供する。
本発明に照らして、患者に投与される用量は、長期間にわたる患者に有益な治療応答(病原体による感染を阻害することが挙げられるが、これに限定されない)、または他の好適な活性を示すために十分な用途に依存する量である。用量は、特定のベクターもしくは調合物の有効性、および採用される非天然アミノ酸ポリペプチドの安定性もしくは血中半減期、および患者の状態、これらと同様に処置される動物の体重または体表面積によって決定される。また、用量の大きさは、特定の患者における特定のベクターまたは調合物などの投与に付随する任意の副作用の存在、性質および程度によって決定される。
疾患(がん、遺伝性疾患、糖尿病またはAIDSなどが挙げられるが、これらに限定されない)の処置または予防において投与されるベクターまたは調合物の有効量の決定において、医師は、循環血漿濃度、調合物の毒性、疾患の進行、および/または(該当する場合に)抗非天然アミノ酸ポリペプチド抗体の産生を評価する。
例えば70キログラムの患者に対して、投与される用量は、関連する組成物の変化されている活性または血中半減期に関して調節される、現在使用されている治療タンパク質の用量と典型的に等しい範囲にある。本発明のベクターは、任意の従来公知の療法(抗体投与、ワクチン投与、細胞毒性剤の投与、天然アミノ酸ポリペプチドの投与、核酸の投与、ヌクレオチド類似物の投与、および生体応答の調節剤の投与などが挙げられる)による障害の処置を補い得る。
投与に関して、本発明の調合物は、関連調合物のLD−50によって、および/または患者の集団および全体的な健康状態に対して適用されるような(これが挙げられるが、限定されない)、種々の条件における非天然アミノ酸ポリペプチドの任意の副作用の観察によって、決定される割合において投与される。投与は単回用量または分けられた用量を介して達成され得る。
調合物の注入を受ける患者が熱を出すか、寒気を覚えるか、または筋肉痛を覚える場合には、その患者は、適量のアスピリン、イブプロフェン、アセトアミノフェン、または他の痛覚/熱制御薬を受ける。注入に対する反作用(例えば熱、筋肉痛および悪寒)を経験する患者は、さらなる注入の30分前に、アスピリン、アセトアミノフェンまたは(これが挙げられるが、限定されない)ジフェンヒドラミンのいずれかを用いて前投与される。メペリジンは、解熱剤および抗ヒスタミン剤にすぐに反応しないひどい悪寒および筋肉痛に対して使用され得る。細胞注入は、反作用の重篤度に依存して速度を落とされるか、または中断される。
本発明のネコ科のEPOポリペプチドは、哺乳類の対象に対して直接に投与され得る。投与は、対象に対するfEPOの導入に通常に使用される経路のうちいずれかによる。本発明の実施形態に係るfEPOポリペプチド組成物としては、経口、直腸、局所、吸入(エアロゾルを介した吸入が挙げられるが、これに限定されない)、頬側(舌下が挙げられるが、これに限定されない)、膣、非経口(皮下、筋肉内、皮内、間接内、胸膜内、腹腔内、大脳内、動脈内、胸膜内または静脈内が挙げられるが、これに限定されない)、局所(すなわち、皮膚および気道の表面を含む粘膜の表面の両方)および経皮の投与に好適なそれらが挙げられるが、所定の場合のいずれかにおける最も好適な経路は、処置される性質および重篤度に依存する。投与は、局所的であるか、または全身性であるかのいずれかであり得る。化合物の調合物は、容器(例えば、アンプルおよびバイアル)に密閉された単回用量または多回用量に存在し得る。本発明のfEPOポリペプチドは、薬学的に受容可能な担体を伴った、単回用量の形態(溶液剤、懸濁剤、または乳剤が挙げられるが、これらに限定されない)における混合物に調製され得る。また、本発明のfEPOポリペプチドは、連続的な注入(浸透圧ポンプといったミニポンプを用いた注入が挙げられるが、これに限定されない)、単回の大量瞬時投与、または緩徐に放出する徐放性製剤調合物によって投与され得る。
投与に好適な調合物としては、抗酸化剤、緩衝液、静菌剤、および調合物に等張性を与える溶液を含有できる水性および非水性の溶液剤、等張無菌溶液剤、ならびに懸濁剤、可溶化剤、増粘剤、安定化剤および防腐剤を含むことができる水性および非水性の無菌懸濁剤が挙げられる。溶液剤および懸濁剤は、これまでに記載したような、無菌の粉末、顆粒、および錠剤から調製され得る。
本発明の薬学的組成物は、薬学的に受容可能な担体を含み得る。薬学的に受容可能な担体は、投与される特定の組成物によって、これと同様に、組成物の投与に使用される特定の方法によって、部分的に決定される。したがって、本発明の薬学的組成物の広範な好適な調合物(薬学的に受容可能な担体、賦形剤、または安定化剤を任意に含む)がある(例えば、Remington’s Pharmaceutical Sciences, 17th ed. 1985)を参照すればよい)。
好適的な担体としては、リン酸塩、ホウ酸塩、HEPES、クエン酸塩および他の有機酸を含有する緩衝液;抗酸化剤(アスコルビン酸が挙げられる);低分子量ポリペプチド(10残基未満のそれらが挙げられる);タンパク質(血清アルブミン、ゼラチン、または免疫グロブリンが挙げられる);親水性ポリマー(ポリビニルピロリドンが挙げられる);アミノ酸(グリシン、グルタミン、アスパラギン、アルギニン、またはリジンが挙げられる);単糖類、2糖類、他の糖(グルコース、マンノース、またはデキストリンが挙げられる);キレート剤(EDTAが挙げられる);2価の金属イオン(亜鉛、コバルト、または銅が挙げられる);糖アルコール(マンニトールまたはソルビトールが挙げられる);塩形成対イオン(ナトリウムが挙げられる);および/または非イオン性界面活性剤(Tween(商標)、Pluronics(商標)またはPEGが挙げられる)が挙げられる。
また、本発明のfEPOポリペプチド(これらに限定されないが、PEGといった水溶性ポリマーに対して連結されるそれらが挙げられる)は、徐放性の系の一部によってか、または一部として投与され得る。徐放性組成物としては、これに限定されないが、成形された製品の形態(これらに限定されないが、フィルム、またはマイクロカプセルが挙げられる)における半透過性のポリマーマトリクスが挙げられる。徐放性のマトリクスとしては、生体適合性材料から得られるもの(例えば、ポリ(2−ヒドロキシエチルメタクリレート)(Langer et al., J. Biomed. Mater. Res., 15: 167-277 (1981); Langer, Chem. Tech., 12: 98-105 (1982))、エチレンビニルアセテート(上述のLanger et al)またはポリ−D−(−)−3−ヒドロキシブチル酸(欧州特許出願公開第133,988号)、ポリラクチド(ポリ酪酸)(米国特許第3,773,919号;欧州特許出願公開第58,481号)、ポリグリコリド(グリコール酸のポリマー)、ポリラクチド−コ−グリコリド(酪酸およびグリコリドの共ポリマー)のポリ無水物、L−グルタミン酸およびガンマ−エチル−L−グルタミン酸塩の共ポリマー(U. Sidman et al., Biopolymers, 22, 547-556 (1983))、ポリ(オルト)エステル、ポリペプチド、ヒアルロン酸、コラーゲン、硫酸コンドロイチン、カルボキシル酸、脂肪酸、リン脂質、多糖、核酸、ポリアミノ酸、アミノ酸(例えば、フェニルアラニン、チロシン、イソロイシン)、ポリヌクレオチド、ポリビニルプロピレン、ポリビニルピロリドンならびにシリコン)が挙げられる。また、徐放性組成物としては、リポソームに取り込まれる化合物が挙げられる。化合物を含有するリポソームは、それ自体が公知の方法によって調製される(独国特許出願公開第3,218,121号;Eppstein et al., Proc. Natl. Acad. Sci. U.S.A., 82: 3688-3692 (1985);Hwang et al., Proc. Natl. Acad. Sci. U.S.A., 77: 4030-4034 (1980);欧州特許出願公開第52,322号;欧州特許出願公開第36,676号;欧州特許出願公開第88,046号;欧州特許出願公開第143,949号;欧州特許出願公開第142,641号;日本国出願公開第83−118008号;米国特許第4,485,045号および米国特許第4,544,545号;および欧州特許出願公開第102,324号)。
リポソームに取り込まれたfEPOポリペプチドは、例えば、独国特許出願公開第3,218,121号;Epstein et al., Proc. Natl. Acad. Sci. U.S.A., 82: 3688-3692 (1985);Hwang et al., Proc. Natl. Acad. Sci. U.S.A., 77: 4030-4034 (1980);欧州特許出願公開第52,322号;欧州特許出願公開第36,676号;欧州特許出願公開第88,046号;欧州特許出願公開第143,949号;欧州特許出願公開第142,641号;日本国出願第83−118008号;米国特許第4,485,045号および米国特許第4,544,545号;および欧州特許出願公開第102,324号に記載されている方法によって調製され得る。組成物およびリポソームの大きさは、公知であるか、または経験的に当業者によって容易に決定され得る。リポソームのいくつかの例が、例えば、Park JW, et al., Proc. Natl. Acad. Sci. USA 92:1327-1331 (1995) ;Lasic D and Papahadjopoulos D (eds): MEDICAL APPLICATIONS OF LIPOSOMES (1998);Drummond DC, et al., Liposomal drug delivery systems for cancer therapy, in Teicher B (ed): CANCER DRUG DISCOVERY AND DEVELOPMENT(2002);Park JW, et al., Clin. Cancer Res. 8:1172-1181 (2002); Nielsen UB, et al., Biochim. Biophys. Acta 1591(1-3):109-118 (2002);Mamot C, et al., Cancer Res. 63: 3154-3161 (2003)に記載されている。
本発明に照らして、患者に対して投与される用量は、長期間にわたって対象に有益な応答を引き起こすに十分な量であるべきである。一般的に、投与ごとに非経口的に投与される本発明のfEPOの治療有効量の総計は、患者の体重の約0.01ug/kg/日から約100ug/kg/日、または約0.05mg/kg/日から約1mg/kg/日の範囲であるが、これは治療の自由裁量にしたがう。また、投与の頻度は、治療の自由裁量にしたがい、ヒトにおける利用を承認されている市販のEPO産物よりも、高い頻度であり得るか、または低い頻度であり得る。一般的に、本発明のPEG付加fEPOポリペプチドは、上述の投与経路のうちのいずれかによって投与され得る。
XVI.本発明のfEPOポリペプチドの治療的な使用
本発明のfEPOポリペプチドは広範な疾患の処置に有効である。本発明のfEPO産物の投与はヒトにおける赤血球形成を起こす。fEPO糖タンパク質産物を含んでいる薬学的組成物は、単独にか、または障害または疾患の一部として低いか、または不完全な赤血球産生によって特徴付けられている血液疾患にかかっているヒト患者に対する種々の方法による投与にとって有効な力価に調合され得る。fEPO糖タンパク質産物の量の平均は、変化し得、特に熟練の医師による推奨および処方に基づくべきである。fEPOの正確な量は、処置される障害の正確な種類、処置される患者の状態、および組成物における他の成分といった要因に依存する優先度の問題である。したがって、本発明のfEPOが使用されて、赤血球細胞の産生を刺激し得、低下した赤血球レベルを修正し得る。赤血球細胞レベルは貧血に起因して最も一般的に低下する。本発明によって処置可能な状態としては、腎機能の低下又は損失(慢性腎不全)に関連する貧血、骨髄抑制性の治療(例えば化学療法薬または抗ウイルス薬(AZTなど))に関連する貧血、非骨髄性腫瘍の進行に関連する貧血、およびウイルス感染(HIVなど)に関連する貧血がが挙げられる。また、健康な個体における貧血を引き起こし得る状態(例えば外科手術中に予想される血液の損失など)を処置可能である。また、fEPOを用いて処置可能な任意の状態は、本発明のPEG:fEPOの抱合体を用いて一般的に処置され得る。また、本発明は、処置中の赤血球新生の増加を維持するための鉄の治療有効量の投与を提供する。与えられる量はfEPOを用いた療法に基づいて当業者によって容易に決定され得る。
XVII.実施例
以下の実施例は、例証のために提供されているのであり、請求されている本発明を限定するものではない。
〔実施例1〕
本実施例において、天然にコードされていないアミノ酸の、fEPOへの組込み部位を選択するための、見込みのある多くの基準のうちのいくつかについて説明する。
本実施例では、fEPO内の好ましい部位が天然にコードされていないアミノ酸の導入のためにどのように選択されたかについて証明されている。fEPOの二次構造に関する分子モデリングおよび公知の情報を使用して、1つ以上の天然にコードされていないアミノ酸が導入される好ましい位置を決定した。他のfEPOの構造、およびfEPOに関する公知の結晶構造の情報を利用して、結晶構造のデータセット間における一次、二次、三次の構造要素の見込みのある異形について試験した。これらの構造に関する同等物(coordinates)は、Protein Data Bank(PDB)(Bernstein et al. J. Mol. Biol. 1997, 112, pp 535)からか、またはhttp://www.rcsb.orgにおけるThe Research Collaboratory for Structural Bioinformatics PDBを介して利用可能である。構造モデル1CN4は、124〜130位の残基、N末端のA1、ならびにC末端のT163、G164、D165およびR166の残基を除いて(結晶に障害を来たすので除外されている)、fEPOの成熟した18kDaの配列の全体を含んでいる。C7およびC161、ならびにC29およびC33によって形成されている2つのジスルフィド架橋が存在している。
本実施例において使用された配列の番号付与は、配列番号2および配列番号4に示されている成熟fEPO(18kDaバリアント)のアミノ酸配列にしたがっている。
本実施例において、天然にコードされていないアミノ酸の、fEPOへの組込み部位を選択するための、見込みのある多くの基準のうちのいくつかについて説明する。以下に記載の基準を用いて、天然にコードされていないアミノ酸(例えば、p−アセチル−フェニルアラニン(pAF))の部位特異的な組込みに利用されるアミノ酸位置は、以下:53位、55位、116位、89位、72位、86位、128位、129位、130位、131位、132位、133位、134位、135位、31位、163位、120位、76位、24位、38位、37位、49位、83位、21位、36位の位置である。種々のEPOの結晶構造を利用して、天然にコードされていないアミノ酸が導入され得る好ましい位置を決定する。これらの構造に関する同等物はProtein Data Bank(PDB)からか、またはhttp://www.rcsb.orgにおけるThe Research Collaboratory for Structural Bioinformatics PDBを介して利用可能である(PDB、PDBのID:1CN4、1EERおよび1BUY)。X線結晶構造の情報を使用して、Cxプログラム(Pintar et al. Bioinformatics, 2002, Vol. 18, p 980)を用いたfEPO分子に対する溶媒の接触可能性の算出を実施する。すべての原子の溶媒に対する接触可能性を算出し、各アミノ酸残基に関するCxの平均値を決定した。それらは図8および9に示されている。以下の基準を使用して天然にコードされていないアミノ酸の導入に関してfEPOの各位置を評価した。(a)fEPOの構造解析ならびに1CN4、1EERおよび1BUY(hEPObpと抱合されているhEPOの結晶構造)に基づいて、fEPObpの結合を妨げない残基、(b)アラニンスキャニング変異生成(Bittorf, T. et al. FEBS, 336:133-136 (1993), Wen, D., et al.JBC, 269:22839-22846 (1994), and Elliot, S. et al. Blood, 89:493-502 (1997))によって影響されない残基、(c)表面露出している残基であって、周囲の残基との最小のファンデルワールス力または水素結合相互作用を意味する最大のCxを示す残基((Bittorf, T. et al. FEBS, 336:133-136 (1993), Wen, D., et al.JBC, 269:22839-22846 (1994))、(d)fEPOバリアントにおいて欠失されているか、または変異性である残基、(e)天然にコードされていないアミノ酸を用いた置換によって保存的な変化を生じる残基、ならびに(f)柔軟性の非常に高い領域(CDループが挙げられるが、これに限定されない)または構造的に堅固な領域(ヘリックスBが挙げられるが、これに限定されない)に見られる残基。さらに、Cxプログラム(Pintar et al. Bioinformatics, 18, pp 980)を用いたさらなる算出をfEPOに対して実施して、各タンパク質の原子に関する突出の程度を評価した。結果として、いくつかの実施形態において、天然にコードされていないアミノ酸は、fEPOの以下:1位より前(すなわちN末端)、1位、2位、3位、4位、7位、8位、9位、10位、13位、17位、20位、21位、24位、25位、27位、30位、31位、32位、34位、36位、37位、38位、40位、43位、49位、50位、52位、53位、54位、55位、56位、58位、65位、68位、69位、72位、75位、76位、79位、80位、82位、83位、84位、85位、86位、87位、88位、89位、90位、92位、93位、110位、111位、115位、116位、117位、118位、119位、120位、121位、122位、123位、124位、125位、126位、127位、128位、129位、130位、131位、132位、133位、134位、136位、139位、159位、161位、162位、163位、164位、165位、166位、167位(すなわちタンパク質のカルボキシル)またはこれらの組合せの位置(これらに限定されない)の1つ以上に置換されている。
fEPOアンタゴニストの生成のためのいくつかの部位としては、10位、11位、14位、15位、96位、97位、100位、103位、104位、107位、110位が挙げられる。アゴニスト設計の基準c〜eを利用してこれらの部位を選択した。また、アゴニストの設計は、fEPObpに対する結合親和性を増大させるために、SiteIの部位特異的な修飾を含み得る。
図3〜9はモデリングおよび位置の選択を示している。図8は、いくつかの実施形態において、天然にコードされていないアミノ酸が、fEPOの以下:53位、55位、116位、89位、72位、86位、128位、129位、130位、131位、132位、133位、134位、135位、31位、163位、120位またはこれらの組合せの位置(これらに限定されない)に置換されていることを示している。図9は、いくつかの実施形態において、天然にコードされていないアミノ酸が、fEPOの以下:53位、55位、76位、24位、116位、38位、89位、37位、72位、86位、49位、83位、21位、36位、128位、129位、130位、131位、132位、133位またはこれらの組合せの位置(これらに限定されない)に置換されていることを示している。
〔実施例2〕
本実施例において、修飾されているfEPOポリペプチドのE. coliにおけるクローニングおよび発現の詳細について説明する。
本実施例において、天然にコードされていないアミノ酸を含んでいるfEPOポリペプチドが、E. coliにおいていかにして発現され得るのかについて証明する。fEPOをコードしているヌクレオチド配列は、Matthews et al., (1996) PNAS 93:9471-76に記載のように一般的に生成される。胎児の肝、成体の肝、胎児の腎および成体の腎のcDNAライブラリが全長および成熟のfEPOをコードしているcDNAをクローニングするライブラリであり、胎児の肝が最も良好な結果を生じる。全長および成熟のfEPOをクローニングするために使用されるプライマーは当業者に公知のプライマーであり得、当該プライマーとしては:
5’cagttacatatgggagttcacgaatgtcctgcctgg3’(配列番号21);および
5’cagttacatatgctccaccaagattaatctgtg3’(配列番号22)が挙げられる。このクローニングに使用され得る3’プライマーの一例は5’ctgcaactcgagtcatctgtcccctgtcctgcag3’(配列番号23)である。クローニングのための反応条件は、2分間にわたる94℃、30秒間にわたる94℃、1分間における50℃、2分間にわたる72℃の30サイクル、および7分間にわたる72℃、これに続く4℃の反応停止であり得る。fEPO(全長のfEPO、N末端シグナル配列およびSNPを欠いているEPOの成熟形態が挙げられる)をコードしている分子を同定する。全長および成熟のfEPOをコードしているcDNAは、クローニングおよび発現のためのアミノ酸配列を変更しない配列の最適化に続いて、発現ベクター(例えば、pBAD、HIScおよびpET20b発現ベクター)に挿入され得る。
直交性のtRNA(O−tRNA)および直交性のアミノアシルtRNA合成酵素(O−RS)を含んでいる導入された翻訳系を使用して、天然にコードされていないアミノ酸を含んでいるfEPOを発現させる。O−RSは、天然にコードされていないアミノ酸とともにO−tRNAを優先的にアミノアシル化する。上記翻訳系は、セレクターコドンに応じて天然にコードされていないアミノ酸をfEPOへ順に挿入する。以下の表(表2)は、全長および成熟の両方のfEPOの配列、ならびにO−RSおよびO−tRNAの配列のうち、これらの実施例において使用されたいくつか、hEPOとともに使用され、およびfEPOとともに使用され得るか、もしくはfEPOをともなう使用のために最適化され得る他のものを含んでいる。
修飾されているfEPO遺伝子および直交性のアミノアシルtRNA合成酵素/tRNA対(所望の天然にコードされていないアミノ酸に特異的である)プラスミドを用いたE. coliの形質転換によって、天然にコードされていないアミノ酸の、fEPOポリペプチドへの部位特異的な組込みが可能になる。0.01〜100mMの特定の天然にコードされていないアミノ酸を含んでいる培地を用いた37℃において成長させた、形質転換されたE. coliは、高い正確さおよび効率を有して、修飾されているfEPOを発現する。天然にコードされていないアミノ酸を含んでいるHisタグつきのfEPOを、封入体または凝集物としてE. coli宿主細胞によって生成させる。6MのグアニジンHClの変性条件において凝集物を可溶化し、親和性精製する。50mMのTRIS−HCl(pH8.0)、40μMのCuSo4および2%(w/v)のSarkosyl、4℃における一晩にわたる透析によってリフォールディングを行う。それから、20mMのTRIS−HCl(pH8.0)、100mMのNaCl、2mMのCaCl2に対して材料を透析し、Hisタグを除去する。Boissel et al., (1993) 268:15983-93を参照すればよい。fEPOの精製方法は、当該分野において公知であり(Nahri et al., (1991) JBC, Vol 266, pp 23022-23026;Narhi et al., (2001) Protein Engineering, Vol14, pp 135-140;Darling et al., (2002) Biochemistry Vol 41, pp 14524-14531;Boissel et al., (1993) 268:15983-93;および国際公開第号0032772号)、SDS−PAGE、ウエスタンブロット解析、またはエレクトロスプレーイオン化質量分析によって確認される。
〔実施例3〕
ネコエリスロポエチンタンパク質(fEPO)を発現する、本発明に係る抑制発現のDNA発現ベクターを構築した。
(A.発現ベクターの構成)
図25に示されている発現コンストラクトは、同系のtRNA合成酵素によってp−アセチルフェニルアラニンを挿入可能なtRNA転写物をコードしている、8コピーのハイブリッドtRNAを含んでいる。tRNA遺伝子の各コピーは、H1プロモータ領域、tRNA配列およびポリメラーゼIII転写終結シグナルを含んでいる。
一過性のトランスフェクションの後にCOS細胞における発現コンストラクト(ベクター)の複製を容易にするシミアンウイルスSV40の複製開始点が、tRNA遺伝子に続いて配置されている。
この場合ではネコEPOのコーディング領域である所望の遺伝子配列の発現カセットが、これらの後に配置されている。発現カセットにおける一番目は、伝達暗号を発現させるヒトサイトメガロウイルスプロモータ(CMV)である。このコンストラクトにおける伝達暗号は、天然のシグナルペプチド(Nat L)の後に続いているネコエリスロポエチン(fEPO)をコードしている。伝達暗号の後にはウシ成長因子のポリアデニル化シグナル(BGH)が続いている。
その後に、マウスのベータグロブリンのメジャープロモータ(ベータ)から始まる発現カセットが配置されており、内部リボソーム進入部位(IRES)によってそれぞれ隔てられているマウスのジヒドロ葉酸還元酵素(DHFR)およびサルモネラのネオマイシンリン酸転移酵素遺伝子(Neo)が、最適化されているE. coliのアセチルフェニルアラニンtRNA合成酵素(OptEcAFRS)をコードしている配列の発現を促進するように、当該カセット内に配置されている。Neo配列の後にはSV40の初期ポリアデニル化シグナル(SV)が続いている。
また、ベクターは、細菌における複製に必要な配列(colEの複製開始点(pUC Ori)、およびアンピシリン耐性を付与するベータラクタマーゼ遺伝子が挙げられる)を含んでいる。
EMCVは市販されており、cDNAはウイルスゲノム内におけるIRES領域に対して商業的に合成された。DNAを増幅し、コーディングドメインの間への挿入に好適な5’末端および3’末端を付加するために、そのcDNAのPCR(ポリメラーゼ連鎖反応)増幅を行った。834〜836位(Genebankの受入れ番号:NC−001479)におけるATGの3ヌクレオチドをDHFRおよびNeo配列の開始コドンとして使用した。
IRESの下流にあるオープンリーディングフレームの翻訳が上流にあるオープンリーディングフレームの翻訳(5’キャップによって開始される翻訳)よりも効率が低くなることが文献に示されているので、DHFRおよびNeo遺伝子を独立したIRESエレメントの直後に配置する方策を採って、クローン選択を容易にするために優勢な選択マーカーを選択的に損なわせた。
抑制発現ベクターの2つの型を生成し、Lucy L(図25)およびIrwin(図26)と名づけた。Lucy Lは、8コピーのtRNA遺伝子、第2のIRESおよびNeo遺伝子を含んでいる。G418を用いた処理を介して細胞のゲノムに安定して統合されているプラスミドの選択を可能にするために、Neo遺伝子を含めている。一方で、Irwinは4コピーのtRNAのみを含んでおり、第2のIRESおよびNeoを欠いている。したがって、Irwinは、サイズがより小さくなり、タンパク質産生の実験レベルの生成のために抑制されているタンパク質の一過性発現にとってより好適である。
図28に示されている遺伝子地図のベクターである“IrwinにおけるNat L BB−Opti FEPO”を、一過性のトランスフェクション手順を用いてCHO−S細胞にトランスフェクションした。当該ベクターの配列は、表3に説明されており、ネコEPOタンパク質をコードしておりかつ抑制エレメントを含んでいる。fEPOの野生型および22のバリアントを用いて同時にこれらのトランスフェクションを行った。当該バリアントにおいて、fEPOの生物活性およびグリカン構造を維持するような様式において抑制を受けるように、アンバーコドンがコーディング領域内に配置されている。fEPOの22のバリアントは図30に示されているバリアント(K52、Q86、E89、E31、E21、E37、R131、K116、F133、L130、R53、Y49、T132、A1、S120、R76、P129、S36、D55、A128、E72、R163)を含んでいる。実験結果から、野生型配列の良好な発現、および22の異なるバリアントの大きく変化している抑制発現が示されているが、22のバリアントのうち少なくとも19はELISAによって検出可能な発現を示した。したがって、本発明の抑制発現コンストラクトの具体例は、種々の位置に配置されているアンバー抑制コドンを用いて所望の遺伝子配列を発現すると予想される。
fEPOの一過性発現を使用して、このタンパク質の生成におけるいくつかの技術的な試みに適応させ得る。当該タンパク質は、例えばpH4付近の等電点およびfEPOの高い糖鎖付加(総量の40%を超える)を有しており、したがってこれまでのものに代わる化学的性質および発現系が使用され得る。
〔実施例4:G418 抵抗性細胞株の生成〕
本実施例における抑制発現コンストラクトは、通常のアラニン残基を置換する1位の残基に位置しているアンバーコドンを用いて修飾されているネコEPOタンパク質をコードしている。図3に示されている遺伝子地図のこの発現コンストラクトは、“Lucy FにおけるNat L BB−Opti FEPO”と呼ばれる。この発現コンストラクトの配列は図4に説明されている。
Lucy FにおけるNat L BB−Opti FEPO(A1にアンバーコドンを含んでいる)を用いて、CHO−DG44の親細胞株をトランスフェクションした。96ウェルプレートごとの4×106のCHO細胞につき、0.5、1.0または2.0ugの直鎖状のDNAを用いてトランスフェクションした。ネオマイシン耐性マーカーをコードしている発現コンストラクトおよびG418を含んでいる培地(CHO−S−SFM II+HT)によって、安定にトランスフェクションされた細胞の優性な選択を行った。
生存していたウェルを同定し、小規模(50ml)の振とう培養に展開し、細胞の生産性をELISAによって評価した。容易に検出可能な分泌fEPOを生成している、種々のG418耐性細胞単離体が得られた。特に5B5および15B3の2つについて、3〜4日においてそれぞれ0.07および0.1mg/L、または0.03ピコグラム/細胞/日(pcd)を産生していることが特定された。StemCell EPO ELISA KIT−ヒトエリスロポエチンに関する免疫アッセイ、カタログ番号01630を用いて、分泌fEPOを検出した。
〔実施例5:ゲノム増幅による発現の増強〕
Lucy Fの抑制発現系は、マウスのDHFR遺伝子をコードしている発現カセットを含んでいる。発現のために使用されたCHO−DG44親細胞株がDHFRの酵素活性を完全に欠いている(二重欠失)ので、統合されている標的遺伝子(マウスのDHFR)の増幅は、メトトレキセート(MTX)を含んでいる培地における選択成長によって可能である。この増幅の間に、直接的に連結されているタンパク質の遺伝子(本実施例におけるfEPO)が同時に増幅される。このようにして、増加している量のfEPOを生成している細胞株の単離が可能である。G418耐性の細胞株の1回目の選択を5nMのMTXにおいて実施する。それから最も高い産生株(ELISAによって決定される)を同定し、性質決定する。
fEPO G418耐性の細胞系統である5B5および15B3を5nMのMTX増幅に供した。抑制発現レベルは、いずれの場合にも増幅に続いて上昇し、以下に挙げられている。
上記表からわかるように、5nMのMTX増幅における発現レベルはおおよそ3〜5倍に上昇している。MTXの濃度を上げた続く増幅では、生産性がさらに上昇していると予想される。
〔実施例6〕
チャイニーズハムスターの卵巣細胞(CHO)において22のfEPOバリアントを発現させた。tRNAおよびRSを含んでいる発現ベクター内にfEPOのバリアントを挿入した。tRNAおよびRSを含んでいない発現ベクター内に野生型のfEPOを挿入した。企業によって開発されたトランスフェクション法を用いて、プラスミド(fEPOのバリアントおよび野生型)を、pAFありまたはなしのCHO細胞にトランスフェクトした。
(野生型のfEPOおよびfEPOのバリアントの一過性発現の方法)
Polyscienceから入手した25kDaの直鎖状のポリエチレンイミン(PEI)の溶液を蒸留水において1mg/mlに調製し、pHを7.2に調整し、使用する前に0.22μmのフィルタを用いてろ過滅菌した。
グルタミンを補ったCHO FreeStyle培地にCHO細胞(Invitrogen)を維持した。Corningから入手した125mlの三角フラスコに30mLの培養物を準備した。トランスフェクションの前日に細胞を0.5×6mlに播いた。トランスフェクションの前に、成長培地を用いて細胞密度を1×106/mLに調整した。トランスフェクションの前に、1mMのパラ−アセチル−フェニルアラニンを加えた。37μgのDNAをRPMI培地に溶解させ、それからDNAを含んでいるRPMI培地に1mg/mLのPEI溶液を74μL加えた。これを15分間にわたってインキュベートした。それから125mlの三角フラスコに入っている30mlの培養物にDNAおよびPEIの混合物を加えた。それから37℃のインキュベーターにフラスコを移した。トランスフェクションの72時間後にヒトELISAアッセイによって上清を定量化した。図30はpAFの存在下におけるfEPOバリアントの抑制レベルを示している。
fEPOの各バリアントは、pAFの位置によって変わる、異なるレベルにおいて抑制された。K52、Q86およびE89はpAFの存在下においてELISAアッセイによって検出されなかった。pAFなしのfEPOバリアントはELISAアッセイによって検出されなかった。その機能に関して上清をTF−1アッセイによって試験した。この実験の結果は図30に示されている。
〔実施例7〕
TF−1増殖アッセイおよびTF−1機能的fEPOアッセイが図11〜24に示されている。成長培地の入っているT−75フラスコに、一晩にわたってTF−1細胞を150000細胞/mlの濃度に播き、アッセイの当日に50ulのアッセイ培地に入れて20000細胞/ウェルの濃度に細胞を播いた(図11)。ATCCからTF−1細胞を購入し、赤白血病患者の骨髄細胞から細胞株を確立した。細胞株は、IL−1、GNcsf、EPOおよびfEPOに対して成長依存性を示している。fEPOに応じたTF−1細胞の増殖によって活性を測定する。増殖の程度をWST−8によって測定する。細胞性のミトコンドリア脱水素酵素によるテトラゾリウム塩wst−8のホルマザンへの開裂は生細胞数と直接的に比例している。450nmにおける色素溶液の吸光度を測定することによって、生細胞によって生成されたホルマザン色素を定量する(図13、図16、図19、図20、図21)。図13において、条件は、ウェルごとに40000、30000、20000および10000の種々の密度に播いた細胞であった。48時間および72時間の異なる2つのインキュベーション時間、異なる2つのfEPO濃度(2500ng/mLおよび500ng/mL)、異なる2つの希釈手順(3×および2.5×)、ならびに24時間にわたってスタベーションした細胞およびスタベーションなしの細胞を使用した。これらの実験および機能アッセイの結果が図面および図面の説明に記載され、示されている。
〔実施例8:ネコエリスロポエチン(fEPO)の野生型およびパラ−アセチルフェニルアラニン(pAF)バリアントの精製、ならびにpAFバリアントに対するポリ(エチレングリコール)の選択的な抱合〕
fEPOおよびpAFバリアントの精製は、3つのカラムクロマトグラフィーステップ:フェニルボロネート、アニオン交換および疎水性相互作用に続く濃縮および透析に関する。精製された材料を、PEG付加の前に濃縮し、PEG付加緩衝液に交換する。
UF/DF:MaterFlexポンプに接続されているSlice 200(Sartorius Stedim)システムを用いて充填するクロマトグラフィーに先立って、細胞の培養上清を濃縮し、10倍量の50mMのHEPES(pH8.5)に交換した。
(フェニルボロネート(PB)クロマトグラフィー)
50mMのHEPES(pH8.5)に平衡化されたPtoSep PBカラムを用いて負の捕捉モードにおいてフェニルボロネート樹脂を実施した。材料を流動洗浄液(50mMのHEPES、pH8.5)に回収した。50mMのHEPES、50mMのソルビトール、pH8.5;50mMのTris、6Mの尿素、pH8.5;および100mMの酢酸における段階溶出を用いて不純物を除去した。
上述のようにアニオン交換クロマトグラフィーに充填する前に、PB流動から得られた材料をUF/DFによって20mMのTris、pH8.0に交換した。
(アニオン交換クロマトグラフィー(AEX))
XK16カラムにおけるQ Sepharose High Performanceカラム(GE Healthcare、Piscataway、NJ)を用いて120cm/時間の流速において材料を精製した。20mMのTris(pH8.0)において平衡化されたカラムに材料を充填した。直線的なAB勾配を用いて溶出を実施した。ここで、緩衝液Aは20mMのTris、pH8.0であり、緩衝液Bは20mMのTris、500mMのNaCl、pH8.0である。固定容積の画分を回収し、SDS−PAGEおよび抗EPOのELISAによって分析した。
(疎水性相互作用クロマトグラフィー(HIC))
fEPOを含んでいるAEXプールを3.5Mの硫酸アンモニウムにおいて希釈して、1.5Mの終濃度の硫酸アンモニウムを得た。20CVの直線的なAB勾配を用いて溶出を実施した。ここで緩衝液Aは20mMのTris、1.5Mの硫酸アンモニウム、pH8.0であり、緩衝液Bは20mMのTris、50%(v/v)のエチレングリコール、pH8.0である。固定容積の画分を回収し、SDS−PAGEおよび抗EPOのELISAによって分析した。
(fEPOのpAFバリアントのPEG付加)
当該フラクションをプールし、VivaSpinカラム10000MWCOを用いて1回につき15000×gにおいて10分間にわたって〜5mg/mlまで濃縮した。サンプルを20mMの酢酸ナトリウム、1mMのEDTA、pH4.0に交換した。12:1モルの割合のPEG:タンパク質、20kDaPEGオキシアミン(Sunbright ME200-CA)、および酢酸を用いてpH4.0に調整された1%(w/v)のアセトヒドラジドを用いて、PEG付加を開始した。28℃において>12時間にわたってPEG付加を実施し、SDS−PAGEによって分析した(図31、図32、図33)。30kDaのPEGを用いてバリアントA1をPEG付加し、40kDaのPEGを用いてバリアントY49をPEG付加し、30kDaのPEGを用いてバリアントP129をPEG付加した。
〔実施例9〕
本実施例において、カルボニル含有アミノ酸の導入および続くアミノオキシ含有PEGとの反応の詳細について説明する。
本実施例において、天然にコードされていないケトン含有アミノ酸を組み込んでいるfEPOポリヌクレオチドの生成方法について証明する。ここで、当該ケトン含有アミノ酸は、約5000MWのアミノオキシ含有PEGとの続く反応を受ける。21位、24位、38位、83位、85位、86位、89位、116位、119位、121位、124位、125位、126位、127位、および128位の残基のそれぞれは、以下の構造:
を有している天然にコードされていないアミノ酸を用いて別々に置換されている。
p−アセチル−フェニルアラニンのfEPOへの部位特異的な組込みに利用された配列は、表2に開示されており、上述の配列(例えば、muttRNAおよびTyrRS LW1、5または6)である。
修飾を施すとすぐに、カルボニル含有アミノ酸を含んでいるfEPOバリアントを、以下の形態:
R-PEG(N)-O-(CH2)n-O-NH2
(ここで、Rはメチルであり、nは3であり、Nは約5000MWである)
のアミノオキシ含有PEGと反応させる。25mMのMES(Sigma Chemical、St. Louis、MO) pH6.0、25mMのHepes(Sigma Chemical、St. Louis、MO) pH7.0、または10mMの酢酸ナトリウム(Sigma Chemical、St. Louis、MO) pH4.5に10mg/mLにおいて溶解させた、p−アセチルフェニルアラニンを含んでいる精製されたfEPOを、10〜100倍の過剰量のアミノオキシ含有PEGと反応させ、それから10〜16時間にわたって室温において攪拌する(Jencks, W. J. Am. Chem. Soc. 1959, 81, pp 475)。それからfEPOは直後の精製および分析にとって適切な緩衝液に希釈される。
〔実施例10〕
ヒドロキシルアミン基を含んでいるPEGを有している抱合物はアミド結合を介してPEGと連結した。
以下の構造:
R-PEG(N)-O-(CH2)2-NH-C(O)(CH2)n-O-NH2
(ここで、Rはメチルであり、nは4であり、Nは約20000MWである)
を有しているPEG試薬を、上述の実施例に記載の手法を用いて天然にコードされていないケトン含有アミノ酸と結合させる。反応、精製および分析の条件は上述の実施例に記載の通りである。
〔実施例11〕
本実施例において、異なる2つの天然にコードされていないアミノ酸の、fEPOへの組込みの詳細について説明する。
本実施例において、天然にコードされていないケトン機能性基を含んでいるアミノ酸を組み込んでいるfEPOポリペプチドの生成方法について証明する。当該アミノ酸は以下の位置:N24X*およびG113X*;N38X*およびQ115X*;N36X*およびS85X*;N36X*およびA125X*;N36X*およびA128X*;Q86X*およびS126X*の2つ位置に組み込まれており、X*は天然にコードされていないアミノ酸を表している。サプレッサコドンが核酸内の異なる2つの部位に導入されていることを除いて、fEPOポリペプチドを上述の実施例に記載の通りに調製する。
〔実施例12〕
本実施例において、ヒドラジド含有PEGに対するfEPOポリペプチドの抱合および続くインシチュ還元の詳細について説明する。
カルボニル含有アミノ酸を組み込んでいるfEPOポリヌクレオチドを上述の実施例に記載の手順にしたがって調製する。修飾を施すとすぐに、以下の構造:
R-PEG(N)-O-(CH2)2-NH-C(O)(CH2)n-X-NH-NH2
(ここで、Rはメチルであり、nは2であり、Nは10000MWであり、Xはカルボニル(C=O)基である)
を有している、ヒドラジン含有PEGをfEPOポリペプチドに抱合させる。25mMのMES(Sigma Chemical、St. Louis、MO) pH6.0、25mMのHepes(Sigma Chemical、St. Louis、MO) pH7.0、または10mMの酢酸ナトリウム(Sigma Chemical、St. Louis、MO) pH4.5に、p−アセチルフェニルアラニンを含んでいる精製された0.1〜10mg/mLのfEPOを溶解させ、10〜100倍の過剰量のアミノオキシ含有PEGと反応させ、ストック濃度1MのNaCNBH3(Sigma Chemical、St. Louis、MO)の添加によって対応するヒドラゾンをインシチュ還元し、10〜50mMの終濃度までH2Oに溶解させた。4℃〜室温の暗所において18〜24時間にわたって反応を実施する。Trisの終濃度が50mMになるまで、1MのTris(Sigma Chemical、St. Louis、MO)、約7.6のpHを加えることによって反応を停止させるか、または直後の精製にとって適切な緩衝液を用いて反応物を希釈する。
〔実施例13〕
本実施例において、アルキン含有アミノ酸の、fEPOに対する導入およびmPEG−アジドを用いた誘導体化の詳細について説明する。
以下の残基:21位、24位、38位、83位、85位、86位、89位、116位、119位、121位、124位、125位、126位、127位および128位のそれぞれが、以下の天然にコードされていないアミノ酸:
を用いて置換されている。
p−プロパルギル−チロシンの、fEPOへの部位特異的な組込みに利用された配列は、muttRNAなどであり、上述の実施例に記載されている。プロパルギルチロシンを含んでいるfEPOを、E. coliにおいて発現させ、上述の条件を用いて精製する。
プロパルギル−チロシンを含んでいる精製されたfEPOを、PB緩衝液(100mMのリン酸ナトリウム、0.15MのNaCl、pH8)に、0.1〜10mg/mLにおいて溶解させ、10〜100倍の過剰量のアジド含有PEGを反応混合物に加える。それから、触媒量のCuSO4およびCuワイヤを反応混合物に加える。混合物をインキュベーション(室温または37℃において約4時間にわたるインキュベーションまたは4℃における一晩にわたるインキュベーションが挙げられるが、これらに限定されない)した後に、H2Oを加え、透析膜に通して混合物をろ過する。上述の実施例に記載の類似の手法に(限定されないが、これが挙げられる)よって、サンプルを付加について分析し得る。
本実施例においてPEGは以下の構造:
R-PEG(N)-O-(CH2)2-NH-C(O)(CH2)n-N3
(ここで、Rはメチルであり、nは4であり、Nは10000MWである)
を有している。
〔実施例14〕
本実施例において、fEPOにおける巨大な疎水性アミノ酸の、プロパルギルチロシンを用いた置換について詳述する。
fEPOの以下の領域:1〜7(N末端)、27〜38(AヘリックスおよびBヘリックスの間の領域)、39〜41(ベータシート1)、42〜46(ベータシート1およびミニヘリックスB’の間の領域)、47〜52(ミニヘリックスB’)、53〜54(ミニヘリックスB’およびBヘリックスの間の領域)、84〜89(BヘリックスおよびCヘリックスの間の領域)、114〜121(ミニC’ヘリックス)、122〜132(ミニC’ヘリックスおよびベータシート2の間の領域)、133〜135(ベータシート2)、136〜137(ベータシート2およびDヘリックスの間の領域)、162〜166(C末端)の1つに存在しているPhe、TrpまたはTyr残基は、上述の実施例に記載の通りに、以下の天然にコードされていないアミノ酸:
を用いて置換されている。
修飾を施すとすぐに、アルキン含有アミノ酸を含んでいるfEPOバリアントにPEGを結合させる。当該PEGは以下の構造:
Me-PEG(N)-O-(CH2)2-N3
を有しており、結合手法は上述の実施例に記載の手法にしたがう。これによって天然にコードされていないアミノ酸を含んでいるfEPOバリアントが生成される。当該アミノ酸は、天然に存在している巨大な疎水性アミノ酸とおよそ等配電子性であり、上記ポリペプチド内の異なる位置においてPEG誘導体を用いて修飾されている。
〔実施例15〕
本実施例において、1つ以上のPEGリンカーによって隔てられているfEPOのホモ二量体、ヘテロ二量体、ホモ多量体またはヘテロ多量体の生成について詳述する。
上述の実施例に記載の、アルキン含有fEPOバリアントを、以下の形態:
N3-(CH2)n-C(O)-NH-(CH2)2-O-PEG(N)-O-(CH2)2-NH-C(O)-(CH2)n-N3
(ここで、nは4であり、PEGは約5000の平均分子量を有している)の機能性PEG誘導体と反応させて、対応するfEPOのホモ二量体を生成する(ここで、2つのfEPO分子はPEGによって物理的に隔てられている)。類似の手法において、1つ以上の他のポリペプチドとfEPOポリペプチドを結合させて、ヘテロ二量体、ホモ多量体またはヘテロ多量体を形成し得る。結合、精製および分析を上述の実施例に記載の通りに実施する。
〔実施例16〕
本実施例においてfEPOに対する糖部分の結合について詳述する。
上述の実施例に記載の通り、以下の残基:21位、24位、28位、30位、31位、36位、37位、38位、55位、72位、83位、85位、86位、87位、89位、113位、116位、119位、120位、121位、123位、124位、125位、126位、127位、128位、129位、130位、および162位の1つが、以下の天然にコードされていないアミノ酸:
を用いて置換されている。
修飾を施すとすぐに、カルボニル含有アミノ酸を含んでいるfEPOバリアントを、N−アセチルグルコサミンのβ結合型アミノオキシ類似物(GlcNAc)と反応させる。fEPOバリアント(10mg/mL)およびアミノオキシ糖(21mM)を100mMの水性の酢酸ナトリウム緩衝液(pH5.5)において混合し、7〜26時間にわたって37℃においてインキュベートする。糖を抱合しているfEPOポリペプチド(5mg/mL)を、UDPグルコース(16mM)およびβ−1,4−ガラシトシルトランスフェラーゼ(0.4ユニット/mL)とともに、150mMのHEPES緩衝液、周囲温度において、48時間にわたってインキュベートすることによって、第2の糖を第1の糖に対して酵素的に結合させる(Schanbacher et al. J. Biol. Chem. 1970, 245, 5057-5061)。
〔実施例17〕
本実施例においてPEG付加fEPOアンタゴニストの生成について詳述する。
上述の実施例に記載の通りに、以下の残基:21位、24位、28位、30位、31位、36位、37位、38位、55位、72位、83位、85位、86位、87位、89位、113位、116位、119位、120位、121位、123位、124位、125位、126位、127位、128位、129位、130位、および162位の1つが、以下の天然にコードされていないアミノ酸:
を用いて置換されている。
修飾を施すと、カルボニル含有アミノ酸を含んでいるfEPOバリアントを、以下の形態:
R-PEG(N)-O-(CH2)n-O-NH2
(ここで、rはメチルであり、Nは20000MWである)
のアミノオキシ含有PEG誘導体と反応させて、ポリペプチド内の単一の部位においてPEG誘導体を用いて修飾されている天然にコードされていないアミノ酸を含んでいるfEPOアンタゴニストを生成させる。結合、精製および分析を上述の実施例に記載の通りに実施する。
〔実施例18:fEPO分子が直接的に連結されている、fEPOのホモ二量体、ヘテロ二量体、ホモ多量体またはヘテロ多量体の生成〕
アルキン含有アミノ酸を含んでいるfEPOバリアントを、アジド含有アミノ酸を含んでいる他のfEPOバリアントに結合させ得る。ここでfEPOバリアントのそれぞれは、上述の実施例に記載の部位に天然にコードされていないアミノ酸の置換を含んでいる。これによって、対応するfEPOホモ二量体が生成される(ここで2つのfEPOバリアントはSite2結合表面において物理的に結合されている)。類似の手法においてfEPOポリペプチドを1つ以上の他のポリペプチドと結合させて、ヘテロ二量体、ホモ多量体またはヘテロ多量体を形成し得る。結合、精製および分析を上述の実施例に記載の通りに実施する。
〔実施例19〕
PEG-OH + Br-(CH2)n-C:CR’ → PEG-O-(CH2)n-C≡CR’
A B
ポリアルキレングリコール(P−OH)をハロゲン化アルキル(A)と反応させて、エーテル(B)を形成する。これらの化合物において、nは1〜9の整数であり、R’は、直鎖状または分枝鎖状の、飽和または不飽和の、C1〜C20のアルキル基またはヘテロアルキル基である。また、R’は、C3〜C7の飽和もしくは不飽和のシクロアルキル基もしくはシクロヘテロアルキル基、置換されているか、もしくは置換されていないアリール基もしくはヘテロアリール基、または置換されているか、もしくは置換されていないアルカリル基(ここでアルキルはC1〜C20の飽和または不飽和のアルキルである)もしくはヘテロアルカリルであり得る。典型的に、P−OHは、800〜40000ダルトン(Da)の分子量を有しているポリエチレングリコール(PEG)またはモノメトキシポリエチレングリコール(mPEG)である。
〔実施例20〕
mPEG-OH + Br-CH2 -C≡CH → mPEG-O-CH2-C≡CH
20000Daの分子量を有しているmPEG−OH(mPEG−OH 20kDa;2.0g、0.1mmol、Sunbio)を、THF(35mL)におけるNaH(12mg、0.5mmol)を用いて処理した。それから、80重量%の溶液としてキシレンに溶解させた臭化プロパルギルの溶液(0.56mL、5mmol、50等量、Aldrich)、および触媒量のKIを上記溶液に加え、生じた混合物を2時間にわたって還流した。それから水(1mL)を加え、真空条件下において溶媒を除去した。残余物にCH2Cl2(25mL)を加え、有機層を分離し、無水Na2SO4に通して乾燥させ、容積を約2mLまで減少させた。このCH2Cl2溶液をジエチルエーテル(150mL)に滴下して加えた。生じた沈殿物を回収し、冷却したジエチルエーテルを用いて数回にわたって洗浄し、乾燥させてプロパルギル−O−PEGを得た。
〔実施例21〕
mPEG-OH + Br-(CH2)3-C≡CH → mPEG-O-(CH2)3-C≡CH
20000Daの分子量を有しているmPEG−OH(mPEG−OH 20kDa;2.0g、0.1mmol、Sunbio)を、THF(35mL)におけるNaH(12mg、0.5mmol)を用いて処理した。それから、15等量の5−クロロ−1−ペンテン(0.53mL、0.5mmol、Aldrich)および触媒量のKIを混合物に加えた。生じた混合物を16時間にわたって加熱して還流した。それから、水(1mL)を加え、真空条件下において溶媒を除去した。残余物にCH2Cl2(25mL)を加え、有機層を分離し、無水Na2SO4に通して乾燥させ、容積を約2mLまで減少させた。このCH2Cl2溶液をジエチルエーテル(150mL)に滴下して加えた。生じた沈殿物を回収し、冷却したジエチルエーテルを用いて数回にわたって洗浄し、乾燥させて対応するアルキンを得た。
〔実施例22〕
(1)m-HOCH2C6H4OH + NaOH + Br-CH2-C≡CH → m-HOCH2C6H4O-CH2-C≡CH
(2)m-HOCH2C6H4O-CH2-C≡CH + MsCl + N(Et) 3 → m-MsOCH2C6H4O-CH2-C≡CH
(3)m-MsOCH2C6H4O-CH2-C≡CH + LiBr → m-Br-CH2C6H4O-CH2-C≡CH
(4)mPEG-OH + m-Br-CH2C6H4O-CH2-C≡CH → mPEG-O-CH2-C6H4O-CH2-C≡C
THF(50mL)および水(2.5mL)における3−ヒドロキシベンジルアルコール(2.4g、20mmol)の溶液に、まず粉末状の水酸化ナトリウム(1.5g、37.5mmol)を加え、それからキシレンにおける80重量%の溶液として溶解させた臭化プロパルギル(3.36mL、30mmol)の溶液を加えた。反応混合物を6時間にわたって加熱して還流した。混合物に対して10%のクエン酸(2.5mL)を加え、真空条件下において溶媒を除去した。酢酸エチル(3×15mL)を用いて残余物を抽出し、飽和NaCl溶液(10mL)を用いて混合性の有機層を洗浄し、MgSO4に通して乾燥させ、濃縮して3−プロパルギロキシベンジルアルコールを得た。
塩化メタンスルホニル(2.5g、15.7mmol)およびトリエチルアミン(2.8mL、20mmol)を、CH2Cl2における化合物3(2.0g、11.0mmol)の溶液に0℃において加え、反応物を16時間にわたって冷却装置に入れておいた。通常の操作によって淡黄色の油状物としてメシレートが生じた。この油状物(2.4g、9.2mmol)をTHF(20mL)に溶解させ、LiBr(2.0g、23.0mmol)を加えた。反応混合物を1時間にわたって加熱して還流し、それから室温まで冷却させた。混合物に水(2.5mL)を加え、真空条件下において溶媒を除去した。酢酸エチル(3×15mL)を用いて残余物を抽出し、飽和NaCl溶液(10mL)を用いて混合性の有機層を洗浄し、無水Na2SO4に通して乾燥させ、濃縮して所望の臭化物を得た。
mPEG−OH 20kDa(1.0g、0.05mmol、Sunbio)をTHF(20mL)に溶解させ、溶液を冷却槽において冷却した。数分間にわたって激しく攪拌しながらNaH(6mg、0.25mmol)を加え、それから上述のように得られた臭化物(2.55g、11.4mmol)および触媒量のKIを加えた。冷却槽を外し、生じた混合物を12時間にわたって加熱して還流した。混合物に水(1.0)を加え、真空条件下において溶媒を除去した。残余物にCH2Cl2(25mL)を加え、有機層を分離し、無水Na2SO4に通して乾燥させ、容積を約2mLまで減少させた。エーテル溶液(150mL)に滴下して加えて、白色の沈殿物を生じさせた。当該沈殿物を回収してPEG誘導体を得た。
〔実施例23〕
mPEG-NH2 + X-C(O)-(CH2)n-C≡CR’ →mPEG-NH-C(O)-(CH2)n-C≡CR’
また、末端アルキン含有ポリ(エチレングリコール)重合体は、末端官能基を含んでいるポリ(エチレングリコール)を上述のアルキン官能基を含んでいるp反応性の分子に対して結合することによって取得され得る。
〔実施例24〕
(1)HO2C-(CH2)2-C≡CH + NHS +DCC → NHSO-C(O)-(CH2)2-C≡CH
(2)mPEG-NH2 + NHSO-C(O)-(CH2)2-C≡CH → mPEG-NH-C(O)-(CH2)2-C≡CH
4−ペンチン酸(2.943g、3.0mmolをCH2Cl2(25mL)に溶解させた。N−ヒドロキシコハク酸塩(3.80g、3.3mmol)およびDCC(4.66、3.0mmol)を加え、溶液を室温において一晩にわたって攪拌した。生じた粗製のNHSエステル7をさらに精製することなく以下の反応に使用した。
5000Daの分子量を有しているmPEG−NH2(mPEG−NH2、Sunbio)をTHF(50mL)に溶解させ、混合物を4℃まで冷却した。激しく攪拌しながらNHSエステル7(400mg、0.4mmol)を幾度かに分けて加えた。混合物を室温まで温めながら3時間にわたって攪拌して放置した。それから、水(2mL)を加え、真空条件下において溶媒を除去した。残余物にCH2Cl2(50mL)を加え、有機層を分離し、無水Na2SO4に通して乾燥させ、容積を約2mLまで減少させた。このCH2Cl2溶液をエーテル(150mL)に滴下して加えた。生じた沈殿物を回収し、真空条件下において乾燥させた。
〔実施例25〕
本実施例において、ポリ(エチレングリコール)のメタンスルホニルエステル(ポリ(エチレングリコール)のメタンスルホン酸塩またはメシレートとも呼ばれる)の調製について説明する。対応するトシレートおよびハロゲン化物を同様の手法によって調製し得る。
mPEG-OH + CH3SO2Cl + N(Et) 3 →mPEG-O-SO2CH3 → mPEG-N3
150mLのトルエンにおけるmPEG−OH(MW=3400、25g、10mmol)を窒素存在下において2時間にわたって共沸蒸留し、溶液を室温まで冷却した。溶液に40mLの無水CH2Cl2および2.1mLの無水トリエチルアミン(15mmol)を加えた。溶液を冷却槽において冷却し、1.2mLの蒸留した塩化メタンスルホン酸(15mmol)を滴下して加えた。窒素存在下の室温において一晩にわたって溶液を攪拌し、2mLの無水エタノールを加えることによって反応を停止させた。真空条件下において混合物を蒸発させて、主にトルエン以外の溶媒を除去し、ろ過し、真空条件下においてふたたび濃縮し、それから100mLのジエチルエーテルにおいて沈殿させた。ろ過物を冷却したエーテルを用いて数回にわたって洗浄し、真空条件下において乾燥させてメシレートを得た。
メシレート(20g、8mmol)を75mLのTHFに溶解させ、溶液を4℃まで冷却した。冷却した溶液にアジ化ナトリウム(1.56g、24mmol)を加えた。反応物を加熱して2時間にわたって窒素存在下において還流した。それから、溶媒を蒸発させ、CH2Cl2を用いて残余物を希釈した。NaClを用いて有機画分を洗浄し、無水MgSO4に通して乾燥させた。容積を20mlまで減少させ、150mLの冷却した無水エーテルを加えることによって生成物を沈殿させた。
〔実施例26〕
(1)N3-C6H4-CO2H → N3-C6H4CH2OH
(2)N3-C6H4CH2OH → Br-CH2-C6H4-N3
(3)mPEG-OH + Br-CH2-C6H4-N3→ mPEG-O-CH2-C6H4-N3
4−アジドベンジルアルコールは、米国特許第5,998,595号に記載の方法を用いて生成され得る。塩化メタンスルホン酸(2.5g、15.7mmol)およびトリエチルアミン(2.8mL、20mmol)を、CH2Cl2における4−アジドベンジルアルコール(1.75g、11.0mmol)の溶液に0℃において加え、16時間にわたって冷却装置に入れておいた。通常の操作によって淡黄色の油状物としてメシレートを得た。この油状物(9.2mmol)をTHF(20mL)に溶解させ、LiBr(2.0g、23.0mmol)を加えた。反応混合物を加熱して1時間にわたって還流し、それから、室温まで冷却した。混合物に水(2.5mL)を加え、真空条件下において溶媒を除去した。酢酸エチル(3×15mL)を用いて残余物を抽出し、飽和NaCl溶液(10mL)を用いて混合性の有機層を洗浄し、無水Na2SO4に通して乾燥させ、濃縮して所望の臭化物を得た。
mPEG−OH 20kDa(2.0g、0.1mmol、Sunbio)を、THF(35mL)におけるNaH(12mg、0.5mmol)を用いて処理し、触媒量のKIとともに臭化物(3.32g、15mmol)を混合物に加えた。生じた混合物を加熱して12時間にわたって還流した。水(1.0)を混合物に加え、真空条件下において溶媒を除去した。残余物にCH2Cl2を加え、有機層を分離し、無水Na2SO4に通して乾燥させ、容積を約2mLまで減少させた。エーテル溶液(150mL)に滴下して加えて沈殿物を生じさせ、沈殿物を回収してmPEG−O−CH2−C6H4−N3を得た。
〔実施例27〕
NH2-PEG-O-CH2CH2CO2H + N3-CH2CH2CO2-NHS → N3-CH2CH2-C(O)NH-PEG-O-CH2CH2CO2H
NH2−PEG−O−CH2CH2CO2H(MW3400、Da、2.0g)をNaHCO3の飽和水溶液(10mL)に溶解させ、溶液を0℃まで冷却した。激しく攪拌しながら3−アジド−1−N−ヒドロキシコハク酸イミドプロピオネート(5等量)を加えた。3時間後に20mLのH2Oを加え、室温においてさらに45分間にわたって混合物を攪拌した。0.5規定のH2SO4を用いてpHを3に調整し、NaClを約15重量%まで加えた。CH2Cl2(100mL×3)を用いて反応混合物を抽出し、Na2SO4に通して乾燥させ、濃縮した。冷却したエーテルを用いた沈殿の後に、生成物をろ過によって回収し、真空条件下において乾燥させてω−カルボキシ−アジドPEG誘導体を得た。
〔実施例28〕
mPEG-OMs + HC≡CLi → mPEG-O-CH2-CH2-C≡C-H
当該分野において公知のように調製され、THFにおいて−78℃まで冷却されたリチウムアセチリド(4等量)の溶液に、THFに溶解させたmPEG−MOの溶液を、激しく攪拌しながら滴下して加えた。3時間後に、反応物を室温まで温め、1mLのブタノールの添加によって反応を停止させた。それから、20mLのH2Oを加え、混合物を室温においてさらに45分間にわたって攪拌した。0.5規定のH2SO4を用いてpHを3に調整し、NaClを約15重量%まで加えた。CH2Cl2(100mL×3)を用いて反応混合物を抽出し、Na2SO4に通して乾燥させ、濃縮した。冷却したジエチルエーテルを用いた沈殿の後に、生成物をろ過によって回収し、真空条件下において乾燥させてω−カルボキシ−アジドPEG誘導体を得た。
〔実施例29〕
L. Wang, et al., (2001), Science 292:498-500, J.W. Chin et al., Science 301:964-7 (2003)), J. W. Chin et al., (2002), Journal of the American Chemical Society 124:9026-9027; J. W. Chin, & P. G. Schultz, (2002), ChemBioChem 11:1135-1137; J. W. Chin, et al., (2002), PNAS United States of America 99:11020-11024: and, L. Wang, & P. G. Schultz, (2002), Chem. Comm., 1-10に記載の方法を用いて、アジド含有アミノ酸およびアセチレン含有アミノ酸をタンパク質へ部位特異的に組み込んだ。アミノ酸を組み込むとすぐに、2mMのPEG誘導体、1mMのCuSO4および〜1mgのCuワイヤの存在下において、リン酸緩衝液(PB)(pH8)における0.01mMのタンパク質を用いて、4時間にわたって37℃において環付加反応を実施した。
〔実施例30:正赤血球性貧血マウスアッセイによって決定されたPEG付加fEPOのインビトロ活性およびインビボ活性〕
PEG−fEPO、修飾を受けていないfEPOおよび緩衝溶液をマウスに投与する。結果は、マウスごとに同じ用量を用いた網状赤血球の有意に増大した量および網状赤血球カウントの最大値のシフトによって示される、修飾を受けていないfEPOと比べて、本発明のPEG付加fEPOの優れた活性および延長された半減期を示している。
正赤血球性貧血マウスアッセイは当該分野において公知である(Pharm. Europa Spec. Issue Erythropoietin BRP Bio 1997(2))。BSA−PBSを用いてサンプルを希釈する。7〜15週齢の健常なマウスの皮下に本発明の0.2mlのPEG付加fEPOを投与する。投与後の72時間に始まる4日間にわたって、尾静脈の穿刺によって採血し、0.1μmolのアクリジンオレンジ染色溶液の1mlに1μlの血液が存在するように血液を希釈する。染色時間は3〜10分間である。赤色蛍光の棒グラフの分析(30000の赤血球ごとに分析された)によって、フローサイトメーターにおいて微蛍光測定的に網状赤血球カウントを実施する。各試験群は1日につき5匹のマウスからなり、マウスは1回のみ採血を受ける。
(生物アッセイ)
Ba/F3−fEPOR細胞増殖によって生物活性が決定されるfEPOの受容体結合アッセイおよび細胞増殖アッセイを用いて、インビトロの生物学的活性について本発明のfEPOポリペプチドをさらに評価する。各アッセイの手順は、Wrighton et al. (1997) Nature Biotechnology 15:1261-1265、米国特許第5,773,569号および米国特許第5,830,851号に記載されている。本発明にしたがって調製されたfEPOポリペプチドに関するEC50値は、組換えエリスロポエチンを用いて得られる最大の活性の50%を生成するために必要な化合物の濃度である。
〔実施例31〕
天然にコードされていないアミノ酸を含んでいるPEG付加fEPOの安全性および/または有効性の臨床試験。
(目的)
天然にコードされていないアミノ酸を含んでいる、皮下に投与されたPEG付加組換えネコEPOの安全性および薬物動態を、市販の組換えhEPO製品であるPROCRITまたはARANESPと比較するため。
(患者)
類似のプロファイル(年齢および体重)の健康な18匹のネコを本試験に登録する。被験体は、臨床的に有意な異常を示す血液学もしくは血清化学に関する検査値を有しておらず、尿に関する毒性スクリーン、HIVスクリーンおよびB型肝炎表面抗原に関して陰性である。被験体らは、以下の任意の徴候:高血圧;任意の主要な血液疾患の既往歴;深刻な肝疾患、腎疾患、心疾患、胃腸疾患、代謝疾患、神経疾患の既往歴;貧血またはてんかん発作の既往歴;細菌または哺乳類由来の産物、PEGまたはヒト血清アルブミンに対する公知の感受性;カフェイン含有飲料の習慣的な大量の消費家;任意の他の臨床試験への関与、または試験開始までの30日以内において輸血されたか、もしくは献血された血液を有すること;試験開始までの3ヶ月以内にhEPOまたはfEPOのばくろを受けたこと;試験開始までの7日以内に病気にかかったこと;ならびに試験開始までの14日以内に試験前の身体検査または臨床検査の評価に対して有意な異常を有しているべきではない。すべての被験体は、安全性に関して評価可能であり、薬物動態分析にとってのすべての血液採取物が予定通りに採取される。制度上の倫理委員会の承認および患者の同意のもとにすべての試験を実施する。
(試験計画)
これは、健康なオスのボランティアにおける、単一施設における無作為化された2期にわたる第1相の非盲検の交差試験である。18の被験体を、2つの処理系列群(9匹の被験体/群)の1つに無作為に割り当てる。天然にコードされていないアミノ酸を含んでいるPEG付加fEPOおよび市販の製品から選択されたものの等量を用いて、大腿の上部に対して皮下注射による大量瞬時投与によって、2つの別々の投与期間にわたってEPOを投与する。市販製品の投与の量および頻度は包装の表示にしたがう。市販の製品を用いた付加的な投与、投与頻度または所望される他の要因を、被験体の付加的な群を含めることによって、試験に加え得る。ヒトの臨床試験の場合に基づく期間(例えば、14日間の洗い流し期間)によって各投与期間を分けられる。2つの投与期間のそれぞれ(2つの投与期間に挟まれた期間ではない)について、投与前の少なくとも12時間、および投与後の少なくとも72時間にわたって試験施設に、被験体を留めおく。PEG付加fEPOについても同様に試験されるべき、付加的な投与、頻度または他の要因がある場合に、被験体の加的な群を加え得る。使用が認可されているEPOの複数の調合物をこの試験に使用し得る。PROCRIT(登録商標)として市販されているエポエチンアルファおよび/またはARANESP(登録商標)として市販されているダルベポエチン(darbepoetin)は、市販のEPO製品であり、動物における治療にも使用されている。fEPOの試験調合物は、天然にコードされていないアミノ酸を含んでいるPEG付加fEPOである。
(血液採取)
EPO投与の前および後に、直接に血管に穿刺することによって、血液の系列を採取する。血清中のエリスロポエチン濃度の決定するための静脈血サンプル(5mL)を、投与の約30、20および10分前(3つの基準サンプル);投与の30分後、1、2、5、8、12、15、18、24、30、36、48、60、および72時間後に取得する。各血清サンプルを2等分する。すべての血清サンプルを−20℃に保存する。血清サンプルをドライアイスに載せる。1日目における初回投与の直前、4日目の朝、16日目における投与の直前、および19日目の朝に、空腹時の臨床検査試験(血液学、血清生化学および尿検査)を実施する。
(生物分析方法)
放射免疫アッセイ(RIA)キットの手法(Diagnostic Systems Laboratory [DSL]、Webster TX)を、血清中のエリスロポエチン濃度の決定に使用する。市販のRIAは、一次抗体としての、尿中のエリスロポエチンに対するウサギポリクロナル抗血清、およびトレーサとしての、125I−標識した尿中のエリスロポエチンを使用する競合的な二重抗体法である。標準物質および性質対照サンプルにおいて、DSLキットに提供されている尿中のエリスロポエチンをエポエチンアルファまたはダルベポエチンに代えている。アッセイに使用される標準濃度は、7.8、15.6、31.3、50、62.5、100および125mIU/mLである。許容可能な正確さを与える最低の規準のためのバックフィット値(back-fit value)の平均として規定される感度は8.6mIU/mLであり、アッセイの範囲は性質対象の希釈によって2000mIU/mLまで広げられる。
(安全性の決定)
各投与(1日目および16日目)の直前、各投与から6、24、48、および72時間目に、生命徴候を記録する。安全性の決定は、有害事象の発生および種類ならびに臨床検査試験の基準からの変化に基づいている。さらに、試験前における生命徴候(血圧および身体検査の結果が挙げられる)の測定からの変化を評価する。
(データ解析)
投与後の値のそれぞれから基準のエリスロポエチン濃度の平均値を差し引くことによって、投与前のGH濃度の基準値に関して、投与後の血清中濃度値を補正する。基準のエリスロポエチン濃度の平均値は、投与までの10、20および30分前において回収された3つのサンプルからエリスロポエチンレベルを平均化することによって得られる。投与前のエリスロポエチン濃度は、それらがアッセイの定量レベルよりも下回っている場合、平均値の算出に含められない。基準のエリスロポエチン濃度に関して補正された血清濃度のデータから薬物動態パラメータを決定する。デジタルイクイップメントコーポレーション VAX8600コンピュータシステムにおいて、BIOAVLソフトウェアの最新バージョンを用いたモデル独立法によって、薬物動態パラメータを算出する。以下の薬物動態パラメータ:ピーク血清濃度(Cmax)、ピーク血清濃度までの時間(tmax);直線台形法を用いて算出された時点0から最後の血液サンプリング時点まで(AUC0−72)の濃度−時間曲線の下にある領域(AUC);および排泄速度定数から計算された末梢排泄半減期(t1/2)を決定する。ログ−リニアの濃度−時間プロットの末端の直線領域における連続的な複数のデータ点の直線回帰によって、排泄速度定数を見積る。薬物動態パラメータの平均値、標準偏差(SD)、および変動係数(CV)を各処置について算出する。パラメータの平均の割合(保存した調合物/保存していない調合物)を算出する。
(安全性の結果)
有害事象の発生は処置群を越えて等しく分布している。基準、試験前の臨床検査試験または血圧からの臨床的に有意な変化はなく、試験前の身体検査結果および生命徴候の測定から顕著な変化はない。2つの処置群に関する安全性の特性は同様と思われる。
(薬物動態の結果)
市販のhEPO(PROCRITO(登録商標)またはARANESP(登録商標))の単回投与を受けた後の、18の被験体のすべてにおける血清エリスロポエチン濃度の平均−時間プロファイル(エリスロポエチンレベルの基準に関する補正なし)を、測定された各時点において、PEG付加fEPOおよび/または利用可能な研究用もしくは市販のfEPOと比較する。比較用のPEG付加fEPOは、天然にコードされていないアミノ酸を含んでいる本発明のEPOの1つであり、各時点において測定される。すべての被験体は、正常な生理学的範囲内にある投与前の基準のエリスロポエチン濃度を有している。投与前の基準のエリスロポエチン濃度の平均に関して補正された血清データから薬物動態パラメータを決定し、Cmaxおよびtmaxを決定する。hEPO(PROCRITO(登録商標))についてのtmaxの平均は、天然にコードされていないアミノ酸を含んでいるPEG付加hEPOについてのtmaxよりも有意に短い。hEPO(PROCRITO(登録商標))についての末梢半減期の値は、天然にコードされていないアミノ酸を含んでいるPEG付加fEPOについての末梢半減期と比べて有意に短い。
本試験は健康な被験体において実施されているが、同様の吸収特性および安全性プロファイルが、他の患者の集団において見込まれる。他の患者の集団は、例えば、がんまたは慢性腎不全の患者、損傷に誘導される貧血症をともなう後天的な損傷、小児腎不全患者、自家の先天的な生体プログラムを有している患者、緊急を要しない手術を予定している患者である。
結論として、天然にコードされていないアミノ酸を含んでいるPEG付加fEPOの皮下投与される単回投与は、安全であり、かつ健康な被験体によって十分に許容される。有害事象の相対的な発生、臨床検査値、生命徴候および身体検査の結果に基づいて、市販/研究用のEPO、hEPO(PROCRITO(登録商標))、天然にコードされていないアミノ酸を含んでいるPEG付加fEPOの安全性は、同等である。天然にコードされていないアミノ酸を含んでいるPEG付加fEPOは、患者および保健医療提供者に対して大きな臨床有用性を提供する。
〔実施例32:PEG付加fEPOバリアントのインビボ活性〕
タンパク質の活性の持続期間に対するPEGの影響は、当該PEGの大きさおよび構造(直鎖状 対 分枝鎖状)に少なくとも部分的に依存している。PEGの大きさが異なるfEPOのバリアントの、ヘマトクリット(Hct)を増加させる相対的な能力を健康なネコにおいて比較する。
p−アミノフェニルアラニン(pAF)置換を位置A1に含んでいる組換えfEPOバリアントをチャイニーズハムスターの卵巣細胞の発現系において発現させた。タンパク質の非本来的なアミノ酸のS置換部位に、20kD、30kDまたは40kDのアミノオキシPEGのいずれかを用いてPEG付加した。20mMのNaPO4、140mMのNaCl、0.005%のポリソルベート−80、pH6.2からなる調合緩衝液に、PEG付加EPOバリアントを調合した。
約3〜6kgの体重を有している24匹の健康なネコ(12匹のオス/12匹のメス)を、Aクラスの供給メーカから購入し、放置して試験設備、食餌および管理手順に順化にさせた。試験の実施前の−14日および−7日に基準の血液サンプルを採取した。アセプロマジンおよびイスフルリンを用いてネコを鎮静させて、血液サンプルの採取のストレスを低減させた。疾患の臨床徴候がなく、健康なネコにとって正常な基準範囲にあるHct値を有している動物を試験への登録のために選択した。
無作為化した区画計画を用いてネコを4つの処置群の1つに割り当て、処理間の基準のヘマトクリットを平等化した。
処理前の0日に動物から採血し、体重を測定した。皮下投与によって割り当てられた処理を用いて1回にわたって動物を処理した。
処理後の3、7、10、14、17、21、24、28、31、35、38および42日にさらなる血液サンプルを採取した。各サンプルについてヘマトクリットを決定した。また、毎日の食料の消費を測定し、任意の健康に関する問題について動物を観察した。
ヘマトクリットおよびRBCに対する種々の処理の影響は図36に示されている。
緩衝液対照に対するHct値の有意な増加が、20kDまたは30kDのPEG付加バリアントのいずれにおいても、投与から3日目以内に観察された。40kDのPEGバリアントを用いた処理は、処理後の約10日までに緩衝液対照に対する有意な増加を示した。最大のHct値は、20kDのPEGバリアントを用いて処理した動物において10日目、30kDのPEGバリアントを用いて処理した動物において14日目、40kDのPEGバリアントを用いて処理した動物において17日目に観察された。20または30kDのいずれかのPEGバリアントを用いて処理した動物におけるヘマトクリットは、投与後の少なくとも28日間を通して緩衝液対照よりも有意に高かった。これらの結果は、1ヵ月につき1回のPEG fEPOの投与が増加したHctレベルの維持を支持するために十分であることを示唆している。試験の継続期間中に有害事象は観察されなかった。
〔実施例33:貧血症のネコにおけるPEG付加fEPOバリアントの有効性〕
貧血症にかかっているネコにおける正常な赤血球(RBC)数を回復させるPEG付加fEPOバリアントの能力を、ステージIIIまたはステージIVの慢性腎疾患(CKD)にかかっているネコにおいて評価し得る。この障害を有しているネコは、内因性のfEPOの主要な供給源である腎の柔細胞の減少に起因する中程度から重篤な非再生性の貧血症を示す。
CKDおよび貧血症にかかっているネコにおける赤血球数を増加させる、PEG付加fEPOの能力を評価するために、CKDの臨床歴および<30%のヘマトクリットを有している約3〜6kgの12匹のネコ(6匹のオスおよび6匹のメス)を、試験施設、食餌および管理手順に順化させる。試験開始前の−14日および−7日に採取された血液サンプルから得られたヘマトクリットおよびRBCを各動物に関する基準の対照として使用する。
無作為化した区画計画を用いて1〜3の処理群にネコを割り当て、処理間における基準のヘマトクリットおよびRBCを平均化した。各処理群は4匹のネコ(2匹のオス/2匹のメス)を含んでいる。2〜8 g/kgの範囲の投与量において皮下注射によって1回にわたってPEG付加fEPOを投与する。
処理後の3、7、10、14、17、21、24、28および31日にさらなる血液サンプルを採取する。ヘマトクリットおよびRBCカウントを各サンプルについて決定する。また、毎日の食料の消費を測定し、生活の質を評価するために抑うつおよび/または昏睡の臨床徴候について毎日、動物を観察し、記録する。
処理後のヘマトクリットおよびRBCカウントをタンパク質の投与前に得られた基準値と比較することによって有効性を決定する。処理後の期間中の任意の時点において、毎日のヘマトクリットおよびRBCカウントの平均値が基準値に対して統計的に有意な増加を示す場合、または毎日の平均値が正常な基準範囲の値にまで増加している場合、タンパク質は有効であると見なされる。
本明細書に記載の実施例および実施形態が例証のみを目的としており、それらに鑑みた種々の改良または変更が当業者に示唆されていること、ならびに当該改良または変更が本願および添付の特許請求の範囲の範囲の精神および範囲に含められるべきであることが理解される。本明細書に引用されているすべての公開物、特許および特許出願は、すべての目的のために参照によってその全体が本明細書に援用される。
ヒトおよびネコのエリスロポエチンの整列化配列を示す図である。
ジーンバンクに寄託されている2つの配列(ジーンバンク受入れ番号:U00685およびジーンバンク受入れ番号:L10606)の間における差異、共通配列を強調している図である。
高親和性および低親和性の受容体とともに、4ヘリックスバンドルタンパク質のエリスロポエチン(EPO)に関する一般的な構造を示す図である。
高親和性および低親和性の受容体とともに、4ヘリックスバンドルタンパク質のエリスロポエチン(EPO)に関する一般的な構造を示す、の別の視点からの図である。
天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位が示されている図である。
天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位を上面視している図である。
天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位を側面視している図である。
天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位、配列番号2および配列番号4に由来する天然に存在しているアミノ酸およびそのアミノ酸位置、ならびにこれらの部位に関するCxの平均値の表を示す図である。
天然にコードされていないアミノ酸の組込みのために選択されるいくつかの部位、配列番号2および配列番号4に由来する天然に存在しているアミノ酸およびそのアミノ酸位置、ならびにこれらの部位に関するCxの平均値の表を示す図である。
調合緩衝液に対してグラフ化されている450nmにおける吸光度を示す図である。
エンドトキシンに対してグラフ化されている450nmにおける吸光度を示す図である。
TF−1増殖アッセイの結果を示す図である。
リガンド結合によるfEPO受容体の二量体化を示す図である。
鐘形の用量応答曲線を示している、fEPOの濃度の増加に対してプロットされた450nmにおける吸光度を示す図である。
TF−1細胞の異なる播種密度を示す図である。
細胞のスタベーションが細胞分裂を同期化し、より大きなダイナミックレンジを生じるか否かを決定する実験結果のグラフを示す図である。
20000の播種密度、72時間のインキュベーション時間、500ng/mlのfEPOの開始濃度および2.5倍希釈を用いたTF−1アッセイのために使用された条件のグラフを示す図である。
細胞の継代数、EC50、吸光度およびダイナミックレンジに関するデータを提供している、アッセイの信頼性を測定する表を示す図である。
野生型のfEPOおよび調合緩衝液を用いたTF−1の成績の表およびグラフを示す図である。
ヒトおよびネコの野生型のEPOの間におけるアッセイの成績を比較するグラフを示す図である。
対照として野生型のfEPOを用いた調整済および未調整のCHO培地の濃度変化に対して測定された吸光度のグラフを示す図である。
低下する濃度および測定された吸光度に関する、野生型のfEPO、CHO/PEI+1.25mg/mLのfEPOおよびCHO/PEI単独を比較するグラフを示す図である。
野生型のfEPOと比較したときの、組み込まれている非天然アミノ酸pAFを有しているfEPOバリアントの相対活性の表およびグラフを示す図である。
組み込まれている非天然アミノ酸pAFを有している種々のfEPOバリアント、およびそれぞれのED50 ng/mLの測定の棒グラフ図である。
野生型のfEPOと比較したときの、4℃および−80℃において5週間以上にわたって保存されたE72 fEPOバリアント、およびそれらの吸光度のグラフを示す図である。
Lucy Fベクター、ならびにtRNA、所望の転写エレメントの遺伝子およびtRNA合成酵素の位置を示す模式図である。
Irwinベクター、ならびにtRNA、所望の転写エレメントの遺伝子およびtRNA合成酵素の位置を示す模式図である。
ネコエリスロポエチンのためのLucy Fにおける抑制発現コンストラクトL BB−Opti FEPOを示す模式図である。
ネコエリスロポエチンのためのIrwinにおける抑制発現コンストラクトL BB−Opti FEPOを示す模式図である。
軽鎖遺伝子および重鎖遺伝子を有している、ジェネリック抗体をコードしている本発明に係る抑制発現コンストラクトを示す模式図である。
ELISAによって測定された、pAF存在下におけるfEPOの抑制レベル(OD−50)を示している棒グラフを示す図である。
SDS−PAGEによるPEG付加fEPOの移動度を示す図である。
fEPOのD55およびP129 pAFバリアントに関するPEG付加反応(30kDa)、これらのPEG付加バリアントのSDS−PAGEの結果を示すしている図である。
fEPO A1 pAFバリアントに対するPEG付加反応(30kDa)の成功をSDS−PAGEの結果によって示す図である。
2者の間に94%の相同性があるcEPO(配列番号31)およびfEPO(配列番号4)のアミノ酸配列の比較の結果を示す図である。
2者の間に94%の相同性があるeEPO(配列番号33)およびfEPO(配列番号4)のアミノ酸配列の比較の結果を示す図である。
実施例32において実施された実験からの、ヘマトクリットおよび赤血球(RBC)に対するバリアント処理の影響を示しているグラフを示す図である。