-
Technischer
Bereich
-
Die
Erfindung betrifft neue Rohformen und kristalline Formen von Lercanidipin-hydrochlorid
und Verfahren zur Herstellung dieser Formen. Pharmazeutische Zusammensetzungen,
welche die neuen kristallinen Formen enthalten, werden ebenfalls
erwogen.
-
Stand der
Technik
-
Lercanidipin
-
(1,1,N-Trimethyl-N-(3,3-diphenylpropyl)-2-aminoethyl-1,4-dehydro-2,6-dimetyl-4-(3-nitrop
henyl)pyridin-3,5-dicarbonsäuremethylester)
ist ein hoch lipophiler Dihydropyridin-Calciumantagonist mit einer
langen Wirkungsdauer und hoher vaskulärer Selektivität. Sein
Mechanismus der antihypertensiven Wirkung wird einer direkt relaxierenden
Wirkung auf die vaskulären
glatten Muskeln zugeschrieben, welche den gesamten peripheren Widerstand
senken. Die empfohlene Ausgangsdosis von Lercanidipin als Monotherapie
beträgt
10 mg täglich über den
oralen Weg, bei einer Wirkstofftitration bis zu gegebenenfalls 20
mg täglich.
Lercanidipin wird nach der oralen Administration rasch absorbiert
mit dem Auftreten von maximalen Plasmaspiegeln 2–3 Stunden nach der Wirkstoffeinnahme.
Die Eliminierung erfolgt im Wesentlichen über den hepatischen Weg.
-
Dank
seiner hohen Lipophilität
und seinem hohen Membrankoeffizienten kombiniert Lercanidipin eine kurze
Plasmahalbwertszeit mit einer langen Wirkungsdauer. Tatsächlich resultiert
die bevorzugte Verteilung des Wirkstoffs in die Membranen der glatten
Muskelzellen in einer Membran-kontrollierten Pharmakokinetik, die
durch eine verlängerte
pharmakologische Wirkung gekennzeichnet ist. Im Vergleich zu anderen
Calciumantagonisten ist Lercanidipin durch einen allmählichen
Beginn und eine langanhaltende Wirkungsdauer trotz sinkender Plasmaspiegel
gekennzeichnet. In-vitro-Untersuchungen zeigen, dass die Reaktion
einer isolierten Rattenaorta auf einen hohe K+-Spiegel
durch Lercanidipin abgeschwächt
werden kann, auch nachdem der Wirkstoff 6 Stunden aus der Umgebung
des Aortengewebes entfernt wurde.
-
Lercanidipin
ist kommerziell erhältlich
von Recordati S.p.A. (Mailand, Italien) und wurde zusammen mit anderen
Verfahren zu seiner Herstellung und Auftrennung in einzelne Enantiomere
in den U.S. Patenten 4 705 797, 5 767 136, 4 968 832, 5 912 51 und
5 696 139 beschrieben. Ein Verfahren zur Herstellung von Lercanidipin
wird im U.S. Patent Nr. 4 705 797 beschrieben und umfasst das folgende
Schema:
(1): Xylol
unter Rückfluss;
(2): Toluol, 85°C;
(3) HCl +CHCl
3; 0°C; (4) HOCH(CH
3)
2 unter Rückfluss
-
Rohes
Lercanidipin ist ein öliger
Rückstand,
der über
Flashchromatographie unter Verwendung von Chloroform, das zunehmende
Mengen an Aceton enthält,
als Eluierungsmittel gereinigt werden muss. Das Lösungsmittel
wird dann bis zur Trockene abgedampft und der verbleibende Rückstand
wird in Methanol gelöst, wobei
ein kleiner Überschuss
an Salzsäure
in Ethanol zugesetzt wird. Nach dem Verdampfen des Lösungsmittels
wird das halbhydrierte Hydrochloridsalz durch Behandlung mit verdünnter Salzsäure in Gegenwart
von Natriumchlorid hergestellt.
-
Ein
Hauptnachteil dieses Verfahrens zur Herstellung von Lercanidipin,
wie es im U.S. Patent Nr. 4 705 797 beschrieben wird, ist, dass
die beschriebene Zyklisierungsreaktion verschiedene Nebenprodukte
erzeugt, was zu einer geringeren Ausbeute an gewünschtem Produkt führt. Darüber hinaus
ist die Reinigung und Isolierung von Lercanidipin aus der Reaktionsmischung
recht kompliziert, da dies eine Vielzahl an Behandlungen mit unterschiedlichen
Lösungsmitteln
erfordert. Schließlich
sind die Reinigungs- und Isolierungsschritte in industriellem Maßstab schwierig
auszuführen,
da eine Produktreinigung über
Säulenchromatgraphie
notwendig ist.
-
U.S.
Patent 5 912 351 beschreibt ein einfacheres Verfahren zur Herstellung
von Lercanidipin-hydrochlorid. Es umfasst die Reaktion von 1,4-Dihydro-2,6-dimethyl-5-methoxycarbonyl-4-(3-nitrophenyl)pyridin-3-carbonsäure mit
Thionylchlorid in Dichlormethan und Dimethylformamid bei einer Temperatur
zwischen –4
and +1 °C
und nachfolgender Veresterung des erhaltenen Säurechlorids mit 2, N-Dimethyl-N-(3,3-diphenylpropyl)-1-amino-2-propylalkohol
bei einer Temperatur zwischen –10
and 0 °C.
Das Verfahren ergibt Lercanidipin-hydrochlorid in einer wasserfreien,
nicht-hygroskopischen kristallinen Form und vermeidet die Bildung
von unerwünschten
Nebenprodukten und die nachfolgende Reinigung auf Chromatographiesäulen.
-
Jedoch
ist die Isolierung von Lercanidipin-hydrochlorid in kristalliner
Form wiederum ziemlich kompliziert. Nach dem Abdampfen des Lösungsmittels
aus der Reaktionsmischung und Lösen
des so erhaltenen Rückstandes
in Ethylacetat, wird die Lösung
zunächst
mit Kochsalzlösung,
dann weitere fünfmal
mit einer 10 %igen Natriumcarbonatlösung, fünfmal mit 1N Salzsäure und
gegebenenfalls noch einmal mit Kochsalzlösung gewaschen.
-
Daher
besteht in dieser Technik Bedarf an einem Verfahren zur Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form, welches einen
weiteren Nachteil der gegenwärtig
verwendeten Verfahren vermeidet.
-
Zusätzlich wurde
gefunden, dass Lercanidipin, hergestellt wie durch das oben an zweiter
Stelle beschriebene Verfahren, trotz sorgfältiger Verfahrenskontrollen
eine Variabilität
von Batch zu Batch aufwies, und sogar eine Beobachtung des Schmelzpunktes,
der für
das feste Produkt für
charakteristisch gehalten wurde, das über das Verfahren aus Beispiel
3 von US Patent 5 767 136 hergestellt wurde, von 186–188 °C. Diese Variabilität zeigte
sich in einem anscheinend unvorhersagbaren Auftauchen (und Verschwinden)
von Unterschieden bezüglich
einer oder mehrerer Produkteigenschaften (z. B. Farbe), dem Schmelzpunkt
und der Löslichkeit.
Daraus ergab sich die Frage, ob eine Reinheit und/oder Reproduzierbarkeit
zugesichert werden kann (z.B. gegenüber ausführenden Behörden), dass das Produkt stets
das Gleiche ist.
-
Weitere
Untersuchungen durch die Erfinder der vorliegende Erfindung zeigten
Batch-zu-Batch-Unterschiede bei der Bioverfügbarkeit bei Tieren und Unterschiede
bei den Kristallgrößen. Im
Verlauf der Untersuchung der Gründe
für dieses Variabilitätsproblem
haben die Erfinder nun überraschenderweise
neue Lercanidipin-hydrochlorid-Polymorphe gefunden. Sie fanden auch
geeignetere Verfahren zur Herstellung und Isolierung von kristallinen
Lercanidipin-hydrochlorid-Produkten aus der Reaktionsmischung. Es
wurde überraschenderweise
gefunden, dass Lercanidipin-hydrochlorid polymorphe Eigenschaften
zeigt und in unterschiedlichen Kristallformen kristallisiert, in
Abhängigkeit
vom verwendeten Verfahren und den verwendeten Lösungsmitteln. Darüber hinaus
wurde die Isolierung von jedem einzelnen kristallinen Polymorph
möglich,
was so die Möglichkeit
einer Batch-zu-Batch-Variabilität
von Lercanidipin vermindert, welche aus Mischungen unterschiedlicher fester
Formen resultierten, die im gleichen Batch vorkamen, und derartige
Mischungen mit unterschiedlichen Zusammensetzungen haben Schmelzpunkte
innerhalb des gleichen engen Bereichs wie die einzelnen Formen,
wie die Erfinder der vorliegenden Erfindung fanden. Daher wurden
reproduzierbarere Batches von Lercanidipin, die für eine Herstellung
im großen
Maßstab
besser geeignet sind, und eine Qualitätskontrolle benötigt.
-
Darstellung der Erfindung
-
Die
vorliegende Erfindung betrifft neue Rohformen und kristalline Formen
von Lercanidipin-hydrochlorid und Verfahren zur Herstellung derselben.
-
In
einer Ausführungsform
stellt die Erfindung rohes Lercanidipin-hydrochlorid in fester Form
(A) bereit, welches einen Schmelzpunkt von etwa 150–152 °C (DSC-Peak)
aufweist und etwa 3–4
Gew.-% Ethylacetat umfasst.
-
In
einer anderen Ausführungsform
stellt die Erfindung rohes Lercanidipin-hydrochlorid in fester Form (B)
bereit, das einen Schmelzpunkt von etwa 131–135 °C (DSC-Peak) aufweist und etwa
0,3–0,7
Gew.-% Ethylacetat umfasst.
-
Es
werden Verfahren für
unabhängige
Synthesen von rohem Lercanidipin-hydrochlorid Form (A) und rohem
Lercanidipin-hydrochlorid Form (B) bereitgestellt, was es ermöglicht,
jede Rohform in isolierter Form zu erhalten.
-
In
einer Ausführungsform
wird isoliertes Lercanidipin-hydrochlorid in kristalliner Form (II)
bereitgestellt, welches ein Röntgenbeugungsmuster
bei einer Wellenlänge
Kα wie gezeigt
aufweist, wobei die Netzebenenabstände, (I/IO)-Verhältnisse
und 2θ-Winkel
der signifikanten Reflexe sind:
-
Das
Lercanidipin-hydrochlorid in kristalliner Form (II) hat einen Schmelzpunkt
von etwa 207–211 °C, wobei
genannter Schmelzpunkt als DSC-Peak bestimmt wird.
-
Die
vorliegende Erfindung ermöglicht
so, Mischungen der Form I, welche das folgenden Röntgenbeugungsmuster
bei einer Wellenlänge
Kα aufweist,
wobei die Abstände
zwischen den Reflexen (D in X), relative Intensitätsverhältnisse
(I/Io)-Verhältnisse
und Winkel von signifikanten Reflexen (2θ) sind:
wobei
Lercanidipin-hydrochlorid in kristalliner Form (I) einen Schmelzpunkt
von etwa 197–201 °C aufweist,
wobei genannte Schmelzpunkte als DSC-Peaks bestimmt wurde, und aus
Form (II) mit einem vorbestimmten und reproduzierbaren Gehalt an
jeder Form und, gegebenenfalls, auch anderen Formen von Lercanidipin,
wie amorphen, erhalten werden.
-
Ebenso
werden Verfahren zur Synthese bereitgestellt, in welchen Lercanidipin
Form (II) unabhängig vom
Ausgangsmaterial von Lercanidipin-hydrochlorid in Rohform (A) oder
Rohform (B) erhalten werden kann.
-
Ebenso
werden pharmazeutische Zusammensetzungen bereitgestellt, umfassend
(1) kristallines Lercanidipin-hydrochlorid und gegebenenfalls andere
Formen von Lercanidipin wie amorphe, wobei kristallines Lercanidipin-hydrochlorid
ausgewählt
wird aus der Gruppe bestehend aus kristallinem Lercanidipin-hydrochlorid
in Form (II) und Kombinationen aus Form (I) und (II), enthaltend
einen vorbestimmten Gehalt an jeder kristallinen Form, und (2) mindestens
einen Bestandteil ausgewählt
aus der Gruppe bestehend aus pharmazeutisch zulässigen Trägern oder Verdünnungsmitteln,
Geschmacksstoffen, Süßungsmitteln,
Konservierungsmitteln, Farbstoffen, Bindemitteln, Suspensionsmitteln,
Dispersionsmitteln, Pigmenten, Sprengmitteln, Hilfsstoffen, Schmiermitteln,
Weichmachern und essbaren Ölen.
-
In
einigen Ausführungsformen
der vorgenannten pharmazeutischen Zusammensetzungen wird eine Dosierungsform
bereitgestellt, die Lercanidipin-hydrochlorid in kristalliner Form
(II) oder eine Kombination aus Form (II) und Form (I) mit einer
vorbestimmten Formulierung von jeder kristallinen Form umfasst.
-
In
weiteren Ausführungsformen
stellt die Erfindung auch die Verwendung von Lercanidipin-hydrochlorid
in kristalliner Form (II) oder Kombinationen aus Form (II) und Form
(I), die einen vorbestimmten Gehalt von jeder Form umfassen, für die Behandlung
von Patienten mit arterieller Hypertonie bereit.
-
In
anderen Ausführungsformen
die Verwendung von Lercanidipin-hydrochlorid in kristalliner Form
(II) oder Kombinationen aus Form (II) mit Form (I) daraus, die einen
vorbestimmten Gehalt von jeder Form umfassen, für die Behandlung und Prävention
von atherosklerotischen Läsionen
in Arterien eines Patienten der einer solchen Behandlung bedarf.
In einer bevorzugten Ausführung
ist ein Patient, der einer Behandlung bedarf, ein Säugetier.
Am meisten bevorzugt ist der Patient, der einer Behandlung bedarf,
ein Mensch.
-
Diese
und andere Formen der vorliegenden Erfindung werden Fachleuten auf
diesem Gebiet im Licht der vorliegenden Beschreibung, Ansprüche und
Abbildungen offensichtlich.
-
Kurze Beschreibung
der Abbildungen
-
1 ist
ein Diagramm einer DSC-Analyse, die an der kristallinen Form (I),
ausgeführt
wurde, gemäß der in
Beispiel 12 beschriebenen Arbeitsbedingungen. Die Ordinate zeigt
den Wärmestrom
in mW und die Abszisse die Temperatur in °C.
-
2 ist
ein Diagramm einer DSC-Analyse, die an der kristallinen Form (II),
ausgeführt
wurde, gemäß der in
Beispiel 12 beschriebenen Arbeitsbedingungen. Die Ordinate zeigt
den Wärmestrom
in mW und die Abszisse die Temperatur in °C.
-
3 ist
ein Diagramm der Ergebnisse von thermogravimetrischen Untersuchungen,
die jeweils an der Form (I) und Form (II) wie in Beispiel 13 beschrieben
ausgeführt
wurden. Die Abszisse zeigt die Temperatur in °C und die Ordinate zeigt die
Veränderung
der Masse in Prozent.
-
4 ist
ein Diagramm der Löslichkeit
der Formen (I) und (II) in Ethanol bei 25 °C bei zunehmenden Wasserkonzentrationen.
Die Experimente werden in Beispiel 15 beschrieben. Die Ordinate
zeigt % Löslichkeit, ausgedrückt in Gew.-%
und die Abszisse Gew.-% Wasser in Ethanol.
-
5 ist
ein Diagramm der Löslichkeit
der Formen (I) und (II) in Ethanol bei 40 °C bei zunehmenden Wasserkonzentrationen.
Die Experimente werden in Beispiel 15 beschrieben. Die Ordinate
zeigt % Löslichkeit, ausgedrückt in Gew.-%
und die Abszisse Gew.-% Wasser in Ethanol.
-
6 zeigt
ein 13C-NMR-Spektrum der festen Phase der
kristallinen Form (I). Die Signale und Zuordnungen der entsprechenden
Kohlenstoffatome können
in Tabelle 4 gefunden werden.
-
7 zeigt
ein 13C-NMR-Spektrum der festen Phase der
kristallinen Form (II). Die Signale und Zuordnungen der entsprechenden
Kohlenstoffatome können
in Tabelle 5 gefunden werden.
-
8 zeigt
ein IR-Spektrum der Form (I). Die Banden und Zuordnungen können in
Tabelle 6 gefunden werden.
-
9 zeigt
ein IR-Spektrum der Form (II). Die Banden und Zuordnungen können in
Tabelle 7 gefunden werden.
-
10 stellt
den prozentualen Durchschnitt der Konzentration an Lercanidipin-hydrochlorid
in Hundeplasma nach Administration der kristallinen Form (I) und
der kristallinen Form (II) in einer Menge von 3 mg/kg, in Form einer
Hartgelatinekapsel dar. Die Ordinate zeigt den mittleren Wert der
Plasmakonzentration und die Abszisse zeigt die Zeit (in Minuten).
-
11 und 12 zeigen
jeweils die Röntgenbeugungsdiagramme
bei der Wellenlänge
Kα der kristallinen
Formen (I) und (II). Die Netzebenenabstände (d) in X, die (I/Io)-Verhältnisse
und Werte der 2θ-Winkel
der signifikantesten Reflexe können
in den unten folgenden Tabellen 1 und 2 gefunden werden. Die Ordinate
zeigt die Zahl der Counts/sec und die Abszisse zeigt die Werte der
2θ-Winkel.
-
13 und 14 sind
Darstellungen der Massenveränderung
in Prozent als Funktion der Zeit bei Hygroskopizitätsuntersuchungen,
die an den Formen (I) und (II) von Lercanidipin-hydrochlorid jeweils
ausgeführt
wurden. Die Ordinate auf der linken Seite zeigt die Massenveränderung
in Prozent und die Ordinate auf der rechten Seite die relative Feuchtigkeit
in Prozent; die Abszisse zeigt die Zeit in Minuten. Das Protokoll
für die
Hygroskopizitätsuntersuchungen
wird in Beispiel 14 beschrieben.
-
15 und 16 zeigen
jeweils die Röntgenbeugungsdiagrammen
bei der Wellenlänge
Kα von rohem
Lercanidipin-hydrochlorid Form (A) und von rohem Lercanidipin-hydrochlorid
Form (B).
-
17 und 18 zeigen
jeweils Ramanspektren von rohem Lercanidipin-hydrochlorid Form (A) und
von rohem Lercanidipin-hydrochlorid Form (B), wobei die Ordinate
die Ramaneinheiten zeigt und die Abszisse die Wellenzahl darstellt
(cm–1).
-
19 und 20 zeigen
die Ergebnisse von thermogravimetrischen Analysen, die jeweils an
rohem Lercanidipin-hydrochlorid Form (A) und an rohem Lercanidipin-hydrochlorid
Form (B) ausgeführt
wurden. In diesen Abbildungen zeigt die Abszisse die Temperatur
(in °C)
und die Ordinate zeigt die Veränderung
der Masse in Prozent.
-
Detaillierte
Beschreibung der Erfindung
-
Die
vorliegende Erfindung betrifft neue Rohformen und kristalline Formen
von Lercanidipin-hydrochlorid und Verfahren zur Herstellung derselben.
Die Erfinder haben ermittelt, dass Lercanidipin-hydrochlorid polymorphe
Eigenschaften zeigt und in unterschiedlichen Kristallformen kristallisiert,
in Abhängigkeit
vom verwendeten Verfahren und den verwendeten Lösungsmitteln, insbesondere
bei der Kristallisation.
-
Außerdem haben
die verschiedenen neuen Formen bestimmte chemische und physikalische
Eigenschaften und Bioverfügbarkeitsprofile
in Tieren, einschließlich
der Menschen, wie hier erläutert.
-
Die
neuen Verfahren zur Herstellung von rohem Lercanidipin-hydrochlorid
sind für
eine hoch reproduzierbare Herstellung in kommerziellem Maßstab von
reproduzierbaren festen Zusammensetzungen von Lercanidipin-hydrochlorid
geeignet. Die Verfahren erzeugen vorteilhafterweise neue Rohformen
(A) und (B) von Lercanidipin-hydrochlorid, welche auch für industrielle
Anwendungen erwünschte
Eigenschaften aufweisen. Die Rohformen (A) und (B), zeigen, z. B.,
eine höhere
Löslichkeit
und schnellere Trocknungsgeschwindigkeiten verglichen mit anderen
Rohformen von Lercanidipin-hydrochlorid, von denen kürzlich berichtet
wurde. Die Rohformen (A) und (B) ermöglichen weiterhin einfachere
Kristallisationsverfahren, welche für die Herstellung von neuen
isolierten kristallinen Formen von Lercanidipin-hydrochlorid verwendet
werden.
-
Die
neue isolierte kristalline Form von Lercanidipin-hydrochlorid der
vorliegenden Erfindung kann aus den Rohformen (A) und (B) von Lercanidipin-hydrochlorid
erhalten werden und wird als Lercanidipin-hydrochlorid kristalline
Form (II) bezeichnet. Die isolierte Form (II) kann reproduzierbar
aus den (A) und (B)-Zwischenstufen erhalten werden, indem die Kristallisationsbedingungen
wie unten beschreiben variiert werden. Die Formen (I) und (II) können auch
unter Verwendung anderer Ausgangsmaterialien erhalten werden. Form (II)
kann zum Beispiel erhalten werden, indem, zum Beispiel, rohes Lercanidipin
Form (C) als Ausgangsmaterial verwendet wird, wie hier beschrieben.
Form (II) kann auch unter Verwendung von Form (I) als Ausgangsmaterial
erhalten werden, wie hier beschrieben.
-
Sowohl
Lercanidipin-hydrochlorid kristalline Form (I) wie auch (II) weisen
eine gute Stabilität
auf.
-
Form
(II) ist durch eine stärker
ausgeprägte
gelbe Farbe, eine größere Kristallgröße, eine
leicht verminderte Löslichkeit
in wässrigen
Medien gekennzeichnet (alles verglichen mit Form (I)), und einem
Schmelzpunkt (DSC-Peak) in einem Bereich von etwa 207–211 °C, und genauer
von etwa 209,3 °C.
-
Form
(II) weist beim Hund eine höhere
Bioverfügbarkeit
auf und war auch beim Menschen nicht äquivalent zu Form (I); es zeigte
eine höhere
Plasmakonzentration (AUC0-t) und eine verzögerte Zeit
bis zur maximalen Konzentration (tmax),
verglichen mit Form (I).
-
Früher bekannte
Verfahren zur Herstellung von kristallinem Lercanidipin-hydrochlorid
wiesen bei der Herstellung von Lercanidipin-hydrochlorid mit vorhersagbaren
physikalischen und chemischen Eigenschaften Schwankungen auf. Daher
hatten die bisher bekannten Verfahren die unerwünschte Eigenschaften, Lercanidipin-hydrochlorid
herzustellen, bei welchem von Batch zu Batch, und sogar innerhalb
von Batches, die durch das gleiche Verfahren und unter den gleichen
Bedingungen erzeugt wurden, z. B., die physiko-chemischen Eigenschaften
variierten. Diese Erfinder haben gefunden, dass die Quelle für diese
Schwankungen, die von den bisher bekannten Verfahren zur Herstellung
von Lercanidipin-hydrochlorid gezeigt werden, die Gegenwart von variierenden
und unvorhersagbaren Mengen an kristallinem Lercanidipin-hydrochlorid
Form (II) ist. Im Gegensatz zu bisher bekannten Verfahren zur Herstellung
von Lercanidipin-hydrochlorid, stellt die Erfindung die neue kristalline
Form (II) bereit, welche eine kristalline Form von Lercanidipin-hydrochlorid
mit einer Reinheit und Gleichförmigkeit
darstellt, die mit bisher erreichten festen Formen von Lercanidipin-hydrochlorid
nicht erhalten wurden.
-
Die
Reinheit und Gleichförmigkeit
der Form (II) ermöglicht
eine größere Einfachheit
bei der Herstellung von Lercanidipin-Dosierungsformen aufgrund,
z. B. genauer definierte physiko-chemische Eigenschaften, wie zum
Beispiel eine größere Gleichförmigkeit
der Partikelgröße nach
einem Mikronisieren und eine reproduzierbarere Löslichkeit. Form (II) stellt
auch Dosierungsformen mit genauer definierten pharmakologischen
Eigenschaften bereit, z. B. Bioverfügbarkeit, verglichen mit früher erreichten
Dosierungsformen, welche von Batch zu Batch in ihren physiko-chemischen
Eigenschaften variierten.
-
In
einer Humanstudie am Menschen, bei der Plasmaspiegel von Lercanidipin
nach Administration einer einzelnen Dosis von entweder Lercanidipin-hydrochlorid
Form (I) oder (II), bestimmt wurden, hatte Form (I) bezogen auf
Form (II) eine kürzere
Zeit bis zum Erreichen der Maximalkonzentration im Plasma. Daher
ist Form (I) mehr geeignet für
Direktfreisetzungsformulierungen und Dosierungsformen. In der gleichen
Studie zeigte Form (II) bezogen auf die Form (I) eine höhere Bioverfügbarkeit
und ist daher für
die Verwendung in Dosierungsformen und Formulierungen mit gesteuerter
Freisetzung geeignet. Demzufolge ermöglicht die Verfügbarkeit
von reinen Formen (I) und (II) die Fähigkeit beide Polymorphe in
Dosierungsformen mit neuen kontrollierten Eigenschaften zu vermischen,
z. B. ein Dosierungsform mit sowohl schnellem Beginn und einer verzögerten biologischen
Wirkung.
-
Wie
hier verwendet, bezeichnet der Begriff „Rohform" die ausgefällten festen Formen, die Kristalle
einer Verbindung umfassen, die nicht gewaschen und/oder umkristallisiert
wurden, um möglicherweise
vorkommende Verunreinigung zu beseitigen (einschließlich Lösungsmitteln,
aber nicht darauf beschränkt).
In der vorliegenden Ausführung
werden die Formen (A) and (B) von Lercanidipin-hydrochlorid mit
Rohformen bezeichnet.
-
Wie
hier verwendet, bezeichnet der Begriff „kristalline Form" Kristalle einer
Verbindung, die gewaschen und umkristallisiert wurde, um Verunreinigungen
zu beseitigen. In der vorliegenden Erfindung bezieht sich der Begriff
kristalline Formen auf die Formen (I) und (II) von Lercanidipin-hydrochlorid.
Diese kristallinen Formen weisen eine HPLC-Reinheit > 99,5 % und einen restlichen
Lösungsmittelgehalt
von < 3000 ppm
auf.
-
Wie
hier verwendet, bezeichnet der Begriff „Polymorphie" eine Eigenschaft
einer Verbindung in zwei oder mehr Formen mit eigenen Strukturen
zu kristallisieren. Die unterschiedlichen kristallinen Formen können direkt
mittels kristallographischer Techniken bestimmt werden oder indirekt
durch Bestimmung der Unterschiede bei den physikalischen und/oder
chemischen Eigenschaften, die mit jedem einzelnen Polymorph verknüpft sind.
-
Wie
hier verwendet, ist ein „Patient,
der einer Behandlung bedarf" ein
Säugetierpatient
(z. B. ein menschlicher), der unter dem bestimmten zu behandelnden
Zustand leidet oder in Gefahr steht, diesen Zustand zu entwickeln,
z. B. essentielle Hypertonie, sekundäre Hypertonie, isolierte systolische
Hypertonie, koronare Herzerkrankungen (z. B. chronische stabile
Angina, Myokardinfarkt), kongestive Herzinsuffizienz. Ein Patient,
der eine Behandlung für
arterielle Hypertonie benötigt,
kann mittels Verfahren identifiziert werden, die im Fachgebiet wohlbekannt
sind, wie zum Beispiel, durch direkte Messung des Blutdrucks unter
Verwendung, zum Beispiel, eines manuellen Sphygmomanometers, automatischer/elektronischer
Vorrichtungen oder ambulanter Blutdrucküberwachung.
-
Die
vorliegende Erfindung betrifft jegliches Verfahren, dass zur Herstellung
der hier beschriebenen neuen Rohformen von Lercanidipin-hydrochlorid
verwendet werden kann. Diese Formen haben unterschiedliche physiko-chemischen
Eigenschaften, z. B. Schmelzpunkte (welche mittels DSC-Analyse bestimmt
werden können)
als die Rohform von Lercanidipin-hydrochlorid, die mittels anderer
bekannter Verfahren hergestellt wurde, z. B. durch das im US Patent
Nr. 5 912 351 beschriebene Verfahren, bezeichnet als Form (C). Form
(A) hat einen Schmelzpunkt von etwa 150 °C bis etwa 152 °C (DSC-Peak),
Form (B) hat einen Schmelzpunkt von etwa 131 °C bis etwa 135 °C (DSC-Peak),
und Form (C) hat einen Schmelzpunkt von etwa 186 °C bis etwa 192 °C (DSC-Peak).
Außerdem
zeigen thermogravimetrische Untersuchungen, dass die Form (A) 3–4 Gew.-% restliches Ethylacetat
umfasst und Form (B) 0,3–0,7
Gew.-% restliches Ethylacetat umfasst. Im Vergleich dazu wurde das
in Form (C) vorkommende restliche Lösungsmittel zu 0–0,1 Gew.-%
bestimmt.
-
Ausführungen
der Erfindung sind auf Verfahren zur Herstellung von Lercanidipin-hydrochlorid
gerichtet, wobei jedes zu einer unterschiedlichen Rohform des Produkts
führt.
Die ersten beiden Schritte zur Herstellung jeder Rohform sind identisch
und sind:
- a) Reagieren lassen von 2,6-Dimethyl-5-methoxycarbonyl-4-(3-nitrophenyl)-1,4-dihydropyridin-3-carbonsäure (hergestellt
wie in der deutschen Patentschrift DE
2 847 237 beschrieben) mit Thionylchlorid oder Oxalylchlorid
in einer Mischung aus einem aprotischen dipolaren Lösungsmittel
und einem aprotischen polaren Lösungsmittel,
um eine Chloridverbindung zu ergeben, und
- (b) einer in-situ-Reaktion des im oben genannten Schritt erhaltenen
Chlorids mit 2,N-Dimethyl-N-(3,3-diphenylpropyl)-1-amino-2-propylalkohol
bei einer Temperatur vorzugsweise zwischen –5 und +5 °C in einer Mischung aus einem
aprotischen dipolaren Lösungsmittel
und einem aprotischen polaren Lösungsmittel.
-
In
einer bevorzugten Ausführungsform
ist die Mischung aus dem aprotischen dipolaren Lösungsmittel und dem aprotischen
polaren Lösungsmittel
Ethylacetat und Dimethylformamid in einem Verhältnis von 4:1.
-
Nach
der in-situ-Reaktion wird das Lercanidipin-hydrochlorid isoliert
und aus der Mischung zurückgewonnen.
Das verwendete Verfahren zur Isolierung bestimmt die erhaltene Rohform
des Lercanipin-hydrochlorids. Folgt man dem folgenden Protokoll
(α Protokoll),
so wird Form (A) erhalten:
- i) Waschen der Mischung
aus Schritt (b), vorzugsweise mit Wasser,
- ii) Entfernen des Wassers aus der Reaktionsmischung aus Schritt
i), vorzugsweise durch azeotrope Destillation unter Vakuum bei 200–300 mmHg
bei einer Temperatur unter etwa 60 °C (vorzugsweise bei 40–50 °C);
- iii) Einengen der Mischung aus Schritt ii) vorzugsweise auf
etwa 1/3 des anfänglichen
Volumens bei der gleichen Temperatur und dem gleichen Druck wie
in Schritt ii), Zugabe von frischem Lösungsmittel (z. B. Ethylacetat),
um vorzugsweise das anfängliche
Volumen zu erhalten, um so eine Suspension mit einem Wassergehalt
vorzugsweise zwischen 0,10 und 0,15 % zu erhalten, bestimmt nach
Karl Fischer (US Arzneibuch 25, Verfahren 921),
- iv) Abkühlen
der Suspension aus Schritt iii), vorzugsweise auf 0–5 °C;
- v) Abfiltrieren des Feststoffes aus Schritt iv),
- vi) Resuspendieren des Feststoffes aus Schritt v) vorzugsweise
in Ethylacetat und Rühren
vorzugsweise bei 60–65 °C für etwa 1
Stunde; und
- vii) Abkühlen
auf 5–10 °C, Abfiltrieren
und Trocknen des erhaltenen Feststoffes (z. B. in einem Ofen bei etwa
70 °C).
-
Das
zweite Verfahren (β Protokoll,
verwendet zur Herstellung von Form (B)) wird unter Verwendung der
folgenden Schritte ausgeführt:
- i')
Waschen der Mischung aus Schritt (b), vorzugsweise mit Wasser,
- ii') Entfernen
des Wassers aus Schritt i'),
vorzugsweise durch azeotropes Erhitzen des Produkt aus Schritt i') auf Rückfluss
mit einer Dean-Stark-Apparatur bis ein Wassergehalt von etwa 2 %
erhalten wird, gemessen nach Karl Fischer,
- iii') Einengen
der Mischung aus Schritt ii')
auf vorzugsweise 3/4 des anfänglichen
Volumens und Zugabe von frischem Lösungsmittel (Ethylacetat) zu
der Mischung vorzugsweise bis (1) das anfängliche Volumen erreicht ist
und (2) ein Wassergehalt zwischen 0,9 und 1,1 % erreicht ist, gemessen
nach Karl Fischer;
- iv') Abkühlen der
in Schritt iii')
erhaltenen Lösung,
vorzugsweise auf 0–5 °C, um einen
Feststoff zu erhalten,
- v') Abfiltrieren
der festen Form aus Schritt iv'),
- vi') Resuspendieren
des Feststoffes aus Schritt v')
vorzugsweise in Ethylacetat und Rühren vorzugsweise bei 60–65 °C für etwa 1
Stunde; und
- vii') Abkühlen der
Suspension aus Schritt vi')
vorzugsweise auf 5–10 °C, Abfiltrieren
und Trocknen des erhaltenen Feststoffes, vorzugsweise in einem Ofen
bei etwa 70 °C.
-
Die
Temperatur in Schritt vii')
sollte sorgfältig
bei 5–10 °C kontrolliert
werden, um die Ausbeute zu maximieren.
-
Diese
neuen Rohformen von Lercanidipin-hydrochlorid weisen den Vorteil
einer höheren
Löslichkeit und
einer schnelleren Trocknungsgeschwindigkeit im Vergleich zu Form
(C) auf und ermöglichen
einen vereinfachten weiteren Kristallisationsprozess (der vorzugsweise
verwendet werden kann, um die Form (I) oder Form (II) herzustellen).
-
Verglichen
mit der Rohform (C), die durch das Verfahren nach US Patent Nr.
5 912 351 hergestellt wird, erlauben diese Formen die Verwendung
von weniger Lösungsmittel,
um die Verbindung umzukristallisieren. Dies erhöht auch die Ausbeute durch
Verminderung des Verlusts an Verbindung. Außerdem sind die Verfahren,
die zur Herstellung dieser Rohformen verwendet werden, besser an
die Verwendung in einem großen Maßstab und
einem kommerziellen Maßstab
angepasst.
-
Es
wurde überraschenderweise
gefunden, dass jede der rohen Lercanidipin-hydrochlorid Formen (A) und
(B), wenn sie verschiedenen Reinigungsbehandlungen unterzogen werden,
in zwei neuen und unterschiedlichen kristallinen Formen von Lercanidipin-hydrochlorid
resultieren. Untersuchungen zeigen, dass diese neuen kristallinen
Formen unterschiedliche physikalische und chemische Eigenschaften
aufweisen. Die DSC-Analyse der kristallinen Form (I) zeigt, dass
diese einen Schmelzpunkt von etwa 197 °C bis etwa 201 °C, insbesondere
von etwa 198,7 °C
aufweist. Die DSC-Analyse der kristallinen Form (II) zeigt, dass
diese einen Schmelzpunkt von etwa 207 °C bis etwa 211 °C, insbesondere
von etwa 209,3 °C
aufweist.
-
Verfahren zur Herstellung
von Form (II)
-
Das
Reinigungsverfahren (δ-Verfahren),
welches die kristalline Form (II) ergibt, umfasst die Schritte:
- d'') Zugabe von Acetonitril
zu rohem Lercanidipin-hydrochlorid (Form (A) oder Form (B)) und
Erhitzen der Mischung auf Rückfluss
unter Rühren;
- e'') Abkühlen der
Mischung aus Schritt d'') auf Raumtemperatur
und Rühren
für vorzugsweise
24 Stunden, um einen Feststoff zu bilden;
- f'') Filtrieren des
in Schritt e'') erhaltenen Feststoffs
und Trocknen desselben vorzugsweise in einem Ofen. In Schritt e''), wird die Kristallisation als vollständig angesehen,
wenn der Gehalt der Lösung ≤ 2 % Lercanidipin·HCl beträgt.
-
Die
vorliegende Anmeldung erwägt
auch zwei zusätzliche
Verfahren zur Herstellung von Form (II).
-
Erstes alternatives Verfahren
zur Herstellung von Form (II)
-
Das
erste alternative Verfahren umfasst die Schritte:
- d''')
Zugabe von Isopropanol oder Ethanol, vorzugsweise Ethanol, mit einem
Wassergehalt von vorzugsweise zwischen 5 bis 10 Gew.-% zu Lercanidipin-hydrochlorid,
Erhitzen auf Rückfluss
unter Rühren,
um eine Lösung
herzustellen;
- e''') Abkühlen der Mischung auf eine
Temperatur vorzugsweise zwischen 20 und 40 °C und Rühren für einen Zeitraum vorzugsweise
zwischen 24 und 96 Stunden, um einen Feststoff zu bilden;
- f''') Filtrieren des Feststoffes und Trocknen
(z. B. in einem Ofen) bei vorzugsweise 70°C für 12–18 Stunden, um Lercanidipin-hydrochlorid
Form (II) herzustellen.
- In Schritt e'''), wird die Kristallisation als vollständig angesehen,
wenn der Gehalt der Lösung ≤ 2 % Lercanidipin·HCl beträgt.
-
Zweites
alternatives Verfahren zur Herstellung von Form (II) Das zweite
alternative Verfahren, um den Form-(II)-Polymorph zu erhalten, umfasst
die Schritte:
- d'''') Lösen
von rohem Lercanidipin-hydrochlorid oder seiner kristallinen Form
(I) in einem protischen polaren oder einem aprotischen dipolaren
Lösungsmittel,
vorzugsweise enthaltend bis zu 50 Gew.-% Wasser bei einer Temperatur
vorzugsweise zwischen 20 und 70 °C,
um eine Lösung
herzustellen;
- e'''')
Rühren
der Lösung
aus Schritt d'''')
bei einer Temperatur vorzugsweise zwischen 20 und 25 °C, um einen
Feststoff herzustellen;
- f'''')
Filtrieren des Feststoffs aus Schritt e'''') und Trocknen (z. B. in einem Ofen)
vorzugsweise bei 70 °C
für vorzugsweise
12–18
Stunden.
-
Das
zweite alternative Verfahren kann gegebenenfalls den Schritt einer
Zugabe von bis zu 60 % Wasser zu der Lösung in Schritt d'''') vor dem Schritt
e'''')
umfassen. Das zweite alternative Verfahren kann weiterhin die Bestrahlung
mit Ultraschall und/oder Zugabe von vorzugsweise authentischen Impfkristallen
der Form (II) zu Schritt e'''')umfassen.
In Schritt e''''),
wird die Kristallisation als vollständig angesehen, wenn der Gehalt
der Lösung ≤ 2 % Lercanidipin·HCl beträgt. In einer
bevorzugten Ausführungsform,
ist das protische polare Lösungsmittel
ein alkoholisches Lösungsmittel
wie, aber nicht beschränkt
auf, Methanol, Ethanol, n-Propanol, Isopropanol. In einer anderen
bevorzugten Ausführungsform,
ist das aprotische Bipolare Lösungsmittel
N-Methylpyrrolidon.
-
Das
bevorzugte Verfahren zur Herstellung von Form (II) ist das δ-Verfahren.
-
Zusätzlich zu
den Unterschieden beim Schmelzpunkt zeigen die beiden kristallinen
Formen Unterschiede bei den Röntgendiffraktogrammen,
den Löslichkeiten
und der Bioverfügbarkeit.
Untersuchungen der Löslichkeit
zeigen, dass Form (I) in Wasser, Ethanol und Mischungen daraus löslicher
ist als Form (II) (siehe Tabellen 2 & 3). Untersuchungen der Bioverfügbarkeit
in Hunden und Menschen weisen darauf hin, dass Form (II) besser
bioverfügbar
ist als Form (I). Die Untersuchung bei Menschen weist jedoch auch
darauf hin, dass Form (I) eine kürzere
Zeit benötigt,
um die maximale Konzentration zu erreichen, und daher für Direktfreisetzungsformulierungen
und -dosierungsformen geeignet ist. Schließlich zeigen Untersuchungen
der Röntgenbeugungsdiagramme,
dass diese beiden Formen unterschiedliche Beugungsmuster aufweisen
(siehe 11 und 12 und
Beispiel 20). Form (I) hat einen kleineren Kristall und daher eine
kleiner Partikelgröße vor dem
Mikronisieren und ist so leichter und schnell zu verarbeiten als
Form (II), welche größere Kristalle
aufweist.
-
Die
vorliegende Anmeldung beschreibt weiterhin pharmazeutische Formulierungen
und Einzeldosierungsformen, die Form (II) oder eine Mischung aus
vorbestimmten Polymorphgehalten von Form (I) und Form (II) umfassen.
-
Die
vorliegende Erfindung richtet sich auch auf die Verwendung von Lercanidipin-hydrochlorid
in kristalliner Form (II) oder Kombinationen aus Form (II) und Form
(I) mit einem vorbestimmten Polymorphgehalt (gegebenenfalls mit
anderen Formen von Lercanidipin, wie der amorphen Form), für die Behandlung
eines Patienten mit Hypertonie (z. B. essentielle Hypertonie, sekundäre Hypertonie
oder isolierte systolische Hypertonie), koronaren Herzerkrankungen
(z. B. chronische stabile Angina, Myokardinfarkt) oder kongestiver
Herzinsuffizienz.
-
Die
Erfindung betrifft auch die Verwendung von Lercanidipin-hydrochlorid
in kristalliner Form (II), oder Kombinationen daraus zur Behandlung
und Vorbeugung von atherosklerotischen Läsionen der Arterien eines Patienten.
-
Pharmazeutische
Zusammensetzungen
-
Die
erfindungsgemäßen Verbindungen
und Polymorphe können
in einer pharmazeutischen Zusammensetzung formuliert werden. Die
erfindungsgemäßen pharmazeutischen
Zusammensetzungen können
Lercanidipin-hydrochlorid (II) oder eine Mischung aus Form (II)
mit Form (I) umfassen. Wenn genannte Zusammensetzungen eine Mischung
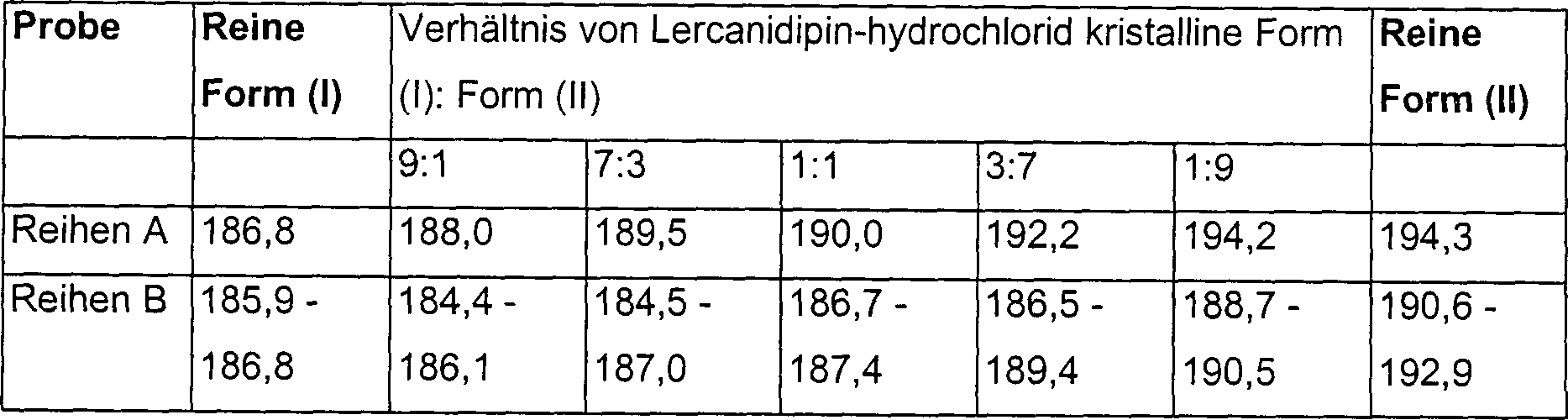
aus genannten kristallinen Formen enthalten, beträgt das Gewichtsverhältnis von
Form (I):(II) vorzugsweise zwischen 1:9 und 9:1, mehr bevorzugte
Ausführungsform
von genannten pharmazeutischen Zusammensetzungen sind solche, in
denen genanntes Gewichtsverhältnis
(I):(II) ausgewählt wird
aus: 9:1, 7:3, 1:1, 3:7 und 1:9. Die pharmazeutische Zusammensetzung
kann gegebenenfalls auch Zusatzstoffe umfassen, typischerweise eine
pharmazeutisch zulässige
Trägersubstanz
oder Verdünnungsmittel, einen
Geschmacksstoff, ein Süßungsmittel,
ein Konservierungsmittel, einen Farbstoff, ein Bindemittel, ein Suspensionsmittel,
ein Dispersionsmittel, ein Pigment, ein Sprengmittel, einen Hilfsstoff,
ein filmbildendes Mittel, einen Schmierstoff, einen Weichmacher,
ein essbares Öl
oder jegliche Kombination aus zwei und mehr der vorgenannten Stoffe.
-
Beide
kristallinen Formen können
einem Mikronisieren unterzogen werden, unter Verwendung von auf dem
Gebiet bekannten Verfahren. Die durchschnittliche durch dieses Verfahren
erzeugte Partikelgröße beträgt vorzugsweise
D(50 %) 2–68 μm, D(90 %) < 15 μm.
-
Geeignete
pharmazeutisch zulässige
Trägerstoffe
oder Verdünnungsmittel
können
Ethanol, Wasser, Glycerin, Propylenglykol, Aloe-vera-Gel, Allantoin,
Glycerin; Vitamin-A- und
E-Öle,
Mineralöl,
PPG2 Myristylpropionat, Magnesiumcarbonat, Kaliumphosphat, pflanzliches Öl, tierisches Öl und Solketal
umfassen.
-
Geeignete
Bindemittel können
Stärke,
Gelatine, natürliche
Zucker wie Glucose, Saccharose und Lactose, Maissüßmittel,
natürliche
und synthetische Gummis wie Gummi arabicum, Tragant, Pflanzengummi
und Natriumalginat, Carboxymethylcellulose, Hydroxypropylmethylcellulose,
Polyethylenglykol; Povidon, Wachse und dergleichen umfassen.
-
Geeignete
Sprengmittel können
Stärke,
z. B. Maisstärke,
Methylcellulose, Agar, Bentonit, Xanthangummi, Natriumstärkeglykolat,
Crospovidon und dergleichen umfassen.
-
Geeignete
Schmiermittel können
Natriumoleat, Natriumstearat, Natriumstearylfumarat, Magnesiumstearat,
Natriumbenzoat, Natriumacetat, Natriumchlorid und dergleichen umfassen.
-
Ein
geeignetes Suspensionsmittel kann Bentonit, ethoxylierte Isostearylalkohole,
Polyoxyethylensorbit und Sorbitanester, mikrokristalline Cellulose,
Aluminiummetahydroxid, Agar-Agar und Tragant, oder Mischungen aus
zwei oder mehreren dieser Substanz und dergleichen umfassen.
-
Geeignete
Dispersions- und Suspensionsmittel können synthetische und natürliche Gummis
wie Pflanzengummi, Tragant, Gummi arabicum, Alginat, Dextran, Natriumcarboxymethylcellulose,
Methylcellulose, Polyvinylpyrrolidon und Gelatine umfassen.
-
Geeignete
filmbildende Mittel können
Hydroxypropylmethylcellulose, Ethylcellulose und Polymethacrylate
umfassen.
-
Geeignete
Weichmacher können
Polyethylenglykole mit unterschiedlichen Molekulargewichten (z.
B. 200–8.000
Da) und Propylenglykol umfassen.
-
Geeignete
Pigmente können
Eisenoxid(e), Titandioxid und natürliche und synthetische Farblacke
umfassen.
-
Geeignete
essbare Öle
können
Baumwollsamenöl,
Sesamöl,
Kokosnussöl
und Erdnussöl
umfassen.
-
Beispiele
für zusätzliche
Additive können
Sorbit, Talkum, Stearinsäure,
Dicalciumphosphat und Polydextrose umfassen.
-
Einheitsdosierungsformen
-
Die
pharmazeutische Zusammensetzung kann als Einheitsdosierungsform
formuliert sein, typischerweise in Form von Tabletten, Pilulae,
Kapseln, Dragees, Bolusen, Pulver, Granulaten, sterilen parenteralen
Lösungen,
sterilen parenteralen Suspensionen, sterilen parenteralen Emulsionen,
Elixieren, Tinkturen, dosierten Aerosolen oder Flüssigsprays, Tropfen,
Ampullen, Autoinjektionsvorrichtungen oder Suppositorien. Einheitsdosierungsformen
können
für orale,
parenterale, intranasale, sublinguale oder rektale Administration
verwendet werden, oder für
Administrationen durch Inhalation oder Insuftlation, transdermale
Pflaster oder lyophilisierte Zusammensetzung. Im Allgemeinen kann
jegliche Zufuhr an aktiven Bestandteilen verwendet werden, die zu
ihrer systemischen Verfügbarkeit
führt.
Vorzugsweise ist die Einheitsdosierungsform eine orale Dosierungsform,
mehr bevorzugt eine feste oral Dosierungsform; daher sind bevorzugte
Dosierungsformen Tabletten, Pilulae, Dragees und Kapseln. Parenterale
Präparate
(z. B. injizierbare Präparate
und Präparate
für Pulverjetsysteme)
sind ebenfalls bevorzugt.
-
Feste
Einheitsdosierungsformen können
hergestellt werden, indem erfindungsgemäßer aktiver Wirkstoff mit einer
pharmazeutisch zulässigen
Trägersubstanz
und jeglichen anderen gewünschten
Zusatzstoffen wie oben beschrieben vermischt wird. Die Mischung
wird typischerweise gemischt, bis eine homogene Mischung der erfindungsgemäßen aktiven
Wirkstoffe und der Trägersubstanz
und jeglichen anderen gewünschten
Zusatzstoffe vorliegt, das heißt,
bis der aktive Wirkstoff gleichmäßig in der
Zusammensetzung dispergiert ist. In diesem Fall können die
Zusammensetzungen als trockene oder feuchte Granulate gebildet werden.
-
Dosierungsformen
mit vorbestimmten Mengen an Lercanidipin-hydrochlorid können ausgehend
von Zusammensetzungen mit bekannten Mengen an Lercanidipin-hydrochlorid
unter Verwendung von in dem Fachgebiet wohlbekannten Verfahren formuliert
werden. In einer bevorzugten Ausführungsform wird eine Dosierungsform
erhalten, indem Zusammensetzungen vermischt werden, die bekannte
Mengen an kristallinem Lercanidipin-hydrochlorid, z. B. in Form
(I) oder (II), gegebenenfalls einschließlich nicht-kristallinem Lercanidipin-hydrochlorid,
enthalten. Weiterhin ist bevorzugt, dass wenn eine Dosierungsform
mit vorbestimmten Mengen an kristallinem Lercanidipin-hydrochlorid
durch Mischen von Zusammensetzungen formuliert wird, die im wesentlichen
reines kristallines Lercanidipin-hydrochlorid enthält, werden
vermischt, um Dosierungsformen zu bilden, die vorbestimmte Verhältnisse
der kristallinen Formen (I) und (II) enthalten.
-
Tabletten
oder Pilulae können
beschichtet oder anders zusammengesetzt werden, um eine Einheitsdosierungsform
mit einer verzögerten
und/oder verlängerten
Wirkung zu bilden, wie Dosierungsformen mit zeitlicher Freisetzung
oder mit verzögerter
Freisetzung. Zum Beispiel kann die Tablette oder Pilula eine innere und
eine äußere Dosierungskomponente
umfassen, wobei die letztere in Form einer Schicht oder Ummantelung über der
ersteren liegt. Die beiden Komponenten können durch eine magensaftresistente
Schicht getrennt sein, die dazu dient, einem Zerfall im Magen zu
widerstehen und der inneren Komponente zu ermöglichen, in intaktem Zustand
in das Duodenum zu gelangen oder verzögert freigesetzt zu werden.
-
Biologisch
abbaubare Polymere zur Kontrolle der Freigabe von aktiven Wirkstoffen
können
Polymilchsäure,
Poly-ε-caprolacton,
Polyhydroxybuttersäure,
Polyorthoester, Polyacetale, Polydihydropyrane, Polycyanoacrylate
und vernetzte oder amphiphile Block-Copolymere von Hydrogelen umfassen.
-
Für flüssige Dosierungsformen
werden die aktiven Substanzen oder ihre physiologisch zulässigen Salze
in Lösung,
Suspension oder Emulsion gebracht, gegebenenfalls mit üblicherweise
verwendeten Substanzen wie Lösungsvermittlern,
Emulgatoren und anderen Hilfsstoffen. Lösungsmittel für aktive
Zusammensetzungen und die entsprechenden physiologisch zulässigen Salze
können
Wasser, physiologische Salzlösungen oder
Alkohole, z. B. Ethanol, Propandiol oder Glycerin, umfassen. Zusätzlich können Zuckerlösungen wie
Glucose- oder Mannit-Lösungen
verwendet werden. Weiterhin kann eine Mischung der erwähnten verschiedenen Lösungsmitteln
in der vorliegenden Erfindung verwendet werden.
-
Ebenso
wird eine transdermale Dosierungsform in der vorliegenden Erfindung
erwogen. Transdermale Formen können
ein diffusionsgetriebenes transdermales System sein (transdermale
Pflaster), unter Verwendung von entweder einem flüssigen Reservoir
oder einem „drug-in-adhesive"-Matrixsystem. Andere
transdermale Dosierungsformen umfassen topische Gele, Lotiones,
Salben, transmukosale Systeme und Vorrichtungen und iontophoretische
(elektrische Diffusion) Zuführungssysteme.
Transdermale Dosierungsformen können
für zeitlich
verzögerte
und verlängerte
Freisetzung von aktiven Wirkstoffen der vorliegenden Erfindung verwendet
werden.
-
Pharmazeutische
Zusammensetzungen und Einheitsdosierungsformen der vorliegenden
Erfindung für
die parenterale Administration, und insbesondere durch Injektion,
umfassen typischerweise eine pharmazeutisch zulässige Trägersubstanz, wie oben beschrieben.
Eine bevorzugte flüssige
Trägersubstanz
ist Pflanzenöl.
Injektionen können,
zum Beispiel, intravenös,
intrathekal, intramuskuläre,
intraruminal, intratracheal oder subkutan erfolgen.
-
Der
aktive Wirkstoff kann auch in Form von Liposomzuführungssystemen
verabreicht werden, wie kleinen unilamellaren Vesikeln (SUV), großen unilamellaren
Vesikeln (LUV) und multilamellaren Vesikeln (MLV). Liposome können aus
einer Vielzahl von Phospholipiden wie Cholesterol, Stearylamin oder
Phosphatidylcholinen gebildet werden.
-
Die
erfindungsgemäßen Polymorphe
können
auch mit löslichen
Polymeren als ansteuerbare Wirkstoffträger gekoppelt werden. Derartige
Polymere können
Polyvinylpyrrolidon, Pyran-Copolymer, Polyhydroxypropylmethacrylamidphenol,
Polyhydroxyethylaspartamidphenol und Polyethylenoxid-polylysin,
das mit Palmitoylresten substituiert ist, umfassen.
-
Administration
-
Die
erfindungsgemäße pharmazeutische
Zusammensetzung oder Einheitsdosierungsform kann über eine
Vielzahl von Wegen verabreicht werden, wie intravenös, intratracheal,
subkutan, oral, mukosal, parenteral, bukkal, sublingual, ophthalmisch,
pulmonal, transmukosal, transdermal und intramuskulär. Einheitsdosierungsformen
können
auch in intranasaler Form verabreicht werden, über topische Verwendung von
geeigneten intranasalen Vehikeln oder über transdermale Wege unter
Verwendung solcher Formen von transdermalen Hautpflastern, die Fachleuten
wohlbekannt sind. Bevorzugt ist die orale Administration.
-
Die
erfindungsgemäßen pharmazeutischen
Zusammensetzungen oder Einheitsdosierungsformen können einem
Tier, vorzugsweise einem Menschen verabreicht werden, der eine antihypertensive
Behandlung benötigt.
Die erfindungsgemäße pharmazeutische
Zusammensetzung oder Einheitsdosierungsform kann gemäß einer
Dosierungs- und Administrationsvorschrift, die durch routinemäßige Tests
im Licht der oben gegebenen Richtlinien verabreicht werden, um eine
optimale antihypertensive Wirkung und einen verminderten Blutdruck
zu erreichen, während
die Toxizität
oder Nebenwirkungen für
einen bestimmten Patienten minimiert werden. Eine derartige Feinabstimmung
der therapeutischen Vorschriften ist jedoch im Licht der hier gegebenen
Richtlinien Routine.
-
Die
Dosierung der erfindungsgemäße Polymorphe
oder Mischungen enthaltenden Zusammensetzung kann gemäß einer
Vielzahl von Faktoren wie dem zugrundeliegenden Krankheitszustand,
dem Zustand des Individuums, Gewicht, Geschlecht und Alter und der Art
der Administration variieren. Bei der oralen Administration kann
die pharmazeutische Zusammensetzung in Form einer bewerteten oder
unbewerteten festen Dosierungsform bereitgestellt werden.
-
Eine
pharmazeutische Zusammensetzung umfassend (1) Lercanidipin-hydrochlorid,
wobei Lercanidipin-hydrochlorid ausgewählt wird aus der Gruppe bestehend
aus isoliertem Lercanidipin-hydrochlorid in kristalliner Form (I),
isoliertem Lercanidipin-hydrochlorid in kristalliner Form (II),
oder Kombinationen daraus mit vorbestimmter Polymorphzusammensetzung,
und (2) mindestens einen Bestandteil ausgewählt aus der Gruppe bestehend
aus pharmazeutisch zulässigen
Trägern
oder Verdünnungsmitteln,
Geschmacksstoffen, Süßungsmitteln,
Konservierungsmitteln, Farbstoffen, Bindemitteln, Suspensionsmitteln,
Dispersionsmitteln, Pigmenten, Sprengmitteln, Hilfsstoffen, Schmiermitteln,
Weichmachern und essbaren Ölen.
In einer bevorzugten Ausführungsform
enthält
die pharmazeutische Zusammensetzung oder Dosierungsform 0,1 bis
400 mg Lercanidipin-hydrochlorid. Vorzugsweise enthält die Zusammensetzung
oder Dosierungsform 1 bis 200 mg Lercanidipin-hydrochlorid. Mehr
bevorzugt enthält
die Zusammensetzung oder Dosierungsform bis 40 mg Lercanidipin-hydrochlorid.
-
Die
pharmazeutische Zusammensetzung oder Einheitsdosierungsform kann
in einer einzelnen Tagesdosis verabreicht werden oder die gesamte
Tagesdosis kann in aufgeteilten Dosen verabreicht werden. Zusätzlich kann
eine Co-Administration oder aufeinanderfolgende Administration von
anderen aktiven Wirkstoffen erwünscht
sein. Die erfindungsgemäßen Polymorphe
und Mischungen daraus können
mit jeglicher bekannter Wirkstofftherapie kombiniert werden, vorzugsweise
für eine
Behandlung von Hypertonie. Zum Beispiel wird durch die vorliegende
Erfindung eine bimodale Therapie erwogen, die zusätzlich ein
Diuretikum, einen β-Rezeptorblocker,
einen ACE-Inhibitor oder einen Angiotensin-II-Rezeptorantagonist
umfasst (siehe, z. B. vorläufige
U.S. Anmeldung Nr. 60/344 601, eingereicht am 23.10.2001 und Italienische
Anmeldung Nr. MI 2001 A 002136, eingereicht am 16.10.2001).
-
Bei
einer Kombinationstherapie können
die Verbindungen anfänglich
als separate Dosierungsformen bereitgestellt werden, bis eine optimale
Dosiskombination und Administrationsvorschrift erreicht wird. Dafür kann der
Patient auf die geeigneten Dosen für seinen/ihren hypertensiven
Zustand titriert werden. Nachdem die geeignete Dosierung jeder der
Verbindung bestimmt wurde, um eine Verminderung des Blutdrucks ohne unerwünschte Nebenwirkungen
zu erreichen, kann der Patient dann auf eine einzelne Dosierungsform
umgestellt werden, welche die geeigneten Dosierungen für jeden
aktiven Wirkstoff enthält,
oder kann mit einer dualen Dosierungsform fortfahren.
-
Die
exakte Dosierung und Administrationsvorschrift unter Verwendung
der erfindungsgemäßen Kombinationstherapie
wird in Übereinstimmung
mit einer Vielzahl von Faktoren ausgewählt, einschließlich Art,
Spezies, Alter, Gewicht, Geschlecht und medizinischer Zustand des
Patienten; die Schwere und Äthiologie
der zu behandelnden Hypertonie; dem Administrationsweg; den renalen
und hepatischen Funktionen des Patienten; der Behandlungsgeschichte
des Patienten; und der Reaktionsfähigkeit des Patienten. Optimale
Genauigkeit beim Erreichen von Konzentrationen der Verbindungen
innerhalb des Bereichs, der Effizienz ohne Toxizität ergibt,
erfordert eine Vorschrift, die auf der Kinetik der Wirkstoffverfügbarkeit
am Zielort basiert. Dies umfasst eine Berücksichtigung von Absorption,
Verteilung, Metabolismus, Wirkstoffausscheidung und Reaktionsfähigkeit
des Patienten auf die Dosierungsvorschrift. Eine derartige Feinabstimmung
der therapeutischen Vorschriften ist jedoch im Licht der hier gegebenen
Richtlinien Routine.
-
Eine
pharmazeutische Zusammensetzung für parenterale Administration
enthält
nicht weniger als 0,1 Gew.-%, vorzugsweise zwischen etwa 0,5 Gew.-%
bis etwa 30 Gew.-%, eines erfindungsgemäßen Polymorphs oder erfindungsgemäßer Mischung,
basierend auf dem Gesamtgewicht der pharmazeutischen Zusammensetzung.
Individuelle isolierte Polymorphe sind für parenterale Administration
bevorzugt.
-
Im
Allgemeinen enthalten transdermale Dosierungsformen zwischen etwa
0,01 Gew.-% bis etwa 100 Gew.-% der aktiven Wirkstoffen, basierend
auf 100 % Gesamtgewicht der Dosierung.
-
In
einer bevorzugten Ausführungsform
der vorliegenden Erfindung wird die Zusammensetzung dem Patienten
täglich
verabreicht. Vorzugsweise enthält
die pharmazeutische Zusammensetzung oder Dosierungsform in der genannten
Ausführungsform
0,1 bis 400 mg Lercanidipin-hydrochlorid. Mehr bevorzugt enthält die Zusammensetzung
oder Dosierungsform 1 bis 200 mg Lercanidipin-hydrochlorid. Noch
mehr bevorzugt enthält
die Zusammensetzung oder Dosierungsform 5 bis 40 mg Lercanidipin-hydrochlorid.
-
Beispiele
-
Die
folgenden Beispiele zur Herstellung von Lercanidipin-hydrochlorid
in den Rohformen (A) und (B) und den kristallinen Formen (I) und
(II) werden nun zusammen mit den Ergebnissen der DSC-Analyse und
Löslichkeits-,
Stabilitäts-
und Hygroskopizitätsuntersuchungen
beschrieben; Bioverfügbarkeitsuntersuchungen
für die
neuen kristallinen Formen werden ebenfalls beschrieben.
-
Beispiel 1 Anfängliche
Herstellung
-
Thionylchlorid
(36 g), verdünnt
in Ethylacetat (25 g), wurde langsam zu einer Lösung aus 2,6-Dimethyl-5-methoxycarbonyl-4-(3-nitrophenyl)-1,4-dihydropyridin-3-carbonsäure (90
g in Dimethylformamid (115 g} und Ethylacetat (396 g) gegeben, wobei
die Temperatur zwischen –1
und +1 °C
gehalten wurde. Eine Lösung von
2, N-Dimethyl-N-(3,3-diphenyhlpropyl)-1-amino-2-propanol (84 g)
in Ethylacetat (72 g) wurde langsam zu der so erhaltenen Mischung
gegeben. Das Ganze wurde unter Rühren
3 Stunden bei der gleichen Temperatur gehalten. Die Mischung wurde
dann auf 20–25 °C erhitzt
und 12 Stunden gerührt.
Dann wurde Wasser (340 ml) zugegeben, das Ganze für 30 min
gerührt,
und nach dem Absetzen wurde die wässrige Phase verworfen. Die
organische Phase wurde wieder mit Wasser (340 ml) gewaschen.
-
Beispiel 2 Rohes Lercanidipin-hydrochlorid
Form (A)
-
Die
in Beispiel 1 erhaltene organische Phase wurde dann einer azeotropen
Destillation unter Vakuum bei etwa 250 mmHg unterzogen, ohne dabei
eine Temperatur von 60 °C
zu überschreiten.
Nach dem Entfernen von etwa 50 ml Wasser wurde die Lösung auf
etwa 1/3 des anfänglichen
Volumens unter den gleichen Temperatur- und Druckbedingungen eingeengt
und dann mit frischem Ethylacetat auf das anfängliche Volumen gebracht, bis
der K.F.-Wert (Karl-Fischer-Wert) etwa 0,10–0,15 % betrug. Die Endsuspension
wurde auf 0–5 °C gekühlt. Der
Feststoff wurde abfiltriert, in Ethylacetat (350 g) suspendiert
und 1 Stunde bei 60–65°C gerührt. Das
Ganze wurde auf 5–10 °C abgekühlt und
dann filtriert. Der Feststoff wurde im einem Ofen bei 70 °C getrocknet.
133 g trockenes, rohes Lercanidipin-hydrochlorid Form (A) wurden
erhalten (75 % Ausbeute), DSC-Peak 150–152 °C.
-
Beispiel 3 Rohes Lercanidipin-hydrochlorid
Form (B)
-
Die
am Ende von Beispiel 1 erhaltene organische Phase wurde auf Rückfluss
erhitzt (70–75 °C) und das
in der Lösung
enthaltene Wasser wurde mit einer Dean-Stark-Apparatur (Spaziani
Rolando, Nettuno, Rom, Italien) entfernt, bis ein K.F.-Wert von
etwa 2 erhalten wurde. Das Ganze wurde dann unter Atmosphärendruck
destilliert, um 3/4 des anfänglichen
Volumens zu erhalten. Die Lösung
wurde durch Zugabe von frischem Ethylacetat auf ihr anfängliches
Volumen gebracht. Der K.F.-Wert am Ende dieses Arbeitsvorgangs betrug
0,9–1,1
%. Die Lösung
wurde auf 0–5 °C abgekühlt. Es
fiel langsam ein Feststoff aus, der dann abfiltriert wurde. Der
so erhaltene Feststoff wurde in Ethylacetat (350 g) suspendiert
und 1 Stunde bei 60–65 °C gerührt. Das
Ganze wurde auf 5–10 °C abgekühlt, dann
abfiltriert und in einem Ofen bei 70 °C getrocknet, um so 133 g rohes
Lercanidipin-hydrochlorid Form (B) zu erhalten, DSC-Peak 131–135 °C; 75 % Ausbeute.
-
Beispiel 3A Rohes Lercanidipin-hydrochlorid
Form (B)
-
Die
am Ende von Beispiel 1 erhaltene organische Phase wurde auf Rückfluss
erhitzt (70–75 °C) und das
in der Lösung
enthaltene Wasser wurde mit einer Dean-Stark-Apparatur entfernt,
bis ein K.F.-Wert von etwa 2 % erhalten wurde. Das Ganze wurde dann
unter Atmosphärendruck
destilliert, um 3/4 des anfänglichen Volumens
zu erhalten. Die Lösung
wurde durch Zugabe von frischem Ethylacetat auf ihr anfängliches
Volumen gebracht. Der K.F.-Wert am Ende dieses Arbeitsvorgangs betrug
0,9–1,1
%. Die endgültige
Lösung
wurde auf 20 °C
abgekühlt,
mit 0,1 % rohem Lercanidipin-hydrochlorid Form (B) geimpft und auf
0–5 °C abgekühlt. Es
fiel langsam ein Feststoff aus, der dann abfiltriert wurde. Der
so erhaltene Feststoff wurde in Ethylacetat (350 g) suspendiert
und 1 Stunde bei 60–65°C gerührt. Das
Ganze wurde auf 5–10 °C abgekühlt, dann
abfiltriert und in einem Ofen 24 Stunden bei 70 °C getrocknet, um so 133 g rohes
Lercanidipin-hydrochlorid Form (B) zu erhalten, DSC-Peak 131–135 °C; 75 % Ausbeute.
-
Beispiel 6 Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form (II)
-
100
g rohes Lercanidipin wurden in einen Reaktor geladen. Die Mischung
wurde unter starkem Rückfluss
und Rühren
erhitzt, und so wurde eine vollständige Auflösung erreicht. Die Mischung
wurde unter leichtem Rühren
auf 20–30 °C gebracht
und bei genannter Temperatur für
24 Stunden gehalten. Der Feststoff wurde abfiltriert und 24 Stunden
im einem Ofen bei 70 °C
getrocknet. Es wurden 95 g des trockenen Produkt erhalten, was einer
Ausbeute von 95 % entspricht; HPLC-Reinheit > 99,5 % in Lercanidipin-hydrochlorid Form (II).
Vergleichbare Ergebnisse wurden erhalten, wenn Lercanidipin-hydrochlorid
in Form (A) oder (B) als Ausgangmaterial verwendet wurden.
-
Beispiel 7 Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form (II)
-
In
separaten typischen Experimenten wurden 100 g rohes Lercanidipin-hydrochlorid
in Form (A), (B), oder (C) in 200 ml 95 %igem Ethanol in einen Reaktor
geladen, die so erhaltene Mischung wurde unter Rühren und starkem Rückfluss
erhitzt und dann unter ständigem
Rühren
auf 25 °C
abgekühlt.
Die Lösung
wurde bei genannter Temperatur 24 Stunden gerührt. Der so erhaltene Niederschlag
wurde abfiltriert und 24 Stunden im einem Ofen bei 70 °C getrocknet.
Es wurden 90 g Form (II) mit einer HPLC-Reinheit > 99,5 erhalten.
-
Beispiel 7A Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form (II)
-
Es
wurden 25 g Lercanidipin-HCl, rohe Substanz oder Form (C), bei 60 °C in 100
ml einer Mischung aus Ethanol-H2O (8:2)
gelöst.
Das Ganze wurde hydrostatisch filtriert, um mögliche unlösliche Anteile zu entfernen,
und mit 100 ml H2O verdünnt. Die so erhaltene Lösung wurde
bei 25 °C
als solche gerührt,
oder es wurden 0,1 g Lercanidipin-hydrochlorid in Form (II) zugegeben,
oder es wurde für
6 Sekunden bei 20 kHz und 100 Watt mit Ultraschall bestrahlt, immer
bei 25 °C.
Was auch immer gewählt
wurde, nach 48-stündigem
Rühren
wurde der so gebildete Niederschlag gesammelt und in einem Ofen
24 Stunden bei 70 °C
getrocknet, und so wurde eine Ausbeute von 80–85 % an Form (II) erhalten.
Vergleichbare Ergebnisse werden unter Verwendung der Rohformen (A)
oder (B) oder von Lercanidipin-hydrochlorid in kristalliner Form
(I) als Ausgangsmaterial erhalten.
-
Als
eine Alternative wird die klare Anfangslösung mit 100 ml Ethanol verdünnt und
mit Lercanidipin-hydrochlorid Form (II) (0,1 g) geimpft. Nach 48
Stunden Rühren
bei 25 °C
wird eine Ausbeute von 80 % bezogen auf die stöchiometrische Lercanidipin-hydrochlorid
Form (II) erhalten.
-
BEISPIEL 8 Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form (II) in wässrigem
Methanol
-
In
typischen unabhängigen
Beispielen wurden 40 g Lercanidipin-hydrochlorid in roher Form (C)
oder kristalliner Form (I) in 100 ml Methanol bei 30 °C gelöst. Das
Ganze wurde hydrostatisch filtriert, um mögliche unlösliche Anteile zu entfernen,
und es wurden 25 ml Wasser zugegeben. Die so erhaltene Lösung wurde
bei 25 °C
als solche gerührt,
oder es wurden 0,1 g Lercanidipin-hydrochlorid in Form (II) zugemischt,
oder es wurde für
6 Sekunden bei 20 kHz und 100 Watt mit Ultraschall bestrahlt, immer
bei 25 °C.
Was auch immer gewählt wurde,
nach 48-stündigem
Rühren
wurde der so gebildete Niederschlag gesammelt und getrocknet, und
so wurde eine Ausbeute von 80–85
% bezogen auf stöchiometrisches
Lercanidipin-hydrochlorid Form (II) erhalten. Es wurden vergleichbare
Ergebnisse unter Verwendung der Rohform (A) oder (B) erhalten.
-
Beispiel 9 Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form (II) in wässrigem
1-Propanol
-
Es
wurden 60 g Lercanidipin-HCl, Rohform (C), bei 60 °C in 100
ml 1-Propanol-H2O (8:2) gelöst. Nach dem
hydrostatischen Abfiltrieren von möglichen unlöslichen Anteilen, wurde die
Lösung
innerhalb von zwei Stunden auf 25 °C abgekühlt und 120 Stunden bei der
genannten Temperatur mit oder ohne Ultraschallbestrahlung für 6 Sekunden
bei 20 kHz und 100 Watt gerührt.
Der so gebildete Niederschlag wurde gesammelt und es wurden 90 Ausbeute
bezogen auf stöchiometrisches
Lercanidipin-hydrochlorid Form (II) nach dem Trocknungsschritt erhalten.
Vergleichbare Ergebnisse werden unter Verwendung der Rohformen (A)
oder (B) oder von Lercanidipin-hydrochlorid in kristalliner Form
(I) als Ausgangsmaterial erhalten.
-
Beispiel 10 Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form (II) in wässrigem
2-Propanol
-
Es
wurden 30 g Lercanidipin-HCl, Rohform (C), bei 60 °C in 100
ml 2-Propanol-H2O (8:2) gelöst. Nach dem
Abfiltrieren von möglichen
unlöslichen
Anteilen, wurde die Lösung
innerhalb von zwei Stunden auf 25 °C abgekühlt und 72 Stunden bei der
genannten Temperatur mit oder ohne Ultraschallbestrahlung für 6 Sekunden bei
20 kHz und 100 Watt gerührt.
Der so gebildete Niederschlag wurde gesammelt und es wurden 85 %
Ausbeute bezogen auf stöchiometrisches
Lercanidipin-hydrochlorid Form (II) nach dem Trocknungsschritt erhalten.
Das gleiche Ergebnis wird durch Rühren für 168 Stunden bei 10 °C erhalten.
Vergleichbare Ergebnisse werden unter Verwendung der Rohformen (A)
oder (B) oder von Lercanidipin-hydrochlorid in kristalliner Form (I)
als Ausgangsmaterial erhalten.
-
Beispiel 11 Herstellung
von Lercanidipin-hydrochlorid in kristalliner Form (II) in wässrigem
N-Methylpyrrolidon
-
Eins
Suspension von 50 g Lercanidipin-hydrochlorid, Rohform (C), in 30
ml N-Methylpyrrolidon/Wasser (1:1) wurde bei 20–25 °C 12 Tage gerührt. Der
so gebildete Feststoff wurde mittels Filtration gesammelt und getrocknet
und ergab 40 g Lercanidipin-hydrochlorid Form (II). Vergleichbare
Ergebnisse werden unter Verwendung der Rohformen (A) oder (B) oder
von Lercanidipin-hydrochlorid in kristalliner Form (I) als Ausgangsmaterial
erhalten.
-
Beispiel 12 DSC-Analyse
von Lercanidipin-hydrochlorid in kristalliner Form (I) und (II)
-
Die
DSC-Analyse misst Veränderungen,
die in einer gegebenen Probe beim Erhitzen auftreten, wobei die
Veränderungen
Phasenübergänge identifizieren.
Enthalpieveränderungen,
die bei einem Phasenübergang stattfinden,
werden auf der Basis der Fläche
unter der Kurve berechnet. Die am häufigsten vorkommenden Phasenübergänge sind
Schmelzen und Sublimieren. Die Temperatur, bei welcher der Übergang
beginnt, Anfangs-T, ist durch den Punkt gegeben, an welchem die
Kurve beginnt, von der Basislinie abzuweichen (flex point).
-
DSC
von Form (I): 3,8 mg Form (I) wurden in einen Goldtiegel eines DSC7-Geräts von Perkin
Elmer gesetzt. Die Aufheizrate während
der Untersuchung betrug 10 °C/min.
-
DSC
Form (II): 4,6 mg Form (I) wurden in einen Goldtiegel eines DSC7-Geräts von Perkin
Elmer gesetzt. Die Aufheizrate während
der Untersuchung betrug 10 °C/min.
-
Die
Daten werden in den
1 und
2 gezeigt,
und die charakteristischen Punkte werden kurz in der folgenden Tabelle
1 zusammengefasst. Tabelle
1
-
Direkt
nach dem Schmelzen von Form (I) oder (II) kann ein exothermes Ereignis
aufgrund der Salzzersetzung beobachtet werden.
-
Beispiel 13 Thermogravimetrie
-
Es
wurde eine gravimetrische Analyse zusammen mit einer IR-Analyse
sowohl an den kristallinen Formen (I) und (II) wie auch an rohem
Lercanidipin-hydrochlorid Form (A) und an rohem Lercanidipin-hydrochlorid Form
(B) ausgeführt;
dabei wurde eine Netsch Thermomicrobalance 209 zusammen mit einem
FTIR-Spektrometer Vector 22 von Bruker durchgeführt.
-
Die
Untersuchungen wurden gemäß der folgenden
Arbeitsbedingungen ausgeführt:
2 – 5
mg Probe wurden in einem Stahltiegel in einer Stickstoffsatmosphäre mit einer
Aufheizrate von 10 °C/min
erhitzt. Die mit den kristallinen Formen (I) und (II) erhaltenen
Ergebnisse sind in 3 gezeigt, aus welcher man den
Schluss ziehen kann, dass in beiden kristallinen Formen kein Gewichtsverlust
bis zu ihrem Schmelzpunkt beobachtet werden kann (d.h., bis etwa
190–200 °C).
-
Während der
Zersetzung, die wie angegeben nach dem Schmelzen stattfindet, kann
ein CO2-Verlust beobachtet werden.
-
Die
Ergebnisse, die mit rohem Lercanidipin-hydrochlorid Form (A) erhalten
wurden, sind in 19 gezeigt, wo ein Gewichtsverlust
von 3,4 % in einem Temperaturbereich von 25–153 °C beobachtet werden konnte.
Die flüchtige
Verbindung wurde durch ihr korrespondierendes IR-Spektrum identifiziert
und es handelt sich um Ethylacetat. Während der Zersetzung (T > 170 °C) konnte
eine kleine Menge Ethylacetat in der Gasphase beobachtet werden.
-
Die
Ergebnisse, die mit rohem Lercanidipin-hydrochlorid Form (B) erhalten
wurden, sind in 20 gezeigt, wo ein Gewichtsverlust
von 0,5 % in einem Temperaturbereich von 25–153 °C beobachtet werden konnte.
-
Die
flüchtige
Verbindung, die durch ihr korrespondierendes IR-Spektrum identifiziert
wurde, ist Ethylacetat (0,4 %) und Wasser (0,1 %). Während der
Zersetzung (T > 170 °C) konnte
eine kleine Menge Ethylacetat in der Gasphase beobachtet werden.
-
Beispiel 14 Hygroskopizität der kristallinen
Formen (I) und (II)
-
Die
Hygroskopizität
beider kristalliner Formen (I) und (II) wurde mittels DVS-Analyse
mittels eines Wasserabsorptionsanalyzers (SURFACE MEASUREMENT SYSTEM,
Marion, Buckinghamshire, UK) gemäß der folgenden
Arbeitsbedingungen gemessen:
10–15 mg Form (I) und (II) wurden
jeweils in einen Quarz-Probenhalter gegeben, nacheinander auf eine
Mikrowaage gesetzt und die Probe wurde Feuchtigkeitszyklen zwischen
0 und 95 % unterzogen, ausgehend von 50 % relativer Feuchtigkeit
(25 °C,
relative Feuchtigkeit (RH): 50–95–0–95–0–50 % bei
RH/h: 5 %).
-
Die
Ergebnisse der Untersuchungen sind in den Diagrammen von 13 und 14 gezeigt.
-
14-1. Mit kristalliner
Form (I) erhaltene Ergebnisse
-
Das
Einwirken lassen von Feuchtigkeit auf Form (I) in dem DVS-Analyzer
resultiert in einer Massenveränderung
von +0,15 % bei 95 % RH, und von –0,3 % bei 0 % RH, mit beinahe
keiner Hysterese während der
Massenzu- und -abnahme. Diese geringfügigen Veränderungen sind vermutlich in
einer reversiblen Oberflächenabsorption
von Wasser begründet.
-
14-2. Mit kristalliner
Form (II) erhaltene Ergebnisse
-
Das
Einwirken lassen von Feuchtigkeit auf Form (II) im DVS verursacht
eine vernachlässigbare
Massenveränderung
(< 0,05 %) im gesamten
untersuchten RH-Bereich.
-
Beispiel 15 Löslichkeit
der kristallinen Formen (I) und (II)
-
15.1 Löslichkeit in Wasser und in
Ethanol bei Raumtemperatur
-
Die
Löslichkeit
bei 23 °C
von beiden kristallinen Formen (I) und (II) wurde mittels UV-Vis-Spektroskopie in
bidestilliertem Wasser (bei einem pH-Wert, der spontan vom System
erreicht wurde) und in absolutem Ethanol untersucht. Das molare
Absorptionsvermögen
wurde im Voraus in Acetonitril bestimmt. Das gleiche molare Absorptionsvermögen wurde
für eine
Bestimmung in Wasser und Ethanol in Betracht gezogen. Die Löslichkeit in
Wasser hängt
mit Sicherheit vom pH-Wert ab. Der restliche Feststoff, der mittels
Filtration aus der Suspension erhalten wurden, wurde sofort mittels
Ramanspektroskopie untersucht. Die Ergebnisse sind in den folgenden
Tabellen 2 und 3 wiedergegeben.
-
Tabelle
2 Löslichkeit
in Wasser (etwa 40 mg/ml als Anfangszustand).
-
Tabelle
3 Löslichkeit
in Ethanol (etwa 100 mg/ml als Anfangszustand).
-
Form
(II) ist in beiden Lösungsmitteln
weniger löslich
als Form (I).
-
15.2 Löslichkeit im Wasser-Ethanolmischungen
bei 25 °C
und bei 40 °C
mit zunehmenden Wasserkonzentrationen.
-
4 und 5 zeigen
die Löslichkeit
in Wasser-Ethanol bei 25 °C
und bei 40 °C
von Form (I) und von Form (II). Die maximale Löslichkeit wird bei beiden Formen
bei beiden Temperaturen erreicht, wenn die Wasserkonzentration 20
% beträgt.
Auch in diesem Fall ist die Löslichkeit
der kristallinen Form (I) höher
als die der kristallinen Form (II).
-
Beispiel 16 Festphasen-13C-NMR-Untersuchungen
-
Die
hochaufgelösten13C-NMR-Festphasenspektren wurden mittels
eines ASX300-Geräts
von Bruker ausgeführt,
ausgestattet mit einem 7 mm Rotorzusatz, unter Verwendung von verschiedenen
kombinierten Techniken:
Magic angle spinning (MAS): etwa 300
mg der Probe wurden in den Rotor gesetzt, der mit 4,3 kHz um eine
im magischen Winkel (54° 70') orientierte Achse
zum Magnetfeld rotierte, um die dipolare Verbreiterung, die durch CSA
verursacht wird (Chemische Verschiebungsanisotropie), zu überwinden.
Die Experimente wurden bei Raumtemperatur ausgeführt.
-
Dipolare
Kopplung. Da ein Grossteil der Verbreiterung in 13C-Spektren
von organischen Feststoffen aus der Protonenkopplung resultiert,
wurde dies durch eine heteronukleare Entkopplung (Entkopplungsenergiespiegel
betrug fast 1 Kilowatt) beseitigt.
-
Kreuzpolarisation
(CP). Die Kreuzpolarisation ermöglicht
der Kohlenstoffmagnetisierung von der größeren Protonenmagnetisierung über eine
Bipolare Kopplung eine Erhöhung
der Signalintensität.
-
Vollständige Unterdrückung der
Rotationsseitenbanden (TOSS). TOSS wurde unter Verwendung von Spinechos
ausgeführt,
die mit der Probenrotation synchronisiert wurden, um eine Phasenänderung
der Rotationsseitenbanden zu verursachen, was zu einer Eliminierung
führt,
wenn aufeinanderfolgende Spektren zusammenaddiert werden.
-
Die
kristallinen Formen (I) und (II) zeigen unterschiedliche 13C-NMR-Spektren in Festphase. Die Signale
(chemische Verschiebung) und Zuordnung der entsprechenden Kohlenstoffatome
(wie in der unten aufgeführten
Formel von Lercanidipin-hydrochlorid durchnummeriert) sind jeweils
in den folgenden Tabellen 4 und 5 aufgeführt.
-
Tabelle
4 Lercanidipin-hydrochlorid kristalline Form (I)
-
Tabelle
5 Lercanidipin-hydrochlorid kristalline Form (II)
-
-
Beispiel 17 IR-Untersuchungen
-
Die
IR-(Infrarot)-Spektren wurden in KBr-Pulver mittels Diffuser Reflexionstechnik
unter Verwendung eines Perkin Elmer Spectrum-one-Geräts aufgenommen.
IR-Spektren, deren Wellenlängen
und entsprechender Zuordnung in den folgenden Tabellen 6 und 7 gezeigt
sind, sind für
die neuen Formen (I) und (II) deutlich unterschiedlich.
-
Tabelle
6 IR-Spektrum in KBr-Pulver von Lercanidipin-hydrochlorid Form (I)
-
Tabelle
7 IR-Spektrum in KBr-Pulver von Lercanidipin-hydrochlorid Form (II)
-
-
Beispiel 18: Ramanspektren
-
Es
wurde ein FT-Raman RFS100-Spektrophotometer von Bruker unter den
folgenden typischen Bedingungen verwendet: etwa 10 mg Probe (ohne
irgendeine Vorbehandlung), 64 Scans, 2 cm–1 Auflösung, 100 mW
Laserenergie, Ge-Detektor.
-
Die
folgenden Tabellen 8 und 9 geben jeweils die signifikantesten Banden
der Ramanspektren von Form (I) und Form (II) wieder. Tabelle
8 Ramanspektrum von kristalliner Farm (I)
* M = mittel; S = stark, Vs = sehr stark Tabelle
9 Ramanspektrum von kristalliner Form (II)
M = mittel; S = stark, Vs = sehr stark
-
Beispiel 19 Bioverfügbarkeit
der kristallinen Formen (I) und (II) Beispiel 19a Hund
-
Es
wurde eine Untersuchung an sechs Beagle-Hunden ausgeführt, um
die Bioverfügbarkeit
der kristallinen Formen (I) und (II) zu untersuchen.
-
Die
Produkte, in mikronisierter Form, wurden oral mittels Hartgelatinekapseln
verabreicht, die mit aktivem Wirkstoff, Form (I) und (II), mit einer
Dosierung von 3 mg/kg gefüllt
waren und einmal am Morgen des Tags des Experiments verabreicht
wurden.
-
Es
wurden zu bestimmten Zeiten Blutproben genommen und die Plasmakonzentrationen
von Lercanidipin wurde mit einem stereoselektiver Analyseverfahren
HPLC-MS/MS gemäß den folgenden
Arbeitsbedingungen bestimmt.
-
Lercanidipin
wurde aus dem Hundeplasma mittels Flüssig-Flüssig-Extraktion mit einer Mischung
aus n-Hexan und Ethylether extrahiert. Der trockene Rückstand
der organischen Phase wurde in einer Mischung aus Methanol und Wasser
aufgenommen und es wurde eine Flüssigphasen-Chromatographietrennung
(LC) ausgeführt;
die beiden Lercanidipinenantiomere wurden auf einer CHIROBIOTIC
V-Säule
(Vancomycin) (Partikelgröße 5 m,
Säulengröße 150 × 4,6 mm
(ASTEC, NJ, USA)) getrennt und mit einem Massenspektrometer (MS/MS)
unter Verwendung der Elektrospraytechnik detektiert.
-
Das
analytische Verfahren wurde in einem Konzentrationsbereich zwischen
0,1 und 20 ng/ml Plasma für
beide Enantiomere validiert. Das Verfahren erwies sich mit einer
Genauigkeit von 15 % als spezifisch. Die durchschnittlichen Konzentrationen
von Lercanidipin in den Tabletten stellt die Summe beider Enantiomere dar.
-
Die
Profile, die den durchschnittlichen Konzentrationen von Lercanidipin
für beide
Formen entsprechen, sind in 10 wiedergegeben.
Die folgenden Tabellen 10 und 11 zeigen die einzelnen Werte bezüglich AUC,
Tmax, Cmax und der
Plasmakonzentrationen.
-
Tabelle
10 Mittlere Werte (n = 5) von AUC
0-t, C
max und T
max von
Lercanidipin-hydrochlorid (S+R) in kristalliner Form (I) und kristalliner
Form (II), in Hunden nach oraler Administration bei einer Dosierung
von 3 mg/kg. Form
(I):
Form
(II)
- * nicht in der Berechnung des Mittelwerts
eingeschlossen
-
Tabelle
11 Durchschnittliche Plasmakonzentrationen von Lercanidipin-hydrochlorid
(S+R) in kristalliner Form (I) und kristalliner Form (II), in Hunden
nach oraler Administration bei einer Dosierung von 3 mg/kg. Form
(I)
Form
(II)
- * nicht in der Berechnung des Mittelwerts
eingeschlossen
-
Die
Form (II) enthaltende Formulierung ist bei 5 von 6 Tieren besser
bioverfügbar
als die kristalline Form (I) enthaltende Formulierung.
-
Um
den Vergleich zu vereinfachen, wurde Hund 2 von der Untersuchung
ausgeschlossen, da Hund 2 nach der Administration von Form (I) einen
Plasma-AUC von 264 ng/h/ml gegenüber
einem Mittelwert von 38 ± 19
(SD) bei den anderen 5 Hunden aufweist. Andererseits ist sein AUC
nach Administration von Form (I) gleichwertig zu dem der anderen
Tiere; der Wert beträgt
120 gegenüber
105 ± 44
ng/h/ml.
-
Die
Bioverfügbarkeit
von Lercanidipin-hydrochlorid (Form (II)), ausgedrückt als
Zunahme des AUC von Lercanidipin (R+S), der nach Administration
von Form (II) erhalten wurde, ist etwa dreimal höher als mit Form (I) erhalten
wurde. Das durchschnittliche Profil der Plasmakonzentrationen für beide
kristallinen Formen ist in 10 wiedergegeben.
-
Die
Analyse dieser Ergebnisse zeigt, dass die Menge an Lercanidipin
(S+R), die nach Administration der kristallinen Form (II) absorbiert
wurde, dreimal höher
ist als bei Form (I), während
die Absorptionsgeschwindigkeit, ausgedrückt als Tmax,
praktisch unverändert
ist.
-
Die
Plasmakonzentrationen 6 Stunden nach Administration (letzte Probennahme)
sind gleichartig; die Konzentrationen betragen 8,5 ± 6,5 ng/ml
nach Administration von Form (I) und 10,9 ± 6,8 ng/ml nach Administration
von Form (II).
-
Beispiel 19b Mensch
-
Es
wurde eine Studie an 16 gesunden Freiwilligen durchgeführt, um
die relative Bioverfügbarkeit
von Lercanidipin-hydrochlorid Form (I) und Form (II) zu bestimmen
Form (I) wurde durch eine Tablette ZanedipR, entsprechend
10 mg von Lercanidipin-hydrochlorid (Referenz R), dargestellt. Form
(II) wurde in Form einer 10-mg-Tablette verabreicht, die auf genau
die gleiche Weise und in genau der gleichen Zusammensetzung wie ZanedipR 10 mg hergestellt wurde, ausgehend von
der mikronisierten Form (II) mit der gleichen Partikelgröße wie Form
I (Test-T). An 15 Punkten in einer Zeit von 0 bis 24 Stunden nach
der Dosierung wurden Blutproben genommen und die Plasmakonzentrationen
von Lercanidipin wurde mit einem stereoselektiven Analyseverfahren
HPLC-MS/MS bestimmt. Die erhaltenen pharmakokinetischen Parameter
sind in der folgenden Tabelle wiedergegeben.
-
-
Die
erhaltenen Ergebnisse zeigten, dass Lercanidipin-hydrochlorid Form
(II) nicht bioäquivalent
zu Form (I) ist, wobei Form (II) die höheren Plasmaspiegel erreicht,
dass Lercanidipin-hydrochlorid Form (I) einen kürzeren tmax aufweist
als Form (II), was darauf hindeutet, dass es für Formulierungen mit sofortiger
Freisetzung verwendet wird.
-
Beispiel 20 Röntgenbeugungsuntersuchungen
-
Es
wurden Philips PW 1710 und Philips Xpert PW 3040 Pulverdiffraktometer
(Kupfer-Kα-Strahlung) verwendet,
unter den folgenden typischen Bedingungen: etwa 5–70 mg Probe
(ohne jegliche Vorbehandlung) mit Anwendung eines geringfügigen Drucks,
um eine flache Oberfläche
zu erhalten. Umgebungsluftatomsphäre. 0,02° 28 Schrittgröße, 2 sec
Schritte-1,2-50 2θ.
-
Die
erhaltenen Diffraktogramme sind 11 und 12 wiedergegeben
und die entsprechende Hauptreflexe sind in den Tabellen 12 und 13
beschrieben. Die Daten unterscheiden sich deutlich für die isolierten
Formen (I) und (II).
-
Tabelle
12 Röntgenbeugungsdiffraktogramm
von Lercanidipin-hydrochlorid Form (I)
-
Tabelle
13 Röntgenbeugungsdiffraktogramm
von Lercanidipin-hydrochlorid Form (II)
-
Beispiel 21 Schmelzpunktbestimmung
von verschiedenen Mischungen von Lercanidipin-hydrochlorid in kristalliner
Form (I) und (II)
-
Die
Schmelzpunkte von Zusammensetzungen bestehend aus bekannten Verhältnissen
von Lercanidipin-hydrochlorid kristalline Formen (I) und (II) wurden
manuell bestimmt. Die Bedingungen bestanden in der Verwendung eines
Sollwerts von 177 °C
und Einführen
der Kapillare in das Gerät
(Schmelzpunktapparatur Modell 535, Büchi Labortechnik AG, Flawil,
Schweiz) bei etwa 5 °C
unterhalb des Schmelzpunktes. Die Ergebnisse sind in Tabelle 14
wiedergegeben.
-
Tabelle
14 Die Schmelzpunkte von Zusammensetzungen bestehend aus bekannten
Verhältnissen
von Lercanidipin-hydrochlorid Formen (I) und (II) Proben der Reihen
A und Reihen B wurden jeweils mit einem Gradienten von 1 °C/min und
0,5 °C/min
erhitzt. Ergebnisse sind in °C
angegeben.
-
-
U.S.
Patent Nr. 5 767 136 beschreibt kristallines Lercanidipin-hydrochlorid
mit einem Schmelzpunkt von 186–188 °C. Tabelle
14 zeigt, dass dieser Schmelzpunkt von Mischungen aus Form (I) und
Form (II) gezeigt wird, in welchen das Verhältnis von Form (I) zu Form
(II) zwischen 9:1 und 3:7 variiert. Bianchi et al. (Drugs of the
Future, 1987, 12:1113–1115)
berichten von einem Schmelzpunkt von 186–188 °C (nicht DSC) für ein Lercanidipinprodukt,
dass sie als „Kristalle" charakterisieren.
Also ist der Schmelzpunkt eines Präparats aus Lercanidipin-hydrochlorid
allein nicht ausreichend, um die jeweilige darin anwesende Form
oder Formen zu unterscheiden, und viele Mischungen mit unterschiedlichen
Zusammensetzungen weisen den bleichen Schmelzpunktbereich auf.
-
Beispiel 22 Mikronisieren
von Lercanidipin-hydrochlorid.
-
Das
Mikronisieren wird mittels eines Verfahrens mit einer Strahlmühle unter
Verwendung einer MICRONETTE M300 von der Firma NUOVA GUSEO (Villanova
sull'Arda-PC-Italy)
ausgeführt.
Die Parameter sind folgende: Injektionsdruck 5 kg/cmq; Mikronisierungsdruck,
9 kg/cmq; und Zyklondruck 2,5 kg/cmq. Die Mikronisierungskapazität beträgt 16 kg/h.
Die Partikelgröße wird
mittels Laserlichtstreuung unter Verwendung eines GALAI CIS 1 Lasergeräts (GALAI,
Haifa, Israel) bestimmt. Das Mikronisieren wird ausgeführt, um
einen durchschnittliche Partikelgröße D (50 %) von 2–8 μm und D (90
%) < 15 μm zu erhalten.