RU2681885C2 - Антигенсвязывающая молекула с регулируемой конъюгацией между тяжелой цепью и легкой цепью - Google Patents
Антигенсвязывающая молекула с регулируемой конъюгацией между тяжелой цепью и легкой цепью Download PDFInfo
- Publication number
- RU2681885C2 RU2681885C2 RU2014122028A RU2014122028A RU2681885C2 RU 2681885 C2 RU2681885 C2 RU 2681885C2 RU 2014122028 A RU2014122028 A RU 2014122028A RU 2014122028 A RU2014122028 A RU 2014122028A RU 2681885 C2 RU2681885 C2 RU 2681885C2
- Authority
- RU
- Russia
- Prior art keywords
- amino acid
- acid residues
- numbering
- chain
- antibody
- Prior art date
Links
- 230000001105 regulatory effect Effects 0.000 title claims abstract description 34
- 239000000427 antigen Substances 0.000 title description 146
- 108091007433 antigens Proteins 0.000 title description 146
- 102000036639 antigens Human genes 0.000 title description 146
- 230000027455 binding Effects 0.000 title description 91
- 230000021615 conjugation Effects 0.000 title 1
- 125000000539 amino acid group Chemical group 0.000 claims abstract description 524
- 238000000034 method Methods 0.000 claims abstract description 124
- 102000039446 nucleic acids Human genes 0.000 claims description 61
- 108020004707 nucleic acids Proteins 0.000 claims description 61
- 150000007523 nucleic acids Chemical class 0.000 claims description 61
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims description 57
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 claims description 53
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 claims description 53
- 239000004472 Lysine Substances 0.000 claims description 48
- 235000013922 glutamic acid Nutrition 0.000 claims description 43
- 239000004220 glutamic acid Substances 0.000 claims description 43
- 238000004519 manufacturing process Methods 0.000 claims description 42
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 24
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims description 22
- 239000004475 Arginine Substances 0.000 claims description 21
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 21
- 235000003704 aspartic acid Nutrition 0.000 claims description 21
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 claims description 21
- 238000006467 substitution reaction Methods 0.000 claims description 19
- 238000012258 culturing Methods 0.000 claims description 8
- 150000001413 amino acids Chemical class 0.000 abstract description 178
- 230000000694 effects Effects 0.000 abstract description 22
- 239000000126 substance Substances 0.000 abstract description 5
- 239000003814 drug Substances 0.000 abstract description 4
- 235000001014 amino acid Nutrition 0.000 description 152
- 229940024606 amino acid Drugs 0.000 description 146
- 230000004048 modification Effects 0.000 description 111
- 238000012986 modification Methods 0.000 description 111
- 210000004027 cell Anatomy 0.000 description 70
- 241000282414 Homo sapiens Species 0.000 description 68
- 108090000765 processed proteins & peptides Proteins 0.000 description 51
- 108090000623 proteins and genes Proteins 0.000 description 51
- 102000004196 processed proteins & peptides Human genes 0.000 description 48
- 229920001184 polypeptide Polymers 0.000 description 47
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 46
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 44
- 125000003275 alpha amino acid group Chemical group 0.000 description 38
- 230000035772 mutation Effects 0.000 description 33
- 102000004169 proteins and genes Human genes 0.000 description 32
- 102000005962 receptors Human genes 0.000 description 30
- 108020003175 receptors Proteins 0.000 description 30
- 235000018102 proteins Nutrition 0.000 description 28
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 22
- 230000002209 hydrophobic effect Effects 0.000 description 21
- 241001465754 Metazoa Species 0.000 description 20
- 239000013604 expression vector Substances 0.000 description 20
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 18
- 238000005516 engineering process Methods 0.000 description 18
- 238000004458 analytical method Methods 0.000 description 17
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 17
- 235000004554 glutamine Nutrition 0.000 description 17
- 239000013598 vector Substances 0.000 description 17
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 15
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 15
- 108020004414 DNA Proteins 0.000 description 14
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 14
- 241000699666 Mus <mouse, genus> Species 0.000 description 14
- 206010028980 Neoplasm Diseases 0.000 description 14
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 14
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 13
- 230000033228 biological regulation Effects 0.000 description 13
- 201000011510 cancer Diseases 0.000 description 13
- 230000003993 interaction Effects 0.000 description 13
- 239000004471 Glycine Substances 0.000 description 11
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 11
- 238000005571 anion exchange chromatography Methods 0.000 description 11
- 238000005277 cation exchange chromatography Methods 0.000 description 11
- 239000012634 fragment Substances 0.000 description 11
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 11
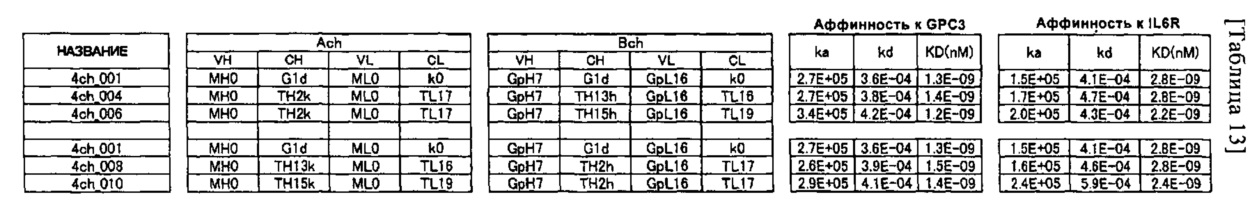
- 101100206915 Arabidopsis thaliana TL17 gene Proteins 0.000 description 10
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 10
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 10
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 10
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 10
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 10
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 10
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 10
- 239000004473 Threonine Substances 0.000 description 10
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 10
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 10
- 235000004279 alanine Nutrition 0.000 description 10
- 238000004587 chromatography analysis Methods 0.000 description 10
- 210000004408 hybridoma Anatomy 0.000 description 10
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 10
- 229960000310 isoleucine Drugs 0.000 description 10
- 229930182817 methionine Natural products 0.000 description 10
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 10
- 235000008521 threonine Nutrition 0.000 description 10
- 239000004474 valine Substances 0.000 description 10
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 9
- 241000283707 Capra Species 0.000 description 9
- 241000196324 Embryophyta Species 0.000 description 9
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 9
- 235000009582 asparagine Nutrition 0.000 description 9
- 229960001230 asparagine Drugs 0.000 description 9
- 235000018417 cysteine Nutrition 0.000 description 9
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 108091033319 polynucleotide Proteins 0.000 description 9
- 102000040430 polynucleotide Human genes 0.000 description 9
- 239000002157 polynucleotide Substances 0.000 description 9
- 101710098119 Chaperonin GroEL 2 Proteins 0.000 description 8
- 102100032530 Glypican-3 Human genes 0.000 description 8
- 101001014668 Homo sapiens Glypican-3 Proteins 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 101000588258 Taenia solium Paramyosin Proteins 0.000 description 8
- 230000001900 immune effect Effects 0.000 description 8
- 230000003053 immunization Effects 0.000 description 8
- 238000002360 preparation method Methods 0.000 description 8
- 241000588724 Escherichia coli Species 0.000 description 7
- 241000699670 Mus sp. Species 0.000 description 7
- 238000012217 deletion Methods 0.000 description 7
- 230000037430 deletion Effects 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 238000002741 site-directed mutagenesis Methods 0.000 description 7
- 230000009261 transgenic effect Effects 0.000 description 7
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 102100037792 Interleukin-6 receptor subunit alpha Human genes 0.000 description 6
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 230000004069 differentiation Effects 0.000 description 6
- 238000002649 immunization Methods 0.000 description 6
- 230000005847 immunogenicity Effects 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 239000008194 pharmaceutical composition Substances 0.000 description 6
- 239000012071 phase Substances 0.000 description 6
- 230000001235 sensitizing effect Effects 0.000 description 6
- 238000007792 addition Methods 0.000 description 5
- 210000004102 animal cell Anatomy 0.000 description 5
- 210000000628 antibody-producing cell Anatomy 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 5
- -1 if necessary Substances 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 210000004698 lymphocyte Anatomy 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 241000208125 Nicotiana Species 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 238000010348 incorporation Methods 0.000 description 4
- 108040006858 interleukin-6 receptor activity proteins Proteins 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 235000013336 milk Nutrition 0.000 description 4
- 239000008267 milk Substances 0.000 description 4
- 210000004080 milk Anatomy 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 239000003643 water by type Substances 0.000 description 4
- 108020004705 Codon Proteins 0.000 description 3
- 241000699800 Cricetinae Species 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- 108091034117 Oligonucleotide Proteins 0.000 description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 3
- 239000002671 adjuvant Substances 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 238000010276 construction Methods 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- 238000010494 dissociation reaction Methods 0.000 description 3
- 230000005593 dissociations Effects 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 210000002257 embryonic structure Anatomy 0.000 description 3
- 210000003527 eukaryotic cell Anatomy 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 230000002538 fungal effect Effects 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000002703 mutagenesis Methods 0.000 description 3
- 231100000350 mutagenesis Toxicity 0.000 description 3
- 201000000050 myeloid neoplasm Diseases 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 230000006798 recombination Effects 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- 102100027211 Albumin Human genes 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 241000255789 Bombyx mori Species 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 125000001433 C-terminal amino-acid group Chemical group 0.000 description 2
- 101150023103 CHI gene Proteins 0.000 description 2
- 241000282836 Camelus dromedarius Species 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 206010071602 Genetic polymorphism Diseases 0.000 description 2
- 101000935587 Homo sapiens Flavin reductase (NADPH) Proteins 0.000 description 2
- 101000599048 Homo sapiens Interleukin-6 receptor subunit alpha Proteins 0.000 description 2
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 2
- 102000001617 Interferon Receptors Human genes 0.000 description 2
- 108010054267 Interferon Receptors Proteins 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- 102000043129 MHC class I family Human genes 0.000 description 2
- 108091054437 MHC class I family Proteins 0.000 description 2
- 102000043131 MHC class II family Human genes 0.000 description 2
- 108091054438 MHC class II family Proteins 0.000 description 2
- 244000061176 Nicotiana tabacum Species 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 241000235070 Saccharomyces Species 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- 102000013275 Somatomedins Human genes 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 230000001270 agonistic effect Effects 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 235000019445 benzyl alcohol Nutrition 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 238000004140 cleaning Methods 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 238000001114 immunoprecipitation Methods 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 239000007928 intraperitoneal injection Substances 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 210000003292 kidney cell Anatomy 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 230000001766 physiological effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 239000003053 toxin Substances 0.000 description 2
- 231100000765 toxin Toxicity 0.000 description 2
- 108700012359 toxins Proteins 0.000 description 2
- 241000701447 unidentified baculovirus Species 0.000 description 2
- HNSDLXPSAYFUHK-UHFFFAOYSA-N 1,4-bis(2-ethylhexyl) sulfosuccinate Chemical compound CCCCC(CC)COC(=O)CC(S(O)(=O)=O)C(=O)OCC(CC)CCCC HNSDLXPSAYFUHK-UHFFFAOYSA-N 0.000 description 1
- IVLXQGJVBGMLRR-UHFFFAOYSA-N 2-aminoacetic acid;hydron;chloride Chemical compound Cl.NCC(O)=O IVLXQGJVBGMLRR-UHFFFAOYSA-N 0.000 description 1
- UZOVYGYOLBIAJR-UHFFFAOYSA-N 4-isocyanato-4'-methyldiphenylmethane Chemical compound C1=CC(C)=CC=C1CC1=CC=C(N=C=O)C=C1 UZOVYGYOLBIAJR-UHFFFAOYSA-N 0.000 description 1
- 102100022464 5'-nucleotidase Human genes 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 1
- 241000589155 Agrobacterium tumefaciens Species 0.000 description 1
- 102100022749 Aminopeptidase N Human genes 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241000228245 Aspergillus niger Species 0.000 description 1
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 102100032912 CD44 antigen Human genes 0.000 description 1
- 102100036008 CD48 antigen Human genes 0.000 description 1
- 101150015099 CHIA1 gene Proteins 0.000 description 1
- 102000011632 Caseins Human genes 0.000 description 1
- 108010076119 Caseins Proteins 0.000 description 1
- 238000012490 Cation-exchange liquid chromatography method Methods 0.000 description 1
- 108010005939 Ciliary Neurotrophic Factor Proteins 0.000 description 1
- 102100031614 Ciliary neurotrophic factor Human genes 0.000 description 1
- 102100025680 Complement decay-accelerating factor Human genes 0.000 description 1
- 102100030886 Complement receptor type 1 Human genes 0.000 description 1
- 102100032768 Complement receptor type 2 Human genes 0.000 description 1
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 102100023471 E-selectin Human genes 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 1
- 102100031780 Endonuclease Human genes 0.000 description 1
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 description 1
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 description 1
- 108010075944 Erythropoietin Receptors Proteins 0.000 description 1
- 102100036509 Erythropoietin receptor Human genes 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 102100021260 Galactosylgalactosylxylosylprotein 3-beta-glucuronosyltransferase 1 Human genes 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000004366 Glucosidases Human genes 0.000 description 1
- 108010056771 Glucosidases Proteins 0.000 description 1
- 102100029880 Glycodelin Human genes 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 102100020948 Growth hormone receptor Human genes 0.000 description 1
- 102100028972 HLA class I histocompatibility antigen, A alpha chain Human genes 0.000 description 1
- 108010075704 HLA-A Antigens Proteins 0.000 description 1
- 102000006354 HLA-DR Antigens Human genes 0.000 description 1
- 108010058597 HLA-DR Antigens Proteins 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 101000678236 Homo sapiens 5'-nucleotidase Proteins 0.000 description 1
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 1
- 101000757160 Homo sapiens Aminopeptidase N Proteins 0.000 description 1
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 1
- 101000716130 Homo sapiens CD48 antigen Proteins 0.000 description 1
- 101000993364 Homo sapiens Ciliary neurotrophic factor Proteins 0.000 description 1
- 101000856022 Homo sapiens Complement decay-accelerating factor Proteins 0.000 description 1
- 101000727061 Homo sapiens Complement receptor type 1 Proteins 0.000 description 1
- 101000941929 Homo sapiens Complement receptor type 2 Proteins 0.000 description 1
- 101000622123 Homo sapiens E-selectin Proteins 0.000 description 1
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 1
- 101000932480 Homo sapiens Fms-related tyrosine kinase 3 ligand Proteins 0.000 description 1
- 101000894906 Homo sapiens Galactosylgalactosylxylosylprotein 3-beta-glucuronosyltransferase 1 Proteins 0.000 description 1
- 101000585553 Homo sapiens Glycodelin Proteins 0.000 description 1
- 101000746367 Homo sapiens Granulocyte colony-stimulating factor Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 1
- 101001078158 Homo sapiens Integrin alpha-1 Proteins 0.000 description 1
- 101001078133 Homo sapiens Integrin alpha-2 Proteins 0.000 description 1
- 101000994378 Homo sapiens Integrin alpha-3 Proteins 0.000 description 1
- 101000994375 Homo sapiens Integrin alpha-4 Proteins 0.000 description 1
- 101000994369 Homo sapiens Integrin alpha-5 Proteins 0.000 description 1
- 101000994365 Homo sapiens Integrin alpha-6 Proteins 0.000 description 1
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 1
- 101001046677 Homo sapiens Integrin alpha-V Proteins 0.000 description 1
- 101000935043 Homo sapiens Integrin beta-1 Proteins 0.000 description 1
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 description 1
- 101001015004 Homo sapiens Integrin beta-3 Proteins 0.000 description 1
- 101000599852 Homo sapiens Intercellular adhesion molecule 1 Proteins 0.000 description 1
- 101000599858 Homo sapiens Intercellular adhesion molecule 2 Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101001055145 Homo sapiens Interleukin-2 receptor subunit beta Proteins 0.000 description 1
- 101001018097 Homo sapiens L-selectin Proteins 0.000 description 1
- 101001129927 Homo sapiens Leptin receptor Proteins 0.000 description 1
- 101000608935 Homo sapiens Leukosialin Proteins 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 description 1
- 101000917824 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-b Proteins 0.000 description 1
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 1
- 101001063392 Homo sapiens Lymphocyte function-associated antigen 3 Proteins 0.000 description 1
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 1
- 101000622137 Homo sapiens P-selectin Proteins 0.000 description 1
- 101001071312 Homo sapiens Platelet glycoprotein IX Proteins 0.000 description 1
- 101001070790 Homo sapiens Platelet glycoprotein Ib alpha chain Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 101000799466 Homo sapiens Thrombopoietin receptor Proteins 0.000 description 1
- 101000835093 Homo sapiens Transferrin receptor protein 1 Proteins 0.000 description 1
- 101000611023 Homo sapiens Tumor necrosis factor receptor superfamily member 6 Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 101000622304 Homo sapiens Vascular cell adhesion protein 1 Proteins 0.000 description 1
- 206010020649 Hyperkeratosis Diseases 0.000 description 1
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 1
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 102100036721 Insulin receptor Human genes 0.000 description 1
- 102100025323 Integrin alpha-1 Human genes 0.000 description 1
- 102100025305 Integrin alpha-2 Human genes 0.000 description 1
- 102100032819 Integrin alpha-3 Human genes 0.000 description 1
- 102100032818 Integrin alpha-4 Human genes 0.000 description 1
- 102100032817 Integrin alpha-5 Human genes 0.000 description 1
- 102100032816 Integrin alpha-6 Human genes 0.000 description 1
- 102100022338 Integrin alpha-M Human genes 0.000 description 1
- 102100022337 Integrin alpha-V Human genes 0.000 description 1
- 102100022297 Integrin alpha-X Human genes 0.000 description 1
- 102100025304 Integrin beta-1 Human genes 0.000 description 1
- 102100025390 Integrin beta-2 Human genes 0.000 description 1
- 102100032999 Integrin beta-3 Human genes 0.000 description 1
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 1
- 102100037872 Intercellular adhesion molecule 2 Human genes 0.000 description 1
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 1
- 102100026879 Interleukin-2 receptor subunit beta Human genes 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- 102100033467 L-selectin Human genes 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- 241000283986 Lepus Species 0.000 description 1
- 102100039564 Leukosialin Human genes 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 1
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 102100030984 Lymphocyte function-associated antigen 3 Human genes 0.000 description 1
- 108010053229 Lysyl endopeptidase Proteins 0.000 description 1
- 241000282567 Macaca fascicularis Species 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- 206010064912 Malignant transformation Diseases 0.000 description 1
- 108090000301 Membrane transport proteins Proteins 0.000 description 1
- 102000003939 Membrane transport proteins Human genes 0.000 description 1
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 1
- 101000993359 Mus musculus Ciliary neurotrophic factor Proteins 0.000 description 1
- 101000852143 Mus musculus Erythropoietin receptor Proteins 0.000 description 1
- 101000932479 Mus musculus Fms-related tyrosine kinase 3 ligand Proteins 0.000 description 1
- 101000746384 Mus musculus Granulocyte colony-stimulating factor Proteins 0.000 description 1
- 101001129925 Mus musculus Leptin receptor Proteins 0.000 description 1
- 101000799459 Mus musculus Thrombopoietin receptor Proteins 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 1
- 102000003729 Neprilysin Human genes 0.000 description 1
- 108090000028 Neprilysin Proteins 0.000 description 1
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 1
- 102100023472 P-selectin Human genes 0.000 description 1
- 241000282577 Pan troglodytes Species 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 101000946120 Petunia hybrida Chalcone-flavanone isomerase A Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102100036851 Platelet glycoprotein IX Human genes 0.000 description 1
- 102100034173 Platelet glycoprotein Ib alpha chain Human genes 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- 108010009341 Protein Serine-Threonine Kinases Proteins 0.000 description 1
- 102000009516 Protein Serine-Threonine Kinases Human genes 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 101000943737 Pseudoalteromonas piscicida Chitinase A Proteins 0.000 description 1
- ODHCTXKNWHHXJC-GSVOUGTGSA-N Pyroglutamic acid Natural products OC(=O)[C@H]1CCC(=O)N1 ODHCTXKNWHHXJC-GSVOUGTGSA-N 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 1
- 101100221606 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) COS7 gene Proteins 0.000 description 1
- 244000000231 Sesamum indicum Species 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 108010068542 Somatotropin Receptors Proteins 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 108010070774 Thrombopoietin Receptors Proteins 0.000 description 1
- 102100034196 Thrombopoietin receptor Human genes 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 102100026144 Transferrin receptor protein 1 Human genes 0.000 description 1
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 102100040403 Tumor necrosis factor receptor superfamily member 6 Human genes 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- 101710100170 Unknown protein Proteins 0.000 description 1
- 102100023543 Vascular cell adhesion protein 1 Human genes 0.000 description 1
- 241000269368 Xenopus laevis Species 0.000 description 1
- 101100166889 Zea mays CHI gene Proteins 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- ODHCTXKNWHHXJC-UHFFFAOYSA-N acide pyroglutamique Natural products OC(=O)C1CCC(=O)N1 ODHCTXKNWHHXJC-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 238000005377 adsorption chromatography Methods 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 239000004178 amaranth Substances 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- 108010079452 beta Adrenergic Receptors Proteins 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000012219 cassette mutagenesis Methods 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 238000003163 cell fusion method Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 101150014959 chi1 gene Proteins 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 108010057085 cytokine receptors Proteins 0.000 description 1
- 102000003675 cytokine receptors Human genes 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 108010005905 delta-hGHR Proteins 0.000 description 1
- 230000030609 dephosphorylation Effects 0.000 description 1
- 238000006209 dephosphorylation reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 230000009881 electrostatic interaction Effects 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 238000012252 genetic analysis Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 102000007318 human leptin receptor Human genes 0.000 description 1
- 230000005660 hydrophilic surface Effects 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 239000003547 immunosorbent Substances 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000009776 industrial production Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000001155 isoelectric focusing Methods 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 238000012933 kinetic analysis Methods 0.000 description 1
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 230000036212 malign transformation Effects 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 230000009061 membrane transport Effects 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000007758 minimum essential medium Substances 0.000 description 1
- 238000000329 molecular dynamics simulation Methods 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 229940053973 novocaine Drugs 0.000 description 1
- 230000001293 nucleolytic effect Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 210000000287 oocyte Anatomy 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 238000004091 panning Methods 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 229940021222 peritoneal dialysis isotonic solution Drugs 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229940080469 phosphocellulose Drugs 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 238000012514 protein characterization Methods 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 239000000941 radioactive substance Substances 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000001846 repelling effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 238000002702 ribosome display Methods 0.000 description 1
- 238000005185 salting out Methods 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229940125723 sedative agent Drugs 0.000 description 1
- 239000000932 sedative agent Substances 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 239000004575 stone Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 235000021247 β-casein Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/303—Liver or Pancreas
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/522—CH1 domain
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Cell Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
Настоящее изобретение относится к области иммунологии. Предложен способ получения биспецифического антитела, предусматривающий введение электрически взаимно отталкивающихся аминокислотных остатков в положения 147 тяжелой цепи и 180 легкой цепи, 147 тяжелой цепи и 131 легкой цепи или 175 тяжелой цепи и 160 легкой цепи (по нумерации ЕС), где тяжелая цепь представляет собой IgG1, а легкая цепь представляет собой IgK (Каппа). Данное изобретение обеспечивает подавление нежелательной ассоциации между константной области 1 тяжелой цепи (CH1) и константной области легкой цепи (CL) путем замещения аминокислот, присутствующих на границе между CH1 и CL, электрически заряженными аминокислотами. Также предложен способ регулирования ассоциации тяжелой цепи и легкой цепи биспецифического антитела такой, что нежелательные ассоциации не образуются между тяжелой и легкой цепями. 2 н. и 10 з.п. ф-лы, 12 ил., 14 табл., 9 пр.
Description
Уровень техники
Настоящее изобретение касается антител с регулируемой ассоциацией тяжелой цепи и легкой цепи, способов получения антитела с регулируемой ассоциацией тяжелой цепи и легкой цепи, способов регулирования ассоциации тяжелой цепи и легкой цепи антитела, фармацевтических композиций, включающих это антитело в качестве активного ингредиента, и т.п.
Область изобретения
Ранее сообщалось о нескольких способах получения биспецифических антител IgG-типа, имеющих константные области человека (антител IgG-типа, имеющих константную область человека, обладающую специфичностью связывания с антигеном A на одном плече и специфичностью связывания с антигеном B на другом плече). В целом биспецифические антитела IgG-типа состоят из двух типов H-цепей (то есть, H-цепи для антигена A и H-цепи для антигена В) и двух типов L-цепей (то есть, L-цепи для антигена A и L-цепи для антигена B). Когда экспрессируются такие биспецифические антитела IgG-типа, возможны 10 типов комбинаций в качестве комбинаций H2L2, поскольку экспрессируются два типа H-цепей и два типа L-цепей. Среди них существует один тип комбинации, имеющий необходимую специфичность связывания (IgG, имеющий специфичность связывания с антигеном A на одном плече и специфичность связывания с антигеном В на другом плече). Таким образом, для получения необходимого биспецифического антитела необходимо выделить один тип нужного антитела из десяти типов антител, что является очень малоэффективным и затруднительным.
Сообщалось о способах решения этой проблемы, включающих преимущественно секретирование IgG, имеющего гетерологичную комбинацию H-цепи для антигена A и H-цепи для антигена В, путем замещения аминокислот в CH3-области IgG H-цепи (патентные документы 1, 2, 3 и 4 и непатентные документы 1 и 2). Среди них сообщалось о способах, в которых используются физические препятствия в форме "выступов" и "впадин", и тех, в которых применяется отталкивание электрических зарядов.
Также сообщалось о способе эффективного получения необходимой молекулы, согласно которому используется общая L-цепь, в которой L-цепь для антигена A и L-цепь для антигена В присутствуют на одной аминокислотной последовательности (патентные документы 5 и 6). Однако, поскольку применение общей L-цепи может значительно снижать аффинность антигена, этот способ не всегда является оптимальным. Таким образом, для того, чтобы биспецифическое антитело связывалось с двумя антигенами с высокой аффинностью, ассоциируют только L-цепь и H-цепь для антигена A и только L-цепь и H-цепь для антигена В. Кроме того, сообщается о способе, позволяющем ассоциировать H-цепи и L-цепи для каждого антигена независимо от вариабельных областей, который включает замещение аминокислот в доменах CH1 и CL, которые являются константными областями, вместо аминокислот в вариабельных областях (патентные документы 2 и 7). Однако этот способ все же недостаточен для эффективного получения необходимого биспецифического антитела.
[Документы существующего уровня техники]
[Патентные документы]
[Патентный документ 1] WO 96/27011
[Патентный документ 2] WO 2006/106905
[Патентный документ 3] WO 2009/089004
[Патентный документ 4] WO 2010/129304
[Патентный документ 5] WO 98/050431
[Патентный документ 6] WO 2006/109592
[Патентный документ 7] WO 2007/147901
[Непатентные документы]
[Непатентный документ 1] Ridgway JB et al., Protein Engineering, 1996, Vol. 9, p. 617-621
[Непатентный документ 2] Merchant AM et al., Nature Biotechnology, 1998, Vol. 16, p. 677-681
Краткое описание изобретения
[Проблемы, решаемые изобретением]
Настоящее изобретение достигалось при таких условиях. Цель настоящего изобретения состоит в обеспечении антител, в которых ассоциация тяжелых цепей и легких цепей является регулируемой, способа получения антител, в которых ассоциация тяжелых цепей и легких цепей является регулируемой, и способа регулирования ассоциации тяжелых цепей и легких цепей антитела. Кроме того, в одном варианте осуществления настоящего изобретения цель настоящего изобретения состоит в обеспечении биспецифических антител, в которых ассоциация на границе CH1 и CL является регулируемой, и способа эффективного получения биспецифического антитела путем регулирования ассоциации на границе CH1 и CL.
[Средства решения проблем]
Авторами настоящего изобретения были выбраны константная область тяжелой цепи, CH1, и константная область легкой цепи (CL) в качестве областей тяжелой цепи и легкой цепи для применения в регулировании ассоциации и проводились специальные исследования регулирования ассоциации CH1 и CL. В результате авторами настоящего изобретения было обнаружено, что ассоциация CH1 и CL может подавляться замещением аминокислотных остатков, присутствующих на границе CH1 и CL, аминокислотными остатками, которые электрически взаимно отталкиваются, или аминокислотными остатками, которые не отталкиваются, и гетерологичные молекулы образуются более эффективно, чем при применении модификаций, которые только включают выступ и впадину в CH3, как было описано выше.
Таким образом, согласно открытиям, сделанным авторами настоящего изобретения, существует возможность регулирования ассоциации CH1 и CL. Кроме того, настоящее изобретение может применяться не только к регулированию ассоциации между CH1 и CL, а также к регулированию ассоциации между произвольными полипептидами.
Кроме того, авторы настоящего изобретения также подтвердили, что биспецифическое антитело согласно настоящему изобретению с регулируемой ассоциацией тяжелой цепи и легкой цепи фактически сохраняет функцию.
Как описывалось выше, авторами настоящего изобретения были успешно разработаны антигенсвязывающие молекулы, в которых ассоциация тяжелой цепи и легкой цепи является регулируемой и, таким образом, выполнено настоящее изобретение.
Настоящее изобретение касается антигенсвязывающих молекул, в которых ассоциация тяжелых цепей и легких цепей является регулируемой, способов получения антигенсвязывающей молекулы, в которой ассоциация тяжелых цепей и легких цепей является регулируемой, и способов регулирования ассоциации тяжелых цепей и легких цепей антигенсвязывающей молекулы. В частности, настоящее изобретение касается следующего:
[1] антигенсвязывающей молекулы, в которой ассоциация тяжелой цепи и легкой цепи является регулируемой, причем
один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), в тяжелой цепи и легкой цепи в антигенсвязывающей молекуле, являются аминокислотными остатками, которые электрически взаимно отталкиваются:
(a) аминокислотный остаток, включенный в константную область тяжелой цепи (CH1) в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в константную область легкой цепи (CL) в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, включенный в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, включенный в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 160, как указывается согласно нумерации EC;
[2] антигенсвязывающей молекулы [1], также характеризующейся тем, что в ней аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в п. (d), являются аминокислотными остатками, которые электрически взаимно отталкиваются:
(d) аминокислотный остаток, включенный в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации EC;
[3] антигенсвязывающей молекулы [1] или [2], в которой аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в набор (X) и (Y), как указано ниже:
(X) глутаминовая кислота (E) или аспарагиновая кислота (D); и
(Y) лизин (K), аргинин (R) или гистидин (H);
[4] любой антигенсвязывающей молекулы с [1] по [3], также характеризующейся тем, что в ней два или более аминокислотных остатков, образующих границу между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, являются аминокислотными остатками, которые электрически взаимно отталкиваются;
[5] антигенсвязывающей молекулы [4], в которой аминокислотные остатки, которые электрически взаимно отталкиваются, представляют собой один набор или два набора аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных в пп. (a) или (b):
(a) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 44 согласно нумерации Kabat;
[6] антигенсвязывающей молекулы [4] или [5], в которой аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в любой из наборов (X) и (Y), как указано ниже:
(X) глутаминовая кислота (E) или аспарагиновая кислота (D); и
(Y) лизин (K), аргинин (R), или гистидин (Н);
[7] антигенсвязывающей молекулы, в которой ассоциация тяжелой цепи и легкой цепи является регулируемой, причем
один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), в ассоциации тяжелой цепи и легкой цепи в антигенсвязывающей молекуле, являются аминокислотными остатками, которые электрически взаимно не отталкиваются:
(a) аминокислотный остаток, включенный в константную область тяжелой цепи (CH1) в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в константную область легкой цепи (CL) в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, включенный в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, включенный в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 160, как указывается согласно нумерации EC;
[8] антигенсвязывающей молекулы [7], также характеризующейся тем, что в ней аминокислотные остатки из набора аминокислотных остатков, показанных ниже в п. (d), представляют собой аминокислотные остатки, которые электрически взаимно не отталкиваются:
(d) аминокислотный остаток, включенный в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации EC;
[9] антигенсвязывающей молекулы [7] или [8], в которой аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся указанные ниже пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z) и (Z) и (Z):
(X) глутаминовая кислота (E) или аспарагиновая кислота (D);
(Y) лизин (K), аргинин (R) или гистидин (H); и
(Z) аланин (A), аспарагин (N), цистеин (C), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (М), фенилаланин (F), пролин (P), серии (S), треонин (T), триптофан (W), тирозин (Y) или валин (V);
[10] любой антигенсвязывающей молекулы с [7] по [9], в которой аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотный остаток, включенный в CH1 в позиции 175, как указывается согласно нумерации EC, который является лизином (K); и аминокислотные остатки, включенные в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, которые все являются глутаминовой кислотой (Е);
[11] любой антигенсвязывающей молекулы с [7] по [9], в которой аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки, включенные в CH1 в позиции 147 и позиции 175, как указывается согласно нумерации EC, которые являются глутаминовой кислотой (E); и аминокислотные остатки, включенные в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, которые все являются лизином (K);
[12] антигенсвязывающей молекулы [11], также характеризующейся тем, что в ней аминокислотный остаток, включенный в CH1 в позиции 213, как указывается согласно нумерации EC, является глутаминовой кислотой (E), и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации EC, является лизином (K);
[13] любой антигенсвязывающей молекулы с [7] по [12], в которой дополнительно два или более аминокислотных остатков, образующих границу между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, представляют собой аминокислотные остатки, которые электрически взаимно не отталкиваются;
[14] антигенсвязывающей молекулы [13], в которой аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой один набор или два набора аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. (а) или (b):
(a) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 44 согласно нумерации Kabat;
[15] антигенсвязывающей молекулы [13] или [14], в которой аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся указанные ниже пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z) и (Z) и (Z):
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D);
(Y) лизин (K), аргинин (R) или гистидин (Н); и
(Z) аланин (А), аспарагин (N), цистеин (С), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (М), фенилаланин (F), пролин (Р), серии (S), треонин (Т), триптофан (W), тирозин (Y) или валин (V);
[16] антигенсвязывающая молекулы по любому из пп. с [1] по [15], причем антигенсвязывающая молекула является биспецифическим антителом;
[17] способа получения антигенсвязывающей молекулы, согласно которому ассоциация тяжелой цепи и легкой цепи является регулируемой, который включает этапы с (1) по (3):
(1) модификации нуклеиновых кислот, кодирующих константную область тяжелой цепи (CH1) и константную область легкой цепи (CL), таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), электрически взаимно отталкивались:
(a) аминокислотный остаток, включенный в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, включенный в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, включенный в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 160, как указывается согласно нумерации EC,
(2) включения модифицированных нуклеиновых кислот в клетку-хозяин и культивирование клетки-хозяина таким образом, чтобы экспрессировались нуклеиновые кислоты, и
(3) сбора антигенсвязывающих молекул из культуры клетки-хозяина;
[18] способа получения антигенсвязывающей молекулы [17], который также включает на этапе (1) модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в п. (d), электрически взаимно отталкивались:
(d) аминокислотный остаток, включенный в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации EC;
[19] способа получения антигенсвязывающей молекулы [17] или [18], который включает на этапе (1) модификацию нуклеиновых кислот таким образом, что аминокислотные остатки, которые электрически взаимно отталкиваются, выбираются из аминокислотных остатков, включенных в группу (X) и (Y), как указано ниже:
(X) глутаминовая кислота (E) или аспарагиновая кислота (D); и
(Y) лизин (K), аргинин (R), или гистидин (H);
[20] способа получения антигенсвязывающей молекулы по любому из пп. с [17] по [19], который также включает на этапе (1) модификацию нуклеиновых кислот таким образом, чтобы два или более аминокислотных остатков, образующих границу между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи являются аминокислотными остатками, которые электрически взаимно отталкиваются;
[21] способа получения антигенсвязывающей молекулы [20], согласно которому аминокислотные остатки, которые электрически взаимно отталкиваются, являются аминокислотными остатками любого набора, выбранного из группы, к которой относятся наборы аминокислотных остатков, показанных в пп. (a) или (b):
(a) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 44 согласно нумерации Kabat;
[22] способа получения антигенсвязывающей молекулы [20] или [21], согласно которому аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в набор (X) и (Y), как указано ниже:
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D); и
(Y) лизин (K), аргинин (R), или гистидин (H);
[23] способа получения антигенсвязывающей молекулы, согласно которому ассоциация тяжелой цепи и легкой цепи является регулируемой, включая следующие этапы с (1) по (3):
(1) модификации нуклеиновых кислот, кодирующих константную область тяжелой цепи (CH1) и константную область легкой цепи (CL), таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), электрически взаимно не отталкивались:
(a) аминокислотный остаток, включенный в константную область тяжелой цепи (CH1) в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в константную область легкой цепи (CL) в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, включенный в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, включенный в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 160, как указывается согласно нумерации EC,
(2) включения модифицированных нуклеиновых кислот в клетку-хозяин и культивирование клетки-хозяина таким образом, чтобы экспрессировались нуклеиновые кислоты, и
(3) сбора антигенсвязывающих молекул из культуры клетки-хозяина;
[24] способа получения антигенсвязывающей молекулы [23], который также включает на этапе (1) модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в п. (d), электрически взаимно не отталкивались:
(d) аминокислотный остаток, включенный в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации EC;
[25] способ получения антигенсвязывающей молекулы [23] или [24], который включает на этапе (1) модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки, которые электрически взаимно не отталкиваются, представляли собой аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся указанные ниже пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z) и (Z) и (Z):
(X) глутаминовая кислота (E) или аспарагиновая кислота (D);
(Y) лизин (K), аргинин (R), или гистидин (H); и
(Z) аланин (A), аспарагин (N), цистеин (C), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), пролин (P), серии (S), треонин (T), триптофан (W), тирозин (Y) или валин (V);
[26] способа получения антигенсвязывающей молекулы по любому из пп. с [23] по [25], который включает на этапе (1) модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотный остаток, включенный в CH1 в позиции 175, как указывается согласно нумерации EC, который является лизином (К), и аминокислотные остатки, включенные в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, которые все являются глутаминовой кислотой (Е);
[27] способа получения антигенсвязывающей молекулы по любому из пп. с [23] по [25], который включает на этапе (1) модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки, включенные в CH1 в позиции 147 и позиции 175, как указывается согласно нумерации EC, которые являются глутаминовой кислотой (E), и аминокислотные остатки, включенные в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, которые все являются лизином (K);
[28] способа получения антигенсвязывающей молекулы по п. [27], который также включает модификацию нуклеиновых кислот таким образом, чтобы аминокислотный остаток, включенный в CH1 в позиции 213, как указывается согласно нумерации EC, являлся глутаминовой кислотой (Е), и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации EC, являлся лизином (K);
[29] способа получения антигенсвязывающей молекулы по любому из пп. с [23] по [28], который также включает на этапе (1) модификацию нуклеиновых кислот таким образом, чтобы два или более аминокислотных остатков, образующих границу между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, представляли собой аминокислотные остатки, которые электрически взаимно не отталкиваются;
[30] способа получения антигенсвязывающей молекулы по п. [29], согласно которому аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки любого набора, выбранного из группы, к которой относятся наборы аминокислотных остатков, показанных в пп. (a) или (b):
(a) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 44 согласно нумерации Kabat;
[31] способа получения антигенсвязывающей молекулы по пп. [29] или [30], согласно которому аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся указанные ниже пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z) и (Z) и (Z):
(X) глутаминовая кислота (E) или аспарагиновая кислота (D);
(Y) лизин (K), аргинин (R) или гистидин (H); и
(Z) аланин (A), аспарагин (N), цистеин (C), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), пролин (P), серии (S), треонин (T), триптофан (W), тирозин (Y) или валин (V);
[32] антигенсвязывающей молекулы, полученной согласно способу получения антигенсвязывающей молекулы по любому из пп. с [17] по [31];
[33] антигенсвязывающей молекулы [32], причем антигенсвязывающая молекула является биспецифическим антителом;
[34] способ регулирования ассоциации тяжелой цепи и легкой цепи антигенсвязывающей молекулы, который включает:
модификацию нуклеиновых кислот таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), являлись аминокислотными остатками, которые электрически взаимно отталкиваются:
(a) аминокислотный остаток, включенный в CHl в позиции 147. как указывается согласно нумерации ЕС, и аминокислотный остаток, включенный в CL в позиции 180, как указывается согласно нумерации ЕС;
(b) аминокислотный остаток, включенный в CHl в позиции 147, как указывается согласно нумерации ЕС, и аминокислотный остаток, включенный в CL в позиции 131, как, указывается согласно нумерации ЕС; и
(c) аминокислотный остаток, включенный в CHl в позиции 175, как указывается согласно нумерации ЕС, и аминокислотный остаток, включенный в CL в позиции 160, как указывается согласно нумерации ЕС;
[35] способа по п. [34], который также включает модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в п. (d), являлись аминокислотными остатками, которые электрически взаимно отталкиваются:
(d) аминокислотный остаток, включенный в CHl в позиции 213, как указывается согласно нумерации ЕС, и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации ЕС;
[36] способа по пп. [34] или [35], согласно которому аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в набор (X) и (Y), как указано ниже:
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D); и
(Y) лизин (K), аргинин (R), или гистидин (Н);
[37] способа по любому из пп. с [34] по [36], согласно которому дополнительно два или более аминокислотных остатков, образующих границу между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, являются аминокислотными остатками, которые электрически взаимно отталкиваются;
[38] способа по п. [37], согласно которому аминокислотные остатки, которые электрически взаимно отталкиваются, являются аминокислотными остатками любого набора, выбранного из группы, к которой относятся наборы аминокислотных остатков, показанных в пп. (а) или (b):
(а) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 38, указанный согласно нумерации Kabat; или
(b) аминокислотный остаток, включенный в вариабельную область тяжелой цепи в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, включенный в вариабельную область легкой цепи в позиции 44 согласно нумерации Kabat;
[39] способа по пп. [37] или [38], согласно которому аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в набор (X) и (Y), как указано ниже:
(X) глутаминовая кислота (E) или аспарагиновая кислота (D); и
(Y) лизин (K), аргинин (R), или гистидин (H);
[40] способа регулирования ассоциации тяжелой цепи и легкой цепи антигенсвязывающей молекулы, включающего:
модификацию нуклеиновых кислот таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), представляли собой аминокислотные остатки, которые электрически взаимно не отталкиваются:
(a) аминокислотный остаток, включенный в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, включенный в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, включенный в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 160, как указывается согласно нумерации EC;
[41] способа по п. [40], который также включает модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в п. (d), представляли собой аминокислотные остатки, которые электрически взаимно не отталкиваются:
(d) аминокислотный остаток, включенный в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, включенный в CL в позиции 123, как указывается согласно нумерации EC;
[42] способа по пп. [40] или [41], согласно которому аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся указанные ниже пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z) и (Z) и (Z):
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D);
(Y) лизин (K), аргинин (R), или гистидин (Н); и
(Z) аланин (А), аспарагин (N), цистеин (С), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (М), фенилаланин (F), пролин (Р), серии (S), треонин (Т), триптофан (W), тирозин (Y) или валин (V);
[43] способа по любому из пп. с [40] по [42], согласно которому аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотный остаток, включенный в CHl в позиции 175, как указывается согласно нумерации ЕС, который является лизином (K), и аминокислотные остатки, включенные в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации ЕС, которые все являются глутаминовой кислотой (Е);
[44] способа по любому из пп. с [40] по [42], согласно которому аминокислотные остатки, которые электрически взаимно не отталкиваются, представляют собой аминокислотные остатки, включенные в CHl в позиции 147 и позиции 175, как указывается согласно нумерации ЕС, которые являются глутаминовой кислотой (Е), и аминокислотные остатки, включенные в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации ЕС, которые все являются лизином (К);
[45] способа по п. [44], согласно которому дополнительно аминокислотный остаток, содержащийся в CHl в позиции 213, как указывается согласно нумерации ЕС, является глутаминовой кислотой (Е), и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации ЕС, является лизином (K);
[46] способа по любому из пп. с [34] по [45], согласно которому антигенсвязывающая молекула является биспецифическим антителом;
[47] композиции, содержащей антигенсвязывающую молекулу по любому из пп. с [1] по [16], [32] и [33] и фармацевтически приемлемый носитель;
[48] нуклеиновой кислоты, кодирующей антигенсвязывающую молекулу по любому из пп. с [1] по [16], [32] и [33]; и
[49] клетки-хозяина, включающей нуклеиновую кислоту [48].
Краткое описание фигур
Фиг. 1 представляет диаграмму модели границы CH1/CL.
Фиг. 2 концептуально представляет антитело с показом возможных комбинаций H-цепи и L-цепи, когда антитело получают путем смешивания одного типа H-цепи и двух типов L-цепей. Считается, что мутированные участки, имеющие большую пропорцию антитела с комбинацией E и K, как показано в квадрате, взаимодействуют электрически.
Фиг. 3 представляет графики, показывающие результаты анализа AIEX каждого из антител.
Фиг. 4 представляет графики, показывающие результаты анализа AIEX каждого из антител.
Фиг. 5 представляет графики, показывающие результаты анализа AIEX каждого из антител.
Фиг. 6 представляет график, показывающий результат анализа AIEX каждого из антител.
Фиг. 7 представляет графики, показывающие результаты анализа CIEX каждого из антител.
Фиг. 8 представляет графики, показывающие результаты анализа CIEX каждого из антител.
Фиг. 9-1 представляет графики, показывающие результаты анализа CIEX каждого из антител.
Фиг. 9-2 является продолжением Фиг. 9-1.
Фиг. 10 представляет графики, показывающие результаты анализа CIEX каждого из антител.
Фиг. 11 представляет графики, показывающие результаты анализа CIEX каждого из антител.
Фиг. 12 представляет диаграмму, которая сравнивает CH1 H-цепи путем выравнивания аминокислотных последовательностей человеческого IgA1 (SEQ ID NO: 63), IgA2 (SEQ ID NO: 64), IgD (SEQ ID NO: 65), IgE (SEQ ID NO: 66), IgG1 (SEQ ID NO: 67), IgG2 (SEQ ID NO: 68), IgG3 (SEQ ID NO: 69), IgG4 (SEQ ID NO: 70) и IgM (SEQ ID NO: 71); и CL L-цепи путем выравнивания аминокислотных последовательностей человеческого IgK (Каппа) (SEQ ID NO: 72), IgL1 (SEQ ID NO: 73), IgL2 (SEQ ID NO: 74), IgL3 (SEQ ID NO: 75), IgL6 (SEQ ID NO: 76), IgL7 (SEQ ID NO: 77) (Лямбда).
[Режим осуществления изобретения]
Настоящее изобретение касается антител, в которых ассоциация тяжелых цепей и легких цепей является регулируемой, способов получения антитела, в котором ассоциация тяжелых цепей и легких цепей является регулируемой, и способов регулирования ассоциации тяжелых цепей и легких цепей антитела.
Согласно настоящему изобретению, термин "антитело" применяется синонимично с термином "антигенсвязывающая молекула". То есть, согласно настоящему изобретению, термины "антитело" и "антигенсвязывающая молекула" применяются в самом широком смысле и включают моноклональные антитела, поликлональные антитела и варианты антител (такие, как химерные антитела, гуманизированные антитела, низкомолекулярные антитела (включая фрагменты антител, к которым могут произвольно добавляться другие молекулы) и мультиспецифические антитела), при условии, что они демонстрируют необходимую антигенсвязывающую активность или биологическую активность. Примером "антитела" или "антигенсвязывающей молекулы" согласно настоящему изобретению может быть молекула, в которой к Fab (антителу, в котором нормальной является только часть Fab) добавлен HAS-связывающий скелет. Кроме того, согласно настоящему изобретению, "антитело" также может быть полипептидом или гетеромерным мультимером. Предпочтительными антителами являются моноклональные антитела, химерные антитела, гуманизированные антитела, человеческие антитела, Fc-слитые антитела и низкомолекулярные антитела, такие, как фрагменты антител.
Антитело согласно настоящему изобретению представляет собой антитело, в котором ассоциация тяжелой цепи и легкой цепи является регулируемой, в котором тяжелая цепь и легкая цепь, составляющие антитело, являются нужной комбинацией тяжелой цепи и легкой цепи, и в котором аминокислотные остатки в данных местах в константной области тяжелой цепи (CH1) и константной области легкой цепи являются электрически взаимно отталкивающимися аминокислотными остатками (обладающими одноименными зарядами).
Согласно настоящему изобретению, преобразование аминокислотных остатков в данных местах в константной области тяжелой цепи (CH1) и константной области легкой цепи нежелательной комбинации тяжелой цепи и легкой цепи в аминокислотные остатки, которые электрически взаимно отталкиваются (то есть, обладающие одноименным зарядом), позволяет избегать образования нежелательных комбинаций тяжелой цепи и легкой цепи путем применения этого отталкивания зарядов, и в результате может быть образована необходимая комбинация тяжелой цепи и легкой цепи.
В другом варианте осуществления антитело согласно настоящему изобретению является антителом, в котором ассоциация тяжелой цепи и легкой цепи является регулируемой, в котором тяжелая цепь и легкая цепь, составляющие антитело, ассоциируются как нужная комбинация тяжелой цепи и легкой цепи, и в котором аминокислотные остатки в данных местах в константной области тяжелой цепи (CH1) и в константной области легкой цепи электрически взаимно не отталкиваются. Преобразование аминокислотных остатков в данных местах в константной области тяжелой цепи (CH1) и константной области легкой цепи нужной комбинации тяжелой цепи и легкой цепи в аминокислотные остатки, которые электрически взаимно не отталкиваются, позволяет образовывать нужную комбинацию тяжелой цепи и легкой цепи, например, путем применения силы притяжения электрических зарядов.
В контексте настоящего изобретения термин "полипептид" в целом относится к пептидам и белкам, длина которых составляет приблизительно десять аминокислот или более. Полипептиды изначально берут из организмов, но не обязательно ограничиваются организмами и, например, могут состоять из искусственно построенной последовательности. Они также могут быть любыми природными полипептидами, синтетическими полипептидами, рекомбинантными полипептидами и т.п. Кроме того, фрагменты вышеупомянутых полипептидов также включаются в полипептиды согласно настоящему изобретению.
В контексте настоящего изобретения фразы "регулировать ассоциацию" и "ассоциация является регулируемой" касаются регулирования для достижения нужного состояния ассоциации, более конкретно - регулирования таким образом, чтобы не образовывались нежелательные ассоциации между тяжелой цепью и легкой цепью.
В контексте настоящего изобретения термин "граница" в целом касается поверхности ассоциации, образуемой в результате ассоциации (взаимодействия), и аминокислотные остатки, образующие границу, изначально представляют собой один или несколько аминокислотных остатков, включенных в полипептидные участки, участвующие в ассоциации, и более предпочтительно являются аминокислотными остатками, приближающимися друг к другу во время ассоциации, и принимают участие во взаимодействии. Более конкретно это взаимодействие включает, например, случаи, в которых аминокислотные остатки приближаются вплотную во время ассоциации для образования водородных связей, электростатического взаимодействия или солевых мостиков друг с другом.
В контексте настоящего изобретения фраза "аминокислотные остатки, образующие границу" более конкретно касается аминокислотных остатков, включенных в полипептидный участок, составляющий границу. Например, полипептидные участки, составляющие границу, означают полипептидные участки, отвечающие за выборочное связывание между молекулами, такими, как антитела, лиганды, рецепторы или субстраты. Более конкретно в антителах такие примеры включают константные области тяжелой цепи, вариабельные области тяжелой цепи, константные области легкой цепи и вариабельные области легкой цепи.
"Модификация" аминокислотных остатков в контексте настоящего изобретения конкретно касается замещения первоначального(ых) аминокислотного(ых) остатка(ов) другим(и) аминокислотным(и) остатком(ами), удаление первоначального(ых) аминокислотного(ых) остатка(ов), добавление нового(ых) аминокислотного(ых) остатка(ов) и т.п., однако предпочтительно касается замещения одного или нескольких первоначальных аминокислотных остатков другими аминокислотными остатками.
В предпочтительном варианте осуществления антитела, согласно настоящему изобретению, антитело имеет аминокислотные остатки в данных местах в константной области тяжелой цепи (CH1) и константной области легкой цепи нежелательной комбинации тяжелой цепи и легкой цепи перед регулированием ассоциации, которые электрически отталкиваются (которые обладают одноименным зарядом).
Считается, что путем модификации аминокислотных остатков в вышеупомянутом антителе до аминокислотных остатков, которые электрически взаимно отталкиваются (обладают одноименным зарядом) ассоциация этих аминокислотных остатков ингибируется силой отталкивания электрических зарядов.
В другом предпочтительном варианте осуществления антитела согласно настоящему изобретению антитело имеет аминокислотные остатки, участвующие в ассоциации на границе полипептидов, которые электрически взаимно не отталкиваются.
Считается, что в вышеупомянутом антителе путем модификации аминокислотных остатков, участвующих в ассоциации на границе полипептидов, до аминокислотных остатков, которые электрически взаимно не отталкиваются, обеспечивается содействие ассоциации этих аминокислотных остатков, например, силой притяжения их электрических зарядов.
Таким образом, в вышеупомянутом антителе модифицированными аминокислотными остатками предпочтительно являются аминокислотные остатки, приближающиеся друг к другу при ассоциации, в полипептидных участках, образующих границу.
Аминокислотные остатки, приближающиеся во время ассоциации, могут определяться, например, путем анализа трехмерной структуры полипептида и исследования аминокислотных последовательностей полипептидных участков, образующих границу во время ассоциации полипептидов. Аминокислотные остатки на границе, которые взаимно приближаются друг к другу, предпочтительно являются мишенями "модификации" в антителе согласно настоящему изобретению.
Известно, что некоторые аминокислоты являются электрически заряженными. Как правило, лизин (K), аргинин (R) и гистидин (H) являются аминокислотами, обладающими положительным зарядом (положительно заряженными аминокислотами). Аспарагиновая кислота (D), глутаминовая кислота (E) и т.п. известны как аминокислоты, обладающие отрицательным зарядом (отрицательно заряженными аминокислотами). Кроме того, аланин (A), аспарагин (N), цистеин (C), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), пролин (P), серии (S), треонин (Т), триптофан (W), тирозин (Y), валин (V) и т.п. известны как аминокислоты, не обладающие зарядом, или неполярные аминокислоты.
Таким образом, аминокислотами, которые электрически взаимно отталкиваются (обладают одноименным зарядом), согласно настоящему изобретению, являются:
(1) аминокислоты, в которых одна из аминокислот является положительно заряженной аминокислотой, и другая аминокислота также является положительно заряженной аминокислотой, и
(2) аминокислоты, в которых одна из аминокислот является отрицательно заряженной аминокислотой, и другая аминокислота также является отрицательно заряженной аминокислотой.
Кроме того, аминокислотами, которые электрически взаимно не отталкиваются, согласно настоящему изобретению, являются:
(1) аминокислоты, в которых одна из аминокислот является положительно заряженной аминокислотой, а другая аминокислота является отрицательно заряженной аминокислотой,
(2) аминокислоты, в которых одна из аминокислот является положительно заряженной аминокислотой, а другая аминокислота является незаряженной аминокислотой или неполярной аминокислотой,
(3) аминокислоты, в которых одна из аминокислот является отрицательно заряженной аминокислотой, и другая аминокислота является незаряженной аминокислотой или неполярной аминокислотой, и
(4) аминокислоты, в которых обе аминокислоты являются незаряженными аминокислотами или неполярными аминокислотами.
Аминокислоты могут быть модифицированы в соответствии с различными способами, известными специалистам в данной области. Примерами таких способов являются, помимо прочих, сайт-специфический мутагенез (Hashimoto-Gotoh, T., Mizuno, T., Ogasahara, Y. and Nakagawa, M. (1995) An oligodeoxyribonucleotide-directed dual amber method for site-directed mutagenesis, Gene 152, 271 - 275; Zoller, M.J. and Smith, M. (1983) Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors, Methods Enzymol. 100, 468-500; Kramer, W., Drutsa, V., Jansen, H.W., Kramer, B., Pflugfelder, M. and Fritz, H.J. (1984) The gapped duplex DNA approach to oligonucleotide-directed mutation construction, Nucleic Acids Res. 12, 9441 - 9456; Kramer, W. and Fritz, H.J. (1987) Oligonucleotide-directed construction of mutations via gapped duplex DNA, Methods Enzymol. 154, 350-367; Kunkel, T.A. (1985) Rapid and efficient site-specific mutagenesis without phenotypic selection, Proc. Natl. Acad. Sci. USA 82, 488-492), ПЦР-мутагенез, кассетный мутагенез и т.п.
Примерами модификации аминокислот могут быть модификации незаряженной аминокислоты или неполярной аминокислоты до положительно заряженной аминокислоты, модификация незаряженной аминокислоты или неполярной аминокислоты до отрицательно заряженной аминокислоты, модификация положительно заряженной аминокислоты до отрицательно заряженной аминокислоты и модификация отрицательно заряженной аминокислоты до положительно заряженной аминокислоты. Кроме того, модификация незаряженной аминокислоты или неполярной аминокислоты до другой незаряженной или неполярной аминокислоты, модификация положительно заряженной аминокислоты до другой положительно незаряженной аминокислоты и модификация отрицательно заряженной аминокислоты до другой отрицательно заряженной аминокислоты также включаются в модификации аминокислот согласно настоящему изобретению.
Модификация аминокислот согласно настоящему изобретению включает создание одной модификации в каждой из тяжелой и легкой цепей или создание множественных модификаций для каждой из тяжелой и легкой цепей. Кроме того, количество модификаций, добавленных к тяжелой цепи и легкой цепи, может быть одинаковым или разным.
Модификация аминокислот согласно настоящему изобретению включает создание множественных модификаций в положительно заряженных аминокислотах в тяжелой цепи или легкой цепи и создание множественных модификаций в отрицательно заряженных аминокислотах в другой цепи. Кроме того, множественные модификации в положительно заряженных аминокислотах, а также множественные модификации в отрицательно заряженных аминокислотах возможны в одной и той же тяжелой цепи или легкой цепи. В этих модификациях также могут соответствующим образом комбинироваться модификации до незаряженных аминокислот или неполярных аминокислот, а также модификации незаряженных аминокислот или неполярных аминокислот.
При модификациях согласно настоящему изобретению, например, аминокислоты в одной из цепей могут использоваться в немодифицированном виде, и в таких случаях тяжелая цепь и легкая цепь не обязательно обе должны быть модифицированы, а может быть модифицирована лишь одна из цепей
Хотя не предусмотрено особых ограничений в отношении количества аминокислотных остатков, подлежащих модификации в антителе согласно настоящему изобретению, например, при модификации константной области антитела, для того, чтобы не снижать активность связывания с антигеном и не повышать иммуногенность, предпочтение отдается модификации как можно меньшего количества аминокислотных остатков. Вышеупомянутое слово "меньшее" означает, например, количество приблизительно от 1 до 30, предпочтительно приблизительно от 1 до 20, более предпочтительно - количество приблизительно от 1 до 15, и наиболее предпочтительно - количество от 1 до 5.
В контексте настоящего изобретения термин "антитело" применяется в самом широком смысле и включает моноклональные антитела, поликлональные антитела, варианты антител (такие, как химерные антитела, гуманизированные антитела, низкомолекулярные антитела (включая фрагменты антител) и мультиспецифические антитела), при условии, что они демонстрируют необходимую биологическую активность. Кроме того, "антитело" согласно настоящему изобретению может быть полипептидом или гетеромерным мультимером. Предпочтительными антителами являются моноклональные антитела, химерные антитела, гуманизированные антитела, человеческие антитела, Fc-слитые антитела и низкомолекулярные антитела, такие, как фрагменты антител.
В контексте настоящего изобретения термин "мультиспецифическое антитело" (применяемый в представленном описании в том же значении, что и "полиспецифическое антитело") относится к антителу, которое может специфически связываться с разными типами эпитопов. Более конкретно, мультиспецифическими антителами являются антитела, обладающие специфичностью по меньшей мере к двум разным типам эпитопов и, помимо антител, распознающих разные антигены, также включаются антитела, распознающие разные эпитопы на одном антигене. (Например, если антигены являются гетерологичными рецепторами, мультиспецифические антитела могут распознавать различные домены, составляющие гетерологичные рецепторы; в альтернативном варианте, если антигены являются мономерами, мультиспецифические антитела распознают множественные сайты на мономерных антигенах). Первоначально такие молекулы связываются с двумя антигенами (биспецифические антитела; применяются согласно изобретению в том же значении, что и "антитела двойной специфичности"), однако они даже могут обладать специфичностью в отношении большего количества антигенов (например, трех типов).
Помимо описанных выше антител, к антителам согласно настоящему изобретению относятся антитела, аминокислотные последовательности которых были модифицированы аминокислотными замещениями, делециями, добавлениями и/или инсерциями или химеризацией, гуманизацией и т.п.Такие модификации аминокислотных последовательностей, такие, как аминокислотные замещения, делеции, добавления и/или инсерции и гуманизация и химеризация, могут достигаться способами, известными специалистам в данной области. Если антитела согласно настоящему изобретению получают как рекомбинантные антитела, подобным образом аминокислотные последовательности вариабельных и константных областей антитела также могут быть модифицированы аминокислотными замещениями, делециями, добавлениями и/или инсерциями или путем химеризации, гуманизации и т.п.
Антитела согласно настоящему изобретению могут быть взяты из организма любого животного, такого, как мышь, человек, крыса, кролик, коза или верблюд. Кроме того, антитела могут быть модифицированы, например, химерные антитела, в особенности модифицированные антитела, включающие аминокислотные замещения в их последовательностях, такие, как гуманизированные антитела. Антитела могут относиться к любому типу антител, такому, как продукты модификации антител, связанные с различными молекулами, фрагменты антител и низкомолекулярные антитела.
"Химерные антитела" являются антителами, полученными путем сочетания последовательностей, взятых из организмов различных животных. Примером может быть антитело, имеющее вариабельные (V) области тяжелой и легкой цепи антитела мыши и константные (C) области тяжелой и легкой цепи человеческого антитела. Химерные антитела могут быть получены известными способами. Для получения таких химерных антител, например, ДНК, кодирующая V-область антитела, может быть сшита с ДНК, кодирующей константную область человеческого антитела; полученный в результате продукт сшивания может быть вставлен в вектор экспрессии; и последовательность может быть включена в организм-хозяин для образования химерного антитела.
"Гуманизированные антитела" также называются реконструированными человеческими антителами и могут быть получены путем замены гипервариабельного участка (CDR) человеческого антитела на CDR антитела, взятого из организма отличного от человека млекопитающего, например, мыши. Способы распознавания CDR известны специалистам в данной области (Kabat et al., Sequence of Proteins of Immunological Interest (1987), National Institute of Health, Bethesda, Md.; Chothia et al, Nature (1989) 342: 877). Общие технологии генетической рекомбинации, подходящие для этой цели, также известны (см. публикацию европейской патентной заявки №ЕР 125023; и документ WO 96/02576). Например, CDR антитела мыши может быть определен известными способами, и ДНК может быть подготовлена таким образом, чтобы она кодировала антитело, в котором CDR сшит с каркасным участком (FR) человеческого антитела. Гуманизированное антитело затем может быть получено с применением системы, в которой используются традиционные векторы экспрессии. Такие ДНК могут быть синтезированы путем ПЦР, с применением в качестве праймеров нескольких олигонуклеотидов, построенных таким образом, чтобы они включали части, которые частично накладываются на концы участков CDR и FR (см. способ, описанный в документе WO 98/13388). FR антитела человека, соединенные через CDR, выбирают таким образом, чтобы CDR образовывали подходящий антигенсвязывающий центр. В случае необходимости аминокислоты в FR вариабельной области антитела могут быть модифицированы таким образом, чтобы CDR реконструированного человеческого антитела могли образовывать подходящий антигенсвязывающий центр (Sato, К. et al., Cancer Res. (1993) 53: 851-856). Модифицируемые аминокислотные остатки в FR включают части, которые непосредственно связываются с антигеном через нековалентные связи (Amit et al., Science (1986) 233: 747-53), части, определенным образом влияющие или воздействующие на структуру CDR (Chothia et al, J. Mol. Biol. (1987) 196: 901-17), и части, участвующие во взаимодействии между VH и VL (документ EP 239400).
Константная область тяжелой цепи антитела согласно настоящему изобретению предпочтительно является человеческой константной областью тяжелой цепи. Кроме того, примерами константных областей тяжелой цепи антитела могут быть константные области типов IgA1, IgA2, IgD, IgE, IgG1, IgG2, IgG3, IgG4 и IgM. Константная область тяжелой цепи антитела согласно настоящему изобретению предпочтительно является константной областью типа IgG1, особенно предпочтительно - константной областью человеческого IgG1, но не ограничивается ею. Несколько аллотипических последовательностей, полученных при помощи генетического полиморфизма, описываются в публикации Sequences of Proteins, имеющих иммунологическое значение, Публикация NIH №91-3242 как константная область человеческого IgG1, и любая из них может применяться согласно настоящему изобретению.
Кроме того, константная область легкой цепи антитела согласно настоящему изобретению предпочтительно является человеческой константной областью легкой цепи. Примерами константной области легкой цепи антитела являются константные области типов IgK (Каппа), IgL1, IgL2, IgL3, IgL6 и IgL7 (Лямбда). Константная область легкой цепи антитела согласно настоящему изобретению предпочтительно является константной областью человеческого IgK (Каппа), но не ограничивается ею. Аминокислотная последовательность константной области человеческого IgK (Каппа) известна (SEQ ID NO: 72). Несколько аллотипических последовательностей, полученных при помощи генетического полиморфизма описываются в публикации Sequences of Proteins, имеющих иммунологическое значение, Публикация NIH №91-3242 как константная область человеческого IgK (Каппа) и константная область человеческого IgL7 (Лямбда), и любая из них может использоваться согласно настоящему изобретению.
Константные области антитела, в частности, константные области тяжелой цепи, могут быть модифицированы в случае необходимости с целью улучшения функции антитела или устойчивости антитела. Примерами модификаций для улучшения функции антитела являются модификации, усиливающие или ослабляющие связывание между антителом и Feγ рецептором (FcγR), модификации, усиливающие или ослабляющие связывание между антителом и FcRn, модификации, усиливающие или ослабляющие цитотоксическая активность антитела (такую, как антителозависимая клеточно-обусловленная цитотоксичность и комплементзависимая цитотоксичность) и т.п. Кроме того, также могут включаться модификации, улучшающие гетерогенность антитела и модификации, улучшающие иммуногенность и/или фармакокинетику.
Кроме того, в качестве гетерогенности C-концевой последовательности тяжелой цепи антитела IgG сообщалось об амидировании C-концевой карбоксильной группы путем делеции C-концевой аминокислоты, лизинового остатка или путем делеции двух C-концевых аминокислот, глицина и лизина (Anal. Biochem. 2007 Jan 1: 360 (1): 75-83). Таким образом, согласно настоящему изобретению, для уменьшения гетерогенности С-конца тяжелой цепи, предпочтение отдается использованию IgG, в котором C-концевой лизин или C-концевой лизин и глицин были делегированы.
Поскольку их антигенность в организме человека была ослаблена, ожидается, что химерные или гуманизированные антитела с использованием взятых из организма человека последовательностей могут использоваться при введении в организм человека з терапевтическими или другими подобными целями.
Кроме того, низкомолекулярные антитела могут использоваться в качестве антител благодаря их in vivo кинетическим характеристикам и дешевому производству с применением E. coli, растительных клеток и т.п.
Фрагменты антител представляют один тип низкомолекулярного антитела. Термин "низкомолекулярное антитело" включает антитела, включающие фрагмент антитела в качестве частичного структурного элемента. Низкомолекулярные антитела согласно настоящему изобретению не имеют особых ограничений ни по структуре, ни по способу получения, при условии, что они сохраняют антигенсвязывающую активность. Некоторые низкомолекулярные антитела обладают активностью, превышающей активность целого антитела (Orita et al, Blood (2005) 105: 562-566). В контексте данного описания "фрагменты антител" не имеют особых ограничений, при условии, что они являются частью целого антитела (например, целого IgG). Однако фрагменты антител предпочтительно включают вариабельную область тяжелой цепи (VH) или вариабельную область легкой цепи (VL), а также включают CH1 или CL. Примерами предпочтительных фрагментов антител являются: Fab, F(ab')2 и Fab'. Аминокислотные последовательности VH, VL, CH1 и CL в фрагменте антитела могут быть модифицированы путем замещения, делеции, добавления и/или инсерции. Кроме того, некоторые части CHI1 CL, VH и VL могут быть делетированы, при условии, что образованные в результате фрагменты сохраняют свою антигенсвязывающую способность, и фрагменты антител, такие, как scFv, Fab, доменное антитело (dAb) и VHH, HAS-связывающий скелет, PEG, альбумин, цитокины, токсины и т.п. (молекулы, описанные в публикации Biodrugs, 2009, 23 (2): 93-109; Methods Mol. Med., 2005, 109: 347-74; AAPS J., 2006 Aug 18, 8 (3): E532 - 51; и т.д.) также могут добавляться для повышения фармакокинетики (РК) или эффективности медикамента.
Фрагмент антитела может быть получен путем обработки антитела ферментом, например, протеазой, такой, как папаин или пепсин (см. Morimoto et al., J. Biochem. Biophys. Methods (1992) 24: 107-17; Brennan et al., Science (1985) 229: 81). В альтернативном варианте фрагменты антител также могут быть получены путем генетической рекомбинации на основе их аминокислотной последовательности.
Низкомолекулярное антитело, имеющее структуру, которая является результатом модификации фрагмента антитела, может быть получено с применением фрагментов антител, полученных путем ферментной обработки или генетической рекомбинации. В альтернативном варианте после построения гена, кодирующего целое низкомолекулярное антитело, и включения последовательности в вектор экспрессии низкомолекулярное антитело может быть экспрессировано в соответствующих клетках-хозяевах (см., например, Со et al., J. Immunol. (1994) 152: 2968-76; Better and Horwitz, Methods Enzymol. (1989) 178: 476-96; Pluckthun and Skerra, Methods Enzymol. (1989) 178: 497-515; Lamoyi, Methods Enzymol. (1986) 121: 652-63; Rousseaux et al., Methods Enzymol. (1986) 121: 663-9; Bird and Walker, Trends Biotechnol. (1991) 9: 132-7).
Предпочтительным примером антитела согласно настоящему изобретению является гетеромерный мультимер, имеющий два или более типов CH1 и два или более типов CL. Этот гетеромерный мультимер предпочтительно распознает два или более типов эпитопов, и его примером может быть полиспецифическое антитело.
Предпочтительным примером полиспецифического антитела согласно настоящему изобретению является биспецифическое антитело. Таким образом, примером предпочтительного варианта осуществления антитела согласно настоящему изобретению является биспецифическое антитело, состоящее из двух типов тяжелых цепей (первой тяжелой цепи и второй тяжелой цепи) и двух типов легких цепей (первой легкой цепи и второй легкой цепи).
В более подробном описании "биспецифических антител" согласно предпочтительным вариантам осуществления антител в соответствии с настоящим изобретением вышеупомянутая "первая тяжелая цепь" означает одну из двух тяжелых цепей (H-цепей), образующих антитело, в "вторая H-цепь" означает другую H-цепь, отличную от первой H-цепи. То есть, из двух H-цепей одна может произвольно определяться как первая H-цепь, а другая может определяться как вторая H-цепь. Подобным образом "первая легкая цепь" означает одну из двух легких цепей (L-цепей), образующих биспецифическое антитело, а "вторая L-цепь" означает другую L-цепь, отличную от первой L-цепи. Из двух L-цепей одна может произвольно определяться как первая L-цепь, а другая может определяться как вторая L-цепь. Как правило, первая L-цепь и первая H-цепь происходят из одного антитела, которое распознает определенный антиген (или эпитоп), а вторая L-цепь и вторая H-цепь также происходят из одного антитела, которое распознает определенный антиген (или эпитоп). В контексте данного описания пара L-цепь-H-цепь, образуемая первыми H-цепью и L-цепью, называется первой парой, а пара L-цепь-H-цепь, образуемая вторыми H-цепью и L-цепью, называется второй парой. Антиген (или эпитоп), используемый для получения антитела, из которого происходит вторая пара, предпочтительно отличается от антигена, используемого для получения антитела, из которого происходит первая пара. Более конкретно, антигены, распознаваемые первой парой и второй парой, могут быть одинаковыми, однако в предпочтительном варианте пары распознают различные антигены (или эпитопы). В этом случае H-цепи и L-цепи первой пары и второй пары предпочтительно имеют аминокислотные последовательности, отличающиеся одна от другой. Когда первая пара и вторая пара распознают разные эпитопы, первая пара и вторая пара могут распознавать полностью отличный антиген, или же они могут распознавать разные центры (разные эпитопы) на одном антигене. Кроме того, одна из них может распознавать антиген, такой, как белок, пептид, ген или сахар, а другая может распознавать цитотоксичные вещества, такие, как радиоактивные вещества, химиотерапевтические вещества или взятые из клеток токсины. Однако в случае потребности в создании антитела, имеющего пары, образованные специфическими комбинациями H-цепей и L-цепей, эти специфические H-цепи и L-цепи могут произвольно определяться как первая пара и вторая пара.
Что касается генов, кодирующих H-цепь или L-цепь антител перед включением мутаций в настоящее изобретение (в данном описании оно может просто указываться как "антитело согласно настоящему изобретению"), могут использоваться известные последовательности, или же они могут быть получены способами, известными специалистам в данной области. Например, они могут быть получены из библиотеки антител, или же они могут быть получены путем клонирования генов, кодирующих антитело из гибридом, вырабатывающих моноклональные антитела.
Что касается библиотек антител, многие библиотеки антител уже хорошо известны, и поскольку способы получения библиотек антител известны, специалисты в данной области смогут соответствующим образом получить библиотеки антител. Например, в отношении фаговых библиотек антител можно обратиться к литературным источникам, таким, как публикации Clackson et al, Nature 1991, 352: 624-8; Marks et al, J. Mol. Biol. 1991, 222: 581-97; Waterhouses et al, Nucleic Acids Res. 1993, 21: 2265-6; Griffiths et al, EMBO J. 1994, 13: 3245-60; Vaughan et al, Nature Biotechnology 1996, 14: 309-14; и публикация японского патента Kohyo (JP-A) H10-504970 (нерассмотренная японская публикация национальной фазы, соответствующая неяпонской международной публикации). Кроме того, могут применяться известные способы, такие, как способы, согласно которым используются эукариотные клетки, в качестве библиотек (WO 95/15393) и способы рибосомных дисплеев. Кроме того, также известны технологии получения человеческих антител путем пэннинга с применением библиотек антител человека. Например, вариабельные области человеческих антител могут быть экспрессированы на поверхности фагов как одноцепочечные антитела (scFvs) с применением способов фаговых дисплеев, и могут быть выбраны фаги, связывающиеся с антигенами. Генетический анализ выбранных фагов может определять последовательности ДНК, кодирующие вариабельные области человеческих антител, которые связываются с антигенами. Сразу после обнаружения последовательностей ДНК scFvs, которые связываются с антигенами, могут быть получены соответствующие векторы экспрессии на основе этих последовательностей для получения человеческих антител. Эти способы уже хорошо известны, и можно обратиться к источникам WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388.
Что касается способов получения генов, кодирующих антитела из гибридом, в основном могут применяться известные технологии, которые включают использование необходимых антигенов или клеток, экспрессирующих необходимые антигены в качестве сенсибилизирующих антигенов, их использование для иммунизации в соответствии с традиционными способами иммунизации, слияние полученных таким образом иммунных клеток с известными родительскими клетками обычными способами слияния клеток, отбор вырабатывающих моноклональное антитело клеток (гибридом) обычными способами отбора, синтез кДНК вариабельных областей антитела (V-областей) из мРНК полученных гибридом с применением обратной транскриптазы и их соединение с ДНК, кодирующими необходимые константные области антитела.
Сенсибилизирующие антигены для получения вышеупомянутых генов антител, кодирующих H-цепь и L-цепь, не ограничиваются конкретными описанными ниже примерами, а включают как полные антигены, обладающие иммуногенностью, так и неполные антигены, включая гаптены и т.п., которые не демонстрируют иммуногенности. Особых ограничений относительно антигена для антител согласно настоящему изобретению не существует, и могут использоваться, например, белок полной длины или частичный пептид белка-мишени, а также вещества, состоящие из полисахаридов, нуклеиновых кислот, липидов и т.п., которые наверняка могут служить в качестве антигена. Антигены могут быть получены в соответствии со способами, известными специалистам в данной области, такими, как способы с использованием бакуловирусов (таких, как описанные в документе WO 98/46777). Гибридомы могут быть получены, например, согласно способам, описанным в публикации Milstein et al. (G. Kohler and C. Milstein, Methods Enzymol. 1981, 73: 3-46) и т.п.При низкой иммуногенности антигена он может связываться с макромолекулой, обладающей иммуногенностью, такой, как альбумин, а затем применяться для иммунизации. Кроме того, благодаря связыванию антигенов с другими молекулами в случае необходимости, они могут быть преобразованы в растворимые антигены. При применении трансмембранных молекул, таких, как рецепторы, в качестве антигенов части внеклеточных участков рецепторов могут использоваться как фрагмент, или клетки, экспрессирующие трансмембранные молекулы на их поверхности, могут использоваться как иммуногены.
Вырабатывающие антитело клетки могут быть получены путем иммунизации животных с применением соответствующих сенсибилизирующих антигенов, описанных выше. В альтернативном варианте вырабатывающие антитело клетки могут быть получены путем in vitro иммунизации лимфоцитов, которые могут вырабатывать антитела. Различные животные могут использоваться в качестве животных для иммунизации, причем обычно используют грызунов, зайцеобразных и приматов. Конкретными примерами таких животных являются мыши, крысы и хомяки как грызуны, кролики как зайцеобразные и обезьяны, включая яванского макака, макака-резуса, гамадрила и шимпанзе, как приматы.
Также известны трансгенные животные, имеющие наборы генов человеческого, и человеческие антитела могут быть получены путем использования этих животных (см. документ WO 96/34096; Mendez et al, Nat. Genet. 1997, 15: 146-56). Вместо использования таких трансгенных животных, например, могут быть получены необходимые человеческие антитела, обладающие активностью связывания против антигенов путем in vitro сенсибилизации человеческих лимфоцитов с нужными антигенами или клеток, экспрессирующих нужные антигены, с последующим слиянием сенсибилизированных лимфоцитов с клетками миеломы человека, например, U266 (см. публикацию японской патентной заявки Kokoku (JP-B) H1-59878 (рассмотренная, утвержденная японская патентная заявка, опубликованная для противопоставления)). Кроме того, нужные человеческие антитела могут быть получены путем иммунизации трансгенных животных, имеющих полный набор генов человеческого антитела с нужными антигенами (см. документы WO 93/12227, WO 92/03918, WO 94/02602, WO 96/34096 и WO 96/33735).
Иммунизацию животных осуществляют путем соответствующего разведения и суспендирования сенсибилизирующего антигена в фосфатно-буферном растворе (PBS), физиологическом растворе и т.п., с образованием эмульсии путем смешивания адъюванта в случае необходимости и ее внутрибрюшинной или подкожной инъекции животным. После этого сенсибилизирующий антиген, смешанный с неполным адъювантом Фрейнда, в предпочтительном варианте вводят несколько раз каждые 4-21 день. Выработка антитела может подтверждаться путем измерения титра антитела-мишени в сыворотке животных с применением традиционных способов.
Вырабатывающие антитело клетки, полученные из лимфоцитов или животных, иммунизированных необходимым антигеном, могут сливаться с клетками миеломы для образования гибридом с применением традиционных факторов, вызывающих слияние (например, полиэтиленгликоля) (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986, 59-103). Затем в случае необходимости клетки гибридомы культивируют и выращивают и измеряют специфичность связывания, аффинность или активность антитела, выработанного из этих гибридом, применяя известные способы анализа, такие, как иммунопреципитация, радиоиммуноанализ (RIA) и твердофазный иммуносорбентный анализ (ELISA). Затем гибридомы, вырабатывающие нужные антитела, специфичность связывания, аффинность или активность которых была определена, могут быть субклонированы такими способами, как предельное разведение.
Затем гены, кодирующие нужные антитела, могут быть клонированы из гибридом или вырабатывающих антитело клеток (сенсибилизированных лимфоцитов и т.п) с применением зондов, которые могут специфично связываться с антителами (например, олигонуклеотидов, комплементарными последовательностям, кодирующим константные области антитела). Также возможно клонирование из мРНК с применением RT-PCR. Иммуноглобулины разделяют на пять разных классов, IgA, IgD, IgE, IgG и IgM. Эти классы далее разделяются на несколько подклассов (изотипов) (например, IgG-1, IgG-2, IgG-3 и IgG-4; IgA-1 и IgA-2; и т.п.). H-цепи и L-цепи, используемые согласно настоящему изобретению для выработки антител, не имеют особых ограничений и могут быть взяты из антител, относящихся к этим классам или подклассам; однако особенное предпочтение отдается IgG.
Также существует возможность модификации кодирующих H-цепь генов и кодирующих L-цепь генов с применением технологий генной инженерии. Генетически модифицированные антитела, такие, как химерные антитела и гуманизированные антитела, которые были искусственно модифицированы с целью снижения гетерологичной антигенности, и антитела против человека, могут быть соответствующим образом получены для таких антител, как антитела мыши, антитела крысы, антитела кролика, антитела хомяка, антитела овцы и антитела верблюда.
Химерными антителами являются антитела, состоящие из вариабельных областей H-цепи и L-цепи антитела отличного от человека млекопитающего, например, принадлежащих антителу мыши, и константных областей H-цепи и L-цепи человеческого антитела. Они могут быть получены путем сшивания ДНК, кодирующей вариабельную область антитела мыши, с ДНК, кодирующей константную область человеческого антитела, включения их в вектор экспрессии и включения вектора в клетку-хозяин для выработки антитела. Гуманизированное антитело также называется реконструированным человеческим антителом. Это гуманизированное антитело может быть синтезировано путем PCR из многих олигонуклеотидов, имеющих перекрывающиеся части на концах последовательностей ДНК, построенных для соединения гипервариабельных участков (CDR) антитела отличного от человека животного (такого, как мышь). Полученная ДНК может быть сшита с ДНК, кодирующей константную область человеческого антитела. Сшитая ДНК может быть включена в вектор экспрессии, и вектор может быть включен в клетку-хозяин для выработки антитела (см. EP 239400 и WO 96/02576). FR антител человека, которые сшиваются через CDR, выбирают в случаях, когда CDR образуют подходящий антигенсвязывающий центр. В случае необходимости аминокислоты в каркасном участке вариабельной области антитела могут быть замещены таким образом, чтобы CDR реконструированного человеческого антитела образовывали соответствующий антигенсвязывающий центр (K. Sato et al., Cancer Res. 1993, 53: 851-856).
Помимо описанных выше способов гуманизации, антитела могут быть модифицированы для улучшения их биологических свойств, например, антигенной аффинности. Такие модификации могут осуществляться с применением таких способов, как сайт-специфический мутагенез (см., например, Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488), ПЦР-мутагенез и кассетный мутагенез. В целом мутантные антитела, биологические свойства которых были улучшены, демонстрируют гомологию и/или подобие аминокислотной последовательности 70% или выше, более предпочтительно 80% или выше, еще более предпочтительно - 90% или выше (например, 95% или выше, 97%, 98%, 99% и т.д.) по сравнению с аминокислотной последовательностью вариабельной области первоначального антитела. В контексте данного описания гомология и/или подобие последовательности определяется как соотношение аминокислотных остатков, которые являются гомологичными (одинаковые остатки) или подобными (аминокислотные остатки, относящиеся к одной группе на основе общих свойств аминокислотных боковых цепей) остаткам первоначального антитела, после максимального увеличения значения гомологии последовательности путем выравнивания последовательности и включения гэпа в случае необходимости. Как правило, природные аминокислотные остатки разделяются на группы на основе характеристик их боковых цепей:
(1) гидрофобные: аланин, изолейцин, норлейцин, валин, метионин и лейцин;
(2) нейтральные гидрофильные: аспарагин, глутамин, цистеин, треонин и серии;
(3) кислотные: аспарагиновая кислота и глутаминовая кислота;
(4) основные: аргинин, гистидин и лизин;
(5) остатки, влияющие на ориентацию цепи: глицин и пролин; и
(6) ароматические: тирозин, триптофан и фенилаланин.
Как правило, антигенсвязывающий центр антитела образуется путем взаимодействия всех шести гипервариабельных участков (участков определения комплементарности; CDR), присутствующих в вариабельных областях H-цепи и L-цепи. Известно, что даже одна из этих вариабельных областей способна распознавать и связывать антиген, хотя аффинность ниже, чем показатель вариабельных областей, содержащих все места связывания. Таким образом, в отношении генов антител согласно настоящему изобретению, кодирующих H-цепи и L-цепи, полипептиды, кодируемые этими генами, требуются только для поддержания способности к связыванию с нужным антигеном и для кодирования части фрагмента, содержащей соответствующие антигенсвязывающие центры H-цепи и L-цепи.
Более подробное объяснение представлено ниже на примере биспецифического антитела IgG-типа, имеющего два типа константных областей тяжелой цепи CHI (CH1-А и CH1-В) и два типа константных областей легкой цепи (CL-A и CL-B); однако настоящее изобретение подобным образом также может применяться к другим антителам.
В случае необходимости в получении биспецифического антитела, которое должно распознавать один эпитоп первой CH1-A и первой CL-A, а другой эпитоп - второй CH1-В и второй CL-B, теоретически существует возможность выработки 10 типов молекул антитела, когда каждый из четырех типов цепей экспрессируется для образования этого антитела.
В этом случае молекулы необходимых антител в предпочтительном варианте могут быть получены, если, например, ассоциация регулируется таким образом, чтобы подавлялась ассоциация CH1-A и CL-B и/или между CH1-B и CL-A.
Примером может быть модификация аминокислотных остатков, образующих границу между CH1-A и CL-B, до положительно заряженных аминокислотных остатков и модификация аминокислотных остатков, образующих границу между CH1-B и CL-A до отрицательно заряженных аминокислотных остатков. В результате этих модификаций непреднамеренная ассоциация между CH1-A и CL-B подавляется, поскольку аминокислотные остатки, образующие границу, оба являются положительно заряженными, и ассоциация между CH1-B и CL-A также подавляется, поскольку аминокислотные остатки, образующие границу оба являются отрицательно заряженными. Таким образом, непреднамеренная ассоциация между CH1-A и CL-B и ассоциация между CH1-B и CL-A подавляются, поскольку аминокислотные остатки, образующие границы, обладают одноименными зарядами. В результате могут быть эффективно получены антитела, имеющие преднамеренную ассоциацию между CH1-A и CL-A и преднамеренную ассоциацию между CH1-В и CL-B. Кроме того, преднамеренная ассоциация между CH1-A и CL-A активизируется, поскольку аминокислотные остатки, образующие границу, обладают разными зарядами; и преднамеренная ассоциация между CH1-B и CL-B также активизируется, поскольку аминокислотные остатки, образующие границу, обладают разными зарядами. Таким образом, могут быть эффективно получены антитела с преднамеренной ассоциацией.
Другим примером может быть модификация аминокислотных остатков, образующих границу между CH1-A и CL-B, до положительно заряженных аминокислотных остатков, при которой аминокислотные остатки, образующие границу между CL-A и CH1-B, являются взаимно незаряженными или неполярными аминокислотами. В результате этой модификации непреднамеренная ассоциация между CH1-A и CL-B подавляется, поскольку аминокислотные остатки, образующие границу оба являются положительно заряженными. С другой стороны, поскольку аминокислотные остатки, образующие границу, являются аминокислотами, которые электрически взаимно не отталкиваются, преднамеренная ассоциация между CH1-A и CL-A и преднамеренная ассоциация между CH1-B и CL-B происходят легче, чем в случае, когда аминокислоты электрически отталкиваются. Таким образом, могут быть эффективно получены антитела, имеющие преднамеренную ассоциацию между CH1-A и CL-A и преднамеренную ассоциацию между CH1-B и CL-B. В то же время, в этом примере в случае, когда аминокислотные остатки, образующие границу между CL-A и CH1-B, не являются взаимно незаряженными или неполярными аминокислотами, они могут быть модифицированы таким образом, чтобы стать взаимно незаряженными или неполярными аминокислотами.
В другом примере, когда аминокислотные остатки, образующие границу между CL-B и CH1-B, являются взаимно незаряженными или неполярными аминокислотами, один из аминокислотных остатков, образующих границу между CH1-A и CL-A, модифицируется до положительно заряженного аминокислотного остатка, а другой модифицируется до отрицательно заряженного аминокислотного остатка. В результате этой модификации, хотя преднамеренная ассоциация между CH1-A и CL-A активизируется, поскольку аминокислотные остатки, образующие границу, представляют собой комбинацию положительного заряда и отрицательного заряда, преднамеренная ассоциация между CH1-B и CL-B не подавляется, поскольку аминокислотные остатки, образующие границу, являются аминокислотами, которые электрически взаимно не отталкиваются. В результате можно эффективно получить антитело, имеющее преднамеренную ассоциацию между CH1-A и CL-A и преднамеренную ассоциацию между CH1-B и CL-B. В то же время, в этом примере в случае, когда аминокислотные остатки, образующие границу между CL-B и CH1-B, не являются взаимно незаряженными или неполярными аминокислотами, они могут быть модифицированы таким образом, чтобы стать взаимно незаряженными или неполярными аминокислотами.
Кроме того, в другом примере, когда аминокислотные остатки, образующие границу между CL-B и CH1-B, являются незаряженными или неполярными аминокислотами в CH1-B, один из аминокислотных остатков, образующих границу между CH1-A и CL-A, модифицируется до положительно заряженного аминокислотного остатка, а другой модифицируется до отрицательно заряженного аминокислотного остатка; и аминокислотные остатки, образующие границу между CL-B и CH1-B в CL-B модифицируются таким образом, чтобы обладать одноименным зарядом с модификацией, осуществленной в CH1-A. В результате этой модификации, хотя преднамеренная ассоциация между CH1-A и CL-A активизируется, поскольку аминокислотные остатки, образующие границу, представляют собой комбинацию положительного заряда и отрицательного заряда, преднамеренная ассоциация между CH1-B и CL-B не подавляется, поскольку аминокислотные остатки, образующие границу, являются аминокислотами, которые электрически взаимно не отталкиваются. В результате можно эффективно получить антитело, имеющее преднамеренную ассоциацию между CH1-А и CL-A и преднамеренную ассоциацию между CH1-В и CL-B. В то же время, в этом примере в случае, когда аминокислотные остатки, образующие границу между CL-B и CH1-B, не являются незаряженными или неполярными аминокислотами в CH1-B, они могут быть модифицированы таким образом, чтобы стать незаряженными или неполярными аминокислотами.
Кроме того, применение регулирования ассоциации согласно настоящему изобретению позволяет подавлять ассоциацию между CH1s (CHI-A и CH1-B) или ассоциацию между CL (CL-A и CL-B).
Специалисты в данной области смогут соответствующим образом определить типы аминокислотных остатков, которые приближаются вплотную во время ассоциации на границе CH1 и CL в нужном полипептиде, для которого требуется регулирование ассоциации согласно настоящему изобретению.
Кроме того, специалисты в данной области также могут соответствующим образом получить последовательности, которые могут использоваться как CH1 или CL антитела в организме, например, человека, обезьяны, мыши, кролика и т.п.путем использования открытых баз данных и т.п.Более конкретно, информация об аминокислотной последовательности CH1 или CL может быть получена способами, описанными ниже в Примерах.
Например, в отношении биспецифических антител, описанных ниже в Примерах, конкретные примеры аминокислотных остатков, приближающихся вплотную (находящихся напротив друг друга или контактирующих) на границе CH1 и CL после ассоциации, включают показанные ниже комбинации:
- лизин (K) в позиции 147, как указывается согласно нумерации EC в CH1 (например, позиция 147 в аминокислотной последовательности SEQ ID NO: 1) и находящийся напротив (контактирующий) треонин (T) в позиции 180, как указывается согласно нумерации EC в CL;
- лизин (K) в позиции 147, как указывается согласно нумерации EC в CH1 и находящийся напротив (контактирующий) серии (S) в позиции 131, как указывается согласно нумерации EC в CL;
- глутамин (Q) в позиции 175, как указывается согласно нумерации EC в CH1 и находящийся напротив (контактирующий) глутамин (Q) в позиции 160, как указывается согласно нумерации EC в CL; и
- лизин (K) в позиции 213, как указывается согласно нумерации EC в CH1 и находящийся напротив (контактирующий) глутаминовая кислота (E) в позиции 123, как указывается согласно нумерации EC в CL.
Номера, указываемые в нумерации EC согласно настоящему изобретению указываются в соответствии с нумерацией EC (последовательности белков, имеющих иммунологическое значение, Публикация NIH №91-3242). В контексте настоящего изобретения фразы "аминокислотный остаток в позиции X, как указывается согласно нумерации EC" и "аминокислота в позиции X, как указывается согласно нумерации EC" (где X означает произвольное число) также могут рассматриваться как "аминокислотный остаток, соответствующий позиции X, как указывается согласно нумерации EC" и "аминокислота, соответствующая позиции X, как указывается согласно нумерации EC".
Как указывается в описываемых ниже Примерах, необходимые антитела могут быть в предпочтительном варианте получены путем модификации этих аминокислотных остатков и осуществления способов согласно настоящему изобретению.
Соответственно, настоящее изобретение обеспечивает антитело, в котором ассоциация тяжелой цепи и легкой цепи является регулируемой, причем один, два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), в тяжелой цепи и легкой цепи антитела, являются аминокислотными остатками, которые электрически взаимно отталкиваются:
(a) аминокислотный остаток, содержащийся в константной области тяжелой цепи (CH1) в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в константной области легкой цепи (CL) в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 160, как указывается согласно нумерации EC.
В другом варианте осуществления настоящее изобретение также обеспечивает антитело, в котором аминокислотные остатки в указанном ниже наборе аминокислотных остатков (d) являются аминокислотными остатками, которые электрически взаимно отталкиваются:
(d) аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC.
В вышеупомянутом антителе "аминокислотные остатки, которые электрически взаимно отталкиваются" или "аминокислотные остатки обладающими одноименными зарядами" предпочтительно являются выбранными из аминокислотных остатков, содержащихся, например, в любом из указанных ниже наборов (X) или (Y):
(X) глутаминовая кислота (E) или аспарагиновая кислота (D); или
(Y) лизин (K), аргинин (R), или гистидин (Н).
В вышеупомянутом антителе конкретные примеры аминокислотных остатков, которые электрически взаимно отталкиваются, включают следующие аминокислотные остатки:
- аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, является лизином (K), и аминокислотные остатки, содержащиеся в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, все являются глутаминовой кислотой (E); и,
- аминокислотные остатки, содержащиеся в CH1 в позиции 147 и позиции 175, как указывается согласно нумерации EC, являются глутаминовой кислотой (E), и аминокислотные остатки, содержащиеся в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, все являются лизином (K).
В вышеупомянутом антителе примеры аминокислотных остатков, которые электрически не отталкиваются, также включают пример, в котором аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, является глутаминовой кислотой (E), и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC, является лизином (K).
Кроме того, способы получения вышеупомянутого антитела и соответствующие настоящему изобретению способы регулирования ассоциации путем модификации аминокислотных остатков в наборах вышеупомянутых аминокислотных остатков с (a) по (d) до аминокислотных остатков, которые электрически взаимно отталкиваются, также являются предпочтительными вариантами осуществления настоящего изобретения.
Кроме того, настоящее изобретение обеспечивает антитело, в котором ассоциация тяжелой цепи и легкой цепи является регулируемой, причем один, два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), в ассоциации тяжелой цепи и легкой цепи антитела представляют собой аминокислотные остатки, которые электрически взаимно не отталкиваются:
(a) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 160, как указывается согласно нумерации EC.
В другом варианте осуществления настоящее изобретение также обеспечивает антитело, в котором аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в п. (d), представляют собой аминокислотные остатки, которые электрически взаимно не отталкиваются:
(d) аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC.
Как указывается в Примерах, описанных ниже на Фиг. 1, каждый из аминокислотных остатков вышеупомянутых комбинаций приближается вплотную при ассоциации. Специалисты в данной области смогут определить места, соответствующие аминокислотным остаткам, описанным в вышеупомянутых пп. с (a) по (d), для необходимых CH1 или CL путем гомологичного моделирования и т.п.с применением доступного на рынке программного обеспечения и для соответствующей модификации аминокислотных остатков в этих местах.
В вышеупомянутом антителе "аминокислотные остатки, которые электрически взаимно не отталкиваются" в предпочтительном варианте являются выбранными, например, из каждого из двух наборов, выбранных из группы, к которой относятся пп. с (X) по (Z), указанные ниже, и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z) и (Z) и (Z):
(X) глутаминовая кислота (E) или аспарагиновая кислота (D);
(Y) лизин (K), аргинин (R) или гистидин (H);
(Z) аланин (A), аспарагин (N), цистеин (C), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), пролин (P), серии (S), треонин (T), триптофан (W), тирозин (Y) или валин (V).
Пример включает выбор (X) и (Y) из группы, включающей пп. с (X) по (Z), выбор глутаминовой кислоты из (X) и выбор лизина (K) из (Y); и модификацию аминокислотного остатка, содержащегося в CH1 в позиции 147, как указывается согласно нумерации EC, до глутаминовой кислоты (E) и модификацию аминокислотного остатка, содержащегося в CL в позиции 180, как указывается согласно нумерации EC, до лизина (K). В этом случае существует потребность в модификации аминокислотного остатка, содержащегося в CH1 в позиции 147, как указывается согласно нумерации EC, если аминокислотным остатком является глутаминовая кислота (E) до модификации.
В вышеупомянутом антителе конкретные примеры аминокислотных остатков, которые электрически взаимно не отталкиваются, включают аминокислотные остатки, указанные ниже:
- аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, является лизином (K), и аминокислотные остатки, содержащиеся в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, все являются глутаминовая кислота (E); и
- аминокислотные остатки, содержащиеся в CH1 в позиции 147 и позиции 175, как указывается согласно нумерации EC, являются глутаминовой кислотой (E), и аминокислотные остатки, содержащиеся в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, все являются лизином (K).
В вышеупомянутом антителе, примеры аминокислотных остатков, которые электрически не отталкиваются, также включают пример, в котором аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, является глутаминовой кислотой (E), и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC, является лизином (K).
Кроме того, способы получения вышеупомянутого антитела и соответствующие настоящему изобретению способы регулирования ассоциации путем модификации аминокислотных остатков в вышеупомянутых наборах аминокислотных остатков в пп. с (a) по (d) до аминокислотных остатков, которые электрически взаимно не отталкиваются, также являются предпочтительными вариантами осуществления настоящего изобретения.
Технология включения электрического отталкивания в границу второй константной области тяжелой цепи (CH2) или третьей константной области тяжелой цепи (CH3) для подавления нежелательной ассоциации между тяжелыми цепями, технология включения электрического отталкивания в границу вариабельной области тяжелой цепи и вариабельной области легкой цепи для подавления непреднамеренной ассоциации между тяжелой цепью и легкой цепью или технология модификации аминокислотных остатков, образующих гидрофобное ядро, присутствующее на границе вариабельной области тяжелой цепи и вариабельной области легкой цепи до полярных аминокислот, обладающих электрическим зарядом, для подавления непреднамеренной ассоциации между тяжелой цепью и легкой цепью также могут применяться к антителу согласно настоящему изобретению (см. документ WO 2006/106905).
Согласно технологии подавления непреднамеренной ассоциации между тяжелыми цепями путем включения электрического отталкивания на границе CH2 или CH3, примерами аминокислотных остатков, контактирующих на границе других константных областей тяжелой цепи, могут быть участки, соответствующие позиции 377 (позиция 356) и позиции 470 (позиция 439), позиции 378 (позиция 357) и позиции 393 (позиция 370), а также позиции 427 (позиция 399) и позиции 440 (позиция 409) в CH3-области. Нумерацию константных областей антитела можно найти в публикации Kabat et al. (Kabat, E.A., et al., 1991, Sequences of Proteins of Immunological Interest, NIH); а для нумерации константных областей тяжелой цепи номера согласно EC представлены в круглых скобках.
Технология модификации аминокислотного остатка в позиции 435, как указывается согласно нумерации EC, который является центром, касающимся связывания между IgG и Протеином A, до аминокислоты, обладающей другой силой связывания в отношении Протеина A, такой, как Arg, также может применяться к антителу согласно настоящему изобретению в комбинации с вышеупомянутыми технологиями. Путем применения этой технологии взаимодействие между H-цепью и Протеином A может быть изменено, и только гетеродимерные антитела могут быть эффективно очищены с использованием колонки с Протеином A. Эта технология также может применяться независимо без сочетания с вышеупомянутыми технологиями.
Более конкретно, например, в антителе, содержащем два типа CH3 областей тяжелой цепи, от одного до трех наборов аминокислотных остатков в CH3 области первой тяжелой цепи, которые выбирают из наборов аминокислотных остатков по указанным ниже пп. с (1) по (3), могут быть преобразованы таким образом, чтобы они электрически взаимно отталкивались:
(1) аминокислотные остатки, содержащиеся в CH3 области тяжелой цепи в позиции 356 и позиции 439, как указывается согласно нумерации EC;
(2) аминокислотные остатки, содержащиеся в CH3 области тяжелой цепи в позиции 357 и позиции 370, как указывается согласно нумерации EC; и
(3) аминокислотные остатки, содержащиеся в CH3 области тяжелой цепи в позиции 399 и позиции 409, как указывается согласно нумерации EC.
Кроме того, антитело может быть антителом, имеющим набор аминокислотных остатков во второй CH3 области тяжелой цепи, отличной от вышеупомянутой первой CH3 области тяжелой цепи, причем набор аминокислотных остатков выбран из наборов аминокислотных остатков, показанных выше в пп. с (1) по (3), и от одного до трех наборов аминокислотных остатков, соответствующих наборам аминокислотных остатков, показанным выше в пп. с (1) по (3), которые электрически взаимно отталкиваются в первой CH3 области тяжелой цепи, электрически не отталкиваются от соответствующих аминокислотных остатков в первой CH3 области тяжелой цепи.
Аминокислотные остатки, описанные выше в пп. с (1) по (3) приближаются друг к другу после ассоциации. Специалисты в данной области смогут определить места, соответствующие аминокислотным остаткам, описанных выше в пп. с (1) по (3) для нужной CH3 области тяжелой цепи или константной области тяжелой цепи, путем гомологичного моделирования и т.п. с применением доступного на рынке программного обеспечения и для соответствующей модификации аминокислотных остатков в этих местах.
В вышеупомянутом антителе "электрически отталкивающиеся" или "обладающие одноименным зарядом" означает, что, например, любые два или более аминокислотных остатков имеют аминокислотные остатки, содержащиеся в любой одной из вышеупомянутых групп (X) и (Y). С другой стороны, "электрически не отталкивающиеся" означает, что, например, антитело имеет аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся (X) и (Y), упомянутые выше и (Z) ниже, причем два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z), а также (Z) и (Z):
(Z) аланин (A), аспарагин (N), цистеин (C), глутамин (Q), глицин (G), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), пролин (P), серии (S), треонин (T), триптофан (W), тирозин (Y) или валин (V).
В предпочтительном варианте осуществления вышеупомянутого антитела первая CH3 область тяжелой цепи и вторая CH3 область тяжелой цепи могут быть сшиты дисульфидными связями.
Согласно настоящему изобретению, аминокислотный остаток, подлежащий "модификации" не ограничивается аминокислотным остатком вариабельной области антитела или константной области антитела, упомянутыми выше. Специалисты в данной области смогут определить аминокислотные остатки, образующие границу в варианте полипептида или гетеромерном мультимере путем гомологичного моделирования и т.п. с применением доступного на рынке программного обеспечения, и модифицировать аминокислотные остатки в этих местах с целью регулирования ассоциации. Гомологичное моделирование представляет собой технологию прогнозирования трехмерной структуры белка с применением доступного на рынке программного обеспечения. При построении структуры белка с неизвестной трехмерной структурой, в первую очередь ищут белок, определяемый как имеющий высокогомологичную трехмерную структуру с белком. Затем, используя эту трехмерную структуру в качестве шаблона строят структуру белка с неизвестной структурой, и структуру также оптимизируют с применением способов молекулярной динамики и т.п. для прогнозирования трехмерной структуры неизвестного белка.
Согласно технологии включения электрического отталкивания в границу вариабельной области тяжелой цепи и вариабельной области легкой цепи для подавления нежелательной ассоциации тяжелой цепи и легкой цепи, примеры аминокислотных остатков, которые контактируют на границе вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), включают глутамин (Q) в позиции 39 согласно нумерации Kabat в вариабельной области тяжелой цепи (FR2 область) и находящийся напротив (контактирующий) глутамин (Q) в позиции 38 согласно нумерации Kabat в вариабельной области легкой цепи (FR2 область). Кроме того, предпочтительным примером является лейцин (L) в позиции 45 согласно нумерации Kabat в вариабельной области тяжелой цепи (FR2) и находящийся напротив пролин (Р) в позиции 44 согласно нумерации Kabat в вариабельной области легкой цепи (FR2). Для нумерации этих центров обращались к публикации Kabat, et al. (Kabat, E.A., et al., 1991, Sequence of Proteins of Immunological Interest, NIH).
Поскольку известно, что эти аминокислотные остатки являются высококонсервативными в организмах человека и мыши (J. Mol. Recognit. 2003; 16: 113-120), ассоциация вариабельных областей антитела может регулироваться для VH-VL ассоциации антител, отличных от указываемых в Примерах, путем модификации аминокислотных остатков, соответствующих вышеупомянутым аминокислотным остаткам.
Конкретным примером является антитело, в котором два или более аминокислотных остатков, образующих границу вариабельной области тяжелой цепи и вариабельной области легкой цепи, являются аминокислотными остатками, которые электрически взаимно отталкиваются.
Более конкретно, примеры включают антитело с одним набором или двумя наборами аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. (a) или (b):
(a) аминокислотный остаток, содержащийся в вариабельной области тяжелой цепи (1) в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, содержащийся в легкой цепи (2) в позиции 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, содержащийся в вариабельной области тяжелой цепи (3) в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, содержащийся в вариабельной области легкой цепи (4) в позиции 44 согласно нумерации Kabat.
Аминокислотные остатки, описанные в вышеупомянутых пп. (a) или (b), приближаются друг к другу при ассоциации. Специалисты в данной области смогут определить места, соответствующие аминокислотным остаткам, описанным в вышеупомянутых пп. (a) или (b) в нужной вариабельной области тяжелой цепи или вариабельной области легкой цепи, путем гомологичного моделирования и т.п. с применением доступного на рынке программного обеспечения, и для соответствующей модификации аминокислотных остатков в этих местах.
В вышеупомянутом антителе "аминокислотные остатки, которые электрически взаимно отталкиваются" предпочтительно являются выбранными из аминокислотных остатков, содержащихся, например, в любом из указанных ниже наборов (X) и (Y):
(X) глутаминовая кислота (E) или аспарагиновая кислота (D); или
(Y) лизин (K), аргинин (R), или гистидин (H).
Кроме того, другой вариант осуществления антитела согласно настоящему изобретению представляет собой, например, антитело, в котором два или более аминокислотных остатков, образующие границу вариабельной области тяжелой цепи и вариабельной области легкой цепи, являются аминокислотными остатками, которые электрически не отталкиваются друг от друга. В частности, примером такого антитела может быть антитело, имеющее один набор или два набора аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных в вышеупомянутых пп. (a) и (b).
Соответствующие аминокислотные остатки, описанные в вышеупомянутых пп. (a) или (b), приближаются друг к другу при ассоциации. Специалисты в данной области смогут определить места, соответствующие аминокислотным остаткам, описанным в вышеупомянутых пп. (a) или (b), для нужной вариабельной области тяжелой цепи или вариабельной области легкой цепи путем гомологичного моделирования и т.п. с применением доступного на рынке программного обеспечения, и для соответствующего подвергания аминокислотных остатков в этих местах модификации.
В вышеупомянутом антителе "аминокислотные остатки, которые электрически взаимно не отталкиваются" означают, например, аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся вышеупомянутые пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z), а также (Z) и (Z).
Как правило, аминокислотными остатками, описанными в вышеупомянутых пп. (a) или (b), в организмах человека и мыши являются:
(1) глутамин (Q),
(2) глутамин (Q),
(3) лейцин (L) и
(4) пролин (P).
Таким образом, в предпочтительном варианте осуществления настоящего изобретения эти аминокислотные остатки подвергаются модификации (например, замещению аминокислотами, обладающими электрическим зарядом). Кроме того, типы аминокислотных остатков вышеупомянутых пп. (a) или (b) не обязательно ограничиваются вышеупомянутыми аминокислотными остатками, а могут быть также другими аминокислотами, равноценными этим аминокислотам. Например, аминокислота в позиции 38 согласно нумерации Kabat в вариабельной области легкой цепи может быть, например, гистидином (H), если речь идет об организме человека.
Согласно технологии модификации аминокислотных остатков, образующих гидрофобное ядро, присутствующее на границе вариабельной области тяжелой цепи, и вариабельной области легкой цепи до полярных аминокислот, обладающих электрическим зарядом, для подавления непреднамеренной ассоциации тяжелой цепи и легкой цепи предпочтительные примеры аминокислотных остатков, способных образовывать гидрофобное ядро на границе вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), включают лейцин (L) в позиции 45 согласно нумерации Kabat в вариабельной области тяжелой цепи (FR2) и находящийся напротив пролин (P) в позиции 44 согласно нумерации Kabat в вариабельной области легкой цепи (FR2). Для нумерации этих центров обращались к публикации Kabat, et al. (Kabat, E.A., et al., 1991, Sequence of Proteins of Immunological Interest, NIH).
Как правило, термин "гидрофобное ядро" относится к части, образуемой путем сборки боковых цепей гидрофобной аминокислоты внутри ассоциированных полипептидов. Примеры гидрофобных аминокислот включают аланин, изолейцин, лейцин, метионин, фенилаланин, пролин, триптофан и валин. Кроме того, аминокислотные остатки, отличные от гидрофобных аминокислот (например, тирозина) могут принимать участие в образовании гидрофобного ядра. Это гидрофобное ядро вместе с гидрофильной поверхностью, на которой боковые цепи гидрофильной аминокислоты являются открытыми наружу, становится движущей силой, содействующей ассоциации водорастворимых полипептидов. Если гидрофобные аминокислоты двух разных доменов присутствуют на молекулярной поверхности и открыты для воздействия молекул воды, энтропия возрастает, и возрастает свободная энергия. Соответственно, два домена ассоциируются друг с другом для снижения свободной энергии и приобретения устойчивости, и гидрофобные аминокислоты на границе маскируются внутри молекулы для образования гидрофобного ядра.
Считается, что при ассоциации полипептидов образование гидрофобного ядра подавляется модификацией гидрофобных аминокислот, образующих гидрофобное ядро, до полярных аминокислот, обладающих электрическим зарядом; следовательно, считается, что подавляется ассоциация полипептидов.
Специалисты в данной области смогут определить присутствие или отсутствие гидрофобного ядра, центр (участок) образования и т.п. путем анализа аминокислотных последовательностей для необходимого полипептида. То есть, антитело согласно настоящему изобретению представляет собой антитело, характеризующееся тем, что аминокислотные остатки, способные образовывать гидрофобное ядро на границе, модифицируются до аминокислотных остатков, обладающих электрическим зарядом. Более конкретно, примеры включают антитело, в котором аминокислотные остатки, показанные ниже в пп. (1) или (2), являются аминокислотными остатками, обладающими электрическим зарядом. Боковых цепей аминокислотных остатков, показанных ниже в пп. (1) и (2), являются смежными и могут образовывать гидрофобное ядро:
(1) аминокислотный остаток, содержащийся в вариабельной области тяжелой цепи в позиции 45 согласно нумерации Kabat; и
(2) аминокислотный остаток, содержащийся в вариабельной области легкой цепи в позиции 44 согласно нумерации Kabat.
Предпочтительные примеры аминокислотных остатков, обладающих электрическим зарядом в вышеупомянутом антителе, включают глутаминовую кислоту (E), аспарагиновую кислоту (D), лизин (K), аргинин (R) и гистидин (H). Более предпочтительные примеры включают глутаминовую кислоту (E) и лизин (K).
Как правило, аминокислотными остатками, описываемыми в вышеупомянутых пп. (1) и (2), в организмах человека и мыши являются следующие:
(1) лейцин (L) и
(2) пролин (P).
Таким образом, в предпочтительном варианте осуществления настоящего изобретения эти аминокислотные остатки подвергаются модификации (например, замещению аминокислотами, обладающими электрическим зарядом). Кроме того, типы вышеупомянутых аминокислотных остатков (1) и (2) не обязательно ограничиваются вышеупомянутыми аминокислотными остатками, а также могут быть другими аминокислотами, равноценными этим аминокислотным остаткам.
К антителам согласно настоящему изобретению могут применяться и другие известные технологии. Например, для содействия ассоциации первой VH (VH1) и первой VL (VL1) и/или второй VH (VH2) и второй VL (VL2) боковая цепь аминокислоты, присутствующая в вариабельной области одной из H-цепей, может быть замещена большей боковой цепью (выступом), а боковая цепь аминокислоты, присутствующая в противоположной вариабельной области другой H-цепи, может быть замещена меньшей боковой цепью (впадиной), таким образом, чтобы выступ мог находиться во впадине, и активизировалась ассоциация VH1 и VL1 и/или VH2 и VL2; следовательно, ассоциация VH1 и VL2 и/или VH2 и VL1 также может подавляться (документ WO 1996/027011; Ridgway, J.B., et al., Protein Engineering (1996) 9, 617-621; Merchant, A.M., et al., Nature Biotechnology (1998) 16, 677-681).
Например, в случае человеческого IgG1 для того, чтобы сделать боковую цепь аминокислоты в CH3-области одной H-цепи большей боковой цепью (выступом), осуществляют модификации Y349C и T366W, а для того, чтобы сделать боковую цепь аминокислоты в CH3-области другой H-цепи меньшей боковой цепью, осуществляют модификации D356C, T336S, L368A и Y407V.
К антителам согласно настоящему изобретению могут применяться и другие известные технологии. Антитело-мишень может быть эффективно получено путем комплементарной ассоциации CH3 с применением подвергнутого инженерии путем замены цепи домена CH3, в котором часть CH3 одной H-цепи антитела заменена на последовательность, взятую из IgA, соответствующего этой части, а комплементарная часть CH3 другой H-цепи включена с последовательностью, взятой из IgA, соответствующей этой части (Protein Engineering Design & Selection, 23: 195-202, 2010).
К антителам согласно настоящему изобретению могут применяться и другие известные технологии. При получении биспецифических антител биспецифическое антитело-мишень может быть получено, например, путем обеспечения разницы в изоэлектрической точке путем различной модификации аминокислот для каждой из вариабельных областей двух типов H-цепей и использования разницы в изоэлектрической точке для очищения путем ионообменной хроматографии (документ WO 2007/114325).
Модификации согласно настоящему изобретению могут применяться для таких антител, как указанное ниже, например, антитела, имеющего структуру, в которой для содействия ассоциации первой VH (VH1) и первой VL (VL1) и/или второй VH (VH2) и второй VL (VL2) VH1 соединяют с Fc областью через первую CH1 и VL1 соединяют с первой CL, и VH2 соединяют с другой Fc областью через вторую CL и VL2 соединяют со второй CH1 (документ WO 09/80254).
Могут применяться несколько, например, две или более из вышеупомянутых известных технологий в комбинации с антителом согласно настоящему изобретению. Кроме того, антитело согласно настоящему изобретению может быть получено на основе антитела, в отношении которого применялись модификации вышеупомянутых известных технологий.
Указанные ниже соответствующие настоящему изобретению способы регулирования ассоциации обеспечивают, например, возможность эффективной выработки активных антител или полипептидов. Примерами такой активности может быть активность связывания, нейтрализующая активность, цитотоксичная активность, агонистическая активность, антагонистическая активность, ферментная активность и т.п. Агонистическая активность означает активность, вызывающую определенный вид изменений в физиологической активности через связывание антитела с антигеном, таким, как рецептор, вызывающий трансдукцию сигнала и т.п. в клетках. Примерами физиологической активности, помимо прочих, могут быть рост, выживание, дифференциация, транскрипция, мембранный транспорт, активность связывания, протеолитическая активность, фосфорилирование/дефосфорилирование, окислительно-восстановительная активность, перенос, нуклеолитическая активность, дегидратация, вызывание гибели клеток и вызывание апоптоза и т.п.
Антитела или полипептиды, распознающие необходимые антигены или связывающиеся с нужными рецепторами, могут быть эффективно получены с применением способов согласно настоящему изобретению.
Антигены согласно настоящему изобретению не имеют особых ограничений, и может применяться любой тип антигена. Примерами антигенов, помимо прочих, могут быть рецепторы или их фрагменты, антигены рака, антигены МНС и антигены дифференциации и т.п.
Примерами рецепторов согласно настоящему изобретению могут быть рецепторы, относящиеся к семейству рецепторов гемопоэтического фактора, семейству рецепторов цитокина, семейству рецепторов тирозинкиназного типа, семейству рецепторов серии/треонинкиназного типа, семейству рецепторов TNF, G-белок-связанному семейству рецепторов, GPI-заякоренному семейству рецепторов, семейству рецепторов тирозинфосфатазного типа, семейству факторов адгезии, гормональному семейству рецепторов и т.п. Информацию о рецепторах, относящихся к этим семействам рецепторов и их характеристиках можно найти в различных задокументированных источниках, например, в публикациях Cooke BA., King RJB., van der Molen HJ. ed. New Comprehensive Biochemistry Vol. 18B "Hormones and their Actions Part II" pp. 1-46 (1988) Elsevier Science Publishers BV., New York, USA; Patthy L. (1990) Cell, 61: 13-14; Ullrich A., et al. (1990) Cell, 61: 203-212; Massagul J. (1992) Cell, 69: 1067-1070; Miyajima A., et al. (1992) Annu. Rev. Immunol., 10: 295-331; Taga T. and Kishimoto T. (1992) FASEB J., 7: 3387-3396; Fantl WI., et al. (1993) Annu. Rev. Biochem., 62: 453-481; Smith CA., et al. (1994) Cell, 76: 959-962; Flower DR. (1999) Biochim. Biophys. Acta, 1422: 207-234; Miyasaka M. ed. Cell Technology, Handbook Series "Handbook for adhesion factors" (1994) Shujunsha, Токио, Япония; и др. Примерами специфических рецепторов, относящихся к вышеупомянутым семействам рецепторов, могут быть рецептор эритропоэтин (EPO) человека или мыши, рецептор гранулоцитарного колониестимулирующего фактора (G-CSF) человека или мыши, рецептор тромбопоэтина (TPO) человека или мыши, рецептор инсулина человека или мыши, рецептор Flt-3-лиганда человека или мыши, рецептор тромбоцитарного фактора роста (PDGF) человека или мыши, рецептор интерферона (IFN)-α или -β человека или мыши, рецептор лептина человека или мыши, рецептор гормона роста (GH) человека или мыши, рецептор интерлейкина (IL)-10 человека или мыши, рецептор инсулиноподобного фактора роста (IGF)-I человека или мыши, рецептор ингибирующего лейкемию фактора (LIF) человека или мыши и рецептор цилиарного нейротрофического фактора (CNTF) человека или мыши (hEPOR: Simon, S. et al. (1990) Blood 76, 31-35; mEPOR: D’Andrea, AD. et al. (1989) Cell 57, 277-285; hG-CSFR: Fukunaga, R. et al. (1990) Proc. Natl. Acad. Sci. USA. 87, 8702-8706; mG-CSFR: Fukunaga, R. et al. (1990) Cell 61, 341-350; hTPOR: Vigon, I. et al. (1992) 89, 5640-5644.; mTPOR: Skoda, RC. et al. (1993) 12, 2645-2653; hInsR: Ullrich, A. et al. (1985) Nature 313, 756-761; hFlt-3: Small, D. et al. (1994) Proc. Natl. Acad. Sci. USA. 91, 459-463; hPDGFR: Gronwald, RGK. et al. (1988) Proc. Natl. Acad. Sci. USA. 85, 3435-3439; hIFN α/β R: Uze, G. et al. (1990) Cell 60, 225-234; и Novick, D. et al. (1994) Cell 77, 391-400).
Антигены рака представляют собой антигены, экспрессируемые вследствие злокачественной трансформации клеток, и также называются опухолеспецифическими антигенами. Кроме того, нарушенные сахарные цепи, появляющиеся на поверхности клеток или на молекулах белков при озлокачествлении клеток, также являются антигенами рака, и они также называются антигенами раковых сахарных цепей. Примерами антигенов рака являются ЕрСАМ, которая экспрессируется в разных раковых клетках, включая рак легких (Proc. Natl. Acad. Sci. USA (1989) 86 (1), 27-31) (ее полинуклеотидная последовательность указывается под инвентарным номером RefSeq NM_002354.2 (SEQ ID NO: 78), а ее полипептидная последовательность указывается под инвентарным номером RefSeq NP_002345.2 (SEQ ID NO: 79)), CA19-9, CA15-3, сиалил SSEA-1 (SLX) и т.п.
Антигены МНС могут быть разделены на два широких класса: антигены МНС I класса и антигены МНС II класса: антигены МНС I класса включают HLA-A, -B, -C, -E, -F, -G, и -Н; а антигены МНС II класса включают HLA-DR, -DQ и -DP.
К антигенам дифференциации относятся CD1, CD2, CD3, CD4, CD5, CD6, CD7, CD8, CD10, CD11a, CD11b, CD11c, CD13, CD14, CD15s, CD16, CD18, CD19, CD20, CD21, CD23, CD25, CD28, CD29, CD30, CD32, CD33, CD34, CD35, CD38, CD40, CD41a, CD41b, CD42a, CD42b, CD43, CD44, CD45, CD45RO, CD48, CD49a, CD49b, CD49c, CD49d, CD49e, CD49f, CD51, CD54, CD55, CD56, CD57, CD58, CD61, CD62E, CD62L, CD62P, CD64, CD69, CD71, CD73, CD95, CD102, CD106, CD122, CD126 и CDwl30.
Антитела согласно настоящему изобретению могут быть биспецифическими антителами; в этом случае два антигена (или эпитопа), распознаваемые этим антителом, могут быть произвольно выбраны из вышеупомянутых рецепторов или их фрагментов, антигенов рака, антигенов МНС, антигенов дифференциации и т.п. Например, два антигена могут быть выбраны из рецепторов или их фрагментов, два могут быть выбраны из антигенов рака, два могут быть выбраны из антигены МНС, или два могут быть выбраны из антигенов дифференциации. Кроме того, каждый антиген может быть выбран из двух антигенов, произвольно выбранных, например, из рецепторов или их фрагментов, антигенов рака, антигенов МНС и антигенов дифференциации.
Кроме того, настоящее изобретение обеспечивает способ получения антитела, в котором ассоциация тяжелой цепи и легкой цепи является регулируемой.
Предпочтительный вариант осуществления способа согласно настоящему изобретению представляет собой способ получения антитела, в котором ассоциация тяжелой цепи и легкой цепи является регулируемой, который включает:
(1) модификацию нуклеиновых кислот, кодирующих CH1 и CL, таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), становились аминокислотными остатками, которые электрически отталкиваются друг от друга:
(a) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 160, как указывается согласно нумерации EC,
(2) включение модифицированных нуклеиновых кислот в клетки-хозяева и культивирование таким образом, чтобы клетки-хозяева экспрессировали нуклеиновые кислоты, и
(3) сбор антитела из культуры клеток-хозяев.
Другой вариант осуществления способа получения согласно настоящему изобретению включает способ получения антитела, согласно которому этап (1) вышеупомянутого способа получения также включает модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки из набора аминокислотных остатков, показанных ниже в п. (d), становились аминокислотными остатками, которые электрически отталкиваются друг от друга:
(d) аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC.
Кроме того, настоящее изобретение касается способа получения, включающего на вышеупомянутом этапе (1) модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки, которые электрически отталкиваются друг от друга, были выбраны из аминокислотных остатков, содержащихся в любой из групп вышеупомянутых пп. (X) и (Y).
Кроме того, настоящее изобретение касается способа получения, включающего на вышеупомянутом этапе (1) модификацию нуклеиновых кислот таким образом, чтобы два или более аминокислотных остатков, образующих границу вариабельной области тяжелой цепи и вариабельной области легкой цепи, являлись аминокислотными остатками, которые электрически отталкиваются друг от друга. Предпочтительно аминокислотные остатки, которые электрически отталкиваются друг от друга, представляют собой любой набор аминокислотных остатков, выбранных из группы, состоящей из, например, наборов аминокислотных остатков, указанных ниже в пп. (a) и (b):
(a) аминокислотный остаток, содержащийся в вариабельной области тяжелой цепи в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, содержащийся в вариабельной области легкой цепи в позиции 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, содержащийся в вариабельной области тяжелой цепи в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, содержащийся в вариабельной области легкой цепи в позиции 44 согласно нумерации Kabat.
Вышеупомянутые аминокислотные остатки, которые электрически отталкиваются друг от друга, предпочтительно являются выбранными из аминокислотных остатков, содержащихся в любом наборе вышеупомянутых (X) и (Y).
Еще один предпочтительный вариант осуществления способа получения согласно настоящему изобретению включает а способ получения антитела, в котором ассоциация тяжелой цепи и легкой цепи является регулируемой, который включает:
(1) модификацию нуклеиновых кислот, кодирующих CH1 и CL, таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), становились аминокислотными остатками, которые электрически не отталкиваются друг от друга:
(a) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 160, как указывается согласно нумерации EC,
(2) включения модифицированных нуклеиновых кислот в клетки-хозяева и культивирование таким образом, чтобы клетки-хозяева экспрессировали нуклеиновые кислоты, и
(3) сбор антитела из культуры клеток-хозяев.
Другой вариант осуществления способа получения согласно настоящему изобретению включает способ получения, который кроме того включает на этапе (1) вышеупомянутого способа получения, модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки из набора аминокислотных остатков, показанных ниже в п. (d), становились аминокислотными остатками, которые электрически не отталкиваются друг от друга:
(d) аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC.
Кроме того, настоящее изобретение касается способа получения, включающего, на вышеупомянутом этапе (1) модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки, которые электрически не отталкиваются друг от друга, являлись аминокислотными остатками, выбранными из каждого из двух наборов, выбранных из группы, к которой относятся вышеупомянутые пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z), а также (Z) и (Z).
Кроме того, конкретные примеры аминокислотных остатков, которые электрически не отталкиваются друг от друга на вышеупомянутом этапе (1) настоящего изобретения, включают следующие аминокислотные остатки:
- аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, который является лизином (K); и аминокислотные остатки, содержащиеся в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, которые все являются глутаминовой кислотой (E); и
- аминокислотные остатки, содержащиеся в CH1 в позиции 147 и позиции 175, как указывается согласно нумерации EC, которые являются глутаминовой кислотой (E), и аминокислотные остатки, содержащиеся в CL в позиции 180, позиции 131 и позиции 160, как указывается согласно нумерации EC, которые все являются лизином (K).
Кроме того, в другом примере, аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, является глутаминовой кислотой (E), и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC, является лизином (K).
Кроме того, настоящее изобретение касается способа получения, включающего на вышеупомянутом этапе (1) модификацию нуклеиновых кислот таким образом, чтобы два или более аминокислотных остатков, образующих границу вариабельной области тяжелой цепи и вариабельной области легкой цепи, были аминокислотными остатками, которые электрически не отталкиваются друг от друга. Предпочтительно аминокислотными остатками, которые электрически не отталкиваются друг от друга, являются, например, аминокислотные остатки любого набора, выбранного из группы, к которой относятся наборы аминокислотных остатков, указанных ниже в пп. (a) и (b):
(a) аминокислотный остаток, содержащийся в вариабельной области тяжелой цепи в позиции 39 согласно нумерации Kabat, и аминокислотный остаток, содержащийся в вариабельной области легкой цепи в позиции 38 согласно нумерации Kabat; и
(b) аминокислотный остаток, содержащийся в вариабельной области тяжелой цепи в позиции 45 согласно нумерации Kabat, и аминокислотный остаток, содержащийся в вариабельной области легкой цепи в позиции 44 согласно нумерации Kabat.
Вышеупомянутые аминокислотные остатки, которые электрически не отталкиваются друг от друга, предпочтительно представляют собой аминокислотные остатки, выбранные из каждого из двух наборов, выбранных из группы, к которой относятся вышеупомянутые пп. с (X) по (Z), и два набора выбраны из комбинаций (X) и (Y), (X) и (Z), (Y) и (Z), а также (Z) и (Z).
Кроме того, настоящее изобретение обеспечивает способ регулирования ассоциации тяжелых цепей и легких цепей антитела.
Предпочтительный вариант осуществления способа регулирования ассоциации настоящего изобретения представляет собой способ регулирования ассоциации тяжелых цепей и легких цепей антитела, включающий модификацию нуклеиновых кислот таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), становились аминокислотными остатками, которые электрически отталкиваются друг от друга:
(a) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 160, как указывается согласно нумерации EC.
Другой вариант осуществления настоящего изобретения обеспечивает способ регулирования ассоциации в антителе, который также включает модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки из набора аминокислотных остатков, показанных ниже в п. (d), были аминокислотными остатками, которые электрически отталкиваются друг от друга:
(d) аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC.
Еще один предпочтительный вариант осуществления способа регулирования ассоциации настоящего изобретения, представляет собой способ регулирования ассоциации тяжелых цепей и легких цепей антитела, включающий модификацию нуклеиновых кислот таким образом, чтобы один набор или два или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (a) по (c), становились аминокислотными остатками, которые электрически не отталкиваются друг от друга:
(a) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 180, как указывается согласно нумерации EC;
(b) аминокислотный остаток, содержащийся в CH1 в позиции 147, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 131, как указывается согласно нумерации EC; и
(c) аминокислотный остаток, содержащийся в CH1 в позиции 175, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 160, как указывается согласно нумерации EC.
Другой вариант осуществления настоящего изобретения обеспечивает способ регулирования ассоциации в антителе, который также включает модификацию нуклеиновых кислот таким образом, чтобы аминокислотные остатки из набора аминокислотных остатков, указанных ниже в п. (d), были аминокислотными остатками, которые электрически не отталкиваются друг от друга:
(d) аминокислотный остаток, содержащийся в CH1 в позиции 213, как указывается согласно нумерации EC, и аминокислотный остаток, содержащийся в CL в позиции 123, как указывается согласно нумерации EC.
В соответствии со способом регулирования ассоциации согласно настоящему изобретению, необходимое биспецифическое антитело может быть получено оптимальным и эффективным способом, как было описано выше. То есть, необходимый гетеромерный мультимер в форме биспецифического антитела может быть эффективно образован из смеси мономеров.
Фраза "модифицировать нуклеиновые кислоты" согласно вышеупомянутым способам настоящего изобретения относится к модификации нуклеиновых кислот таким образом, чтобы они соответствовали аминокислотным остаткам, включенным путем "модификаций" согласно настоящему изобретению. Более конкретно она касается модификации нуклеиновых кислот, кодирующих первоначальные (предварительно модифицированные) аминокислотные остатки, до нуклеиновых кислот, кодирующих аминокислотные остатки, подлежащие включению путем модификации. Как правило, она означает выполнение манипуляций с генами или мутационной обработки, которая в результате приводит как минимум к одной нуклеотидной инсерции, делеции или замещению в первоначальной нуклеиновой кислоте, таким образом, чтобы образовывались кодоны, кодирующие нужные аминокислотные остатки. Более конкретно, кодоны, кодирующие первоначальные аминокислотные остатки, замещаются кодонами, кодирующими аминокислотные остатки, которые подлежат включению путем модификации. Такие модификации нуклеиновых кислот могут выполняться специалистами в данной области с применением известных технологий, таких, как сайт-специфичный мутагенез и ПЦР-мутагенез.
Кроме того, настоящее изобретение обеспечивает нуклеиновые кислоты, которые кодируют антитело согласно настоящему изобретению. Кроме того, векторы, несущие нуклеиновые кислоты, также включаются в настоящее изобретение.
Нуклеиновые кислоты согласно настоящему изобретению, как правило, вставляют в соответствующие векторы, а затем включают в клетки-хозяева. Эти векторы не имеют особых ограничений, при условии, что вставленная нуклеиновая кислота устойчиво сохраняется. Например, при использовании E. coli в качестве хозяина клонирующим вектором предпочтительно является вектор pBluescript (Stratagene) и т.п., однако могут использоваться и различные векторы промышленного производства. Векторы экспрессии особенно приемлемы в качестве векторов для получения полипептидов согласно настоящему изобретению. Векторы экспрессии не имеют особых ограничений при условии, что они могут экспрессировать полипептиды в пробирках, E. coli, культивируемых клетках или отдельных организмах. Например, к предпочтительным векторам относятся вектор pBEST (Promega) для экспрессии в пробирках, pET вектор (Invitrogen) для E. coli, вектор pME18S-FL3 (инвентарный номер в GenBank AB009864) для культивируемых клеток и вектор pME18S (Mol. Cell Biol. 8: 466-472 (1998)) для отдельных организмов. Инсерция ДНК согласно настоящему изобретению в векторы может выполняться, например, с применением комплекта In-Fusion Advantage PCR Cloning Kit (Clontech).
Кроме того, настоящее изобретение обеспечивает клетки-хозяева, несущие вышеописанные нуклеиновые кислоты. Клетки-хозяева не имеют особых ограничений, и в соответствии с этой целью, могут использоваться различные клетки-хозяева, такие, как E. coli и различные клетки животных. Клетки-хозяева могут использоваться, например, в качестве вырабатывающей системы для выработки и экспрессии антитела или полипептидов согласно настоящему изобретению. In vitro и in vivo вырабатывающие системы имеются в наличии для систем выработки полипептидов. Вырабатывающие системы, в которых используются эукариотные клетки или прокариотные клетки, являются примерами in vitro вырабатывающих систем.
Эукариотные клетки, которые могут использоваться в качестве клеток-хозяев, включают, например, клетки животных, растительные клетки и грибковые клетки. К клеткам животных относятся: клетки млекопитающих, например, CHO (J. Exp. Med. (1995) 108: 945), COS, 3T3, миелома, ВНК (клетки почки новорожденного хомяка), HeLa, C127, HEK293, клетки меланомы Боуэса и Vero; клетки земноводных, такие, как ооциты Xenopus laevis (Valle, et al. (1981) Nature 291: 338-340); и клетки насекомых (например, Drosophila S2, Sf9, Sf21 и Tn5). Для экспрессии антител согласно настоящему изобретению могут соответственно использоваться клетки CHO-DG44, CHO-DX11B, COS7 и клетки ВНК. Среди клеток животных клетки CHO являются особенно предпочтительными для крупномасштабной экспрессии.
Векторы могут включаться в клетку-хозяин известными способами, например, способами с применением фосфата кальция, DEAE-декстрана, способами с использованием катионных липосом DOTAP (Boehringer-Mannheim), способами электропорации (Current protocols in Molecular Biology edit. Ausubel et al. (1987) Publish. John Wiley & Sons, Section 9.1-9.9), липофекции, способами с использованием липофектамина (GIBCO-BRL) или способами микроинъекции. Кроме того, введение генов для экспрессии полипептидов также может осуществляться с применением системы экспрессии Free Style 293 (Invitrogen).
К растительным клеткам относятся, например, клетки, взятые из Nicotiana tabacum, известные как вырабатывающая белок система. Культивируют каллюсы из этих клеток для выработки антител согласно настоящему изобретению.
Известными системами экспрессии белка являются системы, в которых используются грибковые клетки, включая дрожжевые клетки, например, клетки рода Saccharomyces, такие, как Saccharomyces cerevisiae и Saccharomyces pombe; и клетки нитчатых грибов, например, клетки рода Aspergillus, такие, как Aspergillus niger. Эти клетки могут использоваться в качестве хозяев для выработки антител согласно настоящему изобретению.
Бактериальные клетки могут использоваться в вырабатывающих системах, использующих прокариотные клетки. Примерами бактериальных клеток могут быть Streptococcus, Staphylococcus, E. coli, Steptomyces, Bacillus subtilis, а также описанная выше E. coli. Такие клетки могут использоваться для выработки антител согласно настоящему изобретению.
При выработке антитела с использованием клетки-хозяина согласно настоящему изобретению полинуклеотид, кодирующий антитело согласно настоящему изобретению, может быть экспрессирован путем культивирования клеток-хозяев, преобразованных вектором экспрессии, содержащим полинуклеотид. Культивирование выполняют с применением известных способов. Например, при использовании клеток животных в качестве хозяев DMEM, MEM, RPMI 1640 или IMDM могут использоваться в качестве культуральной среды, которая может дополняться сывороткой, такой, как FBS или сыворотка эмбрионов крупного рогатого скота (FCS). Также приемлемы бессывороточные культуры. Предпочтительный уровень pH в процессе культивирования составляет приблизительно от 6 до 8. Культивирование обычно осуществляют при температуре приблизительно от 30°C до 40°C в течение приблизительно 15-200 часов. В случае необходимости среду меняют, аэрируют или перемешивают.
С другой стороны, вырабатывающие системы с использованием животных или растений могут применяться в качестве систем для выработки полипептидов in vivo. Необходимый полинуклеотид вводят в организм животного или растение, полипептид вырабатывается в организме животного или растении, а затем его собирают. К "хозяевам" согласно настоящему изобретению относятся такие животные и растения.
Для секреции экспрессируемых клетками-хозяевами полипептидов в просвет эндоплазматического ретикулюма, периплазматическое пространство или внеклеточную среду в нужные полипептиды могут включаться соответствующие сигналы секреции. Эти сигналы могут быть внутренними или инородными для нужных полипептидов.
При секреции полипептидов согласно настоящему изобретению в культуральную среду полипептиды, вырабатываемые вышеупомянутым способом, могут быть собраны путем сбора среды. Если полипептиды согласно настоящему изобретению вырабатываются внутри клеток, сначала клетки подвергают лизису и эти полипептиды собирают.
Животными, используемыми для вырабатывающей системы, могут быть млекопитающие или насекомые. Могут использоваться такие млекопитающие, как козы, свиньи, овцы, мыши и крупный рогатый скот (Vicki Glaser, SPECTRUM Biotechnology Applications (1993)). В альтернативном варианте млекопитающие могут быть трансгенными животными.
Например, полинуклеотид, кодирующий антитело согласно настоящему изобретению, может быть получен как составной ген с геном, кодирующим полипептид, специфично вырабатываемый в молоке, такой, как β-казеин козы. Фрагменты полинуклеотидов, содержащие составной ген, вводят путем инъекции в эмбрионы козы, которые затем вводят обратно в организм коз. Нужное антитело может быть получено из молока, вырабатываемого трансгенными козами, рожденными от коз, которые получали эмбрионы, или от их потомства. Соответствующие гормоны могут вводиться трансгенным козам для увеличения объема молока, содержащего антитело, выработанное трансгенными козами (Ebert et al, Bio/Technology 12: 699-702 (1994)).
Насекомые такие, как шелкопряд, также могут использоваться для выработки антител согласно настоящему изобретению. Бакуловирусы, несущие полинуклеотид, кодирующий нужное антитело, могут использоваться для инфицирования шелкопряда, и нужное антитело может быть получено из жидкостей их организмов (Susumu et al, Nature 315: 592-594 (1985)).
К растениям, используемым для выработки антител согласно настоящему изобретению, относится, например, табак. В случае использования табака полинуклеотид, кодирующий нужное антитело, вставляют в растительный вектор экспрессии, например, pMON 530, а затем вектор вводят в бактерию, такую, как Agrobacterium tumefaciens. Затем бактерии используют для инфицирования табака, такого, как Nicotiana tabacum, и нужные антитела могут быть добыты из листьев табака (Ma et al, Eur. J. Immunol. 24: 131-138 (1994)).
Полученное в результате антитело может быть выделено изнутри или извне (например, из среды и молока) клетки-хозяина и очищено как по сути чистое и гомогенное антитело. Способы не ограничиваются каким-либо конкретным способом, и может применяться любой стандартный способ выделения и очистки антител. Антитела могут быть выделены и очищены путем соответствующего отбора и комбинирования, например, фракционирования сульфатом аммония или этанолом, экстрагирования кислотой, при помощи хроматографических колонок, фильтрации, ультрафильтрации, высаливания, осаждения из растворителя, экстракции растворителем, дистилляции, иммунопреципитации, электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия, изоэлектрического фокусирования, диализа, рекристаллизации и т.п.
Хроматография включает, например, аффинную хроматографию, ионообменную хроматографию, такую, как анионообменная хроматография и катионообменная хроматография, хроматографию на фосфоцеллюлозе, хроматографию с гидрофобным взаимодействием, гель-фильтрацию, хроматографию с обращением фаз, адсорбционную хроматографию, хроматографию с гидроксиапатитом и лектиновую хроматографию (Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al, Cold Spring Harbor Laboratory Press, 1996). Эти виды хроматографии могут осуществляться с применением жидкофазной хроматографии, такой, как HPLC и FPLC. Примерами колонок для аффинной хроматографии могут быть колонки с протеином A и колонки с протеином G. Примерами колонок с протеином А могут быть Hyper D, POROS и Sepharose F.F. (Pharmacia).
Антитело может быть свободно модифицировано и пептидные компоненты могут быть удалены из него путем обработки антитела соответствующим белком, модифицирующим фермент до или после очистки антитела в случае необходимости. К таким модифицирующим белок ферментам относятся, например, трипсины, химотрипсины, лизил-эндопептидазы, протеинкиназы и глюкозидазы.
В другом предпочтительном варианте осуществления настоящее изобретение также включает способы получения антител согласно настоящему изобретению, включающие этапы культивирования клеток-хозяев согласно настоящему изобретению, как описывалось выше, и сбор антител из такой клеточной культуры.
Кроме того, настоящее изобретение касается фармацевтических композиций (лекарственных средств), включающих антитело согласно настоящему изобретению и фармацевтически приемлемый носитель. Согласно настоящему изобретению, фармацевтические композиции обычно означают лекарственные средства для лечения или профилактики или исследования и диагностики болезней.
Фармацевтические композиции согласно настоящему изобретению рецептируют способами, известными специалистам в данной области. Кроме того, антитела согласно настоящему изобретению в случае необходимости могут быть рецептированы в комбинации с другими фармацевтическими веществами. Например, они могут применяться парентерально в форме инъекции стерильного раствора или суспензии с водой или другой фармацевтически приемлемой жидкостью. Например, они могут быть рецептированы как стандартные дозы, соответствующие требованиям к приготовлению фармацевтических препаратов, путем надлежащего сочетания с фармацевтически приемлемыми носителями или средами, в частности, со стерильной водой, физиологическим раствором, растительным маслом, эмульгатором, суспензией, детергентом, стабилизатором, ароматизатором, формообразующим, носителем, консервантом, связующим веществом и т.п. В таких композициях количество активного ингредиента регулируют такими образом, чтобы доза пребывала в соответствующем заданном диапазоне.
Стерильные композиции для инъекций могут быть рецептированы с применением носителей, таких, как дистиллированная вода для инъекций, в соответствии со стандартными протоколами рецептирования.
Водные растворы для инъекций включают, например, физиологический раствор и изотонические растворы, содержащие декстрозу или другие адъюванты (например, D-сорбит, D-маннозу, D-маннит и хлорид натрия). Соответствующие солюбилизаторы, например, спирты (этанол и т.п.), полиспирты (пропиленгликоль, полиэтиленгликоль и т.п.), неионные детергенты (полисорбат 80™, НСО-50 и т.п.) могут применяться в комбинации.
К маслам относятся кунжутное и соевое масла. Бензилбензоат и/или бензиловый спирт могут применяться в комбинации в качестве солюбилизаторов. Также могут сочетаться буферы (например, фосфатный буфер и ацетат натрия), успокоительные вещества (например, новокаин), стабилизаторы (например, бензиловый спирт и фенол) и/или антиоксиданты. Приготовленные препараты для инъекций, как правило, помещают в соответствующие ампулы.
Фармацевтические композиции согласно настоящему изобретению предпочтительно вводят парентерально. Например, композиции могут быть инъекционными, трансназальными композициями, транспульмональными композициями или трансдермальными композициями. Например, такие композиции могут вводиться системно или по месту путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, подкожной инъекции и т.п.
Способы введения могут быть соответствующим образом выбраны с учетом возраста и симптомов пациента. Доза фармацевтической композиции, содержащей антитело или полинуклеотид, кодирующий антитело, может составлять, например, от 0,0001 до 1000 мг/кг при каждом введении. В альтернативном варианте доза может составлять, например, от 0,001 до 100,000 мг на пациента. Однако дозы не обязательно ограничиваются описанными выше диапазонами. Дозы и способы введения могут отличаться в зависимости от массы тела, возраста, симптомов пациента и т.п. Специалисты в данной области смогут выбрать соответствующие дозы и способы введения с учетом описанных выше факторов.
Аминокислоты, содержащиеся в аминокислотных последовательностях согласно настоящему изобретению, могут быть модифицированы посттрансляционно (например, модификация N-концевого глутамина до пироглутаминовой кислоты путем пироглутамилирования хорошо известна специалистам в данной области). Обычно такие посттрансляционно модифицированные аминокислоты включаются в аминокислотные последовательности согласно настоящему изобретению.
Все документы существующего уровня техники, приведенные в данном описании, включены путем ссылки.
Примеры
Далее настоящее изобретение описывается со ссылкой на конкретные Примеры, однако они не ограничивают объема настоящего изобретения. [Пример 1] Поиск центров, регулирующих границу CH1/CL Считалось, что при включении мутаций в каждый из доменов CH1 и CL биспецифического антитела и использовании электрического заряда на границе CH1/CL для регулирования границы CH1/CL специфично ассоциируются только H-цепь и L-цепь для антигена А, и только H-цепь и L-цепь для антигена В. Далее этот процесс указывается как регулирование границы CH1/CL. Проводилось исследование для поиска позиций, в которых граница CH1/CL может контролироваться, с применением модели кристаллической структуры. Аминокислоты поддерживают взаимодействие между боковыми цепями путем гидрофобного взаимодействия, электрического взаимодействия, водородного связывания и т.п.Известно, что такое взаимодействие происходит между боковыми цепями, присутствующими в диапазоне приблизительно 4 Å. Таким образом, аминокислоты были обнаружены в PDB модели 1HZH, в которой расстояние между аминокислотами, присутствующими в CH1, и аминокислотами, присутствующими в CL на границе между CH1 и CL, составляет приблизительно 4 Å. Центры, в которых находятся аминокислоты, показаны на Фиг. 1 и в Таблице 1 (перечень модифицированных центров). Номера аминокислот, показанных в Таблице 1, указаны в соответствии с нумерацией EC (последовательности белков, имеющих иммунологическое значение, Публикация NIH №91-3242). Кроме того, последующие номера аминокислот также указываются в соответствии с нумерацией EC. В представленном примере IgG1 использовали для H-цепи, a IgK (Каппа) использовали для L-цепи.
Для регулирования границы CH1/CL с использованием электрического заряда аминокислот аминокислоты, находящиеся в CH1 H-цепи или CL L-цепи (Таблица 1) замещали положительно заряженными Lys или His и отрицательно заряженными Glu или Asp.Более конкретно, подготавливали константные области: TH2 и TH11, в которых аминокислоты CH1 человеческого G1d (SEQ ID NO: 1) замещали положительно заряженным Lys; и TH1, TH3, TH4, TH9, TH10 и TH12, в которых аминокислоты CH1 человеческого G1d (SEQ ID NO: 1) замещали отрицательно заряженным Glu или Asp.Подобным образом подготавливали константные области: TL2, TL4, TL5, TL6, TL8 и TL12, в которых аминокислоты человеческого CL (SEQ ID NO: 13) замещали положительно заряженным Lys; TL11, в которых аминокислоты человеческого CL (SEQ ID NO: 13) замещали His; и TL1, TL3, TL7, TL9, TL10 и TL13, в которых аминокислоты человеческого CL (SEQ ID NO: 13) замещали отрицательно заряженным Glu или Asp.Названия, центры мутации и номера последовательностей предпочтительных константных областей сведены в Таблице 2 (перечень модифицированных центров).
[Пример 2] Способ отбора центров, регулирующих границу CH1/CL и приготовления и анализа каждого антитела
Влияние на регулирование границы CH1/CL обнаруженных аминокислот подтверждали с применением описанных ниже способов. Отбор проводили с использованием антитела против GPC3. Сначала строили векторы экспрессии H-цепи и L-цепи. Вектор экспрессии H-цепи, имеющий вариабельную область GpH7 H-цепи (SEQ ID NO: 34) и константную область H-цепи, полученные согласно Примеру 1, и вектор экспрессии L-цепи, имеющий вариабельную область GpL16 L-цепи (SEQ ID NO: 35) и константную область L-цепи, полученные согласно Примеру 1, строили в соответствии со Справочным примером 1. Затем комбинации полученных векторов экспрессии H-цепи и L-цепи отбирали описанным ниже способом. Единичную H-цепь, в которой аминокислота в обнаруженном центре обладает положительным зарядом или отрицательным зарядом, выбирали из константных областей, полученных согласно Примеру 1. В таких случаях не обязательно вводили мутацию. Например, хотя позиция 147 ТН1 замещена Glu, мутация не вводится, поскольку аминокислота в позиции 147 G1d представляет собой Lys и изначально обладает положительным зарядом. Затем L-цеп, имеющие мутации в позициях, соответствующих мутированным позициям в CH1 выбранных H-цепей согласно Таблице 1, были выбраны из Таблицы 2. Например, при выборе TH1 для H-цепи TL1 и TL2 выбирали для L-цепи, поскольку ожидалось, что аминокислота в позиции 147 CH1 и аминокислота в позиции 180 CL должны взаимодействовать в качестве границы CH1/CL. Затем выбранные две L-цепи смешивали с выбранной одной H-цепью и антитела экспрессировали в соответствии со Справочным примером 1. И наконец, экспрессированные антитела анализировали в соответствии со Справочным примером 3 или Справочным примером 4, и модификации, эффективные для регулирования границы CH1/CL, отбирали в соответствии с соотношением экспрессии каждого антитела. Поскольку IgG состоит из комплекса из двух H-цепей и двух L-цепей, если один тип H-цепи и два типа L-цепей смешиваются и экспрессируются, должны экспрессироваться три комбинации. Например, если экспрессируются комбинации TH1 в качестве H-цепи и TL1 и TL2 в качестве L-цепей, экспрессируются три указанные ниже комбинации (Фиг. 2):
H-цепь_1:H-цепь_2:L-цепь_1:L-цепь_2=TH1:TH1:TL1:TL1 (указывается как TH1/TL1),
H-цепь_1:H-цепь_2:L-цепь_1:L-цепь_2=TH1:TH1:TL1:TL2 (указывается как TH1/TL1_TL2)
H-цепь_1:H-цепь_2:L-цепь_1:L-цепь_2=TH1:TH1:TL2:TL2 (указывается как TH1/TL2).
В случае, если ассоциация H-цепи и L-цепи не является выборочной, H-цепь и L-цепи должны экспрессироваться в соотношении TH1/TL1:TH1/TL1_TL2:TH1/TL2=1:2:1, поскольку две L-цепи присутствуют в равных количествах. Однако в случае, если H-цепь избирательно связывается лишь с одной из L-цепей на границе CH1/CL, считается, что только эта комбинация избирательно экспрессируется. Например, в случае, если аминокислота в позиции 147 CH1 и аминокислота в позиции 180 CL задействованы на границе CH1/CL, TH1 экспрессируется в качестве H-цепи, а TL1 и TL2 экспрессируются в качестве L-цепей, комбинация ТН1, в которой аминокислота в позиции 147 CH1 является Glu (отрицательно заряженным), и TL2, в которой аминокислота в позиции 180 CL L-цепи является Lys (положительно заряженным), должна избирательно экспрессироваться. Однако в случае, если аминокислота в позиции 147 CH1 и аминокислота в позиции 180 CL не взаимодействуют на границе CH1/CL, поскольку ассоциация H-цепи и L-цепи не является выборочной, они должны экспрессироваться в соотношении TH1/TL1:TH1/TL1_TL2:TH1/TL2=1:2:1. Таким образом, модификации, эффективные для регулирования границы CH1/CL (модификации, задействованные на границе CH1/CL), отбирали путем смешивания и экспрессии одного типа H-цепи и двух типов L-цепей и использования их баланса экспрессии в качестве индикатора.
Комбинации H-цепи и L-цепей сведены в Таблице 3 (также показаны комбинации H-цепи и L-цепей, используемые при экспрессии; центры мутации в H-цепи и L-цепи).
Антитела экспрессировались в соответствии с комбинациями, показанными в Таблице 3, и подтверждалось влияние на регулирование выбранной границы CH1/CL. В это время антитела одного типа H-цепи и одного типа L-цепи одновременно экспрессировали и использовали в анализах в качестве контроля. Антитела экспрессировали в соответствии со способом из Справочного примера 1.
Полученные антитела анализировали при помощи AIEX в соответствии со способом из Справочного примера 3. Данные анализа AIEX сведены на Фиг. 3. Поскольку для анализа AIEX используют анионообменную колонку, отрицательно заряженные антитела элюируются быстрее. Анализируемые данные сведены и показаны в Таблице 4. Пики указываются как пики 1, 2 и 3 в порядке уменьшения времени элюирования. Соотношение каждого пика рассчитывали при общей площади под пиком 100%.
Как показано на Фиг. 2, в случае, если позиции, введенные при мутациях, создают электрическое взаимодействие, соотношение антитела в позиции серого пика возрастает. То есть, места мутации, в которых соотношение окрашенного серым антитела превышает 25%, считаются электрически взаимодействующими.
В результате такого исследования разных центров модификации позиции 147, 175 и 213 H-цепи и позиции 123, 131, 160 и 180 L-цепи были признаны эффективными для регулирования границы CH1/CL. Кроме того, было обнаружено, что модификации только позиции 147 H-цепи и позиции 123 L-цепи, указанные в документах WO 2006/106905 и WO 2007/147901, являются недостаточными для обеспечения специфической ассоциации H-цепи и L-цепи, и специфическая ассоциация возможна только при сочетании модификаций, присутствующих в представленном примере.
[Пример 3] Получение и анализ антител с комбинированными центрами модификации
Считалось, что граница CH1/CL более эффективно регулируется путем комбинирования центров К147, Q175 и К213 в CH1 и центров Е123, S131, Q160 и Т180 в CL, показанных в Примере 2, которые считались оказывающими заметное влияние на регулирование границы CH1/CL. Комбинации модификаций в полученных антителах и экспрессированные антитела сведены в Таблице 5 (Сводка центров модификации).
Получение векторов экспрессии H-цепи или L-цепи, введенных путем мутаций, и экспрессию антитела осуществляли в соответствии со Справочным примером 1, и анализы полученных антител осуществляли в соответствии со Справочным примером 3 или Справочным примером4. Результаты сведены в Таблице 6.
Если сравнить Таблицу 4 и Таблицу 6, станет понятно, что соотношение направленных комбинаций H-цепи и L-цепи повышается благодаря комбинированию модификаций, в отличие от введения одной модификаций. Таким образом, считается, что антитело, в котором ассоциированы только необходимые H-цепь и L-цепь, может быть эффективно получено путем комбинирования модификаций.
[Пример 4] Экспрессия и анализ биспецифических антител В Примере 3 рассматривалось получение биспецифических антител (биспецифических Ab) для ТН2, ТН13 и ТН15 H-цепей и TL16, TL17, TL19 и TL20 L-цепей, которые продемонстрировали значительное влияние на регулирование границы CH1/CL. В этом примере биспецифические антитела получали с применением антитела против IL6R и антитела против GPC3.
Константные области H-цепи (SEQ ID NO: 59) и L-цепи (SEQ ID NO: 60), распознающие антитело против IL6R, и константные области H-цепи (SEQ ID NO: 61) и L-цепь (SEQ ID NO: 62), распознающие антитело против GPC3, замещали ТН2, ТН13 и ТН15 для константных областей H-цепи и TL16, TL17, TL19 и TL20 для CL L-цепи. Кроме того, H-цепь, введенную при модификации "выступ-во-впадину" (KiH) (документ WO 96/27011) получали во избежание ассоциации между гомогенными Н-цепями. Места мутации в этих полученных антителах и экспрессированные антитела сведены в Таблице 7 (Комбинации H-цепи и L-цепи каждого биспецифического антитела).
Выше в Таблице 7 "k" прибавляется после названия варианта для константных областей, в которых была введена модификация "выступ" в H-цепь, и "h" прибавляется после названия варианта, для которого константные области, в которых была введена модификация "впадина". Например, "TH1k" означает, что модификация "выступ" была введена дополнительно к мутации ТН1, а "TH1h" означает, что модификация "впадина" была введена дополнительно к мутации ТН1. Получение векторов экспрессии H-цепи или L-цепи, в которые была введена мутация, а также экспрессию антител осуществляли в соответствии со Справочным примером 1, и анализы полученных антител осуществляли в соответствии со способом анализа CIEX, показанным в Справочном примере 4.
Комбинации H-цепей и L-цепей антитела против IL6R и антитела против GPC3, которые используются в биспецифических антителах, сведены в Таблице 8.
Каждая комбинация объясняется в данном описании с использованием 4ch_001, 4ch_002, 4ch_003, 4ch_004, 4ch_011 и 4ch_012 в качестве примеров. Модификации, регулирующие границу CH1/CL, сведены в Таблице 8.
4ch_001 экспрессировали с использованием H-цепей и L-цепей, в которые не вводились модификации для регулирования границы CH1/CL и модификация KiH. 4ch_002 экспрессировали с использованием H-цепей и L-цепи, в которые вводилась модификация KiH. 4ch_003 экспрессировали с использованием H-цепей и L-цепей, в которые вводились модификации для регулирования границы CH1/CL. 4ch_004 экспрессировали с использованием H-цепей и L-цепей, в которые вводились модификация KiH и модификации для регулирования границы CH1/CL. Кроме того, 4ch_011 экспрессировали с использованием H-цепей антитела против IL6R и H-цепей антитела против GPC3, в которые вводились модификация KiH и модификации для регулирования границы CH1/CL, и L-цепей антитела против IL6R, в которые вводились модификации для регулирования границы CH1/CL. 4ch_012 экспрессировали с использованием H-цепей антитела против IL6R и H-цепей антитела против GPC3, в которые вводились модификация KiH и модификации для регулирования границы CH1/CL, и L-цепей антитела против GPC3, в которые вводились модификации для регулирования границы CH1/CL. Каждое антитело экспрессировали в соответствии со Справочным примером 1 и анализировали при помощи CIEX в соответствии со Справочным примером 4; результаты сведены на Фигурах 9-1 и 9-2. Случай использования вариабельной области H-цепи антитела против IL6R обозначается MHO, а случай использования вариабельной области H-цепи антитела против GPC3 обозначается GpH7. Случай использования вариабельной области L-цепи антитела против IL6R обозначается ML0, а случай использования вариабельной области L-цепи антитела против GPC3 обозначается GpL16. Множество гетерогенных компонентов, которые считаются различными комбинациями H-цепи и L-цепи, обнаруживали путем хроматографии для 4ch_001, которую не вводят при мутациях для контроля границы CH1/CL и KiH. Для сравнения, поскольку ассоциация гомогенных H-цепей подавлялась в 4ch_002 путем мутации KiH, уменьшается количество хроматографических пиков, которые считаются примесями. Кроме того, поскольку подавлялась ассоциация H-цепей и L-цепей в 4ch_003 с использованием ТН2 и ТН13 в Н-цепях и TL16 и TL17 в L-цепях, в которые вводились модификации для регулирования границы CH1/CL, уменьшалось количество хроматографических пиков, которые считаются представляющими примеси. Кроме того, было обнаружено, что 4ch_004 с комбинацией мутаций KiH и модификаций для регулирования границы CH1/CL обычно является главным пиком. Причиной того, что хроматографические пики 4ch_004 почти совпадают с хроматографическими пиками 4ch_011, считается то, что их пики не могут быть отделены путем хроматографии из-за их подобных изоэлектрических точек (pI). Также проводились исследования на 4ch_005, 4ch_006, 4ch_015 и 4ch_016, к которым применялось другое регулирование границы CH1/CL по сравнению с 4ch_004; 4ch_007, 4ch_008, 4ch_013 и 4ch_014, в которых модификации для регулирования границы CH1/CL, введенные в 4ch_004, чередовались между антителом против GPC3 и антителом против IL6R; и 4ch_009, 4ch_010, 4ch_017 и 4ch_018, в которых модификации для регулирования границы CH1/CL, введенные в 4ch_006, чередовались между антителом против GPC3 и антителом против IL6R, с применением тех же способов, что и для 4ch_003, 4ch_004, 4ch_011 и 4ch_012. В результате гетерогенные компоненты, присутствующие на хроматограмме, были значительно уменьшены по сравнению с 4ch_001.
Из вышеуказанного становится очевидно, что биспецифические антитела могут быть эффективно получены путем комбинирования модификаций для регулирования границы CH1/CL и модификации KiH.
[Пример 5] Эффект модифицирующего регулирования границы CH1/CL с использованием различных антител
Из Примера 4 становится очевидным, что регулирование границы с использованием CH1/CL может применяться для получения биспецифических антител. Таким образом, эффект регулирования границы CH1/CL подтверждался с использованием антитела против CD3, М12 (H-цепь: SEQ ID NO: 54, L-цепь: SEQ ID NO: 57) и антитела против GPC3, GC33(2) (H-цепь: SEQ ID NO: 55, L-цепь: SEQ ID NO: 58). Как и в Примере 4, биспецифические антитела получали с использованием ТН2, ТН13 и ТН15 в Н-цепях и TL16, TL17 и TL19 в L-цепях, что продемонстрировало значительный эффект в регулировании границы CH1/CL.
Константные области H-цепи (SEQ ID NO: 54) и L-цепи (SEQ ID NO: 57) CD3, распознающие антитело Ml2, и константные области H-цепи (SEQ ID NO: 55) и L-цепи (SEQ ID NO: 58) GPC3, распознающие антитело GC33(2), замещали ТН2, ТН13 и ТН15 для CHI H-цепи и TL16, TL17 и TL19 для CL L-цепи. Кроме того, H-цепь с модификациями "выступ-во-впадину" (KiH) (Патентный документ 1) получали во избежание ассоциации между гомогенными Н-цепями. Места мутации этих полученных антител и экспрессированные антитела сведены в Таблице 9 (Сводка центров модификации).
Получение векторов экспрессии H-цепей и L-цепей с мутациями и экспрессию антител осуществляли в соответствии со Справочным примером 1 и анализы полученных антител осуществляли в соответствии со способом анализа CIEX, показанным в Справочном примере 4.
Очевидно, что регулирование границы CH1/CL также применимо для получения биспецифических антител с антителом против CD3 и антителом против GPC3.
[Пример 6] Комбинация регулирования границы CH1/CL и регулирования границы вариабельной области
При получении биспецифических антител включение электрического отталкивания в вариабельные области VH и VL является известной технологией, обеспечивающей возможность специфической ассоциации заданных H-цепей м L-цепей (Патентный документ WO 2006/106905). Таким образом, для эффективной экспрессии только заданных компонентов следует вызвать отталкивание между вариабельными областями H-цепи и L-цепи, помимо регулирования границы CH1/CL. Этот процесс называется регулированием границы VH/VL. Получали МН01 (SEQ ID NO: 46), где Gln в позиции 39 согласно нумерации Kabat H-цепи антитела против IL6R был замещен Lys; МН02 (SEQ ID NO: 47), где Gln был замещен Glu; ML01 (SEQ ID NO: 50), где Gln в позиции 38 согласно нумерации Kabat L-цепи был замещен Glu; и ML02 (SEQ ID NO: 51), где Glu был замещен Lys. Кроме того, соответственно получали GpH71 (SEQ ID NO: 48), где Gln в позиции 39 согласно нумерации Kabat H-цепи антитела против GPC3 был замещен Lys; GpH72 (SEQ ID NO: 49), где Gln был замещен Glu; GpL161 (SEQ ID NO: 52), где Gln в позиции 38 согласно нумерации Kabat L-цепи был замещен Glu; и GpL162 (SEQ ID NO: 53), где Gln был замещен Lys. Получение векторов экспрессии антитела осуществляли в соответствии со способом из Справочного примера 1. Биспецифические антитела экспрессировали, используя полученные антитела. Комбинации модификаций в полученных антителах и экспрессированные антитела сведены в Таблице 10.
Экспрессию антитела осуществляли в соответствии со Справочным примером 1 и анализы полученных антител осуществляли в соответствии со Справочным примером 4.
Поскольку пики, наблюдаемые на хроматограммах 4ch_006 и 4ch_008, в которые были введены мутации для регулирования границы CH1/CL, которые считаются представляющими гетерогенные компоненты, исчезали в 4ch_1,2 006 и 4ch_2,1 008, в которые были вставлены мутации для регулирования границы VH/VL, стало очевидным, что только заданные компоненты могут быть эффективно получены путем применения регулирования границы VH/VL помимо регулирования границы CH1/CL (Фигуры 10 и 11). Кроме того, пики, которые считаются представляющими новые гетерогенные компоненты, не обнаруживались даже при осуществлении дополнительной мутации для регулирования границы VH/VL в 4ch_004 и 4ch_010, в которых мутации были введены только в CH1/CL, и в которых только компоненты, которые рассматривались как заданные компоненты, считались очищенными (Фигуры 10 и 11).
Из вышеуказанного становится очевидно, что добавление регулирования границы VH/VL к регулированию границы CH1/CL дополнительно способствует очистке заданных компонентов и при этом не имеет неблагоприятного воздействия на очистку, когда только заданные компоненты считаются уже очищенными.
[Пример 7] Измерение Tm антител с комбинированными центрами модификации
Модификации для регулирования границы CH1/CL могут влиять на устойчивость Fab. Таким образом, устойчивость Fab или Tm измеряли в соответствии со способом из Справочного примера 2 для комбинаций TH2/TL17, TH13/TL16 и TH15/TL19. Антитела, в которых H-цепь/L-цепь состояли из TH2/TL17, TH13/TL16 и TH15/TL19, получали с применением антитела против IL6R. Комбинации модификаций антител и экспрессированные антитела сведены в Таблице 11.
Экспрессию антител измеряли в соответствии со Справочным примером 1, и Tm (°C) каждого из полученных антител измеряли в соответствии со Справочным примером 2. Результат показывает, что значения Tm для Fab G1d/k0 без введения мутаций и для Fab TH2/TL17, TH13/TL16 и TH15/TL19 с введенными мутациями в CH1/CL, составляли 95,0°C, 93,1°C, 95,1°C и 94,8°C, соответственно. Было обнаружено, что мутации для регулирования границы CH1/CL не имеют влияния на устойчивость Fab.
[Пример 8] Влияние введения мутаций для регулирования границы CH1/CL на активность связывания
Возможность модификаций для регулирования границы CH1/CL, влияющих на связывание антигена, не может быть полностью исключена. Таким образом, для измерения аффинности к IL-6R и GPC3 измеряли активность связывания TH2/TL17, TH13/TL16 и TH15/TL19 в соответствии со способом из Справочного примера 5 (Таблица 12).
Поскольку активность связывания с IL-6R и активность связывания с GPC3 TH2/TL17, TH13/TL16 и TH15/TL19, в которые были введены мутации для регулирования границы CH1/CL, не отличалась от активности связывания природного G1d/k0 с IL-6R и GPC3, стало очевидным, что модификации для регулирования границы CH1/CL не влияют на аффинность. Кроме того, при измерении аффинности к двум антигенам, IL-6R и GPC3, в соответствии со Справочным примером 5 с применением 4ch_004, 4ch_006, 4ch_008 и 4ch_010, полученных согласно Примеру 4, было обнаружено, что их аффинность равняется показателю природного G1d/k0, показанного в Таблице 12 (Таблицы 13 и 14).
В соответствии с исследованиями, проведенными согласно Примерам с 1 по 8, стало очевидным, что только заданные компоненты могут быть эффективно очищены путем введения мутации в CH1/CL без снижения устойчивости Fab и без снижения активности связывания.
[Пример 9]
Аминокислотные последовательности человеческого IgA1 (SEQ ID NO: 63), IgA2 (SEQ ID NO: 64), IgD (SEQ ID NO: 65), IgE (SEQ ID NO: 66), IgG1 (SEQ ID NO: 67), IgG2 (SEQ ID NO: 68), IgG3 (SEQ ID NO: 69), IgG4 (SEQ ID NO: 70) и IgM (SEQ ID NO: 71) выравнивали относительно CH1 H-цепи; и аминокислотные последовательности человеческого IgK (Каппа) (SEQ ID NO: 72), IgL1 (SEQ ID NO: 73), IgL2 (SEQ ID NO: 74), IgL3 (SEQ ID NO: 75), IgL6 (SEQ ID NO: 76) и IgL7 (SEQ ID NO: 77) (Лямбда) выравнивали относительно CL L-цепи с их последующим сравнением. Результаты показаны на Фиг. 12. Модификации, обнаруженные в представленном примере, показаны стрелками. В результате введения аминокислот, обладающих разными зарядами, в H-цепь и L-цепь, таким образом, чтобы аминокислоты, показанные стрелками, отталкивались между CH1 H-цепи и CL L-цепи, как указано в представленном примере, считается, что заданные H-цепь и L-цепь могут быть специфично ассоциированы.
[Справочный пример 1] Получение векторов экспрессии антитела и экспрессия и очистка антител
Аминокислотные замещения вводили согласно способу, известному среди специалистов в данной области, с применением комплекта QuikChange для сайт-специфического мутагенеза (Stratagene), ПЦР или комплекта для ПЦР-клонирования In-fusion Advantage (Takara) и т.п., с последующим построением векторов экспрессии. Основные последовательности полученных векторов экспрессии определяли в соответствии со способом, известным среди специалистов в данной области. Антитела экспрессировали путем временной трансфекции полученных плазмид в производные от эмбриональных раковых клеток почек человека линии клеток НЕК293Н (Invitrogen) или клетки FreeStyle 293 (Invitrogen). Антитела очищали от полученного супернатанта культуры в соответствии со способом, известным среди специалистов в данной области, с применением rProtein A Sepharose™ Fast Flow (GE Healthcare). Концентрацию очищенных антител определяли путем измерения оптической плотности при 280 нм при помощи спектрофотометра и концентрацию антитела рассчитывали по полученному показателю с использованием коэффициента поглощения, рассчитанного в соответствии со способом PACE (Protein Science 1995; 4: 2411-2423).
[Справочный пример 2] Определение температуры плавления (Tm) модифицированных антител при помощи дифференциальной сканирующей калориметрии
В этом исследовании определяли температурную устойчивость путем измерения температуры плавления (Tm) антител при помощи дифференциального сканирующего калориметра; MicroCal Capillary DSC (DKSH).
Аликвоты по 500 мкл раствора каждого антитела помещали в измерительную чашку и температуру повышали с 20°C до 115°C. Наблюдали скорость повышения температуры 120°C/ч и изменения в теплоемкости.
Данные анализировали при помощи Origin7 (Light Stone) и температуру, при которой наблюдались изменения в теплоемкости, рассчитывали и определяли как значение Tm.
[Справочный пример 3] Анализ при помощи анионообменной хроматографии (AIEX)
Полученные антитела анализировали с применением способа AIEX при помощи системы Alliance (Waters). Анализы осуществляли согласно способу с применением двухжидкостного градиента с использованием TSK-геля DEAE-NPR (Tosoh) для аналитической колонки, 10 ммоль/л Tris-HCl (pH 7,5) для мобильной фазы A и 10 ммоль/л Tris-HCl и 500 ммоль/л NaCl (рН 7,5) для мобильной фазы B. Измерения осуществляли при длине волны 280 нм.
Данные анализировали при помощи Empower2 (Waters) с последующим вычислением соотношения каждого обнаруженного пика.
[Справочный пример 4] Анализ при помощи катионообменной хроматографии (CIEX)
Полученные антитела анализировали с применением способа CIEX при помощи системы Alliance (Waters). Анализы осуществляли согласно способу с применением двухжидкостного градиента с использованием WCX-10 (Dionex) для аналитической колонки, 25 ммоль/л MES (pH 6,1) для мобильной фазы A и 25 ммоль/л MES и 500 ммоль/л NaCl (pH 6,1) для мобильной фазы B. Измерения осуществляли при длине волны 280 нм.
Данные анализировали при помощи Empower2 (Waters) с последующим вычислением соотношения каждого обнаруженного пика.
[Справочный пример 5] Измерение аффинности к IL6R и GPC3
Взаимодействие между антителом-мишенью и hIL6R или GPC3 анализировали при помощи Biacore Т100 (GE Healthcare). HBS-EP+(GE Healthcare) использовали для подвижного буфера, и температура измерения составляла 25°C. Протеин A/G (Thermo Scientific) иммобилизировали на сенсорном чипе серии S СМ5 (GE Healthcare) путем аминного связывания и использовали в качестве чипа. Антитело-мишень захватывали на чип, и оно взаимодействовало с каждым антигеном, разведенным подвижным буфером. Антитела, захваченные на чипе, смывали путем реакции с 10 мМ глицина-HCl (pH 1,5) для восстановления чипа для повторного использования.
Константу диссоциации (KD) каждого антитела для антигена рассчитывали путем проведения кинетического анализа результатов измерения Biacore. Более конкретно, константу скорости ассоциации ka (л/моль/с) и константу скорости диссоциации kd (л/с) рассчитывали при помощи сенсограмм глобальной подгонки, полученных путем измерения с применением программы Biacore Evaluation в 1:1 модели связывания Ленгмюра с последующим вычислением константы диссоциации KD (моль/л) на основе этих значений. Промышленная применимость
Способ, обеспечиваемый настоящим изобретением, позволяет регулировать ассоциацию без изменения структуры, функции, активности и т.п. первоначального полипептида (антитела) и является чрезвычайно полезным, поскольку требует лишь малого количества аминокислотных замещений. Кроме того, способ также мало воздействует на антигенность.
Применение настоящего изобретения обеспечивает возможность эффективного получения биспецифических антител, которые фактически сохраняют активность.
Claims (38)
1. Способ получения биспецифического антитела, согласно которому нежелательные ассоциации не образуются между тяжелой и легкой цепями, где тяжелая цепь представляет собой IgG1, а легкая цепь представляет собой IgK (Каппа), который включает этапы с (1) по (3):
(1) введение замен в нуклеиновые кислоты, кодирующие тяжелую и легкую цепи биспецифического антитела таким образом, что тяжелая и легкая цепи содержат один или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в пп. с (а) по (с), которые электрически взаимно отталкиваются:
(a) аминокислотный остаток, присутствующий в константной области 1 тяжелой цепи (СН1) в положении 147, как указывается согласно нумерации ЕС, и аминокислотный остаток, присутствующий в константной области легкой цепи (CL) в положении 180, как указывается согласно нумерации ЕС;
(b) аминокислотный остаток, присутствующий в СН1 в положении 147, как указывается согласно нумерации ЕС, и аминокислотный остаток, присутствующий в CL в положении 131, как указывается согласно нумерации ЕС; и
(c) аминокислотный остаток, присутствующий в СН1 в положении 175, как указывается согласно нумерации ЕС, и аминокислотный остаток, присутствующий в CL в положении 160, как указывается согласно нумерации ЕС,
(2) введение нуклеиновых кислот с указанными заменами в клетку-хозяина и культивирование клетки-хозяина таким образом, чтобы экспрессировались нуклеиновые кислоты, и
(3) сбор биспецифического антитела из культуры клетки-хозяина.
2. Способ получения биспецифического антитела по п. 1, дополнительно включающий на этапе (1) введение замен в нуклеиновые кислоты таким образом, что аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в (d), электрически взаимно отталкиваются:
(d) аминокислотный остаток, присутствующий в СН1 в положении 213, как указывается согласно нумерации EU, и аминокислотный остаток, присутствующий в CL в положении 123, как указывается согласно нумерации EU.
3. Способ получения биспецифического антитела по п. 1 или 2, включающий на этапе (1) введение замен в нуклеиновые кислоты таким образом, что аминокислотные остатки, которые электрически взаимно отталкиваются, выбираются из аминокислотных остатков, включенных в группу (X) или (Y), как указано ниже:
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D); и
(Y) лизин (К), аргинин (R) или гистидин (Н).
4. Способ получения биспецифического антитела по п. 1 или 2, дополнительно включающий на этапе (1) введение замен в нуклеиновые кислоты таким образом, что два или более аминокислотных остатка, образующих границу между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, являются аминокислотными остатками, которые электрически взаимно отталкиваются.
5. Способ получения биспецифического антитела по п. 4, отличающийся тем, что аминокислотные остатки, которые электрически взаимно отталкиваются, являются аминокислотными остатками любого набора, выбранного из группы, к которой относятся наборы указанных ниже аминокислотных остатков, показанных ниже в (а) или (b):
(a) аминокислотный остаток, присутствующий в вариабельной области тяжелой цепи в положении 39 согласно нумерации Kabat, и аминокислотный остаток, присутствующий в вариабельной области легкой цепи в положении 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, присутствующий в вариабельной области тяжелой цепи в положении 45 согласно нумерации Kabat, и аминокислотный остаток, присутствующий в вариабельной области легкой цепи в положении 44 согласно нумерации Kabat.
6. Способ получения биспецифического антитела по п. 5, отличающийся тем, что аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в набор (X) или (Y), как указано ниже:
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D); и
(Y) лизин (К), аргинин (R) или гистидин (Н).
7. Способ регулирования ассоциации тяжелой цепи и легкой цепи биспецифического антитела такой, что нежелательные ассоциации не образуются между тяжелой и легкой цепями, где тяжелая цепь представляет собой IgG1, а легкая цепь представляет собой IgK (Каппа), включающий:
1) введение замен в нуклеиновые кислоты, кодирующие тяжелую и легкую цепи биспецифического антитела таким образом, что тяжелая и легкая цепи содержат один или более наборов аминокислотных остатков, выбранных из группы, состоящей из наборов аминокислотных остатков, показанных ниже в (а)-(с), являются аминокислотными остатками, которые электрически взаимно отталкиваются:
(a) аминокислотный остаток, присутствующий в СН1 в положении 147, как указывается согласно нумерации ЕС, и аминокислотный остаток, присутствующий в CL в положении 180, как указывается согласно нумерации ЕС;
(b) аминокислотный остаток, присутствующий в СН1 в положении 147, как указывается согласно нумерации ЕС, и аминокислотный остаток, присутствующий в CL в положении 131, как указывается согласно нумерации ЕС; и
(c) аминокислотный остаток, присутствующий в СН1 в положении 175, как указывается согласно нумерации ЕС, и аминокислотный остаток, присутствующий в CL в положении 160, как указывается согласно нумерации ЕС,
(2) введение нуклеиновых кислот с указанными заменами в клетку-хозяина и культивирование клетки-хозяина таким образом, чтобы экспрессировались нуклеиновые кислоты, и
(3) сбор биспецифического антитела из культуры клетки-хозяина.
8. Способ по п. 7, дополнительно включающий введение замен в нуклеиновые кислоты таким образом, что аминокислотные остатки в наборе аминокислотных остатков, показанных ниже в (d), являются аминокислотными остатками, которые электрически взаимно отталкиваются:
(d) аминокислотный остаток, присутствующий в СН1 в положении 213, как указывается согласно нумерации ЕС, и аминокислотный остаток, присутствующий в CL в положении 123, как указывается согласно нумерации ЕС.
9. Способ по п. 7 или 8, отличающийся тем, что аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в набор (X) или (Y), как указано ниже:
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D); и
(Y) лизин (К), аргинин (R) или гистидин (Н).
10. Способ по п. 7 или 8, отличающийся тем, что дополнительно два или более аминокислотных остатка, образующих границу между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, являются аминокислотными остатками, которые электрически взаимно отталкиваются.
11. Способ по п. 10, отличающийся тем, что аминокислотные остатки, которые электрически взаимно отталкиваются, являются аминокислотными остатками любого набора, выбранного из группы, к которой относятся наборы аминокислотных остатков, показанных ниже в (а) или (b):
(a) аминокислотный остаток, присутствующий в вариабельной области тяжелой цепи в положении 39 согласно нумерации Kabat, и аминокислотный остаток, присутствующий в вариабельной области легкой цепи в положении 38 согласно нумерации Kabat; или
(b) аминокислотный остаток, присутствующий в вариабельной области тяжелой цепи в положении 45 согласно нумерации Kabat, и аминокислотный остаток, присутствующий в вариабельной области легкой цепи в положении 44 согласно нумерации Kabat.
12. Способ по п. 11, отличающийся тем, что аминокислотные остатки, которые электрически взаимно отталкиваются, выбраны из аминокислотных остатков, включенных в набор (X) или (Y), как указано ниже:
(X) глутаминовая кислота (Е) или аспарагиновая кислота (D); и
(Y) лизин (К), аргинин (R) или гистидин (Н).
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011238873 | 2011-10-31 | ||
| JP2011-238873 | 2011-10-31 | ||
| JP2011-2388732011 | 2011-10-31 | ||
| PCT/JP2012/078103 WO2013065708A1 (ja) | 2011-10-31 | 2012-10-31 | 重鎖と軽鎖の会合が制御された抗原結合分子 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2014122028A RU2014122028A (ru) | 2015-12-10 |
| RU2681885C2 true RU2681885C2 (ru) | 2019-03-13 |
Family
ID=48192053
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014122028A RU2681885C2 (ru) | 2011-10-31 | 2012-10-31 | Антигенсвязывающая молекула с регулируемой конъюгацией между тяжелой цепью и легкой цепью |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US11851476B2 (ru) |
| EP (1) | EP2787078B1 (ru) |
| JP (2) | JP6371059B2 (ru) |
| KR (2) | KR102168733B1 (ru) |
| CN (3) | CN104011207B (ru) |
| BR (1) | BR112014010257A2 (ru) |
| CA (1) | CA2853230C (ru) |
| ES (1) | ES2732712T3 (ru) |
| HK (2) | HK1259059A1 (ru) |
| MX (1) | MX359775B (ru) |
| RU (1) | RU2681885C2 (ru) |
| WO (1) | WO2013065708A1 (ru) |
Families Citing this family (93)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1870459B1 (en) | 2005-03-31 | 2016-06-29 | Chugai Seiyaku Kabushiki Kaisha | Methods for producing polypeptides by regulating polypeptide association |
| DK2006381T3 (en) | 2006-03-31 | 2016-02-22 | Chugai Pharmaceutical Co Ltd | PROCEDURE FOR REGULATING ANTIBODIES BLOOD PHARMACOKINETICS |
| DK2009101T3 (en) | 2006-03-31 | 2018-01-15 | Chugai Pharmaceutical Co Ltd | Antibody modification method for purification of a bispecific antibody |
| HUE029635T2 (en) | 2007-09-26 | 2017-03-28 | Chugai Pharmaceutical Co Ltd | A method for modifying an isoelectric point of an antibody by amino acid substitution in CDR |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| WO2010115589A1 (en) | 2009-04-07 | 2010-10-14 | Roche Glycart Ag | Trivalent, bispecific antibodies |
| US9676845B2 (en) | 2009-06-16 | 2017-06-13 | Hoffmann-La Roche, Inc. | Bispecific antigen binding proteins |
| US9493578B2 (en) | 2009-09-02 | 2016-11-15 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| AU2011283694B2 (en) | 2010-07-29 | 2017-04-13 | Xencor, Inc. | Antibodies with modified isoelectric points |
| RU2620071C2 (ru) | 2010-11-17 | 2017-05-22 | Чугаи Сеияку Кабушики Каиша | Мультиспецифическая связывающая антиген молекула, которая обладает альтернативной функцией к функции фактора свертывания крови viii |
| TW202323302A (zh) * | 2010-11-30 | 2023-06-16 | 日商中外製藥股份有限公司 | 細胞傷害誘導治療劑 |
| RU2607038C2 (ru) | 2011-02-28 | 2017-01-10 | Ф. Хоффманн-Ля Рош Аг | Антигенсвязывающие белки |
| CA2824824A1 (en) | 2011-02-28 | 2012-09-07 | F. Hoffmann-La Roche Ag | Monovalent antigen binding proteins |
| US10851178B2 (en) | 2011-10-10 | 2020-12-01 | Xencor, Inc. | Heterodimeric human IgG1 polypeptides with isoelectric point modifications |
| KR102168733B1 (ko) | 2011-10-31 | 2020-10-23 | 추가이 세이야쿠 가부시키가이샤 | 중쇄와 경쇄의 회합이 제어된 항원 결합 분자 |
| WO2013152860A2 (en) * | 2012-04-11 | 2013-10-17 | Dutalys Gmbh | Improved antibody light chains |
| CN105121630B (zh) | 2012-10-03 | 2018-09-25 | 酵活有限公司 | 定量重链和轻链多肽对的方法 |
| US9914785B2 (en) | 2012-11-28 | 2018-03-13 | Zymeworks Inc. | Engineered immunoglobulin heavy chain-light chain pairs and uses thereof |
| BR112015012385A2 (pt) | 2012-11-28 | 2019-08-27 | Zymeworks Inc | constructo de polipeptídeo de ligação de antígeno isolado, polinucleotídeo isolado ou conjunto de polinucleotídeos isolados, vetor ou conjunto de vetores, célula isolada, composição farmacêutica, uso do constructo, método para tratar um sujeito tendo uma doença ou distúrbio ou câncer ou doença vascular, método para inibir, reduzir ou bloquear um sinal dentro de uma célula, método para obter o constructo, método para preparar o constructo, meio de armazenamento legível por computador, método implementado por computador e método para produzir um constructo de polipeptídeo de ligação de antígeno bi-específico |
| US10968276B2 (en) | 2013-03-12 | 2021-04-06 | Xencor, Inc. | Optimized anti-CD3 variable regions |
| US11053316B2 (en) | 2013-01-14 | 2021-07-06 | Xencor, Inc. | Optimized antibody variable regions |
| EP3620473A1 (en) | 2013-01-14 | 2020-03-11 | Xencor, Inc. | Novel heterodimeric proteins |
| US9701759B2 (en) | 2013-01-14 | 2017-07-11 | Xencor, Inc. | Heterodimeric proteins |
| US10131710B2 (en) | 2013-01-14 | 2018-11-20 | Xencor, Inc. | Optimized antibody variable regions |
| US9605084B2 (en) | 2013-03-15 | 2017-03-28 | Xencor, Inc. | Heterodimeric proteins |
| US10487155B2 (en) | 2013-01-14 | 2019-11-26 | Xencor, Inc. | Heterodimeric proteins |
| US9738722B2 (en) | 2013-01-15 | 2017-08-22 | Xencor, Inc. | Rapid clearance of antigen complexes using novel antibodies |
| WO2014124326A1 (en) * | 2013-02-08 | 2014-08-14 | Stem Centrx, Inc. | Novel multispecific constructs |
| EP3486255A3 (en) * | 2013-03-13 | 2019-11-13 | Ibentrus Inc. | Protein in which electrical interaction is introduced within hydrophobic interaction site and preparation method therefor |
| US10519242B2 (en) | 2013-03-15 | 2019-12-31 | Xencor, Inc. | Targeting regulatory T cells with heterodimeric proteins |
| EP2970486B1 (en) | 2013-03-15 | 2018-05-16 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| US10858417B2 (en) | 2013-03-15 | 2020-12-08 | Xencor, Inc. | Heterodimeric proteins |
| US10106624B2 (en) | 2013-03-15 | 2018-10-23 | Xencor, Inc. | Heterodimeric proteins |
| CA2925256C (en) | 2013-09-27 | 2023-08-15 | Chugai Seiyaku Kabushiki Kaisha | Method for producing polypeptide heteromultimer |
| EP3055329B1 (en) | 2013-10-11 | 2018-06-13 | F. Hoffmann-La Roche AG | Multispecific domain exchanged common variable light chain antibodies |
| US9822186B2 (en) | 2014-03-28 | 2017-11-21 | Xencor, Inc. | Bispecific antibodies that bind to CD38 and CD3 |
| UA117289C2 (uk) * | 2014-04-02 | 2018-07-10 | Ф. Хоффманн-Ля Рош Аг | Мультиспецифічне антитіло |
| JP6629187B2 (ja) | 2014-04-07 | 2020-01-15 | 中外製薬株式会社 | 免疫活性化抗原結合分子 |
| EA201692287A1 (ru) | 2014-05-13 | 2017-06-30 | Чугаи Сеияку Кабушики Каиша | Антигенсвязывающая молекула, перенаправляющая т-клетки на клетки, обладающие иммуносупрессорной функцией |
| WO2015181805A1 (en) | 2014-05-28 | 2015-12-03 | Zymeworks Inc. | Modified antigen binding polypeptide constructs and uses thereof |
| MA40764A (fr) | 2014-09-26 | 2017-08-01 | Chugai Pharmaceutical Co Ltd | Agent thérapeutique induisant une cytotoxicité |
| EP3204415B1 (en) * | 2014-10-09 | 2020-06-17 | EngMab Sàrl | Bispecific antibodies against cd3epsilon and ror1 |
| AU2015329966A1 (en) * | 2014-10-09 | 2017-04-27 | Engmab Sàrl | Bispecific antibodies against CD3epsilon and ROR1 for use in the treatment of ovarian cancer |
| JP2017536830A (ja) | 2014-11-26 | 2017-12-14 | ゼンコー・インコーポレイテッドXencor、 Inc. | Cd3及びcd38に結合するヘテロ二量体抗体 |
| US10259887B2 (en) | 2014-11-26 | 2019-04-16 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and tumor antigens |
| EA201791139A1 (ru) | 2014-11-26 | 2018-04-30 | Ксенкор, Инк. | Гетеродимерные антитела, которые связывают cd3 и опухолевые антигены |
| JP6721590B2 (ja) | 2014-12-03 | 2020-07-15 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性抗体 |
| WO2016105450A2 (en) | 2014-12-22 | 2016-06-30 | Xencor, Inc. | Trispecific antibodies |
| US10953106B2 (en) | 2015-02-16 | 2021-03-23 | Lonza Ltd | Antibodies |
| WO2016141387A1 (en) | 2015-03-05 | 2016-09-09 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| EP3279216A4 (en) | 2015-04-01 | 2019-06-19 | Chugai Seiyaku Kabushiki Kaisha | PROCESS FOR PREPARING POLYPEPTIDE HETERO OLIGOMER |
| AU2016252773B2 (en) * | 2015-04-24 | 2022-06-02 | Genentech, Inc. | Multispecific antigen-binding proteins |
| NZ737205A (en) | 2015-06-24 | 2024-07-26 | F Hoffmann La Roche Ag | Anti-transferrin receptor antibodies with tailored affinity |
| EP3150636A1 (en) * | 2015-10-02 | 2017-04-05 | F. Hoffmann-La Roche AG | Tetravalent multispecific antibodies |
| MY192668A (en) * | 2015-10-02 | 2022-08-30 | Hoffmann La Roche | Bispecific anti-human cd20/human transferrin receptor antibodies and methods of use |
| AR106189A1 (es) | 2015-10-02 | 2017-12-20 | Hoffmann La Roche | ANTICUERPOS BIESPECÍFICOS CONTRA EL A-b HUMANO Y EL RECEPTOR DE TRANSFERRINA HUMANO Y MÉTODOS DE USO |
| JP6932693B2 (ja) | 2015-10-08 | 2021-09-08 | ザイムワークス,インコーポレイテッド | カッパ及びラムダ軽鎖を含む抗原結合ポリペプチド構築物及びその使用 |
| EP3378487B1 (en) | 2015-11-18 | 2022-03-16 | Chugai Seiyaku Kabushiki Kaisha | Combination therapy using t cell redirection antigen binding molecule against cell having immunosuppressing function |
| WO2017086419A1 (ja) | 2015-11-18 | 2017-05-26 | 中外製薬株式会社 | 液性免疫応答の増強方法 |
| EP3387013B1 (en) | 2015-12-07 | 2022-06-08 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and psma |
| EP3395835B1 (en) | 2015-12-25 | 2021-02-03 | Chugai Seiyaku Kabushiki Kaisha | Antibody having enhanced activity, and method for modifying same |
| EP3398965A4 (en) | 2015-12-28 | 2019-09-18 | Chugai Seiyaku Kabushiki Kaisha | METHOD FOR PROMOTING THE EFFICACY OF PURIFYING A POLYPEPTIDE CONTAINING AN FC REGION |
| EP3397646A1 (en) | 2015-12-28 | 2018-11-07 | Massachusetts Institute of Technology | Bispecific antibodies having constant region mutations and uses therefor |
| MX2018008934A (es) | 2016-01-22 | 2019-03-28 | Janssen Biotech Inc | Anticuerpos anti-ror1, anticuerpos biespecíficos ror1 x cd3 y métodos para su uso. |
| US11072666B2 (en) | 2016-03-14 | 2021-07-27 | Chugai Seiyaku Kabushiki Kaisha | Cell injury inducing therapeutic drug for use in cancer therapy |
| RU2767357C2 (ru) | 2016-06-14 | 2022-03-17 | Ксенкор, Инк. | Биспецифические антитела-ингибиторы контрольных точек |
| WO2018005706A1 (en) | 2016-06-28 | 2018-01-04 | Xencor, Inc. | Heterodimeric antibodies that bind somatostatin receptor 2 |
| SG11201900373WA (en) * | 2016-07-19 | 2019-02-27 | Ibentrus Inc | Bispecific proteins and methods for preparing same |
| US10793632B2 (en) | 2016-08-30 | 2020-10-06 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| RU2019114175A (ru) | 2016-10-14 | 2020-11-16 | Ксенкор, Инк. | Биспецифические гетеродимерные слитые белки, содержащие fc-слитые белки il-15/il-15ra и фрагменты антитела к pd-1 |
| CN110382529B (zh) | 2017-03-02 | 2024-03-08 | 诺华股份有限公司 | 工程化的异源二聚体蛋白质 |
| JP7432365B2 (ja) * | 2017-03-27 | 2024-02-16 | ビオミューネクス・ファルマシューティカル | 安定な多重特異性抗体 |
| WO2019006472A1 (en) | 2017-06-30 | 2019-01-03 | Xencor, Inc. | TARGETED HETETRODIMERIC FUSION PROTEINS CONTAINING IL-15 / IL-15RA AND ANTIGEN-BINDING DOMAINS |
| UA128389C2 (uk) * | 2017-09-29 | 2024-07-03 | Чугаі Сейяку Кабусікі Кайся | Мультиспецифічна антигензв'язувальна молекула, яка має активність заміщувати кофакторну функцію фактора коагуляції крові viii (fviii), та фармацевтичний склад, який містить згадану молекулу як активний інгредієнт |
| US10981992B2 (en) | 2017-11-08 | 2021-04-20 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| CA3082383A1 (en) | 2017-11-08 | 2019-05-16 | Xencor, Inc. | Bispecific and monospecific antibodies using novel anti-pd-1 sequences |
| MX2020006322A (es) | 2017-12-19 | 2020-09-18 | Xencor Inc | Proteinas de fusion il-2 fc modificadas. |
| WO2019148412A1 (en) | 2018-02-01 | 2019-08-08 | Merck Sharp & Dohme Corp. | Anti-pd-1/lag3 bispecific antibodies |
| EP3773911A2 (en) | 2018-04-04 | 2021-02-17 | Xencor, Inc. | Heterodimeric antibodies that bind fibroblast activation protein |
| JP2021520829A (ja) | 2018-04-18 | 2021-08-26 | ゼンコア インコーポレイテッド | IL−15/IL−15RA Fc融合タンパク質およびTIM−3抗原結合ドメインを含む、TIM−3標的化ヘテロ二量体融合タンパク質 |
| MX2020010910A (es) | 2018-04-18 | 2021-02-09 | Xencor Inc | Proteinas de fusion heterodimericas dirigidas a pd-1 que contienen proteinas de fusion il-15 / il-15ra fc y dominios de union al antigeno pd-1 y usos de los mismos. |
| US11358999B2 (en) | 2018-10-03 | 2022-06-14 | Xencor, Inc. | IL-12 heterodimeric Fc-fusion proteins |
| AU2019412561A1 (en) | 2018-12-24 | 2021-08-12 | Sanofi | Multispecific binding proteins with mutant Fab domains |
| EP3930850A1 (en) | 2019-03-01 | 2022-01-05 | Xencor, Inc. | Heterodimeric antibodies that bind enpp3 and cd3 |
| CN113950485A (zh) | 2019-07-10 | 2022-01-18 | 中外制药株式会社 | 密蛋白-6结合分子及其用途 |
| US11919956B2 (en) | 2020-05-14 | 2024-03-05 | Xencor, Inc. | Heterodimeric antibodies that bind prostate specific membrane antigen (PSMA) and CD3 |
| MX2023001962A (es) | 2020-08-19 | 2023-04-26 | Xencor Inc | Composiciones anti-cd28. |
| US11739153B2 (en) * | 2020-09-18 | 2023-08-29 | Chugai Seiyaku Kabushiki Kaisha | Anti-HLA-DQ2.5 antibody and its use for the treatment of celiac disease |
| CN114437226A (zh) * | 2020-11-05 | 2022-05-06 | 杭州菁因康生物科技有限公司 | 制备双特异性抗体的方法 |
| AU2022232375A1 (en) | 2021-03-09 | 2023-09-21 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and cldn6 |
| EP4305065A1 (en) | 2021-03-10 | 2024-01-17 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and gpc3 |
| WO2023053282A1 (ja) | 2021-09-29 | 2023-04-06 | 中外製薬株式会社 | がんの治療に用いるための細胞傷害誘導治療剤 |
| JPWO2023058723A1 (ru) | 2021-10-08 | 2023-04-13 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1870459A1 (en) * | 2005-03-31 | 2007-12-26 | Chugai Seiyaku Kabushiki Kaisha | Methods for producing polypeptides by regulating polypeptide association |
| WO2007147901A1 (en) * | 2006-06-22 | 2007-12-27 | Novo Nordisk A/S | Production of bispecific antibodies |
| EP2009101A1 (en) * | 2006-03-31 | 2008-12-31 | Chugai Seiyaku Kabushiki Kaisha | Antibody modification method for purifying bispecific antibody |
Family Cites Families (136)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS58201994A (ja) | 1982-05-21 | 1983-11-25 | Hideaki Hagiwara | 抗原特異的ヒト免疫グロブリンの生産方法 |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| JP3101690B2 (ja) | 1987-03-18 | 2000-10-23 | エス・ビィ・2・インコーポレイテッド | 変性抗体の、または変性抗体に関する改良 |
| JPH06508511A (ja) | 1990-07-10 | 1994-09-29 | ケンブリッジ アンティボディー テクノロジー リミティド | 特異的な結合ペアーの構成員の製造方法 |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| DK0814159T3 (da) | 1990-08-29 | 2005-10-24 | Genpharm Int | Transgene, ikke-humane dyr, der er i stand til at danne heterologe antistoffer |
| DE69229477T2 (de) | 1991-09-23 | 1999-12-09 | Cambridge Antibody Technology Ltd., Melbourn | Methoden zur Herstellung humanisierter Antikörper |
| US5474771A (en) | 1991-11-15 | 1995-12-12 | The Trustees Of Columbia University In The City Of New York | Murine monoclonal antibody (5c8) recognizes a human glycoprotein on the surface of T-lymphocytes, compositions containing same |
| US6025165A (en) | 1991-11-25 | 2000-02-15 | Enzon, Inc. | Methods for producing multivalent antigen-binding proteins |
| ES2313867T3 (es) | 1991-12-02 | 2009-03-16 | Medical Research Council | Produccion de anticuerpos anti-auto de repertorios de segmentos de anticuerpo expresados en la superficie de fagos. |
| CA2124967C (en) | 1991-12-17 | 2008-04-08 | Nils Lonberg | Transgenic non-human animals capable of producing heterologous antibodies |
| US5667988A (en) | 1992-01-27 | 1997-09-16 | The Scripps Research Institute | Methods for producing antibody libraries using universal or randomized immunoglobulin light chains |
| WO1993019172A1 (en) | 1992-03-24 | 1993-09-30 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| GB9206422D0 (en) | 1992-03-24 | 1992-05-06 | Bolt Sarah L | Antibody preparation |
| CA2140638C (en) | 1992-07-24 | 2010-05-04 | Raju Kucherlapati | Generation of xenogeneic antibodies |
| ZA936260B (en) | 1992-09-09 | 1994-03-18 | Smithkline Beecham Corp | Novel antibodies for conferring passive immunity against infection by a pathogen in man |
| GB9313509D0 (en) | 1993-06-30 | 1993-08-11 | Medical Res Council | Chemisynthetic libraries |
| EP0731842A1 (en) | 1993-12-03 | 1996-09-18 | Medical Research Council | Recombinant binding proteins and peptides |
| WO1995015393A1 (fr) | 1993-12-03 | 1995-06-08 | Asahi Kasei Kogyo Kabushiki Kaisha | Nouveau vecteur de detection d'expression |
| AU701342B2 (en) | 1994-07-13 | 1999-01-28 | Chugai Seiyaku Kabushiki Kaisha | Reconstituted human antibody against human interleukin-8 |
| US6485943B2 (en) | 1995-01-17 | 2002-11-26 | The University Of Chicago | Method for altering antibody light chain interactions |
| WO1996026648A1 (en) | 1995-02-28 | 1996-09-06 | The Procter & Gamble Company | Preparation of noncarbonated beverage products having superior microbial stability |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| EP1709970A1 (en) | 1995-04-27 | 2006-10-11 | Abgenix, Inc. | Human antibodies against EGFR, derived from immunized xenomice |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| KR100259828B1 (ko) | 1995-09-11 | 2000-06-15 | 히라타 다다시 | 인체 인터루킨 5 수용체 알파-사슬에 대한 항체 |
| HUP9904177A3 (en) | 1996-09-26 | 2001-10-29 | Chugai Pharmaceutical Co Ltd | Antibody against human parathormone related peptides |
| FR2761994B1 (fr) | 1997-04-11 | 1999-06-18 | Centre Nat Rech Scient | Preparation de recepteurs membranaires a partir de baculovirus extracellulaires |
| US20020062010A1 (en) | 1997-05-02 | 2002-05-23 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| DK0979281T3 (da) | 1997-05-02 | 2005-11-21 | Genentech Inc | Fremgangsmåde til fremstilling af multispecifikke antistoffer med heteromultimere og fælles bestanddele |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| US7029652B2 (en) | 1998-09-16 | 2006-04-18 | The Regents Of The University Of California | Method of treating tumors |
| WO2000018806A1 (de) | 1998-09-25 | 2000-04-06 | Horst Lindhofer | Bispezifische und trispezifische antikörper, die spezifisch mit induzierbaren oberflächenantigenen als operationelle zielstrukturen reagieren |
| US7183387B1 (en) | 1999-01-15 | 2007-02-27 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| KR101155191B1 (ko) | 1999-01-15 | 2012-06-13 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| EP1299419A2 (en) | 2000-05-24 | 2003-04-09 | Imclone Systems, Inc. | Bispecific immunoglobulin-like antigen binding proteins and method of production |
| CN1294148C (zh) | 2001-04-11 | 2007-01-10 | 中国科学院遗传与发育生物学研究所 | 环状单链三特异抗体 |
| US6833441B2 (en) | 2001-08-01 | 2004-12-21 | Abmaxis, Inc. | Compositions and methods for generating chimeric heteromultimers |
| HUP0600342A3 (en) | 2001-10-25 | 2011-03-28 | Genentech Inc | Glycoprotein compositions |
| US20030224397A1 (en) | 2002-02-11 | 2003-12-04 | Genentech, Inc. | Antibody variants with faster antigen association rates |
| US20040002587A1 (en) | 2002-02-20 | 2004-01-01 | Watkins Jeffry D. | Fc region variants |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| US20040110226A1 (en) | 2002-03-01 | 2004-06-10 | Xencor | Antibody optimization |
| US7736652B2 (en) | 2002-03-21 | 2010-06-15 | The Regents Of The University Of California | Antibody fusion proteins: effective adjuvants of protein vaccination |
| JP2004086862A (ja) | 2002-05-31 | 2004-03-18 | Celestar Lexico-Sciences Inc | タンパク質相互作用情報処理装置、タンパク質相互作用情報処理方法、プログラム、および、記録媒体 |
| EP1510943A4 (en) | 2002-05-31 | 2007-05-09 | Celestar Lexico Sciences Inc | INTERACTION PREDICTION DEVICE |
| EP2135879A3 (en) | 2002-06-28 | 2010-06-23 | Domantis Limited | Ligand |
| US20060235208A1 (en) | 2002-09-27 | 2006-10-19 | Xencor, Inc. | Fc variants with optimized properties |
| PL218660B1 (pl) | 2002-10-17 | 2015-01-30 | Genmab As | Izolowane ludzkie przeciwciało monoklonalne wiążące ludzki CD20, związane z tym przeciwciałem transfektoma, komórka gospodarza, transgeniczne zwierzę lub roślina, kompozycja, immunokoniugat, cząsteczka bispecyficzna, wektor ekspresyjny, kompozycja farmaceutyczna, zastosowanie medyczne, zestaw oraz przeciwciało antyidiotypowe i jego zastosowanie |
| US8388955B2 (en) | 2003-03-03 | 2013-03-05 | Xencor, Inc. | Fc variants |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| EP2502935B1 (en) | 2003-08-22 | 2017-03-29 | Biogen MA Inc. | Improved antibodies having altered effector function and methods for making the same |
| WO2005035753A1 (ja) | 2003-10-10 | 2005-04-21 | Chugai Seiyaku Kabushiki Kaisha | 機能蛋白質を代替する二重特異性抗体 |
| WO2005063815A2 (en) | 2003-11-12 | 2005-07-14 | Biogen Idec Ma Inc. | Fcϝ receptor-binding polypeptide variants and methods related thereto |
| CA2550996A1 (en) | 2003-12-22 | 2005-07-14 | Centocor, Inc. | Methods for generating multimeric molecules |
| SG188175A1 (en) | 2004-06-03 | 2013-03-28 | Novimmune Sa | Anti-cd3 antibodies and methods of use thereof |
| NZ579543A (en) | 2004-07-09 | 2011-07-29 | Chugai Pharmaceutical Co Ltd | Anti-glypican 3 antibody |
| EP2213683B1 (en) | 2004-08-04 | 2013-06-05 | Mentrik Biotech, LLC | Variant Fc regions |
| AU2005282700A1 (en) | 2004-09-02 | 2006-03-16 | Genentech, Inc. | Heteromultimeric molecules |
| US20060074225A1 (en) | 2004-09-14 | 2006-04-06 | Xencor, Inc. | Monomeric immunoglobulin Fc domains |
| CA2595169A1 (en) | 2005-01-12 | 2006-07-20 | Xencor, Inc. | Antibodies and fc fusion proteins with altered immunogenicity |
| EP1870458B1 (en) | 2005-03-31 | 2018-05-09 | Chugai Seiyaku Kabushiki Kaisha | sc(Fv)2 STRUCTURAL ISOMERS |
| AU2006230413B8 (en) | 2005-03-31 | 2011-01-20 | Xencor, Inc | Fc variants with optimized properties |
| CA2603264C (en) | 2005-04-08 | 2017-03-21 | Chugai Seiyaku Kabushiki Kaisha | Antibody substituting for function of blood coagulation factor viii |
| CN101262885B (zh) * | 2005-06-10 | 2015-04-01 | 中外制药株式会社 | 含有sc(Fv)2的药物组合物 |
| TW200718780A (en) | 2005-06-10 | 2007-05-16 | Chugai Pharmaceutical Co Ltd | Sc(Fv)2 site-directed mutant |
| DK1931709T3 (en) | 2005-10-03 | 2017-03-13 | Xencor Inc | FC VARIETIES WITH OPTIMIZED FC RECEPTOR BINDING PROPERTIES |
| WO2007053659A2 (en) | 2005-11-01 | 2007-05-10 | Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | Method of screening for hepatocellular carcinoma |
| EP1820513A1 (en) | 2006-02-15 | 2007-08-22 | Trion Pharma Gmbh | Destruction of tumor cells expressing low to medium levels of tumor associated target antigens by trifunctional bispecific antibodies |
| TW200745163A (en) | 2006-02-17 | 2007-12-16 | Syntonix Pharmaceuticals Inc | Peptides that block the binding of IgG to FcRn |
| JP5474531B2 (ja) | 2006-03-24 | 2014-04-16 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | 操作されたヘテロ二量体タンパク質ドメイン |
| CN101460622A (zh) * | 2006-03-31 | 2009-06-17 | 中外制药株式会社 | 用于纯化双特异性抗体的抗体修饰方法 |
| DK2006381T3 (en) | 2006-03-31 | 2016-02-22 | Chugai Pharmaceutical Co Ltd | PROCEDURE FOR REGULATING ANTIBODIES BLOOD PHARMACOKINETICS |
| GB0611116D0 (en) | 2006-06-06 | 2006-07-19 | Oxford Genome Sciences Uk Ltd | Proteins |
| JP2009539841A (ja) | 2006-06-06 | 2009-11-19 | トラークス,インコーポレイテッド | 自己免疫疾患の治療における抗cd3抗体の投与 |
| JPWO2008090960A1 (ja) | 2007-01-24 | 2010-05-20 | 協和発酵キリン株式会社 | ガングリオシドgm2に特異的に結合する遺伝子組換え抗体組成物 |
| CA2681974C (en) | 2007-03-29 | 2019-12-31 | Genmab A/S | Bispecific antibodies and methods for production thereof |
| WO2008119567A2 (en) | 2007-04-03 | 2008-10-09 | Micromet Ag | Cross-species-specific cd3-epsilon binding domain |
| WO2009011941A2 (en) | 2007-04-04 | 2009-01-22 | The Government Of U.S.A., As Represented By The Secretary, Departmetnt Of Health & Human Services | Monoclonal antibodies against dengue and other viruses with deletion in fc region |
| JP6071165B2 (ja) | 2007-05-31 | 2017-02-01 | ゲンマブ エー/エス | 安定なIgG4抗体 |
| CA2691618A1 (en) | 2007-06-29 | 2009-01-08 | Schering Corporation | Mdl-1 uses |
| SG193868A1 (en) | 2007-09-26 | 2013-10-30 | Chugai Pharmaceutical Co Ltd | Modified antibody constant region |
| JP5314033B2 (ja) | 2007-10-22 | 2013-10-16 | メルク セローノ ソシエテ アノニム | 突然変異IgGFcフラグメントと融合した単一IFN−ベータ |
| US8242247B2 (en) | 2007-12-21 | 2012-08-14 | Hoffmann-La Roche Inc. | Bivalent, bispecific antibodies |
| US8227577B2 (en) | 2007-12-21 | 2012-07-24 | Hoffman-La Roche Inc. | Bivalent, bispecific antibodies |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| HUE028536T2 (en) | 2008-01-07 | 2016-12-28 | Amgen Inc | Method for producing antibody to FC heterodimer molecules using electrostatic control effects |
| SI2274008T1 (sl) | 2008-03-27 | 2014-08-29 | Zymogenetics, Inc. | Sestavki in metode za zaviranje PDGFRBETA in VEGF-A |
| DK2708559T3 (en) | 2008-04-11 | 2018-06-14 | Chugai Pharmaceutical Co Ltd | Antigen-binding molecule capable of repeatedly binding two or more antigen molecules |
| EP2282769A4 (en) | 2008-04-29 | 2012-04-25 | Abbott Lab | DUAL VARIABLE DOMAIN IMMUNOGLOBULINS AND ITS USES |
| EP2342231A1 (en) | 2008-09-26 | 2011-07-13 | Roche Glycart AG | Bispecific anti-egfr/anti-igf-1r antibodies |
| DE202008016028U1 (de) | 2008-12-04 | 2010-04-15 | Melitta Haushaltsprodukte Gmbh & Co. Kg | Behälter zur Aufbewahrung von Gegenständen |
| JP2012515556A (ja) | 2009-01-23 | 2012-07-12 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 低下したエフェクタ機能を有する安定化Fcポリペプチドおよび使用方法 |
| RU2015132478A (ru) | 2009-03-05 | 2015-12-10 | Эббви Инк. | Связывающие il-17 белки |
| TWI682995B (zh) | 2009-03-19 | 2020-01-21 | 日商中外製藥股份有限公司 | 抗體恆定區域改變體 |
| JP5717624B2 (ja) | 2009-03-19 | 2015-05-13 | 中外製薬株式会社 | 抗体定常領域改変体 |
| EP2233500A1 (en) | 2009-03-20 | 2010-09-29 | LFB Biotechnologies | Optimized Fc variants |
| CA2757382A1 (en) | 2009-04-01 | 2010-10-21 | Kristi Elkins | Anti-fcrh5 antibodies and immunoconjugates |
| WO2010115589A1 (en) | 2009-04-07 | 2010-10-14 | Roche Glycart Ag | Trivalent, bispecific antibodies |
| US9067986B2 (en) | 2009-04-27 | 2015-06-30 | Oncomed Pharmaceuticals, Inc. | Method for making heteromultimeric molecules |
| MA33405B1 (fr) | 2009-05-15 | 2012-07-03 | Chugai Pharmaceutical Co Ltd | Anticorps anti-axl |
| KR101747103B1 (ko) | 2009-06-26 | 2017-06-14 | 리제너론 파마슈티칼스 인코포레이티드 | 천연 면역글로불린 포맷을 가지는 용이하게 분리된 이중특이성 항체 |
| US10053513B2 (en) | 2009-11-30 | 2018-08-21 | Janssen Biotech, Inc. | Antibody Fc mutants with ablated effector functions |
| BR112012017124C1 (pt) | 2009-12-25 | 2021-08-31 | Chugai Pharmaceutical Co Ltd | Método para produzir e para purificar um multímero polipeptídico |
| CA2791652C (en) | 2010-03-02 | 2018-06-12 | Kyowa Hakko Kirin Co., Ltd. | Modified antibody composition |
| WO2011108714A1 (ja) | 2010-03-04 | 2011-09-09 | 中外製薬株式会社 | 抗体定常領域改変体 |
| JP6040148B2 (ja) | 2010-04-20 | 2016-12-07 | ゲンマブ エー/エス | ヘテロ二量体抗体Fc含有タンパク質およびその産生方法 |
| ES2617777T5 (es) | 2010-04-23 | 2022-10-13 | Hoffmann La Roche | Producción de proteínas heteromultiméricas |
| JP6022444B2 (ja) | 2010-05-14 | 2016-11-09 | ライナット ニューロサイエンス コーポレイション | ヘテロ二量体タンパク質ならびにそれを生産および精製するための方法 |
| CN107253992B (zh) | 2010-05-27 | 2022-03-11 | 根马布股份公司 | 针对her2的单克隆抗体 |
| EP2603526A1 (en) | 2010-08-13 | 2013-06-19 | Medimmune Limited | Monomeric polypeptides comprising variant fc regions and methods of use |
| DK2635607T3 (da) | 2010-11-05 | 2019-11-18 | Zymeworks Inc | Stabilt heterodimert antistofdesign med mutationer i fc-domænet |
| RU2620071C2 (ru) | 2010-11-17 | 2017-05-22 | Чугаи Сеияку Кабушики Каиша | Мультиспецифическая связывающая антиген молекула, которая обладает альтернативной функцией к функции фактора свертывания крови viii |
| TW202323302A (zh) * | 2010-11-30 | 2023-06-16 | 日商中外製藥股份有限公司 | 細胞傷害誘導治療劑 |
| KR20230005405A (ko) | 2011-02-25 | 2023-01-09 | 추가이 세이야쿠 가부시키가이샤 | FcγRIIb 특이적 Fc 항체 |
| CA2812739A1 (en) | 2011-03-25 | 2012-10-04 | Glenmark Pharmaceuticals S.A. | Hetero-dimeric immunoglobulins |
| AU2012328322A1 (en) | 2011-10-27 | 2014-06-12 | Genmab A/S | Production of heterodimeric proteins |
| KR102168733B1 (ko) | 2011-10-31 | 2020-10-23 | 추가이 세이야쿠 가부시키가이샤 | 중쇄와 경쇄의 회합이 제어된 항원 결합 분자 |
| HRP20211773T1 (hr) | 2011-11-04 | 2022-03-04 | Zymeworks Inc. | Stabilna heterodimerni dizajn antitijela s mutacijama u fc domeni |
| WO2014067011A1 (en) | 2012-11-02 | 2014-05-08 | Zymeworks Inc. | Crystal structures of heterodimeric fc domains |
| GB201203051D0 (en) | 2012-02-22 | 2012-04-04 | Ucb Pharma Sa | Biological products |
| EA035344B1 (ru) | 2012-04-20 | 2020-05-29 | Мерюс Н.В. | Способ получения двух антител из одной клетки-хозяина |
| ES2773107T3 (es) | 2012-10-05 | 2020-07-09 | Kyowa Kirin Co Ltd | Composición de proteína heterodimérica |
| CA2925256C (en) | 2013-09-27 | 2023-08-15 | Chugai Seiyaku Kabushiki Kaisha | Method for producing polypeptide heteromultimer |
| MA40764A (fr) | 2014-09-26 | 2017-08-01 | Chugai Pharmaceutical Co Ltd | Agent thérapeutique induisant une cytotoxicité |
| EP3279216A4 (en) | 2015-04-01 | 2019-06-19 | Chugai Seiyaku Kabushiki Kaisha | PROCESS FOR PREPARING POLYPEPTIDE HETERO OLIGOMER |
| EP3463451A1 (en) | 2016-05-26 | 2019-04-10 | Qilu Puget Sound Biotherapeutics Corporation | Mixtures of antibodies |
| SG11201900373WA (en) | 2016-07-19 | 2019-02-27 | Ibentrus Inc | Bispecific proteins and methods for preparing same |
| EP3619238A4 (en) | 2017-05-02 | 2021-02-24 | Chugai Seiyaku Kabushiki Kaisha | CYTOTOXICITY INDUCING THERAPEUTIC |
| JP2020522266A (ja) | 2017-06-05 | 2020-07-30 | ヤンセン バイオテツク,インコーポレーテツド | 非対称なch2−ch3領域の変異を有する、操作された多重特異性抗体及び他の多量体タンパク質 |
| UA128389C2 (uk) * | 2017-09-29 | 2024-07-03 | Чугаі Сейяку Кабусікі Кайся | Мультиспецифічна антигензв'язувальна молекула, яка має активність заміщувати кофакторну функцію фактора коагуляції крові viii (fviii), та фармацевтичний склад, який містить згадану молекулу як активний інгредієнт |
| WO2019131988A1 (en) | 2017-12-28 | 2019-07-04 | Chugai Seiyaku Kabushiki Kaisha | Cytotoxicity-inducing therapeutic agent |
| KR20210011002A (ko) | 2018-05-16 | 2021-01-29 | 얀센 바이오테크 인코포레이티드 | 암을 치료하는 방법 및 t-세포 재유도 치료제의 효능을 향상시키는 방법 |
| JPWO2021201202A1 (ru) | 2020-04-02 | 2021-10-07 |
-
2012
- 2012-10-31 KR KR1020147013743A patent/KR102168733B1/ko active IP Right Grant
- 2012-10-31 CN CN201280065166.0A patent/CN104011207B/zh active Active
- 2012-10-31 MX MX2014005045A patent/MX359775B/es active IP Right Grant
- 2012-10-31 KR KR1020207028953A patent/KR102398736B1/ko active IP Right Grant
- 2012-10-31 CN CN201811040840.5A patent/CN109111524B/zh active Active
- 2012-10-31 CA CA2853230A patent/CA2853230C/en active Active
- 2012-10-31 WO PCT/JP2012/078103 patent/WO2013065708A1/ja active Application Filing
- 2012-10-31 CN CN201811040667.9A patent/CN109134658B/zh active Active
- 2012-10-31 US US14/351,654 patent/US11851476B2/en active Active
- 2012-10-31 BR BR112014010257A patent/BR112014010257A2/pt not_active Application Discontinuation
- 2012-10-31 EP EP12846665.3A patent/EP2787078B1/en not_active Revoked
- 2012-10-31 JP JP2013541800A patent/JP6371059B2/ja active Active
- 2012-10-31 ES ES12846665T patent/ES2732712T3/es active Active
- 2012-10-31 RU RU2014122028A patent/RU2681885C2/ru active
-
2017
- 2017-05-30 JP JP2017106434A patent/JP6557286B2/ja active Active
-
2019
- 2019-01-29 HK HK19101559.0A patent/HK1259059A1/zh unknown
- 2019-01-29 HK HK19101558.1A patent/HK1259058A1/zh unknown
- 2019-11-22 US US16/692,676 patent/US20200087380A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1870459A1 (en) * | 2005-03-31 | 2007-12-26 | Chugai Seiyaku Kabushiki Kaisha | Methods for producing polypeptides by regulating polypeptide association |
| EP2009101A1 (en) * | 2006-03-31 | 2008-12-31 | Chugai Seiyaku Kabushiki Kaisha | Antibody modification method for purifying bispecific antibody |
| WO2007147901A1 (en) * | 2006-06-22 | 2007-12-27 | Novo Nordisk A/S | Production of bispecific antibodies |
Non-Patent Citations (8)
Also Published As
| Publication number | Publication date |
|---|---|
| KR20200123842A (ko) | 2020-10-30 |
| US20200087380A1 (en) | 2020-03-19 |
| CN104011207A (zh) | 2014-08-27 |
| RU2014122028A (ru) | 2015-12-10 |
| HK1259059A1 (zh) | 2019-11-22 |
| KR102168733B1 (ko) | 2020-10-23 |
| ES2732712T3 (es) | 2019-11-25 |
| US20140370020A1 (en) | 2014-12-18 |
| BR112014010257A2 (pt) | 2017-04-18 |
| CN109134658B (zh) | 2022-10-14 |
| JPWO2013065708A1 (ja) | 2015-04-02 |
| MX2014005045A (es) | 2014-08-22 |
| WO2013065708A1 (ja) | 2013-05-10 |
| CN104011207B (zh) | 2018-09-18 |
| CN109111524A (zh) | 2019-01-01 |
| CN109134658A (zh) | 2019-01-04 |
| MX359775B (es) | 2018-10-10 |
| EP2787078A1 (en) | 2014-10-08 |
| JP6557286B2 (ja) | 2019-08-07 |
| CN109111524B (zh) | 2022-10-28 |
| EP2787078B1 (en) | 2019-05-22 |
| KR20140084249A (ko) | 2014-07-04 |
| CA2853230A1 (en) | 2013-05-10 |
| HK1259058A1 (zh) | 2019-11-22 |
| KR102398736B1 (ko) | 2022-05-16 |
| CA2853230C (en) | 2021-11-23 |
| US11851476B2 (en) | 2023-12-26 |
| EP2787078A4 (en) | 2015-06-17 |
| JP2017212981A (ja) | 2017-12-07 |
| JP6371059B2 (ja) | 2018-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2681885C2 (ru) | Антигенсвязывающая молекула с регулируемой конъюгацией между тяжелой цепью и легкой цепью | |
| US20220389054A1 (en) | Polypeptide modification method for purifying polypeptide multimers | |
| CN101874042B9 (zh) | 利用cdr的氨基酸取代来改变抗体等电点的方法 | |
| KR101374454B1 (ko) | 회합제어에 의한 폴리펩티드 제조방법 |