KR20140002594A - 면역억제 조절 화합물 - Google Patents
면역억제 조절 화합물 Download PDFInfo
- Publication number
- KR20140002594A KR20140002594A KR1020137001288A KR20137001288A KR20140002594A KR 20140002594 A KR20140002594 A KR 20140002594A KR 1020137001288 A KR1020137001288 A KR 1020137001288A KR 20137001288 A KR20137001288 A KR 20137001288A KR 20140002594 A KR20140002594 A KR 20140002594A
- Authority
- KR
- South Korea
- Prior art keywords
- strand
- loop
- amino acid
- amino acids
- peptide
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/02—Drugs for genital or sexual disorders; Contraceptives for disorders of the vagina
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/06—Drugs for disorders of the endocrine system of the anterior pituitary hormones, e.g. TSH, ACTH, FSH, LH, PRL, GH
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/10—Drugs for disorders of the endocrine system of the posterior pituitary hormones, e.g. oxytocin, ADH
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/18—Drugs for disorders of the endocrine system of the parathyroid hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 발명은 세포예정사 1 (PD1) 신호전달 경로를 억제할 수 있는 면역억제 화합물을 제공한다. 본 발명은 또한 PD-1, PD-L1 또는 PD-L2에 의한 면역억제 신호전달의 억제에 의해 야기된 면역강화를 통해 감염을 치료하고 암을 치료하기 위한 펩티드계 조성물; 이들을 이용한 치료; 및 활성성분으로서 포함된 면역강화 기질을 제공한다. 또한, 본 발명은 암, 암 전이, 면역결핍증, 감염 질환 등을 위한 예방 및/또는 치료제에 대한 펩티드 부분을 함유하는 조성물의 이용; 이러한 질병에 대한 시험 또는 진단 시약 또는 연구 시약으로서 펩티드 부분의 이용을 제공한다.
Description
본 출원은 본 명세서에서 참고로 하는 출원으로서 2010년 6월 25일 출원된 인도 임시 출원번호 제 1805/CHE/2010 호 및 2010년 9월 10일 출원된 미국 임시 출원번호 제 61/381,593 호의 우선권을 주장한다.
본 발명은 하기 화학식 (I)의 신규한 펩티드 화합물 또는 약학적으로 허용되는 그의 염에 관한 것이다:
(I)
상기 식에서, 화합물은 세포예정사(programed cell death)1 (PD1) 신호전달 경로를 억제할 수 있는 치료제로서 유용한 적어도 5개의 아미노산을 포함한다.
본 발명은 또한 치료제의 변형체 및 유도체에 관한 것이다.
본 발명은 또한 상기 화학식(I)의 신규 펩티드 화합물 또는 치료제로서 약학적으로 허용되는 그의 염을 포함하는 의약 조성물에 관한 것이다.
본 발명의 화합물은 PD-1, PD-L1, 또는 PD-L2로 인해 유발된 면역억제 신호의 억제를 포함하는 면역 강화에 유리한, 특수 질환 또는 그와 관련된 질병을 치료하는 데 유용하다.
본 발명은 세포예정사 1 (PD1) 신호전달 경로를 억제할 수 있는 치료제로서 신규 펩티드에 관한 것이다.
본 발명은 또한 치료제의 변형체(modification) 및 유도체에 관한 것이다.
본 발명은 또한 치료제로서 상기 신규 펩티드 및 그의 유도체를 포함하는 의약 조성물에 관한 것이다.
본 발명은 또한 PD-1, PD-L1, 또는 PD-L2으로 인해 유발된 면역 억제 신호의 억제를 포함하는 면역 강화를 통해 질병을 치료하기 위한 상기 치료제, 변형체 및 유도체의 용도를 포함한다.
세포예정사(Programmed Cell Death) 1 또는 PD-1 ('PDCD1'이라고도 함)는 50 내지 55 kD 형 I 막당단백(membrane glycoprotein)이다 (Shinohara T 일행, Genomics, 1994, Vol. 23, No. 3, pp.704-706). PD-1은 특수 리간드와의 상호작용에 의해 신호전달을 하는 T 세포 항원 수용체를 네가티브 조절하는 CD28 상과(superfamily)의 수용체이고, 자가관용(self tolerance) 유지 역활을 하는 것으로 알려져 있다.
PD-1 펩티드는 자기면역, 종양 면역, 감염 면역, 이식 면역, 알레르기 및 면역학적 특성을 포함한 면역 반응의 거의 모든 양상에 관한 것이다.
PD-1 단백질의 구조는 다음을 포함한다:
* 다음과 연결되는 세포외 IgV 도메인
* 경막(transmembrane) 영역 및
* 세포내 테일(tail)
세포내 테일은 면역 수용체 티로신-계 억제 모티프 및 면역 수용체 티로신-계 전환 모티프에 위치한 2개의 인산화 부위를 함유하는 데, 이는 PD-1이 TCR 신호를 네가티브 조절하는 것을 나타낸다. 또한, PD-1은 CTLA-4 ((CD152 (분화무리 152)로 알려진 세포독성 T-림프구 항원 4는 면역 체계에서 중요한 조절 역할을 하는 단백질임)에 비해, PD-1은 면역 반응을 더욱 광범위하게 네가티브 조절하는 것을 암시하며 활성화된 T 세포, B 세포, 및 포식세포의 표면에 발현된다(Y. Agata 일행, Int Immunol 8, 765, May 1996).
PD-1은, 2개의 리간드, PD-L1 (예정사 리간드 1또는 PDCD1L1 또는 B7-H1) (Freeman GJ 일행, Journal of Experimental Medicine, 2000, Vol. 19, No. 7, pp.1027-1034 ) 및 PD-L2 (예정사 리간드 2 또는 PDCD1L2 또는 B7-DC) (Latchman Y 일행, Nature Immunology, 2001, Vol. 2, No. 3, pp.261-267)를 가지며, 이들은 B7 과(family)의 일원이다. PD-L1은 면역 세포뿐만 아니라 특정 종류의 종양 세포주 (예, 단핵구 백혈병-파생 세포주, 비만세포 종양-파생 세포주, 혈종-파생 세포주, 신경모세포종-파생 세포주, 및 각종 포유동물 유선종양-파생 세포주) 및 다양한 인간 암 조직으로부터 파생된 암 세포 (Latchman Y 일행, Nature Immunology, 2001, Vol. 2, No. 3, pp.261-267)에서, 그리고 IFN-γ로 치료할 때 PA1 골수종, P815 비만세포종, 및 B16 흑색종을 포함한 거의 모든 손쥐(murine) 종양 세포주 상에서 발현되는 것으로 알려져 있다(Y. Iwai 일행, Proc Natl Acad Sci U S A 99, 12293, Sep 17, 2002 및 C. Blank 일행, Cancer Res 64, 1140, Feb, 2004). 마찬가지로 PD-L2 발현은 더욱 제한되고, 가지 세포 및 약간의 종양 세포주에 의해 주로 발현된다. PD-L2 발현은 호지킨(Hodgkin) 림프종 세포주 등에서 입증되었다. 암 또는 종양 세포의 일부는 T-세포 면역 반응을 그들 자체로 억제 또는 차단하기 위해 PD-1과 PD-L1 또는 PD-L2 사이의 상호 작용으로부터 유익을 취한다는 가설이 있다(Iwai Y 일행, Proceedings of the National Academy of Science of the United States of America, 2002, Vol. 99, No. 19, pp.12293-12297).
종양 세포 및 바이러스 (HCV 및 HIV 포함) 감염 세포는 숙주 T 세포에 의한 면역 감시를 피하기 위해서 PD-1 (면역억제 형성)에 대한 리간드를 발현하는 것으로 알려져 있다. PD-1 유전자는 전신홍반루푸스와 같은 자가면역 질환의 원인이 되는 유전자들중 하나라고 보고되었다 (Prokunina 일행, Nature Genectics, 2002, Vol. 32, No. 4, 666-669). PD-1-결핍 생쥐가 사구체신염 및 관절염 (Nishimura H 일행, International Immunology, 1998, Vol. 10, No. 10, pp.1563-1572; Nishimura H 일행, 면역, 1999, Vol. 11, No. 2, pp.141-151)과 같은 루푸스 자가면역 질환, 및 확장 심근병증 같은 질환(Nishimura H 일행, Science, 2001, Vol. 291, No. 5502, pp. 319-332 )을 발전시키기 때문에, PD-1은 자가면역 질환의 발병, 특히 말초 자가관용의 조절인자로서 작용하는 것으로 보고되었다. 그러므로, 한 시도로서 PD-1과 그의 리간드 (PD-L1, PD-L2 또는 모두)와의 상호작용을 차단하면 특이 종양 및 바이러스 면역치료에 효과적인 방법을 제공할 수 있다.
우드(Wood) 일행에게 허여된 미국특허 제 6,808,710 호에서는, 네가티브 신호가 PD-1을 통해 변환되어 면역 반응을 하향 조절하도록, PD-1을 발현하는 면역 세포를 PD-1에 다가 형태로 결합(bind)하는 항체와 접촉하는 것을 포함하는 면역 반응을 하향 조절하는 방법에 대해 기재하고 있다. 이러한 항체는 PD-1에 가교된 항체이거나 또는 PD-1에 부동화된 항체일 수 있다.
프리맨(Freeman) 일행에게 허여된 미국특허 제 6936704 호 및 그의 분할출원 제 US 7038013 호에서는, 폴리펩티드가 제1 표면에 존재하고 그리고 T-세포 수용체를 통해 활성 신호를 전달하는 항원 또는 다클론 활성제가 제2의 상이한 표면에 존재할 때, 시험관내 T 세포 증식을 공동으로 자극하는 항-B7-4 항체, 신규 B7-4 폴리펩티드, 분리된 B7-4 단백질, 융합 단백질, 및 항원성 펩티드를 코딩하는 분리된 핵산 분자, 지정된 B7-4 핵산 분자에 대해서 기재하고 있다.
PD-1의 면역 억제 작용, 또는 PD-1과 PD-L1 또는 PD-L2 간의 상호작용, 뿐만 아니라 그의 용도를 나타내는 물질에 대한 일부 보고가 있다. PD-1 억제 항체 또는 PD-1 억제 펩티드의 구조는 국제 공개 WO 01/14557, WO 2004/004771, 및 WO 2004/056875에 보고되어 있다. 한편, PD-L1 억제 항체 또는 PD-L1 억제 펩티드는 국제 공개 WO 02/079499, WO 03/042402, WO 2002/086083, 및 WO 2001/039722에 보고되어 있다. PD-L2 억제 항체 또는 PD-L2 억제 펩티드는 국제 공개 제 WO 03/042402 호 및 제 WO 02/00730 호에 보고되어 있다.
국제 공개 제 WO2007005874 호에서는, 높은 친화력으로 PD-L1에 특별히 결합하는 분리된 인간 단클론 항체에 대해서 기재하고 있다. 이 공개 명세서에서는 항-PD-L1 항체를 이용하여 암을 포함한 각종 질병을 치료하는 방법을 제공한다.
미국 특허출원 제 US2009/0305950 호에서는, PD-1 또는 PD-L1의 세포외 도메인의 다합체, 특히 사합체에 대해서 기재하고 있다. 이 출원에서는 치료용 펩티드에 대해서 기재하고 있다.
또한, 명세서에서는, 이를테면 환자에게 공동 자극(co-stimulation)을 변경함으로써 질병을 치료하는데 펩티드가 사용될 수 있다는 것을 언급하고 있다. 분리된 B7-4 또는 PD-1 단백질, 또는 그의 일부 또는 단편(또는 이러한 폴리펩티드를 코딩하는 핵산 분자)은, 다클론 및 단클론 항체 제조를 위한 표준 기술을 이용하여 B7-4 또는 PD-1을 결합하는 항체를 생성하기 위한 면역원으로서 사용될 수 있다. B7-4 또는 PD-1 단백질의 전체 길이가 사용될 수 있거나, 아니면 본 발명에서는 면역원으로서 사용하기 위한 B7-4 또는 PD-1의 항원성 펩티드 단편을 제공한다. B7-4 또는 PD-1의 항원성 펩티드는, 펩티드에 대항하여 발생된 항체는 B7-4 또는 PD-1와의 특이 면역 복합체를 형성하도록, 적어도 8의 아미노산 잔기를 갖고 B7-4 또는 PD-1의 에피토프(epitope)를 포함한다. 바람직하게는, 항원성 펩티드는 적어도 10의 아미노산 잔기, 더욱 바람직하게는 적어도 15의 아미노산 잔기, 더 더욱 바람직하게는 적어도 아미노산 잔기, 및 가장 바람직하게는 적어도 30의 아미노산 잔기를 포함한다.
프리맨(Freeman) 일행에게 허여된 미국특허 제 US7432059 호에서는, PD-1-매개 신호의 존재 하에서 T 세포 활성을 향상 조절하는 화합물을 확인하는 방법을 기재하고 특허청구범위로 하고 있다. 이 발명의 조성물을 이용하여 진단 및 치료하는 방법도 또한 상기 특허에 제공되어 있다.
또한, 프리맨(Freeman) 일행에게 허여된 미국특허 US 7,709,214에서는, PD-L2과 PD-1 사이의 상호작용을 억제하는 약품으로 면역 반응을 향상 조절하기 위한 방법을 포함하고 있다.
그러나 수많은 공지 기술이 존재함에도 불구하고, 치료 영역에서 대체 치료제로서 효과적인 펩티드 또는 개선된 펩티드가 부족하기 때문에, 아직까지도 크게 충족하지 못하는 의학적 수요가 존재한다. 합성 펩티드는 세포 물질, 낮은 면역원성, 개선된 효능 및 특이성을 갖고 더욱 새로운 기술, 더 좋은 순도 및 오염없이 용이한 제조와 같이 항체보다 특정한 장점을 제공하는 것으로 알려져 있다. 펩티드는 항체보다 더욱 안정하고 더 좋은 저장성을 제공할 수 있다. 더욱이, 종종 펩티드는 항체에 비해 조직 침투가 더 좋아 더 좋은 효과를 얻을 수 있다. 펩티드는 또한 낮은 독성 및 더 낮은 의약-의약 상호작용과 같이 소분자 치료제 상대물보다 분명한 장점을 제공할 수 있다.
그러므로, 본 발명은 PD1 엑토도메인을 기본으로 하는 신규 합성 펩티드 및 그의 유도체를 제공함으로써 상술한 충족되지 않은 의학적 수요에 대한 해결책을 제공할 수 있다.
도 1은 HEK293 세포를 발현하는 hPDL2를 사용하여 PD-L2에 대한 PD1의 결합을 억제하기 위한 분석 시험에서 화합물 번호 8에 대한 효능을 나타낸 그래프이다.
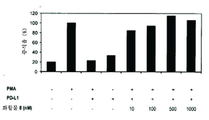
도 2는 화합물 8로 쥐 PBMC 증식의 PDL1 매개 억제의 폐지를 나타내는 막대 그래프이다.
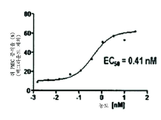
도 3은 PD-1/PD-L1 경로의 상황에 있어서 쥐 PBMC 증식 시험에서 화합물 8에 대한 EC50 측정치를 나타낸 그래프이다.
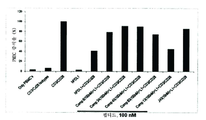
도 4는 인간 PDL1의 상황에서 여러 화합물로 인간 PBMC 증식의 회복을 나타내는 막대 그래프이다.
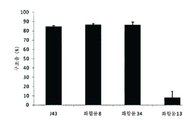
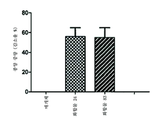
도 5는 화합물 8, 13, 34 및 J43 항체의 생쥐 비세포(splenocyte) 증식 구조(rescue)율(%)을 비교한 막대 그래프이다.
도 6은 세포독성 T 림프구 시험에서 IFN-γ 생성에 대한 여러 시험 화합물의 효과를 나타낸 막대 그래프이다.
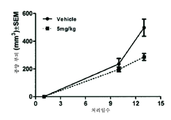
도 7은 피하주사된 B16F10 세포의 종양 성장 억제에 관한 화합물 8의 효과를 나타낸 그래프이다.
도 8은 정맥주사된 B16F10 세포의 폐 전이에 관한 화합물 8의 효과를 나타낸 사진이다.
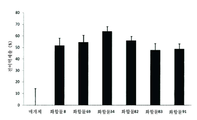
도 9는 B16F10 모델에서 폐 전이에 관한 여러 화합물의 효과를 나타낸 막대 그래프이다.
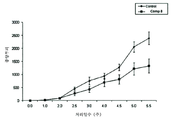
도 10은 포유동물 지방 패드에 동소(orthotopically) 주사된 4T1 세포의 종양 성장 억제에 관한 화합물 번호 8의 효과를 나타낸 그래프이다.
도 11은 RENCA 세포로 동소 주사된 신장에서 종양 부담을 감소하는 펩티드의 효과를 나타낸 그래프이다.
도 12는 대장균 패혈증 모델에 대한 화합물 8의 생체 내 효과를 나타낸 그래프이다.
아미노산 서열 정보:
SEQ ID NO: 1은 인간 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 2는 인간 PD-1 엑토도메인의 A 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 3은 인간 PD-1 엑토도메인의 B 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 4는 인간 PD-1 엑토도메인의 BC 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 5는 인간 PD-1 엑토도메인의 C 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 6은 인간 PD-1 엑토도메인의 C-C' 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 7은 인간 PD-1 엑토도메인의 C' 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 8은 인간 PD-1 엑토도메인 아미노산의 C'-C" 루프의 서열을 나타낸다.
SEQ ID NO: 9는 인간 PD-1 엑토도메인의 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 10은 인간 PD-1 엑토도메인의 C"-D 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 11은 인간 PD-1 엑토도메인의 D 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 12는 인간 PD-1 엑토도메인의 D-E 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 13은 인간 PD-1 엑토도메인의 E 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 14는 인간 PD-1 엑토도메인의 F 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 15는 인간 PD-1 엑토도메인의 FG 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 16은 인간 PD-1 엑토도메인의 G 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 17은 생쥐 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 18은 쥐 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 19는 개 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 20은 말 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 21은 인간 PD-1 엑토도메인의 C' 스트랜드 내지 C'-C" 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 22는 인간 PD-1 엑토도메인의 C' 스트랜드 내지 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 23은 인간 PD-1 엑토도메인의 C-C' 루프 내지 C' 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 24는 인간 PD-1 엑토도메인의 FG 루프 내지 G 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 25는 인간 PD-1 엑토도메인의 D 스트랜드 내지 DE 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 26은 생쥐 PD-1 엑토도메인의 B 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 27은 생쥐 PD-1 엑토도메인의 BC 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 28은 생쥐 PD-1 엑토도메인의 C-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 29는 생쥐 PD-1 엑토도메인의 C-C' 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 30은 생쥐 PD-1 엑토도메인의 C'-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 31은 생쥐 PD-1 엑토도메인의 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 32는 생쥐 PD-1 엑토도메인의 C"-D-루프의 아미노산 서열을 나타낸다. \SEQ ID NO: 33은 생쥐 PD-1 엑토도메인의 D-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 34는 생쥐 PD-1 엑토도메인의 F-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 35는 생쥐 PD-1 엑토도메인의 F-G 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 36은 생쥐 PD-1 엑토도메인의 G-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 37은 생쥐 PD-1 엑토도메인의 C' 스트랜드 내지 C'-C" 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 38은 생쥐 PD-1 엑토도메인의 C' 스트랜드 내지 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 39는 생쥐 PD-1 엑토도메인의 C-C' 루프 내지 C' 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 40은 생쥐 PD-1 엑토도메인의 FG 루프 내지 G 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 41은 생쥐 PD-1 엑토도메인의 D 스트랜드 내지 DE 루프의 아미노산 서열을 나타낸다.
도 2는 화합물 8로 쥐 PBMC 증식의 PDL1 매개 억제의 폐지를 나타내는 막대 그래프이다.
도 3은 PD-1/PD-L1 경로의 상황에 있어서 쥐 PBMC 증식 시험에서 화합물 8에 대한 EC50 측정치를 나타낸 그래프이다.
도 4는 인간 PDL1의 상황에서 여러 화합물로 인간 PBMC 증식의 회복을 나타내는 막대 그래프이다.
도 5는 화합물 8, 13, 34 및 J43 항체의 생쥐 비세포(splenocyte) 증식 구조(rescue)율(%)을 비교한 막대 그래프이다.
도 6은 세포독성 T 림프구 시험에서 IFN-γ 생성에 대한 여러 시험 화합물의 효과를 나타낸 막대 그래프이다.
도 7은 피하주사된 B16F10 세포의 종양 성장 억제에 관한 화합물 8의 효과를 나타낸 그래프이다.
도 8은 정맥주사된 B16F10 세포의 폐 전이에 관한 화합물 8의 효과를 나타낸 사진이다.
도 9는 B16F10 모델에서 폐 전이에 관한 여러 화합물의 효과를 나타낸 막대 그래프이다.
도 10은 포유동물 지방 패드에 동소(orthotopically) 주사된 4T1 세포의 종양 성장 억제에 관한 화합물 번호 8의 효과를 나타낸 그래프이다.
도 11은 RENCA 세포로 동소 주사된 신장에서 종양 부담을 감소하는 펩티드의 효과를 나타낸 그래프이다.
도 12는 대장균 패혈증 모델에 대한 화합물 8의 생체 내 효과를 나타낸 그래프이다.
아미노산 서열 정보:
SEQ ID NO: 1은 인간 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 2는 인간 PD-1 엑토도메인의 A 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 3은 인간 PD-1 엑토도메인의 B 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 4는 인간 PD-1 엑토도메인의 BC 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 5는 인간 PD-1 엑토도메인의 C 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 6은 인간 PD-1 엑토도메인의 C-C' 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 7은 인간 PD-1 엑토도메인의 C' 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 8은 인간 PD-1 엑토도메인 아미노산의 C'-C" 루프의 서열을 나타낸다.
SEQ ID NO: 9는 인간 PD-1 엑토도메인의 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 10은 인간 PD-1 엑토도메인의 C"-D 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 11은 인간 PD-1 엑토도메인의 D 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 12는 인간 PD-1 엑토도메인의 D-E 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 13은 인간 PD-1 엑토도메인의 E 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 14는 인간 PD-1 엑토도메인의 F 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 15는 인간 PD-1 엑토도메인의 FG 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 16은 인간 PD-1 엑토도메인의 G 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 17은 생쥐 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 18은 쥐 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 19는 개 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 20은 말 PD-1 엑토도메인의 아미노산 서열을 나타낸다.
SEQ ID NO: 21은 인간 PD-1 엑토도메인의 C' 스트랜드 내지 C'-C" 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 22는 인간 PD-1 엑토도메인의 C' 스트랜드 내지 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 23은 인간 PD-1 엑토도메인의 C-C' 루프 내지 C' 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 24는 인간 PD-1 엑토도메인의 FG 루프 내지 G 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 25는 인간 PD-1 엑토도메인의 D 스트랜드 내지 DE 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 26은 생쥐 PD-1 엑토도메인의 B 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 27은 생쥐 PD-1 엑토도메인의 BC 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 28은 생쥐 PD-1 엑토도메인의 C-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 29는 생쥐 PD-1 엑토도메인의 C-C' 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 30은 생쥐 PD-1 엑토도메인의 C'-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 31은 생쥐 PD-1 엑토도메인의 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 32는 생쥐 PD-1 엑토도메인의 C"-D-루프의 아미노산 서열을 나타낸다. \SEQ ID NO: 33은 생쥐 PD-1 엑토도메인의 D-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 34는 생쥐 PD-1 엑토도메인의 F-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 35는 생쥐 PD-1 엑토도메인의 F-G 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 36은 생쥐 PD-1 엑토도메인의 G-스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 37은 생쥐 PD-1 엑토도메인의 C' 스트랜드 내지 C'-C" 루프의 아미노산 서열을 나타낸다.
SEQ ID NO: 38은 생쥐 PD-1 엑토도메인의 C' 스트랜드 내지 C" 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 39는 생쥐 PD-1 엑토도메인의 C-C' 루프 내지 C' 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 40은 생쥐 PD-1 엑토도메인의 FG 루프 내지 G 스트랜드의 아미노산 서열을 나타낸다.
SEQ ID NO: 41은 생쥐 PD-1 엑토도메인의 D 스트랜드 내지 DE 루프의 아미노산 서열을 나타낸다.
본 발명에 따라서, 세포예정사 1 (PD1) 신호전달 경로를 억압 및/또는 억제할 수 있는 변형된 신규 펩티드가 제공된다.
본 발명의 요지는, 하기 화학식(I)의 구조를 갖는 화합물 또는 약학적으로 허용되는 그의 염을 제공하는 것이다:
(I)
상기 식에서,
화합물은 적어도 5개의 아미노산을 포함하고,
A는 3개의 아미노산으로부터, FG 루프, BC 루프, C-C' 루프, C 스트랜드, C' 스트랜드 내지 C'-C" 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 A가 존재하지 않고;
B는 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드, C 스트랜드, D 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 포유동물 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 B가 존재하지 않고;
Z는 하기 (i), (ii) 또는 (iii)으로 나타내지고;
(i) 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, G 스트랜드, C 스트랜드, F 스트랜드, C' 스트랜드, C" 스트랜드, C"-D 루프, C' 스트랜드 내지 C'-C" 루프, C' 스트랜드 내지 C" 스트랜드 또는 D 스트랜드 내지 DE 루프로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1 내지 4의 펩티드 서열;
(ii) G-L-Z'
G는 3개의 아미노산으로부터 D-스트랜드의 포유동물 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 존재하지 않고;
L은 -CO(CH2)n-NH-, 및 PEG 2-20 KD로부터 선택되고;
'n'은 2∼10의 정수이고; 그리고
Z'는 3개의 아미노산으로부터, FG 루프 및 G-스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼3의 펩티드 서열이거나; 또는
(iii) 3개의 아미노산으로부터, D-스트랜드, FG 루프 및 G 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열되고, 펩티드 서열의 2 이상의 아미노산이 서로 조합되어 2개의 단편 사이 또는 단편들 내에서 락탐 결합을 형성하는 1∼4의 펩티드 서열;
D는 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 2 이하의 펩티드 서열이거나 존재하지 않고;
E는 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, C-C' 루프 내지 C' 스트랜드, G 스트랜드, FG 루프 내지 G 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 4 이하의 펩티드 서열이거나 존재하지 않고;
X 및 X'는 리신, 오르니틴, 디아미노프로피온산, 디아미노부티르산, 또는 부가적인 리신과 임의로 연결되는 하기 화학식의 올레핀성 아미노산으로부터 독립적으로 선택되고:
X 및 X'는 서로 조합되어 부가적인 리신과 임의로 연결되는 올레핀성 아미노산을 갖는 고리를 형성하거나; 또는
X 및 X' 중 하나 또는 모두는 존재하지 않고;
'm'은 1∼6의 정수이고;
R1은 C2-C20 아실 및 PEG 2-20 KD 부분으로 이루어진 군으로부터 선택되거나; 또는 존재하지 않고;
R2 및 R3는 C2-C20 아실 및 PEG 2-20 KD로 이루어진 군으로부터 독립적으로 선택되거나, 존재하지 않거나 또는 Ra-L'이고;
Ra는 비오틴 및 말레이미도 프로피온산으로부터 선택되고;
L'는 링커 -CO(CH2)n-NH-, -CO(CH2-CH2-O-)nNH 및 -COCH2(-OCH2-CH2)nNH-로부터 선택되고; 그리고
'n'은 2∼10의 정수이고;
R4 및 R5는 독립적으로 NH2이거나, 또는 R4 및 R5 중 하나 또는 모두가 존재하지 않는다.
단, 상기 화학식(I)의 화합물에서,
a) 5∼25%의 아미노산은 다른 천연 또는 인조 아미노산으로 치환될 수 있고;
b) 30% 이하의 아미노산은 생략될 수 있고;
c) 상기 각 펩티드 서열에서 2 이하의 아미노산이 어떠한 위치에서도 개별적으로 부가될 수 있고;
d) 5∼25%의 펩티드 결합은 환원된 아미드 결합(-CH2NH-)으로 대체될 수 있고;
e) 100% 이하의 아미노산은 D-아미노산일 수 있고;
f) 100% 이하의 아미노산은 역순으로 될 수 있다.
본 발명의 또 다른 요지는, 세포예정사 1 (PD1) 신호전달 경로를 억제하는 데 유리하고, PD-1에 대한 PD-L1 또는 PD-L2의 결합을 감소할 수 있으며, 그 결과 PD-1에 의한 면역억제 신호전달을 형성할 수 있는, 질병 또는 질환의 치료 또는 예방에 유용한 화학식(I)의 화합물을 제공하는 것이다.
본 명세서에서 '펩티드'란 용어는 펩티드 결합 또는 환원된 펩티드 결합에 의해 상기 서열에 결합된 천연 또는 인조 아미노산의 서열을 나타내는데 사용된다.
본 명세서에서 '화합물'이란 용어는 본 발명에서 기술된 펩티드를 포함하는 의미이다.
본 명세서에서 하기에 나타낸 아미노산의 일반 약어는 다음과 같다:
본 명세서에서 소문자 코드는 D-아미노산을 나타내기 위해 사용된다.
이하 설명되는 펩티드의 변형은 어디에 관계되든지 L-아미노산의 일부 또는 모두를 D-아미노산으로 치환하고, α 아미노기 이외에서 아미노산을 결합하고, 분기 사슬에 아미노 또는 카르복시기를 포함하고, 펩티드 서열들 간에 비-펩티드 링커를 포함하고, 가교, 지질화, 스테이플링(stapling), 및 PEG화(PEGylation)를 포함하는 의미이다.
이하 설명되는 펩티드의 변형은 어디에 관계되든지 또한 2개의 아미노산 사이에 변형된 펩티드 결합을 포함하는데, 여기서, 2개의 아미노산 사이의 통상적인 펩티드 결합 (-CONH-)은 환원된 아미드 결합 (-CH2NH-)으로 대체된다. 종래의 확인 방법을 이용할 때, 이는 변형된 펩티드 결합을 나타내는 기호 "Ψ"를 갖는 -Ψ[CH2NH]-으로서 특징지어진다.
본 명세서에서, "인조 아미노산"이란 용어는 포유동물에서 자연적으로 형성되지 않거나(예를 들면, 유전자 코드에 의해 암호화되거나 또는 번역후(posttranslational) 변형으로부터 얻어짐) 또는 자연적으로 발견되지 않는 아미노산을 의미한다. 인조 아미노산은 통상적으로 단백질에 존재하지 않는 아미노산(예, D-구조를 갖는 α-아미노산, 또는 그의 (D,L)-이성질체 혼합물), 자연에 존재하는 아미노산의 동족체(예, β- 또는 γ- 아미노산 유사체), 자연적으로 존재하는 아미노산의 α,α-디-치환된 유사체, 또는 아미노산 측쇄가 디아미노프로피온산 (DAP), 디아미노부티르산 (DAB), 오르니틴 (Orn) 등을 포함하지만 이들에 한정되지 않는 메틸렌 기에 의해 짧아지거나; 또는 10 이하의 탄소 원자까지 길어지거나; 또는 다음을 포함하지만 이에 한정되지 않는 올레핀기를 갖는 10 이하의 탄소 원자까지 길어지는 α-아미노산을 포함한다:
기타 인조 아미노산은 (S)-3-(아미노메틸)-5-메틸헥사노산 (프레가발린), 2-[l-(아미노메틸)시클로헥실]아세트산 (가바펜틴), 또는 본 명세서에서 참고로 하는 요기스와리(Yogeeswari) 일행의 "Recent Patents on CNS Drug Discovery 2006;l:113-118"에 기재된 것들과 같은 GABA 유사체인 γ-아미노산을 포함한다.
본 발명은 세포예정사 1 (PD1) 신호전달 경로를 억압 및/또는 억제할 수 있는 면역억제 조절 펩티드를 제공한다.
본 발명은 또한 PD-1, PD-L1, 또는 PD-L2에 의해 유발된 면역억제 신호의 억제에 의해 야기된 면역 강화작용을 통해 암이나 감염의 치료를 위한 펩티드를 포함하는 펩티드 및 약제 조성물의 변형체, 유도체, 그들 및 활성 성분으로서 포함된 면역-기능성 기질을 이용한 치료를 제공한다.
인간 PD-1의 완전한 아미노산 서열은 미국 특허출원 제 5629204 호(Honjo 일행) 및 핑거(Finger)일행의 문헌(유전자, 1997, 197:177-187)에 기술되어 있다. 인간 및 생쥐 PD-1은 아미노산이 약 60%를 차지하는데 반해, 세포외 IgV 도메인은 CD28 및 CTLA4에 대해 각각 오직 21% 및 16% 서열을 나타낸다.
PD-1은 다중 루프 구조와 루프들 사이에 스트랜드를 갖는 엑토도메인을 포함한다. 인간 PD-1 엑토도메인의 아미노산 서열은 SEQ ID NO: 1에 나타낸 바와 나타낸 바와 같다.
SEQ ID NO: 1 인간 PD-1
PPTFSPALLVVTEGDNATFTCSFSNTSESFVLNWYRMSPSNQTDKLAAFPEDRSQPGQDCRFRVTQLPNGRDFHMSVVRARRNDSGTYLCGAISLAPKAQIKESLRAELRVTERRAEVPTAHPSPSPRSAGQFQTLV
인간 PD-1 엑토도메인 서열 내의 루프 및 스트랜드 서열은 다음과 같다:
A 스트랜드: PPTFS SEQ ID NO: 2
B 스트랜드: ATFT CSF SEQ ID NO: 3
BC 루프: SNTSESF SEQ ID NO: 4
C-스트랜드: VLNWYRM SEQ ID NO: 5
C-C' 루프: SPS NQ SEQ ID NO: 6
C'-스트랜드: TDKLAAFP SEQ ID NO: 7
C'-C" 루프: ED SEQ ID NO: 8
C" 스트랜드: RSQP SEQ ID NO: 9
C"-D-루프: GQDCR SEQ ID NO: 10
D-스트랜드: FRVTQ SEQ ID NO: 11
DE 루프: LPNG R SEQ ID NO: 12
E 스트랜드: DFHMSV SEQ ID NO: 13
F-스트랜드: GTYLC GAIS SEQ ID NO: 14
F-G 루프: LAPKA SEQ ID NO: 15
G-스트랜드: QIKE SEQ ID NO: 16
C' 스트랜드 내지 C'-C" 루프: FPED SEQ ID NO: 21
C' 스트랜드 내지 C" 스트랜드: TDKLAAFPEDRSQP SEQ ID NO: 22
C-C' 루프 내지 C' 스트랜드: SPSNQTDKLAAFP SEQ ID NO: 23
FG 루프 내지 G 스트랜드: LAPKAQIKE SEQ ID NO: 24
D 스트랜드 내지 DE 루프: FRVTQLPNGR SEQ ID NO: 25
SEQ
ID
NO
: 17 생쥐-
PD
-1
SLTFYPAWLTVSEGANATFTCSLSNWSEDLMLNWNRLSPSNQTEKQAAFCNGLSQPVQDARFQIIQLPNRHDFHMNILDTRRNDSGIYLCGAISLHPKAKIEESPGAELVVTERILETSTRYPSPSPKPEGRFQGMV
생쥐 PD-1 엑토도메인 서열 내에서의 루프 및 스트랜드 서열은 다음과 같다:
B 스트랜드: ATFT CSL SEQ ID NO: 26
BC 루프: SNWSEDL SEQ ID NO: 27
C-스트랜드: MLNWNRL SEQ ID NO: 28
C-C' 루프: SPSNQ SEQ ID NO: 29
C'-스트랜드: TEKQAAFC SEQ ID NO: 30
C" 스트랜드: LSQP SEQ ID NO: 31
C"-D-루프: VQDAR SEQ ID NO: 32
D-스트랜드: FQIIQ SEQ ID NO: 33
F-스트랜드: GIYLC GAIS SEQ ID NO: 34
F-G 루프: LHPKA SEQ ID NO: 35
G-스트랜드: KIEE SEQ ID NO: 36
C' 스트랜드 내지 C'-C" 루프: FCNG SEQ ID NO: 37
C' 스트랜드 내지 C" 스트랜드: TEKQAAFCNGLSQP SEQ ID NO: 38
C'-C' 루프 내지 C' 스트랜드: SPSNQTEKQAAFC SEQ ID NO: 39
FG 루프 내지 G 스트랜드: LHPKAKIEE SEQ ID NO: 40
D 스트랜드 내지 DE 루프: FQIIQLPNRH SEQ ID NO: 41
EQ
ID
NO
: 18 쥐 -
PD
-1
QLSWQSGWLLVSEGANATFTCSFSNWSEDLKLNWYRLSPSNQTEKQAAFCNGYSQPVRDARFQIVQLPNGHDFHMNILDARRNDSGIYLCGAISLPPKAQIKESPGAELVVTERILETPTRYPRPSPKPEGQFQGLV
SEQ
ID
NO
: 19 개 -
PD
-1
PLTFSPAQLTVQEGENATFTCSLADIPDSFVLNWYRLSPRNQTDKLAAFQEDRIEPGRDRRFRVMRLPNGRDFHMSIVAARLNDSGIYLCGAIYLPPNTQINESPRAELSVTERTLEPPTQSPSPPPRLSGQLQGLV
SEQ
ID
NO
: 20 말 -
PD
-1
PLTFSPARLMVPEGANATFTCSFSNTSEHFVLNWYRMSPSNQTDKLAAFPEDSSQPGRSGRFRVTRLPNGRDFHMSVLAARRNDSGIYLCGAISLPPKTQINESPRAELTVTERIPEPPTEHPSPPPSPAGQLQGLV
이들 아미노산의 루프 및 스트랜드 기능(assignments)은 Lazar-Molnar 일행의 문헌(PNAS, 2008, 105, 30, 10483-10488)에 보고된 인간 및 손쥐 단백질 사이의 아미노산 서열 변이를 고려하여 상기 문헌에 보고된 손쥐 PD-1/PD-L2 복합체의 1.8-Å-분해(resolution) 구조를 기본으로 한다. Lazar-Molnar 일행은 생쥐, 인간, 쥐, 개 및 말 PD-1의 PD-1 엑토도메인의 배열이 서열 상의 화살표 세그먼트로 나타내진 생쥐 PD-1에서 표시된 β 스트랜드로 나타내진다는 것을 기술하고 있다.
본 발명은 또한 손쥐, 쥐, 개 또는 말 PD-1의 엑토도메인 펩티드 단편을 포함하는 화합물을 제공한다(Lazar-Molnar 일행, PNAS, 2008, 105, 30, 10483-10488).
그러므로, 분기된 펩티드를 포함하는 화합물에서, 1 이상의 가지는 상기 엑토오메인 부분의 펩티드 부분으로서 적어도 5개의 아미노산 잔기를 포함하는 인간 PD-1 (SEQ ID NO: 1)을 함유할 수 있다.
본 발명에 따른 일 실시양태에서, 세포예정사 1 (PD1) 신호전달 경로를 억제하고 PD-1에 대한 PD-L1 또는 PD-L2의 결합을 감소하고 그 결과 PD-1에 의한 면역억제 신호전달을 형성할 수 있는 화합물을 제공하는데, 여기서 화합물은 35 이하, 바람직하게는 30 이하의 아미노산 잔기를 갖는 펩티드 부분을 포함한다.
본 발명에 따른 화합물 또는 약학적으로 허용되는 그 염의 구조는 하기 화학식(I)으로 나타내진다:
(I)
상기 식에서,
화합물은 적어도 5개의 아미노산을 포함하고,
A는 3개의 아미노산으로부터, FG 루프, BC 루프, C-C' 루프, C 스트랜드, C' 스트랜드 내지 C'-C" 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 A가 존재하지 않고;
B는 3개의 아미노산으로부터, BC 루프, FG 루프, C C' 루프 내지 C' 스트랜드, C 스트랜드, D 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 포유동물 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 B가 존재하지 않고;
Z는 하기 (i), (ii) 또는 (iii)으로 나타내지고;
(i) 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, G 스트랜드, C 스트랜드, F 스트랜드, C' 스트랜드, C" 스트랜드, C"-D 루프, C' 스트랜드 내지 C'-C" 루프, C' 스트랜드 내지 C" 스트랜드 또는 D 스트랜드 내지 DE 루프로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼4의 펩티드 서열;
(ii) G-L-Z'
G는 3개의 아미노산으로부터 D-스트랜드의 포유동물 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 존재하지 않고;
L은 -CO(CH2)n-NH-, 및 PEG 2-20 KD로부터 선택되고;
'n'은 2∼10의 정수이고; 및
Z'는 3개의 아미노산으로부터, FG 루프 및 G-스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼3의 펩티드 서열이거나; 또는
(iii) 3개의 아미노산으로부터, D-스트랜드, FG 루프 및 G 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열되고, 펩티드 서열의 2 이상의 아미노산이 서로 조합되어 2개의 단편 사이 또는 단편들 내에서 락탐 결합을 형성하는 1∼4의 펩티드 서열;
D는 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 2 이하의 펩티드 서열이거나 존재하지 않고;
E는 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, C-C' 루프 내지 C' 스트랜드, G 스트랜드, FG 루프 내지 G 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 4 이하의 펩티드 서열이거나 존재하지 않고;
X 및 X'는 리신, 오르니틴, 디아미노프로피온산, 디아미노부티르산, 또는 부가적인 리신과 임의로 연결되는 하기 화학식의 올레핀성 아미노산으로부터 독립적으로 선택되고:
X 및 X'는 서로 조합되어 부가적인 리신과 임의로 연결되는 올레핀성 아미노산을 갖는 고리를 형성하거나; 또는
X 및 X' 중 하나 또는 모두는 존재하지 않고;
'm'은 1∼6의 정수이고;
R1은 C2-C20 아실 및 PEG 2-20 KD 부분으로 이루어진 군으로부터 선택되거나; 또는 존재하지 않고;
R2 및 R3는 C2-C20 아실 및 PEG 2-20 KD로 이루어진 군으로부터 독립적으로 선택되거나, 존재하지 않거나 또는 Ra-L'이고;
Ra는 비오틴 및 말레이미도 프로피온산으로부터 선택되고;
L'는 링커 -CO(CH2)n-NH-, -CO(CH2-CH2-O-)nNH 및 -COCH2(-OCH2-CH2)nNH-로부터 선택되고; 그리고
'n'은 2∼10의 정수이고;
R4 및 R5는 독립적으로 NH2이거나, 또는 R4 및 R5 중 하나 또는 모두가 존재하지 않는다.
단, 상기 화학식(I)의 화합물에서,
a) 5∼25%의 아미노산은 다른 천연 또는 인조 아미노산으로 치환될 수 있고;
b) 30% 이하의 아미노산은 생략될 수 있고;
c) 상기 각 펩티드 서열에서 2 이하의 아미노산이 어떠한 위치에서도 개별적으로 부가될 수 있고;
d) 5∼25%의 펩티드 결합은 환원된 아미드 결합(-CH2NH-)으로 대체될 수 있고;
e) 100% 이하의 아미노산은 D-아미노산일 수 있고;
f) 100% 이하의 아미노산은 역순으로 될 수 있다.
본 발명의 일 실시양태에 따라서, 특별히 하기와 같이 정의되는 화학식(I)의 화합물을 제공한다:
A는 하기 표에서 나타낸 바와 같이 3개의 아미노산으로부터, FG 루프, BC 루프, C-C' 루프, C 스트랜드, C' 스트랜드 내지 C'-C" 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 A가 존재하지 않고;
B는 하기 표에서 나타낸 바와 같이 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드, C 스트랜드, D 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 B가 존재하지 않고;
Z는 하기 (i), (ii) 또는 (iii)으로 나타내지고;
(i) 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, G 스트랜드, C 스트랜드, F 스트랜드, C' 스트랜드, C" 스트랜드, C"-D 루프, C' 스트랜드 내지 C'-C" 루프, C' 스트랜드 내지 C" 스트랜드 또는 D 스트랜드 내지 DE 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼4의 펩티드 서열;
(ii) G-L-Z'
G는 3개의 아미노산으로부터 D-스트랜드의 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 존재하지 않고;
L은 -CO(CH2)n-NH-, 및 PEG 2-20 KD로부터 선택되고;
'n'은 2∼10의 정수이고; 및
Z'는 3개의 아미노산으로부터, FG 루프 및 G-스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼3의 펩티드 서열이거나; 또는
(iii) 3개의 아미노산으로부터, D-스트랜드, FG 루프 및 G 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열되고, 펩티드 서열의 2 이상의 아미노산이 서로 조합되어 2개의 단편 사이 또는 단편들 내에서 락탐 결합을 형성하는 1∼4의 펩티드 서열;
여기서 상기 단편들은 하기 표에 정의한 바와 같고;
D는 하기 표에 나타낸 바와 같이 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 2 이하의 펩티드 서열이거나, 또는 존재하지 않고;
E는 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, C'-C' 루프 내지 C' 스트랜드, G 스트랜드, FG 루프 내지 G 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 4 이하의 펩티드 서열이거나, 또는 존재하지 않고;
X 및 X'는 리신, 오르니틴, 디아미노프로피온산, 디아미노부티르산 또는 부가적인 리신과 임의로 연결되는 하기 화학식의 올레핀성 아미노산으로부터 독립적으로 선택되고:
X 및 X'는 서로 조합되어 부가적인 리신과 임의로 연결되는 올레핀성 아미노산을 갖는 고리를 형성하거나; 또는
X 및 X' 중 하나 또는 모두는 존재하지 않고;
'm'은 1∼6의 정수이고;
R1은 C2-C20 아실 및 PEG 2-20 KD 부분으로 이루어진 군으로부터 선택되거나; 또는 존재하지 않고;
R2 및 R3는 C2-C20 아실 및 PEG 2-20 KD로 이루어진 군으로부터 독립적으로 선택되거나, 존재하지 않거나 또는 Ra-L'이고;
Ra는 비오틴 및 말레이미도 프로피온산으로부터 선택되고;
L'는 링커 -CO(CH2)n-NH-, -CO(CH2-CH2-O-)nNH 또는 -COCH2(-OCH2-CH2)nNH-로부터 선택되고; 그리고
'n'은 2∼10의 정수이고;
R4 및 R5는 독립적으로 NH2이거나, 또는 R4 및 R5 중 하나 또는 모두가 존재하지 않는다.
단, 상기 화학식(I)의 화합물에서,
a) 5∼25%의 아미노산은 다른 천연 또는 인조 아미노산으로 치환될 수 있고;
b) 30% 이하의 아미노산은 생략될 수 있고;
c) 상기 각 펩티드 서열에서 2 이하의 아미노산이 어떠한 위치에서도 개별적으로 부가될 수 있고;
d) 5∼25%의 펩티드 결합은 환원된 아미드 결합(-CH2NH-)으로 대체될 수 있고;
e) 100% 이하의 아미노산은 D-아미노산일 수 있고;
f) 100% 이하의 아미노산은 역순으로 될 수 있다.
하기 본 발명의 실시양태는 예증적인 것이며, 청구범위를 특정 실시양태에 한정하는 것은 아니다.
본 발명의 일 실시양태에 따라서, Z가 하나의 상기 펩티드 서열로 이루어지고, 그리고 A, B, D 및 E 중 적어도 하나가 존재하는 화학식(I)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, A, B, D 및 E가 존재하지 않고, 그리고 Z가 2∼4의 동일하거나 상이한 펩티드 서열을 포함하는 화학식(I)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, Z가 D 스트랜드, FG 루프 및 G 스트랜드의 조합인 화학식(I)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, X가 리신이고 그리고 X'가 존재하지 않는 화학식(I)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, X 및 X' 모두가 리신인 화학식(I)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, R2 및 R3가 C2-C20 아실 및 Ra-L'로부터 선택되는 화학식(I)의 화합물을 특별히 제공하고, 여기서
Ra는 말레이미도 프로피온산이고;
L'는 -COCH2(-OCH2-CH2)nNH-이고; 그리고
'n'은 2∼10의 정수이다.
또 다른 실시양태에 따라서 본 발명은 하기 화학식(Ia)의 화합물 또는 약학적으로 허용되는 그의 염을 제공한다:
(Ia)
상기 식에서,
A는 3개의 아미노산으로부터, FG 루프, BC 루프, C' 스트랜드, C-C' 루프, C' 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, 또는 A가 존재하지 않고;
B는 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드, C 스트랜드, D 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, B가 존재하지 않고;
Z는 3개의 아미노산으로부터, D 스트랜드, FG 루프, G 스트랜드, C 스트랜드 및 F 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지 임의의 순서로 배열된 1∼3의 펩티드 서열이고; 그리고
X는 리신이다.
본 발명의 또 다른 실시양태에 따라서, A 및 B가 독립적으로 3개의 아미노산으로부터 상기 BC 루프의 전체 길이까지의 아미노산 서열인 화학식(Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, A 및 B가 독립적으로 상기 BC 루프의 전체 길이인 화학식(Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, A가 BC 루프이고, 모든 아미노산이 역순인 화학식(Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, Z가 D 스트랜드-FG 루프-G 스트랜드인 화학식(Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, R1, R2 및 R3가 존재하지 않는 화학식(Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, R3가 C16-아실인 화학식(Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, 3 이하의 아미노산이 D-아미노산인 화학식(I) 또는 (Ia)의 화합물을 특별히 제공한다. 임의적으로는 10% 이하, 대안적으로는 20% 이하, 대안적으로는 50% 이하, 대안적으로는 80% 이하 또는 90% 이하의 아미노산이 D-아미노산이거나, 또는 적어도 10%, 또는 적어도 20%, 또는 적어도 50%, 또는 적어도 80% 또는 적어도 90%가 D-아미노산이다.
본 발명의 또 다른 실시양태에 따라서, 모든 아미노산이 D-아미노산인 화학식(I) 또는 (Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, 5∼25%의 펩티드 결합이 환원된 아미드 결합 (-CH2NH-)으로 치환된 수 있는 화학식(I) 또는 (Ia)의 화합물을 특별히 제공한다. 한편, 1 또는 2 이하 또는 3 또는 20% 이하 또는 10%의 펩티드 결합이 환원된 아미드 결합 (-CH2NH-)으로 대체될 수 있다.
본 발명의 또 다른 실시양태에 따라서, 모든 아미노산이 역순이거나 또는 2 이상, 임의로는 5 이상, 임의로는 10 이상의 아미노산의 서열이 역순이고, 또는 10 이하, 또는 5 이하가 역순인 화학식(I) 또는 (Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, 5∼25%의 아미노산이 기타 천연 또는 인조 아미노산으로 치환될 수 있는 화학식(I) 또는 (Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, 30% 이하, 바람직하게는 20% 이하, 또는 10% 이하의 아미노산이 생략될 수 있는 화학식(I) 또는 (Ia)의 화합물을 특별히 제공한다.
본 발명의 또 다른 실시양태에 따라서, 상기 각 펩티드 서열에서 3 이하의 아미노산, 바람직하게는 2 이하의 아미노산 또는 오직 하나의 아미노산이 개별적으로 어떠한 위치에도 첨가될 수 있는 화학식(I) 또는 (Ia)의 화합물을 특별히 제공한다.
본 발명의 화합물은 선형 또는 분기형 펩티드를 포함할 수 있으나, 1 이상의 펩티드 부분을 갖는 분기된 펩티드를 포함하는 화합물이 바람직하고, 1 이상의 가지가 존재할 수 있다.
일 실시양태는 본 발명의 화합물에 관한 것으로, 상기 화합물은 분기되어 있고, 1 이상의 가지는 적어도 5개의 아미노산 잔기의 인간 또는 손쥐 PD-1의 상기 엑토도메인 부분을 포함하는 펩티드 부분을 함유하고, 그리고 상기 화합물은 제1 N-말단 부분과 제2 N-말단 부분의 펩티드 부분을 포함하고, 이 두 부분은 분기점에서 C-말단 부분의 펩티드 부분에 결합되어 있다.
또 다른 실시양태는 본 발명의 화합물에 관한 것으로, 상기 화합물은 분기되어 있고, 1 이상의 가지는 적어도 5개의 아미노산 잔기의 인간 PD-1의 상기 엑토도메인 부분을 포함하는 펩티드 부분을 함유하고, 그리고 상기 화합물은 제1 N-말단 부분 및 제2 N-말단 부분의 펩티드 부분을 포함하고, 이 두 부분은 분기점에서 중간 펩티드 부분에 결합되어 있고, 이 중간 펩티드 부분은 다시 또 다른 분기점에서 제1 C-말단 부분 및 제2 C-말단 부분의 펩티드 부분의 각각에 결합되어 있다.
본 발명의 또 다른 실시양태는 화합물이 지질화되고 및/또는 글리코실화되어 있는 본 발명에서 기술된 화합물에 관한 것이다.
본 발명의 또 다른 실시양태는 화합물이 PEG 부분을 함유하고 본 발명에서 기술된 화합물에 관한 것이다.
본 발명의 또 다른 실시양태는 본 발명에서 기술된 화합물에 관한 것으로, 이 화합물에서 펩티드 부분의 1 이상의 아미노산이 D-아미노산으로 치환되어 있다.
본 발명의 또 다른 실시양태는 본 발명에서 기술된 화합물에 관한 것으로, 이 화합물에서 펩티드 부분의 1 이상의 아미노산이 D-아미노산으로 치환되어 있고, D-아미노산은 펩티드 부분의 N-말단 또는 C-말단의 아미노산 내에 존재한다.
본 발명의 또 다른 실시양태는 본 발명에서 기술된 화합물에 관한 것으로, 이 화합물에서 펩티드 부분의 1 이상의 아미노산이 D-아미노산으로 치환되어 있고, 상기 D-아미노산은 펩티드 부분의 N-말단 또는 C-말단에 존재한다.
본 발명의 실시양태에서는 세포예정사 1 (PD1) 신호전달 경로를 억제하고 PD-1에 대한 PD-L1 또는 PD-L2의 결합을 감소하여 PD-1에 의한 면역억제 신호전달을 형성할 수 있는 능을 갖고, 35 이하의 아미노산 잔기의 펩티드 부분을 포함하는 화합물을 제공한다.
본 발명의 또 다른 실시양태에 따라서, 세포예정사 1 (PD1) 신호전달 경로를 억제하고 PD-1에 대한 PD-L1 또는 PD-L2의 결합을 감소하여 PD-1에 의한 면역억제 신호전달을 형성하는 능을 갖는 화합물을 제공하고, 상기 화합물이 35 이하의 아미노산 잔기의 펩티드 부분을 포함하고, 상기 펩티드 부분이 다음 3 아미노산 잔기 서열 중 하나를 포함하는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 엑토도메인 부분을 포함하거나 또는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 엑토도메인 부분의 변이체를 함유하고, 상기 잔기들 중 2 이하가 삭제되거나, 치환되거나 변형되거나 2 이하의 추가적인 아미노산 잔기가 첨가된다:
본 발명의 또 다른 실시양태에 따라서, 다음 서열들 중 적어도 하나를 포함하는 본 발명에서 기술된 화합물을 제공한다:
PPTFS EDRSQ
NATFT GQDCR
FTCSP FRVTQ
SNTSESF LPNGR
VLNWY DFHMSV
NWYRM GTYLC
SNQTDK CGAIS
TDKLAA LAPKA
KLAAFP QIKE
PEDSQP
또 다른 실시양태는 본 발명의 화합물에 관한 것으로, 상기 3개의 아미노산 잔기 서열 내에 포함된 아미노산 잔기 중 1 이하가 삭제, 치환 또는 변형된다.
또 다른 실시양태는 본 발명의 화합물에 관한 것으로, 상기 화합물은 분기되고, 1 이상의 가지는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 상기 엑토도메인 부분을 포함하는 펩티드 부분을 함유한다.
또 다른 실시양태는 본 발명의 화합물에 관한 것으로, 상기 화합물은 분기되고, 1 이상의 가지는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 상기 엑토도메인 부분을 포함하는 펩티드 부분을 함유하고, 그리고 상기 화합물은 제1 N-말단 부분 및 제2 N-말단 부분의 펩티드 부분을 포함하고, 여기서 상기 두 말단 부분들은 분기점에서 C-말단 부분의 펩티드 부분에 결합된다.
또 다른 실시양태는 본 발명의 화합물에 관한 것으로, 상기 화합물은 분기되고, 1 이상의 가지는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 상기 엑토도메인 부분을 포함하는 펩티드 부분을 함유하고, 그리고 상기 화합물은 제1 N-말단 부분 및 제2 N-말단 부분의 펩티드 부분을 포함하고, 여기서 상기 두 말단 부분들은 분기점에서 중간 펩티드 부분에 결합되고, 펩티드 부분은 다시 또 다른 분기점에서 제1 C-말단 부분 및 제2 C-말단 부분의 펩티드 부분에 각각 결합된다.
본 발명의 또 다른 실시양태는 제1 N-말단 부분 및 제2 N-말단 부분의 펩티드 부분을 포함하는 본 발명의 분기된 화합물에 관한 것으로, 여기서 상기 제1 및/또는 제2 N-말단 부분의 펩티드 부분은 다음 3개의 아미노산 잔기 서열들 중 하나를 포함하는 적어도 5의 인접 아미노산 잔기의 인간 PD-1의 엑토도메인 부분을 포함한다:
본 발명의 또 다른 실시양태는 제1 N-말단 부분 및 제2 N-말단 부분의 펩티드 부분을 포함하는 본 발명의 분기된 화합물에 관한 것으로, 여기서 상기 제1 및/또는 제2 N-말단 부분의 펩티드 부분은 다음 3개의 아미노산 잔기 서열들 중 하나를 포함하는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 엑토도메인 부분을 포함한다:
또 다른 실시양태는 본 발명의 화합물에 관한 것으로, 상기 화합물은 분기되고, 1 이상의 가지는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 상기 엑토도메인 부분을 포함하는 펩티드 부분을 함유하고, 그리고 상기 화합물은 제1 N-말단 부분 및 제2 N-말단 부분의 펩티드 부분을 포함하고, 여기서 상기 두 말단 부분들은 분기점에서 C-말단 부분 펩티드 부분에 결합되고, 상기 C-말단 부분 또는 제1 및/또는 제2 C-말단 부분은 다음 3개의 아미노산 잔기 서열들 중 하나를 포함하는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 엑토도메인 부분을 포함한다:
또 다른 실시양태는 본 발명의 화합물에 관한 것으로, 상기 화합물은 분기되고, 1 이상의 가지는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 상기 엑토도메인 부분을 포함하는 펩티드 부분을 함유하고, 그리고 상기 화합물은 제1 N-말단 부분 및 제2 N-말단 부분의 펩티드 부분을 포함하고, 여기서 상기 두 말단 부분들은 분기점에서 중간 펩티드 부분에 결합되고, 상기 펩티드 부분은 다시 또 다른 분기점에서 제1 C-말단 부분 및 제2 C-말단 부분의 펩티드 부분 각각에 결합되고, 상기 제 1 및 상기 제2 C-말단 부분 중 하나는 다음 3개의 아미노산 잔기 서열들 중 하나를 포함하는 5 이상의 인접 아미노산 잔기의 인간 PD-1의 엑토도메인 부분을 포함한다:
본 발명의 일 실시양태에 따라서, 세포예정사 1 (PD1) 신호전달 경로를 억제하고 PD-1에 대한 PD-L1 또는 PD-L2의 결합을 감소하여 PD-1에 의한 면역억제 신호전달을 형성하는 능을 갖고, 35 이하의 아미노산 잔기의 펩티드 부분을 포함하는 화합물을 제공한다.
본 발명의 또 다른 실시양태에 따라서, 하기 표에서처럼 개별 종으로부터 선택된 서열 중 적어도 하나를 포함하는, 본 발명에서 기술된 화합물을 제공한다:
대표적인 화합물로는 다음과 같은 것들이 있으며, 이들 화합물은 예증적인 것이며 본 발명의 범위를 한정하는 것은 아니다.
본 발명의 화합물은, 지질화되고, PEG되고 및/또는 글리코실화되는 펩티드 부분을 포함할 수 있다. 펩티드의 1 이상의 아미노산은 생체 내에서 안정성을 증가시킨다는 면에서 D-아미노산일 수 있다.
본 발명은 통상적으로 약학적으로 허용되는 담체 또는 희석제와의 조합에 의해 약제 투여를 위해 배합된 상술한 화합물을 포함한다.
본 발명은 의학적 치료법, 예를 들면, 암 치료, 세균 및 바이러스 감염의 치료에 사용하기 위한 상술한 바와 같은 화합물을 포함한다.
본 발명은 또한 PD-1과 PD-1 리간드 사이의 상호작용을 차단하기 위해 화합물을 스크린하는 방법을 포함하며, 이 방법은 상술한 종류의 후보 화합물을 PD-1 또는 PD-1의 부분을 결합하는 PD-1 리간드와 접촉하고 PD-1 리간드 또는 PD-1 리간드의 부분을 결합하는 PD-1과 접촉하는 단계, 및 PD-1/PD-1 리간드의 결합도를 측정하는 단계를 포함한다.
상술한 바와 같이, 본 발명의 화합물은 PEG화에 의해 변형된 펩티드일 수 있다. 중합체는 약물동태학 및 약물력학을 개선하므로 펩티드, 단백질, 및 소분자와 같은 약제의 성능을 개선하기 위해 널리 사용되어 왔다. 약제에 이용하기 위해 가장 널리 사용되는 중합체는 폴리에틸렌 글리콜 ("PEG")이다. "PEG화"란 1 이상의 PEG 분자를 약제에 공유결합("coupling")하도록 약제를 화학적으로 변형시키는 방법을 의미한다 (얼마나 많은 부위가 약제 상에서 상호작용하고 PEG에 공액(conjugated)되느냐에 따라 달라짐). 약제의 PEG화와 관련하여 개선된 약학적 및 생물학적 성질은 의약 기술에 잘 알려져 있다. 예를 들면, PEG화는 단백질분해 효소에 의해 열화를 감소하고 그에 따라 약제 농도를 증가하고; 그 효소가 부착되는 약제의 크기를 증가하여 약제 생체분포를 개선하고; 그리고 원하는 경우 면역원성을 감소함에 있어 항원성 에피토프를 차단하는 것을 포함하는 수단에 의해 치료 효과를 증가할 수 있다. 치료 효과를 증가함으로써, 투여 횟수 및/또는 치료 효과를 얻는 데 필요한 약제 투여량을 줄일 수 있다.
선형 폴리에테르로서 PEG는 일반식 HO-(CH2-CH2O)n-CH2CH2-OH (여기서 n은 통상 약 10∼2000임)을 갖는다.
PEG는 H2N-(CH2-CH2O)n-CH2CH2-COOH(여기서 n은 통상적으로 약 10∼2000임)을 포함하도록 변형될 수 있다.
PEG 유도체 (PEG 및 PEG 유도체는 본 기술분야에서 "PEG"로 알려져 있음)를 형성하는 데 있어서 수많은 PEG 변형은 PEG 분자를 약제에 공유결합하기 위해 이용되도록 화학적 반응성 관능기를 부가 또는 변형함에 있어 말단기(관능기)와 관련되어 있다. 여러가지 PEG 유도체가 알려져 있다. PEG를 약제에 결합하기 위해서, 통상적으로 PEG 분자의 관능기는 화학적 반응성을 갖도록 활성화될 필요가 있다. 관능기의 형태 및 특성은 PEG 분자가 결합되는 약제에 대한 화학 반응기의 선택을 기본으로 한다. 단백질 및 펩티드에 대해 가장 일반적인 것으로서, 화학 반응기는 화학 유리 반응기 (예를 들면, 리신, 시스테인, 글루탐산, 세린, 트레오닌 등을 포함, 그러나 이들에 한정되지 않음), N-말단 아미노산 (화학 유리 반응기로서 N-말단 아민 기, 또는 측쇄 아민 기를 가짐), C-말단 아미노산 (화학 유리 반응기로서 C-말단 카르복시산, 또는 측쇄 아민 기를 가짐) 또는 이들의 조합물을 함유하는 측쇄를 갖는 내부 아미노산인 아미노산에 존재한다. PEG에 결합될 펩티드의 부위 중에서, 가장 자주 선택되는 것은, 펩티드의 N-말단 아미노산의 N-말단 아민 기 ("알파 아민"), 및 리신 (펩티드의 N-말단 아미노산 또는 C-말단 아미노산이 아닌 아미노산 서열 내에 발견된 리신)의 입실론 아민 기 ("입실론 아민") 또는 리신이 N-말단 아미노산 또는 C-말단 아미노산으로서 펩티드에 존재할 때, 리신의 입실론 아민 기이다.
펩티드에 복수개의 리신 기가 존재하고 그리고 PEG 분자의 복수 결합이 불필요한 경우에, PEG화 과정에서 PEG의 아민-반응성 관능기와의 화학 반응으로부터 화학적 보호제로 차단되는 1 이상의 아민기(예를 들면, 1 이상의 알파 아민 또는 입실론 아민)를 합성 과정에서 선택된 아미노산 위치에서 아미노산 서열에 혼입할 수 있고, 그 결과 PEG에 공유결합될 합성 펩티드의 선택된 아미노산 위치에서(화학적 변형을 통해) 유리 아민 기만이 PEG화를 가능하게 된다.
PEG화에 사용하기에 바람직한 폴리올은 수용성 폴리 (알킬렌 옥사이드) 중합체를 포함하고, 선형 또는 분기형 사슬을 가질 수 있다. "폴리올" 이란 용어는 바람직하게는 폴리에틸렌 글리콜 ("PEG"), 폴리프로필렌 글리콜 ("PPG"), 디에틸렌 글리콜, 트리에틸렌 글리콜, 에틸렌 글리콜, 디프로필렌 글리콜, PPG를 포함하는 공중합체(예, 에틸렌 글리콜/PPG), PEG를 포함하는 공중합체(예, PEG/PPG), mPEG (모노메톡시-폴리 (에틸렌) 글리콜) 등을 포함하는 수용성 폴리알코올을 의미하지만, 이들 화합물에 한정되는 것은 아니다. 적당한 폴리올은 동종중합체 및 공중합체를 포함하며, 본 기술 분야에서 통상의 지식을 가진 자에게 알려진 분기형 구조 또는 선형 구조를 포함하는 구조를 가질 수 있다.
바람직하게는, 중합체는 개별적으로 생체내에 이용될 때 사실상 비독성이다. 바람직한 실시양태에서, 중합체는 약 200∼40,000 달톤의 분자량을 갖고; 더욱 바람직한 실시양태에서, 중합체는 약 400∼10,000 달톤의 분자량을 갖는다. 본 발명에서 이용하기에 바람직한 중합체는 폴리에틸렌 글리콜 ("PEG")을 포함하고, 그리고 본 발명에서 이용하기에 더욱 바람직한 중합체는 약 400∼20,000 달톤의 분자량을 갖는 폴리에틸렌 글리콜을 포함한다.
상술한 바와 같이, 통상적으로 말단기 또는 PEG 분자를 약제에 공유결합시키는데 이용되는 화학적 반응성 관능기가 다른 PEG의 여러가지 형태가 있다. 여러 PEG들이 공지되어 있다. 본 발명에 따른 합성 펩티드의 비보호 아민기 1 이상에 결합하는 데 사용하기에 바람직한 PEG는, 1 이상의 비보호 아민기에 PEG를 공유결합하는데 사용될 수 있는 화학적 반응성 기(예를 들면 "관능기")를 갖는다. PEG는 다음과 같은 화합물을 포함할 수 있지만, 이들에 한정되는 것은 아니다: PEG-트레실레이트, 헤테로이관능성 PEG, PEG 디클로로트리아진, PEG 숙신이미딜 카보네이트, PEG 벤조트리아졸 카보네이트, PEG p-니트로페닐 카보네이트, PEG 트리클로로페닐 카보네이트, PEG 카르보닐이미다졸, PEG 숙신이미딜 숙시네이트, mPEG 숙신이미딜 프로피오네이트, mPEG 숙신이미딜 부타노에이트, PEG 부티르알데히드, mPEG-프로피온알데히드, PEG 알데히드, PEG-아세트알데히드, PEG 아세트알데히드 디에틸 아세탈, PEG 카르복시산, mPEG 페닐 에테르 숙신이미딜 카보네이트, mPEG 벤즈아미드 숙신이미딜 카보네이트, PEG 티오에스테르, 선형 PEG, 분기된 PEG, 및 선형의 갈라진 PEG.
또한, 본 발명의 화합물은 덴드리머와 같은 운반체 분자, 예를 들면 pAMAM 덴드리머, 리포좀, 마이크로입자 및 나노입자, 이를테면 폴리시아노아크릴레이트 나노입자와 조합될 수 있으며, 그리고 이들은 PEG화 될 수 있다.
본 발명의 화합물과 유사하지만 변형되어 있으며 PD-1 신호전달 경로를 차단하는데 있어 활성을 낮게하는 화합물이 예를 들면 프로토콜을 스크린함에 있어 조절제로서 유용할 수 있다. 이러한 화합물들은 대부분 또는 모든 아미노산이 D-아미노산인 상술한 본 발명의 화합물의 유사체, 대부분 또는 모든 아미노산이 역전된 서열 (레트로-화합물)인 상술한 본 발명의 화합물의 유사체, 그리고 대부분 또는 모든 아미노산이 D-아미노산 또는 레트로인버소(retroinverso)-화합물인 이러한 레트로-화합물의 유사체로 예상된다.
본 발명의 또 다른 실시양태는 본 발명에서 기술한 화합물에 관한 것으로, 여기서 펩티드 부분의 아미노산 1 이상이 D-아미노산으로 치환된다.
본 발명에서 기술된 화합물은 약제 투여용으로 배합된다.
본 발명의 또 다른 실시양태는 상술한 화합물 및 약학적으로 허용되는 담체 또는 희석제를 포함하는 의약 조성물을 제공하는 것이다.
본 발명의 또 다른 실시양태는 암을 치료하기 위한 약제를 제조하기 위해 본 발명에 기술된 화합물의 용도를 제공하는 것이다.
본 발명의 또 다른 실시양태는 세균 및 바이러스 감염을 치료하기 위한 약제를 제조하기 위해 본 발명에서 기술된 화합물의 용도를 제공하는 것이다.
본 발명의 또 다른 실시양태는 본 발명에 따른 화합물 및/또는 펩티드의 유료량을 환자에게 투여하는 것을 포함하는 암의 치료 방법을 제공하는 것이다.
본 발명의 또 다른 실시양태는 본 발명에 따른 화합물의 유효량을 환자에 투여함으로써 종양 세포의 성장 및/또는 전이를 억제하는 방법을 제공하는 것이다.
상기 종양 세포는 다음과 같은 암을 포함하지만 이들에 한정되는 것은 아니다: 흑색종, 신장암, 전립선암, 유방암, 결장암 및 폐암, 뼈암, 췌장암, 피부암, 머리나 목의 암, 피부 또는 안구 악성흑색종, 자궁 암, 난소암, 직장암, 항문 부위 암, 위암, 고환암, 자궁암, 난관 암종, 자궁내막 암종, 자궁경부 암종, 질 암종, 음문 암종, 호지킨병, 비호지킨 림프종, 식도암, 소장암, 내분비 계통의 암, 갑상샘암, 부갑상샘 암, 부신암, 연조직의 육종, 요도암, 음경암, 급성 골수성 백혈병, 만성 골수성 백혈병, 급성 림프모구 백혈병, 만성 림프성 백혈병과 같은 만성 또는 급성 백혈병, 어린이의 고형 종양, 림프성 림프종, 방광암, 신장 또는 요관암, 신우 암종, 중추 신경계(CNS)의 신생물, 일차 CNS 림프종, 종양 혈관형성, 척추축 종양, 뇌 줄기 신경아교종, 하수체선종, 카포시육종, 표피유사 암, 편평상피세포 암, T-세포 림프종, 석면에 의해 유발된 환경 유발암, 및 상기 암들의 조합.
본 발명의 또 다른 실시양태는 PD-1, PD-L1, 또는 PD-L2에 의해 유발된 면역억제 신호를 억제함으로써 야기된 면역강화를 통해 감염성 질환을 치료하는 방법을 제공하는데, 이 치료 방법은 본 발명에 따른 화합물 및/또는 펩티드의 유효량을 필요 환자에게 투여하는 것을 포함한다.
감염성 질병은 다음과 같은 것들이 있으나 이들에 한정되는 것은 아니다: HIV, 인풀루엔자, 포진, 편모충, 말라리아, 리슈만편모충(Leishmania), 바이러스 간염 (A, B, 및 C), 포진 바이러스 (예를 들면, VZV, HSV-I, HAV-6, HSV-II, 및 CMV, 엡스타인 바 바이러스), 아데노 바이러스, 인풀루엔자 바이러스, 플라비바이러스, 에코바이러스, 리노바이러스, 콕사키바이러스, 코르노바이러스, 호흡기 세포융합 바이러스, 볼거리 바이러스, 로타바이러스, 홍역 바이러스, 풍진 바이러스, 파르보 바이러스, 우두 바이러스, HTLV 바이러스, 뎅기열 바이러스, 유두종 바이러스, 물렁종바이러스, 회색질척수염 바이러스, 광견병 바이러스, JC 바이러스 및 아르보바이러스 뇌염 바이러스에 의한 병원성 감염; 박테리아 클라미디아, 리케차 박테리아, 미코박테리아, 포도구균, 연쇄구균, 뉴모노코치(pneumonococci), 수막구균성 및 코노코치(conococci), 클레브시엘라(klebsiella), 프로테우스, 세라티아(serratia), 슈도모나스, 대장균, 레기오넬라, 디프테리아, 살모넬라, 바실리(bacilli), 콜레라, 파상풍, 보툴리눔독소증, 탄저병, 흑사병, 렙토스피라병 및 라임질환 박테리아에 의한 병원성 감염; 진균 칸디다 (알비칸스, 크루세이, 글라브라타, 트로피칼리스 등), 크립토코쿠스 네오포르만스, 아스페르길루스 (푸미가투스, 니게르 등), 무코랄스(Mucorales)속 (무코르, 압시디아, 리조푸스), 스포로트릭스 쉐엔키(Sporothrix schenkii), 블라스토마이세스 데르마티티디스 (Blastomyces dermatitidis), 브라질파라콕시디오이데스 (Paracoccidioides brasiliensis), 콕시디오이데스 이미티스 (Coccidioides immitis) 및 히스토플리스마 캡슐라툼 (Histoplasma capsulatum)에 의한 병원성 감염; 및 기생충 이질아메바, 대장 발란티듐, 나에글레리아포울레리(Naegleriafowleri), 가시아메바 종(Acanthamoeba sp.), 람블편모충, 와포자충 종(Cryptosporidium sp.), 쥐폐포자충, 삼일열원충, 쥐바베스열원충, 트리파노소마 브루세이, 크루스파동편모충, 도너반리슈만편모충, 톡소포자충, 니포스트롱길루스 브라질리엔시스(Nippostrongylus brasiliensis)에 의한 병원성 감염.
본 발명의 화합물은 의학적 치료 방법에 사용하기 위한 것이다.
본 발명의 화합물은 단일 약제 또는 약학적으로 허용가능한 여러 물질과 혼합되는 의약 조성물로서 사용될 수 있다.
의약 조성물은 통상 비경구 경로로 투여되지만, 경구 또는 흡입 경로로 투여될 수 있다. 비경구 투여의 예로는 주사, 피하, 점막관통, 콧속통과 및 경폐 투여가 있다.
주사 가능한 물질은 용액, 현탁액, 및 사용 전 용매에 용해 또는 현탁되는 고형 주사액이다.
주사액은 1 이상의 활성 성분이 용매에 용해, 현탁 또는 유화된 후 사용된다. 용매의 예로는 수용성 용매 (예를 들면, 증류수, 생리식염수 및 링거액), 오일 용매 (예를 들면, 올리브 기름, 참기름, 목화씨 기름 및 옥수수 기름과 같은 식물성 기름, 및 프로필렌 글리콜, 폴리에틸렌 글리콜 및 에탄올과 같은 알코올), 및 이들의 조합물이 있다.
또한, 주사액은 다음을 함유할 수 있다: 안정화제 (예를 들면, 인간 혈청 알부민), 용해제 (예를 들면, 폴리에틸렌 글리콜, 프로필렌 글리콜, D-만니톨, 트레할로스, 벤질 벤조에이트, 에탄올, 트리스아미노메탄, 콜레스테롤, 트리에탄올 아민, 탄산나트륨, 구연산나트륨, 살리실산나트륨 및 아세트산나트륨), 현탁제(예를 들면, 계면활성제, 이를테면 스테아릴 트리에탄올 아민, 나트륨 라우릴 설페이트, 라우릴 아미노프로피온산, 레시틴, 벤잘코늄 클로라이드,벤잘코늄 클로라이드 및 글리세릴 모노스테아레이트; 친수성 중합체, 이를테면 폴리비닐 알코올, 폴리비닐 피롤리돈, 나트륨 카르복시메틸 셀룰로오스, 메틸 셀룰로오스, 히드록시메틸 셀룰로오스, 히드록시에틸 셀룰로오스 및 히드록시프로필 셀룰로오스; 폴리소르베이트; 및 폴리옥시에틸렌 경화 피마자유), 유화제, 진정제 (예를 들면, 벤질 알코올), 긴장제 (예를 들면, 염화나트륨, 글리세린, D-만니톨, D-소르비톨 및 글루코오스), 완충제, 보존제 (예를 들면, 메틸파라벤, 프로필파라벤, 벤질 알코올, 클로로부탄올 및 페놀), 방부제(예를 들면, 파라옥시벤조산 에스테르, 클로로부탄올, 벤질 알코올, 펜에틸알코올, 데하이드로아세트산 및 소르브산), 항산화제 (예를 들면, 설파이트 및 아스코브산염) 및 분산제 (예를 들면, 폴리소르베이트 80, 폴리옥시에틸렌 경화 피마자유 60, 에틸렌 글리콜, 카르복시메틸 셀룰로오스 및 나트륨 알긴산염).
이들 주사제는 조제 기술 분야에서 공지된 방법, 이를테면 여러가지 약전에 설명된 방법에 의해 제조될 수 있다. 주사제는 예를 들면, 최종 단계에서의 멸균법을 통해, 또는 무균 조작법에 의해 제조된다. 또한 무균 고형 배합물, 이를테면 냉동 건조 생성물을 사용할 수 있는데, 여기서 무균 고형 배합물은 사용 전에 주사용 무균 또는 멸균 증류수 또는 기타 용매에 제조 및 용해된다.
이들 비경구 용액은 표준 용량의 용기, 이를테면 플라스틱 또는 유리 바이얼, 앰푸울, 주사기 및 인젝터에 넣어져 공급되거나 또는 병과 같은 큰 용량의 용기에 넣어져 공급될 수 있다.
본 발명에 따른 화합물의 투여는 나이, 체중, 증상, 치료 효과, 투여 법 및/또는 치료 시간에 따라 달라진다. 본 발명의 화합물들은 일반적으로 비경구 경로 (바람직하게는 정맥 투여)에 의해, 성인의 경우, 1 ng∼100 mg/시간의 양으로, 며칠에 한번, 3일에 한번, 2일에 한번, 하루에 한번 내지 하루 수회 투여될 수 있거나, 또는 하루에 1∼24 시간 정맥 투여에 의해 연속적으로 투여될 수 있다. 투여량은 여러 조건에 의해 영향을 받기 때문에, 상기 투여량보다 적은 양으로 때로는 충분히 효과를 내지만, 어떤 경우에는 더 많은 투여량이 필요할 때가 있다.
주사에 의한 비경구 투여는 모든 형태의 주사를 포함하고, 또한 정맥 액을 포함한다. 예를 들면, 근육내 주사, 피하 주사, 피부내 주사, 동맥내 주사, 정맥 주사, 복강내 주사, 척추강(spinal cavity) 주사, 및 정맥 내 방울 주입이 있다.
본 발명의 화합물은, (1) 본 발명에 따른 약제의 예방 및/또는 치료 효과에 대한 보충 및/또는 촉진, (2) 본 발명에 따른 예방 및/또는 치료 약제의 동역학, 흡수 개선, 투여량 감소, 및/또는 (3) 본 발명에 따른 예방 및/또는 치료 부작용 감소를 위해 기타 약제와 조합되어 투여될 수 있다.
본 발명의 펩티드 및 기타 약제를 포함하는 수반 의약(concomitant medicine)은, 2 성분이 단일 배합물에 함유되는 조합 제제로서 투여되거나 별도의 배합물로서 투여될 수 있다. 별도의 배합물에 의한 투여는 동시 투여 및 수 시간 간격의 투여를 포함한다. 수 시간 간격으로 투여하는 경우에, 본 발명의 화합물이 먼저 투여된 후, 또 다른 약제가 투여되거나, 또는 또 다른 약제가 먼저 투여된 후 본 발명의 화합물이 투여될 수 있다. 각 약제의 투여법은 동일하거나 상이할 수 있다.
기타 약제의 투여량은 임상적으로 사용된 투여량을 기본으로 적절히 선택될 수 있다. 본 발명에 따른 화합물과 기타 약제의 혼합비는 환자의 나이 및 체중, 투여법, 투여 시간, 치료할 질환, 증상 및 이들의 조합에 따라 적절히 선택될 수 있다. 예를 들면, 기타 약제는 본 발명의 화합물 1 질량부를 기준으로 0.01∼100 질량부의 양으로 사용될 수 있다. 기타 약제는 2종 이상의 임의의 약제를 적절한 비로 포함하는 조합물일 수 있다. 본 발명에 따른 화합물의 예방 및/또는 치료 화과를 보충 및/또는 촉진하는 기타 약제는 상기 메커니즘을 기본으로 할 때, 이미 발견된 것뿐만 아니라 장래 발견될 것도 포함한다.
이러한 수반 사용에 의해 예방 및/또는 치료 효과를 나타내는 질병은 특히 제한되지 않는다. 수반 의약은, 본 발명에 따른 화합물의 예방 및/또는 치료 효과를 보충 및/또는 촉진하는 한, 어떠한 질병에도 사용될 수 있다.
특히, 본 발명의 화합물은 림프구 세포를 자극 또는 증식하는 효과를 나타내기 때문에, 다른 약제와 수반하여 사용하면 일반적으로 사용되는 화학치료제의 투여량이나 방사선 치료의 방사선 조사량을 감소할 수 있다. 이는 화학요법 및 방사선 치료에 수반하는 부작용을 억제한다.
본 발명의 화합물은 현존하는 화학치료제와 함께 사용되거나 또는 그 혼합물 형태로 사용될 수 있다. 화학치료제의 예로는 알킬화제, 니트로소우레아제, 항대사물질, 항암 항생제, 식물성 알칼로이드, 국소이성화효소 억제제, 호르몬 약제, 호르몬 길항제, 아로마타제(aromatase) 억제제, P-글리코단백질 억제제, 백금 복합 유도체, 기타 면역 치료 약제 및 기타 항암 약제가 있다. 또한, 이들은 암 치료 보조제, 이를테면 백혈구감소(호중성 백혈구 감소증) 치료약제, 저혈소판증 치료약제, 항구토제 및 암 통증완화제와 함께 사용되거나, 또는 혼합물 형태로 사용될 수 있다.
본 발명의 화합물은 기타 면역조절 물질과 함께 사용되거나 또는 혼합물 형태로 사용될 수 있다. 면역조절물질의 예로는 여러가지 시토킨이 있다. 면역 반응을 자극하는 시토킨스의 예로는 GM-CSF, M-CSF, G-CSF, 인터페론-α, β 또는 γ IL-1, IL-2, IL-3 및 IL-12이 있다.
본 발명에 따른 화합물 및 암 항원을 함께 사용하면 추가 또는 상승 효과를 얻을 수 있다. 암 항원의 예로는 악성 흑색종의 MAGE-1 또는 MAGE-3로부터 유도된 HLA-A1 및 HLA-A2 유도 펩티드, MART-1 및 gp100, 유방 암 및 난소 암의 HER2/뉴펩티드, 아데노 암종의 MUC-1 펩티드 및 전이성 암의 NY-ESO-1가 있다.
본 발명의 화합물은 그의 리간드 분자에 강하고 특이적으로 결합하기 때문에, 그의 라벨링제는 세포 표면 관능성 분자 또는 리간드 분자가 간여하는 질병의 시험 또는 진단 약제 또는 연구 시약으로서 사용될 수 있다.
본 발명의 화합물을 라벨할 수 있는 라벨링제의 예로는 방사성 동위원소, 효소, 형광물질, 발광물질, 자외선 흡수 물질이 있다.
본 발명의 화합물이 효소-연결 면역흡수분석(EIA) 법에 사용될 때, 그 화합물은 효소, 이를테면 알칼리 포스페이트, β-갈락토시다제, 퍼옥시다제, 마이크로퍼옥시다제, 글루코오스 옥시다제, 글루코오스-6-포스페이트 탈수소 효소, 아세틸콜린에스테라제, 말레이트 탈수소 효소 및 루시퍼라제로 라벨링함으로써 사용될 수 있다.
본 발명의 화합물이 방사면역측정(RIA) 법에 사용될 때, 그 화합물은 방사성동위원소, 이를테면 131I, 125I, 99 mTc, 355S, 32P, 14C 및 3H로 라벨링함으로써 사용될 수 있다.
본 발명의 화합물이 형광 면역(FIA) 법에 사용될 때, 그 화합물은 형광물질, 이를테면 플루오레세인, 댄실(dansyl), 플루오레스카민, 쿠마린, 나프틸아민, 플루오레세인 이소티오시아네이트, 로다민, 로다민 X 이소티오시아네이트, 설포로다민 101, 루시퍼(Lucifer) 옐로우, 아크리딘, 아크리딘 이소티오시아네이트, 리보플라빈 및 그 유도체, 그리고 유로피움(Eu)으로 라벨링함으로써 사용될 수 있다.
본 발명의 화합물이 화학발광 면역분석 (CLIA)법에 사용될 때, 그 화합물은 발광물질, 이를테면 루미놀 유도체, 예를 들면, 루시페린, 이소루미놀, 루미놀, 아미노에틸 이소루미놀, 아미노에틸에틸 이소루미놀, 아미노프로필 이소루미놀, 아미노부틸 이소루미놀 및 아미노헥실에틸 이소루미놀; 루시페린; 루시게닌; 및 비스(2,4,6-트리플루오로페닐) 옥살레이트로 라벨링함으로써 사용될 수 있다.
본 발명의 화합물이 자외선 흡수법에 사용될 때, 그 화합물은 특정 자외선 파장에서 흡수를 갖는 물질, 이를테면 페놀, 나프톨, 안트라센 및 그 유도체로 라벨링함으로써 사용될 수 있다.
본 발명의 화합물이 전자 스핀 공명 (ESR) 법에 사용될 때, 그 화합물은 옥실 기를 갖는 화합물, 이를테면 4-아미노-2,2,6,6-테트라메틸피페리딘-1-옥실, 3-아미노-2,2,5,5-테트라메틸피롤리딘-1-옥실, 2,6-디-t-부틸-α-(3,5-디-t-부틸-4-옥소-2,5-시클로헥사디엔-1-일리덴)-p-톨일옥실로 나타내지는 스핀 라벨링제로 라벨링함으로써 사용될 수 있다.
또한, 본 발명의 화합물은 본 기술분야에서 통상적으로 사용되는 어떠한 라벨링제로도 라벨될 수 있다.
상기 라벨링제를 본 발명에 따른 화합물의 펩티드 부분에 결합하기 위해서, EIA, RIA, FIA 등에 통상적으로 실시되는 공지된 라벨링 방법들, 이를테면 "Medical Chemistry Experimental Course, 제 1판., Vol. 8, 발행인 U. Yamamura, Nakayama Bookstore 출판, 1971; Illustrated Fluorescent Antibody, 제 1판, A. Kawao 저, Softscience 출판, 1983; 및 Enzyme-linked immunoassay, 제 2판, 편집인 E. Ishikawa, T. Kawai 및 K. Muroi, Igakushoin 출판, 1982"에 기재된 방법들이 이용된다.
이들 라벨링 방법 중에서, 바람직한 방법은 아비딘 (또는 스트렙타비딘)과 비오틴 간의 반응을 이용하는 방법이다. 아비딘 (또는 스트렙타비딘)과 비오틴 간의 반응을 이용하는 경우에, 비오틴을 본 발명에 따른 화합물의 펩티드 부분과 결합하는 방법은 시중에서 구입할 수 있는 비오틴화제[예를 들면, 숙신이미드 기 (예를 들면, NHS-비오틴)가 도입되는 비오틴 또는 N-히드록시숙신산 이미드(NHS)를 스페이서를 통해 비오틴과 결합함으로써 제조된 약품]를 단백질 내의 아미노 기와 반응시키는 방법 ('Biological Chemistry' 잡지, 1989, Vol. 264, pp.272-279); 시중에서 구입할 수 있는 비오틴-HPDP (N-[6-(비오틴아미드)헥실]-3'-(2'-피리딜티오)프로피온 아미드) 또는 N-요도아세틸-N-비오틴일헥실렌디아민을 단백질 내의 티올 기와 반응시키는 방법 (Ann. New York Acad. Sci., 1975, Vol. 254, No. 203); 또는 히드라진 기가 도입되는 비오틴을 알데히드화 단백질 내의 알데히드 기와 반응시키는 방법 (Biotech. Apple. Biochem., 1987, Vol. 9, pp.488-496)이 있다.
본 발명은 이하 실시예에 의해 더욱 상세히 설명된다.
자동화 펩티드 합성이 프로테인 테크놀로지 인코포레이티드(Protein Technologies Inc.) 제품의 "심포니 페럴렐 합성기(Symphony Parallel Synthesizer)"에서 실시되었다.
심포니
패럴렐
합성기를 사용한 시험법(프로토콜)
[표 1] 팽윤을 위한 프로그램, 제1 잔기 부착 및 캡핑
[표 2] 아미노산를 결합하기 위한 프로그램
[표 3] N-말단 아미노산의 결합 프로그램
펩티딜
수지의 분해 및 전체적인 보호해제의 과정
펩티딜 수지를 MeOH (6 x 15 ml) 및 용매 에테르 (3 x 15 ml)로 세척한 후 진공 하에 건조하였다. 고체 지지체로부터 펩티드의 분해는 펩티드-수지를 실온에서 2.5 시간 동안 각 펩티드에 대해 명시된 분해 혼합물(cleavage cocktail)로 처리함으로써 이루어진다. 분해 혼합물을 여과 수집한 후, 수지를 TFA 및 DCM으로 세척하였다. 과량의 TFA 및 DCM을 질소 하에서 소량으로 농축한 후, DCM을 잔류물에 첨가한 다음 질소 하에서 증발시켰다. 이러한 공정을 3∼4회 반복하여 대부분의 휘발성 불순물을 제거하였다. 잔류물을 0℃까지 냉각한 후, 무수 에테르를 첨가하여 펩티드를 침전시켰다. 침전된 펩티드를 원심분리한 후, 상청액 에테르를 제거한 다음, 새로운 에테르를 펩티드에 첨가하여 다시 원심분리하였다. 잔류물을 밀리포어(Millipore) 물에 용해한 후, 동결건조하여 원(crude) 펩티드를 얻었다.
분해 혼합물 A= 82.5% TFA/5% 페놀/5% 티오아니솔/2.5% 1,2-에탄디티올/5% 물
분해 혼합물 B= 80% TFA/5% 페놀/5% 티오아니솔/2.5% 1,2-에탄디티올/5% DCM/ 2.5 % DMS
분해 혼합물 C= 90% TFA/5% TIPS/5% 물
펩티드의 정제 및 특성화
Zorbax Eclipse XDB-C18 실리카 컬럼 (4.6 mm x 250 mm, 5 ㎛)을 이용하여 역전 상 분석 HPLC를 실시하였다.
이용된 용출(elution) 조건은 다음과 같다:
방법-1: 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴/물(9:1) 내의 0.1% TFA.
2 % 완충액 B로 채워진 컬럼의 평형화 및 2%∼70% 완충액 B에 의해 15분 동안 용출.
방법-2: 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴/물(9:1) 내의 0.1% TFA.
2 % 완충액 B로 채워진 컬럼의 평형화 및 2%∼25% 완충액 B에 의해 5 분 및 25%∼40% 완충액 B에 의해 총 작업시간 20 분 동안 용출.
방법-3: 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴/물(9:1) 중 0.1% TFA.
2 % 완충액 B로 채워진 컬럼의 평형화 및 0∼15 분=2∼70% 완충액 B, 15∼20 분 = 70∼95 % 완충액 B의 차에 의한 용출.
LCMS는, Mercury MS 컬럼을 사용하고, G1315 B DAD 다이오드 어레이 검출기를 갖는 Agilent 1100 시리즈 HPLC로 AP1 2000 LC/MS/MS 트리플 쿼드(triple quad) (이용된 바이오시스템) 상에서 실시되었다.
실시예 1; 하기 화합물의 합성
(서열 ID NO 47)
선형 단편의 합성: FRVTQKFRVTQ[Ahx]LAPKAQIKE-NH2
건조된(desiccated) CLEAR-아미드 수지 ((100-200 메쉬) 0.4 mmol/g, 0.5 g)를 폴리프로필렌 필터가 구비된 2개의 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기(Symphony parallel synthesizer) (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑(capping)을 실시하였다. 표 II에서 설명한 바와 같이 후속적인 아미노산 결합(coupling)을 실시하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Ahx-OH (Fmoc-6-아미노헥사노산), Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다. 자동 펩티드 합성기에서 선형 합성 단편화를 종료한 후, 수지를 꺼낸 후 함께 모은 후 수동으로 합성을 실시하였다.
펩티드의 선형 사슬에 있는 N-말단 아미노산 페닐알라닌은 N-Fmoc 아미노산에 이용되는 것과 동일한 방법으로 N-Boc 아미노산으로서 결합되었다. 분기점으로서 사용된 제6 리신 (N 말단으로부터)의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 5 및 15 분 동안 처리함으로써 직각 방향으로(orthogollally) 보호해제되었다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. 보호해제는 포지티브 닌히드린 시험에 의해 확인되었다. 무수 DMF 내의 Fmoc - Phe - OH (0.39 g; 5 당량, 1 mmol)를 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.16 mL; 5 당량) 및 HOBT (0.14 g; 5 당량)로 결합반응(coupling)을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기에 의해 회전하였다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. 결합 종료 시 펩티드 수지 일정부분(aliquot)에 관한 카이저(Kaiser) 시험은 네가티브이었다. 펩티딜 수지의 Fmoc 기는 20% (v/v) 피페리딘/DMF 용액으로 5 및 15 분 (10 mL) 동안 2회 처리함으로써 보호해제 되었다. 수지를 DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 그 다음, 무수 DMF 내의 펩티드 서열 Fmoc - Ser ( OtBu )- OH (0.39 g; 5 당량 1 mmol)에서 아미노산을 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.16 mL; 5 당량) 및 HOBT (0.14 g; 5 당량)로 결합을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기로 회전하였다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 세린 결합의 종료 시, 세린 상의 Fmoc 기는 5 및 15 분 (10 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 그 다음, 무수 DMF 내의 아미노산 Fmoc - Glu ( OtBu )- OH (0.43 g; 5 당량 1 mmol)을 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.16 mL; 5 당량) 및 HOBT (0.14 g; 5 당량)로 결합을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기로 회전하였다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL) 로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지 상의 Fmoc 기는 5 및 15 분 (10 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 그 다음, 무수 DMF 내의 아미노산 Fmoc - Ser (OtBu)-OH (0.39 g; 5 당량 1 mmol)을 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.16 mL; 5 당량) 및 HOBT (0.14 g; 5 당량)로 결합을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기로 회전하였다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL) 로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지 상의 Fmoc 기는 5 및 15 분 (10 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 그 다음, 무수 DMF 내의 아미노산 Fmoc - Thr ( OtBu )- OH (0.4 g; 5 당량 1 mmol)을 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.16 mL; 5 당량) 및 HOBT (0.14 g; 5 당량)로 결합을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기로 회전하였다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL) 로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지 상의 Fmoc 기는 5 및 15 분 (10 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 그 다음, 무수 DMF 내의 아미노산 Fmoc - Asn ( Trt )- OH (0.6 g; 5 당량 1 mmol)을 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.16 mL; 5 당량) 및 HOBT (0.14 g; 5 당량)로 결합을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기로 회전하였다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL) 로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지 상의 Fmoc 기는 5 및 15 분 (10 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 그 다음, 무수 DMF 내의 아미노산 Fmoc - Ser ( OtBu )- OH (0.39 g; 5 당량 1 mmol)을 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.16 mL; 5 당량) 및 HOBT (0.14 g; 5 당량)로 결합을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기로 회전하였다. 수지를 여과한 후, DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 x 10 mL) 로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지 상의 Fmoc 기는 5 및 15 분 (10 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 10 mL), DCM (6 x 10 mL) 및 DMF (6 X 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 A를 사용하여 펩티딜 수지를 분할하여 수율 69%로서 450 mg을 얻었다. 완충액 A: 0.1% TFA/물, 아세토니트릴/물(9:1) 내의 완충액 B: 0.1% TFA로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질(crude material)을 정제하였다. 5 mL/분의 유속으로 구배 용리(gradient elution) 0∼5 분 = 5∼20 % 완충액 B, 5∼40 분 = 20∼35 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 2): 실온, 14.6 분 (94.4%); LCMS 이론 질량: 3237.83, 측정 질량: 1619.9 [M/2+H]+; 1080.2 [M/3+H]+
실시예 2: 하기 화합물의 합성
(서열
ID
NO
49)
선형 단편-
Fmoc
-
FRVTQLAPKAQIKE
의 합성
건조된 CLEAR-아미드 수지 ((100-200 메쉬) 0.4 mmol/g, 0.5 g)를 폴리프로필렌 필터가 구비된 2개의 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적인 아미노산 결합을 실시하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다. Fmoc-Phe-OH 결합 종료 후, 수지를 펩티드 합성기로부터 꺼낸 다음, 하기와 같이 결합을 수동으로 실시하였다.
자동 합성기로부터 얻어진 Fmoc-Phe-OH 펩티딜 수지를 프릿(frit) 처리된 유리 용기에 넣었다. 펩티딜 수지의 Fmoc 기는 5 및 15 분 (10 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 15 mL), DCM (6 x 15 mL) 및 DMF (6 x 10 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 무수 DMF 내의 Fmoc -Lys ( Fmoc )- OH (0.48 g; 4 당량. 0.8 mmol)를 보호해제된 수지에 첨가한 후, DMF 내의 DIC (0.15 mL; 5 당량, 1 mmol) 및 HOBT (0.08 g; 5 당량, 0.6 mmol)로 결합을 개시하였다. 반응 혼합물 중 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 3 시간 동안 회전기로 회전하였다. 수지를 여과한 후, DMF (6 x 15 mL), DCM (6 x 15 mL) 및 DMF (6 x 15 mL)로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지 상의 Fmoc 기는 5 및 15 분 (15 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 15 mL), DCM (6 x 15 mL) 및 DMF (6 x 15 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. Fmoc-Lys(Fmoc)-부착 펩티딜 수지 상의 Fmoc 기를 보호해제한 후, 수지 함량(loading)에 대해 8 당량 과량의 아미노산 (1.6 mmol), 8 당량 과량의 HOBt (0.22 g, 1.6 mmol) 및 10 당량 과량의 DIC (0.32 mL, 2 mmol)를 사용하여 유리 아미노 말단 모두로부터 펩티드 사슬을 성장시켰다. 실온에서 3 시간 동안 결합을 실시하였다. 펩티딜 수지에 결합된 아미노산은 Fmoc-Phe-OH (0.62 g; 8 당량,1.6 mmol), Fmoc-Ser (OtBu)-OH (0.62 g; 8 당량, 1.6 mmol), Fmoc-Glu (OtBu)-OH (0.68 g; 8 당량, 1.6 mmol), Fmoc-Ser (OtBu)-OH (0.62 g; 8 당량,1.6 mmol), Fmoc-Thr (OtBu)-OH (0.64 g; 8 당량, 1.6 mmol), Fmoc-Asn (Trt)-OH (0.95 g; 8 당량, 1.6 mmol) 및 Boc-Ser (OtBu)-OH (0.41 g; 8 당량, 1.6 mmol)로서 N-말단 아미노산이었다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 A를 사용하여 펩티딜 수지를 분할함으로써 수율 70%로 565 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼5 분 = 5∼10 % 완충액 B, 10∼20 분 = 29 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12 분 (96 %); LCMS 이론 질량: 3261.62, 측정 질량: 1631.6 [M/2+H]+; 1088 [M/3+H]+;); 816.2[M/4+H]+;
실시예 3: 하기 화합물의 합성
(서열 ID NO 102)
건조된 CLEAR-아미드 수지 ((100-200 메쉬) 0.49 mmol/g, 0.5 g)를 폴리프로필렌 필터가 구비된 2개의 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Ser(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적인 Fmoc-아미노산 결합을 실시하였다. 합성에 사용된 아미노산은 Fmoc-Glu(OtBu)-OH, Fmoc-Tyr(OtBu)-OH, Fmoc-Trp(Boc)-OH, Fmoc-Asp(OtBu)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Asn(Trt)-OH Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH, Fmoc-Ahx-OH이었다. 비오틴 결합의 경우에, 비오틴 (2.5 mL DMF 내의 0.15g)을 DMF/DMSO (1:1)에 용해한 후, 자동 펩티드 합성기 내의 반응 용기에 수동으로 첨가한 다음, 표 II의 단계 3 및 4에서처럼 결합반응을 계속하였다(아미노산 대신 비오틴 사용).
Dde
기의 직각방향 보호해제
분기점으로서 사용된 제16 잔기 리신(N 말단으로부터)의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가하고 자동 합성기에서 직각 방향으로 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 패럴렐 합성기에서 수동으로 세척하였다. 분기에서 아미노산의 결합은 Fmoc-Ser (OtBu)-OH으로 출발하여 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 분기된 펩티딜 수지 내의 N-말단 산에 표 III의 프로그램을 이용하여 Fmoc-Lys(Boc)-OH를 결합하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 B를 사용하여 펩티딜 수지를 분할함으로써 수율 65%로 516 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼4 분 = 10 % 완충액 B, 4∼25 분 = 10∼28 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 11.94 분 (96 %); LCMS 이론 질량: 3245.69, 측정 질량: 1623 [M/2+H]+; 1082.3 [M/3+H]+; 811.8 [M/4+H]+;
실시예 4: 하기 화합물의 합성
(서열 ID NO 61)
건조된 CLEAR-아미드 수지 ((100-200 메쉬) 0.4 mmol/g, 0.3 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적인 Fmoc-아미노산 결합을 실시하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ile-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다.
Dde
기의 직각방향 보호해제
N-Fmoc 아미노산에 이용된 것과 동일한 방법으로 N-말단 아미노산 Ser(OtBu)-OH을 펩티드의 선형 사슬에 N-Boc 아미노산으로서 결합하였다. 분기점으로서 사용된 제15 잔기 리신 (C-말단으로부터)의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가하고 자동 합성기에서 직각 방향으로 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 패럴렐 합성기에서 수동 프로그램으로 세척하였다. 분기에서 아미노산의 결합은 Fmoc-Phe-OH로 출발하여 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 합성에 사용된 아미노산은 Fmoc-Thr(OtBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다. 헥사노산(0.22g, 2.5 mL DMF)을 사용하여 N-말단 아미노산 결합을 실시한 후, 자동 펩티드 합성기 내의 반응 용기에 수동으로 첨가한 다음, 표 II의 단계 3 및 4 에서처럼 결합반응을 계속하였다(아미노산 대신 헥사노산 사용). 분할 방법에서 설명한 바와 같이, 분할 혼합물 A를 사용하여 펩티딜 수지를 분할함으로써 수율 74%로 320 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴/물(9:1) 내의 0.1% TFA로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼25분 = 5∼50 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.8분(94.4%); LCMS 이론 질량: 3359.62, 측정 질량: 1680.3 [M/2+H]+; 1120.4 [M/3+H]+; 840.5 [M/4+H]+
실시예 5: 하기 화합물의 합성
(서열 ID NO 64)
2개의 반응 용기에서 심포니 패럴렐 합성기를 사용하여 펩티드로부터 투명한 아미드 수지(0.46 mmol/g; 500 mg) 상에서 실시예 5의 합성을 실시하였다. 표 1의 시험법에 따라 제1 아미노산 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 2의 설명에 따라 후속적으로 아미노산 결합을 실시하였다. 위치 8 및 12의 결합을 위해 자동 합성하는 동안, 표 II의 세척 단계 (단계 2) 후에 Fmoc-(R)-2-(4'-펜테닐) 알라닌을 수동으로 첨가한 다음, 표 2의 단계 3, 4에 언급된 시약을 프로그램에 따라 수동으로 첨가하여 서열을 중단하고, 그리고 후속적으로 아미노산 결합을 위해 서열을 재개하였다. Fmoc-아미노산을 위해 사용된 유사한 방법을 이용하여 Boc 아미노산으로서 N-말단 아미노산을 부착하였다.
Dde 기의 직각방향 보호해제
C-말단으로부터 제15 잔기 리신의 ε-아미노 기는 분기점으로서 사용되고 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가하고 자동 합성기에서 직각 방향으로 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 수동 프로그램으로 다시 세척하였다. 분기에서 아미노산의 결합은 Fmoc-Phe-OH로 출발하여 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 합성에 사용된 아미노산은 Fmoc-Thr(OtBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다. Fmoc-아미노산을 위해 사용된 유사한 방법을 이용하여 Boc 아미노산으로서 N-말단 아미노산을 부착하였다.
올레핀성
아미노산의 스티칭(
Stitching
)
소결된 디스크를 갖는 20 mL 용량의 맞춤형 고체상 펩티드 용기에서 2개의 올레핀성 아미노산의 스티칭(stitching)을 실시하였다. 선형 펩티드 서열의 종료 후, 탈기된 1,2-디클로로에탄 (DCE) 내의 20 mol% Grubbs 촉매(1.7 g, 15 ml)를 사용하여 실온에서 2 시간 동안 수지 결합 N-말단 캡핑된 펩티드의 고리 폐쇄 병부전위(closure metathesis)를 실시하였다. 2 시간 후 수지를 DCE, DCM, 메탄올로 세척한 다음, 진공에서 철야 건조하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 C를 사용하여 펩티딜 수지를 분할함으로써 수율 63%로 530 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼30 분 = 10∼80 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.9 분(95.4%); LCMS 이론 질량: 3697, 측정 질량: 1232.5 [M/3+H]+; 924.9 [M/4+H]+; 740.2[M/5+H]+
실시예 6: 하기 화합물의 합성
Ser-Asn-Thr-Ser-Glu-Ser-Phe-Lys-Ser-Asn-Thr-Ser-Glu-Ser-Phe-Phe-Arg-Val-Thr-Gln-Leu-Ala-Pro-Lys-Ala-Gln-Ile-Lys-Glu-NH2 (서열 ID NO 69)
건조된 CLEAR-아미드 수지 ((100-200 메쉬) 0.46 mmol/g, 0.25 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적으로 Fmoc-아미노산을 결합하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH, Fmoc-Ser(OtBu)-OH이었다. 표 III의 프로그램에 대하여 N-말단 아미노산 Fmoc-Ser(OtBu)를 결합하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 A를 사용하여 펩티딜 수지를 분할함으로써 수율 70%로 265 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼30 분 = 10∼80 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.04 분 (95.2%); LCMS 이론 질량: 3261.8, 측정 질량: 1630.7 [M/2+H]+; 1087.5 [M/3+H]+;
실시예 7: 하기 화합물의 합성
(서열 ID NO 83)
건조된 CLEAR-아미드 수지 ((100-200 메쉬) 0.4 mmol/g, 0.3 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에 나타낸 바와 같이 후속적으로 아미노산 결합을 실시하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다.
Dde
기의 직각방향 보호해제
펩티드의 선형 사슬에서 N-Fmoc 아미노산에 이용된 것과 동일한 방법으로 N-말단 아미노산 Ser(OtBu)-OH을 N-Boc 아미노산으로서 결합하였다. 분기점으로서 사용된 제13 잔기 리신 (N 말단으로부터)의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가하고 자동 합성기에서 직각 방향으로 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 세척하였다. 분기에서 아미노산의 결합은 Fmoc-Phe-OH로 출발하여 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 합성에 사용된 아미노산은 Fmoc-Thr(OtBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다. 표 III의 프로그램에서와 같이 N-말단 아미노산 Fmoc-Ser(OtBu)를 결합하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 A를 사용하여 펩티딜 수지를 분할함으로써 수율 74%로 320 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴 내의 0.1% TFA로 채워진 Zorbax Eclipse XDB-C18 Prep-HT 컬럼 (21.2 mm x 150 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 18 mL/분의 유속으로 구배 용리 0∼5 분 = 5∼20 % 완충액 B, 5∼22 분 = 20∼30 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.5 분 (97.6 %); LCMS 이론 질량: 3261.62, 측정 질량: 1631.6 [M/2+H]+; 1088 [M/3+H]+; 816.2 [M/4+H]+;
실시예 8: 하기 화합물의 합성
(서열 ID NO 88)
건조된 CLEAR-아미드 수지 ((100-200 메쉬) 0.4 mmol/g, 0.3 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에 나타낸 바와 같이 후속적으로 아미노산 결합을 실시하였다. 수지 함량에 대해 5 당량 과량의 아미노산 및 결합제를 사용하여 결합을 실시하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다.
Dde
기의 직각방향 보호해제
N-Fmoc 아미노산에 이용된 것과 동일한 방법으로 N-말단 아미노산 Ser(OtBu)-OH를 펩티드의 선형 사슬에 N-Boc 아미노산으로서 결합하였다. 분기점으로서 사용된 제8 잔기 리신의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 자동 합성기에서 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가함으로써 자동 합성기에서 직각 방향으로 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 세척하였다. 분기에서 아미노산의 결합은 Fmoc-D-Phe-OH 로 출발하여 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 D-아미노산을 혼입함으로써 실시되었다. 합성에 사용된 아미노산은 Fmoc-D-Thr(OtBu)-OH, Fmoc-D-Asn(Trt)-OH, Fmoc-D-Ser(OtBu)-OH, Fmoc-D-Glu(OtBu)-OH이었다. 표 III의 프로그램에서와 같이 N-말단 아미노산 Fmoc-D-Ser(OtBu)를 결합하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 A를 사용하여 펩티딜 수지를 분할함으로써 수율 89%로 350 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴 내의 0.1% TFA로 채워진 Zorbax Eclipse XDB-C18 Prep-HT 컬럼 (21.2 mm x 150 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 18 mL/분의 유속으로 구배 용리 0∼5 분 = 5∼20 % 완충액 B, 5∼18 분 = 20∼27 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.06 분 (96.6%); LCMS 이론 질량: 3261.6, 측정 질량: 1631.6 [M/2+H]+; 1088 [M/3+H]+; 816.2 [M/4+H]+;
실시예 9: 하기 화합물의 합성
(서열 ID NO 124)
건조된 Rink-아미드 MBHA 수지 ((100∼200 메쉬) 0.66 mmol/g, 1 g)를 폴리프로필렌 필터가 구비된 4개의 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적으로 아미노산을 결합하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다. 선형 서열에서 N-말단으로부터 제 8 아미노산 Lys가 Fmoc-Lys(Fmoc)-OH로서 결합되었다. 그 다음 잔기로부터 계속하여(Fmoc-Phe-OH), 10 당량 과량의 아미노산 (1 M NMM/DMF 내의 0.25 M 아미노산, 0.25 M HBTU 각 5 mL)으로 표 II에서와 같이 후속적인 아미노산의 결합을 실시하고, 결합을 위해 수지 함량에 대한 결합제를 사용하였다. 펩티드의 두 N-말단에서 N-말단 아미노산 Ser(OtBu)-OH는 N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로 N-Boc 아미노산으로서 결합되었다.
Dde
기의 직각방향 보호해제
분기점으로서 사용된 N-말단으로부터 제17 잔기 리신의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 자동 합성기에서 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가함으로써 직각 방향으로 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 수동 프로그램을 이용하여 다시 세척하였다. 분기에서 아미노산의 결합은 Fmoc-8-아미노 3,6-디옥사옥타노산 (0.24 g, 2.5 mL DMF) 및 말레이미도 프로파노산 (0.1 g, 2.5 mL DMF)로 출발하여 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 C를 사용하여 펩티딜 수지를 분할함으로써 수율 70%로 1.6g을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Phenomenex-C18 실리카 컬럼 (10 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 6 mL/분의 유속으로 구배 용리 0∼9 분 = 10∼15 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 11.7 분 (95 %); LCMS 이론 질량: 3557.09, 측정 질량: 1779.8[M/2+H]+ 1187.1[M/3+H]+
실시예 10: 하기 화합물의 합성
(서열 ID NO 77)
건조된 CLEAR -아미드 ((100-200 메쉬) 0.4 mmol/g, 0.3 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적으로 아미노산을 결합하였다. 선형 서열에서 N-말단으로부터 제 8 아미노산 Lys가 Fmoc-Lys(Dde)-OH로서 결합되었다. 선형 사슬의 제 16 리신 잔기는 Fmoc-Lys (Alloc)-OH로서 결합되었다. N-말단 아미노산 Ser(OtBu)-OH는 N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로 N-Boc 아미노산으로서 결합되었다.
Dde
기의 직각방향 보호해제
분기점으로서 사용된 N-말단으로부터 제8 잔기 리신의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬을 종료한 후, 리신의 ε-아미노 기의 Dde 보호는 자동 합성기에서 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가함으로써 직각 방향으로 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 수동으로 세척하였다. 분기에서 아미노산의 결합은 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 사용된 아미노산은 Fmoc-Phe-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다. N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로, 분기 내의 N-말단 아미노산, 펩티드의 선형 사슬 중 Ser(OtBu)-OH를 N-Boc 아미노산으로서 결합하였다.
Alloc
보호기의 보호해제
선형 서열에서 추가 분기점을 개시하기 위해서 N-말단으로부터 제16 잔기 리신의 ε-아미노 기는 Lys(Alloc)로서 결합되었다. Lys (Alloc)의 Alloc 보호기는 클로로포름/N-메틸피롤리딘 (95/5 v/v)의 용액 중에서 테트라키스트리페닐포스핀 팔라듐(0) (5 당량; 2.8 g) 및 페닐실란 (10 당량 0.65 mL)으로 6 시간 동안 아르곤 하에 처리함으로써 펩티딜 수지로부터 제거되었다. 클로로포름(6 x 10 mL) 내의 10% NMP, DMF (6 x 10 mL) 내의 1% DIEPA, DCM (6 x 10 mL), DMF (6 x 10 mL)의 용액으로 수지를 세척하였다. Alloc 보호해제를 종료한 후, 수지를 자동 펩티드 합성기에 다시 도입하였다. 유리 아미노 기를 서열에서 제2 분기점으로서 사용하였다. 분기에서 아미노산의 결합은 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 사용된 아미노산은 Fmoc-Lys(Boc)-OH, Fmoc-Ala-OH, Boc-Pro-OH이었다. N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로, 분기 내의 N-말단 아미노산, 프롤린을 N-Boc 아미노산으로서 결합하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 A를 사용하여 펩티딜 수지를 분할함으로써 수율 50%로 200 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴 내의 0.1% TFA로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼2 분 = 10∼20 % 완충액 B, 2∼8 분 = 20∼25 % 완충액 B, 8∼19 분 = 25∼29 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.3 분 (94 %); LCMS 이론 질량: 3389.8, 측정 질량: 1695.2 [M/2+H]+;1130.5 [M/3+H]+ 848.3 [M/4+H]+
실시예 11: 하기 화합물의 합성
(서열 ID NO 129)
빌딩 블록(
building
block
)의 합성
-20 ℃의 THF (100 mL) 내의 N-Boc 아미노산 (10.0 g, 38.28 mmol)의 용액에, N-메틸 모르폴린 (NMM, 4.25 g, 42.11 mmol) 및 에틸클로로포르메이트 (4.57 g, 42.11 mmol)을 첨가하고, 그 혼합물을 동일한 온도에서 20분 동안 교반하였다. 무기 염을 여과 제거한 후, 그 여액을 습윤 NaBH4 (2.9 g, 76.56 mmol)로 10∼15 분 동안 교반하였다. 반응 혼합물을 물과 EtOAc 사이에 분리되었다. 유기층을 물, 10% NaHCO3 용액 (100 mL x 2) 및 염수로 세척한 후, Na2SO4 상에서 건조한 다음, 감압 하에서 증발하여 N-Boc 아민올을 얻었다. 상기에서 얻어진 아민올을 실리카 겔 컬럼 크로마토그라피 (용리액: 헥산 내의 0∼50% EtOAc)로 정제하여 생성물 8.2 g을 얻었다[수율: 85.4%, 이론 질량: 247.3, 측정 질량: 248.2 (M+1), 270.2 (M+Na)].
증류된 DCM (30.0 mL) 내의 N-Boc-아민올 (3.0 g, 12.13 mmol)의 용액에 Dess-Martin 페리오디난 (10.3 g, 24.27 mmol)을 0 ℃에서 소량씩 첨가한 후, 반응물이 TLC 분석에 의해 소비될 때까지 실온의 N2 분위기 하에서 30 분 동안 교반하였다. 1.0M Na2S2O3 용액을 첨가하여 반응 혼합물을 급냉한 후, 생성물을 DCM으로 추출하였다. 유기 추출물을 (5%, 1:1) Na2S2O3/NaHCO3 용액 (20 mL x 2), 염수 (20 mL) 로 세척한 후, Na2SO4 상에서 건조하였다. 용매를 감압 하에서 제거하여 얻은 조 생성물을 실리카 겔 컬럼 크로마토그라피 (용리액: 헥산 내의 0∼20% EtOAc)에 의해 더 정제하여 2.4 g의 순수 생성물 1을 얻었다 (수율 82%, 이론 질량 245.32, 측정 질량 247.9 (M+1), 265.1 (M+Na)).
DMF 30.0 mL 내의 Fmoc-Asn(trt)-OH (4.0 g, 6.7 mmol)의 용액에 Cs2CO3 (2.62 g, 8.0 mmol)를 첨가하였다. 그 혼합물을 0 oC까지 냉각한 후, 벤질 브로마이드 (1.37 g, 8.0 mmol)를 첨가한 다음, 얻어진 용액을 0 oC에서 30분 동안 교반한 후, 실온에서 12 시간 동안 다시 교반하였다. 반응 혼합물을 감압 하에서 농축한 후, EtOAc (50 mL)로 희석한 다음, 유기층을 NaHCO3 (2 x 50 mL) 및 염수 (1 x 50 mL)로 세척한 다음, Na2SO4 상에서 건조하고, 진공에서 여과 및 농축한 다음, 실리카 겔 컬럼 크로마토그라피 (용리액: 헥산 내의 0∼30% EtOAc)에 의해 정제하여 백색 고체로서 Fmoc-Asn(trt)-Obn를 얻었다[수율: 4.5 g, 98.0%;, 이론 질량 686.28, 측정 질량 687.3 (M+1), 709.1 (M+Na].
DCM (14.0 mL) 내의 Fmoc-Asn(Trt)-OBn (3.5 g, 5.1 mmol) 용액에, 디에틸아민 (14.0 mL)을 첨가하고 실온에서 1 시간 동안 교반하였다. 그 결과 얻어진 용액을 진공에서 농축하고, 탁한 잔류물을 중성 알루미나 컬럼 크로마토그라피 (용리액: 헥산 내의 0∼50% EtOAc, 그 다음 CHCl3 내의 0∼5% MeOH)에 의해 정제하여 H-Asn(trt)-Obn 2를 얻었다(수율: 1.75 g, 73.0%; 이론 질량 464.21, 측정 질량 465.3 (M+1), 487.2 (M+Na]).
H-Asn(Trt)-OBn (4.5 g, 9.7 mmol), DIPEA (2.5 g, 19.4 mmol) 및 Boc-Ser(OtBu)-CHO (2.4 g, 9.7 mmol)을 0 ℃의 DCM (45 mL) 중에서 혼합한 다음, 실온에서 1 시간 동안 교반하였다. 다시 반응 혼합물을 0 ℃까지 냉각한 후, 나트륨 트리아세톡시 붕수소화물(4.1g, 19.4 mmol)로 처리한 다음, 그 혼합물을, 반응물이 TLC 분석에 의해 소비될 때까지, 실온의 N2 분위기 하에서 6 시간 동안 교반하였다. 물을 첨가하여 반응 혼합물을 급냉한 다음, 얻어진 생성물을 DCM으로 추출하였다. 유기 추출물을 5% NaHCO3 용액 (50 mL x 2), 5% 구연산 용액 (50 mL x 2), 염수 (50 mL)로 세척한 다음, Na2SO4 상에서 건조하였다. 용매를 증발시켜 얻은 조 생성물을 실리카 겔 컬럼 크로마토그라피 (용리액: 헥산 내의 5∼40 % EtOAc)에 의해 더 정제하여 목적으로 하는 생성물 3을 얻었다 (수율: 4.2 g, 62.0%; 이론 질량 693.27, 측정 질량 694.4 (M+1), 716.0 (M+Na)).
메탄올 (70.0 mL) 내의 화합물 3 (4.0 g)의 용액에 10% Pd-C (1.0 g)를 불활성 분위기 하에서 첨가한 후, 그 혼합물을 H2 분위기 하에서 4 시간 동안 교반하였다. TLC 분석에 의해 반응 종료를 확인하였다. 셀라이트(celite) 패드를 통해 여과하여 촉매를 제거한 후, 50 mL의 메탄올로 세척하였다. 조합된 유기 여액을 감압 하에서 증발하여 생성물 4를 분리하였다(수율: 3.3 g, 96.0 %; 이론 질량 603.25, 측정 질량 604.4 (M+1), 626.4 (M+Na).
펩티드 합성:
건조된 Rink-아미드 MBHA 수지 ((100-200 메쉬) 0.66 mmol/g, 1 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적으로 아미노산을 결합하였다. 수지 함량에 대해 5 당량 과량의 아미노산 및 결합제를 사용하여 결합을 실시하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다. 선형 서열에서 N-말단으로부터 제 8 아미노산 Lys가 Fmoc-Lys(Dde)-OH로서 결합되었다. 그 다음 잔기로부터 계속하여(Fmoc-Phe-OH), 10 당량 과량의 아미노산 (1 M NMM/DMF 내의 0.25 M 아미노산, 0.25 M HBTU 각 5 mL)으로 표 II에서와 같이 후속적인 아미노산의 결합을 실시하고, 수지 함량에 대한 결합제를 결합에 사용하였다. 합성에 사용된 아미노산은 Fmoc-Thr(OtBu)-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다. 두 N-말단에서 N-말단 아미노산 Boc-SerΨ[CH2NH]Asn(Trt)-OH (0.4 g, 5 mL)는 N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로 N-Boc 아미노산으로서 결합되었다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 C를 사용하여 펩티딜 수지를 분할함으로써 수율 70%로 150 mg을 얻었다. 원료 샘플은 정제 및 동결건조된 준비된 HPLC이었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼25 분 = 2∼30% 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12분(93 %); LCMS 이론 질량: 3232.8, 측정 질량: 1617.4[M/2+H]+ 809.6[M/4+H]+
실시예 12: 하기 화합물의 합성
(서열 ID NO 75)
건조된 Rink 아미드 MBHA-수지 (100∼200 메쉬, 0.66 mmol/g, 15 g)를 프릿 처리된 소결된 디스크 유리 반응용기가 구비된 주문제작된 5개의 고체 상 펩티드 용기에 동일하게 분배하였다. 각 반응기 내의 수지를, DCM (30 mL) 중에서 1 시간 및 DMF (30 mL) 중에서 1 시간 동안 팽윤하였다. Rink 아미드 MBHA-아미드의 Fmoc 기는 20% (v/v) 피페리딘/DMF 용액으로 5 및 15 분 (30 mL) 동안 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)으로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. C-말단 아미노산으로서, 무수 DMF에 용해된 Fmoc - Glu ( OtBu )- OH (21 g; 5 당량. 49.5 mmol)을 5개의 유리 반응기 모두에 동일하게 분배하였다. 5개의 유리 반응기 용기에 동일하게 분배된 DMF에 용해된 DIC (7.6 mL; 5 당량, 49.5 mmol) 및 HOBT (6.7 g; 49.5 mmol)를 첨가함으로써 결합을 개시하였다. 반응 혼합물 내의 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 2 시간 동안 회전기에서 회전하였다. 수지를 여과한 후, DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 제1 아미노산 부착 후, 수지 중에 미반응 아미노 기가 있다면, 그 아미노기는 서열의 종결을 피하기 위해서 아세트산 무수물/피리딘/DCM (1:8:8)을 사용하여 20 분 동안 캡핑되었다. 캡핑 후, 각 반응기 내에 있는 수지를 DCM (6 x 30 mL), DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)으로 세척하였다. 펩티딜 수지에 부착된 C-말단 아미노산 상의 Fmoc 기는 5 및 15 분 (30 mL) 동안 20% (v/v) 피페리딘/DMF 용액으로 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)으로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 후속적인 아미노산 Fmoc-Lys(Boc)-OH, Fmoc-Ile-OH, Fmoc-Gln(Trt)-OH 및 Fmoc-Ala-OH는 수지 함량에 대해 5 당량 과량의 아미노산, DIC 및 HOBt을 이용하여 결합되었다. C-말단 Lys로부터 제 6 잔기는 Fmoc-Lys(Dde)-OH로서 결합되었다. 무수 DMF에 용해된 Fmoc-Lys(Dde)-OH (16 g; 3 당량. 29.7 mmol)를 동일한 부피로 5개의 유리 반응기 모두에 분배하였다. 5개의 유리 반응 용기에 동일하게 분배된 DMF에 용해된 DIC (4.5 mL; 3 당량, 29.7 mmol) 및 HOBT (4 g; 3 당량, 29.7 mmol)를 첨가함으로써 결합을 개시하였다. 반응 혼합물 내의 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 3 시간 동안 회전기에서 회전하였다. 수지를 여과한 후, DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지의 Fmoc 기는 20% (v/v) 피페리딘/DMF 용액으로 5 및 15 분 (30 mL) 동안 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)로 세척하였다. Fmoc-보호해제 종료 시 펩티드 수지 일정부분에 관한 카이저 시험은 포지티브이었다. 후속적인 아미노산 Fmoc-Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln (Trt)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH는 5 당량 과량의 아미노산, HOBt 및 DIC 법을 이용하여 펩티딜 수지에 결합되었다. 실온에서 3 시간 동안 반응을 실시하였다. C-말단 Lys로부터 제 15 잔기를 Fmoc-Lys(Fmoc)-OH로서 결합하였다. 무수 DMF에 용해된 Fmoc-Lys(Fmoc)-OH (17.5 g; 3 당량. 29.7 mmol)를 5개의 유리 반응기 모두에 동일한 부피로 분배하였다. 5개의 유리 반응 용기에 동일하게 분배된 DMF에 용해된 DIC (4.5 mL; 3 당량, 29.7 mmol) 및 HOBT (4 g; 3 당량, 29.7 mmol)를 첨가함으로써 결합이 개시되었다. 반응 혼합물 내의 각 반응물의 농도는 약 0.4 M이었다. 혼합물을 실온에서 3 시간 동안 회전기에서 회전하였다. 수지를 여과한 후, DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)로 세척하였다. 결합 종료시 펩티드 수지 일정부분에 관한 카이저 시험은 네가티브이었다. 펩티딜 수지의 Fmoc 기는 20% (v/v) 피페리딘/DMF 용액으로 5 및 15 분 (30 mL) 동안 2회 처리함으로써 보호해제되었다. 수지를 DMF (6 x 30 mL), DCM (6 x 30 mL) 및 DMF (6 x 30 mL)로 세척하였다. Fmoc-Lys(Fmoc)-부착 펩티딜 수지의 보호해제 후, 수지 함량에 대해 8 당량 과량의 아미노산 (79 mmol), 8 당량 과량의 HOBt (79 mmol) 및 10 당량 과량의 DIC (99 mmol)를 사용하여 유리 아미노 말단 모두로부터 펩티드 사슬을 성장시켰다. 실온에서 2 시간 동안 반응을 실시하였다. 합성에 사용된 아미노산은 Fmoc-Phe-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Asn (Trt)-OH, Fmoc-Ser(OtBu)-OH 및 Fmoc-Glu(OtBu)-OH이었다. DIC/ HOBT 법 (수지 함량에 대해 8 당량 과량)을 이용하여 Boc-Ser(OtBu)-OH으로서 N-말단 아미노산 세린을 결합하였다.
Dde 기의 직각방향 보호해제: 분기점으로서 사용된 N-말단으로부터 제 17 잔기 리신의 ε-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬의 종료 후, 리신의 ε-아미노 기의 Dde 보호는, 실시예 1에서 설명한 바와 같이 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리함으로써 직각방향으로 보호해제되었다.
팔미트산의 결합
리신의 유리 ε-아미노 기에, DMF에 용해된 팔미트산(12 g, 5 당량, 49.5 mmol)을 동일한 비율로 5개의 반응 용기에 넣고, 유사한 방법으로 DMF에 용해된 DIC (7.6 mL; 5 당량, 49.5 mmol) 및 HOBT (6.7 g; 49.5 mmol)를 첨가하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 C를 사용하여 펩티딜 수지를 분할함으로써 수율 65%로 22 g을 얻었다. 원료 샘플은 정제 및 동결건조된 준비된 HPLC이었다. 완충액 A: 0.1% TFA/물, 완충액 B: 0.1% TFA/아세토니트릴로 채워진 x-Bridge Prep C18-OBD 컬럼 (19 mm x 150 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 15 mL/분의 유속으로 구배 용리 0∼3 분 = 15∼25% 완충액 B, 3∼5 분 = 25∼38% 완충액 B, 5∼15 분 = 38∼50% 완충액 B, 15∼19 분 = 50 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 3): 실온, 17.5 분 (95.4 %); LCMS 이론 질량: 3499.62, 측정 질량: 1750.3 [M/2+H]+; 1167.2 [M/3+H]+
실시예 13: 하기 화합물의 합성
(서열 ID NO 103)
건조된 Rink-아미드 MBHA 수지 ((100∼200 메쉬) 0.6 mmol/g, 0.28 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적으로 아미노산을 결합하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다. 선형 단편에서, C-말단으로부터 제2 아미노산은 Fmoc-Lys(Alloc)-OH로서 결합되었고, 그리고 C-말단으로부터 제 6 아미노산은 Fmoc-Glu(OAll)-OH으로서 결합되었다. 선형 서열에서 N-말단으로부터 제 8 아미노산 Lys가 Fmoc-Lys(Fmoc)-OH로서 결합되었다. 그 다음 잔기로부터 계속하여(Fmoc-Phe-OH), 결합제로서 1 M NMM/DMF 내의 0.25 M 아미노산, 0.25 M HBTU 각 5 mL를 사용하여 표 II에서와 같이 후속적인 아미노산의 결합을 실시하였다. 합성에 사용된 아미노산은 Fmoc-Thr(OtBu)-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다. 양 말단에서의 N-말단 아미노산은 Boc-Ser(OtBu)-OH로서 결합되었다.
Alloc
보호기의 보호해제
모든 펩티드 서열의 종료 후, 리신 및 글루탐산에 존재하는 직각방향 Alloc 및 알릴 보호기는 아르곤 하에서 6 시간 동안 클로로포름/N-메틸피롤리딘 (95/5 v/v) 용액 내의 테트라키스트리페닐포스핀 팔라듐(0) (10 당량; 2.1 g) 및 페닐실란 (20 당량, 0.32 mL)으로 처리함으로써 펩티딜 수지로부터 제거되었다. 수지를 클로로포름 내의 10% NMP (6 x 10 mL), DMF 내의 1% DIEPA (6 x 10 mL), DCM (6 x 10 mL), DMF (6 x 10 mL)의 용액으로 세척하였다. 리신의 ε-유리 아미노 기 및 글루탐산의 γ-유리 카르복시기는 NMP에 용해된 HOBt (0.12 g; 0.92 mmol) 및 DIC(0.18 mL; 1.1 mmol)를 사용하여 락탐 연결을 위해 유지되었다. 17 시간 후, 수지를 여과한 다음, DMF (6 x 10 mL), DCM (6 x 10 mL), DMF (6 x 10 mL)로 세척하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 C를 사용하여 펩티딜 수지를 분할함으로써 수율 68%로 407 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (9.4 mm x 250 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 7 mL/분의 유속으로 구배 용리 0∼4 분 = 10 % 완충액 B, 4∼21.5 분 = 10∼30.9 % 완충액 B, 21.5∼30.9 분 = 30.9∼35 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.5 분 LCMS 이론 질량: 3244.12, 측정 질량: 1622.9 [M/2+H]+; 1082.1 [M/3+H]+
실시예 14: 하기 화합물의 합성
(서열 ID NO 140)
건조된 Rink-아미드 MBHA 수지 ((100∼200 메쉬) 0.66 mmol/g, 0.3 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 팽윤하면서, 표 I의 시험법에 따라 C-말단 아미노산 [Fmoc-Glu(OtBu)-OH] 부착 및 펩티딜 수지의 캡핑을 실시하였다. 표 II에서 설명한 바와 같이 후속적으로 아미노산을 결합하였다. 선형 서열에서 N-말단, Orn으로부터 제 8 아미노산은 Fmoc-Orn-(Dde)-OH으로서 결합되었다. 펩티드의 선형 사슬에서 N-말단 아미노산 Ser(OtBu)-OH는 N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로 N-Boc 아미노산으로서 결합되었다.
Dde
기의 직각방향 보호해제
분기점으로서 사용된 제 8 잔기 오르니틴의 δ-아미노 기는 Dde 기로 보호되었다. 선형 펩티드 사슬의 종료 후, 오르니틴의 δ-아미노 기의 Dde 보호는 수지를 DMF 내의 2.5% (v/v) 히드라진 수화물 용액으로 처리(2 x 7.30 분)하고, 히드라진 수화물 용액을 수동으로 첨가하고 자동 합성기에서 직각 방향으로(orthogollally) 보호해제 되었다. 수지를 표 II의 단계 4에서처럼 합성기에서 수동 프로그램을 이용하여 더 세척하였다. 분기에서 아미노산의 결합은 표 II에서와 같이 아미노산 결합을 위한 프로그램을 이용하여 후속적으로 아미노산을 혼입함으로써 실시되었다. 사용된 아미노산은 Fmoc-Phe-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Ser(OtBu)-OH, Fmoc-Glu(OtBu)-OH이었다. N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로, 분기 내의 N-말단 아미노산, 펩티드의 선형 사슬 중 Ser(OtBu)-OH를 N-Boc 아미노산으로서 결합하였다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 C를 사용하여 펩티딜 수지를 분할함으로써 수율 70%로 295 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (21.2 mm x 150 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 18 mL/분의 유속으로 구배 용리 0∼5 분 = 5∼20 % 완충액 B, 5∼15 분 = 20∼25 % 완충액 B로 펩티드를 용출하였다. HPLC: (방법 1): 실온, 11.1 분 LCMS 이론 질량: 2135.77, 측정 질량: 1067.9 [M/2]+; 711.9 [M/3]+
실시예 15: 하기 화합물의 합성
(서열 ID NO 133)
건조된 H-Glu (OtBu)-2-클로로트리틸 클로라이드 수지 ((100∼200 메쉬) 0.5 mmol/g, 0.35 g)를 폴리프로필렌 필터가 구비된 폴리에틸렌 용기에 넣었다. 하기 표에 나타낸 합성 프로그램을 이용하고 심포니 패럴렐 합성기 (PTI)를 사용하여 고체 상으로 선형 펩티드 합성을 자동 실시하였다. 표 II에서 설명한 바와 같이 후속적으로 아미노산을 결합하였다. 합성에 사용된 아미노산은 Fmoc Phe-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Val-OH, Fmoc-Thr(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Lys(Boc)-OH, Fmoc-Leu-OH, Fmoc-Ala-OH, Fmoc-Pro-OH, Fmoc-Ile-OH이었다. 선형 서열에서 N-말단 Lys로부터 제 8 아미노산은 Fmoc-Lys(Fmoc)-OH으로서 결합되었다. 그 다음 잔기로부터 계속하여(Fmoc-Phe-OH), 결합제로서 1 M NMM/DMF 내의 0.25 M 아미노산, 0.25 M HBTU 각 5 mL를 사용하여 표 II에서와 같이 후속적인 아미노산의 결합을 실시하였다. 펩티드의 양 N-말단에서 N-말단 아미노산 Ser(OtBu)-OH는 N-Fmoc 아미노산을 위해 이용된 것과 동일한 방법으로 N-Boc 아미노산으로서 결합되었다. 분할 방법에서 설명한 바와 같이, 분할 혼합물 C를 사용하여 펩티딜 수지를 분할함으로써 수율 66%로 400 mg을 얻었다. 완충액 A: 0.1% TFA/물, 완충액 B: 아세토니트릴로 채워진 Zorbax Eclipse XDB-C18 컬럼 (21.2 mm x 150 mm, 5 ㎛)에서 준비된 HPLC에 의해 원료 물질을 정제하였다. 18 mL/분의 유속으로 구배 용리 0∼5 분 = 5∼20 % 완충액 B, 5∼18 분 = 20∼27 % 완충액 B에 의해 펩티드를 용출하였다. HPLC: (방법 1): 실온, 12.1 분 LCMS 이론 질량: 3262.62, 측정 질량: 1088.6 [M/3+H]+; 813.4 [M/4+H]+
본 발명의 다른 화합물은 본 기술분야에서 통상의 지식을 가진 자에게 알려진 적당한 변형에 따라 상술한 방법과 유사한 방법으로 제조되었다. 펩티드의 정체는 LCMS (표 IV)에 의해 확인되었다.
[표 IV]
실시예
16: 흐름 세포측정법(
Flow
Cytometry
)에 의한 바인딩(
binding
) 억제 분석
시약
:
포유동물 세포에서의 손쥐 Fc 영역과 PD1 융합의 발현: 인간 PD1 (1-167 아미노산 잔기)의 세포외(extracellular) 도메인은 pFUSE-Fc (Invivogen, CA)에 클론되었다. 이러한 구조는 Lipofectamine 2000 (Invitrogen)을 사용하여 HEK293 세포 (CRL 1573, ATCC) 속으로 전달감염되고 일시적으로 발현되었다. 손쥐 IgG의 Fc 영역과 융합된 세포외 PD1 단백질을 함유하는 숨겨진 재조합 단백질은 전달감염된 세포가 성장한 배지로부터 정제되었다.
PD1 을 위한 리간드의 소스로서 세포주: MDA-MB-231 세포는 RT-PCR에 의해 PD-L1을 발현하는 것으로 밝혀졌으므로 분석에서 PD-L1의 소스로서 사용되었다. HEK293 세포를 발현하는 재조합 PDL2는 세포와 관련하여 PDL2의 소스로서 사용되었다.
흐름 세포측정법을 기본으로 하는
PD1
과 그의
리간드와의
바인딩 측정:
이 분석은 PD1과 그의 리간드 PD-L1 및 PD-L2와의 바인딩에 미치는 화합물의 영향을 측정하기 위해 실시되었다. 요약하면, 재조합 hPDL-을 안정한 방법으로 과도하게 발현하는 HEK 293 세포 (ATCC:CRL-1573)와 pcDNA Myc HisA 전달감염된 HEK 293 (네가티브 대조용) 세포주는 완전한 DMEM 배지(Sigma D5648-1L)를 사용하여 60∼70% 합류율(confluency)까지 성장되었다. 세포는 세포 용해 완충액 (Invitrogen-13151-014)으로 용해된 후, 그 수를 센 다음, 2 x 105 세포가 FACS 튜브에서 완전한 DMEM 배지 50㎕에 재현탁되었다.
세포를 용해하기 전에, Fc (일시적으로 전달감염된 세포의 농축된 상청액으로부터 유도)로 태그된 가용성 PD1은 총 부피 10㎕에서 1 시간 동안 시험 화합물 번호 8과 함께 배양되었다. PD1-중화 항체 (생쥐 단클론 IgG2B clone 192106, 카달로그 번호 MAB1086; R&D Labs, USA)는 또한 PD1이 그의 리간드에 바인딩하는 것을 억제하기 위한 포지티브 대조군으로서 사용되도록 가용성 PD1과 함께 미리 배양되었다. PD1/pFuse의 혼합물은 여러 투여량의 화합물 번호 8로 미리 배양되고; 화합물이 세포에 첨가되어 바인딩되게 하였다.
세포를 발현하는 리간드에 대한 PD1의 연합을 측정하기 위해서, 1:1000의 희석비로 Alexafluor 488 (Invitrogen, 카달로그 번호 11001)에 콘주게이트된 항-생쥐 2차 항체를 세포에 첨가하고 4℃에서 30분 동안 배양하였다. 30분 후에 500 ㎕ FACS 호액(sheath fluid) (BD, 카달로그 번호 336524)를 이들 튜브에 첨가하고, BD FACS 캘리버(Calibur) 장치로 분석을 실시하였다. 화합물 번호 8은, 도1에 나타낸 유력한 방법으로 HEK 293 세포에서 발현된 PD-L2에 대한 PD1의 바인딩을 억제할 수 있었다.
실시예
17: 쥐
PBMC
증식의 복원 측정
이 분석시험은 PBMC의 기능에 미치는 펩티드의 영향을 시험하기 위해 실시되었다. PD1 (PBMC에 발현) 및 그의 리간드 (종양 세포에 발현) 사이의 상호 작용에 미치는 펩티드의 영향의 결과로서, PBMC 증식은 영향을 받는다. PBMC 증식은 방해 펩티드의 존재 하에서 PD1과 그의 리간드 사이에 바인딩 폐지(abrogation) 시 증가할 것으로 예상된다. 이러한 상호작용에 미치는 시험 화합물의 영향을 측정하기 위해서, hPDL1 발현 MDA-MB231 세포 (ATCC:CRL HTB-26)은 완전한 DMEM 배지 (Sigma 카달로그 번호 D5648)를 함유하는 24-웰(well) 플레이트에 접종되었고, 여기에 제네티신(Geneticin) 100 ㎍/ml (Sigma, 카달로그 번호 G8168)가 hPDL2 세포를 위해 첨가되었다.
PMA (Phorbol 12-미리스테이트 13-아세테이트) 6.25 ng/ml (Sigma, 카달로그 번호 8139) 및 이오노마이신(Ionomycin) 0.5 ㎍/ml (Sigma, 카달로그 번호 I0634)과 함께 5X DMEM 배지로 희석된 쥐 혈액 1 ml를 세포의 상부에 놓이게 하였다. 시험 화합물을 10 ㎕/웰을 초과하지 않는 부피에서 적절한 농도로 혈액과 함께 각 웰에 첨가한 후, 플레이트를 37℃의 CO2 인큐베이터에서 배양하였다.
48 시간 후, 쥐 PBMC들은 히스토파크(Histopaque)1077 (Sigma, 카달로그 번호 10771)를 사용하여 분리되었고, 샘플은 70% 에탄올에 고정된 다음, RNase (Sigma, R6513)로 처리된 후, 프로피듐(Propidium) 요오드화물(Sigma 카달로그 번호 81845)로 착색 처리되었다. 이들 샘플은 BD FACS 캘리버 흐름 세포측정기에서 분석되었다. 도 2에서 나타낸 바와 같이, MDA-MB231 세포를 발현하는 리간드의 존재 하에서 PMA 자극 PBMC 세포에 대해서 최소한의 증식이 관찰됨과 동시에, 화합물 번호 8의 도입은 증식을 효과적으로 회복할 수 있었다.
실시예
18: 쥐
PBMC
증식 구조 분석시험에서 화합물 8의 효능 측정
이 연구는 상기 실시예 17에서 설명된 시험법을 이용하여 실시되었다. 여러 농도의 화합물 8을 사용하여 이 분석시험에서 시험하였으며, 펩티드 화합물 8의 효능은 PMA 자극 PBMC의 증식의 회복으로 측정되었다. 이 분석시험은 도 3에 나타낸 바와 같이, MDA-MB231를 발현하는 PD-L1과 관련하여 실시되었다.
실시예
19: 인간
PBMC
증식의 회복 측정
인간 혈액을 헤파린과 함께 수집하여 포스페이트 완충 식염수로 희석한 다음, 히스토파크를 사용하여 말초 혈액 단핵 세포 (PBMC)를 분리하였다. 24-웰 플레이트를 항-Cd3 및 항-Cd28 (5ug/ml)로 3 시간 동안 미리 코팅하였다. 증식 유도를 위한 네가티브 대조용으로 사용하기 위해 동종형(Isotype) 대조용 항체 (IgG1/IgG2a)로 또 다른 플레이트를 미리 코팅하였다. PBMC의 수를 세고, 웰당 재조합 hPDL1 1 ㎍/ml와 함께 웰당 600,000 세포/ml로 접종한 다음, 적절한 농도로 시험 화합물을 첨가하였다. 플레이트를 48 시간 동안 배양하고, PBMC를 수집하여 프로피듐 요오드화물 착색(staining)에 의해 세포 사이클 프로필(cycle profile)의 분석시험을 위해 에탄올로 고정하였다. 시험 화합물에 대한 인간 PBMC 증식의 회복 자료는 도 4에 나타냈다.
실시예 20: PDL1을 발현하는 MDMBA231 종양 세포에 의해 억제된 생쥐 비세포 증식에 미치는 펩티드의 영향
PD
-
L1
의 소스로서
MDA
-
MB
-231 세포의 사용:
MDA-MB-231 세포는 RT-PCR에 의해 PD-L1을 발현하는 것으로 밝혀졌으므로, 분석시험에서 PD-L1의 소스로서 사용되었다.
요건:
6∼8 주령 C57 BL6 생쥐로부터 채취된 생쥐 비세포; RPMI 1640 (GIBCO, 카달로그 번호 11875); 고 글루코오스 (GIBCO, 카달로그 번호 D6429)을 갖는 DMEM; 우태아 혈청[Hyclone, 카달로그 번호 SH30071.03]; 펜실린(10000 유닛/ml)-스트렙토마이신(10,000 ㎍/ml) 액(GIBCO, 카달로그 번호 15140-122); MEM 나트륨 피루베이트 용액 100mM (100x), Liquid (GIBCO, 카달로그 번호 11360); 비필수 아미노산 (GIBCO, 카달로그 번호 11140); L-글루타민 (GIBCO, 카달로그 번호 25030); 항-CD3 항체 (eBiosciences-16-0032); 항-CD28 항체 (eBiosciences-16-0281); ACK 용해(lysis) 완충액 (1mL) (GIBCO, 카달로그 번호 A10492); Histopaque (밀도 1.083 gm/ml) (SIGMA 10831); Trypan 블루 용액 (SIGMA-T8154); Hemacytometer (Bright line-SIGMA Z359629); FACS 완충액 (PBS/0.1% BSA): 0.1% 소 혈청 알부민 (BSA) (SIGMA A7050) 및 나트륨 아지드 (SIGMA 08591)을 갖는 포스페이트 완충 식염수(PBS) pH 7.2 (HiMedia TS1006); CFSE의 원액(stock solution) 5 mM: CFSE 원액은 동결건조된 CFSE를 180 ㎕의 디메틸 술폭사이드(DMSO C2H6SO, SIGMA-D-5879)로 희석함으로써 제조되고, 추가 사용을 위해 튜브 내에 분배되었다. 실험 농도는 10μM∼1μM로 적정되었다. (eBioscience-650850-85); 96-웰 포맷 ELISA 플레이트 (코닝 CLS3390); BD FACS 캘리버 (E6016).
프로토콜
비세포
준비:
40 ㎛ 세포 스트레이너(strainer)에서 비장을 분쇄함으로써 50 ml 팔콘 튜브에 수집된 비세포는 실온에서 5분 동안 1 ml ACK 용해 완충액으로 추가 처리하였다. 9 ml의 RPMI 완전 배지로 세척한 후, 세포를 15 ml 튜브에서 3 ml의 1 x PBS에 재현탁하였다. 비세포 현탁액의 도포(overlaying)를 방해하지 않고 튜브의 바닥까지 매우 주의깊게 3ml의 히스토파크(histopaque)를 첨가하였다. 실온에서 20분 동안 800 xg 에서 튜브를 스핀하였다. 림프구의 불투명한 층은 층들을 동요/혼합하지 않고 주의깊게 수집되었다. 세포를 차가운 1 x PBS로 2회 세척한 후, 트리판 블루(trypan blue) 배제법을 이용하여 총 세포 수를 센다음, 추가 세포 기본 분석시험을 위해 사용하였다.
CFSE
증식 분석시험:
종양 세포 (MDMBA231)를 배양한 후, 고 글루코오스 완전 DMEM 배지에 유지하였다. 1 x 105 종양 세포는 PD1 유도 펩티드의 필요 농도로 96 웰 플레이트에 도포된 다음, 37℃에서 4 시간 동안 유착되었다. 수집된 비세포 1 x 106 세포/ml를 37℃에서 10분 동안 미리 가온된 1xPBS/0.1% BSA 용액에 5μM의 CFSE로 처리하였다. 세포에 대해 5 배 부피의 얼음 냉각 배양 배지를 사용하여 과량의 CFSE를 급냉한 후, 얼음에서 5분 동안 배양하였다. CFSE 라벨 비세포를 얼음 냉각된 완전 DMEM 배지로 3회 세척하였다. 상기 웰에 첨가된 CFSE 라벨 1 x 105 비세포는 종양 세포 및 시험 화합물을 함유하였다. 비세포는 항-CD3 및 항-CD28 항체 (각각 1 ㎍/ml)로 자극된 후, 공동 배양물을 37℃에서 72 시간 동안 5% CO2 중에서 배양하였다. 세포를 수집하여 얼음 냉각 FACS 완충액으로 3회 세척한 후, 488 nm 자극 및 521 nm 배출 필터가 구비된 FACS 캘리버를 사용하여 증식율(%)을 분석하였다. 각 실험 조건을 3회 반복 실시하고, 각 실험은 적어도 3회 실시하였다. 세포 탐색 FACS 프로그램을 이용하여 비세포 증식을 분석하고, 개별적인 값을 배경 증식율(%)로 표준화함으로써 폴드 유도(fold induction)를 계산하였다.
폴드 유도 = 비세포 증식율(%)/배경 증식율(%)
자극된 비세포: 비세포 + 항-CD3/CD28 자극
배경 증식: 비세포 + 항-CD3/CD28 + 종양
증식 구조율(%) = {(화합물 증식율(%)-배경 증식율(%))/(자극된 증식율(%)-배경 증식율(%))}*100.
(a) 화합물 8, 13 및 34와
mAb
J43
항체에 있어서 증식 구조율의 비교.
상기 프로토콜에서 설명된 CFSE 법을 이용하여 생쥐 비세포 증식 구조 연구를 위해 mAb J43 (Int. Immunol. 1996-8(5):765-72) 및 시험 펩티드를 분석하고, 그 결과를 도 5에 요약하였다.
(b)
CFSE
기본 생쥐
비세포
증식 구조 연구에서 화합물의 작용
상기 프로토콜에서 언급한 방법을 이용하여 생쥐 비세포 증식 구조 연구를 위해 시험 화합물을 분석하고, 화합물 8 펩티드와 비교하여 데이터를 표 V에서 처럼 활성율(%)로 나타냈다.
표 V: CFSE 법을 이용한 생쥐 비세포 증식 분석을 통해 얻어진 여러 화합물의 활성율(%)
실시예
21: 세포독성 T 림프구
IFN
-γ 분석시험
종양 세포 (MDMBA231)를 배양한 후, 고 글루코오스 완전 DMEM 배지에 유지하였다. 1 x 105 종양 세포는 시험 화합물의 필요 농도로 96 웰 플레이트에 도포된 다음, 37 ℃에서 4 시간 동안 유착되었다. 수집된 비세포 1 x 105 를 종양 세포 및 시험 화합물 함유 웰에 첨가하였다. 비세포는 항-CD3 및 항-CD28 항체 (각각 1 ㎍/ml)로 자극된 후, 공동 배양물을 37℃에서 72 시간 동안 5% CO2 중에서 배양하였다. 배양 72 시간 후, 세포 배양 상청액을 수집하고 제조업체의 ELISA 프로토콜(e Biosciences; 88-7314)에 의해 생쥐 IFN γ 측정을 위한 처리를 하였다.
ELISA
: 제조업체의 프로토콜에 대하여
요약하면, 96 웰 ELISA 플레이트를 코팅 완충액 중 캡쳐 항체의 100 ㎕/웰로 코팅한 후, 4℃에서 철야 배양하였다. 플레이트를 세척 완충액으로 5회 세척한 후, 200 ㎕의 1x 분석 희석액으로 실온에서 1 시간 동안 블록킹하였다. 세척 단계 후, 100 ㎕의 세포 배양 상청액을 웰에 첨가한 다음, 실온에서 2 시간 동안 더 배양하였다. 적절한 표준물도 또한 포함하였다. 세척 단계 후, 플레이트를 100 ㎕/웰의 검출 항체와 함께 1 시간 동안 배양하였다. 세척 단계를 반복하고 플레이트를 100 ㎕/웰의 Avidin-HRP와 함께 30 분 동안 배양하였다. 플레이트를 세척 완충액으로 수회 다시 세척한 후, 100 ㎕/웰의 기질 용액과 함께 15분 동안 배양하였다. 50 ㎕의 정지 용액을 각 웰에 첨가한 후, 플레이트를 450 nm에서 관찰하였다. 표준물에 대한 흡수치를 작도한 후, IFN-γ 농도는 Graph Pad Prism 소프트웨어를 이용하여 측정되었다(도 6). 각 실험 조건을 3회 반복 실시하고, 각 실험은 적어도 3회 실시하였다.
폴드 유도 = 화합물/배경 IFN-γ방출의 존재 또는 부재 하에 자극된 비세포에 의해 방출된 IFN-γ
자극된 비세포: 비세포 + 시험 화합물의 존재 또는 부재 하에 항-CD3/CD28 자극
배경 IFN-γ방출: 비세포 + 항-CD3/CD28 + 종양
실시예 22: B16F10 피하 흑색종 모델에서 일차 종양 성장 및 폐 전이에 대한 화합물 번호 8의 생체내 효과
동물:
6∼8주령의 C57/Black6 암컷 생쥐 (Aurigene, Bangalore, India)를 실험에 사용하였다. 실험을 실시하기 전에 실험실에서 1 주일 동안 동물을 적응시켰다.
0일 째, 70∼75% 융합도로 10% FBS를 함유하는 DMEM에서 성장된 B16F10 세포를 수집한 후, 동물당 1 x 106 세포를 생쥐의 오른쪽 옆구리 피하에 주사하였다. 1일째, PBS에 용해된 펩티드 (화합물 번호 8) (5mg/kg의 투여량, pH 7.4)을 매일 한번씩 14일 동안 10ml/kg 부피비로 피하 투여하였다. 생쥐의 매개체 대조군은 식염수만을 섭취하게 하였다. 각 군은 10 마리의 동물로 구성되었다. 체중과 임상적 증상을 매일 기록하였다. 종양 부피를 슬라이드 캘리퍼로 측정하였다. 5 mg/kg으로 투여된 화합물 번호 8은, 종양 성장을 44 % 정도까지 억제하였다(p <0.001, 2-웨이 ANOVA). 투여하는 기간 동안 체중 감소가 없었고, 임상적 증상이 관찰되지 않았다. 14 일의 투여 기간의 말기에 매개체로 처리된 동물의 평균 종양 부피는 496 mm3이었고, 화합물 번호 8로 처리된 동물의 종양 부피는 276 mm3 이었다(도 7). 투여 기간 말기에, 폐를 적출하여 검은 결절의 수를 셈으로써 전이 분석을 하였다. 화합물 8은 전이율을 60% 이상 감소된 것이 관찰되었다. 매개체와 화합물 8로 처리된 폐의 사진을 도 8에 나타냈다.
실시예 23 B16F10 전이 모델에서 전이 억제에 미치는 화합물 번호 8, 34, 69, 82, 83, 91의 생체내 효과
전이 모델의 경우에, 0.1 x 106 B16F10 세포를 C57/Black6 생쥐에게 정맥 주사하였다. pH 7.4의 PBS에 용해된 시험 화합물을 매일 한번 5 mg/kg의 양으로 피하 투여하였다. 매개체 대조군의 생쥐는 식염수만을 섭취하게 하였다. 각 군은 10 마리의 동물로 구성되었다. 체중과 임상적 증상을 매일 기록하였다. 처리 11일 후, 폐 전이는 해부 현미경으로 결절의 수를 측정하여 평가되었다. 도 9는 투여한 지 11일 말기에 대한 것을 나타낸다.
실시예 24 4T1 동소 포유동물 암종 모델로 화합물 번호 8의 효과
0일 째, 70∼75% 융합도(confluency)에서 10% FBS를 함유하는 RPMI 1640 에서 성장된 4T1 세포를 수집한 후, 동물당 1 x 106 세포를 포유동물 지방 피드에 마트리겔(matrigel) 동소적으로 주사하였다. 1일째, pH 7.4의 PBS에 용해된 펩티드 (화합물 번호 8) (3mg/kg의 투여량)을 매일 한번 5.5주 동안 10ml/kg 부피비로 피하 투여하였다. 생쥐의 매개체 대조군은 식염수만을 섭취하게 하였다. 각 군은 10 마리의 동물로 구성되었다. 체중과 임상적 증상을 매일 기록하였다. 종양 부피를 슬라이드 캘리퍼로 측정하였다. 연구 말기에, 폐 전이는 해부 현미경으로 결절의 수를 측정하여 평가되었다. 도 10은 투여한 지 40일 말기에 대한 것을 나타낸다. 3 mg/kg으로 투여된 화합물 번호 8은 일차 종양의 부피를 44 % 정도까지 억제하였다. 투여하는 기간 동안 체중 감소가 없었다. 화합물 번호 8로 처리된 군의 동물중 10%는 완전 회복되었고, 또 다른 10%는 종양 성장의 부분 회복을 나타냈다. 40일째, 동물을 안락사시킨 후, 그들의 폐에서 해부 현미경으로 종양 결절을 관찰하였다. 종양 부피가 매체 처리된 군과 유사할지라도, 한 동물에서는 전이가 완전 억제되었다 (종양 결절이 관찰되지 않음). 일차 종양 부피의 완전한 회복을 나타낸 동물에서는 또한 종양 결절이 관찰되지 않았다. 화합물 번호 8로 처리된 동물은 >60 % 이상까지 평균 전이 감소율을 나타냈다.
실시예 25 신장 세포 암종 모델에서 화합물 34 및 83의 효과
6∼8주령의 BALB/c 암컷 생쥐를 임의로 제공된 음식과 물의 12/12 h 명암 스케줄로 온도 제어된 방에 유지하였다. 비융합성 단층으로부터 수집된 RENCA 세포는 복막을 개복하지 않고 1일째 신장 캡슐 하에 주입하였다. 피부 절개는 자동 봉합 클립으로 밀봉하였다. 1일째, 배지 40 ㎕ 내의 신장 세포 (15 x 104)를 생쥐의 신장 캡슐 하에 주입하였다. 펩티드를 5 mpk에서 2일부터 피하 투여하고, 21일 동안 평가하였다. 투여 말기(21일)에 동물을 안락사시킨 후, 좌우 신장(대조용)의 종양의 중량을 측정한 다음, 11에 나타낸 것처럼 억제율(%)을 작도하였다.
실시예
26: 액체 배지
미세희석법에
의한 최소 억제 농도(
MIC
) 측정 방법
화합물의 필요량을 평량한 후, 물/디메틸 술폭시드/적합한 용매에 용해하여 1 mg/ml의 원액을 얻었다. 원액을 MHB/CAMHB에 희석하여 요건에 맞는 8 ㎍/ml 또는 64 ㎍/ml 또는 512 ㎍/ml 용액을 얻었다. 멀티채널 피펫을 사용하고 MHB/CAMHB을 사용하여 96 웰 마이크로적정 트레이에서 연속 2배 희석액의 화합물을 준비하였다. 유기체를 35±2 oC, 110±10 rpm에서 4∼5 시간 동안 MHB/CAMHB에서 성장시켰다. 배양액의 광학 밀도(OD)는 0.5 Mc Farland 표준(1∼2 x 108 cfu/ml)에 해당하는 625 nm까지 조절된 후, (5±5) x 104 cfu/웰의 최종 접종물을 얻도록 희석되었다. 액체 배지, 화합물 및 유기체 대조군을 고정하였다. 미세 희석 트레이를 35±2 ℃의 주위 공기 인큐베이터에서 16∼20 시간 동안 배양하였다. 배양 기간 후, 웰 내의 유기체 성장은 관측 장치에 의해 맨눈으로 검사하였다. 맨눈으로 측정한 유기체의 성장을 완전 억제하는 가장 낮은 농도의 항균제를 MIC로서 취했다. MIC 값 측정 결과, 시험 화합물 8 (MIC (㎍/ml)- >32)이 항박테리아 작용을 나타내지 않고, 표준 시약 즉, 레보플록사신 및 시프로플록사신은 동일한 실험에서 MIC ((㎍/ml) 값 0.015 및 0.007을 나타냈다.
실시예
27: 대장균 패혈증의 생쥐 모델에서 화합물의
생체내
효과
물질 및 방법
사용된 박테리아 균주는 대장균 ATCC 25922이고, 박테리아 현탁액을 보통 식염수로 제조되어 접종물 약 5 x 108 CFU/ml를 얻었다. BALB/c 또는 스위스 알비노 생쥐(체중 18∼22 g)를 연구용으로 사용하였다. 동물을 개별적으로 환기되는 케이지 (IVCs)에서 5일 동안 격리시켰다. 음식과 물을 임의로 제공하였다. 약간 어두운 곳에서 12 시간의 주기로 22∼26℃에서 온도를 유지하였다.
과정
약 1∼2 x 108 CFU/ml를 함유하는 최종 접종물을 정맥 경로로 동물에 투여되었다. 감염 24 시간 후에 처리를 개시하고, 화합물을 2일 동안 3 시간 간격으로 하루 3회 투여하였다. 동물의 한 그룹은 처리하지 않은 채 감염 대조용으로 사용하였다. 2일 동안 처리를 종료한 다음, 마지막 투여 3 시간 후 모든 동물(처리 및 비처리)을 죽이고, 여러 기관(신장, 비장 및 폐)을 무균상태로 적출하여 박테리아 수를 측정하기 위해 처리하였다. 적출된 기관 샘플을 균질화 한 후, 보통 식염수로 연속적으로 희석한 다음, TSA 플레이트에 도포하였다. 플레이트를 35 ± 2℃에서 18∼24 시간 동안 배양한 후, 박테리아 수를 측정하였다. 처리된 동물과 대조용 동물을 비교 분석하고, 적절한 통계법을 이용하여 도 12에 나타낸 바와 같이 통계치를 계산하였다.
SEQUENCE LISTING
<110> AURIGENE DISCOVERY TECHNOLOGIES LIMITED
<120> IMMUNOSUPPRESSION MODULATING COMPOUNDS
<130> FPAA2481PCT
<150> 1805/CHE/2010
<151> 2010-06-25
<150> US 61/381,593
<151> 2010-09-10
<160> 148
<170> PatentIn version 3.5
<210> 1
<211> 137
<212> PRT
<213> Homo sapien
<220>
<221> PEPTIDE
<222> (1)..(137)
<223> Human PD-1 ectodomain
<400> 1
Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn
1 5 10 15
Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu
20 25 30
Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala
35 40 45
Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val
50 55 60
Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala
65 70 75 80
Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala
85 90 95
Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr
100 105 110
Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg
115 120 125
Ser Ala Gly Gln Phe Gln Thr Leu Val
130 135
<210> 2
<211> 5
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (1)..(5)
<223> A strand
<400> 2
Pro Pro Thr Phe Ser
1 5
<210> 3
<211> 7
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (17)..(23)
<223> B strand
<400> 3
Ala Thr Phe Thr Cys Ser Phe
1 5
<210> 4
<211> 7
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (24)..(30)
<223> BC loop
<400> 4
Ser Asn Thr Ser Glu Ser Phe
1 5
<210> 5
<211> 7
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (31)..(37)
<223> C-Strand
<400> 5
Val Leu Asn Trp Tyr Arg Met
1 5
<210> 6
<211> 5
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (38)..(42)
<223> C-C' loop
<400> 6
Ser Pro Ser Asn Gln
1 5
<210> 7
<211> 8
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (43)..(50)
<223> C'-strand
<400> 7
Thr Asp Lys Leu Ala Ala Phe Pro
1 5
<210> 8
<211> 2
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (51)..(52)
<223> C'-C" loop
<400> 8
Glu Asp
1
<210> 9
<211> 4
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (53)..(56)
<223> C" strand
<400> 9
Arg Ser Gln Pro
1
<210> 10
<211> 5
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (57)..(61)
<223> C"-D-loop
<400> 10
Gly Gln Asp Cys Arg
1 5
<210> 11
<211> 5
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (62)..(66)
<223> D-strand
<400> 11
Phe Arg Val Thr Gln
1 5
<210> 12
<211> 5
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (67)..(71)
<223> DE loop
<400> 12
Leu Pro Asn Gly Arg
1 5
<210> 13
<211> 6
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (72)..(77)
<223> E strand
<400> 13
Asp Phe His Met Ser Val
1 5
<210> 14
<211> 9
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (86)..(94)
<223> F-strand
<400> 14
Gly Thr Tyr Leu Cys Gly Ala Ile Ser
1 5
<210> 15
<211> 5
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (95)..(99)
<223> F-G loop
<400> 15
Leu Ala Pro Lys Ala
1 5
<210> 16
<211> 4
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (100)..(103)
<223> G-strand
<400> 16
Gln Ile Lys Glu
1
<210> 17
<211> 137
<212> PRT
<213> Mus sp.
<220>
<221> PEPTIDE
<222> (1)..(137)
<223> Mouse-PD-1
<400> 17
Ser Leu Thr Phe Tyr Pro Ala Trp Leu Thr Val Ser Glu Gly Ala Asn
1 5 10 15
Ala Thr Phe Thr Cys Ser Leu Ser Asn Trp Ser Glu Asp Leu Met Leu
20 25 30
Asn Trp Asn Arg Leu Ser Pro Ser Asn Gln Thr Glu Lys Gln Ala Ala
35 40 45
Phe Cys Asn Gly Leu Ser Gln Pro Val Gln Asp Ala Arg Phe Gln Ile
50 55 60
Ile Gln Leu Pro Asn Arg His Asp Phe His Met Asn Ile Leu Asp Thr
65 70 75 80
Arg Arg Asn Asp Ser Gly Ile Tyr Leu Cys Gly Ala Ile Ser Leu His
85 90 95
Pro Lys Ala Lys Ile Glu Glu Ser Pro Gly Ala Glu Leu Val Val Thr
100 105 110
Glu Arg Ile Leu Glu Thr Ser Thr Arg Tyr Pro Ser Pro Ser Pro Lys
115 120 125
Pro Glu Gly Arg Phe Gln Gly Met Val
130 135
<210> 18
<211> 137
<212> PRT
<213> Rattus sp
<220>
<221> PEPTIDE
<222> (1)..(137)
<223> Rat- PD-1
<400> 18
Gln Leu Ser Trp Gln Ser Gly Trp Leu Leu Val Ser Glu Gly Ala Asn
1 5 10 15
Ala Thr Phe Thr Cys Ser Phe Ser Asn Trp Ser Glu Asp Leu Lys Leu
20 25 30
Asn Trp Tyr Arg Leu Ser Pro Ser Asn Gln Thr Glu Lys Gln Ala Ala
35 40 45
Phe Cys Asn Gly Tyr Ser Gln Pro Val Arg Asp Ala Arg Phe Gln Ile
50 55 60
Val Gln Leu Pro Asn Gly His Asp Phe His Met Asn Ile Leu Asp Ala
65 70 75 80
Arg Arg Asn Asp Ser Gly Ile Tyr Leu Cys Gly Ala Ile Ser Leu Pro
85 90 95
Pro Lys Ala Gln Ile Lys Glu Ser Pro Gly Ala Glu Leu Val Val Thr
100 105 110
Glu Arg Ile Leu Glu Thr Pro Thr Arg Tyr Pro Arg Pro Ser Pro Lys
115 120 125
Pro Glu Gly Gln Phe Gln Gly Leu Val
130 135
<210> 19
<211> 137
<212> PRT
<213> Canis sp
<220>
<221> PEPTIDE
<222> (1)..(137)
<223> Dog -PD-1
<400> 19
Pro Leu Thr Phe Ser Pro Ala Gln Leu Thr Val Gln Glu Gly Glu Asn
1 5 10 15
Ala Thr Phe Thr Cys Ser Leu Ala Asp Ile Pro Asp Ser Phe Val Leu
20 25 30
Asn Trp Tyr Arg Leu Ser Pro Arg Asn Gln Thr Asp Lys Leu Ala Ala
35 40 45
Phe Gln Glu Asp Arg Ile Glu Pro Gly Arg Asp Arg Arg Phe Arg Val
50 55 60
Met Arg Leu Pro Asn Gly Arg Asp Phe His Met Ser Ile Val Ala Ala
65 70 75 80
Arg Leu Asn Asp Ser Gly Ile Tyr Leu Cys Gly Ala Ile Tyr Leu Pro
85 90 95
Pro Asn Thr Gln Ile Asn Glu Ser Pro Arg Ala Glu Leu Ser Val Thr
100 105 110
Glu Arg Thr Leu Glu Pro Pro Thr Gln Ser Pro Ser Pro Pro Pro Arg
115 120 125
Leu Ser Gly Gln Leu Gln Gly Leu Val
130 135
<210> 20
<211> 137
<212> PRT
<213> Equus sp
<220>
<221> PEPTIDE
<222> (1)..(137)
<223> Horse -PD-1
<400> 20
Pro Leu Thr Phe Ser Pro Ala Arg Leu Met Val Pro Glu Gly Ala Asn
1 5 10 15
Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu His Phe Val Leu
20 25 30
Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala
35 40 45
Phe Pro Glu Asp Ser Ser Gln Pro Gly Arg Ser Gly Arg Phe Arg Val
50 55 60
Thr Arg Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Leu Ala Ala
65 70 75 80
Arg Arg Asn Asp Ser Gly Ile Tyr Leu Cys Gly Ala Ile Ser Leu Pro
85 90 95
Pro Lys Thr Gln Ile Asn Glu Ser Pro Arg Ala Glu Leu Thr Val Thr
100 105 110
Glu Arg Ile Pro Glu Pro Pro Thr Glu His Pro Ser Pro Pro Pro Ser
115 120 125
Pro Ala Gly Gln Leu Gln Gly Leu Val
130 135
<210> 21
<211> 4
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (49)..(52)
<223> C' strand to C'C'' loop
<400> 21
Phe Pro Glu Asp
1
<210> 22
<211> 14
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (43)..(56)
<223> C' strand to C'' strand
<400> 22
Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro
1 5 10
<210> 23
<211> 13
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (38)..(50)
<223> CC' loop to C' strand
<400> 23
Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro
1 5 10
<210> 24
<211> 9
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (95)..(103)
<223> FG loop to G strand
<400> 24
Leu Ala Pro Lys Ala Gln Ile Lys Glu
1 5
<210> 25
<211> 10
<212> PRT
<213> Homo sapiens
<220>
<221> PEPTIDE
<222> (62)..(71)
<223> D strand to DE loop
<400> 25
Phe Arg Val Thr Gln Leu Pro Asn Gly Arg
1 5 10
<210> 26
<211> 7
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (17)..(23)
<223> B strand
<400> 26
Ala Thr Phe Thr Cys Ser Leu
1 5
<210> 27
<211> 7
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (24)..(30)
<223> BC loop
<400> 27
Ser Asn Trp Ser Glu Asp Leu
1 5
<210> 28
<211> 7
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (31)..(37)
<223> C-Strand
<400> 28
Met Leu Asn Trp Asn Arg Leu
1 5
<210> 29
<211> 5
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (38)..(42)
<223> C-C' loop
<400> 29
Ser Pro Ser Asn Gln
1 5
<210> 30
<211> 8
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (43)..(50)
<223> C'-strand
<400> 30
Thr Glu Lys Gln Ala Ala Phe Cys
1 5
<210> 31
<211> 4
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (53)..(56)
<223> C" strand
<400> 31
Leu Ser Gln Pro
1
<210> 32
<211> 5
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (57)..(61)
<223> C"-D-loop
<400> 32
Val Gln Asp Ala Arg
1 5
<210> 33
<211> 5
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (62)..(66)
<223> D-strand
<400> 33
Phe Gln Ile Ile Gln
1 5
<210> 34
<211> 9
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (86)..(94)
<223> F-strand
<400> 34
Gly Ile Tyr Leu Cys Gly Ala Ile Ser
1 5
<210> 35
<211> 5
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (95)..(99)
<223> F-G loop
<400> 35
Leu His Pro Lys Ala
1 5
<210> 36
<211> 4
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (100)..(103)
<223> G-strand
<400> 36
Lys Ile Glu Glu
1
<210> 37
<211> 4
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (49)..(52)
<223> C' strand to C'C'' loop
<400> 37
Phe Cys Asn Gly
1
<210> 38
<211> 14
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (43)..(56)
<223> C' strand to C'' strand
<400> 38
Thr Glu Lys Gln Ala Ala Phe Cys Asn Gly Leu Ser Gln Pro
1 5 10
<210> 39
<211> 13
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (38)..(50)
<223> CC' loop to C' strand
<400> 39
Ser Pro Ser Asn Gln Thr Glu Lys Gln Ala Ala Phe Cys
1 5 10
<210> 40
<211> 9
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (95)..(103)
<223> FG loop to G strand
<400> 40
Leu His Pro Lys Ala Lys Ile Glu Glu
1 5
<210> 41
<211> 10
<212> PRT
<213> Mus sp
<220>
<221> PEPTIDE
<222> (62)..(71)
<223> D strand to DE loop
<400> 41
Phe Gln Ile Ile Gln Leu Pro Asn Arg His
1 5 10
<210> 42
<211> 7
<212> PRT
<213> Artificial
<220>
<223> C terminal modified with NH2 group
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> BC loop having C terminal modified with NH2 group
<400> 42
Ser Asn Thr Ser Glu Ser Phe
1 5
<210> 43
<211> 7
<212> PRT
<213> Artificial
<220>
<223> Ac or CH3CO group attached at the N terminal and C terminal
modified with NH2 group
<220>
<221> MISC_FEATURE
<222> (1)..(7)
<223> Ac group added on N terminal
<400> 43
Ser Asn Thr Ser Glu Ser Phe
1 5
<210> 44
<211> 19
<212> PRT
<213> Artificial
<220>
<223> C terminal modified with NH2
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> C terminal modified with NH2
<400> 44
Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu Asp Ser Gln Pro
1 5 10 15
Gly Gln Asp
<210> 45
<211> 11
<212> PRT
<213> Artificial
<220>
<223> C terminal modified with NH2 group
<220>
<221> MISC_FEATURE
<222> (1)..(11)
<223> C terminal modified with NH2
<400> 45
Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg
1 5 10
<210> 46
<211> 14
<212> PRT
<213> Artificial
<220>
<223> C terminal modified with NH2 group
<220>
<221> MISC_FEATURE
<222> (1)..(14)
<223> C terminal modified with NH2 group
<400> 46
Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu
1 5 10
<210> 47
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal ;
branching at Lys6
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> Branch sequence Sequence ID 4 attached to Lys6
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> Amino Hexanoic acid present in between Gln 11 and Lys12
<400> 47
Phe Arg Val Thr Gln Lys Phe Arg Val Thr Gln Leu Ala Pro Lys Ala
1 5 10 15
Gln Ile Lys Glu
20
<210> 48
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Branched at LYS6 with Seq ID 4 and C terminal modified with NH2
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> branched amino acid sequence, Seq ID 4 attached to the Lys6 residue
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> C terminal modified with NH2
<400> 48
Phe Arg Val Thr Gln Lys Phe Arg Val Thr Gln Leu Ala Pro Lys Ala
1 5 10 15
Gln Ile Lys Glu
20
<210> 49
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide at LYS8 with Seq ID 4
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branched amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 49
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 50
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Branched at LYS6 with a peptide of sequence SNQTDK and C terminal
modified with NH2
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> branched amino acid sequence SNQTDK attached to the Lys6 residue
<400> 50
Ser Asn Gln Thr Asp Lys Phe Arg Val Thr Gln Leu Ala Pro Lys Ala
1 5 10 15
Gln Ile Lys Glu
20
<210> 51
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and branch
amino acid sequence at Lys6 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branched amino acid sequence SNQTDK attached to the Lys6 residue
<400> 51
Ser Asn Gln Thr Asp Lys Val Leu Asn Trp Tyr Arg Met Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 52
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and branch
amino acid sequence at Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branched amino acid sequence SNQTDK attached to the Lys8 residue
<400> 52
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 53
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and two
branched amino acid sequence; attached at Lys8 residue and Lys14
residue
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> first branch amino acid sequence SNQTDK attached to the Lys8
residue and the second branch amino acid sequence LAP
attached to the Lys14 residue
<400> 53
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Lys Ala Gln
1 5 10 15
Ile Lys Glu
<210> 54
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal ; branch
amino acid sequence attached to the Lys8 residue; and all amino
acids are D amino acids
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 54
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 55
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and branch
amino acid sequence attached to the Lys14 residue
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> branch amino acid sequence, KDTQNS attached to the Lys14
residue
<400> 55
Glu Lys Ile Gln Ala Lys Pro Ala Tyr Trp Asn Leu Val Lys Asp Thr
1 5 10 15
Gln Asn Ser
<210> 56
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
Biotin-Ahx attached to the N terminal; and branching at Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 56
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 57
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; C6 lipid
attached to the N terminal; and branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 57
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 58
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; Ac
(CH3CO) group attached to the N terminal; and branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 58
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 59
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branch
amino acid sequence at Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence attached to the Lys8 residue; the
branch amino acid sequence is Sequence ID 4 with a modified PEG
molecule (NH2-[PEG]11-CO-) attached to its N terminal
<400> 59
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 60
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 ; and a modified PEG molecule (NH-[PEG]11-CO-) between
Lys8 and Lue9
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> Branched amino acid sequence Sequence ID 4 attached to the Lys8
residue
<400> 60
Ser Asn Thr Ser Glu Ser Phe Lys Leu Ala Pro Lys Ala Gln Ile Lys
1 5 10 15
Glu
<210> 61
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence is Sequence ID 4 with a C6 lipid group
attached to its N terminal
<400> 61
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 62
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8; and C6 lipid group attached to both Branch & N-terminal
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 62
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 63
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; and two
olefinic amino acids joined together forming a loop structure
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> Two Xaa are olefinic amino acids in position 8 and 12, where the
olefinic amino acids are joined forming a loop structure
<400> 63
Ser Asn Thr Ser Glu Ser Phe Xaa Pro Lys Ala Xaa Ser Asn Thr Ser
1 5 10 15
Glu Ser Phe
<210> 64
<211> 34
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; with two
olefinic amino acids joined together forming a loop structure and
a branch amino acid sequence attached to Lys13 residue
<220>
<221> MISC_FEATURE
<222> (1)..(34)
<223> two Xaa residues are olefinic amino acids positioned at 8 and 12,
where the olefinic amino acids are joined forming a loop
structure
<220>
<221> MISC_FEATURE
<222> (1)..(34)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys13
residue
<400> 64
Ser Asn Thr Ser Glu Ser Phe Xaa Pro Lys Ala Xaa Lys Ser Asn Thr
1 5 10 15
Ser Glu Ser Phe Phe Arg Val Thr Gln Leu Ala Pro Lys Ala Gln Ile
20 25 30
Lys Glu
<210> 65
<211> 13
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; having
two Xaa (olefinic amino acids) in position 8 and 12, and a
branching at Lys13
<220>
<221> MISC_FEATURE
<222> (1)..(13)
<223> Two olefinic amino acids (Xaa) are in position 8 and 12, and are
joined forming a loop structure
<220>
<221> MISC_FEATURE
<222> (1)..(13)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys13
residue
<400> 65
Ser Asn Thr Ser Glu Ser Phe Xaa Pro Lys Ala Xaa Lys
1 5 10
<210> 66
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<400> 66
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Gln
1 5 10 15
Ile Lys Glu
<210> 67
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(21)
<400> 67
Ser Asn Thr Ser Glu Ser Phe Phe Arg Val Thr Gln Leu Ala Pro Lys
1 5 10 15
Ala Gln Ile Lys Glu
20
<210> 68
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<400> 68
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 69
<211> 29
<212> PRT
<213> Artificial
<220>
<223> Peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(29)
<400> 69
Ser Asn Thr Ser Glu Ser Phe Lys Ser Asn Thr Ser Glu Ser Phe Phe
1 5 10 15
Arg Val Thr Gln Leu Ala Pro Lys Ala Gln Ile Lys Glu
20 25
<210> 70
<211> 8
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(8)
<223> branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 70
Ser Asn Thr Ser Glu Ser Phe Lys
1 5
<210> 71
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> Branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 71
Ser Asn Thr Ser Glu Ser Phe Lys Leu Ala Pro Lys Ala Gln Ile Lys
1 5 10 15
Glu
<210> 72
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> Branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<400> 72
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Lys Ala Gln
1 5 10 15
Ile Lys Glu
<210> 73
<211> 14
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(14)
<223> Branched amino acid sequence Sequence ID 4 attached to the Lys8
residue
<400> 73
Ser Asn Thr Ser Glu Ser Phe Lys Lys Ala Gln Ile Lys Glu
1 5 10
<210> 74
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 residue; and a lipid attached to Lys 21
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C16 lipid attached to Lys 21
<400> 74
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 75
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 and a lipid attached to Lys 17
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C16 lipid attached to Lys 17
<400> 75
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 76
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; with two
branches
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> first branch amino acid sequence Sequence ID 4 attached to the
Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> a second branch LAP attached to Lys 14
<400> 76
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Lys Lys Ala
1 5 10 15
Gln Ile Lys Glu
20
<210> 77
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; with two
branch
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> first branch amino acid sequence Sequence ID 4 attached to the
Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> second branch PKA attached to Lys 16
<400> 77
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Lys
1 5 10 15
Gln Ile Lys Glu
20
<210> 78
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; with
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence LAP attached to the Lys8 residue
<400> 78
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 79
<211> 18
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys4
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<223> branch amino acid sequence LAP attached to the Lys4 residue
<400> 79
Leu Ala Pro Lys Phe Arg Val Thr Gln Leu Ala Pro Lys Ala Gln Ile
1 5 10 15
Lys Glu
<210> 80
<211> 9
<212> PRT
<213> Artificial
<220>
<223> Peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(9)
<400> 80
Leu Ala Pro Lys Ala Gln Ile Lys Glu
1 5
<210> 81
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 residue; and a lipid attached to Lys 10
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C16 lipid attached to Lys 10
<400> 81
Ser Asn Thr Ser Glu Ser Phe Lys Phe Lys Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 82
<211> 16
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(16)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<400> 82
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
<210> 83
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys13
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence Sequence ID 4 attached to the Lys13
residue
<400> 83
Ser Asn Thr Ser Glu Ser Phe Phe Arg Val Thr Gln Lys Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 84
<211> 14
<212> PRT
<213> Artificial
<220>
<223> Peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(14)
<400> 84
Phe Arg Val Thr Gln Leu Ala Pro Lys Ala Gln Ile Lys Glu
1 5 10
<210> 85
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 and a lipid attached to Lys 10
<220>
<221> MISC_FEATURE
<222> (1)..(21)
<223> Branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(21)
<223> C8 (CH3(CH2)6CO) lipid attached to Lys 10
<400> 85
Ser Asn Thr Ser Glu Ser Phe Lys Phe Lys Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 86
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 and a lipid attached to Lys 17
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C8 lipid attached to Lys 17
<400> 86
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 87
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 ; and a lipid attached to Lys 21
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C8 (CH3(CH2)6CO) lipid attached to Lys 21
<400> 87
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 88
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 and D-amino acids in the branch
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence Sequence ID 4 attached to the Lys8
residue
<400> 88
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 89
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys15
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, FSESTNS attached to the Lys15
residue
<400> 89
Glu Lys Ile Gln Ala Lys Pro Ala Leu Gln Thr Val Arg Phe Lys Phe
1 5 10 15
Ser Glu Ser Thr Asn Ser
20
<210> 90
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys15; The peptide sequence is an retro inverso and
contains all D-amino acid
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, FSESTNS attached to the Lys15
residue
<400> 90
Glu Lys Ile Gln Ala Lys Pro Ala Leu Gln Thr Val Arg Phe Lys Phe
1 5 10 15
Ser Glu Ser Thr Asn Ser
20
<210> 91
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 residue and PEG-20 attached to Lys21
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 91
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 92
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 and PEG-20 attached to Lys21
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 92
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 93
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 and PEG-20 attached to Lys17
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 93
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 94
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 residue and a mini PEG molecule attached to
Lys10
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 94
Ser Asn Thr Ser Glu Ser Phe Lys Phe Lys Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 95
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 residue and PEG-10 attached to Lys17
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 95
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 96
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 residue and PEG-20 attached to Lys21
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 96
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 97
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 residue and CH3CO group attached to the Lys10
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 97
Ser Asn Thr Ser Glu Ser Phe Lys Phe Lys Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 98
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 and CH3CO group attached to Lys17
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> CH3CO group attached to the Lys17
<400> 98
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 99
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> CH3CO group attached to the Lys21
<400> 99
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 100
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal and
branching at Lys8 and lipid group attached
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C6lipid group attached to the Lys17
<400> 100
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 101
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
Biotin-Ahx attached at the N terminal; and branching at Lys8
residue; all are D Amino acids
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 101
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 102
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
Biotin-Ahx attached at the N terminal; and branching at Lys14 ;
all are D Amino acids
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> branch amino acid sequence, KDTQNS attached to the Lys14
residue
<400> 102
Glu Lys Ile Gln Ala Lys Pro Ala Tyr Trp Asn Leu Val Lys Asp Thr
1 5 10 15
Gln Asn Ser
<210> 103
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 and lactum bond present between Glu17 and
Lys21
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 103
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Glu Ala Gln Ile Lys Glu
20
<210> 104
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 , lactum bond present between Lys10 and Glu14
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 104
Ser Asn Thr Ser Glu Ser Phe Lys Phe Lys Val Thr Gln Glu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 105
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue, lactum bond present between Glu13 and
Lys17
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, Sequence ID 4 attached to the Lys8
residue
<400> 105
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Glu Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 106
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue; a lipid attached to Lys21 and Ac
(CH3CO) group attached to both N terminal and branch
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C8 lipid attached to the Lys21 residue
<400> 106
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 107
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue; lipid attached to Lys21 and Ac
(CH3CO) group attached to both N terminal and branch
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue; Ac (CH3CO) group is attached to its N terminal
<400> 107
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 108
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; a
branching at Lys8 ; a lipid attached to Lys21 and Ac (CH3CO)
group attached to both N terminal of straight chain and branch
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue; with Ac (CH3CO) group attached to its N terminal
<400> 108
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 109
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 ; a lipid attached to Lys21 and Ac (CH3CO)
group attached to both N terminal and branch
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue with Ac (CH3CO) group attached to its N terminal
<400> 109
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 110
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SNWSEDL attached to the Lys8 residue
<400> 110
Ser Asn Trp Ser Glu Asp Leu Lys Phe Gln Ile Ile Gln Leu His Pro
1 5 10 15
Lys Ala Lys Ile Glu Glu
20
<210> 111
<211> 17
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys3
<220>
<221> MISC_FEATURE
<222> (1)..(17)
<223> branch amino acid sequence, SEQUENCE ID 8 attached to the Lys3
residue
<400> 111
Glu Asp Lys Phe Arg Val Thr Gln Leu Ala Pro Lys Ala Gln Ile Lys
1 5 10 15
Glu
<210> 112
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SEQUENCE ID 8 attached to the Lys8
residue
<400> 112
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 113
<211> 20
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys6
<220>
<221> MISC_FEATURE
<222> (1)..(20)
<223> branch amino acid sequence, SEQUENCE ID 8 attached to the Lys6
residue
<400> 113
Leu Ala Pro Lys Ala Lys Phe Arg Val Thr Gln Leu Ala Pro Lys Ala
1 5 10 15
Gln Ile Lys Glu
20
<210> 114
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys7
<220>
<221> MISC_FEATURE
<222> (1)..(21)
<223> Branch amino acid sequence, SEQUENCE ID 8 attached to the Lys7
residue
<400> 114
Ser Asn Gln Thr Asp Lys Lys Phe Arg Val Thr Gln Leu Ala Pro Lys
1 5 10 15
Ala Gln Ile Lys Glu
20
<210> 115
<211> 24
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys6
<220>
<221> MISC_FEATURE
<222> (1)..(24)
<223> Branch amino acid sequence, SNQTDK attached to the Lys6 residue
<400> 115
Ser Asn Gln Thr Asp Lys Gly Ile Tyr Leu Cys Gly Ala Ile Ser Leu
1 5 10 15
Ala Pro Lys Ala Gln Ile Lys Glu
20
<210> 116
<211> 25
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys7
<220>
<221> MISC_FEATURE
<222> (1)..(25)
<223> Branch amino acid sequence, VLNWYRM attached to the Lys7 residue
<400> 116
Ser Asn Gln Thr Asp Lys Lys Gly Ile Tyr Leu Cys Gly Ala Ile Ser
1 5 10 15
Leu Ala Pro Lys Ala Gln Ile Lys Glu
20 25
<210> 117
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys3
<220>
<221> MISC_FEATURE
<222> (1)..(21)
<223> Branch amino acid sequence, VLNWYRM attached to the Lys3 residue
<400> 117
Glu Asp Lys Gly Ile Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys
1 5 10 15
Ala Gln Ile Lys Glu
20
<210> 118
<211> 26
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(26)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 118
Ser Asn Thr Ser Glu Ser Phe Lys Gly Ile Tyr Leu Cys Gly Ala Ile
1 5 10 15
Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu
20 25
<210> 119
<211> 24
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(24)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 119
Ser Asn Thr Ser Glu Ser Phe Lys Val Leu Asn Trp Tyr Arg Met Leu
1 5 10 15
Ala Pro Lys Ala Gln Ile Lys Glu
20
<210> 120
<211> 26
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(26)
<223> Branch amino acid sequence, SNQTDK attached to the Lys8 residue
<400> 120
Val Leu Asn Trp Tyr Arg Met Lys Gly Ile Tyr Leu Cys Gly Ala Ile
1 5 10 15
Ser Leu Ala Pro Lys Ala Gln Ile Lys Glu
20 25
<210> 121
<211> 18
<212> PRT
<213> Artificial
<220>
<223> Peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(18)
<400> 121
Gly Ile Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala Gln Ile
1 5 10 15
Lys Glu
<210> 122
<211> 21
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys7
<220>
<221> MISC_FEATURE
<222> (1)..(21)
<223> Branch amino acid sequence, SNQTDK attached to the Lys7 residue
<400> 122
Ser Asn Gln Thr Asp Lys Lys Phe Arg Val Thr Gln Leu Ala Pro Lys
1 5 10 15
Ala Gln Ile Lys Glu
20
<210> 123
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 and lipid attached to Lys19
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, SNWSEDL attached to the Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> C16 lipid branch attached to the Lys19 residue
<400> 123
Ser Asn Trp Ser Glu Asp Leu Lys Phe Gln Ile Ile Gln Leu His Pro
1 5 10 15
Lys Ala Lys Ile Glu Glu
20
<210> 124
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; with two
branches
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> First branch amino acid sequence, SEQUENCE ID 4 attached to the
Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Second branch MPA-NH-CH2-CH2-O-CH2-CH2-O-CO attached to the Lys17
residue
<400> 124
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 125
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> branch amino acid sequence, sNTSESF attached to the Lys8 residue
<400> 125
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 126
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 and Ser1 is D amino acid
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 126
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 127
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 and Ser in N terminal and branch are D amino
acid
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 127
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 128
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; with two
branches
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> First branch amino acid sequence, SEQUENCE ID 4 attached to the
Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Second branch MPA-NH-CH2-CH2-O-CH2-CH2-O-CO attached to the Lys21
residue
<400> 128
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 129
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue; with amide bond between Ser1 and Asn2
reduced at both the N terminal and branch
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 129
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 130
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue; and D-Asn at N-terminus
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 130
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 131
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 residue; and D-Asn in the branch
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 131
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 132
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; two
branches
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> First branch amino acid sequence, SNWSEDL attached to the Lys8
residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Second branch MPA-NH-CH2-CH2-O-CH2-CH2-O-CO attached to the Lys17
residue
<400> 132
Ser Asn Trp Ser Glu Asp Leu Lys Phe Gln Ile Ile Gln Leu His Pro
1 5 10 15
Lys Ala Lys Ile Glu Glu
20
<210> 133
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with branching at Lys8
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 133
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 134
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 ; the amide bond between Ser1 and Asn2 at the
N terminal is reduced
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 134
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 135
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 ;
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue; the amide bond between Ser1 and Asn2 at the N terminal
of the branch SEQUENCE ID 4 is reduced
<400> 135
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 136
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue; the amide bond between Asn2 and Thr3
at the N terminal is reduced
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 136
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 137
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 ;
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue; the amide bond between Asn2 and Thr3 at the N terminal
of the branch SEQUENCE ID 4 is reduced
<400> 137
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 138
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue; the amide bonds between Asn2 and Thr3
at the N terminal and the branch are reduced
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue ; the amide bonds between Asn2 and Thr3 at the N
terminal of the branch is reduced
<400> 138
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 139
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence; with two branches
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> First branch amino acid sequence, SEQUENCE ID 4 attached to the
Lys8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Second branch C16 lipid attached to the Lys 17 residue
<400> 139
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 140
<211> 14
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; Xaa is
Orn residue present at the 8th position and branch amino acid
sequence attached to the Orn8 residue
<220>
<221> MISC_FEATURE
<222> (1)..(14)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Orn8
residue
<400> 140
Ser Asn Thr Ser Glu Ser Phe Xaa Lys Ala Gln Ile Lys Glu
1 5 10
<210> 141
<211> 14
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; Xaa is 2,3-diaminopropionic acid
residue present at the 8th position and a branch amino acid
sequence attached to the Xaa residue
<220>
<221> MISC_FEATURE
<222> (1)..(14)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Dpr8
residue
<400> 141
Ser Asn Thr Ser Glu Ser Phe Xaa Lys Ala Gln Ile Lys Glu
1 5 10
<210> 142
<211> 14
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; Xaa is 2,4-diaminobutric acid
residue present at the 8th position and a branch amino acid
sequence, attached to the Xaa residue
<220>
<221> MISC_FEATURE
<222> (1)..(14)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Dbu8
residue
<400> 142
Ser Asn Thr Ser Glu Ser Phe Xaa Lys Ala Gln Ile Lys Glu
1 5 10
<210> 143
<211> 23
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 residue; lactum bond present between Lys17 and Glu21
<220>
<221> MISC_FEATURE
<222> (1)..(23)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 143
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Thr Gln Leu Ala Pro
1 5 10 15
Lys Ile Ala Gln Glu Lys Glu
20
<210> 144
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 residue; lactum bond present between Lys9 and Glu13
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 144
Ser Asn Thr Ser Glu Ser Phe Lys Lys Arg Val Thr Glu Leu Ala Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 145
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal; branching
at Lys8 residue; lactum bond present between Lys11 and Glu15
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 145
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Lys Thr Gln Leu Glu Pro
1 5 10 15
Lys Ala Gln Ile Lys Glu
20
<210> 146
<211> 22
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Lys8 residue; lactum bond present between Glu12 and
Lys16
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> Branch amino acid sequence, SEQUENCE ID 4 attached to the Lys8
residue
<400> 146
Ser Asn Thr Ser Glu Ser Phe Lys Phe Arg Val Glu Gln Leu Ala Lys
1 5 10 15
Pro Ala Gln Ile Lys Glu
20
<210> 147
<211> 5
<212> PRT
<213> Artificial
<220>
<223> Peptide Sequence with NH2 modified C terminal
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<400> 147
Leu Ala Pro Lys Ala
1 5
<210> 148
<211> 19
<212> PRT
<213> Artificial
<220>
<223> Branched peptide Sequence with NH2 modified C terminal;
branching at Ala5
<220>
<221> MISC_FEATURE
<222> (1)..(19)
<223> Branch amino acid sequence, SNQTDK attached to the Ala5 residue
<400> 148
Leu Ala Pro Lys Ala Phe Arg Val Thr Gln Leu Ala Pro Lys Ala Gln
1 5 10 15
Ile Lys Glu
Claims (29)
- 하기 화학식(I)을 갖는 화합물 또는 약학적으로 허용되는 그의 염:
(I)
상기 식에서,
화합물은 적어도 5개의 아미노산을 포함하고,
A는 3개의 아미노산으로부터, FG 루프, BC 루프, C-C' 루프, C 스트랜드, C' 스트랜드 내지 C'-C" 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 A가 존재하지 않고;
B는 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드, C 스트랜드, D 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 포유동물 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 B가 존재하지 않고;
Z는 하기 (i), (ii) 또는 (iii)으로 나타내지고;
(i) 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, G 스트랜드, C 스트랜드, F 스트랜드, C' 스트랜드, C" 스트랜드, C"-D 루프, C' 스트랜드 내지 C'-C" 루프, C' 스트랜드 내지 C" 스트랜드 또는 D 스트랜드 내지 DE 루프로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1 내지 4의 펩티드 서열;
(ii) G-L-Z'
G는 3개의 아미노산으로부터 D-스트랜드의 포유동물 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 존재하지 않고;
L은 -CO(CH2)n-NH-, 및 PEG 2-20 KD로부터 선택되고;
'n'은 2∼10의 정수이고; 그리고
Z'는 3개의 아미노산으로부터, FG 루프 및 G-스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼3의 펩티드 서열이거나; 또는
(iii) 3개의 아미노산으로부터, D-스트랜드, FG 루프 및 G 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열되고, 펩티드 서열의 2 이상의 아미노산이 서로 조합되어 2개의 단편 사이 또는 단편들 내에서 락탐 결합을 형성하는 1∼4의 펩티드 서열;
D는 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 2 이하의 펩티드 서열이거나 존재하지 않고;
E는 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, C-C' 루프 내지 C' 스트랜드, G 스트랜드, FG 루프 내지 G 스트랜드로부터 선택된 포유동물 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 4 이하의 펩티드 서열이거나 존재하지 않고;
X 및 X'는 리신, 오르니틴, 디아미노프로피온산, 디아미노부티르산, 또는 부가적인 리신과 임의로 연결되는 하기 화학식의 올레핀성 아미노산으로부터 독립적으로 선택되고:
; 또는
X 및 X'는 서로 조합되어 부가적인 리신과 임의로 연결되는 올레핀성 아미노산을 갖는 고리를 형성하거나; 또는
X 및 X' 중 하나 또는 모두는 존재하지 않고;
'm'은 1∼6의 정수이고;
R1은 C2-C20 아실 및 PEG 2-20 KD 부분으로 이루어진 군으로부터 선택되거나; 또는 존재하지 않고;
R2 및 R3는 C2-C20 아실 및 PEG 2-20 KD로 이루어진 군으로부터 선택되거나, 존재하지 않거나 또는 Ra-L'이고;
Ra는 비오틴 및 말레이미도 프로피온산으로부터 선택되고;
L'는 링커 -CO(CH2)n-NH-, -CO(CH2-CH2-O-)nNH 및 -COCH2(-OCH2-CH2)nNH-로부터 선택되고; 그리고
'n'은 2∼10의 정수이고;
R4 및 R5는 독립적으로 NH2이거나, 또는 R4 및 R5 중 하나 또는 모두가 존재하지 않고;
단, 상기 화학식(I)의 화합물에서,
a) 5∼25%의 아미노산은 다른 천연 또는 인조 아미노산으로 치환될 수 있고;
b) 30% 이하의 아미노산은 생략될 수 있고;
c) 상기 각 펩티드 서열에서 2 이하의 아미노산이 어떠한 위치에서도 개별적으로 부가될 수 있고;
d) 5∼25%의 펩티드 결합은 환원된 아미드 결합(-CH2NH-)으로 대체될 수 있고;
e) 100% 이하의 아미노산은 D-아미노산일 수 있고;
f) 100% 이하의 아미노산은 역순으로 될 수 있다. - 제 1항에 있어서, 상기 포유동물 PD1 엑토도메인 단편이 인간, 손쥐(murine), 개, 말 또는 쥐 PD1인 것을 특징으로 하는 화합물.
- 제 1항에 있어서, 하기와 같이 정의되는 것을 특징으로 하는 화학식(I)의 화합물:
A는 하기 표에서 나타낸 바와 같이 3개의 아미노산으로부터, FG 루프, BC 루프, C-C' 루프, C 스트랜드, C' 스트랜드 내지 C'-C" 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 A가 존재하지 않고;
B는 하기 표에서 나타낸 바와 같이 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드, C 스트랜드, D 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 Glu-Asp이거나, 또는 B가 존재하지 않고;
Z는 하기 (i), (ii) 또는 (iii)으로 나타내지고;
(i) 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, G 스트랜드, C 스트랜드, F 스트랜드, C' 스트랜드, C" 스트랜드, C"-D 루프, C' 스트랜드 내지 C'-C" 루프, C' 스트랜드 내지 C" 스트랜드 또는 D 스트랜드 내지 DE 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼4의 펩티드 서열;
(ii) G-L-Z'
G는 3개의 아미노산으로부터 D-스트랜드의 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열 전체 길이까지의 아미노산 서열이거나, 또는 존재하지 않고;
L은 -CO(CH2)n-NH-, 및 PEG 2-20 KD로부터 선택되고;
'n'은 2∼10의 정수이고; 및
Z'는 3개의 아미노산으로부터, FG 루프 및 G-스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 1∼3의 펩티드 서열이거나; 또는
(iii) 3개의 아미노산으로부터, D-스트랜드, FG 루프 및 G 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열되고, 펩티드 서열의 2 이상의 아미노산이 서로 조합되어 2개의 단편 사이 또는 단편들 내에서 락탐 결합을 형성하는 1∼4의 펩티드 서열;
여기서 상기 단편들은 하기 표에 정의한 바와 같고;
D는 하기 표에 나타낸 바와 같이 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 2 이하의 펩티드 서열이거나, 또는 존재하지 않고;
E는 3개의 아미노산으로부터, BC 루프, D 스트랜드, FG 루프, C'-C' 루프 내지 C' 스트랜드, G 스트랜드, FG 루프 내지 G 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 전체 길이까지 임의의 순서로 배열된 4 이하의 펩티드 서열이거나, 또는 존재하지 않고;
X 및 X'는 리신, 오르니틴, 디아미노프로피온산, 디아미노부티르산 또는 부가적인 리신과 임의로 연결되는 하기 화학식의 올레핀성 아미노산으로부터 독립적으로 선택되고:
; 또는
X 및 X'는 서로 조합되어 부가적인 리신과 임의로 연결되는 올레핀성 아미노산을 갖는 고리를 형성하거나; 또는
X 및 X' 중 하나 또는 모두는 존재하지 않고;
'm'은 1∼6의 정수이고;
R1은 C2-C20 아실 및 PEG 2-20 KD 부분으로 이루어진 군으로부터 선택되거나; 또는 존재하지 않고;
R2 및 R3는 C2-C20 아실 및 PEG 2-20 KD로 이루어진 군으로부터 독립적으로 선택되거나, 존재하지 않거나 또는 Ra-L'이고;
Ra는 비오틴 및 말레이미도 프로피온산으로부터 선택되고;
L'는 링커 -CO(CH2)n-NH-, -CO(CH2-CH2-O-)nNH 또는 -COCH2(-OCH2-CH2)nNH-로부터 선택되고; 그리고
'n'은 2∼10의 정수이고;
R4 및 R5는 독립적으로 NH2이거나, 또는 R4 및 R5 중 하나 또는 모두가 존재하지 않고;
단, 화학식(I)의 화합물에서,
a) 5∼25%의 아미노산은 다른 천연 또는 인조 아미노산으로 치환될 수 있고;
b) 30% 이하의 아미노산은 생략될 수 있고;
c) 상기 각 펩티드 서열에서 2 이하의 아미노산이 어떠한 위치에서도 개별적으로 부가될 수 있고;
d) 5∼25%의 펩티드 결합은 환원된 아미드 결합(-CH2NH-)으로 대체될 수 있고;
e) 100% 이하의 아미노산은 D-아미노산일 수 있고;
f) 100% 이하의 아미노산은 역순으로 될 수 있다. - 제 1항 내지 제 3항 중 어느 하나에 있어서, Z가 하나의 상기 펩티드 서열로 이루어지고, A, B, D 및 E 중 적어도 하나가 존재하지 않는 것을 특징으로 하는 화합물.
- 제 1항 내지 제 3항 중 어느 하나에 있어서, A, B, D 및 E가 존재하지 않는 경우, Z가 2∼4의 상기 펩티드 서열을 포함하는 것을 특징으로 하는 화합물.
- 제 1항 내지 제 3항 중 어느 하나에 있어서, Z가 D 스트랜드, FG 루프 및 G 스트랜드의 조합인 것을 특징으로 하는 화합물.
- 제 1항 내지 제 6항 중 어느 하나에 있어서, X가 리신이고, X'가 존재하지 않는 것을 특징으로 하는 화합물.
- 제 1항 내지 제 6항 중 어느 하나에 있어서, X 및 X'가 모두 리신인 것을 특징으로 하는 화합물.
- 제 1항 내지 제 8항 중 어느 하나에 있어서, R2 및 R3 가 C2-C20 아실로부터 선택되거나, 또는 Ra-L'이고, 여기서,
Ra 가 말레이미도 프로피온산이고;
L'가 -COCH2(-OCH2-CH2)nNH-이고;
'n'가 2∼10의 정수인 것을 특징으로 하는 화합물. - 제 1항 내지 제 6항 중 어느 하나에 있어서, X', D, E 및 R5 가 존재하지 않고, R4가 NH2인 것을 특징으로 하는 화합물.
- 제 3항에 있어서, 하기 화학식(Ia)을 갖는 화합물 또는 약학적으로 허용되는 그의 염:
(Ia)
상기 식에서,
A는 3개의 아미노산으로부터, FG 루프, BC 루프, C' 스트랜드, C-C' 루프, C' 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, 또는 A가 존재하지 않고;
B는 3개의 아미노산으로부터, BC 루프, FG 루프, C-C' 루프 내지 C' 스트랜드, C 스트랜드, D 스트랜드, C' 스트랜드 내지 C'-C" 루프로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지의 아미노산 서열이거나, B가 존재하지 않고;
Z는 3개의 아미노산으로부터, D 스트랜드, FG 루프, G 스트랜드, C 스트랜드 및 F 스트랜드로부터 선택된 인간 또는 손쥐 PD1 엑토도메인 단편의 펩티드 서열의 전체 길이까지 임의의 순서로 배열된 1∼3의 펩티드 서열이고; 그리고
X는 리신이다. - 제 12항에 있어서, A 및 B가 독립적으로 3개의 아미노산으로부터 상기 BC 루프의 전체 길이까지의 아미노산 서열인 것을 특징으로 하는 화합물.
- 제 13항에 있어서, A 및 B가 독립적으로 상기 BC 루프의 전체 길이인 것을 특징으로 하는 화합물.
- 제 12항에 있어서, Z가 D 스트랜드-FG 루프-G 스트랜드인 것을 특징으로 하는 화합물.
- 제 12항에 있어서, R1, R2 및 R3 가 존재하지 않는 것을 특징으로 하는 화합물.
- 제 12항에 있어서, R3 가 C16-아실인 것을 특징으로 하는 화합물.
- 제 12항에 있어서, 3 이하의 아미노산이 D-아미노산인 것을 특징으로 하는 화합물.
- 제 12항에 있어서, 모든 아미노산이 D-아미노산인 것을 특징으로 하는 화합물.
- 제 12항에 있어서, 3 이하의 아미드 결합(-CH2NH-)을 포함하는 것을 특징으로 하는 화합물.
- 약제로서 사용하기 위한, 제 1항에 따른 화학식(I)의 화합물 또는 약학적으로 허용되는 그의 염.
- 암 또는 감염 질병을 치료하기 위한 약제로서 사용하기 위한, 제 1항에 따른 화학식(I)의 화합물 또는 약학적으로 허용되는 그의 염.
- 제 1항에 따른 화학식(I)의 화합물 또는 약학적으로 허용되는 그의 염 및 약학적으로 허용되는 희석제 또는 담체를 포함하는 것을 특징으로 하는 의약 조성물.
- 환자의 면역 반응이 조절되도록 제 1항 내지 제 20항 중 어느 하나에 다른 화합물의 치료 유효량을 환자에게 투여하는 것을 포함하는, 환자에게서 PD-1 신호전달 경로에 의해 매개된 면역반응을 조절하는 방법.
- 세포예정사 1 (PD1) 신호전달 경로를 억제할 수 있는 제 1항 내지 제 20항 중 어느 하나에 따른 화합물의 치료 유효량을 환자에게 투여하는 것을 포함하는, 환자에게서 종양 세포의 성장 및/또는 전이를 억제하는 방법.
- 제 25항에 있어서, 종양 세포가 흑색종, 신장암, 전립선암, 유방암, 결장암 및 폐암으로 이루어진 군으로부터 선택된 암인 것을 특징으로 하는 방법.
- 제 25항에 있어서, 종양 세포가 뼈암, 췌장암, 피부암, 머리 또는 목암, 피부 또는 안구 악성흑색종, 자궁암, 난소암, 직장암, 항문 부위 암, 위암, 고환암, 자궁암, 난관 암종, 자궁내막 암종, 자궁경부 암종, 질 암종, 음문 암종, 호지킨병, 비호지킨 림프종, 식도암, 소장암, 내분비 계통의 암, 갑상샘암, 부갑상샘암, 부신 암, 연조직의 육종, 요도암, 음경암, 급성 골수성 백혈병, 만성 골수성 백혈병, 급성 림프모구 백혈병, 만성 림프성 백혈병을 포함한 만성 또는 급성 백혈병, 어린이의 고형 종양, 림프성 림프종, 방광암, 신장 또는 요관암, 신우 암종, 중추 신경계(CNS)의 신생물, 일차 CNS 림프종, 종양 혈관형성, 척추축 종양, 뇌 줄기 신경아교종, 하수체선종, 카포시육종, 표피유사 암, 편평상피세포 암, T-세포 림프종, 석면 유발을 포함한 환경유발, 및 이들 암의 조합으로 이루어진 군으로부터 선택되는 암인 것을 특징으로 하는 방법.
- 환자의 감염 질환을 치료하도록 세포예정사 1 (PD1) 신호전달 경로를 억제할 수 있는 제 1항 내지 제 20항 중 어느 하나에 다른 화합물의 치료 유효량을 환자에게 투여하는 것을 포함하는, 환자에게서 감염 질환을 치료하는 방법.
- 환자의 박테리아 및 바이러스 감염 질환을 치료하도록 세포예정사 1 (PD1) 신호전달 경로를 억제할 수 있는 제 1항 내지 제 20항 중 어느 하나에 다른 화합물의 치료 유효량을 환자에게 투여하는 것을 포함하는, 환자에게서 박테리아 및 바이러스 감염 질환을 치료하는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IN1805CH2010 | 2010-06-25 | ||
| IN1805/CHE/2010 | 2010-06-25 | ||
| US38159310P | 2010-09-10 | 2010-09-10 | |
| US61/381,593 | 2010-09-10 | ||
| PCT/IN2011/000426 WO2011161699A2 (en) | 2010-06-25 | 2011-06-27 | Immunosuppression modulating compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140002594A true KR20140002594A (ko) | 2014-01-08 |
Family
ID=44514877
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020137001288A KR20140002594A (ko) | 2010-06-25 | 2011-06-27 | 면역억제 조절 화합물 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US8907053B2 (ko) |
| EP (1) | EP2585099A2 (ko) |
| JP (2) | JP2013534922A (ko) |
| KR (1) | KR20140002594A (ko) |
| CN (1) | CN103096915B (ko) |
| AU (1) | AU2011268484B2 (ko) |
| CA (1) | CA2803859A1 (ko) |
| CU (1) | CU24171B1 (ko) |
| EA (1) | EA027040B9 (ko) |
| IL (1) | IL223678A (ko) |
| IN (1) | IN2013CN00306A (ko) |
| MX (1) | MX2012014785A (ko) |
| NZ (1) | NZ605533A (ko) |
| SG (1) | SG186809A1 (ko) |
| WO (1) | WO2011161699A2 (ko) |
| ZA (1) | ZA201300313B (ko) |
Families Citing this family (447)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT2118123E (pt) | 2007-01-31 | 2016-02-10 | Harvard College | Péptidos de p53 estabilizados e suas utilizações |
| EP2508531B1 (en) | 2007-03-28 | 2016-10-19 | President and Fellows of Harvard College | Stitched polypeptides |
| US8907053B2 (en) | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| CA2807685C (en) | 2010-08-13 | 2020-10-06 | Aileron Therapeutics, Inc. | P53 derived peptidomimetic macrocycle |
| US9096642B2 (en) | 2011-06-08 | 2015-08-04 | Aurigene Discovery Technologies Limited | Therapeutic compounds for immunomodulation |
| HUE052198T2 (hu) | 2011-07-21 | 2021-04-28 | Sumitomo Dainippon Pharma Oncology Inc | Heterociklusos protein kináz inhibitorok |
| CN102286092B (zh) * | 2011-09-14 | 2014-01-01 | 深圳翰宇药业股份有限公司 | 利拉鲁肽的固相合成方法 |
| US11951157B2 (en) | 2011-10-11 | 2024-04-09 | Universitat Zurich | Methods of treating malignant tumour with IL-12 and anti-PD-1 antibody |
| EP2766035B1 (en) | 2011-10-11 | 2018-03-28 | Universität Zürich Prorektorat MNW | Combination medicament comprising il-12 and an agent for blockade of t-cell inhibitory molecules for tumour therapy |
| TWI643868B (zh) | 2011-10-18 | 2018-12-11 | 艾利倫治療公司 | 擬肽巨環化合物 |
| US8987414B2 (en) | 2012-02-15 | 2015-03-24 | Aileron Therapeutics, Inc. | Triazole-crosslinked and thioether-crosslinked peptidomimetic macrocycles |
| MX362492B (es) | 2012-02-15 | 2019-01-21 | Aileron Therapeutics Inc | Macrociclos peptidomiméticos. |
| WO2013132317A1 (en) | 2012-03-07 | 2013-09-12 | Aurigene Discovery Technologies Limited | Peptidomimetic compounds as immunomodulators |
| WO2013133032A1 (ja) * | 2012-03-09 | 2013-09-12 | 森永乳業株式会社 | ジペプチジルペプチダーゼ-iv阻害剤 |
| RU2014143443A (ru) | 2012-03-29 | 2016-05-20 | Ориджин Дискавери Текнолоджиз Лимитед | Иммуномодулирующие циклические соединения |
| IL289834B1 (en) | 2012-06-13 | 2024-03-01 | Incyte Holdings Corp | Conversion of tricyclic compounds as FGFR inhibitors |
| EP2890714A2 (en) | 2012-08-30 | 2015-07-08 | Amgen Inc. | A method for treating melanoma using a herpes simplex virus and an immune checkpoint inhibitor |
| EP2914256B1 (en) | 2012-11-01 | 2019-07-31 | Aileron Therapeutics, Inc. | Disubstituted amino acids and methods of preparation and use thereof |
| PL2928474T3 (pl) | 2012-12-07 | 2019-05-31 | Chemocentryx Inc | Laktamy diazolowe |
| US9308236B2 (en) | 2013-03-15 | 2016-04-12 | Bristol-Myers Squibb Company | Macrocyclic inhibitors of the PD-1/PD-L1 and CD80(B7-1)/PD-L1 protein/protein interactions |
| SI2986610T1 (en) | 2013-04-19 | 2018-04-30 | Incyte Holdings Corporation | Bicyclic heterocycles as inhibitors of FGFR |
| TWI676636B (zh) * | 2013-07-12 | 2019-11-11 | Vlp醫療股份有限公司 | 包含pd-1抗原或pd-1配體抗原的類病毒粒子 |
| ME03476B (me) | 2013-08-01 | 2020-01-20 | Five Prime Therapeutics Inc | Nefukozilisana anti-fgfr2iiib antitijela |
| AU2014316682B2 (en) | 2013-09-06 | 2018-11-22 | Aurigene Discovery Technologies Limited | 1,2,4-oxadiazole derivatives as immunomodulators |
| EP3041468B1 (en) * | 2013-09-06 | 2018-06-13 | Aurigene Discovery Technologies Limited | Cyclic peptidomimetic compounds as immunomodulators |
| ES2682040T3 (es) * | 2013-09-06 | 2018-09-18 | Aurigene Discovery Technologies Limited | Derivados de 1,3,4-oxadiazol y 1,3,4-tiadiazol como inmunomoduladores |
| WO2015036927A1 (en) * | 2013-09-10 | 2015-03-19 | Aurigene Discovery Technologies Limited | Immunomodulating peptidomimetic derivatives |
| EP3178849B1 (en) | 2013-09-20 | 2019-03-20 | Bristol-Myers Squibb Company | Combination of anti-lag-3 antibodies and anti-pd-1 antibodies to treat tumors |
| WO2015044900A1 (en) * | 2013-09-27 | 2015-04-02 | Aurigene Discovery Technologies Limited | Therapeutic immunomodulating compounds |
| JP6622703B2 (ja) | 2013-12-20 | 2019-12-18 | インターベット インターナショナル ベー. フェー. | アンタゴニストの、抗イヌpd−1抗体 |
| EP3151921B1 (en) | 2014-06-06 | 2019-08-28 | Bristol-Myers Squibb Company | Antibodies against glucocorticoid-induced tumor necrosis factor receptor (gitr) and uses thereof |
| US10385101B2 (en) | 2014-08-08 | 2019-08-20 | Vlp Therapeutics, Llc | Virus like particle comprising modified envelope protein E3 |
| JP6405457B2 (ja) | 2014-09-11 | 2018-10-17 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | Pd−1/pd−l1およびcd80(b7−1)/pd−l1タンパク質/タンパク質相互作用の大環状阻害剤 |
| EP3191589A4 (en) | 2014-09-11 | 2018-05-09 | VLP Therapeutics, LLC | Flavivirus virus like particle |
| SG10201902594QA (en) | 2014-09-24 | 2019-04-29 | Aileron Therapeutics Inc | Peptidomimetic macrocycles and uses thereof |
| CN107106642B (zh) | 2014-09-24 | 2021-02-26 | 艾瑞朗医疗公司 | 拟肽大环化合物及其制剂 |
| US9732119B2 (en) | 2014-10-10 | 2017-08-15 | Bristol-Myers Squibb Company | Immunomodulators |
| US9856292B2 (en) | 2014-11-14 | 2018-01-02 | Bristol-Myers Squibb Company | Immunomodulators |
| PT3220927T (pt) | 2014-11-20 | 2022-02-07 | Promega Corp | Sistemas e métodos para avaliar moduladores de pontos de verificação imunitária |
| TWI758928B (zh) | 2014-11-21 | 2022-03-21 | 美商必治妥美雅史谷比公司 | 抗cd73抗體及其用途 |
| HUE052526T2 (hu) | 2014-11-21 | 2021-05-28 | Bristol Myers Squibb Co | Antitestek, amelyek tartalmaznak módosított nehéz konstans régiókat |
| SG11201704975SA (en) | 2014-12-18 | 2017-07-28 | Amgen Inc | Stable frozen herpes simplex virus formulation |
| US9861680B2 (en) | 2014-12-18 | 2018-01-09 | Bristol-Myers Squibb Company | Immunomodulators |
| US9944678B2 (en) | 2014-12-19 | 2018-04-17 | Bristol-Myers Squibb Company | Immunomodulators |
| CA2971732A1 (en) | 2014-12-23 | 2016-06-30 | Bristol-Myers Squibb Company | Antibodies to tigit |
| US20160222060A1 (en) | 2015-02-04 | 2016-08-04 | Bristol-Myers Squibb Company | Immunomodulators |
| US10983128B2 (en) | 2015-02-05 | 2021-04-20 | Bristol-Myers Squibb Company | CXCL11 and SMICA as predictive biomarkers for efficacy of anti-CTLA4 immunotherapy |
| ES2751669T3 (es) | 2015-02-20 | 2020-04-01 | Incyte Corp | Heterociclos bicíclicos como inhibidores FGFR |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| CA2979142A1 (en) * | 2015-03-10 | 2016-09-15 | Aurigene Discovery Technologies Limited | Therapeutic cyclic compounds as immunomodulators |
| PL3267984T3 (pl) | 2015-03-10 | 2022-05-02 | Aurigene Discovery Technologies Limited | Związki 1,2,4-oksadiazolu i tiadiazolu jako immunomodulatory |
| JP2018507885A (ja) * | 2015-03-10 | 2018-03-22 | オーリジーン ディスカバリー テクノロジーズ リミテッドAurigene Discovery Technologies Limited | 免疫調節剤としての1,3,4−オキサジアゾールおよびチアジアゾール化合物 |
| US9809625B2 (en) | 2015-03-18 | 2017-11-07 | Bristol-Myers Squibb Company | Immunomodulators |
| AU2016235424A1 (en) | 2015-03-20 | 2017-10-05 | Aileron Therapeutics, Inc. | Peptidomimetic macrocycles and uses thereof |
| CN104761633B (zh) * | 2015-03-25 | 2018-11-27 | 新乡学院 | 阻断猪pd-1/pd-l1通路的多肽及其应用 |
| GB201506411D0 (en) | 2015-04-15 | 2015-05-27 | Bergenbio As | Humanized anti-axl antibodies |
| LT3303396T (lt) | 2015-05-29 | 2023-01-10 | Bristol-Myers Squibb Company | Antikūnai prieš ox40 ir jų panaudojimo būdai |
| EA201890162A1 (ru) | 2015-06-29 | 2018-07-31 | Бристол-Маерс Сквибб Компани | Антитела к cd40 с повышенной агонистической активностью |
| JP6727237B2 (ja) | 2015-07-02 | 2020-07-22 | セルジーン コーポレイション | 血液がん及び固形腫瘍の治療のための併用療法 |
| NZ739503A (en) | 2015-07-16 | 2023-06-30 | Bioxcel Therapeutics Inc | A novel approach for treatment of cancer using immunomodulation |
| US10682390B2 (en) | 2015-07-16 | 2020-06-16 | Biokine Therapeutics Ltd. | Compositions and methods for treating cancer |
| JP6791951B2 (ja) | 2015-08-27 | 2020-11-25 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | 肺ガンを患っている患者の生存時間を予測するための方法 |
| EP3347372A4 (en) | 2015-09-10 | 2019-09-04 | Aileron Therapeutics, Inc. | PEPTIDOMIMETIC MACROCYCLES AS MODULATORS OF MCL-1 |
| MA44909A (fr) | 2015-09-15 | 2018-07-25 | Acerta Pharma Bv | Association thérapeutique d'un inhibiteur du cd19 et d'un inhibiteur de la btk |
| WO2017055320A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of cytotoxic lymphocytes in a tissue sample |
| WO2017055326A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of myeloid dendritic cells in a tissue sample |
| WO2017055327A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of endothelial cells in a tissue sample |
| WO2017055325A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of nk cells in a tissue sample |
| WO2017055319A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of b cells in a tissue sample |
| WO2017055324A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of cells of monocytic origin in a tissue sample |
| WO2017055322A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of neutrophils in a tissue sample |
| WO2017055321A1 (en) | 2015-09-29 | 2017-04-06 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of fibroblasts in a tissue sample |
| TW201725044A (zh) | 2015-10-01 | 2017-07-16 | 基利科學股份有限公司 | 用於治療癌症之btk抑制劑及查核點抑制劑之組合 |
| BR112018006531A2 (pt) | 2015-10-01 | 2018-12-11 | Potenza Therapeutics Inc | proteína isolada de ligação ao antígeno (abp), polinucleotídeo isolado, vetor, célula hospedeira, método para produzir uma proteína isolada de ligação ao antígeno (abp), composição farmacêutica, método para tratar ou prevenir uma doença ou condição num sujeito em necessidade deste, método para modular uma resposta imune num indivíduo em necessidade deste e kit |
| WO2017060397A1 (en) | 2015-10-09 | 2017-04-13 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting the survival time of subjects suffering from melanoma metastases |
| US10149887B2 (en) | 2015-10-23 | 2018-12-11 | Canbas Co., Ltd. | Peptides and peptidomimetics in combination with t cell activating and/or checkpoint inhibiting agents for cancer treatment |
| EP3371311B1 (en) | 2015-11-06 | 2021-07-21 | Orionis Biosciences BV | Bi-functional chimeric proteins and uses thereof |
| AU2016356780A1 (en) | 2015-11-19 | 2018-06-28 | Bristol-Myers Squibb Company | Antibodies against glucocorticoid-induced tumor necrosis factor receptor (GITR) and uses thereof |
| WO2017091580A1 (en) * | 2015-11-23 | 2017-06-01 | Five Prime Therapeutics, Inc. | Predicting response to cancer treatment with fgfr2 inhibitors |
| US10590169B2 (en) * | 2015-12-09 | 2020-03-17 | Virogin Biotech Canada Ltd | Compositions and methods for inhibiting CD279 interactions |
| US11091556B2 (en) | 2015-12-18 | 2021-08-17 | Intervet Inc. | Caninized human antibodies to human IL-4R alpha |
| MA55194A (fr) | 2015-12-22 | 2022-05-04 | Incyte Corp | Composés hétérocycliques en tant qu'immunomodulateurs |
| SG11201805777QA (en) | 2016-01-08 | 2018-08-30 | Celgene Corp | Formulations of 2-(4-chlorophenyl)-n-((2-(2,6-dioxopiperidin-3-yl)-1-oxoisoindolin-5-yl)methyl)-2,2-difluoroacetamide |
| SG10202003099XA (en) | 2016-01-08 | 2020-05-28 | Celgene Corp | Antiproliferative compounds, and their pharmaceutical compositions and uses |
| AR107320A1 (es) | 2016-01-08 | 2018-04-18 | Celgene Corp | Formas sólidas de 2-(4-clorofenil)-n-((2-(2,6-dioxopiperidin-3-il)-1-oxoindolin-5-il)metil)-2,2-difluoroacetamida y sus composiciones farmacéuticas y usos |
| HUE052893T2 (hu) | 2016-01-13 | 2021-05-28 | Acerta Pharma Bv | Antifolát és BTK-gátló terápiás kombinációi |
| WO2017129763A1 (en) | 2016-01-28 | 2017-08-03 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for the treatment of signet ring cell gastric cancer |
| WO2017129790A1 (en) | 2016-01-28 | 2017-08-03 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical composition for the treatment of cancer |
| JP6902040B2 (ja) | 2016-01-28 | 2021-07-14 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | 免疫チェックポイント阻害剤の効力を増強する方法 |
| CA3013551A1 (en) | 2016-02-05 | 2017-08-10 | Orionis Biosciences Nv | Clec9a binding agents and use thereof |
| SG11201805941WA (en) | 2016-02-17 | 2018-09-27 | Novartis Ag | Tgfbeta 2 antibodies |
| BR112018067525A2 (pt) | 2016-02-26 | 2019-02-05 | Centre Nat Rech Scient | anticorpos tendo especificidade para o btla e seus usos |
| US10143746B2 (en) | 2016-03-04 | 2018-12-04 | Bristol-Myers Squibb Company | Immunomodulators |
| US20190284293A1 (en) | 2016-03-04 | 2019-09-19 | Bristol-Myers Squibb Company | Combination therapy with anti-cd73 antibodies |
| CN107226842B (zh) * | 2016-03-24 | 2022-01-28 | 华东理工大学 | 靶向pd-1的多肽及其应用 |
| US10358463B2 (en) | 2016-04-05 | 2019-07-23 | Bristol-Myers Squibb Company | Immunomodulators |
| EP3439653B1 (en) | 2016-04-07 | 2021-01-20 | ChemoCentryx, Inc. | Reducing tumor burden by administering ccr1 antagonists in combination with pd-1 inhibitors or pd-l1 inhibitors |
| SG11201808821WA (en) | 2016-04-18 | 2018-11-29 | Celldex Therapeutics Inc | Agonistic antibodies that bind human cd40 and uses thereof |
| CA3023881A1 (en) | 2016-05-13 | 2017-11-16 | Orionis Biosciences Nv | Therapeutic targeting of non-cellular structures |
| WO2017194783A1 (en) | 2016-05-13 | 2017-11-16 | Orionis Biosciences Nv | Targeted mutant interferon-beta and uses thereof |
| AU2017268291B2 (en) | 2016-05-19 | 2022-09-29 | Bristol-Myers Squibb Company | PET-imaging immunomodulators |
| WO2017202962A1 (en) | 2016-05-24 | 2017-11-30 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for the treatment of non small cell lung cancer (nsclc) that coexists with chronic obstructive pulmonary disease (copd) |
| RU2741786C2 (ru) | 2016-05-25 | 2021-01-28 | Энсэрм (Энститю Насьональ Де Ла Санте Э Де Ла Решерш Медикаль) | Способы и композиции для лечения опухолей |
| WO2017210335A1 (en) | 2016-06-01 | 2017-12-07 | Bristol-Myers Squibb Company | Imaging methods using 18f-radiolabeled biologics |
| UA125391C2 (uk) | 2016-06-20 | 2022-03-02 | Інсайт Корпорейшн | Гетероциклічні сполуки як імуномодулятори |
| JP7054681B2 (ja) | 2016-06-24 | 2022-04-14 | インフィニティー ファーマシューティカルズ, インコーポレイテッド | 組合せ療法 |
| WO2018011166A2 (en) | 2016-07-12 | 2018-01-18 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for quantifying the population of myeloid dendritic cells in a tissue sample |
| CN117683135A (zh) | 2016-07-14 | 2024-03-12 | 百时美施贵宝公司 | 针对tim3的抗体及其用途 |
| EP3497448B1 (en) * | 2016-08-11 | 2023-11-15 | The Council of the Queensland Institute of Medical Research | Immune status biomarkers and uses therefor |
| WO2018029336A1 (en) | 2016-08-12 | 2018-02-15 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for determining whether a subject was administered with an activator of the ppar beta/delta pathway. |
| TWI739887B (zh) | 2016-08-19 | 2021-09-21 | 英屬開曼群島商百濟神州有限公司 | 使用包含btk抑制劑的組合產品治療癌症 |
| US10858390B2 (en) * | 2016-09-02 | 2020-12-08 | Cem Corporation | Use of excess carbodiimide for peptide synthesis at elevated temperatures |
| WO2018046738A1 (en) | 2016-09-12 | 2018-03-15 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting the survival time of patients suffering from cancer |
| WO2018047143A1 (en) * | 2016-09-12 | 2018-03-15 | Aurigene Discovery Technologies Limited | Vista signaling pathway inhibitory compounds useful as immunomodulators |
| WO2018046736A1 (en) | 2016-09-12 | 2018-03-15 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting the survival time of patients suffering from cancer |
| US10799555B2 (en) | 2016-09-15 | 2020-10-13 | Leidos, Inc. | PD-1 peptide inhibitors |
| DK3512536T3 (da) | 2016-09-15 | 2020-11-23 | Leidos Inc | Pd-1-peptidinhibitorer |
| US20200016177A1 (en) | 2016-09-22 | 2020-01-16 | Inserm (Institut National De La Sante Et De La Recherche Medicale) | Methods and pharmaceutical compositions for reprograming immune environment in a subject in need thereof |
| SG11201903042VA (en) | 2016-10-14 | 2019-05-30 | Precision Biosciences Inc | Engineered meganucleases specific for recognition sequences in the hepatitis b virus genome |
| WO2018075447A1 (en) | 2016-10-19 | 2018-04-26 | The Trustees Of Columbia University In The City Of New York | Combination of braf inhibitor, talimogene laherparepvec, and immune checkpoint inhibitor for use in the treatment cancer (melanoma) |
| WO2018077893A1 (en) | 2016-10-24 | 2018-05-03 | Orionis Biosciences Nv | Targeted mutant interferon-gamma and uses thereof |
| TWI788307B (zh) | 2016-10-31 | 2023-01-01 | 美商艾歐凡斯生物治療公司 | 用於擴增腫瘤浸潤性淋巴細胞之工程化人造抗原呈現細胞 |
| JP7085545B2 (ja) | 2016-11-07 | 2022-06-16 | ブリストル-マイヤーズ スクイブ カンパニー | 免疫修飾因子 |
| US20190345500A1 (en) | 2016-11-14 | 2019-11-14 | |Nserm (Institut National De La Santé Et De La Recherche Médicale) | Methods and pharmaceutical compositions for modulating stem cells proliferation or differentiation |
| WO2018094275A1 (en) | 2016-11-18 | 2018-05-24 | Tolero Pharmaceuticals, Inc. | Alvocidib prodrugs and their use as protein kinase inhibitors |
| WO2018098352A2 (en) | 2016-11-22 | 2018-05-31 | Jun Oishi | Targeting kras induced immune checkpoint expression |
| ES2934230T3 (es) | 2016-12-22 | 2023-02-20 | Incyte Corp | Derivados de benzooxazol como inmunomoduladores |
| CA3047508A1 (en) | 2016-12-23 | 2018-06-28 | Virttu Biologics Limited | Treatment of cancer |
| WO2018122245A1 (en) | 2016-12-28 | 2018-07-05 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods of predicting the survival time of patients suffering from cms3 colorectal cancer |
| WO2018122249A1 (en) | 2016-12-28 | 2018-07-05 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting the survival time of patients suffering from a microsatellite stable colorectal cancer |
| US11034667B2 (en) | 2017-01-09 | 2021-06-15 | Shuttle Pharmaceuticals, Inc. | Selective histone deacetylase inhibitors for the treatment of human disease |
| US11584733B2 (en) | 2017-01-09 | 2023-02-21 | Shuttle Pharmaceuticals, Inc. | Selective histone deacetylase inhibitors for the treatment of human disease |
| WO2018140671A1 (en) | 2017-01-27 | 2018-08-02 | Celgene Corporation | 3-(1-oxo-4-((4-((3-oxomorpholino) methyl)benzyl)oxy)isoindolin-2-yl)piperidine-2,6-dione and isotopologues thereof |
| AU2018216032B2 (en) | 2017-02-06 | 2022-04-07 | Orionis Biosciences BV | Targeted chimeric proteins and uses thereof |
| JP2020505955A (ja) | 2017-02-06 | 2020-02-27 | オリオンズ バイオサイエンス インコーポレイテッド | 標的化改変型インターフェロン及びその使用 |
| WO2018146128A1 (en) | 2017-02-07 | 2018-08-16 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Detection of kit polymorphism for predicting the response to checkpoint blockade cancer immunotherapy |
| WO2018146148A1 (en) | 2017-02-07 | 2018-08-16 | INSERM (Institut National de la Santé et de la Recherche Médicale) | A method for predicting the response to checkpoint blockade cancer immunotherapy |
| WO2018146612A1 (en) | 2017-02-10 | 2018-08-16 | Novartis Ag | 1-(4-amino-5-bromo-6-(1 h-pyrazol-1-yl)pyrimidin-2-yl)-1 h-pyrazol-4-ol and use thereof in the treatment of cancer |
| UY37621A (es) | 2017-02-28 | 2018-09-28 | Sanofi Sa | Arn terapéutico que codifica citoquinas |
| MA51630A (fr) | 2017-03-15 | 2020-01-22 | Amgen Inc | Utilisation de virus oncolytiques, seuls ou en combinaison avec un inhibiteur de point de contrôle immunitaire, pour le traitement du cancer |
| US11684660B2 (en) | 2017-03-28 | 2023-06-27 | Ohio State Innovation Foundation | Human PD1 peptide vaccines and uses thereof |
| JOP20190203A1 (ar) | 2017-03-30 | 2019-09-03 | Potenza Therapeutics Inc | بروتينات رابطة لمولد ضد مضادة لـ tigit وطرق استخدامها |
| DK3391907T3 (da) | 2017-04-20 | 2020-03-09 | Iomx Therapeutics Ag | Intracellulær kinase sik3, der er associeret med resistens over for antitumorimmunresponser, og anvendelser deraf |
| KR20190141666A (ko) | 2017-04-20 | 2019-12-24 | 에이디씨 테라퓨틱스 에스에이 | 항-axl 항체-약물 접합체로의 병용 요법 |
| CN110582303A (zh) | 2017-04-20 | 2019-12-17 | Adc治疗有限公司 | 使用抗cd25抗体-药物缀合物的组合疗法 |
| WO2018200430A1 (en) | 2017-04-26 | 2018-11-01 | Bristol-Myers Squibb Company | Methods of antibody production that minimize disulfide bond reduction |
| AR111651A1 (es) | 2017-04-28 | 2019-08-07 | Novartis Ag | Conjugados de anticuerpos que comprenden agonistas del receptor de tipo toll y terapias de combinación |
| CN110621336A (zh) | 2017-05-16 | 2019-12-27 | 戊瑞治疗有限公司 | 癌症治疗中抗fgfr2抗体与化学治疗剂的组合 |
| WO2018213297A1 (en) | 2017-05-16 | 2018-11-22 | Bristol-Myers Squibb Company | Treatment of cancer with anti-gitr agonist antibodies |
| AR111760A1 (es) | 2017-05-19 | 2019-08-14 | Novartis Ag | Compuestos y composiciones para el tratamiento de tumores sólidos mediante administración intratumoral |
| KR20200013241A (ko) | 2017-05-25 | 2020-02-06 | 브리스톨-마이어스 스큅 컴퍼니 | 변형된 중쇄 불변 영역을 포함하는 항체 |
| AR111960A1 (es) | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| EP3630842A2 (en) | 2017-05-30 | 2020-04-08 | Bristol-Myers Squibb Company | Compositions comprising a combination of an anti-lag-3 antibody, a pd-1 pathway inhibitor, and an immunotherapeutic agent |
| US11723975B2 (en) | 2017-05-30 | 2023-08-15 | Bristol-Myers Squibb Company | Compositions comprising an anti-LAG-3 antibody or an anti-LAG-3 antibody and an anti-PD-1 or anti-PD-L1 antibody |
| CN110720039A (zh) | 2017-05-30 | 2020-01-21 | 百时美施贵宝公司 | Lag-3阳性肿瘤的治疗 |
| JOP20190279A1 (ar) | 2017-05-31 | 2019-11-28 | Novartis Ag | الصور البلورية من 5-برومو -2، 6-داي (1h-بيرازول -1-يل) بيريميدين -4- أمين وأملاح جديدة |
| MX2019015042A (es) | 2017-06-14 | 2020-08-06 | Adc Therapeutics Sa | Regimen de dosificacion. |
| WO2018229715A1 (en) | 2017-06-16 | 2018-12-20 | Novartis Ag | Compositions comprising anti-cd32b antibodies and methods of use thereof |
| JP2020524157A (ja) | 2017-06-20 | 2020-08-13 | アンスティテュート キュリー | がん併用療法における使用のためのsuv39h1ヒストンメチルトランスフェラーゼの阻害剤 |
| US20200172628A1 (en) | 2017-06-22 | 2020-06-04 | Novartis Ag | Antibody molecules to cd73 and uses thereof |
| WO2018235056A1 (en) | 2017-06-22 | 2018-12-27 | Novartis Ag | IL-1BETA BINDING ANTIBODIES FOR USE IN THE TREATMENT OF CANCER |
| CN110785187B (zh) | 2017-06-22 | 2024-04-05 | 诺华股份有限公司 | 针对cd73的抗体分子及其用途 |
| MX2019015731A (es) | 2017-06-22 | 2020-08-03 | Celgene Corp | Tratamiento de carcinoma hepatocelular caracterizado por infeccion por virus de hepatitis b. |
| US20190048072A1 (en) | 2017-06-22 | 2019-02-14 | Novartis Ag | USE OF IL-1beta BINDING ANTIBODIES |
| KR20200020858A (ko) | 2017-06-23 | 2020-02-26 | 브리스톨-마이어스 스큅 컴퍼니 | Pd-1의 길항제로서 작용하는 면역조정제 |
| US11560425B2 (en) | 2017-06-27 | 2023-01-24 | Neuracle Science Co., Ltd. | Use of anti-FAM19A5 antibodies for treating cancers |
| JP2020525483A (ja) | 2017-06-27 | 2020-08-27 | ノバルティス アーゲー | 抗tim−3抗体のための投与レジメンおよびその使用 |
| FI3644999T3 (fi) | 2017-06-30 | 2023-03-19 | Celgene Corp | 2-(4-kloorifenyyli)-n-((2-(2,6-dioksopiperidin-3-yyli)-1-oksoisoindolin-5-yyli)metyyli)-2,2-difluoriasetamidin koostumukset ja menetelmät sen käyttämiseksi |
| CN110869021B (zh) | 2017-07-10 | 2023-06-30 | 细胞基因公司 | 抗增殖化合物及其使用方法 |
| AU2018302283A1 (en) | 2017-07-20 | 2020-02-06 | Novartis Ag | Dosage regimens of anti-LAG-3 antibodies and uses thereof |
| EP3658173A1 (en) | 2017-07-25 | 2020-06-03 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and pharmaceutical compositions for modulating monocytopoiesis |
| SG11202001441WA (en) | 2017-08-18 | 2020-03-30 | Tragara Pharmaceuticals Inc | Polymorphic form of tg02 |
| US11497756B2 (en) | 2017-09-12 | 2022-11-15 | Sumitomo Pharma Oncology, Inc. | Treatment regimen for cancers that are insensitive to BCL-2 inhibitors using the MCL-1 inhibitor alvocidib |
| US20210060158A1 (en) | 2017-09-19 | 2021-03-04 | Institut Curie | Agonist of aryl hydrocarbon receptor for use in cancer combination therapy |
| WO2019061324A1 (en) | 2017-09-29 | 2019-04-04 | Curis Inc. | CRYSTALLINE FORMS OF IMMUNOMODULATORS |
| JP7257393B2 (ja) | 2017-10-03 | 2023-04-13 | ブリストル-マイヤーズ スクイブ カンパニー | 免疫調節剤 |
| WO2019075090A1 (en) | 2017-10-10 | 2019-04-18 | Tilos Therapeutics, Inc. | ANTI-LAP ANTIBODIES AND USES THEREOF |
| AU2018348350A1 (en) | 2017-10-11 | 2020-04-02 | Aurigene Oncology Limited | Crystalline forms of 3-substituted 1,2,4-oxadiazole |
| US20210040205A1 (en) | 2017-10-25 | 2021-02-11 | Novartis Ag | Antibodies targeting cd32b and methods of use thereof |
| JP2021501801A (ja) | 2017-11-01 | 2021-01-21 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | 癌の処置に用いるための免疫刺激アゴニスト抗体 |
| CN111372584A (zh) | 2017-11-03 | 2020-07-03 | 奥瑞基尼探索技术有限公司 | Tim-3和pd-1途径的双重抑制剂 |
| CN111386128A (zh) | 2017-11-06 | 2020-07-07 | 奥瑞基尼探索技术有限公司 | 用于免疫调节的联合疗法 |
| MX2020004567A (es) | 2017-11-06 | 2020-08-13 | Genentech Inc | Metodos diagnosticos y terapeuticos para el cancer. |
| US20200353050A1 (en) | 2017-11-10 | 2020-11-12 | Armo Biosciences, Inc. | Compositions and methods of use of interleukin-10 in combination with immune check-point pathway inhibitors |
| MX2020004756A (es) | 2017-11-16 | 2020-08-20 | Novartis Ag | Terapias de combinacion. |
| JP7408036B2 (ja) | 2017-11-24 | 2024-01-05 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | ガンを処置するための方法及び組成物 |
| TW201925782A (zh) | 2017-11-30 | 2019-07-01 | 瑞士商諾華公司 | 靶向bcma之嵌合抗原受體及其用途 |
| KR20210035915A (ko) | 2017-11-30 | 2021-04-01 | 그리폴스 다이어그노스틱 솔루션즈 인크. | 면역 관문 억제제인 pd-1 및 pd-l1에 대한 항체 치료를 모니터링하기 위한 면역분석 및 조작된 단백질 |
| AU2018392212B9 (en) | 2017-12-20 | 2021-03-18 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3' cyclic dinucleotides with phosphonate bond activating the STING adaptor protein |
| AU2018392213B2 (en) | 2017-12-20 | 2021-03-04 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3' cyclic dinucleotides with phosphonate bond activating the STING adaptor protein |
| WO2019133747A1 (en) | 2017-12-27 | 2019-07-04 | Bristol-Myers Squibb Company | Anti-cd40 antibodies and uses thereof |
| EP3737408A1 (en) | 2018-01-08 | 2020-11-18 | Novartis AG | Immune-enhancing rnas for combination with chimeric antigen receptor therapy |
| WO2019139921A1 (en) | 2018-01-09 | 2019-07-18 | Shuttle Pharmaceuticals, Inc. | Selective histone deacetylase inhibitors for the treatment of human disease |
| KR20200108870A (ko) | 2018-01-12 | 2020-09-21 | 브리스톨-마이어스 스큅 컴퍼니 | Tim3에 대한 항체 및 그의 용도 |
| SG11202005323SA (en) | 2018-01-12 | 2020-07-29 | Bristol Myers Squibb Co | Combination therapy with anti-il-8 antibodies and anti-pd-1 antibodies for treating cancer |
| WO2019144126A1 (en) | 2018-01-22 | 2019-07-25 | Pascal Biosciences Inc. | Cannabinoids and derivatives for promoting immunogenicity of tumor and infected cells |
| WO2019152660A1 (en) | 2018-01-31 | 2019-08-08 | Novartis Ag | Combination therapy using a chimeric antigen receptor |
| CA3090406A1 (en) | 2018-02-05 | 2019-08-08 | Orionis Biosciences, Inc. | Fibroblast binding agents and use thereof |
| WO2019157124A1 (en) | 2018-02-08 | 2019-08-15 | Bristol-Myers Squibb Company | Combination of a tetanus toxoid, anti-ox40 antibody and/or anti-pd-1 antibody to treat tumors |
| WO2019160956A1 (en) | 2018-02-13 | 2019-08-22 | Novartis Ag | Chimeric antigen receptor therapy in combination with il-15r and il15 |
| US10836769B2 (en) | 2018-02-26 | 2020-11-17 | Gilead Sciences, Inc. | Substituted pyrrolizine compounds and uses thereof |
| CA3092470A1 (en) | 2018-02-27 | 2019-09-06 | Incyte Corporation | Imidazopyrimidines and triazolopyrimidines as a2a / a2b inhibitors |
| WO2019170727A1 (en) | 2018-03-06 | 2019-09-12 | Institut Curie | Inhibitor of setdb1 histone methyltransferase for use in cancer combination therapy |
| CA3092589A1 (en) | 2018-03-21 | 2019-09-26 | Five Prime Therapeutics, Inc. | Antibodies binding to vista at acidic ph |
| WO2019185792A1 (en) | 2018-03-29 | 2019-10-03 | Philogen S.P.A | Cancer treatment using immunoconjugates and immune check-point inhibitors |
| EP3774883A1 (en) | 2018-04-05 | 2021-02-17 | Gilead Sciences, Inc. | Antibodies and fragments thereof that bind hepatitis b virus protein x |
| TW202005654A (zh) | 2018-04-06 | 2020-02-01 | 捷克科學院有機化學與生物化學研究所 | 2,2,─環二核苷酸 |
| TWI818007B (zh) | 2018-04-06 | 2023-10-11 | 捷克科學院有機化學與生物化學研究所 | 2'3'-環二核苷酸 |
| JP7296398B2 (ja) | 2018-04-06 | 2023-06-22 | インスティチュート オブ オーガニック ケミストリー アンド バイオケミストリー エーエスシーアール,ヴイ.ヴイ.アイ. | 3’3’-環状ジヌクレオチド |
| US11142750B2 (en) | 2018-04-12 | 2021-10-12 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the Hepatitis B virus genome |
| CA3096674A1 (en) | 2018-04-12 | 2019-10-17 | Bristol-Myers Squibb Company | Anticancer combination therapy with cd73 antagonist antibody and pd-1/pd-l1 axis antagonist antibody |
| US20210147547A1 (en) | 2018-04-13 | 2021-05-20 | Novartis Ag | Dosage Regimens For Anti-Pd-L1 Antibodies And Uses Thereof |
| EP3781206A2 (en) | 2018-04-20 | 2021-02-24 | iOmx Therapeutics AG | A 5-thiazolecarboxamide kinase inhibitor and uses thereof |
| WO2019207030A1 (en) | 2018-04-26 | 2019-10-31 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods for predicting a response with an immune checkpoint inhibitor in a patient suffering from a lung cancer |
| WO2019211799A1 (en) | 2018-05-03 | 2019-11-07 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 2'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide |
| EP3788047A2 (en) | 2018-05-04 | 2021-03-10 | Incyte Corporation | Solid forms of an fgfr inhibitor and processes for preparing the same |
| MX2020011639A (es) | 2018-05-04 | 2021-02-15 | Incyte Corp | Sales de un inhibidor de receptores de factor de crecimiento de fibroblastos (fgfr). |
| JP7391046B2 (ja) | 2018-05-18 | 2023-12-04 | インサイト・コーポレイション | A2a/a2b阻害剤としての縮合ピリミジン誘導体 |
| EA202092830A1 (ru) | 2018-05-23 | 2021-04-08 | Селджин Корпорейшн | Антипролиферативные соединения и биспецифические антитела к bcma и cd3 для комбинированного применения |
| KR20210024454A (ko) | 2018-05-23 | 2021-03-05 | 셀진 코포레이션 | 다발성 골수종의 치료 및 4-(4-(4-(((2-(2,6-디옥소피페리딘-3-일)-1-옥소이소인돌린-4-일)옥시)메틸)벤질)피페라진-1-일)-3-플루오로벤조니트릴에 대한 바이오마커의 용도 |
| WO2019224275A1 (en) | 2018-05-23 | 2019-11-28 | Adc Therapeutics Sa | Molecular adjuvant |
| TW202015726A (zh) | 2018-05-30 | 2020-05-01 | 瑞士商諾華公司 | Entpd2抗體、組合療法、及使用該等抗體和組合療法之方法 |
| WO2019232244A2 (en) | 2018-05-31 | 2019-12-05 | Novartis Ag | Antibody molecules to cd73 and uses thereof |
| EP3802611A2 (en) | 2018-06-01 | 2021-04-14 | Novartis AG | Binding molecules against bcma and uses thereof |
| US20210347842A1 (en) | 2018-06-19 | 2021-11-11 | Eli Lilly And Company | Compositions and methods of use of il-10 agents in conjunction with chimeric antigen receptor cell therapy |
| BR112020026384A2 (pt) | 2018-06-23 | 2021-03-30 | Genentech, Inc. | Métodos para tratar um indivíduo com câncer de pulmão e para tratar um indivíduo com câncer de pulmão de pequenas células, kits, anticorpo anti-pd-l1 e composição |
| JP7411627B2 (ja) | 2018-07-09 | 2024-01-11 | ファイヴ プライム セラピューティクス インク | Ilt4と結合する抗体 |
| IL278951B (en) | 2018-07-10 | 2022-08-01 | Novartis Ag | History of 3-(5-hydroxy-1-oxoisoindolin-2-yl)piperidine-6,2-dione and their use in the treatment of ikzf2-dependent diseases |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| MX2021000213A (es) | 2018-07-11 | 2021-03-25 | Five Prime Therapeutics Inc | Anticuerpos de union al supresor de activacion de linfocitos t que contiene inmunoglobulina con dominio v (vista) a ph acidico. |
| US20210277135A1 (en) | 2018-07-13 | 2021-09-09 | Bristol-Myers Squibb Company | Ox-40 agonist, pd-1 pathway inhibitor and ctla-4 inhibitor combination for use in a method of treating a cancer or a solid tumor |
| CA3104147A1 (en) | 2018-07-18 | 2020-01-23 | Genentech, Inc. | Methods of treating lung cancer with a pd-1 axis binding antagonist, an antimetabolite, and a platinum agent |
| BR112021000727A2 (pt) | 2018-07-20 | 2021-04-13 | Surface Oncology, Inc. | Composições anti-cd112r e métodos |
| WO2020021465A1 (en) | 2018-07-25 | 2020-01-30 | Advanced Accelerator Applications (Italy) S.R.L. | Method of treatment of neuroendocrine tumors |
| SG11202100693UA (en) | 2018-07-26 | 2021-02-25 | Bristol Myers Squibb Co | Lag-3 combination therapy for the treatment of cancer |
| WO2020028097A1 (en) | 2018-08-01 | 2020-02-06 | Gilead Sciences, Inc. | Solid forms of (r)-11-(methoxymethyl)-12-(3-methoxypropoxy)-3,3-dimethyl-8-0x0-2,3,8,13b-tetrahydro-1h-pyrido[2,1-a]pyrrolo[1,2-c] phthalazine-7-c arboxylic acid |
| WO2020030634A1 (en) | 2018-08-06 | 2020-02-13 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods and compositions for treating cancers |
| WO2020044252A1 (en) | 2018-08-31 | 2020-03-05 | Novartis Ag | Dosage regimes for anti-m-csf antibodies and uses thereof |
| TW202031273A (zh) | 2018-08-31 | 2020-09-01 | 美商艾歐凡斯生物治療公司 | 抗pd-1抗體難治療性之非小細胞肺癌(nsclc)病患的治療 |
| WO2020051099A1 (en) | 2018-09-03 | 2020-03-12 | Genentech, Inc. | Carboxamide and sulfonamide derivatives useful as tead modulators |
| WO2020049534A1 (en) | 2018-09-07 | 2020-03-12 | Novartis Ag | Sting agonist and combination therapy thereof for the treatment of cancer |
| JP2022501038A (ja) | 2018-09-20 | 2022-01-06 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 凍結保存腫瘍サンプルからのtilの拡大培養 |
| US11130802B2 (en) | 2018-10-10 | 2021-09-28 | Tilos Therapeutics, Inc. | Anti-lap antibody variants |
| US11066404B2 (en) | 2018-10-11 | 2021-07-20 | Incyte Corporation | Dihydropyrido[2,3-d]pyrimidinone compounds as CDK2 inhibitors |
| CN112867803A (zh) | 2018-10-16 | 2021-05-28 | 诺华股份有限公司 | 单独的或与免疫标志物组合的肿瘤突变负荷作为生物标志物用于预测对靶向疗法的应答 |
| WO2020079164A1 (en) | 2018-10-18 | 2020-04-23 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Combination of a big-h3 antagonist and an immune checkpoint inhibitor for the treatment of solid tumor |
| CA3117016A1 (en) | 2018-10-19 | 2020-04-23 | Bristol-Myers Squibb Company | Combination therapy for melanoma |
| EP3643713A1 (en) | 2018-10-23 | 2020-04-29 | iOmx Therapeutics AG | Heterocyclic kinase inhibitors and uses thereof |
| PE20211655A1 (es) | 2018-10-31 | 2021-08-24 | Gilead Sciences Inc | Compuestos de 6-azabencimidazol sustituidos como inhibidores de hpk1 |
| WO2020089811A1 (en) | 2018-10-31 | 2020-05-07 | Novartis Ag | Dc-sign antibody drug conjugates |
| CN112969505B (zh) | 2018-10-31 | 2023-11-14 | 吉利德科学公司 | 具有hpk1抑制活性的取代的6-氮杂苯并咪唑化合物 |
| US20220008515A1 (en) | 2018-11-16 | 2022-01-13 | Neoimmunetech, Inc. | Method of treating a tumor with a combination of il-7 protein and an immune checkpoint inhibitor |
| BR112021009929B1 (pt) | 2018-11-21 | 2023-10-03 | Mayo Foundation For Medical Education And Research | Adenovírus recombinante, composição farmacêutica compreendendo o mesmo e seus usos para tratamento de câncer |
| EP3887397A1 (en) | 2018-11-28 | 2021-10-06 | Bristol-Myers Squibb Company | Antibodies comprising modified heavy constant regions |
| CN113490499A (zh) | 2018-12-04 | 2021-10-08 | 大日本住友制药肿瘤公司 | 用作治疗癌症的活性剂的cdk9抑制剂及其多晶型物 |
| MX2021007392A (es) | 2018-12-20 | 2021-08-24 | Novartis Ag | Regimen de dosificacion y combinacion farmaceutica que comprende derivados de 3-(1-oxoisoindolin-2-il)piperidina-2,6-diona. |
| US20220025036A1 (en) | 2018-12-21 | 2022-01-27 | Novartis Ag | Use of il-1beta binding antibodies |
| AU2019408408A1 (en) | 2018-12-21 | 2021-06-03 | Valerio Therapeutics | New conjugated nucleic acid molecules and their uses |
| WO2020128637A1 (en) | 2018-12-21 | 2020-06-25 | Novartis Ag | Use of il-1 binding antibodies in the treatment of a msi-h cancer |
| SG11202104699TA (en) | 2018-12-21 | 2021-07-29 | Novartis Ag | Use of il-1 beta antibodies in the treatment or prevention of myelodysplastic syndrome |
| JP2022514087A (ja) | 2018-12-21 | 2022-02-09 | ノバルティス アーゲー | IL-1β結合抗体の使用 |
| CA3124408A1 (en) | 2018-12-21 | 2020-06-25 | Aim Immunotech Inc. | Compositions and methods for cancer therapy |
| EP3902529A1 (en) | 2018-12-27 | 2021-11-03 | Amgen Inc. | Lyophilized virus formulations |
| AU2020205150A1 (en) | 2019-01-03 | 2021-07-22 | Assistance Publique-Hôpitaux De Paris (Aphp) | Methods and pharmaceutical compositions for enhancing CD8+ T cell-dependent immune responses in subjects suffering from cancer |
| CN114394954B (zh) | 2019-01-09 | 2024-04-02 | 细胞基因公司 | 包含氧代异吲哚化合物及其盐的固体形式,以及包含它们的组合物和它们的使用方法 |
| CN113597301A (zh) | 2019-01-09 | 2021-11-02 | 细胞基因公司 | 包含(s)-4-(4-(4-(((2-(2,6-二氧代哌啶-3-基)-1-氧代异吲哚啉-4-基)氧基)甲基)苄基)哌嗪-1-基)-3-氟苄腈的药物组合物以及使用它的方法 |
| WO2020146440A1 (en) | 2019-01-09 | 2020-07-16 | Celgene Corporation | Antiproliferative compounds and second active agents for use in treating multiple myeloma |
| TW202043272A (zh) | 2019-01-14 | 2020-12-01 | 美商建南德克公司 | 使用pd-1軸結合拮抗劑及rna疫苗治療癌症之方法 |
| TWI829857B (zh) | 2019-01-29 | 2024-01-21 | 美商英塞特公司 | 作為a2a / a2b抑制劑之吡唑并吡啶及三唑并吡啶 |
| JP2022520361A (ja) | 2019-02-12 | 2022-03-30 | スミトモ ダイニッポン ファーマ オンコロジー, インコーポレイテッド | 複素環式タンパク質キナーゼ阻害剤を含む製剤 |
| JP2022520811A (ja) | 2019-02-15 | 2022-04-01 | ノバルティス アーゲー | 3-(1-オキソ-5-(ピペリジン-4-イル)イソインドリン-2-イル)ピペリジン-2,6-ジオン誘導体及びその使用 |
| MX2021009682A (es) | 2019-02-15 | 2021-11-12 | Incyte Corp | Biomarcadores de cinasa 2 dependientes de ciclinas y sus usos. |
| WO2020168197A1 (en) | 2019-02-15 | 2020-08-20 | Incyte Corporation | Pyrrolo[2,3-d]pyrimidinone compounds as cdk2 inhibitors |
| KR20210129672A (ko) | 2019-02-15 | 2021-10-28 | 노파르티스 아게 | 치환된 3-(1-옥소이소인돌린-2-일)피페리딘-2,6-디온 유도체 및 이의 용도 |
| WO2020180959A1 (en) | 2019-03-05 | 2020-09-10 | Incyte Corporation | Pyrazolyl pyrimidinylamine compounds as cdk2 inhibitors |
| EA202192420A1 (ru) | 2019-03-05 | 2021-12-13 | Эмджен Инк. | Применение онколитических вирусов для лечения рака |
| WO2020178768A1 (en) | 2019-03-07 | 2020-09-10 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotide analogue comprising a cyclopentanyl modified nucleotide as sting modulator |
| DK3934757T3 (da) | 2019-03-07 | 2023-04-17 | Inst Of Organic Chemistry And Biochemistry Ascr V V I | 2'3'-cykliske dinukleotider og prodrugs deraf |
| US20220143061A1 (en) | 2019-03-07 | 2022-05-12 | Institute Of Organic Chemistry And Biochemistry Ascr, V.V.I. | 3'3'-cyclic dinucleotides and prodrugs thereof |
| US11628162B2 (en) | 2019-03-08 | 2023-04-18 | Incyte Corporation | Methods of treating cancer with an FGFR inhibitor |
| WO2020191326A1 (en) | 2019-03-20 | 2020-09-24 | Sumitomo Dainippon Pharma Oncology, Inc. | Treatment of acute myeloid leukemia (aml) with venetoclax failure |
| AU2020245437A1 (en) | 2019-03-22 | 2021-09-30 | Sumitomo Pharma Oncology, Inc. | Compositions comprising PKM2 modulators and methods of treatment using the same |
| KR20220009941A (ko) | 2019-03-26 | 2022-01-25 | 더 리젠츠 오브 더 유니버시티 오브 미시간 | Stat3의 저분자 분해제 |
| US11919904B2 (en) | 2019-03-29 | 2024-03-05 | Incyte Corporation | Sulfonylamide compounds as CDK2 inhibitors |
| EP3947403A1 (en) | 2019-03-29 | 2022-02-09 | The Regents Of The University Of Michigan | Stat3 protein degraders |
| TW202102543A (zh) | 2019-03-29 | 2021-01-16 | 美商安進公司 | 溶瘤病毒在癌症新輔助療法中之用途 |
| TW202210480A (zh) | 2019-04-17 | 2022-03-16 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TW202212339A (zh) | 2019-04-17 | 2022-04-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| WO2020214995A1 (en) | 2019-04-19 | 2020-10-22 | Genentech, Inc. | Anti-mertk antibodies and their methods of use |
| US11485767B2 (en) * | 2019-04-29 | 2022-11-01 | Mayo Foundation For Medical Education And Research | Multivalent PD-L1 binding compounds for treating cancer |
| US11440914B2 (en) | 2019-05-01 | 2022-09-13 | Incyte Corporation | Tricyclic amine compounds as CDK2 inhibitors |
| WO2020223558A1 (en) | 2019-05-01 | 2020-11-05 | Incyte Corporation | Tricyclic amine compounds as cdk2 inhibitors |
| CN114096278A (zh) | 2019-05-07 | 2022-02-25 | 英谬免疫股份有限公司 | 通过体外单采血增加对检查点抑制剂的反应 |
| TWI826690B (zh) | 2019-05-23 | 2023-12-21 | 美商基利科學股份有限公司 | 經取代之烯吲哚酮化物及其用途 |
| EP3983377A1 (en) | 2019-06-12 | 2022-04-20 | Vanderbilt University | Dibenzylamines as amino acid transport inhibitors |
| CA3141405A1 (en) | 2019-06-12 | 2020-12-17 | H. Charles Manning | Amino acid transport inhibitors and the uses thereof |
| MX2021015433A (es) | 2019-07-02 | 2022-06-08 | Hutchinson Fred Cancer Res | Vectores ad35 recombinantes y mejoras de la terapia génica relacionadas. |
| CA3145864A1 (en) | 2019-07-03 | 2021-01-07 | Sumitomo Dainippon Pharma Oncology, Inc. | Tyrosine kinase non-receptor 1 (tnk1) inhibitors and uses thereof |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| CN114127073A (zh) | 2019-07-16 | 2022-03-01 | 美国密歇根州立大学试剂中心 | 作为eed抑制剂的咪唑并嘧啶和其用途 |
| WO2021024020A1 (en) | 2019-08-06 | 2021-02-11 | Astellas Pharma Inc. | Combination therapy involving antibodies against claudin 18.2 and immune checkpoint inhibitors for treatment of cancer |
| PE20221010A1 (es) | 2019-08-14 | 2022-06-15 | Incyte Corp | Compuestos de imidazolil pirimidinilamina como inhibidores de cdk2 |
| EP4017476A1 (en) | 2019-08-19 | 2022-06-29 | Gilead Sciences, Inc. | Pharmaceutical formulations of tenofovir alafenamide |
| CA3151824A1 (en) | 2019-08-27 | 2021-03-04 | The Regents Of The University Of Michigan | Cereblon e3 ligase inhibitors |
| CN110669108A (zh) * | 2019-09-06 | 2020-01-10 | 中国药科大学 | 一种多肽及其应用 |
| TW202124446A (zh) | 2019-09-18 | 2021-07-01 | 瑞士商諾華公司 | 與entpd2抗體之組合療法 |
| US20220348651A1 (en) | 2019-09-18 | 2022-11-03 | Novartis Ag | Entpd2 antibodies, combination therapies, and methods of using the antibodies and combination therapies |
| WO2021055756A1 (en) | 2019-09-19 | 2021-03-25 | The Regents Of The University Of Michigan | Spirocyclic androgen receptor protein degraders |
| JP2022548292A (ja) | 2019-09-19 | 2022-11-17 | ブリストル-マイヤーズ スクイブ カンパニー | 酸性pHでVISTAと結合する抗体 |
| US11497808B2 (en) | 2019-09-30 | 2022-11-15 | Gilead Sciences, Inc. | HBV vaccines and methods treating HBV |
| JP2022551668A (ja) | 2019-10-11 | 2022-12-12 | インサイト・コーポレイション | Cdk2阻害剤としての二環式アミン |
| BR112022007163A2 (pt) | 2019-10-14 | 2022-08-23 | Incyte Corp | Heterociclos bicíclicos como inibidores de fgfr |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| CN114786679A (zh) | 2019-10-21 | 2022-07-22 | 诺华股份有限公司 | 具有维奈托克和tim-3抑制剂的组合疗法 |
| TW202128191A (zh) | 2019-10-21 | 2021-08-01 | 瑞士商諾華公司 | Tim-3抑制劑及其用途 |
| AU2020385113A1 (en) | 2019-11-11 | 2022-05-19 | Incyte Corporation | Salts and crystalline forms of a PD-1/PD-L1 inhibitor |
| CA3155989A1 (en) | 2019-11-13 | 2021-05-20 | Jason Robert ZBIEG | Therapeutic compounds and methods of use |
| US20220395553A1 (en) | 2019-11-14 | 2022-12-15 | Cohbar, Inc. | Cxcr4 antagonist peptides |
| WO2021102343A1 (en) | 2019-11-22 | 2021-05-27 | Sumitomo Dainippon Pharma Oncology, Inc. | Solid dose pharmaceutical composition |
| GB201917254D0 (en) | 2019-11-27 | 2020-01-08 | Adc Therapeutics Sa | Combination therapy |
| KR20220131900A (ko) | 2019-12-04 | 2022-09-29 | 인사이트 코포레이션 | Fgfr 억제제의 유도체 |
| US11897891B2 (en) | 2019-12-04 | 2024-02-13 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
| US20230031465A1 (en) | 2019-12-06 | 2023-02-02 | Precision Biosciences, Inc. | Optimized engineered meganucleases having specificity for a recognition sequence in the hepatitis b virus genome |
| WO2021123902A1 (en) | 2019-12-20 | 2021-06-24 | Novartis Ag | Combination of anti tim-3 antibody mbg453 and anti tgf-beta antibody nis793, with or without decitabine or the anti pd-1 antibody spartalizumab, for treating myelofibrosis and myelodysplastic syndrome |
| CA3163389A1 (en) | 2020-01-03 | 2021-07-08 | Mi ZENG | Biphenyl derivative inhibitor, preparation method therefor and use thereof |
| TW202135824A (zh) | 2020-01-03 | 2021-10-01 | 美商英塞特公司 | 包含a2a/a2b及pd-1/pd-l1抑制劑之組合療法 |
| IL293752A (en) | 2020-01-17 | 2022-08-01 | Novartis Ag | A combination containing a tim-3 inhibitor and a substance that causes hypomethylation for use in the treatment of myeloplastic syndrome or chronic myelomonocytic leukemia |
| KR20220133996A (ko) | 2020-01-30 | 2022-10-05 | 오엔에이 테라퓨틱스 에스.엘. | 암 및 암 전이를 치료하기 위한 병용 요법 |
| CN116650628A (zh) | 2020-01-31 | 2023-08-29 | 基因泰克公司 | 用pd-1轴结合拮抗剂和rna疫苗诱导新表位特异性t细胞的方法 |
| CA3174442A1 (en) | 2020-03-06 | 2021-09-10 | ONA Therapeutics S.L. | Anti-cd36 antibodies and their use to treat cancer |
| US20210275666A1 (en) | 2020-03-06 | 2021-09-09 | Incyte Corporation | Combination therapy comprising axl/mer and pd-1/pd-l1 inhibitors |
| US20230093147A1 (en) | 2020-03-09 | 2023-03-23 | President And Fellows Of Harvard College | Methods and compositions relating to improved combination therapies |
| KR20220151189A (ko) | 2020-03-09 | 2022-11-14 | 브리스톨-마이어스 스큅 컴퍼니 | 증진된 효능제 활성을 갖는 cd40에 대한 항체 |
| JP2023518433A (ja) | 2020-03-20 | 2023-05-01 | ギリアード サイエンシーズ, インコーポレイテッド | 4’-c-置換-2-ハロ-2’-デオキシアデノシンヌクレオシドのプロドラッグ並びにその製造法及び使用法 |
| US20230159573A1 (en) | 2020-03-26 | 2023-05-25 | The Regents Of The University Of Michigan | Small molecule stat protein degraders |
| EP4132971A1 (en) | 2020-04-09 | 2023-02-15 | Merck Sharp & Dohme LLC | Affinity matured anti-lap antibodies and uses thereof |
| US20210355121A1 (en) | 2020-04-16 | 2021-11-18 | Incyte Corporation | Fused tricyclic kras inhibitors |
| EP3901151A1 (en) | 2020-04-21 | 2021-10-27 | iOmx Therapeutics AG | Halogenated-heteroaryl and other heterocyclic kinase inhibitors, and uses thereof |
| JP2023524639A (ja) | 2020-04-22 | 2023-06-13 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 患者特異的免疫療法用細胞の製造調整システム及び調整方法 |
| WO2021219731A2 (en) | 2020-04-28 | 2021-11-04 | Iomx Therapeutics Ag | Bicyclic kinase inhibitors and uses thereof |
| US11739102B2 (en) | 2020-05-13 | 2023-08-29 | Incyte Corporation | Fused pyrimidine compounds as KRAS inhibitors |
| US20230192867A1 (en) | 2020-05-15 | 2023-06-22 | Bristol-Myers Squibb Company | Antibodies to garp |
| EP4157923A2 (en) | 2020-05-29 | 2023-04-05 | President And Fellows Of Harvard College | Living cells engineered with polyphenol-functionalized biologically active nanocomplexes |
| EP4161952A1 (en) | 2020-06-04 | 2023-04-12 | Leidos, Inc. | Immunomodulatory compounds |
| TW202214857A (zh) | 2020-06-19 | 2022-04-16 | 法商昂席歐公司 | 新型結合核酸分子及其用途 |
| JP2023531676A (ja) | 2020-06-23 | 2023-07-25 | ノバルティス アーゲー | 3-(1-オキソイソインドリン-2-イル)ピぺリジン-2,6-ジオン誘導体を含む投与レジメン |
| WO2021262969A1 (en) | 2020-06-24 | 2021-12-30 | The General Hospital Corporation | Materials and methods of treating cancer |
| EP4171550A1 (en) | 2020-06-25 | 2023-05-03 | Celgene Corporation | Methods for treating cancer with combination therapies |
| JP2023531305A (ja) | 2020-06-30 | 2023-07-21 | アンスティチュ ナショナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシュ メディカル | 術前補助療法後の固形癌患者の再発及び/又は死亡のリスクを予測するための方法。 |
| CN115843335A (zh) | 2020-06-30 | 2023-03-24 | 国家医疗保健研究所 | 用于预测患有实体癌的患者在术前辅助治疗和根治性手术后复发和/或死亡风险的方法 |
| AU2021305052A1 (en) | 2020-07-07 | 2023-02-09 | Celgene Corporation | Pharmaceutical compositions comprising (S)-4-(4-(4-(((2-(2,6-dioxopiperidin-3-yl)-1-oxoisoindolin-4-yl)oxy)methyl) benzyl)piperazin-1-yl)-3-fluorobenzonitrile and methods of using the same |
| EP4178611A1 (en) | 2020-07-07 | 2023-05-17 | BioNTech SE | Therapeutic rna for hpv-positive cancer |
| US20230257365A1 (en) | 2020-07-10 | 2023-08-17 | The Regents Of The University Of Michigan | Small molecule androgen receptor protein degraders |
| WO2022011205A1 (en) | 2020-07-10 | 2022-01-13 | The Regents Of The University Of Michigan | Androgen receptor protein degraders |
| US11787775B2 (en) | 2020-07-24 | 2023-10-17 | Genentech, Inc. | Therapeutic compounds and methods of use |
| JP2023536164A (ja) | 2020-08-03 | 2023-08-23 | ノバルティス アーゲー | ヘテロアリール置換3-(1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン誘導体及びその使用 |
| JP2023537412A (ja) | 2020-08-13 | 2023-08-31 | ブリストル-マイヤーズ スクイブ カンパニー | 目的の細胞を標的とするためのil-2の向け直し方法 |
| WO2022047093A1 (en) | 2020-08-28 | 2022-03-03 | Incyte Corporation | Vinyl imidazole compounds as inhibitors of kras |
| WO2022043557A1 (en) | 2020-08-31 | 2022-03-03 | Advanced Accelerator Applications International Sa | Method of treating psma-expressing cancers |
| EP4204020A1 (en) | 2020-08-31 | 2023-07-05 | Advanced Accelerator Applications International S.A. | Method of treating psma-expressing cancers |
| AU2021344422A1 (en) | 2020-09-16 | 2023-05-04 | Gordon J. Freeman | Methods of treating an individual that has failed an anti-pd-1/anti-pd-l1 therapy |
| US11767320B2 (en) | 2020-10-02 | 2023-09-26 | Incyte Corporation | Bicyclic dione compounds as inhibitors of KRAS |
| AR123855A1 (es) | 2020-10-20 | 2023-01-18 | Genentech Inc | Anticuerpos anti-mertk conjugados con peg y métodos de uso |
| EP4236960A1 (en) | 2020-10-28 | 2023-09-06 | Ikena Oncology, Inc. | Combination of an ahr inhibitor with a pdx inhibitor or doxorubicine |
| WO2022093981A1 (en) | 2020-10-28 | 2022-05-05 | Genentech, Inc. | Combination therapy comprising ptpn22 inhibitors and pd-l1 binding antagonists |
| US11780836B2 (en) | 2020-11-06 | 2023-10-10 | Incyte Corporation | Process of preparing a PD-1/PD-L1 inhibitor |
| CA3200844A1 (en) | 2020-11-06 | 2022-05-12 | Incyte Corporation | Process for making a pd-1/pd-l1 inhibitor and salts and crystalline forms thereof |
| US11760756B2 (en) | 2020-11-06 | 2023-09-19 | Incyte Corporation | Crystalline form of a PD-1/PD-L1 inhibitor |
| EP4240491A1 (en) | 2020-11-06 | 2023-09-13 | Novartis AG | Cd19 binding molecules and uses thereof |
| AU2021376218A1 (en) | 2020-11-08 | 2023-06-15 | Seagen Inc. | Combination Therapy |
| WO2022119830A1 (en) | 2020-12-02 | 2022-06-09 | Genentech, Inc. | Methods and compositions for neoadjuvant and adjuvant urothelial carcinoma therapy |
| KR20220082558A (ko) | 2020-12-10 | 2022-06-17 | 재단법인 의약바이오컨버젼스연구단 | 면역 증진 활성이 있는 신규 crs 단편 펩타이드 및 이의 용도 |
| TW202237119A (zh) | 2020-12-10 | 2022-10-01 | 美商住友製藥腫瘤公司 | Alk﹘5抑制劑和彼之用途 |
| WO2022135666A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Treatment schedule for cytokine proteins |
| TW202245808A (zh) | 2020-12-21 | 2022-12-01 | 德商拜恩迪克公司 | 用於治療癌症之治療性rna |
| WO2022135667A1 (en) | 2020-12-21 | 2022-06-30 | BioNTech SE | Therapeutic rna for treating cancer |
| WO2022147092A1 (en) | 2020-12-29 | 2022-07-07 | Incyte Corporation | Combination therapy comprising a2a/a2b inhibitors, pd-1/pd-l1 inhibitors, and anti-cd73 antibodies |
| EP4274616A2 (en) | 2021-01-11 | 2023-11-15 | Synthekine, Inc. | Compositions and methods related to receptor pairing |
| EP4284510A1 (en) | 2021-01-29 | 2023-12-06 | Novartis AG | Dosage regimes for anti-cd73 and anti-entpd2 antibodies and uses thereof |
| EP4292596A1 (en) | 2021-02-10 | 2023-12-20 | Curon Biopharmaceutical (Shanghai) Co., Limited | Method and combination for treating tumors |
| GB202102396D0 (en) | 2021-02-19 | 2021-04-07 | Adc Therapeutics Sa | Molecular adjuvant |
| WO2022187419A1 (en) | 2021-03-03 | 2022-09-09 | The Regents Of The University Of Michigan | Small molecule degraders of androgen receptor |
| WO2022187423A1 (en) | 2021-03-03 | 2022-09-09 | The Regents Of The University Of Michigan | Cereblon ligands |
| JP2024511373A (ja) | 2021-03-18 | 2024-03-13 | ノバルティス アーゲー | がんのためのバイオマーカーおよびその使用 |
| JP2024511067A (ja) | 2021-03-19 | 2024-03-12 | トレインド セラピューティクス ディスカバリー,インコーポレーテッド | 訓練された免疫を調節するための化合物およびその使用方法 |
| TW202304506A (zh) | 2021-03-25 | 2023-02-01 | 日商安斯泰來製藥公司 | 涉及抗claudin 18.2抗體的組合治療以治療癌症 |
| TW202304979A (zh) | 2021-04-07 | 2023-02-01 | 瑞士商諾華公司 | 抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途 |
| WO2022217026A1 (en) | 2021-04-09 | 2022-10-13 | Seagen Inc. | Methods of treating cancer with anti-tigit antibodies |
| CA3215903A1 (en) | 2021-04-12 | 2022-10-20 | Incyte Corporation | Combination therapy comprising an fgfr inhibitor and a nectin-4 targeting agent |
| TW202309022A (zh) | 2021-04-13 | 2023-03-01 | 美商努法倫特公司 | 用於治療具egfr突變之癌症之胺基取代雜環 |
| AR125396A1 (es) | 2021-04-20 | 2023-07-12 | Seagen Inc | Modulación de citotoxicidad celular dependiente de anticuerpos |
| EP4330436A1 (en) | 2021-04-30 | 2024-03-06 | Genentech, Inc. | Therapeutic and diagnostic methods and compositions for cancer |
| TW202348237A (zh) | 2021-05-13 | 2023-12-16 | 美商基利科學股份有限公司 | TLR8調節化合物及抗HBV siRNA療法之組合 |
| AR125874A1 (es) | 2021-05-18 | 2023-08-23 | Novartis Ag | Terapias de combinación |
| EP4352059A1 (en) | 2021-06-09 | 2024-04-17 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| CA3220155A1 (en) | 2021-06-09 | 2022-12-15 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| TW202317200A (zh) | 2021-06-11 | 2023-05-01 | 美商基利科學股份有限公司 | Mcl-1抑制劑與抗體藥物接合物之組合 |
| CA3222269A1 (en) | 2021-06-11 | 2022-12-15 | Gilead Sciences, Inc. | Combination mcl-1 inhibitors with anti-cancer agents |
| KR20240025616A (ko) | 2021-06-23 | 2024-02-27 | 길리애드 사이언시즈, 인코포레이티드 | 다이아실글리세롤 키나제 조절 화합물 |
| US20230060354A1 (en) | 2021-06-23 | 2023-03-02 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| AU2022298639A1 (en) | 2021-06-23 | 2023-12-07 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| AU2022297367A1 (en) | 2021-06-23 | 2023-12-07 | Gilead Sciences, Inc. | Diacylglyercol kinase modulating compounds |
| KR20240028452A (ko) | 2021-07-02 | 2024-03-05 | 제넨테크, 인크. | 암을 치료하기 위한 방법 및 조성물 |
| US20230056631A1 (en) | 2021-07-07 | 2023-02-23 | Incyte Corporation | Tricyclic compounds as inhibitors of kras |
| AU2022312698A1 (en) | 2021-07-13 | 2024-01-25 | BioNTech SE | Multispecific binding agents against cd40 and cd137 in combination therapy for cancer |
| WO2023287896A1 (en) | 2021-07-14 | 2023-01-19 | Incyte Corporation | Tricyclic compounds as inhibitors of kras |
| WO2023010094A2 (en) | 2021-07-28 | 2023-02-02 | Genentech, Inc. | Methods and compositions for treating cancer |
| AU2022317820A1 (en) | 2021-07-28 | 2023-12-14 | F. Hoffmann-La Roche Ag | Methods and compositions for treating cancer |
| CA3226281A1 (en) | 2021-07-30 | 2023-02-02 | ONA Therapeutics S.L. | Anti-cd36 antibodies and their use to treat cancer |
| WO2023034229A1 (en) * | 2021-08-30 | 2023-03-09 | The Regents Of The University Of California | Immune checkpoint targeting therapeutic nanoparticles |
| WO2023034290A1 (en) | 2021-08-31 | 2023-03-09 | Incyte Corporation | Naphthyridine compounds as inhibitors of kras |
| US20230151005A1 (en) | 2021-09-21 | 2023-05-18 | Incyte Corporation | Hetero-tricyclic compounds as inhibitors of kras |
| WO2023051926A1 (en) | 2021-09-30 | 2023-04-06 | BioNTech SE | Treatment involving non-immunogenic rna for antigen vaccination and pd-1 axis binding antagonists |
| TW202321308A (zh) | 2021-09-30 | 2023-06-01 | 美商建南德克公司 | 使用抗tigit抗體、抗cd38抗體及pd—1軸結合拮抗劑治療血液癌症的方法 |
| WO2023056421A1 (en) | 2021-10-01 | 2023-04-06 | Incyte Corporation | Pyrazoloquinoline kras inhibitors |
| CA3234647A1 (en) | 2021-10-06 | 2023-04-13 | Genmab A/S | Multispecific binding agents against pd-l1 and cd137 in combination therapy |
| TW202333802A (zh) | 2021-10-11 | 2023-09-01 | 德商拜恩迪克公司 | 用於肺癌之治療性rna(二) |
| US11939328B2 (en) | 2021-10-14 | 2024-03-26 | Incyte Corporation | Quinoline compounds as inhibitors of KRAS |
| WO2023077034A1 (en) | 2021-10-28 | 2023-05-04 | Lyell Immunopharma, Inc. | Methods for culturing immune cells |
| WO2023080900A1 (en) | 2021-11-05 | 2023-05-11 | Genentech, Inc. | Methods and compositions for classifying and treating kidney cancer |
| WO2023083439A1 (en) | 2021-11-09 | 2023-05-19 | BioNTech SE | Tlr7 agonist and combinations for cancer treatment |
| AU2022384793A1 (en) | 2021-11-12 | 2024-04-11 | Advanced Accelerator Applications | Combination therapy for treating lung cancer |
| WO2023091746A1 (en) | 2021-11-22 | 2023-05-25 | Incyte Corporation | Combination therapy comprising an fgfr inhibitor and a kras inhibitor |
| TW202340212A (zh) | 2021-11-24 | 2023-10-16 | 美商建南德克公司 | 治療性化合物及其使用方法 |
| WO2023097195A1 (en) | 2021-11-24 | 2023-06-01 | Genentech, Inc. | Therapeutic indazole compounds and methods of use in the treatment of cancer |
| US20230203010A1 (en) | 2021-12-03 | 2023-06-29 | Incyte Corporation | Bicyclic amine cdk12 inhibitors |
| US20230183251A1 (en) | 2021-12-10 | 2023-06-15 | Incyte Corporation | Bicyclic amines as cdk12 inhibitors |
| WO2023111203A1 (en) | 2021-12-16 | 2023-06-22 | Onxeo | New conjugated nucleic acid molecules and their uses |
| US20230192722A1 (en) | 2021-12-22 | 2023-06-22 | Incyte Corporation | Salts and solid forms of an fgfr inhibitor and processes of preparing thereof |
| TW202342023A (zh) | 2022-03-07 | 2023-11-01 | 美商英塞特公司 | Cdk2抑制劑之固體形式、鹽及製備方法 |
| WO2023170606A1 (en) | 2022-03-08 | 2023-09-14 | Alentis Therapeutics Ag | Use of anti-claudin-1 antibodies to increase t cell availability |
| WO2023192478A1 (en) | 2022-04-01 | 2023-10-05 | Bristol-Myers Squibb Company | Combination therapy with anti-il-8 antibodies and anti-pd-1 antibodies for treating cancer |
| WO2023191816A1 (en) | 2022-04-01 | 2023-10-05 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| CN114805499A (zh) * | 2022-04-24 | 2022-07-29 | 中南大学湘雅医院 | 以pd-l1通路为靶点的pet分子探针及其应用 |
| WO2023214325A1 (en) | 2022-05-05 | 2023-11-09 | Novartis Ag | Pyrazolopyrimidine derivatives and uses thereof as tet2 inhibitors |
| WO2023219613A1 (en) | 2022-05-11 | 2023-11-16 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| WO2023218046A1 (en) | 2022-05-12 | 2023-11-16 | Genmab A/S | Binding agents capable of binding to cd27 in combination therapy |
| WO2023240058A2 (en) | 2022-06-07 | 2023-12-14 | Genentech, Inc. | Prognostic and therapeutic methods for cancer |
| WO2023239768A1 (en) | 2022-06-08 | 2023-12-14 | Incyte Corporation | Tricyclic triazolo compounds as dgk inhibitors |
| WO2023250430A1 (en) | 2022-06-22 | 2023-12-28 | Incyte Corporation | Bicyclic amine cdk12 inhibitors |
| US20240101557A1 (en) | 2022-07-11 | 2024-03-28 | Incyte Corporation | Fused tricyclic compounds as inhibitors of kras g12v mutants |
| WO2024015897A1 (en) | 2022-07-13 | 2024-01-18 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| WO2024020432A1 (en) | 2022-07-19 | 2024-01-25 | Genentech, Inc. | Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies |
| WO2024049949A1 (en) | 2022-09-01 | 2024-03-07 | Genentech, Inc. | Therapeutic and diagnostic methods for bladder cancer |
| WO2024069009A1 (en) | 2022-09-30 | 2024-04-04 | Alentis Therapeutics Ag | Treatment of drug-resistant hepatocellular carcinoma |
| WO2024077095A1 (en) | 2022-10-05 | 2024-04-11 | Genentech, Inc. | Methods and compositions for classifying and treating bladder cancer |
| WO2024077166A1 (en) | 2022-10-05 | 2024-04-11 | Genentech, Inc. | Methods and compositions for classifying and treating lung cancer |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07291996A (ja) | 1994-03-01 | 1995-11-07 | Yuu Honshiyo | ヒトにおけるプログラムされた細胞死に関連したポリペプチド、それをコードするdna、そのdnaからなるベクター、そのベクターで形質転換された宿主細胞、そのポリペプチドの抗体、およびそのポリペプチドまたはその抗体を含有する薬学的組成物 |
| US5789542A (en) * | 1994-04-22 | 1998-08-04 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Amphipathic peptides |
| HUP0001930A3 (en) * | 1997-04-15 | 2001-10-29 | Pharmexa As | Modified tnfalpha molecules, dna encoding such modified tnfalpha molecules and vaccines comprising such modified tnfalpha molecules and dna |
| IL148021A0 (en) | 1999-08-23 | 2002-09-12 | Dana Farber Cancer Inst Inc | Novel b7-4 molecules and uses therefor |
| PT1210428E (pt) * | 1999-08-23 | 2015-07-21 | Genetics Inst Llc | Pd-1, um recetor para b7-4 e suas utilizações |
| CA2392477A1 (en) | 1999-11-30 | 2001-06-07 | Mayo Foundation For Medical Education And Research | B7-h1, a novel immunoregulatory molecule |
| AU7309601A (en) | 2000-06-28 | 2002-01-08 | Genetics Inst | Pd-l2 molecules: novel pd-1 ligands and uses therefor |
| JP2002112782A (ja) * | 2000-10-04 | 2002-04-16 | Ajinomoto Co Inc | 抗血栓活性を有する蛋白質及びその製造法 |
| CA2442066C (en) | 2001-04-02 | 2005-11-01 | Wyeth | Pd-1, a receptor for b7-4, and uses therefor |
| US7794710B2 (en) | 2001-04-20 | 2010-09-14 | Mayo Foundation For Medical Education And Research | Methods of enhancing T cell responsiveness |
| EP1456652A4 (en) | 2001-11-13 | 2005-11-02 | Dana Farber Cancer Inst Inc | IMMUNOCELL ACTIVATION MODULATING SUBSTANCES AND USE METHOD THEREFOR |
| PT1451224E (pt) | 2001-12-04 | 2012-10-09 | Theramab Llc | Péptido ou proteína contendo um anel c¿- d da família de receptores cd28 |
| JP4409430B2 (ja) | 2002-07-03 | 2010-02-03 | 小野薬品工業株式会社 | 免疫賦活組成物 |
| CN1753912B (zh) | 2002-12-23 | 2011-11-02 | 惠氏公司 | 抗pd-1抗体及其用途 |
| GB0400440D0 (en) | 2004-01-09 | 2004-02-11 | Isis Innovation | Receptor modulators |
| BRPI0611766A2 (pt) * | 2005-06-08 | 2011-12-20 | Dana Farber Cancer Inst Inc | métodos e composições para o tratamento de infecções persistentes e cáncer por inibição da rota de morte celular programada |
| DK1907424T3 (en) | 2005-07-01 | 2015-11-09 | Squibb & Sons Llc | HUMAN MONOCLONAL ANTIBODIES TO PROGRAMMED death ligand 1 (PD-L1) |
| WO2007027906A2 (en) | 2005-08-31 | 2007-03-08 | Cell Signaling Technology, Inc. | Reagents for the detection of protein phosphorylation in leukemia signaling pathways |
| US8216996B2 (en) | 2006-03-03 | 2012-07-10 | Ono Pharmaceutical Co., Ltd. | Multimer of extracellular domain of cell surface functional molecule |
| WO2009025806A2 (en) * | 2007-08-20 | 2009-02-26 | Adnexus, A Bristol-Myers Squibb R & D Company | Use of vegfr-2 inhibitors for treating metastatic cancer |
| CN101215329B (zh) | 2008-01-04 | 2011-02-02 | 中国人民解放军第四军医大学 | 可溶性人程序性死亡蛋白-1-IgV及其制备方法 |
| PE20110435A1 (es) | 2008-08-25 | 2011-07-20 | Amplimmune Inc | Composiciones antagonistas del pd-1 |
| WO2011066342A2 (en) | 2009-11-24 | 2011-06-03 | Amplimmune, Inc. | Simultaneous inhibition of pd-l1/pd-l2 |
| US8907053B2 (en) | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
-
2011
- 2011-06-24 US US13/168,453 patent/US8907053B2/en not_active Expired - Fee Related
- 2011-06-27 SG SG2012095113A patent/SG186809A1/en unknown
- 2011-06-27 IN IN306CHN2013 patent/IN2013CN00306A/en unknown
- 2011-06-27 KR KR1020137001288A patent/KR20140002594A/ko not_active Application Discontinuation
- 2011-06-27 CA CA2803859A patent/CA2803859A1/en not_active Abandoned
- 2011-06-27 AU AU2011268484A patent/AU2011268484B2/en not_active Ceased
- 2011-06-27 EP EP11749257.9A patent/EP2585099A2/en not_active Withdrawn
- 2011-06-27 EA EA201300005A patent/EA027040B9/ru not_active IP Right Cessation
- 2011-06-27 JP JP2013516061A patent/JP2013534922A/ja active Pending
- 2011-06-27 CN CN201180040592.4A patent/CN103096915B/zh not_active Expired - Fee Related
- 2011-06-27 CU CU20120176A patent/CU24171B1/es active IP Right Grant
- 2011-06-27 WO PCT/IN2011/000426 patent/WO2011161699A2/en active Application Filing
- 2011-06-27 NZ NZ605533A patent/NZ605533A/en not_active IP Right Cessation
- 2011-06-27 MX MX2012014785A patent/MX2012014785A/es active IP Right Grant
-
2012
- 2012-12-16 IL IL223678A patent/IL223678A/en not_active IP Right Cessation
-
2013
- 2013-01-14 ZA ZA2013/00313A patent/ZA201300313B/en unknown
-
2016
- 2016-07-26 JP JP2016146811A patent/JP2017008065A/ja not_active Ceased
Also Published As
| Publication number | Publication date |
|---|---|
| NZ605533A (en) | 2014-12-24 |
| IN2013CN00306A (ko) | 2015-07-03 |
| EP2585099A2 (en) | 2013-05-01 |
| CN103096915B (zh) | 2016-08-03 |
| EA027040B9 (ru) | 2017-11-30 |
| US20110318373A1 (en) | 2011-12-29 |
| EA201300005A1 (ru) | 2014-03-31 |
| EA027040B1 (ru) | 2017-06-30 |
| JP2017008065A (ja) | 2017-01-12 |
| WO2011161699A2 (en) | 2011-12-29 |
| CU24171B1 (es) | 2016-04-25 |
| MX2012014785A (es) | 2013-04-29 |
| CU20120176A7 (es) | 2013-05-31 |
| IL223678A (en) | 2017-08-31 |
| AU2011268484A1 (en) | 2013-01-31 |
| US8907053B2 (en) | 2014-12-09 |
| JP2013534922A (ja) | 2013-09-09 |
| CA2803859A1 (en) | 2011-12-29 |
| ZA201300313B (en) | 2016-10-26 |
| CN103096915A (zh) | 2013-05-08 |
| AU2011268484B2 (en) | 2015-04-23 |
| SG186809A1 (en) | 2013-02-28 |
| WO2011161699A3 (en) | 2012-05-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8907053B2 (en) | Immunosuppression modulating compounds | |
| US9783578B2 (en) | Immunosuppression modulating compounds | |
| US9096642B2 (en) | Therapeutic compounds for immunomodulation | |
| US9422339B2 (en) | Immunomodulating cyclic compounds | |
| AU2017276218B2 (en) | Erythrocyte-binding therapeutics | |
| JP4949844B2 (ja) | エリスロポエチン受容体に結合する新規ペプチド | |
| WO2015044900A1 (en) | Therapeutic immunomodulating compounds | |
| BR112021000347A2 (pt) | Proteína de fusão variante pd1-4-1bbl e métodos de uso da mesma | |
| JP2023514010A (ja) | 修飾il-2ポリペプチドおよびその使用 | |
| TWI820361B (zh) | 包含含有il-2蛋白與cd80蛋白之融合蛋白及免疫檢查點抑制劑的用於治療癌症的藥學組成物 | |
| CN111315398A (zh) | 白介素-10与免疫检查点途径抑制剂的组合的组合物和使用方法 | |
| EP2827908A2 (en) | Peptides | |
| US20200399335A1 (en) | Modified immunomodulatory peptide | |
| EP4230223A1 (en) | Composition | |
| US20210139608A1 (en) | Bio-responsive adhesive antibody delivery platform for immunotherapy and preparation method thereof | |
| EP4122447A1 (en) | Fusion protein preparation comprising il-2 and cd80 proteins |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |