JP7604397B2 - Psmaコンジュゲートの調製方法 - Google Patents
Psmaコンジュゲートの調製方法 Download PDFInfo
- Publication number
- JP7604397B2 JP7604397B2 JP2021569296A JP2021569296A JP7604397B2 JP 7604397 B2 JP7604397 B2 JP 7604397B2 JP 2021569296 A JP2021569296 A JP 2021569296A JP 2021569296 A JP2021569296 A JP 2021569296A JP 7604397 B2 JP7604397 B2 JP 7604397B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- resin
- group
- dimethylformamide
- based compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D257/00—Heterocyclic compounds containing rings having four nitrogen atoms as the only ring hetero atoms
- C07D257/02—Heterocyclic compounds containing rings having four nitrogen atoms as the only ring hetero atoms not condensed with other rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/0402—Organic compounds carboxylic acid carriers, fatty acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/0497—Organic compounds conjugates with a carrier being an organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C201/00—Preparation of esters of nitric or nitrous acid or of compounds containing nitro or nitroso groups bound to a carbon skeleton
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Urology & Nephrology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Optics & Photonics (AREA)
- Physics & Mathematics (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Toxicology (AREA)
- Cell Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Description
本出願は、2019年5月20日に出願された米国仮特許出願第62/850,119号、2019年10月4日に出願された米国仮特許出願第62/910,777号、及び2019年10月8日に出願された米国仮特許出願第62/912,353号の利益及び優先権を主張し、その開示全体は、参照により本明細書に組み込まれる。
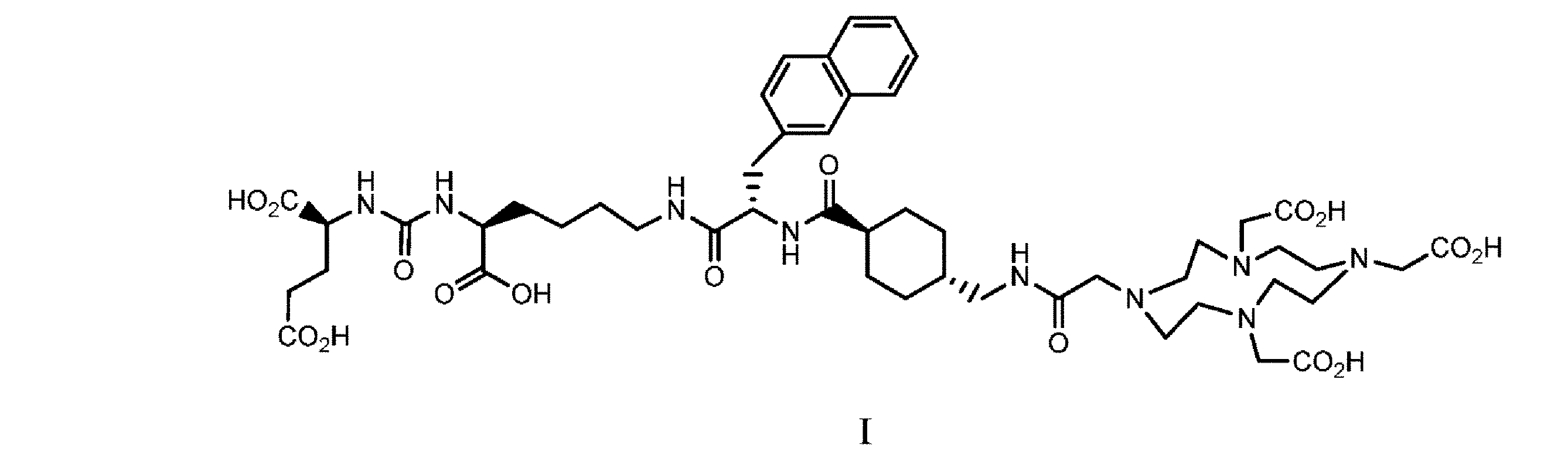
(別名PSMA-617)である。
の化合物を調製するための方法であって、
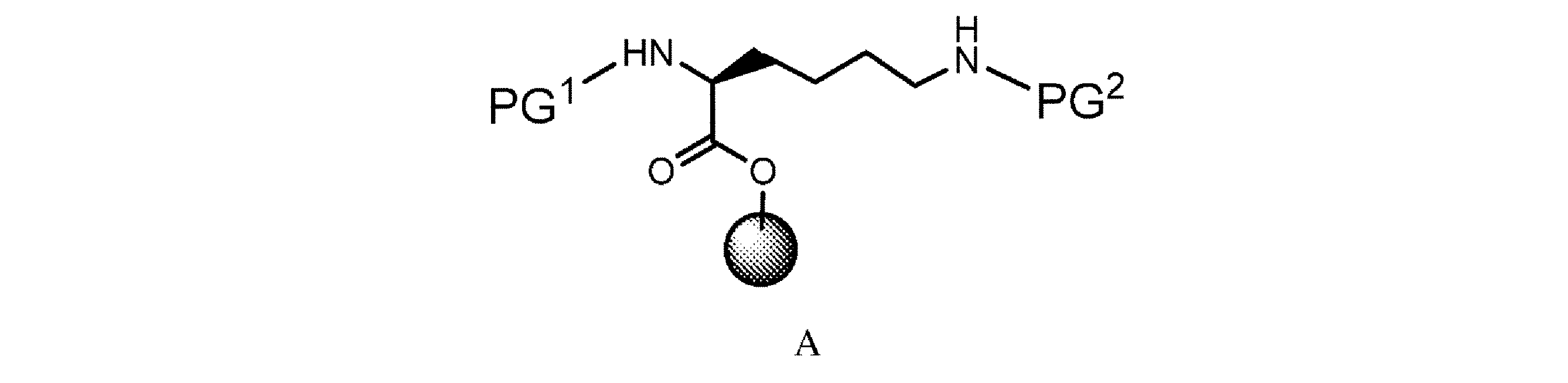
a. 式A
の樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式A’
の樹脂系化合物を提供すること、又は
b. 式A’の樹脂系化合物を、式B
の化合物と、有機溶媒及び塩基の存在下で接触させて、式C
の樹脂系化合物を提供すること、又は
c. 式Cの樹脂系化合物を、有機溶媒の存在下で第2の脱保護剤と接触させて、式C’
の樹脂系化合物を提供すること、又は
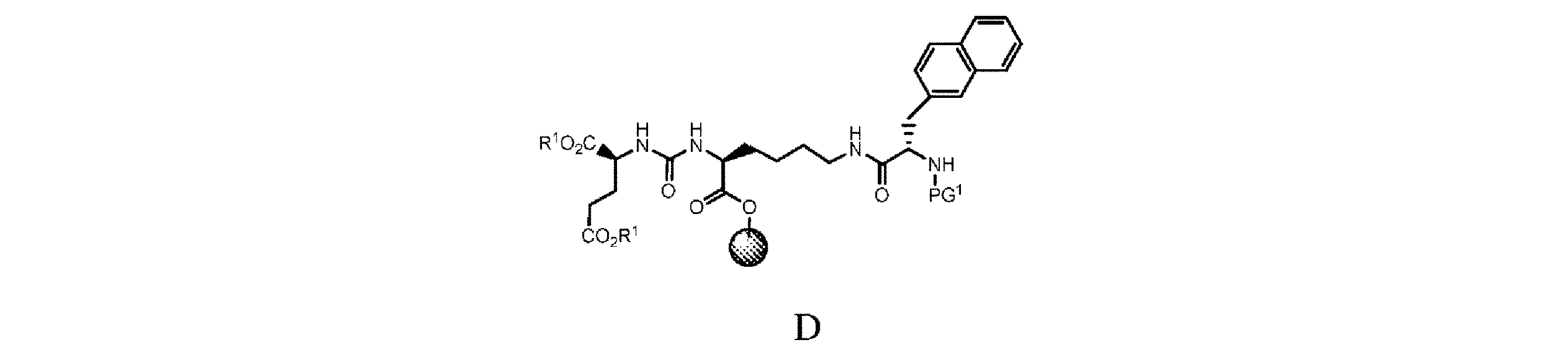
d. 式C’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤及び塩基の存在下で、PG1-3-(2-ナフチル)-L-アラニンと接触させて、式D
の樹脂系化合物を提供すること、又は
e. 式Dの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式D’
の樹脂系化合物を提供すること、又は
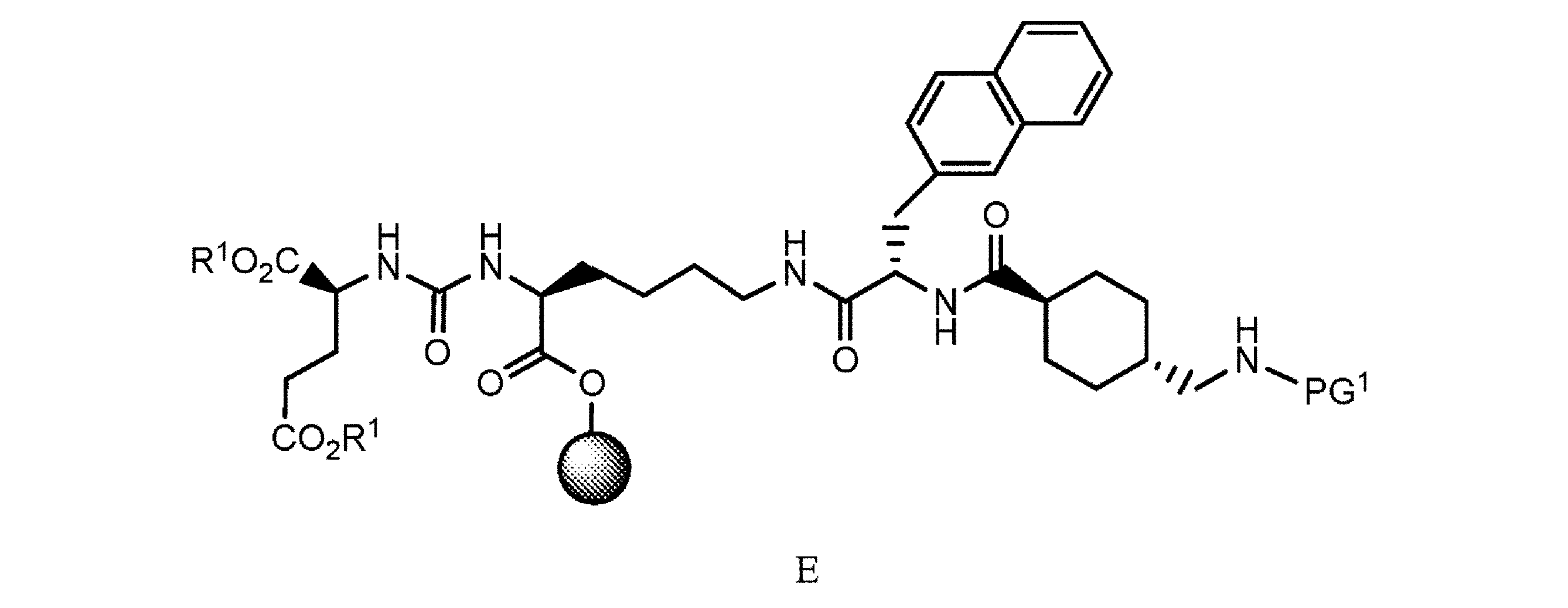
f. 式D’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤及び塩基の存在下でPG1-トラネキサム酸と接触させて、式E
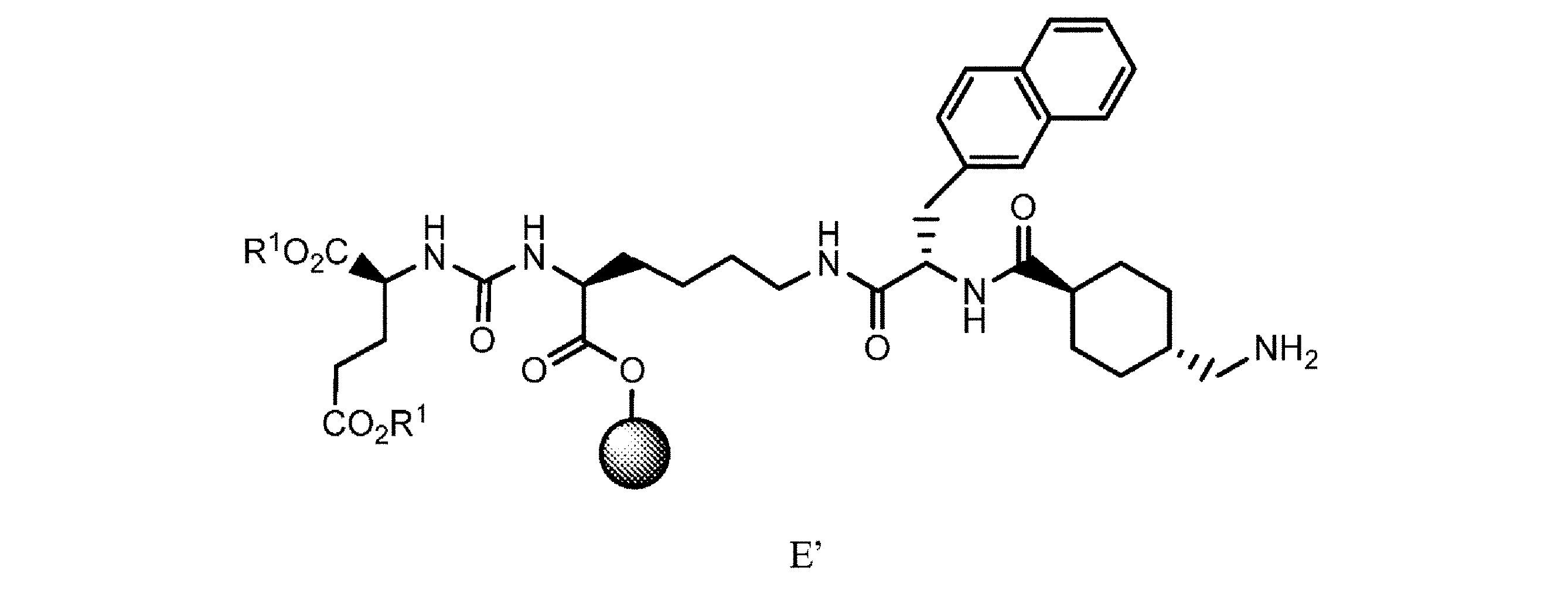
の樹脂系化合物を提供すること、又は
g. 式Eの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式E’
の樹脂系化合物を提供すること、又は
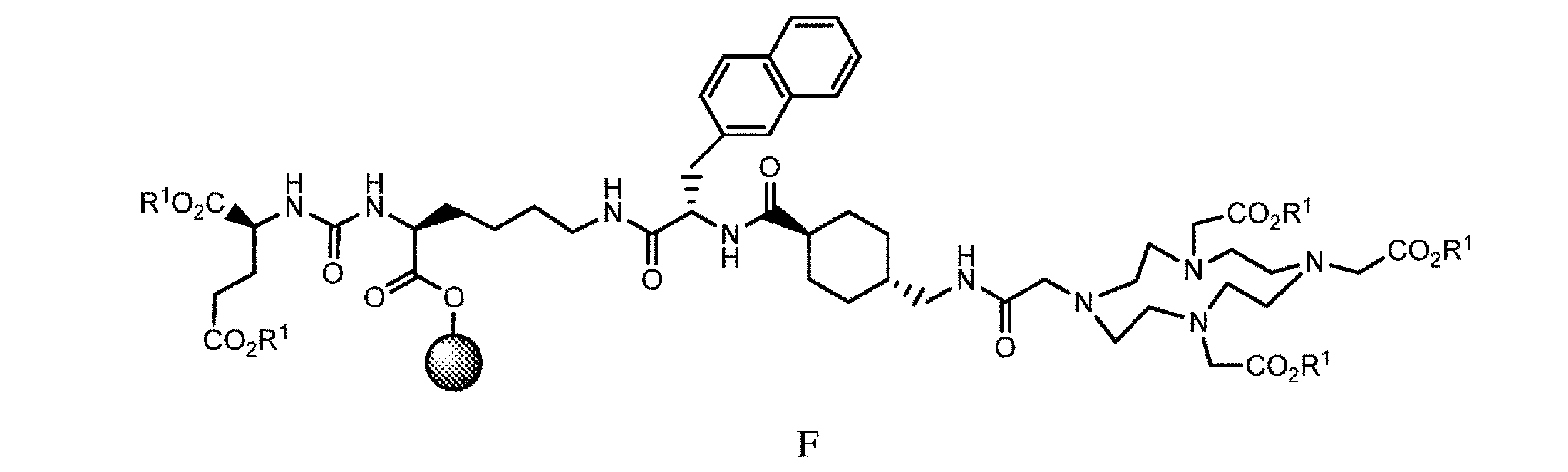
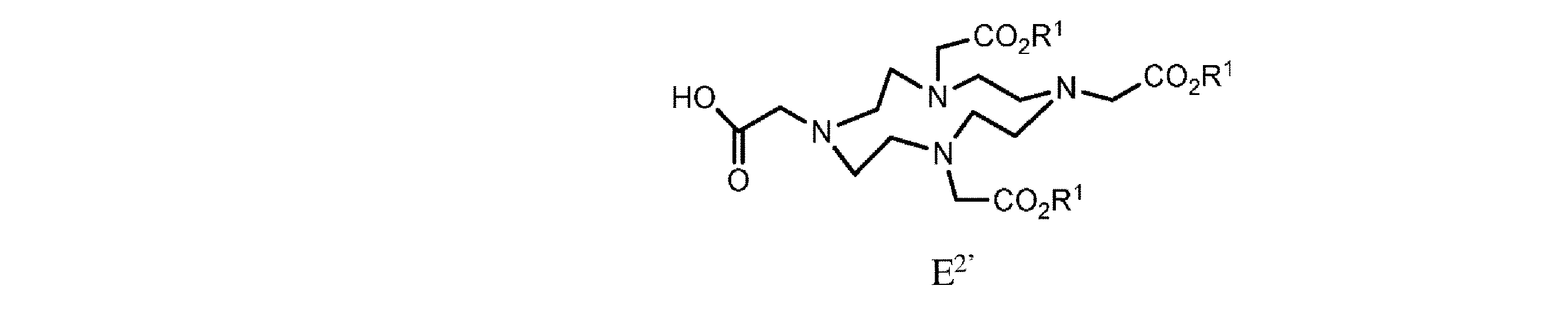
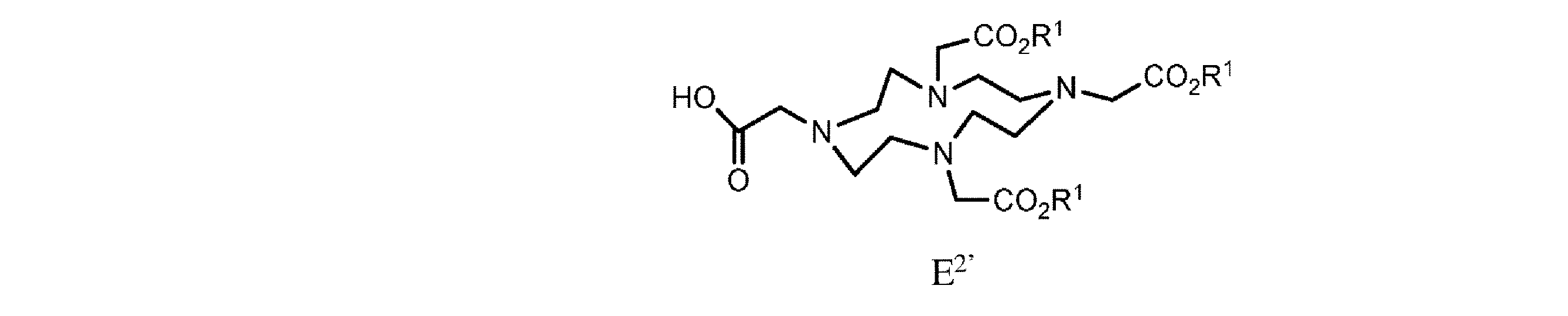
h. 式E’の樹脂系化合物を、式E2’
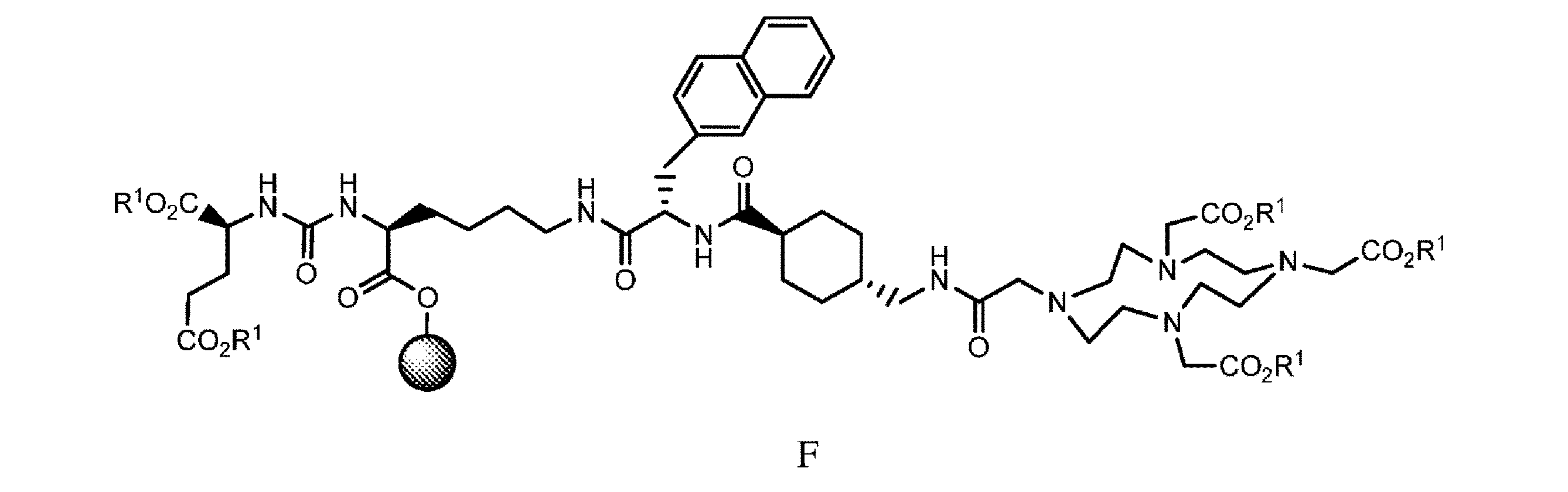
の化合物と、極性非プロトン性溶媒、カップリング剤、及び塩基の存在下で接触させて、式F
の樹脂系化合物を提供すること、又は
i. 式Fの樹脂系化合物を、有機溶媒中で第3の脱保護剤及び/又は切断試薬と接触させることを含み、
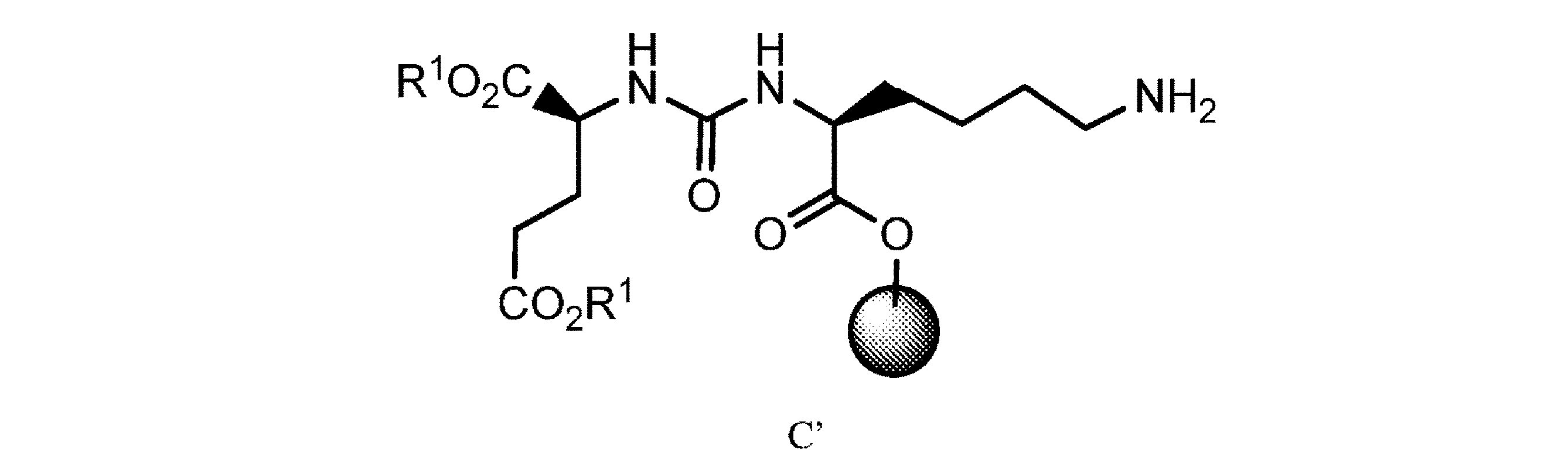
式中、PG1及びPG2は、アミン保護基であり、LGは、離脱基であり、R1は、C1~C4アルキル又はシクロヘキシルである、方法。
の化合物の調製方法であって、以下
a. 式I
の樹脂系化合物を、溶媒の存在下で第1の脱保護剤と接触させて、式2
の樹脂系化合物を提供すること、又は
b. 式2の樹脂系化合物を、式3
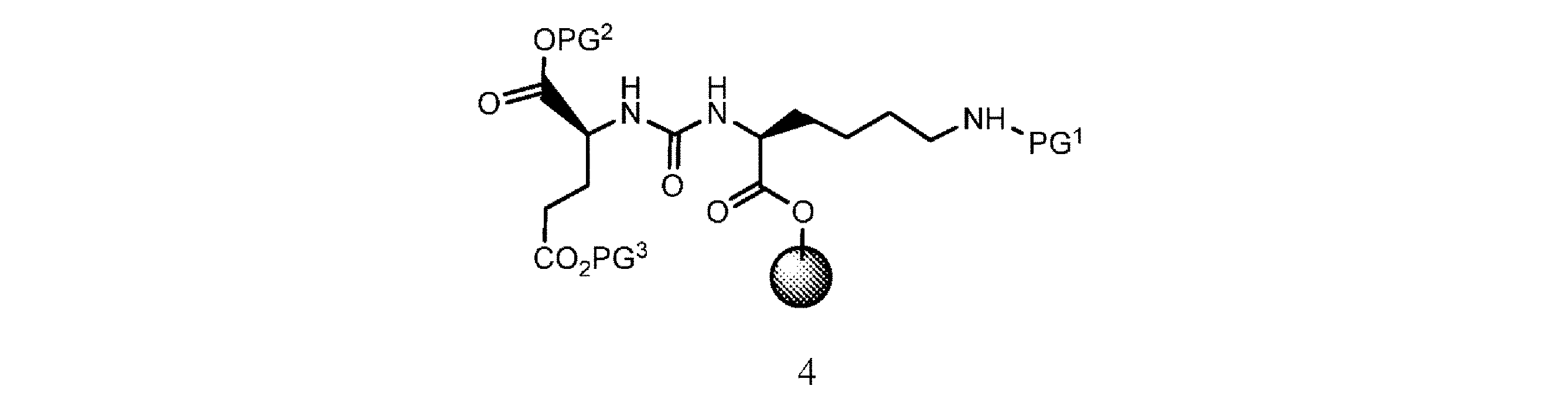
の化合物と有機溶媒及び塩基の存在下で接触させて、式4
の樹脂系化合物を提供すること、又は
c. 式4の樹脂系化合物を、有機溶媒の存在下で第2の脱保護剤と接触させて、式5
の樹脂系化合物を提供すること、又は
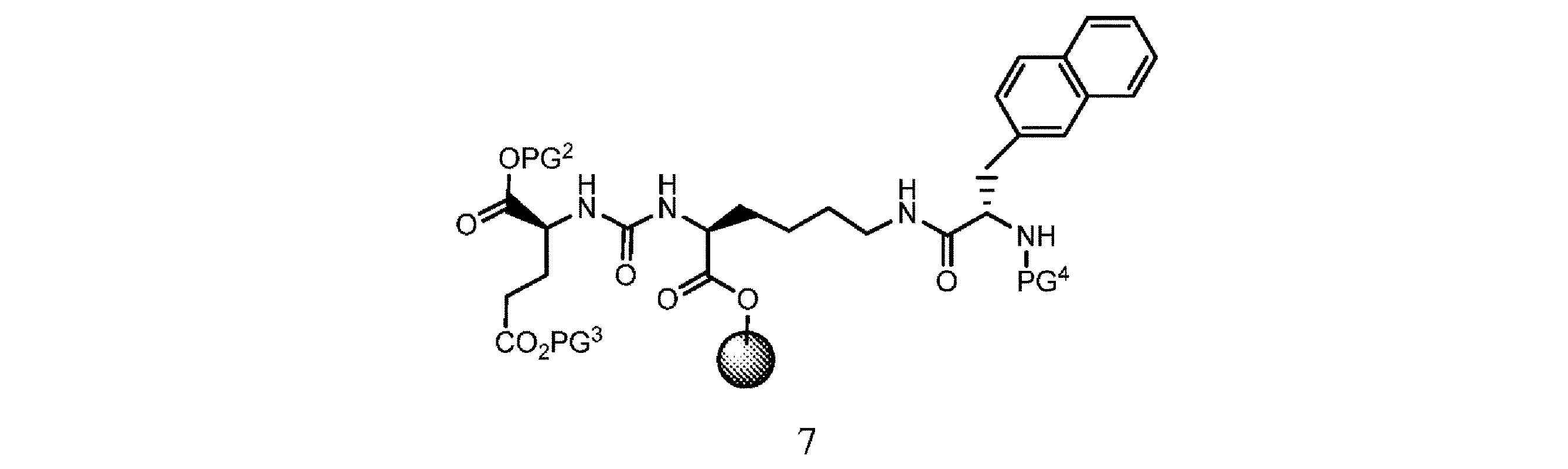
d. 式5の樹脂系化合物を、式6
の化合物と、溶媒、カップリング剤、並びに場合により塩基及び/又は添加剤の存在下で接触させて、式7
の樹脂系化合物を提供すること、又は
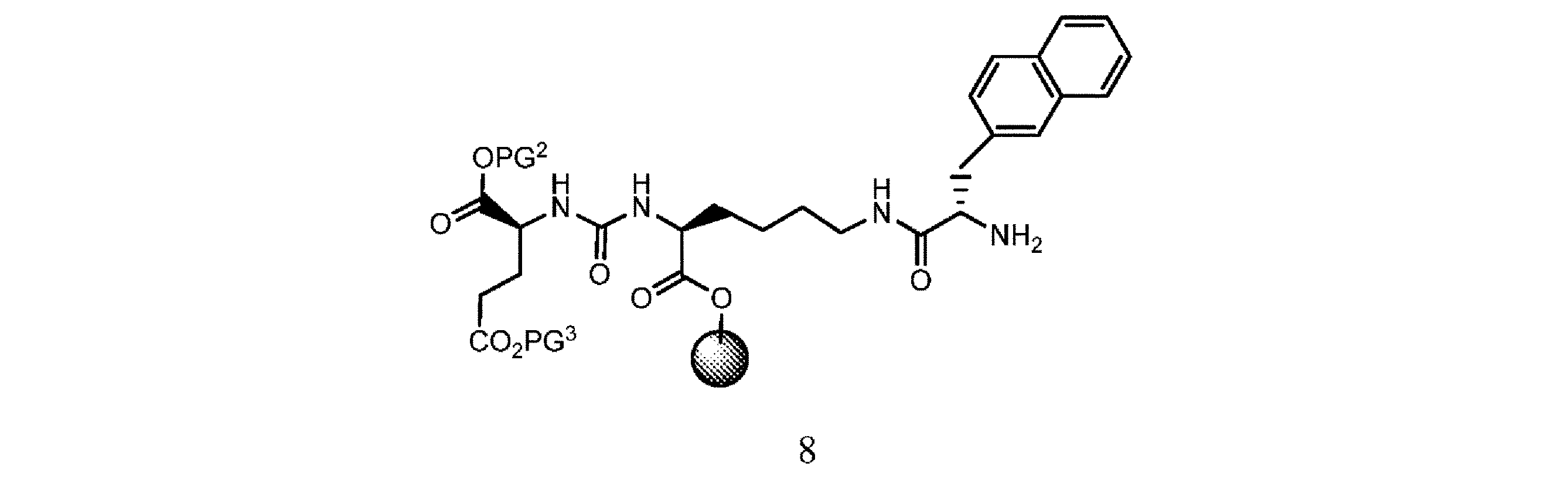
e. 式7の樹脂系化合物を、溶媒の存在下で第3の脱保護剤と接触させて、式8
の樹脂系化合物を提供すること、又は
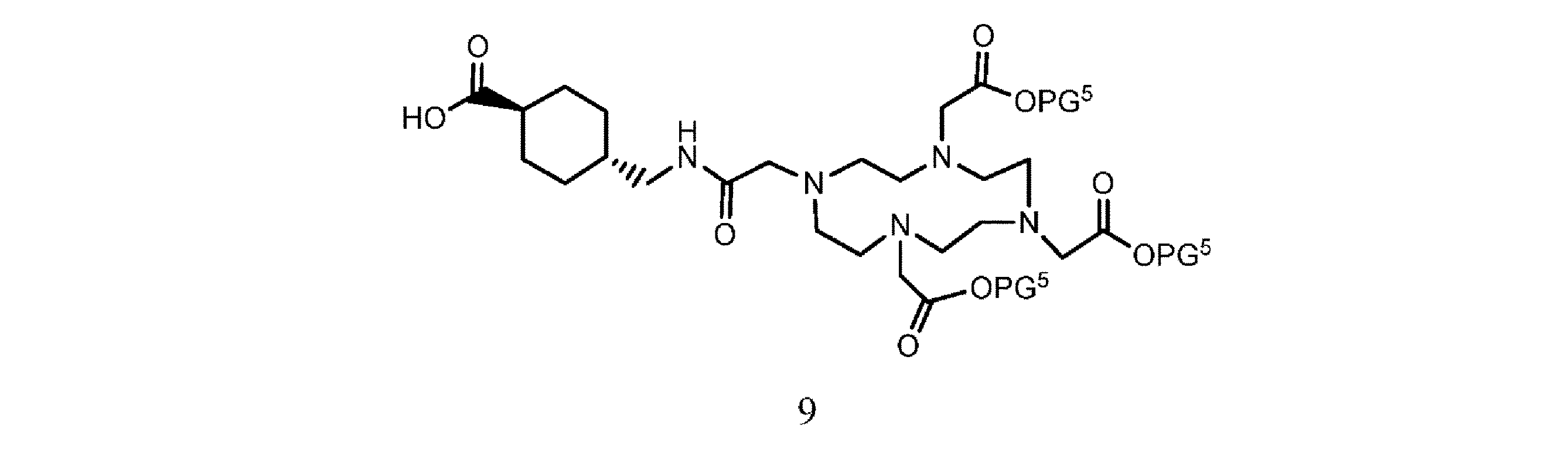
f. 式8の樹脂系化合物を、式9
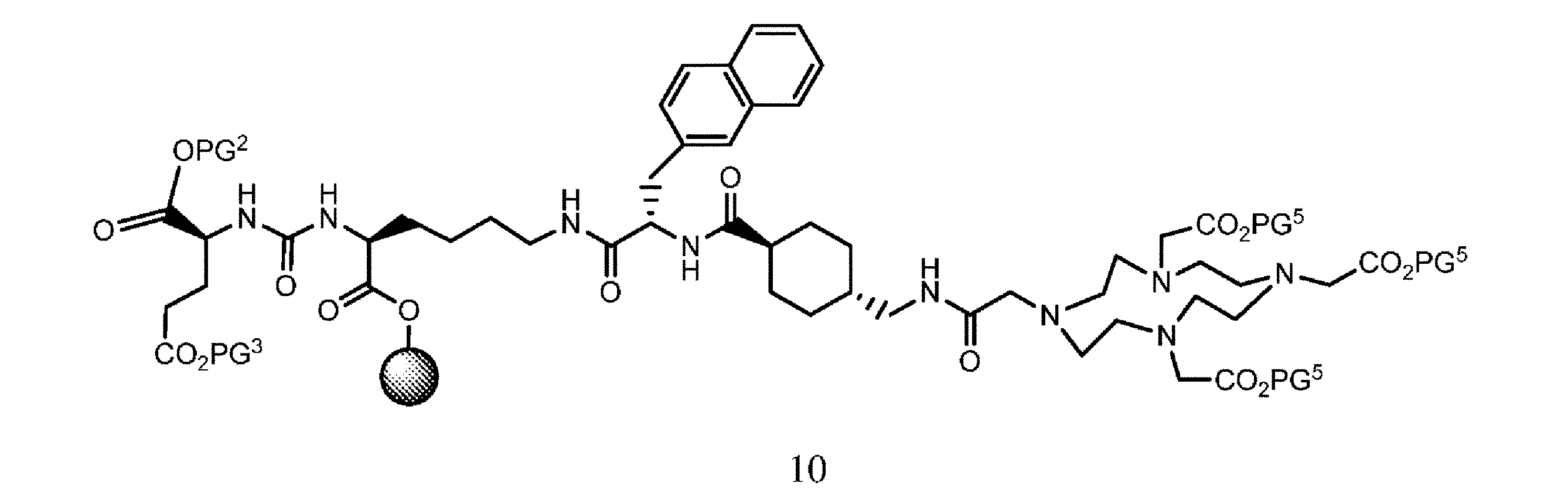
の化合物と、溶媒、カップリング剤、並びに場合により塩基及び/又は添加剤の存在下で接触させて、式10
の樹脂系化合物を提供すること、又は
g. 式10の樹脂系化合物を、有機溶媒の存在下で少なくとも1つの第3の脱保護剤及び/又は切断試薬と接触させて、式Iの化合物を提供すること
のうちの1つ以上を含み、
式中、PG、PG1及びPG4は、アミン保護基であり、PG2、PG3、及びPG5は、カルボニル保護基であり、化合物CのLGは、離脱基である、方法。
(式中、化合物6’のLGは、脱離基である)の活性化化合物を含む混合物を形成する、条項52~94のいずれか1項に記載の方法。
(式中、化合物6’のLGは、脱離基である)の活性化化合物のインサイチュ形成の前に、又はそれと同時に、式5の樹脂系化合物の化合物、式6の化合物、溶媒、カップリング剤、並びに場合により塩基及び/又は添加剤を、一緒に接触させる、条項52~94のいずれか1項に記載の方法。
(式中、化合物9’のLGは、脱離基である)の活性化化合物を含む混合物を形成する、前項のいずれか1項に記載の方法。
(式中、化合物9’のLGは、脱離基である)の活性化化合物のインサイチュ形成の前に、又はそれと同時に、式8の樹脂系化合物、式9の化合物、溶媒、カップリング剤、並びに場合により塩基及び/又は添加剤を一緒に接触させる、条項52~98のいずれか1項に記載の方法。
本明細書で使用される場合、用語「アルキル」は、場合により分岐し、1~4個の炭素原子などを含有する炭素原子の鎖を含み、「低級アルキル」と呼ばれ得る。例示的なアルキル基としては、メチル、エチル、n-プロピル、イソプロピル、n-ブチル、イソブチル、sec-ブチル、及びtert-ブチルが挙げられるが、これらに限定されない。
方法1:
いくつかの実施形態において、本開示は、式I
の化合物を調製するための方法を提供し、該方法は、
a. 式A
の樹脂系化合物を、第1の脱保護剤と極性非プロトン性溶媒中で接触させて、式A’
の樹脂系化合物を提供すること、又は
b. 式A’の樹脂系化合物を、式B
の化合物と、有機溶媒及び塩基の存在下で接触させて
、式Cの樹脂系化合物を提供すること、又は、
c. 式Cの樹脂系化合物を、有機溶媒の存在下で第2の脱保護剤と接触させて、式C’
の樹脂系化合物を提供すること、又は
d. 式C’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤、及び塩基の存在下でPG1-3-(2-ナフチル)-L-アラニンと接触させて、式D
の樹脂系化合物を提供すること、又は
e. 式Dの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式D’
の樹脂系化合物を提供すること、又は
f. 式D’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤、及び塩基の存在下でPG1-トラネキサム酸と接触させて、式E
の樹脂系化合物を提供すること、又は
g. 式Eの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式E’
の樹脂系化合物を提供すること、又は
h. 式E’の樹脂系化合物を、式E2’
の化合物と、極性非プロトン性溶媒、カップリング剤、及び塩基の存在下で接触させて、式F
の樹脂系化合物を提供すること、又は
i. 式Fの樹脂系化合物を、有機溶媒中で第3の脱保護剤及び/又は切断試薬と接触させること
を含み、
式中、PG1及びPG2は、アミン保護基であり、LGは、離脱基であり、R1は、C1~C4アルキル又はシクロヘキシルである。
代替的に、いくつかの実施形態では、本開示は、式1
の化合物を調製するための方法を提供し、該方法は、以下
a. 式1
の樹脂系化合物を、溶媒の存在下で第1の脱保護剤と接触させて、式2
の樹脂系化合物を提供すること、又は
b. 式2の樹脂系化合物を、式3
の化合物と、有機溶媒及び塩基の存在下で接触させて、式4
の樹脂系化合物を提供すること、又は
c. 式4の樹脂系化合物を、有機溶媒の存在下で第2の脱保護剤と接触させて、式5
の樹脂系化合物を提供すること、又は
d. 式5の樹脂系化合物を、式6
の化合物と、溶媒、カップリング剤、並びに場合により塩基及び/又は添加剤の存在下で接触させて、式7
の樹脂系化合物を提供すること、又は
e. 式7の樹脂系化合物を、溶媒の存在下で第3の脱保護剤と接触させて、式8
の樹脂系化合物を提供すること、又は
f. 式8の樹脂系化合物を、式9
の化合物と、溶媒、カップリング剤、並びに場合により塩基及び/又は添加剤の存在下で接触させて、式10
の樹脂系化合物を提供すること、又は
g. 式10の樹脂系化合物を、有機溶媒の存在下で少なくとも1つの第3の脱保護剤及び/又は切断試薬と接触させて、式Iの化合物を提供すること
のうちの1つ以上を含み、
式中、PG、PG1及びPG4は、アミン保護基であり、PG2、PG3、及びPG5は、カルボキシル保護基であり、化合物CのLGは、離脱基である。
は、9-フルオレニルメチル-カルボニル(Fmoc)又はt-ブチルカルボニル(Boc)などの保護基であってもよい。PG1の選択については、上記の方法1の工程(a)を参照されたい。方法1の工程(d)において、極性非プロトン性溶媒は、当技術分野で一般に知られている任意の極性非プロトン性溶媒であり得る。適切な極性非プロトン性溶媒としては、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)が挙げられるが、これらに限定されない。いくつかの実施形態では、極性非プロトン性溶媒は、DMFである。適切な塩基としては、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンが挙げられるが、これらに限定されない。いくつかの実施形態では、方法1の工程(d)における塩基は、N,N-ジイソプロピルエチルアミン(iPr2NEt)である。カップリング剤は、樹脂ベースの合成のために当技術分野で一般に知られている任意のカップリング剤であり得る。適切なカップリング剤としては、HATU、TBTU、HBTU、CDMT、HDMC、COMU、TATU、TOTT、T3P、DMTMMが挙げられるが、これらに限定されない。いくつかの実施形態では、方法1の工程(d)におけるカップリング剤は、(PyBOP)である。方法1の工程(d)は、室温、冷却下、又は加温条件下など、固相合成で一般に使用される任意の温度で行うことができることが認識されるであろう。方法1のカップリング工程(d)は、約5分~約200分、又は約10分~約100分、又は約40分~約60分~約15分、又は約30分、又は約90分などの期間、行うことができる。方法1のカップリング工程(d)に続いて、方法1の工程(d)で製造された式Dの樹脂系化合物を、DMF、IPA、CH2Cl2などの当技術分野で一般に知られている試薬で洗浄することができる。
9-フルオレニルメチル-カルボニル(Fmoc)又はt-ブチルカルボニル(Boc)などの保護基であってもよい。PG1の選択については、上記の方法1の工程(a)を参照されたい。方法1の工程(f)において、極性非プロトン性溶媒は、当技術分野で一般に知られている任意の極性非プロトン性溶媒であり得る。適切な極性非プロトン性溶媒としては、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)が挙げられるが、これらに限定されない。いくつかの実施形態では、極性非プロトン性溶媒は、DMFである。適切な塩基としては、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンが挙げられるが、これらに限定されない。いくつかの実施形態では、方法1の工程(f)における塩基は、N,N-ジイソプロピルエチルアミン(iPr2NEt)である。カップリング剤は、樹脂ベースの合成のために当技術分野で一般に知られている任意のカップリング剤であり得る。適切なカップリング剤としては、HATU、TBTU、HBTU、CDMT、HDMC、COMU、TATU、TOTT、T3P、DMTMMが挙げられるが、これらに限定されない。いくつかの実施形態では、方法1の工程(f)におけるカップリング剤は、(PyBOP)である。方法1の工程(f)は、室温、冷却下、又は加温条件下など、固相合成で一般に使用される任意の温度で行うことができることが認識されるであろう。方法1のカップリング工程(f)は、約5分~約200分、又は約10分~約100分、又は約40分~約60分~約15分、又は約30分、又は約90分などの期間、行うことができる。方法1のカップリング工程(f)に続いて、方法1の工程(f)で製造された式Eの樹脂系化合物を、DMF、IPA、CH2Cl2などの当技術分野で一般に知られている試薬で洗浄することができる。
本明細書に記載の実施例は、当業者に知られている以下の略語によって記載されるものを含むがそれらに限定されない材料を使用する:
化合物AB2は、以下の合成スキームに従って調製した:
403mgの4-ニトロフェニルクロロホルメート(2.0mmol、0.95当量)を、丸底フラスコ内の21mLのジクロロメタン(CH2Cl2)中の621mgのL-グルタミン酸ジ-tert-ブチルエステル塩酸塩(2.1mmol、1.0当量)の撹拌溶液にアルゴン下で加えた。この溶液を0℃に冷却した後、5mLのCH2Cl2中の0.730mLのジイソプロピルエチルアミン(iPr2NEt)(4.2ミリモル、2.0当量)の溶液を、均圧添加漏斗を用いて滴加した。iPr2NEtの添加が完了した後、反応混合物を30分間撹拌し、室温に温め、さらに30分間撹拌した。次いで、反応混合物を蒸発させて、粗生成物を油状残留物として得た。この残留物をさらに精製することなく使用し、所望するまで高真空下に保持した。
反応容器に0.891gの4-ニトロフェニルクロロホルメート(4.42mmol)及び15mLのジクロロメタン(CH2Cl2)を入れ、アルゴンでパージした。反応容器に温度プローブを取り付け、IPA/氷浴を用いて溶液を-10℃以下に冷却した。別のフラスコ内で、1.44gのL-グルタミン酸ジ-tert-ブチルエステル塩酸塩(4.87mmol)を15mLのジクロロメタン(CH2Cl2)に溶解し、続いて1.54mLのジイソプロピルエチルアミン(iPr2NEt)(8.84mmol)を加えた。L-グルタミン酸ジ-tert-ブチルエステル塩酸塩溶液を、-11℃~-5℃の温度を維持しながら、冷却した4-ニトロフェニルクロロホルメート溶液に滴下した。添加が完了した後、氷浴を除去し、反応混合物を室温で4時間撹拌し、このとき、UPLC/MSを使用して反応が完了したことを示した。反応混合物をさらに精製することなく使用した。
式Iの化合物は、Fmoc-Lys(N-4-メトキシトリチル)-2-クロロトリチル-樹脂から出発して、SPPSによって調製した。式Iの化合物を、以下の合成スキームに従って調製した:
合成方法に使用する前に、ペプチド合成容器にFmoc-Lys(Mtt)-Wang樹脂(樹脂充填量=0.54mmol/g)2.00g(1.08mmol)を入れた。樹脂を20mLのジメチルホルムアミド(DMF)で5分間洗浄し、次いで容器から液を排出した。洗浄工程をさらに1回繰り返した。
ペプチド合成容器に溶解素樹脂を加えた。Fmoc脱保護のためのDMF(約20mL)中の20%ピペリジンの溶液を加えた。アルゴンを溶液に15分間通気し、次いで排出した。DMF(約20mL)中の20%ピペリジンを加え、通気を5分間続けた後、排出した(2回繰り返した)。樹脂をDMF(約20mL×3)で洗浄し、続いてIPA(約20mL×3)で洗浄し、最後にCH2Cl2(約20mL×3)で洗浄した。AB2の粗残留物を60mLのCH2Cl2に溶解し、容積の半分を脱保護リジン樹脂に加え、続いてiPr2NEtを加えた。アルゴンを溶液に45分間通気し、次いで排出した。残りの粗AB2溶液、続いてiPr2NEtを樹脂に加え、アルゴンを溶液にさらに30分間通気した。次いで、反応容器を排出し、樹脂をCH2Cl2(約20mL×3)で洗浄した後、IPA(約20mL×3)及び再びCH2Cl2(約20mL×3)で洗浄した。
ペプチド合成容器に溶解素樹脂を加えた。実施例1bからのAB2反応混合物を、0.188mLのiPr2NEt(1.08ミリモル)とともに樹脂に加えた。反応混合物を一晩(約18時間)撹拌した。樹脂をCH2Cl2(約20mL×3)で洗浄した。
CH2Cl2(約20mL)中の2% TFAを加え、アルゴンを5分間溶液に通気した。少量のCH2Cl2を反応容器に加えて、通気が激しい場合に同量を維持した。次いで、黄色溶液を排出し、5回繰り返した。濾液が透明のままになるまで、樹脂を新鮮なCH2Cl2で洗浄した。CH2Cl2中のTFAの2%溶液をもう一度加えた。溶液が透明なままであれば、反応混合物を排出し、次のカップリング工程を行った。溶液が黄色に変わった場合、樹脂を透明になるまで新鮮なCH2Cl2で洗浄し、透明な反応溶液が得られるまでこのプロセスを繰り返した。樹脂をDMF(約20mL×3)で洗浄した。
112mLのCH2Cl2、32mLの2,2,2-トリフルオロエタノール(TFE)、及び16mLの酢酸(AcOH)の溶液を調製した。20mLのAcOH-TFE溶液を、ペプチド合成容器内の樹脂に加えた。この混合物を約1時間撹拌し、液をペプチド合成容器から排出した。この手順をさらに1回繰り返した。20mLのAcOH-TFE溶液をペプチド合成容器内の樹脂に加え、この混合物を一晩撹拌した。液をペプチド合成容器から排出した。20mLのAcOH-TFE溶液をペプチド合成容器内の樹脂に加え、この混合物を約1時間撹拌した。液をペプチド合成容器から排出した。この手順をさらに1回繰り返した。樹脂を3×CH2Cl2、3×2-プロパノール(IPA)、及び3×DMFで洗浄した。
アミノ酸のDMF(約20mL)溶液、iPr2NEt及びPyBOPをペプチド合成容器に加えた。アルゴンを溶液に1時間通気し、次いで排出した。樹脂をDMF(約20mL×3)、続いてIPA(約20mL×3)及び再びDMF(約20mL×3)で洗浄した。
アミノ酸のDMF(約20mL)溶液、DMF(約20mL)中のPyBOP、及びiPr2NEtを、樹脂を収容するペプチド合成容器に加えた。この混合物を約4時間撹拌し、次いで液をペプチド合成容器から排出した。樹脂をDMF(約20mL×3)、続いてIPA(約20mL×3)で洗浄した。
脱保護工程は、各アミノ酸カップリング工程の前に行った(CH2Cl2中2% TFAを使用したMtt脱保護に加えて)。Fmoc脱保護のためのDMF(約20mL)中の20%ピペリジンの溶液を加えた。アルゴンを溶液に15分間通気し、次いで排出した。DMF(約20mL)中の20%ピペリジンを加え、通気を5分間続けた後、排出した(2×)。樹脂をDMF(約20mL×3)、続いてIPA(約20mL×3)及び再びDMF(約20mL×3)で洗浄した。
代替的な脱保護工程は、各アミノ酸カップリング工程の前に行った(Mtt脱保護に加えて)。樹脂に、DMF(約20mL)中の20%ピペリジンの溶液を加えた。反応物を約10分間撹拌した。液を反応容器から排出し、このプロセスをさらに2回繰り返した。樹脂をDMF(約20mL×3)、続いてIPA(約20mL×3)で洗浄した。場合によっては、樹脂をDMF(約20mL×3)又は代替的にCH2Cl2(約20mL×3)でさらに洗浄した。
樹脂をCH2Cl2(約20mL×3)で洗浄し、排出した。25mLの切断試薬(95% TFA、2.5% H20、2.5%トリイソプロピルシラン)をペプチド合成容器に加え、アルゴンを1時間通気し、排出し、新鮮な切断試薬(10mL、15分間)で2回繰り返した。濾液をアルゴン下、室温で一晩撹拌した。反応混合物を10mlが残るまで減圧下で濃縮した。生成物を40mLのジエチルエーテル中で粉砕し、遠心分離した。得られたペレットから溶液をデカントした。ペレットを50mLのジエチルエーテルに再懸濁し、遠心分離することによって、前の工程を2回繰り返した。ペレットをアルゴン流上で乾燥し、次いで高真空で乾燥した。
42mLのトリフルオロ酢酸(TFA)、0.90mLの水、及び3.0mLのトリイソプロピルシラン(TIPS)の混合物を調製し、ペプチド合成容器内の樹脂に加えた。この混合物を6時間撹拌した(最後の1時間は、水浴で30℃に温めた)。樹脂を濾過し、固体を2mLのTFAで洗浄した。濾液及び洗浄液を含む生成物を合わせた。氷水浴中で冷却した420mLのメチル-t-ブチルエーテル(MTBE)で洗浄した。固体生成物を濾過により集めた。固体を5mLのMTBEで洗浄した。固体を真空下で乾燥して、1.19gの式Iの粗化合物を提供した。
得られた粉末を少量のDMSOに溶解し、C18カラムにロードした。所望の生成物を逆相クロマトグラフィー(50mM炭酸アンモニウム緩衝液中0~55%アセトニトリル、pH7.0)により精製した。アセトニトリルを減圧下で蒸発させ、残った水性緩衝溶液を凍結させ、凍結乾燥によって除去した。256mg(49.2%)の所望の生成物を白色粉末として回収した。
式Iの化合物を、移動相A=水中0.1% TFA及び移動相B=アセトニトリル(ACN)(流速=45mL/分、1CV=90mL、275nmでの収集波長)を有するBiotage 60g C18 ULTRAカラムを使用して精製した。3mLのACNを含む20mLの水中0.1% TFA中の粗PSMA-617をカラムにロードする。精製を1CV 15% B、7CV 15%B~25%Bで行い、25% Bに保持した。生成物ピークは約5CVで溶出し始め、画分を集めた。UPLC-MSを用いて画分を調べ、許容可能な生成物画分(275nmで≧98%)を合わせ、生成物溶液をロータリーエバポレーターを使用して濃縮してACNを除去した(最終容積=59mL)。式Iの化合物を、Biotage 30g C18 ULTRAカラムを使用して脱塩し、このカラムは移動相A=水中0.1% AcOH及び移動相B=ACN(流速=25mL/分、1CV=45mL、275nmでの収集波長)でセットアップした。水性PSMA-617(59mL)に、0.28gの酢酸アンモニウム、0.36mLのAcOH、及び3mLのACNを加えた。PSMA-617溶液をカラムにロードし、カラムを5CV 5% Bで洗浄した。生成物を3CV 39% Bを用いてカラムから溶出した。生成物ピークは6CVで溶出し、1画分を回収した。生成物溶液をロータリーエバポレーターを使用して濃縮して、ACNを除去した。固体を凍結乾燥によって単離して、0.675gの式Iの化合物を提供した。
1H NMR(D6-DMSO):8.03(t、1H)、7.88(t、1H)、7.84(d、1H)、7.69-7.80(m、2H)、7.69(s、1H)、7.43-7.47(m、2H)、7.39(dd、1H)、6.29-6.33(m、2H)、4.50-4.52(m、1H)、4.08-4.11(m、1H)、3.99-4.02(m、1H)、3.46(br s、6H)、3.13(br s、2H)、3.10(d、1H)、2.89-3.04(m、17H)、2.68(s、4H)、2.22-2.27(m、2H)、2.07(s、1H)、1.91(s,1H),1.57~1.74(m,5H),1.46~1.50(m,2H),1.31~1.35(m,3H),1.22~1.26(m,3H),1.06~1.12(m,1H),0.80~0.82(m,2H)。
本発明は次の実施態様を含む。
[請求項1]
式I
a)式A
b)式A’の樹脂系化合物を、式B
c)式Cの樹脂系化合物を、有機溶媒の存在下で第2の脱保護剤と接触させて、式C’
d)式C’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤、及び塩基の存在下で、PG 1 -3-(2-ナフチル)-L-アラニンと接触させて、式D
e)式Dの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式D’
f)式D’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤及び塩基の存在下でPG 1 -トラネキサム酸と接触させて、式E
g)式Eの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式E’
h)式E’の樹脂系化合物を、式E 2’
i)式Fの前記樹脂系化合物を、有機溶媒中で第3の脱保護剤及び/又は切断試薬と接触させることを含み、
式中、PG 1 及びPG 2 は、アミン保護基であり、LGは、離脱基であり、R 1 は、C 1 ~C 4 アルキル又はシクロヘキシルである、方法。
[請求項2]
工程(a)の前記第1の脱保護剤が、ピペリジン、モルホリン、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU)、ジエチルアミン(DEA)、ジシクロヘキサミン、4-メチルピペリジン(4MP)、トリス(2-アミノエチル)アミン、ピリジン及びコリジンからなる群から選択される、請求項1に記載の方法。
[請求項3]
工程(a)の前記第1の脱保護剤がピペリジンである、請求項2に記載の方法。
[請求項4]
工程(a)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項3に記載の方法。
[請求項5]
工程(a)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項4に記載の方法。
[請求項6]
工程(b)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項1に記載の方法。
[請求項7]
前記工程(b)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)である、請求項6に記載の方法。
[請求項8]
工程(b)の前記有機溶媒が、CH 2 Cl 2 、THF、ジエチルエーテル、MeOH、EtOH、アセトン、アセトニトリルからなる群から選択される、請求項7に記載の方法。
[請求項9]
工程(b)の前記有機溶媒がCH 2 Cl 2 である、請求項8に記載の方法。
[請求項10]
工程(c)の前記第2の脱保護剤が、トリフルオロ酢酸(TFA)、酢酸、トリフルオロエタノール、ジクロロメタン、ヘキサフルオロイソプロパノール、ジクロロメタン、及びこれらの組み合わせからなる群から選択される、請求項1に記載の方法。
[請求項11]
工程(c)の前記第2の脱保護剤が、トリフルオロ酢酸(TFA)、又は酢酸とトリフルオロエタノールとの混合物である、請求項10に記載の方法。
[請求項12]
工程(c)の前記有機溶媒が、CH 2 Cl 2 、THF、ジエチルエーテル、MeOH、EtOH、アセトン、アセトニトリルからなる群から選択される、請求項11に記載の方法。
[請求項13]
工程(c)の前記有機溶媒がCH 2 Cl 2 である、請求項12に記載の方法。
[請求項14]
工程(d)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項1に記載の方法。
[請求項15]
工程(d)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項14に記載の方法。
[請求項16]
工程(d)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項15に記載の方法。
[請求項17]
工程(d)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)である、請求項16に記載の方法。
[請求項18]
工程(d)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)、1-[ビス(ジメチルアミノ)メチレン]-1H-1,2,3-トリアゾロ[4,5-b]ピリジニウム3-オキシドヘキサフルオロホスフェート(HATU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムテトラフルオロボレート(TBTU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)、N-[(5-クロロ-3-オキシド-1H-ベンゾトリアゾール-1-イル)-4-モルホリニルメチレン]-N-メチルメタンアミニウムヘキサフルオロホスフェート(HDMC)、1-シアノ-2-エトキシ-2-オキソエチリデンアミノオキシ)ジメチルアミノ-モルホリノ-カルベニウムヘキサフルオロホスフェート(COMU)、ジメチルアミノ(トリアゾロ[4,5-b]ピリジン-3-イルオキシ)メチリデン]-ジメチルアザニウム;テトラフルオロボレート(TATU)、N,N,N’,N’-テトラメチル-S-(1-オキシド-2-ピリジル)チオウロニウムテトラフルオロボレート(TOTT)、N-エトキシカルボニル-2-エトキシ-1,2-ジヒドロキノリン(EEDQ)、1-プロパンホスホン酸無水物(T3P)、及び4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチル-モルホリニウムクロリド(DMTMM)からなる群から選択される。請求項17に記載の方法。
[請求項19]
工程(d)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)である、請求項18に記載の方法。
[請求項20]
工程(e)の前記第1の脱保護剤が、ピペリジン、モルホリン、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU)、ジエチルアミン(DEA)、ジシクロヘキサミン、4-メチルピペリジン(4MP)、トリス(2-アミノエチル)アミン、ピリジン及びコリジンからなる群から選択される、請求項1に記載の方法。
[請求項21]
工程(e)の前記第1の脱保護剤がピペリジンである、請求項20に記載の方法。
[請求項22]
工程(e)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項21に記載の方法。
[請求項23]
工程(e)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項22に記載の方法。
[請求項24]
工程(f)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項1に記載の方法。
[請求項25]
工程(f)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項24に記載の方法。
[請求項26]
工程(f)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項25に記載の方法。
[請求項27]
工程(f)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)である、請求項26に記載の方法。
[請求項28]
工程(f)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)、1-[ビス(ジメチルアミノ)メチレン]-1H-1,2,3-トリアゾロ[4,5-b]ピリジニウム3-オキシドヘキサフルオロホスフェート(HATU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムテトラフルオロボレート(TBTU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)、N-[(5-クロロ-3-オキシド-1H-ベンゾトリアゾール-1-イル)-4-モルホリニルメチレン]-N-メチルメタンアミニウムヘキサフルオロホスフェート(HDMC)、1-シアノ-2-エトキシ-2-オキソエチリデンアミノオキシ)ジメチルアミノ-モルホリノ-カルベニウムヘキサフルオロホスフェート(COMU)、ジメチルアミノ(トリアゾロ[4,5-b]ピリジン-3-イルオキシ)メチリデン]-ジメチルアザニウム;テトラフルオロボレート(TATU)、N,N,N’,N’-テトラメチル-S-(1-オキシド-2-ピリジル)チオウロニウムテトラフルオロボレート(TOTT)、N-エトキシカルボニル-2-エトキシ-1,2-ジヒドロキノリン(EEDQ)、1-プロパンホスホン酸無水物(T3P)、及び4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチル-モルホリニウムクロリド(DMTMM)からなる群から選択される、請求項27に記載の方法。
[請求項29]
工程(f)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)である、請求項28に記載の方法。
[請求項30]
工程(g)の前記第1の脱保護剤が、ピペリジン、モルホリン、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU)、ジエチルアミン(DEA)、ジシクロヘキサミン、4-メチルピペリジン(4MP)、トリス(2-アミノエチル)アミン、ピリジン及びコリジンからなる群から選択される、請求項1に記載の方法。
[請求項31]
工程(g)の前記第1の脱保護剤がピペリジンである、請求項30に記載の方法。
[請求項32]
工程(g)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項31に記載の方法。
[請求項33]
工程(g)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項32に記載の方法。
[請求項34]
工程(h)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項1に記載の方法。
[請求項35]
工程(h)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項34に記載の方法。
[請求項36]
工程(h)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項35に記載の方法。
[請求項37]
工程(h)の前記塩基が、N,N-ジイソプロピルエチルアミン( i Pr 2 NEt)である、請求項36に記載の方法。
[請求項38]
工程(h)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)、1-[ビス(ジメチルアミノ)メチレン]-1H-1,2,3-トリアゾロ[4,5-b]ピリジニウム3-オキシドヘキサフルオロホスフェート(HATU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムテトラフルオロボレート(TBTU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)、N-[(5-クロロ-3-オキシド-1H-ベンゾトリアゾール-1-イル)-4-モルホリニルメチレン]-N-メチルメタンアミニウムヘキサフルオロホスフェート(HDMC)、1-シアノ-2-エトキシ-2-オキソエチリデンアミノオキシ)ジメチルアミノ-モルホリノ-カルベニウムヘキサフルオロホスフェート(COMU)、ジメチルアミノ(トリアゾロ[4,5-b]ピリジン-3-イルオキシ)メチリデン]-ジメチルアザニウム;テトラフルオロボレート(TATU)、N,N,N’,N’-テトラメチル-S-(1-オキシド-2-ピリジル)チオウロニウムテトラフルオロボレート(TOTT)、N-エトキシカルボニル-2-エトキシ-1,2-ジヒドロキノリン(EEDQ)、1-プロパンホスホン酸無水物(T3P)、及び4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチル-モルホリニウムクロリド(DMTMM)からなる群から選択される、請求項37に記載の方法。
[請求項39]
工程(h)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)である、請求項38に記載の方法。
[請求項40]
工程(i)の前記第3の脱保護剤が、トリフルオロ酢酸(TFA)、フッ化水素酸(HF)、トリフリック酸(TfOH)、トリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物、トリフルオロ酢酸(TFA)/ジクロロメタン(DCM)混合物、トリエチルサリン(TES)、インドール、フェノール/アニソール混合物、及びチオアニソールからなる群から選択される、請求項1に記載の方法。
[請求項41]
工程(i)の前記第3の脱保護剤が、トリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物である、請求項40に記載の方法。
[請求項42]
工程(i)の前記切断試薬が、トリフルオロ酢酸(TFA)又はトリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物である、請求項41に記載の方法。
[請求項43]
工程(i)の前記有機溶媒が、CH 2 Cl 2 、THF、ジエチルエーテル、MeOH、EtOH、アセトン、アセトニトリルからなる群から選択される、請求項42に記載の方法。
[請求項44]
工程(i)の前記切断試薬が、トリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物である、請求項43に記載の方法。
[請求項45]
工程(i)の前記有機溶媒がCH 2 Cl 2 である、請求項44に記載の方法。
[請求項46]
PG 1 が9-フルオレニルメチル-カルボニル(Fmoc)又はt-ブチルカルボニル(Boc)である、請求項1に記載の方法。
[請求項47]
PG 1 が9-フルオレニルメチル-カルボニル(Fmoc)である、請求項46に記載の方法。
[請求項48]
PG 2 がモノメトキシトリチル(MMt)又は4-メチルトリチル(Mtt)である、請求項1に記載の方法。
[請求項49]
PG 2 が4-メチルトリチル(Mtt)である、請求項47に記載の方法。
[請求項50]
LGが、
[請求項51]
R 1 がt-ブチルである、請求項1に記載の方法。
[請求項52]
式C
の樹脂系化合物。
[請求項53]
式C’
の樹脂系化合物。
[請求項54]
式D
の樹脂系化合物。
[請求項55]
式D’
の樹脂系化合物。
[請求項56]
式E
の樹脂系化合物。
[請求項57]
式E’
の樹脂系化合物。
[請求項58]
式F
の樹脂系化合物。
[請求項59]
PG 1 が9-フルオレニルメチル-カルボニル(Fmoc)又はt-ブチルカルボニル(Boc)である、請求項54又は56に記載の樹脂系化合物。
[請求項60]
PG 1 が9-フルオレニルメチル-カルボニル(Fmoc)である、請求項54、56、又は59のいずれか1項に記載の樹脂系化合物。
[請求項61]
PG 2 がモノメトキシトリチル(MMt)又は4-メチルトリチル(Mtt)である、請求項52に記載の樹脂系化合物。
[請求項62]
PG 2 が4-メチルトリチル(Mtt)である、請求項52又は61に記載の樹脂系化合物。
[請求項63]
R 1 がt-ブチルである、条項52~62のいずれか1項に記載の樹脂系化合物。
Claims (45)
- 式I
a)式A
b)式A’の樹脂系化合物を、式B
c)式Cの樹脂系化合物を、有機溶媒の存在下で第2の脱保護剤と接触させて、式C’
d)式C’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤、及び塩基の存在下で、PG1-3-(2-ナフチル)-L-アラニンと接触させて、式D
e)式Dの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式D’
f)式D’の樹脂系化合物を、極性非プロトン性溶媒、カップリング剤及び塩基の存在下でPG1-トラネキサム酸と接触させて、式E
g)式Eの樹脂系化合物を、極性非プロトン性溶媒中で第1の脱保護剤と接触させて、式E’
h)式E’の樹脂系化合物を、式E2’
i)式Fの前記樹脂系化合物を、有機溶媒中で第3の脱保護剤及び/又は切断試薬と接触させることを含み、
式中、PG1 は、9-フルオレニルメチル-カルボニル(Fmoc)であり、PG2は、4-メチルトリチル(Mtt)であり、LGは、4-ニトロフェノキシであり、R1は、C1~C4アルキル又はシクロヘキシルである、方法。 - 工程(a)の前記第1の脱保護剤が、ピペリジン、モルホリン、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU)、ジエチルアミン(DEA)、ジシクロヘキサミン、4-メチルピペリジン(4MP)、トリス(2-アミノエチル)アミン、ピリジン及びコリジンからなる群から選択される、請求項1に記載の方法。
- 工程(a)の前記第1の脱保護剤がピペリジンである、請求項2に記載の方法。
- 工程(a)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項3に記載の方法。
- 工程(a)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項4に記載の方法。
- 工程(b)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項1に記載の方法。
- 前記工程(b)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)である、請求項6に記載の方法。
- 工程(b)の前記有機溶媒が、CH2Cl2、THF、ジエチルエーテル、MeOH、EtOH、アセトン、アセトニトリルからなる群から選択される、請求項7に記載の方法。
- 工程(b)の前記有機溶媒がCH2Cl2である、請求項8に記載の方法。
- 工程(c)の前記第2の脱保護剤が、トリフルオロ酢酸(TFA)、酢酸、トリフルオロエタノール、ジクロロメタン、ヘキサフルオロイソプロパノール、ジクロロメタン、及びこれらの組み合わせからなる群から選択される、請求項1に記載の方法。
- 工程(c)の前記第2の脱保護剤が、トリフルオロ酢酸(TFA)、又は酢酸とトリフルオロエタノールとの混合物である、請求項10に記載の方法。
- 工程(c)の前記有機溶媒が、CH2Cl2、THF、ジエチルエーテル、MeOH、EtOH、アセトン、アセトニトリルからなる群から選択される、請求項11に記載の方法。
- 工程(c)の前記有機溶媒がCH2Cl2である、請求項12に記載の方法。
- 工程(d)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項1に記載の方法。
- 工程(d)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項14に記載の方法。
- 工程(d)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項15に記載の方法。
- 工程(d)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)である、請求項16に記載の方法。
- 工程(d)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)、1-[ビス(ジメチルアミノ)メチレン]-1H-1,2,3-トリアゾロ[4,5-b]ピリジニウム3-オキシドヘキサフルオロホスフェート(HATU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムテトラフルオロボレート(TBTU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)、N-[(5-クロロ-3-オキシド-1H-ベンゾトリアゾール-1-イル)-4-モルホリニルメチレン]-N-メチルメタンアミニウムヘキサフルオロホスフェート(HDMC)、1-シアノ-2-エトキシ-2-オキソエチリデンアミノオキシ)ジメチルアミノ-モルホリノ-カルベニウムヘキサフルオロホスフェート(COMU)、ジメチルアミノ(トリアゾロ[4,5-b]ピリジン-3-イルオキシ)メチリデン]-ジメチルアザニウム;テトラフルオロボレート(TATU)、N,N,N’,N’-テトラメチル-S-(1-オキシド-2-ピリジル)チオウロニウムテトラフルオロボレート(TOTT)、N-エトキシカルボニル-2-エトキシ-1,2-ジヒドロキノリン(EEDQ)、1-プロパンホスホン酸無水物(T3P)、及び4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチル-モルホリニウムクロリド(DMTMM)からなる群から選択される。請求項17に記載の方法。
- 工程(d)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)である、請求項18に記載の方法。
- 工程(e)の前記第1の脱保護剤が、ピペリジン、モルホリン、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU)、ジエチルアミン(DEA)、ジシクロヘキサミン、4-メチルピペリジン(4MP)、トリス(2-アミノエチル)アミン、ピリジン及びコリジンからなる群から選択される、請求項1に記載の方法。
- 工程(e)の前記第1の脱保護剤がピペリジンである、請求項20に記載の方法。
- 工程(e)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項21に記載の方法。
- 工程(e)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項22に記載の方法。
- 工程(f)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項1に記載の方法。
- 工程(f)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項24に記載の方法。
- 工程(f)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項25に記載の方法。
- 工程(f)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)である、請求項26に記載の方法。
- 工程(f)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)、1-[ビス(ジメチルアミノ)メチレン]-1H-1,2,3-トリアゾロ[4,5-b]ピリジニウム3-オキシドヘキサフルオロホスフェート(HATU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムテトラフルオロボレート(TBTU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)、N-[(5-クロロ-3-オキシド-1H-ベンゾトリアゾール-1-イル)-4-モルホリニルメチレン]-N-メチルメタンアミニウムヘキサフルオロホスフェート(HDMC)、1-シアノ-2-エトキシ-2-オキソエチリデンアミノオキシ)ジメチルアミノ-モルホリノ-カルベニウムヘキサフルオロホスフェート(COMU)、ジメチルアミノ(トリアゾロ[4,5-b]ピリジン-3-イルオキシ)メチリデン]-ジメチルアザニウム;テトラフルオロボレート(TATU)、N,N,N’,N’-テトラメチル-S-(1-オキシド-2-ピリジル)チオウロニウムテトラフルオロボレート(TOTT)、N-エトキシカルボニル-2-エトキシ-1,2-ジヒドロキノリン(EEDQ)、1-プロパンホスホン酸無水物(T3P)、及び4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチル-モルホリニウムクロリド(DMTMM)からなる群から選択される、請求項27に記載の方法。
- 工程(f)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)である、請求項28に記載の方法。
- 工程(g)の前記第1の脱保護剤が、ピペリジン、モルホリン、1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン(DBU)、ジエチルアミン(DEA)、ジシクロヘキサミン、4-メチルピペリジン(4MP)、トリス(2-アミノエチル)アミン、ピリジン及びコリジンからなる群から選択される、請求項1に記載の方法。
- 工程(g)の前記第1の脱保護剤がピペリジンである、請求項30に記載の方法。
- 工程(g)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項31に記載の方法。
- 工程(g)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項32に記載の方法。
- 工程(h)の前記極性非プロトン性溶媒が、ジメチルホルムアミド(DMF)、N-メチル-2-ピロリドン(NMP)、ジクロロメタン(DCM)、ジクロロメタン/ジメチルホルムアミド混合物、アセトニトリル(ACN)、アセトニトリル/ジメチルホルムアミド混合物、及びジメチルスルホキシド(DMSO)からなる群から選択される、請求項1に記載の方法。
- 工程(h)の前記極性非プロトン性溶媒がジメチルホルムアミド(DMF)である、請求項34に記載の方法。
- 工程(h)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)、トリエチルアミン(TEA)、4-メチルモルホリン(NMM)、イミダゾール、ピリジン、及びコリジンからなる群から選択される、請求項35に記載の方法。
- 工程(h)の前記塩基が、N,N-ジイソプロピルエチルアミン(iPr2NEt)である、請求項36に記載の方法。
- 工程(h)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)、1-[ビス(ジメチルアミノ)メチレン]-1H-1,2,3-トリアゾロ[4,5-b]ピリジニウム3-オキシドヘキサフルオロホスフェート(HATU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムテトラフルオロボレート(TBTU)、2-(1H-ベンゾトリアゾール-1-イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、2-クロロ-4,6-ジメトキシ-1,3,5-トリアジン(CDMT)、N-[(5-クロロ-3-オキシド-1H-ベンゾトリアゾール-1-イル)-4-モルホリニルメチレン]-N-メチルメタンアミニウムヘキサフルオロホスフェート(HDMC)、1-シアノ-2-エトキシ-2-オキソエチリデンアミノオキシ)ジメチルアミノ-モルホリノ-カルベニウムヘキサフルオロホスフェート(COMU)、ジメチルアミノ(トリアゾロ[4,5-b]ピリジン-3-イルオキシ)メチリデン]-ジメチルアザニウム;テトラフルオロボレート(TATU)、N,N,N’,N’-テトラメチル-S-(1-オキシド-2-ピリジル)チオウロニウムテトラフルオロボレート(TOTT)、N-エトキシカルボニル-2-エトキシ-1,2-ジヒドロキノリン(EEDQ)、1-プロパンホスホン酸無水物(T3P)、及び4-(4,6-ジメトキシ-1,3,5-トリアジン-2-イル)-4-メチル-モルホリニウムクロリド(DMTMM)からなる群から選択される、請求項37に記載の方法。
- 工程(h)の前記カップリング剤が、ベンゾトリアゾール-1-イル-オキシトリピロリジノホスホニウムヘキサフルオロホスフェート(PyBOP)である、請求項38に記載の方法。
- 工程(i)の前記第3の脱保護剤が、トリフルオロ酢酸(TFA)、フッ化水素酸(HF)、トリフリック酸(TfOH)、トリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物、トリフルオロ酢酸(TFA)/ジクロロメタン(DCM)混合物、トリエチルサリン(TES)、インドール、フェノール/アニソール混合物、及びチオアニソールからなる群から選択される、請求項1に記載の方法。
- 工程(i)の前記第3の脱保護剤が、トリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物である、請求項40に記載の方法。
- 工程(i)の前記切断試薬が、トリフルオロ酢酸(TFA)又はトリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物である、請求項41に記載の方法。
- 工程(i)の前記有機溶媒が、CH2Cl2、THF、ジエチルエーテル、MeOH、EtOH、アセトン、アセトニトリルからなる群から選択される、請求項42に記載の方法。
- 工程(i)の前記切断試薬が、トリフルオロ酢酸(TFA)/水/トリイソプロピルシラン混合物である、請求項43に記載の方法。
- 工程(i)の前記有機溶媒がCH2Cl2である、請求項44に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024216071A JP2025038037A (ja) | 2019-05-20 | 2024-12-11 | Psmaコンジュゲートの調製方法 |
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962850119P | 2019-05-20 | 2019-05-20 | |
| US62/850,119 | 2019-05-20 | ||
| US201962910777P | 2019-10-04 | 2019-10-04 | |
| US62/910,777 | 2019-10-04 | ||
| US201962912353P | 2019-10-08 | 2019-10-08 | |
| US62/912,353 | 2019-10-08 | ||
| PCT/US2020/033584 WO2020236808A1 (en) | 2019-05-20 | 2020-05-19 | Methods for preparing psma conjugates |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024216071A Division JP2025038037A (ja) | 2019-05-20 | 2024-12-11 | Psmaコンジュゲートの調製方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022538379A JP2022538379A (ja) | 2022-09-02 |
| JP7604397B2 true JP7604397B2 (ja) | 2024-12-23 |
Family
ID=73459444
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021569296A Active JP7604397B2 (ja) | 2019-05-20 | 2020-05-19 | Psmaコンジュゲートの調製方法 |
| JP2024216071A Pending JP2025038037A (ja) | 2019-05-20 | 2024-12-11 | Psmaコンジュゲートの調製方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024216071A Pending JP2025038037A (ja) | 2019-05-20 | 2024-12-11 | Psmaコンジュゲートの調製方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US12473265B2 (ja) |
| EP (1) | EP3972627A4 (ja) |
| JP (2) | JP7604397B2 (ja) |
| CN (3) | CN120097930A (ja) |
| WO (1) | WO2020236808A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4541378A3 (en) | 2013-11-14 | 2025-07-30 | Endocyte, Inc. | Compounds for positron emission tomography |
| CN112368024A (zh) | 2018-04-17 | 2021-02-12 | 恩多塞特公司 | 治疗癌症的方法 |
| EP4247833B1 (en) * | 2020-11-19 | 2025-09-24 | Novartis AG | Synthesis of prostate specific membrane antigen (psma) ligands |
| BR112023017157A2 (pt) * | 2021-02-26 | 2024-02-06 | Telix Pharmaceuticals Innovations Pty Ltd | Síntese em fase sólida de conjugados de alvejamento do antígeno de membrana específico da próstata (psma) derivados de glutamato-ureia-lisina (derivados de gul) e seu uso como precursores de agentes terapêuticos e/ou diagnósticos |
| WO2023240135A2 (en) | 2022-06-07 | 2023-12-14 | Actinium Pharmaceuticals, Inc. | Bifunctional chelators and conjugates |
| WO2023231452A1 (zh) * | 2023-02-14 | 2023-12-07 | 北京师范大学 | 含硝基芳香杂环基团的psma靶向放射性金属配合物及其制备 |
| CN117924253A (zh) * | 2023-08-17 | 2024-04-26 | 厦门大学 | 谷氨酸尿素类化合物及其制备方法和应用、核素靶向探针及其制备方法和应用、药物组合物 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109134602A (zh) | 2018-08-28 | 2019-01-04 | 兰州大学 | 一种高效的前列腺特异性膜抗原配体psma-617的固相制备方法 |
Family Cites Families (280)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4713249A (en) | 1981-11-12 | 1987-12-15 | Schroeder Ulf | Crystallized carbohydrate matrix for biologically active substances, a process of preparing said matrix, and the use thereof |
| DE116208T1 (de) | 1982-12-07 | 1985-02-28 | Kyowa Hakko Kogyo Co., Ltd., Tokio/Tokyo | Mitomycin-analoge. |
| JPS60255789A (ja) | 1984-06-01 | 1985-12-17 | Kyowa Hakko Kogyo Co Ltd | マイトマイシン誘導体,その製造法および抗腫瘍剤 |
| US5266333A (en) | 1985-03-06 | 1993-11-30 | American Cyanamid Company | Water dispersible and water soluble carbohydrate polymer compositions for parenteral administration of growth hormone |
| DE3750846T2 (de) | 1986-08-29 | 1995-05-11 | Kyowa Hakko Kogyo Kk | Mitomycin-derivate. |
| AU634314B2 (en) | 1989-11-13 | 1993-02-18 | Green Cross Corporation, The | Chimeric mouse-human a10 antibody with specificity to a human tumor cell antigen |
| US5627165A (en) | 1990-06-13 | 1997-05-06 | Drug Innovation & Design, Inc. | Phosphorous prodrugs and therapeutic delivery systems using same |
| AU653565B2 (en) | 1990-12-21 | 1994-10-06 | Nikken Corporation | Raw sewage disposal apparatus and prefab for accomodating the same |
| US6291196B1 (en) | 1992-01-31 | 2001-09-18 | Research Corporation Technologies, Inc. | Melanoma and prostate cancer specific antibodies for immunodetection and immunotherapy |
| US7070782B1 (en) | 1992-11-05 | 2006-07-04 | Sloan-Kettering Institute For Cancer Research | Prostate-specific membrane antigen |
| US5674977A (en) | 1993-02-05 | 1997-10-07 | The Ontario Cancer Institute | Branched synthetic peptide conjugate |
| US6569432B1 (en) | 1995-02-24 | 2003-05-27 | Sloan-Kettering Institute For Cancer Research | Prostate-specific membrane antigen and uses thereof |
| JP3538221B2 (ja) | 1993-11-19 | 2004-06-14 | 富士写真フイルム株式会社 | 定着濃厚液およびそれを用いたハロゲン化銀写真感光材料の処理方法 |
| US5417982A (en) | 1994-02-17 | 1995-05-23 | Modi; Pankaj | Controlled release of drugs or hormones in biodegradable polymer microspheres |
| US5866679A (en) | 1994-06-28 | 1999-02-02 | Merck & Co., Inc. | Peptides |
| GB9417873D0 (en) | 1994-09-06 | 1994-10-26 | Sandoz Ltd | Organic compounds |
| US6946133B1 (en) | 1996-03-20 | 2005-09-20 | The United States Of America As Represented By The Department Of Health And Human Services | Prostate specific antigen oligo-epitope peptide |
| DE69729380T2 (de) | 1996-04-01 | 2005-07-14 | Epix Medical, Inc., Cambridge | Bioaktivierte diagnostische bilderzeugungskontrastmittel |
| WO1997038313A1 (en) | 1996-04-05 | 1997-10-16 | The Johns Hopkins University | A method of enriching rare cells |
| US5795877A (en) | 1996-12-31 | 1998-08-18 | Guilford Pharmaceuticals Inc. | Inhibitors of NAALADase enzyme activity |
| US5863536A (en) | 1996-12-31 | 1999-01-26 | Guilford Pharmaceuticals Inc. | Phosphoramidate derivatives |
| US6054444A (en) | 1997-04-24 | 2000-04-25 | Guilford Pharmaceuticals Inc. | Phosphonic acid derivatives |
| US5672592A (en) | 1996-06-17 | 1997-09-30 | Guilford Pharmaceuticals Inc. | Certain phosphonomethyl-pentanedioic acid derivatives thereof |
| US5902817A (en) | 1997-04-09 | 1999-05-11 | Guilford Pharmaceuticals Inc. | Certain sulfoxide and sulfone derivatives |
| US5998362A (en) | 1996-09-12 | 1999-12-07 | Merck & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| US6368598B1 (en) | 1996-09-16 | 2002-04-09 | Jcrt Radiation Oncology Support Services, Inc. | Drug complex for treatment of metastatic prostate cancer |
| US5962521A (en) | 1997-04-04 | 1999-10-05 | Guilford Pharmaceuticals Inc. | Hydroxamic acid derivatives |
| US6177404B1 (en) | 1996-10-15 | 2001-01-23 | Merck & Co., Inc. | Conjugates useful in the treatment of benign prostatic hyperplasia |
| US5948750A (en) | 1996-10-30 | 1999-09-07 | Merck & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| DE69840669D1 (de) | 1997-04-10 | 2009-04-30 | Stichting Katholieke Univ | Pca3, pca3-gene und verfahren zu ihrer verwendung |
| US6127333A (en) | 1997-07-10 | 2000-10-03 | Merck & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| US6391305B1 (en) | 1997-09-10 | 2002-05-21 | Merck & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| US20020115596A1 (en) | 1997-10-27 | 2002-08-22 | Merk & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| EA002745B1 (ru) | 1997-12-02 | 2002-08-29 | Мерк Энд Ко., Инк. | Конъюгаты, которые можно использовать при лечении рака предстательной железы |
| ZA9810974B (en) | 1997-12-02 | 1999-06-03 | Merck & Co Inc | Conjugates useful in the treatment of prostate cancer |
| US20040081659A1 (en) | 1997-12-02 | 2004-04-29 | Merck & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| WO1999045374A2 (en) | 1998-03-03 | 1999-09-10 | Mosaic Technologies | Purification and detection processes using reversible affinity electrophoresis |
| US20020103136A1 (en) | 1998-03-05 | 2002-08-01 | Dong-Mei Feng | Conjugates useful in the treatment of prostate cancer |
| US6232287B1 (en) | 1998-03-13 | 2001-05-15 | The Burnham Institute | Molecules that home to various selected organs or tissues |
| US6093382A (en) | 1998-05-16 | 2000-07-25 | Bracco Research Usa Inc. | Metal complexes derivatized with folate for use in diagnostic and therapeutic applications |
| PT1086223E (pt) | 1998-06-01 | 2009-11-03 | Agensys Inc | Novos antigénios transmembranares em serpentina expressos em cancros humanos e suas utilizações |
| US6833438B1 (en) | 1999-06-01 | 2004-12-21 | Agensys, Inc. | Serpentine transmembrane antigens expressed in human cancers and uses thereof |
| US7138103B2 (en) | 1998-06-22 | 2006-11-21 | Immunomedics, Inc. | Use of bi-specific antibodies for pre-targeting diagnosis and therapy |
| US20070020327A1 (en) | 1998-11-10 | 2007-01-25 | John Fikes | Inducing cellular immune responses to prostate cancer antigens using peptide and nucleic acid compositions |
| US6174858B1 (en) | 1998-11-17 | 2001-01-16 | Merck & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| US20030207808A1 (en) | 1999-02-18 | 2003-11-06 | Kinneret Savitzky | Novel nucleic acid and amino acid sequences |
| WO2000059930A1 (en) | 1999-04-05 | 2000-10-12 | Merck & Co., Inc. | A method of treating cancer |
| US6528499B1 (en) | 2000-04-27 | 2003-03-04 | Georgetown University | Ligands for metabotropic glutamate receptors and inhibitors of NAALADase |
| WO2000064911A1 (en) | 1999-04-28 | 2000-11-02 | Georgetown University | Ligands for metabotropic glutamate receptors |
| AUPQ014799A0 (en) | 1999-05-04 | 1999-05-27 | Access Pharmaceuticals Australia Pty Limited | Amplification of folate-mediated targeting to tumor cells using polymers |
| JP3625690B2 (ja) | 1999-05-14 | 2005-03-02 | 学校法人東京歯科大学 | 歯科実習机 |
| US7166573B1 (en) | 1999-05-28 | 2007-01-23 | Ludwig Institute For Cancer Research | Breast, gastric and prostate cancer associated antigens and uses therefor |
| US20040146516A1 (en) | 1999-06-17 | 2004-07-29 | Utah Ventures Ii L.P. | Lumen-exposed molecules and methods for targeted delivery |
| US7361338B2 (en) | 1999-10-05 | 2008-04-22 | Agensys, Inc. | Methods to inhibit growth of prostate cancer cells |
| US6692724B1 (en) | 1999-10-25 | 2004-02-17 | Board Of Regents, The University Of Texas System | Ethylenedicysteine (EC)-drug conjugates, compositions and methods for tissue specific disease imaging |
| US6428785B1 (en) | 1999-10-28 | 2002-08-06 | Immunolytics Inc. | Method and composition for treating prostate cancer |
| CA2391534A1 (en) | 1999-11-15 | 2001-05-25 | Drug Innovation & Design, Inc. | Selective cellular targeting: multifunctional delivery vehicles |
| AU2001256970C1 (en) | 2000-03-31 | 2008-07-03 | Purdue Research Foundation | Method of treatment using ligand-immunogen conjugates |
| IL153218A0 (en) | 2000-06-02 | 2003-07-06 | Univ Texas | Ethylenedicysteine (ec) -drug conjugates |
| US20030072794A1 (en) | 2000-06-09 | 2003-04-17 | Teni Boulikas | Encapsulation of plasmid DNA (lipogenes™) and therapeutic agents with nuclear localization signal/fusogenic peptide conjugates into targeted liposome complexes |
| WO2002033116A2 (en) | 2000-10-16 | 2002-04-25 | Gilead Sciences, Inc. | Nucleic acid ligands to the prostate specific membrane antigen |
| US20020132983A1 (en) | 2000-11-30 | 2002-09-19 | Junghans Richard P. | Antibodies as chimeric effector cell receptors against tumor antigens |
| AU2002239403A1 (en) | 2000-12-01 | 2002-06-11 | The Johns Hopkins University | Tissue specific prodrugs |
| JP2004536034A (ja) | 2001-01-08 | 2004-12-02 | ネオルクス コーポレイション | 治療的および診断的化合物、組成物および方法 |
| JP2005507857A (ja) | 2001-02-07 | 2005-03-24 | ベズ イズレイル ディーコネス メディカル センター | 改変psmaリガンド及びそれに関する利用 |
| JP3596479B2 (ja) | 2001-03-05 | 2004-12-02 | 森 勇蔵 | 光散乱法による表面の複合評価システム |
| US7767202B2 (en) | 2001-03-16 | 2010-08-03 | The Johns Hopkins University | Modulation of systemic immune responses by transplantation of hematopoietic stem cells transduced with genes encoding antigens and antigen presenting cell regulatory molecules |
| EP1389209B1 (en) | 2001-04-24 | 2009-04-08 | Purdue Research Foundation | Folate mimetics and folate-receptor binding conjugates thereof |
| RU2316349C2 (ru) | 2001-05-02 | 2008-02-10 | Пердью Рисерч Фаундейшн | Лечение и диагностика заболеваний, опосредованных макрофагами |
| US20040092890A1 (en) | 2001-05-10 | 2004-05-13 | Ash Stephen R. | Catheter lock solution including a photo-oxidant |
| US7109165B2 (en) | 2001-05-18 | 2006-09-19 | Sirna Therapeutics, Inc. | Conjugates and compositions for cellular delivery |
| JP4619651B2 (ja) | 2001-06-01 | 2011-01-26 | コーネル・リサーチ・ファンデーション・インコーポレイテッド | 前立腺特異的膜抗原に対する修飾抗体およびその使用 |
| US7514078B2 (en) | 2001-06-01 | 2009-04-07 | Cornell Research Foundation, Inc. | Methods of treating prostate cancer with anti-prostate specific membrane antigen antibodies |
| US20040018203A1 (en) | 2001-06-08 | 2004-01-29 | Ira Pastan | Pegylation of linkers improves antitumor activity and reduces toxicity of immunoconjugates |
| US7135301B2 (en) | 2001-06-21 | 2006-11-14 | Glycomimetics, Inc. | Detection and treatment of prostate cancer |
| WO2003000201A2 (en) | 2001-06-25 | 2003-01-03 | Drug Innovation & Design, Incorporated | Exponential pattern recognition based cellular targeting, compositions, methods and anticancer applications |
| US7893223B2 (en) | 2001-07-17 | 2011-02-22 | Bracco Imaging S.P.A. | Multidentate AZA ligands able to complex metal ions and the use thereof in diagnostics and therapy |
| WO2003018611A2 (en) | 2001-08-24 | 2003-03-06 | University Of Victoria Innovation And Development Corporation | Proaerolysin containing protease activation sequences and methods of use for treatment of prostate cancer |
| MXPA03012022A (es) | 2001-09-20 | 2005-07-01 | Cornell Res Foundation Inc | Metodos y composiciones para tratar o prevenir padecimientos de la piel, utilizando agentes de enlace especificos para el antigeno de membrana especifico de prostata. |
| US20030232760A1 (en) | 2001-09-21 | 2003-12-18 | Merck & Co., Inc. | Conjugates useful in the treatment of prostate cancer |
| CA2461877A1 (en) | 2001-09-28 | 2003-04-10 | Purdue Research Foundation | Method of treatment using ligand-immunogen conjugates |
| US20030215456A1 (en) | 2001-10-02 | 2003-11-20 | Sui-Long Yao | Method of treating cancer |
| US20030133927A1 (en) | 2001-10-10 | 2003-07-17 | Defeo-Jones Deborah | Conjugates useful in the treatment of prostate cancer |
| US20040058857A1 (en) | 2001-11-29 | 2004-03-25 | Siu-Long Yao | Method of treating cancer |
| US20070031438A1 (en) | 2001-12-10 | 2007-02-08 | Junghans Richard P | Antibodies as chimeric effector cell receptors against tumor antigens |
| CA2473289C (en) | 2002-01-10 | 2014-07-29 | The Johns Hopkins University | Asymmetric urea compounds useful as naaladase and psma imaging agents |
| US7344700B2 (en) | 2002-02-28 | 2008-03-18 | University Of Tennessee Research Corporation | Radiolabeled selective androgen receptor modulators and their use in prostate cancer imaging and therapy |
| EP1497462A4 (en) | 2002-03-07 | 2007-11-07 | Univ Johns Hopkins Med | GENOMIC SCREEN ON EPIGENETIC MUTED CANCER ASSOCIATED GENES |
| US7534580B2 (en) | 2002-05-01 | 2009-05-19 | Ambrilia Biopharma Inc. | PSP94 diagnostic reagents and assays |
| DK2260875T3 (da) | 2002-05-06 | 2014-06-30 | Endocyte Inc | Folatreceptor-targetede billeddannelsesmidler |
| US7910594B2 (en) | 2002-05-15 | 2011-03-22 | Endocyte, Inc. | Vitamin-mitomycin conjugates |
| US7597876B2 (en) | 2007-01-11 | 2009-10-06 | Immunomedics, Inc. | Methods and compositions for improved F-18 labeling of proteins, peptides and other molecules |
| US7767803B2 (en) | 2002-06-18 | 2010-08-03 | Archemix Corp. | Stabilized aptamers to PSMA and their use as prostate cancer therapeutics |
| AR040956A1 (es) | 2002-07-31 | 2005-04-27 | Schering Ag | Nuevos conjugados de efectores, procedimientos para su preparacion y su uso farmaceutico |
| PT2357006E (pt) | 2002-07-31 | 2016-01-22 | Seattle Genetics Inc | Conjugados de fármacos e sua utilização para tratamento do cancro, de uma doença autoimune ou de uma doença infeciosa |
| WO2006028429A2 (en) | 2002-08-05 | 2006-03-16 | The Johns Hopkins University | Peptides for targeting the prostate specific membrane antigen |
| WO2004015086A2 (en) | 2002-08-08 | 2004-02-19 | Johns Hopkins University | Enhancement of adenoviral oncolytic activity in prostate cells by modification of the e1a gene product |
| US8487128B2 (en) | 2002-11-26 | 2013-07-16 | Chs Pharma, Inc. | Protection of normal cells |
| AU2003303374A1 (en) | 2002-12-20 | 2004-07-22 | The Johns Hopkins University | Treatment of metastatic cancer with the b-subunit of shiga toxin |
| US7226577B2 (en) | 2003-01-13 | 2007-06-05 | Bracco Imaging, S. P. A. | Gastrin releasing peptide compounds |
| US20080008649A1 (en) | 2003-01-13 | 2008-01-10 | Bracco Imaging S.P.A. | Gastrin Releasing Peptide Compounds |
| AR042942A1 (es) | 2003-01-27 | 2005-07-06 | Endocyte Inc | Conjugados de administracion de drogas de union de receptores de vitaminas |
| EP2336189A1 (en) | 2003-01-28 | 2011-06-22 | Proscan RX Pharma | Prostate cancer diagnosis and treatment |
| EP1444990A1 (en) | 2003-02-07 | 2004-08-11 | Amersham plc | Improved Radiometal Complex Compositions |
| US7638122B2 (en) | 2003-03-07 | 2009-12-29 | University Of South Florida | Stat3 antagonists and their use as vaccines against cancer |
| EP1603392A2 (en) | 2003-03-07 | 2005-12-14 | The University Of Toledo | Paclitaxel hybrid derivatives |
| US20070179100A1 (en) | 2003-04-09 | 2007-08-02 | Muthiah Manoharan | Protected monomers |
| AU2004233092C9 (en) | 2003-04-17 | 2010-10-28 | Alnylam Pharmaceuticals, Inc. | Modified iRNA agents |
| EP1641742A4 (en) | 2003-05-01 | 2006-11-29 | Nst Neurosurvival Technologies | COMPOUNDS BINDING SELECTIVELY TO MEMBRANES OF APOPTOTIC CELLS |
| US8088387B2 (en) | 2003-10-10 | 2012-01-03 | Immunogen Inc. | Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates |
| CA2529027C (en) | 2003-06-13 | 2013-09-10 | Immunomedics, Inc. | D-amino acid peptides |
| US7232805B2 (en) | 2003-09-10 | 2007-06-19 | Inflabloc Pharmaceuticals, Inc. | Cobalamin conjugates for anti-tumor therapy |
| US20050085417A1 (en) | 2003-10-16 | 2005-04-21 | Thomas Jefferson University | Compounds and methods for diagnostic imaging and therapy |
| US20050255042A1 (en) | 2003-11-24 | 2005-11-17 | The Regents Of The University Of California Office Of Technology Transfer, University Of California | On-demand cleavable linkers for radioconjugates for cancer imaging and therapy |
| FR2864546A1 (fr) | 2003-12-24 | 2005-07-01 | Assist Publ Hopitaux De Paris | Methode d'identification et de preparation de lymphocytes t regulateurs/suppresseurs, compositions et utilisations |
| WO2006051531A2 (en) | 2004-11-09 | 2006-05-18 | Spectrum Dynamics Llc | Radioimaging |
| US8586932B2 (en) | 2004-11-09 | 2013-11-19 | Spectrum Dynamics Llc | System and method for radioactive emission measurement |
| DE102004004787A1 (de) | 2004-01-30 | 2005-08-18 | Schering Ag | Neue Effektor-Konjugate, Verfahren zu ihrer Herstellung und ihre pharmazeutische Verwendung |
| JP5064037B2 (ja) | 2004-02-23 | 2012-10-31 | ジェネンテック, インコーポレイテッド | 複素環式自壊的リンカーおよび結合体 |
| JP2008509379A (ja) | 2004-03-03 | 2008-03-27 | ビオメリュー | 活性化可能な遊離型psaの検出方法、並びに、前立腺の良性病状及び前立腺ガンの診断におけるその使用 |
| WO2005094882A1 (en) | 2004-03-03 | 2005-10-13 | Millennium Pharmaceuticals, Inc. | Modified antibodies to prostate-specific membrane antigen and uses thereof |
| ES2311895T3 (es) | 2004-03-15 | 2009-02-16 | F. Hoffmann-La Roche Ag | El uso de los peptidos tipo bnp y de los peptidos tipo anf para evaluar el riesgo de padecer una complicacion cardio-vascular como frecuencia de sobrecarga del volumen. |
| US20060105975A1 (en) | 2004-04-19 | 2006-05-18 | Shannon Pendergrast | Aptamer-mediated intracellular delivery of therapeutic oligonucleotides |
| EP1756166A4 (en) | 2004-04-19 | 2008-08-27 | Proscan Rx Pharma | DIAGNOSIS AND TREATMENT OF PROSTATE CANCER |
| WO2005112919A2 (en) | 2004-05-19 | 2005-12-01 | Medarex, Inc. | Self-immolative linkers and drug conjugates |
| US7691962B2 (en) | 2004-05-19 | 2010-04-06 | Medarex, Inc. | Chemical linkers and conjugates thereof |
| US20080008719A1 (en) | 2004-07-10 | 2008-01-10 | Bowdish Katherine S | Methods and compositions for the treatment of prostate cancer |
| EP1789391B1 (en) | 2004-07-23 | 2017-06-28 | Endocyte, Inc. | Bivalent linkers and conjugates thereof |
| PL1776384T3 (pl) | 2004-08-04 | 2013-10-31 | Mentrik Biotech Llc | WARIANTY REGIONÓW Fc |
| CN101035783A (zh) | 2004-08-30 | 2007-09-12 | 神经医药品有限公司 | 作为钙通道阻断剂的脲衍生物 |
| US7713944B2 (en) | 2004-10-13 | 2010-05-11 | Isis Pharmaceuticals, Inc. | Oligomers comprising activated disulfides which bind to plasma proteins and their use for delivery to cells |
| ES2341268T3 (es) | 2004-10-27 | 2010-06-17 | Janssen Pharmaceutica Nv | Tiofenos trisubstituidos utilizados como antagonistas del receptor de la progesterona. |
| US8423125B2 (en) | 2004-11-09 | 2013-04-16 | Spectrum Dynamics Llc | Radioimaging |
| US20060140871A1 (en) | 2004-11-30 | 2006-06-29 | Sillerud Laurel O | Magnetic resonance imaging of prostate cancer |
| US20060155021A1 (en) | 2005-01-13 | 2006-07-13 | Lenges Christian P | Coating compositions containing rheology control agents |
| US7741510B2 (en) | 2005-01-13 | 2010-06-22 | E. I. Du Pont De Nemours And Company | Rheology control agents |
| US7872235B2 (en) | 2005-01-13 | 2011-01-18 | Spectrum Dynamics Llc | Multi-dimensional image reconstruction and analysis for expert-system diagnosis |
| US20090258002A1 (en) | 2005-02-01 | 2009-10-15 | Government Of The Us, As Represented By The Secretary, Department Of Health And Human Services | Biomarkers for Tissue Status |
| WO2006093991A1 (en) | 2005-03-02 | 2006-09-08 | The Cleveland Clinic Foundation | Compounds which bind psma and uses thereof |
| EP1863828A4 (en) | 2005-03-07 | 2010-10-13 | Archemix Corp | STABILIZED APTAMERS FOR PSMA AND THEIR USE AS PROSTATE ACID THERAPEUTICS |
| KR100621632B1 (ko) | 2005-03-22 | 2006-09-19 | 삼성전자주식회사 | 시리얼 센싱 동작을 수행하는 노어 플래시 메모리 장치 |
| CN101184506B (zh) | 2005-03-25 | 2013-07-17 | 健泰科生物技术公司 | 用于调节超稳定化的c-met的方法和组合物 |
| US8088908B2 (en) | 2005-05-10 | 2012-01-03 | City Of Hope | Humanized anti-prostate stem cell antigen monoclonal antibody |
| KR101068612B1 (ko) | 2005-05-24 | 2011-09-30 | 휴마시스 주식회사 | 유사구조 단백질 비율 측정을 이용한 진단장치 |
| NZ564954A (en) | 2005-06-14 | 2011-02-25 | Protox Therapeutics Inc | Method of treating or preventing benign prostatic hyperplasia using modified pore-forming proteins |
| EP1912677B1 (en) | 2005-06-20 | 2013-10-02 | Psma Development Company, L.L.C. | PSMA antibody-drug conjugates |
| EP1904183B1 (en) | 2005-07-05 | 2014-10-15 | Purdue Research Foundation | Pharmaceutical composition for the treatment of osteoarthritis |
| US20070010014A1 (en) | 2005-07-06 | 2007-01-11 | General Electric Company | Compositions and methods for enhanced delivery to target sites |
| EP1909853B1 (en) | 2005-07-19 | 2015-03-18 | Biosensors International Group, Ltd. | Imaging protocols |
| CN103893778A (zh) | 2005-08-19 | 2014-07-02 | 恩多塞特公司 | 多药物配体缀合物 |
| WO2007022493A2 (en) | 2005-08-19 | 2007-02-22 | Endocyte, Inc. | Ligand conjugates of vinca alkaloids, analogs, and derivatives |
| EP2015781A4 (en) | 2005-09-12 | 2009-12-23 | Univ Johns Hopkins | COMPOSITIONS HAVING ANTIANGIOGENIC ACTIVITY AND USES THEREOF |
| CA2625196C (fr) | 2005-10-07 | 2016-04-05 | Guerbet | Composes comprenant une partie de reconnaissance d'une cible biologique, couplee a une partie de signal capable de complexer le gallium |
| CA2670355A1 (en) | 2005-11-21 | 2008-04-24 | Medivas, Llc | Polymer particles for delivery of macromolecules and methods of use |
| DK2963011T3 (en) | 2005-11-23 | 2018-08-06 | Ventana Med Syst Inc | MOLECULAR CONJUGATE |
| WO2007081751A2 (en) | 2006-01-05 | 2007-07-19 | The Johns Hopkins University | Compositions and methods for the treatment of cancer |
| US7635682B2 (en) | 2006-01-06 | 2009-12-22 | Genspera, Inc. | Tumor activated prodrugs |
| JP2009532338A (ja) | 2006-03-14 | 2009-09-10 | キャンサー ターゲテッド テクノロジー エルエルシー | Psmaのペプチド模倣体阻害剤、それらを含む化合物、およびそれらの使用方法 |
| ATE509033T1 (de) | 2006-03-20 | 2011-05-15 | Univ California | Manipulierte anti-prostatastammzellenantigen (psca)-antikörper für krebs-targeting |
| US20070225213A1 (en) | 2006-03-23 | 2007-09-27 | Kosak Matthew K | Nucleic acid carriers for delivery of therapeutic agents |
| JP2009534309A (ja) | 2006-03-31 | 2009-09-24 | マサチューセッツ インスティテュート オブ テクノロジー | 治療剤の標的化送達のためのシステム |
| US20140314864A1 (en) | 2006-03-31 | 2014-10-23 | Massachusetts Institute Of Technology | System for Targeted Delivery of Therapeutic Agents |
| US9265746B2 (en) | 2006-05-31 | 2016-02-23 | Merck & Cie | Method for cell-specific targeting |
| EP2046658A4 (en) | 2006-07-31 | 2009-11-04 | Bayer Consumer Care Ag | TWO-PIECE CONTAINER WITH AN ADJUSTABLE OPERATOR FOR A CUTTING DEVICE |
| US7842280B2 (en) | 2006-09-06 | 2010-11-30 | Case Western Reserve University | Flexibly labeling peptides |
| US10925977B2 (en) | 2006-10-05 | 2021-02-23 | Ceil>Point, LLC | Efficient synthesis of chelators for nuclear imaging and radiotherapy: compositions and applications |
| CA2668197A1 (en) | 2006-11-03 | 2008-05-15 | Philip S. Low | Ex vivo flow cytometry method and device |
| DK2097111T3 (en) | 2006-11-08 | 2015-08-24 | Molecular Insight Pharm Inc | Heterodimers of glutamic acid |
| EP2500015A1 (en) | 2006-12-05 | 2012-09-19 | Landec Corporation | Delivery of drugs |
| US8507434B2 (en) | 2007-01-03 | 2013-08-13 | The Johns Hopkins University | Peptide modulators of angiogenesis and use thereof |
| US8709382B2 (en) | 2007-01-11 | 2014-04-29 | Immunomedics, Inc. | Methods and compositions for improved F-18 labeling of proteins, peptides and other molecules |
| US8889100B2 (en) | 2007-01-11 | 2014-11-18 | Immunomedics, Inc. | Methods and compositions for improved F-18 labeling of proteins, peptides and other molecules |
| US20160045626A1 (en) | 2007-01-11 | 2016-02-18 | Immunomedics, Inc. | Methods and Compositions for Improved Labeling of Targeting Peptides |
| EP2117604B1 (en) | 2007-01-11 | 2017-07-26 | Immunomedics, Inc. | Methods and compositions for improved f-18 labeling of proteins, peptides and other molecules |
| AU2007345648A1 (en) | 2007-01-26 | 2008-08-07 | City Of Hope | Methods and compositions for the treatment of cancer or other diseases |
| EP2567711A3 (en) | 2007-02-07 | 2013-05-01 | Purdue Research Foundation | Positron emission tomography imaging method |
| WO2008101231A2 (en) | 2007-02-16 | 2008-08-21 | Endocyte, Inc. | Methods and compositions for treating and diagnosing kidney disease |
| JP5829793B2 (ja) | 2007-03-14 | 2015-12-09 | エンドサイト・インコーポレイテッドEndocyte, Inc. | 結合性リガンドが結合したツブリシンの薬剤送達結合体 |
| WO2008124197A1 (en) | 2007-04-10 | 2008-10-16 | The Johns Hopkins University | Imaging and therapy of virus-associated tumors |
| WO2009002993A1 (en) | 2007-06-25 | 2008-12-31 | Endocyte, Inc. | Conjugates containing hydrophilic spacer linkers |
| JP5680409B2 (ja) | 2007-06-26 | 2015-03-04 | ザ ジョンズ ホプキンス ユニバーシティ | 前立腺特異膜抗原(psma)の標識阻害剤、生物学的評価およびイメージング剤としての使用 |
| GB0723246D0 (en) | 2007-07-03 | 2008-01-09 | Barton Michelle | p53 modulator |
| CA2693707A1 (en) | 2007-07-13 | 2009-03-05 | The Johns Hopkins University | B7-dc variants |
| WO2009018500A1 (en) | 2007-07-31 | 2009-02-05 | The Johns Hopkins University | Polypeptide-nucleic acid conjugate for immunoprophylaxis or immunotherapy for neoplastic or infectious disorders |
| PT2187965T (pt) | 2007-08-17 | 2020-01-17 | Purdue Research Foundation | Conjugados ligando-ligante de ligação a psma e métodos para utilização |
| WO2009026274A1 (en) | 2007-08-22 | 2009-02-26 | Medarex, Inc. | Site-specific attachment of drugs or other agents to engineered antibodies with c-terminal extensions |
| WO2009035942A1 (en) | 2007-09-13 | 2009-03-19 | Chemimage Corporation | Distinguishing between renal oncocytoma and chromophobe renal cell carcinoma using raman molecular imaging |
| JP5410434B2 (ja) | 2007-09-28 | 2014-02-05 | バインド セラピューティックス インコーポレイテッド | ナノ粒子を用いた癌細胞の標的化 |
| CN101909441B (zh) | 2007-10-25 | 2015-05-13 | 恩多塞特公司 | 微管蛋白抑制剂及其制备方法 |
| US8450290B2 (en) | 2007-11-26 | 2013-05-28 | Enzon Pharmaceuticals, Inc. | Methods for treating androgen receptor dependent disorders including cancers |
| WO2009070302A1 (en) | 2007-11-30 | 2009-06-04 | The Johns Hopkins University | Prostate specific membrane antigen (psma) targeted nanoparticles for therapy of prostate cancer |
| CA2708171C (en) | 2007-12-04 | 2018-02-27 | Alnylam Pharmaceuticals, Inc. | Folate conjugates |
| US20090180951A1 (en) | 2007-12-12 | 2009-07-16 | Molecular Insight Pharmaceuticals, Inc. | Inhibitors of integrin vla-4 |
| EP2240171B1 (en) | 2008-01-09 | 2014-08-13 | Molecular Insight Pharmaceuticals, Inc. | Inhibitors of carbonic anhydrase IX |
| US8562945B2 (en) | 2008-01-09 | 2013-10-22 | Molecular Insight Pharmaceuticals, Inc. | Technetium- and rhenium-bis(heteroaryl) complexes and methods of use thereof |
| ITTO20080313A1 (it) | 2008-04-22 | 2009-10-23 | Marco Colombatti | Anticorpo monoclonale isolato o suo frammento legante l'antigene specifico di membrana della prostata, suoi coniugati e suoi usi |
| EP2990487A1 (en) | 2008-05-08 | 2016-03-02 | Asuragen, INC. | Compositions and methods related to mirna modulation of neovascularization or angiogenesis |
| US8852630B2 (en) | 2008-05-13 | 2014-10-07 | Yale University | Chimeric small molecules for the recruitment of antibodies to cancer cells |
| JP5746615B2 (ja) | 2008-05-13 | 2015-07-08 | エール ユニヴァーシティ | 癌細胞への抗体の動員のためのキメラ小分子 |
| EA020954B1 (ru) | 2008-06-16 | 2015-03-31 | Бинд Терапьютикс, Инк. | Загруженные лекарственным средством полимерные наночастицы, фармацевтическая композиция и способ лечения рака |
| PL2318366T3 (pl) | 2008-08-01 | 2017-10-31 | Univ Johns Hopkins | Środki wiążące PSMA i ich zastosowania |
| US8685937B2 (en) | 2008-08-09 | 2014-04-01 | University Of Iowa Research Foundation | Nucleic acid aptamers |
| AU2009281732A1 (en) | 2008-08-15 | 2010-02-18 | Georgetown University | Na channels, disease, and related assays and compositions |
| PT2326350E (pt) | 2008-09-08 | 2013-12-10 | Psma Dev Company L L C | Compostos para matar células cancerosas resistentes a taxano, que expressam psma |
| EP2166021A1 (en) | 2008-09-16 | 2010-03-24 | Ganymed Pharmaceuticals AG | Monoclonal antibodies for treatment of cancer |
| JP5675619B2 (ja) | 2008-09-17 | 2015-02-25 | エンドサイト, インク.Endocyte, Inc. | 葉酸拮抗薬の葉酸受容体結合性コンジュゲート |
| WO2010045598A2 (en) | 2008-10-17 | 2010-04-22 | Purdue Research Foundation | Psma binding ligand-linker conjugates and methods for using |
| AU2009322171A1 (en) | 2008-12-05 | 2011-06-30 | Molecular Insight Pharmaceuticals, Inc. | CA-IX specific radiopharmaceuticals for the treatment and imaging of cancer |
| WO2010065906A2 (en) | 2008-12-05 | 2010-06-10 | Molecular Insight Pharmaceuticals, Inc. | Ca-ix specific radiopharmaceuticals for the treatment and imaging of cancer |
| ES2712732T3 (es) | 2009-02-17 | 2019-05-14 | Cornell Res Foundation Inc | Métodos y kits para el diagnóstico de cáncer y la predicción de valor terapéutico |
| WO2010107909A2 (en) | 2009-03-17 | 2010-09-23 | The Johns Hopkins University | Methods and compositions for the detection of cancer |
| CA3257131A1 (en) | 2009-03-19 | 2025-04-15 | The Johns Hopkins University | PSMA-TARGETING COMPOUNDS AND RELATED USES |
| CA2769444A1 (en) | 2009-05-19 | 2010-11-25 | Aic Blab Company | Composite current collector and methods therefor |
| AU2010260195B2 (en) | 2009-06-15 | 2014-11-20 | Molecular Insight Pharmaceuticals, Inc. | Process for production of heterodimers of glutamic acid |
| CN104857534A (zh) | 2009-07-31 | 2015-08-26 | 恩多塞特公司 | 叶酸盐靶向的诊断和治疗 |
| US8394922B2 (en) | 2009-08-03 | 2013-03-12 | Medarex, Inc. | Antiproliferative compounds, conjugates thereof, methods therefor, and uses thereof |
| US8313128B2 (en) | 2009-08-20 | 2012-11-20 | Rhoost, Llc. | Safety locking mechanism for doors |
| WO2011031517A1 (en) | 2009-08-27 | 2011-03-17 | Nuclea Biotechnologies, LLC | Method and assay for determining fas expression |
| AU2010325969B2 (en) | 2009-12-02 | 2016-10-20 | Imaginab, Inc. | J591 minibodies and cys-diabodies for targeting human prostate specific membrane antigen |
| CN102811743B (zh) | 2009-12-11 | 2015-11-25 | 佰恩德治疗股份有限公司 | 冻干治疗颗粒的稳定制剂 |
| EP2531029B1 (en) | 2010-02-04 | 2016-10-19 | Radius Health, Inc. | Selective androgen receptor modulators |
| CA2790577A1 (en) | 2010-02-25 | 2011-09-01 | Purdue Research Foundation | Psma binding ligand-linker conjugates and methods for using |
| US9951324B2 (en) | 2010-02-25 | 2018-04-24 | Purdue Research Foundation | PSMA binding ligand-linker conjugates and methods for using |
| JP2010159277A (ja) | 2010-03-04 | 2010-07-22 | Sumitomo Chemical Co Ltd | 有害生物防除組成物及び有害生物の防除方法 |
| TWI540136B (zh) | 2010-04-15 | 2016-07-01 | 梅迪繆思有限公司 | 吡咯并苯并二氮呯及其共軛物 |
| CN101863924B (zh) | 2010-05-17 | 2012-06-27 | 北京师范大学 | 99mTc标记肼基烟酰胺基-二氧辛酰-叶酸配合物及制备方法 |
| KR101236142B1 (ko) | 2010-09-30 | 2013-02-21 | 경북대학교 산학협력단 | 가돌리늄 착물을 함유하는 mri조영제 |
| US9687572B2 (en) | 2010-12-06 | 2017-06-27 | Molecular Insight Pharmaceuticals, Inc. | PSMA-targeted dendrimers |
| US20140308363A1 (en) | 2011-05-31 | 2014-10-16 | Bind Therapeutics, Inc. | Drug loaded polymeric nanoparticles and methods of making and using same |
| PL2721039T3 (pl) | 2011-06-15 | 2018-06-29 | Cancer Targeted Technology Llc | Chelatowane inhibitory PSMA |
| ES2732060T3 (es) | 2011-08-05 | 2019-11-20 | Molecular Insight Pharm Inc | Inhibidores radiomarcados del antígeno de membrana específico de la próstata |
| WO2013028664A1 (en) | 2011-08-22 | 2013-02-28 | Siemens Medical Solutions Usa, Inc. | Psma imaging agents |
| US9629918B2 (en) | 2012-02-29 | 2017-04-25 | Purdue Research Foundation | Folate receptor alpha binding ligands |
| EP2908818A4 (en) | 2012-10-16 | 2016-07-13 | Endocyte Inc | CONJUGATES OF DRUG DELIVERY CONTAINING ARTIFICIAL AMINO ACIDS AND METHODS OF USE |
| US20140107316A1 (en) | 2012-10-16 | 2014-04-17 | Endocyte, Inc. | Drug delivery conjugates containing unnatural amino acids and methods for using |
| US9636413B2 (en) | 2012-11-15 | 2017-05-02 | Endocyte, Inc. | Conjugates for treating diseases caused by PSMA expressing cells |
| US20140154702A1 (en) | 2012-11-30 | 2014-06-05 | Endocyte, Inc. | Methods For Treating Cancer Using Combination Therapies |
| EA032986B1 (ru) | 2012-12-21 | 2019-08-30 | Медимьюн Лимитед | Пирролобензодиазепины |
| SG11201504235UA (en) | 2012-12-28 | 2015-07-30 | Blend Therapeutics Inc | Targeted conjugates encapsulated in particles and formulations thereof |
| EP2958596B1 (en) | 2013-02-15 | 2019-12-04 | Case Western Reserve University | Psma ligands and uses thereof |
| US20140249315A1 (en) | 2013-03-01 | 2014-09-04 | Endocyte, Inc. | Processes for preparing tubulysins |
| US20170232119A1 (en) | 2013-03-15 | 2017-08-17 | Purdue Research Foundation | Synthesis and composition of amino acid linking groups conjugated to compounds used for the targeted imaging of tumors |
| JP2016528299A (ja) | 2013-08-22 | 2016-09-15 | ロバート・ドイルRobert DOYLE | ビタミンb12および内因子を含む組成物およびその使用方法 |
| JP6190240B2 (ja) | 2013-10-16 | 2017-08-30 | 浜松ホトニクス株式会社 | 癌に対する治療効果の診断剤 |
| US10406246B2 (en) | 2013-10-17 | 2019-09-10 | Deutsches Kresbsforschungszentrum | Double-labeled probe for molecular imaging and use thereof |
| US20150110814A1 (en) | 2013-10-18 | 2015-04-23 | Psma Development Company, Llc | Combination therapies with psma ligand conjugates |
| AU2014336638C1 (en) | 2013-10-18 | 2020-09-17 | Novartis Ag | Labeled inhibitors of prostate specific membrane antigen (PSMA), their use as imaging agents and pharmaceutical agents for the treatment of prostate cancer |
| EP4541378A3 (en) | 2013-11-14 | 2025-07-30 | Endocyte, Inc. | Compounds for positron emission tomography |
| JP6595479B2 (ja) | 2013-12-18 | 2019-10-23 | コーニンクレッカ フィリップス エヌ ヴェ | 心臓特性または呼吸特性に基づき睡眠除波活動をエンハンスするシステム及び方法 |
| CN103951668A (zh) | 2014-04-25 | 2014-07-30 | 广州军区广州总医院 | 叶酸衍生物的正电子核素标记物及其应用 |
| CN111285918B (zh) * | 2014-05-06 | 2024-05-31 | 约翰霍普金斯大学 | 用于psma靶向的成像和放射疗法的金属/放射性金属标记的psma抑制物 |
| PL3177632T3 (pl) | 2014-08-06 | 2022-06-13 | The Johns Hopkins University | Proleki inhibitora antygenu błony swoistego dla stercza (PSMA) |
| EP2993171A1 (en) | 2014-09-04 | 2016-03-09 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Method for the production of 18F-labeled PSMA-specific PET-tracers |
| WO2016030329A1 (en) | 2014-08-24 | 2016-03-03 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Method for the production of 18f-labeled active esters and their application exemplified by the preparation of a psma-specific pet-tracer |
| WO2016040179A1 (en) | 2014-09-08 | 2016-03-17 | Molecular Insight Pharmaceuticals, Inc. | Organ protection in psma-targeted radionuclide therapy of prostate cancer |
| US10188759B2 (en) | 2015-01-07 | 2019-01-29 | Endocyte, Inc. | Conjugates for imaging |
| SG11201705323WA (en) | 2015-01-16 | 2017-07-28 | Academia Sinica | Molecular constructs with targeting and effector elements |
| IL237525A (en) | 2015-03-03 | 2017-05-29 | Shalom Eli | Method for labeling a prostate-specific membrane antigen with a radioactive isotope |
| US10406238B2 (en) | 2015-05-11 | 2019-09-10 | Purdue Research Foundation | Ligand ionophore conjugates |
| EP3116208A1 (en) | 2015-07-09 | 2017-01-11 | Alcatel Lucent | Multiple destinations information for advice of charge |
| US9808538B2 (en) | 2015-09-09 | 2017-11-07 | On Target Laboratories, LLC | PSMA-targeted NIR dyes and their uses |
| US10842887B2 (en) | 2015-09-09 | 2020-11-24 | On Target Laboratories, LLC | PSMA-targeted NIR dyes and their uses |
| KR101639599B1 (ko) | 2015-11-09 | 2016-07-14 | 서울대학교산학협력단 | 펩타이드 싸이오우레아 유도체, 이를 포함하는 방사성 동위원소 표지 화합물 및 이를 유효 성분으로 함유하는 전립선암 치료 또는 진단용 약학적 조성물 |
| FR3043970B1 (fr) | 2015-11-25 | 2019-06-21 | Medtech Sa | Systeme mecanique de stabilisation au sol pour vehicules a roulettes |
| US10688200B2 (en) | 2015-12-31 | 2020-06-23 | Five Eleven Pharma Inc. | Urea-based prostate specific membrane antigen (PSMA) inhibitors for imaging and therapy |
| AU2017204979B2 (en) | 2016-01-10 | 2020-11-19 | Provincial Health Services Authority | 18/19F-labelled compounds which target the prostate specific membrane antigen |
| US20180027190A1 (en) | 2016-07-21 | 2018-01-25 | General Electric Company | Infrared non-destructive evaluation of cooling holes using evaporative membrane |
| EP3496707A4 (en) | 2016-08-09 | 2020-03-25 | Angimmune, LLC | Treatment of cancer using a combination of immunomodulation and check point inhibitors |
| CN110199195B (zh) | 2016-09-09 | 2022-08-30 | 目标实验室有限责任公司 | Psma靶向的nir染料及其用途 |
| DE212016000299U1 (de) | 2016-12-15 | 2019-09-05 | The European Atomic Energy Community (Euratom), Represented By The European Commission | Behandlung vpm PMSA-exprimierenden Krebsarten |
| CN110730908B (zh) | 2017-04-07 | 2025-01-21 | 朱诺治疗学股份有限公司 | 表达前列腺特异性膜抗原(psma)或其修饰形式的工程化细胞及相关方法 |
| EP3609544B1 (en) | 2017-04-11 | 2025-04-09 | The Johns Hopkins University | Prodrugs of 2-pmpa for healthy tissue protection during psma-targeted cancer imaging or radiotherapy |
| PL3498308T3 (pl) | 2017-12-13 | 2025-03-31 | Sciencons AS | Kompleks zawierający związek celujący w PSMA połączony z radionuklidem ołowiu lub toru |
| CA3090812A1 (en) | 2018-02-22 | 2019-08-29 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Chemical conjugates of evans blue derivatives and their use as radiotherapy and imaging agents for targeting prostate cancer |
| CN112368024A (zh) | 2018-04-17 | 2021-02-12 | 恩多塞特公司 | 治疗癌症的方法 |
| EP3810282A1 (en) | 2018-06-21 | 2021-04-28 | Regeneron Pharmaceuticals, Inc. | Bispecific anti-psma x anti-cd28 antibodies and uses thereof |
| US20210323985A1 (en) | 2018-09-21 | 2021-10-21 | Endocyte, Inc. | Shielding agents and their use |
| AU2019345320B2 (en) | 2018-09-21 | 2025-12-11 | Endocyte, Inc. | Methods of treating cancer |
| US20230098279A1 (en) | 2020-02-18 | 2023-03-30 | Endocyte, Inc. | Method of treating psma-expressing cancers |
| TW202304531A (zh) | 2021-04-02 | 2023-02-01 | 法商先進加速器應用公司 | 放射性配體顯像劑在前列腺癌的用途及注射或輸液用溶液 |
-
2020
- 2020-05-19 JP JP2021569296A patent/JP7604397B2/ja active Active
- 2020-05-19 US US17/612,283 patent/US12473265B2/en active Active
- 2020-05-19 CN CN202510255534.7A patent/CN120097930A/zh active Pending
- 2020-05-19 CN CN202510255478.7A patent/CN120097929A/zh active Pending
- 2020-05-19 WO PCT/US2020/033584 patent/WO2020236808A1/en not_active Ceased
- 2020-05-19 CN CN202080050827.7A patent/CN114096264B/zh active Active
- 2020-05-19 EP EP20810194.9A patent/EP3972627A4/en active Pending
-
2024
- 2024-12-11 JP JP2024216071A patent/JP2025038037A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109134602A (zh) | 2018-08-28 | 2019-01-04 | 兰州大学 | 一种高效的前列腺特异性膜抗原配体psma-617的固相制备方法 |
Non-Patent Citations (2)
| Title |
|---|
| Journal of Medicinal Chemistry,2016年,Vol.59,p.1761-1775 |
| The Journal of Nuclear Medicine,2015年,Vol.56, No.6,p.914-920 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2020236808A1 (en) | 2020-11-26 |
| CN120097930A (zh) | 2025-06-06 |
| CN120097929A (zh) | 2025-06-06 |
| CN114096264B (zh) | 2025-03-14 |
| CN114096264A (zh) | 2022-02-25 |
| EP3972627A4 (en) | 2023-06-21 |
| EP3972627A1 (en) | 2022-03-30 |
| US12473265B2 (en) | 2025-11-18 |
| JP2022538379A (ja) | 2022-09-02 |
| JP2025038037A (ja) | 2025-03-18 |
| US20220220085A1 (en) | 2022-07-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7604397B2 (ja) | Psmaコンジュゲートの調製方法 | |
| AU2023202704B2 (en) | Compounds for positron emission tomography | |
| ES2586411T3 (es) | Macrociclos sustitutos de enlace de hidrógeno como moduladores de Ras | |
| US10207005B2 (en) | Photodynamic therapy composition | |
| JP2017039747A (ja) | ジグリシドエーテル誘導体治療剤およびその使用方法 | |
| CN108383893A (zh) | 用于治疗实体瘤的fap-活化的蛋白酶体抑制剂 | |
| EP3209336A1 (en) | 18f-tagged inhibitors of prostate specific membrane antigen (psma), their use as imaging agents and pharmaceutical agents for the treatment of prostate cancer | |
| TWI480070B (zh) | 具礦質親和能力之多歧狀胜肽構型 | |
| EP1077218B1 (en) | Peptido-mimetic compounds containing RGD sequence useful as integrin inhibitors | |
| WO2004112839A2 (en) | Specific high-relaxivity conjugate compounds for magnetic resonance imaging | |
| CA3162958A1 (en) | Reactive conjugates | |
| CA3198066A1 (en) | Reactive conjugates | |
| CN111909240B (zh) | 一种pd-1/pd-l1多肽类抑制剂及其医药用途 | |
| WO2024187158A1 (en) | Benzaldehyde acetal acid-degradable amphiphilic lipid and self-assembling peptides | |
| AU2015289178A1 (en) | Novel compounds | |
| TW202320863A (zh) | 用於治療、預防或管理過度增生性病症之化合物、醫藥組合物及方法 | |
| CN107663228A (zh) | 核磁共振显像化合物、核磁共振显像剂及应用、以及核磁共振成像方法 | |
| JPH06306096A (ja) | ペプチド誘導体及びその用途 | |
| CN112010940A (zh) | 抑制pd-1/pd-l1的大环化合物及其应用 | |
| CN102875651A (zh) | 抗肿瘤靶向激活的多肽阿霉素、其制备方法和用途 | |
| JPH06298797A (ja) | ペプチド誘導体およびその用途 | |
| WO2024260421A1 (zh) | 一种类肽化合物及其配合物、药物组合物和应用 | |
| CN120209069A (zh) | 一种可增强fap抑制剂亲和力并改善药代动力学的化合物及用途 | |
| JPH08225457A (ja) | 癌転移抑制用組成物 | |
| EP4619049A1 (en) | Imaging agents for detecting cd206+ macrophages |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20230518 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240604 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240830 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20241119 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20241211 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7604397 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |